Настоящее изобретение относится к препаратам олигосахарида грудного молока. Более конкретно, настоящее изобретение относится к твердым препаратам олигосахаридов грудного молока и к способам изготовления указанных твердых препаратов олигосахаридов грудного молока.
Предшествующий уровень техники
Человеческое грудное молоко содержит существенное количество углеводов. Данные углеводы включают моносахариды, такие как L-фукоза и N-ацетилнейраминовая кислота (Neu5Ac). Дисахарид лактоза также присутствует в человеческом грудном молоке. Помимо лактозы, один литр человеческого грудного молока содержит вплоть до 20 г/л олигосахаридов, так называемых «олигосахаридов грудного молока (ОГМ)». ОГМ представляют третий по распространенности компонент человеческого грудного молока. Предположительно, в грудном молоке присутствует более 150 структурно различных олигосахаридов. Грудное молоко обычно содержит от 10 до 13 основных ОГМ, которые находятся в концентрации от граммов до нескольких сотен миллиграммов на литр (Thurl et al., (2017), Nutrition Reviews 75(11) 920-933). ОГМ включают нейтральные ОГМ, а также кислотные ОГМ, которые содержат одну или более группировок сиаловой кислоты. Наиболее значимые ОГМ показаны в Таблице 1. Сложность структуры и распространенность данных олигосахаридов является спецификой человеческого грудного молока и не обнаружена в молоке других млекопитающих, таких как, например, одомашненные молочные животные.
Поскольку ОГМ не перевариваются человеком, физиологическая роль данных сахаридов исследуется на протяжении нескольких десятилетий. Пребиотический эффект ОГМ открыт более 100 лет назад. ОГМ способны модулировать микробном кишечника человека посредством обеспечения пищей полезных бактерий. В последние годы было исследовано несколько других функциональных эффектов ОГМ, особенно их воздействие на развитие новорожденных. Известно, что ОГМ действуют в качестве ловушек для снижения риска инфекций, вызываемых бактериальными и вирусными патогенами, которые прилипают к клеткам человека посредством связывания с гликопротеинами клеточной поверхности. Кроме того, разные ОГМ обладают противовоспалительным действием и действуют в качестве иммуномодуляторов. Следовательно, предположили, что ОГМ снижают риски развития пищевых аллергий.
Положительный эффект сиалированных ОГМ, оказываемый на развитие мозга новорожденных, широко обсуждается (рассмотрено в «Prebiotics and Probiotics in Human Milk, Origins and functions of milk-borne oligosaccharides and bacteria», Academic Press (2017) editors: McGuire M., McGuire M., and Bode L).
ОГМ включают несколько структурно различающихся лактофукопентаоз Наилучшим образом охарактеризованные лактофукопентаозы представляют собой лакто-N-фукопентаозу I (LNFPI - от англ. lacto-N-fucopentaose I; Fuc(α1,2)Gal(β1,3)GlcNAc(β1,3)Gal(β1,4)Glc), лакто-N-фукопентаозу II (NPFII - от англ. lacto-N-fucopentaose II; Gal(β1,3)(Fuc(α1,4))GlcNAc(β1,3)Gal(β1,4)Glc), лакто-N-фукопентаозу III (LNFPIII - от англ. lacto-N-fucopentaose III; Gal(β1,4)(Fuc(α1,3))GlcNAc(β1,3)Gal(β1,4)Glc) и лакто-N-фукопентаозу V (LNFPV - от англ. lacto-N-fucopentaose V; Gal(β1,3)GlcNAc(β1,3)Gal(β1,4)(Fuc(α1,3))Glc).
Первым этапом для того, чтобы воспользоваться полезными эффектами ОГМ в отношении детей на искусственном вскармливании, является добавление отдельных ОГМ к детской питательной смеси. Однако, было бы лучше дополнять детские питательные смеси комбинацией структурно разных ОГМ, поскольку комбинация структурно разных ОГМ будет оказывать действия, которые более похожи на действия их исходного источника, грудного молока, и которые не могут быть вызваны отдельными ОГМ.
Ограниченное добавление отдельных ОГМ для дополнения детских питательных смесей сначала привело к развитию химического синтеза ОГМ с последующей разработкой биокаталитических подходов с использованием очищенных ферментов. На сегодняшний день, ферментацию генетически модифицированных бактериальных клеток используют для получения разных ОГМ в промышленном масштабе (WO 2015/150328 А1, WO 2017/043382 А1, WO 2010/070104 А1, WO2012/ 097950 А1). ОГМ, которые синтезируются бактериальными клетками, могут быть очищены от ферментационного бульона или клеточного лизата с получением по существу чистых препаратов ОГМ, таким образом, что они могут быть использованы в питании человека, особенно в детском питании.
Во время их очистки лакто-N-фукопентаоза присутствует в форме жидкого технологического потока. Вместе с очисткой концентрация лакто-N-фукопентаозы в данном технологическом потоке повышена. Однако, водный раствор лакто-N-фукопентаозы сильно подвержен бактериальному или грибному загрязнению. Таким образом, предпочтительно предоставлять лакто-N-фукопентаозу в виде сухого продукта, имеющего низкое содержание воды, таким образом, чтобы рост микробов был невозможен.
Обычно, сахарид получают в твердой форме посредством кристаллизации. Кристаллизация отдельных ОГМ описана: для 3-фукозиллактозы (WO 2014/075680 А), для 2'-фукозиллактозы (WO 2011/150939 А), Ди-фукозиллактозы (WO 2016/086947 А), лакто-N-тетраозы (WO 2017/101953 А), лакто-N-неотетраозы (WO 2014/094783 А). Кристаллизация ОГМ включает применение органических растворителей, таких как спирты, главным образом этанол или метанол, или органические кислоты, такие как ледяная уксусная кислота. Однако, применение органических растворителей для кристаллизации ОГМ в качестве последней стадии в способе получения конечного продукта в твердой форме не является уместным, если ОГМ будут использоваться в качестве пищевых ингредиентов. Кроме того, органические растворители являются вредными для окружающей среды и для любого индивида, работающего с ними. Таким образом, применение органических растворителей требует соблюдения мер безопасности труда и соответствующей ликвидации, которая делает применение органических растворителей дорогостоящим. Таким образом, кристаллизация ОГМ для предоставления ОГМ в твердой форме должна считаться недостатком в получении ОГМ в промышленном масштабе.
Таким образом, желательным является способ, согласно которому предоставляются ОГМ, в частности лакто-N-фукопентаозы, в твердой форме, который применим в промышленном получении ОГМ и который не включает применения органического растворителя в конце схемы очистки с предоставлением твердого препарата указанного ОГМ.
Проблема решается посредством способа получения порошка, по существу состоящего из очищенного ОГМ, где указанный способ включает распылительную сушку водного раствора, который содержит данный ОГМ.
Краткое изложение сущности изобретения
В первом аспекте предложен высушенный распылением порошок, по существу состоящий по меньшей мере из одной лакто-N-фукопентаозы.
Во втором аспекте предложен способ изготовления высушенного распылением порошка, по существу состоящего по меньшей мере из одной лакто-N-фукопентаозы.
В третьем аспекте предложено применение высушенного распылением порошка, по существу состоящего по меньшей мере из одной лакто-N-фукопентаозы, для изготовления питательной композиции.
В четвертом аспекте предложена питательная композиция, содержащая высушенный распылением порошок, по существу состоящий по меньшей мере из одной лакто-N-фукопентаозы.
Описание графических материалов
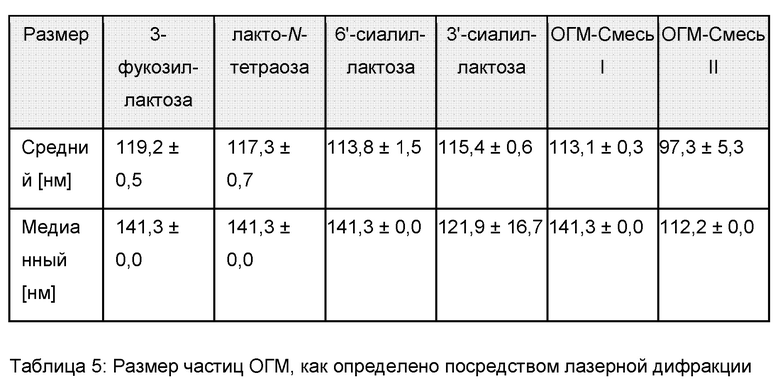
На Фиг. 1 показан график, иллюстрирующий результаты порошковой рентгеновской дифракции 3-фукозиллактозы, высушенной посредством распылительной сушки.
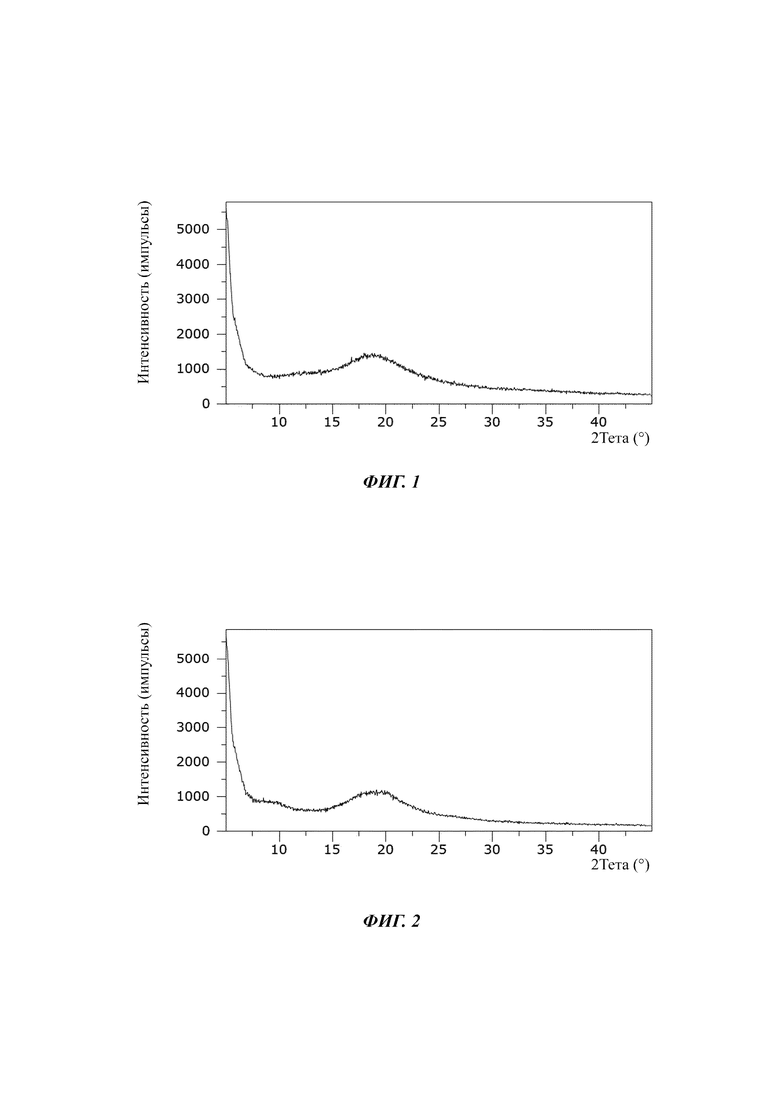
На Фиг. 2 показан график, иллюстрирующий результаты порошковой рентгеновской дифракции лакто-N-тетраозы, высушенной посредством распылительной сушки.
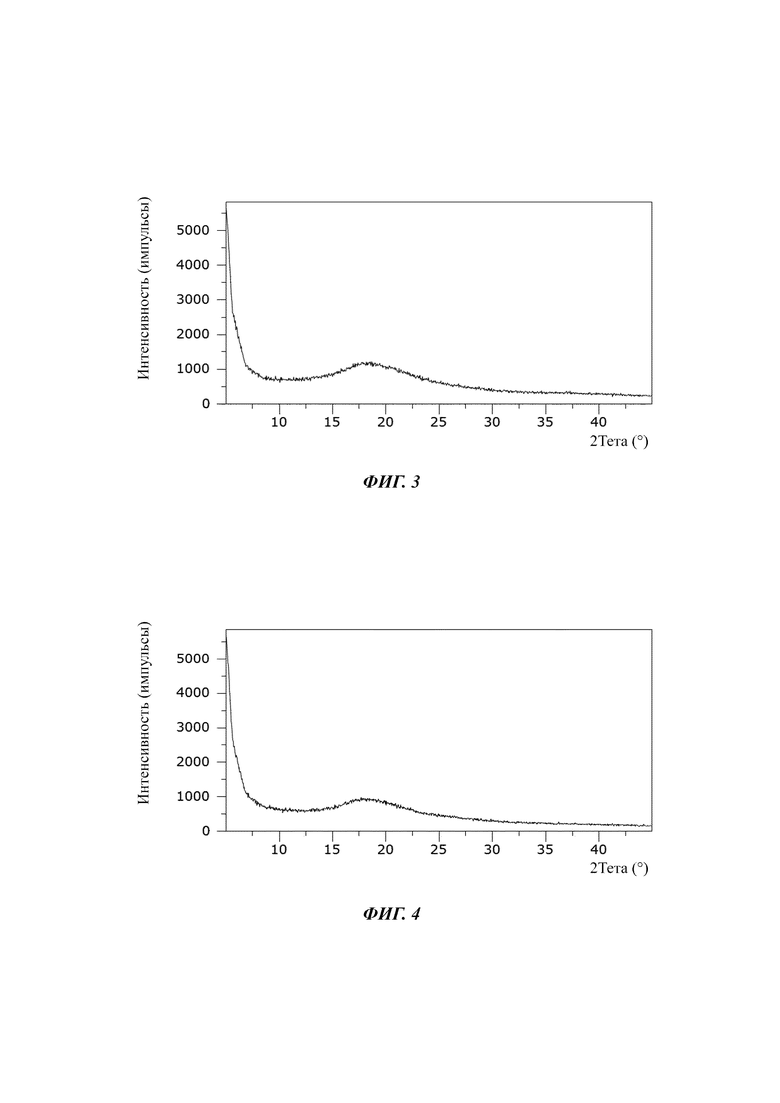
На Фиг. 3 показан график, иллюстрирующий результаты порошковой рентгеновской дифракции 6'-сиалиллактозы, высушенной посредством распылительной сушки.
На Фиг. 4 показан график, иллюстрирующий результаты порошковой рентгеновской дифракции 3'-сиалиллактозы, высушенной посредством распылительной сушки.
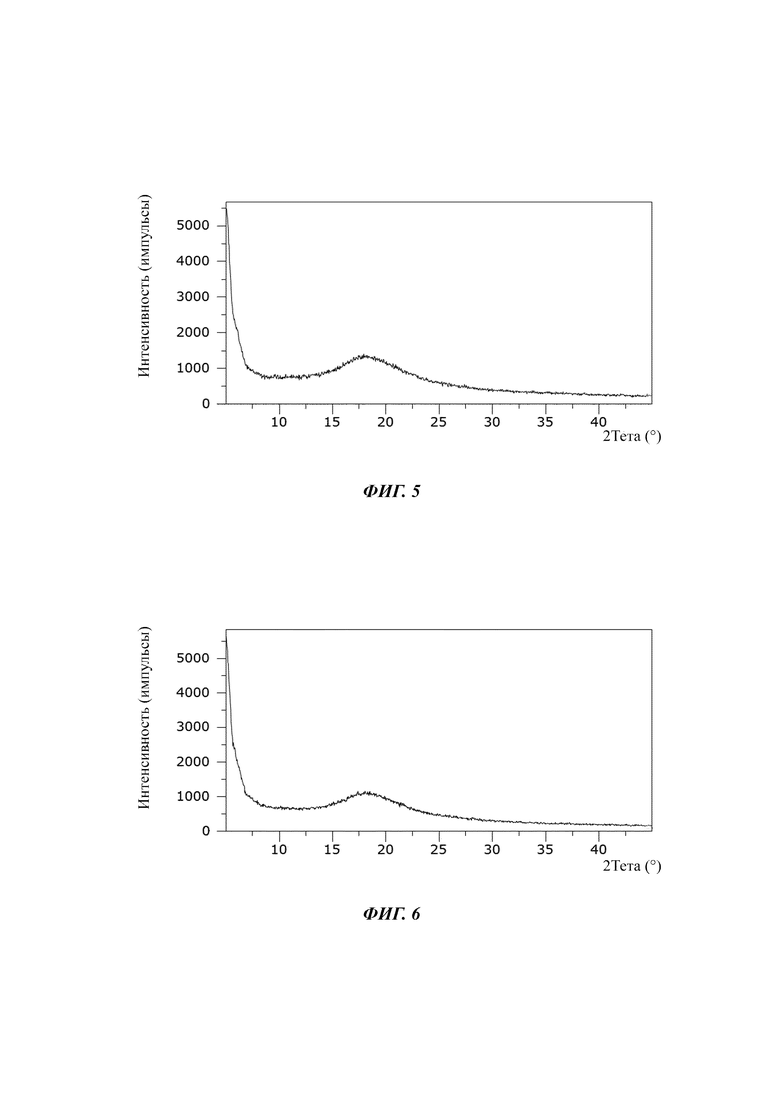
На Фиг. 5 показан график, иллюстрирующий результаты порошковой рентгеновской дифракции высушенной посредством распылительной сушки смеси 2'-фукозиллактозы и лакто-N-тетраозы.
На Фиг. 6 показан график, иллюстрирующий результаты порошковой рентгеновской дифракции высушенной посредством распылительной сушки смеси 2'-фукозиллактозы, 3-фукозиллактозы, лакто-N-тетраозы, 3'-сиалиллактозы и 6'-сиалиллактозы.
Подробное описание
Согласно первому аспекту предложен высушенный распылением порошок, по существу состоящий по меньшей мере из одной лакто-N-фукопентаозы, где указанная лакто-N-фукопентаоза получена посредством микробной ферментации.
Лакто-N-фукопентаозу получают посредством микробной ферментации, как описано ниже в данном документе. Термин «по существу состоящий из», в том виде, в котором он используется в данном документе, означает, что высушенный распылением порошок состоит по меньшей мере из одной лакто-N-фукопентаозы и - возможно - побочных продуктов, которые образуются во время микробной ферментации для продукции по меньшей мере одной лакто-N-фукопентаозы, но которые не могли быть удалены из технологического потока, полученного в результате микробной ферментации. Термин «по существу состоящий из» включает высушенные посредством распылительной сушки порошки, состоящие из по меньшей мере 80 масс. %, по меньшей мере 85 масс. %, по меньшей мере 90 масс. %, по меньшей мере 93 масс. %, по меньшей мере 95 масс. % или по меньшей мере 98 масс. % лакто-N-фукопентаозы.
В дополнительном и/или альтернативном воплощении по меньшей мере одна лакто-N-фукопентаоза выбрана из группы, состоящей из L/VFPI, L/VFPII, L/VFPIII и L/VFPV. В одном конкретном воплощении лакто-N-фукопентаоза представляет собой лакто-N-фукопентаозу I. В альтернативном воплощении высушенный распылением порошок по существу состоит из смеси лакто-N-фукопентаоз, где лакто-N-фукопентаозы данной смеси предпочтительно выбраны из группы, состоящей из UVFPI, LA/FPII, L/VFPIII и L/VFPV.
В дополнительном и/или альтернативном воплощении лакто-N-фукопентаоза находится в высушенном распылением порошке в аморфной форме.
В дополнительном и/или альтернативном воплощении высушенный распылением порошок содержит 15 масс. % воды или менее, предпочтительно 10 масс. % воды или менее, более предпочтительно 7 масс. % воды или менее, наиболее предпочтительно 5 масс. % воды или менее.
В дополнительном и/или альтернативном воплощении высушенный распылением порошок не содержит генетически модифицированных микроорганизмов и молекул нуклеиновой кислоты, происходящих из генетически модифицированных микроорганизмов.
Согласно второму аспекту предложен способ изготовления высушенного распылением порошка, по существу состоящего по меньшей мере из одной лакто-N-фукопентаозы, которая была получена посредством микробной ферментации. Способ включает следующие стадии:
а) очистка лакто-N-фукопентаозы от технологического потока;
б) предоставление водного раствора по меньшей мере одной лакто-N-фукопентаозы стадии а); и
в) подвергание раствора стадии б) распылительной сушке.
В дополнительном и/или альтернативном воплощении очистка лакто-N-фукопентаозы от технологического потока включает одну или более из следующих стадий:
i) удаление клеток микробов из ферментационного бульона и/или лизис клеток микробов с получением технологического потока;
и) подвергание данного технологического потока по меньшей мере одной ультрафильтрации;
iii) обработка технологического потока по меньшей мере один раз катионообменной смолой и/или по меньшей мере один раз анионообменной смолой;
iv) подвергание технологического потока по меньшей мере одной нанофильтрации;
v) подвергание технологического потока по меньшей мере одному электродиализу;
vi) обработка технологического потока по меньшей мере один раз активированным углем; и/или
vii) подвергание технологического потока по меньшей мере один раз стадии кристаллизации и/или осаждения.
Лакто-N-фукопентаоза может быть получена посредством микробной ферментации, в которой генетически модифицированный микроорганизм, который способен синтезировать лакто-N-фукопентаозу, культивируют в культуральной среде (ферментационный бульон) и в условиях, которые являются пермиссивными для синтеза лакто-N-фукопентаозы указанным генетически модифицированным микроорганизмом. Очистка лакто-N-фукопентаозы, полученной посредством микробной ферментации, включает стадию отделения клеток микробов от ферментационного бульона с получением осветленного технологического потока, который по существу не содержит клеток и который содержит лакто-N-фукопентаозу. Данная стадия представляет собой первую стадию в способе очистки желательных олигосахаридов.
Подходящие способы отделения микробных клеток от ферментационного бульона включают центрифугирование, при котором микробные клетки получают в виде осадка и ферментационный бульон в виде супернатанта. В дополнительном и/или альтернативном воплощении микробные клетки отделяют от ферментационного бульона посредством фильтрации. Подходящие способы отделения клеток от ферментационного бульона на основе фильтрации включают микрофильтрацию и ультрафильтрацию.
Микрофильтрация как таковая представляет собой физический способ фильтрации, где жидкость, содержащую частицы, пропускают через мембрану со специальным размером пор для отделения частиц от жидкости. Термин «микрофильтрация», в том виде, в котором он используется в данном документе, относится к физическому способу фильтрации, где клетки отделяют от ферментационного бульона.
Ультрафильтрация представляет собой разновидность мембранной фильтрации и фундаментально не отличается. При ультрафильтрации силы, подобно градиентам давления или концентраций, приводят к разделению через полупроницаемую мембрану. Клетки, суспендированные твердые вещества и растворенные высокомолекулярные вещества задерживаются в так называемом ретентате, в то время как вода и низкомолекулярные растворенные вещества, такие как желательный сиалированный олигосахарид, проходят через мембрану в пермеат (фильтрат).
Ультрафильтрационные мембраны определяются номинальным отсечением по молекулярной массе (MWCO - от англ. molecular weight cut-off) используемой мембраны. Ультрафильтрацию применяют в режиме поперечного потока или тупого конца.
В воплощениях, в которых по меньшей мере часть лакто-N-фукопентаозы, которая была синтезирована микробной клеткой, не секретируется в ферментационный бульон, а остается внутри клетки, клетки могут быть удалены из ферментационного бульона и лизированы. Нерастворимые компоненты могут быть удалены из клеточного лизата, который затем становится технологическим потоком, в котором содержится лакто-N-фукопентаоза.
Несмотря на то, что способ используют для очистки лакто-N-фукопентаозы, которая была получена в результате микробной ферментации, указанный способ может также использоваться для очистки лакто-N-фукопентаозы, которая была получена в результате ферментативного катализа in-vitro. Лакто-N-фукопентаозу можно очищать от реакционной смеси в конце биокаталитической реакции. Указанную реакционную смесь подвергают способу очистки в виде технологического потока.
Технологический поток содержит лакто-N-фукопентаозу, а также побочные продукты и нежелательные примеси, такие как - например - моносахариды, дисахариды, нежелательные побочные продукты олигосахаридов, ионы, аминокислоты, полипептиды, белки и/или нуклеиновые кислоты.
В дополнительном и/или альтернативном воплощении способ очистки лакто-N-фукопентаозы включает стадию по меньшей мере одной обработки катионообменной смолой для удаления положительно заряженных соединений из осветленного технологического потока.
Подходящие катионообменные смолы для удаления положительно заряженных соединений включают Lewatit S2568 (Н+) (Lanxess AG, Cologne, DE).
В дополнительном и/или альтернативном воплощении способ очистки лакто-N-фукопентаозы включает стадию обработки анионообменной смолой для удаления нежелательных отрицательно заряженных соединений из осветвленного технологического потока.
Подходящие анионообменные смолы включают Lewatit S6368 A, Lewatit S4268, Lewatit S5528, Lewatit S6368A (Lanxess AG. Cologne, DE), Dowex AG 1x2 (Mesh 200-400), Dowex 1×8 (Mesh 100-200), Purolite Chromalite CGA100×4 (Purolite GmbH, Ratingen, DE), Dow Amberlite FPA51 (Dow Chemicals, Ml, США).
В дополнительном и/или альтернативном воплощении способ очистки лакто-N-фукопентаозы включает стадию нанофильтрации и/или диафильтрации для удаления примесей, имеющих низкую молекулярную массу, и для концентрирования желательных олигосахаридов.
Диафильтрация включает добавление свежей воды к раствору для удаления (вымывания) мембранопроницаемых компонентов. Диафильтрацию можно использовать для разделения компонентов на основе размера и заряда их молекул посредством использования соответствующих мембран, где одно или более соединений эффективно удерживаются, а другие соединения являются мембранопроницаемыми. В частности, диафильтрация с использованием нанофильтрационной мембраны является эффективной в отношении разделения низкомолекулярных соединений, подобно малой молекуле, и солей. Нанофильтрационные мембраны обычно имеют номинальное отсечение по молекулярной массе в интервале 150 - 1000 Дальтон. Нанофильтрацию широко используют в молочной промышленности для концентрирования и деминерализации молочной сыворотки.
Подходящие мембраны для нанофильтрации и/или диафильтрации включают Dow Filmtec NF270-4040, Trisep 4040-XN45-TSF (Microdyn-Nadir GmbH, Wiesbaden, DE), GE4040F30 и GH4040F50 (GE Water & Process Technologies, Ratingen, DE).
Обнаружили, что диафильтрация с использованием нанофильтрационных мембран является эффективной в качестве предварительной обработки для удаления значительных количеств загрязняющих веществ перед обработкой на основе электродиализа раствора, содержащего олигосахарид. Применение нанофильтрационных мембран для концентрирования и диафильтрации во время очистки ОГМ приводит к более низким энергетическим затратам и затратам на обработку и лучшему качеству продукта, благодаря уменьшенному тепловому воздействию, приводя к сниженному уровню реакций Майяра и альдольных реакций.
В дополнительном и/или альтернативном воплощении способ очистки лакто-N-фукопентаозы включает по меньшей мере одну стадию электродиализа.
Электродиализ (ED - от англ. electrodialysis) объединяет диализ и электролиз и может использоваться для разделения или концентрирования ионов в растворах на основе их селективной электромиграции через полупроницаемые мембраны.
Основной принцип электродиализа заключается в электролитической ячейке, содержащей пару электродов, погруженных в электролит для проводимости ионов, соединенных с генератором постоянного тока. Электрод, соединенный с положительным полюсом генератора постоянного тока, является анодом, и электрод, соединенный с отрицательным полюсом, является катодом. В таком случае, раствор электролита поддерживает прохождение электрического тока, который образуется в результате движения отрицательно заряженных и положительно заряженных ионов в направлении анода и катода, соответственно. Мембраны, используемые для электродиализа, по существу представляют собой листы пористых ионообменных смол с отрицательно заряженными или положительно заряженными группами, и, таким образом, описаны, как катионные или анионные мембраны, соответственно. Ионообменные мембраны обычно сделаны из полистирола, несущего подходящую функциональную группу (как например, сульфоновая кислота в случае катионных мембран или группа четвертичного аммония в случае анионных мембран), сшитого с дивинилбензолом. Электролит может, например, представлять собой хлорид натрия, ацетат натрия, пропионат натрия или аминосульфоновую кислоту. В таком случае, электродиализный пакет собран таким образом, чтобы анионные и катионные мембраны были параллельны, как в фильтр-прессе между двумя электродными блоками, таким образом, чтобы поток, испытывающий обеднение ионами, был хорошо отделен от потока, испытывающего обогащение ионами (данные два раствора также называются разбавленным раствором (испытывающим обеднение ионами) и концентратом (испытывающим обогащение ионами)). Основой способа электродиализа является мембранный пакет, который состоит из нескольких анионообменных мембран и катионообменных мембран, разделенных спейсерами, установленными между двумя электродами. Подавая постоянный электрический ток, анионы и катионы будут мигрировать через мембраны в направлении электродов.
В дополнительном и/или альтернативном воплощении способ очистки лакто-N-фукопентаозы дополнительно включает стадию непрерывной хроматографии, такой как хроматография с псевдодвижущимся слоем (SMB - от англ. simulated bed moving).
Хроматография с псевдодвижущимся слоем (SMB) брала начало в нефтехимической и минеральной промышленностях. В настоящее время, SMB хроматография используется в фармацевтической промышленности для выделения энантиомеров из рацемических смесей. Крупномасштабная SMB хроматография уже была использована для выделения моносахарида фруктоза из растворов фруктозы-глюкозы и для выделения дисахарида сахароза из сиропов сахарной свеклы или сахарного тростника.
В SMB способах, используемых для разделения сахаридов, используются, например, кальций-заряженные смолы на основе сшитого полистирола, анионообменные смолы в бисульфитной форме (Bechthold М., et al., Chemie Ingenieur Technik, 2010, 82, 65-75) или смола на основе сильнокислотного катионита в водородной форме и геля полистирола (Purolite PCR833H) (Purolite, Bala Cynwyd, США).
В условиях непрерывного режима работы, повторного использования подвижной фазы и также возможности использования больших размеров колонок, SMB системы могут в принципе расширяться для достижения объемов производства, составляющих сотни тонн.
Стадия способа хроматографии с псевдодвижущимся слоем является преимущественной в том, что данная стадия способа делает возможным дополнительное удаление олигосахаридов, являющихся структурно близкими с желательным олигосахаридом.
В дополнительном и/или альтернативном воплощении способ очистки лакто-N-фукопентаозы включает обработку технологического потока активированным углем для удаления загрязняющих веществ, таких как красители, из технологического потока.
В дополнительном и/или альтернативном воплощении способ очистки лакто-N-фукопентаозы включает по меньшей мере одну стадию кристаллизации или осаждения лакто-N-фукопентаозы из технологического потока. Кристаллизация или осаждение лакто-N-фукопентаозы из технологического потока можно проводить посредством добавления подходящего количества органического растворителя, который смешивается с водой, к технологическому потоку, содержащему лакто-N-фукопентаозу. Органический растворитель может быть выбран из группы, состоящей из С1-С6-спиртов и С1-С4-карбоновых кислот.
В дополнительном и/или альтернативном воплощении способ очистки лакто-N-фукопентаозы включает стадию стерильной фильтрации и/или удаления эндотоксинов, предпочтительно посредством фильтрации технологического потока через 3 кДа фильтр или 6 кДа фильтр.
В дополнительном и/или альтернативном воплощении способ очистки лакто-N-фукопентаозы включает стадию повышения концентрации лакто-N-фукопентаозы в технологическом потоке. Концентрация лакто-N-фукопентаозы в технологическом потоке может быть повышена в результате подвергания технологического потока упариванию под вакуумом, обратному осмосу или нанофильтрации (например, нонофильтрации с помощью нанофильтрационной мембраны, имеющей эксклюзионный предел равный 20 А или менее). В качестве альтернативы, кристаллизованную или осажденную лакто-N-фукопентаозу растворяют в воде с получением раствора лакто-N-фукопентаозы, имеющего желательную концентрацию лакто-N-фукопентаозы.
В дополнительном и/или альтернативном воплощении полученный технологический поток представляет собой водный раствор, который содержит по меньшей мере одну лакто-N-фукопентаозу в концентрации, равной 20 г/л или более, равной 25 г/л или более, равной 30 г/л или более, равной 40 г/л или более, 60 г/л или более, равной 100 г/л или более, равной 200 г/л или более или даже равной 300 г/л или более.
В дополнительном и/или альтернативном воплощении водный раствор содержит по меньшей мере одну лакто-N-фукопентаозу с чистотой по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 93%, по меньшей мере 95% или по меньшей мере 98% относительно массы сухого вещества/растворенных веществ в растворе.
Полученный концентрат, содержащий очищенную лакто-N-фукопентаозу, может храниться в соответствующих условиях.
Способ очистки лакто-N-фукопентаозы является рентабельным и легко увеличивается в масштабе, что делает его подходящим в качестве основы для многотонного масштабного способа производства.
Способ очистки лакто-N-фукопентаозы является также преимущественным тем, что водный раствор не содержит генетически модифицированных микроорганизмов и молекул нуклеиновых кислот, происходящих из генетически модифицированных микроорганизмов. Кроме того, водный раствор не содержит белков. Общее удаление белков исключает риск вызова аллергий у потенциального потребителя.
Способ изготовления высушенного распылением порошка включает стадию предоставления водного раствора, содержащего по меньшей мере одну лакто-N-фукопентаозу.
В дополнительном и/или альтернативном воплощении водный раствор содержит по меньшей мере одну лакто-N-фукопентаозу в количестве по меньшей мере 20% (масс/об.), 30% (масс/об.), 35% (масс/об.) и вплоть до 45% (масс/об.), 50% (масс/об.), 60% (масс/об.).
В дополнительном и/или альтернативном воплощении водный раствор содержит по меньшей мере одну лакто-N-фукопентаозу с чистотой по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 93%, по меньшей мере 95% или по меньшей мере 98% относительно массы сухого вещества/растворенных веществ в растворе.
В дополнительном и/или альтернативном воплощении водный раствор не содержит генетически модифицированных микроорганизмов, молекул нуклеиновых кислот, происходящих из генетически модифицированных микроорганизмов, и белков.
В способе изготовления высушенного распылением порошка, водный раствор, содержащий по меньшей мере одну лакто-N-фукопентаозу, подвергают распылительной сушке.
Распылительная сушка представляет собой способ получения сухих порошков, где раствор, содержащий исследуемое вещество (а именно лакто-N-фукопентаозу), сначала распыляют на капли, которые быстро высыхают посредством горячего воздуха. Распылительная сушка является очень быстрой, и воздействие высоких температур на вещество, подлежащее сушке, является довольно непродолжительным.
В дополнительном и/или альтернативном воплощении водный раствор, содержащий по меньшей мере одну лакто-N-фукопентаозу, которая была очищена от ферментационного бульона или технологического потока, подвергают распылительной сушке при температуре сопла по меньшей мере 110°С, предпочтительно по меньшей мере 120°С, более предпочтительно по меньшей мере 125°С и меньше чем 150°С, предпочтительно меньше чем 140°С и более предпочтительно меньше чем 135°С.
В дополнительном и/или альтернативном воплощении водный раствор, содержащий по меньшей мере одну лакто-N-фукопентаозу, которая была очищена от ферментационного бульона или технологического потока, подвергают распылительной сушке при температуре на выходе по меньшей мере 60°С, предпочтительно по меньшей мере 65°С и меньше чем 80°С, предпочтительно меньше чем 70°С. В особенно предпочтительном воплощении водный раствор, содержащий по меньшей мере одну лакто-N-фукопентаозу, подвергается распылительной сушке при температуре сопла от примерно 68°С до примерно 70°С.
Подразумевается, что любая из структурно различающихся лакто-N-фукопентаоз может быть очищена и высушена посредством распылительной сушки по отдельности, и что полученные порошки, высушенные посредством распылительной сушки, могут быть смешаны в любом желательном соотношении. В дополнительном и/или альтернативном воплощении отдельные водные растворы, где каждый содержит отдельную, структурно отличающуюся лакто-N-фукопентаозу, могут быть смешаны в любом желательном соотношении, и полученный водный раствор содержит смесь структурно отличающихся лакто-N-фукопентаоз в желательном соотношении, может подвергаться распылительной сушке. Соотношение разных лакто-N-фукопентаоз в порошке, полученном посредством распылительной сушки, соответствует соотношению разных лакто-N-фукопентаоз в водном растворе.
Распылительная сушка водного раствора, содержащего по меньшей мере одну лакто-N-фукопентаозу, обеспечивает порошок низкой гигроскопичности, где лакто-N-фукопентаоза находится в аморфной форме, и где размер частиц является однородным.
Согласно третьему аспекту предложено применение порошка, высушенного посредством распылительной сушки, содержащего по меньшей мере одну лакто-N-фукопентаозу, которая была очищена от технологического потока, для изготовления питательной композиции. Высушенный распылением порошок, по существу состоящий по меньшей мере из одной лакто-N-фукопентаозы, подходит для потреблений человеком и может, таким образом, быть включен в препараты для потребления человеком, такие как медицинские композиции, детские питательные смеси, молочные напитки или биологически активные добавки.
Согласно четвертому аспекту предложены питательные композиции, которые содержат высушенный распылением порошок, как описано в первом аспекте, или как изготовлено согласно второму аспекту.
В дополнительном и/или альтернативном воплощении питательная композиция содержит по меньшей мере один дополнительный ОГМ, который не является по меньшей мере одной лакто-N-фукопентаозой, который находится в или в виде указанного порошка, высушенного посредством распылительной сушки. По меньшей мере один дополнительный ОГМ может представлять собой нейтральный ОГМ, предпочтительно выбранный из группы, состоящей из 2'-фукозиллактозы (2'-FL - от англ. 2'-fucosyllactose), 3-фукозиллактозы (3-FL - от англ. 3-fucosyllactose), лакто-N-тетраозы (LNT - от англ. lacto-N-tetraose), лакто-N-неотетраозы (LNnT - от англ. lacto-N-neotetraose) и лакто-N-фукопентаозы I (LNFPI), лакто-N-фукопентаозы II (LNFPII), лакто-N-фукопентаозы III (LNFPIII) и лакто-N-фукопентаозы V (LNFPV).
В дополнительном и/или альтернативном воплощении по меньшей мере один дополнительный ОГМ может представлять собой сиалированный ОГМ, предпочтительно выбранный из группы, состоящей из 3'-сиалиллактозы (3'-SL - от англ. 3'-sialyllactose), 6'- сиалиллактозы (6'-SL - от англ. 6'-sialyllactose), сиалиллакто-N-тетраозы (LST - от англ. sialyllacto-N-tetraose)-a, LST-b, LST-c и дисиалиллакто-N-тетраозы (DSLNT - от англ. disialyllacto-N-tetraose).
В дополнительном и/или альтернативном воплощении питательная композиция включает смесь, по существу состоящую из Neu5Ac, 2'-FL, 3-FL, LNT, LNnT, LNFPI, 3'-SL, 6'-SL, сиаловой кислоты и L-фукозы. Питательная композиция, включающая предпочтительные количества каждого из указанных соединений, представлена в таблице 1.
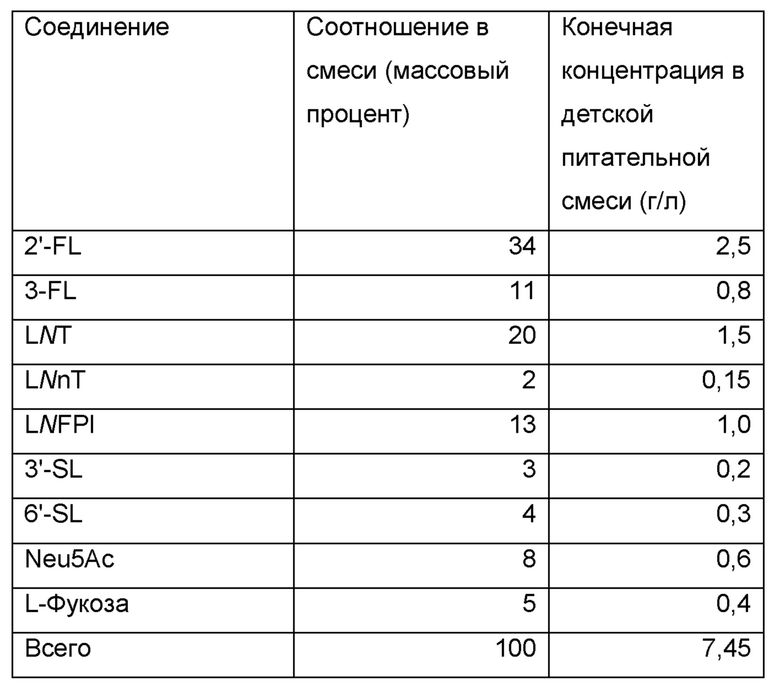
Таблица 1: Состав иллюстративной смеси, содержащей подходящее дополнение для детских питательных смесей
Состав в соответствии со вторым столбцом в Таблице 1 является особенно преимущественным для дополнения детской питательной смеси, таким образом, что конечная детская питательная смесь для непосредственного потребления может содержать соединения смеси в концентрациях, как указано в третьем столбце Таблицы 1.
В дополнительном и/или альтернативном воплощении питательная композиция содержит один или более дополнительных ингредиентов. Указанный один или более дополнительных ингредиентов выбраны из группы, состоящей из масла, жира и жирных кислот (таких как оливковое масло, подсолнечное масло, кокосовое масло, ореховое масло, рапсовое масло, пальмовое масло, льняное масло, рыбий жир, линоленовая кислота, соевое масло и т.д.), углеводов (таких как глюкоза, фруктоза, лактоза, мальтодекстрин, крахмал, сахароза, инозитол и т.д.), белков (из обезжиренного молока, молочной сыворотки, казеина (происходящего из любых одомашненных молочных животных) или соевых бобов), витаминов (А, В1, В2, В5, В6, В12, С, D, Е, K, биотин, фолиевая кислота, ниацин, холин), минералов и микроэлементов (натрий, калий, хлорид, кальций, фосфор, магний, железо, цинк, марганец, фторид, селен, йод, медь).
В предпочтительном воплощении питательная композиция, содержащая высушенные посредством распылительной сушки олигосахариды грудного молока или смесь олигосахаридов грудного молока или смесь олигосахаридов грудного молока с функциональными моносахаридами или смесь олигосахаридов грудного молока с другими волокнами, представляет собой детскую питательную смесь, которая удовлетворяет требованиям к составу, изложенным в Регламенте (EU) 2016/127 и/или в Своде федеральных нормативных актов (США), раздел 21 107.100 (требования к питательным веществам). Типичный состав детских питательных смесей указан в Таблицах 2 и 3.
Детская питательная смесь: Обезжиренное молоко
Растительные масла (пальмовое масло, рапсовое
масло, подсолнечное масло)
Олигосахариды грудного молока
LNFPI
Обезжиренное молоко в порошке
Масло Mortierella alpine
Рыбий жир
Карбонат кальция
Хлорид калия
Витамин С
Хлорид натрия
Витамин Е
Ацетат железа
Сульфат цинка
Ниацин
Кальция д-пантотенат
Сульфат меди
Витамин А
Витамин В1
Витамин В6
Сульфат магния
Йодат калия
Фолиевая кислота
Витамин K
Селенит натрия
Витамин D
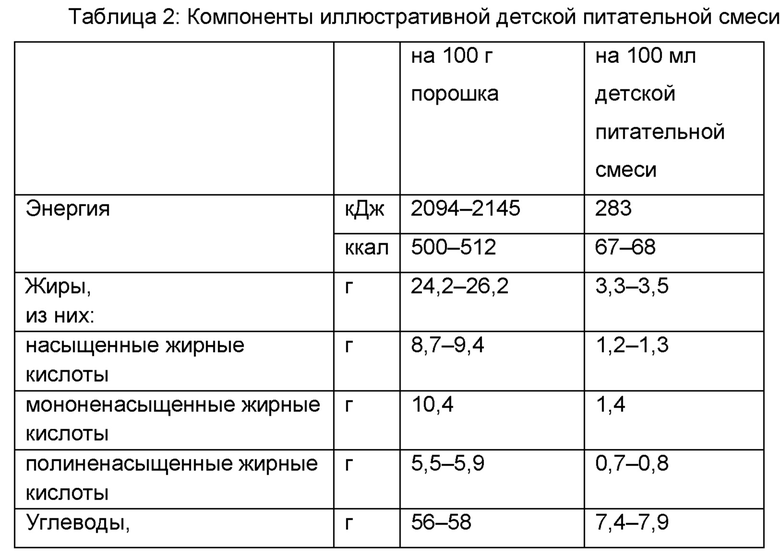
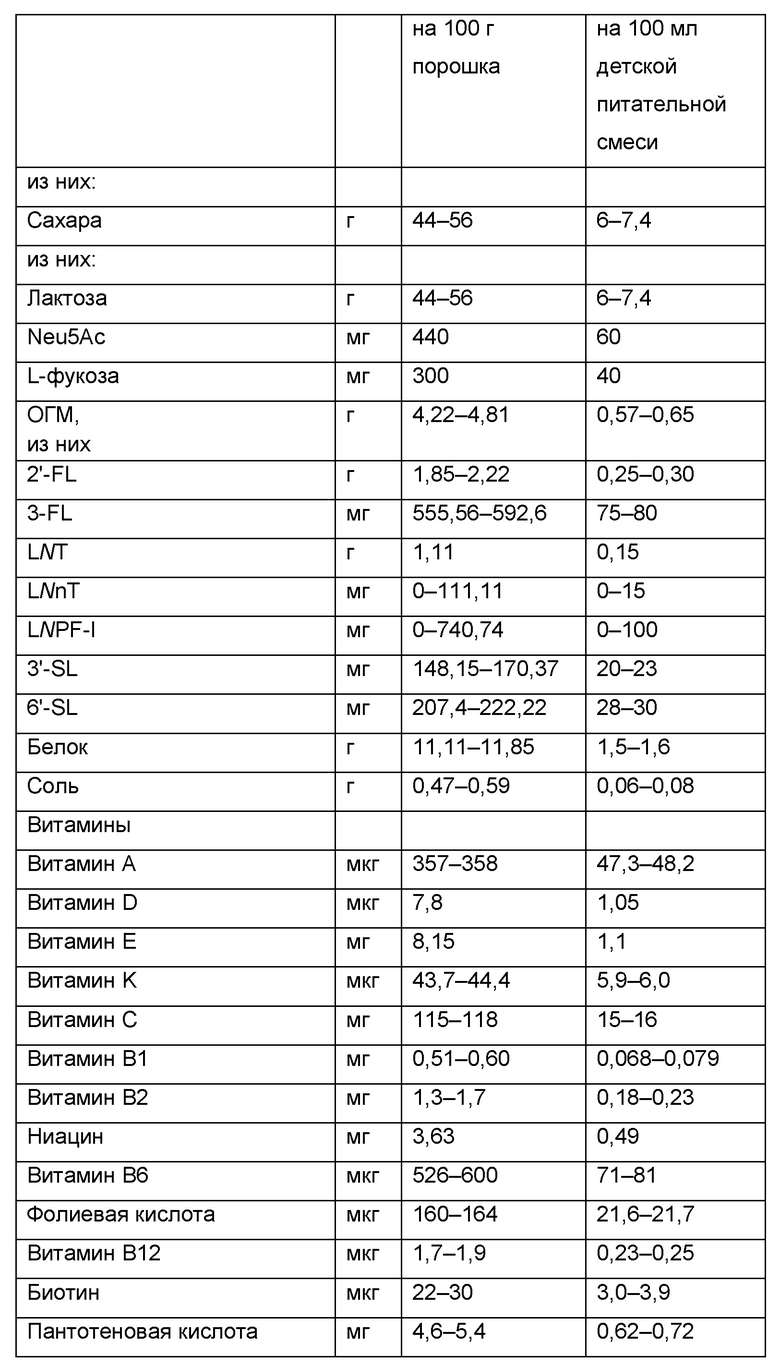
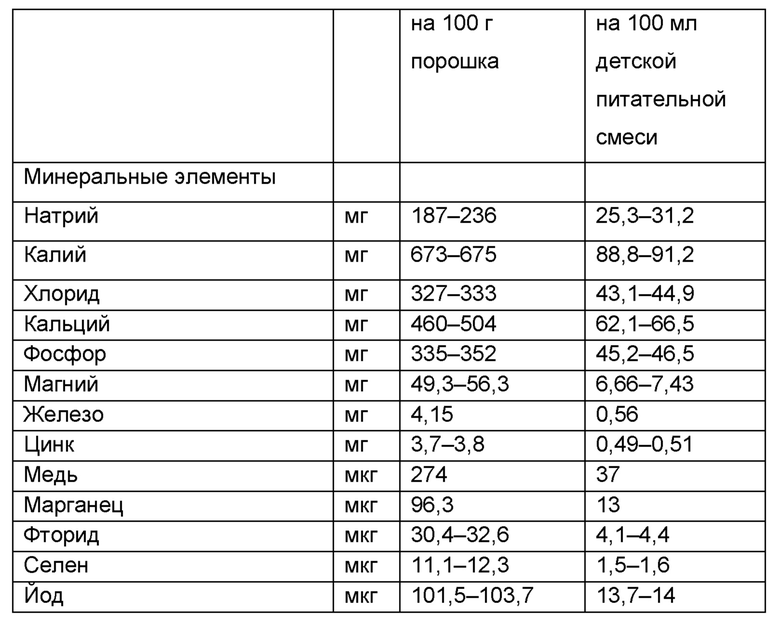
Таблица 3: Состав иллюстративной детской питательной смеси. Конечная концентрация в расчете на препарат 13,5 г порошка в 90 мл воды
В дополнительном и/или альтернативном воплощении питательная композиция также содержит микроорганизмы, предпочтительно пробиотические микроорганизмы. Для применений детского питания предпочтительные микроорганизмы происходят из или могут быть обнаружены в микробиоме здорового человека. Предпочтительно, но без ограничений, микроорганизмы выбраны из видов Bifidobacterium, Lactobacillus, Enterococcus, Streptococcus, Staphylococcus, Peptostreptococcus, Leuconostoc, Clostridium, Eubacterium, Veilonella, Fusobacterium, Bacterioides, Prevotella, Escherichia, Propionibacterium и Saccharomyces. В дополнительном и/или альтернативном воплощении микроорганизм выбран из группы, состоящей из Bifidobacterium adolescentis, В. animalis, В. bifidum, В. breve, В. infantis, В. lactis, В. longum; Enterococcus faecium; Escherichia coli; Klyveromyces marxianus; Lactobacillus acidophilus, L. bulgaricus, L. casei, L. crispatus, L. fermentum, L. gasseri, L. helveticus, Ljohnsonii, L. paracasei, L. plantarum, L. reuteri, L. rhamnosus, L. salivarius, L. sakei; Lactococcus lactis (включая, но не ограничиваясь подвидами lactis, cremoris и diacetylactis); Leuconostoc mesenteroides (включая, но не ограничиваясь подвидом mesenteroides); Pedicoccus acidilactici, P. pentosaceus; Propionibacterium acidipropionici, P. freudenreichii ssp.shermanii; Staphylococcus carnosus и Streptococcus thermophilus.
Помимо комбинации живых организмов питательная композиция может также включать культуры неживых клеток. В области пробиотиков иногда используют культуры убитых клеток (например, тиндализованные бактерии). Данные убитые культуры могут обеспечивать белки, пептиды, олигосахариды, фрагменты наружной клеточной стенки и продукты природного происхождения, приводя к кратковременной стимуляции иммунной системы.
Включение пробиотических микроорганизмов в питательную композицию, особенно в присутствии ОГМ, особенно представляет интерес тем, что оно также стимулирует становление здорового микробиома кишечника.
В дополнительном и/или альтернативном воплощении питательная композиция также включает пребиотики, такие как галакто-олигосахариды (GOS - от англ. galacto-oligosaccharide), фрукто-олигосахариды (FOS - от англ. fructo-oligosaccharide), инулин или их комбинации.
Питательная композиция находится в твердой форме, включая порошки, гранулы, хлопья, пеллеты или их комбинации, но, не ограничиваясь ими.
В дополнительном воплощении питательная композиция выбрана из группы, состоящей из медицинских препаратов, детских питательных смесей, молочных напитков и биологически активных добавок.
В качестве медицинского препарата питательная композиция может быть использована для улучшения когнитивной деятельности, особенно для улучшения внимания, обучаемости и/или памяти.
Настоящее изобретение будет описано в отношении конкретных воплощений и со ссылкой на графические материалы, но данное изобретение не ограничивается ими, а только формулой изобретения. Кроме того, термины первый, второй и тому подобное в описании и в формуле изобретения используются для проведения различия между похожими элементами и не обязательно для описания последовательности, или во времени, или в пространстве, или в расположении или любым другим образом. Следует понимать, что термины, используемые таким образом, являются взаимозаменяемыми в соответствующих обстоятельствах, и что воплощения изобретения, описанные в данном документе, способны действовать в последовательностях, отличных от последовательностей, описанных или проиллюстрированных в данном документе.
Следует отметить, что термин «содержащий», используемый в формуле изобретения, не следует считать ограниченным средствами, перечисленными далее; он не исключает других элементов или стадий. Таким образом, его следует понимать как точно определяющий наличие установленных признаков, целых чисел, стадий или компонентов, на которые ссылаются, но он не исключает наличия или добавления одного или более других признаков, целых чисел, стадий или компонентов или их групп. Таким образом, объем выражения «устройство, содержащее средства А и В», не должен ограничиваться устройствами, состоящими только из компонентов А и В. Это означает, что в отношении настоящего изобретения А и В являются лишь релевантными компонентами данного устройства.
Ссылка на всем протяжении данного описания изобретения на «одно воплощение» или «воплощение» означает, что конкретный признак, структура или характеристика, описанная в связи с воплощением, включена в по меньшей мере одно воплощение настоящего изобретения. Таким образом, появления фраз «в одном воплощении» или «в воплощении» в разных местах на всем протяжении данного описания изобретения не обязательно всегда относятся к одному и тому же воплощению. Кроме того, конкретные признаки, структуры или характеристики могут объединяться любым подходящим образом, как будет очевидно обычному специалисту в данной области на основе данного раскрытия, в одном или более воплощениях.
Аналогично, следует понимать, что в описании иллюстративных воплощений изобретения разные признаки изобретения иногда группируют вместе в одном единственном воплощении, фигуре или их описании в целях упрощения раскрытия и оказания помощи в понимании одного или более разных аспектов изобретения. Данный способ раскрытия не должен восприниматься как свидетельствование о намерении, что заявленное изобретение требует больше признаков, чем явным образом перечислены в каждом пункте. Напротив, о чем свидетельствует нижеприведенная формула изобретения, аспекты изобретения могут требовать меньше чем все признаки любого вышеприведенного раскрытого воплощения. Таким образом, формула изобретения, следующая после подробного описания, тем самым явным образом включена в данное подробное описание, причем каждый пункт формулы изобретения выступает сам по себе в качестве отдельного воплощения данного изобретения.
Кроме того, в то время как некоторые воплощения, описанные в данном документе, включают некоторые, но не другие признаки, включенные в другие воплощения, подразумевается, что комбинации признаков разных воплощений находятся в пределах объема изобретения и образуют разные воплощения, как будет понятно специалистам в данной области. Например, в нижеследующей формуле изобретения любые из заявленных воплощений могут быть использованы в любой комбинации.
Кроме того, некоторые воплощения описаны в данном документе как способ или комбинация элементов способа, который может осуществляться посредством процессора компьютерной системы или посредством других средств осуществления функции. Таким образом, процессор с необходимыми инструкциями для осуществления такого способа или элемента способа образует средство осуществления способа или элемента способа. Кроме того, описанный в данном документе элемент воплощения устройства представляет собой пример средства осуществления функции, выполняемой элементом, с целью осуществления изобретения.
В описании и графических материалах, предложенных в данном документе, изложено множество конкретных подробностей. Однако, понятно, что воплощения изобретения могут быть осуществлены на практике без данных конкретных подробностей. В других примерах хорошо известные способы, структуры и методики не показаны подробно для того, чтобы облегчать понимание данного описания и графических материалов.
Теперь изобретение будет описано посредством подробного описания нескольких воплощений изобретения. Ясно, что другие воплощения изобретения могут быть сконфигурированы в соответствии со знанием специалистов в данной области без отступления от истинной сущности или технической идеи изобретения, причем изобретение ограничивается только терминами прилагаемой формулы изобретения.
Пример 1: Очистка 2'-фукозиллактозы от ферментационного бульона
Получение 2'-фукозиллактозы посредством ферментации с использованием генетически модифицированного штамма Е. coli осуществляли, как описано в европейской патентной заявке №16 196 486.1. 2'-Фукозиллактозу очищали от ферментационного бульона посредством фильтрации, ионообменной хроматографии, нанофильтрации, диафильтрации или электродиализа и обработки углем, как описано в WO 2015/106943 А1. Полученный раствор, содержащий 2'-фукозиллактозу, подвергали распылительной сушке с получением стабильного твердого продукта.
Пример 2: Очистка 3-фукозиллактозы от ферментационного бульона 3-Фукозиллактозу получали посредством ферментации с использованием генетически модифицированного штамма Е. coli, как описано в европейской патентной заявке №16 196 486.1.
Клетки отделяли от культуральной среды посредством ультрафильтрации (отсечение 0,05 мкм) (CUT мембранная технология, Erkrath, Германия) с последующим использованием фильтра с перекрестным потоком с MWCO 150 кДа (Microdyn-Nadir, Wiesbaden, Германия). Ферментационную среду, не содержащую клеток, содержащую примерно 30 г/л 3-фукозиллактозы, пропускали через сильный катионообменник (Lewatit S 2568 (Lanxess, Cologne, Германия) в форме Н+ для удаления положительно заряженных загрязняющих веществ. Затем, в растворе устанавливали рН 7,0, используя гидроксид натрия, и его наносили на анионообменник (Lewatit S6368 A, Lanxess) в форме хлорида. Оба ионообменника использовали в объеме 200 л. После второй фильтрации (150 кДа; Microdyn-Nadir, Wiesbaden, Германия) раствор, не содержащий частиц, концентрировали в 5 раз посредством нанофильтрации, используя мембрану Filmtech NF270 (Dow, Midland, США), и в 2,5 раза посредством упаривания под вакуумом. Концентрированный раствор с проводимостью примерно 15 мСм/см-1 фильтровали (10 кДа; Microdyn-Nadir, Wiesbaden, Германия), очищали посредством активированного угля (CAS:7440-44-0, Carl Roth, Karlsruhe, Германия) и деионизировали посредством электродиализа. Для этого использовали электродиализатор PC-Cell BED 1-3 (PC-Cell, Heusweiler, Германия) с мембранным пакетом PC-Cell Е200, содержащий следующие мембраны: катионообменная мембрана СЕМ:РС SK и анионообменная мембрана AEM:PCAcid60. В качестве электролита в данном способе использовали 0,25 М аминосульфоновую кислоту. Для уменьшения коричневатой окраски, обусловленной реакциями Майяра и альдольными продуктами, происходящими из процесса ферментации, проводили второй раунд ионообменной хроматографии, используя тот же ионообменный материал, как и упомянутый выше, в форме Na+ и СГ, однако в объеме 50 л. После концентрирования раствора Сахаров посредством упаривания, проводимость снова снижалась с 4 мСм/см-1 до 0,4 мСм/см-1 или меньше посредством электродиализа с использованием PC-Cell BED 1-3, упомянутого ранее. Для дополнительного обесцвечивания раствор смешивали с активированным углем (CAS:7440-44-0, Carl Roth, Karlsruhe, Германия), и посредством фильтрации получали почти бесцветный раствор.
Пример 3: Очистка лакто-N-тетраозы от ферментационного бульона Ферментационную продукцию лакто-N-тетраозы проводили, используя штамм генетически модифицированной Е. coli BL21 (DE3) ΔlacZ c интегрированными в геном генами, необходимыми для синтеза in vivo лакто-N-тетраозы, а именно генами N-ацетилглюкозамингликозилтрансферазы (IgtA из Neisseria meningitidis МС58), β-1,3-галактозилтрансфераз (wbdO из Salmonella enterica подвид salamae serovar Greenside), IacY из E.coli K12, УДФ (уридиндифосфат)-глюкозо-4-эпимеразы galE и УТФ (уридинтрифосфат)-глюкозо-1-фосфатуридилтрансферазы galU, оба из E.coli K12. Кроме того, сверхэкспрессировался ген galS, кодирующий глюкозамин-6-фосфат-синтазу. Для ферментационной продукции лакто-N-тетраозы штамм выращивали в определенной среде с минеральными солями, содержащей 2% глюкозу в качестве источника углерода. Антивспенивающий агент добавляли при необходимости. рН контролировали, используя 25%-ый раствор аммония. Лактозу добавляли постепенно до конечной концентрации 15 мМ из 216 г л-1 стока лактозы, концентрация лактозы в культуральной среде оставалась постоянной на протяжении всего процесса ферментации. Остаточная лактоза и лакто-N-триоза II, накопленная на протяжении процесса в качестве побочного продукта, подвергалась гидролизу вторым штаммом Е. coli, который добавляли в ферментер. Данный штамм экспрессировал функциональную бета-лактамазу, бета-N-ацетилгексозаминидазу (bbhl из Bifidobacterium bifidum JCM1254) и функциональный gal-оперон для деградации моносахаридов (ЕР 2 845 905 А).
Клетки отделяли от ферментационного бульона, и жидкость, содержащую лакто-N-тетраозу, очищали до чистоты 75-80%, определяемой по балансу массы, в соответствии со способом, описанным в примере 2.
Загрязняющие углеводные побочные продукты, полученные в результате неэффективной ферментативной деградации и метаболизирования, удаляли посредством хроматографии с использованием хроматографии с псевдодвижущимся слоем (SMB) согласно WO 2015/049331. В качестве альтернативы, лакто-N-тетраозу очищали посредством кристаллизации изопропанолом. Для кристаллизации раствор, содержащий лакто-N-тетраозу, концентрировали посредством упаривания до концентрации 20% и подвергали распылительной сушке. Используя распылительную сушилку NUBILOSA LTC-GMP (NUBILOSA, Konstanz, Германия), раствор пропускали в потоке азота через сопла распылительных сушилок с температурой на входе 130°С, одновременно контролируя, чтобы поток продукта поддерживал температуру на выходе от 67°С до 68°С.
Твердый материал добавляли к смеси изопропанола и воды (3:1 (об./об.)) в соотношении 1 кг порошка в 12 л изопропанола/воды. Суспензию интенсивно перемешивали, затем нерастворимую лакто-N-тетраозу фильтровали и сушили при 40°С. Начиная с 73-89% чистого материала, кристаллизованную лакто-N-тетраозу очищали до примерно 95%, с восстановлением 85%. Сахар растворяли в воде до концентрации 25% и последовательно пропускали через 6 кДа фильтр (модуль ультрафильтрации Pall Microza SIP-2013, Pall Corporation, Dreieich, Германия) и 0,2 мкм стерильный фильтр. Твердый материал получали посредством распылительной сушки стерильного материала в условиях, описанных выше.
Пример 4: Очистка 3'- и 6'-сиалиллактозы от ферментационного бульона
Для продукции 3'-сиалиллактозы и 6'-сиалиллактозы использовали рекомбинантные штаммы Е. coli BL21 (DE3) ΔlacZ. Данные штаммы имели следующие общие генетические модификации: хромосомная конститутивная экспрессия глюкозамин-6-фосфат-синтазы GlmS из Е. coli, N-ацетилглюкозамин-2-эпимеразы Slr1975 из Synechocystis sp., глюкозамин-6-фосфат-N-ацетилтрансферазы Gna1 из Saccharomyces cerevisiae, фосфоенолпируватсинтазы PpsA из Е. coli, N-ацетилнейраминатсинтазы NeuB и синтетазы СМР-сиаловой кислоты NeuA, обе последние из Campylobacter jejuni. Кроме того, гены, кодирующие лактозопермеазу LacY из Е. coli, cscB (сахарозопермеаза), cscK (фруктокиназа), cscA (сахарозогидролаза) и cscR (регулятор транскрипции) из Е. coli W и функциональный gal-оперон, состоящий из генов galE (УДФ-глюкозо-4-эпимераза), galT (галактозо-1-фосфат-уридилтрансфераза), galK (галактокиназа) и galM (галактозо-1-эпимераза) из Е. coli K12, интегрировали в геном штамма BL21 и конститутивно экспрессировали.
Штамм, синтезирующий 3'-сиалиллактозу, несет ген альфа-2,3-сиалилтрансферазы из Vibrio sp.JT-FAJ-16, в то время как штамм, продуцирующий 6'-сиалиллактозу, содержит альфа-2,6-сиалилтрансферазу plsT6 из Photobacterium leiognathi JT-SHIZ-119.
Штаммы, продуцирующие сиалиллактозу, выращивали в определенной среде с минеральными солями, содержащей 2% сахарозы в качестве источника углерода. Подпитку сахарозой (500 г л-1), подаваемую в фазу периодической подпитки, дополняли 8 мМ MgSO4, 0,1 мМ CaCl2, микроэлементами и 5 г л-1 NH4Cl.
Для образования сиалиллактозы использовали подпитку лактозой 216 г л-1. рН контролировали, используя раствор аммония (25% об./об.). Периодическую ферментацию с подпиткой проводили при 30°С при постоянной аэрации и перемешивании. Для удаления остаточной лактозы в конце ферментации в ферментационный чан добавляли β-галактозидазу. Полученные моносахариды метаболизировались производственным штаммом.
Затем, жидкость, не содержащую клеток, деионизировали посредством ионообменной хроматографии. Сначала, катионные загрязняющие вещества удаляли на сильном катионообменнике в объеме 200 л (Lewatit S 2568 (Lanxess, Cologne, Германия) в форме Н+. Используя NaOH, рН полученного раствора устанавливали на уровне 7,0. На второй стадии анионы и нежелательные красители удаляли из раствора, используя сильный анионообменник Lewatit S 6368 S (Lanxess, Cologne, Германия) в форме хлорида. Ионообменник имел объем слоя 200 л. Используя вторую стадию фильтрации на фильтре с перекрестным потоком (отсечение 150 кДа) (Microdyn-Nadir, Wiesbaden, Германия), осадки, возникающие в результате подкисления раствора, удаляли. Для концентрирования сахара раствор нанофильтровали на Dow FILMTECH NF270-4040 (Inaqua, Monchengladbach, Германия) или в качестве альтернативы на мембране Trisep 4040-XN45-TSF (отсечение 0,5 кДа) (Microdyn-Nadir, Wiesbaden, Германия). Используя последнюю, моносахарид N-ацетилглюкозамин, возникающий в результате ферментационного процесса и загрязняющий раствор сиалиллактозы, отделяли от продукта. Концентрированный раствор сиалиллактозы затем обрабатывали активированным углем (CAS:7440-44-0, Carl Roth, Karlsruhe, Германия) для удаления красителей, таких как продукты реакции Майяра и продукты альдольной реакции. Для отделения сиалиллактозы от побочных продуктов, которые возникают в результате процесса ферментации, подобно сиаловой кислоте и N-ацетилглюкозамину, раствор фильтровали на мембране GE4040F30 (GE water & process technologies, Ratingen, Германия) с отсечением 1 кДа, и осуществляли диафильтрацию до проводимости 0,6 - 0,8 мСм/см-1. Разбавленный раствор концентрировали на роторном испарителе до концентрации примерно 300 г/л. При конечном хроматографическом разделении удаляли другие загрязняющие сахара, подобно ди-сиалиллактозе. Для этого, концентрированный раствор наносили на слабую анионообменную смолу в форме ацетата (Amberlite FPA51, Dow Chemical, Michigan, США). В то время как сиалиллактоза редко связывается со смолой, ди-сиалиллактоза адсорбируется. Таким образом, сиалиллактозу элюируют 10 мМ ацетатом аммония, в то время как ди-сиалиллактозу элюируют 1 М ацетатом аммония. Для удаления ацетата аммония сиалиллактозу осаждали 10-кратным избытком этанола. Твердую фракцию фильтровали и сушили.
Продукт приводили к окончательному виду посредством пропускания 20%-ого раствора сиалиллактозы последовательно через фильтр 6 кДа (Pall Microza модуль ультрафильтрации SIP-2013, Pall Corporation, Dreieich, Германия) и 0,2 мкм стерильный фильтр.
Часть раствора подвергали распылительной сушке, используя распылительную сушилку Buchi (Buchi Mini Spray Dryer B-290) (Buchi, Essen, Германия), применяя следующие параметры: температура на входе: 130°С, температура на выходе 67°С-71°С, газовый поток 670 л/ч, аспиратор 100%.
6'-Сиалиллактоза, высушенная посредством распылительной сушки, обладала чистотой 91%, в то время как вещество 3'-сиалиллактоза обладало чистотой 93%.
Пример 5: Получение смесей ОГМ
Смеси ОГМ получали из твердых продуктов. Для этого, осуществляли распылительную сушку отдельных ОГМ, и порошок смешивали. ОГМ-Смесь I содержала 2'-фукозиллактозу и лакто-N-тетраозу в соотношении 70% - 30%; ОГМ-Смесь II содержала 2'-фукозиллактозу (52%), 3-фукозиллактозу (13%), лакто-N-тетраозу (26%), 3'-сиалиллактозу (4%) и 6'-сиалиллактозу (5%). Смешанные порошки растворяли в воде до получения 20%-ого раствора сахара и еще раз подвергали распылительной сушке, используя распылительную сушилку Buchi, как описано в примере 4.
Пример 6: Характеристика олигосахаридов грудного молока, высушенных посредством распылительной сушки
6.1 Дифференциальная сканирующая калориметрия (ДСК) Используя дифференциальную сканирующую калориметрию (ДСК) на Mettler Toledo 821е (Mettler Toledo, Giessen, Германия), определяли тепловые события высушенных посредством распылительной сушки олигосахаридов грудного молока, а именно 3-фукозиллактозы, 6'-сиалиллактозы, 3'-сиалиллактозы, лакто-N-тетраозы, и высушенных посредством распылительной сушки смесей олигосахаридов грудного молока, смеси (ОГМ-Смесь I) 2'-фукозиллактозы/лакто-N-тетраозы и смеси (ОГМ-Смесь II) 2'-фукозиллактозы, 3-фукозиллактозы, лакто-N-тетраозы, 6'-сиалиллактозы, 3'-сиалиллактозы, соответственно.
Mettler Toledo 821е (Mettler Toledo, Giessen, Германия) использовали для определения тепловых событий продуктов, высушенных посредством распылительной сушки (температура стеклования (Tg), другие экзо- и эндотермические события).
Приблизительно 25 мг высушенных распылением олигосахаридов грудного молока анализировали в рифленых Al-тиглях (Mettler Toledo, Giessen, Германия). Образцы охлаждали до 0°С со скоростью 10 K/мин и повторно нагревали до 100°С со скоростью сканирования 10 K/мин. После охлаждения образцов до 0°С во втором цикле нагревания образцы повторно нагревали до 150°С. Среднюю точку эндотермического сдвига исходного уровня во время сканирования нагревания принимали за температуру стеклования (Tg). Об экзотермических и эндотермических пиках сообщается посредством максимальной температуры и нормализованной энергии данного события.
Первое сканирование нагревания во всех образцах демонстрировало главное событие стеклования в общем тепловом потоке, о чем свидетельствует основной ступенчатый переход в диапазоне приблизительно 48-58°С у большинства образцов, причем главное событие стеклования наблюдалось при первом сканировании нагревания, повторно возникало при втором сканировании нагревания. Результаты ДСК-анализов обобщены в таблице 4.
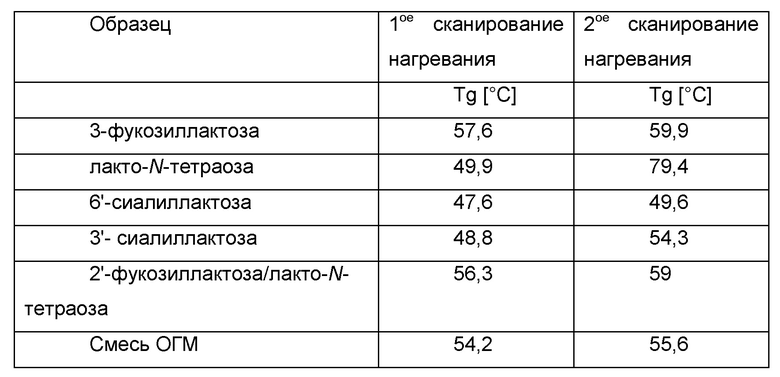
Таблица 4: Тепловые события ОГМ, как определено посредством дифференциальной сканирующей калориметрии
В случае 3-фукозиллактозы выявляли эндотермический релаксационный пик после Tg в первом сканировании нагревания. В случае лакто-N-тетраозы во 2ом сканировании нагревания выявляли гораздо более высокую Tg примерно 79°С, по сравнению с Tg других образцов. Это могло быть вызвано эндотермическим событием во время первого сканирования нагревания при примерно 89°С (-6,04 Дж/г). Как в случае 3-фукозиллактозы, также в случае 6'-сиалиллактозы выявляли эндотермический релаксационный пик после Tg, однако, в данном образце дополнительно происходило эндотермическое событие при 77°С (-0,22 Дж/г). Эндотермических событий не выявляли в случае 3'-сиалиллактозы и ОГМ-Смеси I, в случае ОГМ-Смеси II эндотермическое событие во время 1ого сканирования нагревания имело место при 79°С (0,34 Дж/г).
6.2 Рентгеновская порошковая дифракция (XRD)
Широкоугольную рентгеновскую порошковую дифракцию (XRD - от англ. Х-ray powder diffraction) использовали для исследования морфологии лиофилизированных продуктов. Рентгеновский дифрактометр Empyrean (Panalytical, Almelo, Нидерланды), оснащенный медным анодом (45 кВ, 40 мА, Kα1 испускание при длине волны 0,154 нм), и использовали детектор PIXcel3D. Приблизительно 100 мг образцов, высушенных посредством распылительной сушки, анализировали в режиме «на отражение» в угловом диапазоне от 5 до 45° 2θ, с размером шага 0,04° 2θ и временем счета 100 секунд/шаг.
Все отдельные олигосахариды, а также ОГМ-Смеси I и II демонстрировали полностью аморфное состояние (Фиг. 1 - 6). В случае лакто-N-тетраозы второй (аморфный) сигнал выявляли около 9-10°.
6.3 Лазерная дифракция
Размер частиц порошка оценивали посредством лазерной дифракции. Система выявляет рассеянный и дифрагированный свет посредством целого ряда концентрически расположенных сенсорных элементов. Затем программно реализованный алгоритм аппроксимирует количество частиц посредством расчета z-значений величин интенсивности света, которые поступают на разные сенсорные элементы. Анализ проводили, используя систему количественного определения лазерной дифракции (qLD) калибровочной машины для агрегатов SALD-7500 (Shimadzu Corporation, Kyoto, Япония).
Маленькое количество (на кончике шпателя) каждого образца диспергировали в 2 мл изооктана и гомогенизировали посредством обработки ультразвуком в течение пяти минут. Дисперсию переносили в ячейку периодического действия, наполненную изооктаном, и анализировали в ручном режиме.
Установки получения данных выглядели следующим образом: число усреднений сигнала на измерение: 128, число нарастаний сигнала: 3 и интервал: 2 секунды.
Перед измерением систему гасили изооктаном. Измерение на каждой дисперсии образца проводили 3 раза, и представлены средние значения и стандартное отклонение. Данные оценивали, используя программное обеспечение WING SALD II, версия V3.1. Поскольку показатель преломления образца был неизвестен, показатель преломления частиц сахара (дисахарида) (1,530) использовали для определения профилей распределения частиц по размеру. Представлены значения размера для среднего и медианного диаметра.
Средние размеры частиц для всех образцов были очень похожи, чуть более низкие значения были измерены в случае ОГМ-Смеси II. Размерные характеристики частиц обобщены в Таблице 5. Кроме того, распределение частиц по размерам демонстрировало наличие одной основной размерной совокупности для всех образцов.
Изобретение относится к пищевой промышленности. Предложенная питательная композиция содержит высушенный распылением порошок, содержащий по меньшей мере 80 масс.% одной лакто-N-фукопентаозы, которая была получена посредством микробной ферментации. Причем высушенный распылением порошок содержит 15 масс.% воды или менее. При этом питательная композиция содержит по меньшей мере один дополнительный олигосахарид грудного молока (ОГМ), где указанный по меньшей мере один дополнительный ОГМ представляет собой сиалированный ОГМ. Также предложен способ получения высушенного распылением порошка лакто-N-фукопентаозы для указанной питательной композиции. Способ включает очистку лакто-N-фукопентаозы от ферментационного бульона, предоставление водного раствора, содержащего очищенную от ферментационного бульона лакто-N-фукопентаозу и подвергание указанного раствора распылительной сушке. Изобретение направлено на получение лакто-N-фукопентаозы в твердой форме с одинаковым средним размером частиц. 2 н. и 13 з.п. ф-лы, 3 ил., 5 табл., 6 пр.
1. Питательная композиция, содержащая высушенный распылением порошок, содержащий по меньшей мере 80 масс.% одной лакто-N-фукопентаозы, которая была получена посредством микробной ферментации, где высушенный распылением порошок содержит 15 масс.% воды или менее, и где питательная композиция содержит по меньшей мере один дополнительный олигосахарид грудного молока (ОГМ), где указанный по меньшей мере один дополнительный ОГМ представляет собой сиалированный ОГМ.
2. Питательная композиция по п. 1, дополнительно содержащая по меньшей мере один дополнительный ОГМ, где указанный по меньшей мере один дополнительный ОГМ представляет собой нейтральный ОГМ.
3. Питательная композиция по п. 2, в которой по меньшей мере один нейтральный ОГМ выбран из группы, состоящей из 2'-фукозиллактозы, 3-фукозиллактозы, лакто-N-тетраозы, лакто-N-неотетраозы, лакто-N-фукопентаозы I, лакто-N-фукопентаозы II, лакто-N-фукопентаозы III и лакто-N-фукопентаозы V.
4. Питательная композиция по любому из пп. 1-3, в которой по меньшей мере один сиалированный ОГМ выбран из группы, состоящей из 3'-сиалиллактозы, 6'-сиалиллактозы, сиалиллакто-N-тетраоз LST-a, LST-b, LST-c и дисиалиллакто-N-тетраозы.
5. Питательная композиция по любому из пп. 1-4, где питательная композиция содержит по меньшей мере один пробиотический микроорганизм.
6. Питательная композиция по любому из пп. 1-5, где высушенный распылением порошок содержит по меньшей мере 85 масс.%, по меньшей мере 90 масс.%, по меньшей мере 93 масс.%, по меньшей мере 95 масс.% или по меньшей мере 98 масс.% лакто-N-фукопентаозы.
7. Питательная композиция по любому из пп. 1-6, в которой лакто-N-фукопентаоза находится в аморфной форме.
8. Питательная композиция по любому из пп. 1-7, где высушенный распылением порошок содержит 10 масс.% воды или менее, предпочтительно 7 масс.% воды или менее, более предпочтительно 5 масс.% воды или менее.
9. Питательная композиция по любому из пп. 1-8, где высушенный распылением порошок не содержит генетически модифицированных микроорганизмов и молекул нуклеиновых кислот, происходящих из генетически модифицированных микроорганизмов.
10. Питательная композиция по любому из пп. 1-9, где питательная композиция представляет собой детскую питательную смесь.
11. Способ получения высушенного распылением порошка лакто-N-фукопентаозы для питательной композиции по любому из пп. 1-10, где способ включает следующие стадии:
а) очистка лакто-N-фукопентаозы от ферментационного бульона;
б) предоставление водного раствора, содержащего лакто-N-фукопентаозу стадии а); и
в) подвергание указанного раствора стадии б) распылительной сушке.
12. Способ по п. 11, в котором стадия а) очистки лакто-N-фукопентаозы от ферментационного бульона включает в качестве первой стадии:
i) удаление клеток микробов из ферментационного бульона и/или лизис клеток с получением технологического потока;
и стадия а) дополнительно включает необязательно одну или более из следующих стадий:
ii) подвергание технологического потока по меньшей мере одной ультрафильтрации;
iii) обработка технологического потока по меньшей мере один раз катионообменной смолой и/или по меньшей мере один раз анионообменной смолой;
iv) подвергание технологического потока по меньшей мере одной нанофильтрации и/или диафильтрации;
v) подвергание технологического потока по меньшей мере одному электродиализу;
vi) обработка технологического потока по меньшей мере один раз активированным углем; и/или
vii) подвергание технологического потока по меньшей мере один раз стадии кристаллизации и/или осаждения.
13. Способ по п. 11 или 12, в котором водный раствор содержит лакто-N-фукопентаозу в количестве по меньшей мере 20% масс./об., 30% масс./об., 35% масс./об. и вплоть до 45% масс./об., 50% масс./об., 60% масс./об.
14. Способ по любому из пп. 11-13, в котором водный раствор, содержащий лакто-N-фукопентаозу, подвергают распылительной сушке при температуре сопла по меньшей мере 110°C, предпочтительно по меньшей мере 120°C, более предпочтительно по меньшей мере 125°C, и меньше чем 150°C, предпочтительно меньше чем 140°C и более предпочтительно меньше чем 135°C.
15. Способ по любому из пп. 11-14, в котором водный раствор, содержащий лакто-N-фукопентаозу, подвергают распылительной сушке при температуре на выходе по меньшей мере 60°C, предпочтительно по меньшей мере 65°C, и меньше чем 80°C, предпочтительно меньше чем 70°C.
| WO 2015106943 A1, 23.07.2015 | |||
| WO 2015049331 A1, 09.04.2015 | |||
| WO 2013185780 A1, 19.12.2013 | |||
| WO 2014086373 A1, 12.06.2014 | |||
| ФУКОЗИЛЛАКТОЗА В КАЧЕСТВЕ НЕУСВОЯЕМОГО ОЛИГОСАХАРИДА, ИДЕНТИЧНОГО ГРУДНОМУ МОЛОКУ, С НОВОЙ ФУНКЦИОНАЛЬНОЙ ПОЛЬЗОЙ | 2010 |
|
RU2530641C2 |
Авторы
Даты
2024-02-05—Публикация
2018-12-07—Подача