Настоящее изобретение относится к препаратам на основе олигосахаридов грудного молока. более конкретно, настоящее изобретение относится к твердым препаратам на основе олигосахаридов грудного молока и к способам приготовления указанных твердых препаратов.
Предшествующий уровень техники
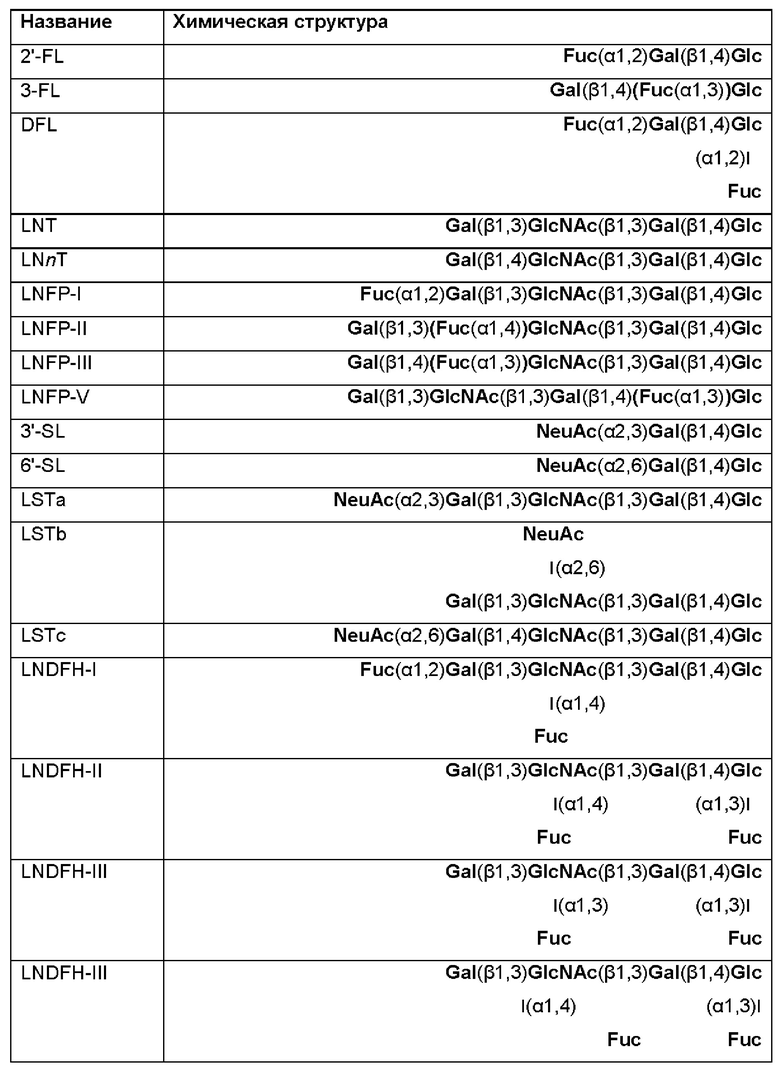
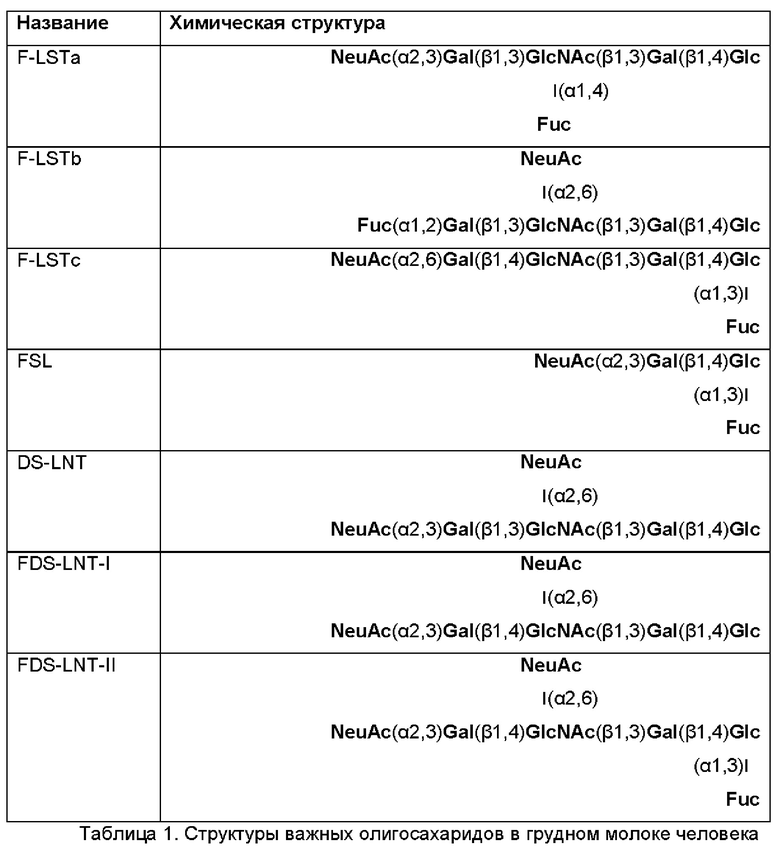
Женское грудное молоко содержит значительные количества углеводов. Углеводы, которые присутствуют в женском грудном молоке, включают моносахариды, такие как L-фукоза и N-ацетилнейраминовая кислота, дисахарид лактозу и олигосахариды, так называемые "олигосахариды грудного молока (НМО)", в концентрации до 20 г/л включительно. НМО представляют собой третий из наиболее преобладающих компонентов женского грудного молока. Предположительно в грудном молоке присутствуют более 150 различающихся по структуре олигосахаридов. Отобранные НМО показаны в Таблице 1. Каждый из примерно 10-13 этих НМО присутствует в грудном молоке в концентрации от нескольких сотен миллиграммов до нескольких граммов на один литр (Thurl et al., (2017), Nutrition Reviews, 75(11), 920-933). Среди HMO известны нейтральные HMO, а также кислые HMO, которые содержат по меньшей мере одну группировку N-ацетилнейраминовой кислоты (NeuAc). Структурная сложность и содержание этих олигосахаридов уникальны для грудного молока человека, и они не были обнаружены в молоке других млекопитающих, таких как, например, дающие молоко домашние животные.
Поскольку в организме человека НМО не перевариваются, исследования физиологической роли этих сахаридов проводятся в течение нескольких десятилетий, более 100 лет назад был открыт пребиотический эффект НМО. При употреблении в пищу НМО способны изменять состав микробиома кишечника человека путем поддержания роста полезных бактерий.
За последние годы были выявлены некоторые функциональные эффекты НМО, в особенности их влияние на развитие новорожденных. Известно, что НМО действуют как ловушки для снижения риска инфекций, вызываемых бактериальными и вирусными патогенами, которые слипаются с человеческими клетками посредством связывания с гликопротеинами на поверхности этих клеток. Кроме того, различные НМО обладают противовоспалительным эффектом и действуют как иммуномодуляторы. Поэтому было высказано предположение, что присутствие НМО снижает риски развития пищевых аллергий. Также интенсивно обсуждается положительное влияние сиалилированных НМО на развитие центральной нервной системы новорожденных (обзор представлен в "Prebiotics and Probiotics in Human Milk, Origins and functions of milk-borne oligosaccharides and bacteria", Academic Press (2017), под редакцией McGuire M., McGuire M. и Bode L).
Чтобы воспользоваться преимуществом благоприятных эффектов НМО, прилагаются усилия по добавлению отдельных НМО в питательную композицию, в частности, в детскую питательную смесь. Однако, лучше было бы добавить в питательные композиции комбинацию различных НМО, поскольку такие композиции больше напоминают природный источник НМО, т.е. грудное молоко человека, и с большей долей вероятности будут оказывать более полезное действие на здоровье и развитие человека, чем композиции, содержащие только один вид НМО.
Дефицит НМО как добавок для питательных композиций привело к разработке методик химического синтеза НМО. Недостатки таких методик химического синтеза приводят к разработке биокаталитических подходов, согласно которым НМО синтезируют in vitro с использованием таких очищенных ферментов, как гликозилтрансферазы. Сегодня отдельные НМО получают в промышленном масштабе, используя культивирование созданных методами генетической инженерии клеток микроорганизмов (WO 2015/150328 А1, WO 2017/043382 А1, WO 2010/070104 А1, WO 2012/097950 А1). Такие НМО синтезируются клетками микроорганизмов, созданными методами генетической инженерии, и их можно извлечь из ферментационного бульона и/или клеточного лизата с получением по существу чистого препарата НМО.
Обычно при извлечении НМО из ферментационного бульона они находятся в жидкости в составе технологического потока, например, в форме водного раствора, который содержит представляющий интерес НМО и который также может содержать нежелательные НМО, являющиеся побочными продуктами, образовавшимися в процессе ферментативного получения желаемого НМО. Наряду с извлечением желаемого НМО, т.е. представляющего интерес НМО, повышаются его концентрация в технологическом потоке и его чистота. Однако водный раствор, содержащий НМО, подвержен бактериальной или грибковой контаминации. Поэтому предпочтительно получать желаемые НМО в виде сухого или твердого продукта, который содержит небольшое количество воды. На/в таком твердом продукте вряд ли возможен рост микробных организмов.
Обычно сахарид получают в твердой форме посредством кристаллизации. Кристаллизация отдельных НМО из водного раствора описана для 3-фукозиллактозы (WO 2014/075680 А), для 2'-фукозиллактозы (WO 2011/150939 А), дифукозиллактозы (DFL) (WO 2016/086947 А), лакто-N-тетраозы (WO 2017/101953 А), лакто-N-неотетраозы (WO 2014/094783 А). Кристаллизация НМО заключается в использовании органических растворителей, таких как спирты, главным образом этанол или метанол, или органических кислот, таких как ледяная уксусная кислота. Однако, использование спиртов, особенно метанола, для кристаллизации НМО в конце процесса извлечения нецелесообразно, если НМО будут использованы для потребления человеком. Помимо этого, органические растворители представляют собой дорогостоящие продукты с точки зрения закупки и утилизации. Кроме того, органические растворители оказывают вредное воздействие на окружающую среду и персонал, работающий с ними. Таким образом, кристаллизация НМО является недостатком при производстве НМО в промышленных масштабах, и ее следует избегать, особенно в конце процесса извлечения желаемого НМО.
Поэтому существует потребность в способах, которые обеспечивают получение смеси НМО, предпочтительно в комбинации по меньшей мере с одним моносахаридом, в твердой форме, причем данный способ применим для получения в промышленном масштабе и не включает использования органического растворителя на конечной стадии очистки одного или нескольких НМО для приготовления твердого препарата указанных НМО.
Эта цель достигнута с использованием способа получения высушенного распылением порошка, содержащего смесь различающихся по структуре НМО.
Краткое описание сущности изобретения
Согласно первому аспекту предложен высушенный распылением порошок, состоящий по существу из смеси или содержащий смесь различающихся по структуре НМО.
Согласно второму аспекту предложен способ получения высушенного распылением порошка, состоящего по существу из смеси или содержащего смесь различающихся по структуре НМО.
Согласно третьему аспекту предложено применение высушенного распылением порошка, состоящего по существу из смеси или содержащего смесь различающихся по структуре НМО, для приготовления питательной композиции.
Согласно четвертому аспекту предложена питательная композиция, содержащая высушенный распылением порошок, который состоит по существу из смеси или содержит смесь различающихся по структуре НМО.
Описание фигур
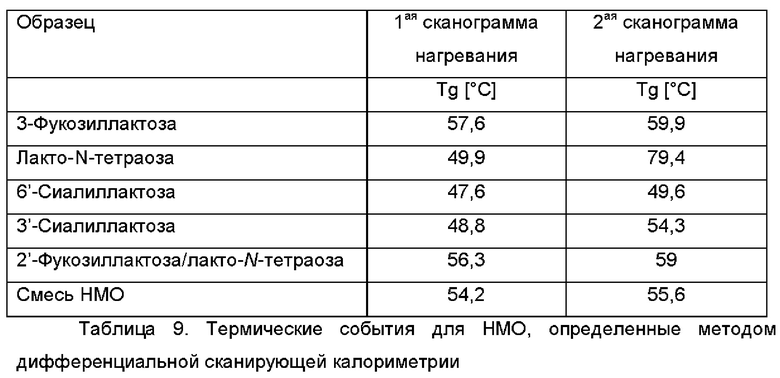
На Фиг. 1 показан график, иллюстрирующий результаты дифракции рентгеновских лучей на порошке для высушенной распылением 3-фукозиллактозы.
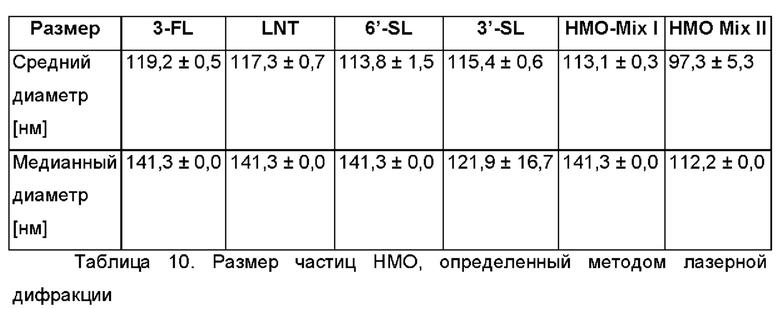
На Фиг. 2 показан график, иллюстрирующий результаты дифракции рентгеновских лучей на порошке для высушенной распылением лакто-N-тетраозы.
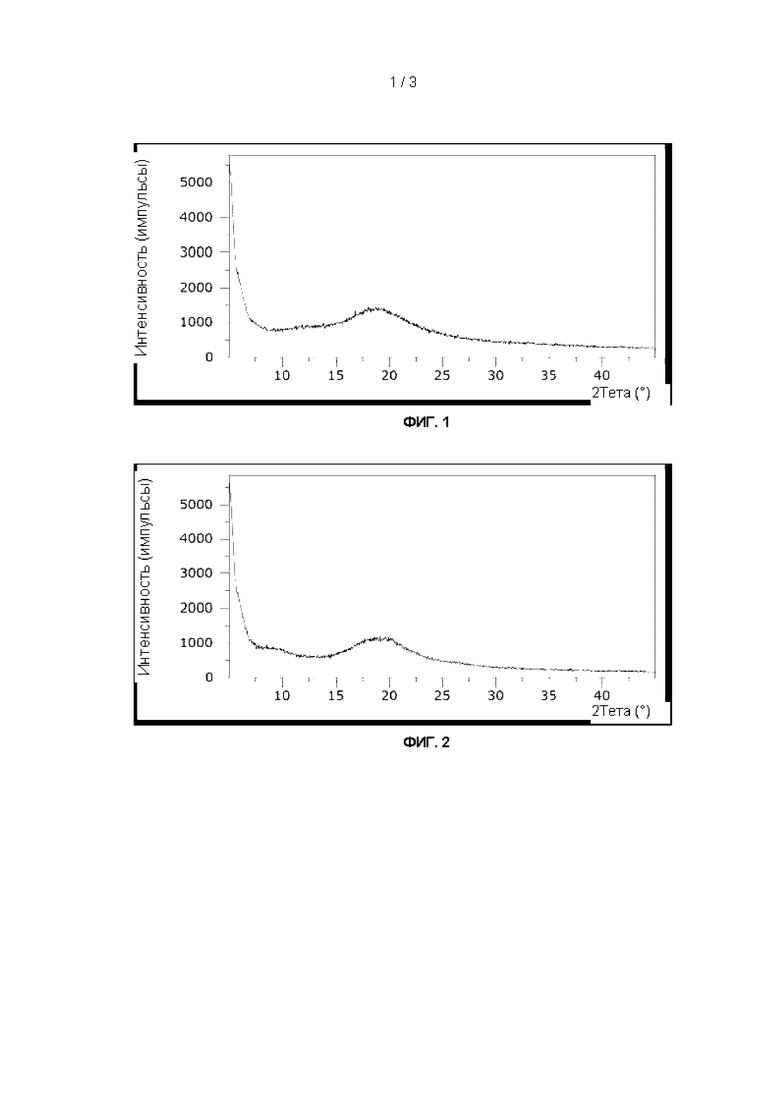
На Фиг. 3 показан график, иллюстрирующий результаты дифракции рентгеновских лучей на порошке для высушенной распылением 6'-сиалиллактозы.
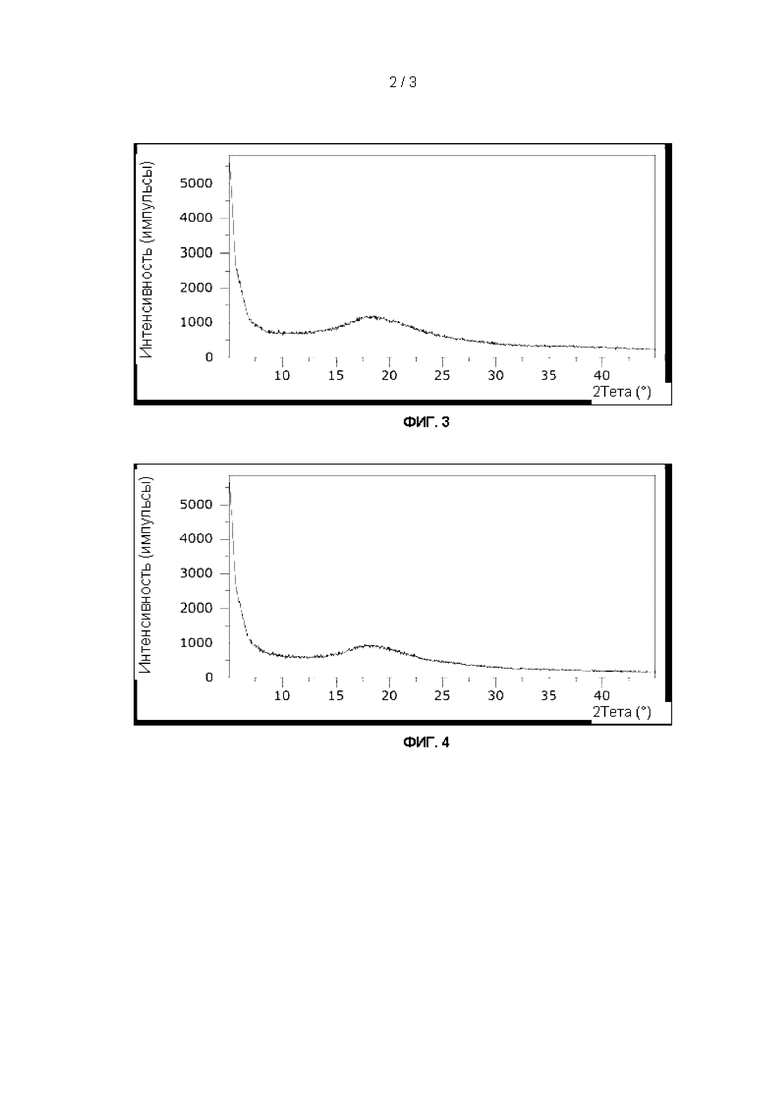
На Фиг. 4 показан график, иллюстрирующий результаты дифракции рентгеновских лучей на порошке для высушенной распылением з3'-сиалиллактозы.
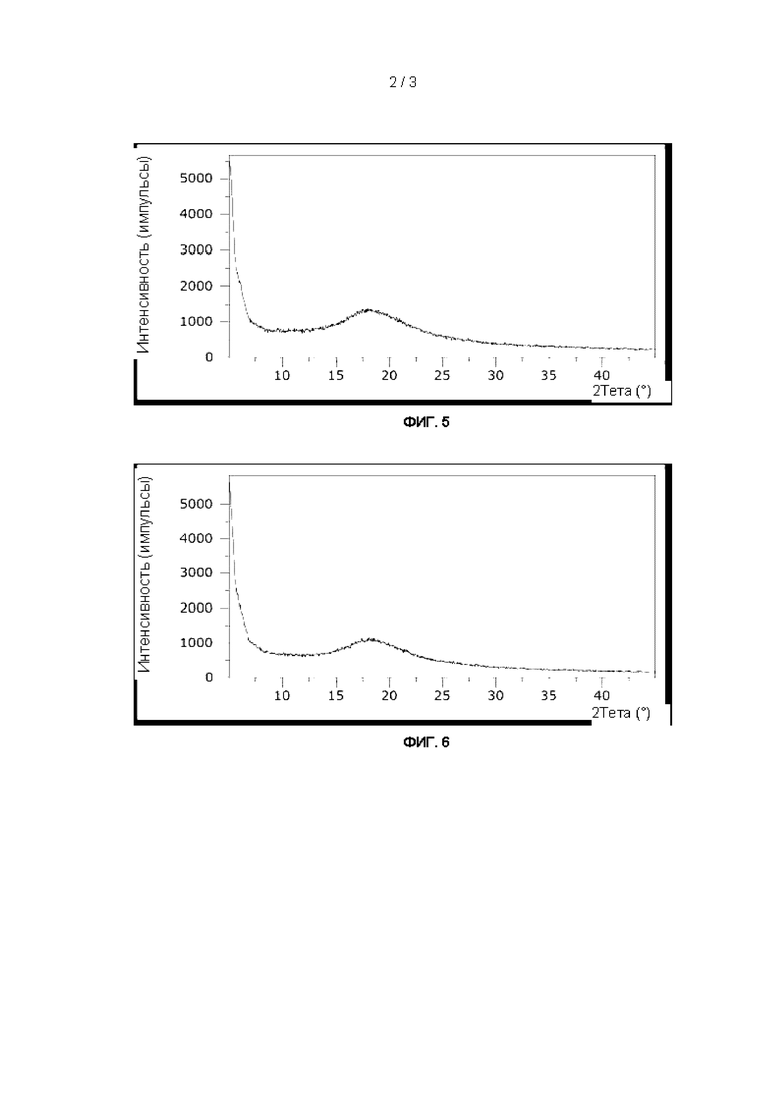
На Фиг. 5 показан график, иллюстрирующий результаты дифракции рентгеновских лучей на порошке для высушенной распылением смеси 2'-фукозиллактозы и лакто-N-тетраозы.
На Фиг. 6 показан график, иллюстрирующий результаты дифракции рентгеновских лучей на порошке для высушенной распылением смеси 2'-фукозиллактозы, 3-фукозиллактозы, лакто-N-тетраозы, 3'-сиалиллактозы и 6'-сиалиллактозы.
Подробное описание
Согласно первому аспекту предложен высушенный распылением порошок, который состоит по существу из смеси или содержит смесь различающихся по структуре НМО.
В одном из воплощений высушенный распылением порошок состоит по существу из смеси различающихся по структуре НМО.
Термин "состоящий по существу из", использованный в данном описании, относится к композициям, состоящим из соединения(ий), приведенного(ых) после указанного термина, и возможно, неизбежных побочных продуктов. Указанные неизбежные побочные продукты включают, например, соединения, которые были образованы в процессе микробиологической ферментации для получения одного или нескольких НМО, а также соединения, которые были введены в технологический поток, из которого извлекают (один или более) НМО, но которые невозможно было оттуда удалить. Термин "состоящий по существу из" применительно к высушенным распылением порошкам включает в себя высушенные распылением порошки, содержащие из расчета на сухое вещество высушенного распылением порошка по меньшей мере 80 масс. %, по меньшей мере 85 масс. %, по меньшей мере 90 масс. %, по меньшей мере 93 масс. %, по меньшей мере 95 масс. % или по меньшей мере 98 масс. % НМО. Термин "состоящий по существу из" также используется в отношении высушенных распылением порошков, технологических потоков и растворов, содержащих НМО.
В дополнительном и/или альтернативном воплощении смесь различающихся по структуре НМО состоит из двух, трех, четырех, пяти, шести, семи или более семи различающихся по структуре НМО. Различающиеся по структуре НМО включают нейтральные НМО и сиалилированные НМО. Так, смесь НМО может содержать по меньшей мере один нейтральный НМО и/или по меньшей мере один кислый НМО.
По меньшей мере один нейтральный НМО можно выбрать из группы, состоящей из 2'-фукозиллактозы (2'-FL), 3-фукозиллактозы (3-FL), лакто-N-тетраозы (LNT), лакто-N-неотетраозы (LNnT) и лакто-N-фукопентаозы I (LNFPI).
По меньшей мере один кислый НМО можно выбрать из группы, состоящей из сиалилированных НМО, предпочтительно из группы, состоящей из 3'-сиалиллактозы (3'-SL), 6'-сиалиллактозы (6'-SL), сиалиллакто-N-тетраозы a (LST-a), сиалиллакто-N-тетраозы b (LST-b), сиалиллакто-N-тетраозы с (LST-c) и дисиалиллакто-N-тетраозы (DSLNT).
Таким образом, различающиеся по структуре НМО для смеси различающихся по структуре НМО могут быть выбраны из группы, состоящей из 2'-FL, 3-FL, LNT, LNnT, LNFPI, 3'-SL, 6'-SL, LST-a, LST-b, LST-c и DSLNT.
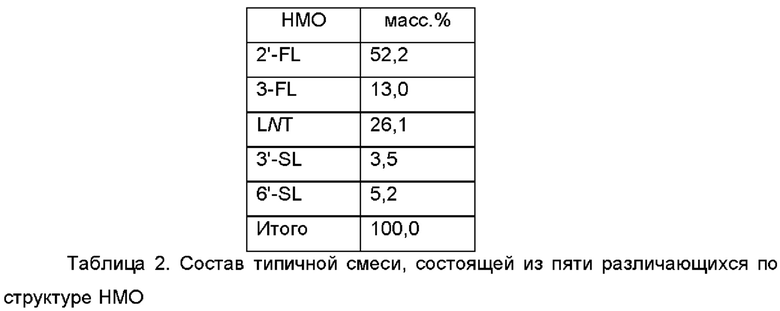
В дополнительном и/или альтернативном воплощении смесь различающихся по структуре НМО содержит пять или состоит по существу из пяти различающихся по структуре НМО. В дополнительном воплощении указанные пять различающихся по структуре НМО представляют собой 2'-FL, 3-FL, LNT, 3'-SL и 6'-SL. В типичной композиции на основе такой смеси эти пять различающихся по структуре НМО присутствуют в смеси различающихся по структуре НМО в количествах, указанных в Таблице 2.
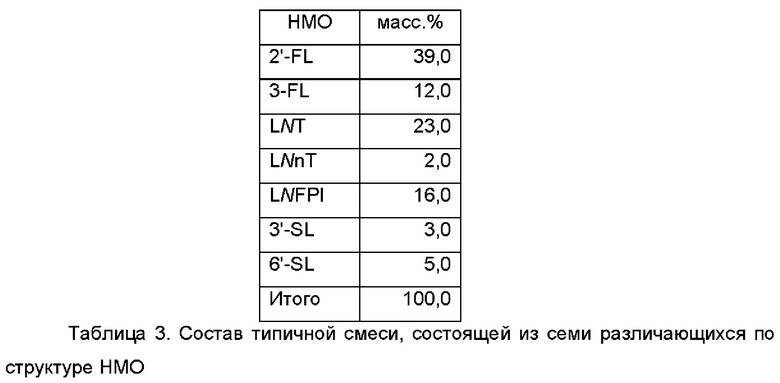
В дополнительном и/или альтернативном воплощении смесь различающихся по структуре НМО содержит семь или состоит по существу из семи различающихся по структуре НМО. В дополнительном воплощении указанные семь различающихся по структуре НМО представляют собой 2'-FL, 3-FL, LNT, LNnT, LNFPI, 3'-SL и 6'-SL. В типичной композиции на основе такой смеси эти семь различающихся по структуре НМО присутствуют в смеси в количествах, указанных в Таблице 3.
В дополнительном и/или альтернативном воплощении высушенный распылением порошок содержит смесь или состоит по существу из смеси различающихся по структуре НМО и по меньшей мере одного моносахарида. Предпочтительно, указанный по меньшей мере один моносахарид выбран из группы, состоящей из L-фукозы и N-ацетилнейраминовой кислоты (NeuAc). В дополнительном и/или альтернативном воплощении высушенный распылением порошок содержит моносахариды L-фукозу и N-ацетилнейраминовую кислоту.
В конкретном воплощении высушенный распылением порошок состоит по существу из таких НМО, как 2'-FL, 3-FL, LNT, LNnT, LNFPI, 3'-SL и 6'-SL, и моносахаридов L-фукозы и N-ацетилнейраминовой кислоты.
В типичной композиции семь различающихся по структуре НМО и два моносахарида присутствуют в количествах, указанных в Таблице 4.
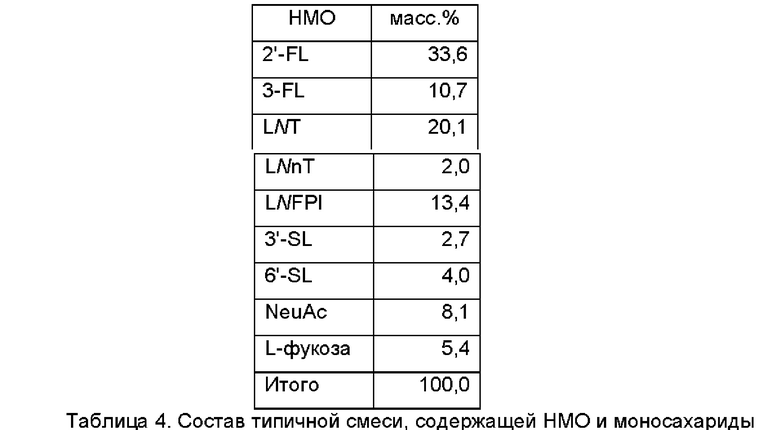
В дополнительном и/или альтернативном воплощении высушенный распылением порошок содержит композицию или состоит по существу из композиции, которая представлена в Таблице 5.
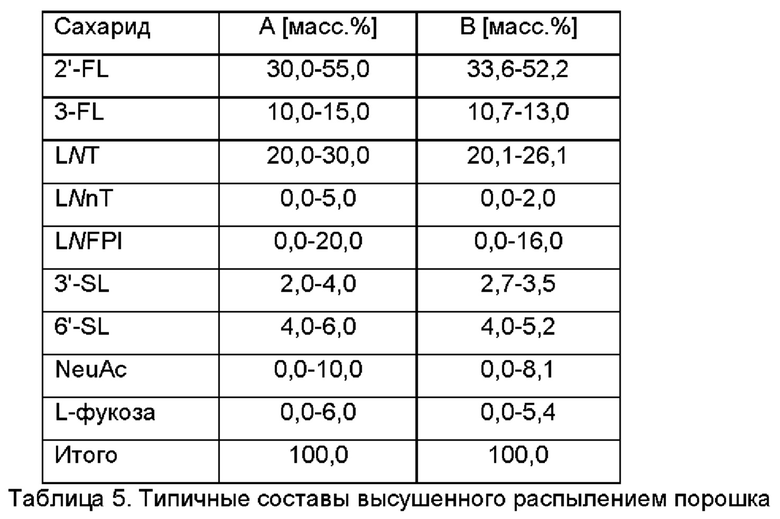
В дополнительном и/или альтернативном воплощении по меньшей мере один из НМО, представленных в смеси различающихся по структуре НМО и/или в высушенном распылением порошке, получен путем микробиологической ферментации. В конкретном воплощении все НМО, представленные в смеси различающихся по структуре НМО и/или в высушенном распылением порошке, получены путем микробиологической ферментации.
В дополнительном и/или альтернативном воплощении, где высушенный распылением порошок содержит по меньшей мере один моносахарид, указанный по меньшей мере один моносахарид получен путем микробиологической ферментации. В другом воплощении, где высушенный распылением порошок содержит L-фукозу и N-ацетилнейраминовую кислоту, оба моносахарида получены путем микробиологической ферментации.
Таким образом, в конкретном воплощении все сахариды, которые присутствуют в высушенном распылением порошке, т.е. НМО или НМО и моносахариды, получены путем микробиологической ферментации.
В дополнительном и/или альтернативном воплощении по меньшей мере один из НМО в высушенном распылением порошке, предпочтительно все НМО в высушенном распылением порошке, присутствуют в аморфной форме. В тех воплощениях, где высушенный распылением порошок содержит L-фукозу и/или N-ацетилнейраминовую кислоту, моносахарид, по меньшей мере один из моносахаридов или оба моносахарида, присутствует/присутствуют в аморфной форме.
В дополнительном и/или альтернативном воплощении высушенный распылением порошок содержит небольшое количество воды. Термин "небольшое количество воды" относится к количеству, составляющему ≤15 масс. % воды, предпочтительно ≤10 масс. % воды, более предпочтительно ≤7 масс. % воды, наиболее предпочтительно ≤5 масс. % воды.
В дополнительном и/или альтернативном воплощении высушенный распылением порошок не содержит созданных методами генетической инженерии микроорганизмов и не содержит молекул нуклеиновой кислоты, происходящих из созданных методами генетической инженерии микроорганизмов.
Высушенный распылением порошок, состоящий по существу из смеси различающихся по структуре НМО, возможно в комбинации по меньшей мере с одним моносахаридом, имеет преимущество перед жидкими композициями в том, что указанный высушенный распылением порошок менее уязвим для микробного загрязнения. Указанный высушенный распылением порошок также имеет преимущество перед порошками с тем же составом ингредиентов, полученными сублимационной сушкой или лиофилизацией, в том смысле, что высушенный распылением порошок менее гигроскопичен и остается текучим намного дольше.
Согласно второму аспекту предложен способ получения высушенного распылением порошка, состоящего по существу из смеси или содержащего смесь различающихся по структуре НМО, где по меньшей мере один из различающихся по структуре НМО, предпочтительно все из различающихся по структуре НМО, получен/получены путем микробиологической ферментации. Данный способ включает стадии:
a) извлечения по меньшей мере одного из различающихся по структуре НМО из ферментационного бульона;
b) предоставления водного раствора по меньшей мере одного НМО со стадии а); и
c) подвергания раствора со стадии b) распылительной сушке.
В дополнительном и/или альтернативном воплощении очистка по меньшей мере одного НМО от ферментационного бульона (стадия а) включает одну или более чем одну из стадий
1) удаления клеток микроорганизмов из ферментационного бульона с получением технологического потока;
2) подвергания технологического потока по меньшей мере одной процедуре ультрафильтрации;
3) обработки технологического потока по меньшей мере один раз с использованием катионообменной смолы и/или по меньшей мере один раз с использованием анионообменной смолы;
4) подвергания технологического потока по меньшей мере одной процедуре нанофильтрации;
5) подвергания технологического потока по меньшей мере одной процедуре электродиализа;
6) обработки технологического потока по меньшей мере один раз активированным углем; и/или
7) подвергания технологического потока по меньшей мере один раз стадии кристаллизации и/или осаждения.
По меньшей мере один НМО или любой из различающихся по структуре НМО в этой смеси может быть получен путем микробиологической ферментации, при этом созданный методами генетической инженерии микроорганизм, способный синтезировать НМО, культивируют в культуральной среде (среде ферментации) и в условиях, которые рекомендованы для синтеза указанного НМО указанным микроорганизмом, созданным методами генетической инженерии. Очистка НМО, который был синтезирован клетками микроорганизма, созданного методами генетической инженерии, включает стадию отделения клеток микроорганизма от ферментационного бульона с получением технологического потока. Технологический поток по существу не содержит клеток и содержит указанный(ые) НМО. Эта стадия является первой стадией способа очистки желаемого НМО.
Подходящие способы отделения клеток микроорганизмов от ферментационного бульона включают центрифугирование, при этом клетки микроорганизмов получают в виде осадка после центрифугирования, а среду ферментации в виде супернатанта. В дополнительном и/или альтернативном воплощении клетки микроорганизмов отделяют от ферментационного бульона посредством фильтрования. Методы фильтрования, подходящие для отделения клеток от ферментационного бульона, включают микрофильтрацию и ультрафильтрацию.
Микрофильтрация как таковая представляет собой способ физического разделения, при котором содержащую частицы жидкость пропускают через мембрану со специальным размером пор для отделения частиц от жидкости. Термин "микрофильтрация", использованный в данном описании, относится к способу физического разделения, при котором клетки удаляют из ферментационного бульона.
Ультрафильтрация представляет собой форму мембранной фильтрации и радикально не отличается от нее. При проведении ультрафильтрации силы, создаваемые градиентами давления и концентрации, приводят к разделению веществ путем пропускания через полупроницаемую мембрану. Клетки, суспендированные твердые вещества и растворенные вещества высокой молекулярной массы удерживаются в так называемом ретентате, в то время как вода и низкомолекулярные растворенные вещества, такие как сиалилированный олигосахарид, проходят через мембрану в пермеат (фильтрат).
Мембраны для ультрафильтрации характеризуются в соответствии с их значением отсечения по молекулярной массе (MWCO) для используемой мембраны. Ультрафильтрацию применяют в режиме с тангенциальным потоком или в тупиковом режиме.
Обычно, клетки микроорганизмов синтезируют НМО внутриклеточно. В зависимости от структуры НМО, НМО либо выделяется в среду ферментации, либо остается внутри клетки микроорганизма. В первом случае полученный таким образом НМО присутствует в среде ферментации по окончании ферментации и может быть извлечен из ферментационного бульона, которая тем самым становится технологическим потоком. В последнем случае для высвобождения НМО клетки микроорганизма, несущие такие НМО, отделяют от ферментационного бульона и подвергают лизису. Таким образом, клеточный лизат содержит НМО и становится технологическим потоком для очистки НМО, как описано в данной заявке далее.
Несмотря на то, что данный способ используется для очистки НМО, которые были получены путем микробиологической ферментации, указанный способ также может быть применен для очистки НМО, которые были получены методом ферментативного катализа in vitro. Тогда НМО может быть очищен из реакционной смеси после проведения биокаталитической реакции. Указанную реакционную смесь подвергают способу очистки в виде технологического потока.
Технологический поток содержит желаемый(ые) НМО, а также побочные продукты и нежелательные примеси, такие как, например, моносахариды, дисахариды, нежелательные побочные продукты олигосахаридной природы, ионы, аминокислоты, полипептиды, белки и/или молекулы нуклеиновых кислот.
В дополнительном и/или альтернативном воплощении способ очистки НМО включает стадию по меньшей мере одной обработки на катионообменнике для удаления положительно заряженных соединений из очищенного технологического потока.
Катионообменные смолы, подходящие для удаления положительно заряженных ионов из очищенного технологического потока, включают Lewatit® S б368 A (Lanxess AG, Cologne, DE) в Н+-форме; Lewatit® S 2568 (H+) (Lanxess AG, Cologne, DE).
В дополнительном и/или альтернативном воплощении способ очистки НМО включает стадию обработки на анионообменнике для удаления нежелательных отрицательно заряженных соединений из очищенного технологического потока.
Подходящие анионообменные смолы включают Lewatit® S 2568 (СГ) (Lanxess AG, Cologne, DE) Lewatit® S 6368 A (Lanxess AG, Cologne, DE), Lewatit® S 4268 (Lanxess AG, Cologne, DE), Lewatit® S 5528 (Lanxess AG, Cologne, DE), Dowex® AG 1x2 (меш 200-400), Dowex® 1x8 (меш 100-200), Purolite® Chromalite® CGA100x4 (Purolite GmbH, Ratingen, DE), Dow® Amberlite™ FPA51 (DowChemicals, MI, США).
В дополнительном и/или альтернативном воплощении способ очистки НМО включает стадию нанофильтрации и/или стадию диафильтрации для удаления примесей, имеющих более низкую молекулярную массу, и для концентрирования желаемого НМО.
Диафильтрация включает добавление к раствору свежей воды с целью удаления (вымывания) проходящих через мембрану компонентов. Диафильтрацию можно использовать для разделения компонентов на основании их молекулярного размера и заряда, применяя соответствующие мембраны, при этом один или более видов компонентов эффективно удерживаются, а другие виды компонентов проходят через мембрану. В частности, для отделения низкомолекулярных соединений, таких как малые молекулы и соли, эффективна диафильтрация с использованием нанофильтрационной мембраны. Нанофильтрационные мембраны обычно имеют значение отсечения по молекулярной массе в диапазоне 150-1000 дальтон. Нанофильтрация широко используется в молочной промышленности для концентрирования и деминерализации молочной сыворотки.
Мембраны, подходящие для нанофильтрации и/или диафильтрации, включают Dow® Filmtec™ NF270-4040, Trisep® 4040-XN45-TSF (Microdyn-Nadir GmbH, Wiesbaden, DE), GE4040F30 и GH4040F50 (GE Water & Process Technologies, Ratingen, DE).
Было обнаружено, что диафильтрация с использованием нанофильтрационных мембран эффективна в качестве стадии предварительной обработки для удаления значительных количеств примесей перед обработкой раствора, содержащего конкретный олигосахарид, электродиализом. Применение нанофильтрационных мембран для концентрирования и диафильтрации в ходе очистки НМО приводит к снижению энергетических затрат и затрат на переработку, а также к улучшению качества продукта благодаря уменьшению теплового воздействия, что обуславливает ослабление реакций Майяра и альдольных реакций.
В дополнительном и/или альтернативном воплощении способ очистки НМО включает по меньшей мере одну стадию электродиализа.
Электродиализ (ED) сочетает в себе диализ и электролиз, и его можно использовать для разделения или концентрирования ионов в растворах на основании их селективной электромиграции через полупроницаемые мембраны.
Основной принцип электродиализа заключается в использовании электролитической ячейки, содержащей пару электродов, погруженных для обеспечения ионной проводимости в электролит и подключенных к источнику постоянного тока. Электрод, соединенный с положительным полюсом источника постоянного тока, представляет собой анод, а электрод, соединенный с отрицательным полюсом, представляет собой катод. Таким образом, раствор электролита поддерживает электрический ток, который обусловлен движением отрицательных и положительных ионов по направлению к аноду и катоду, соответственно. Мембраны, используемые для электродиализа, по существу представляют собой листы из пористых ионообменных смол с отрицательно или положительно заряженными группами и поэтому описываются как катионные или анионные мембраны, соответственно. Ионообменные мембраны обычно изготовлены из полистирола, несущего подходящую функциональную группу (такую как сульфогруппа для катионных мембран или группа четвертичного аммония для анионных мембран), перекрестно сшитого с использованием дивинилбензола. Электролитом может быть, например, хлорид натрия, ацетат натрия, пропионат натрия или сульфаминовая кислота. затем собирают электродиализный пакет таким образом, чтобы анионные и катионные мембраны располагались параллельно как в фильтр-прессе между двумя электродными блоками, с тем, чтобы поток, подвергающийся обеднению ионами, хорошо отделялся от потока, подвергающегося обогащению ионами (эти два раствора также называются разбавленным раствором (раствором, подвергающимся обеднению ионами) и концентратом (раствором, подвергающимся обогащению ионами)). Основой процесса электродиализа является использование пакета мембран, который состоит из нескольких разделенных прокладками анионообменных мембран и катионообменных мембран, установленных между двумя электродами. При подключении источника постоянного электрического тока анионы и катионы будут мигрировать сквозь мембраны по направлению к электродам.
В дополнительном и/или альтернативном воплощении способ очистки НМО дополнительно включает стадию непрерывной хроматографии, такой как хроматография с псевдодвижущимся слоем (SMB).
Хроматография с псевдодвижущимся слоем (SMB) возникла в нефтехимической и горнодобывающей отраслях промышленности. В настоящее время хроматографию с SMB применяют в фармацевтической промышленности для выделения энантиомеров из рацемических смесей. Уже описано крупномасштабное применение хроматографии с SMB для выделения моносахарида фруктозы из фруктозо-глюкозных растворов и для выделения дисахарида сахарозы из сиропов, полученных из сахарной свеклы или сахарного тростника.
В способах хроматографии с SMB, применяемых для разделения сахаридов, используются, например, заряженные кальцием, перекрестно сшитые полистирольные смолы, анионообменные смолы в бисульфитной форме (Bechthold М., et al., Chemie Ingenieur Technik, 2010, 82, 65-75) или полистирольная гелевая сильнокислотная катионообменная смола в водородной форме (Purolite® PCR833H) (Purolite, Bala Cynwyd, США).
Учитывая непрерывный режим работы, рециркуляцию подвижной фазы, а также возможность применения колонок больших размеров, системы для хроматографии с SMB в принципе можно масштабировать для достижения объемов производства в сотни тонн.
Стадия способа с применением хроматографии с псевдодвижущимся слоем имеет преимущество в том, что эта стадия способа позволяет осуществлять дополнительное удаление олигосахаридов, близких по структуре желаемому олигосахариду.
В дополнительном и/или альтернативном воплощении способ очистки по меньшей мере одного НМО включает обработку технологического потока активированным углем для удаления загрязняющих веществ, таких как окрашенные вещества, из технологического потока.
В дополнительном и/или альтернативном воплощении способ очистки по меньшей мере одного НМО включает по меньшей мере одну стадию кристаллизации или осаждения НМО из технологического потока. Кристаллизация или осаждение по меньшей мере одного НМО из технологического потока может быть выполнена путем добавления подходящего количества органического растворителя, который смешивается с водой, к технологическому потоку, содержащему указанный по меньшей мере один НМО. Органический растворитель может быть выбран из группы, состоящей из С1-С6-спиртов и С1-С4-карбоновых кислот. Стадию кристаллизации или осаждения по меньшей мере одного НМО не выполняют на заключительном этапе процесса извлечения, в результате чего оставшиеся количества органического растворителя или карбоновой кислоты можно удалить на последующих стадиях способа.
В дополнительном и/или альтернативном воплощении способ очистки по меньшей мере одного НМО включает стадию стерилизующей фильтрации и/или удаления эндотоксина, предпочтительно фильтрованием технологического потока через фильтр с отсечением 3 кДа или фильтр с отсечением 6 кДа.
В дополнительном и/или альтернативном воплощении способ очистки по меньшей мере одного НМО включает стадию повышения концентрации указанного по меньшей мере одного НМО в технологическом потоке. Концентрацию по меньшей мере одного НМО в технологическом потоке можно повысить, подвергая технологический поток упариванию в вакууме, обратному осмосу или нанофильтрации (например, нанофильтрации с применением нанофильтрационной мембраны, имеющей предел исключения по размеру ≤20 Å). Альтернативно, закристаллизованные или выпавшие в осадок НМО растворяют в воде с получением водного раствора указанного по меньшей мере одного НМО, при этом водный раствор имеет желаемую концентрацию указанного по меньшей мере одного НМО.
В дополнительном и/или альтернативном воплощении полученный в результате технологический поток представляет собой водный раствор, который содержит по меньшей мере один НМО в концентрации ≥20 г/л, ≥25 г/л, ≥30 г/г, ≥40 г/л, ≥60 г/л, ≥100 г/л, ≥200 г/л или даже ≥300 г/л.
В дополнительном и/или альтернативном воплощении водный раствор содержит по меньшей мере один НМО с чистотой по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 93%, по меньшей мере 95% или по меньшей мере 98% из расчета на массу сухого вещества/растворенных веществ в растворе.
Термин "чистота", использованный в данном описании, относится к химической чистоте, т.е. степени, в которой вещество является неразбавленным или несмешанным с посторонними веществами. Таким образом, химическая чистота представляет собой показатель взаимосвязи между по меньшей мере одним НМО и побочными продуктами/примесями. Химическую чистоту выражают в виде процентного содержания (%) и рассчитывают, используя следующую формулу:

Чистота НМО в препарате может быть определена любым подходящим методом, известным специалисту в данной области техники, например, посредством использования высокоэффективной жидкостной хроматографии (HPLC) и расчета отношения площади под пиком(ами), представляющим (им и) количество НМО, к сумме площадей под пиками, представляющими количество НМО и всех соединений, отличающихся от указанного(ых) НМО, на одной и той же хроматограмме.
Водный раствор, содержащий по меньшей мере один НМО, можно хранить в соответствующих условиях, например, указанный водный раствор можно заморозить.
Способ очистки по меньшей мере одного НМО является экономически выгодным и легко масштабируемым, что делает его пригодным в качестве основы для многотоннажного способа производства.
Кроме того, преимущество данного способа очистки по меньшей мере одного НМО заключается в том, что водный раствор не содержит созданных методами генетической инженерии микроорганизмов и молекул нуклеиновых кислот, происходящих из созданных методами генетической инженерии микроорганизмов. Вдобавок, водный раствор не содержит белков. Полное удаление белков устраняет риск вызывания аллергий у потенциального потребителя.
Способ получения высушенного распылением порошка включает стадию предоставления водного раствора, содержащего по меньшей мере один НМО или смесь различающихся по структуре НМО, и, возможно, по меньшей мере одного моносахарида.
В дополнительном и/или альтернативном воплощении по меньшей мере один НМО выбран из группы, состоящей из 2'-FL, 3-FL, LNT, LNnT, LNFPI, 3'-SL, 6'-SL, LST-a, LST-b, LST-c и DSLNT.
В дополнительном и/или альтернативном воплощении смесь различающихся по структуре НМО состоит из пяти различающихся по структуре НМО, предпочтительно из 2'-FL, 3-FL, LNT, 3'-SL и 6'-SL. В другом воплощении смесь различающихся по структуре НМО состоит из семи различающихся по структуре НМО, предпочтительно из 2'-FL, 3-FL, LNT, LNnT, LNFPI, 3'-SL и 6'-SL.
В дополнительном и/или альтернативном воплощении водный раствор дополнительно содержит по меньшей мере один моносахарид, предпочтительно выбранный из группы, состоящей из L-фукозы и N-ацетилнейраминовой кислоты. В другом воплощении водный раствор дополнительно содержит L-фукозу и N-ацетилнейраминовую кислоту.
В дополнительном и/или альтернативном воплощении водный раствор содержит по меньшей мере один НМО или смесь НМО и/или по меньшей мере один моносахарид в количестве, соответствующем общему количеству сахаридов, составляющему по меньшей мере 20% (масс./об.), 30% (масс./об.), 35% (масс./об.) и до 45% (масс./об.), 50% (масс./об.), б0% (масс./об.) включительно.
В дополнительном и/или альтернативном воплощении водный раствор содержит по меньшей мере один НМО или смесь НМО с чистотой по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 93%, по меньшей мере 95% или по меньшей мере 98% из расчета на массу сухого вещества/растворенных веществ в растворе.
В дополнительном и/или альтернативном воплощении водный раствор не содержит созданных методами генетической инженерии микроорганизмов, молекул нуклеиновых кислот, происходящих из созданных методами генетической инженерии микроорганизмов, и белков.
В способе получения высушенного распылением порошка водный раствор, содержащий по меньшей мере один НМО или смесь различающихся по структуре НМО, подвергают распылительной сушке.
Распылительная сушка представляет собой метод получения сухих порошков, где раствор, содержащий представляющее интерес вещество, сначала распыляют до капель, которые быстро сушат горячим воздухом. Распылительная сушка представляет собой очень быстрый процесс, и воздействие на вещество высоких температур в процессе сушки является весьма кратким.
В дополнительном и/или альтернативном воплощении водный раствор, содержащий по меньшей мере один НМО или смесь различающихся по структуре НМО, подвергают сушке распылением при температуре сопла по меньшей мере 110°С, предпочтительно по меньшей мере 120°С, более предпочтительно по меньшей мере 125°С и ниже 150°С, предпочтительно ниже 140°С и более предпочтительно ниже 135°С.
В дополнительном и/или альтернативном воплощении водный раствор, содержащий по меньшей мере один НМО или смесь различающихся по структуре НМО, подвергают сушке распылением при температуре на выходе по меньшей мере 60°С, предпочтительно по меньшей мере 65°С и ниже 80°С, предпочтительно ниже 70°С. В особенно предпочтительном воплощении водный раствор, содержащий (один или более) НМО, подвергают сушке распылением при температуре сопла от примерно 68°С до примерно 70°С.
Очевидно, что каждый вид различающихся по структуре НМО, возможно в комбинации по меньшей мере с одним моносахаридом, может быть очищен и высушен распылением по отдельности, и что полученные в результате высушенные распылением порошки могут быть смешаны в любом желаемом соотношении. В альтернативном воплощении водные растворы содержат все различающиеся по структуре НМО, и полученный в результате водный раствор, содержащий смесь различающихся по структуре НМО в желаемом соотношении, подвергают распылительной сушке.
В дополнительном и/или альтернативном воплощении водный раствор, содержащий по меньшей мере один НМО или смесь различающихся по структуре НМО, дополнительно содержит по меньшей мере один моносахарид, такой как, например, L-фукоза и/или N-ацетилнейраминовая кислота. Водный раствор, содержащий по меньшей мере один НМО или смесь различающихся по структуре НМО и по меньшей мере один моносахарид, затем подвергают распылительной сушке с получением высушенного распылением порошка, состоящего по существу из данного по меньшей мере одного НМО и по меньшей мере одного моносахарида или смеси различающихся по структуре НМО и по меньшей мере одного моносахарида.
Соотношение сахаридов (НМО и моносахаридов)) в полученном высушенном распылением порошке соответствует соотношению этих сахаридов в водном растворе.
Последняя методика имеет то преимущество, что моносахариды, которые не могут быть высушены распылением по отдельности, становятся пригодными для распылительной сушки в присутствии одного или более НМО.
После распылительной сушки водного раствора, содержащего по меньшей мере один НМО или смесь различающихся по структуре НМО, получают порошок с низкой гигроскопичностью, при этом НМО присутствует в аморфной форме, и при этом частицы являются однородными по размеру. Высушенный распылением порошок, состоящий по существу из по меньшей мере одного НМО или смеси различающихся по структуре НМО, менее гигроскопичен, чем порошок идентичного состава, который получали сублимационной сушкой. Таким образом, высушенные распылением порошки, описанные в данной заявке, имеют преимущества в плане их дальнейшего применения и обработки.
Согласно третьему аспекту предложено применение высушенного распылением порошка, состоящего по существу из смеси различающихся по структуре НМО или содержащего смесь различающихся по структуре НМО и по меньшей мере одного моносахарида, предпочтительно L-фукозы и/или N-ацетилнейраминовой кислоты, для приготовления питательной композиции. Высушенный распылением порошок, состоящий по существу из смеси различающихся по структуре НМО и возможно по меньшей мере одного моносахарида, предпочтительно выбранного из группы, состоящей из L-фукозы и N-ацетилнейраминовой кислоты, подходит для потребления человеком и поэтому может быть включен в препараты для потребления человеком, такие как лекарственные композиции, детская питательная смесь, молочные напитки или пищевые добавки.
Согласно четвертому аспекту предложены питательные композиции, содержащие высушенный распылением порошок, описанный в первом аспекте и/или полученный согласно второму аспекту.
В дополнительном и/или альтернативном воплощении питательная композиция включает смесь, состоящую по существу из N-ацетилнейраминовой кислоты (NeuSAc), 2'-FL, 3-FL, INT, LNnT, LNFPI, 3'-SL, 6'-SL и L-фукозы. Композиция, содержащая предпочтительные количества каждого из указанных соединений, приведена в Таблице 6.
Композиция, соответствующая второй колонке в Таблице 6, имеет особое преимущество для использования в качестве добавки к детской питательной смеси, в результате чего конечная детская питательная смесь для непосредственного употребления может содержать соединения в смеси в концентрациях, указанных в третьей колонке Таблицы 6.
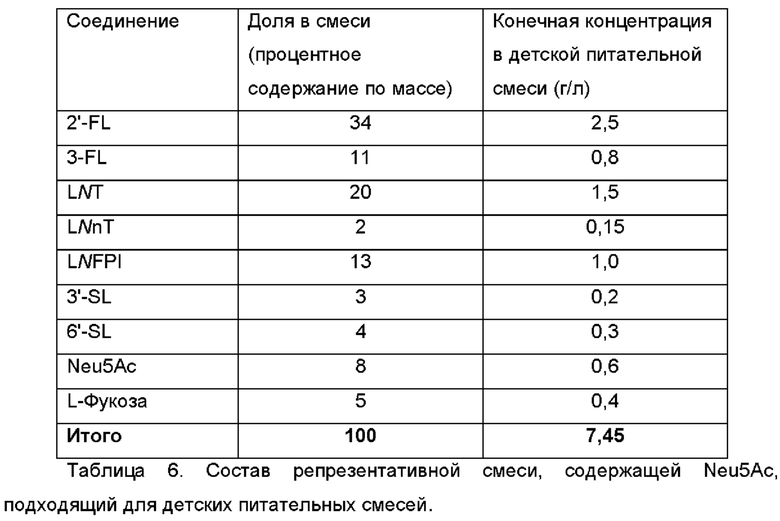
В дополнительном и/или альтернативном воплощении питательная композиция содержит один или более дополнительных ингредиентов. Указанные один или более дополнительных ингредиентов выбраны из группы, состоящей из масла, жира и жирных кислот (например, оливкового масла, подсолнечного масла, кокосового масла, орехового масла, рапсового масла, пальмового масла, льняного масла, рыбьего жира, линоленовой кислоты, соевого масла и т.д.), углеводов (таких как глюкоза, фруктоза, лактоза, мальтодекстрин, крахмал, сахароза, инозит и т.д.), белков (из обезжиренного молока, молочной сыворотки, казеина (полученного от любых домашних молочных животных) или соевых бобов), витаминов (А, В1, В2, В5, В6, В12, С, D, Е, K, биотина, фолиевой кислоты, ниацина, холина), минеральных веществ и микроэлементов (натрия, калия, хлорида, кальция, фосфора, магния, железа, цинка, марганца, фторида, селена, йода, меди).
В предпочтительном воплощении питательная композиция, включающая в себя высушенный распылением порошок, содержащий по существу по меньшей мере один олигосахарид грудного молока, или смесь олигосахаридов грудного молока, или смесь по меньшей мере одного олигосахарида грудного молока по меньшей мере с одним моносахаридом, или смесь различающихся по структуре олигосахаридов грудного молока с другими пищевыми волокнами (fibers) либо состоящий по существу из всего перечисленного выше, представляет собой детскую питательную смесь, которая соответствует требованиям к композициям, изложенным в Делегированном регламенте Комиссии Европейского союза (ЕС) 2016/127 и/или в Своде федеральных регулирующих актов (США), Статья 21, параграф 107.100 (описания питательных веществ). Репрезентативные составы детских питательных смесей указаны в Таблицах 7 и 8.



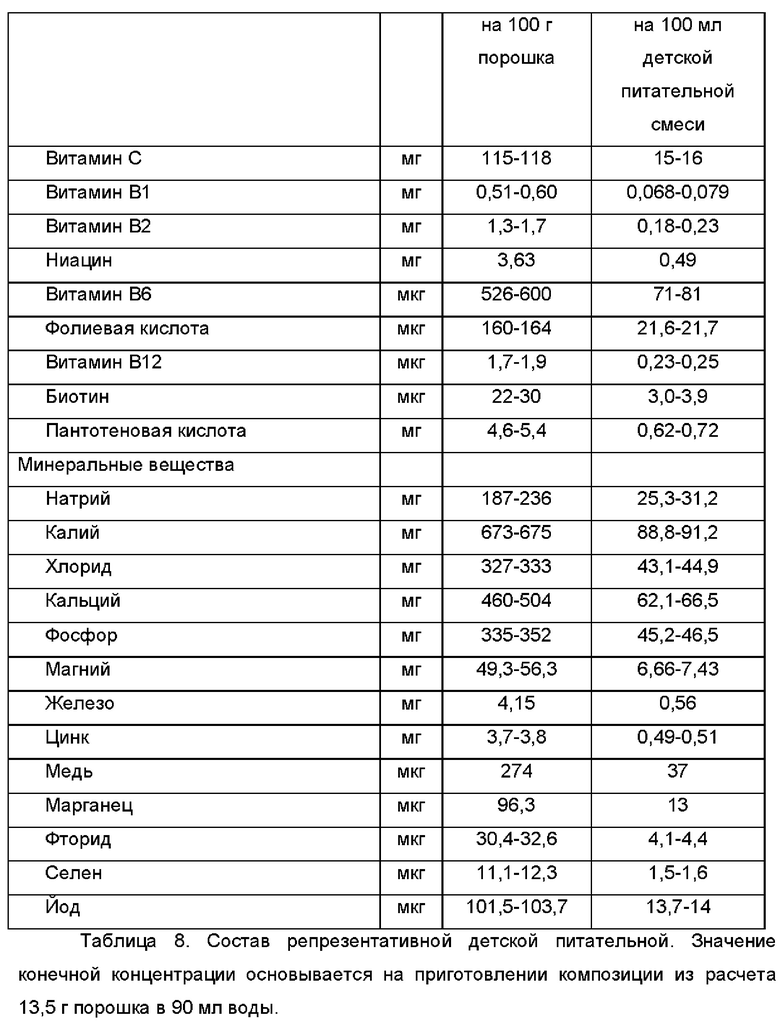
В дополнительном и/или альтернативном воплощении питательная композиция дополнительно содержит микроорганизмы, предпочтительно пробиотические микроорганизмы. В случае использования в детских питательных смесях предпочтительные микроорганизмы происходят из микробиома, или их можно обнаружить в микробиоме здорового человека. Предпочтительно, но не ограничиваясь этим, микроорганизмы выбраны из родов Bifidobacterium, Lactobacillus, Enterococcus, Streptococcus, Staphylococcus, Peptostreptococcus, Leuconostoc, Clostridium, Eubacterium, Veilonella, Fusobacterium, Bacteroides, Prevotella, Escherichia, Proprionibacterium и Saccharomyces. В дополнительном и/или альтернативном воплощении микроорганизм выбран из группы, состоящей из Bifidobacterium adolescentis, В. animalis, В. bifidum, В. breve, В. infantis, В. lactis, В. longum; Enterococcus faecium; Escherichia coil; Klyveromyces marxianus; Lactobacillus acidophilus, L. bulgaricus, L. casei, L. crispatus, L. fermentum, L. gasseri, L. helveticus, L. johnsonii, L. para casei, L. plantarum, L. reuteri, L. rhamnosus, L. salivarius, L. sakei; Lactococcus lactis (включая, но не ограничиваясь, подвидами lactis, cremoris и diacetylactis); Leuconostoc mesenteroides (включая, но не ограничиваясь, подвидами mesenteroides); Pedicoccus acidilactici, P. pentosaceus; Propionibacterium acidipropionici, P. freudenreichii ssp. shermanii; Staphylococcus carnosus; и Streptococcus thermophiius.
Помимо комбинирования с живыми микроорганизмами питательная композиция также может включать в себя культуры мертвых клеток. В области пробиотиков иногда используют культуры убитых клеток (например, подвергнутые тиндализации бактерии). Такие убитые культуры могут обеспечивать наличие белков, пептидов, олигосахаридов, фрагментов наружных клеточных стенок, природных продуктов, которые могут вызывать кратковременную стимуляцию иммунной системы.
Включение пробиотических микроорганизмов в питательную композицию, особенно в присутствии НМО, имеет особое преимущество в том, что облегчается формирование здорового микробиома кишечника.
В дополнительном и/или альтернативном воплощении питательная композиция также включает в себя пребиотики, такие как галакто-олигосахариды (GOS), фрукто-олигосахариды (FOS), инулин или их комбинации.
Питательная композиция может быть представлена в жидкой форме или в твердой форме, включая, но не ограничиваясь этим, порошки, гранулы, хлопья и пеллеты.
В дополнительном воплощении питательная композиция выбрана из группы, состоящей из лекарственных композиций, детских питательных смесей и питательных добавок.
Настоящее изобретение будет описано применительно к конкретным воплощениям и со ссылкой на графические материалы, однако данное изобретение не ограничивается ими, а только формулой изобретения. Кроме того, термины "первый", "второй" и тому подобные в описании и в формуле изобретения используются для различения схожих элементов и необязательно для описания последовательности либо во времени, либо в пространстве, либо при ранжировании, либо для описания любым другим образом. Следует понимать, что используемые таким образом термины являются взаимозаменяемыми при соответствующих обстоятельствах, и что воплощения изобретения, описанные в данной заявке, могут работать в других последовательностях, чем изложено или проиллюстрировано в данном описании.
Нужно отметить, что термин "содержащий", использованный в формуле изобретения, не следует интерпретировать как термин, ограниченный перечисленными ниже средствами; он не исключает другие элементы или стадии. Таким образом, его следует интерпретировать как термин, конкретизирующий наличие указанных признаков, целых чисел, стадий или компонентов, которые упомянуты, но не исключающий наличия или добавления одного или нескольких других признаков, целых чисел, стадий или компонентов либо их групп. Таким образом, объем выражения "устройство, содержащее средства А и В", не следует ограничивать устройствами, состоящими только из компонентов А и В. Применительно к настоящему изобретению это означает, что единственными релевантными компонентами данного устройства являются А и В.
Упоминание по всему этому описанию "одного из воплощений" или "какого-либо воплощения" означает, что по меньшей мере в одно из воплощений настоящего изобретения включены конкретный признак, конкретная структура или конкретное характерное свойство, описанные вместе с данным воплощением. Таким образом, случаи появления в различных местах по всему данному описанию фраз "в одном из воплощений" или "в воплощении" не обязательно всегда относятся к одному и тому же воплощению. Кроме того, конкретные признаки, структуры или характеристики могут быть объединены любым подходящим образом в одном или нескольких воплощениях, что будет очевидно специалисту средней квалификации в данной области техники из этого описания.
Аналогичным образом, должно быть очевидно, что в описании репрезентативных воплощений изобретения различные признаки данного изобретения иногда сгруппированы вместе в одном воплощении, на одном чертеже или его описании с целью оптимизации раскрытия и помощи в понимании одного или более чем одного из различных аспектов изобретения. Этот способ раскрытия не следует интерпретировать как отражение намерения, что заявляемое изобретение требует большего количества признаков, чем явно указанные в каждом пункте формулы изобретения. Скорее, как отражено следующей далее формулой изобретения, аспекты изобретения могут требовать наличия не всех признаков какого-либо описанного выше воплощения. Таким образом, формула изобретения, приведенная после подробного описания, тем самым явно включена в это подробное описание, причем каждый пункт формулы изобретения имеет силу сам по себе в качестве отдельного воплощения данного изобретения.
Кроме того, хотя некоторые воплощения, описанные в данной заявке, включают в себя некоторые, но не другие признаки, включенные в другие воплощения, подразумевается, что комбинации признаков различных воплощений находятся в пределах объема изобретения и образуют различные воплощения, что будет понятно специалистам в данной области техники. Например, в приведенной далее формуле изобретения любое из заявляемых воплощений можно использовать в любой комбинации.
Кроме того, некоторые из воплощений описаны в данной заявке как способ или комбинация элементов способа, который может быть реализован с использованием процессора компьютерной системы или другого средства выполнения данной функции. Таким образом, процессор с необходимыми инструкциями для выполнения такого способа или элемента способа образует средство для осуществления способа или элемента способа. Кроме того, описанный в данной заявке элемент воплощения устройства представляет собой пример средства для осуществления функции, выполняемой этим элементом с целью осуществления изобретения.
В описании и графических материалах, представленных в данной заявке, приведены многочисленные конкретные подробности. Однако очевидно, что воплощения изобретения могут быть осуществлены на практике без этих конкретных подробностей. В других случаях общеизвестные способы, структуры и методы не показаны подробно, чтобы не затруднять понимания описания и графических материалов.
Теперь данное изобретение будет раскрыто посредством подробного описания нескольких воплощений изобретения. Очевидно, что в соответствии со знаниями специалистов в данной области техники могут быть созданы другие воплощения изобретения без отклонения от истинной сущности или технической ценности изобретения, при этом изобретение ограничено только условиями прилагаемой формулы изобретения.
Пример 1. Очистка 2'-фукозиллактозы от ферментационного бульона
Получение 2'-фукозиллактозы посредством ферментации с использованием генетически модифицированного штамма Е. coli осуществляли так, как описано в заявке на европейский патент №16196486.1. 2'-Фукозиллактозу очищали от ферментационного бульона фильтрованием, ионообменной хроматографией, нанофильтрацией, диафильтрацией или электродиализом и с применением обработки активированным углем, как описано в WO 2015/106943 А1. Полученный раствор, содержащий 2'-фукозиллактозу, подвергали распылительной сушке, получая стабильный твердый продукт.
Пример 2. Очистка 3-фукозиллактозы от ферментационного бульона
3-Фукозиллактозу получали посредством ферментации, используя генетически модифицированный штамм Е. coli, как описано в заявке на европейский патент №16196486.1.
Клетки отделяли от культуральной среды путем ультрафильтрации (с отсечением, соответствующим порам с размером 0,05 мкм) (CUT membrane technology, Erkrath, Германия), после чего использовали тангециальный фильтр с MWCO 150 кДа (Microdyn-Nadir, Wiesbaden, Германия). Эту бесклеточную среду ферментации, содержащую з-фукозиллактозу в концентрации примерно 30 г/л, пропускали через сильный катионообменник (Lewatit S 2568 (Lanxess, Cologne, Германия)) в Н+-форме для удаления положительно заряженных загрязняющих веществ. После этого рН раствора устанавливали на значении 7,0, используя гидроксид натрия, и наносили на анионообменник (Lewatit S6368 A, Lanxess) в хлоридной форме. Оба ионообменника использовали в объеме 200 л. После второй фильтрации (150 кДа; Microdyn-Nadir, Wiesbaden, Германия) не содержащий частиц раствор концентрировали в 5 раз посредством нанофильтрации, используя мембрану Filmtech NF270 (Dow, Midland, США), и в 2,5 раза путем упаривания в вакууме. Этот концентрированный раствор с электропроводностью примерно 15 мСм⋅см-1 фильтровали (10 кДа; Microdyn-Nadir, Wiesbaden, Германия), осветляли активированным углем (CAS (Химическая реферативная служба): 7440-44-0, Carl Roth, Karlsruhe, Германия) и деионизировали, применяя электродиализ. Для этого использовали систему для электродиализа PC-Cell BED 1-3 (производства PC-Cell, Heusweiler, Германия) с пакетом мембран PC-Cell Е200, содержащим следующие мембраны: катионообменную мембрану (СЕМ): PC SK и анионообменную мембрану (АЕМ): PCAcid60. В данном способе в качестве электролита использовали 0,25 М сульфаминовую кислоту. Для уменьшения коричневатой окраски, вызванной присутствием продуктов реакций Майяра и альдольных реакций, образующихся в процессе ферментации, проводили второй цикл ионообменной хроматографии с использованием тех же ионообменных носителей, которые упомянуты выше, в Na+- и Cl--форме, но в объеме 50 л. После концентрирования раствора сахара путем упаривания электропроводность снова уменьшали от 4 мСм⋅см-1 до 0,4 мСм⋅см-1 или меньше посредством электродиализа с использованием системы PC-Cell BED 1-3, упомянутой выше. Для дальнейшего обесцвечивания раствор смешивали с активированным углем (CAS: 7440-44-0, Carl Roth, Karlsruhe, Германия) и путем фильтрования получали почти бесцветный раствор.
Пример 3. Очистка лакто-N-тетраозы от ферментационного бульона
Получение лакто-N-тетраозы ферментативным путем проводили, используя генетически модифицированный штамм Е. coli BL21 (DE3) ΔlacZ, содержащий интегрированные в геном гены, исключительно важные для синтеза in vivo лакто-N-тетраозы, а именно, гены N-ацетилглюкозамин-гликозилтрансферазы (IgtA из Neisseria meningitidis МС58), β-1,3-галактозилтрансферазы (wbdO из Salmonella enterica подвида salamae, серологического варианта Greenside), lacY из Е. coli К12, УДФ(уридиндифосфат)-глюкозо-4-эпимеразы galE и УТФ(уридинтрифосфат)-глюкозо-1-фосфат-уридилтрансферазы galU, обе из Е. coli К12. Для получения лакто-N-тетраозы ферментативным путем этот штамм растили на определенной среде с минеральными солями, содержащей: NH4H2PO4 - 7 г⋅л-1; K2HPO4 - 7 г⋅л-1; KОН - 2 г⋅л-1; лимонную кислоту - 0,3 г⋅л-1; NH4Cl - 5 г⋅л-1; 0,1 мМ CaCl2; 8 мМ MgSO4, микроэлементы (нитрилотриуксусную кислоту - 0,101 г⋅л-1, рН 6,5; лимоннокислое аммиачное трехвалентное железо - 0,056 г⋅л-1; MnCl2 × 4H2O - 0,01 г⋅л-1; CoCl2 × 6H2O - 0,002 г⋅л-1; CuCl2 × 2H2O - 0,001 г⋅л-1; борную кислоту - 0,002 г⋅л-1; ZnSO4 × 7H2O - 0,009 г⋅л-1; Na2MoO4 × 2H2O - 0,001 г⋅л-1; Na2SeO3 - 0,002 г⋅л-1; NiSO4 × 6H2O - 0,002 г⋅л-1) и 2% глюкозы в качестве источника углерода. При необходимости добавляли противовспенивающий агент (Struktol J673, Schill + Seilacher). Значение рН регулировали путем использования 25%-ного раствора аммиака. Лактозу добавляли пошагово до конечной концентрации 15 мМ, используя концентрированный раствор лактозы 216 г⋅л-1, концентрацию лактозы в культуральной среде поддерживали постоянной на протяжении всего процесса ферментации. Оставшуюся лактозу и лакто-N-триозу II, накапливающуюся в ходе процесса ферментации в качестве побочного продукта, подвергали гидролизу под действием второго штамма Е. coli, который добавляли в ферментер. Этот штамм экспрессировал функциональную бета-лактамазу, бета-N-ацетилгексозаминидазу (bbhl из Bifidobacterium bifidum JCM1254) и функциональный gal-оперон для расщепления моносахаридов (ЕР 2845905 А).
Клетки отделяли от ферментационного бульона и жидкость, содержащую лакто-N-тетраозу, очищали до чистоты 75-80%, определенной из условий материального баланса, согласно методике, описанной в примере 2.
Примесные углеводные побочные продукты, образующиеся в результате неэффективного ферментативного расщепления и метаболизирования, удаляли посредством хроматографии с применением хроматографии с псевдодвижущимся слоем (SMB) в соответствии с WO 2015/049331. Альтернативно, лакто-N-тетраозу очищали кристаллизацией с использованием изопропанола. Для кристаллизации содержащий лакто-N-тетраозу раствор концентрировали путем упаривания до концентрации 20% и подвергали сушке распылением. Используя распылительную сушилку NUBILOSA LTC-GMP (NUBILOSA, Konstanz, Германия), этот раствор пропускали в токе азота через сопла распылительной сушилки с температурой на входе 130°С с одновременным регулированием потока продукта, поддерживая температуру на выходе от 67°С до 68°С.
Твердое вещество добавляли к смеси изопропанола и воды (3:1 (об./об.)) в соотношении 1 кг порошка в 12 л смеси изопропанол/вода. Суспензию энергично перемешивали, затем нерастворенную лакто-N-тетраозу отфильтровывали и сушили при 40°С. После очистки кристаллизацией, исходя из вещества с чистотой 73-89%, чистота лакто-N-тетраозы составляла примерно 95%, при этом степень извлечения составляла 85%. Сахар растворяли в воде до концентрации 25% и последовательно пропускали через фильтр с отсечением б кДа (ультрафильтрационный модуль SIP-2013 Pall Microza, Pall Corporation, Dreieich, Германия) и стерилизующий фильтр с диаметром пор 0,2 мкм. Путем распылительной сушки стерильного вещества в условиях, описанных выше, получали твердое вещество.
Пример 4. Очистка 3'- и 6'-сиалиллактозы от ферментационного бульона
Для получения 3'- и 6'-сиалиллактозы использовали рекомбинантные штаммы Е. coli BL21 (DE3) ΔlacZ. Эти штаммы имели общие генетические модификации: хромосомную конститутивную экспрессию глюкозамин-6-фосфат-синтазы GlmS из Е. coli, N-ацетилглюкозамин-2-эпимеразы Slr1975 из Synechocystis sp., глюкозамин-6-фосфат-N-ацетилтрансферазы Gna1 из Saccharomyces cerevisiae, фосфоенолпируват-синтазы PpsA из Е. coli, N-ацетилнейраминат-синтазы NeuB и синтетазы CMP (цитидин-монофосфо)-сиаловых кислот NeuA, обе последние из Campylobacter jejuni. Кроме того, в геном штамма BL21 интегрировали и конститутивно экспрессировали гены, кодирующие пермеазу лактозы LacY из Е. coli, cscB (пермеазу сахарозы), cscK (фруктокиназу), cscA (гидролазу сахарозы) и cscR (регулятор транскрипции) из Е. coli W, и функциональный gal-оперон, состоящий из генов galE (УДФ-глюкозо-4-эпимеразы), galT (галактозо-1-фосфат-уридилилтрансферазы), galK (галактокиназы) и galM (галактозо-1-эпимеразы) из Е. coli K12.
Штамм, синтезирующий 3'-сиалиллактозу, несет ген 3'-сиалилтрансферазы из Vibrio sp. JT-FAJ-16, тогда как 6'-сиалиллактоза-продуцирующий штамм содержит ген альфа-2,6-сиалилтрансферазы plsT6 из Photobacterium leiognathi JT-SHIZ-119.
Сиалиллактоза-продуцирующие штаммы растили на определенной среде с минеральными солями, содержащей: NH4H2PO4 - 7 г⋅л-1; K2HPO4 - 7 г⋅л-1; KОН - 2 г⋅л-1; лимонную кислоту - 0,3; NH4Cl - 5 г⋅л-1; противовспенивающий агент (Struktol J673, Schill + Seilacher) - 1 мл⋅л-1; 0,1 мМ CaCl2; 8 мМ MgSO4, микроэлементы и 2% сахарозы в качестве источника углерода. Подпитку сахарозой (500 г⋅л-1), подаваемой в режиме подпитки, дополняли 8 мМ MgSO4, 0,1 мМ CaCl2, микроэлементами и NH4Cl (5 г⋅л-1).
В состав микроэлементов входили: нитрилотриуксусная кислота - 0,101 г⋅л-1, рН 6,5; лимоннокислое аммиачное трехвалентное железо - 0,056 г⋅л-1; MnCl2 × 4H2O - 0,01 г⋅л-1; CoCl2 × 6Н20 - 0,002 г⋅л-1; CuCl2 × 2H2O - 0,001 г⋅л-1; борная кислота - 0,002 г⋅л-1; ZnSO4 × 7H2O - 0,009; Na2MoO4 × 2H2O - 0,001 г⋅л-1; Na2SeO3 - 0,002 г⋅л-1; NiSO4 × 6H2O - 0,002 г⋅л-1.
Для образования сиалиллактозы применяли подпитку лактозой в концентрации 216 г⋅л-1. значение рН регулировали путем использования раствора аммиака (25%-ного, об./об.). Ферментацию с подпиткой проводили при 30°С при постоянном аэрировании и перемешивании. Чтобы удалить оставшуюся лактозу после проведения ферментации, в сосуд для ферментации добавляли β-галактозидазу. Полученные моносахариды подвергали метаболизму штаммом-продуцентом.
Не содержащую клеток жидкость затем деионизировали, применяя ионообменную хроматографию. Сначала на сильном катионообменнике объемом 200 л (Lewatit® S 2568 (Lanxess, Cologne, Германия) в Н+-форме) удаляли катионные примеси. Используя NaOH, рН полученного раствора устанавливали на значении 7,0. На второй стадии, используя сильный анионообменник Lewatit® S 6368 S (Lanxess, Cologne, Германия) в хлоридной форме, из раствора удаляли анионы и нежелательные окрашенные вещества. Ионообменник имел объем слоя 200 л. Применяя вторую стадию фильтрации с использованием тангециального фильтра (с отсечением 150 кДа) (Microdyn-Nadir, Wiesbaden, Германия), удаляли осадки, образующиеся в результате подкисления раствора. Для концентрирования раствора сахара проводили нанофильтрацию раствора на Dow FILMTECH NF270-4040 (Inaqua, Mönchengladbach, Германия) или, альтернативно, на мембране Trisep 4040-XN45-TSF (с отсечением 0,5 кДа) (Microdyn-Nadir, Wiesbaden, Германия). С использованием последней от продукта отделяли моносахарид N-ацетилглюкозамин, образующийся в ходе процесса ферментации и загрязняющий раствор сиалиллактозы. затем концентрированный раствор сиалиллактозы обрабатывали активированным углем (CAS: 7440-44-0, Carl Roth, Karlsruhe, Германия) для удаления окрашенных веществ, таких как продукты реакций Майяра и продукты альдольных реакций. Для отделения сиалиллактозы от побочных продуктов, которые образуются в ходе процесса ферментации, подобных сиаловой кислоте и N-ацетилглюкозамину, раствор фильтровали с использованием мембраны GE4040F30 с отсечением 1 кДа (GE water & process technologies, Ratingen, Германия) и подвергали диафильтрации до достижения электропроводности 0,6-0,8 мСм⋅см-1. Разбавленный раствор концентрировали на роторном испарителе до концентрации примерно 300 г⋅л-1. При проведении конечного хроматографического разделения удаляли другие примесные сахара, такие как ди-сиалиллактоза. Для этого концентрированный раствор наносили на слабую анионообменную смолу в ацетатной форме (Amberlite FPA51, Dow Chemical, Michigan, США). Хотя сиалиллактоза плохо связывается с этой смолой, ди-сиалиллактоза адсорбируется. Так, сиалиллактоза элюируется 10 мМ раствором ацетата аммония, в то время как ди-сиалиллактоза элюируется 1 М раствором ацетата аммония. Для удаления ацетата аммония сиалиллактозу осаждали этанолом в 10-кратном избытке. Твердую фракцию фильтровали и сушили.
Окончательно продукт получали путем последовательного пропускания 20%-ного раствора сиалиллактозы через фильтр с отсечением 6 кДа (ультрафильтрационный модуль SIP-2013 Pall Microza, Pall Corporation, Dreieich, Германия) и стерилизующий фильтр с диаметром пор 0,2 мкм.
Часть раствора сушили распылением, используя распылительную сушилку от Büchi (распылительную минисушилку В-290 от Büchi) (Büchi, Essen, Германия), применяя следующие параметры: температура на входе: 130°С, температура на выходе 67°С-71°С, скорость потока газа 670 л/ч, вытяжной вентилятор 100%.
Высушенная распылением 6'-сиалиллактоза имела чистоту 91%, в то время как вещество 3'-сиалиллактоза имело чистоту 93%.
Пример 5. Приготовление смесей НМО
Смеси разных НМО готовили из твердых продуктов. Поэтому отдельные НМО подвергали сушке распылением и полученные порошки смешивали. Смесь HMO-Mix I содержала 2'-фукозиллактозу и лакто-N-тетраозу в соотношении от 70 масс. % до 30 масс. %; смесь HMO-Mix II содержала 2'-фукозиллактозу (52 масс. %), 3-фукозиллактозу (13 масс. %), лакто-N-тетраозу (26 масс. %), 3'-сиалиллактозу (4 масс. %) и 6'-сиалиллактозу (5 масс. %). Смеси порошков растворяли в воде, получая раствор, содержащий 20 масс. % НМО, и полученный раствор снова сушили распылением, используя распылительную сушилку от Büchi, как описано в примере 4.
Анализ полученного в результате высушенного распылением порошка выявил, что его состав в плане соотношения разных НМО был таким же, как и в подвергнутом распылительной сушке растворе.
Пример 6. Приготовление смесей сахаридов
В 50 мл дистиллированной воды растворяли 8 г 2'-FL и 1 г L-фукозы. Полученный раствор сушили распылением, используя распылительную сушилку от Büchi, как описано в примере 4. Получали высушенный распылением порошок, который состоял по существу из 2'-FL и L-фукозы, причем соотношение 2'-FL и L-фукозы в высушенном распылением порошке было идентично соотношению 2'-FL и L-фукозы в растворе, который подвергали распылительной сушке. Таким образом, L-фукозу можно сушить распылением в присутствии НМО.
Пример 7. Характеристика высушенных распылением олигосахаридов грудного молока
1. Дифференциальная сканирующая калориметрия (DSC)
Используя дифференциальную сканирующую калориметрию (DSC) на приборе 821 е от Mettler Toledo (Mettler Toledo, Giessen, Германия), определяли термические события для высушенных распылением олигосахаридов грудного молока, а именно, 3-фукозиллактозы, 6'-сиалиллактозы, 3'-сиалиллактозы, лакто-N-тетраозы, и для высушенных распылением смесей олигосахаридов грудного молока, смеси (HMO-Mix I) 2'-фукозиллактозы/лакто-N-тетраозы и смеси (НМО Mix II) 2'-фукозиллактозы, 3-фукозиллактозы, лакто-N-тетраозы, 6'-сиалиллактозы, 3'-сиалиллактозы, соответственно.
Чтобы определить термические события для высушенных распылением продуктов (температуру стеклования (Tg), другие экзо- и эндотермические события), использовали прибор 821е от Mettler Toledo (Mettler Toledo, Giessen, Германия).
Приблизительно по 25 мг высушенных распылением олигосахаридов грудного молока анализировали в гофрированных алюминиевых тиглях (Mettler Toledo, Giessen, Германия). Образцы охлаждали до 0°С со скоростью 10 K/мин и повторно нагревали до 100°С со скоростью сканирования 10 K/мин. После охлаждения образцов до 0°С во втором цикле нагревания образцы повторно нагревали до 150°С. Среднюю точку эндотермического сдвига базовой линии на сканограмме нагревания принимали за температуру стеклования (Tg). Экзотермические и эндотермические пики приведены с использованием значения соответствующей пикам температуры и нормированной энергии события.
Первая сканограмма нагревания для всех образцов показала главное событие - стеклование в общем тепловом потоке, о чем свидетельствует основной ступенчатый переход в диапазоне приблизительно 48-58°С для большинства образцов; это главное событие - стеклование, наблюдаемое на первой сканограмме нагревания, повторилось на второй сканограмме нагревания. Результаты анализов с использованием DSC суммированы в Таблице 9.
В случае 3-фукозиллактозы обнаруживали пик эндотермической релаксации после Tg на первой сканограмме нагревания. В случае лакто-N-тетраозы на 2ой сканограмме нагревания обнаруживали гораздо более высокое значение Tg, составляющее примерно 79°С, по сравнению с таковым для других образцов. Это может быть вызвано эндотермическим событием при примерно 89°С (-6,04 Дж/г) во время снятия первой сканограммы нагревания. Как и в случае 3-фукозиллактозы, для 6'-сиалиллактозы пик эндотермической релаксации обнаруживали после Tg, однако в этом образце происходило дополнительное эндотермическое событие при 77°С (-0,22 Дж/г). Никаких эндотермических событий в случае 3'-сиалиллактозы и HMO-Mix I обнаружено не было, в случае HMO-Mix II эндотермическое событие во время снятия 1ой сканограммы нагревания наблюдали при 79°С (0,34 Дж/г).
2. Дифракция рентгеновских лучей на порошке (XRPD)
Для изучения морфологии лиофилизированных продуктов использовали широкоугольную дифракцию рентгеновских лучей на порошке (XRPD). Применяли рентгеновский дифрактометр Empyrean (Panalytical, Almelo, Нидерланды), оснащенный медным анодом (45 кВ, 40 мА, Kα1-излучение на длине волны 0,154 нм) и детектором PIXcel3D. Приблизительно по 100 мг высушенных распылением образцов анализировали в режиме отражения в диапазоне углов 5-45° 2θ, с размером шага 0,04° 2θ и временем счета 100 секунд за один шаг.
Все отдельные олигосахариды, а также смеси НМО Mix I и II показали полностью аморфную структуру (Фиг. 1-6). Для лакто-N-тетраозы был обнаружен второй (соответствующий аморфной структуре) сигнал около 9-10°.
3. Лазерная дифракция
Размер частиц порошка оценивали методом лазерной дифракции. С помощью этой системы детектируют рассеянный и дифрагированный свет, используя массив сферически расположенных сенсорных элементов. Затем, применяя программно-реализованный алгоритм, проводят аппроксимацию количеств частиц путем подсчета z-значений величин интенсивности света, который поступает на различные сенсорные элементы. Анализ выполняли, используя систему для количественной оценки методом лазерной дифракции (qLD) SALD-7500 Aggregate Sizer (Shimadzu Corporation, Kyoto, Япония).
Небольшое количество (на кончике шпателя) каждого образца диспергировали в 2 мл изооктана и гомогенизировали посредством обработки ультразвуком в течение пяти минут. Дисперсию переносили в ячейку для образцов, заполненную изооктаном, и анализировали в ручном режиме.
Применяли следующие настройки для сбора данных: число усреднения сигналов за одно измерение: 128, число накопления сигналов: 3, и интервал: 2 секунды.
Перед проведением измерения систему промывали, используя изооктан. Для каждого образца в форме дисперсии измерения проводили 3 раза, и приведены средние значения и стандартное отклонение. Оценку данных проводили, используя программное обеспечение WING SALD II, версию V3.1. Поскольку показатель преломления образца был неизвестен, для определения профилей распределения по размерам использовали показатель преломления для частиц сахара (дисахарида) (1,530). Приведены значения размеров для среднего и медианного диаметра.
Средние размеры частиц для всех образцов оказались очень схожими, слегка более низкие значения были измерены для HMO-Mix II. Характеристики размера частиц суммированы в Таблице 10. Помимо этого распределение частиц по размерам показало наличие группы одного основного размера для всех образцов.
Изобретение относится к пищевой промышленности. Предложен высушенный распылением порошок для приготовления питательной композиции, содержащий смесь различающихся по структуре олигосахаридов грудного молока. При этом высушенный распылением порошок содержит по меньшей мере один моносахарид, выбранный из группы, состоящей из L-фукозы и N-ацетилнейраминовой кислоты. Все олигосахариды грудного молока получены путем микробиологической ферментации. Изобретение обеспечивает получение смеси олигосахаридов грудного молока без использования органического растворителя. 4 н. и 13 з.п. ф-лы, 6 ил., 10 табл., 7 пр.
1. Высушенный распылением порошок для приготовления питательной композиции, содержащий смесь различающихся по структуре олигосахаридов грудного молока (HMO), где высушенный распылением порошок содержит по меньшей мере один моносахарид, выбранный из группы, состоящей из L-фукозы и N-ацетилнейраминовой кислоты, и где все олигосахариды грудного молока получены путем микробиологической ферментации.
2. Высушенный распылением порошок по п. 1, где различающиеся по структуре HMO в данной смеси выбраны из группы, состоящей из 2'-фукозиллактозы (2'-FL), 3-фукозиллактозы (3-FL), лакто-N-тетраозы (LNT), лакто-N-неотетраозы (LNnT), лакто-N-фукопентаозы I (LNFPI), 3'-сиалиллактозы (3'-SL), 6'-сиалиллактозы (6'-SL), сиалиллакто-N-тетраозы a (LST-a), сиалиллакто-N-тетраозы b (LST-b), сиалиллакто-N-тетраозы с (LST-c) и дисиалиллакто-N-тетраозы (DSLNT).
3. Высушенный распылением порошок по любому из пп. 1 или 2, где указанный высушенный распылением порошок содержит по меньшей мере 80 масс.%, по меньшей мере 85 масс.%, по меньшей мере 90 масс.%, по меньшей мере 93 масс.%, по меньшей мере 95 масс.% или по меньшей мере 98 масс.% олигосахаридов грудного молока.
4. Высушенный распылением порошок по любому из пп. 1-3, где по меньшей мере один HMO в данной смеси, предпочтительно все HMO в данной смеси, возможно по меньшей мере один моносахарид, присутствуют в аморфной форме.
5. Высушенный распылением порошок по любому из пп. 3 или 4, где по меньшей мере один моносахарид, предпочтительно все моносахариды присутствуют в аморфной форме.
6. Высушенный распылением порошок по любому из пп. 1-5, где указанный высушенный распылением порошок содержит 15 масс.% воды или менее, предпочтительно 10 масс.% воды или менее, более предпочтительно 7 масс.% воды или менее, наиболее предпочтительно 5 масс.% воды или менее.
7. Способ получения высушенного распылением порошка по любому из пп. 1-6, включающий следующие стадии:
a) очистка по меньшей мере одного из различающихся по структуре HMO от ферментационного бульона;
b) предоставление водного раствора, содержащего по меньшей мере один HMO стадии a); и
c) подвергание раствора стадии b) распылительной сушке.
8. Способ по п. 7, где водный раствор стадии b) содержит по меньшей мере пять, предпочтительно семь различающихся по структуре HMO, при этом указанные различающиеся по структуре HMO предпочтительно выбраны из группы, состоящей из 2'-FL, 3-FL, LNT, LNnT, LNFPI, 3'-SL, 6'-SL, LST-a, LST-b, LST-c и DSLNT.
9. Способ по п. 7 или 8, где водный раствор стадии b) дополнительно содержит по меньшей мере один моносахарид, причем указанный по меньшей мере один моносахарид выбран из группы, состоящей из L-фукозы и N- ацетилнейраминовой кислоты.
10. Способ по любому из пп. 7-9, где стадия очистки по меньшей мере одного HMO и/или по меньшей мере одного моносахарида от ферментационного бульона (стадия a) включает одну или более следующих стадий:
1) удаление клеток микроорганизмов из ферментационного бульона с получением технологического потока;
2) подвергание указанного технологического потока по меньшей мере одной ультрафильтрации;
3) обработка указанного технологического потока по меньшей мере один раз катионообменной смолой и/или по меньшей мере один раз анионообменной смолой;
4) подвергание указанного технологического потока по меньшей мере одной нанофильтрации и/или диафильтрации;
5) подвергание указанного технологического потока по меньшей мере одному электродиализу;
6) обработка указанного технологического потока по меньшей мере один раз активированным углем; и/или
7) подвергание указанного технологического потока по меньшей мере один раз стадии кристаллизации и/или осаждения.
11. Способ по любому из пп. 7-10, где водный раствор содержит по меньшей мере один HMO, смесь различающихся по структуре HMO и/или по меньшей мере один моносахарид в количестве, соответствующем общему количеству сахаридов, составляющему по меньшей мере 20% (масс./об.), 30% (масс./об.), 35% (масс./об.) и до 45% (масс./об.), 50% (масс./об.), 60% (масс./об.) включительно.
12. Способ по любому из пп. 7-11, где водный раствор, содержащий по меньшей мере один HMO и возможно по меньшей мере один моносахарид, подвергают сушке распылением при температуре сопла, составляющей по меньшей мере 110°C, предпочтительно по меньшей мере 120°C, более предпочтительно по меньшей мере 125°C и ниже 150°C, предпочтительно ниже 140°C и более предпочтительно ниже 135°C.
13. Способ по любому из пп. 7-12, где водный раствор, содержащий по меньшей мере один HMO и возможно по меньшей мере один моносахарид, подвергают сушке распылением при температуре на выходе, составляющей по меньшей мере 60°C, предпочтительно по меньшей мере 65°C и ниже 80°C, предпочтительно ниже 70°C.
14. Применение высушенного распылением порошка по любому из пп. 1-6 для приготовления питательной композиции.
15. Применение высушенного распылением порошка по п. 14, где питательная композиция представляет собой детскую питательную смесь.
16. Питательная композиция, содержащая высушенный распылением порошок по любому из пп. 1-6.
17. Питательная композиция по п. 16, где указанная питательная композиция дополнительно содержит по меньшей мере один пробиотический микроорганизм.
| WO 2017103019 A1, 22.06.2017 | |||
| US 20160186223 A1, 30.06.2016 | |||
| СПОСОБ ПОЛУЧЕНИЯ СИАЛИЛИРОВАННЫХ ОЛИГОСАХАРИДОВ | 2007 |
|
RU2473695C2 |
| СМЕСЬ ОЛИГОСАХАРИДОВ И ПРОДУКТ ПИТАНИЯ, СОДЕРЖАЩИЙ ЭТУ СМЕСЬ, В ЧАСТНОСТИ ПИТАТЕЛЬНАЯ СМЕСЬ ДЛЯ КОРМЛЕНИЯ МЛАДЕНЦЕВ | 2011 |
|
RU2581731C2 |
| ВЫДЕЛЕНИЕ И ОЧИСТКА КОМПОНЕНТОВ СЫВОРОТКИ | 2010 |
|
RU2522491C2 |
| WO 2016157108 A1, 06.10.2016. | |||
Авторы
Даты
2023-09-21—Публикация
2018-12-07—Подача