Область техники, к которой относится изобретение
Настоящее изобретение касается комбинированного применения 1) молекулы антитела, которая специфично связывает FcγRIIb посредством своего участка Fab, но не имеет участка Fc или обладает пониженным связыванием посредством своего участка Fc, как минимум с одним рецептором Fcγ, и 2) иммунной клетки, истощающей или дезактивирующей молекулу антитела, которая специфично связывается с рецептором, присутствующим на иммунной клетке, которая подавляет противораковый иммунитет, и у которой иммунная клетка, истощающая или дезактивирующая молекулу антитела, имеет участок Fc, который связывается как минимум с одним активирующим рецептором Fcγ, при лечении FcγRIIb-негативных форм рака.
Предпосылки к созданию изобретения
Давно известно, что ингибирующий Fc-гамма-рецептор (FcγR) IIB, экспрессируемый многочисленными клетками иммунной системы, негативно регулирует как врожденный, так и приобретенный иммунитет за счет вовлечения иммунных комплексов (ИК). Подобным образом данные о том, что FcγRIIB ингибирует иммунотерапию моноклональными антителами, известны уже более десяти лет. Как таковые, мыши, дефицитные по FcγRIIB, способны более эффективно излечиваться от опухолей, чем мыши дикого типа (WT), при лечении терапевтическими антителами mAb, что указывает на то, что экспрессия FcγRIIB на эффекторных клетках (т.е. макрофагах и моноцитах) приводит к подавлению их фагоцитарного и цитотоксического потенциала in vivo. Более того, FcγRIIB регулирует антигенпрезентирующий потенциал дендритных клеток (ДК) и FcγRIIB–ve (van Montfoor и соавторы, J. Immunol. 2012 Jul 1; 189 (1): 92-101). 2012 июл 1; 189 (1): 92-101). Дендритные клетки обладают повышенной способностью активировать интактные Т-клетки. Недавно были разработаны антагонистические антитела, которые блокируют передачу сигналов FcγRIIB и интернализацию в В-клетках. Такие антитела демонстрировали эффективную делецию B-клеток, экспрессирующих FcγRIIB, и эффективно усиливали опосредованную ритуксимабом делецию нормальных и злокачественных B-клеток, демонстрируя благоприятный эффект при гематологическом раке. Однако не было исследовано или показано, могут ли такие антитела иметь благоприятный эффект также при лечении FcγRIIB-негативных форм рака, таких как солидные формы рака.
Сущность изобретения
В настоящей заявке было неожиданно показано, что только антитела анти-FcγRIIB, которые не имеют участка Fc или у которых участок Fc демонстрирует пониженное или нарушенное связывание с рецепторами FcγR, например, антитела F(ab)’2 или агликозилированные антитела, способны усиливать терапевтическую активность антител, применяющихся для лечения FcγRIIB-негативных форм рака, включая солидные формы рака. Это открытие было неожиданным, поскольку предыдущие исследования показали, что анти-FcγRIIB антитела IgG1 дикого типа одинаково способны блокировать рецепторы FcγRIIB и в равной степени способны предотвращать интернализацию ритуксимаба и индуцированное ритуксимабом фосфорилирование FcγRIIB in vitro.
Согласно настоящему изобретению возможно повысить терапевтическую активность иммуномодулирующих противораковых антител, терапевтическая активность которых зависит от вовлечения рецепторов FcγR. Такие антитела включают, но не ограничиваются ими, антитела к так называемым мишеням ингибитора контрольной точки иммунного ответа, например, CTLA-4, иммунные агонистические мишени, например, OX40, 4-1BB и GITR, и рецептор интерлейкина-2 (IL-2R).
В настоящей заявке раскрыта молекула первого антитела, которая специфично связывается с FcγRIIb посредством (или через) свой участок Fab и в которой отсутствует участок Fc или которая обладает пониженным связыванием с рецепторами Fcγ посредством (или через) свой участок Fc, для применения в комбинации с молекулой второго антитела, которая специфично связывается с рецептором, присутствующим на иммунной клетке, причем эта иммунная клетка представляет собой иммунную клетку, которая подавляет противораковый иммунитет, в которой молекула второго антитела имеет участок Fc, который связывается как минимум с одним активирующим рецептором Fcγ, и при этом связывание молекулы второго антитела с рецептором на иммунной клетке вызывает истощение и/или дезактивацию этой иммунной клетки, в лечении FcγRIIb-негативного рака у пациента.
В настоящей заявке также раскрыта фармацевтическая композиция, содержащая:
(i) молекулу первого антитела, которая специфично связывает FcγRIIb посредством своего участка Fab и в которой отсутствует участок Fc или которая обладает пониженным связыванием с рецепторами Fcγ посредством своего участка Fc; и
(ii) молекулу второго антитела, которая специфично связывается с рецептором, присутствующим на иммунной клетке, причем эта иммунная клетка представляет собой иммунную клетку, которая подавляет противораковый иммунитет, в которой молекула второго антитела имеет участок Fc, который связывается как минимум с одним активирующим рецептором Fcγ, и при этом связывание второго антитела с рецептором на иммунной клетке вызывает истощение и/или дезактивацию этой иммунной клетки;
для применения при лечении FcγRIIb-негативного рака у пациента.
Дополнительно в настоящей заявке раскрыт набор для применения в лечении FcγRIIb-негативного рака, включающий:
(i) молекулу первого антитела, которая специфично связывает FcγRIIb посредством своего участка Fab и в которой отсутствует участок Fc или которая обладает пониженным связыванием с рецепторами Fcγ посредством своего участка Fc; и
(ii) молекулу второго антитела, которая специфично связывается с рецептором, присутствующим на иммунной клетке, причем эта иммунная клетка представляет собой иммунную клетку, которая подавляет противораковый иммунитет, в которой молекула второго антитела имеет участок Fc, который связывается как минимум с одним активирующим рецептором Fcγ, и при этом связывание молекулы второго антитела с рецептором на иммунной клетке вызывает истощение или дезактивацию этой иммунной клетки.
Дополнительно в настоящей заявке раскрыто применение:
(i) молекулы первого антитела, которая специфично связывает FcγRIIb посредством своего участка Fab и в которой отсутствует участок Fc или которая обладает пониженным связыванием с рецепторами Fcγ посредством своего участка Fc; и
(ii) молекулы второго антитела, которая специфично связывается с рецептором, присутствующим на иммунной клетке, причем эта иммунная клетка представляет собой иммунную клетку, которая подавляет противораковый иммунитет, в которой молекула второго антитела имеет участок Fc, который связывается как минимум с одним активирующим рецептором Fcγ, и при этом связывание второго антитела с рецептором на иммунной клетке вызывает истощение или дезактивацию иммунной клетки;
в производстве лекарственного средства для применения при лечении FcγRIIb-негативного рака у пациента.
Также в настоящей заявке раскрыт способ лечения FcyRIIb-негативного рака у пациента, включающий введение:
(i) молекулы первого антитела, которая специфично связывает FcyRIIb посредством своего участка Fab и которая не имеет участка Fc или которая обладает пониженным связыванием с рецепторами Fcy посредством своего участка Fc; и
(ii) молекулы второго антитела, которая специфично связывается с рецептором, присутствующим на иммунной клетке, причем эта иммунная клетка является иммунной клеткой, которая подавляет противоопухолевый иммунитет, в которой молекула второго антитела имеет участок Fc, который способен активировать как минимум один активирующий рецептор Fcγ, и при этом связывание второго антитела с рецептором на этой иммунной клетке приводит к истощению или дезактивации этой иммунной клетки.
Подробное описание настоящего изобретения
Таким образом, настоящее изобретение касается комбинированного применения:
(i) молекулы антитела, которая специфично связывает FcγRIIb посредством своего участка Fab и которая не имеет области Fc или имеет пониженное связывание с рецепторами Fcγ посредством своего участка Fc (ниже часто обозначается как молекула первого антитела); и
(ii) молекулы антитела, которая специфично связывается с рецептором, присутствующим на иммунной клетке (ниже часто обозначается как второе антитело), причем эта иммунная клетка представляет собой иммунную клетку, которая подавляет противораковый иммунитет, в которой молекула антитела имеет область Fc, которая связывается как минимум с одним активирующим рецептором Fcγ, и при этом связывание этой молекулы антитела с рецептором на иммунной клетке вызывает истощение или дезактивацию иммунной клетки. Таким образом, эта молекула второго антитела является иммунной клеткой, истощающей или дезактивирующей молекулу антитела.
Эта комбинация предназначена для применения при лечении FcγRIIb-негативного рака у пациента с целью повышения терапевтической эффективности молекулы второго антитела посредством улучшенного связывания его участка Fc с активирующими рецепторами FcγR, при пониженном связывании/активации ингибирующего рецептора FcγR.
Рецепторы Fc представляют собой мембранные белки, которые находятся на поверхности иммунных эффекторных клеток, таких как макрофаги. Название происходит от специфичности их связывания с участком Fc антител, что является обычным способом связывания антитела с рецептором. Однако некоторые антитела могут также связывать рецепторы Fc через последовательности антител CDR в случае антител, специфично связывающихся с одним или несколькими рецепторами Fc.
Подгруппой рецепторов Fc являются рецепторы Fcγ (Fc-гамма-рецепторы, FcgammaR), которые специфичны для антител IgG. Существует два типа рецепторов Fcγ: активирующие рецепторы Fcγ (также обозначаемые как активационные рецепторы Fcγ) и ингибирующие рецепторы Fcγ. Активирующие и ингибирующие рецепторы передают свои сигналы через активационные тирозинсодержащие мотивы иммунорецепторов (ITAM) или ингибирующие тирозинсодержащие мотивы иммунорецепторов (ITIM) соответственно. У людей FcγRIIb (CD32b) является ингибирующим рецептором Fcγ, тогда как FcγRI (CD64), FcγRIIa (CD32a), FcγRIIc (CD32c), FcγRIIIa (CD16a) и FcγRIV активируют рецепторы Fcγ. FcγgRIIIb является GPI-связанным рецептором, экспрессируемым на нейтрофилах, у которого отсутствует мотив ITAM, но благодаря его способности сшивать липидные рафты и взаимодействовать с другими рецепторами он также считается активационным. У мышей активирующими рецепторами являются FcγRI, FcγRIII и FcγRIV.
Хорошо известно, что антитела модулируют активность иммунных клеток посредством взаимодействия с рецепторами Fcγ. В частности, то, как иммунные комплексы антител модулируют активацию иммунных клеток, определяется их относительным связыванием активирующих и ингибирующих рецепторов Fcγ. Различные изотипы антител связываются с активирующим и ингибирующим рецепторам Fcγ с различным сродством, что приводит к различным соотношениям A : I (соотношения активации к ингибированию) (Nimmerjahn et al.; Science. 2005 Dec 2; 310 (5753): 1510-2). 2005 декабря 2; 310 (5753): 1510-2).
Связываясь с ингибирующим рецептором Fcγ, антитело может ингибировать, блокировать и/или снижать функции эффекторных клеток.
Связываясь с активирующим рецептором Fcγ, антитело может активировать функции эффекторных клеток и тем самым запускать такие механизмы, как антителозависимая клеточная цитотоксичность (ADCC), антителозависимый клеточный фагоцитоз (ADCP), высвобождение цитокинов и/или антителозависимый эндоцитоз, а также нетоз (т.е. активация и высвобождение нейтрофилов, нейтрофильных внеклеточных ловушек) в случае нейтрофилов. Связывание антител с активирующим рецептором Fcγ также может приводить к увеличению некоторых маркеров активации, таких как CD40, MHCII, CD38, CD80 и/или CD86.
Молекула антитела в соответствии с настоящим изобретением, которая специфично связывает FcγRIIb, т.е. первое антитело, связывается или взаимодействует с этим рецептором Fcγ через участок Fab антитела, т.е. через антигенсвязывающий участок на антителе, которое связывается с антигенами, которые состоят из одного константного и одного вариабельного домена каждой тяжелой и легкой цепи. В частности, он связывается с FcγRIIb, присутствующим на иммунной эффекторной клетке, и в частности с FcγRIIb, присутствующим на поверхности иммунной эффекторной клетки. Если бы это антитело имело обычный или ординарный участок Fc, это антитело могло бы также связываться с активирующим рецептором Fcγ посредством нормального взаимодействия между участком Fc и рецептором Fc. Однако в соответствии с настоящим изобретением молекула антитела, которая специфично связывает FcγRIIb, полностью лишена участка Fc или имеет пониженное связывание с рецепторами Fcγ, что означает то, что молекула антитела, которая специфично связывается или взаимодействует с FcγRIIb, плохо связывается или вообще не может связываться или взаимодействовать с рецепторами Fcγ. По-видимому, это имеет как минимум два терапевтически важных последствия:
1) отсутствие Fc-опосредованного связывания с активирующими рецепторами FcγR оставляет большее количество активирующих Fc-гамма-рецепторов, доступных для связывания с Fc (других) терапевтических противораковых антител. Это важно, поскольку кластеризация растущего числа активирующих рецепторов FcγR (в противоположность ингибирующим рецепторам FcγR; Nimmerjahn et al.; Science. 2005 Dec 2; 310 (5753): 1510-2), как известно, увеличивает опосредованную эффекторными клетками делецию клеток-мишеней, механизм, лежащий в основе активности как ингибитора контрольной точки иммунного ответа, иммунного агониста, так и других иммуномодулирующих антител, таких как анти-IL-2R.
2) было показано, что отсутствие или снижение Fc-опосредованного связывания с ингибирующим FcγR снижает передачу ингибирующих сигналов в FcγR-экспрессирующих иммунных эффекторных клетках. Таким образом, отсутствие или снижение Fc-опосредованного связывания с FcγR антитела, нацеленного на FcγRIIB, вероятно, повышает терапевтическую эффективность с помощью как минимум двух механизмов, включая как улучшенную передачу активирующих сигналов FcγR, так и пониженную передачу ингибирующих сигналов Fcγ в иммунных эффекторных клетках в ответ на второе иммуномодулирующее противораковое антитело.
В данном контексте «пониженное связывание» или «связывание с пониженной аффинностью» означает, что молекула антитела имеет пониженное Fc-опосредованное связывание с рецепторами Fcγ или, другими словами, что участок Fc молекулы антитела, которая специфично связывает FcγRIIb, связывается с активирующим рецептором Fcγ с более низкой аффинностью, чем участок Fc нормального человеческого IgG1. Снижение связывания можно оценить с помощью таких способов, как поверхностный плазмонный резонанс. В данном контексте «нормальный IgG1» означает традиционно продуцируемый IgG1 с немутантным участком Fc, который не был продуцирован с целью изменить его гликозилирование. В качестве эталона для этого «нормального IgG1» можно использовать ритуксимаб, продуцируемый в клетках яичника китайского хомячка (СНО) без каких-либо модификаций (Tipton et al., Blood 2015 125: 1901-1909; ритуксимаб описан среди прочего в Европейской Фармакопее ЕР 0605442).
«Пониженное связывание» означает, что связывание участка Fc молекулы антитела, который специфично связывает FcγRIIb, с активирующим рецептором Fcγ, как минимум в 10 раз снижено для всех рецепторов Fc по сравнению со связыванием участка Fc нормального человеческого IgG1 с одними и теми же рецепторами. В некоторых вариантах реализации изобретения оно снижается как минимум в 20 раз. В некоторых вариантах реализации изобретения оно снижается как минимум в 30 раз. В некоторых вариантах реализации изобретения оно снижается как минимум в 40 раз. В некоторых вариантах реализации изобретения оно снижается как минимум в 50 раз. В некоторых вариантах реализации изобретения оно снижается как минимум в 60 раз. В некоторых вариантах реализации изобретения оно снижается как минимум в 70 раз.
В некоторых вариантах реализации настоящего изобретения молекула антитела, которая специфично связывает FcγRIIb, совсем не связывается с его участком Fc, а в некоторых таких случаях антитело не имеет участка Fc; тогда это могут быть Fab, Fab’2, scFv или их пегилированные варианты.
В некоторых вариантах реализации изобретения молекула антитела, которая специфично связывает FcγRIIb, может представлять собой антитело ламы и, в частности, антитело hcIgG ламы. Как и все млекопитающие, животное, относящееся к семейству верблюдовых, производят обычные антитела, состоящие из двух тяжелых цепей и двух легких цепей, связанных вместе дисульфидными связями в форме Y (IgG1). Однако они также продуцируют два уникальных подкласса иммуноглобулина G, IgG2 и IgG3, также известных как тяжелые цепи IgG (hcIgG). Эти антитела состоят только из двух тяжелых цепей, которые не имеют участка CH1, но все же имеют антигенсвязывающий домен на своем N-конце, называемом VнH. Обычный Ig требует ассоциации вариабельных участков, как тяжелой, так и легкой цепей, чтобы обеспечить большое разнообразие взаимодействий антиген-антитело. Хотя изолированные тяжелые и легкие цепи все же демонстрируют эту способность, они проявляют очень низкую аффинность4 по сравнению с парными тяжелыми и легкими цепями. Уникальной особенностью hcIgG является способность их мономерных антигенсвязывающих участков связывать антигены со специфичностью, аффинностью и особенно разнообразием, которые сопоставимы с обычными антителами, без необходимости соединения с другим участком.
В некоторых вариантах реализации изобретения «пониженное связывание» означает, что аффинность данного антитела в отношении связывания с FcγRI снижена в 20 раз.
Для получения пониженного связывания какого-либо антитела IgG1, такого как антитело IgG1, с рецептором Fc, можно модифицировать участок Fc антитела IgG путем агликозилирования. Такое агликозилирование, например, антитела IgG1, может быть достигнуто, например, путем замещения аминокислоты, аспарагина, в позиции 297 (N297X) в цепи этого антитела. Замещение может быть глютамином (N297Q) или аланином (N297A), или глицином (N297G), или аспарагином (N297D), или серином (N297S).
Участок Fc может быть модифицирован дополнительными замещениями, например, как описано Jacobsen FW с соавторами, JBC 2017, 292, 1865-1875 (см., например, Таблицу 1). Такие дополнительные замещения включают L242C, V259C, A287C, R292C, V302C, L306C, V323C, I332C и/или K334C. Такие модификации также включают следующие комбинации замен в IgG1:
L242C, N297G, K334C,
A287C, N297G, L306C,
R292C, N297G, V302C,
N297G, V323C, I332C и F71Y.
V259C, N297G, L306C;
В качестве альтернативы, углевод на участке Fc можно расщепить с помощью ферментов; и/или клетки, применяющиеся для производства антитела, можно выращивать в среде, которую ухудшает добавление углевода, и/или клетки, генетически измененные так, чтобы они не имели возможности добавлять сахара, можно применять для производства антител или путем производства антител в клетках хозяина, которые не гликозилируют или функционально не гликозилируют антитела, например, в клетках прокариотов, включая E. coli, как объясняется выше.
Снижение аффинности для Fc-гамма-рецепторов может быть дополнительно достигнуто за счет биоинжениринга аминокислот на участке Fc антитела (такие модификации ранее были описаны, например, такими авторами, как Xencor, Macrogenics и Genentech) или за счет производства антител в клетках хозяина, которые не гликозилируют или функционально не гликозилируют антитела, например прокариот, включая E. coli.
В дополнение к тому, что у молекулы антитела имеется пониженное связывание с рецепторами Fcy посредством участка Fc, в некоторых вариантах реализации изобретения предпочтительно, чтобы молекула антитела, которая специфично связывает FcyRIIb, не вызывала фосфорилирования FcyRIIb при связывании мишени. Фосфорилирование ингибирующего тирозинсодержащего мотива иммунорецепторов (ITIM) FcyRIIb является ингибирующим процессом, который блокирует активность в иммунной клетке.
Fc-гамма-рецептор, экспрессирующий иммунную эффекторную клетку, относится в настоящей заявке, главным образом, к врожденным эффекторным клеткам и включает в себя, в частности, макрофаги, нейтрофилы, моноциты, естественные киллеры (NK-клетки), базофилы, эозинофилы, тучные клетки и тромбоциты. Цитотоксические Т-клетки и Т-клетки памяти, как правило, не экспрессируют рецепторы FcyR, но могут делать это в определенных условиях. В некоторых вариантах реализации изобретения иммунная эффекторная клетка является врожденной иммунной эффекторной клеткой. В некоторых вариантах реализации изобретения иммунная эффекторная клетка является макрофагом.
В отличие от молекулы антитела, которая специфично связывает FcyRIIb, молекула антитела, которая специфично связывается или взаимодействует с рецептором, присутствующим на целевой иммунной клетке, т.е. молекула второго антитела или иммунная клетка, истощающая или дезактивирующая молекулу антитела, имеет участок Fc, который связывается или взаимодействует с активирующим рецептором Fcy в степени, которая не уменьшается или, по меньшей мере, существенно не уменьшается. Иммунная клетка, с которой связывается молекула второго антитела, т.е. иммунная клетка, истощающая и дезактивирующая молекулу антитела, является иммунной клеткой, которая подавляет противораковый иммунитет, и связывание второго антитела с клеткой приводит к истощению или дезактивации этой иммунной клетки, которая может принадлежать к врожденному (например, TAM, TAN или MDSC) или приобретенному плечу (например, Т-клетки) иммунной системы.
Под истощением клетки в настоящей заявке подразумевается истощение, делеция или элиминация иммунных клеток посредством физического устранения клеток. В частности, имеется в виду истощение внутриопухолевых иммунных клеток или истощение ассоциированных с опухолью иммунных клеток, например, тех клеток, которые были предварительно посланы в лимфатические узлы, дренирующие опухоль.
Под дезактивацией иммунной клетки в настоящей заявке подразумевается заблокированная или сниженная активность, например, сниженная продукция цитокинов, факторов роста, аргиназы или окиси азота. В контексте настоящей заявки дезактивация иммунной клетки также включает искажение иммунных клеток таким образом, что их проопухолевый фенотип изменяется в противоопухолевый фенотип, например, за счет снижения высвобождения противовоспалительных цитокинов, снижения высвобождения проангиогенных факторов роста, а также увеличения высвобождения провоспалительных цитокинов и увеличения активных форм кислорода (АФК), фагоцитоза или активности антителозависимой клеточной цитотоксичности (ADCC).
Ниже объясняется, как определить, является ли антитело иммунной клеткой, истощающей или дезактивирующей антитело.
Иммунная клетка, с которой специфично связывается молекула второго антитела, является иммунной клеткой, которая подавляет противораковый иммунитет. В данном контексте противораковый иммунитет включает в себя, но не ограничивается этим, индукцию приобретенного опосредованного Т-клетками противоракового иммунитета, включая выработку иммунного ответа на то, что сохранено в иммунологической памяти.
Иммунная клетка, с которой специфично связывается молекула второго антитела, может быть регуляторной Т-клеткой. Регуляторные Т-клетки, Treg-клетки (Tregs или Tregs) (ранее известные как супрессорные Т-клетки, иногда также называемые супрессивными регуляторными Т-клетками) представляют собой субпопуляцию Т-клеток, которые способны подавлять другие иммунные клетки в условиях нормального иммунитета и в условиях патологического иммунитета. Иммунная клетка, с которой специфично связывается молекула второго антитела, может альтернативно быть миелоидной клеткой, в частности ассоциированной с опухолью миелоидной клеткой. В некоторых вариантах реализации изобретения ассоциированная с опухолью миелоидная клетка представляет собой ассоциированный с опухолью макрофаг, который иногда обозначается как ТАМ. В некоторых вариантах реализации изобретения это ассоциированный с опухолью нейтрофил, который иногда обозначается как TAN. В некоторых вариантах реализации изобретения это дендритная клетка. В некоторых вариантах реализации изобретения это миелоидная супрессорная клетка, которая может быть моноцитарного или гранулоцитарного типа.
Кроме связывания конкретно с какой-либо мишенью на иммунной клетке, молекула второго антитела связывается посредством своего участка Fc с активирующим рецептором Fcγ, присутствующим на одной и той же иммунной эффекторной клетке, как FcyRIIb, с которой связывается молекула первого антитела, и/или с активирующим рецептором Fcγ, присутствующим на другой иммунной эффекторной клетке. Для того чтобы иметь возможность связываться с активирующим рецептором Fcy, участок Fc второго антитела должен как минимум в некоторых вариантах реализации изобретения быть гликозилирован в позиции 297. Углеводный остаток в этом положении способствует связыванию с рецепторами Fcy. В некоторых вариантах реализации изобретения предпочтительно, чтобы эти остатки были биантенными углеводами, которые содержат GlnNAc, маннозу с концевыми остатками галактозы и сиаловую кислоту. Он должен содержать участок CH2 молекулы Fc.
Рак, который подвергается лечению или поддающийся лечению в соответствии с настоящим изобретением, является раком, отрицательным по FcyRIIb, что означает то, что это рак, при котором не имеется никаких рецепторов FcyRIIb. Это можно проверить, применяя специфические анти-FcyRIIB антитела в различных способах, включая иммуногистохимический способ и способ проточной цитометрии, как показано в работе Tutt et al. J Immunol 2015, 195 (11) 5503-5516.
Антитела хорошо известны специалистам в области иммунологии и молекулярной биологии. Как правило, антитело состоит из двух тяжелых (H) цепей и двух легких (L) цепей. В настоящей заявке иногда эта полная молекула антитела называется полноразмерным антителом или антителом полной длины. Тяжелая цепь антитела содержит один вариабельный домен (VH) и три константных домена (CH1, CH2 и CH3), а легкая цепь молекулы антитела содержит один вариабельный домен (VL) и один константный домен (CL). Вариабельные домены (иногда вместе именуемые как участок FV) связываются с мишенью антитела или антигеном. Каждый вариабельный домен состоит из трех петель, называемых участками, определяющими комплементарность (CDR), которые отвечают за связывание с мишенью. Константные домены не участвуют непосредственно в связывании антитела с антигеном, но демонстрируют различные эффекторные функции. Антитела или иммуноглобулины могут быть отнесены к разным классам в зависимости от аминокислотной последовательности константного участка их тяжелых цепей. Существует пять основных классов иммуноглобулинов: IgA, IgD, IgE, IgG и IgM, а у человека некоторые из этих иммуноглобулинов дополнительно делятся на подклассы (изотипы), например IgG1, IgG2, IgG3 и IgG4; IgA1 и IgA2.
Другой частью антитела является участок Fc (также известный как кристаллизующийся фрагмент домена), который состоит из двух константных доменов каждой из тяжелых цепей антитела. Как уже упоминалось выше, участок Fc отвечает за взаимодействие между антителом и рецептором Fc.
Термин «молекула антитела», употребляющийся в настоящей заявке, относится к полноразмерным антителам или антителам полной длины, а также к функциональным фрагментам полноразмерных антител и производным молекул таких антител.
Функциональные фрагменты полноразмерного антитела имеют те же характеристики связывания антигена, что и соответствующее полноразмерное антитело, и включают либо те же вариабельные домены (т.е. последовательности VH и VL), либо те же последовательности CDR, что и соответствующее полноразмерное антитело. То, что функциональный фрагмент имеет те же характеристики связывания антигена, что и соответствующее полноразмерное антитело, означает то, что он связывается с тем же эпитопом на мишени, что и полноразмерное антитело. Такой функциональный фрагмент может соответствовать участку Fv полноразмерного антитела. Как альтернатива, такой фрагмент может быть Fab, также обозначаемым F(ab), который является моновалентным антигенсвязывающим фрагментом, не содержащим участки Fc, или F(ab’)2, который является двухвалентным антигенсвязывающим фрагментом, содержащим два антигенсвязывающие участка Fab, связанные между собой дисульфидными связями, или F(ab’), т.е. моновалентным вариантом F(ab’)2. Таким фрагментом может быть также одноцепочечный вариабельный фрагмент (scFv).
Функциональный фрагмент не всегда содержит все шесть участков, определяющих комплементарность (CDR) соответствующего полноразмерного антитела. Следует отметить, что молекулы, содержащие три или меньшее количество участков CDR (в некоторых случаях даже только один участок CDR или его часть), способны сохранять антигенсвязывающую активность антитела, производными которого являются участки, определяющие комплементарность (CDR). Например, в работе Gao et al., 1994, J. Biol. Chem., 269: 32389-93 указано, что вся цепь VL (включая все три участка CDR) имеет высокое сродство к своему субстрату.
Молекулы, содержащие два участка CDR, описаны, например, в работе Vaughan & Sollazzo 2001, Combinatorial Chemistry & High Proposal Screening, 4: 417-430. На странице 418 (правая колонка - 3 «Наша стратегия проектирования») описано миниантитело, включающее только гипервариабельные участки H1 и H2 CDR, перемежающиеся внутри каркасных участков. Это миниантитело описывают, как способное связываться с мишенью. На работы Pessi et al., 1993, Nature, 362: 367-9, и Bianchi et al., 1994, J. Mol. Biol., 236: 649-59, ссылаются Vaughan и Sollazzo и более подробно описывают миниантитела H1 и H2 и их свойства. В работе Qiu et al., 2007, Nature Biotechnology, 25:921-9 показано, что молекула, состоящая из двух связанных участков CDR, способна связывать антиген. Quiocho 1993, Nature, 362: 293-4, дает краткое описание технологии «миниантитела». Ladner 2007, Nature Biotechnology, 25:875-7, комментирует, что молекулы, содержащие два участка CDR, способны сохранять антигенсвязывающую активность.
Молекулы антител, содержащие один участок CDR, описаны, например, в работе Laune et al., 1997, JBC, 272: 30937-44, в которой показано, что ряд гексапептидов, полученных из участка CDR, демонстрируют антигенсвязывающую активность, и отмечается, что синтетические пептиды полного единичного участка CDR демонстрируют сильную связывающую активность. В работе Monnet et al., 1999, JBC, 274: 3789-96, показано, что ряд 12-мерных пептидов и связанных с ними каркасных участков обладают антигенсвязывающей активностью, и прокомментировано, что один только CDR3-подобный пептид способен связывать антиген. В работе Heap et al., 2005, J. Gen. Virol., 86: 1791-1800, сообщается, что “микроантитело” (молекула, содержащая один участок CDR) способно связывать антиген, и показано, что циклический пептид из анти-ВИЧ антитела обладает антигенсвязывающей активностью и функцией. В работе Nicaise et al., 2004, Protein Science, 13: 1882-91, показано, что один участок CDR может придавать антигенсвязывающую активность и аффинность к своему лизоцимному антигену.
Таким образом, молекулы антител, имеющие пять, четыре, три или меньшее количество участков CDR способны сохранять антигенсвязывающие свойства полноразмерных антител, производными которых они являются.
Такая молекула антитела может также быть производной полноразмерного антитела или фрагментом такого антитела. При использовании производного оно должно обладать теми же антигенсвязывающими характеристиками, что и соответствующее полноразмерное антитело, в том смысле, что оно связывается с тем же эпитопом на мишени, что и полноразмерное антитело.
Таким образом, под термином «молекула антитела», который употребляется в настоящей заявке, понимаются все типы молекул антител и их функциональные фрагменты, а также их производные, включая: моноклональные антитела, поликлональные антитела, синтетические антитела, рекомбинантно полученные антитела, мультиспецифичные антитела, биспецифичные антитела, человеческие антитела, антитела человеческого происхождения, гуманизированные антитела, химерные антитела, одноцепочечные антитела, одноцепочечные Fvs (scFv), фрагменты Fab, фрагменты F(ab')2, фрагменты F(ab'), Fvs (sdFv) с дисульфидной связью, тяжелые цепи антител, легкие цепи антител, гомодимеры тяжелых цепей антител, гомодимеры легких цепей антител, гетеродимеры тяжелых цепей антител, гетеродимеры легких цепей антител, антигенсвязывающие функциональные фрагменты таких гомо- и гетеродимеров.
Кроме того, термин «молекула антитела», употребляемый в настоящей заявке, включает все классы молекул антител и функциональных фрагментов, включая: IgG, IgG1, IgG2, IgG3, IgG4, IgA, IgM, IgD и IgE, если не указано иное.
В некоторых вариантах реализации изобретения это антитело является человеческим IgG1. Специалист в области иммунологии будет утверждать, что мышиный иммуноглобулин IgG2a и человеческий иммуноглобулин IgG1 взаимодействуют с активирующими Fc-гамма-рецепторами и демонстрируют способность активировать делецию клеток-мишеней посредством активации активирующих Fc-гамма-рецепторов, имеющих иммунные клетки, например, ADCP и ADCC. Таким образом, в вариантах реализации изобретения, где мышиный иммуноглобулин IgG2a является предпочтительным изотипом для делеции у мыши, человеческий иммуноглобулин IgG1 является предпочтительным изотипом для делеции у человека в таких вариантах реализации изобретения.
Как указывается выше, настоящее изобретение включает в себя различные типы и формы молекул антител, которые должны быть известны специалисту в области иммунологии. Хорошо известно, что антитела, применяющиеся в терапевтических целях, часто модифицируются дополнительными компонентами, которые изменяют свойства молекулы антитела.
Соответственно, в настоящей заявке учитывается, что молекула антитела по настоящему изобретению или молекула антитела, применяющаяся в соответствии с настоящим изобретением (например, молекула моноклонального антитела и/или молекула поликлональого антитела, и/или молекула биспецифического антитела), содержит обнаруживаемый фрагмент молекулы и/или цитотоксический фрагмент молекулы.
Под «обнаруживаемым фрагментом молекулы» нами подразумевается одна или большее количество групп, состоящих из: фермента, радиоактивного атома, флуоресцентного фрагмента молекулы, хемилюминесцентного фрагмента молекулы, биолюминесцентного фрагмента молекулы. Обнаруживаемый фрагмент молекулы позволяет визуализировать молекулу антитела in vitro и/или in vivo, и/или ex vivo.
Под «цитотоксическим фрагментом молекулы» в настоящем изобретении подразумевается радиоактивная часть и/или фермент, причем фермент является каспазой; и/или токсин, причем токсин является бактериальным токсином или ядом; причем цитотоксический фрагмент способен индуцировать лизис клеток.
Также в настоящем изобретении подразумевается, что молекула антитела может быть в изолированной форме и/или очищенной форме, и/или может быть пегилирована. Пегилирование - это способ, с помощью которого полимеры полиэтиленгликоля добавляются к молекуле, такой как молекула антитела или производное, с целью изменить ее поведение, например, продлить период полураспада путем увеличения ее гидродинамического размера, препятствуя выведению почками.
Как уже обсуждалось выше, участки антитела, определяющие комплементарность (CDR), связываются с антителом-мишенью. Назначение аминокислот каждому участку CDR, описанному в настоящей заявке, соответствует определениям, согласно работе Kabat EA et al. 1991, в «Sequences of Proteins of Immunological Interest» (последовательности белков, представляющих иммунологический интерес), пятое издание, публикация NIH No. 91-3242, pp xv- xvii.
Как может быть известно специалисту в области иммунологии, существуют и другие способы назначения аминокислот каждому участку CDR. Например, Международная информационная система иммуногенетики (IMGT (R)) (http://www.imgt.org / и книга иммунологических фактов, Lefranc и Lefranc, опубликованные издательством Academic Press, 2001).
В дополнительном варианте реализации изобретения молекула антитела по настоящему изобретению или используемая в соответствии с настоящим изобретением, представляет собой молекулу антитела, которое способно конкурировать со специфическими антителами, представленными в настоящей заявке, например, с молекулами антител, содержащими любую из аминокислотных последовательностей, указанных, например, в последовательностях SEQ ID NO: 1-194, для связывания со специфической мишенью.
Под «способное конкурировать за» подразумевается то, что конкурирующее антитело способно ингибировать или иным образом вмешиваться, по меньшей мере частично, в связывание молекулы антитела, как определено в настоящей заявке, с конкретной мишенью.
Например, такая молекула конкурирующего антитела может быть способна ингибировать связывание описанной здесь молекулы антитела, как минимум приблизительно на 10%; например, как минимум приблизительно на 20% или как минимум приблизительно на 30%, как минимум приблизительно на 40%, как минимум приблизительно на 50%, как минимум приблизительно на 60%, как минимум приблизительно на 70%, как минимум приблизительно на 80%, как минимум приблизительно на 90%, как минимум приблизительно на 95%, приблизительно на 100%, и/или ингибировать способность описанного в настоящей заявке антитела препятствовать связыванию или уменьшать связывание со специфической мишенью как минимум приблизительно на 10%, например, как минимум приблизительно на 20%, как минимум приблизительно на 30%, как минимум приблизительно на 40%, как минимум приблизительно на 50%, как минимум приблизительно на 60%, как минимум приблизительно на 70%, как минимум приблизительно на 80%, как минимум приблизительно на 90%, как минимум приблизительно на 95% или приблизительно на 100%.
Конкурентное связывание может быть определено способами, хорошо известными специалистам в данной области, такими как иммуноферментный анализ (ИФА).
Анализы ИФА можно применять для оценки эпитоп-модифицирующих или блокирующих антител. Дополнительные способы, пригодные для выявления конкурирующего антитела, описаны в лабораторном руководстве Antibodies: A Laboratory Manual, Harlow & Lane («Антитела: Лабораторное руководство», авторы - Харлоу и Лейн), которое включено в настоящую заявку посредством ссылки (например, см. стр. 567 - 569, 574 - 576, 583 и 590 - 612, 1988, CSHL, NY, ISBN 0-87969-314-2).
Хорошо известно, что антитело специфично связывается или взаимодействует с определенной целевой молекулой или антигеном. Иными словами, антитело предпочтительно и избирательно связывает свою мишень, а не молекулу, которая не является мишенью.
Мишени антител согласно настоящему изобретению или антител, используемых в соответствии с настоящим изобретением, экспрессируются на поверхности клеток, т.е. они являются поверхностным клеточным антигеном, который может включать эпитоп (также известный в контексте настоящей заявки как эпитоп поверхности клетки) для этого антитела. Поверхностный клеточный антиген и эпитоп - это термины, которые может легко понять специалист в области иммунологии или клеточной биологии.
Под «поверхностным клеточным антигеном» в настоящей заявке подразумевается то, что поверхностный клеточный антиген расположен на внеклеточной стороне клеточной мембраны, но может располагаться на внеклеточной стороне клеточной мембраны только временно. Под «временно располагаться» в настоящей заявке подразумевается то, что поверхностный клеточный антиген может быть интернализован в клетку или высвобожден с внеклеточной стороны клеточной мембраны во внеклеточное пространство. Антиген клеточной поверхности может высвобождаться с внеклеточной стороны клеточной мембраны путем расщепления, которое может быть опосредовано протеазой.
Поверхностный клеточный антиген может высвобождаться с внеклеточной стороны клеточной мембраны путем расщепления, которое может происходить при участии протеазы. Термин «временно связанный» означает, что антиген клеточной поверхности может высвобождаться с внеклеточной стороны клеточной мембраны во внеклеточное пространство. Поверхностный клеточный антиген может высвобождаться с внеклеточной стороны клеточной мембраны путем расщепления, которое может происходить при участии протеазы.
В настоящей заявке также подразумевается то, что поверхностный клеточный антиген может быть пептидом, или полипептидом, или углеводом, или олигосахаридной цепью, или липидом, и/или эпитопом, который присутствует на белке или гликопротеине, или липопротеине.
Способы оценки связывания белков известны специалистам в области биохимии и иммунологии. Было бы желательно, чтобы специалисты могли применять эти способы для оценки связывания антитела с мишенью и/или связывания участка Fc антитела с рецептором Fc, а также для оценки относительной силы или специфичности, или ингибирования, или уменьшения этих взаимодействий, или препятствования этим взаимодействиям. Примерами способов, которые можно применять для оценки связывания белков, являются, например, иммуноанализ, анализ межклеточного взаимодействия с помощью систем BIAcore, вестерн-блоттинг, радиоиммуноанализ (RIA) и иммуноферментный анализ (ИФА) (обсуждения специфичности антител см. в Fundamental Immunology Second Edition, Raven Press, New York, на страницах 332-336 (1989) (для обсуждения специфичности антитела см. «Фундаментальную иммунологию», второе издание, Raven Press, New York) (1989).
Соответственно, под «молекулой антитела, специфично связывающейся» или «молекулой антитела, специфичной для мишени» в настоящей заявке подразумеваем то, что молекула антитела специфично связывается с мишенью, но не связывается с участком, не являющимся мишенью, или связывается с участком, не являющимся мишенью (таким участком, как участок с более низким сродством), более слабо, чем с мишенью.
Также настоящая заявка включает концепцию того, что антитело специфично связывается с мишенью как минимум в два раза сильнее, или как минимум в пять раз сильнее, или как минимум в 10 раз сильнее, или как минимум в 20 раз сильнее, или как минимум в 50 раз сильнее, или как минимум в 100 раз сильнее, или как минимум в 200 раз сильнее, или как минимум в 500 раз сильнее, или как минимум приблизительно в 1000 раз сильнее, чем с участком, не являющимся мишенью.
Кроме того настоящая заявка включает концепцию того, что антитело специфично связывается с мишенью, если оно связывается с мишенью с Kd как минимум приблизительно 10-1 Kd, или как минимум приблизительно 10-2 Kd, или как минимум приблизительно 10-3 Kd, или как минимум приблизительно 10-4 Kd, или как минимум приблизительно 10-5 Kd, или как минимум приблизительно 10-6 Kd, или как минимум приблизительно 10-7 Kd, или как минимум приблизительно 10-8 Kd, или как минимум приблизительно 10-9 Kd, или как минимум приблизительно 10-10 Kd, или как минимум приблизительно 10-11 Kd, или как минимум приблизительно 10-12 Kd, или как минимум приблизительно 10-13 Kd, или как минимум приблизительно 10-14 Kd, или как минимум приблизительно 10-15 Kd.
Употребляющийся в настоящей заявке термин «молекула антитела, истощающая иммунную клетку», или «молекула антитела, дезактивирующая иммунную клетку», относится к молекуле антитела, которая при введении пациенту специфично связывается с мишенью, экспрессируемой на поверхности иммунной клетки, причем это связывание приводит к истощению или дезактивации иммунной клетки. В некоторых вариантах реализации изобретения такой мишенью является мишень, которая преимущественно экспрессируется на опухоли или в микросреде опухоли.
Чтобы решить, является или нет молекула антитела молекулой иммунной клетки, истощающей молекулу антитела, в концепции настоящего изобретения, можно применить анализ in vitro антителозависимой клеточной цитотоксичности (ADCC) или антителозависимого клеточного фагоцитоза (ADCP). Чтобы решить, является ли молекула антитела молекулой иммунной клетки, истощающей молекулу антитела, тот же анализ будет выполнен в присутствии истощающего антитела и без истощающего антитела, что покажет, действительно ли истощающее антитело, которое тестируется, является истощающим.
Анализ ADCC можно провести путем маркировки клеток-мишеней кальцеином АМ (ацетилметиловый эфир) с последующим добавлением разбавляющих концентраций антитела. Затем клетки-мишени культивируют с мононуклеарными клетками периферической крови человека (PBMC) в соотношении эффектор: мишень (E : T) 50 : 1 в течение 4 ч при температуре 37°C. Планшет центрифугируют при центробежном ускорении 400 g в течение 5 мин для получения осадка клеток в пробирке после центрифугирования, а надосадочную жидкость переносят на белый 96-луночный планшет. Высвобождение кальцеина измеряют с помощью прибора Varioskan (Thermo Scientific) с длиной волны возбуждения 485 нм и длиной волны излучения 530 нм. Процент максимального высвобождения рассчитывается следующим образом: % максимального высвобождения = (образец/обработанный тритоном) * 100.
Анализ ADCP можно провести путем маркировки клеток-мишеней с помощью 5 мМ карбоксифлуоресцеин сукцинимидилового эфира (CFSE) в течение 10 мин при комнатной температуре перед промывкой в среде, содержащей эмбриональную телячью сыворотку. Затем меченные CFSE мишени опсонизируют разбавляющими концентрациями антитела перед совместным культивированием с макрофагами костномозгового происхождения (BMDM) в соотношении 1: 5 E:T в 96-луночных пластинах в течение 1 ч при температуре 37°C. Затем макрофаги костномозгового происхождения (BMDM) маркируют анти-F4/80-аллофикоцианином в течение 15 мин при комнатной температуре и промывают дважды фосфатно солевым буфером (PBS). Планшеты выдерживают на льду, лунки выскабливают для сбора макрофагов костномозгового происхождения (BMDM), а фагоцитоз оценивают способом проточной цитометрии с помощью аналитической системы FACSCalibur (BD) для определения процентного содержания клеток F4/80+CFSE+ в популяции клеток F4/80+.
Также можно использовать способ, описано Cleary и соавторами в J Immunol, April 12, 2017, 1601473.
В некоторых вариантах реализации изобретения молекула антитела, которая специфично связывает FcyRIIb, является человеческим антителом.
В некоторых вариантах реализации изобретения молекула антитела, которая специфично связывает FcyRIIb, является антителом человеческого происхождения, т.е. первоначально человеческим антителом, которое было модифицировано, как описано в настоящей заявке.
В некоторых вариантах реализации изобретения молекула антитела, которая специфично связывает FcyRIIb, является гуманизированным антителом, т.е. первоначально нечеловеческим антителом, которое было модифицировано для увеличения его подобия с человеческим антителом. Гуманизированные антитела могут быть, например, мышиными антителами или антителами ламы.
В некоторых вариантах реализации изобретения молекула антитела, которая специфично связывает FcyRIIb, содержит следующие константные участки (CH и CL):
IgG1-CH [SEQ ID NO: 1]
ASTKGPSVFPLAPSSKSTSGGTAALGCLVKDYFPEPVTVSWNSGALTSGVHTFPAVLQSSGLYSLSSVVTVPSSSLGTQTYICNVNHKPSNTKVDKKVEPKSCDKTHTCPPCPAPELLGGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSHEDPEVKFNWYVDGVEVHNAKTKPREEQYNSTYRVVSVLTVLHQDWLNGKEYKCKVSNKALPAPIEKTISKAKGQPREPQVYTLPPSRDELTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSKLTVDKSRWQQGNVFSCSVMHEALHNHYTQKSLSLSPGK
IgG1-CL [SEQ ID NO: 2]
QPKAAPSVTLFPPSSEELQANKATLVCLISDFYPGAVTVAWKADSSPVKAGVETTTPSKQSNNKYAASSYLSLTPEQWKSHRSYSCQVTHEGSTVEKTVAPTECS
Эти константные участки (SEQ ID NO: 1 и SEQ ID NO: 2) имеют человеческое происхождение. Участок Fc дополнительно модифицируется для снижения связывания с рецепторами Fcy посредством его области Fc. Как упоминается в настоящей заявке, в некоторых вариантах реализации изобретения предпочтительно, чтобы последовательность SEQ ID NO: 1 была агликозилирована путем замещения N297Q, тогда IgG1-CH имеет следующую последовательность CH [SEQ ID NO: 195], причем остаток 297 Q отмечен жирным шрифтом:
ASTKGPSVFPLAPSSKSTSGGTAALGCLVKDYFPEPVTVSWNSGALTSGVHTFPAVLQSSGLYSLSSVVTVPSSSLGTQTYICNVNHKPSNTKVDKKVEPKSCDKTHTCPPCPAPELLGGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSHEDPEVKFNWYVDGVEVHNAKTKPREEQY Q STYRVVSVLTVLHQDWLNGKEYKCKVSNKALPAPIEKTISKAKGQPREPQVYTLPPSRDELTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSKLTVDKSRWQQGNVFSCSVMHEALHNHYTQKSLSLSPGK
В некоторых вариантах реализации изобретения и/или примерах применяются молекулы мышиных антител. Их также можно применять для получения суррогатных антител Тогда они могут включать следующие константные участки (CH и CL):
CH [SEQ ID NO: 196]
AKTTAPSVYPLAPVCGDTTGSSVTLGCLVKGYFPEPVTLTWNSGSLSSGVHTFPAVLQSDLYTLSSSVTVTSSTWPSQSITCNVAHPASSTKVDKKIEPRGPTIKPCPPCKCPAPNLLGGPSVFIFPPKIKDVLMISLSPIVTCVVVDVSEDDPDVQISWFVNNVEVHTAQTQTHREDY STLRVVSALPIQHQDWMSGKEFKCKVNNKDLPAPIERTISKPKGSVRAPQVYVLPPPEEEMTKKQVTLTCMVTDFMPEDIYVEWTNNGKTELNYKNTEPVLDSDGSYFMYSKLRVEKKNWVERNSYSCSVVHEGLHNHHTTKSFSRTPGK
CL [SEQ ID NO: 197]
QPKSSPSVTLFPPSSEELETNKATLVCTITDFYPGVVTVDWKVDGTPVTQGMETTQPSKQSNNKYMASSYLTLTARAWERHSSYSCQVTHEGHTVEKSLSRADCS
Таким образом, эти константные участки (SEQ ID NO: 196 и SEQ ID NO: 197) имеют мышиное происхождение. Последовательность SEQ ID NO: 196 содержит мутацию N297A (в приведенной выше последовательности остаток 297 A выделен жирным шрифтом). Эта мутация N297A в мышиной последовательности соответствует мутации N297Q в человеческой последовательности.
В некоторых вариантах реализации изобретения молекула антитела, которая специфично связывает FcyRIIb, содержит одну или большее количество последовательностей следующих клонов:
Клон антитела: 1A01
1A01-VH [SEQ ID NO: 3]
EVQLLESGGGLVQPGGSLRLSCAASGFTFSDYYMNWIRQTPGKGLEWVSLIGWDGGSTYYADSVKGRFTISRDNSENTLYLQMNSLRAEDTAVYYCARAYSGYELDYWGQGTLVTVSS
1A01-VL [SEQ ID NO: 27]
QSVLTQPPSASGTPGQRVTISCSGSSSNIGNNAVNWYQQLPGTAPKLLIYDNNNRPSGVPDRFSGSKSGTSASLAISGLRSEDEADYYCAAWDDSLNASIFGGGTKLTVLG
Участки, определяющие комплементарность CDR
CDRH1: DYYMN [SEQ ID NO: 51]
CDRH2: LIGWDGGSTYYADSVKG [SEQ ID NO: 52]
CDRH3: AYSGYELDY [SEQ ID NO: 53]
CDRL1: SGSSSNIGNNAVN [SEQ ID NO: 54]
CDRL2: DNNNRPS [SEQ ID NO: 55]
CDRL3: AAWDDSLNASI [SEQ ID NO: 56]
Клон антитела: 1B07
1B07-VH [SEQ ID NO: 4]
EVQLLESGGGLVQPGGSLRLSCAASGFTFSSYGMHWVRQAPGKGLEWVAFTRYDGSNKYYADSVRGRFTISRDNSKNTLYLQMNSLRAEDTAVYYCARENIDAFDVWGQGTLVTVSS
1B07-VL [SEQ ID NO: 28]
QSVLTQPPSASGTPGQRVTISCSGSSSNIGNNAVNWYQQLPGTAPKLLIYDNQQRPSGVPDRFSGSKSGTSASLAISGLRSEDEADYYCEAWDDRLFGPVFGGGTKLTVLG
Участки CDR
CDRH1: SYGMH [SEQ ID NO: 57]
CDRH2: FTRYDGSNKYYADSVRG [SEQ ID NO: 58]
CDRH3: ENIDAFDV [SEQ ID NO: 59]
CDRL1: SGSSSNIGNNAVN [SEQ ID NO: 60]
CDRL2: DNQQRPS [SEQ ID NO: 61]
CDRL3: WDDRLFGPV [SEQ ID NO: 62]
Клон антитела: 1C04
1C04-VH [SEQ ID NO: 5]
EVQLLESGGGLVQPGGSLRLSCAASGFTFSSYAMSWVRQAPGKGLEWVSSISDSGAGRYYADSVEGRFTISRDNSKNTLYLQMNSLRAEDTAVYYCARTHDSGELLDAFDIWGQGTLVTVSS
1C04-VL [SEQ ID NO: 29]
QSVLTQPPSASGTPGQRVTISCSGSSSNIGSNHVLWYQQLPGTAPKLLIYGNSNRPSGVPDRFSGSKSGTSASLAISGLRSEDEADYYCAAWDDSLNGWVFGGGTKLTVLG
Участки CDR
CDRH1: SYAMS [SEQ ID NO: 63]
CDRH2: SISDSGAGRYYADSVEG [SEQ ID NO: 64]
CDRH3: THDSGELLDAFDI [SEQ ID NO: 65]
CDRL1: SGSSSNIGSNHVL [SEQ ID NO: 66]
CDRL2: GNSNRPS [SEQ ID NO: 67]
CDRL3: AAWDDSLNGWV [SEQ ID NO: 68]
Клон антитела: 1E05
1E05-VH [SEQ ID NO: 6]
EVQLLESGGGLVQPGGSLRLSCAASGFTFSTYAMNWVRQVPGKGLEWVAVISYDGSNKNYVDSVKGRFTISRDNSKNTLYLQMNSLRAEDTAVYYCARNFDNSGYAIPDAFDIWGQGTLVTVSS
1E05-VL [SEQ ID NO: 30]
QSVLTQPPSASGTPGQRVTISCTGSSSNIGAGYDVHWYQQLPGTAPKLLIYDNNSRPSGVPDRFSGSKSGTSASLAISGLRSEDEADYYCAAWDDSLGGPVFGGGTKLTVLG
Участки CDR
CDRH1: TYAMN [SEQ ID NO: 69]
CDRH2: VISYDGSNKNYVDSVKG [SEQ ID NO: 70]
CDRH3: NFDNSGYAIPDAFDI [SEQ ID NO: 71]
CDRL1: TGSSSNIGAGYDVH [SEQ ID NO: 72]
CDRL2: DNNSRPS [SEQ ID NO: 73]
CDRL3: AAWDDSLGGPV [SEQ ID NO: 74]
Клон антитела: 2А09
2A09-VH [SEQ ID NO: 7]
EVQLLESGGGLVQPGGSLRLSCAASGFTFSNAWMSWVRQAPGKGLEWVAYISRDADITHYPASVKGRFTISRDNSKNTLYLQMNSLRAEDTAVYYCTTGFDYAGDDAFDIWGQGTLVTVSS
2A09-VL [SEQ ID NO: 31]
QSVLTQPPSASGTPGQRVTISCSGSSSNIGSNAVNWYQQLPGTAPKLLIYGNSDRPSGVPDRFSGSKSGTSASLAISGLRSEDEADYYCAAWDDSLNGRWVFGGGTKLTVLG
Участки CDR
CDRH1: NAWMS [SEQ ID NO: 75]
CDRH2: YISRDADITHYPASVKG [SEQ ID NO: 76]
CDRH3: GFDYAGDDAFDI [SEQ ID NO: 77]
CDRL1: SGSSSNIGSNAVN [SEQ ID NO: 78]
CDRL2: GNSDRPS [SEQ ID NO: 79]
CDRL3: AAWDDSLNGRWV [SEQ ID NO: 80]
Клон антитела: 2B08
2B08-VH [SEQ ID NO: 8]
EVQLLESGGGLVQPGGSLRLSCAASGFTFSDYYMSWVRQAPGKGLEWVALIGHDGNNKYYLDSLEGRFTISRDNSKNTLYLQMNSLRAEDTAVYYCARATDSGYDLLYWGQGTLVTVSS
2B08-VL [SEQ ID NO: 32]
QSVLTQPPSASGTPGQRVTISCSGSSSNIGNNAVNWYQQLPGTAPKLLIYYDDLLPSGVPDRFSGSKSGTSASLAISGLRSEDEADYYCTTWDDSLSGVVFGGGTKLTVLG
Участки CDR
CDRH1: DYYMS [SEQ ID NO: 81]
CDRH2: LIGHDGNNKYYLDSLEG [SEQ ID NO: 82]
CDRH3: ATDSGYDLLY [SEQ ID NO: 83]
CDRL1: SGSSSNIGNNAVN [SEQ ID NO: 84]
CDRL2: YDDLLPS [SEQ ID NO: 85]
CDRL3: TTWDDSLSGVV [SEQ ID NO: 86]
Клон антитела: 2E8-VH
2E8-VH [SEQ ID NO: 9]
EVQLLESGGGLVQPGGSLRLSCAASGFTFSDYYMSWIRQAPGKGLEWVSAIGFSDDNTYYADSVKGRFTISRDNSKNTLYLQMNSLRAEDTAVYYCAGGDGSGWSFWGQGTLVTVSS
2E8-VL [SEQ ID NO: 33]
QSVLTQPPSASGTPGQRVTISCSGSSSNIGNNAVNWYQQLPGTAPKLLIYDNNKRPSGVPDRFSGSKSGTSASLAISGLRSEDEADYYCATWDDSLRGWVFGGGTKLTVLG
Участки CDR
CDRH1: DYYMS [SEQ ID NO: 87]
CDRH2: AIGFSDDNTYYADSVKG [SEQ ID NO: 88]
CDRH3: GDGSGWSF [SEQ ID NO: 89]
CDRL1: SGSSSNIGNNAVN [SEQ ID NO: 90]
CDRL2: DNNKRPS [SEQ ID NO: 91]
CDRL3: ATWDDSLRGWV [SEQ ID NO: 92]
Клон антитела: 5C04
5C04-VH [SEQ ID NO: 10]
EVQLLESGGGLVQPGGSLRLSCAASGFTFSNYGMHWVRQAPGKGLEWVAVISYDGSNKYYADSVKGRFTISRDNSKNTLYLQMNSLRAEDTAVYYCAREWRDAFDIWGQGTLVTVSS
5C04-VL [SEQ ID NO: 34]
QSVLTQPPSASGTPGQRVTISCTGSSSNIGAGYDVHWYQQLPGTAPKLLIYSDNQRPSGVPDRFSGSKSGTSASLAISGLRSEDEADYYCAAWDDSLSGSWVFGGGTKLTVLG
Участки CDR
CDRH1: NYGMH [SEQ ID NO: 93]
CDRH2: VISYDGSNKYYADSVKG [SEQ ID NO: 94]
CDRH3: WRDAFDI [SEQ ID NO: 95]
CDRL1: TGSSSNIGAGYDVH [SEQ ID NO: 96]
CDRL2: SDNQRPS [SEQ ID NO: 97]
CDRL3: AAWDDSLSGSWV [SEQ ID NO: 98]
Клон антитела: 5C05
5C05-VH [SEQ ID NO: 11]
EVQLLESGGGLVQPGGSLRLSCAASGFTFSTYGMHWVRQAPGKGLEWVAVISYDGSNKYYADSVKGRFTISRDNSKNTLYLQMNSLRAEDTAVYYCARENFDAFDVWGQGTLVTVSS
5C05-VL [SEQ ID NO: 35]
QSVLTQPPSASGTPGQRVTISCTGSSSNIGAGYDVHWYQQLPGTAPKLLIYSNSQRPSGVPDRFSGSKSGTSASLAISGLRSEDEADYYCAAWDDSLNGQVVFGGGTKLTVLG
Участок CDR
CDRH1: TYGMH [SEQ ID NO: 99]
CDRH2: VISYDGSNKYYADSVKG [SEQ ID NO: 100]
CDRH3: ENFDAFDV [SEQ ID NO: 101]
CDRL1: TGSSSNIGAGYDVH [SEQ ID NO: 102]
CDRL2: SNSQRPS [SEQ ID NO: 103]
CDRL3: AAWDDSLNGQVV [SEQ ID NO: 104]
Клон антитела: 5D07
5D07-VH [SEQ ID NO: 12]
EVQLLESGGGLVQPGGSLRLSCAASGFTFSTYGMHWVRQAPGKGLEWVAVIAYDGSKKDYADSVKGRFTISRDNSKNTLYLQMNSLRAEDTAVYYCAREYRDAFDIWGQGTLVTVSS
5D07-VL [SEQ ID NO: 36]
QSVLTQPPSASGTPGQRVTISCTGSSSNIGAGYDVHWYQQLPGTAPKLLIYGNSNRPSGVPDRFSGSKSGTTASLAISGLRSEDEADYYCAAWDDSVSGWMFGGGTKLTVLG
Участки CDR
CDRH1: TYGMH [SEQ ID NO: 105]
CDRH2: VIAYDGSKKDYADSVKG [SEQ ID NO: 106]
CDRH3: EYRDAFDI [SEQ ID NO: 107]
CDRL1: TGSSSNIGAGYDVH [SEQ ID NO: 108]
CDRL2: GNSNRPS [SEQ ID NO: 109]
CDRL3: AAWDDSVSGWM [SEQ ID NO: 110]
Клон антитела: 5E12
5E12-VH [SEQ ID NO: 13]
EVQLLESGGGLVQPGGSLRLSCAASGFTFSSYGMHWVRQAPGKGLEWVAVISYDGINKDYADSMKGRFTISRDNSKNTLYLQMNSLRAEDTAVYYCARERKDAFDIWGQGTLVTVSS
5E12-VL [SEQ ID NO: 37]
QSVLTQPPSASGTPGQRVTISCTGSSSNIGAGYDVHWYQQLPGTAPKLLIYSNNQRPSGVPDRFSGSKSGTSASLAISGLRSEDEADYYCATWDDSLNGLVFGGGTKLTVLG
Участки CDR
CDRH1: SYGMH [SEQ ID NO: 111]
CDRH2: VISYDGINKDYADSMKG [SEQ ID NO: 112]
CDRH3: ERKDAFDI [SEQ ID NO: 113]
CDRL1: TGSSSNIGAGYDVH [SEQ ID NO: 114]
CDRL2: SNNQRPS [SEQ ID NO: 115]
CDRL3: ATWDDSLNGLV [SEQ ID NO: 116]
Клон антитела: 5G08
5G08-VH [SEQ ID NO: 14]
EVQLLESGGGLVQPGGSLRLSCAASGFTFNNYGMHWVRQAPGKGLEWVAVISYDGSNRYYADSVKGRFTMSRDNSKNTLYLQMNSLRAEDTAVYYCARDRWNGMDVWGQGTLVTVSS
5G08-VL [SEQ ID NO: 38]
QSVLTQPPSASGTPGQRVTISCSGSSSNIGAGYDVHWYQQLPGTAPKLLIYANNQRPSGVPDRFSGSKSGTSASLAISGLRSEDEADYYCAAWDDSLNGPWVFGGGTKLTVLG
Участки CDR
CDRH1: NYGMH [SEQ ID NO: 117]
CDRH2: VISYDGSNRYYADSVKG [SEQ ID NO: 118]
CDRH3: DRWNGMDV [SEQ ID NO: 119]
CDRL1: SGSSSNIGAGYDVH [SEQ ID NO: 120]
CDRL2: ANNQRPS [SEQ ID NO: 121]
CDRL3: AAWDDSLNGPWV [SEQ ID NO: 122]
Клон антитела: 5H06
5H06-VH [SEQ ID NO: 15]
EVQLLESGGGLVQPGGSLRLSCAASGFTFSSYGMHWVRQAPGKGLEWVAVISYDGSDTAYADSVKGRFTISRDNSKNTLYLQMNSLRAEDTAVYYCARDHSVIGAFDIWGQGTLVTVSS
5H06-VL [SEQ ID NO: 39]
QSVLTQPPSASGTPGQRVTISCSGSSSNIGSNTVNWYQQLPGTAPKLLIYDNNKRPSGVPDRFSGSKSGTSASLAISGLRSEDEADYYCSSYAGSNNVVFGGGTKLTVLG
Участки CDR
CDRH1: SYGMH [SEQ ID NO: 123]
CDRH2: VISYDGSDTAYADSVKG [SEQ ID NO: 124]
CDRH3: DHSVIGAFDI [SEQ ID NO: 125]
CDRL1: SGSSSNIGSNTVN [SEQ ID NO: 126]
CDRL2: DNNKRPS [SEQ ID NO: 127]
CDRL3: SSYAGSNNVV [SEQ ID NO: 128]
Клон антитела: 6А09
6A09-VH [SEQ ID NO: 16]
EVQLLESGGGLVQPGGSLRLSCAASGFTFSSYGMHWVRQAPGKGLEWVAVTSYDGNTKYYANSVKGRFTISRDNSKNTLYLQMNSLRAEDTAVYYCAREDCGGDCFDYWGQGTLVTVSS
6A09-VL [SEQ ID NO: 40]
QSVLTQPPSASGTPGQRVTISCTGSSSNIGAGYDVHWYQQLPGTAPKLLIYGNSNRPSGVPDRFSGSKSGTSASLAISGLRSEDEADYYCAAWDDSLNEGVFGGGTKLTVLG
Участки CDR
CDRH1: SYGMH [SEQ ID NO: 129]
CDRH2: VTSYDGNTKYYANSVKG [SEQ ID NO: 130]
CDRH3: EDCGGDCFDY [SEQ ID NO: 131]
CDRL1: TGSSSNIGAGYDVH [SEQ ID NO: 132]
CDRL2: GNSNRPS [SEQ ID NO: 133]
CDRL3: AAWDDSLNEGV [SEQ ID NO: 134]
Клон антитела: 6В01
6B01-VH [SEQ ID NO: 17]
EVQLLESGGGLVQPGGSLRLSCAASGFTFSNYGMHWVRQAPGKGLEWVAVISYDGSNKYYADSVKGRFTISRDNSKNTLYLQMNSLRAEDTAVYYCARDQLGEAFDIWGQGTLVTVSS
6B01-VL [SEQ[SEQ ID NO: 41]
QSVLTQPPSASGTPGQRVTISCTGSSSNIGAGYDVHWYQQLPGTAPKLLIYDNNKRPSGVPDRFSGSKSGTSASLAISGLRSEDEADYYCATWDDSLSGPVFGGGTKLTVLG
Участки CDR
CDRH1: NYGMH [SEQ ID NO: 135]
CDRH2: VISYDGSNKYYADSVKG [SEQ ID NO: 136]
CDRH3: DQLGEAFDI [SEQ ID NO: 137]
CDRL1: TGSSSNIGAGYDVH [SEQ ID NO: 138]
CDRL2: DNNKRPS [SEQ ID NO: 139]
CDRL3: ATWDDSLSGPV [SEQ ID NO: 140]
Клон антитела: 6C11
6C11-VH [SEQ ID NO: 18]
EVQLLESGGGLVQPGGSLRLSCAASGFTFDDYGMSWVRQAPGKGLEWVSAISGSGSSTYYADSVKGRFTISRDNSKNTLYLQMNSLRAEDTAVYYCAGGDIDYFDYWGQGTLVTVSS
6C11-VL [SEQ ID NO: 42]
QSVLTQPPSASGTPGQRVTISCTGSSSNFGAGYDVHWYQQLPGTAPKLLIYENNKRPSGVPDRFSGSKSGTSASLAISGLRSEDEADYYCAAWDDSLNGPVFGGGTKLTVLG
Участки CDR
CDRH1: DYGMS [SEQ ID NO: 141]
CDRH2: AISGSGSSTYYADSVKG [SEQ ID NO: 142]
CDRH3: GDIDYFDY [SEQ ID NO: 143]
CDRL1: TGSSSNFGAGYDVH [SEQ ID NO: 144]
CDRL2: ENNKRPS [SEQ ID NO: 145]
CDRL3: AAWDDSLNGPV [SEQ ID NO: 146]
Клон антитела: 6C12
6C12-VH [SEQ ID NO: 19]
EVQLLESGGGLVQPGGSLRLSCAASGFTFSSYGMHWVRQAPGKGLEWVAVISYDGSNKYYADSVKGRFTISRDNSKNTLYLQMNSLRAEDTAVYYCARERRDAFDIWGQGTLVTVSS
6C12-VL [SEQ ID NO: 43]
QSVLTQPPSASGTPGQRVTISCTGSSSNIGAGYDVHWYQQLPGTAPKLLIYSDNQRPSGVPDRFSGSKSGTSASLAISGLRSEDEADYYCATWDSDTPVFGGGTKLTVLG
Участки CDR
CDRH1: SYGMH [SEQ ID NO: 147]
CDRH2: VISYDGSNKYYADSVKG [SEQ ID NO: 148]
CDRH3: ERRDAFDI [SEQ ID NO: 149]
CDRL1: TGSSSNIGAGYDVH [SEQ ID NO: 150]
CDRL2: SDNQRPS [SEQ ID NO: 151]
CDRL3: ATWDSDTPV [SEQ ID NO: 152]
Клон антитела: 6D01
6D01-VH [SEQ ID NO: 20]
EVQLLESGGGLVQPGGSLRLSCAASGFTFSSYGMHWVRQAPGKGLEWVAVISYDGSNKYYADSVKGRFTISRDNSKNTLYLQMNSLRAEDTAMYYCARDHSAAGYFDYWGQGTLVTVSS
6D01-VL [SEQ ID NO: 44]
QSVLTQPPSASGTPGQRVTISCSGSSSNIGSNTVNWYQQLPGTAPKLLIYGNSIRPSGGPDRFSGSKSGTSASLAISGLRSEDEADYYCASWDDSLSSPVFGGGTKLTVLG
Участки CDR
CDRH1: SYGMH [SEQ ID NO: 153]
CDRH2: VISYDGSNKYYADSVKG [SEQ ID NO: 154]
CDRH3: DHSAAGYFDY [SEQ ID NO: 155]
CDRL1: SGSSSNIGSNTVN [SEQ ID NO: 156]
CDRL2: GNSIRPS [SEQ ID NO: 157]
CDRL3: ASWDDSLSSPV [SEQ ID NO: 158]
Клон антитела: 6G03
6G03-VH [SEQ ID NO: 21]
EVQLLESGGGLVQPGGSLRLSCAASGFTFGSYGMHWVRQAPGKGLEWVSGISWDSAIIDYAGSVKGRFTISRDNSKNTLYLQMNSLRAEDTAVYYCAKDEAAAGAFDIWGQGTLVTVSS
6G03-VL [SEQ ID NO: 45]
QSVLTQPPSASGTPGQRVTISCTGSSSNIGAGYDVHWYQQLPGTAPKLLIYGNTDRPSGVPDRFSGSKSGTSASLAISGLRSEDEADYYCAAWDDSLSGPVVFGGGTKLTVLG
Участки CDR
CDRH1: SYGMH [SEQ ID NO: 159]
CDRH2: GISWDSAIIDYAGSVKG [SEQ ID NO: 160]
CDRH3: DEAAAGAFDI [SEQ ID NO: 161]
CDRL1: TGSSSNIGAGYDVH [SEQ ID NO: 162]
CDRL2: GNTDRPS [SEQ ID NO: 163]
CDRL3: AAWDDSLSGPVV [SEQ ID NO: 164]
Клон антитела: 6G08
6G08-VH [SEQ ID NO: 22]
EVQLLESGGGLVQPGGSLRLSCAASGFTLSSYGISWVRQAPGKGLEWVSGISGSGGNTYYADSVKGRFTISRDNSKNTLYLQMNSLRAEDTAVYYCASSVGAYANDAFDIWGQGTLVTVSS
6G08-VL [SEQ ID NO: 46]
QSVLTQPPSASGTPGQRVTISCTGSSSNIGAGYDVHWYQQLPGTAPKLLIYGDTNRPSGVPDRFSGSKSGTSASLAISGLRSEDEADYYCAAWDDSLNGPVFGGGTKLTVLG
Участки CDR
CDRH1: SYGIS [SEQ ID NO: 165]
CDRH2: GISGSGGNTYYADSVKG [SEQ ID NO: 166]
CDRH3: SVGAYANDAFDI [SEQ ID NO: 167]
CDRL1: TGSSSNIGAGYDVH [SEQ ID NO: 168]
CDRL2: GDTNRPS [SEQ ID NO: 169]
CDRL3: AAWDDSLNGPV [SEQ ID NO: 170]
Клон антитела: 6G11
6G11-VH [SEQ ID NO: 23]
EVQLLESGGGLVQPGGSLRLSCAASGFTFSSYGMHWVRQAPGKGLEWMAVISYDGSNKYYADSVKGRFTISRDNSKNTLYLQMNSLRAEDTAVYYCARELYDAFDIWGQGTLVTVSS
6G11-VL [SEQ ID NO: 47]
QSVLTQPPSASGTPGQRVTISCTGSSSNIGAGYDVHWYQQLPGTAPKLLIYADDHRPSGVPDRFSGSKSGTSASLAISGLRSEDEADYYCASWDDSQRAVIFGGGTKLTVLG
Участки CDR
CDRH1: SYGMH [SEQ ID NO: 171]
CDRH2: VISYDGSNKYYADSVKG [SEQ ID NO: 172]
CDRH3: ELYDAFDI [SEQ ID NO: 173]
CDRL1: TGSSSNIGAGYDVH [SEQ ID NO: 174]
CDRL2: ADDHRPS [SEQ ID NO: 175]
CDRL3: ASWDDSQRAVI [SEQ ID NO: 176]
Клон антитела: 6H08
6H08-VH [SEQ ID NO: 24]
EVQLLESGGGLVQPGGSLRLSCAASGFTFNNYGMHWVRQAPGKGLEWVAVISYDGSNKYYADSVKGRFTISKDNSKNTLYLQMNSLRAEDTAVYYCAREYKDAFDIWGQGTLVTVSS
6H08-VL [SEQ ID NO: 48]
QSVLTQPPSASGTPGQRVTISCTGSSSNIGSNTVNWYQQLPGTAPKLLIYDNNKRPSGVPDRFSGSKSGTSASLAISGLRSEDEADYYCQAWGTGIRVFGGGTKLTVLG
Участки CDR
CDRH1: NYGMH [SEQ ID NO: 177]
CDRH2: VISYDGSNKYYAD SVKG [SEQ ID NO: 178]
CDRH3: EYKDAFDI [SEQ ID NO: 179]
CDRL1: TGSSSNIGSNTVN [SEQ ID NO: 180]
CDRL2: DNNKRPS [SEQ ID NO: 181]
CDRL3: QAWGTGIRV [SEQ ID NO: 182]
Клон антитела: 7C07
7C07-VH [SEQ ID NO: 25]
EVQLLESGGGLVQPGGSLRLSCAASGFTFSSYGMHWVRQAPGKGLEWVAVISYDGSNKYYADSVKGRFTISRDNSQNTLYLQMNSLRAEDTAVYYCAREFGYIILDYWGQGTLVTVSS
7C07-VL [SEQ ID NO: 49]
QSVLTQPPSASGTPGQRVTISCSGSSSNIGSNTVNWYQQLPGTAPKLLIYRDYERPSGVPDRFSGSKSGTSASLAISGLRSEDEADYYCMAWDDSLSGVVFGGGTKLTVLG
Участки CDR
CDRH1: SYGMH [SEQ ID NO: 183]
CDRH2: VISYDGSNKYYADSVKG [SEQ ID NO: 184]
CDRH3: EFGYIILDY [SEQ ID NO: 185]
CDRL1: SGSSSNIGSNTVN [SEQ ID NO: 186]
CDRL2: RDYERPS [SEQ ID NO: 187]
CDRL3: MAWDDSLSGVV [SEQ ID NO: 188]
Клон антитела: 4B02
4B02-VH [SEQ ID NO: 26]
EVQLLESGGGLVQPGGSLRLSCAASGFTFSNHGMHWVRQAPGKGLEWVAVISYDGTNKYYADSVRGRFTISRDNSKNTLYLQMNSLRAEDTAVYYCARETWDAFDVWGQGTLVTVSS
4B02-VL [SEQ ID NO: 50]
QSVLTQPPSASGTPGQRVTISCSGSSSNIGSNNANWYQQLPGTAPKLLIYDNNKRPSGVPDRFSGSKSGTSASLAISGLRSEDEADYYCQAWDSSTVVFGGGTKLTVLG
Участки CDR
CDRH1: NHGMH [SEQ ID NO: 189]
CDRH2: VISYDGTNKYYADSVRG [SEQ ID NO: 190]
CDRH3: ETWDAFDV [SEQ ID NO: 191]
CDRL1: SGSSSNIGSNNAN [SEQ ID NO: 192]
CDRL2: DNNKRPS [SEQ ID NO: 193]
CDRL3: QAWDSSTVV [SEQ ID NO: 194]
В некоторых вариантах реализации изобретения, которые иногда являются предпочтительными вариантами реализации изобретения, молекула антитела, которая специфично связывает FcyRIIb, содержит следующие участки CDR: SEQ ID NO: 171 (CDRH1), SEQ ID NO: 172 (CDRH2), SEQ ID NO: 173 (CDRH3), SEQ ID NO: 174 (CDRL1), SEQ ID NO: 175 (CDRL2) and SEQ ID NO: 176 (CDRL3), т.е. Участки CDR клона 6G11.
В некоторых вариантах реализации изобретения, которые иногда являются предпочтительными вариантами реализации изобретения, молекула антитела, которая специфично связывает FcyRIIb, содержит следующие константные участки: SEQ ID NO: 1 (CH) и SEQ ID NO: 2 (CL); и следующие вариабельные участки: SEQ ID NO: 23 (VL) И SEQ ID NO: 47 (VH), т.е. константные и вариабельные участки клона 6G11, молекула антитела которого была дополнительно модифицирована для уменьшения связывания с рецепторами Fcy через его участок Fc. В некоторых вариантах реализации изобретения, которые иногда являются предпочтительными вариантами реализации изобретения, молекула антитела, которая специфично связывает FcyRIIb, содержит следующие константные участки: SEQ ID NO: 195 (CH) и SEQ ID NO: 2 (CL); и следующие вариабельные участки: SEQ ID NO: 23 (VL) и SEQ ID NO: 47 (VH), т.е. константные и вариабельные участки клона 6G11, включая мутацию N297Q.
В некоторых вариантах реализации изобретения иммунная клетка, истощающая или дезактивирующая молекулу антитела, является молекулой человеческого антитела или молекулой антитела человеческого происхождения. В некоторых таких вариантах реализации изобретения молекула человеческого антитела или молекула антитела человеческого происхождения является антителом IgG. В некоторых таких вариантах реализации изобретения молекула человеческого антитела или молекула антитела человеческого происхождения является антителом IgG1 или IgG2.
В некоторых вариантах реализации изобретения иммунная клетка, истощающая или дезактивирующая молекулу антитела, представляет собой молекулу гуманизированного антитела.
В некоторых вариантах реализации изобретения иммунная клетка, истощающая или дезактивирующая молекулу антитела, является химерным антителом.
Как уже упоминалось выше, иммунная клетка, истощающая или дезактивирующая антитело, должна обладать способностью связываться с рецепторами FcyR.
Мишень, с которой связывается иммунная клетка, истощающая или дезактивирующая молекулу антитела, в соответствии с настоящим изобретением, можно выбрать из группы, состоящей из CTLA-4, 4-1BB, OX40, TNFR2, PD-L1, IL-2R и GITR.
В некоторых вариантах реализации изобретения мишенью, с которой связывается иммунная клетка, истощающая или дезактивирующая молекулу антитела, в соответствии с настоящим изобретением, является CTLA-4. CTLA-4 или CTLA4, который означает цитотоксический Т-лимфоцит-ассоциированный белок 4, также известен как CD152. Это белковый рецептор, который, который функционирует как контрольная точка иммунного ответа, понижает иммунный ответ. CTLA4 конститутивно экспрессируется в регуляторных Т-клетках, но активируется только в обычных Т-клетках после активации - феномена, который особенно заметен при раке. В некоторых таких вариантах реализации изобретения иммунной клеткой, истощающей молекулу антитела, является ипилимумаб (такой, как Yervoy® производства компании Bristol-Myers Squibb). В некоторых таких вариантах реализации изобретения иммунной клеткой, истощающей молекулу антитела, является тремелимумаб (ранее обозначаемый как тицилимумаб и CP-675,206), который является полностью человеческим моноклональным антителом против CTLA-4, разрабатывавшийся ранее компанией Pfizer, а теперь находящийся в клинической разработке компании MedImmune.
В некоторых вариантах реализации настоящего изобретения как минимум одной мишенью является 4-1BB, который также обозначается как CD137 и как член 9 суперсемейства рецепторов фактора некроза опухоли (TNFRSF9). 4-1BB экспрессируется на регуляторных Т-клетках (Treg) после активации CD4+ и CD8+ Т-клеток, и его лигирование требуется для оптимального защитного ответа клеток CD8-Т против вирусов и В-клеточной лимфомы у мышей. Специфические анти-4-1BB антитела увеличивают пролиферацию и выживаемость стимулированных антигеном Т-клеток in vitro и, подобно антителам анти-CD40, антитител анти-4-1BB mAb способствуют противоопухолевому иммунитету в доклинических моделях рака, зависящих в значительной степени от Т-клеток CD8. В некоторых таких вариантах реализации изобретения иммунной клеткой, истощающей молекулу антитела, является урелумаб, агонистическое гуманизированное моноклональное антитело - иммуноглобулин IgG4, разработанное компанией Bristol-Myers Squibb. В некоторых таких вариантах реализации изобретения иммунной клеткой, истощающей молекулу антитела, является утомилумаб (также обозначаемый как PF-05082566, PF-2566 и PF-5082566), человеческий агонист HuCAL mAb иммунной агонистической мишени 4-1BB, разработанной компанией Pfizer.
В некоторых вариантах реализации настоящего изобретения как минимум одной мишенью является OX40. OX40, также известный как член 4 суперсемейства рецепторов фактора некроза опухоли (TNFRSF4) и как CD134, является вторичной ко-стимулирующей иммунной молекулой контрольной точки иммунного ответа. В некоторых таких вариантах реализации изобретения иммунной клеткой, истощающей молекулу антитела, является MEDI6469 (9B12), MEDI0562, PF-04518600, INCAGN01949, BMS-986178, MOXR0916, GSK3174998, MEDI6383 (см., например, таблицу 1, составленную Buchan et al., Blood 2018 131: 39-48).
В некоторых вариантах реализации настоящего изобретения как минимум одной мишенью является TNFR-2. Рецептор 2 фактора некроза опухоли (TNFR-2 или TNFR2), также известный как член 1B суперсемейства рецепторов фактора некроза опухоли (TNFRSF1B) и CD120b, который является мембранным рецептором, связывающим фактор «альфа» некроза опухоли (TNFα).
В некоторых вариантах реализации настоящего изобретения мишенью, с которой связывается иммунная клетка, истощающая или дезактивирующая молекулу антитела, в соответствии с настоящим изобретением, является запрограммированный лиганд смерти 1 (PD-L1), также известный как CD274 или гомолог B7 1 (B7-H1).
В некоторых вариантах реализации настоящего изобретения как минимум одной мишенью является IL-2R. IL-2R также известен как CD25 и высоко экспрессируется преимущественно на регуляторных Т-клетках. В некоторых вариантах реализации настоящего изобретения как минимум одной мишенью является GITR.
В некоторых вариантах реализации настоящего изобретения как минимум одной мишенью является GITR. GITR является членом TNFSFR и также прежде всего экспрессируется на регуляторных Т-клетках.
В некоторых вариантах реализации изобретения молекулу антитела, которая специфично связывает FcyRIIb, и иммунную клетку, истощающую или дезактивирующую молекулу антитела, вводят пациенту одновременно, что означает, что они либо вводятся вместе в одно время, либо по отдельности очень близко друг к другу по времени.
В некоторых вариантах реализации изобретения молекулу антитела, которая специфично связывает FcyRIIb, вводят пациенту до введения иммунной клетки, истощающей или дезактивирующей молекулу антитела. Такое последовательное введение может быть достигнуто путем временного разделения двух антител. Как альтернатива или в комбинации с первым вариантом, последовательное введение может быть также достигнуто путем пространственного разделения двух молекул антитела: молекулу антитела, которое специфично связывает FcyRIIb, вводят интратуморально, так чтобы она достигла области рака до того, как иммунная клетка истощит молекулу антитела; а иммунную клетку затем вводят системно, так чтобы она достигла области рака после молекулы антитела, которая специфично связывает FcyRIIb.
В некоторых вариантах реализации изобретения иммунную клетку, истощающую антитело, вводят пациенту до введения молекулы антитела, которая специфично связывает FcyRIIb. Такое последовательное введение может быть достигнуто, как описано выше.
Специалисту в области медицины может быть известно, что лекарства могут быть модифицированы с помощью различных добавок, например, чтобы изменить скорость всасывания лекарства в организме; и могут быть модифицированы в различных формах, например, чтобы обеспечить определенный путь введения в организм.
Соответственно, в настоящей заявке подразумевается, что композиция и/или антитело, и/или лекарственное средство по настоящему изобретению можно скомбинировать с наполнителем и/или фармацевтически приемлемым носителем, и/или фармацевтически приемлемым разбавителем и/или адъювантом.
В настоящей заявке также подразумевается, что композиция, и/или антитело, и/или лекарственное средство по настоящему изобретению могут быть пригодны для парентерального введения, включая водные и/или неводные стерильные инъекционные растворы, которые могут содержать антиоксиданты, и/или буферы, и/или бактериостатики, и/или растворенные вещества, которые делают состав изотоническим с кровью предполагаемого реципиента; и/или водные и/или неводные стерильные суспензии, которые могут включать суспензирующие агенты и/или загустители. Эта композиция и/или антитело, и/или агент, и/или лекарственное средство по настоящему изобретению могут быть представлены в однодозовых или многодозовых контейнерах, например, в герметичных ампулах и флаконах, и могут храниться в высушенном сублимацией (т.е. лиофилизированном) состоянии, требующем только добавления стерильного жидкого носителя, например воды для инъекций, непосредственно перед применением.
Экстемпоральные инъекционные растворы и суспензии можно приготовить из стерильных порошков и/или гранул, и/или таблеток ранее описанного вида.
Для парентерального введения больным людям суточная доза молекулы антитела, которая специфично связывает FcyRIIb, и/или иммунной клетки, истощающей или дезактивирующей молекулу антитела, как правило, составляет от 1 мг/кг до 20 мг/кг массы тела пациента, а в некоторых случаях даже до 100 мг/кг массы тела пациента; вводится в однократной дозе или в разделенных дозах. Более низкие дозы можно применять в особых обстоятельствах, например, при длительном введении. В любом случае врач определит фактическую дозировку, которая будет наиболее подходящей для каждого отдельного пациента, и которая будет варьировать в зависимости от возраста, веса и реакции конкретного пациента. Приведенные выше дозы являются типовыми для среднего случая. Конечно, могут быть отдельные случаи, когда оправданы более высокие или более низкие диапазоны дозировок, и такие случаи относятся к сфере применения настоящего изобретения.
Как правило, композиция и/или лекарственное средство настоящего изобретения содержит молекулу антитела, которая специфично связывает FcyRIIb, и/или иммунную клетку, истощающую или дезактивирующую антитело, в концентрации в диапазоне приблизительно от 2 мг/мл до 150 мг/мл или приблизительно от 2 мг/мл до 200 мг/мл. В предпочтительном варианте реализации изобретения лекарственные средства и/или композиции по настоящему изобретению будут содержать молекулу антитела, которая специфично связывает FcyRIIb, и/или молекулу иммунной клетки, истощающую или дезактивирующую антитело, в концентрации 10 мг мл.
Как правило, у человека пероральное или парентеральное введение композиции и/или антитела, и/или агента, и/или лекарственного средства по настоящему изобретению является предпочтительным путем введения, поскольку он является наиболее удобным. Для ветеринарного применения композицию и/или антитело, и/или агент, и/или лекарственное средство по настоящему изобретению вводят в виде подходящей приемлемой лекарственной формы в соответствии с обычной ветеринарной практикой, а ветеринарный врач определяет режим дозирования и способ введения, который будет наиболее подходящим для конкретного животного. Таким образом, настоящее изобретение обеспечивает фармацевтическую композицию, содержащую количество антитела и/или агента по настоящему изобретению, эффективное для лечения различных состояний (как описано выше и далее ниже). Предпочтительно, чтобы композиция и/или антитело, и/или агент, и/или лекарственное средство было адаптировано для доставки путем введения, выбранным из группы, включающей: внутривенное (IV); подкожное (SC), внутримышечное (IM) или интратуморальное введение.
В некоторых вариантах реализации изобретения либо молекула первого антитела, либо второе антитело, либо и то и другое, можно вводить с помощью плазмид или вирусов. Такие плазмиды тогда содержат нуклеотидные последовательности, кодирующие либо молекулу первого антитела, либо второе антитело, либо и то и другое. В некоторых вариантах реализации изобретения нуклеотидные последовательности, кодирующие части последовательностей или полные последовательности, либо молекулы первого антитела, либо второго антитела, либо и того и другого, интегрируются в клетку или вирусный геном, либо в вирион вируса; тогда такая клетка или вирус действуют как средство доставки либо для молекулы первого антитела, либо для второго антитела, либо для обоих (или средство доставки для нуклеотидной последовательности, кодирующей либо молекулу первого антитела, либо второе антитело, либо и то и другое). Например, в некоторых вариантах реализации изобретения такой вирус может быть в форме терапевтического онколитического вируса, содержащего нуклеотидные последовательности, кодирующие как минимум одну из молекул антител, описанных в настоящей заявке. В некоторых вариантах реализации изобретения такой онколитический вирус содержит нуклеотидные последовательности, кодирующие полноразмерное человеческое антитело IgG. Онколитические вирусы известны специалистам в области медицины и вирусологии.
Настоящее изобретение также включает композицию и/или антитело, и/или агент, и/или лекарственное средство, содержащее фармацевтически приемлемые кислые или оснóвные аддитивные соли полипептидсвязывающих группировок по настоящему изобретению. Кислоты, которые применяются для получения фармацевтически приемлемых кислых аддитивных солей вышеупомянутых оснóвных соединений, полезных в настоящем изобретении, являются кислотами, которые образуют нетоксичные кислые аддитивные соли, т.е. соли, содержащие фармакологически приемлемые анионы, в частности, такие как соли гидрохлорид, гидробромид, гидройодид, нитрат, сульфат, бисульфат, фосфат, кислый фосфат, ацетат, лактат, цитрат, кислый цитрат, тартрат, битартрат, сукцинат, малеат, фумарат, глюконат, сахарат, бензоат, метансульфонат, этансульфонат, бензолсульфонат, п-толуолсульфонат и памоат [т.е. 1 ,1' - метилен-бис-(2-гидрокси-3 нафтоат)]. Фармацевтически приемлемые оснóвные аддитивные соли также можно применять для получения фармацевтически приемлемых солевых форм агентов согласно настоящему изобретению. Химические основания, которые можно применять в качестве реактивов для получения фармацевтически приемлемых оснóвных солей настоящих агентов, которые являются кислотными по своей природе, являются химические основания, которые образуют с такими соединениями нетоксичные оснóвные соли. Такие нетоксичные оснóвные соли включают, но не ограничиваются ими, нетоксичные оснóвные соли, являющиеся производными таких фармакологически приемлемых катионов, как катионы щелочных металлов (например, калия и натрия) и катионы щелочноземельных металлов (например, калция и магния). кальций и магний), аммоний или водорастворимые аминовые аддитивные соли, такие как N-метилглюкамин-(меглюмин), а также в том числе низший алканоламмоний и другие оснóвные соли фармацевтически приемлемых органических аминов. Эти агенты и/или полипептидсвязывающие группировки по настоящему изобретению могут быть лиофилизированы для хранения и ресуспензированы в подходящем носителе перед применением. Можно применять любой подходящий способ лиофилизации (например, распылительная сушка, сушка осадка) и/или способы ресуспензирования. Специалисты в данной области примут во внимание то, что лиофилизация и ресуспензирование могут привести к потере организмом в различной степени активности антител (например, при применении обычных иммуноглобулинов антитела IgM имеют тенденцию к большей потере активности, чем антитела IgG) и что для компенсации этого уровни применения могут быть скорректированы в сторону увеличения. В одном варианте реализации изобретения лиофилизированная (сублимированная) полипептидсвязывающая группировка теряет приблизительно не более 20%, или приблизительно не более 25%, или приблизительно не более 30%, или приблизительно не более 35%, или приблизительно не более 40%, или приблизительно не более 45%, или приблизительно не более 50% своей активности (до лиофилизации) при регидратации.
Комбинация молекулы антитела, которая специфично связывает FcyRIIb, и иммунной клетки, истощающей или дезактивирующей молекулу антитела, может быть применена для лечения рака.
Термин «пациент», употребляющийся в настоящей заявке, относится к животному, включая человека, у которого был диагностирован рак, отрицательный по FcyRIIb, или рак, который считается раком, вероятно отрицательным по FcyRIIb, и/или который демонстрирует симптомы такого рака.
В настоящей заявке предполагается, что пациент может быть млекопитающим или не млекопитающим. Предпочтительно, чтобы пациент был человеком или млекопитающим, например, лошадью, коровой, овцой, свиньей, верблюдом, собакой или кошкой. Более всего предпочтительно, чтобы пациент-млекопитающее был человеком.
Под «демонстрировать» в настоящей заявке подразумевается, что субъект демонстрирует симптом рака и/или диагностический маркер рака; и/или симптом рака и/или диагностический маркер рака можно измерить и/или оценить, и/или количественно определить.
Специалист в области медицины сразу поймет, каковы симптомы рака и диагностические маркеры рака, а также, как измерить и/или оценить, и/или количественно определить, происходит ли уменьшение или увеличение тяжести симптомов рака или уменьшение или увеличение диагностических маркеров рака; а также как эти симптомы рака и/или диагностические маркеры рака можно использовать для формирования прогноза течения рака.
Лечение рака часто назначают в виде курса лечения, то есть лекарственный препарат вводят в течение определенного периода времени. Продолжительность курса лечения будет зависеть от ряда факторов, которые среди прочего могут включать тип вводимого лекарственного препарата; тип рака, который подвергается лечению; тяжесть рака, который подвергается лечению; возраст и состояние здоровья пациента.
Под «во время лечения» в настоящей заявке подразумевается то, что пациент в настоящее время проходит курс лечения и/или получает лекарственный препарат, и/или получает курс лекарственного препарата.
В некоторых вариантах реализации изобретения FcyRIIb-негативный рак, который подвергается лечению в соответствии с настоящим изобретением, является солидным раком.
В некоторых вариантах реализации изобретения этот рак выбирают из группы, состоящей из карцином, сарком и лимфом.
В некоторых вариантах реализации изобретения этот рак является карциномой, выбранной из группы, состоящей из аденокарциномы, плоскоклеточной карциномы, аденосквамозной карциномы, анапластической или недифференцированной карциномы, крупноклеточной карциномы и мелкоклеточной карциномы.
В некоторых вариантах реализации изобретения этот рак представляет собой саркому, выбранную из группы, состоящей из остеосаркомы, хондросаркомы, липосаркомы и лейомиосаркомы.
FcyRIIb-негативный рак выбирают из группы, состоящей из меланомы, рака молочной железы, рака яичников, рака предстательной железы, метастатического гормонально-рефрактерного рака предстательной железы, рака толстой кишки, рака легких, мелкоклеточной карциномы легких (NSCLC), мелкоклеточного рака легких (SCLC), немелкоклеточного рака легких, уротелиальной карциномы, рака мочевого пузыря, рака почек, мезотелиомы, Меркель-клеточной карциномы и рака головы и шеи.
Каждый из вышеописанных видов рака хорошо известен, а симптомы и диагностические маркеры рака хорошо описаны, как и лекарственные препараты, применяющиеся для лечения этих видов рака. Соответственно, симптомы, диагностические маркеры рака и лекарственные препараты, применяющиеся для лечения вышеуказанных типов рака, известны специалистам в области медицины.
Клинические определения диагноза, прогноза и прогрессирования большого количества раковых заболеваний основаны на определенных классификациях, известных как определение стадии рака. Эти системы определения стадии рака действуют для сопоставления ряда различных диагностических маркеров рака и симптомов рака, для обеспечения формулировки диагноза и/или прогноза, и/или прогрессирования рака. Эти системы определения стадии рака действуют для сопоставления ряда различных диагностических маркеров рака и симптомов рака, для обеспечения формулировки диагноза и/или прогноза, и/или прогрессирования рака.
Под «определением стадии рака» в настоящей заявке подразумевается определение стадии рака по классификации Rai, которая включает в себя стадию 0, стадию I, стадию II, стадию III и стадию IV, и/или по классификации Binet, которая включает в себя стадию А, стадию B и стадию C, и/или по классификации Ann Arbour, которая включает стадию I, стадию II, стадию III и стадию IV.
Известно, что рак может вызывать аномалии в морфологии клеток. Эти аномалии часто повторно встречаются при определенных видах рака, что означает то, что исследование этих изменений в морфологии (также известное как гистологическое исследование) можно применять в диагностике или прогнозировании рака. Способы визуализации образцов для изучения морфологии клеток и подготовки образцов для визуализации хорошо известны в данной области техники; например, световая микроскопия или конфокальная микроскопия.
Под «гистологическим исследованием» в настоящей заявке подразумевается наличие мелких зрелых лимфоцитов и/или наличие мелких зрелых лимфоцитов с узкой каймой цитоплазмы, наличие мелких зрелых лимфоцитов с плотным ядром, лишенным отчетливо видимых ядрышек, и/или наличие мелких зрелых лимфоцитов с узкой каймой цитоплазмы, и/или с плотным ядром, лишенным отчетливо видимых ядрышек, и/или наличие атипичных клеток, и/или расщепленных клеток, и/или пролимфоцитов.
Хорошо известно, что рак является результатом мутаций в ДНК клетки, которые могут привести к тому, что клетка избегает клеточной гибели или бесконтрольно размножается. Поэтому исследование этих мутаций (также известное как цитогенетическое исследование) может быть полезным инструментом для оценки диагноза и/или прогноза рака. Примером этого является делеция хромосомной локации 13q14.1, которая характерна для хронической лимфоцитарной лейкемии. Способы исследования мутаций в клетках хорошо известны в данной области техники; например, флуоресцентная гибридизация in situ (FISH).
Под «цитогенетическим исследованием» в настоящей заявке подразумевается исследование ДНК в клетке и, в частности, хромосом. Цитогенетическое исследование можно применять для выявления изменений в ДНК, которые могут быть связаны с наличием рефрактерного рака и/или рецидивирующего рака. Такие изменения ДНК могут включать: делеции в длинном плече хромосомы 13 и/или делеции локуса 13q14.1 хромосомы, и/или трисомию хромосомы 12, и/или делеции в длинном плече хромосомы 12, и/или делеции в длинном плече хромосомы 11, и/или делецию 11q, и/или делеции в длинном плече хромосомы 6, и/или делецию 6q, и/или делеции в коротком плече хромосомы 17, и/или делецию в 17p, и/или транслокацию t(11:14), и/или транслокацию (q13:q32), и/или перестройку рецептора гена антигена, и/или перестройки BCL2, и/или перестройки BCL6, и/или транслокации t(14:18), и/или транслокации t(11:14), и/или транслокации (q13:q32), и/или транслокации (3:v), и/или транслокации (8:14), и/или транслокации (8:v), и / или транслокации t(11:14) и (q13:q32).
Известно, что больные раком проявляют определенные физикальные симптомы, которые часто являются результатом бремени рака на организм. Эти симптомы часто повторяются при одном и том же раке, и поэтому могут быть характерными для диагноза, и/или прогноза, и/или прогрессирования заболевания. Специалист в области медицины должен понимать, какие физикальные симптомы связаны с какими видами рака, и как оценка этих физикальных систем может коррелировать с диагнозом, и/или прогнозом, и/или прогрессированием заболевания. Под «физикальными симптомами» в настоящей заявке подразумевается гепатомегалия и/или спленомегалия.
Краткое описание графических материалов
В приведенных ниже примерах делается ссылка на следующие фигуры:
фиг. 1 - показан потенциальный механизм, объясняющий, почему настоящее изобретение работает. Иммунная клетка, истощающая или дезактивирующая молекулу антитела, в данном случае анти-CTLA-4 антитела, связывается с рецептором, присутствующим на иммунной клетке, которая подавляет противораковое действие, в данном случае это регуляторная Т-клетка (Treg). Участок Fc анти-CTLA-4 антитела связывается с активным рецептором Fcy, который в данном случае присутствует на поверхности макрофага. Кроме того, молекула антитела, которая специфично связывает FcyRIIb, связывается с FcyRIIb, присутствующим на поверхности макрофага. Поскольку это специфическое антитело имеет участок Fc со сниженным связыванием с активирующими рецепторами Fcy, оно не связывается ни с одним из активирующих рецепторов Fcy, присутствующих на макрофаге, которые вместо этого свободны для связывания с участком Fc анти-CTLA-4 антитела.
Фиг. 1А - показано применение только анти-CTLA-4 антитела. Анти-CTLA-4 антитело связывается как с активирующими, так и с ингибирующими рецепторами Fcγ, и тем самым активирует их, что приводим к слабой активации и, следовательно, к пониженному эффекту по сравнению с тем, что было в ситуации, когда анти-CTLA-4 антитело связывалось только с активирующими рецепторами Fcγ.
Фиг. 1В - показано, что комбинация анти-CTLA-4 антитела и антитела FcγRIIb дикого типа (WT) приводит к снижению активации. В этом случае антитело FcγRIIb одновременно блокирует активирующие рецепторы Fcγ и активирует ингибирующие рецепторы Fcγ, что является противоположностью желаемому эффекту в соответствии с настоящим изобретением.
Фиг. 1С - показано, что комбинация анти-CTLA-4 антитела и агликозилированного антитела FcγRIIb согласно настоящему изобретению приводит к максимальной активации. Не происходит блокирование активации рецепторов Fcγ и не происходит активация ингибирующих рецепторов Fcγ, ведущая к максимальной делеции мишени. В настоящей заявке агликозилированное антитело FcγRIIb может быть одним из антител, связывающих домен Fc, или иметь иным образом сниженное связывание с рецепторами FcR.
Фиг. 2 - показано, что антитела FcyRIIB со сниженным связыванием Fc с активирующими рецепторами Fc, но не антитела дикого типа с сохраненным связыванием с активирующими рецепторами Fc, усиливают истощение В-клеток антителами CD20 mAb.
Фиг. 2 А-Б - спленоциты CFSE+ hCD20+/- x mFcyRII-/- (мишень) и mFcyRII-/- (не мишень) вводили мышам-реципиентам hFcyRIIB+/- x mFcyRII-/-. Мыши получали антитела дикого типа (WT) или терапевтические антитела N297Q FcyRIIB mAb (6G11) (2 x 20 мг/кг) с последующим введением ритуксимаба (Rit) (0,2-2 мг/кг); соотношение клеток крови (А) и селезенки (В) CFSE+ CD19+ определяли, как и раньше. Объединены данные как минимум из двух независимых экспериментов. (Фиг. 2С) Спленоциты CFSE+ hCD20+/- x mFcγRII-/- (мишень) и mFcyRII-/- (не мишень) вводили мышам-реципиентам hFcyRIIB+/- х mFcyRII-/-. Мыши получали антитела дикого типа (WT) или терапевтические антитела N297Q FcγRIIB mAb (6G11) (20 мг/кг) с последующим введением ритуксимаба (Rit) (2 мг/кг), а экспрессию активирующих рецепторов mFcγR количественно определяли на эффекторных клетках селезенки F4/80+ с помощью указанных терапевтических антител mAb. (Фиг. 2 D-E). Способность антител дикого типа (WT) и специфических терапевтических антител N297Q (NQ) hFcγRIIB mAb (6G11; 10 мкг/мл в течение 15 мин) вызывать фосфорилирование ингибирующего тирозинсодержащего мотива иммунорецепторов (ITIM) hFcγRIIB (pFcγRIIB) на (фиг. 2D) мышиных макрофагах костномозгового происхождения (BMDM) и (фиг. 2 Е) изолированных первичных моноцитах периферической крови после культивирования клеток для достижения высокой плотности их массы, соответственно. В качестве контроля нагрузки применяли α-Тубулин, GAPDH и hFcγRIIB, как указано; показаны репрезентативные пятна.
Фиг. 3 - показано, что антитела дикого типа (WT) и терапевтические антитела FcγR-null FcγRIIB mAb могут быть объединены для оптимального истощения клеток-мишеней.
Спленоциты CFSE+ hCD20+/- (мишень) и mFcγRII-/- (не мишень) вводили мышам-реципиентам hFcγRIIB+/- x mFcγRII-/- (мыши Balb/c). Мыши получали антитела дикого типа (WT) (2 x 10-20 мг/кг) или терапевтические антитела F(ab’)2 (2 x 20 мг/кг) mFcyRII (AT130-5) или антитела дикого типа (WT) (2 x 20 мг/кг) или терапевтические антитела F(ab’)2 (2 x 40 мг/кг) hFcyRIIB mAb (AT10) с последующим введением ритуксимаба (Rit) (0,2-2 мг/кг), как указано на оси X; соотношение селезеночных клеток CFSE+ к CD19+ определяли, как и раньше. Данные объединены из 1-3 независимых экспериментов. Каждая точка изображает результат отдельной мыши; средние соотношения обозначаются горизонтальной линией. Данные анализируются с помощью однофакторного дисперсионного анализа (ANOVA).
Фиг. 4 - показана оценка делеции регуляторной Т-клетки (Treg) с блокадой антитела анти-IL2R mAb +/- FcyRIIB с мутантным антителом Fc-inert-NA mAb. Фигура 4 А): 100 мкг АТ130-2 NA, вводимого внутрибрюшинно (в/б) самкам мышей Balb/C. 100 мкг PC61 вводили внутрибрюшинно через 6 часов. Через 4 дня определяли регуляторные Т-клетки (FoxP3+) в крови, селезенке и лимфатических узлах с помощью аналитической системы FACS. Мышей умерщвляли и получали суспензию одиночных клеток из селезенки, лимфатических узлов и крови, которые окрашивали антителами против CD4, CD8 и B220 перед внутриклеточным окрашиванием красителем FoxP3 перед проведением анализа с помощью аналитической системы FACS canto. Определяли количество лейкоцитов в каждой ткани. Регуляторные Т-клетки (Treg) были определены как CD8-CD4+FoxP3+, а количество регуляторных Т-клеток рассчитывали с помощью количества лейкоцитов. Фигура 4 В - как указано выше, но с мышами C57BL/6. Фигура 4 С - соотношение CD8/Treg, рассчитанное из данных фиг. 4 В).
Фиг. 5 - показана оценка делеции Treg с блокадой антителом анти-IL2R mAb +/- FcγRIIB с антителом дикого типа (WT) или NA-мутантным антителом mAb. Антитело дикого типа (WT) AT130-2, по-видимому, не дает никакого улучшения делеции, тогда как вариант NA дает улучшение делеции. А) 100 мкг AT130-2 NA или mIgG1 WT AT130-2 вводили внутрибрюшинно самкам мышей Balb/C. Через 6 часов внутрибрюшинно вводили 100 мкг PC61. Регуляторные Т-клетки (FoxP3+) в селезенке определяли с помощью аналитической системы FACS через 4 дня Мышей умерщвляли и получали суспензию одиночных клеток из селезенки, которую окрашивали антителами против CD4, CD8 и B220 перед внутриклеточным окрашиванием красителем FoxP3 перед проведением анализа с помощью аналитической системы FACS canto. Определяли количество лейкоцитов в каждой ткани. Регуляторные Т-клетки (Treg) определяли как CD8-CD4+FoxP3+; количество регуляторных Т-клеток рассчитывали с помощью количества лейкоцитов. В селезенке мышей, получавших через 4 дня антитела N297A в комбинации с PC61, наблюдалось значительно меньшее количество регуляторных Т-клеток по сравнению с мышами, получавшими антитела дикого типа mIgG1 AT130-2 (t-критерий Стьюдента для одной выборки, Р=0,044).
Фиг. 6 - показана комбинированная терапия с блокадой анти-CTLA-4 и FcγRIIB. Самкам мышей BALB/c подкожно вводили клетки CT26 в количестве 5x105. Мышей рандомизировали в лечебные группы, когда площадь опухоли (ширина опухоли х длину опухоли) составляла приблизительно 100 мм2. Лечение проводили в 0-й, 2-й, 4-й и 11-й день. Каждый день мыши получали только анти-мышиные антитела CTLA4 хомяка (9H10) в дозе 200 мкг внутрибрюшинно в 200 мкл фосфатно солевого буфера (PBS). В 0-й день мыши, получавшие комбинированное лечение, получали 100 мкг AT130-2 N297A (антимышиные антитела CD32) внутрибрюшинно в 200 мкл PBS и через 6 часов 200 мкг 9H10 внутрибрюшинно в 200 мкл PBS. На 2-й, 4-й и 11-й день мыши, получавшие комбинированное лечение, получали оба антитела (200 мкг 9Н10 и 100 мкг АТ130-2 NA) в одной инъекции 200 мкл внутрибрюшинно. Производили замер ширины и длины опухоли; мышей умерщвляли, когда площадь опухоли (длина опухоли х ширину опухоли) превышала 400 мм2. Фиг. 6 А) - представлен график лечения. Группа 1: Антитела не вводили; Группа 2: анти-mCD32 (AT130-2 NA; 100 мкг); Группа 3: анти-CTLA-4 (9H10; 200 мкг); Группа 4: комбинация (PC61) через 6 часов после AT130-2. Было разрешено устанавливать и лечить опухоли при их площади 100 мм2. Дополнительную дозу давали на 12-й день. Фиг. 6 В) - показан рост отдельных опухолей. Фиг. 6 C) - показана средняя площадь опухоли +/- стандартное отклонение (SD) или стандартная ошибка среднего значения (SEM). Фиг. 6 D) - показана выживаемость животных. Фиг. 6 Е) - комбинация данных из 2 отдельных экспериментов (n=10/группа), демонстрирующая выживаемость; также показано, что комбинация 9Н10 и АТ130-2НК (комбинация NA) значительно более эффективна для увеличения выживаемости, чем только 9Н10 (Р=0,0179).
Фиг. 7 - показана комбинированная терапия антител анти-CTLA-4 и блокада FcγRIIB по сравнению с терапией антителами дикого типа (WT) (обозначается как комбинация M1) и антителами Fc-inert (обозначается как комбинация NA) АТ130-2 mAb. Клетки CT26 в количестве 5 x105 вводили подкожно самкам мышей BALB/c. Мышей рандомизировали в лечебные группы, когда площадь опухоли (ширина опухоли х длину опухоли) составила приблизительно 100 мм2. Лечение проводили в 0-й, 2-й, 4-й и 11-й день. В 0-й день мыши, получавшие комбинированное лечение, получали 100 мкг AT130-2 N297A или AT130-2 mIgG1 (антимышиные антитела CD32) в 200 мкл PBS внутрибрюшинно, а через 6 часов получали 200 мкг 9H10 в 200 мкл PBS внутрибрюшинно. На 2-й, 4-й и 11-й день мыши, получавшие комбинированное лечение, получали оба антитела (200 мкг 9Н10 и 100 мкг АТ130-2 NA/mIgG1) в одной инъекции 200 мкл внутрибрюшинно. Производили замер ширины и длины опухоли и умерщвляли мышей, когда площадь опухоли (длина х ширину) превышала 400 мм2. Данные приведены на кривой выживаемости ниже N=11-12. В группе, получавшей комбинированное лечение NA, наблюдалась значительно более длительная выживаемость по сравнению с мышами, получавшими комбинацию mIgG1 (логарифмический ранговый критерий P=0,0460).
Фиг. 8 - показана комбинированная терапия с блокадой антител анти-PD-L1 и FcγRIIB; для выяснения того, зависит ли этот эффект от формата NA антитела, эксперимент проводился с использованием как антитела mIgG1 дикого типа (WT), так и антитела формата NA. Фиг. 8 А) - показан рост отдельных опухолей в каждой группе (по одному графику на каждую группу). Число указывает на количество выживших мышей в каждой группе. Фиг. 8 В) - показаны кривые выживаемости мышей.
Фиг. 9 - показаны форматы дикого типа (вверху) и N297A (внизу) для связывания анти-мышиного антитела FcγRIIB mAb AT130-2, связывающегося с рецепторами FcγR. Показан анализ AT130-2 способом поверхностного плазмонного резонанса (SPR) в любом формате связывания с указанными рецепторами FcγR мыши (100 нм).
Фиг. 10 - показано связывание 6G11 дикого типа по сравнению с N297A 6G11 с Fc-гамма-рецепторами (мышиными и человеческими). Показан анализ способом поверхностного плазмонного резонанса (SPR) связывания нативных антител и антител N297A анти-huCD32b 6G11 hIgG1 с указанными рецепторами FcγR человека и мыши с низкой аффинностью. Фиг. 10 A и B) - показаны результаты для человеческого рецептора FcγR (100 нм). На фиг.10 C и D показаны результаты для мышиного FcγR (100 нМ). Фиг. 10 E и F) - показаны результаты для человеческого рецептора FcγR (последовательные увеличивающиеся добавки) - FcγRIIb и hCD64. Фиг. 10 G и H) - показаны результаты для рецептора FcγR мыши (100 нм), то есть те же, что и на фиг. С и В), но масштабированные для более четкого представления.
Примеры
Теперь будут описаны конкретные примеры, не имеющие ограничительного характера, которые содержат в себе определенные аспекты настоящего изобретения. Для обеспечения исследования эффекта блокады FcγRIIB в сложных системах in vivo необходимо использовать два набора суррогатных антител. Мышиный эквивалент 6G11 называется AT130-2. Для блокирования участка Fc человеческого антитела (следовательно, для оказания воздействия на связывание с рецепторами FcγR, сильно нарушенными или не принимающимися в расчет), в настоящей заявке заменили аминокислоту N в позиции 297 аминокислотой Q. Для блокирования участка Fc мышиного антитела, аминокислота N в той же позиции заменена аминокислотой Q. Следовательно, в мышиной системе мы будем ссылаться на антитело AT-130, в то время как настоящая патентная заявка касается человеческого аналога антитела 6G11. Кратко: человеческое антитело 6G11 соответствует суррогатному мышиному антителу AT1302-2, в то время как 6G11-N297Q соответствует AT130-3-N297A.
Другим способом блокирования участка Fc антитела (который хорошо известен специалистам в этой области техники) могло быть удаление участка Fc и формирование фрагмента Fab или Fab2.
Экспериментальные процедуры
Животные
Ранее были описаны мыши hCD20 Tg (трансгенные) hFcγRIIB+/- и mFcγRIIB-/- (Beers et al., Blood 2008 Nov 15; 112(10): 4170-7; Roghanian et al., Cancer Cell 27, 473-488, April 13, 2015) с генотипами, подтвержденными полимеразной цепной реакцией (ПЦР) и/или проточной цитометрией. Мышей разводили и содержали на местных объектах в соответствии с инструктивными материалами Министерства внутренних дел Великобритании или Шведского комитета по этике.
Культура клеток
Культивирование клеток проводили в обогащенной питательной среде RPMI (среда RPMI 1640, содержащая 2 мМ глутамина, 1 мМ пирувата, 100 МЕ/мл пенициллина и стрептомицина, и 10% FCS [Миоклон]) (GIBCO BRL, Пейсли, Шотландия). Мышиные селезеночные В-клетки очищали путем негативной селекции с использованием наборов для выделения В-клеток MACS (Miltenyi Biotec, UK) и культивировали в тех же средах. Клеточные линии были получены из Европейской коллекции аутентифицированных клеточных культур (ECACC) и выдержаны в усиленной питательной среде RPMI, не содержащей антибиотиков.
Получение человеческих макрофагов моноцитарного происхождения (MDM) и мышиных макрофагов костномозгового происхождения (BMDM)
Человеческие макрофаги моноцитарного происхождения (MDM) были дифференцированы из периферической крови, полученной либо из Национальной службы крови, больницы общего профиля Саутгемптона, Великобритания (National Blood Service, Southampton General Hospital (Southampton, UK)), либо из центров крови больницы Хальмштада (Halmstad) или клинической больницы Сконе 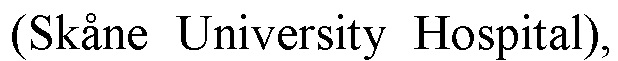 Швеция. Кратко: адгезивные моноциты CD14+ культивировали в обогащенной питателньой среде RPMI, содержащем 25-100 нг/мл рекомбинантного человеческого макрофаг-колониестимулирующего фактора с низкой эндотоксичностью (M-CSF производства R&D Systems, США, или собственного производства), как описано ранее (Roghanian et al., Cell Immunol. 2010; 265 (2): 120-6). Половину питательной среды заменяли свежим M-CSF каждые 2 дня до сбора клеток. Макрофаги моноцитарного происхождения (MDM) собирали на 7-10-й день культивирования после короткой инкубации с холодным PBS.
Швеция. Кратко: адгезивные моноциты CD14+ культивировали в обогащенной питателньой среде RPMI, содержащем 25-100 нг/мл рекомбинантного человеческого макрофаг-колониестимулирующего фактора с низкой эндотоксичностью (M-CSF производства R&D Systems, США, или собственного производства), как описано ранее (Roghanian et al., Cell Immunol. 2010; 265 (2): 120-6). Половину питательной среды заменяли свежим M-CSF каждые 2 дня до сбора клеток. Макрофаги моноцитарного происхождения (MDM) собирали на 7-10-й день культивирования после короткой инкубации с холодным PBS.
Мышиные макрофаги костномозгового происхождения (BMDM) были получены из клеток, выделенных из костного мозга бедренной и большеберцовой костей мышей, как сообщалось ранее (Williams et al., J Immunol. 2013 15 Oct; 191(8): 4130-40.). Кратко: клетки костного мозга культивировали в обогащенной питательной среде RPMI, содержащей 20% среды, кондиционированной клетками L929 (содержащей M-CSF). Клетки культивировали при температуре 37°C, в атмосфере 5% CO2 в течение 10-12 дней перед применением. Дифференцировку макрофагов стандартно подтверждали морфологическим исследованием и/или способом проточной цитометрией для экспрессии CD11b и F4/80.
Антитела и реагенты
Как правило, антитела mAb получали из надосадочной жидкости культуры гибридомы или стабильно трансфицированных клеток CHO-k1 (полученных из ECACC). Были получены фрагмента F(ab’)2, как описано ранее (Glennie et al., 1987). Антитело hFcγRII mAb AT10 было описано ранее (Greenman et al., 1991). Анти-CTLA4 (9H10; Bio X Cell, США), анти-IL2R (PC-61.5.3; Bio X Cell/in-house), анти-PDL-1 (10F.9G2 Bio X Cell, США). Антитела hFcγRII mAb 6G11 hIgG1 и N297Q были получены компанией BioInvent (см. работу Roghanian et al, Cancer Cell 27, 473-488, April 13, 2015). Антитела MFcyRII mAb AT130-2 mIgG1, mIgG2a и mIgG1 N297A были произведены самостоятельно. Антитело AT130-5 (Williams et al, Eur J Immunol. . 2012; 42(8): 2109-20, и Tutt et al., J Immunol 2015, 195 (11) 5503-5516) - это мышиное анти-мышиное антитело FcyRII, аналогичное клону человеческого антитела 6G11). Антитела против hFcyRIIB (клон EP888Y; Abcam, Великобритания), фосфорилированные антитела hFcyRIIB (клон EP926Y; Origene, США), GAPDH (Abcam, Великобритания) и α-тубулин (Cell Signaling, США) применяли для иммуноблоттинга. Для иммунофенотипирования мононуклеарных клеток периферической крови (PBMC) применяли антитела FcyRIIB mAb, меченные PE, с помощью комплекта для маркировки Зенон (молекулярные зонды) в сочетании с антителами анти-CD3-FITC, анти-CD19-PerCP-Cy5.5 и анти-CD56-APC (антитела, полученные от компании Biolegend).
Проточная цитометрия
Флуоресцентно конъюгированные антитела mAb были приобретены в компаниях BD Biosciences, eBiosciences, Biolegend, AbD Serotec (все из Великобритании) или сделаны собственными силами. Проточная цитометрия проводилась так, как описано ранее (Tutt et al., 1998) с образцами, оценку которых проводили на аналитических системах FACScan, FACSCalibur или FACSCanto II, при этом данные анализировали с помощью программного обеспечения CellQuest Pro, FACSDiva (все программное обеспечение производства компании BD Biosciences, Великобритания) или FCS Express (производства De Novo Software, штат Калифорния, США).
Вестерн-блоттинг
Как описано ранее (Roghanian et al, Cancer Cell 27, 473-488, April 13, 2015).
Иммунотерапия in vivo
Адоптивный перенос: как подробно описано ранее (Beers et al., Blood. 2010 Jun 24; 115 (25): 5191-201).
Истощение В-клеток: мышам вводили внутривенно антитела hCD20 или hFcyRIIB mAb, отдельно или в комбинации, и лейкоциты, оцениваемые как и раньше (Beers et al., Blood. 2010 Jun 24;115(25):5191-201). 2010 Jun 24; 115 (25): 5191-201).
Клетки CT26
Клетки CT26 хранили в полной среде Игла, модифицированной по способу Дульбекко (DMEM) и собирали с помощью раствора трипсин-ЭДТА. Клетки промывали, ресуспензировали в PBS и доводили концентрацию до 5х106 клеток/мл с помощью гемоцитометра. 100 мкл клеточной суспензии (5х105 клеток) вводили подкожно мышам BALB/c (выведенным своими силами из исходной породы, полученной из Чарльз-Ривер, Великобритания). Разрешалось устанавливать опухоли и измерять их размеры 3 раза в неделю до рандомизации и лечения. Опухоли считались терминальными, когда их площадь (длина х ширину) превышала 400 мм2.
Клетки MC38
Клетки MC38 хранили в полной среде DMEM и собирали с помощью раствора трипсин-ЭДТА. Клетки промывали, ресуспензировали в PBS и доводили концентрацию до 5х106 клеток/мл с помощью гемоцитометра. Мышам C56/Bl6 (полученным из Taconic, Дания) вводили подкожно 100 мкл клеточной суспензии (5х105 клеток). Разрешалось устанавливать опухоли и измерять их размеры до рандомизации и лечения. Лечение начинали с площади опухоли 50-100 мм2, а затем опухоли измеряли 2 раза в неделю. Лечение проводили 4 раза с интервалом между лечебными сеансами 3-4 дня; дозу анти-PD-L1 устанавливали на уровне 10 мг/кг, а дозу обоих вариантов АТ130-2 - на уровне 20 мг/кг. Опухоли считались терминальными, когда их площадь превышала 2000 мм2.
Статистический анализ
Для сравнения экспериментальных групп были проведены анализ с помощью критерия знаковых рангов Уилкоксона, парного t-критерия или t-критерия Стьюдента для одной выборки, получены кривые Каплана Мейера и проанализированы с помощью логарифмического рангового критерия. Для анализа адаптивного переноса in vivo, содержащего > 2 групп, использовали одно- или двухфакторный дисперсионный анализ (ANOVA).
Для определения различий в OR и CR использовали критерий хи-квадрат. Статистический анализ проводили с помощью программного обеспечения GraphPadPrism (версия 5 или 6). Звездочки обозначают значимость следующим образом: *Р ≤ 0,05, **Р ≤ 0,01, ***Р ≤ 0,001 и ****Р ≤ 0,0001, если не указано иное.
Результаты
Эффективность истощения В-клеток зависит от формата антитела FcγRIIB mAb
Антитела FcγRIIB экспрессируется, как на В-клетках-мишенях, так и на эффекторных моноцитах/макрофагах, что затрудняет интерпретацию в случае, когда антитела FcγRIIB mAb вносят свой вклад в более глубокую делецию клеток-мишеней. Для того чтобы дополнительно проанализировать это, в настоящей заявке использовалось преимущество различных имеющихся линий мышей hFcγRIIB Tg и KO, чтобы обеспечить системы, в которых либо клетка-мишень, либо эффектор, либо и то и другое могут быть нацелены на антитела FcγRIIB mAb. В анализах, где мишени hCD20+/-, у которых не было hFcγRIIB, были адоптивно перенесены в реципиенты hFcγRIIB+/- x mFcγRIIB-/-, лечение только одними антителами FcyR-null и антителами дикого тира (WT) FcγRIIB mAb не оказывало ожидаемого влияния на делецию В-клеток (фиг. 2А). В комбинации с ритуксимабом антитело FcγR-null FcγRIIB mAb потенцировало истощение, как циркулирующих клеток-мишеней (фиг. 2А), так и резидентных клеток ткани (фиг. 2Б), являющихся клетками-мишенями, в то время как антитело дикого типа (WT) FcγRIIB mAb нарушало делецию. Это показывает то, что при применении нормального моноклонального антитела FcγRIIB нарушается делеция клеток-мишеней посредством второго антитела, что было очень неожиданно для изобретателей. При проведении оценки экспрессии рецепторов FcγR на селезеночных макрофагах F4/80+ мышей, получавших лечение, было очевидно, что обнаружение mFcγRIV (фиг. 2C) было меньше при использовании антител дикого типа (WT), но не антител FcγR-null FcγRIIB mAb, что может частично объяснить ингибирующие эффекты антител дикого типа (WT) FcγRIIB mAb. Это показывает то, что нормальное моноклональное антитело IgG FcγRIIB ухудшает делецию, поскольку блокирует активирующий рецептор FcγRIV.
Этот так называемый «эффект скорпиона» (обзор Hogarth) возникает, когда функциональный домен Fc с поверхности клетки, связывающий антитело mAb, занимает Fc-связывающую щель рецептора FcγR, экспрессирующегося на той же клетке, и, следовательно, не наблюдается с антителом FcγR-null FcγRIIB mAb. Это было описано ранее и объясняет возможную чрезмерную интерпретацию относительной важности отдельных рецепторов FcγR, когда они блокируются антителом анти-FcγR mAb с функциональным доменом Fc, таким как антитело FcγRIV mAb 9E9 (Tipton et al, Blood 2015 125:1901-1909).
В дополнение к физической блокаде, этот «эффект скорпиона» также имеет потенциал для обеспечения перекрестного связывания и активации рецептора FcγR. Поскольку ITIM-содержащий рецептор FcγRIIB является единственным ингибирующим рецептором FcγR на эффекторных клетках, его активация может способствовать ингибированию функции эффекторных клеток (Dahal et al., Immunol Rev. 2015 Nov; 268(1):104-22), в настоящей заявке проведена оценка его активации после лечения антителами дикого типа (WT) или антителами FcγR-null FcγRIIB mAb. Ранее в настоящей заявке было показано, что на В-клетках (которые экспрессируют только FcyRIIB) лечение антагонистом дикого антитела 6G11 WT или антитела NQ mAb не активирует FcyRIIB (Roghanian et al, Cancer Cell 27, 473-488, April 13, 2015). Однако лечение антителами дикого типа (WT), но не антителами FcγR-null FcγRIIB mAb, привело к фосфорилированию FcγRIIB-ITIM, как у тех, кого лечили человеческими макрофагами моноцитарного происхождения (MDM) (фиг. 2D), так и мышиными макрофагами костномозгового происхождения hFcγRIIB+/- x mFcγRIIB-/- (фиг. 2Е), предоставляя доказательство этому явлению в нашей системе и указывая, что активация эффектора не может быть оптимальной, при применении антитела дикого типа WT FcγRIIB mAb. Это показывает то, что нормальное антитело FcyRIIB mAb активирует ингибирующие сигналы в иммунных эффекторных клетках. С учетом этого наблюдения с вышеприведенными наблюдениями, рассматривающими оптимальный формат FcγRIIB mAb для делеции целевых клеток, в настоящей заявке дополнительно исследуется, как может быть получена оптимальная делеция.
Антитела дикого типа (WT) и антитела FcγR-null hFcyRIIB mAb можно комбинировать для оптимального истощения клеток-мишеней
Далее в настоящей заявке исследуется эффективность различных форм антител hFcγRIIB и mFcγRII mAb в присутствии или в отсутствии ритуксимаба в системе, в которой mFcγRIIB экспрессировался только на целевых В-клетках, а hFcγRIIB экспрессировался только на эффекторных клетках. Эта система позволяла проводить одновременный анализ целенаправленного воздействия на FcγRIIB, ограниченный мишенями и эффекторами. Первоначально в настоящей заявке исследовалось влияние на антитело mAb, связывающее FcγRIIB только на мишени. Лечение мышей субоптимальными дозами только одного препарата ритуксимаб приводило к минимальному истощению целевых В-клеток (фиг. 3). Лечение мышей оптимальными дозами только одного антитела WT mFcγRII mAb (нацеленного на FcγRIIB, присутствующего только на мишенях) приводило к истощению клеток-мишеней приблизительно на 50%. Одновременное введение антитела дикого типа WT mFcyRII mAb с ритуксимабом приводило к глубокому истощению (около 75% резидентных В-клеток селезенки), тогда как добавление антитела Fc-null F(ab’)2 mFcγRII mAb не оказывало никакого эффекта ни при введении в виде монотерапии, ни при введении совместно с ритуксимабом. Это демонстрирует то, что для достижения делеции мишени, экспрессирующей FcγRIIB, в отсутствие FcγRIIB на эффекторах, можно использовать нормальное антитело FcγRIIB mAb.
Впоследствии мы исследовали целенаправленное воздействие FcγRIIB конкретно на эффекторные клетки; лечение мышей антителами дикого типа (WT) или антителами F(ab’)2 hFcγRIIB (целенаправленное воздействие FcγRIIB только на эффекторы) не привело к делеции В-клеток, как ожидалось. Однако комбинация ритуксимаба и антител дикого типа (WT) или F(ab’)2 hFcγRIIB привела к увеличению истощения клеток-мишеней по сравнению с лечением одним только ритуксимабом. Еще более интенсивная делеция наблюдалась, когда антитело WT mFcγRII mAb применяли для целенаправленного воздействовать на В-клетки B, а F(аb’)2 hFcyRIIB применяли для целенаправленного воздействия на эффекторы. В отличие от этого, лечение антителом WT mFcγRIIB mAb наряду с антителом WT hFcγRIIB mAb подавляло истощение (фиг. 3). Это показывает то, что нормальная блокировка FcγRIIB mAb нарушает истощение мишени. Для блокировки эффекторов использовалось антитело Fab2 mAb с модифицированным Fc.
При дальнейшем исследовании этих комбинаций, когда антитело WT hFcγRIIB mAb использовалось для блокирования hFcyRIIB эффекторных клеток, истощение при введении комбинации ритуксимаба и антитела дикого типа WT mFcγRII mAb составляло всего около 30%. Гораздо более глубокое истощение наблюдалось, когда ритуксимаб и антитело WT mFcγRII mAb, оба из которых опсонизируют B-клетки-мишени, были скомбинированы с антителом Fc-null F(ab’)2 hFcγRIIB mAb, которое блокирует эффекторные клетки hFcγRIIB, что приводит к истощению клеток-мишеней приблизительно на 90% (фиг. 3).
Оптимальные форматы усиления делеции регуляторных Т-клеток (Treg) блокированием FcgRIIB антителом mAb
На следующем этапе проводилась оценка того, может ли способность усиливать делецию клеток-мишеней путем блокирования FcgRIIB быть перенесена на другие клеточные мишени, такие как регуляторные Т-клетки (Treg). Это похоже на приведенный выше пример, но с использованием IL2R для истощения регуляторных Т-клеток (Treg). Для решения этого мышам Balb/c внутрибрюшинно вводили 100 мкг Fc-инертного анти-FcγRIIb mAb анитела (AT130-2 mIgG1 NA, фиг. 9). Впоследствии 100 мкг анти-IL2R (PC61) вводили внутрибрюшинно через 6 часов для делеции клеток регуляторноных Т-клеток FoxP3+. Затем через 4 дня проводили их оценку в крови, селезенке и лимфатических узлах с помощью аналитической системы FACS. Было показано, что AT130-2 NA улучшает делецию регуляторноных Т-клеток, особенно в селезенке (фиг. 4А). Для решения вопроса о воспроизводимости этого влияния, данный эксперимент был повторен на мышах C57BL/6. И снова было замечено, что АТ130-2 NA улучшает делецию регуляторноных Т-клеток у мышей B6, особенно в селезенке и лимфатических узлах (фиг. 4B), что приводит к более высоким соотношениям CD8:Treg в крови, селезенке и лимфатических узлах (фиг. 4C). Это соотношение в крови было значительно выше при применении комбинации NA, чем при применении только PC61 (PC61 по сравнению с комбинацией, P=0,0218). Для подтверждения предыдущих выводов, затем проводилась оценка способности мутанта дикого типа WT AT130-2 по сравнению с мутантом AT130-2 NA, имеющим инертный участок Fc, улучшать IL2R mAb-опосредованную делецию регуляторных Т-клеток. Вариант WT AT130-2 не дал никакого усиления делеции, в то время как вариант NA усилил делецию (* t-критерий Стьюдента для одной выборки, P=0,044) (фиг. 5). Таким образом, это показывает, что нормальное антитело mAb, блокирующее FcγRIIb, не усиливает истощение.
mAb-опосредованная блокада FcgRIIB усиливает иммунотерапию CTLA-4
И снова это та же концепция, что и указанная выше, но с использованием антитела к еще одной мишени, сильно экспрессирующейся на связанных с опухолью регуляторных Т-клетках (CTLA-4), приводящих к противоопухолевому иммунитету. Таким образом, чтобы решить, может ли этот подход усилить противораковую иммунотерапию, клетки CT26 были введены подкожно самкам мышей BALB/C. Мыши были рандомизированы в лечебные группы, когда площадь опухоли (ширина х длину опухоли) составляла приблизительно 100 мм2. Мышам вводили 200 мкг антитела 9H10 (анти-мышиные антитела CTLA4 хомяка) внутрибрюшинно в 200 мкл PBS в 0-й, 2-й, 4-й и 11-й день. В 0-й день мыши, получавшие комбинированное лечение, получали 100 мкг АТ130-2 N297A. Проводили измерение ширины и длины опухолей и умерщвляли мышей, когда площадь опухоли (длина х ширину опухоли) превышала 400 мм2 (фиг. 6А). На фиг. 6В показан рост отдельных опухолей в каждой группе, а на фиг. 6С показана медианная площадь (+/- стандартная ошибка среднего значения (SEM) или стандартное отклонение (SD)). Кривая выживаемости для этих мышей показана на фиг. 6D; кривая выживаемости из второго эксперимента, в котором лечение проводилось комбинацией NA, представлена на фиг. 6E, при этом разница в выживаемости между мышами, получавшими лечение комбинацией NA, по сравнению мышами, получавшими лечение только 9H10, была статистически значимой (логарифмический ранговый критерий P 0,0179). И наконец, чтобы решить, зависит ли этот эффект от формата NA антитела, эксперимент повторяли с антителами WT mIgG1 (дикого типа) и сравнивали с форматом NA, как раньше. Вариант NA существенно не отличался от группы, получавшей только 9H10, а комбинация с NA была значительно более эффективной, чем комбинация с WT mAb (логарифмический ранговый критерий P=0,0460) (фиг. 7) Это показывает, что комбинация с антителом дикого типа WT Ab, то есть нормальным гликозилированным антителом mAb, неэффективна и даже наоборот ухудшает желаемый терапевтический эффект.
mAb-опосредованная блокада FcγRIIB усиливает иммунотерапию PD-L1
Как и в случае с CTLA4, считается, что эффект антител, целенаправленно воздействующих на PD-L1, зависит от активации рецепторов FcγR. Однако отчетливая форма CTLA-4, PD-L1 экспрессируется на различных клетках, в первую очередь на клетках миелоидного ряда и раковых клетках. Чтобы решить, усиливает ли комбинация антитела PD-L1 с блокадой FcγRIIB противораковую иммунотерапию, клетки MC38 вводили подкожно самкам мышей C57/Bl6. Мыши были рандомизированы в лечебные группы, когда площадь опухоли (ширина опухоли х длину опухоли) составляла приблизительно 100 мм2. Мыши получали антитела 9H10 в дозе 10 мг/кг (анти-мышиные антитела CTLA4 хомяка) внутрибрюшинно в 200 мкл PBS в 0-й, 2-й, 4-й и 11-й день. В 0-й день мыши, получавшие комбинацию, получали 100 мкг AT130-2 N297A или WT AT130-2. Производили замер ширины и длины опухолей и умерщвляли мышей, когда площадь опухоли превышала 2000 мм2. На фиг. 8А показан рост отдельных опухолей в каждой группе. Число указывает количество выживших мышей в каждой группе. На фиг. 8В показаны кривые выживаемости мышей. Чтобы решить, зависит ли этот эффект от формата NA антитела, эксперимент был проведен с применением, как антител дикого типа WT mIgG1, так и антител формата NA, как и раньше. Вариант NA был более эффективным, чем комбинация с WT mAb, и привел к большей выживаемости мышей (фиг. 8 В). Это показывает, что наиболее эффективной комбинацией для антител PD-L1, целенаправленно воздействующих в первую очередь на раковые клетки и моноциты/макрофаги/миелоидные супрессорные клетки, является агликозилированный NA-формат.
В совокупности вышеприведенные данные показывают, что блокада FcyRIIB как средство повышения терапевтической эффективности других антител является широкой и применимой для антител против различных мишеней (CD20, CD25, CTLA4 и PD-L1), экспрессируемых на различных типах клеток (В-клетки, регуляторные T-клетки и миелоидные клетки).
Сравнение связывания WT 6G11 и N297A 6G11 с Fc-гамма-рецепторами (мышиными и человеческими)
Анализ способом поверхностного плазмонного резонанса (SPR) был проведен с помощью системы BIAcore T200 (GE Healthcare). Образцы прогоняли при температуре 25oC в буфере HBS-EP+ со скоростью 30 мл/мин. Данные анализировали с помощью программного обеспечения BiaEvaluation. Ответ контрольной проточной ячейки автоматически вычитали до анализа данных. Для сравнения связывания Fc-гамма-рецепторами (FcγR) антитело дикого типа 6g11 WT или 6G11 N297Q hIgG1 было иммобилизировано при рН 5 на сенсорном чипе CM5 по аминогруппе; рекомбинантные человеческие и мышиные FcγR (100 нМ) вводили инъекционно (Системы R&D) через обе поверхности в течение 180 секунд. В качестве альтернативы последовательно добавляли различные концентрации FcγR в диапазоне от 0-500 нМ и измеряли ответы. Результаты показаны на фиг. 10 А-H.
| название | год | авторы | номер документа |
|---|---|---|---|
| КОМБИНАЦИИ АНТИТЕЛ ДЛЯ ЛЕЧЕНИЯ РАКА У КОНКРЕТНЫХ ПАЦИЕНТОВ | 2020 |
|
RU2816531C2 |
| АНТИТЕЛА ПРОТИВ АЛЬФА5-БЕТА 1 И ИХ ПРИМЕНЕНИЕ | 2009 |
|
RU2528736C2 |
| АНТИТЕЛА ПРОТИВ РЕЦЕПТОРА FcγRIIB И ИХ ПРИМЕНЕНИЕ | 2005 |
|
RU2404991C2 |
| МЕДИКАМЕНТЫ, ПРИМЕНЕНИЯ И СПОСОБЫ | 2015 |
|
RU2712283C2 |
| АНТИГЕНСВЯЗЫВАЮЩАЯ МОЛЕКУЛА ДЛЯ УСКОРЕНИЯ ЭЛИМИНАЦИИ АНТИГЕНОВ | 2012 |
|
RU2772771C1 |
| СПОСОБ ИЗМЕНЕНИЯ УДЕРЖАНИЯ В ПЛАЗМЕ И ИММУНОГЕННОСТИ АНТИГЕНСВЯЗЫВАЮЩЕЙ МОЛЕКУЛЫ | 2012 |
|
RU2799423C1 |
| КОМБИНИРОВАННАЯ ТЕРАПИЯ ДЛЯ ЛЕЧЕНИЯ РАКА | 2016 |
|
RU2731202C2 |
| ТРИСПЕЦИФИЧНЫЕ СВЯЗЫВАЮЩИЕ МОЛЕКУЛЫ, КОТОРЫЕ СПЕЦИФИЧЕСКИ СВЯЗЫВАЮТ АНТИГЕНЫ МНОЖЕСТВА ЗЛОКАЧЕСТВЕННЫХ ОПУХОЛЕЙ, И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2015 |
|
RU2718692C2 |
| ГУМАНИЗИРОВАННЫЕ АНТИТЕЛА К OX40 И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2015 |
|
RU2709742C2 |
| АНТИТЕЛА ПРОТИВ ЧЕЛОВЕЧЕСКОГО VISTA И ИХ ПРИМЕНЕНИЕ | 2017 |
|
RU2746994C2 |





































































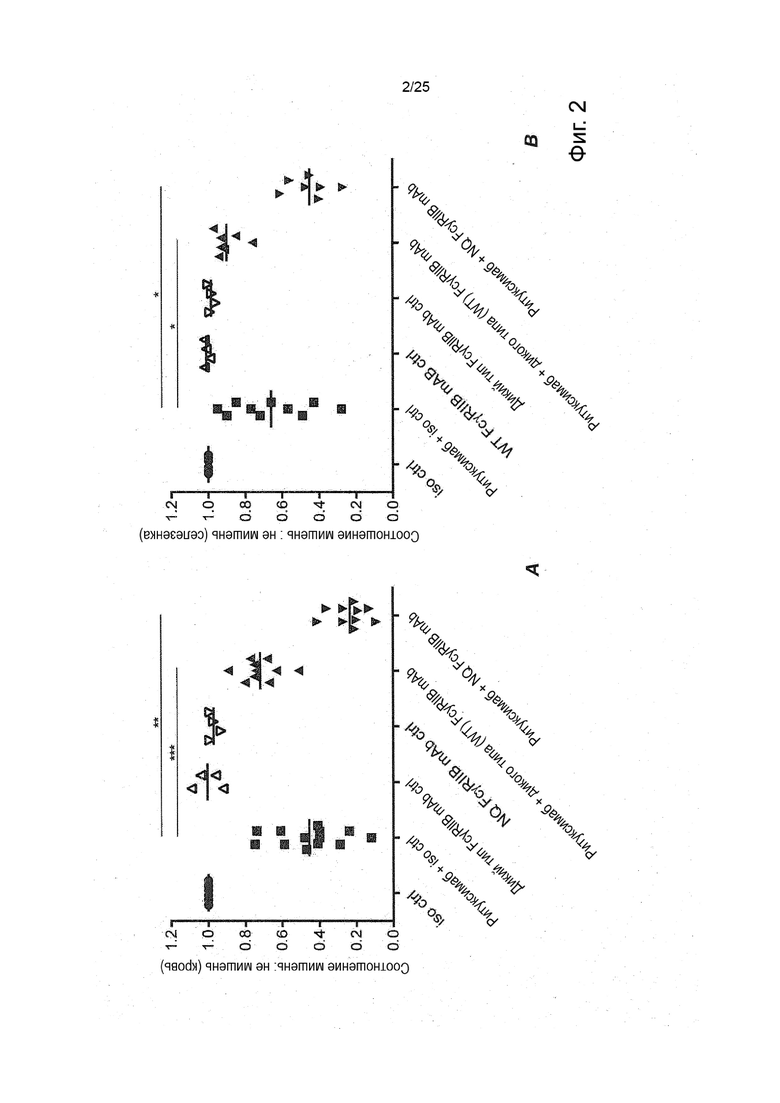
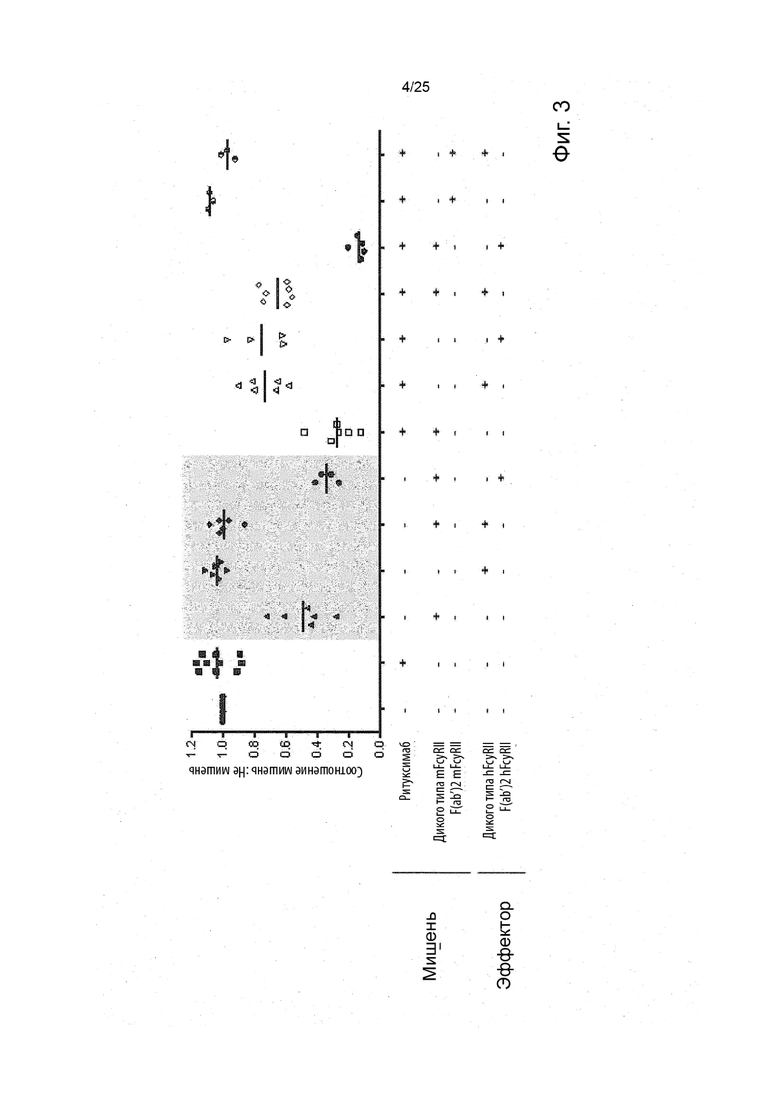

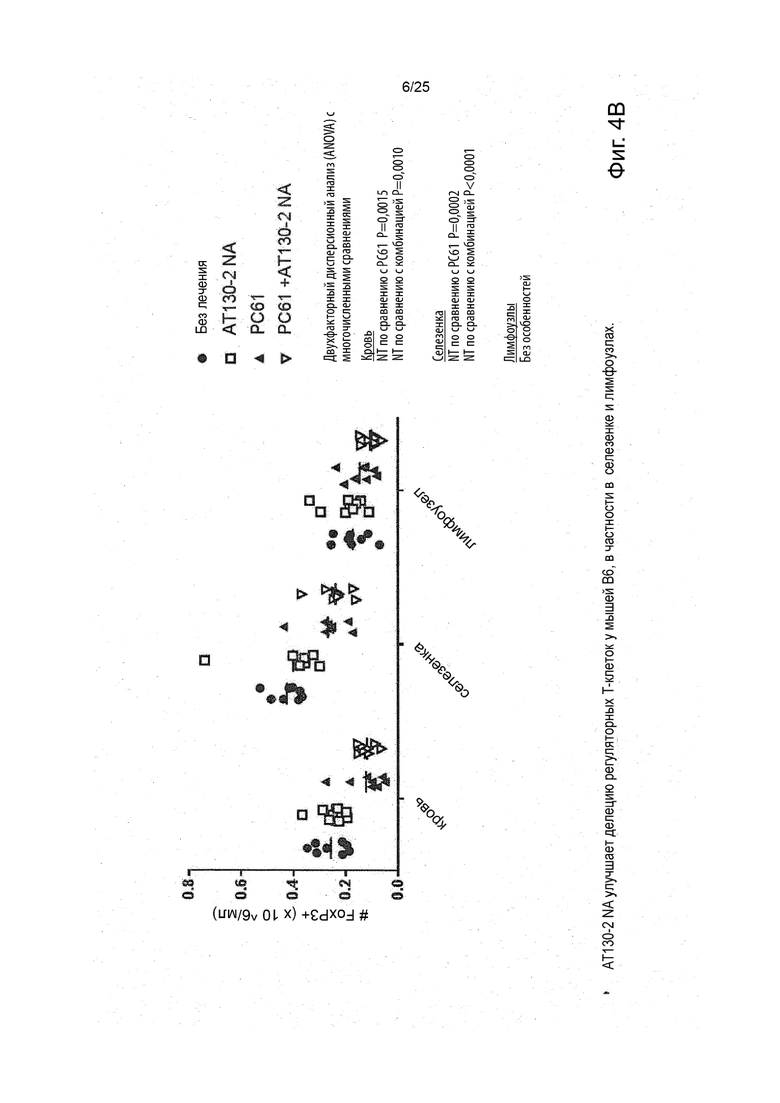
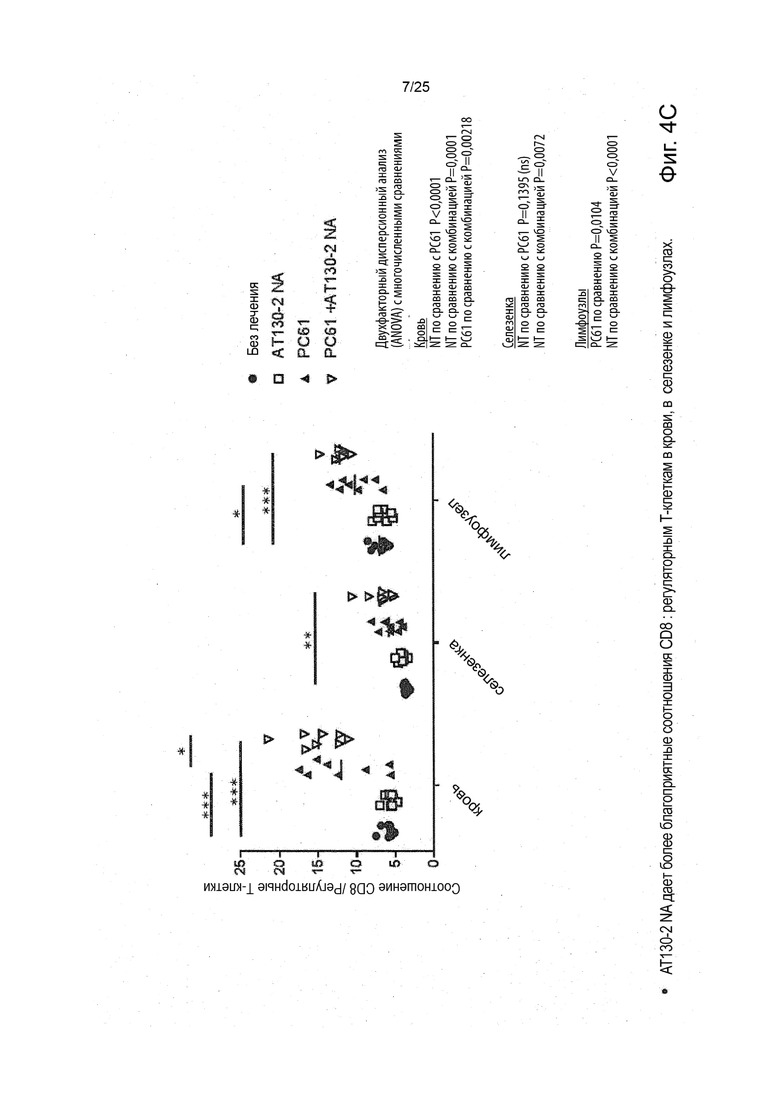
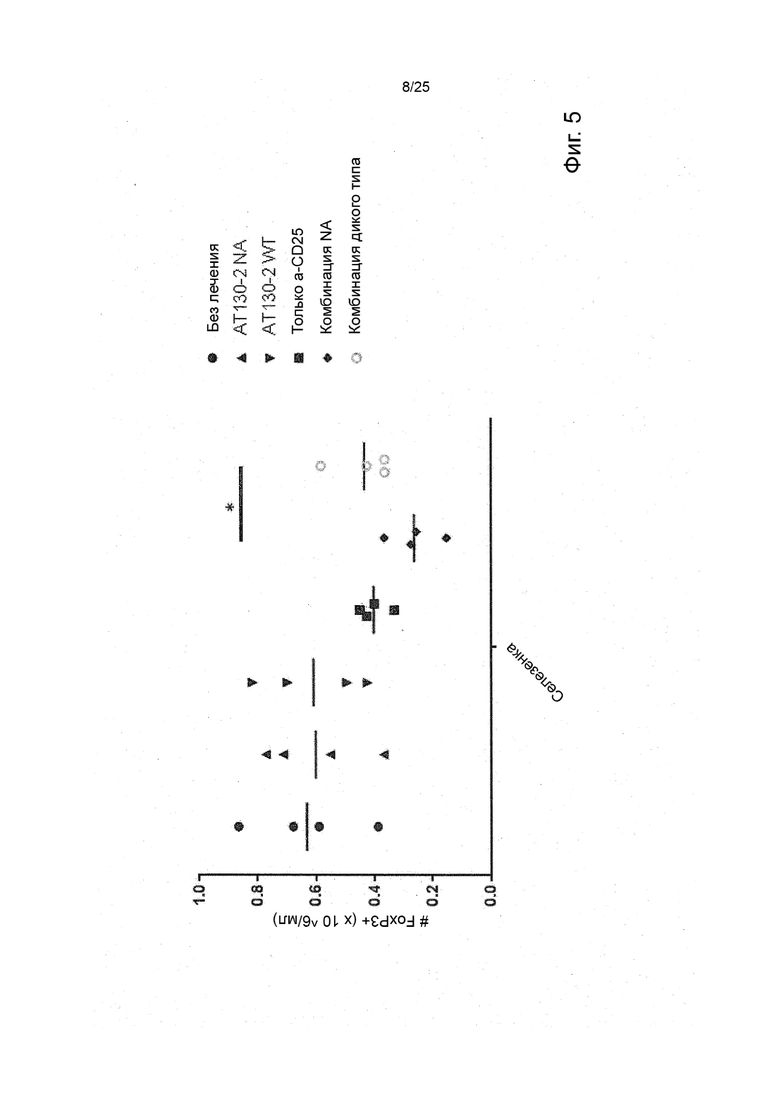

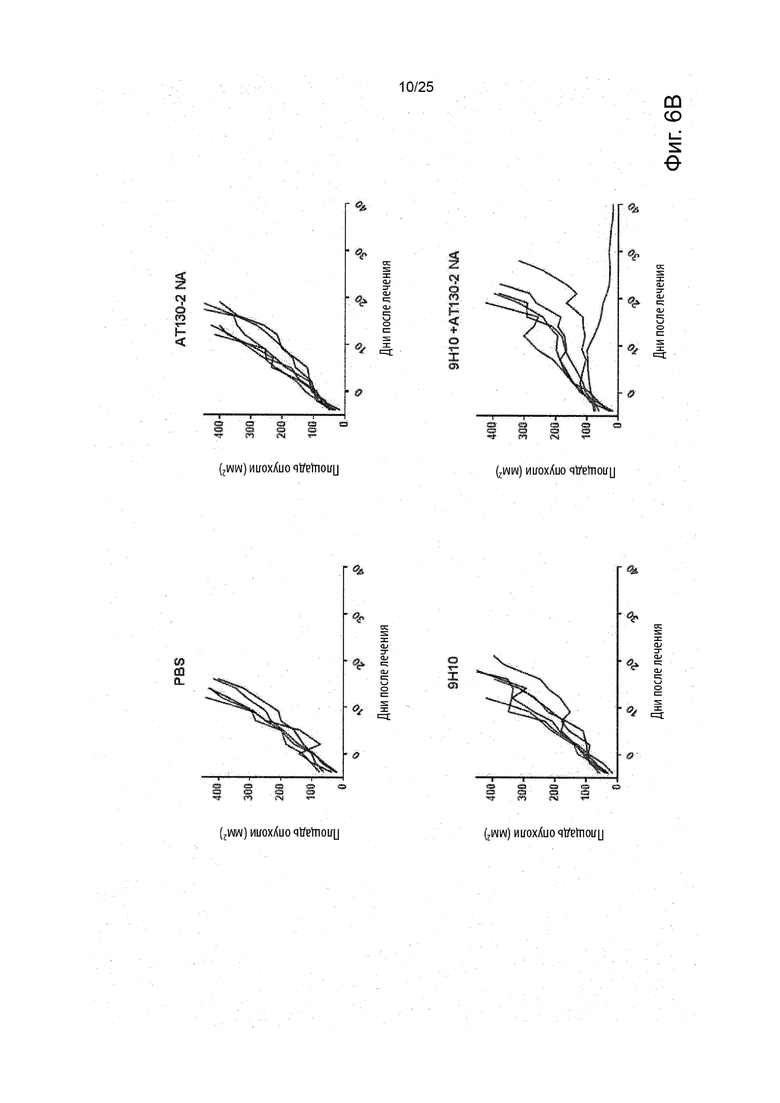

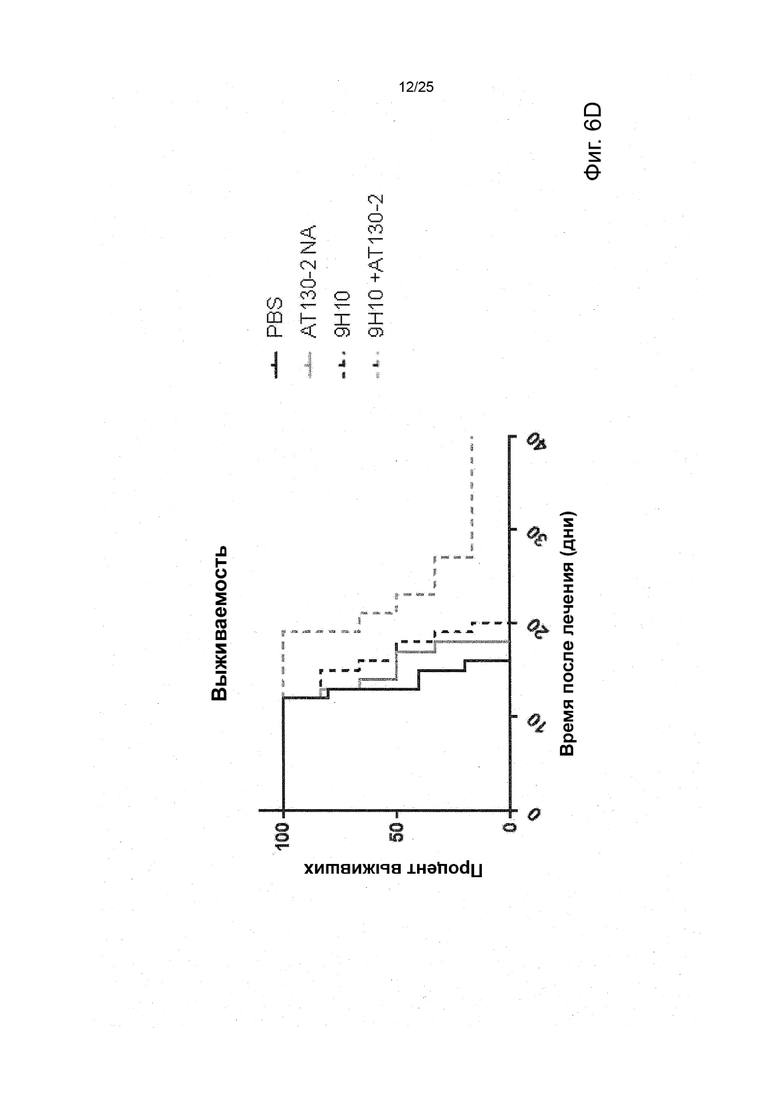
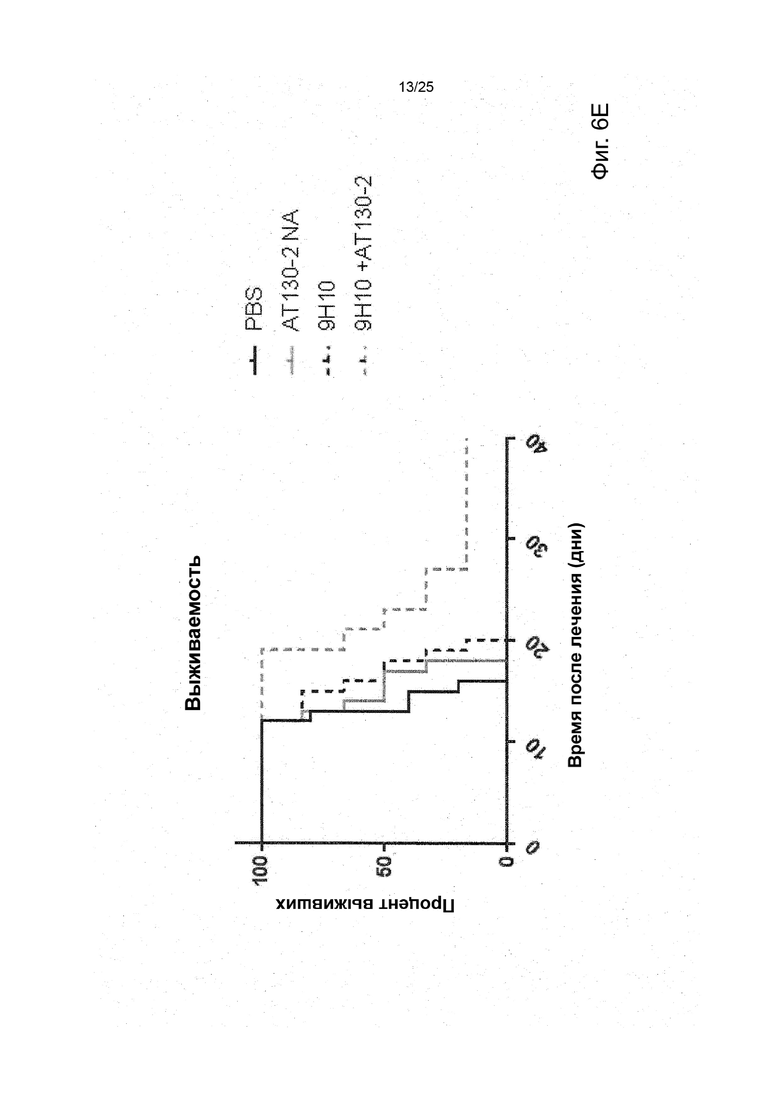
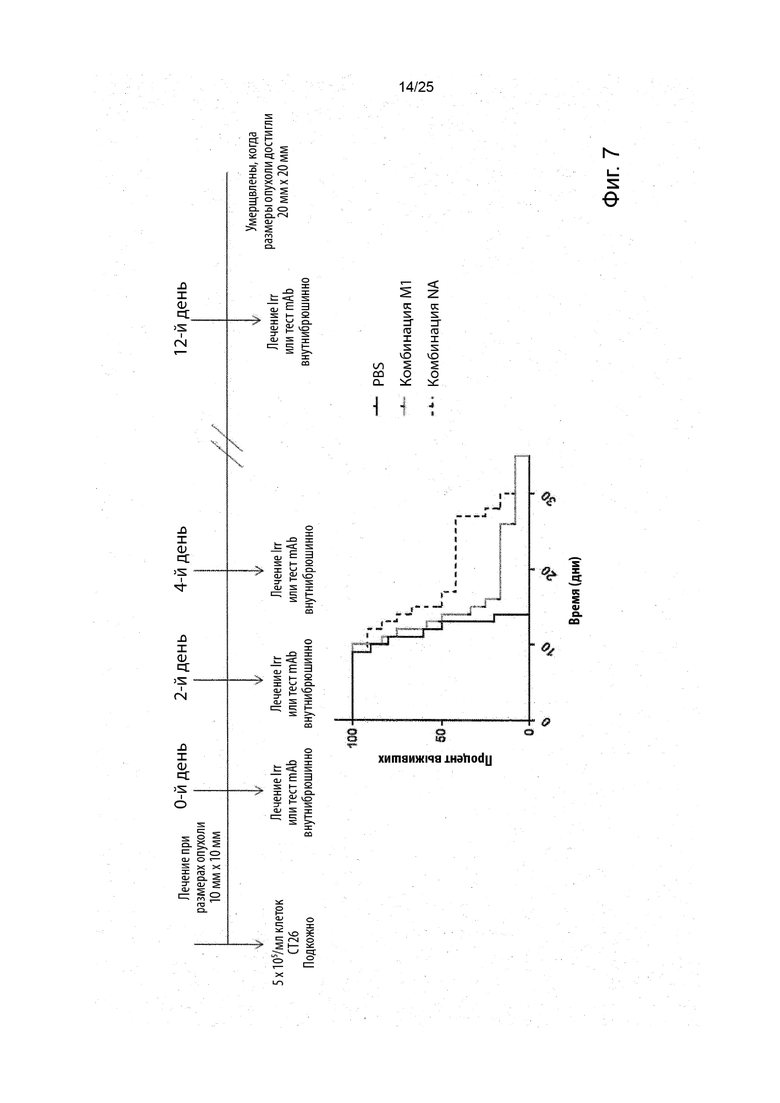

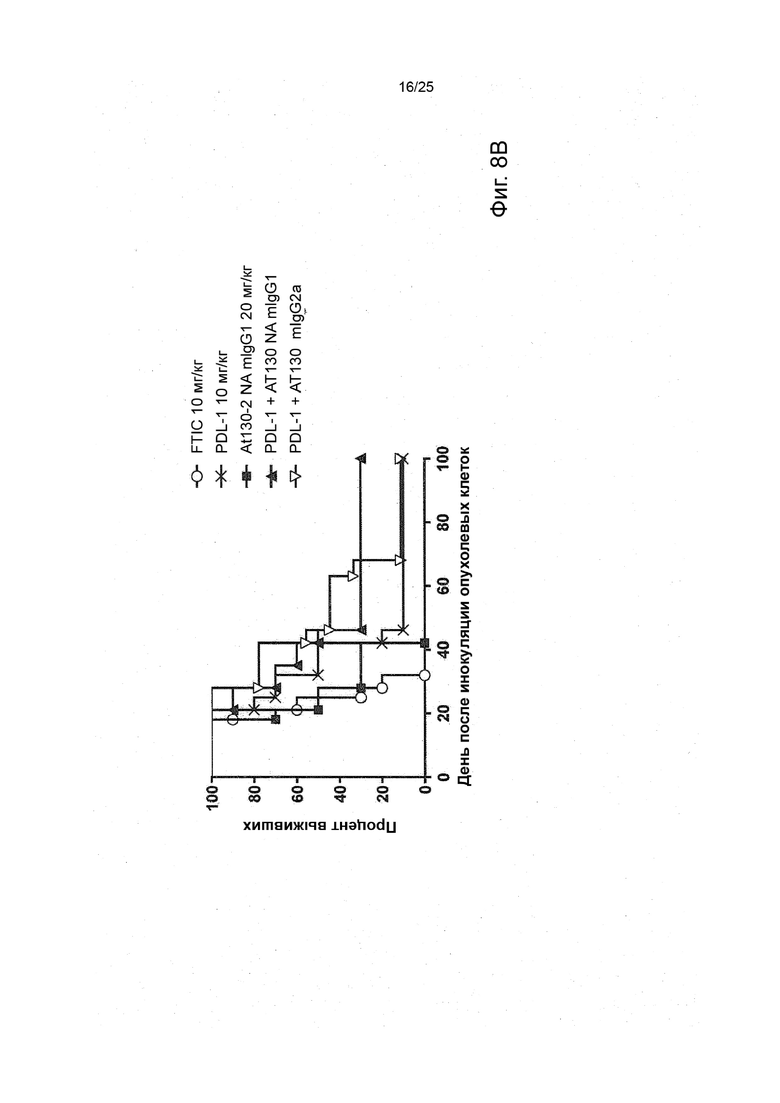
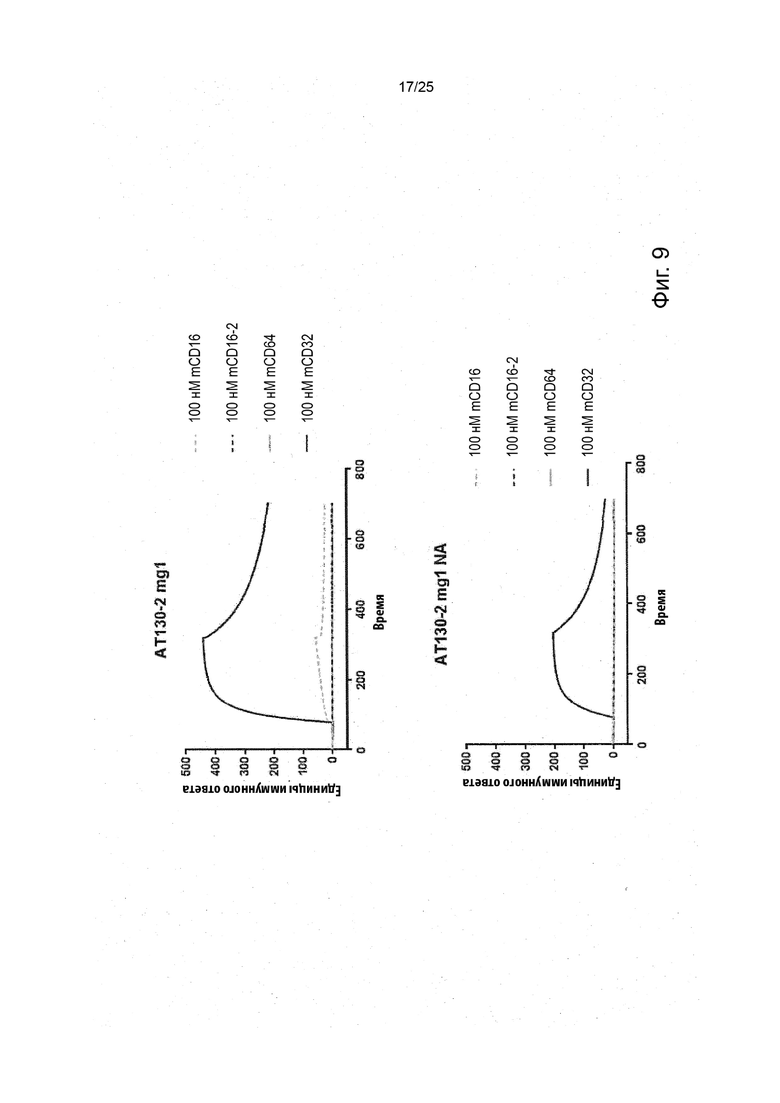
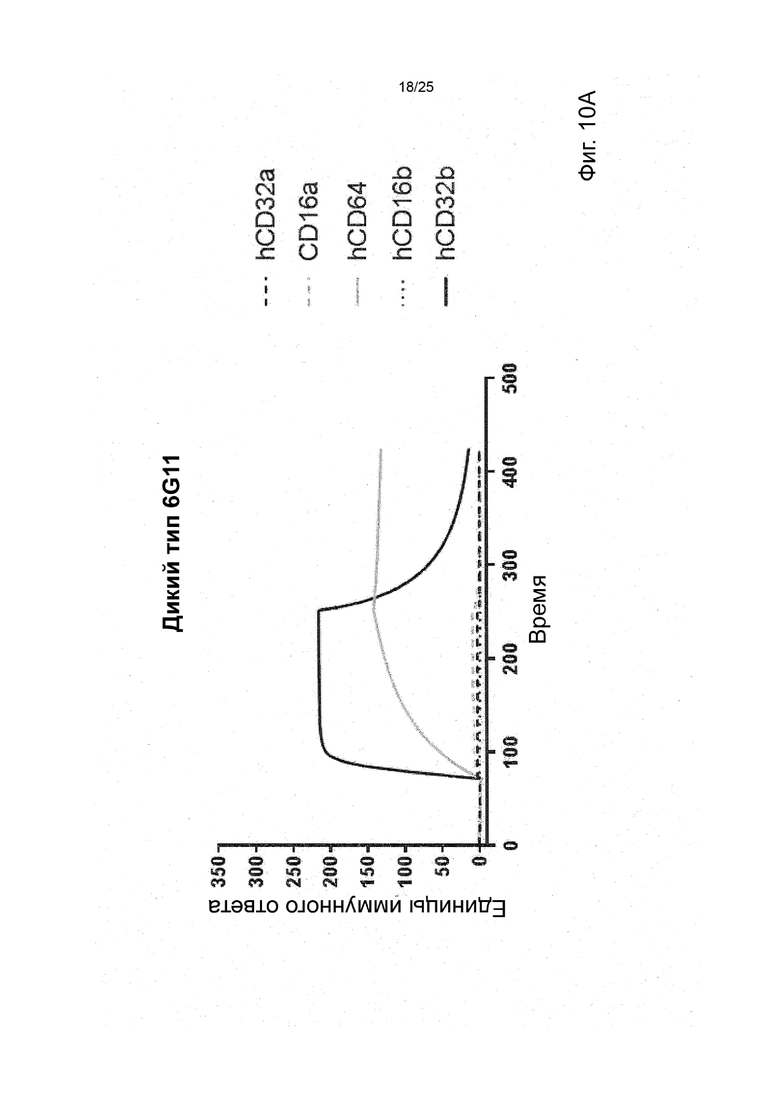
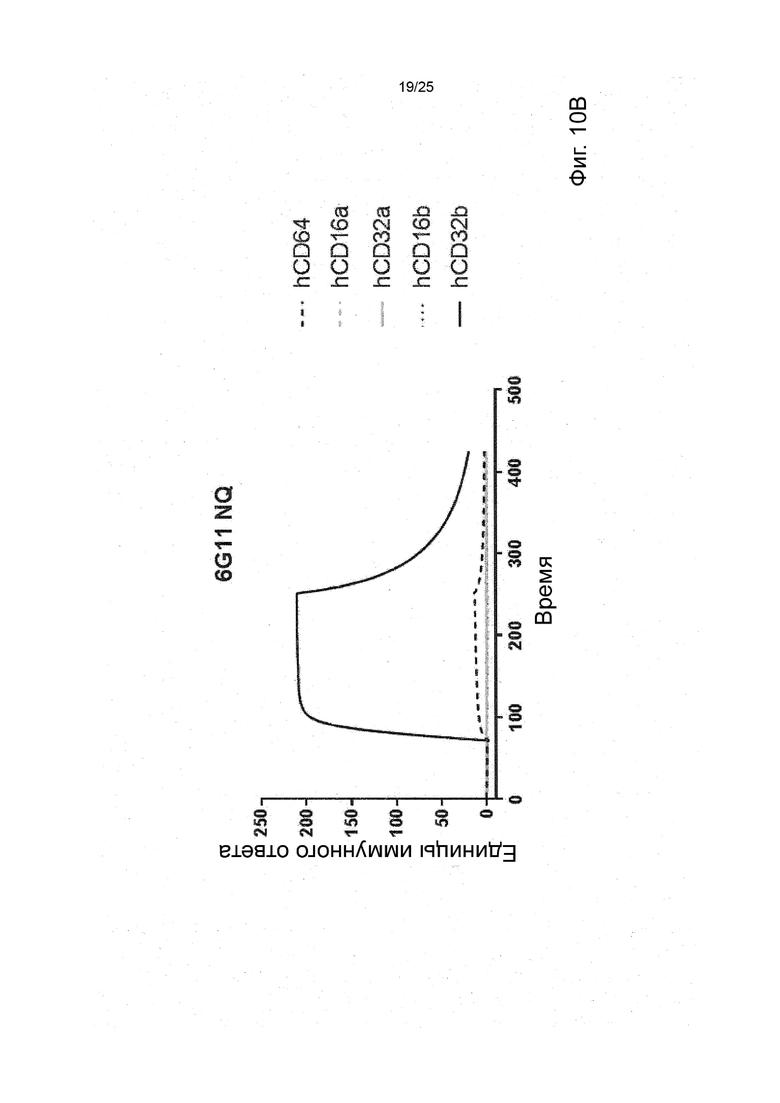
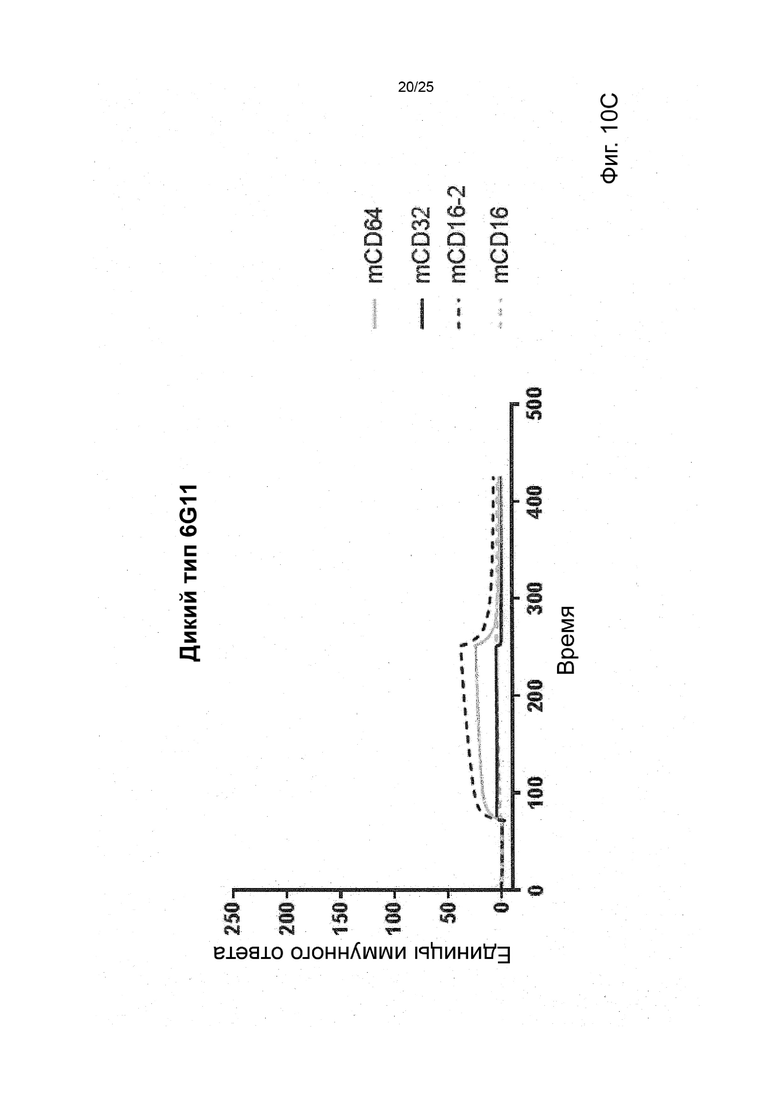

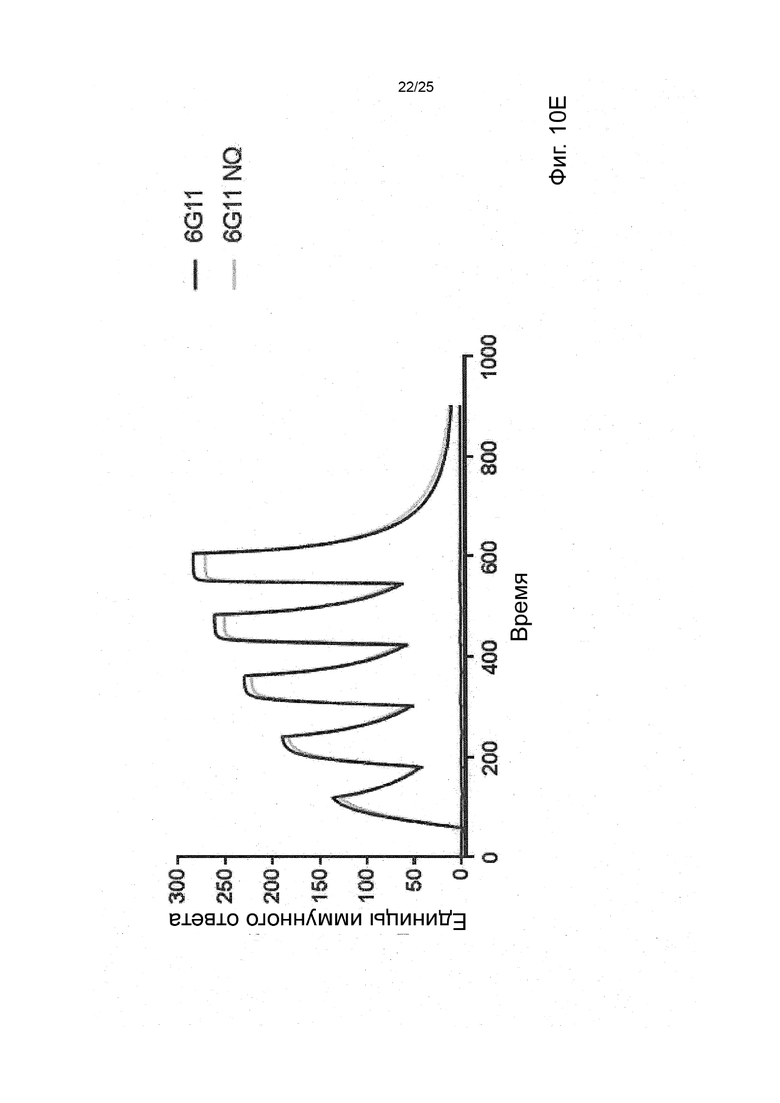
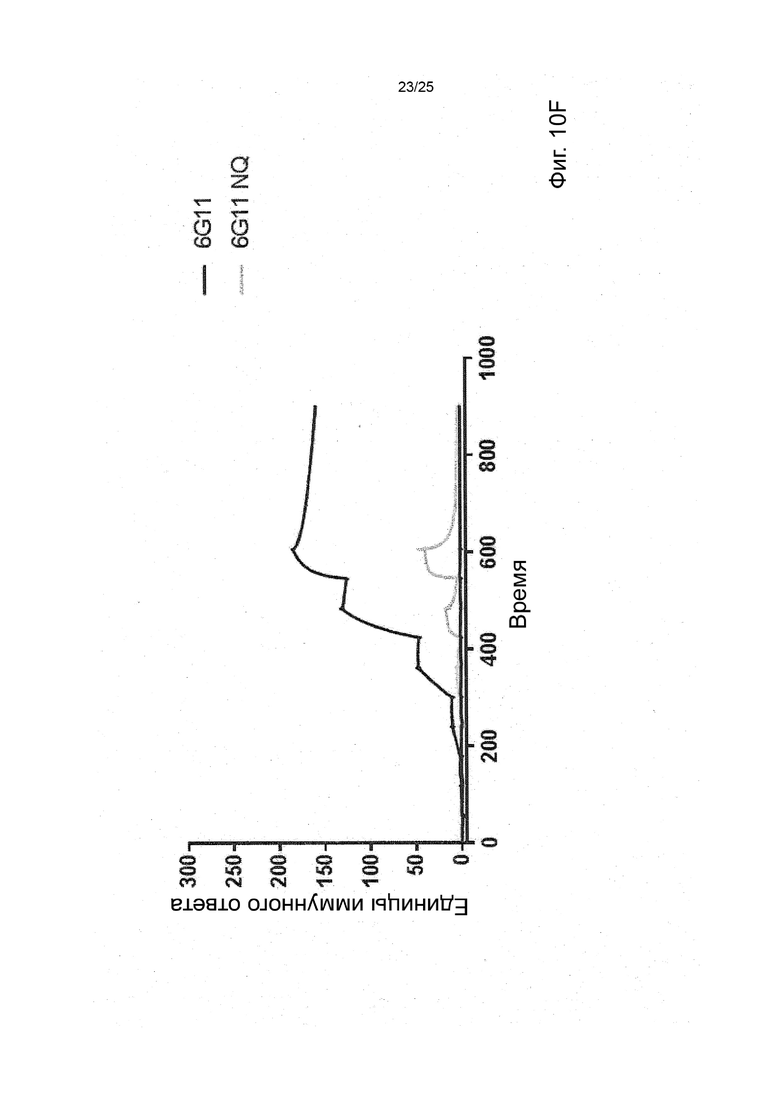
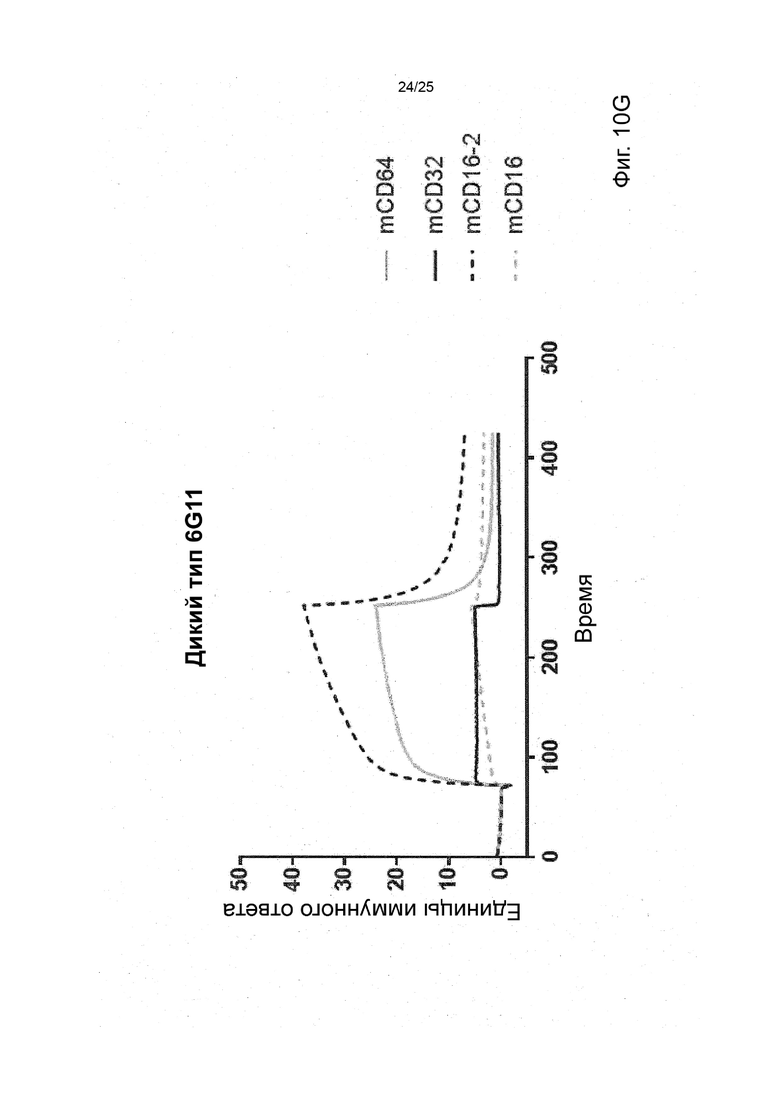
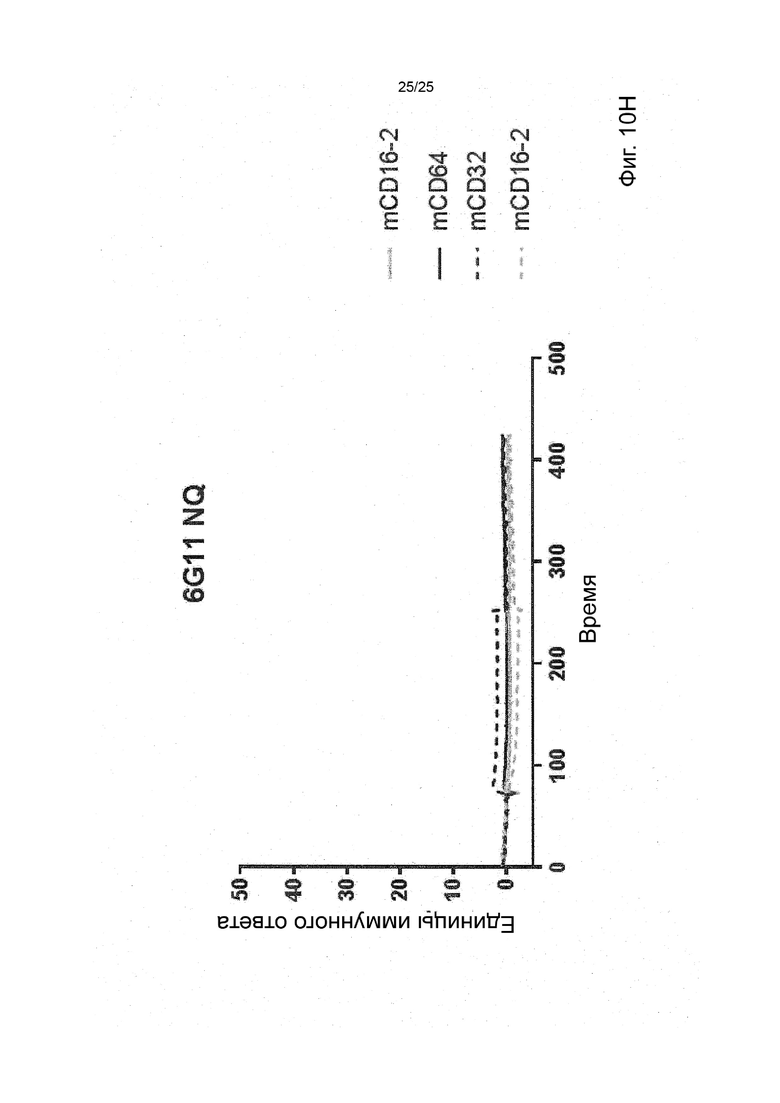
Изобретение относится к области биотехнологии, а именно к применению новой комбинации антител. Применение предусматривает использование молекулы первого антитела, которая специфично связывает FcγRIIb посредством своего участка Fab, но не имеет участка Fc или имеет пониженное связывание с рецепторами Fcγ посредством своего участка Fc, для применения в комбинации с молекулой второго антитела, которая специфично связывается с рецептором, присутствующим на иммунной клетке. Изобретение эффективно для лечения FcγRIIb-негативного рака у пациента. 5 н. и 28 з.п. ф-лы, 10 ил., 1 пр.
1. Применение комбинации
молекулы первого антитела или его антигенсвязывающего фрагмента, которая специфично связывает FcγRIIb посредством своего участка Fab, и которая не имеет участка Fc или имеет пониженное связывание с рецепторами Fcγ посредством своего участка Fc, и
молекулы второго антитела, которая специфично связывается с рецептором, присутствующим на иммунной клетке, причем эта иммунная клетка является иммунной клеткой, которая подавляет противораковый иммунитет, у которой молекула второго антитела имеет участок Fc, который связывается как минимум с одним активирующим рецептором Fcγ, и при этом связывание молекулы второго антитела с этим рецептором на иммунной клетке вызывает истощение и/или дезактивацию этой иммунной клетки;
при лечении FcγRIIb-негативного рака у пациента.
2. Применение по п. 1, где первое антитело или его антигенсвязывающий фрагмент не имеет участка Fc.
3. Применение по п. 1 или 2, в котором иммунная клетка, подавляющая противораковый иммунитет, является регуляторной Т-клеткой (Treg).
4. Применение по п. 1 или 2, в котором иммунная клетка, подавляющая противораковый иммунитет, представляет собой миелоидную клетку.
5. Применение по п. 4, в котором миелоидная клетка является макрофагом, ассоциированным с опухолью.
6. Применение по любому из пп. 1-5, причем FcγRIIb-негативный рак является солидным раком.
7. Применение по п. 6, в котором солидный рак выбирают из группы, состоящей из: карциномы; саркомы и лимфомы.
8. Применение по п. 6 или 7, в котором солидный рак выбирают из группы, состоящей из: меланомы, рака молочной железы, рака предстательной железы, рака толстой кишки, рака легких, рака мочевого пузыря, рака почек, мезотелиомы, карциномы клеток Меркеля и рака головы и шеи.
9. Применение по любому из пп. 1-8, в котором молекулу первого антитела или его антигенсвязывающего фрагмента выбирают из группы, состоящей из молекулы антитела человека, молекулы гуманизированного антитела и молекулы антитела человеческого происхождения.
10. Применение по любому из пп. 1-9, в котором молекула первого антитела или его антигенсвязывающего фрагмента представляет собой молекулу моноклонального антитела или молекулу антитела моноклонального происхождения.
11. Применение по любому из пп. 1-10, в котором молекулу первого антитела или его антигенсвязывающего фрагмента выбирают из группы, состоящей из: полноразмерного антитела, химерного антитела, одноцепочечного антитела, фрагмента Fab, фрагмента (Fab')2, фрагмента Fab', фрагмента Fv и фрагмента scFv.
12. Применение по любому из пп. 1-11, причем молекула первого антитела или его антигенсвязывающего фрагмента представляет собой молекулу антитела человеческого IgG, имеющую агликозилированный участок Fc, или молекулу антитела IgG человеческого происхождения, имеющую агликозилированный участок Fc.
13. Применение по п. 12, причем молекула антитела IgG представляет собой молекулу антитела IgG1 или IgG2.
14. Применение по п. 13, причем молекула антитела IgG представляет собой агликозилированное человеческое антитело IgG1, или агликозилированное гуманизированное мышиное антитело, или агликозилированное гуманизированное антитело ламы hcIgG, или агликозилированный химеризированный мышиный IgG.
15. Применение по п. 14, где молекула первого антитела или его антигенсвязывающего фрагмента была агликозилирована путем замены аминокислоты в позиции 297.
16. Применение по п. 15, где молекула первого антитела или его антигенсвязывающего фрагмента была агликозилирована посредством замены N297Q.
17. Применение по любому из пп. 1-16, причем молекула первого антитела или его антигенсвязывающего фрагмента содержит вариабельную тяжелую цепь (VH), содержащую следующие CDR:
(i) SEQ ID NO: 51, и SEQ ID NO: 52, и SEQ ID NO: 53; или
(ii) SEQ ID NO: 57, и SEQ ID NO: 58, и SEQ ID NO: 59; или
(iii) SEQ ID NO: 63, и SEQ ID NO: 64, и SEQ ID NO: 65; или
(iv) SEQ ID NO: 69, и SEQ ID NO: 70, и SEQ ID NO: 71; или
(v) SEQ ID NO: 75, и SEQ ID NO: 76, и SEQ ID NO: 77; или
(vi) SEQ ID NO: 81, и SEQ ID NO: 82, и SEQ ID NO: 83; или
(viiSEQ ID NO: 87, и SEQ ID NO: 88, и SEQ ID NO: 89; или
(viii) SEQ ID NO: 93, и SEQ ID NO: 94, и SEQ ID NO: 95; или
(ix) SEQ ID NO: 99, и SEQ ID NO: 100, и SEQ ID NO: 101; или
(x) SEQ ID NO: 105, и SEQ ID NO: 106, и SEQ ID NO: 107; или
(xi) SEQ ID NO: 111, и SEQ ID NO: 112, и SEQ ID NO: 113; или
(xii) SEQ ID NO: 117, и SEQ ID NO: 118, и SEQ ID NO: 119; или
(xiii) SEQ ID NO: 123, и SEQ ID NO: 124, и SEQ ID NO: 125; или
(xiv) SEQ ID NO: 129, и SEQ ID NO: 130, и SEQ ID NO: 131; или
(xv) SEQ ID NO: 135, и SEQ ID NO: 136, и SEQ ID NO: 137; или
(хvi) SEQ ID NO: 141, и SEQ ID NO: 142, и SEQ ID NO: 143; или
(хvii) SEQ ID NO: 147, и SEQ ID NO: 148, и SEQ ID NO: 149; или
(хviii) SEQ ID NO: 153, и SEQ ID NO: 154, и SEQ ID NO: 155; или
(xix) SEQ ID NO: 159, и SEQ ID NO: 160, и SEQ ID NO: 161; или
(хх) SEQ ID NO: 165, и SEQ ID NO: 166, и SEQ ID NO: 167; или
(xxi) SEQ ID NO: 171, и SEQ ID NO: 172, и SEQ ID NO: 173; или
(ххii) SEQ ID NO: 177, и SEQ ID NO: 178, и SEQ ID NO: 179; или
(ххiii) SEQ ID NO: 183, и SEQ ID NO: 184, и SEQ ID NO: 185; или
(ххiv) SEQ ID NO: 189, и SEQ ID NO: 190, и SEQ ID NO: 191.
18. Применение по любому из пп. 1-17, причем молекула первого антитела или его антигенсвязывающего фрагмента содержит вариабельную легкую цепь (VL), содержащую следующие CDRs:
(i) SEQ ID NO: 54, и SEQ ID NO: 55, и SEQ ID NO: 56; или
(ii) SEQ ID NO: 60, и SEQ ID NO: 61, и SEQ ID NO: 62; или
(iii) SEQ ID NO: 66, и SEQ ID NO: 67, и SEQ ID NO: 68; или
(iv) SEQ ID NO: 72, и SEQ ID NO: 73, и SEQ ID NO: 74; или
(v) SEQ ID NO: 78, и SEQ ID NO: 79, и SEQ ID NO: 80; или
(vi) SEQ ID NO: 84, и SEQ ID NO: 85, и SEQ ID NO: 86; или
(vii) SEQ ID NO: 90, и SEQ ID NO: 91, и SEQ ID NO: 92; или
(viii) SEQ ID NO: 96, и SEQ ID NO: 97, и SEQ ID NO: 98; или
(ix) SEQ ID NO: 102, и SEQ ID NO: 103, и SEQ ID NO: 104; или
(x) SEQ ID NO: 108, и SEQ ID NO: 109, и SEQ ID NO: 110; или
(xi) SEQ ID NO: 114, и SEQ ID NO: 115, и SEQ ID NO: 116; или
(xii) SEQ ID NO: 120, и SEQ ID NO: 121, и SEQ ID NO: 122; или
(xiii) SEQ ID NO: 126, и SEQ ID NO: 127, и SEQ ID NO: 128; или
(xiv) SEQ ID NO: 132, и SEQ ID NO: 133, и SEQ ID NO: 134; или
(xv) SEQ ID NO: 138, и SEQ ID NO: 139, и SEQ ID NO: 140; или
(хvi) SEQ ID NO: 144, и SEQ ID NO: 145, и SEQ ID NO: 146; или
(хvii) SEQ ID NO: 150, и SEQ ID NO: 151, и SEQ ID NO: 152; или
(хviii) SEQ ID NO: 156, и SEQ ID NO: 157, и SEQ ID NO: 158; или
(xix) SEQ ID NO: 162, и SEQ ID NO: 163, и SEQ ID NO: 164; или
(хх) SEQ ID NO: 168, и SEQ ID NO: 169, и SEQ ID NO: 170; или
(xxi) SEQ ID NO: 174, и SEQ ID NO: 175, и SEQ ID NO: 176; или
(ххii) SEQ ID NO: 180, и SEQ ID NO: 181, и SEQ ID NO: 182; или
(ххiii) SEQ ID NO: 186, и SEQ ID NO: 187, и SEQ ID NO: 188; или
(ххiv) SEQ ID NO: 192, и SEQ ID NO: 193, и SEQ ID NO: 194.
19. Применение по любому из пп. 1-18, причем молекула первого антитела или его антигенсвязывающего фрагмента содержит аминокислотную последовательность с вариабельной тяжелой цепью (VH), выбранную из группы, состоящей из: SEQ ID NO: 3; SEQ ID NO: 4; SEQ ID NO: 5; SEQ ID NO: 6; SEQ ID NO: 7; SEQ ID NO: 8; SEQ ID NO: 9; SEQ ID NO: 10; SEQ ID NO: 11; SEQ ID NO: 12; SEQ ID NO: 13; SEQ ID NO: 14; SEQ ID NO: 15; SEQ ID NO: 16; SEQ ID NO: 17; SEQ ID NO: 18; SEQ ID NO: 19; SEQ ID NO: 20; SEQ ID NO: 21; SEQ ID NO: 22; SEQ ID NO: 23; SEQ ID NO: 24; SEQ ID NO: 25 и SEQ ID NO: 26.
20. Применение по любому из пп. 1-19, причем молекула первого антитела или его антигенсвязывающего фрагмента содержит аминокислотную последовательность с вариабельной легкой цепью (VL), выбранную из группы, состоящей из: SEQ ID NO: 27; SEQ ID NO: 28; SEQ ID NO: 29; SEQ ID NO: 30; SEQ ID NO: 31; SEQ ID NO: 32; SEQ ID NO: 33; SEQ ID NO: 34; SEQ ID NO: 35; SEQ ID NO: 36; SEQ ID NO: 37; SEQ ID NO: 38 SEQ ID NO: 39; SEQ ID NO: 40; SEQ ID NO: 41; SEQ ID NO: 42; SEQ ID NO: 43; SEQ ID NO: 44; SEQ ID NO: 45; SEQ ID NO: 46; SEQ ID NO: 47; SEQ ID NO: 48; SEQ ID NO: 49 и SEQ ID NO: 50.
21. Применение по любому из пп. 1-20, причем молекула первого антитела или его антигенсвязывающего фрагмента содержит следующие аминокислотные последовательности CDR:
(i) SEQ ID NO: 51, и SEQ ID NO: 52, и SEQ ID NO: 53, и SEQ ID NO: 54, и SEQ ID NO: 55, и SEQ ID NO: 56; или
(ii) SEQ ID NO: 57, и SEQ ID NO: 58, и SEQ ID NO: 59, и SEQ ID NO: 60, и SEQ ID NO: 61, и SEQ ID NO: 62; или
(iii) SEQ ID NO: 63, и SEQ ID NO: 64, и SEQ ID NO: 65, и SEQ ID NO: 66, и SEQ ID NO: 67, и SEQ ID NO: 68; или
(iv) SEQ ID NO: 69, и SEQ ID NO: 70, и SEQ ID NO: 71, и SEQ ID NO: 72, и SEQ ID NO: 73, и SEQ ID NO: 74; или
(v) SEQ ID NO: 75, и SEQ ID NO: 76, и SEQ ID NO: 77, и SEQ ID NO: 78, и SEQ ID NO: 79, и SEQ ID NO: 80; или
(vi) SEQ ID NO: 81, и SEQ ID NO: 82, и SEQ ID NO: 83, и SEQ ID NO: 84, и SEQ ID NO: 85, и SEQ ID NO: 86; или
(vii) SEQ ID NO: 87, и SEQ ID NO: 88, и SEQ ID NO: 89, и SEQ ID NO: 90, и SEQ ID NO: 91, и SEQ ID NO: 92; или
(viii) SEQ ID NO: 93, и SEQ ID NO: 94, и SEQ ID NO: 95, и SEQ ID NO: 96, и SEQ ID NO: 97, и SEQ ID NO: 98; или
(ix) SEQ ID NO: 99, и SEQ ID NO: 100, и SEQ ID NO: 101, и SEQ ID NO: 102, и SEQ ID NO: 103, и SEQ ID NO: 104; или
(x) SEQ ID NO: 105, и SEQ ID NO: 106, и SEQ ID NO: 107, и SEQ ID NO: 108, и SEQ ID NO: 109, и SEQ ID NO: 110; или
(xi) SEQ ID NO: 111, и SEQ ID NO: 112, и SEQ ID NO: 113, и SEQ ID NO: 114, и SEQ ID NO: 115, и SEQ ID NO: 116; или
(xii) SEQ ID NO: 117, и SEQ ID NO: 118, и SEQ ID NO: 119, и SEQ ID NO: 120, и SEQ ID NO: 121, и SEQ ID NO: 122; или
(xiii) SEQ ID NO: 123, и SEQ ID NO: 124, и SEQ ID NO: 125, и SEQ ID NO: 126, и SEQ ID NO: 127, и SEQ ID NO: 128; или
(xiv) SEQ ID NO: 129, и SEQ ID NO: 130, и SEQ ID NO: 131, и SEQ ID NO: 132, и SEQ ID NO: 133, и SEQ ID NO: 134; или
(xv) SEQ ID NO: 135, и SEQ ID NO: 136, и SEQ ID NO: 137, и SEQ ID NO: 138, и SEQ ID NO: 139, и SEQ ID NO: 140; или
(хvi) SEQ ID NO: 141, и SEQ ID NO: 142, и SEQ ID NO: 143, и SEQ ID NO: 144, и SEQ ID NO: 145, и SEQ ID NO: 146; или
(хvii) SEQ ID NO: 147, и SEQ ID NO: 148, и SEQ ID NO: 149, и SEQ ID NO: 150, и SEQ ID NO: 151, и SEQ ID NO: 152; или
(хviii) SEQ ID NO: 153, и SEQ ID NO: 154, и SEQ ID NO: 155, и SEQ ID NO: 156, и SEQ ID NO: 157, и SEQ ID NO: 158; или
(xix) SEQ ID NO: 159, и SEQ ID NO: 160, и SEQ ID NO: 161, и SEQ ID NO: 162, и SEQ ID NO: 163, и SEQ ID NO: 164; или
(хх) SEQ ID NO: 165, и SEQ ID NO: 166, и SEQ ID NO: 167, и SEQ ID NO: 168, и SEQ ID NO: 169, и SEQ ID NO: 170; или
(xxi) SEQ ID NO: 171, и SEQ ID NO: 172, и SEQ ID NO: 173, и SEQ ID NO: 174, и SEQ ID NO: 175, и SEQ ID NO: 176; или
(ххii) SEQ ID NO: 177, и SEQ ID NO: 178, и SEQ ID NO: 179, и SEQ ID NO: 180, и SEQ ID NO: 181, и SEQ ID NO: 182; или
(ххiii) SEQ ID NO: 183, и SEQ ID NO: 184, и SEQ ID NO: 185, и SEQ ID NO: 186, и SEQ ID NO: 187, и SEQ ID NO: 188; или
(ххiv) SEQ ID NO: 189, и SEQ ID NO: 190, и SEQ ID NO: 191, и SEQ ID NO: 192, и SEQ ID NO: 193, и SEQ ID NO: 194.
22. Применение по любому из пп. 1-21, причем молекула первого антитела или его антигенсвязывающего фрагмента содержит следующие аминокислотные последовательности:
(i) SEQ ID NO: 3 и SEQ ID NO: 27; или
(ii) SEQ IS NO: 4 и SEQ ID NO: 28; или
(iii) SEQ IS NO: 5 и SEQ ID NO: 29; или
(iv) SEQ ID NO: 6 и SEQ ID NO: 30; или
(v) SEQ ID NO: 7 и SEQ ID NO: 31; или
(vi) SEQ ID NO: 8 и SEQ ID NO: 32; или
(vii) SEQ ID NO: 9 и SEQ ID NO: 33; или
(viii) SEQ ID NO: 10 и SEQ ID NO: 34; или
(ix) SEQ ID NO: 11 и SEQ ID NO: 35; или
(x) SEQ ID NO: 12 и SEQ ID NO: 36; или
(xi) SEQ ID NO: 13 и SEQ ID NO: 37; или
(xii) SEQ ID NO: 14 и SEQ ID NO: 38; или
(xiii) SEQ ID NO: 15 и SEQ ID NO: 39; или
(xiv) SEQ ID NO: 16 и SEQ ID NO: 40; или
(xv) SEQ ID NO: 17 и SEQ ID NO: 41; или
(хvi) SEQ ID NO: 18 и SEQ ID NO: 42; или
(хvii) SEQ ID NO: 19 и SEQ ID NO: 43; или
(хviii) SEQ ID NO: 20 и SEQ ID NO: 44; или
(xix) SEQ ID NO: 21 и SEQ ID NO: 45; или
(хх) SEQ ID NO: 22 и SEQ ID NO: 46; или
(xxi) SEQ ID NO: 23 и SEQ ID NO: 47; или
(ххii) SEQ ID NO: 24 и SEQ ID NO: 48; или
(ххiii) SEQ ID NO: 25 и SEQ ID NO: 49; или
(ххiv) SEQ ID NO: 26 и SEQ ID NO: 50.
23. Применение по любому из пп. 1-16, причем молекула первого антитела или его антигенсвязывающего фрагмента, представляет собой молекулу антитела или его антигенсвязывающего фрагмента, способную конкурировать за связывание с FcγRIIb с молекулой антитела, которая:
(а) содержит вариабельную тяжелую цепь (VH), содержащую следующие CDR:
(i) SEQ ID NO: 51, и SEQ ID NO: 52, и SEQ ID NO: 53; или
(ii) SEQ ID NO: 57, и SEQ ID NO: 58, и SEQ ID NO: 59; или
(iii) SEQ ID NO: 63, и SEQ ID NO: 64, и SEQ ID NO: 65; или
(iv) SEQ ID NO: 69, и SEQ ID NO: 70, и SEQ ID NO: 71; или
(v) SEQ ID NO: 75, и SEQ ID NO: 76, и SEQ ID NO: 77; или
(vi) SEQ ID NO: 81, и SEQ ID NO: 82, и SEQ ID NO: 83; или
(vii) SEQ ID NO: 87, и SEQ ID NO: 88, и SEQ ID NO: 89; или
(viii) SEQ ID NO: 93, и SEQ ID NO: 94, и SEQ ID NO: 95; или
(ix) SEQ ID NO: 99, и SEQ ID NO: 100, и SEQ ID NO: 101; или
(x) SEQ ID NO: 105, и SEQ ID NO: 106, и SEQ ID NO: 107; или
(xi) SEQ ID NO: 111, и SEQ ID NO: 112, и SEQ ID NO: 113; или
(xii) SEQ ID NO: 117, и SEQ ID NO: 118, и SEQ ID NO: 119; или
(xiii) SEQ ID NO: 123, и SEQ ID NO: 124, и SEQ ID NO: 125; или
(xiv) SEQ ID NO: 129, и SEQ ID NO: 130, и SEQ ID NO: 131; или
(xv) SEQ ID NO: 135, и SEQ ID NO: 136, и SEQ ID NO: 137; или
(хvi) SEQ ID NO: 141, и SEQ ID NO: 142, и SEQ ID NO: 143; или
(хvii) SEQ ID NO: 147, и SEQ ID NO: 148, и SEQ ID NO: 149; или
(хviii) SEQ ID NO: 153, и SEQ ID NO: 154, и SEQ ID NO: 155; или
(xix) SEQ ID NO: 159, и SEQ ID NO: 160, и SEQ ID NO: 161; или
(хх) SEQ ID NO: 165, и SEQ ID NO: 166, и SEQ ID NO: 167; или
(xxi) SEQ ID NO: 171, и SEQ ID NO: 172, и SEQ ID NO: 173; или
(ххii) SEQ ID NO: 177, и SEQ ID NO: 178, и SEQ ID NO: 179; или
(ххiii) SEQ ID NO: 183, и SEQ ID NO: 184, и SEQ ID NO: 185; или
(ххiv) SEQ ID NO: 189, и SEQ ID NO: 190, и SEQ ID NO: 191; и
содержит вариабельную легкую цепь (VL), содержащую следующие CDRs:
(i) SEQ ID NO: 54, и SEQ ID NO: 55, и SEQ ID NO: 56; или
(ii) SEQ ID NO: 60, и SEQ ID NO: 61, и SEQ ID NO: 62; или
(iii) SEQ ID NO: 66, и SEQ ID NO: 67, и SEQ ID NO: 68; или
(iv) SEQ ID NO: 72, и SEQ ID NO: 73, и SEQ ID NO: 74; или
(v) SEQ ID NO: 78, и SEQ ID NO: 79, и SEQ ID NO: 80; или
(vi) SEQ ID NO: 84, и SEQ ID NO: 85, и SEQ ID NO: 86; или
(vii) SEQ ID NO: 90, и SEQ ID NO: 91, и SEQ ID NO: 92; или
(viii) SEQ ID NO: 96, и SEQ ID NO: 97, и SEQ ID NO: 98; или
(ix) SEQ ID NO: 102, и SEQ ID NO: 103, и SEQ ID NO: 104; или
(x) SEQ ID NO: 108, и SEQ ID NO: 109, и SEQ ID NO: 110; или
(xi) SEQ ID NO: 114, и SEQ ID NO: 115, и SEQ ID NO: 116; или
(xii) SEQ ID NO: 120, и SEQ ID NO: 121, и SEQ ID NO: 122; или
(xiii) SEQ ID NO: 126, и SEQ ID NO: 127, и SEQ ID NO: 128; или
(xiv) SEQ ID NO: 132, и SEQ ID NO: 133, и SEQ ID NO: 134; или
(xv) SEQ ID NO: 138, и SEQ ID NO: 139, и SEQ ID NO: 140; или
(хvi) SEQ ID NO: 144, и SEQ ID NO: 145, и SEQ ID NO: 146; или
(хvii) SEQ ID NO: 150, и SEQ ID NO: 151, и SEQ ID NO: 152; или
(хviii) SEQ ID NO: 156, и SEQ ID NO: 157, и SEQ ID NO: 158; или
(xix) SEQ ID NO: 162, и SEQ ID NO: 163, и SEQ ID NO: 164; или
(хх) SEQ ID NO: 168, и SEQ ID NO: 169, и SEQ ID NO: 170; или
(xxi) SEQ ID NO: 174, и SEQ ID NO: 175, и SEQ ID NO: 176; или
(ххii) SEQ ID NO: 180, и SEQ ID NO: 181, и SEQ ID NO: 182; или
(ххiii) SEQ ID NO: 186, и SEQ ID NO: 187, и SEQ ID NO: 188; или
(ххiv) SEQ ID NO: 192, и SEQ ID NO: 193, и SEQ ID NO: 194; или
(b) содержит аминокислотную последовательность с вариабельной тяжелой цепью (VH), выбранную из группы, состоящей из: SEQ ID NO: 3; SEQ ID NO: 4; SEQ ID NO: 5; SEQ ID NO: 6; SEQ ID NO: 7; SEQ ID NO: 8; SEQ ID NO: 9; SEQ ID NO: 10; SEQ ID NO: 11; SEQ ID NO: 12; SEQ ID NO: 13; SEQ ID NO: 14; SEQ ID NO: 15; SEQ ID NO: 16; SEQ ID NO: 17; SEQ ID NO: 18; SEQ ID NO: 19; SEQ ID NO: 20; SEQ ID NO: 21; SEQ ID NO: 22; SEQ ID NO: 23; SEQ ID NO: 24; SEQ ID NO: 25 и SEQ ID NO: 26, и вариабельной легкой цепью (VL), выбранную из группы, состоящей из: SEQ ID NO: 27; SEQ ID NO: 28; SEQ ID NO: 29; SEQ ID NO: 30; SEQ ID NO: 31; SEQ ID NO: 32; SEQ ID NO: 33; SEQ ID NO: 34; SEQ ID NO: 35; SEQ ID NO: 36; SEQ ID NO: 37; SEQ ID NO: 38 SEQ ID NO: 39; SEQ ID NO: 40; SEQ ID NO: 41; SEQ ID NO: 42; SEQ ID NO: 43; SEQ ID NO: 44; SEQ ID NO: 45; SEQ ID NO: 46; SEQ ID NO: 47; SEQ ID NO: 48; SEQ ID NO: 49 и SEQ ID NO: 50, или
(с) содержит следующие аминокислотные последовательности CDR:
(i) SEQ ID NO: 51, и SEQ ID NO: 52, и SEQ ID NO: 53, и SEQ ID NO: 54, и SEQ ID NO: 55, и SEQ ID NO: 56; или
(ii) SEQ ID NO: 57, и SEQ ID NO: 58, и SEQ ID NO: 59, и SEQ ID NO: 60, и SEQ ID NO: 61, и SEQ ID NO: 62; или
(iii) SEQ ID NO: 63, и SEQ ID NO: 64, и SEQ ID NO: 65, и SEQ ID NO: 66, и SEQ ID NO: 67, и SEQ ID NO: 68; или
(iv) SEQ ID NO: 69, и SEQ ID NO: 70, и SEQ ID NO: 71, и SEQ ID NO: 72, и SEQ ID NO: 73, и SEQ ID NO: 74; или
(v) SEQ ID NO: 75, и SEQ ID NO: 76, и SEQ ID NO: 77, и SEQ ID NO: 78, и SEQ ID NO: 79, и SEQ ID NO: 80; или
(vi) SEQ ID NO: 81, и SEQ ID NO: 82, и SEQ ID NO: 83, и SEQ ID NO: 84, и SEQ ID NO: 85, и SEQ ID NO: 86; или
(vii) SEQ ID NO: 87, и SEQ ID NO: 88, и SEQ ID NO: 89, и SEQ ID NO: 90, и SEQ ID NO: 91, и SEQ ID NO: 92; или
(viii) SEQ ID NO: 93, и SEQ ID NO: 94, и SEQ ID NO: 95, и SEQ ID NO: 96, и SEQ ID NO: 97, и SEQ ID NO: 98; или
(ix) SEQ ID NO: 99, и SEQ ID NO: 100, и SEQ ID NO: 101, и SEQ ID NO: 102, и SEQ ID NO: 103, и SEQ ID NO: 104; или
(x) SEQ ID NO: 105, и SEQ ID NO: 106, и SEQ ID NO: 107, и SEQ ID NO: 108, и SEQ ID NO: 109, и SEQ ID NO: 110; или
(xi) SEQ ID NO: 111, и SEQ ID NO: 112, и SEQ ID NO: 113, и SEQ ID NO: 114, и SEQ ID NO: 115, и SEQ ID NO: 116; или
(xii) SEQ ID NO: 117, и SEQ ID NO: 118, и SEQ ID NO: 119, и SEQ ID NO: 120, и SEQ ID NO: 121, и SEQ ID NO: 122; или
(xiii) SEQ ID NO: 123, и SEQ ID NO: 124, и SEQ ID NO: 125, и SEQ ID NO: 126, и SEQ ID NO: 127, и SEQ ID NO: 128; или
(xiv) SEQ ID NO: 129, и SEQ ID NO: 130, и SEQ ID NO: 131, и SEQ ID NO: 132, и SEQ ID NO: 133, и SEQ ID NO: 134; или
(xv) SEQ ID NO: 135, и SEQ ID NO: 136, и SEQ ID NO: 137, и SEQ ID NO: 138, и SEQ ID NO: 139, и SEQ ID NO: 140; или
(хvi) SEQ ID NO: 141, и SEQ ID NO: 142, и SEQ ID NO: 143, и SEQ ID NO: 144, и SEQ ID NO: 145, и SEQ ID NO: 146; или
(хvii) SEQ ID NO: 147, и SEQ ID NO: 148, и SEQ ID NO: 149, и SEQ ID NO: 150, и SEQ ID NO: 151, и SEQ ID NO: 152; или
(хviii) SEQ ID NO: 153, и SEQ ID NO: 154, и SEQ ID NO: 155, и SEQ ID NO: 156, и SEQ ID NO: 157, и SEQ ID NO: 158; или
(xix) SEQ ID NO: 159, и SEQ ID NO: 160, и SEQ ID NO: 161, и SEQ ID NO: 162, и SEQ ID NO: 163, и SEQ ID NO: 164; или
(хх) SEQ ID NO: 165, и SEQ ID NO: 166, и SEQ ID NO: 167, и SEQ ID NO: 168, и SEQ ID NO: 169, и SEQ ID NO: 170; или
(xxi) SEQ ID NO: 171, и SEQ ID NO: 172, и SEQ ID NO: 173, и SEQ ID NO: 174, и SEQ ID NO: 175, и SEQ ID NO: 176; или
(ххii) SEQ ID NO: 177, и SEQ ID NO: 178, и SEQ ID NO: 179, и SEQ ID NO: 180, и SEQ ID NO: 181, и SEQ ID NO: 182; или
(ххiii) SEQ ID NO: 183, и SEQ ID NO: 184, и SEQ ID NO: 185, и SEQ ID NO: 186, и SEQ ID NO: 187, и SEQ ID NO: 188; или
(ххiv) SEQ ID NO: 189, и SEQ ID NO: 190, и SEQ ID NO: 191, и SEQ ID NO: 192, и SEQ ID NO: 193, и SEQ ID NO: 194.
24. Применение по любому из пп. 1-23, причем молекулу второго антитела выбирают из группы, состоящей из молекулы человеческого антитела, молекулы гуманизированного антитела и молекулы антитела человеческого происхождения.
25. Применение по любому из пп. 1-24, причем молекула второго антитела представляет собой человеческое антитело IgG.
26. Применение по любому из пп. 1-25, причем молекула второго антитела специфично связывается с рецептором, выбранным из группы, состоящей из: CTLA-4; 4-1BB; OX40; TNFR2; PD-L1; Il-2R и GITR.
27. Применение по п. 26, причем молекула второго антитела специфично связывается с CTLA-4.
28. Применение по п. 26, причем молекула второго антитела специфично связывается с PD-L1.
29. Фармацевтическая композиция, содержащая:
(i) молекулу первого антитела или его антигенсвязывающего фрагмента, которая специфично связывает FcγRIIb посредством своего участка Fab и которая не имеет участка Fc или имеет пониженное связывание с рецепторами Fcγ посредством своего участка Fc; и
(ii) молекулу второго антитела, которая специфично связывается с рецептором, присутствующим на иммунной клетке, причем эта иммунная клетка является иммунной клеткой, которая подавляет противораковый иммунитет, в которой молекула второго антитела имеет участок Fc, который связывается как минимум с одним активирующим рецептором Fcγ, и при этом связывание второго антитела с этим рецептором на иммунной клетке вызывает истощение и/или дезактивацию этой иммунной клетки;
для применения в лечении FcγRIIb-негативного рака у пациента.
30. Фармацевтическая композиция для применения по п. 29, причем первое антитело или его антигенсвязывающий фрагмент не имеет участка Fc.
31. Фармацевтическая композиция для применения по п. 29 или 30, где иммунная клетка, подавляющая противораковый иммунитет, является регуляторной Т-клеткой (Treg).
32. Фармацевтическая композиция для применения по п. 29 или 30, в которой иммунная клетка, подавляющая противораковый иммунитет, представляет собой миелоидную клетку.
33. Фармацевтическая композиция для применения по п. 32, в которой миелоидная клетка является макрофагом, ассоциированным с опухолью.
34. Фармацевтическая композиция для применения по любому из пп. 29-33, причем FcγRIIb-негативный рак является солидным раком.
35. Фармацевтическая композиция для применения по п. 34, в которой солидный рак выбирают из группы, состоящей из: карциномы, саркомы и лимфомы.
36. Фармацевтическая композиция для применения по п. 34 или 35, в которой солидный рак выбирают из группы, состоящей из: меланомы, рака молочной железы, рака предстательной железы, рака толстой кишки, рака легких, рака мочевого пузыря, рака почек, мезотелиомы, карциномы клеток Меркеля и рака головы и шеи.
37. Фармацевтическая композиция для применения по любому из пп. 29-36, в которой молекулу первого антитела или его антигенсвязывающего фрагмента выбирают из группы, состоящей из молекулы антитела человека, молекулы гуманизированного антитела и молекулы антитела человеческого происхождения.
38. Фармацевтическая композиция для применения по любому из пп. 29-37, в которой молекула первого антитела или его антигенсвязывающего фрагмента представляет собой молекулу моноклонального антитела или молекулу антитела моноклонального происхождения.
39. Фармацевтическая композиция для применения по любому из пп. 29-38, в которой молекулу первого антитела или его антигенсвязывающего фрагмента выбирают из группы, состоящей из: полноразмерного антитела, химерного антитела, одноцепочечного антитела, фрагмента Fab, фрагмента (Fab')2, фрагмента Fab', фрагмента Fv и фрагмента scFv.
40. Фармацевтическая композиция для применения по любому из пп. 29-39, причем молекула первого антитела или его антигенсвязывающего фрагмента представляет собой молекулу антитела человеческого IgG, имеющую агликозилированный участок Fc, или молекулу антитела IgG человеческого происхождения, имеющую агликозилированный участок Fc.
41. Фармацевтическая композиция для применения по п. 40, причем молекула антитела IgG представляет собой молекулу антитела IgG1 или IgG2.
42. Фармацевтическая композиция для применения по п. 41, причем молекула антитела IgG представляет собой агликозилированное человеческое антитело IgG1, или агликозилированное гуманизированное мышиное антитело, или агликозилированное гуманизированное антитело ламы hcIgG, или агликозилированный химеризированный мышиный IgG.
43. Фармацевтическая композиция для применения по п. 42, где молекула первого антитела или его антигенсвязывающего фрагмента была агликозилирована путем замены аминокислоты в позиции 297.
44. Фармацевтическая композиция для применения по п. 43, где молекула первого антитела или его антигенсвязывающего фрагмента была агликозилирована посредством замены N297Q.
45. Фармацевтическая композиция для применения по любому из пп. 29-44, причем молекула первого антитела или его антигенсвязывающего фрагмента содержит вариабельную тяжелую цепь (VH), содержащую следующие CDR:
(i) SEQ ID NO: 51, и SEQ ID NO: 52 и SEQ ID NO: 53; или
(ii) SEQ ID NO: 57, и SEQ ID NO: 58, и SEQ ID NO: 59; или
(iii) SEQ ID NO: 63, и SEQ ID NO: 64, и SEQ ID NO: 65; или
(iv) SEQ ID NO: 69, и SEQ ID NO: 70, и SEQ ID NO: 71; или
(v) SEQ ID NO: 75, и SEQ ID NO: 76, и SEQ ID NO: 77; или
(vi) SEQ ID NO: 81, и SEQ ID NO: 82, и SEQ ID NO: 83; или
(vii) SEQ ID NO: 87, и SEQ ID NO: 88, и SEQ ID NO: 89; или
(viii) SEQ ID NO: 93, и SEQ ID NO: 94, и SEQ ID NO: 95; или
(ix) SEQ ID NO: 99, и SEQ ID NO: 100, и SEQ ID NO: 101; или
(x) SEQ ID NO: 105, и SEQ ID NO: 106, и SEQ ID NO: 107; или
(xi) SEQ ID NO: 111, и SEQ ID NO: 112, и SEQ ID NO: 113; или
(xii) SEQ ID NO: 117, и SEQ ID NO: 118, и SEQ ID NO: 119; или
(xiii) SEQ ID NO: 123, и SEQ ID NO: 124, и SEQ ID NO: 125; или
(xiv) SEQ ID NO: 129, и SEQ ID NO: 130, и SEQ ID NO: 131; или
(xv) SEQ ID NO: 135, и SEQ ID NO: 136, и SEQ ID NO: 137; или
(хvi) SEQ ID NO: 141, и SEQ ID NO: 142, и SEQ ID NO: 143; или
(хvii) SEQ ID NO: 147, и SEQ ID NO: 148, и SEQ ID NO: 149; или
(хviii) SEQ ID NO: 153, и SEQ ID NO: 154, и SEQ ID NO: 155; или
(xix) SEQ ID NO: 159, и SEQ ID NO: 160, и SEQ ID NO: 161; или
(хх) SEQ ID NO: 165, и SEQ ID NO: 166, и SEQ ID NO: 167; или
(xxi) SEQ ID NO: 171, и SEQ ID NO: 172, и SEQ ID NO: 173; или
(ххii) SEQ ID NO: 177, и SEQ ID NO: 178, и SEQ ID NO: 179; или
(ххiii) SEQ ID NO: 183, и SEQ ID NO: 184, и SEQ ID NO: 185; или
(ххiv) SEQ ID NO: 189, и SEQ ID NO: 190, и SEQ ID NO: 191.
46. Фармацевтическая композиция для применения по любому из пп. 29-45, причем молекула первого антитела или его антигенсвязывающего фрагмента содержит вариабельную легкую цепь (VL), содержащую следующие CDRs:
(i) SEQ ID NO: 54, и SEQ ID NO: 55, и SEQ ID NO: 56; или
(ii) SEQ ID NO: 60, и SEQ ID NO: 61, и SEQ ID NO: 62; или
(iii) SEQ ID NO: 66, и SEQ ID NO: 67, и SEQ ID NO: 68; или
(iv) SEQ ID NO: 72, и SEQ ID NO: 73, и SEQ ID NO: 74; или
(v) SEQ ID NO: 78, и SEQ ID NO: 79, и SEQ ID NO: 80; или
(vi) SEQ ID NO: 84, и SEQ ID NO: 85, и SEQ ID NO: 86; или
(vii) SEQ ID NO: 90, и SEQ ID NO: 91, и SEQ ID NO: 92; или
(viii) SEQ ID NO: 96, и SEQ ID NO: 97, и SEQ ID NO: 98; или
(ix) SEQ ID NO: 102, и SEQ ID NO: 103, и SEQ ID NO: 104; или
(x) SEQ ID NO: 108, и SEQ ID NO: 109, и SEQ ID NO: 110; или
(xi) SEQ ID NO: 114, и SEQ ID NO: 115, и SEQ ID NO: 116; или
(xii) SEQ ID NO: 120, и SEQ ID NO: 121, и SEQ ID NO: 122; или
(xiii) SEQ ID NO: 126, и SEQ ID NO: 127, и SEQ ID NO: 128; или
(xiv) SEQ ID NO: 132, и SEQ ID NO: 133, и SEQ ID NO: 134; или
(xv) SEQ ID NO: 138, и SEQ ID NO: 139, и SEQ ID NO: 140; или
(хvi) SEQ ID NO: 144, и SEQ ID NO: 145, и SEQ ID NO: 146; или
(хvii) SEQ ID NO: 150, и SEQ ID NO: 151, и SEQ ID NO: 152; или
(хviii) SEQ ID NO: 156, и SEQ ID NO: 157, и SEQ ID NO: 158; или
(xix) SEQ ID NO: 162, и SEQ ID NO: 163, и SEQ ID NO: 164; или
(хх) SEQ ID NO: 168, и SEQ ID NO: 169, и SEQ ID NO: 170; или
(xxi) SEQ ID NO: 174, и SEQ ID NO: 175, и SEQ ID NO: 176; или
(ххii) SEQ ID NO: 180, и SEQ ID NO: 181, и SEQ ID NO: 182; или
(ххiii) SEQ ID NO: 186, и SEQ ID NO: 187, и SEQ ID NO: 188; или
(ххiv) SEQ ID NO: 192, и SEQ ID NO: 193, и SEQ ID NO: 194.
47. Фармацевтическая композиция для применения по любому из пп. 29-46, причем молекула первого антитела или его антигенсвязывающего фрагмента содержит аминокислотную последовательность с вариабельной тяжелой цепью (VH), выбранную из группы, состоящей из: SEQ ID NO: 3; SEQ ID NO: 4; SEQ ID NO: 5; SEQ ID NO: 6; SEQ ID NO: 7; SEQ ID NO: 8; SEQ ID NO: 9; SEQ ID NO: 10; SEQ ID NO: 11; SEQ ID NO: 12; SEQ ID NO: 13; SEQ ID NO: 14; SEQ ID NO: 15; SEQ ID NO: 16; SEQ ID NO: 17; SEQ ID NO: 18; SEQ ID NO: 19; SEQ ID NO: 20; SEQ ID NO: 21; SEQ ID NO: 22; SEQ ID NO: 23; SEQ ID NO: 24; SEQ ID NO: 25 и SEQ ID NO: 26.
48. Фармацевтическая композиция для применения по любому из пп. 29-47, причем молекула первого антитела или его антигенсвязывающего фрагмента содержит аминокислотную последовательность с вариабельной легкой цепью (VL), выбранную из группы, состоящей из: SEQ ID NO: 27; SEQ ID NO: 28; SEQ ID NO: 29; SEQ ID NO: 30; SEQ ID NO: 31; SEQ ID NO: 32; SEQ ID NO: 33; SEQ ID NO: 34; SEQ ID NO: 35; SEQ ID NO: 36; SEQ ID NO: 37; SEQ ID NO: 38 SEQ ID NO: 39; SEQ ID NO: 40; SEQ ID NO: 41; SEQ ID NO: 42; SEQ ID NO: 43; SEQ ID NO: 44; SEQ ID NO: 45; SEQ ID NO: 46; SEQ ID NO: 47; SEQ ID NO: 48; SEQ ID NO: 49 и SEQ ID NO: 50.
49. Фармацевтическая композиция для применения по любому из пп. 29-48, причем молекула первого антитела или его антигенсвязывающего фрагмента содержит следующие аминокислотные последовательности CDR:
(i) SEQ ID NO: 51, и SEQ ID NO: 52, и SEQ ID NO: 53, и SEQ ID NO: 54, и SEQ ID NO: 55, и SEQ ID NO: 56; или
(ii) SEQ ID NO: 57, и SEQ ID NO: 58, и SEQ ID NO: 59, и SEQ ID NO: 60, и SEQ ID NO: 61, и SEQ ID NO: 62; или
(iii) SEQ ID NO: 63, и SEQ ID NO: 64, и SEQ ID NO: 65, и SEQ ID NO: 66, и SEQ ID NO: 67, и SEQ ID NO: 68; или
(iv) SEQ ID NO: 69, и SEQ ID NO: 70, и SEQ ID NO: 71, и SEQ ID NO: 72, и SEQ ID NO: 73, и SEQ ID NO: 74; или
(v) SEQ ID NO: 75, и SEQ ID NO: 76, и SEQ ID NO: 77, и SEQ ID NO: 78, и SEQ ID NO: 79, и SEQ ID NO: 80; или
(vi) SEQ ID NO: 81, и SEQ ID NO: 82, и SEQ ID NO: 83, и SEQ ID NO: 84, и SEQ ID NO: 85, и SEQ ID NO: 86; или
(vii) SEQ ID NO: 87, и SEQ ID NO: 88, и SEQ ID NO: 89, и SEQ ID NO: 90, и SEQ ID NO: 91, и SEQ ID NO: 92; или
(viii) SEQ ID NO: 93, и SEQ ID NO: 94, и SEQ ID NO: 95, и SEQ ID NO: 96, и SEQ ID NO: 97, и SEQ ID NO: 98; или
(ix) SEQ ID NO: 99, и SEQ ID NO: 100, и SEQ ID NO: 101, и SEQ ID NO: 102, и SEQ ID NO: 103, и SEQ ID NO: 104; или
(x) SEQ ID NO: 105, и SEQ ID NO: 106, и SEQ ID NO: 107, и SEQ ID NO: 108, и SEQ ID NO: 109, и SEQ ID NO: 110; или
(xi) SEQ ID NO: 111, и SEQ ID NO: 112, и SEQ ID NO: 113, и SEQ ID NO: 114, и SEQ ID NO: 115, и SEQ ID NO: 116; или
(xii) SEQ ID NO: 117, и SEQ ID NO: 118, и SEQ ID NO: 119, и SEQ ID NO: 120, и SEQ ID NO: 121, и SEQ ID NO: 122; или
(xiii) SEQ ID NO: 123, и SEQ ID NO: 124, и SEQ ID NO: 125, и SEQ ID NO: 126, и SEQ ID NO: 127, и SEQ ID NO: 128; или
(xiv) SEQ ID NO: 129, и SEQ ID NO: 130, и SEQ ID NO: 131, и SEQ ID NO: 132, и SEQ ID NO: 133, и SEQ ID NO: 134; или
(xv) SEQ ID NO: 135, и SEQ ID NO: 136, и SEQ ID NO: 137, и SEQ ID NO: 138, и SEQ ID NO: 139, и SEQ ID NO: 140; или
(хvi) SEQ ID NO: 141, и SEQ ID NO: 142, и SEQ ID NO: 143, и SEQ ID NO: 144, и SEQ ID NO: 145, и SEQ ID NO: 146; или
(хvii) SEQ ID NO: 147, и SEQ ID NO: 148, и SEQ ID NO: 149, и SEQ ID NO: 150, и SEQ ID NO: 151, и SEQ ID NO: 152; или
(хviii) SEQ ID NO: 153, и SEQ ID NO: 154, и SEQ ID NO: 155, и SEQ ID NO: 156, и SEQ ID NO: 157, и SEQ ID NO: 158; или
(xix) SEQ ID NO: 159, и SEQ ID NO: 160, и SEQ ID NO: 161, и SEQ ID NO: 162, и SEQ ID NO: 163, и SEQ ID NO: 164; или
(хх) SEQ ID NO: 165, и SEQ ID NO: 166, и SEQ ID NO: 167, и SEQ ID NO: 168, и SEQ ID NO: 169, и SEQ ID NO: 170; или
(xxi) SEQ ID NO: 171, и SEQ ID NO: 172, и SEQ ID NO: 173, и SEQ ID NO: 174, и SEQ ID NO: 175, и SEQ ID NO: 176; или
(ххii) SEQ ID NO: 177, и SEQ ID NO: 178, и SEQ ID NO: 179, и SEQ ID NO: 180, и SEQ ID NO: 181, и SEQ ID NO: 182; или
(ххiii) SEQ ID NO: 183, и SEQ ID NO: 184, и SEQ ID NO: 185, и SEQ ID NO: 186, и SEQ ID NO: 187, и SEQ ID NO: 188; или
(ххiv) SEQ ID NO: 189, и SEQ ID NO: 190, и SEQ ID NO: 191, и SEQ ID NO: 192, и SEQ ID NO: 193, и SEQ ID NO: 194.
50. Фармацевтическая композиция для применения по любому из пп. 29-49, причем молекула первого антитела или его антигенсвязывающего фрагмента содержит следующие аминокислотные последовательности:
(i) SEQ ID NO: 3 и SEQ ID NO: 27; или
(ii) SEQ ID NO: 4 и SEQ ID NO: 28; или
(iii) SEQ ID NO: 5 и SEQ ID NO: 29; или
(iv) SEQ ID NO: 6 и SEQ ID NO: 30; или
(v) SEQ ID NO: 7 и SEQ ID NO: 31; или
(vi) SEQ ID NO: 8 и SEQ ID NO: 32; или
(vii) SEQ ID NO: 9 и SEQ ID NO: 33; или
(viii) SEQ ID NO: 10 и SEQ ID NO: 34; или
(ix) SEQ ID NO: 11 и SEQ ID NO: 35; или
(x) SEQ ID NO: 12 и SEQ ID NO: 36; или
(xi) SEQ ID NO: 13 и SEQ ID NO: 37; или
(xii) SEQ ID NO: 14 и SEQ ID NO: 38; или
(xiii) SEQ ID NO: 15 и SEQ ID NO: 39; или
(xiv) SEQ ID NO: 16 и SEQ ID NO: 40; или
(xv) SEQ ID NO: 17 и SEQ ID NO: 41; или
(хvi) SEQ ID NO: 18 и SEQ ID NO: 42; или
(хvii) SEQ ID NO: 19 и SEQ ID NO: 43; или
(хviii) SEQ ID NO: 20 и SEQ ID NO: 44; или
(xix) SEQ ID NO: 21 и SEQ ID NO: 45; или
(хх) SEQ ID NO: 22 и SEQ ID NO: 46; или
(xxi) SEQ ID NO: 23 и SEQ ID NO: 47; или
(ххii) SEQ ID NO: 24 и SEQ ID NO: 48; или
(ххiii) SEQ ID NO: 25 и SEQ ID NO: 49; или
(ххiv) SEQ ID NO: 26 и SEQ ID NO: 50.
51. Фармацевтическая композиция для применения по любому из пп. 29-44, причем молекула первого антитела или его антигенсвязывающего фрагмента представляет собой молекулу антитела или его антигенсвязывающего фрагмента, способную конкурировать за связывание с FcγRIIb с молекулой антитела, которая:
(а) содержит вариабельную тяжелую цепь (VH), содержащую следующие CDR:
(i) SEQ ID NO: 51, и SEQ ID NO: 52, и SEQ ID NO: 53; или
(ii) SEQ ID NO: 57, и SEQ ID NO: 58, и SEQ ID NO: 59; или
(iii) SEQ ID NO: 63, и SEQ ID NO: 64, и SEQ ID NO: 65; или
(iv) SEQ ID NO: 69, и SEQ ID NO: 70, и SEQ ID NO: 71; или
(v) SEQ ID NO: 75, и SEQ ID NO: 76, и SEQ ID NO: 77; или
(vi) SEQ ID NO: 81, и SEQ ID NO: 82, и SEQ ID NO: 83; или
(vii) SEQ ID NO: 87, и SEQ ID NO: 88 и SEQ ID NO: 89; или
(viii) SEQ ID NO: 93, и SEQ ID NO: 94, и SEQ ID NO: 95; или
(ix) SEQ ID NO: 99, и SEQ ID NO: 100, и SEQ ID NO: 101; или
(x) SEQ ID NO: 105, и SEQ ID NO: 106, и SEQ ID NO: 107; или
(xi) SEQ ID NO: 111, и SEQ ID NO: 112, и SEQ ID NO: 113; или
(xii) SEQ ID NO: 117, и SEQ ID NO: 118, и SEQ ID NO: 119; или
(xiii) SEQ ID NO: 123, и SEQ ID NO: 124, и SEQ ID NO: 125; или
(xiv) SEQ ID NO: 129, и SEQ ID NO: 130, и SEQ ID NO: 131; или
(xv) SEQ ID NO: 135, и SEQ ID NO: 136, и SEQ ID NO: 137; или
(хvi) SEQ ID NO: 141, и SEQ ID NO: 142, и SEQ ID NO: 143; или
(хvii) SEQ ID NO: 147, и SEQ ID NO: 148, и SEQ ID NO: 149; или
(хviii) SEQ ID NO: 153, и SEQ ID NO: 154, и SEQ ID NO: 155; или
(xix) SEQ ID NO: 159, и SEQ ID NO: 160, и SEQ ID NO: 161; или
(хх) SEQ ID NO: 165, и SEQ ID NO: 166, и SEQ ID NO: 167; или
(xxi) SEQ ID NO: 171, и SEQ ID NO: 172, и SEQ ID NO: 173; или
(ххii) SEQ ID NO: 177, и SEQ ID NO: 178, и SEQ ID NO: 179; или
(ххiii) SEQ ID NO: 183, и SEQ ID NO: 184, и SEQ ID NO: 185; или
(ххiv) SEQ ID NO: 189, и SEQ ID NO: 190, и SEQ ID NO: 191; и
содержит вариабельную легкую цепь (VL), содержащую следующие CDRs:
(i) SEQ ID NO: 54 и SEQ ID NO: 55 и SEQ ID NO: 56; или
(ii) SEQ ID NO: 60 и SEQ ID NO: 61 и SEQ ID NO: 62; или
(iii) SEQ ID NO: 66 и SEQ ID NO: 67 и SEQ ID NO: 68; или
(iv) SEQ ID NO: 72 и SEQ ID NO: 73 и SEQ ID NO: 74; или
(v) SEQ ID NO: 78 и SEQ ID NO: 79 и SEQ ID NO: 80; или
(vi) SEQ ID NO: 84 и SEQ ID NO: 85 и SEQ ID NO: 86; или
(vii) SEQ ID NO: 90 и SEQ ID NO: 91 и SEQ ID NO: 92; или
(viii) SEQ ID NO: 96 и SEQ ID NO: 97 и SEQ ID NO: 98; или
(ix) SEQ ID NO: 102, и SEQ ID NO: 103, и SEQ ID NO: 104; или
(x) SEQ ID NO: 108, и SEQ ID NO: 109, и SEQ ID NO: 110; или
(xi) SEQ ID NO: 114, и SEQ ID NO: 115, и SEQ ID NO: 116; или
(xii) SEQ ID NO: 120, и SEQ ID NO: 121, и SEQ ID NO: 122; или
(xiii) SEQ ID NO: 126, и SEQ ID NO: 127, и SEQ ID NO: 128; или
(xiv) SEQ ID NO: 132, и SEQ ID NO: 133, и SEQ ID NO: 134; или
(xv) SEQ ID NO: 138, и SEQ ID NO: 139, и SEQ ID NO: 140; или
(хvi) SEQ ID NO: 144, и SEQ ID NO: 145, и SEQ ID NO: 146; или
(хvii) SEQ ID NO: 150, и SEQ ID NO: 151, и SEQ ID NO: 152; или
(хviii) SEQ ID NO: 156, и SEQ ID NO: 157, и SEQ ID NO: 158; или
(xix) SEQ ID NO: 162, и SEQ ID NO: 163, и SEQ ID NO: 164; или
(хх) SEQ ID NO: 168, и SEQ ID NO: 169, и SEQ ID NO: 170; или
(xxi) SEQ ID NO: 174, и SEQ ID NO: 175, и SEQ ID NO: 176; или
(ххii) SEQ ID NO: 180, и SEQ ID NO: 181, и SEQ ID NO: 182; или
(ххiii) SEQ ID NO: 186, и SEQ ID NO: 187, и SEQ ID NO: 188; или
(ххiv) SEQ ID NO: 192, и SEQ ID NO: 193, и SEQ ID NO: 194; или
(b) содержит аминокислотную последовательность с вариабельной тяжелой цепью (VH), выбранную из группы, состоящей из: SEQ ID NO: 3; SEQ ID NO: 4; SEQ ID NO: 5; SEQ ID NO: 6; SEQ ID NO: 7; SEQ ID NO: 8; SEQ ID NO: 9; SEQ ID NO: 10; SEQ ID NO: 11; SEQ ID NO: 12; SEQ ID NO: 13; SEQ ID NO: 14; SEQ ID NO: 15; SEQ ID NO: 16; SEQ ID NO: 17; SEQ ID NO: 18; SEQ ID NO: 19; SEQ ID NO: 20; SEQ ID NO: 21; SEQ ID NO: 22; SEQ ID NO: 23; SEQ ID NO: 24; SEQ ID NO: 25 и SEQ ID NO: 26, и аминокислотную последовательность с вариабельной легкой цепью (VL), выбранную из группы, состоящей из: SEQ ID NO: 27; SEQ ID NO: 28; SEQ ID NO: 29; SEQ ID NO: 30; SEQ ID NO: 31; SEQ ID NO: 32; SEQ ID NO: 33; SEQ ID NO: 34; SEQ ID NO: 35; SEQ ID NO: 36; SEQ ID NO: 37; SEQ ID NO: 38 SEQ ID NO: 39; SEQ ID NO: 40; SEQ ID NO: 41; SEQ ID NO: 42; SEQ ID NO: 43; SEQ ID NO: 44; SEQ ID NO: 45; SEQ ID NO: 46; SEQ ID NO: 47; SEQ ID NO: 48; SEQ ID NO: 49 и SEQ ID NO: 50; или
(с) содержит следующие аминокислотные последовательности CDR:
(i) SEQ ID NO: 51, и SEQ ID NO: 52, и SEQ ID NO: 53, и SEQ ID NO: 54, и SEQ ID NO: 55, и SEQ ID NO: 56; или
(ii) SEQ ID NO: 57, и SEQ ID NO: 58, и SEQ ID NO: 59, и SEQ ID NO: 60, и SEQ ID NO: 61, и SEQ ID NO: 62; или
(iii) SEQ ID NO: 63, и SEQ ID NO: 64, и SEQ ID NO: 65, и SEQ ID NO: 66, и SEQ ID NO: 67 и SEQ ID NO: 68; или
(iv) SEQ ID NO: 69, и SEQ ID NO: 70, и SEQ ID NO: 71, и SEQ ID NO: 72, и SEQ ID NO: 73 и SEQ ID NO: 74; или
(v) SEQ ID NO: 75, и SEQ ID NO: 76, и SEQ ID NO: 77, и SEQ ID NO: 78, и SEQ ID NO: 79 и SEQ ID NO: 80; или
(vi) SEQ ID NO: 81, и SEQ ID NO: 82, и SEQ ID NO: 83, и SEQ ID NO: 84, и SEQ ID NO: 85 и SEQ ID NO: 86; или
(vii) SEQ ID NO: 87, и SEQ ID NO: 88, и SEQ ID NO: 89, и SEQ ID NO: 90, и SEQ ID NO: 91 и SEQ ID NO: 92; или
(viii) SEQ ID NO: 93, и SEQ ID NO: 94, и SEQ ID NO: 95, и SEQ ID NO: 96, и SEQ ID NO: 97 и SEQ ID NO: 98; или
(ix) SEQ ID NO: 99, и SEQ ID NO: 100, и SEQ ID NO: 101, и SEQ ID NO: 102, и SEQ ID NO: 103, и SEQ ID NO: 104; или
(x) SEQ ID NO: 105, и SEQ ID NO: 106, и SEQ ID NO: 107, и SEQ ID NO: 108, и SEQ ID NO: 109, и SEQ ID NO: 110; или
(xi) SEQ ID NO: 111, и SEQ ID NO: 112, и SEQ ID NO: 113, и SEQ ID NO: 114, и SEQ ID NO: 115, и SEQ ID NO: 116; или
(xii) SEQ ID NO: 117, и SEQ ID NO: 118 и SEQ ID NO: 119, и SEQ ID NO: 120, и SEQ ID NO: 121, и SEQ ID NO: 122; или
(xiii) SEQ ID NO: 123, и SEQ ID NO: 124, и SEQ ID NO: 125, и SEQ ID NO: 126, и SEQ ID NO: 127, и SEQ ID NO: 128; или
(xiv) SEQ ID NO: 129, и SEQ ID NO: 130, и SEQ ID NO: 131, и SEQ ID NO: 132, и SEQ ID NO: 133, и SEQ ID NO: 134; или
(xv) SEQ ID NO: 135, и SEQ ID NO: 136, и SEQ ID NO: 137, и SEQ ID NO: 138, и SEQ ID NO: 139, и SEQ ID NO: 140; или
(хvi) SEQ ID NO: 141, и SEQ ID NO: 142, и SEQ ID NO: 143, и SEQ ID NO: 144, и SEQ ID NO: 145, и SEQ ID NO: 146; или
(хvii) SEQ ID NO: 147, и SEQ ID NO: 148, и SEQ ID NO: 149, и SEQ ID NO: 150, и SEQ ID NO: 151, и SEQ ID NO: 152; или
(хviii) SEQ ID NO: 153, и SEQ ID NO: 154, и SEQ ID NO: 155, и SEQ ID NO: 156, и SEQ ID NO: 157, и SEQ ID NO: 158; или
(xix) SEQ ID NO: 159, и SEQ ID NO: 160, и SEQ ID NO: 161, и SEQ ID NO: 162, и SEQ ID NO: 163, и SEQ ID NO: 164; или
(хх) SEQ ID NO: 165, и SEQ ID NO: 166, и SEQ ID NO: 167, и SEQ ID NO: 168, и SEQ ID NO: 169, и SEQ ID NO: 170; или
(xxi) SEQ ID NO: 171, и SEQ ID NO: 172, и SEQ ID NO: 173, и SEQ ID NO: 174, и SEQ ID NO: 175, и SEQ ID NO: 176; или
(ххii) SEQ ID NO: 177, и SEQ ID NO: 178, и SEQ ID NO: 179, и SEQ ID NO: 180, и SEQ ID NO: 181, и SEQ ID NO: 182; или
(ххiii) SEQ ID NO: 183, и SEQ ID NO: 184, и SEQ ID NO: 185, и SEQ ID NO: 186, и SEQ ID NO: 187, и SEQ ID NO: 188; или
(ххiv) SEQ ID NO: 189, и SEQ ID NO: 190, и SEQ ID NO: 191, и SEQ ID NO: 192, и SEQ ID NO: 193, и SEQ ID NO: 194.
52. Фармацевтическая композиция для применения по любому из пп. 29-51, причем молекулу второго антитела выбирают из группы, состоящей из молекулы человеческого антитела, молекулы гуманизированного антитела и молекулы антитела человеческого происхождения.
53. Фармацевтическая композиция для применения по любому из пп. 29-52, причем молекула второго антитела представляет собой человеческое антитело IgG.
54. Фармацевтическая композиция для применения по любому из пп. 29-53, причем молекула второго антитела специфично связывается с рецептором, выбранным из группы, состоящей из: CTLA-4; 4-1BB; OX40; TNFR2; PD-L1; Il-2R и GITR.
55. Фармацевтическая композиция для применения по п. 54, причем молекула второго антитела специфично связывается с CTLA-4.
56. Фармацевтическая композиция для применения по п. 54, причем молекула второго антитела специфично связывается с PD-L1.
57. Набор для использования в лечении FcγRIIb-негативного рака, содержащий:
(i) молекулу первого антитела или его антигенсвязывающего фрагмента, которая специфично связывает FcγRIIb посредством своего участка Fab и которая не имеет участка Fc или имеет пониженное связывание с рецепторами Fcγ посредством своего участка Fc; и
(ii) молекулу второго антитела, которая специфично связывается с рецептором, присутствующим на иммунной клетке, причем эта иммунная клетка является иммунной клеткой, которая подавляет противораковый иммунитет, в которой молекула второго антитела имеет участок Fc, который связывается как минимум с одним активирующим рецептором Fcγ, и при этом связывание молекулы второго антитела с этим рецептором на иммунной клетке вызывает истощение и/или дезактивацию этой иммунной клетки.
58. Набор для использования по п. 57, причем первое антитело или его антигенсвязывающий фрагмент не имеет участка Fc.
59. Набор для использования по п. 57 или 58, в котором иммунная клетка, подавляющая противораковый иммунитет, является регуляторной Т-клеткой (Treg).
60. Набор для использования по п. 57 или 58, в котором иммунная клетка, подавляющая противораковый иммунитет, представляет собой миелоидную клетку.
61. Набор для использования по п. 60, в котором миелоидная клетка является макрофагом, ассоциированным с опухолью.
62. Набор для использования по любому из пп. 57-61, причем FcγRIIb- негативный рак является солидным раком.
63. Набор для использования по п. 62, в котором солидный рак выбирают из группы, состоящей из: карциномы; саркомы и лимфомы.
64. Набор для использования по п. 62 или 63, в котором солидный рак выбирают из группы, состоящей из: меланомы, рака молочной железы, рака предстательной железы, рака толстой кишки, рака легких, рака мочевого пузыря, рака почек, мезотелиомы, карциномы клеток Меркеля и рака головы и шеи.
65. Набор для использования по любому из пп. 57-64, в котором молекулу первого антитела или его антигенсвязывающего фрагмента выбирают из группы, состоящей из молекулы антитела человека, молекулы гуманизированного антитела и молекулы антитела человеческого происхождения.
66. Набор для использования по любому из пп. 57-65, в котором молекула первого антитела или его антигенсвязывающего фрагмента представляет собой молекулу моноклонального антитела или молекулу антитела моноклонального происхождения.
67. Набор для использования по любому из пп. 57-66, в котором молекулу первого антитела или его антигенсвязывающего фрагмента выбирают из группы, состоящей из: полноразмерного антитела, химерного антитела, одноцепочечного антитела, фрагмента Fab, фрагмента (Fab')2, фрагмента Fab', фрагмента Fv и фрагмента scFv .
68. Набор для использования по любому из пп. 57-67, причем молекула первого антитела или его антигенсвязывающего фрагмента представляет собой молекулу антитела человеческого IgG, имеющую агликозилированный участок Fc, или молекулу антитела IgG человеческого происхождения, имеющую агликозилированный участок Fc.
69. Набор для использования по п. 68, причем молекула антитела IgG представляет собой молекулу антитела IgG1 или IgG2.
70. Набор для использования по п. 69, причем молекула антитела IgG представляет собой агликозилированное человеческое антитело IgG1, или агликозилированное гуманизированное мышиное антитело, или агликозилированное гуманизированное антитело ламы hcIgG, или агликозилированный химеризированный мышиный IgG.
71. Набор для использования по п. 70, где молекула первого антитела или его антигенсвязывающего фрагмента была агликозилирована путем замены аминокислоты в позиции 297.
72. Набор для использования по п. 71, где молекула первого антитела или его антигенсвязывающего фрагмента была агликозилирована посредством замены N297Q.
73. Набор для использования по любому из пп. 57-72, причем молекула первого антитела или его антигенсвязывающего фрагмента содержит вариабельную тяжелую цепь (VH), содержащую следующие CDR:
(i) SEQ ID NO: 51, и SEQ ID NO: 52, и SEQ ID NO: 53; или
(ii) SEQ ID NO: 57, и SEQ ID NO: 58, и SEQ ID NO: 59; или
(iii) SEQ ID NO: 63, и SEQ ID NO: 64, и SEQ ID NO: 65; или
(iv) SEQ ID NO: 69, и SEQ ID NO: 70, и SEQ ID NO: 71; или
(v) SEQ ID NO: 75, и SEQ ID NO: 76, и SEQ ID NO: 77; или
(vi) SEQ ID NO: 81, и SEQ ID NO: 82, и SEQ ID NO: 83; или
(vii) SEQ ID NO: 87, и SEQ ID NO: 88, и SEQ ID NO: 89; или
(viii) SEQ ID NO: 93, и SEQ ID NO: 94, и SEQ ID NO: 95; или
(ix) SEQ ID NO: 99, и SEQ ID NO: 100, и SEQ ID NO: 101; или
(x) SEQ ID NO: 105, и SEQ ID NO: 106, и SEQ ID NO: 107; или
(xi) SEQ ID NO: 111, и SEQ ID NO: 112, и SEQ ID NO: 113; или
(xii) SEQ ID NO: 117, и SEQ ID NO: 118, и SEQ ID NO: 119; или
(xiii) SEQ ID NO: 123, и SEQ ID NO: 124, и SEQ ID NO: 125; или
(xiv) SEQ ID NO: 129, и SEQ ID NO: 130, и SEQ ID NO: 131; или
(xv) SEQ ID NO: 135, и SEQ ID NO: 136, и SEQ ID NO: 137; или
(хvi) SEQ ID NO: 141, и SEQ ID NO: 142, и SEQ ID NO: 143; или
(хvii) SEQ ID NO: 147, и SEQ ID NO: 148, и SEQ ID NO: 149; или
(хviii) SEQ ID NO: 153, и SEQ ID NO: 154, и SEQ ID NO: 155; или
(xix) SEQ ID NO: 159, и SEQ ID NO: 160, и SEQ ID NO: 161; или
(хх) SEQ ID NO: 165, и SEQ ID NO: 166, и SEQ ID NO: 167; или
(xxi) SEQ ID NO: 171, и SEQ ID NO: 172, и SEQ ID NO: 173; или
(ххii) SEQ ID NO: 177, и SEQ ID NO: 178, и SEQ ID NO: 179; или
(ххiii) SEQ ID NO: 183, и SEQ ID NO: 184, и SEQ ID NO: 185; или
(ххiv) SEQ ID NO: 189, и SEQ ID NO: 190, и SEQ ID NO: 191.
74. Набор для использования по любому из пп. 57-73, причем молекула первого антитела или его антигенсвязывающего фрагмента содержит вариабельную легкую цепь (VL), содержащую следующие CDRs:
(i) SEQ ID NO: 54, и SEQ ID NO: 55, и SEQ ID NO: 56; или
(ii) SEQ ID NO: 60, и SEQ ID NO: 61, и SEQ ID NO: 62; или
(iii) SEQ ID NO: 66, и SEQ ID NO: 67, и SEQ ID NO: 68; или
(iv) SEQ ID NO: 72, и SEQ ID NO: 73, и SEQ ID NO: 74; или
(v) SEQ ID NO: 78, и SEQ ID NO: 79, и SEQ ID NO: 80; или
(vi) SEQ ID NO: 84, и SEQ ID NO: 85, и SEQ ID NO: 86; или
(vii) SEQ ID NO: 90, и SEQ ID NO: 91, и SEQ ID NO: 92; или
(viii) SEQ ID NO: 96, и SEQ ID NO: 97, и SEQ ID NO: 98; или
(ix) SEQ ID NO: 102, и SEQ ID NO: 103, и SEQ ID NO: 104; или
(x) SEQ ID NO: 108, и SEQ ID NO: 109, и SEQ ID NO: 110; или
(xi) SEQ ID NO: 114, и SEQ ID NO: 115, и SEQ ID NO: 116; или
(xii) SEQ ID NO: 120, и SEQ ID NO: 121, и SEQ ID NO: 122; или
(xiii) SEQ ID NO: 126, и SEQ ID NO: 127, и SEQ ID NO: 128; или
(xiv) SEQ ID NO: 132, и SEQ ID NO: 133, и SEQ ID NO: 134; или
(xv) SEQ ID NO: 138, и SEQ ID NO: 139, и SEQ ID NO: 140; или
(хvi) SEQ ID NO: 144, и SEQ ID NO: 145, и SEQ ID NO: 146; или
(хvii) SEQ ID NO: 150, и SEQ ID NO: 151, и SEQ ID NO: 152; или
(хviii) SEQ ID NO: 156, и SEQ ID NO: 157, и SEQ ID NO: 158; или
(xix) SEQ ID NO: 162, и SEQ ID NO: 163, и SEQ ID NO: 164; или
(хх) SEQ ID NO: 168, и SEQ ID NO: 169, и SEQ ID NO: 170; или
(xxi) SEQ ID NO: 174, и SEQ ID NO: 175, и SEQ ID NO: 176; или
(ххii) SEQ ID NO: 180, и SEQ ID NO: 181, и SEQ ID NO: 182; или
(ххiii) SEQ ID NO: 186, и SEQ ID NO: 187, и SEQ ID NO: 188; или
(ххiv) SEQ ID NO: 192, и SEQ ID NO: 193, и SEQ ID NO: 194.
75. Набор для использования по любому из пп. 57-74, причем молекула первого антитела или его антигенсвязывающего фрагмента содержит аминокислотную последовательность с вариабельной тяжелой цепью (VH), выбранную из группы, состоящей из: SEQ ID NO: 3; SEQ ID NO: 4; SEQ ID NO: 5; SEQ ID NO: 6; SEQ ID NO: 7; SEQ ID NO: 8; SEQ ID NO: 9; SEQ ID NO: 10; SEQ ID NO: 11; SEQ ID NO: 12; SEQ ID NO: 13; SEQ ID NO: 14; SEQ ID NO: 15; SEQ ID NO: 16; SEQ ID NO: 17; SEQ ID NO: 18; SEQ ID NO: 19; SEQ ID NO: 20; SEQ ID NO: 21; SEQ ID NO: 22; SEQ ID NO: 23; SEQ ID NO: 24; SEQ ID NO: 25 и SEQ ID NO: 26.
76. Набор для использования по любому из пп. 57-75, причем молекула первого антитела или его антигенсвязывающего фрагмента содержит аминокислотную последовательность с вариабельной легкой цепью (VL), выбранную из группы, состоящей из: SEQ ID NO: 27; SEQ ID NO: 28; SEQ ID NO: 29; SEQ ID NO: 30; SEQ ID NO: 31; SEQ ID NO: 32; SEQ ID NO: 33; SEQ ID NO: 34; SEQ ID NO: 35; SEQ ID NO: 36; SEQ ID NO: 37; SEQ ID NO: 38 SEQ ID NO: 39; SEQ ID NO: 40; SEQ ID NO: 41; SEQ ID NO: 42; SEQ ID NO: 43; SEQ ID NO: 44; SEQ ID NO: 45; SEQ ID NO: 46; SEQ ID NO: 47; SEQ ID NO: 48; SEQ ID NO: 49 и SEQ ID NO: 50.
77. Набор для использования по любому из пп. 57-76, причем молекула первого антитела или его антигенсвязывающего фрагмента содержит следующие аминокислотные последовательности CDR:
(i) SEQ ID NO: 51, и SEQ ID NO: 52, и SEQ ID NO: 53, и SEQ ID NO: 54, и SEQ ID NO: 55, и SEQ ID NO: 56; или
(ii) SEQ ID NO: 57, и SEQ ID NO: 58, и SEQ ID NO: 59, и SEQ ID NO: 60, и SEQ ID NO: 61, и SEQ ID NO: 62; или
(iii) SEQ ID NO: 63, и SEQ ID NO: 64, и SEQ ID NO: 65, и SEQ ID NO: 66, и SEQ ID NO: 67, и SEQ ID NO: 68; или
(iv) SEQ ID NO: 69, и SEQ ID NO: 70, и SEQ ID NO: 71, и SEQ ID NO: 72, и SEQ ID NO: 73, и SEQ ID NO: 74; или
(v) SEQ ID NO: 75, и SEQ ID NO: 76, и SEQ ID NO: 77, и SEQ ID NO: 78, и SEQ ID NO: 79, и SEQ ID NO: 80; или
(vi) SEQ ID NO: 81, и SEQ ID NO: 82, и SEQ ID NO: 83, и SEQ ID NO: 84, и SEQ ID NO: 85, и SEQ ID NO: 86; или
(vii) SEQ ID NO: 87, и SEQ ID NO: 88, и SEQ ID NO: 89 и SEQ ID NO: 90 и SEQ ID NO: 91 и SEQ ID NO: 92; или
(viii) SEQ ID NO: 93, и SEQ ID NO: 94, и SEQ ID NO: 95, и SEQ ID NO: 96, и SEQ ID NO: 97, и SEQ ID NO: 98; или
(ix) SEQ ID NO: 99, и SEQ ID NO: 100, и SEQ ID NO: 101, и SEQ ID NO: 102, и SEQ ID NO: 103, и SEQ ID NO: 104; или
(x) SEQ ID NO: 105, и SEQ ID NO: 106, и SEQ ID NO: 107, и SEQ ID NO: 108, и SEQ ID NO: 109, и SEQ ID NO: 110; или
(xi) SEQ ID NO: 111, и SEQ ID NO: 112, и SEQ ID NO: 113, и SEQ ID NO: 114, и SEQ ID NO: 115, и SEQ ID NO: 116; или
(xii) SEQ ID NO: 117, и SEQ ID NO: 118, и SEQ ID NO: 119, и SEQ ID NO: 120, и SEQ ID NO: 121, и SEQ ID NO: 122; или
(xiii) SEQ ID NO: 123, и SEQ ID NO: 124, и SEQ ID NO: 125, и SEQ ID NO: 126, и SEQ ID NO: 127, и SEQ ID NO: 128; или
(xiv) SEQ ID NO: 129, и SEQ ID NO: 130, и SEQ ID NO: 131, и SEQ ID NO: 132, и SEQ ID NO: 133, и SEQ ID NO: 134; или
(xv) SEQ ID NO: 135, и SEQ ID NO: 136, и SEQ ID NO: 137, и SEQ ID NO: 138, и SEQ ID NO: 139, и SEQ ID NO: 140; или
(хvi) SEQ ID NO: 141, и SEQ ID NO: 142, и SEQ ID NO: 143, и SEQ ID NO: 144, и SEQ ID NO: 145, и SEQ ID NO: 146; или
(хvii) SEQ ID NO: 147, и SEQ ID NO: 148, и SEQ ID NO: 149, и SEQ ID NO: 150, и SEQ ID NO: 151, и SEQ ID NO: 152; или
(хviii) SEQ ID NO: 153, и SEQ ID NO: 154, и SEQ ID NO: 155, и SEQ ID NO: 156, и SEQ ID NO: 157, и SEQ ID NO: 158; или
(xix) SEQ ID NO: 159, и SEQ ID NO: 160, и SEQ ID NO: 161, и SEQ ID NO: 162, и SEQ ID NO: 163, и SEQ ID NO: 164; или
(хх) SEQ ID NO: 165, и SEQ ID NO: 166, и SEQ ID NO: 167, и SEQ ID NO: 168, и SEQ ID NO: 169, и SEQ ID NO: 170; или
(xxi) SEQ ID NO: 171, и SEQ ID NO: 172, и SEQ ID NO: 173, и SEQ ID NO: 174, и SEQ ID NO: 175, и SEQ ID NO: 176; или
(ххii) SEQ ID NO: 177, и SEQ ID NO: 178, и SEQ ID NO: 179, и SEQ ID NO: 180, и SEQ ID NO: 181, и SEQ ID NO: 182; или
(ххiii) SEQ ID NO: 183, и SEQ ID NO: 184, и SEQ ID NO: 185, и SEQ ID NO: 186, и SEQ ID NO: 187, и SEQ ID NO: 188; или
(ххiv) SEQ ID NO: 189, и SEQ ID NO: 190, и SEQ ID NO: 191, и SEQ ID NO: 192, и SEQ ID NO: 193, и SEQ ID NO: 194.
78. Набор для использования по любому из пп. 57-77, причем молекула первого антитела или его антигенсвязывающего фрагмента содержит следующие аминокислотные последовательности:
(i) SEQ ID NO: 3 и SEQ ID NO: 27; или
(ii) SEQ IS NO: 4 и SEQ ID NO: 28; или
(iii) SEQ IS NO: 5 и SEQ ID NO: 29; или
(iv) SEQ ID NO: 6 и SEQ ID NO: 30; или
(v) SEQ ID NO: 7 и SEQ ID NO: 31; или
(vi) SEQ ID NO: 8 и SEQ ID NO: 32; или
(vii) SEQ ID NO: 9 и SEQ ID NO: 33; или
(viii) SEQ ID NO: 10 и SEQ ID NO: 34; или
(ix) SEQ ID NO: 11 и SEQ ID NO: 35; или
(x) SEQ ID NO: 12 и SEQ ID NO: 36; или
(xi) SEQ ID NO: 13 и SEQ ID NO: 37; или
(xii) SEQ ID NO: 14 и SEQ ID NO: 38; или
(xiii) SEQ ID NO: 15 и SEQ ID NO: 39; или
(xiv) SEQ ID NO: 16 и SEQ ID NO: 40; или
(xv) SEQ ID NO: 17 и SEQ ID NO: 41; или
(хvi) SEQ ID NO: 18 и SEQ ID NO: 42; или
(хvii) SEQ ID NO: 19 и SEQ ID NO: 43; или
(хviii) SEQ ID NO: 20 и SEQ ID NO: 44; или
(xix) SEQ ID NO: 21 и SEQ ID NO: 45; или
(хх) SEQ ID NO: 22 и SEQ ID NO: 46; или
(xxi) SEQ ID NO: 23 и SEQ ID NO: 47; или
(ххii) SEQ ID NO: 24 и SEQ ID NO: 48; или
(ххiii) SEQ ID NO: 25 и SEQ ID NO: 49; или
(ххiv) SEQ ID NO: 26 и SEQ ID NO: 50.
79. Набор для использования по любому из пп. 57-72, причем молекула первого антитела или его антигенсвязывающего фрагмента, представляет собой молекулу антитела или его антигенсвязывающего фрагмента, способную конкурировать за связывание с FcγRIIb с молекулой антитела, которая:
(а) содержит вариабельную тяжелую цепь (VH), содержащую следующие CDR:
(i) SEQ ID NO: 51, и SEQ ID NO: 52, и SEQ ID NO: 53; или
(ii) SEQ ID NO: 57, и SEQ ID NO: 58, и SEQ ID NO: 59; или
(iii) SEQ ID NO: 63, и SEQ ID NO: 64, и SEQ ID NO: 65; или
(iv) SEQ ID NO: 69, и SEQ ID NO: 70, и SEQ ID NO: 71; или
(v) SEQ ID NO: 75, и SEQ ID NO: 76, и SEQ ID NO: 77; или
(vi) SEQ ID NO: 81, и SEQ ID NO: 82, и SEQ ID NO: 83; или
(vii) SEQ ID NO: 87, и SEQ ID NO: 88, и SEQ ID NO: 89; или
(viii) SEQ ID NO: 93, и SEQ ID NO: 94, и SEQ ID NO: 95; или
(ix) SEQ ID NO: 99, и SEQ ID NO: 100, и SEQ ID NO: 101; или
(x) SEQ ID NO: 105, и SEQ ID NO: 106, и SEQ ID NO: 107; или
(xi) SEQ ID NO: 111, и SEQ ID NO: 112, и SEQ ID NO: 113; или
(xii) SEQ ID NO: 117, и SEQ ID NO: 118, и SEQ ID NO: 119; или
(xiii) SEQ ID NO: 123, и SEQ ID NO: 124, и SEQ ID NO: 125; или
(xiv) SEQ ID NO: 129, и SEQ ID NO: 130, и SEQ ID NO: 131; или
(xv) SEQ ID NO: 135, и SEQ ID NO: 136, и SEQ ID NO: 137; или
(хvi) SEQ ID NO: 141, и SEQ ID NO: 142, и SEQ ID NO: 143; или
(хvii) SEQ ID NO: 147, и SEQ ID NO: 148, и SEQ ID NO: 149; или
(хviii) SEQ ID NO: 153, и SEQ ID NO: 154, и SEQ ID NO: 155; или
(xix) SEQ ID NO: 159, и SEQ ID NO: 160, и SEQ ID NO: 161; или
(хх) SEQ ID NO: 165, и SEQ ID NO: 166, и SEQ ID NO: 167; или
(xxi) SEQ ID NO: 171, и SEQ ID NO: 172, и SEQ ID NO: 173; или
(ххii) SEQ ID NO: 177, и SEQ ID NO: 178, и SEQ ID NO: 179; или
(ххiii) SEQ ID NO: 183, и SEQ ID NO: 184, и SEQ ID NO: 185; или
(ххiv) SEQ ID NO: 189, и SEQ ID NO: 190, и SEQ ID NO: 191; и
вариабельную легкую цепь (VL), содержащую следующие CDRs:
(i) SEQ ID NO: 54, и SEQ ID NO: 55, и SEQ ID NO: 56; или
(ii) SEQ ID NO: 60, и SEQ ID NO: 61, и SEQ ID NO: 62; или
(iii) SEQ ID NO: 66, и SEQ ID NO: 67, и SEQ ID NO: 68; или
(iv) SEQ ID NO: 72, и SEQ ID NO: 73, и SEQ ID NO: 74; или
(v) SEQ ID NO: 78, и SEQ ID NO: 79, и SEQ ID NO: 80; или
(vi) SEQ ID NO: 84, и SEQ ID NO: 85, и SEQ ID NO: 86; или
(vii) SEQ ID NO: 90, и SEQ ID NO: 91, и SEQ ID NO: 92; или
(viii) SEQ ID NO: 96, и SEQ ID NO: 97, и SEQ ID NO: 98; или
(ix) SEQ ID NO: 102, и SEQ ID NO: 103, и SEQ ID NO: 104; или
(x) SEQ ID NO: 108, и SEQ ID NO: 109, и SEQ ID NO: 110; или
(xi) SEQ ID NO: 114, и SEQ ID NO: 115, и SEQ ID NO: 116; или
(xii) SEQ ID NO: 120, и SEQ ID NO: 121, и SEQ ID NO: 122; или
(xiii) SEQ ID NO: 126, и SEQ ID NO: 127, и SEQ ID NO: 128; или
(xiv) SEQ ID NO: 132, и SEQ ID NO: 133, и SEQ ID NO: 134; или
(xv) SEQ ID NO: 138, и SEQ ID NO: 139, и SEQ ID NO: 140; или
(хvi) SEQ ID NO: 144, и SEQ ID NO: 145, и SEQ ID NO: 146; или
(хvii) SEQ ID NO: 150, и SEQ ID NO: 151, и SEQ ID NO: 152; или
(хviii) SEQ ID NO: 156, и SEQ ID NO: 157, и SEQ ID NO: 158; или
(xix) SEQ ID NO: 162, и SEQ ID NO: 163, и SEQ ID NO: 164; или
(хх) SEQ ID NO: 168, и SEQ ID NO: 169, и SEQ ID NO: 170; или
(xxi) SEQ ID NO: 174, и SEQ ID NO: 175, и SEQ ID NO: 176; или
(ххii) SEQ ID NO: 180, и SEQ ID NO: 181, и SEQ ID NO: 182; или
(ххiii) SEQ ID NO: 186, и SEQ ID NO: 187, и SEQ ID NO: 188; или
(ххiv) SEQ ID NO: 192, и SEQ ID NO: 193, и SEQ ID NO: 194; или
(b) содержит аминокислотную последовательность с вариабельной тяжелой цепью (VH), выбранную из группы, состоящей из: SEQ ID NO: 3; SEQ ID NO: 4; SEQ ID NO: 5; SEQ ID NO: 6; SEQ ID NO: 7; SEQ ID NO: 8; SEQ ID NO: 9; SEQ ID NO: 10; SEQ ID NO: 11; SEQ ID NO: 12; SEQ ID NO: 13; SEQ ID NO: 14; SEQ ID NO: 15; SEQ ID NO: 16; SEQ ID NO: 17; SEQ ID NO: 18; SEQ ID NO: 19; SEQ ID NO: 20; SEQ ID NO: 21; SEQ ID NO: 22; SEQ ID NO: 23; SEQ ID NO: 24; SEQ ID NO: 25 и SEQ ID NO: 26, и содержит аминокислотную последовательность с вариабельной легкой цепью (VL), выбранную из группы, состоящей из: SEQ ID NO: 27; SEQ ID NO: 28; SEQ ID NO: 29; SEQ ID NO: 30; SEQ ID NO: 31; SEQ ID NO: 32; SEQ ID NO: 33; SEQ ID NO: 34; SEQ ID NO: 35; SEQ ID NO: 36; SEQ ID NO: 37; SEQ ID NO: 38 SEQ ID NO: 39; SEQ ID NO: 40; SEQ ID NO: 41; SEQ ID NO: 42; SEQ ID NO: 43; SEQ ID NO: 44; SEQ ID NO: 45; SEQ ID NO: 46; SEQ ID NO: 47; SEQ ID NO: 48; SEQ ID NO: 49 и SEQ ID NO: 50; или
(с) содержит следующие аминокислотные последовательности CDR:
(i) SEQ ID NO: 51, и SEQ ID NO: 52, и SEQ ID NO: 53, и SEQ ID NO: 54, и SEQ ID NO: 55, и SEQ ID NO: 56; или
(ii) SEQ ID NO: 57, и SEQ ID NO: 58, и SEQ ID NO: 59, и SEQ ID NO: 60, и SEQ ID NO: 61, и SEQ ID NO: 62; или
(iii) SEQ ID NO: 63, и SEQ ID NO: 64, и SEQ ID NO: 65, и SEQ ID NO: 66, и SEQ ID NO: 67, и SEQ ID NO: 68; или
(iv) SEQ ID NO: 69, и SEQ ID NO: 70, и SEQ ID NO: 71, и SEQ ID NO: 72, и SEQ ID NO: 73, и SEQ ID NO: 74; или
(v) SEQ ID NO: 75, и SEQ ID NO: 76, и SEQ ID NO: 77, и SEQ ID NO: 78, и SEQ ID NO: 79, и SEQ ID NO: 80; или
(vi) SEQ ID NO: 81, и SEQ ID NO: 82, и SEQ ID NO: 83, и SEQ ID NO: 84, и SEQ ID NO: 85, и SEQ ID NO: 86; или
(vii) SEQ ID NO: 87, и SEQ ID NO: 88, и SEQ ID NO: 89, и SEQ ID NO: 90, и SEQ ID NO: 91, и SEQ ID NO: 92; или
(viii) SEQ ID NO: 93, и SEQ ID NO: 94, и SEQ ID NO: 95, и SEQ ID NO: 96, и SEQ ID NO: 97, и SEQ ID NO: 98; или
(ix) SEQ ID NO: 99, и SEQ ID NO: 100, и SEQ ID NO: 101, и SEQ ID NO: 102, и SEQ ID NO: 103, и SEQ ID NO: 104; или
(x) SEQ ID NO: 105, и SEQ ID NO: 106, и SEQ ID NO: 107, и SEQ ID NO: 108, и SEQ ID NO: 109, и SEQ ID NO: 110; или
(xi) SEQ ID NO: 111, и SEQ ID NO: 112, и SEQ ID NO: 113, и SEQ ID NO: 114, и SEQ ID NO: 115, и SEQ ID NO: 116; или
(xii) SEQ ID NO: 117, и SEQ ID NO: 118, и SEQ ID NO: 119, и SEQ ID NO: 120, и SEQ ID NO: 121, и SEQ ID NO: 122; или
(xiii) SEQ ID NO: 123, и SEQ ID NO: 124, и SEQ ID NO: 125, и SEQ ID NO: 126, и SEQ ID NO: 127, и SEQ ID NO: 128; или
(xiv) SEQ ID NO: 129, и SEQ ID NO: 130, и SEQ ID NO: 131, и SEQ ID NO: 132, и SEQ ID NO: 133, и SEQ ID NO: 134; или
(xv) SEQ ID NO: 135, и SEQ ID NO: 136, и SEQ ID NO: 137, и SEQ ID NO: 138, и SEQ ID NO: 139, и SEQ ID NO: 140; или
(хvi) SEQ ID NO: 141, и SEQ ID NO: 142, и SEQ ID NO: 143, и SEQ ID NO: 144, и SEQ ID NO: 145, и SEQ ID NO: 146; или
(хvii) SEQ ID NO: 147, и SEQ ID NO: 148, и SEQ ID NO: 149, и SEQ ID NO: 150, и SEQ ID NO: 151, и SEQ ID NO: 152; или
(хviii) SEQ ID NO: 153, и SEQ ID NO: 154, и SEQ ID NO: 155, и SEQ ID NO: 156, и SEQ ID NO: 157, и SEQ ID NO: 158; или
(xix) SEQ ID NO: 159, и SEQ ID NO: 160, и SEQ ID NO: 161, и SEQ ID NO: 162, и SEQ ID NO: 163, и SEQ ID NO: 164; или
(хх) SEQ ID NO: 165, и SEQ ID NO: 166, и SEQ ID NO: 167, и SEQ ID NO: 168, и SEQ ID NO: 169, и SEQ ID NO: 170; или
(xxi) SEQ ID NO: 171, и SEQ ID NO: 172, и SEQ ID NO: 173, и SEQ ID NO: 174, и SEQ ID NO: 175, и SEQ ID NO: 176; или
(ххii) SEQ ID NO: 177, и SEQ ID NO: 178, и SEQ ID NO: 179, и SEQ ID NO: 180, и SEQ ID NO: 181, и SEQ ID NO: 182; или
(ххiii) SEQ ID NO: 183, и SEQ ID NO: 184, и SEQ ID NO: 185, и SEQ ID NO: 186, и SEQ ID NO: 187, и SEQ ID NO: 188; или
(ххiv) SEQ ID NO: 189, и SEQ ID NO: 190, и SEQ ID NO: 191, и SEQ ID NO: 192, и SEQ ID NO: 193, и SEQ ID NO: 194.
80. Набор для использования по любому из пп. 57-79, причем молекулу второго антитела выбирают из группы, состоящей из молекулы человеческого антитела, молекулы гуманизированного антитела и молекулы антитела человеческого происхождения.
81. Набор для использования по любому из пп. 57-80, причем молекула второго антитела представляет собой человеческое антитело IgG.
82. Набор для использования по любому из пп. 57-81, причем молекула второго антитела специфично связывается с рецептором, выбранным из группы, состоящей из: CTLA-4; 4-1BB; OX40; TNFR2; PD-L1; Il-2R и GITR.
83. Набор для использования по п. 82, причем молекула второго антитела специфично связывается с CTLA-4.
84. Набор для использования по п. 82, причем молекула второго антитела специфично связывается с PD-L1.
85. Применение
(i) молекулы первого антитела или его антигенсвязывающего фрагмента, которая специфично связывает FcγRIIb посредством своего участка Fab и которая не имеет участка Fc или имеет пониженное связывание с рецепторами Fcγ посредством своего участка Fс; и
(ii) молекулы второго антитела, которая специфично связывается с рецептором, присутствующим на иммунной клетке, причем эта иммунная клетка является иммунной клеткой, которая подавляет противораковый иммунитет, в которой молекула второго антитела имеет участок Fc, который связывается как минимум с одним активирующим рецептором Fcγ, и при этом связывание второго антитела с этим рецептором на иммунной клетке вызывает истощение и/или дезактивацию этой иммунной клетки;
при производстве лекарственного средства для применения в лечении FcγRIIb-негативного рака у пациента.
86. Применение по п. 85, причем первое антитело или его антигенсвязывающий фрагмент не имеет участка Fc.
87. Применение по п. 85 или 86, в котором иммунная клетка, подавляющая противораковый иммунитет, является регуляторной Т-клеткой (Treg).
88. Применение по п. 85 или 86, в котором иммунная клетка, подавляющая противораковый иммунитет, представляет собой миелоидную клетку.
89. Применение по п. 88, в котором миелоидная клетка является макрофагом, ассоциированным с опухолью.
90. Применение по любому из пп. 85-89, причем FcγRIIb- негативный рак является солидным раком.
91. Применение по п. 90, в котором солидный рак выбирают из группы, состоящей из: карциномы; саркомы и лимфомы.
92. Применение по п. 90 или 91, в котором солидный рак выбирают из группы, состоящей из: меланомы, рака молочной железы, рака предстательной железы, рака толстой кишки, рака легких, рака мочевого пузыря, рака почек, мезотелиомы, карциномы клеток Меркеля и рака головы и шеи.
93. Применение по любому из пп. 85-92, в котором молекулу первого антитела или его антигенсвязывающего фрагмента выбирают из группы, состоящей из молекулы антитела человека, молекулы гуманизированного антитела и молекулы антитела человеческого происхождения.
94. Применение по любому из пп. 85-93, в котором молекула первого антитела или его антигенсвязывающего фрагмента представляет собой молекулу моноклонального антитела или молекулу антитела моноклонального происхождения.
95. Применение по любому из пп. 85-94, в котором молекулу первого антитела или его антигенсвязывающего фрагмента выбирают из группы, состоящей из: полноразмерного антитела, химерного антитела, одноцепочечного антитела, фрагмента Fab, фрагмента (Fab')2, фрагмента Fab', фрагмента Fv и фрагмента scFv .
96. Применение по любому из пп. 85-95, причем молекула первого антитела или его антигенсвязывающего фрагмента представляет собой молекулу антитела человеческого IgG, имеющую агликозилированный участок Fc, или молекулу антитела IgG человеческого происхождения, имеющую агликозилированный участок Fc.
97. Применение по п. 96, причем молекула антитела IgG представляет собой молекулу антитела IgG1 или IgG2.
98. Применение по п. 97, причем молекула антитела IgG представляет собой агликозилированное человеческое антитело IgG1, или агликозилированное гуманизированное мышиное антитело, или агликозилированное гуманизированное антитело ламы hcIgG, или агликозилированный химеризированный мышиный IgG.
99. Применение по п. 98, где молекула первого антитела или его антигенсвязывающего фрагмента была агликозилирована путем замены аминокислоты в позиции 297.
100. Применение по п. 99, где молекула первого антитела или его антигенсвязывающего фрагмента была агликозилирована посредством замены N297Q.
101. Применение по любому из пп. 85-100, причем молекула первого антитела или его антигенсвязывающего фрагмента содержит вариабельную тяжелую цепь (VH), содержащую следующие CDR:
(i) SEQ ID NO: 51, и SEQ ID NO: 52, и SEQ ID NO: 53; или
(ii) SEQ ID NO: 57, и SEQ ID NO: 58, и SEQ ID NO: 59; или
(iii) SEQ ID NO: 63, и SEQ ID NO: 64, и SEQ ID NO: 65; или
(iv) SEQ ID NO: 69, и SEQ ID NO: 70, и SEQ ID NO: 71; или
(v) SEQ ID NO: 75, и SEQ ID NO: 76, и SEQ ID NO: 77; или
(vi) SEQ ID NO: 81, и SEQ ID NO: 82, и SEQ ID NO: 83; или
(vii) SEQ ID NO: 87, и SEQ ID NO: 88, и SEQ ID NO: 89; или
(viii) SEQ ID NO: 93, и SEQ ID NO: 94, и SEQ ID NO: 95; или
(ix) SEQ ID NO: 99, и SEQ ID NO: 100, и SEQ ID NO: 101; или
(x) SEQ ID NO: 105, и SEQ ID NO: 106, и SEQ ID NO: 107; или
(xi) SEQ ID NO: 111, и SEQ ID NO: 112, и SEQ ID NO: 113; или
(xii) SEQ ID NO: 117, и SEQ ID NO: 118, и SEQ ID NO: 119; или
(xiii) SEQ ID NO: 123, и SEQ ID NO: 124, и SEQ ID NO: 125; или
(xiv) SEQ ID NO: 129, и SEQ ID NO: 130, и SEQ ID NO: 131; или
(xv) SEQ ID NO: 135, и SEQ ID NO: 136, и SEQ ID NO: 137; или
(хvi) SEQ ID NO: 141, и SEQ ID NO: 142, и SEQ ID NO: 143; или
(хvii) SEQ ID NO: 147, и SEQ ID NO: 148, и SEQ ID NO: 149; или
(хviii) SEQ ID NO: 153, и SEQ ID NO: 154, и SEQ ID NO: 155; или
(xix) SEQ ID NO: 159, и SEQ ID NO: 160, и SEQ ID NO: 161; или
(хх) SEQ ID NO: 165, и SEQ ID NO: 166, и SEQ ID NO: 167; или
(xxi) SEQ ID NO: 171, и SEQ ID NO: 172, и SEQ ID NO: 173; или
(ххii) SEQ ID NO: 177, и SEQ ID NO: 178, и SEQ ID NO: 179; или
(ххiii) SEQ ID NO: 183, и SEQ ID NO: 184, и SEQ ID NO: 185; или
(ххiv) SEQ ID NO: 189, и SEQ ID NO: 190, и SEQ ID NO: 191.
102. Применение по любому из пп. 85-101, причем молекула первого антитела или его антигенсвязывающего фрагмента содержит вариабельную легкую цепь (VL), содержащую следующие CDRs:
(i) SEQ ID NO: 54, и SEQ ID NO: 55, и SEQ ID NO: 56; или
(ii) SEQ ID NO: 60, и SEQ ID NO: 61, и SEQ ID NO: 62; или
(iii) SEQ ID NO: 66, и SEQ ID NO: 67, и SEQ ID NO: 68; или
(iv) SEQ ID NO: 72, и SEQ ID NO: 73, и SEQ ID NO: 74; или
(v) SEQ ID NO: 78, и SEQ ID NO: 79, и SEQ ID NO: 80; или
(vi) SEQ ID NO: 84, и SEQ ID NO: 85, и SEQ ID NO: 86; или
(vii) SEQ ID NO: 90, и SEQ ID NO: 91, и SEQ ID NO: 92; или
(viii) SEQ ID NO: 96, и SEQ ID NO: 97, и SEQ ID NO: 98; или
(ix) SEQ ID NO: 102, и SEQ ID NO: 103, и SEQ ID NO: 104; или
(x) SEQ ID NO: 108, и SEQ ID NO: 109, и SEQ ID NO: 110; или
(xi) SEQ ID NO: 114, и SEQ ID NO: 115, и SEQ ID NO: 116; или
(xii) SEQ ID NO: 120, и SEQ ID NO: 121, и SEQ ID NO: 122; или
(xiii) SEQ ID NO: 126, и SEQ ID NO: 127, и SEQ ID NO: 128; или
(xiv) SEQ ID NO: 132, и SEQ ID NO: 133, и SEQ ID NO: 134; или
(xv) SEQ ID NO: 138, и SEQ ID NO: 139, и SEQ ID NO: 140; или
(хvi) SEQ ID NO: 144, и SEQ ID NO: 145, и SEQ ID NO: 146; или
(хvii) SEQ ID NO: 150, и SEQ ID NO: 151, и SEQ ID NO: 152; или
(хviii) SEQ ID NO: 156, и SEQ ID NO: 157, и SEQ ID NO: 158; или
(xix) SEQ ID NO: 162, и SEQ ID NO: 163, и SEQ ID NO: 164; или
(хх) SEQ ID NO: 168, и SEQ ID NO: 169, и SEQ ID NO: 170; или
(xxi) SEQ ID NO: 174, и SEQ ID NO: 175, и SEQ ID NO: 176; или
(ххii) SEQ ID NO: 180, и SEQ ID NO: 181, и SEQ ID NO: 182; или
(ххiii) SEQ ID NO: 186, и SEQ ID NO: 187, и SEQ ID NO: 188; или
(ххiv) SEQ ID NO: 192, и SEQ ID NO: 193, и SEQ ID NO: 194.
103. Применение по любому из пп. 85-102, причем молекула первого антитела или его антигенсвязывающего фрагмента содержит аминокислотную последовательность с вариабельной тяжелой цепью (VH), выбранную из группы, состоящей из: SEQ ID NO: 3; SEQ ID NO: 4; SEQ ID NO: 5; SEQ ID NO: 6; SEQ ID NO: 7; SEQ ID NO: 8; SEQ ID NO: 9; SEQ ID NO: 10; SEQ ID NO: 11; SEQ ID NO: 12; SEQ ID NO: 13; SEQ ID NO: 14; SEQ ID NO: 15; SEQ ID NO: 16; SEQ ID NO: 17; SEQ ID NO: 18; SEQ ID NO: 19; SEQ ID NO: 20; SEQ ID NO: 21; SEQ ID NO: 22; SEQ ID NO: 23; SEQ ID NO: 24; SEQ ID NO: 25 и SEQ ID NO: 26.
104. Применение по любому из пп. 85-103, причем молекула первого антитела или его антигенсвязывающего фрагмента содержит аминокислотную последовательность с вариабельной легкой цепью (VL), выбранную из группы, состоящей из: SEQ ID NO: 27; SEQ ID NO: 28; SEQ ID NO: 29; SEQ ID NO: 30; SEQ ID NO: 31; SEQ ID NO: 32; SEQ ID NO: 33; SEQ ID NO: 34; SEQ ID NO: 35; SEQ ID NO: 36; SEQ ID NO: 37; SEQ ID NO: 38 SEQ ID NO: 39; SEQ ID NO: 40; SEQ ID NO: 41; SEQ ID NO: 42; SEQ ID NO: 43; SEQ ID NO: 44; SEQ ID NO: 45; SEQ ID NO: 46; SEQ ID NO: 47; SEQ ID NO: 48; SEQ ID NO: 49 и SEQ ID NO: 50.
105. Применение по любому из пп. 85-104, причем молекула первого антитела или его антигенсвязывающего фрагмента содержит следующие аминокислотные последовательности CDR:
(i) SEQ ID NO: 51, и SEQ ID NO: 52, и SEQ ID NO: 53, и SEQ ID NO: 54, и SEQ ID NO: 55, и SEQ ID NO: 56; или
(ii) SEQ ID NO: 57, и SEQ ID NO: 58, и SEQ ID NO: 59, и SEQ ID NO: 60, и SEQ ID NO: 61, и SEQ ID NO: 62; или
(iii) SEQ ID NO: 63, и SEQ ID NO: 64, и SEQ ID NO: 65, и SEQ ID NO: 66, и SEQ ID NO: 67, и SEQ ID NO: 68; или
(iv) SEQ ID NO: 69, и SEQ ID NO: 70, и SEQ ID NO: 71, и SEQ ID NO: 72, и SEQ ID NO: 73, и SEQ ID NO: 74; или
(v) SEQ ID NO: 75, и SEQ ID NO: 76, и SEQ ID NO: 77, и SEQ ID NO: 78, и SEQ ID NO: 79, и SEQ ID NO: 80; или
(vi) SEQ ID NO: 81, и SEQ ID NO: 82, и SEQ ID NO: 83, и SEQ ID NO: 84, и SEQ ID NO: 85, и SEQ ID NO: 86; или
(vii) SEQ ID NO: 87, и SEQ ID NO: 88, и SEQ ID NO: 89, и SEQ ID NO: 90, и SEQ ID NO: 91, и SEQ ID NO: 92; или
(viii) SEQ ID NO: 93, и SEQ ID NO: 94, и SEQ ID NO: 95, и SEQ ID NO: 96, и SEQ ID NO: 97, и SEQ ID NO: 98; или
(ix) SEQ ID NO: 99, и SEQ ID NO: 100, и SEQ ID NO: 101, и SEQ ID NO: 102, и SEQ ID NO: 103, и SEQ ID NO: 104; или
(x) SEQ ID NO: 105, и SEQ ID NO: 106, и SEQ ID NO: 107, и SEQ ID NO: 108, и SEQ ID NO: 109, и SEQ ID NO: 110; или
(xi) SEQ ID NO: 111, и SEQ ID NO: 112, и SEQ ID NO: 113, и SEQ ID NO: 114, и SEQ ID NO: 115, и SEQ ID NO: 116; или
(xii) SEQ ID NO: 117, и SEQ ID NO: 118, и SEQ ID NO: 119, и SEQ ID NO: 120, и SEQ ID NO: 121, и SEQ ID NO: 122; или
(xiii) SEQ ID NO: 123, и SEQ ID NO: 124, и SEQ ID NO: 125, и SEQ ID NO: 126, и SEQ ID NO: 127, и SEQ ID NO: 128; или
(xiv) SEQ ID NO: 129, и SEQ ID NO: 130, и SEQ ID NO: 131, и SEQ ID NO: 132, и SEQ ID NO: 133, и SEQ ID NO: 134; или
(xv) SEQ ID NO: 135, и SEQ ID NO: 136, и SEQ ID NO: 137, и SEQ ID NO: 138, и SEQ ID NO: 139, и SEQ ID NO: 140; или
(хvi) SEQ ID NO: 141, и SEQ ID NO: 142, и SEQ ID NO: 143, и SEQ ID NO: 144, и SEQ ID NO: 145, и SEQ ID NO: 146; или
(хvii) SEQ ID NO: 147, и SEQ ID NO: 148, и SEQ ID NO: 149, и SEQ ID NO: 150, и SEQ ID NO: 151, и SEQ ID NO: 152; или
(хviii) SEQ ID NO: 153, и SEQ ID NO: 154, и SEQ ID NO: 155, и SEQ ID NO: 156, и SEQ ID NO: 157, и SEQ ID NO: 158; или
(xix) SEQ ID NO: 159, и SEQ ID NO: 160 и SEQ ID NO: 161, и SEQ ID NO: 162, и SEQ ID NO: 163, и SEQ ID NO: 164; или
(хх) SEQ ID NO: 165, и SEQ ID NO: 166, и SEQ ID NO: 167, и SEQ ID NO: 168, и SEQ ID NO: 169, и SEQ ID NO: 170; или
(xxi) SEQ ID NO: 171, и SEQ ID NO: 172, и SEQ ID NO: 173, и SEQ ID NO: 174, и SEQ ID NO: 175, и SEQ ID NO: 176; или
(ххii) SEQ ID NO: 177, и SEQ ID NO: 178, и SEQ ID NO: 179, и SEQ ID NO: 180, и SEQ ID NO: 181, и SEQ ID NO: 182; или
(ххiii) SEQ ID NO: 183, и SEQ ID NO: 184, и SEQ ID NO: 185, и SEQ ID NO: 186, и SEQ ID NO: 187, и SEQ ID NO: 188; или
(ххiv) SEQ ID NO: 189, и SEQ ID NO: 190, и SEQ ID NO: 191, и SEQ ID NO: 192, и SEQ ID NO: 193, и SEQ ID NO: 194.
106. Применение по любому из пп. 85-105, причем молекула первого антитела или его антигенсвязывающего фрагмента содержит следующие аминокислотные последовательности:
(i) SEQ ID NO: 3 и SEQ ID NO: 27; или
(ii) SEQ IS NO: 4 и SEQ ID NO: 28; или
(iii) SEQ IS NO: 5 и SEQ ID NO: 29; или
(iv) SEQ ID NO: 6 и SEQ ID NO: 30; или
(v) SEQ ID NO: 7 и SEQ ID NO: 31; или
(vi) SEQ ID NO: 8 и SEQ ID NO: 32; или
(vii) SEQ ID NO: 9 и SEQ ID NO: 33; или
(viii) SEQ ID NO: 10 и SEQ ID NO: 34; или
(ix) SEQ ID NO: 11 и SEQ ID NO: 35; или
(x) SEQ ID NO: 12 и SEQ ID NO: 36; или
(xi) SEQ ID NO: 13 и SEQ ID NO: 37; или
(xii) SEQ ID NO: 14 и SEQ ID NO: 38; или
(xiii) SEQ ID NO: 15 и SEQ ID NO: 39; или
(xiv) SEQ ID NO: 16 и SEQ ID NO: 40; или
(xv) SEQ ID NO: 17 и SEQ ID NO: 41; или
(хvi) SEQ ID NO: 18 и SEQ ID NO: 42; или
(хvii) SEQ ID NO: 19 и SEQ ID NO: 43; или
(хviii) SEQ ID NO: 20 и SEQ ID NO: 44; или
(xix) SEQ ID NO: 21 и SEQ ID NO: 45; или
(хх) SEQ ID NO: 22 и SEQ ID NO: 46; или
(xxi) SEQ ID NO: 23 и SEQ ID NO: 47; или
(ххii) SEQ ID NO: 24 и SEQ ID NO: 48; или
(ххiii) SEQ ID NO: 25 и SEQ ID NO: 49; или
(ххiv) SEQ ID NO: 26 и SEQ ID NO: 50.
107. Применение по любому из пп. 85-100, причем молекула первого антитела или его антигенсвязывающего фрагмента, представляет собой молекулу антитела или его антигенсвязывающего фрагмента, способную конкурировать за связывание с FcγRIIb с молекулой антитела, которая:
(а) содержит вариабельную тяжелую цепь (VH), содержащую следующие CDR:
(i) SEQ ID NO: 51, и SEQ ID NO: 52, и SEQ ID NO: 53; или
(ii) SEQ ID NO: 57, и SEQ ID NO: 58, и SEQ ID NO: 59; или
(iii) SEQ ID NO: 63, и SEQ ID NO: 64, и SEQ ID NO: 65; или
(iv) SEQ ID NO: 69, и SEQ ID NO: 70, и SEQ ID NO: 71; или
(v) SEQ ID NO: 75, и SEQ ID NO: 76, и SEQ ID NO: 77; или
(vi) SEQ ID NO: 81, и SEQ ID NO: 82, и SEQ ID NO: 83; или
(vii) SEQ ID NO: 87, и SEQ ID NO: 88, и SEQ ID NO: 89; или
(viii) SEQ ID NO: 93, и SEQ ID NO: 94, и SEQ ID NO: 95; или
(ix) SEQ ID NO: 99, и SEQ ID NO: 100, и SEQ ID NO: 101; или
(x) SEQ ID NO: 105, и SEQ ID NO: 106, и SEQ ID NO: 107; или
(xi) SEQ ID NO: 111, и SEQ ID NO: 112, и SEQ ID NO: 113; или
(xii) SEQ ID NO: 117, и SEQ ID NO: 118, и SEQ ID NO: 119; или
(xiii) SEQ ID NO: 123, и SEQ ID NO: 124, и SEQ ID NO: 125; или
(xiv) SEQ ID NO: 129, и SEQ ID NO: 130, и SEQ ID NO: 131; или
(xv) SEQ ID NO: 135, и SEQ ID NO: 136, и SEQ ID NO: 137; или
(хvi) SEQ ID NO: 141, и SEQ ID NO: 142, и SEQ ID NO: 143; или
(хvii) SEQ ID NO: 147, и SEQ ID NO: 148, и SEQ ID NO: 149; или
(хviii) SEQ ID NO: 153, и SEQ ID NO: 154, и SEQ ID NO: 155; или
(xix) SEQ ID NO: 159, и SEQ ID NO: 160, и SEQ ID NO: 161; или
(хх) SEQ ID NO: 165, и SEQ ID NO: 166, и SEQ ID NO: 167; или
(xxi) SEQ ID NO: 171, и SEQ ID NO: 172, и SEQ ID NO: 173; или
(ххii) SEQ ID NO: 177, и SEQ ID NO: 178, и SEQ ID NO: 179; или
(ххiii) SEQ ID NO: 183, и SEQ ID NO: 184, и SEQ ID NO: 185; или
(ххiv) SEQ ID NO: 189, и SEQ ID NO: 190, и SEQ ID NO: 191, и
содержит вариабельную легкую цепь (VL), содержащую следующие CDRs:
(i) SEQ ID NO: 54, и SEQ ID NO: 55 и SEQ ID NO: 56; или
(ii) SEQ ID NO: 60, и SEQ ID NO: 61 и SEQ ID NO: 62; или
(iii) SEQ ID NO: 66, и SEQ ID NO: 67, и SEQ ID NO: 68; или
(iv) SEQ ID NO: 72, и SEQ ID NO: 73, и SEQ ID NO: 74; или
(v) SEQ ID NO: 78, и SEQ ID NO: 79, и SEQ ID NO: 80; или
(vi) SEQ ID NO: 84, и SEQ ID NO: 85, и SEQ ID NO: 86; или
(vii) SEQ ID NO: 90, и SEQ ID NO: 91, и SEQ ID NO: 92; или
(viii) SEQ ID NO: 96, и SEQ ID NO: 97, и SEQ ID NO: 98; или
(ix) SEQ ID NO: 102, и SEQ ID NO: 103, и SEQ ID NO: 104; или
(x) SEQ ID NO: 108, и SEQ ID NO: 109, и SEQ ID NO: 110; или
(xi) SEQ ID NO: 114, и SEQ ID NO: 115, и SEQ ID NO: 116; или
(xii) SEQ ID NO: 120, и SEQ ID NO: 121, и SEQ ID NO: 122; или
(xiii) SEQ ID NO: 126, и SEQ ID NO: 127, и SEQ ID NO: 128; или
(xiv) SEQ ID NO: 132, и SEQ ID NO: 133, и SEQ ID NO: 134; или
(xv) SEQ ID NO: 138, и SEQ ID NO: 139, и SEQ ID NO: 140; или
(хvi) SEQ ID NO: 144, и SEQ ID NO: 145, и SEQ ID NO: 146; или
(хvii) SEQ ID NO: 150, и SEQ ID NO: 151, и SEQ ID NO: 152; или
(хviii) SEQ ID NO: 156, и SEQ ID NO: 157, и SEQ ID NO: 158; или
(xix) SEQ ID NO: 162, и SEQ ID NO: 163, и SEQ ID NO: 164; или
(хх) SEQ ID NO: 168, и SEQ ID NO: 169, и SEQ ID NO: 170; или
(xxi) SEQ ID NO: 174, и SEQ ID NO: 175, и SEQ ID NO: 176; или
(ххii) SEQ ID NO: 180, и SEQ ID NO: 181, и SEQ ID NO: 182; или
(ххiii) SEQ ID NO: 186, и SEQ ID NO: 187, и SEQ ID NO: 188; или
(ххiv) SEQ ID NO: 192, и SEQ ID NO: 193, и SEQ ID NO: 194; или
(b) содержит аминокислотную последовательность с вариабельной тяжелой цепью (VH), выбранную из группы, состоящей из: SEQ ID NO: 3; SEQ ID NO: 4; SEQ ID NO: 5; SEQ ID NO: 6; SEQ ID NO: 7; SEQ ID NO: 8; SEQ ID NO: 9; SEQ ID NO: 10; SEQ ID NO: 11; SEQ ID NO: 12; SEQ ID NO: 13; SEQ ID NO: 14; SEQ ID NO: 15; SEQ ID NO: 16; SEQ ID NO: 17; SEQ ID NO: 18; SEQ ID NO: 19; SEQ ID NO: 20; SEQ ID NO: 21; SEQ ID NO: 22; SEQ ID NO: 23; SEQ ID NO: 24; SEQ ID NO: 25 и SEQ ID NO: 26, и содержит аминокислотную последовательность с вариабельной легкой цепью (VL), выбранную из группы, состоящей из: SEQ ID NO: 27; SEQ ID NO: 28; SEQ ID NO: 29; SEQ ID NO: 30; SEQ ID NO: 31; SEQ ID NO: 32; SEQ ID NO: 33; SEQ ID NO: 34; SEQ ID NO: 35; SEQ ID NO: 36; SEQ ID NO: 37; SEQ ID NO: 38 SEQ ID NO: 39; SEQ ID NO: 40; SEQ ID NO: 41; SEQ ID NO: 42; SEQ ID NO: 43; SEQ ID NO: 44; SEQ ID NO: 45; SEQ ID NO: 46; SEQ ID NO: 47; SEQ ID NO: 48; SEQ ID NO: 49 и SEQ ID NO: 50; или
(с) содержит следующие аминокислотные последовательности CDR:
(i) SEQ ID NO: 51, и SEQ ID NO: 52, и SEQ ID NO: 53, и SEQ ID NO: 54, и SEQ ID NO: 55, и SEQ ID NO: 56; или
(ii) SEQ ID NO: 57, и SEQ ID NO: 58, и SEQ ID NO: 59, и SEQ ID NO: 60, и SEQ ID NO: 61, и SEQ ID NO: 62; или
(iii) SEQ ID NO: 63, и SEQ ID NO: 64, и SEQ ID NO: 65, и SEQ ID NO: 66, и SEQ ID NO: 67, и SEQ ID NO: 68; или
(iv) SEQ ID NO: 69, и SEQ ID NO: 70, и SEQ ID NO: 71, и SEQ ID NO: 72, и SEQ ID NO: 73, и SEQ ID NO: 74; или
(v) SEQ ID NO: 75, и SEQ ID NO: 76, и SEQ ID NO: 77, и SEQ ID NO: 78, и SEQ ID NO: 79, и SEQ ID NO: 80; или
(vi) SEQ ID NO: 81, и SEQ ID NO: 82, и SEQ ID NO: 83, и SEQ ID NO: 84, и SEQ ID NO: 85, и SEQ ID NO: 86; или
(vii) SEQ ID NO: 87, и SEQ ID NO: 88, и SEQ ID NO: 89, и SEQ ID NO: 90, и SEQ ID NO: 91, и SEQ ID NO: 92; или
(viii) SEQ ID NO: 93, и SEQ ID NO: 94, и SEQ ID NO: 95, и SEQ ID NO: 96, и SEQ ID NO: 97, и SEQ ID NO: 98; или
(ix) SEQ ID NO: 99, и SEQ ID NO: 100, и SEQ ID NO: 101, и SEQ ID NO: 102, и SEQ ID NO: 103, и SEQ ID NO: 104; или
(x) SEQ ID NO: 105, и SEQ ID NO: 106, и SEQ ID NO: 107, и SEQ ID NO: 108, и SEQ ID NO: 109, и SEQ ID NO: 110; или
(xi) SEQ ID NO: 111, и SEQ ID NO: 112, и SEQ ID NO: 113, и SEQ ID NO: 114, и SEQ ID NO: 115, и SEQ ID NO: 116; или
(xii) SEQ ID NO: 117, и SEQ ID NO: 118, и SEQ ID NO: 119, и SEQ ID NO: 120, и SEQ ID NO: 121, и SEQ ID NO: 122; или
(xiii) SEQ ID NO: 123, и SEQ ID NO: 124, и SEQ ID NO: 125, и SEQ ID NO: 126, и SEQ ID NO: 127, и SEQ ID NO: 128; или
(xiv) SEQ ID NO: 129, и SEQ ID NO: 130, и SEQ ID NO: 131, и SEQ ID NO: 132, и SEQ ID NO: 133, и SEQ ID NO: 134; или
(xv) SEQ ID NO: 135, и SEQ ID NO: 136, и SEQ ID NO: 137, и SEQ ID NO: 138, и SEQ ID NO: 139, и SEQ ID NO: 140; или
(хvi) SEQ ID NO: 141, и SEQ ID NO: 142, и SEQ ID NO: 143, и SEQ ID NO: 144, и SEQ ID NO: 145, и SEQ ID NO: 146; или
(хvii) SEQ ID NO: 147, и SEQ ID NO: 148, и SEQ ID NO: 149, и SEQ ID NO: 150, и SEQ ID NO: 151, и SEQ ID NO: 152; или
(хviii) SEQ ID NO: 153, и SEQ ID NO: 154, и SEQ ID NO: 155, и SEQ ID NO: 156, и SEQ ID NO: 157, и SEQ ID NO: 158; или
(xix) SEQ ID NO: 159, и SEQ ID NO: 160, и SEQ ID NO: 161, и SEQ ID NO: 162, и SEQ ID NO: 163, и SEQ ID NO: 164; или
(хх) SEQ ID NO: 165, и SEQ ID NO: 166, и SEQ ID NO: 167, и SEQ ID NO: 168, и SEQ ID NO: 169, и SEQ ID NO: 170; или
(xxi) SEQ ID NO: 171, и SEQ ID NO: 172, и SEQ ID NO: 173, и SEQ ID NO: 174, и SEQ ID NO: 175, и SEQ ID NO: 176; или
(ххii) SEQ ID NO: 177, и SEQ ID NO: 178, и SEQ ID NO: 179, и SEQ ID NO: 180, и SEQ ID NO: 181, и SEQ ID NO: 182; или
(ххiii) SEQ ID NO: 183, и SEQ ID NO: 184, и SEQ ID NO: 185, и SEQ ID NO: 186, и SEQ ID NO: 187, и SEQ ID NO: 188; или
(ххiv) SEQ ID NO: 189, и SEQ ID NO: 190, и SEQ ID NO: 191, и SEQ ID NO: 192, и SEQ ID NO: 193, и SEQ ID NO: 194.
108. Применение по любому из пп. 85-107, причем молекулу второго антитела выбирают из группы, состоящей из молекулы человеческого антитела, молекулы гуманизированного антитела и молекулы антитела человеческого происхождения.
109. Применение по любому из пп. 85-108, причем молекула второго антитела представляет собой человеческое антитело IgG.
110. Применение по любому из пп. 85-109, причем молекула второго антитела специфично связывается с рецептором, выбранным из группы, состоящей из: CTLA-4; 4-1BB; OX40; TNFR2; PD-L1; Il-2R и GITR.
111. Применение по п. 110, причем молекула второго антитела специфично связывается с CTLA-4.
112. Применение по п. 110, причем молекула второго антитела специфично связывается с PD-L1.
113. Способ лечения FcγRIIb-негативного рака у пациента, включающий введение:
(i) молекулы первого антитела или его антигенсвязывающего фрагмента, которая специфично связывает FcγRIIb посредством своего участка Fab и которая не имеет участка Fc или имеет пониженное связывание с рецепторами Fcγ посредством своего участка Fc; и
(ii) молекула второго антитела, которая специфично связывается с рецептором, присутствующим на иммунной клетке, причем эта иммунная клетка является иммунной клеткой, которая подавляет противораковый иммунитет, в которой молекула второго антитела имеет участок Fc, который способен активировать как минимум один активирующий рецептор Fcγ, и при этом связывание второго антитела с этим рецептором на иммунной клетке вызывает истощение и/или дезактивацию этой иммунной клетки.
114. Способ по п. 113, причем первое антитело или его антигенсвязывающий фрагмент не имеет участка Fc.
115. Способ по п. 113 или 114, в котором иммунная клетка, подавляющая противораковый иммунитет, является регуляторной Т-клеткой (Treg).
116. Способ по п. 113 или 114, в котором иммунная клетка, подавляющая противораковый иммунитет, представляет собой миелоидную клетку.
117. Способ по п. 116, в котором миелоидная клетка является макрофагом, ассоциированным с опухолью.
118. Способ по любому из пп. 113-117, причем FcγRIIb-негативный рак является солидным раком.
119. Способ по п. 118, в котором солидный рак выбирают из группы, состоящей из: карциномы; саркомы и лимфомы.
120. Способ по п. 118 или 119, в котором солидный рак выбирают из группы, состоящей из: меланомы, рака молочной железы, рака предстательной железы, рака толстой кишки, рака легких, рака мочевого пузыря, рака почек, мезотелиомы, карциномы клеток Меркеля и рака головы и шеи.
121. Способ по любому из пп. 113-120, в котором молекулу первого антитела или его антигенсвязывающего фрагмента выбирают из группы, состоящей из молекулы антитела человека, молекулы гуманизированного антитела и молекулы антитела человеческого происхождения.
122. Способ по любому из пп. 113-121, в котором молекула первого антитела или его антигенсвязывающего фрагмента представляет собой молекулу моноклонального антитела или молекулу антитела моноклонального происхождения.
123. Способ по любому из пп. 113-122, в котором молекулу первого антитела или его антигенсвязывающего фрагмента выбирают из группы, состоящей из: полноразмерного антитела, химерного антитела, одноцепочечного антитела, фрагмента Fab, фрагмента (Fab')2, фрагмента Fab', фрагмента Fv и фрагмента scFv .
124. Способ по любому из пп. 113-123, причем молекула первого антитела или его антигенсвязывающего фрагмента представляет собой молекулу антитела человеческого IgG, имеющую агликозилированный участок Fc, или молекулу антитела IgG человеческого происхождения, имеющую агликозилированный участок Fc.
125. Способ по п. 124, причем молекула антитела IgG представляет собой молекулу антитела IgG1 или IgG2.
126. Способ по п. 125, причем молекула антитела IgG представляет собой агликозилированное человеческое антитело IgG1, или агликозилированное гуманизированное мышиное антитело, или агликозилированное гуманизированное антитело ламы hcIgG, или агликозилированный химеризированный мышиный IgG.
127. Способ по п. 126, причем молекула первого антитела или его антигенсвязывающего фрагмента была агликозилирована путем замены аминокислоты в позиции 297.
128. Способ по п. 127, причем молекула первого антитела или его антигенсвязывающего фрагмента была агликозилирована посредством замены N297Q.
129. Способ по любому из пп. 113-128, причем молекула первого антитела или его антигенсвязывающего фрагмента содержит вариабельную тяжелую цепь (VH), содержащую следующие CDR:
(i) SEQ ID NO: 51, и SEQ ID NO: 52, и SEQ ID NO: 53; или
(ii) SEQ ID NO: 57, и SEQ ID NO: 58, и SEQ ID NO: 59; или
(iii) SEQ ID NO: 63, и SEQ ID NO: 64, и SEQ ID NO: 65; или
(iv) SEQ ID NO: 69, и SEQ ID NO: 70, и SEQ ID NO: 71; или
(v) SEQ ID NO: 75, и SEQ ID NO: 76, и SEQ ID NO: 77; или
(vi) SEQ ID NO: 81, и SEQ ID NO: 82, и SEQ ID NO: 83; или
(vii) SEQ ID NO: 87, и SEQ ID NO: 88, и SEQ ID NO: 89; или
(viii) SEQ ID NO: 93, и SEQ ID NO: 94, и SEQ ID NO: 95; или
(ix) SEQ ID NO: 99, и SEQ ID NO: 100, и SEQ ID NO: 101; или
(x) SEQ ID NO: 105, и SEQ ID NO: 106, и SEQ ID NO: 107; или
(xi) SEQ ID NO: 111, и SEQ ID NO: 112, и SEQ ID NO: 113; или
(xii) SEQ ID NO: 117, и SEQ ID NO: 118, и SEQ ID NO: 119; или
(xiii) SEQ ID NO: 123, и SEQ ID NO: 124, и SEQ ID NO: 125; или
(xiv) SEQ ID NO: 129, и SEQ ID NO: 130, и SEQ ID NO: 131; или
(xv) SEQ ID NO: 135, и SEQ ID NO: 136, и SEQ ID NO: 137; или
(хvi) SEQ ID NO: 141, и SEQ ID NO: 142, и SEQ ID NO: 143; или
(хvii) SEQ ID NO: 147, и SEQ ID NO: 148, и SEQ ID NO: 149; или
(хviii) SEQ ID NO: 153, и SEQ ID NO: 154, и SEQ ID NO: 155; или
(xix) SEQ ID NO: 159, и SEQ ID NO: 160, и SEQ ID NO: 161; или
(хх) SEQ ID NO: 165, и SEQ ID NO: 166, и SEQ ID NO: 167; или
(xxi) SEQ ID NO: 171, и SEQ ID NO: 172, и SEQ ID NO: 173; или
(ххii) SEQ ID NO: 177, и SEQ ID NO: 178, и SEQ ID NO: 179; или
(ххiii) SEQ ID NO: 183, и SEQ ID NO: 184, и SEQ ID NO: 185; или
(ххiv) SEQ ID NO: 189, и SEQ ID NO: 190, и SEQ ID NO: 191.
130. Способ по любому из пп. 113-129, причем молекула первого антитела или его антигенсвязывающего фрагмента содержит вариабельную легкую цепь (VL), содержащую следующие CDRs:
(i) SEQ ID NO: 54, и SEQ ID NO: 55, и SEQ ID NO: 56; или
(ii) SEQ ID NO: 60, и SEQ ID NO: 61, и SEQ ID NO: 62; или
(iii) SEQ ID NO: 66, и SEQ ID NO: 67, и SEQ ID NO: 68; или
(iv) SEQ ID NO: 72, и SEQ ID NO: 73, и SEQ ID NO: 74; или
(v) SEQ ID NO: 78, и SEQ ID NO: 79, и SEQ ID NO: 80; или
(vi) SEQ ID NO: 84, и SEQ ID NO: 85, и SEQ ID NO: 86; или
(vii) SEQ ID NO: 90, и SEQ ID NO: 91, и SEQ ID NO: 92; или
(viii) SEQ ID NO: 96, и SEQ ID NO: 97, и SEQ ID NO: 98; или
(ix) SEQ ID NO: 102, и SEQ ID NO: 103, и SEQ ID NO: 104; или
(x) SEQ ID NO: 108, и SEQ ID NO: 109, и SEQ ID NO: 110; или
(xi) SEQ ID NO: 114, и SEQ ID NO: 115, и SEQ ID NO: 116; или
(xii) SEQ ID NO: 120, и SEQ ID NO: 121, и SEQ ID NO: 122; или
(xiii) SEQ ID NO: 126, и SEQ ID NO: 127, и SEQ ID NO: 128; или
(xiv) SEQ ID NO: 132, и SEQ ID NO: 133, и SEQ ID NO: 134; или
(xv) SEQ ID NO: 138, и SEQ ID NO: 139, и SEQ ID NO: 140; или
(хvi) SEQ ID NO: 144, и SEQ ID NO: 145, и SEQ ID NO: 146; или
(хvii) SEQ ID NO: 150, и SEQ ID NO: 151, и SEQ ID NO: 152; или
(хviii) SEQ ID NO: 156, и SEQ ID NO: 157, и SEQ ID NO: 158; или
(xix) SEQ ID NO: 162, и SEQ ID NO: 163, и SEQ ID NO: 164; или
(хх) SEQ ID NO: 168, и SEQ ID NO: 169, и SEQ ID NO: 170; или
(xxi) SEQ ID NO: 174, и SEQ ID NO: 175, и SEQ ID NO: 176; или
(ххii) SEQ ID NO: 180, и SEQ ID NO: 181, и SEQ ID NO: 182; или
(ххiii) SEQ ID NO: 186, и SEQ ID NO: 187, и SEQ ID NO: 188; или
(ххiv) SEQ ID NO: 192, и SEQ ID NO: 193, и SEQ ID NO: 194.
131. Способ по любому из пп. 113-130, причем молекула первого антитела или его антигенсвязывающего фрагмента содержит аминокислотную последовательность с вариабельной тяжелой цепью (VH), выбранную из группы, состоящей из: SEQ ID NO: 3; SEQ ID NO: 4; SEQ ID NO: 5; SEQ ID NO: 6; SEQ ID NO: 7; SEQ ID NO: 8; SEQ ID NO: 9; SEQ ID NO: 10; SEQ ID NO: 11; SEQ ID NO: 12; SEQ ID NO: 13; SEQ ID NO: 14; SEQ ID NO: 15; SEQ ID NO: 16; SEQ ID NO: 17; SEQ ID NO: 18; SEQ ID NO: 19; SEQ ID NO: 20; SEQ ID NO: 21; SEQ ID NO: 22; SEQ ID NO: 23; SEQ ID NO: 24; SEQ ID NO: 25 и SEQ ID NO: 26.
132. Способ по любому из пп. 113-131, причем молекула первого антитела или его антигенсвязывающего фрагмента содержит аминокислотную последовательность с вариабельной легкой цепью (VL), выбранную из группы, состоящей из: SEQ ID NO: 27; SEQ ID NO: 28; SEQ ID NO: 29; SEQ ID NO: 30; SEQ ID NO: 31; SEQ ID NO: 32; SEQ ID NO: 33; SEQ ID NO: 34; SEQ ID NO: 35; SEQ ID NO: 36; SEQ ID NO: 37; SEQ ID NO: 38 SEQ ID NO: 39; SEQ ID NO: 40; SEQ ID NO: 41; SEQ ID NO: 42; SEQ ID NO: 43; SEQ ID NO: 44; SEQ ID NO: 45; SEQ ID NO: 46; SEQ ID NO: 47; SEQ ID NO: 48; SEQ ID NO: 49 и SEQ ID NO: 50.
133. Сособ по любому из пп. 113-132, причем молекула первого антитела или его антигенсвязывающего фрагмента содержит следующие аминокислотные последовательности CDR:
(i) SEQ ID NO: 51, и SEQ ID NO: 52, и SEQ ID NO: 53, и SEQ ID NO: 54, и SEQ ID NO: 55, и SEQ ID NO: 56; или
(ii) SEQ ID NO: 57, и SEQ ID NO: 58, и SEQ ID NO: 59, и SEQ ID NO: 60, и SEQ ID NO: 61, и SEQ ID NO: 62; или
(iii) SEQ ID NO: 63, и SEQ ID NO: 64, и SEQ ID NO: 65, и SEQ ID NO: 66, и SEQ ID NO: 67, и SEQ ID NO: 68; или
(iv) SEQ ID NO: 69, и SEQ ID NO: 70, и SEQ ID NO: 71, и SEQ ID NO: 72, и SEQ ID NO: 73, и SEQ ID NO: 74; или
(v) SEQ ID NO: 75, и SEQ ID NO: 76, и SEQ ID NO: 77, и SEQ ID NO: 78, и SEQ ID NO: 79, и SEQ ID NO: 80; или
(vi) SEQ ID NO: 81, и SEQ ID NO: 82, и SEQ ID NO: 83, и SEQ ID NO: 84, и SEQ ID NO: 85, и SEQ ID NO: 86; или
(vii) SEQ ID NO: 87, и SEQ ID NO: 88, и SEQ ID NO: 89, и SEQ ID NO: 90, и SEQ ID NO: 91, и SEQ ID NO: 92; или
(viii) SEQ ID NO: 93, и SEQ ID NO: 94, и SEQ ID NO: 95, и SEQ ID NO: 96, и SEQ ID NO: 97, и SEQ ID NO: 98; или
(ix) SEQ ID NO: 99, и SEQ ID NO: 100, и SEQ ID NO: 101, и SEQ ID NO: 102, и SEQ ID NO: 103, и SEQ ID NO: 104; или
(x) SEQ ID NO: 105, и SEQ ID NO: 106, и SEQ ID NO: 107, и SEQ ID NO: 108, и SEQ ID NO: 109, и SEQ ID NO: 110; или
(xi) SEQ ID NO: 111, и SEQ ID NO: 112, и SEQ ID NO: 113, и SEQ ID NO: 114, и SEQ ID NO: 115, и SEQ ID NO: 116; или
(xii) SEQ ID NO: 117, и SEQ ID NO: 118, и SEQ ID NO: 119, и SEQ ID NO: 120, и SEQ ID NO: 121, и SEQ ID NO: 122; или
(xiii) SEQ ID NO: 123, и SEQ ID NO: 124, и SEQ ID NO: 125, и SEQ ID NO: 126, и SEQ ID NO: 127, и SEQ ID NO: 128; или
(xiv) SEQ ID NO: 129, и SEQ ID NO: 130, и SEQ ID NO: 131, и SEQ ID NO: 132, и SEQ ID NO: 133, и SEQ ID NO: 134; или
(xv) SEQ ID NO: 135, и SEQ ID NO: 136, и SEQ ID NO: 137, и SEQ ID NO: 138, и SEQ ID NO: 139, и SEQ ID NO: 140; или
(хvi) SEQ ID NO: 141, и SEQ ID NO: 142, и SEQ ID NO: 143, и SEQ ID NO: 144, и SEQ ID NO: 145, и SEQ ID NO: 146; или
(хvii) SEQ ID NO: 147, и SEQ ID NO: 148, и SEQ ID NO: 149, и SEQ ID NO: 150, и SEQ ID NO: 151, и SEQ ID NO: 152; или
(хviii) SEQ ID NO: 153, и SEQ ID NO: 154, и SEQ ID NO: 155, и SEQ ID NO: 156, и SEQ ID NO: 157, и SEQ ID NO: 158; или
(xix) SEQ ID NO: 159, и SEQ ID NO: 160, и SEQ ID NO: 161, и SEQ ID NO: 162, и SEQ ID NO: 163, и SEQ ID NO: 164; или
(хх) SEQ ID NO: 165, и SEQ ID NO: 166, и SEQ ID NO: 167, и SEQ ID NO: 168, и SEQ ID NO: 169, и SEQ ID NO: 170; или
(xxi) SEQ ID NO: 171, и SEQ ID NO: 172, и SEQ ID NO: 173, и SEQ ID NO: 174, и SEQ ID NO: 175, и SEQ ID NO: 176; или
(ххii) SEQ ID NO: 177, и SEQ ID NO: 178, и SEQ ID NO: 179, и SEQ ID NO: 180, и SEQ ID NO: 181, и SEQ ID NO: 182; или
(ххiii) SEQ ID NO: 183, и SEQ ID NO: 184, и SEQ ID NO: 185, и SEQ ID NO: 186, и SEQ ID NO: 187, и SEQ ID NO: 188; или
(ххiv) SEQ ID NO: 189, и SEQ ID NO: 190, и SEQ ID NO: 191, и SEQ ID NO: 192, и SEQ ID NO: 193, и SEQ ID NO: 194.
134. Способ по любому из пп. 113-133, причем молекула первого антитела или его антигенсвязывающего фрагмента содержит следующие аминокислотные последовательности:
(i) SEQ ID NO: 3 и SEQ ID NO: 27; или
(ii) SEQ IS NO: 4 и SEQ ID NO: 28; или
(iii) SEQ IS NO: 5 и SEQ ID NO: 29; или
(iv) SEQ ID NO: 6 и SEQ ID NO: 30; или
(v) SEQ ID NO: 7 и SEQ ID NO: 31; или
(vi) SEQ ID NO: 8 и SEQ ID NO: 32; или
(vii) SEQ ID NO: 9 и SEQ ID NO: 33; или
(viii) SEQ ID NO: 10 и SEQ ID NO: 34; или
(ix) SEQ ID NO: 11 и SEQ ID NO: 35; или
(x) SEQ ID NO: 12 и SEQ ID NO: 36; или
(xi) SEQ ID NO: 13 и SEQ ID NO: 37; или
(xii) SEQ ID NO: 14 и SEQ ID NO: 38; или
(xiii) SEQ ID NO: 15 и SEQ ID NO: 39; или
(xiv) SEQ ID NO: 16 и SEQ ID NO: 40; или
(xv) SEQ ID NO: 17 и SEQ ID NO: 41; или
(хvi) SEQ ID NO: 18 и SEQ ID NO: 42; или
(хvii) SEQ ID NO: 19 и SEQ ID NO: 43; или
(хviii) SEQ ID NO: 20 и SEQ ID NO: 44; или
(xix) SEQ ID NO: 21 и SEQ ID NO: 45; или
(хх) SEQ ID NO: 22 и SEQ ID NO: 46; или
(xxi) SEQ ID NO: 23 и SEQ ID NO: 47; или
(ххii) SEQ ID NO: 24 и SEQ ID NO: 48; или
(ххiii) SEQ ID NO: 25 и SEQ ID NO: 49; или
(ххiv) SEQ ID NO: 26 и SEQ ID NO: 50.
135. Способ по любому из пп. 113-128, причем молекула первого антитела или его антигенсвязывающего фрагмента, представляет собой молекулу антитела или его антигенсвязывающего фрагмента, способную конкурировать за связывание с FcγRIIb с молекулой антитела, которая:
(а) содержит вариабельную тяжелую цепь (VH), содержащую следующие CDR:
(i) SEQ ID NO: 51, и SEQ ID NO: 52, и SEQ ID NO: 53; или
(ii) SEQ ID NO: 57, и SEQ ID NO: 58, и SEQ ID NO: 59; или
(iii) SEQ ID NO: 63, и SEQ ID NO: 64, и SEQ ID NO: 65; или
(iv) SEQ ID NO: 69, и SEQ ID NO: 70, и SEQ ID NO: 71; или
(v) SEQ ID NO: 75, и SEQ ID NO: 76, и SEQ ID NO: 77; или
(vi) SEQ ID NO: 81, и SEQ ID NO: 82, и SEQ ID NO: 83; или
(viiSEQ ID NO: 87, и SEQ ID NO: 88, и SEQ ID NO: 89; или
(viii) SEQ ID NO: 93, и SEQ ID NO: 94, и SEQ ID NO: 95; или
(ix) SEQ ID NO: 99, и SEQ ID NO: 100, и SEQ ID NO: 101; или
(x) SEQ ID NO: 105, и SEQ ID NO: 106, и SEQ ID NO: 107; или
(xi) SEQ ID NO: 111, и SEQ ID NO: 112, и SEQ ID NO: 113; или
(xii) SEQ ID NO: 117, и SEQ ID NO: 118, и SEQ ID NO: 119; или
(xiii) SEQ ID NO: 123, и SEQ ID NO: 124, и SEQ ID NO: 125; или
(xiv) SEQ ID NO: 129, и SEQ ID NO: 130, и SEQ ID NO: 131; или
(xv) SEQ ID NO: 135, и SEQ ID NO: 136, и SEQ ID NO: 137; или
(хvi) SEQ ID NO: 141, и SEQ ID NO: 142, и SEQ ID NO: 143; или
(хvii) SEQ ID NO: 147, и SEQ ID NO: 148, и SEQ ID NO: 149; или
(хviii) SEQ ID NO: 153, и SEQ ID NO: 154, и SEQ ID NO: 155; или
(xix) SEQ ID NO: 159, и SEQ ID NO: 160, и SEQ ID NO: 161; или
(хх) SEQ ID NO: 165, и SEQ ID NO: 166, и SEQ ID NO: 167; или
(xxi) SEQ ID NO: 171, и SEQ ID NO: 172, и SEQ ID NO: 173; или
(ххii) SEQ ID NO: 177, и SEQ ID NO: 178, и SEQ ID NO: 179; или
(ххiii) SEQ ID NO: 183, и SEQ ID NO: 184, и SEQ ID NO: 185; или
(ххiv) SEQ ID NO: 189, и SEQ ID NO: 190, и SEQ ID NO: 191, и
содержит вариабельную легкую цепь (VL), содержащую следующие CDRs:
(i) SEQ ID NO: 54, и SEQ ID NO: 55, и SEQ ID NO: 56; или
(ii) SEQ ID NO: 60, и SEQ ID NO: 61, и SEQ ID NO: 62; или
(iii) SEQ ID NO: 66, и SEQ ID NO: 67, и SEQ ID NO: 68; или
(iv) SEQ ID NO: 72, и SEQ ID NO: 73, и SEQ ID NO: 74; или
(v) SEQ ID NO: 78, и SEQ ID NO: 79, и SEQ ID NO: 80; или
(vi) SEQ ID NO: 84, и SEQ ID NO: 85, и SEQ ID NO: 86; или
(vii) SEQ ID NO: 90, и SEQ ID NO: 91, и SEQ ID NO: 92; или
(viii) SEQ ID NO: 96, и SEQ ID NO: 97, и SEQ ID NO: 98; или
(ix) SEQ ID NO: 102, и SEQ ID NO: 103, и SEQ ID NO: 104; или
(x) SEQ ID NO: 108, и SEQ ID NO: 109, и SEQ ID NO: 110; или
(xi) SEQ ID NO: 114, и SEQ ID NO: 115, и SEQ ID NO: 116; или
(xii) SEQ ID NO: 120, и SEQ ID NO: 121, и SEQ ID NO: 122; или
(xiii) SEQ ID NO: 126, и SEQ ID NO: 127, и SEQ ID NO: 128; или
(xiv) SEQ ID NO: 132, и SEQ ID NO: 133, и SEQ ID NO: 134; или
(xv) SEQ ID NO: 138, и SEQ ID NO: 139, и SEQ ID NO: 140; или
(хvi) SEQ ID NO: 144, и SEQ ID NO: 145, и SEQ ID NO: 146; или
(хvii) SEQ ID NO: 150, и SEQ ID NO: 151, и SEQ ID NO: 152; или
(хviii) SEQ ID NO: 156, и SEQ ID NO: 157, и SEQ ID NO: 158; или
(xix) SEQ ID NO: 162, и SEQ ID NO: 163, и SEQ ID NO: 164; или
(хх) SEQ ID NO: 168, и SEQ ID NO: 169, и SEQ ID NO: 170; или
(xxi) SEQ ID NO: 174, и SEQ ID NO: 175, и SEQ ID NO: 176; или
(ххii) SEQ ID NO: 180, и SEQ ID NO: 181, и SEQ ID NO: 182; или
(ххiii) SEQ ID NO: 186, и SEQ ID NO: 187, и SEQ ID NO: 188; или
(ххiv) SEQ ID NO: 192, и SEQ ID NO: 193, и SEQ ID NO: 194; или
(b) содержит аминокислотную последовательность с вариабельной тяжелой цепью (VH), выбранную из группы, состоящей из: SEQ ID NO: 3; SEQ ID NO: 4; SEQ ID NO: 5; SEQ ID NO: 6; SEQ ID NO: 7; SEQ ID NO: 8; SEQ ID NO: 9; SEQ ID NO: 10; SEQ ID NO: 11; SEQ ID NO: 12; SEQ ID NO: 13; SEQ ID NO: 14; SEQ ID NO: 15; SEQ ID NO: 16; SEQ ID NO: 17; SEQ ID NO: 18; SEQ ID NO: 19; SEQ ID NO: 20; SEQ ID NO: 21; SEQ ID NO: 22; SEQ ID NO: 23; SEQ ID NO: 24; SEQ ID NO: 25 и SEQ ID NO: 26, и содержит аминокислотную последовательность с вариабельной легкой цепью (VL), выбранную из группы, состоящей из: SEQ ID NO: 27; SEQ ID NO: 28; SEQ ID NO: 29; SEQ ID NO: 30; SEQ ID NO: 31; SEQ ID NO: 32; SEQ ID NO: 33; SEQ ID NO: 34; SEQ ID NO: 35; SEQ ID NO: 36; SEQ ID NO: 37; SEQ ID NO: 38 SEQ ID NO: 39; SEQ ID NO: 40; SEQ ID NO: 41; SEQ ID NO: 42; SEQ ID NO: 43; SEQ ID NO: 44; SEQ ID NO: 45; SEQ ID NO: 46; SEQ ID NO: 47; SEQ ID NO: 48; SEQ ID NO: 49 и SEQ ID NO: 50, или
(с) содержит следующие аминокислотные последовательности CDR:
(i) SEQ ID NO: 51, и SEQ ID NO: 52, и SEQ ID NO: 53, и SEQ ID NO: 54, и SEQ ID NO: 55, и SEQ ID NO: 56; или
(ii) SEQ ID NO: 57, и SEQ ID NO: 58, и SEQ ID NO: 59, и SEQ ID NO: 60, и SEQ ID NO: 61, и SEQ ID NO: 62; или
(iii) SEQ ID NO: 63, и SEQ ID NO: 64, и SEQ ID NO: 65, и SEQ ID NO: 66, и SEQ ID NO: 67, и SEQ ID NO: 68; или
(iv) SEQ ID NO: 69, и SEQ ID NO: 70, и SEQ ID NO: 71, и SEQ ID NO: 72, и SEQ ID NO: 73, и SEQ ID NO: 74; или
(v) SEQ ID NO: 75, и SEQ ID NO: 76, и SEQ ID NO: 77, и SEQ ID NO: 78, и SEQ ID NO: 79, и SEQ ID NO: 80; или
(vi) SEQ ID NO: 81, и SEQ ID NO: 82, и SEQ ID NO: 83, и SEQ ID NO: 84, и SEQ ID NO: 85, и SEQ ID NO: 86; или
(vii) SEQ ID NO: 87, и SEQ ID NO: 88, и SEQ ID NO: 89, и SEQ ID NO: 90, и SEQ ID NO: 91, и SEQ ID NO: 92; или
(viii) SEQ ID NO: 93, и SEQ ID NO: 94, и SEQ ID NO: 95, и SEQ ID NO: 96, и SEQ ID NO: 97, и SEQ ID NO: 98; или
(ix) SEQ ID NO: 99, и SEQ ID NO: 100, и SEQ ID NO: 101, и SEQ ID NO: 102 и SEQ ID NO: 103 и SEQ ID NO: 104; или
(x) SEQ ID NO: 105, и SEQ ID NO: 106, и SEQ ID NO: 107, и SEQ ID NO: 108, и SEQ ID NO: 109 и SEQ ID NO: 110; или
(xi) SEQ ID NO: 111, и SEQ ID NO: 112, и SEQ ID NO: 113, и SEQ ID NO: 114, и SEQ ID NO: 115 и SEQ ID NO: 116; или
(xii) SEQ ID NO: 117, и SEQ ID NO: 118, и SEQ ID NO: 119, и SEQ ID NO: 120, и SEQ ID NO: 121 и SEQ ID NO: 122; или
(xiii) SEQ ID NO: 123, и SEQ ID NO: 124, и SEQ ID NO: 125, и SEQ ID NO: 126, и SEQ ID NO: 127 и SEQ ID NO: 128; или
(xiv) SEQ ID NO: 129, и SEQ ID NO: 130, и SEQ ID NO: 131, и SEQ ID NO: 132, и SEQ ID NO: 133 и SEQ ID NO: 134; или
(xv) SEQ ID NO: 135, и SEQ ID NO: 136, и SEQ ID NO: 137, и SEQ ID NO: 138, и SEQ ID NO: 139, и SEQ ID NO: 140; или
(хvi) SEQ ID NO: 141, и SEQ ID NO: 142, и SEQ ID NO: 143, и SEQ ID NO: 144, и SEQ ID NO: 145, и SEQ ID NO: 146; или
(хvii) SEQ ID NO: 147, и SEQ ID NO: 148, и SEQ ID NO: 149, и SEQ ID NO: 150, и SEQ ID NO: 151, и SEQ ID NO: 152; или
(хviii) SEQ ID NO: 153, и SEQ ID NO: 154, и SEQ ID NO: 155, и SEQ ID NO: 156, и SEQ ID NO: 157, и SEQ ID NO: 158; или
(xix) SEQ ID NO: 159, и SEQ ID NO: 160, и SEQ ID NO: 161, и SEQ ID NO: 162, и SEQ ID NO: 163, и SEQ ID NO: 164; или
(хх) SEQ ID NO: 165, и SEQ ID NO: 166, и SEQ ID NO: 167, и SEQ ID NO: 168, и SEQ ID NO: 169, и SEQ ID NO: 170; или
(xxi) SEQ ID NO: 171, и SEQ ID NO: 172, и SEQ ID NO: 173, и SEQ ID NO: 174, и SEQ ID NO: 175, и SEQ ID NO: 176; или
(ххii) SEQ ID NO: 177, и SEQ ID NO: 178, и SEQ ID NO: 179, и SEQ ID NO: 180, и SEQ ID NO: 181, и SEQ ID NO: 182; или
(ххiii) SEQ ID NO: 183, и SEQ ID NO: 184, и SEQ ID NO: 185, и SEQ ID NO: 186, и SEQ ID NO: 187, и SEQ ID NO: 188; или
(ххiv) SEQ ID NO: 189, и SEQ ID NO: 190, и SEQ ID NO: 191, и SEQ ID NO: 192, и SEQ ID NO: 193, и SEQ ID NO: 194, или
(d) содержит следующие аминокислотные последовательности:
(i) SEQ ID NO: 3 и SEQ ID NO: 27; или
(ii) SEQ IS NO: 4 и SEQ ID NO: 28; или
(iii) SEQ IS NO: 5 и SEQ ID NO: 29; или
(iv) SEQ ID NO: 6 и SEQ ID NO: 30; или
(v) SEQ ID NO: 7 и SEQ ID NO: 31; или
(vi) SEQ ID NO: 8 и SEQ ID NO: 32; или
(vii) SEQ ID NO: 9 и SEQ ID NO: 33; или
(viii) SEQ ID NO: 10 и SEQ ID NO: 34; или
(ix) SEQ ID NO: 11 и SEQ ID NO: 35; или
(x) SEQ ID NO: 12 и SEQ ID NO: 36; или
(xi) SEQ ID NO: 13 и SEQ ID NO: 37; или
(xii) SEQ ID NO: 14 и SEQ ID NO: 38; или
(xiii) SEQ ID NO: 15 и SEQ ID NO: 39; или
(xiv) SEQ ID NO: 16 и SEQ ID NO: 40; или
(xv) SEQ ID NO: 17 и SEQ ID NO: 41; или
(хvi) SEQ ID NO: 18 и SEQ ID NO: 42; или
(хvii) SEQ ID NO: 19 и SEQ ID NO: 43; или
(хviii) SEQ ID NO: 20 и SEQ ID NO: 44; или
(xix) SEQ ID NO: 21 и SEQ ID NO: 45; или
(хх) SEQ ID NO: 22 и SEQ ID NO: 46; или
(xxi) SEQ ID NO: 23 и SEQ ID NO: 47; или
(ххii) SEQ ID NO: 24 и SEQ ID NO: 48; или
(ххiii) SEQ ID NO: 25 и SEQ ID NO: 49; или
(ххiv) SEQ ID NO: 26 и SEQ ID NO: 50.
136. Способ по любому из пп. 113-135, причем молекулу второго антитела выбирают из группы, состоящей из молекулы человеческого антитела, молекулы гуманизированного антитела и молекулы антитела человеческого происхождения.
137. Способ по любому из пп. 113-136, причем молекула второго антитела представляет собой человеческое антитело IgG.
138. Способ по любому из пп. 113-137, причем молекула второго антитела специфично связывается с рецептором, выбранным из группы, состоящей из: CTLA-4; 4-1BB; OX40; TNFR2; PD-L1; Il-2R и GITR.
139. Способ по п. 138, причем молекула второго антитела специфично связывается с CTLA-4.
140. Способ по п. 138, причем молекула второго антитела специфично связывается с PD-L1.
| US 20070014795 A1, 18.01.2007 | |||
| WO 2017174331 A1, 12.10.2017 | |||
| EA 0200970416 A1, 30.04.2010 | |||
| АНТИТЕЛА ПРОТИВ РЕЦЕПТОРА FcγRIIB И ИХ ПРИМЕНЕНИЕ | 2005 |
|
RU2404991C2 |
| WO 2012022985 A1, 23.02.2012. | |||
Авторы
Даты
2023-07-14—Публикация
2019-01-10—Подача