Изобретение относится к экспериментальной медицине и предназначено для повышения лимфотока в центральной нервной системе (ЦНС) путем комбинированного иглоукалывания и фотовоздействия на зону акупунктуры Feng Chi (GB20) в затылочной области головы с целью активации лимфодренажных процессов головного мозга мышей.
Известен способ электровоздействия на зоны акупунктур GB20 и GV26 (Shui Gou) с целью доставки лекарственных препаратов в ткани мозга крыс (Zhang J, Lin X, Zhou H, Chen Y, Xiao S, Jiao J, Zhao Y, Di Z. Electroacupuncture: a new approach to open the blood-brain barrier in rats recovering from middle cerebral artery occlusion. Acupunct Med. 2018; 36(6):377-385. doi: 10.1136/acupmed-2017-011496). Способ заключается в электрической стимуляции (частота - 100 Гц; сила тока - 2 мА) зон акупунктур GB20 и GV26 в течении 8 мин, что сопровождается повышением проницаемости церебральных микрососудов крыс для высокомолекулярных соединений.
Однако данный способ направлен на повышение проницаемости гематоэнцефалического барьера (ГЭБ) и доставки препаратов в ткани мозга. Его эффективность в отношении активации лимфодренажной функции мозга с целью выведения токсинов из ЦНС не описана. Электростимуляция зон акупунктур GB20 и GV26 оказывает генерализованный эффект как на электрические явления мозга, так и на церебральный кровоток, т.е. не является специфичным. Связано это с тем, что зоны акупунктур располагаются в затылочной области головы (GB20) и носа (GV26) и воздействие электрическими импульсами в этих зонах вовлекает в свои эффекты многие процессы мозга, помимо воздействия на ГЭБ. Применение электрического тока имеет ограничения на моделях грызунов с эпилепсией и нарушением сердечного ритма.
Известен способ лечения неврита зрительного нерва у мышей с рассеянным склерозом путем иглоукалывания в зонах акупунктур GB20 и GB16 (Fengfu) (Chen J, Zhang L, Gan X, Zhang R, He Y, Lv Q, Fu H, Liu X, Miao L. Effects of Retinal Transcription Regulation After GB20 Needling Treatment in Retina With Optic Neuritis. Front Integr Neurosci. 2020 29;14:568449. doi: 10.3389/fnint.2020.568449). Способ заключается во введении игл для акупунктуры в зоны GB20 и GB16 на глубину 2 мм. Иглы должны находиться в зонах акупунктур в течение 20 мин. Курс лечения составляет 3 недели через каждые 3 дня.
Данный способ лечения способствует восстановлению проводящей способности зрительного нерва и зрения у мышей с рассеянным склерозом за счет модуляции активности генов, ответственных за регенерацию аксонов.
Однако способ требует длительного применения и глубокого введения игл для акупунктуры на глубину 2 мм с целью достижения контакта области анатомического выхода зрительного нерва. Способ неэффективен для стимуляции лимфотока и не оказывает терапевтического эффекта при однократном применении. Для достижения терапевтического воздействия требуется иглоукалывание двух зон акупунктуры GB20 и GB16 на протяжении 20 мин через каждый 3 дня в течение 3 недель, что сопровождается повышением стресса у животного. Связано это с тем, что животное берут в руки, что является сильным эмоциональным переживанием для мышей, а также оказывают болевое воздействие на четыре точки акупунктуры GB20 и GB16 (2 слева и 2 справа). Повышенный стрессорный фактор снижает достоверность получаемых научных результатов и скорость восстановительных процессов.
Наиболее близким к предлагаемому является способ повышения лимфодренажной функции мозга мышей путем транскраниального фотовоздействия на менингеальные лимфососуды (Патент РФ 2766527, МПК A61N 5/00, опубл. 15.03.2022). Способ заключается в том, что осуществляется стимуляция очистительной функции лимфатической системы мозга путем фотовоздействия на лимфатические сосуды, согласно решению, воздействие осуществляют неинвазивно излучением длиной лазерной волны 1267 нм и с мощностью, не превышающего порога фотоповреждения, на зоны расположения лимфатических сосудов оболочек мозга, головы и шеи во время стадии глубокого сна детектируемого на электроэнцефалограмме на протяжении всего цикла сна, однократно или курсом, подбираемым индивидуально.
Способ имеет ряд недостатков. Для достижения результата требуется применение лазерного воздействия на менингеальные лимфососуды, расположенные под черепом в оболочках мозга мышей. Лазерная энергия существенно рассеивается при прохождении через плотные ткани черепа. Привязанность способа фотовоздействия на менингеальные лимфососуды во время сна делает метод неудобным в применении, поскольку требует дополнительного использования специального оборудования для регистрации электрической активности мозга на электроэнцефалографии с применением электродов, которые вживляются хирургическим путем.
Техническая проблема заключается в разработке способа активации лимфодренажных процессов мозга за счет комбинированного фотовоздействия и иглостимуляции зон акупунктуры GB20 у мышей.
Технический результат заключается в повышении степени активации лимфодренажной функции мозга.
Техническая проблема изобретения решается тем, что способ стимуляции лимфовыводящей функции мозга мыши, согласно решению, осуществляется путем игловоздействия в зонах акупунктуры GB20 один раз с правой и левой сторон на глубине залегания затылочных лимфоузлов мыши (200 мкм) в сочетании с фотовоздействием длиной волны 1267 нм в дозе 9 Дж/см2 данной зоны акупунктуры, что стимулирует лимфовыводящую функцию мозга и сопровождается очищением его тканей от ненужных соединений.
Способ поясняется иллюстрациями и таблицами, где представлены:
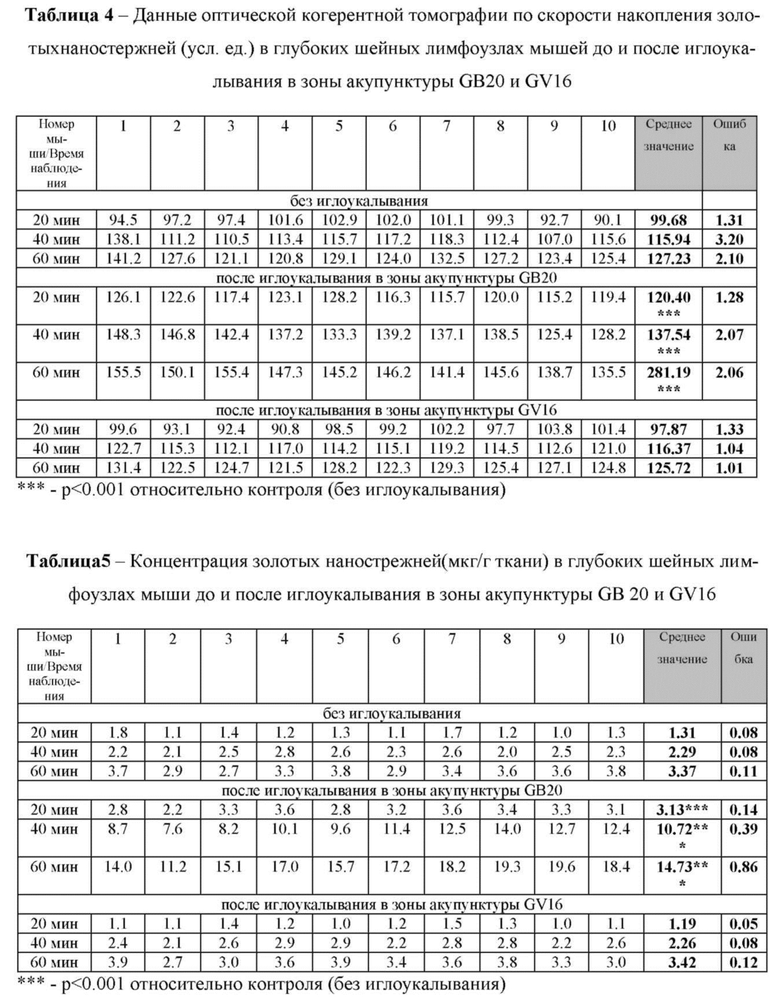
на фиг. 1 - Схема комбинированного фотовоздействия и иглоукалывания в зоне акупунктуры GB20: (а и б) - фото и схема анатомического расположения точек акупунктуры GB20 для фотовоздействия и иглоукалывания; (в) - схема расположения контрольной точки акупунктуры GV16 относительно исследуемой зоны акупунктуры GB20;
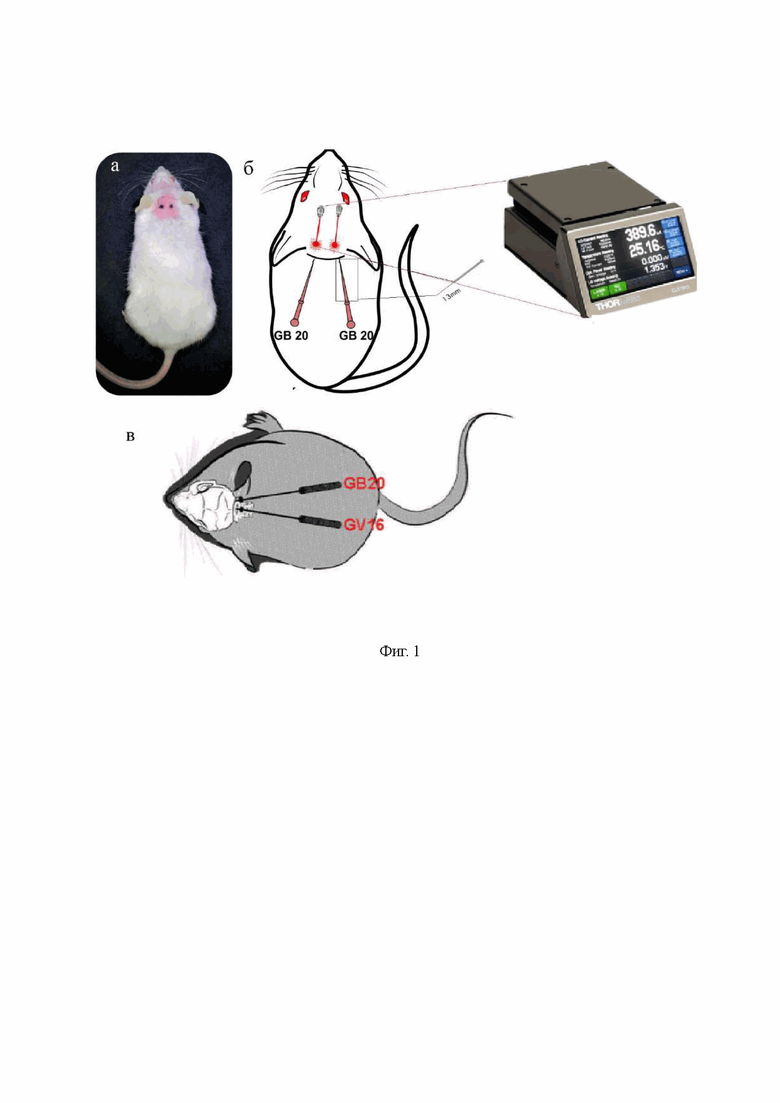
на фиг. 2 - Гистологический анализ тканей мозга мышей до и после сеанса фотовоздействия (ФС) в различных дозах: (a) до ФС и после ФС (б) 3 Дж/см2; (в) 6 Дж/см2; (г) 9 Дж/см2; (д) 18 Дж/см2 and (е) 27 Дж/см2 (на поверхности скальпа), n=5 в каждой группе, размер шкалы - 246.4x;
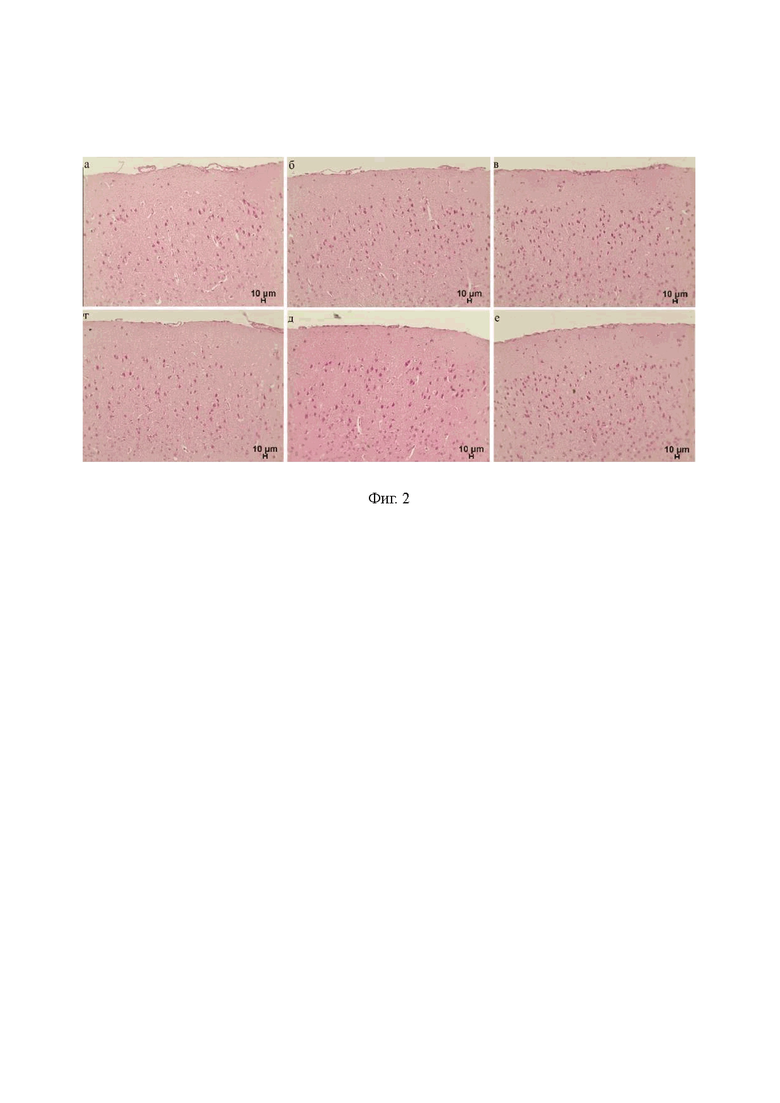
на фиг. 3 - Установка оптической когерентной томографии (а) для мониторинга накопления золотых наностержней в глубоком шейном лимфатическом узле мыши (б) в динамике (в);
на фиг. 4 - Анализ активации лимфодренажной и лимфовыводящей функции мозга мышей на протяжении 2 часов с использованием магнитно-резонансной томографии (МРТ) после комбинированного фотовоздействия (9 Дж/см2) и иглоукалывания в зоне акупунктуры GB20: (а) - оценка интенсивности сигнала распределения контраста (Omniscan) по тканям мозга и в глубоких шейных лимфоузлах (указаны стрелкой) после его введения в правый боковой желудочек (AP=-0.5 мм; ML=-1.06 мм; DV=2.5 мм) без (слева) и после (справа) комбинированного фотовоздействия и иглоукалывания в зоне акупунктуры GB20; (б) - количественный анализ накопления контраста в глубоких шейных лимфоузлах до и после комбинированного фотовоздействия и иглоукалывания в зоне акупунктуры GB20, n=7 в каждой группе, *** - p<0.001 относительно группы интактных мышей (без фотовоздействия и иглоукалывания), тест Манн-Уитни;
на фиг. 5 - Анализ активации лимфодренажной и лимфовыводящей функции мозга мышей на протяжении 2 часов с использованием МРТ после раздельного фотовоздействия или иглоукалывания в зоне акупунктуры GB20: (а и б) - оценка интенсивности сигнала распределения контраста (Omniscan) по тканям мозга и в глубоких шейных лимфоузлах после его введения в правый боковой желудочек (AP=-0.5 мм; ML=-1.06 мм; DV=2.5 мм) после (а) фотоэффектов и (б) иглоукалывания в зоне акупунктуры GB20; (в) - количественный анализ накопления контраста в глубоких шейных лимфоузлах до и после фотовоздействия и иглоукалывания в зоне акупунктуры GB20, соответственно, n=7 в каждой группе, *** - p<0.001 относительно контроля (до воздействия), различия между иглоукалыванием и фотовоздействием были не достоверными, тест Манн-Уитни;
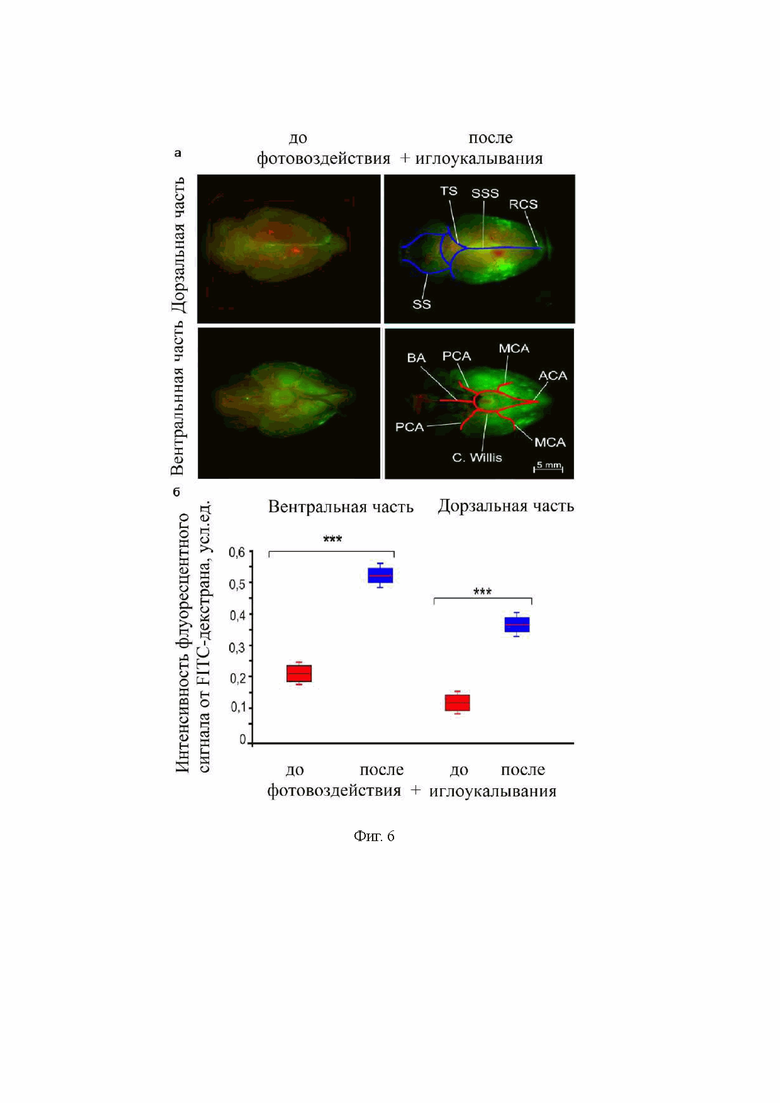
на фиг. 6 - Анализ активации лимфодренажной и лимфовыводящей функции мозга мышей после комбинированного фотовоздействия и иглоукалывания на протяжении 2 часов с использованием флуоресцентной микроскопии: (а) - пример изображения распределения красителя FITC-декстран 70 кДа (зеленый) по дорзальной и вентральной частям мозга после его введения в правый боковой желудочек (AP=-0.5 мм; ML=-1.06 мм; DV=2.5 мм), церебральные сосуды окрашены красителем Evans Blue (красный цвет, краситель вводили внутривенно); (б) - количественный анализ накопления FITC-декстран 70 кДа в глубоких шейных лимфоузлах без и после комбинированного фотовоздействия и иглоукалывания в зоне акупунктуры GB20, n=7 в каждой группе, *** - p<0.001 относительно группы интактных мышей (без воздействия), тест Манн-Уитни;
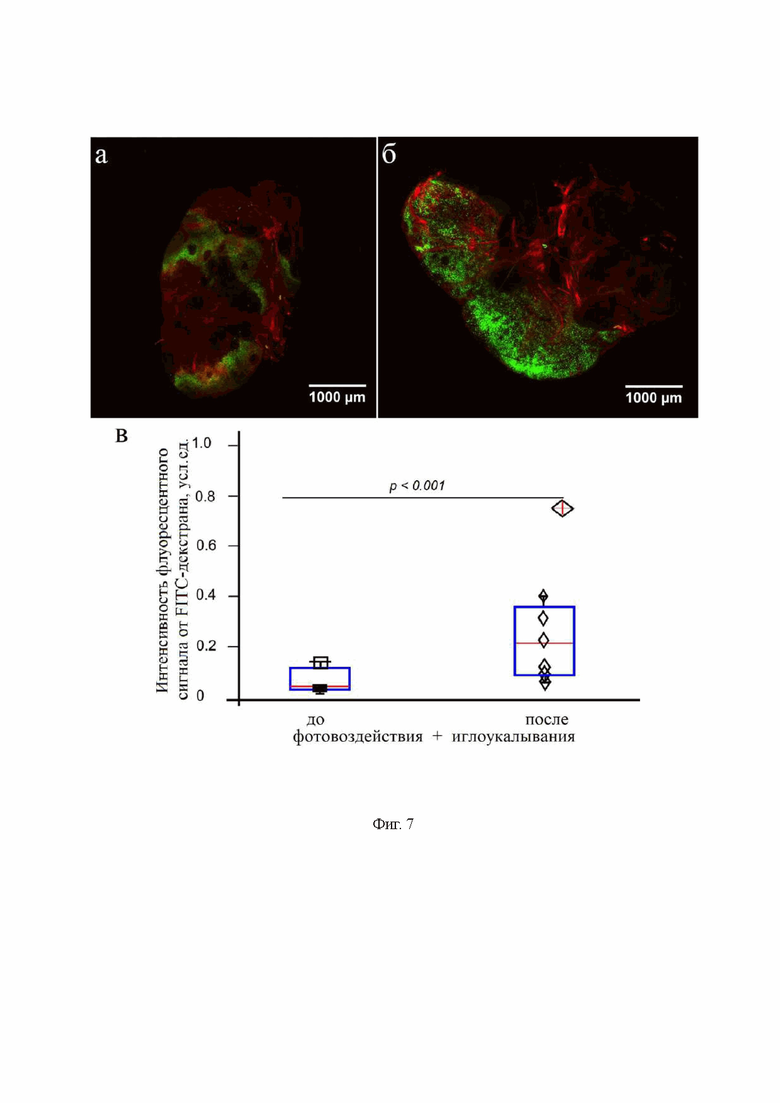
на фиг. 7 - Анализ накопления красителя FITC-декстран 70 кДа в глубоких шейных лимфоузлах мыши: (а) до и (б) после комбинированного фотовоздействия и иглоукалывания в зоне акупунктуры GB20; (в) - количественный анализ накопления красителя в глубоких шейных лимфоузлах без и после комбинированного фотовоздействия и иглоукалывания в зоне акупунктуры GB20, n=7 в каждой группе, *** - p<0.001 относительно группы интактных мышей (без воздействия), тест Манн-Уитни;
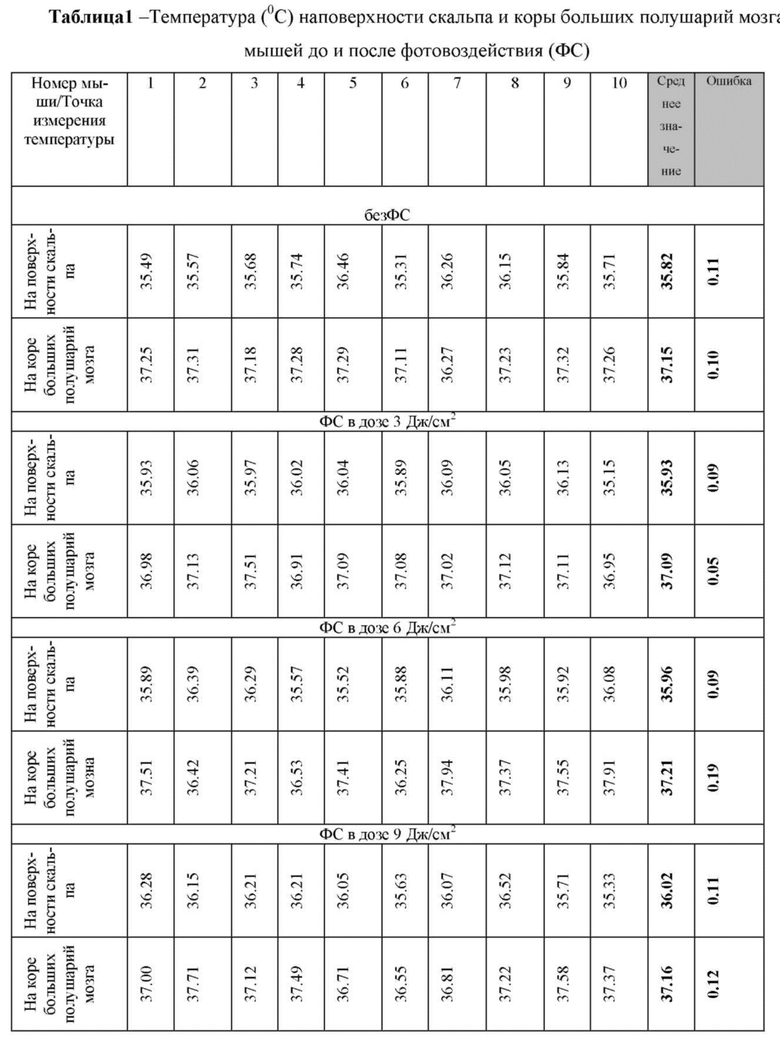
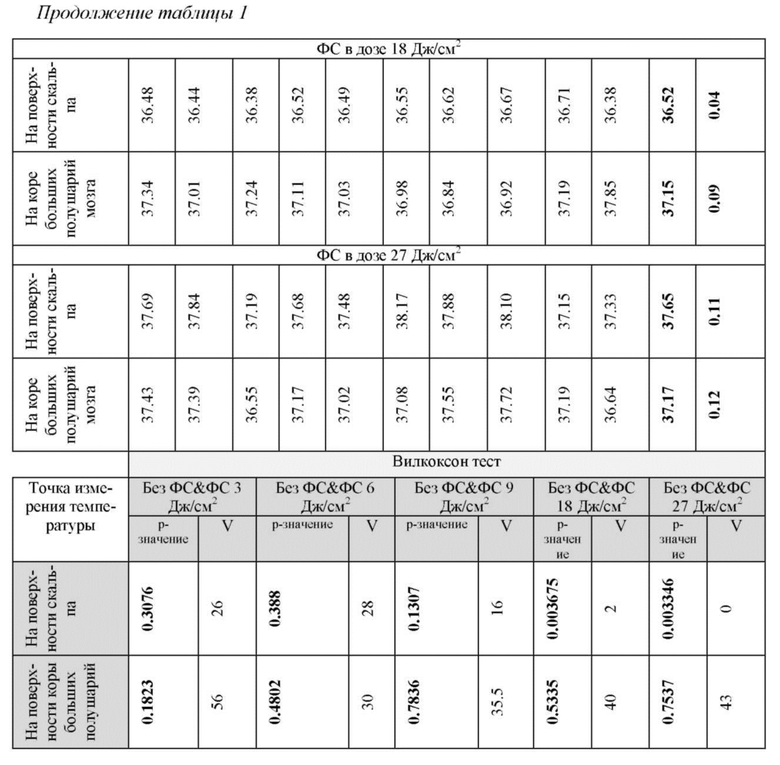
в таблице 1 - Температура (°C) на поверхности скальпа и коры больших полушарий мозга мышей до и после фотовоздействия;
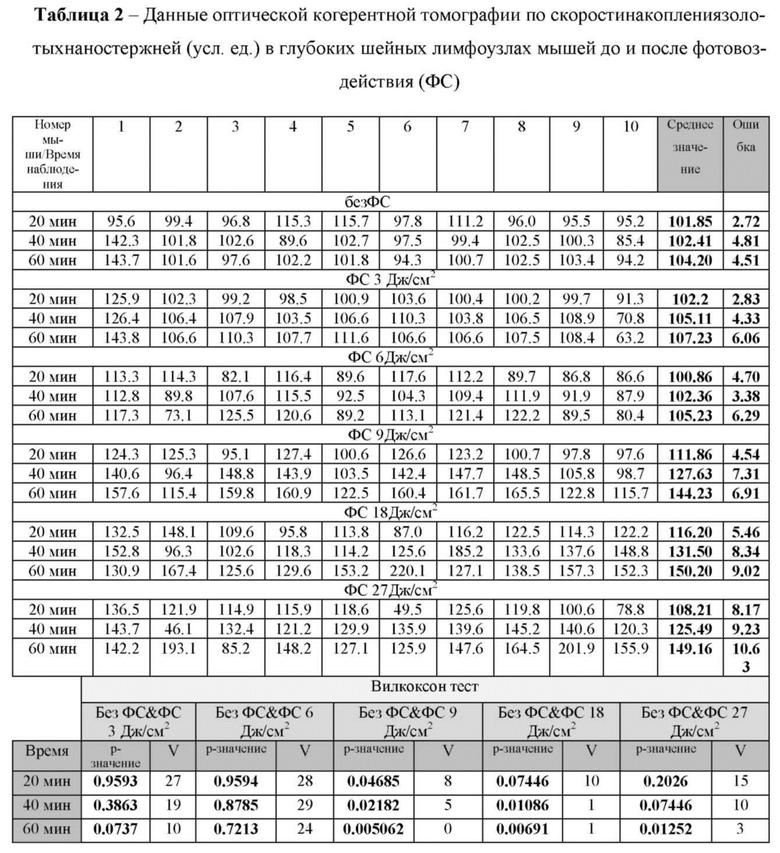
в таблице 2 - Данные оптической когерентной томографии по скорости накопления золотых наностержней (усл. ед.) в глубоких шейных лимфоузлах мышей до и после фотовоздействия;
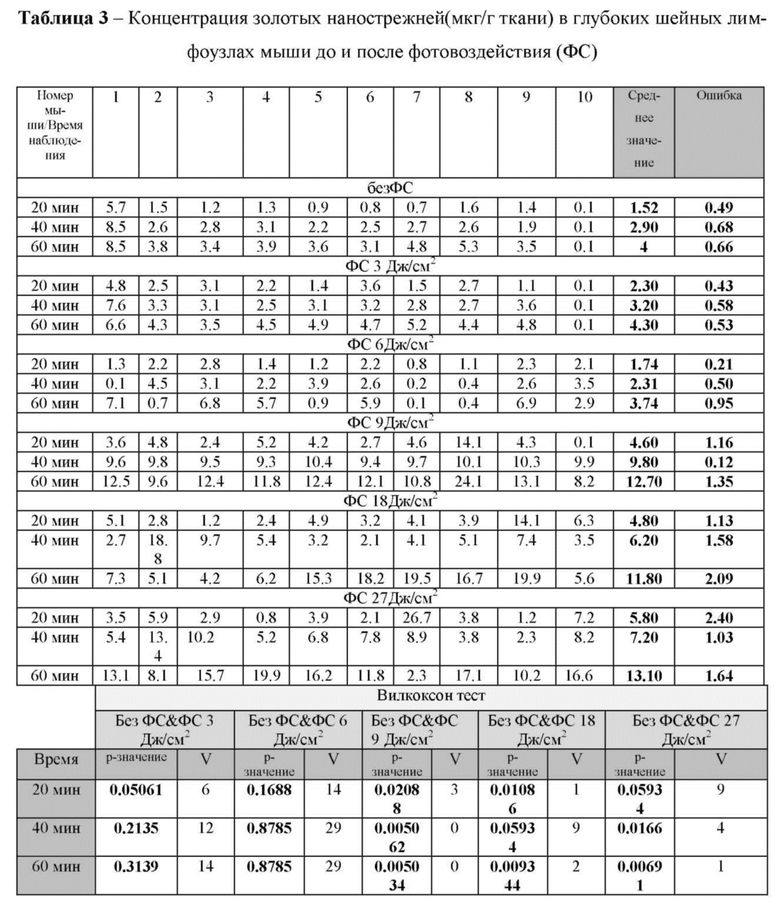
в таблице 3 - Концентрация золотых нанострежней (мкг/г ткани) в глубоких шейных лимфоузлах мыши до и после фотовоздействия (ФС);
в таблице 4 - Данные оптической когерентной томографии по скорости накопления золотых наностержней (усл. ед.) в глубоких шейных лимфоузлах мышей до и после иглоукалывания в зоны акупунктуры GB 20 и GV16;
в таблице 5 - Концентрация золотых нанострежней (мкг/г ткани) в глубоких шейных лимфоузлах мыши до и после иглоукалывания в зоны акупунктуры GB 20 и GV16.
Для достижения способа взрослые мыши C57BL/6 (25 гр.) подвергаются легкой газовой анестезии (2% изофлуран, 1 л/мин N2O/O2 - 70:30), после достижения достаточной глубины наркоза (проверяется по зрачковому рефлексу и отсутствия болевого ощущения при щипании хвоста пинцетом), сбривается шерсть в районе затылка и осуществляется введение игл акупунктуры (длина 10 мм и диаметр 0,25 мм; HanYi, Changchun, Китай) в зону GB20 справа и слева как показано на фиг. 1. GB20 расположена в месте встречи основания черепа и верхней части шеи, латеральнее сухожилий трапециевидной мышцы. В качестве группы сравнения была выбрана рядом располагающаяся зона акупунктуры GV16, которая локализуется на затылочно-заднем суставе атланта затылочного гребня. Иглы для акупунктуры вводятся на глубину 200 мкм, что контролируется 1/5 длины иглы. Иглы присутствуют в течение 10 мин в зоне акупунктуры.
После иглоукалывания в те же точки акупунктуры GB20 подают локальное фотовоздействие в течение 10 мин. Лазерное воздействие осуществляется на длине волны 1268 нм (LD-1267-FBG-350, Innolume, Германия) в дозе излучения (от 9 до 18 Дж/см2), что не превышает порог фотоповреждения и фотонагрева тканей шеи мыши. Оптимальную дозу фотовоздействия определяли в двух сериях экспериментов. В первой серии выявляли, какая доза фотовоздействия не будет вызывать повышения температуры на поверхности мозга, поскольку фотовоздействие проводиться на затылочной части головы. Повышение температуры в мозге даже на 0.5 °С приводит к немедленному изменению функций нейронов, а при достижении 1°С и выше - к серьезным нарушениям в передаче нервного импульса и активности ионных каналов (Hoffmann HM, Dionne VE. Temperature dependence of ion permeation at the endplate channel. J Gen Physiol 81, 687-703 (1983); Moser E, Mathiesen I, Andersen P. Association between brain temperature and dentate field potentials in exploring and swimming rats. Science 259, 1324-1326 (1993)).
С помощью термопары проводили измерение температуры на поверхности кожи мыши и на поверхности коры больших полушарий мозга через трепанационное окно. Дозы фотовоздействия были выбраны рандомно 3-6-9-18-27 Дж/см2. Таблица 1 демонстрирует, что низкие дозы фотоизлучения 3-6-9-18-28 Дж/см2 вызывали повышение температуры на поверхности мозга на 0.11-0.14-0.20-0.70-1.83 °С (n=10 в каждой групп, Вилкоксон тест), что, однако, не сопровождалось повышением температуры на поверхности коры больших полушарий мозга.
Во второй серии экспериментов изучали эффекты фотовоздействия в выбранных дозах 3-6-9-18-27 Дж/см2 на морфологические показатели тканей мозга. После фотовоздействия всех мышей умерщвляли внутрибрюшинной инъекцией летальной дозы кетамина и ксилазина (10 мкг/кг и 100 мкг/кг, соответственно). После этого мозг удаляли и фиксировали в 10% забуференном параформальдегиде. Образцы с фиксированным параформальдегидом помещали в парафин, делали срезы (4 мкм) и окрашивали гематоксилином и эозином. Гистологические срезы оценивали с помощью световой микроскопии с использованием цифровой системы анализа изображений Mikrovizor medical μVizo-103 (ЛОМО, Россия). Результаты гистологического анализа представлены на фиг. 2, где показано отсутствие изменений со стороны тканей мозга мышей после сеанса фотовоздействия в указанных дозах.
Для выяснения эффективной дозы фотовоздействия с целью активации лимфовыводящей функции были проведены эксперименты по выведению из цистерны магна золотых наностержней без и после фотовоздействия с дозами 3-6-9-18-27 Дж/см2. Эксперименты были выполнены с применением оптической когерентной томографии (ОСТ) и мониторинга в реальном режиме времени накопления золотых наностержней в глубоких шейных лимфоузлах, которые являются первой анатомической станцией вывода жидкостей мозга и растворенных в них веществ в периферическую лимфатическую систему (Louveau, A., Smirnov, I., Keyes, T. et al. Structural and functional features of central nervous system lymphatic vessels. Nature 523, 337-341 (2015). https://doi.org/10.1038/nature14432). Дополнительно, результаты подтверждали опытами ex vivo по определению содержания золотых наностержней в глубоких шейных лимфоузлах с применением атомно-абсорбционной спектроскопии (АСС).
Золотые наностержни применяли в качестве контрастных агентов, поскольку лимфатические сосуды прозрачные. Пигелированные золотые наностержни (размер: диаметр - 16±3 нм and длина - 92±17 нм) вводили в цистерну магна в объеме 5 мкл со скоростью 0.1 мкл/мин, концентрация Au 500 мкг/мл). Мониторинг накопления золотых наностержней в глубоких лимфатических узлах проводили в течение 1 часа после введения. В исследованиях использовали коммерческий спектральный оптический когерентный томограф Thorlabs GANYMEDE (центральная длина волны 930 нм, ширина спектра 150 нм, продольное разрешение 4.4 мкм в водной среде, максимальная глубина зондирования 2.7 мм). Объектив LSM02 применяли для достижения пространственного оптического разрешения в 13 мкм. Частота следования А-сканов томографа была равна 30 кГц. 2048 А-скана использовались для построения одного Б-скана для достижения необходимой плотности пространственной выборки. 150 Б-сканов были отсняты в одной и той же области объекта, затем, данный набор Б-сканов подвергался цифровой стабилизации, в качестве референсных участков использовались пустоты в лимфатическом узле. После стабилизации каждое изображение исследовали на предмет артефактов, вызванных движениями объекта. Изображения с ненадлежащим качеством исключали из анализа. Данная проблема возникала в связи с тем, что глубокий лимфатический узел не может был полностью изолирован от близлежащих органов и тканей, в связи с чем, любое движение или сокращение мышц приводило к существенному снижению качества ОКТ изображения. На фиг. 3 представлена установка ОСТ для мониторинга накопления золотых наностержней в глубоких шейных лимфатических узлах мыши.
Оставшиеся изображения усреднялись для достижения лучшего соотношения сигнал шум. Алгоритм линейной регрессии использован для нахождения линии тренда массива данных. Угол наклона данной линии был использован как параметр скорости аккумуляции. Все расчеты производились в линейной шкале интенсивности ОКТ изображений.
Золотые наностержни тиолированным полиэтиленгликолем получали путем опосредованного роста «зерен» в бинарной смеси поверхностно-активных веществ. Спектры экстинкции измеряли на спектрофотометре Specord 250 (Analytik, Jena, Germany). Изображения получали методом просвечивающей электронной микроскопии на просвечивающем электронном микроскопе Libra-120 (Carl Zeiss, Jena, Германия) на базе ЦКП «СИМБИОЗ» ИБФРМ РАН.
Содержание золотых наностержней в тканях головного мозга оценивали методом ААС с помощью спектрофотометра Dual Atomizer Zeeman AA iCE 3500 (Thermo Scientific Inc. США). Процесс подготовки образца ткани осуществлялся в автоматическом режиме с постоянным контролем температуры в микроволновой системе "MARS Xpress" (США). Для калибровки спектрометра использовался стандарт AAC (Fluke).
Результаты исследований представлены в таблицах 1 и 2, где видно, что дозы фотовоздействия 3-6 Дж/см2 не оказывали влияния на скорость выведения золотых нанострежней из цистерны магна. Дозы фотовоздействия 9-18-27 Дж/см2 сопровождались одинаковыми эффектами на выведение трейсера из оболочек мозга.
На основе полученных результатов была выбрана доза фотоизлучения 9 Дж/см2 в качестве эффективной дозы для дальнейших экспериментов, поскольку данная доза не сопровождалась повышением температуры на поверхности кожи головы мышей в отличие от доз 18-27 Дж/см2. Несмотря на тот факт, что ни одна из указанных доз фотовоздействия не приводила к повышению температуры на поверхности мозга, тем не менее, повышение температуры на коже с применением доз 18-27 Дж/см2 можно рассматривать как один из рисков, который может искажать полученные результаты за счет воздействия на систему крови и ее оксигенацию (Kaestner L, Juzeniene A, Moan J. Erythrocytes-the 'house elves' of photodynamic therapy. Photochemical & photobiological sciences: Official journal of the European Photochemistry Association and the European Society for Photobiology 3, 981-989 (2004)).
Для установления эффективности иглоукалывания в зоны акупунктуры GB20 в качестве контрольной точки были выбраны зоны акупунктуры GV16, расположенные в анатомической близости. Проводили исследования с применением ОСТ по изучению скорости выведения золотых нанострежней и их содержания в глубоких шейных лимфососудах с применением ААС. Результаты представлены в таблицах 4 и 5, где показано, что иглоукалывание в зоны акупунктуры GV16 в отличие от зоны акупунктуры GB20 не сопровождается активацией лимфовыводящей функции. Это связано с тем, что последние расположены рядом с затылочными лимфоузлами за счет чего осуществляется стимуляция лимфатических сосудов, в то время как зона акупунктуры GV16 располагается в 2 мм латеральнее от затылочных лимфоузлов мыши.
На финальном этапе проводили сравнение комбинированного и раздельного применения фотоизлучения (9 Дж/см2) и иглоукалывания в зонах акупунктуры GB20 на эффективность выведения контраста (Omniscan®) из мозга при его введении в правый боковой желудочек с применением сверхвысокопольного томографа BioSpec 117/16 USR (Bruker, Германия) - 11.7 Тесла. За 3 минуты до исследования мышей обездвиживали газовой смесью 2% изофлюрана (1л/мин N2O/O2 - 70:30) при помощи наркозного аппарата (The Univentor 400 Anaesthesia Unit, Univentor, Malta). Температуру животных поддерживали с помощью водного контура в томографическом столике-кроватке, имевшем температуру поверхности 30°С. Под нижнюю часть туловища помещали пневматический датчик дыхания (SA Instruments, Stony Brook, N.Y., USA), что позволяло контролировать глубину наркоза.
Распределение контраста по структурам мозга мыши (коре больших полушарий, боковому и четвертому желудочкам, зрительному нерву) исследовали с помощью Т1- взвешенных изображений, полученных с использованием метода RARE (Rapid Acquisition with Relaxation Enhancement). Параметры импульсной последовательности метода (TE = 10 мс, TR = 400 мс), параметры изображения (размер 1,8 × 1,8 см; матрица 256 × 256 точек; толщина среза 0.5 мм; размеры вокселя 75 μм х 75 μм х 0.5 мм; расстояние между срезами 0.5 мм; количество срезов 9; ориентация срезов - коронарная) общее время сканирования составляло 7 мин.
Накопление МРТ контраста выражали как отношение уровня МРТ-сигнала в исследуемых структурах к уровню МРТ-сигнала в референсе, которым служила микропробирка с фосфатным буфером (0.5 мл), помещенная вдоль головы мыши. Контролем служили МРТ данные, полученные от интактных мышей без введения контраста. Обработку МРТ сканов проводили в программе ImageJ.
Результаты исследований представлены на фиг. 4 и 5. Результаты показали, что по-отдельности фотовоздействие и иглоукалывание оказывают примерно одинаковое влияние на процесс выведения контраста Omniscan из правого бокового желудочка (2.00±0.16 против 0.15±0.14 усл.ед. после фотовоздействия, p<0.001; 2.24±0.18 против 0.15±0.14 усл.ед. после иглоукалывания, p<0.001, тест Манн-Уитни), в то время как комбинированное применение этих двух воздействий существенно увеличивает эффект (3.75±0.10 усл.ед. против 2.00±0.11 усл.ед. для фотовоздействия и 3.75±0.10 усл.ед. против 2.24±0.15 усл.ед. для иглоукалывания, p<0.001 для всех сравнений, тест Манн-Уитни).
Для дополнительного подтверждения результатов использовали флуоресцентную микроскопию для 2-часового исследования распределения FITC-декстрана 70 кДа (5 мкл, скорость введения 0.1 мкл/мин, 0,5% раствор, Sigma-Aldrich, Сент-Луис, США) по дорзальной и вентральной частям мозга, а также его выведения в глубокие шейные лимфоузлы после инъекции трейсера в правый боковой желудочек (AP=-0.5 мм; ML=-1.06 мм; DV=2.5 мм). Исследования проводили без и после комбинированного фотовоздействия и иглоукалывания в зонах акупунктуры GB20. Результаты представлены на фиг. 6 и 7, где видно, что комбинированное применение фотовоздействия и иглоукалывания сопровождается более интенсивным выведением FITC-декстрана из мозга по сравнению с контрольной группой (без какого-либо воздействия).
Таким образом, результаты in vivo и ex vivo экспериментов с применением разных методов мониторинга лимфовыводящей функции мозга свидетельствуют о том, что комбинированное фотовоздействие в дозе 9 Дж/см2 и иглоукалывание стимулирует лимфовыводящую функцию мозга, что сопровождается очищением его тканей от ненужных соединений.
Разработанный метод стимуляции лимфовыводящей функции мозга через фото- и игловоздействия в зонах акупунктуры GB20 имеет важное значение как для фундаментальной, так и прикладной медицины. Лимфатическая система оболочек мозга была переоткрыта и признана научной общественностью всего 7 лет назад (Louveau, A., Smirnov, I., Keyes, T. et al. Structural and functional features of central nervous system lymphatic vessels. Nature 523, 337-341 (2015). https://doi.org/10.1038/nature14432).
В тканях мозга присутствие лимфатических сосудов еще только обсуждается (O. Semyachkina-Glushkovskaya, I. Fedosov, N. Navolokin, A. Shirokov, G. Maslyakova, A. Bucharskaya, I. Blokhina, A. Terskov, A. Khorovodov, D. Postnov, J. Kurths. Pilot identification of the Live-1/Prox-1 expressing lymphatic vessels and lymphatic elements in the unaffected and affected human brain. bioRxiv 2021.09.05.458990; doi: https://doi.org/10.1101/2021.09.05.458990).
Изучение лимфовыводящих функций в мозге является пионерским направлением в нейробиологии. Появление нового инструмента воздействия на эти процессы будет являться информативной платформой для дальнейшего экспериментального изучения путей коммуникации между лимфососудами мозга, его оболочек, головы и шеи, что заложит основу развития инновационных решений для практической медицины. В частности, для управления процессами иммунитета в мозге, выведения из его тканей токсинов, что лежит в основе развития и прогрессирования целого ряда заболеваний центральной нервной системы. Это накопление бета-амилоида и тау протеина в тканях мозга, что приводит к развитию болезни Альцгеймера (Da Mesquita, S., Louveau, A., Vaccari, A. et al. Functional aspects of meningeal lymphatics in ageing and Alzheimer's disease. Nature 560, 185-191 (2018). https://doi.org/10.1038/s41586-018-0368-8); отложение альфа- синуклеина в тканях мозга, что лежит в основе развития болезни Паркинсона (Ding, XB., Wang, XX., Xia, DH. et al. Impaired meningeal lymphatic drainage in patients with idiopathic Parkinson's disease. Nat Med 27, 411-418 (2021). https://doi.org/10.1038/s41591-020-01198-1); токсичное воздействие крови на функции мозга после развития черепно-мозговых травм и внутримозговых геморрагий (Chen, J., Wang, L., Xu, H. et al. Meningeal lymphatics clear erythrocytes that arise from subarachnoid hemorrhage. Nat Commun 11, 3159 (2020). https://doi.org/10.1038/s41467-020-16851-z); развитие эдемы на фоне прогрессирования опухолей мозга (Hu, X., Deng, Q., Ma, L. et al. Meningeal lymphatic vessels regulate brain tumor drainage and immunity. Cell Res 30, 229-243 (2020). https://doi.org/10.1038/s41422-020-0287-8). Развитие методов стимуляции лимфатической системы мозга является приоритетным направлением в современной медицине, что позволит создать новые бренды для медицинских технологий будущего и повысить конкурентноспособность российского бизнеса на международной арене, а также качество медицинских услуг пациентам, нуждающихся в нейрореабилитации с нейродегенеративными заболеваниями и травмами мозга. Поскольку предложенный способ безопасен, прост в его выполнении, экономически выгоден, не требует фармакологического вмешательства, имеет историю применения в медицине, он может быть быстро внедрен в клиническую практику в качестве технологии для стимуляции выведения из тканей мозга токсинов, крови и других ненужных соединений.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ СТИМУЛЯЦИИ ОЧИСТИТЕЛЬНОЙ ФУНКЦИИ ЛИМФАТИЧЕСКОЙ СИСТЕМЫ МОЗГА | 2020 |
|
RU2766527C1 |
| Способ лечения пациентов с хронической лимфовенозной недостаточностью нижних конечностей | 2024 |
|
RU2823180C1 |
| СПОСОБ ОЗДОРОВЛЕНИЯ И ОМОЛОЖЕНИЯ КОЖНЫХ ПОКРОВОВ ГОЛОВЫ И ШЕИ ЧЕЛОВЕКА | 2000 |
|
RU2201193C2 |
| СПОСОБ ЛЕЧЕНИЯ РАКА ПОЛОСТИ РТА | 2019 |
|
RU2713530C2 |
| СПОСОБ ВИЗУАЛИЗАЦИИ ГЛИМФАТИЧЕСКОЙ СИСТЕМЫ МОЗГА МЕТОДОМ ОПТИЧЕСКОЙ КОГЕРЕНТНОЙ ТОМОГРАФИИ IN VIVO | 2019 |
|
RU2703393C1 |
| СПОСОБ МОДЕЛИРОВАНИЯ РАЗВИТИЯ МОЗГОВЫХ ГЕМОРРАГИЙ У ГИПЕРТЕНЗИВНЫХ МЫШЕЙ | 2017 |
|
RU2678798C1 |
| СПОСОБ УСИЛЕНИЯ ДЕЙСТВИЯ УЛЬТРАЗВУКА ПРИ ЛЕЧЕНИИ ГИПЕРТЕРМИЕЙ ОПУХОЛЕВЫХ ТКАНЕЙ ПУТЕМ ИСПОЛЬЗОВАНИЯ НАНОКЛАСТЕРОВ КРЕМНИЯ | 2010 |
|
RU2447915C1 |
| Способ интраоперационной фотодинамической терапии в комбинированном лечении первичного местно-распространенного рака языка | 2022 |
|
RU2797433C1 |
| СПОСОБ ЛЕЧЕНИЯ БОЛЬНЫХ С ОСТЕОХОНДРОЗОМ ШЕЙНОГО ИЛИ ПОЯСНИЧНОГО ОТДЕЛА ПОЗВОНОЧНИКА | 2004 |
|
RU2267337C1 |
| Способ сочетанного лечения детей с катаральными осложнениями нижних отделов респираторного тракта | 2019 |
|
RU2722716C1 |

Изобретение может быть использовано в экспериментальной медицине и предназначено для повышения лимфотока в центральной нервной системе (ЦНС) путем комбинированного воздействия иглоукалывания и фотовоздействия на зону акупунктуры Feng Chi (GB20) в затылочной области головы с целью активации лимфодренажных процессов головного мозга мышей. Проводят стимуляцию лимфодренажной функции мозга мыши за счет игловоздействия в зонах акупунктуры GB20 один раз с правой и левой сторон на глубине залегания затылочных лимфоузлов мыши (200 мкм) и фотовоздействия длиной волны 1267 нм в дозе 9 Дж/см2 данной зоны акупунктуры. Способ обеспечивает повышение степени активации лимфодренажной функции мозга. 7 ил., 5 табл.
Способ стимуляции повышения лимфотока в центральной нервной системе мышей, включающий неинвазийное фотовоздействие инфракрасным излучением с длиной волны 1267 нм, отличающийся тем, что дополнительно перед фотовоздействием осуществляют воздействие на зоны акупунктуры GB20 иглоукалыванием один раз с правой и левой сторон на глубине залегания затылочных лимфоузлов мыши, при этом фотовоздействие осуществляют в той же зоне акупунктуры в дозе 9 Дж/см2.
| СПОСОБ СТИМУЛЯЦИИ ОЧИСТИТЕЛЬНОЙ ФУНКЦИИ ЛИМФАТИЧЕСКОЙ СИСТЕМЫ МОЗГА | 2020 |
|
RU2766527C1 |
| US 20030109906 A1, 12.06.2003 | |||
| РАБОЧИЙ ОРГАН КРОТОДРЕНАЖНОЙ МАШИНЫ | 2015 |
|
RU2611800C1 |
| SEMYACHKINA‐GLUSHKOVSKAYA O | |||
| et al | |||
| Photostimulation of cerebral and peripheral lymphatic functions //Translational Biophotonics | |||
| Способ восстановления спиралей из вольфрамовой проволоки для электрических ламп накаливания, наполненных газом | 1924 |
|
SU2020A1 |
| Т | |||
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| N | |||
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
Авторы
Даты
2023-07-18—Публикация
2022-07-12—Подача