Изобретение относится к биотехнологии и генной инженерии, микробиологической промышленности и ветеринарии и представляет собой рекомбинантную плазмидную ДНК, обеспечивающую синтез в клетках дрожжей и секрецию в культуральную среду фрагмента белка VP2 вируса инфекционной бурсальной болезни птиц, взаимодействующих с антителами к белку VP2, и может быть использовано для создания тест-систем и конструирования субъединичных вакцин против инфекционной бурсальной болезни.
Инфекционная бурсальная болезнь птиц (ИББ) или болезнь Гамборо является одним из наиболее часто встречающихся и экономически значимых вирусных заболеваний птиц [1]. Возбудителем ИББ является РНК-содержащий вирус семейства Birnaviridae [2]. Вирус попадает в организм птицы через слизистые оболочки пищеварительного и респираторного трактов. Основной мишенью является иммунная система, в первую очередь поражается сумка Фабрициуса, содержащая лимфоидные фолликулы, в которых происходит рост и созревание предшественников В-лимфоцитов. Вследствие этого у зараженных птиц происходит угнетение иммунитета (иммуносупрессия) и возрастает вероятность заболеваний, вызванных условно патогенной микрофлорой их организма. Особую опасность возбудители ИББ представляют для молодых цыплят, относительную защиту которых могут обеспечить материнские антитела [3, 4].
Наиболее мощным и действенным способом предупреждения инфекционных заболеваний является вакцинация. Использование вакцин направлено на обеспечение защиты от клинической формы заболевания, снижение восприимчивости к инфекции и уменьшение возможных последствий заболевания. Вакцинация сельскохозяйственных животных имеет огромное значение не только для сохранения их поголовья, но и для здоровья человека. Чрезмерное использование антибиотиков способствовало появлению микроорганизмов с множественной лекарственной устойчивостью, которые быстро распространяются с продуктами питания и уже становятся серьезной угрозой не только для животноводства и птицеводства, но и для населения. Для эффективной профилактики и контроля распространения болезней животных могут быть использованы различные вакцины и стратегии их применения. Снижение восприимчивости к инфекции и уменьшение возможных последствий заболевания оказывают эффект на уровне всей популяции вакцинированных животных.
Ветеринарные вакцины не только должны обеспечивать индукцию быстрого и продолжительного иммунного ответа для защиты животных-хозяев от инфекционных заболеваний и предотвращения распространения таких заболеваний за счет горизонтального переноса возбудителя внутри популяции, но должны быть достаточно стабильными и простыми в применении, а также экономически выгодными.
Традиционно в птицеводстве используют живые аттенуированные вирусные и/или инактивированные вирусные вакцины. Основой живых вакцин являются аттенуированные штаммы возбудителя, у которых отсутствует или подавлена вирулентность. Эти вакцины достаточно просты в применении, отличаются высокой эффективностью, обеспечивают быстрый иммунный ответ и длительный иммунитет, по напряженности подобный иммунитету, возникающему после перенесенного заболевания. Существенным недостатком живых вакцин является вероятность возврата аттенуированного штамма к вирулентности вследствие рекомбинации с природными штаммами.
Достижения в области иммунологии, молекулярной биологии, генетической инженерии, обратной генетики способствовали разработке новых технологий получения вакцин с повышенной эффективностью и безопасностью. Среди вакцин нового поколения все большее внимание привлекают субъединичные вакцины [5].
Основу субъединичной вакцины составляет иммуногенный белок возбудителя заболевания или фрагменты этого белка, способные индуцировать иммунный ответ. Такая вакцина не содержит дополнительных балластных белков, липополисахаридов, токсинов патогена, которые могут вызвать нежелательные побочные реакции при вакцинации. Для разработки субъединичных вакцин необходимо идентифицировать белки возбудителя, которые участвуют в патогенезе заболевания, определить уровень синтеза нейтрализующих антител в ответ на тот или иной белок и оценить перспективу использования конкретного иммуногенного белка в качестве вакцины.
Иммуногенные белки, необходимые для создания субъединичной вакцины, могут быть выделены из патогенного организма, для получения отдельных фрагментов (эпитопов) этих белков можно использовать химический синтез. Однако эти подходы не позволяют получить белки в количествах, необходимых для их использования в качестве вакцинных препаратов.
Эта проблема может быть решена при помощи гетерологичного синтеза. Для продукции гетерологичных белков можно использовать различные организмы как прокариотические (бактерии), так и эукариотические (дрожжи, растения, клетки насекомых и млекопитающих).
Достоинствами дрожжевых систем экспрессии является относительная простота работы, сравнимая с бактериальными системами экспрессии, а также возможность осуществления посттрансляционной модификации белков, характерной для эукариотических организмов [6]. Использование стандартных питательных сред и возможность выращивания штаммов-продуцентов в строго заданных условиях позволяют выполнять GLP (Good Laboratory Practice) и GMP (Good Manufacturing Practice) требования при производстве гетерологичных белков. Длительный опыт использования дрожжей, свидетельствующий об их непатогенности, позволил присвоить им статус GRAS [7]. В настоящее время для продукции чужеродных белков используют дрожжи Saccharomyces cerevisiae, Kluyveromyces lactis, Yarrowia lipolytica, Hansenula polymorpha и Komugataella pastoris (Pichia pastoris) [8]. Дрожжи K. pastoris оказались наиболее эффективными продуцентами белков вирусов, бактерий, грибов, простейших, растений, беспозвоночных и позвоночных животных и человека. Достоинствами этих дрожжей является наличие сильного строго регулируемого промотора гена AOX1, а также отсутствие иммуногенных альфа-1,3-маннозных связей в составе гликопротеинов [9].
В качестве прототипа можно рассматривать патент RU2630620C2.
Прототип №1. В указанном патенте для продукции белка VP2 вируса ИББ в качестве организма-продуцента применяют дрожжи Kluyveromyces lactis. Для культивирования дрожжей используют среды относительно простого состава, для них разработаны способы повышения уровня продукции и секреции рекомбинантных белков [10].
Недостатком этой системы экспрессии является то, что активность регулируемого промотора LAC4, используемого для экспрессии гена VP2, не полностью репрессирована в отсутствие своего индуктора - лактозы. Это приводит к значительной фоновой экспрессии целевого гена и синтезу целевого белка, что может отрицательно сказываться на жизнеспособности штамма-продуцента [11]. В указанном патенте заявлена продукция полноразмерного белка VP2, который, как известно, в цитоплазме клеток дрожжей образует высокомолекулярные агрегаты [12]. Кроме того, в указанном патенте термоинактивированные клетки дрожжей штамма-продуцента белка VP2 использовали в качестве вакцины и продемонстрировали меньшую эффективность при пероральном применении. Это очевидно обусловлено тем, что в пищеварительном тракте птиц клеточные стенки дрожжей перевариваются медленно, не обеспечивая высвобождения достаточное количество антигена [12].
Заявленное изобретение свободно от указанных недостатков за счет того, что в качестве продуцента используются дрожжи Komagataella pastoris, экспрессия гена VP2 находится под контролем сильного промотора гена АОХ1, который активен только в присутствии индуктора - метанола. Синтез фрагмента белка VP2, включающего вариабельный участок (от 206 до 350 аминокислоты), который входит в состав эпитопов, нейтрализуемых моноклональными антителами, позволит избежать образования высокомолекулярных агрегатов целевого белка [13]. Секреция синтезированного фрагмента белка VP2 на поверхность клетки дрожжей и в культуральную жидкость обеспечит возможность перорального применения вакцины против ИББ на основе полученного штамма-продуцента.
Целью предлагаемого объекта изобретения является создание рекомбинантной плазмидной ДНК, обеспечивающей синтез фрагмента белка VP2 вируса инфекционной бурсальной болезни птиц, штамма дрожжей Komagataella pastoris - синтезирующего и секретирующего фрагмент белка VP2, взаимодействующие с антителами к белку VP2.
Технический результат заключается в создании рекомбинантной плазмидной ДНК, обеспечивающей синтез фрагмента белка VP2 вируса инфекционной бурсальной болезни птиц, штамма дрожжей Komagataella pastoris - синтезирующего и секретирующего фрагмент белка VP2 на поверхность клетки дрожжей и в культуральную жидкость, который может быть использован для создания тест-систем и конструирования субъединичных вакцин против инфекционной бурсальной болезни птиц.
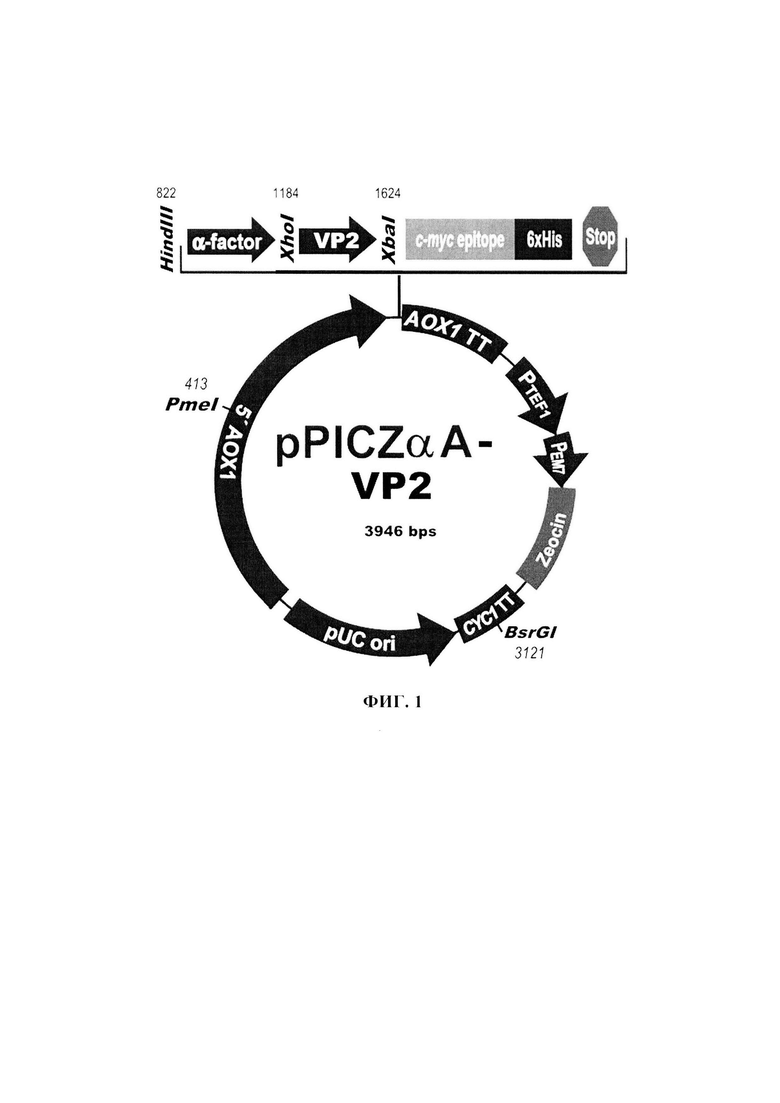
Плазмидная ДНК pPICZα-VP2, обеспечивающая синтез фрагмента белка VP2 трансформированными ею клетками дрожжей, состоит из следующих элементов:
- XhoI-XbaI - фрагмент плазмидной ДНК дрожжевого вектора pPICZαB размером 3 512 п.о. (из которого удалена область сайта множественного клонирования размером 25 п. о. между сайтами распознавания рестриктаз XhoI и XbaI), включающий ген устойчивости к зеоцину, бактериальную область инициации репликации; фрагмент 5'-некодирующей области дрожжевого гена АОХ1 размером 940 п.о., содержащий область, обеспечивающую активацию транскрипции этого гена в присутствии метанола в качестве источника углерода в культуральной среде; препрообласть гена МFальфа фактора дрожжей Saccharomyces cerevisiae размером 247 п.о., обеспечивающую секрецию рекомбинантного белка на поверхность клетки дрожжей и в культуральную жидкость; фрагмент гена АОХ1 размером 342 п.о., содержащий область терминации транскрипции этого гена;
- XhoI-XbaI фрагмент размером 434 п.о., содержащий фрагмент кодирующей части гена белка VP2;
Схема плазмидной ДНК pPICZα-VP2 изображена на Фиг. 1, где XhoI и XbaI -сайты распознавания соответствующих рестриктаз. Общий размер плазмиды pPICZα-VP2 - 3946 п.о.
Для достижения цели используют следующий способ конструирования плазмиды, обеспечивающей синтез фрагмента белка VP2 в клетках дрожжей.
Из плазмиды pPICZαB (Invitrogen) с помощью ферментов рестрикции XbaI и XhoI вырезают фрагмент сайта множественного клонирования размером 25 п. о., после чего плазмиду дефосфорилируют. Вставку - фрагмент кодирующей части гена белка VP2 размером 434 п.о. (SEQ ID NO: 1) - получают путем обработки ферментами рестрикции XbaI и XhoI промежуточного вектора pAL2T-VP2, сконструированного ранее путем лигирования фрагмента гена белка VP2, полученного методом полимеразной цепной реакции с обратной транскрипцией, с линеаризованным вектором pAL2T (Евроген). Полученную вставку лигируют с дефосфорилированной плазмидой pPICZαB.
Полученной лигазной смесью трансформируют клетки штамма XL1-Blue (Евроген), с последующим высеванием на низкосолевую среду LB с добавлением зеоцина. С помощью рестрикционного и ПЦР анализа доказывают наличие плазмиды pPICZα-VP2 у трансформантов.
После интеграции указанной последовательности в плазмиду pPICZαB открытая рамка считывания содержит: сигнал секреции МFальфа фактора дрожжей Saccharomyces cerevisiae, открытую рамку считывания фрагмента гена белка VP2, а также последовательностей эпитопа с-Мус и метки Hisx6 для очистки итогового рекомбинантного белка методом аффинной хроматографии (SEQ ID NO: 2).
Выбор конструкции плазмиды для продукции фрагмента белка VP2 обусловлен следующими причинами. Плазмида pPICZα-VP2 (SEQ ID NO: 3) получена на основе дрожжевого интегративного вектора pPICZαB. В результате трансформации линеаризованной плазмидой и последующей гомологичной рекомбинации происходит встраивание экспрессионной кассеты в хромосому дрожжей Komagataella pastoris, что обеспечивает стабильное поддержание клонированного фрагмента гена белка VP2. В состав плазмиды входит ген устойчивости к зеоцину, что позволяет селективно отбирать бактериальных и дрожжевых трансформантов на селективной среде с добавлением зеоцина.
Экспрессия фрагмента гена белка VP2 в составе плазмиды pPICZα-VP2 находится под контролем промотора гена АОХ1, содержащим области, обеспечивающие активацию транскрипции в присутствии метанола в культуральной среде, а также область инициации транскрипции. Промотор гена АОХ1 относится к числу наиболее сильных дрожжевых промоторов. Уровень экспрессии генов, находящихся под контролем АОХ1 промотора, эффективно регулируется источниками углерода. Транскрипция гена АОХ1 полностью блокирована при выращивании дрожжей на среде с глюкозой, на среде с глицерином наблюдается только базальный уровень экспрессии гена. Использование метанола в качестве единственного источника углерода значительно усиливает экспрессию гена АОХ1 и, следовательно, генов, находящихся под контролем АОХ1 промотора. Это позволяет регулировать синтез фрагмента белка VP2 в клетках дрожжей. Регулируемая экспрессия клонированного гена позволяет существенно снизить метаболическую нагрузку на клетку дрожжей.
В качестве продуцента фрагмента белка VP2 используют штамм Y-3489-VP2. Штамм Y-3489-VP2 получен при трансформации штамма дрожжей Komagataella pastoris Y-3489 (wt) (ВКПМ) плазмидой pPICZα-VP2. Штамм Y-3489 не несет гена устойчивости к зеоцину, что позволяет селективно отбирать трансформантов, несущих плазмиду pPICZα-VP2.
Штамм дрожжей Komagataella pastoris Y-3489-VP2 характеризуется следующими признаками.
Культурально-морфологические признаки.
На полной дрожжевой среде образует кремоватые колонии, гладкие, блестящие, пастообразной консистенции, клетки от круглых до овальных (2,0-4,0)×(2,2-5,8) мкм. На жидкой среде образует осадок и пленку. Культура имеет характерный запах метилотрофных дрожжей.
Клетки хорошо растут на полной дрожжевой среде YEPD: 2% пептона, 1% дрожжевого экстракта, 2% глюкозы или 1% глицерина.
Кроме того, клетки хорошо растут на минеральной среде SC: 1,34% Yeast Nitrogen Base («Difco», США), 2% глюкозы (1% глицерина, 0,5% метанола), а также на других синтетических средах для дрожжей.
Физиолого-биохимические признаки.
Клетки растут в пределах от 4 до 35°С. Оптимальной температурой выращивания является 30°С. При росте в аэробных условиях клетки незначительно защелачивают среду. Оптимум рН для роста составляет 4,5-6,5.
В качестве источника углерода клетки могут использовать многие простые соединения, такие как: глюкоза, глицерин, метанол.
В качестве источника азота клетки могут использовать минеральные соли в аммонийной форме, аминокислоты, мочевину.
Клетки способны к аэробному росту.
Существенными признаками штамма является устойчивость к зеоцину.
Способ получения плазмиды pPICZα-VP2 проиллюстрирован следующим примером.
ПРИМЕР 1.
Нуклеотидная последовательность фрагмента гена белка VP2 (SEQ ID NO: 4) -кДНК - получена при помощи обратной транскрипции на матрице РНК вируса ИББ. Для амплификации кДНК указанного фрагмента гена белка VP2 вируса ИББ в ПЦР использовали следующие праймеры (5'->3'): прямой праймер, содержащий сайт рестрикции XhoI (SEQ ID NO: 5), и обратный праймер, содержащий сайт рестрикции XbaI (SEQ ID NO: 6).
Прямой праймер также содержал последовательность узнавания протеазой Kex2 (SEQ ID NO: 7) для обеспечения правильного удаления сигнала секреции МFальфа фактора дрожжей Saccharomyces cerevisiae.
Режим реакции ПЦР:
1 цикл: 95°С - 3 мин. 30 циклов:
95°С - 30 сек.
55°С - 30 сек.
72°С - 60 сек.
1 цикл: 72°С - 3 мин.
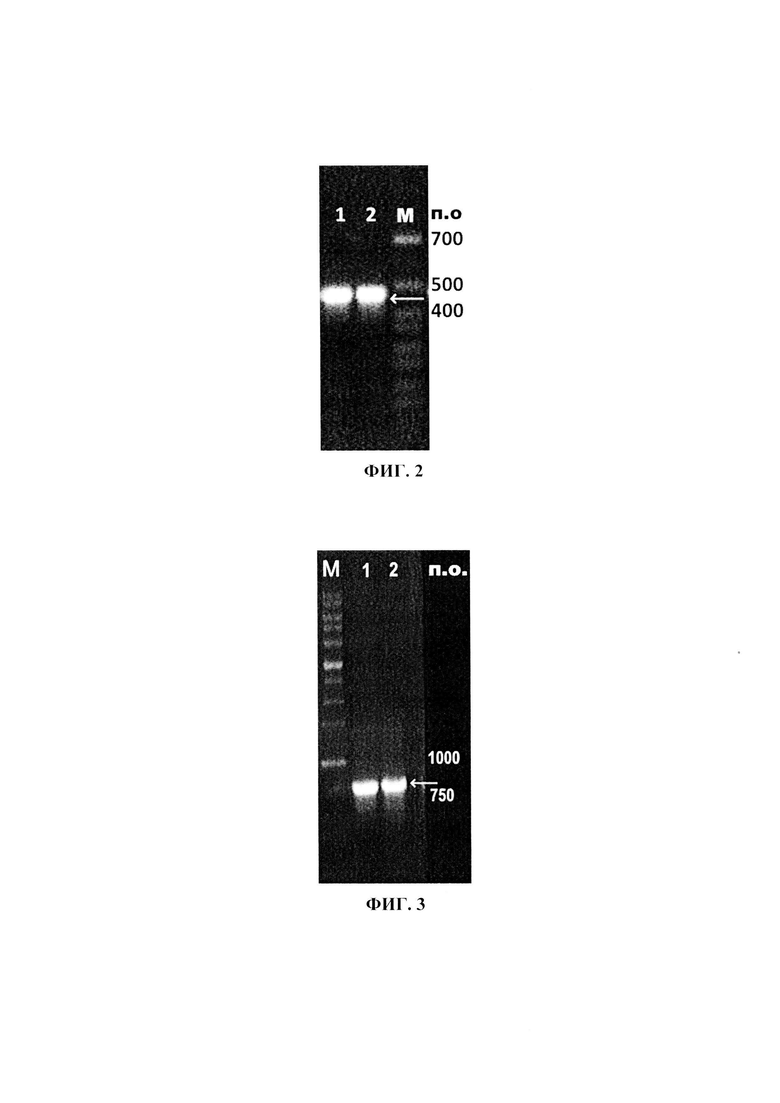
Далее проводили электрофорез продукта ПЦР реакции в 0,7% агарозном геле в буфере ТВЕ (0,1 М трис-боратный буфер, рН 8,3, содержащий 1 мМ ЭДТА). Для контроля размера амплифицированного фрагмента ДНК при электрофорезе использован молекулярный маркер 1 kb NL001 (Евроген). Результат проверки - электрофореграмма продуктов ПЦР при амплификации фрагмента гена белка VP2 вируса ИББ - представлен на Фиг. 2, где в 1, 2 - проба ПЦР продукта, М - маркер молекулярной массы. Размер ПЦР продукта соответствует теоретически ожидаемому - 458 п.о.
Выделение ПЦР фрагмента гена белка VP2 вируса ИББ из агарозного геля проводят по методике, разработанной фирмой QIAGEN. Полоску геля с фрагментом ДНК помещают в пробирку и добавляют раствор QX1 (300 мкл на 100 мг геля). Пробу нагревают до 50°С, добавляют реактив QIAEX (10 мкл на 5 мкг ДНК) и инкубируют при температуре 50°С в течение 10 минут, периодически перемешивая. Далее центрифугируют 30 секунд при 15000 об/мин, супернатант отбрасывают, осадок дважды экстрагируют растворами QX2 и QX3, удаляют супернатант центрифугированием при 15000 об/мин в течение 30 секунд. Осадок высушивают на воздухе, растворяют в 20 мкл буфера ТЕ (10 мМ трис-хлоридный буфер, рН8,0, содержащий 1 мМ ЭДТА), центрифугируют 30 секунд при 15000 об/мин, супернатант переносят в новую пробирку.
Выделенный ПЦР фрагмент гена белка VP2 вируса ИББ лигируют с линеаризованным вектором pAL2T (Евроген). Для этого 10 мкл реакционной смеси (2 мкл 5Х Quick ligation буфер, 1 мкл pAL2-T вектор (50 нг/мкл), 1 мкл Quick-TA Т4 ДНК лигаза, 3 мкл ПЦР продукт (50 нг/мкл), 3 мкл вода) инкубируют в течение 30 минут при 22°С. Продуктом лигирования является плазмида pAL2T-VP2.
Полученную лигазную смесь используют для трансформации компетентных бактерий Escherichia coli XL 1-Blue recA1 endA1 gyrA96 thi-1 hsdR17 supE44 relA1 lac [F'proAB lacIqZΔM15 Tn10 (Tetr)] (Евроген). Для этого клетки Escherichia coli выращивают в 100 мл среды LB при 37°С до достижения культурой густоты клеточной суспензии, соответствующей 0,4-0,6 ед. оптической плотности при длине волны 550 нм. Клеточную суспензию охлаждают в ледяной бане, центрифугируют при 5000 об/мин в течение 10 минут при 4°С. Клетки суспендируют в 100 мл 10 мМ хлористого натрия, собирают центрифугированием в тех же условиях. Далее клетки суспендируют в 50 мл 75 мМ хлористого кальция, выдерживают в ледяной бане в течение 40 минут, осаждают центрифугированием в тех же условиях и суспендируют в 1 мл 75 мМ хлористого кальция. К суспензии компетентных клеток добавляют глицерин до конечной концентрации 15%, разделяют на аликвоты и хранят при -70°С. Перед трансформацией суспензию компетентных клеток размораживают в ледяной бане, добавляют лигазную смесь и инкубируют в ледяной бане в течение 40 минут.
К 200 мкл компетентных клеток добавляют 1-2 мкл лигазной смеси и инкубируют 15-20 минут во льду. Далее проводят тепловой шок в течение 60-90 секунд с возвращением клеток на 2 минуты в лед. После добавления среды LB (1% пептона, 0,5% дрожжевого экстракта, 1% хлористого натрия) проводят инкубацию в течение одного часа. Аликвоту суспензии клеток в 100 мкл высевают на твердую среду LB с ампициллином. Колонии трансформантов отбирают после инкубирования в течение 12 часов при температуре 37°С.
Клетки бактерий Escherichia coli, содержащие плазмиду pAL2T-VP2 выращивают при 37°С в течение ночи в 1 л питательной среды LB (1% пептона, 0,5% дрожжевого экстракта, 1% хлористого натрия), содержащей ампициллин в концентрации 50 мг/л. Клетки собирают центрифугированием при 5000 об/мин в течение 10 минут при 4°С, суспендируют в 20 мл 25 мМ трис-хлоридного буфера (рН 8,0), содержащего 10 мМ ЭДТА и 50 мМ глюкозы, добавляют 30 мг лизоцима и инкубируют 10 минут при комнатной температуре. Далее добавляют 40 мл 0,2 М гидроокиси натрия, содержащей 1% додецилсульфата натрия, осторожно перемешивают и инкубируют в течение 10 минут при 4°С. Раствор нейтрализуют добавлением 30 мл 3 М ацетата натрия (рН 5,0) и выдерживают в течение 10 минут при 4°С. После этого центрифугируют при 14000 об/мин в течение 40 минут при 4°С. К супернатанту добавляют 0,6 объема изопропилового спирта, выдерживают 20 минут при комнатной температуре и центрифугируют при 14000 об/мин в течение 20 минут при 20°С. Полученный осадок промывают 70% этиловым спиртом, высушивают в вакууме и растворяют в 4 мл дистиллированной воды. Далее добавляют 4,2 г хлористого цезия и 0,36 мл раствора бромистого этидия (10 мг/мл). Полученный раствор выдерживают в течение 1 часа при 4°С, затем центрифугируют при 15000 об/мин в течение 15 минут. Далее супернатант центрифугируют при 70000 об/мин в течение 16 часов в центрифуге TL100 («Beckman»). После центрифугирования отбирают полосу плазмидной ДНК (нижнюю из двух флюоресцирующих в ультрафиолетовом свете полос), дважды экстрагируют бромистый этидий равным объемом изоамилового спирта, разбавляют в два раза дистиллированной водой и осаждают плазмидную ДНК двумя объемами этилового спирта и 1/15 объема 3 М ацетата натрия (рН 5,0). Осадок собирают центрифугированием при 10000 об/мин в течение 10 минут, промывают 70% этиловым спиртом и растворяют в 0,5-1 мл буфера ТЕ (10 мМ трис-хлоридный буфер, рН8,0, содержащий 1 мМ ЭДТА).
Концентрацию плазмидной ДНК определяют по поглощению раствора при длине волны 260 нм. Чистоту препарата контролируют при помощи электрофореза в 0,7% агарозном геле в буфере ТВЕ (0,1 М трис-боратный буфер, рН 8,3, содержащий 1 мМ ЭДТА).
Гидролиз плазмиды pAL2T-VP2 рестриктазами XbaI и XhoI проводят в 10 мМ трисхлоридном буфере (рН 8,0), содержащем 100 мМ хлористого калия, 5 мМ хлористого магния, 0,02% тритона Х-100 и 0,1 мг/мл бычьего сывороточного альбумина. К 5 мкг плазмидной ДНК в объеме 20 мкл добавляют по 5 ед. каждой рестриктазы, после чего пробу инкубируют в течение 2 часов при 37°С. Далее проводят разделение продуктов рестрикции методом электрофореза в агарозном геле и проводят выделение фрагмента, соответствующего вставке фрагмента гена белка VP2 вируса ИББ. Выделение фрагмента вставки ДНК из агарозного геля проводят по указанной выше методике QIAGEN.
Аналогично проводят обработку плазмиды pPICZαB рестриктазами XbaI и XhoI. Далее продукт рестрикции дефосфорилируют с помощью щелочной фосфатазы AnP (NEB). Для этого на 20 мкл реакционной смеси добавляют: 2 мкл десятикратного буфера, 1-3 мкл плазмидной ДНК (50 нг/мкл), деионизованной воды - до 20 мкл, 1 мкл (5 ед.) щелочной фосфатазы. Инкубируют в течение 30 минут при 37°С. Производят остановку реакции нагревом до 80°С в течение 2 минут. Очищают ДНК гель-фильтрацией на спин-колонках с последующим высаждением 96%-ным этанолом для удаления фосфатазы.
Для получения плазмиды pPICZα-VP2 проводят лигирование 1 мкг дефосфорилированной линеаризованной плазмиды pPICZαB, гидролизованной рестриктазами XbaI и XhoI, и 3 мкг вставки целевого гена, гидролизованного рестриктазами XbaI и XhoI, в 10 мкл 70 мМ трис-хлоридного буфера (рН 7,6), содержащего 5 мМ дитиотреитола, 5 мМ хлористого магния, 1 мМ АТФ, добавляя 10 ед. ДНК-лигазы фага Т4 и инкубируя при 14°С в течение ночи.
Полученной лигазной смесью трансформируют компетентные клетки штамма Escherichia coli XL1-Blue recA1 endA1 gyrA96 thi-1 hsdR17 supE44 relA1 lac [F'proAB lacIqZΔM15 Tn10 (Tetr)] (Евроген), полученные по методике, использованной при трансформации плазмидой pAL2T-VP2. Перед трансформацией суспензию компетентных клеток размораживают в ледяной бане, добавляют лигазную смесь и инкубируют в ледяной бане в течение 40 минут. Далее клетки подвергают действию теплового шока при 42°С в течение 2 минут, после чего инкубируют в 1,5 мл среды LB при 37°С в течение 1 часа. Клетки собирают центрифугированием при 5000 об/мин в течение 10 минут и высевают на чашки Петри с низкосолевой средой LB, содержащей, 0,5% NaCl, 2% агара и 25 мкг/мл зеоцина. Чашки инкубируют при 37°С в течение 12-16 часов.
Из выросших отдельных клонов трансформантов выделяют плазмидную ДНК при помощи методики, использованной для получения плазмиды pAL2T-VP2, за исключением того, что клетки Escherichia coli выращивают в 10 мл LB, и, соответственно, объемы всех растворов уменьшают в 100 раз, и проводят проверку методом ПЦР наличия вставки целевого гена. Для этого используют праймеры к 5'-AOX1 промотору и 3'-VP2 в составе плазмиды: (5'->3'): прямой праймер, соответствующий 5'-AOX1 промотору (SEQ ID NO: 8), и обратный праймер, соответствующий 3'- участку фрагмента гена белка VP2 (SEQ ID NO: 6). Результат проверки - электрофореграмма продуктов ПЦР на матрице плазмиды pPICZα-VP2 - представлен на Фиг. 3, где 1, 2 - пробы продуктов ПЦР, М - маркер молекулярной массы. Размер ПЦР продукта соответствует теоретически ожидаемому - 781 п.о.
Режим реакции ПЦР: 1 цикл: 95°С - 3 мин. 30 циклов:
95°С - 30 сек.
55°С - 30 сек.
72°С - 90 сек.
1 цикл: 72°С - 2 мин.
Из выявленного таким образом клона препаративно выделяют плазмиду pPICZα-VP2, так же, как описано для плазмиды pAL2T-VP2, и гидролизуют рестриктазой Pf123II в однократном буфере (66 мМ ацетат калия, 33 мМ Трис-ацетат, 10 мМ ацетат магния, 100 мкг/мл бычий сывороточный альбумин, рН 7.9 при 37°С) (Thermo Scientific). Pf123II -фрагмент плазмиды pPICZα-VP2, размером 3946 п. о, выделяют по описанной выше методике фирмы QIAGEN, исключая стадию нагревания и используют его для трансформации клеток дрожжей, как описано в примере 2.
ПРИМЕР 2.
Для получения штамма дрожжей Komagataella pastoris Y-3489-VP2 - продуцента секреторного фрагмента белка VP2 вируса ИББ, клетки дрожжей штамма Komagataella pastoris Y-3489 (wt) трансформируют плазмидой pPICZα-VP2.
Клетки дрожжей выращивают в 100 мл среды YEPD при 30°С до достижения культурой оптической плотности, соответствующей 2-4 ед поглощения при длине волны 600 нм. Клетки дважды промывают стерильной водой, после чего суспендируют в 0,3 мл 100 мМ раствора ацетата лития и инкубируют при 30°С в течение 30 минут. К 50 мкл полученной суспензии клеток добавляют 0,1-1 мкг плазмидной ДНК, 50 мкг ДНК спермы лосося, предварительно денатурированной нагреванием (10 минут при 100°С) и 0,3 мл раствора 100 мМ ацетата лития, содержащего 40% полиэтиленгликоля 4000. Далее пробу инкубируют 30 минут при 30°С и 20 минут при 42°С, помещают на 15 секунд в ледяную баню и центрифугируют 10 секунд при 10000 об/мин. Клетки суспендируют в 1 мл стерильной воды и высевают на твердую полную дрожжевую среду YPD (1% дрожжевого экстракта, 2% пептона, 2% глюкозы) с содержанием 100 мкг/ мл зеоцина. Клоны трансформантов вырастают через 2-3 суток.
Для анализа продукции фрагмента белка VP2 вируса ИББ клетками трансформантов их выращивают при 30°С в 100 мл жидкой среды BMGY (2% пептона, 1% дрожжевого экстракта, 1% глицерина, 10 мл 1 М калий-фосфатного буфера, рН 6,0, 1,34% Yeast Nitrogen Base («Difco», США) до стационарной фазы роста в течение 2 суток. Клетки собирают центрифугированием при 5000 об/мин в течение 10 минут, супернатант сливают, и переносят всю биомассу в 100 мл жидкой среды BMMY (2% пептона, 1% дрожжевого экстракта, 0,5% метанола, 10 мл 1 М калий-фосфатного буфера, рН 6,0, 1,34% Yeast Nitrogen Base («Difco», США) для индукции экспрессии гена VP2 вируса ИББ. Индукцию проводят при 30° в течение 4 суток. По окончании индукции отбирают пробы культуральной жидкости, из которых белок концентрируют осаждением 80% раствором сульфата аммония. Разделение белков проводят в 15% полиакриламидном геле в денатурирующих условиях (электродный буфер: 25 мМ трис, 192 мМ глицин, 0,1% додецилсульфат натрия, рН 8,3; буфер для геля: 375 мМ трис-хлоридный буфер, рН 8,8).
Параллельно проводят разделение белков культуральной жидкости контрольного штамма (штамм дикого типа Y-3489), выращенного в идентичных условиях. В качестве стандартов молекулярной массы используют маркеры PageRuler Prestained Protein Ladder, 10 to 180 kDa (Thermo Fisher Scientific).
По окончании электрофореза белки ренатурируют, выдерживая гели 15 минут в 10 мМ трис-хлоридном буфере (рН 7,5), содержащем 4 М мочевину, 20 мМ ЭДТА, и переносят на нитроцеллюлозную мембрану в 25 мМ трис-192 мМ глициновом буфере (рН 8,3), содержащем 20% метилового спирта, при 30-40 В, в течение 1,5 часов. Далее мембрану выдерживают в буфере TBST (10 мМ трис-хлоридный буфер (рН8,0), содержащего 150 мМ хлористого натрия, 0,05% твин-20, 1% бычьего сывороточного альбумина) в течение 2 часов при 37°С. Затем помещают мембрану в тот же буфер, содержащий разведенные в 500 раз мышиные моноклональные антитела к с-Мус эпитопу, меченые биотином («NatuTec» Германия), и инкубируют 2 часа при 37°С. Далее трижды промывают мембрану буфером TBST и инкубируют 1 час при 37°C с разбавленным в 3000 раз конъюгатом стрептавидина со щелочной фосфатазой («Силекс М», Москва). После отмывки мембраны буфером PBST (58 мМ двузамещенного фосфата натрия, 17 мМ однозамещенного фосфата натрия, 68 мМ хлористого натрия, 0,1% твин-20) добавляют раствор субстратов для щелочной фосфатазы 0,56 мМ BCIP (5-бром-4-хлор-3-индолилфосфата р-толуидиновая соль), 0,48 мМ NBT (нитротетрозолиум синий) в 10 мМ трис-хлоридном буфере (рН 9,2), содержащем 59,3 мМ хлористого магния.
Параллельно окрашивают гели 0,15% раствором кумасси G250 в 25% изо-пропаноле и 10% уксусной кислоте и отмывают в 10% уксусной кислоте.
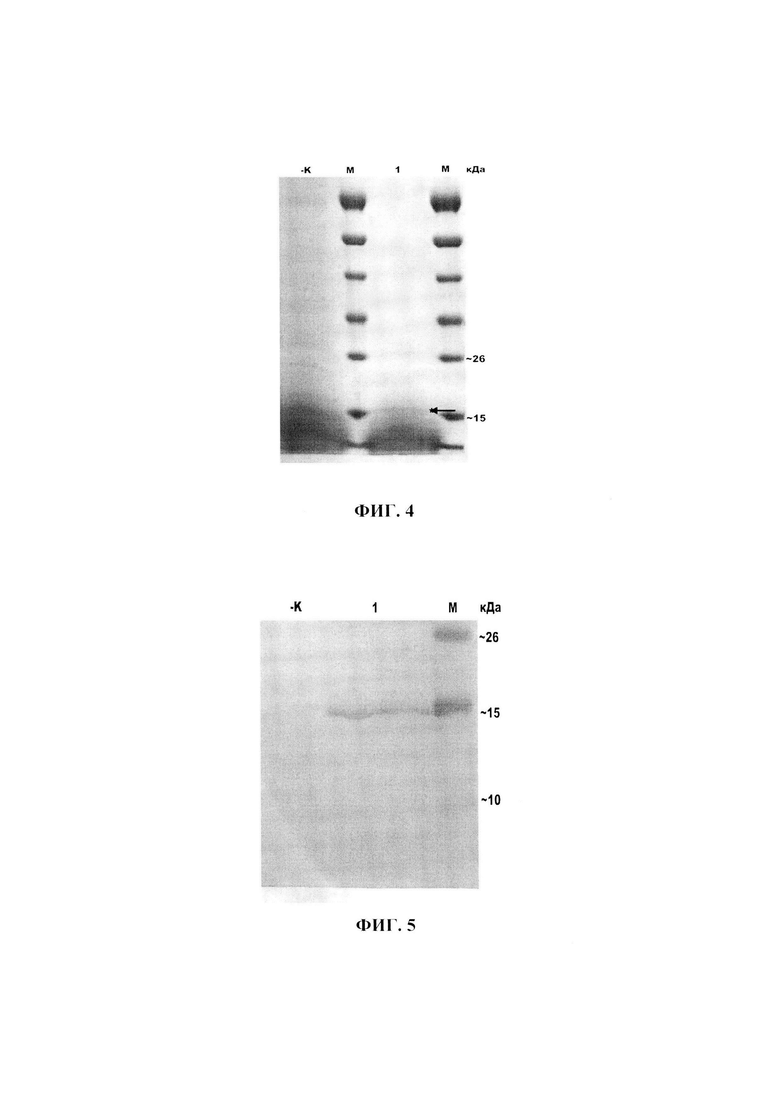
Среди секретируемых белков штамма-продуцента Y-3489-VP2 появляется дополнительная белковая полоса с молекулярной массой около 17,3 кДа, что соответствует расчетной массе фрагмента белка VP2 вируса ИББ (SEQ ID NO: 2), рассчитанной сервисом https://sciencegateway.org/tools/proteinmw.htm. Дополнительный белок дает положительную реакцию с антителами к С-тус эпитопу. Результаты электрофореза белков культуральной жидкости показаны на Фиг. 4, результаты гибридизации с антителами к С-тус эпитопу показаны на Фиг. 5, где 1 - белки культуральной жидкости штамма Y-3489-VP2, М - маркер молекулярной массы белков, - К - белки культуральной жидкости штамма дикого типа Y-3489. Стрелками отмечены полосы, соответствующие фрагменту белка VP2.
Уровень синтеза фрагмента белка VP2 вируса ИББ определяют, сравнивая интенсивность окрашивания полосы рекомбинантного белка с полосой маркерного белка соответствующего веса (15 кДа). Согласно полученным данным штамм дрожжей Y-3489-VP2 синтезирует около 120 мг фрагмента белка VP2 на литр культуры дрожжей.
Полученный штамм дрожжей Komagataella pastoris Y-3489-VP2 синтезирует и секретирует фрагмент белка VP2 вируса ИББ и может быть использован для создания тест-систем и конструирования субъединичных вакцин против инфекционной бурсальной болезни птиц.
Список использованных источников информации:
1. Marangon S., Busani L. The use of vaccination in poultry production. Rev. Sci Tech. 2007; 26(1): 265-274.
2. Hon C.C., Lam T.T., Yip C.W. et al. Phylogenetic evidence for homologous recombination within the family Birnaviridae. J. Gen. Virol. 2008; 89(Pt 12): 3156-3164. https://doi: 10.1099/vir.0.2008/004101-0.
3. Berg T.P. Acute infectious bursal disease in poultry: a review. Avian Pathol. 2000; 29(3): 175-194. https://doi: 10.1080/03079450050045431.
4. Muller H., Mundt E., Eterradossi N. et al. Current status of vaccines against infectious bursal disease. Avian Pathol. 2012; 41(2): 133-139. https://doi: 10.1080/03079457.2012.661403.
5. Ellis R.W. Development of combination vaccines. Vaccine. 1999; 17(13-14): 1635-1642. https://doi: 10.1016/s0264-410x(98)00424-l.
6. Eckart M.R., Bussineau CM. Quality and authenticity of heterologous proteins synthesized in yeast. Curr. Opin. Biotechnol. 1996; 7(5): 525-530. https://doi: 10.1016/s0958-1669(96)80056-5.
7. Berlec A., Strukelj B. Current state and recent advances in biopharmaceutical production in Escherichia coli, yeasts and mammalian cells. J. Ind. Microbiol. Biotechnol. 2013; 40(3-4): 257-274. https://doi: 10.1007/s10295-013-1235-0.
8. Celik E, Calik P. Production of recombinant proteins by yeast cells. Biotechnol. Adv. 2012; 30(5): 1108-1118. https://doi: 10.1016/j.biotechadv.2011.09.011.
9. Ahmad M., Hirz M., Pichler H. et al. Protein expression in Pichia pastoris: recent achievements and perspectives for heterologous protein production. Appl. Microbiol. Biotechnol. 2014; 98(12): 5301-5317. https://doi: 10.1007/s00253-014-5732-5.
10. Патент РФ на изобретение №2630620/ 2008. [Patent RUS No 2630620/ 2008.(In Russ.)]. Прототип №1.
11. Sakhtah Н, Behler J, Ali-Reynolds A, Causey ТВ, Vainauskas S, Taron CH. A Novel Regulated Hybrid Promoter That Permits Autoinduction of Heterologous Protein Expression in Kluyveromyces lactis. Appl. Environ. Microbiol. 2019; 85(14):e00542-19. doi: 10.1128/AEM.00542-19.
12. Taghavian O., Spiegel H., Hauck R., Hafez H.M., Fischer R., Schillberg S. Protective oral vaccination against infectious bursal disease virus using the major viral antigenic protein VP2 produced in Pichia pastoris. PLoS One. 2013; 8(12): e83210. doi: 10.1371/journal.pone.0083210. eCollection 2013.
13. Letzel Т., Coulibaly F., Rey F.A., Delmas В., Jagt E., van Loon A.A., Mundt E. Molecular and structural bases for the antigenicity of VP2 of infectious bursal disease virus // J. Virol. - 2007. - Vol.81, №23. - P. 12827-12835.






Изобретение относится к области биотехнологии. Предложена рекомбинантная плазмидная ДНК pPICZα-VP2, которая обеспечивает синтез в клетках дрожжей и секрецию фрагмента белка VP2 вируса инфекционной бурсальной болезни (ИББ) птиц. Также представлен способ конструирования рекомбинантной плазмидной ДНК pPICZα-VP2. Также представлен рекомбинантный штамм дрожжей Komagataella pastoris Y-3489-VP2, продуцирующий фрагмент белка VP2 вируса ИББ птиц. Изобретение позволяет получать фрагмент белка VP2 вируса ИББ птиц, синтезируемый и секретируемый клетками дрожжей, который может быть использован для создания тест-систем и конструирования субъединичных вакцин против ИББ птиц. 3 н.п. ф-лы, 5 ил., 2 пр.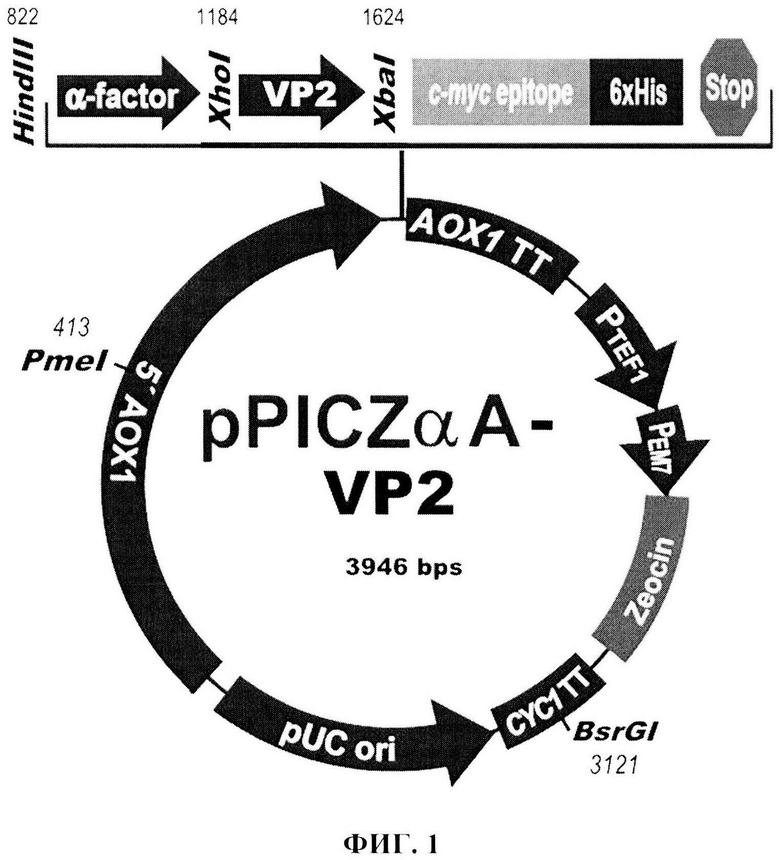
1. Рекомбинантная плазмидная ДНК pPICZα-VP2, обеспечивающая биосинтез и секрецию фрагмента белка VP2 вируса ИББ, имеющая размер 3946 п.о. и состоящая из следующих элементов:
- XhoI-XbaI - фрагмент плазмидной ДНК дрожжевого вектора pPICZαB размером 3512 п.о. (из которого удалена область сайта множественного клонирования размером 25 п.о. между сайтами распознавания рестриктаз XhoI и XbaI), включающий ген устойчивости к зеоцину, бактериальную область инициации репликации; фрагмент 5'-некодирующей области дрожжевого гена АОХ1 размером 940 п.о., содержащий область, обеспечивающую активацию транскрипции этого гена в присутствии метанола в качестве источника углерода в культуральной среде; препрообласть гена МFальфа фактора дрожжей Saccharomyces cerevisiae размером 247 п.о., обеспечивающую секрецию рекомбинантного белка на поверхность клетки дрожжей и в культуральную жидкость; фрагмент гена АОХ1 размером 342 п.о., содержащий область терминации транскрипции этого гена;
- XhoI-XbaI - фрагмент гена VP2 размером 434 п.о., кодирующий фрагмент белка VP2 с 206 до 350 аминокислоты;
- уникальные сайты распознавания следующих рестриктаз: XhoI - 1184 п.о.; HindIII - 872 п.о.; XbaI - 1624 п.о.; BsrGI - 3121 п.о.; PmeI - 4134 п.о.,
- характеризующаяся схемой, приведенной на фиг. 1.
2. Способ конструирования рекомбинантной плазмидной ДНК pPICZα-VP2 по п. 1, обеспечивающей синтез и секрецию фрагмента белка VP2 вируса ИББ с 206 до 350 аминокислоты в клетках дрожжей Komagataella pastoris, заключающийся в том, что из плазмиды pPICZαB с помощью гидролиза рестриктазами XhoI и XbaI удаляют область сайта множественного клонирования размером 25 п.о. и далее лигируют по данным сайтам рестрикции последовательность фрагмента гена белка VP2 вируса ИББ, включающего фрагмент открытой рамки считывания гена белка VP2 вируса ИББ, нуклеотидную последовательность, кодирующую участок узнавания и расщепления протеазой Kex2 для правильного удаления препрообласти гена МFальфа фактора дрожжей Saccharomyces cerevisiae, а также последовательностей эпитопа с-Мус и метки Hisx6 для очистки итогового рекомбинантного белка методом аффинной хроматографии, полученной лигазной смесью трансформируют клетки бактерий Escherichia coli и отбирают клоны, содержащие рекомбинантную плазмидную ДНК pPICZα-VP2.
3. Рекомбинантный штамм дрожжей Komagataella pastoris Y-3489-VP2 - продуцент фрагмента белка VP2 вируса ИББ, полученный трансформацией штамма дрожжей Komagataella pastoris Y-3489 (ВКПМ) плазмидой pPICZα-VP2 по п. 1.
| GOUDARZI H | |||
| et al., Expression of the VP2 gene of classical D78 infectious bursal disease virus in the methylotrophic yeast Pichia pastoris as a secretory protein, Archives of Razi Institute, 2006, Vol | |||
| Устройство для сортировки каменного угля | 1921 |
|
SU61A1 |
| Переносная печь для варки пищи и отопления в окопах, походных помещениях и т.п. | 1921 |
|
SU3A1 |
| LETZEL T | |||
| et al., Molecular and Structural Bases for the Antigenicity of VP2 of Infectious Bursal Disease Virus, Journal | |||
Авторы
Даты
2023-07-21—Публикация
2021-12-07—Подача