ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННЫЕ ЗАЯВКИ
[0001] По настоящей заявке испрашивается приоритет на основании предварительной заявки США № 62/583403, поданной 8 ноября 2017 года, полное содержание которой включено в настоящее описание посредством ссылки.
ОБЛАСТЬ ТЕХНИКИ
[0002] Настоящее изобретение относится к содержащим фулвестрант составам и способам их применения в лечении заболевания.
УРОВЕНЬ ТЕХНИКИ
[0003] Фулвестрант, или 7-(9-(4,4,5,5,5-пентафторпентилсульфинил)нонил)эстра-1,3,5(10)-триен-3,17-диол, имеет структуру формулы (1):
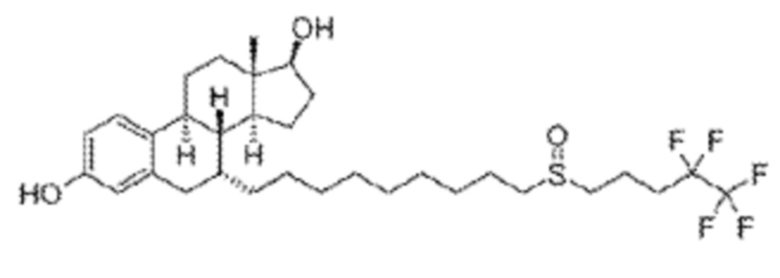 (1)
(1)
[0004] Фулвестрант является селективным супрессором эстрогеновых рецепторов (SERD), показанным для лечения гормон-рецептор-положительного метастазирующего рака молочной железы у женщин после менопаузы с прогрессированием заболевания после антиэстрогеновой терапии.
[0005] Как и в случае других подобных стероидам соединений, фулвестрант имеет физические свойства, затрудняющие получение его водных суспензий. Фулвестрант является особенно липофильной молекулой, даже по сравнению с другими стероидными соединениями, и его растворимость в воде является крайне низкой.
[0006] Из-за плохой растворимости и пероральной биодоступности фулвестранта, лекарственное средство в настоящее время вводят посредством внутримышечной инъекции состава фулвестранта на основе масла. Существующий коммерческий состав фулвестранта FASLODEX® вводят в дозе 500 мг, и в случае него необходимы две внутримышечные инъекции по 5 мл 50 мг/мл состава фулвестранта. Каждая инъекция 5 мл включает 10% масс./об. спирта, 10% масс./об. бензилового спирта и 15% масс./об. бензилбензоата в качестве сорастворителей, дополненные до 100% масс./об. касторовым маслом в качестве дополнительного сорастворителя и модификатора скорости высвобождения. Введение состава является медленным (1-2 минуты на инъекцию) и болезненным из-за вязкого маслянистого носителя, используемого для солюбилизации фулвестранта. На вкладыш к FASLODEX® добавлено предупреждение, касающееся болезненных инъекций, ишиаса, невропатической боли и периферической невропатии.
[0007] Ранее сообщали (патент США № 6774122 AstraZeneca), что внутримышечные инъекции фулвестранта в форме водной суспензии непригодны для использования. Эти суспензии приводили к обширному местному раздражению тканей в месте инъекции, а также плохому профилю высвобождения из-за наличия фулвестранта в форме твердых частиц. Кроме того, сообщали, что скорость высвобождения фулвестранта не является клинически значимой.
[0008] Существует потребность в составах фулвестранта с улучшенными свойствами, касающимися введения. Настоящее изобретение относится к этим и другим важным потребностям.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
[0009] Настоящее изобретение относится к водным суспензиям, содержащим солюбилизированный фулвестрант, частицы несолюбилизированного фулвестранта, имеющие один или более из LD Dv(10) от приблизительно 1,5 до приблизительно 2,1 мкм, LD Dv(50) от приблизительно 5,5 до приблизительно 9,0 мкм и LD Dv(90) от приблизительно 15 до приблизительно 35 мкм, водным суспензиям, дополнительно содержащим поверхностно-активное вещество, поливинилпирролидон, сахарный спирт и водорастворимый эксципиент. Водорастворимый эксципиент может являться арил-C1-6-алк-OH, C1-6-алкил-OH, буферной солью, полисорбатом, полиалкиленгликолем, C1-12-алкиленгликолем, фосфатидилхолином или их комбинацией.
[0010] Настоящее изобретение относится к способам лечения рака молочной железы у субъекта, включающим введение субъекту водных суспензий по изобретению. Рак молочной железы может являться гормон-рецептор (HR)-положительным раком молочной железы.
[0011] Настоящее изобретение также относится к способам получения и применения продуктов, представленных в настоящем описании.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
[0012] Сущность изобретения, а также следующее подробное описание будут более понятными при чтении вместе с сопутствующими чертежами. В целях иллюстрирования изобретения на чертежах показаны примеры вариантов осуществления настоящего изобретения; однако, настоящее изобретение не ограничено конкретными описанными способами, композициями и устройствами. На чертежах:
[0013] На фиг. 1 показаны фармакокинетические данные по введению коммерческих составов фулвестранта (FASLODEX®) и некоторых иллюстративных водных суспензий по настоящему изобретению крысам.
[0014] На фиг. 2 показаны фармакокинетические данные по введению коммерческих составов фулвестранта (FASLODEX®) и иллюстративной водной суспензии по настоящему изобретению людям.
[0015] На фиг. 3 показаны фармакокинетические данные по введению коммерческих составов фулвестранта (FASLODEX®) и иллюстративной водной суспензии по настоящему изобретению людям.
[0016] На фиг. 4 показаны фармакокинетические данные по введению коммерческих составов фулвестранта (FASLODEX®) и иллюстративной водной суспензии по настоящему изобретению людям.
[0017] На фиг. 5 показаны фармакокинетические данные по введению коммерческих составов фулвестранта (FASLODEX®) и иллюстративной водной суспензии по настоящему изобретению людям.
[0018] На фиг. 6 показаны фармакокинетические данные по введению коммерческих составов фулвестранта (FASLODEX®) и иллюстративной водной суспензии по настоящему изобретению людям.
[0019] На фиг. 7 показаны фармакокинетические данные по введению коммерческих составов фулвестранта (FASLODEX®) и иллюстративной водной суспензии по настоящему изобретению людям.
[0020] Таким образом, все обозначения и аннотации на фигурах включены в настоящее описание так, как если бы они были полностью приведены в настоящем описании
ПОДРОБНОЕ ОПИСАНИЕ ИЛЛЮСТРАТИВНЫХ ВАРИАНТОВ ОСУЩЕСТВЛЕНИЯ
[0021] Настоящее описание будет более понятным с учетом следующего подробного описания и сопутствующих фигур и примеров, образующих часть настоящего описания. Следует понимать, что настоящее изобретение не ограничено конкретными устройствами, способами, применением, условиями или параметрами, описанными и/или представленными в настоящем описании, и что терминология, используемая в настоящем описании, предназначена для описания конкретных вариантов осуществления исключительно в качестве примера, и не следует истолковывать ее как ограничение заявленного изобретения.
[0022] В описании, включающем формулу изобретения, формы в единственном числе включают ссылку на множественное число, и ссылка на конкретное числовое значение включает по меньшей мере это конкретное значение, если контекст четко не указывает на иное.
[0023] Если представлен диапазон значений, другой вариант осуществления включает диапазон от одного конкретного значения и/или до другого конкретного значения. Все диапазоны являются инклюзивными и комбинируемыми. Кроме того, ссылка на значения, указанные в диапазоне, включает каждое значение в пределах диапазона. Если значения выражены как приблизительные значения с использованием предшествующего термина "приблизительно", следует понимать, что конкретное значение образует другой вариант осуществления. В рамках изобретения термин "приблизительно" по отношению к измеримому значению, такому как количество, длительность периода времени и т.п., предназначен для включения приемлемых колебаний значения, таких как, например, ±10% относительно указанного значения. Например, фраза "приблизительно 50%" может включать ±10% от 50 или от 45% до 55%.
[0024] Следует понимать, что некоторые признаки изобретения, для ясности представленные в настоящем описании в контексте отдельных вариантов осуществления, также можно представлять в комбинации в одном варианте осуществления. И наоборот, разные признаки изобретения, для краткости описанные в контексте одного варианта осуществления, также можно представлять раздельно или в любой подкомбинации.
ТЕРМИНЫ
[0025] В рамках изобретения следует понимать, что фразу "способ лечения", в отдельности или в комбинации с другим термином или терминами, можно использовать взаимозаменяемо с фразой "для применения в лечении" конкретного заболевания.
[0026] В рамках изобретения термин "фармацевтически приемлемый" в отдельности или в комбинации с другим термином или терминами означает, что указанное вещество, такое как, например, например, фармацевтически приемлемый эксципиент, как правило, является химически и/или физически совместимыми с другими ингредиентами в составе и/или, как правило, является физиологически совместимым с его реципиентом.
[0027] В рамках изобретения термины "субъекты" и "пациенты" в отдельности или в комбинации с другим термином или терминами относятся к млекопитающим, включая людей. Термин "люди" относится к ребенку, подростку или взрослому человеку и включает ребенка, подростка или взрослого человека.
[0028] В рамках изобретения термины "лечить", "подвергаемый лечению" и "лечение" в отдельности или в комбинации с другим термином или терминами относятся к облегчающему симптомы, паллиативному и/или излечивающему применению и результатам или любой их комбинации и включают их. В других вариантах осуществления способы, представленные в настоящем описании, можно использовать профилактически. Следует понимать, что термины "профилактика" или "профилактическое применение или результат" не относятся к абсолютной или тотальной профилактике (т.е. 100% профилактическому применению или результату) и не включают его. В рамках изобретения термины "профилактика" или "профилактическое применение или результат" относятся к применению и результатам, при которых введение соединения или состава снижает тяжесть конкретного состояния, симптома, нарушения или заболевания, представленного в настоящем описании; снижает вероятность развития конкретного состояния, симптома, нарушения или заболевания, представленного в настоящем описании; или задерживает дебют или рецидив конкретного состояния, симптома, нарушения или заболевания, представленного в настоящем описании; или имеет место любая комбинация указанного выше.
[0029] В рамках изобретения термины "терапевтический" и "терапевтически эффективное количество" в отдельности или в комбинации с другим термином или терминами относятся к количеству соединения или состава, с помощью которого (a) лечат конкретное состояние, симптом, нарушение или заболевание, представленное в настоящем описании; (b) уменьшают, улучшают или устраняют один или более симптомов конкретного состояния, нарушения или заболевания, представленного в настоящем описании; (c) задерживают дебют или рецидив конкретного состояния, симптома, нарушения или заболевания, представленного в настоящем описании. Следует понимать, что термины "терапевтический" и "терапевтически эффективный" включают любой из указанных выше эффектов (a)-(c) в отдельности или в комбинации с любым из других из (a)-(c).
[0030] В рамках изобретения термин "терапевтическое средство" в отдельности или в комбинации с другим термином или терминами относится к любому веществу, включенному в состав, который можно использовать в лечении заболевания, состояния или нарушения или сопутствующего заболевания (т.е. заболевания, состояния или нарушения, существующего одновременно с раком молочной железы), и неявляющемуся фулвестрантом.
[0031] В рамках изобретения термин "суспензия" в отдельности или в комбинации с другим термином или терминами относится к твердым частицам, диспергированным в жидком носителе. В рамках изобретения термин "водная суспензия" в отдельности или в комбинации с другим термином или терминами относится к суспензии, в которой жидкий носитель содержит по меньшей мере приблизительно 50% масс./масс. воды. В рамках изобретения термин "носитель" в отдельности или в комбинации с другим термином или терминами означает суспензионную среду, предпочтительно - фармацевтически приемлемую суспензионную среду.
[0032] В рамках изобретения термины "доза" и "дозировка" в отдельности или в комбинации с другим термином или терминами относятся к количеству фулвестранта в водной суспензии.
[0033] В рамках изобретения термин "арил" в отдельности или в комбинации с другим термином или терминами, если его используют в отдельности или в качестве части группы заместителя, относится к моно- или бициклической структуре ароматического углеводородного кольца, содержащего от 6 до 10 атомов углерода. Предпочтительные арильные остатки включают фенил и нафтил.
[0034] В рамках изобретения термин "C1-C6-алк" в отдельности или в комбинации с другим термином или терминами, если его используют в отдельности или в качестве части группы заместителя, относится к алифатическому линкеру, содержащему 1, 2, 3, 4, 5 или 6 атомов углерода, и включает, например, -CH2-, -CH(CH3)-, -CH(CH3)-CH2- и -C(CH3)2-. Термин "-C0-алк-" относится к связи.
[0035] В рамках изобретения термин "алкил" в отдельности или в комбинации с другим термином или терминами, если его используют в отдельности или в качестве части группы заместителя, относится к неразветвленной или разветвленной углеводородной группе, содержащей от 1 до 12 атомов углерода ("C1-C12"), предпочтительно - от 1 до 6 атомов углерода ("C1-C6"), в группе. Примеры алкильных групп включают метил (Me, C1-алкил), этил (Et, C2-алкил), n-пропил (C3-алкил), изопропил (C3-алкил), бутил (C4-алкил), изобутил (C4-алкил), втор-бутил (C4-алкил), трет-бутил (C4-алкил), пентил (C5-алкил), изопентил (C5-алкил), трет-пентил (C5-алкил), гексил (C6-алкил), изогексил (C6-алкил) и т.п.
[0036] Когда в настоящем описании используют диапазон количества атомов углерода, например, C1-C6, он включает все диапазоны, а также отдельные количества атомов углерода. Например, "C1-C3" включает C1-C3, C1-C2, C2-C3, C1, C2 и C3.
[0037] В рамках изобретения с помощью терминов "Dv(10)", "Dv(50)" и "Dv(90)" определяют средневзвешенные по объему диаметры частиц, где в совокупности 10%, 50% или 90% об./об. частиц при измерении имеют равный или меньший диаметр, соответственно. Например, если популяция частиц имеет Dv(50) приблизительно 25 мкм, 50% частиц в объеме имеют диаметр приблизительно 25 мкм или менее.
[0038] В рамках изобретения с помощью терминов "Dn(10)", "Dn(50)" и "Dn(90)" определяют средневзвешенные по количеству диаметры частиц, где в совокупности 10%, 50% или 90% частиц при измерении имеют равный или меньший диаметр, соответственно. Например, если популяция частиц имеет Dn(50) приблизительно 25 мкм, 50% частиц от общего количества имеют диаметр приблизительно 25 мкм или менее.
[0039] Размер частиц и распределения размера частиц можно определять посредством измерения с помощью лазерной дифракции. Анализ размера частиц способами лазерной дифракции известен в этой области и более подробно описан в ISO 13320: 2009(E), "Particle size analysis - Laser diffraction methods," International Organization for Standardization, включенном в настоящее описание посредством ссылки для всех целей в полном объеме. Размеры частиц, определяемые посредством лазерной дифракции, представлены в виде диаметра сферы, имеющей объем, эквивалентный объему частицы, определяемому в соответствии с теорией рассеяния света Ми. Измерения посредством лазерной дифракции можно осуществлять с использованием образцов "в том виде, как они есть" или "с ультразвуковой обработкой". Значения, измеряемые посредством лазерной дифракции с использованием образцов "в том виде, как они есть", указаны в таком виде в таблицах или их обозначают в настоящем описании как "Dv(##) при лазерной дифракции", "LD Dv(##)", "диаметр при лазерной дифракции" или "LD диаметр". В данных для образцов, "подвергнутых ультразвуковой обработке", указано, что образец для измерения подвергали ультразвуковой обработке для диспергирования агломератов непосредственно перед анализом, как более подробно описано в ISO 13320:2009(E). Значения, измеряемые посредством лазерной дифракции, для образцов, подвергнутых ультразвуковой обработке, конкретно указаны в настоящем описании как "Dv(##) при лазерной дифракции с ультразвуковой обработкой", "LD Dv(##)" при ультразвуковой обработке, "диаметр при лазерной дифракции с ультразвуковой обработкой", или "диаметр LD при ультразвуковой обработке". В таблицах 3-6 представлены данные о размере частиц и распределении размера частиц ("PSD") при лазерной дифракции для некоторых примеров вариантов осуществления настоящего изобретения.
[0040] Размер частиц и распределения размера частиц также можно определять с помощью захвата и анализа изображений, полученных посредством микроскопии. При захвате и анализе изображений, полученных посредством микроскопии, получают двухмерное изображение трехмерной частицы и вычисляют различные параметры размера и формы с помощью двухмерного изображения. Размеры частиц, определяемые с помощью захвата и анализа изображений, полученных посредством микроскопии, представлены в виде диаметра круга с площадью, эквивалентной двухмерному изображению частицы, и обозначены в настоящем описании как диаметр эквивалента круга или диаметр "CE". Анализ размера частиц с помощью захвата и анализа изображений, полученных посредством микроскопии, известен в этой области и более подробно описан в ISO 13322-1:2014, "Particle size analysis - Image analysis methods ~ Part 1: Static image analysis methods", International Organization for Standardization, включенный в настоящее описание посредством ссылки для всех целей в полном объеме. Значения, измеряемые с помощью захвата и анализа изображений, полученных посредством микроскопии, в настоящем описании обозначают как "диаметр эквивалента круга", "диаметр CE", "Dv(##) эквивалента круга", "CE Dv(##)" или "CE Dn(##)". В таблице 6 представлены данные о размере частиц и распределении размера частиц, полученные с помощью захвата и анализа изображений, полученных посредством микроскопии, для некоторых примеров вариантов осуществления настоящего изобретения.
Водные суспензии
[0041] В конкретных вариантах осуществления настоящее изобретение относится к водным суспензиям, содержащим солюбилизированный фулвестрант и частицы несолюбилизированного фулвестранта. Частицы несолюбилизированного фулвестранта могут иметь разные распределения размера частиц, как более подробно описано в другом месте в настоящем описании. В некоторых вариантах осуществления водные суспензии по изобретению могут иметь общую концентрацию фулвестранта с учетом солюбилизированного фулвестранта и несолюбилизированного фулвестранта от приблизительно 80 мг/мл до приблизительно 170 мг/мл, включая все диапазоны и поддиапазоны между ними. В других вариантах осуществления общая концентрация фулвестранта составляет от приблизительно 75 мг/мл до приблизительно 125 мг/мл. В конкретных вариантах осуществления общая концентрация фулвестранта составляет приблизительно 75 мг/мл, приблизительно 80 мг/мл, приблизительно 85 мг/мл, приблизительно 90 мг/мл, приблизительно 95 мг/мл, приблизительно 100 мг/мл, приблизительно 105 мг/мл, приблизительно 110 мг/мл, приблизительно 115 мг/мл, приблизительно 120 мг/мл, приблизительно 125 мг/мл, приблизительно 130 мг/мл, приблизительно 135 мг/мл, приблизительно 140 мг/мл, приблизительно 145 мг/мл, приблизительно 150 мг/мл, приблизительно 155 мг/мл, приблизительно 160 мг/мл, приблизительно 165 мг/мл или приблизительно 170 мг/мл. В дополнительных вариантах осуществления общая концентрация фулвестранта составляет приблизительно 100 мг/мл.
[0042] Водные суспензии по изобретению содержат солюбилизированный фулвестрант, т.е. фулвестрант, присутствующий в недисперсной форме, и который можно растворять в водной среде суспензии. В некоторых вариантах осуществления изобретения водные суспензии могут содержать от приблизительно 0,01 мг/мл до приблизительно 0,10 мг/мл, от приблизительно 0,05 мг/мл до приблизительно 0,10 мг/мл, от приблизительно 0,05 мг/мл до приблизительно 0,08 мг/мл или приблизительно 0,06 мг/мл солюбилизированного фулвестранта. Например, водные суспензии могут содержать 0,01, 0,02, 0,03, 0,04, 0,05, 0,06, 0,07, 0,08, 0,09,или 0,1 мг/мл солюбилизированного фулвестранта.
[0043] В некоторых вариантах осуществления водные суспензии, содержащие солюбилизированный фулвестрант и частицы несолюбилизированного фулвестранта, также содержат поверхностно-активное вещество, поливинилпирролидон, сахарный спирт и водорастворимый эксципиент.
[0044] В некоторых вариантах осуществления изобретения, поверхностно-активные вещества могут представлять собой, в качестве неограничивающих примеров, полиэтиленоксид (PEO), производное PEO, полисорбат 80, полисорбат 20, полоксамер 188 (включая, в качестве неограничивающих примеров, полоксамер PLURONIC® F-68, продаваемый BASF Corp. (Wyandotte, MI, USA)), полоксамер 124 (включая, в качестве неограничивающих примеров, полоксамер PLURONIC® L44, продаваемый BASF Corp. (Wyandotte, MI, USA)), полоксамер 407 (включая, в качестве неограничивающих примеров, полоксамер PLURONIC® F127, продаваемый BASF Corp. (Wyandotte, MI, USA)), полиэтоксилированные растительные масла, полиэтоксилированное касторовое масло (включая, в качестве неограничивающих примеров, KOLLIPHOR® EL, ранее известный как CREMOPHOR® EL, продаваемый BASF Corp. (Wyandotte, MI, USA)), сорбитан пальмитат (включая, в качестве неограничивающих примеров, SPAN™ 40, продаваемый Croda International Pic), лецитин, поливиниловый спирт ("PVA"), сывороточный альбумин человека и их смеси.
[0045] В некоторых вариантах осуществления изобретения поливинилпирролидоны могут представлять собой, в качестве неограничивающих примеров, повидон K12, повидон K17, повидон PLASDONE™ C-12 (Ashland, Inc., Covington, KY, USA), повидон PLASDONE™ C-17 (Ashland, Inc., Covington, KY, USA), повидон PLASDONE™ C-30 (Ashland, Inc., Covington, KY, USA) и их смеси. В некоторых вариантах осуществления поливинилпирролидон является повидоном PLASDONE™ C-12, имеющим значение K 10,2-13,8 и номинальную молекулярную массу 4000 Да.
[0046] В некоторых вариантах осуществления изобретения сахарные спирты могут представлять собой, в качестве неограничивающих примеров, декстрозу, глицерин, маннит, эритрит, треит, арабит, ксилит, рибит, сорбит, галактит, фуцит, идит, инозитол, волемит, изомальт, мальтит, лактитол, мальтотриит, мальтотетраит, полиглицит и их смеси. В дополнительных вариантах осуществления изобретения сахарный спирт представляет собой маннит, ксилит, мальтит, лактитол, мальтотриит, сорбит, глицерин или их смесь. В дополнительных вариантах осуществления изобретения сахарный спирт представляет собой маннит.
[0047] В рамках изобретения водные суспензии содержат водорастворимый эксципиент, который может представлять собой арил-C1-6-алк-OH, C1-6-алкил-OH, буферную соль, полисорбат, полиалкиленгликоль, C1-12-алкиленгликоль, фосфатидилхолин или их комбинацию.
[0048] В некоторых вариантах осуществления водные суспензии по изобретению содержат от приблизительно 0,1% до приблизительно 5% (масс./масс.), от приблизительно 0,5% до приблизительно 5% (масс./масс.), от приблизительно 0,5% до приблизительно 2,5% (масс./масс.), от приблизительно 0,9% до приблизительно 1,5% (масс./масс.), приблизительно 4% (масс./масс.) или приблизительно 1% (масс./масс.) арил-C1-6-алк-OH. Например, водные суспензии могут содержать 0,1, 0,2, 0,3, 0,4, 0,5, 0,6, 0,7, 0,8, 0,9, 1, 1,1, 1,2, 1,3, 1,4, 1,5, 1,6, 1,7, 1,8, 1,9, 2, 2,1, 2,2, 2,3, 2,4, 2,5, 2,6, 2,7, 2,8, 2,9, 3, 3,1, 3,2, 3,3, 3,4, 3,5, 3,6, 3,7, 3,8, 3,9, 4, 4,1, 4,2, 4,3, 4,4, 4,5, 4,6, 4,7, 4,8, 4,9 или 5% (масс./масс.) арил-C1-6-алк-OH. Арил-C1-6-алк-OH, предпочтительно, представляет собой фенил-C1-6-алк-OH, например, фенил-C1-2-OH. В дополнительных вариантах осуществления арил-C1-6-алк-OH представляет собой бензиловый спирт (фенил-CH2-OH).
[0049] В некоторых вариантах осуществления водные суспензии содержат от приблизительно 1% до приблизительно 10% (масс./масс.), от приблизительно 5% до приблизительно 10% (масс./масс.), от приблизительно 2% до приблизительно 4% (масс./масс.), приблизительно 2% (масс./масс.), приблизительно 4% (масс./масс.), приблизительно 5% (масс./масс.) или приблизительно 8% (масс./масс.) C1-6-алкил-OH. Например, водные суспензии могут содержать приблизительно 1, 1,5, 2, 2,5, 3, 3,5, 4, 4,5, 5, 5,5, 6, 6,5, 7, 7,5, 8, 8,5, 9, 9,5 или 10% (масс./масс.) C1-6-алкил-OH. Предпочтительные C1-6-алкил-OH включают метанол, этанол, пропанол, изопропанол, бутанол, втор-бутанол, трет-бутанол и их комбинации. В дополнительных вариантах осуществления C1-6-алкил-OH представляет собой этанол.
[0050] В некоторых вариантах осуществления водные суспензии по изобретению содержат одну или более буферных солей, которые могут представлять собой средство, которое при добавлении в водную суспензию приводит к получению водной суспензии, устойчивой к изменениям pH, или к изменению pH. В рамках изобретения pH измеряют с использованием общепринятого оборудования при температуре окружающей среды, например, от 20°C до 25°C, предпочтительно - 23°C. Буферная соль может являться, например, фосфатом натрия (например, Na2HPO4⋅H2O, Na2HPO4⋅2H2O, безводным Na2HPO4), фосфатом калия (например, гидроортофосфатом калия (K2HPO4), дигидроортофосфатом калия (KH2PO4)), лимонной кислотой или ее солью (например, цитратом натрия), трометан(трис(гидроксиметил)аминометаном ("Трис") или их смесью. В некоторых вариантах осуществления водная суспензия содержит приблизительно от 1 мМ до 20 мМ буферных солей, включая все диапазоны и поддиапазоны между этими значениями. В конкретных вариантах осуществления изобретения водная суспензия содержит приблизительно от 1 до 2 мМ, от 1 до 3 мМ, от 1 до 5 мМ, от 2 до 8 мМ, от 5 до 6 мМ, от 5 до 10 мМ, от 8 до 12 мМ, от 10 до 15 мМ или от 15 до 20 мМ одной или более буферных солей, включая все диапазоны и поддиапазоны между этими значениями. В дополнительных вариантах осуществления изобретения водная суспензия содержит приблизительно 1 мМ, 2 мМ, 3 мМ, 4 мМ, 5 мМ, 6 мМ, 7 мМ, 8 мМ, 9 мМ, 10 мМ, 11 мМ, 12 мМ, 13 мМ, 14 мМ, 15 мМ, 16 мМ, 17 мМ, 18 мМ, 19 мМ или 20 мМ одной или более буферных солей.
[0051] В некоторых вариантах осуществления водные суспензии могут содержать от приблизительно 0,1% до приблизительно 2% (масс./масс.), от приблизительно 0,25% и приблизительно 1,80% (масс./масс.) или приблизительно 0,75% (масс./масс.) полисорбата. Например, водные суспензии по изобретению могут содержать приблизительно 0,1, 0,2, 0,3, 0,4, 0,5, 0,6, 0,7, 0,75, 0,8, 0,9, 1, 1,1, 1,2, 1,3, 1,4, 1,5, 1,6, 1,7, 1,8, 1,9 или приблизительно 2% (масс./масс.) полисорбата. Полисорбаты известны в этой области как класс соединений, полученных из этоксилированного сорбитана, этерифицированного жирными кислотами. В некоторых вариантах осуществления полисорбат может представлять собой полисорбат 20, полисорбат 40, полисорбат 60, полисорбат 80 или их комбинацию.
[0052] В некоторых вариантах осуществления водные суспензии могут содержать от приблизительно 1% до приблизительно 10% (масс./масс.), от приблизительно 0,5% до приблизительно 8% (масс./масс.) или приблизительно 5% (масс./масс.) полиалкиленгликоля. Например, водные суспензии могут содержать приблизительно 0,1, 0,2, 0,3, 0,4, 0,5, 0,6, 0,7, 0,8, 0,9, 1, 1,5, 2, 2,5, 3, 3,5, 4, 4,5, 5, 5,5, 6, 6,5, 7, 7,5, 8, 8,5, 9, 9,5 или приблизительно 10% (масс./масс.) полиалкиленгликоля. Полиалкиленгликоли известны в этой области. Предпочтительные полиалкиленгликоли включают полиэтиленгликоли. Полиэтиленгликоли, которые можно использовать в изобретении, будут иметь молекулярную массу от приблизительно 300 г/моль до приблизительно 10000 г/моль, включая, в качестве неограничивающих примеров, PEG 200, PEG 300, PEG 400, PEG 540, PEG 600, PEG 1000, PEG 1450, PEG 1540, PEG 3350, PEG 3500, PEG 4000, PEG 6000, PEG 8000 или их комбинации.
[0053] В некоторых вариантах осуществления водные суспензии по изобретению могут содержать от приблизительно 0,1% до приблизительно 5% (масс./масс.), от приблизительно 0,5% до приблизительно 4% (масс./масс.) или приблизительно 2,5% (масс./масс.) C1-12-алкиленгликоля. Например, водные суспензии могут содержать приблизительно 0,1, 0,2, 0,3, 0,4, 0,5, 0,6, 0,7, 0,8, 0,9, 1, 1,1, 1,2, 1,3, 1,4, 1,5, 1,6, 1,7, 1,8, 1,9, 2, 2,1, 2,2, 2,3, 2,4, 2,5, 2,6, 2,7, 2,8, 2,9, 3, 3,1, 3,2, 3,3, 3,4, 3,5, 3,6, 3,7, 3,8, 3,9, 4, 4,1, 4,2, 4,3, 4,4, 4,5, 4,6, 4,7, 4,8, 4,9 или приблизительно 5% (масс./масс.) C1-12-алкиленгликоля. В рамках изобретения термин "C1-12-алкиленгликоль" относится к алифатическому гликолю, содержащему 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11 или 12 атомов углерода. Примеры C1-12-алкиленгликолей включают, например, пропиленгликоль и этиленгликоль. В некоторых вариантах осуществления изобретения C1-12-алкиленгликоль является пропиленгликолем.
[0054] В некоторых вариантах осуществления водные суспензии по изобретению содержат от приблизительно 0,1% до приблизительно 5% (масс./масс.), от приблизительно 0,1% до приблизительно 2% (масс./масс.) или приблизительно 0,3% (масс./масс.) фосфатидилхолина. Например, водные суспензии могут содержать приблизительно 0,1, 0,2, 0,3, 0,4, 0,5, 0,6, 0,7, 0,8, 0,9, 1, 1,1, 1,2, 1,3, 1,4, 1,5, 1,6, 1,7, 1,8, 1,9, 2, 2,1, 2,2, 2,3, 2,4, 2,5, 2,6, 2,7, 2,8, 2,9, 3, 3,1, 3,2, 3,3, 3,4, 3,5, 3,6, 3,7, 3,8, 3,9, 4, 4,1, 4,2, 4,3, 4,4, 4,5, 4,6, 4,7, 4,8, 4,9 или приблизительно 5% (масс./масс.) фосфатидилхолина. Фосфатидилхолины известны в этой области как класс фосфолипидов, включающих концевую группу холина. В некоторых вариантах осуществления изобретения фосфатидилхолин является лецитином.
[0055] В некоторых вариантах осуществления водные суспензии могут содержать один или более дополнительных фармацевтически приемлемых эксципиентов. В рамках изобретения фармацевтически приемлемый эксципиент, как правило, является химически и/или физически совместимым с другими ингредиентами в водной суспензии и/или, как правило, физиологически совместимым с его реципиентом. В некоторых вариантах осуществления один или более дополнительных фармацевтически приемлемых эксципиентов выбраны из группы, состоящей из консервантов, антиоксидантов, противовспенивателей или их смесей. В дополнительных вариантах осуществления изобретения дополнительный фармацевтически приемлемый эксципиент является консервантом, в качестве неограничивающих примеров, таким как фенол, крезол, p-гидроксибензойный сложный эфир, хлорбутанол или их смеси. В дополнительных вариантах осуществления изобретения дополнительный фармацевтически приемлемый эксципиент является антиоксидантом, в качестве неограничивающих примеров, таким как аскорбиновая кислота, пиросульфит натрия, пальмитиновая кислота, бутилированный гидроксианизол, бутилированный гидрокситолуол, токоферолы или их смеси. В дополнительных вариантах осуществления изобретения дополнительный фармацевтически приемлемый эксципиент является противовспенивателем, в качестве неограничивающих примеров, таким как диметикон, симетикон или их смеси.
[0056] В некоторых вариантах осуществления изобретения водные суспензии могут содержать водорастворимый эксципиент, представляющий собой арил-C1-6-алк-OH, C1-6-алкил-OH, полисорбат, буферную соль или их комбинацию. В некоторых вариантах осуществления водорастворимый эксципиент представляет собой арил-C1-6-алк-OH (например, бензиловый спирт), C1-6-алкил-OH (например, этанол) и полисорбат. В дополнительных вариантах осуществления изобретения водорастворимый эксципиент представляет собой C1-6-алкил-OH (например, этанол) и полисорбат. В дополнительных вариантах осуществления изобретения, водорастворимый эксципиент представляет собой арил-C1-6-алк-OH (например, бензиловый спирт). В других вариантах осуществления изобретения водорастворимый эксципиент представляет собой арил-C1-6-алк-OH (например, бензиловый спирт) и полисорбат. В некоторых вариантах осуществления изобретения водорастворимый эксципиент представляет собой арил-C1-6-алк-OH (например, бензиловый спирт), полисорбат и одну или более буферных солей. В некоторых вариантах осуществления изобретения водорастворимый эксципиент представляет собой C1-6-алкил-ΟΗ (например, этанол), полисорбат и одну или более буферных солей.
[0057] В некоторых вариантах осуществления водные суспензии содержат приблизительно 100 мг/мл фулвестранта, приблизительно 0,5% (масс./масс.) полисорбата 80, приблизительно 5,0% (масс./масс.) маннита, приблизительно 0,16% (масс./масс.) PLASDONE™ C-12, приблизительно 1,2% (масс./масс.) бензилового спирта, приблизительно 0,75% (масс./масс.) полисорбата 20 и 5 мМ буферных солей.
[0058] В некоторых вариантах осуществления водные суспензии содержат фулвестрант ((приблизительно) 100 мг/мл), полисорбат 80 (приблизительно 0,5% (масс./масс.)), маннит (приблизительно 5,0% (масс./масс.)), PLASDONE™ C-12 (приблизительно 0,16% (масс./масс.)), этанол (приблизительно 4% (масс./масс.)) и полисорбат 20 (приблизительно 0,75% (масс./масс.)).
[0059] В некоторых вариантах осуществления водные суспензии содержат фулвестрант (приблизительно 100 мг/мл), полисорбат 80 (приблизительно 0,5% (масс./масс.)), маннит (приблизительно 5,0% (масс./масс.)), PLASDONE™ C-12 (приблизительно 0,16% (масс./масс.)), этанол (приблизительно 2% (масс./масс.)), полисорбат 20 (приблизительно 0,25% (масс./масс.)) и 5 мМ буферных солей.
[0060] В некоторых вариантах осуществления водные суспензии содержат фулвестрант (приблизительно 100 мг/мл), полисорбат 80 (приблизительно 0,5% (масс./масс.)), маннит (приблизительно 5,0% (масс./масс.)), PLASDONE™ C-12 (приблизительно 0,16% (масс./масс.)), бензиловый спирт (приблизительно 2% (масс./масс.)), полисорбат 20 (приблизительно 1,5% (масс./масс.)) и 10 мМ буферных солей. В дополнительных вариантах осуществления изобретения буферные соли включают дигидроортофосфат натрия (KH2PO4)) (приблизительно 0,24% (масс./масс.)).
[0061] В некоторых вариантах осуществления водные суспензии содержат фулвестрант (приблизительно 100 мг/мл), полисорбат 80 (приблизительно 0,5% (масс./масс.)), маннит (приблизительно 5,0% (масс./масс.)), PLASDONE™ C-12 (приблизительно 0,16% (масс./масс.)), бензиловый спирт (приблизительно 1,2% (масс./масс.)), полисорбат 20 (приблизительно 0,75% (масс./масс.)) и 15 мМ буферных солей. В дополнительных вариантах осуществления изобретения буферные соли включают дигидроортофосфат натрия (KH2PO4)) (приблизительно 0,36% (масс./масс.)).
[0062] В некоторых вариантах осуществления водные суспензии содержат фулвестрант (приблизительно 100 мг/мл), полисорбат 80 (приблизительно 0,5% (масс./масс.)), маннит (приблизительно 5,0% (масс./масс.)), PLASDONE™ C-12 (приблизительно 0,16% (масс./масс.)), бензиловый спирт (приблизительно 2% (масс./масс.)), полисорбат 20 (приблизительно 1,5% (масс./масс.)) и 10 мМ буферных солей. В дополнительных вариантах осуществления изобретения, буферные соли включают дигидроортофосфат натрия (KH2PO4)) (приблизительно 0,24% (масс./масс.)).
[0063] В некоторых вариантах осуществления водные суспензии содержат фулвестрант (приблизительно 100 мг/мл), полисорбат 80 (приблизительно 0,5% (масс./масс.)), маннит (приблизительно 5,0% (масс./масс.)), PLASDONE™ C-12 (приблизительно 0,16% (масс./масс.)), бензиловый спирт (приблизительно 1,6% (масс./масс.)), полисорбат 20 (приблизительно 1,2% (масс./масс.)) и 5 мМ буферных солей. В дополнительных вариантах осуществления изобретения буферные соли включают дигидроортофосфат натрия (KH2PO4)) (приблизительно 0,12% (масс./масс.)). В дополнительных вариантах осуществления изобретения водные суспензии могут дополнительно содержать хлорид натрия (приблизительно 0,9% (масс./масс.)).
[0064] В некоторых вариантах осуществления водные суспензии содержат фулвестрант (приблизительно 100 мг/мл), полисорбат 80 (приблизительно 0,5% (масс./масс.)), маннит (приблизительно 5,0% (масс./масс.)), PLASDONE™ C-12 (приблизительно 0,16% (масс./масс.)), бензиловый спирт (приблизительно 1,2% (масс./масс.)), полисорбат 20 (приблизительно 1,5% (масс./масс.)) и 5 мМ буферных солей. В дополнительных вариантах осуществления изобретения буферные соли включают дигидроортофосфат натрия (KH2PO4)) (приблизительно 0,12% (масс./масс.)).
[0065] В некоторых вариантах осуществления водные суспензии имеют pH приблизительно 3-10, например, приблизительно 3, 4, 5, 6, 7, 8, 9 или приблизительно 10. В рамках изобретения pH измеряют с использованием общепринятого оборудования при температуре окружающей среды, например, от 20°C до 25°C, предпочтительно - 23°C. В дополнительных вариантах осуществления изобретения водная суспензия имеет pH приблизительно 5-8. В дополнительных вариантах осуществления изобретения водная суспензия имеет pH приблизительно 6-8. В дополнительных вариантах осуществления изобретения водная суспензия имеет pH приблизительно 3-7. В некоторых вариантах осуществления водная суспензия имеет pH приблизительно от 6,0 до 8,0. В конкретных вариантах осуществления изобретения водная суспензия имеет pH приблизительно от 6,0 до 7,0, от 6,5 до 7,0, от 6,5 до 7,5, от 6,7 до 7,2, от 7,0 до 7,2, от 7,0 до 7,5, или от 7,0 до 8,0. В дополнительных вариантах осуществления изобретения водная суспензия имеет pH приблизительно 7,0.
Способы получения водных суспензий
[0066] В некоторых вариантах осуществления изобретения способы получения водной суспензии включают смешивание водной среды и по меньшей мере одного из поверхностно-активного вещества, поливинилпирролидона, сахарного спирта и водорастворимого эксципиента для получения суспензионного носителя, добавление количества фулвестранта к суспензионному носителю и диспергирование фулвестранта в суспензионном носителе для получения водной суспензии. В дополнительных вариантах осуществления эти способы могут включать гомогенизацию водной суспензии. В дополнительных вариантах осуществления способы со стадией гомогенизации или без нее могут дополнительно включать концентрирование водной суспензии посредством фазового разделения водной суспензии и удаления части супернатанта. В конкретных дополнительных вариантах осуществления после стадии концентрирования способы могут дополнительно включать добавление к гомогенизированной водной суспензии фулвестранта одного или более поверхностно-активных веществ, поливинилпирролидонов, сахарных спиртов и водорастворимых эксципиентов и смешивание одного или более поверхностно-активных веществ, поливинилпирролидонов, сахарных спиртов и водорастворимых эксципиентов в суспензию. В некоторых вариантах осуществления изобретения способы включают стадию диспергирования, осуществляемую с использованием перемешивания с высоким усилием сдвига, стадию гомогенизации, осуществляемую с использованием гомогенизации под высоким давлением, или и стадию диспергирования, осуществляемую с использованием перемешивания с высоким усилием сдвига, и стадию гомогенизации, осуществляемую с использованием гомогенизации под высоким давлением.
[0067] В дополнительных вариантах осуществления изобретения, включающих одно или более поверхностно-активных веществ, поливинилпирролидонов, сахарных спиртов и водорастворимых эксципиентов, одно или более поверхностно-активных веществ, поливинилпирролидонов, сахарных спиртов и водорастворимых эксципиентов можно включать в составы на одной или более стадиях способов получения водных суспензий. В некоторых вариантах осуществления по меньшей мере часть или все из поверхностно-активных веществ, поливинилпирролидонов, сахарных спиртов и водорастворимых эксципиентов в водной суспензии добавляют в водную среду вместе с количеством фулвестранта перед некоторыми или всеми из любых стадий смешивания, гомогенизации или удаления супернатанта. В других вариантах осуществления по меньшей мере часть или все из одного или более поверхностно-активных веществ, поливинилпирролидонов, сахарных спиртов и водорастворимых эксципиентов в водной суспензии добавляют в водные суспензии после завершения некоторых или всех из любых стадий смешивания, гомогенизации или удаления супернатанта. В дополнительных вариантах осуществления по меньшей мере часть или все из поверхностно-активных веществ, поливинилпирролидонов и водорастворимых эксципиентов в водных суспензиях комбинируют с водной средой и фулвестрантом перед некоторыми или всеми из любых стадий смешивания, гомогенизации или удаления супернатанта и по меньшей мере часть или все из сахарных спиртов и водорастворимых эксципиентов добавляют в водную суспензию после некоторых или всех из любых стадий смешивания, гомогенизации или удаления супернатанта.
[0068] Частицы фулвестранта, представленные в настоящем описании, можно получать способом, включающим стадии диспергирования частиц фулвестранта в жидкой суспензионной среде и приложения механических сил в присутствии абразивных сред для снижения размера частиц несолюбилизированного фулвестранта до желаемого размера.
[0069] В дополнительных вариантах осуществления изобретения один или более растворителей, таких как вода, спирт или их комбинация, присутствующих в водной суспензии, можно удалять частично или полностью соответствующими способами, известными в этой области, такими как лиофилизация или сушка распылением, для получения высушенной фармацевтической композиции. В некоторых вариантах осуществления высушенная фармацевтическая композиция может содержать до приблизительно 1%, приблизительно 2%, приблизительно 5%, или приблизительно 10% одного или более растворителей. Высушенные фармацевтические композиции, полученные посредством лиофилизации, могут находиться в форме лиофилизированной таблетки.
[0070] В некоторых вариантах осуществления водные суспензии можно получать посредством восстановления высушенной фармацевтической композиции (например, лиофилизированной таблетки). Восстановление можно осуществлять с использованием подходящего разбавителя. В некоторых вариантах осуществления разбавитель может представлять собой воду для инъекций (WFI). В дополнительных вариантах осуществления разбавитель может представлять собой WFI с хлоридом натрия в количестве от приблизительно 0,01% до приблизительно 1,8% масс./масс., в качестве неограничивающих примеров, такую как нормальный физиологический раствор с 0,9% масс./масс. хлорида натрия. В некоторых вариантах осуществления изобретения по меньшей мере часть эксципиентов, иных, чем фулвестрант, можно исключать из водной суспензии и включать как часть разбавителя и добавлять в водную суспензию после восстановления высушенной фармацевтической композиции с помощью разбавителя для получения конечного состава. В дополнительных вариантах осуществления разбавитель может представлять собой WFI и один или более из водорастворимых эксципиентов, представленных где-либо в настоящем описании. В дополнительных вариантах осуществления разбавитель может представлять собой WFI, один или более из водорастворимых эксципиентов, представленных где-либо в настоящем описании, и один или более из поверхностно-активных веществ, поливинилпирролидонов и сахарных спиртов, представленных где-либо в настоящем описании. В дополнительных вариантах осуществления водные суспензии можно получать с использованием более высоких или более низких концентраций компонентов, чем желаемая концентрация в водных суспензиях для введения, получать из них фармацевтические композиции и помещать во флаконы в подходящих количествах высушенных фармацевтических композиций для достижения целевых доз фулвестранта на флакон для последующего восстановления с использованием подходящего разбавителя для получения желаемой водной суспензии для введения.
Фармакокинетика
[0071] В некоторых вариантах осуществления водные суспензии биоэквивалентны коммерческой фармацевтической композиции FASLODEX®. Параметры PK однократной дозы у пациентов после менопаузы с раком молочной железы на поздней стадии, которым вводили FASLODEX® внутримышечно в дозе 500 мг с дополнительной дозой в день 15, представлены как геометрическое среднее и коэффициент вариации (%), Cmax 25,1 (35,3) нг/мл, Cmin 16,3 (25,9) нг/мл и AUC 11,400 (33,4) нг⋅ч/мл.
[0072] В дополнительных вариантах осуществления изобретения 90%-ные доверительные интервалы (CI) относительной средней Cmax, AUC(0-t) и AUC(0-∞) водной суспензии по изобретению составляют от 80% до 125% от относительной средней Cmax, AUC(0-t) и AUC(0-∞), соответственно, для FASLODEX®. В дополнительных вариантах осуществления изобретения 90%-ные доверительные интервалы (CI) относительной средней Cmax, AUC(0-t) и AUC(0-∞) водной суспензии по изобретению составляют от 80% до 125% от относительной средней Cmax, AUC(0-t) и AUC(0-∞), соответственно, для FASLODEX® натощак. В дополнительных вариантах осуществления изобретения 90%-ные доверительные интервалы (CI) относительной средней Cmax, AUC(0-t) и AUC(0-∞) водной суспензии по изобретению составляют от 80% до 125% от относительной средней Cmax, AUC(0-t) и AUC(0-∞), соответственно, для FASLODEX® после приема пищи.
[0073] В других вариантах осуществления изобретения 90%-ные доверительные интервалы (CI) относительной средней Cmax, AUC(0-t) и AUC(0-∞) водной суспензии по изобретению, имеющей концентрацию фулвестранта 100 мг/мл, составляют от 80% до 125% от относительной средней Cmax, AUC(0-t) и AUC(0-∞), соответственно, для FASLODEX®. В других вариантах осуществления изобретения 90%-ные доверительные интервалы (CI) относительной средней Cmax, AUC(0-t) и AUC(0-∞) водной суспензии по изобретению, имеющей концентрацию фулвестранта 100 мг/мл, составляют от 80% до 125% от относительной средней Cmax, AUC(0-t) и AUC(0-∞), соответственно, для FASLODEX® натощак. В других вариантах осуществления изобретения 90%-ные доверительные интервалы (CI) относительной средней Cmax, AUC(0-t) и AUC(0-∞) водной суспензии по изобретению, имеющей концентрацию фулвестранта 100 мг/мл, составляют от 80% до 125% от относительной средней Cmax, AUC(0-t) и AUC(0-∞), соответственно, для FASLODEX® после приема пищи.
[0074] В конкретных вариантах осуществления изобретения водная суспензия имеет фармакокинетические параметры однократной и многократных доз, приведенные в таблице 1 и 2. В таблице 1 приведены фармакокинетические параметры для дозы 500 мг водных суспензий по изобретению. В случае данных, помеченных как "однократная доза" в таблице 1, данные о концентрации фулвестранта в плазме крови приведены для начальной дозы 500 мг с дополнительной дозой 500 мг, вводимой в день 15. В случае данных, помеченных как "равновесное состояние для многократных доз" в таблице 1, данные о концентрации фулвестранта в плазме крови приведены для измерения в месяц 3, после введения дозы 500 мг в дни 1, 15, 20, а затем один раз в месяц. В таблице 2 приведены фармакокинетические параметры для однократной дозы 250 мг водных суспензий по изобретению. В таблице 2 данные выражены как геометрическое среднее (CV%), за исключением Tmax, представленного в виде медианного значения с диапазоном, указанным в скобках.
Таблица 1
Таблица 2
л)
[0075] В конкретных вариантах осуществления доза приблизительно 500 мг фулвестранта в водной суспензии по изобретению является биоэквивалентной 500 мг коммерческой фармацевтической композиции FASLODEX®. В некоторых вариантах осуществления доза менее 500 мг фулвестранта в водной суспензии по изобретению является биоэквивалентной 500 мг коммерческой фармацевтической композиции FASLODEX®. В дополнительных вариантах осуществления доза приблизительно от 400 до 450 мг фулвестранта в водной суспензии по изобретению является биоэквивалентной 500 мг коммерческой фармацевтической композиции FASLODEX®. В дополнительных вариантах осуществления доза приблизительно от 350 до 400 мг фулвестранта в водной суспензии по изобретению является биоэквивалентной 500 мг коммерческой фармацевтической композиции FASLODEX®. В дополнительных вариантах осуществления доза приблизительно от 300 до 350 мг фулвестранта в водной суспензии по изобретению является биоэквивалентной 500 мг коммерческой фармацевтической композиции FASLODEX®. В дополнительных вариантах осуществления доза приблизительно от 250 до 300 мг фулвестранта в водной суспензии по изобретению является биоэквивалентной 500 мг коммерческой фармацевтической композиции FASLODEX®.
[0076] В других вариантах осуществления изобретения доза 500 мг фулвестранта в водной суспензии по изобретению обеспечивает 90%-ные доверительные интервалы (CI) относительной средней Cmax, AUC(0-t) и AUC(0-∞), составляющие от 80% до 125% от относительной средней Cmax, AUC(0-t) и AUC(0-∞), соответственно, для дозы 500 мг FASLODEX®.
[0077] В других вариантах осуществления изобретения доза менее 500 мг фулвестранта в водной суспензии по изобретению обеспечивает 90%-ные доверительные интервалы (CI) относительной средней Cmax, AUC(0-t) и AUC(0-∞), составляющие от 80% до 125% от относительной средней Cmax, AUC(0-t) и AUC(0-∞), соответственно, дозы 500 мг FASLODEX®.
[0078] В некоторых вариантах осуществления изобретения водные суспензии по изобретению можно вводить в виде однократной внутримышечной инъекции, при этом 90%-ные доверительные интервалы (CI) относительной средней Cmax, AUC(0-t) и AUC(0-∞) фулвестранта составляли от 80% до 125% от относительной средней Cmax, AUC(0-t) и AUC(0-∞), соответственно, фулвестранта после введения 500 мг фулвестранта в форме FASLODEX®, вводимого внутримышечно в виде двух инъекций по 5 мл. В дополнительных вариантах осуществления такие водные суспензии, вводимые в виде однократной внутримышечной инъекции, содержат дозу приблизительно 500 мг фулвестранта. В дополнительных вариантах осуществления такие водные суспензии, вводимые в виде однократной внутримышечной инъекции, содержат дозу приблизительно 500 мг фулвестранта в объеме инъекции от приблизительно 3,0 мл до приблизительно 6,0 мл, от приблизительно 3,0 мл до приблизительно 5,0 мл, от приблизительно 4,5 мл до приблизительно 5,5 мл, от приблизительно 3,5 мл до приблизительно 4,5 мл, приблизительно 3,0 мл, приблизительно 3,5 мл, приблизительно 4,0 мл, приблизительно 4,5 мл или приблизительно 5,0 мл. В некоторых вариантах осуществления изобретения водные суспензии по изобретению можно вводить в виде однократной подкожной инъекции, при этом 90%-ные доверительные интервалы (CI) относительной средней Cmax, AUC(0-t) и AUC(0-∞) фулвестранта составляют от 80% до 125% от относительной средней Cmax, AUC(0-t) и AUC(0-∞), соответственно, фулвестранта после введения 500 мг фулвестранта в форме FASLODEX®, вводимого внутримышечно в виде двух инъекций по 5 мл. В дополнительных вариантах осуществления такие водные суспензии, вводимые в виде однократной подкожной инъекции, содержат дозу приблизительно 500 мг фулвестранта. В дополнительных вариантах осуществления такие водные суспензии, вводимые в виде однократной подкожной инъекции, содержат дозу приблизительно 500 мг фулвестранта в объеме инъекции от приблизительно 3,0 мл до приблизительно 6,0 мл, от приблизительно 3,0 мл до приблизительно 5,0 мл, от приблизительно 4,5 мл до приблизительно 5,5 мл, приблизительно от 3,5 мл до приблизительно 4,5 мл, приблизительно 3,0 мл, приблизительно 3,5 мл, приблизительно 4,0 мл, приблизительно 4,5 мл или приблизительно 5,0 мл.
[0079] В некоторых вариантах осуществления 90%-ные доверительные интервалы (CI) относительной средней AUC(0-t), относительной средней AUC(0-∞) или и той, и другой для водных суспензий по изобретению составляют от 80% до 125% от относительной средней AUC(0-t) и относительной средней AUC(0-∞), соответственно, FASLODEX®, и относительная средняя Cmax водных суспензий по изобретению составляет менее 80% от относительной средней Cmax FASLODEX®. Полагают, что такие варианты осуществления могут обеспечивать преимущества, обеспечивая воздействие терапевтически эффективного количества фулвестранта на субъекта, при этом снижая степень одного или более Cmax-регулируемых побочных эффектов или токсичностей по сравнению со степенью побочных эффектов или токсичностей, переносимых субъектом при введении терапевтически эффективного количества фулвестранта с помощью одной или более доз FASLODEX®.
[0080] В некоторых вариантах осуществления изобретения 90%-ные доверительные интервалы (CI) относительной средней AUC(0-t), относительной средней AUC(0-∞) или и той, и другой для водных суспензий по изобретению составляют от 80% до 125% от относительной средней AUC(0-t) и относительной средней AUC(0-∞), соответственно, для FASLODEX®, и относительная средняя Cmax водных суспензий по изобретению составляет менее 80%, менее 75%, менее 70%, менее 65%, менее 60%, менее 55%, менее 50%, менее 45% или менее 40% от относительной средней Cmax FASLODEX®. В дополнительных вариантах осуществления такие водные суспензии вводят в виде однократной внутримышечной инъекции, и они содержат дозу приблизительно 500 мг фулвестранта в концентрации от приблизительно 80 мг/мл до приблизительно 170 мг/мл или приблизительно 100 мг/мл.
[0081] В дополнительных вариантах осуществления изобретения 90%-ные доверительные интервалы (CI) относительной средней AUC(0-t), относительной средней AUC(0-∞) или и той, и другой для водных суспензий по изобретению составляют от 80% до 125% от относительной средней AUC(0-t) и относительной средней AUC(0-∞), соответственно, для FASLODEX®, и относительная средняя Cmax водных суспензий по изобретению составляет менее 80%, менее 75%, менее 70%, менее 65%, менее 60%, менее 55%, менее 50%, менее 45% или менее 40% от относительной средней Cmax FASLODEX® натощак. В дополнительных вариантах осуществления такие водные суспензии вводят в виде однократной внутримышечной инъекции, и они содержат дозу приблизительно 500 мг фулвестранта в концентрации от приблизительно 80 мг/мл до приблизительно 170 мг/мл или приблизительно 100 мг/мл.
[0082] В дополнительных вариантах осуществления изобретения 90%-ные доверительные интервалы (CI) относительной средней AUC(0-t), относительной средней AUC(0-∞) или и той, и другой для водных суспензий по изобретению составляют от 80% до 125% от относительной средней AUC(0-t) и относительной средней AUC(0-∞), соответственно, для FASLODEX®, и относительная средняя Cmax водных суспензий по изобретению составляет менее 80%, менее 75%, менее 70%, менее 65%, менее 60%, менее 55%, менее 50%, менее 45% или менее 40% от относительной средней Cmax FASLODEX® после приема пищи. В дополнительных вариантах осуществления такие водные суспензии вводят в виде однократной внутримышечной инъекции, и они содержат дозу приблизительно 500 мг фулвестранта в концентрации от приблизительно 80 мг/мл до приблизительно 170 мг/мл или приблизительно 100 мг/мл.
[0083] В некоторых вариантах осуществления изобретения 90%-ные доверительные интервалы (CI) относительной средней AUC(0-t), относительной средней AUC(0-∞) или и той, и другой для водных суспензий по изобретению составляет от 80% до 125% от относительной средней AUC(0-t) и относительной средней AUC(0-∞), соответственно, для FASLODEX®, и относительная средняя Cmax водных суспензий по изобретению составляет приблизительно 45%, приблизительно 50%, приблизительно 55%, приблизительно 60%, приблизительно 65%, приблизительно 70%, приблизительно 75%, приблизительно 80%, приблизительно 85%, приблизительно 90%, от приблизительно 45% до приблизительно 55%, от приблизительно 55% до приблизительно 65%, от приблизительно 65% до приблизительно 75%, от приблизительно 50% до приблизительно 60%, от приблизительно 60% до приблизительно 70% или от приблизительно 70% до приблизительно 80% от относительной средней Cmax FASLODEX®. В дополнительных вариантах осуществления такие водные суспензии вводят в виде однократной внутримышечной инъекции, и они содержат дозу приблизительно 500 мг фулвестранта в концентрации от приблизительно 80 мг/мл до приблизительно 170 мг/мл или приблизительно 100 мг/мл. В дополнительных вариантах осуществления такие водные суспензии вводят в виде однократной подкожной инъекции, и они содержат дозу приблизительно 500 мг фулвестранта в концентрации от приблизительно 80 мг/мл до приблизительно 170 мг/мл или приблизительно 100 мг/мл.
[0084] В дополнительных вариантах осуществления изобретения 90%-ные доверительные интервалы (CI) относительной средней AUC(0-t), относительной средней AUC(0-∞) или и той, и другой для водных суспензий по изобретению составляют от 80% до 125% от относительной средней AUC(0-t) и относительной средней AUC(0-∞), соответственно, для FASLODEX®, относительная средняя Cmax водных суспензий по изобретению составляет приблизительно 45%, приблизительно 50%, приблизительно 55%, приблизительно 60%, приблизительно 65%, приблизительно 70%, приблизительно 75%, приблизительно 80%, приблизительно 85%, приблизительно 90%, от приблизительно 45% до приблизительно 55%, от приблизительно 55% до приблизительно 65%, от приблизительно 65% до приблизительно 75%, от приблизительно 50% до приблизительно 60%, от приблизительно 60% до приблизительно 70% или от приблизительно 70% до приблизительно 80% от относительной средней Cmax FASLODEX® натощак. В дополнительных вариантах осуществления такие водные суспензии вводят в виде однократной внутримышечной инъекции, и они содержат дозу приблизительно 500 мг фулвестранта в концентрации от приблизительно 80 мг/мл до приблизительно 170 мг/мл или приблизительно 100 мг/мл. В дополнительных вариантах осуществления такие водные суспензии вводят в виде однократной подкожной инъекции, и они содержат дозу приблизительно 500 мг фулвестранта в концентрации от приблизительно 80 мг/мл до приблизительно 170 мг/мл или приблизительно 100 мг/мл.
[0085] В дополнительных вариантах осуществления изобретения, 90%-ные доверительные интервалы (CI) относительной средней AUC(0-t), относительной средней AUC(0-∞) или и той, и другой для водных суспензий по изобретению составляют от 80% до 125% от относительной средней AUC(0-t) и относительной средней AUC(0-∞), соответственно, для FASLODEX®, и относительная средняя Cmax водных суспензий по изобретению составляет приблизительно 45%, приблизительно 50%, приблизительно 55%, приблизительно 60%, приблизительно 65%, приблизительно 70%, приблизительно 75%, приблизительно 80%, приблизительно 85%, приблизительно 90%, от приблизительно 45% до приблизительно 55%, от приблизительно 55% до приблизительно 65%, от приблизительно 65% до приблизительно 75%, от приблизительно 50% до приблизительно 60%, от приблизительно 60% до приблизительно 70% или от приблизительно 70% до приблизительно 80% от относительной средней Cmax FASLODEX® после приема пищи. В дополнительных вариантах осуществления такие водные суспензии вводят в виде однократной внутримышечной инъекции, и они содержат дозу приблизительно 500 мг фулвестранта в концентрации от приблизительно 80 мг/мл до приблизительно 170 мг/мл или приблизительно 100 мг/мл. В дополнительных вариантах осуществления такие водные суспензии вводят в виде однократной подкожной инъекции, и они содержат дозу приблизительно 500 мг фулвестранта в концентрации от приблизительно 80 мг/мл до приблизительно 170 мг/мл или приблизительно 100 мг/мл.
[0086] В конкретных вариантах осуществления доза более 500 мг фулвестранта в водной суспензии по изобретению, например, до приблизительно 3000 мг, является биоэквивалентной 500 мг коммерческой фармацевтической композиции FASLODEX®. В некоторых вариантах осуществления доза приблизительно 550, 600, 650, 700, 750, 800, 850, 900, 950, 1000, 1100, 1200, 1300, 1400, 1500, 1600, 1700, 1800, 1900, 2000, 2100, 2200, 2300, 2400, 2500, 2600, 2700, 2800, 2900 или приблизительно 3000 мг фулвестранта в водной суспензии по изобретению является биоэквивалентной 500 мг коммерческой фармацевтической композиции FASLODEX®. В дополнительных вариантах осуществления доза приблизительно от 500 до 1000 мг фулвестранта в водной суспензии по изобретению является биоэквивалентной 500 мг коммерческой фармацевтической композиции FASLODEX®. В дополнительных вариантах осуществления доза приблизительно от 1000 до 2000 мг фулвестранта в водной суспензии по изобретению является биоэквивалентной 500 мг коммерческой фармацевтической композиции FASLODEX®. В дополнительных вариантах осуществления доза приблизительно от 2000 до 3000 мг фулвестранта в водной суспензии по изобретению является биоэквивалентной 500 мг коммерческой фармацевтической композиции, FASLODEX®. В дополнительных вариантах осуществления доза приблизительно от 750 до 1000 мг фулвестранта в водной суспензии по изобретению является биоэквивалентной 500 мг коммерческой фармацевтической композиции FASLODEX®.
[0087] В других вариантах осуществления изобретения доза более 500 мг фулвестранта в водной суспензии по изобретению, например, до приблизительно 3000 мг, обеспечивает 90%-ные доверительные интервалы (CI) относительной средней Cmax, AUC(0-t) и AUC(0-∞) от 80% до 125% от относительной средней Cmax, AUC(0-t) и AUC(0-∞), соответственно, для дозы 500 мг FASLODEX®. Например, доза приблизительно 550, 600, 650, 700, 750, 800, 850, 900, 950, 1000, 1100, 1200, 1300, 1400, 1500, 1600, 1700, 1800, 1900, 2000, 2100, 2200, 2300, 2400, 2500, 2600, 2700, 2800, 2900 или приблизительно 3000 мг фулвестранта в водной суспензии по изобретению обеспечивает 90%-ные доверительные интервалы (CI) относительной средней Cmax, AUC(0-t) и AUC(0-∞) от 80% до 125% от относительной средней Cmax, AUC(0-t) и AUC(0-∞), соответственно, для дозы 500 мг FASLODEX®.
[0088] В некоторых вариантах осуществления изобретения водные суспензии по изобретению, содержащие более 500 мг фулвестранта, например, до приблизительно 3000 мг, можно вводить в виде однократной внутримышечной инъекции, при этом 90%-ные доверительные интервалы (CI) относительной средней Cmax, AUC(0-t) и AUC(0-∞) фулвестранта составляют от 80% до 125% от относительной средней Cmax, AUC(0-t) и AUC(0-∞), соответственно, фулвестранта после введения 500 мг фулвестранта в форме FASLODEX®, вводимого внутримышечно в виде двух инъекций по 5 мл. Например, водные суспензии по изобретению, содержащие приблизительно 550, 600, 650, 700, 750, 800, 850, 900, 950, 1000, 1100, 1200, 1300, 1400, 1500, 1600, 1700, 1800, 1900, 2000, 2100, 2200, 2300, 2400, 2500, 2600, 2700, 2800, 2900 или приблизительно 3000 мг фулвестранта можно вводить в виде однократной внутримышечной инъекции, при этом 90%-ные доверительные интервалы (CI) относительной средней Cmax, AUC(0-t) и AUC(0-∞) фулвестранта составляют от 80% до 125% от относительной средней Cmax, AUC(0-t) и AUC(0-∞), соответственно, фулвестранта после введения 500 мг фулвестранта в форме FASLODEX®, вводимого внутримышечно в виде двух инъекций по 5 мл.
[0089] В дополнительных вариантах осуществления такие водные суспензии, вводимые в виде однократной внутримышечной инъекции, содержат дозу более 500 мг фулвестранта, например, до приблизительно 3000 мг фулвестранта, в объеме инъекции от приблизительно 3,0 мл до приблизительно 6,0 мл, от приблизительно 3,0 мл до приблизительно 5,0 мл, от приблизительно 4,5 мл до приблизительно 5,5 мл, от приблизительно 3,5 мл до приблизительно 4,5 мл, приблизительно 3,0 мл, приблизительно 3,5 мл, приблизительно 4,0 мл, приблизительно 4,5 мл или приблизительно 5,0 мл. Например, водные суспензии по изобретению, вводимые в виде однократной внутримышечной инъекции, содержат приблизительно 550, 600, 650, 700, 750, 800, 850, 900, 950, 1000, 1100, 1200, 1300, 1400, 1500, 1600, 1700, 1800, 1900, 2000, 2100, 2200, 2300, 2400, 2500, 2600, 2700, 2800, 2900 или приблизительно 3000 мг фулвестранта в объеме инъекции от приблизительно 3,0 мл до приблизительно 6,0 мл, от приблизительно 3,0 мл до приблизительно 5,0 мл, от приблизительно 4,5 мл до приблизительно 5,5 мл, от приблизительно 3,5 мл до приблизительно 4,5 мл, приблизительно 3,0 мл, приблизительно 3,5 мл, приблизительно 4,0 мл, приблизительно 4,5 мл или приблизительно 5,0 мл.
[0090] В некоторых вариантах осуществления изобретения водные суспензии по изобретению, содержащие более 500 мг фулвестранта, например, до приблизительно 3000 мг, можно вводить в виде однократной подкожной инъекции, при этом 90%-ные доверительные интервалы (CI) относительной средней Cmax, AUC(0-t) и AUC(0-∞) фулвестранта составляют от 80% до 125% от относительной средней Cmax, AUC(0-t) и AUC(0-∞), соответственно, фулвестранта после введения 500 мг фулвестранта в форме FASLODEX®, вводимого внутримышечно в виде двух инъекций по 5 мл. В дополнительных вариантах осуществления такие водные суспензии, вводимые в виде однократной подкожной инъекции, содержат дозу 550, 600, 650, 700, 750, 800, 850, 900, 950, 1000, 1100, 1200, 1300, 1400, 1500, 1600, 1700, 1800, 1900, 2000, 2100, 2200, 2300, 2400, 2500, 2600, 2700, 2800, 2900 или приблизительно 3000 мг фулвестранта. В дополнительных вариантах осуществления такие водные суспензии, вводимые в виде однократной подкожной инъекции, содержат дозу более 500 мг фулвестранта, например, до приблизительно 3000 мг, в объеме инъекции от приблизительно 3,0 мл до приблизительно 6,0 мл, от приблизительно 3,0 мл до приблизительно 5,0 мл, от приблизительно 4,5 мл до приблизительно 5,5 мл, от приблизительно 3,5 мл до приблизительно 4,5 мл, приблизительно 3,0 мл, приблизительно 3,5 мл, приблизительно 4,0 мл, приблизительно 4,5 мл или приблизительно 5,0 мл.
[0091] В некоторых вариантах осуществления изобретения водные суспензии вводят в виде однократной внутримышечной инъекции, и они содержат дозу более 500 мг фулвестранта, например, до приблизительно 3000 мг (например, 550, 600, 650, 700, 750, 800, 850, 900, 950, 1000, 1100, 1200, 1300, 1400, 1500, 1600, 1700, 1800, 1900, 2000, 2100, 2200, 2300, 2400, 2500, 2600, 2700, 2800, 2900 или приблизительно 3000 мг фулвестранта), в концентрации от приблизительно 80 мг/мл до приблизительно 170 мг/мл или приблизительно 100 мг/мл, и 90%-ные доверительные интервалы (CI) относительной средней AUC(0-t), относительной средней AUC(0-∞) или и той, и другой для водных суспензий по изобретению составляют от 80% до 125% относительной средней AUC(0-t) и относительной средней AUC(0-∞), соответственно, FASLODEX®, и относительная средняя Cmax водных суспензий по изобретению составляет менее 80%, менее 75%, менее 70%, менее 65%, менее 60%, менее 55%, менее 50%, менее 45% или менее 40% от относительной средней Cmax FASLODEX®.
[0092] В дополнительных вариантах осуществления изобретения водные суспензии вводят в виде однократной внутримышечной инъекции, и они содержат дозу более 500 мг фулвестранта, например, до приблизительно 3000 мг (например, 550, 600, 650, 700, 750, 800, 850, 900, 950, 1000, 1100, 1200, 1300, 1400, 1500, 1600, 1700, 1800, 1900, 2000, 2100, 2200, 2300, 2400, 2500, 2600, 2700, 2800, 2900 или приблизительно 3000 мг фулвестранта), в концентрации от приблизительно 80 мг/мл до приблизительно 170 мг/мл или приблизительно 100 мг/мл, и 90%-ные доверительные интервалы (CI) относительной средней AUC(0-t), относительной средней AUC(0-∞) или и той, и другой для водных суспензий по изобретению составляют от 80% до 125% от относительной средней AUC(0-t) и относительной средней AUC(0-∞), соответственно, FASLODEX®, и относительная средняя Cmax водных суспензий по изобретению составляет менее 80%, менее 75%, менее 70%, менее 65%, менее 60%, менее 55%, менее 50%, менее 45% или менее 40% от относительной средней Cmax FASLODEX® натощак.
[0093] В дополнительных вариантах осуществления изобретения, водные суспензии вводят в виде однократной внутримышечной инъекции, и они содержат дозу более 500 мг фулвестранта, например, до приблизительно 3000 мг (например, 550, 600, 650, 700, 750, 800, 850, 900, 950, 1000, 1100, 1200, 1300, 1400, 1500, 1600, 1700, 1800, 1900, 2000, 2100, 2200, 2300, 2400, 2500, 2600, 2700, 2800, 2900 или приблизительно 3000 мг фулвестранта), в концентрации приблизительно от 80 мг/мл до приблизительно 170 мг/мл или приблизительно 100 мг/мл, и 90%-ные доверительные интервалы (CI) относительной средней AUC(0-t), относительной средней AUC(0-∞) или и той, и другой для водных суспензий по изобретению составляют от 80% до 125% от относительной средней AUC(0-t) и относительной средней AUC(0-∞), соответственно, для FASLODEX®, и относительная средняя Cmax водных суспензий по изобретению составляет менее 80%, менее 75%, менее 70%, менее 65%, менее 60%, менее 55%, менее 50%, менее 45% или менее 40% от относительной средней Cmax FASLODEX® после приема пищи.
[0094] В некоторых вариантах осуществления изобретения водные суспензии вводят в виде однократной внутримышечной инъекции, и они содержат дозу более 500 мг фулвестранта, например, до приблизительно 3000 мг (например, 550, 600, 650, 700, 750, 800, 850, 900, 950, 1000, 1100, 1200, 1300, 1400, 1500, 1600, 1700, 1800, 1900, 2000, 2100, 2200, 2300, 2400, 2500, 2600, 2700, 2800, 2900 или приблизительно 3000 мг фулвестранта), в концентрации от приблизительно 80 мг/мл до приблизительно 170 мг/мл или приблизительно 100 мг/мл, и 90%-ные доверительные интервалы (CI) относительной средней AUC(0-t), относительной средней AUC(0-∞) или и той, и другой для водных суспензий по изобретению составляют от 80% до 125% относительной средней AUC(0-t) и относительной средней AUC(0-∞), соответственно, для FASLODEX®, и относительная средняя Cmax водных суспензий по изобретению составляет приблизительно 45%, приблизительно 50%, приблизительно 55%, приблизительно 60%, приблизительно 65%, приблизительно 70%, приблизительно 75%, приблизительно 80%, приблизительно 85%, приблизительно 90%, от приблизительно 45% до приблизительно 55%, от приблизительно 55% до приблизительно 65%, от приблизительно 65% до приблизительно 75%, от приблизительно 50% до приблизительно 60%, от приблизительно 60% до приблизительно 70% или от приблизительно 70% до приблизительно 80% от относительной средней Cmax FASLODEX®.
[0095] В дополнительных вариантах осуществления изобретения водные суспензии вводят в виде однократной внутримышечной инъекции, и они содержат дозу более 500 мг фулвестранта, например, до приблизительно 3000 мг (например, 550, 600, 650, 700, 750, 800, 850, 900, 950, 1000, 1100, 1200, 1300, 1400, 1500, 1600, 1700, 1800, 1900, 2000, 2100, 2200, 2300, 2400, 2500, 2600, 2700, 2800, 2900 или приблизительно 3000 мг фулвестранта), в концентрации от приблизительно 80 мг/мл до приблизительно 170 мг/мл или приблизительно 100 мг/мл, и 90%-ные доверительные интервалы (CI) относительной средней AUC(0-t), относительной средней AUC(0-∞) или и той, и другой для водных суспензий по изобретению составляют от 80% до 125% от относительной средней AUC(0-t) и относительной средней AUC(0-∞), соответственно, для FASLODEX®, относительная средняя Cmax водных суспензий по изобретению составляет приблизительно 45%, приблизительно 50%, приблизительно 55%, приблизительно 60%, приблизительно 65%, приблизительно 70%, приблизительно 75%, приблизительно 80%, приблизительно 85%, приблизительно 90%, от приблизительно 45% до приблизительно 55%, от приблизительно 55% до приблизительно 65%, от приблизительно 65% до приблизительно 75%, от приблизительно 50% до приблизительно 60%, от приблизительно 60% до приблизительно 70% или от приблизительно 70% до приблизительно 80% от относительной средней Cmax FASLODEX® натощак.
[0096] В дополнительных вариантах осуществления изобретения водные суспензии вводят в виде однократной внутримышечной инъекции, и они содержат дозу более 500 мг фулвестранта, например, до приблизительно 3000 мг (например, 550, 600, 650, 700, 750, 800, 850, 900, 950, 1000, 1100, 1200, 1300, 1400, 1500, 1600, 1700, 1800, 1900, 2000, 2100, 2200, 2300, 2400, 2500, 2600, 2700, 2800, 2900 или приблизительно 3000 мг фулвестранта), в концентрации от приблизительно 80 мг/мл до приблизительно 170 мг/мл или приблизительно 100 мг/мл, и 90%-ные доверительные интервалы (CI) относительной средней AUC(0-t), относительной средней AUC(0-∞) или и той, и другой для водных суспензий по изобретению составляют от 80% до 125% от относительной средней AUC(0-t) и относительной средней AUC(0-∞), соответственно, для FASLODEX®, и относительная средняя Cmax водных суспензий по изобретению составляет приблизительно 45%, приблизительно 50%, приблизительно 55%, приблизительно 60%, приблизительно 65%, приблизительно 70%, приблизительно 75%, приблизительно 80%, приблизительно 85%, приблизительно 90%, от приблизительно 45% до приблизительно 55%, от приблизительно 55% до приблизительно 65%, от приблизительно 65% до приблизительно 75%, от приблизительно 50% до приблизительно 60%, от приблизительно 60% до приблизительно 70% или от приблизительно 70% до приблизительно 80% от относительной средней Cmax FASLODEX® после приема пищи.
[0097] В некоторых вариантах осуществления изобретения водные суспензии по изобретению, содержащие более 500 мг фулвестранта, например, до приблизительно 3000 мг, можно вводить в виде двух внутримышечных инъекций, при этом 90%-ные доверительные интервалы (CI) относительной средней Cmax, AUC(0-t) и AUC(0-∞) фулвестранта составляют от 80% до 125% от относительной средней Cmax, AUC(0-t) и AUC(0-∞), соответственно, фулвестранта после введения 500 мг фулвестранта в форме FASLODEX®, вводимого внутримышечно в виде двух инъекций по 5 мл. Например, водные суспензии по изобретению, содержащие приблизительно 550, 600, 650, 700, 750, 800, 850, 900, 950, 1000, 1100, 1200, 1300, 1400, 1500, 1600, 1700, 1800, 1900, 2000, 2100, 2200, 2300, 2400, 2500, 2600, 2700, 2800, 2900 или приблизительно 3000 мг фулвестранта можно вводить в виде двух внутримышечных инъекций, при этом 90%-ные доверительные интервалы (CI) относительной средней Cmax, AUC(0-t) и AUC(0-∞) фулвестранта составляют от 80% до 125% от относительной средней Cmax, AUC(0-t) и AUC(0-∞), соответственно, фулвестранта после введения 500 мг фулвестранта в форме FASLODEX®, вводимого внутримышечно в виде двух инъекций по 5 мл.
[0098] В дополнительных вариантах осуществления такие водные суспензии, вводимые в виде двух внутримышечных инъекций, содержат дозу более 500 мг фулвестранта, например, до приблизительно 3000 мг фулвестранта, в объеме инъекции в случае каждой инъекции от приблизительно 3,0 мл до приблизительно 6,0 мл, от приблизительно 3,0 мл до приблизительно 5,0 мл, от приблизительно 4,5 мл до приблизительно 5,5 мл, от приблизительно 3,5 мл до приблизительно 4,5 мл, приблизительно 3,0 мл, приблизительно 3,5 мл, приблизительно 4,0 мл, приблизительно 4,5 мл или приблизительно 5,0 мл. Например, водные суспензии по изобретению, вводимые в виде двух внутримышечных инъекций, содержат приблизительно 550, 600, 650, 700, 750, 800, 850, 900, 950, 1000, 1100, 1200, 1300, 1400, 1500, 1600, 1700, 1800, 1900, 2000, 2100, 2200, 2300, 2400, 2500, 2600, 2700, 2800, 2900 или приблизительно 3000 мг фулвестранта в объеме инъекции в случае каждой инъекции от приблизительно 3,0 мл до приблизительно 6,0 мл, от приблизительно 3,0 мл до приблизительно 5,0 мл, от приблизительно 4,5 мл до приблизительно 5,5 мл, от приблизительно 3,5 мл до приблизительно 4,5 мл, приблизительно 3,0 мл, приблизительно 3,5 мл, приблизительно 4,0 мл, приблизительно 4,5 мл или приблизительно 5,0 мл.
[0099] В некоторых вариантах осуществления изобретения водные суспензии по изобретению, содержащие более 500 мг фулвестранта, например, до приблизительно 3000 мг, можно вводить в виде двух подкожных инъекций, при этом 90%-ные доверительные интервалы (CI) относительной средней Cmax, AUC(0-t) и AUC(0-∞) фулвестранта составляют от 80% до 125% от относительной средней Cmax, AUC(0-t) и AUC(0-∞), соответственно, фулвестранта после введения 500 мг фулвестранта в форме FASLODEX®, вводимого внутримышечно в виде двух инъекций по 5 мл. В дополнительных вариантах осуществления такие водные суспензии, вводимые в виде двух подкожных инъекций, содержат дозу 550, 600, 650, 700, 750, 800, 850, 900, 950, 1000, 1100, 1200, 1300, 1400, 1500, 1600, 1700, 1800, 1900, 2000, 2100, 2200, 2300, 2400, 2500, 2600, 2700, 2800, 2900 или приблизительно 3000 мг фулвестранта. В дополнительных вариантах осуществления такие водные суспензии, вводимые в виде двух подкожных инъекций, содержат дозу более 500 мг фулвестранта, например, до приблизительно 3000 мг, в объеме инъекции в случае каждой инъекции от приблизительно 3,0 мл до приблизительно 6,0 мл, от приблизительно 3,0 мл до приблизительно 5,0 мл, от приблизительно 4,5 мл до приблизительно 5,5 мл, от приблизительно 3,5 мл до приблизительно 4,5 мл, приблизительно 3,0 мл, приблизительно 3,5 мл, приблизительно 4,0 мл, приблизительно 4,5 мл или приблизительно 5,0 мл.
[00100] В некоторых вариантах осуществления изобретения водные суспензии вводят в виде двух внутримышечных инъекций, и они содержат дозу более 500 мг фулвестранта, например, до приблизительно 3000 мг (например, 550, 600, 650, 700, 750, 800, 850, 900, 950, 1000, 1100, 1200, 1300, 1400, 1500, 1600, 1700, 1800, 1900, 2000, 2100, 2200, 2300, 2400, 2500, 2600, 2700, 2800, 2900 или приблизительно 3000 мг фулвестранта), в концентрации от приблизительно 80 мг/мл до приблизительно 170 мг/мл или приблизительно 100 мг/мл, и 90%-ные доверительные интервалы (CI) относительной средней AUC(0-t), относительной средней AUC(0-∞) или и той, и другой для водных суспензий по изобретению составляют от 80% до 125% относительной средней AUC(0-t) и относительной средней AUC(0-∞), соответственно, для FASLODEX®, и относительная средняя Cmax водных суспензий по изобретению составляет менее 80%, менее 75%, менее 70%, менее 65%, менее 60%, менее 55%, менее 50%, менее 45% или менее 40% от относительной средней Cmax FASLODEX®.
[00101] В дополнительных вариантах осуществления изобретения водные суспензии вводят в виде двух внутримышечных инъекций, и они содержат дозу более 500 мг фулвестранта, например, до приблизительно 3000 мг (например, 550, 600, 650, 700, 750, 800, 850, 900, 950, 1000, 1100, 1200, 1300, 1400, 1500, 1600, 1700, 1800, 1900, 2000, 2100, 2200, 2300, 2400, 2500, 2600, 2700, 2800, 2900 или приблизительно 3000 мг фулвестранта), в концентрации от приблизительно 80 мг/мл до приблизительно 170 мг/мл или приблизительно 100 мг/мл, и 90%-ные доверительные интервалы (CI) относительной средней AUC(0-t), относительной средней AUC(0-∞) или и той, и другой для водных суспензий по изобретению составляют от 80% до 125% относительной средней AUC(0-t) и относительной средней AUC(0-∞), соответственно, для FASLODEX®, и относительная средняя Cmax водных суспензий по изобретению составляет менее 80%, менее 75%, менее 70%, менее 65%, менее 60%, менее 55%, менее 50%, менее 45% или менее 40% от относительной средней Cmax FASLODEX® натощак.
[00102] В дополнительных вариантах осуществления изобретения водные суспензии вводят в виде двух внутримышечных инъекций, и они содержат дозу более 500 мг фулвестранта, например, до приблизительно 3000 мг (например, 550, 600, 650, 700, 750, 800, 850, 900, 950, 1000, 1100, 1200, 1300, 1400, 1500, 1600, 1700, 1800, 1900, 2000, 2100, 2200, 2300, 2400, 2500, 2600, 2700, 2800, 2900 или приблизительно 3000 мг фулвестранта), в концентрации от приблизительно 80 мг/мл до приблизительно 170 мг/мл или приблизительно 100 мг/мл, и 90%-ные доверительные интервалы (CI) относительной средней AUC(0-t), относительной средней AUC(0-∞) или и той, и другой для водных суспензий по изобретению составляют от 80% до 125% относительной средней AUC(0-t) и относительной средней AUC(0-∞), соответственно, для FASLODEX®, и относительная средняя Cmax водных суспензий по изобретению составляет менее 80%, менее 75%, менее 70%, менее 65%, менее 60%, менее 55%, менее 50%, менее 45% или менее 40% от относительной средней Cmax FASLODEX® после приема пищи.
[00103] В некоторых вариантах осуществления изобретения водные суспензии вводят в виде двух внутримышечных инъекций, и они содержат дозу более 500 мг фулвестранта, например, до приблизительно 3000 мг (например, 550, 600, 650, 700, 750, 800, 850, 900, 950, 1000, 1100, 1200, 1300, 1400, 1500, 1600, 1700, 1800, 1900, 2000, 2100, 2200, 2300, 2400, 2500, 2600, 2700, 2800, 2900 или приблизительно 3000 мг фулвестранта), в концентрации от приблизительно 80 мг/мл до приблизительно 170 мг/мл или приблизительно 100 мг/мл, и 90%-ные доверительные интервалы (CI) относительной средней AUC(0-t), относительной средней AUC(0-∞) или и той, и другой для водных суспензий по изобретению составляют от 80% до 125% относительной средней AUC(0-t) и относительной средней AUC(0-∞), соответственно, для FASLODEX®, и относительная средняя Cmax водных суспензий по изобретению составляет приблизительно 45%, приблизительно 50%, приблизительно 55%, приблизительно 60%, приблизительно 65%, приблизительно 70%, приблизительно 75%, приблизительно 80%, приблизительно 85%, приблизительно 90%, от приблизительно 45% до приблизительно 55%, от приблизительно 55% до приблизительно 65%, от приблизительно 65% до приблизительно 75%, от приблизительно 50% до приблизительно 60%, от приблизительно 60% до приблизительно 70% или от приблизительно 70% до приблизительно 80% от относительной средней Cmax FASLODEX®.
[00104] В дополнительных вариантах осуществления изобретения водные суспензии вводят в виде двух внутримышечных инъекций, и они содержат дозу более 500 мг фулвестранта, например, до приблизительно 3000 мг (например, 550, 600, 650, 700, 750, 800, 850, 900, 950, 1000, 1100, 1200, 1300, 1400, 1500, 1600, 1700, 1800, 1900, 2000, 2100, 2200, 2300, 2400, 2500, 2600, 2700, 2800, 2900 или приблизительно 3000 мг фулвестранта), в концентрации от приблизительно 80 мг/мл до приблизительно 170 мг/мл или приблизительно 100 мг/мл, и 90%-ные доверительные интервалы (CI) относительной средней AUC(0-t), относительной средней AUC(0-∞) или и той, и другой для водных суспензий по изобретению составляют от 80% до 125% относительной средней AUC(0-t) и относительной средней AUC(0-∞), соответственно, для FASLODEX®, относительная средняя Cmax водных суспензий по изобретению составляет приблизительно 45%, приблизительно 50%, приблизительно 55%, приблизительно 60%, приблизительно 65%, приблизительно 70%, приблизительно 75%, приблизительно 80%, приблизительно 85%, приблизительно 90%, от приблизительно 45% до приблизительно 55%, от приблизительно 55% до приблизительно 65%, от приблизительно 65% до приблизительно 75%, от приблизительно 50% до приблизительно 60%, от приблизительно 60% до приблизительно 70% или от приблизительно 70% до приблизительно 80% от относительной средней Cmax FASLODEX® натощак.
[00105] В дополнительных вариантах осуществления изобретения водные суспензии вводят в виде двух внутримышечных инъекций, и они содержат дозу более 500 мг фулвестранта, например, до приблизительно 3000 мг (например, 550, 600, 650, 700, 750, 800, 850, 900, 950, 1000, 1100, 1200, 1300, 1400, 1500, 1600, 1700, 1800, 1900, 2000, 2100, 2200, 2300, 2400, 2500, 2600, 2700, 2800, 2900 или приблизительно 3000 мг фулвестранта), в концентрации от приблизительно 80 мг/мл до приблизительно 170 мг/мл или приблизительно 100 мг/мл, и 90%-ные доверительные интервалы (CI) относительной средней AUC(0-t), относительной средней AUC(0-∞) или и той, и другой для водных суспензий по изобретению составляют от 80% до 125% относительной средней AUC(0-t) и относительной средней AUC(0-∞), соответственно, для FASLODEX®, и относительная средняя Cmax водных суспензий по изобретению составляет приблизительно 45%, приблизительно 50%, приблизительно 55%, приблизительно 60%, приблизительно 65%, приблизительно 70%, приблизительно 75%, приблизительно 80%, приблизительно 85%, приблизительно 90%, от приблизительно 45% до приблизительно 55%, от приблизительно 55% до приблизительно 65%, от приблизительно 65% до приблизительно 75%, от приблизительно 50% до приблизительно 60%, от приблизительно 60% до приблизительно 70% или от приблизительно 70% до приблизительно 80% от относительной средней Cmax FASLODEX® после приема пищи.
[00106] В некоторых вариантах осуществления изобретения водные суспензии по изобретению, содержащие более 500 мг фулвестранта, например, до приблизительно 3000 мг, можно вводить в виде трех или более внутримышечных инъекций, при этом 90%-ные доверительные интервалы (CI) относительной средней Cmax, AUC(0-t) и AUC(0-∞) фулвестранта составляют от 80% до 125% от относительной средней Cmax, AUC(0-t) и AUC(0-∞), соответственно, фулвестранта после введения 500 мг фулвестранта в форме FASLODEX®, вводимого внутримышечно в виде двух инъекций по 5 мл. Например, водные суспензии по изобретению, содержащие 550, 600, 650 приблизительно 700, 750, 800, 850, 900, 950, 1000, 1100, 1200, 1300, 1400, 1500, 1600, 1700, 1800, 1900, 2000, 2100, 2200, 2300, 2400, 2500, 2600, 2700, 2800, 2900 или приблизительно 3000 мг фулвестранта можно вводить в виде трех или более внутримышечных инъекций, при этом 90%-ные доверительные интервалы (CI) относительной средней Cmax, AUC(0-t) и AUC(0-∞) фулвестранта составляют от 80% до 125% от относительной средней Cmax, AUC(0-t) и AUC(0-∞), соответственно, фулвестранта после введения 500 мг фулвестранта в форме FASLODEX®, вводимого внутримышечно в виде двух инъекций по 5 мл.
[00107] В дополнительных вариантах осуществления такие водные суспензии, вводимые в виде трех или более внутримышечных инъекций, содержат дозу более 500 мг фулвестранта, например, до приблизительно 3000 мг фулвестранта, в объеме инъекции в случае каждой инъекции от приблизительно 3,0 мл до приблизительно 6,0 мл, от приблизительно 3,0 мл до приблизительно 5,0 мл, от приблизительно 4,5 мл до приблизительно 5,5 мл, от приблизительно 3,5 мл до приблизительно 4,5 мл, приблизительно 3,0 мл, приблизительно 3,5 мл, приблизительно 4,0 мл, приблизительно 4,5 мл или приблизительно 5,0 мл. Например, водные суспензии по изобретению, вводимые в виде трех или более внутримышечных инъекций, содержат приблизительно 550, 600, 650, 700, 750, 800, 850, 900, 950, 1000, 1100, 1200, 1300, 1400, 1500, 1600, 1700, 1800, 1900, 2000, 2100, 2200, 2300, 2400, 2500, 2600, 2700, 2800, 2900 или приблизительно 3000 мг фулвестранта в объеме инъекции в случае каждой инъекции от приблизительно 3,0 мл до приблизительно 6,0 мл, от приблизительно 3,0 мл до приблизительно 5,0 мл, от приблизительно 4,5 мл до приблизительно 5,5 мл, от приблизительно 3,5 мл до приблизительно 4,5 мл, приблизительно 3,0 мл, приблизительно 3,5 мл, приблизительно 4,0 мл, приблизительно 4,5 мл или приблизительно 5,0 мл.
[00108] В некоторых вариантах осуществления изобретения водные суспензии по изобретению, содержащие более 500 мг фулвестранта, например, до приблизительно 3000 мг, можно вводить в виде трех или более подкожных инъекций, при этом 90%-ные доверительные интервалы (CI) относительной средней Cmax, AUC(0-t) и AUC(0-∞) фулвестранта составляют от 80% до 125% от относительной средней Cmax, AUC(0-t) и AUC(0-∞), соответственно, фулвестранта после введения 500 мг фулвестранта в форме FASLODEX®, вводимого внутримышечно в виде двух инъекций по 5 мл. В дополнительных вариантах осуществления такие водные суспензии, вводимые в виде трех или более подкожных инъекций, содержат дозу 550, 600, 650, 700, 750, 800, 850, 900, 950, 1000, 1100, 1200, 1300, 1400, 1500, 1600, 1700, 1800, 1900, 2000, 2100, 2200, 2300, 2400, 2500, 2600, 2700, 2800, 2900 или приблизительно 3000 мг фулвестранта. В дополнительных вариантах осуществления такие водные суспензии, вводимые в виде трех или более подкожных инъекций, содержат дозу более 500 мг фулвестранта, например, до приблизительно 3000 мг, в объеме инъекции в случае каждой инъекции от приблизительно 3,0 мл до приблизительно 6,0 мл, от приблизительно 3,0 мл до приблизительно 5,0 мл, от приблизительно 4,5 мл до приблизительно 5,5 мл, от приблизительно 3,5 мл до приблизительно 4,5 мл, приблизительно 3,0 мл, приблизительно 3,5 мл, приблизительно 4,0 мл, приблизительно 4,5 мл или приблизительно 5,0 мл.
[00109] В некоторых вариантах осуществления изобретения водные суспензии вводят в виде трех или более внутримышечных инъекций, и они содержат дозу более 500 мг фулвестранта, например, до приблизительно 3000 мг (например, 550, 600, 650, 700, 750, 800, 850, 900, 950, 1000, 1100, 1200, 1300, 1400, 1500, 1600, 1700, 1800, 1900, 2000, 2100, 2200, 2300, 2400, 2500, 2600, 2700, 2800, 2900 или приблизительно 3000 мг фулвестранта), в концентрации от приблизительно 80 мг/мл до приблизительно 170 мг/мл или приблизительно 100 мг/мл, и 90%-ные доверительные интервалы (CI) относительной средней AUC(0-t), относительной средней AUC(0-∞) или и той, и другой для водных суспензий по изобретению составляют от 80% до 125% от относительной средней AUC(0-t) и относительной средней AUC(0-∞), соответственно, для FASLODEX®, и относительная средняя Cmax водных суспензий по изобретению составляют менее 80%, менее 75%, менее 70%, менее 65%, менее 60%, менее 55%, менее 50%, менее 45% или менее чем40% от относительной средней Cmax FASLODEX®.
[00110] В дополнительных вариантах осуществления изобретения водные суспензии вводят в виде трех или более внутримышечных инъекций, и они содержат дозу более 500 мг фулвестранта, например, до приблизительно 3000 мг (например, 550, 600, 650, 700, 750, 800, 850, 900, 950, 1000, 1100, 1200, 1300, 1400, 1500, 1600, 1700, 1800, 1900, 2000, 2100, 2200, 2300, 2400, 2500, 2600, 2700, 2800, 2900 или приблизительно 3000 мг фулвестранта), в концентрации от приблизительно 80 мг/мл до приблизительно 170 мг/мл или приблизительно 100 мг/мл, и 90%-ные доверительные интервалы (CI) относительной средней AUC(0-t), относительной средней AUC(0-∞) или и той, и другой для водных суспензий по изобретению составляют от 80% до 125% от относительной средней AUC(0-t) и относительной средней AUC(0-∞), соответственно, для FASLODEX®, и относительная средняя Cmax водных суспензий по изобретению составляет менее 80%, менее 75%, менее 70%, менее 65%, менее 60%, менее 55%, менее 50%, менее 45% или менее 40% от относительной средней Cmax FASLODEX® натощак.
[00111] В дополнительных вариантах осуществления изобретения водные суспензии вводят в виде трех или более внутримышечных инъекций, и они содержат дозу более 500 мг фулвестранта, например, до приблизительно 3000 мг (например, 550, 600, 650, 700, 750, 800, 850, 900, 950, 1000, 1100, 1200, 1300, 1400, 1500, 1600, 1700, 1800, 1900, 2000, 2100, 2200, 2300, 2400, 2500, 2600, 2700, 2800, 2900 или приблизительно 3000 мг фулвестранта), в концентрации от приблизительно 80 мг/мл до приблизительно 170 мг/мл или приблизительно 100 мг/мл, и 90%-ные доверительные интервалы (CI) относительной средней AUC(0-t), относительной средней AUC(0-∞) или и той, и другой для водных суспензий по изобретению составляют от 80% до 125% от относительной средней AUC(0-t) и относительной средней AUC(0-∞), соответственно, для FASLODEX®, и относительная средняя Cmax водных суспензий по изобретению составляет менее 80%, менее 75%, менее 70%, менее 65%, менее 60%, менее 55%, менее 50%, менее 45% или менее 40% от относительной средней Cmax FASLODEX® после приема пищи.
[00112] В некоторых вариантах осуществления изобретения водные суспензии вводят в виде трех или более внутримышечных инъекций, и они содержат дозу более 500 мг фулвестранта, например, до приблизительно 3000 мг (например, 550, 600, 650, 700, 750, 800, 850, 900, 950, 1000, 1100, 1200, 1300, 1400, 1500, 1600, 1700, 1800, 1900, 2000, 2100, 2200, 2300, 2400, 2500, 2600, 2700, 2800, 2900 или приблизительно 3000 мг фулвестранта), в концентрации от приблизительно 80 мг/мл до приблизительно 170 мг/мл или приблизительно 100 мг/мл, и 90%-ные доверительные интервалы (CI) относительной средней AUC(0-t), относительной средней AUC(0-∞) или и той, и другой для водных суспензий по изобретению составляют от 80% до 125% от относительной средней AUC(0-t) и относительной средней AUC(0-∞), соответственно, для FASLODEX®, и относительная средняя Cmax водных суспензий по изобретению составляет приблизительно 45%, приблизительно 50%, приблизительно 55%, приблизительно 60%, приблизительно 65%, приблизительно 70%, приблизительно 75%, приблизительно 80%, приблизительно 85%, приблизительно 90%, от приблизительно 45% до приблизительно 55%, от приблизительно 55% до приблизительно 65%, от приблизительно 65% до приблизительно 75%, от приблизительно 50% до приблизительно 60%, от приблизительно 60% до приблизительно 70% или от приблизительно 70% до приблизительно 80% от относительной средней Cmax FASLODEX®.
[00113] В дополнительных вариантах осуществления изобретения водные суспензии вводят в виде трех или более внутримышечных инъекций, и они содержат дозу более 500 мг фулвестранта, например, до приблизительно 3000 мг (например, 550, 600, 650, 700, 750, 800, 850, 900, 950, 1000, 1100, 1200, 1300, 1400, 1500, 1600, 1700, 1800, 1900, 2000, 2100, 2200, 2300, 2400, 2500, 2600, 2700, 2800, 2900 или приблизительно 3000 мг фулвестранта), в концентрации от приблизительно 80 мг/мл до приблизительно 170 мг/мл или приблизительно 100 мг/мл, и 90%-ные доверительные интервалы (CI) относительной средней AUC(0-t), относительной средней AUC(0-∞) или и той, и другой для водных суспензий по изобретению составляют от 80% до 125% от относительной средней AUC(0-t) и относительной средней AUC(0-∞), соответственно, для FASLODEX®, относительная средняя Cmax водных суспензий по изобретению составляет приблизительно 45%, приблизительно 50%, приблизительно 55%, приблизительно 60%, приблизительно 65%, приблизительно 70%, приблизительно 75%, приблизительно 80%, приблизительно 85%, приблизительно 90%, от приблизительно 45% до приблизительно 55%, от приблизительно 55% до приблизительно 65%, от приблизительно 65% до приблизительно 75%, от приблизительно 50% до приблизительно 60%, от приблизительно 60% до приблизительно 70% или от приблизительно 70% до приблизительно 80% от относительной средней Cmax FASLODEX® натощак.
[00114] В дополнительных вариантах осуществления изобретения водные суспензии вводят в виде трех или более внутримышечных инъекций, и они содержат дозу более 500 мг фулвестранта, например, до приблизительно 3000 мг (например, 550, 600, 650, 700, 750, 800, 850, 900, 950, 1000, 1100, 1200, 1300, 1400, 1500, 1600, 1700, 1800, 1900, 2000, 2100, 2200, 2300, 2400, 2500, 2600, 2700, 2800, 2900 или приблизительно 3000 мг фулвестранта), в концентрации от приблизительно 80 мг/мл до приблизительно 170 мг/мл или приблизительно 100 мг/мл, и 90%-ные доверительные интервалы (CI) относительной средней AUC(0-t), относительной средней AUC(0-∞) или и той, и другой для водных суспензий по изобретению составляют от 80% до 125% от относительной средней AUC(0-t) и относительной средней AUC(0-∞), соответственно, для FASLODEX®, и относительная средняя Cmax водных суспензий по изобретению составляет приблизительно 45%, приблизительно 50%, приблизительно 55%, приблизительно 60%, приблизительно 65%, приблизительно 70%, приблизительно 75%, приблизительно 80%, приблизительно 85%, приблизительно 90%, от приблизительно 45% до приблизительно 55%, от приблизительно 55% до приблизительно 65%, от приблизительно 65% до приблизительно 75%, от приблизительно 50% до приблизительно 60%, от приблизительно 60% до приблизительно 70%,или от приблизительно 70% до приблизительно 80% от относительной средней Cmax FASLODEX® после приема пищи.
Способы лечения
[00115] В дополнительных вариантах осуществления изобретение относится к способам лечения, включающим введение фармацевтически эффективного количества любых из водных суспензий, представленных в настоящем описании, нуждающемуся в этом пациенту. В конкретных вариантах осуществления изобретение относится к способу лечения рака молочной железы, включающему введение фармацевтически приемлемого количества любых из водных суспензий, представленных в настоящем описании. В некоторых вариантах осуществления рак молочной железы является метастазирующим раком молочной железы. В других вариантах осуществления изобретения рак молочной железы является гормон-рецептор (HR)-положительным раком молочной железы. В других вариантах осуществления изобретения изобретение относится к способу лечения гормон-рецептор (HR)-положительного рака молочной железы у женщин после менопаузы, включающему введение фармацевтически эффективного количества любых из водных суспензий, представленных в настоящем описании. В других вариантах осуществления изобретение относится к способу лечения гормон-рецептор (HR)-положительного рака молочной железы у женщин после менопаузы с прогрессированием заболевания после антиэстрогеновой терапии, включающему введение фармацевтически эффективного количества любых из водных суспензий, представленных в настоящем описании. В дополнительных вариантах осуществления изобретение относится к способу лечения HR-положительного, отрицательного по рецептору эпидермального фактора роста 2 человека (HER2) рака молочной железы на поздней стадии или метастазирующего рака молочной железы у женщин с прогрессированием заболевания после эндокринной терапии. В дополнительных вариантах осуществления изобретение относится к способам лечения, включающим введение посредством внутримышечной инъекции в вентро-ягодичный квадрант или верхний наружный квадрант. В других вариантах осуществления изобретение относится к способам лечения, включающим введение водных суспензий, представленных в настоящем описании, посредством подкожной инъекции.
[00116] В конкретных вариантах осуществления изобретения водную суспензию, представленную в настоящем описании, вводят в дни 1, 15, 29, а затем раз в месяц. В дополнительных вариантах осуществления изобретения дозу 500 мг любых из водных суспензий, представленных в настоящем описании, вводят в дни 1, 15, 29, а затем раз в месяц. В дополнительных вариантах осуществления изобретения дозу 250 мг любых из водных суспензий, представленных в настоящем описании, вводят в дни 1, 15, 29, а затем раз в месяц.
[00117] В некоторых вариантах осуществления водную суспензию, представленную в настоящем описании, вводят в виде однократной инъекции. В других вариантах осуществления изобретения дозу 500 мг любых из водных суспензий, представленных в настоящем описании, вводят в виде однократной инъекции. В других вариантах осуществления изобретения дозу 500 мг любых из водных суспензий, представленных в настоящем описании, вводят в виде однократной инъекции 5 мл. В дополнительных вариантах осуществления изобретения дозу 500 мг любых из водных суспензий, представленных в настоящем описании, вводят в виде однократной инъекции 4 мл. В дополнительных вариантах осуществления дозу 500 мг любых из водных суспензий, представленных в настоящем описании, вводят в виде однократной инъекции 3 мл.
[00118] В других вариантах осуществления изобретения вводят общую дозу фулвестранта более 500 мг, например, до приблизительно 3000 мг, любых из водных суспензий, представленных в настоящем описании. Например, общую дозу фулвестранта, составляющую приблизительно 525, 550, 575, 600, 625, 650, 675, 700, 725, 750, 775, 800, 825, 850, 875, 900, 925, 950, 975, 1000, 1100, 1200, 1300, 1400, 1500, 1600, 1700, 1800, 1900, 2000, 2100, 2200, 2300, 2400, 2500, 2600, 2700, 2800, 2900 или приблизительно 3000 мг, вводят в виде любой водной суспензии, представленной в настоящем описании. В некоторых вариантах осуществления изобретения водную суспензию, представленную в настоящем описании, вводят в виде однократной инъекции. В других вариантах осуществления изобретения дозу фулвестранта более 500 мг, например, до приблизительно 3000 мг, любых из водных суспензий, представленных в настоящем описании, вводят в виде однократной инъекции. В других вариантах осуществления изобретения дозу фулвестранта более 500 мг, например, до приблизительно 3000 мг, любых из водных суспензий, представленных в настоящем описании, вводят в виде однократной инъекции 5 мл. В дополнительных вариантах осуществления изобретения дозу 500 мг, например, до приблизительно 3000 мг, любых из водных суспензий, представленных в настоящем описании, вводят в виде однократной инъекции 4 мл. В дополнительных вариантах осуществления дозу фулвестранта более 500 мг, например, до приблизительно 3000 мг, любых из водных суспензий, представленных в настоящем описании, вводят в виде однократной инъекции 3 мл. В дополнительных вариантах осуществления дозу фулвестранта более 500 мг, например, до приблизительно 3000 мг, любых из водных суспензий, представленных в настоящем описании, вводят в виде однократной инъекции 6 мл. В дополнительных вариантах осуществления дозу фулвестранта более 500 мг, например, до приблизительно 3000 мг, любых из водных суспензий, представленных в настоящем описании, вводят в виде однократной инъекции приблизительно 5,5 мл, приблизительно 6,0 мл, приблизительно 6,5 мл, приблизительно 7,0 мл или приблизительно 7,5 мл.
[00119] В конкретных вариантах осуществления изобретения водную суспензию, представленную в настоящем описании, вводят в виде двух инъекций. В дополнительных вариантах осуществления изобретения дозу 500 мг любых из водных суспензий, представленных в настоящем описании, вводят в виде двух инъекций. В дополнительных вариантах осуществления изобретения дозу 500 мг любых из водных суспензий, представленных в настоящем описании, вводят в виде двух инъекций по 5 мл. В дополнительных вариантах осуществления изобретения дозу 500 мг любых из водных суспензий, представленных в настоящем описании, вводят в виде двух инъекций по 1,5 мл, двух инъекций по 2 мл, двух инъекций по 2,5 мл, двух инъекций по 3 мл, двух инъекций по 3,5 мл или двух инъекций по 4 мл.
[00120] В дополнительных вариантах осуществления изобретения дозу фулвестранта более 500 мг, например, до приблизительно 3000 мг, любых из водных суспензий, представленных в настоящем описании, вводят в виде двух инъекций. Например, общую дозу фулвестранта, составляющую приблизительно 525, 550, 575, 600, 625, 650, 675, 700, 725, 750, 775, 800, 825, 850, 875, 900, 925, 950, 975, 1000, 1100, 1200, 1300, 1400, 1500, 1600, 1700, 1800, 1900, 2000, 2100, 2200, 2300, 2400, 2500, 2600, 2700, 2800, 2900 или приблизительно 3000 мг, в виде любой водной суспензии, представленной в настоящем описании, вводят в виде двух инъекций. В дополнительных вариантах осуществления изобретения дозу фулвестранта более 500 мг, например, до приблизительно 3000 мг, любых из водных суспензий, представленных в настоящем описании, вводят в виде двух инъекций по приблизительно 4,5 мл, приблизительно 5,0 мл, приблизительно 5,5 мл, приблизительно 6,0 мл, приблизительно 6,5 мл, приблизительно 7,0 мл или приблизительно 7,5 мл. В дополнительных вариантах осуществления изобретения дозу фулвестранта более 500 мг, например, до приблизительно 3000 мг, любых из водных суспензий, представленных в настоящем описании, вводят в виде двух инъекций по 5 мл. В дополнительных вариантах осуществления изобретения дозу фулвестранта более 500 мг, например, до приблизительно 3000 мг, любых из водных суспензий, представленных в настоящем описании, вводят в виде двух инъекций по 1,5 мл, двух инъекций по 2 мл, двух инъекций по 2,5 мл, двух инъекций по 3 мл, двух инъекций по 3,5 мл или двух инъекций по 4 мл.
[00121] В некоторых вариантах осуществления водную суспензию вводят в виде двух инъекций в дозах приблизительно 500 мг фулвестранта в каждой инъекции с общей дозой приблизительно 1000 мг. В некоторых вариантах осуществления две инъекции в дозах по приблизительно 500 мг фулвестранта в каждой являются инъекциями по приблизительно 5,0 мл. В некоторых вариантах осуществления водную суспензию вводят в виде двух инъекций в дозах приблизительно 550 мг фулвестранта в каждой инъекции с общей дозой приблизительно 1100 мг. В некоторых вариантах осуществления водную суспензию вводят в виде двух инъекций в дозах приблизительно 600 мг фулвестранта в каждой инъекции с общей дозой приблизительно 1200 мг. В некоторых вариантах осуществления водную суспензию вводят в виде двух инъекций в дозах приблизительно 650 мг фулвестранта в каждой инъекции с общей дозой приблизительно 1300 мг. В некоторых вариантах осуществления водную суспензию вводят в виде двух инъекций в дозах приблизительно 700 мг фулвестранта в каждой инъекции с общей дозой приблизительно 1400 мг. В некоторых вариантах осуществления водную суспензию вводят в виде двух инъекций в дозах приблизительно 750 мг фулвестранта в каждой инъекции с общей дозой приблизительно 1500 мг. В некоторых вариантах осуществления водную суспензию вводят в виде двух инъекций в дозах приблизительно 800 мг фулвестранта в каждой инъекции с общей дозой приблизительно 1600 мг. В некоторых вариантах осуществления водную суспензию вводят в виде двух инъекций в дозах приблизительно 850 мг фулвестранта в каждой инъекции с общей дозой приблизительно 1700 мг. В некоторых вариантах осуществления водную суспензию вводят в виде двух инъекций в дозах приблизительно 900 мг фулвестранта в каждой инъекции с общей дозой приблизительно 1800 мг. В некоторых вариантах осуществления водную суспензию вводят в виде двух инъекций в дозах приблизительно 950 мг фулвестранта в каждой инъекции с общей дозой приблизительно 1900 мг. В некоторых вариантах осуществления водную суспензию вводят в виде двух инъекций в дозах приблизительно 1000 мг фулвестранта в каждой инъекции с общей дозой приблизительно 2000 мг. В некоторых вариантах осуществления водную суспензию вводят в виде двух инъекций в дозах приблизительно 1100 мг фулвестранта в каждой инъекции с общей дозой приблизительно 2200 мг. В некоторых вариантах осуществления водную суспензию вводят в виде двух инъекций в дозах приблизительно 1200 мг фулвестранта в каждой инъекции с общей дозой приблизительно 2400 мг. В некоторых вариантах осуществления водную суспензию вводят в виде двух инъекций в дозах приблизительно 1300 мг фулвестранта в каждой инъекции с общей дозой приблизительно 2600 мг. В некоторых вариантах осуществления водную суспензию вводят в виде двух инъекций в дозах приблизительно 1400 мг фулвестранта в каждой инъекции с общей дозой приблизительно 2800 мг. В некоторых вариантах осуществления водную суспензию вводят в виде двух инъекций в дозах приблизительно 1500 мг фулвестранта в каждой инъекции с общей дозой приблизительно 3000 мг.
[00122] В конкретных вариантах осуществления изобретения водную суспензию, представленную в настоящем описании, вводят в виде трех или более инъекций. В дополнительных вариантах осуществления изобретения дозу 500 мг любых из водных суспензий, представленных в настоящем описании, вводят в виде трех или более инъекций. В дополнительных вариантах осуществления изобретения дозу 500 мг любых из водных суспензий, представленных в настоящем описании, вводят в виде трех или более инъекций 5 мл. В дополнительных вариантах осуществления изобретения дозу 500 мг любых из водных суспензий, представленных в настоящем описании, вводят в виде трех или более инъекций 1,5 мл, трех или более инъекций 2 мл, трех или более инъекций 2,5 мл, трех или более инъекций 3 мл, трех или более инъекций 3,5 мл или трех или более инъекций 4 мл.
[00123] В дополнительных вариантах осуществления изобретения дозу фулвестранта более 500 мг, например, до приблизительно 3000 мг, любых из водных суспензий, представленных в настоящем описании, вводят в виде трех или более инъекций с равным количеством фулвестранта в каждой инъекции. Например, общую дозу фулвестранта, составляющую приблизительно 525, 550, 575, 600, 625, 650, 675, 700, 725, 750, 775, 800, 825, 850, 875, 900, 925,950, 975, 1000, 1100, 1200, 1300, 1400, 1500, 1600, 1700, 1800, 1900, 2000, 2100, 2200, 2300, 2400, 2500, 2600, 2700, 2800, 2900 или приблизительно 3000 мг, в виде любой водной суспензии, представленной в настоящем описании, вводят в виде трех или более инъекций. В дополнительных вариантах осуществления изобретения дозу фулвестранта более 500 мг, например, до приблизительно 3000 мг, любых из водных суспензий, представленных в настоящем описании, вводят в виде трех или более инъекций приблизительно 4,5 мл, приблизительно 5,0 мл, приблизительно 5,5 мл, приблизительно 6,0 мл, приблизительно 6,5 мл, приблизительно 7,0 мл или приблизительно 7,5 мл. В дополнительных вариантах осуществления изобретения дозу фулвестранта более 500 мг, например, до приблизительно 3000 мг, любых из водных суспензий, представленных в настоящем описании, вводят в виде трех или более инъекций 5 мл. В дополнительных вариантах осуществления изобретения дозу фулвестранта более 500 мг, например, до приблизительно 3000 мг, любых из водных суспензий, представленных в настоящем описании, вводят в виде трех или более инъекций 1,5 мл, трех или более инъекций 2 мл, трех или более инъекций 2,5 мл, трех или более инъекций 3 мл, трех или более инъекций 3,5 мл или трех или более инъекций 4 мл.
[00124] В некоторых вариантах осуществления водную суспензию вводят в виде трех или более инъекций равных количеств фулвестранта в каждой инъекции с общей дозой приблизительно 1000 мг. В некоторых вариантах осуществления две инъекции в дозах приблизительно 500 мг фулвестранта в каждой инъекции представляют собой инъекции по приблизительно 5,0 мл. В некоторых вариантах осуществления водную суспензию вводят в виде трех или более инъекций равных количеств фулвестранта в каждой инъекции с общей дозой приблизительно 1100 мг. В некоторых вариантах осуществления водную суспензию вводят в виде трех или более инъекций равных количеств фулвестранта в каждой инъекции с общей дозой приблизительно 1200 мг. В некоторых вариантах осуществления водную суспензию вводят в виде трех или более инъекций равных количеств фулвестранта в каждой инъекции с общей дозой приблизительно 1300 мг. В некоторых вариантах осуществления водную суспензию вводят в виде трех или более инъекций равных количеств фулвестранта в каждой инъекции с общей дозой приблизительно 1400 мг. В некоторых вариантах осуществления водную суспензию вводят в виде трех или более инъекций равных количеств фулвестранта в каждой инъекции с общей дозой приблизительно 1500 мг. В некоторых вариантах осуществления водную суспензию вводят в виде трех или более инъекций равных количеств фулвестранта в каждой инъекции с общей дозой приблизительно 1600 мг. В некоторых вариантах осуществления водную суспензию вводят в виде трех или более инъекций равных количеств фулвестранта в каждой инъекции с общей дозой приблизительно 1700 мг. В некоторых вариантах осуществления водную суспензию вводят в виде трех или более инъекций равных количеств фулвестранта в каждой инъекции с общей дозой приблизительно 1800 мг. В некоторых вариантах осуществления водную суспензию вводят в виде трех или более инъекций равных количеств фулвестранта в каждой инъекции с общей дозой приблизительно 1900 мг. В некоторых вариантах осуществления водную суспензию вводят в виде трех или более инъекций равных количеств фулвестранта в каждой инъекции с общей дозой приблизительно 2000 мг. В некоторых вариантах осуществления водную суспензию вводят в виде трех или более инъекций равных количеств фулвестранта в каждой инъекции с общей дозой приблизительно 2200 мг. В некоторых вариантах осуществления водную суспензию вводят в виде трех или более инъекций равных количеств фулвестранта в каждой инъекции с общей дозой приблизительно 2400 мг. В некоторых вариантах осуществления водную суспензию вводят в виде трех или более инъекций равных количеств фулвестранта в каждой инъекции с общей дозой приблизительно 2600 мг. В некоторых вариантах осуществления водную суспензию вводят в виде трех или более инъекций равных количеств фулвестранта в каждой инъекции с общей дозой приблизительно 2800 мг. В некоторых вариантах осуществления водную суспензию вводят в виде трех или более инъекций равных количеств фулвестранта в каждой инъекции с общей дозой приблизительно 3000 мг.
[00125] Водные суспензии, представленные в настоящем описании, можно вводить в отдельности или в комбинации с одним или более дополнительными терапевтическими средствами, представленными в настоящем описании. Дополнительное терапевтическое средство можно использовать для лечения одного или более основных симптомов и/или сопутствующих заболеваний, ассоциированных со злокачественным новообразованием в целом или раком молочной железы в частности. В одном из аспектов фулвестрант составляют (и вводят) по меньшей мере с одним терапевтическим средством в фиксированной дозе. В другом аспекте фулвестрант составляют (и вводят) отдельно от терапевтических средств.
[00126] Некоторые неограничивающие примеры терапевтических средств, которые можно использовать в комбинации с водными суспензиями, включают, например, ингибитор киназы EGFR, ингибитор киназы PDGFR, ингибитор киназы FGFR или любое из других цитотоксических, химиотерапевтических, противогормональных, антиангиогенных, антипролиферативных, проапоптотических средств, средств против HER2, лучевой терапии или радиофармацевтических средств, ингибиторов передачи сигнала или других противоопухолевых средств или способов лечения. Примеры конкретных средств, которые можно использовать в комбинации с водными суспензиями по изобретению, включают палбоциклиб, летрозол, анастрозол, доксорубицин, паклитаксел, доцетаксел, винорелбин и 5-фторурацил. В других вариантах осуществления терапевтические средства, которые можно использовать в комбинации с водными суспензиями, включают, в качестве неограничивающих примеров, средства или способы лечения одного или более из боли, тошноты, рвоты, приливов, запора и головокружения.
Способы введения доз
[00127] В некоторых вариантах осуществления водные суспензии, представленные в настоящем описании, можно вводить в многократных дозах. В некоторых вариантах осуществления изобретения первую дозу с количеством фулвестранта, соответствующим первой дозе, можно вводить в день 1. В дополнительных вариантах осуществления изобретения вторую дозу с количеством фулвестранта, соответствующим второй дозе, можно вводить после первого периода времени, следующего после первой дозы. В дополнительных вариантах осуществления изобретения одну или более дополнительных доз с количеством фулвестранта, соответствующим третьей дозе, можно вводить после второго периода времени, следующего за второй дозой, и повторять с частотой одна доза на третий период времени. В некоторых вариантах осуществления изобретения введение в многократных дозах, представленных в настоящем описании, можно использовать в способах лечения рака молочной железы по изобретению.
[00128] В некоторых вариантах осуществления изобретения количество фулвестранта, соответствующее первой дозе, может составлять от приблизительно 500 мг до приблизительно 3000 мг, от приблизительно 500 мг до приблизительно 1500 мг, от приблизительно 750 мг до приблизительно 1500 мг, от приблизительно 750 мг до приблизительно 1250 мг, от приблизительно 750 мг до приблизительно 1000 мг, от приблизительно 800 мг до приблизительно 1200 мг, от приблизительно 850 мг до приблизительно 1150 мг, от приблизительно 900 мг до приблизительно 1100 мг или от приблизительно 950 мг до приблизительно 1050 мг. В дополнительных вариантах осуществления изобретения количество фулвестранта, соответствующее первой дозе, может составлять приблизительно 500 мг, приблизительно 550 мг, приблизительно 600 мг, приблизительно 650 мг, приблизительно 700 мг, приблизительно 750 мг, приблизительно 800 мг, приблизительно 850 мг, приблизительно 900 мг, приблизительно 950 мг, приблизительно 1000 мг, приблизительно 1050 мг, приблизительно 1100 мг, приблизительно 1150 мг, приблизительно 1200 мг, приблизительно 1250 мг, приблизительно 1300 мг, приблизительно 1350 мг, приблизительно 1400 мг, приблизительно 1450 мг, приблизительно 1500 мг, приблизительно 1550 мг, приблизительно 1600 мг, приблизительно 1650 мг, приблизительно 1700 мг, приблизительно 1750 мг, приблизительно 1800 мг, приблизительно 1850 мг, приблизительно 1900 мг, приблизительно 1950 мг, приблизительно 2000 мг, приблизительно 2050 мг, приблизительно 2100 мг, приблизительно 2150 мг, приблизительно 2200 мг, приблизительно 2250 мг, приблизительно 2300 мг, приблизительно 2350 мг, приблизительно 2400 мг, приблизительно 2450 мг, приблизительно 2500 мг, приблизительно 2550 мг, приблизительно 2600 мг, приблизительно 2650 мг, приблизительно 2700 мг, приблизительно 2750 мг, приблизительно 2800 мг, приблизительно 2850 мг, приблизительно 2900 мг, приблизительно 2950 мг или приблизительно 3000 мг.
[00129] В некоторых вариантах осуществления изобретения количество фулвестранта, соответствующее второй дозе, может составлять от приблизительно 500 мг до приблизительно 3000 мг, от приблизительно 500 мг до приблизительно 1500 мг, от приблизительно 750 мг до приблизительно 1500 мг, от приблизительно 750 мг до приблизительно 1250 мг, от приблизительно 750 мг до приблизительно 1000 мг, от приблизительно 800 мг до приблизительно 1200 мг, от приблизительно 850 мг до приблизительно 1150 мг, от приблизительно 900 мг до приблизительно 1100 мг или от приблизительно 950 мг до приблизительно 1050 мг. В дополнительных вариантах осуществления изобретения количество фулвестранта, соответствующее второй дозе, может составлять приблизительно 500 мг, приблизительно 550 мг, приблизительно 600 мг, приблизительно 650 мг, приблизительно 700 мг, приблизительно 750 мг, приблизительно 800 мг, приблизительно 850 мг, приблизительно 900 мг, приблизительно 950 мг, приблизительно 1000 мг, приблизительно 1050 мг, приблизительно 1100 мг, приблизительно 1150 мг, приблизительно 1200 мг, приблизительно 1250 мг, приблизительно 1300 мг, приблизительно 1350 мг, приблизительно 1400 мг, приблизительно 1450 мг, приблизительно 1500 мг, приблизительно 1550 мг, приблизительно 1600 мг, приблизительно 1650 мг, приблизительно 1700 мг, приблизительно 1750 мг, приблизительно 1800 мг, приблизительно 1850 мг, приблизительно 1900 мг, приблизительно 1950 мг, приблизительно 2000 мг, приблизительно 2050 мг, приблизительно 2100 мг, приблизительно 2150 мг, приблизительно 2200 мг, приблизительно 2250 мг, приблизительно 2300 мг, приблизительно 2350 мг, приблизительно 2400 мг, приблизительно 2450 мг, приблизительно 2500 мг, приблизительно 2550 мг, приблизительно 2600 мг, приблизительно 2650 мг, приблизительно 2700 мг, приблизительно 2750 мг, приблизительно 2800 мг, приблизительно 2850 мг, приблизительно 2900 мг, приблизительно 2950 мг или приблизительно 3000 мг.
[00130] В некоторых вариантах осуществления изобретения количество фулвестранта, соответствующее третьей дозе, может составлять от приблизительно 500 мг до приблизительно 3000 мг, от приблизительно 500 мг до приблизительно 1500 мг, от приблизительно 750 мг до приблизительно 1500 мг, от приблизительно 750 мг до приблизительно 1250 мг, от приблизительно 750 мг до приблизительно 1000 мг, от приблизительно 800 мг до приблизительно 1200 мг, от приблизительно 850 мг до приблизительно 1150 мг, от приблизительно 900 мг до приблизительно 1100 мг или от приблизительно 950 мг до приблизительно 1050 мг. В дополнительных вариантах осуществления изобретения количество фулвестранта, соответствующее третьей дозе, может составлять приблизительно 500 мг, приблизительно 550 мг, приблизительно 600 мг, приблизительно 650 мг, приблизительно 700 мг, приблизительно 750 мг, приблизительно 800 мг, приблизительно 850 мг, приблизительно 900 мг, приблизительно 950 мг, приблизительно 1000 мг, приблизительно 1050 мг, приблизительно 1100 мг, приблизительно 1150 мг, приблизительно 1200 мг, приблизительно 1250 мг, приблизительно 1300 мг, приблизительно 1350 мг, приблизительно 1400 мг, приблизительно 1450 мг, приблизительно 1500 мг, приблизительно 1550 мг, приблизительно 1600 мг, приблизительно 1650 мг, приблизительно 1700 мг, приблизительно 1750 мг, приблизительно 1800 мг, приблизительно 1850 мг, приблизительно 1900 мг, приблизительно 1950 мг, приблизительно 2000 мг, приблизительно 2050 мг, приблизительно 2100 мг, приблизительно 2150 мг, приблизительно 2200 мг, приблизительно 2250 мг, приблизительно 2300 мг, приблизительно 2350 мг, приблизительно 2400 мг, приблизительно 2450 мг, приблизительно 2500 мг, приблизительно 2550 мг, приблизительно 2600 мг, приблизительно 2650 мг, приблизительно 2700 мг, приблизительно 2750 мг, приблизительно 2800 мг, приблизительно 2850 мг, приблизительно 2900 мг, приблизительно 2950 мг или приблизительно 3000 мг.
[00131] В некоторых вариантах осуществления первый период времени, следующий после первой дозы, когда можно вводить вторую дозу, может составлять от приблизительно 1 дня до приблизительно 30 дней, от приблизительно 5 дней до приблизительно 25 дней, от приблизительно 10 дней до приблизительно 20 дней, от приблизительно 10 дней до приблизительно 15 дней, от приблизительно 12 дней до приблизительно 16 дней или от приблизительно 13 дней до приблизительно 15 дней. В некоторых вариантах осуществления первый период времени, следующий после первой дозы, когда можно вводить вторую дозу, может составлять приблизительно 1 день, приблизительно 2 дня, приблизительно 3 дня, приблизительно 4 дня, приблизительно 5 дней, приблизительно 6 дней, приблизительно 7 дней, приблизительно 8 дней, приблизительно 9 дней, приблизительно 10 дней, приблизительно 11 дней, приблизительно 12 дней, приблизительно 13 дней, приблизительно 14 дней, приблизительно 15 дней, приблизительно 16 дней, приблизительно 17 дней, приблизительно 18 дней, приблизительно 19 дней, приблизительно 20 дней, приблизительно 21 день, приблизительно 22 дня, приблизительно 23 дня, приблизительно 24 дня, приблизительно 25 дней, приблизительно 26 дней, приблизительно 27 дней, приблизительно 28 дней, приблизительно 29 дней или приблизительно 30 дней.
[00132] В некоторых вариантах осуществления второй период времени, следующий после второй дозы, когда можно вводить первую из одной или более дополнительных доз, может составлять от приблизительно 1 дня до приблизительно 30 дней, от приблизительно 5 дней до приблизительно 25 дней, от приблизительно 10 дней до приблизительно 20 дней, от приблизительно 10 дней до приблизительно 15 дней, от приблизительно 12 дней до приблизительно 16 дней или от приблизительно 13 дней до приблизительно 15 дней. В дополнительных вариантах осуществления изобретения второй период времени, следующий после второй дозы, когда можно вводить первую из одной или более дополнительных доз, может составлять приблизительно 1 день, приблизительно 2 дня, приблизительно 3 дня, приблизительно 4 дня, приблизительно 5 дней, приблизительно 6 дней, приблизительно 7 дней, приблизительно 8 дней, приблизительно 9 дней, приблизительно 10 дней, приблизительно 11 дней, приблизительно 12 дней, приблизительно 13 дней, приблизительно 14 дней, приблизительно 15 дней, приблизительно 16 дней, приблизительно 17 дней, приблизительно 18 дней, приблизительно 19 дней, приблизительно 20 дней, приблизительно 21 день, приблизительно 22 дня, приблизительно 23 дня, приблизительно 24 дня, приблизительно 25 дней, приблизительно 26 дней, приблизительно 27 дней, приблизительно 28 дней, приблизительно 29 дней или приблизительно 30 дней.
[00133] В некоторых вариантах осуществления изобретения одну или более дополнительных доз можно повторно вводить с частотой одна доза на третий период времени, который может составлять от приблизительно 1 дня до приблизительно 180 дней, от приблизительно 1 дня до приблизительно 150 дней, от приблизительно 1 дня до приблизительно 120 дней, от приблизительно 1 дня до приблизительно 90 дней, от приблизительно 60 дней до приблизительно 90 дней, от приблизительно 75 дней до приблизительно 90 дней, от приблизительно 30 дней до приблизительно 60 дней, от приблизительно 45 дней до приблизительно 60 дней, от приблизительно 45 дней до приблизительно 75 дней, от приблизительно 50 дней до приблизительно 70 дней, от приблизительно 55 дней до приблизительно 65 дней, от приблизительно 10 дней до приблизительно 50 дней, от приблизительно 15 дней до приблизительно 45 дней, от приблизительно 20 дней до приблизительно 40 дней, от приблизительно 25 дней до приблизительно 35 дней, от приблизительно 5 дней до приблизительно 35 дней, от приблизительно 10 дней до приблизительно 30 дней, от приблизительно 15 дней до приблизительно 25 дней, от приблизительно 1 недели до приблизительно 12 недель, от приблизительно 6 недель до приблизительно 12 недель, от приблизительно 7 недель до приблизительно 12 недель, от приблизительно 8 недель до приблизительно 12 недель, от приблизительно 9 недель до приблизительно 12 недель, от приблизительно 10 недель до приблизительно 12 недель, от приблизительно 11 недель до приблизительно 12 недель, от приблизительно 4 недель до приблизительно 10 недель, от приблизительно 5 недель до приблизительно 10 недель, от приблизительно 6 недель до приблизительно 10 недель, от приблизительно 7 недель до приблизительно 10 недель, от приблизительно 8 недель до приблизительно 10 недель, от приблизительно 9 недель до приблизительно 10 недель, от приблизительно 2 недель до приблизительно 8 недель, от приблизительно 3 недель до приблизительно 8 недель, от приблизительно 4 недель до приблизительно 8 недель, от приблизительно 5 недель до приблизительно 8 недель, от приблизительно 6 недель до приблизительно 8 недель, от приблизительно 7 недель до приблизительно 8 недель, от приблизительно 1 недели до приблизительно 6 недель, от приблизительно 2 недель до приблизительно 6 недель, от приблизительно 3 недель до приблизительно 6 недель, от приблизительно 4 недель до приблизительно 6 недель, от приблизительно 5 недель до приблизительно 6 недель, от приблизительно 1 недели до приблизительно 4 недель, от приблизительно 2 недель до приблизительно 4 недель, от приблизительно 3 недель до приблизительно 4 недель, от приблизительно 1 недели до приблизительно 3 недель, от приблизительно 2 недель до приблизительно 3 недель, от приблизительно 1 месяца до приблизительно 3 месяцев, от приблизительно 2 месяцев до приблизительно 3 месяцев, приблизительно от 1,5 месяцев до 2,5 месяцев, приблизительно от 1,5 месяцев до 3,5 месяцев, от приблизительно 2,0 месяцев до приблизительно 3,5 месяцев или от приблизительно 2,0 месяцев до приблизительно 2,5 месяцев. В дополнительных вариантах осуществления изобретения одну или более дополнительных доз можно повторно вводить с частотой одна доза на третий период времени, который может составлять приблизительно 1 день, приблизительно 2 дня, приблизительно 3 дня, приблизительно 4 дня, приблизительно 5 дней, приблизительно 6 дней, приблизительно 7 дней, приблизительно 8 дней, приблизительно 9 дней, приблизительно 10 дней, приблизительно 11 дней, приблизительно 12 дней, приблизительно 13 дней, приблизительно 14 дней, приблизительно 15 дней, приблизительно 16 дней, приблизительно 17 дней, приблизительно 18 дней, приблизительно 19 дней, приблизительно 20 дней, приблизительно 21 день, приблизительно 22 дня, приблизительно 23 дня, приблизительно 24 дня, приблизительно 25 дней, приблизительно 26 дней, приблизительно 27 дней, приблизительно 28 дней, приблизительно 29 дней, приблизительно 30 дней, приблизительно 31 день, приблизительно 32 дня, приблизительно 33 дня, приблизительно 34 дня, приблизительно 35 дней, приблизительно 36 дней, приблизительно 37 дней, приблизительно 38 дней, приблизительно 39 дней, приблизительно 40 дней, приблизительно 41 день, приблизительно 42 дня, приблизительно 43 дня, приблизительно 44 дня, приблизительно 45 дней, приблизительно 46 дней, приблизительно 47 дней, приблизительно 48 дней, приблизительно 49 дней, приблизительно 50 дней, приблизительно 51 день, приблизительно 52 дня, приблизительно 53 дня, приблизительно 54 дня, приблизительно 55 дней, приблизительно 56 дней, приблизительно 57 дней, приблизительно 58 дней, приблизительно 59 дней, приблизительно 60 дней, приблизительно 61 день, приблизительно 62 дня, приблизительно 63 дня, приблизительно 64 дня, приблизительно 65 дней, приблизительно 66 дней, приблизительно 67 дней, приблизительно 68 дней, приблизительно 69 дней, приблизительно 70 дней, приблизительно 71 день, приблизительно 72 дня, приблизительно 73 дня, приблизительно 74 дня, приблизительно 75 дней, приблизительно 76 дней, приблизительно 77 дней, приблизительно 78 дней, приблизительно 79 дней, приблизительно 80 дней, приблизительно 81 день, приблизительно 82 дня, приблизительно 83 дня, приблизительно 84 дня, приблизительно 85 дней, приблизительно 86 дней, приблизительно 87 дней, приблизительно 88 дней, приблизительно 89 дней, приблизительно 90 дней, приблизительно 1 месяц, приблизительно 1,5 месяца, приблизительно 2 месяца, приблизительно 2,5 месяца, приблизительно 3 месяца или приблизительно 3,5 месяца.
[00134] В некоторых вариантах осуществления изобретения первую дозу с количеством фулвестранта, соответствующим первой дозе, можно вводить в день 1. В дополнительных вариантах осуществления изобретения вторую дозу с количеством фулвестранта, соответствующим второй дозе, можно вводить после первого периода времени, следующего после первой дозы. В дополнительных вариантах осуществления изобретения одну или более дополнительных доз с количеством фулвестранта, соответствующим третьей дозе, можно вводить после второго периода времени, следующего после второй дозы, и повторять с частотой одна доза на третий период времени.
[00135] В некоторых вариантах осуществления изобретения первую дозу с количеством фулвестранта, соответствующим первой дозе приблизительно 550 мг, можно вводить в день 1, вторую дозу с количеством фулвестранта, соответствующим второй дозе приблизительно 550 мг, можно вводить после первого периода времени, составляющего приблизительно 14 дней, следующих после первой дозы, и одну или более дополнительных доз с количеством фулвестранта, соответствующим третьей дозе приблизительно 500 мг, можно вводить после второго периода времени, составляющего приблизительно 14 дней, следующих после второй дозы, и повторять с частотой одна доза на третий период времени, составляющий приблизительно 2 месяца.
[00136] В некоторых вариантах осуществления изобретения первую дозу с количеством фулвестранта, соответствующим первой дозе приблизительно 600 мг, можно вводить в день 1, вторую дозу с количеством фулвестранта, соответствующим второй дозе приблизительно 600 мг, можно вводить после первого периода времени, составляющего приблизительно 14 дней, следующих после первой дозы, и одну или более дополнительных доз с количеством фулвестранта, соответствующим третьей дозе приблизительно 500 мг, можно вводить после второго периода времени, составляющего приблизительно 14 дней, следующих после второй дозы, и повторять с частотой одна доза на третий период времени, составляющий приблизительно 2 месяца.
[00137] В некоторых вариантах осуществления изобретения первую дозу с количеством фулвестранта, соответствующим первой дозе приблизительно 650 мг, можно вводить в день 1, вторую дозу с количеством фулвестранта, соответствующим второй дозе приблизительно 650 мг, можно вводить после первого периода времени, составляющего приблизительно 14 дней, следующих после первой дозы, и одну или более дополнительных доз с количеством фулвестранта, соответствующим третьей дозе приблизительно 500 мг, можно вводить после второго периода времени, составляющего приблизительно 14 дней, следующих после второй дозы, и повторять с частотой одна доза на третий период времени, составляющий приблизительно 2 месяца.
[00138] В некоторых вариантах осуществления изобретения первую дозу с количеством фулвестранта, соответствующим первой дозе приблизительно 700 мг, можно вводить в день 1, вторую дозу с количеством фулвестранта, соответствующим второй дозе приблизительно 700 мг, можно вводить после первого периода времени, составляющего приблизительно 14 дней, следующих после первой дозы, и одну или более дополнительных доз с количеством фулвестранта, соответствующим третьей дозе приблизительно 500 мг, можно вводить после второго периода времени, составляющего приблизительно 14 дней, следующих после второй дозы, и повторять с частотой одна доза на третий период времени, составляющий приблизительно 2 месяца.
[00139] В некоторых вариантах осуществления изобретения первую дозу с количеством фулвестранта, соответствующим первой дозе приблизительно 750 мг, можно вводить в день 1, вторую дозу с количеством фулвестранта, соответствующим второй дозе приблизительно 750 мг можно, вводить после первого периода времени, составляющего приблизительно 14 дней, следующих после первой дозы, и одну или более дополнительных доз с количеством фулвестранта, соответствующим третьей дозе приблизительно 500 мг, можно вводить после второго периода времени, составляющего приблизительно 14 дней, следующих после второй дозы, и повторять с частотой одна доза на третий период времени, составляющий приблизительно 2 месяца.
[00140] В некоторых вариантах осуществления изобретения первую дозу с количеством фулвестранта, соответствующим первой дозе приблизительно 800 мг, можно вводить в день 1, вторую дозу с количеством фулвестранта, соответствующим второй дозе приблизительно 800 мг, можно вводить после первого периода времени, составляющего приблизительно 14 дней, следующих после первой дозы, и одну или более дополнительных доз с количеством фулвестранта, соответствующим третьей дозе приблизительно 500 мг, можно вводить после второго периода времени, составляющего приблизительно 14 дней, следующих после второй дозы, и повторять с частотой одна доза на третий период времени, составляющий приблизительно 2 месяца.
[00141] В некоторых вариантах осуществления изобретения первую дозу с количеством фулвестранта, соответствующим первой дозе приблизительно 850 мг, можно вводить в день 1, вторую дозу с количеством фулвестранта, соответствующим второй дозе приблизительно 850 мг, можно вводить после первого периода времени, составляющего приблизительно 14 дней, следующих после первой дозы, и одну или более дополнительных доз с количеством фулвестранта, соответствующим третьей дозе приблизительно 500 мг, можно вводить после второго периода времени, составляющего приблизительно 14 дней, следующих после второй дозы, и повторять с частотой одна доза на третий период времени, составляющий приблизительно 2 месяца.
[00142] В некоторых вариантах осуществления изобретения первую дозу с количеством фулвестранта, соответствующим первой дозе приблизительно 900 мг, можно вводить в день 1, вторую дозу с количеством фулвестранта, соответствующим второй дозе приблизительно 900 мг, можно вводить после первого периода времени, составляющего приблизительно 14 дней, следующих после первой дозы, и одну или более дополнительных доз с количеством фулвестранта, соответствующим третьей дозе приблизительно 500 мг, можно вводить после второго периода времени, составляющего приблизительно 14 дней, следующих после второй дозы, и повторять с частотой одна доза на третий период времени, составляющий приблизительно 2 месяца.
[00143] В некоторых вариантах осуществления изобретения первую дозу с количеством фулвестранта, соответствующим первой дозе приблизительно 950 мг, можно вводить в день 1, вторую дозу с количеством фулвестранта, соответствующим второй дозе приблизительно 950 мг, можно вводить после первого периода времени, составляющего приблизительно 14 дней, следующих после первой дозы, и одну или более дополнительных доз с количеством фулвестранта, соответствующим третьей дозе приблизительно 500 мг, можно вводить после второго периода времени, составляющего приблизительно 14 дней, следующих после второй дозы, и повторять с частотой одна доза на третий период времени, составляющий приблизительно 2 месяца.
[00144] В некоторых вариантах осуществления изобретения первую дозу с количеством фулвестранта, соответствующим первой дозе приблизительно 1000 мг, можно вводить в день 1, вторую дозу с количеством фулвестранта, соответствующим второй дозе приблизительно 1000 мг, можно вводить после первого периода времени, составляющего приблизительно 14 дней, следующих после первой дозы, и одну или более дополнительных доз с количеством фулвестранта, соответствующим третьей дозе приблизительно 500 мг, можно вводить после второго периода времени, составляющего приблизительно 14 дней, следующих после второй дозы, и повторять с частотой одна доза на третий период времени, составляющий приблизительно 2 месяца.
[00145] В некоторых вариантах осуществления изобретения первую дозу с количеством фулвестранта, соответствующим первой дозе приблизительно 1050 мг, можно вводить в день 1, вторую дозу с количеством фулвестранта, соответствующим второй дозе приблизительно 1050 мг, можно вводить после первого периода времени, составляющего приблизительно 14 дней, следующих после первой дозы, и одну или более дополнительных доз с количеством фулвестранта, соответствующим третьей дозе приблизительно 500 мг, можно вводить после второго периода времени, составляющего приблизительно 14 дней, следующих после второй дозы, и повторять с частотой одна доза на третий период времени, составляющий приблизительно 2 месяца.
[00146] В некоторых вариантах осуществления изобретения первую дозу с количеством фулвестранта, соответствующим первой дозе приблизительно 1100 мг, можно вводить в день 1, вторую дозу с количеством фулвестранта, соответствующим второй дозе приблизительно 1100 мг, можно вводить после первого периода времени, составляющего приблизительно 14 дней, следующих после первой дозы, и одну или более дополнительных доз с количеством фулвестранта, соответствующим третьей дозе приблизительно 500 мг, можно вводить после второго периода времени, составляющего приблизительно 14 дней, следующих после второй дозы, и повторять с частотой одна доза на третий период времени, составляющий приблизительно 2 месяца.
[00147] В некоторых вариантах осуществления изобретения первую дозу с количеством фулвестранта, соответствующим первой дозе приблизительно 1150 мг, можно вводить в день 1, вторую дозу с количеством фулвестранта, соответствующим второй дозе приблизительно 1150 мг, можно вводить после первого периода времени, составляющего приблизительно 14 дней, следующих после первой дозы, и одну или более дополнительных доз с количеством фулвестранта, соответствующим третьей дозе приблизительно 500 мг, можно вводить после второго периода времени, составляющего приблизительно 14 дней, следующих после второй дозы, и повторять с частотой одна доза на третий период времени, составляющий приблизительно 2 месяца.
[00148] В некоторых вариантах осуществления изобретения первую дозу с количеством фулвестранта, соответствующим первой дозе приблизительно 1200 мг, можно вводить в день 1, вторую дозу с количеством фулвестранта, соответствующим второй дозе приблизительно 1200 мг, можно вводить после первого периода времени, составляющего приблизительно 14 дней, следующих после первой дозы, и одну или более дополнительных доз с количеством фулвестранта, соответствующим третьей дозе приблизительно 500 мг, можно вводить после второго периода времени, составляющего приблизительно 14 дней, следующих после второй дозы, и повторять с частотой одна доза на третий период времени, составляющий приблизительно 2 месяца.
[00149] В некоторых вариантах осуществления изобретения первую дозу с количеством фулвестранта, соответствующим первой дозе приблизительно 1250 мг, можно вводить в день 1, вторую дозу с количеством фулвестранта, соответствующим второй дозе приблизительно 1250 мг, можно вводить после первого периода времени, составляющего приблизительно 14 дней, следующих после первой дозы, и одну или более дополнительных доз с количеством фулвестранта, соответствующим третьей дозе приблизительно 500 мг, можно вводить после второго периода времени, составляющего приблизительно 14 дней, следующих после второй дозы, и повторять с частотой одна доза на третий период времени, составляющий приблизительно 2 месяца.
[00150] В некоторых вариантах осуществления изобретения первую дозу с количеством фулвестранта, соответствующим первой дозе приблизительно 550 мг, можно вводить в день 1, вторую дозу с количеством фулвестранта, соответствующим второй дозе приблизительно 550 мг, можно вводить после первого периода времени, составляющего приблизительно 14 дней, следующих после первой дозы, и одну или более дополнительных доз с количеством фулвестранта, соответствующим третьей дозе приблизительно 500 мг, можно вводить после второго периода времени, составляющего приблизительно 14 дней, следующих после второй дозы, и повторять с частотой одна доза на третий период времени, составляющий приблизительно 1 месяц.
[00151] В некоторых вариантах осуществления изобретения первую дозу с количеством фулвестранта, соответствующим первой дозе приблизительно 600 мг, можно вводить в день 1, вторую дозу с количеством фулвестранта, соответствующим второй дозе приблизительно 600 мг, можно вводить после первого периода времени, составляющего приблизительно 14 дней, следующих после первой дозы, и одну или более дополнительных доз с количеством фулвестранта, соответствующим третьей дозе приблизительно 500 мг, можно вводить после второго периода времени, составляющего приблизительно 14 дней, следующих после второй дозы, и повторять с частотой одна доза на третий период времени, составляющий приблизительно 1 месяц.
[00152] В некоторых вариантах осуществления изобретения первую дозу с количеством фулвестранта, соответствующим первой дозе приблизительно 650 мг, можно вводить в день 1, вторую дозу с количеством фулвестранта, соответствующим второй дозе приблизительно 650 мг, можно вводить после первого периода времени, составляющего приблизительно 14 дней, следующих после первой дозы, и одну или более дополнительных доз с количеством фулвестранта, соответствующим третьей дозе приблизительно 500 мг, можно вводить после второго периода времени, составляющего приблизительно 14 дней, следующих после второй дозы, и повторять с частотой одна доза на третий период времени, составляющий приблизительно 1 месяц.
[00153] В некоторых вариантах осуществления изобретения первую дозу с количеством фулвестранта, соответствующим первой дозе приблизительно 700 мг, можно вводить в день 1, вторую дозу с количеством фулвестранта, соответствующим второй дозе приблизительно 700 мг, можно вводить после первого периода времени, составляющего приблизительно 14 дней, следующих после первой дозы, и одну или более дополнительных доз с количеством фулвестранта, соответствующим третьей дозе приблизительно 500 мг, можно вводить после второго периода времени, составляющего приблизительно 14 дней, следующих после второй дозы, и повторять с частотой одна доза на третий период времени, составляющий приблизительно 1 месяц.
[00154] В некоторых вариантах осуществления изобретения первую дозу с количеством фулвестранта, соответствующим первой дозе приблизительно 750 мг, можно вводить в день 1, вторую дозу с количеством фулвестранта, соответствующим второй дозе приблизительно 750 мг, можно вводить после первого периода времени, составляющего приблизительно 14 дней, следующих после первой дозы, и одну или более дополнительных доз с количеством фулвестранта, соответствующим третьей дозе приблизительно 500 мг, можно вводить после второго периода времени, составляющего приблизительно 14 дней, следующих после второй дозы, и повторять с частотой одна доза на третий период времени, составляющий приблизительно 1 месяц.
[00155] В некоторых вариантах осуществления изобретения первую дозу с количеством фулвестранта, соответствующим первой дозе приблизительно 800 мг, можно вводить в день 1, вторую дозу с количеством фулвестранта, соответствующим второй дозе приблизительно 800 мг, можно вводить после первого периода времени, составляющего приблизительно 14 дней, следующих после первой дозы, и одну или более дополнительных доз с количеством фулвестранта, соответствующим третьей дозе приблизительно 500 мг, можно вводить после второго периода времени, составляющего приблизительно 14 дней, следующих после второй дозы, и повторять с частотой одна доза на третий период времени, составляющий приблизительно 1 месяц.
[00156] В некоторых вариантах осуществления изобретения первую дозу с количеством фулвестранта, соответствующим первой дозе приблизительно 850 мг, можно вводить в день 1, вторую дозу с количеством фулвестранта, соответствующим второй дозе приблизительно 850 мг, можно вводить после первого периода времени, составляющего приблизительно 14 дней, следующих после первой дозы, и одну или более дополнительных доз с количеством фулвестранта, соответствующим третьей дозе приблизительно 500 мг, можно вводить после второго периода времени, составляющего приблизительно 14 дней, следующих после второй дозы, и повторять с частотой одна доза на третий период времени, составляющий приблизительно 1 месяц.
[00157] В некоторых вариантах осуществления изобретения первую дозу с количеством фулвестранта, соответствующим первой дозе приблизительно 900 мг, можно вводить в день 1, вторую дозу с количеством фулвестранта, соответствующим второй дозе приблизительно 900 мг, можно вводить после первого периода времени, составляющего приблизительно 14 дней, следующих после первой дозы, и одну или более дополнительных доз с количеством фулвестранта, соответствующим третьей дозе приблизительно 500 мг, можно вводить после второго периода времени, составляющего приблизительно 14 дней, следующих после второй дозы, и повторять с частотой одна доза на третий период времени, составляющий приблизительно 1 месяц.
[00158] В некоторых вариантах осуществления изобретения первую дозу с количеством фулвестранта, соответствующим первой дозе приблизительно 950 мг, можно вводить в день 1, вторую дозу с количеством фулвестранта, соответствующим второй дозе приблизительно 950 мг, можно вводить после первого периода времени, составляющего приблизительно 14 дней, следующих после первой дозы, и одну или более дополнительных доз с количеством фулвестранта, соответствующим третьей дозе приблизительно 500 мг, можно вводить после второго периода времени, составляющего приблизительно 14 дней, следующих после второй дозы, и повторять с частотой одна доза на третий период времени, составляющий приблизительно 1 месяц.
[00159] В некоторых вариантах осуществления изобретения первую дозу с количеством фулвестранта, соответствующим первой дозе приблизительно 1000 мг, можно вводить в день 1, вторую дозу с количеством фулвестранта, соответствующим второй дозе приблизительно 1000 мг, можно вводить после первого периода времени, составляющего приблизительно 14 дней, следующих после первой дозы, и одну или более дополнительных доз с количеством фулвестранта, соответствующим третьей дозе приблизительно 500 мг, можно вводить после второго периода времени, составляющего приблизительно 14 дней, следующих после второй дозы, и повторять с частотой одна доза на третий период времени, составляющий приблизительно 1 месяц.
[00160] В некоторых вариантах осуществления изобретения первую дозу с количеством фулвестранта, соответствующим первой дозе приблизительно 1050 мг, можно вводить в день 1, вторую дозу с количеством фулвестранта, соответствующим второй дозе приблизительно 1050 мг, можно вводить после первого периода времени, составляющего приблизительно 14 дней, следующих после первой дозы, и одну или более дополнительных доз с количеством фулвестранта, соответствующим третьей дозе приблизительно 500 мг, можно вводить после второго периода времени, составляющего приблизительно 14 дней, следующих после второй дозы, и повторять с частотой одна доза на третий период времени, составляющий приблизительно 1 месяц.
[00161] В некоторых вариантах осуществления изобретения первую дозу с количеством фулвестранта, соответствующим первой дозе приблизительно 1100 мг, можно вводить в день 1, вторую дозу с количеством фулвестранта, соответствующим второй дозе приблизительно 1100 мг, можно вводить после первого периода времени, составляющего приблизительно 14 дней, следующих после первой дозы, и одну или более дополнительных доз с количеством фулвестранта, соответствующим третьей дозе приблизительно 500 мг, можно вводить после второго периода времени, составляющего приблизительно 14 дней, следующих после второй дозы, и повторять с частотой одна доза на третий период времени, составляющий приблизительно 1 месяц.
[00162] В некоторых вариантах осуществления изобретения первую дозу с количеством фулвестранта, соответствующим первой дозе приблизительно 1150 мг, можно вводить в день 1, вторую дозу с количеством фулвестранта, соответствующим второй дозе приблизительно 1150 мг, можно вводить после первого периода времени, составляющего приблизительно 14 дней, следующих после первой дозы, и одну или более дополнительных доз с количеством фулвестранта, соответствующим третьей дозе приблизительно 500 мг, можно вводить после второго периода времени, составляющего приблизительно 14 дней, следующих после второй дозы, и повторять с частотой одна доза на третий период времени, составляющий приблизительно 1 месяц.
[00163] В некоторых вариантах осуществления изобретения первую дозу с количеством фулвестранта, соответствующим первой дозе приблизительно 1200 мг, можно вводить в день 1, вторую дозу с количеством фулвестранта, соответствующим второй дозе приблизительно 1200 мг, можно вводить после первого периода времени, составляющего приблизительно 14 дней, следующих после первой дозы, и одну или более дополнительных доз с количеством фулвестранта, соответствующим третьей дозе приблизительно 500 мг, можно вводить после второго периода времени, составляющего приблизительно 14 дней, следующих после второй дозы, и повторять с частотой одна доза на третий период времени, составляющий приблизительно 1 месяц.
[00164] В некоторых вариантах осуществления изобретения первую дозу с количеством фулвестранта, соответствующим первой дозе приблизительно 1250 мг, можно вводить в день 1, вторую дозу с количеством фулвестранта, соответствующим второй дозе приблизительно 1250 мг, можно вводить после первого периода времени, составляющего приблизительно 14 дней, следующих после первой дозы, и одну или более дополнительных доз с количеством фулвестранта, соответствующим третьей дозе приблизительно 500 мг, можно вводить после второго периода времени, составляющего приблизительно 14 дней, следующих после второй дозы, и повторять с частотой одна доза на третий период времени, составляющий приблизительно 1 месяц.
[00165] В некоторых вариантах осуществления изобретения первую дозу с количеством фулвестранта, соответствующим первой дозе приблизительно 550 мг, можно вводить в день 1, вторую дозу с количеством фулвестранта, соответствующим второй дозе приблизительно 550 мг, можно вводить после первого периода времени, составляющего приблизительно 14 дней, следующих после первой дозы, и одну или более дополнительных доз с количеством фулвестранта, соответствующим третьей дозе приблизительно 500 мг, можно вводить после второго периода времени, составляющего приблизительно 14 дней, следующих после второй дозы, и повторять с частотой одна доза на третий период времени, составляющий приблизительно 4 недели.
[00166] В некоторых вариантах осуществления изобретения первую дозу с количеством фулвестранта, соответствующим первой дозе приблизительно 600 мг, можно вводить в день 1, вторую дозу с количеством фулвестранта, соответствующим второй дозе приблизительно 600 мг, можно вводить после первого периода времени, составляющего приблизительно 14 дней, следующих после первой дозы, и одну или более дополнительных доз с количеством фулвестранта, соответствующим третьей дозе приблизительно 500 мг, можно вводить после второго периода времени, составляющего приблизительно 14 дней, следующих после второй дозы, и повторять с частотой одна доза на третий период времени, составляющий приблизительно 4 недели.
[00167] В некоторых вариантах осуществления изобретения первую дозу с количеством фулвестранта, соответствующим первой дозе приблизительно 650 мг, можно вводить в день 1, вторую дозу с количеством фулвестранта, соответствующим второй дозе приблизительно 650 мг, можно вводить после первого периода времени, составляющего приблизительно 14 дней, следующих после первой дозы, и одну или более дополнительных доз с количеством фулвестранта, соответствующим третьей дозе приблизительно 500 мг, можно вводить после второго периода времени, составляющего приблизительно 14 дней, следующих после второй дозы, и повторять с частотой одна доза на третий период времени, составляющий приблизительно 4 недели.
[00168] В некоторых вариантах осуществления изобретения первую дозу с количеством фулвестранта, соответствующим первой дозе приблизительно 700 мг, можно вводить в день 1, вторую дозу с количеством фулвестранта, соответствующим второй дозе приблизительно 700 мг, можно вводить после первого периода времени, составляющего приблизительно 14 дней, следующих после первой дозы, и одну или более дополнительных доз с количеством фулвестранта, соответствующим третьей дозе приблизительно 500 мг, можно вводить после второго периода времени, составляющего приблизительно 14 дней, следующих после второй дозы, и повторять с частотой одна доза на третий период времени, составляющий приблизительно 4 недели.
[00169] В некоторых вариантах осуществления изобретения первую дозу с количеством фулвестранта, соответствующим первой дозе приблизительно 750 мг, можно вводить в день 1, вторую дозу с количеством фулвестранта, соответствующим второй дозе приблизительно 750 мг, можно вводить после первого периода времени, составляющего приблизительно 14 дней, следующих после первой дозы, и одну или более дополнительных доз с количеством фулвестранта, соответствующим третьей дозе приблизительно 500 мг, можно вводить после второго периода времени, составляющего приблизительно 14 дней, следующих после второй дозы, и повторять с частотой одна доза на третий период времени, составляющий приблизительно 4 недели.
[00170] В некоторых вариантах осуществления изобретения первую дозу с количеством фулвестранта, соответствующим первой дозе приблизительно 800 мг, можно вводить в день 1, вторую дозу с количеством фулвестранта, соответствующим второй дозе приблизительно 800 мг, можно вводить после первого периода времени, составляющего приблизительно 14 дней, следующих после первой дозы, и одну или более дополнительных доз с количеством фулвестранта, соответствующим третьей дозе приблизительно 500 мг, можно вводить после второго периода времени, составляющего приблизительно 14 дней, следующих после второй дозы, и повторять с частотой одна доза на третий период времени, составляющий приблизительно 4 недели.
[00171] В некоторых вариантах осуществления изобретения первую дозу с количеством фулвестранта, соответствующим первой дозе приблизительно 850 мг, можно вводить в день 1, вторую дозу с количеством фулвестранта, соответствующим второй дозе приблизительно 850 мг, можно вводить после первого периода времени, составляющего приблизительно 14 дней, следующих после первой дозы, и одну или более дополнительных доз с количеством фулвестранта, соответствующим третьей дозе приблизительно 500 мг, можно вводить после второго периода времени, составляющего приблизительно 14 дней, следующих после второй дозы, и повторять с частотой одна доза на третий период времени, составляющий приблизительно 4 недели.
[00172] В некоторых вариантах осуществления изобретения первую дозу с количеством фулвестранта, соответствующим первой дозе приблизительно 900 мг, можно вводить в день 1, вторую дозу с количеством фулвестранта, соответствующим второй дозе приблизительно 900 мг, можно вводить после первого периода времени, составляющего приблизительно 14 дней, следующих после первой дозы, и одну или более дополнительных доз с количеством фулвестранта, соответствующим третьей дозе приблизительно 500 мг, можно вводить после второго периода времени, составляющего приблизительно 14 дней, следующих после второй дозы, и повторять с частотой одна доза на третий период времени, составляющий приблизительно 4 недели.
[00173] В некоторых вариантах осуществления изобретения первую дозу с количеством фулвестранта, соответствующим первой дозе приблизительно 950 мг, можно вводить в день 1, вторую дозу с количеством фулвестранта, соответствующим второй дозе приблизительно 950 мг, можно вводить после первого периода времени, составляющего приблизительно 14 дней, следующих после первой дозы, и одну или более дополнительных доз с количеством фулвестранта, соответствующим третьей дозе приблизительно 500 мг, можно вводить после второго периода времени, составляющего приблизительно 14 дней, следующих после второй дозы, и повторять с частотой одна доза на третий период времени, составляющий приблизительно 4 недели.
[00174] В некоторых вариантах осуществления изобретения первую дозу с количеством фулвестранта, соответствующим первой дозе приблизительно 1000 мг, можно вводить в день 1, вторую дозу с количеством фулвестранта, соответствующим второй дозе приблизительно 1000 мг, можно вводить после первого периода времени, составляющего приблизительно 14 дней, следующих после первой дозы, и одну или более дополнительных доз с количеством фулвестранта, соответствующим третьей дозе приблизительно 500 мг, можно вводить после второго периода времени, составляющего приблизительно 14 дней, следующих после второй дозы, и повторять с частотой одна доза на третий период времени, составляющий приблизительно 4 недели.
[00175] В некоторых вариантах осуществления изобретения первую дозу с количеством фулвестранта, соответствующим первой дозе приблизительно 1050 мг, можно вводить в день 1, вторую дозу с количеством фулвестранта, соответствующим второй дозе приблизительно 1050 мг, можно вводить после первого периода времени, составляющего приблизительно 14 дней, следующих после первой дозы, и одну или более дополнительных доз с количеством фулвестранта, соответствующим третьей дозе приблизительно 500 мг, можно вводить после второго периода времени, составляющего приблизительно 14 дней, следующих после второй дозы, и повторять с частотой одна доза на третий период времени, составляющий приблизительно 4 недели.
[00176] В некоторых вариантах осуществления изобретения первую дозу с количеством фулвестранта, соответствующим первой дозе приблизительно 1100 мг, можно вводить в день 1, вторую дозу с количеством фулвестранта, соответствующим второй дозе приблизительно 1100 мг, можно вводить после первого периода времени, составляющего приблизительно 14 дней, следующих после первой дозы, и одну или более дополнительных доз с количеством фулвестранта, соответствующим третьей дозе приблизительно 500 мг, можно вводить после второго периода времени, составляющего приблизительно 14 дней, следующих после второй дозы, и повторять с частотой одна доза на третий период времени, составляющий приблизительно 4 недели.
[00177] В некоторых вариантах осуществления изобретения первую дозу с количеством фулвестранта, соответствующим первой дозе приблизительно 1150 мг, можно вводить в день 1, вторую дозу с количеством фулвестранта, соответствующим второй дозе приблизительно 1150 мг, можно вводить после первого периода времени, составляющего приблизительно 14 дней, следующих после первой дозы, и одну или более дополнительных доз с количеством фулвестранта, соответствующим третьей дозе приблизительно 500 мг, можно вводить после второго периода времени, составляющего приблизительно 14 дней, следующих после второй дозы, и повторять с частотой одна доза на третий период времени, составляющий приблизительно 4 недели.
[00178] В некоторых вариантах осуществления изобретения первую дозу с количеством фулвестранта, соответствующим первой дозе приблизительно 1200 мг, можно вводить в день 1, вторую дозу с количеством фулвестранта, соответствующим второй дозе приблизительно 1200 мг, можно вводить после первого периода времени, составляющего приблизительно 14 дней, следующих после первой дозы, и одну или более дополнительных доз с количеством фулвестранта, соответствующим третьей дозе приблизительно 500 мг, можно вводить после второго периода времени, составляющего приблизительно 14 дней, следующих после второй дозы, и повторять с частотой одна доза на третий период времени, составляющий приблизительно 4 недели.
[00179] В некоторых вариантах осуществления изобретения первую дозу с количеством фулвестранта, соответствующим первой дозе приблизительно 1250 мг, можно вводить в день 1, вторую дозу с количеством фулвестранта, соответствующим второй дозе приблизительно 1250 мг, можно вводить после первого периода времени, составляющего приблизительно 14 дней, следующих после первой дозы, и одну или более дополнительных доз с количеством фулвестранта, соответствующим третьей дозе приблизительно 500 мг, можно вводить после второго периода времени, составляющего приблизительно 14 дней, следующих после второй дозы, и повторять с частотой одна доза на третий период времени, составляющий приблизительно 4 недели.
[00180] В некоторых вариантах осуществления изобретения первую дозу с количеством фулвестранта, соответствующим первой дозе приблизительно 550 мг, можно вводить в день 1, вторую дозу с количеством фулвестранта, соответствующим второй дозе приблизительно 550 мг, можно вводить после первого периода времени, составляющего приблизительно 14 дней, следующих после первой дозы, и одну или более дополнительных доз с количеством фулвестранта, соответствующим третьей дозе приблизительно 500 мг, можно вводить после второго периода времени, составляющего приблизительно 14 дней, следующих после второй дозы, и повторять с частотой одна доза на третий период времени, составляющий приблизительно 6 недель.
[00181] В некоторых вариантах осуществления изобретения первую дозу с количеством фулвестранта, соответствующим первой дозе приблизительно 600 мг, можно вводить в день 1, вторую дозу с количеством фулвестранта, соответствующим второй дозе приблизительно 600 мг, можно вводить после первого периода времени, составляющего приблизительно 14 дней, следующих после первой дозы, и одну или более дополнительных доз с количеством фулвестранта, соответствующим третьей дозе приблизительно 500 мг, можно вводить после второго периода времени, составляющего приблизительно 14 дней, следующих после второй дозы, и повторять с частотой одна доза на третий период времени, составляющий приблизительно 6 недель.
[00182] В некоторых вариантах осуществления изобретения первую дозу с количеством фулвестранта, соответствующим первой дозе приблизительно 650 мг, можно вводить в день 1, вторую дозу с количеством фулвестранта, соответствующим второй дозе приблизительно 650 мг, можно вводить после первого периода времени, составляющего приблизительно 14 дней, следующих после первой дозы, и одну или более дополнительных доз с количеством фулвестранта, соответствующим третьей дозе приблизительно 500 мг, можно вводить после второго периода времени, составляющего приблизительно 14 дней, следующих после второй дозы, и повторять с частотой одна доза на третий период времени, составляющий приблизительно 6 недель.
[00183] В некоторых вариантах осуществления изобретения первую дозу с количеством фулвестранта, соответствующим первой дозе приблизительно 700 мг, можно вводить в день 1, вторую дозу с количеством фулвестранта, соответствующим второй дозе приблизительно 700 мг, можно вводить после первого периода времени, составляющего приблизительно 14 дней, следующих после первой дозы, и одну или более дополнительных доз с количеством фулвестранта, соответствующим третьей дозе приблизительно 500 мг, можно вводить после второго периода времени, составляющего приблизительно 14 дней, следующих после второй дозы, и повторять с частотой одна доза на третий период времени, составляющий приблизительно 6 недель.
[00184] В некоторых вариантах осуществления изобретения первую дозу с количеством фулвестранта, соответствующим первой дозе приблизительно 750 мг, можно вводить в день 1, вторую дозу с количеством фулвестранта, соответствующим второй дозе приблизительно 750 мг, можно вводить после первого периода времени, составляющего приблизительно 14 дней, следующих после первой дозы, и одну или более дополнительных доз с количеством фулвестранта, соответствующим третьей дозе приблизительно 500 мг, можно вводить после второго периода времени, составляющего приблизительно 14 дней, следующих после второй дозы, и повторять с частотой одна доза на третий период времени, составляющий приблизительно 6 недель.
[00185] В некоторых вариантах осуществления изобретения первую дозу с количеством фулвестранта, соответствующим первой дозе приблизительно 800 мг, можно вводить в день 1, вторую дозу с количеством фулвестранта, соответствующим второй дозе приблизительно 800 мг, можно вводить после первого периода времени, составляющего приблизительно 14 дней, следующих после первой дозы, и одну или более дополнительных доз с количеством фулвестранта, соответствующим третьей дозе приблизительно 500 мг, можно вводить после второго периода времени, составляющего приблизительно 14 дней, следующих после второй дозы, и повторять с частотой одна доза на третий период времени, составляющий приблизительно 6 недель.
[00186] В некоторых вариантах осуществления изобретения первую дозу с количеством фулвестранта, соответствующим первой дозе приблизительно 850 мг, можно вводить в день 1, вторую дозу с количеством фулвестранта, соответствующим второй дозе приблизительно 850 мг, можно вводить после первого периода времени, составляющего приблизительно 14 дней, следующих после первой дозы, и одну или более дополнительных доз с количеством фулвестранта, соответствующим третьей дозе приблизительно 500 мг, можно вводить после второго периода времени, составляющего приблизительно 14 дней, следующих после второй дозы, и повторять с частотой одна доза на третий период времени, составляющий приблизительно 6 недель.
[00187] В некоторых вариантах осуществления изобретения первую дозу с количеством фулвестранта, соответствующим первой дозе приблизительно 900 мг, можно вводить в день 1, вторую дозу с количеством фулвестранта, соответствующим второй дозе приблизительно 900 мг, можно вводить после первого периода времени, составляющего приблизительно 14 дней, следующих после первой дозы, и одну или более дополнительных доз с количеством фулвестранта, соответствующим третьей дозе приблизительно 500 мг, можно вводить после второго периода времени, составляющего приблизительно 14 дней, следующих после второй дозы, и повторять с частотой одна доза на третий период времени, составляющий приблизительно 6 недель.
[00188] В некоторых вариантах осуществления изобретения первую дозу с количеством фулвестранта, соответствующим первой дозе приблизительно 950 мг, можно вводить в день 1, вторую дозу с количеством фулвестранта, соответствующим второй дозе приблизительно 950 мг, можно вводить после первого периода времени, составляющего приблизительно 14 дней, следующих после первой дозы, и одну или более дополнительных доз с количеством фулвестранта, соответствующим третьей дозе приблизительно 500 мг, можно вводить после второго периода времени, составляющего приблизительно 14 дней, следующих после второй дозы, и повторять с частотой одна доза на третий период времени, составляющий приблизительно 6 недель.
[00189] В некоторых вариантах осуществления изобретения первую дозу с количеством фулвестранта, соответствующим первой дозе приблизительно 1000 мг, можно вводить в день 1, вторую дозу с количеством фулвестранта, соответствующим второй дозе приблизительно 1000 мг, можно вводить после первого периода времени, составляющего приблизительно 14 дней, следующих после первой дозы, и одну или более дополнительных доз с количеством фулвестранта, соответствующим третьей дозе приблизительно 500 мг, можно вводить после второго периода времени, составляющего приблизительно 14 дней, следующих после второй дозы, и повторять с частотой одна доза на третий период времени, составляющий приблизительно 6 недель.
[00190] В некоторых вариантах осуществления изобретения первую дозу с количеством фулвестранта, соответствующим первой дозе приблизительно 1050 мг, можно вводить в день 1, вторую дозу с количеством фулвестранта, соответствующим второй дозе приблизительно 1050 мг, можно вводить после первого периода времени, составляющего приблизительно 14 дней, следующих после первой дозы, и одну или более дополнительных доз с количеством фулвестранта, соответствующим третьей дозе приблизительно 500 мг, можно вводить после второго периода времени, составляющего приблизительно 14 дней, следующих после второй дозы, и повторять с частотой одна доза на третий период времени, составляющий приблизительно 6 недель.
[00191] В некоторых вариантах осуществления изобретения первую дозу с количеством фулвестранта, соответствующим первой дозе приблизительно 1100 мг, можно вводить в день 1, вторую дозу с количеством фулвестранта, соответствующим второй дозе приблизительно 1100 мг, можно вводить после первого периода времени, составляющего приблизительно 14 дней, следующих после первой дозы, и одну или более дополнительных доз с количеством фулвестранта, соответствующим третьей дозе приблизительно 500 мг, можно вводить после второго периода времени, составляющего приблизительно 14 дней, следующих после второй дозы, и повторять с частотой одна доза на третий период времени, составляющий приблизительно 6 недель.
[00192] В некоторых вариантах осуществления изобретения первую дозу с количеством фулвестранта, соответствующим первой дозе приблизительно 1150 мг, можно вводить в день 1, вторую дозу с количеством фулвестранта, соответствующим второй дозе приблизительно 1150 мг, можно вводить после первого периода времени, составляющего приблизительно 14 дней, следующих после первой дозы, и одну или более дополнительных доз с количеством фулвестранта, соответствующим третьей дозе приблизительно 500 мг, можно вводить после второго периода времени, составляющего приблизительно 14 дней, следующих после второй дозы, и повторять с частотой одна доза на третий период времени, составляющий приблизительно 6 недель.
[00193] В некоторых вариантах осуществления изобретения первую дозу с количеством фулвестранта, соответствующим первой дозе приблизительно 1200 мг, можно вводить в день 1, вторую дозу с количеством фулвестранта, соответствующим второй дозе приблизительно 1200 мг, можно вводить после первого периода времени, составляющего приблизительно 14 дней, следующих после первой дозы, и одну или более дополнительных доз с количеством фулвестранта, соответствующим третьей дозе приблизительно 500 мг, можно вводить после второго периода времени, составляющего приблизительно 14 дней, следующих после второй дозы, и повторять с частотой одна доза на третий период времени, составляющий приблизительно 6 недель.
[00194] В некоторых вариантах осуществления изобретения первую дозу с количеством фулвестранта, соответствующим первой дозе приблизительно 1250 мг, можно вводить в день 1, вторую дозу с количеством фулвестранта, соответствующим второй дозе приблизительно 1250 мг, можно вводить после первого периода времени, составляющего приблизительно 14 дней, следующих после первой дозы, и одну или более дополнительных доз с количеством фулвестранта, соответствующим третьей дозе приблизительно 500 мг, можно вводить после второго периода времени, составляющего приблизительно 14 дней, следующих после второй дозы, и повторять с частотой одна доза на третий период времени, составляющий приблизительно 6 недель.
[00195] В некоторых вариантах осуществления изобретения первую дозу с количеством фулвестранта, соответствующим первой дозе приблизительно 550 мг, можно вводить в день 1, вторую дозу с количеством фулвестранта, соответствующим второй дозе приблизительно 550 мг, можно вводить после первого периода времени, составляющего приблизительно 14 дней, следующих после первой дозы, и одну или более дополнительных доз с количеством фулвестранта, соответствующим третьей дозе приблизительно 500 мг, можно вводить после второго периода времени, составляющего приблизительно 14 дней, следующих после второй дозы, и повторять с частотой одна доза на третий период времени, составляющий приблизительно 8 недель.
[00196] В некоторых вариантах осуществления изобретения первую дозу с количеством фулвестранта, соответствующим первой дозе приблизительно 600 мг, можно вводить в день 1, вторую дозу с количеством фулвестранта, соответствующим второй дозе приблизительно 600 мг, можно вводить после первого периода времени, составляющего приблизительно 14 дней, следующих после первой дозы, и одну или более дополнительных доз с количеством фулвестранта, соответствующим третьей дозе приблизительно 500 мг, можно вводить после второго периода времени, составляющего приблизительно 14 дней, следующих после второй дозы, и повторять с частотой одна доза на третий период времени, составляющий приблизительно 8 недель.
[00197] В некоторых вариантах осуществления изобретения первую дозу с количеством фулвестранта, соответствующим первой дозе приблизительно 650 мг, можно вводить в день 1, вторую дозу с количеством фулвестранта, соответствующим второй дозе приблизительно 650 мг, можно вводить после первого периода времени, составляющего приблизительно 14 дней, следующих после первой дозы, и одну или более дополнительных доз с количеством фулвестранта, соответствующим третьей дозе приблизительно 500 мг, можно вводить после второго периода времени, составляющего приблизительно 14 дней, следующих после второй дозы, и повторять с частотой одна доза на третий период времени, составляющий приблизительно 8 недель.
[00198] В некоторых вариантах осуществления изобретения первую дозу с количеством фулвестранта, соответствующим первой дозе приблизительно 700 мг, можно вводить в день 1, вторую дозу с количеством фулвестранта, соответствующим второй дозе приблизительно 700 мг, можно вводить после первого периода времени, составляющего приблизительно 14 дней, следующих после первой дозы, и одну или более дополнительных доз с количеством фулвестранта, соответствующим третьей дозе приблизительно 500 мг, можно вводить после второго периода времени, составляющего приблизительно 14 дней, следующих после второй дозы, и повторять с частотой одна доза на третий период времени, составляющий приблизительно 8 недель.
[00199] В некоторых вариантах осуществления изобретения первую дозу с количеством фулвестранта, соответствующим первой дозе приблизительно 750 мг, можно вводить в день 1, вторую дозу с количеством фулвестранта, соответствующим второй дозе приблизительно 750 мг, можно вводить после первого периода времени, составляющего приблизительно 14 дней, следующих после первой дозы, и одну или более дополнительных доз с количеством фулвестранта, соответствующим третьей дозе приблизительно 500 мг, можно вводить после второго периода времени, составляющего приблизительно 14 дней, следующих после второй дозы, и повторять с частотой одна доза на третий период времени, составляющий приблизительно 8 недель.
[00200] В некоторых вариантах осуществления изобретения первую дозу с количеством фулвестранта, соответствующим первой дозе приблизительно 800 мг, можно вводить в день 1, вторую дозу с количеством фулвестранта, соответствующим второй дозе приблизительно 800 мг, можно вводить после первого периода времени, составляющего приблизительно 14 дней, следующих после первой дозы, и одну или более дополнительных доз с количеством фулвестранта, соответствующим третьей дозе приблизительно 500 мг, можно вводить после второго периода времени, составляющего приблизительно 14 дней, следующих после второй дозы, и повторять с частотой одна доза на третий период времени, составляющий приблизительно 8 недель.
[00201] В некоторых вариантах осуществления изобретения первую дозу с количеством фулвестранта, соответствующим первой дозе приблизительно 850 мг, можно вводить в день 1, вторую дозу с количеством фулвестранта, соответствующим второй дозе приблизительно 850 мг, можно вводить после первого периода времени, составляющего приблизительно 14 дней, следующих после первой дозы, и одну или более дополнительных доз с количеством фулвестранта, соответствующим третьей дозе приблизительно 500 мг, можно вводить после второго периода времени, составляющего приблизительно 14 дней, следующих после второй дозы, и повторять с частотой одна доза на третий период времени, составляющий приблизительно 8 недель.
[00202] В некоторых вариантах осуществления изобретения первую дозу с количеством фулвестранта, соответствующим первой дозе приблизительно 900 мг, можно вводить в день 1, вторую дозу с количеством фулвестранта, соответствующим второй дозе приблизительно 900 мг, можно вводить после первого периода времени, составляющего приблизительно 14 дней, следующих после первой дозы, и одну или более дополнительных доз с количеством фулвестранта, соответствующим третьей дозе приблизительно 500 мг, можно вводить после второго периода времени, составляющего приблизительно 14 дней, следующих после второй дозы, и повторять с частотой одна доза на третий период времени, составляющий приблизительно 8 недель.
[00203] В некоторых вариантах осуществления изобретения первую дозу с количеством фулвестранта, соответствующим первой дозе приблизительно 950 мг, можно вводить в день 1, вторую дозу с количеством фулвестранта, соответствующим второй дозе приблизительно 950 мг, можно вводить после первого периода времени, составляющего приблизительно 14 дней, следующих после первой дозы, и одну или более дополнительных доз с количеством фулвестранта, соответствующим третьей дозе приблизительно 500 мг, можно вводить после второго периода времени, составляющего приблизительно 14 дней, следующих после второй дозы, и повторять с частотой одна доза на третий период времени, составляющий приблизительно 8 недель.
[00204] В некоторых вариантах осуществления изобретения первую дозу с количеством фулвестранта, соответствующим первой дозе приблизительно 1000 мг, можно вводить в день 1, вторую дозу с количеством фулвестранта, соответствующим второй дозе приблизительно 1000 мг, можно вводить после первого периода времени, составляющего приблизительно 14 дней, следующих после первой дозы, и одну или более дополнительных доз с количеством фулвестранта, соответствующим третьей дозе приблизительно 500 мг, можно вводить после второго периода времени, составляющего приблизительно 14 дней, следующих после второй дозы, и повторять с частотой одна доза на третий период времени, составляющий приблизительно 8 недель.
[00205] В некоторых вариантах осуществления изобретения первую дозу с количеством фулвестранта, соответствующим первой дозе приблизительно 1050 мг, можно вводить в день 1, вторую дозу с количеством фулвестранта, соответствующим второй дозе приблизительно 1050 мг, можно вводить после первого периода времени, составляющего приблизительно 14 дней, следующих после первой дозы, и одну или более дополнительных доз с количеством фулвестранта, соответствующим третьей дозе приблизительно 500 мг, можно вводить после второго периода времени, составляющего приблизительно 14 дней, следующих после второй дозы, и повторять с частотой одна доза на третий период времени, составляющий приблизительно 8 недель.
[00206] В некоторых вариантах осуществления изобретения первую дозу с количеством фулвестранта, соответствующим первой дозе приблизительно 1100 мг, можно вводить в день 1, вторую дозу с количеством фулвестранта, соответствующим второй дозе приблизительно 1100 мг, можно вводить после первого периода времени, составляющего приблизительно 14 дней, следующих после первой дозы, и одну или более дополнительных доз с количеством фулвестранта, соответствующим третьей дозе приблизительно 500 мг, можно вводить после второго периода времени, составляющего приблизительно 14 дней, следующих после второй дозы, и повторять с частотой одна доза на третий период времени, составляющий приблизительно 8 недель.
[00207] В некоторых вариантах осуществления изобретения первую дозу с количеством фулвестранта, соответствующим первой дозе приблизительно 1150 мг, можно вводить в день 1, вторую дозу с количеством фулвестранта, соответствующим второй дозе приблизительно 1150 мг, можно вводить после первого периода времени, составляющего приблизительно 14 дней, следующих после первой дозы, и одну или более дополнительных доз с количеством фулвестранта, соответствующим третьей дозе приблизительно 500 мг, можно вводить после второго периода времени, составляющего приблизительно 14 дней, следующих после второй дозы, и повторять с частотой одна доза на третий период времени, составляющий приблизительно 8 недель.
[00208] В некоторых вариантах осуществления изобретения первую дозу с количеством фулвестранта, соответствующим первой дозе приблизительно 1200 мг, можно вводить в день 1, вторую дозу с количеством фулвестранта, соответствующим второй дозе приблизительно 1200 мг, можно вводить после первого периода времени, составляющего приблизительно 14 дней, следующих после первой дозы, и одну или более дополнительных доз с количеством фулвестранта, соответствующим третьей дозе приблизительно 500 мг, можно вводить после второго периода времени, составляющего приблизительно 14 дней, следующих после второй дозы, и повторять с частотой одна доза на третий период времени, составляющий приблизительно 8 недель.
[00209] В некоторых вариантах осуществления изобретения первую дозу с количеством фулвестранта, соответствующим первой дозе приблизительно 1250 мг, можно вводить в день 1, вторую дозу с количеством фулвестранта, соответствующим второй дозе приблизительно 1250 мг, можно вводить после первого периода времени, составляющего приблизительно 14 дней, следующих после первой дозы, и одну или более дополнительных доз с количеством фулвестранта, соответствующим третьей дозе приблизительно 500 м, г можно вводить после второго периода времени, составляющего приблизительно 14 дней, следующих после второй дозы, и повторять с частотой одна доза на третий период времени, составляющий приблизительно 8 недель.
Частицы несолюбилизированного фулвестранта
[00210] В некоторых вариантах осуществления частицы несолюбилизированного фулвестранта имеют диаметр, измеряемый посредством лазерной дифракции, приблизительно 1 мкм или более. В дополнительных вариантах осуществления изобретения по меньшей мере часть частиц несолюбилизированного фулвестранта имеет диаметр при лазерной дифракции менее приблизительно 1 мкм. В других вариантах осуществления изобретения частицы несолюбилизированного фулвестранта имеют диаметр при лазерной дифракции приблизительно 2 мкм или более. В других вариантах осуществления изобретения по меньшей мере часть частиц несолюбилизированного фулвестранта имеет диаметр при лазерной дифракции менее приблизительно 2 мкм.
[00211] В некоторых вариантах осуществления частицы несолюбилизированного фулвестранта имеют диаметр при лазерной дифракции приблизительно 0,5 мкм или более. В других вариантах осуществления изобретения по меньшей мере часть частиц несолюбилизированного фулвестранта имеет диаметр при лазерной дифракции менее приблизительно 0,5 мкм. В других вариантах осуществления изобретения частицы несолюбилизированного фулвестранта имеют диаметр при лазерной дифракции приблизительно 1 мкм или более. В других вариантах осуществления изобретения по меньшей мере часть частиц несолюбилизированного фулвестранта имеет диаметр при лазерной дифракции менее приблизительно 1 мкм. В других вариантах осуществления изобретения частицы несолюбилизированного фулвестранта имеют диаметр при лазерной дифракции приблизительно 1,5 мкм или более. В других вариантах осуществления изобретения по меньшей мере часть частиц несолюбилизированного фулвестранта имеет диаметр при лазерной дифракции менее приблизительно 1,5 мкм. В других вариантах осуществления изобретения частицы несолюбилизированного фулвестранта имеют диаметр при лазерной дифракции приблизительно 2 мкм или более. В других вариантах осуществления изобретения по меньшей мере часть частиц несолюбилизированного фулвестранта имеет диаметр при лазерной дифракции менее приблизительно 2 мкм.
[00212] В дополнительных вариантах осуществления изобретения приблизительно 98% частиц несолюбилизированного фулвестранта имеют диаметр при лазерной дифракции приблизительно 0,5 мкм или более. В других вариантах осуществления изобретения, приблизительно 98% частиц несолюбилизированного фулвестранта имеют диаметр при лазерной дифракции приблизительно 1 мкм или более. В других вариантах осуществления изобретения, приблизительно 98% частиц несолюбилизированного фулвестранта имеют диаметр при лазерной дифракции приблизительно 1,5 мкм или более. В других вариантах осуществления изобретения приблизительно 98% частиц несолюбилизированного фулвестранта имеют диаметр при лазерной дифракции приблизительно 2 мкм или более.
[00213] В некоторых вариантах осуществления частицы несолюбилизированного фулвестранта имеют LD Dv(90) от приблизительно 4 мкм до приблизительно 120 мкм, от приблизительно 4 мкм до приблизительно 100 мкм, от приблизительно 4 мкм до приблизительно 75 мкм, от приблизительно 4 мкм до приблизительно 60 мкм, от приблизительно 4 мкм до приблизительно 50 мкм, от приблизительно 4 мкм до приблизительно 40 мкм, от приблизительно 4 мкм до приблизительно 30 мкм, от приблизительно 4 мкм до приблизительно 20 мкм, от приблизительно 4 мкм до приблизительно 15 мкм, от приблизительно 4 мкм до приблизительно 10 мкм, от приблизительно 15 мкм до приблизительно 35 мкм, от приблизительно 20 мкм до приблизительно 60 мкм, от приблизительно 20 мкм до приблизительно 45 мкм, от приблизительно 20 мкм до приблизительно 30 мкм, от приблизительно 30 мкм до приблизительно 50 мкм или от приблизительно 4 мкм до приблизительно 9 мкм. В других вариантах осуществления изобретения частицы несолюбилизированного фулвестранта имеют LD Dv(90), равный приблизительно 4 мкм, приблизительно 5 мкм, приблизительно 6 мкм, приблизительно 7 мкм, приблизительно 8 мкм, приблизительно 9 мкм, приблизительно 10 мкм, приблизительно 11 мкм, приблизительно 12 мкм, приблизительно 13 мкм, приблизительно 14 мкм, приблизительно 15 мкм, приблизительно 16 мкм, приблизительно 17 мкм, приблизительно 18 мкм, приблизительно 19 мкм, приблизительно 20 мкм, приблизительно 25 мкм, приблизительно 30 мкм, приблизительно 35 мкм, приблизительно 40 мкм, приблизительно 45 мкм, приблизительно 50 мкм, приблизительно 55 мкм, приблизительно 60 мкм, приблизительно 65 мкм, приблизительно 70 мкм, приблизительно 75 мкм, приблизительно 80 мкм, приблизительно 85 мкм, приблизительно 90 мкм, приблизительно 95 мкм, приблизительно 100 мкм, приблизительно 105 мкм, приблизительно 110 мкм, приблизительно 115 мкм или приблизительно 120 мкм.
[00214] В некоторых вариантах осуществления частицы несолюбилизированного фулвестранта имеют LD Dv(90) приблизительно 120 мкм или менее. В некоторых вариантах осуществления частицы несолюбилизированного фулвестранта имеют LD Dv(90) приблизительно 100 мкм или менее. В некоторых вариантах осуществления частицы несолюбилизированного фулвестранта имеют LD Dv(90) приблизительно 80 мкм или менее. В некоторых вариантах осуществления частицы несолюбилизированного фулвестранта имеют LD Dv(90) приблизительно 60 мкм или менее. В некоторых вариантах осуществления частицы несолюбилизированного фулвестранта имеют LD Dv(90) приблизительно 50 мкм или менее. В некоторых вариантах осуществления частицы несолюбилизированного фулвестранта имеют LD Dv(90) приблизительно 40 мкм или менее. В некоторых вариантах осуществления частицы несолюбилизированного фулвестранта имеют LD Dv(90) приблизительно 30 мкм или менее. В дополнительных вариантах осуществления изобретения частицы имеют LD Dv(90) приблизительно 25 мкм или менее. В дополнительных вариантах осуществления изобретения частицы имеют LD Dv(90) приблизительно 18 мкм или менее. В дополнительных вариантах осуществления изобретения частицы имеют LD Dv(90) приблизительно 16 мкм или менее. В дополнительных вариантах осуществления изобретения частицы имеют LD Dv(90) приблизительно 14 мкм или менее. В дополнительных вариантах осуществления изобретения частицы имеют LD Dv(90) приблизительно 11 мкм или менее. В дополнительных вариантах осуществления изобретения частицы имеют LD Dv(90) приблизительно 9 мкм или менее. В дополнительных вариантах осуществления изобретения частицы имеют LD Dv(90) приблизительно 7 мкм или менее. В дополнительных вариантах осуществления изобретения частицы имеют LD Dv(90) приблизительно 5 мкм или менее. В конкретных вариантах осуществления изобретения частицы имеют LD Dv(90) приблизительно 9-14 мкм. В других вариантах осуществления изобретения частицы имеют LD Dv(90) приблизительно 12-14 мкм. В других вариантах осуществления изобретения частицы имеют LD Dv(90) приблизительно 9-11 мкм. В других вариантах осуществления изобретения частицы имеют LD Dv(90) приблизительно 7-9 мкм. В других вариантах осуществления изобретения частицы имеют LD Dv(90) приблизительно 6-8 мкм. В других вариантах осуществления изобретения частицы имеют LD Dv(90) приблизительно 6-7 мкм. В других вариантах осуществления изобретения частицы имеют LD Dv(90) приблизительно 3-6 мкм.
[00215] В некоторых вариантах осуществления частицы несолюбилизированного фулвестранта имеют LD Dv(50) от приблизительно 2 мкм до приблизительно 35 мкм, от приблизительно 2 мкм до приблизительно 25 мкм, от приблизительно 2 мкм до приблизительно 20 мкм, от приблизительно 2 мкм до приблизительно 15 мкм, от приблизительно 2 мкм до приблизительно 10 мкм, от приблизительно 2 мкм до приблизительно 8 мкм, от приблизительно 2 мкм до приблизительно 7 мкм, от приблизительно 2 мкм до приблизительно 6 мкм, от приблизительно 2 мкм до приблизительно 5 мкм, от приблизительно 2 мкм до приблизительно 4 мкм, от приблизительно 5 мкм до приблизительно 10 мкм, от приблизительно 5,5 мкм до приблизительно 9,0 мкм, от приблизительно 5 мкм до приблизительно 15 мкм, от приблизительно 7 мкм до приблизительно 10 мкм, от приблизительно 8 мкм до приблизительно 10 мкм или от приблизительно 9 мкм до приблизительно 16 мкм. В других вариантах осуществления изобретения частицы несолюбилизированного фулвестранта имеют LD Dv(50), равный приблизительно 2 мкм, 3 мкм, 4 мкм, приблизительно 5 мкм, приблизительно 6 мкм, приблизительно 7 мкм, приблизительно 8 мкм, приблизительно 9 мкм, приблизительно 10 мкм, приблизительно 11 мкм, приблизительно 12 мкм, приблизительно 13 мкм, приблизительно 14 мкм, приблизительно 15 мкм, приблизительно 16 мкм, приблизительно 17 мкм, приблизительно 18 мкм, приблизительно 19 мкм, приблизительно 20 мкм, приблизительно 25 мкм, приблизительно 30 мкм или приблизительно 35 мкм.
[00216] В некоторых вариантах осуществления частицы несолюбилизированного фулвестранта имеют LD Dv(50) приблизительно 9 мкм или менее. В других вариантах осуществления изобретения частицы имеют LD Dv(50) приблизительно 7 мкм или менее. В других вариантах осуществления изобретения частицы имеют LD Dv(50) приблизительно 6 мкм или менее. В других вариантах осуществления изобретения частицы имеют LD Dv(50) приблизительно 5 мкм или менее. В конкретных вариантах осуществления изобретения частицы имеют LD Dv(50) приблизительно 4 мкм или менее. В дополнительных вариантах осуществления изобретения частицы имеют LD Dv(50) приблизительно 3 мкм или менее. В дополнительных вариантах осуществления изобретения частицы имеют LD Dv(50) приблизительно 4-6 мкм. В дополнительных вариантах осуществления изобретения частицы имеют LD Dv(50) приблизительно 3-5 мкм. В дополнительных вариантах осуществления изобретения частицы имеют LD Dv(50) приблизительно 3-4 мкм. В дополнительных вариантах осуществления изобретения частицы имеют LD Dv(50) приблизительно 2-3 мкм.
[00217] В некоторых вариантах осуществления частицы несолюбилизированного фулвестранта имеют LD Dv(10) не более приблизительно 3 мкм, приблизительно 2 мкм или приблизительно 1 мкм. В дополнительных вариантах осуществления изобретения частицы имеют LD Dv(10) от приблизительно 1 мкм до приблизительно 3 мкм. В дополнительных вариантах осуществления изобретения частицы имеют LD Dv(10) приблизительно 2 мкм или более. В дополнительных вариантах осуществления изобретения частицы имеют LD Dv(10) от приблизительно 1,5 мкм до приблизительно 2,5 мкм. В других вариантах осуществления частицы имеют LD Dv(10) от приблизительно 1,5 мкм до приблизительно 2,1 мкм. В дополнительных вариантах осуществления изобретения частицы имеют LD Dv(10) от приблизительно 1 мкм до приблизительно 2 мкм. В дополнительных вариантах осуществления изобретения частицы имеют LD Dv(10) от приблизительно 1,0 мкм до приблизительно 1,5 мкм. В дополнительных вариантах осуществления изобретения частицы имеют LD Dv(10) приблизительно 2 мкм. В дополнительных вариантах осуществления изобретения частицы имеют LD Dv(10) приблизительно 1,5 мкм.
[00218] В некоторых вариантах осуществления частицы несолюбилизированного фулвестранта имеют LD Dv(90) приблизительно 25 мкм или менее и LD Dv(50) приблизительно 9 мкм или менее. В конкретных вариантах осуществления изобретения частицы имеют LD Dv(90) приблизительно 16 мкм или менее и LD Dv(50) приблизительно 6 мкм или менее. В других вариантах осуществления изобретения частицы имеют LD Dv(90) приблизительно 11 мкм или менее и LD Dv(50) приблизительно 5 мкм или менее. В других вариантах осуществления изобретения частицы имеют LD Dv(90) приблизительно 9 мкм или менее и LD Dv(50) приблизительно 4 мкм или менее. В других вариантах осуществления изобретения частицы имеют LD Dv(90) приблизительно 8 мкм или менее и LD Dv(50) приблизительно 4 мкм или менее.
[00219] В некоторых вариантах осуществления частицы несолюбилизированного фулвестранта имеют LD Dv(90) приблизительно 9-14 мкм и LD Dv(50) приблизительно 4-6 мкм. В других вариантах осуществления изобретения частицы имеют LD Dv(90) приблизительно 9-11 мкм и LD Dv(50) приблизительно 4-6 мкм. В конкретных вариантах осуществления изобретения частицы имеют LD Dv(90) приблизительно 12-14 мкм и LD Dv(50) приблизительно 4-6 мкм. В дополнительных вариантах осуществления изобретения частицы имеют LD Dv(90) приблизительно 6-8 мкм и LD Dv(50) приблизительно 2-4 мкм. В дополнительных вариантах осуществления изобретения частицы несолюбилизированного фулвестранта имеют диаметр при лазерной дифракции приблизительно 1 мкм или более. В дополнительных вариантах осуществления изобретения по меньшей мере часть частиц несолюбилизированного фулвестранта имеет диаметр при лазерной дифракции менее приблизительно 1 мкм. В других вариантах осуществления изобретения частицы несолюбилизированного фулвестранта имеют диаметр при лазерной дифракции приблизительно 2 мкм или более. В других вариантах осуществления изобретения по меньшей мере часть частиц несолюбилизированного фулвестранта имеет диаметр при лазерной дифракции менее приблизительно 2 мкм.
[00220] В некоторых вариантах осуществления частицы несолюбилизированного фулвестранта имеют LD Dv(90) приблизительно 9-14 мкм, LD Dv(50) приблизительно 4-6 мкм и LD Dv(10) приблизительно 2-3 мкм. В других вариантах осуществления изобретения частицы имеют LD Dv(90) приблизительно 9-11 мкм, LD Dv(50) приблизительно 4-6 мкм и LD Dv(10) приблизительно 2-3 мкм. В других вариантах осуществления изобретения частицы имеют LD Dv(90) приблизительно 12-14 мкм, LD Dv(50) приблизительно 4-6 мкм и LD Dv(10) приблизительно 2-3 мкм. В других вариантах осуществления изобретения частицы имеют LD Dv(90) приблизительно 6-9 мкм, LD Dv(50) приблизительно 2-4 мкм и LD Dv(10) приблизительно 1-2 мкм. В дополнительных вариантах осуществления изобретения частицы несолюбилизированного фулвестранта имеют диаметр при лазерной дифракции приблизительно 1 мкм или более. В дополнительных вариантах осуществления изобретения по меньшей мере часть частиц несолюбилизированного фулвестранта имеет диаметр при лазерной дифракции менее приблизительно 1 мкм. В других вариантах осуществления изобретения частицы несолюбилизированного фулвестранта имеют диаметр при лазерной дифракции приблизительно 2 мкм или более. В других вариантах осуществления изобретения по меньшей мере часть частиц несолюбилизированного фулвестранта имеет диаметр при лазерной дифракции менее приблизительно 2 мкм.
[00221] В некоторых вариантах осуществления частицы несолюбилизированного фулвестранта имеют LD Dv(90) приблизительно 9-14 мкм, LD Dv(50) от приблизительно 4-6 мкм и LD Dv(10) приблизительно 2-3 мкм, и частицы несолюбилизированного фулвестранта имеют диаметр при лазерной дифракции приблизительно 1 мкм или более. В других вариантах осуществления изобретения частицы имеют LD Dv(90) приблизительно 9-14 мкм, LD Dv(50) приблизительно 4-6 мкм и LD Dv(10) приблизительно 2-3 мкм, и по меньшей мере часть частиц несолюбилизированного фулвестранта имеет диаметр при лазерной дифракции менее приблизительно 1 мкм. В других вариантах осуществления изобретения частицы несолюбилизированного фулвестранта имеют LD Dv(90) от приблизительно 30 мкм до приблизительно 110 мкм, LD Dv(50) от приблизительно 5 мкм до приблизительно 30 мкм и LD Dv(10) от приблизительно 1,5 мкм до приблизительно 3 мкм. В других вариантах осуществления изобретения частицы имеют LD Dv(90) приблизительно 9-14 мкм, LD Dv(50) приблизительно 4-6 мкм и LD Dv(10) приблизительно 2-3 мкм, и частицы несолюбилизированного фулвестранта имеют диаметр при лазерной дифракции приблизительно 2 мкм или более. В других вариантах осуществления изобретения частицы имеют LD Dv(90) приблизительно 9-14 мкм, LD Dv(50) приблизительно 4-6 мкм и LD Dv(10) приблизительно 2-3 мкм, и по меньшей мере часть частиц несолюбилизированного фулвестранта имеет диаметр при лазерной дифракции менее приблизительно 2 мкм. В других вариантах осуществления изобретения частицы имеют LD Dv(90) приблизительно 6-9 мкм, LD Dv(50) приблизительно 2-4 мкм, LD Dv(10) приблизительно 1-2 мкм, и частицы несолюбилизированного фулвестранта имеют диаметр при лазерной дифракции приблизительно 0,5 мкм или более. В других вариантах осуществления изобретения частицы имеют LD Dv(90) приблизительно 6-9 мкм, LD Dv(50) приблизительно 2-4 мкм, LD Dv(10) приблизительно 1-2 мкм, и по меньшей мере часть частиц несолюбилизированного фулвестранта имеет диаметр при лазерной дифракции менее приблизительно 0,5 мкм. В дополнительных вариантах осуществления изобретения частицы несолюбилизированного фулвестранта имеют диаметр при лазерной дифракции приблизительно 1 мкм или более. В дополнительных вариантах осуществления изобретения по меньшей мере часть частиц несолюбилизированного фулвестранта имеет диаметр при лазерной дифракции менее приблизительно 1 мкм. В других вариантах осуществления изобретения частицы несолюбилизированного фулвестранта имеют диаметр при лазерной дифракции приблизительно 2 мкм или более. В других вариантах осуществления изобретения по меньшей мере часть частиц несолюбилизированного фулвестранта имеет диаметр при лазерной дифракции менее приблизительно 2 мкм.
[00222] В некоторых вариантах осуществления частицы несолюбилизированного фулвестранта имеют LD Dv(90) от приблизительно 15 мкм до приблизительно 35 мкм, LD Dv(50) от приблизительно 5,5 мкм до приблизительно 9,0 мкм и LD Dv(10) от приблизительно 1,5 мкм до приблизительно 2,1 мкм.
[00223] В некоторых вариантах осуществления частицы несолюбилизированного фулвестранта имеют LD Dv(10) при обработке ультразвуком от приблизительно 0,9 мкм до приблизительно 1,5 мкм, от приблизительно 1,0 мкм до приблизительно 1,2 мкм или от приблизительно 1,0 мкм до приблизительно 1,3 мкм. В других вариантах осуществления изобретения частицы несолюбилизированного фулвестранта имеют LD Dv(10) при обработке ультразвуком, равный приблизительно 0,9 мкм, 1,0 мкм, 1,1 мкм, приблизительно 1,2 мкм, приблизительно 1,3 мкм, приблизительно 1,4 мкм или приблизительно 1,5 мкм.
[00224] В некоторых вариантах осуществления частицы несолюбилизированного фулвестранта имеют LD Dv(50) при обработке ультразвуком от приблизительно 2,5 мкм до приблизительно 5,0 мкм, от приблизительно 2,5 мкм до приблизительно 4,5 мкм, от приблизительно 2,5 мкм до приблизительно 3,5 мкм, от приблизительно 3,0 мкм до приблизительно 4,0 мкм или от приблизительно 3,0 мкм до приблизительно 3,5 мкм. В других вариантах осуществления изобретения частицы несолюбилизированного фулвестранта имеют LD Dv(50) при обработке ультразвуком, равный приблизительно 2,5 мкм, 2,6 мкм, 2,7 мкм, приблизительно 2,8 мкм, приблизительно 2,9 мкм, приблизительно 3,0 мкм, приблизительно 3,1 мкм, приблизительно 3,2 мкм, приблизительно 3,3 мкм, приблизительно 3,4 мкм, приблизительно 3,5 мкм, приблизительно 3,6 мкм, приблизительно 3,7 мкм, приблизительно 3,8 мкм, приблизительно 3,9 мкм, приблизительно 4,0 мкм, приблизительно 4,1 мкм, приблизительно 4,2 мкм, приблизительно 4,3 мкм, приблизительно 4,4 мкм, приблизительно 4,5 мкм или приблизительно 5,0 мкм.
[00225] В некоторых вариантах осуществления частицы несолюбилизированного фулвестранта имеют LD Dv(90) при обработке ультразвуком от приблизительно 6,0 мкм до приблизительно 10,0 мкм, от приблизительно 6,5 мкм до приблизительно 9,0 мкм, от приблизительно 6,0 мкм до приблизительно 9,0 мкм, от приблизительно 6,5 мкм до приблизительно 7,5 мкм, или от приблизительно 6,5 мкм до приблизительно 8,5 мкм. В других вариантах осуществления изобретения частицы несолюбилизированного фулвестранта имеют LD Dv(90) при обработке ультразвуком, равный приблизительно 6,0 мкм, 6,5 мкм, 7,0 мкм, приблизительно 7,5 мкм, приблизительно 8,0 мкм, приблизительно 8,5 мкм, приблизительно 9,0 мкм, приблизительно 9,5 мкм или приблизительно 10,0 мкм. В дополнительных вариантах осуществления изобретения частицы несолюбилизированного фулвестранта имеют LD Dv(90) при обработке ультразвуком, равный приблизительно 6,1, 6,2, 6,3, 6,4, 6,6, 6,7, 6,8, 6,9, 7,1, 7,2, 7,3, 7,4, 7,6, 7,7, 7,8, 7,9, 8,1, 8,2, 8,3 или приблизительно 8,4 мкм.
[00226] В некоторых вариантах осуществления частицы несолюбилизированного фулвестранта имеют LD Dv(10) при обработке ультразвуком от приблизительно 1,0 и приблизительно 1,2 мкм, LD Dv(50) при обработке ультразвуком от приблизительно 3,0 и приблизительно 4,0 мкм и LD Dv(90) при обработке ультразвуком от приблизительно 6 мкм до приблизительно 9 мкм.
[00227] В некоторых вариантах осуществления частицы несолюбилизированного фулвестранта имеют CE Dv(10) от приблизительно 1 мкм до приблизительно 25 мкм, от приблизительно 2 мкм до приблизительно 25 мкм, от приблизительно 3 мкм до приблизительно 7 мкм, от приблизительно 4 мкм до приблизительно 15 мкм, от приблизительно 4 мкм до приблизительно 10 мкм, от приблизительно 4 мкм до приблизительно 8 мкм, от приблизительно 6 мкм до приблизительно 8 мкм, от приблизительно 6 мкм до приблизительно 7 мкм, от приблизительно 1 мкм до приблизительно 10 мкм, от приблизительно 3 мкм до приблизительно 6 мкм или от приблизительно 3,5 мкм до приблизительно 5,2 мкм. В других вариантах осуществления изобретения частицы несолюбилизированного фулвестранта имеют CE Dv(10), равный приблизительно 1 мкм, приблизительно 2 мкм, приблизительно 3 мкм, приблизительно 4 мкм, приблизительно 5 мкм, приблизительно 6 мкм, приблизительно 7 мкм, приблизительно 8 мкм, приблизительно 9 мкм, приблизительно 10 мкм, приблизительно 11 мкм, приблизительно 12 мкм, приблизительно 13 мкм, приблизительно 14 мкм, приблизительно 15 мкм, приблизительно 16 мкм, приблизительно 17 мкм, приблизительно 18 мкм, приблизительно 19 мкм, приблизительно 20 мкм, приблизительно 21 мкм, приблизительно 22 мкм, приблизительно 23 мкм, приблизительно 24 мкм или приблизительно 25 мкм.
[00228] В некоторых вариантах осуществления частицы несолюбилизированного фулвестранта имеют CE Dv(50) от приблизительно 5 мкм до приблизительно 60 мкм, от приблизительно 5 мкм до приблизительно 50 мкм, от приблизительно 9 мкм до приблизительно 20 мкм, от приблизительно 9 мкм до приблизительно 15 мкм, от приблизительно 10 мкм до приблизительно 50 мкм, от приблизительно 10 мкм до приблизительно 40 мкм, от приблизительно 10 мкм до приблизительно 30 мкм, от приблизительно 10 мкм до приблизительно 20 мкм, от приблизительно 15 мкм до приблизительно 30 мкм, от приблизительно 15 мкм до приблизительно 25 мкм, от приблизительно 15 мкм до приблизительно 20 мкм, от приблизительно 10 мкм до приблизительно 15 мкм, от приблизительно 8 мкм до приблизительно 15 мкм, от приблизительно 7,0 мкм до приблизительно 16,0 мкм или от приблизительно 7,8 мкм до приблизительно 14,9 мкм. В других вариантах осуществления изобретения частицы несолюбилизированного фулвестранта имеют CE Dv(50), равный приблизительно 5 мкм, приблизительно 6 мкм, приблизительно 7 мкм, приблизительно 8 мкм, приблизительно 9 мкм, приблизительно 10 мкм, приблизительно 11 мкм, приблизительно 12 мкм, приблизительно 13 мкм, приблизительно 14 мкм, приблизительно 15 мкм, приблизительно 16 мкм, приблизительно 17 мкм, приблизительно 18 мкм, приблизительно 19 мкм, приблизительно 20 мкм, приблизительно 21 мкм, приблизительно 22 мкм, приблизительно 23 мкм, приблизительно 24 мкм, приблизительно 25 мкм, приблизительно 30 мкм, приблизительно 35 мкм, приблизительно 40 мкм, приблизительно 45 мкм, приблизительно 50 мкм, приблизительно 55 мкм или приблизительно 60 мкм.
[00229] В некоторых вариантах осуществления частицы несолюбилизированного фулвестранта имеют CE Dv(90) от приблизительно 10 мкм до приблизительно 200 мкм, от приблизительно 25 мкм до приблизительно 150 мкм, от приблизительно 25 мкм до приблизительно 125 мкм, от приблизительно 25 мкм до приблизительно 100 мкм, от приблизительно 20 мкм до приблизительно 90 мкм, от приблизительно 23,3 до приблизительно 85,3 мкм, от приблизительно 25 мкм до приблизительно 75 мкм, от приблизительно 25 мкм до приблизительно 50 мкм, от приблизительно 25 мкм до приблизительно 40 мкм, от приблизительно 25 мкм до приблизительно 35 мкм, от приблизительно 35 мкм до приблизительно 90 мкм, от приблизительно 35 мкм до приблизительно 75 мкм, от приблизительно 35 мкм до приблизительно 50 мкм, от приблизительно 35 мкм до приблизительно 45 мкм, от приблизительно 50 мкм до приблизительно 100 мкм, от приблизительно 50 мкм до приблизительно 75 мкм или от приблизительно 20 мкм до приблизительно 40 мкм. В других вариантах осуществления изобретения частицы несолюбилизированного фулвестранта имеют CE Dv(90), равный приблизительно 10 мкм, приблизительно 15 мкм, приблизительно 20 мкм, приблизительно 25 мкм, приблизительно 30 мкм, приблизительно 35 мкм, приблизительно 40 мкм, приблизительно 45 мкм, приблизительно 50 мкм, приблизительно 55 мкм, приблизительно 60 мкм, приблизительно 65 мкм, приблизительно 70 мкм, приблизительно 75 мкм, приблизительно 80 мкм, приблизительно 85 мкм, приблизительно 90 мкм, приблизительно 95 мкм, приблизительно 100 мкм, приблизительно 105 мкм, приблизительно 110 мкм, приблизительно 115 мкм, приблизительно 120 мкм, приблизительно 125 мкм, приблизительно 130 мкм, приблизительно 135 мкм, приблизительно 140 мкм, приблизительно 145 мкм, приблизительно 150 мкм, приблизительно 155 мкм, приблизительно 160 мкм, приблизительно 165 мкм, приблизительно 170 мкм, приблизительно 175 мкм или приблизительно 200 мкм.
[00230] В некоторых вариантах осуществления частицы несолюбилизированного фулвестранта имеют CE Dv(90) от приблизительно 35 мкм до приблизительно 90 мкм, CE Dv(50) от приблизительно 10 мкм до приблизительно 35 мкм и CE Dv(10) от приблизительно 4 мкм до приблизительно 10 мкм. В других вариантах осуществления изобретения частицы несолюбилизированного фулвестранта имеют CE Dv(90) от приблизительно 25 мкм до приблизительно 60 мкм, CE Dv(50) от приблизительно 10 мкм до приблизительно 25 мкм и CE Dv(10) от приблизительно 4 мкм до приблизительно 8 мкм. В других вариантах осуществления изобретения частицы несолюбилизированного фулвестранта имеют CE Dv(90) от приблизительно 20 мкм до приблизительно 35 мкм, CE Dv(50) от приблизительно 10 мкм до приблизительно 20 мкм и CE Dv(10) от приблизительно 4 мкм до приблизительно 8 мкм. В других вариантах осуществления изобретения частицы несолюбилизированного фулвестранта имеют CE Dv(90) от приблизительно 30 мкм до приблизительно 100 мкм, CE Dv(50) от приблизительно 10 мкм до приблизительно 50 мкм и CE Dv(10) от приблизительно 4 мкм до приблизительно 10 мкм. В других вариантах осуществления изобретения частицы несолюбилизированного фулвестранта имеют CE Dv(90) от приблизительно 50 мкм до приблизительно 100 мкм, CE Dv(50) от приблизительно 20 мкм до приблизительно 50 мкм, CE Dv(10) от приблизительно 6 мкм до приблизительно 8 мкм. В других вариантах осуществления изобретения частицы несолюбилизированного фулвестранта имеют CE Dv(90) от приблизительно 50 мкм до приблизительно 75 мкм, CE Dv(50) от приблизительно 30 мкм до приблизительно 40 мкм, CE Dv(10) от приблизительно 8 мкм до приблизительно 10 мкм. В других вариантах осуществления изобретения частицы несолюбилизированного фулвестранта имеют CE Dv(90) от приблизительно 20 мкм до приблизительно 60 мкм, CE Dv(50) от приблизительно 9 мкм до приблизительно 20 мкм и CE Dv(10) от приблизительно 3 мкм до приблизительно 7 мкм. В дополнительных вариантах осуществления изобретения частицы несолюбилизированного фулвестранта имеют CE Dv(90) от приблизительно 20 мкм до приблизительно 50 мкм, CE Dv(50) от приблизительно 9 мкм до приблизительно 20 мкм и CE Dv(10) от приблизительно 3 мкм до приблизительно 7 мкм. В других вариантах осуществления изобретения частицы несолюбилизированного фулвестранта имеют CE Dv(90) от приблизительно 20 мкм до приблизительно 45 мкм, CE Dv(50) от приблизительно 9 мкм до приблизительно 20 мкм и CE Dv(10) от приблизительно 3 мкм до приблизительно 7 мкм. В дополнительных вариантах осуществления изобретения частицы несолюбилизированного фулвестранта имеют CE Dv(90) от приблизительно 20 мкм до приблизительно 40 мкм, CE Dv(50) от приблизительно 9 мкм до приблизительно 15 мкм и CE Dv(10) от приблизительно 3 мкм до приблизительно 7 мкм. В дополнительных вариантах осуществления изобретения частицы несолюбилизированного фулвестранта имеют CE Dv(90) от приблизительно 20 мкм до приблизительно 35 мкм, CE Dv(50) от приблизительно 9 мкм до приблизительно 15 мкм и CE Dv(10) от приблизительно 3 мкм до приблизительно 7 мкм. В других вариантах осуществления изобретения частицы несолюбилизированного фулвестранта имеют CE Dv(90) от приблизительно 20 мкм до приблизительно 45 мкм, CE Dv(50) от приблизительно 9 мкм до приблизительно 15 мкм и CE Dv(10) от приблизительно 3 мкм до приблизительно 7 мкм. В других вариантах осуществления изобретения частицы несолюбилизированного фулвестранта имеют CE Dv(10) от приблизительно 3,0 мкм до приблизительно 6,0 мкм, CE Dv(50) от приблизительно 7,0 мкм до приблизительно 16,0 мкм и CE Dv(90) от приблизительно 20 мкм до приблизительно 90 мкм. В других вариантах осуществления изобретения частицы несолюбилизированного фулвестранта имеют CE Dv(10) от приблизительно 3,5 мкм до приблизительно 5,2 мкм, CE Dv(50) от приблизительно 7,8 мкм до приблизительно 14,9 мкм и CE Dv(90) от приблизительно 23,3 и приблизительно 85,3 мкм.
[00231] В некоторых вариантах осуществления частицы несолюбилизированного фулвестранта имеют CE Dn(90) от приблизительно 4 мкм до приблизительно 20 мкм, от приблизительно 6 мкм до приблизительно 15 мкм, от приблизительно 6 мкм до приблизительно 12 мкм, от приблизительно 8 мкм до приблизительно 12 мкм, от приблизительно 8 мкм до приблизительно 11 мкм, от приблизительно 4 мкм до приблизительно 10 мкм, от приблизительно 4 мкм до приблизительно 8 мкм, от приблизительно 4 мкм до приблизительно 7 мкм или от приблизительно 4 мкм до приблизительно 6 мкм. В других вариантах осуществления изобретения частицы несолюбилизированного фулвестранта имеют CE Dn(90), равный приблизительно 4 мкм, приблизительно 5 мкм, приблизительно 6 мкм, приблизительно 7 мкм, приблизительно 8 мкм, приблизительно 9 мкм, приблизительно 10 мкм, приблизительно 11 мкм, приблизительно 12 мкм, приблизительно 13 мкм, приблизительно 14 мкм, приблизительно 15 мкм, приблизительно 16 мкм, приблизительно 17 мкм, приблизительно 18 мкм, приблизительно 19 мкм или приблизительно 20 мкм.
[00232] В некоторых вариантах осуществления частицы несолюбилизированного фулвестранта имеют CE Dn(50) от приблизительно 2,0 мкм до приблизительно 10,0 мкм, от приблизительно 2,0 мкм до приблизительно 8,0 мкм, от приблизительно 2,0 мкм до приблизительно 6,0 мкм, от приблизительно 2,0 мкм до приблизительно 5,0 мкм, от приблизительно 3,0 мкм до приблизительно 5,0 мкм, от приблизительно 3,5 мкм до приблизительно 4,5 мкм, от приблизительно 2,0 мкм до приблизительно 4,0 мкм, от приблизительно 2,5 мкм до приблизительно 4,5 мкм или от приблизительно 2,5 мкм до приблизительно 3,5 мкм. В других вариантах осуществления изобретения частицы несолюбилизированного фулвестранта имеют CE Dn(50), равный приблизительно 2,0 мкм, приблизительно 2,5 мкм, приблизительно 3,0 мкм, приблизительно 3,5 мкм, приблизительно 4,0 мкм, приблизительно 4,5 мкм, приблизительно 5,0 мкм, приблизительно 5,5 мкм, приблизительно 6,0 мкм, приблизительно 6,5 мкм, приблизительно 7,0 мкм, приблизительно 7,5 мкм, приблизительно 8,0 мкм, приблизительно 8,5 мкм, приблизительно 9,0 мкм, приблизительно 9,5 мкм или приблизительно 10,0 мкм.
[00233] В некоторых вариантах осуществления частицы несолюбилизированного фулвестранта имеют CE Dn(10) от приблизительно 0,5 мкм до приблизительно 2,0 мкм, от приблизительно 0,5 мкм до приблизительно 1,5 мкм, от приблизительно 1,0 мкм до приблизительно 1,5 мкм, от приблизительно 0,8 мкм до приблизительно 1,2 мкм, от приблизительно 0,9 мкм до приблизительно 1,1 мкм, или от приблизительно 0,5 мкм до приблизительно 1,0 мкм. В других вариантах осуществления изобретения частицы несолюбилизированного фулвестранта имеют CE Dn(10), равный приблизительно 0,5, приблизительно 0,6, приблизительно 0,7, приблизительно 0,8, приблизительно 0,9, приблизительно 1,0, приблизительно 1,1, приблизительно 1,2, приблизительно 1,3, приблизительно 1,4, приблизительно 1,5, приблизительно 1,6, приблизительно 1,7, приблизительно 1,8, приблизительно 1,9 или приблизительно 2,0 мкм.
[00234] В некоторых вариантах осуществления частицы несолюбилизированного фулвестранта имеют CE Dn(90) от приблизительно 4 мкм до приблизительно 20 мкм, CE Dn(50) от приблизительно 2,0 мкм до приблизительно 10,0 мкм и CE Dn(10) от приблизительно 0,5 мкм до приблизительно 2,0 мкм. В других вариантах осуществления изобретения частицы несолюбилизированного фулвестранта имеют CE Dn(90) от приблизительно 6 мкм до приблизительно 12 мкм, CE Dn(50) от приблизительно 2,0 мкм до приблизительно 6,0 мкм и CE Dn(10) от приблизительно 0,5 мкм до приблизительно 1,5 мкм. В дополнительных вариантах осуществления изобретения частицы несолюбилизированного фулвестранта имеют CE Dn(90) от приблизительно 8 мкм до приблизительно 1 мкм, CE Dn(50) от приблизительно 3,0 мкм до приблизительно 5,0 мкм и CE Dn(10) от приблизительно 0,8 мкм до приблизительно 1,2 мкм.
[00235] Специалистам в этой области будет понятно, что в предпочтительных вариантах осуществления настоящего изобретения можно осуществлять многочисленные изменения и модификации, и что такие изменения и модификации можно осуществлять без отклонения от сущности изобретения. Таким образом, предполагают, что следующие примеры и формула изобретения охватывают все такие эквивалентные варианты, попадающие в сущность и объем настоящего изобретения.
[00236] Таким образом, описания каждого патента, патентной заявки и публикации, процитированных или описанных в настоящей заявке, включены в настоящее описание посредством ссылки в полном объеме.
ПРИМЕРЫ
ПРИМЕР 1: Аналитические способы
[00237] В некоторых аспектах количество солюбилизированного фулвестранта в водных суспензиях измеряли посредством анализа ВЭЖХ. Водные суспензии фильтровали с использованием шприцевых фильтров PVDF 0,2 мкм, 25 мм для удаления дисперсных частиц, и отфильтрованные образцы впрыскивали напрямую в устройство для ВЭЖХ для анализа. ВЭЖХ осуществляли с использованием модуля Agilent Technologies Agilent 1260 Infinity Quaternary LC G1311B (Agilent Technologies, Santa Clara, CA). Для анализа солюбилизированных концентраций фулвестранта также можно использовать другие устройства для ВЭЖХ.
[00238] В некоторых аспектах размер частиц и распределения размера частиц анализировали с использованием Malvern Mastersizer 3000 (Malvern Instruments Ltd., Malvern, Worcestershire, UK) посредством лазерной дифракции. Восстановленные суспензии анализировали в том виде, в котором они были, или после ультразвуковой обработки с использованием присоединенного модуля для диспергирования образцов с поточным зондом для обработки ультразвуком перед анализом посредством лазерной дифракции.
[00239] В некоторых аспектах размер частиц и распределения размера частиц анализировали с помощью Malvern Morphologi G3 (Malvern Instruments Ltd., Malvern, Worcestershire, UK) для определения диаметров эквивалента круга (CE) посредством захвата и анализа изображений, полученных посредством микроскопии. Диаметры CE измеряли и определяли параметры средневзвешенного по объему распределения размера частиц.
ПРИМЕР 2: Анализ водных суспензий фулвестранта in vitro
[00240] Получали тестовые флаконы с лиофилизированным лекарственным составом фулвестранта, состоящим из фулвестранта, 500 мг; полисорбата 80, 25 мг; маннита, 250 мг, и повидона PLASDONE™ C-12, 8,0 мг, лиофилизированным из суспензий, содержащих фулвестрант, USP 100 мг/мл, полисорбат 80, NF: 0,5% (масс./масс.), маннит, USP: 5,0% (масс./масс.), PLASDONE™ C-12, NF (средняя MW=4000): 0,16% (масс./масс.). Анализы in vitro проводили на водных суспензиях, полученных с разными водными разбавителями. Водные суспензии получали, медленно инъецируя водный разбавитель в тестовый флакон, и осторожно вращали флакон рукой в течение пяти минут для перемешивания суспензии. Анализировали размер частиц, распределения размера частиц и растворимость фулвестранта, как указано в таблицах 3-8 ниже.
ТАБЛИЦА 3
ТАБЛИЦА 4
ТАБЛИЦА 5
ТАБЛИЦА 6
ТАБЛИЦА 7
ТАБЛИЦА 8
ПРИМЕР 3: Фармакокинетическое исследование внутримышечного введения крысам
[00241] Фармакокинетическое исследование однократной внутримышечной дозы на крысах осуществляли с использованием новых восстановленных суспензий фулвестранта. Десяти самкам крыс Спрег-Доули [Crl:CD®(SD)]/группу вводили однократные внутримышечные (IM) болюсные дозы 15 мг/кг новых восстановленных суспензий фулвестранта или FASLODEX® (средство для сравнения) посредством инъекций в крупные мышечные массы в левую заднюю конечность каждой крысы. Объем дозы новых восстановленных суспензий составлял 0,15 мл/кг. Объем дозы FASLODEX® составлял 0,3 мл/кг. Учитывая площадь поверхности тела, 15 мг/кг составляет приблизительно одну треть рекомендуемой дозы для человека 500 мг/субъекта/месяц. Возраст крыс составлял по меньшей мере 10-13 недель, а вес составлял 233-282 граммов в день исследования 1 (день введения дозы). Новые восстановленные суспензии фулвестранта получали из лиофилизированного лекарственного продукта, состоящего из фулвестранта, 500 мг; полисорбата 80, 25 мг; маннита, 250 мг; и повидона PLASDONE™ C-12, 8,0 мг, лиофилизированных из суспензий, содержащих фулвестрант, USP 100 мг/мл, полисорбат 80, NF: 0,5% (масс./масс.), маннит, USP: 5,0% (масс./масс.), PLASDONE™ C-12, NF (средняя MW=4000): 0,16% (масс./масс.), обозначенных в таблице 9 как "тестовый продукт". Флаконы с лиофилизированным лекарственным продуктом восстанавливали перед введением с использованием разбавителей, приведенных в таблице 9 ниже. Коммерчески доступный состав FASLODEX® использовали в таком виде, как он есть, и описано, что он содержит 10% масс./об. спирта, USP; 10% масс./об. бензилового спирта, NF; и 15% масс./об. бензилбензоата, USP, в 100% масс./об. касторового масла, USP.
ТАБЛИЦА 9
[00242] Время забора крови для всех крыс представляло собой момент до введения дозы и 1, 3, 6, 12, 24, 48, 72, 120, 168, 216, 288, 360, 432, 576, 720, 888, 1056 и 1224 часов после введения дозы. Плазму получали из образцов крови и анализировали на концентрацию фулвестранта с использованием сертифицированного анализа. Выбор состава был основан на фармакокинетических данных до 720 часов (30 дней) после введения дозы на основе фиксации соответствующей части конечной фазы элиминации. Фармакокинетические параметры вычисляли с использованием внемодельных способов для каждого животного и каждой группы, и они включали максимальную наблюдаемую концентрацию в плазме (Cmax), время максимальной наблюдаемой концентрации в плазме (Tmax), среднее время удержания от момента введения дозы, экстраполированное до бесконечности (MRTINF), скорректированное Rsq (R2) и площадь под кривой концентрация в плазме-время (AUC). Для всех животных, имеющих по меньшей мере три последовательные измеримые концентрации, использовали линейный метод трапеций. Значения времени полужизни (T1/2) регистрировали для каждого профиля концентрация в плазме-время, который включал достаточные концентрации в плазме конечную фазу элиминации (по меньшей мере три образца, не включая Tmax). Дополнительные оценки включали ежедневные клинические осмотры и еженедельное определение массы тела.
[00243] Средние фармакокинетические параметры для группы 6, разбавителя 10 в объеме 5 мл и FASLODEX® приведены в таблице 10 ниже.
ТАБЛИЦА 10
Геометрические средние (± стандартное отклонение) для фармакокинетических параметров после однократных IM инъекций водных суспензий в группе 6, разбавитель 10 (объем 5 мл) или FASLODEX® у крыс
[00244] Параметры AUC для групп 5-13 приведены в таблице 11 ниже.
ТАБЛИЦА 11
[00245] Концентрации в плазме крови для групп 1, 2, 3, 5, 6, 7 и 8 графически представлены на фиг. 1.
ПРИМЕР 4: Фармакокинетическое исследование внутримышечного введения на людях
[00246] Фармакокинетическое исследование однократной внутримышечной дозы на людях осуществляли с использованием новых восстановленных суспензий фулвестранта. 600 здоровым женщинам вводили однократные внутримышечные (IM) дозы восстановленных суспензий фулвестранта или FASLODEX® (средства для сравнения) в левый или правый верхний наружный квадрант, рандомизировали их в группы лечения в соотношении 1:1. Исследование проводили на здоровых женщинах в менопаузе и после менопаузы возрастом от 40 до 75 лет с индексом массы от 18 кг/м2 до 32 кг/м2 и массой тела по меньшей мере 50 кг при скрининге. Приблизительно половина женщин находилась в менопаузе, а половина - после менопаузы. По меньшей мере 20% рандомизированных женщин после менопаузы имели возраст >65 лет.
[00247] Субъектам, которым вводили тестовый продукт, инъецировали восстановленные суспензии, содержащие 500 мг (100 мг/мл) фулвестранта 1×5 мл (500 мг) за 1 минуту в правый или левый верхний наружный квадрант в день 1 (в других аспектах субъектам, которым вводили тестовый продукт, вводили восстановленные суспензии, содержащие более 500 мг фулвестранта, например, до приблизительно 3000 мг, в левый или правый верхний наружный квадрант в день 1). Другим субъектам вводили коммерчески доступный FASLODEX® (250 мг/5 мл), поставляемый в картонных упаковках, каждая из которых содержит 2 заранее наполненных шприца, который медленно инъецировали за 1-2 минуты в левый или правый верхний наружный квадрант в виде 2 инъекций по 5 мл (500 мг) в день 1. Образцы крови собирали для анализа PK фулвестранта перед введением дозы (в пределах 60 минут [мин] до введения дозы) и через 3, 6, 12 ч. после введения дозы в день 1 и в дни 2, 3, 4, 5, 6, 7, 8, 9, 10, 12, 15, 18, 21, 28, 35, 42, 49 56, 63, 70, 77, 84, 98, 112, 126 и 140. Все образцы для анализа PK, собранные в дни 2-10, получали в пределах 1 часа от соответствующего времени введения дозы в день 1, в пределах 3 часов от соответствующего времени введения дозы в дни 12-21, в пределах 4 часов от соответствующего времени введения дозы в дни 28-84, и ±1 день, но в пределах 6 часов от соответствующего времени введения дозы в дни 98-140. Плазму собирали и анализировали на концентрации фулвестранта с использованием валидированного способа жидкостной хроматографии-тандемной масс-спектрометрии.
[00248] Тестовый продукт в исследовании предоставляли во флаконах, которые необходимо восстанавливать разбавителем. После восстановления 5 мл предоставленного разбавителя для достижения концентрации фулвестранта 100 мг/мл в водной суспензии однократную дозу 5 мл (500 мг) вводили внутримышечно с помощью иглы калибра 23 (длиной 1,5 дюйма) в левый или правый верхний наружный квадрант (по выбору исследователя) в день 1 (в других аспектах после восстановления с помощью предоставленного разбавителя для достижения концентрации фулвестранта 100 мг/мл в водной суспензии, однократную дозу более 500 мг фулвестранта, например, до 3000 мг фулвестранта, вводили внутримышечно с помощью иглы калибра 23 (длиной 1,5 дюйма) в левый или правый верхний наружный квадрант (по выбору исследователя) в день 1). Восстановленный продукт инъецировали в пределах 2 часов после получения. Тестовый продукт хранили в холодильной камере (2-8°C).
[00249] Восстановленные суспензии фулвестранта получали из лиофилизированного лекарственного продукта с композицией, представленной в таблице 12, предоставляемой в виде белого или грязно-белого лиофилизированного порошка в стеклянном флаконе.
ТАБЛИЦА 12
[00250] Флаконы с лиофилизированным лекарственным продуктом перед введением восстанавливали объемом 5,0 мл разбавителя, приведенного в таблице 13. Восстановление осуществляли посредством перемешивания вращением вручную и осторожного переворачивания стеклянного флакона.
ТАБЛИЦА 13
[00251] Восстановленная суспензия имела композицию, приведенную в таблице 14. pH восстановленной суспензии составлял приблизительно 7,6. Восстановленная суспензия выглядела молочно-белой.
ТАБЛИЦА 14
[00252] Коммерчески доступный состав FASLODEX® хранили в холодильной камере при 2-8°C (36-46°F) в его оригинальной картонной упаковке до использования и использовали его в том виде, как он есть. Описано, что состав FASLODEX® содержит 10% масс./об. спирта, USP; 10% масс./об. бензилового спирта, NF; и 15% масс./об. бензилбензоата, USP в до 100% масс./об. касторового масла, USP.
[00253] Плазму отделяли посредством центрифугирования образцов крови при 1800×g в течение 10 мин и переноса 1 мл супернатанта плазмы в криофлакон 2 мл, который хранили при -20°C до отправки в биоаналитическую лабораторию для определения уровня фулвестранта.
[00254] В анализ PK включали всех субъектов, которым вводили исследуемое лекарственное средство, и у которых были анализы крови, достаточные для определения по меньшей мере одного параметра PK. Для включения в выборку PK должно было отсутствовать не более одного образца крови в течение первых 15 дней после введения дозы и не более двух последовательных образцов крови в дни 18-140.
[00255] Данные о концентрации суммировали в соответствии с номинальным (определенным протоколом) временем забора образцов. Параметры PK вычисляли некомпартментными способами и точное время, прошедшее с введения дозы, использовали для оценки индивидуальных параметров PK в плазме. Общее воздействие (AUCпоследн.) фулвестранта сравнивали между 2 группами лечения с использованием дисперсионного анализа. Дисперсионный анализ с использованием общей линейной модели осуществляли с помощью логарифмически преобразованной AUCпоследн. в качестве зависимой переменной и группы лечения (тестовую или сравнения) и дозовых когорт в качестве фиксированных эффектов. Вторичный параметр PK Cmax оценивали посредством описательной статистики. Площадь под кривой от нуля до последней измеренной концентрации (AUCпоследн.) вычисляли линейным методом трапеций. В качестве значений для отсутствующих образцов не использовали предполагаемые значения концентрации. Любой образец с отсутствующим значением обрабатывали так, как если бы образец не планировали собирать. Если субъект имел промежуточные уровни перед введением дозы (образец 0 ч), составляющие более 5% от их измеренного значения Cmax, субъекта исключали из статистического анализа.
[00256] Перед анализом AUCпоследн. логарифмически преобразовывали. Дисперсионный анализ (ANOVA) осуществляли с помощью общей линейной модели (GLM) в SAS с проверкой гипотезы об эффектах лечения при α=0,05. Статистическая модель включала основные эффекты лечения и дозовую когорту. Все эффекты тестировали против параметра среднеквадратической ошибки из ANOVA. Используя режим SAS ESTIMATE, получали средние значения, полученные методом наименьших квадратов, для групп лечения (режим LSMEANS), различия между этими средними, стандартные ошибки, ассоциированные с различиями, и 90%-ный доверительный интервал для различий. Соотношение геометрических средних, рассчитанных методом наименьших квадратов, для тестовой группы и группы сравнения и 90%-ный доверительный интервал для соотношения получали, беря антилогарифм различия и 90%-ный доверительный интервал этого различия. Сравнение Cmax осуществляли с использованием логарифмически преобразованных данных так же, как описано для AUCпоследн. Результаты представлены в таблице 15. В таблице 15 приведены вычисленные значения "RefLSM", что означает среднее значение, полученное методом наименьших квадратов, логарифмически преобразованного измеренного значения для всех субъектов, которых лечили с помощью FASLODEX®, "RefGeoLSM", что означает геометрическое среднее, рассчитанное методом наименьших квадратов, измеренного значения для всех субъектов, которых лечили с помощью FASLODEX®, "TestLSM", что означает среднее значение, полученное методом наименьших квадратов, логарифмически преобразованного измеренного значения для всех субъектов, которых лечили тестовым продуктом, восстановленной суспензией фулвестранта, "TestGeoLSM", что означает геометрическое среднее, рассчитанное методом наименьших квадратов, измеренного значения для всех субъектов, которых лечили тестовым продуктом, восстановленной суспензией фулвестранта. В строке, помеченной "Ln(Cmax)", указаны значения Cmax в нг/мл, логарифмически преобразованные в указанных столбцах. В строке, помеченной "Ln(AUCпоследн.)", указаны значения AUCпоследн. в дни*нг/мл, логарифмически преобразованные в указанных столбцах. Арифметические средние значения и стандартные отклонения для Cmax и AUCпоследн. вычисляли для субъектов, которых лечили тестовым продуктом (включены данные для n=291 субъектов) со средней Cmax=6,00 нг/мл (с SD 7,47 нг/мл) и средней AUCпоследн.=286 дней*нг/мл (с SD 101 день*нг/мл).
ТАБЛИЦА 15
[00257] На фиг. 2-7 показаны линейные и полулогарифмические графики средних концентраций фулвестранта в плазме крови в случае тестового продукта и FASLODEX®. Точки данных о средних концентрациях в плазме крови, используемые на фиг. 2-7, приведены в таблице 16.
ТАБЛИЦА 16
[00258] Когда в настоящем описании используют диапазоны для химических или физических свойств, таких как размер частиц или распределение размера частиц, концентрации компонентов состава или фармакокинетические свойства, они предназначены для включения всех комбинаций и подкомбинаций диапазонов в конкретных вариантах осуществления.
[00259] Описания каждого патента, патентной заявки и публикации, процитированной или описанной в настоящей заявке, включены, таким образом, в настоящее описание посредством ссылки в полном объеме.
[00260] Специалистам в этой области будет понятно, что можно осуществлять многочисленные изменения и модификации предпочтительных вариантов осуществления изобретения, и что такие изменения и модификации можно осуществлять без отклонения от сущности изобретения. Таким образом, предполагают, что формула изобретения охватывает все такие эквивалентные варианты как попадающие в сущность и объем настоящего изобретения.
| название | год | авторы | номер документа |
|---|---|---|---|
| СОСТАВЫ ФУЛЬВЕСТРАНТА И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2017 |
|
RU2775225C2 |
| СПОСОБ ВВЕДЕНИЯ СУСПЕНЗИИ ПАЛИПЕРИДОНА ПАЛЬМИТАТА ДЛЯ ИНЪЕКЦИЙ С ПРОЛОНГИРОВАННЫМ ВЫСВОБОЖДЕНИЕМ | 2018 |
|
RU2777552C2 |
| СОСТАВЫ ВНУТРИВЕННЫХ РАСТВОРОВ ПОЗАКОНАЗОЛА, СТАБИЛИЗИРОВАННЫЕ ПОСРЕДСТВОМ ЗАМЕЩЕННОГО БЕТА-ЦИКЛОДЕКСТРИНА | 2011 |
|
RU2575768C2 |
| СПОСОБ ЛЕЧЕНИЯ ЗАБОЛЕВАНИЙ ПРЕДСТАТЕЛЬНОЙ ЖЕЛЕЗЫ, ОСНОВАННЫЙ НА МЕСТНОЙ ДОСТАВКЕ АКТИВНЫХ ВЕЩЕСТВ | 2006 |
|
RU2404747C2 |
| КОМПОЗИЦИИ ГРАПИПРАНТА И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2015 |
|
RU2811411C2 |
| КОМПОЗИЦИИ ГРАПИПРАНТА И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2015 |
|
RU2679631C2 |
| АНТАГОНИСТ РЕЦЕПТОРА CRF1, ЕГО ФАРМАЦЕВТИЧЕСКИЕ СОСТАВЫ И ТВЕРДЫЕ ФОРМЫ ДЛЯ ЛЕЧЕНИЯ ВРОЖДЕННОЙ ГИПЕРПЛАЗИИ НАДПОЧЕЧНИКОВ | 2019 |
|
RU2824490C2 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ И СПОСОБЫ ПРИМЕНЕНИЯ | 2017 |
|
RU2719450C1 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ С ДЛИТЕЛЬНЫМ ПОСТЕПЕННЫМ ВЫСВОБОЖДЕНИЕМ, СОДЕРЖАЩАЯ ВОДНУЮ СУСПЕНЗИЮ БИСФОСФОНАТА | 2007 |
|
RU2453316C2 |
| МОДУЛЯТОРЫ АКТИВНОСТИ КОМПЛЕМЕНТА | 2016 |
|
RU2733720C2 |
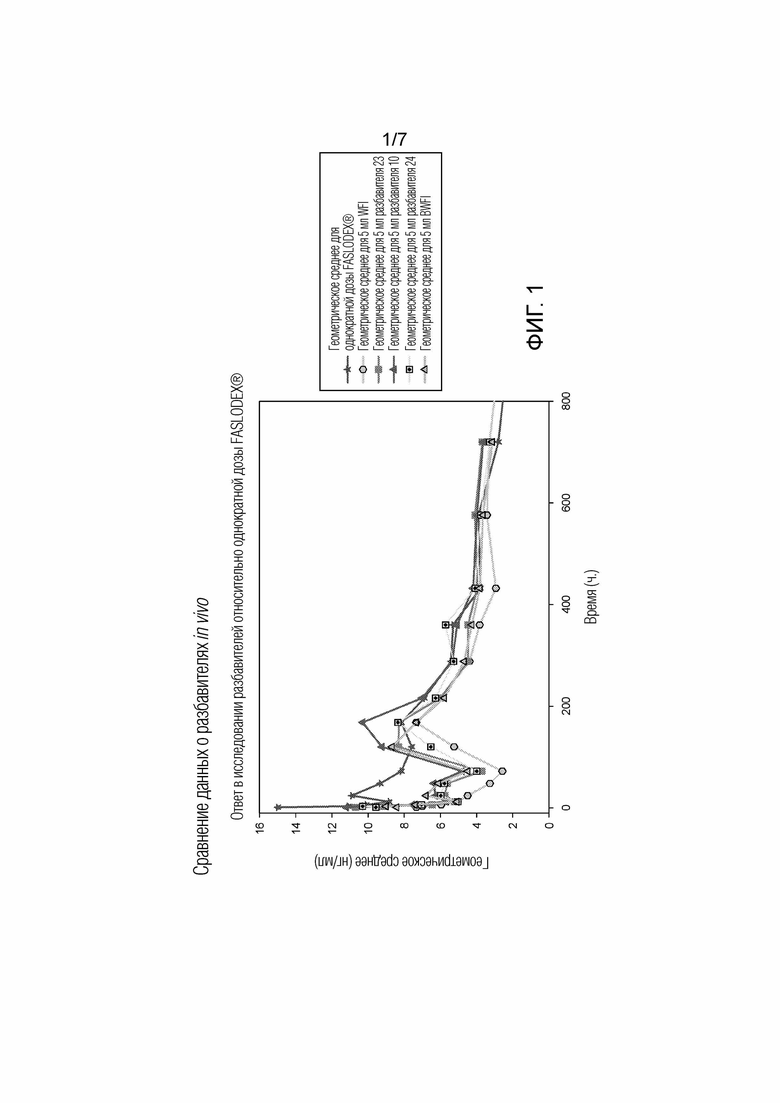
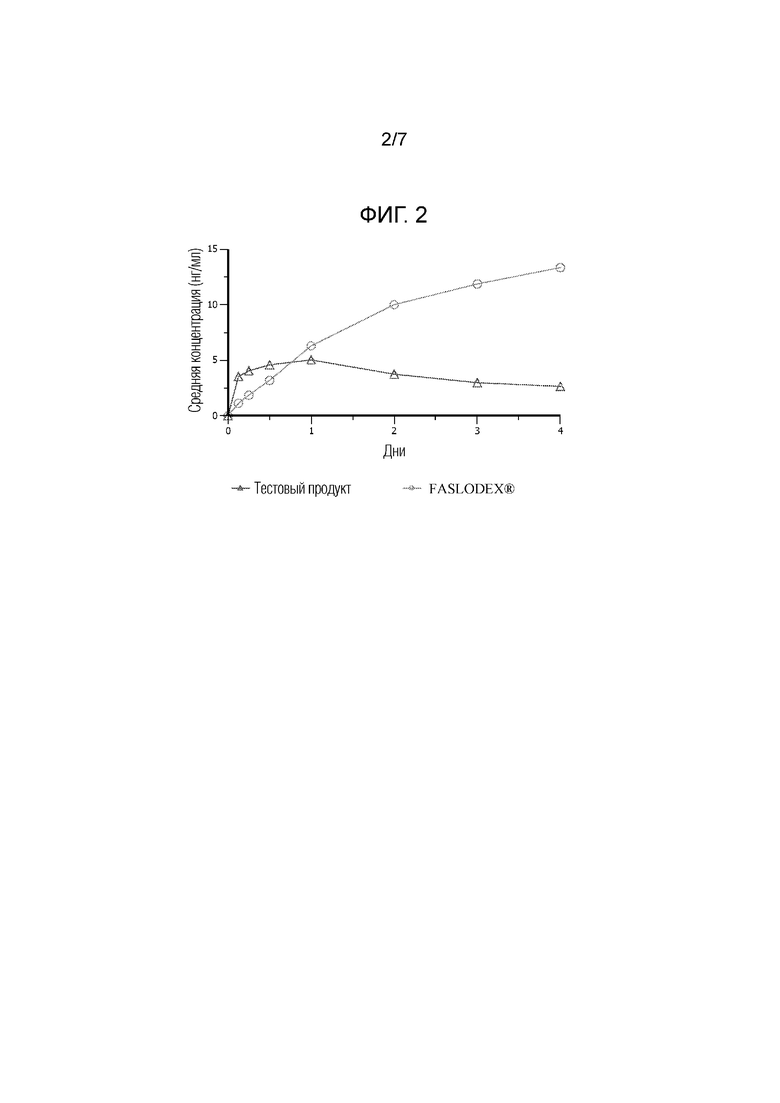
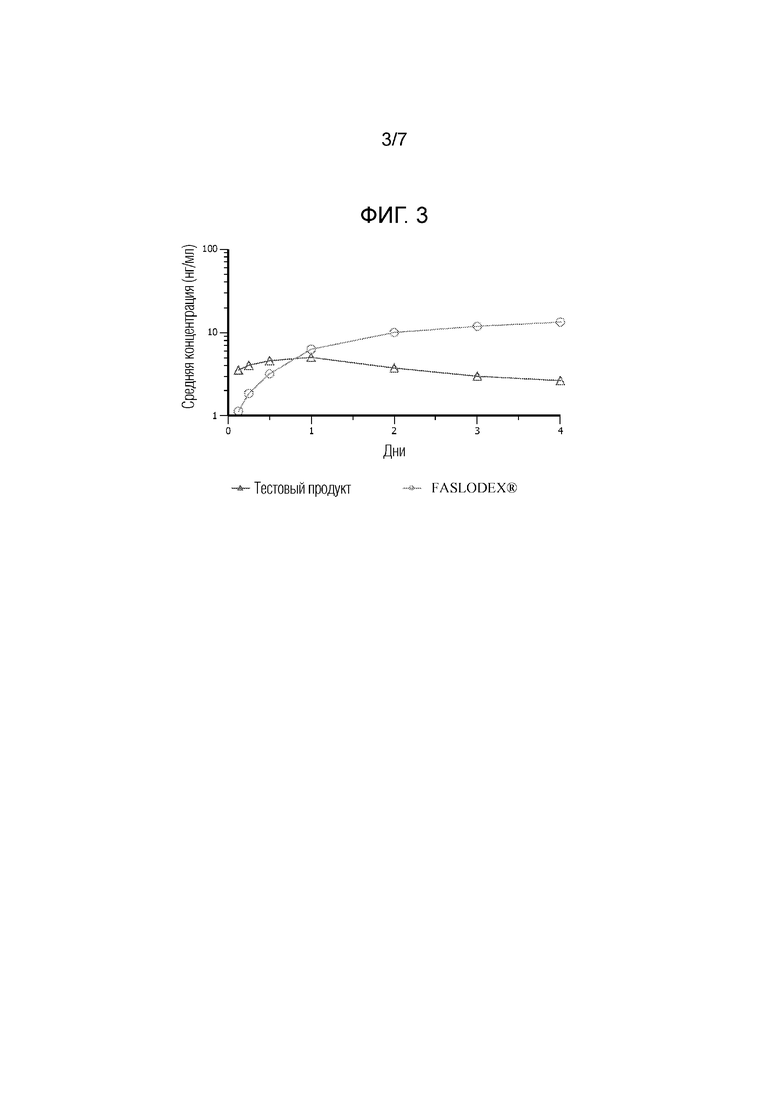
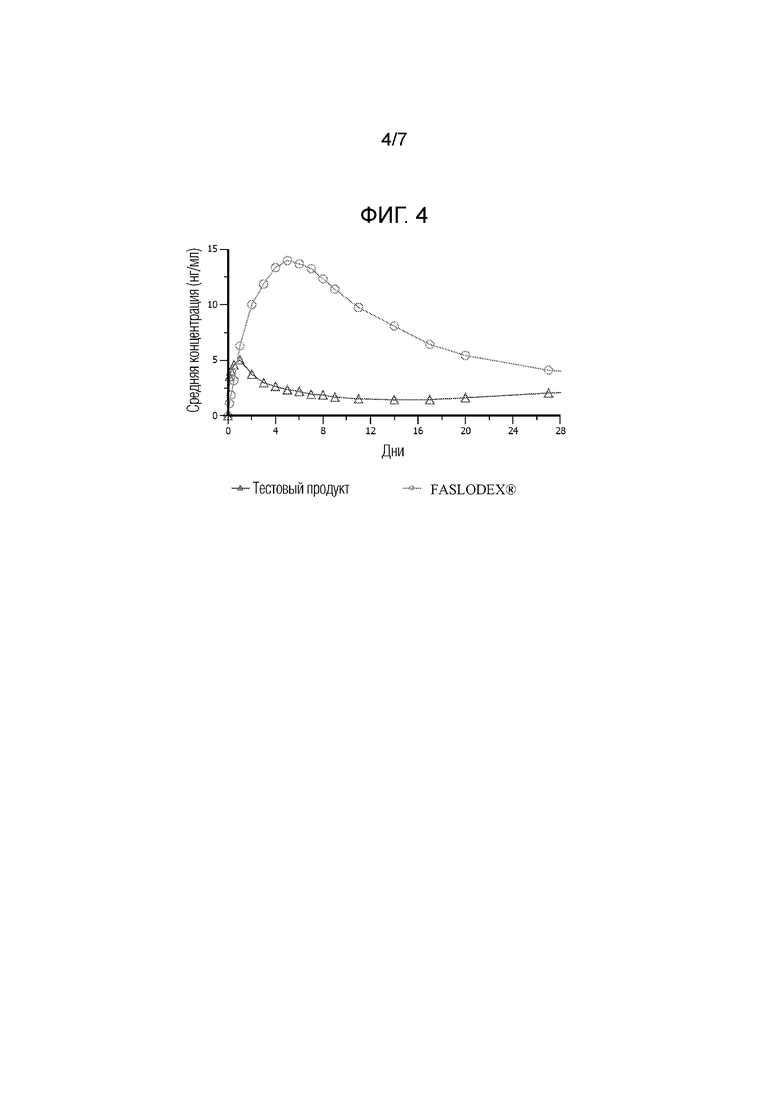
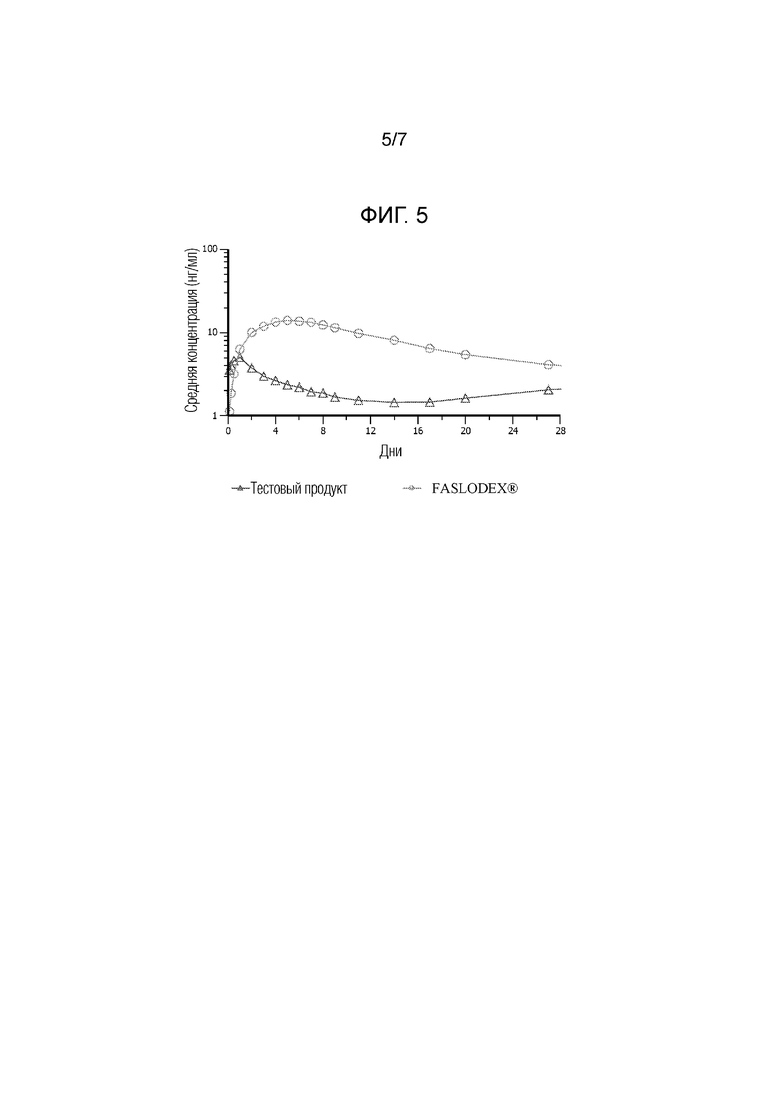
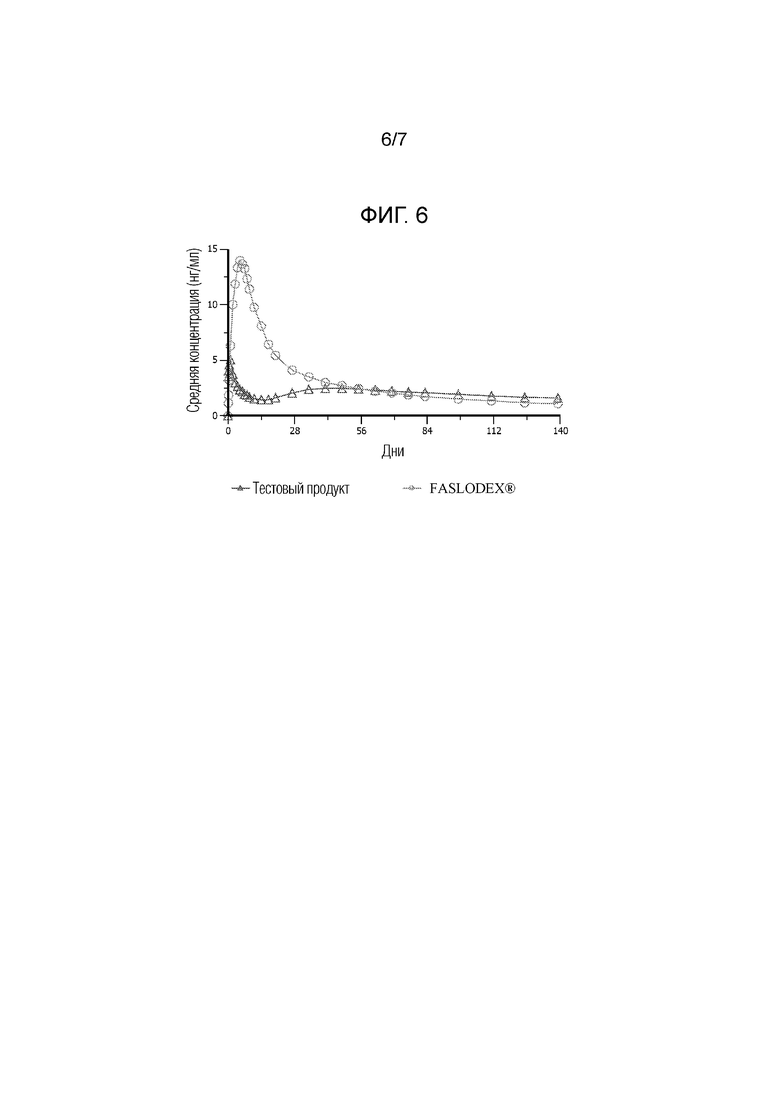
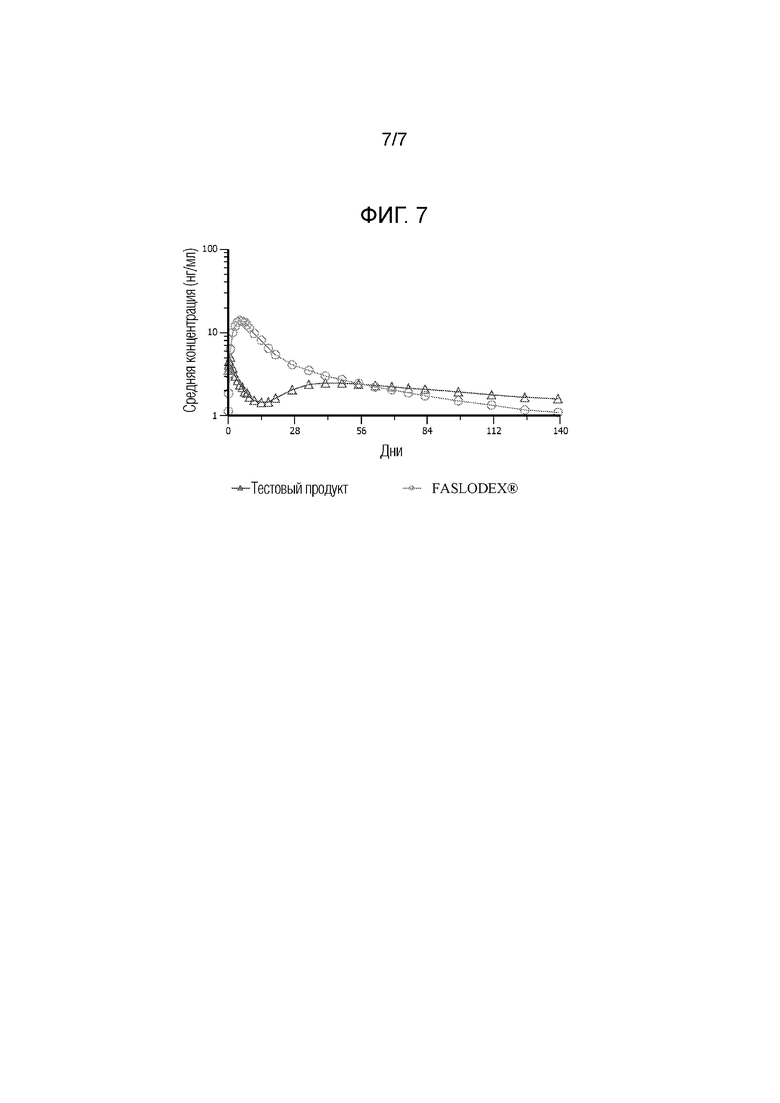
Настоящее изобретение относится к способам лечения рака молочной железы, включающим введение водных суспензий, содержащих солюбилизированный фулвестрант, частицы несолюбилизированного фулвестранта, имеющие один или более из LD Dv(10) от приблизительно 1,5 до приблизительно 2,1 мкм, LD Dv(50) от приблизительно 5,5 до приблизительно 9,0 мкм и LD Dv(90) от приблизительно 15 до приблизительно 35 мкм, при этом водные суспензии дополнительно включают поверхностно-активное вещество, поливинилпирролидон, сахарный спирт и водорастворимый эксципиент. Водорастворимый эксципиент может представлять собой арил-C1-6-алк-OH, C1-6-алкил-OH, буферную соль, полисорбат, полиалкиленгликоль, C1-12-алкиленгликоль, фосфатидилхолин или их комбинацию. 34 з.п. ф-лы, 4 пр., 16 табл., 7 ил.
1. Способ лечения рака молочной железы у субъекта, включающий введение субъекту водной суспензии, содержащей:
солюбилизированный фулвестрант;
частицы несолюбилизированного фулвестранта, имеющие один или более из:
LD Dv(10) от 1,5 мкм до 2,1 мкм,
LD Dv(50) от 5,5 мкм до 9,0 мкм и
LD Dv(90) от 15 мкм до 35 мкм;
поверхностно-активное вещество, содержащее от 0,1% до 2% (масс./масс.), от 0,25% до 1,80% (масс./масс.) или 0,75% (масс./масс.) полисорбата;
поливинилпирролидон; и
сахарный спирт, содержащий маннит, ксилит, мальтит, лактитол, мальтотриит, сорбит, глицерин или их смесь; и водорастворимый эксципиент, содержащий арил-С1-6-алк-ОН и C1-6-алкил-ОН, буферную соль, полисорбат, полиалкиленгликоль, C1-12-алкиленгликоль, фосфатидилхолин, или их комбинацию;
отличающийся тем, что водная суспензия содержит от 0,1% до 5% (масс./масс.), от 0,5% до 5% (масс./масс.), от 0,5% до 2,5% (масс./масс.), от 0,9% до 1,5% (масс./масс.), 4% (масс./масс.) или 1% (масс./масс.) арил-С1-6-алкил-ОН.
2. Способ по п. 1, где рак молочной железы является гормон-рецептор (HR)-положительным раком молочной железы.
3. Способ по любому из пп. 1 и 2, где субъект представляет собой женщину после менопаузы с прогрессированием заболевания после антиэстрогеновой терапии.
4. Способ по любому из пп. 2 и 3, где рак молочной железы является HR-положительным, отрицательным по рецептору эпидермального фактора роста 2 человека (HER2) раком молочной железы на поздней стадии или метастазирующим раком молочной железы.
5. Способ по любому из пп. 1-4, где субъект представляет собой женщину с прогрессированием заболевания после эндокринной терапии.
6. Способ по любому из пп. 1-5, где введение осуществляют в виде однократной внутримышечной инъекции.
7. Способ по п. 6, где осуществляют однократную внутримышечную инъекцию в вентро-ягодичный квадрант или верхний наружный квадрант.
8. Способ по любому из пп. 1-5, где введение осуществляют в виде двух внутримышечных инъекций.
9. Способ по любому из пп. 1-5, где введение осуществляют в виде однократной подкожной инъекции.
10. Способ по любому из пп. 1-5, где введение осуществляют в виде двух подкожных инъекций.
11. Способ по любому из предшествующих пунктов, дополнительно включающий введение дополнительных терапевтических средств, выбранных из палбоциклиба, летрозола, анастрозола, доксорубицина, паклитаксела, доцетаксела, винорелбина и 5-фторурацила.
12. Способ по п. 11, где дополнительное терапевтическое средство представляет собой палбоциклиб.
13. Способ по любому из предшествующих пунктов, где арил-C1-6-алк-ОН представляет собой бензиловый спирт.
14. Способ по любому из предшествующих пунктов, где C1-6-алкил-ОН представляет собой этанол.
15. Способ по любому из предшествующих пунктов, где буферная соль представляет собой NaH2PO4, K2НРО4, KН2РО4, лимонную кислоту или ее фармацевтически приемлемую соль, трометан или его фармацевтически приемлемую соль или их смесь.
16. Способ по любому из предшествующих пунктов, где полисорбат представляет собой полисорбат 20, полисорбат 60, полисорбат 80 или их комбинацию.
17. Способ по любому из предшествующих пунктов, где водная суспензия содержит от 1% до 10% (масс./масс.), от 0,5% до 8% (масс./масс.) или 5% (масс./масс.) полиалкиленгликоля.
18. Способ по любому из предшествующих пунктов, где полиалкиленгликоль представляет собой полиэтиленгликоль.
19. Способ по любому из предшествующих пунктов, где водная суспензия содержит от 0,1% до 5% (масс./масс.), от 0,5% до 4% (масс./масс.) или 2,5% (масс./масс.) C1-12-алкиленгликоля.
20. Способ по любому из предшествующих пунктов, где С1-12-алкиленгликоль представляет собой пропиленгликоль.
21. Способ по любому из предшествующих пунктов, где водная суспензия содержит от 0,1% до 5% (масс./масс.), от 0,1% до 2% (масс./масс.) или 0,3% (масс./масс.) фосфатидилхолина.
22. Способ по любому из предшествующих пунктов, где фосфатидилхолин представляет собой лецитин.
23. Способ по любому из предшествующих пунктов, где водорастворимый эксципиент содержит арил-С1-6-алк-ОН и C1-6-алкил-ОН, полисорбат, буферную соль или их комбинацию.
24. Способ по любому из предшествующих пунктов, где водная суспензия имеет рН от 6,0 до 8,0, 7 или 7,5.
25. Способ по любому из предшествующих пунктов, где частицы несолюбилизированного фулвестранта в водной суспензии имеют один или более из:
LD Dv(10) при обработке ультразвуком от 1,0 мкм до 1,2 мкм;
LD Dv(50) при обработке ультразвуком от 3,0 мкм до 4,0 мкм; и
LD Dv(90) при обработке ультразвуком от 6 мкм до 9 мкм.
26. Способ по любому из предшествующих пунктов, где частицы несолюбилизированного фулвестранта в водной суспензии имеют один или более из:
СЕ Dv(10) от 3,0 мкм до 6,0 мкм;
СЕ Dv(50) от 7,0 мкм до 16,0 мкм; и
СЕ Dv(90) от 20 мкм до 90 мкм.
27. Способ по любому из предшествующих пунктов, где при введении водной суспензии субъекту в однократной внутримышечной инъекции 90%-ные доверительные интервалы (CI) относительной средней AUC(0-t) и AUC(0-∞) фулвестранта составляют от 80% до 125% от относительной средней AUC(0-t) и AUC(0-∞), соответственно, фулвестранта после введения 500 мг фулвестранта в форме FASLODEX®, вводимого внутримышечно в виде двух инъекций по 5 мл.
28. Способ по любому из предшествующих пунктов, где при введении водной суспензии субъекту в однократной внутримышечной инъекции 90%-ные доверительные интервалы (CI) относительной средней AUC(0-t) и AUC(0-∞) фулвестранта составляют от 90% до 110% от относительной средней AUC(0-t) и AUC(0-∞), соответственно, фулвестранта после введения 500 мг фулвестранта в форме FASLODEX®, вводимого внутримышечно в виде двух инъекций по 5 мл.
29. Способ по любому из предшествующих пунктов, где при введении водной суспензии субъекту в однократной внутримышечной инъекции 90%-ные доверительные интервалы (CI) относительной средней Cmax фулвестранта составляют от 4 0% до 80% от относительной средней Cmax фулвестранта после введения 500 мг фулвестранта в форме FASLODEX®, вводимого внутримышечно в виде двух инъекций по 5 мл.
30. Способ по любому из пп. 1-26, где при введении водной суспензии субъекту в двух внутримышечных инъекциях 90%-ные доверительные интервалы (CI) относительной средней AUC(0-t) и AUC(0-∞) фулвестранта составляют от 80% до 125% от относительной средней AUC(0-t) и AUC(0-∞), соответственно, фулвестранта после введения 500 мг фулвестранта в форме FASLODEX®, вводимого внутримышечно в виде двух инъекций по 5 мл.
31. Способ по любому из пп. 1-2 6, где при введении водной суспензии субъекту в двух внутримышечных инъекциях 90%-ные доверительные интервалы (CI) относительной средней AUC(0-t) и AUC(0-∞) фулвестранта составляют от 90% до 110% от относительной средней AUC(0-t) и AUC(0-∞), соответственно, фулвестранта после введения 500 мг фулвестранта в форме FASLODEX®, вводимого внутримышечно в виде двух инъекций по 5 мл.
32. Способ по любому из пп. 1-26, где при введении водной суспензии субъекту в двух внутримышечных инъекциях 90%-ные доверительные интервалы (CI) относительной средней Cmax фулвестранта составляют от 40% до 80% от относительной средней Cmax фулвестранта после введения 500 мг фулвестранта в форме FASLODEX®, вводимого внутримышечно в виде двух инъекций по 5 мл.
33. Способ по любому из предшествующих пунктов, где водная суспензия имеет объем от 3,0 мл до 6,0 мл или 5 мл.
34. Способ по любому из предшествующих пунктов, где водная суспензия имеет объем от 8,0 мл до 12,0 мл или 10,0 мл.
35. Способ по любому из предшествующих пунктов, где общее количество фулвестранта с учетом солюбилизированного фулвестранта и частиц несолюбилизированного фулвестранта в водной суспензии составляет от 80 мг/мл до 170 мг/мл или 100 мг/мл.
| WO 03006064 A1, 2003.01.23 | |||
| WO 2012035516 A1, 2012.03.22 | |||
| WO 2013153559 A1, 2013.10.17 | |||
| WO 2013182668 A1, 2013.12.12 | |||
| КОМПОЗИЦИЯ ФУЛЬВЕСТРАНТА | 2001 |
|
RU2263507C2 |
| СПОСОБ ОЧИСТКИ ПОЛИСАХАРИДОВ Streptococcus pneumoniae 3 ТИПА (ВАРИАНТЫ) | 2007 |
|
RU2460539C2 |
| WO 2015033302 A2, 2015.03.12. | |||
Авторы
Даты
2023-07-31—Публикация
2018-11-08—Подача