ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
[0001]
Настоящее изобретение относится к новому иммуноиндуцирующему средству, которое может применяться в качестве терапевтического и/или профилактического средства или подобного средства против рака.
[0002]
Настоящее изобретение также относится к антигенпрезентирующей клетке или цитотоксической Т-клетке для применения в иммунотерапии рака или к способу получения таких клеток.
УРОВЕНЬ ТЕХНИКИ
[0003]
Рак является одной из главных причин смерти. В настоящее время основной формой лечения рака является хирургическое лечение, которое проводят в сочетании с лучевой терапией и химиотерапией. Несмотря на развитие новых хирургических методик и открытие новых противоопухолевых средств за последние годы, результаты лечения рака пока не удается улучшить, за исключением случаев некоторых типов рака. В последние годы определены раковые антигены, распознаваемые цитотоксическими Т-клетками, которые являются реактивными в отношении рака, и гены, кодирующие раковые антигены, наряду с развитием молекулярной биологии и онколоиммунологии, что усилило ожидания в отношении антигенспецифической иммунотерапии.
[0004]
Иммунотерапия требует специфического для раковых клеток присутствия пептида, полипептида или белка, который распознается как антиген-мишень, а также по существу его отсутствия в нормальных клетках с точки зрения ослабления побочных эффектов. В 1991 году Boon с соавт. (Ludwig Institute for Cancer Research, Belgium) выделили антиген меланомы человека MAGE1, распознаваемый CD8+ T-клеткой, путем экспрессионного клонирования кДНК при использовании линии аутологичных раковых клеток и опухолереактивных Т-клеток (Непатентный источник 1). После этого сообщали о методе SEREX (серологическая идентификация антигенов с помощью рекомбинантного экспрессионного клонирования), который позволяет определять опухолевый антиген, распознаваемый антителом, продуцируемым в ответ на аутологичный рак в организме больного раком, посредством экспрессионного клонирования генов (Патентный источник 1, Патентный источник 2). Некоторые раковые антигены были выделены с помощью таких методов. Кроме того, были начаты клинические исследования иммунотерапии рака, направленной на некоторые из таких раковых антигенов.
[0005]
Как и в случае с людьми, собаки и кошки, как известно, страдают различными опухолями, такими как рак молочной железы и плоскоклеточная карцинома, причем опухоли составляют высокие проценты в статистике болезней собак или кошек. Однако в настоящее время не существует эффективных терапевтических, профилактических или диагностических средств при раке собак или кошек. Большинство владельцев собак или кошек не замечают опухолей у собак или кошек до тех пор, пока опухоли не станут запущенными и увеличенными. Даже если опухоли удаляют с помощью хирургической операции или вводят лекарственные средства для применения у человека (например, противоопухолевые лекарственные средства), опухоли обычно уже не поддаются лечению, и животные часто умирают вскоре после лечения. В таких обстоятельствах, если становятся доступными терапевтические, профилактические и диагностические средства при раке, эффективные для собак или кошек, можно ожидать их применение при раке у собак или кошек.
[0006]
Хондроитинсульфат протеогликан 5 (CSPG5) представляет собой трансмембранный белок 1-го типа и является одним из белков семейства нейрегулина. Также сообщали, что CSPG5 связывает ErbB3, действуя как фактор роста; и что экспрессия CSPG5 повышается при раке яичника с мутацией BRCA1 (Непатентные источники 3 и 4). Кроме того, известно, что CSPG5 экспрессируется на высоком уровне в тканях нервной системы, таких как ганглионарные клетки сетчатки, клетки Пуркинье и гиппокамп, и служит в качестве фактора пролиферации/дифференцировки нервных клеток, участвующих в удлинении аксонов нервных клеток (Непатентные источники 5, 6 и 7). Тем не менее, отсутствуют какие-либо сообщения о том, что белок CSPG5 обладает иммуноиндуцирующей активностью против раковых клеток и поэтому может применяться для лечения и профилактики рака.
СПИСОК ИСПОЛЬЗОВАННЫХ ИСТОЧНИКОВ
ПАТЕНТНЫЕ ИСТОЧНИКИ
[0007]
Патентный источник 1: Патент США 5698396
НЕПАТЕНТНЫЕ ИСТОЧНИКИ
[0008]
Непатентный источник 1: Bruggen, P. et al., Science, 254:1643-1647 (1991)
Непатентный источник 2: Sahin, U et al., Proc. Natl. Acad. Sci. USA, 92: 11810-11813 (1995)
Непатентный источник 3: Kinugasa, Y. et al., Biochem. Biophys. Res. Commun 321: 1045 (2004)
Непатентный источник 4: Press, JZ. et al., Neoplasia. Dec; 12 (12): 993-1002 (2010)
Непатентный источник 5: Yasuda, Y. et al., Neurosci. Res. 32: 313 (1998)
Непатентный источник 6: Aono, S. et al., J. Neurosci. Res.83: 110 (2006)
Непатентный источник 7: Nakanishi, K. et al., J. Biol. Chem. 281: 24970 (2006)
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
ТЕХНИЧЕСКАЯ ЗАДАЧА
[0009]
Цель настоящего изобретения состоит в поиске нового полипептида, применимого в качестве терапевтического и/или профилактического средства для лечения рака, и в обеспечении применения такого полипептида в качестве иммуноиндуцирующего средства.
РЕШЕНИЕ ЗАДАЧИ
[0010]
Авторы настоящего изобретения провели интенсивные исследования и в результате получили кДНК, кодирующую белок, связывающийся с антителом, присутствующим в сыворотке у несущих злокачественную опухоль живых организмов, с помощью метода SEREX при использовании библиотеки кДНК, полученной из семенника собаки, а также сыворотки несущих злокачественную опухоль собак. На основе кДНК авторы настоящего изобретения получили полипептид хондроитинсульфат протеогликана 5 собаки (далее называемый "CSPG5"), имеющий аминокислотную последовательность, представленную в SEQ ID NO: 2. Кроме того, на основе генов человека, кошки и мыши, гомологичных полученному гену, были получены полипептиды CSPG5 человека, кошки и мыши, имеющие аминокислотные последовательности, представленные в SEQ ID NO: 4, 6, 8, 10, 12, 14 и 16. Авторы настоящего изобретения также обнаружили, что указанные полипептиды CSPG5 специфически экспрессируются в тканях или клетках рака молочной железы, рака легкого, опухоли головного мозга, рака яичника, лейкоза, злокачественной лимфомы, аденокарциномы, мастоцитомы, плоскоклеточной карциномы, меланомы или нейробластомы. Кроме того, было обнаружено, что иммунные клетки против CSPG5 можно индуцировать in vivo путем введения таких CSPG5 живым организмам, и что размер опухоли у живых организмов, у которых экспрессируется CSPG5, может быть уменьшен. Кроме того, было обнаружено, что рекомбинантный вектор, способный экспрессировать полинуклеотид, кодирующий полипептид CSPG5 или его фрагмент, индуцирует противоопухолевое действие в отношении CSPG5-экспрессирующего рака in vivo.
[0011]
Авторы настоящего изобретения также обнаружили, что полипептид CSPG5 презентируется антигенпрезентирующей клеткой и обладает способностью (то есть иммуноиндуцирующей активностью) активировать и вызывать пролиферацию цитотоксической Т-клетки, специфичной в отношении полипептида; что благодаря такой способности данный полипептид может применяться для лечения и/или профилактики рака; и что антигенпрезентирующая клетка, которая находилась в контакте с полипептидом, и Т-клетка, которая находилась в контакте с антигенпрезентирующей клеткой, могут применяться для лечения и/или профилактики рака. На основании полученных данных настоящее изобретение было осуществлено.
[0012]
Таким образом, настоящее изобретение включает следующие признаки.
(1) Иммуноиндуцирующее средство, содержащее в качестве действующего компонента: (i) по меньшей мере один полипептид, обладающий иммуноиндуцирующей активностью и выбранный из следующих полипептидов (а), (b) и (с), или (ii) рекомбинантный вектор, содержащий полинуклеотид, кодирующий полипептид и способный экспрессировать указанный полипептид in vivo:
(а) полипептид, состоящий из аминокислотной последовательности, представленной в SEQ ID NO: 8, 4, 6, 10, 12, 2 или 14, и полипептид, состоящий из 7 или более последовательных аминокислот в данной аминокислотной последовательности;
(b) полипептид, обладающий идентичностью последовательности 85% или более с аминокислотной последовательностью, представленной в SEQ ID NO: 8, 4, 6, 10, 12, 2 или 14, и полипептид, состоящий из 7 или более последовательных аминокислот в данной аминокислотной последовательности полипептида;
(c) полипептид, содержащий полипептид (a) или (b) в качестве неполной последовательности.
(2) Иммуноиндуцирующее средство согласно (1), где полипептид, обладающий иммуноиндуцирующей активностью, представляет собой полипептид, состоящий из аминокислотной последовательности, представленной в SEQ ID NO: 8, 4, 6, 10, 12, 2 или 14,
(3) Иммуноиндуцирующее средство согласно (1) или (2), которое предназначено для применения в обработке антигенпрезентирующей клетки.
(4) Иммуноиндуцирующее средство согласно (1) или (2), которое предназначено для лечения и/или профилактики рака.
(5) Иммуноиндуцирующее средство согласно (4), где рак представляет собой CSPG5-экспрессирующий рак.
(6) Иммуноиндуцирующее средство согласно (4) или (5), где рак является опухолью головного мозга, лейкозом, злокачественной лимфомой или нейробластомой.
(7) Иммуноиндуцирующее средство согласно любому из пунктов (1)-(6), дополнительно включающее иммуноусилитель.
(8) Иммуноиндуцирующее средство согласно (7), где иммуноусилителем является по меньшей мере одно, выбранное из группы, состоящей из неполного адъюванта Фрейнда, Монтанида, поли-IC и их производных, CpG-олигонуклеотидов, интерлейкина 12, интерлейкина 18, интерферона α, интерферона β, интерферона ω, интерферона γ и лиганда Flt 3.
(9) Способ получения антигенпрезентирующей клетки, содержащей комплекс полипептида, определенного в (1), и молекулы МНС, включающий контакт полипептида с антигенпрезентирующей клеткой субъекта ex vivo или in vitro.
(10) Способ согласно (9), где антигенпрезентирующая клетка представляет собой дендритную клетку или В-клетку, имеющую молекулу МНС класса I.
(11) Способ получения цитотоксической Т-клетки, специфичной к полипептиду, определенному в (1), включающий контакт антигенпрезентирующей клетки, полученной с помощью способа согласно (9) или (10), с Т-клеткой субъекта ex vivo или in vitro, в результате чего происходит активация Т-клетки.
(12) Антигенпрезентирующая клетка, полученная способом согласно (9) или (10) и содержащая комплекс полипептида, определенного в (1), и молекулы МНС.
(13) Цитотоксическая Т-клетка, полученная способом согласно (11) и специфичная к полипептиду, определенному в (1).
[0013]
Настоящее описание включает содержание, раскрытое в заявке на патент Японии 2015-093354, на основании которой испрашивает приоритет настоящая заявка.
[0014]
Согласно настоящему изобретению предложено новое иммуноиндуцирующее средство, применимое для лечения и/или профилактики и т.п. злокачественных опухолей. В случае, когда полипептид или вектор, кодирующий полипептид, применяемый в изобретении, вводят субъекту, можно индуцировать иммуноциты в живом организме субъекта, при этом может быть уменьшен размер злокачественной опухоли, которая уже появилась, или вызвать ее регрессию, как конкретно показано в Примерах, описанных ниже. Таким образом, полипептид или вектор могут применяться для лечения и предотвращения онкологических заболеваний.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
[0015]
[Фиг. 1] На данной фигуре показаны профили экспрессии гена CSPG5, идентифицированного в тканях опухолей или линиях раковых клеток собаки. Номер позиции 1 показывает профили экспрессии гена CSPG5 собаки в отдельных тканях и линиях клеток собаки; и номер позиции 2 показывает профили экспрессии гена GAPDH собаки в отдельных тканях и линиях клеток собаки.
[Фиг. 2] На данной фигуре показаны профили экспрессии гена CSPG5, идентифицированного в тканях опухолей или линиях раковых клеток человека. Человеческий ген GAPDH, как было обнаружено, экспрессируется во всех тканях и линиях клеток человека.
[Фиг. 3] На данной фигуре показаны профили экспрессии гена CSPG5, идентифицированного в тканях опухолей или линиях раковых клеток мыши. Номер позиции 3 показывает профили экспрессии гена CSPG5 мыши в отдельных тканях и линиях клеток мыши; номер позиции 4 показывает профили экспрессии гена GAPDH мыши в отдельных тканях и линиях клеток мыши.
ОПИСАНИЕ ВАРИАНТОВ ОСУЩЕСТВЛЕНИЯ
[0016]
Далее настоящее изобретение будет описано более конкретно.
1. Полипептид
В качестве полипептида, обладающего иммуноиндуцирующей активностью и содержащегося в качестве действующего компонента в иммуноиндуцирующем средстве согласно настоящему изобретению, включены полипептиды, определенные в следующих пунктах (a)-(c):
[0017]
(a) полипептид, состоящий из аминокислотной последовательности, представленной в SEQ ID NO: 8, 4, 6, 10, 12, 2 или 14, или полипептид, состоящий из 7 или более последовательных аминокислот в данной аминокислотной последовательности;
(b) полипептид, обладающий идентичностью последовательности 85% или больше с аминокислотной последовательностью, представленной в SEQ ID NO: 8, 4, 6, 10, 12, 2 или 14, или полипептид, состоящий из 7 или более последовательных аминокислот в данной аминокислотной последовательности полипептида;
(c) полипептид, включающий полипептид (a) или (b) в качестве неполной последовательности.
[0018]
В настоящем описании термин "полипептид" относится к молекуле, сформированной из множества аминокислот, которые связаны посредством пептидной связи, и включает не только молекулу полипептида, состоящую из большого количества аминокислот, но также и молекулу с низкой молекулярной массой (т.е. олигопептид), состоящую из небольшого количества аминокислот, или полноразмерный белок. В настоящее изобретение также включен полноразмерный белок CSPG5, имеющий аминокислотную последовательность, представленную в SEQ ID NO: 8, 4, 6, 10, 12, 2 или 14.
[0019]
В настоящем описании фраза "имеющий аминокислотную последовательность" означает, что аминокислотные остатки расположены в порядке, показанном в аминокислотной последовательности, если не указано иное. Таким образом, например, "полипептид, имеющий аминокислотную последовательность, представленную в SEQ ID NO: 8" относится к полипептиду, имеющему размер 566 аминокислотных остатков и состоящему из аминокислотной последовательности Met Gly Arg Ala, Gly.. (пропуск).. Asn, Asn, Leu и Thr, представленной в SEQ ID NO:8. "Полипептид, имеющий аминокислотную последовательность, представленную в SEQ ID NO: 8" иногда просто указан как, например, "полипептид в SEQ ID NO: 8". То же применимо к выражению "имеющий нуклеотидную последовательность". Во фразе "имеющий аминокислотную последовательность" или "имеющий нуклеотидную последовательность", термин "имеющий" может быть заменен термином "состоящий из", если не указано иное.
[0020]
В настоящем описании термин "иммуноиндуцирующая активность" относится к способности индуцировать иммуноциты, секретирующие цитокины, такие как интерферон, в живом организме субъекта.
[0021]
В настоящем описании термин "субъект" относится к животному, нуждающемуся в индукции иммунитета для лечения или предотвращения рака (или опухоли) с применением иммуноиндуцирующего средства согласно настоящему изобретению, предпочтительно относится к млекопитающему, в том числе человеку, домашнему животному, такому как собака или кошка, животному, такому как панда, выращенному в зоопарке, сельскохозяйственному животному, такому как корова, и скаковому животному, такому как лошадь.
[0022]
Обладает ли полипептид, указанный выше, иммуноиндуцирующей активностью, может быть подтверждено при помощи, например, анализа ELISpot (иммуноферментного спот-анализа), известного в уровне техники. В частности, например, как описано в Примерах ниже, иммуноиндуцирующая активность может быть оценена с помощью следующего: получение клеток, таких как мононуклеарные клетки периферической крови, у животного, которому был введен полипептид, оцениваемый на иммуноиндуцирующую активность; сокультивирование клеток с полипептидом; и измерение количества цитокина, продуцируемого клетками, при помощи специфичного антитела, с определением количества иммуноцитов в клетках.
[0023]
Как описано в Примерах ниже, когда каждый из полипептидов согласно вышеуказанным пунктам (a)-(c) (предпочтительно рекомбинантный полипептид) вводят несущим злокачественную опухоль живым организмам, опухоли могут регрессировать вследствие иммуноиндуцирующей активности полипептидов. Таким образом, иммуноиндуцирующую активность можно оценивать как способность подавлять пролиферацию раковых клеток или уменьшать размер раковой (опухолевой) ткани, или устранять раковую (опухолевую) ткань (в дальнейшем именуемая как "противоопухолевая активность"). Противоопухолевая активность полипептида может быть фактически подтверждена при введении полипептида несущим злокачественную опухоль животным и проверке, например, уменьшился ли размер опухоли, например, как конкретно описано в Примерах ниже. В альтернативе противоопухолевая активность полипептида может быть оценена при проверке, например, демонстрирует ли цитотоксическая Т-клетка, которая индуцирована путем введения полипептида несущим злокачественную опухоль животным, цитотоксическую активность в отношении опухоли. Цитотоксическую активность Т-клетки можно определять in vivo, при введении антитела, которое удаляет Т-клетку из живого организма, несущим злокачественную опухоль животным и проверке, уменьшился ли размер опухоли. Впрочем, способ определения цитотоксической активности не ограничен указанными выше способами.
[0024]
В альтернативе противоопухолевая активность вышеуказанных полипептидов может быть оценена при проверке, демонстрируют ли стимулированные полипептидами Т-клетки (в частности, Т-клетки, подвергнутые контакту с антигенпрезентирующими клетками, которые презентируют полипептиды) цитотоксическую активность против опухолевых клеток in vitro. Т-клетки и антигенпрезентирующие клетки можно подвергать контакту друг с другом при совместном культивировании таких клеток в жидкой среде, как описано ниже. Цитотоксическую активность можно измерять с помощью известного метода, называемого анализ высвобождения 51Cr, например, описанный в D. D. Kharkevitch et al., Int. J. Cancer, 58: 317-323, 1994. В случае применения вышеуказанных полипептидов для лечения и/или профилактики онкологических заболеваний, иммуноиндуцирующую активность предпочтительно оценивают с применением противоопухолевой активности в качестве индикатора, хотя такая оценка конкретно не ограничена этим.
[0025]
В настоящем изобретении аминокислотные последовательности, представленные в SEQ ID NO: 8, 4, 6, 10, 12, 2 и 14, как описано в Списке последовательностей, представляют собой аминокислотные последовательности CSPG5, которые были выделены в виде полипептидов, которые связываются с конкретными антителами, присутствующими в сыворотке, полученной от собак, несущих злокачественную опухоль, с помощью метода SEREX с применением библиотеки кДНК, полученной из семенника собаки, и сывороток собак, несущих злокачественную опухоль, а также в виде гомологичных факторов человека, кошки и мыши (см. Пример 1). Человеческий CSPG5, который является человеческим гомологом, гомологичным с CSPG5 собаки, обладает идентичностью нуклеотидной последовательности 87% и идентичностью аминокислотной последовательности 87%. CSPG5 кошки, который является кошачьим гомологом, обладает идентичностью нуклеотидной последовательности 92% и идентичностью аминокислотной последовательности 91%. CSPG5 мыши, который является мышиным гомологом, обладает идентичностью нуклеотидной последовательности 84% и идентичностью аминокислотной последовательности 85%.
[0026]
Полипептид, определенный в (а) выше, является полипептидом, который состоит из 7 или более последовательных аминокислот, предпочтительно 8, 9 или 10 или более последовательных аминокислот в полипептиде, имеющем аминокислотную последовательность, представленную в SEQ ID NO: 8, 4, 6, 10, 12, 2 или 14, и который обладает иммуноиндуцирующей активностью. Более предпочтительно полипептид состоит из аминокислотной последовательности, обладающей идентичностью последовательности 85% или более с аминокислотной последовательностью, представленной в SEQ ID NO: 8; и наиболее предпочтительно полипептид имеет аминокислотную последовательность, представленную в SEQ ID NO: 8, 4, 6, 10, 12, 2 или 14. Как известно в уровне техники, если полипептид имеет около 7 или более аминокислотных остатков, то полипептид может демонстрировать антигенность и иммуногенность. Таким образом, когда полипептид имеет 7 или более последовательных аминокислотных остатков в аминокислотной последовательности, представленной в SEQ ID NO: 8, 4, 6, 10, 12, 2 или 14, он может обладать иммуноиндуцирующей активностью и, следовательно, может применяться для получения иммуноиндуцирующего средства согласно изобретению.
[0027]
В качестве принципа иммунной индукции посредством введения ракового антигенного полипептида известен следующий способ: полипептид вводят в антигенпрезентирующую клетку, и затем он подвергается расщеплению на более мелкие фрагменты пептидазами в клетке с последующим презентированием фрагментов на поверхности клетки. После этого фрагменты распознаются цитотоксической Т-клеткой или подобной, которая селективно убивает клетки, презентирующие антиген. Размер полипептида, презентируемого на поверхности клетки, презентирующей антиген, является относительно небольшим и составляет от 7 до 30 аминокислот. Таким образом, в отношении презентирования полипептида на поверхности клетки, презентирующей антиген, одним из предпочтительных вариантов вышеописанного полипептида (а) является полипептид, состоящий из приблизительно от 7 до 30 последовательных аминокислот в аминокислотной последовательности, представленной в SEQ ID NO: 8, 4, 6, 10, 12, 2 или 14, и, более предпочтительно, полипептид, состоящий из приблизительно 8-30 или приблизительно от 9 до 30 аминокислот, является достаточным в качестве полипептида (а). В некоторых случаях эти относительно небольшие полипептиды презентируются непосредственно на поверхности антигенпрезентирующей клетки без включения в антигенпрезентирующие клетки.
[0028]
Кроме того, поскольку полипептид, включенный в антигенпрезентирующую клетку, расщепляется по случайным сайтам пептидазами в клетке с получением различных полипептидных фрагментов, которые затем презентируются на поверхности антигенпрезентирующей клетки, введение крупного полипептида, такого как полноразмерная область SEQ ID NO: 8, 4, 6, 10, 12, 2 или 14, неизбежно вызывает продукцию полипептидных фрагментов в результате расщепления в антигенпрезентирующей клетке, причем такие фрагменты эффективны для иммунной индукции посредством антигенпрезентирующей клетки. Таким образом, также для иммунной индукции посредством антигенпрезентирующих клеток, может предпочтительно применяться крупный полипептид, причем полипептид может состоять не менее чем из 30, предпочтительно не менее чем из 100, более предпочтительно не менее чем из 200, еще более предпочтительно не менее чем из 250 аминокислот. Полипептид может еще более предпочтительно состоять из полноразмерной области SEQ ID NO: 8, 4, 6, 10, 12, 2 или 14.
[0029]
Полипептид, описанный выше в (b), является полипептидом, который получают в результате замещения, делеции и/или добавления или вставки небольшого количества (предпочтительно одного или нескольких) аминокислотных остатков в полипептид, имеющий аминокислотную последовательность, представленную в SEQ ID NO: 8, 4, 6, 10, 12, 2 или 14 в списке последовательностей и описанную выше в пункте (a), и который обладает способностью индуцировать иммунитет; или полипептидом, который обладает идентичностью последовательности 85% или более, 90% или более, предпочтительно 95% или более, более предпочтительно 98% или более, еще более предпочтительно 99% или более, или 99,5% или более с исходной (т.е. немодифицированной) последовательностью, и который обладает иммуноиндуцирующей активностью. Как правило, специалистам в данной области техники известно, что белковый антиген, даже если он имеет замещение, делецию или добавление или вставку небольшого количества аминокислотных остатков в аминокислотной последовательности белка, может обладать по существу такой же антигенностью, что и исходный белок. Таким образом, полипептид, определенный (b) выше, может демонстрировать иммуноиндуцирующую активность и, таким образом, может применяться при получении иммуноиндуцирующего средства согласно настоящему изобретению. Также предпочтительно, чтобы полипептид согласно (b) выше являлся предпочтительно полипептидом, полученным в результате замещения, делеции и/или добавления или вставки одного или нескольких аминокислотных остатков в аминокислотной последовательности, представленной в SEQ ID NO: 8, 4, 6, 10, 12, 2 или 14. В настоящем описании термин "несколько" относится к целому числу от 2 до 10, предпочтительно от 2 до 6 и еще предпочтительно от 2 до 4.
[0030]
При использовании в настоящем описании термин "идентичность последовательности" в отношении аминокислотных последовательностей (или нуклеотидных последовательностей) означает значение, вычисленное путем выравнивания двух аминокислотных последовательностей (или нуклеотидных последовательностей), которые предполагается сравнить, причем количество совпавших аминокислотных остатков (или нуклеотидов) между аминокислотными последовательностями (или нуклеотидными последовательностями) является максимально возможным, и деления количества совпавших аминокислотных остатков (или количества совпавших нуклеотидов) на общее количество аминокислотных остатков (или общее количество нуклеотидов), при этом данное значение выражают в процентах. При выполнении выравнивания в одну или обе из двух последовательностей, которые требуется сравнить, вводят пропуск(и) при необходимости. Такое выравнивание последовательностей может быть выполнено с использованием известной программы, такой как BLAST, FASTA или CLUSTAL W. При введении пропуска(ов), вышеописанное общее количество аминокислотных остатков представляет собой количество остатков, вычисленных при подсчете одного пропуска как одного аминокислотного остатка. В случае, когда подсчитанное таким образом общее количество аминокислотных остатков отличается для двух подлежащих сравнению последовательностей, идентичность последовательностей (%) вычисляют путем деления количества совпавших аминокислотных остатков на общее количество аминокислотных остатков в более протяженной последовательности.
[0031]
20 типов аминокислот, составляющих природные белки, можно разделить на группы, для каждой из которых характерны общие свойства, например, на нейтральные аминокислоты с боковыми цепями, имеющими низкую полярность (Gly, Ile, Val, Leu, Ala, Met, Pro), нейтральные аминокислоты, имеющие гидрофильные боковые цепи (Asn, Gln, Thr, Ser, Tyr, Cys), кислотные аминокислоты (Asp, Glu), основные аминокислоты (Arg, Lys, His) и ароматические аминокислоты (Phe, Tyr, Trp). Известно, что в большинстве случаев замены аминокислот в пределах одной группы не приводят к изменению свойств полипептида. Таким образом, в случаях, когда аминокислотный остаток(ки) в полипептиде(ах) заменен, вероятность того, что иммуноиндуцирующая активность может сохраняться, становится высокой в случае замены аминокислотами в пределах каждой группы, и поэтому замена является предпочтительной.
[0032]
Полипептид (c) включает полипептид (a) или (b) в качестве неполной последовательности и обладает иммуноиндуцирующей активностью. Таким образом, полипептид (c) содержит по меньшей мере еще один аминокислотный остаток или (один или более) другой полипептид(ы), добавленный на одном конце или обоих концах полипептида (a) или (b), и обладает иммуноиндуцирующей активностью. Такой полипептид также может применяться при получении иммуноиндуцирующего средства согласно настоящему изобретению.
[0033]
Вышеописанные полипептиды могут быть синтезированы, например, с помощью метода химического синтеза, такого как метод Fmoc (флуоренилметилоксикарбонильный метод) или метод tBoc (т- бутилоксикарбонильный метод). Кроме того, они могут быть синтезированы с помощью стандартных методов при использовании различных типов доступных в продаже синтезаторов пептидов. Кроме того, представляющий интерес полипептид может быть получен при использовании известных методов генной инженерии, путем получения полинуклеотида, кодирующего вышеуказанный полипептид, и встраивания полинуклеотида в вектор экспрессии, который затем вводят в клетку-хозяина с последующим обеспечением продукции полипептида в клетке-хозяине.
[0034]
Полинуклеотид, кодирующий вышеуказанный полипептид, может быть легко получен с помощью известной методики генной инженерии или стандартного метода, при использовании доступного в продаже синтезатора нуклеиновых кислот. Например, ДНК, имеющая нуклеотидную последовательность, показанную в SEQ ID NO: 1, может быть получена при выполнении ПЦР с использованием собачьей хромосомной ДНК или библиотеки кДНК в качестве матрицы и пары праймеров, подобранных таким образом, что нуклеотидная последовательность, показанная в SEQ ID NO: 1, может быть амплифицирована при использовании праймеров. ДНК, имеющая нуклеотидную последовательность SEQ ID NO: 3, может быть так же получена при использовании человеческой хромосомной ДНК или библиотеки кДНК в качестве матрицы. Условия реакции ПЦР могут быть установлены соответствующим образом, и их примеры включают, без ограничения, повтор процесса реакции при 94°C в течение 30 секунд (денатурация), 55°C в течение от 30 секунд до 1 минуты (отжиг) и 72°C в течение 2 минут (удлинение) в качестве одного цикла, 30 циклов, например, с последующей реакцией при 72°C в течение 7 минут. Затем нужная ДНК может быть выделена путем получения подходящего зонда(ов) или праймера(ов) на основе информации нуклеотидных последовательностей и аминокислотных последовательностей, показанных в SEQ ID NO: 1 и 3 в Списке последовательностей, описанном в настоящей заявке, и скрининга библиотеки кДНК собаки, человека и т.п. при использовании данного зонда(ов) или праймера(ов). Библиотеку кДНК предпочтительно получают из клеток, органов или тканей, экспрессирующих белок SEQ ID NO: 2 или 4. Вышеописанные операции, такие как получение зонда(ов) или праймера(ов), конструирование библиотеки кДНК, скрининг библиотеки кДНК и клонирование целевого гена, известны специалистам в данной области и могут быть выполнены согласно методам, описанным в Molecular Cloning, Second Edition (Cold Spring Harbor Laboratory Press); Current Protocols in Molecular Biology (JOHN WILLY & SONS); и/или т.п. Из полученной таким образом ДНК может быть получена ДНК, кодирующая полипептид (a). Кроме того, так как кодоны, кодирующие каждую аминокислоту, известны, нуклеотидная последовательность полинуклеотида, кодирующего определенную аминокислотную последовательность, может быть легко определена. Таким образом, так как последовательность оснований полинуклеотида, кодирующего полипептид (b) или полипептид (c), также может быть легко определена, такой полинуклеотид можно также легко синтезировать при использовании доступного в продаже синтезатора нуклеиновых кислот согласно стандартному методу.
[0035]
Клетки-хозяева не ограничены при условии, что они могут экспрессировать вышеописанный полипептид, и их примеры включают, без ограничения перечисленными, прокариотические клетки, такие как E. coli; и эукариотические клетки, такие как культивируемые клетки млекопитающих, в том числе клетки почки обезьяны COS1 и клетки яичника китайского хомячка CHO; почкующиеся дрожжи; делящиеся дрожжи; клетки тутового шелкопряда; и яйцеклетки Xenopus laevis.
[0036]
В случае, когда прокариотические клетки используются в качестве клеток-хозяев, используют вектор экспрессии, который содержит точку начала репликации, которая обеспечивает репликацию вектора в прокариотической клетке, промотор, последовательность Шайна-Дальгарно (или участок связывания рибосомы), сайт клонирования ДНК, терминатор и/или подобное. Примеры вектора экспрессии для E. coli включают систему pUC, pBluescript II, систему экспрессии pET и систему экспрессии pGEX. При встраивании ДНК, кодирующей вышеуказанный полипептид, в такой вектор экспрессии и трансформации прокариотических клеток-хозяев таким вектором, с последующим культивированием полученных транформантов, полипептид, кодируемый ДНК, может экспрессироваться в прокариотических клетках-хозяевах. В этом процессе полипептид также может экспрессироваться в виде слитого белка с другим белком.
[0037]
В случае, когда эукариотические клетки используются в качестве клеток-хозяев, в качестве вектора экспрессии используют вектор экспрессии для эукариотических клеток, содержащий промотор, область сплайсинга, участок присоединения поли-(A) и/или подобное. Примеры такого вектора экспрессии включают pKA1, pCDM8, pSVK3, pMSG, pSVL, pBK-CMV, pBK-RSV, вектор EBV, pRS, pcDNA3, pMSG и pYES2. Таким же образом, как описано выше, при встраивании ДНК, кодирующей вышеуказанный полипептид, в такой вектор экспрессии и трансформации эукариотических клеток-хозяев вектором, с последующим культивированием полученных транформантов, полипептид, кодируемый ДНК, может экспрессироваться в эукариотических клетках-хозяевах. В случаях, когда в качестве вектора экспрессии используются pIND/V5-His, pFLAG-CMV-2, pEGFP-N1, pEGFP-C1 и т.п., вышеуказанный полипептид может экспрессироваться в виде слитого белка, в который добавляют метку, такую как His метка, FLAG метка, myc метка, HA метка или GFP.
[0038]
Для введения вектора экспрессии в клетки-хозяева могут использоваться известные методы, такие как электропорация, метод с фосфатом кальция, липосомный метод и метод с DEAE декстраном.
[0039]
Выделение и очистка представляющего интерес полипептида из клеток-хозяев могут быть выполнены с применением комбинации известных операций разделения. Примеры известных операций разделения включают, без ограничения перечисленными, обработку денатурирующим агентом, таким как мочевина, или поверхностно-активным веществом; обработку ультразвуком; расщепление ферментами; высаливание или фракционное осаждение растворителями; диализ; центрифугирование; ультрафильтрацию; гель-фильтрацию; ДСН-ПААГЭ; изоэлектрическое фокусирование; ионообменную хроматографию; гидрофобную хроматографию; афинную хроматографию; и обращено-фазовую хроматографию.
[0040]
Полипептиды, полученные вышеуказанным способом, также включают, как указано выше, полипептиды в виде слитого белка с другим произвольно выбранным белком. Их примеры включают слитые белки с глутатион-S-трансферазой (GST) или с His меткой. Такой полипептид в форме слитого белка также включен в объем настоящего изобретения в качестве описанного выше полипептида (с). Кроме того, в некоторых случаях полипептид, экспрессируемый в трансформированной клетке, подвергается модификациям различными способами в клетке после трансляции. Такой посттрансляционно модифицированный полипептид также входит в объем настоящего изобретения, если он обладает иммуноиндуцирующей активностью. Примеры такой посттрансляционной модификации включают: удаление N-концевого метионина; N-концевое ацетилирование; гликозилирование; ограниченное расщепление внутриклеточной протеазой; миристоилирование; изопренилирование; и фосфорилирование.
2. Иммуноиндуцирующее средство
Как более конкретно описано в Примерах, описанных ниже, опухоль, которая уже появилась, может подвергаться регрессии при введении полипептида, обладающего иммуноиндуцирующей активностью, животному, несущему злокачественную опухоль. Таким образом, иммуноиндуцирующее средство согласно настоящему изобретению может применяться для лечения и/или профилактики онкологических заболеваний. Кроме того, полипептид, обладающий иммуноиндуцирующей активностью, может применяться в способе лечения и/или предотвращения онкологических заболеваний посредством индукции иммунитета.
[0041]
При использовании в настоящем описании термины "опухоль" и "рак" означают злокачественную опухоль и используются попеременно.
[0042]
В данном случае рак, являющийся объектом воздействия, предпочтительно представляет собой рак, который экспрессирует CSPG5, более предпочтительно, рак молочной железы, рак легкого, опухоль головного мозга, рак яичника, лейкоз, злокачественную лимфому, аденокарциному, мастоцитому, плоскоклеточную карциному, меланому или нейробластому и, наиболее предпочтительно, рак молочной железы, рак легкого, опухоль головного мозга, лейкоз, злокачественную лимфому, мастоцитому, меланому или нейробластому.
[0043]
Интересующее животное (то есть субъект) предпочтительно является млекопитающим, как описано выше; более предпочтительно млекопитающим, включающим примата, домашнее животное, любое животное, выращенное в зоопарке, или подобное, сельскохозяйственное животное и скаковое животное; и наиболее предпочтительно человеком, собакой или кошкой.
[0044]
Путь введения иммуноиндуцирующего средства согласно настоящему изобретению в живой организм может быть как пероральным, так и парентеральным введением, и предпочтительно является парентеральным введением, таким как внутримышечное введение, подкожное введение, внутривенное введение или внутриартериальное введение. В случае, когда иммуноиндуцирующее средство применяется для лечения рака, его можно вводить в регионарный лимфатический узел вблизи от опухоли, подлежащей лечению, как описано в примерах ниже, для усиления его противоопухолевой активности. Доза может быть любой дозой при условии, что доза является эффективной для индукции иммунитета, и, например, в тех случаях, когда средство применяется для лечения и/или профилактики рака, доза может быть дозой, эффективной для лечения и/или профилактики онкологических заболеваний. Доза, эффективная для лечения и/или профилактики рака, выбирается надлежащим образом в зависимости от размера и симптомов опухоли и т.п., при этом эффективная доза обычно составляет от 0,0001 до 1000 мкг, предпочтительно от 0,001 до 1000 мкг на каждое животное в день, где указанное количество можно вводить один или несколько раз. Средство предпочтительно вводят несколько раз, от нескольких дней до нескольких месяцев. Как конкретно указано в Примерах ниже, иммуноиндуцирующее средство согласно настоящему изобретению может вызывать регрессию опухоли, которая уже появилась. Таким образом, поскольку средство может проявлять свое противоопухолевое действие также против небольшого числа раковых клеток на ранней стадии, развитие или рецидив рака можно предотвратить путем применения средства до развития рака или после лечения рака. Таким образом, иммуноиндуцирующее средство согласно настоящему изобретению эффективно как для лечения, так и для профилактики рака.
[0045]
Иммуноиндуцирующее средство согласно настоящему изобретению может состоять только из полипептида(ов) или может находиться в форме препарата, полученного путем надлежащего смешивания добавок, таких как фармацевтически приемлемый носитель, разбавитель, вспомогательное вещество и подобное, которые пригодны для лекарственных форм. Термин "препарат" может использоваться попеременно с "композицией для индукции иммунитета" или "лекарственным средством для индукции иммунитета". Способ получения препарата, а также пригодные для применения добавки хорошо известны в области фармацевтических препаратов, при этом могут применяться любые способы и добавки. Примеры добавок включают, без ограничения перечисленными, разбавители, такие как физиологические буферные растворы; вспомогательные вещества, такие как сахар, лактозу, кукурузный крахмал, фосфат кальция, сорбит и глицин; связующие вещества, такие как сироп, желатин, гуммиарабик, сорбит, поливинилхлорид и трагакант; и смазывающие вещества, такие как стеарат магния, полиэтиленгликоль, тальк и диоксид кремния. Примеры лекарственных форм могут включать пероральные препараты, такие как таблетки, капсулы, гранулы, порошок и сиропы; и парентеральные препараты, такие как препараты для ингаляции, препараты для инъекций, суппозитории и растворы. Такие препараты могут быть получены способами, общеизвестными в данной области.
[0046]
Иммуноиндуцирующее средство согласно настоящему изобретению может применяться в сочетании с иммуноусилителем, способным усиливать иммунный ответ у живого организма. Иммуноусилитель может содержаться в иммуноиндуцирующем средстве согласно настоящему изобретению или может быть введен в качестве отдельной композиции больному в сочетании с иммуноиндуцирующим средством согласно настоящему изобретению.
[0047]
Примеры иммуноусилителя включают адъюванты. Адъюванты могут усиливать иммунный ответ, обеспечивая резервуар антигена (внеклеточно или в макрофагах), активируя макрофаги и стимулируя специфические наборы лимфоцитов, что приводит к усилению иммунного ответа и, таким образом, противоопухолевого действия. Таким образом, особенно в тех случаях, когда иммуноиндуцирующее средство согласно настоящему изобретению применяется для лечения и/или профилактики рака, иммуноиндуцирующее средство предпочтительно содержит адъювант в дополнение к вышеописанному полипептиду в качестве действующего компонента. Многие типы адъювантов хорошо известны в уровне техники, при этом может применяться любой из таких адъювантов. Конкретные примеры адъювантов включают MPL (SmithKline Beecham), гомологи липополисахарида Salmonella minnesota Re 595, полученные после очистки и кислотного гидролиза липополисахарида; QS21 (SmithKline Beecham), чистый сапонин QA-21, очищенный из экстракта Quillja saponaria; DQS21, описанный в заявке РСТ WO96/33739 (SmithKline Beecham); QS-7, QS-17, QS-18 и QS-L1 (So et al., "Molecules and Cells", 1997, Vol. 7, p. 178-186); неполный адъювант Фрейнда; полный адъювант Фрейнда; витамин Е; Монтанид; алюминиевые квасцы или гидроксид алюминия; CpG-олигонуклеотиды (см., например, Kreig at al., Nature, Vol. 374, p. 546-549); поли-IC и его производные (например, поли ICLC); а также различные водно-масляные эмульсии, полученные из биоразлагаемых масел, таких как сквален и/или токоферол; и α-галактозилцерамид. Из перечисленного предпочтительными являются неполный адъювант Фрейнда, Монтанид, поли-IC и его производные, и CpG олигонуклеотиды. Соотношение при смешивании вышеописанного адъюванта и полипептида обычно составляет от 1:10 до 10:1, предпочтительно от 1:5 до 5:1, более предпочтительно приблизительно 1:1. Однако адъювант не ограничивается вышеописанными примерами, и адъюванты, известные в уровне техники, отличные от описанных выше, также могут применяться при введении иммуноиндуцирующего средства согласно настоящему изобретению (см., например, Goding, "Monoclonal Antibodies: Principles and Practice, 2nd edition", 1986). Способы получения смесей или эмульсий полипептида и адъюванта хорошо известны специалистам в области вакцинации.
[0048]
Кроме того, помимо вышеописанных адъювантов, факторы, которые стимулируют представляющий интерес иммунный ответ, могут применяться в качестве вышеописанного иммуноусилителя. Например, различные цитокины, обладающие свойством стимулировать лимфоциты и/или антигенпрезентирующие клетки, могут применяться в качестве иммуноусилителя в комбинации с иммуноиндуцирующим средством согласно настоящему изобретению. Ряд таких цитокинов, способных усиливать иммунный ответ, известны специалистам в данной области, и соответствующие примеры включают, без ограничения перечисленными, интерлейкин-12 (IL-12), ГМ-КСФ, IL-18, интерферон-α, интерферон-β, интерферон-ω, интерферон-γ и Flt3-лиганд, которые, как сообщали, усиливают профилактическое действие вакцин. Такие факторы можно применять в качестве иммуноусилителя и вводить больному, добавляя их к иммуноиндуцирующему средству согласно настоящему изобретению, или вводить в виде независимой композиции в комбинации с иммуноиндуцирующим средством согласно настоящему изобретению.
[0049]
Путем приведения описанного выше полипептида в контакт с антигенпрезентирующими клетками (от субъекта) ex vivo, in vivo или in vitro, можно вызвать презентирование полипептида антигенпрезентирующими клетками. То есть описанный выше полипептид (a), (b) или (c) может применяться в качестве средства для обработки антигенпрезентирующих клеток. Примеры антигенпрезентирующих клеток, которые могут предпочтительно применяться, включают дендритные клетки или В-клетки, имеющие молекулу МНС класса I. Различные молекулы МНС класса I были идентифицированы и хорошо известны. Молекулы MHC у человека называются HLA. Примеры молекул HLA класса I включают HLA-A, HLA-B и HLA-C, в частности, HLA-A1, HLA-A0201, HLA-A0204, HLA-A0205, HLA-A0206, HLA-A0207, HLA-A11, HLA-A24, HLA-A31, HLA-A6801, HLA-B7, HLA-B8, HLA-B2705, HLA-B37, HLA-Cw0401 и HLA-Cw0602.
[0050]
Примеры применения вышеописанного полипептида при обработке антигенпрезентирующих клеток, как описано в Разделе 3 ниже, включают применение полипептида для получения антигенпрезентирующей клетки, содержащей комплекс полипептида и молекулы MHC, и применение полипептида для получения цитотоксической Т-клетки, специфичной к полипептиду.
[0051]
Дендритные клетки или В-клетки, имеющие молекулу МНС класса I, могут быть получены из периферической крови известным способом. Например, опухолеспецифичные дендритные клетки можно индуцировать путем индукции дендритных клеток из костного мозга, пуповинной крови или периферической крови больного с использованием гранулоцитарно-макрофагального колониестимулирующего фактора (ГМ-КСФ) и IL-3 (или IL-4), и затем добавления опухолеассоциированного пептида в культуру клеток.
[0052]
При введении эффективного количества таких дендритных клеток можно индуцировать ответ, необходимый для терапии рака. В качестве используемых клеток можно применять костный мозг или пуповинную кровь от здорового донора, или костный мозг, периферическую кровь и т.п. от самого больного. В случае использования аутологичных клеток больного может быть достигнута высокая безопасность, при этом можно ожидать отсутствие серьезных побочных эффектов. Периферическая кровь или костный мозг могут быть из любого свежего образца, образца, хранившегося в холодильной камере, и замороженного образца. Что касается периферической крови, можно культивировать цельную кровь или можно выделять и культивировать только отдельные лейкоцитарные компоненты, причем последнее более эффективно и, следовательно, является предпочтительным. Кроме того, из лейкоцитарных компонентов могут быть выделены мононуклеарные клетки. В случаях, когда клетки происходят из костного мозга или пуповинной крови, цельные клетки, составляющие костный мозг, можно культивировать или мононуклеарные клетки можно выделять из них и культивировать. Периферическая кровь, ее лейкоцитарные компоненты и клетки костного мозга содержат мононуклеарные клетки, гемопоэтические стволовые клетки и незрелые дендритные клетки, из которых происходят дендритные клетки, а также CD4-положительные клетки и т.п. Что касается используемого цитокина, способ его изготовления не ограничен, причем может применяться природный или рекомбинантный цитокин или подобное, при условии, что подтверждена его безопасность и физиологическая активность. Предпочтительно препарат с гарантированным качеством для медицинского применения применяется в минимально необходимом количестве. Концентрация добавляемого цитокина(ов) не ограничена при условии, что дендритные клетки индуцируются при такой концентрации, при этом общая концентрация цитокина(ов) обычно составляет предпочтительно около 10-1000 нг/мл, более предпочтительно около 20-500 нг/мл. Культивирование можно проводить при использовании общеизвестной среды, обычно используемой для культивирования лейкоцитов. Температура культивирования не ограничена при условии, что пролиферация лейкоцитов достигается при такой температуре, при этом наиболее предпочтительной является температура около 37°C, которая является температурой тела человека. Атмосферная среда во время культивирования не ограничена при условии, что пролиферация лейкоцитов будет проходить в такой среде, при этом предпочтительно осуществляют вентиляцию с 5% СО2. Период культивирования не ограничен при условии, что в течение такого периода индуцируется необходимое количество клеток, и обычно составляет от 3 дней до 2 недель. Что касается аппаратов, используемых для разделения и культивирования клеток, то могут применяться соответствующие аппараты, предпочтительно такие, безопасность которых при применении в медицинских целях подтверждена, и работа которых является стабильной и простой. В частности, что касается аппарата для культивирования клеток, то может использоваться не только обычная емкость, такая как чашка Петри, колба или флакон, но также емкость пленочного типа, многокамерная емкость, роллерный флакон, флакон вращающегося типа, емкость для культивирования пакетного типа, колонка с полым волокном или подобное.
[0053]
Также при экспрессии полинуклеотида, кодирующего полипептиды (а), (b) или (с), в организме животного-субъекта, продукция антител и цитотоксические Т-клетки могут быть индуцированы в живом организме, при этом может быть получен эффект, сравнимый с эффектом, получаемым в случае введения полипептида. То есть иммуноиндуцирующее средство согласно настоящему изобретению может быть средством, включающим в качестве действующего компонента рекомбинантный вектор, содержащий полинуклеотид, кодирующий полинуклеотид (а), (b) или (с), причем такой рекомбинантный вектор способен экспрессировать полипептид в живом организме. Такой рекомбинантный вектор, способный экспрессировать антигенный полипептид, как показано в Примерах, описанных ниже, также называют генной вакциной.
[0054]
Вектор, применяемый для получения генной вакцины, не ограничен при условии, что он является вектором, способным экспрессировать полипептид в клетке животного-субъекта (предпочтительно в клетке млекопитающего), и может быть либо плазмидным вектором, либо вирусным вектором, при этом может применяться любой вектор, известный в области генных вакцин. Полинуклеотид, такой как ДНК или РНК, кодирующий описанный выше полипептид, может быть легко получен, как указано выше, с помощью стандартного способа. Встраивание полинуклеотида в вектор можно осуществлять с применением способа, хорошо известного специалистам в данной области.
[0055]
Путь введения генной вакцины предпочтительно является парентеральным путем, таким как внутримышечное, подкожное, внутривенное или внутриартериальное введение, при этом доза может быть соответственно выбрана в зависимости от типа антигена и т.п. и обычно составляет от приблизительно 0,1 мкг до 100 мг, предпочтительно от приблизительно 1 мкг до 10 мг в единицах массы генной вакцины на 1 кг массы тела.
[0056]
Примеры способа с применением вирусного вектора включают способы, в которых полинуклеотид, кодирующий вышеописанный полипептид, включают в РНК-вирус или ДНК-вирус, такой как ретровирус, аденовирус, аденоассоциированный вирус, вирус герпеса, вирус осповакцины, поксвирус, вирус полимиелита или вирус Синдбис, и затем животное-субъект инфицируют полученным вирусом. Наиболее предпочтительными из указанных способов являются способы, в которых применяется ретровирус, аденовирус, аденоассоциированный вирус и т.п., в особенности вирус осповакцины.
[0057]
Примеры других способов включают способ, в котором экспрессионную плазмиду непосредственно вводят внутримышечно (способ ДНК вакцины), липосомный способ, способ липофекции, способ микроинъекций, способ с фосфатом кальция и способ электропорации, при этом способ ДНК вакцины и липосомный способ являются особенно предпочтительными.
[0058]
Способы, которые фактически позволяют гену, кодирующему описанный выше полипептид, применяемый в настоящем изобретении, действовать в качестве лекарственного средства, включают способ in vivo, в котором ген непосредственно вводят в организм, и способ ex vivo, в котором клетки определенного типа собирают у животного-субъекта и вводят ген в клетки вне организма, а затем возвращают клетки в организм (Nikkei Science, 1994, April, p. 20-45; The Pharmaceutical Monthly, 1994, Vol. 36, No. 1, p. 23-48; Experimental Medicine, Extra Edition, 1994, Vol. 12, No. 15; а также ссылки, цитируемые в этих источниках и т.п.). Более предпочтительным является способ in vivo.
[0059]
При введении гена в способе in vivo, его можно вводить подходящим путем введения в зависимости от заболевания, подлежащего лечению, симптома и так далее. Ген можно вводить, например, путем внутривенного, внутриартериального, подкожного или внутримышечного введения. В случае, когда ген вводят способом in vivo, его можно подготовить в форме препарата, такого как раствор, при этом, как правило, его включают в раствор для инъекций или подобный, содержащий ДНК, кодирующую описанный выше пептид согласно настоящему изобретению, в качестве действующего компонента, и, при необходимости, к раствору может быть добавлен фармацевтически приемлемый носитель (например, физиологический раствор или буферный раствор). В случае липосомы или липосомы, слитой с мембраной (например, вирус Сендай (HVJ)-липосомы), содержащей ДНК, липосома может быть подготовлена в форме липосомного препарата, такого как суспензия, замороженный препарат или сконцентрированный центрифугированием замороженный препарат.
[0060]
В настоящем изобретении "нуклеотидная последовательность, представленная в SEQ ID NO:1", включает не только нуклеотидную последовательность, представленную в SEQ ID NO:1 непосредственно, но также и последовательность, комплементарную ей. Таким образом, "полинуклеотид, имеющий нуклеотидную последовательность, представленную в SEQ ID NO:1", включает одноцепочечный полинуклеотид, имеющий нуклеотидную последовательность, представленную в SEQ ID NO:1 непосредственно, одноцепочечный полинуклеотид, имеющий нуклеотидную последовательность, комплементарную ей, и двухцепочечный полинуклеотид, состоящий из указанных одноцепочечных полинуклеотидов. Когда полинуклеотид, кодирующий полипептид, применяемый в настоящем изобретении, получен, любую из указанных нуклеотидных последовательностей соответственно выбирают, при этом специалисты в данной области могут легко произвести такой выбор.
3. Антигенпрезентирующая клетка или цитотоксическая Т-клетка
В настоящем изобретении также предложен способ получения антигенпрезентирующей клетки, содержащей комплекс полипептида, указанного выше, и молекулы MHC, включающий контакт полипептида с антигенпрезентирующей клеткой субъекта ex vivo или in vitro.
[0061]
В настоящем изобретении также предложена антигенпрезентирующая клетка, отличающаяся тем, что она содержит комплекс полипептида, указанного выше, и молекулы MHC и получена с применением указанного способа.
[0062]
Непосредственно способ контакта полипептида, как указано выше, с антигенпрезентирующей клеткой ex vivo или in vitro может быть выполнен способом, известным в уровне техники, например, посредством культивирования антигенпрезентирующей клетки в жидкой среде, содержащей полипептид. В качестве среды могут применяться доступные в продаже среды для культивирования антигенпрезентирующих клеток. Концентрация пептида в среде, которая конкретно не ограничена, обычно составляет приблизительно 1-100 мкг/мл и предпочтительно составляет приблизительно 5-20 мкг/мл. Плотность клеток в процессе культивирования, которая конкретно не ограничена, обычно составляет приблизительно 103-107 клеток/мл и предпочтительно составляет от приблизительно 5×104 до 5×106 клеток/мл. Культивирование предпочтительно выполняют с применением стандартных методов при 37°C в атмосфере с 5% CO2. Длина пептида, который может быть презентирован антигенпрезентирующей клеткой на ее поверхности, обычно составляет приблизительно 30 аминокислотных остатков максимум. Таким образом, в случае контакта антигенпрезентирующей клетки с полипептидом ex vivo или in vitro, может быть получен полипептид, имеющий длину 30 аминокислотных остатков или меньше; однако длина не ограничивается этим.
[0063]
При культивировании антигенпрезентирующей клетки в присутствии полипептида, как указано выше, полипептид интегрируется в молекулу MHC антигенпрезентирующей клетки и презентируется на поверхности клетки, презентирующей антиген. Таким образом, можно получить выделенную антигенпрезентирующую клетку, содержащую комплекс полипептида и молекулы МНС. Такая антигенпрезентирующая клетка может презентировать полипептид in vivo, ex vivo или in vitro Т-клетке и может индуцировать и депонировать цитотоксическую Т-клетку, специфичную в отношении полипептида.
[0064]
В настоящем изобретении также предложен способ получения цитотоксической Т-клетки, специфичной в отношении полипептида, указанного выше, включающий контакт антигенпрезентирующей клетки с Т-клеткой субъекта ex vivo или in vitro, в результате чего происходит активация Т-клетки.
[0065]
В настоящем изобретении также предложена цитотоксическая Т-клетка, специфичная в отношении полипептида, указанного выше, полученная с применением такого способа.
[0066]
При контакте антигенпрезентирующей клетки, которая содержит комплекс полипептида, указанного выше, и молекулы МНС, полученной вышеуказанным способом с применением Т-клетки ex vivo или in vitro, цитотоксическая Т-клетка, специфичная в отношении полипептида, может индуцироваться и пролиферировать. Контакт может быть осуществлен путем совместного культивирования антигенпрезентирующей клетки и Т-клетки в жидкой среде; например, путем суспендирования антигенпрезентирующей клетки в жидкой среде, помещения полученной суспензии в емкость, такую как лунки микропланшета, добавления Т-клетки в лунки и их культивирования. Соотношение при смешивании антигенпрезентирующей клетки и Т-клетки в процессе совместного культивирования, которое конкретно не ограничено, обычно составляет от приблизительно 1:1 до приблизительно 1:100, предпочтительно от приблизительно 1:5 до приблизительно 1:20 при выражении отношения в количестве клеток. Плотность антигенпрезентирующей клетки в жидкой среде, которая конкретно не ограничена, обычно составляет от 100 до 1000000 клеток/мл и предпочтительно составляет от приблизительно 10000 до 1000000 клеток/мл. Совместное культивирование предпочтительно проводят с помощью стандартных методов при 37°C в атмосфере с 5% СО2. В качестве среды можно использовать коммерчески доступную среду для культивирования антигенпрезентирующей клетки/Т-клетки. Время культивирования, которое конкретно не ограничено, обычно составляет от 2 дней до 3 недель и предпочтительно составляет от 4 дней до 2 недель. Совместное культивирование предпочтительно проводят в присутствии одного или нескольких типов интерлейкинов, таких как IL-2, IL-6, IL-7 и IL-12. В данном случае концентрации IL-2 и IL-7 обычно составляют от 5 до 20 Ед/мл, концентрация IL-6 обычно составляет от приблизительно 500 до 2000 Ед/мл, и концентрация IL-12 обычно составляет приблизительно 5-20 нг/мл; однако концентрации не ограничиваются этим. Совместное культивирование можно повторять один или несколько раз, добавляя новую антигенпрезентирующую клетку. Например, операцию, которая включает удаление супернатанта культуры после совместного культивирования, добавление суспензии новой антигенпрезентирующей клетки и проведение совместного культивирования, можно повторять один или несколько раз. Условия совместного культивирования могут быть такими же, как указано выше.
[0067]
При совместном культивировании цитотоксическая Т-клетка, специфичная в отношении полипептида, индуцируется и пролиферирует. Таким образом, применение вышеуказанного полипептида можно использовать для получения выделенной Т-клетки, которая селективно связывает комплекс полипептида и молекулы МНС.
[0068]
Как описано в Примерах ниже, ген CSPG5 специфично экспрессируется в клетке рака молочной железы, ткани рака молочной железы, клетке рака легкого, ткани рака легкого, клетке рака печени, ткани рака печени, клетке опухоли головного мозга, ткани опухоли головного мозга, клетке рака яичника, ткани рака яичника, лейкозе, злокачественной лимфоме, клетке аденокарциномы, ткани аденокарциномы, мастоцитоме, клетке плоскоклеточной карциномы, клетке меланомы или клетке нейробластомы. Таким образом, считается, что в таких злокачественных опухолях CSPG5 присутствует на значительно большем уровне, чем в нормальных клетках. Если цитотоксическую Т-клетку, полученную вышеописанным образом, вводят in vivo таким образом, что часть полипептида CSPG5, существующего в раковых клетках, презентируется молекулой MHC на поверхности раковой клетки, цитотоксическая Т-клетка может повреждать раковую клетку при использовании части полипептида CSPG5 в качестве маркера. Антигенпрезентирующая клетка, презентирующая часть полипептида CSPG5, может индуцировать и вызывать пролиферацию цитотоксической Т-клетки, специфичной в отношении полипептида, in vivo. Таким образом, раковые клетки также могут повреждаться при введении антигенпрезентирующей клетки в живой организм. В частности, цитотоксическая Т-клетка и антигенпрезентирующая клетка, полученные с применением вышеуказанного полипептида, также могут применяться для лечения и/или предотвращения рака аналогично иммуноиндуцирующему средству согласно настоящему изобретению.
[0069]
В случаях, когда вышеописанные выделенные антигенпрезентирующие клетки или выделенные Т-клетки вводят в живой организм, их предпочтительно получают путем обработки антигенпрезентирующих клеток или Т-клеток, собранных у подлежащего лечению больного, полипептидом (a), (b) или (c), как описано выше, чтобы избежать иммунного ответа у живого организма, который атакует такие клетки как чужеродные тела.
[0070]
Лечебное и/или профилактическое средство против рака, включающее в качестве действующего компонента антигенпрезентирующие клетки или Т-клетки, предпочтительно вводят путем парентерального введения, например путем внутривенного или внутриартериального введения. Дозу подбирают соответствующим образом в зависимости от симптомов, цели введения и подобного, при этом доза обычно составляет от 1 до 10000000000000 клеток, предпочтительно от 1000000 клеток до 1000000000 клеток, причем такую дозу предпочтительно вводят от одного раза в несколько дней до одного раза в несколько месяцев. Препарат может быть, например, клетками, суспендированными в буферизированном физиологическом растворе, при этом препарат может применяться в комбинации с другим противоопухолевым средством(ами), цитокином(ами) и т.п. Кроме того, может быть добавлена одна или несколько добавок, известных в области фармацевтических препаратов.
ПРИМЕРЫ
[0071]
Далее настоящее изобретение будет описано более конкретно на основе Примеров; впрочем, объем настоящего изобретения не ограничивается Примерами.
<Пример 1>
<Получение нового ракового антигенного белка с помощью метода SEREX>
(1) Получение библиотеки кДНК
Суммарную РНК выделяли из семенников собаки согласно методу с использованием кислого гуанидина-фенола-хлороформа, и затем поли-(A) РНК очищали с помощью набора для очистки мРНК Oligotex-dT30 (Takara Shuzo Co., Ltd., Kyoto, Japan) в соответствии с протоколом, прилагаемым к набору.
[0072]
При использовании полученной мРНК (5 мкг) синтезировали фаговую библиотеку кДНК. Для получения фаговой библиотеки кДНК применяли набор для синтеза кДНК, набор для синтеза Zap-cDNA или набор для клонирования ZAP-cDNA GigapackIII Gold (STRATAGENE) в соответствии с протоколом, прилагаемым к набору. Размер полученной фаговой библиотеки кДНК составлял 1×106 БОЕ/мл.
[0073]
(2) Скрининг библиотеки кДНК с использованием сыворотки
При использовании полученной фаговой библиотеки кДНК выполняли иммунный скрининг. В частности, штамм E. coli (XL1-Blue MRF') заражали фагом с получением 2340 клонов на чашке с агарозой NZY ∅90×15 мм и культивировали при 42°C в течение 3-4 часов, получив бляшки. Чашку покрывали нитроцеллюлозной мембраной (Hybond C Extra: GE Healthcare Bio-Science), пропитанной ИПТГ (изопропил-β-D-тиогалактозидом), при 37°C на 4 часа для индукции экспрессии белка и переносили белок на мембрану. После этого мембрану снимали, пропитывали TBS (10 мМ Трис-HCl, 150 мМ NaCl, pH 7,5), содержащим 0,5% обезжиренного сухого молока, и оставляли на ночь при 4°C с перемешиванием для подавления неспецифичной реакции. Этот фильтр оставляли реагировать с разведенной в 500 раз сывороткой больной собаки при комнатной температуре в течение 2-3 часов.
[0074]
В качестве указанной выше сыворотки больной собаки использовали сыворотку, забранную у собак с раком молочной железы. Сыворотку хранили при -80°C и подвергали предварительной обработке непосредственно перед применением. Методика предварительной обработки сыворотки являлась следующей. То есть, во-первых, штамм Escherichia coli (XL1-Blue MRF') заражали фагом λ ZAP Express, в который не был встроен никакой чужеродный ген, и затем культивировали на чашке со средой NZY при 37°C в течение ночи. Затем в чашку добавляли 0,2 М NaHCO3 буфер (pH 8,3), содержащий 0,5 М NaCl, и оставляли чашку при 4°C на 15 часов, после чего супернатант собирали как экстракт Escherichia coli/фага. После этого собранный экстракт Escherichia coli/фага пропускали через NHS колонку (GE Healthcare Bio-Science) для иммобилизации на колонке белков, полученных из Escherichia coli/фага. Сыворотку больной собаки также пропускали через колонку для взаимодействия с иммобилизованным на колонке белком, чтобы удалить из сыворотки антитела, адсорбированные на Escherichia coli и фаге. Фракцию сыворотки, выходящую из колонки, разводили в 500 раз TBS, содержащим 0,5% обезжиренного сухого молока, и использовали полученный разбавитель в качестве материала для иммунного скрининга.
[0075]
Мембрану, на которую были перенесены обработанная таким образом сыворотка и вышеописанный слитый белок, 4 раза промывали TBS-T (0,05% Tween 20/TBS) и позволяли взаимодействовать с IgG козы против антител собаки (HRP-конюгат IgG-h+1 козы против антител собаки, BETHYL Laboratories), разведенным в 5000 раз в TBS, содержащем 0,5% обезжиренного сухого молока, в качестве вторичного антитела, при комнатной температуре в течение 1 часа с последующим детектированием с помощью ферментативной цветной реакции при использовании реакционного раствора NBT/BCIP (Roche). Колонии в положениях, в которых наблюдали положительную реакцию окрашивания, собирали с чашки с NZY агарозой, имеющей размер ∅90×15 мм, и разводили в 500 мкл буфера SM (100 мМ NaCl, 10 мМ MgClSO4, 50 мМ Трис-HCl, 0,01% желатина, рН 7,5). Скрининг повторяли в качестве второго и третьего скрининга так же, как описано выше, до тех пор, пока не была получена одна колония с положительной реакцией окрашивания, в результате чего был выделен один положительный клон после скрининга 9110 фаговых клонов, реагирующих с IgG в сыворотке.
[0076]
(3) Поиск идентичности последовательности гена выделенного антигена
Чтобы выполнить анализ нуклеотидной последовательности единственного положительного клона, выделенного с помощью вышеописанного способа, проводили операцию конверсии фагового вектора в плазмидный вектор. В частности, раствор (200 мкл), содержащий штамм Escherichia coli (XL1-Blue MRF'), полученный таким образом, чтобы показывать оптическую плотность OD600=1,0, очищенный раствор фага (100 мкл) и дополнительный 1 мкл хелперного фага ExAssist (STRATAGENE) смешивали и оставляли реагировать при 37°C в течение 15 минут. Добавляли среду LB (3 мл) и проводили культивирование при 37°C в течение 2,5-3 часов. Полученную культуру немедленно помещали в водяную баню с температурой 70°C на 20 минут и затем центрифугировали при 4°C и 1000×g в течение 15 минут с получением супернатанта в качестве раствора фагмиды. Затем раствор (200 мкл), содержащий фагмидный штамм Escherichia coli (SOLR), приготовленный с оптической плотностью OD600=1,0, и очищенный раствор фага (10 мкл) смешивали и позволяли реагировать при 37°C в течение 15 минут. Полученный раствор (50 мкл) сеяли на содержащую ампициллин (конечная концентрация: 50 мкг/мл) агаровую LB среду и культивировали при 37°C в течение ночи. Одиночную трансформированную колонию SOLR отбирали, культивировали в содержащей ампициллин (конечная концентрация: 50 мкг/мл) среде LB при 37°C и затем очищали с помощью набора QIAGEN plasmid Miniprep Kit (QIAGEN), получив плазмидную ДНК, содержащую нужную вставку.
[0077]
Очищенную плазмиду подвергали методу праймер-опосредованной прогулки при использовании праймера T3, представленного в SEQ ID NO: 17, и праймера T7, представленного в SEQ ID NO: 18, для анализа полноразмерной последовательности вставки. Последовательность гена, представленную в SEQ ID NO: 1, получали с помощью анализа секвенирования. При использовании нуклеотидной последовательности гена и соответствующей ей аминокислотной последовательности, поиск идентичности последовательности, который является поиском идентичной последовательности с известными генами, проводили с помощью программы поиска идентичности последовательности BLAST (http://www.ncbi.nlm.nih.gov/BLAST/). В результате было обнаружено, что ген, полученный выше, является геном CSPG5. В человеческом CSPG5, который является человеческим фактором, гомологичным CSPG5 собаки, идентичность нуклеотидной последовательности и идентичность аминокислотной последовательности с CSPG5 собаки составили 87%. В CSPG5 кошки идентичность нуклеотидной последовательности составляла 92%, а идентичность аминокислотной последовательности составляла 91%. В гомологичном факторе мыши, т.е. мышином CSPG5, идентичность нуклеотидной последовательности составляла 84%, а идентичность аминокислотной последовательности составляла 85%. Нуклеотидные последовательности человеческого CSPG5 представлены в SEQ ID NO: 3, 5, 7, 9 и 11, а соответствующие аминокислотные последовательности представлены в SEQ ID NO: 4, 6, 8, 10 и 12. Нуклеотидная последовательность CSPG5 кошки представлена в SEQ ID NO: 13, и соответствующая ей аминокислотная последовательность представлена в SEQ ID NO: 14. Нуклеотидная последовательность CSPG5 мыши представлена в SEQ ID NO: 15, и соответствующая ей аминокислотная последовательность представлена в SEQ ID NO: 16.
[0078]
(4) Анализ экспрессии генов в различных тканях
Экспрессия генов, полученных с помощью вышеуказанного способа, в нормальных тканях и раковых тканях, и линиях раковых клеток собак, людей и мышей исследовали с помощью метода ОТ-ПЦР (ПЦР с обратной транскрипцией). Реакцию обратной транскрипции проводили следующим образом. Сначала суммарную РНК выделяли из отдельных тканей (50-100 мг) и отдельных клеточных линий (5-10×106 клеток) при помощи реактива TRIZOL (Invitrogen) в соответствии с прилагаемым протоколом. При использовании суммарной РНК синтезировали кДНК с использованием системы Superscript First-Strand Synthesis System для ОТ-ПЦР (Invitrogen) в соответствии с прилагаемым протоколом. В качестве кДНК нормальных тканей человека (из головного мозга, гиппокампа, яичка, толстой кишки и плаценты) использовали пул кДНК генов (Invitrogen), кДНК QUICK-Clone (Clontech) и библиотеку кДНК Large-Insert (Clontech). Реакцию ПЦР проводили при помощи ген-специфических праймеров (собачьи праймеры представлены в SEQ ID NO: 19 и 20, человеческие праймеры представлены в SEQ ID NO: 21 и 22, мышиные праймеры представлены в SEQ ID NO: 23 и 24), полученных следующим образом. То есть реактивы добавляли к прилагаемому буферу, где реактивы содержали 0,25 мкл образца, полученного в реакции обратной транскрипции, вышеуказанные праймеры (по 2 мкM каждого), дНТФ (по 0,2 мМ каждого) и 0,65 Ед полимеразы ExTaq (Takara Shuzo Co., Ltd.). Реакционную смесь в общем объеме 25 мкл подвергали ПЦР при использовании Thermal Cycler (BIO RAD). В ПЦР повторяли 30 циклов, где один цикл состоял из следующих обработок: 94°C в течение 30 секунд; 55°C в течение 30 секунд; и 72°C в течение одной минуты. Для сравнения одновременно использовали GAPDH-специфичные праймеры (т.е. праймеры к GAPDH собаки и человека, представленные в SEQ ID NO: 25 и 26, и праймеры к GAPDH мыши, представленные в SEQ ID NO: 27 и 28). В результате, как показано на Фиг. 1, ген CSPG5 собаки не экспрессировался почти ни в одной из нормальных тканей собаки, но при этом он сильно экспрессировался в опухолевых тканях собаки. Аналогично гену CSPG5 собаки, экспрессия генов CSPG5 человека и мыши в нормальных тканях человека и мыши почти не подтверждалась; однако их экспрессия была обнаружена в раковых клетках, т.е. раке молочной железы, раке легкого, опухоли головного мозга, раке яичника, лейкозе, линиях клеток злокачественной лимфомы (Фиг. 2 и 3).
<Пример 2>
<Анализ in vivo раковой антигенности CSPG5>
(1) Получение рекомбинантного вектора, экспрессирующего CSPG5 in vivo
Рекомбинантный вектор, экспрессирующий CSPG5 in vivo, получали на основе нуклеотидной последовательности, представленной в SEQ ID NO: 15, в соответствии со следующим способом. ПЦР проводили следующим образом. Реакционную смесь подготавливали, добавляя следующие реактивы: молекула кДНК (1 мкл), которую получали из линии клеток нейробластомы мыши 1 (N2a: приобретенной в ATCC), экспрессию которой наблюдали в Примере 1, два типа праймеров (по 0,4 мкМ каждого), имеющих расщепленные рестриктазами HindIII и XbaI последовательности (представленные в SEQ ID NO: 29 и 30), 0,2 мм дНТФ и 1,25 Ед полимеразы PrimeSTAR HS (Takara Shuzo Co., Ltd.), а также прилагаемый буфер, с получением общего количества 50 мкл; и подвергали ПЦР с использованием Thermal Cycler (BIO RAD). В ПЦР повторяли 30 циклов, где один цикл состоял из следующих обработок: 98°C в течение 10 секунд; 55°C в течение 15 секунд; и в 72°C в течение 4 минут. Вышеуказанные праймеры двух типов использовали для амплификации области, кодирующей полноразмерную аминокислотную последовательность, представленную в SEQ ID NO: 15. После ПЦР амплифицированную ДНК подвергали электрофорезу в 1% агарозном геле, и нужный фрагмент ДНК размером 1000 пн очищали при помощи набора QIAquick Gel Extraction Kit (QIAGEN).
[0079]
Очищенный фрагмент ДНК лигировали в клонирующий вектор, pCR-Blunt (Invitrogen), который затем трансформировали в клетки E. coli с последующим выделением плазмидного вектора. В результате его секвенирования подтверждали, что последовательность амплифицированного фрагмента гена была идентична требуемой последовательности. Плазмиду, последовательность которой была идентична требуемой последовательности, обрабатывали рестриктазами HindIII и XbaI. После выполнения очистки при помощи набора QIAquick Gel Extraction Kit, нужную последовательность гена встраивали в вектор для экспрессии в клетках млекопитающих PCDNA3.1 (Invitrogen), обработанный рестриктазами HindIII и XbaI. В результате применения указанного вектора белок CSPG5 продуцировался в клетке млекопитающего.
[0080]
К плазмидной ДНК (100 мкг), полученной выше, добавляли 50 мкг частиц золота (Bio Rad), спермидин (100 мкл) (SIGMA) и 1М CaCl2 (100 мкл (SIGMA)). Смесь перемешивали на вортексе и оставляли на 10 минут при комнатной температуре (в дальнейшем именуется как "частицы золота-ДНК"). После центрифугирования при 3000 об/мин в течение одной минуты, супернатант удаляли, затем три раза промывали осадок 100% этанолом (WAKO). К частицам золота-ДНК добавляли 100% этанол (6 мл) и перемешивали смесь в достаточной степени на вортексе. Частицы золота-ДНК вводили в трубку из Тефзела (Bio Rad) с их осаждением на стенке трубки. Трубку из Тефзела с прикрепленными частицами золота-ДНК сушили на воздухе, удаляя этанол, и после этого нарезали на части, имеющие подходящую длину для использования в генной пушке.
[0081]
(2) Противоопухолевое действие CSPG5 в способе ДНК вакцины
Использовали десять мышей A/J (7 недель, самцы, приобретенные в Japan SLC). Трубку, подготовленную выше, устанавливали в генную пушку. ДНК вакцину чрескожно вводили в выбритый живот (в брюшную полость) мышей с помощью чистого гелия под давлением 400 фунтов на кв.дюйм (2,75 МПа) три раза в 7 дней (количество вводимой плазмидной ДНК: 2 мкг/животное). После чрескожного введения, клетки N2a, которые представляют собой линию клеток нейробластомы мыши, перевивали каждой мыши для оценки противоопухолевого действия (указанной как профилактическая модель). Для контроля плазмидную ДНК без вставленного гена CSPG5 вводили 10 мышам в каждой модельной группе.
[0082]
Противоопухолевое действие оценивали по размеру опухоли (наибольший диаметр×(наименьший диаметр)2/2) и проценту выживших мышей. В результате в профилактической модели размеры опухоли после 21 дня в контрольной группе и группе введения плазмиды CSPG5 составили 1866 мм3 и 459 мм3, соответственно. Таким образом, было установлено, что размер опухоли значимо уменьшился в группе введения плазмиды CSPG5. В результате, поскольку ситуацию с выживанием наблюдали в профилактической модели, все животные в контрольной группе погибли через 54 дня после введения; тогда как в группе введения плазмиды CSPG5 60% мышей остались живы. На основе этих результатов было продемонстрировано значимое противоопухолевое действие в группе введения плазмиды CSPG5 по сравнению с контрольной группой.
ПРОМЫШЛЕННАЯ ПРИМЕНИМОСТЬ
[0083]
В настоящем изобретении предложено иммуноиндуцирующее средство, включающее полипептид, демонстрирующий противоопухолевую активность в отношении раковых опухолей, и таким образом, применимый для лечения и/или предотвращения онкологических заболеваний.
СПИСОК ПОСЛЕДОВАТЕЛЬНОСТЕЙ В ФОРМЕ ОТКРЫТОГО ТЕКСТА
[0084]
SEQ ID NO: 17: праймер T3
SEQ ID NO: 18: праймер T7
SEQ ID NO: 19: Собачий (собака) ОТ-праймер, смысловой
SEQ ID NO: 20: Собачий (собака) ОТ-праймер, антисмысловой
SEQ ID NO: 21: человеческий ОТ-праймер, смысловой
SEQ ID NO: 22: человеческий ОТ-праймер, антисмысловой
SEQ ID NO: 23: мышиный ОТ-праймер, смысловой
SEQ ID NO: 24: мышиный ОТ-праймер, антисмысловой
SEQ ID NO: 25 и 26: праймер к GAPDH
SEQ ID NO: 27 и 28: праймер к GAPDH
SEQ ID NO: 29: смысловой праймер mus-fullCSPG5
SEQ ID NO: 30: антисмысловой праймер mus-fullCSPG5
Все публикации, патенты и заявки на патенты, цитируемые в настоящем документе, полностью включены посредством отсылки.
--->
Список последовательностей
<110> TORAY INDUSTRIES, INC.
<120> Иммуноиндуктор
<130> PH-6534-PCT
<150> JP 2015-093354
<151> 2015-04-30
<160> 30
<170> PatentIn version 3.1
<210> 1
<211> 2270
<212> ДНК
<213> Canis familiaris
<220>
<221> CDS
<222> (1)..(1434)
<223>
<400> 1
ggg gag gag gag acc tcg tgt act gca cct ggc ggc ctg ccg gcc gtg 48
Gly Glu Glu Glu Thr Ser Cys Thr Ala Pro Gly Gly Leu Pro Ala Val
1 5 10 15
gtg ggg cct ggg gtc ggg cca gag gag gcg ctg gag gcg tcc gcg gcc 96
Val Gly Pro Gly Val Gly Pro Glu Glu Ala Leu Glu Ala Ser Ala Ala
20 25 30
gtg acc ggc aca gcc tgg ctg gag gct gac agc ccg ggc ctg ggc gga 144
Val Thr Gly Thr Ala Trp Leu Glu Ala Asp Ser Pro Gly Leu Gly Gly
35 40 45
gcg acc gta gag gct ggc agc ggc gac acc cag gcc ctt ccg gcc acg 192
Ala Thr Val Glu Ala Gly Ser Gly Asp Thr Gln Ala Leu Pro Ala Thr
50 55 60
ctc ccg act ccg gag gag gcc ctc cga cgt gca tcg gtg gcc ccc gcc 240
Leu Pro Thr Pro Glu Glu Ala Leu Arg Arg Ala Ser Val Ala Pro Ala
65 70 75 80
acc ccc gag act aca gag gcc agc gga cca ccc tcc ccc act cct ggc 288
Thr Pro Glu Thr Thr Glu Ala Ser Gly Pro Pro Ser Pro Thr Pro Gly
85 90 95
gac cag cta cgc cca ggc ccc gaa ctc ccc aag gag agc ccc ttg gag 336
Asp Gln Leu Arg Pro Gly Pro Glu Leu Pro Lys Glu Ser Pro Leu Glu
100 105 110
gtt tgg ctg aac ctg gga ggc agc aca cat gac ccg cat ggg cca gag 384
Val Trp Leu Asn Leu Gly Gly Ser Thr His Asp Pro His Gly Pro Glu
115 120 125
ccc acg ttc ccc ttt cag ggc aca ctg gag ccc cgg ccg gcg tca gat 432
Pro Thr Phe Pro Phe Gln Gly Thr Leu Glu Pro Arg Pro Ala Ser Asp
130 135 140
atc att gac atc gac tac ttc gaa gga ttg gat ggt gag ggc cgt ggc 480
Ile Ile Asp Ile Asp Tyr Phe Glu Gly Leu Asp Gly Glu Gly Arg Gly
145 150 155 160
gcc gac ttg ggg agc ttc ccg gtg tcg cca gga acc tca gag cac cac 528
Ala Asp Leu Gly Ser Phe Pro Val Ser Pro Gly Thr Ser Glu His His
165 170 175
ccc gat act ggg gga gag acc cct tcc tgg agc ctg ctt gac tta tac 576
Pro Asp Thr Gly Gly Glu Thr Pro Ser Trp Ser Leu Leu Asp Leu Tyr
180 185 190
gat gac ttc acc ccc ttt gat gaa tct gac ttc tac ccc act aca tcc 624
Asp Asp Phe Thr Pro Phe Asp Glu Ser Asp Phe Tyr Pro Thr Thr Ser
195 200 205
ttc tat gat gac ttg gag gaa gag gag gag gaa gag gat gac gac aag 672
Phe Tyr Asp Asp Leu Glu Glu Glu Glu Glu Glu Glu Asp Asp Asp Lys
210 215 220
gat gca gcg gaa ggt gga gac ctg gaa gat gaa agt gac ctt ctg gtg 720
Asp Ala Ala Glu Gly Gly Asp Leu Glu Asp Glu Ser Asp Leu Leu Val
225 230 235 240
ccc act gag aag cct ggg ctg agg cca ggg cct ggc cag ccc acc agt 768
Pro Thr Glu Lys Pro Gly Leu Arg Pro Gly Pro Gly Gln Pro Thr Ser
245 250 255
cgg tgg cat gct gtc ccc cca cag cat act ctg ggg ttg gtc cct ggc 816
Arg Trp His Ala Val Pro Pro Gln His Thr Leu Gly Leu Val Pro Gly
260 265 270
agc agc atc gcc ctc aga ccc cgt ccg gga gag ccg ggc agg gac ctg 864
Ser Ser Ile Ala Leu Arg Pro Arg Pro Gly Glu Pro Gly Arg Asp Leu
275 280 285
gcc ccg agc gag aac ggc act gag tgc cgc agc ggc ttt gtg cgg cat 912
Ala Pro Ser Glu Asn Gly Thr Glu Cys Arg Ser Gly Phe Val Arg His
290 295 300
aac ggc tcc tgc cga tcc gtg tgc gac ctc ttc cca agt tac tgt cac 960
Asn Gly Ser Cys Arg Ser Val Cys Asp Leu Phe Pro Ser Tyr Cys His
305 310 315 320
aac ggc ggc cag tgc tac ctg gtg gac aac ata ggg gcc ttc tgc agg 1008
Asn Gly Gly Gln Cys Tyr Leu Val Asp Asn Ile Gly Ala Phe Cys Arg
325 330 335
tgt aac aca cag gac tac atc tgg cac aag ggg atg cgc tgc gag tcc 1056
Cys Asn Thr Gln Asp Tyr Ile Trp His Lys Gly Met Arg Cys Glu Ser
340 345 350
atc atc acc gac ttc cag gtg atg tgc gtg gcc gtc ggc tca gcc gcc 1104
Ile Ile Thr Asp Phe Gln Val Met Cys Val Ala Val Gly Ser Ala Ala
355 360 365
ctc gtg ctg ctc ctg ctc ttc atg atg aca gtg ttc ttc gcc aag aag 1152
Leu Val Leu Leu Leu Leu Phe Met Met Thr Val Phe Phe Ala Lys Lys
370 375 380
ctg tat ctg ctc aag aca gag aat acc aag ctg cgt agg acc aac aaa 1200
Leu Tyr Leu Leu Lys Thr Glu Asn Thr Lys Leu Arg Arg Thr Asn Lys
385 390 395 400
ttc cgg acc ccg tct gag ctc cac aac gat aac ttc tcc ctt tcc acc 1248
Phe Arg Thr Pro Ser Glu Leu His Asn Asp Asn Phe Ser Leu Ser Thr
405 410 415
att gcc gaa ggc tct cac cca aac gac gat ccc agt gct tcc cac aaa 1296
Ile Ala Glu Gly Ser His Pro Asn Asp Asp Pro Ser Ala Ser His Lys
420 425 430
atc cag gag gtt ctc aag tcc tgc ctg aaa gag gag gag tca ttt aac 1344
Ile Gln Glu Val Leu Lys Ser Cys Leu Lys Glu Glu Glu Ser Phe Asn
435 440 445
atc cag aac tcc atg tcc ccc aaa ctg gag ggt ggc aaa ggt gac cag 1392
Ile Gln Asn Ser Met Ser Pro Lys Leu Glu Gly Gly Lys Gly Asp Gln
450 455 460
gct gac ttg gag gtg aac tgt ctt cag aac aac ctc acc taa 1434
Ala Asp Leu Glu Val Asn Cys Leu Gln Asn Asn Leu Thr
465 470 475
agcagagcaa gaagagaggg aatgggggag ggcggggggt ggcaggggaa gaaacatgac 1494
ctcctcttgt acagagtcta tttcttgtaa ccatttgtta aactctcttc tttttctggt 1554
ctcatggcat gccttgatgt attttgtaca ggagggagaa aacacaaaat aagcaaagaa 1614
cctgaacaga atcgcataca ccgggttgtt tcgtctgtgc tgtctgtata ttgcttctgc 1674
tgctgtgatt tctaaaccta tgctgttatt caactgactt tttttttgta ctttgaccca 1734
cctttttttg aaataagagt taaaaaacaa agttcttgaa ataaaacttt ttaaaaagcc 1794
attttccatc agtgtgtcca cttcctaccc attcttgtca gcttgagttg aattcttacg 1854
ttccctgaag atgtatattt atatgtgttt gaaatcctgg aagtgctctc tgtattagcc 1914
taggttgccg taactaaaca tcatagactg gatcacttaa gcaatagaaa tttatttttg 1974
aacagtaata gaggctggat ccccaagatc aaggtgccaa cagagttggt ttctggcagg 2034
gcctctctgc ctggcttgca aagagccatc ttcttgctat gtcctcacaa ggccttttgt 2094
ctgtgcacat ctcttcctct tctgataagg acaccagtcc tattggccta ggatccattt 2154
aacctcaatt acctcctcat aggccctact ccagatacag tcacacttag gggttatggc 2214
ttcaacatga cttttggggt gacataattc agtccacaag tctgtagcac ctgatt 2270
<210> 2
<211> 477
<212> Белок
<213> Canis familiaris
<400> 2
Gly Glu Glu Glu Thr Ser Cys Thr Ala Pro Gly Gly Leu Pro Ala Val
1 5 10 15
Val Gly Pro Gly Val Gly Pro Glu Glu Ala Leu Glu Ala Ser Ala Ala
20 25 30
Val Thr Gly Thr Ala Trp Leu Glu Ala Asp Ser Pro Gly Leu Gly Gly
35 40 45
Ala Thr Val Glu Ala Gly Ser Gly Asp Thr Gln Ala Leu Pro Ala Thr
50 55 60
Leu Pro Thr Pro Glu Glu Ala Leu Arg Arg Ala Ser Val Ala Pro Ala
65 70 75 80
Thr Pro Glu Thr Thr Glu Ala Ser Gly Pro Pro Ser Pro Thr Pro Gly
85 90 95
Asp Gln Leu Arg Pro Gly Pro Glu Leu Pro Lys Glu Ser Pro Leu Glu
100 105 110
Val Trp Leu Asn Leu Gly Gly Ser Thr His Asp Pro His Gly Pro Glu
115 120 125
Pro Thr Phe Pro Phe Gln Gly Thr Leu Glu Pro Arg Pro Ala Ser Asp
130 135 140
Ile Ile Asp Ile Asp Tyr Phe Glu Gly Leu Asp Gly Glu Gly Arg Gly
145 150 155 160
Ala Asp Leu Gly Ser Phe Pro Val Ser Pro Gly Thr Ser Glu His His
165 170 175
Pro Asp Thr Gly Gly Glu Thr Pro Ser Trp Ser Leu Leu Asp Leu Tyr
180 185 190
Asp Asp Phe Thr Pro Phe Asp Glu Ser Asp Phe Tyr Pro Thr Thr Ser
195 200 205
Phe Tyr Asp Asp Leu Glu Glu Glu Glu Glu Glu Glu Asp Asp Asp Lys
210 215 220
Asp Ala Ala Glu Gly Gly Asp Leu Glu Asp Glu Ser Asp Leu Leu Val
225 230 235 240
Pro Thr Glu Lys Pro Gly Leu Arg Pro Gly Pro Gly Gln Pro Thr Ser
245 250 255
Arg Trp His Ala Val Pro Pro Gln His Thr Leu Gly Leu Val Pro Gly
260 265 270
Ser Ser Ile Ala Leu Arg Pro Arg Pro Gly Glu Pro Gly Arg Asp Leu
275 280 285
Ala Pro Ser Glu Asn Gly Thr Glu Cys Arg Ser Gly Phe Val Arg His
290 295 300
Asn Gly Ser Cys Arg Ser Val Cys Asp Leu Phe Pro Ser Tyr Cys His
305 310 315 320
Asn Gly Gly Gln Cys Tyr Leu Val Asp Asn Ile Gly Ala Phe Cys Arg
325 330 335
Cys Asn Thr Gln Asp Tyr Ile Trp His Lys Gly Met Arg Cys Glu Ser
340 345 350
Ile Ile Thr Asp Phe Gln Val Met Cys Val Ala Val Gly Ser Ala Ala
355 360 365
Leu Val Leu Leu Leu Leu Phe Met Met Thr Val Phe Phe Ala Lys Lys
370 375 380
Leu Tyr Leu Leu Lys Thr Glu Asn Thr Lys Leu Arg Arg Thr Asn Lys
385 390 395 400
Phe Arg Thr Pro Ser Glu Leu His Asn Asp Asn Phe Ser Leu Ser Thr
405 410 415
Ile Ala Glu Gly Ser His Pro Asn Asp Asp Pro Ser Ala Ser His Lys
420 425 430
Ile Gln Glu Val Leu Lys Ser Cys Leu Lys Glu Glu Glu Ser Phe Asn
435 440 445
Ile Gln Asn Ser Met Ser Pro Lys Leu Glu Gly Gly Lys Gly Asp Gln
450 455 460
Ala Asp Leu Glu Val Asn Cys Leu Gln Asn Asn Leu Thr
465 470 475
<210> 3
<211> 2175
<212> ДНК
<213> Homo sapiens
<220>
<221> CDS
<222> (177)..(1796)
<223>
<400> 3
ggggaggcgc ggcgcgccgg ggacagcggc ggacggcggc ggcggcggca tgcggctcct 60
cgcgctgccc atcgtgggct gaggcggccg cagaaccggc gggaggcgcg gcggccgggc 120
gagccgaggg cgcagccagc cgggcggacc gcggacagcg gtcggggcgc cgcgcc atg 179
Met
1
ggg cga gcc ggg ggc ggg ggc ccg ggc cgg ggg ccg ccg cca ctg ctg 227
Gly Arg Ala Gly Gly Gly Gly Pro Gly Arg Gly Pro Pro Pro Leu Leu
5 10 15
ctg ttt ctg ggg gcc gcg ctg gtc ctg gcc tct ggg gcc gtg ccg gcg 275
Leu Phe Leu Gly Ala Ala Leu Val Leu Ala Ser Gly Ala Val Pro Ala
20 25 30
cgt gag gcg ggc agc gcg gtt gag gcc gaa gag ctg gtg aag ggc agc 323
Arg Glu Ala Gly Ser Ala Val Glu Ala Glu Glu Leu Val Lys Gly Ser
35 40 45
ccg gcg tgg gag ccg cct gcc aac gac acg cgg gaa gaa gcc ggc cca 371
Pro Ala Trp Glu Pro Pro Ala Asn Asp Thr Arg Glu Glu Ala Gly Pro
50 55 60 65
cca gcg gct ggg gaa gat gag gcg tcg tgg acg gcg ccc ggt ggc gag 419
Pro Ala Ala Gly Glu Asp Glu Ala Ser Trp Thr Ala Pro Gly Gly Glu
70 75 80
ctg gcc ggg cca gaa gag gtg ctg cag gag tcg gct gcg gtg acc ggc 467
Leu Ala Gly Pro Glu Glu Val Leu Gln Glu Ser Ala Ala Val Thr Gly
85 90 95
acc gcc tgg ctg gaa gct gac agc cca ggc ctg gga gga gtg acc gca 515
Thr Ala Trp Leu Glu Ala Asp Ser Pro Gly Leu Gly Gly Val Thr Ala
100 105 110
gag gcg ggc agc ggc gat gcc cag gcc ctt cca gct acg ctc cag gct 563
Glu Ala Gly Ser Gly Asp Ala Gln Ala Leu Pro Ala Thr Leu Gln Ala
115 120 125
ccc cac gag gtc ctc ggg cag tca atc atg ccc cct gcc att cct gag 611
Pro His Glu Val Leu Gly Gln Ser Ile Met Pro Pro Ala Ile Pro Glu
130 135 140 145
gct aca gag gcc agc ggg cca ccc tcc ccc acc ccc ggc gac aag ctg 659
Ala Thr Glu Ala Ser Gly Pro Pro Ser Pro Thr Pro Gly Asp Lys Leu
150 155 160
agc cca gct tct gaa ctc ccc aag gag agc ccc ttg gag gtt tgg ctg 707
Ser Pro Ala Ser Glu Leu Pro Lys Glu Ser Pro Leu Glu Val Trp Leu
165 170 175
aac ctg ggg ggc agc aca ccc gac cct caa ggg cca gag ctg act tac 755
Asn Leu Gly Gly Ser Thr Pro Asp Pro Gln Gly Pro Glu Leu Thr Tyr
180 185 190
cca ttt cag ggc acc ctg gag ccc caa ccg gca tca gat atc att gac 803
Pro Phe Gln Gly Thr Leu Glu Pro Gln Pro Ala Ser Asp Ile Ile Asp
195 200 205
atc gac tac ttc gaa gga ctg gat ggt gag ggt cgt ggc gca gat ctg 851
Ile Asp Tyr Phe Glu Gly Leu Asp Gly Glu Gly Arg Gly Ala Asp Leu
210 215 220 225
ggg agc ttc cca ggg tca cca gga acc tca gag aac cac cct gat act 899
Gly Ser Phe Pro Gly Ser Pro Gly Thr Ser Glu Asn His Pro Asp Thr
230 235 240
gag gga gag acc cct tcc tgg agc ctg ctt gac tta tac gat gat ttc 947
Glu Gly Glu Thr Pro Ser Trp Ser Leu Leu Asp Leu Tyr Asp Asp Phe
245 250 255
acc ccc ttc gat gaa tct gat ttc tac ccc acc aca tcc ttt tat gat 995
Thr Pro Phe Asp Glu Ser Asp Phe Tyr Pro Thr Thr Ser Phe Tyr Asp
260 265 270
gac ttg gat gaa gag gag gag gaa gag gag gat gac aaa gat gca gta 1043
Asp Leu Asp Glu Glu Glu Glu Glu Glu Glu Asp Asp Lys Asp Ala Val
275 280 285
gga ggt gga gac cta gaa gat gaa aat gag ctt cta gtg ccc act ggg 1091
Gly Gly Gly Asp Leu Glu Asp Glu Asn Glu Leu Leu Val Pro Thr Gly
290 295 300 305
aag cct ggt ctg ggg ccc ggg aca ggc cag ccc acc agt cgg tgg cat 1139
Lys Pro Gly Leu Gly Pro Gly Thr Gly Gln Pro Thr Ser Arg Trp His
310 315 320
gct gtc cct cca cag cac act ctg ggg tcg gtc ccc ggc agc agc atc 1187
Ala Val Pro Pro Gln His Thr Leu Gly Ser Val Pro Gly Ser Ser Ile
325 330 335
gcc ctc agg ccc cgc cca gga gag cca ggc agg gac ttg gcc tcc agt 1235
Ala Leu Arg Pro Arg Pro Gly Glu Pro Gly Arg Asp Leu Ala Ser Ser
340 345 350
gaa aat ggc act gag tgc cgc agt ggc ttt gtg cgg cat aac ggc tcc 1283
Glu Asn Gly Thr Glu Cys Arg Ser Gly Phe Val Arg His Asn Gly Ser
355 360 365
tgc cgg tca gtg tgc gac ctc ttc cca agt tac tgt cac aat ggc ggc 1331
Cys Arg Ser Val Cys Asp Leu Phe Pro Ser Tyr Cys His Asn Gly Gly
370 375 380 385
cag tgc tac ctg gtg gag aac ata ggg gcc ttc tgc agg tgc aac acg 1379
Gln Cys Tyr Leu Val Glu Asn Ile Gly Ala Phe Cys Arg Cys Asn Thr
390 395 400
cag gac tac atc tgg cac aag ggg atg cgc tgc gag tcc atc atc acc 1427
Gln Asp Tyr Ile Trp His Lys Gly Met Arg Cys Glu Ser Ile Ile Thr
405 410 415
gac ttc cag gtg atg tgc gtg gcc gtg ggc tcg gct gcc ctc gtc ctg 1475
Asp Phe Gln Val Met Cys Val Ala Val Gly Ser Ala Ala Leu Val Leu
420 425 430
ctc ctg ctc ttc atg atg acg gtg ttc ttt gcc aag aag ctc tac ctg 1523
Leu Leu Leu Phe Met Met Thr Val Phe Phe Ala Lys Lys Leu Tyr Leu
435 440 445
ctc aag acg gag aat acc aag ctg cgt agg acc aac aaa ttc cgg acc 1571
Leu Lys Thr Glu Asn Thr Lys Leu Arg Arg Thr Asn Lys Phe Arg Thr
450 455 460 465
cca tct gag ctc cac aat gat aac ttc tcc ctc tcc acc att gcc gag 1619
Pro Ser Glu Leu His Asn Asp Asn Phe Ser Leu Ser Thr Ile Ala Glu
470 475 480
ggc tct cac cca aat gat gat cct agt gct ccc cac aaa atc cag gag 1667
Gly Ser His Pro Asn Asp Asp Pro Ser Ala Pro His Lys Ile Gln Glu
485 490 495
gtt ctc aag tcc tgc ctg aaa gag gag gag tca ttt aac atc cag aac 1715
Val Leu Lys Ser Cys Leu Lys Glu Glu Glu Ser Phe Asn Ile Gln Asn
500 505 510
tcc atg tcg ccc aaa ctt gag ggt ggc aaa ggt gac cag gct gac ttg 1763
Ser Met Ser Pro Lys Leu Glu Gly Gly Lys Gly Asp Gln Ala Asp Leu
515 520 525
gat gtg aac tgt ctt cag aat aat tta acc taa agcagagcaa gaagagagga 1816
Asp Val Asn Cys Leu Gln Asn Asn Leu Thr
530 535
agcgggggta gtgggtgggg ggtaggggaa gaaacattat ctcctcttgt acagagtcta 1876
tttcttgtaa ccatttgtta aactcttttc tttttctgat ctcatggcat gcttttatgt 1936
attttgtaca ggaggcaaaa aaatacttaa aataagcaaa gaaactgaac agaattgcat 1996
acattgggtt gttttttctg tgctgtctgt acattgcttc tgctgctgtg atttctaaac 2056
ctgtgctgtt attcaactga cttttttttg tactttgacc cacgtttttt tgaaatacca 2116
gtaaaaaaca aagttcttga aataaaactt tttaaaaagt taaaaaaaaa aaaaaaaaa 2175
<210> 4
<211> 539
<212> Белок
<213> Homo sapiens
<400> 4
Met Gly Arg Ala Gly Gly Gly Gly Pro Gly Arg Gly Pro Pro Pro Leu
1 5 10 15
Leu Leu Phe Leu Gly Ala Ala Leu Val Leu Ala Ser Gly Ala Val Pro
20 25 30
Ala Arg Glu Ala Gly Ser Ala Val Glu Ala Glu Glu Leu Val Lys Gly
35 40 45
Ser Pro Ala Trp Glu Pro Pro Ala Asn Asp Thr Arg Glu Glu Ala Gly
50 55 60
Pro Pro Ala Ala Gly Glu Asp Glu Ala Ser Trp Thr Ala Pro Gly Gly
65 70 75 80
Glu Leu Ala Gly Pro Glu Glu Val Leu Gln Glu Ser Ala Ala Val Thr
85 90 95
Gly Thr Ala Trp Leu Glu Ala Asp Ser Pro Gly Leu Gly Gly Val Thr
100 105 110
Ala Glu Ala Gly Ser Gly Asp Ala Gln Ala Leu Pro Ala Thr Leu Gln
115 120 125
Ala Pro His Glu Val Leu Gly Gln Ser Ile Met Pro Pro Ala Ile Pro
130 135 140
Glu Ala Thr Glu Ala Ser Gly Pro Pro Ser Pro Thr Pro Gly Asp Lys
145 150 155 160
Leu Ser Pro Ala Ser Glu Leu Pro Lys Glu Ser Pro Leu Glu Val Trp
165 170 175
Leu Asn Leu Gly Gly Ser Thr Pro Asp Pro Gln Gly Pro Glu Leu Thr
180 185 190
Tyr Pro Phe Gln Gly Thr Leu Glu Pro Gln Pro Ala Ser Asp Ile Ile
195 200 205
Asp Ile Asp Tyr Phe Glu Gly Leu Asp Gly Glu Gly Arg Gly Ala Asp
210 215 220
Leu Gly Ser Phe Pro Gly Ser Pro Gly Thr Ser Glu Asn His Pro Asp
225 230 235 240
Thr Glu Gly Glu Thr Pro Ser Trp Ser Leu Leu Asp Leu Tyr Asp Asp
245 250 255
Phe Thr Pro Phe Asp Glu Ser Asp Phe Tyr Pro Thr Thr Ser Phe Tyr
260 265 270
Asp Asp Leu Asp Glu Glu Glu Glu Glu Glu Glu Asp Asp Lys Asp Ala
275 280 285
Val Gly Gly Gly Asp Leu Glu Asp Glu Asn Glu Leu Leu Val Pro Thr
290 295 300
Gly Lys Pro Gly Leu Gly Pro Gly Thr Gly Gln Pro Thr Ser Arg Trp
305 310 315 320
His Ala Val Pro Pro Gln His Thr Leu Gly Ser Val Pro Gly Ser Ser
325 330 335
Ile Ala Leu Arg Pro Arg Pro Gly Glu Pro Gly Arg Asp Leu Ala Ser
340 345 350
Ser Glu Asn Gly Thr Glu Cys Arg Ser Gly Phe Val Arg His Asn Gly
355 360 365
Ser Cys Arg Ser Val Cys Asp Leu Phe Pro Ser Tyr Cys His Asn Gly
370 375 380
Gly Gln Cys Tyr Leu Val Glu Asn Ile Gly Ala Phe Cys Arg Cys Asn
385 390 395 400
Thr Gln Asp Tyr Ile Trp His Lys Gly Met Arg Cys Glu Ser Ile Ile
405 410 415
Thr Asp Phe Gln Val Met Cys Val Ala Val Gly Ser Ala Ala Leu Val
420 425 430
Leu Leu Leu Leu Phe Met Met Thr Val Phe Phe Ala Lys Lys Leu Tyr
435 440 445
Leu Leu Lys Thr Glu Asn Thr Lys Leu Arg Arg Thr Asn Lys Phe Arg
450 455 460
Thr Pro Ser Glu Leu His Asn Asp Asn Phe Ser Leu Ser Thr Ile Ala
465 470 475 480
Glu Gly Ser His Pro Asn Asp Asp Pro Ser Ala Pro His Lys Ile Gln
485 490 495
Glu Val Leu Lys Ser Cys Leu Lys Glu Glu Glu Ser Phe Asn Ile Gln
500 505 510
Asn Ser Met Ser Pro Lys Leu Glu Gly Gly Lys Gly Asp Gln Ala Asp
515 520 525
Leu Asp Val Asn Cys Leu Gln Asn Asn Leu Thr
530 535
<210> 5
<211> 2253
<212> ДНК
<213> Homo sapiens
<220>
<221> CDS
<222> (669)..(1874)
<223>
<400> 5
agtccagtga ggaataactg tagataagat gagatgatgg gcattaagtg taactgctga 60
gaagccttca tagagggaaa ggtgataaga actgagtttt tctggcatga ggagtttacc 120
aggcaggaga ggtggagacg ctaggctagg caaataggct gcagccatag ttctgctgag 180
aaacaggttt tgaaccaagg caactccatc tggagatatg tatcagaaag attaggagat 240
agaatctcca tcttggtcac ttatttggtc ttctaagaca gcaatgggac cgtctcttaa 300
atactggagt tgtcctatct ccttgggctg ataccctgaa ctgtcatttg gcgcgtgagg 360
cgggcagcgc ggttgaggcc gaagagctgg tgaagggcag cccggcgtgg gagccgcctg 420
ccaacgacac gcgggaagaa gccggcccac cagcggctgg ggaagatgag gcgtcgtgga 480
cggcgcccgg tggcgagctg gccgggccag aagaggtgct gcaggagtcg gctgcggtga 540
ccggcaccgc ctggctggaa gctgacagcc caggcctggg aggagtgacc gcagaggcgg 600
gcagcggcga tgcccaggcc cttccagcta cgctccaggc tccccacgag gtcctcgggc 660
agtcaatc atg ccc cct gcc att cct gag gct aca gag gcc agc ggg cca 710
Met Pro Pro Ala Ile Pro Glu Ala Thr Glu Ala Ser Gly Pro
1 5 10
ccc tcc ccc acc ccc ggc gac aag ctg agc cca gct tct gaa ctc ccc 758
Pro Ser Pro Thr Pro Gly Asp Lys Leu Ser Pro Ala Ser Glu Leu Pro
15 20 25 30
aag gag agc ccc ttg gag gtt tgg ctg aac ctg ggg ggc agc aca ccc 806
Lys Glu Ser Pro Leu Glu Val Trp Leu Asn Leu Gly Gly Ser Thr Pro
35 40 45
gac cct caa ggg cca gag ctg act tac cca ttt cag ggc acc ctg gag 854
Asp Pro Gln Gly Pro Glu Leu Thr Tyr Pro Phe Gln Gly Thr Leu Glu
50 55 60
ccc caa ccg gca tca gat atc att gac atc gac tac ttc gaa gga ctg 902
Pro Gln Pro Ala Ser Asp Ile Ile Asp Ile Asp Tyr Phe Glu Gly Leu
65 70 75
gat ggt gag ggt cgt ggc gca gat ctg ggg agc ttc cca ggg tca cca 950
Asp Gly Glu Gly Arg Gly Ala Asp Leu Gly Ser Phe Pro Gly Ser Pro
80 85 90
gga acc tca gag aac cac cct gat act gag gga gag acc cct tcc tgg 998
Gly Thr Ser Glu Asn His Pro Asp Thr Glu Gly Glu Thr Pro Ser Trp
95 100 105 110
agc ctg ctt gac tta tac gat gat ttc acc ccc ttc gat gaa tct gat 1046
Ser Leu Leu Asp Leu Tyr Asp Asp Phe Thr Pro Phe Asp Glu Ser Asp
115 120 125
ttc tac ccc acc aca tcc ttt tat gat gac ttg gat gaa gag gag gag 1094
Phe Tyr Pro Thr Thr Ser Phe Tyr Asp Asp Leu Asp Glu Glu Glu Glu
130 135 140
gaa gag gag gat gac aaa gat gca gta gga ggt gga gac cta gaa gat 1142
Glu Glu Glu Asp Asp Lys Asp Ala Val Gly Gly Gly Asp Leu Glu Asp
145 150 155
gaa aat gag ctt cta gtg ccc act ggg aag cct ggt ctg ggg ccc ggg 1190
Glu Asn Glu Leu Leu Val Pro Thr Gly Lys Pro Gly Leu Gly Pro Gly
160 165 170
aca ggc cag ccc acc agt cgg tgg cat gct gtc cct cca cag cac act 1238
Thr Gly Gln Pro Thr Ser Arg Trp His Ala Val Pro Pro Gln His Thr
175 180 185 190
ctg ggg tcg gtc ccc ggc agc agc atc gcc ctc agg ccc cgc cca gga 1286
Leu Gly Ser Val Pro Gly Ser Ser Ile Ala Leu Arg Pro Arg Pro Gly
195 200 205
gag cca ggc agg gac ttg gcc tcc agt gaa aat ggc act gag tgc cgc 1334
Glu Pro Gly Arg Asp Leu Ala Ser Ser Glu Asn Gly Thr Glu Cys Arg
210 215 220
agt ggc ttt gtg cgg cat aac ggc tcc tgc cgg tca gtg tgc gac ctc 1382
Ser Gly Phe Val Arg His Asn Gly Ser Cys Arg Ser Val Cys Asp Leu
225 230 235
ttc cca agt tac tgt cac aat ggc ggc cag tgc tac ctg gtg gag aac 1430
Phe Pro Ser Tyr Cys His Asn Gly Gly Gln Cys Tyr Leu Val Glu Asn
240 245 250
ata ggg gcc ttc tgc agg tgc aac acg cag gac tac atc tgg cac aag 1478
Ile Gly Ala Phe Cys Arg Cys Asn Thr Gln Asp Tyr Ile Trp His Lys
255 260 265 270
ggg atg cgc tgc gag tcc atc atc acc gac ttc cag gtg atg tgc gtg 1526
Gly Met Arg Cys Glu Ser Ile Ile Thr Asp Phe Gln Val Met Cys Val
275 280 285
gcc gtg ggc tcg gct gcc ctc gtc ctg ctc ctg ctc ttc atg atg acg 1574
Ala Val Gly Ser Ala Ala Leu Val Leu Leu Leu Leu Phe Met Met Thr
290 295 300
gtg ttc ttt gcc aag aag ctc tac ctg ctc aag acg gag aat acc aag 1622
Val Phe Phe Ala Lys Lys Leu Tyr Leu Leu Lys Thr Glu Asn Thr Lys
305 310 315
ctg cgt agg acc aac aaa ttc cgg acc cca tct gag ctc cac aat gat 1670
Leu Arg Arg Thr Asn Lys Phe Arg Thr Pro Ser Glu Leu His Asn Asp
320 325 330
aac ttc tcc ctc tcc acc att gcc gag ggc tct cac cca aat gat gat 1718
Asn Phe Ser Leu Ser Thr Ile Ala Glu Gly Ser His Pro Asn Asp Asp
335 340 345 350
cct agt gct ccc cac aaa atc cag gag gtt ctc aag tcc tgc ctg aaa 1766
Pro Ser Ala Pro His Lys Ile Gln Glu Val Leu Lys Ser Cys Leu Lys
355 360 365
gag gag gag tca ttt aac atc cag aac tcc atg tcg ccc aaa ctt gag 1814
Glu Glu Glu Ser Phe Asn Ile Gln Asn Ser Met Ser Pro Lys Leu Glu
370 375 380
ggt ggc aaa ggt gac cag gct gac ttg gat gtg aac tgt ctt cag aat 1862
Gly Gly Lys Gly Asp Gln Ala Asp Leu Asp Val Asn Cys Leu Gln Asn
385 390 395
aat tta acc taa agcagagcaa gaagagagga agcgggggta gtgggtgggg 1914
Asn Leu Thr
400
ggtaggggaa gaaacattat ctcctcttgt acagagtcta tttcttgtaa ccatttgtta 1974
aactcttttc tttttctgat ctcatggcat gcttttatgt attttgtaca ggaggcaaaa 2034
aaatacttaa aataagcaaa gaaactgaac agaattgcat acattgggtt gttttttctg 2094
tgctgtctgt acattgcttc tgctgctgtg atttctaaac ctgtgctgtt attcaactga 2154
cttttttttg tactttgacc cacgtttttt tgaaatacca gtaaaaaaca aagttcttga 2214
aataaaactt tttaaaaagt taaaaaaaaa aaaaaaaaa 2253
<210> 6
<211> 401
<212> Белок
<213> Homo sapiens
<400> 6
Met Pro Pro Ala Ile Pro Glu Ala Thr Glu Ala Ser Gly Pro Pro Ser
1 5 10 15
Pro Thr Pro Gly Asp Lys Leu Ser Pro Ala Ser Glu Leu Pro Lys Glu
20 25 30
Ser Pro Leu Glu Val Trp Leu Asn Leu Gly Gly Ser Thr Pro Asp Pro
35 40 45
Gln Gly Pro Glu Leu Thr Tyr Pro Phe Gln Gly Thr Leu Glu Pro Gln
50 55 60
Pro Ala Ser Asp Ile Ile Asp Ile Asp Tyr Phe Glu Gly Leu Asp Gly
65 70 75 80
Glu Gly Arg Gly Ala Asp Leu Gly Ser Phe Pro Gly Ser Pro Gly Thr
85 90 95
Ser Glu Asn His Pro Asp Thr Glu Gly Glu Thr Pro Ser Trp Ser Leu
100 105 110
Leu Asp Leu Tyr Asp Asp Phe Thr Pro Phe Asp Glu Ser Asp Phe Tyr
115 120 125
Pro Thr Thr Ser Phe Tyr Asp Asp Leu Asp Glu Glu Glu Glu Glu Glu
130 135 140
Glu Asp Asp Lys Asp Ala Val Gly Gly Gly Asp Leu Glu Asp Glu Asn
145 150 155 160
Glu Leu Leu Val Pro Thr Gly Lys Pro Gly Leu Gly Pro Gly Thr Gly
165 170 175
Gln Pro Thr Ser Arg Trp His Ala Val Pro Pro Gln His Thr Leu Gly
180 185 190
Ser Val Pro Gly Ser Ser Ile Ala Leu Arg Pro Arg Pro Gly Glu Pro
195 200 205
Gly Arg Asp Leu Ala Ser Ser Glu Asn Gly Thr Glu Cys Arg Ser Gly
210 215 220
Phe Val Arg His Asn Gly Ser Cys Arg Ser Val Cys Asp Leu Phe Pro
225 230 235 240
Ser Tyr Cys His Asn Gly Gly Gln Cys Tyr Leu Val Glu Asn Ile Gly
245 250 255
Ala Phe Cys Arg Cys Asn Thr Gln Asp Tyr Ile Trp His Lys Gly Met
260 265 270
Arg Cys Glu Ser Ile Ile Thr Asp Phe Gln Val Met Cys Val Ala Val
275 280 285
Gly Ser Ala Ala Leu Val Leu Leu Leu Leu Phe Met Met Thr Val Phe
290 295 300
Phe Ala Lys Lys Leu Tyr Leu Leu Lys Thr Glu Asn Thr Lys Leu Arg
305 310 315 320
Arg Thr Asn Lys Phe Arg Thr Pro Ser Glu Leu His Asn Asp Asn Phe
325 330 335
Ser Leu Ser Thr Ile Ala Glu Gly Ser His Pro Asn Asp Asp Pro Ser
340 345 350
Ala Pro His Lys Ile Gln Glu Val Leu Lys Ser Cys Leu Lys Glu Glu
355 360 365
Glu Ser Phe Asn Ile Gln Asn Ser Met Ser Pro Lys Leu Glu Gly Gly
370 375 380
Lys Gly Asp Gln Ala Asp Leu Asp Val Asn Cys Leu Gln Asn Asn Leu
385 390 395 400
Thr
<210> 7
<211> 2256
<212> ДНК
<213> Homo sapiens
<220>
<221> CDS
<222> (177)..(1877)
<223>
<400> 7
ggggaggcgc ggcgcgccgg ggacagcggc ggacggcggc ggcggcggca tgcggctcct 60
cgcgctgccc atcgtgggct gaggcggccg cagaaccggc gggaggcgcg gcggccgggc 120
gagccgaggg cgcagccagc cgggcggacc gcggacagcg gtcggggcgc cgcgcc atg 179
Met
1
ggg cga gcc ggg ggc ggg ggc ccg ggc cgg ggg ccg ccg cca ctg ctg 227
Gly Arg Ala Gly Gly Gly Gly Pro Gly Arg Gly Pro Pro Pro Leu Leu
5 10 15
ctg ttt ctg ggg gcc gcg ctg gtc ctg gcc tct ggg gcc gtg ccg gcg 275
Leu Phe Leu Gly Ala Ala Leu Val Leu Ala Ser Gly Ala Val Pro Ala
20 25 30
cgt gag gcg ggc agc gcg gtt gag gcc gaa gag ctg gtg aag ggc agc 323
Arg Glu Ala Gly Ser Ala Val Glu Ala Glu Glu Leu Val Lys Gly Ser
35 40 45
ccg gcg tgg gag ccg cct gcc aac gac acg cgg gaa gaa gcc ggc cca 371
Pro Ala Trp Glu Pro Pro Ala Asn Asp Thr Arg Glu Glu Ala Gly Pro
50 55 60 65
cca gcg gct ggg gaa gat gag gcg tcg tgg acg gcg ccc ggt ggc gag 419
Pro Ala Ala Gly Glu Asp Glu Ala Ser Trp Thr Ala Pro Gly Gly Glu
70 75 80
ctg gcc ggg cca gaa gag gtg ctg cag gag tcg gct gcg gtg acc ggc 467
Leu Ala Gly Pro Glu Glu Val Leu Gln Glu Ser Ala Ala Val Thr Gly
85 90 95
acc gcc tgg ctg gaa gct gac agc cca ggc ctg gga gga gtg acc gca 515
Thr Ala Trp Leu Glu Ala Asp Ser Pro Gly Leu Gly Gly Val Thr Ala
100 105 110
gag gcg ggc agc ggc gat gcc cag gcc ctt cca gct acg ctc cag gct 563
Glu Ala Gly Ser Gly Asp Ala Gln Ala Leu Pro Ala Thr Leu Gln Ala
115 120 125
ccc cac gag gtc ctc ggg cag tca atc atg ccc cct gcc att cct gag 611
Pro His Glu Val Leu Gly Gln Ser Ile Met Pro Pro Ala Ile Pro Glu
130 135 140 145
gct aca gag gcc agc ggg cca ccc tcc ccc acc ccc ggc gac aag ctg 659
Ala Thr Glu Ala Ser Gly Pro Pro Ser Pro Thr Pro Gly Asp Lys Leu
150 155 160
agc cca gct tct gaa ctc ccc aag gag agc ccc ttg gag gtt tgg ctg 707
Ser Pro Ala Ser Glu Leu Pro Lys Glu Ser Pro Leu Glu Val Trp Leu
165 170 175
aac ctg ggg ggc agc aca ccc gac cct caa ggg cca gag ctg act tac 755
Asn Leu Gly Gly Ser Thr Pro Asp Pro Gln Gly Pro Glu Leu Thr Tyr
180 185 190
cca ttt cag ggc acc ctg gag ccc caa ccg gca tca gat atc att gac 803
Pro Phe Gln Gly Thr Leu Glu Pro Gln Pro Ala Ser Asp Ile Ile Asp
195 200 205
atc gac tac ttc gaa gga ctg gat ggt gag ggt cgt ggc gca gat ctg 851
Ile Asp Tyr Phe Glu Gly Leu Asp Gly Glu Gly Arg Gly Ala Asp Leu
210 215 220 225
ggg agc ttc cca ggg tca cca gga acc tca gag aac cac cct gat act 899
Gly Ser Phe Pro Gly Ser Pro Gly Thr Ser Glu Asn His Pro Asp Thr
230 235 240
gag gga gag acc cct tcc tgg agc ctg ctt gac tta tac gat gat ttc 947
Glu Gly Glu Thr Pro Ser Trp Ser Leu Leu Asp Leu Tyr Asp Asp Phe
245 250 255
acc ccc ttc gat gaa tct gat ttc tac ccc acc aca tcc ttt tat gat 995
Thr Pro Phe Asp Glu Ser Asp Phe Tyr Pro Thr Thr Ser Phe Tyr Asp
260 265 270
gac ttg gat gaa gag gag gag gaa gag gag gat gac aaa gat gca gta 1043
Asp Leu Asp Glu Glu Glu Glu Glu Glu Glu Asp Asp Lys Asp Ala Val
275 280 285
gga ggt gga gac cta gaa gat gaa aat gag ctt cta gtg ccc act ggg 1091
Gly Gly Gly Asp Leu Glu Asp Glu Asn Glu Leu Leu Val Pro Thr Gly
290 295 300 305
aag cct ggt ctg ggg ccc ggg aca ggc cag ccc acc agt cgg tgg cat 1139
Lys Pro Gly Leu Gly Pro Gly Thr Gly Gln Pro Thr Ser Arg Trp His
310 315 320
gct gtc cct cca cag cac act ctg ggg tcg gtc ccc ggc agc agc atc 1187
Ala Val Pro Pro Gln His Thr Leu Gly Ser Val Pro Gly Ser Ser Ile
325 330 335
gcc ctc agg ccc cgc cca gga gag cca ggc agg gac ttg gcc tcc agt 1235
Ala Leu Arg Pro Arg Pro Gly Glu Pro Gly Arg Asp Leu Ala Ser Ser
340 345 350
gaa aat ggc act gag tgc cgc agt ggc ttt gtg cgg cat aac ggc tcc 1283
Glu Asn Gly Thr Glu Cys Arg Ser Gly Phe Val Arg His Asn Gly Ser
355 360 365
tgc cgg tca gtg tgc gac ctc ttc cca agt tac tgt cac aat ggc ggc 1331
Cys Arg Ser Val Cys Asp Leu Phe Pro Ser Tyr Cys His Asn Gly Gly
370 375 380 385
cag tgc tac ctg gtg gag aac ata ggg gcc ttc tgc agg tgc aac acg 1379
Gln Cys Tyr Leu Val Glu Asn Ile Gly Ala Phe Cys Arg Cys Asn Thr
390 395 400
cag gac tac atc tgg cac aag ggg atg cgc tgc gag tcc atc atc acc 1427
Gln Asp Tyr Ile Trp His Lys Gly Met Arg Cys Glu Ser Ile Ile Thr
405 410 415
gac ttc cag gtg atg tgc gtg gcc gtg ggc tcg gct gcc ctc gtc ctg 1475
Asp Phe Gln Val Met Cys Val Ala Val Gly Ser Ala Ala Leu Val Leu
420 425 430
ctc ctg ctc ttc atg atg acg gtg ttc ttt gcc aag aag ctc tac ctg 1523
Leu Leu Leu Phe Met Met Thr Val Phe Phe Ala Lys Lys Leu Tyr Leu
435 440 445
ctc aag acg gag aat acc aag ctg cgt agg acc aac aaa ttc cgg acc 1571
Leu Lys Thr Glu Asn Thr Lys Leu Arg Arg Thr Asn Lys Phe Arg Thr
450 455 460 465
cca tct gag ctc cac aat gat aac ttc tcc ctc tcc acc att gcc gag 1619
Pro Ser Glu Leu His Asn Asp Asn Phe Ser Leu Ser Thr Ile Ala Glu
470 475 480
ggc tct cac cca aat gta agg aaa ctt tgc aac act ccc cgt acc tcc 1667
Gly Ser His Pro Asn Val Arg Lys Leu Cys Asn Thr Pro Arg Thr Ser
485 490 495
tcc ccc cat gcc cgt gcc ttg gct cac tat gat aac gtt atc tgt cag 1715
Ser Pro His Ala Arg Ala Leu Ala His Tyr Asp Asn Val Ile Cys Gln
500 505 510
gat gat cct agt gct ccc cac aaa atc cag gag gtt ctc aag tcc tgc 1763
Asp Asp Pro Ser Ala Pro His Lys Ile Gln Glu Val Leu Lys Ser Cys
515 520 525
ctg aaa gag gag gag tca ttt aac atc cag aac tcc atg tcg ccc aaa 1811
Leu Lys Glu Glu Glu Ser Phe Asn Ile Gln Asn Ser Met Ser Pro Lys
530 535 540 545
ctt gag ggt ggc aaa ggt gac cag gct gac ttg gat gtg aac tgt ctt 1859
Leu Glu Gly Gly Lys Gly Asp Gln Ala Asp Leu Asp Val Asn Cys Leu
550 555 560
cag aat aat tta acc taa agcagagcaa gaagagagga agcgggggta 1907
Gln Asn Asn Leu Thr
565
gtgggtgggg ggtaggggaa gaaacattat ctcctcttgt acagagtcta tttcttgtaa 1967
ccatttgtta aactcttttc tttttctgat ctcatggcat gcttttatgt attttgtaca 2027
ggaggcaaaa aaatacttaa aataagcaaa gaaactgaac agaattgcat acattgggtt 2087
gttttttctg tgctgtctgt acattgcttc tgctgctgtg atttctaaac ctgtgctgtt 2147
attcaactga cttttttttg tactttgacc cacgtttttt tgaaatacca gtaaaaaaca 2207
aagttcttga aataaaactt tttaaaaagt taaaaaaaaa aaaaaaaaa 2256
<210> 8
<211> 566
<212> Белок
<213> Homo sapiens
<400> 8
Met Gly Arg Ala Gly Gly Gly Gly Pro Gly Arg Gly Pro Pro Pro Leu
1 5 10 15
Leu Leu Phe Leu Gly Ala Ala Leu Val Leu Ala Ser Gly Ala Val Pro
20 25 30
Ala Arg Glu Ala Gly Ser Ala Val Glu Ala Glu Glu Leu Val Lys Gly
35 40 45
Ser Pro Ala Trp Glu Pro Pro Ala Asn Asp Thr Arg Glu Glu Ala Gly
50 55 60
Pro Pro Ala Ala Gly Glu Asp Glu Ala Ser Trp Thr Ala Pro Gly Gly
65 70 75 80
Glu Leu Ala Gly Pro Glu Glu Val Leu Gln Glu Ser Ala Ala Val Thr
85 90 95
Gly Thr Ala Trp Leu Glu Ala Asp Ser Pro Gly Leu Gly Gly Val Thr
100 105 110
Ala Glu Ala Gly Ser Gly Asp Ala Gln Ala Leu Pro Ala Thr Leu Gln
115 120 125
Ala Pro His Glu Val Leu Gly Gln Ser Ile Met Pro Pro Ala Ile Pro
130 135 140
Glu Ala Thr Glu Ala Ser Gly Pro Pro Ser Pro Thr Pro Gly Asp Lys
145 150 155 160
Leu Ser Pro Ala Ser Glu Leu Pro Lys Glu Ser Pro Leu Glu Val Trp
165 170 175
Leu Asn Leu Gly Gly Ser Thr Pro Asp Pro Gln Gly Pro Glu Leu Thr
180 185 190
Tyr Pro Phe Gln Gly Thr Leu Glu Pro Gln Pro Ala Ser Asp Ile Ile
195 200 205
Asp Ile Asp Tyr Phe Glu Gly Leu Asp Gly Glu Gly Arg Gly Ala Asp
210 215 220
Leu Gly Ser Phe Pro Gly Ser Pro Gly Thr Ser Glu Asn His Pro Asp
225 230 235 240
Thr Glu Gly Glu Thr Pro Ser Trp Ser Leu Leu Asp Leu Tyr Asp Asp
245 250 255
Phe Thr Pro Phe Asp Glu Ser Asp Phe Tyr Pro Thr Thr Ser Phe Tyr
260 265 270
Asp Asp Leu Asp Glu Glu Glu Glu Glu Glu Glu Asp Asp Lys Asp Ala
275 280 285
Val Gly Gly Gly Asp Leu Glu Asp Glu Asn Glu Leu Leu Val Pro Thr
290 295 300
Gly Lys Pro Gly Leu Gly Pro Gly Thr Gly Gln Pro Thr Ser Arg Trp
305 310 315 320
His Ala Val Pro Pro Gln His Thr Leu Gly Ser Val Pro Gly Ser Ser
325 330 335
Ile Ala Leu Arg Pro Arg Pro Gly Glu Pro Gly Arg Asp Leu Ala Ser
340 345 350
Ser Glu Asn Gly Thr Glu Cys Arg Ser Gly Phe Val Arg His Asn Gly
355 360 365
Ser Cys Arg Ser Val Cys Asp Leu Phe Pro Ser Tyr Cys His Asn Gly
370 375 380
Gly Gln Cys Tyr Leu Val Glu Asn Ile Gly Ala Phe Cys Arg Cys Asn
385 390 395 400
Thr Gln Asp Tyr Ile Trp His Lys Gly Met Arg Cys Glu Ser Ile Ile
405 410 415
Thr Asp Phe Gln Val Met Cys Val Ala Val Gly Ser Ala Ala Leu Val
420 425 430
Leu Leu Leu Leu Phe Met Met Thr Val Phe Phe Ala Lys Lys Leu Tyr
435 440 445
Leu Leu Lys Thr Glu Asn Thr Lys Leu Arg Arg Thr Asn Lys Phe Arg
450 455 460
Thr Pro Ser Glu Leu His Asn Asp Asn Phe Ser Leu Ser Thr Ile Ala
465 470 475 480
Glu Gly Ser His Pro Asn Val Arg Lys Leu Cys Asn Thr Pro Arg Thr
485 490 495
Ser Ser Pro His Ala Arg Ala Leu Ala His Tyr Asp Asn Val Ile Cys
500 505 510
Gln Asp Asp Pro Ser Ala Pro His Lys Ile Gln Glu Val Leu Lys Ser
515 520 525
Cys Leu Lys Glu Glu Glu Ser Phe Asn Ile Gln Asn Ser Met Ser Pro
530 535 540
Lys Leu Glu Gly Gly Lys Gly Asp Gln Ala Asp Leu Asp Val Asn Cys
545 550 555 560
Leu Gln Asn Asn Leu Thr
565
<210> 9
<211> 2099
<212> ДНК
<213> Homo sapiens
<220>
<221> CDS
<222> (177)..(1610)
<223>
<400> 9
ggggaggcgc ggcgcgccgg ggacagcggc ggacggcggc ggcggcggca tgcggctcct 60
cgcgctgccc atcgtgggct gaggcggccg cagaaccggc gggaggcgcg gcggccgggc 120
gagccgaggg cgcagccagc cgggcggacc gcggacagcg gtcggggcgc cgcgcc atg 179
Met
1
ggg cga gcc ggg ggc ggg ggc ccg ggc cgg ggg ccg ccg cca ctg ctg 227
Gly Arg Ala Gly Gly Gly Gly Pro Gly Arg Gly Pro Pro Pro Leu Leu
5 10 15
ctg ttt ctg ggg gcc gcg ctg gtc ctg gcc tct ggg gcc gtg ccg gcg 275
Leu Phe Leu Gly Ala Ala Leu Val Leu Ala Ser Gly Ala Val Pro Ala
20 25 30
cgt gag gcg ggc agc gcg gtt gag gcc gaa gag ctg gtg aag ggc agc 323
Arg Glu Ala Gly Ser Ala Val Glu Ala Glu Glu Leu Val Lys Gly Ser
35 40 45
ccg gcg tgg gag ccg cct gcc aac gac acg cgg gaa gaa gcc ggc cca 371
Pro Ala Trp Glu Pro Pro Ala Asn Asp Thr Arg Glu Glu Ala Gly Pro
50 55 60 65
cca gcg gct ggg gaa gat gag gcg tcg tgg acg gcg ccc ggt ggc gag 419
Pro Ala Ala Gly Glu Asp Glu Ala Ser Trp Thr Ala Pro Gly Gly Glu
70 75 80
ctg gcc ggg cca gaa gag gtg ctg cag gag tcg gct gcg gtg acc ggc 467
Leu Ala Gly Pro Glu Glu Val Leu Gln Glu Ser Ala Ala Val Thr Gly
85 90 95
acc gcc tgg ctg gaa gct gac agc cca ggc ctg gga gga gtg acc gca 515
Thr Ala Trp Leu Glu Ala Asp Ser Pro Gly Leu Gly Gly Val Thr Ala
100 105 110
gag gcg ggc agc ggc gat gcc cag gcc ctt cca gct acg ctc cag gct 563
Glu Ala Gly Ser Gly Asp Ala Gln Ala Leu Pro Ala Thr Leu Gln Ala
115 120 125
ccc cac gag gtc ctc ggg cag tca atc atg ccc cct gcc att cct gag 611
Pro His Glu Val Leu Gly Gln Ser Ile Met Pro Pro Ala Ile Pro Glu
130 135 140 145
gct aca gag gcc agc ggg cca ccc tcc ccc acc ccc ggc gac aag ctg 659
Ala Thr Glu Ala Ser Gly Pro Pro Ser Pro Thr Pro Gly Asp Lys Leu
150 155 160
agc cca gct tct gaa ctc ccc aag gag agc ccc ttg gag gtt tgg ctg 707
Ser Pro Ala Ser Glu Leu Pro Lys Glu Ser Pro Leu Glu Val Trp Leu
165 170 175
aac ctg ggg ggc agc aca ccc gac cct caa ggg cca gag ctg act tac 755
Asn Leu Gly Gly Ser Thr Pro Asp Pro Gln Gly Pro Glu Leu Thr Tyr
180 185 190
cca ttt cag ggc acc ctg gag ccc caa ccg gca tca gat atc att gac 803
Pro Phe Gln Gly Thr Leu Glu Pro Gln Pro Ala Ser Asp Ile Ile Asp
195 200 205
atc gac tac ttc gaa gga ctg gat ggt gag ggt cgt ggc gca gat ctg 851
Ile Asp Tyr Phe Glu Gly Leu Asp Gly Glu Gly Arg Gly Ala Asp Leu
210 215 220 225
ggg agc ttc cca ggg tca cca gga acc tca gag aac cac cct gat act 899
Gly Ser Phe Pro Gly Ser Pro Gly Thr Ser Glu Asn His Pro Asp Thr
230 235 240
gag gga gag acc cct tcc tgg agc ctg ctt gac tta tac gat gat ttc 947
Glu Gly Glu Thr Pro Ser Trp Ser Leu Leu Asp Leu Tyr Asp Asp Phe
245 250 255
acc ccc ttc gat gaa tct gat ttc tac ccc acc aca tcc ttt tat gat 995
Thr Pro Phe Asp Glu Ser Asp Phe Tyr Pro Thr Thr Ser Phe Tyr Asp
260 265 270
gac ttg gat gaa gag gag gag gaa gag gag gat gac aaa gat gca gta 1043
Asp Leu Asp Glu Glu Glu Glu Glu Glu Glu Asp Asp Lys Asp Ala Val
275 280 285
gga ggt gga gac cta gaa gat gaa aat gag ctt cta gtg ccc act ggg 1091
Gly Gly Gly Asp Leu Glu Asp Glu Asn Glu Leu Leu Val Pro Thr Gly
290 295 300 305
aag cct ggt ctg ggg ccc ggg aca ggc cag ccc acc agt cgg tgg cat 1139
Lys Pro Gly Leu Gly Pro Gly Thr Gly Gln Pro Thr Ser Arg Trp His
310 315 320
gct gtc cct cca cag cac act ctg ggg tcg gtc ccc ggc agc agc atc 1187
Ala Val Pro Pro Gln His Thr Leu Gly Ser Val Pro Gly Ser Ser Ile
325 330 335
gcc ctc agg ccc cgc cca gga gag cca ggc agg gac ttg gcc tcc agt 1235
Ala Leu Arg Pro Arg Pro Gly Glu Pro Gly Arg Asp Leu Ala Ser Ser
340 345 350
gaa aat ggc act gag tgc cgc agt ggc ttt gtg cgg cat aac ggc tcc 1283
Glu Asn Gly Thr Glu Cys Arg Ser Gly Phe Val Arg His Asn Gly Ser
355 360 365
tgc cgg tca gtg tgc gac ctc ttc cca agt tac tgt cac aat ggc ggc 1331
Cys Arg Ser Val Cys Asp Leu Phe Pro Ser Tyr Cys His Asn Gly Gly
370 375 380 385
cag tgc tac ctg gtg gag aac ata ggg gcc ttc tgc agg tgc aac acg 1379
Gln Cys Tyr Leu Val Glu Asn Ile Gly Ala Phe Cys Arg Cys Asn Thr
390 395 400
cag gac tac atc tgg cac aag ggg atg cgc tgc gag tcc atc atc acc 1427
Gln Asp Tyr Ile Trp His Lys Gly Met Arg Cys Glu Ser Ile Ile Thr
405 410 415
gac ttc cag gtg atg tgc gtg gcc gtg ggc tcg gct gcc ctc gtc ctg 1475
Asp Phe Gln Val Met Cys Val Ala Val Gly Ser Ala Ala Leu Val Leu
420 425 430
ctc ctg ctc ttc atg atg acg gtg ttc ttt gcc aag aag ctc tac ctg 1523
Leu Leu Leu Phe Met Met Thr Val Phe Phe Ala Lys Lys Leu Tyr Leu
435 440 445
ctc aag acg gag aat acc aag ctg cgt agg acc aag atg atc cta gtg 1571
Leu Lys Thr Glu Asn Thr Lys Leu Arg Arg Thr Lys Met Ile Leu Val
450 455 460 465
ctc ccc aca aaa tcc agg agg ttc tca agt cct gcc tga aagaggagga 1620
Leu Pro Thr Lys Ser Arg Arg Phe Ser Ser Pro Ala
470 475
gtcatttaac atccagaact ccatgtcgcc caaacttgag ggtggcaaag gtgaccaggc 1680
tgacttggat gtgaactgtc ttcagaataa tttaacctaa agcagagcaa gaagagagga 1740
agcgggggta gtgggtgggg ggtaggggaa gaaacattat ctcctcttgt acagagtcta 1800
tttcttgtaa ccatttgtta aactcttttc tttttctgat ctcatggcat gcttttatgt 1860
attttgtaca ggaggcaaaa aaatacttaa aataagcaaa gaaactgaac agaattgcat 1920
acattgggtt gttttttctg tgctgtctgt acattgcttc tgctgctgtg atttctaaac 1980
ctgtgctgtt attcaactga cttttttttg tactttgacc cacgtttttt tgaaatacca 2040
gtaaaaaaca aagttcttga aataaaactt tttaaaaagt taaaaaaaaa aaaaaaaaa 2099
<210> 10
<211> 477
<212> Белок
<213> Homo sapiens
<400> 10
Met Gly Arg Ala Gly Gly Gly Gly Pro Gly Arg Gly Pro Pro Pro Leu
1 5 10 15
Leu Leu Phe Leu Gly Ala Ala Leu Val Leu Ala Ser Gly Ala Val Pro
20 25 30
Ala Arg Glu Ala Gly Ser Ala Val Glu Ala Glu Glu Leu Val Lys Gly
35 40 45
Ser Pro Ala Trp Glu Pro Pro Ala Asn Asp Thr Arg Glu Glu Ala Gly
50 55 60
Pro Pro Ala Ala Gly Glu Asp Glu Ala Ser Trp Thr Ala Pro Gly Gly
65 70 75 80
Glu Leu Ala Gly Pro Glu Glu Val Leu Gln Glu Ser Ala Ala Val Thr
85 90 95
Gly Thr Ala Trp Leu Glu Ala Asp Ser Pro Gly Leu Gly Gly Val Thr
100 105 110
Ala Glu Ala Gly Ser Gly Asp Ala Gln Ala Leu Pro Ala Thr Leu Gln
115 120 125
Ala Pro His Glu Val Leu Gly Gln Ser Ile Met Pro Pro Ala Ile Pro
130 135 140
Glu Ala Thr Glu Ala Ser Gly Pro Pro Ser Pro Thr Pro Gly Asp Lys
145 150 155 160
Leu Ser Pro Ala Ser Glu Leu Pro Lys Glu Ser Pro Leu Glu Val Trp
165 170 175
Leu Asn Leu Gly Gly Ser Thr Pro Asp Pro Gln Gly Pro Glu Leu Thr
180 185 190
Tyr Pro Phe Gln Gly Thr Leu Glu Pro Gln Pro Ala Ser Asp Ile Ile
195 200 205
Asp Ile Asp Tyr Phe Glu Gly Leu Asp Gly Glu Gly Arg Gly Ala Asp
210 215 220
Leu Gly Ser Phe Pro Gly Ser Pro Gly Thr Ser Glu Asn His Pro Asp
225 230 235 240
Thr Glu Gly Glu Thr Pro Ser Trp Ser Leu Leu Asp Leu Tyr Asp Asp
245 250 255
Phe Thr Pro Phe Asp Glu Ser Asp Phe Tyr Pro Thr Thr Ser Phe Tyr
260 265 270
Asp Asp Leu Asp Glu Glu Glu Glu Glu Glu Glu Asp Asp Lys Asp Ala
275 280 285
Val Gly Gly Gly Asp Leu Glu Asp Glu Asn Glu Leu Leu Val Pro Thr
290 295 300
Gly Lys Pro Gly Leu Gly Pro Gly Thr Gly Gln Pro Thr Ser Arg Trp
305 310 315 320
His Ala Val Pro Pro Gln His Thr Leu Gly Ser Val Pro Gly Ser Ser
325 330 335
Ile Ala Leu Arg Pro Arg Pro Gly Glu Pro Gly Arg Asp Leu Ala Ser
340 345 350
Ser Glu Asn Gly Thr Glu Cys Arg Ser Gly Phe Val Arg His Asn Gly
355 360 365
Ser Cys Arg Ser Val Cys Asp Leu Phe Pro Ser Tyr Cys His Asn Gly
370 375 380
Gly Gln Cys Tyr Leu Val Glu Asn Ile Gly Ala Phe Cys Arg Cys Asn
385 390 395 400
Thr Gln Asp Tyr Ile Trp His Lys Gly Met Arg Cys Glu Ser Ile Ile
405 410 415
Thr Asp Phe Gln Val Met Cys Val Ala Val Gly Ser Ala Ala Leu Val
420 425 430
Leu Leu Leu Leu Phe Met Met Thr Val Phe Phe Ala Lys Lys Leu Tyr
435 440 445
Leu Leu Lys Thr Glu Asn Thr Lys Leu Arg Arg Thr Lys Met Ile Leu
450 455 460
Val Leu Pro Thr Lys Ser Arg Arg Phe Ser Ser Pro Ala
465 470 475
<210> 11
<211> 2334
<212> ДНК
<213> Homo sapiens
<220>
<221> CDS
<222> (669)..(1955)
<223>
<400> 11
agtccagtga ggaataactg tagataagat gagatgatgg gcattaagtg taactgctga 60
gaagccttca tagagggaaa ggtgataaga actgagtttt tctggcatga ggagtttacc 120
aggcaggaga ggtggagacg ctaggctagg caaataggct gcagccatag ttctgctgag 180
aaacaggttt tgaaccaagg caactccatc tggagatatg tatcagaaag attaggagat 240
agaatctcca tcttggtcac ttatttggtc ttctaagaca gcaatgggac cgtctcttaa 300
atactggagt tgtcctatct ccttgggctg ataccctgaa ctgtcatttg gcgcgtgagg 360
cgggcagcgc ggttgaggcc gaagagctgg tgaagggcag cccggcgtgg gagccgcctg 420
ccaacgacac gcgggaagaa gccggcccac cagcggctgg ggaagatgag gcgtcgtgga 480
cggcgcccgg tggcgagctg gccgggccag aagaggtgct gcaggagtcg gctgcggtga 540
ccggcaccgc ctggctggaa gctgacagcc caggcctggg aggagtgacc gcagaggcgg 600
gcagcggcga tgcccaggcc cttccagcta cgctccaggc tccccacgag gtcctcgggc 660
agtcaatc atg ccc cct gcc att cct gag gct aca gag gcc agc ggg cca 710
Met Pro Pro Ala Ile Pro Glu Ala Thr Glu Ala Ser Gly Pro
1 5 10
ccc tcc ccc acc ccc ggc gac aag ctg agc cca gct tct gaa ctc ccc 758
Pro Ser Pro Thr Pro Gly Asp Lys Leu Ser Pro Ala Ser Glu Leu Pro
15 20 25 30
aag gag agc ccc ttg gag gtt tgg ctg aac ctg ggg ggc agc aca ccc 806
Lys Glu Ser Pro Leu Glu Val Trp Leu Asn Leu Gly Gly Ser Thr Pro
35 40 45
gac cct caa ggg cca gag ctg act tac cca ttt cag ggc acc ctg gag 854
Asp Pro Gln Gly Pro Glu Leu Thr Tyr Pro Phe Gln Gly Thr Leu Glu
50 55 60
ccc caa ccg gca tca gat atc att gac atc gac tac ttc gaa gga ctg 902
Pro Gln Pro Ala Ser Asp Ile Ile Asp Ile Asp Tyr Phe Glu Gly Leu
65 70 75
gat ggt gag ggt cgt ggc gca gat ctg ggg agc ttc cca ggg tca cca 950
Asp Gly Glu Gly Arg Gly Ala Asp Leu Gly Ser Phe Pro Gly Ser Pro
80 85 90
gga acc tca gag aac cac cct gat act gag gga gag acc cct tcc tgg 998
Gly Thr Ser Glu Asn His Pro Asp Thr Glu Gly Glu Thr Pro Ser Trp
95 100 105 110
agc ctg ctt gac tta tac gat gat ttc acc ccc ttc gat gaa tct gat 1046
Ser Leu Leu Asp Leu Tyr Asp Asp Phe Thr Pro Phe Asp Glu Ser Asp
115 120 125
ttc tac ccc acc aca tcc ttt tat gat gac ttg gat gaa gag gag gag 1094
Phe Tyr Pro Thr Thr Ser Phe Tyr Asp Asp Leu Asp Glu Glu Glu Glu
130 135 140
gaa gag gag gat gac aaa gat gca gta gga ggt gga gac cta gaa gat 1142
Glu Glu Glu Asp Asp Lys Asp Ala Val Gly Gly Gly Asp Leu Glu Asp
145 150 155
gaa aat gag ctt cta gtg ccc act ggg aag cct ggt ctg ggg ccc ggg 1190
Glu Asn Glu Leu Leu Val Pro Thr Gly Lys Pro Gly Leu Gly Pro Gly
160 165 170
aca ggc cag ccc acc agt cgg tgg cat gct gtc cct cca cag cac act 1238
Thr Gly Gln Pro Thr Ser Arg Trp His Ala Val Pro Pro Gln His Thr
175 180 185 190
ctg ggg tcg gtc ccc ggc agc agc atc gcc ctc agg ccc cgc cca gga 1286
Leu Gly Ser Val Pro Gly Ser Ser Ile Ala Leu Arg Pro Arg Pro Gly
195 200 205
gag cca ggc agg gac ttg gcc tcc agt gaa aat ggc act gag tgc cgc 1334
Glu Pro Gly Arg Asp Leu Ala Ser Ser Glu Asn Gly Thr Glu Cys Arg
210 215 220
agt ggc ttt gtg cgg cat aac ggc tcc tgc cgg tca gtg tgc gac ctc 1382
Ser Gly Phe Val Arg His Asn Gly Ser Cys Arg Ser Val Cys Asp Leu
225 230 235
ttc cca agt tac tgt cac aat ggc ggc cag tgc tac ctg gtg gag aac 1430
Phe Pro Ser Tyr Cys His Asn Gly Gly Gln Cys Tyr Leu Val Glu Asn
240 245 250
ata ggg gcc ttc tgc agg tgc aac acg cag gac tac atc tgg cac aag 1478
Ile Gly Ala Phe Cys Arg Cys Asn Thr Gln Asp Tyr Ile Trp His Lys
255 260 265 270
ggg atg cgc tgc gag tcc atc atc acc gac ttc cag gtg atg tgc gtg 1526
Gly Met Arg Cys Glu Ser Ile Ile Thr Asp Phe Gln Val Met Cys Val
275 280 285
gcc gtg ggc tcg gct gcc ctc gtc ctg ctc ctg ctc ttc atg atg acg 1574
Ala Val Gly Ser Ala Ala Leu Val Leu Leu Leu Leu Phe Met Met Thr
290 295 300
gtg ttc ttt gcc aag aag ctc tac ctg ctc aag acg gag aat acc aag 1622
Val Phe Phe Ala Lys Lys Leu Tyr Leu Leu Lys Thr Glu Asn Thr Lys
305 310 315
ctg cgt agg acc aac aaa ttc cgg acc cca tct gag ctc cac aat gat 1670
Leu Arg Arg Thr Asn Lys Phe Arg Thr Pro Ser Glu Leu His Asn Asp
320 325 330
aac ttc tcc ctc tcc acc att gcc gag ggc tct cac cca aat gta agg 1718
Asn Phe Ser Leu Ser Thr Ile Ala Glu Gly Ser His Pro Asn Val Arg
335 340 345 350
aaa ctt tgc aac act ccc cgt acc tcc tcc ccc cat gcc cgt gcc ttg 1766
Lys Leu Cys Asn Thr Pro Arg Thr Ser Ser Pro His Ala Arg Ala Leu
355 360 365
gct cac tat gat aac gtt atc tgt cag gat gat cct agt gct ccc cac 1814
Ala His Tyr Asp Asn Val Ile Cys Gln Asp Asp Pro Ser Ala Pro His
370 375 380
aaa atc cag gag gtt ctc aag tcc tgc ctg aaa gag gag gag tca ttt 1862
Lys Ile Gln Glu Val Leu Lys Ser Cys Leu Lys Glu Glu Glu Ser Phe
385 390 395
aac atc cag aac tcc atg tcg ccc aaa ctt gag ggt ggc aaa ggt gac 1910
Asn Ile Gln Asn Ser Met Ser Pro Lys Leu Glu Gly Gly Lys Gly Asp
400 405 410
cag gct gac ttg gat gtg aac tgt ctt cag aat aat tta acc taa 1955
Gln Ala Asp Leu Asp Val Asn Cys Leu Gln Asn Asn Leu Thr
415 420 425
agcagagcaa gaagagagga agcgggggta gtgggtgggg ggtaggggaa gaaacattat 2015
ctcctcttgt acagagtcta tttcttgtaa ccatttgtta aactcttttc tttttctgat 2075
ctcatggcat gcttttatgt attttgtaca ggaggcaaaa aaatacttaa aataagcaaa 2135
gaaactgaac agaattgcat acattgggtt gttttttctg tgctgtctgt acattgcttc 2195
tgctgctgtg atttctaaac ctgtgctgtt attcaactga cttttttttg tactttgacc 2255
cacgtttttt tgaaatacca gtaaaaaaca aagttcttga aataaaactt tttaaaaagt 2315
taaaaaaaaa aaaaaaaaa 2334
<210> 12
<211> 428
<212> Белок
<213> Homo sapiens
<400> 12
Met Pro Pro Ala Ile Pro Glu Ala Thr Glu Ala Ser Gly Pro Pro Ser
1 5 10 15
Pro Thr Pro Gly Asp Lys Leu Ser Pro Ala Ser Glu Leu Pro Lys Glu
20 25 30
Ser Pro Leu Glu Val Trp Leu Asn Leu Gly Gly Ser Thr Pro Asp Pro
35 40 45
Gln Gly Pro Glu Leu Thr Tyr Pro Phe Gln Gly Thr Leu Glu Pro Gln
50 55 60
Pro Ala Ser Asp Ile Ile Asp Ile Asp Tyr Phe Glu Gly Leu Asp Gly
65 70 75 80
Glu Gly Arg Gly Ala Asp Leu Gly Ser Phe Pro Gly Ser Pro Gly Thr
85 90 95
Ser Glu Asn His Pro Asp Thr Glu Gly Glu Thr Pro Ser Trp Ser Leu
100 105 110
Leu Asp Leu Tyr Asp Asp Phe Thr Pro Phe Asp Glu Ser Asp Phe Tyr
115 120 125
Pro Thr Thr Ser Phe Tyr Asp Asp Leu Asp Glu Glu Glu Glu Glu Glu
130 135 140
Glu Asp Asp Lys Asp Ala Val Gly Gly Gly Asp Leu Glu Asp Glu Asn
145 150 155 160
Glu Leu Leu Val Pro Thr Gly Lys Pro Gly Leu Gly Pro Gly Thr Gly
165 170 175
Gln Pro Thr Ser Arg Trp His Ala Val Pro Pro Gln His Thr Leu Gly
180 185 190
Ser Val Pro Gly Ser Ser Ile Ala Leu Arg Pro Arg Pro Gly Glu Pro
195 200 205
Gly Arg Asp Leu Ala Ser Ser Glu Asn Gly Thr Glu Cys Arg Ser Gly
210 215 220
Phe Val Arg His Asn Gly Ser Cys Arg Ser Val Cys Asp Leu Phe Pro
225 230 235 240
Ser Tyr Cys His Asn Gly Gly Gln Cys Tyr Leu Val Glu Asn Ile Gly
245 250 255
Ala Phe Cys Arg Cys Asn Thr Gln Asp Tyr Ile Trp His Lys Gly Met
260 265 270
Arg Cys Glu Ser Ile Ile Thr Asp Phe Gln Val Met Cys Val Ala Val
275 280 285
Gly Ser Ala Ala Leu Val Leu Leu Leu Leu Phe Met Met Thr Val Phe
290 295 300
Phe Ala Lys Lys Leu Tyr Leu Leu Lys Thr Glu Asn Thr Lys Leu Arg
305 310 315 320
Arg Thr Asn Lys Phe Arg Thr Pro Ser Glu Leu His Asn Asp Asn Phe
325 330 335
Ser Leu Ser Thr Ile Ala Glu Gly Ser His Pro Asn Val Arg Lys Leu
340 345 350
Cys Asn Thr Pro Arg Thr Ser Ser Pro His Ala Arg Ala Leu Ala His
355 360 365
Tyr Asp Asn Val Ile Cys Gln Asp Asp Pro Ser Ala Pro His Lys Ile
370 375 380
Gln Glu Val Leu Lys Ser Cys Leu Lys Glu Glu Glu Ser Phe Asn Ile
385 390 395 400
Gln Asn Ser Met Ser Pro Lys Leu Glu Gly Gly Lys Gly Asp Gln Ala
405 410 415
Asp Leu Asp Val Asn Cys Leu Gln Asn Asn Leu Thr
420 425
<210> 13
<211> 2592
<212> ДНК
<213> Felis catus
<220>
<221> CDS
<222> (1)..(2217)
<223>
<400> 13
atg ggc ttt ggc tat gga cgg att agg tct gat ccg att aga gcc cgg 48
Met Gly Phe Gly Tyr Gly Arg Ile Arg Ser Asp Pro Ile Arg Ala Arg
1 5 10 15
gcc gtc ggc ttc gcc ccc ttg cct ggc gct gcc agc gcc cgc ccc gcc 96
Ala Val Gly Phe Ala Pro Leu Pro Gly Ala Ala Ser Ala Arg Pro Ala
20 25 30
ctc gtg gac acc cgc aga cct ccc cga gac cct tcc cct ccc cga aca 144
Leu Val Asp Thr Arg Arg Pro Pro Arg Asp Pro Ser Pro Pro Arg Thr
35 40 45
cgg cat tgg cgc aga aat ctg aga ggt ccg tgc acc ccg ggc tcg gct 192
Arg His Trp Arg Arg Asn Leu Arg Gly Pro Cys Thr Pro Gly Ser Ala
50 55 60
cat ttc cac agc tcc agc tcg ggc ttc cgc ccc ctg cgg ccc ttc cga 240
His Phe His Ser Ser Ser Ser Gly Phe Arg Pro Leu Arg Pro Phe Arg
65 70 75 80
gcc ccg ccc caa gct tgc ggg tgt ctg ggc ccc cgc ctc cgt gct cgc 288
Ala Pro Pro Gln Ala Cys Gly Cys Leu Gly Pro Arg Leu Arg Ala Arg
85 90 95
cgc gtg gcg ggt ggg ttc ctc gca ggt ggg ggg ccc gtg cca gct ctc 336
Arg Val Ala Gly Gly Phe Leu Ala Gly Gly Gly Pro Val Pro Ala Leu
100 105 110
cac ggg gag ggc ggg ccc cgc ccc aca ggt ctc ccg ccc gtg cac ctg 384
His Gly Glu Gly Gly Pro Arg Pro Thr Gly Leu Pro Pro Val His Leu
115 120 125
tcg gct aac gcc acg cac ggc gct gtg ctc cgc acc cgc gct act cca 432
Ser Ala Asn Ala Thr His Gly Ala Val Leu Arg Thr Arg Ala Thr Pro
130 135 140
cgt ccg ttt gtc tcg gcg tcc cga gcc ggg ggt acc gac tgc gac cag 480
Arg Pro Phe Val Ser Ala Ser Arg Ala Gly Gly Thr Asp Cys Asp Gln
145 150 155 160
gac ccc cgc ggc cct cgc gcc cca ccc tgg gcc agg gtc ccg ctg gcc 528
Asp Pro Arg Gly Pro Arg Ala Pro Pro Trp Ala Arg Val Pro Leu Ala
165 170 175
tcg ggt aca ggc gga gtt agc gag ctg tgg caa ggg ggc ggg gca gct 576
Ser Gly Thr Gly Gly Val Ser Glu Leu Trp Gln Gly Gly Gly Ala Ala
180 185 190
cct tgc ccg cga ccg ggg cgg ggg aag ggg cgc gcg aag agg tgg gat 624
Pro Cys Pro Arg Pro Gly Arg Gly Lys Gly Arg Ala Lys Arg Trp Asp
195 200 205
act tgg ggg agg ccg agg ggt tgg ggg cgg ccc cgg ccc ggg tgt ccg 672
Thr Trp Gly Arg Pro Arg Gly Trp Gly Arg Pro Arg Pro Gly Cys Pro
210 215 220
gac aga gcc cgt gag gct ggc agc gcc gtc gag gcc cac gag cag gtg 720
Asp Arg Ala Arg Glu Ala Gly Ser Ala Val Glu Ala His Glu Gln Val
225 230 235 240
aag agc atc ctg gcg agg gag ccg act gcc aac gaa acg agg gag aag 768
Lys Ser Ile Leu Ala Arg Glu Pro Thr Ala Asn Glu Thr Arg Glu Lys
245 250 255
gcc ggc cca cca gca gct gag gaa gac gag acc tcg tgg acc gca cct 816
Ala Gly Pro Pro Ala Ala Glu Glu Asp Glu Thr Ser Trp Thr Ala Pro
260 265 270
ggc ggt gag cag gcc atg atg ggg cct agt gtc ggg cca gag gag gtg 864
Gly Gly Glu Gln Ala Met Met Gly Pro Ser Val Gly Pro Glu Glu Val
275 280 285
ctg gag gcg tcg gca gcg gtg acc ggc gca ccc tgg ctg gag gct gac 912
Leu Glu Ala Ser Ala Ala Val Thr Gly Ala Pro Trp Leu Glu Ala Asp
290 295 300
agc cct ggc ctg ggt gga gtg acc gca gag gcc ggc agc ggc gac acc 960
Ser Pro Gly Leu Gly Gly Val Thr Ala Glu Ala Gly Ser Gly Asp Thr
305 310 315 320
cag gcc ctt cca gct acg ctc ccg gct ccc aag gag gcc ctg gga cag 1008
Gln Ala Leu Pro Ala Thr Leu Pro Ala Pro Lys Glu Ala Leu Gly Gln
325 330 335
tca tcg atg gcc ccc tcc atc ccc aag gct aca gag gcc agc aga cca 1056
Ser Ser Met Ala Pro Ser Ile Pro Lys Ala Thr Glu Ala Ser Arg Pro
340 345 350
ccc tcc ccc aca cct ggc gac atg ctg agc ccc ggc cca gaa cac ccc 1104
Pro Ser Pro Thr Pro Gly Asp Met Leu Ser Pro Gly Pro Glu His Pro
355 360 365
aag gag agt ccc ttg gag gtt tgg ttg aac ctg gga ggc agc aca cat 1152
Lys Glu Ser Pro Leu Glu Val Trp Leu Asn Leu Gly Gly Ser Thr His
370 375 380
gac cct cat ggg cca gag ccc aca ttc ccc ttt cag ggc aca atg gag 1200
Asp Pro His Gly Pro Glu Pro Thr Phe Pro Phe Gln Gly Thr Met Glu
385 390 395 400
ccc cag cca gtg tca gat ata att gac atc gac tac ttc gaa gga ttg 1248
Pro Gln Pro Val Ser Asp Ile Ile Asp Ile Asp Tyr Phe Glu Gly Leu
405 410 415
gat ggt gag ggc cgt ggt gcc gac ctg gag agc ttc cca ggg tcg cca 1296
Asp Gly Glu Gly Arg Gly Ala Asp Leu Glu Ser Phe Pro Gly Ser Pro
420 425 430
gga acc tca gag cac cac cct gat act ggg gga gag acc cct tcc tgg 1344
Gly Thr Ser Glu His His Pro Asp Thr Gly Gly Glu Thr Pro Ser Trp
435 440 445
agc ctg ctt gac tta tac gat gac ttc acc ccc ttt gat gaa tct gac 1392
Ser Leu Leu Asp Leu Tyr Asp Asp Phe Thr Pro Phe Asp Glu Ser Asp
450 455 460
ttc tac ccc acc aca tcc ttc tat gat gac ctt gat gaa gag gag gag 1440
Phe Tyr Pro Thr Thr Ser Phe Tyr Asp Asp Leu Asp Glu Glu Glu Glu
465 470 475 480
gaa gag gat gac aag gat gca gcg gga ggt gaa gac ctg gaa gat gaa 1488
Glu Glu Asp Asp Lys Asp Ala Ala Gly Gly Glu Asp Leu Glu Asp Glu
485 490 495
agt gac ctt ctg gtg cct acc gag aag cct ggt ctg ggg ccc ggg act 1536
Ser Asp Leu Leu Val Pro Thr Glu Lys Pro Gly Leu Gly Pro Gly Thr
500 505 510
ggc cag cct acc agt cgg tgg cat gct gtg ccc cca cag cat act ctg 1584
Gly Gln Pro Thr Ser Arg Trp His Ala Val Pro Pro Gln His Thr Leu
515 520 525
ggg atg gtc cct ggc agc agc atc gcc ctc agg ccc cgc cct gga gag 1632
Gly Met Val Pro Gly Ser Ser Ile Ala Leu Arg Pro Arg Pro Gly Glu
530 535 540
cca ggc agg gac ctg acc cca agc gag aat ggc act gag tgc cgc agc 1680
Pro Gly Arg Asp Leu Thr Pro Ser Glu Asn Gly Thr Glu Cys Arg Ser
545 550 555 560
ggc ttt gtg cga cat aac ggc tcc tgc cgg tca gtg tgc gac ctc ttt 1728
Gly Phe Val Arg His Asn Gly Ser Cys Arg Ser Val Cys Asp Leu Phe
565 570 575
cca agt tac tgt cac aat ggc ggc cag tgc tac ctg gtg gag aac ata 1776
Pro Ser Tyr Cys His Asn Gly Gly Gln Cys Tyr Leu Val Glu Asn Ile
580 585 590
ggg gcc ttc tgc agg tgc aac aca cag gac tac atc tgg cac aag ggg 1824
Gly Ala Phe Cys Arg Cys Asn Thr Gln Asp Tyr Ile Trp His Lys Gly
595 600 605
atg cgc tgc gag tcc atc atc acc gac ttc cag gtg atg tgc gtg gcc 1872
Met Arg Cys Glu Ser Ile Ile Thr Asp Phe Gln Val Met Cys Val Ala
610 615 620
gtc ggc tcg gct gcc ctt gta ctg ctc ctg ctc ttc atg atg aca gtg 1920
Val Gly Ser Ala Ala Leu Val Leu Leu Leu Leu Phe Met Met Thr Val
625 630 635 640
ttc ttc gcc aag aag cta tat ctg ctc aag aca gag aat acc aag ctg 1968
Phe Phe Ala Lys Lys Leu Tyr Leu Leu Lys Thr Glu Asn Thr Lys Leu
645 650 655
cgt agg acc aac aaa ttc cgg acc ccg tct gaa ctc cac aac gat aac 2016
Arg Arg Thr Asn Lys Phe Arg Thr Pro Ser Glu Leu His Asn Asp Asn
660 665 670
ttc tcc ctc tcc acc att gcc gaa ggc tct cac cca aac gat gac cct 2064
Phe Ser Leu Ser Thr Ile Ala Glu Gly Ser His Pro Asn Asp Asp Pro
675 680 685
agt gct ccc cac aaa atc cag gaa gct ctc aag tcc tgc ctg aaa gag 2112
Ser Ala Pro His Lys Ile Gln Glu Ala Leu Lys Ser Cys Leu Lys Glu
690 695 700
gag gag tca ttt aac atc cag aac tcc atg tca ccc aaa ctt gag ggt 2160
Glu Glu Ser Phe Asn Ile Gln Asn Ser Met Ser Pro Lys Leu Glu Gly
705 710 715 720
ggc aaa ggt gac cag gct gac ttg gag gtg aac tgt ctt cag aat aac 2208
Gly Lys Gly Asp Gln Ala Asp Leu Glu Val Asn Cys Leu Gln Asn Asn
725 730 735
cta acc taa agcagaacaa gaagagagga aatgggggga gggggggtac 2257
Leu Thr
ggggagaaac atgacctcct cttgtacaga gtctatttct tgtaaccatt tgttaaactc 2317
ttttcttttt ctgatctcat ggcatgcttt gatgtatttt gtacaggagg ggaaacacac 2377
acacacacac acacacacac acacacacac acacacacta agcaaagaac ccagacaaaa 2437
ttgcatacgt tgggttgttt tgtctgtgct gtctgtacat tgcttctgct gctgtgattt 2497
ctaaacctac gctgttattc aactactttt tttttgtact ttgacccacc tttttttgaa 2557
ataagagtaa aaaacaaagt tcttgaaata aaact 2592
<210> 14
<211> 738
<212> Белок
<213> Felis catus
<400> 14
Met Gly Phe Gly Tyr Gly Arg Ile Arg Ser Asp Pro Ile Arg Ala Arg
1 5 10 15
Ala Val Gly Phe Ala Pro Leu Pro Gly Ala Ala Ser Ala Arg Pro Ala
20 25 30
Leu Val Asp Thr Arg Arg Pro Pro Arg Asp Pro Ser Pro Pro Arg Thr
35 40 45
Arg His Trp Arg Arg Asn Leu Arg Gly Pro Cys Thr Pro Gly Ser Ala
50 55 60
His Phe His Ser Ser Ser Ser Gly Phe Arg Pro Leu Arg Pro Phe Arg
65 70 75 80
Ala Pro Pro Gln Ala Cys Gly Cys Leu Gly Pro Arg Leu Arg Ala Arg
85 90 95
Arg Val Ala Gly Gly Phe Leu Ala Gly Gly Gly Pro Val Pro Ala Leu
100 105 110
His Gly Glu Gly Gly Pro Arg Pro Thr Gly Leu Pro Pro Val His Leu
115 120 125
Ser Ala Asn Ala Thr His Gly Ala Val Leu Arg Thr Arg Ala Thr Pro
130 135 140
Arg Pro Phe Val Ser Ala Ser Arg Ala Gly Gly Thr Asp Cys Asp Gln
145 150 155 160
Asp Pro Arg Gly Pro Arg Ala Pro Pro Trp Ala Arg Val Pro Leu Ala
165 170 175
Ser Gly Thr Gly Gly Val Ser Glu Leu Trp Gln Gly Gly Gly Ala Ala
180 185 190
Pro Cys Pro Arg Pro Gly Arg Gly Lys Gly Arg Ala Lys Arg Trp Asp
195 200 205
Thr Trp Gly Arg Pro Arg Gly Trp Gly Arg Pro Arg Pro Gly Cys Pro
210 215 220
Asp Arg Ala Arg Glu Ala Gly Ser Ala Val Glu Ala His Glu Gln Val
225 230 235 240
Lys Ser Ile Leu Ala Arg Glu Pro Thr Ala Asn Glu Thr Arg Glu Lys
245 250 255
Ala Gly Pro Pro Ala Ala Glu Glu Asp Glu Thr Ser Trp Thr Ala Pro
260 265 270
Gly Gly Glu Gln Ala Met Met Gly Pro Ser Val Gly Pro Glu Glu Val
275 280 285
Leu Glu Ala Ser Ala Ala Val Thr Gly Ala Pro Trp Leu Glu Ala Asp
290 295 300
Ser Pro Gly Leu Gly Gly Val Thr Ala Glu Ala Gly Ser Gly Asp Thr
305 310 315 320
Gln Ala Leu Pro Ala Thr Leu Pro Ala Pro Lys Glu Ala Leu Gly Gln
325 330 335
Ser Ser Met Ala Pro Ser Ile Pro Lys Ala Thr Glu Ala Ser Arg Pro
340 345 350
Pro Ser Pro Thr Pro Gly Asp Met Leu Ser Pro Gly Pro Glu His Pro
355 360 365
Lys Glu Ser Pro Leu Glu Val Trp Leu Asn Leu Gly Gly Ser Thr His
370 375 380
Asp Pro His Gly Pro Glu Pro Thr Phe Pro Phe Gln Gly Thr Met Glu
385 390 395 400
Pro Gln Pro Val Ser Asp Ile Ile Asp Ile Asp Tyr Phe Glu Gly Leu
405 410 415
Asp Gly Glu Gly Arg Gly Ala Asp Leu Glu Ser Phe Pro Gly Ser Pro
420 425 430
Gly Thr Ser Glu His His Pro Asp Thr Gly Gly Glu Thr Pro Ser Trp
435 440 445
Ser Leu Leu Asp Leu Tyr Asp Asp Phe Thr Pro Phe Asp Glu Ser Asp
450 455 460
Phe Tyr Pro Thr Thr Ser Phe Tyr Asp Asp Leu Asp Glu Glu Glu Glu
465 470 475 480
Glu Glu Asp Asp Lys Asp Ala Ala Gly Gly Glu Asp Leu Glu Asp Glu
485 490 495
Ser Asp Leu Leu Val Pro Thr Glu Lys Pro Gly Leu Gly Pro Gly Thr
500 505 510
Gly Gln Pro Thr Ser Arg Trp His Ala Val Pro Pro Gln His Thr Leu
515 520 525
Gly Met Val Pro Gly Ser Ser Ile Ala Leu Arg Pro Arg Pro Gly Glu
530 535 540
Pro Gly Arg Asp Leu Thr Pro Ser Glu Asn Gly Thr Glu Cys Arg Ser
545 550 555 560
Gly Phe Val Arg His Asn Gly Ser Cys Arg Ser Val Cys Asp Leu Phe
565 570 575
Pro Ser Tyr Cys His Asn Gly Gly Gln Cys Tyr Leu Val Glu Asn Ile
580 585 590
Gly Ala Phe Cys Arg Cys Asn Thr Gln Asp Tyr Ile Trp His Lys Gly
595 600 605
Met Arg Cys Glu Ser Ile Ile Thr Asp Phe Gln Val Met Cys Val Ala
610 615 620
Val Gly Ser Ala Ala Leu Val Leu Leu Leu Leu Phe Met Met Thr Val
625 630 635 640
Phe Phe Ala Lys Lys Leu Tyr Leu Leu Lys Thr Glu Asn Thr Lys Leu
645 650 655
Arg Arg Thr Asn Lys Phe Arg Thr Pro Ser Glu Leu His Asn Asp Asn
660 665 670
Phe Ser Leu Ser Thr Ile Ala Glu Gly Ser His Pro Asn Asp Asp Pro
675 680 685
Ser Ala Pro His Lys Ile Gln Glu Ala Leu Lys Ser Cys Leu Lys Glu
690 695 700
Glu Glu Ser Phe Asn Ile Gln Asn Ser Met Ser Pro Lys Leu Glu Gly
705 710 715 720
Gly Lys Gly Asp Gln Ala Asp Leu Glu Val Asn Cys Leu Gln Asn Asn
725 730 735
Leu Thr
<210> 15
<211> 3881
<212> ДНК
<213> Mus musculus
<220>
<221> CDS
<222> (1816)..(3516)
<223>
<400> 15
atttctctgc agggagggga gaagatagtt gaggaaggaa atatttcaca ttcgcttgtt 60
tgttctactg atcaaaacag aatttaaaag gatagttacg ggtgggaaat agggtagata 120
gaaggatttg gttggttagt tggttctaga cagggattac agacataagc taccataacc 180
agcaaataca attattttgc agtactagga attgaacctg aagtctcact cattttaggc 240
aagtgctctc cctaactctt aagtgtttta ccataagtag gaaaagactt tattgtgacc 300
atgccctagc atgaaaggac ttacatagga tctcctgtgt ggtaggaact tccaccaaca 360
tccacttttg acaactacca cccaggaatt gaagagagaa ataggtatta tatctgggta 420
agcaagcccc ctcttgactg gaactccaaa ctaggacacg tatgtctggt tgccactctc 480
tagatgtcat acagacccta catagccacc tccgagccag gatataagag cctagctgct 540
ggaattttgt cagccttgag gggactctaa gctgcaacca tacttgtgag agaaaaggag 600
tgttgaacca aggcaactca ctagaagaca ggtatgagac agattaaatg atggtcctcc 660
atcttgttca tatttggtca ctgacagaag actatcaaca ccagcatcgc ccttggacta 720
acccttggac tgagctgaac atgatcattt aggtcgataa taaaacatca atatgtaggc 780
tatttggagg cggggaaagc caggtgacta agctgtagtt ctgcctccct tccaacaggt 840
ctcccagtaa gcagtgaacc tgggttagga acagagacct ctctctccac gttgcatgtg 900
cacctggcag tgatctagac ctcttggttt aaccaggaac ttgggtttgg gtagtactgg 960
tcacctgcgg aaggccgccc tggatttaga aaacgcaagg tggagtccaa atactgggga 1020
ccggataaca cgttgggtgg acctggctgt gcaagattta aactaatggc tttggctgtg 1080
gacagattag gtctgatcca attagagcct aggccgtagt attcgcctcc ttgccaggct 1140
ctgtcgatgt tctccctgct ctccggaaga agacttagag tcggactgga gaaccttctg 1200
gacaccgaat tctggattgg caccggacag tccgtgcccc gggctccgct ctctccacac 1260
tgggggcgcg ggcttccgcc ccctgtggcc cttccgagcc ccgccccgag cctgcgggtg 1320
tcggagcccg cgacgtcccc gcctcccctg cgcgcgcgtg gcgggtgggt tcctcgcagg 1380
tccgcggccc agcgcgctca gcactggaag cgcaagcggg ccccgtgggc tgccgccggt 1440
gcacctgtcg gcttccccca gtggctctgc tgccgcccct gcgcgccgcg cttgcatcgc 1500
tctccacgtc ccgtgccaga ggggtctgac tgtcccctgg cgaggaagac cgagaggggc 1560
cggcgtcaac gcgacgtgct gcggggcggg cggagtgggg gcggcgccga acgcggcagc 1620
ggcaagcggc agcggcggcg cgggaggcgg ggaggcgcgg cgctcggagg acagcggctg 1680
acggcggcat gcggcggctc atgctgccca ccgtgggctg aggcggccgc acacgggcgg 1740
caggcgcagc ggccgggcaa gccgagggcg cagccaagcc gcgcgcaccg cgcacagcgg 1800
caggggctcc gcgca atg ggc cga gct gga ggc ggg ggc ccg gac tgg ggg 1851
Met Gly Arg Ala Gly Gly Gly Gly Pro Asp Trp Gly
1 5 10
ccg ccg cca gtg ctg ctg ctt ctg ggg gtc acg ctg gtg ctc acc gct 1899
Pro Pro Pro Val Leu Leu Leu Leu Gly Val Thr Leu Val Leu Thr Ala
15 20 25
ggg gcc gta ccg gca cgg gaa aca ggc agt gcg atc gag gct gaa gag 1947
Gly Ala Val Pro Ala Arg Glu Thr Gly Ser Ala Ile Glu Ala Glu Glu
30 35 40
ctg gtg agg agc agc ctg gca tgg gag tcg cgt gcc aat gac acg cgg 1995
Leu Val Arg Ser Ser Leu Ala Trp Glu Ser Arg Ala Asn Asp Thr Arg
45 50 55 60
gag gaa gcc ggc ctg cca gca gct ggg gaa gat gag acc tcg tgg aca 2043
Glu Glu Ala Gly Leu Pro Ala Ala Gly Glu Asp Glu Thr Ser Trp Thr
65 70 75
gag cgg ggc agt gag atg gct gcg gtg ggc cct ggg gtc ggg cca gag 2091
Glu Arg Gly Ser Glu Met Ala Ala Val Gly Pro Gly Val Gly Pro Glu
80 85 90
gag gca cta gag gca tcg gct gca gtg act ggc act gcc tgg cta gag 2139
Glu Ala Leu Glu Ala Ser Ala Ala Val Thr Gly Thr Ala Trp Leu Glu
95 100 105
gca gat ggc cca ggc ctg ggt gga gtg act gca gag gct ggc agt ggc 2187
Ala Asp Gly Pro Gly Leu Gly Gly Val Thr Ala Glu Ala Gly Ser Gly
110 115 120
gac gcc cag acc ctt cca gct acg ctc cag gct cct gat gag gcc ctt 2235
Asp Ala Gln Thr Leu Pro Ala Thr Leu Gln Ala Pro Asp Glu Ala Leu
125 130 135 140
ggg tca tct aca atg ccc cct gcc atc cct gag gct act gaa acc agt 2283
Gly Ser Ser Thr Met Pro Pro Ala Ile Pro Glu Ala Thr Glu Thr Ser
145 150 155
gga cct ccc tcc cct gct gtc cat gat aag cct agt gta ggc cct gaa 2331
Gly Pro Pro Ser Pro Ala Val His Asp Lys Pro Ser Val Gly Pro Glu
160 165 170
ctc cct aaa gag atc ccc ttg gag gtt cgg ctg aac ctg gga ggc agc 2379
Leu Pro Lys Glu Ile Pro Leu Glu Val Arg Leu Asn Leu Gly Gly Ser
175 180 185
aca cca gag ccc act ttt ccc ctt cag ggc act ctc gag acc caa cca 2427
Thr Pro Glu Pro Thr Phe Pro Leu Gln Gly Thr Leu Glu Thr Gln Pro
190 195 200
gcc tca gat ata att gac att gat tac ttt gaa gga ttg gat agt gag 2475
Ala Ser Asp Ile Ile Asp Ile Asp Tyr Phe Glu Gly Leu Asp Ser Glu
205 210 215 220
ggt cgt ggt gca gac atg ggc agc ttc ccg ggg tca cca gga acc tca 2523
Gly Arg Gly Ala Asp Met Gly Ser Phe Pro Gly Ser Pro Gly Thr Ser
225 230 235
gaa aat cac cct gat acc gaa gga gag acc cct tcc tgg agc ctg ctt 2571
Glu Asn His Pro Asp Thr Glu Gly Glu Thr Pro Ser Trp Ser Leu Leu
240 245 250
gat ttg tat gat gac ttc acc cct ttt gat gag tct gat ttc tac ccc 2619
Asp Leu Tyr Asp Asp Phe Thr Pro Phe Asp Glu Ser Asp Phe Tyr Pro
255 260 265
acc aca tcc ttc tat gat gat ttg gaa gag gag gaa gaa gag gag gag 2667
Thr Thr Ser Phe Tyr Asp Asp Leu Glu Glu Glu Glu Glu Glu Glu Glu
270 275 280
gat aag gat aca gta gga ggt gga gac ctg gaa gat gaa aac gac ctt 2715
Asp Lys Asp Thr Val Gly Gly Gly Asp Leu Glu Asp Glu Asn Asp Leu
285 290 295 300
ctc ctg ccc tct caa aag cct ggt gtg ggg cct ggg aca gga cag ccc 2763
Leu Leu Pro Ser Gln Lys Pro Gly Val Gly Pro Gly Thr Gly Gln Pro
305 310 315
acc aac cgg tgg cat gct gtt ccc cca cag cat act ctg ggg atg gta 2811
Thr Asn Arg Trp His Ala Val Pro Pro Gln His Thr Leu Gly Met Val
320 325 330
cct ggc agc agc atc tct ctt agg ccc cgc ccc gga gat cca ggc aag 2859
Pro Gly Ser Ser Ile Ser Leu Arg Pro Arg Pro Gly Asp Pro Gly Lys
335 340 345
gac ctg gcc tca gga gaa aat ggc aca gag tgc cga gtt ggc ttc gtc 2907
Asp Leu Ala Ser Gly Glu Asn Gly Thr Glu Cys Arg Val Gly Phe Val
350 355 360
agg cac aat ggc tcc tgc cgg tca gtc tgt gac ctc ttt ccg agt tac 2955
Arg His Asn Gly Ser Cys Arg Ser Val Cys Asp Leu Phe Pro Ser Tyr
365 370 375 380
tgt cac aac ggc ggc cag tgc tac ctg gtg gag aac ata ggg gct ttc 3003
Cys His Asn Gly Gly Gln Cys Tyr Leu Val Glu Asn Ile Gly Ala Phe
385 390 395
tgc agg tgt aac acc cag gac tac atc tgg cac aag ggg atg cgc tgt 3051
Cys Arg Cys Asn Thr Gln Asp Tyr Ile Trp His Lys Gly Met Arg Cys
400 405 410
gag tcc atc atc acg gac ttc cag gtg atg tgc gtg gcc gtt ggc tcg 3099
Glu Ser Ile Ile Thr Asp Phe Gln Val Met Cys Val Ala Val Gly Ser
415 420 425
gct gct ctc gtg ctt ctc ctc ctg ttc atg atg act gtg ttc ttt gcc 3147
Ala Ala Leu Val Leu Leu Leu Leu Phe Met Met Thr Val Phe Phe Ala
430 435 440
aag aag ctc tat ctg ctc aag act gag aat acc aag ctg cgg agg acc 3195
Lys Lys Leu Tyr Leu Leu Lys Thr Glu Asn Thr Lys Leu Arg Arg Thr
445 450 455 460
aat aaa ttc cgg acc cca tct gag ctc cac aac gac aac ttc tcc ctc 3243
Asn Lys Phe Arg Thr Pro Ser Glu Leu His Asn Asp Asn Phe Ser Leu
465 470 475
tcc acc att gcc gag ggc tct cat cca aat gta agg aaa ttt tgc gac 3291
Ser Thr Ile Ala Glu Gly Ser His Pro Asn Val Arg Lys Phe Cys Asp
480 485 490
act ccc cgt gtc tcc tcc ccc cat gcc cgt gcc ttg gct cac tat gat 3339
Thr Pro Arg Val Ser Ser Pro His Ala Arg Ala Leu Ala His Tyr Asp
495 500 505
aac att gtc tgt cag gac gac ccc agc gct ccc cac aaa atc cag gac 3387
Asn Ile Val Cys Gln Asp Asp Pro Ser Ala Pro His Lys Ile Gln Asp
510 515 520
cct ctc aag tcc cgc ctg aag gag gaa gag tcc ttt aac atc cag aac 3435
Pro Leu Lys Ser Arg Leu Lys Glu Glu Glu Ser Phe Asn Ile Gln Asn
525 530 535 540
tcc atg tca ccc aaa ctt gag ggt ggc aaa ggt gac cag gat gac ttg 3483
Ser Met Ser Pro Lys Leu Glu Gly Gly Lys Gly Asp Gln Asp Asp Leu
545 550 555
ggg gtg aac tgt ctg cag aat aac cta acc tga gactgaggaa gaagagagga 3536
Gly Val Asn Cys Leu Gln Asn Asn Leu Thr
560 565
aaggggggtg ggggagggaa ggactgttgt ctcctctcgg gcagagtcgg cttcttgtaa 3596
ccatttgtta agcttttctt tttctgatct catggcatgc tctgatgtgt tttgtaggag 3656
gggaaacact taaaataagc aaagaaaccg agcaggattg catatatcgg atggttcttg 3716
tctgtgctct ctgtacgttg cttctgcagc tgtgatttct aaacctctgc tggcactcag 3776
ctgacttttt gttttgtact ttgacccgcc tttttttgga ataccaagtt aaaaaaaaaa 3836
agttcttgaa ataaaacttt ttaaaaagct gtccaaaaaa aaaaa 3881
<210> 16
<211> 566
<212> Белок
<213> Mus musculus
<400> 16
Met Gly Arg Ala Gly Gly Gly Gly Pro Asp Trp Gly Pro Pro Pro Val
1 5 10 15
Leu Leu Leu Leu Gly Val Thr Leu Val Leu Thr Ala Gly Ala Val Pro
20 25 30
Ala Arg Glu Thr Gly Ser Ala Ile Glu Ala Glu Glu Leu Val Arg Ser
35 40 45
Ser Leu Ala Trp Glu Ser Arg Ala Asn Asp Thr Arg Glu Glu Ala Gly
50 55 60
Leu Pro Ala Ala Gly Glu Asp Glu Thr Ser Trp Thr Glu Arg Gly Ser
65 70 75 80
Glu Met Ala Ala Val Gly Pro Gly Val Gly Pro Glu Glu Ala Leu Glu
85 90 95
Ala Ser Ala Ala Val Thr Gly Thr Ala Trp Leu Glu Ala Asp Gly Pro
100 105 110
Gly Leu Gly Gly Val Thr Ala Glu Ala Gly Ser Gly Asp Ala Gln Thr
115 120 125
Leu Pro Ala Thr Leu Gln Ala Pro Asp Glu Ala Leu Gly Ser Ser Thr
130 135 140
Met Pro Pro Ala Ile Pro Glu Ala Thr Glu Thr Ser Gly Pro Pro Ser
145 150 155 160
Pro Ala Val His Asp Lys Pro Ser Val Gly Pro Glu Leu Pro Lys Glu
165 170 175
Ile Pro Leu Glu Val Arg Leu Asn Leu Gly Gly Ser Thr Pro Glu Pro
180 185 190
Thr Phe Pro Leu Gln Gly Thr Leu Glu Thr Gln Pro Ala Ser Asp Ile
195 200 205
Ile Asp Ile Asp Tyr Phe Glu Gly Leu Asp Ser Glu Gly Arg Gly Ala
210 215 220
Asp Met Gly Ser Phe Pro Gly Ser Pro Gly Thr Ser Glu Asn His Pro
225 230 235 240
Asp Thr Glu Gly Glu Thr Pro Ser Trp Ser Leu Leu Asp Leu Tyr Asp
245 250 255
Asp Phe Thr Pro Phe Asp Glu Ser Asp Phe Tyr Pro Thr Thr Ser Phe
260 265 270
Tyr Asp Asp Leu Glu Glu Glu Glu Glu Glu Glu Glu Asp Lys Asp Thr
275 280 285
Val Gly Gly Gly Asp Leu Glu Asp Glu Asn Asp Leu Leu Leu Pro Ser
290 295 300
Gln Lys Pro Gly Val Gly Pro Gly Thr Gly Gln Pro Thr Asn Arg Trp
305 310 315 320
His Ala Val Pro Pro Gln His Thr Leu Gly Met Val Pro Gly Ser Ser
325 330 335
Ile Ser Leu Arg Pro Arg Pro Gly Asp Pro Gly Lys Asp Leu Ala Ser
340 345 350
Gly Glu Asn Gly Thr Glu Cys Arg Val Gly Phe Val Arg His Asn Gly
355 360 365
Ser Cys Arg Ser Val Cys Asp Leu Phe Pro Ser Tyr Cys His Asn Gly
370 375 380
Gly Gln Cys Tyr Leu Val Glu Asn Ile Gly Ala Phe Cys Arg Cys Asn
385 390 395 400
Thr Gln Asp Tyr Ile Trp His Lys Gly Met Arg Cys Glu Ser Ile Ile
405 410 415
Thr Asp Phe Gln Val Met Cys Val Ala Val Gly Ser Ala Ala Leu Val
420 425 430
Leu Leu Leu Leu Phe Met Met Thr Val Phe Phe Ala Lys Lys Leu Tyr
435 440 445
Leu Leu Lys Thr Glu Asn Thr Lys Leu Arg Arg Thr Asn Lys Phe Arg
450 455 460
Thr Pro Ser Glu Leu His Asn Asp Asn Phe Ser Leu Ser Thr Ile Ala
465 470 475 480
Glu Gly Ser His Pro Asn Val Arg Lys Phe Cys Asp Thr Pro Arg Val
485 490 495
Ser Ser Pro His Ala Arg Ala Leu Ala His Tyr Asp Asn Ile Val Cys
500 505 510
Gln Asp Asp Pro Ser Ala Pro His Lys Ile Gln Asp Pro Leu Lys Ser
515 520 525
Arg Leu Lys Glu Glu Glu Ser Phe Asn Ile Gln Asn Ser Met Ser Pro
530 535 540
Lys Leu Glu Gly Gly Lys Gly Asp Gln Asp Asp Leu Gly Val Asn Cys
545 550 555 560
Leu Gln Asn Asn Leu Thr
565
<210> 17
<211> 20
<212> ДНК
<213> Искусственная
<220>
<223> праймер T3
<400> 17
aattaaccct cactaaaggg 20
<210> 18
<211> 19
<212> ДНК
<213> Искусственная
<220>
<223> праймер T7
<400> 18
taatacgact cactatagg 19
<210> 19
<211> 20
<212> ДНК
<213> Искусственная
<220>
<223> собачий ОТ-праймер, смысловой
<400> 19
aagttactgt cacaacggcg 20
<210> 20
<211> 20
<212> ДНК
<213> Искусственная
<220>
<223> собачий ОТ-праймер, антисмысловой
<400> 20
tcatcatgaa gagcaggagc 20
<210> 21
<211> 21
<212> ДНК
<213> Искусственная
<220>
<223> человеческий ОТ-праймер, смысловой
<400> 21
aagttactgt cacaatggcg g 21
<210> 22
<211> 20
<212> ДНК
<213> Искусственная
<220>
<223> человеческий ОТ-праймер, антисмысловой
<400> 22
tcatcatgaa gagcaggagc 20
<210> 23
<211> 20
<212> ДНК
<213> Искусственная
<220>
<223> мышиный ОТ-праймер, смысловой
<400> 23
gagttactgt cacaacggcg 20
<210> 24
<211> 20
<212> ДНК
<213> Искусственная
<220>
<223> мышиный ОТ-праймер, антисмысловой
<400> 24
tcatcatgaa caggaggaga 20
<210> 25
<211> 18
<212> ДНК
<213> Искусственная
<220>
<223> праймер к GAPDH
<400> 25
gggctgcttt taactctg 18
<210> 26
<211> 18
<212> ДНК
<213> Искусственная
<220>
<223> праймер к GAPDH
<400> 26
ccaggaaatg agcttgac 18
<210> 27
<211> 20
<212> ДНК
<213> Искусственная
<220>
<223> праймер к GAPDH
<400> 27
cttcaccacc atggagaagg 20
<210> 28
<211> 20
<212> ДНК
<213> Искусственная
<220>
<223> праймер к GAPDH
<400> 28
tgaagtcgca ggagacaacc 20
<210> 29
<211> 30
<212> ДНК
<213> Искусственная
<220>
<223> праймер mus-fullCSPG5, смысловой
<400> 29
atgggccgag ctggaggcgg gggcccggac 30
<210> 30
<211> 30
<212> ДНК
<213> Искусственная
<220>
<223> праймер mus-fullCSPG5, антисмысловой
<400> 30
tcaggttagg ttattctgca gacagttcac 30
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ ДЛЯ ЛЕЧЕНИЯ И/ИЛИ ПРЕДОТВРАЩЕНИЯ ЗЛОКАЧЕСТВЕННОЙ ОПУХОЛИ | 2016 |
|
RU2714205C2 |
| Вакцина против герпеса | 2019 |
|
RU2731073C1 |
| СПОСОБ ПОЛУЧЕНИЯ L-АМИНОКИСЛОТ С ПОМОЩЬЮ КОРИНЕБАКТЕРИЙ С ПРИМЕНЕНИЕМ СИСТЕМЫ РАСЩЕПЛЕНИЯ ГЛИЦИНА | 2015 |
|
RU2713298C2 |
| КОМПОЗИЦИИ И СПОСОБЫ ДЛЯ БИОЛОГИЧЕСКОГО ПОЛУЧЕНИЯ ЛАКТАТА ИЗ С1-СОЕДИНЕНИЙ С ПРИМЕНЕНИЕМ ТРАНСФОРМАНТОВ ЛАКТАТ ДЕГИДРОГЕНАЗЫ | 2014 |
|
RU2710714C2 |
| СПОСОБ УВЕЛИЧЕНИЯ ФОТОСИНТЕТИЧЕСКОЙ ФИКСАЦИИ УГЛЕРОДА С ИСПОЛЬЗОВАНИЕМ БЕЛКА СЛИЯНИЯ ИЗ МНОГИХ СУБЪЕДИНИЦ ГЛИКОЛАТДЕГИДРОГЕНАЗЫ | 2011 |
|
RU2651501C2 |
| КОНСТРУКЦИИ НУКЛЕИНОВОЙ КИСЛОТЫ И ВЕКТОРЫ ДЛЯ ГЕНОТЕРАПИИ ДЛЯ ПРИМЕНЕНИЯ ДЛЯ ЛЕЧЕНИЯ БОЛЕЗНИ ВИЛЬСОНА И ДРУГИХ СОСТОЯНИЙ | 2015 |
|
RU2745567C2 |
| МАТЕРИАЛЫ И МЕТОДЫ, ИСПОЛЬЗУЕМЫЕ ДЛЯ ЛЕЧЕНИЯ РЕСПИРАТОРНЫХ ЗАБОЛЕВАНИЙ У СОБАК | 2020 |
|
RU2811752C2 |
| СПОСОБ УПРАВЛЕНИЯ РИТМОМ СЕРДЦА И СОКРАЩЕНИЕМ ОТДЕЛЬНЫХ КАРДИОМИОЦИТОВ ПРИ ПОМОЩИ ТЕРМОГЕНЕТИКИ | 2022 |
|
RU2802995C1 |
| БИОСЕНСОРНАЯ СИСТЕМА ДЛЯ БЫСТРОГО ОБНАРУЖЕНИЯ ОПРЕДЕЛЯЕМЫХ КОМПОНЕНТОВ | 2016 |
|
RU2717658C2 |
| СПОСОБ ПРОДУЦИРОВАНИЯ ПОЧЕЧНЫХ КЛЕТОК-ПРЕДШЕСТВЕННИКОВ | 2016 |
|
RU2730861C2 |
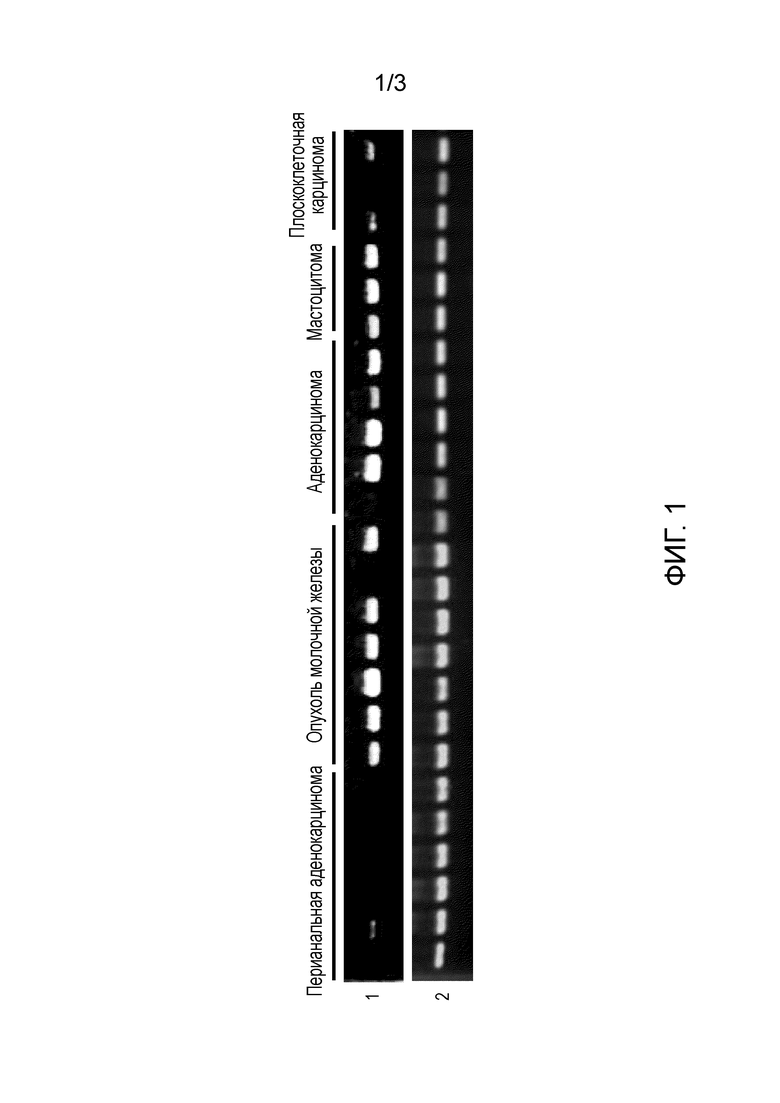
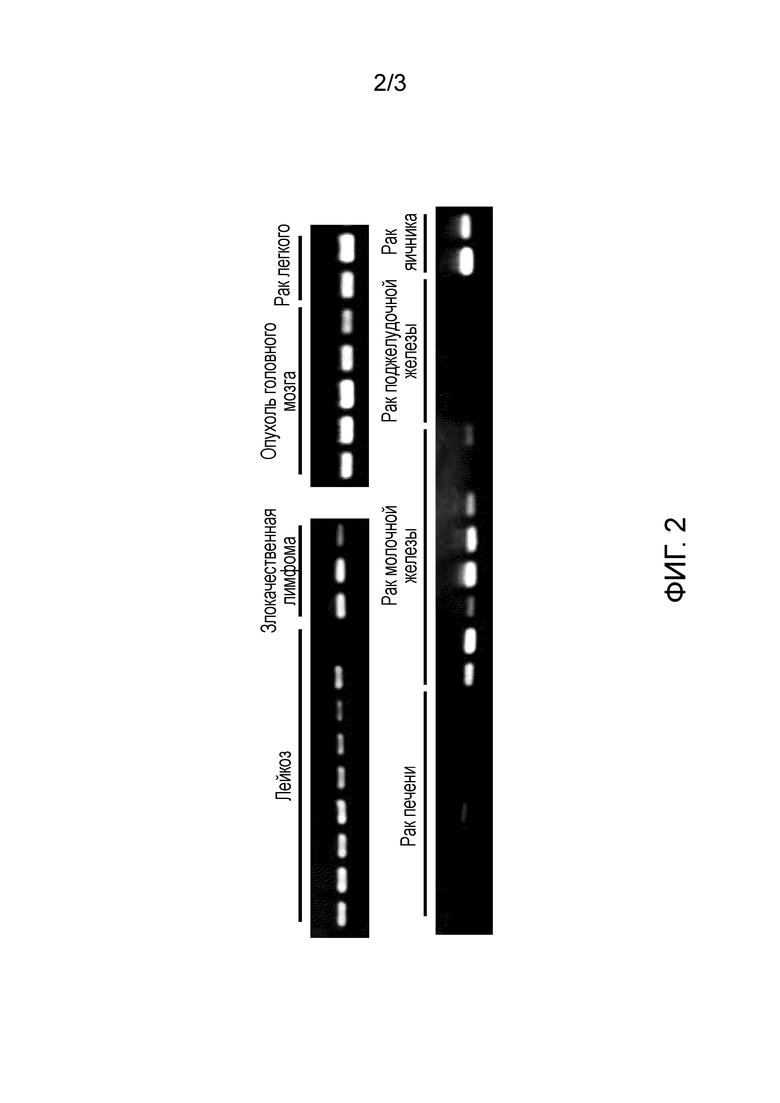
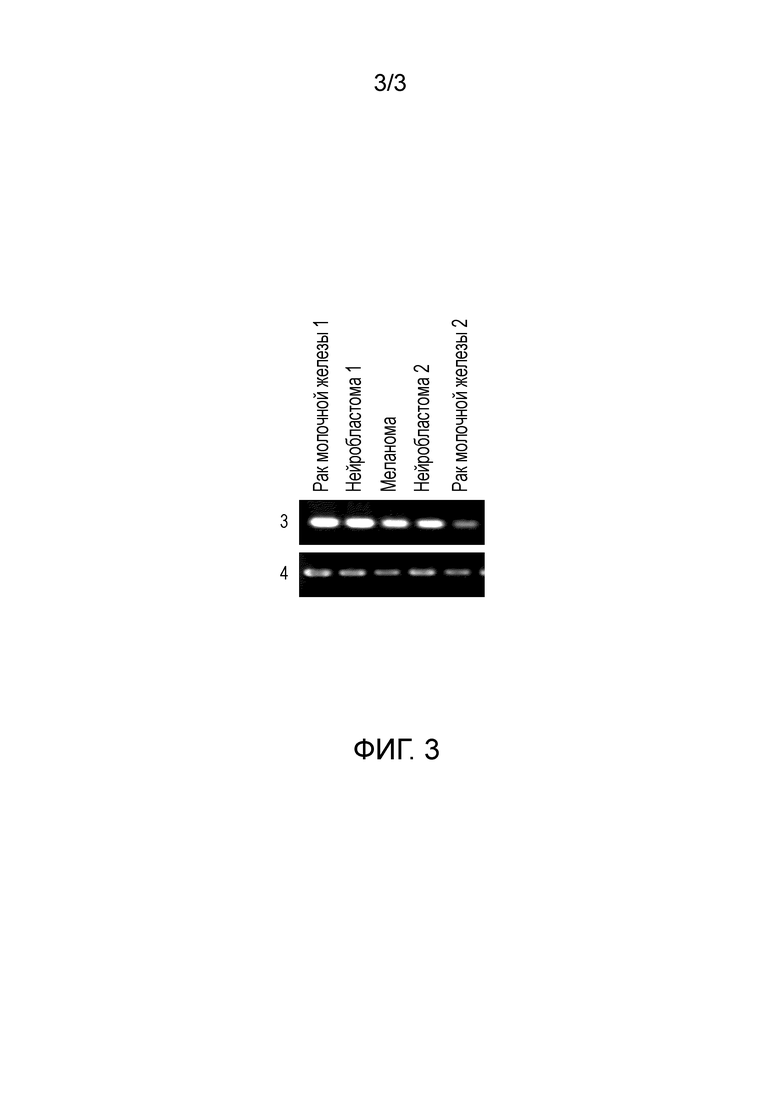
Группа изобретений относится к иммуноиндуцирующему средству для лечения и/или предотвращения рака, экспрессирующего CSPG5. Средство включает в качестве действующего компонента: (i) эффективное количество по меньшей мере одного полипептида, обладающего иммуноиндуцирующей активностью и выбранного из полипептидов (a), (b) и (c), или (ii) эффективное количество рекомбинантного вектора, способного экспрессировать указанный полипептид in vivo, где (a) полипептид состоит из аминокислотной последовательности SEQ ID NO: 8, 4, 6, 10, 12, 2 или 14; (b) полипептид обладает идентичностью последовательности 85% или больше с SEQ ID NO: 8, 4, 6, 10, 12, 2 или 14; или (c) полипептид включает полипептид (a) или (b). Также предложен способ получения антигенпрезентирующей клетки, содержащей комплекс указанного полипептида и молекулы MHC, где полипептид приводят в контакт с антигенпрезентирующей клеткой субъекта ex vivo или in vitro. Предложен способ получения цитотоксической Т-клетки, специфичной в отношении указанного полипептида, включающий контакт антигенпрезентирующей клетки с Т-клеткой субъекта ex vivo или in vitro. Полученные антигенпрезентирующая клетка и цитотоксическая Т-клетка пригодны для лечения и/или предотвращения рака, экспрессирующего CSPG5, у субъекта, нуждающегося в этом. 5 н. и 5 з.п. ф-лы, 3 ил., 2 пр.
1. Иммуноиндуцирующее средство для лечения и/или предотвращения рака, экспрессирующего CSPG5, у субъекта, нуждающегося в этом, включающее, в качестве действующего компонента: (i) эффективное количество по меньшей мере одного полипептида, обладающего иммуноиндуцирующей активностью и выбранного из следующих полипептидов (a), (b) и (c), или (ii) эффективное количество рекомбинантного вектора, включающего полинуклеотид, кодирующий полипептид, и способного экспрессировать указанный полипептид in vivo:
(a) полипептид, состоящий из аминокислотной последовательности, представленной в SEQ ID NO: 8, 4, 6, 10, 12, 2 или 14;
(b) полипептид, обладающий идентичностью последовательности 85% или больше с аминокислотной последовательностью, представленной в SEQ ID NO: 8, 4, 6, 10, 12, 2 или 14;
(c) полипептид, включающий полипептид (a) или (b) в качестве неполной последовательности.
2. Иммуноиндуцирующее средство по п.1, где полипептид, обладающий иммуноиндуцирующей активностью, является полипептидом, состоящим из аминокислотной последовательности, представленной в SEQ ID NO: 8, 4, 6, 10, 12, 2 или 14.
3. Иммуноиндуцирующее средство по п.1 или 2, где рак является опухолью головного мозга, лейкозом, злокачественной лимфомой или нейробластомой.
4. Иммуноиндуцирующее средство по любому из пп.1-3, дополнительно включающее иммуноусилитель.
5. Иммуноиндуцирующее средство по п.4, где иммуноусилитель является по меньшей мере одним, выбранным из группы, состоящей из неполного адъюванта Фрейнда, Монтанида, поли-IC и их производных, олигонуклеотидов CpG, интерлейкина 12, интерлейкина 18, интерферона α, интерферона β, интерферона ω, интерферона γ и лиганда Flt 3.
6. Способ получения антигенпрезентирующей клетки, содержащей комплекс полипептида и молекулы MHC, включающий контакт полипептида с антигенпрезентирующей клеткой субъекта ex vivo или in vitro, где указанный полипептид представляет собой по меньшей мере один полипептид, обладающий иммуноиндуцирующей активностью и выбранный из следующих полипептидов (a), (b) и (c):
(a) полипептид, состоящий из аминокислотной последовательности, представленной в SEQ ID NO: 8, 4, 6, 10, 12, 2 или 14;
(b) полипептид, обладающий идентичностью последовательности 85% или больше с аминокислотной последовательностью, представленной в SEQ ID NO: 8, 4, 6, 10, 12, 2 или 14;
(c) полипептид, включающий полипептид (a) или (b) в качестве неполной последовательности.
7. Способ по п.6, где антигенпрезентирующая клетка является дендритной клеткой или В-клеткой, имеющей молекулу MHC класса I.
8. Способ получения цитотоксической Т-клетки, специфичной в отношении полипептида, включающий контакт антигенпрезентирующей клетки, полученной с применением способа по п.6 или 7, с Т-клеткой субъекта ex vivo или in vitro, в результате чего происходит активация Т-клетки, где указанный полипептид представляет собой по меньшей мере один полипептид, обладающий иммуноиндуцирующей активностью и выбранный из следующих полипептидов (a), (b) и (c):
(a) полипептид, состоящий из аминокислотной последовательности, представленной в SEQ ID NO: 8, 4, 6, 10, 12, 2 или 14;
(b) полипептид, обладающий идентичностью последовательности 85% или больше с аминокислотной последовательностью, представленной в SEQ ID NO: 8, 4, 6, 10, 12, 2 или 14;
(c) полипептид, включающий полипептид (a) или (b) в качестве неполной последовательности.
9. Антигенпрезентирующая клетка для лечения и/или предотвращения рака, экспрессирующего CSPG5, у субъекта, нуждающегося в этом, полученная с применением способа по п.6 или 7 и содержащая комплекс полипептида и молекулы MHC, где указанный полипептид представляет собой по меньшей мере один полипептид, обладающий иммуноиндуцирующей активностью и выбранный из следующих полипептидов (a), (b) и (c):
(a) полипептид, состоящий из аминокислотной последовательности, представленной в SEQ ID NO: 8, 4, 6, 10, 12, 2 или 14;
(b) полипептид, обладающий идентичностью последовательности 85% или больше с аминокислотной последовательностью, представленной в SEQ ID NO: 8, 4, 6, 10, 12, 2 или 14;
(c) полипептид, включающий полипептид (a) или (b) в качестве неполной последовательности.
10. Цитотоксическая Т-клетка для лечения и/или предотвращения рака, экспрессирующего CSPG5, у субъекта, нуждающегося в этом, полученная с применением способа по п.8 и специфичная в отношении полипептида, который представляет собой по меньшей мере один полипептид, обладающий иммуноиндуцирующей активностью и выбранный из следующих полипептидов (a), (b) и (c):
(a) полипептид, состоящий из аминокислотной последовательности, представленной в SEQ ID NO: 8, 4, 6, 10, 12, 2 или 14;
(b) полипептид, обладающий идентичностью последовательности 85% или больше с аминокислотной последовательностью, представленной в SEQ ID NO: 8, 4, 6, 10, 12, 2 или 14;
(c) полипептид, включающий полипептид (a) или (b) в качестве неполной последовательности.
| RICCARDO F | |||
| et al., CSPG4-Specific Immunity and Survival Prolongation in Dogs with Oral Malignant Melanoma Immunized with Human CSPG4 DNA, CLINICAL CANCER RESEARCH, 2014, vol.20, no.14, p.3753-3762 | |||
| WU W.K | |||
| et al., Expression of ErbB Receptors and their Cognate Ligands in Gastric and Colon Cancer Cell Lines, Anticancer Research, 2009., vol.29, |
Авторы
Даты
2021-03-16—Публикация
2016-04-28—Подача