Настоящее изобретение относится к способам диагностики/прогностики онкологических заболеваний. Предложен простой, не трудоемкий, не затратный, частично автоматизированный, количественный и относительно быстрый метод диагностики/прогностики онкологических заболеваний и определения метастатического потенциала биопсионного/операционного материала. После экстракции клеток из недавно резецированных опухолевых тканей человека (с помощью коммерчески доступных комплектов для диссоциации в течение 2-4 часов), клетки переносят в планшеты с культуральной средой для инкубации в течение ночи. В продолжение клетки инкубируют с флуоресцентными нанозондами и ядерными красителями в течение 1 часа, промывают, фиксируют (30 минут) (опционально) и отправляют на автоматическую микроскопию (30 минут). Полученные дигитальные изображения обрабатывают с помощью специально разработанного автоматического алгоритма, основанном на встроенных функциях Imagej. В результате количественные значения коэффициента Пирсона, отражающего колоколизацию интернализованных частиц с клетками, получают для каждого образца. В итоге весь процесс занимает не более суток, и предоставляет количественный результат для прогнозирования метастатического потенциала. Быстрое, количественное, индивидуальное для пациента определение вероятности метастазирования на временной шкале первичной резекции / биопсии напрямую влияет на выбор протоколов лечения для пациентов и, в конечном итоге, увеличивает их продолжительность жизни.
Была установлена прямая связь между метастатическим потенциалом клеток рака молочной железы и их способностью инкапсулировать нано-частицы (размерами 100 и 200 нм). В частности, доброкачественные клетки (MCF10-A) в заданных экспериментальных условиях оказались неспособными к инкапсулированию наночастиц, тогда как клетки с низким метастатическим потенциалом (MCF7) инкапсулировали в 1.5 раза больше частиц чем контрольная группа, а клетки с высоким метастатическим потенциалом (MDA-MB-231) - более чем в 2.2 раза.
Основная причина смертности от рака - метастазы; таким образом, их прогнозирование может критически повлиять на выживаемость пациентов. В настоящее время метастазы прогнозируются на основе статуса лимфатических узлов, размера опухоли, гистопатологии и генетического тестирования, однако все эти методы не являются полностью безошибочными, и для получения результатов могут потребоваться недели.
Например, примерно у 30% больных раком молочной железы с отрицательным статусом лимфатических узлов будут развиваться метастазы; напротив, гистологически градуированные опухоли анапластической аденокарциномы предстательной железы могут иметь низкий метастатический потенциал. Классификация TNM, основанная на размере первичной опухоли и метастазах в лимфатические узлы или отдаленные участки, не учитывает органы возможного метастатического роста. Генетическое тестирование, дополнительный метод прогнозирования метастатического рака позволяет идентифицировать определенные подтипы в рамках общей категории заболеваний на основе различий в экспрессии генов. К сожалению, этот метод может предоставить информацию только о конкретно идентифицированных генах, в то время как во многих специфических видах рака и раковых мутациях, прогностические маркеры еще не определены. На практике чувствительность и специфичность отдельных маркеров могут сильно различаться, и на результаты могут влиять некоторые физиологические и патологические факторы, таких как загрязнения окружающей среды, курение, ожирение и т.д. Стандартное гистологическое исследование образца опухоли может занять недели и месяцы. Неуверенность пациентов в окончательном диагнозе связана со значительным биохимическим дистрессом, который влияет на иммунную защиту и заживление. В свете всех перечисленных выше ограничений требуются новые инновационные подходы для точной оценки склонности к метастазированию, желательно с быстрым предоставлением количественных результатов, независимых от предвзятости и квалификации исполнителя.
Выявление новых потенциальных прогностических факторов будет важным источником информации о рисках для практикующего онколога, что потенциально приведет к улучшению лечению пациентов за счет упреждающей оптимизации стратегий терапии, и является целью настоящего изобретения.
Техническим результатом в достижении целей и задач по настоящему изобретению является простой, не трудоемкий, не затратный, частично-автоматизированный, количественный и относительно быстрый метод диагностики/прогностики онкологических заболеваний и, одновременно, определения метастатического потенциала биопсионного/операционного материала, а также расширение арсенала средств методов ускоренной диагностики онкологических заболеваний.
Авторы настоящего изобретения внезапно обнаружили, что порядок способа по настоящему изобретению обеспечивает достижение настоящего технического результата, а именно:
Полученные результаты показывают четкую и достоверную разницу (p<0,0001) между клетками РМЖ с высоким, низким метастатическим потенциалом (МП) и доброкачественными клетками для протестированных размеров нано-частиц. За короткое время (1 ч) высоко-метастатичные (ВМ) клетки могут интернализировать в 2,18 и 1,4 раза больше наночастиц размером 100 и 200 нм соответственно, чем низко-метастатичные (НМ) клетки. Одновременно ВМ-клетки интернализуют и прикрепляют (адгезируют) в 2,22 раза и в 1,46 раза больше наночастиц размером 100 и 200 нм, соответственно, чем НМ-клетки, что делает добавление прилипших частиц незначительным для обнаружения различий между клетками с различным метастатическим потенциалом. Кроме того, ВМ-клетки инкапсулируют в 2,85 и 2,56 раза больше наночастиц размером 100 и 200 нм соответственно, чем доброкачественные клетки. Несмотря на то, что клетки НМ инкапсулируют только в 1,3 и 1,85 раза больше наночастиц размером 100 и 200 нм, соответственно, чем доброкачественные клетки, это все же делает возможной дифференциацию метастатических клеток от доброкачественных клеток. Таким образом, интернализация наночастиц вместе с адгезией позволяет четко дифференцировать НМ от доброкачественных клеток (в 1,74 и 2,15 раза больше наночастиц размером 100 и 200 нм соответственно), а интернализация вместе с адгезией наночастиц 100 и 200 нм обеспечивала дифференцировку ВМ от доброкачественных клеток 3,86. раз и 3,15 раза соответственно.
Носители, используемые в фармацевтических композиций по настоящему изобретению, представляют собой носители, которые применяются в сфере фармацевтики для получения распространенных форм, в том числе: в пероральных формах используются связующие вещества, смазывающие агенты, дезинтеграторы, растворители, разбавители, стабилизаторы, суспендирующие агенты, бесцветные агенты, корригенты вкуса; в формах для инъекций используются антисептические агенты, солюбилизаторы, стабилизаторы; в местных формах используются основы, разбавители, смазывающие агенты, антисептические агенты.
Предметом настоящего изобретения является способ определения метастатического потенциала опухолевых новообразований, согласно которому
экстрагируют клетки из опухолевых новообразований,
инкубируют клетки с культуральной средой,
клетки инкапсулируют наноразмерные флуоресцентные зонды,
результат промывают, фиксируют, отправляют на автоматическую микроскопию,
полученные дигитальные изображения обрабатывают с помощью автоматического алгоритма,
получают количественное значение, отражающее колоколизацию интернализованных частиц с клетками,
на основе полученного значения делают вывод о величине метастатического потенциала.
Более предпочтительным является способ, отличающийся тем, что экстрагируют клетки из опухолевых новообразований в течение 2-4 часов.
Более предпочтительным является способ, отличающийся тем, что инкубируют клетки с культуральной средой в течение 8-12 часов.
Более предпочтительным является способ, отличающийся тем, что клетки инкапсулируют нано-размерные (50-1000 нм) флуоресцентные зонды посредством инкубации клеток с флуоресцентными нано-зондами и ядерными красителями в течение 1 часа.
Более предпочтительным является способ, отличающийся тем, что полученные микроскопические изображения обрабатывают с помощью специально-разработанного автоматического алгоритма, основанного на встроенных функциях Imagej.
Более предпочтительным является способ, отличающийся тем, что количественное значение, отражающее колоколизацию интернализованных частиц с клетками, представляет собой коэффициент инкапсуляции.
Более предпочтительным является способ, отличающийся тем, что наноразмерные флуоресцентные зонды представляют собой нано-сферы на основе полиакриламида или кремнезема с карбоксилированным или другим покрытием.
Более предпочтительным является способ для определения развития онкологического заболевания.
Более предпочтительным является способ для определения развития рака молочной железы.
Более предпочтительным является способ, отличающийся тем, что онкологическое заболевание выбрано из группы, включающей рак легких, рак поджелудочной железы, рак шейки матки, колоректальный рак, глиальную астроцитому.
Метастатическая миграция и инвазия через ткани являются критическими этапами образования метастазов. Широко используемая мера агрессивности рака - это клеточная инвазивность, или способность клетки вторгаться в окружающую среду. В нескольких исследованиях изучались механизмы инвазии или миграции раковых клеток в 2-D и 3-D средах, при этом внутриклеточная механика играет существенную роль в этом процессе. Изменения внутриклеточной механики во время злокачественной трансформации влияют на инвазию раковых клеток. Различные методы, такие как атомно-силовая микроскопия, субклеточная лазерная абляция, магнитная скручивающая цитометрия, магнитная микро-реология эндосом и микро-реология, отслеживающая множественные частицы, использовались в последние годы для характеризации свойства раковых клеток при внутриклеточных процессах. Более динамичная внутренняя среда ВМ клеток и их более редкий и подвижный цитоскелет по сравнению как с НМ клетками, так и с доброкачественными клетками, делают клетки ВМ более способными к интернализации веществ из их окружения. Отличная способность к восстановлению и пластичность ВМ клеток связаны с актомиозиновым сократительным аппаратом и ремоделированием актина. Ремоделирование актинового цитоскелета, опосредованное Rho GTPases, является существенным механизмом инвазии метастатических клеток. Во время инвазии клетки прикладывают силы через актомиозиновую сеть, которая толкает клеточную мембрану; увеличение сил, генерируемых актомиозином, прямо коррелирует с повышенной инвазивностью метастатических клеток. Актин также играет существенную роль в эндоцитозе - актин участвует на нескольких стадиях эндоцитоза, включая инвагинацию мембраны, разрыв и продвижение эндоцитарного пузырька. Активное ремоделирование ВМ клетками актиновой сети, может успешно способствовать эндоцитозу. Такие препараты, как латрункулин А, ингибируют эндоцитоз в клетках и, в то же время, играют важную роль в ингибировании клеточной инвазии, что было проверено с помощью метода гель-инвазии. Таким образом, существует прямая связь между способностью раковых клеток к миграции и инвазии и их склонностью к адгезии и инкапсуляции.
В зависимости от размера и типа частиц, пути и механизма интернализации, различают три основных режима клеточного эндоцитоза, которые сосуществуют в клетке и действуют параллельно: фагоцитоз (интернализация крупных твердых частиц>0,5 мкм), пиноцитоз (0,5-5 мкм). m везикул) и рецептор-опосредованный эндоцитоз (интернализация мелких<0,5 мкм частиц через специфические рецепторы). Роль эндоцитоза неоспорима важна в опухолевой прогрессии из-за сходства сигналов и процессов, направляющих движение клеток и эндоцитоз. Эндоцитоз происходит в областях плазматической мембраны, участвующих в распространении, поэтому может непосредственно способствовать миграции клеток. Похоже, что нарушенный эндоцитоз может вносить значительный вклад в устойчивую пролиферацию раковых клеток, повышенную инвазивность и предотвращение апоптоза. Наиболее изученный для раковых клеток эндоцитарный способ представляет собой рецептор-опосредованный эндоцитоз, в частности, клатрин-опосредованный эндоцитоз имеет решающее значение при раке и метастазировании. Клатрин явно активируется в клетках немелкоклеточного рака легкого и связан с плохим прогнозом. Известно, что регуляция специфических рецепторов влияет на рак и метастазирование с помощью клатрин- и не клатрин-опосредованных путей интернализации. Опосредованный кавеолами эндоцитоз (CavME) является жизненно важным для трансцитотического транспорта через клетки и механосенсорного восприятия. Компоненты CavME играют жизненно важную роль в клеточной миграции, инвазии и метастазировании. Нокдаун CAV-1 в клетках рака молочной железы и простаты снижает скорость, направленность и постоянство клеточной миграции. Верхний предел размера эндоцитарных везикул для клатрин-опосредованного эндоцитоза составляет около 200 нм, и кинетические параметры могут определять почти полную интернализацию таких частиц по этому пути, а не через кавеолы. Поэтому мы решили сосредоточить наши исследования на частицах диаметром 100-200 нм (более мелкие частицы нуждались в специальном оборудовании для расширения пределов обнаружения в экспериментах). Размер и форма наночастиц являются критическими физико-химическими свойствами, которые определяют степень и эффективность начальных взаимодействий наночастиц с клеткой. В исследованиях, опосредованных эндоцитозом, изучались различные размеры частиц и сложные формы с различными сложными и дорогостоящими обработками и модификациями поверхности. Частицы остаются в основном в клеточном ободе, предположительно из-за взаимодействия с отрицательно заряженными белками плазматической мембраны на клеточной поверхности. Здесь мы оцениваем кратковременную интернализацию частиц диаметром 100 и 200 нм, сравнивая доброкачественные, НМ и ВМ эпителиальные клетки рака молочной железы, а также сопоставление эффективности интернализации с инвазивными способностями раковых клеток.
Приведенные ниже примеры осуществления изобретения иллюстрируют, но не ограничивают изобретение.
Пример 1. Используют две коммерчески доступные линии эпителиальных клеток человека от рака молочной железы с высоким (MDA-MB-231) и низким (MCF7) метастатическим потенциалом (из Американской коллекции культур тканей (ATCC), Манассас, Вирджиния). Линии клеток культивируют в соответствующих средах в соответствии с рекомендациями АТСС: используют модифицированную Дульбекко среду Игла (DMEM) (Thermo Fisher, Gibco, Waltham, MA) с добавлением 10 об.% эмбриональной бычьей сыворотки (FBS) (Диа-М, Москва), Россия), и по 1 об.% L-глутамина (ООО НПП ПанЭко, Москва, Россия), пенициллина-стрептомицина (ООО НПП ПанЭко, Москва, Россия) и пирувата натрия (ООО НПП ПанЭко, Москва, Россия). Доброкачественные клетки (MCF10-A), использованные в качестве контроля, выращивают в среде DMEM/Ham'sF-12 с добавлением 5% лошадиной сыворотки (Hyclone, Waltham, MA), 1 об.% L-глутамина и пенициллина/стрептомицина, 10 мкг/мл инсулина, 10 нг/мл эпидермального фактора роста, 0,5 мкг/мл гидрокортизона и 100 нг/мл холерного токсина; эксперименты проводят со средами, содержащими FBS. Клетки культивируют при 37°С, 5% СО2 и высокой влажности. Анализ на микоплазму не проводят.Клетки замораживают при низких пассажах из запаса АТСС (т.е. 3-5), а для экспериментов клетки размораживают и используют в пассажах 7-30.
Пример 2. Используют желто-зеленые (возбуждение/испускание 505/515 нм) модифицированные карбоксилатом флуоресцентные частицы диаметром 100 и 200 нм (Molecular probes, Invitrogen life Technologies, Карлсбад, Калифорния) для достижения эффективности адгезии и инкапсуляции клеток. Клетки высевают за 24 часа до визуализации на 386-луночные планшеты с плоским дном (Corning Incorporated, Corning, NY). Плотность высева клеток составляет 100000 клеток/мл, что позволяет получить около 1000 близко расположенных, но не образующих монослоя клеток в каждой лунке (площадь лунки 5,6 мм2). Флуоресцентные частицы и краситель для ядер (реагент NucBlue Live Cell Stain ReadyProbes, Eugene, OR) добавляютза 1 час до визуализации. Для экспериментов по адгезии клетки тщательно промывают фосфатно-солевым буфером (PBS) перед визуализацией (2 раза по 2 минуты путем пипетирования при комнатной температуре (КТ)). Для экспериментов по инкапсулированию клетки промывают PBS (2 мин, КТ), а затем промывают трипсином (ООО НПП ПанЭко, Москва, Россия) (2 мин, КТ). Жизнеспособность подтверждали флуоресцентным окрашиванием живых/мертвых ядер (реагент NucBlue Live Cell Stain ReadyProbes, Eugene, OR). В каждом эксперименте положительные контроли (частицы без клеток) и отрицательные контроли (клетки без частиц) проводят в одних и тех же условиях. Проводят не менее четырех биологически независимых экспериментов для каждого типа клеток и состояния.
Пример 3. Цифровые изображения клеток в проходящем свете и флуоресценции (DAPI и TRITC) получают с использованием высококонтрастного флуоресцентного инвертированного микроскопа ImageXpress Micro XL System (Molecular Devices LLC, Сан-Хосе, Калифорния, США), оснащенного иммерсионной системой 40x/0,60 NA, объектив с большим рабочим расстоянием. Визуализацию проводят сразу после промывания клеток (или после фиксации клеток 4% раствором формальдегида) при комнатной температуре в течение 15-20 минут.Посев клеток с последующей промывкой позволяет получить в среднем 20±10 жизнеспособных клеток на поле зрения (ПЗ) (площадь ПЗ 0,125 мм2). В каждом эксперименте автоматически отображается не менее 20 лунок с 4 ПЗ на лунку. Только ПЗ, содержащие более четырех клеток и не содержащие артефактов изображения (таких как неожиданное изменение глубины фокуса или гиперэкспрессия), подвергают дальнейшему анализу, в результате чего получают не менее 110 ПЗ для каждого условия. Не менее 1100 клеток визуализируют в четырех независимых экспериментах для каждого экспериментального условия. Псевдоконфокальная визуализация с шагом Z-стека 1-2 мкм выполняется для каждого типа раковых клеток и типа обработки, чтобы убедиться в наличии флуоресцентных наночастиц внутри визуализируемых клеток.
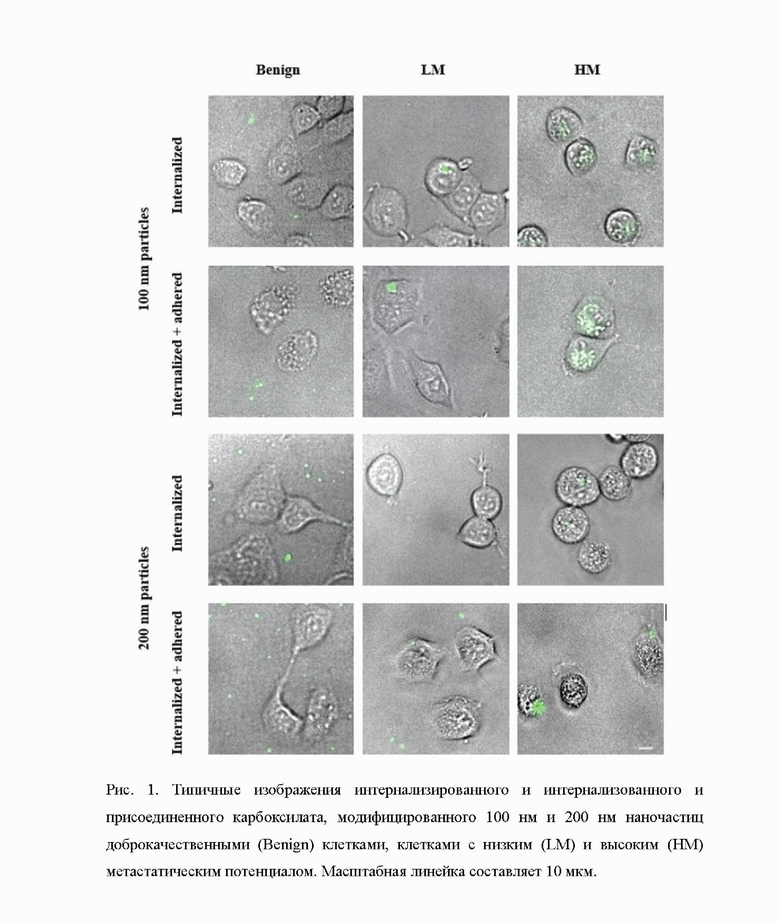
Пример 4. Оценивают эффективность кратковременной инкапсуляции и адгезии наночастиц раковыми клетками (с высоким и низким МП) и доброкачественными клетками. Используя систему автоматического флуоресцентного микроскопа, визуализируют случайные области 386-луночных планшетов с плоским дном с засеянными и прикрепленными клетками через 1 час после добавления наночастиц. Жизнеспособность была выше 92%, определяемой флуоресцентным окрашиванием живых/мертвых клеток для всех промывок. Морфология ВМ и НМ клеток рака молочной железы человека на жесткой поверхности очень похожа (рис. 1). Частицы распределены в основном вблизи краев клеток как для ВМ, так и для НМ клеток рака молочной железы. На поверхности и внутри доброкачественных клеток частиц практически не обнаружено. Не обнаружено видимой разницы между интернализованными клетками частицами размером 100 и 200 нм, однако в доброкачественных клетках практически не наблюдается интернализированных частиц, как показано на рис. 1.
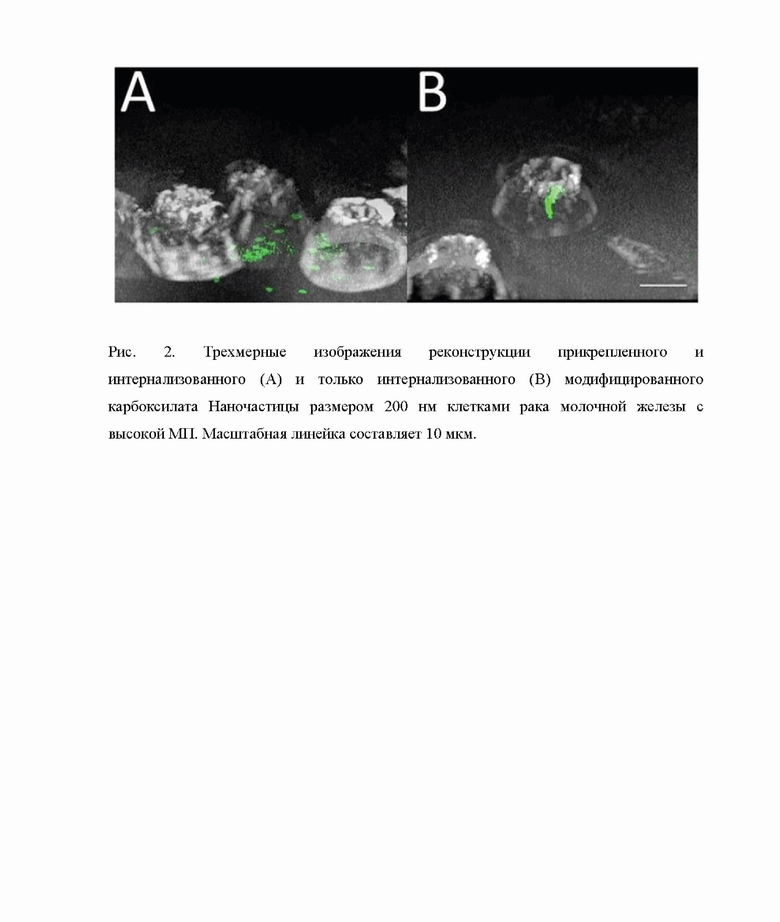
Псевдоконфокальную визуализацию с шагом Z-стека 1-2 мкм выполняют для каждого типа раковых клеток и типа обработки, чтобы доказать наличие флуоресцентных наночастиц в изображенных клетках. Как показано на рис.2, наночастицы присутствуют во всей глубине клетки, а не только на поверхности клетки. Более того, после промывок трипсином частицы в основном обнаруживают внутри клеток (только интернализованные частицы), тогда как после промывки PBS достаточное количество частиц обнаруживают на поверхности клеток (интернализованные и прилипшие частицы).
Наночастицы модифицированного карбоксилатом полистирола (номинальные размеры 100 нм и 200 нм), загруженные флуоресцентными красителями для создания интенсивной флуоресценции, обычно практически не проявляют фотообесцвечивания даже при возбуждении интенсивным освещением, необходимым для флуоресцентной микроскопии. Из-за их широкой доступности для научного сообщества частицы используют в качестве модельных частиц для понимания интернализации и адгезии в линиях эпителиальных клеток. Проводят анализ колокализации флуоресцентных наночастиц с флуоресцентно помеченными ядрами клеток и строят диаграмму рассеяния. Рассчитывают коэффициент регрессии Пирсона, коэффициент линейного перекрытия R, наклон и точку пересечения рассеяния и выбирают коэффициент корреляции Пирсона для измерения статистической взаимосвязи или ассоциации между двумя переменными. Коэффициент известен как лучший метод измерения связи между интересующими переменными, поскольку он основан на методе нормализованной ковариации; он дает информацию о величине ассоциации или корреляции, а также о направлении взаимосвязи. Расчитывают коэффициенты Пирсона по крайней мере для 110 ПЗ для каждого состояния, в результате чего было получено более 1100 изображений для каждого типа клеток и способа обработки.
Способ по настоящему изобретению может использоваться в медицине, диагностике/прогностике онкологических заболеваний.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ЛЕЧЕНИЯ ЗЛОКАЧЕСТВЕННЫХ НОВООБРАЗОВАНИЙ С ПОМОЩЬЮ МАГНИТНОЙ ГИПЕРТЕРМИИ И КОМПОЗИЦИЯ ДЛЯ ПРИМЕНЕНИЯ В УКАЗАННОМ СПОСОБЕ | 2020 |
|
RU2792161C2 |
| СПОСОБЫ ИНГИБИРОВАНИЯ МИГРАЦИИ РАКОВЫХ КЛЕТОК | 2006 |
|
RU2404805C2 |
| ПРОТИВООПУХОЛЕВЫЙ ПРЕПАРАТ | 2011 |
|
RU2451509C1 |
| Способ применения гидроксихлорохина и его производных для доставки химиотерапевтического лекарственного препарата в очаг ракового заболевания (варианты) | 2023 |
|
RU2834400C2 |
| РЕЦЕПТОР-НАПРАВЛЕННЫЕ КОНСТРУКЦИИ И ИХ ПРИМЕНЕНИЕ | 2015 |
|
RU2682335C2 |
| МОДУЛЬНЫЕ ЧАСТИЦЫ ДЛЯ ИММУНОТЕРАПИИ | 2014 |
|
RU2672055C2 |
| ПРОДУКТЫ ДЛЯ ДОСТАВКИ ТЕРАПЕВТИЧЕСКИХ/ДИАГНОСТИЧЕСКИХ СОЕДИНЕНИЙ К СЕРДЦУ | 2015 |
|
RU2721778C2 |
| НОВЫЙ РАКОВЫЙ АНТИГЕН ДЛЯ РАННЕГО ВЫЯВЛЕНИЯ РАКА, СПОСОБ ЕГО ПОЛУЧЕНИЯ, ВЫДЕЛЕНИЯ И ДЕТЕКЦИИ | 2020 |
|
RU2818471C2 |
| ПОЛУЧЕННЫЕ ИЗ БАКТЕРИЙ ИНТАКТНЫЕ МИНИ-КЛЕТКИ ДЛЯ ДОСТАВКИ ЛЕКАРСТВЕННЫХ СРЕДСТВ К ОПУХОЛЯМ МОЗГА | 2012 |
|
RU2664698C2 |
| ТЕРАПЕВТИЧЕСКИЕ КОМПОЗИЦИИ И СПОСОБЫ ПРИМЕНЕНИЯ ДЛЯ ЛЕЧЕНИЯ РАКА | 2016 |
|
RU2720984C2 |
Настоящее изобретение относится к способу определения метастатического потенциала опухолевых новообразований, согласно которому экстрагируют клетки из опухолевых новообразований, инкубируют их с культуральной средой, инкапсулируют наноразмерные флуоресцентные зонды, результат промывают, фиксируют, отправляют на автоматическую микроскопию. Полученные дигитальные изображения обрабатывают с помощью автоматического алгоритма, получают количественное значение, отражающее колоколизацию интернализованных частиц с клетками, на основании чего делают вывод о величине метастатического потенциала. Техническим результатом изобретения является простой, не трудоемкий, не затратный, частично-автоматизированный, количественный и относительно быстрый метод диагностики/прогностики онкологических заболеваний и, одновременно, определения метастатического потенциала биопсионного/операционного материала, а также расширение арсенала средств методов ускоренной диагностики онкологических заболеваний. 9 з.п. ф-лы, 2 ил., 3 пр.
1. Способ определения метастатического потенциала опухолевых новообразований, согласно которому
экстрагируют клетки из опухолевых новообразований,
инкубируют клетки с культуральной средой,
клетки инкапсулируют наноразмерные флуоресцентные зонды,
результат промывают, фиксируют, отправляют на автоматическую микроскопию,
полученные дигитальные изображения обрабатывают с помощью автоматического алгоритма,
получают количественное значение, отражающее колоколизацию интернализованных частиц с клетками,
на основании полученного количественного значения делают вывод о величине метастатического потенциала.
2. Способ по п. 1, отличающийся тем, что экстрагируют клетки из опухолевых новообразований в течение 2-4 часов.
3. Способ по п. 1, отличающийся тем, что инкубирую клетки с культуральной средой в течение 8-12 часов.
4. Способ по п. 1, отличающийся тем, что клетки инкапсулируют наноразмерные (50-1000 нм) флуоресцентные зонды посредством инкубации клеток с флуоресцентными нанозондами и ядерными красителями в течение 1 часа.
5. Способ по п. 1, отличающийся тем, что полученные дигитальные изображения обрабатывают с помощью специально разработанного автоматического алгоритма, основанного на встроенных функциях Imagej.
6. Способ по п. 1, отличающийся тем, что количественное значение, отражающее колоколизацию интернализованных частиц с клетками, представляет собой коэффициент инкапсуляции.
7. Способ по п. 1, отличающийся тем, что наноразмерные флуоресцентные зонды представляют собой наносферы на основе полиакриламида или кремнезема с карбоксилированным или другим покрытием.
8. Способ по любому из пп. 1-7 для определения развития онкологического заболевания.
9. Способ по п. 8 для определения развития рака молочной железы.
10. Способ по п. 8, отличающийся тем, что онкологическое заболевание выбрано из группы, включающей рак легких, рак поджелудочной железы, рак шейки матки, колоректальный рак, глиальную астроцитому.
| US 5726015 A1, 10.03.1998 | |||
| Способ определения метастатического потенциала инвазивного протокового рака молочной железы и композиция для его осуществления | 2018 |
|
RU2697055C1 |
| Способ и композиция для лечения рака, уничтожения метастатических раковых клеток и профилактики метастазов рака, используя антитела к конечным продуктам повышенного гликирования ( AGE) | 2017 |
|
RU2728964C2 |
| US 10765376 B2, 08.09.2020. | |||
Авторы
Даты
2023-08-23—Публикация
2022-12-20—Подача