ИСПРАШИВАЕМЫЙ ПРИОРИТЕТ
[0001] По настоящей заявке испрашивается приоритет предварительной заявки США № 61/603882, поданной 27 февраля 2012 г., и предварительной заявки США № 61/710352, поданной 5 октября 2012 г. Полные содержания приоритетных заявок включены в настоящее описание посредством ссылки.
ОБЛАСТЬ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
[0002] Настоящее изобретение относится к фармацевтическим композициям, содержащим твердую дисперсию N-[2,4-бис(1,1-диметилэтил)-5-гидроксифенил]-1,4-дигидро-4-оксохинолин-3-карбоксамида, включая композиции твердых дисперсий в порошках, гранулах и мини-таблетках, к способам получения и обработки порошков, гранул и мини-таблеток, и к способам лечения кистозного фиброза с использованием этой фармацевтической композиции.
ПРЕДПОСЫЛКИ К СОЗДАНИЮ ИЗОБРЕТЕНИЯ
[0003] Кистозный фиброз (КФ) представляет собой рецессивное генетическое заболевание, которое поражает приблизительно 30000 детей и взрослых в Соединенных Штатах и, приблизительно, 30000 детей и взрослых в Европе. Несмотря на прогресс в лечении КФ, лекарства не существует.
[0004] КФ вызывается мутациями в гене муковисцидозного трансмембранного регулятора проводимости (CFTR), который кодирует белок муковисцидозного трансмембранного регулятора проводимости (CFTR), эпителиальный хлорный ионный канал, отвечающий за облегчение регуляции солевой и водной абсорбции и секреции в различные ткани. Низкомолекулярные лекарственные средства, известные как потенциаторы, которые повышают возможность открытия CFTR канала, представляют одну возможную терапевтическую стратегию лечения КФ.
[0005] Более конкретно, CFTR представляет собой цАМФ/АТФ-опосредованный анионный канал, который экспрессируется в целом ряде клеточных типов, включая абсорбционные и секреторные эпителиальные клетки, где он регулирует анионный поток через мембрану, а также активность других ионных каналов и белков. В эпителиальных клетках нормальное функционирование CFTR является важным для поддержания транспорта электролитов по всему организму, включая дыхательные и пищеварительные ткани. CFTR состоит приблизительно из 1480 аминокислот, которые кодируют белок, состоящий из тандемного повтора трансмембранных доменов, каждый из которых содержит шесть трансмембранных спиралей, и нуклеотидсвязывающего домена. Два трансмембранных домена связаны большим полярным регуляторным (R)-доменом с множеством сайтов фосфорилирования, которые регулируют активность канала и клеточную миграцию.
[0006] Ген, кодирующий CFTR, был идентифицирован и секвенирован (смотри Gregory, R. J. et al. (1990) Nature 347:382-386; Rich, D. P. et al. (1990) Nature 347:358-362), (Riordan, J. R. et al. (1989) Science 245:1066-1073). Дефект или мутация этого гена вызывает мутации в CFTR, приводя в результате к кистозному фиброзу («КФ»), наиболее распространенному фатальному генетическому заболеванию у людей. Кистозный фиброз поражает приблизительно одного на 2500 грудных детей в Соединенных Штатах. В общей популяции Соединенных Штатов до 10 миллионов людей являются носителями одной копии поврежденного гена без видимых патологических эффектов. В отличие от этого, индивидуумы с двумя копиями гена, связанного с КФ, страдают от изнуряющих и фатальных эффектов КФ, включая хроническое заболевание легких.
[0007] У пациентов с КФ мутации в CFTR, эндогенно эспрессированные в эпителии дыхательных путей, приводят к сниженной апикальной секреции анионов, вызывая дисбаланс в ионном транспорте и транспорте жидкости. Полученное в результате снижение анионного транспорта вносит вклад в повышенном накоплении слизи в легких и сопутствующие микробные инфекции, которые в конечном итоге вызывают смерть пациентов с КФ. Помимо респираторного заболевания пациенты с КФ обычно страдают от желудочно-кишечных проблем и недостаточности поджелудочной железы, которая, оставаясь не леченной, в результате приводит к смерти. Кроме того, большинство мужчин с кистозным фиброзом являются бесплодными, и фертильность снижена среди женщин с кистозным фиброзом. В отличие от тяжелых эффектов двух копий гена, связанного с КФ, индивидуумы с одной копией гена, связанного с КФ, проявляют повышенную резистентность к холере и дегидрататции в результате диареи - возможно, объясняя сравнительно высокую частоту КФ гена в популяции.
[0008] Анализ последовательности гена CFTR КФ хромосом CF показал целый ряд мутаций, вызывающих заболевание (Cutting, G. R. et al. (1990) Nature 346:366-369; Dean, M. et al. (1990) Cell 61:863:870; и Kerem, B-S. et al. (1989) Science 245:1073-1080; Kerem, B-S et al. (1990) Proc. Natl. Acad. Sci. USA 87:8447-8451). До настоящего времени в гене КФ было идентифицировано >1000 мутаций, вызывающих заболевание (http://www.genet.sickkids.on.ca/cftr/app). Наиболее преобладающей мутацией является делеция фенилаланина в положении 508 аминокислотной последовательности CFTR, и обычно называемая ΔF508-CFTR. Эта мутация встречается приблизительно в 70% случаев кистозного фиброза и связана с тяжелым заболеванием.
[0009] Эта делеция остатка 508 в ΔF508-CFTR препятствует правильной укладке образующегося белка. В результате это приводит к неспособности мутантного белка покинуть ER и двигаться к плазматической мембране. В результате, число каналов, находящихся в мембране, гораздо меньше, чем наблюдается в клетках, экспрессирующих CFTR дикого типа. Помимо нарушенного перемещения, эта мутация в результате приводит к нарушению работы воротного механизма ионных каналов. Все вместе, сниженное количество каналов в мембране и нарушение работы воротного механизма, приводит к снижению анионного транспорта через эпителий, приводя к нарушению ионного транспорта и транспорта жидкости. (Quinton, P. M. (1990), FASEB J. 4:2709-2727). Исследования показали, однако, что сниженные количества ΔF508-CFTR в мембране являются функционально активными, хотя, менее чем CFTR дикого типа. (Dalemans et al. (1991), Nature Lond. 354: 526-528; Denning et al., выше; Pasyk and Foskett (1995), J. Cell. Biochem. 270:12347-50). Помимо ΔF508-CFTR, другие мутации в CFTR, вызывающие заболевание, которые в результате приводят к нарушению перемещения, синтеза и/или работы воротного механизма каналов, могли быть активированы или подавлены для изменения анионной секреции и изменения прогрессирования заболевания и/или его тяжести.
[0010] Хотя CFTR помимо анионов переносит целый ряд молекул, ясно, что эта роль (транспорт анионов) представляет один элемент в важном механизме транспорта ионов и воды через эпителиальную ткань. Другие элементы включают эпителиальный Na+ канал, ENaC, Na+/2Cl-/K+ котранспортер, Na+-K+-АТФазный насос и базолатеральные мембранные K+ каналы, которые отвечают за вхождение хлорида в клетки.
[0011] Эти элементы работают вместе для осуществления направленного транспорта через эпителиальную ткань посредством их селективной экспрессии и локализации в клетке. Абсорбция хлорида имеет место посредством координированной активности ENaC и CFTR, находящихся на апикальной мембране, и Na+-K+-ATФазного насоса и Cl- ионных каналов, экспрессированных на базолатеральной поверхности клетки. Вторичный активный транспорт хлорида с внутренней стороны приводит к накоплению внутриклеточного хлорида, который затем может пассивно покидать клетку через Cl- каналы, что в результате приводит к векторному переносу. Локализация в определенном порядке Na+/2Cl-/K+ котранспортера, Na+-K+-АТФазного насоса и базолатеральных мембранных K+ каналов на базолатеральной поверхности и CFTR на внутренней стороне координирует секрецию хлорида через CFTR на внутренней стороне. Поскольку вода, вероятно, никогда активно не переносится, ее поток через эпителий зависит от малейших трансэпителиальных осмотических градиентов, генерируемых массовым передвижением натрия и хлорида.
[0012] Как рассмотрено выше, считается, что делеция остатка 508 в ΔF508-CFTR препятствует правильной укладке образующегося белка, приводя в результате к неспособности этого мутантного белка выходить из ER и двигаться к плазматической мембране. В результате, на плазматической мембране находится недостаточное количество зрелого белка, и транспорт хлорида в эпителиальных тканях значительно снижается. Действительно, было показано, что этот клеточный феномен нарушенного ER процессинга ABC транспортеров механизмом ER является основополагающей основой не только для заболевания КФ, но и для целого ряда других отдельных и наследственных заболеваний.
[0013] N-[2,4-бис(1,1-диметилэтил)-5-гидроксифенил]-1,4-дигидро-4-оксохинолин-3-карбоксамид представляет собой эффективный и селективный стимулятор CFTR дикого типа и мутантных (в том числе, например, ΔF508, R117H и G551D) форм CFTR человека. N-[2,4-бис(1,1-диметилэтил)-5-гидроксифенил]-1,4-дигидро-4-оксохинолин-3-карбоксамид применяется для лечения взрослых пациентов с кистозным фиброзом и по меньшей мере одной аллелью G551D-CFTR.
[0014] Для пациентов детского возраста с КФ может потребоваться введение фармацевтических композиций в лекарственной форме, которая облегчает глотание или которая может быть легко смешана с легко перевариваемыми продуктами. Применение порошков и дробленых таблеток при введении фармацевтических композиций детям зачастую представляет проблемы при введении и дозировании. Введение композиций дробленых таблеток детям может приводить к проблемам с абсорбцией, фрагменты которых являются либо слишком трудными для проглатывания, либо оказываются нерастворимыми и остаются непереваренными, приводя в результате к неблагоприятному исходу лечения или неправильному дозированию. Кроме того, дозирование дробленых таблеток может приводить к неправильному дозированию, вследствие трудностей, связанных с обработкой дробленых таблеток. Использование порошкообразных смесей также может приводить к неправильному дозированию. В других случаях активные порошкообразные агенты могут оставаться адгезированными к внутренним стенкам капсулы, пакета или пачки во время введения, приводя, в результате, к терапевтической дозе менее требуемой. Такие ошибки дозирования особенно преобладают, когда лицо, вводящее дозу, является неопытным и когда доза является низкой, как те, которые используются для пациентов детского возраста. Ошибки дозирования, включая КФ фармацевтически активные агенты, следовательно, становятся критичными в детских популяциях, в особенности, принимая во внимание тот факт, что фармацевтические КФ активные агенты вводят в низких дозах (например, менее 100 мг или менее 50 мг на единичную дозу). Эти ошибки дозирования становятся критичными у пациентов детского возраста, имеющих низкий порог для отклонения от дозы.
[0015] Соответственно, существует необходимость в стабильных биологически активных фармацевтических композициях N-[2,4-бис(1,1-диметилэтил)-5-гидроксифенил]-1,4-дигидро-4-оксохинолин-3-карбоксамида, применимых для лечения пациентов, например, пациентов с КФ, имеющих проблемы с глотанием таблеток для взрослых, в том числе, но не только, пациентов детского возраста, и способах их производства и введения.
[0016] Существует необходимость в стабильных биологически активных фармацевтических композициях N-[2,4-бис(1,1-диметилэтил)-5-гидроксифенил]-1,4-дигидро-4-оксохинолин-3-карбоксамида, применимых для лечения конкретной популяции с нереализованной потребностью медицины, такой как дети до 6-летнего возраста, дети или грудные дети, которые не могут глотать таблетки для взрослых.
[0017] Существует необходимость в стабильных биологически активных фармацевтических композициях N-[2,4-бис(1,1-диметилэтил)-5-гидроксифенил]-1,4-дигидро-4-оксохинолин-3-карбоксамида, которые можно вводить в сочетании с некоторыми общепринятыми продуктами для детского питания для лечения грудных детей.
[0018] Существует необходимость в стабильных биологически активных фармацевтических композициях N-[2,4-бис(1,1-диметилэтил)-5-гидроксифенил]-1,4-дигидро-4-оксохинолин-3-карбоксамида, которые позволяют точно и гибко вводить дозу пациентам детского возраста, в том числе, но не только, грудным детям, путем изменения количества мини-таблеток в единичной дозе, пачке, пакете или капсуле.
[0019] Соединение 1 (N-[2,4-бис(1,1-диметилэтил)-5-гидроксифенил]-1,4-дигидро-4-оксохинолин-3-карбоксамид) было удостоено признания в качестве терапии прорыва от Управления по контролю качества пищевых продуктов и лекарственных средств (FDA) для лечения кистозного фиброза, одного всего из двух таких признаний на момент подачи этой заявки. Это демонстрирует значительную неудовлетворенную потребность в эффективном лечении причины кистозного фиброза по сравнению с симптоматическими лечениями.
КРАТКОЕ ИЗЛОЖЕНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
[0020] Настоящее изобретение относится к фармацевтическим композициям, содержащим твердую дисперсию N-[2,4-бис(1,1-диметилэтил)-5-гидроксифенил]-1,4-дигидро-4-оксохинолин-3-карбоксамида, и к способам получения и введения фармацевтических композиций, содержащих N-[2,4-бис(1,1-диметилэтил)-5-гидроксифенил]-1,4-дигидро-4-оксохинолин-3-карбоксамид. Фармацевтические композиции, содержащие твердую дисперсию N-[2,4-бис(1,1-диметилэтил)-5-гидроксифенил]-1,4-дигидро-4-оксохинолин-3-карбоксамида (в дальнейшем Соединение 1), также могут включать один или более из следующих эксципиентов: один или более наполнителей, подсластитель, дезинтегрант, увлажнитель, скользящее вещество и смазывающее вещество.
[0021] Фармацевтические композиции по настоящему изобретению относятся к композиции свободнотекучего порошка, который может быть составлен в таблетки, мини-таблетки, гранулы, пеллеты, пастилки и другие лекарственные формы. Порошкообразные формы фармацевтической композиции, такие как таблетки, мини-таблетки, гранулы, заполненные гранулами капсулы, пеллеты, шарики, частицы, микрочастицы, пастилки и другие лекарственные формы, содержащие порошкообразные формы фармацевтической композиции, могут содержаться в капсулах, пакетах, пачках, саше, бутылях или блистерных упаковках. Таблетки, мини-таблетки, гранулы, заполненные гранулами капсулы, пеллеты, шарики, микрочастицы, или частицы также могут быть прессованы в другие твердые формы. В одном варианте осуществления фармацевтическая композиция может включать порошковые составы, описанные в настоящем изобретении, содержащие: твердую дисперсию, содержащую по существу аморфное или аморфное Соединение 1 и эксципиент (например, один или более наполнителей, подсластитель, разрыхлитель, необязательно увлажнитель, скользящее вещество и смазывающее вещество) и составленную в капсулу или пачку, капсулу или пачку, содержащие определенное количество по существу аморфного или аморфного Соединения 1 в интервале от по меньшей мере 1 мг до по меньшей мере 250 мг. Таблетки, мини-таблетки, гранулы, заполненные гранулами капсулы, пеллеты, шарики, микрочастицы или частицы и другие лекарственные формы могут содержать гранулированные частицы или другие порошковые формы по существу аморфного или аморфного Соединения 1.
[0022] В одном варианте осуществления настоящее изобретение относится к фармацевтической композиции, содержащей твердую дисперсию аморфного Соединения 1, где твердая дисперсия содержит до приблизительно 1 мг аморфного Соединения 1. В другом варианте осуществления настоящее изобретение относится к фармацевтической композиции, содержащей твердую дисперсию аморфного Соединения 1, где твердая дисперсия содержит до приблизительно 5 мг аморфного Соединения 1. В некоторых вариантах осуществления твердая дисперсия содержит до приблизительно 5 мг по существу аморфного Соединения 1. Например, твердая дисперсия содержит 0,25 мг, 0,5 мг, 0,75 мг, 1 мг, 2 мг, 3 мг, 4 мг или 5 мг аморфного или по существу аморфного Соединения 1.
[0023] В другом варианте осуществления настоящее изобретение относится к фармацевтической композиции, содержащей твердую дисперсию по существу аморфного Соединения 1, где твердая дисперсия содержит до приблизительно 1 мг по существу аморфного Соединения 1. В некоторых вариантах осуществления твердая дисперсия содержит до приблизительно 1 мг аморфного или по существу аморфного Соединения 1. Например, твердая дисперсия содержит 0,25 мг, 0,5 мг, 0,75 мг или 1 мг аморфного или по существу аморфного Соединения 1.
[0024] В одном варианте осуществления настоящее изобретение относится к фармацевтической композиции, содержащей твердую дисперсию аморфного Соединения 1, где твердая дисперсия содержит приблизительно 5 мг аморфного Соединения 1. В некоторых вариантах осуществления твердая дисперсия содержит приблизительно 5 мг по существу аморфного Соединения 1.
[0025] В одном варианте осуществления настоящее изобретение относится к фармацевтической композиции, содержащей твердую дисперсию аморфного Соединения 1, где твердая дисперсия содержит приблизительно 10 мг аморфного Соединения 1. В некоторых вариантах осуществления твердая дисперсия содержит приблизительно 10 мг по существу аморфного Соединения 1.
[0026] В одном варианте осуществления настоящее изобретение относится к фармацевтической композиции, содержащей твердую дисперсию аморфного Соединения 1, где твердая дисперсия содержит приблизительно 12,5 мг аморфного Соединения 1. В некоторых вариантах осуществления твердая дисперсия содержит приблизительно 12,5 мг по существу аморфного Соединения 1.
[0027] В одном варианте осуществления настоящее изобретение относится к фармацевтической композиции, содержащей твердую дисперсию аморфного Соединения 1, где твердая дисперсия содержит приблизительно 15 мг аморфного Соединения 1. В некоторых вариантах осуществления твердая дисперсия содержит приблизительно 15 мг по существу аморфного Соединения 1.
[0028] В одном варианте осуществления настоящее изобретение относится к фармацевтической композиции, содержащей твердую дисперсию аморфного Соединения 1, где твердая дисперсия содержит приблизительно 20 мг аморфного Соединения 1. В некоторых вариантах осуществления твердая дисперсия содержит приблизительно 20 мг по существу аморфного Соединения 1.
[0029] В одном варианте осуществления настоящее изобретение относится к фармацевтической композиции, содержащей твердую дисперсию аморфного Соединения 1, где твердая дисперсия содержит приблизительно 25 мг аморфного Соединения 1. В некоторых вариантах осуществления твердая дисперсия содержит приблизительно 25 мг по существу аморфного Соединения 1.
[0030] В одном варианте осуществления настоящее изобретение относится к фармацевтической композиции, содержащей твердую дисперсию аморфного Соединения 1, где твердая дисперсия содержит приблизительно 30 мг аморфного Соединения 1. В некоторых вариантах осуществления твердая дисперсия содержит приблизительно 30 мг по существу аморфного Соединения 1.
[0031] В одном варианте осуществления настоящее изобретение относится к фармацевтической композиции, содержащей твердую дисперсию аморфного Соединения 1, где твердая дисперсия содержит приблизительно 35 мг аморфного Соединения 1. В некоторых вариантах осуществления твердая дисперсия содержит приблизительно 35 мг по существу аморфного Соединения 1.
[0032] В одном варианте осуществления настоящее изобретение относится к фармацевтической композиции, содержащей твердую дисперсию аморфного Соединения 1, где твердая дисперсия содержит приблизительно 37,5 мг аморфного Соединения 1. В некоторых вариантах осуществления твердая дисперсия содержит приблизительно 37,5 мг по существу аморфного Соединения 1.
[0033] В одном варианте осуществления настоящее изобретение относится к фармацевтической композиции, содержащей твердую дисперсию аморфного Соединения 1, где твердая дисперсия содержит приблизительно 40 мг аморфного Соединения 1. В некоторых вариантах осуществления твердая дисперсия содержит приблизительно 40 мг по существу аморфного Соединения 1.
[0034] В одном варианте осуществления настоящее изобретение относится к фармацевтической композиции, содержащей твердую дисперсию аморфного Соединения 1, где твердая дисперсия содержит приблизительно 45 мг аморфного Соединения 1. В некоторых вариантах осуществления твердая дисперсия содержит приблизительно 45 мг по существу аморфного Соединения 1.
[0035] В одном варианте осуществления настоящее изобретение относится к фармацевтической композиции, содержащей твердую дисперсию аморфного Соединения 1, где твердая дисперсия содержит приблизительно 50 мг аморфного Соединения 1. В некоторых вариантах осуществления твердая дисперсия содержит приблизительно 50 мг по существу аморфного Соединения 1.
[0036] В одном варианте осуществления настоящее изобретение относится к фармацевтической композиции, содержащей твердую дисперсию аморфного Соединения 1, где твердая дисперсия содержит приблизительно 62,5 мг аморфного Соединения 1. В некоторых вариантах осуществления твердая дисперсия содержит приблизительно 62,5 мг по существу аморфного Соединения 1.
[0037] В одном варианте осуществления настоящее изобретение относится к фармацевтической композиции, содержащей твердую дисперсию аморфного Соединения 1, где твердая дисперсия содержит приблизительно 75 мг аморфного Соединения 1. В некоторых вариантах осуществления твердая дисперсия содержит приблизительно 75 мг по существу аморфного Соединения 1.
[0038] В одном варианте осуществления настоящее изобретение относится к фармацевтической композиции, содержащей твердую дисперсию аморфного Соединения 1, где твердая дисперсия содержит приблизительно 100 мг аморфного Соединения 1. В некоторых вариантах осуществления твердая дисперсия содержит приблизительно 100 мг по существу аморфного Соединения 1.
[0039] В одном варианте осуществления настоящее изобретение относится к фармацевтической композиции, содержащей твердую дисперсию аморфного Соединения 1, где твердая дисперсия содержит приблизительно 125 мг аморфного Соединения 1. В некоторых вариантах осуществления твердая дисперсия содержит приблизительно 125 мг по существу аморфного Соединения 1.
[0040] В одном варианте осуществления настоящее изобретение относится к фармацевтической композиции, содержащей твердую дисперсию аморфного Соединения 1, где твердая дисперсия содержит приблизительно 150 мг аморфного Соединения 1. В некоторых вариантах осуществления твердая дисперсия содержит приблизительно 150 мг по существу аморфного Соединения 1.
[0041] В одном варианте осуществления настоящее изобретение относится к фармацевтической композиции, содержащей твердую дисперсию аморфного Соединения 1, где твердая дисперсия содержит приблизительно 175 мг аморфного Соединения 1. В некоторых вариантах осуществления твердая дисперсия содержит приблизительно 175 мг по существу аморфного Соединения 1.
[0042] В одном варианте осуществления настоящее изобретение относится к фармацевтической композиции, содержащей твердую дисперсию аморфного Соединения 1, где твердая дисперсия содержит приблизительно 200 мг аморфного Соединения 1. В некоторых вариантах осуществления твердая дисперсия содержит приблизительно 200 мг по существу аморфного Соединения 1.
[0043] В одном варианте осуществления настоящее изобретение относится к фармацевтической композиции, содержащей твердую дисперсию аморфного Соединения 1, где твердая дисперсия содержит приблизительно 225 мг аморфного Соединения 1. В некоторых вариантах осуществления твердая дисперсия содержит приблизительно 225 мг по существу аморфного Соединения 1.
[0044] В одном варианте осуществления настоящее изобретение относится к фармацевтической композиции, содержащей твердую дисперсию аморфного Соединения 1, где твердая дисперсия содержит приблизительно 250 мг аморфного Соединения 1. В некоторых вариантах осуществления твердая дисперсия содержит приблизительно 250 мг по существу аморфного Соединения 1.
[0045] В одном аспекте твердая форма Соединения 1 в фармацевтической композиции представляет собой твердую дисперсию, содержащую по существу аморфное или аморфное Соединение 1 и полимер, такой как гидроксипропилметилцеллюлоза (HPMC), сукцинат ацетата гидроксипропилметилцеллюлозы (HPMCAS), сополимер поливинилпирролидона/винилацетата (PVP/VA), поливинилпирролидон (PVP), сополимеры метакриловой кислоты/метакрилата, гидроксипропилцеллюлоза (HPC), или любое их сочетание. Варианты осуществления этого аспекта включают одно или более из следующего: твердая дисперсия представляет собой порошок, имеющий средний диаметр частиц, превышающий приблизительно 5 мкм, или твердая дисперсия имеет объемную плотность приблизительно 0,10 г/куб.см или выше.
[0046] В некоторых случаях твердая дисперсия имеет концентрацию по меньшей мере 20 масс.% Соединения 1 по массе твердой дисперсии. В других случаях твердая дисперсия содержит 80 масс.% или менее HPMCAS. Некоторые твердые дисперсии содержат от приблизительно 40 масс.% до приблизительно 60 масс.% по существу аморфного или аморфного Соединения 1 по массе твердой дисперсии и от приблизительно 60 масс.% до приблизительно 40 масс.% полимера по массе твердой дисперсии. Другие твердые дисперсии содержат от приблизительно 60 масс.% до приблизительно 95 масс.% по существу аморфного или аморфного Соединения 1 по массе твердой дисперсии и от приблизительно 40 масс.% до приблизительно 5 масс.% полимера по массе твердой дисперсии.
[0047] Твердые дисперсии также необязательно могут содержать добавки, например, увлажнитель (например, лаурилсульфат натрия (SLS)), который может находиться в концентрации менее 10 масс.% увлажнителя по массе твердой дисперсии.
[0048] Другие твердые дисперсии содержат от приблизительно 45 масс.% до приблизительно 85 масс.% по существу аморфного или аморфного Соединения 1, от приблизительно 0,45 масс.% до приблизительно 0,55 масс.% SLS и от приблизительно 14,45 масс.% до приблизительно 55,55 масс.% HPMCAS по массе твердой дисперсии.
[0049] В других дополнительных вариантах осуществления фармацевтические композиции также содержат один или более наполнителей (например, маннит, целлюлозы, карбонат кальция, крахмалы, сахара (например, декстрозу, лактозу или подобные)) в концентрациях по меньшей мере приблизительно 10 масс.% по массе композиции; подсластитель (например, сукралозу, сорбит, сахарин, фруктозу, аспартам или их сочетания) в концентрации приблизительно 10% или менее по массе этой композиции; разрыхлитель (например, кроскармеллозу, гликоляткрахмал натрия или их сочетания) в концентрациях приблизительно 10 масс.% или менее по массе композиции; необязательно увлажнитель (например, лаурилсульфат натрия, SLS) в концентрациях приблизительно 10 масс.% или менее по массе композиции; скользящее вещество (например, коллоидный диоксид кремния, тальк или их сочетания) в концентрациях приблизительно 2 масс.% или менее по массе композиции; и смазывающее вещество (например, стеарат магния, стеариновую кислоту, гидрогенизированное масло, стеарилфумарат натрия или любое их сочетание) в концентрациях приблизительно 5 масс.% или менее по массе композиции.
[0050] Такие фармацевтические композиции необязательно могут содержать один или более красителей, ароматизаторов и/или вкусовых добавок для улучшения их внешней привлекательности, вкуса и аромата.
[0051] В других вариантах осуществления настоящее изобретение относится к фармацевтической композиции в форме порошковой композиции, как описано выше, которая также может быть составлена в виде твердых единичных дозированных форм для лечения различных заболеваний, связанных с формами дикого типа и мутантными формами CFTR человека (включая, например, ΔF508, R117H и G551D). Настоящее изобретение, следовательно, также рассматривает новые лекарственные формы, такие как гранулы, пеллеты, мини-таблетки и другие твердые лекарственные формы, которые преодолевают проблемы, описанные выше, в отношении ошибок дозирования, в частности, для пациентов детского возраста. Эти стабильные твердые единичные дозированные формы могут иметь любую форму, в том числе овальную, сферическую, цилиндрическую, эллиптическую, кубическую, квадратную или треугольную, среди прочих. Таблетки или мини-таблетки могут иметь плоскую, уплощенную, стандартную глубоко выпуклую или глубокую двояковыпуклую поверхности или их сочетания.
[0052] В одном аспекте фармацевтическая композиция может быть составлена в единичную дозированную форму, например, капсулу, саше и подобные, содержащую по меньшей мере одну или более мини-таблеток для облегчения введения фармацевтической композиции. В некоторых вариантах осуществления единичная доза может включать капсулу или пачку, содержащую по меньшей мере одну мини-таблетку или множество мини-таблеток, как указано выше и в описании, представленном ниже. В другом варианте осуществления единичная доза может включать пакет, пачку или саше, содержащие конкретную дозу по существу аморфного или аморфного Соединения 1 в форме порошка.
[0053] Такие фармацевтические композиции, как описано в настоящей заявке, могут быть в форме мини-таблетки и/или множества мини-таблеток, состоящих из любого количества мини-таблеток (например, по меньшей мере 2, по меньшей мере 3, по меньшей мере 4, по меньшей мере 5, по меньшей мере 6, по меньшей мере 7, по меньшей мере 8, по меньшей мере 9, по меньшей мере 10, по меньшей мере 11, по меньшей мере 12, по меньшей мере 13, по меньшей мере 14, по меньшей мере 15, по меньшей мере 16, по меньшей мере 17, по меньшей мере 18, по меньшей мере 19, по меньшей мере 20, по меньшей мере 21, по меньшей мере 22, по меньшей мере 23, по меньшей мере 24, по меньшей мере 25, по меньшей мере 26, по меньшей мере 27 , по меньшей мере 28, по меньшей мере 29, по меньшей мере 30, по меньшей мере 31, по меньшей мере 32, по меньшей мере 33, по меньшей мере 34, по меньшей мере 35, по меньшей мере 36, по меньшей мере 37, по меньшей мере 38, по меньшей мере 39, по меньшей мере 40, по меньшей мере 41, по меньшей мере 42, по меньшей мере 43, по меньшей мере 44, по меньшей мере 45, по меньшей мере 46, по меньшей мере 47, по меньшей мере 48, по меньшей мере 49, по меньшей мере 50, по меньшей мере 51, по меньшей мере 52, по меньшей мере 53, по меньшей мере 54, по меньшей мере 55, по меньшей мере 56, по меньшей мере 57, по меньшей мере 58, по меньшей мере 59, по меньшей мере 60 или любого количества, превышающего 60). Фармацевтические композиции, как описано в настоящей заявке, также могут быть в форме мини-таблетки и/или множества мини-таблеток (например, по меньшей мере 2, по меньшей мере 4, по меньшей мере 6, по меньшей мере 8, по меньшей мере 10, по меньшей мере 12, по меньшей мере 14, по меньшей мере 16, по меньшей мере 18, по меньшей мере 20, по меньшей мере 22, по меньшей мере 24, по меньшей мере 26, по меньшей мере 28, по меньшей мере 29, по меньшей мере 30, по меньшей мере 32, по меньшей мере 34, по меньшей мере 36, по меньшей мере 38, по меньшей мере 39 или по меньшей мере 60 мини-таблетки, включая все интервалы между ними). В одном варианте осуществления фармацевтическая композиция находится в форме 10, 19, 29 или 58 мини-таблеток. В другом варианте осуществления фармацевтическая композиция находится в форме 13, 26, 39 или 77 мини-таблеток. Еще в одном варианте осуществления фармацевтическая композиция находится в форме 30, 60, 90 или 179 мини-таблеток. В другом варианте осуществления фармацевтическая композиция находится в форме 1, 2, 3, 4 или 5 мини-таблеток. В другом варианте осуществления фармацевтическая композиция находится в форме 13, 21, 26, 39, 52, 65, 78, 91, 104, 117, 130 или 336 мини-таблеток. Еще в одном дополнительном варианте осуществления фармацевтическая композиция находится в форме 5 мини-таблеток. В другом варианте осуществления фармацевтическая композиция находится в форме 10 мини-таблеток. В одном варианте осуществления фармацевтическая композиция находится в форме 13 мини-таблеток. Еще в одном дополнительном варианте осуществления фармацевтическая композиция находится в форме 15 мини-таблеток. В другом варианте осуществления фармацевтическая композиция находится в форме 21 мини-таблетки. В одном варианте осуществления фармацевтическая композиция находится в форме 26 мини-таблеток. В другом варианте осуществления фармацевтическая композиция находится в форме 39 мини-таблеток. В одном варианте осуществления фармацевтическая композиция находится в форме 52 мини-таблеток. Другой аспект настоящего изобретения относится к фармацевтической композиции, состоящей по меньшей мере из одной мини-таблетки, указанная мини-таблетка содержит твердую дисперсию, один или более наполнителей, подсластитель, разрыхлитель, необязательно увлажнитель, скользящее вещество и смазывающее вещество, где растворимость указанной мини-таблетки составляет по меньшей мере приблизительно 50% приблизительно за 30 минут, и твердая дисперсия содержит аморфное Соединение 1. Как отмечено ниже, растворение может быть измерено с помощью стандартного прибора USP типа II, содержащего среду растворения 0,5 или 0,7% лаурилсульфат натрия, растворенный в 900 мл 50 мМ фосфатно-натриевого буфера с pH 6,8 при температуре приблизительно 37°C. Растворимость мини-таблеток определяется путем регистрации растворимости множества мини-таблеток, содержащих, в агрегате, 75 мг (используя 0,5% лаурилсульфат натрия) или 150 мг (используя 0,7% лаурилсульфат натрия) Соединения 1 в среде растворения. Отдельные мини-таблетки могут проявлять растворимость, которая ниже, равна или выше растворимости множества, со средней растворимостью каждой отдельной мини-таблетки, сходной со средней растворимостью множества.
[0054] Другой аспект настоящего изобретения относится к фармацевтической композиции, состоящей из мини-таблетки или множества мини-таблеток, где каждая мини-таблетка содержит твердую дисперсию, содержащую аморфное или по существу аморфное Соединение 1 и HPMCAS; и один или более наполнителей, подсластитель, разрыхлитель, необязательно увлажнитель, скользящее вещество и смазывающее вещество, где мини-таблетка имеет среднюю прочность при растяжении приблизительно между 0,5 МПа и приблизительно 4 МПа. В некоторых вариантах осуществления мини-таблетка имеет среднюю прочность при растяжении по меньшей мере 0,5 MPa, по меньшей мере 1,0 MPa, по меньшей мере 1,5 MPa, по меньшей мере 2,0 MPa или по меньшей мере 2,5 MPa. Еще в одном аспекте на мини-таблетки, описанные в настоящем изобретении, необязательно нанесено покрытие.
[0055] В другом аспекте мини-таблетки с нанесенным покрытием, описанные в настоящем изобретении, являются окрашенными, например, путем включения красителя в состав мини-таблетки или путем окрашивания поверхности мини-таблетки.
[0056] В другом аспекте настоящее изобретение относится к новым способам производства, которые обеспечивают получение состава миниатюризированных вариантов лекарственных форм для взрослых и других твердых единичных дозированных форм, описанных выше, диапазон размера которых составляет от приблизительно 1 мм до приблизительно 5 мм (например, 2 мм или 4 мм) в любом одном или более измерениях. Эти миниатюризированные твердые единичные дозированные формы дополнительно могут быть заключены в капсулы, бутыли или саше. В других вариантах осуществления фармацевтическая композиция, содержащая мини-таблетку или множество мини-таблеток, может быть в пакетах, саше, пачках, бутылках или блистерных упаковках, или необязательно дополнительно прессованы в другие твердые единичные дозированные формы, которые можно легко вводить пациентам, которые имеют трудности в глотании составов размера таблеток для взрослых. В связи с этим, эти новые порошковые фармацевтические композиции и единичные дозированные формы, содержащие указанные фармацевтические композиции, являются приемлемыми по органолептическим свойствам для указанных пациентов, впрыскиваются в жидкости или легкие пищевые продуты и распадаются или диспергируются в этих различных жидкостях и легких пищевых продуктах или пищевых композициях, таких как молоко (в том числе грудное молоко), детские молочные смеси или молочные смеси для грудных детей, яблочное пюре, вода, йогурт без добавок, мороженое, детское питание, следя за тем, чтобы вся предписанная доза была дезинтегрирована или диспергирована и ее можно было вводить пациентам, имеющим трудности с проглатыванием таблеток для взрослых. Детское питание включает, но не ограничивается этим, морковь или морковное пюре. Фармацевтическую композицию также можно вводить в клубничное варенье, рисовый пудинг, шоколадный пудинг и подобное. В одном варианте осуществления единичную дозированную форму впрыскивают в легкую пищу и вводят. В другом варианте осуществления единичную дозированную форму впрыскивают в жидкость и вводят. В одном варианте осуществления единичную дозированную форму впрыскивают в легкую пищу, перемешивают и вводят. В другом варианте осуществления единичную дозированную форму впрыскивают в жидкость, перемешивают, и вводят. Жидкости могут включать, но не ограничиваться указанным, детские смеси, молочные смеси для грудных детей, молоко или грудное молоко. В некоторых случаях мини-таблетки или гранулы меньшего размера, содержимое пачек, пакетов, капсул, бутылей или саше могут быть введены непосредственно в ротовую полость с последующим введением грудного молока или молочной смеси. Способы введения по настоящему изобретению необязательно также могут включать для мини-таблеток или гранул меньшего размера введение содержимого пачек, пакетов, капсул, бутылей или саше непосредственно в ротовую полость с последующим введением жидкости или напитка. В некоторых вариантах осуществления любые способы введения по настоящему изобретению необязательно могут включать пероральное введение с жиросодержащей пищей, такой как стандартное CF высококалорийное с высоким содержанием жира блюдо или закуска. В других вариантах осуществления любые способы введения по настоящему изобретению, необязательно, могут включать пероральное введение одновременно, до или после пищи, содержащей жир, такой как стандартное CF высококалорийное с высоким содержанием жира блюдо или закуска. В одном варианте осуществления фармацевтические композиции по настоящему изобретению и их твердые единичные дозированные формы, как правило, находят применение при лечении CFTR-опосредованного заболевания в популяции пациентов детского возраста.
[0057] Другой аспект настоящего изобретения относится к способу получения фармацевтической композиции, включающему стадии получения смеси твердой диспресии аморфного Соединения 1, подсластителя, одного или более наполнителей, разрыхлителя, необязательно увлажнителя, скользящего вещества и смазывающего вещества, и прессования этой смеси в твердую лекарственную форму, например гранулу, пеллету или мини-таблетки, твердая лекарственная форма, имеющая растворимость по меньшей мере приблизительно 50% приблизительно за 30 минут. В одном примере смесь прессуют в твердую лекарственную форму, например, мини-таблетку, имеющую среднюю прочность при растяжении между приблизительно 0,5 МПа и приблизительно 4 МПа. Другой аспект настоящего изобретения относится к способу получения фармацевтической композиции, включающему стадии получения смеси твердой дисперсии аморфного Соединения 1, одного или более наполнителей, подсластителя, разрыхлителя, необязательно увлажнителя, скользящего вещества и смазывающего вещества, и прессования этой смеси в твердую лекарственную форму, например, одну или более мини-таблеток, где твердая лекарственная форма способна растворяться по меньшей мере приблизительно на 70% приблизительно за 30 минут.
[0058] Другой аспект настоящего изобретения относится к способу введения фармацевтической композиции путем перорального введения пациенту, например, человеку-пациенту детского возраста, по меньшей мере один раз в сутки, единичной дозы (посредством капсулы, саше, блистерной упаковки, пакета, пачки, бутылки или другого контейнера), содержащей порошкообразную форму фармацевтической композиции и/или мини-таблетку или множество мини-таблеток, где единичная доза содержит твердую дисперсию по существу аморфного или аморфного Соединения 1, один или более наполнителей, подсластитель, разрыхлитель, необязательно увлажнитель, скользящее вещество и смазывающее вещество, в которой единичная доза содержит по меньшей мере приблизительно 10 мг по существу аморфного или аморфного Соединения 1. В некоторых вариантах осуществления единичную дозу вводят перорально пациенту один раз в сутки. В некоторых других вариантах осуществления единичную дозу вводят перорально пациенту дважды в сутки или каждые 12 часов.
[0059] Другой аспект настоящего изобретения относится к способу введения фармацевтической композиции путем перорального введения пациенту, например, пациенту-человеку детского возраста, по меньшей мере один раз в сутки, единичной дозы (посредством капсулы, саше, блистерной упаковки, пакета, пачки, бутылки или другого контейнера), содержащей порошкообразную форму фармацевтической композиции и/или мини-таблетку или множество мини-таблеток, где указанная единичная доза содержит твердую дисперсию по существу аморфного или аморфного Соединения 1, один или более наполнителей, подсластитель, разрыхлитель, необязательно увлажнитель, скользящее вещество и смазывающее вещество, где указанная единичная доза содержит по меньшей мере приблизительно 12,5 мг по существу аморфного или аморфного Соединения 1. В некоторых вариантах осуществления единичную дозу перорально вводят пациенту один раз в сутки. В некоторых других вариантах осуществления единичную дозу перорально вводят пациенту дважды в сутки, или каждые 12 часов.
[0060] Другой аспект настоящего изобретения относится к способу введения фармацевтической композиции путем перорального введения пациенту, например, пациенту-человеку детского возраста, по меньшей мере один раз в сутки, единичной дозы (посредством капсулы, саше, блистерной упаковки, пакета, пачки, бутылки или другого контейнера), содержащей порошкообразную форму фармацевтической композиции и/или мини-таблетки или множество мини-таблеток, где указанная единичная доза содержит твердую дисперсию по существу аморфного или аморфного Соединения 1, один или более наполнителей, подсластитель, разрыхлитель, необязательно увлажнитель, скользящее вещество и смазывающее вещество, где указанная единичная доза содержит по меньшей мере приблизительно 15 мг по существу аморфного или аморфного Соединения 1. В некоторых вариантах осуществления единичную дозу перорально вводят пациенту один раз в сутки. В некоторых других вариантах осуществления единичную дозу перорально вводят пациенту дважды в сутки, или каждые 12 часов.
[0061] Другой аспект настоящего изобретения относится к способу введения фармацевтической композиции путем перорального введения пациенту, например, пациенту-человеку детского возраста, по меньшей мере один раз в сутки, единичной дозы (посредством капсулы, саше, блистерной упаковки, пакета, пачки, бутылки или другого контейнера), содержащей порошкообразную форму фармацевтической композиции и/или мини-таблетки или множество мини-таблеток, где указанная единичная доза содержит твердую дисперсию по существу аморфного или аморфного Соединения 1, один или более наполнителей, подсластитель, разрыхлитель, необязательно увлажнитель, скользящее вещество и смазывающее вещество, где указанная единичная доза содержит по меньшей мере приблизительно 20 мг по существу аморфного или аморфного Соединения 1. В некоторых вариантах осуществления единичную дозу перорально вводят пациенту один раз в сутки. В некоторых других вариантах осуществления единичную дозу перорально вводят пациенту дважды в сутки, или каждые 12 часов.
[0062] Другой аспект настоящего изобретения относится к способу введения фармацевтической композиции путем перорального введения пациенту, например, пациенту-человеку детского возраста, по меньшей мере один раз в сутки, единичной дозы (посредством капсулы, саше, блистерной упаковки, пакета, пачки, бутылки или другого контейнера), содержащей порошкообразную форму фармацевтической композиции и/или мини-таблетки или множество мини-таблеток, где указанная единичная доза содержит твердую дисперсию по существу аморфного или аморфного Соединения 1, один или более наполнителей, подсластитель, разрыхлитель, необязательно увлажнитель, скользящее вещество и смазывающее вещество, где указанная единичная доза содержит по меньшей мере приблизительно 25 мг по существу аморфного или аморфного Соединения 1. В некоторых вариантах осуществления единичную дозу перорально вводят пациенту один раз в сутки. В некоторых других вариантах осуществления единичную дозу перорально вводят пациенту дважды в сутки, или каждые 12 часов.
[0063] Другой аспект настоящего изобретения относится к способу введения фармацевтической композиции путем перорального введения пациенту, например, пациенту-человеку детского возраста, по меньшей мере один раз в сутки, единичной дозы (посредством капсулы, саше, блистерной упаковки, пакета, пачки, бутылки или другого контейнера), содержащей порошкообразную форму фармацевтической композиции и/или мини-таблетку или множество мини-таблеток, где указанная единичная доза содержит твердую дисперсию по существу аморфного или аморфного Соединения 1, один или более наполнителей, подсластитель, разрыхлитель, необязательно увлажнитель, скользящее вещество и смазывающее вещество, где указанная единичная доза содержит по меньшей мере приблизительно 30 мг по существу аморфного или аморфного Соединения 1. В некоторых вариантах осуществления единичную дозу перорально вводят пациенту один раз в сутки. В некоторых других вариантах осуществления единичную дозу перорально вводят пациенту дважды в сутки, или каждые 12 часов.
[0064] Другой аспект настоящего изобретения относится к способу введения фармацевтической композиции путем перорального введения пациенту, например, пациенту-человеку детского возраста, по меньшей мере один раз в сутки, единичной дозы (посредством капсулы, саше, блистерной упаковки, пакета, пачки, бутылки или другого контейнера), содержащей порошкообразную форму фармацевтической композиции и/или мини-таблетку или множество мини-таблеток, где указанная единичная доза содержит твердую дисперсию по существу аморфного или аморфного Соединения 1, один или более наполнителей, подсластитель, разрыхлитель, необязательно увлажнитель, скользящее вещество и смазывающее вещество, где указанная единичная доза содержит по меньшей мере приблизительно 37,5 мг по существу аморфного или аморфного Соединения 1. В некоторых вариантах осуществления единичную дозу перорально вводят пациенту один раз в сутки. В некоторых других вариантах осуществления единичную дозу перорально вводят пациенту дважды в сутки, или каждые 12 часов.
[0065] Другой аспект настоящего изобретения относится к способу введения фармацевтической композиции путем перорального введения пациенту, например, пациенту-человеку детского возраста, по меньшей мере один раз в сутки, единичной дозы (посредством капсулы, саше, блистерной упаковки, пакета, пачки, бутылки или другого контейнера), содержащей порошкообразную форму фармацевтической композиции и/или мини-таблетку или множество мини-таблеток, где указанная единичная доза содержит твердую дисперсию по существу аморфного или аморфного Соединения 1, один или более наполнителей, подсластитель, разрыхлитель, необязательно увлажнитель, скользящее вещество и смазывающее вещество, где указанная единичная доза содержит по меньшей мере приблизительно 40 мг по существу аморфного или аморфного Соединения 1. В некоторых вариантах осуществления единичную дозу перорально вводят пациенту один раз в сутки. В некоторых других вариантах осуществления единичную дозу перорально вводят пациенту дважды в сутки, или каждые 12 часов.
[0066] Другой аспект настоящего изобретения относится к способу введения фармацевтической композиции путем перорального введения пациенту, например, пациенту-человеку детского возраста, по меньшей мере один раз в сутки, единичной дозы (посредством капсулы, саше, блистерной упаковки, пакета, пачки, бутылки или другого контейнера), содержащей порошкообразную форму фармацевтической композиции и/или мини-таблетку или множество мини-таблеток, где указанная единичная доза содержит твердую дисперсию по существу аморфного или аморфного Соединения 1, один или более наполнителей, подсластитель, разрыхлитель, необязательно увлажнитель, скользящее вещество и смазывающее вещество, где указанная единичная доза содержит по меньшей мере приблизительно 50 мг по существу аморфного или аморфного Соединения 1. В некоторых вариантах осуществления единичную дозу перорально вводят пациенту один раз в сутки. В некоторых других вариантах осуществления единичную дозу перорально вводят пациенту дважды в сутки, или каждые 12 часов.
[0067] Другой аспект настоящего изобретения относится к способу введения фармацевтической композиции путем перорального введения пациенту, например, пациенту-человеку детского возраста, по меньшей мере один раз в сутки, единичной дозы (посредством капсулы, саше, блистерной упаковки, пакета, пачки, бутылки или другого контейнера), содержащей порошкообразную форму фармацевтической композиции и/или мини-таблетку или множество мини-таблеток, где указанная единичная доза содержит твердую дисперсию по существу аморфного или аморфного Соединения 1, один или более наполнителей, подсластитель, разрыхлитель, необязательно увлажнитель, скользящее вещество и смазывающее вещество, где указанная единичная доза содержит по меньшей мере приблизительно 62,5 мг по существу аморфного или аморфного Соединения 1. В некоторых вариантах осуществления единичную дозу перорально вводят пациенту один раз в сутки. В некоторых других вариантах осуществления единичную дозу перорально вводят пациенту дважды в сутки, или каждые 12 часов.
[0068] Другой аспект настоящего изобретения относится к способу введения фармацевтической композиции путем перорального введения пациенту, например, пациенту-человеку детского возраста, по меньшей мере один раз в сутки, единичной дозы (посредством капсулы, саше, блистерной упаковки, пакета, пачки, бутылки или другого контейнера), содержащей порошкообразную форму фармацевтической композиции и/или мини-таблетку или множество мини-таблеток, где указанная единичная доза содержит твердую дисперсию по существу аморфного или аморфного Соединения 1, один или более наполнителей, подсластитель, разрыхлитель, необязательно увлажнитель, скользящее вещество и смазывающее вещество, где указанная единичная доза содержит по меньшей мере приблизительно 75 мг по существу аморфного или аморфного Соединения 1. В некоторых вариантах осуществления единичную дозу перорально вводят пациенту один раз в сутки. В некоторых других вариантах осуществления единичную дозу перорально вводят пациенту дважды в сутки, или каждые 12 часов.
[0069] Другой аспект настоящего изобретения относится к способу введения фармацевтической композиции путем перорального введения пациенту, например, пациенту-человеку детского возраста, по меньшей мере один раз в сутки, единичной дозы (посредством капсулы, саше, блистерной упаковки, пакета, пачки, бутылки или другого контейнера), содержащей порошкообразную форму фармацевтической композиции и/или мини-таблетку или множество мини-таблеток, где указанная единичная доза содержит твердую дисперсию по существу аморфного или аморфного Соединения 1, один или более наполнителей, подсластитель, разрыхлитель, необязательно увлажнитель, скользящее вещество и смазывающее вещество, где указанная единичная доза содержит по меньшей мере приблизительно 100 мг по существу аморфного или аморфного Соединения 1. В некоторых вариантах осуществления единичную дозу перорально вводят пациенту один раз в сутки. В некоторых других вариантах осуществления единичную дозу перорально вводят пациенту дважды в сутки.
[0070] Другой аспект настоящего изобретения относится к способу введения фармацевтической композиции путем перорального введения пациенту, например, пациенту-человеку детского возраста, по меньшей мере один раз в сутки, единичной дозы (посредством капсулы, саше, блистерной упаковки, пакета, пачки, бутылки или другого контейнера), содержащей порошкообразную форму фармацевтической композиции и/или мини-таблетку или множество мини-таблеток, где указанная единичная доза содержит твердую дисперсию по существу аморфного или аморфного Соединения 1, один или более наполнителей, подсластитель, разрыхлитель, необязательно увлажнитель, скользящее вещество и смазывающее вещество, где указанная единичная доза содержит по меньшей мере приблизительно 125 мг по существу аморфного или аморфного Соединения 1. В некоторых вариантах осуществления единичную дозу перорально вводят пациенту один раз в сутки. В некоторых других вариантах осуществления единичную дозу перорально вводят пациенту дважды в сутки.
[0071] Другой аспект настоящего изобретения относится к способу введения фармацевтической композиции путем перорального введения пациенту, например, пациенту-человеку детского возраста, по меньшей мере один раз в сутки, единичной дозы (посредством капсулы, саше, блистерной упаковки, пакета, пачки, бутылки или другого контейнера), содержащей порошкообразную форму фармацевтической композиции и/или мини-таблетку или множество мини-таблеток, где указанная единичная доза содержит твердую дисперсию по существу аморфного или аморфного Соединения 1, один или более наполнителей, подсластитель, разрыхлитель, необязательно увлажнитель, скользящее вещество и смазывающее вещество, где указанная единичная доза содержит по меньшей мере приблизительно 150 мг по существу аморфного или аморфного Соединения 1. В некоторых вариантах осуществления единичную дозу перорально вводят пациенту один раз в сутки. В некоторых других вариантах осуществления единичную дозу перорально вводят пациенту дважды в сутки.
[0072] Другой аспект настоящего изобретения относится к способу введения фармацевтической композиции путем перорального введения пациенту, например, пациенту-человеку детского возраста, по меньшей мере один раз в сутки, единичной дозы (посредством капсулы, саше, блистерной упаковки, пакета, пачки, бутылки или другого контейнера), содержащей порошкообразную форму фармацевтической композиции и/или мини-таблетку или множество мини-таблеток, где указанная единичная доза содержит твердую дисперсию по существу аморфного или аморфного Соединения 1, один или более наполнителей, подсластитель, разрыхлитель, необязательно увлажнитель, скользящее вещество и смазывающее вещество, где указанная единичная доза содержит по меньшей мере приблизительно 175 мг по существу аморфного или аморфного Соединения 1. В некоторых вариантах осуществления единичную дозу перорально вводят пациенту один раз в сутки. В некоторых других вариантах осуществления единичную дозу перорально вводят пациенту дважды в сутки.
[0073] Другой аспект настоящего изобретения относится к способу введения фармацевтической композиции путем перорального введения пациенту, например, пациенту-человеку детского возраста, по меньшей мере один раз в сутки, единичной дозы (посредством капсулы, саше, блистерной упаковки, пакета, пачки, бутылки или другого контейнера), содержащей порошкообразную форму фармацевтической композиции и/или мини-таблетку или множество мини-таблеток, где указанная единичная доза содержит твердую дисперсию по существу аморфного или аморфного Соединения 1, один или более наполнителей, подсластитель, разрыхлитель, необязательно увлажнитель, скользящее вещество и смазывающее вещество, где указанная единичная доза содержит по меньшей мере приблизительно 200 мг по существу аморфного или аморфного Соединения 1. В некоторых вариантах осуществления единичную дозу перорально вводят пациенту один раз в сутки. В некоторых других вариантах осуществления единичную дозу перорально вводят пациенту дважды в сутки.
[0074] Другой аспект настоящего изобретения относится к способу введения фармацевтической композиции путем перорального введения пациенту, например, пациенту-человеку детского возраста, по меньшей мере один раз в сутки, единичной дозы (посредством капсулы, саше, блистерной упаковки, пакета, пачки, бутылки или другого контейнера), содержащей порошкообразную форму фармацевтической композиции и/или мини-таблетку или множество мини-таблеток, где указанная единичная доза содержит твердую дисперсию по существу аморфного или аморфного Соединения 1, один или более наполнителей, подсластитель, разрыхлитель, необязательно увлажнитель, скользящее вещество и смазывающее вещество, где указанная единичная доза содержит по меньшей мере приблизительно 225 мг по существу аморфного или аморфного Соединения 1. В некоторых вариантах осуществления единичную дозу перорально вводят пациенту один раз в сутки. В некоторых других вариантах осуществления единичную дозу перорально вводят пациенту дважды в сутки.
[0075] Другой аспект настоящего изобретения относится к способу введения фармацевтической композиции путем перорального введения пациенту, например, пациенту-человеку детского возраста, по меньшей мере один раз в сутки, единичной дозы (посредством капсулы, саше, блистерной упаковки, пакета, пачки, бутылки или другого контейнера), содержащей порошкообразную форму фармацевтической композиции и/или мини-таблетку или множество мини-таблеток, где указанная единичная доза содержит твердую дисперсию по существу аморфного или аморфного Соединения 1, один или более наполнителей, подсластитель, разрыхлитель, необязательно увлажнитель, скользящее вещество и смазывающее вещество, где указанная единичная доза содержит по меньшей мере приблизительно 250 мг по существу аморфного или аморфного Соединения 1. В некоторых вариантах осуществления единичную дозу перорально вводят пациенту один раз в сутки. В некоторых других вариантах осуществления единичную дозу перорально вводят пациенту дважды в сутки.
[0076] Единичные дозированные формы, используемые в этом способе, содержат твердую дисперсию, содержащую по меньшей мере приблизительно 5 мг по существу аморфного или аморфного Соединения 1, по меньшей мере приблизительно 10 мг по существу аморфного или аморфного Соединения 1, по меньшей мере 12,5 мг по существу аморфного или аморфного Соединения 1, по меньшей мере 15 мг по существу аморфного или аморфного Соединения 1, по меньшей мере приблизительно 20 мг по существу аморфного или аморфного Соединения 1, по меньшей мере 25 мг по существу аморфного или аморфного Соединения 1, по меньшей мере приблизительно 30 мг по существу аморфного или аморфного Соединения 1, по меньшей мере 37,5 мг по существу аморфного или аморфного Соединения 1, по меньшей мере приблизительно 40 мг по существу аморфного или аморфного Соединения 1, по меньшей мере 50 мг по существу аморфного или аморфного Соединения 1, по меньшей мере 62,5 мг по существу аморфного или аморфного Соединения 1, по меньшей мере 75 мг по существу аморфного или аморфного Соединения 1, по меньшей мере 100 мг по существу аморфного или аморфного Соединения 1, по меньшей мере 125 мг по существу аморфного или аморфного Соединения 1, по меньшей мере 150 мг по существу аморфного или аморфного Соединения 1, по меньшей мере 175 мг по существу аморфного или аморфного Соединения 1, по меньшей мере 200 мг по существу аморфного или аморфного Соединения 1, по меньшей мере 225 мг по существу аморфного или аморфного Соединения 1, или по меньшей мере 250 мг по существу аморфного или аморфного Соединения 1. Некоторые единичные дозированные формы, используемые в этом способе, содержат твердую дисперсию, содержащую по меньшей мере от приблизительно 1 мг до приблизительно 250 мг по существу аморфного или аморфного Соединения 1 (включая все значения и интервалы, содержащиеся в этом диапазоне) в смеси с одним или более эксципиентами.
[0077] В другом аспекте настоящее изобретение относится к способу производства единичной дозированной формы, содержащей мини-таблетку или множество мини-таблеток, включающих фармацевтическую композицию, описанную в настоящей заявке. Указанный способ включает стадии
a) перемешивания твердой дисперсии по существу аморфного Соединения 1 или аморфного Соединения 1 и полимера, полимера, содержащего HPMCAS, со скользящим веществом, подсластителем и необязательно увлажнителем с получением первой смеси;
b) просеивания первой смеси;
c) перемешивания просеянной первой смеси в 20% просеянного смазывающего вещества с получением первой перемешанной смеси;
d) перемешивания просеянного наполнителя и просеянного разрыхлителя в первой перемешанной смеси с получением второй перемешанной смеси;
e) распределения второй перемешанной смеси с получением гомогенной смеси;
f) перемешивания 80% просеянного смазывающего вещества с гомогенной смесью с получением прессовочной смеси; и
g) прессования прессовочной смеси с получением мини-таблеток. В других вариантах осуществления мини-таблетки по настоящему изобретению могут быть получены в соответствии со следующими стадиями:
i) перемешивание твердой дисперсии по существу аморфного Соединения 1 или аморфного Соединения 1 и полимера, полимера, содержащего HPMCAS, PVP/VA или их сочетаний со скользящим веществом и подсластителем с получением первой смеси;
ii) просеивание первой смеси;
iii) перемешивание просеянной первой смеси;
iv) перемешивание просеянного наполнителя и просеянного разрыхлителя с первой перемешанной смесью с получением второй перемешанной смеси;
v) распределение второй перемешанной смеси с получением гомогенной смеси;
vi) перемешивание просеянного смазывающего вещества с гомогенной смесью с получением прессовочной смеси; и
vii) прессование прессовочной смеси с получением мини-таблетки.
[0078] Введение включает пероральное введение пациенту по меньшей мере один раз в сутки по меньшей мере одной единичной дозированной формы, содержащей твердую дисперсию по существу аморфного или аморфного Соединения 1, одного или более наполнителей, подсластитель, разрыхлитель, необязательно увлажнитель, скользящее вещество и смазывающее вещество, где по меньшей мере одна дозированная форма содержит по меньшей мере приблизительно 75 мг по существу аморфного или аморфного Соединения 1. В некоторых вариантах осуществления по меньшей мере одна дозированная форма содержит по меньшей мере приблизительно 75 мг по существу аморфного или аморфного Соединения 1.
[0079] В различных вариантах осуществления фармацевтическая композиция представляет собой порошок и дополнительно в составе капсулы или пачки. В других вариантах осуществления фармацевтическая композиция находится в составе твердой лекарственной формы, такой как одна или более мини-таблеток или гранул или пеллет, и необязательно заключена в капсулы, саше, блистерные упаковки, пакеты, пачки, бутылки или другой контейнер. Твердая лекарственная форма фармацевтической композиции или содержимое капсул или пачек затем может быть введена перорально пациенту один раз в сутки. Например, порошок фармацевтической композиции или мини-таблетки удаляют из капсулы или пачки, добавляют в пищу, а затем дают пациенту. Альтернативно, порошковую фармацевтическую композицию или мини-таблетки удаляют из капсулы или пачки, добавляют в пищу, перемешивают, а затем дают пациенту. Дополнительно порошковую композицию или мини-таблетки удаляют из капсулы или пачки, а затем дают пациенту, если пациент способен непосредственно принимать внутрь порошковую фармацевтическую композицию или мини-таблетки.
[0080] В одном аспекте настоящее изобретение включает фармацевтическую композицию, содержащую твердую дисперсию аморфного или по существу аморфного Соединения 1, один или более наполнителей, подсластитель, разрыхлитель, скользящее вещество и смазывающее вещество, и необязательно увлажнитель.
[0081] В одном варианте осуществления этого аспекта фармацевтическая композиция содержит от приблизительно 30 до приблизительно 50 процентов твердой дисперсии по массе композиции.
[0082] В одном варианте осуществления фармацевтическая композиция содержит приблизительно 35 процентов твердой дисперсии по массе композиции.
[0083] В другом варианте осуществления фармацевтическая композиция содержит приблизительно 47 процентов твердой дисперсии по массе композиции.
[0084] В одном варианте осуществления фармацевтическая композиция содержит приблизительно 46,9 процентов твердой дисперсии по массе композиции.
[0085] В одном варианте осуществления наполнитель содержит:
маннит, лактозу, сахарозу, декстрозу, мальтодекстрин, сорбит, ксилит, порошкообразную целлюлозу, многоатомные спирты, микрокристаллическую целлюлозу, силикатированную микрокристаллическую целлюлозу, ацетат целлюлозы, метилцеллюлозу, этилцеллюлозу, гидроксиэтилцеллюлозу, метилгидроксиэтилцеллюлозу, тальк, крахмал, прежелатинизированный крахмал, двухосновный фосфат кальция, сульфат кальция, карбонат кальция или их сочетания.
[0086] В другом варианте осуществления наполнитель содержит маннит, который находится в количестве от приблизительно 30 до приблизительно 80 процентов по массе композиции.
[0087] В дополнительном варианте осуществления наполнитель содержит маннит, который находится в количестве от приблизительно 42 до приблизительно 57,5 процентов по массе композиции.
[0088] В одном варианте осуществления подсластитель содержит:
глюкозу, сахарозу, мальтозу, маннозу, декстрозу, фруктозу, лактозу, трегалозу, мальтит, лактит, ксилит, сорбит, маннит, тагатозу, глицерин, эритрит, изомальт, мальтозу, сукралозу, аспартам, неотам, алитам, неогесперидин дигидрохалькон, цикламат, тауматин, ацесульфам калия, сахарин, сахарин натрия или их сочетания.
[0089] В другом варианте осуществления подсластитель содержит сукралозу, которая присутствует в количестве от приблизительно 0,1 до приблизительно 5 процентов по массе композиции.
[0090] В одном варианте осуществления разрыхлитель содержит: кроскармеллозу натрия, альгинат натрия, альгинат кальция, альгиновую кислоту, крахмал, прежелатинизированный крахмал, гликоляткрахмал натрия, поливинилпирролидон, сополимеры поливинилпирролидона, кросповидон, карбоксиметилцеллюлозу кальция, целлюлозу и ее производные, карбоксиметилцеллюлозу натрия, полисахарид сои, глины, камеди и ионобменную смолу, шипучую систему на основе пищевых кислот и компонент карбонат щелочей, бикарбонат натрия или их сочетания.
[0091] В дополнительном варианте осуществления разрыхлитель содержит кроскармеллозу натрия, которая присутствует в количестве от приблизительно 1,5 до приблизительно 8 процентов по массе композиции.
[0092] В одном варианте осуществления увлажнитель содержит: лаурилсульфат натрия, цетостеариловый спирт, цетомакрогол эмульгирующий воск, желатин, казеин, докузат натрия, хлорид бензалкония, стеарат кальция, полиэтиленгликоли, фосфаты, сложные эфиры жирных кислот полиоксиэтиленсорбитана, акациевую камедь, холестерин, трагакант, простые стеариловые эфиры полиоксиэтилена 20, простые алкильные эфиры полиоксиэтилена, производные полиоксиэтилена касторового масла, ПЭГилированные гидрогенизированные касторовые масла, сложные эфиры сорбитана жирных кислот, витамин E или производные токоферола, витамин E TPGS, сложные эфиры токоферила, лецитин, фосфолипиды и их производные, полоксамеры, стеариновую кислоту, олеиновую кислоту, олеиновый спирт, цетиловый спирт, моно- и диглицериды, сложные эфиры пропиленгликоля и жирных кислот, сложные эфиры глицерина и жирных кислот, этиленгликоль пальмитостеарат, полиоксилглицериды, пропиленгликоль монокаприлат, пропиленгликоль монолаурат, спирты алкиларилполиэфира и полиглицерилолеат или их сочетания.
[0093] В другом варианте осуществления увлажнитель содержит лаурилсульфат натрия, который присутствует в количестве приблизительно 2 или менее процентов по массе композиции.
[0094] В одном варианте осуществления скользящее вещество содержит тальк, коллоидный диоксид кремния, осажденный диоксид кремния, оксид магния, силикат магния, лейцин и крахмал.
[0095] В дополнительном варианте осуществления скользящее вещество содержит коллоидный диоксид кремния, который присутствует в количестве от приблизительно 0,1 до приблизительно 5 процентов по массе композиции.
[0096] В одном варианте осуществления смазывающее вещество содержит: тальк, жирную кислоту, стеариновую кислоту, стеарат магния, стеарат кальция, стеарат натрия, стеариновую кислоту, глицерилмоностеарат, лаурилсульфат натрия, стеарилфумарат натрия, гидрогенизированные масла, полиэтиленгликоль, спирт жирного ряда, сложный эфир жирной кислоты, глицерилбегенат, минеральное масло, растительное масло, лейцин, бензоат натрия, или их сочетания.
[0097] В дополнительном варианте осуществления смазывающее вещество содержит стеарат магния, который присутствует в количестве от приблизительно 0,1 до приблизительно 7 процентов по массе композиции.
[0098] В одном варианте осуществления твердая дисперсия содержит приблизительно 80 процентов аморфного Соединения 1 по массе твердой дисперсии и приблизительно 19,5 процентов HPMCAS по массе твердой дисперсии, и приблизительно 0,5 процентов SLS по массе дисперсии.
[0099] В другом аспекте настоящее изобретение включает фармацевтическую композицию, содержащую:
твердую дисперсию аморфного или по существу аморфного Соединения 1 в количестве от приблизительно 15 до приблизительно 47 процентов по массе фармацевтической композиции;
сукралозу в количестве приблизительно 2 процентов по массе фармацевтической композиции;
кроскармеллозу натрия в количестве от приблизительно 3 до приблизительно 6 процентов по массе фармацевтической композиции;
SLS в количестве от приблизительно 0 до приблизительно 0,5 процентов по массе фармацевтической композиции;
коллоидный диоксид кремния в количестве приблизительно 1 процента по массе фармацевтической композиции;
стеарат магния в количестве приблизительно 1,5 процентов по массе фармацевтической композиции; и
маннит в количестве от приблизительно 42 до приблизительно 77,5 процентов по массе фармацевтической композиции.
[00100] В другом аспекте настоящее изобретение включает фармацевтическую композицию, содержащую:
твердую дисперсию аморфного или по существу аморфного Соединения 1 в количестве от приблизительно 35 до приблизительно 47 процентов по массе фармацевтической композиции;
сукралозу в количестве приблизительно 2 процентов по массе фармацевтической композиции;
кроскармеллозу натрия в количестве от приблизительно 3 до приблизительно 6 процентов по массе фармацевтической композиции;
SLS в количестве от приблизительно 0 до приблизительно 0,5 процентов по массе фармацевтической композиции;
коллоидный диоксид кремния в количестве приблизительно 1 процента по массе фармацевтической композиции;
стеарат магния в количестве приблизительно 1,5 процентов по массе фармацевтической композиции; и
маннит в количестве от приблизительно 42 до приблизительно 57,5 процентов по массе фармацевтической композиции.
[00101] В одном варианте осуществления этого аспекта кроскармеллоза натрия присутствует в количестве приблизительно 5 процентов по массе фармацевтической композиции.
[00102] В другом варианте осуществления SLS присутствует в количестве приблизительно 0,5 процентов по массе фармацевтической композиции.
[00103] В одном варианте осуществления твердая дисперсия присутствует в количестве приблизительно 35 процентов по массе фармацевтической композиции.
[00104] В другом варианте осуществления твердая дисперсия присутствует в количестве приблизительно 47 процентов по массе фармацевтической композиции.
[00105] В другом аспекте настоящее изобретение включает фармацевтическую композицию, содержащую:
твердую дисперсию аморфного или по существу аморфного Соединения 1 в количестве приблизительно 35 процентов по массе фармацевтической композиции;
сукралозу в количестве приблизительно 2 процентов по массе фармацевтической композиции;
кроскармеллозу натрия в количестве приблизительно 6 процентов по массе фармацевтической композиции;
коллоидный диоксид кремния в количестве приблизительно 1 процента по массе фармацевтической композиции;
стеарат магния в количестве приблизительно 1,5 процентов по массе фармацевтической композиции;
маннит в количестве приблизительно 13,5 процентов по массе фармацевтической композиции; и
лактозу в количестве приблизительно 41 процент по массе фармацевтической композиции.
[00106] В одном варианте осуществления фармацевтическая композиция представляет собой единичную дозированную форму, содержащую одно или множество из гранул, пеллет, частиц или мини-таблеток, и где единичная дозированная форма содержит от приблизительно 1 мг до приблизительно 250 мг по существу аморфного или аморфного Соединения 1.
[00107] В дополнительном варианте осуществления единичная дозированная форма содержит от приблизительно 50 мг по существу аморфного или аморфного Соединения 1.
[00108] В другом варианте осуществления единичная дозированная форма содержит от приблизительно 75 мг по существу аморфного или аморфного Соединения 1.
[00109] В дополнительном варианте осуществления единичная дозированная форма содержит от приблизительно 25 до приблизительно 40 мини-таблеток.
[00110] В дополнительном варианте осуществления единичная дозированная форма содержит от приблизительно 1, 2, 3, 4 или 5 мини-таблеток.
[00111] В дополнительном варианте осуществления твердая дисперсия присутствует в количестве приблизительно 35 процентов по массе фармацевтической композиции, и единичная дозированная форма содержит 1, 2, 3, 4, или 5 мини-таблеток.
[00112] В дополнительном варианте осуществления твердая дисперсия присутствует в количестве приблизительно 35 процентов по массе фармацевтической композиции, и единичная дозированная форма содержит 1 мини-таблетку.
[00113] В дополнительном варианте осуществления единичная дозированная форма содержит от приблизительно 21 до приблизительно 52 мини-таблеток.
[00114] В дополнительном варианте осуществления твердая дисперсия присутствует в количестве приблизительно 35 процентов по массе фармацевтической композиции, и единичная дозированная форма содержит 5 мини-таблеток.
[00115] В дополнительном варианте осуществления твердая дисперсия присутствует в количестве приблизительно 35 процентов по массе фармацевтической композиции, и единичная дозированная форма содержит 13 мини-таблеток.
[00116] В дополнительном варианте осуществления твердая дисперсия присутствует в количестве приблизительно 35 процентов по массе фармацевтической композиции, и единичная дозированная форма содержит приблизительно 21 мини-таблетку.
[00117] В одном варианте осуществления твердая дисперсия присутствует в количестве приблизительно 35 процентов по массе фармацевтической композиции, и единичная дозированная форма содержит приблизительно 26 мини-таблеток.
[00118] В дополнительном варианте осуществления твердая дисперсия присутствует в количестве приблизительно 35 процентов по массе фармацевтической композиции, и единичная дозированная форма содержит приблизительно 39 мини-таблеток.
[00119] В дополнительном варианте осуществления твердая дисперсия присутствует в количестве приблизительно 35 процентов по массе фармацевтической композиции, и единичная дозированная форма содержит приблизительно 52 мини-таблетки.
[00120] В одном варианте осуществления фармацевтическая композиция представляет собой единичную дозированную форму, содержащую гранулу, пеллету или мини-таблетку, и где единичная дозированная форма содержит приблизительно 10 мг по существу аморфного или аморфного Соединения 1.
[00121] В дополнительном варианте осуществления твердая дисперсия присутствует в количестве приблизительно 47 процентов по массе фармацевтической композиции, и единичная дозированная форма представляет собой мини-таблетку, имеющую форму, которая представляет собой форму наподобие цилиндра, овала, конуса, сферы, эллипса, многоугольника или их сочетания, где мини-таблетка имеет наибольший размер или диаметр длиной приблизительно 4 мм.
[00122] В другом варианте осуществления твердая дисперсия присутствует в количестве приблизительно 35 процентов по массе фармацевтической композиции, и единичная дозированная форма представляет собой мини-таблетку, имеющую форму, которая представляет собой форму наподобие цилиндра, овала, конуса, сферы, эллипса, многоугольника или их сочетания, где мини-таблетка имеет наибольший размер или диаметр длиной приблизительно 4 мм.
[00123] В дополнительном варианте осуществления твердая дисперсия присутствует в количестве приблизительно 35 процентов по массе фармацевтической композиции, и единичная дозированная форма представляет собой мини-таблетку, имеющую форму, которая представляет собой форму наподобие цилиндра, овала, конуса, сферы, эллипса, многоугольника или их сочетания, где мини-таблетка имеет наибольший размер или диаметр длиной приблизительно 2 мм.
[00124] Другой аспект настоящего изобретения относится к способу введения фармацевтической композиции путем перорального введения пациенту по меньшей мере один раз в сутки по меньшей мере одной единичной дозированной формы, содержащей порошковую фармацевтическую композицию и/или твердую лекарственную форму фармацевтической композиции (например, мини-таблетку или множество мини-таблеток), содержащей твердую дисперсию по существу аморфного или аморфного Соединения 1, один или более наполнителей, подсластитель, разрыхлитель, необязательно увлажнитель, скользящее вещество и смазывающее вещество, где порошковая фармацевтическая композиция и/или твердая лекарственная форма фармацевтической композиции содержит до приблизительно 5 мг по существу аморфного или аморфного Соединения 1. Например, твердая дисперсия содержит 0,25 мг, 0,5 мг, 0,75 мг, 1 мг, 2 мг, 3 мг, 4 мг или 5 мг по существу аморфного или аморфного Соединения 1. В некоторых вариантах осуществления порошковую фармацевтическую композицию и/или твердую лекарственную форму фармацевтической композиции вводят перорально пациенту один раз в сутки. Например, порошковую фармацевтическую композицию или мини-таблетки удаляют из капсулы или пачки, добавляют в пищу, перемешивают, а затем кормят пациента.
[00125] Еще в одном аспекте настоящее изобретение относится к способу введения фармацевтической композиции путем перорального введения пациенту по меньшей мере один раз в сутки по меньшей мере одной единичной дозированной формы, содержащей порошковую фармацевтическую композицию, и/или твердой лекарственной формы фармацевтической композиции (например, мини-таблетку или множество мини-таблеток), содержащей твердую дисперсию по существу аморфного или аморфного Соединения 1, один или более наполнителей, подсластитель, разрыхлитель, необязательно увлажнитель, скользящее вещество и смазывающее вещество, где порошковая фармацевтическая композиция и/или твердая лекарственная форма фармацевтической композиции содержит до приблизительно 1 мг по существу аморфного или аморфного Соединения 1. В другом варианте осуществления твердая дисперсия содержит от приблизительно 0,1 мг до приблизительно 1 мг по существу аморфного или аморфного Соединения 1. В другом варианте осуществления твердая дисперсия содержит от приблизительно 0,1 мг до приблизительно 5 мг (включая все значения и диапазоны в этом интервале). В конкретном варианте осуществления твердая дисперсия содержит 0,25 мг, 0,5 мг, 0,75 мг или 1 мг по существу аморфного или аморфного Соединения 1. В некоторых вариантах осуществления настоящее изобретение относится к способу перорального введения фармацевтических композиций, описанных в настоящей заявке, по меньшей мере один раз в сутки. В других вариантах осуществления настоящее изобретение относится к способу перорального введения фармацевтической композиции, описанной в настоящей заявке, один раз в сутки. В некоторых вариантах осуществления настоящее изобретение относится к способу перорального введения фармацевтических композиций, описанных в настоящей заявке, по меньшей мере один раз в сутки. В некоторых вариантах осуществления настоящее изобретение относится к способу перорального введения фармацевтической композиции, описанной в настоящей заявке, два раза в сутки или большее количество раз в сутки.
[00126] В одном аспекте настоящее изобретение также относится к способу лечения или снижения тяжести заболевания у пациента, включающему введение указанному пациенту одной из композиций, описанных в настоящей заявке, и указанное заболевание выбрано из кистозного фиброза, астмы, индуцированной дымом ХОБЛ, хронического бронхита, риносинусита, констипации, панкреатита, недостаточности поджелудочной железы, мужского бесплодия, обусловленного врожденным двусторонним отсутствием семявыносящего протока (CBAVD), легочной болезни легкой степени тяжести, идиопатического панкреатита, аллергического бронхолегочного аспергиллеза (ABPA), болезни печени, наследственной эмфиземы, наследственного гемохроматоза, нарушений коагуляции-фибринолиза, таких как недостаточность белка С, наследственный ангионевротический отек типа 1, нарушений процессинга липидов, таких как семейная гиперхолестеринемия, хейломикронемия типа 1, абеталипопротеинемия, лизосомных болезней накопления, таких как болезнь клеточных включений/псевдо-Гурлера, мукополисахаридозы, болезнь Сандхоффа/Тея-Сакса, болезнь Криглера-Найяра II типа, полиэндокринопатия/гиперинсулинемия, сахарный диабет, карликовость лароновского типа, дефицит миелопероксидазы, первичный гипопаратиреоз, меланома, гликогеноз CDG 1 типа, врожденный гипертиреоз, несовершенный остеогенез, наследственная гипофибриногенемия, дефицит ACT, несахарный диабет (DI), нейрогипофизарный DI, нефрогенный DI, синдром Шарко-Мари-Тута, болезнь Пелицеуса-Мерцбахера, нейродегенеративных болезней, таких как болезнь Альцгеймера, болезнь Паркинсона, боковой амиотрофический склероз, прогрессирующий супрануклеарный паралич, болезнь Пика, некоторых неврологических расстройств, характеризующихся отложением полиглутамин-содержащих протеинов [в ядрах нейронов], таких как болезнь Хантингтона, спинально-мозжечковая атаксия I типа, спинально-бульбарная мышечная атрофия, дентаторубро-паллидолюисова атрофия и миотоническая дистрофия, а также губчатых энцефалопатий, таких как наследственная болезнь Крейцфельда-Якоба (вследствие нарушения процессинга прионного белка), болезнь Фабри, синдром Герстманна-Штраусслера-Шейнкера, COPD, болезнь сухих глаз, болезнь Шегрена, остеопороз, остеопения, болезнь Горхема, хлоридных каналопатий, таких как врожденная миотония (формы Томсона и Бекера), синдром Бартера III типа, болезнь Дента, эпилепсия, гиперэкплексия, лизосомная болезнь накопления, синдром Ангельмана и первичная цилиарная дискинезия (PCD), термин для унаследованных нарушений структуры и/или функции ресничного эпителия, включая PCD с полной инверсией внутренних органов (также известную как синдром Картагенера), PCD без полной инверсии внутренних органов и цилиарной аплазии.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
[00127] На фиг. 1 представлено схематичное изображение производства и стадий процесса, используемых для получения некоторых мини-таблеток, приводимых в качестве примера в соответствии с различными вариантами осуществления по настоящему изобретению.
[00128] На фиг. 2 представлено схематичное изображение производства и стадий процесса, используемых для получения других приводимых в качестве примера мини-таблеток в соответствии с различными вариантами осуществления по настоящему изобретению.
[00129] Эти фигуры представлены в качестве примера и не предназначены для ограничения изобретения.
ПОДРОБНОЕ ОПИСАНИЕ
[00130] Настоящее изобретение относится к фармацевтической композиции, содержащей твердую дисперсию N-[2,4-бис(1,1-диметилэтил)-5-гидроксифенил]-1,4-дигидро-4-оксохинолин-3-карбоксамида, способу получения фармацевтической композиции, содержащей N-[2,4-бис(1,1-диметилэтил)-5-гидроксифенил]-1,4-дигидро-4-оксохинолин-3-карбоксамид, и к способу введения фармацевтической композиции, содержащей твердую форму N-[2,4-бис(1,1-диметилэтил)-5-гидроксифенил]-1,4-дигидро-4-оксохинолин-3-карбоксамида.
I. ОПРЕДЕЛЕНИЯ
[00131] В контексте настоящего изобретения термин «активный фармацевтический ингредиент» или «API» относится к биологически активному соединению. Приводимые в качестве примера API включают CF потенциирующее средство (например, N-[2,4-бис(1,1-диметилэтил)-5-гидроксифенил]-1,4-дигидро-4-оксохинолин-3-карбоксамид).
[00132] В контексте настоящего изобретения термин «Соединение 1» используется взаимозаменяемо с «N-[2,4-бис(1,1-диметилэтил)-5-гидроксифенил]-1,4-дигидро-4-оксохинолин-3-карбоксамидом», который имеет следующую структуру:
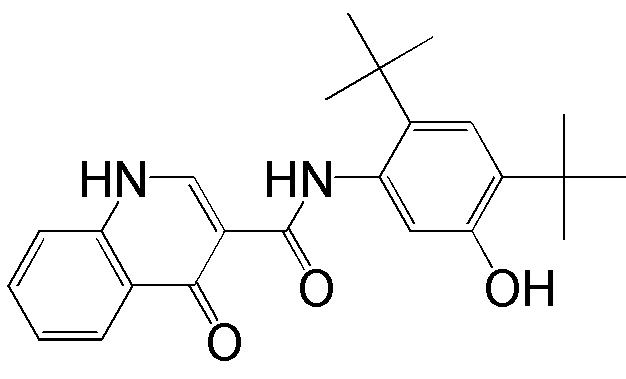
[00133] «Соединение 1» также означает таутомерные формы, такие как:
[00134] В контексте настоящего изобретения термин «аморфный» относится к твердому веществу, не имеющему дальнего порядка в положении его молекул. Аморфные твердые вещества обычно представляют собой переохлажденные жидкости, в которых молекулы расположены случайным образом, так, что не существует четко определенного расположения, например, молекулярной упаковки, и нет дальнего порядка. Аморфные твердые вещества обычно являются изотропными, то есть проявляют аналогичные свойства во всех направлениях и не имеют определенных температур плавления. Например, аморфное вещество представляет собой твердое вещество, не имеющее отчетливых характеристических кристаллических пиков на их дифракционных картинах порошкового рентгеноструктурного анализа (XRPD) (т.е., не является кристаллическим по определению с помощью XRPD). Вместо этого один или несколько широких пиков (например, ореолы) появляются на их XRPD картинах. Широкие пики являются характеристикой аморфного твердого вещества. Смотри US 2004/0006237 для сравнения XRPD аморфного вещества и кристаллического вещества.
[00135] В контексте настоящего изобретения термин «по существу аморфное» относится к твердому веществу, имеющему небольшой или не имеющему дальний порядок в положении его молекул. Например, по существу аморфные вещества имеют приблизительно менее 15% кристалличности (например, приблизительно менее 10% кристалличности или приблизительно менее 5% кристалличности). Также следует отметить, что термин «по существу аморфное» включает характеристику «аморфное», которая относится к веществам, не имеющим кристалличности (0%).
[00136] В контексте настоящего изобретения термин «дисперсия» относится к дисперсионной системе, в которой одно вещество, дисперсная фаза, распределено в дискретных единицах по второму веществу (диспергирующая фаза или носитель). Размер дисперсной фазы может значительно изменяться (например, одиночные молекулы, коллоидные частицы нанометровой размерности, до размера множества микрон). В основном, дисперсные фазы могут представлять собой твердые вещества, жидкости или газы. В случае твердой дисперсии как дисперсная, так и диспергирующая фазы являются твердыми веществами. В фармацевтических применениях твердая дисперсия может включать: аморфное лекарственное средство в аморфном полимере; аморфное лекарственное средство в кристаллическом полимере; кристаллическое лекарственное средство в аморфном полимере; или кристаллическое лекарственное средство в кристаллическом полимере. В данном изобретении твердая дисперсия может включать аморфное лекарственное средство в аморфном полимере или аморфное лекарственное средство в кристаллическом полимере. В некоторых вариантах осуществления твердая дисперсия включает полимер, составляющий дисперсную фазу, а лекарственное средство составляет диспергирующую фазу. Или твердая дисперсия включает лекарственное средство, составляющее дисперсную фазу, а полимер составляет диспергирующую фазу.
[00137] В контексте настоящего изобретения термин «твердая дисперсия» в основном относится к твердой дисперсии двух или более компонентов, обычно одного или более лекарственных средств (например, одного лекарственного средства (например, Соединения 1)) и полимера, но возможно содержание других компонентов, таких как поверхностно-активные вещества или другие фармацевтические эксципиенты, где лекарственное средство (средства) (например, Соединение 1) представляет собой по существу аморфное (например, имеющее приблизительно 15% или менее (например, приблизительно 10% или менее, или приблизительно 5% или менее)) кристаллическое лекарственное средство (например, N-[2,4-бис(1,1-диметилэтил)-5-гидроксифенил]-1,4-дигидро-4-оксохинолин-3-карбоксамид) или аморфное (т.е., некристаллическое лекарственное средство), и физическая стабильность и/или растворение и/или растворимость по существу аморфного или аморфного лекарственного средства усилена другими компонентами. Твердые дисперсии обычно включают соединение, диспергированное в соответствующей несущей среде, такой как твердофазный носитель. Например, носитель содержит полимер (например, водорастворимый полимер или частично водорастворимый полимер) и может включать необязательные эксципиенты, такие как функциональные эксципиенты (например, одно или более поверхностно-активных веществ) или нефункциональные эксципиенты (например, один или более наполнителей). Другой приводимой в качестве примера твердой дисперсией является копреципитат или корасплав N-[2,4-бис(1,1-диметилэтил)-5-гидроксифенил]-1,4-дигидро-4-оксохинолин-3-карбоксамида по меньшей мере с одним полимером.
[00138] «Копреципитат» представляет собой продукт после растворения лекарственного средства и полимера в растворителе или смеси растворителей с последующим удалением растворителя или смеси растворителей. Иногда полимер может быть суспендирован в растворителе или смеси растворителей. Растворитель или смесь растворителей включает органические растворители и свехкритические жидкости. «Корасплав» представляет собой продукт после нагревания лекарственного средства и полимера до плавления, необязательно в присутствии растворителя или смеси растворителей, с последующим смешением, удалением по меньшей мере части растворителя, если это возможно, и охлаждением до комнатной температуры с выбранной скоростью.
[00139] В контексте настоящего изобретения «кристалличность» относится к степени структурной упорядоченности в твердом веществе. Например, Соединение 1, которое по существу является аморфным, имеет приблизительно менее 15% кристалличности, или его твердотельная структура является кристаллической приблизительно менее 15%. В другом примере Соединение 1, которое является аморфным, имеет нулевую (0%) кристалличность.
[00140] В контексте настоящего изобретения «CF потенциирующее вещество» относится к соединению, которое проявляет биологическую активность, характеризуемую повышением функциональности воротного механизма мутантного белка CFTR, находящегося на клеточной поверхности до приблизительно уровней дикого типа (т.е., соединение, которое увеличивает или индуцирует активность каналов белка CFTR, расположенного на клеточной поверхности, приводя в результате к повышенной функциональной активности).
[00141] В контексте настоящего изобретения термин «CFTR корректор» относится к соединению, которое увеличивает или индуцирует количество функционально активного белка CFTR на клеточной поверхности, приводя в результате к повышенной функциональной активности.
[00142] В контексте настоящего изобретения «твердая лекарственная форма» включает капсулы, пачки, саше, пакеты, содержащие фармацевтическую композицию либо в форме порошка, либо в прессованной форме, такой как гранулы, пеллеты, частицы, мини-таблетки и подобное, твердая лекарственная форма содержит определенное количество Соединения 1.
[00143] В контексте настоящего изобретения «эксципиент» представляет собой неактивный ингредиент в фармацевтической композиции. Примеры эксципиентов включают наполнитель, подсластитель, разрыхлитель, скользящее вещество, смазывающее вещество и подобные.
[00144] В контексте настоящего изобретения «разрыхлитель» представляет собой эксципиент, который гидратирует фармацевтическую композицию и способствует диспергированию таблетки. Примеры разрыхлителей включают кроскармеллозу натрия и/или гликоляткрахмал натрия.
[00145] В контексте настоящего изобретения «разбавитель» или «наполнитель» представляет собой эксципиент, который способствует приданию фармацевтической композиции заданного объема. Примеры наполнителей включают маннит, целлюлозу, этилцеллюлозу, ацетат целлюлозы, карбонат кальция, картофельный крахмал, сорбит, многоатомные спирты, декстрозу или их сочетания.
[00146] В контексте настоящего изобретения «увлажнитель» представляет собой эксципиент, который придает фармацевтическим композициям повышенную растворимость и/или смачиваемость. Примеры увлажнителей включают лаурилсульфат натрия (SLS), стеарилфумарат натрия (SSF), полиоксиэтилен 20 сорбитанмоноолеат (например, Tween™) или любое их сочетание.
[00147] В контексте настоящего изобретения «подсластитель» представляет собой эксципиент, который придает фармацевтическим композициям сладкий вкус и/или маскирует другие неприятные вкусовые ощущения. Примеры подсластителей включают сукралозу, сорбит, ксилит и их сочетания.
[00148] В контексте настоящего изобретения «скользящее вещество» представляет собой эксципиент, который придает фармацевтическим композициям улучшенные свойства текучести. Примеры скользящих веществ включают коллоидный диоксид кремния, осажденный диоксид кремния и/или тальк.
[00149] В контексте настоящего изобретения «краситель» представляет собой эксципиент, который придает фармацевтическим композициям желаемый цвет. Примеры красителей включают коммерчески доступные пигменты, такие как FD&C Blue # 1 Aluminum Lake, FD&C Blue #2, другие цвета FD&C Blue, диоксид титана, оксид железа и/или их сочетания.
[00150] В контексте настоящего изобретения «смазывающее вещество» представляет собой эксципиент, который добавляют к фармацевтическим композициям, для минимизирования прилипания к поверхностям, в особенности, для фармацевтических композиций, которые подлежат прессованию в таблетки. Смазывающее вещество облегчает выталкивание таблетки фармацевтической композиции из пресс-формы. Примеры смазывающих веществ включают стеарат магния, стеариновую кислоту (стеарин), гидрогенизированное масло, стеарилфумарат натрия или любое их сочетание.
[00151] В контексте настоящего изобретения «средний диаметр частиц» представляет собой средний диаметр частиц, измеренный с использованием таких методов, как лазерное светорассеяние, анализ изображений или гранулометрический анализ.
[00152] В контексте настоящего изобретения «насыпная плотность» представляет собой массу частиц материала, деленную на общий объем, который занимают частицы. Общий объем заключает в себя объем частиц, объем пустот между частицами и внутренний объем пор. Объемная плотность не является внутренним свойством материала; она может изменяться в зависимости от того, каким образом обработан материал.
[00153] В контексте настоящего изобретения термин «фармацевтически приемлемая соль» относится к солям, которые, в пределах разумной медицинской оценки, являются подходящими для использования в контакте с тканями людей и низших животных без проявления неспецифической токсичности, раздражения, аллергической реакции и т.п., и отвечают разумному соотношению польза/риск. «Фармацевтически приемлемая соль» означает любую нетоксичную соль или соль сложного эфира соединения по данному изобретению, которая, после введения реципиенту, способна обеспечить, либо напрямую, либо опосредованно, соединение по данному изобретению или его способный ингибировать активный метаболит или остаток.
[00154] В контексте настоящего изобретения термин «мини-таблетка» является эквивалентом термину «гранула».
[00155] В контексте настоящего изобретения «CFTR» или «белок CFTR» означает белок регулятор трансмембранной проводимости при кистозном фиброзе.
[00156] В контексте настоящего изобретения «CFTR» или «ген CFTR» означает ген регулятора трансмембранной проводимости при кистозном фиброзе.
[00157] В контексте настоящего изобретения «мутации» могут относиться к мутациям в гене CFTR или белке CFTR. «Мутация CFTR» относится к мутации в гене CFTR, а «мутация CFTR» относится к мутации в белке CFTR. Генетический дефект или мутация, или изменение в нуклеотидах в гене, как правило, в результате приводит к мутации в белке CFTR, транслируемом из этого гена. Например, мутация G551D CFTR представляет собой мутацию или изменение в нуклеотидах гена CFTR, которое в результате приводит к мутации G551D CFTR в транслируемом белке CFTR, где аминокислота в положении 551 белка CFTR изменена с глицина (G) на аспарагиновую кислоту (D) вследствие мутации или изменения в нуклеотидах гена CFTR. Аналогично, ΔF508 или F508del представляет собой специфическую мутацию в белке CFTR. Мутация ΔF508 или F508del CFTR представляет собой делецию трех нуклеотидов в гене CFTR, который содержит кодон для аминокислоты фенилаланин в положении 508 белка CFTR, что в результате приводит к мутации ΔF508 или F508del CFTR или белку CFTR, который лишен этого конкретного фенилаланина.
[00158] Термин «мутация воротного механизма CFTR», используемый в контексте настоящего изобретения, означает мутацию CFTR, которая в результате приводит к продукции белка CFTR, для которого преобладающим дефектом является низкая способность к открытию канала по сравнению с нормальным CFTR (Van Goor, F., Hadida S. и Grootenhuis P., «Pharmacological Rescue of Mutant CFTR function for the Treatment of Cystic Fibrosis», Top. Med. Chem. 3:91-120 (2008)). Мутации воротного механизма включают, но не ограничиваются указанными, G551D, G178R, S549N, S549R, G551S, G970R, G1244E, S1251N, S1255P и G1349D.
[00159] Термин «фенотип остаточной функции» в контексте настоящего изобретения относится к наличию у CFTR остаточной функции. Другими словами, индивидуум, который демонстрирует фенотип остаточной функции, имеет остаточную функцию CFTR. Индивидуумы, которые имеют CFTR с остаточной функцией, например с мутацией R117H (вследствие либо дефекта воротного механизма, проводимости, либо количеств функционально активного белка CFTR), имеют тенденцию к позднему появлению клинических симптомов и легкому течению болезни. Многие из этих индивидуумов имеют доказательства либо достаточной функции поджелудочной железы, либо позднего проявления частичной недостаточности функции поджелудочной железы. Такие индивидуумы также имеют тенденцию к медленному прогрессированию синусно-пульмональных заболеваниий, запоздалому диагностированию и величине хлорида пота, которая является промежуточной между нормой и тяжелыми мутациями (McKone E.F., et al., «CFTR Genotype as a Predictor as a Predictor of Prognosis in Cystic Fibrosis», Chest., 130:1441-7 (2006); Kristidis, P., et al, «Genetic Determination of Exocrine Pancreatic Function in Cystic Fibrosis», Am. J. Hum. Genet., 50:1178-84 (1992); Kerem, E. и Kerem B, «Genotype-Phenotype Correlations in Cystic Fibrosis», Pediatr. Pulmonol., 22:387-95 (1996); Green, D.M., et al., «Mutations that Permit Residual CFTR Function Delay Acquisition of Multiple Respiratory Pathogens in CF Patients», Respir. Res., 11:140-(2010)).
[00160] Фармацевтически приемлемые соли хорошо известны из уровня техники. Например, S. M. Berge, et al. подробно описывает фармацевтически приемлемые соли в J. Pharmaceutical Sciences, 1977, 66, 1-19, включенном в настоящее описание в виде ссылки. Фармацевтически приемлемые соли соединений по данному изобретению включают фармацевтически приемлемые соли, полученные из подходящих неорганических и органических кислот и оснований. Примерами фармацевтически приемлемых, нетоксичных аддитивных солей кислоты являются соли аминогруппы, образованные с неорганическими кислотами, такими как хлороводородная кислота, бромоводородная кислота, фосфорная кислота, серная кислота и перхлорная кислота, или с органическими кислотами, такими как уксусная кислота, щавелевая кислота, малеиновая кислота, винная кислота, лимонная кислота, янтарная кислота или малоновая кислота, или путем использования других способов, используемых в данной области, такого как ионный обмен.
[00161] Другие фармацевтически приемлемые соли включают такие соли, как адипатные, альгинатные, аскорбатные, аспартатные, бензолсульфонатные, бензоатные, бисульфатные, боратные, бутиратные, камфоратные, камфорсульфонатные, цитратные, циклопентанпропионатные, диглюконатные, додецилсульфатные, эдисилатные (этандисульфонат), этансульфонатные, формиатные, фумаратные, глюкогептонатные, глицерофосфатные, глюконатные, гемисульфатные, гептаноатные, гексаноатные, гидройодиды, 2-гидрокси-этансульфонатные, лактобионатные, лактатные, лауратные, лаурилсульфатные, малатные, малеатные, малонатные, метансульфонатные, 2-нафталинсульфонатные, никотинатные, нитратные, олеатные, оксалатные, пальмитатные, памоатные, пектинатные, персульфатные, 3-фенилпропионатные, фосфатные, пикратные, пивалатные, пропионатные, стеаратные, сукцинатные, сульфатные, тартратные, тиоцианатные, п-толуолсульфонатные, ундеканоатные, валератные и т.п. Соли, полученные из подходящих оснований, включают соли щелочных металлов, щелочноземельных металлов, аммония и N+(C1-4алкил)4 соли. Кроме того, данное изобретение предусматривает кватернизацию любых основных азотсодержащих групп соединений, раскрытых в настоящем описании. С помощью такой кватернизации можно получить растворимые или диспергируемые в воде или масле продукты. Репрезентативные соли щелочных или щелочноземельных металлов включают натрий, литий, калий, кальций, магний и т.п. Другие фармацевтически приемлемые соли включают, когда это целесообразно, нетоксичные катионы аммония, четвертичного аммония и амина, полученные, используя противоионы, такие как галогенид, гидроксид, карбоксилат, сульфат, фосфат, нитрат, низший алкилсульфонат и арилсульфонат.
II. ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ
[00162] В одном аспекте настоящее изобретение относится к фармацевтической композиции, содержащей порошковую смесь, включающую в себя API, CF потенцирующее средство (например, твердую дисперсию Соединения 1). Как проиллюстрировано в настоящем описании, фармацевтическая композиция по настоящему изобретению может представлять собой порошковую смесь API, CF потенцирующего средства (например, твердую дисперсию Соединения 1) и одного или более эксципиентов, описанных в настоящей заявке. Альтернативно, фармацевтическая композиция может быть получена в виде единичной дозированной формы, содержащей порошковую смесь, или единичной дозированной формы, полученной таким образом, что она содержит прессованную твердую лекарственную форму порошковой смеси помимо одного или более дополнительных функциональных эксципиентов, например, необязательно увлажнителя и/или смазывающего вещества, для осуществления прессования порошковой смеси в гранулы, пеллеты, частицы или одну или более мини-таблетки, фармацевтическая композиция и/или единичная дозированная форма содержат определенные ингредиенты в заданных количествах. Фармацевтическая композиция может быть получена в виде единичной дозированной формы, например, таблетки, капсулы, саше, пастилок, блистерной упаковки и подобного, содержащей порошок и/или прессованную форму фармацевтической композиции по настоящему изобретению.
[00163] В одном варианте осуществления настоящее изобретение относится к фармацевтической композиции, содержащей твердую дисперсию по существу аморфного Соединения 1, где фармацевтическая композиция содержит до приблизительно 1 мг по существу аморфного Соединения 1. Например, твердая дисперсия содержит приблизительно 0,25 мг, приблизительно 0,5 мг, приблизительно 0,75 мг или приблизительно 1 мг по существу аморфного Соединения 1.
[00164] В одном варианте осуществления настоящее изобретение относится к фармацевтической композиции, содержащей твердую дисперсию по существу аморфного Соединения 1, где фармацевтическая композиция содержит до приблизительно 5 мг по существу аморфного Соединения 1. Например, фармацевтическая композиция содержит приблизительно 0,25 мг, 0,5 мг, приблизительно 0,75 мг, приблизительно 1 мг, приблизительно 2 мг, приблизительно 3 мг, приблизительно 4 мг или приблизительно 5 мг по существу аморфного Соединения 1.
[00165] В одном варианте осуществления настоящее изобретение относится к фармацевтической композиции, содержащей твердую дисперсию по существу аморфного Соединения 1, где фармацевтическая композиция содержит приблизительно 10 мг по существу аморфного Соединения 1.
[00166] В одном варианте осуществления настоящее изобретение относится к фармацевтической композиции, содержащей твердую дисперсию по существу аморфного Соединения 1, где фармацевтическая композиция содержит приблизительно 12,5 мг по существу аморфного Соединения 1.
[00167] В одном варианте осуществления настоящее изобретение относится к фармацевтической композиции, содержащей твердую дисперсию по существу аморфного Соединения 1, где твердая дисперсия содержит приблизительно 15 мг по существу аморфного Соединения 1.
[00168] В одном варианте осуществления настоящее изобретение относится к фармацевтической композиции, содержащей твердую дисперсию по существу аморфного Соединения 1, где твердая дисперсия содержит приблизительно 20 мг по существу аморфного Соединения 1.
[00169] В одном варианте осуществления настоящее изобретение относится к фармацевтической композиции, содержащей твердую дисперсию по существу аморфного Соединения 1, где твердая дисперсия содержит приблизительно 25 мг по существу аморфного Соединения 1.
[00170] В одном варианте осуществления настоящее изобретение относится к фармацевтической композиции, содержащей твердую дисперсию по существу аморфного Соединения 1, где твердая дисперсия содержит приблизительно 30 мг по существу аморфного Соединения 1.
[00171] В одном варианте осуществления настоящее изобретение относится к фармацевтической композиции, содержащей твердую дисперсию по существу аморфного Соединения 1, где твердая дисперсия содержит приблизительно 37,5 мг по существу аморфного Соединения 1.
[00172] В одном варианте осуществления настоящее изобретение относится к фармацевтической композиции, содержащей твердую дисперсию по существу аморфного Соединения 1, где твердая дисперсия содержит приблизительно 40 мг по существу аморфного Соединения 1.
[00173] В одном варианте осуществления настоящее изобретение относится к фармацевтической композиции, содержащей твердую дисперсию по существу аморфного Соединения 1, где твердая дисперсия содержит приблизительно 50 мг по существу аморфного Соединения 1.
[00174] В одном варианте осуществления настоящее изобретение относится к фармацевтической композиции, содержащей твердую дисперсию по существу аморфного Соединения 1, где твердая дисперсия содержит приблизительно 62,5 мг по существу аморфного Соединения 1.
[00175] В одном варианте осуществления настоящее изобретение относится к фармацевтической композиции, содержащей твердую дисперсию по существу аморфного Соединения 1, где твердая дисперсия содержит приблизительно 75 мг по существу аморфного Соединения 1.
[00176] В одном варианте осуществления настоящее изобретение относится к фармацевтической композиции, содержащей твердую дисперсию по существу аморфного Соединения 1, где фармацевтическая композиция содержит приблизительно 100 мг по существу аморфного Соединения 1.
[00177] В одном варианте осуществления настоящее изобретение относится к фармацевтической композиции, содержащей твердую дисперсию по существу аморфного Соединения 1, где твердая дисперсия содержит приблизительно 125 мг по существу аморфного Соединения 1.
[00178] В одном варианте осуществления настоящее изобретение относится к фармацевтической композиции, содержащей твердую дисперсию по существу аморфного Соединения 1, где твердая дисперсия приблизительно 150 мг по существу аморфного Соединения 1.
[00179] В одном варианте осуществления настоящее изобретение относится к фармацевтической композиции, содержащей твердую дисперсию по существу аморфного Соединения 1, где твердая дисперсия содержит приблизительно 175 мг по существу аморфного Соединения 1.
[00180] В одном варианте осуществления настоящее изобретение относится к фармацевтической композиции, содержащей твердую дисперсию по существу аморфного Соединения 1, где твердая дисперсия содержит приблизительно 200 мг по существу аморфного Соединения 1.
[00181] В одном варианте осуществления настоящее изобретение относится к фармацевтической композиции, содержащей твердую дисперсию по существу аморфного Соединения 1, где твердая дисперсия содержит приблизительно 225 мг по существу аморфного Соединения 1.
[00182] В одном варианте осуществления настоящее изобретение относится к фармацевтической композиции, содержащей твердую дисперсию по существу аморфного Соединения 1, где твердая дисперсия содержит приблизительно 250 мг по существу аморфного Соединения 1.
[00183] В одном варианте осуществления настоящее изобретение относится к фармацевтической композиции, содержащей твердую дисперсию аморфного Соединения 1, где твердая дисперсия содержит до приблизительно 1 мг аморфного Соединения 1. Например, твердая дисперсия содержит приблизительно 0,25 мг, приблизительно 0,5 мг, приблизительно 0,75 мг или приблизительно 1 мг аморфного Соединения 1.
[00184] В одном варианте осуществления настоящее изобретение относится к фармацевтической композиции, содержащей твердую дисперсию по существу аморфного Соединения 1, где твердая дисперсия содержит до приблизительно 5 мг аморфного Соединения 1. Например, твердая дисперсия содержит приблизительно 0,5 мг, приблизительно 0,75 мг, приблизительно 1 мг, приблизительно 2 мг, приблизительно 3 мг, приблизительно 4 мг или приблизительно 5 мг аморфного Соединения 1.
[00185] В одном варианте осуществления настоящее изобретение относится к фармацевтической композиции, содержащей твердую дисперсию аморфного Соединения 1, где твердая дисперсия содержит приблизительно 10 мг аморфного Соединения 1.
[00186] В одном варианте осуществления настоящее изобретение относится к фармацевтической композиции, содержащей твердую дисперсию аморфного Соединения 1, где твердая дисперсия содержит приблизительно 12,5 мг аморфного Соединения 1.
[00187] В одном варианте осуществления настоящее изобретение относится к фармацевтической композиции, содержащей твердую дисперсию аморфного Соединения 1, где твердая дисперсия содержит приблизительно 15 мг аморфного Соединения 1.
[00188] В одном варианте осуществления настоящее изобретение относится к фармацевтической композиции, содержащей твердую дисперсию аморфного Соединения 1, где твердая дисперсия содержит приблизительно 20 мг аморфного Соединения 1.
[00189] В одном варианте осуществления настоящее изобретение относится к фармацевтической композиции, содержащей твердую дисперсию аморфного Соединения 1, где твердая дисперсия содержит приблизительно 25 мг аморфного Соединения 1.
[00190] В одном варианте осуществления настоящее изобретение относится к фармацевтической композиции, содержащей твердую дисперсию аморфного Соединения 1, где твердая дисперсия содержит приблизительно 30 мг аморфного Соединения 1.
[00191] В одном варианте осуществления настоящее изобретение относится к фармацевтической композиции, содержащей твердую дисперсию аморфного Соединения 1, где твердая дисперсия содержит приблизительно 37,5 мг аморфного Соединения 1.
[00192] В одном варианте осуществления настоящее изобретение относится к фармацевтической композиции, содержащей твердую дисперсию аморфного Соединения 1, где твердая дисперсия содержит приблизительно 40 мг аморфного Соединения 1.
[00193] В одном варианте осуществления настоящее изобретение относится к фармацевтической композиции, содержащей твердую дисперсию аморфного Соединения 1, где твердая дисперсия содержит приблизительно 50 мг аморфного Соединения 1.
[00194] В одном варианте осуществления настоящее изобретение относится к фармацевтической композиции, содержащей твердую дисперсию аморфного Соединения 1, где твердая дисперсия содержит приблизительно 62,5 мг аморфного Соединения 1.
[00195] В одном варианте осуществления настоящее изобретение относится к фармацевтической композиции, содержащей твердую дисперсию аморфного Соединения 1, где твердая дисперсия содержит приблизительно 75 мг аморфного Соединения 1.
[00196] В одном варианте осуществления настоящее изобретение относится к фармацевтической композиции, содержащей твердую дисперсию аморфного Соединения 1, где твердая дисперсия содержит приблизительно 100 мг аморфного Соединения 1.
[00197] В одном варианте осуществления настоящее изобретение относится к фармацевтической композиции, содержащей твердую дисперсию аморфного Соединения 1, где твердая дисперсия содержит приблизительно 125 мг аморфного Соединения 1.
[00198] В одном варианте осуществления настоящее изобретение относится к фармацевтической композиции, содержащей твердую дисперсию аморфного Соединения 1, где твердая дисперсия содержит приблизительно 150 мг аморфного Соединения 1.
[00199] В одном варианте осуществления настоящее изобретение относится к фармацевтической композиции, содержащей твердую дисперсию аморфного Соединения 1, где твердая дисперсия содержит приблизительно 175 мг аморфного Соединения 1.
[00200] В одном варианте осуществления настоящее изобретение относится к фармацевтической композиции, содержащей твердую дисперсию аморфного Соединения 1, где твердая дисперсия содержит приблизительно 200 мг аморфного Соединения 1.
[00201] В одном варианте осуществления настоящее изобретение относится к фармацевтической композиции, содержащей твердую дисперсию аморфного Соединения 1, где твердая дисперсия содержит приблизительно 225 мг аморфного Соединения 1.
[00202] В одном варианте осуществления настоящее изобретение относится к фармацевтической композиции, содержащей твердую дисперсию аморфного Соединения 1, где твердая дисперсия содержит приблизительно 250 мг аморфного Соединения 1.
[00203] В одном варианте осуществления настоящее изобретение относится к фармацевтической композиции, содержащей твердую дисперсию по существу аморфного Соединения 1 и HPMCAS, где фармацевтическая композиция содержит до приблизительно 1 мг по существу аморфного Соединения 1. Например, твердая дисперсия содержит приблизительно 0,5 мг, приблизительно 0,75 мг или приблизительно 1 мг по существу аморфного Соединения 1.
[00204] В одном варианте осуществления настоящее изобретение относится к фармацевтической композиции, содержащей твердую дисперсию по существу аморфного Соединения 1 и HPMCAS, где твердая дисперсия содержит от приблизительно 0,1 мг до приблизительно 5 мг по существу аморфного Соединения 1. Например, твердая дисперсия содержит приблизительно 0,25 мг, приблизительно 0,5 мг, приблизительно 0,75 мг, приблизительно 1 мг, приблизительно 2 мг, приблизительно 3 мг, приблизительно 4 мг или приблизительно 5 мг по существу аморфного Соединения 1.
[00205] В одном варианте осуществления настоящее изобретение относится к фармацевтической композиции, содержащей твердую дисперсию по существу аморфного Соединения 1 и HPMCAS, где фармацевтическая композиция содержит приблизительно 10 мг по существу аморфного Соединения 1.
[00206] В одном варианте осуществления настоящее изобретение относится к фармацевтической композиции, содержащей твердую дисперсию по существу аморфного Соединения 1 и HPMCAS, где фармацевтическая композиция содержит приблизительно 12,5 мг по существу аморфного Соединения 1.
[00207] В одном варианте осуществления настоящее изобретение относится к фармацевтической композиции, содержащей твердую дисперсию по существу аморфного Соединения 1 и HPMCAS, где фармацевтическая композиция содержит приблизительно 15 мг по существу аморфного Соединения 1.
[00208] В одном варианте осуществления настоящее изобретение относится к фармацевтической композиции, содержащей твердую дисперсию по существу аморфного Соединения 1 и HPMCAS, где фармацевтическая композиция содержит приблизительно 20 мг по существу аморфного Соединения 1.
[00209] В одном варианте осуществления настоящее изобретение относится к фармацевтической композиции, содержащей твердую дисперсию по существу аморфного Соединения 1 и HPMCAS, где фармацевтическая композиция содержит приблизительно 25 мг по существу аморфного Соединения 1.
[00210] В одном варианте осуществления настоящее изобретение относится к фармацевтической композиции, содержащей твердую дисперсию по существу аморфного Соединения 1 и HPMCAS, где фармацевтическая композиция содержит приблизительно 30 мг по существу аморфного Соединения 1.
[00211] В одном варианте осуществления настоящее изобретение относится к фармацевтической композиции, содержащей твердую дисперсию по существу аморфного Соединения 1 и HPMCAS, где фармацевтическая композиция содержит приблизительно 35 мг по существу аморфного Соединения 1.
[00212] В одном варианте осуществления настоящее изобретение относится к фармацевтической композиции, содержащей твердую дисперсию по существу аморфного Соединения 1 и HPMCAS, где фармацевтическая композиция содержит приблизительно 37,5 мг по существу аморфного Соединения 1.
[00213] В одном варианте осуществления настоящее изобретение относится к фармацевтической композиции, содержащей твердую дисперсию по существу аморфного Соединения 1 и HPMCAS, где фармацевтическая композиция содержит приблизительно 40 мг по существу аморфного Соединения 1.
[00214] В одном варианте осуществления настоящее изобретение относится к фармацевтической композиции, содержащей твердую дисперсию по существу аморфного Соединения 1 и HPMCAS, где фармацевтическая композиция содержит приблизительно 45 мг по существу аморфного Соединения 1.
[00215] В одном варианте осуществления настоящее изобретение относится к фармацевтической композиции, содержащей твердую дисперсию по существу аморфного Соединения 1 и HPMCAS, где фармацевтическая композиция содержит приблизительно 50 мг по существу аморфного Соединения 1.
[00216] В одном варианте осуществления настоящее изобретение относится к фармацевтической композиции, содержащей твердую дисперсию по существу аморфного Соединения 1 и HPMCAS, где фармацевтическая композиция содержит приблизительно 62,5 мг по существу аморфного Соединения 1.
[00217] В одном варианте осуществления настоящее изобретение относится к фармацевтической композиции, содержащей твердую дисперсию по существу аморфного Соединения 1 и HPMCAS, где фармацевтическая композиция содержит приблизительно 75 мг по существу аморфного Соединения 1.
[00218] В одном варианте осуществления настоящее изобретение относится к фармацевтической композиции, содержащей твердую дисперсию по существу аморфного Соединения 1 и HPMCAS, где фармацевтическая композиция содержит приблизительно 100 мг по существу аморфного Соединения 1.
[00219] В одном варианте осуществления настоящее изобретение относится к фармацевтической композиции, содержащей твердую дисперсию по существу аморфного Соединения 1 и HPMCAS, где фармацевтическая композиция содержит приблизительно 125 мг по существу аморфного Соединения 1.
[00220] В одном варианте осуществления настоящее изобретение относится к фармацевтической композиции, содержащей твердую дисперсию по существу аморфного Соединения 1 и HPMCAS, где фармацевтическая композиция содержит приблизительно 150 мг по существу аморфного Соединения 1.
[00221] В одном варианте осуществления настоящее изобретение относится к фармацевтической композиции, содержащей твердую дисперсию по существу аморфного Соединения 1 и HPMCAS, где фармацевтическая композиция содержит приблизительно 175 мг по существу аморфного Соединения 1.
[00222] В одном варианте осуществления настоящее изобретение относится к фармацевтической композиции, содержащей твердую дисперсию по существу аморфного Соединения 1 и HPMCAS, где фармацевтическая композиция содержит приблизительно 200 мг по существу аморфного Соединения 1.
[00223] В одном варианте осуществления настоящее изобретение относится к фармацевтической композиции, содержащей твердую дисперсию по существу аморфного Соединения 1 и HPMCAS, где фармацевтическая композиция содержит приблизительно 225 мг по существу аморфного Соединения 1.
[00224] В одном варианте осуществления настоящее изобретение относится к фармацевтической композиции, содержащей твердую дисперсию по существу аморфного Соединения 1 и HPMCAS, где фармацевтическая композиция содержит приблизительно 250 мг по существу аморфного Соединения 1.
[00225] В одном варианте осуществления настоящее изобретение относится к фармацевтической композиции, содержащей твердую дисперсию аморфного Соединения 1 и HPMCAS, где твердая дисперсия содержит до приблизительно 5 мг аморфного Соединения 1. Например, твердая дисперсия содержит приблизительно 0,25 мг, приблизительно 0,5 мг, приблизительно 0,75 мг, приблизительно 1 мг, приблизительно 2 мг, приблизительно 3 мг, приблизительно 4 мг или приблизительно 5 мг аморфного Соединения 1.
[00226] В одном варианте осуществления настоящее изобретение относится к фармацевтической композиции, содержащей твердую дисперсию аморфного Соединения 1 и HPMCAS, где фармацевтическая композиция содержит приблизительно 10 мг аморфного Соединения 1.
[00227] В одном варианте осуществления настоящее изобретение относится к фармацевтической композиции, содержащей твердую дисперсию аморфного Соединения 1 и HPMCAS, где фармацевтическая композиция содержит приблизительно 12,5 мг аморфного Соединения 1.
[00228] В одном варианте осуществления настоящее изобретение относится к фармацевтической композиции, содержащей твердую дисперсию аморфного Соединения 1 и HPMCAS, где фармацевтическая композиция содержит приблизительно 15 мг аморфного Соединения 1.
[00229] В одном варианте осуществления настоящее изобретение относится к фармацевтической композиции, содержащей твердую дисперсию аморфного Соединения 1 и HPMCAS, где фармацевтическая композиция содержит приблизительно 20 мг аморфного Соединения 1.
[00230] В одном варианте осуществления настоящее изобретение относится к фармацевтической композиции, содержащей твердую дисперсию аморфного Соединения 1 и HPMCAS, где фармацевтическая композиция содержит приблизительно 25 мг аморфного Соединения 1.
[00231] В одном варианте осуществления настоящее изобретение относится к фармацевтической композиции, содержащей твердую дисперсию аморфного Соединения 1 и HPMCAS, где фармацевтическая композиция содержит приблизительно 30 мг аморфного Соединения 1.
[00232] В одном варианте осуществления настоящее изобретение относится к фармацевтической композиции, содержащей твердую дисперсию аморфного Соединения 1 и HPMCAS, где фармацевтическая композиция содержит приблизительно 35 мг аморфного Соединения 1.
[00233] В одном варианте осуществления настоящее изобретение относится к фармацевтической композиции, содержащей твердую дисперсию аморфного Соединения 1 и HPMCAS, где фармацевтическая композиция содержит приблизительно 37,5 мг аморфного Соединения 1.
[00234] В одном варианте осуществления настоящее изобретение относится к фармацевтической композиции, содержащей твердую дисперсию аморфного Соединения 1 и HPMCAS, где фармацевтическая композиция содержит приблизительно 40 мг аморфного Соединения 1.
[00235] В одном варианте осуществления настоящее изобретение относится к фармацевтической композиции, содержащей твердую дисперсию аморфного Соединения 1 и HPMCAS, где фармацевтическая композиция содержит приблизительно 45 мг аморфного Соединения 1.
[00236] В одном варианте осуществления настоящее изобретение относится к фармацевтической композиции, содержащей твердую дисперсию аморфного Соединения 1 и HPMCAS, где фармацевтическая композиция содержит приблизительно 50 мг аморфного Соединения 1.
[00237] В одном варианте осуществления настоящее изобретение относится к фармацевтической композиции, содержащей твердую дисперсию аморфного Соединения 1 и HPMCAS, где фармацевтическая композиция содержит приблизительно 62,5 мг аморфного Соединения 1.
[00238] В одном варианте осуществления настоящее изобретение относится к фармацевтической композиции, содержащей твердую дисперсию аморфного Соединения 1 и HPMCAS, где фармацевтическая композиция содержит приблизительно 75 мг аморфного Соединения 1.
[00239] В одном варианте осуществления настоящее изобретение относится к фармацевтической композиции, содержащей твердую дисперсию аморфного Соединения 1 и HPMCAS, где фармацевтическая композиция содержит приблизительно 100 мг аморфного Соединения 1.
[00240] В одном варианте осуществления настоящее изобретение относится к фармацевтической композиции, содержащей твердую дисперсию аморфного Соединения 1 и HPMCAS, где фармацевтическая композиция содержит приблизительно 125 мг аморфного Соединения 1.
[00241] В одном варианте осуществления настоящее изобретение относится к фармацевтической композиции, содержащей твердую дисперсию аморфного Соединения 1 и HPMCAS, где фармацевтическая композиция содержит приблизительно 150 мг аморфного Соединения 1.
[00242] В одном варианте осуществления настоящее изобретение относится к фармацевтической композиции, содержащей твердую дисперсию аморфного Соединения 1 и HPMCAS, где фармацевтическая композиция содержит приблизительно 175 мг аморфного Соединения 1.
[00243] В одном варианте осуществления настоящее изобретение относится к фармацевтической композиции, содержащей твердую дисперсию аморфного Соединения 1 и HPMCAS, где фармацевтическая композиция содержит приблизительно 200 мг аморфного Соединения 1.
[00244] В одном варианте осуществления настоящее изобретение относится к фармацевтической композиции, содержащей твердую дисперсию аморфного Соединения 1 и HPMCAS, где фармацевтическая композиция содержит приблизительно 225 мг аморфного Соединения 1.
[00245] В одном варианте осуществления настоящее изобретение относится к фармацевтической композиции, содержащей твердую дисперсию аморфного Соединения 1 и HPMCAS, где фармацевтическая композиция содержит приблизительно 250 мг аморфного Соединения 1.
[00246] В одном варианте осуществления настоящее изобретение относится к фармацевтической композиции, содержащей твердую дисперсию аморфного Соединения 1 и HPMCAS, где фармацевтическая композиция содержит от приблизительно 5 мг до приблизительно 250 мг Соединения 1.
[00247] В одном варианте осуществления настоящее изобретение относится к фармацевтической композиции, содержащей:
a. твердую дисперсию по существу аморфного Соединения 1 и полимер;
b. один или более наполнителей;
c. подсластитель;
d. скользящее вещество; и
e. смазывающее вещество,
где твердая дисперсия содержит до приблизительно 1 мг по существу аморфного Соединения 1.
[00248] В одном варианте осуществления настоящее изобретение относится к фармацевтической композиции, содержащей:
a. твердую дисперсию по существу аморфного Соединения 1 и полимер;
b. один или более наполнителей;
c. подсластитель;
d. скользящее вещество; и
e. смазывающее вещество,
где твердая дисперсия содержит до приблизительно 5 мг по существу аморфного Соединения 1.
[00249] В одном варианте осуществления настоящее изобретение относится к фармацевтической композиции, содержащей:
a. твердую дисперсию по существу аморфного Соединения 1 и полимер;
b. один или более наполнителей;
c. подсластитель;
d. скользящее вещество; и
e. смазывающее вещество,
где фармацевтическая композиция содержит приблизительно 5 мг по существу аморфного Соединения 1.
[00250] В одном варианте осуществления настоящее изобретение относится к фармацевтической композиции, содержащей:
a. твердую дисперсию по существу аморфного Соединения 1 и полимер;
b. один или более наполнителей;
c. подсластитель;
d. скользящее вещество; и
e. смазывающее вещество,
где фармацевтическая композиция содержит приблизительно 10 мг по существу аморфного Соединения 1.
[00251] В одном варианте осуществления настоящее изобретение относится к фармацевтической композиции, содержащей:
a. твердую дисперсию по существу аморфного Соединения 1 и полимер;
b. один или более наполнителей;
c. подсластитель;
d. скользящее вещество; и
e. смазывающее вещество,
где фармацевтическая композиция содержит приблизительно 12,5 мг по существу аморфного Соединения 1.
[00252] В одном варианте осуществления настоящее изобретение относится к фармацевтической композиции, содержащей:
a. твердую дисперсию по существу аморфного Соединения 1 и полимер;
b. один или более наполнителей;
c. подсластитель;
d. скользящее вещество; и
e. смазывающее вещество,
где фармацевтическая композиция содержит приблизительно 15 мг по существу аморфного Соединения 1.
[00253] В одном варианте осуществления настоящее изобретение относится к фармацевтической композиции, содержащей:
a. твердую дисперсию по существу аморфного Соединения 1 и полимер;
b. один или более наполнителей;
c. подсластитель;
d. скользящее вещество; и
e. смазывающее вещество,
где фармацевтическая композиция содержит приблизительно 20 мг по существу аморфного Соединения 1.
[00254] В одном варианте осуществления настоящее изобретение относится к фармацевтической композиции, содержащей:
a. твердую дисперсию по существу аморфного Соединения 1 и полимер;
b. один или более наполнителей;
c. подсластитель;
d. скользящее вещество; и
e. смазывающее вещество,
где фармацевтическая композиция содержит приблизительно 25 мг по существу аморфного Соединения 1.
[00255] В одном варианте осуществления настоящее изобретение относится к фармацевтической композиции, содержащей:
a. твердую дисперсию по существу аморфного Соединения 1 и полимер;
b. один или более наполнителей;
c. подсластитель;
d. скользящее вещество; и
e. смазывающее вещество,
где фармацевтическая композиция содержит приблизительно 30 мг по существу аморфного Соединения 1.
[00256] В одном варианте осуществления настоящее изобретение относится к фармацевтической композиции, содержащей:
a. твердую дисперсию по существу аморфного Соединения 1 и полимер;
b. один или более наполнителей;
c. подсластитель;
d. скользящее вещество; и
e. смазывающее вещество,
где фармацевтическая композиция содержит приблизительно 35 мг по существу аморфного Соединения 1.
[00257] В одном варианте осуществления настоящее изобретение относится к фармацевтической композиции, содержащей:
a. твердую дисперсию по существу аморфного Соединения 1 и полимер;
b. один или более наполнителей;
c. подсластитель;
d. скользящее вещество; и
e. смазывающее вещество,
где фармацевтическая композиция содержит приблизительно 37,5 мг по существу аморфного Соединения 1.
[00258] В одном варианте осуществления настоящее изобретение относится к фармацевтической композиции, содержащей:
a. твердую дисперсию по существу аморфного Соединения 1 и полимер;
b. один или более наполнителей;
c. подсластитель;
d. скользящее вещество; и
e. смазывающее вещество,
где фармацевтическая композиция содержит приблизительно 40 мг по существу аморфного Соединения 1.
[00259] В одном варианте осуществления настоящее изобретение относится к фармацевтической композиции, содержащей:
a. твердую дисперсию по существу аморфного Соединения 1 и полимер;
b. один или более наполнителей;
c. подсластитель;
d. скользящее вещество; и
e. смазывающее вещество,
где фармацевтическая композиция содержит приблизительно 45 мг по существу аморфного Соединения 1.
[00260] В одном варианте осуществления настоящее изобретение относится к фармацевтической композиции, содержащей:
a. твердую дисперсию по существу аморфного Соединения 1 и полимер;
b. один или более наполнителей;
c. подсластитель;
d. скользящее вещество; и
e. смазывающее вещество,
где фармацевтическая композиция содержит приблизительно 50 мг по существу аморфного Соединения 1.
[00261] В одном варианте осуществления настоящее изобретение относится к фармацевтической композиции, содержащей:
a. твердую дисперсию по существу аморфного Соединения 1 и полимер;
b. один или более наполнителей;
c. подсластитель;
d. скользящее вещество; и
e. смазывающее вещество,
где фармацевтическая композиция содержит приблизительно 62,5 мг по существу аморфного Соединения 1.
[00262] В другом варианте осуществления настоящее изобретение относится к фармацевтической композиции, содержащей:
a. твердую дисперсию по существу аморфного Соединения 1 и полимер;
b. один или более наполнителей;
c. подсластитель;
d. скользящее вещество; и
e. смазывающее вещество,
где фармацевтическая композиция содержит приблизительно 75 мг по существу аморфного Соединения 1.
[00263] В одном варианте осуществления настоящее изобретение относится к фармацевтической композиции, содержащей:
a. твердую дисперсию по существу аморфного Соединения 1 и полимер;
b. один или более наполнителей;
c. подсластитель;
d. скользящее вещество; и
e. смазывающее вещество,
где фармацевтическая композиция содержит приблизительно 100 мг по существу аморфного Соединения 1.
[00264] В одном варианте осуществления настоящее изобретение относится к фармацевтической композиции, содержащей:
a. твердую дисперсию по существу аморфного Соединения 1 и полимер;
b. один или более наполнителей;
c. подсластитель;
d. скользящее вещество; и
e. смазывающее вещество,
где фармацевтическая композиция содержит приблизительно 125 мг по существу аморфного Соединения 1.
[00265] В одном варианте осуществления настоящее изобретение относится к фармацевтической композиции, содержащей:
a. твердую дисперсию по существу аморфного Соединения 1 и полимер;
b. один или более наполнителей;
c. подсластитель;
d. скользящее вещество; и
e. смазывающее вещество,
где фармацевтическая композиция содержит приблизительно 150 мг по существу аморфного Соединения 1.
[00266] В одном варианте осуществления настоящее изобретение относится к фармацевтической композиции, содержащей:
a. твердую дисперсию по существу аморфного Соединения 1 и полимер;
b. один или более наполнителей;
c. подсластитель;
d. скользящее вещество; и
e. смазывающее вещество,
где фармацевтическая композиция содержит приблизительно 175 мг по существу аморфного Соединения 1.
[00267] В одном варианте осуществления настоящее изобретение относится к фармацевтической композиции, содержащей:
a. твердую дисперсию по существу аморфного Соединения 1 и полимер;
b. один или более наполнителей;
c. подсластитель;
d. скользящее вещество; и
e. смазывающее вещество,
где фармацевтическая композиция содержит приблизительно 200 мг по существу аморфного Соединения 1.
[00268] В одном варианте осуществления настоящее изобретение относится к фармацевтической композиции, содержащей:
a. твердую дисперсию по существу аморфного Соединения 1 и полимер;
b. один или более наполнителей;
c. подсластитель;
d. скользящее вещество; и
e. смазывающее вещество,
где фармацевтическая композиция содержит приблизительно 225 мг по существу аморфного Соединения 1.
[00269] В одном варианте осуществления настоящее изобретение относится к фармацевтической композиции, содержащей:
a. твердую дисперсию по существу аморфного Соединения 1 и полимер;
b. один или более наполнителей;
c. подсластитель;
d. скользящее вещество; и
e. смазывающее вещество,
где фармацевтическая композиция содержит приблизительно 250 мг по существу аморфного Соединения 1.
[00270] В дополнительном варианте осуществления один или более наполнителей - это двухкомпонентный наполнитель, содержащий смесь 2 наполнителей. В другом дополнительном варианте осуществления двухкомпонентный наполнитель представляет собой смесь маннита и другого наполнителя. В другом дополнительном варианте осуществления двухкомпонентный наполнитель представляет собой смесь лактозы и другого наполнителя. В другом дополнительном варианте осуществления двухкомпонентный наполнитель представляет собой смесь маннита и лактозы.
[00271] В другом дополнительном варианте осуществления фармацевтическая композиция содержит двухкомпонентный наполнитель, где двухкомпонентный наполнитель содержит маннит в количестве до приблизительно 100 масс.% двухкомпонентного наполнителя. Еще в одном дополнительном варианте осуществления фармацевтическая композиция содержит двухкомпонентный наполнитель, где двухкомпонентный наполнитель содержит лактозу в количестве до приблизительно 100 масс.% двухкомпонентного наполнителя. Еще в одном дополнительном варианте осуществления фармацевтическая композиция содержит двухкомпонентный наполнитель, где двухкомпонентный наполнитель содержит маннит в количестве до приблизительно 100 масс.% двухкомпонентного наполнителя и лактозу в таком количестве, что сумма количеств маннита и лактозы равна 100 масс.%.
[00272] В некоторых вариантах осуществления фармацевтическая композиция содержит двухкомпонентный наполнитель, где двухкомпонентный наполнитель содержит маннит и другой наполнитель в соотношении маннита к другому наполнителю приблизительно 3:1, в соотношении приблизительно 1:1 маннита к другому наполнителю, или в соотношении приблизительно 1:3 маннита к другому наполнителю. В некоторых вариантах осуществления фармацевтическая композиция содержит двухкомпонентный наполнитель, где двухкомпонентный наполнитель содержит лактозу и другой наполнитель в соотношении лактозы к другому наполнителю приблизительно 3:1, в соотношении лактозы к другому наполнителю приблизительно 1:1, или в соотношении лактозы к другому наполнителю приблизительно 1:3. В некоторых вариантах осуществления фармацевтическая композиция содержит двухкомпонентный наполнитель, где двухкомпонентный наполнитель содержит маннит и лактозу в соотношении приблизительно 3:1 маннита к лактозе, в соотношении приблизительно 1:1 маннита к лактозе, или в соотношении приблизительно 1:3 маннита к лактозе.
[00273] В одном варианте осуществления настоящее изобретение относится к фармацевтической композиции, содержащей:
a. твердую дисперсию аморфного Соединения 1 и полимер;
b. один или более наполнителей;
c. подсластитель;
d. скользящее вещество; и
e. смазывающее вещество,
где твердая дисперсия содержит до приблизительно 1 мг аморфного Соединения 1.
[00274] В одном варианте осуществления настоящее изобретение относится к фармацевтической композиции, содержащей:
a. твердую дисперсию аморфного Соединения 1 и полимер;
b. один или более наполнителей;
c. подсластитель;
d. скользящее вещество; и
e. смазывающее вещество,
где твердая дисперсия содержит до приблизительно 5 мг аморфного Соединения 1.
[00275] В одном варианте осуществления настоящее изобретение относится к фармацевтической композиции, содержащей:
a. твердую дисперсию аморфного Соединения 1 и полимер;
b. один или более наполнителей;
c. подсластитель;
d. скользящее вещество; и
e. смазывающее вещество,
где фармацевтическая композиция содержит приблизительно 10 мг аморфного Соединения 1.
[00276] В одном варианте осуществления настоящее изобретение относится к фармацевтической композиции, содержащей:
a. твердую дисперсию аморфного Соединения 1 и полимер;
b. один или более наполнителей;
c. подсластитель;
d. скользящее вещество; и
e. смазывающее вещество,
где фармацевтическая композиция содержит приблизительно 12,5 мг аморфного Соединения 1.
[00277] В одном варианте осуществления настоящее изобретение относится к фармацевтической композиции, содержащей:
a. твердую дисперсию аморфного Соединения 1 и полимер;
b. один или более наполнителей;
c. подсластитель;
d. скользящее вещество; и
e. смазывающее вещество,
где фармацевтическая композиция содержит приблизительно 15 мг аморфного Соединения 1.
[00278] В одном варианте осуществления настоящее изобретение относится к фармацевтической композиции, содержащей:
a. твердую дисперсию аморфного Соединения 1 и полимер;
b. один или более наполнителей;
c. подсластитель;
d. скользящее вещество; и
e. смазывающее вещество,
где фармацевтическая композиция содержит приблизительно 20 мг аморфного Соединения 1.
[00279] В одном варианте осуществления настоящее изобретение относится к фармацевтической композиции, содержащей:
a. твердую дисперсию аморфного Соединения 1 и полимер;
b. один или более наполнителей;
c. подсластитель;
d. скользящее вещество; и
e. смазывающее вещество,
где фармацевтическая композиция содержит приблизительно 25 мг аморфного Соединения 1.
[00280] В одном варианте осуществления настоящее изобретение относится к фармацевтической композиции, содержащей:
a. твердую дисперсию аморфного Соединения 1 и полимер;
b. один или более наполнителей;
c. подсластитель;
d. скользящее вещество; и
e. смазывающее вещество,
где фармацевтическая композиция содержит приблизительно 30 мг аморфного Соединения 1.
[00281] В одном варианте осуществления настоящее изобретение относится к фармацевтической композиции, содержащей:
a. твердую дисперсию аморфного Соединения 1 и полимер;
b. один или более наполнителей;
c. подсластитель;
d. скользящее вещество; и
e. смазывающее вещество,
где фармацевтическая композиция содержит приблизительно 35 мг аморфного Соединения 1.
[00282] В одном варианте осуществления настоящее изобретение относится к фармацевтической композиции, содержащей:
a. твердую дисперсию аморфного Соединения 1 и полимер;
b. один или более наполнителей;
c. подсластитель;
d. скользящее вещество; и
e. смазывающее вещество,
где фармацевтическая композиция содержит приблизительно 37,5 мг аморфного Соединения 1.
[00283] В одном варианте осуществления настоящее изобретение относится к фармацевтической композиции, содержащей:
a. твердую дисперсию аморфного Соединения 1 и полимер;
b. один или более наполнителей;
c. подсластитель;
d. скользящее вещество; и
e. смазывающее вещество,
где фармацевтическая композиция содержит приблизительно 40 мг аморфного Соединения 1.
[00284] В одном варианте осуществления настоящее изобретение относится к фармацевтической композиции, содержащей:
a. твердую дисперсию аморфного Соединения 1 и полимер;
b. один или более наполнителей;
c. подсластитель;
d. скользящее вещество; и
e. смазывающее вещество,
где фармацевтическая композиция содержит приблизительно 45 мг аморфного Соединения 1.
[00285] В одном варианте осуществления настоящее изобретение относится к фармацевтической композиции, содержащей:
a. твердую дисперсию аморфного Соединения 1 и полимер;
b. один или более наполнителей;
c. подсластитель;
d. скользящее вещество; и
e. смазывающее вещество,
где фармацевтическая композиция содержит приблизительно 50 мг аморфного Соединения 1.
[00286] В одном варианте осуществления настоящее изобретение относится к фармацевтической композиции, содержащей:
a. твердую дисперсию аморфного Соединения 1 и полимер;
b. один или более наполнителей;
c. подсластитель;
d. скользящее вещество; и
e. смазывающее вещество,
где фармацевтическая композиция содержит приблизительно 62,5 мг аморфного Соединения 1.
[00287] В другом варианте осуществления настоящее изобретение относится к фармацевтической композиции, содержащей:
a. твердую дисперсию аморфного Соединения 1 и полимер;
b. один или более наполнителей;
c. подсластитель;
d. скользящее вещество; и
e. смазывающее вещество,
где фармацевтическая композиция содержит приблизительно 75 мг аморфного Соединения 1.
[00288] В одном варианте осуществления настоящее изобретение относится к фармацевтической композиции, содержащей:
a. твердую дисперсию аморфного Соединения 1 и полимер;
b. один или более наполнителей;
c. подсластитель;
d. скользящее вещество; и
e. смазывающее вещество,
где фармацевтическая композиция содержит приблизительно 100 мг аморфного Соединения 1.
[00289] В одном варианте осуществления настоящее изобретение относится к фармацевтической композиции, содержащей:
a. твердую дисперсию аморфного Соединения 1 и полимер;
b. один или более наполнителей;
c. подсластитель;
d. скользящее вещество; и
e. смазывающее вещество,
где фармацевтическая композиция содержит приблизительно 125 мг аморфного Соединения 1.
[00290] В одном варианте осуществления настоящее изобретение относится к фармацевтической композиции, содержащей:
a. твердую дисперсию аморфного Соединения 1 и полимер;
b. один или более наполнителей;
c. подсластитель;
d. скользящее вещество; и
e. смазывающее вещество,
где фармацевтическая композиция содержит приблизительно 150 мг аморфного Соединения 1.
[00291] В одном варианте осуществления настоящее изобретение относится к фармацевтической композиции, содержащей:
a. твердую дисперсию аморфного Соединения 1 и полимер;
b. один или более наполнителей;
c. подсластитель;
d. скользящее вещество; и
e. смазывающее вещество,
где фармацевтическая композиция содержит приблизительно 175 мг аморфного Соединения 1.
[00292] В одном варианте осуществления настоящее изобретение относится к фармацевтической композиции, содержащей:
a. твердую дисперсию аморфного Соединения 1 и полимер;
b. один или более наполнителей;
c. подсластитель;
d. скользящее вещество; и
e. смазывающее вещество,
где фармацевтическая композиция содержит приблизительно 200 мг аморфного Соединения 1.
[00293] В одном варианте осуществления настоящее изобретение относится к фармацевтической композиции, содержащей:
a. твердую дисперсию аморфного Соединения 1 и полимер;
b. один или более наполнителей;
c. подсластитель;
d. скользящее вещество; и
e. смазывающее вещество,
где фармацевтическая композиция содержит приблизительно 225 мг аморфного Соединения 1.
[00294] В одном варианте осуществления настоящее изобретение относится к фармацевтической композиции, содержащей:
a. твердую дисперсию аморфного Соединения 1 и полимер;
b. один или более наполнителей;
c. подсластитель;
d. скользящее вещество; и
e. смазывающее вещество,
где фармацевтическая композиция содержит приблизительно 250 мг аморфного Соединения 1.
[00295] В дополнительном варианте осуществления один или более наполнителей представляет собой двухкомпонентный наполнитель, содержащий смесь 2 наполнителей. В другом дополнительном варианте осуществления двухкомпонентный наполнитель представляет собой смесь маннита и другого наполнителя. В другом дополнительном варианте осуществления двухкомпонентный наполнитель представляет собой смесь лактозы и другого наполнителя. В другом дополнительном варианте осуществления двухкомпонентный наполнитель представляет собой смесь маннита и лактозы.
[00296] В другом дополнительном варианте осуществления фармацевтическая композиция содержит двухкомпонентный наполнитель, где двухкомпонентный наполнитель содержит маннит в количестве до приблизительно 100 масс.% двухкомпонентного наполнителя. Еще в одном дополнительном варианте осуществления фармацевтическая композиция содержит двухкомпонентный наполнитель, где двухкомпонентный наполнитель содержит лактозу в количестве до приблизительно 100 масс.% двухкомпонентного наполнителя. Еще в одном дополнительном варианте осуществления фармацевтическая композиция содержит двухкомпонентный наполнитель, где двухкомпонентный наполнитель содержит маннит в количестве до приблизительно 100 масс.% двухкомпонентного наполнителя и лактозу в таком количестве, что сумма количеств маннита и лактозы равна 100 масс.%.
[00297] В некоторых вариантах осуществления фармацевтическая композиция содержит двухкомпонентный наполнитель, где двухкомпонентный наполнитель содержит маннит и другой наполнитель в соотношении маннита к другому наполнителю приблизительно 3:1, в соотношении маннита к другому наполнителю приблизительно 1:1, или в соотношении маннита к другому наполнителю приблизительно 1:3. В некоторых вариантах осуществления фармацевтическая композиция содержит двухкомпонентный наполнитель, где двухкомпонентный наполнитель содержит лактозу и другой наполнитель в соотношении лактозы к другому наполнителю приблизительно 3:1, в соотношении лактозы к другому наполнителю приблизительно 1:1, или в соотношении лактозы к другому наполнителю приблизительно 1:3. В некоторых вариантах осуществления фармацевтическая композиция содержит двухкомпонентный наполнитель, где двухкомпонентный наполнитель содержит маннит и лактозу в соотношении приблизительно 3:1 маннита к лактозе, в соотношении приблизительно 1:1 маннита к лактозе, или в соотношении приблизительно 1:3 маннита к лактозе.
[00298] В одном варианте осуществления настоящее изобретение относится к фармацевтической композиции, содержащей:
a. твердую дисперсию по существу аморфного Соединения 1 и HPMCAS;
b. один или более наполнителей;
c. подсластитель;
d. скользящее вещество; и
e. смазывающее вещество,
где твердая дисперсия содержит до приблизительно 1 мг по существу аморфного Соединения 1.
[00299] В одном варианте осуществления настоящее изобретение относится к фармацевтической композиции, содержащей:
a. твердую дисперсию по существу аморфного Соединения 1 и HPMCAS;
b. один или более наполнителей;
c. подсластитель;
d. скользящее вещество; и
e. смазывающее вещество,
где твердая дисперсия содержит до приблизительно 5 мг по существу аморфного Соединения 1.
[00300] В одном варианте осуществления настоящее изобретение относится к фармацевтической композиции, содержащей:
a. твердую дисперсию по существу аморфного Соединения 1 и HPMCAS;
b. один или более наполнителей;
c. подсластитель;
d. скользящее вещество; и
e. смазывающее вещество,
где фармацевтическая композиция содержит приблизительно 5 мг по существу аморфного Соединения 1.
[00301] В одном варианте осуществления настоящее изобретение относится к фармацевтической композиции, содержащей:
a. твердую дисперсию по существу аморфного Соединения 1 и HPMCAS;
b. один или более наполнителей;
c. подсластитель;
d. скользящее вещество; и
e. смазывающее вещество,
где фармацевтическая композиция содержит приблизительно 10 мг по существу аморфного Соединения 1.
[00302] В одном варианте осуществления настоящее изобретение относится к фармацевтической композиции, содержащей:
a. твердую дисперсию по существу аморфного Соединения 1 и HPMCAS;
b. один или более наполнителей;
c. подсластитель;
d. скользящее вещество; и
e. смазывающее вещество,
где фармацевтическая композиция содержит приблизительно 12,5 мг по существу аморфного Соединения 1.
[00303] В одном варианте осуществления настоящее изобретение относится к фармацевтической композиции, содержащей:
a. твердую дисперсию по существу аморфного Соединения 1 и HPMCAS;
b. один или более наполнителей;
c. подсластитель;
d. скользящее вещество; и
e. смазывающее вещество,
где фармацевтическая композиция содержит приблизительно 15 мг по существу аморфного Соединения 1.
[00304] В одном варианте осуществления настоящее изобретение относится к фармацевтической композиции, содержащей:
a. твердую дисперсию по существу аморфного Соединения 1 и HPMCAS;
b. один или более наполнителей;
c. подсластитель;
d. скользящее вещество; и
e. смазывающее вещество,
где фармацевтическая композиция содержит приблизительно 20 мг по существу аморфного Соединения 1.
[00305] В одном варианте осуществления настоящее изобретение относится к фармацевтической композиции, содержащей:
a. твердую дисперсию по существу аморфного Соединения 1 и HPMCAS;
b. один или более наполнителей;
c. подсластитель;
d. скользящее вещество; и
e. смазывающее вещество,
где фармацевтическая композиция содержит приблизительно 25 мг по существу аморфного Соединения 1.
[00306] В одном варианте осуществления настоящее изобретение относится к фармацевтической композиции, содержащей:
a. твердую дисперсию по существу аморфного Соединения 1 и HPMCAS;
b. один или более наполнителей;
c. подсластитель;
d. скользящее вещество; и
e. смазывающее вещество,
где фармацевтическая композиция содержит приблизительно 30 мг по существу аморфного Соединения 1.
[00307] В одном варианте осуществления настоящее изобретение относится к фармацевтической композиции, содержащей:
a. твердую дисперсию по существу аморфного Соединения 1 и HPMCAS;
b. один или более наполнителей;
c. подсластитель;
d. скользящее вещество; и
e. смазывающее вещество,
где фармацевтическая композиция содержит приблизительно 35 мг по существу аморфного Соединения 1.
[00308] В одном варианте осуществления настоящее изобретение относится к фармацевтической композиции, содержащей:
a. твердую дисперсию по существу аморфного Соединения 1 и HPMCAS;
b. один или более наполнителей;
c. подсластитель;
d. скользящее вещество; и
e. смазывающее вещество,
где фармацевтическая композиция содержит приблизительно 37,5 мг по существу аморфного Соединения 1.
[00309] В одном варианте осуществления настоящее изобретение относится к фармацевтической композиции, содержащей:
a. твердую дисперсию по существу аморфного Соединения 1 и HPMCAS;
b. один или более наполнителей;
c. подсластитель;
d. скользящее вещество; и
e. смазывающее вещество,
где фармацевтическая композиция содержит приблизительно 40 мг по существу аморфного Соединения 1.
[00310] В одном варианте осуществления настоящее изобретение относится к фармацевтической композиции, содержащей:
a. твердую дисперсию по существу аморфного Соединения 1 и HPMCAS;
b. один или более наполнителей;
c. подсластитель;
d. скользящее вещество; и
e. смазывающее вещество,
где фармацевтическая композиция содержит приблизительно 45 мг по существу аморфного Соединения 1.
[00311] В одном варианте осуществления настоящее изобретение относится к фармацевтической композиции, содержащей:
a. твердую дисперсию по существу аморфного Соединения 1 и HPMCAS;
b. один или более наполнителей;
c. подсластитель;
d. скользящее вещество; и
e. смазывающее вещество,
где фармацевтическая композиция содержит приблизительно 50 мг по существу аморфного Соединения 1.
[00312] В одном варианте осуществления настоящее изобретение относится к фармацевтической композиции, содержащей:
a. твердую дисперсию по существу аморфного Соединения 1 и HPMCAS;
b. один или более наполнителей;
c. подсластитель;
d. скользящее вещество; и
e. смазывающее вещество,
где фармацевтическая композиция содержит приблизительно 62,5 мг по существу аморфного Соединения 1.
[00313] В другом варианте осуществления настоящее изобретение относится к фармацевтической композиции, содержащей:
a. твердую дисперсию по существу аморфного Соединения 1 и HPMCAS;
b. один или более наполнителей;
c. подсластитель;
d. скользящее вещество; и
e. смазывающее вещество,
где фармацевтическая композиция содержит приблизительно 75 мг по существу аморфного Соединения 1.
[00314] В одном варианте осуществления настоящее изобретение относится к фармацевтической композиции, содержащей:
a. твердую дисперсию по существу аморфного Соединения 1 и HPMCAS;
b. один или более наполнителей;
c. подсластитель;
d. скользящее вещество; и
e. смазывающее вещество,
где фармацевтическая композиция содержит приблизительно 100 мг по существу аморфного Соединения 1.
[00315] В одном варианте осуществления настоящее изобретение относится к фармацевтической композиции, содержащей:
a. твердую дисперсию по существу аморфного Соединения 1 и HPMCAS;
b. один или более наполнителей;
c. подсластитель;
d. скользящее вещество; и
e. смазывающее вещество,
где фармацевтическая композиция содержит приблизительно 125 мг по существу аморфного Соединения 1.
[00316] В одном варианте осуществления настоящее изобретение относится к фармацевтической композиции, содержащей:
a. твердую дисперсию по существу аморфного Соединения 1 и HPMCAS;
b. один или более наполнителей;
c. подсластитель;
d. скользящее вещество; и
e. смазывающее вещество,
где фармацевтическая композиция содержит приблизительно 150 мг по существу аморфного Соединения 1.
[00317] В одном варианте осуществления настоящее изобретение относится к фармацевтической композиции, содержащей:
a. твердую дисперсию по существу аморфного Соединения 1 и HPMCAS;
b. один или более наполнителей;
c. подсластитель;
d. скользящее вещество; и
e. смазывающее вещество,
где фармацевтическая композиция содержит приблизительно 175 мг по существу аморфного Соединения 1.
[00318] В одном варианте осуществления настоящее изобретение относится к фармацевтической композиции, содержащей:
a. твердую дисперсию по существу аморфного Соединения 1 и HPMCAS;
b. один или более наполнителей;
c. подсластитель;
d. скользящее вещество; и
e. смазывающее вещество,
где фармацевтическая композиция содержит приблизительно 200 мг по существу аморфного Соединения 1.
[00319] В одном варианте осуществления настоящее изобретение относится к фармацевтической композиции, содержащей:
a. твердую дисперсию по существу аморфного Соединения 1 и HPMCAS;
b. один или более наполнителей;
c. подсластитель;
d. скользящее вещество; и
e. смазывающее вещество,
где фармацевтическая композиция содержит приблизительно 225 мг по существу аморфного Соединения 1.
[00320] В одном варианте осуществления настоящее изобретение относится к фармацевтической композиции, содержащей:
a. твердую дисперсию по существу аморфного Соединения 1 и HPMCAS;
b. один или более наполнителей;
c. подсластитель;
d. скользящее вещество; и
e. смазывающее вещество,
где фармацевтическая композиция содержит приблизительно 250 мг по существу аморфного Соединения 1.
[00321] В дополнительном варианте осуществления один или более наполнителей представляет собой двухкомпонентный наполнитель, содержащий смесь 2 наполнителей. В другом дополнительном варианте осуществления двухкомпонентный наполнитель представляет собой смесь маннита и другого наполнителя. В другом дополнительном варианте осуществления двухкомпонентный наполнитель представляет собой смесь лактозы и другого наполнителя. В другом дополнительном варианте осуществления двухкомпонентный наполнитель представляет собой смесь маннита и лактозы.
[00322] В другом дополнительном варианте осуществления фармацевтическая композиция содержит двухкомпонентный наполнитель, где двухкомпонентный наполнитель содержит маннит в количестве до приблизительно 100 масс.% двухкомпонентного наполнителя. Еще в одном дополнительном варианте осуществления фармацевтическая композиция содержит двухкомпонентный наполнитель, где двухкомпонентный наполнитель содержит лактозу в количестве до приблизительно 100 масс.% двухкомпонентного наполнителя. Еще в одном дополнительном варианте осуществления фармацевтическая композиция содержит двухкомпонентный наполнитель, где двухкомпонентный наполнитель содержит маннит в количестве до приблизительно 100 масс.% двухкомпонентного наполнителя и лактозу в таком количестве, что сумма количеств маннита и лактозы равна 100 масс.%.
[00323] В некоторых вариантах осуществления фармацевтическая композиция содержит двухкомпонентный наполнитель, где двухкомпонентный наполнитель содержит маннит и другой наполнитель в соотношении маннита к другому наполнителю приблизительно 3:1, в соотношении маннита к другому наполнителю приблизительно 1:1, или в соотношении маннита к другому наполнителю приблизительно 1:3. В некоторых вариантах осуществления фармацевтическая композиция содержит двухкомпонентный наполнитель, где двухкомпонентный наполнитель содержит лактозу и другой наполнитель в соотношении лактозы к другому наполнителю приблизительно 3:1, в соотношении лактозы к другому наполнителю приблизительно 1:1, или в соотношении лактозы к другому наполнителю приблизительно 1:3. В некоторых вариантах осуществления фармацевтическая композиция содержит двухкомпонентный наполнитель, где двухкомпонентный наполнитель содержит маннит и лактозу в соотношении приблизительно 3:1 маннита к лактозе, в соотношении приблизительно 1:1 маннита к лактозе, или в соотношении приблизительно 1:3 маннита к лактозе.
[00324] В одном варианте осуществления настоящее изобретение относится к фармацевтической композиции, содержащей:
a. твердую дисперсию аморфного Соединения 1 и HPMCAS;
b. один или более наполнителей;
c. подсластитель;
d. скользящее вещество; и
e. смазывающее вещество,
где твердая дисперсия содержит до приблизительно 1 мг аморфного Соединения 1.
[00325] В одном варианте осуществления настоящее изобретение относится к фармацевтической композиции, содержащей:
a. твердую дисперсию аморфного Соединения 1 и HPMCAS;
b. один или более наполнителей;
c. подсластитель;
d. скользящее вещество; и
e. смазывающее вещество,
где твердая дисперсия содержит до приблизительно 5 мг аморфного Соединения 1.
[00326] В одном варианте осуществления настоящее изобретение относится к фармацевтической композиции, содержащей:
a. твердую дисперсию аморфного Соединения 1 и HPMCAS;
b. один или более наполнителей;
c. подсластитель;
d. скользящее вещество; и
e. смазывающее вещество,
где фармацевтическая композиция содержит приблизительно 5 мг аморфного Соединения 1.
[00327] В одном варианте осуществления настоящее изобретение относится к фармацевтической композиции, содержащей:
a. твердую дисперсию аморфного Соединения 1 и HPMCAS;
b. один или более наполнителей;
c. подсластитель;
d. скользящее вещество; и
e. смазывающее вещество,
где фармацевтическая композиция содержит приблизительно 10 мг аморфного Соединения 1.
[00328] В одном варианте осуществления настоящее изобретение относится к фармацевтической композиции, содержащей:
a. твердую дисперсию аморфного Соединения 1 и HPMCAS;
b. один или более наполнителей;
c. подсластитель;
d. скользящее вещество; и
e. смазывающее вещество,
где фармацевтическая композиция содержит приблизительно 12,5 мг аморфного Соединения 1.
[00329] В одном варианте осуществления настоящее изобретение относится к фармацевтической композиции, содержащей:
a. твердую дисперсию аморфного Соединения 1 и HPMCAS;
b. один или более наполнителей;
c. подсластитель;
d. скользящее вещество; и
e. смазывающее вещество,
где фармацевтическая композиция содержит приблизительно 15 мг аморфного Соединения 1.
[00330] В одном варианте осуществления настоящее изобретение относится к фармацевтической композиции, содержащей:
a. твердую дисперсию аморфного Соединения 1 и HPMCAS;
b. один или более наполнителей;
c. подсластитель;
d. скользящее вещество; и
e. смазывающее вещество,
где фармацевтическая композиция содержит приблизительно 20 мг аморфного Соединения 1.
[00331] В одном варианте осуществления настоящее изобретение относится к фармацевтической композиции, содержащей:
a. твердую дисперсию аморфного Соединения 1 и HPMCAS;
b. один или более наполнителей;
c. подсластитель;
d. скользящее вещество; и
e. смазывающее вещество,
где фармацевтическая композиция содержит приблизительно 25 мг аморфного Соединения 1.
[00332] В одном варианте осуществления настоящее изобретение относится к фармацевтической композиции, содержащей:
a. твердую дисперсию аморфного Соединения 1 и HPMCAS;
b. один или более наполнителей;
c. подсластитель;
d. скользящее вещество; и
e. смазывающее вещество,
где фармацевтическая композиция содержит приблизительно 30 мг аморфного Соединения 1.
[00333] В одном варианте осуществления настоящее изобретение относится к фармацевтической композиции, содержащей:
a. твердую дисперсию аморфного Соединения 1 и HPMCAS;
b. один или более наполнителей;
c. подсластитель;
d. скользящее вещество; и
e. смазывающее вещество,
где фармацевтическая композиция содержит приблизительно 35 мг аморфного Соединения 1.
[00334] В одном варианте осуществления настоящее изобретение относится к фармацевтической композиции, содержащей:
a. твердую дисперсию аморфного Соединения 1 и HPMCAS;
b. один или более наполнителей;
c. подсластитель;
d. скользящее вещество; и
e. смазывающее вещество,
где фармацевтическая композиция содержит приблизительно 37,5 мг аморфного Соединения 1
[00335] В одном варианте осуществления настоящее изобретение относится к фармацевтической композиции, содержащей:
a. твердую дисперсию аморфного Соединения 1 и HPMCAS;
b. один или более наполнителей;
c. подсластитель;
d. скользящее вещество; и
e. смазывающее вещество,
где фармацевтическая композиция содержит приблизительно 40 мг аморфного Соединения 1.
[00336] В одном варианте осуществления настоящее изобретение относится к фармацевтической композиции, содержащей:
a. твердую дисперсию аморфного Соединения 1 и HPMCAS;
b. один или более наполнителей;
c. подсластитель;
d. скользящее вещество; и
e. смазывающее вещество,
где фармацевтическая композиция содержит приблизительно 45 мг аморфного Соединения 1.
[00337] В одном варианте осуществления настоящее изобретение относится к фармацевтической композиции, содержащей:
a. твердую дисперсию аморфного Соединения 1 и HPMCAS;
b. один или более наполнителей;
c. подсластитель;
d. скользящее вещество; и
e. смазывающее вещество,
где фармацевтическая композиция содержит приблизительно 50 мг аморфного Соединения 1.
[00338] В одном варианте осуществления настоящее изобретение относится к фармацевтической композиции, содержащей:
a. твердую дисперсию аморфного Соединения 1 и HPMCAS;
b. один или более наполнителей;
c. подсластитель;
d. скользящее вещество; и
e. смазывающее вещество,
где фармацевтическая композиция содержит приблизительно 62,5 мг аморфного Соединения 1.
[00339] В другом варианте осуществления настоящее изобретение относится к фармацевтической композиции, содержащей:
a. твердую дисперсию аморфного Соединения 1 и HPMCAS;
b. один или более наполнителей;
c. подсластитель;
d. скользящее вещество; и
e. смазывающее вещество,
где фармацевтическая композиция содержит приблизительно 75 мг аморфного Соединения 1.
[00340] В одном варианте осуществления настоящее изобретение относится к фармацевтической композиции, содержащей:
a. твердую дисперсию аморфного Соединения 1 и HPMCAS;
b. один или более наполнителей;
c. подсластитель;
d. скользящее вещество; и
e. смазывающее вещество,
где фармацевтическая композиция содержит приблизительно 100 мг аморфного Соединения 1.
[00341] В одном варианте осуществления настоящее изобретение относится к фармацевтической композиции, содержащей:
a. твердую дисперсию аморфного Соединения 1 и HPMCAS;
b. один или более наполнителей;
c. подсластитель;
d. скользящее вещество; и
e. смазывающее вещество,
где фармацевтическая композиция содержит приблизительно 125 мг аморфного Соединения 1.
[00342] В одном варианте осуществления настоящее изобретение относится к фармацевтической композиции, содержащей:
a. твердую дисперсию аморфного Соединения 1 и HPMCAS;
b. один или более наполнителей;
c. подсластитель;
d. скользящее вещество; и
e. смазывающее вещество,
где фармацевтическая композиция содержит приблизительно 150 мг аморфного Соединения 1.
[00343] В одном варианте осуществления настоящее изобретение относится к фармацевтической композиции, содержащей:
a. твердую дисперсию аморфного Соединения 1 и HPMCAS;
b. один или более наполнителей;
c. подсластитель;
d. скользящее вещество; и
e. смазывающее вещество,
где фармацевтическая композиция содержит приблизительно 175 мг аморфного Соединения 1.
[00344] В одном варианте осуществления настоящее изобретение относится к фармацевтической композиции, содержащей:
a. твердую дисперсию аморфного Соединения 1 и HPMCAS;
b. один или более наполнителей;
c. подсластитель;
d. скользящее вещество; и
e. смазывающее вещество,
где фармацевтическая композиция содержит приблизительно 200 мг аморфного Соединения 1.
[00345] В одном варианте осуществления настоящее изобретение относится к фармацевтической композиции, содержащей:
a. твердую дисперсию аморфного Соединения 1 и HPMCAS;
b. один или более наполнителей;
c. подсластитель;
d. скользящее вещество; и
e. смазывающее вещество,
где фармацевтическая композиция содержит приблизительно 225 мг аморфного Соединения 1.
[00346] В одном варианте осуществления настоящее изобретение относится к фармацевтической композиции, содержащей:
a. твердую дисперсию аморфного Соединения 1 и HPMCAS;
b. один или более наполнителей;
c. подсластитель;
d. скользящее вещество; и
e. смазывающее вещество,
где фармацевтическая композиция содержит приблизительно 250 мг аморфного Соединения 1.
[00347] В дополнительном варианте осуществления один или более наполнителей представляет собой двухкомпонентный наполнитель, содержащий смесь 2 наполнителей. В другом дополнительном варианте осуществления двухкомпонентный наполнитель представляет собой смесь маннита и другого наполнителя. В другом дополнительном варианте осуществления двухкомпонентный наполнитель представляет собой смесь лактозы и другого наполнителя. В другом дополнительном варианте осуществления двухкомпонентный наполнитель представляет собой смесь маннита и лактозы.
[00348] В другом дополнительном варианте осуществления фармацевтическая композиция содержит двухкомпонентный наполнитель, где двухкомпонентный наполнитель содержит маннит в количестве до приблизительно 100 масс.% двухкомпонентного наполнителя. Еще в одном дополнительном варианте осуществления фармацевтическая композиция содержит двухкомпонентный наполнитель, где двухкомпонентный наполнитель содержит лактозу в количестве до приблизительно 100 масс.% двухкомпонентного наполнителя. Еще в одном дополнительном варианте осуществления фармацевтическая композиция содержит двухкомпонентный наполнитель, где двухкомпонентный наполнитель содержит маннит в количестве до приблизительно 100 масс.% двухкомпонентного наполнителя и лактозу в таком количестве, что сумма количеств маннита и лактозы равна 100 масс.%.
[00349] В некоторых вариантах осуществления фармацевтическая композиция содержит двухкомпонентный наполнитель, где двухкомпонентный наполнитель содержит маннит и другой наполнитель в соотношении маннита к другому наполнителю приблизительно 3:1, в соотношении маннита к другому наполнителю приблизительно 1:1, или в соотношении маннита к другому наполнителю приблизительно 1:3. В некоторых вариантах осуществления фармацевтическая композиция содержит двухкомпонентный наполнитель, где двухкомпонентный наполнитель содержит лактозу и другой наполнитель в соотношении лактозы к другому наполнителю приблизительно 3:1, в соотношении лактозы к другому наполнителю приблизительно 1:1, или в соотношении лактозы к другому наполнителю приблизительно 1:3. В некоторых вариантах осуществления фармацевтическая композиция содержит двухкомпонентный наполнитель, где двухкомпонентный наполнитель содержит маннит и лактозу в соотношении приблизительно 3:1 маннита к лактозе, в соотношении приблизительно 1:1 маннита к лактозе, или в соотношении приблизительно 1:3 маннита к лактозе.
[00350] Подходящие твердые дисперсии Соединения 1, то есть N-[2,4-бис(1,1-диметилэтил)-5-гидроксифенил]-1,4-дигидро-4-оксохинолин-3-карбоксамида, включают без ограничения, дисперсии, описанные в публикациях РСТ WO 2007/079139, WO 2010/019239, WO 2011/019413, US 2010/0074949, US 2010/0256184 и US 2011/0064811, которые таким образом включены посредством ссылки в полном объеме.
[00351] В одном варианте осуществления фармацевтическая композиция по настоящему изобретению содержит твердую дисперсию Соединения 1. Например, твердая дисперсия содержит по существу аморфное Соединение 1, где Соединение 1 является кристаллическим приблизительно менее 15% (например, приблизительно менее 10% или приблизительно менее 5%), и по меньшей мере один полимер. В другом примере твердая дисперсия содержит аморфное Соединение 1, то есть Соединение 1 имеет приблизительно 0% кристалличности. Концентрация Соединения 1 в твердой дисперсии зависит от нескольких факторов, таких как количество фармацевтической композиции, необходимое для обеспечения желаемого количества Соединения 1 и желаемый профиль растворения фармацевтической композиции.
[00352] Полимеры, используемые в таких твердых дисперсиях, являются инертными, фармацевтически приемлемыми полимерами, которые по меньшей мере частично являются растворимыми в воде или биологических жидкостях. Полимеры могут включать гомополимеры (например, полисахариды) или сополимеры (например, блок-сополимеры). В одном примере твердая дисперсия содержит по существу аморфный или аморфный N-[2,4-бис(1,1-диметилэтил)-5-гидроксифенил]-1,4-дигидро-4-оксохинолин-3-карбоксамид и по меньшей мере один полимер, независимо выбранный из гидроксипропилметилцеллюлозы (HPMC), гидроксипропилметилцеллюлозы ацетат сукцината (HPMCAS), сополимера поливинилпирролидона/винилацетата (PVP/VA), поливинилпирролидона (PVP), сополимеров метакриловой кислоты/метакрилата, гидроксипропилцеллюлозы (HPC) или любого их сочетания. В другом примере твердая дисперсия содержит по существу аморфный или аморфный N-[2,4-бис(1,1-диметилэтил)-5-гидроксифенил]-1,4-дигидро-4-оксохинолин-3-карбоксамид и HPMCAS или PVP/VA.
[00353] В другом варианте осуществления фармацевтическая композиция содержит твердую дисперсию, которая содержит по существу аморфное Соединение 1 и HPMCAS, где твердая дисперсия имеет средний диаметр частиц, измеренный с помощью светорассеяния (например, используя Malvern Mastersizer, доступный от компании Malvern Instruments в Англии), приблизительно более 5 мкм (например, приблизительно более 6 мкм, приблизительно более 7 мкм, приблизительно более 8 мкм или приблизительно более 10 мкм). Например, фармацевтическая композиция содержит твердую дисперсию, которая содержит аморфное Соединение 1 и HPMCAS, где твердая дисперсия имеет средний диаметр частиц, измеренный с помощью светорассеяния, приблизительно более 5 мкм (например, приблизительно более 6 мкм, приблизительно более 7 мкм, приблизительно более 8 мкм или приблизительно более 10 мкм). В другом примере фармацевтическая композиция содержит твердую дисперсию, содержащую по существу аморфное Соединение 1 и HPMCAS, где твердая дисперсия имеет средний диаметр частиц, измеренный с помощью светорассеяния, от приблизительно 7 мкм до приблизительно 25 мкм. Например, фармацевтическая композиция содержит твердую дисперсию, содержащую аморфное Соединение 1 и HPMCAS, где твердая дисперсия имеет средний диаметр частиц, измеренный с помощью светорассеяния, от приблизительно 7 мкм до приблизительно 25 мкм. Еще в одном примере фармацевтическая композиция содержит твердую дисперсию, содержащую по существу аморфное Соединение 1 и HPMCAS, где твердая дисперсия имеет средний диаметр частиц, измеренный с помощью светорассеяния, от приблизительно 10 мкм до приблизительно 35 мкм. Например, фармацевтическая композиция содержит твердую дисперсию, содержащую аморфное Соединение 1 и HPMCAS, где твердая дисперсия имеет средний диаметр частиц, измеренный с помощью светорассеяния, от приблизительно 10 мкм до приблизительно 35 мкм.
[00354] Например, фармацевтическая композиция содержит твердую дисперсию, содержащую аморфное Соединение 1 и HPMCAS, где твердая дисперсия имеет средний диаметр частиц, измеренный с помощью светорассеяния, от приблизительно 10 мкм до приблизительно 100 мкм.
[00355] Например, фармацевтическая композиция содержит твердую дисперсию, содержащую аморфное Соединение 1 и HPMCAS, где твердая дисперсия имеет средний диаметр частиц, измеренный с помощью светорассеяния, от приблизительно 50 мкм до приблизительно 150 мкм.
[00356] Например, фармацевтическая композиция содержит твердую дисперсию, содержащую аморфное Соединение 1 и HPMCAS, где твердая дисперсия имеет средний диаметр частиц, измеренный с помощью светорассеяния, от приблизительно 100 мкм до приблизительно 200 мкм.
[00357] Например, фармацевтическая композиция содержит твердую дисперсию, содержащую аморфное Соединение 1 и HPMCAS, где твердая дисперсия имеет средний диаметр частиц, измеренный с помощью светорассеяния, от приблизительно 150 мкм до приблизительно 300 мкм.
[00358] В другом примере фармацевтическая композиция содержит твердую дисперсию, содержащую по существу аморфное Соединение 1 и HPMCAS, где твердая дисперсия имеет объемную плотность приблизительно 0,10 г/куб.см или более (например, 0,15 г/куб.см или более, 0,17 г/куб.см или более). Например, фармацевтическая композиция содержит твердую дисперсию, содержащую аморфное Соединение 1 и HPMCAS, где твердая дисперсия имеет объемную плотность приблизительно 0,10 г/куб.см или более (например, 0,15 г/куб.см или более, 0,17 г/куб.см или более). В другом примере фармацевтическая композиция содержит твердую дисперсию, которая содержит по существу аморфное Соединение 1 и HPMCAS, где твердая дисперсия имеет объемную плотность от приблизительно 0,10 г/куб.см до приблизительно 0,45 г/куб.см (например, от приблизительно 0,15 г/куб.см до приблизительно 0,42 г/куб.см, или от приблизительно 0,17 г/куб.см до приблизительно 0,40 г/куб.см). Еще в одном примере фармацевтическая композиция содержит твердую дисперсию которая включает аморфное Соединение 1 и HPMCAS, где твердая дисперсия имеет объемную плотность от приблизительно 0,10 г/куб.см до приблизительно 0,45 г/куб.см (например, от приблизительно 0,15 г/куб.см до приблизительно 0,42 г/куб.см, или от приблизительно 0,17 г/куб.см до приблизительно 0,40 г/куб.см). В другом примере фармацевтическая композиция содержит твердую дисперсию, которая содержит по существу аморфное Соединение 1 и HPMCAS, где твердая дисперсия имеет объемную плотность от приблизительно 0,10 г/куб.см до приблизительно 0,45 г/куб.см (например, от приблизительно 0,15 г/куб.см до приблизительно 0,42 г/куб.см, или от приблизительно 0,17 г/куб.см до приблизительно 0,40 г/куб.см). Например, фармацевтическая композиция включает твердую дисперсию, которая содержит аморфное Соединение 1 и HPMCAS, где твердая дисперсия имеет объемную плотность от приблизительно 0,10 г/куб.см до приблизительно 0,45 г/куб.см (например, от приблизительно 0,15 г/куб.см до приблизительно 0,42 г/куб.см, или от приблизительно 0,17 г/куб.см до приблизительно 0,40 г/куб.см).
[00359] Альтернативные твердые дисперсии содержат по существу аморфное или аморфное Соединение 1 и HPMCAS, где по существу аморфное Соединение 1 или аморфное Соединение 1 присутствует в количестве по меньшей мере 20 масс.% (например, по меньшей мере 40 масс.%, по меньшей мере 45 масс.%, по меньшей мере 49 масс.% или по меньшей мере 50 масс.%) по массе твердой дисперсии. В некоторых вариантах осуществления твердая дисперсия содержит HPMCAS и от приблизительно 20 масс.% до приблизительно 99 масс.%, включая все значения и интервалы, содержащиеся в этом диапазоне, (например, от приблизительно 40 масс.% до приблизительно 90 масс.%, от приблизительно 42 масс.% до приблизительно 88 масс.%, от приблизительно 45 масс.% до приблизительно 85 масс.% или от приблизительно 50 масс.% до приблизительно 80 масс.%) по существу аморфного или аморфного Соединения 1 по массе твердой дисперсии. Например, твердая дисперсия содержит HPMCAS и от приблизительно 40 масс.% до приблизительно 60 масс.%, включая все значения и интервалы, содержащиеся в этом диапазоне, (например, от приблизительно 42 масс.% до приблизительно 57 масс.%, от приблизительно 45 масс.% до приблизительно 55 масс.% или от приблизительно 47 масс.% до приблизительно 53 масс.%) по существу аморфного или аморфного Соединения 1 по массе твердой дисперсии. В другом примере твердая дисперсия содержит HPMCAS и от приблизительно 65 масс.% до приблизительно 95 масс.%, включая все значения и интервалы, содержащиеся в этом диапазоне, (например, от приблизительно 67 масс.% до приблизительно 92 масс.%, от приблизительно 70 масс.% до приблизительно 90 масс.% или от приблизительно 72 масс.% до приблизительно 88 масс.%) по существу аморфного Соединения 1 или аморфного Соединения 1 по массе твердой дисперсии.
[00360] В других вариантах осуществления твердая дисперсия содержит 80 масс.% или менее (например, 60 масс.% или менее, 55 масс.% или менее, или 50 масс.% или менее) полимера (например, HPMCAS) по массе твердой дисперсии. В некоторых случаях твердая дисперсия содержит от приблизительно 1 масс.% до приблизительно 80 масс.%, включая все значения и интервалы, содержащиеся в этом диапазоне, (например, от приблизительно 10 масс.% до приблизительно 60 масс.%) полимера (например, HPMCAS).
[00361] Некоторые твердые дисперсии содержат от приблизительно 40 масс.% до приблизительно 60 масс.%, включая все значения и интервалы, содержащиеся в этом диапазоне, (например, от приблизительно 42 масс.% до приблизительно 57 масс.%, от приблизительно 45 масс.% до приблизительно 55 масс.% или от приблизительно 47 масс.% до приблизительно 53 масс.%) по существу аморфного Соединения 1 по массе твердой дисперсии и от приблизительно 60 масс.% до приблизительно 40 масс.% полимера (например, HPMCAS). Альтернативные твердые дисперсии содержат от приблизительно 40 масс.% до приблизительно 60 масс.%, включая все значения и интервалы, содержащиеся в этом диапазоне, (например, от приблизительно 42 масс.% до приблизительно 57 масс.%, от приблизительно 45 масс.% до приблизительно 55 масс.% или от приблизительно 47 масс.% до приблизительно 53 масс.%) аморфного Соединения 1 по массе твердой дисперсии и от приблизительно 60 масс.% до приблизительно 40 масс.% полимера (например, HPMCAS).
[00362] Другие твердые дисперсии содержат от приблизительно 65 масс.% до приблизительно 95 масс.%, включая все значения и интервалы, содержащиеся в этом диапазоне (например, от приблизительно 67 масс.% до приблизительно 92 масс.%, от приблизительно 70 масс.% до приблизительно 90 масс.% или от приблизительно 72 масс.% до приблизительно 88 масс.%), по существу аморфного Соединения 1 по массе твердой дисперсии и от приблизительно 45 масс.% до приблизительно 5 масс.% полимера (например, HPMCAS). Например, твердая дисперсия содержит от приблизительно 65 масс.% до приблизительно 95 масс.%, включая все значения и интервалы, содержащиеся в этом диапазоне, (например, от приблизительно 67 масс.% до приблизительно 92 масс.%, от приблизительно 70 масс.% до приблизительно 90 масс.% или от приблизительно 72 масс.% до приблизительно 88 масс.%) аморфного Соединения 1 по массе твердой дисперсии и от приблизительно 45 масс.% до приблизительно 5 масс.% полимера (например, HPMCAS).
[00363] В альтернативных вариантах осуществления твердая дисперсия содержит от приблизительно 45 масс.% до приблизительно 85 масс.% по существу аморфного или аморфного Соединения 1, от приблизительно 0,45 масс.% до приблизительно 0,55 масс.% SLS и от приблизительно 14,45 масс.% до приблизительно 55,55 масс.% HPMCAS по массе твердой дисперсии. Одна, приводимая в качестве примера, твердая дисперсия содержит приблизительно 50 масс.% по существу аморфного или аморфного Соединения 1, приблизительно 49,5 масс.% HPMCAS и приблизительно, 0,5 масс.% SLS по массе твердой дисперсии. Другая, приводимая в качестве примера, твердая дисперсия содержит приблизительно 72,4 масс.% по существу аморфного или аморфного Соединения 1, приблизительно 27,1 масс.% HPMCAS и приблизительно 0,5 масс.% SLS.
[00364] Другая, приводимая в качестве примера, твердая дисперсия содержит приблизительно 80 масс.% по существу аморфного или аморфного Соединения 1, приблизительно 19,5 масс.% HPMCAS и приблизительно 0,5 масс.% SLS.
[00365] Помимо твердой дисперсии Соединения 1, фармацевтические композиции по настоящему изобретению также содержат один или более таких эксципиентов, как наполнители, подсластители, разрыхлители, увлажнители, скользящие вещества, смазывающие вещества, красители, ароматизаторы или их сочетания. Следует отметить, что некоторые эксципиенты могут выполнять более одной функции, например, некоторые наполнители также могут быть подсластителями и некоторые разрыхлители также могут быть увлажнителями (например, маннит является наполнителем и подсластителем, SLS является увлажнителем и смазывающим веществом).
[00366] Наполнители, подходящие для настоящего изобретения, являются совместимыми с ингредиентами фармацевтической композиции, то есть они существенно не снижают растворимость, химическую стабильность, физическую стабильность или биологическую активность фармацевтической композиции. Примеры наполнителя могут включать, но не ограничиваться указанным, маннит, лактозу, сахарозу, декстрозу, мальтодекстрин, сорбит, ксилит, целлюлозу в порошке, многоатомные спирты, микрокристаллическую целлюлозу, силикатированную микрокристаллическую целлюлозу, ацетат целлюлозы, метилцеллюлозу, этилцеллюлозу, гидроксиэтилцеллюлозу, метилгидроксиэтилцеллюлозу, тальк, крахмал (т.е., картофельный крахмал), прежелатинизированный крахмал, двухосновный фосфат кальция, сульфат кальция и карбонат кальция. В одном варианте осуществления фармацевтическая композиция содержит по меньшей мере один наполнитель в количестве по меньшей мере приблизительно 10 масс.% (например, по меньшей мере приблизительно 20 масс.%, по меньшей мере приблизительно 25 масс.% или по меньшей мере приблизительно 27 масс.%) по массе композиции. Например, фармацевтическая композиция содержит от приблизительно 10 масс.% до приблизительно 90 масс.% (например, от приблизительно 10 масс.% до приблизительно 60 масс.%, от приблизительно 20 масс.% до приблизительно 55 масс.%, от приблизительно 25 масс.% до приблизительно 50 масс.% или от приблизительно 27 масс.% до приблизительно 45 масс.%) наполнителя по массе композиции. В другом примере фармацевтическая композиция содержит по меньшей мере приблизительно 20 масс.% (например, по меньшей мере 25 масс.% или по меньшей мере 27 масс.%) маннита по массе композиции. Еще в одном примере фармацевтическая композиция содержит от приблизительно 30 масс.% до приблизительно 90 масс.% (например, от приблизительно 30 масс.% до приблизительно 80 масс.%, от приблизительно 30 масс.% до приблизительно 60 масс.%, от приблизительно 35 масс.% до приблизительно 55 масс.% или от приблизительно 40 масс.% до приблизительно 50 масс.%) маннита по массе композиции. Еще в одном примере фармацевтическая композиция содержит приблизительно 45,1% маннита по массе композиции. В другом примере фармацевтическая композиция содержит приблизительно 80,37% маннита по массе композиции. В другом примере фармацевтическая композиция содержит приблизительно 82,5% маннита по массе композиции. В другом примере фармацевтическая композиция содержит приблизительно 82% маннита по массе композиции. В другом примере фармацевтическая композиция содержит приблизительно 79% маннита по массе композиции. В другом примере фармацевтическая композиция содержит приблизительно 79,5% маннита по массе композиции. В другом примере фармацевтическая композиция содержит приблизительно 75% маннита по массе композиции. В другом примере фармацевтическая композиция содержит приблизительно 59,28% маннита по массе композиции. Еще в одном примере фармацевтическая композиция содержит приблизительно 43,1% маннита по массе композиции. Еще в одном примере фармацевтическая композиция содержит приблизительно 55% маннита по массе композиции. Еще в одном примере фармацевтическая композиция содержит приблизительно 42% (т.е., приблизительно 42,0% или приблизительно 42,1%) маннита по массе композиции. Еще в одном примере фармацевтическая композиция содержит приблизительно 57% маннита по массе композиции. Еще в одном примере фармацевтическая композиция содержит приблизительно 57,5% маннита по массе композиции. В другом примере фармацевтическая композиция содержит приблизительно 45,5% маннита по массе композиции. В другом примере фармацевтическая композиция содержит приблизительно 45,1% маннита по массе композиции. Еще в одном примере фармацевтическая композиция содержит приблизительно 45% маннита по массе композиции. Еще в одном примере фармацевтическая композиция содержит приблизительно 54,5% маннита по массе композиции. Еще в одном примере фармацевтическая композиция содержит приблизительно 54% маннита по массе композиции. Еще в одном примере фармацевтическая композиция содержит приблизительно 42,5% маннита по массе композиции. Еще в одном примере фармацевтическая композиция содержит приблизительно 49,75% маннита по массе композиции. В одном варианте осуществления фармацевтическая композиция содержит по меньшей мере 10 масс.% маннита по массе композиции. Еще в одном примере фармацевтическая композиция содержит приблизительно 13,5% маннита по массе композиции. В одном варианте осуществления фармацевтическая композиция содержит по меньшей мере 10 масс.% лактозы по массе композиции. Еще в одном примере фармацевтическая композиция содержит приблизительно 57% лактозы по массе композиции. Еще в одном примере фармацевтическая композиция содержит приблизительно 57,5% лактозы по массе композиции. В другом примере фармацевтическая композиция содержит приблизительно 45,5% лактозы по массе композиции. В другом примере фармацевтическая композиция содержит приблизительно 45,1% лактозы по массе композиции. Еще в одном примере фармацевтическая композиция содержит приблизительно 45% лактозы по массе композиции. Еще в одном примере фармацевтическая композиция содержит приблизительно 54,5% лактозы по массе композиции. Еще в одном примере фармацевтическая композиция содержит приблизительно 54% лактозы по массе композиции. Еще в одном примере фармацевтическая композиция содержит приблизительно 42,5% лактозы по массе композиции. Еще в одном примере фармацевтическая композиция содержит приблизительно 49,75% лактозы по массе композиции. Еще в одном примере фармацевтическая композиция содержит приблизительно 13,5% лактозы по массе композиции.
[00367] В другом варианте осуществления фармацевтическая композиция содержит ряд наполнителей. В одном варианте осуществления фармацевтическая композиция содержит ряд наполнителей, где общее количество наполнителя составляет по меньшей мере приблизительно 10 масс.% (например, по меньшей мере приблизительно 20 масс.%, по меньшей мере приблизительно 25 масс.% или по меньшей мере приблизительно 27 масс.%) по массе композиции. Например, фармацевтическая композиция содержит от приблизительно 10 масс.% до приблизительно 90 масс.% (например, от приблизительно 20 масс.% до приблизительно 70 масс.%, от приблизительно 30 масс.% до приблизительно 60 масс.%, от приблизительно 40 масс.% до приблизительно 55 масс.%, от приблизительно 40 масс.% до приблизительно 45 масс.%, от приблизительно 45 масс.% до приблизительно 50 масс.% или от приблизительно 50 масс.% до приблизительно 55 масс.%; или приблизительно 54,5 масс.%, приблизительно 48,5 масс.% или приблизительно 42,5 масс.%) наполнителя по массе композиции. В некоторых вариантах осуществления фармацевтическая композиция содержит от одного до трех наполнителей. В некоторых вариантах осуществления фармацевтическая композиция содержит два наполнителя (двухкомпонентный наполнитель). В дополнительном варианте осуществления наполнители выбраны из маннита и лактозы. В одном варианте осуществления фармацевтическая композиция содержит двухкомпонентный наполнитель, где двухкомпонентный наполнитель содержит маннит в количестве вплоть до 100 масс.% двухкомпонентного наполнителя и лактозу в таком количестве, что количество маннита плюс лактозы равно 100 масс.%. В одном варианте осуществления фармацевтическая композиция содержит двухкомпонентный наполнитель, где двухкомпонентный наполнитель содержит маннит и лактозу в соотношении приблизительно 3:1 маннита к лактозе. В одном варианте осуществления фармацевтическая композиция содержит двухкомпонентный наполнитель, где двухкомпонентный наполнитель содержит маннит и лактозу в соотношении приблизительно 1:1 маннита к лактозе. В одном варианте осуществления фармацевтическая композиция содержит двухкомпонентный наполнитель, где двухкомпонентный наполнитель содержит маннит и лактозу в соотношении приблизительно 1:3 маннита к лактозе. В одном варианте осуществления фармацевтическая композиция содержит двухкомпонентный наполнитель, где двухкомпонентный наполнитель содержит маннит в количестве от приблизительно 0 масс.% до приблизительно 70 масс.% (например, от приблизительно 10 масс.% до приблизительно 60 масс.%, от приблизительно 10 масс.% до приблизительно 15 масс.%, от приблизительно 20 масс.% до приблизительно 30 масс.% или от приблизительно 40 масс.% до приблизительно 60 масс.%; или приблизительно 13,5 масс.%, приблизительно 21,25 масс.%, приблизительно 24,25 масс.%, приблизительно 27,25 масс.%, приблизительно 41 масс.%, приблизительно 42,5 масс.% или приблизительно 54,5 масс.%) композиции и лактозу в количестве от приблизительно 0 масс.% до приблизительно 70 масс.% (например, от приблизительно 10 масс.% до приблизительно 60 масс.%, от приблизительно 10 масс.% до приблизительно 15 масс.%, от приблизительно 20 масс.% до приблизительно 30 масс.% или от приблизительно 40 масс.% до приблизительно 60 масс.%; или приблизительно 13,5 масс.%, приблизительно 21,25 масс.%, приблизительно 24,25 масс.%, приблизительно 27,25 масс.%, приблизительно 41 масс.%, приблизительно 42,5 масс.% или приблизительно 54,5 масс.%) композиции. В дополнительном варианте осуществления фармацевтическая композиция содержит двухкомпонентный наполнитель, где двухкомпонентный наполнитель содержит приблизительно 13,5 масс.% маннита и приблизительно 41 масс.% лактозы по массе композиции. В другом дополнительном варианте осуществления фармацевтическая композиция содержит двухкомпонентный наполнитель, где двухкомпонентный наполнитель содержит приблизительно 41 масс.% маннита и приблизительно 13,5 масс.% лактозы по массе композиции. В другом дополнительном варианте осуществления фармацевтическая композиция содержит двухкомпонентный наполнитель, где двухкомпонентный наполнитель содержит приблизительно 27,25 масс.% маннита и приблизительно 27,25 масс.% лактозы по массе композиции. В другом дополнительном варианте осуществления фармацевтическая композиция содержит двухкомпонентный наполнитель, где двухкомпонентный наполнитель содержит приблизительно 24,25 масс.% маннита и приблизительно 24,25 масс.% лактозы по массе композиции. В другом дополнительном варианте осуществления фармацевтическая композиция содержит двухкомпонентный наполнитель, где двухкомпонентный наполнитель содержит приблизительно 21,25 масс.% маннита и приблизительно 21,25 масс.% лактозы по массе композиции.
[00368] Фармацевтическая композиция также содержит подсластитель для маскировки и улучшения вкуса композиции. В некоторых вариантах осуществления один или более подсластителей включают, но не ограничиваются указанными, моносахариды, дисахариды и полисахариды. Примеры подходящих подсластителей включают как природные, так и искусственные подсластители. Примеры могут включать, но не ограничиваться указанным, глюкозу, сахарозу, мальтозу, маннозу, декстрозу, фруктозу, лактозу, трегалозу, мальтит, лактит, ксилит, сорбит, маннит, тагатозу, глицерин, эритрит, изомальт, мальтозу, сукралозу, аспартам, неотам, алитам, неогесперидин дигидрохалькон, цикламат (то есть, цикламат натрия), тауматин, ацесульфам калия, сахарин и сахарин натрия. Концентрация подсластителя в композициях по настоящему изобретению может находиться интервале от приблизительно 0,1 масс.% до приблизительно 5 масс.% (например, от приблизительно 1 масс.% до приблизительно 5 масс.%, от приблизительно 1 масс.% до приблизительно 3 масс.%, от приблизительно 1,5 масс.% до приблизительно 2,5 масс.%) фармацевтической композиции. В одном варианте осуществления подсластителем является сукралоза. В другом варианте осуществления фармацевтическая композиция содержит сукралозу в концентрации от приблизительно 0,1 масс.% до приблизительно 5 масс.% (например, от приблизительно 1 масс.% до приблизительно 5 масс.%, от приблизительно 1 масс.% до приблизительно 3 масс.%, от приблизительно 1,5 масс.% до приблизительно 2,5 масс.%). В дополнительном варианте осуществления фармацевтическая композиция содержит сукралозу в концентрации приблизительно 2 масс.%.
[00369] Разрыхлители, подходящие для настоящего изобретения, повышают диспергирование фармацевтической композиции и являются совместимыми с ингредиентами фармацевтической композиции, то есть они существенно не снижают химическую стабильность, физическую стабильность или биологическую активность фармацевтической композиции. Приводимые в качестве примера разрыхлители включают: кроскармеллозу натрия (например, AcDiSol), альгинат натрия, альгинат кальция, альгиновую кислоту, крахмал, прежелатинизированный крахмал, гликоляткрахмал натрия, поливинилпирролидон, сополимеры поливинилпирролидона, кросповидона, карбоксиметилцеллюлозы кальция, целлюлозы и ее производных, карбоксиметилцеллюлозу натрия, полисахарид сои, глины, камеди (то есть гуаровую камедь), ионобменную смолу, шипучую систему на основе пищевых кислот и компонента карбоната щелочей и бикарбонат натрия. В одном варианте осуществления фармацевтическая композиция содержит разрыхлитель в количестве приблизительно 10 масс.% или менее (например, приблизительно 8 масс.% или менее, приблизительно 7 масс.% или менее, приблизительно 6 масс.% или менее, или приблизительно 5 масс.% или менее) по массе композиции. Например, фармацевтическая композиция содержит от приблизительно 1 масс.% до приблизительно 10 масс.% (например, от приблизительно 1,5 масс.% до приблизительно 7,5 масс.% или от приблизительно 2,5 масс.% до приблизительно 6 масс.%) разрыхлителя по массе композиции. В другом примере фармацевтическая композиция содержит приблизительно 10 масс.% или менее (например, 7 масс.% или менее, 6 масс.% или менее, или 5 масс.% или менее) кроскармеллозы натрия по массе композиции. В некоторых примерах фармацевтическая композиция содержит от приблизительно 0,1% до приблизительно 10 масс.% (например, от приблизительно 0,5 масс.% до приблизительно 7,5 масс.% или от приблизительно 1,5 масс.% до приблизительно 6 масс.%) разрыхлителя по массе композиции. В других примерах фармацевтическая композиция содержит от приблизительно 0,5% до приблизительно 10 масс.% (например, от приблизительно 1,5 масс.% до приблизительно 7,5 масс.%, от приблизительно 3 масс.% до приблизительно 6 масс.% или от приблизительно 2 масс.% до приблизительно 5 масс.%) разрыхлителя по массе композиции. Еще в одном примере фармацевтическая композиция содержит от приблизительно 0,1 масс.% до приблизительно 10 масс.% (например, от приблизительно 1,5 масс.% до приблизительно 7,5 масс.%, от приблизительно 1 масс.% до приблизительно 6 масс.%, от приблизительно 3 масс.% до приблизительно 6 масс.% или от приблизительно 2 масс.% до приблизительно 5 масс.%) кроскармеллозы натрия по массе композиции. Еще в одном примере фармацевтическая композиция содержит приблизительно 3 масс.% кроскармеллозы натрия по массе композиции. В другом примере фармацевтическая композиция содержит приблизительно 4 масс.% кроскармеллозы натрия по массе композиции. В другом примере фармацевтическая композиция содержит приблизительно 4,5 масс.% кроскармеллозы натрия по массе композиции. В другом примере фармацевтическая композиция содержит приблизительно 5 масс.% кроскармеллозы натрия по массе композиции. В другом примере фармацевтическая композиция содержит приблизительно 6 масс.% кроскармеллозы натрия по массе композиции. В другом примере фармацевтическая композиция содержит приблизительно 7 масс.% кроскармеллозы натрия по массе композиции. В другом примере фармацевтическая композиция содержит приблизительно 8 масс.% кроскармеллозы натрия по массе композиции.
[00370] Увлажнители и/или поверхностно-активные вещества, подходящие для настоящего изобретения, могут повышать растворимость или смачиваемость фармацевтической композиции и являются совместимыми с ингредиентами фармацевтической композиции, то есть они существенно не снижают химическую стабильность, физическую стабильность или биологическую активность фармацевтической композиции. В некоторых вариантах осуществления один или более увлажнителей включают одно или более поверхностно-активных веществ. Примеры увлажнителей/поверхностно-активных веществ могут включать, но не ограничиваться, следующее: лаурилсульфат натрия (также называемый додецилсульфатом натрия (SDS)), цетостеариловый спирт, цетомакрогол эмульгирующий воск, желатин, казеин, докузат натрия, хлорид бензалкония, стеарат кальция, полиэтиленгликоли, фосфаты, сложные эфиры жирных кислот полиоксиэтиленсорбитана (например, Полисорбат 80, Полисорбат 20), акациевую камедь, холестерин, трагакант, простые стеариловые эфиры полиоксиэтилена 20, простые алкильные эфиры полиоксиэтилена, производные полиоксиэтилена касторового масла, ПЭГилированные гидрогенизированные касторовые масла, сложные эфиры сорбитана жирных кислот, витамин E или производные токоферола, витамин E TPGS, сложные эфиры токоферила, лецитин, фосфолипиды и их производные, полоксамеры, стеариновую кислоту, олеиновую кислоту, олеиновый спирт, цетиловый спирт, моно- и диглицериды, сложные эфиры пропиленгликоля и жирных кислот, сложные эфиры глицерина и жирных кислот (то есть, моностеарат глицерина), этиленгликоль пальмитостеарат, полиоксилглицериды, пропиленгликоль монокаприлат, пропиленгликоль монолаурат, спирты алкиларилполиэфира (Triton®) и полиглицерилолеат. В одном варианте осуществления фармацевтическая композиция содержит увлажнитель в количестве приблизительно 10 масс.% или менее (например, приблизительно 5 масс.% или менее, приблизительно 2 масс.% или менее, приблизительно 1 масс.% или менее, приблизительно 0,8 масс.% или менее, или приблизительно 0,6 масс.% или менее) по массе композиции. Например, фармацевтическая композиция включает от приблизительно 10 масс.% до приблизительно 0,01 масс.% (например, от приблизительно 5 масс.% до приблизительно 0,05 масс.% или от приблизительно 2 масс.% до приблизительно 0,1 масс.%) увлажнителя по массе композиции. В другом примере фармацевтическая композиция содержит 10 масс.% или менее (например, приблизительно 5 масс.% или менее, приблизительно 2 масс.% или менее, приблизительно 1 масс.% или менее, приблизительно 0,8 масс.% или менее, или приблизительно 0,6 масс.% или менее) лаурилсульфата натрия по массе композиции. Еще в одном примере фармацевтическая композиция содержит от приблизительно 10 масс.% до приблизительно 0,01 масс.% (например, от приблизительно 3 масс.% до приблизительно 0,01 масс.% или от приблизительно 2 масс.% до приблизительно 0,05 масс.%) лаурилсульфата натрия по массе композиции. Еще в одном примере фармацевтическая композиция содержит приблизительно 0,5 масс.% лаурилсульфата натрия по массе композиции. В другом примере фармацевтическая композиция содержит приблизительно 0 масс.% лаурилсульфата натрия по массе композиции. Еще в одном примере фармацевтическая композиция содержит приблизительно 0,175 масс.% лаурилсульфата натрия по массе композиции. Еще в одном примере фармацевтическая композиция содержит приблизительно 0,205 масс.% лаурилсульфата натрия по массе композиции. Еще в одном примере фармацевтическая композиция содержит приблизительно 0,235 масс.% лаурилсульфата натрия по массе композиции. Еще в одном примере фармацевтическая композиция содержит приблизительно 0,675 масс.% лаурилсульфата натрия по массе композиции. Еще в одном примере фармацевтическая композиция содержит приблизительно 0,705 масс.% лаурилсульфата натрия по массе композиции. Еще в одном примере фармацевтическая композиция содержит приблизительно 0,735 масс.% лаурилсульфата натрия по массе композиции.
[00371] Скользящие вещества, подходящие для настоящего изобретения, улучшают свойства текучести фармацевтической композиции и являются совместимыми с ингредиентами фармацевтической композиции, то есть они по существу не снижают растворимость, химическую стабильность, физическую стабильность или биологическую активность фармацевтической композиции. «Скользящее вещество» представляет собой вещество, которое способствует скольжению порошка путем уменьшения трения между частицами и слипания частиц друг с другом, обусловленных их взаимодействием. В некоторых вариантах осуществления один или более эксципиентов может включать одно или более скользящих веществ. Примеры скользящих веществ могут включать, но не ограничиваться, тальк, коллоидный диоксид кремния (например, Cabosil M-5P), осажденный диоксид кремния, оксид магния, силикат магния, лейцин и крахмал. В одном варианте осуществления фармацевтическая композиция содержит скользящее вещество в количестве 5 масс.% или менее (например, 1,75 масс.%, 1,25 масс.% или менее, или 1,00 масс.% или менее) по массе композиции. Например, фармацевтическая композиция содержит от приблизительно 5 масс.% до приблизительно 0,1 масс.% (например, от приблизительно 4 масс.% до приблизительно 0,02 масс.% или от приблизительно 3 масс.% до приблизительно 0,5 масс.%) скользящего вещества по массе композиции. В другом примере фармацевтическая композиция содержит 5 масс.% или менее (например, 1,75 масс.%, 1,25 масс.% или менее, или 1,00 масс.% или менее) коллоидного диоксида кремния по массе композиции. Еще в одном примере фармацевтическая композиция содержит от приблизительно 5 масс.% до приблизительно 0,1 масс.% (например, от приблизительно 4 масс.% до приблизительно 0,2 масс.% или от приблизительно 3 масс.% до приблизительно 0,5 масс.%) коллоидного диоксида кремния по массе композиции. Еще в одном примере фармацевтическая композиция содержит приблизительно 1 масс.% коллоидного диоксида кремния по массе композиции.
[00372] Смазывающие вещества, подходящие для настоящего изобретения, облегчают прессование и выталкивание прессованных фармацевтических композиций из пресс-формы. Смазывающие вещества могут дополнительно обладать противоприлипающими или антиадгезионными свойствами и свести к минимуму прилипание в различных технологических операциях по настоящему изобретению, включая такие операции, как, например, инкапсулирование, и являются совместимыми с ингредиентами фармацевтической композиции, то есть они по существу не снижают растворимость или биологическую активность фармацевтической композиции. Примеры смазывающих веществ могут включать, но не ограничиваться ими, тальк, жирную кислоту, стеариновую кислоту, стеарат магния, стеарат кальция, стеарат натрия, стеариновую кислоту, глицерилмоностеарат, лаурилсульфат натрия, стеарилфумарат натрия, гидрогенизированные масла (то есть, гидрогенизированное растительное масло), полиэтиленгликоль, спирт жирного ряда, сложный эфир жирной кислоты, глицерилбегенат, минеральное масло, растительное масло, лейцин, бензоат натрия или их сочетания. В одном варианте осуществления фармацевтическая композиция содержит смазывающее вещество в количестве 10 масс.% или менее (например, 2,5 масс.%, 2,0 масс.%, 1,75 масс.%, 1,5 масс.% или менее, 1,25 масс.% или менее, или 1,00 масс.% или менее) по массе композиции. Например, фармацевтическая композиция содержит от приблизительно 7 масс.% до приблизительно 0,10 масс.% (например, от приблизительно 6 масс.% до приблизительно 0,15 масс.% или от приблизительно 5 масс.% до приблизительно 0.30 масс.%) смазывающего вещества по массе композиции. В другом примере фармацевтическая композиция содержит 10 масс.% или менее (например, 2,5 масс.% или менее, 1,75 масс.% или менее, 1,5 масс.% или менее, 1,25 масс.% или менее, или 1,00 масс.% или менее) стеарата магния по массе композиции. Еще в одном примере фармацевтическая композиция содержит от приблизительно 10 масс.% до приблизительно 0,10 масс.% (например, от приблизительно 7 масс.% до приблизительно 0,1 масс.% или от приблизительно 5 масс.% до приблизительно 0,30 масс.%) стеарата магния по массе композиции. Еще в одном примере фармацевтическая композиция содержит приблизительно 1,5 масс.% стеарата магния по массе композиции. Еще в одном примере фармацевтическая композиция содержит приблизительно 1,0 масс.% стеарата магния по массе композиции.
[00373] Фармацевтические композиции по настоящему изобретению необязательно могут содержать один или более красителей, вкусовых добавок и/или ароматизаторов для улучшения внешнего вида, вкуса и/или запаха композиции. Подходящие красители, вкусовые добавки или ароматизаторы являются совместимыми с ингредиентами фармацевтической композиции, то есть они по существу не снижают растворимость, химическую стабильность, физическую стабильность или биологическую активность фармацевтической композиции. В одном варианте осуществления фармацевтическая композиция содержит краситель, вкусовую добавку и/или ароматизатор. Например, фармацевтическая композиция содержит приблизительно менее 1 масс.% (например, приблизительно менее 0,75 масс.% или приблизительно менее 0,5 масс.%) каждого необязательного ингредиента, то есть красителя, вкусовой добавки и/или ароматизатора, по массе композиции. В другом примере фармацевтическая композиция содержит приблизительно менее 1 масс.% (например, приблизительно менее 0,75 масс.% или приблизительно менее 0,5 масс.%) красителя. Еще в одном примере фармацевтическая композиция содержит приблизительно менее 1 масс.% (например, приблизительно менее 0,75 масс.% или приблизительно менее 0,5 масс.%) голубого красителя (например, FD&C Blue #1 и/или FD&C Blue #2 Aluminum Lake, коммерчески доступного от компании Colorcon, Inc. West Point, PA.).
[00374] Подходящие вкусовые добавки могут включать, например, вкусовые добавки, которые известны специалистам в данной области, например, такие как природные вкусовые добавки, искусственные вкусовые добавки и их сочетания. Вкусовые добавки являются совместимыми с ингредиентами фармацевтической композиции, то есть они существенно не снижают химическую стабильность, физическую стабильность или биологическую активность фармацевтической композиции. Вкусовые добавки могут быть выбраны, например, например, из синтетических ароматических масел и ароматизирующих ароматических соединений и/или масел, олеосмол, экстрактов, полученных из растений, листьев, цветов, фруктов, и т.п., и их комбинаций. Неограничивающие примеры ароматизирующих масел включают масло мяты курчавой, коричное масло, масло гаультерии (метилсалицилат), масло перечной мяты, гвоздичное масло, лавровое масло, анисовое масло, эвкалиптовое масло, тимьяновое масло, масло из листьев кедра, масло мускатного ореха, масло гвоздичного дерева, масло шалфея, масло сушеной шелухи мускатного ореха, масло горького миндаля и масло кассии. Подходящие вкусовые добавки, кроме того, включают, например, искусственный, натуральный и синтетический микрозернистый порошок, полученный из фруктовых ароматизаторов, таких как ваниль, этилванилин, цитрусовые масла (например, лимона, апельсина, мандарина, лайма и грейпфрута), и фруктовые эссенции (например, натуральный и/или искусственный ароматизатор яблока, груши, персика, апельсина, винограда, земляники, малины, вишни, сливы, ананаса и абрикоса), и подобные, и их сочетания. Вкусовые добавки могут быть использованы в жидкой или твердой форме и, как указано выше, могут быть использованы по отдельности или в смеси. Другие вкусовые добавки могут включать, например, некоторые альдегиды и сложные эфиры, например, циннамилацетат, циннамальдегид, цитралдиэтилацеталь, дигидрокарвилацетат, эвгенилформиат, п-метиламизол, и т.п., и их сочетания.
[00375] A. ПОРОШКОВЫЕ ЛЕКАРСТВЕННЫЕ ФОРМЫ ФАРМАЦЕВТИЧЕСКОЙ КОМПОЗИЦИИ
[00376] В некоторых вариантах осуществления настоящее изобретение относится к фармацевтической композиции, которая может быть использована для лечения пациента, имеющего мутантные формы CFTR человека. В некоторых вариантах осуществления фармацевтическая композиция может включать порошковую смесь ингредиентов фармацевтической композиции, описанных выше, заключенных в капсулу, пачку, пакет, саше или какой-либо другой контейнер, предназначенный для обеспечения единичной дозой порошковой фармацевтической композиции пациента, нуждающегося в этом.
[00377] В некоторых вариантах осуществления порошковая фармацевтическая композиция или лекарственная форма «порошковая смесь» получена путем введения ее в пищу или в жидкость, предназначенных для потребления пациентом. Такие порошковые лекарственные формы, главным образом, хотя и не только, полезны для пациентов, которые не могут проглотить таблетку размером для взрослого, или которые имеют проблемы, связанные с проглатыванием таких таблеток размером для взрослого или их фрагментов.
[00378] В одном варианте осуществления порошковая фармацевтическая композиция содержит твердую дисперсию и эксципиент, например: один или более наполнителей, подсластитель, скользящее вещество, смазывающее вещество, и их сочетания, где твердая дисперсия содержит от приблизительно 30 масс.% до приблизительно 95 масс.% Соединения 1 по массе дисперсии и полимер.
[00379] В некоторых вариантах осуществления твердая дисперсия содержит от приблизительно 45 масс.% до приблизительно 85 масс.% включая все значения и интервалы в указанном диапазоне (например, приблизительно 50 масс.%, приблизительно 72,4 масс.%, приблизительно 78,8 масс.% или приблизительно 80 масс.%) Соединения 1 по массе дисперсии и полимер.
[00380] Одна, приводимая в качестве примера, фармацевтическая композиция содержит от приблизительно 5 масс.% до приблизительно 70 масс.% (например, от приблизительно 5 масс.% до приблизительно 65 масс.%, от приблизительно 5 масс.% до приблизительно 50 масс.%, от приблизительно 10 масс.% до приблизительно 20 масс.%, от приблизительно 30 масс.% до приблизительно 40 масс.% или от приблизительно 40 масс.% до приблизительно 50 масс.%) твердой дисперсии по массе композиции, содержащей от приблизительно 30 масс.% до приблизительно 90 масс.% по существу аморфного Соединения 1, по массе дисперсии, и от приблизительно 70 масс.% до приблизительно 10 масс.% полимера, по массе дисперсии; от приблизительно 25 масс.% до приблизительно 90 масс.% одного или более наполнителей; от приблизительно 0,1 масс.% до приблизительно 5 масс.% подсластителя; от приблизительно 5 масс.% до приблизительно 0,1 масс.% скользящего вещества; и от приблизительно 7 масс.% до приблизительно 0,1 масс.% смазывающего вещества. Или порошковая фармацевтическая композиция содержит от приблизительно 5 масс.% до приблизительно 65 масс.% (например, от приблизительно 5 масс.% до приблизительно 25 масс.%, от приблизительно 15 масс.% до приблизительно 40 масс.% или от приблизительно 30 масс.% до приблизительно 50 масс.%) твердой дисперсии по массе композиции, содержащей от приблизительно 30 масс.% до приблизительно 90 масс.% аморфного Соединения 1, по массе дисперсии, и от приблизительно 70 масс.% до приблизительно 20 масс.% полимера, по массе дисперсии; от приблизительно 10 масс.% до приблизительно 90 масс.% одного или более наполнителей; от приблизительно 0,1 масс.% до приблизительно 5 масс.% подсластителя; от приблизительно 5 масс.% до приблизительно 0,1 масс.% скользящего вещества; и от приблизительно 7 масс.% до приблизительно 0,1 масс.% смазывающего вещества.
[00381] Другая, приводимая в качестве примера, фармацевтическая композиция содержит от приблизительно 5 масс.% до приблизительно 60 масс.% (например, от приблизительно 5 масс.% до приблизительно 55 масс.%, от приблизительно 15 масс.% до приблизительно 50 масс.% или от приблизительно 30 масс.% до приблизительно 50 масс.%) твердой дисперсии по массе композиции, содержащей от приблизительно 30 масс.% до приблизительно 90 масс.% по существу аморфного Соединения 1, по массе дисперсии, и от приблизительно 70 масс.% до приблизительно 10 масс.% полимера, по массе дисперсии; от приблизительно 10 масс.% до приблизительно 90 масс.% одного или более наполнителей; от приблизительно 0,1 масс.% до приблизительно 5 масс.% подсластителя, от приблизительно 7 масс.% до приблизительно 0,1 масс.% смазывающего вещества; и от приблизительно 5 масс.% до приблизительно 0,1 масс.% скользящего вещества. Или фармацевтическая композиция содержит от приблизительно 5 масс.% до приблизительно 55 масс.% (например, от приблизительно 5 масс.% до приблизительно 50 масс.%, от приблизительно 5 масс.% до приблизительно 45 масс.%, или от приблизительно 5 масс.% до приблизительно 40 масс.%) твердой дисперсии по массе композиции, содержащей от приблизительно 30 масс.% до приблизительно 90 масс.% аморфного Соединения 1, по массе дисперсии, и от приблизительно 70 масс.% до приблизительно 10 масс.% полимера, по массе дисперсии; от приблизительно 10 масс.% до приблизительно 90 масс.% одного или более наполнителей; от приблизительно 5 масс.% до приблизительно 0,1 масс.% подсластителя; от приблизительно 5 масс.% до приблизительно 0,1 масс.% скользящего вещества; и от приблизительно 7 масс.% до приблизительно 0,1 масс.% смазывающего вещества.
[00382] Одна фармацевтическая композиция в форме порошка в соответствии с настоящим изобретением содержит приблизительно 46,9 масс.% твердой дисперсии по массе композиции, где указанная дисперсия содержит приблизительно 80 масс.% по существу аморфного или аморфного Соединения 1 по массе дисперсии, приблизительно 19,5 масс.% HPMCAS по массе дисперсии и приблизительно 0,5 масс.% SLS по массе дисперсии; приблизительно 49,1 масс.% маннита по массе композиции; приблизительно 2 масс.% сукралозы по массе композиции; приблизительно 1 масс.% коллоидного диоксида кремния по массе композиции; и приблизительно 1 масс.% стеарата магния по массе композиции. Или порошковая фармацевтическая композиция по настоящему изобретению содержит приблизительно 15 масс.% твердой дисперсии по массе композиции, где указанная дисперсия содержит приблизительно 80 масс.% аморфного Соединения 1 по массе дисперсии, приблизительно 19,5 масс.% HPMCAS по массе дисперсии и приблизительно 0,5 масс.% SLS по массе дисперсии; приблизительно 81 масс.% маннита по массе композиции; приблизительно 2 масс.% сукралозы по массе композиции; приблизительно 1 масс.% коллоидного диоксида кремния по массе композиции; и приблизительно 1 масс.% стеарата магния по массе композиции. Или порошковая фармацевтическая композиция по настоящему изобретению содержит приблизительно 36,8 масс.% твердой дисперсии по массе композиции, где указанная дисперсия содержит приблизительно 80 масс.% аморфного Соединения 1 по массе дисперсии, приблизительно 19,5 масс.% HPMCAS по массе дисперсии и приблизительно 0,5 масс.% SLS по массе дисперсии; приблизительно 59,2 масс.% маннита по массе композиции; приблизительно 2 масс.% сукралозы по массе композиции; приблизительно 1 масс.% коллоидного диоксида кремния по массе композиции; и приблизительно 1 масс.% стеарата магния по массе композиции.
[00383] Другая фармацевтическая композиция в форме порошка в соответствии с настоящим изобретением содержит приблизительно 24,6 масс.% (эквивалент 24,6 мг действующего вещества в 200 мг единичной дозе) твердой дисперсии по массе композиции, где указанная дисперсия содержит приблизительно 50 масс.% по существу аморфного или аморфного Соединения 1 по массе дисперсии, приблизительно 49,5 масс.% HPMCAS по массе дисперсии и приблизительно 0,5 масс.% SLS по массе дисперсии; приблизительно 71,4 масс.% маннита по массе композиции; приблизительно 2 масс.% сукралозы по массе композиции; приблизительно 1 масс.% коллоидного диоксида кремния по массе композиции; и приблизительно 1 масс.% стеарата магния по массе композиции. Или фармацевтическая композиция по настоящему изобретению содержит приблизительно 34 масс.% (эквивалент 49,2 мг действующего вещества на дозу 200 мг) твердой дисперсии по массе композиции, где указанная дисперсия содержит приблизительно 72,4 масс.% по существу аморфного или аморфного Соединения 1 по массе дисперсии, приблизительно 27,1 масс.% HPMCAS по массе дисперсии и приблизительно 0,5 масс.% SLS по массе дисперсии; приблизительно 62 масс.% маннита по массе композиции; приблизительно 2 масс.% сукралозы по массе композиции; приблизительно 1 масс.% коллоидного диоксида кремния по массе композиции; и приблизительно 1 масс.% стеарата магния по массе композиции.
[00384] Другая фармацевтическая композиция в форме порошка в соответствии с настоящим изобретением содержит приблизительно 61,6 масс.% твердой дисперсии по массе композиции, где указанная дисперсия содержит приблизительно 80 масс.% по существу аморфного или аморфного Соединения 1 по массе дисперсии, приблизительно 19,5 масс.% HPMCAS по массе дисперсии и приблизительно 0,5 масс.% SLS по массе дисперсии; приблизительно 34,4 масс.% маннита по массе композиции; приблизительно 2 масс.% сукралозы по массе композиции; приблизительно 1 масс.% коллоидного диоксида кремния по массе композиции; приблизительно 1 масс.% стеарата магния по массе композиции. Или порошковая фармацевтическая композиция по настоящему изобретению содержит приблизительно 68,7 масс.% твердой дисперсии по массе композиции, где указанная дисперсия содержит приблизительно 80 масс.% по существу аморфного или аморфного Соединения 1 по массе дисперсии, приблизительно 19,5 масс.% HPMCAS по массе дисперсии и приблизительно 0,5 масс.% SLS по массе дисперсии; приблизительно 27,3 масс.% маннита по массе композиции; приблизительно 2 масс.% сукралозы по массе композиции; приблизительно 1 масс.% коллоидного диоксида кремния по массе композиции; приблизительно 1 масс.% стеарата магния по массе композиции. Необязательно, указанные выше фармацевтические композиции также могут включать приблизительно 0,4 масс.% красителя по массе композиции.
[00385] Одна порошковая фармацевтическая композиция по настоящему изобретению содержит приблизительно 46,9 масс.% твердой дисперсии по массе композиции, где указанная дисперсия содержит приблизительно 80 масс.% по существу аморфного или аморфного Соединения 1 по массе дисперсии, приблизительно 19,5 масс.% HPMCAS по массе дисперсии и приблизительно 0,5 масс.% SLS по массе дисперсии; приблизительно 49,1 масс.% маннита по массе композиции; приблизительно 2 масс.% сукралозы по массе композиции; приблизительно 1 масс.% коллоидного диоксида кремния по массе композиции; и приблизительно 1 масс.% стеарата магния по массе композиции, где указанная композиция содержит приблизительно 75 мг Соединения 1. Или порошковая фармацевтическая композиция по настоящему изобретению содержит приблизительно 15 масс.% твердой дисперсии по массе композиции, где указанная дисперсия содержит приблизительно 80 масс.% аморфного Соединения 1 по массе дисперсии, приблизительно 19,5 масс.% HPMCAS по массе дисперсии и приблизительно 0,5 масс.% SLS по массе дисперсии; приблизительно 81 масс.% маннита по массе композиции; приблизительно 2 масс.% сукралозы по массе композиции; приблизительно 1 масс.% коллоидного диоксида кремния по массе композиции; и приблизительно 1 масс.% стеарата магния по массе композиции, где указанная композиция содержит приблизительно 50 мг Соединения 1.
[00386] Другая, приводимая в качестве примера, фармацевтическая композиция содержит от приблизительно 30 масс.% до приблизительно 50 масс.% твердой дисперсии по массе композиции, содержащей от приблизительно 30 масс.% до приблизительно 90 масс.% по существу аморфного Соединения 1, по массе дисперсии, и от приблизительно 70 масс.% до приблизительно 10 масс.% полимера, по массе дисперсии; от приблизительно 30 масс.% до приблизительно 60 масс.% двух наполнителей; от приблизительно 0,1 масс.% до приблизительно 5 масс.% подсластителя, от приблизительно 7 масс.% до приблизительно 0,1 масс.% смазывающего вещества; от приблизительно 8 масс.% до приблизительно 0,1 масс.% разрыхлителя, и от приблизительно 5 масс.% до приблизительно 0,1 масс.% скользящего вещества. В некоторых вариантах осуществления каждый из двух наполнителей может независимо присутствовать в количестве до приблизительно 60 масс.%.
[00387] В одном аспекте настоящее изобретение относится к фармацевтической композиции, содержащей от приблизительно 30 масс.% до приблизительно 50 масс.% твердой дисперсии по массе композиции, где указанная дисперсия содержит приблизительно 80 масс.% по существу аморфного или аморфного Соединения 1 по массе дисперсии, приблизительно 19,5 масс.% HPMCAS по массе дисперсии и приблизительно 0,5 масс.% SLS по массе дисперсии; от приблизительно 30 масс.% до приблизительно 60 масс.% двухкомпонентного наполнителя, где двухкомпонентный наполнитель содержит от приблизительно 0 масс.% до приблизительно 60 масс.% маннита по массе композиции и от приблизительно 0 масс.% до приблизительно 60 масс.% лактозы по массе композиции; от приблизительно 1,5 масс.% до приблизительно 2,5 масс.% сукралозы по массе композиции; от приблизительно 4 масс.% до приблизительно 8 масс.% кроскармеллозы натрия по массе композиции; от приблизительно 0,5 масс.% до приблизительно 1,5 масс.% коллоидного диоксида кремния по массе композиции; и от приблизительно 1 масс.% до приблизительно 2 масс.% стеарата магния по массе композиции.
[00388] Одна порошковая фармацевтическая композиция по настоящему изобретению содержит приблизительно 35 масс.% твердой дисперсии по массе композиции, где указанная дисперсия содержит приблизительно 80 масс.% по существу аморфного или аморфного Соединения 1 по массе дисперсии, приблизительно 19,5 масс.% HPMCAS по массе дисперсии и приблизительно 0,5 масс.% SLS по массе дисперсии; приблизительно 13,5 масс.% маннита по массе композиции; приблизительно 41 масс.% лактозы по массе композиции; приблизительно 2 масс.% сукралозы по массе композиции; приблизительно 6 масс.% кроскармеллозы; приблизительно 1 масс.% коллоидного диоксида кремния по массе композиции; и приблизительно 1 масс.% стеарата магния по массе композиции, где указанная композиция содержит приблизительно 10 мг Соединения 1.
[00389] Другая фармацевтическая композиция в форме порошка в соответствии с настоящим изобретением содержит приблизительно 35 масс.% твердой дисперсии по массе композиции, где указанная дисперсия содержит приблизительно 80 масс.% по существу аморфного или аморфного Соединения 1 по массе дисперсии, приблизительно 19,5 масс.% HPMCAS по массе дисперсии и приблизительно 0,5 масс.% SLS по массе дисперсии; приблизительно 13,5 масс.% маннита по массе композиции; приблизительно 41 масс.% лактозы по массе композиции; приблизительно 2 масс.% сукралозы по массе композиции; приблизительно 6 масс.% кроскармеллозы; приблизительно 1 масс.% коллоидного диоксида кремния по массе композиции; и приблизительно 1 масс.% стеарата магния по массе композиции, где указанная композиция содержит приблизительно 12,5 мг Соединения 1.
[00390] Одна порошковая фармацевтическая композиция по настоящему изобретению содержит приблизительно 35 масс.% твердой дисперсии по массе композиции, где указанная дисперсия содержит приблизительно 80 масс.% по существу аморфного или аморфного Соединения 1 по массе дисперсии, приблизительно 19,5 масс.% HPMCAS по массе дисперсии и приблизительно 0,5 масс.% SLS по массе дисперсии; приблизительно 13,5 масс.% маннита по массе композиции; приблизительно 41 масс.% лактозы по массе композиции; приблизительно 2 масс.% сукралозы по массе композиции; приблизительно 6 масс.% кроскармеллозы; приблизительно 1 масс.% коллоидного диоксида кремния по массе композиции; и приблизительно 1 масс.% стеарата магния по массе композиции, где указанная композиция содержит приблизительно 20 мг Соединения 1.
[00391] Одна порошковая фармацевтическая композиция по настоящему изобретению содержит приблизительно 35 масс.% твердой дисперсии по массе композиции, где указанная дисперсия содержит приблизительно 80 масс.% по существу аморфного или аморфного Соединения 1 по массе дисперсии, приблизительно 19,5 масс.% HPMCAS по массе дисперсии и приблизительно 0,5 масс.% SLS по массе дисперсии; приблизительно 13,5 масс.% маннита по массе композиции; приблизительно 41 масс.% лактозы по массе композиции; приблизительно 2 масс.% сукралозы по массе композиции; приблизительно 6 масс.% кроскармеллозы; приблизительно 1 масс.% коллоидного диоксида кремния по массе композиции; и приблизительно 1 масс.% стеарата магния по массе композиции, где указанная композиция содержит приблизительно 25 мг Соединения 1.
[00392] Одна порошковая фармацевтическая композиция по настоящему изобретению содержит приблизительно 35 масс.% твердой дисперсии по массе композиции, где указанная дисперсия содержит приблизительно 80 масс.% по существу аморфного или аморфного Соединения 1 по массе дисперсии, приблизительно 19,5 масс.% HPMCAS по массе дисперсии и приблизительно 0,5 масс.% SLS по массе дисперсии; приблизительно 13,5 масс.% маннита по массе композиции; приблизительно 41 масс.% лактозы по массе композиции; приблизительно 2 масс.% сукралозы по массе композиции; приблизительно 6 масс.% кроскармеллозы; приблизительно 1 масс.% коллоидного диоксида кремния по массе композиции; и приблизительно 1 масс.% стеарата магния по массе композиции, где указанная композиция содержит приблизительно 30 мг Соединения 1.
[00393] Одна порошковая фармацевтическая композиция по настоящему изобретению содержит приблизительно 35 масс.% твердой дисперсии по массе композиции, где указанная дисперсия содержит приблизительно 80 масс.% по существу аморфного или аморфного Соединения 1 по массе дисперсии, приблизительно 19,5 масс.% HPMCAS по массе дисперсии и приблизительно 0,5 масс.% SLS по массе дисперсии; приблизительно 13,5 масс.% маннита по массе композиции; приблизительно 41 масс.% лактозы по массе композиции; приблизительно 2 масс.% сукралозы по массе композиции; приблизительно 6 масс.% кроскармеллозы; приблизительно 1 масс.% коллоидного диоксида кремния по массе композиции; и приблизительно 1 масс.% стеарата магния по массе композиции, где указанная композиция содержит приблизительно 37,5 мг Соединения 1.
[00394] Одна порошковая фармацевтическая композиция по настоящему изобретению содержит приблизительно 35 масс.% твердой дисперсии по массе композиции, где указанная дисперсия содержит приблизительно 80 масс.% по существу аморфного или аморфного Соединения 1 по массе дисперсии, приблизительно 19,5 масс.% HPMCAS по массе дисперсии и приблизительно 0,5 масс.% SLS по массе дисперсии; приблизительно 13,5 масс.% маннита по массе композиции; приблизительно 41 масс.% лактозы по массе композиции; приблизительно 2 масс.% сукралозы по массе композиции; приблизительно 6 масс.% кроскармеллозы; приблизительно 1 масс.% коллоидного диоксида кремния по массе композиции; и приблизительно 1 масс.% стеарата магния по массе композиции, где указанная композиция содержит приблизительно 40 мг Соединения 1.
[00395] Одна порошковая фармацевтическая композиция по настоящему изобретению содержит приблизительно 35 масс.% твердой дисперсии по массе композиции, где указанная дисперсия содержит приблизительно 80 масс.% по существу аморфного или аморфного Соединения 1 по массе дисперсии, приблизительно 19,5 масс.% HPMCAS по массе дисперсии и приблизительно 0,5 масс.% SLS по массе дисперсии; приблизительно 13,5 масс.% маннита по массе композиции; приблизительно 41 масс.% лактозы по массе композиции; приблизительно 2 масс.% сукралозы по массе композиции; приблизительно 6 масс.% кроскармеллозы; приблизительно 1 масс.% коллоидного диоксида кремния по массе композиции; и приблизительно 1 масс.% стеарата магния по массе композиции, где указанная композиция содержит приблизительно 50 мг Соединения 1.
[00396] Одна порошковая фармацевтическая композиция по настоящему изобретению содержит приблизительно 35 масс.% твердой дисперсии по массе композиции, где указанная дисперсия содержит приблизительно 80 масс.% по существу аморфного или аморфного Соединения 1 по массе дисперсии, приблизительно 19,5 масс.% HPMCAS по массе дисперсии и приблизительно 0,5 масс.% SLS по массе дисперсии; приблизительно 13,5 масс.% маннита по массе композиции; приблизительно 41 масс.% лактозы по массе композиции; приблизительно 2 масс.% сукралозы по массе композиции; приблизительно 6 масс.% кроскармеллозы; приблизительно 1 масс.% коллоидного диоксида кремния по массе композиции; и приблизительно 1 масс.% стеарата магния по массе композиции, где указанная композиция содержит приблизительно 62,5 мг Соединения 1.
[00397] Одна порошковая фармацевтическая композиция по настоящему изобретению содержит приблизительно 35 масс.% твердой дисперсии по массе композиции, где указанная дисперсия содержит приблизительно 80 масс.% по существу аморфного или аморфного Соединения 1 по массе дисперсии, приблизительно 19,5 масс.% HPMCAS по массе дисперсии и приблизительно 0,5 масс.% SLS по массе дисперсии; приблизительно 13,5 масс.% маннита по массе композиции; приблизительно 41 масс.% лактозы по массе композиции; приблизительно 2 масс.% сукралозы по массе композиции; приблизительно 6 масс.% кроскармеллозы; приблизительно 1 масс.% коллоидного диоксида кремния по массе композиции; и приблизительно 1 масс.% стеарата магния по массе композиции, где указанная композиция содержит приблизительно 75 мг Соединения 1.
[00398] Одна порошковая фармацевтическая композиция по настоящему изобретению содержит приблизительно 35 масс.% твердой дисперсии по массе композиции, где указанная дисперсия содержит приблизительно 80 масс.% по существу аморфного или аморфного Соединения 1 по массе дисперсии, приблизительно 19,5 масс.% HPMCAS по массе дисперсии и приблизительно 0,5 масс.% SLS по массе дисперсии; приблизительно 13,5 масс.% маннита по массе композиции; приблизительно 41 масс.% лактозы по массе композиции; приблизительно 2 масс.% сукралозы по массе композиции; приблизительно 6 масс.% кроскармеллозы; приблизительно 1 масс.% коллоидного диоксида кремния по массе композиции; и приблизительно 1 масс.% стеарата магния по массе композиции, где указанная композиция содержит приблизительно 100 мг Соединения 1.
[00399] Одна порошковая фармацевтическая композиция по настоящему изобретению содержит приблизительно 35 масс.% твердой дисперсии по массе композиции, где указанная дисперсия содержит приблизительно 80 масс.% по существу аморфного или аморфного Соединения 1 по массе дисперсии, приблизительно 19,5 масс.% HPMCAS по массе дисперсии и приблизительно 0,5 масс.% SLS по массе дисперсии; приблизительно 13,5 масс.% маннита по массе композиции; приблизительно 41 масс.% лактозы по массе композиции; приблизительно 2 масс.% сукралозы по массе композиции; приблизительно 6 масс.% кроскармеллозы; приблизительно 1 масс.% коллоидного диоксида кремния по массе композиции; и приблизительно 1 масс.% стеарата магния по массе композиции, где указанная композиция содержит приблизительно 125 мг Соединения 1.
[00400] Одна порошковая фармацевтическая композиция по настоящему изобретению содержит приблизительно 35 масс.% твердой дисперсии по массе композиции, где указанная дисперсия содержит приблизительно 80 масс.% по существу аморфного или аморфного Соединения 1 по массе дисперсии, приблизительно 19,5 масс.% HPMCAS по массе дисперсии и приблизительно 0,5 масс.% SLS по массе дисперсии; приблизительно 13,5 масс.% маннита по массе композиции; приблизительно 41 масс.% лактозы по массе композиции; приблизительно 2 масс.% сукралозы по массе композиции; приблизительно 6 масс.% кроскармеллозы; приблизительно 1 масс.% коллоидного диоксида кремния по массе композиции; и приблизительно 1 масс.% стеарата магния по массе композиции, где указанная композиция содержит приблизительно 150 мг Соединения 1.
[00401] Одна порошковая фармацевтическая композиция по настоящему изобретению содержит приблизительно 35 масс.% твердой дисперсии по массе композиции, где указанная дисперсия содержит приблизительно 80 масс.% по существу аморфного или аморфного Соединения 1 по массе дисперсии, приблизительно 19,5 масс.% HPMCAS по массе дисперсии и приблизительно 0,5 масс.% SLS по массе дисперсии; приблизительно 13,5 масс.% маннита по массе композиции; приблизительно 41 масс.% лактозы по массе композиции; приблизительно 2 масс.% сукралозы по массе композиции; приблизительно 6 масс.% кроскармеллозы; приблизительно 1 масс.% коллоидного диоксида кремния по массе композиции; и приблизительно 1 масс.% стеарата магния по массе композиции, где указанная композиция содержит приблизительно 175 мг Соединения 1.
[00402] Одна порошковая фармацевтическая композиция по настоящему изобретению содержит приблизительно 35 масс.% твердой дисперсии по массе композиции, где указанная дисперсия содержит приблизительно 80 масс.% по существу аморфного или аморфного Соединения 1 по массе дисперсии, приблизительно 19,5 масс.% HPMCAS по массе дисперсии и приблизительно 0,5 масс.% SLS по массе дисперсии; приблизительно 13,5 масс.% маннита по массе композиции; приблизительно 41 масс.% лактозы по массе композиции; приблизительно 2 масс.% сукралозы по массе композиции; приблизительно 6 масс.% кроскармеллозы; приблизительно 1 масс.% коллоидного диоксида кремния по массе композиции; и приблизительно 1 масс.% стеарата магния по массе композиции, где указанная композиция содержит приблизительно 200 мг Соединения 1.
[00403] Одна порошковая фармацевтическая композиция по настоящему изобретению содержит приблизительно 35 масс.% твердой дисперсии по массе композиции, где указанная дисперсия содержит приблизительно 80 масс.% по существу аморфного или аморфного Соединения 1 по массе дисперсии, приблизительно 19,5 масс.% HPMCAS по массе дисперсии и приблизительно 0,5 масс.% SLS по массе дисперсии; приблизительно 13,5 масс.% маннита по массе композиции; приблизительно 41 масс.% лактозы по массе композиции; приблизительно 2 масс.% сукралозы по массе композиции; приблизительно 6 масс.% кроскармеллозы; приблизительно 1 масс.% коллоидного диоксида кремния по массе композиции; и приблизительно 1 масс.% стеарата магния по массе композиции, где указанная композиция содержит приблизительно 225 мг Соединения 1.
[00404] Одна порошковая фармацевтическая композиция по настоящему изобретению содержит приблизительно 35 масс.% твердой дисперсии по массе композиции, где указанная дисперсия содержит приблизительно 80 масс.% по существу аморфного или аморфного Соединения 1 по массе дисперсии, приблизительно 19,5 масс.% HPMCAS по массе дисперсии и приблизительно 0,5 масс.% SLS по массе дисперсии; приблизительно 13,5 масс.% маннита по массе композиции; приблизительно 41 масс.% лактозы по массе композиции; приблизительно 2 масс.% сукралозы по массе композиции; приблизительно 6 масс.% кроскармеллозы; приблизительно 1 масс.% коллоидного диоксида кремния по массе композиции; и приблизительно 1 масс.% стеарата магния по массе композиции, где указанная композиция содержит приблизительно 250 мг Соединения 1.
[00405] B. ПРЕССОВАННЫЕ ЛЕКАРСТВЕННЫЕ ФОРМЫ ФАРМАЦЕВТИЧЕСКОЙ КОМПОЗИЦИИ
[00406] Другой аспект настоящего изобретения относится к твердым лекарственным формам и единичным дозированным формам, содержащим фармацевтическую композицию, в составе гранулы, пеллеты, частицы, мини-таблетки, покрывающих частиц и подобного, или прессованную в виде этих лекарственных форм. Твердые лекарственные формы и единичные дозированные формы содержат прессованные порошковые фармацевтические композиции, описанные выше, с добавлением одного или более функциональных эксципиентов, например, разрыхлителя, скользящего вещества, смазывающего вещества, наполнителя и/или увлажнителя для облегчения прессования порошковой фармацевтической композиции в прессованную фармацевтическую композицию, и для облегчения дезинтеграции и растворения прессованного порошка. Прессованная фармацевтическая композиция (твердые лекарственные формы) такие как гранулы, пеллеты, частицы, мини-таблетки и подобное, может быть включена в состав единичных дозированных форм, таких как таблетки, капсулы, пакеты, пачки, саше, флаконы и блистерные упаковки, содержащих одну или ряд таких твердых лекарственных форм. Количество твердых лекарственных форм, необходимое для каждой единичной дозированной формы, будет зависеть от концентрации Соединения 1 в каждой твердой лекарственной форме (например, каждой грануле, пеллете или мини-таблетке), и необходимого конечного количества Соединения 1 предусмотренного единичной дозированной формой. Только для целей иллюстрации, если для единичной дозированной формы (например, капсулы, пакета, пачки, саше, флакона или блистерной упаковки, содержащей мини-таблетку или множество мини-таблеток) требуется конечная доза приблизительно 75 мг, и масса каждой мини-таблетки составляет приблизительно 7 мг, и каждая мини-таблетка содержит приблизительно 2,6 мг Соединения 1, тогда каждая капсула или пачка может содержать приблизительно 29 мини-таблеток. Если для единичной дозированной формы требуется конечная доза приблизительно 40 мг, а масса каждой мини-таблетки составляет приблизительно 6,9 мг, тогда каждая капсула, пакет, пачка, саше, флакон или блистерная упаковка может содержать приблизительно 21 мини-таблетку. Если для единичной дозированной формы требуется конечная доза приблизительно 50 мг, а масса каждой мини-таблетки составляет приблизительно 6,9 мг, тогда каждая капсула, пакет, пачка, саше, флакон или блистерная упаковка может содержать приблизительно 26 мини-таблеток. Если для единичной дозированной формы требуется конечная доза приблизительно 75 мг, а масса каждой мини-таблетки составляет приблизительно 7 мг, а каждая мини-таблетка содержит приблизительно 2 мг Соединения 1, тогда каждая капсула, пакет, пачка, саше, флакон или блистерная упаковка может содержать приблизительно 39 мини-таблеток. Также, если для единичной дозированной формы требуется конечная доза приблизительно 75 мг, а масса каждой мини-таблетки составляет приблизительно 6,9 мг, тогда каждая капсула, пакет, пачка, саше, флакон или блистерная упаковка может содержать приблизительно 39 мини-таблеток. Если для единичной дозированной формы требуется конечная доза приблизительно 100 мг, а масса каждой мини-таблетки составляет приблизительно 6,9 мг, тогда каждая капсула, пакет, пачка, саше, флакон или блистерная упаковка может содержать приблизительно 52 мини-таблетки. Если для единичной дозированной формы требуется конечная доза приблизительно 75 мг, а масса каждой мини-таблетки составляет приблизительно 7 мг, а каждая мини-таблетка содержит приблизительно 0,84 мг Соединения 1, тогда каждая капсула, пакет, пачка, саше, флакон или блистерная упаковка может содержать приблизительно 90 мини-таблеток. Если для единичной дозированной формы требуется конечная доза приблизительно 150 мг, а масса каждой мини-таблетки составляет приблизительно 7 мг, а каждая мини-таблетка содержит приблизительно 2,6 мг Соединения 1, тогда каждая капсула, пакет, пачка, саше, флакон или блистерная упаковка может содержать приблизительно 58 мини-таблеток. Если для единичной дозированной формы требуется конечная доза приблизительно 150 мг, а масса каждой мини-таблетки составляет приблизительно 7 мг, а каждая мини-таблетка содержит приблизительно 2 мг Соединения 1, тогда каждая капсула, пакет, пачка, саше, флакон или блистерная упаковка может содержать приблизительно 75 мини-таблеток. Если для единичной дозированной формы требуется конечная доза приблизительно 150 мг, а масса каждой мини-таблетки составляет приблизительно 7 мг, а каждая мини-таблетка содержит приблизительно 0,84 мг Соединения 1, тогда каждая капсула, пакет, пачка, саше, флакон или блистерная упаковка может содержать приблизительно 179 мини-таблеток. Если для единичной дозированной формы требуется конечная доза приблизительно 25 мг, а масса каждой мини-таблетки составляет приблизительно 7 мг, а каждая мини-таблетка содержит приблизительно 2,6 мг Соединения 1, тогда каждая капсула, пакет, пачка, саше, флакон или блистерная упаковка может содержать приблизительно 10 мини-таблеток. Если для единичной дозированной формы требуется конечная доза приблизительно 25 мг, а масса каждой мини-таблетки составляет приблизительно 7 мг, а каждая мини-таблетка содержит приблизительно 2 мг Соединения 1, тогда каждая капсула, пакет, пачка, саше, флакон или блистерная упаковка может содержать приблизительно 13 мини-таблеток. Если для единичной дозированной формы требуется конечная доза приблизительно 25 мг, а масса каждой мини-таблетки составляет приблизительно 7 мг, а каждая мини-таблетка содержит приблизительно 0,84 мг Соединения 1, тогда каждая капсула, пакет, пачка, саше, флакон или блистерная упаковка может содержать приблизительно 30 мини-таблеток. Если для единичной дозированной формы требуется конечная доза приблизительно 50 мг, а масса каждой мини-таблетки составляет приблизительно 7 мг, а каждая мини-таблетка содержит приблизительно 2,6 мг Соединения 1, тогда каждая капсула, пакет, пачка, саше, флакон или блистерная упаковка может содержать приблизительно 19 мини-таблеток. Если для единичной дозированной формы требуется конечная доза приблизительно 50 мг, а масса каждой мини-таблетки составляет приблизительно 7 мг, а каждая мини-таблетка содержит приблизительно 2 мг Соединения 1, тогда каждая капсула, пакет, пачка, саше, флакон или блистерная упаковка может содержать приблизительно 25 мини-таблеток. Если для единичной дозированной формы требуется конечная доза приблизительно 50 мг, а масса каждой мини-таблетки составляет приблизительно 7 мг, а каждая мини-таблетка содержит приблизительно 0,84 мг Соединения 1, тогда каждая капсула, пакет, пачка, саше, флакон или блистерная упаковка может содержать приблизительно 60 мини-таблеток. Если для единичной дозированной формы требуется конечная доза приблизительно 10 мг, а каждая мини-таблетка содержит приблизительно 10 мг Соединения 1, а масса каждой мини-таблетки составляет приблизительно 26,7 мг или 35,7 мг, тогда каждая капсула, пакет, пачка, саше, флакон или блистерная упаковка может содержать 1 мини-таблетку. Если для единичной дозированной формы требуется конечная доза приблизительно 20 мг, а каждая мини-таблетка содержит приблизительно 10 мг Соединения 1, а масса каждой мини-таблетки составляет приблизительно 26,7 мг или 35,7 мг, тогда каждая капсула, пакет, пачка, саше, флакон или блистерная упаковка может содержать приблизительно 2 мини-таблетки. Если для единичной дозированной формы требуется конечная доза приблизительно 30 мг, а каждая мини-таблетка содержит приблизительно 10 мг Соединения 1, а масса каждой мини-таблетки составляет приблизительно 26,7 мг или 35,7 мг, тогда каждая капсула, пакет, пачка, саше, флакон или блистерная упаковка может содержать приблизительно 3 мини-таблетки. Если для единичной дозированной формы требуется конечная доза приблизительно 40 мг, а каждая мини-таблетка содержит приблизительно 10 мг Соединения 1, а масса каждой мини-таблетки составляет приблизительно 26,7 мг или 35,7 мг, тогда каждая капсула, пакет, пачка, саше, флакон или блистерная упаковка может содержать приблизительно 4 мини-таблетки. Если для единичной дозированной формы требуется конечная доза приблизительно 50 мг, а каждая мини-таблетка содержит приблизительно 10 мг Соединения 1, а масса каждой мини-таблетки составляет приблизительно 26,7 мг или 35,7 мг, тогда каждая капсула, пакет, пачка, саше, флакон или блистерная упаковка может содержать приблизительно 5 мини-таблеток. Если для единичной дозированной формы требуется конечная доза приблизительно 70 мг, а каждая мини-таблетка содержит приблизительно 10 мг Соединения 1, а масса каждой мини-таблетки составляет приблизительно 26,7 мг или 35,7 мг, тогда каждая капсула, пакет, пачка, саше, флакон или блистерная упаковка может содержать приблизительно 7 мини-таблеток. Если для единичной дозированной формы требуется конечная доза приблизительно 80 мг, а каждая мини-таблетка содержит приблизительно 10 мг Соединения 1, а масса каждой мини-таблетки составляет приблизительно 26,7 мг или 35,7 мг, тогда каждая капсула, пакет, пачка, саше, флакон или блистерная упаковка может содержать приблизительно 8 мини-таблеток. Если для единичной дозированной формы требуется конечная доза приблизительно 100 мг, а каждая мини-таблетка содержит приблизительно 10 мг Соединения 1, а масса каждой мини-таблетки составляет приблизительно 26,7 мг или 35,7 мг, тогда каждая капсула, пакет, пачка, саше, флакон или блистерная упаковка может содержать приблизительно 10 мини-таблеток. Если для единичной дозированной формы требуется конечная доза приблизительно 150 мг, а каждая мини-таблетка содержит приблизительно 10 мг Соединения 1, а масса каждой мини-таблетки составляет приблизительно 26,7 мг или 35,7 мг, тогда каждая капсула, пакет, пачка, саше, флакон или блистерная упаковка может содержать приблизительно 15 мини-таблеток. Если для единичной дозированной формы требуется конечная доза приблизительно 12,5 мг, а каждая мини-таблетка содержит приблизительно 12,5 мг Соединения 1, а масса каждой мини-таблетки составляет приблизительно 33,2 мг или 44,6 мг, тогда каждая капсула, пакет, пачка, саше, флакон или блистерная упаковка может содержать приблизительно 1 мини-таблетку. Если для единичной дозированной формы требуется конечная доза приблизительно 25 мг, а каждая мини-таблетка содержит приблизительно 12,5 мг Соединения 1, а масса каждой мини-таблетки составляет приблизительно 33,2 мг или 44,6 мг, тогда каждая капсула, пакет, пачка, саше, флакон или блистерная упаковка может содержать приблизительно 2 мини-таблетки. Если для единичной дозированной формы требуется конечная доза приблизительно 37,5 мг, а каждая мини-таблетка содержит приблизительно 12,5 мг Соединения 1, а масса каждой мини-таблетки составляет приблизительно 33,2 мг или 44,6 мг, тогда каждая капсула, пакет, пачка, саше, флакон или блистерная упаковка может содержать приблизительно 3 мини-таблетки. Если для единичной дозированной формы требуется конечная доза приблизительно 50 мг, а каждая мини-таблетка содержит приблизительно 12,5 мг Соединения 1, а масса каждой мини-таблетки составляет приблизительно 33,2 мг или 44,6 мг, тогда каждая капсула, пакет, пачка, саше, флакон или блистерная упаковка может содержать приблизительно 4 мини-таблетки. Если для единичной дозированной формы требуется конечная доза приблизительно 62,5 мг, а каждая мини-таблетка содержит приблизительно 12,5 мг Соединения 1, а масса каждой мини-таблетки составляет приблизительно 33,2 мг или 44,6 мг, тогда каждая капсула, пачка, пакет, саше, флакон или блистерная упаковка может содержать приблизительно 5 мини-таблеток. Если для единичной дозированной формы требуется конечная доза приблизительно 75 мг, а каждая мини-таблетка содержит приблизительно 12,5 мг Соединения 1, а масса каждой мини-таблетки составляет приблизительно 33,2 мг или 44,6 мг, тогда каждая капсула, пакет, пачка, саше, флакон или блистерная упаковка может содержать приблизительно 6 мини-таблеток. Если для единичной дозированной формы требуется конечная доза приблизительно 87,5 мг, а каждая мини-таблетка содержит приблизительно 12,5 мг Соединения 1, а масса каждой мини-таблетки составляет приблизительно 33,2 мг или 44,6 мг, тогда каждая капсула, пакет, пачка, саше, флакон или блистерная упаковка может содержать приблизительно 7 мини-таблеток. Если для единичной дозированной формы требуется конечная доза приблизительно 100 мг, а каждая мини-таблетка содержит приблизительно 12,5 мг Соединения 1, а масса каждой мини-таблетки составляет приблизительно 33,2 мг или 44,6 мг, тогда каждая капсула, пакет, пачка, саше, флакон или блистерная упаковка может содержать приблизительно 8 мини-таблеток. Если для единичной дозированной формы требуется конечная доза приблизительно 125 мг, а каждая мини-таблетка содержит приблизительно 12,5 мг Соединения 1, а масса каждой мини-таблетки составляет приблизительно 33,2 мг или 44,6 мг, тогда каждая капсула, пакет, пачка, саше, флакон или блистерная упаковка может содержать приблизительно 10 мини-таблеток. Если для единичной дозированной формы требуется конечная доза приблизительно 150 мг, а каждая мини-таблетка содержит приблизительно 12,5 мг Соединения 1, а масса каждой мини-таблетки составляет приблизительно 33,2 мг или 44,6 мг, тогда каждая капсула, пакет, пачка, саше, флакон или блистерная упаковка может содержать приблизительно 12 мини-таблеток.
[00407] Если для единичной дозированной формы требуется конечная доза приблизительно 12,5 мг, а каждая мини-таблетка содержит приблизительно 12,5 мг Соединения 1, а масса каждой мини-таблетки составляет приблизительно 44,7 мг, тогда каждая капсула, пакет, пачка, саше, флакон или блистерная упаковка может содержать приблизительно 1 мини-таблетку. Если для единичной дозированной формы требуется конечная доза приблизительно 25 мг, а каждая мини-таблетка содержит приблизительно 12,5 мг Соединения 1, а масса каждой мини-таблетки составляет приблизительно 44,7 мг, тогда каждая капсула, пакет, пачка, саше, флакон или блистерная упаковка может содержать приблизительно 2 мини-таблетки. Если для единичной дозированной формы требуется конечная доза приблизительно 37,5 мг, а каждая мини-таблетка содержит приблизительно 12,5 мг Соединения 1, а масса каждой мини-таблетки составляет приблизительно 44,7 мг, тогда каждая капсула, пакет, пачка, саше, флакон или блистерная упаковка может содержать приблизительно 3 мини-таблетки. Если для единичной дозированной формы требуется конечная доза приблизительно 50 мг, а каждая мини-таблетка содержит приблизительно 12,5 мг Соединения 1, а масса каждой мини-таблетки составляет приблизительно 44,7 мг, тогда каждая капсула, пакет, пачка, саше, флакон или блистерная упаковка может содержать приблизительно 4 мини-таблетки. Если для единичной дозированной формы требуется конечная доза приблизительно 62,5 мг, а каждая мини-таблетка содержит приблизительно 12,5 мг Соединения 1, а масса каждой мини-таблетки составляет приблизительно 44,7 мг, тогда каждая капсула, пакет, пачка, саше, флакон или блистерная упаковка может содержать приблизительно 5 мини-таблеток. Если для единичной дозированной формы требуется конечная доза приблизительно 75 мг, а каждая мини-таблетка содержит приблизительно 12,5 мг Соединения 1, а масса каждой мини-таблетки составляет приблизительно 44,7 мг, тогда каждая капсула, пакет, пачка, саше, флакон или блистерная упаковка может содержать приблизительно 6 мини-таблеток. Если для единичной дозированной формы требуется конечная доза приблизительно 87,5 мг, а каждая мини-таблетка содержит приблизительно 12,5 мг Соединения 1, а масса каждой мини-таблетки составляет приблизительно 44,7 мг, тогда каждая капсула, пакет, пачка, саше, флакон или блистерная упаковка может содержать приблизительно 7 мини-таблеток. Если для единичной дозированной формы требуется конечная доза приблизительно 100 мг, а каждая мини-таблетка содержит приблизительно 12,5 мг Соединения 1, а масса каждой мини-таблетки составляет приблизительно 44,7 мг, тогда каждая капсула, пакет, пачка, саше, флакон или блистерная упаковка может содержать приблизительно 8 мини-таблеток. Если для единичной дозированной формы требуется конечная доза приблизительно 125 мг, а каждая мини-таблетка содержит приблизительно 12,5 мг Соединения 1, а масса каждой мини-таблетки составляет приблизительно 44,7 мг, тогда каждая капсула, пакет, саше, пачка, флакон или блистерная упаковка может содержать приблизительно 10 мини-таблеток. Если для единичной дозированной формы требуется конечная доза приблизительно 150 мг, а каждая мини-таблетка содержит приблизительно 12,5 мг Соединения 1, а масса каждой мини-таблетки составляет приблизительно 44,7 мг, тогда каждая капсула, пакет, пачка, саше, флакон или блистерная упаковка может содержать приблизительно 12 мини-таблеток.
[00408] Конечная доза зависит от количества Соединения 1 в твердой дисперсии, количества твердой дисперсии в мини-таблетке, массы мини-таблетки и количества мини-таблетки(таблеток). Хотя примеры иллюстрируют 2-мм и 4-мм мини-таблетки с массой 6,9 мг, 7 мг, 35,7 мг, 44,7 мг, специалисту в данной области было бы понятно, что для отдельного состава лекарственной формы любая желаемая доза может достигаться путем корректировки массы мини-таблетки, а затем введения соответствующего количества мини-таблеток в средство доставки желаемой дозы. Например, 100 мини-таблеток, в которых каждая мини-таблетка весит 5 мг и включает 35 масс.% указанной дисперсии, описанной в примерах как промежуточное соединение 1, в результате приводят к получению конечной дозы 140 мг Соединения 1.
[00409] В некоторых вариантах осуществления прессованные готовые лекарственные формы имеют размер от около 1 мм до около 5 мм (например, 2 мм или 4 мм) по всем измерениям. В некоторых вариантах осуществления прессованные лекарственные формы включают гранулы любой формы, в том числе неправильной формы, которые имеют размер от около 1 мм до около 5 мм (например, 2 мм или 4 мм) по всем измерениям. Например, сферическая гранула имеет диаметр, начиная от приблизительно 1 мм и до приблизительно 5 мм (например, 2 мм или 4 мм). Гранула эллиптической формы имеет длину, начиная от приблизительно 1 мм и до приблизительно 5 мм (например, 2 мм или 4 мм), и диаметр, начиная от приблизительно 1 мм и до приблизительно 5 мм (например, 2 мм или 4 мм). Мини-таблетка может иметь цилиндрическую форму и иметь диаметр, начиная от приблизительно 1 мм и до приблизительно 5 мм (например, 2 мм или 4 мм), и длину или толщину, начиная от приблизительно 1 мм и до приблизительно 5 мм (например, 2 мм или 4 мм). Не существует ограничений по геометрии прессованной лекарственной формы, и она ограничена только геометрией инструментального оборудования (т.е., пресс-форм и пуансонов), используемого для прессования порошковой смеси фармацевтической композиции по настоящему изобретению в различные прессованные твердые лекарственные формы.
[00410] Только с целью иллюстрации, в вариантах осуществления настоящего изобретения будут приведены примеры использования мини-таблетки, имеющей диаметр приблизительно 2 мм и длину приблизительно 2 мм. Партию мини-таблеткок, содержащих одну фармацевтическую композицию, получают в составе капсулы, пакета, пачки, саше, флакона или блистерной упаковки (единичная доза), указанная капсула, пакет, пачка, саше, флакон или блистерная упаковка содержит от приблизительно 1 мг до приблизительно 250 мг Соединения 1, или от приблизительно 10 мг до приблизительно 250 мг, или от приблизительно 15 мг до приблизительно 250 мг Соединения 1. Количество мини-таблеток, используемых для получения капсулы, пакета, пачки, саше, флакона или блистерной упаковки, может варьировать от 1 до 350 (например: 1-336, 1-150, 1-100, 1-50, 1-30) мини-таблеток на капсулу, пакет, пачку, саше, флакон или блистерную упаковку. Каждая партия мини-таблеток, проиллюстрированная в Примерах, приведенных ниже, содержит прессованную порошковую фармацевтическую композицию, указанная композиция содержит твердую дисперсию Соединения 1, где твердая дисперсия содержит полимер, и один или более наполнителей, подсластитель, разрыхлитель, необязательно увлажнитель, скользящее вещество и смазывающее вещество. Различные партии прессованных фармацевтических композиций могут содержать одинаковые или различные количества Соединения 1 и/или различные количества эксципиентов.
[00411] В некоторых вариантах осуществления настоящее изобретение относится к фармацевтической композиции, содержащей мини-таблетку или множество мини-таблеток в единичной дозированной форме, где каждая из мини-таблеток содержит:
a) твердую дисперсию по существу аморфного или аморфного Соединения 1 и полимера, указанный полимер содержит HPMCAS;
b) один или более наполнителей;
c) подсластитель;
d) разрыхлитель;
e) необязательно увлажнитель;
f) скользящее вещество; и
g) смазывающее вещество,
где единичная дозированная форма содержит количество по существу аморфного Соединения 1 или аморфного Соединения 1 в интервале от приблизительно 1 мг до приблизительно 250 мг.
[00412] В некоторых вариантах осуществления настоящее изобретение относится к фармацевтической композиции, содержащей мини-таблетку или множество мини-таблеток в единичной дозированной форме, где каждая из мини-таблеток содержит:
a) твердую дисперсию по существу аморфного или аморфного Соединения 1 и полимера, указанный полимер содержит HPMCAS;
b) один или более наполнителей;
c) подсластитель;
d) разрыхлитель;
e) необязательно увлажнитель;
f) скользящее вещество; и
g) смазывающее вещество,
где указанная мини-таблетка или множество мини-таблеток содержит приблизительно 5 мг по существу аморфного Соединения 1 или аморфного Соединения 1.
[00413] В некоторых вариантах осуществления настоящее изобретение относится к фармацевтической композиции, содержащей мини-таблетку или множество мини-таблеток в единичной дозированной форме, где каждая из мини-таблеток содержит:
a) твердую дисперсию по существу аморфного или аморфного Соединения 1 и полимера, указанный полимер содержит HPMCAS;
b) один или более наполнителей;
c) подсластитель;
d) разрыхлитель;
e) необязательно увлажнитель;
f) скользящее вещество; и
g) смазывающее вещество,
где указанная мини-таблетка или множество мини-таблеток содержит приблизительно 10 мг по существу аморфного Соединения 1 или аморфного Соединения 1.
[00414] В некоторых вариантах осуществления настоящее изобретение относится к фармацевтической композиции, содержащей мини-таблетку или множество мини-таблеток в единичной дозированной форме, где каждая из мини-таблеток содержит:
a) твердую дисперсию по существу аморфного или аморфного Соединения 1 и полимера, указанный полимер содержит HPMCAS;
b) один или более наполнителей;
c) подсластитель;
d) разрыхлитель;
e) необязательно увлажнитель;
f) скользящее вещество; и
g) смазывающее вещество,
где указанная мини-таблетка или множество мини-таблеток содержит приблизительно 12,5 мг по существу аморфного Соединения 1 или аморфного Соединения 1.
[00415] В некоторых вариантах осуществления настоящее изобретение относится к фармацевтической композиции, содержащей мини-таблетку или множество мини-таблеток в единичной дозированной форме, где каждая из мини-таблеток содержит:
a) твердую дисперсию по существу аморфного или аморфного Соединения 1 и полимера, указанный полимер содержит HPMCAS;
b) один или более наполнителей;
c) подсластитель;
d) разрыхлитель;
e) необязательно увлажнитель;
f) скользящее вещество; и
g) смазывающее вещество,
где указанная мини-таблетка или множество мини-таблеток содержит приблизительно 15 мг по существу аморфного Соединения 1 или аморфного Соединения 1.
[00416] В некоторых вариантах осуществления настоящее изобретение относится к фармацевтической композиции, содержащей мини-таблетку или множество мини-таблеток в единичной дозированной форме, где каждая из мини-таблеток содержит:
a) твердую дисперсию по существу аморфного или аморфного Соединения 1 и полимера, указанный полимер содержит HPMCAS;
b) один или более наполнителей;
c) подсластитель;
d) разрыхлитель;
e) необязательно увлажнитель;
f) скользящее вещество; и
g) смазывающее вещество,
где указанная мини-таблетка или множество мини-таблеток содержит приблизительно 20 мг по существу аморфного Соединения 1 или аморфного Соединения 1.
[00417] В некоторых вариантах осуществления настоящее изобретение относится к фармацевтической композиции, содержащей мини-таблетку или множество мини-таблеток в единичной дозированной форме, где каждая из мини-таблеток содержит:
a) твердую дисперсию по существу аморфного или аморфного Соединения 1 и полимера, указанный полимер содержит HPMCAS;
b) один или более наполнителей;
c) подсластитель;
d) разрыхлитель;
e) необязательно увлажнитель;
f) скользящее вещество; и
g) смазывающее вещество,
где единичная дозированная форма содержит приблизительно 25 мг по существу аморфного Соединения 1 или аморфного Соединения 1.
[00418] В некоторых вариантах осуществления настоящее изобретение относится к фармацевтической композиции, содержащей мини-таблетку или множество мини-таблеток в единичной дозированной форме, где каждая из мини-таблеток содержит:
a) твердую дисперсию по существу аморфного или аморфного Соединения 1 и полимера, указанный полимер содержит HPMCAS;
b) один или более наполнителей;
c) подсластитель;
d) разрыхлитель;
e) необязательно увлажнитель;
f) скользящее вещество; и
g) смазывающее вещество,
где указанная мини-таблетка или множество мини-таблеток содержит приблизительно 30 мг по существу аморфного Соединения 1 или аморфного Соединения 1.
[00419] В некоторых вариантах осуществления настоящее изобретение относится к фармацевтической композиции, содержащей мини-таблетку или множество мини-таблеток в единичной дозированной форме, где каждая из мини-таблеток содержит:
a) твердую дисперсию по существу аморфного или аморфного Соединения 1 и полимера, указанный полимер содержит HPMCAS;
b) один или более наполнителей;
c) подсластитель;
d) разрыхлитель;
e) необязательно увлажнитель;
f) скользящее вещество; и
g) смазывающее вещество,
где указанная мини-таблетка или множество мини-таблеток содержит приблизительно 35 мг по существу аморфного Соединения 1 или аморфного Соединения 1.
[00420] В некоторых вариантах осуществления настоящее изобретение относится к фармацевтической композиции, содержащей мини-таблетку или множество мини-таблеток в единичной дозированной форме, где каждая из мини-таблеток содержит:
a) твердую дисперсию по существу аморфного или аморфного Соединения 1 и полимера, указанный полимер содержит HPMCAS;
b) один или более наполнителей;
c) подсластитель;
d) разрыхлитель;
e) необязательно увлажнитель;
f) скользящее вещество; и
g) смазывающее вещество,
где указанная мини-таблетка или множество мини-таблеток содержит приблизительно 37,5 мг по существу аморфного Соединения 1 или аморфного Соединения 1.
[00421] В некоторых вариантах осуществления настоящее изобретение относится к фармацевтической композиции, содержащей мини-таблетку или множество мини-таблеток в единичной дозированной форме, где каждая из мини-таблеток содержит:
a) твердую дисперсию по существу аморфного или аморфного Соединения 1 и полимера, указанный полимер содержит HPMCAS;
b) один или более наполнителей;
c) подсластитель;
d) разрыхлитель;
e) необязательно увлажнитель;
f) скользящее вещество; и
g) смазывающее вещество,
где указанная мини-таблетка или множество мини-таблеток содержит приблизительно 40 мг по существу аморфного Соединения 1 или аморфного Соединения 1.
[00422] В некоторых вариантах осуществления настоящее изобретение относится к фармацевтической композиции, содержащей мини-таблетку или множество мини-таблеток в единичной дозированной форме, где каждая из мини-таблеток содержит:
a) твердую дисперсию по существу аморфного или аморфного Соединения 1 и полимера, указанный полимер содержит HPMCAS;
b) один или более наполнителей;
c) подсластитель;
d) разрыхлитель;
e) необязательно увлажнитель;
f) скользящее вещество; и
g) смазывающее вещество,
где указанная мини-таблетка или множество мини-таблеток содержит приблизительно 45 мг по существу аморфного Соединения 1 или аморфного Соединения 1.
[00423] В некоторых вариантах осуществления настоящее изобретение относится к фармацевтической композиции, содержащей мини-таблетку или множество мини-таблеток в единичной дозированной форме, где каждая из мини-таблеток содержит:
a) твердую дисперсию по существу аморфного или аморфного Соединения 1 и полимера, указанный полимер содержит HPMCAS;
b) один или более наполнителей;
c) подсластитель;
d) разрыхлитель;
e) необязательно увлажнитель;
f) скользящее вещество; и
g) смазывающее вещество,
где единичная дозированная форма содержит приблизительно 50 мг по существу аморфного Соединения 1 или аморфного Соединения 1.
[00424] В некоторых вариантах осуществления настоящее изобретение относится к фармацевтической композиции, содержащей мини-таблетку или множество мини-таблеток в единичной дозированной форме, где каждая из мини-таблеток содержит:
a) твердую дисперсию по существу аморфного или аморфного Соединения 1 и полимера, указанный полимер содержит HPMCAS;
b) один или более наполнителей;
c) подсластитель;
d) разрыхлитель;
e) необязательно увлажнитель;
f) скользящее вещество; и
g) смазывающее вещество,
где указанная мини-таблетка или множество мини-таблеток содержит приблизительно 62,5 мг по существу аморфного Соединения 1 или аморфного Соединения 1.
[00425] В некоторых вариантах осуществления настоящее изобретение относится к фармацевтической композиции, содержащей мини-таблетку или множество мини-таблеток в единичной дозированной форме, где каждая из мини-таблеток содержит:
a) твердую дисперсию по существу аморфного или аморфного Соединения 1 и полимера, указанный полимер содержит HPMCAS;
b) один или более наполнителей;
c) подсластитель;
d) разрыхлитель;
e) необязательно увлажнитель;
f) скользящее вещество; и
g) смазывающее вещество,
где единичная дозированная форма содержит приблизительно 75 мг по существу аморфного Соединения 1 или аморфного Соединения 1.
[00426] В некоторых вариантах осуществления настоящее изобретение относится к фармацевтической композиции, содержащей мини-таблетку или множество мини-таблеток в единичной дозированной форме, где каждая из мини-таблеток содержит:
a) твердую дисперсию по существу аморфного или аморфного Соединения 1 и полимера, указанный полимер содержит HPMCAS;
b) один или более наполнителей;
c) подсластитель;
d) разрыхлитель;
e) необязательно увлажнитель;
f) скользящее вещество; и
g) смазывающее вещество,
где единичная дозированная форма содержит приблизительно 100 мг по существу аморфного Соединения 1 или аморфного Соединения 1.
[00427] В некоторых вариантах осуществления настоящее изобретение относится к фармацевтической композиции, содержащей мини-таблетку или множество мини-таблеток в единичной дозированной форме, где каждая из мини-таблеток содержит:
a) твердую дисперсию по существу аморфного или аморфного Соединения 1 и полимера, указанный полимер содержит HPMCAS;
b) один или более наполнителей;
c) подсластитель;
d) разрыхлитель;
e) необязательно увлажнитель;
f) скользящее вещество; и
g) смазывающее вещество,
где указанная мини-таблетка или множество мини-таблеток содержит приблизительно 125 мг по существу аморфного Соединения 1 или аморфного Соединения 1.
[00428] В некоторых вариантах осуществления настоящее изобретение относится к фармацевтической композиции, содержащей мини-таблетку или множество мини-таблеток в единичной дозированной форме, где каждая из мини-таблеток содержит:
a) твердую дисперсию по существу аморфного или аморфного Соединения 1 и полимера, указанный полимер содержит HPMCAS;
b) один или более наполнителей;
c) подсластитель;
d) разрыхлитель;
e) необязательно увлажнитель;
f) скользящее вещество; и
g) смазывающее вещество,
где единичная дозированная форма содержит приблизительно 150 мг по существу аморфного Соединения 1 или аморфного Соединения 1.
[00429] В некоторых вариантах осуществления настоящее изобретение относится к фармацевтической композиции, содержащей мини-таблетку или множество мини-таблеток в единичной дозированной форме, где каждая из мини-таблеток содержит:
a) твердую дисперсию по существу аморфного или аморфного Соединения 1 и полимера, указанный полимер содержит HPMCAS;
b) один или более наполнителей;
c) подсластитель;
d) разрыхлитель;
e) необязательно увлажнитель;
f) скользящее вещество; и
g) смазывающее вещество,
где указанная мини-таблетка или множество мини-таблеток содержит приблизительно 175 мг по существу аморфного Соединения 1 или аморфного Соединения 1.
[00430] В некоторых вариантах осуществления настоящее изобретение относится к фармацевтической композиции, содержащей мини-таблетку или множество мини-таблеток в единичной дозированной форме, где каждая из мини-таблеток содержит:
a) твердую дисперсию по существу аморфного или аморфного Соединения 1 и полимера, указанный полимер содержит HPMCAS;
b) один или более наполнителей;
c) подсластитель;
d) разрыхлитель;
e) необязательно увлажнитель;
f) скользящее вещество; и
g) смазывающее вещество,
где указанная мини-таблетка или множество мини-таблеток содержит приблизительно 200 мг по существу аморфного Соединения 1 или аморфного Соединения 1.
[00431] В некоторых вариантах осуществления настоящее изобретение относится к фармацевтической композиции, содержащей мини-таблетку или множество мини-таблеток в единичной дозированной форме, где каждая из мини-таблеток содержит:
a) твердую дисперсию по существу аморфного или аморфного Соединения 1 и полимера, указанный полимер содержит HPMCAS;
b) один или более наполнителей;
c) подсластитель;
d) разрыхлитель;
e) необязательно увлажнитель;
f) скользящее вещество; и
g) смазывающее вещество,
где указанная мини-таблетка или множество мини-таблеток содержит приблизительно 225 мг по существу аморфного Соединения 1 или аморфного Соединения 1.
[00432] В некоторых вариантах осуществления настоящее изобретение относится к фармацевтической композиции, содержащей мини-таблетку или множество мини-таблеток в единичной дозированной форме, где каждая из мини-таблеток содержит:
a) твердую дисперсию по существу аморфного или аморфного Соединения 1 и полимера, указанный полимер содержит HPMCAS;
b) один или более наполнителей;
c) подсластитель;
d) разрыхлитель;
e) необязательно увлажнитель;
f) скользящее вещество; и
g) смазывающее вещество,
где указанная мини-таблетка или множество мини-таблеток содержит приблизительно 250 мг по существу аморфного Соединения 1 или аморфного Соединения 1.
[00433] В дополнительном варианте осуществления один или более наполнителей представляет собой двухкомпонентный наполнитель, содержащий смесь 2 наполнителей. В другом дополнительном варианте осуществления двухкомпонентный наполнитель представляет собой смесь маннита и другого наполнителя. В другом дополнительном варианте осуществления двухкомпонентный наполнитель представляет собой смесь лактозы и другого наполнителя. В другом дополнительном варианте осуществления двухкомпонентный наполнитель представляет собой смесь маннита и лактозы.
[00434] В другом дополнительном варианте осуществления фармацевтическая композиция содержит двухкомпонентный наполнитель, где двухкомпонентный наполнитель содержит маннит в количестве до приблизительно 100 масс.% двухкомпонентного наполнителя. Еще в одном дополнительном варианте осуществления фармацевтическая композиция содержит двухкомпонентный наполнитель, где двухкомпонентный наполнитель содержит лактозу в количестве до приблизительно 100 масс.% двухкомпонентного наполнителя. Еще в одном дополнительном варианте осуществления фармацевтическая композиция содержит двухкомпонентный наполнитель, где двухкомпонентный наполнитель содержит маннит в количестве до приблизительно 100 масс.% двухкомпонентного наполнителя и лактозу в таком количестве, что сумма количества маннита и лактозы равна 100 масс.%.
[00435] В некоторых вариантах осуществления фармацевтическая композиция содержит двухкомпонентный наполнитель, где двухкомпонентный наполнитель содержит маннит и другой наполнитель в соотношении приблизительно 3:1 маннита к другому наполнителю, в соотношении приблизительно 1:1 маннита к другому наполнителю, или в соотношении приблизительно 1:3 маннита к другому наполнителю. В некоторых вариантах осуществления фармацевтическая композиция содержит двухкомпонентный наполнитель, где двухкомпонентный наполнитель содержит лактозу и другой наполнитель в соотношении приблизительно 3:1 лактозы к другому наполнителю, в соотношении приблизительно 1:1 лактозы к другому наполнителю, или в соотношении приблизительно 1:3 лактозы к другому наполнителю. В некоторых вариантах осуществления фармацевтическая композиция содержит двухкомпонентный наполнитель, где двухкомпонентный наполнитель содержит маннит и лактозу в соотношении приблизительно 3:1 маннита к лактозе, в соотношении приблизительно 1:1 маннита к лактозе, или в соотношении приблизительно 1:3 маннита к лактозе.
[00436] Одна, приводимая в качестве примера, прессованная фармацевтическая композиция содержит от приблизительно 5 масс.% до приблизительно 70 масс.% (например, от приблизительно 5 масс.% до приблизительно 65 масс.%, от приблизительно 5 масс.% до приблизительно 50 масс.% или от приблизительно 30 масс.% до приблизительно 40 масс.%) твердой дисперсии по массе композиции, содержащей от приблизительно 30 масс.% до приблизительно 90 масс.% по существу аморфного Соединения 1, по массе дисперсии, и от приблизительно 70 масс.% до приблизительно 10 масс.% полимера, по массе дисперсии; от приблизительно 10 масс.% до приблизительно 90 масс.% одного или более наполнителей; от приблизительно 1 масс.% до приблизительно 10 масс.% разрыхлителя; необязательно от приблизительно 3 масс.% до приблизительно 0,01 масс.% увлажнителя; от приблизительно 0,1 масс.% до приблизительно 5 масс.% подсластителя; от приблизительно 5 масс.% до приблизительно 0,1 масс.% скользящего вещества; и от приблизительно 7 масс.% до приблизительно 0,1 масс.% смазывающего вещества. Или прессованная фармацевтическая композиция содержит от приблизительно 5 масс.% до приблизительно 65 масс.% (например, от приблизительно 5 масс.% до приблизительно 25 масс.%, от приблизительно 15 масс.% до приблизительно 40 масс.% или от приблизительно 30 масс.% до приблизительно 50 масс.%) твердой дисперсии по массе композиции, содержащей от приблизительно 30 масс.% до приблизительно 90 масс.% аморфного Соединения 1, по массе дисперсии, и от приблизительно 70 масс.% до приблизительно 10 масс.% полимера, по массе дисперсии; от приблизительно 10 масс.% до приблизительно 90 масс.% одного или более наполнителей; от приблизительно 1 масс.% до приблизительно 10 масс.% разрыхлителя; необязательно от приблизительно 3 масс.% до приблизительно 0,01 масс.% увлажнителя; от приблизительно 0,1 масс.% до приблизительно 5 масс.% подсластителя; от приблизительно 5 масс.% до приблизительно 0,1 масс.% скользящего вещества; и от приблизительно 7 масс.% до приблизительно 0,1 масс.% смазывающего вещества.
[00437] Другая, приводимая в качестве примера, фармацевтическая композиция содержит от приблизительно 5 масс.% до приблизительно 60 масс.% (например, от приблизительно 5 масс.% до приблизительно 55 масс.%, от приблизительно 15 масс.% до приблизительно 50 масс.% или от приблизительно 30 масс.% до приблизительно 50 масс.%) твердой дисперсии по массе композиции, содержащей от приблизительно 30 масс.% до приблизительно 90 масс.% по существу аморфного Соединения 1, по массе дисперсии, и от приблизительно 70 масс.% до приблизительно 10 масс.% полимера, по массе дисперсии; от приблизительно 10 масс.% до приблизительно 90 масс.% одного или более наполнителей; от приблизительно 1 масс.% до приблизительно 10 масс.% разрыхлителя; от приблизительно 0,1 масс.% до приблизительно 5 масс.% подсластителя, от приблизительно 7 масс.% до приблизительно 0,1 масс.% смазывающего вещества; необязательно от приблизительно 0,01 масс.% до приблизительно 3 масс.% увлажнителя; от приблизительно 5 масс.% до приблизительно 0,1 масс.% скользящего вещества. Или фармацевтическая композиция содержит от приблизительно 5 масс.% до приблизительно 70 масс.% (например, от приблизительно 5 масс.% до приблизительно 65 масс.%, от приблизительно 5 масс.% до приблизительно 50 масс.% или от приблизительно 30 масс.% до приблизительно 50 масс.%) твердой дисперсии по массе композиции, содержащей от приблизительно 40 масс.% до приблизительно 90 масс.% аморфного Соединения 1, по массе дисперсии, и от приблизительно 60 масс.% до приблизительно 10 масс.% полимера, по массе дисперсии; от приблизительно 10 масс.% до приблизительно 90 масс.% одного или более наполнителей; от приблизительно 1 масс.% до приблизительно 10 масс.% разрыхлителя; от приблизительно 5 масс.% до приблизительно 0,1 масс.% подсластителя; необязательно от приблизительно 3 масс.% до приблизительно 0,01 масс.% увлажнителя; от приблизительно 5 масс.% до приблизительно 0,1 масс.% скользящего вещества; и от приблизительно 7 масс.% до приблизительно 0,1 масс.% смазывающего вещества.
[00438] Одна фармацевтическая композиция по настоящему изобретению содержит приблизительно 46,9 масс.% твердой дисперсии по массе композиции, где указанная дисперсия содержит приблизительно 80 масс.% по существу аморфного или аморфного Соединения 1 по массе дисперсии, приблизительно 19,5 масс.% HPMCAS по массе дисперсии и приблизительно 0,5 масс.% SLS по массе дисперсии; приблизительно 45,1 масс.% маннита по массе композиции; приблизительно 2 масс.% сукралозы по массе композиции; приблизительно 3 масс.% кроскармеллозы натрия по массе композиции; приблизительно 0,5 масс.% SLS по массе композиции; приблизительно 1 масс.% коллоидного диоксида кремния по массе композиции; и приблизительно 1,5 масс.% стеарата магния по массе композиции.
[00439] Другая прессованная фармацевтическая композиция по настоящему изобретению содержит приблизительно 24,6 масс.% (эквивалент 24,6 мг действующего вещества для 200 мг единицы) твердой дисперсии по массе композиции, где указанная дисперсия содержит приблизительно 50 масс.% по существу аморфного или аморфного Соединения 1 по массе дисперсии, приблизительно 49,5 масс.% HPMCAS по массе дисперсии и приблизительно 0,5 масс.% SLS по массе дисперсии; приблизительно 67,4 масс.% маннита по массе композиции; приблизительно 2 масс.% сукралозы по массе композиции; приблизительно 3 масс.% кроскармеллозы натрия по массе композиции; приблизительно 0,5 масс.% SLS по массе композиции; приблизительно 1 масс.% коллоидного диоксида кремния по массе композиции; и приблизительно 1,5 масс.% стеарата магния по массе композиции.
[00440] В другом варианте осуществления прессованная фармацевтическая композиция по настоящему изобретению содержит приблизительно 35 масс.% твердой дисперсии по массе композиции, где указанная дисперсия содержит приблизительно 72,4 масс.% по существу аморфного или аморфного Соединения 1 по массе дисперсии, приблизительно 27,1 масс.% HPMCAS по массе дисперсии и приблизительно 0,5 масс.% SLS по массе дисперсии; приблизительно 54 масс.% маннита по массе композиции; приблизительно 2 масс.% сукралозы по массе композиции; приблизительно 6 масс.% кроскармеллозы натрия по массе композиции; приблизительно 0,5 масс.% SLS по массе композиции; приблизительно 1 масс.% коллоидного диоксида кремния по массе композиции; и приблизительно 1,5 масс.% стеарата магния по массе композиции.
[00441] В некоторых вариантах осуществления прессованная фармацевтическая композиция по настоящему изобретению содержит приблизительно 61,6 масс.% твердой дисперсии по массе композиции, где указанная дисперсия содержит приблизительно 80 масс.% по существу аморфного или аморфного Соединения 1 по массе дисперсии, приблизительно 19,5 масс.% HPMCAS по массе дисперсии и приблизительно 0,5 масс.% SLS по массе дисперсии; приблизительно 30,4 масс.% маннита по массе композиции; приблизительно 2 масс.% сукралозы по массе композиции; приблизительно 3 масс.% кроскармеллозы натрия по массе композиции; приблизительно 0,5 масс.% SLS по массе композиции; приблизительно 1 масс.% коллоидного диоксида кремния по массе композиции; приблизительно 1,5 масс.% стеарата магния по массе композиции.
[00442] В некоторых вариантах осуществления прессованная фармацевтическая композиция по настоящему изобретению содержит приблизительно 68,7 масс.% твердой дисперсии по массе композиции, где указанная дисперсия содержит приблизительно 80 масс.% по существу аморфного или аморфного Соединения 1 по массе дисперсии, приблизительно 19,5 масс.% HPMCAS по массе дисперсии и приблизительно 0,5 масс.% SLS по массе дисперсии; приблизительно 23,3 масс.% маннита по массе композиции; приблизительно 2 масс.% сукралозы по массе композиции; приблизительно 3 масс.% кроскармеллозы натрия по массе композиции; приблизительно 0,5 масс.% SLS по массе композиции; приблизительно 1 масс.% коллоидного диоксида кремния по массе композиции; приблизительно 1,5 масс.% стеарата магния по массе композиции. Необязательно, указанные выше прессованные фармацевтические композиции также могут включать приблизительно 0,4 масс.% красителя по массе композиции.
[00443] Еще в одной дополнительной прессованной фармацевтической композиции по настоящему изобретению, фармацевтическая композиция содержит приблизительно 34 масс.% твердой дисперсии по массе композиции, где указанная дисперсия содержит приблизительно 80 масс.% по существу аморфного или аморфного Соединения 1 по массе дисперсии, приблизительно 19,5 масс.% HPMCAS по массе дисперсии и приблизительно 0,5 масс.% SLS по массе дисперсии; приблизительно 58 масс.% маннита по массе композиции; приблизительно 2 масс.% сукралозы по массе композиции; приблизительно 3 масс.% кроскармеллозы натрия по массе композиции; приблизительно 0,5 масс.% SLS по массе композиции; приблизительно 1 масс.% коллоидного диоксида кремния по массе композиции; и приблизительно 1,5 масс.% стеарата магния по массе композиции.
[00444] В одном аспекте настоящее изобретение относится к фармацевтической композиции, содержащей от приблизительно 30 масс.% до приблизительно 50 масс.% твердой дисперсии по массе композиции, где указанная дисперсия содержит приблизительно 80 масс.% по существу аморфного или аморфного Соединения 1 по массе дисперсии, приблизительно 19,5 масс.% HPMCAS по массе дисперсии, и приблизительно 0,5 масс.% SLS по массе дисперсии; от приблизительно 30 масс.% до приблизительно 60 масс.% двухкомпонентного наполнителя, где двухкомпонентный наполнитель содержит от приблизительно 0 масс.% до приблизительно 60 масс.% маннита по массе композиции и от приблизительно 0 масс.% до приблизительно 60 масс.% лактозы по массе композиции; от приблизительно 1,5 масс.% до приблизительно 2,5 масс.% сукралозы по массе композиции; от приблизительно 4 масс.% до приблизительно 8 масс.% кроскармеллозы натрия по массе композиции; от приблизительно 0,5 масс.% до приблизительно 1,5 масс.% коллоидного диоксида кремния по массе композиции; и от приблизительно 1 масс.% до приблизительно 2 масс.% стеарата магния по массе композиции.
[00445] В одном варианте осуществления фармацевтическая композиция содержит приблизительно 35 масс.% твердой дисперсии по массе композиции, где указанная дисперсия содержит приблизительно 80 масс.% по существу аморфного или аморфного Соединения 1 по массе дисперсии, приблизительно 19,5 масс.% HPMCAS по массе дисперсии и приблизительно 0,5 масс.% SLS по массе дисперсии; приблизительно 13,5 масс.% маннита по массе композиции; приблизительно 41 масс.% лактозы по массе композиции; приблизительно 2 масс.% сукралозы по массе композиции; приблизительно 6 масс.% кроскармеллозы натрия по массе композиции; приблизительно 1 масс.% коллоидного диоксида кремния по массе композиции; и приблизительно 1,5 масс.% стеарата магния по массе композиции.
[00446] В некоторых вариантах осуществления прессованная фармацевтическая композиция содержит 25-40 мини-таблеток, указанные мини-таблетки, в совокупности содержащие 75 мг Соединения 1, дополнительно могут быть в составе единичной дозы, например, капсулы, пакета, пачки, саше, флакона или блистерной упаковки. В других вариантах осуществления единичная доза, включающая капсулу, пакет, пачку, саше, флакон или блистерную упаковку, содержащую 25-40 мини-таблеток, может содержать приблизительно 50 мг, приблизительно 40 мг, приблизительно 30 мг, приблизительно 25 мг, приблизительно 20 мг, приблизительно 15 мг, приблизительно 10 мг или приблизительно 5 мг Соединения 1.
[00447] В некоторых вариантах осуществления прессованная фармацевтическая композиция содержит 5-30 мини-таблеток, указанные мини-таблетки, в совокупности содержащие 75 мг Соединения 1, дополнительно могут быть в составе единичной дозы, например, капсулы, пакета, саше, флакона или блистерной упаковки. В других вариантах осуществления единичная доза, включающая капсулу, пакет, пачку, саше, флакон или блистерную упаковку, содержащую 5-30 мини-таблеток, может содержать приблизительно 50 мг, приблизительно 40 мг, приблизительно 30 мг, приблизительно 25 мг, приблизительно 20 мг, приблизительно 15 мг, приблизительно 10 мг или приблизительно 5 мг Соединения 1.
[00448] В некоторых вариантах осуществления прессованная фармацевтическая композиция содержит 1-30 мини-таблеток, указанные мини-таблетки, в совокупности содержащие 50 мг Соединения 1, дополнительно могут быть в составе единичной дозы, например капсулы, пакета, саше, флакона или блистерной упаковки. В других вариантах осуществления единичная доза, включающая капсулу, пакет, пачку, саше, флакон или блистерную упаковку, содержащую 1-30 мини-таблеток, может содержать приблизительно 75 мг, приблизительно 50 мг, приблизительно 40 мг, приблизительно 30 мг, приблизительно 25 мг, приблизительно 20 мг, приблизительно 15 мг, приблизительно 10 мг или приблизительно 5 мг Соединения 1.
[00449] В некоторых вариантах осуществления прессованная фармацевтическая композиция содержит приблизительно 1-50 мини-таблеток (например, от приблизительно 27 до приблизительно 32 или от приблизительно 35 до приблизительно 42), указанные мини-таблетки, в совокупности содержащие 75 мг Соединения 1, дополнительно могут быть в составе единичной дозы, например, капсулы, пакета, пачки, саше, флакона или блистерной упаковки. В других вариантах осуществления единичная доза, включающая капсулу, пакет, пачку, саше, флакон или блистерную упаковку, содержащую 1-30 мини-таблеток (например, приблизительно 25, приблизительно 20, приблизительно 19, приблизительно 15, приблизительно 12, приблизительно 10, приблизительно 9, приблизительно 8, приблизительно 7, приблизительно 6, приблизительно 5, приблизительно 4, приблизительно 3, приблизительно 2 или приблизительно 1), может содержать приблизительно 50 мг, приблизительно 40 мг, приблизительно 30 мг, приблизительно 25 мг, приблизительно 20 мг, приблизительно 15 мг, приблизительно 10 мг или приблизительно 5 мг Соединения 1.
[00450] Еще в одной дополнительной фармацевтической композиции по настоящему изобретению, прессованная в мини-таблетку фармацевтическая композиция имеет среднюю прочность при растяжении от приблизительно 0,5 МПа до приблизительно 4 МПа и содержит приблизительно 46,9 масс.% твердой дисперсии по массе композиции, где указанная дисперсия содержит приблизительно 80 масс.% по существу аморфного или аморфного Соединения 1 по массе дисперсии, приблизительно 19,5 масс.% HPMCAS по массе дисперсии и приблизительно 0,5 масс.% SLS по массе дисперсии; приблизительно 45,1 масс.% маннита по массе композиции; приблизительно 2 масс.% сукралозы по массе композиции; приблизительно 3 масс.% кроскармеллозы натрия по массе композиции; приблизительно 0,5 масс.% SLS по массе композиции; приблизительно 1 масс.% коллоидного диоксида кремния по массе композиции; и приблизительно 1,5 масс.% стеарата магния по массе композиции. В некоторых вариантах осуществления прессованная фармацевтическая композиция, содержащая мини-таблетку или множество мини-таблеток, содержит 75 мг Соединения 1. В некоторых вариантах осуществления прессованная фармацевтическая композиция в составе единичной дозы содержит 75 мг Соединения 1.
[00451] Еще в одной фармацевтической композиции по настоящему изобретению фармацевтическая композиция, прессованная в мини-таблетку, имеющая начальную среднюю прочность при растяжении 3,14 Мпа, содержит приблизительно 49,3 масс.% твердой дисперсии по массе композиции, где указанная дисперсия содержит приблизительно 50 масс.% по существу аморфного или аморфного Соединения 1 по массе дисперсии, приблизительно 49,5 масс.% HPMCAS по массе дисперсии и приблизительно 0,5 масс.% SLS по массе дисперсии; приблизительно 42,7 масс.% маннита по массе композиции; приблизительно 2% масс.% сукралозы по массе композиции; приблизительно 3 масс.% кроскармеллозы натрия по массе композиции; приблизительно 0,5 масс.% SLS по массе композиции; приблизительно 1 масс.% коллоидного диоксида кремния по массе композиции; и приблизительно 1,5 масс.% стеарата магния по массе композиции. В некоторых вариантах осуществления капсула, пакет, пачка, саше, флакон или блистерная упаковка заполнены мини-таблеткой или множеством мини-таблеток, содержащих 50 мг Соединения 1.
[00452] Еще в одной прессованной фармацевтической композиции по настоящему изобретению, фармацевтическая композиция в виде мини-таблетки, имеющая начальную среднюю прочность при растяжении 3,1 МПа, содержит приблизительно 24,6 масс.% твердой дисперсии по массе композиции, где указанная дисперсия содержит приблизительно 50 масс.% по существу аморфного Соединения 1 по массе дисперсии, приблизительно 49,5 масс.% HPMCAS по массе дисперсии и приблизительно 0,5 масс.% SLS по массе дисперсии; приблизительно 67,4 масс.% маннита по массе композиции; приблизительно 2 масс.% сукралозы; приблизительно 3 масс.% кроскармеллозы натрия по массе композиции; приблизительно 0,5 масс.% SLS по массе композиции; приблизительно 1 масс.% коллоидного диоксида кремния по массе композиции; и приблизительно 1,5 масс.% стеарата магния по массе композиции. В некоторых аспектах единичная доза, содержащая капсулу или пачку, заполненную мини-таблеткой или множеством мини-таблеток, содержит 25 мг Соединения 1.
[00453] В других аспектах указанная фармацевтическая композиция в виде мини-таблетки по настоящему изобретению необязательно включает цветное покрытие. В некоторых вариантах осуществления этого аспекта указанная мини-таблетка в форме твердой лекарственной формы содержит голубое покрытие OPADRY® II. В некоторых вариантах осуществления капсула или пачка, содержащая фармацевтическую композицию в форме мини-таблетки или множества мини-таблеток, содержит 25 мг Соединения 1.
[00454] В некоторых вариантах осуществления капсула или пачка, содержащая 20-40 мини-таблеток, содержит приблизительно 75 мг Соединения 1. В некоторых аспектах указанная фармацевтическая композиция в виде мини-таблетки необязательно дополнительно может содержать цветное покрытие и/или восковое покрытие. В некоторых аспектах фармацевтическая композиция, содержащая 20-60 мини-таблеток, содержащаяся в капсуле или пачке, содержит 100 мг Соединения 1.
[00455] В другой прессованной фармацевтической композиции по настоящему изобретению, мини-таблетка, полученная в способах, описанных в настоящем изобретении, имеет начальную среднюю прочность при растяжении между 2,1 и 4,0 МПа и содержит приблизительно 61,6 масс.% твердой дисперсии по массе композиции, где указанная дисперсия содержит приблизительно 80 масс.% по существу аморфного Соединения 1 по массе дисперсии, приблизительно 19,5 масс.% HPMCAS по массе дисперсии и приблизительно 0,5 масс.% SLS по массе дисперсии; приблизительно 30,4 масс.% маннита по массе композиции; приблизительно 2 масс.% сукралозы по массе композиции; приблизительно 3 масс.% кроскармеллозы натрия по массе композиции; приблизительно 0,1 масс.% SLS по массе композиции; приблизительно 1,5 масс.% коллоидного диоксида кремния по массе композиции; и приблизительно 1,5 масс.% стеарата магния по массе композиции. В некоторых аспектах капсула или пачка, содержащая мини-таблетку или множество мини-таблеток, содержит 100 мг Соединения 1. В некоторых аспектах единичная дозированная форма (например, капсула или пачка) содержит мини-таблетку или множество мини-таблеток, например, от приблизительно 20 до приблизительно 50 мини-таблетки. В некоторых вариантах осуществления капсула или пачка, содержащая 39 мини-таблеток, содержит 150 мг Соединения 1.
[00456] В другой фармацевтической композиции по настоящему изобретению фармацевтическая композиция содержит приблизительно 34,1 масс.% твердой дисперсии по массе композиции, где указанная дисперсия содержит приблизительно 80 масс.% по существу аморфного или аморфного Соединения 1 по массе дисперсии, приблизительно 19,5 масс.% HPMCAS по массе дисперсии и приблизительно 0,5 масс.% SLS по массе дисперсии; приблизительно 57,9 масс.% маннита по массе композиции; приблизительно 2 масс.% сукралозы по массе композиции; приблизительно 3 масс.% кроскармеллозы натрия по массе композиции; приблизительно 0,5 масс.% SLS по массе композиции; приблизительно 1 масс.% коллоидного диоксида кремния по массе композиции; и приблизительно 1,5 масс.% стеарата магния по массе композиции. В некоторых аспектах фармацевтическая мини-таблетка содержит 1,91 мг Соединения 1. В других вариантах осуществления фармацевтическая композиция, содержащая мини-таблетку, содержит 1,72 мг Соединения 1.
[00457] В одном варианте осуществления фармацевтическая композиция содержит приблизительно 35 масс.% твердой дисперсии по массе композиции, где указанная дисперсия содержит приблизительно 80 масс.% по существу аморфного или аморфного Соединения 1 по массе дисперсии, приблизительно 19,5 масс.% HPMCAS по массе дисперсии и приблизительно 0,5 масс.% SLS по массе дисперсии; приблизительно 13,5 масс.% маннита по массе композиции; приблизительно 41 масс.% лактозы по массе композиции; приблизительно 2 масс.% сукралозы по массе композиции; приблизительно 6 масс.% кроскармеллозы натрия по массе композиции; приблизительно 1 масс.% коллоидного диоксида кремния по массе композиции; и приблизительно 1,5 масс.% стеарата магния по массе композиции. В некоторых аспектах фармацевтическая мини-таблетка содержит 1,93 мг Соединения 1. В других вариантах осуществления фармацевтическая композиция, содержащая мини-таблетку, содержит 1,96 мг Соединения 1. В некоторых аспектах фармацевтическая мини-таблетка содержит 10 мг Соединения 1. В других вариантах осуществления фармацевтическая композиция, содержащая мини-таблетку, содержит 12,5 мг Соединения 1. В некоторых аспектах фармацевтическая мини-таблетка содержит 1,92 мг Соединения 1.
[00458] Также отмечается, что фармацевтические композиции, содержащие одну или более мини-таблеток по настоящему изобретению, могут быть обработаны в форму капсулы или расфасованы в саше или пачки для перорального приема, или могут быть восстановлены в водном растворителе (например, деионизированной воде или физиологическом растворе) для перорального или внутривенного введения. Предпочтительно, указанные фармацевтические композиции в форме мини-таблетки, описанные в настоящей заявке, получают и заключают в капсулы, флаконы или саше. В других вариантах осуществления фармацевтическая композиция, содержащая мини-таблетку или множество мини-таблеток, может находиться в пакетах, пачках, саше, флаконах или блистерных упаковках. В одном варианте осуществления фармацевтическая композиция, содержащая мини-таблетку или множество мини-таблеток, может находиться в пачках.
[00459] Другой аспект по настоящему изобретению относится к фармацевтической композиции, состоящей из 1-200 мини-таблеток, каждая мини-таблетка включает CF потенциирующее средство API (например, твердую дисперсию N-[2,4-бис(1,1-диметилэтил)-5-гидроксифенил]-1,4-дигидро-4-оксохинолин-3-карбоксамид) и другие эксципиенты (например, один или более наполнителей, разрыхлитель, подсластитель, увлажнитель, скользящее вещество, смазывающее вещество или любое их сочетание), каждое из которых описано выше и в приведенных ниже примерах, где указанная мини-таблетка или множество мини-таблеток имеет растворимость по меньшей мере приблизительно 50% (например, по меньшей мере приблизительно 60%, по меньшей мере приблизительно 70% или по меньшей мере приблизительно 80%) приблизительно за 30 минут. В одном примере фармацевтическая композиция состоит из капсулы или пачки, содержащей приблизительно 29 мини-таблеток, которая включает CF потенциирующее средство API (например, твердую дисперсию Соединения 1) и другие эксципиенты (например, один или более наполнителей, подсластитель, разрыхлитель, увлажнитель, скользящее вещество и смазывающее вещество, или любое их сочетание), каждое из которых описано выше и в приведенных ниже примерах, где в некоторых вариантах осуществления указанная мини-таблетка имеет растворимость от приблизительно 50% до приблизительно 100% (например, от приблизительно 55% до приблизительно 95%, от приблизительно 60% до приблизительно 90% или от приблизительно 70% до приблизительно 80%) приблизительно за 30 минут. В другом примере фармацевтическая композиция состоит из капсулы или пачки, содержащей приблизительно 29 мини-таблеток, каждая мини-таблетка содержит твердую дисперсию, содержащую по существу аморфное или аморфное Соединение 1 и HPMCAS; и один или более наполнителей, подсластитель, разрыхлитель, необязательно увлажнитель, скользящее вещество и смазывающее вещество, где содержимое капсулы или пачки имеет растворимость по меньшей мере приблизительно 50% (например, по меньшей мере приблизительно 60%, по меньшей мере приблизительно 70%, по меньшей мере приблизительно 80%, по меньшей мере приблизительно 90%) приблизительно за 30 минут. Еще в одном примере фармацевтическая композиция состоит из капсулы или пачки, содержащей приблизительно 29 мини-таблеток, каждая мини-таблетка содержит твердую дисперсию, содержащую по существу аморфное или аморфное Соединение 1 и HPMCAS; и один или более наполнителей, подсластитель, разрыхлитель, необязательно увлажнитель, скользящее вещество и смазывающее вещество, где содержимое капсулы или пачки имеет растворимость от приблизительно 50% до приблизительно 100% (например, от приблизительно 55% до приблизительно 95%, от приблизительно 60% до приблизительно 90% или от приблизительно 70% до приблизительно 80%) приблизительно за 30 минут.
[00460] В одном варианте осуществления капсула или пачка содержит мини-таблетку или множество мини-таблеток, где указанная мини-таблетка или множество мини-таблеток содержит твердую дисперсию, содержащую по меньшей мере приблизительно 15 мг (например, по меньшей мере приблизительно 20 мг, по меньшей мере приблизительно 25 мг, по меньшей мере приблизительно 30 мг, по меньшей мере приблизительно 40 мг или по меньшей мере приблизительно 50 мг) по существу аморфного или аморфного Соединения 1, полимер HPMCAS и SLS. В другом варианте осуществления капсула или пачка содержит мини-таблетку или множество мини-таблеток, где указанная мини-таблетка или множество мини-таблеток содержит твердую дисперсию, содержащую по меньшей мере приблизительно 15 мг (например, по меньшей мере 20 мг, по меньшей мере 25 мг, по меньшей мере приблизительно 30 мг, по меньшей мере приблизительно 40 мг, по меньшей мере приблизительно 50 мг, по меньшей мере приблизительно 75 мг, по меньшей мере приблизительно 100 мг или по меньшей мере 150 мг) по существу аморфного или аморфного Соединения 1, и HPMCAS и SLS.
[00461] Растворимость может быть измерена с использованием стандартного прибора USP Типа II, содержащего растворитель 0,5 или 0,7% лаурилсульфат натрия, растворенный в 900 мл 50 мМ натрий-фосфатного буфера при pH 6,8 при температуре приблизительно 37°C. Растворение мини-таблеток определяют путем регистрации растворения множества мини-таблеток, содержащих, в целом, 75 мг (используя 0,5% лаурилсульфат натрия) или 150 мг (используя 0,7% лаурилсульфат натрия) Соединения 1 в растворителе. Отдельные мини-таблетки могут демонстрировать растворимость, которая ниже, эквивалентна или выше растворимости множества, со средней растворимостью каждой отдельной мини-таблетки, сходной со средней растворимостью множества.
[00462] Другой аспект настоящего изобретения относится к фармацевтической композиции, содержащей мини-таблетку, которая содержит CF потенциирующее средство API (например, твердую дисперсию Соединения 1) и другие эксципиенты (например, один или более наполнителей, подсластитель, разрыхлитель, увлажнитель, скользящее вещество и смазывающее вещество, или любое их сочетание), каждое из которых описано выше и в приведенных ниже примерах, где мини-таблетка имеет среднюю прочность при растяжении в интервале от приблизительно 0,5 МПа до приблизительно 4 МПа, например, по меньшей мере приблизительно 0,5 МПа, по меньшей мере приблизительно 1 МПа или по меньшей мере приблизительно 2 МПа. В одном примере фармацевтическая композиция состоит из мини-таблетки, которая содержит CF потенциирующее средство API (например, твердую дисперсию Соединения 1) и другие эксципиенты (например, один или более наполнителей, подсластитель, разрыхлитель, увлажнитель, скользящее вещество и смазывающее вещество, или любое их сочетание), каждое из которых описано выше и в приведенных ниже примерах, где мини-таблетка имеет среднюю прочность при растяжении в интервале от приблизительно 0,5 МПа до приблизительно 4 МПа, например, по меньшей мере приблизительно 0,5 МПа, по меньшей мере приблизительно 1 МПа или по меньшей мере приблизительно 2 МПа.
[00463] Еще в одной дополнительной фармацевтической композиции по настоящему изобретению, фармацевтическая композиция в форме мини-таблетки, имеющая среднюю прочность при растяжении в интервале от приблизительно 0,5 МПа до приблизительно 4,1 МПа (например, от приблизительно 0,5 МПа до приблизительно 4 МПа, от приблизительно 0,5 МПа до приблизительно 3 МПа, от приблизительно 0,75 МПа до приблизительно 3 МПа, от приблизительно 1 МПа до приблизительно 2 МПа, от приблизительно 1 МПа до приблизительно 1,5 МПа или от приблизительно 2,1 до приблизительно 4,05 МПа) и содержит приблизительно 46,7 масс.% твердой дисперсии по массе композиции, где указанная дисперсия содержит приблизительно 78,8 масс.% по существу аморфного или аморфного Соединения 1 по массе дисперсии, приблизительно 20,7 масс.% HPMCAS по массе дисперсии и приблизительно 0,5 масс.% SLS по массе дисперсии; приблизительно 45,1 масс.% маннита по массе композиции; приблизительно 2 масс.% сукралозы по массе композиции; приблизительно 3 масс.% кроскармеллозы натрия по массе композиции; приблизительно 0,5 масс.% SLS по массе композиции; приблизительно 1 масс.% коллоидного диоксида кремния по массе композиции; и приблизительно 1,5 масс.% стеарата магния по массе композиции. В некоторых вариантах осуществления фармацевтическая композиция, содержащая одну или более мини-таблеток, содержит 75 мг Соединения 1.
[00464] Еще в одной фармацевтической композиции по настоящему изобретению фармацевтическая композиция в форме мини-таблетки, имеющая начальную среднюю прочность при растяжении в интервале от приблизительно 0,5 МПа до приблизительно 4,1 МПа (например, от приблизительно 0,5 МПа до приблизительно 4 МПа, от приблизительно 0,5 МПа до приблизительно 3 МПа, от приблизительно 0,75 МПа до приблизительно 3 МПа, от приблизительно 1 МПа до приблизительно 2 МПа, от приблизительно 1 МПа до приблизительно 1,5 МПа или приблизительно 3,14 МПа) и содержит приблизительно 49,3 масс.% твердой дисперсии по массе композиции, где указанная дисперсия содержит приблизительно 50 масс.% по существу аморфного или аморфного Соединения 1 по массе дисперсии, приблизительно 49,5 масс.% HPMCAS по массе дисперсии и приблизительно 0,5 масс.% SLS по массе дисперсии; приблизительно 42,7 масс.% маннита по массе композиции; приблизительно 2% масс.% сукралозы по массе композиции; приблизительно 3 масс.% кроскармеллозы натрия по массе композиции; приблизительно 0,5 масс.% SLS по массе композиции; приблизительно 1 масс.% коллоидного диоксида кремния по массе композиции; и приблизительно 1,5 масс.% стеарата магния по массе композиции. В некоторых вариантах осуществления капсула или пачка, заполненная мини-таблеткой или множеством мини-таблеток, содержит 50 мг Соединения 1.
[00465] Еще в одной фармацевтической композиции по настоящему изобретению фармацевтическая композиция в форме мини-таблетки, имеющая начальную среднюю прочность при растяжении в интервале от приблизительно 0,5 МПа до приблизительно 4,1 МПа (например, от приблизительно 0,5 МПа до приблизительно 4 МПа, от приблизительно 0,5 МПа до приблизительно 3 МПа, от приблизительно 0,75 МПа до приблизительно 3 МПа, от приблизительно 1 МПа до приблизительно 2 МПа, от приблизительно 1 МПа до приблизительно 1,5 МПа или приблизительно 3,1 МПа) и содержит приблизительно 24,6 масс.% твердой дисперсии по массе композиции, где указанная дисперсия содержит приблизительно 50 масс.% по существу аморфного Соединения 1 по массе дисперсии, приблизительно 49,5 масс.% HPMCAS по массе дисперсии и приблизительно 0,5 масс.% SLS по массе дисперсии; приблизительно 67,4 масс.% маннита по массе композиции; приблизительно 2 масс.% сукралозы; приблизительно 3 масс.% кроскармеллозы натрия по массе композиции; приблизительно 0,5 масс.% SLS по массе композиции; приблизительно 1 масс.% коллоидного диоксида кремния по массе композиции; и приблизительно 1,5 масс.% стеарата магния по массе композиции. В некоторых аспектах фармацевтическая композиция, содержащая капсулу или пачку, заполненную мини-таблеткой или множеством мини-таблеток, содержит 25 мг Соединения 1. В некоторых вариантах осуществления капсула или пачка, содержащая фармацевтическую композицию в форме мини-таблетки или множества мини-таблеток, содержит 25 мг Соединения 1.
[00466] В другой фармацевтической композиции по настоящему изобретению композиция мини-таблетки, имеющая начальную среднюю прочность при растяжении между 2,1 и 4,0 МПа, содержит приблизительно 61,6 масс.% твердой дисперсии по массе композиции, где указанная дисперсия содержит приблизительно 80 масс.% по существу аморфного Соединения 1 по массе дисперсии, приблизительно 19,5 масс.% HPMCAS по массе дисперсии и приблизительно 0,5 масс.% SLS по массе дисперсии; приблизительно 30,4 масс.% маннита по массе композиции; приблизительно 2 масс.% сукралозы по массе композиции; приблизительно 3 масс.% кроскармеллозы натрия по массе композиции; приблизительно 0,1 масс.% SLS по массе композиции; приблизительно 1,5 масс.% коллоидного диоксида кремния по массе композиции; и приблизительно 1,5 масс.% стеарата магния по массе композиции. В некоторых аспектах капсула или пачка, содержащая мини-таблетку или множество мини-таблеток, содержит 100 мг Соединения 1. В некоторых аспектах прессованная фармацевтическая композиция, содержащая мини-таблетку или множество мини-таблеток, например, от приблизительно 20 до приблизительно 50 мини-таблеток, например, 43 мини-таблетки, содержит 150 мг Соединения 1.
[00467] В некоторых вариантах осуществления капсула или пачка, содержащая 20-40 мини-таблеток, содержит приблизительно 75 мг Соединения 1. В некоторых аспектах фармацевтическая композиция, содержащая 20-40 мини-таблеток, содержащихся в капсуле или пачке, содержит 100 мг Соединения 1.
[00468] Еще в одной дополнительной фармацевтической композиции по настоящему изобретению прессованная фармацевтическая композиция содержит приблизительно 34 масс.% твердой дисперсии по массе композиции, где указанная дисперсия содержит приблизительно 80 масс.% по существу аморфного или аморфного Соединения 1 по массе дисперсии, приблизительно 19,5 масс.% HPMCAS по массе дисперсии и приблизительно 0,5 масс.% SLS по массе дисперсии; приблизительно 58 масс.% маннита по массе композиции; приблизительно 2 масс.% сукралозы по массе композиции; приблизительно 3 масс.% кроскармеллозы натрия по массе композиции; приблизительно 0,5 масс.% SLS по массе композиции; приблизительно 1 масс.% коллоидного диоксида кремния по массе композиции; и приблизительно 1,5 масс.% стеарата магния по массе композиции. В некоторых вариантах осуществления фармацевтическая композиция, содержащая капсулу или пачку, содержащую 25-30 (например, приблизительно 26) мини-таблеток, содержит 50 мг Соединения 1. В других вариантах осуществления фармацевтическая композиция, содержащая капсулу или пачку, содержащую 20-30 мини-таблеток, содержит 25, 15 или 10 мг Соединения 1.
[00469] В другой фармацевтической композиции по настоящему изобретению фармацевтическая композиция содержит приблизительно 34,1 масс.% твердой дисперсии по массе композиции, где указанная дисперсия содержит приблизительно 80 масс.% по существу аморфного или аморфного Соединения 1 по массе дисперсии, приблизительно 19,5 масс.% HPMCAS по массе дисперсии и приблизительно 0,5 масс.% SLS по массе дисперсии; приблизительно 57,9 масс.% маннита по массе композиции; приблизительно 2 масс.% сукралозы по массе композиции; приблизительно 3 масс.% кроскармеллозы натрия по массе композиции; приблизительно 0,5 масс.% SLS по массе композиции; приблизительно 1 масс.% коллоидного диоксида кремния по массе композиции; и приблизительно 1,5 масс.% стеарата магния по массе композиции. В некоторых аспектах прессованная мини-таблетка содержит 1,91 мг Соединения 1. В других вариантах осуществления указанная мини-таблетка содержит 1,72 мг Соединения 1.
[00470] В одном аспекте настоящее изобретение относится к фармацевтической композиции, содержащей от приблизительно 30 масс.% до приблизительно 50 масс.% твердой дисперсии по массе композиции, где указанная дисперсия содержит приблизительно 80 масс.% по существу аморфного или аморфного Соединения 1 по массе дисперсии, приблизительно 19,5 масс.% HPMCAS по массе дисперсии и приблизительно 0,5 масс.% SLS по массе дисперсии; от приблизительно 30 масс.% до приблизительно 60 масс.% двухкомпонентного наполнителя, где двухкомпонентный наполнитель содержит от приблизительно 0 масс.% до приблизительно 60 масс.% маннита по массе композиции и от приблизительно 0 масс.% до приблизительно 60 масс.% лактозы по массе композиции; от приблизительно 1,5 масс.% до приблизительно 2,5 масс.% сукралозы по массе композиции; от приблизительно 4 масс.% до приблизительно 8 масс.% кроскармеллозы натрия по массе композиции; от приблизительно 0,5 масс.% до приблизительно 1,5 масс.% коллоидного диоксида кремния по массе композиции; и от приблизительно 1 масс.% до приблизительно 2 масс.% стеарата магния по массе композиции.
[00471] В одном варианте осуществления фармацевтическая композиция содержит приблизительно 35 масс.% твердой дисперсии по массе композиции, где указанная дисперсия содержит приблизительно 80 масс.% по существу аморфного или аморфного Соединения 1 по массе дисперсии, приблизительно 19,5 масс.% HPMCAS по массе дисперсии и приблизительно 0,5 масс.% SLS по массе дисперсии; приблизительно 13,5 масс.% маннита по массе композиции; приблизительно 41 масс.% лактозы по массе композиции; приблизительно 2 масс.% сукралозы по массе композиции; приблизительно 6 масс.% кроскармеллозы натрия по массе композиции; приблизительно 1 масс.% коллоидного диоксида кремния по массе композиции; и приблизительно 1,5 масс.% стеарата магния по массе композиции.
[00472] В дополнительном варианте осуществления этого аспекта фармацевтическая композиция находится в форме мини-таблетки. В другом варианте осуществления размер указанной мини-таблетки приблизительно составляет 2 мм. В другом варианте осуществления размер указанной мини-таблетки составляет 4 мм. В дополнительном варианте осуществления множество 2-мм мини-таблеток в совокупности образует дозу, содержащую от приблизительно 20 мг до приблизительно 275 мг Соединения 1, например, множество 2-мм мини-таблеток в совокупности образует дозу, содержащую приблизительно 25 мг, приблизительно 50 мг, приблизительно 75 мг, приблизительно 100 мг, приблизительно 125 мг, приблизительно 150 мг, приблизительно 175 мг, приблизительно 200 мг, приблизительно 225 мг, или приблизительно 250 мг. В другом дополнительном варианте осуществления множество 4-мм мини-таблеток в совокупности образует дозу, содержащую от приблизительно 5 мг до приблизительно 70 мг Соединения 1, например, множество 4-мм мини-таблеток в совокупности образует дозу, содержащую приблизительно 10 мг, 12,5 мг, приблизительно 20 мг, 25 мг, приблизительно 30 мг, приблизительно 37,5 мг, 40 мг, 50 мг, приблизительно 62,5 мг, приблизительно 75 мг, приблизительно 100 мг, приблизительно 125 мг, приблизительно 150 мг, приблизительно 175 мг, приблизительно 200 мг, приблизительно 225 мг или приблизительно 250 мг.
[00473] В одном варианте осуществления фармацевтическая композиция содержит приблизительно 35 масс.% твердой дисперсии по массе композиции, где указанная дисперсия содержит приблизительно 80 масс.% по существу аморфного или аморфного Соединения 1 по массе дисперсии, приблизительно 19,5 масс.% HPMCAS по массе дисперсии и приблизительно 0,5 масс.% SLS по массе дисперсии; приблизительно 13,5 масс.% маннита по массе композиции; приблизительно 41 масс.% лактозы по массе композиции; приблизительно 2 масс.% сукралозы по массе композиции; приблизительно 6 масс.% кроскармеллозы натрия по массе композиции; приблизительно 1 масс.% коллоидного диоксида кремния по массе композиции; и приблизительно 1,5 масс.% стеарата магния по массе композиции. В одном варианте осуществления фармацевтическая композиция содержит множество мини-таблеток, имеющих приблизительно 50 мг Соединения 1 на 26 мини-таблеток и 75 мг Соединения 1 на 39 мини-таблеток. В дополнительном варианте осуществления каждая мини-таблетка составляет приблизительно 2 мм в диаметре и приблизительно 2 мм в толщину. В дополнительном варианте осуществления масса каждой мини-таблетки составляет приблизительно 7 мг. В некоторых вариантах осуществления масса каждой мини-таблетки составляет приблизительно 6,9 мг. Еще в одном дополнительном варианте осуществления мини-таблетки имеют цилиндрическую форму. В одном варианте осуществления фармацевтическая композиция включает капсулу или пачку, содержащую множество мини-таблеток. В одном дополнительном варианте осуществления капсула или пачка содержит приблизительно 26 мини-таблеток и приблизительно 50 мг Соединения 1. В другом дополнительном варианте осуществления капсула или пачка содержит приблизительно 39 мини-таблеток и приблизительно 75 мг Соединения 1.
[00474] В одном варианте осуществления фармацевтическая композиция содержит приблизительно 35 масс.% твердой дисперсии по массе композиции, где указанная дисперсия содержит приблизительно 80 масс.% по существу аморфного или аморфного Соединения 1 по массе дисперсии, приблизительно 19,5 масс.% HPMCAS по массе дисперсии и приблизительно 0,5 масс.% SLS по массе дисперсии; приблизительно 13,5 масс.% маннита по массе композиции; приблизительно 41 масс.% лактозы по массе композиции; приблизительно 2 масс.% сукралозы по массе композиции; приблизительно 6 масс.% кроскармеллозы натрия по массе композиции; приблизительно 1 масс.% коллоидного диоксида кремния по массе композиции; и приблизительно 1,5 масс.% стеарата магния по массе композиции. В одном варианте осуществления фармацевтическая композиция содержит множество мини-таблеток, имеющих приблизительно 40 мг Соединения 1 на 21 мини-таблетку и 100 мг Соединения 1 на 52 мини-таблетки. В дополнительном варианте осуществления диаметр каждой мини-таблетки составляет приблизительно 2 мм, и толщина составляет приблизительно 2 мм. В дополнительном варианте осуществления масса каждой мини-таблетки составляет приблизительно 6,9 мг. Еще в одном варианте осуществления мини-таблетки имеют цилиндрическую форму. В одном варианте осуществления фармацевтическая композиция включает капсулу или пачку, содержащую множество мини-таблеток. В одном дополнительном варианте осуществления капсула или пачка содержит приблизительно 21 мини-таблетку и приблизительно 40 мг Соединения 1. В другом дополнительном варианте осуществления капсула или пачка содержит приблизительно 52 мини-таблетки и приблизительно 100 мг Соединения 1.
[00475] В одном варианте осуществления фармацевтическая композиция содержит приблизительно 35 масс.% твердой дисперсии по массе композиции, где указанная дисперсия содержит приблизительно 80 масс.% по существу аморфного или аморфного Соединения 1 по массе дисперсии, приблизительно 19,5 масс.% HPMCAS по массе дисперсии и приблизительно 0,5 масс.% SLS по массе дисперсии; приблизительно 13,5 масс.% маннита по массе композиции; приблизительно 41 масс.% лактозы по массе композиции; приблизительно 2 масс.% сукралозы по массе композиции; приблизительно 6 масс.% кроскармеллозы натрия по массе композиции; приблизительно 1 масс.% коллоидного диоксида кремния по массе композиции; и приблизительно 1,5 масс.% стеарата магния по массе композиции. В одном варианте осуществления фармацевтическая композиция содержит одну или более таблеток, имеющих приблизительно 10 мг Соединения 1 на таблетку. В дополнительном варианте осуществления диаметр таблетки составляет приблизительно 4 мм, а толщина таблетки составляет приблизительно 3 мм. В дополнительном варианте осуществления масса таблетки составляет приблизительно 35,7 мг. Еще в одном дополнительном варианте осуществления мини-таблетки имеют двояковыпуклую цилиндрическую форму. В других вариантах осуществления мини-таблетки имеют любую форму, в том числе овальную, сферическую, цилиндрическую, эллиптическую, кубическую, квадратную или треугольную с плоскими, узкими, стандартными, сильно выпуклыми или двойными сильно выпуклыми поверхностями или их сочетания.
[00476] В одном варианте осуществления фармацевтическая композиция содержит приблизительно 35 масс.% твердой дисперсии по массе композиции, где указанная дисперсия содержит приблизительно 80 масс.% по существу аморфного или аморфного Соединения 1 по массе дисперсии, приблизительно 19,5 масс.% HPMCAS по массе дисперсии и приблизительно 0,5 масс.% SLS по массе дисперсии; приблизительно 13,5 масс.% маннита по массе композиции; приблизительно 41 масс.% лактозы по массе композиции; приблизительно 2 масс.% сукралозы по массе композиции; приблизительно 6 масс.% кроскармеллозы натрия по массе композиции; приблизительно 1 масс.% коллоидного диоксида кремния по массе композиции; и приблизительно 1,5 масс.% стеарата магния по массе композиции. В одном варианте осуществления фармацевтическая композиция содержит одну или более таблеток, имеющих приблизительно 12,5 мг Соединения 1 на таблетку. В дополнительном варианте осуществления диаметр таблетки составляет приблизительно 4 мм, а толщина составляет приблизительно 3,7 мм. В дополнительном варианте осуществления масса таблетки составляет приблизительно 44,7 мг. Еще в одном дополнительном варианте осуществления мини-таблетки имеют выпуклую цилиндрическую форму. В других вариантах осуществления мини-таблетки имеют любую форму, в том числе овальную, сферическую, цилиндрическую, эллиптическую, кубическую, квадратную или треугольную с плоскими, узкими, стандартными, сильно выпуклыми или двойными сильно выпуклыми поверхностями или их сочетания.
[00477] В одном варианте осуществления фармацевтическая композиция содержит приблизительно 35 масс.% твердой дисперсии по массе композиции, где указанная дисперсия содержит приблизительно 80 масс.% по существу аморфного или аморфного Соединения 1 по массе дисперсии, приблизительно 19,5 масс.% HPMCAS по массе дисперсии и приблизительно 0,5 масс.% SLS по массе дисперсии; приблизительно 13,5 масс.% маннита по массе композиции; приблизительно 41 масс.% лактозы по массе композиции; приблизительно 2 масс.% сукралозы по массе композиции; приблизительно 6 масс.% кроскармеллозы натрия по массе композиции; приблизительно 1 масс.% коллоидного диоксида кремния по массе композиции; и приблизительно 1,5 масс.% стеарата магния по массе композиции. В одном варианте осуществления фармацевтическая композиция содержит множество мини-таблеток, имеющих приблизительно 50 мг Соединения 1 на 26 мини-таблеток и 75 мг Соединения 1 на 39 мини-таблеток. В дополнительном варианте осуществления диаметр каждой мини-таблетки составляет приблизительно 2 мм, и толщина составляет приблизительно 2 мм. В дополнительном варианте осуществления масса каждой мини-таблетки составляет приблизительно 7 мг. Еще в одном дополнительном варианте осуществления мини-таблетки имеют цилиндрическую форму. В одном варианте осуществления фармацевтическая композиция включает капсулу или пачку, содержащую множество мини-таблеток. В одном дополнительном варианте осуществления капсула или пачка содержит приблизительно 26 мини-таблеток и приблизительно 50 мг Соединения 1. В другом дополнительном варианте осуществления капсула или пачка содержит приблизительно 39 мини-таблеток и приблизительно 75 мг Соединения 1.
[00478] Также отмечается, что единичные дозированные формы, содержащие прессованные фармацевтические композиции, содержащие одну или более мини-таблеток по настоящему изобретению, могут быть обработаны в форму таблетки, форму капсулы или заполнены в саше, пакеты, пачки, флаконы и подобное для перорального введения, или могут быть восстановлены в водном растворителе (например, деионизированной воде или физиологическом растворе) для перорального или внутривенного введения. Также, для перорального введения единичные дозированные формы могут быть введены в легкую пищу, например, яблочное пюре, йогурт без добавок, мороженое, детское питание. Детское питание может включать, но не ограничиваться ими, морковь или морковное пюре. Также для перорального приема единичные дозированные формы могут быть введены в жидкости, такие как молоко (в том числе, в грудное молоко), детские смеси или молочные смеси. Пищевые продукты также могут включать клубничное варенье, рисовый пудинг или шоколадный пудинг. Жидкости также могут включать воду. В одном варианте осуществления единичную дозированную форму впрыскивают в легкую пищу и вводят. В другом варианте осуществления единичную дозированную форму впрыскивают в легкую пищу, перемешивают и вводят. В одном варианте осуществления единичную дозированную форму впрыскивают в жидкость, такую как, но не только, детская смесь, молочная смесь, молоко или грудное молоко, и вводят. В другом варианте осуществления единичную дозированную форму впрыскивают в жидкость, такую как, но не только, детская смесь, молочная смесь, молоко или грудное молоко, перемешивают и вводят. Предпочтительно, указанные прессованные фармацевтические композиции в форме мини-таблетки, описанные в настоящей заявке, получают и заключают в капсулы, флаконы или саше. В других вариантах осуществления фармацевтическая композиция, содержащая мини-таблетку или множество мини-таблеток, может находиться в пакетах, пачках, саше, флаконах или блистерных упаковках. В некоторых случаях, для мини-таблеток или гранул меньшего размера, содержимое пачек, пакетов, капсул, флаконов или саше можно вводить непосредственно в ротовую полость с последующим введением грудного молока или смеси. Способы введения по настоящему изобретению необязательно также могут включать, для мини-таблеток или гранул меньшего размера, введение содержимого пачек, пакетов, капсул, флаконов или саше непосредственно в ротовую полость с последующим введением жидкости или напитка. В некоторых вариантах осуществления любые способы введения по настоящему изобретению необязательно могут включать пероральное введение с жиросодержащей пищей, например, стандартным CF высококалорийным с высоким содержанием жира блюдом или закуской. В одном аспекте, в соответствии с настоящим изобретением, все способы введения по настоящему изобретению необязательно могут включать пероральное введение одновременно, до или после жиросодержащей пищи, например, стандартного CF высококалорийного с высоким содержанием жира блюда или закуски.
[00479] Другой аспект настоящего изобретения относится к прессованной фармацевтической композиции, содержащей 20-50 мини-таблеток, каждая мини-таблетка включает CF потенциирующее средство API (например, твердую дисперсию N-[2,4-бис(1,1-диметилэтил)-5-гидроксифенил]-1,4-дигидро-4-оксохинолин-3-карбоксамида) и другие эксципиенты (например, один или более наполнителей, разрыхлитель, подсластитель, увлажнитель, скользящее вещество, смазывающее вещество или любое их сочетание), каждое из которых описано выше и в приведенных ниже примерах, где указанная мини-таблетка или множество мини-таблеток имеет растворимость по меньшей мере приблизительно 50% (например, по меньшей мере приблизительно 60%, по меньшей мере приблизительно 70% или по меньшей мере приблизительно 80%) приблизительно за 30 минут. В одном примере фармацевтическая композиция состоит из капсулы или пачки, содержащей приблизительно 29 мини-таблеток, которые включают CF потенциирующее средство API (например, твердую дисперсию Соединения 1) и другие эксципиенты (например, один или более наполнителей, подсластитель, разрыхлитель, увлажнитель, скользящее вещество и смазывающее вещество, или любое их сочетание), каждое из которых описано выше и в приведенных ниже примерах, где в некоторых вариантах осуществления указанная мини-таблетка имеет растворимость от приблизительно 50% до приблизительно 100% (например, от приблизительно 55% до приблизительно 95%, от приблизительно 60% до приблизительно 90% или от приблизительно 70% до приблизительно 80%) приблизительно за 30 минут. В другом примере фармацевтическая композиция состоит из капсулы или пачки, содержащей приблизительно 29 мини-таблеток, каждая мини-таблетка содержит твердую дисперсию, содержащую по существу аморфное или аморфное Соединение 1 и HPMCAS; и один или более наполнителей, подсластитель, разрыхлитель, необязательно увлажнитель, скользящее вещество и смазывающее вещество, где содержимое капсулы или пачки имеет растворимость по меньшей мере приблизительно 50% (например, по меньшей мере приблизительно 60%, по меньшей мере приблизительно 70%, по меньшей мере приблизительно 80%, по меньшей мере приблизительно 90%) приблизительно за 30 минут. Еще в одном примере фармацевтическая композиция состоит из капсулы или пачки, содержащей приблизительно 29 мини-таблеток, каждая мини-таблетка содержит твердую дисперсию, содержащую по существу аморфное или аморфное Соединение 1 и HPMCAS; и один или более наполнителей, подсластитель, разрыхлитель, необязательно увлажнитель, скользящее вещество и смазывающее вещество, где мини-таблетки содержащиеся в капсуле или пачке в совокупности имеют растворимость от приблизительно 50% до приблизительно 100% (например, от приблизительно 55% до приблизительно 95%, от приблизительно 60% до приблизительно 90% или от приблизительно 70% до приблизительно 80%) приблизительно за 30 минут.
[00480] В одном варианте осуществления единичная дозированная форма содержит мини-таблетку или множество мини-таблеток, указанная мини-таблетка или множество мини-таблеток содержит твердую дисперсию, содержащую по меньшей мере приблизительно 5 мг (например, по меньшей мере приблизительно 10 мг, по меньшей мере приблизительно 15 мг, по меньшей мере приблизительно 20 мг, по меньшей мере приблизительно 25 мг, по меньшей мере приблизительно 30 мг, по меньшей мере приблизительно 40 мг или по меньшей мере приблизительно 50 мг) по существу аморфного или аморфного Соединения 1; HPMCAS и SLS. В другом варианте осуществления капсула или пачка содержит мини-таблетку или множество мини-таблеток, указанная мини-таблетка или множество мини-таблеток содержат твердую дисперсию, содержащую по меньшей мере приблизительно 10 мг (например, по меньшей мере приблизительно 15 мг, по меньшей мере 20 мг, по меньшей мере 25 мг, по меньшей мере приблизительно 30 мг, по меньшей мере приблизительно 40 мг, по меньшей мере приблизительно 50 мг, по меньшей мере приблизительно 75 мг, по меньшей мере приблизительно 100 мг или по меньшей мере 150 мг) по существу аморфного или аморфного Соединения 1; и HPMCAS и SLS.
[00481] Растворение может быть измерено с использованием стандартного устройства USP Тип II, содержащего среду для растворения из 0,5 или 0,7% лаурилсульфата натрия, растворенного в 900 мл 50 мМ натрий фосфатного буфера при рН 6,8 при температуре приблизительно 37°C. Растворение мини-таблеток определяют, регистрируя растворение множества мини-таблеток, содержащих в совокупности 75 мг (используя 0,5% лаурилсульфат натрия) или 150 мг (используя 0,7% лаурилсульфат натрия) Соединения 1 в среде растворения. Отдельные мини-таблетки могут демонстрировать растворимость ниже, эквивалентную или выше, чем растворимость множества, причем средняя растворимость каждой отдельной мини-таблетки аналогична средней растворимости множества.
[00482] Другой аспект настоящего изобретения относится к фармацевтической композиции, состоящей из мини-таблетки, которая содержит CF потенциирующее средство API (например, твердую дисперсию Соединения 1) и другие эксципиенты (например, один или более наполнителей, подсластитель, разрыхлитель, увлажнитель, скользящее вещество и смазывающее вещество, или любое их сочетание), каждое из которых описано выше и в приведенных ниже примерах, где мини-таблетка имеет среднюю прочность при растяжении в интервале от приблизительно 0,5 МПа до приблизительно 4 МПа, например, по меньшей мере приблизительно 0,5 МПа, по меньшей мере приблизительно 1 МПа или по меньшей мере приблизительно 2 МПа. В одном примере фармацевтическая композиция состоит из мини-таблетки, которая содержит CF потенциирующее средство API (например, твердую дисперсию Соединения 1) и другие эксципиенты (например, один или более наполнителей, подсластитель, разрыхлитель, увлажнитель, скользящее вещество и смазывающее вещество, или любое их сочетание), каждое из которых описано выше и в приведенных ниже примерах, где мини-таблетка имеет среднюю прочность при растяжении в интервале от приблизительно 0,5 МПа до приблизительно 4 МПа, например, по меньшей мере приблизительно 0,5 МПа, по меньшей мере приблизительно 1 МПа или по меньшей мере приблизительно 2 МПа.
III. СПОСОБ ПОЛУЧЕНИЯ ФАРМАЦЕВТИЧЕСКОЙ КОМПОЗИЦИИ
[00483] Другой аспект настоящего изобретения относится к способу получения фармацевтической композиции, включающему получение смеси твердой дисперсии по существу аморфного или аморфного N-[2,4-бис(1,1-диметилэтил)-5-гидроксифенил]-1,4-дигидро-4-оксохинолин-3-карбоксамида, одного или более наполнителей, подсластителя, разрыхлителя, необязательно увлажнителя, скользящего вещества и смазывающего вещества, и прессования этой смеси в мини-таблетку. В некоторых вариантах осуществления указанная мини-таблетка имеет растворимость по меньшей мере приблизительно 50% приблизительно за 30 минут. В некоторых дополнительных вариантах осуществления мини-таблетка или множество мини-таблеток (например, по меньшей мере 2, по меньшей мере 4, по меньшей мере 10, по меньшей мере 15, по меньшей мере 20, по меньшей мере 25) в совокупности имеют растворимость по меньшей мере приблизительно 50% приблизительно за 30 минут.
[00484] Каждый из ингредиентов этой смеси описан выше и в нижеследующих Примерах. Кроме того, смесь может включать необязательные добавки, такие как один или более красителей, одно или более вкусовых веществ и/или одно или более ароматизирующих веществ, описанных выше и в нижеследующих Примерах. Относительные концентрации (например, % масс.) каждого из этих ингредиентов (и любых необязательных добавок) в смеси также представлены выше и в нижеприведенных Примерах. Ингредиенты, составляющие смесь, могут предоставляться последовательно или в любом сочетании добавлений; и ингредиенты или сочетание ингредиентов могут поставляться в любом порядке. В одном варианте осуществления смазывающее вещество, или части смазывающего вещества, является последним компонентом, добавляемым к смеси до прессования.
[00485] В другом варианте осуществления способ получения фармацевтической композиции включает получение смеси твердой дисперсии по существу аморфного Соединения 1, одного или более наполнителей, подсластителя, разрыхлителя, необязательно увлажнителя, скользящего вещества и смазывающего вещества; перемешивания этой смеси, пока эта смесь не станет по существу гомогенной, и прессование этой смеси в твердую лекарственную форму, как описано выше или в представленных ниже Примерах. Или способ получения фармацевтической композиции включает получение смеси твердой дисперсии аморфного Соединения 1, одного или более наполнителей, подсластителя, разрыхлителя, необязательно увлажнителя, скользящего вещества и смазывающего вещества; перемешивание этой смеси, пока она не станет по существу гомогенной, и прессование этой смеси в мини-таблетку, как описано выше или в Примерах, приведенных ниже. Например, смесь смешивают путем перемешивания, смешения, встряхивания и подобного, посредством смешивания вручную, мешалки, смесителя, любого их сочетания или подобного. В тех случаях, когда ингредиенты или сочетания ингредиентов добавляют последовательно, перемешивание может осуществляться между последующими добавлениями, непрерывно на протяжении добавления ингредиента, после добавления всех ингредиентов или сочетаний ингредиентов, или любое их сочетание. Кроме того, до или после каждой стадии перемешивания, перемешанные ингредиенты дополнительно могут быть просеяны, путем пропускания ингредиентов или смеси через сито с подходящим размером ячеек или подвергнуты декомкованию с использованием мельницы с соответствующим размером ячеек. Смесь перемешивают до тех пор, пока она не приобретет по существу гомогенный состав. Эта смесь/порошкообразная смесь далее может быть заполнена в соответствующую лекарственную форму или упаковку, то есть она может быть инкапсулирована или наполнена в пакеты, пачки, саше, флаконы и так далее для введения. Порошкообразная смесь также дополнительно может быть обработана с получением гранул или пеллет, или мини-таблеток и подобного. Эта смесь или часть смеси (некоторые из компонентов состава) может быть гранулирована, при необходимости, с использованием соответствующих способов грануляции, таких как сухая грануляция (уплотнение либо путем комкования, либо путем прокатки между валками с противоположным вращением), влажная грануляция с использованием грануляторов с высоким усилием сдвига, грануляция с использованием двухшнекового экструдера, грануляция в псевдоожиженном слое, экструзия-сферонизация, экструзия расплава, сушка распылением и подобные. Гранулы могут быть перемешаны с дополнительными ингредиентами, при необходимости, и прессованы в таблетки, мини-таблетки и т.п., или ими могут быть заполнены капсулы, пачки, саше и т.п. Гранулы, пеллеты, мини-таблетки и подобное также могут быть заполнены в соответствующую единичную дозированную форму или упаковку для введения, т.е. могут быть инкапсулированы или ими могут быть заполнены пакеты, пачки, саше, флаконы и т.п., или они могут быть дополнительно обработаны с дополнительными ингредиентами, если требуется, и прессованы в таблетки, пастилки и подобное. Было обнаружено, что путем добавления части смазывающего вещества во время стадий перемешивания твердой дисперсии, скользящее вещество, подсластитель и увлажнитель и перед добавлением наполнителя и разрыхлителя, в результате получают снижению потери твердой дисперсии на поверхностях во время обработки, такой как перемешивание, декомкование и прессование фармацевтической композиции в роторных таблетирующих машинах, подготовленных для производства мини-таблеток. В одном варианте осуществления способ получения фармацевтической композиции по настоящему изобретению схематически представлен на фиг. 1. В других вариантах осуществления мини-таблетки по настоящему изобретению могут быть получены в соответствии со следующими стадиями:
a) перемешивание твердой дисперсии по существу аморфного Соединения 1 или аморфного Соединения 1 и полимера, указанный полимер содержит HPMCAS, PVP/VA или их сочетания, со скользящим веществом, подсластителем и, необязательно, увлажнителем с получением первой смеси;
b) просеивание первой смеси;
c) перемешивание просеянной первой смеси с 20% просеянного смазывающего вещества до образования первой перемешанной смеси;
d) перемешивание просеянного наполнителя и просеянного разрыхлителя с первой перемешанной смесью с получением второй перемешанной смеси;
e) распределение второй перемешанной смеси с получением гомогенной смеси;
f) перемешивание 80% просеянного смазывающего вещества с гомогенной смесью с получением прессовочной смеси; и
g) прессование прессовочной смеси с получением мини-таблетки. В других вариантах осуществления мини-таблетки по настоящему изобретению могут быть получены в соответствии со следующими стадиями:
i) перемешивание твердой дисперсии по существу аморфного Соединения 1 или аморфного Соединения 1 и полимера, указанный полимер содержит HPMCAS, PVP/VA или их сочетания, со скользящим веществом и подсластителем с получением первой смеси;
ii) просеивание первой смеси;
iii) перемешивание просеянной первой смеси;
iv) перемешивание просеянного наполнителя и просеянного разрыхлителя с первой перемешанной смесью с получением второй перемешанной смеси;
v) распределение второй перемешанной смеси с получением гомогенной смеси;
vi) перемешивание просеянного смазывающего вещества с гомогенной смесью с получением прессовочной смеси; и
vii) прессование прессовочной смеси с получением мини-таблетки.
[00486] В одном варианте осуществления смесь содержит твердую дисперсию по существу аморфного или аморфного Соединения 1, один или более наполнителей, подсластитель, разрыхлитель, необязательно увлажнитель, скользящее вещество и смазывающее вещество, где каждый из этих ингредиентов предоставляется в форме порошка (например, предоставляется в виде частиц, имеющих средний диаметр, измеренный с помощью светорассеяния, 250 мкм или менее (например, 150 мкм или менее, 100 мкм или менее, 50 мкм или менее, 45 мкм или менее, 40 мкм или менее, или 35 мкм или менее)). Например, смесь содержит твердую дисперсию аморфного Соединения 1, один или более наполнителей, подсластитель, разрыхлитель, необязательно увлажнитель, скользящее вещество и смазывающее вещество, где каждый из этих ингредиентов предоставляется в форме порошка (например, представлен в виде частиц, имеющих средний диаметр, измеренный с помощью светорассеяния, 250 мкм или менее (например, 150 мкм или менее, 100 мкм или менее, 50 мкм или менее, 45 мкм или менее, 40 мкм или менее, или 35 мкм или менее)).
[00487] В другом варианте осуществления смесь содержит твердую дисперсию по существу аморфного Соединения 1, один или более наполнителей, подсластитель, разрыхлитель, необязательно увлажнитель, скользящее вещество и смазывающее вещество, где каждый их этих ингредиентов по существу свободен от воды. Каждый из этих ингредиентов содержит менее 6 масс.% (например, менее 2 масс.%, менее 1 масс.%, менее 0,75 масс.%, менее 0,5 масс.%, или менее 0,25 масс.%) воды по массе ингредиента. Например, эта смесь содержит твердую дисперсию аморфного Соединения 1, один или более наполнителей, подсластитель, разрыхлитель, необязательно увлажнитель, скользящее вещество и смазывающее вещество, где каждый из этих ингредиентов по существу свободен от воды.
[00488] В другом варианте осуществления прессование смеси в мини-таблетку выполняют путем заполнения формы (например, пресс-формы) прессовочной смесью и приложения давления к прессовочной смеси. Эту операцию можно выполнять, используя пресс-формы и подходящего размера пуансоны, на прессе или другом аналогичном оборудовании, таком как роторная таблетирующая машина. Отмечается также, что приложение давления к прессовочной смеси, находящейся в форме, можно производить неоднократно, используя одинаковое прикладываемое давление во время каждого прессования или используя разные прикладываемые давления во время прессования. В другом примере прессуемая смесь может подвергаться прессованию, используя давление, достаточное для получения твердой дозированной формы, например, гранулы, пеллеты, частицы, имеющей определенную форму, или мини-таблетки, твердой лекарственной формы. В некоторых вариантах, для реализации целей настоящих способов, может быть использован роторный таблеточный пресс, коммерчески доступный от Kikusui America (Model Virgo), имеющий 19 позиций пресс-инструмента, функционирующий в режиме получения мини-таблеток цилиндрической формы размером 2 мм (7 мг на мини-таблетку). В других вариантах осуществления роторная таблеточная машина, коммерчески доступная от компании IMA KILIAN GMBH & CO., Кельн, Германия, может быть использована для целей настоящего изобретения. Например, прессовочную смесь прессуют, используя подходящую инструментальную оснастку (пресс-формы и пуансоны на пресс-машине), получая 2-мм мини-таблетку цилиндрической формы, имеющую среднюю прочность при растяжении приблизительно между 0,5 МПа и приблизительно 4 МПа.
IV. ВВЕДЕНИЕ ФАРМАЦЕВТИЧЕСКОЙ КОМПОЗИЦИИ
[00489] В другом аспекте настоящее изобретение относится к способу лечения или снижения степени тяжести заболевания у пациента, включающему введение указанному пациенту одной из фармацевтических композиций, определенных в данном контексте, и это указанное заболевание выбрано из кистозного фиброза, астмы, индуцированноЙ курением ХОБЛ; хронического бронхита, риносинусита, констипации, панкреатита, недостаточности поджелудочной железы, мужского бесплодия, обусловленного врожденным двусторонним отсутствием семявыносящего протока (CBAVD); легочной болезни легкой степени тяжести, идиопатического панкреатита, аллергического бронхолегочного аспергиллеза (ABPA), болезни печени, наследственной эмфиземы, наследственного гемохроматоза, нарушений коагуляции-фибринолиза, таких как недостаточность белка С, наследственный ангионевротический отек типа 1, нарушений процессинга липидов, таких как семейная гиперхолестеринемия, хейломикронемия типа 1, абеталипопротеинемия, лизосомных болезней накопления, таких как болезнь клеточных включений/псевдо-Гурлера, мукополисахаридозы, болезнь Сандхоффа/Тея-Сакса, болезнь Криглера-Найяра II типа, полиэндокринопатия/гиперинсулинемия, сахарный диабет, карликовость лароновского типа, дефицит миелопероксидазы, первичный гипопаратиреоз, меланома, гликогеноз CDG 1 типа, врожденный гипертиреоз, несовершенный остеогенез, наследственная гипофибриногенемия, дефицит ACT, несахарный диабет (DI), нейрогипофизарный DI, нефрогенный DI, синдром Шарко-Мари-Тута, болезнь Пелицеуса-Мерцбахера, нейродегенеративных болезней, таких как болезнь Альцгеймера, болезнь Паркинсона, боковой амиотрофический склероз, прогрессирующий супрануклеарный паралич, болезнь Пика, некоторых неврологических расстройств, характеризующихся отложением полиглутамин-содержащих протеинов в ядрах нейронов, таких как болезнь Хантингтона, спинально-мозжечковая атаксия I типа, спинально-бульбарная мышечная атрофия, дентато-рубро-паллидо-льюисова атрофия и миотоническая дистрофия, а также губчатых энцефалопатий, таких как наследственная болезнь Крейцфельда-Якоба (вследствие нарушения процессинга прионного белка), болезнь Фабри, синдром Герстманна-Штраусслера-Шейнкера, COPD, болезнь сухих глаз, болезнь Шегрена, остеопороз, остеопения, костное сращение и костеобразование (включая костную репарацию, костную регенерацию, снижение резорбции костной ткани и увеличение отложения в костях), болезнь Горхема, хлоридных каналопатий, таких как врожденная миотония (формы Томсона и Бекера), синдром Бартера III типа, болезнь Дента, эпилепсия, гиперэкплексия, лизосомная болезнь накопления, синдром Ангельмана и первичная цилиарная дискинезия (PCD), термин для унаследованных нарушений структуры и/или функции ресничного эпителия, включая PCD с полной инверсией внутренних органов (также известную как синдром Картагенера), PCD без полной инверсии внутренних органов и цилиарной аплазии.
[00490] Соединение 1 (N-[2,4-бис(1,1-диметилэтил)-5-гидроксифенил]-1,4-дигидро-4-оксохинолин-3-карбоксамид) был признан в качестве нового препарата терапии прорыва Государственным управлением по контролю качества пищевых продуктов и лекарственных средств (FDA) для лечения кистозного фиброза, только одним из двух на время подачи этой заявки. Это демонстрирует значительную неудовлетворенную потребность в эффективном лечении причин кистозного фиброза по сравнению с симптоматическими лечениями.
[00491] В некоторых вариантах осуществления способ включает лечение или снижение степени тяжести кистозного фиброза у пациента, например, пациента детского возраста, и этот способ включает введение пациенту одной из фармацевтических композиций, описанных в настоящем изобретении. Хотя фармацевтические композиции по данному изобретению не ограничены их применением для лечения пациентов детского возраста, готовые лекарственные формы, представленные в настоящей заявке, подходят для пациентов, которые сталкиваются с трудностями при глотании необходимых для них лекарственных средств в форме таблеток или которые, как им рекомендовано, принимают свои лекарственные средства в смеси с пищей или жидкостями. Некоторые из этих пациентов обычно переносят необходимые для них фармацевтические композиции из единичной дозированной формы в пищу или жидкую среду, предназначенных для употребления.
[00492] В некоторых вариантах осуществления пациент имеет мутантные формы CFTR человека. В других вариантах осуществления пациент имеет одну или более из следующих мутаций ΔF508, R117H и G551D CFTR человека. В некоторых вариантах осуществления пациент имеет мутацию воротного механизма CFTR. В некоторых вариантах осуществления пациент имеет мутацию воротного механизма CFTR, в том числе, но не только, G551D, G178R, G551S, G970R, G1244E, S1255P, G1349D, S549N, S549R и S1251N. В некоторых вариантах осуществления пациент имеет одну или более из следующих мутаций воротного механизма CFTR человека: G551D, G178R, G551S, G970R, G1244E, S1255P, G1349D, S549N, S549R и S1251N. В одном варианте осуществления указанный способ включает в себя лечение или снижение тяжести кистозного фиброза у пациента, имеющего мутацию ΔF508 CFTR человека, включающее введение указанному пациенту одной из фармацевтических композиций, описанных в настоящей заявке. В одном варианте осуществления указанный способ включает в себя лечение или снижение тяжести кистозного фиброза у пациента, имеющего мутацию G551D CFTR человека, включающее введение указанному пациенту одной из фармацевтических композиций, описанных в настоящей заявке. В одном варианте осуществления указанный способ включает в себя лечение или снижение тяжести кистозного фиброза у пациента, имеющего R117H мутацию CFTR человека, включающее введение указанному пациенту одной из фармацевтических композиций, описанных в настоящей заявке. В одном варианте осуществления указанный способ включает в себя лечение или снижение тяжести кистозного фиброза у пациента, имеющего ΔF508 мутацию CFTR человека по меньшей мере в одной аллеле, включающее введение указанному пациенту одной из композиций, описанных в настоящем изобретении. В одном варианте осуществления указанный способ включает в себя лечение или снижение тяжести кистозного фиброза у пациента, имеющего ΔF508 мутацию CFTR человека в обеих аллелях, включающее введение указанному пациенту одной из композиций, описанных в настоящем изобретении. В одном варианте осуществления указанный способ включает в себя лечение или снижение тяжести кистозного фиброза у пациента, имеющего G551D мутацию CFTR человека по меньшей мере в одной аллели, включающее введение указанному пациенту одной из композиций, описанных в настоящем изобретении. В одном варианте осуществления указанный способ включает в себя лечение или снижение тяжести кистозного фиброза у пациента, имеющего G551D мутацию CFTR человека в обеих аллелях, включающее введение пациенту одной из композиций, описанных в настоящем изобретении. В одном варианте осуществления указанный способ включает в себя лечение или снижение тяжести кистозного фиброза у пациента, имеющего R117H мутацию CFTR человека по меньшей мере в одной аллели, включающее введение указанному пациенту одной из композиций, описанных в настоящем изобретении. В одном варианте осуществления указанный способ включает в себя лечение или снижение тяжести кистозного фиброза у пациента, имеющего R117H мутацию CFTR человека в обеих аллелях включающее введение пациенту одной из композиций, описанных в настоящем изобретении.
[00493] В одном варианте осуществления указанный способ включает в себя лечение или снижение тяжести кистозного фиброза у пациента, имеющего мутацию воротного механизма CFTR человека, включающее введение указанному пациенту одной из фармацевтических композиций, описанных в настоящей заявке. В одном варианте осуществления указанный способ включает в себя лечение или снижение тяжести кистозного фиброза у пациента, имеющего мутацию воротного механизма CFTR по меньшей мере в одной аллели, включающее введение указанному пациенту одной из композиций, описанных в настоящем изобретении. В одном варианте осуществления указанный способ включает в себя лечение или снижение тяжести кистозного фиброза у пациента, имеющего мутацию воротного механизма CFTR в обеих аллелях, включающее введение указанному пациенту одной из композиций, описанных в настоящем изобретении.
[00494] В одном варианте осуществления указанный способ включает в себя лечение или снижение тяжести кистозного фиброза у пациента, имеющего G178R мутацию CFTR человека, включающее введение указанному пациенту одной из фармацевтических композиций, описанных в настоящей заявке. В другом варианте осуществления указанный способ включает в себя лечение или снижение тяжести кистозного фиброза у пациента, имеющего G178R мутацию CFTR человека по меньшей мере в одной аллели, включающее введение указанному пациенту одной из композиций, описанных в настоящем изобретении. В другом варианте осуществления указанный способ включает в себя лечение или снижение тяжести кистозного фиброза у пациента, имеющего G178R мутацию CFTR человека в обеих аллелях, включающее введение указанному пациенту одной из композиций, описанных в настоящем изобретении.
[00495] В одном варианте осуществления указанный способ включает в себя лечение или снижение тяжести кистозного фиброза у пациента, имеющего G551S мутацию CFTR человека, включающее введение указанному пациенту одной из фармацевтических композиций, описанных в настоящей заявке. В другом варианте осуществления указанный способ включает в себя лечение или снижение тяжести кистозного фиброза у пациента, имеющего G551S мутацию CFTR человека по меньшей мере в одной аллели, включающее введение указанному пациенту одной из композиций, описанных в настоящем изобретении. В другом варианте осуществления указанный способ включает в себя лечение или снижение тяжести кистозного фиброза у пациента, имеющего G551S мутацию CFTR человека в обеих аллелях, включающее введение указанному пациенту одной из композиций, описанных в настоящем изобретении.
[00496] В одном варианте осуществления указанный способ включает в себя лечение или снижение тяжести кистозного фиброза у пациента, имеющего G970R мутацию CFTR человека, включающее введение указанному пациенту одной из фармацевтических композиций, описанных в настоящей заявке. В другом варианте осуществления указанный способ включает в себя лечение или снижение тяжести кистозного фиброза у пациента, имеющего G970R мутацию CFTR человека по меньшей мере в одной аллели, включающее введение указанному пациенту одной из композиций, описанных в настоящем изобретении. В другом варианте осуществления указанный способ включает в себя лечение или снижение тяжести кистозного фиброза у пациента, имеющего G970R мутацию CFTR человека в обеих аллелях, включающее введение указанному пациенту одной из композиций, описанных в настоящем изобретении.
[00497] В одном варианте осуществления указанный способ включает в себя лечение или снижение тяжести кистозного фиброза у пациента, имеющего G1244E мутацию CFTR человека, включающее введение указанному пациенту одной из фармацевтических композиций, описанных в настоящей заявке. В другом варианте осуществления указанный способ включает в себя лечение или снижение тяжести кистозного фиброза у пациента, имеющего G1244E мутацию CFTR человека по меньшей мере в одной аллели, включающее введение указанному пациенту одной из композиций, описанных в настоящем изобретении. В другом варианте осуществления указанный способ включает в себя лечение или снижение тяжести кистозного фиброза у пациента, имеющего G1244E мутацию CFTR человека в обеих аллелях, включающее введение указанному пациенту одной из композиций, описанных в настоящем изобретении.
[00498] В одном варианте осуществления указанный способ включает в себя лечение или снижение тяжести кистозного фиброза у пациента, имеющего S1255P мутацию CFTR человека, включающее введение указанному пациенту одной из фармацевтических композиций, описанных в настоящей заявке. В другом варианте осуществления указанный способ включает в себя лечение или снижение тяжести кистозного фиброза у пациента, имеющего S1255P мутацию CFTR человека по меньшей мере в одной аллели, включающее введение указанному пациенту одной из композиций, описанных в настоящем изобретении. В другом варианте осуществления указанный способ включает в себя лечение или снижение тяжести кистозного фиброза у пациента, имеющего S1255P мутацию CFTR человека в обеих аллелях, включающее введение указанному пациенту одной из композиций, описанных в настоящем изобретении.
[00499] В одном варианте осуществления указанный способ включает в себя лечение или снижение тяжести кистозного фиброза у пациента, имеющего G1349D мутацию CFTR человека, включающее введение указанному пациенту одной из фармацевтических композиций, описанных в настоящей заявке. В другом варианте осуществления указанный способ включает в себя лечение или снижение тяжести кистозного фиброза у пациента, имеющего G1349D мутацию CFTR человека по меньшей мере в одной аллели, включающее введение указанному пациенту одной из композиций, описанных в настоящем изобретении. В другом варианте осуществления указанный способ включает в себя лечение или снижение тяжести кистозного фиброза у пациента, имеющего G1349D мутацию CFTR человека в обеих аллелях, включающее введение указанному пациенту одной из композиций, описанных в настоящем изобретении.
[00500] В одном варианте осуществления указанный способ включает в себя лечение или снижение тяжести кистозного фиброза у пациента, имеющего S549N мутацию CFTR человека, включающее введение указанному пациенту одной из фармацевтических композиций, описанных в настоящей заявке. В другом варианте осуществления указанный способ включает в себя лечение или снижение тяжести кистозного фиброза у пациента, имеющего S549N мутацию CFTR человека по меньшей мере в одной аллели, включающее введение указанному пациенту одной из композиций, описанных в настоящем изобретении. В другом варианте осуществления указанный способ включает в себя лечение или снижение тяжести кистозного фиброза у пациента, имеющего S549N мутацию CFTR человека в обеих аллелях, включающее введение указанному пациенту одной из композиций, описанных в настоящем изобретении.
[00501] В одном варианте осуществления указанный способ включает в себя лечение или снижение тяжести кистозного фиброза у пациента, имеющего S549R мутацию CFTR человека, включающее введение указанному пациенту одной из фармацевтических композиций, описанных в настоящей заявке. В другом варианте осуществления указанный способ включает в себя лечение или снижение тяжести кистозного фиброза у пациента, имеющего S549R мутацию CFTR человека по меньшей мере в одной аллели, включающее введение указанному пациенту одной из композиций, описанных в настоящем изобретении. В другом варианте осуществления указанный способ включает в себя лечение или снижение тяжести кистозного фиброза у пациента, имеющего S549R мутацию CFTR человека в обеих аллелях, включающее введение указанному пациенту одной из композиций, описанных в настоящем изобретении.
[00502] В одном варианте осуществления указанный способ включает в себя лечение или снижение тяжести кистозного фиброза у пациента, имеющего S1251N мутацию CFTR человека, включающее введение указанному пациенту одной из фармацевтических композиций, описанных в настоящей заявке. В другом варианте осуществления указанный способ включает в себя лечение или снижение тяжести кистозного фиброза у пациента, имеющего S1251N мутацию CFTR человека по меньшей мере в одной аллели, включающее введение указанному пациенту одной из композиций, описанных в настоящем изобретении. В другом варианте осуществления указанный способ включает в себя лечение или снижение тяжести кистозного фиброза у пациента, имеющего S1251N мутацию CFTR человека в обеих аллелях, включающее введение указанному пациенту одной из композиций, описанных в настоящем изобретении.
[00503] В одном варианте осуществления указанный способ включает в себя лечение или снижение тяжести кистозного фиброза у пациента, имеющего CFTR с остаточной функцией или фенотипом остаточной функции, включающее введение указанному пациенту одной из фармацевтических композиций, описанных в настоящей заявке.
[00504] В некоторых вариантах осуществления способ введения по настоящему изобретению включает пероральное введение жидкости или напитка, в том числе, но не только, молока (в том числе грудного молока), смеси для детского питания или молочной смеси, или мягкой пищи, в том числе, но не только, яблочного пюре, йогурта без добавок, мороженого, продукта для детского питания (в том числе моркови и морковного пюре). В некоторых вариантах осуществления способы введения по настоящему изобретению включают пероральное введение жидкости или напитка, в том числе, но не только, молока (в том числе грудного молока), смеси для детского питания или молочной смеси. В некоторых вариантах осуществления способы введения по настоящему изобретению включают пероральное введение мягкой пищи, в том числе, но не только, яблочного пюре, йогурта без добавок, мороженого, продукта для детского питания (в том числе моркови и морковного пюре). В других вариантах осуществления способы введения по настоящему изобретению включают пероральное введение жидкости, такой как вода. В одном варианте осуществления единичную дозированную форму впрыскивают в напиток или жидкость, в том числе, но не только, смесь для детского питания, молочную смесь, молоко или грудное молоко, и вводят. В другом варианте осуществления единичную дозированную форму впрыскивают в напиток или жидкость, в том числе, но не только, смесь для детского питания, молочную смесь, молоко или грудное молоко, перемешивают и вводят. В одном варианте осуществления единичную дозированную форму впрыскивают в мягкую пищу, в том числе, но не только, яблочное пюре, йогурт без добавок, мороженое, продукт для детского питания (в том числе морковь и морковное пюре), и вводят. В другом варианте осуществления единичную дозированную форму впрыскивают в мягкую пищу, в том числе, но не только, яблочное пюре, йогурт без добавок, мороженое, продукт для детского питания (в том числе морковь и морковное пюре), перемешивают и вводят. Способы введения по настоящему изобретению также необязательно могут включать для мини-таблеток или гранул уменьшенного размера введение содержимого пачек, пакетов, капсул, флаконов или саше непосредственно в ротовую полость с последующим введением грудного молока или смеси. Способы введения по настоящему изобретению также необязательно могут включать для мини-таблеток или гранул уменьшенного размера введение содержимого пачек, пакетов, капсул, флаконов или саше непосредственно в ротовую полость с последующим введением жидкости или напитка. Отмечается, что любой из способов введения по настоящему изобретению необязательно может включать пероральное введение с жиросодержащей пищей, такой как стандартное CF высококалорийное с высоким содержанием жира блюдо или закуска. В некоторых вариантах осуществления любой из способов введения по настоящему изобретению необязательно может включать пероральное введение одновременно, до или после жиросодержащей пищи, такой как стандартное CF высококалорийное с высоким содержанием жира блюдо или закуска.
[00505] Также отмечается, что способы введения по настоящему изобретению включают введение композиций по настоящему изобретению пациенту в соответствии с возрастом или массой тела. В некоторых вариантах осуществления способ введения фармацевтической композиции включает пероральное введение пациенту каждые 12 часов по меньшей мере одной капсулы или пачки, содержащей мини-таблетку или множество мини-таблеток, где каждая мини-таблетка содержит фармацевтическую композицию, описанную в настоящем изобретении, где пациент моложе шестилетнего возраста, в том числе, но не только, в возрасте от 2 до 5 лет, моложе 2, от нуля (т.е. с рождения) до 2 летнего возраста, от 1 до 2 лет, от 9 месяцев до 2 лет, от 6 месяцев до 2 лет, от 3 месяцев до 2 лет и от 2 месяцев до 2-летнего возраста. В некоторых вариантах осуществления рождение означает рождение после нормального срока беременности. В других вариантах осуществления способ введения фармацевтической композиции включает пероральное введение пациенту каждые 12 часов по меньшей мере одной капсулы или пачки, содержащей мини-таблетку или множество мини-таблеток, где каждая мини-таблетка содержит фармацевтическую композицию, описанную в настоящем изобретении, где пациент включает тех пациентов, но не только их, масса тела которых превышает или равна приблизительно 14 килограммов. В других вариантах осуществления способ введения фармацевтической композиции включает пероральное введение пациенту каждые 12 часов по меньшей мере одной капсулы или пачки, содержащей мини-таблетку или множество мини-таблеток, где каждая мини-таблетка содержит фармацевтическую композицию, описанную в настоящем изобретении, где пациент включает тех пациентов, но не только, масса тела которых менее 14 килограммов. В других вариантах осуществления способ введения фармацевтической композиции включает пероральное введение пациенту каждые 12 часов по меньшей мере одной капсулы или пачки, содержащей мини-таблетку или множество мини-таблеток, где каждая мини-таблетка содержит фармацевтическую композицию, описанную в настоящем изобретении, где пациент включает тех пациентов, масса тела которых составляет от приблизительно 7,5 килограммов до менее 14 килограммов. В других вариантах осуществления способ введения фармацевтической композиции включает пероральное введение пациенту каждые 12 часов по меньшей мере одной капсулы или пачки, содержащей мини-таблетку или множество мини-таблеток, где каждая мини-таблетка содержит фармацевтическую композицию, описанную в настоящем изобретении, где пациент включает тех пациентов, масса тела которых составляет от приблизительно 5 килограммов до менее 7,5 килограммов. В других вариантах осуществления способ введения фармацевтической композиции включает пероральное введение пациенту каждые 12 часов по меньшей мере одной капсулы или пачки, содержащей мини-таблетку или множество мини-таблеток, где каждая мини-таблетка содержит фармацевтическую композицию, описанную в настоящем изобретении, где пациент включает тех пациентов, масса тела которых составляет от приблизительно 2,5 килограммов до менее 5 килограммов. В других вариантах осуществления способ введения фармацевтической композиции включает пероральное введение пациенту каждые 12 часов по меньшей мере одной капсулы или пачки, содержащей мини-таблетку или множество мини-таблеток, где каждая мини-таблетка содержит фармацевтическую композицию, описанную в настоящем изобретении, где пациент включает тех пациентов, масса тела которых составляет менее 7,5 килограммов. В других вариантах осуществления способ введения фармацевтической композиции включает пероральное введение пациенту каждые 12 часов по меньшей мере одной капсулы или пачки, содержащей мини-таблетку или множество мини-таблеток, где каждая мини-таблетка содержит фармацевтическую композицию, описанную в настоящем изобретении, где пациент включает тех пациентов, масса тела которых составляет от приблизительно 5 килограммов до более 5 килограммов. В других вариантах осуществления способ введения фармацевтической композиции включает пероральное введение пациенту каждые 12 часов по меньшей мере одной капсулы или пачки, содержащей мини-таблетку или множество мини-таблеток, где каждая мини-таблетка содержит фармацевтическую композицию, описанную в настоящем изобретении, где пациент включает тех пациентов, масса тела которых составляет менее 5 килограммов. В других вариантах осуществления способ введения фармацевтической композиции включает пероральное введение пациенту каждые 12 часов по меньшей мере одной капсулы или пачки, содержащей мини-таблетку или множество мини-таблеток, где каждая мини-таблетка содержит фармацевтическую композицию, описанную в настоящем изобретении, где пациент включает тех пациентов, масса тела которых составляет от приблизительно 2,5 килограммов до более 2,5 килограммов.
[00506] Также отмечается, что способы введения по настоящему изобретению включают введение композиций по настоящему изобретению пациенту в соответствии с возрастом или массой тела. В некоторых вариантах осуществления способ введения фармацевтической композиции включает пероральное введение пациенту один раз в сутки по меньшей мере одной капсулы или пачки, содержащей мини-таблетку или множество мини-таблеток, где каждая мини-таблетка содержит фармацевтическую композицию, описанную в настоящем изобретении, где возраст пациента меньше шести лет, в том числе, но не только, в возрасте от 2 до 5 лет, моложе 2, от нуля (т.е. с рождения) до 2 летнего возраста, от 1 до 2 лет, от 9 месяцев до 2 лет, от 6 месяцев до 2 лет, от 3 месяцев до 2 лет и от 2 месяцев до 2-летнего возраста. В некоторых вариантах осуществления рождение означает рождение после нормального срока беременности. В других вариантах осуществления способ введения фармацевтической композиции включает пероральное введение пациенту один раз в сутки по меньшей мере одной капсулы или пачки, содержащей мини-таблетку или множество мини-таблеток, где каждая мини-таблетка содержит фармацевтическую композицию, описанную в настоящем изобретении, где пациент включает, но не только, тех пациентов, масса тела которых превышает или равна приблизительно 14 килограммов. В других вариантах осуществления способ введения фармацевтической композиции включает пероральное введение пациенту один раз в сутки по меньшей мере одной капсулы или пачки, содержащей мини-таблетку или множество мини-таблеток, где каждая мини-таблетка содержит фармацевтическую композицию, описанную в настоящем изобретении, где пациент включает, но не только, тех пациентов, масса тела которых менее 14 килограммов. В других вариантах осуществления способ введения фармацевтической композиции включает пероральное введение пациенту один раз в сутки по меньшей мере одной капсулы или пачки, содержащей мини-таблетку или множество мини-таблеток, где каждая мини-таблетка содержит фармацевтическую композицию, описанную в настоящем изобретении, где пациент включает тех пациентов, масса тела которых составляет приблизительно от 7,5 килограммов до 14 килограммов. В других вариантах осуществления способ введения фармацевтической композиции включает пероральное введение пациенту один раз в сутки по меньшей мере одной капсулы или пачки, содержащей мини-таблетку или множество мини-таблеток, где каждая мини-таблетка содержит фармацевтическую композицию, описанную в настоящем изобретении, где пациент включает тех пациентов, масса тела которых от приблизительно 5 килограммов до 7,5 килограммов. В других вариантах осуществления способ введения фармацевтической композиции включает пероральное введение пациенту один раз в сутки по меньшей мере одной капсулы или пачки, содержащей мини-таблетку или множество мини-таблеток, где каждая мини-таблетка содержит фармацевтическую композицию, описанную в настоящем изобретении, где пациент включает тех пациентов, масса тела которых составляет от приблизительно 2,5 килограммов до 5 килограммов. В других вариантах осуществления способ введения фармацевтической композиции включает пероральное введение пациенту один раз в сутки по меньшей мере одной капсулы или пачки, содержащей мини-таблетку или множество мини-таблеток, где каждая мини-таблетка содержит фармацевтическую композицию, описанную в настоящем изобретении, где пациент включает тех пациентов, масса тела которых составляет менее 7,5 килограммов. В других вариантах осуществления способ введения фармацевтической композиции включает пероральное введение пациенту один раз в сутки по меньшей мере одной капсулы или пачки, содержащей мини-таблетку или множество мини-таблеток, где каждая мини-таблетка содержит фармацевтическую композицию, описанную в настоящем изобретении, где пациент включает тех пациентов, масса тела которых составляет от приблизительно 5 килограммов и выше. В других вариантах осуществления способ введения фармацевтической композиции включает пероральное введение пациенту один раз в сутки по меньшей мере одной капсулы или пачки, содержащей мини-таблетку или множество мини-таблеток, где каждая мини-таблетка содержит фармацевтическую композицию, описанную в настоящем изобретении, где пациент включает тех пациентов, масса тела которых составляет менее 5 килограммов. В других вариантах осуществления способ введения фармацевтической композиции включает пероральное введение пациенту один раз в сутки по меньшей мере одной капсулы или пачки, содержащей мини-таблетку или множество мини-таблеток, где каждая мини-таблетка содержит фармацевтическую композицию, описанную в настоящем изобретении, где пациент включает тех пациентов, масса тела которых составляет приблизительно 2,5 килограмма и выше.
[00507] Также отмечается, что способы введения по настоящему изобретению включают введение композиций по настоящему изобретению пациенту в соответствии с возрастом или массой тела. В некоторых вариантах осуществления способ введения фармацевтической композиции включает пероральное введение пациенту два раза в сутки по меньшей мере одной капсулы или пачки, содержащей мини-таблетку или множество мини-таблеток, где каждая мини-таблетка содержит фармацевтическую композицию, описанную в настоящем изобретении, где возраст пациента меньше шести лет, в том числе, но не только, от 2 до 5 лет, моложе 2, от нуля (т.е. с рождения) до 2 летнего возраста, от 1 до 2 лет, от 9 месяцев до 2 лет, от 6 месяцев до 2 лет, от 3 месяцев до 2 лет и от 2 месяцев до 2-летнего возраста. В некоторых вариантах осуществления рождение означает рождение после нормального срока беременности. В других вариантах осуществления способ введения фармацевтической композиции включает пероральное введение пациенту два раза в сутки по меньшей мере одной капсулы или пачки, содержащей мини-таблетку или множество мини-таблеток, где каждая мини-таблетка содержит фармацевтическую композицию, описанную в настоящем изобретении, где пациент включает, но не только, тех пациентов, масса тела которых превышает или равна приблизительно 14 килограммов. В других вариантах осуществления способ введения фармацевтической композиции включает пероральное введение пациенту два раза в сутки по меньшей мере одной капсулы или пачки, содержащей мини-таблетку или множество мини-таблеток, где каждая мини-таблетка содержит фармацевтическую композицию, описанную в настоящем изобретении, где пациент включает, но не только, тех пациентов, масса тела которых менее 14 килограммов. В других вариантах осуществления способ введения фармацевтической композиции включает пероральное введение пациенту два раза в сутки по меньшей мере одной капсулы или пачки, содержащей мини-таблетку или множество мини-таблеток, где каждая мини-таблетка содержит фармацевтическую композицию, описанную в настоящем изобретении, где пациент включает тех пациентов, масса тела которых составляет приблизительно от 7,5 килограммов до 14 килограммов. В других вариантах осуществления способ введения фармацевтической композиции включает пероральное введение пациенту два раза в сутки по меньшей мере одной капсулы или пачки, содержащей мини-таблетку или множество мини-таблеток, где каждая мини-таблетка содержит фармацевтическую композицию, описанную в настоящем изобретении, где пациент включает тех пациентов, масса тела которых приблизительно от 5 килограммов до 7,5 килограммов. В других вариантах осуществления способ введения фармацевтической композиции включает пероральное введение пациенту два раза в сутки по меньшей мере одной капсулы или пачки, содержащей мини-таблетку или множество мини-таблеток, где каждая мини-таблетка содержит фармацевтическую композицию, описанную в настоящем изобретении, где пациент включает тех пациентов, масса тела которых составляет приблизительно от 2,5 килограммов до 5 килограммов. В других вариантах осуществления способ введения фармацевтической композиции включает пероральное введение пациенту два раза в сутки по меньшей мере одной капсулы или пачки, содержащей мини-таблетку или множество мини-таблеток, где каждая мини-таблетка содержит фармацевтическую композицию, описанную в настоящем изобретении, где пациент включает тех пациентов, масса тела которых составляет менее 7,5 килограммов. В других вариантах осуществления способ введения фармацевтической композиции включает пероральное введение пациенту два раза в сутки по меньшей мере одной капсулы или пачки, содержащей мини-таблетку или множество мини-таблеток, где каждая мини-таблетка содержит фармацевтическую композицию, описанную в настоящем изобретении, где пациент включает тех пациентов, масса тела которых составляет от приблизительно 5 килограммов и выше. В других вариантах осуществления способ введения фармацевтической композиции включает пероральное введение пациенту два раза в сутки по меньшей мере одной капсулы или пачки, содержащей мини-таблетку или множество мини-таблеток, где каждая мини-таблетка содержит фармацевтическую композицию, описанную в настоящем изобретении, где пациент включает тех пациентов, масса тела которых составляет менее 5 килограммов. В других вариантах осуществления способ введения фармацевтической композиции включает пероральное введение пациенту два раза в сутки по меньшей мере одной капсулы или пачки, содержащей мини-таблетку или множество мини-таблеток, где каждая мини-таблетка содержит фармацевтическую композицию, описанную в настоящем изобретении, где пациент включает тех пациентов, масса тела которых составляет от приблизительно 2,5 килограммов и выше.
[00508] В некоторых вариантах осуществления указанный способ включает лечение или уменьшение тяжести кистозного фиброза у пациента, предусматривающее введение указанному пациенту фармацевтической композиции, содержащей порошковую композицию или прессованную фармацевтическую композицию. В одном варианте осуществления пациенту вводят капсулу или пачку, содержащую порошковую фармацевтическую композицию, содержащую от 1 мг до приблизительно 250 мг Соединения 1.
[00509] В некоторых вариантах осуществления указанная композиция может содержать порошковую фармацевтическую композицию, содержащую твердую дисперсию и эксципиент, например: один или более наполнителей, подсластитель, скользящее вещество, смазывающее вещество и их сочетания, где твердая дисперсия содержит от приблизительно 30 масс.% до приблизительно 95 масс.% Соединения 1 по массе дисперсии и полимер.
[00510] В некоторых вариантах осуществления твердая дисперсия содержит от приблизительно 45 масс.% до приблизительно 85 масс.%, включая все значения и интервалы в указанном диапазоне (например, приблизительно 50 масс.%, приблизительно 72,4 масс.%, приблизительно 78,8 масс.% или приблизительно 80 масс.%) Соединения 1 по массе дисперсии и полимер.
[00511] Одна, приводимая в качестве примера, фармацевтическая композиция содержит от приблизительно 5 масс.% до приблизительно 70 масс.% (например, от приблизительно 5 масс.% до приблизительно 65 масс.%, от приблизительно 5 масс.% до приблизительно 50 масс.% или от приблизительно 30 масс.% до приблизительно 40 масс.%) твердой дисперсии по массе композиции, содержащей от приблизительно 30 масс.% до приблизительно 90 масс.% по существу аморфного Соединения 1, по массе дисперсии, и от приблизительно 70 масс.% до приблизительно 10 масс.% полимера, по массе дисперсии; от приблизительно 10 масс.% до приблизительно 90 масс.% одного или более наполнителей; от приблизительно 0,1 масс.% до приблизительно 5 масс.% подсластителя; от приблизительно 5 масс.% до приблизительно 0,1 масс.% скользящего вещества; и от приблизительно 7 масс.% до приблизительно 0,1 масс.% смазывающего вещества. Или порошковая фармацевтическая композиция содержит от приблизительно 5 масс.% до приблизительно 65 масс.% (например, от приблизительно 5 масс.% до приблизительно 25 масс.%, от приблизительно 15 масс.% до приблизительно 40 масс.% или от приблизительно 30 масс.% до приблизительно 50 масс.%) твердой дисперсии по массе композиции, содержащей от приблизительно 30 масс.% до приблизительно 90 масс.% аморфного Соединения 1, по массе дисперсии, и от приблизительно 70 масс.% до приблизительно 20 масс.% полимера, по массе дисперсии; от приблизительно 10 масс.% до приблизительно 90 масс.% одного или более наполнителей; от приблизительно 0,1 масс.% до приблизительно 5 масс.% подсластителя; от приблизительно 5 масс.% до приблизительно 0,1 масс.% скользящего вещества; и от приблизительно 7 масс.% до приблизительно 0,1 масс.% смазывающего вещества.
[00512] Другая, приводимая в качестве примера, фармацевтическая композиция содержит от приблизительно 5 масс.% до приблизительно 60 масс.% (например, от приблизительно 5 масс.% до приблизительно 55 масс.%, от приблизительно 15 масс.% до приблизительно 50 масс.% или от приблизительно 30 масс.% до приблизительно 50 масс.%) твердой дисперсии по массе композиции, содержащей от приблизительно 30 масс.% до приблизительно 90 масс.% по существу аморфного Соединения 1, по массе дисперсии, и от приблизительно 70 масс.% до приблизительно 10 масс.% полимера, по массе дисперсии; от приблизительно 10 масс.% до приблизительно 90 масс.% одного или более наполнителей; от приблизительно 0,1 масс.% до приблизительно 5 масс.% подсластителя, от приблизительно 7 масс.% до приблизительно 0,1 масс.% смазывающего вещества; и от приблизительно 5 масс.% до приблизительно 0,1 масс.% скользящего вещества. Или фармацевтическая композиция содержит от приблизительно 5 масс.% до приблизительно 55 масс.% (например, от приблизительно 5 масс.% до приблизительно 50 масс.%, от приблизительно 5 масс.% до приблизительно 45 масс.% или от приблизительно 5 масс.% до приблизительно 40 масс.%) твердой дисперсии по массе композиции, содержащей от приблизительно 30 масс.% до приблизительно 90 масс.% аморфного Соединения 1, по массе дисперсии, и от приблизительно 70 масс.% до приблизительно 10 масс.% полимера, по массе дисперсии; от приблизительно 10 масс.% до приблизительно 90 масс.% одного или более наполнителей; от приблизительно 5 масс.% до приблизительно 0,1 масс.% подсластителя; от приблизительно 5 масс.% до приблизительно 0,1 масс.% скользящего вещества; и от приблизительно 7 масс.% до приблизительно 0,1 масс.% смазывающего вещества.
[00513] Одна порошковая фармацевтическая композиция по настоящему изобретению содержит приблизительно 46,9 масс.% твердой дисперсии по массе композиции, где указанная дисперсия содержит приблизительно 80 масс.% по существу аморфного или аморфного Соединения 1 по массе дисперсии, приблизительно 19,5 масс.% HPMCAS по массе дисперсии и приблизительно 0,5 масс.% SLS по массе дисперсии; приблизительно 49,1 масс.% маннита по массе композиции; приблизительно 2 масс.% сукралозы по массе композиции; приблизительно 1 масс.% коллоидного диоксида кремния по массе композиции; и приблизительно 1,0 масс.% стеарата магния по массе композиции. Или порошковая фармацевтическая композиция по настоящему изобретению содержит приблизительно 15,6 масс.% твердой дисперсии по массе композиции, где указанная дисперсия содержит приблизительно 80 масс.% аморфного Соединения 1 по массе дисперсии, приблизительно 19,5 масс.% HPMCAS по массе дисперсии и приблизительно 0,5 масс.% SLS по массе дисперсии; приблизительно 80,4 масс.% маннита по массе композиции; приблизительно 2 масс.% сукралозы по массе композиции; приблизительно 1 масс.% коллоидного диоксида кремния по массе композиции; и приблизительно 1,0 масс.% стеарата магния по массе композиции.
[00514] Другая фармацевтическая композиция в форме порошка в соответствии с настоящим изобретением содержит приблизительно 24,6 масс.% твердой дисперсии по массе композиции, где указанная дисперсия содержит приблизительно 50 масс.% по существу аморфного или аморфного Соединения 1 по массе дисперсии, приблизительно 49,5 масс.% HPMCAS по массе дисперсии и приблизительно 0,5 масс.% SLS по массе дисперсии; приблизительно 71,4 масс.% маннита по массе композиции; приблизительно 2 масс.% сукралозы по массе композиции; приблизительно 1 масс.% коллоидного диоксида кремния по массе композиции; и приблизительно 1,0 масс.% стеарата магния по массе композиции. Или фармацевтическая композиция по настоящему изобретению содержит приблизительно 34 масс.% твердой дисперсии по массе композиции, где указанная дисперсия содержит приблизительно 72,4 масс.% по существу аморфного или аморфного Соединения 1 по массе дисперсии, приблизительно 27,1 масс.% HPMCAS по массе дисперсии и приблизительно 0,5 масс.% SLS по массе дисперсии; приблизительно 62 масс.% маннита по массе композиции; приблизительно 2 масс.% сукралозы по массе композиции; приблизительно 1 масс.% коллоидного диоксида кремния по массе композиции; и приблизительно 1,0 масс.% стеарата магния по массе композиции.
[00515] Другая фармацевтическая композиция в форме порошка в соответствии с настоящим изобретением содержит приблизительно 61,6 масс.% твердой дисперсии по массе композиции, где указанная дисперсия содержит приблизительно 80 масс.% по существу аморфного или аморфного Соединения 1 по массе дисперсии, приблизительно 19,5 масс.% HPMCAS по массе дисперсии и приблизительно 0,5 масс.% SLS по массе дисперсии; приблизительно 34,4 масс.% маннита по массе композиции; приблизительно 2 масс.% сукралозы по массе композиции; приблизительно 1 масс.% коллоидного диоксида кремния по массе композиции; приблизительно 1,0 масс.% стеарата магния по массе композиции. Или порошковая фармацевтическая композиция по настоящему изобретению содержит приблизительно 68,7 масс.% твердой дисперсии по массе композиции, где указанная дисперсия содержит приблизительно 80 масс.% по существу аморфного или аморфного Соединения 1 по массе дисперсии, приблизительно 19,5 масс.% HPMCAS по массе дисперсии и приблизительно 0,5 масс.% SLS по массе дисперсии; приблизительно 27,3 масс.% маннита по массе композиции; приблизительно 2 масс.% сукралозы по массе композиции; приблизительно 1 масс.% коллоидного диоксида кремния по массе композиции; приблизительно 1,0 масс.% стеарата магния по массе композиции. Необязательно, указанные выше фармацевтические композиции также могут включать приблизительно 0,4 масс.% красителя по массе композиции.
[00516] В одном аспекте настоящее изобретение относится к фармацевтической композиции, содержащей от приблизительно 30 масс.% до приблизительно 50 масс.% твердой дисперсии по массе композиции, где указанная дисперсия содержит приблизительно 80 масс.% по существу аморфного или аморфного Соединения 1 по массе дисперсии, приблизительно 19,5 масс.% HPMCAS по массе дисперсии и приблизительно 0,5 масс.% SLS по массе дисперсии; от приблизительно 30 масс.% до приблизительно 60 масс.% двухкомпонентного наполнителя, где двухкомпонентный наполнитель содержит от приблизительно 0 масс.% до приблизительно 60 масс.% маннита по массе композиции и от приблизительно 0 масс.% до приблизительно 60 масс.% лактозы по массе композиции; от приблизительно 1,5 масс.% до приблизительно 2,5 масс.% сукралозы по массе композиции; от приблизительно 4 масс.% до приблизительно 8 масс.% кроскармеллозы натрия по массе композиции; от приблизительно 0,5 масс.% до приблизительно 1,5 масс.% коллоидного диоксида кремния по массе композиции; и от приблизительно 1 масс.% до приблизительно 2 масс.% стеарата магния по массе композиции.
[00517] В одном варианте осуществления фармацевтическая композиция содержит приблизительно 35 масс.% твердой дисперсии по массе композиции, где указанная дисперсия содержит приблизительно 80 масс.% по существу аморфного или аморфного Соединения 1 по массе дисперсии, приблизительно 19,5 масс.% HPMCAS по массе дисперсии и приблизительно 0,5 масс.% SLS по массе дисперсии; приблизительно 13,5 масс.% маннита по массе композиции; приблизительно 41 масс.% лактозы по массе композиции; приблизительно 2 масс.% сукралозы по массе композиции; приблизительно 6 масс.% кроскармеллозы натрия по массе композиции; приблизительно 1 масс.% коллоидного диоксида кремния по массе композиции; и приблизительно 1,5 масс.% стеарата магния по массе композиции.
[00518] В других дополнительных вариантах осуществления фармацевтическая композиция содержит 1-200 мини-таблеток, (например, приблизительно 1-50 или приблизительно 25-35 мини-таблеток). Каждая мини-таблетка фармацевтической композиции содержит от приблизительно 20 масс.% до приблизительно 70 масс.% твердой дисперсии по массе композиции, где указанная дисперсия содержит от приблизительно 30 масс.% до приблизительно 85 масс.% по существу аморфного или аморфного Соединения 1 по массе дисперсии, от приблизительно 70 масс.% до приблизительно 14 масс.% HPMCAS по массе дисперсии и от приблизительно 0,45 масс.% до приблизительно 0,55 масс.% SLS по массе дисперсии; от приблизительно 22 масс.% до приблизительно 70 масс.% маннита по массе композиции; от приблизительно 0,1 масс.% до приблизительно 5 масс.% сукралозы по массе композиции; от приблизительно 1 масс.% до приблизительно 10 масс.% кроскармеллозы натрия по массе композиции; от приблизительно 0,01 масс.% до приблизительно 3 масс.% SLS по массе композиции; от приблизительно 0,1 масс.% до приблизительно 3 масс.% коллоидного диоксида кремния по массе композиции; и от приблизительно 0,1 масс.% до приблизительно 7 масс.% стеарата магния по массе композиции. В некоторых аспектах фармацевтическая композиция, например, мини-таблетка или множество мини-таблеток, заполняются в капсулу или пачку, где капсула или пачка содержит 5 мг Соединения 1. В других вариантах осуществления фармацевтическая композиция содержит 10 мг Соединения 1. В других вариантах осуществления фармацевтическая композиция содержит 12,5 мг Соединения 1. В других вариантах осуществления фармацевтическая композиция содержит 15 мг Соединения 1. В других вариантах осуществления фармацевтическая композиция содержит 20 мг Соединения 1. В других вариантах осуществления фармацевтическая композиция содержит 25 мг Соединения 1. В других вариантах осуществления фармацевтическая композиция содержит 30 мг Соединения 1. В других вариантах осуществления фармацевтическая композиция содержит 35 мг Соединения 1. В других вариантах осуществления фармацевтическая композиция содержит 37,5 мг Соединения 1. В других вариантах осуществления фармацевтическая композиция содержит 40 мг Соединения 1. В других вариантах осуществления фармацевтическая композиция содержит 45 мг Соединения 1. В других вариантах осуществления фармацевтическая композиция содержит 50 мг Соединения 1. В других вариантах осуществления фармацевтическая композиция содержит 62,5 мг Соединения 1. В других вариантах осуществления фармацевтическая композиция содержит 75 мг Соединения 1. В других вариантах осуществления фармацевтическая композиция содержит 100 мг Соединения 1. В других вариантах осуществления фармацевтическая композиция содержит 125 мг Соединения 1. В других вариантах осуществления фармацевтическая композиция содержит 150 мг Соединения 1. В других вариантах осуществления фармацевтическая композиция содержит 175 мг Соединения 1. В других вариантах осуществления фармацевтическая композиция содержит 200 мг Соединения 1. В других вариантах осуществления фармацевтическая композиция содержит 225 мг Соединения 1. В других вариантах осуществления фармацевтическая композиция содержит 250 мг Соединения 1.
[00519] В некоторых вариантах осуществления фармацевтическая композиция, содержащая мини-таблетку или множество мини-таблеток, заполняется в капсулы, флаконы или саше. В других вариантах осуществления фармацевтическая композиция, содержащая мини-таблетку или множество мини-таблеток, может находиться в пакетах, пачках, саше, флаконах или блистерных упаковках.
[00520] В некоторых вариантах осуществления указанный способ включает снижение тяжести кистозного фиброза у пациента, предусматривающий введение указанному пациенту одной из композиций, описанных в настоящем изобретении. В некоторых вариантах осуществления пациент имеет мутантные формы CFTR человека. В других вариантах осуществления пациент имеет одну или более из следующих мутаций: ΔF508, R117H и G551D в CFTR человека. В одном варианте осуществления указанный способ включает снижение тяжести кистозного фиброза у пациента, имеющего ΔF508 мутацию CFTR человека, предусматривающий введение указанному пациенту одной из композиций, описанных в настоящем изобретении. В одном варианте осуществления указанный способ включает снижение тяжести кистозного фиброза у пациента, имеющего G551D мутацию CFTR человека, предусматривающий введение указанному пациенту одной из композиций, описанных в настоящем изобретении. В одном варианте осуществления указанный способ включает снижение тяжести кистозного фиброза у пациента, имеющего R117H мутацию CFTR человека, предусматривающий введение указанному пациенту одной из композиций, описанных в настоящем изобретении. В одном варианте осуществления указанный способ включает снижение тяжести кистозного фиброза у пациента, имеющего ΔF508 мутацию CFTR человека по меньшей мере в одной аллели, предусматривающий введение указанному пациенту одной из композиций, описанных в настоящем изобретении. В одном варианте осуществления указанный способ включает снижение тяжести кистозного фиброза у пациента, имеющего ΔF508 мутацию CFTR человека в обеих аллелях, предусматривающий введение указанному пациенту одной из композиций, описанных в настоящем изобретении. В одном варианте осуществления указанный способ включает снижение тяжести кистозного фиброза у пациента, имеющего G551D мутацию CFTR человека по меньшей мере в одной аллели, предусматривающий введение указанному пациенту одной из композиций, описанных в настоящем изобретении. В одном варианте осуществления указанный способ включает снижение тяжести кистозного фиброза у пациента, имеющего G551D мутацию CFTR человека в обеих аллелях, предусматривающий введение указанному пациенту одной из композиций, описанных в настоящем изобретении. В одном варианте осуществления указанный способ включает снижение тяжести кистозного фиброза у пациента, имеющего R117H мутацию CFTR человека по меньшей мере в одной аллели, предусматривающий введение указанному пациенту одной из композиций, описанных в настоящем изобретении. В одном варианте осуществления указанный способ включает снижение тяжести кистозного фиброза у пациента, имеющего R117H мутацию CFTR человека в обеих аллелях, предусматривающий введение указанному пациенту одной из композиций, описанных в настоящем изобретении. В другом варианте осуществления указанный способ включает снижение тяжести кистозного фиброза у пациента, имеющего CFTR с остаточной функцией или фенотип остаточной функции, предусматривающий введение указанному пациенту одной из фармацевтических композиций, описанных в настоящей заявке. В одном варианте осуществления указанный способ включает в себя лечение или снижение тяжести кистозного фиброза у пациента, имеющего мутацию воротного механизма CFTR человека, предусматривающий введение указанному пациенту одной из фармацевтических композиций, описанных в настоящей заявке. В некоторых вариантах осуществления пациент имеет одну или более из следующих мутаций воротного механизма CFTR человека: G551D, G178R, G551S, G970R, G1244E, S1255P, G1349D, S549N, S549R и S1251N. В некоторых вариантах осуществления пациент имеет по меньшей мере одну из мутаций воротного механизма CFTR человека, в том числе, но не только, G551D, G178R, G551S, G970R, G1244E, S1255P, G1349D, S549N, S549R и S1251N. В одном варианте осуществления указанный способ включает в себя лечение или снижение тяжести кистозного фиброза у пациента, имеющего мутацию воротного механизма CFTR человека по меньшей мере в одной аллели, предусматривающий введение указанному пациенту одной из фармацевтических композиций, описанных в настоящей заявке. В одном варианте осуществления указанный способ включает в себя лечение или снижение тяжести кистозного фиброза у пациента, имеющего мутацию воротного механизма CFTR человека в обеих аллелях, предусматривающий введение указанному пациенту одной из фармацевтических композиций, описанных в настоящей заявке.
[00521] В некоторых вариантах осуществления указанный способ включает снижение тяжести кистозного фиброза у пациента, предусматривающий введение указанному пациенту фармацевтической композиции, содержащей порошкообразную смесь, где композиция порошкообразной смеси содержит приблизительно 46,9 масс.% твердой дисперсии по массе композиции, где указанная дисперсия содержит приблизительно 80 масс.% по существу аморфного или аморфного Соединения 1 по массе дисперсии, приблизительно 19,5 масс.% HPMCAS по массе дисперсии и приблизительно 0,5 масс.% SLS по массе дисперсии; приблизительно 49,1 масс.% маннита по массе композиции; приблизительно 2 масс.% сукралозы по массе композиции; приблизительно 1 масс.% коллоидного диоксида кремния по массе композиции; и приблизительно 1,5 масс.% стеарата магния по массе композиции.
[00522] В некоторых вариантах осуществления указанный способ предусматривает введение указанному пациенту фармацевтической композиции, содержащей от приблизительно 30 масс.% до приблизительно 50 масс.% твердой дисперсии по массе композиции, где указанная дисперсия содержит приблизительно 80 масс.% по существу аморфного или аморфного Соединения 1 по массе дисперсии, приблизительно 19,5 масс.% HPMCAS по массе дисперсии и приблизительно 0,5 масс.% SLS по массе дисперсии; от приблизительно 30 масс.% до приблизительно 60 масс.% двухкомпонентного наполнителя, где двухкомпонентный наполнитель содержит от приблизительно 0 масс.% до приблизительно 60 масс.% маннита по массе композиции и от приблизительно 0 масс.% до приблизительно 60 масс.% лактозы по массе композиции; от приблизительно 1,5 масс.% до приблизительно 2,5 масс.% сукралозы по массе композиции; от приблизительно 4 масс.% до приблизительно 8 масс.% кроскармеллозы натрия по массе композиции; от приблизительно 0,5 масс.% до приблизительно 1,5 масс.% коллоидного диоксида кремния по массе композиции; и от приблизительно 1 масс.% до приблизительно 2 масс.% стеарата магния по массе композиции.
[00523] В одном варианте осуществления фармацевтическая композиция содержит приблизительно 35 масс.% твердой дисперсии по массе композиции, где указанная дисперсия содержит приблизительно 80 масс.% по существу аморфного или аморфного Соединения 1 по массе дисперсии, приблизительно 19,5 масс.% HPMCAS по массе дисперсии и приблизительно 0,5 масс.% SLS по массе дисперсии; приблизительно 13,5 масс.% маннита по массе композиции; приблизительно 41 масс.% лактозы по массе композиции; приблизительно 2 масс.% сукралозы по массе композиции; приблизительно 6 масс.% кроскармеллозы натрия по массе композиции; приблизительно 1 масс.% коллоидного диоксида кремния по массе композиции; и приблизительно 1,5 масс.% стеарата магния по массе композиции.
[00524] В некоторых аспектах фармацевтическая композиция содержит 10 мг Соединения 1. В некоторых аспектах единичная доза, содержащая фармацевтическую композицию по настоящему изобретению, содержит 5 мг Соединения 1. В некоторых аспектах фармацевтическая композиция, например, мини-таблетка или множество мини-таблеток, заполняется в капсулу или пачку, где капсула или пачка содержит 5 мг Соединения 1. В других вариантах осуществления фармацевтическая композиция содержит 10 мг Соединения 1. В других вариантах осуществления фармацевтическая композиция содержит 12,5 мг Соединения 1. В других вариантах осуществления фармацевтическая композиция содержит 15 мг Соединения 1. В других вариантах осуществления фармацевтическая композиция содержит 20 мг Соединения 1. В других вариантах осуществления фармацевтическая композиция содержит 25 мг Соединения 1. В других вариантах осуществления фармацевтическая композиция содержит 30 мг Соединения 1. В других вариантах осуществления фармацевтическая композиция содержит 35 мг Соединения 1. В других вариантах осуществления фармацевтическая композиция содержит 37,5 мг Соединения 1. В других вариантах осуществления фармацевтическая композиция содержит 40 мг Соединения 1. В других вариантах осуществления фармацевтическая композиция содержит 45 мг Соединения 1. В других вариантах осуществления фармацевтическая композиция содержит 50 мг Соединения 1. В других вариантах осуществления фармацевтическая композиция содержит 62,5 мг Соединения 1. В других вариантах осуществления фармацевтическая композиция содержит 75 мг Соединения 1. В других вариантах осуществления фармацевтическая композиция содержит 100 мг Соединения 1. В других вариантах осуществления фармацевтическая композиция содержит 125 мг Соединения 1. В других вариантах осуществления фармацевтическая композиция содержит 150 мг Соединения 1. В других вариантах осуществления фармацевтическая композиция содержит 175 мг Соединения 1. В других вариантах осуществления фармацевтическая композиция содержит 200 мг Соединения 1. В других вариантах осуществления фармацевтическая композиция содержит 225 мг Соединения 1. В других вариантах осуществления фармацевтическая композиция содержит 250 мг Соединения 1.
[00525] В некоторых дополнительных аспектах фармацевтическая композиция содержит мини-таблетку или множество мини-таблеток. В некоторых вариантах осуществления указанный способ предусматривает снижение тяжести кистозного фиброза у пациента, включающий введение указанному пациенту фармацевтической композиции, содержащей мини-таблетку или множество мини-таблеток в интервале от 1 до 40 мини-таблеток, например, приблизительно 5, приблизительно 10, приблизительно 22, приблизительно 24, приблизительно 26, приблизительно 28, приблизительно 29, приблизительно 30, приблизительно 31, приблизительно 33, приблизительно 35, приблизительно 37 или приблизительно 39 мини-таблеток, где каждая из мини-таблеток в указанной композиции содержит приблизительно 46,9 масс.% твердой дисперсии по массе композиции, где указанная дисперсия содержит приблизительно 80 масс.% по существу аморфного или аморфного Соединения 1 по массе дисперсии, приблизительно 19,5 масс.% HPMCAS по массе дисперсии и приблизительно 0,5 масс.% SLS по массе дисперсии; приблизительно 45,1 масс.% маннита по массе композиции; приблизительно 2 масс.% сукралозы по массе композиции; приблизительно 3 масс.% кроскармеллозы натрия по массе композиции; приблизительно 0,5 масс.% SLS по массе композиции; приблизительно 1 масс.% коллоидного диоксида кремния по массе композиции; и приблизительно 1,5 масс.% стеарата магния по массе композиции.
[00526] В некоторых аспектах фармацевтическая композиция содержит 5 мг Соединения 1. В некоторых аспектах фармацевтическая композиция содержит 10 мг Соединения 1. В некоторых аспектах единичная доза, содержащая фармацевтическую композицию по настоящему изобретению, содержит 12,5 мг Соединения 1. В некоторых аспектах единичная доза, содержащая фармацевтическую композицию по настоящему изобретению, содержит 15 мг Соединения 1. В некоторых аспектах фармацевтическая композиция содержит 20 мг Соединения 1. В некоторых аспектах единичная доза, содержащая фармацевтическую композицию, содержит 25 мг Соединения 1. В некоторых аспектах фармацевтическая композиция содержит 30 мг Соединения 1. В некоторых аспектах фармацевтическая композиция содержит 35 мг Соединения 1. В некоторых аспектах фармацевтическая композиция содержит 37,5 мг Соединения 1. В некоторых аспектах фармацевтическая композиция содержит 40 мг Соединения 1. В некоторых аспектах фармацевтическая композиция содержит 45 мг Соединения 1. В некоторых аспектах единичная доза, содержащая фармацевтическую композицию, содержит 50 мг Соединения 1. В некоторых аспектах фармацевтическая композиция содержит 62,5 мг Соединения 1. В некоторых аспектах единичная доза, содержащая фармацевтическую композицию, содержит 75 мг Соединения 1. В других вариантах осуществления единичная доза, содержащая фармацевтическую композицию, содержит 100 мг Соединения 1. В некоторых аспектах фармацевтическая композиция содержит 125 мг Соединения 1. В других вариантах осуществления единичная доза, содержащая фармацевтическую композицию, содержит 150 мг по существу аморфного или аморфного Соединения 1. В некоторых аспектах фармацевтическая композиция содержит 175 мг Соединения 1. В некоторых аспектах фармацевтическая композиция содержит 200 мг Соединения 1. В некоторых аспектах фармацевтическая композиция содержит 225 мг Соединения 1. В некоторых аспектах фармацевтическая композиция содержит 250 мг Соединения 1.
[00527] В некоторых аспектах настоящее изобретение относится к способу лечения или снижения тяжести остеопороза у пациента, предусматривающему введение указанному пациенту Соединения 1 или его фармацевтически приемлемой соли.
[00528] В некоторых вариантах осуществления указанный способ лечения или снижения тяжести остеопороза у пациента предусматривает введение указанному пациенту по существу аморфного Соединения 1 или его фармацевтически приемлемой соли.
[00529] В других вариантах осуществления указанный способ лечения или снижения тяжести остеопороза у пациента предусматривает введение указанному пациенту аморфного Соединения 1 или его фармацевтически приемлемой соли.
[00530] В некоторых вариантах осуществления указанный способ лечения или снижения тяжести остеопороза у пациента предусматривает введение указанному пациенту фармацевтической композиции, содержащей мини-таблетку или множество мини-таблеток, как описано в настоящем изобретении.
[00531] В некоторых вариантах осуществления указанный способ включает снижение тяжести остеопороза у пациента, предусматривая введение указанному пациенту фармацевтической композиции, содержащей порошкообразную смесь, где композиция порошкообразной смеси содержит приблизительно 46,9 масс.% твердой дисперсии по массе композиции, где указанная дисперсия содержит приблизительно 80 масс.% по существу аморфного или аморфного Соединения 1 по массе дисперсии, приблизительно 19,5 масс.% HPMCAS по массе дисперсии и приблизительно 0,5 масс.% SLS по массе дисперсии; приблизительно 49,1 масс.% маннита по массе композиции; приблизительно 2 масс.% сукралозы по массе композиции; приблизительно 1 масс.% коллоидного диоксида кремния по массе композиции; и приблизительно 1,0 масс.% стеарата магния по массе композиции. В некоторых аспектах фармацевтическая композиция в виде порошкообразной смеси содержит 10 мг Соединения 1. В некоторых аспектах единичная доза, содержащая фармацевтическую композицию в виде порошкообразной смеси по настоящему изобретению, содержит 12,5 мг Соединения 1. В некоторых аспектах единичная доза, содержащая фармацевтическую композицию в виде порошкообразной смеси по настоящему изобретению, содержит 15 мг Соединения 1. В некоторых аспектах единичная доза, содержащая фармацевтическую композицию в виде порошкообразной смеси по настоящему изобретению, содержит 20 мг Соединения 1. В некоторых аспектах единичная доза, содержащая фармацевтическую композицию в виде порошкообразной смеси, содержит 25 мг Соединения 1. В некоторых аспектах единичная доза, содержащая фармацевтическую композицию в виде порошкообразной смеси по настоящему изобретению, содержит 30 мг Соединения 1. В некоторых аспектах единичная доза, содержащая фармацевтическую композицию в виде порошкообразной смеси по настоящему изобретению, содержит 35 мг Соединения 1. В некоторых аспектах единичная доза, содержащая фармацевтическую композицию в виде порошкообразной смеси по настоящему изобретению, содержит 40 мг Соединения 1. В некоторых аспектах единичная доза, содержащая фармацевтическую композицию в виде порошкообразной смеси по настоящему изобретению, содержит 45 мг Соединения 1. В некоторых аспектах единичная доза, содержащая фармацевтическую композицию в виде порошкообразной смеси, содержит 50 мг Соединения 1. В некоторых аспектах единичная доза, содержащая фармацевтическую композицию в виде порошкообразной смеси, содержит 75 мг Соединения 1. В других вариантах осуществления единичная доза, содержащая фармацевтическую композицию в виде порошкообразной смеси, содержит 100 мг Соединения 1. В других вариантах осуществления единичная доза, содержащая фармацевтическую композицию в виде порошкообразной смеси, содержит 150 мг по существу аморфного или аморфного Соединения 1.
[00532] В конкретных вариантах осуществления указанный способ лечения или снижения тяжести остеопороза у пациента предусматривает введение указанному пациенту фармацевтической композиции, содержащей мини-таблетку или множество мини-таблеток, где указанная композиция содержит от приблизительно 20 масс.% до приблизительно 70 масс.% твердой дисперсии по массе композиции, где указанная дисперсия содержит от приблизительно 30 масс.% до приблизительно 85 масс.% по существу аморфного или аморфного Соединения 1 по массе дисперсии, от приблизительно 70 масс.% до приблизительно 14 масс.% HPMCAS по массе дисперсии и от приблизительно 0,45 масс.% до приблизительно 0,55 масс.% SLS по массе дисперсии; от приблизительно 22 масс.% до приблизительно 70 масс.% маннита по массе композиции; от приблизительно 0,1 масс.% до приблизительно 5 масс.% сукралозы по массе композиции; от приблизительно 1 масс.% до приблизительно 8 масс.% кроскармеллозы натрия по массе композиции; от приблизительно 0,01 масс.% до приблизительно 3 масс.% SLS по массе композиции; от приблизительно 0,1 масс.% до приблизительно 3 масс.% коллоидного диоксида кремния по массе композиции; и от приблизительно 0,1 масс.% до приблизительно 7 масс.% стеарата магния по массе композиции. В некоторых аспектах фармацевтическая композиция, например, мини-таблетка или множество мини-таблеток, получена в виде капсулы или пачки, где капсула или пачка содержит 5 мг Соединения 1. В некоторых аспектах фармацевтическую композицию, например, мини-таблетку или множество мини-таблеток, получают в виде капсулы или пачки, где капсула или пачка содержит 10 мг Соединения 1. В некоторых аспектах фармацевтическую композицию, например, мини-таблетку или множество мини-таблеток, получают в виде капсулы или пачки, где капсула или пачка содержит 12,5 мг Соединения 1. В некоторых аспектах фармацевтическую композицию, например, мини-таблетку или множество мини-таблеток, получают в виде капсулы или пачки, где капсула или пачка содержит 15 мг Соединения 1. В других вариантах осуществления единичная доза, содержащая фармацевтическую композицию, содержит 20 мг Соединения 1. В других вариантах осуществления единичная доза, содержащая фармацевтическую композицию, содержит 25 мг Соединения 1. В других вариантах осуществления единичная доза, содержащая фармацевтическую композицию, содержит 30 мг Соединения 1. В других вариантах осуществления единичная доза, содержащая фармацевтическую композицию, содержит 35 мг Соединения 1. В других вариантах осуществления единичная доза, содержащая фармацевтическую композицию, содержит 40 мг Соединения 1. В других вариантах осуществления единичная доза, содержащая фармацевтическую композицию, содержит 45 мг Соединения 1. В других вариантах осуществления единичная доза, содержащая фармацевтическую композицию, содержит 50 мг Соединения 1. В других вариантах осуществления единичная доза, содержащая фармацевтическую композицию, содержит 75 мг Соединения 1. В других вариантах осуществления единичная доза, содержащая фармацевтическую композицию, содержит 100 мг Соединения 1. В других вариантах осуществления единичная доза, содержащая фармацевтическую композицию, содержит 150 мг Соединения 1.
[00533] В других вариантах осуществления указанный способ лечения или снижения тяжести остеопороза у пациента предусматривает введение пациенту фармацевтической композиции, содержащей от приблизительно 30 масс.% до приблизительно 50 масс.% твердой дисперсии по массе композиции, где указанная дисперсия содержит приблизительно 80 масс.% по существу аморфного или аморфного Соединения 1 по массе дисперсии, приблизительно 19,5 масс.% HPMCAS по массе дисперсии и приблизительно 0,5 масс.% SLS по массе дисперсии; от приблизительно 30 масс.% до приблизительно 60 масс.% двухкомпонентного наполнителя, где двухкомпонентный наполнитель содержит от приблизительно 0 масс.% до приблизительно 60 масс.% маннита по массе композиции и от приблизительно 0 масс.% до приблизительно 60 масс.% лактозы по массе композиции; от приблизительно 1,5 масс.% до приблизительно 2,5 масс.% сукралозы по массе композиции; от приблизительно 4 масс.% до приблизительно 8 масс.% кроскармеллозы натрия по массе композиции; от приблизительно 0,5 масс.% до приблизительно 1,5 масс.% коллоидного диоксида кремния по массе композиции; и от приблизительно 1 масс.% до приблизительно 2 масс.% стеарата магния по массе композиции.
[00534] В одном варианте осуществления фармацевтическая композиция содержит приблизительно 35 масс.% твердой дисперсии по массе композиции, где указанная дисперсия содержит приблизительно 80 масс.% по существу аморфного или аморфного Соединения 1 по массе дисперсии, приблизительно 19,5 масс.% HPMCAS по массе дисперсии и приблизительно 0,5 масс.% SLS по массе дисперсии; приблизительно 13,5 масс.% маннита по массе композиции; приблизительно 41 масс.% лактозы по массе композиции; приблизительно 2 масс.% сукралозы по массе композиции; приблизительно 6 масс.% кроскармеллозы натрия по массе композиции; приблизительно 1 масс.% коллоидного диоксида кремния по массе композиции; и приблизительно 1,5 масс.% стеарата магния по массе композиции.
[00535] В некоторых аспектах фармацевтическая композиция содержит 10 мг Соединения 1. В некоторых аспектах единичная доза, содержащая фармацевтическую композицию по настоящему изобретению, содержит 5 мг Соединения 1. В некоторых аспектах фармацевтическую композицию, например, мини-таблетку или множество мини-таблеток, помещают в капсулу или пачку, где капсула или пачка содержит 5 мг Соединения 1. В других вариантах осуществления фармацевтическая композиция содержит 10 мг Соединения 1. В других вариантах осуществления фармацевтическая композиция содержит 12,5 мг Соединения 1. В других вариантах осуществления фармацевтическая композиция содержит 15 мг Соединения 1. В других вариантах осуществления фармацевтическая композиция содержит 20 мг Соединения 1. В других вариантах осуществления фармацевтическая композиция содержит 25 мг Соединения 1. В других вариантах осуществления фармацевтическая композиция содержит 30 мг Соединения 1. В других вариантах осуществления фармацевтическая композиция содержит 35 мг Соединения 1. В других вариантах осуществления фармацевтическая композиция содержит 37,5 мг Соединения 1. В других вариантах осуществления фармацевтическая композиция содержит 40 мг Соединения 1. В других вариантах осуществления фармацевтическая композиция содержит 45 мг Соединения 1. В других вариантах осуществления фармацевтическая композиция содержит 50 мг Соединения 1. В других вариантах осуществления фармацевтическая композиция содержит 62,5 мг Соединения 1. В других вариантах осуществления фармацевтическая композиция содержит 75 мг Соединения 1. В других вариантах осуществления фармацевтическая композиция содержит 100 мг Соединения 1. В других вариантах осуществления фармацевтическая композиция содержит 125 мг Соединения 1. В других вариантах осуществления фармацевтическая композиция содержит 150 мг Соединения 1. В других вариантах осуществления фармацевтическая композиция содержит 175 мг Соединения 1. В других вариантах осуществления фармацевтическая композиция содержит 200 мг Соединения 1. В других вариантах осуществления фармацевтическая композиция содержит 225 мг Соединения 1. В других вариантах осуществления фармацевтическая композиция содержит 250 мг Соединения 1.
[00536] В некоторых аспектах настоящее изобретение относится к способу лечения или снижения тяжести остеопении у пациента, предусматривающему введение указанному пациенту Соединения 1 или его фармацевтически приемлемой соли.
[00537] В некоторых вариантах осуществления указанный способ лечения или снижения тяжести остеопении у пациента предусматривает введение указанному пациенту по существу аморфного Соединения 1 или его фармацевтически приемлемой соли.
[00538] В других вариантах осуществления указанный способ лечения или снижения тяжести остеопении у пациента предусматривает введение указанному пациенту аморфного Соединения 1.
[00539] В некоторых вариантах осуществления указанный способ лечения или снижения тяжести остеопении у пациента предусматривает введение указанному пациенту фармацевтической композиции, описанной в настоящем изобретении.
[00540] В конкретных вариантах осуществления указанный способ включает снижение тяжести остеопении у пациента, предусматривающий введение указанному пациенту фармацевтической композиции, содержащей порошкообразную смесь, где композиция порошкообразной смеси содержит приблизительно 46,9 масс.% твердой дисперсии по массе композиции, где указанная дисперсия содержит приблизительно 80 масс.% по существу аморфного или аморфного Соединения 1 по массе дисперсии, приблизительно 19,5 масс.% HPMCAS по массе дисперсии и приблизительно 0,5 масс.% SLS по массе дисперсии; приблизительно 49,1 масс.% маннита по массе композиции; приблизительно 2 масс.% сукралозы по массе композиции; приблизительно 1 масс.% коллоидного диоксида кремния по массе композиции; и приблизительно 1,0 масс.% стеарата магния по массе композиции. В некоторых аспектах фармацевтическая композиция в виде порошкообразной смеси содержит 5 мг Соединения 1. В некоторых аспектах фармацевтическая композиция в виде порошкообразной смеси содержит 10 мг Соединения 1. В некоторых аспектах фармацевтическая композиция в виде порошкообразной смеси содержит 12,5 мг Соединения 1. В некоторых аспектах единичная доза, содержащая фармацевтическую композицию в виде порошкообразной смеси по настоящему изобретению, содержит 15 мг Соединения 1. В некоторых аспектах единичная доза, содержащая фармацевтическую композицию в виде порошкообразной смеси по настоящему изобретению, содержит 20 мг Соединения 1. В некоторых аспектах единичная доза, содержащая фармацевтическую композицию в виде порошкообразной смеси, содержит 25 мг Соединения 1. В некоторых аспектах единичная доза, содержащая фармацевтическую композицию в виде порошкообразной смеси по настоящему изобретению, содержит 30 мг Соединения 1. В некоторых аспектах единичная доза, содержащая фармацевтическую композицию в виде порошкообразной смеси по настоящему изобретению, содержит 35 мг Соединения 1. В некоторых аспектах единичная доза, содержащая фармацевтическую композицию в виде порошкообразной смеси по настоящему изобретению, содержит 40 мг Соединения 1. В некоторых аспектах единичная доза, содержащая фармацевтическую композицию в виде порошкообразной смеси по настоящему изобретению, содержит 45 мг Соединения 1. В некоторых аспектах единичная доза, содержащая фармацевтическую композицию в виде порошкообразной смеси, содержит 50 мг Соединения 1. В некоторых аспектах единичная доза, содержащая фармацевтическую композицию в виде порошкообразной смеси, содержит 75 мг Соединения 1. В других вариантах осуществления единичная доза, содержащая фармацевтическую композицию в виде порошкообразной смеси, содержит 100 мг Соединения 1. В других вариантах осуществления единичная доза, содержащая фармацевтическую композицию в виде порошкообразной смеси, содержит 150 мг по существу аморфного или аморфного Соединения 1.
[00541] В конкретных вариантах осуществления указанный способ лечения или снижения тяжести остеопении у пациента предусматривает введение указанному пациенту фармацевтической композиции, содержащей мини-таблетку или множество мини-таблеток, где указанная композиция содержит от приблизительно 20 масс.% до приблизительно 70 масс.% твердой дисперсии по массе композиции, где указанная дисперсия содержит от приблизительно 30 масс.% до приблизительно 85 масс.% по существу аморфного или аморфного Соединения 1 по массе дисперсии, от приблизительно 70 масс.% до приблизительно 14 масс.% HPMCAS по массе дисперсии, и от приблизительно 0,45 масс.% до приблизительно 0,55 масс.% SLS по массе дисперсии; от приблизительно 22 масс.% до приблизительно 70 масс.% маннита по массе композиции; от приблизительно 0,1 масс.% до приблизительно 5 масс.% сукралозы по массе композиции; от приблизительно 1 масс.% до приблизительно 8 масс.% кроскармеллозы натрия по массе композиции; от приблизительно 0,01 масс.% до приблизительно 3 масс.% SLS по массе композиции; от приблизительно 0,1 масс.% до приблизительно 3 масс.% коллоидного диоксида кремния по массе композиции; и от приблизительно 0,1 масс.% до приблизительно 7 масс.% стеарата магния по массе композиции. В некоторых аспектах фармацевтическую композицию, например, мини-таблетку или множество мини-таблеток, получают в виде капсулы или пачки, где капсула или пачка содержит 5 мг Соединения 1. В других вариантах осуществления фармацевтическая композиция содержит 10 мг Соединения 1. В других вариантах осуществления фармацевтическая композиция содержит 12,5 мг Соединения 1. В других вариантах осуществления фармацевтическая композиция содержит 15 мг Соединения 1. В других вариантах осуществления фармацевтическая композиция содержит 20 мг Соединения 1. В других вариантах осуществления фармацевтическая композиция содержит 25 мг Соединения 1. В других вариантах осуществления фармацевтическая композиция содержит 30 мг Соединения 1. В других вариантах осуществления фармацевтическая композиция содержит 35 мг Соединения 1. В других вариантах осуществления фармацевтическая композиция содержит 40 мг Соединения 1. В других вариантах осуществления фармацевтическая композиция содержит 45 мг Соединения 1. В других вариантах осуществления фармацевтическая композиция содержит 50 мг Соединения 1. В других вариантах осуществления фармацевтическая композиция содержит 75 мг Соединения 1. В других вариантах осуществления фармацевтическая композиция содержит 100 мг Соединения 1. В других вариантах осуществления фармацевтическая композиция содержит 150 мг Соединения 1. В некоторых дополнительных аспектах фармацевтическая композиция содержит одну или более мини-таблеток.
[00542] В конкретных вариантах осуществления указанный способ лечения или снижения тяжести остеопении у пациента предусматривает введение указанному пациенту фармацевтической композиции, содержащей от приблизительно 30 масс.% до приблизительно 50 масс.% твердой дисперсии по массе композиции, где указанная дисперсия содержит приблизительно 80 масс.% по существу аморфного или аморфного Соединения 1 по массе дисперсии, приблизительно 19,5 масс.% HPMCAS по массе дисперсии и приблизительно 0,5 масс.% SLS по массе дисперсии; от приблизительно 30 масс.% до приблизительно 60 масс.% двухкомпонентного наполнителя, где двухкомпонентный наполнитель содержит от приблизительно 0 масс.% до приблизительно 60 масс.% маннита по массе композиции и от приблизительно 0 масс.% до приблизительно 60 масс.% лактозы по массе композиции; от приблизительно 1,5 масс.% до приблизительно 2,5 масс.% сукралозы по массе композиции; от приблизительно 4 масс.% до приблизительно 8 масс.% кроскармеллозы натрия по массе композиции; от приблизительно 0,5 масс.% до приблизительно 1,5 масс.% коллоидного диоксида кремния по массе композиции; и от приблизительно 1 масс.% до приблизительно 2 масс.% стеарата магния по массе композиции.
[00543] В одном варианте осуществления фармацевтическая композиция содержит приблизительно 35 масс.% твердой дисперсии по массе композиции, где указанная дисперсия содержит приблизительно 80 масс.% по существу аморфного или аморфного Соединения 1 по массе дисперсии, приблизительно 19,5 масс.% HPMCAS по массе дисперсии и приблизительно 0,5 масс.% SLS по массе дисперсии; приблизительно 13,5 масс.% маннита по массе композиции; приблизительно 41 масс.% лактозы по массе композиции; приблизительно 2 масс.% сукралозы по массе композиции; приблизительно 6 масс.% кроскармеллозы натрия по массе композиции; приблизительно 1 масс.% коллоидного диоксида кремния по массе композиции; и приблизительно 1,5 масс.% стеарата магния по массе композиции.
[00544] В некоторых аспектах фармацевтическая композиция содержит 10 мг Соединения 1. В некоторых аспектах единичная доза, содержащая фармацевтическую композицию по настоящему изобретению, содержит 5 мг Соединения 1. В некоторых аспектах фармацевтическую композицию, например, мини-таблетку или множество мини-таблеток, помещают в капсулу или пачку, где капсула или пачка содержит 5 мг Соединения 1. В других вариантах осуществления фармацевтическая композиция содержит 10 мг Соединения 1. В других вариантах осуществления фармацевтическая композиция содержит 12,5 мг Соединения 1. В других вариантах осуществления фармацевтическая композиция содержит 15 мг Соединения 1. В других вариантах осуществления фармацевтическая композиция содержит 20 мг Соединения 1. В других вариантах осуществления фармацевтическая композиция содержит 25 мг Соединения 1. В других вариантах осуществления фармацевтическая композиция содержит 30 мг Соединения 1. В других вариантах осуществления фармацевтическая композиция содержит 35 мг Соединения 1. В других вариантах осуществления фармацевтическая композиция содержит 37,5 мг Соединения 1. В других вариантах осуществления фармацевтическая композиция содержит 40 мг Соединения 1. В других вариантах осуществления фармацевтическая композиция содержит 45 мг Соединения 1. В других вариантах осуществления фармацевтическая композиция содержит 50 мг Соединения 1. В других вариантах осуществления фармацевтическая композиция содержит 62,5 мг Соединения 1. В других вариантах осуществления фармацевтическая композиция содержит 75 мг Соединения 1. В других вариантах осуществления фармацевтическая композиция содержит 100 мг Соединения 1. В других вариантах осуществления фармацевтическая композиция содержит 125 мг Соединения 1. В других вариантах осуществления фармацевтическая композиция содержит 150 мг Соединения 1. В других вариантах осуществления фармацевтическая композиция содержит 175 мг Соединения 1. В других вариантах осуществления фармацевтическая композиция содержит 200 мг Соединения 1. В других вариантах осуществления фармацевтическая композиция содержит 225 мг Соединения 1. В других вариантах осуществления фармацевтическая композиция содержит 250 мг Соединения 1.
[00545] В некоторых аспектах настоящее изобретение относится к способу сращивания кости и/или репарации костной ткани у пациента, предусматривающему введение указанному пациенту Соединения 1 или его фармацевтически приемлемой соли.
[00546] В некоторых вариантах осуществления способ сращивания кости и/или репарации костной ткани у пациента предусматривает введение указанному пациенту по существу аморфного Соединения 1 или его фармацевтически приемлемой соли.
[00547] В других вариантах осуществления способ сращивания кости и/или репарации костной ткани у пациента предусматривает введение указанному пациенту аморфного Соединения 1 или его фармацевтически приемлемой соли.
[00548] В некоторых вариантах осуществления способ сращивания кости и/или репарации костной ткани у пациента предусматривает введение указанному пациенту фармацевтической композиции, описанной в настоящем изобретении.
[00549] В некоторых вариантах осуществления способ сращивания кости и/или репарации костной ткани у пациента предусматривает введение указанному пациенту фармацевтической композиции, содержащей порошкообразную смесь, где композиция порошкообразной смеси содержит приблизительно 46,9 масс.% твердой дисперсии по массе композиции, где указанная дисперсия содержит приблизительно 80 масс.% по существу аморфного или аморфного Соединения 1 по массе дисперсии, приблизительно 19,5 масс.% HPMCAS по массе дисперсии и приблизительно 0,5 масс.% SLS по массе дисперсии; приблизительно 49,1 масс.% маннита по массе композиции; приблизительно 2 масс.% сукралозы по массе композиции; приблизительно 1 масс.% коллоидного диоксида кремния по массе композиции; и приблизительно 1,0 масс.% стеарата магния по массе композиции. В некоторых аспектах фармацевтическая композиция в виде порошкообразной смеси содержит 5 мг Соединения 1. В некоторых аспектах фармацевтическая композиция в виде порошкообразной смеси содержит 10 мг Соединения 1. В некоторых аспектах единичная доза, содержащая фармацевтическую композицию в виде порошкообразной смеси по настоящему изобретению, содержит 12,5 мг Соединения 1. В некоторых аспектах единичная доза, содержащая фармацевтическую композицию в виде порошкообразной смеси по настоящему изобретению, содержит 15 мг Соединения 1. В некоторых аспектах единичная доза, содержащая фармацевтическую композицию в виде порошкообразной смеси по настоящему изобретению, содержит 20 мг Соединения 1. В некоторых аспектах единичная доза, содержащая фармацевтическую композицию в виде порошкообразной смеси, содержит 25 мг Соединения 1. В некоторых аспектах единичная доза, содержащая фармацевтическую композицию в виде порошкообразной смеси по настоящему изобретению, содержит 30 мг Соединения 1. В некоторых аспектах единичная доза, содержащая фармацевтическую композицию в виде порошкообразной смеси по настоящему изобретению, содержит 35 мг Соединения 1. В некоторых аспектах единичная доза, содержащая фармацевтическую композицию в виде порошкообразной смеси по настоящему изобретению, содержит 40 мг Соединения 1. В некоторых аспектах единичная доза, содержащая фармацевтическую композицию в виде порошкообразной смеси по настоящему изобретению, содержит 45 мг Соединения 1. В некоторых аспектах единичная доза, содержащая фармацевтическую композицию в виде порошкообразной смеси, содержит 50 мг Соединения 1. В некоторых аспектах единичная доза, содержащая фармацевтическую композицию в виде порошкообразной смеси, содержит 75 мг Соединения 1. В других вариантах осуществления единичная доза, содержащая фармацевтическую композицию в виде порошкообразной смеси, содержит 100 мг Соединения 1. В других вариантах осуществления единичная доза, содержащая фармацевтическую композицию в виде порошкообразной смеси, содержит 150 мг по существу аморфного или аморфного Соединения 1.
[00550] В конкретных вариантах осуществления способ сращивания кости и/или репарации костной ткани у пациента предусматривает введение указанному пациенту фармацевтической композиции, содержащей мини-таблетку или множество мини-таблеток, где указанная композиция содержит от приблизительно 20 масс.% до приблизительно 70 масс.% твердой дисперсии по массе композиции, где указанная дисперсия содержит от приблизительно 30 масс.% до приблизительно 85 масс.% по существу аморфного или аморфного Соединения 1 по массе дисперсии, от приблизительно 70 масс.% до приблизительно 14 масс.% HPMCAS по массе дисперсии и от приблизительно 0,45 масс.% до приблизительно 0,55 масс.% SLS по массе дисперсии; от приблизительно 22 масс.% до приблизительно 70 масс.% маннита по массе композиции; от приблизительно 0,1 масс.% до приблизительно 5 масс.% сукралозы по массе композиции; от приблизительно 1 масс.% до приблизительно 8 масс.% кроскармеллозы натрия по массе композиции; от приблизительно 0,01 масс.% до приблизительно 3 масс.% SLS по массе композиции; от приблизительно 0,1 масс.% до приблизительно 3 масс.% коллоидного диоксида кремния по массе композиции; и от приблизительно 0,1 масс.% до приблизительно 7 масс.% стеарата магния по массе композиции. В некоторых аспектах фармацевтическую композицию, например, мини-таблетку или множество мини-таблеток, получают в виде капсулы или пачки, где капсула или пачка содержит 5 мг Соединения 1. В других вариантах осуществления фармацевтическая композиция содержит 10 мг Соединения 1. В других вариантах осуществления фармацевтическая композиция содержит 12,5 мг Соединения 1. В других вариантах осуществления фармацевтическая композиция содержит 15 мг Соединения 1. В других вариантах осуществления фармацевтическая композиция содержит 20 мг Соединения 1. В других вариантах осуществления фармацевтическая композиция содержит 25 мг Соединения 1. В других вариантах осуществления фармацевтическая композиция содержит 30 мг Соединения 1. В других вариантах осуществления фармацевтическая композиция содержит 35 мг Соединения 1. В других вариантах осуществления фармацевтическая композиция содержит 40 мг Соединения 1. В других вариантах осуществления фармацевтическая композиция содержит 45 мг Соединения 1. В других вариантах осуществления фармацевтическая композиция содержит 50 мг Соединения 1. В других вариантах осуществления фармацевтическая композиция содержит 75 мг Соединения 1. В других вариантах осуществления фармацевтическая композиция содержит 100 мг Соединения 1. В других вариантах осуществления фармацевтическая композиция содержит 150 мг Соединения 1.
[00551] В конкретных вариантах осуществления способ сращивания кости и/или репарации костной ткани у пациента предусматривает введение указанному пациенту фармацевтической композиции, содержащей от приблизительно 30 масс.% до приблизительно 50 масс.% твердой дисперсии по массе композиции, где указанная дисперсия содержит приблизительно 80 масс.% по существу аморфного или аморфного Соединения 1 по массе дисперсии, приблизительно 19,5 масс.% HPMCAS по массе дисперсии и приблизительно 0,5 масс.% SLS по массе дисперсии; от приблизительно 30 масс.% до приблизительно 60 масс.% двухкомпонентного наполнителя, где двухкомпонентный наполнитель содержит от приблизительно 0 масс.% до приблизительно 60 масс.% маннита по массе композиции и от приблизительно 0 масс.% до приблизительно 60 масс.% лактозы по массе композиции; от приблизительно 1,5 масс.% до приблизительно 2,5 масс.% сукралозы по массе композиции; от приблизительно 4 масс.% до приблизительно 8 масс.% кроскармеллозы натрия по массе композиции; от приблизительно 0,5 масс.% до приблизительно 1,5 масс.% коллоидного диоксида кремния по массе композиции; и от приблизительно 1 масс.% до приблизительно 2 масс.% стеарата магния по массе композиции.
[00552] В одном варианте осуществления фармацевтическая композиция содержит приблизительно 35 масс.% твердой дисперсии по массе композиции, где указанная дисперсия содержит приблизительно 80 масс.% по существу аморфного или аморфного Соединения 1 по массе дисперсии, приблизительно 19,5 масс.% HPMCAS по массе дисперсии и приблизительно 0,5 масс.% SLS по массе дисперсии; приблизительно 13,5 масс.% маннита по массе композиции; приблизительно 41 масс.% лактозы по массе композиции; приблизительно 2 масс.% сукралозы по массе композиции; приблизительно 6 масс.% кроскармеллозы натрия по массе композиции; приблизительно 1 масс.% коллоидного диоксида кремния по массе композиции; и приблизительно 1,5 масс.% стеарата магния по массе композиции.
[00553] В некоторых аспектах фармацевтическая композиция содержит 10 мг Соединения 1. В некоторых аспектах единичная доза, содержащая фармацевтическую композицию по настоящему изобретению, содержит 5 мг Соединения 1. В некоторых аспектах фармацевтическую композицию, например, мини-таблетку или множество мини-таблеток, помещают в капсулу или пачку, где капсула или пачка содержит 5 мг Соединения 1. В других вариантах осуществления фармацевтическая композиция содержит 10 мг Соединения 1. В других вариантах осуществления фармацевтическая композиция содержит 12,5 мг Соединения 1. В других вариантах осуществления фармацевтическая композиция содержит 15 мг Соединения 1. В других вариантах осуществления фармацевтическая композиция содержит 20 мг Соединения 1. В других вариантах осуществления фармацевтическая композиция содержит 25 мг Соединения 1. В других вариантах осуществления фармацевтическая композиция содержит 30 мг Соединения 1. В других вариантах осуществления фармацевтическая композиция содержит 35 мг Соединения 1. В других вариантах осуществления фармацевтическая композиция содержит 37,5 мг Соединения 1. В других вариантах осуществления фармацевтическая композиция содержит 40 мг Соединения 1. В других вариантах осуществления фармацевтическая композиция содержит 45 мг Соединения 1. В других вариантах осуществления фармацевтическая композиция содержит 50 мг Соединения 1. В других вариантах осуществления фармацевтическая композиция содержит 62,5 мг Соединения 1. В других вариантах осуществления фармацевтическая композиция содержит 75 мг Соединения 1. В других вариантах осуществления фармацевтическая композиция содержит 100 мг Соединения 1. В других вариантах осуществления фармацевтическая композиция содержит 125 мг Соединения 1. В других вариантах осуществления фармацевтическая композиция содержит 150 мг Соединения 1. В других вариантах осуществления фармацевтическая композиция содержит 175 мг Соединения 1. В других вариантах осуществления фармацевтическая композиция содержит 200 мг Соединения 1. В других вариантах осуществления фармацевтическая композиция содержит 225 мг Соединения 1. В других вариантах осуществления фармацевтическая композиция содержит 250 мг Соединения 1.
[00554] В некоторых аспектах настоящее изобретение относится к способу снижения резорбции костной ткани у пациента, предусматривающему введение указанному пациенту Соединения 1 или его фармацевтически приемлемой соли.
[00555] В некоторых вариантах осуществления указанный способ снижения резорбции костной ткани у пациента предусматривает введение указанному пациенту по существу аморфного Соединения 1 или его фармацевтически приемлемой соли.
[00556] В других вариантах осуществления указанный способ снижения резорбции костной ткани у пациента предусматривает введение указанному пациенту аморфного Соединения 1 или его фармацевтически приемлемой соли.
[00557] В некоторых вариантах осуществления указанный способ снижения резорбции костной ткани у пациента предусматривает введение указанному пациенту фармацевтической композиции, описанной в настоящей заявке.
[00558] В некоторых вариантах осуществления указанный способ снижения резорбции костной ткани у пациента предусматривает введение указанному пациенту фармацевтической композиции, содержащей порошкообразную смесь, где композиция порошкообразной смеси содержит приблизительно 46,9 масс.% твердой дисперсии по массе композиции, где указанная дисперсия содержит приблизительно 80 масс.% по существу аморфного или аморфного Соединения 1 по массе дисперсии, приблизительно 19,5 масс.% HPMCAS по массе дисперсии и приблизительно 0,5 масс.% SLS по массе дисперсии; приблизительно 49,1 масс.% маннита по массе композиции; приблизительно 2 масс.% сукралозы по массе композиции; приблизительно 1 масс.% коллоидного диоксида кремния по массе композиции; и приблизительно 1,0 масс.% стеарата магния по массе композиции. В некоторых аспектах фармацевтическая композиция в виде порошкообразной смеси содержит 5 мг Соединения 1. В некоторых аспектах фармацевтическая композиция в виде порошкообразной смеси содержит 10 мг Соединения 1. В некоторых аспектах единичная доза, содержащая фармацевтическую композицию в виде порошкообразной смеси по настоящему изобретению, содержит 12,5 мг Соединения 1. В некоторых аспектах единичная доза, содержащая фармацевтическую композицию в виде порошкообразной смеси по настоящему изобретению, содержит 15 мг Соединения 1. В некоторых аспектах единичная доза, содержащая фармацевтическую композицию в виде порошкообразной смеси по настоящему изобретению, содержит 20 мг Соединения 1. В некоторых аспектах единичная доза, содержащая фармацевтическую композицию в виде порошкообразной смеси, содержит 25 мг Соединения 1. В некоторых аспектах единичная доза, содержащая фармацевтическую композицию в виде порошкообразной смеси по настоящему изобретению, содержит 30 мг Соединения 1. В некоторых аспектах единичная доза, содержащая фармацевтическую композицию в виде порошкообразной смеси по настоящему изобретению, содержит 35 мг Соединения 1. В некоторых аспектах единичная доза, содержащая фармацевтическую композицию в виде порошкообразной смеси по настоящему изобретению, содержит 40 мг Соединения 1. В некоторых аспектах единичная доза, содержащая фармацевтическую композицию в виде порошкообразной смеси по настоящему изобретению, содержит 45 мг Соединения 1. В некоторых аспектах единичная доза, содержащая фармацевтическую композицию в виде порошкообразной смеси, содержит 50 мг Соединения 1. В некоторых аспектах единичная доза, содержащая фармацевтическую композицию в виде порошкообразной смеси, содержит 75 мг Соединения 1. В других вариантах осуществления единичная доза, содержащая фармацевтическую композицию в виде порошкообразной смеси, содержит 100 мг Соединения 1. В других вариантах осуществления единичная доза, содержащая фармацевтическую композицию в виде порошкообразной смеси, содержит 150 мг по существу аморфного или аморфного Соединения 1.
[00559] В конкретных вариантах осуществления указанный способ снижения резорбции костной ткани у пациента предусматривает введение указанному пациенту фармацевтической композиции, содержащей мини-таблетку или множество мини-таблеток, где указанная композиция содержит от приблизительно 20 масс.% до приблизительно 70 масс.% твердой дисперсии по массе композиции, где указанная дисперсия содержит от приблизительно 30 масс.% до приблизительно 85 масс.% по существу аморфного или аморфного Соединения 1 по массе дисперсии, от приблизительно 70 масс.% до приблизительно 14 масс.% HPMCAS по массе дисперсии и от приблизительно 0,45 масс.% до приблизительно 0,55 масс.% SLS по массе дисперсии; от приблизительно 22 масс.% до приблизительно 70 масс.% маннита по массе композиции; от приблизительно 0,1 масс.% до приблизительно 5 масс.% сукралозы по массе композиции; от приблизительно 1 масс.% до приблизительно 8 масс.% кроскармеллозы натрия по массе композиции; от приблизительно 0,01 масс.% до приблизительно 3 масс.% SLS по массе композиции; от приблизительно 0,1 масс.% до приблизительно 3 масс.% коллоидного диоксида кремния по массе композиции; и от приблизительно 0,1 масс.% до приблизительно 7 масс.% стеарата магния по массе композиции. В некоторых аспектах фармацевтическую композицию, например, мини-таблетку или множество мини-таблеток, получают в виде капсулы или пачки, где капсула или пачка содержит 5 мг Соединения 1. В других вариантах осуществления фармацевтическая композиция содержит 10 мг Соединения 1. В других вариантах осуществления фармацевтическая композиция содержит 12,5 мг Соединения 1. В других вариантах осуществления фармацевтическая композиция содержит 15 мг Соединения 1. В других вариантах осуществления фармацевтическая композиция содержит 25 мг Соединения 1. В других вариантах осуществления фармацевтическая композиция содержит 30 мг Соединения 1. В других вариантах осуществления фармацевтическая композиция содержит 35 мг Соединения 1. В других вариантах осуществления фармацевтическая композиция содержит 40 мг Соединения 1. В других вариантах осуществления фармацевтическая композиция содержит 45 мг Соединения 1. В других вариантах осуществления фармацевтическая композиция содержит 50 мг Соединения 1. В других вариантах осуществления фармацевтическая композиция содержит 75 мг Соединения 1. В других вариантах осуществления фармацевтическая композиция содержит 100 мг Соединения 1. В других вариантах осуществления фармацевтическая композиция содержит 150 мг Соединения 1.
[00560] В некоторых вариантах осуществления указанный способ снижения резорбции костной ткани у пациента предусматривает введение указанному пациенту фармацевтической композиции, содержащей от приблизительно 30 масс.% до приблизительно 50 масс.% твердой дисперсии по массе композиции, где указанная дисперсия содержит приблизительно 80 масс.% по существу аморфного или аморфного Соединения 1 по массе дисперсии, приблизительно 19,5 масс.% HPMCAS по массе дисперсии и приблизительно 0,5 масс.% SLS по массе дисперсии; от приблизительно 30 масс.% до приблизительно 60 масс.% двухкомпонентного наполнителя, где двухкомпонентный наполнитель содержит от приблизительно 0 масс.% до приблизительно 60 масс.% маннита по массе композиции и от приблизительно 0 масс.% до приблизительно 60 масс.% лактозы по массе композиции; от приблизительно 1,5 масс.% до приблизительно 2,5 масс.% сукралозы по массе композиции; от приблизительно 4 масс.% до приблизительно 8 масс.% кроскармеллозы натрия по массе композиции; от приблизительно 0,5 масс.% до приблизительно 1,5 масс.% коллоидного диоксида кремния по массе композиции; и от приблизительно 1 масс.% до приблизительно 2 масс.% стеарата магния по массе композиции.
[00561] В одном варианте осуществления фармацевтическая композиция содержит приблизительно 35 масс.% твердой дисперсии по массе композиции, где указанная дисперсия содержит приблизительно 80 масс.% по существу аморфного или аморфного Соединения 1 по массе дисперсии, приблизительно 19,5 масс.% HPMCAS по массе дисперсии и приблизительно 0,5 масс.% SLS по массе дисперсии; приблизительно 13,5 масс.% маннита по массе композиции; приблизительно 41 масс.% лактозы по массе композиции; приблизительно 2 масс.% сукралозы по массе композиции; приблизительно 6 масс.% кроскармеллозы натрия по массе композиции; приблизительно 1 масс.% коллоидного диоксида кремния по массе композиции; и приблизительно 1,5 масс.% стеарата магния по массе композиции.
[00562] В некоторых аспектах фармацевтическая композиция содержит 10 мг Соединения 1. В некоторых аспектах единичная доза, содержащая фармацевтическую композицию по настоящему изобретению, содержит 5 мг Соединения 1. В некоторых аспектах фармацевтическую композицию, например, мини-таблетку или множество мини-таблеток, помещают в капсулу или пачку, где капсула или пачка содержит 5 мг Соединения 1. В других вариантах осуществления фармацевтическая композиция содержит 10 мг Соединения 1. В других вариантах осуществления фармацевтическая композиция содержит 12,5 мг Соединения 1. В других вариантах осуществления фармацевтическая композиция содержит 15 мг Соединения 1. В других вариантах осуществления фармацевтическая композиция содержит 20 мг Соединения 1. В других вариантах осуществления фармацевтическая композиция содержит 25 мг Соединения 1. В других вариантах осуществления фармацевтическая композиция содержит 30 мг Соединения 1. В других вариантах осуществления фармацевтическая композиция содержит 35 мг Соединения 1. В других вариантах осуществления фармацевтическая композиция содержит 37,5 мг Соединения 1. В других вариантах осуществления фармацевтическая композиция содержит 40 мг Соединения 1. В других вариантах осуществления фармацевтическая композиция содержит 45 мг Соединения 1. В других вариантах осуществления фармацевтическая композиция содержит 50 мг Соединения 1. В других вариантах осуществления фармацевтическая композиция содержит 62,5 мг Соединения 1. В других вариантах осуществления фармацевтическая композиция содержит 75 мг Соединения 1. В других вариантах осуществления фармацевтическая композиция содержит 100 мг Соединения 1. В других вариантах осуществления фармацевтическая композиция содержит 125 мг Соединения 1. В других вариантах осуществления фармацевтическая композиция содержит 150 мг Соединения 1. В других вариантах осуществления фармацевтическая композиция содержит 175 мг Соединения 1. В других вариантах осуществления фармацевтическая композиция содержит 200 мг Соединения 1. В других вариантах осуществления фармацевтическая композиция содержит 225 мг Соединения 1. В других вариантах осуществления фармацевтическая композиция содержит 250 мг Соединения 1.
[00563] В некоторых аспектах настоящее изобретение относится к способу увеличения массы и объема костной ткани у пациента, предусматривающему введение указанному пациенту Соединения 1 или его фармацевтически приемлемой соли.
[00564] В некоторых вариантах осуществления указанный способ увеличения массы и объема костной ткани у пациента предусматривает введение указанному пациенту по существу аморфного Соединения 1 или его фармацевтически приемлемой соли.
[00565] В других вариантах осуществления указанный способ увеличения массы и объема костной ткани у пациента предусматривает введение указанному пациенту аморфного Соединения 1 или его фармацевтически приемлемой соли.
[00566] В некоторых вариантах осуществления указанный способ увеличения массы и объема костной ткани у пациента предусматривает введение указанному пациенту фармацевтической композиции, описанной в настоящей заявке.
[00567] В некоторых вариантах осуществления указанный способ увеличения массы и объема костной ткани у пациента предусматривает введение указанному пациенту фармацевтической композиции, содержащей порошкообразную смесь, где композиция порошкообразной смеси содержит приблизительно 46,9 масс.% твердой дисперсии по массе композиции, где указанная дисперсия содержит приблизительно 80 масс.% по существу аморфного или аморфного Соединения 1 по массе дисперсии, приблизительно 19,5 масс.% HPMCAS по массе дисперсии и приблизительно 0,5 масс.% SLS по массе дисперсии; приблизительно 49,1 масс.% маннита по массе композиции; приблизительно 2 масс.% сукралозы по массе композиции; приблизительно 1 масс.% коллоидного диоксида кремния по массе композиции; и приблизительно 1,0 масс.% стеарата магния по массе композиции. В некоторых аспектах фармацевтическая композиция в виде порошкообразной смеси содержит 5 мг Соединения 1. В некоторых аспектах фармацевтическая композиция в виде порошкообразной смеси содержит 10 мг Соединения 1. В некоторых аспектах единичная доза, содержащая фармацевтическую композицию в виде порошкообразной смеси по настоящему изобретению, содержит 12,5 мг Соединения 1. В некоторых аспектах единичная доза, содержащая фармацевтическую композицию в виде порошкообразной смеси по настоящему изобретению, содержит 15 мг Соединения 1. В некоторых аспектах фармацевтическая композиция в виде порошкообразной смеси содержит 20 мг Соединения 1. В некоторых аспектах единичная доза, содержащая фармацевтическую композицию в виде порошкообразной смеси, содержит 25 мг Соединения 1. В некоторых аспектах фармацевтическая композиция в виде порошкообразной смеси содержит 30 мг Соединения 1. В некоторых аспектах фармацевтическая композиция в виде порошкообразной смеси содержит 35 мг Соединения 1. В некоторых аспектах фармацевтическая композиция в виде порошкообразной смеси содержит 40 мг Соединения 1. В некоторых аспектах фармацевтическая композиция в виде порошкообразной смеси содержит 45 мг Соединения 1. В некоторых аспектах единичная доза, содержащая фармацевтическую композицию в виде порошкообразной смеси, содержит 50 мг Соединения 1. В некоторых аспектах единичная доза, содержащая фармацевтическую композицию в виде порошкообразной смеси, содержит 75 мг Соединения 1. В других вариантах осуществления единичная доза, содержащая фармацевтическую композицию в виде порошкообразной смеси, содержит 100 мг Соединения 1. В других вариантах осуществления единичная доза, содержащая фармацевтическую композицию в виде порошкообразной смеси, содержит 150 мг по существу аморфного или аморфного Соединения 1.
[00568] В конкретных вариантах осуществления указанный способ увеличения массы и объема костной ткани у пациента предусматривает введение указанному пациенту фармацевтической композиции, содержащей мини-таблетку или множество мини-таблеток, где указанная композиция содержит от приблизительно 20 масс.% до приблизительно 70 масс.% твердой дисперсии по массе композиции, где указанная дисперсия содержит от приблизительно 30 масс.% до приблизительно 85 масс.% по существу аморфного или аморфного Соединения 1 по массе дисперсии, от приблизительно 70 масс.% до приблизительно 14 масс.% HPMCAS по массе дисперсии и от приблизительно 0,45 масс.% до приблизительно 0,55 масс.% SLS по массе дисперсии; от приблизительно 22 масс.% до приблизительно 70 масс.% маннита по массе композиции; от приблизительно 0,1 масс.% до приблизительно 5 масс.% сукралозы по массе композиции; от приблизительно 1 масс.% до приблизительно 8 масс.% кроскармеллозы натрия по массе композиции; от приблизительно 0,01 масс.% до приблизительно 3 масс.% SLS по массе композиции; от приблизительно 0,1 масс.% до приблизительно 3 масс.% коллоидного диоксида кремния по массе композиции; и от приблизительно 0,1 масс.% до приблизительно 7 масс.% стеарата магния по массе композиции. В некоторых аспектах фармацевтическую композицию, например, мини-таблетку или множество мини-таблеток, получают в виде капсулы или пачки, где капсула или пачка содержит 5 мг Соединения 1. В других вариантах осуществления фармацевтическая композиция содержит 10 мг Соединения 1. В других вариантах осуществления фармацевтическая композиция содержит 12,5 мг Соединения 1. В других вариантах осуществления фармацевтическая композиция содержит 15 мг Соединения 1. В других вариантах осуществления фармацевтическая композиция содержит 25 мг Соединения 1. В других вариантах осуществления фармацевтическая композиция содержит 30 мг Соединения 1. В других вариантах осуществления фармацевтическая композиция содержит 35 мг Соединения 1. В других вариантах осуществления фармацевтическая композиция содержит 40 мг Соединения 1. В других вариантах осуществления фармацевтическая композиция содержит 45 мг Соединения 1. В других вариантах осуществления фармацевтическая композиция содержит 50 мг Соединения 1. В других вариантах осуществления фармацевтическая композиция содержит 75 мг Соединения 1. В других вариантах осуществления фармацевтическая композиция содержит 100 мг Соединения 1. В других вариантах осуществления фармацевтическая композиция содержит 150 мг Соединения 1.
[00569] В некоторых вариантах осуществления указанный способ увеличения массы и объема костной ткани у пациента предусматривает введение указанному пациенту фармацевтической композиции, содержащей от приблизительно 30 масс.% до приблизительно 50 масс.% твердой дисперсии по массе композиции, где указанная дисперсия содержит приблизительно 80 масс.% по существу аморфного или аморфного Соединения 1 по массе дисперсии, приблизительно 19,5 масс.% HPMCAS по массе дисперсии и приблизительно 0,5 масс.% SLS по массе дисперсии; от приблизительно 30 масс.% до приблизительно 60 масс.% двухкомпонентного наполнителя, где двухкомпонентный наполнитель содержит от приблизительно 0 масс.% до приблизительно 60 масс.% маннита по массе композиции и от приблизительно 0 масс.% до приблизительно 60 масс.% лактозы по массе композиции; от приблизительно 1,5 масс.% до приблизительно 2,5 масс.% сукралозы по массе композиции; от приблизительно 4 масс.% до приблизительно 8 масс.% кроскармеллозы натрия по массе композиции; от приблизительно 0,5 масс.% до приблизительно 1,5 масс.% коллоидного диоксида кремния по массе композиции; и от приблизительно 1 масс.% до приблизительно 2 масс.% стеарата магния по массе композиции.
[00570] В одном варианте осуществления фармацевтическая композиция содержит приблизительно 35 масс.% твердой дисперсии по массе композиции, где указанная дисперсия содержит приблизительно 80 масс.% по существу аморфного или аморфного Соединения 1 по массе дисперсии, приблизительно 19,5 масс.% HPMCAS по массе дисперсии и приблизительно 0,5 масс.% SLS по массе дисперсии; приблизительно 13,5 масс.% маннита по массе композиции; приблизительно 41 масс.% лактозы по массе композиции; приблизительно 2 масс.% сукралозы по массе композиции; приблизительно 6 масс.% кроскармеллозы натрия по массе композиции; приблизительно 1 масс.% коллоидного диоксида кремния по массе композиции; и приблизительно 1,5 масс.% стеарата магния по массе композиции.
[00571] В некоторых аспектах фармацевтическая композиция содержит 10 мг Соединения 1. В некоторых аспектах единичная доза, содержащая фармацевтическую композицию по настоящему изобретению, содержит 5 мг Соединения 1. В некоторых аспектах фармацевтическую композицию, например, мини-таблетку или множество мини-таблеток, помещают в капсулу или пачку, где капсула или пачка содержит 5 мг Соединения 1. В других вариантах осуществления фармацевтическая композиция содержит 10 мг Соединения 1. В других вариантах осуществления фармацевтическая композиция содержит 12,5 мг Соединения 1. В других вариантах осуществления фармацевтическая композиция содержит 15 мг Соединения 1. В других вариантах осуществления фармацевтическая композиция содержит 20 мг Соединения 1. В других вариантах осуществления фармацевтическая композиция содержит 25 мг Соединения 1. В других вариантах осуществления фармацевтическая композиция содержит 30 мг Соединения 1. В других вариантах осуществления фармацевтическая композиция содержит 35 мг Соединения 1. В других вариантах осуществления фармацевтическая композиция содержит 37,5 мг Соединения 1. В других вариантах осуществления фармацевтическая композиция содержит 40 мг Соединения 1. В других вариантах осуществления фармацевтическая композиция содержит 45 мг Соединения 1. В других вариантах осуществления фармацевтическая композиция содержит 50 мг Соединения 1. В других вариантах осуществления фармацевтическая композиция содержит 62,5 мг Соединения 1. В других вариантах осуществления фармацевтическая композиция содержит 75 мг Соединения 1. В других вариантах осуществления фармацевтическая композиция содержит 100 мг Соединения 1. В других вариантах осуществления фармацевтическая композиция содержит 125 мг Соединения 1. В других вариантах осуществления фармацевтическая композиция содержит 150 мг Соединения 1. В других вариантах осуществления фармацевтическая композиция содержит 175 мг Соединения 1. В других вариантах осуществления фармацевтическая композиция содержит 200 мг Соединения 1. В других вариантах осуществления фармацевтическая композиция содержит 225 мг Соединения 1. В других вариантах осуществления фармацевтическая композиция содержит 250 мг Соединения 1.
[00572] В некоторых аспектах настоящее изобретение относится к способу лечения или снижения тяжести ХОБЛ у пациента, предусматривающему введение указанному пациенту Соединения 1 или его фармацевтически приемлемой соли. В некоторых вариантах осуществления указанный способ лечения или снижения тяжести ХОБЛ у пациента предусматривает введение указанному пациенту по существу аморфного Соединения 1 или его фармацевтически приемлемой соли.
[00573] В других вариантах осуществления указанный способ лечения или снижения тяжести ХОБЛ у пациента предусматривает введение указанному пациенту аморфного Соединения 1 или его фармацевтически приемлемой соли.
[00574] В некоторых вариантах осуществления указанный способ лечения или снижения тяжести ХОБЛ у пациента предусматривает введение указанному пациенту фармацевтической композиции, описанной в настоящей заявке.
[00575] В некоторых вариантах осуществления указанный способ лечения или снижения тяжести ХОБЛ у пациента предусматривает введение указанному пациенту фармацевтической композиции, содержащей порошкообразную смесь, где композиция порошкообразной смеси содержит приблизительно 46,9 масс.% твердой дисперсии по массе композиции, где указанная дисперсия содержит приблизительно 80 масс.% по существу аморфного или аморфного Соединения 1 по массе дисперсии, приблизительно 19,5 масс.% HPMCAS по массе дисперсии и приблизительно 0,5 масс.% SLS по массе дисперсии; приблизительно 49,1 масс.% маннита по массе композиции; приблизительно 2 масс.% сукралозы по массе композиции; приблизительно 1 масс.% коллоидного диоксида кремния по массе композиции; и приблизительно 1,0 масс.% стеарата магния по массе композиции. В некоторых аспектах фармацевтическая композиция в виде порошкообразной смеси содержит 5 мг Соединения 1. В некоторых аспектах фармацевтическая композиция в виде порошкообразной смеси содержит 10 мг Соединения 1. В некоторых аспектах единичная доза, содержащая фармацевтическую композицию в виде порошкообразной смеси по настоящему изобретению, содержит 12,5 мг Соединения 1. В некоторых аспектах единичная доза, содержащая фармацевтическую композицию в виде порошкообразной смеси по настоящему изобретению, содержит 15 мг Соединения 1. В некоторых аспектах фармацевтическая композиция в виде порошкообразной смеси содержит 20 мг Соединения 1. В некоторых аспектах единичная доза, содержащая фармацевтическую композицию в виде порошкообразной смеси, содержит 25 мг Соединения 1. В некоторых аспектах фармацевтическая композиция в виде порошкообразной смеси содержит 30 мг Соединения 1. В некоторых аспектах фармацевтическая композиция в виде порошкообразной смеси содержит 40 мг Соединения 1. В некоторых аспектах единичная доза, содержащая фармацевтическую композицию в виде порошкообразной смеси, содержит 50 мг Соединения 1. В некоторых аспектах единичная доза, содержащая фармацевтическую композицию в виде порошкообразной смеси, содержит 75 мг Соединения 1. В других вариантах осуществления единичная доза, содержащая фармацевтическую композицию в виде порошкообразной смеси, содержит 100 мг Соединения 1. В других вариантах осуществления единичная доза, содержащая фармацевтическую композицию в виде порошкообразной смеси, содержит 150 мг по существу аморфного или аморфного Соединения 1.
[00576] В конкретных вариантах осуществления указанный способ лечения или снижения тяжести ХОБЛ у пациента предусматривает введение указанному пациенту фармацевтической композиции, содержащей мини-таблетку или множество мини-таблеток, где указанная композиция содержит от приблизительно 20 масс.% до приблизительно 70 масс.% твердой дисперсии по массе композиции, где указанная дисперсия содержит от приблизительно 30 масс.% до приблизительно 85 масс.% по существу аморфного или аморфного Соединения 1 по массе дисперсии, от приблизительно 70 масс.% до приблизительно 14 масс.% HPMCAS по массе дисперсии и от приблизительно 0,45 масс.% до приблизительно 0,55 масс.% SLS по массе дисперсии; от приблизительно 22 масс.% до приблизительно 70 масс.% маннита по массе композиции; от приблизительно 0,1 масс.% до приблизительно 5 масс.% сукралозы по массе композиции; от приблизительно 1 масс.% до приблизительно 8 масс.% кроскармеллозы натрия по массе композиции; от приблизительно 0,01 масс.% до приблизительно 3 масс.% SLS по массе композиции; от приблизительно 0,1 масс.% до приблизительно 3 масс.% коллоидного диоксида кремния по массе композиции; и от приблизительно 0,1 масс.% до приблизительно 7 масс.% стеарата магния по массе композиции. В некоторых аспектах фармацевтическую композицию, например, мини-таблетку или множество мини-таблеток, получают в виде капсулы или пачки, где капсула или пачка содержит 5 мг Соединения 1. В других вариантах осуществления фармацевтическая композиция содержит 10 мг Соединения 1. В других вариантах осуществления фармацевтическая композиция содержит 12,5 мг Соединения 1. В других вариантах осуществления фармацевтическая композиция содержит 15 мг Соединения 1. В других вариантах осуществления фармацевтическая композиция содержит 20 мг Соединения 1. В других вариантах осуществления фармацевтическая композиция содержит 25 мг Соединения 1. В других вариантах осуществления фармацевтическая композиция содержит 30 мг Соединения 1. В других вариантах осуществления фармацевтическая композиция содержит 35 мг Соединения 1. В других вариантах осуществления фармацевтическая композиция содержит 40 мг Соединения 1. В других вариантах осуществления фармацевтическая композиция содержит 45 мг Соединения 1. В других вариантах осуществления фармацевтическая композиция содержит 50 мг Соединения 1. В других вариантах осуществления фармацевтическая композиция содержит 75 мг Соединения 1. В других вариантах осуществления фармацевтическая композиция содержит 100 мг Соединения 1. В других вариантах осуществления фармацевтическая композиция содержит 150 мг Соединения 1.
[00577] В некоторых вариантах осуществления указанный способ лечения или снижения тяжести ХОБЛ у пациента предусматривает введение указанному пациенту фармацевтической композиции, содержащей от приблизительно 30 масс.% до приблизительно 50 масс.% твердой дисперсии по массе композиции, где указанная дисперсия содержит приблизительно 80 масс.% по существу аморфного или аморфного Соединения 1 по массе дисперсии, приблизительно 19,5 масс.% HPMCAS по массе дисперсии и приблизительно 0,5 масс.% SLS по массе дисперсии; от приблизительно 30 масс.% до приблизительно 60 масс.% двухкомпонентного наполнителя, где двухкомпонентный наполнитель содержит от приблизительно 0 масс.% до приблизительно 60 масс.% маннита по массе композиции и от приблизительно 0 масс.% до приблизительно 60 масс.% лактозы по массе композиции; от приблизительно 1,5 масс.% до приблизительно 2,5 масс.% сукралозы по массе композиции; от приблизительно 4 масс.% до приблизительно 8 масс.% кроскармеллозы натрия по массе композиции; от приблизительно 0,5 масс.% до приблизительно 1,5 масс.% коллоидного диоксида кремния по массе композиции; и от приблизительно 1 масс.% до приблизительно 2 масс.% стеарата магния по массе композиции.
[00578] В одном варианте осуществления фармацевтическая композиция содержит приблизительно 35 масс.% твердой дисперсии по массе композиции, где указанная дисперсия содержит приблизительно 80 масс.% по существу аморфного или аморфного Соединения 1 по массе дисперсии, приблизительно 19,5 масс.% HPMCAS по массе дисперсии и приблизительно 0,5 масс.% SLS по массе дисперсии; приблизительно 13,5 масс.% маннита по массе композиции; приблизительно 41 масс.% лактозы по массе композиции; приблизительно 2 масс.% сукралозы по массе композиции; приблизительно 6 масс.% кроскармеллозы натрия по массе композиции; приблизительно 1 масс.% коллоидного диоксида кремния по массе композиции; и приблизительно 1,5 масс.% стеарата магния по массе композиции.
[00579] В некоторых аспектах фармацевтическая композиция содержит 10 мг Соединения 1. В некоторых аспектах единичная доза, содержащая фармацевтическую композицию по настоящему изобретению, содержит 5 мг Соединения 1. В некоторых аспектах фармацевтическую композицию, например, мини-таблетку или множество мини-таблеток, помещают в капсулу или пачку, где капсула или пачка содержит 5 мг Соединения 1. В других вариантах осуществления фармацевтическая композиция содержит 10 мг Соединения 1. В других вариантах осуществления фармацевтическая композиция содержит 12,5 мг Соединения 1. В других вариантах осуществления фармацевтическая композиция содержит 15 мг Соединения 1. В других вариантах осуществления фармацевтическая композиция содержит 20 мг Соединения 1. В других вариантах осуществления фармацевтическая композиция содержит 25 мг Соединения 1. В других вариантах осуществления фармацевтическая композиция содержит 30 мг Соединения 1. В других вариантах осуществления фармацевтическая композиция содержит 35 мг Соединения 1. В других вариантах осуществления фармацевтическая композиция содержит 37,5 мг Соединения 1. В других вариантах осуществления фармацевтическая композиция содержит 40 мг Соединения 1. В других вариантах осуществления фармацевтическая композиция содержит 45 мг Соединения 1. В других вариантах осуществления фармацевтическая композиция содержит 50 мг Соединения 1. В других вариантах осуществления фармацевтическая композиция содержит 62,5 мг Соединения 1. В других вариантах осуществления фармацевтическая композиция содержит 75 мг Соединения 1. В других вариантах осуществления фармацевтическая композиция содержит 100 мг Соединения 1. В других вариантах осуществления фармацевтическая композиция содержит 125 мг Соединения 1. В других вариантах осуществления фармацевтическая композиция содержит 150 мг Соединения 1. В других вариантах осуществления фармацевтическая композиция содержит 175 мг Соединения 1. В других вариантах осуществления фармацевтическая композиция содержит 200 мг Соединения 1. В других вариантах осуществления фармацевтическая композиция содержит 225 мг Соединения 1. В других вариантах осуществления фармацевтическая композиция содержит 250 мг Соединения 1.
[00580] В некоторых аспектах настоящее изобретение относится к способу лечения или снижения тяжести ХОБЛ, индуцированной дымом, у пациента, предусматривающему введение указанному пациенту Соединения 1 или его фармацевтически приемлемой соли.
[00581] В некоторых вариантах осуществления указанный способ лечения или снижения тяжести ХОБЛ, индуцированной дымом, у пациента предусматривает введение указанному пациенту по существу аморфного Соединения 1 или его фармацевтически приемлемой соли.
[00582] В других вариантах осуществления указанный способ лечения или снижения тяжести ХОБЛ, индуцированной дымом, у пациента предусматривает введение указанному пациенту аморфного Соединения 1 или его фармацевтически приемлемой соли.
[00583] В некоторых вариантах осуществления указанный способ лечения или снижения тяжести ХОБЛ, индуцированной дымом, у пациента предусматривает введение указанному пациенту фармацевтической композиции, описанной в настоящей заявке.
[00584] В некоторых вариантах осуществления указанный способ лечения или снижения тяжести ХОБЛ, индуцированной дымом, у пациента предусматривает введение указанному пациенту фармацевтической композиции, содержащей порошкообразную смесь, где композиция порошкообразной смеси содержит приблизительно 46,9 масс.% твердой дисперсии по массе композиции, где указанная дисперсия содержит приблизительно 80 масс.% по существу аморфного или аморфного Соединения 1 по массе дисперсии, приблизительно 19,5 масс.% HPMCAS по массе дисперсии и приблизительно 0,5 масс.% SLS по массе дисперсии; приблизительно 49,1 масс.% маннита по массе композиции; приблизительно 2 масс.% сукралозы по массе композиции; приблизительно 1 масс.% коллоидного диоксида кремния по массе композиции; и приблизительно 1,0 масс.% стеарата магния по массе композиции. В некоторых аспектах фармацевтическая композиция в виде порошкообразной смеси содержит 5 мг Соединения 1. В некоторых аспектах фармацевтическая композиция в виде порошкообразной смеси содержит 10 мг Соединения 1. В некоторых аспектах единичная доза, содержащая фармацевтическую композицию в виде порошкообразной смеси по настоящему изобретению, содержит 12,5 мг Соединения 1. В некоторых аспектах единичная доза, содержащая фармацевтическую композицию в виде порошкообразной смеси по настоящему изобретению, содержит 15 мг Соединения 1. В некоторых аспектах фармацевтическая композиция в виде порошкообразной смеси содержит 20 мг Соединения 1. В некоторых аспектах единичная доза, содержащая фармацевтическую композицию в виде порошкообразной смеси, содержит 25 мг Соединения 1. В некоторых аспектах фармацевтическая композиция в виде порошкообразной смеси содержит 30 мг Соединения 1. В некоторых аспектах фармацевтическая композиция в виде порошкообразной смеси содержит 35 мг Соединения 1. В некоторых аспектах фармацевтическая композиция в виде порошкообразной смеси содержит 40 мг Соединения 1. В некоторых аспектах фармацевтическая композиция в виде порошкообразной смеси содержит 45 мг Соединения 1. В некоторых аспектах единичная доза, содержащая фармацевтическую композицию в виде порошкообразной смеси, содержит 50 мг Соединения 1. В некоторых аспектах единичная доза, содержащая фармацевтическую композицию в виде порошкообразной смеси, содержит 75 мг Соединения 1. В других вариантах осуществления единичная доза, содержащая фармацевтическую композицию в виде порошкообразной смеси, содержит 100 мг Соединения 1. В других вариантах осуществления единичная доза, содержащая фармацевтическую композицию в виде порошкообразной смеси, содержит 150 мг по существу аморфного или аморфного Соединения 1.
[00585] В конкретных вариантах осуществления указанный способ лечения или снижения тяжести ХОБЛ, индуцированной дымом, у пациента предусматривает введение указанному пациенту фармацевтической композиции, содержащей мини-таблетку или множество мини-таблеток, где указанная композиция содержит от приблизительно 20 масс.% до приблизительно 70 масс.% твердой дисперсии по массе композиции, где указанная дисперсия содержит от приблизительно 30 масс.% до приблизительно 85 масс.% по существу аморфного или аморфного Соединения 1 по массе дисперсии, от приблизительно 70 масс.% до приблизительно 14 масс.% HPMCAS по массе дисперсии и от приблизительно 0,45 масс.% до приблизительно 0,55 масс.% SLS по массе дисперсии; от приблизительно 22 масс.% до приблизительно 70 масс.% маннита по массе композиции; от приблизительно 0,1 масс.% до приблизительно 5 масс.% сукралозы по массе композиции; от приблизительно 1 масс.% до приблизительно 8 масс.% кроскармеллозы натрия по массе композиции; от приблизительно 0,01 масс.% до приблизительно 3 масс.% SLS по массе композиции; от приблизительно 0,1 масс.% до приблизительно 3 масс.% коллоидного диоксида кремния по массе композиции; и от приблизительно 0,1 масс.% до приблизительно 7 масс.% стеарата магния по массе композиции. В некоторых аспектах фармацевтическую композицию, например, мини-таблетку или множество мини-таблеток, получают в виде капсулы или пачки, где капсула или пачка содержит 5 мг Соединения 1. В других вариантах осуществления фармацевтическая композиция содержит 10 мг Соединения 1. В других вариантах осуществления фармацевтическая композиция содержит 15 мг Соединения 1. В других вариантах осуществления фармацевтическая композиция содержит 12,5 мг Соединения 1. В других вариантах осуществления фармацевтическая композиция содержит 25 мг Соединения 1. В других вариантах осуществления фармацевтическая композиция содержит 30 мг Соединения 1. В других вариантах осуществления фармацевтическая композиция содержит 35 мг Соединения 1. В других вариантах осуществления фармацевтическая композиция содержит 40 мг Соединения 1. В других вариантах осуществления фармацевтическая композиция содержит 45 мг Соединения 1. В других вариантах осуществления фармацевтическая композиция содержит 50 мг Соединения 1. В других вариантах осуществления фармацевтическая композиция содержит 75 мг Соединения 1. В других вариантах осуществления фармацевтическая композиция содержит 100 мг Соединения 1. В других вариантах осуществления фармацевтическая композиция содержит 150 мг Соединения 1.
[00586] В некоторых вариантах осуществления указанный способ лечения или снижения тяжести ХОБЛ, индуцированной дымом, у пациента предусматривает введение указанному пациенту фармацевтической композиции, содержащей от приблизительно 30 масс.% до приблизительно 50 масс.% твердой дисперсии по массе композиции, где указанная дисперсия содержит приблизительно 80 масс.% по существу аморфного или аморфного Соединения 1 по массе дисперсии, приблизительно 19,5 масс.% HPMCAS по массе дисперсии и приблизительно 0,5 масс.% SLS по массе дисперсии; от приблизительно 30 масс.% до приблизительно 60 масс.% двухкомпонентного наполнителя, где двухкомпонентный наполнитель содержит от приблизительно 0 масс.% до приблизительно 60 масс.% маннита по массе композиции и от приблизительно 0 масс.% до приблизительно 60 масс.% лактозы по массе композиции; от приблизительно 1,5 масс.% до приблизительно 2,5 масс.% сукралозы по массе композиции; от приблизительно 4 масс.% до приблизительно 8 масс.% кроскармеллозы натрия по массе композиции; от приблизительно 0,5 масс.% до приблизительно 1,5 масс.% коллоидного диоксида кремния по массе композиции; и от приблизительно 1 масс.% до приблизительно 2 масс.% стеарата магния по массе композиции.
[00587] В одном варианте осуществления фармацевтическая композиция содержит приблизительно 35 масс.% твердой дисперсии по массе композиции, где указанная дисперсия содержит приблизительно 80 масс.% по существу аморфного или аморфного Соединения 1 по массе дисперсии, приблизительно 19,5 масс.% HPMCAS по массе дисперсии и приблизительно 0,5 масс.% SLS по массе дисперсии; приблизительно 13,5 масс.% маннита по массе композиции; приблизительно 41 масс.% лактозы по массе композиции; приблизительно 2 масс.% сукралозы по массе композиции; приблизительно 6 масс.% кроскармеллозы натрия по массе композиции; приблизительно 1 масс.% коллоидного диоксида кремния по массе композиции; и приблизительно 1,5 масс.% стеарата магния по массе композиции.
[00588] В некоторых аспектах фармацевтическая композиция содержит 10 мг Соединения 1. В некоторых аспектах единичная доза, содержащая фармацевтическую композицию по настоящему изобретению, содержит 5 мг Соединения 1. В некоторых аспектах фармацевтическую композицию, например, мини-таблетку или множество мини-таблеток, помещают в капсулу или пачку, где капсула или пачка содержит 5 мг Соединения 1. В других вариантах осуществления фармацевтическая композиция содержит 10 мг Соединения 1. В других вариантах осуществления фармацевтическая композиция содержит 12,5 мг Соединения 1. В других вариантах осуществления фармацевтическая композиция содержит 15 мг Соединения 1. В других вариантах осуществления фармацевтическая композиция содержит 20 мг Соединения 1. В других вариантах осуществления фармацевтическая композиция содержит 25 мг Соединения 1. В других вариантах осуществления фармацевтическая композиция содержит 30 мг Соединения 1. В других вариантах осуществления фармацевтическая композиция содержит 35 мг Соединения 1. В других вариантах осуществления фармацевтическая композиция содержит 37,5 мг Соединения 1. В других вариантах осуществления фармацевтическая композиция содержит 40 мг Соединения 1. В других вариантах осуществления фармацевтическая композиция содержит 45 мг Соединения 1. В других вариантах осуществления фармацевтическая композиция содержит 50 мг Соединения 1. В других вариантах осуществления фармацевтическая композиция содержит 62,5 мг Соединения 1. В других вариантах осуществления фармацевтическая композиция содержит 75 мг Соединения 1. В других вариантах осуществления фармацевтическая композиция содержит 100 мг Соединения 1. В других вариантах осуществления фармацевтическая композиция содержит 125 мг Соединения 1. В других вариантах осуществления фармацевтическая композиция содержит 150 мг Соединения 1. В других вариантах осуществления фармацевтическая композиция содержит 175 мг Соединения 1. В других вариантах осуществления фармацевтическая композиция содержит 200 мг Соединения 1. В других вариантах осуществления фармацевтическая композиция содержит 225 мг Соединения 1. В других вариантах осуществления фармацевтическая композиция содержит 250 мг Соединения 1.
[00589] В некоторых аспектах настоящее изобретение относится к способу лечения или снижения тяжести хронического бронхита у пациента, предусматривающему введение указанному пациенту Соединения 1 или его фармацевтически приемлемой соли.
[00590] В некоторых вариантах осуществления указанный способ лечения или снижения тяжести хронического бронхита у пациента предусматривает введение указанному пациенту по существу аморфного Соединения 1 или его фармацевтически приемлемой соли.
[00591] В других вариантах осуществления указанный способ лечения или снижения тяжести хронического бронхита у пациента предусматривает введение указанному пациенту аморфного Соединения 1 или его фармацевтически приемлемой соли.
[00592] В некоторых вариантах осуществления указанный способ лечения или снижения тяжести хронического бронхита у пациента предусматривает введение указанному пациенту фармацевтической композиции, описанной в настоящей заявке.
[00593] В некоторых вариантах осуществления указанный способ лечения или снижения тяжести хронического бронхита у пациента предусматривает введение указанному пациенту фармацевтической композиции, содержащей порошкообразную смесь, где композиция порошкообразной смеси содержит приблизительно 46,9 масс.% твердой дисперсии по массе композиции, где указанная дисперсия содержит приблизительно 80 масс.% по существу аморфного или аморфного Соединения 1 по массе дисперсии, приблизительно 19,5 масс.% HPMCAS по массе дисперсии и приблизительно 0,5 масс.% SLS по массе дисперсии; приблизительно 49,1 масс.% маннита по массе композиции; приблизительно 2 масс.% сукралозы по массе композиции; приблизительно 1 масс.% коллоидного диоксида кремния по массе композиции; и приблизительно 1,0 масс.% стеарата магния по массе композиции. В некоторых аспектах фармацевтическая композиция в виде порошкообразной смеси содержит 5 мг Соединения 1. В некоторых аспектах единичная доза, содержащая фармацевтическую композицию в виде порошкообразной смеси по настоящему изобретению, содержит 10 мг Соединения 1. В некоторых аспектах единичная доза, содержащая фармацевтическую композицию в виде порошкообразной смеси по настоящему изобретению, содержит 12,5 мг Соединения 1. В некоторых аспектах единичная доза, содержащая фармацевтическую композицию в виде порошкообразной смеси по настоящему изобретению, содержит 15 мг Соединения 1. В некоторых аспектах единичная доза, содержащая фармацевтическую композицию в виде порошкообразной смеси по настоящему изобретению, содержит 20 мг Соединения 1. В некоторых аспектах единичная доза, содержащая фармацевтическую композицию в виде порошкообразной смеси, содержит 25 мг Соединения 1. В некоторых аспектах единичная доза, содержащая фармацевтическую композицию в виде порошкообразной смеси по настоящему изобретению, содержит 30 мг Соединения 1. В некоторых аспектах единичная доза, содержащая фармацевтическую композицию в виде порошкообразной смеси по настоящему изобретению, содержит 35 мг Соединения 1. В некоторых аспектах единичная доза, содержащая фармацевтическую композицию в виде порошкообразной смеси по настоящему изобретению, содержит 40 мг Соединения 1. В некоторых аспектах единичная доза, содержащая фармацевтическую композицию в виде порошкообразной смеси по настоящему изобретению, содержит 45 мг Соединения 1. В некоторых аспектах единичная доза, содержащая фармацевтическую композицию в виде порошкообразной смеси, содержит 50 мг Соединения 1. В некоторых аспектах единичная доза, содержащая фармацевтическую композицию в виде порошкообразной смеси, содержит 75 мг Соединения 1. В других вариантах осуществления единичная доза, содержащая фармацевтическую композицию в виде порошкообразной смеси, содержит 100 мг Соединения 1. В других вариантах осуществления единичная доза, содержащая фармацевтическую композицию в виде порошкообразной смеси, содержит 150 мг по существу аморфного или аморфного Соединения 1.
[00594] В конкретных вариантах осуществления указанный способ лечения или снижения тяжести хронического бронхита у пациента предусматривает введение указанному пациенту фармацевтической композиции, содержащей мини-таблетку или множество мини-таблеток, где указанная композиция содержит от приблизительно 20 масс.% до приблизительно 70 масс.% твердой дисперсии по массе композиции, где указанная дисперсия содержит от приблизительно 30 масс.% до приблизительно 85 масс.% по существу аморфного или аморфного Соединения 1 по массе дисперсии, от приблизительно 70 масс.% до приблизительно 14 масс.% HPMCAS по массе дисперсии и от приблизительно 0,45 масс.% до приблизительно 0,55 масс.% SLS по массе дисперсии; от приблизительно 22 масс.% до приблизительно 70 масс.% маннита по массе композиции; от приблизительно 0,1 масс.% до приблизительно 5 масс.% сукралозы по массе композиции; от приблизительно 1 масс.% до приблизительно 8 масс.% кроскармеллозы натрия по массе композиции; от приблизительно 0,01 масс.% до приблизительно 3 масс.% SLS по массе композиции; от приблизительно 0,1 масс.% до приблизительно 3 масс.% коллоидного диоксида кремния по массе композиции; и от приблизительно 0,1 масс.% до приблизительно 7 масс.% стеарата магния по массе композиции. В некоторых аспектах фармацевтическую композицию, например, мини-таблетку или множество мини-таблеток, получают в виде капсулы или пачки, где капсула или пачка содержит 5 мг Соединения 1. В других вариантах осуществления фармацевтическая композиция содержит 10 мг Соединения 1. В других вариантах осуществления фармацевтическая композиция содержит 12,5 мг Соединения 1. В других вариантах осуществления фармацевтическая композиция содержит 15 мг Соединения 1. В других вариантах осуществления фармацевтическая композиция содержит 20 мг Соединения 1. В других вариантах осуществления фармацевтическая композиция содержит 25 мг Соединения 1. В других вариантах осуществления фармацевтическая композиция содержит 30 мг Соединения 1. В других вариантах осуществления фармацевтическая композиция содержит 35 мг Соединения 1. В других вариантах осуществления фармацевтическая композиция содержит 40 мг Соединения 1. В других вариантах осуществления фармацевтическая композиция содержит 45 мг Соединения 1. В других вариантах осуществления фармацевтическая композиция содержит 50 мг Соединения 1. В других вариантах осуществления фармацевтическая композиция содержит 75 мг Соединения 1. В других вариантах осуществления фармацевтическая композиция содержит 100 мг Соединения 1. В других вариантах осуществления фармацевтическая композиция содержит 150 мг Соединения 1.
[00595] В некоторых вариантах осуществления указанный способ лечения или снижения тяжести хронического бронхита у пациента предусматривает введение указанному пациенту фармацевтической композиции, содержащей от приблизительно 30 масс.% до приблизительно 50 масс.% твердой дисперсии по массе композиции, где указанная дисперсия содержит приблизительно 80 масс.% по существу аморфного или аморфного Соединения 1 по массе дисперсии, приблизительно 19,5 масс.% HPMCAS по массе дисперсии и приблизительно 0,5 масс.% SLS по массе дисперсии; от приблизительно 30 масс.% до приблизительно 60 масс.% двухкомпонентного наполнителя, где двухкомпонентный наполнитель содержит от приблизительно 0 масс.% до приблизительно 60 масс.% маннита по массе композиции и от приблизительно 0 масс.% до приблизительно 60 масс.% лактозы по массе композиции; от приблизительно 1,5 масс.% до приблизительно 2,5 масс.% сукралозы по массе композиции; от приблизительно 4 масс.% до приблизительно 8 масс.% кроскармеллозы натрия по массе композиции; от приблизительно 0,5 масс.% до приблизительно 1,5 масс.% коллоидного диоксида кремния по массе композиции; и от приблизительно 1 масс.% до приблизительно 2 масс.% стеарата магния по массе композиции.
[00596] В одном варианте осуществления фармацевтическая композиция содержит приблизительно 35 масс.% твердой дисперсии по массе композиции, где указанная дисперсия содержит приблизительно 80 масс.% по существу аморфного или аморфного Соединения 1 по массе дисперсии, приблизительно 19,5 масс.% HPMCAS по массе дисперсии и приблизительно 0,5 масс.% SLS по массе дисперсии; приблизительно 13,5 масс.% маннита по массе композиции; приблизительно 41 масс.% лактозы по массе композиции; приблизительно 2 масс.% сукралозы по массе композиции; приблизительно 6 масс.% кроскармеллозы натрия по массе композиции; приблизительно 1 масс.% коллоидного диоксида кремния по массе композиции; и приблизительно 1,5 масс.% стеарата магния по массе композиции.
[00597] В некоторых аспектах фармацевтическая композиция содержит 10 мг Соединения 1. В некоторых аспектах единичная доза, содержащая фармацевтическую композицию по настоящему изобретению, содержит 5 мг Соединения 1. В некоторых аспектах фармацевтическую композицию, например, мини-таблетку или множество мини-таблеток, помещают в капсулу или пачку, где капсула или пачка содержит 5 мг Соединения 1. В других вариантах осуществления фармацевтическая композиция содержит 10 мг Соединения 1. В других вариантах осуществления фармацевтическая композиция содержит 12,5 мг Соединения 1. В других вариантах осуществления фармацевтическая композиция содержит 15 мг Соединения 1. В других вариантах осуществления фармацевтическая композиция содержит 20 мг Соединения 1. В других вариантах осуществления фармацевтическая композиция содержит 25 мг Соединения 1. В других вариантах осуществления фармацевтическая композиция содержит 30 мг Соединения 1. В других вариантах осуществления фармацевтическая композиция содержит 35 мг Соединения 1. В других вариантах осуществления фармацевтическая композиция содержит 37,5 мг Соединения 1. В других вариантах осуществления фармацевтическая композиция содержит 40 мг Соединения 1. В других вариантах осуществления фармацевтическая композиция содержит 45 мг Соединения 1. В других вариантах осуществления фармацевтическая композиция содержит 50 мг Соединения 1. В других вариантах осуществления фармацевтическая композиция содержит 62,5 мг Соединения 1. В других вариантах осуществления фармацевтическая композиция содержит 75 мг Соединения 1. В других вариантах осуществления фармацевтическая композиция содержит 100 мг Соединения 1. В других вариантах осуществления фармацевтическая композиция содержит 125 мг Соединения 1. В других вариантах осуществления фармацевтическая композиция содержит 150 мг Соединения 1. В других вариантах осуществления фармацевтическая композиция содержит 175 мг Соединения 1. В других вариантах осуществления фармацевтическая композиция содержит 200 мг Соединения 1. В других вариантах осуществления фармацевтическая композиция содержит 225 мг Соединения 1. В других вариантах осуществления фармацевтическая композиция содержит 250 мг Соединения 1.
[00598] Другой аспект настоящего изобретения относится к способу введения фармацевтической композиции, путем перорального введения пациенту по меньшей мере один раз в сутки указанной композиции, содержащей одну или более мини-таблеток, где указанная композиция содержит до приблизительно 1 мг по существу аморфного или аморфного Соединения 1.
[00599] Другой аспект настоящего изобретения относится к способу введения фармацевтической композиции, путем перорального введения пациенту по меньшей мере один раз в сутки указанной композиции, содержащей мини-таблетку или множество мини-таблеток, где указанная композиция содержит до приблизительно 5 мг по существу аморфного или аморфного Соединения 1.
[00600] Другой аспект настоящего изобретения относится к способу введения фармацевтической композиции, путем перорального введения пациенту по меньшей мере один раз в сутки указанной композиции, содержащей мини-таблетку или множество мини-таблеток, где указанная композиция содержит до приблизительно 10 мг по существу аморфного или аморфного Соединения 1.
[00601] Другой аспект настоящего изобретения относится к способу введения фармацевтической композиции, путем перорального введения пациенту по меньшей мере один раз в сутки указанной композиции, содержащей мини-таблетку или множество мини-таблеток, где указанная композиция содержит до приблизительно 12,5 мг по существу аморфного или аморфного Соединения 1.
[00602] Другой аспект настоящего изобретения относится к способу введения фармацевтической композиции, путем перорального введения пациенту по меньшей мере один раз в сутки указанной композиции, содержащей мини-таблетку или множество мини-таблеток, где указанная композиция содержит до приблизительно 15 мг по существу аморфного или аморфного Соединения 1.
[00603] Другой аспект настоящего изобретения относится к способу введения фармацевтической композиции, путем перорального введения пациенту по меньшей мере один раз в сутки указанной композиции, содержащей мини-таблетку или множество мини-таблеток, где указанная композиция содержит до приблизительно 20 мг по существу аморфного или аморфного Соединения 1.
[00604] Другой аспект настоящего изобретения относится к способу введения фармацевтической композиции, путем перорального введения пациенту по меньшей мере один раз в сутки указанной композиции, содержащей мини-таблетку или множество мини-таблеток, где указанная композиция содержит до приблизительно 25 мг по существу аморфного или аморфного Соединения 1.
[00605] Другой аспект настоящего изобретения относится к способу введения фармацевтической композиции, путем перорального введения пациенту по меньшей мере один раз в сутки указанной композиции, содержащей мини-таблетку или множество мини-таблеток, где указанная композиция содержит до приблизительно 30 мг по существу аморфного или аморфного Соединения 1.
[00606] Другой аспект настоящего изобретения относится к способу введения фармацевтической композиции, путем перорального введения пациенту по меньшей мере один раз в сутки указанной композиции, содержащей мини-таблетку или множество мини-таблеток, где указанная композиция содержит до приблизительно 35 мг по существу аморфного или аморфного Соединения 1.
[00607] Другой аспект настоящего изобретения относится к способу введения фармацевтической композиции, путем перорального введения пациенту по меньшей мере один раз в сутки указанной композиции, содержащей мини-таблетку или множество мини-таблеток, где указанная композиция содержит до приблизительно 37,5 мг по существу аморфного или аморфного Соединения 1.
[00608] Другой аспект настоящего изобретения относится к способу введения фармацевтической композиции, путем перорального введения пациенту по меньшей мере один раз в сутки указанной композиции, содержащей мини-таблетку или множество мини-таблеток, где указанная композиция содержит до приблизительно 40 мг по существу аморфного или аморфного Соединения 1.
[00609] Другой аспект настоящего изобретения относится к способу введения фармацевтической композиции, путем перорального введения пациенту по меньшей мере один раз в сутки указанной композиции, содержащей мини-таблетку или множество мини-таблеток, где указанная композиция содержит до приблизительно 45 мг по существу аморфного или аморфного Соединения 1.
[00610] Другой аспект настоящего изобретения относится к способу введения фармацевтической композиции, путем перорального введения пациенту по меньшей мере один раз в сутки указанной композиции, содержащей мини-таблетку или множество мини-таблеток, где указанная композиция содержит до приблизительно 50 мг по существу аморфного или аморфного Соединения 1.
[00611] Другой аспект настоящего изобретения относится к способу введения фармацевтической композиции, путем перорального введения пациенту по меньшей мере один раз в сутки указанной композиции, содержащей мини-таблетку или множество мини-таблеток, где указанная композиция содержит до приблизительно 62,5 мг по существу аморфного или аморфного Соединения 1.
[00612] Другой аспект настоящего изобретения относится к способу введения фармацевтической композиции, путем перорального введения пациенту по меньшей мере один раз в сутки указанной композиции, содержащей мини-таблетку или множество мини-таблеток, где указанная композиция содержит до приблизительно 75 мг по существу аморфного или аморфного Соединения 1.
[00613] Другой аспект настоящего изобретения относится к способу введения фармацевтической композиции, путем перорального введения пациенту по меньшей мере один раз в сутки указанной композиции, содержащей мини-таблетку или множество мини-таблеток, где указанная композиция содержит до приблизительно 100 мг по существу аморфного или аморфного Соединения 1.
[00614] Другой аспект настоящего изобретения относится к способу введения фармацевтической композиции, путем перорального введения пациенту по меньшей мере один раз в сутки указанной композиции, содержащей мини-таблетку или множество мини-таблеток, где указанная композиция содержит до приблизительно 125 мг по существу аморфного или аморфного Соединения 1.
[00615] Другой аспект настоящего изобретения относится к способу введения фармацевтической композиции, путем перорального введения пациенту по меньшей мере один раз в сутки указанной композиции, содержащей мини-таблетку или множество мини-таблеток, где указанная композиция содержит до приблизительно 150 мг по существу аморфного или аморфного Соединения 1.
[00616] Другой аспект настоящего изобретения относится к способу введения фармацевтической композиции, путем перорального введения пациенту по меньшей мере один раз в сутки указанной композиции, содержащей мини-таблетку или множество мини-таблеток, где указанная композиция содержит до приблизительно 175 мг по существу аморфного или аморфного Соединения 1.
[00617] Другой аспект настоящего изобретения относится к способу введения фармацевтической композиции, путем перорального введения пациенту по меньшей мере один раз в сутки указанной композиции, содержащей мини-таблетку или множество мини-таблеток, где указанная композиция содержит до приблизительно 200 мг по существу аморфного или аморфного Соединения 1.
[00618] Другой аспект настоящего изобретения относится к способу введения фармацевтической композиции, путем перорального введения пациенту по меньшей мере один раз в сутки указанной композиции, содержащей мини-таблетку или множество мини-таблеток, где указанная композиция содержит до приблизительно 225 мг по существу аморфного или аморфного Соединения 1.
[00619] Другой аспект настоящего изобретения относится к способу введения фармацевтической композиции, путем перорального введения пациенту по меньшей мере один раз в сутки указанной композиции, содержащей мини-таблетку или множество мини-таблеток, где указанная композиция содержит до приблизительно 250 мг по существу аморфного или аморфного Соединения 1.
[00620] Другой аспект настоящего изобретения относится к способу введения фармацевтической композиции, путем перорального введения пациенту дважды в сутки указанной композиции, содержащей одну или более мини-таблеток, где указанная композиция содержит до приблизительно 1 мг по существу аморфного или аморфного Соединения 1.
[00621] Другой аспект настоящего изобретения относится к способу введения фармацевтической композиции, путем перорального введения пациенту дважды в сутки указанной композиции, содержащей мини-таблетку или множество мини-таблеток, где указанная композиция содержит до приблизительно 5 мг по существу аморфного или аморфного Соединения 1.
[00622] Другой аспект настоящего изобретения относится к способу введения фармацевтической композиции, путем перорального введения пациенту дважды в сутки указанной композиции, содержащей мини-таблетку или множество мини-таблеток, где указанная композиция содержит до приблизительно 10 мг по существу аморфного или аморфного Соединения 1.
[00623] Другой аспект настоящего изобретения относится к способу введения фармацевтической композиции, путем перорального введения пациенту дважды в сутки указанной композиции, содержащей мини-таблетку или множество мини-таблеток, где указанная композиция содержит до приблизительно 12,5 мг по существу аморфного или аморфного Соединения 1.
[00624] Другой аспект настоящего изобретения относится к способу введения фармацевтической композиции, путем перорального введения пациенту дважды в сутки указанной композиции, содержащей мини-таблетку или множество мини-таблеток, где указанная композиция содержит до приблизительно 15 мг по существу аморфного или аморфного Соединения 1.
[00625] Другой аспект настоящего изобретения относится к способу введения фармацевтической композиции, путем перорального введения пациенту дважды в сутки указанной композиции, содержащей мини-таблетку или множество мини-таблеток, где указанная композиция содержит до приблизительно 20 мг по существу аморфного или аморфного Соединения 1.
[00626] Другой аспект настоящего изобретения относится к способу введения фармацевтической композиции, путем перорального введения пациенту дважды в сутки указанной композиции, содержащей мини-таблетку или множество мини-таблеток, где указанная композиция содержит до приблизительно 25 мг по существу аморфного или аморфного Соединения 1.
[00627] Другой аспект настоящего изобретения относится к способу введения фармацевтической композиции, путем перорального введения пациенту дважды в сутки указанной композиции, содержащей мини-таблетку или множество мини-таблеток, где указанная композиция содержит до приблизительно 30 мг по существу аморфного или аморфного Соединения 1.
[00628] Другой аспект настоящего изобретения относится к способу введения фармацевтической композиции, путем перорального введения пациенту дважды в сутки указанной композиции, содержащей мини-таблетку или множество мини-таблеток, где указанная композиция содержит до приблизительно 35 мг по существу аморфного или аморфного Соединения 1.
[00629] Другой аспект настоящего изобретения относится к способу введения фармацевтической композиции, путем перорального введения пациенту дважды в сутки указанной композиции, содержащей мини-таблетку или множество мини-таблеток, где указанная композиция содержит до приблизительно 37,5 мг по существу аморфного или аморфного Соединения 1.
[00630] Другой аспект настоящего изобретения относится к способу введения фармацевтической композиции, путем перорального введения пациенту дважды в сутки указанной композиции, содержащей мини-таблетку или множество мини-таблеток, где указанная композиция содержит до приблизительно 40 мг по существу аморфного или аморфного Соединения 1.
[00631] Другой аспект настоящего изобретения относится к способу введения фармацевтической композиции, путем перорального введения пациенту дважды в сутки указанной композиции, содержащей мини-таблетку или множество мини-таблеток, где указанная композиция содержит до приблизительно 45 мг по существу аморфного или аморфного Соединения 1.
[00632] Другой аспект настоящего изобретения относится к способу введения фармацевтической композиции, путем перорального введения пациенту дважды в сутки указанной композиции, содержащей мини-таблетку или множество мини-таблеток, где указанная композиция содержит до приблизительно 50 мг по существу аморфного или аморфного Соединения 1.
[00633] Другой аспект настоящего изобретения относится к способу введения фармацевтической композиции, путем перорального введения пациенту дважды в сутки указанной композиции, содержащей мини-таблетку или множество мини-таблеток, где указанная композиция содержит до приблизительно 62,5 мг по существу аморфного или аморфного Соединения 1.
[00634] Другой аспект настоящего изобретения относится к способу введения фармацевтической композиции, путем перорального введения пациенту дважды в сутки указанной композиции, содержащей мини-таблетку или множество мини-таблеток, где указанная композиция содержит до приблизительно 75 мг по существу аморфного или аморфного Соединения 1.
[00635] Другой аспект настоящего изобретения относится к способу введения фармацевтической композиции, путем перорального введения пациенту дважды в сутки указанной композиции, содержащей мини-таблетку или множество мини-таблеток, где указанная композиция содержит до приблизительно 100 мг по существу аморфного или аморфного Соединения 1.
[00636] Другой аспект настоящего изобретения относится к способу введения фармацевтической композиции, путем перорального введения пациенту дважды в сутки указанной композиции, содержащей мини-таблетку или множество мини-таблеток, где указанная композиция содержит до приблизительно 125 мг по существу аморфного или аморфного Соединения 1.
[00637] Другой аспект настоящего изобретения относится к способу введения фармацевтической композиции, путем перорального введения пациенту дважды в сутки указанной композиции, содержащей мини-таблетку или множество мини-таблеток, где указанная композиция содержит до приблизительно 150 мг по существу аморфного или аморфного Соединения 1.
[00638] Другой аспект настоящего изобретения относится к способу введения фармацевтической композиции, путем перорального введения пациенту дважды в сутки указанной композиции, содержащей мини-таблетку или множество мини-таблеток, где указанная композиция содержит до приблизительно 175 мг по существу аморфного или аморфного Соединения 1.
[00639] Другой аспект настоящего изобретения относится к способу введения фармацевтической композиции, путем перорального введения пациенту дважды в сутки указанной композиции, содержащей мини-таблетку или множество мини-таблеток, где указанная композиция содержит до приблизительно 200 мг по существу аморфного или аморфного Соединения 1.
[00640] Другой аспект настоящего изобретения относится к способу введения фармацевтической композиции, путем перорального введения пациенту дважды в сутки указанной композиции, содержащей мини-таблетку или множество мини-таблеток, где указанная композиция содержит до приблизительно 225 мг по существу аморфного или аморфного Соединения 1.
[00641] Другой аспект настоящего изобретения относится к способу введения фармацевтической композиции, путем перорального введения пациенту дважды в сутки указанной композиции, содержащей мини-таблетку или множество мини-таблеток, где указанная композиция содержит до приблизительно 250 мг по существу аморфного или аморфного Соединения 1.
[00642] Другой аспект настоящего изобретения относится к способу введения фармацевтической композиции, путем перорального введения пациенту однократно каждые 12 часов композиции, содержащей мини-таблетку или множество мини-таблеток, где указанная композиция содержит до приблизительно 1 мг по существу аморфного или аморфного Соединения 1.
[00643] Другой аспект настоящего изобретения относится к способу введения фармацевтической композиции, путем перорального введения пациенту однократно каждые 12 часов композиции, содержащей мини-таблетку или множество мини-таблеток, где указанная композиция содержит до приблизительно 5 мг по существу аморфного или аморфного Соединения 1.
[00644] Другой аспект настоящего изобретения относится к способу введения фармацевтической композиции, путем перорального введения пациенту однократно каждые 12 часов фармацевтической композиции, содержащей мини-таблетку или множество мини-таблеток, где указанная композиция содержит до приблизительно 10 мг по существу аморфного или аморфного Соединения 1.
[00645] Другой аспект настоящего изобретения относится к способу введения фармацевтической композиции, путем перорального введения пациенту однократно каждые 12 часов фармацевтической композиции, содержащей мини-таблетку или множество мини-таблеток, где указанная композиция содержит до приблизительно 12,5 мг по существу аморфного или аморфного Соединения 1.
[00646] Другой аспект настоящего изобретения относится к способу введения фармацевтической композиции, путем перорального введения пациенту однократно каждые 12 часов фармацевтической композиции, содержащей мини-таблетку или множество мини-таблеток, где указанная композиция содержит до приблизительно 15 мг по существу аморфного или аморфного Соединения 1.
[00647] Другой аспект настоящего изобретения относится к способу введения фармацевтической композиции, путем перорального введения пациенту однократно каждые 12 часов фармацевтической композиции, содержащей мини-таблетку или множество мини-таблеток, где указанная композиция содержит до приблизительно 20 мг по существу аморфного или аморфного Соединения 1.
[00648] Другой аспект настоящего изобретения относится к способу введения фармацевтической композиции, путем перорального введения пациенту однократно каждые 12 часов фармацевтической композиции, содержащей мини-таблетку или множество мини-таблеток, где указанная композиция содержит до приблизительно 25 мг по существу аморфного или аморфного Соединения 1.
[00649] Другой аспект настоящего изобретения относится к способу введения фармацевтической композиции, путем перорального введения пациенту однократно каждые 12 часов фармацевтической композиции, содержащей мини-таблетку или множество мини-таблеток, где указанная композиция содержит до приблизительно 30 мг по существу аморфного или аморфного Соединения 1.
[00650] Другой аспект настоящего изобретения относится к способу введения фармацевтической композиции, путем перорального введения пациенту однократно каждые 12 часов фармацевтической композиции, содержащей мини-таблетку или множество мини-таблеток, где указанная композиция содержит до приблизительно 35 мг по существу аморфного или аморфного Соединения 1.
[00651] Другой аспект настоящего изобретения относится к способу введения фармацевтической композиции, путем перорального введения пациенту однократно каждые 12 часов фармацевтической композиции, содержащей мини-таблетку или множество мини-таблеток, где указанная композиция содержит до приблизительно 37,5 мг по существу аморфного или аморфного Соединения 1.
[00652] Другой аспект настоящего изобретения относится к способу введения фармацевтической композиции, путем перорального введения пациенту однократно каждые 12 часов фармацевтической композиции, содержащей мини-таблетку или множество мини-таблеток, где указанная композиция содержит до приблизительно 40 мг по существу аморфного или аморфного Соединения 1.
[00653] Другой аспект настоящего изобретения относится к способу введения фармацевтической композиции, путем перорального введения пациенту однократно каждые 12 часов фармацевтической композиции, содержащей мини-таблетку или множество мини-таблеток, где указанная композиция содержит до приблизительно 45 мг по существу аморфного или аморфного Соединения 1.
[00654] Другой аспект настоящего изобретения относится к способу введения фармацевтической композиции, путем перорального введения пациенту однократно каждые 12 часов фармацевтической композиции, содержащей мини-таблетку или множество мини-таблеток, где указанная композиция содержит до приблизительно 50 мг по существу аморфного или аморфного Соединения 1.
[00655] Другой аспект настоящего изобретения относится к способу введения фармацевтической композиции, путем перорального введения пациенту однократно каждые 12 часов фармацевтической композиции, содержащей мини-таблетку или множество мини-таблеток, где указанная композиция содержит до приблизительно 62,5 мг по существу аморфного или аморфного Соединения 1.
[00656] Другой аспект настоящего изобретения относится к способу введения фармацевтической композиции, путем перорального введения пациенту однократно каждые 12 часов фармацевтической композиции, содержащей мини-таблетку или множество мини-таблеток, где указанная композиция содержит до приблизительно 75 мг по существу аморфного или аморфного Соединения 1.
[00657] Другой аспект настоящего изобретения относится к способу введения фармацевтической композиции, путем перорального введения пациенту однократно каждые 12 часов фармацевтической композиции, содержащей мини-таблетку или множество мини-таблеток, где указанная композиция содержит до приблизительно 100 мг по существу аморфного или аморфного Соединения 1.
[00658] Другой аспект настоящего изобретения относится к способу введения фармацевтической композиции, путем перорального введения пациенту однократно каждые 12 часов фармацевтической композиции, содержащей мини-таблетку или множество мини-таблеток, где указанная композиция содержит до приблизительно 125 мг по существу аморфного или аморфного Соединения 1.
[00659] Другой аспект настоящего изобретения относится к способу введения фармацевтической композиции, путем перорального введения пациенту однократно каждые 12 часов фармацевтической композиции, содержащей мини-таблетку или множество мини-таблеток, где указанная композиция содержит до приблизительно 150 мг по существу аморфного или аморфного Соединения 1.
[00660] Другой аспект настоящего изобретения относится к способу введения фармацевтической композиции, путем перорального введения пациенту однократно каждые 12 часов фармацевтической композиции, содержащей мини-таблетку или множество мини-таблеток, где указанная композиция содержит до приблизительно 175 мг по существу аморфного или аморфного Соединения 1.
[00661] Другой аспект настоящего изобретения относится к способу введения фармацевтической композиции, путем перорального введения пациенту однократно каждые 12 часов фармацевтической композиции, содержащей мини-таблетку или множество мини-таблеток, где указанная композиция содержит до приблизительно 200 мг по существу аморфного или аморфного Соединения 1.
[00662] Другой аспект настоящего изобретения относится к способу введения фармацевтической композиции, путем перорального введения пациенту однократно каждые 12 часов фармацевтической композиции, содержащей мини-таблетку или множество мини-таблеток, где указанная композиция содержит до приблизительно 225 мг по существу аморфного или аморфного Соединения 1.
[00663] Другой аспект настоящего изобретения относится к способу введения фармацевтической композиции, путем перорального введения пациенту однократно каждые 12 часов фармацевтической композиции, содержащей мини-таблетку или множество мини-таблеток, где указанная композиция содержит до приблизительно 250 мг по существу аморфного или аморфного Соединения 1.
[00664] В других аспектах настоящего изобретения фармацевтическую композицию, описанную в настоящей заявке, вводят перорально пациенту однократно каждые 24 часа.
[00665] Другой аспект настоящего изобретения относится к способу введения фармацевтической композиции, путем перорального введения пациенту один раз в сутки указанной композиции, содержащей мини-таблетку или множество мини-таблеток, где указанная композиция содержит по меньшей мере приблизительно 10 мг по существу аморфного или аморфного Соединения 1.
[00666] Другой аспект настоящего изобретения относится к способу введения фармацевтической композиции, путем перорального введения пациенту один раз в сутки указанной композиции, содержащей мини-таблетку или множество мини-таблеток, где указанная композиция содержит по меньшей мере приблизительно 12,5 мг по существу аморфного или аморфного Соединения 1.
[00667] Другой аспект настоящего изобретения относится к способу введения фармацевтической композиции, путем перорального введения пациенту один раз в сутки указанной композиции, содержащей мини-таблетку или множество мини-таблеток, где указанная композиция содержит по меньшей мере приблизительно 15 мг по существу аморфного или аморфного Соединения 1.
[00668] Другой аспект настоящего изобретения относится к способу введения фармацевтической композиции, путем перорального введения пациенту один раз в сутки указанной композиции, содержащей мини-таблетку или множество мини-таблеток, где указанная композиция содержит по меньшей мере приблизительно 20 мг по существу аморфного или аморфного Соединения 1.
[00669] Другой аспект настоящего изобретения относится к способу введения фармацевтической композиции, путем перорального введения пациенту один раз в сутки указанной композиции, содержащей мини-таблетку или множество мини-таблеток, где указанная композиция содержит по меньшей мере приблизительно 25 мг по существу аморфного или аморфного Соединения 1.
[00670] Другой аспект настоящего изобретения относится к способу введения фармацевтической композиции, путем перорального введения пациенту один раз в сутки указанной композиции, содержащей мини-таблетку или множество мини-таблеток, где указанная композиция содержит по меньшей мере приблизительно 30 мг по существу аморфного или аморфного Соединения 1.
[00671] Другой аспект настоящего изобретения относится к способу введения фармацевтической композиции, путем перорального введения пациенту один раз в сутки указанной композиции, содержащей мини-таблетку или множество мини-таблеток, где указанная композиция содержит по меньшей мере приблизительно 35 мг по существу аморфного или аморфного Соединения 1.
[00672] Другой аспект настоящего изобретения относится к способу введения фармацевтической композиции, путем перорального введения пациенту один раз в сутки указанной композиции, содержащей мини-таблетку или множество мини-таблеток, где указанная композиция содержит по меньшей мере приблизительно 37,5 мг по существу аморфного или аморфного Соединения 1.
[00673] Другой аспект настоящего изобретения относится к способу введения фармацевтической композиции, путем перорального введения пациенту один раз в сутки указанной композиции, содержащей мини-таблетку или множество мини-таблеток, где указанная композиция содержит по меньшей мере приблизительно 40 мг по существу аморфного или аморфного Соединения 1.
[00674] Другой аспект настоящего изобретения относится к способу введения фармацевтической композиции, путем перорального введения пациенту один раз в сутки указанной композиции, содержащей мини-таблетку или множество мини-таблеток, где указанная композиция содержит по меньшей мере приблизительно 45 мг по существу аморфного или аморфного Соединения 1.
[00675] Другой аспект настоящего изобретения относится к способу введения фармацевтической композиции, путем перорального введения пациенту один раз в сутки указанной композиции, содержащей мини-таблетку или множество мини-таблеток, где указанная композиция содержит по меньшей мере приблизительно 50 мг по существу аморфного или аморфного Соединения 1.
[00676] Другой аспект настоящего изобретения относится к способу введения фармацевтической композиции, путем перорального введения пациенту один раз в сутки указанной композиции, содержащей мини-таблетку или множество мини-таблеток, где указанная композиция содержит по меньшей мере приблизительно 62,5 мг по существу аморфного или аморфного Соединения 1.
[00677] Другой аспект настоящего изобретения относится к способу введения фармацевтической композиции, путем перорального введения пациенту один раз в сутки указанной композиции, содержащей мини-таблетку или множество мини-таблеток, где указанная композиция содержит по меньшей мере приблизительно 75 мг по существу аморфного или аморфного Соединения 1.
[00678] Другой аспект настоящего изобретения относится к способу введения фармацевтической композиции, путем перорального введения пациенту один раз в сутки указанной композиции, содержащей мини-таблетку или множество мини-таблеток, где указанная композиция содержит по меньшей мере приблизительно 100 мг по существу аморфного или аморфного Соединения 1.
[00679] Другой аспект настоящего изобретения относится к способу введения фармацевтической композиции, путем перорального введения пациенту один раз в сутки указанной композиции, содержащей мини-таблетку или множество мини-таблеток, где указанная композиция содержит по меньшей мере приблизительно 125 мг по существу аморфного или аморфного Соединения 1.
[00680] Другой аспект настоящего изобретения относится к способу введения фармацевтической композиции, путем перорального введения пациенту один раз в сутки указанной композиции, содержащей мини-таблетку или множество мини-таблеток, где указанная композиция содержит по меньшей мере приблизительно 150 мг по существу аморфного или аморфного Соединения 1.
[00681] Другой аспект настоящего изобретения относится к способу введения фармацевтической композиции, путем перорального введения пациенту один раз в сутки указанной композиции, содержащей мини-таблетку или множество мини-таблеток, где указанная композиция содержит по меньшей мере приблизительно 175 мг по существу аморфного или аморфного Соединения 1.
[00682] Другой аспект настоящего изобретения относится к способу введения фармацевтической композиции, путем перорального введения пациенту один раз в сутки указанной композиции, содержащей мини-таблетку или множество мини-таблеток, где указанная композиция содержит по меньшей мере приблизительно 200 мг по существу аморфного или аморфного Соединения 1.
[00683] Другой аспект настоящего изобретения относится к способу введения фармацевтической композиции, путем перорального введения пациенту один раз в сутки указанной композиции, содержащей мини-таблетку или множество мини-таблеток, где указанная композиция содержит по меньшей мере приблизительно 225 мг по существу аморфного или аморфного Соединения 1.
[00684] Другой аспект настоящего изобретения относится к способу введения фармацевтической композиции, путем перорального введения пациенту один раз в сутки указанной композиции, содержащей мини-таблетку или множество мини-таблеток, где указанная композиция содержит по меньшей мере приблизительно 250 мг по существу аморфного или аморфного Соединения 1.
[00685] Другой аспект настоящего изобретения относится к способу введения фармацевтической композиции, предусматривающему пероральное введение пациенту по меньшей мере один раз в сутки по меньшей мере одной капсулы или пачки, содержащей мини-таблетку или множество мини-таблеток (в одном примере в интервале приблизительно от 2 до 20; приблизительно от 2 до 6; приблизительно от 5 до 15; приблизительно от 20 до 50, приблизительно от 25 до приблизительно 35, или приблизительно от 27 до приблизительно 32 мини-таблеток, например, 6, 10, 29 или 48 мини-таблеток на капсулу или пачку, и в конкретном примере 29 мини-таблеток на капсулу или пачку; в другом примере в интервале от приблизительно 1 до приблизительно 20; в другом примере 1 мини-таблетку на капсулу или пачку или 2, 3, 4, 5, 7, 8, 10, 15 или 20 таблеток на капсулу, пачку или множество капсул или пачек), и где каждая мини-таблетка содержит фармацевтическую композицию, содержащую твердую дисперсию по существу аморфного Соединения 1, один или более наполнителей, подсластитель, разрыхлитель, необязательно увлажнитель, скользящее вещество и смазывающее вещество, каждое из которых описано выше и в приведенных ниже примерах, где твердая дисперсия содержит до приблизительно 5 мг (например, приблизительно 0,25 мг, приблизительно 0,5 мг, приблизительно 0,75 мг, приблизительно 1 мг, приблизительно 1,25 мг, приблизительно 1,5 мг, приблизительно 1,75 мг, приблизительно 2 мг, приблизительно 2,25 мг, приблизительно 2,5 мг, приблизительно 2,75 мг, приблизительно 3 мг, приблизительно 3,25 мг, приблизительно 3,5 мг, приблизительно 3,75 мг, приблизительно 4 мг, приблизительно 4,25 мг, приблизительно 4,5 мг или приблизительно 4,75 мг) по существу аморфного или аморфного Соединения 1.
[00686] Другой аспект настоящего изобретения относится к способу введения фармацевтической композиции, предусматривающему пероральное введение пациенту по меньшей мере один раз в сутки по меньшей мере одной капсулы или пачки, содержащей мини-таблетку или множество мини-таблеток (в одном примере в интервале приблизительно от 2 до 20, приблизительно от 2 до 6, приблизительно от 5 до 15, приблизительно от 20 до 50, приблизительно от 25 до приблизительно 35 или от приблизительно 27 до приблизительно 32 мини-таблеток, например, 6, 10, 29 или 48 мини-таблеток на капсулу или пачку, и в конкретном примере 29 мини-таблеток на капсулу или пачку; в другом примере в интервале от приблизительно 1 до приблизительно 20; в другом примере 1 мини-таблетку на капсулу или пачку, или 2, 3, 4, 5, 7, 8, 10, 15 или 20 мини-таблеток на капсулу, пачку или множество капсул или пачек), и где каждая мини-таблетка содержит фармацевтическую композицию, содержащую твердую дисперсию по существу аморфного Соединения 1, один или более наполнителей, подсластитель, разрыхлитель, скользящее вещество и смазывающее вещество, каждое из которых описано выше и в приведенных ниже примерах, где твердая дисперсия содержит до приблизительно 5 мг (например, приблизительно 0,25 мг, приблизительно 0,5 мг, приблизительно 0,75 мг, приблизительно 1 мг, приблизительно 1,25 мг, приблизительно 1,5 мг, приблизительно 1,75 мг, приблизительно 2 мг, приблизительно 2,25 мг, приблизительно 2,5 мг, приблизительно 2,75 мг, приблизительно 3 мг, приблизительно 3,25 мг, приблизительно 3,5 мг, приблизительно 3,75 мг, приблизительно 4 мг, приблизительно 4,25 мг, приблизительно 4,5 мг или приблизительно 4,75 мг) по существу аморфного или аморфного Соединения 1.
[00687] Другой аспект настоящего изобретения относится к способу введения фармацевтической композиции, предусматривающему пероральное введение пациенту по меньшей мере один раз в сутки мини-таблетки или множества мини-таблеток (например, в интервале от приблизительно 20 до 40, от приблизительно 25 до приблизительно 35 или от приблизительно 27 до приблизительно 32 мини-таблеток на капсулу или пачку, например, 21, 26, 39 и 52 мини-таблетки), и где каждая мини-таблетка содержит фармацевтическую композицию, содержащую твердую дисперсию по существу аморфного Соединения 1, один или более наполнителей, подсластитель, разрыхлитель, необязательно увлажнитель, скользящее вещество и смазывающее вещество, каждое из которых описано выше и в приведенных ниже примерах, и где указанная мини-таблетка или множество мини-таблеток в совокупности содержит до приблизительно 250 мг (например, приблизительно 5 мг, приблизительно 10 мг, приблизительно 12,5 мг, приблизительно 15 мг, приблизительно 20 мг, приблизительно 25 мг, приблизительно 30 мг, приблизительно 35 мг, приблизительно 37,5 мг, приблизительно 40 мг, приблизительно 45 мг, приблизительно 50 мг, приблизительно 55 мг, приблизительно 60 мг, приблизительно 62,5 мг, приблизительно 65 мг, приблизительно 70 мг, приблизительно 75 мг, приблизительно 80 мг, приблизительно 85 мг, приблизительно 87,5 мг, приблизительно 90 мг, приблизительно 95 мг, приблизительно 100 мг, приблизительно 110 мг, приблизительно 112,5 мг, приблизительно 120 мг, приблизительно 125 мг, приблизительно 130 мг, приблизительно 137,5 мг, приблизительно 140 мг, приблизительно 150 мг, приблизительно 160 мг, приблизительно 162,5 мг, приблизительно 170 мг, приблизительно 175 мг, приблизительно 187,5 мг, приблизительно 200 мг, приблизительно 212,5 мг, приблизительно 225 мг, приблизительно 237,5 мг или приблизительно 250 мг) по существу аморфного или аморфного Соединения 1.
[00688] Другой аспект настоящего изобретения относится к способу введения фармацевтической композиции, предусматривающему пероральное введение пациенту по меньшей мере один раз в сутки мини-таблетки или множества мини-таблеток (например, в интервале от приблизительно 1 до приблизительно 140, от приблизительно 20 до приблизительно 100, от приблизительно 20 до приблизительно 80, от приблизительно 20 до приблизительно 60, от приблизительно 20 до приблизительно 40, от приблизительно 25 до приблизительно 35 или от приблизительно 27 до приблизительно 32 мини-таблеток на капсулу или пачку), и где каждая мини-таблетка содержит фармацевтическую композицию, содержащую твердую дисперсию по существу аморфного Соединения 1, один или более наполнителей, подсластитель, разрыхлитель, скользящее вещество и смазывающее вещество, каждое из которых описано выше и в приведенных ниже примерах, и где указанная мини-таблетка или множество мини-таблеток содержит до приблизительно 250 мг (например, приблизительно 5 мг, приблизительно 10 мг, 12,5 мг, приблизительно 15 мг, приблизительно 20 мг, приблизительно 25 мг, приблизительно 30 мг, приблизительно 35 мг, приблизительно 37,5 мг, приблизительно 40 мг, приблизительно 45 мг, приблизительно 50 мг, приблизительно 55 мг, приблизительно 60 мг, приблизительно 62,5 мг, приблизительно 65 мг, приблизительно 70 мг, приблизительно 75 мг, приблизительно 80 мг, приблизительно 85 мг, приблизительно 87,5 мг, приблизительно 90 мг, приблизительно 95 мг, приблизительно 100 мг приблизительно 110 мг, приблизительно 112,5 мг, приблизительно 120 мг, приблизительно 125 мг, приблизительно 130 мг, приблизительно 137,5 мг, приблизительно 140 мг, приблизительно 150 мг, приблизительно 160 мг, приблизительно 162,5 мг, приблизительно 170 мг, приблизительно 175 мг, приблизительно 187,5 мг, приблизительно 200 мг, приблизительно 212,5 мг, приблизительно 225 мг, приблизительно 237,5 мг или приблизительно 250 мг) по существу аморфного или аморфного Соединения 1.
[00689] Другой аспект настоящего изобретения относится к способу введения фармацевтической композиции путем перорального введения пациенту детского возраста каждые 12 часов, где указанная композиция содержит 50 мг по существу аморфного или аморфного Соединения 1; где указанная композиция может быть в форме таблетки, мини-таблетки, гранул, пеллет, пастилок и других лекарственных форм. В одном варианте осуществления пациенту детского возраста от двух до пяти лет. В другом варианте осуществления масса тела пациента детского возраста составляет менее 14 килограммов.
[00690] Один аспект настоящего изобретения относится к способу введения фармацевтической композиции путем перорального введения пациенту детского возраста каждые 12 часов, где указанная композиция содержит 50 мг по существу аморфного или аморфного Соединения 1; где указанная композиция может быть в форме таблетки, мини-таблетки, гранул, пеллет, пастилок и других лекарственных форм; где пациенту детского возраста от двух до пяти лет и масса тела которого составляет менее 14 килограммов.
[00691] Другой аспект настоящего изобретения относится к способу введения фармацевтической композиции путем перорального введения пациенту детского возраста каждые 12 часов, где указанная композиция содержит 75 мг по существу аморфного или аморфного Соединения 1; где указанная композиция может быть в форме таблетки, мини-таблетки, гранул, пеллет, пастилок и других лекарственных форм. В одном варианте осуществления пациенту детского возраста от двух до пяти лет. В другом варианте осуществления масса тела пациента детского возраста составляет 14 килограммов или более 14 килограммов.
[00692] Другой аспект настоящего изобретения относится к способу введения фармацевтической композиции путем перорального введения пациенту детского возраста каждые 12 часов, где указанная композиция содержит 75 мг по существу аморфного или аморфного Соединения 1; где указанная композиция может быть в форме таблетки, мини-таблетки, гранул, пеллет, пастилок и других лекарственных форм; где пациенту детского возраста от двух до пяти лет и масса тела которого составляет 14 килограммов или более 14 килограммов.
[00693] Другой аспект настоящего изобретения относится к способу введения фармацевтической композиции путем перорального введения пациенту детского возраста каждые 12 часов, где указанная композиция содержит 50 мг по существу аморфного или аморфного Соединения 1; где указанная композиция может быть в форме таблетки, мини-таблетки, гранул, пеллет, пастилок и других лекарственных форм. В одном варианте осуществления пациенту детского возраста менее 2 лет. В другом варианте осуществления масса тела пациента детского возраста составляет приблизительно от 7,5 килограммов до 14 килограммов.
[00694] Другой аспект настоящего изобретения относится к способу введения фармацевтической композиции путем перорального введения пациенту детского возраста каждые 12 часов, где указанная композиция содержит 50 мг по существу аморфного или аморфного Соединения 1; где указанная композиция может быть в форме таблетки, мини-таблетки, гранул, пеллет, пастилок и других лекарственных форм; где пациенту детского возраста менее двух лет и масса тела которого составляет приблизительно от 7,5 килограммов до 14 килограммов.
[00695] Другой аспект настоящего изобретения относится к способу введения фармацевтической композиции путем перорального введения пациенту детского возраста каждые 12 часов, где указанная композиция содержит 35 мг по существу аморфного или аморфного Соединения 1; где указанная композиция может быть в форме таблетки, мини-таблетки, гранул, пеллет, пастилок и других лекарственных форм. В одном варианте осуществления пациенту детского возраста менее 2 лет. В другом варианте осуществления масса тела пациента детского возраста составляет приблизительно от 5 килограммов до 7,5 килограммов.
[00696] Другой аспект настоящего изобретения относится к способу введения фармацевтической композиции путем перорального введения пациенту детского возраста каждые 12 часов, где указанная композиция содержит 35 мг по существу аморфного или аморфного Соединения 1; где указанная композиция может быть в форме таблетки, мини-таблетки, гранул, пеллет, пастилок и других лекарственных форм; где пациенту детского возраста менее двух лет и масса тела которого составляет приблизительно от 5 килограммов до 7,5 килограммов.
[00697] Другой аспект настоящего изобретения относится к способу введения фармацевтической композиции путем перорального введения пациенту детского возраста каждые 12 часов, где указанная композиция содержит 35 мг по существу аморфного или аморфного Соединения 1; где указанная композиция может быть в форме таблетки, мини-таблетки, гранул, пеллет, пастилок и других лекарственных форм. В одном варианте осуществления пациенту детского возраста менее 2 лет. В другом варианте осуществления масса тела пациента детского возраста составляет менее 7,5 килограммов.
[00698] Другой аспект настоящего изобретения относится к способу введения фармацевтической композиции путем перорального введения пациенту детского возраста каждые 12 часов, где указанная композиция содержит 35 мг по существу аморфного или аморфного Соединения 1; где указанная композиция может быть в форме таблетки, мини-таблетки, гранул, пеллет, пастилок и других лекарственных форм; где пациенту детского возраста менее двух лет и масса тела которого составляет менее 7,5 килограммов.
[00699] Другой аспект настоящего изобретения относится к способу введения фармацевтической композиции путем перорального введения пациенту детского возраста каждые 12 часов, где указанная композиция содержит 35 мг по существу аморфного или аморфного Соединения 1; где указанная композиция может быть в форме таблетки, мини-таблетки, гранул, пеллет, пастилок и других лекарственных форм. В одном варианте осуществления пациенту детского возраста менее 2 лет. В другом варианте осуществления масса тела пациента детского возраста составляет 5 килограммов или более 5 килограммов.
[00700] Другой аспект настоящего изобретения относится к способу введения фармацевтической композиции путем перорального введения пациенту детского возраста каждые 12 часов, где указанная композиция содержит 35 мг по существу аморфного или аморфного Соединения 1; где указанная композиция может быть в форме таблетки, мини-таблетки, гранул, пеллет, пастилок и других лекарственных форм; где пациенту детского возраста менее двух лет и масса тела которого составляет 5 килограммов или более 5 килограммов.
[00701] Другой аспект настоящего изобретения относится к способу введения фармацевтической композиции путем перорального введения пациенту детского возраста каждые 12 часов, где указанная композиция содержит 25 мг по существу аморфного или аморфного Соединения 1; где указанная композиция может быть в форме таблетки, мини-таблетки, гранул, пеллет, пастилок и других лекарственных форм. В одном варианте осуществления пациенту детского возраста менее 2 лет. В другом варианте осуществления масса тела пациента детского возраста составляет приблизительно от 2,5 килограммов до 5 килограммов.
[00702] Другой аспект настоящего изобретения относится к способу введения фармацевтической композиции путем перорального введения пациенту детского возраста каждые 12 часов, где указанная композиция содержит 25 мг по существу аморфного или аморфного Соединения 1; где указанная композиция может быть в форме таблетки, мини-таблетки, гранул, пеллет, пастилок и других лекарственных форм; где пациенту детского возраста менее двух лет и масса тела которого составляет приблизительно от 2,5 килограммов до 5 килограммов.
[00703] Другой аспект настоящего изобретения относится к способу введения фармацевтической композиции путем перорального введения пациенту детского возраста каждые 12 часов, где указанная композиция содержит 25 мг по существу аморфного или аморфного Соединения 1; где указанная композиция может быть в форме таблетки, мини-таблетки, гранул, пеллет, пастилок и других лекарственных форм. В одном варианте осуществления пациенту детского возраста менее 2 лет. В другом варианте осуществления масса тела пациента детского возраста составляет менее 5 килограммов.
[00704] Другой аспект настоящего изобретения относится к способу введения фармацевтической композиции путем перорального введения пациенту детского возраста каждые 12 часов, где указанная композиция содержит 25 мг по существу аморфного или аморфного Соединения 1; где указанная композиция может быть в форме таблетки, мини-таблетки, гранул, пеллет, пастилок и других лекарственных форм; где пациенту детского возраста менее двух лет и масса тела которого составляет менее 5 килограммов.
[00705] Другой аспект настоящего изобретения относится к способу введения фармацевтической композиции путем перорального введения пациенту детского возраста каждые 12 часов, где указанная композиция содержит 25 мг по существу аморфного или аморфного Соединения 1; где указанная композиция может быть в форме таблетки, мини-таблетки, гранул, пеллет, пастилок и других лекарственных форм. В одном варианте осуществления пациенту детского возраста менее 2 лет. В другом варианте осуществления масса тела пациента детского возраста составляет 2,5 килограмм или более 2,5 килограммов.
[00706] Другой аспект настоящего изобретения относится к способу введения фармацевтической композиции путем перорального введения пациенту детского возраста каждые 12 часов, где указанная композиция содержит 25 мг по существу аморфного или аморфного Соединения 1; где указанная композиция может быть в форме таблетки, мини-таблетки, гранул, пеллет, пастилок и других лекарственных форм; где пациенту детского возраста менее двух лет и масса тела которого составляет 2,5 килограммов или более 2,5 килограммов.
[00707] Другой аспект настоящего изобретения относится к способу введения фармацевтической композиции путем перорального введения пациенту детского возраста каждые 12 часов, где указанная композиция содержит 50 мг по существу аморфного или аморфного Соединения 1; где указанная композиция может быть в форме таблетки, мини-таблетки, гранул, пеллет, пастилок и других лекарственных форм; где пациенту детского возраста от двух до пяти лет и который имеет мутацию воротного механизма CFTR по меньшей мере в одной аллели. Другой аспект настоящего изобретения относится к способу введения фармацевтической композиции путем перорального введения пациенту детского возраста каждые 12 часов, где указанная композиция содержит 50 мг по существу аморфного или аморфного Соединения 1; где указанная композиция может быть в форме таблетки, мини-таблетки, гранул, пеллет, пастилок и других лекарственных форм; где пациенту детского возраста менее двух лет и который имеет мутацию воротного механизма CFTR по меньшей мере в одной аллели.
[00708] Другой аспект настоящего изобретения относится к способу введения фармацевтической композиции путем перорального введения пациенту детского возраста каждые 12 часов, где указанная композиция содержит 75 мг по существу аморфного или аморфного Соединения 1; где указанная композиция может быть в форме таблетки, мини-таблетки, гранул, пеллет, пастилок и других лекарственных форм; где пациенту детского возраста от двух до пяти лет и который имеет мутацию воротного механизма CFTR по меньшей мере в одной аллели. Другой аспект настоящего изобретения относится к способу введения фармацевтической композиции путем перорального введения пациенту детского возраста каждые 12 часов, где указанная композиция содержит 75 мг по существу аморфного или аморфного Соединения 1; где указанная композиция может быть в форме таблетки, мини-таблетки, гранул, пеллет, пастилок и других лекарственных форм; где пациенту детского возраста менее двух лет и который имеет мутацию воротного механизма CFTR по меньшей мере в одной аллели.
[00709] Другой аспект настоящего изобретения относится к способу введения фармацевтической композиции путем перорального введения пациенту детского возраста каждые 12 часов, где указанная композиция содержит 75 мг по существу аморфного или аморфного Соединения 1; где указанная композиция может быть в форме таблетки, мини-таблетки, гранул, пеллет, пастилок и других лекарственных форм; где масса тела пациента детского возраста составляет 14 килограммов или более и у которого имеется мутация воротного механизма CFTR по меньшей мере в одной аллели. Другой аспект настоящего изобретения относится к способу введения фармацевтической композиции путем перорального введения пациенту детского возраста каждые 12 часов, где указанная композиция содержит 50 мг по существу аморфного или аморфного Соединения 1; где указанная композиция может быть в форме таблетки, мини-таблетки, гранул, пеллет, пастилок и других лекарственных форм; где масса тела пациента детского возраста составляет менее 14 килограммов и у которого имеется мутация воротного механизма CFTR по меньшей мере в одной аллели. Другой аспект настоящего изобретения относится к способу введения фармацевтической композиции путем перорального введения пациенту детского возраста каждые 12 часов, где указанная композиция содержит 50 мг по существу аморфного или аморфного Соединения 1; где указанная композиция может быть в форме таблетки, мини-таблетки, гранул, пеллет, пастилок и других лекарственных форм; где масса тела пациента детского возраста составляет приблизительно от 7,5 килограммов до 14 килограммов и у которого имеется мутация воротного механизма CFTR по меньшей мере в одной аллели. Другой аспект настоящего изобретения относится к способу введения фармацевтической композиции путем перорального введения пациенту детского возраста каждые 12 часов, где указанная композиция содержит 35 мг по существу аморфного или аморфного Соединения 1; где указанная композиция может быть в форме таблетки, мини-таблетки, гранул, пеллет, пастилок и других лекарственных форм; где масса тела пациента детского возраста составляет приблизительно от 5 килограммов до 7,5 килограммов и у которого имеется мутация воротного механизма CFTR по меньшей мере в одной аллели. Другой аспект настоящего изобретения относится к способу введения фармацевтической композиции путем перорального введения пациенту детского возраста каждые 12 часов, где указанная композиция содержит 25 мг по существу аморфного или аморфного Соединения 1; где указанная композиция может быть в форме таблетки, мини-таблетки, гранул, пеллет, пастилок и других лекарственных форм; где масса тела пациента детского возраста составляет приблизительно от 2,5 килограммов до 5 килограммов и у которого имеется мутация воротного механизма CFTR по меньшей мере в одной аллели.
[00710] В некоторых вариантах осуществления настоящее изобретение относится к способу введения фармацевтической композиции, предусматривающему пероральное введение пациенту единичной дозированной формы, содержащей мини-таблетку или множество мини-таблеток, где каждая из мини-таблеток содержит:
a) твердую дисперсию по существу аморфного или аморфного Соединения 1 и полимера, указанный полимер содержит HPMCAS;
b) один или более наполнителей;
c) подсластитель;
d) разрыхлитель;
e) необязательно увлажнитель;
f) скользящее вещество; и
g) смазывающее вещество,
где единичная дозированная форма содержит количество по существу аморфного Соединения 1 или аморфного Соединения 1 в интервале от приблизительно 1 мг до приблизительно 250 мг.
[00711] В некоторых вариантах осуществления настоящее изобретение относится к способу введения фармацевтической композиции, предусматривающему пероральное введение пациенту единичной дозированной формы, содержащей мини-таблетку или множество мини-таблеток, где каждая из мини-таблеток содержит:
a) твердую дисперсию по существу аморфного или аморфного Соединения 1 и полимера, указанный полимер содержит HPMCAS;
b) один или более наполнителей;
c) подсластитель;
d) разрыхлитель;
e) необязательно увлажнитель;
f) скользящее вещество; и
g) смазывающее вещество,
где единичная дозированная форма содержит приблизительно 15 мг по существу аморфного Соединения 1 или аморфного Соединения 1.
[00712] В некоторых вариантах осуществления настоящее изобретение относится к способу введения фармацевтической композиции, предусматривающему пероральное введение пациенту единичной дозированной формы, содержащей мини-таблетку или множество мини-таблеток, где каждая из мини-таблеток содержит:
a) твердую дисперсию по существу аморфного или аморфного Соединения 1 и полимера, указанный полимер содержит HPMCAS;
b) один или более наполнителей;
c) подсластитель;
d) разрыхлитель;
e) необязательно увлажнитель;
f) скользящее вещество; и
g) смазывающее вещество,
где единичная дозированная форма содержит приблизительно 5 мг по существу аморфного Соединения 1 или аморфного Соединения 1.
[00713] В некоторых вариантах осуществления настоящее изобретение относится к способу введения фармацевтической композиции, предусматривающему пероральное введение пациенту единичной дозированной формы, содержащей мини-таблетку или множество мини-таблеток, где каждая из мини-таблеток содержит:
a) твердую дисперсию по существу аморфного или аморфного Соединения 1 и полимера, указанный полимер содержит HPMCAS;
b) один или более наполнителей;
c) подсластитель;
d) разрыхлитель;
e) необязательно увлажнитель;
f) скользящее вещество; и
g) смазывающее вещество,
где единичная дозированная форма содержит приблизительно 10 мг по существу аморфного Соединения 1 или аморфного Соединения 1.
[00714] В некоторых вариантах осуществления настоящее изобретение относится к способу введения фармацевтической композиции, предусматривающему пероральное введение пациенту единичной дозированной формы, содержащей мини-таблетку или множество мини-таблеток, где каждая из мини-таблеток содержит:
a) твердую дисперсию по существу аморфного или аморфного Соединения 1 и полимера, указанный полимер содержит HPMCAS;
b) один или более наполнителей;
c) подсластитель;
d) разрыхлитель;
e) необязательно увлажнитель;
f) скользящее вещество; и
g) смазывающее вещество,
где единичная дозированная форма содержит приблизительно 12,5 мг по существу аморфного Соединения 1 или аморфного Соединения 1.
[00715] В некоторых вариантах осуществления настоящее изобретение относится к способу введения фармацевтической композиции, предусматривающему пероральное введение пациенту единичной дозированной формы, содержащей мини-таблетку или множество мини-таблеток, где каждая из мини-таблеток содержит:
a) твердую дисперсию по существу аморфного или аморфного Соединения 1 и полимера, указанный полимер содержит HPMCAS;
b) один или более наполнителей;
c) подсластитель;
d) разрыхлитель;
e) необязательно увлажнитель;
f) скользящее вещество; и
g) смазывающее вещество,
где единичная дозированная форма содержит приблизительно 20 мг по существу аморфного Соединения 1 или аморфного Соединения 1.
[00716] В некоторых вариантах осуществления настоящее изобретение относится к способу введения фармацевтической композиции, предусматривающему пероральное введение пациенту единичной дозированной формы, содержащей мини-таблетку или множество мини-таблеток, где каждая из мини-таблеток содержит:
a) твердую дисперсию по существу аморфного или аморфного Соединения 1 и полимера, указанный полимер содержит HPMCAS;
b) один или более наполнителей;
c) подсластитель;
d) разрыхлитель;
e) необязательно увлажнитель;
f) скользящее вещество; и
g) смазывающее вещество,
где единичная дозированная форма содержит приблизительно 25 мг по существу аморфного Соединения 1 или аморфного Соединения 1.
[00717] В некоторых вариантах осуществления настоящее изобретение относится к способу введения фармацевтической композиции, предусматривающему пероральное введение пациенту единичной дозированной формы, содержащей мини-таблетку или множество мини-таблеток, где каждая из мини-таблеток содержит:
a) твердую дисперсию по существу аморфного или аморфного Соединения 1 и полимера, указанный полимер содержит HPMCAS;
b) один или более наполнителей;
c) подсластитель;
d) разрыхлитель;
e) необязательно увлажнитель;
f) скользящее вещество; и
g) смазывающее вещество,
где единичная дозированная форма содержит приблизительно 30 мг по существу аморфного Соединения 1 или аморфного Соединения 1.
[00718] В некоторых вариантах осуществления настоящее изобретение относится к способу введения фармацевтической композиции, предусматривающему пероральное введение пациенту единичной дозированной формы, содержащей мини-таблетку или множество мини-таблеток, где каждая из мини-таблеток содержит:
a) твердую дисперсию по существу аморфного или аморфного Соединения 1 и полимера, указанный полимер содержит HPMCAS;
b) один или более наполнителей;
c) подсластитель;
d) разрыхлитель;
e) необязательно увлажнитель;
f) скользящее вещество; и
g) смазывающее вещество,
где единичная дозированная форма содержит приблизительно 35 мг по существу аморфного Соединения 1 или аморфного Соединения 1.
[00719] В некоторых вариантах осуществления настоящее изобретение относится к способу введения фармацевтической композиции, предусматривающему пероральное введение пациенту единичной дозированной формы, содержащей мини-таблетку или множество мини-таблеток, где каждая из мини-таблеток содержит:
a) твердую дисперсию по существу аморфного или аморфного Соединения 1 и полимера, указанный полимер содержит HPMCAS;
b) один или более наполнителей;
c) подсластитель;
d) разрыхлитель;
e) необязательно увлажнитель;
f) скользящее вещество; и
g) смазывающее вещество,
где единичная дозированная форма содержит приблизительно 37,5 мг по существу аморфного Соединения 1 или аморфного Соединения 1.
[00720] В некоторых вариантах осуществления настоящее изобретение относится к способу введения фармацевтической композиции, предусматривающему пероральное введение пациенту единичной дозированной формы, содержащей мини-таблетку или множество мини-таблеток, где каждая из мини-таблеток содержит:
a) твердую дисперсию по существу аморфного или аморфного Соединения 1 и полимера, указанный полимер содержит HPMCAS;
b) один или более наполнителей;
c) подсластитель;
d) разрыхлитель;
e) необязательно увлажнитель;
f) скользящее вещество; и
g) смазывающее вещество,
где единичная дозированная форма содержит приблизительно 40 мг по существу аморфного Соединения 1 или аморфного Соединения 1.
[00721] В некоторых вариантах осуществления настоящее изобретение относится к способу введения фармацевтической композиции, предусматривающему пероральное введение пациенту единичной дозированной формы, содержащей мини-таблетку или множество мини-таблеток, где каждая из мини-таблеток содержит:
a) твердую дисперсию по существу аморфного или аморфного Соединения 1 и полимера, указанный полимер содержит HPMCAS;
b) один или более наполнителей;
c) подсластитель;
d) разрыхлитель;
e) необязательно увлажнитель;
f) скользящее вещество; и
g) смазывающее вещество,
где единичная дозированная форма содержит приблизительно 45 мг по существу аморфного Соединения 1 или аморфного Соединения 1.
[00722] В некоторых вариантах осуществления настоящее изобретение относится к способу введения фармацевтической композиции, предусматривающему пероральное введение пациенту единичной дозированной формы, содержащей мини-таблетку или множество мини-таблеток, где каждая из мини-таблеток содержит:
a) твердую дисперсию по существу аморфного или аморфного Соединения 1 и полимера, указанный полимер содержит HPMCAS;
b) один или более наполнителей;
c) подсластитель;
d) разрыхлитель;
e) необязательно увлажнитель;
f) скользящее вещество; и
g) смазывающее вещество,
где единичная дозированная форма содержит приблизительно 50 мг по существу аморфного Соединения 1 или аморфного Соединения 1.
[00723] В некоторых вариантах осуществления настоящее изобретение относится к способу введения фармацевтической композиции, предусматривающему пероральное введение пациенту единичной дозированной формы, содержащей мини-таблетку или множество мини-таблеток, где каждая из мини-таблеток содержит:
a) твердую дисперсию по существу аморфного или аморфного Соединения 1 и полимера, указанный полимер содержит HPMCAS;
b) один или более наполнителей;
c) подсластитель;
d) разрыхлитель;
e) необязательно увлажнитель;
f) скользящее вещество; и
g) смазывающее вещество,
где единичная дозированная форма содержит приблизительно 62,5 мг по существу аморфного Соединения 1 или аморфного Соединения 1.
[00724] В некоторых вариантах осуществления настоящее изобретение относится к способу введения фармацевтической композиции, предусматривающему пероральное введение пациенту единичной дозированной формы, содержащей мини-таблетку или множество мини-таблеток, где каждая из мини-таблеток содержит:
a) твердую дисперсию по существу аморфного или аморфного Соединения 1 и полимера, указанный полимер содержит HPMCAS;
b) один или более наполнителей;
c) подсластитель;
d) разрыхлитель;
e) необязательно увлажнитель;
f) скользящее вещество; и
g) смазывающее вещество,
где единичная дозированная форма содержит приблизительно 75 мг по существу аморфного Соединения 1 или аморфного Соединения 1.
[00725] В некоторых вариантах осуществления настоящее изобретение относится к способу введения фармацевтической композиции, предусматривающему пероральное введение пациенту единичной дозированной формы, содержащей мини-таблетку или множество мини-таблеток, где каждая из мини-таблеток содержит:
a) твердую дисперсию по существу аморфного или аморфного Соединения 1 и полимера, указанный полимер содержит HPMCAS;
b) один или более наполнителей;
c) подсластитель;
d) разрыхлитель;
e) необязательно увлажнитель;
f) скользящее вещество; и
g) смазывающее вещество,
где единичная дозированная форма содержит приблизительно 100 мг по существу аморфного Соединения 1 или аморфного Соединения 1.
[00726] В некоторых вариантах осуществления настоящее изобретение относится к способу введения фармацевтической композиции, предусматривающему пероральное введение пациенту единичной дозированной формы, содержащей мини-таблетку или множество мини-таблеток, где каждая из мини-таблеток содержит:
a) твердую дисперсию по существу аморфного или аморфного Соединения 1 и полимера, указанный полимер содержит HPMCAS;
b) один или более наполнителей;
c) подсластитель;
d) разрыхлитель;
e) необязательно увлажнитель;
f) скользящее вещество; и
g) смазывающее вещество,
где единичная дозированная форма содержит приблизительно 125 мг по существу аморфного Соединения 1 или аморфного Соединения 1.
[00727] В некоторых вариантах осуществления настоящее изобретение относится к способу введения фармацевтической композиции, предусматривающему пероральное введение пациенту единичной дозированной формы, содержащей мини-таблетку или множество мини-таблеток, где каждая из мини-таблеток содержит:
a) твердую дисперсию по существу аморфного или аморфного Соединения 1 и полимера, указанный полимер содержит HPMCAS;
b) один или более наполнителей;
c) подсластитель;
d) разрыхлитель;
e) необязательно увлажнитель;
f) скользящее вещество; и
g) смазывающее вещество,
где единичная дозированная форма содержит приблизительно 150 мг по существу аморфного Соединения 1 или аморфного Соединения 1.
[00728] В некоторых вариантах осуществления настоящее изобретение относится к способу введения фармацевтической композиции, предусматривающему пероральное введение пациенту единичной дозированной формы, содержащей мини-таблетку или множество мини-таблеток, где каждая из мини-таблеток содержит:
a) твердую дисперсию по существу аморфного или аморфного Соединения 1 и полимера, указанный полимер содержит HPMCAS;
b) один или более наполнителей;
c) подсластитель;
d) разрыхлитель;
e) необязательно увлажнитель;
f) скользящее вещество; и
g) смазывающее вещество,
где единичная дозированная форма содержит приблизительно 175 мг по существу аморфного Соединения 1 или аморфного Соединения 1.
[00729] В некоторых вариантах осуществления настоящее изобретение относится к способу введения фармацевтической композиции, предусматривающему пероральное введение пациенту единичной дозированной формы, содержащей мини-таблетку или множество мини-таблеток, где каждая из мини-таблеток содержит:
a) твердую дисперсию по существу аморфного или аморфного Соединения 1 и полимера, указанный полимер содержит HPMCAS;
b) один или более наполнителей;
c) подсластитель;
d) разрыхлитель;
e) необязательно увлажнитель;
f) скользящее вещество; и
g) смазывающее вещество,
где единичная дозированная форма содержит приблизительно 200 мг по существу аморфного Соединения 1 или аморфного Соединения 1.
[00730] В некоторых вариантах осуществления настоящее изобретение относится к способу введения фармацевтической композиции, предусматривающему пероральное введение пациенту единичной дозированной формы, содержащей мини-таблетку или множество мини-таблеток, где каждая из мини-таблеток содержит:
a) твердую дисперсию по существу аморфного или аморфного Соединения 1 и полимера, указанный полимер содержит HPMCAS;
b) один или более наполнителей;
c) подсластитель;
d) разрыхлитель;
e) необязательно увлажнитель;
f) скользящее вещество; и
g) смазывающее вещество,
где единичная дозированная форма содержит приблизительно 225 мг по существу аморфного Соединения 1 или аморфного Соединения 1.
[00731] В некоторых вариантах осуществления настоящее изобретение относится к способу введения фармацевтической композиции, предусматривающему пероральное введение пациенту единичной дозированной формы, содержащей мини-таблетку или множество мини-таблеток, где каждая из мини-таблеток содержит:
a) твердую дисперсию по существу аморфного или аморфного Соединения 1 и полимера, указанный полимер содержит HPMCAS;
b) один или более наполнителей;
c) подсластитель;
d) разрыхлитель;
e) необязательно увлажнитель;
f) скользящее вещество; и
g) смазывающее вещество,
где единичная дозированная форма содержит приблизительно 250 мг по существу аморфного Соединения 1 или аморфного Соединения 1.
[00732] В дополнительном варианте осуществления один или более наполнителей представляет собой двухкомпонентный наполнитель, содержащий смесь 2 наполнителей. В другом дополнительном варианте осуществления двухкомпонентный наполнитель представляет собой смесь маннита и другого наполнителя. В другом дополнительном варианте осуществления двухкомпонентный наполнитель представляет собой смесь лактозы и другого наполнителя. В другом дополнительном варианте осуществления двухкомпонентный наполнитель представляет собой смесь маннита и лактозы.
[00733] В другом дополнительном варианте осуществления фармацевтическая композиция содержит двухкомпонентный наполнитель, где двухкомпонентный наполнитель содержит маннит в количестве до приблизительно 100 масс.% двухкомпонентного наполнителя. Еще в одном дополнительном варианте осуществления фармацевтическая композиция содержит двухкомпонентный наполнитель, где двухкомпонентный наполнитель содержит лактозу в количестве до приблизительно 100 масс.% двухкомпонентного наполнителя. Еще в одном дополнительном варианте осуществления фармацевтическая композиция содержит двухкомпонентный наполнитель, где двухкомпонентный наполнитель содержит маннит в количестве до приблизительно 100 масс.% двухкомпонентного наполнителя и лактозу в количестве, таком, что сумма количества маннита и лактозы равна 100 масс.%.
[00734] В некоторых вариантах осуществления фармацевтическая композиция содержит двухкомпонентный наполнитель, где двухкомпонентный наполнитель содержит маннит и другой наполнитель в соотношении приблизительно 3:1 маннита к другому наполнителю, в соотношении приблизительно 1:1 маннита к другому наполнителю, или в соотношении приблизительно 1:3 маннита к другому наполнителю. В некоторых вариантах осуществления фармацевтическая композиция содержит двухкомпонентный наполнитель, где двухкомпонентный наполнитель содержит лактозу и другой наполнитель в соотношении приблизительно 3:1 лактозы к другому наполнителю, в соотношении приблизительно 1:1 лактозы к другому наполнителю, или в соотношении приблизительно 1:3 лактозы к другому наполнителю. В некоторых вариантах осуществления фармацевтическая композиция содержит двухкомпонентный наполнитель, где двухкомпонентный наполнитель содержит маннит и лактозу в соотношении приблизительно 3:1 маннита к лактозе, в соотношении приблизительно 1:1 маннита к лактозе, или в соотношении приблизительно 1:3 маннита к лактозе.
[00735] В некоторых вариантах осуществления настоящее изобретение относится к способу перорального введения фармацевтической композиции, описанной в настоящей заявке, один раз в сутки. В других вариантах осуществления настоящее изобретение относится к способу перорального введения фармацевтической композиции, описанной в настоящей заявке, два раза в сутки.
[00736] Другой аспект настоящего изобретения относится к способу введения фармацевтической композиции путем перорального введения пациенту по меньшей мере один раз в сутки мини-таблетки или множества мини-таблеток, мини-таблетки, содержащей твердую дисперсию по существу аморфного или аморфного Соединения 1, одного или более наполнителей, подсластитель, разрыхлитель, необязательно увлажнитель, скользящее вещество; и смазывающее вещество, где капсула или пачка содержит по меньшей мере приблизительно 15 мг по существу аморфного или аморфного Соединения 1. В некоторых вариантах осуществления указанную композицию вводят перорально пациенту один раз в сутки. В другом способе введение предусматривает пероральное введение пациенту дважды в сутки мини-таблетки или множества мини-таблеток, мини-таблеток, содержащих мини-таблетку по существу аморфного или аморфного Соединения 1, один или более наполнителей, подсластитель, разрыхлитель, необязательно увлажнитель, скользящее вещество и смазывающее вещество, где капсула или пачка содержит по меньшей мере приблизительно 5 мг по существу аморфного или аморфного Соединения 1. В другом способе введение предусматривает пероральное введение пациенту дважды в сутки мини-таблетки или множества мини-таблеток, мини-таблеток, содержащих мини-таблетку по существу аморфного или аморфного Соединения 1, один или более наполнителей, подсластитель, разрыхлитель, необязательно увлажнитель, скользящее вещество и смазывающее вещество, где капсула или пачка содержит по меньшей мере приблизительно 10 мг по существу аморфного или аморфного Соединения 1. В другом способе введение предусматривает пероральное введение пациенту дважды в сутки мини-таблетки или множества мини-таблеток, мини-таблеток, содержащих мини-таблетку по существу аморфного или аморфного Соединения 1, один или более наполнителей, подсластитель, разрыхлитель, необязательно увлажнитель, скользящее вещество и смазывающее вещество, где капсула или пачка содержит по меньшей мере приблизительно 15 мг по существу аморфного или аморфного Соединения 1. В другом способе введение предусматривает пероральное введение пациенту дважды в сутки мини-таблетки или множества мини-таблеток, мини-таблеток, содержащих мини-таблетку по существу аморфного или аморфного Соединения 1, один или более наполнителей, подсластитель, разрыхлитель, необязательно увлажнитель, скользящее вещество и смазывающее вещество, где капсула или пачка содержит по меньшей мере приблизительно 12,5 мг по существу аморфного или аморфного Соединения 1. В другом способе введение предусматривает пероральное введение пациенту один раз в сутки мини-таблетки или множества мини-таблеток, мини-таблеток, содержащих мини-таблетку по существу аморфного или аморфного Соединения 1, один или более наполнителей, подсластитель, разрыхлитель, необязательно увлажнитель, скользящее вещество и смазывающее вещество, где капсула или пачка содержит по меньшей мере приблизительно 25 мг по существу аморфного или аморфного Соединения 1. В другом способе введение предусматривает пероральное введение пациенту дважды в сутки мини-таблетки или множества мини-таблеток, мини-таблеток, содержащих мини-таблетку по существу аморфного или аморфного Соединения 1, один или более наполнителей, подсластитель, разрыхлитель, необязательно увлажнитель, скользящее вещество и смазывающее вещество, где капсула или пачка содержит по меньшей мере приблизительно 30 мг по существу аморфного или аморфного Соединения 1. В другом способе введение предусматривает пероральное введение пациенту дважды в сутки мини-таблетки или множества мини-таблеток, мини-таблеток, содержащих мини-таблетку по существу аморфного или аморфного Соединения 1, один или более наполнителей, подсластитель, разрыхлитель, необязательно увлажнитель, скользящее вещество и смазывающее вещество, где капсула или пачка содержит по меньшей мере приблизительно 37,5 мг по существу аморфного или аморфного Соединения 1. В другом способе введение предусматривает пероральное введение пациенту дважды в сутки мини-таблетки или множества мини-таблеток, мини-таблеток, содержащих мини-таблетку по существу аморфного или аморфного Соединения 1, один или более наполнителей, подсластитель, разрыхлитель, необязательно увлажнитель, скользящее вещество и смазывающее вещество, где капсула или пачка содержит по меньшей мере приблизительно 40 мг по существу аморфного или аморфного Соединения 1. В другом способе введение предусматривает пероральное введение пациенту дважды в сутки мини-таблетки или множества мини-таблеток, мини-таблеток, содержащих мини-таблетку по существу аморфного или аморфного Соединения 1, один или более наполнителей, подсластитель, разрыхлитель, необязательно увлажнитель, скользящее вещество и смазывающее вещество, где капсула или пачка содержит по меньшей мере приблизительно 50 мг по существу аморфного или аморфного Соединения 1. В другом способе введение предусматривает пероральное введение пациенту дважды в сутки мини-таблетки или множества мини-таблеток, мини-таблеток, содержащих мини-таблетку по существу аморфного или аморфного Соединения 1, один или более наполнителей, подсластитель, разрыхлитель, необязательно увлажнитель, скользящее вещество и смазывающее вещество, где капсула или пачка содержит по меньшей мере приблизительно 62,5 мг по существу аморфного или аморфного Соединения 1. В другом способе введение предусматривает пероральное введение пациенту дважды в сутки мини-таблетки или множества мини-таблеток, мини-таблеток, содержащих мини-таблетку по существу аморфного или аморфного Соединения 1, один или более наполнителей, подсластитель, разрыхлитель, необязательно увлажнитель, скользящее вещество и смазывающее вещество, где капсула или пачка содержит по меньшей мере приблизительно 75 мг по существу аморфного или аморфного Соединения 1. В другом способе введение предусматривает пероральное введение пациенту дважды в сутки мини-таблетки или множества мини-таблеток, мини-таблеток, содержащих мини-таблетку по существу аморфного или аморфного Соединения 1, один или более наполнителей, подсластитель, разрыхлитель, необязательно увлажнитель, скользящее вещество и смазывающее вещество, где капсула или пачка содержит по меньшей мере приблизительно 100 мг по существу аморфного или аморфного Соединения 1. В другом способе введение предусматривает пероральное введение пациенту дважды в сутки мини-таблетки или множества мини-таблеток, мини-таблеток, содержащих мини-таблетку по существу аморфного или аморфного Соединения 1, один или более наполнителей, подсластитель, разрыхлитель, необязательно увлажнитель, скользящее вещество и смазывающее вещество, где капсула или пачка содержит по меньшей мере приблизительно 125 мг по существу аморфного или аморфного Соединения 1. В другом способе введение предусматривает пероральное введение пациенту дважды в сутки мини-таблетки или множества мини-таблеток, мини-таблеток, содержащих мини-таблетку по существу аморфного или аморфного Соединения 1, один или более наполнителей, подсластитель, разрыхлитель, необязательно увлажнитель, скользящее вещество и смазывающее вещество, где капсула или пачка содержит по меньшей мере приблизительно 150 мг по существу аморфного или аморфного Соединения 1. В другом способе введение предусматривает пероральное введение пациенту дважды в сутки мини-таблетки или множества мини-таблеток, мини-таблеток, содержащих мини-таблетку по существу аморфного или аморфного Соединения 1, один или более наполнителей, подсластитель, разрыхлитель, необязательно увлажнитель, скользящее вещество и смазывающее вещество, где капсула или пачка содержит по меньшей мере приблизительно 175 мг по существу аморфного или аморфного Соединения 1. В другом способе введение предусматривает пероральное введение пациенту дважды в сутки мини-таблетки или множества мини-таблеток, мини-таблеток, содержащих мини-таблетку по существу аморфного или аморфного Соединения 1, один или более наполнителей, подсластитель, разрыхлитель, необязательно увлажнитель, скользящее вещество и смазывающее вещество, где капсула или пачка содержит по меньшей мере приблизительно 200 мг по существу аморфного или аморфного Соединения 1. В другом способе введение предусматривает пероральное введение пациенту дважды в сутки мини-таблетки или множества мини-таблеток, мини-таблеток, содержащих мини-таблетку по существу аморфного или аморфного Соединения 1, один или более наполнителей, подсластитель, разрыхлитель, необязательно увлажнитель, скользящее вещество и смазывающее вещество, где капсула или пачка содержит по меньшей мере приблизительно 225 мг по существу аморфного или аморфного Соединения 1. В другом способе введение предусматривает пероральное введение пациенту дважды в сутки мини-таблетки или множества мини-таблеток, мини-таблеток, содержащих мини-таблетку по существу аморфного или аморфного Соединения 1, один или более наполнителей, подсластитель, разрыхлитель, необязательно увлажнитель, скользящее вещество и смазывающее вещество, где капсула или пачка содержит по меньшей мере приблизительно 250 мг по существу аморфного или аморфного Соединения 1.
[00737] В другом способе введение предусматривает пероральное введение пациенту один раз в сутки мини-таблетку или множество мини-таблеток, мини-таблетки, содержащей твердую дисперсию по существу аморфного или аморфного Соединения 1, один или более наполнителей, подсластитель, разрыхлитель, необязательно увлажнитель, скользящее вещество и смазывающее вещество, где капсула или пачка содержит по меньшей мере приблизительно 50 мг по существу аморфного или аморфного Соединения 1. В другом способе введение предусматривает пероральное введение пациенту дважды в сутки мини-таблетки или множества мини-таблеток, мини-таблетки, содержащей твердую дисперсию по существу аморфного или аморфного Соединения 1, один или более наполнителей, подсластитель, разрыхлитель, необязательно увлажнитель, скользящее вещество и смазывающее вещество, где капсула или пачка содержит по меньшей мере приблизительно 50 мг по существу аморфного или аморфного Соединения 1. Некоторые фармацевтические композиции, используемые в этом способе, содержат мини-таблетку или множество мини-таблеток, содержащих твердую дисперсию, содержащую по меньшей мере приблизительно 75 мг по существу аморфного или аморфного Соединения 1. В другом способе введение предусматривает пероральное введение пациенту один раз в сутки мини-таблетки или множества мини-таблеток, эти мини-таблетки содержат твердую дисперсию по существу аморфного или аморфного Соединения 1, одного или более наполнителей, подсластителя, разрыхлителя, скользящего вещества и смазывающего вещества, где капсула или пачка содержит по меньшей мере приблизительно 75 мг по существу аморфного или аморфного Соединения 1. В другом способе введение предусматривает пероральное введение пациенту дважды в сутки мини-таблетки или множества мини-таблеток, указанные мини-таблетки содержат твердую дисперсию по существу аморфного или аморфного Соединения 1, одного или более наполнителей, подсластителя, разрыхлителя, скользящего вещества и смазывающего вещества, где капсула или пачка содержит по меньшей мере приблизительно 75 мг по существу аморфного или аморфного Соединения 1.
[00738] Другой аспект настоящего изобретения относится к способу введения фармацевтической композиции путем перорального введения пациенту по меньшей мере один раз в сутки твердой дисперсии по существу аморфного или аморфного Соединения 1, одного или более наполнителей, подсластителя, разрыхлителя, скользящего вещества и смазывающего вещества, где твердая дисперсия содержит по меньшей мере приблизительно 10 мг по существу аморфного или аморфного Соединения 1. В некоторых вариантах осуществления твердую дисперсию вводят перорально пациенту один раз в сутки. В другом способе введение предусматривает пероральное введение пациенту дважды в сутки твердой дисперсии, где твердая дисперсия содержит твердую дисперсию по существу аморфного или аморфного Соединения 1, одного или более наполнителей, подсластителя, разрыхлителя, скользящего вещества и смазывающего вещества, где твердая дисперсия содержит по меньшей мере приблизительно 10 мг по существу аморфного или аморфного Соединения 1.
[00739] Другой аспект настоящего изобретения относится к способу введения фармацевтической композиции путем перорального введения пациенту по меньшей мере один раз в сутки твердой дисперсии по существу аморфного или аморфного Соединения 1, одного или более наполнителей, подсластителя, разрыхлителя, скользящего вещества и смазывающего вещества, где твердая дисперсия содержит по меньшей мере приблизительно 12,5 мг по существу аморфного или аморфного Соединения 1. В некоторых вариантах осуществления твердую дисперсию вводят перорально пациенту один раз в сутки. В другом способе введение предусматривает пероральное введение пациенту дважды в сутки твердой дисперсии, где твердая дисперсия содержит твердую дисперсию по существу аморфного или аморфного Соединения 1, одного или более наполнителей, подсластителя, разрыхлителя, скользящего вещества и смазывающего вещества, где твердая дисперсия содержит по меньшей мере приблизительно 12,5 мг по существу аморфного или аморфного Соединения 1.
[00740] Другой аспект настоящего изобретения относится к способу введения фармацевтической композиции путем перорального введения пациенту по меньшей мере один раз в сутки твердой дисперсии по существу аморфного или аморфного Соединения 1, одного или более наполнителей, подсластителя, разрыхлителя, скользящего вещества и смазывающего вещества, где твердая дисперсия содержит по меньшей мере приблизительно 15 мг по существу аморфного или аморфного Соединения 1. В некоторых вариантах осуществления твердую дисперсию вводят перорально пациенту один раз в сутки. В другом способе введение предусматривает пероральное введение пациенту дважды в сутки твердой дисперсии, где твердая дисперсия содержит твердую дисперсию по существу аморфного или аморфного Соединения 1, одного или более наполнителей, подсластителя, разрыхлителя, скользящего вещества и смазывающего вещества, где твердая дисперсия содержит по меньшей мере приблизительно 15 мг по существу аморфного или аморфного Соединения 1.
[00741] Другой аспект настоящего изобретения относится к способу введения фармацевтической композиции путем перорального введения пациенту по меньшей мере один раз в сутки твердой дисперсии по существу аморфного или аморфного Соединения 1, одного или более наполнителей, подсластителя, разрыхлителя, скользящего вещества и смазывающего вещества, где твердая дисперсия содержит по меньшей мере приблизительно 20 мг по существу аморфного или аморфного Соединения 1. В некоторых вариантах осуществления твердую дисперсию вводят перорально пациенту один раз в сутки. В другом способе введение предусматривает пероральное введение пациенту дважды в сутки твердой дисперсии, где твердая дисперсия содержит твердую дисперсию по существу аморфного или аморфного Соединения 1, одного или более наполнителей, подсластителя, разрыхлителя, скользящего вещества и смазывающего вещества, где твердая дисперсия содержит по меньшей мере приблизительно 20 мг по существу аморфного или аморфного Соединения 1.
[00742] Другой аспект настоящего изобретения относится к способу введения фармацевтической композиции путем перорального введения пациенту по меньшей мере один раз в сутки твердой дисперсии по существу аморфного или аморфного Соединения 1, одного или более наполнителей, подсластителя, разрыхлителя, скользящего вещества и смазывающего вещества, где твердая дисперсия содержит по меньшей мере приблизительно 25 мг по существу аморфного или аморфного Соединения 1. В некоторых вариантах осуществления твердую дисперсию вводят перорально пациенту один раз в сутки. В другом способе введение предусматривает пероральное введение пациенту дважды в сутки твердой дисперсии, где твердая дисперсия содержит твердую дисперсию по существу аморфного или аморфного Соединения 1, одного или более наполнителей, подсластителя, разрыхлителя, скользящего вещества и смазывающего вещества, где твердая дисперсия содержит по меньшей мере приблизительно 25 мг по существу аморфного или аморфного Соединения 1.
[00743] Другой аспект настоящего изобретения относится к способу введения фармацевтической композиции путем перорального введения пациенту по меньшей мере один раз в сутки твердой дисперсии по существу аморфного или аморфного Соединения 1, одного или более наполнителей, подсластителя, разрыхлителя, скользящего вещества и смазывающего вещества, где твердая дисперсия содержит по меньшей мере приблизительно 30 мг по существу аморфного или аморфного Соединения 1. В некоторых вариантах осуществления твердую дисперсию вводят перорально пациенту один раз в сутки. В другом способе введение предусматривает пероральное введение пациенту дважды в сутки твердой дисперсии, где твердая дисперсия содержит твердую дисперсию по существу аморфного или аморфного Соединения 1, одного или более наполнителей, подсластителя, разрыхлителя, скользящего вещества и смазывающего вещества, где твердая дисперсия содержит по меньшей мере приблизительно 30 мг по существу аморфного или аморфного Соединения 1.
[00744] Другой аспект настоящего изобретения относится к способу введения фармацевтической композиции путем перорального введения пациенту по меньшей мере один раз в сутки твердой дисперсии по существу аморфного или аморфного Соединения 1, одного или более наполнителей, подсластителя, разрыхлителя, скользящего вещества и смазывающего вещества, где твердая дисперсия содержит по меньшей мере приблизительно 35 мг по существу аморфного или аморфного Соединения 1. В некоторых вариантах осуществления твердую дисперсию вводят перорально пациенту один раз в сутки. В другом способе введение предусматривает пероральное введение пациенту дважды в сутки твердой дисперсии, где твердая дисперсия содержит твердую дисперсию по существу аморфного или аморфного Соединения 1, одного или более наполнителей, подсластителя, разрыхлителя, скользящего вещества и смазывающего вещества, где твердая дисперсия содержит по меньшей мере приблизительно 35 мг по существу аморфного или аморфного Соединения 1.
[00745] Другой аспект настоящего изобретения относится к способу введения фармацевтической композиции путем перорального введения пациенту по меньшей мере один раз в сутки твердой дисперсии по существу аморфного или аморфного Соединения 1, одного или более наполнителей, подсластителя, разрыхлителя, скользящего вещества и смазывающего вещества, где твердая дисперсия содержит по меньшей мере приблизительно 37,5 мг по существу аморфного или аморфного Соединения 1. В некоторых вариантах осуществления твердую дисперсию вводят перорально пациенту один раз в сутки. В другом способе введение предусматривает пероральное введение пациенту дважды в сутки твердой дисперсии, где твердая дисперсия содержит твердую дисперсию по существу аморфного или аморфного Соединения 1, одного или более наполнителей, подсластителя, разрыхлителя, скользящего вещества и смазывающего вещества, где твердая дисперсия содержит по меньшей мере приблизительно 37,5 мг по существу аморфного или аморфного Соединения 1.
[00746] Другой аспект настоящего изобретения относится к способу введения фармацевтической композиции путем перорального введения пациенту по меньшей мере один раз в сутки твердой дисперсии по существу аморфного или аморфного Соединения 1, одного или более наполнителей, подсластителя, разрыхлителя, скользящего вещества и смазывающего вещества, где твердая дисперсия содержит по меньшей мере приблизительно 40 мг по существу аморфного или аморфного Соединения 1. В некоторых вариантах осуществления твердую дисперсию вводят перорально пациенту один раз в сутки. В другом способе введение предусматривает пероральное введение пациенту дважды в сутки твердой дисперсии, где твердая дисперсия содержит твердую дисперсию по существу аморфного или аморфного Соединения 1, одного или более наполнителей, подсластителя, разрыхлителя, скользящего вещества и смазывающего вещества, где твердая дисперсия содержит по меньшей мере приблизительно 40 мг по существу аморфного или аморфного Соединения 1.
[00747] Другой аспект настоящего изобретения относится к способу введения фармацевтической композиции путем перорального введения пациенту по меньшей мере один раз в сутки твердой дисперсии по существу аморфного или аморфного Соединения 1, одного или более наполнителей, подсластителя, разрыхлителя, скользящего вещества и смазывающего вещества, где твердая дисперсия содержит по меньшей мере приблизительно 45 мг по существу аморфного или аморфного Соединения 1. В некоторых вариантах осуществления твердую дисперсию вводят перорально пациенту один раз в сутки. В другом способе введение предусматривает пероральное введение пациенту дважды в сутки твердой дисперсии, где твердая дисперсия содержит твердую дисперсию по существу аморфного или аморфного Соединения 1, одного или более наполнителей, подсластителя, разрыхлителя, скользящего вещества и смазывающего вещества, где твердая дисперсия содержит по меньшей мере приблизительно 45 мг по существу аморфного или аморфного Соединения 1.
[00748] Другой аспект настоящего изобретения относится к способу введения фармацевтической композиции путем перорального введения пациенту по меньшей мере один раз в сутки твердой дисперсии по существу аморфного или аморфного Соединения 1, одного или более наполнителей, подсластителя, разрыхлителя, скользящего вещества и смазывающего вещества, где твердая дисперсия содержит по меньшей мере приблизительно 50 мг по существу аморфного или аморфного Соединения 1. В некоторых вариантах осуществления твердую дисперсию вводят перорально пациенту один раз в сутки. В другом способе введение предусматривает пероральное введение пациенту дважды в сутки твердой дисперсии, где твердая дисперсия содержит твердую дисперсию по существу аморфного или аморфного Соединения 1, одного или более наполнителей, подсластителя, разрыхлителя, скользящего вещества и смазывающего вещества, где твердая дисперсия содержит по меньшей мере приблизительно 50 мг по существу аморфного или аморфного Соединения 1.
[00749] Другой аспект настоящего изобретения относится к способу введения фармацевтической композиции путем перорального введения пациенту по меньшей мере один раз в сутки твердой дисперсии по существу аморфного или аморфного Соединения 1, одного или более наполнителей, подсластителя, разрыхлителя, скользящего вещества и смазывающего вещества, где твердая дисперсия содержит по меньшей мере приблизительно 62,5 мг по существу аморфного или аморфного Соединения 1. В некоторых вариантах осуществления твердую дисперсию вводят перорально пациенту один раз в сутки. В другом способе введение предусматривает пероральное введение пациенту дважды в сутки твердой дисперсии, где твердая дисперсия содержит твердую дисперсию по существу аморфного или аморфного Соединения 1, одного или более наполнителей, подсластителя, разрыхлителя, скользящего вещества и смазывающего вещества, где твердая дисперсия содержит по меньшей мере приблизительно 62,5 мг по существу аморфного или аморфного Соединения 1.
[00750] Другой аспект настоящего изобретения относится к способу введения фармацевтической композиции путем перорального введения пациенту по меньшей мере один раз в сутки твердой дисперсии по существу аморфного или аморфного Соединения 1, одного или более наполнителей, подсластителя, разрыхлителя, скользящего вещества и смазывающего вещества, где твердая дисперсия содержит по меньшей мере приблизительно 75 мг по существу аморфного или аморфного Соединения 1. В некоторых вариантах осуществления твердую дисперсию вводят перорально пациенту один раз в сутки. В другом способе введение предусматривает пероральное введение пациенту дважды в сутки твердой дисперсии, где твердая дисперсия содержит твердую дисперсию по существу аморфного или аморфного Соединения 1, одного или более наполнителей, подсластителя, разрыхлителя, скользящего вещества и смазывающего вещества, где твердая дисперсия содержит по меньшей мере приблизительно 75 мг по существу аморфного или аморфного Соединения 1.
[00751] Другой аспект настоящего изобретения относится к способу введения фармацевтической композиции путем перорального введения пациенту по меньшей мере один раз в сутки твердой дисперсии по существу аморфного или аморфного Соединения 1, одного или более наполнителей, подсластителя, разрыхлителя, скользящего вещества и смазывающего вещества, где твердая дисперсия содержит по меньшей мере приблизительно 100 мг по существу аморфного или аморфного Соединения 1. В некоторых вариантах осуществления твердую дисперсию вводят перорально пациенту один раз в сутки. В другом способе введение предусматривает пероральное введение пациенту дважды в сутки твердой дисперсии, где твердая дисперсия содержит твердую дисперсию по существу аморфного или аморфного Соединения 1, один или более наполнителей, подсластитель, разрыхлитель, скользящее вещество и смазывающее вещество, где твердая дисперсия содержит по меньшей мере приблизительно 100 мг по существу аморфного или аморфного Соединения 1.
[00752] Другой аспект настоящего изобретения относится к способу введения фармацевтической композиции путем перорального введения пациенту по меньшей мере один раз в сутки твердой дисперсии по существу аморфного или аморфного Соединения 1, одного или более наполнителей, подсластителя, разрыхлителя, скользящего вещества и смазывающего вещества, где твердая дисперсия содержит по меньшей мере приблизительно 125 мг по существу аморфного или аморфного Соединения 1. В некоторых вариантах осуществления твердую дисперсию вводят перорально пациенту один раз в сутки. В другом способе введение предусматривает пероральное введение пациенту дважды в сутки твердой дисперсии, где твердая дисперсия содержит твердую дисперсию по существу аморфного или аморфного Соединения 1, одного или более наполнителей, подсластителя, разрыхлителя, скользящего вещества и смазывающего вещества, где твердая дисперсия содержит по меньшей мере приблизительно 125 мг по существу аморфного или аморфного Соединения 1.
[00753] Другой аспект настоящего изобретения относится к способу введения фармацевтической композиции путем перорального введения пациенту по меньшей мере один раз в сутки твердой дисперсии по существу аморфного или аморфного Соединения 1, одного или более наполнителей, подсластителя, разрыхлителя, скользящего вещества и смазывающего вещества, где твердая дисперсия содержит по меньшей мере приблизительно 150 мг по существу аморфного или аморфного Соединения 1. В некоторых вариантах осуществления твердую дисперсию вводят перорально пациенту один раз в сутки. В другом способе введение предусматривает пероральное введение пациенту дважды в сутки твердой дисперсии, где твердая дисперсия содержит твердую дисперсию по существу аморфного или аморфного Соединения 1, одного или более наполнителей, подсластителя, разрыхлителя, скользящего вещества и смазывающего вещества, где твердая дисперсия содержит по меньшей мере приблизительно 150 мг по существу аморфного или аморфного Соединения 1.
[00754] Другой аспект настоящего изобретения относится к способу введения фармацевтической композиции путем перорального введения пациенту по меньшей мере один раз в сутки твердой дисперсии по существу аморфного или аморфного Соединения 1, одного или более наполнителей, подсластителя, разрыхлителя, скользящего вещества и смазывающего вещества, где твердая дисперсия содержит по меньшей мере приблизительно 175 мг по существу аморфного или аморфного Соединения 1. В некоторых вариантах осуществления твердую дисперсию вводят перорально пациенту один раз в сутки. В другом способе введение предусматривает пероральное введение пациенту дважды в сутки твердой дисперсии, где твердая дисперсия содержит твердую дисперсию по существу аморфного или аморфного Соединения 1, одного или более наполнителей, подсластителя, разрыхлителя, скользящего вещества и смазывающего вещества, где твердая дисперсия содержит по меньшей мере приблизительно 175 мг по существу аморфного или аморфного Соединения 1.
[00755] Другой аспект настоящего изобретения относится к способу введения фармацевтической композиции путем перорального введения пациенту по меньшей мере один раз в сутки твердой дисперсии по существу аморфного или аморфного Соединения 1, одного или более наполнителей, подсластителя, разрыхлителя, скользящего вещества и смазывающего вещества, где твердая дисперсия содержит по меньшей мере приблизительно 200 мг по существу аморфного или аморфного Соединения 1. В некоторых вариантах осуществления твердую дисперсию вводят перорально пациенту один раз в сутки. В другом способе введение предусматривает пероральное введение пациенту дважды в сутки твердой дисперсии, где твердая дисперсия содержит твердую дисперсию по существу аморфного или аморфного Соединения 1, одного или более наполнителей, подсластителя, разрыхлителя, скользящего вещества и смазывающего вещества, где твердая дисперсия содержит по меньшей мере приблизительно 200 мг по существу аморфного или аморфного Соединения 1.
[00756] Другой аспект настоящего изобретения относится к способу введения фармацевтической композиции путем перорального введения пациенту по меньшей мере один раз в сутки твердой дисперсии по существу аморфного или аморфного Соединения 1, одного или более наполнителей, подсластителя, разрыхлителя, скользящего вещества и смазывающего вещества, где твердая дисперсия содержит по меньшей мере приблизительно 225 мг по существу аморфного или аморфного Соединения 1. В некоторых вариантах осуществления твердую дисперсию вводят перорально пациенту один раз в сутки. В другом способе введение предусматривает пероральное введение пациенту дважды в сутки твердой дисперсии, где твердая дисперсия содержит твердую дисперсию по существу аморфного или аморфного Соединения 1, одного или более наполнителей, подсластителя, разрыхлителя, скользящего вещества и смазывающего вещества, где твердая дисперсия содержит по меньшей мере приблизительно 225 мг по существу аморфного или аморфного Соединения 1.
[00757] Другой аспект настоящего изобретения относится к способу введения фармацевтической композиции путем перорального введения пациенту по меньшей мере один раз в сутки твердой дисперсии по существу аморфного или аморфного Соединения 1, одного или более наполнителей, подсластителя, разрыхлителя, скользящего вещества и смазывающего вещества, где твердая дисперсия содержит по меньшей мере приблизительно 250 мг по существу аморфного или аморфного Соединения 1. В некоторых вариантах осуществления твердую дисперсию вводят перорально пациенту один раз в сутки. В другом способе введение предусматривает пероральное введение пациенту дважды в сутки твердой дисперсии, где твердая дисперсия содержит твердую дисперсию по существу аморфного или аморфного Соединения 1, одного или более наполнителей, подсластителя, разрыхлителя, скользящего вещества и смазывающего вещества, где твердая дисперсия содержит по меньшей мере приблизительно 250 мг по существу аморфного или аморфного Соединения 1.
[00758] В одном варианте осуществления способ введения фармацевтической композиции, предусматривающий пероральное введение пациенту по меньшей мере один раз в сутки по меньшей мере одной капсулы или содержимого пакета или пачки, содержащих мини-таблетку или множество мини-таблеток, каждая мини-таблетка включает фармацевтическую композицию, содержащую твердую дисперсию аморфного Соединения 1, один или более наполнителей, подсластитель, разрыхлитель, необязательно увлажнитель, скользящее вещество и смазывающее вещество, каждое из которых описано выше и в приведенных ниже примерах, где указанная капсула, пакет или пачка, содержащие указанную мини-таблетку или множество мини-таблеток, содержит по меньшей мере 5 мг (например, по меньшей мере 10 мг, по меньшей мере 12,5 мг, по меньшей мере 15 мг, по меньшей мере 20 мг, по меньшей мере 25 мг, по меньшей мере 30 мг, по меньшей мере 35 мг, по меньшей мере 37,5 мг, по меньшей мере 40 мг, по меньшей мере 45 мг, по меньшей мере 50 мг, по меньшей мере 55 мг, по меньшей мере 60 мг, по меньшей мере 62,5 мг, по меньшей мере 65 мг, по меньшей мере 70, по меньшей мере 75 мг, по меньшей мере 100 мг, по меньшей мере 125 мг, по меньшей мере 150 мг, по меньшей мере 175 мг, по меньшей мере 200 мг, по меньшей мере 225 мг или по меньшей мере 250 мг) по существу аморфного или аморфного Соединения 1.
[00759] В одном варианте осуществления способ введения фармацевтической композиции включает пероральное введение пациенту по меньшей мере один раз в сутки по меньшей мере одной капсулы или содержимого пакета или пачки, содержащих мини-таблетку или множество мини-таблеток, каждая мини-таблетка включает фармацевтическую композицию, содержащую твердую дисперсию по существу аморфного или аморфного Соединения 1, один или более наполнителей, подсластитель, разрыхлитель, необязательно увлажнитель, скользящее вещество и смазывающее вещество, где указанная капсула, пакет или пачка, содержащие указанную мини-таблетку или множество мини-таблеток, содержит от приблизительно 10 мг до приблизительно 300 мг (например, от приблизительно 15 мг до приблизительно 280 мг, или от приблизительно 25 мг до приблизительно 260 мг, или от приблизительно 30 мг до приблизительно 200 мг, или от приблизительно 10 мг до приблизительно 150 мг, или от приблизительно 10 мг до приблизительно 100 мг, или от приблизительно 15 мг до приблизительно 75 мг) по существу аморфного или аморфного Соединения 1. Или способ введения фармацевтической композиции включает пероральное введение пациенту по меньшей мере один раз в сутки по меньшей мере одной капсулы или содержимого пакета или пачки, содержащих мини-таблетку или множество мини-таблеток, каждая мини-таблетка содержит фармацевтическую композицию, содержащую твердую дисперсию аморфного Соединения 1, один или более наполнителей, подсластитель, разрыхлитель, необязательно увлажнитель, скользящее вещество и смазывающее вещество, где указанная капсула, пакет или пачка содержит от приблизительно 10 мг до приблизительно 300 мг (например, от приблизительно 15 мг до приблизительно 280 мг или от приблизительно 25 мг до приблизительно 260 мг, или от приблизительно 30 мг до приблизительно 200 мг, или от приблизительно 10 мг до приблизительно 150 мг, или от приблизительно 10 мг до приблизительно 100 мг, или от приблизительно 15 мг до приблизительно 75 мг) аморфного Соединения 1.
[00760] В другом варианте осуществления способ введения фармацевтической композиции включает пероральное введение пациенту один раз в сутки по меньшей мере одной капсулы или содержимого пакета или пачки, содержащих мини-таблетку или множество мини-таблеток, где каждая мини-таблетка содержит фармацевтическую композицию, содержащую твердую дисперсию Соединения 1, один или более наполнителей, подсластитель, разрыхлитель, необязательно увлажнитель, скользящее вещество и смазывающее вещество, каждое из которых описано выше и в приведенных ниже примерах, где указанная капсула, пакет или пачка, содержащие указанную мини-таблетку или множество мини-таблеток, содержит по меньшей мере 5 мг (например, по меньшей мере 10 мг, по меньшей мере 15 мг, по меньшей мере 20 мг, по меньшей мере 25 мг, по меньшей мере 30 мг, по меньшей мере 37,5 мг, по меньшей мере 35 мг, по меньшей мере 40 мг, по меньшей мере 45 мг, по меньшей мере 50 мг, по меньшей мере 55 мг, по меньшей мере 60 мг, по меньшей мере 62,5 мг, по меньшей мере 65 мг, по меньшей мере 70 мг, по меньшей мере 75 мг, по меньшей мере 100 мг, по меньшей мере 125 мг, по меньшей мере приблизительно 150 мг, по меньшей мере 175 мг, по меньшей мере 200 мг, по меньшей мере 225 мг, или по меньшей мере приблизительно 250 мг) по существу аморфного Соединения 1 или аморфного Соединения 1. Например, способ введения фармацевтической композиции включает пероральное введение пациенту один раз в сутки по меньшей мере одной капсулы или содержимого пакета или пачки, содержащих фармацевтическую композицию, содержащую мини-таблетку или множество мини-таблеток, каждая мини-таблетка содержит твердую дисперсию Соединения 1, один или более наполнителей, подсластитель, разрыхлитель, необязательно увлажнитель, скользящее вещество и смазывающее вещество, где указанная капсула, пакет или пачка, содержащие указанную мини-таблетку или множество мини-таблеток, содержит по меньшей мере 75 мг (например, по меньшей мере 100 мг, по меньшей мере 125 мг, по меньшей мере 140 мг, по меньшей мере 150 мг, по меньшей мере 175 мг, по меньшей мере 200 мг, по меньшей мере 225 мг, или по меньшей мере 250 мг) по существу аморфного Соединения 1 или аморфного Соединения 1. В другом примере способ введения фармацевтической композиции включает пероральное введение пациенту один раз в сутки мини-таблетки или множества капсул или пачек (например, две капсулы, три капсулы, четыре или пять капсул), где каждая капсула или пачка содержит мини-таблетку или множество мини-таблеток, каждая мини-таблетка содержит фармацевтическую композицию, содержащую твердую дисперсию по существу аморфного Соединения 1 или аморфного Соединения 1, один или более наполнителей, подсластитель, разрыхлитель, необязательно увлажнитель, скользящее вещество и смазывающее вещество, где капсула или пачка, содержащая указанную мини-таблетку или множество мини-таблеток, содержит по меньшей мере 5 мг (например, по меньшей мере 10 мг, по меньшей мере 15 мг, по меньшей мере 20 мг, по меньшей мере 25 мг, по меньшей мере 30 мг, по меньшей мере 37,5 мг, по меньшей мере 35 мг, по меньшей мере 40 мг, по меньшей мере 45 мг, по меньшей мере 50 мг, по меньшей мере 55 мг, по меньшей мере 60 мг, по меньшей мере 62,5 мг, по меньшей мере 65 мг, по меньшей мере 70 мг, по меньшей мере 75 мг, по меньшей мере 100 мг, по меньшей мере 125 мг, по меньшей мере приблизительно 150 мг, по меньшей мере 175 мг, по меньшей мере 200 мг, по меньшей мере 225 мг, или по меньшей мере приблизительно 250 мг) по существу аморфного Соединения 1 или аморфного Соединения 1.
[00761] В другом варианте осуществления способ введения фармацевтической композиции включает пероральное введение пациенту дважды в сутки по меньшей мере одной капсулы или содержимого пакета или пачки, содержащих мини-таблетку или множество мини-таблеток, где каждая мини-таблетка содержит фармацевтическую композицию, содержащую твердую дисперсию Соединения 1, один или более наполнителей, подсластитель, разрыхлитель, необязательно увлажнитель, скользящее вещество и смазывающее вещество, каждое из которых описано выше и в приведенных ниже примерах, и где указанная капсула, пакет или пачка, содержащие указанную мини-таблетку или множество мини-таблеток, содержит по меньшей мере 5 мг (например, по меньшей мере 10 мг, по меньшей мере 15 мг, по меньшей мере 20 мг, по меньшей мере 25 мг, по меньшей мере 30 мг, по меньшей мере 37,5 мг, по меньшей мере 35 мг, по меньшей мере 40 мг, по меньшей мере 45 мг, по меньшей мере 50 мг, по меньшей мере 55 мг, по меньшей мере 60 мг, по меньшей мере 62,5 мг, по меньшей мере 65 мг, по меньшей мере 70 мг, по меньшей мере 75 мг, по меньшей мере 100 мг, по меньшей мере 125 мг, по меньшей мере приблизительно 150 мг, по меньшей мере 175 мг, по меньшей мере 200 мг, по меньшей мере 225 мг, или по меньшей мере приблизительно 250 мг) по существу аморфного Соединения 1 или аморфного Соединения 1. Например, способ введения фармацевтической композиции включает пероральное введение пациенту дважды в сутки одной капсулы или содержимого пакета или пачки, содержащих мини-таблетку или множество мини-таблеток, каждая мини-таблетка содержит фармацевтическую композицию, содержащую твердую дисперсию Соединения 1, один или более наполнителей, подсластитель, разрыхлитель, скользящее вещество и смазывающее вещество, где капсула, пакет или пачка содержит по меньшей мере 75 мг (например, по меньшей мере 100 мг, по меньшей мере 125 мг, по меньшей мере 140 мг, по меньшей мере 150 мг, по меньшей мере 175 мг, по меньшей мере 200 мг, по меньшей мере 225 мг, или по меньшей мере 250 мг) по существу аморфного Соединения 1 или аморфного Соединения 1. В другом примере способ введения фармацевтической композиции включает пероральное введение пациенту дважды в сутки мини-таблетки или множества капсул (например, две капсулы, три капсулы, четыре или пять капсул) или содержимого пакета или пачки, где каждая капсула, пачка или пакет содержит мини-таблетку или множество мини-таблеток, каждая мини-таблетка содержит фармацевтическую композицию, содержащую твердую дисперсию по существу аморфного Соединения 1 или аморфного Соединения 1, один или более наполнителей, подсластитель, разрыхлитель, необязательно увлажнитель, скользящее вещество и смазывающее вещество, и где указанная капсула, пачка или пакет содержит по меньшей мере 5 мг (например, по меньшей мере 10 мг, по меньшей мере 15 мг, по меньшей мере 20 мг, по меньшей мере 25 мг, по меньшей мере 30 мг, по меньшей мере 37,5 мг, по меньшей мере 35 мг, по меньшей мере 40 мг, по меньшей мере 45 мг, по меньшей мере 50 мг, по меньшей мере 55 мг, по меньшей мере 60 мг, по меньшей мере 62,5 мг, по меньшей мере 65 мг, по меньшей мере 70 мг, по меньшей мере 75 мг, по меньшей мере 100 мг, по меньшей мере 125 мг, по меньшей мере приблизительно 150 мг, по меньшей мере 175 мг, по меньшей мере 200 мг, по меньшей мере 225 мг, или по меньшей мере приблизительно 250 мг) по существу аморфного Соединения 1 или аморфного Соединения 1.
[00762] Отмечается, что способы введения по настоящему изобретению необязательно могут включать пероральное введение напитка (молока (в том числе грудного молока), смеси для детского питания или молочной смеси, или подобного), мягкой пищи (в том числе яблочного пюре, йогурта без добавок, мороженого, продукта для детского питания (в том числе моркови и морковного пюре) или подобного), и/или дополнительных фармацевтических композиций, включая дополнительные API. В некоторых вариантах осуществления жидкость также может включать воду. В тех случаях, когда способ введения предусматривает пероральное введение напитка (воды, молока (в том числе грудного молока), смеси для детского питания или молочной смеси, или подобного), мягкой пищи или продуктов питания (в том числе стандартного высококалорийного CF блюда или закуски с высоким содержанием жира), и/или дополнительных фармацевтических композиций, включая дополнительные API, пероральное введение напитка, пищи и/или дополнительных API может иметь место одновременно с пероральным введением мини-таблеток или множества мини-таблеток, перед пероральным введением мини-таблеток или множества мини-таблеток и/или после введения мини-таблеток или множества мини-таблеток. В одном варианте осуществления единичную дозированную форму впрыскивают в мягкую пищу, в том числе, но не только, яблочное пюре, йогурт без добавок, мороженое, продукт для детского питания (в том числе морковь и морковного пюре), и вводят. В другом варианте осуществления единичную дозированную форму впрыскивают в мягкую пищу, в том числе, но не только, яблочное пюре, йогурт без добавок, мороженое, продукт для детского питания (в том числе морковь и морковного пюре), перемешивают и вводят. В одном варианте осуществления единичную дозированную форму впрыскивают в жидкость, в том числе, но не только, смесь для детского питания, молочную смесь, молоко или грудное молоко, перемешивают и вводят. В другом варианте осуществления единичную дозированную форму впрыскивают в жидкость, в том числе, но не только, смесь для детского питания, молочную смесь, молоко или грудное молоко, и вводят. Способы введения по настоящему изобретению также необязательно могут включать, для мини-таблеток или гранул уменьшенного размера, введение содержимого пачек, пакетов, капсул, флаконов или саше непосредственно в ротовую полость с последующим введением грудного молока или смеси. Способы введения по настоящему изобретению также необязательно могут включать, для мини-таблеток или гранул уменьшенного размера, введение содержимого пачек, пакетов, капсул, флаконов или саше непосредственно в ротовую полость с последующим введением жидкости или напитка. Также отмечается, что все способы введения в соответствии с настоящим изобретением необязательно могут включать пероральное введение одновременно, до или после введения жиросодержащей пищи, такой как стандартное CF высококалорийное с высоким содержанием жира блюдо или закуска. В некоторых вариантах осуществления все способы введения в соответствии с настоящим изобретением необязательно могут включать пероральное введение с жиросодержащей пищей, такой как стандартное CF высококалорийное с высоким содержанием жира блюдо или закуска. В одном примере способ введения фармацевтической композиции включает пероральное введение пациенту по меньшей мере один раз в сутки по меньшей мере одной капсулы или одной пачки, содержащей мини-таблетку или множество мини-таблеток, каждая мини-таблетка содержит твердую дисперсию по существу аморфного Соединения 1 или аморфного Соединения 1, один или более наполнителей, подсластитель, разрыхлитель, необязательно увлажнитель, скользящее вещество и смазывающее вещество, и второй API. В другом примере способ введения фармацевтической композиции включает пероральное введение пациенту по меньшей мере один раз в сутки по меньшей мере одной капсулы или содержимого пачки или пакета, содержащих мини-таблетку или множество мини-таблеток, каждая мини-таблетка содержит твердую дисперсию по существу аморфного Соединения 1 или аморфного Соединения 1, один или более наполнителей, подсластитель, разрыхлитель, необязательно увлажнитель, скользящее вещество и смазывающее вещество, где капсула, пачка или пакет содержит по меньшей мере 5 мг (например, по меньшей мере 10 мг, по меньшей мере 15 мг, по меньшей мере 20 мг, по меньшей мере 25 мг, по меньшей мере 30 мг, по меньшей мере 37,5 мг, по меньшей мере 35 мг, по меньшей мере 40 мг, по меньшей мере 45 мг, по меньшей мере 50 мг, по меньшей мере 55 мг, по меньшей мере 60 мг, по меньшей мере 62,5 мг, по меньшей мере 65 мг, по меньшей мере 70 мг, по меньшей мере 75 мг, по меньшей мере 100 мг, по меньшей мере 125 мг, по меньшей мере приблизительно 150 мг, по меньшей мере 175 мг, по меньшей мере 200 мг, по меньшей мере 225 мг, или по меньшей мере приблизительно 250 мг) по существу аморфного Соединения 1 или аморфного Соединения 1, и пероральное введение пациенту по меньшей мере один раз в сутки второй фармацевтической композиции, содержащей второй API. В других примерах способ введения фармацевтической композиции включает пероральное введение пациенту каждые 12 часов по меньшей мере одной капсулы или пачки, содержащей мини-таблетку или множество мини-таблеток, каждая мини-таблетка содержит фармацевтическую композицию, описанную в настоящем изобретении, где указанную мини-таблетку или множество мини-таблеток перемешивают с пищевым продуктом или напитком для употребления пациентом, имеющим трудности с проглатыванием таблетки для взрослых, например, пациентом детского возраста, в том числе, но не только, пациентами моложе шестилетнего возраста, пациентами от 2 до 5 лет, пациентами моложе 2 лет, пациентами от нуля (т.е. с рождения) до 2 летнего возраста, пациентами, которым от 1 до 2 лет, которым от 9 месяцев до 2 лет, которым от 6 месяцев до 2 лет, которым от 3 месяцев до 2 лет и которым от 2 месяцев до 2 лет. В некоторых вариантах осуществления рождение означает рождение после нормального срока беременности. В других примерах способ введения фармацевтической композиции включает пероральное введение пациенту каждые 12 часов по меньшей мере одной капсулы или пачки, содержащей мини-таблетку или множество мини-таблеток, каждая мини-таблетка содержит фармацевтическую композицию, описанную в настоящем изобретении, где указанную мини-таблетку или множество мини-таблеток перемешивают с пищевым продуктом или напитком для употребления пациентом, имеющим трудности с проглатыванием таблетки для взрослых, например, пациентом детского возраста, в том числе, но не только, масса тела которого превышает или равна приблизительно 14 килограммов, менее 14 килограммов, приблизительно от 7,5 килограммов до 14 килограммов, приблизительно от 5 килограммов до 7,5 килограммов и приблизительно от 2,5 килограммов до 5 килограммов.
[00763] Также отмечается, что способы введения по настоящему изобретению необязательно могут включать пероральное введение фармацевтической композиции, описанной в настоящей заявке в отсутствие пищевого продукта или напитка. В представленном способе пероральное введение выполняют непосредственно после или вскоре после (например, в течение 30 минут) приема пациентом пищи или напитков. В другом варианте осуществления пероральное введение осуществляют по меньшей мере через 1 час (например, по меньшей мере 2 часа, по меньшей мере 3 часа, по меньшей мере 4 часа, по меньшей мере 5 часов, по меньшей мере 8 часов, по меньшей мере 12 часов или по меньшей мере 24 часа) после приема пищи или напитков. Например, в одном примере способ введения фармацевтической композиции включает пероральное введение пациенту по меньшей мере один раз в сутки по меньшей мере одной капсулы или содержимого пачки или пакета, содержащих мини-таблетку или множество мини-таблеток, каждая мини-таблетка содержит твердую дисперсию по существу аморфного Соединения 1 или аморфного Соединения 1, один или более наполнителей, подсластитель, разрыхлитель, необязательно увлажнитель, скользящее вещество и смазывающее вещество, и второй API. В другом примере способ введения фармацевтической композиции включает пероральное введение пациенту по меньшей мере один раз в сутки по меньшей мере одной капсулы содержимого пачки или пакета, содержащих мини-таблетку или множество мини-таблеток, каждая мини-таблетка содержит твердую дисперсию по существу аморфного Соединения 1 или аморфного Соединения 1, один или более наполнителей, подсластитель, разрыхлитель, необязательно увлажнитель, скользящее вещество и смазывающее вещество, где капсула, пачка или пакет содержит по меньшей мере 5 мг (например, по меньшей мере 10 мг, по меньшей мере 15 мг, по меньшей мере 20 мг, по меньшей мере 25 мг, по меньшей мере 30 мг, по меньшей мере 37,5 мг, по меньшей мере 35 мг, по меньшей мере 40 мг, по меньшей мере 45 мг, по меньшей мере 50 мг, по меньшей мере 55 мг, по меньшей мере 60 мг, по меньшей мере 62,5 мг, по меньшей мере 65 мг, по меньшей мере 70 мг, по меньшей мере 75 мг, по меньшей мере 100 мг, по меньшей мере 125 мг, по меньшей мере приблизительно 150 мг, по меньшей мере 175 мг, по меньшей мере 200 мг, по меньшей мере 225 мг или по меньшей мере приблизительно 250 мг) по существу аморфного Соединения 1 или аморфного Соединения 1, и пероральное введение пациенту по меньшей мере один раз в сутки второй фармацевтической композиции, содержащей второй API. В других примерах способ введения фармацевтической композиции включает пероральное введение пациенту каждые 12 часов по меньшей мере одной капсулы или пачки, содержащей мини-таблетку или множество мини-таблеток, каждая мини-таблетка содержит фармацевтическую композицию, описанную в настоящем изобретении, где указанную мини-таблетку или множество мини-таблеток вводят пациенту, имеющему трудности с проглатыванием таблетки для взрослых, например, пациенту детского возраста, в том числе, но не только, пациентам моложе шестилетнего возраста, тем, которым от 2 до 5 лет, которые моложе 2 лет, которым от нуля (т.е., с рождения) до 2 лет, которым от 1 до 2 лет, которым от 9 месяцев до 2 лет, которым от 6 месяцев до 2 лет, которым от 3 месяцев до 2 лет и которым от 2 месяцев до 2 лет. В некоторых вариантах осуществления рождение означает рождение после нормального срока беременности. В других примерах способ введения фармацевтической композиции включает пероральное введение пациенту каждые 12 часов по меньшей мере одной капсулы или пачки, содержащей мини-таблетку или множество мини-таблеток, каждая мини-таблетка содержит фармацевтическую композицию, описанную в настоящем изобретении, где указанную мини-таблетку или множество мини-таблеток перемешивают с пищевым продуктом или напитком для употребления пациентом, имеющим трудности с проглатыванием таблетки для взрослых, например, пациентом детского возраста, в том числе, но не только, масса тела которых превышает или равна приблизительно 14 килограммов, менее 14 килограммов, приблизительно от 7,5 килограммов до 14 килограммов, от приблизительно 5 килограммов до 7,5 килограммов и приблизительно от 2,5 килограммов до 5 килограммов. Также будет понятно, что соединение и фармацевтически приемлемые композиции по настоящему изобретению могут быть использованы в комбинированной терапии, то есть соединение и фармацевтически приемлемые композиции можно вводить одновременно, до или последовательно с одним или более другими желаемыми лекарственными средствами или медицинскими процедурами. Конкретное сочетание способов лечения (лекарственных средств или процедур) для использования в комбинированном режиме будет принимать во внимание совместимость желаемых лекарственных средств и/или процедур и желаемого терапевтического эффекта, который должен быть достигнут. Также будет понятно, что используемые лекарственные средства могут достигать желаемого эффекта для одних и тех же нарушений (например, соединение по настоящему изобретению можно принимать одновременно с другим средством, используемым для лечения того же нарушения), или они могут достигать различных эффектов (например, контролировать любой из побочных эффектов). В контексте настоящего изобретения дополнительные терапевтические средства, которые обычно вводят для лечения или профилактики конкретного заболевания или патологического состояния, известны как «подходящие для заболевания или патологического состояния, подвергаемого лечению».
[00764] В одном варианте осуществления дополнительное средство выбирают из муколитического средства, бронходилятатора, антибиотика, противоинфекционного средства, противовоспалительного средства, модулятора CFTR, отличного от Соединения 1 по настоящему изобретению, или питательного вещества.
[00765] В некоторых вариантах осуществления, в которых проводят лечение, профилактику и/или наблюдение за кистозным фиброзом, соединение или композицию по настоящему изобретению можно объединить, например, с 552-02, 5-метилтетрагидрофолатом и витамином B12, Ad5-CB-CFTR, вектором аденоассоциированный вирус-CFTR, альбутеролом, алендронатом, альфа токоферолом плюс аскорбиновая кислота, амилоридом HCl, aquADEK™, аталуреном (PTC124), AZD1236, AZD9668, азитромицином, бевацизумабом, биаксином (кларитромицин), BIIL 283 BS (амелубент), бупрофеном, карбонатом кальция, цефтазидимом, холекальциферолом, холиновой добавкой, CPX, регулятором трансмембранной проводимости при кистозном фиброзе, добавкой, обогащенной DHA, дигитоксином, докозагексаеновой кислотой (DHA), доксициклином, ECGC, рекомбинантным IGF-1 человека, натриевой солью восстановленного глутатиона, эргокальциферолом (витамин D2), фторметолоном, гадобутролом (GADOVIST®, BAY86-4875), гентамицином, грелином, гларгином, глутамином, гормоном роста, GS-9411, H5.001CBCFTR, рекомбинатным гормоном роста человека, гидроксихлорохином, гипербарическим кислородом, гипертоническим солевым раствором, проантоцианидиновым экстрактом виноградных косточек IH636, инсулином, интерфероном гамма-1b, IoGen (молекулярный йод), лозартаном калия, изотоническим солевым раствором, итрконазолом, нитратом галлия IV (GANITE.RTM.) для инфузий, кеторолак ацетатом, ланзопразолом, L-аргинином, линезолидом, лубипростоном, меропенемом, миглустатом, MP-376 (раствором левофлоксацина для ингаляции), нормальным солевым раствором для внутривенного введения, нутропином AQ, триглицеридами омега-3, pGM169/GL67A, липидным комплексом гена pGT-1, пиоглитазоном, PTC124, QAU145, сальметеролом, SB656933, SB656933, симвастатином, ситаглипином, 4-фенилбутиратом натрия, стандартизованным экстрактом желтокорня канадского, tgAAVCF, блокатором TNF, TOBI, тобрамицином, токотриенолом, неконъюгированными изофлавонами 100, витаминами: холин битартратом (2-гидроксиэтил) триметиламмонийной солью 1:1, ацетатом цинка, или их сочетаниями.
[00766] В одном варианте осуществления настоящее изобретение относится к набору, содержащему таблетку по настоящему изобретению и отдельное терапевтическое средство или его фармацевтическую композицию. В одном варианте осуществления дополнительным терапевтическим средством является регулятор CFTR. В другом варианте осуществления терапевтическое средство представляет собой (3-(6-(1-(2,2-дифторбензо[d][1,3]диоксол-5-ил)циклопропанкарбоксамидо)-3-метилпиридин-2-ил)бензойную кислоту или (R)-1-(2,2-дифторбензо[d][1,3]диоксол-5-ил)-N-(1-(2,3-дигидроксипропил)-6-фтор-2-(1-гидрокси-2-метилпропан-2-ил)-1H-индол-5-ил)циклопропанкарбоксамид. В другом варианте осуществления терапевтическое средство представляет собой (3-(6-(1-(2,2-дифторбензо[d][1,3]диоксол-5-ил)циклопропанкарбоксамидо)-3-метилпиридин-2-ил)бензойную кислоту. В другом варианте осуществления терапевтическое средство представляет собой (R)-1-(2,2-дифторбензо[d][1,3]диоксол-5-ил)-N-(1-(2,3-дигидроксипропил)-6-фтор-2-(1-гидрокси-2-метилпропан-2-ил)-1H-индол-5-ил)циклопропанкарбоксамид. В другом варианте осуществления таблетка и терапевтическое средство находятся в отдельных контейнерах. В другом варианте осуществления отдельные контейнеры представляют собой флаконы. В другом варианте осуществления отдельные контейнеры представляют собой пузырьки. В другом варианте осуществления отдельные контейнеры представляют собой блистерные упаковки.
[00767] В одном варианте осуществления дополнительным средством является антибиотик. Приводимые в качестве примера антибиотики, используемые в настоящем изобретении, включают тобрамицин, в том числе порошок тобрамицина для ингаляций (TIP), азитромицин, азтреонам, в том числе аэрозольную форму азтреонама, амикацин, в том числе его липосомные составы, ципрофлоксацин, в том числе его составы, подходящие для введения путем ингаляции, левофлоксацин, в том числе его аэрозольные составы, и сочетания двух антибиотиков, например, фосфомицина и тобрамицина.
[00768] В другом варианте осуществления дополнительное средство представляет собой муколитическое средство. Приводимые в качестве примера муколитические средства, используемые в настоящем изобретении, включают Pulmozyme®.
[00769] В другом варианте осуществления дополнительное средство представляет собой бронходилятатор. Приводимые в качестве примера бронходилятаторы включают альбутерол, метапротеренола сульфат, пирбутерола ацетат, сальметерол и тербуталина сульфат.
[00770] В другом варианте осуществления дополнительное средство является эффективным для восстановления поверхностной жидкости легочных дыхательных путей. Такие средства способствуют продвижению соли в и из клеток, помогая тем самым гидратации слизи в местах ее накопления в легочных дыхательных путях и, следовательно, способствуя их очищению. Типичные вышеуказанные средства включают гипертонический солевой раствор, денофозол тетранатрий ([[(3S,5R)-5-(4-амино-2-оксопиримидин-1-ил)-3-гидроксиоксолан-2-ил]метокси-гидроксифосфорил][[[(2R,3S,4R,5R)-5-(2,4-диоксопиримидин-1-ил)-3,4-дигидроксиоксолан-2-ил]метокси-гидроксифосфорил]окси-гидроксифосфорил]гидрофосфат), или бронхитол (ингаляционный препарат маннита).
[00771] В другом варианте осуществления дополнительное средство представляет собой противовоспалительное средство, т.е. средство, которое может уменьшить воспаление в легких. Типичные вышеуказанные средства, используемые в настоящем описании, включают ибупрофен, докозагексановую кислоту (DHA), силденафил, ингаляционный глутатион, пиоглитазон, гидроксихлорохин или симвастатин.
[00772] В другом варианте осуществления дополнительное средство представляет собой модулятор CFTR, отличный от Соединения 1, то есть средство, которое обладает свойствами модулятора активности CFTR. Приводимые в качестве примера вышеуказанные средства включают аталурен ("PTC124®"; 3-[5-(2-фторфенил)-1,2,4-оксадиказол-3-ил]бензойная кислота), синапултид, ланковутид, депелестат (ингибитор рекомбинантной нейтрофилэластазы человека), кобипростон (7-{(2R, 4aR, 5R, 7aR)-2-[(3S)-1,1-дифтор-3-метилпентил]-2-гидрокси-6-оксооктагидроциклопета[b]пиран-5-ил}гептановая кислота) или (3-(6-(1-(2,2-дифторбензо[d][1,3]диоксол-5-ил)циклопропан-карбоксамидо)-3-метилпиридин-2-ил)бензойную кислоту. В другом варианте дополнительным средством является (3-(6-(1-(2,2-дифторбензо[d][1,3]диоксол-5-ил)циклопропакарбоксамидо)-3-метилпиридин-2-ил)бензойная кислота.
[00773] В другом варианте осуществления дополнительное средство представляет собой питательное вещество. Такие средства, приводимые в качестве примера, включают панкрелипазу (заменитель фермента поджелудочной железы), в том числе Pancrease®, Pancreacarb®, Ultrase® или Creon®, Liprotamase® (ранее Trizytek®), Aquadeks® или ингаляционный глутатион. В одном варианте осуществления дополнительным питательным веществом является панкрелипаза.
V. ПРИМЕРЫ
[00774] Для более полного понимания изобретения, представленного в настоящем описании, приводятся следующие примеры. Должно быть понятно, что эти примеры представлены только с целью иллюстрации и их не следует рассматривать как какое-либо ограничение данного изобретения.
[00775] A. Производство капсул
[00776] Пример 1: Получение промежуточного соединения 1, содержащего по существу аморфное или аморфное Соединение 1
[00777] Синтез N-[2,4-бис(1,1-диметилэтил)-5-гидроксифенил]-1,4-дигидро-4-оксохинолин-3-карбоксамида описан в публикациях патентных заявок Соединенных Штатов US 2006/0074075 (в настоящее время патент US 7495103), US 2011/0064811, US 2010/0267768 и US 2011/0230519, содержание которых таким образом включено посредством ссылки в полном объеме. Систему растворителя из MEK и DI [деионизированной] воды, полученную при соотношении 90% масс. MEK/10% масс. DI вода, нагревали до температуры 20-30°C в реакторе, оснащенном магнитной мешалкой и тепловым контуром. В эту систему растворителя добавляли полимер ацетат сукцинат гипромеллозы (HPMCAS) (высокой очистки), SLS и N-[2,4-бис(1,1-диметилэтил)-5-гидроксифенил]-1,4-дигидро-4-оксохинолин-3-карбоксамид в соответствии с соотношением 19,5 масс.% ацетат сукцината гипромелозы/0,5 масс.% SLS/80 масс.% N-[2,4-бис(1,1-диметилэтил)-5-гидроксифенил]-1,4-дигидро-4-оксохинолин-3-карбоксамида. Полученная в результате смесь содержала 10,5 масс.% твердых веществ. Фактические количества ингредиентов и растворителей, используемые для получения этой смеси, перечислены в Таблице 1а, приведенной ниже:
Ингредиенты твердой распыляемой дисперсии для промежуточного соединения 1
[00779] Температуру смеси устанавливают в интервале 20-45°C и перемешивают, пока эта смесь не станет по существу гомогенной и все компоненты не будут растворены в значительной степени.
[00780] Распылительную сушилку, Niro PSD4 Commercial Spray Dryer, оборудованную форсункой высокого давления (Spray Systems Maximum Passage series SK-MFP, имеющие размер сопло/сердечник 54/21), оснащенной колпачком для выравнивания распылительной струи, используют в обычном режиме сушки распылением, следуя параметрам способа сушки распылением, представленным в Таблице 1b, приведенной ниже.
Параметры способа сушки распылением, используемые для получения промежуточного соединения 1.
затем 110°C (±5°C)
[00782] Циклон с высокой эффективностью отделял влажный продукт от газа-распылителя и паров растворителей. Влажный продукт содержал 8,5-9,7% MEK и 0,56-0,83% воды и имел средний размер частиц 17-19 мкм и насыпную плотность 0,27-0,33 г/см3. Влажный продукт переносили в вакуумную сушилку с двойным конусом из нержавеющей стали емкостью 4000 л для дальнейшей сушки с целью снижения содержания остаточных растворителей до уровня примерно меньше 5000 ч/млн и получения сухого Промежуточного соединения 1. Сухое промежуточное соединение 1 содержало <0,03% MEK и 0,3% воды.
[00783] Несмотря на приведенное выше описание получения промежуточного соединения 1, отчасти, путем смешения ингредиентов распыляемой дисперсии твердых веществ с применением нагрева для образования гомогенной смеси, ингредиенты распыляемой дисперсии твердых веществ могут быть также смешаны и без применения нагрева с получением смеси ингредиентов распыляемой дисперсии твердых веществ.
[00784] Пример 2: Получение порошкообразной смеси, содержащей примерно 75 мг по существу аморфного или аморфного Соединения 1, инкапсулированной в приводимую в качестве примера капсулу 1
[00785] Получают партию порошкообразной смеси для инкапсулирования, содержащую приблизительно 75 мг Соединения 1 на капсулу, используя количества ингредиентов, представленные в Таблице 2.
Ингредиенты для приводимой в качестве примера капсулы 1, содержащей порошкообразную смесь.
[00787] Промежуточное соединение 1, маннит (Pearlitol® 100 SD, коммерчески доступный от компании Roquette America Inc. of Keokuk IA), сукралозу (Splenda®, коммерчески доступную от компании Tate and Lyle of Decatur, IL), коллоидный диоксид кремния (Cabot Cab-O-Sil® M-5P Fumed Silicon Dioxide, коммерчески доступный от компании Cabot Corporation of Alpharetta, GA) и стеарат магния (Fisher Scientific или как Hyqual®, коммерчески доступный от компании Mallinckrodt Chemicals) просеивают через сито 20 и 60 меш для удаления комков.
[00788] Промежуточное соединение 1, коллоидный диоксид кремния и сукралозу перемешивают вместе в течение 25 минут и просеивают через сито с размером ячеек 20 меш для удаления любых комков. Стеарат магния просеивают через сито 60 меш для удаления комков. Смесь промежуточного соединения 1 добавляют к 20% от всего количества стеарата магния и объединяют в V-образном смесителе емкостью 8 кварт и перемешивают в течение 25 минут при 20-24 об/мин, получая, таким образом, первую перемешанную смесь. Маннит просеивают через сито 20 меш для удаления комков. Маннит затем добавляют в первую перемешанную смесь и перемешивают в течение дополнительных 25 минут при 20-24 об/мин с получением второй перемешанной смеси. Вторую перемешанную смесь дополнительно протирают через сито 024R, используя Comil, а затем оставшиеся 80% от всего количества стеарат магния добавляют в просеянную вторую перемешанную смесь, с получением порошкообразной смеси. Один эквивалент единичной дозы порошкообразной смеси (всего 203 мг), содержащей приблизительно 75 мг по существу аморфного или аморфного Соединения 1, затем инкапсулируют, используя IN-CAP® автоматическую настольную машину для заполнения капсул, используя твердые желатиновые или HPMC капсулы.
[00789] Пример 3: Получение порошкообразной смеси, содержащей примерно 75 мг по существу аморфного или аморфного Соединения 1 инкапсулированного в приводимую в качестве примера капсулу 2
[00790] Получали партию порошкообразной смеси для инкапсулирования, содержащую приблизительно 75 мг Соединения 1 на капсулу, используя количества ингредиентов, представленные в Таблице 3.
Ингредиенты для приводимой в качестве примера капсулы 2,
содержащей порошкообразную смесь.
[00792] Промежуточное соединение 1 и сукралозу (коммерчески доступную от компании Tate and Lyle of Decatur, IL) совместно просеивали через сито 20 меш (850 микрометров). Маннит (Pearlitol® 100 SD, коммерчески доступный от компании Roquette America Inc. of Keokuk IA) и коллоидный диоксид кремния (Cabot Cab-O-Sil® M-5P Fumed Silicon Dioxide, коммерчески доступный от компании Cabot Corporation of Alpharetta, GA) совместно просеивали через сито 20 меш (850 микрометров). Стеарат магния (коммерчески доступный от компании Fisher Scientific, Pittsburgh, PA) просеивали через сито 60 меш (250 микрометров) для удаления комков.
[00793] Промежуточное соединение 1 и сукралозу (совместно просеянные), и маннит, и коллоидный диоксид кремния (совместно просеянные) перемешивали вместе в течение 6,5 минут при 20-27 об/мин в V-образном смесителе емкостью 4 кварты. Стеарат магния (предварительно просеянный) добавляли в эту смесь в V-образный смеситель емкостью 4 кварты и перемешивали в течение 4 минут при 20-27 об/мин. Один эквивалент единичной дозы порошкообразной смеси (всего 200 мг, содержащей приблизительно 75 мг по существу аморфного или аморфного Соединения 1) затем инкапсулировали, используя IN-CAP® автоматическую настольную машину для заполнения капсул. используя твердые желатиновые или HPMC капсулы.
[00794] Пример 4: Получение порошкообразной смеси, содержащей примерно 75 мг по существу аморфного или аморфного Соединения 1, инкапсулированного в приводимую в качестве примера капсулу 3
[00795] Получали партию порошкообразной смеси для инкапсулирования, содержащую приблизительно 75 мг Соединения 1 на капсулу, используя количества ингредиентов, представленные в Таблице 4.
Ингредиенты для приводимой в качестве примера капсулы 3,
содержащей порошкообразную смесь.
[00797] Промежуточное соединение 1 и сукралозу (коммерчески доступную от компании Tate and Lyle of Decatur, IL) совместно просеивали через сито 30 меш (600 микрометров). Маннит (Pearlitol® 100 SD, коммерчески доступный от компании Roquette America Inc. of Keokuk IA) и коллоидный диоксид кремния (Cabot Cab-O-Sil® M-5P Fumed Silicon Dioxide, коммерчески доступный от компании Cabot Corporation of Alpharetta, GA) совместно просеивали через сито 30 меш (600 микрометров). Стеарат магния (коммерчески доступный от компании Fisher Scientific, Pittsburgh, PA) просеивали через сито 60 меш (250 микрометров) для удаления комков.
[00798] Промежуточное соединение 1 и сукралозу (совместно просеянные), и маннит, и коллоидный диоксид кремния (совместно просеянные) перемешивали вместе в течение 7 минут при 20-27 об/мин в V-образном смесителе емкостью 2 кварты. Эту смесь протирали через сито 024R (610 микрометров) при 5000 об/мин, используя Quadro Comil U5. Стеарат магния (предварительно просеянный) добавляют в эту смесь в V-образном смесителе емкостью 2 кварты и перемешивают в течение 5,5 минут при 20-27 об/мин. Один эквивалент единичной дозы порошкообразной смеси (всего 200 мг, содержащей приблизительно 75 мг по существу аморфного или аморфного Соединения 1) затем инкапсулировали, используя IN-CAP® автоматическую настольную машину для заполнения капсул, с использованием капсул HPMC.
[00799] Пример 5: Получение порошкообразной смеси, содержащей приблизительно 15 мг по существу аморфного или аморфного Соединения 1, инкапсулированной в приводимую в качестве примера капсулу 4
[00800] Получали партию порошкообразной смеси для инкапсулирования, содержащую приблизительно 15 мг Соединения 1 на капсулу, используя количества ингредиентов, представленные в Таблице 5.
Ингредиенты для приводимой в качестве примера капсулы 4, содержащей порошкообразную смесь
[00802] Промежуточное соединение 1 и Сукралозу (коммерчески доступно от компании Tate and Lyle of Decatur, IL) совместно просеивали через сито 20 меш (850 микрометров). Маннит (Pearlitol® 100 SD, коммерчески доступный от компании Roquette America Inc. of Keokuk IA) и коллоидный диоксид кремния (Cabot Cab-O-Sil® M-5P Fumed Silicon Dioxide, коммерчески доступный от компании Cabot Corporation of Alpharetta, GA) совместно просеивали через сито 20 меш (850 микрометров). Стеарат магния (коммерчески доступный от компании Fisher Scientific, Pittsburgh, PA) просеивали через сито 60 меш (250 микрометров) для удаления комков.
[00803] Промежуточное соединение 1 и сукралозу (совместно просеянные) и маннит, и коллоидный диоксид кремния (совместно просеянные) перемешивали вместе в течение 6 минут при 20-27 об/мин в V-образном смесителе емкостью 4 кварты. Стеарат магния (предварительно просеянный) добавляли в эту смесь в V-образном смесителе емкостью 4 кварты и перемешивали в течение 4 минут при 20-27 об/мин. Один эквивалент единичной дозы порошкообразной смеси (всего 120 мг, содержащие приблизительно 15 мг по существу аморфного или аморфного Соединения 1) затем инкапсулировали, используя IN-CAP® автоматическую настольную машину для заполнения капсул, используя твердые желатиновые или HPMC капсулы.
[00804] Пример 6: Получение порошкообразной смеси, содержащей приблизительно 50 мг по существу аморфного или аморфного Соединения 1 инкапсулированной в приводимую в качестве примера капсулу 5.
[00805] Получали партию порошкообразной смеси для инкапсулирования, содержащую приблизительно 50 мг Соединения 1 на капсулу, используя количества ингредиентов, представленные в Таблице 6.
Ингредиенты для приводимой в качестве примера капсулы 5, содержащей порошкообразную смесь
[00807] Промежуточное соединение 1 и сукралозу (коммерчески доступную от компании Tate and Lyle of Decatur, IL) совместно просеивали через сито 20 меш (850 микрометров). Маннит (Pearlitol® 100 SD, коммерчески доступный от компании Roquette America Inc. of Keokuk IA) и коллоидный диоксид кремния (Cabot Cab-O-Sil® M-5P Fumed Silicon Dioxide, коммерчески доступный от компании Cabot Corporation of Alpharetta, GA) совместно просеивали через сито 30 меш (600 микрометров). Стеарат магния (коммерчески доступный от компании Fisher Scientific, Pittsburgh, PA) просеивали через сито 60 меш (250 микрометров) для удаления комков.
[00808] Промежуточное соединение 1 и сукралозу (совместно просеянные), и маннит, и коллоидный диоксид кремния (совместно просеянные) перемешивали вместе в течение 6 минут при 20-27 об/мин в V-образном смесителе емкостью 4 кварты. Эту смесь протирали через сито 018R при 5000 об/мин, используя Quadro Comil U5. Стеарат магния (предварительно просеянный) добавляли в эту смесь в V-образный смеситель 4 Q и перемешивали в течение 4 минут при 20-27 об/мин. Один эквивалент единичной дозы порошкообразной смеси (всего 170 мг, содержащей приблизительно 50 мг по существу аморфного или аморфного Соединения 1) затем инкапсулировали, используя IN-CAP автоматическую настольную машину для заполнения капсул, используя твердые желатиновые или HPMC капсулы.
[00809] B. Получение мини-таблеток и капсул, содержащих мини-таблетки
[00810] Пример 7: Приводимая в качестве примера мини-таблетка 1 в составе приводимой в качестве примера капсулы 6 (капсула получена таким образом, что содержит приблизительно 75 мг Соединения 1)
[00811] Получали партию цилиндрических мини-таблеток диаметром 2 мм, длиной 2 мм (масса каждой мини-таблетки составляет приблизительно 7,0 мг каждая), содержащих приблизительно 75 мг Соединения 1 приблизительно на 29 мини-таблеток, используя количества ингредиентов, представленные в Таблице 7, приведенной ниже.
Ингредиенты для приводимых в качестве примера мини-таблеток
для капсулы 6
[00813] Промежуточное соединение 1, маннит (Pearlitol® 100 SD, коммерчески доступный от компании Roquette America Inc. of Keokuk IA), сукралозу (Splenda® коммерчески доступную от компании Lyle and Tate of Decatur, IL), кроскармеллозу натрия (FMC Ac-Di-Sol®, коммерчески доступную от компании FMC BioPolymer Corporation of Philadelphia, PA), лаурилсульфат натрия (SLS), доступный от Fischer Scientific, и коллоидный диоксид кремния (Cabot Cab-O-Sil® M-5P Fumed Silicon Dioxide, коммерчески доступный от компании Cabot Corporation of Alpharetta, GA) и стеарат магния (Hyqual®, коммерчески доступный от компании Mallinckrodt Chemicals) просеивают через сито 30 и 60 меш для удаления комков.
[00814] Промежуточное соединение 1, коллоидный диоксид кремния, сукралозу и SLS перемешивают вместе в течение 25 минут и просеивают через сито 20 меш для удаления каких-либо комков. Стеарат магния просеивают через сито 60 меш для удаления комков. Смесь промежуточного соединения 1 добавляют к 20% от всего количества стеарата магния и объединяют в V-образном смесителе емкостью 8 кварт, и перемешивают в течение 25 минут при 20-24 об/мин, получая, таким образом, первую перемешанную смесь. Маннит и кроскармеллозу натрия добавляют вместе и просеивают через сито 20 меш для удаления комков. Смесь маннита и кроскармеллозы натрия затем добавляют к первой перемешанной смеси и перемешивают в течение дополнительных 25 минут при 20-24 об/мин с получением второй перемешанной смеси. Вторую перемешанную смесь дополнительно протирают, используя Comil, через сито 30 меш, а затем добавляют оставшиеся 80% от всего количества стеарата магния к просеянной второй перемешанной смеси, получая прессуемую смесь. После завершения получения прессуемой смеси, эту прессуемую смесь переносят в 19-позиционный роторный таблеточный пресс Kikusui B-Tooling (полуоснащенный) для прессования (Kikusui USA, Lakewood, NJ). Прессование смеси в мини-таблетки давало цилидрические мини-таблетки диаметром 2 мм, длиной 2 мм, каждая мини-таблетка приблизительно содержит 2,63 мг N-[2,4-бис(1,1-диметилэтил)-5-гидроксифенил]-1,4-дигидро-4-оксохинолин-3-карбоксамида и имеет начальную прочность при растяжении между приблизительно 0,5 МПа и приблизительно 4 МПа. Примерно 29 мини-таблеток (всего 203 мг) затем инкасулируют, используя IN-CAP® автоматическую настольную машину для заполнения капсул, используя твердые желатиновые или HPMC капсулы.
[00815] Пример 8: Приводимая в качестве примера мини-таблетка 1 в составе приводимой в качестве примера капсулы 7 (капсула получена таким образом, что содержит приблизительно 75 мг Соединения 1)
[00816] Получали партию мелких выпуклых цилиндрических мини-таблеток диаметром 2 мм, длиной 2 мм (масса каждой мини-таблетки составляет приблизительно 7,0 мг), содержащих приблизительно 75 мг Соединения 1 приблизительно на 29 мини-таблеток, используя количества ингредиентов, представленные в Таблице 8, приведенной ниже.
Ингредиенты для приводимых в качестве примера мини-таблеток
для капсулы 7
[00818] Промежуточное соединение 1, сукралозу (коммерчески доступную от компании Tate and Lyle of Decatur, IL), лаурилсульфат натрия (SLS, of Fisher Scientific) и коллоидный диоксид кремния (Cabot Cab-O-Sil® M-5P Fumed Silicon Dioxide, коммерчески доступный от компании Cabot Corporation of Alpharetta, GA) совместно просеивали через сито 30 меш (600 микрометров). Маннит (Pearlitol® 100 SD, коммерчески доступный от компании Roquette America Inc. of Keokuk IA) и кроскармеллозу натрия (FMC Ac-Di-Sol®, коммерчески доступную от компании FMC BioPolymer Corporation of Philadelphia, PA) совместно просеивали через сито 30 меш (600 микрометров). Стеарат магния (Hyqual®, коммерчески доступный от компании Mallinckrodt Chemicals) просеивали через сито 60 меш (250 микрометров).
[00819] Совместно просеянное промежуточное соединение 1, коллоидный диоксид кремния, сукралозу и SLS, и 20 масс.% просеянного стеарата магния перемешивали вместе в течение 15 минут при 20-27 об/мин в V-образном смесителе емкостью 4 кварты. Совместно просеянные маннит и кроскармеллозу натрия добавляли в эту смесь и перемешивали в течение 7 минут при 20-27 об/мин. Вторую перемешанную смесь протирали через сито 610 микрометров, используя Comil. Оставшиеся 80% от всего количества стеарата магния добавляли в эту смесь в V-образном смесителе емкостью 4 кварты и перемешивали в течение 5 минут при 20-27 об/мин, с получением прессуемой смеси. После завершения получения прессуемой смеси, эту прессуемую смесь переносят в Kikusui B-tooling роторный таблеточный пресс. Порошкообразную смесь прессовали в мини-таблетки, используя все 19 положений таблеточного пресса 19 Kikusui (Kikusui USA, Lakewood, NJ). Мини-таблетки прессовали в мелкую выпуклую цилиндрическую форму диаметром 2 мм, толщиной приблизительно 2мм, массой приблизительно 7 мг, каждая мини-таблетка приблизительно содержит 2,6 мг N-[2,4-бис(1,1-диметилэтил)-5-гидроксифенил]-1,4-дигидро-4-оксохинолин-3-карбоксамида и имеет среднюю прочность при растяжении приблизительно 3,1 МПа. Примерно 29 мини-таблеток (всего 203 мг) затем инкапсулируют, используя IN-CAP® автоматическую настольную машину для заполнения капсул, с использованием HPMC капсулы.
[00820] Пример 9: Приводимая в качестве примера мини-таблетка 1 в составе приводимой в качестве примера капсулы 8 (капсула получена таким образом, что содержит приблизительно 75 мг Соединения 1)
[00821] Получали партию мелких выпуклых цилиндрических мини-таблеток диаметром 2 мм, длиной 2 мм (масса каждой мини-таблетки составляет приблизительно 7,0 мг), содержащих приблизительно 75 мг Соединения 1 приблизительно на 29 мини-таблеток, используя количества ингредиентов, представленные в Таблице 9, приведенной ниже.
Ингредиенты для приводимых в качестве примера мини-таблеток
для капсулы 8
[00823] Промежуточное соединение 1, сукралозу (коммерчески доступную от компании Tate and Lyle of Decatur, IL), лаурилсульфат натрия (SLS, of Fisher Scientific) и коллоидный диоксид кремния (Cabot Cab-O-Sil® M-5P Fumed Silicon Dioxide, коммерчески доступный от компании Cabot Corporation of Alpharetta, GA) совместно просеивали через сито 30 меш (600 микрометров). Маннит (Pearlitol® 100 SD, коммерчески доступный от компании Roquette America Inc. of Keokuk IA) и кроскармеллозу натрия (FMC Ac-Di-Sol®, коммерчески доступную от компании FMC BioPolymer Corporation of Philadelphia, PA) совместно просеивали через сито 30 меш (600 микрометров). Стеарат магния (Hyqual®, коммерчески доступный от компании Mallinckrodt Chemicals) просеивали через сито 60 меш (250 микрометров).
[00824] Совместно просеянное промежуточное соединение 1, коллоидный диоксид кремния, сукралозу и SLS, и 20 масс.% просеянного стеарата Mg перемешивали вместе в течение 15 минут при 20-27 об/мин в V-образном смесителе емкостью 4 кварты. Совместно просеянные маннит и кроскармеллозу натрия добавляли в эту смесь и перемешивали в течение 7 минут при 20-27 об/мин. Эту смесь протирали через сито 024R (610 микрометров) при 2700 об/мин, используя Quadro Comil 197. Оставшиеся 80% от всего количества стеарата магния добавляли в эту смесь (протертую, с использованием конусной мельницы) в V-образном смесителе емкостью 4 кварты и перемешивали в течение 5 минут при 20-27 об/мин с получением прессуемой смеси. После завершения получения прессуемой смеси прессуемую смесь переносили в роторный таблеточный пресс Kikusui B-tooling. Порошкообразную смесь прессовали в мини-таблетки, используя все 19 положений таблеточного пресса Kikusui (Kikusui USA, Lakewood, NJ). Мини-таблетки прессовали в мелкие выпуклые цилиндрической формы диаметром 2 мм, толщиной приблизительно 2 мм, массой приблизительно 7 мг, каждая мини-таблетка приблизительно содержит 2,6 мг N-[2,4-бис(1,1-диметилэтил)-5-гидроксифенил]-1,4-дигидро-4-оксохинолин-3-карбоксамида и имеет среднюю прочность при растяжении приблизительно 2,5 МПа. Примерно 29 мини-таблеток (всего 203 мг) затем инкапсулировали, используя IN-CAP® автоматическую настольную машину для заполнения капсул, с использованием HPMC капсулы.
[00825] Пример 10: Приводимая в качестве примера мини-таблетка 2, содержащая приблизительно 10 мг по существу аморфного или аморфного Соединения 1
[00826] Получали партию стандартных выпуклых цилиндрических таблеток диаметром 4 мм, толщиной приблизительно 2,5-3 мм, содержащих приблизительно 10 мг Соединения 1 на таблетку, используя количества ингредиентов, представленные в Таблице 10.
Ингредиенты для приводимой в качестве примера мини-таблетки 2
[00828] Промежуточное соединение 1, сукралозу (коммерчески доступную от компании Tate and Lyle of Decatur, IL), лаурилсульфат натрия (SLS, of Fisher Scientific) и коллоидный диоксид кремния (Cabot Cab-O-Sil® M-5P Fumed Silicon Dioxide, коммерчески доступный от компании Cabot Corporation of Alpharetta, GA) совместно просеивали через сито 30 меш (600 микрометров). Маннит (Pearlitol® 100 SD, коммерчески доступный от компании Roquette America Inc. of Keokuk IA) и кроскармеллозу натрия (FMC Ac-Di-Sol®, коммерчески доступную от компании FMC BioPolymer Corporation of Philadelphia, PA) совместно просеивали через сито 30 меш (600 микрометров). Стеарат магния (коммерчески доступный от компании Fisher Scientific, Pittsburgh, PA) просеивали через сито 60 меш (250 микрометров).
[00829] Совместно просеянное промежуточное соединение 1, коллоидный диоксид кремния, сукралозу и SLS, и 20 масс.% просеянного стеарата магния перемешивали вместе в течение 15 минут при 20-27 об/мин в V-образном смесителе емкостью 4 кварты. Совместно просеянные маннит и кроскармеллозу натрия добавляли в эту смесь и перемешивали в течение 7 минут при 20-27 об/мин. Вторую перемешанную смесь протирали, используя Comil, через сито 610 микрометров. Оставшиеся 80% от всего количества стеарата магния добавляли в эту смесь в V-образном смесителе емкостью 4 кварты и перемешивали в течение 5 минут при 20-27 об/мин с получением прессуемой смеси. Прессуемую смесь переносили в Piccola 8-позиционный таблеточный пресс. Круглые выпуклые таблетки диаметром 4 мм прессовали, используя стандартную круглую чашечную оснастку диаметром 4 мм. Масса каждой таблетки составляла приблизительно 26,7 мг, а толщина составляла ~2,5-3 мм. Каждая таблетка содержала приблизительно 10 мг Соединения 1.
[00830] Пример 11: Приводимая в качестве примера мини-таблетка 3, содержащая, приблизительно, 10 мг по существу аморфного или аморфного Соединения 1
[00831] Получали партию стандартных выпуклых цилиндрических таблеток диаметром 4 мм, толщиной приблизительно 2,5-3,5 мм, содержащих приблизительно 10 мг Соединения 1 на таблетку, используя количества ингредиентов, представленные в Таблице 11.
Ингредиенты для приводимой в качестве примера мини-таблетки 3
[00833] Промежуточное соединение 1, сукралозу (коммерчески доступную от компании Tate and Lyle of Decatur, IL), лаурилсульфат натрия (SLS, of Fisher Scientific) и коллоидный диоксид кремния (Cabot Cab-O-Sil® M-5P Fumed Silicon Dioxide, коммерчески доступный от компании Cabot Corporation of Alpharetta, GA) совместно просеивали через сито 30 меш (600 микрометров). Маннит (Pearlitol® 100 SD, коммерчески доступный от компании Roquette America Inc. of Keokuk IA) и кроскармеллозу натрия (FMC Ac-Di-Sol®, коммерчески доступно от компании FMC BioPolymer Corporation of Philadelphia, PA) совместно просеивали через сито 30 меш (600 микрометров). Стеарат магния (коммерчески доступный от компании Fisher Scientific, Pittsburgh, PA) просеивали через сито 60 меш (250 микрометров).
[00834] Совместно просеянное промежуточное соединение 1, коллоидный диоксид кремния, сукралозу и SLS, и 20 масс.% просеянного стеарата магния перемешивали вместе в течение 15 минут при 20-27 об/мин в V-образном смесителе емкостью 4 кварты. Совместно просеянные маннит и кроскармеллозу натрия добавляли в эту смесь и перемешивали в течение 7 минут при 20-27 об/мин. Вторую перемешанную смесь протирали, используя Comil, через сито 610 микрометров. Оставшиеся 80% от всего количества стеарата магния добавляли в эту смесь в V-образном смесителе емкостью 4 кварты и перемешивали в течение 5 минут при 20-27 об/мин с получением прессуемой смеси. Прессуемую смесь переносили в Piccola 8-позиционный таблеточный пресс. Круглые выпуклые таблетки диаметром 4 мм прессовали, используя стандартную круглую чашечную оснастку диаметром 4 мм. Масса каждой таблетки составляла приблизительно 35,7 мг, а толщина составляла 2,5-3,5 мм. Каждая таблетка содержала приблизительно 10 мг Соединения 1.
[00835] Пример 12: Приводимая в качестве примера мини-таблетка 4 в составе приводимой в качестве примера капсулы 9 (капсула содержит приблизительно 75 мг Соединения 1)
[00836] Получали партию цилиндрических мини-таблеток диаметром 2 мм, толщиной приблизительно 2 мм (масса каждой мини-таблетки составляет приблизительно 7 мг), содержащих приблизительно 75 мг Соединения 1 приблизительно на 38 мини-таблеток, используя количества ингредиентов, представленные в Таблице 12.
Ингредиенты для приводимой в качестве примера Мини-таблетки 4
[00838] Промежуточное соединение 1, сукралозу (коммерчески доступную от компании Tate and Lyle of Decatur, IL), лаурилсульфат натрия (SLS, of Fisher Scientific) и коллоидный диоксид кремния (Cabot Cab-O-Sil® M-5P Fumed Silicon Dioxide, коммерчески доступный от компании Cabot Corporation of Alpharetta, GA) совместно просеивали через сито 30 меш (600 микрометров). Маннит (Pearlitol® 100 SD, коммерчески доступныый от компании Roquette America Inc. of Keokuk IA) и кроскармеллозу натрия (FMC Ac-Di-Sol®, коммерчески доступную от компании FMC BioPolymer Corporation of Philadelphia, PA) совместно просеивали через сито 30 меш (600 микрометров). Стеарат магния (коммерчески доступный от компании Fisher Scientific, Pittsburgh, PA) просеивали через сито 60 меш (250 микрометров).
[00839] Совместно просеянное промежуточное соединение 1, коллоидный диоксид кремния, сукралозу и SLS, и 20 масс.% просеянного стеарата магния перемешивали вместе в течение 15 минут при 20-27 об/мин в V-образном смесителе емкостью 2 кварты. Совместно просеянные маннит и кроскармеллозу натрия добавляли в эту смесь и перемешивали в течение 7 минут при 20-27 об/мин. Вторую перемешанную смесь протирали через сито 610 микрометров, используя Comil. Оставшиеся 80% от всего количества стеарата магния добавляли в эту смесь в V-образном смесителе емкостью 2 кварты и перемешивали в течение 5 минут при 20-27 об/мин с получением прессуемой смеси. Прессуемую смесь переносили в 8 позиционный таблеточный пресс Piccola. Круглые выпуклые таблетки диаметром 2 мм прессовали, используя круглую мелкую чашечную оснастку диаметром 2 мм. Масса каждой таблетки составляла приблизительно 7 мг, а толщина составляла ~2 мм. Каждая таблетка содержит приблизительно 1,97 мг Соединения 1.
[00840] Пример 13: Приводимая в качестве примера мини-таблетка 5, полученная способом сухой грануляции, в составе приводимой в качестве примера капсулы 10 (капсула содержит приблизительно 75 мг Соединения 1)
[00841] Получали партию цилиндрических мини-таблеток диаметром 2 мм, толщиной приблизительно 2 мм, (масса каждой мини-таблетки составляет приблизительно 7 мг), содержащих приблизительно 75 мг Соединения 1 приблизительно на 29 мини-таблеток, используя количества ингредиентов, представленные в Таблице 13.
Ингредиенты для приводимой в качестве примера мини-таблетки 5
(Pearlitol 25C)
[00843] Промежуточное соединение 1 и Cabosil просеивали через сито 20 меш, а затем перемешивали вручную в небольшом контейнере, а затем совместно просеивали через сито 40 меш. Эту смесь перемешивали в смесителе Turbula в течение 10 минут при 32 об/мин. Эту смесь пропускали через Comil 193при 2000 об/мин, используя сито 032R. Маннит (Pearlitol 25C) и SLS и Сукралозу и AcDiSol просеивали через сито 20 меш. Эту смесь и смесь промежуточного соединения 1 и Cabosil перемешивали в течение 10 минут при 32 об/мин в смесителе Turbula. Эту смесь пропускали через Comil 193 при 2000 об/мин, используя сито 032R. Этот продукт затем перемешивали в течение 15 минут в смесителе Turbula при 32 об/мин. Стеарат магния просеивали через сито 40 меш и половину перемешивали вручную с 3 объемами смеси. Эту смесь перемешивали в течение 4 минут в смесителе Turbula с оствшейся смесью при 32 об/мин. Порошкообразную смесь затем прессовали в плоские круглые заготовки размером ~0,5 дюйма, имеющие прочность при растяжении ~0,25 МПа, используя F-Press. Указанные заготовки осторожно измельчали вручную, используя ступку с пестиком, и пропускали через сито 30 меш. Оставшуюся половину просеянного стеарата магния перемешивали вручную с тремя объемами смеси. Эту смесь перемешивали в течение 4 мин с оставшейся смесью в смесителе Turbula при 32 об/мин для получения прессуемой смеси. Прессуемую смесь затем прессовали в выпуклые 2 мм мини-таблетки диаметром 2 мм на Key Press, используя мелкую круглую чашечную оснастку диаметром 2 мм. Масса каждой мини-таблетки составляла ~7 мг и содержала ~2,63 мг Соединения 1.
[00844] Пример 14: Приводимая в качестве примера мини-таблетка 6 в составе приводимой в качестве примера капсулы 11 (в составе капсулы приблизительно 50 мг и приблизительно 75 мг Соединения 1)
[00845] Получали партию цилиндрических мини-таблеток диаметром ~2 мм, толщиной ~2 мм (масса каждой мини-таблетки составляет приблизительно 6,9 мг), таким образом, чтобы содержалось приблизительно 50 мг Соединения 1 на 26 мини-таблеток и приблизительно 75 мг Соединения 1 на 39 мини-таблеток, с использованием количеств ингредиентов, перечисленных в приведенной ниже Таблице 14.
Ингредиенты для мини-таблеток для капсулы 11 с активностью
50 мг и 75 мг
[00847] Промежуточное соединение 1, сукралозу (коммерчески доступную от компании Tate and Lyle of Decatur, IL) и коллоидный диоксид кремния (Cabot Cab-O-Sil® M-5P Fumed Silicon Dioxide, коммерчески доступный от компании Cabot Corporation of Alpharetta, GA) совместно просеивали через сито 30 меш (600 микрометров). Маннит (Pearlitol® 100 SD, коммерчески доступный от компании Roquette America Inc. of Keokuk IA), лактозу (высушенный распылением моногидрат лактозы Fast Flo 316, коммерчески доступный от компании Foremost Bara-boo, WI) и кроскармеллозу натрия (Ac-Di-Sol®, коммерчески доступную от компании FMC BioPolymer Corporation of Philadelphia, PA) совместно просеивали через сито 30 меш (600 микрометров). Стеарат магния (коммерчески доступный от компании Fisher Scientific) просеивали через сито 60 меш (250 микрометров).
[00848] Совместно просеянное промежуточное соединение 1, коллоидный диоксид кремния, сукралозу и 20 масс.% просеянного стеарата Mg перемешивали вместе в течение 15 минут при 35 об/мин в 20-литровом бункерном смесителе из нержавеющей стали Bohle. Совместно просеянные маннит и лактозу и кроскармеллозу натрия добавляли в эту смесь и перемешивали в течение 7 минут при 35 об/мин. Эту смесь обрабатывали на конусной мельнице через сито 024R (610 микрометров) при 5000 об/мин с использованием Quadro Comil 197. Оставшиеся 80% от всего количества стеарата магния добавляли в смесь, обработанную на конусной мельнице, в 20-литровом бункерном смесителе из нержавеющей стали Bohle и перемешивали в течение 5 минут при 35 об/мин с образованием прессовочной смеси. Эту прессовочную смесь переносили в Korsch XM12 B-tooling роторный таблеточный пресс, оснащенный 9 наборами инструментов с множеством насадок (8 насадок на пуасон). Эту смесь прессовали в мини-таблетки цилиндрической формы диаметром ~2 мм, с толщиной приблизительно 1,94 мм, с массой приблизительно 6,9 мг, каждая мини-таблетка содержит приблизительно 1,92 мг N-[2,4-бис(1,1-диметилэтил)-5-гидроксифенил]-1,4-дигидро-4-оксохинолин-3-карбоксамида и имеет среднюю прочность при растяжении приблизительно 1 МПа. 26 мини-таблеток (всего ~178,6 мг, с активностью 50 мг) затем инкапсулировали, используя IN-CAP® автоматическую настольную машину для заполнения капсул, используя капсулы Vcaps Plus HPMC. Капсулы с активностью 75 мг были изготовлены путем заполнения капсул Vcaps Plus HPMC 39 мини-таблетками.
[00849] Пример 15: Приводимая в качестве примера мини-таблетка 7 в составе приводимой в качестве примера капсулы 12 (в составе капсулы приблизительно 40 мг и приблизительно 100 мг Соединения 1)
[00850] Получали партию цилиндрических мини-таблеток диаметром ~2 мм, толщиной ~2 мм (масса каждой мини-таблетки составляет приблизительно 6,9 мг), таким образом, чтобы содержалось приблизительно 40 мг Соединения 1 на 21 мини-таблетку и приблизительно 100 мг Соединения 1 на 52 мини-таблетки, используя количества ингредиентов, представленные в Таблице 15, приведенной ниже.
Ингредиенты для мини-таблеток для капсулы 12 с активностью
40 мг и 100 мг.
[00852] Промежуточное соединение 1, сукралозу (коммерчески доступную от компании Tate and Lyle of Decatur, IL) и коллоидный диоксид кремния (Cabot Cab-O-Sil® M-5P Fumed Silicon Dioxide, коммерчески доступный от компании Cabot Corporation of Alpharetta, GA) совместно просеивали через сито 30 меш (600 микрометров). Маннит (Pearlitol® 100 SD, коммерчески доступный от компании Roquette America Inc. of Keokuk IA), лактозу (высушенный распылением моногидрат лактозы Fast Flo 316, коммерчески доступный от компании Foremost Bara-boo, WI) и кроскармеллозу натрия (Ac-Di-Sol®, коммерчески доступную от компании FMC BioPolymer Corporation of Philadelphia, PA) совместно просеивали через сито 30 меш (600 микрометров). Стеарат магния (Hyqual®, коммерчески доступный от компании Mallinckrodt Chemicals) просеивали через сито 60 меш (250 микрометров).
[00853] Совместно просеянное промежуточное соединение 1, коллоидный диоксид кремния, сукралозу и 20 масс.% просеянного стеарата Mg перемешивали вместе в течение 41 минуты при 12 об/мин в V-образном смесителе из нержавеющей стали емкостью 8 кварт. Совместно просеянные маннит и лактозу и кроскармеллозу натрия добавляли в эту смесь и перемешивали в течение 15 минут при 12 об/мин. Эту смесь обрабатывали на конусной мельнице через сито 024R (610 микрометров) при 5000 об/мин, используя Quadro Comil 197. Оставшиеся 80% от всего количества стеарата магния добавляли в смесь, обработанную на конусной мельнице, и перемешивали в течение 10 минут при 12 об/мин в V-образном смесителе из нержавеющей стали емкостью 8 кварт с образованием прессовочной смеси. Эту прессовочную смесь переносили в Korsch XM12 B-tooling роторный таблеточный пресс, оснащенный 9 наборами инструментов с множеством насадок (8 насадок на пуасон). Эту смесь прессовали в мини-таблетки цилиндрической формы диаметром ~2 мм, с толщиной приблизительно 1,97 мм, массой приблизительно 6,9 мг, каждая мини-таблетка приблизительно содержит 1,92 мг N-[2,4-бис(1,1-диметилэтил)-5-гидроксифенил]-1,4-дигидро-4-оксохинолин-3-карбоксамида и имеет среднюю прочность при растяжении приблизительно 1 МПа. 21 мини-таблетку (всего ~142,9 мг, с активностью 40 мг) затем инкапсулировали, используя IN-CAP® автоматическую настольную машину для заполнения капсул, используя капсулы Vcaps Plus HPMC. Капсулы с активностью 100 мг были изготовлены путем заполнения капсул Vcaps Plus HPMC 52 мини-таблетками.
[00854] Пример 16: Приводимая в качестве примера таблетка 8 с активностью 10 мг
[00855] Получали партию стандартных цилиндрических выпуклых таблеток диаметром ~4 мм, толщиной ~3 мм (масса каждой таблетки приблизительно 35,7 мг), содержащих приблизительно 10 мг Соединения 1 на таблетку, используя количества ингредиентов, представленные в Таблице 16, приведенной ниже.
Ингредиенты для приводимой в качестве примера таблетки 8 с активностью 10 мг
[00857] Промежуточное соединение 1, сукралозу (коммерчески доступную от компании Tate and Lyle of Decatur, IL) и коллоидный диоксид кремния (Cabot Cab-O-Sil® M-5P Fumed Silicon Dioxide, коммерчески доступный от компании Cabot Corporation of Alpharetta, GA) совместно просеивали через сито 30 меш (600 микрометров). Маннит (Pearlitol® 100 SD, коммерчески доступный от компании Roquette America Inc. of Keokuk IA), лактозу (высушенный распылением моногидрат лактозы Fast Flo 316, коммерчески доступный от компании Foremost Bara-boo, WI) и кроскармеллозу натрия (Ac-Di-Sol®, коммерчески доступную от компании FMC BioPolymer Corporation of Philadelphia, PA) совместно просеивали через сито 30 меш (600 микрометров). Стеарат магния (Hyqual®, коммерчески доступный от компании Mallinckrodt Chemicals) просеивали через сито 60 меш (250 микрометров).
[00858] Совместно просеянное промежуточное соединение 1, коллоидный диоксид кремния, сукралозу и 20 масс.% просеянного стеарата Mg перемешивали вместе в течение 41 минут при 12 об/мин в V-образном смесителе из нержавеющей стали емкостью 8 кварт. Совместно просеянные маннит и лактозу, и кроскармеллозу натрия добавляли в эту смесь и перемешивали в течение 15 минут при 12 об/мин. Эту смесь обрабатывали на конусной мельнице через сито 024R (610 микрометров) при 5000 об/мин, используя Quadro Comil 197. Оставшиеся 80% от всего количества стеарата магния добавляли в смесь, обработанную на конусной мельнице, и перемешивали в течение 10 минут при 12 об/мин в V-образном смесителе из нержавеющей стали емкостью 8 кварт с образованием прессовочной смеси. Прессовочную смесь переносили в 8-позиционный роторный таблеточный пресс Piccola D-tooling, оснащенный 4 наборами инструментов. Порошковую смесь прессовали в стандартные выпуклые таблетки диаметром ~4 мм, толщиной приблизительно 3 мм, массой приблизительно 35,7 мг, каждая таблетка содержит приблизительно 10 мг N-[2,4-бис(1,1-диметилэтил)-5-гидроксифенил]-1,4-дигидро-4-оксохинолин-3-карбоксамида и имеет среднюю прочность при растяжении приблизительно 1 МПа.
[00859] Пример 17: Приводимая в качестве примера таблетка 9 с активностью 12,5 мг
[00860] Получали партию стандартных выпуклых цилиндрических таблеток диаметром ~4 мм, толщиной ~3,7 мм (масса каждой таблетки приблизительно 44,7 мг), содержащих приблизительно 12,5 мг Соединения 1 на таблетку, используя количества ингредиентов, представленные в Таблице 17, приведенной ниже.
Ингредиенты для приводимой в качестве примера таблетки с активностью 12,5 мг
[00862] Промежуточное соединение 1, сукралозу (коммерчески доступную от компании Tate and Lyle of Decatur, IL) и коллоидный диоксид кремния (Cabot Cab-O-Sil® M-5P Fumed Silicon Dioxide, коммерчески доступный от компании Cabot Corporation of Alpharetta, GA) совместно просеивали через сито 30 меш (600 микрометров). Маннит (Pearlitol® 100 SD, коммерчески доступный от компании Roquette America Inc. of Keokuk IA), лактозу (высушенный распылением моногидрат лактозы Fast Flo 316, коммерчески доступный от компании Foremost Bara-boo, WI) и кроскармеллозу натрия (Ac-Di-Sol®, коммерчески доступную от компании FMC BioPolymer Corporation of Philadelphia, PA) совместно просеивали через сито 30 меш (600 микрометров). Стеарат магния (Hyqual®, коммерчески доступный от компании Mallinckrodt Chemicals) просеивали через сито 60 меш (250 микрометров).
[00863] Совместно просеянное промежуточное соединение 1, коллоидный диоксид кремния, сукралозу и 20 масс.% просеянного стеарата Mg перемешивали вместе в течение 41 минут при 12 об/мин в V-образном смесителе из нержавеющей стали емкостью 8 кварт. Совместно просеянные маннит и лактозу, и кроскармеллозу натрия добавляли в эту смесь и перемешивали в течение 15 минут при 12 об/мин. Эту смесь обрабатывали на конусной мельнице через сито 024R (610 микрометров) при 5000 об/мин, используя Quadro Comil 197. Оставшиеся 80% от всего количества стеарата магния добавляли в смесь, обработанную на конусной мельнице, и перемешивали в течение 10 минут при 12 об/мин в V-образном смесителе из нержавеющей стали емкостью 8 кварт с образованием прессовочной смеси. Прессовочную смесь переносили в 8-позиционный роторный таблеточный пресс Piccola D-tooling, оснащенный 4 наборами инструментов. Порошкообразную смесь прессовали в стандартные выпуклые таблетки диаметром ~4 мм с толщиной приблизительно 3,7 мм, массой приблизительно 44,7 мг, каждая таблетка содержит приблизительно 12,5 мг N-[2,4-бис(1,1-диметилэтил)-5-гидроксифенил]-1,4-дигидро-4-оксохинолин-3-карбоксамида и имеет среднюю прочность при растяжении приблизительно 1 МПа.
[00864] Пример 18: Приводимая в качестве примера мини-таблетка 10
[00865] Получали партию цилиндрических мини-таблеток диаметром ~2 мм, толщиной ~2 мм (масса каждой мини-таблетки составляет приблизительно 7 мг), содержащую приблизительно 50 мг Соединения 1 на 26 мини-таблеток и приблизительно 75 мг Соединения 1 на 39 мини-таблеток, используя количества ингредиентов, представленные в Таблице 18, приведенной ниже.
Ингредиенты для мини-таблеток с активностью 50 мг и 75 мг
[00867] Промежуточное соединение 1, сукралозу (коммерчески доступную от компании Tate and Lyle of Decatur, IL) и коллоидный диоксид кремния (Cabot Cab-O-Sil® M-5P Fumed Silicon Dioxide, коммерчески доступный от компании Cabot Corporation of Alpharetta, GA) совместно просеивали через сито 30 меш (600 микрометров). Маннит (Pearlitol® 100 SD, коммерчески доступный от компании Roquette America Inc. of Keokuk IA), лактозу (высушенный распылением моногидрат лактозы Fast Flo 316, коммерчески доступный от компании Foremost Bara-boo, WI) и кроскармеллозу натрия (Ac-Di-Sol®, коммерчески доступную от компании FMC BioPolymer Corporation of Philadelphia, PA) совместно просеивали через сито 30 меш (600 микрометров). Стеарат магния (коммерчески доступный от компании Fisher Scientific) просеивали через сито 60 меш (250 микрометров).
[00868] Совместно просеянное промежуточное соединение 1, коллоидный диоксид кремния и сукралозу перемешивали вместе в течение 15 минут при 35 об/мин в 5-литровом бункерном смесителе из нержавеющей стали Bohle. Совместно просеянные маннит и лактозу, и кроскармеллозу натрия добавляли в эту смесь и перемешивали в течение 7 минут при 35 об/мин. Эту смесь обрабатывали на конусной мельнице через сито 024R (610 микрометров) при 5000 об/мин, используя Quadro Comil 197. 50% от всего количества стеарата магния добавляли в смесь, обработанную на конусной мельнице, и перемешивали в течение 5 минут при 35 об/мин в 5-литровом бункерном смесителе из нержавеющей стали Bohle с получением смеси для сухой грануляции.
[00869] Сухое гранулирование указанной выше смеси проводили на роликовом прессе Alexanderwerk WP-120 с постоянной скоростью вращения 3,0 об/мин, величиной зазора 2,5 мм и давлением прокатки 30 и 40 бар. Ленты измельчали посредством роторного гранулятора тонкого помола Alexanderwerk Rotary Fine Granulator (100 об/мин) или Comil (3000 об/мин), используя сито размером ~500 микрон.
[00870] Четыре партии измельченных гранул смазывали оставшимся стеаратом магния. Mg стеарат добавляли при 0,75 масс.% и перемешивали в стеклянном контейнере в течение 5 минут при 32 об/мин, используя смеситель Turbula.
[00871] Смазанные гранулы переносили в 8-позиционный роторный таблеточный пресс Piccola D-tooling, оснащенный 1 набором инструментов с множеством насадок (10 насадок на пуасон), и прессовали в мини-таблетки цилиндрической формы диаметром ~2 мм, толщиной приблизительно 1,95 мм, массой приблизительно 7 мг, каждая мини-таблетка приблизительно содержит 1,92 мг N-[2,4-бис(1,1-диметилэтил)-5-гидроксифенил]-1,4-дигидро-4-оксохинолин-3-карбоксамида и имеет среднюю прочность при растяжении приблизительно 1-1,5 МПа.
[00872] Пример 19: Приводимые в качестве примера мини-таблетки 11
[00873] Получали партию мелких выпуклых цилиндрических мини-таблеток диаметром 2 мм, длиной 2 мм (масса каждой мини-таблетки составляет приблизительно 7,0 мг), используя количества ингредиентов, представленные в Таблице 19, приведенной ниже.
Ингредиенты для приводимых в качестве примера мини-таблеток
[00875] Промежуточное соединение 1, сукралозу (коммерчески доступную от компании Tate and Lyle of Decatur, IL) и коллоидный диоксид кремния (Cabot Cab-O-Sil® M-5P Fumed Silicon Dioxide, коммерчески доступный от компании Cabot Corporation of Alpharetta, GA) совместно просеивали через сито 30 меш (600 микрометров). Маннит (Pearlitol® 100 SD, коммерчески доступный от компании Roquette America Inc. of Keokuk IA) и кроскармеллозу натрия (FMC Ac-Di-Sol®, коммерчески доступную от компании FMC BioPolymer Corporation of Philadelphia, PA), и лактозу (Fast Flo Лактоза 316, доступная от Foremost of Baraboo, WI) совместно просеивали через сито 30 меш (600 микрометров). Стеарат магния (Hyqual®, коммерчески доступный от компании Mallinckrodt Chemicals) просеивали через сито 60 меш (250 микрометров).
[00876] Совместно просеянное промежуточное соединение 1, коллоидный диоксид кремния и сукралозу перемешивали вместе в течение 40 минут при 12 об/мин в бункерном смесителе объемом 3 куб. фута. Совместно просеянные маннит, лактозу и кроскармеллозу натрия добавляли в эту смесь и перемешивали в течение 15 минут при 12 об/мин. Вторую перемешанную смесь совместно измельчали через сито 610 микрометров. Просеянный стеарат магния добавляли в смесь, обработанную на конусной мельнице, в бункерный смеситель объемом 3 куб. фута и перемешивали в течение 10 минут при 12 об/мин с получением прессовочной смеси. После полного завершения формирования прессовочной смеси, эту прессовочную смесь переносили в роторный таблеточный пресс Kilian TX32 B-tooling. Порошкообразную смесь прессовали в мини-таблетки, используя таблеточный пресс Kilian (IMA KILIAN GMBH & CO. KG, Koln, Germany). Мини-таблетки прессовали диаметром 2 мм, мелкими, выпуклой цилиндрической формы, толщиной приблизительно 2 мм, массой приблизительно 7 мг, каждая мини-таблетка приблизительно содержит 1,92 мг N-[2,4-бис(1,1-диметилэтил)-5-гидроксифенил]-1,4-дигидро-4-оксохинолин-3-карбоксамида и имеет среднюю прочность при растяжении приблизительно 1 МПа.
[00877] Пример 20: Приводимые в качестве примера мини-таблетки 12
[00878] Получали партию мелких выпуклых цилиндрических мини-таблеток диаметром 2 мм, длиной 2 мм (масса каждой мини-таблетки составляет приблизительно 7,0 мг) в соответствии с приведенным выше Примером 19. Дозы 25 мг, 50 мг, 75 мг и 100 мг получали путем изменения количества используемых мини-таблеток партии в Примере 19, приведенном выше (смотри Таблицу 20) в капсуле, пачке или пакете.
Ингредиенты для приводимых в качестве примера мини-таблеток
[00880] Специалисту в данной области будет понятно, что другие дозы также могут быть получены путем изменения количества мини-таблеток из Примера 19, приведенного выше, используемых в капсуле, пачке или пакете.
[008801] Как очевидно специалисту в данной области, вышеприведенное перечисление процентного содержания и/или масс каждого из ингредиентов может также включать отклонения, обычно ожидаемые в областях, связанных с технологией получения лекарственного средства. Например, каждое количество эксципиента, Соединения 1, массы порошкообразной смеси и массы каждой мини-таблетки может изменяться на величину 0,01%, или приблизительно 0,1%, или приблизительно 0,5%, или приблизительно 1,0%, или приблизительно 1,5%, или приблизительно 2%, или приблизительно вплоть до 5%, или по меньшей мере до величины стандартного отклонения каждого измерения, допускаемого измерительными приборами, используемыми в настоящей заявке для соответствующих измерений. Например, мини-таблетка 7 мг может иметь массу от приблизительно 0,01 до приблизительно 5% выше или ниже предполагаемых 7 мг. Аналогично, количество Соединения 1 в каждой из полученных доз может варьировать от приблизительно 0,01 до приблизительно 5% выше или ниже предполагаемых количеств, раскрытых в композициях и способах, описанных в настоящем изобретении. В другом примере масса каждой мини-таблетки может варьировать на 0,01%, или приблизительно 0,1%, или приблизительно 0,5%, или приблизительно 1,0%, или приблизительно 1,5%, или приблизительно 2%, или приблизительно 5%, или приблизительно 7,5%, или приблизительно на целых 15% или по меньшей мере в два раза от стандартного отклонения каждого измерения, допускаемого измерительными приборами, используемыми в настоящей заявке. Например, мини-таблетка 7 мг может весить от приблизительно 0,01 до приблизительно 15% выше или ниже предполагаемых 7 мг.
[00882] C. Введение фармацевтических композиций
[00883] Пример 21: Приводимое в качестве примера введение «A»
[00884] Пациентам детского возраста перорально вводят фармацевтическую композицию в соответствии с Таблицей 21:
Приводимое в качестве примера введение «A» фармацевтических композиций по настоящему изобретению пациентам детского возраста.
[00886] Фармацевтические композиции вводят пациентам по утрам после приема пищи, и фармацевтическую композицию дают приблизительно в одно и то же время (в пределах 1 часа) в каждом случае введения. Перед введением содержимое соответствующего контейнера (например, капсулы, саше, блистерной упаковки, пакета, пачки, флакона или подобного), содержащего Соединение 1, добавляют к смеси для детского питания или молочной смеси или яблочному пюре, перемешивают и оставляют распадаться в течение приблизительно 3 минут до введения. Эти композиции вводят перорально с жиросодержащей пищей, такой как стандартное CF высококалорийное с высоким содержанием жира блюдо или закуска. Для детей, способных принимать пищевые продукты, примеры стандартного CF высококалорийного с высоким содержанием жира блюда или закуски могут включать яйца, сливочное масло, ореховую пасту, пиццу с сыром и подобные. Для детей младшего возраста, не способных принимать пищу, примерами могут служить смеси и грудное молоко. Для детей, способных принимать мягкую пищу, примеры стандартного CF высококалорийного с высоким содержанием жира блюда или закуски могут включать мороженое и йогурт.
[00887] Пример 22: Приводимое в качестве примера введение «B»
[00888] Пациентам детского возраста перорально вводят фармацевтическую композицию в соответствии с Таблицей 22:
Приводимое в качестве примера введение «B» фармацевтических композиций по настоящему изобретению.
[00890] Фармацевтические композиции вводят пациентам детского возраста приблизительно каждые 12 часов, где каждое введение пациент получает после приема пищи. В других вариантах осуществления фармацевтические композиции, содержащие 75 Соединения 1, вводят взрослым пациентам каждые 12 часов. Перед введением содержимое соответствующего контейнера (например, капсулы, саше, блистерной упаковки, пакета, пачки, флакона или подобного) содержащего Соединение 1, добавляют к смеси для детского питания или молочной смеси или яблочному пюре, перемешивают и оставляют распадаться приблизительно в течение 3 минут до введения. Эти композиции вводят перорально с жиросодержащей пищей, такой как стандартное CF высококалорийное с высоким содержанием жира блюдо или закуска. Для детей, способных принимать пищевые продукты, примеры стандартного CF высококалорийного с высоким содержанием жира блюда или закуски могут включать яйца, сливочное масло, ореховую пасту, пиццу с сыром и подобные. Для детей младшего возраста, не способных принимать пищу, примерами могут служить смеси и грудное молоко. Для детей, способных принимать мягкую пищу, примеры стандартного CF высококалорийного с высоким содержанием жира блюда или закуски могут включать мороженое и йогурт.
VI. ВАРИАНТЫ ОСУЩЕСТВЛЕНИЯ/ЧАСТИ ФОРМУЛЫ ИЗОБРЕТЕНИЯ
[00891] Вариант осуществления 1. Фармацевтическая композиция, содержащая твердую дисперсию аморфного или по существу аморфного Соединения 1, один или более наполнителей, подсластитель, разрыхлитель, скользящее вещество и смазывающее вещество, и необязательно увлажнитель.
[00892] Вариант осуществления 2. Фармацевтическая композиция в соответствии с вариантом осуществления 1, где фармацевтическая композиция содержит от приблизительно 30 до приблизительно 50 процентов твердой дисперсии по массе композиции.
[00893] Вариант осуществления 3. Фармацевтическая композиция в соответствии с вариантом осуществления 2, где фармацевтическая композиция содержит приблизительно 35 процентов твердой дисперсии по массе композиции.
[00894] Вариант осуществления 4. Фармацевтическая композиция в соответствии с вариантом осуществления 1, где один или более наполнителей содержит:
маннит, лактозу, сахарозу, декстрозу, мальтодекстрин, сорбит, ксилит, целлюлозу в порошке, многоатомные спирты, микрокристаллическую целлюлозу, силикатированную микрокристаллическую целлюлозу, ацетат целлюлозы, метилцеллюлозу, этилцеллюлозу, гидроксиэтилцеллюлозу, метилгидроксиэтилцеллюлозу, тальк, крахмал, прежелатинизированный крахмал, двухосновный фосфат кальция, сульфат кальция, карбонат кальция или их сочетания.
[00895] Вариант осуществления 5. Фармацевтическая композиция в соответствии с вариантом осуществления 4, где один или более наполнителей выбраны из группы, состоящей из маннита, лактозы, сахарозы, декстрозы и мальтодекстрина.
[00896] Вариант осуществления 6. Фармацевтическая композиция в соответствии с вариантом осуществления 5, где один или более наполнителей в совокупности присутствуют в количестве от приблизительно 30 до приблизительно 60 процентов по массе композиции.
[00897] Вариант осуществления 7. Фармацевтическая композиция в соответствии с любым из вариантов осуществления 1-6, где один или более наполнителей содержат маннит.
[00898] Вариант осуществления 8. Фармацевтическая композиция в соответствии с вариантом осуществления 7, где маннит присутствует в количестве от приблизительно 0 масс.% до приблизительно 60 масс.%.
[00899] Вариант осуществления 9. Фармацевтическая композиция в соответствии с вариантом осуществления 7, где один или более наполнителей дополнительно содержат лактозу.
[00900] Вариант осуществления 10. Фармацевтическая композиция в соответствии с вариантом осуществления 9, где лактоза присутствует в количестве от приблизительно 0 масс.% до приблизительно 60 масс.%.
[00901] Вариант осуществления 11. Фармацевтическая композиция в соответствии с вариантом осуществления 10, где маннит присутствует в количестве от приблизительно 0 масс.% до приблизительно 60 масс.%.
[00902] Вариант осуществления 12. Фармацевтическая композиция в соответствии с любым из вариантов осуществления 1-6, где один или более наполнителей содержат лактозу.
[00903] Вариант осуществления 13. Фармацевтическая композиция в соответствии с вариантом осуществления 12, где лактоза присутствует в количестве от приблизительно 0 масс.% до приблизительно 60 масс.%.
[00904] Вариант осуществления 14. Фармацевтическая композиция в соответствии с вариантом осуществления 9, где наполнитель содержит маннит и маннит и лактозу в соотношении приблизительно 3:1 маннита к лактозе.
[00905] Вариант осуществления 15. Фармацевтическая композиция в соответствии с вариантом осуществления 9, где наполнитель содержит маннит и маннит и лактозу в соотношении приблизительно 1:1 маннита к лактозе.
[00906] Вариант осуществления 16. Фармацевтическая композиция в соответствии с вариантом осуществления 9, где наполнитель содержит маннит и маннит и лактозу в соотношении приблизительно 1:3 маннита к лактозе.
[00907] Вариант осуществления 17. Фармацевтическая композиция в соответствии с вариантом осуществления 16, где маннит присутствует в количестве приблизительно 13,5 процентов по массе композиции.
[00908] Вариант осуществления 18. Фармацевтическая композиция в соответствии с вариантами осуществления 16 или 17, где лактоза присутствует в количестве приблизительно 41 процент по массе композиции.
[00909] Вариант осуществления 19. Фармацевтическая композиция в соответствии с вариантом осуществления 1, где подсластитель содержит:
глюкозу, сахарозу, мальтозу, маннозу, декстрозу, фруктозу, лактозу, трегалозу, мальтит, лактит, ксилит, сорбит, маннит, тагатозу, глицерин, эритрит, изомальт, мальтозу, сукралозу, аспартам, неотам, алитам, неогесперидин дигидрохалькон, цикламат, тауматин, ацесульфам калия, сахарин, сахарин натрия или их сочетания.
[00910] Вариант осуществления 20. Фармацевтическая композиция в соответствии с вариантом осуществления 19, где подсластитель содержит сукралозу, которая присутствует в количестве от приблизительно 0,1 до приблизительно 5 процентов по массе композиции.
[00911] Вариант осуществления 21. Фармацевтическая композиция в соответствии с вариантом осуществления 1, где разрыхлитель содержит: кроскармеллозу натрия, альгинат натрия, альгинат кальция, альгиновую кислоту, крахмал, прежелатинизированный крахмал, гликоляткрахмал натрия, поливинилпирролидон, сополимеры поливинилпирролидона, кросповидон, карбоксиметилцеллюлозу кальция, целлюлозу и ее производные, карбоксиметилцеллюлозу натрия, полисахарид сои, глины, камеди и ионобменную смолу, шипучую систему на основе пищевых кислот и компонент карбонат щелочей, бикарбонат натрия или их сочетания.
[00912] Вариант осуществления 22. Фармацевтическая композиция в соответствии с вариантом осуществления 21, где разрыхлитель содержит кроскармеллозу натрия, которая присутствует в количестве от приблизительно 4 до приблизительно 8 процентов по массе композиции.
[00913] Вариант осуществления 23. Фармацевтическая композиция в соответствии с вариантом осуществления 1, где увлажнитель содержит: лаурилсульфат натрия, цетостеариловый спирт, цетомакрогол эмульгирующий воск, желатин, казеин, докузат натрия, хлорид бензалкония, стеарат кальция, полиэтиленгликоли, фосфаты, сложные эфиры жирных кислот полиоксиэтиленсорбитана, акациевую камедь, холестерин, трагакант, простые стеариловые эфиры полиоксиэтилена 20, простые алкильные эфиры полиоксиэтилена, производные полиоксиэтилена касторового масла, ПЭГилированные гидрогенизированные касторовые масла, сложные эфиры сорбитана жирных кислот, витамин E или производные токоферола, витамин E TPGS, сложные эфиры токоферила, лецитин, фосфолипиды и их производные, полоксамеры, стеариновую кислоту, олеиновую кислоту, олеиновый спирт, цетиловый спирт, моно- и диглицериды, сложные эфиры пропиленгликоля и жирных кислот, сложные эфиры глицерина и жирных кислот, этиленгликоль пальмитостеарат, полиоксилглицериды, пропиленгликоль монокаприлат, пропиленгликоль монолаурат, спирты алкиларилполиэфира и полиглицерилолеат или их сочетания.
[00914] Вариант осуществления 24. Фармацевтическая композиция в соответствии с вариантом осуществления 23, где увлажнитель содержит лаурилсульфат натрия, который присутствует в количестве приблизительно 2 или менее процентов по массе композиции.
[00915] Вариант осуществления 25. Фармацевтическая композиция в соответствии с вариантом осуществления 1, где скользящее вещество содержит: тальк, коллоидный диоксид кремния, осажденный диоксид кремния, оксид магния, силикат магния, лейцин и крахмал.
[00916] Вариант осуществления 26. Фармацевтическая композиция в соответствии с вариантом осуществления 25, где скользящее вещество содержит коллоидный диоксид кремния, который присутствует в количестве от приблизительно 0,1 до приблизительно 5 процентов по массе композиции.
[00917] Вариант осуществления 27. Фармацевтическая композиция в соответствии с вариантом осуществления 1, где смазывающее вещество содержит: тальк, жирную кислоту, стеариновую кислоту, стеарат магния, стеарат кальция, стеарат натрия, стеариновую кислоту, глицерилмоностеарат, лаурилсульфат натрия, стеарилфумарат натрия, гидрогенизированные масла, полиэтиленгликоль, спирт жирного ряда, сложный эфир жирной кислоты, глицерилбегенат, минеральное масло, растительное масло, лейцин, бензоат натрия или их сочетания.
[00918] Вариант осуществления 28. Фармацевтическая композиция в соответствии с вариантом осуществления 27, где смазывающее вещество содержит стеарат магния, который присутствует в количестве от приблизительно 0,1 до приблизительно 7 процентов по массе композиции.
[00919] Вариант осуществления 29. Фармацевтическая композиция в соответствии с вариантом осуществления 1, где твердая дисперсия содержит приблизительно 80 процентов аморфного Соединения 1 по массе твердой дисперсии, и приблизительно 19,5 процентов HPMCAS по массе твердой дисперсии, и приблизительно 0,5 процентов SLS по массе дисперсии.
[00920] Вариант осуществления 30. Фармацевтическая композиция, содержащая:
твердую дисперсию аморфного или по существу аморфного Соединения 1 в количестве от приблизительно 30 до приблизительно 50 процентов по массе фармацевтической композиции;
сукралозу в количестве от приблизительно 1,5 масс.% до приблизительно 2,5 масс.% процентов по массе фармацевтической композиции;
кроскармеллозу натрия в количестве от приблизительно 4 до приблизительно 8 процентов по массе фармацевтической композиции;
коллоидный диоксид кремния в количестве от приблизительно 0,5 масс.% до приблизительно 1,5 масс.% процентов по массе фармацевтической композиции;
стеарат магния в количестве от приблизительно 0,5 масс.% до приблизительно 1,5 масс.% процентов по массе фармацевтической композиции; и
один или более наполнителей, в совокупности, в количестве от приблизительно 30 до приблизительно 60 процентов по массе фармацевтической композиции.
[00921] Вариант осуществления 31. Фармацевтическая композиция в соответствии с вариантом осуществления 30, где один или более наполнителей содержат маннит.
[00922] Вариант осуществления 32. Фармацевтическая композиция в соответствии с вариантами осуществления 30 или 31, где один или более наполнителей содержат лактозу.
[00923] Вариант осуществления 33. Фармацевтическая композиция в соответствии с вариантом осуществления 32, где наполнитель содержит маннит и лактозу в соотношении приблизительно 3:1 маннита к лактозе.
[00924] Вариант осуществления 34. Фармацевтическая композиция в соответствии с вариантом осуществления 32, где наполнитель содержит маннит и лактозу в соотношении приблизительно 1:1 маннита к лактозе.
[00925] Вариант осуществления 35. Фармацевтическая композиция в соответствии с вариантом осуществления 32, где наполнитель содержит маннит и лактозу в соотношении приблизительно 1:3 маннита к лактозе.
[00926] Вариант осуществления 36. Фармацевтическая композиция в соответствии с вариантом осуществления 30, где один или более наполнителей содержат маннит в количестве приблизительно 13,5 процентов по массе композиции.
[00927] Вариант осуществления 37. Фармацевтическая композиция в соответствии с вариантом осуществления 36, где один или более наполнителей содержат лактозу.
[00928] Вариант осуществления 38. Фармацевтическая композиция в соответствии с вариантом осуществления 37, где лактоза присутствует в количестве приблизительно 41 процент по массе композиции.
[00929] Вариант осуществления 39. Фармацевтическая композиция в соответствии с любым из вариантов осуществления 30-38, где кроскармеллоза натрия присутствует в количестве приблизительно 6 процентов по массе фармацевтической композиции.
[00930] Вариант осуществления 40. Фармацевтическая композиция в соответствии с любым из вариантов осуществления 30-39, где твердая дисперсия присутствует в количестве приблизительно 35 процентов по массе фармацевтической композиции.
[00931] Вариант осуществления 41. Фармацевтическая композиция, содержащая:
приблизительно 35 масс.% твердой дисперсии по массе композиции, где указанная дисперсия содержит приблизительно 80 масс.% по существу аморфного или аморфного Соединения 1 по массе дисперсии, приблизительно 19,5 масс.% HPMCAS по массе дисперсии и приблизительно 0,5 масс.% SLS по массе дисперсии;
приблизительно 13,5 масс.% маннита по массе композиции;
приблизительно 41 масс.% лактозы по массе композиции;
приблизительно 2 масс.% сукралозы по массе композиции;
приблизительно 6 масс.% кроскармеллозы натрия по массе композиции;
приблизительно 1 масс.% коллоидного диоксида кремния по массе композиции; и
приблизительно 1,5 масс.% стеарата магния по массе композиции.
[00932] Вариант осуществления 42. Фармацевтическая композиция в соответствии с любым из вариантов осуществления 30-41, где фармацевтическая композиция представляет собой единичную дозированную форму, содержащую одно или множество из гранул, пеллет, частиц или мини-таблеток, и где единичная дозированная форма содержит от приблизительно 1 мг до приблизительно 250 мг по существу аморфного или аморфного Соединения 1.
[00933] Вариант осуществления 42.5. Фармацевтическая композиция в соответствии с вариантом осуществления 42, где единичная дозированная форма содержит приблизительно 5 мг по существу аморфного или аморфного Соединения 1.
[00934] Вариант осуществления 43. Фармацевтическая композиция в соответствии с вариантом осуществления 42, где единичная дозированная форма содержит приблизительно 10 мг по существу аморфного или аморфного Соединения 1.
[00935] Вариант осуществления 44. Фармацевтическая композиция в соответствии с вариантом осуществления 42, где единичная дозированная форма содержит приблизительно 12,5 мг по существу аморфного или аморфного Соединения 1.
[00936] Вариант осуществления 45. Фармацевтическая композиция в соответствии с вариантом осуществления 42, где единичная дозированная форма содержит приблизительно 15 мг по существу аморфного или аморфного Соединения 1.
[00937] Вариант осуществления 46. Фармацевтическая композиция в соответствии с вариантом осуществления 42, где единичная дозированная форма содержит приблизительно 20 мг по существу аморфного или аморфного Соединения 1.
[00938] Вариант осуществления 47. Фармацевтическая композиция в соответствии с вариантом осуществления 42, где единичная дозированная форма содержит приблизительно 25 мг по существу аморфного или аморфного Соединения 1.
[00939] Вариант осуществления 48. Фармацевтическая композиция в соответствии с вариантом осуществления 42, где единичная дозированная форма содержит приблизительно 30 мг по существу аморфного или аморфного Соединения 1.
[00940] Вариант осуществления 48.5. Фармацевтическая композиция в соответствии с вариантом осуществления 42, где единичная дозированная форма содержит приблизительно 35 мг по существу аморфного или аморфного Соединения 1.
[00941] Вариант осуществления 49. Фармацевтическая композиция в соответствии с вариантом осуществления 42, где единичная дозированная форма содержит приблизительно 40 мг по существу аморфного или аморфного Соединения 1.
[00942] Вариант осуществления 49.5. Фармацевтическая композиция в соответствии с вариантом осуществления 42, где единичная дозированная форма содержит приблизительно 45 мг по существу аморфного или аморфного Соединения 1.
[00943] Вариант осуществления 50. Фармацевтическая композиция в соответствии с вариантом осуществления 42, где единичная дозированная форма содержит от приблизительно 50 мг по существу аморфного или аморфного Соединения 1.
[00944] Вариант осуществления 51. Фармацевтическая композиция в соответствии с вариантом осуществления 42, где единичная дозированная форма содержит приблизительно 62,5 мг по существу аморфного или аморфного Соединения 1.
[00945] Вариант осуществления 52. Фармацевтическая композиция в соответствии с вариантом осуществления 42, где единичная дозированная форма содержит от приблизительно 75 мг по существу аморфного или аморфного Соединения 1.
[00946] Вариант осуществления 53. Фармацевтическая композиция в соответствии с вариантом осуществления 42, где единичная дозированная форма содержит приблизительно 100 мг по существу аморфного или аморфного Соединения 1.
[00947] Вариант осуществления 54. Фармацевтическая композиция в соответствии с вариантом осуществления 42, где единичная дозированная форма содержит приблизительно 125 мг по существу аморфного или аморфного Соединения 1.
[00948] Вариант осуществления 55. Фармацевтическая композиция в соответствии с вариантом осуществления 42, где единичная дозированная форма содержит приблизительно 150 мг по существу аморфного или аморфного Соединения 1.
[00949] Вариант осуществления 56. Фармацевтическая композиция в соответствии с вариантом осуществления 42, где единичная дозированная форма содержит приблизительно 175 мг по существу аморфного или аморфного Соединения 1.
[00950] Вариант осуществления 57. Фармацевтическая композиция в соответствии с вариантом осуществления 42, где единичная дозированная форма содержит приблизительно 200 мг по существу аморфного или аморфного Соединения 1.
[00951] Вариант осуществления 58. Фармацевтическая композиция в соответствии с вариантом осуществления 42, где единичная дозированная форма содержит приблизительно 225 мг по существу аморфного или аморфного Соединения 1.
[00952] Вариант осуществления 59. Фармацевтическая композиция в соответствии с вариантом осуществления 42, где единичная дозированная форма содержит приблизительно 250 мг по существу аморфного или аморфного Соединения 1.
[00953] Вариант осуществления 60. Фармацевтическая композиция в соответствии с вариантом осуществления 42, где единичная дозированная форма содержит от приблизительно 25 до приблизительно 40 мини-таблеток.
[00954] Вариант осуществления 61. Фармацевтическая композиция в соответствии с вариантом осуществления 42, где твердая дисперсия присутствует в количестве приблизительно 35 процентов по массе фармацевтической композиции и единичная дозированная форма содержит от приблизительно 26 мини-таблеток.
[00955] Вариант осуществления 62. Фармацевтическая композиция в соответствии с вариантом осуществления 61, где единичная дозированная форма содержит приблизительно 50 мг по существу аморфного или аморфного Соединения 1.
[00956] Вариант осуществления 63. Фармацевтическая композиция в соответствии с вариантом осуществления 42, где твердая дисперсия присутствует в количестве приблизительно 35 процентов по массе фармацевтической композиции и единичная дозированная форма содержит от приблизительно 21 мини-таблетки.
[00957] Вариант осуществления 64. Фармацевтическая композиция в соответствии с вариантом осуществления 63, где единичная дозированная форма содержит от приблизительно 40 мг по существу аморфного или аморфного Соединения 1.
[00958] Вариант осуществления 65. Фармацевтическая композиция в соответствии с вариантом осуществления 42, где твердая дисперсия присутствует в количестве приблизительно 35 процентов по массе фармацевтической композиции, и единичная дозированная форма содержит от приблизительно 39 мини-таблеток.
[00959] Вариант осуществления 66. Фармацевтическая композиция в соответствии с вариантом осуществления 65, где единичная дозированная форма содержит от приблизительно 75 мг по существу аморфного или аморфного Соединения 1.
[00960] Вариант осуществления 67. Фармацевтическая композиция в соответствии с вариантом осуществления 42, где твердая дисперсия присутствует в количестве приблизительно 35 процентов по массе фармацевтической композиции и единичная дозированная форма содержит от приблизительно 52 мини-таблеток.
[00961] Вариант осуществления 68. Фармацевтическая композиция в соответствии с вариантом осуществления 67, где единичная дозированная форма содержит от приблизительно 100 мг по существу аморфного или аморфного Соединения 1.
[00962] Вариант осуществления 69. Фармацевтическая композиция в соответствии с любым из вариантов осуществления 60-68, где указанная мини-таблетка имеет цилиндрическую, овальную, конусовидную, сферическую, эллиптическую, многоугольную форму или их сочетания, где указанная мини-таблетка имеет наибольший размер или длину диаметра приблизительно 2 мм.
[00963] Вариант осуществления 70. Фармацевтическая композиция в соответствии с вариантом осуществления 42, где фармацевтическая композиция представляет собой единичную дозированную форму, включающую гранулу, пеллету, частицу или мини-таблетку, и где единичная дозированная форма содержит от приблизительно 10 мг по существу аморфного или аморфного Соединения 1.
[00964] Вариант осуществления 71. Фармацевтическая композиция в соответствии с вариантом осуществления 42, где фармацевтическая композиция представляет собой единичную дозированную форму, включающую гранулу, пеллету, частицу или мини-таблетку, и где единичная дозированная форма содержит от приблизительно 12,5 мг по существу аморфного или аморфного Соединения 1.
[00965] Вариант осуществления 72. Фармацевтическая композиция в соответствии с вариантом осуществления 70 или вариантом осуществления 71, где твердая дисперсия присутствует в количестве приблизительно 35 процентов по массе фармацевтической композиции и единичная дозированная форма представляет собой мини-таблетку, имеющую цилиндрическую, овальную, конусовидную, сферическую, эллиптическую, многоугольную форму или их сочетания, где указанная мини-таблетка имеет наибольший размер или длину диаметра приблизительно 4 мм.
[00966] Вариант осуществления 73. Способ лечения или снижения тяжести заболевания, опосредованного CFTR, у пациента детского возраста, предусматривающий введение пациенту детского возраста фармацевтической композиции в соответствии с любым из вариантов осуществления 1-72 и 78-80.
[00967] Вариант осуществления 74. Способ в соответствии с вариантом осуществления 73, где заболевание, опосредованное CFTR, выбрано из кистозного фиброза, астмы, индуцированной курением ХОБЛ, хронического бронхита, риносинусита, констипации, панкреатита, недостаточности поджелудочной железы, мужского бесплодия, обусловленного врожденным двусторонним отсутствием семявыносящего протока (CBAVD), легочной болезни легкой степени тяжести, идиопатического панкреатита, аллергического бронхолегочного аспергиллеза (ABPA), болезни печени, наследственной эмфиземы, наследственного гемохроматоза, нарушений коагуляции-фибринолиза, таких как недостаточность белка С, наследственный ангионевротический отек типа 1, нарушений процессинга липидов, таких как семейная гиперхолестеринемия, хейломикронемия типа 1, абеталипопротеинемия, лизосомных болезней накопления, таких как болезнь клеточных включений/псевдо-Гурлера, мукополисахаридозы, болезнь Сандхоффа/Тея-Сакса, болезнь Криглера-Найяра II типа, полиэндокринопатия/гиперинсулинемия, сахарный диабет, карликовость лароновского типа, дефицит миелопероксидазы, первичный гипопаратиреоз, меланома, гликогеноз CDG 1 типа, врожденный гипертиреоз, несовершенный остеогенез, наследственная гипофибриногенемия, дефицит ACT, несахарный диабет (DI), нейрогипофизарный DI, нефрогенный DI, синдром Шарко-Мари-Тута, болезнь Пелицеуса-Мерцбахера, нейродегенеративных болезней, таких как болезнь Альцгеймера, болезнь Паркинсона, боковой амиотрофический склероз, прогрессирующий супрануклеарный паралич, болезнь Пика, некоторых неврологических расстройств, характеризующихся отложением полиглутамин-содержащих протеинов [в ядрах нейронов], таких как болезнь Хантингтона, спинально-мозжечковая атаксия I типа, спинально-бульбарная мышечная атрофия, дентаторубро-паллидолюисова атрофия и миотоническая дистрофия, а также губчатых энцефалопатий, таких как наследственная болезнь Крейцфельда-Якоба (вследствие нарушения процессинга прионного белка), болезнь Фабри, синдром Герстманна-Штраусслера-Шейнкера, COPD, болезнь сухих глаз, болезнь Шегрена, остеопороз, остеопения, болезнь Горхема, хлоридных каналопатий, таких как врожденная миотония (формы Томсона и Бекера), синдром Бартера III типа, болезнь Дента, эпилепсия, гиперэкплексия, лизосомная болезнь накопления, синдром Ангельмана и первичная цилиарная дискинезия (PCD), термин для унаследованных нарушений структуры и/или функции ресничного эпителия, включая PCD с полной инверсией внутренних органов (также известную как синдром Картагенера), PCD без полной инверсии внутренних органов и цилиарной аплазии.
[00968] Вариант осуществления 75. Способ в соответствии с вариантом осуществления 74, где заболевание, опосредованное СFTR, представляет собой кистозный фиброз, ХОБЛ, эмфизему, болезнь сухих глаз или остеопороз.
[00969] Вариант осуществления 76. Способ в соответствии с вариантом осуществления 75, где заболевание, опосредованное СFTR, представляет собой кистозный фиброз.
[00970] Вариант осуществления 77. Способ в соответствии с вариантом осуществления 76, где пациент имеет одну или более из следующих мутаций CFTR человека: ΔF508, R117H и G551D.
[00971] Вариант осуществления 78. Фармацевтическая композиция, содержащая:
твердую дисперсию аморфного или по существу аморфного Соединения 1 в количестве от приблизительно 30 до приблизительно 50 процентов по массе фармацевтической композиции;
сукралозу в количестве, от приблизительно 1,5 масс.% до приблизительно 2,5 масс.% процентов по массе фармацевтической композиции;
кроскармеллозу натрия в количестве от приблизительно 4 до приблизительно 8 процентов по массе фармацевтической композиции;
коллоидный диоксид кремния в количестве от приблизительно 0,5 масс.% до приблизительно 1,5 масс.% процентов по массе фармацевтической композиции;
стеарат магния в количестве от приблизительно 0,5 масс.% до приблизительно 5 масс.% процентов по массе фармацевтической композиции; и
один или более наполнителей, в совокупности, в количестве от приблизительно 30 до приблизительно 60 процентов по массе фармацевтической композиции.
[00972] Вариант осуществления 79. Фармацевтическая композиция, содержащая:
твердую дисперсию аморфного или по существу аморфного Соединения 1 в количестве от приблизительно 30 до приблизительно 50 процентов по массе фармацевтической композиции;
сукралозу в количестве, приблизительно, от 1,5 масс.% до приблизительно 2,5 масс.% процентов по массе фармацевтической композиции;
кроскармеллозу натрия в количестве от приблизительно 4 до приблизительно 8 процентов по массе фармацевтической композиции;
коллоидный диоксид кремния в количестве от приблизительно 0,5 масс.% до приблизительно 1,5 масс.% процентов по массе фармацевтической композиции;
стеарат магния в количестве от приблизительно 0,5 масс.% до приблизительно 5 масс.% процентов по массе фармацевтической композиции; и
лактозу в количестве от приблизительно 30 до приблизительно 60 процентов по массе фармацевтической композиции.
[00973] Вариант осуществления 80. Фармацевтическая композиция, содержащая:
приблизительно 35 масс.% твердой дисперсии по массе композиции, где указанная дисперсия содержит приблизительно 80 масс.% по существу аморфного или аморфного Соединения 1 по массе дисперсии, приблизительно 19,5 масс.% HPMCAS по массе дисперсии и приблизительно 0,5 масс.% SLS по массе дисперсии;
приблизительно 54,5 масс.% лактозы по массе композиции;
приблизительно 2 масс.% сукралозы по массе композиции;
приблизительно 6 масс.% кроскармеллозы натрия по массе композиции;
приблизительно 1 масс.% коллоидного диоксида кремния по массе композиции; и
приблизительно 1,5 масс.% стеарата магния по массе композиции.
[00974] Вариант осуществления 81. Способ в соответствии с вариантом осуществления 76, где пациент имеет мутацию воротного механизма CFTR.
[00975] Вариант осуществления 82. Способ в соответствии с вариантом осуществления 81, где мутация воротного механизма выбрана из G551D, G178R, G551S, G970R, G1244E, S1255P, G1349D, S549N, S549R и S1251N.
[00976] Вариант осуществления 83. Способ в соответствии с вариантом осуществления 81, где мутации воротного механизма CFTR находится по меньшей мере в одной аллели.
[00977] Вариант осуществления 84. Способ в соответствии с вариантом осуществления 81, где мутация воротного механизма CFTR находится в обеих аллелях.
[00978] Вариант осуществления 85. Способ в соответствии с вариантами осуществления 73-77 и 81-84, где возраст пациента составляет от 2 до 5 лет.
[00979] Вариант осуществления 86. Способ в соответствии с вариантами осуществления 73-77 и 81-84, где возраст пациента составляет от 0 до 2 лет.
[00980] Вариант осуществления 87. Способ в соответствии с вариантами осуществления 73-77 и 81-84, где масса тела пациента составляет 14 килограммов или больше, чем 14 килограммов.
[00981] Вариант осуществления 88. Способ в соответствии с вариантами осуществления 73-77 и 81-84, где масса тела пациента составляет менее 14 килограммов.
[00982] Вариант осуществления 89. Способ в соответствии с вариантом осуществления 76, где пациент имеет фенотип остаточной функции.
[00983] Вариант осуществления 90. Способ в соответствии с вариантом осуществления 76, где пациент имеет остаточную функцию CFTR.
[00984] Вариант осуществления 91. Способ в соответствии с вариантом осуществления 76, где пациент имеет мутацию R117H CFTR.
| название | год | авторы | номер документа |
|---|---|---|---|
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ И ЕЕ ВВЕДЕНИЯ | 2013 |
|
RU2692779C2 |
| ТВЕРДЫЕ ДИСПЕРСИИ И ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ, ВКЛЮЧАЮЩИЕ ЗАМЕЩЕННЫЙ ИНДАН, И СПОСОБЫ ИХ ПРИГОТОВЛЕНИЯ И ПРИМЕНЕНИЯ | 2019 |
|
RU2772693C1 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ СОЕДИНЕНИЯ ПИРАЗОЛА, ДИСПЕРГИРОВАННОГО В МАТРИЦЕ ПОЛИМЕРА | 2020 |
|
RU2826604C1 |
| СОСТАВЫ ТВЕРДЫХ ДОЗИРОВАННЫХ ЛЕКАРСТВЕННЫХ ФОРМ АНТАГОНИСТА ОРЕКСИНОВОГО РЕЦЕПТОРА | 2013 |
|
RU2759837C2 |
| СПОСОБ ПОЛУЧЕНИЯ ФАРМАЦЕВТИЧЕСКИХ КОМПОЗИЦИЙ ДЛЯ ЛЕЧЕНИЯ ОПОСРЕДОВАННЫХ CFTR ЗАБОЛЕВАНИЙ | 2014 |
|
RU2718044C2 |
| СОСТАВЫ ТВЕРДЫХ ДОЗИРОВАННЫХ ЛЕКАРСТВЕННЫХ ФОРМ АНТАГОНИСТА ОРЕКСИНОВОГО РЕЦЕПТОРА | 2013 |
|
RU2699358C2 |
| ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ ДЛЯ ЛЕЧЕНИЯ ЗАБОЛЕВАНИЙ, ОПОСРЕДОВАННЫХ ТРАНСМЕМБРАННЫМ РЕГУЛЯТОРОМ КИСТОЗНОГО ФИБРОЗА CFTR | 2013 |
|
RU2827711C2 |
| ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ ДЛЯ ЛЕЧЕНИЯ ЗАБОЛЕВАНИЙ, ОПОСРЕДОВАННЫХ ТРАНСМЕМБРАННЫМ РЕГУЛЯТОРОМ КИСТОЗНОГО ФИБРОЗА (CFTR) | 2013 |
|
RU2692676C2 |
| ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ ДЛЯ ЛЕЧЕНИЯ МУКОВИСЦИДОЗА | 2019 |
|
RU2822220C2 |
| ТВЁРДЫЕ ДИСПЕРСИИ | 2016 |
|
RU2694832C2 |
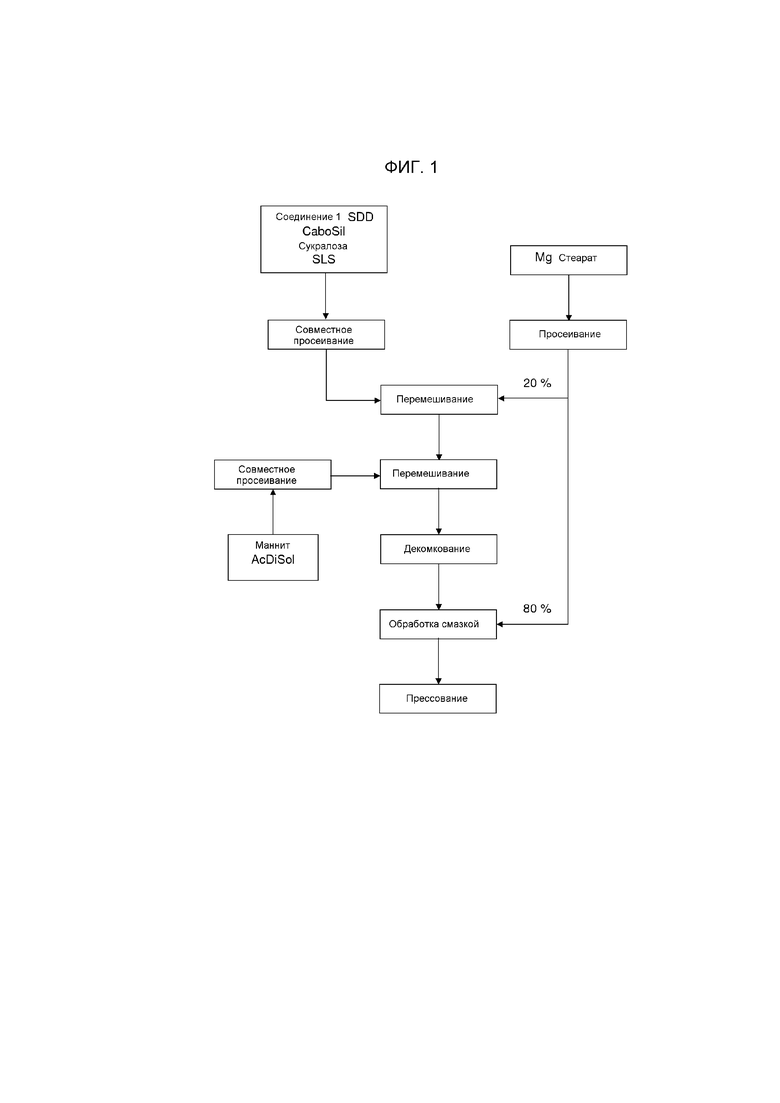
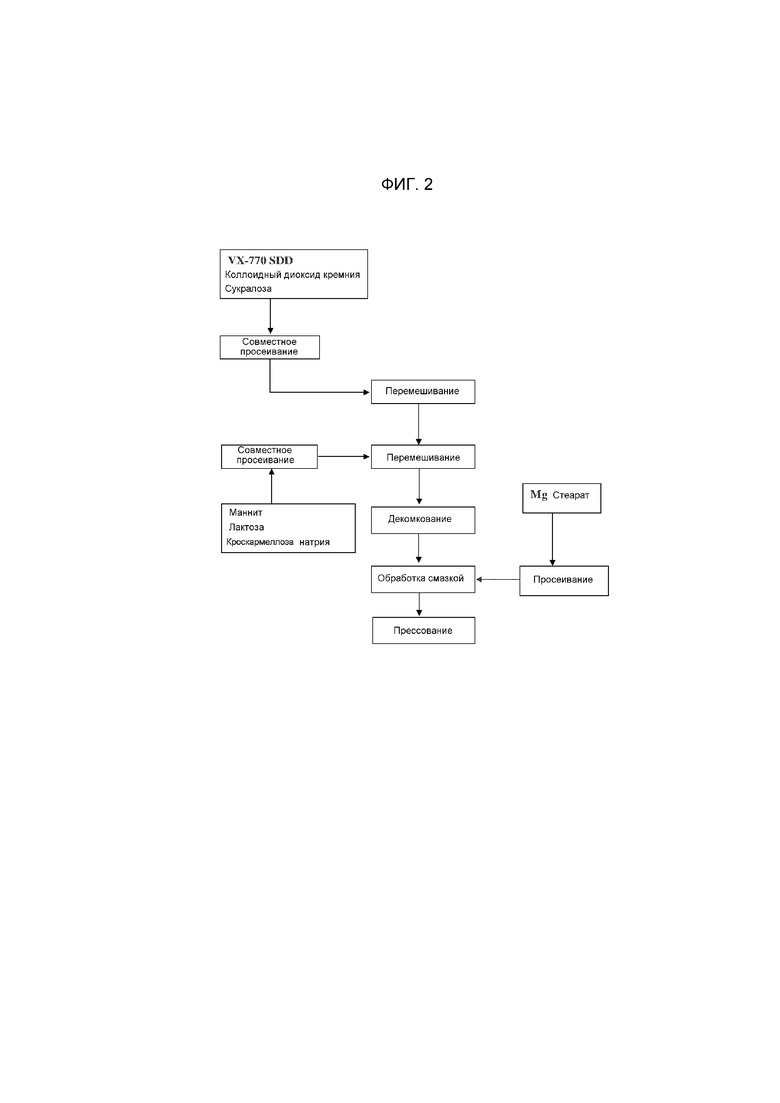
Заявленная группа изобретений относится к области медицины и раскрывает фармацевтическую композицию для лечения кистозного фиброза у пациентов детского возраста в единичной дозированной форме, включающую одно или множество из гранул или мини-таблеток, где композиция содержит: (a) твердую дисперсию в количестве от 30 до 40 мас.% по массе композиции, где дисперсия содержит: (i) 80 мас.% по существу аморфного или аморфного N-[2,4-бис(1,1-диметилэтил)-5-гидроксифенил]-1,4-дигидро-4-оксохинолин-3-карбоксамида (Соединение 1) по массе дисперсии, (ii) 19,5 мас.% сукцината ацетата гидроксипропилметилцеллюлозы (HPMCAS) по массе дисперсии и (iii) 0,5 мас.% лаурилсульфата натрия (SLS) по массе дисперсии; (b) двухкомпонентный наполнитель, содержащий маннит и лактозу в соотношении 1:3 маннита к лактозе; (c) подсластитель, который представляет собой сукралозу; (d) дезинтегрант; (e) скользящее вещество; и (f) смазывающее вещество; где единичная дозированная форма содержит от 1 до 250 мг по существу аморфного или аморфного Соединения 1 и где по существу аморфное Соединение 1 имеет менее 15% кристалличности. Также группа изобретений относится к способу лечения или снижения тяжести кистозного фиброза у пациента детского возраста. Техническим результатом группы изобретений является повышение вкусовой привлекательности фармацевтической композиции, улучшение технологических свойств с сохранением необходимой биодоступности. 2 н. и 25 з.п. ф-лы, 22 табл., 2 ил., 22 пр.
1. Фармацевтическая композиция для лечения кистозного фиброза у пациентов детского возраста в единичной дозированной форме, включающей одно или множество из гранул или мини-таблеток, где композиция содержит:
(a) твердую дисперсию в количестве от 30 до 40 мас.% по массе композиции, где дисперсия содержит:
(i) 80 мас.% по существу аморфного или аморфного N-[2,4-бис(1,1-диметилэтил)-5-гидроксифенил]-1,4-дигидро-4-оксохинолин-3-карбоксамида (Соединение 1) по массе дисперсии,
(ii) 19,5 мас.% сукцината ацетата гидроксипропилметилцеллюлозы (HPMCAS) по массе дисперсии, и
(iii) 0,5 мас.% лаурилсульфата натрия (SLS) по массе дисперсии;
(b) двухкомпонентный наполнитель, содержащий маннит и лактозу в соотношении 1:3 маннита к лактозе;
(c) подсластитель, который представляет собой сукралозу;
(d) дезинтегрант;
(e) скользящее вещество; и
(f) смазывающее вещество;
где единичная дозированная форма содержит от 1 до 250 мг по существу аморфного или аморфного Соединения 1 и
где по существу аморфное Соединение 1 имеет менее 15% кристалличности.
2. Фармацевтическая композиция по п. 1, где двухкомпонентный наполнитель присутствует в количестве от 30 до 60 процентов по массе композиции.
3. Фармацевтическая композиция по п. 1, где подсластитель представляет собой сукралозу в количестве от 1,5 до 2,5 мас.% по массе композиции.
4. Фармацевтическая композиция по п. 1, где дезинтегрант представляет собой кроскармеллозу натрия в количестве от 4 до 8 мас.% по массе композиции.
5. Фармацевтическая композиция по п. 1, где скользящее вещество представляет собой коллоидный диоксид кремния в количестве от 0,5 до 3 мас.% по массе композиции.
6. Фармацевтическая композиция по п. 1, где смазывающее вещество представляет собой стеарат магния в количестве от 0,3 до 5 мас.% по массе композиции.
7. Фармацевтическая композиция по п. 1, где фармацевтическая композиция не содержит SLS вне твёрдой суспензии.
8. Фармацевтическая композиция по п. 1, где единичная дозированная форма содержит от 1 до 100 мг по существу аморфного или аморфного Соединения 1.
9. Фармацевтическая композиция по п. 8, где единичная дозированная форма содержит 50 мг по существу аморфного или аморфного Соединения 1.
10. Фармацевтическая композиция по п. 8, где единичная дозированная форма содержит 75 мг по существу аморфного или аморфного Соединения 1.
11. Фармацевтическая композиция по п. 8, где единичная дозированная форма содержит от 25 до 40 гранул.
12. Фармацевтическая композиция по п. 1, где твердая дисперсия присутствует в количестве 35 процентов по массе фармацевтической композиции и единичная дозированная форма содержит 26 гранул.
13. Фармацевтическая композиция по п. 12, где единичная дозированная форма содержит 50 мг по существу аморфного или аморфного Соединения 1.
14. Фармацевтическая композиция по п. 1, где твердая дисперсия присутствует в количестве 35 процентов по массе фармацевтической композиции и единичная дозированная форма содержит 39 гранул.
15. Фармацевтическая композиция по п. 12, где единичная дозированная форма содержит 75 мг по существу аморфного или аморфного Соединения 1.
16. Фармацевтическая композиция по п. 1, где указанная гранула имеет цилиндрическую, овальную, конусовидную, сферическую, эллиптическую, многоугольную форму или их сочетания, где гранула имеет наибольший размер или длину диаметра 2 мм.
17. Фармацевтическая композиция по п. 1, где по существу аморфное Соединение 1 содержит менее чем 5% кристаллического Соединения 1.
18. Способ лечения или снижения тяжести кистозного фиброза у пациента детского возраста, включающий введение пациенту детского возраста фармацевтической композиции по любому из пп. 1-17.
19. Способ по п. 18, где пациент имеет мутацию воротного механизма CFTR.
20. Способ по п. 19, где мутация воротного механизма CFTR выбрана из G551D, G178R, G551S, G970R, G1244E, S1255P, G1349D, S549N, S549R и S1251N.
21. Способ по п. 19, где мутация воротного механизма CFTR находится по меньшей мере в одной аллели.
22. Способ по п. 19, где мутация воротного механизма CFTR находится в обеих аллелях.
23. Способ по п. 18, где пациент имеет одну или обе из следующих мутаций гена муковисцидозного трансмембранного регулятора проводимости (CFTR) человека: ΔF508 и R117H.
24. Способ по п. 18, где возраст пациента составляет от 2 до 5 лет.
25. Способ по п. 18, где возраст пациента составляет от 0 до 2 лет.
26. Способ по п. 18, где масса тела пациента составляет 14 килограммов или более 14 килограммов.
27. Способ по п. 18, где масса тела пациента меньше 14 килограммов.
| WO 2011019413 A1, 17.02.2011 | |||
| WO 2009023509 A2, 19.02.2009 | |||
| US 20060074075 A1, 06.04.2006 | |||
| МОДУЛЯТОРЫ ТРАНСПОРТЕРОВ АТФ-СВЯЗЫВАЮЩЕЙ КАССЕТЫ | 2005 |
|
RU2382779C2 |
Авторы
Даты
2023-08-29—Публикация
2013-02-27—Подача