Изобретение относится к способу получения (2Е,2Е)-2,2'-(1,2,4-тиадиазол-3,5-диил)бис(3-арил(гетарил)акрилонитрилов) общей формулы 1:
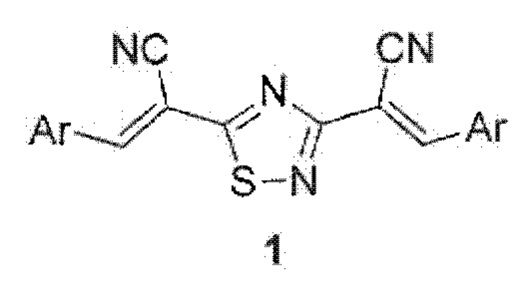
где Ar = 2-(трифторметил)фенил, 4-этилфенил, 2-бромфенил, 5-метил-2-фурил, 3,4-бис(бензилокси)фенил или 3,4,5-триметоксифенил, являющихся:
- промежуточными продуктами в синтезе различных гетероциклических соединений [Дахно П.Г., Левченко А.Г., Доценко В.В. Окисление 3,5-(α-цианостирил)-1,2,4-тиадиазолов по Радзишевскому // Успехи в химии и химической технологии. Т. XXXV. 2021. №8. С. 66]
- потенциальными антидотами гербицида 2,4-Д [Стрелков В.Д., Дядюченко Л.В., Дмитриев И.Г. Синтез новых гербицидных антидотов для подсолнечника. Краснодар: Просвещение-Юг, 2014];
В литературе к настоящему времени описано два способа получения (2E,2'Е)-2,2-(1,2,4-тиадиазол-3,5-диил)бис(3-арилакрилонитрилов) 1.
Первый способ основан на взаимодействии (Е)-3-арил-2-цианопроп-2-ентиоамидов общей формулы 2 с двукратным мольным избытком бромнитрометана [Доценко В.В., Кривоколыско С.Г. Взаимодействие 3-арил-2-цианопроп-2-ентиоамидов с бромнитрометаном: новый метод синтеза функциональных производных 1,2.4-тиадиазола // Химия гетероциклических соединений. - 2014. - №. 4. - С. 607-613] согласно схеме:
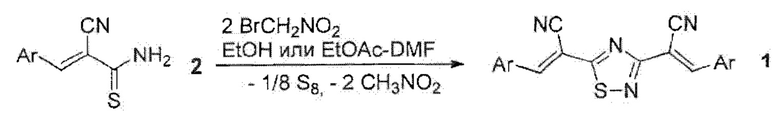
Исходные 3-арил-2-цианопроп-2-ентиоамиды 2 легко получаются реакцией цианотиоацетамида с ароматическими альдегидами в присутствии следовых количеств оснований в этаноле при 25°С или незначительном нагревании [Гринштейн В.Я., Шеринь Л.А. // Изв. АН Латв. ССР. Сер. хим. 1963. №4. С. 469; Grinsteins V., Serina L. Latvijas PSR Zinatnu Akad. Vestis Kim. Ser. N 4. P. 469 // Chem. Abstr. 1964. Vol.60. 539lh; Brunskill J.S.A., De A.5 Evving D.F. // J. Chem. Soc, Perkin Trans. 1. 1978. Vol. 6. P. 629].
Недостатком данного способа является необходимость использования в качестве окислителя избыточных количеств бромнитрометана -дорогостоящего реагента, обладающего лакриматорным и раздражающим действием, а также проведение реакции в относительно жестких условиях (при кипячении) и невысокие выходы целевых продуктов (21-52%). Данный способ является атом-неэкономным, поскольку в ходе реакции, помимо неорганического побочного продукта (серы), на 1 моль продукта образуется также 2 моль нитрометана.
Наиболее близким аналогом (прототипом) к предлагаемому техническому решению является второй способ получения (2Е,2'Е)-2,2'-(1,2,4-тиадиазол-3,5-диил)бис(3-арилакрилонитрилов) 1, который основывается на окислении (Е)-3-арил-2-цианолроп-2-ентиоамидрв 2 под действием диметилсульфоксида (ДМСО) и концентрированной соляной кислоты в среде ДМСО или в ацетоне [Доценко В.В., Кривоколыско С.Г. Окисление тиоамидов системой ДМСО-НС 1: удобный и эффективный метод синтеза 1,2,4-тиадиазолов, изотиазоло[5,4-b]пиридинов и гетероциклических дисульфидов // Химия гетероциклических соединений. - 2013. - №. 4. - С. 682-690; Доценко В.В., Кривоколыско С.Г. Взаимодействие 3-арил-2-цианопроп-2-ентиоа.мидов с бромнитрометаном: новый метод синтеза функциональных производных 1,2,4-тиадиазола // Химия гетероциклических соединений. - 2014. - №. 4. - С. 607-613] согласно схеме:
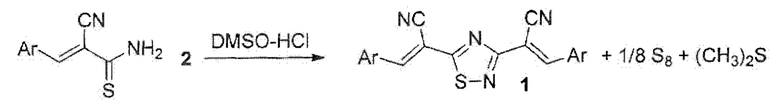
Данный подход имеет преимущества перед способом, основанным на применении бромнитрометана; система ДМСО-HCl представляет собой доступный и дешевый окислитель, выходы целевых продуктов выше (в среднем 50-70%), реакция протекает без нагревания или при незначительном нагревании. Однако серьезным недостатком данного метода является побочное выделение заметных количеств диметилсульфида (CH3)2S - легковоспламеняющегося органического соединения с весьма сильным неприятным запахом, обладающего общетоксическим действием» Кроме того, данный способ является атом-неэкономным, поскольку в ходе реакции, помимо неорганического побочного продукта (серы), образуется также органический побочный продукт - диметилсульфид.
Задачей изобретения является усовершенствование способа получения (2Е,2'Е)-2,2'-(1,2,4-тиадиазол-3,5-диил)бис[3-арил(гетарил)акрилонитрилов] 1.
Техническим результатом предлагаемого способа является увеличение выходов целевых продуктов, отсутствие токсичных, легковоспламеняющихся или дурнопахнущих побочных продуктов.
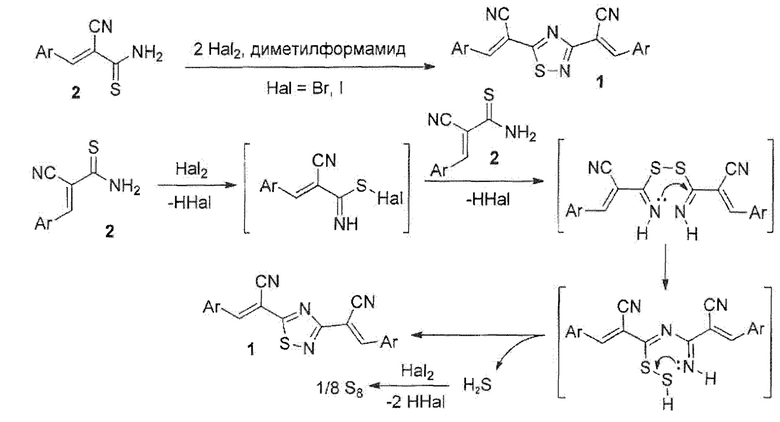
Технический результат предлагаемого изобретения достигается путем введения (Е)-3-арил-2-цианопроп-2-ентиоамидов общей формулы 2 в реакцию с двукратным мольным избытком брома в среде N,N-диметилформамида. При этом достигаются высокие выходы целевых продуктов, отсутствуют токсичные, легковоспламеняющиеся или обладающие неприятным запахом побочные продукты. Важным преимуществом является большая атом-экономность процесса - в ходе окисления не образуются стехиометрические количества органических побочных продуктов.
N,N-Диметилформамид является предпочтительным растворителем, поскольку исходные тиоакриламиды 2 в нем хорошо растворимы, тогда как (2Е,2'Е)-2,2'-(1,2,4-тиадиазол-3,5-диил)бис(3-арилакрилонитрилы) 1 растворимы плохо, выпадают в осадок из реакционной массы, что облегчает отделение продуктов. Использование других растворителей (метанол, этанол) приводит к неудовлетворительным результатам, поскольку исходные тиоакриламиды 2 плохо растворимы в спиртах, что ведет к образованию продуктов, загрязненных примесью исходных реагентов. Реакция протекает по механизму, представленному на схеме:
Общими признаками предлагаемого способа и прототипа являются: использование 3-арил-2-цианопроп-2-ентиоамидов в качестве исходных соединений;
- использование реакции окисления как принципиального подхода к получению (2Е,2'Е)-2,2'-(1,2,4-тиадиазол-3,5-диил)бис(3-арил(гетарил)акрилонитрилов);
- образование элементной серы как побочного продукта. Отличительными признаками являются:
- использование двукратного мольного избытка брома как окислителя;
- использование N,N-диметилформамида как растворителя;
- отсутствие токсичных, легковоспламеняющихся либо зловонных побочных продуктов;
Пример 1. Получение (2Е,2'Е)-2,2'-(1,2,4-тиадиазол-3,5-диил)бис{3-[2-(трифторметил)фенил]акрилонитрила) с использованием брома как окислителя.
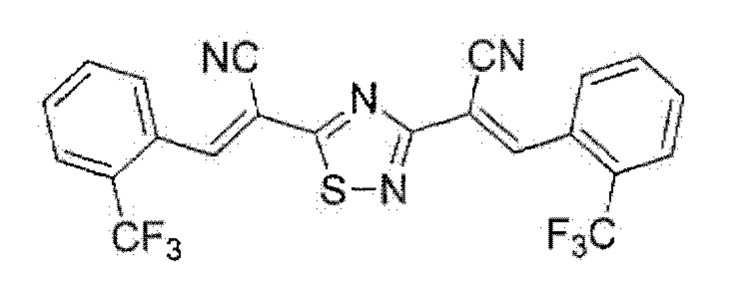
К раствору 0.51 г (2 ммоль) (Е)-3-12-(трифторметил)фенил]-2-цианопроп-2-ентиоамида в 15 мл N,N-диметилформамида при перемешивании по каплям добавляли 0.21 мл (4 ммоль) брома, после чего сразу же отфильтровывали реакционную массу через складчатый бумажный фильтр для удаления примеси серы. Через 24 ч смесь разбавляли этанолом, осадок отделяли, промывали этанолом, сушили 3 ч при 60°С. Выход 82%, желто-зеленый мелкокристаллический порошок, т.пл. 151-152°С. ИК спектр, ν, см-1: 2227 ср (C≡N). Спектр ЯМР 1Н (ДМСО-d6), δН, м.д.: 7.77-7.84 м (2Н, Н Ar), 7.90-7.98 м (4Н, Н Ar), 8.16-8.19 м (211, Н Ar), 8.78 с (1H, -СН=), 8.83 с (1H, -СН=). Спектр ЯМР 13С DEPTQ (ДМСО-d6), δС, м.д.; 107.3 (CC≡N), 109,4 (CC≡N), 114.5 (C≡N), 114.8 (C≡N), 123.7 к (CF3, 1JCF=274.0 Гц), 123.1 к (CF3, 1JCF=274.0 Гц), 126.6* к (С3Н Ar, 3JCF=5.3 Гц), 126.8* к (С3Н Ar, 3JCF=5.0 Гц), 127.2-127.8 м (2 С-CF3), 130.0* (СН Ar), 130.1 (С1 Ar), 130.2* (СН Ar), 130.4 (С1 Ar), 131.7* (СН Ar), 132.2* (СН Ar), 133.2* (СН Ar), 133.3* (СН Ar), 146.0* (-СН-), 146,5* (-СН=), 167.2 (С3тиадиазол), 183.2 (С5тиадиазол). *Сигнал в противофазе. Найдено, %: С 55.33; Н 2.05; N 11.69. C22H10F6N4S (М 476.4). Вычислено, %: С 55.47; Н 2.12; N 11.76.
Пример 2. Получение (2Е,2'Е)-2,2'-(1,2,4-тиадиазол-3,5-диил)бис[3-(4-этилфенил)акрилонитрила] с использованием брома как окислителя.

К раствору 0.43 г (2 ммоль) (Е)-3-(4-этилфенил)-2-цианопроп-2-ентиоамида в 15 мл N,N-диметилформамида при перемешивании по каплям добавляли 0.21 мл (4 ммоль) брома, после чего сразу же отфильтровывали реакционную массу через складчатый бумажный фильтр для удаления примеси серы. Через 24 ч смесь разбавляли этанолом, осадок отделяли, промывали этанолом, сушили 3 ч при 60°С. Выход 83%, желто-зеленый мелкокристаллический порошок, т.пл. 202-204°С. Спектр ЯМР 1Н (ДМСО-d6, δН, м.д.: 1.20-1.23 м (611, 2Ме), 2.68-2.76 м (411, 2СН2), 7.45-7.50 м (411, 2Ar), 8.00-8.06 м (4Н, 2Ar), 8.59 уш. с (211, 2 -СР=). Спектр ЯМР 13С DEPTQ (ДМСО-d4), δC, м.д.: 15.06* (Me), 15.14* (Me), 28.3 (СН2), 28.4 (СН2), 100.2 (CC≡N), 102.9 (C≡N), 116.0 (C≡N), 116.4 (C≡N), 128.8* (СН Ar), 129.0* (СН Ar), 129.5 (С Ar), 129.8 (С Ar), 130.4* (СН Ar), 130.9* (СН Ar), 149.2 (С Ar), 149.9* (-СН-), 150.3 (С Ar), 150.7* (-СН=), 168.4 (С3тиадиазол)5 184.4 (С5тиадиазол). *Сигнал в противофазе. Найдено, %; С 72.66; Н 5.05; N 14.09. C24H20N4S (М 396.5). Вычислено, %: С 72.70; Н 5.08; N 14.13.
Пример 3. Получение (2E,2'Е)-2,2'-(1,2,4-тиадиазол-3,5-диил)бис[3-(2-бромфенил)акрилонитрила] с использованием брома как окислителя.
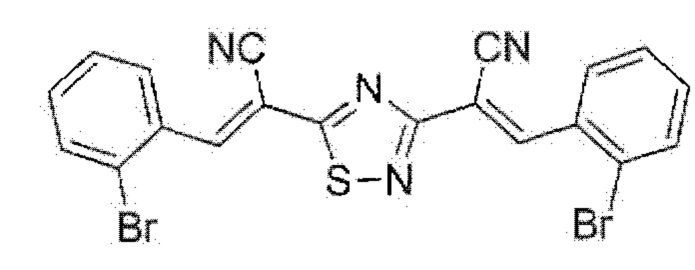
К раствору 0.51 г (2 ммоль) (Е)-3-(2-бромфенил)-2-цианопроп-2-ентиоамида в 15 мл N,N-диметилформамида при перемешивании по каплям добавляли 0.21 мл (4 ммоль) брома, после чего сразу же отфильтровывали реакционную массу через складчатый бумажный фильтр для удаления примеси серы. Через 24 ч смесь разбавляли этанолом, осадок отделяли, промывали этанолом, сушили 3 ч при 60°С. Выход 61%, желтые игольчатые кристаллы, т.пл. 257-259°С. ИК спектр, ν, см-1: 2220 ш (C≡N). Спектр ЯМР 1Н (ДМСО-4), δH, м.д.: 7.51-7.58 м (2Н, Ar), 7.62-7.68 м (2Н, Ar), 7.86-7.90 м (2Н, Ar), 8.12-8.15 м (2Н, Ar), 8.68 с (1Н, -CH=), 8.77 с (1H, -СН=). Спектр ЯМР 13С DEPTQ (ДМСО-d6), δC, м.д.: 105.5 (CC≡N), 107.7 (CC≡N), 114.8 (C≡N), 115.2 (C≡N), 124.8 (C-Br), 125.0 (C-Br), 128.4* (CH Ar), 128.5* (CH Ar), 129.9* (CH Ar), 130.2* (CH Ar), 132.1 (C1 Ar), 132.3 (C1 Ar), 133.4* (CH Ar), 133.45* (CH Ar), 133.52* (CH Ar), 134.0* (CH Ar), 148.5* (-CH=), 149.1* (-CH=), 167.6 (С3тиадиазол), 183.6 (С5тиадиазол). * Сигнал в противофазе. Найдено, %: С 48,17; Н 2.04; N 11.11. C20H10Br2N4S (М 498.2). Вычислено, %: С 48.22; Н 2.02; N 11,25.
Пример 4. Получение (2Е,2'Е)-2,2'-(1,2,4-тиадиазол-3,5-диил)бис[3-(5-метил-2-фурил)акрилонитрила] с использованием брома как окислителя.
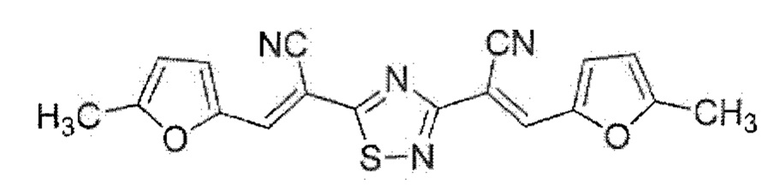
К раствору 0.38 г (2 ммоль) (Е)-3-(5-метил-2-фурил)-2-цианопроп-2-ентиоамида в 10 мл N,N-диметилформамида при перемешивании по каплям добавляли 0.21 мл (4 ммоль) брома, после чего сразу же отфильтровывали реакционную массу через складчатый бумажный фильтр для удаления примеси серы. Через 24 ч смесь разбавляли этанолом, осадок отделяли, промывали этанолом, сушили 3 ч при 60°С. Выход 79%, желто-зеленый мелкокристаллический порошок, т.пл. 198-200°С.ИК спектр, ν, см-1: 2224 ш (C≡N). Спектр ЯМР 1Н (ДМСО-d6), δH, м.д.: 2.43 с (3Н, Me), 2.46 с (3Н, Me), 6.51 д (1H, фурил, 3JHH=3.4 Гц), 6.58 д (1H, фурил, 3JHH=3.4 Гц), 7.36 д (1Н, фурил, 3JHH=3.4 Гц), 7.44 д (1H, фурил, 3JHH=3.4 Гц), 8.20 с (1H, -СН=), 8.24 c (1H, -СН=). Спектр ЯМР 13С DEPTQ (ДМСО-d6), δС, м.д.: 13.9* (Me), 14.1* (Me), 93.6 (CC≡N), 97.1 (CC≡N), 111.1* (CH Фурил), 111.9* (CH Фурил), 115.9 (C≡N), 116.1 (ON), 123.5* (CH Фурил), 126.8* (CH Фурил), 133.5* (-CH-), 134.0* (-CH=), 147.3 (2C Фурил), 158.9 (С Фурил), (С3тиадиазол), 184.1 (С5тиадиазол). *Сигнал в противофазе. Найдено, %: С 62.00; Н 3.36; N 16.12. C18H12N4O2S (М 348.4). Вычислено, %: С 62.06; Н 3.47; N 16.08.
Пример 5. Получение (2Е,2'Е)-2,2'-(1,2,4-тиадиазол-3,5-диил)5ис{3-[3,4-бмс(бензилокси)фенил]акрилонитрила} с использованием брома как окислителя.
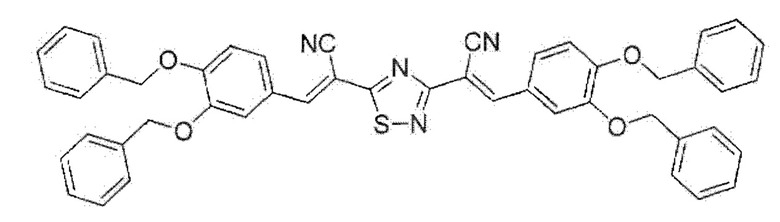
К раствору 0.80 г (2 ммоль) (Е)-3-(3,4-(дибензилокси)фенил)-2-цианопроп-2-снтиоамида в 15 мл N,N-диметилформамида при перемешивании по каплям добавляли 0.21 мл (4 ммоль) брома, после чего сразу же отфильтровывали реакционную массу через складчатый бумажный фильтр для удаления примеси серы. Через 24 ч смесь разбавляли этанолом, осадок отделяли, промывали этанолом, сушили 3 ч при 60°С. Выход 93%, оранжевый мелкокристаллический порошок, т.пл. 198-200°С ИК спектр, ν, см-1; 2220 ш (C≡N). Спектр ЯМР 1H (ДМСО-d6), δН, м.д.; 5.20 уш. с (4Н, 2СН2), 5.28 с (2Н, СН2), 5.30 с (2Н, СН2), 7.30-7.48 м (22Н, Ar), 7.73 д (1Н, Ar, 3JHH=8.8 Гц), 7.79 д (1Н, Ar, 3JHH=8.9 Гц), 7.88 с (1H, Ar), 7.90 с (1Н, Ar), 8.47 с (1H, -СН=), 8.48 с (1H, -СН=). Найдено, %: С 75.22; Н 4.69; N 7.22. C48H36N4O4S (М 764.9). Вычислено, %: С 75.37; Н 4.74; N 7.32.
Пример 6. Получение (2Е,2'Е)-2,2'-(1,2,4-тиадиазол-3,5-диил)бис[3-(3,4,5-триметоксифенил)акрилонитрила] с использованием брома как окислителя.

К раствору 0.56 г (2 ммоль) (Е)-3-(3,4,5-триметоксифенил)-2-цианопроп-2-ентиоамида в 15 мл N,N-диметилформамида при перемешивании по каплям добавляли 0.21 мл (4 ммоль) брома, после чего сразу же отфильтровывали реакционную массу через складчатый бумажный фильтр для удаления примеси серы. Через 24 ч смесь разбавляли этанолом, осадок отделяли, промывали этанолом, сушили 3 ч при 60°С. Выход 84%, желто-оранжевый мелкокристаллический порошок, т.пл. 208-210°С. ИК спектр, ν, см-1; 2216 ср (C≡N). Спектр ЯМР 1Н (ДМСО-d6), δН, м.д.: 3.78 с (3Н, МеО), 3,80 с (3Н, МеО), 3.85-3.86 м (12Н, наложение 4МеО), 7.48-7.49 м (2Н, Ar), 7.53-7.54 м (2Н, Ar), 8.51 уш. с (2Н, 2 - CH=). Спектр ЯМР 13С DEPTQ (ДМСО-d6), δC, м.д.: 56.03* (2МеО), 56.04* (2МеО), 60.3* (МеО), 60.4* (МеО), 99.7 (CC≡N), 102.6 (CON), 107.9* (СН Ar), 108.5* (СН Ar), 116.1 (ON), 116.6 (ON), 127.0 (С1 Ar), 127.4 (С1 Ar), 141.1 (С-ОМе Ar), 142.0 (С-ОМе Ar), 149.7* (-СН=), 150.5* (-СН=), 152.9 (4 С-ОМе Ar), 168.5 (С3тиадиазол), 184.1 (С5тиадиазол). *Сигнал в противофазе. Найдено, %: С 59.81; Н 4,59; N 10.71. C26H24N4O6S (М 520.6). Вычислено, %: С 59.99; Н 4.65; N 10.76.
Как видно из приведенных примеров конкретного выполнения, выходы (2Е,2'Е)-2,2'-(1,2,4-тиадиазол-3,5-диил)бис(3-арил(гетарил)акрилонитрилов) 1 при окислении двукратным мольным избытком йода или брома не ниже либо выше выходов, достигнутых при использовании других методов, в ходе реакции не образуются токсичные, легковоспламеняющиеся или обладающие неприятным запахом побочные продукты,
На основании изложенного следует вывод, что предлагаемое техническое решение является новым, обладает отличительными признаками и может быть масштабировано для использования в тонком органическом синтезе.
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ получения (2E,2'E)-2,2'-(1,2,4-тиадиазол-3,5-диил)бис(3-арилакрилонитрилов) | 2022 |
|
RU2802633C1 |
| Способ получения 5-арил-4-тиоксо-3,4,5,6-тетрагидро-2H-пиридо[3,2-e][1,3]тиазин-7(8H)-онов | 2024 |
|
RU2831154C1 |
| Способ получения 6-амино-4-арил-2-тиоксо-1,2-дигидропиридин-3,5-дикарбонитрилов | 2022 |
|
RU2792625C1 |
| Способ получения 4-гетарил-3,6-диоксо-2,3,4,5,6,7-гексагидроизотиазоло[5,4-b]пиридин-5-карбонитрилов | 2023 |
|
RU2812610C1 |
| Способ получения замещенных (Е)-3-арил-N-(гидроксиметил)-2-цианотиоакриламидов | 2023 |
|
RU2808411C1 |
| Применение (E)-N-(гидроксиметил)-3-(4-хлорфенил)-2-цианопроп-2-ентиоамида в качестве антидота 2,4-Д на подсолнечнике | 2023 |
|
RU2808337C1 |
| СПОСОБ ПОЛУЧЕНИЯ 2-СУЛЬФОНИЛАМИНО-1,2,4,-ТРИАЗОЛО[1,5-a] ПИРИМИДИНОВ | 2007 |
|
RU2325390C1 |
| СОЕДИНЕНИЯ ДЛЯ РАЗДЕЛЕНИЯ РЕДКОЗЕМЕЛЬНЫХ ЭЛЕМЕНТОВ И S-, P-, D-МЕТАЛЛОВ, СПОСОБЫ РАЗДЕЛЕНИЯ И ИХ ПРИМЕНЕНИЕ | 2018 |
|
RU2783526C2 |
| СПОСОБ СИНТЕЗА ПРОИЗВОДНЫХ АМИНО-МЕТИЛТЕТРАЛИНА | 2009 |
|
RU2512285C2 |
| КОНДЕНСИРОВАННОЕ ПРОИЗВОДНОЕ 1,2,4-ТИАДИАЗИНА, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ И СПОСОБ ПОЛУЧЕНИЯ ЛЕКАРСТВЕННОГО ПРЕПАРАТА | 1998 |
|
RU2215004C2 |
Изобретение относится к способу получения (2Е,2'Е)-2,2'-(1,2,4-тиадиазол-3,5-диил)бис[3-арил(гетарил)акрилонитрилов] общей формулы 1, где Ar = 2-(трифторметил)фенил, 4-этилфенил, 2-бромфенил, 5-метил-2-фурил, 3,4-бис(бензилокси)фенил или 3,4,5-триметоксифенил. Способ включает проведение реакции (Е)-3-арил(гетарил)-2-цианопроп-2-ентиоамидов с двукратным мольным избытком брома в среде N,N-диметилформамида. Техническим результатом предлагаемого способа является увеличение выходов целевых продуктов, отсутствие токсичных, легковоспламеняющихся или дурнопахнущих побочных продуктов. 6 пр.
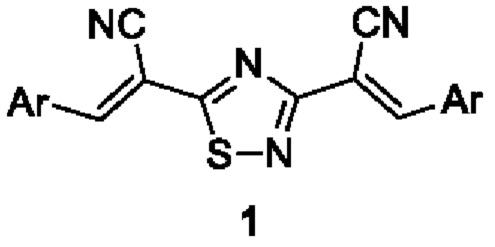
Способ получения (2E,2'E)-2,2'-(1,2,4-тиадиазол-3,5-диил)бис[3-арил(гетарил)акрилонитрилов] общей формулы 1:
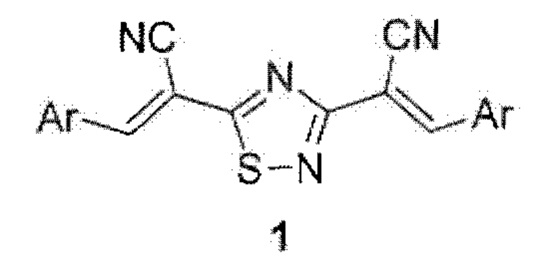 ,
,
где Аr = 2-(трифторметил)фенил, 4-этилфенил, 2-бромфенил, 5-метил-2-фурил, 3,4-бис(бензилокси)фенил или 3,4,5-триметоксифенил, отличающийся тем, что (E)-3-арил(гетарил)-2-цианопроп-2-ентиоамиды вводят в реакцию с двукратным мольным избытком брома в среде N,N-диметилформамида.
| ДОЦЕНКО В.В | |||
| и др., Окисление тиоамидов системой ДМСО-HCl: удобный и эффективный метод синтеза 1,2,4-тиадиазолов, изотиазоло[5,4-b]пиридинов и гетероциклических дисульфидов, Химия гетероциклических соединений, 2013, N 4, с.682-690 | |||
| CHAI L | |||
| et al., One-pot Synthesis of 3,5-Disubstituted 1,2,4-Thiadiazoles from Nitriles and Thioamides via |
Авторы
Даты
2023-08-30—Публикация
2022-12-06—Подача