Изобретение относится к области получения органических веществ и может быть использовано в производстве гербицидов и других биологически активных соединений.
Известен способ получения 2-арилсульфониламино-5,7-диметокси-1,2,4-триазоло[1,5-а]пиримидинов сульфонилированием 2-амино-5,7-диметокси-1,2,4-триазоло[1,5-а] пиримидина ароматическими сульфохлоридами в ацетонитриле в присутствии пиридина [US Patent 6559101 Int. C1. C07D 487/04. N-(5,7-dimethoxy[1,2,4]triazolo[1,5-a]pyrimidin-2-yl) arylsulfonamide compounds and their use as herbicides // Johnson T.C., VanHeertum J.C., Ouse D.G., et al. - 06.05.2003]. Недостатком этого способа является невозможность получения сульфониламинопроизводных, в которых заместители в положениях 5 и 7 триазолопиримидинового цикла отличаются от группы ОСН3, а заместитель в положении 2 не является арилсульфониламиногруппой.
Известен способ получения 2-арилсульфониламино-1,2,4-триазоло[1,5-а]пиримидинов циклоконденсацией 3-арилсульфониламино-5-амино-1,2,4-триазолов с 1,3-дикарбонильными соединениями в уксусной кислоте [US Patent 4822404 Int. C1. C07D 487/04. Sulfonamides derived from substituted 2-amino-1,2,4-triazolo[1,5-a]pyrimidines and compositions and methods of controlling undesired vegetation // Kleschick W.A. - 18.04.1989].
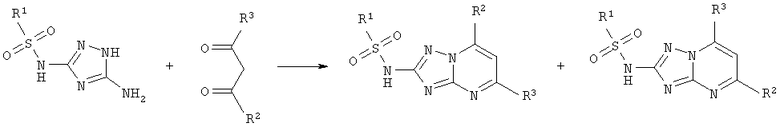
Основным недостатком этого способа является низкая региоселективность реакции циклоконденсации и возможность образования смеси изомерных продуктов при использовании несимметричных 1,3-дикарбонильных соединений (R2≠R3), а также высокая стоимость исходных 3-арисульфониламино-5-амино-1,2,4-триазолов и 1,3-дикарбонильных соединений.
Наиболее близким по технической сущности и достигаемому результату является способ получения 2-сульфониламино-1,2,4-триазоло[1,5-а]пиримидинов сульфонилированием 2-амино-1,2,4-триазоло[1,5-а]пиримидинов, содержащих различные заместители в пиримидиновом цикле, ароматическими сульфохлоридами в пиридине [US Patent 4822404 Int. C1. C07D 487/04. Sulfonamides derived from substituted 2-amino-1,2,4-triazolo[1,5-a]pyrimidines and compositions and methods of controlling undesired vegetation // Kleschick W.A. - 18.04.1989]. Недостаток этого способа заключается в низком выходе целевых продуктов и большой длительности синтеза, что объясняется пониженной нуклеофильностью аминогруппы вследствие электроноакцепторного влияния π-дефицитного пиримидинового цикла, сопряженного с триазольным кольцом, а также высокая стоимость исходных 2-амино-1,2,4-триазоло[1,5-а]пиримидинов.
Задачей изобретения является разработка способа получения 2-сульфониламино-1,2,4-триазоло[1,5-а]пиримидинов общей формулы (I) из дешевых и доступных исходных веществ, позволяющего повысить выход целевых продуктов и сократить время синтеза.
Поставленная задача достигается за счет сульфонилирования 2-амино-4,7-дигидро-1,2,4-триазоло[1,5-а]пиримидинов (II) сульфохлоридами (III) в пиридине и окисления полученных 2-сульфониламино-4,7-дигидро-1,2,4-триазоло[1,5-а]пиримидинов (IV) бромом (Br2) в уксусной кислоте в присутствии ацетата натрия (СН3COONa)

Нами установлено, что в отличие от 2-амино-1,2,4-триазоло[1,5-а]пиримидинов 2-амино-4,7-дигидро-1,2,4-триазоло[1,5-а]пиримидины легко сульфонилируются при взаимодействии с сульфохлоридами в пиридине, образуя соединения (IV). Вероятно, это связано с меньшей электроноакцепторной способностью дигидропиримидинового фрагмента по сравнению с пиримидиновым. Соединения (IV) окисляются бромом в уксусной кислоте, давая целевые соединения (I). Исходные 2-амино-4,7-дигидро-1,2,4-триазоло[1,5-а]пиримидины можно синтезировать из 3,5-диамино-1,2,4-триазола и ароматических кетонов и альдегидов [Десенко С.М., Колос Н.Н., Туэни М., Орлов В.Д. // ХГС.1990. № 7. С.938-941].
В предлагаемом способе получения 2-сульфониламино-1,2,4-триазоло[1,5-а]пиримидинов общей формулы (I) к 2-амино-4,7-дигидро-1,2,4-триазоло[1,5-а]пиримидину общей формулы (II) прибавляют сульфохлорид (III) при мольном соотношении (II):(III)=1:1.1-1.3 и кипятят в пиридине. К раствору прибавляют воду, выпавший осадок 2-сульфониламино-4,7-дигидро-1,2,4-триазоло[1,5-а]пиримидина общей формулы (IV) отфильтровывают, смешивают с ацетатом натрия и уксусной кислотой, к полученной смеси прибавляют бром при мольном соотношении (IV):(Br2):(CH3COONa)=1:1.00-1.05:2.1-2.2 при температуре 0-25°С и перемешивании. Затем к полученному раствору прибавляют воду, осадок 2-сульфониламино-1,2,4-триазоло[1,5-а]пиримидина общей формулы (I) отфильтровывают и перекристаллизовывают.
Исследования показали, что изменение мольного соотношения (II):(III)=1:1.1-1.3 на стадии сульфонилирования приводит либо к неполному протеканию реакции и неудовлетворительной чистоте соединений (IV) (пример 6, 7), либо к перерасходу реагентов, что экономически неоправданно.
Мольное соотношение (IV):(Br2):(СН3COONa)=1:1.00-1.05:2.1-2.2 на стадии окисления является оптимальным. Изменение соотношения приводит либо к неполному протеканию реакции, либо к образованию побочных продуктов, загрязняющих целевые соединения (пример 6). Проведение реакции при температуре ниже 0°С снижает скорость протекания процесса и приводит к увеличению продолжительности синтеза, что технически нецелесообразно. Повышение температуры выше 25°С уменьшает выход целевых продуктов вследствие протекания побочных реакций (пример 7).
Пример 1
К смеси 1.0 г (4.4 ммоль) 2-амино-5-метил-7-фенил-4,7-дигидро-1,2,4-триазоло[1,5-а]пиримидина и 5 мл пиридина присыпают при перемешивании 1.0 г (5.3 ммоль) п-толуолсульфохлорида. Реакционную смесь кипятят с обратным холодильником 10-15 мин, охлаждают до 20°С и разбавляют 10 мл воды. Выпавший осадок отфильтровывают. Получают 1.4 г (87%) 2-[(4-метилфенил)сульфониламино]-5-метил-7-фенил-4,7-дигидро-1,2,4-триазоло[1,5-а]пиримидина. Тпл 226-228°С.
Спектр ЯМР 1Н, δ, м.д. (J, Гц) (ДМСО-d6): 1.79 с (3Н, СН3), 2.34 с (3Н, СН3), 4.50 д (1Н, СН, J=3.7), 5.79 д (1Н, СН, J=3.7), 7.07 м (2Н, аром.), 7.24-7.30 м (5Н, аром.), 7.63 м (2Н, аром.), 9.56 с (1Н, NH), 10.71 с (1Н, NH).
Найдено (%): С 59.74; Н 5.04; N 18.39.
C19H19N5O2S
Вычислено (%): С 59.83; Н 5.02; N 18.36.
К смеси 1.0 г (2.6 ммоль) 2-[(4-метилфенил)сульфониламино]-5-метил-7-фенил-4,7-дигидро-1,2,4-триазоло[1,5-а]пиримидина, 0.44 г (5.2 ммоль) ацетата натрия и 2 мл уксусной кислоты приливают 0.14 мл (2.6 ммоль) брома. Реакционную массу перемешивают при температуре 0-25°С в течение 20-30 мин, затем разбавляют 10 мл воды. Выпавший осадок отфильтровывают. Получают 0.9 г (90%) 2-[(4-метилфенил)сульфониламино]-5-метил-7-фенил-1,2,4-триазоло[1,5-а]пиримидина. Тпл 284-285°С (из смеси ДМФА/этанол 1:5).
Спектр ЯМР 1Н, δ, м.д. (ДМСО-d6): 2.36 с (3Н, СН3), 2.58 с (3Н, СН3), 7.39 м (3Н, аром.), 7.63 м (3Н, аром.), 7.86 м (2Н, аром.), 8.00 м (2Н, аром.), 11.90 уш. c (1H, NH).
Найдено (%): С 60.19; Н 4.26; N 18.28.
C19H17N5O2S
Вычислено (%): С 60.14; Н 4.52; N 18.46.
Пример 2
К смеси 1.0 г (3.5 ммоль) 2-амино-5,7-дифенил-4,7-дигидро-1,2,4-триазоло[1,5-а]пиримидина и 5 мл пиридина присыпают при перемешивании 0.8 г (3.8 ммоль) п-хлорбензолсульфохлорида. Реакционную смесь кипятят с обратным холодильником 15-20 мин, охлаждают до 20°С и разбавляют 10 мл воды. Выпавший осадок отфильтровывают. Получают 1.6 г (69%) 2-[(4-хлорфенил)сульфониламино]-5,7-дифенил-4,7-дигидро-1,2,4-триазоло[1,5-а]пиримидина. Тпл 274-276°С.
Спектр ЯМР 1Н, δ, м.д. (J, Гц) (ДМСО-d6): 5.15 д (1Н, СН, J=3.7), 6.03 д (1Н, СН, J=3.7), 7.16 м (2Н, аром.), 7.31-7.38 м (6Н, аром.), 7.52 м (4Н, аром.), 7.76 м (2Н, аром.), 10.02 с (1Н, NH), 11.05 с (1Н, NH).
Найдено (%): С 59.60; Н 4.01; N 15.29.
C23H18N5ClO2S
Вычислено (%): С 59.54; Н 3.91; N 15.10.
К смеси 1.0 г (2.2 ммоль) 2-[(4-хлорфенил)сульфониламино]-5,7-дифенил-4,7-дигидро-1,2,4-триазоло[1,5-а]пиримидина, 0.38 г (4.6 ммоль) ацетата натрия и 2 мл уксусной кислоты приливают 0.12 мл (2.3 ммоль) брома. Реакционную массу перемешивают при температуре 0-25°С в течение 20-25 мин, затем разбавляют 10 мл воды. Выпавший осадок отфильтровывают. Получают 0.96 г (94%) 2-[(4-хлорфенил)сульфониламино]-5,7-дифенил-1,2,4-триазоло[1,5-а]пиримидина. Тпл 276-277°С (из смеси ДМФА/этанол 1:5).
Спектр ЯМР 1Н, δ, м.д. (ДМСО-d6): 7.55-7.72 м (8Н, аром.), 7.99 м (3Н, аром.), 8.10 м (2Н, аром.), 8.30 м (2Н, аром.), 12.23 уш. с (1Н, NH).
Найдено (%): С 60.02; Н 3.26; N 15.38.
C23H16N5ClO2S
Вычислено (%): С 59.80; Н 3.49; N 15.16.
Пример 3
К смеси 1.0 г (3.3 ммоль) 2-амино-5-фенил-7-(4-метилфенил)-4,7-дигидро-1,2,4-триазоло[1,5-а]пиримидина и 5 мл пиридина приливают при перемешивании 0.3 мл (4.3 ммоль) метансульфохлорида. Реакционную смесь кипятят с обратным холодильником 15-20 мин, охлаждают до 20°С и разбавляют 10 мл воды. Выпавший осадок отфильтровывают. Получают 0.75 г (60%) 2-метилсульфониламино-5-фенил-7-(4-метилфенил)-4,7-дигидро-1,2,4-триазоло[1,5-а]пиримидина. Тпл 238-240°С.
Спектр ЯМР 1Н, δ, м.д. (J, Гц) (ДМСО-d6): 2.27 с (3Н, СН3), 3.19 с (3Н, СН3), 5.17 д (1Н, СН, J=3.7), 6.04 д (1Н, СН, J=3.7), 7.14 м (4Н, аром.), 7.38 м (3Н, аром.), 7.57 м (2Н, аром.), 10.07 с (1Н, NH), 10.48 с (1Н, NH).
Найдено (%): С 59.70; Н 5.05; N 18.29.
C19H19N5O2S
Вычислено (%): С 59.83; Н 5.02; N 18.36.
К смеси 1.0 г (2.6 ммоль) 2-метилсульфониламино-5-фенил-7-(4-метилфенил)-4,7-дигидро-1,2,4-триазоло[1,5-а]пиримидина, 0.45 г (5.5 ммоль) ацетата натрия и 2 мл уксусной кислоты приливают 0.14 мл (2.7 ммоль) брома. Реакционную массу перемешивают при температуре 0-25°С в течение 25-30 мин, затем разбавляют 10 мл воды. Выпавший осадок отфильтровывают. Получают 0.89 г (90%) 2-метилсульфониламино-5-фенил-7-(4-метилфенил)-1,2,4-триазоло[1,5-а]пиримидина. Тпл 288-289°С (из смеси ДМФА/этанол 1:5).
Спектр ЯМР 1Н, δ, м.д. (ДМСО-d6): 2.44 с (3Н, СН3), 3.41 с (3Н, СН3), 7.44-7.59 м (5Н, аром.), 8.05 с (1Н, СН), 8.19 м (2Н, аром.), 8.35 м (2Н, аром.), 11.59 уш. c (1H, NH).
Найдено (%): С 60.01; Н 4.16; N 18.58.
C19H17N5O2S
Вычислено (%): С 60.14; Н 4.52; N 18.46.
Пример 4
К смеси 1.0 г (3.3 ммоль) 2-амино-5-(4-метилфенил)-7-фенил-4,7-дигидро-1,2,4-триазоло[1,5-а]пиримидина и 5 мл пиридина приливают при перемешивании 0.5 мл (4.0 ммоль) бензолсульфохлорида. Реакционную смесь кипятят с обратным холодильником 10-15 мин, охлаждают до 20°С и разбавляют 10 мл воды. Выпавший осадок отфильтровывают. Получают 0.86 г (59%) 2-фенилсульфониламино-5-(4-метилфенил)-7-фенил-4,7-дигидро-1,2,4-триазоло[1,5-а]пиримидина. Тпл 250-252°С.
Спектр ЯМР 1Н, δ, м.д. (J, Гц) (ДМСО-d6): 2.28 с (3Н, СН3), 5.10 д (1Н, СН, J=3.7), 6.01 д (1Н, СН, J=3.7), 7.15 м (4Н, аром.), 7.28-7.62 м (8Н, аром.), 7.78 м (2Н, аром.), 9.96 с (1Н, NH), 10.92 с (1Н, NH).
Найдено (%): С 64.89; Н 5.06; N 15.28.
C24H21N5O2S
Вычислено (%): С 64.99; Н 4.77; N 15.79.
К смеси 1.0 г (2.2 ммоль) 2-фенилсульфониламино-5-(4-метилфенил)-7-фенил-4,7-дигидро-1,2,4-триазоло[1,5-а]пиримидина, 0.39 г (4.6 ммоль) ацетата натрия и 2 мл уксусной кислоты приливают 0.12 мл (2.3 ммоль) брома. Реакционную массу перемешивают при температуре 0-25°С в течение 20-25 мин, затем разбавляют 10 мл воды. Выпавший осадок отфильтровывают. Получают 0.87 г (90%) 2-фенилсульфониламино-5-(4-метилфенил)-7-фенил-1,2,4-триазоло[1,5-а]пиримидина. Тпл>320°С (из смеси ДМФА/этанол 1:5).
Спектр ЯМР 1Н, δ, м.д. (ДМСО-d6): 2.37 с (3Н, СН3), 7.34 м (2Н, аром.), 7.62 м (6Н, аром.), 7.97-8.23 м (7Н, аром.), 12.11 уш. с (1Н, NH).
Найдено (%): С 65.01; Н 4.21; N 15.58.
C24H19N5O2S
Вычислено (%): С 65.29; Н 4.34; N 15.86.
Пример 5
К смеси 1.0 г (3.1 ммоль) 2-амино-5-фенил-7-(4-метоксифенил)-4,7-дигидро-1,2,4-триазоло[1,5-а]пиримидина и 5 мл пиридина присыпают при перемешивании 0.7 г (3.4 ммоль) п-хлорбензолсульфохлорида. Реакционную смесь кипятят с обратным холодильником 10-15 мин, охлаждают до 20°С и разбавляют 10 мл воды. Выпавший осадок отфильтровывают. Получают 1.1 г (71%) 2-[(4-хлорфенил)сульфониламино]-5-фенил-7-(4-метоксифенил)-4,7-дигидро-1,2,4-триазоло[1,5-а]пиримидина. Тпл 256-257°С.
Спектр ЯМР 1Н, δ, м.д. (J, Гц) (ДМСО-d6): 3.73 с (3Н, СН3), 5.12 д (1Н, СН, J=3.7), 5.97 д (1Н, СН, J=3.7), 6.87 м (2Н, аром.), 7.11 м (2Н, аром.), 7.36-7.56 м (7Н, аром.), 7.76 м (2Н, аром.), 9.97 с (1Н, NH), 10.37 с (1H, NH).
Найдено (%): С 59.50; Н 3.98; N 14.22.
С24Н20N5ClO3S
Вычислено (%): С 59.36; Н 4.08; N 14.18.
К смеси 1.0 г (2.0 ммоль) 2-[(4-хлорфенил)сульфониламино]-5-фенил-7-(4-метоксифенил)-4,7-дигидро-1,2,4-триазоло[1,5-а]пиримидина, 0.34 г (4.2 ммоль) ацетата натрия и 2 мл уксусной кислоты приливают 0.11 мл (2.0 ммоль) брома. Реакционную массу перемешивают при температуре 0-25°С в течение 25-30 мин, разбавляют 10 мл воды. Выпавший осадок отфильтровывают. Получают 0.89 г (91%) 2-[(4-хлорфенил)сульфониламино]-5-фенил-7-(4-метоксифенил)-1,2,4-триазоло[1,5-а]пиримидина. Тпл 280-282°С (из смеси ДМФА/этанол 1:5).
Спектр ЯМР 1Н, δ, м.д. (ДМСО-d6): 3.90 с (3Н, СН3), 6.87 м (2Н, аром.), 7.17 м (2Н, аром.), 7.54-7.71 м (5Н, аром.), 7.99 м (3Н, аром.), 8.19 м (4Н, аром.), 12.27 уш. с (1Н, NH).
Найдено (%): С 58.73; Н 3.51; N 14.57.
С24Н18N5ClO3S
Вычислено (%): С 58.60; Н 3.69; N 14.24.
Пример 6
К смеси 1.0 г (3.1 ммоль) 2-амино-5-фенил-7-(4-метоксифенил)-4,7-дигидро-1,2,4-триазоло[1,5-а]пиримидина и 5 мл пиридина присыпают при перемешивании 0.7 г (3.1 ммоль) п-хлорбензолсульфохлорида. Реакционную смесь кипятят с обратным холодильником 15-20 мин, охлаждают до 20°С и разбавляют 10 мл воды. Выпавший осадок отфильтровывают. Получают 0.8 г (52%) 2-[(4-хлорфенил)сульфониламино]-5-фенил-7-(4-метоксифенил)-4,7-дигидро-1,2,4-триазоло[1,5-а]пиримидина. Тпл 254-255°С.
Спектр ЯМР 1Н, δ, м.д. (J, Гц) (ДМСО-d6): 3.73 с (3Н, СН3), 5.12 д (1Н, СН, J=3.7), 5.97 д (1Н, СН, J=3.7), 6.87 м (2Н, аром.), 7.11 м (2Н, аром.), 7.36-7.56 м (7Н, аром.), 7.76 м (2Н, аром.), 9.97 с (1Н, NH), 10.37 с (1H, NH).
Найдено (%): С 59.50; Н 3.98; N 14.22.
С24Н20N5ClO3S
Вычислено (%): С 59.36; Н 4.08; N 14.18.
К смеси 1.0 г (2.0 ммоль) 2-[(4-хлорфенил)сульфониламино]-5-фенил-7-(4-метоксифенил)-4,7-дигидро-1,2,4-триазоло[1,5-а]пиримидина, 0.34 г (4.2 ммоль) ацетата натрия и 2 мл уксусной кислоты приливают 0.14 мл (2.5 ммоль) брома. Реакционную массу перемешивают при температуре 0-25°С в течение 25-30 мин, затем разбавляют 10 мл воды. Выпавший осадок отфильтровывают. Получают 0.68 г (70%) 2-[(4-хлорфенил)сульфониламино]-5-фенил-7-(4-метоксифенил)-1,2,4-триазоло[1,5-а]пиримидина. Тпл 280-282°С (из смеси ДМФА/этанол 1:5).
Спектр ЯМР 1Н, δ, м.д. (ДМСО-d6): 3.90 с (3Н, СН3), 6.87 м (2Н, аром.), 7.17 м (2Н, аром.), 7.54-7.71 м (5Н, аром.), 7.99 м (3Н, аром.), 8.19 м (4Н, аром.), 12.27 уш. с (1Н, NH).
Найдено (%): С 58.73; Н 3.51; N 14.57.
C24H18N5ClO3S
Вычислено (%): С 58.60; Н 3.69; N 14.24.
Пример 7
К смеси 1.0 г (4.4 ммоль) 2-амино-5-метил-7-фенил-4,7-дигидро-1,2,4-триазоло[1,5-а]пиримидина и 5 мл пиридина присыпают при перемешивании 1.4 г (7.5 ммоль) п-толуолсульфохлорида. Реакционную смесь кипятят с обратным холодильником 10-15 мин, охлаждают до 20°С и разбавляют 10 мл воды. Выпавший аморфный осадок промывают 2 раза водой (10 мл) и отфильтровывают. Получают 1.2 г (75%) 2-[(4-метилфенил)сульфониламино]-5-метил-7-фенил-4,7-дигидро-1,2,4-триазоло[1,5-а]пиримидина. Тпл 224-228°С.
Спектр ЯМР 1Н, δ, м.д. (J, Гц) (ДМСО-d6): 1.79 с (3Н, СН3), 2.34 с (3Н, СН3), 4.50 д (1Н, СН, J=3.7), 5.79 д (1Н, СН, J=3.7), 7.07 м (2Н, аром.), 7.24-7.30 м (5Н, аром.), 7.63 м (2Н, аром.), 9.56 с (1Н, NH), 10.71 с (1Н, NH).
Найдено (%): С 59.74; Н 5.04; N 18.39.
C19H19N5O2S
Вычислено (%): С 59.83; Н 5.02; N 18.36.
К смеси 1.0 г (2.6 ммоль) 2-[(4-метилфенил)сульфониламино]-5-метил-7-фенил-4,7-дигидро-1,2,4-триазоло[1,5-а]пиримидина и 0.44 г (5.2 ммоль) ацетата натрия в 2 мл уксусной кислоты приливают 0.14 мл (2.6 ммоль) брома. Реакционную массу перемешивают при температуре 35-40°С в течение 25-30 мин, затем разбавляют 10 мл воды. Выпавший осадок отфильтровывают. Получают 0.6 г (61%) 2-[(4- метилфенил)сульфониламино]-5-метил-7-фенил-1,2,4-триазоло[1,5-а]пиримидина. Тпл 284-285°С (из смеси ДМФА/этанол 1:5).
Спектр ЯМР 1Н, δ, м.д. (ДМСО-d6): 2.36 с (3Н, СН3), 2.58 с (3Н, СН3), 7.39 м (3Н, аром.), 7.63 м (3Н, аром.), 7.86 м (2Н, аром.), 8.00 м (2Н, аром.), 11.90 уш. с (1Н, NH).
Найдено (%): С 60.19; Н 4.26; N 18.28.
C19H17N5O2S
Вычислено (%): С 60.14; Н 4.52; N 18.46.
| название | год | авторы | номер документа |
|---|---|---|---|
| СЕЛЕКТИВНЫЕ ПРОТИВОТУБЕРКУЛЕЗНЫЕ АГЕНТЫ, ПРЕДСТАВЛЯЮЩИЕ СОБОЙ ЗАМЕЩЕННЫЕ 7-АРИЛ(ГЕТЕРИЛ)-6-КАРБЭТОКСИ-4,7-ДИГИДРО-1,2,4-ТРИАЗОЛО[1,5-a]ПИРИМИДИНЫ ИЛИ ЗАМЕЩЕННЫЕ 7-АРИЛ(ГЕТЕРИЛ)-4,7-ДИГИДРО-6-НИТРО-1,2,4-ТРИАЗОЛО[1,5-a]ПИРИМИДИНЫ ИЛИ ИХ ФАРМАЦЕВТИЧЕСКИ ПРИЕМЛЕМЫЕ АДДИТИВНЫЕ СОЛИ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ИХ ОСНОВЕ И СПОСОБ ПОЛУЧЕНИЯ ЗАМЕЩЕННЫХ 7-АРИЛ(ГЕТЕРИЛ)-6-КАРБЭТОКСИ-5-МЕТИЛ-4,7-ДИГИДРО-1,2,4-ТРИАЗОЛО[1,5-a]ПИРИМИДИНОВ | 2007 |
|
RU2360905C2 |
| СПОСОБ ПОЛУЧЕНИЯ 5-АМИНО-3-N-R-АМИНО-1-R-1,2,4-ТРИАЗОЛОВ | 2005 |
|
RU2290398C2 |
| Способ получения 6-бензилоксикарбонил-5-метил-7-(гет)арил-4,7-дигидроазоло[1,5-a]пиримидинов, в том числе активных в отношении вируса гриппа A/H1N1 | 2024 |
|
RU2836465C1 |
| СПОСОБ ПОЛУЧЕНИЯ СУЛЬФОНИЛПРОИЗВОДНЫХ 3,5-ДИАМИНО-1,2,4-ТРИАЗОЛА | 2005 |
|
RU2277532C1 |
| ПРОИЗВОДНЫЕ 3,7-ДИГИДРО-[1,2,4]ТРИАЗОЛО[1,5-а]ПИРИМИДИН-5-КАРБОКСАМИДОВ С АКТИВНОСТЬЮ ПРОТИВ ТУБЕРКУЛЕЗА, ИХ ПРИМЕНЕНИЕ И СОДЕРЖАЩАЯ ИХ ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 2024 |
|
RU2836654C1 |
| Соединения формул (I) и (A), фармацевтическая композиция, лекарственное средство, применение и способ получения соединения формулы (I) | 2018 |
|
RU2822758C2 |
| СПОСОБ ПОЛУЧЕНИЯ R-МЕТИЛПРОИЗВОДНЫХ 3,5-ДИАМИНО-1,2,4-ТРИАЗОЛА | 2005 |
|
RU2292340C1 |
| 4-(ИМИДАЗО[1,2-а]ПИРИДИН-3-ИЛ)-ПИРИМИДИНОВЫЕ ПРОИЗВОДНЫЕ | 2020 |
|
RU2822388C2 |
| БИЦИКЛИЧЕСКИЕ ЛАКТАМЫ И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2016 |
|
RU2827714C1 |
| 2-(5-НИТРОНИЛФУРАН-2-ИЛ)-5-МЕТИЛ-6-НИТРО-1,2,4-ТРИАЗОЛО[1,5-А]ПИРИМИДИН-7(4Н)-ОН И ЕГО СОЛИ | 2018 |
|
RU2716715C2 |
Изобретение относится к области получения органических веществ и может быть использовано в производстве гербицидов и других биологически активных соединений. Способ получения 2-сульфониламино-1,2,4-триазоло[1,5-а]пиримидинов общей формулы (I), где R1 представляет собой метильную, фенильную, 4-метилфенильную, 4-хлорфенильную группу, R2 представляет собой фенильную, 4-метилфенильную, 4-хлорфенильную, 4-метоксифенильную группу, R3 представляет собой метильную, фенильную, 4-метилфенильную, 4-хлорфенильную группу, осуществляется сульфонилированием 2-амино-4,7-дигидро-1,2,4-триазоло[1,5-а]пиримидинов (II) сульфохлоридами (III) в пиридине и окислением образовавшихся 2-сульфониламино-4,7-дигидро-1,2,4-триазоло[1,5-а]пиримидинов (IV) бромом в уксусной кислоте в присутствии ацетата натрия. Способ позволяет получать 2-сульфониламино-1,2,4-триазоло[1,5-а]пиримидины общей формулы (I) из дешевого и доступного сырья без применения сложных технологических операций.

Способ получения 2-сульфониламино-1,2,4-триазоло[1,5-а]пиримидинов общей формулы (I)
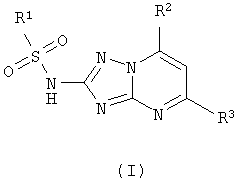
где R1 представляет собой метильную, фенильную, 4-метилфенильную, 4-хлорфенильную группу,
R2 представляет собой фенильную, 4-метилфенильную, 4-хлорфенильную, 4-метоксифенильную группу,
R3 представляет собой метильную, фенильную, 4-метилфенильную, 4-хлорфенильную группу,
включающий сульфонилирование сульфохлоридами в присутствии пиридина,
отличающийся тем, что к смеси 2-амино-4,7-дигидро-1,2,4-триазоло[1,5-а] пиримидина формулы (II)

где R2 и R3 имеют указанные значения, и пиридина прибавляют сульфохлорид общей формулы (III)
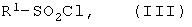
где R1 имеет указанные выше значения,
при мольном соотношении (II):(III)=1:1.1-1.3, реакционную смесь кипятят с обратным холодильником, разбавляют водой, 2-сульфониламино-4,7-дигидро-1,2,4-триазоло[1,5-а]пиримидин общей формулы (IV)

где R1, R2 и R3 имеет указанные значения,
отфильтровывают, смешивают с уксусной кислотой и ацетатом натрия, затем прибавляют бром при мольном соотношении (IV):(Br2):(СН3COONa)=1:1,00-1,05:2,1-2,2 и перемешивают при температуре 0-25°С.
| US 4822404 А, 18.04.1989 | |||
| US 6559101 А, 06.05.2003 | |||
| US 5985883 А, 16.11.1999 | |||
| Кассета для красящей ленты | 1973 |
|
SU550113A3 |
| ПРОИЗВОДНЫЕ ТРИАЗОЛОПИРИМИДИНА, СПОСОБ ИХ ПОЛУЧЕНИЯ, ФУНГИЦИДНАЯ КОМПОЗИЦИЯ | 1992 |
|
RU2089552C1 |
Авторы
Даты
2008-05-27—Публикация
2007-01-29—Подача