ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННЫЕ ЗАЯВКИ
[1] Настоящая заявка испрашивает приоритет, и основывается на дате подачи, согласно предварительной заявке США № 62/722793, поданной 24 августа 2018 г., предварительной заявке США №62/650235, которая была подана 29 марта 2018 г., и предварительной заявке США №62/721969, которая была подана 23 августа 2018 г., каждая из которых полностью включена в настоящую заявку посредством ссылки.
ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
[2] Настоящая заявка содержит Перечень последовательностей, который был представлен в электронном виде в формате ASCII и тем самым полностью включен посредством ссылки. Указанная копия в формате ASCII, созданная 29 марта 2019 г., называется 0341_0003-PCT_SL.txt и имеет размер в байтах.
ОБЛАСТЬ ТЕХНИКИ
[3] Настоящее изобретение относится к области антибактериальных агентов и, более конкретно, к полипептидам, обладающим активностью лизина против грамотрицательных бактерий, а также к применению этих агентов в уничтожении грамотрицательных бактерий и борьбе с бактериальной инфекцией и загрязнением.
УРОВЕНЬ ТЕХНИКИ
[4] Грамотрицательные бактерии, в частности, представители рода Pseudomonas и новый патоген с множественной лекарственной устойчивостью Acinetobacter baumannii, являются важной причиной серьезных и потенциально опасных для жизни инвазивных инфекций. Инфекция Pseudomonas представляет собой серьезную проблему при ожоговых ранах, хронических ранах, хронической обструктивной болезни легких (ХОБЛ), муковисцидозе, росте на поверхности имплантированных биоматериалов, а также на поверхностях в больницах и в системах водоснабжения, где она несет множество угроз для уязвимых пациентов.
[5] После развития у пациента инфекция P. aeruginosa особенно трудно поддается лечению. Геном кодирует множество генов устойчивости, включая помпы, выкачивающие множество лекарственных средств, и ферменты, придающие устойчивость к бета-лактамным и аминогликозидным антибиотикам, что делает терапию против этого грамотрицательного патогена особенно проблематичной из-за отсутствия новых противомикробных терапевтических средств. Эта проблема усугубляется способностью P. aeruginosa расти в биопленке, что может усиливать его способность вызывать инфекции из-за предохранения бактерий от защитных сил хозяина и химиотерапии.
[6] В медицинских учреждениях повышается распространенность штаммов Pseudomonas aeruginosa, устойчивых к лекарственным средствам. В исследовании методом наблюдения инфекций кровотока (BSI), ассоциированных с оказанием медицинской помощи, в общественных больницах P. aeruginosa был одним из четырех основных патогенов с множественной лекарственной устойчивостью (MDR) и внес вклад в общую смертность в больницах, составившую 18%. Кроме того, вспышки MDR P. aeruginosa хорошо подтверждены документально. С MDR-штаммами P. aeruginosa ассоциированы неблагоприятные исходы, которые часто требуют лечения лекарственными средствами крайней меры, такими как колистин.
[7] Чтобы удовлетворить потребность в новых противомикробных агентах с новыми механизмами, исследователи изучают ряд лекарственных средств и биопрепаратов. Один из таких классов противомикробных агентов включает лизины. Лизины представляют собой гидролазы пептидогликана клеточной стенки, которые действуют как «молекулярные ножницы», разрушая пептидогликановую сеть, ответственную за поддержание формы клеток и противодействие внутреннему осмотическому давлению. Разрушение пептидогликана приводит к осмотическому лизису. Однако лизины, как правило, неэффективны против грамотрицательных бактерий, по меньшей мере частично, из-за наличия внешней мембраны (ВМ), которая отсутствует у грамположительных бактерий и которая ограничивает доступ к нижележащему пептидогликану. Также были разработаны модифицированные лизины («артилизины»). Эти агенты, которые содержат лизины, гибридизованные со специфическими α-спиральными доменами с поликатионными, амфипатическими и гидрофобными признаками, способны перемещаться через ВМ. Однако артилизины, как правило, проявляют низкую активность in vivo.
[8] Несмотря на то что в недавних публикациях описаны новые лизины, которые можно применять против грамотрицательных бактерий с различными уровнями эффективности in vivo, все еще сохраняется медицинская потребность в дополнительных антибактериальных агентах, которые сохраняют активность в матриксах крови человека, для нацеливания на MDR P. aeruginosa и другие грамотрицательные бактерии для лечения инвазивных инфекций.
КРАТКОЕ ОПИСАНИЕ
[9] Настоящая заявка относится к новым полипептидным конструкциям, содержащим лизины и противомикробные пептиды (AMP), которые можно применять, например, для лечения бактериальных инфекций, включая инфекции, вызванные грамотрицательными бактериями, в частности, грамотрицательными бактериями с множественной лекарственной устойчивостью, включая, но не ограничиваясь им, Pseudomonas aeruginosa. Также предложены впервые идентифицированные лизины и их варианты, а также варианты других лизинов. Как описано в настоящей заявке, полипептидные конструкции лизин-AMP, впервые полученные лизины и варианты лизинов могут быть включены в фармацевтические композиции, которые можно применять, например, для лечения бактериальных инфекций. Также в настоящей заявке, помимо прочего, предложены способы применения полипептидных конструкций лизин-AMP, впервые идентифицированных лизинов и вариантов лизинов для лечения бактериальных инфекций, повышения эффективности антибиотиков и в целом ингибирования роста, уменьшения количества (популяции) или уничтожения грамотрицательных бактерий, таких как P. aeruginosa. Также предложены полипептиды вариантов лизина и полинуклеотиды, кодирующие конструкции и варианты лизина.
[10] Согласно одному аспекту настоящее изобретение относится к полипептидной конструкции лизин-AMP, содержащей: (a) первый компонент, содержащий полипептидную последовательность: (i) лизина, выбранного из группы, состоящей из GN76 (SEQ ID NO: 203), GN4 (SEQ ID NO: 74), GN146 (SEQ ID NO: 78), GN14 (SEQ ID NO: 124), GN37 (SEQ ID NO: 84), необязательно с одиночной мутацией, повышающей pI, GN316 (SEQ ID NO: 22), необязательно с одиночной точечной мутацией, лизина Pap2_gp17 (SEQ ID NO: 96), GN329 (SEQ ID NO: 26), GN424 (SEQ ID NO: 56), GN202 (SEQ ID NO: 118), GN425 (SEQ ID NO: 58), GN428 (SEQ ID NO: 60), GN431 (SEQ ID NO: 64), GN486 (SEQ ID NO: 66), GN333 (SEQ ID NO: 28), GN485 (SEQ ID NO: 68), GN123 (SEQ ID NO: 173) и GN121 (SEQ ID NO: 175); или (ii) полипептида, обладающего активностью лизина и имеющего по меньшей мере 80% идентичность последовательности с полипептидной последовательностью по меньшей мере одной из SEQ ID NO: 203, 74, 78, 124, 84, 22, 96, 26, 56, 118, 58, 60, 64, 66, 28, 68, 173 или 175; или (iii) активного фрагмента лизина; и
(b) второй компонент, содержащий полипептидную последовательность: (i) по меньшей мере одного противомикробного пептида (AMP), выбранного из группы, состоящей из Chp1 (SEQ ID NO: 133), Chp2 (SEQ ID NO: 70), CPAR39 (SEQ ID NO: 135), Chp3 (SEQ ID NO: 137), Chp4 (SEQ ID NO: 102), Chp6 (SEQ ID NO: 106), Chp7 (SEQ ID NO: 139), Chp8 (SEQ ID NO: 141), Chp9 (SEQ ID NO: 143), Chp10 (SEQ ID NO: 145), Chp11 (SEQ ID NO: 147), Chp12 (SEQ ID NO: 149), Gkh1 (SEQ ID NO: 151), Gkh2 (SEQ ID NO: 90), Unp1 (SEQ ID NO: 153), Ecp1 (SEQ ID NO: 155), Ecp2 (SEQ ID NO: 104), Tma1 (SEQ ID NO: 157), Osp1 (SEQ ID NO: 108), Unp2 (SEQ ID NO: 159), Unp3 (SEQ ID NO: 161), Gkh3 (SEQ ID NO: 163), Unp5 (SEQ ID NO: 165), Unp6 (SEQ ID NO: 167), Spi1 (SEQ ID NO: 169), Spi2 (SEQ ID NO: 171), Ecp3 (SEQ ID NO: 177), Ecp4 (SEQ ID NO: 179), ALCES1 (SEQ ID NO: 181), AVQ206 (SEQ ID NO: 183), AVQ244 (SEQ ID NO: 185), CDL907 (SEQ ID NO: 187), AGT915 (SEQ ID NO: 189), HH3930 (SEQ ID NO: 191), Fen7875 (SEQ ID NO: 193), SBR77 (SEQ ID NO: 195), Bdp1 (SEQ ID NO: 197), LVP1 (SEQ ID NO: 199), Lvp2 (SEQ ID NO: 201), фрагмента эскулентина (SEQ ID NO: 80), RI12 (SEQ ID NO: 88), TI15 (SEQ ID NO: 94), RI18 (SEQ ID NO: 92), FIRL (SEQ ID NO: 114), фрагмента ЛПС-связывающего белка (SEQ ID NO: 76), RR12Whydro (SEQ ID NO: 110), производного пептида RI18 (SEQ ID NO: 131) и катионного пептида (SEQ ID NO: 120), или (ii) полипептида, обладающего активностью AMP, причем указанный полипептид по меньшей мере на 80% идентичен по меньшей мере одной из SEQ ID NO: 133, 70, 135, 137, 102, 106, 139, 141, 143, 145, 147, 149, 151, 90, 153, 155, 104, 157, 108, 159, 161, 163, 165, 167, 169, 171, 177, 179, 181, 183, 185, 187, 189, 191, 193, 195, 197, 199, 201, 80, 88, 94, 92, 114, 76, 110, 131 и 120, при этом указанная полипептидная конструкция лизин-AMP обладает по меньшей мере одним видом активности, выбранным из ингибирования роста бактерий P. aeruginosa, уменьшения количества бактерий P. aeruginosa и/или уничтожения P. aeruginosa в отсутствие и/или в присутствии сыворотки человека.
[11] Согласно другому аспекту настоящее изобретение относится к выделенному полипептиду, содержащему лизин, выбранный из группы, состоящей из лизина GN217 (SEQ ID NO: 8), лизина GN394 (SEQ ID NO: 48), лизина GN396 (SEQ ID NO: 50), лизина GN408 (SEQ ID NO: 52), лизина GN418 (SEQ ID NO: 54) и GN486 (SEQ ID NO: 66) или активного фрагмента указанного лизина, причем указанный лизин или его активный фрагмент ингибирует рост бактерий P. aeruginosa, уменьшает количество бактерий P. aeruginosa и/или приводит к уничтожению P. aeruginosa в отсутствие и/или в присутствии сыворотки человека.
[12] Настоящее изобретение также относится к выделенному полинуклеотиду, содержащему молекулу нуклеиновой кислоты, кодирующую полипептидную конструкцию лизин-противомикробный пептид (AMP), причем указанная молекула нуклеиновой кислоты содержит:
(a) первую молекулу нуклеиновой кислоты, кодирующую первый компонент, содержащий: (i) лизин, выбранный из группы, состоящей из GN76 (SEQ ID NO: 203), GN4 (SEQ ID NO: 74), GN146 (SEQ ID NO: 78), GN14 (SEQ ID NO: 124), GN37 (SEQ ID NO: 84), необязательно с одиночной мутацией, повышающей pI, GN316 (SEQ ID NO: 22), необязательно с одиночной точечной мутацией, лизина Pap2_gp17 (SEQ ID NO: 96), GN329 (SEQ ID NO: 26), GN424 (SEQ ID NO: 56), GN202 (SEQ ID NO: 118), GN425 (SEQ ID NO: 58), GN428 (SEQ ID NO: 60), GN431 (SEQ ID NO: 64), GN486 (SEQ ID NO: 66), GN333 (SEQ ID NO: 28), GN485 (SEQ ID NO: 68), GN123 (SEQ ID NO: 173) и GN121 (SEQ ID NO: 175); или (ii) полипептид, обладающий активностью лизина, причем указанный полипептид по меньшей мере на 80% идентичен по меньшей мере одной из SEQ ID NO: 203, 74, 78, 124, 84, 22, 96, 26, 56, 118, 58, 60, 64, 66, 28, 68, 173 или 175; или (iii) активный фрагмент лизина; и
(b) вторую молекулу нуклеиновой кислоты, кодирующую второй компонент, содержащий: (i) по меньшей мере один противомикробный пептид (AMP), выбранный из группы, состоящей из Chp1 (SEQ ID NO: 133), Chp2 (SEQ ID NO: 70), CPAR39 (SEQ ID NO: 135), Chp3 (SEQ ID NO: 137), Chp4 (SEQ ID NO: 102), Chp6 (SEQ ID NO: 106), Chp7 (SEQ ID NO: 139), Chp8 (SEQ ID NO: 141), Chp9 (SEQ ID NO: 143), Chp10 (SEQ ID NO: 145), Chp11 (SEQ ID NO: 147), Chp12 (SEQ ID NO: 149), Gkh1 (SEQ ID NO: 151), Gkh2 (SEQ ID NO: 90), Unp1 (SEQ ID NO: 153), Ecp1 (SEQ ID NO: 155), Ecp2 (SEQ ID NO: 104), Tma1 (SEQ ID NO: 157), Osp1 (SEQ ID NO: 108), Unp2 (SEQ ID NO: 159), Unp3 (SEQ ID NO: 161), Gkh3 (SEQ ID NO: 163), Unp5 (SEQ ID NO: 165), Unp6 (SEQ ID NO: 167), Spi1 (SEQ ID NO: 169), Spi2 (SEQ ID NO: 171), Ecp3 (SEQ ID NO: 177), Ecp4 (SEQ ID NO: 179), ALCES1 (SEQ ID NO: 181), AVQ206 (SEQ ID NO: 183), AVQ244 (SEQ ID NO: 185), CDL907 (SEQ ID NO: 187), AGT915 (SEQ ID NO: 189), HH3930 (SEQ ID NO: 191), Fen7875 (SEQ ID NO: 193), SBR77 (SEQ ID NO: 195), Bdp1 (SEQ ID NO: 197), LVP1 (SEQ ID NO: 199), Lvp2 (SEQ ID NO: 201), фрагмента эскулентина (SEQ ID NO: 80), RI12 (SEQ ID NO: 88), TI15 (SEQ ID NO: 94), RI18 (SEQ ID NO: 92), FIRL (SEQ ID NO: 114), фрагмента ЛПС-связывающего белка (SEQ ID NO: 76), RR12Whydro (SEQ ID NO: 110), производного пептида RI18 (SEQ ID NO: 131) и катионного пептида (SEQ ID NO: 120), или (ii) полипептид, обладающий активностью AMP, причем указанный полипептид по меньшей мере на 80% идентичен по меньшей мере одной из SEQ ID NO: 133, 70, 135, 137, 102, 106, 139, 141, 143, 145, 147, 149, 151, 90, 153, 155, 104, 157, 108, 159, 161, 163, 165, 167, 169, 171, 177, 179, 181, 183, 185, 187, 189, 191, 193, 195, 197, 199, 201, 80, 88, 94, 92, 114, 76, 110, 131 и 120, при этом указанная полипептидная конструкция лизин-AMP обладает по меньшей мере одним видом активности, выбранным из ингибирования роста бактерий P. aeruginosa, уменьшения количества бактерий P. aeruginosa и/или уничтожения P. aeruginosa в отсутствие и/или в присутствии сыворотки человека.
[13] Согласно еще одному аспекту настоящее изобретение относится к выделенной полинуклеотидной последовательности, содержащей молекулу нуклеиновой кислоты, кодирующую лизин, выбранный из группы, состоящей из лизина GN217 (SEQ ID NO: 8), лизина GN394 (SEQ ID NO: 48), лизина GN396 (SEQ ID NO: 50), лизина GN408 (SEQ ID NO: 52), лизина GN418 (SEQ ID NO: 54) и GN486 (SEQ ID NO: 66) или активного фрагмента указанного лизина, причем указанный лизин или его активный фрагмент ингибирует рост бактерий P. aeruginosa, уменьшает количество бактерий P. aeruginosa и/или приводит к уничтожению P. aeruginosa в отсутствие и/или в присутствии сыворотки человека.
[14] Согласно одному аспекту настоящее изобретение относится к фармацевтической композиции, содержащей выделенный лизин и/или полипептидную конструкцию лизин-противомикробный пептид (AMP) и фармацевтически приемлемый носитель,
причем указанный выделенный лизин содержит по меньшей мере один из: (i) GN121 (SEQ ID NO: 175), GN123 (SEQ ID NO: 173), GN217 (SEQ ID NO: 8), варианта GN316 (SEQ ID NO: 24), GN316 (SEQ ID NO: 22), GN329 (SEQ ID NO: 26), GN333 (SEQ ID NO: 28), GN394 (SEQ ID NO: 48), GN396 (SEQ ID NO: 50), GN408 (SEQ ID NO: 52), GN418 (SEQ ID NO: 54), GN424 (SEQ ID NO: 56), GN425 (SEQ ID NO: 58), GN428 (SEQ ID NO: 60), GN431 (SEQ ID NO: 64), GN486 (SEQ ID NO: 66), GN485 (SEQ ID NO: 68), лизина PaP2_gp17 (SEQ ID NO: 96), (ii) активного фрагмента указанного лизина, или (iii) полипептида, обладающего активностью лизина и по меньшей мере 80% идентичностью последовательности с полипептидной последовательностью по меньшей мере одной из SEQ ID NO: 175, 173, 8, 24, 22, 26, 28, 48, 50, 52, 54, 56, 58, 60, 64, 66, 68 или 96;
причем указанная полипептидная конструкция лизин-AMP содержит: (а) первый компонент, содержащий полипептидную последовательность: (i) лизина, выбранного из группы, состоящей из GN76 (SEQ ID NO: 203), GN4 (SEQ ID NO: 74), GN146 (SEQ ID NO: 78), GN14 (SEQ ID NO: 124), GN37 (SEQ ID NO: 84), необязательно с одиночной мутацией, повышающей pI, GN316 (SEQ ID NO: 22), необязательно с одиночной точечной мутацией, лизина Pap2_gp17 (SEQ ID NO: 96), GN329 (SEQ ID NO: 26), GN424 (SEQ ID NO: 56), GN202 (SEQ ID NO: 118), GN425 (SEQ ID NO: 58), GN428 (SEQ ID NO: 60), GN431 (SEQ ID NO: 64), GN486 (SEQ ID NO: 66), GN333 (SEQ ID NO: 28), GN485 (SEQ ID NO: 68), GN123 (SEQ ID NO: 173) и GN121 (SEQ ID NO: 175); или (ii) полипептида, обладающего активностью лизина и имеющего по меньшей мере 80% идентичность последовательности с полипептидной последовательностью по меньшей мере одной из SEQ ID NO: 203, 74, 78, 124, 84, 22, 96, 26, 56, 118, 58, 60, 64, 66, 28, 68, 173 или 175; или (iii) активного фрагмента лизина; и (b) второй компонент, содержащий полипептидную последовательность: (i) по меньшей мере одного противомикробного пептида (AMP), выбранного из группы, состоящей из Chp1 (SEQ ID NO: 133), Chp2 (SEQ ID NO: 70), CPAR39 (SEQ ID NO: 135), Chp3 (SEQ ID NO: 137), Chp4 (SEQ ID NO: 102), Chp6 (SEQ ID NO: 106), Chp7 (SEQ ID NO: 139), Chp8 (SEQ ID NO: 141), Chp9 (SEQ ID NO: 143), Chp10 (SEQ ID NO: 145), Chp11 (SEQ ID NO: 147), Chp12 (SEQ ID NO: 149), Gkh1 (SEQ ID NO: 151), Gkh2 (SEQ ID NO: 90), Unp1 (SEQ ID NO: 153), Ecp1 (SEQ ID NO: 155), Ecp2 (SEQ ID NO: 104), Tma1 (SEQ ID NO: 157), Osp1 (SEQ ID NO: 108), Unp2 (SEQ ID NO: 159), Unp3 (SEQ ID NO: 161), Gkh3 (SEQ ID NO: 163), Unp5 (SEQ ID NO: 165), Unp6 (SEQ ID NO: 167), Spi1 (SEQ ID NO: 169), Spi2 (SEQ ID NO: 171), Ecp3 (SEQ ID NO: 177), Ecp4 (SEQ ID NO: 179), ALCES1 (SEQ ID NO: 181), AVQ206 (SEQ ID NO: 183), AVQ244 (SEQ ID NO: 185), CDL907 (SEQ ID NO: 187), AGT915 (SEQ ID NO: 189), HH3930 (SEQ ID NO: 191), Fen7875 (SEQ ID NO: 193), SBR77 (SEQ ID NO: 195), Bdp1 (SEQ ID NO: 197), LVP1 (SEQ ID NO: 199), Lvp2 (SEQ ID NO: 201), фрагмента эскулентина (SEQ ID NO: 80), RI12 (SEQ ID NO: 88), TI15 (SEQ ID NO: 94), RI18 (SEQ ID NO: 92), FIRL (SEQ ID NO: 114), фрагмента ЛПС-связывающего белка (SEQ ID NO: 76), RR12Whydro (SEQ ID NO: 110), производного пептида RI18 (SEQ ID NO: 131) и катионного пептида (SEQ ID NO: 120), или (ii) полипептида, обладающего активностью AMP, причем указанный полипептид по меньшей мере на 80% идентичен по меньшей мере одной из SEQ ID NO: 133, 70, 135, 137, 102, 106, 139, 141, 143, 145, 147, 149, 151, 90, 153, 155, 104, 157, 108, 159, 161, 163, 165, 167, 169, 171, 177, 179, 181, 183, 185, 187, 189, 191, 193, 195, 197, 199, 201, 80, 88, 94, 92, 114, 76, 110, 131 и 120, при этом указанная фармацевтическая композиция обладает по меньшей мере одним видом активности, выбранным из ингибирования роста бактерий P. aeruginosa, уменьшения количества бактерий P. aeruginosa и/или уничтожения P. aeruginosa в отсутствие и/или в присутствии сыворотки человека.
[15] Согласно другому аспекту настоящее изобретение относится к способу лечения бактериальной инфекции, вызванной грамотрицательными бактериями, причем указанные грамотрицательные бактерии включают P. aeruginosa и необязательно один или более дополнительных видов грамотрицательных бактерий, при этом указанный способ включает: введение субъекту, у которого диагностирована, который подвержен риску или который демонстрирует симптомы бактериальной инфекции, фармацевтической композиции, описанной в настоящей заявке.
[16] Согласно еще одному аспекту настоящее изобретение относится к способу предотвращения или лечения бактериальной инфекции, включающему: совместное введение субъекту, у которого диагностирована, который подвержен риску или который демонстрирует симптомы бактериальной инфекции, комбинации первого эффективного количества фармацевтической композиции, описанной в настоящей заявке, и второго эффективного количества антибиотика, подходящего для лечения инфекции, вызванной грамотрицательными бактериями.
[17] Согласно одному аспекту настоящее изобретение относится к способу повышения эффективности антибиотика, подходящего для лечения инфекции, вызванной грамотрицательными бактериями, включающему: совместное введение антибиотика в комбинации с композицией, содержащей эффективное количество выделенного лизина и/или полипептидной конструкции лизин-противомикробный пептид (AMP),
причем указанный выделенный лизин содержит по меньшей мере один из: (i) GN121 (SEQ ID NO: 175), GN123 (SEQ ID NO: 173), GN217 (SEQ ID NO: 8), варианта GN316 (SEQ ID NO: 24), GN316 (SEQ ID NO: 22), GN329 (SEQ ID NO: 26), GN333 (SEQ ID NO: 28), GN394 (SEQ ID NO: 48), GN396 (SEQ ID NO: 50), GN408 (SEQ ID NO: 52), GN418 (SEQ ID NO: 54), GN424 (SEQ ID NO: 56), GN425 (SEQ ID NO:58), GN428 (SEQ ID NO: 60), GN431 (SEQ ID NO: 64), GN486 (SEQ ID NO: 66), GN485 (SEQ ID NO: 68), лизина PaP2_gp17 (SEQ ID NO: 96), или (ii) активного фрагмента указанного лизина, или (iii) полипептида, обладающего активностью лизина и по меньшей мере 80% идентичностью последовательности с полипептидной последовательностью по меньшей мере одной из SEQ ID NO: 175, 173, 8, 24, 22, 26, 28, 48, 50, 52, 54, 56, 58, 60, 64, 66, 68 или 96;
при этом указанная полипептидная конструкция лизин-AMP содержит: (а) первый компонент, содержащий полипептидную последовательность: (i) лизина, выбранного из группы, состоящей из GN76 (SEQ ID NO: 203), GN4 (SEQ ID NO: 74), GN146 (SEQ ID NO: 78), GN14 (SEQ ID NO: 124), GN37 (SEQ ID NO: 84), необязательно с одиночной мутацией, повышающей pI, GN316 (SEQ ID NO: 22), необязательно с одиночной точечной мутацией, лизина Pap2_gp17 (SEQ ID NO: 96), GN329 (SEQ ID NO: 26), GN424 (SEQ ID NO: 56), GN202 (SEQ ID NO: 118), GN425 (SEQ ID NO: 58), GN428 (SEQ ID NO: 60), GN431 (SEQ ID NO: 64), GN486 (SEQ ID NO: 66), GN333 (SEQ ID NO: 28), GN485 (SEQ ID NO: 68), GN123 (SEQ ID NO: 173) и GN121 (SEQ ID NO: 175); или (ii) полипептида, обладающего активностью лизина и имеющего по меньшей мере 80% идентичность последовательности с полипептидной последовательностью по меньшей мере одной из SEQ ID NO: 203, 74, 78, 124, 84, 22, 26, 56, 118, 58, 60, 64, 66, 28, 68, 173 или 175; или (iii) активного фрагмента лизина; и (b) второй компонент, содержащий полипептидную последовательность: (i) по меньшей мере одного противомикробного пептида (AMP), выбранного из группы, состоящей из Chp1 (SEQ ID NO: 133), Chp2 (SEQ ID NO: 70), CPAR39 (SEQ ID NO: 135), Chp3 (SEQ ID NO: 137), Chp4 (SEQ ID NO: 102), Chp6 (SEQ ID NO: 106), Chp7 (SEQ ID NO: 139), Chp8 (SEQ ID NO: 141), Chp9 (SEQ ID NO: 143), Chp10 (SEQ ID NO: 145), Chp11 (SEQ ID NO: 147), Chp12 (SEQ ID NO: 149), Gkh1 (SEQ ID NO: 151), Gkh2 (SEQ ID NO: 90), Unp1 (SEQ ID NO: 153), Ecp1 (SEQ ID NO: 155), Ecp2 (SEQ ID NO: 104), Tma1 (SEQ ID NO: 157), Osp1 (SEQ ID NO: 108), Unp2 (SEQ ID NO: 159), Unp3 (SEQ ID NO: 161), Gkh3 (SEQ ID NO: 163), Unp5 (SEQ ID NO: 165), Unp6 (SEQ ID NO: 167), Spi1 (SEQ ID NO: 169), Spi2 (SEQ ID NO: 171), Ecp3 (SEQ ID NO: 177), Ecp4 (SEQ ID NO: 179), ALCES1 (SEQ ID NO: 181), AVQ206 (SEQ ID NO: 183), AVQ244 (SEQ ID NO: 185), CDL907 (SEQ ID NO: 187), AGT915 (SEQ ID NO: 189), HH3930 (SEQ ID NO: 191), Fen7875 (SEQ ID NO: 193), SBR77 (SEQ ID NO: 195), Bdp1 (SEQ ID NO: 197), LVP1 (SEQ ID NO: 199), Lvp2 (SEQ ID NO: 201), фрагмента эскулентина (SEQ ID NO: 80), RI12 (SEQ ID NO: 88), TI15 (SEQ ID NO: 94), RI18 (SEQ ID NO: 92), FIRL (SEQ ID NO: 114), фрагмента ЛПС-связывающего белка (SEQ ID NO: 76), RR12Whydro (SEQ ID NO: 110), производного пептида RI18 (SEQ ID NO: 131) и катионного пептида (SEQ ID NO: 120), или (ii) полипептида, обладающего активностью AMP, причем указанный полипептид по меньшей мере на 80% идентичен по меньшей мере одной из SEQ ID NO: 133, 70, 135, 137, 102, 106, 139, 141, 143, 145, 147, 149, 151, 90, 153, 155, 104, 157, 108, 159, 161, 163, 165, 167, 169, 171, 177, 179, 181, 183, 185, 187, 189, 191, 193, 195, 197, 199, 201, 80, 88, 94, 92, 114, 76, 110, 131 и 120, при этом указанная композиция обладает по меньшей мере одним видом активности, выбранным из ингибирования роста бактерий P. aeruginosa, уменьшения количества бактерий P. aeruginosa и/или уничтожения P. aeruginosa в отсутствие и/или в присутствии сыворотки человека, и при этом введение комбинации более эффективно ингибирует рост или уменьшает количество, или приводит к уничтожению грамотрицательных бактерий в присутствии или в отсутствие, или как в присутствии, так и в отсутствие сыворотки человека, чем введение либо антибиотика, либо лизина, либо полипептидной конструкции лизин-AMP по отдельности.
[18] Согласно другому аспекту настоящее изобретение относится к способу ингибирования роста или уменьшения количества, или уничтожения по меньшей мере одного вида грамотрицательных бактерий, причем указанный по меньшей мере один вид грамотрицательных бактерий представляет собой P. aeruginosa и необязательно один или более дополнительных видов грамотрицательных бактерий, при этом указанный способ включает: приведение бактерий в контакт с композицией, содержащей эффективное количество выделенного лизина и/или полипептидной конструкции лизин-противомикробный пептид (AMP),
при этом указанный выделенный лизин содержит по меньшей мере один из: (i) GN121 (SEQ ID NO: 175), GN123 (SEQ ID NO: 173), GN217 (SEQ ID NO: 8), варианта GN316 (SEQ ID NO: 24), GN316 (SEQ ID NO: 22), GN329 (SEQ ID NO: 26), GN333 (SEQ ID NO: 28), GN394 (SEQ ID NO: 48), GN396 (SEQ ID NO: 50), GN408 (SEQ ID NO: 52), GN418 (SEQ ID NO: 54), GN424 (SEQ ID NO: 56), GN425 (SEQ ID NO:58), GN428 (SEQ ID NO: 60), GN431 (SEQ ID NO: 64), GN486 (SEQ ID NO: 66), GN485 (SEQ ID NO: 68), лизина PaP2_gp17 (SEQ ID NO: 96), или (ii) активного фрагмента указанного лизина, или (iii) полипептида, обладающего активностью лизина и по меньшей мере 80% идентичностью последовательности с полипептидной последовательностью по меньшей мере одной из SEQ ID NO: 175, 173, 8, 24, 22, 26, 28, 48, 50, 52, 54, 56, 58, 60, 64, 66, 68 или 96;
при этом указанная полипептидная конструкция лизин-AMP содержит: (a) первый компонент, содержащий полипептидную последовательность: (i) лизина, выбранного из группы, состоящей из GN76 (SEQ ID NO: 203), GN4 (SEQ ID NO: 74), GN146 (SEQ ID NO: 78), GN14 (SEQ ID NO: 124), GN37 (SEQ ID NO: 84), необязательно с одиночной мутацией, повышающей pI, GN316 (SEQ ID NO: 22), необязательно с одиночной точечной мутацией, лизина Pap2_gp17 (SEQ ID NO: 96), GN329 (SEQ ID NO: 26), GN424 (SEQ ID NO: 56), GN202 (SEQ ID NO: 118), GN425 (SEQ ID NO: 58), GN428 (SEQ ID NO: 60), GN431 (SEQ ID NO: 64), GN486 (SEQ ID NO: 66), GN333 (SEQ ID NO: 28), GN485 (SEQ ID NO: 68), GN123 (SEQ ID NO: 173) и GN121 (SEQ ID NO: 175); или (ii) полипептида, обладающего активностью лизина и имеющего по меньшей мере 80% идентичность последовательности с полипептидной последовательностью по меньшей мере одной из SEQ ID NO: 203, 74, 78, 124, 84, 22, 96, 26, 56, 118, 58, 60, 64, 66, 28, 68, 173 или 175; или (iii) активного фрагмента лизина; и (b) второй компонент, содержащий полипептидную последовательность: (i) по меньшей мере одного противомикробного пептида (AMP), выбранного из группы, состоящей из Chp1 (SEQ ID NO: 133), Chp2 (SEQ ID NO: 70), CPAR39 (SEQ ID NO: 135), Chp3 (SEQ ID NO: 137), Chp4 (SEQ ID NO: 102), Chp6 (SEQ ID NO: 106), Chp7 (SEQ ID NO: 139), Chp8 (SEQ ID NO: 141), Chp9 (SEQ ID NO: 143), Chp10 (SEQ ID NO: 145), Chp11 (SEQ ID NO: 147), Chp12 (SEQ ID NO: 149), Gkh1 (SEQ ID NO: 151), Gkh2 (SEQ ID NO: 90), Unp1 (SEQ ID NO: 153), Ecp1 (SEQ ID NO: 155), Ecp2 (SEQ ID NO: 104), Tma1 (SEQ ID NO: 157), Osp1 (SEQ ID NO: 108), Unp2 (SEQ ID NO: 159), Unp3 (SEQ ID NO: 161), Gkh3 (SEQ ID NO: 163), Unp5 (SEQ ID NO: 165), Unp6 (SEQ ID NO: 167), Spi1 (SEQ ID NO: 169), Spi2 (SEQ ID NO: 171), Ecp3 (SEQ ID NO: 177), Ecp4 (SEQ ID NO: 179), ALCES1 (SEQ ID NO: 181), AVQ206 (SEQ ID NO: 183), AVQ244 (SEQ ID NO: 185), CDL907 (SEQ ID NO: 187), AGT915 (SEQ ID NO: 189), HH3930 (SEQ ID NO: 191), Fen7875 (SEQ ID NO: 193), SBR77 (SEQ ID NO: 195), Bdp1 (SEQ ID NO: 197), LVP1 (SEQ ID NO: 199), Lvp2 (SEQ ID NO: 201), фрагмента эскулентина (SEQ ID NO: 80), RI12 (SEQ ID NO: 88), TI15 (SEQ ID NO: 94), RI18 (SEQ ID NO: 92), FIRL (SEQ ID NO: 114), фрагмента ЛПС-связывающего белка (SEQ ID NO: 76), RR12Whydro (SEQ ID NO: 110), производного пептида RI18 (SEQ ID NO: 131) и катионного пептида (SEQ ID NO: 120), или (ii) полипептида, обладающего активностью AMP, причем указанный полипептид по меньшей мере на 80% идентичен по меньшей мере одной из SEQ ID NO: 133, 70, 135, 137, 102, 106, 139, 141, 143, 145, 147, 149, 151, 90, 153, 155, 104, 157, 108, 159, 161, 163, 165, 167, 169, 171, 177, 179, 181, 183, 185, 187, 189, 191, 193, 195, 197, 199, 201, 80, 88, 94, 92, 114, 76, 110, 131 и 120, и при этом указанная композиция обладает по меньшей мере одним видом активности, выбранным из ингибирования роста бактерий P. aeruginosa, уменьшения количества бактерий P. aeruginosa и/или уничтожения P. aeruginosa в отсутствие и/или в присутствии сыворотки человека.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
[19] На ФИГ. 1 изображены трехмерные модели, предсказанные с помощью I-Tasser для структур представителей семейства пептидов фага Chlamydia (Chp) Chp1, Chp2, Chp4, Chp5, Chp6, Chp7, Ecp1, Ecp2 и Osp1. Эффекторный пептид врожденной иммунной системы человека LL-37 включен для сравнения. Можно наблюдать альфа-спиральные структуры, а верхний конец обычно представляет собой N-конец.
ПОДРОБНОЕ ОПИСАНИЕ
Определения
[20] В настоящей заявке следующие термины и родственные им слова должны иметь значения, представленные ниже, если контекст явно не указывает иное:
[21] «Носитель» относится к растворителю, добавке, вспомогательному веществу, дисперсионной среде, солюбилизирующему агенту, покрытию, консерванту, изотоническому агенту и замедляющему всасывание агенту, поверхностно-активному веществу, пропелленту, разбавителю, носителю и т. п., с которыми вводят активное соединение. Такие носители могут представлять собой стерильные жидкости, такие как вода, физиологические солевые растворы, водные растворы декстрозы, водные растворы глицерина, а также масла, включая масла нефтяного, животного, растительного или синтетического происхождения, такие как арахисовое масло, соевое масло, минеральное масло, кунжутное масло и тому подобное.
[22] «Фармацевтически приемлемый носитель» относится к любым и всем растворителям, добавкам, вспомогательным веществам, дисперсионным средам, солюбилизирующим агентам, покрытиям, консервантам, изотоническим агентам и замедляющим всасывание агентам, поверхностно-активным веществам, пропеллентам, разбавителям, носителям и т. п., которые являются физиологически совместимыми. Носитель (и) должен (должны) быть «приемлемым (ми)» в смысле их безвредности для субъекта, подлежащего лечению, в количествах, как правило, применяемых в лекарственных средствах. Фармацевтически приемлемые носители совместимы с другими ингредиентами композиции и не делают композицию неподходящей для предполагаемой цели ее применения. Кроме того, фармацевтически приемлемые носители являются подходящими для применения у субъектов, как предусмотрено в настоящей заявке, без неоправданных нежелательных побочных эффектов (таких как токсичность, раздражение и аллергическая реакция). Побочные эффекты являются «неоправданными», когда их риск превышает пользу, обеспечиваемую композицией. Неограничивающие примеры фармацевтически приемлемых носителей или вспомогательных веществ включают любые из стандартных фармацевтических носителей, таких как фосфатно-солевые буферные растворы, вода и эмульсии, такие как эмульсии масло/вода и микроэмульсии. Подходящие фармацевтические носители описаны, например, в Remington's Pharmaceutical Sciences под ред. E.W. Martin, 18 изд. Фармацевтически приемлемый носитель может представлять собой носитель, не существующий в природе.
[23] «Бактерицидный» или «бактерицидная активность» относится к способности вызывать гибель бактерий или способности уничтожать бактерии в степени, которая соответствует уменьшению по меньшей мере на 3-log10 (99,9%) или более исходного количества бактерий в течение 18-24-часового периода.
[24] «Бактериостатический» или «бактериостатическая активность» относится к способности ингибировать рост бактерий, включая ингибирование роста бактериальных клеток, вызывая таким образом уменьшение на 2-log (99%) или более и до немного менее 3-log исходного количества бактерий в течение 18-24-часового периода.
[25] «Антибактериальный» относится как к бактериостатическим, так и к бактерицидным агентам.
[26] «Антибиотик» относится к соединению, обладающему свойствами, которые оказывают отрицательное влияние на бактерии, например, летальность или уменьшение роста. Антибиотик может оказывать отрицательное влияние на грамположительные бактерии, грамотрицательные бактерии или на то и другое. Например, антибиотик может отрицательно влиять на биосинтез пептидогликана клеточной стенки, целостность клеточной мембраны или синтез ДНК или белка у бактерий. Неограничивающие примеры антибиотиков, активных против грамотрицательных бактерий, включают цефалоспорины, такие как цефтриаксон-цефотаксим, цефтазидим, цефепим, цефоперазон и цефтобипрол; фторхинолоны, такие как ципрофлоксацин и левофлоксацин; аминогликозиды, такие как гентамицин, тобрамицин и амикацин; пиперациллин, тикарциллин, имипенем, меропенем, дорипенем, пенициллины широкого спектра действия с ингибиторами бета-лактамазы или без них, рифампицин, полимиксин B и колистин.
[27] «Устойчивый к лекарственным средствам» обычно относится к бактерии, которая устойчива к антибактериальной активности лекарственного средства. При более конкретном использовании устойчивость к лекарственным средствам конкретно относится к устойчивости к антибиотикам. В некоторых случаях бактерия, которая обычно восприимчива к конкретному антибиотику, может выработать устойчивость к антибиотику, в результате чего она становится микроорганизмом или штаммом, устойчивым к лекарственным средствам. Патоген с «множественной лекарственной устойчивостью» («MDR») представляет собой патогена, у которого развилась устойчивость по меньшей мере к двум классам противомикробных лекарственных средств, каждое из которых используется в виде монотерапии. Например, было обнаружено, что некоторые штаммы S. aureus устойчивы к нескольким антибиотикам, включая метициллин и/или ванкомицин (Antibiotic Resistant Threats in the United States, 2013, Министерство здравоохранения и социальных служб США, Центры по контролю и предотвращению заболеваний). Специалист в данной области техники может легко определить, является ли бактерия устойчивой к лекарственным средствам, используя обычные лабораторные методики, которые позволяют определить восприимчивость или устойчивость бактерии к лекарственному средству или антибиотику.
[28] «Эффективное количество» относится к количеству, которое, при применении или введении с соответствующей частотой или схемой дозирования, является достаточным для предотвращения, уменьшения, ингибирования или устранения роста бактерий или бактериальной нагрузки или предотвращения, уменьшения или улучшения начала, степени тяжести, продолжительности или прогрессирования нарушения, которое лечат (например, роста грамотрицательного бактериального патогена или инфекции им), предотвращения прогрессирования нарушения, которое лечат, вызова регрессии нарушения, которое лечат, или усиления или улучшения профилактического (их) или терапевтического (их) эффекта (ов) другой терапии, такой как терапия антибиотиками или бактериостатиками.
[29] «Совместное введение» относится к введению двух агентов, таких как лизин или полипептид лизин-AMP и антибиотика или любого другого антибактериального агента, последовательным образом, а также к введению этих агентов по существу одновременно, например, в одной смеси/композиции или в дозах, вводимых по отдельности, но, тем не менее, вводимых субъекту по существу одновременно, например, в разные моменты времени в один и тот же день или в течение 24-часового периода. Такое совместное введение двух агентов, таких как лизин или полипептид лизин-AMP с одним или более дополнительными антибактериальными агентами может быть обеспечено в виде непрерывного лечения, длящегося в течение периода до дней, недель или месяцев. Кроме того, в зависимости от применения, совместное введение не обязательно должно быть непрерывным или одинаковым по продолжительности. Например, если применение в качестве местного антибактериального агента использовали для лечения, например, бактериальной язвы или инфицированной диабетической язвы, лизин или полипептид лизин-AMP может быть введен только вначале в течение 24 часов после применения дополнительного антибиотика, а затем можно продолжать применение дополнительного антибиотика без последующего введения лизина или полипептида лизин-AMP.
[30] «Субъект» относится к млекопитающему, растению, низшему животному, одноклеточному организму или культуре клеток. Например, термин «субъект» предназначен для включения организмов, например, прокариотов и эукариотов, которые восприимчивы к бактериальным инфекциям или поражены ими, например, инфекциям, вызванным грамположительными или грамотрицательными бактериями. Примеры субъектов включают млекопитающих, например, людей, собак, коров, лошадей, свиней, овец, коз, кошек, мышей, кроликов, крыс и трансгенных животных, отличных от человека. Согласно определенным вариантам реализации настоящего изобретения субъект представляет собой человека, например, человека, страдающего, подверженного риску или восприимчивого к инфекции, вызванной грамотрицательными бактериями, вне зависимости от того, является ли такая инфекция системной, местной или локализованной иным образом, или ограниченной конкретным органом или тканью.
[31] В настоящей заявке «полипептид» используется взаимозаменяемо с термином «пептид» или «белок» и относится к полимеру, полученному из остатков аминокислот и обычно имеющему по меньшей мере приблизительно 30 остатков аминокислот. Термин включает не только полипептиды в выделенной форме, но также их активные фрагменты и производные. Термин «полипептид» дополнительно включает гибридные белки или гибридные полипептиды, содержащие лизин или AMP, описанные в настоящей заявке, и сохраняющие, например, литическую функцию. В зависимости от ситуации полипептид может представлять собой природный полипептид или рекомбинантный, сконструированный или полученный синтетическим способом полипептид. Конкретный полипептид лизина, например, может происходить или может быть выделен, например, из нативного белка с помощью ферментативного или химического расщепления или может быть получен с использованием обычных методик синтеза пептидов (например, твердофазного синтеза) или методик молекулярной биологии (таких как те, которые раскрыты в Sambrook, J. et al., Molecular Cloning: A Laboratory Manual, Cold Spring Harbor Press, Cold Spring Harbor, N.Y. (1989)), или может быть рационально усечен или сегментирован с получением активных фрагментов, сохраняя, например, литическую активность против той же или по меньшей мере одной общей бактерии-мишени.
[32] «Гибридный полипептид» относится к продукту экспрессии, полученному в результате гибридизации двух или более сегментов нуклеиновой кислоты с получением гибридного продукта экспрессии, который, как правило, имеет два или более доменов или сегментов, которые, как правило, имеют различные свойства или функциональность. В более конкретном смысле термин «гибридный полипептид» также может относиться к полипептиду или пептиду, содержащему два или более гетерологичных полипептидов или пептидов, ковалентно связанных либо непосредственно, либо за счет аминокислотного или пептидного линкера. Полипептиды, образующие гибридный полипептид, как правило, связаны С-концом с N-концом, несмотря на то, что они также могут быть связаны С-концом с С-концом, N-концом с N-концом или N-концом с С-концом. Термин «гибридный полипептид» может быть использован взаимозаменяемо с термином «гибридный белок». Таким образом, неограничивающее выражение «полипептид, содержащий» определенную структуру включает молекулы большего размера, чем указанная структура, такие как гибридные полипептиды.
[33] «Гетерологичный» относится к нуклеотидным, пептидным или полипептидным последовательностям, которые не являются смежными в природных условиях. Например, применительно к настоящему изобретению термин «гетерологичный» может быть использован для описания комбинации или гибрида двух или более пептидов и/или полипептидов, причем указанный гибридный пептид или полипептид обычно не встречается в природе, например, лизин или его активный фрагмент и противомикробный пептид, включая катионный и/или поликатионный пептид, амфипатический пептид, sushi-пептид (Ding et al. Cell Mol Life Sci., 65(7-8):1202-19 (2008)), пептид дефензина (Ganz, T. Nature Reviews Immunology 3, 710-720 (2003)), гидрофобный пептид, который может обладать повышенной литической активностью.
[34] «Активный фрагмент» относится к части полипептида, которая сохраняет одну или более функций или видов биологической активности выделенного полипептида, из которого был получен фрагмент, например, бактерицидную активность против одной или более грамотрицательных бактерий.
[35] «Амфипатический пептид» относится к пептиду, имеющему как гидрофильные, так и гидрофобные функциональные группы. Согласно определенным вариантам реализации вторичная структура может обеспечивать размещение гидрофобных и гидрофильных остатков аминокислот на противоположных сторонах (например, внутренняя сторона по сравнению с внешней стороной, когда пептид находится в растворителе, таком как вода) амфипатического пептида. Эти пептиды могут принимать, согласно определенным вариантам реализации, спиральную вторичную структуру, такую как альфа-спиральная вторичная структура.
[36] «Катионный пептид» относится к пептиду, имеющему высокий процент положительно заряженных остатков аминокислот. Согласно определенным вариантам реализации катионный пептид имеет значение pKa 8,0 или выше. Термин «катионный пептид», применительно к настоящему изобретению, дополнительно включает поликатионные пептиды, которые представляют собой пептиды, полученные синтетическим способом, состоящие в основном из положительно заряженных остатков аминокислот, таких как остатки лизина (Lys) и/или аргинина (Arg). Остатки аминокислот, которые не являются положительно заряженными, могут представлять собой нейтрально заряженные остатки аминокислот, отрицательно заряженные остатки аминокислот и/или гидрофобные остатки аминокислот.
[37] «Гидрофобная группа» относится к химической группе, такой как боковая цепь аминокислоты, которая имеет низкую аффинность в отношении молекул воды или не обладает такой аффинностью, но более высокую аффинность в отношении молекул масла. Гидрофобные вещества склонны иметь низкую растворимость в воде или водных фазах или не обладают такой растворимостью и, как правило, являются неполярными, но склонны иметь более высокую растворимость в масляных фазах. Примеры гидрофобных аминокислот включают глицин (Gly), аланин (Ala), валин (Val), лейцин (Leu), изолейцин (Ile), пролин (Pro), фенилаланин (Phe), метионин (Met) и триптофан (Trp).
[38] «Повышение» относится к степени активности агента, такой как противомикробная активность, которая выше, чем она была бы в ином случае. «Повышение» включает аддитивные, а также синергические (сверхаддитивные) эффекты.
[39] «Синергический» или «сверхаддитивный» относится к благоприятному эффекту, обусловленному двумя веществами в комбинации, который превышает сумму эффектов двух агентов, действующих независимо. Согласно определенным вариантам реализации синергический или сверхаддитивный эффект достоверно, например, статистически достоверно, превышает сумму эффектов двух агентов, действующих независимо. Один или оба активных ингредиента можно применять на подпороговом уровне, т. е. на уровне, при котором активное вещество, если оно применяется по отдельности, не вызывает эффекта или он является очень незначительным. Эффект может быть измерен с помощью анализов, таких как анализ методом «шахматной доски», описанный в настоящей заявке.
[40] «Лечение» относится к любому способу, действию, применению, терапии или тому подобному, при которых субъекту, такому как человек, оказывают медицинскую помощь с целью излечения нарушения, устранения патогена или улучшения состояния субъекта, непосредственно или косвенно. Лечение также относится к уменьшению заболеваемости, ослаблению симптомов, устранению рецидива, предотвращению рецидива, предотвращению заболеваемости, уменьшению риска заболеваемости, улучшению симптомов, улучшению прогноза или их комбинациям. «Лечение» также может включать уменьшение количества, скорости роста или вирулентности бактерий у субъекта и посредством этого контроль или уменьшение бактериальной инфекции у субъекта или бактериального загрязнения органа, ткани или окружающей среды. Таким образом, «лечение», которое приводит к уменьшению заболеваемости, например, может быть эффективным для ингибирования роста по меньшей мере одной грамотрицательной бактерии в конкретной среде, будь то субъект или окружающая среда. С другой стороны, «лечение» уже развившейся инфекции относится к ингибированию роста, уменьшению количества, уничтожению, включая устранение, грамотрицательных бактерий, вызывающих инфекцию или загрязнение.
[41] «Предотвращение» относится к предотвращению заболеваемости, рецидива, распространения, начала или развития нарушения, такого как бактериальная инфекция. Не предусмотрено, что настоящее изобретение ограничено полным предотвращением или предотвращением развития инфекции. Согласно некоторым вариантам реализации настоящего изобретения начало отсрочено, или степень тяжести впоследствии приобретенного заболевания или вероятность приобретения заболевания уменьшается, что составляет примеры предотвращения.
[42] «Приобретенные заболевания» относятся к заболеваниям, которые проявляются клиническими или субклиническими симптомами, такими как обнаружение лихорадки, сепсиса или бактериемии, а также к заболеваниям, которые могут быть обнаружены на основании роста бактериального патогена (например, в культуре), когда симптомы, ассоциированные с такой патологией, еще не проявляются.
[43] Термин «производное», применительно к пептиду или полипептиду, или их активному фрагменту, предназначен для включения, например, полипептида, модифицированного так, чтобы он содержал одну или более химических групп, отличных от аминокислоты, которые не оказывают существенного нежелательного влияния на активность полипептида или не нарушают ее (например, литическую активность). Химическая группа может быть ковалентно связана с пептидом, например, за счет амино-концевого остатка аминокислоты, карбокси-концевого остатка аминокислоты или у внутреннего остатка аминокислоты. Такие модификации могут быть природными или неприродными. Согласно определенным вариантам реализации неприродная модификация может включать добавление защитной или кэпирующей группы на реакционноспособную группу, добавление обнаруживаемой метки, такой как антитело и/или флуоресцентная метка, добавление или модификацию гликозилирования, или добавление объемной группы, такой как ПЭГ (пегилирование), и другие изменения, известные специалистам в данной области техники. Согласно определенным вариантам реализации неприродная модификация может представлять собой кэпирующую модификацию, такую как N-концевые ацетилирования и C-концевые амидирования. Примерные защитные группы, которые могут быть добавлены к полипептидам лизина или AMP, включают, но не ограничиваются ими, t-Boc и Fmoc. Обычно применяемые белки флуоресцентной метки, такие как, но не ограничиваясь ими, зеленый флуоресцентный белок (GFP), красный флуоресцентный белок (RFP), голубой флуоресцентный белок (CFP), желтый флуоресцентный белок (YFP) и mCherry, являются компактными белками, которые могут быть связаны ковалентно или нековалентно с полипептидом или гибридизованы с полипептидом без нарушения нормальных функций клеточных белков. Согласно определенным вариантам реализации полинуклеотид, кодирующий флуоресцентный белок, может быть вставлен в 5'-направлении или 3'-направлении относительно полинуклеотидной последовательности лизина или AMP. Это позволит получить гибридный белок (например, полипептид лизина::GFP), который не нарушает клеточную функцию или функцию полипептида, к которому он присоединен. Конъюгацию полиэтиленгликоля (ПЭГ) с белками применяют в качестве способа увеличения периода полужизни в кровотоке многих фармацевтических белков. Таким образом, применительно к производным полипептида, таким как производные полипептида лизина, термин «производное» включает полипептиды, такие как полипептиды лизина, химически модифицированные с помощью ковалентного присоединения одной или более молекул ПЭГ. Как ожидается, полипептиды лизина, такие как пегилированные лизины, проявят пролонгированный период полужизни в кровотоке по сравнению с непегилированными полипептидами, сохраняя при этом биологическую и терапевтическую активность.
[44] «Процент идентичности аминокислотной последовательности» относится к проценту остатков аминокислот в последовательности-кандидате, которые идентичны остаткам аминокислот в последовательности референсного полипептида, такой как последовательность полипептида лизина, после выравнивания последовательностей и введения пробелов, при необходимости, чтобы достичь максимального процента идентичности последовательностей и без учета каких-либо консервативных замен как части идентичности последовательностей. Выравнивание в целях определения процента идентичности аминокислотной последовательности можно осуществлять различными способами, которые находятся в пределах квалификации в данной области техники, например, с использованием общедоступного программного обеспечения, такого как BLAST, или коммерчески доступного программного обеспечения, например, от DNASTAR. Две или более полипептидных последовательностей могут быть на 0-100% идентичными в любом месте или на любое целочисленное значение в пределах указанных значений. Применительно к настоящему изобретению два полипептида являются «по существу идентичными», когда по меньшей мере 80% остатков аминокислот (например, по меньшей мере приблизительно 85%, по меньшей мере приблизительно 90%, по меньшей мере приблизительно 92,5%, по меньшей мере приблизительно 95%, по меньшей мере приблизительно 98% или по меньшей мере приблизительно 99%) являются идентичными. Термин «процент (%) идентичности аминокислотной последовательности», описанный в настоящей заявке, также применим к пептидам. Таким образом, термин «по существу идентичный» будет включать мутированные, усеченные, гибридные варианты или варианты с модифицированной иным образом последовательностью выделенных полипептидов лизина и пептидов, а также AMP, описанных в настоящей заявке, и их активные фрагменты, а также полипептиды с существенной идентичностью последовательности (например, по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 92,5%, по меньшей мере 95%, по меньшей мере 98% или по меньшей мере 99% идентичностью, измеренной, например, с помощью одного или более способов, указанных выше), по сравнению с референсным (дикого типа или другим интактным) полипептидом.
[45] В настоящей заявке две аминокислотные последовательности являются «по существу гомологичными», когда по меньшей мере приблизительно 80% остатков аминокислот (например, по меньшей мере приблизительно 85%, по меньшей мере приблизительно 90%, по меньшей мере приблизительно 92,5%, по меньшей мере приблизительно 95%, по меньшей мере приблизительно 98% или по меньшей мере приблизительно 99%) являются идентичными или представляют собой консервативные замены. Последовательности полипептидов согласно настоящему изобретению являются по существу гомологичными, когда одна или более, например, до 10%, до 15% или до 20% аминокислот полипептида, такого как лизин, AMP и/или гибридные полипептиды, описанные в настоящей заявке, заменены сходной или консервативной аминокислотной заменой, и при этом полученные пептиды обладают по меньшей мере одним видом активности (например, антибактериальным эффектом) и/или видами специфичности в отношении бактерий референсного полипептида, такого как лизин, AMP и/или гибридные полипептиды, описанные в настоящей заявке.
[46] В настоящей заявке «консервативная аминокислотная замена» представляет собой замену, при которой остаток аминокислоты заменяют остатком аминокислоты, имеющим боковую цепь с аналогичным зарядом. Семейства остатков аминокислот, имеющих боковые цепи с аналогичными зарядами, были определены в данной области техники. Эти семейства включают аминокислоты с основными боковыми цепями (например, лизин, аргинин, гистидин), кислотными боковыми цепями (например, аспарагиновую кислоту, глутаминовую кислоту), незаряженными полярными боковыми цепями (например, глицин, аспарагин, глутамин, серин, треонин, тирозин, цистеин), неполярными боковыми цепями (например, аланин, валин, лейцин, изолейцин, пролин, фенилаланин, метионин, триптофан), бета-разветвленными боковыми цепями (например, треонин, валин, изолейцин) и ароматическими боковыми цепями (например, тирозин, фенилаланин, триптофан, гистидин).
[47] «Композиция для ингаляции» относится к фармацевтическим композициям согласно настоящему изобретению, которые изготовлены для непосредственной доставки в дыхательные пути во время или в сочетании с обычным или искусственным дыханием (например, с помощью интратрахеобронхиального, легочного и/или назального введения), включая, но не ограничиваясь ими, мелкодисперсные, распыленные, сухие порошковые и/или аэрозольные составы.
[48] «Биопленка» относится к бактериям, которые прикрепляются к поверхностям и агрегируют в гидратированном полимерном матриксе, который может состоять из компонентов, происходящих из бактерий и/или хозяина. Биопленка представляет собой агрегат из микроорганизмов, в котором клетки прилипают друг к другу на биотической или абиотической поверхности. Эти прилипшие клетки часто внедрены в матрикс, состоящий из внеклеточного полимерного вещества (EPS), но не ограничиваясь этим. Биопленка EPS, которую также называют слизью (несмотря на то, что не все, описываемое как слизь, представляет собой биопленку) или бляшкой, представляет собой полимерный конгломерат, обычно состоящий из внеклеточной ДНК, белков и полисахаридов.
[49] «Подходящий», применительно к антибиотику, подходящему для применения против определенных бактерий, относится к антибиотику, который, как было обнаружено, является эффективным против этих бактерий, даже если впоследствии развивается устойчивость.
[50] «Внешняя мембрана» или «ВМ» относится к отличительному признаку грамотрицательных бактерий. Внешняя мембрана состоит из липидного бислоя с внутренним фосфолипидным слоем и внешним амфифильным слоем, состоящим в основном из липополисахарида (ЛПС). ЛПС имеет три основные части: гексаацилированный фосфолипид на основе глюкозамина, называемый липидом A, полисахаридное ядро и удлиненную внешнюю полисахаридную цепь, называемую O-антигеном. ВМ представляет собой нежидкий континуум, стабилизированный тремя основными взаимодействиями, включая: i) авидное связывание молекул ЛПС друг с другом, в частности, если присутствуют катионы для нейтрализации фосфатных групп; ii) плотную упаковку в основном насыщенных ацильных цепей; и iii) гидрофобную укладку («stacking») групп липида А. Полученная структура является барьером как для гидрофобных, так и гидрофильных молекул. ПГ образует тонкий слой под ВМ, который очень чувствителен к гидролитическому расщеплению, в отличие от пептидогликана грамотрицательных бактерий, который имеет толщину 30-100 нанометров (нм) и содержит до 40 слоев, пептидогликан грамотрицательных бактерий имеет толщину всего 2-3 нм и состоит всего из 1-3 слоев.
ПОЛИПЕПТИДЫ
Лизины, варианты лизинов, их активные фрагменты или производные
[51] Настоящее изобретение относится к выделенным полипептидам, содержащим лизины, варианты лизинов, их активные фрагменты или производные. Согласно некоторым вариантам реализации настоящего изобретения выделенные полипептиды, содержащие лизины, варианты лизинов, их активные фрагменты или производные, комбинируют с противомикробными пептидами («AMP») с получением полипептидной конструкции лизин-AMP, причем указанная полипептидная конструкция лизин-AMP обладает активностью лизина. В настоящей заявке термин «активность лизина» включает способность лизина приводить к уничтожению бактерий (например, P. aeruginosa), уменьшать количество бактерий или ингибировать рост бактерий (например, путем проникновения через внешнюю мембрану грамотрицательных бактерий), необязательно в присутствии сыворотки человека. Активность лизина дополнительно включает способность удалять или уменьшать биопленку и/или способность уменьшать минимальную ингибирующую концентрацию (МИК) антибиотика, необязательно в присутствии сыворотки человека.
[52] Согласно некоторым вариантам реализации настоящего изобретения выделенные полипептиды согласно настоящему изобретению, содержащие лизины, варианты лизинов, их активные фрагменты или производные, способны проникать через внешнюю мембрану грамотрицательных бактерий. Не ограничиваясь какой-либо теорией, после проникновения через внешнюю мембрану выделенные полипептиды согласно настоящему изобретению, содержащие лизины, варианты лизинов, их активные фрагменты или их производные, могут разрушать пептидогликан, основной структурный компонент бактериальной клеточной стенки, что приводит, например, к лизису клеток или нелетальному повреждению, которое ингибирует рост бактерий. Согласно некоторым вариантам реализации настоящего изобретения выделенные полипептиды согласно настоящему изобретению, содержащие лизины, варианты лизинов, их активные фрагменты или производные, раскрытые в настоящей заявке, содержат положительно заряженные (и амфипатические) N- и/или C-концевые α-спиральные домены, которые облегчают связывание с анионной внешней мембраной грамотрицательных бактерий для осуществления транслокации в нижележащий пептидогликан.
[53] Способность лизина проникать через внешнюю мембрану грамотрицательных бактерий можно оценить с помощью любого способа, известного в данной области техники, например, описанного в WO 2017/049233, который полностью включен в настоящую заявку посредством ссылки. Например, лизин можно инкубировать с грамотрицательными бактериями и гидрофобным соединением. Большинство грамотрицательных бактерий очень устойчивы к гидрофобным соединениям из-за наличия внешней мембраны и, таким образом, не поглощают гидрофобные агенты, такие как 1-N-фенилнафтиламин (NPN), кристаллический фиолетовый или 8-анилино-1-нафталинсульфоновую кислоту (ANS). NPN, например, сильно флуоресцирует в гидрофобных условиях и слабо в водных условиях. Соответственно, флуоресценцию NPN можно применять как меру проницаемости внешней мембраны.
[54] Более конкретно, способность лизина проникать через внешнюю стенку можно оценить путем инкубации, например, NPN с грамотрицательной бактерией, например, штаммом P. aeruginosa PA01, в присутствии лизина, активность которого тестируют. Более высокая индукция флуоресценции по сравнению с флуоресценцией, испускаемой в отсутствие лизина (отрицательный контроль), указывает на проникновение через внешнюю мембрану. Кроме того, индукцию флуоресценции можно сравнить с индукцией общеизвестных агентов, повышающих проницаемость, таких как ЭДТА (этилендиаминтетраацетат) или антибиотик, такой как антибиотик крайней меры, применяемый в лечении P. aeruginosa, т. е. полимиксин B (PMB), чтобы оценить уровень проницаемости внешней мембраны.
[55] Согласно некоторым вариантам реализации настоящего изобретения выделенные полипептиды согласно настоящему изобретению, содержащие лизины, варианты лизинов, их активные фрагменты или производные, проявляют активность лизина в присутствии и/или в отсутствие сыворотки человека. Подходящие способы оценки активности лизина в сыворотке человека известны в данной области техники и описаны в примерах. В общих чертах, значение МИК (т. е. минимальной концентрации пептида, достаточной для подавления по меньшей мере 80% роста бактерий по сравнению с контролем) может быть определено для лизина и сопоставлено, например, с исходным лизином или соединением, неактивным в сыворотке человека, например, лизоцимом фага Т4 или артилизином GN126. Лизоцим фага Т4 коммерчески доступен, например, от Sigma-Aldrich, Inc. GN126 соответствует Art-175, который описан в литературе и может быть получен путем гибридизации AMP SMAP-29 с GN-лизином KZ144. См. Briers et al. 2014, Antimicrob, Agents Chemother. 58:3774-3784, которая полностью включена в настоящую заявку посредством ссылки.
[56] Более конкретно, значения МИК для лизина могут быть определены против, например, лабораторного штамма P. aeruginosa PA01, например, в бульоне Мюллера-Хинтона, бульоне Мюллера-Хинтона с добавлением сыворотки человека, среде CAA, описанной в настоящей заявке, которая содержит физиологические концентрации солей, и CAA с добавлением сыворотки человека. Применение PA01 позволяет проводить тестирование в присутствии повышенных концентраций сыворотки, поскольку в отличие от большинства клинических изолятов PA01 нечувствителен к антибактериальной активности матриксов крови человека.
[57] Согласно некоторым вариантам реализации настоящего изобретения выделенные полипептиды согласно настоящему изобретению, содержащие лизины, варианты лизинов, их активные фрагменты или производные, способны уменьшать биопленку. Способы оценки минимальной концентрации устранения биопленки (MBEC) лизина или AMP могут быть определены с использованием варианта метода микроразведения в бульоне для оценки МИК с модификациями (см. Ceri et al. 1999. J. Clin Microbial. 37:1771-1776, которая полностью включена в настоящую заявку посредством ссылки, и Schuch et al., 2017, Antimicrob. Agents Chemother. 61, pages 1-18, которая полностью включена в настоящую заявку посредством ссылки). В этом методе свежие колонии, например, штамма P. aeruginosa, такого как ATCC 17647, суспендируют в среде, например, фосфатно-солевом буфере (ФСБ), разведенном, например, 1:100 в TSBg (триптический соевый бульон с добавлением 0,2% глюкозы), добавляют, например, в виде аликвот объемом 0,15 мл к устройству Calgary Biofilm Device (96-луночный планшет с крышкой, несущей 96 поликарбонатных колышков; Innovotech Inc.) и инкубируют в течение, например, 24 часов при 37°C. Затем биопленки промывают и обрабатывают, например, 2-кратными последовательными разведениями лизина в TSBg, например, при 37°C в течение 24 часов. После обработки лунки промывают, высушивают на воздухе, например, при 37°C и окрашивают, например, 0,05% кристаллическим фиолетовым в течение 10 минут. После окрашивания биопленки обесцвечивают, например, в 33% уксусной кислоте и определяют OD600, например, экстрагированного кристаллического фиолетового. MBEC каждого образца представляет собой минимальную концентрацию лизина, необходимую для удаления >95% биомассы биопленки, согласно количественной оценке кристаллического фиолетового.
[58] Согласно некоторым вариантам реализации настоящего изобретения выделенные полипептиды согласно настоящему изобретению, содержащие лизины, варианты лизинов, их активные фрагменты или производные, уменьшают минимальную ингибирующую концентрацию (МИК) антибиотика, необходимую для ингибирования бактерий в присутствии и/или в отсутствие сыворотки человека. Для оценки МИК можно применять любой известный метод. Согласно некоторым вариантам реализации настоящего изобретения для определения эффекта лизина на концентрацию антибиотика применяют анализ методом «шахматной доски». Анализ методом «шахматной доски» основан на модификации метода CLSI для определения МИК с помощью микроразведения в бульоне (см. Институт клинических и лабораторных стандартов (CLSI), CLSI. 2015. Methods for Dilution Antimicrobial Susceptibility Tests for Bacteria That Grow Aerobically; Approved Standard-10 изд. Clinical and Laboratory Standards Institute, Уэйн, Пенсильвания, который полностью включен в настоящую заявку посредством ссылки, и работу Ceri et al. 1999. J. Clin. Microbiol. 37: 1771-1776, которая также полностью включена в настоящую заявку посредством ссылки).
[59] «Шахматные доски» конструируют путем сначала подготовки столбцов, например, 96-луночного полипропиленового планшета для микротитрования, в котором в каждой лунке вдоль горизонтальной оси содержится одинаковое количество антибиотика, разведенного в 2 раза. В отдельном планшете готовят сопоставимые ряды, в которых в каждой лунке вдоль вертикальной оси содержится одинаковое количество лизина, разведенного в 2 раза. Разведения лизина и антибиотика затем объединяют так, что в каждом столбце содержится постоянное количество антибиотика и двойные разведения лизина, в то время как в каждом ряду содержится постоянное количество лизина и двойные разведения антибиотика. Таким образом, каждая лунка содержит уникальную комбинацию лизина и антибиотика. Бактерии добавляют к комбинациям лекарственных средств в концентрациях 1×105 КОЕ/мл в CAA, например, с сывороткой человека или без нее. МИК каждого лекарственного средства, по отдельности или в комбинации, затем регистрируют, например, через 16 часов при 37°C в окружающем воздухе. Суммарные фракционные ингибирующие концентрации (ΣFIC) рассчитывают для каждого лекарственного средства, и минимальное значение ΣFIC (ΣFICmin) применяют для определения эффекта комбинации лизин/антибиотик.
[60] Согласно некоторым вариантам реализации настоящего изобретения лизины и полипептидные конструкции лизин-AMP согласно настоящему изобретению способны оказывать синергическое действие с антибиотиками, такими как имипенем и меропенем, и инициировать повторную сенсибилизацию грамотрицательных бактерий, включая организмы с MDR, такие как устойчивый к карбапенему P. aeruginosa. Такая повторная сенсибилизация может быть определена путем комбинирования лизинов или полипептидных конструкций лизин-AMP согласно настоящему изобретению с антибиотиком в анализе методом «шахматной доски», описанном в настоящей заявке. Устойчивые к антибиотикам бактерии, такие как устойчивый к карбапенему P. aeruginosa, добавляют к комбинации лизина или полипептидной конструкции лизин-AMP. Обычно повторная сенсибилизация происходит в синергических комбинациях, в которых значения МИК антибиотика уменьшаются ниже установленных пограничных значений, например, значение МИК≤2 для чувствительных к антибиотикам бактерий, значение МИК равное 4 для бактерий с промежуточной чувствительностью и значение МИК≥8 для бактерий, устойчивых к антибиотикам, например, изолятов, устойчивых к карбапенему. См. Институт клинических и лабораторных стандартов (CLSI), CLSI. 2019. M100 Performance Standards for Antimicrobial Susceptibility Testing; 29 изд. Clinical and Laboratory Standards Institute, Уэйн, Пенсильвания.
[61] Согласно некоторым вариантам реализации настоящего изобретения выделенные полипептиды согласно настоящему изобретению, содержащие лизины, варианты лизинов, их активные фрагменты или производные, проявляют низкую токсичность в отношении эритроцитов. Любая методология, известная в данной области техники, может быть использована для оценки потенциальной гемолитической активности выделенных полипептидов согласно настоящему изобретению, содержащих лизины, варианты лизинов, их активные фрагменты или производные.
[62] Примеры подходящих лизинов согласно настоящему изобретению, в частности, для применения с полипептидными конструкциями лизин-AMP, описанными в настоящей заявке, включают лизин GN316, полученный из фага Klebsiella 0507-KN2-1 (референсная последовательность NCBI: YP_008531963.1, SEQ ID NO: 22), лизин PaP2_gp17, полученный из фага Pseudomonas (референсная последовательность NCBI: YP_024745.1, SEQ ID NO: 96), GN333, полученный из Delftia sp. (референсная последовательность NCBI: WP_016064791.1, SEQ ID NO: 28), GN424, полученный из Burkholderia pseudomultivorans (референсная последовательность NCBI: WP_060250996.1, SEQ ID NO: 56), лизин GN425, полученный из Pseudomonas flexibilis (референсная последовательность NCBI: WP_039605935.1, SEQ ID NO: 58), GN428, полученный из вируса Escherichia CBA120 (референсная последовательность NCBI: YP_004957781.1, SEQ ID NO: 60), GN431, полученный из фага Dickeya phiD3 (референсная последовательность NCBI: AIM51349.1, SEQ ID NO: 64), GN485, полученный из Erwinia sp. Leaf5 (референсная последовательность NCBI: WP_056233282.1, SEQ ID NO: 68) и GN123, полученный из фага Pseudomonas PhiPA3 (референсная последовательность NCBI: YP_009217242.1, SEQ ID NO: 175).
[63] Описанные выше лизины были идентифицированы с помощью методик биоинформатики. Несмотря на то, что некоторые из идентифицированных последовательностей были аннотированы как предполагаемые белки, связывающие пептидогликан, полипептиды, имеющие эти последовательности, ранее не были определенно соотнесены с какой-либо функцией. Авторы настоящего изобретения неожиданно обнаружили, что идентифицированные последовательности, упомянутые выше, подходят для применения в качестве антибактериальных агентов, в частности, против грамотрицательных бактерий, как описано в примерах.
[64] Дополнительные примеры подходящих лизинов согласно настоящему изобретению, в частности, лизинов для применения с полипептидными конструкциями лизин-AMP согласно настоящему изобретению, включают лизин GN76, полученный из фага Acinetobacter vB_AbaP_CEB1 (референсная последовательность NCBI ALC76575.1, SEQ ID NO: 203 GenBank: ALC76575.1), лизин GN4, полученный из фага Pseudomonas PAJU2 (референсная последовательность NCBI YP 002284361.1, SEQ ID NO: 74), лизин GN14, полученный из фага Pseudomonas Lull (референсная последовательность NCBI YP 006382555.1, SEQ ID NO: 124), и лизин GN37, полученный из Micavibrio aeruginosavorus (референсная последовательность NCBI WP _014102102.1, SEQ ID NO: 84). Каждый из упомянутых выше лизинов также раскрыт в WO 2017/049233, который полностью включен в настоящую заявку посредством ссылки.
[65] Согласно некоторым вариантам реализации настоящего изобретения выделенные полипептиды согласно настоящему изобретению содержат вариант лизина, например, лизин, содержащий одну или более вставок, делеций и/или замен аминокислот по сравнению с референсным полипептидом лизина, например, природным лизином или исходным лизином, который сам представляет собой вариант лизина. Согласно некоторым вариантам реализации настоящего изобретения выделенная полипептидная последовательность, содержащая вариант лизина, его активный фрагмент или производное, имеет по меньшей мере 80%, например, по меньшей мере 85%, например, по меньшей мере 90%, например, по меньшей мере 95%, например, по меньшей мере 98% или, например, по меньшей мере 99% идентичность последовательности с референсным лизином и/или его активным фрагментом, описанным в настоящей заявке.
[66] Варианты лизина согласно настоящему изобретению, как правило, сохраняют один или более видов функциональной или биологической активности референсного лизина. Согласно некоторым вариантам реализации настоящего изобретения модификация улучшает антибактериальную активность лизина. Как правило, вариант лизина обладает улучшенной антибактериальной активностью in vitro (например, в буфере и/или средах) по сравнению с референсным лизином. Согласно другим вариантам реализации настоящего изобретения вариант лизина обладает улучшенной антибактериальной активностью in vivo (например, в модели инфекции на животных). Согласно некоторым вариантам реализации настоящего изобретения модификация улучшает антибактериальную активность лизина в отсутствие и/или в присутствии сыворотки человека.
[67] Подходящие варианты лизинов, в частности, те, которые предназначены для применения в полипептидных конструкциях лизин-AMP согласно настоящему изобретению, включают лизин GN146 (SEQ ID NO: 78), лизин GN156 (SEQ ID NO: 126), лизин GN202 (SEQ ID NO: 118) и лизин GN121 (SEQ ID NO: 175). Каждый из упомянутых выше лизинов также раскрыт в предварительной заявке США №62/597577, которая была подана 12 декабря 2017 г., и в предварительной заявке США №62/721969, которая была подана 23 августа 2018 г. и полностью включена в настоящую заявку посредством ссылки. Лизины, описанные в предварительной заявке США №62/721969, как правило, модифицированы по отношению к их природным аналогам для повышения активности лизина в сыворотке, например, путем введения аминокислотных замен и/или введения фрагментов аминокислот из более крупных противомикробных пептидов. Например, аминокислотную последовательность GPRRPRRPGRRAPV (остатки 1-14 SEQ ID NO: 126), описанную Daniels and Scepartz, 2007, J. Am. Chem. Soc. 129:14578-14579, которая полностью включена в настоящую заявку посредством ссылки, вводят, например, на N-конце GN4 (SEQ ID NO: 74) с получением GN156 (SEQ ID NO: 126), неприродной полипептидной конструкции лизин-AMP.
[68] Согласно некоторым вариантам реализации настоящего изобретения варианты лизинов получают путем модификации референсного лизина для включения модификации, приводящей к изменению общей изоэлектрической точки (pI) лизина, то есть pH, при котором молекула имеет общий нейтральный заряд, например, путем включения одиночной мутации, повышающей pI, такой как одиночная точечная мутация, в референсный лизин. Подходящие референсные полипептиды лизина включают лизин, выбранный из группы, состоящей из GN76 (SEQ ID NO: 203), GN4 (SEQ ID NO: 74), GN146 (SEQ ID NO: 78), GN14 (SEQ ID NO: 124), GN37 (SEQ ID NO: 84) GN316 (SEQ ID NO: 22) лизина Pap2_gp17 (SEQ ID NO: 96), GN329 (SEQ ID NO: 26), GN424 (SEQ ID NO: 56), GN202 (SEQ ID NO: 118), GN425 (SEQ ID NO: 58), GN428 (SEQ ID NO: 60), GN431 (SEQ ID NO: 64), GN486 (SEQ ID NO: 66), GN333 (SEQ ID NO: 28) GN485 (SEQ ID NO: 68) GN123 (SEQ ID NO: 173) и GN121 (SEQ ID NO: 175). Согласно определенным вариантам реализации настоящего изобретения вариант лизина имеет по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 98% или по меньшей мере 99% идентичность последовательности с референсным полипептидом лизина, имеющим аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 203, 74, 78, 124, 84, 22, 96, 26, 56, 118, 58, 60, 64, 66, 28, 68, 173 и 175.
[69] Например, лизин GN37 (SEQ ID NO: 84) может быть модифицирован для повышения pI путем введения аминокислотной замены, R79H, чтобы получить лизин GN217 (SEQ ID NO: 8). В этом варианте реализации активность лизина GN217 (SEQ ID NO: 8) повышена как в присутствии, так и в отсутствие сыворотки человека по сравнению с активностью референсного лизина, GN37 (SEQ ID NO: 84), как описано в примерах.
[70] Другие примеры подходящих мутаций, модифицирующих pI, включают введение аминокислотной замены, такой как K218D, K228D, R85H и/или K22D, в референсный лизин, такой как GN316 (SEQ ID NO: 22), чтобы получить, например, лизин GN394 (SEQ ID NO: 48), лизин GN396 (SEQ ID NO: 50), лизин GN408 (SEQ ID NO: 52) и лизин GN418 (SEQ ID NO: 54), соответственно. Согласно некоторым вариантам реализации настоящего изобретения упомянутые выше мутации, модифицирующие pI, улучшают антибактериальную активность лизина в отсутствие сыворотки человека и/или в ее присутствии, как проиллюстрировано в настоящей заявке.
[71] Согласно некоторым вариантам реализации настоящего изобретения варианты лизина согласно настоящему изобретению, как правило, разработаны для сохранения α-спирального домена, наличие или отсутствие которого можно легко определить с помощью различных компьютерных программ, таких как Jpred4 (compio.dundee.ac.uk/jpred), Helical Wheel (hael.net/helical.htm), HeliQuest (zhanglab.ccmb.med.umich.edu/I-TASSER/) и PEP-FOLD 3 (bioserv.rpbs.univ-paris-diderot.fr/services/PEP-FOLD3).
[72] Согласно некоторым вариантам реализации настоящего изобретения α-спиральный домен расположен на С-конце лизина. Согласно другим вариантам реализации настоящего изобретения α-спиральный домен расположен на N-конце лизина. Более типично α-спиральный домен расположен на С-конце. Размер α-спирального домена лизинов согласно настоящему изобретению варьируется от приблизительно 20 до 40 аминокислот, более типично от приблизительно 15 до 33 остатков аминокислот. Например, α-спиральный домен GN14, который расположен на N-конце, содержит 15 аминокислот (остатки с 66 по 80 в SEQ ID NO: 124). α-спиральный домен GN37, который расположен на С-конце, содержит 14 аминокислот (остатки с 113 по 126 в SEQ ID NO: 84). α-спиральный домен GN4, который также расположен на С-конце, содержит 25 аминокислот (остатки с 116 по 140 SEQ ID NO: 74).
[73] Согласно некоторым вариантам реализации настоящего изобретения варианты лизинов, их активные фрагменты или их производные, раскрытые в настоящей заявке, модифицированы для включения метки для очистки, например, GSHHHHHHG (SEQ ID NO: 100). Метка для очистки может быть вставлена в любом месте лизина, как правило, между первой и второй аминокислотами. Например, метка для очистки может быть вставлена между первым метионином и первым аланином на N-конце лизина GN316 (SEQ ID NO: 22) с получением варианта лизина GN316 (SEQ ID NO: 24) без отрицательного влияния на активность. Согласно другим вариантам реализации настоящего изобретения метка для очистки может быть вставлена между первым метионином и первым глицином на N-конце лизина GN156 (SEQ ID NO: 156) с получением варианта GN486 (SEQ ID NO: 66).
[74] Варианты лизина могут быть получены с помощью любого способа, известного в данной области техники и описанного в WO 2017/049233, который полностью включен в настоящую заявку посредством ссылки, например, путем модификации любого из лизинов, их активных фрагментов и производных, описанных в настоящей заявке, с помощью сайт-направленного мутагенеза или за счет мутаций у хозяев, которые продуцируют лизины согласно настоящему изобретению, которые сохраняют одну или более биологических функций, описанных в настоящей заявке. Варианты лизина согласно настоящему изобретению могут быть усеченными, химерными, перетасованными или «природными» и могут входить в состав комбинации, как описано, например, в патенте США №5604109, который полностью включен в настоящую заявку посредством ссылки.
[75] Например, специалист в данной области техники может надлежащим образом выполнить и протестировать замены или перестановки, например, в α-спиральном домене или областях за пределами α-спирального домена. Сравнение последовательностей с базой данных Genbank может быть выполнено, например, с полной аминокислотной последовательностью, описанной в настоящей заявке, например, для идентификации аминокислот для замены.
[76] Мутации могут быть выполнены в аминокислотных последовательностях или в последовательностях нуклеиновых кислот, кодирующих полипептиды и лизины, активные фрагменты или производные, таким образом, что конкретный кодон изменяют на кодон, который кодирует другую аминокислоту, аминокислоту заменяют другой аминокислотой или удаляют одну или более аминокислот.
[77] Такую мутацию обычно выполняют с помощью изменений наименьшего возможного числа нуклеотидов. Мутация путем замены такого рода может быть выполнена для изменения аминокислоты в полученном белке неконсервативным образом (например, путем изменения кодона аминокислоты, принадлежащей к группе аминокислот, имеющих определенный размер или характеристику, на кодон аминокислоты, принадлежащей к другой группе) или консервативным образом (например, путем изменения кодона аминокислоты, принадлежащей к группе аминокислот, имеющих определенный размер или характеристику, на кодон аминокислоты, принадлежащей к этой же группе). Такое консервативное изменение обычно приводит к менее значительному изменению структуры и функции полученного белка. Неконсервативное изменение с большей вероятностью изменит структуру, активность или функцию полученного белка. Следует учитывать, что настоящее изобретение включает последовательности, содержащие консервативные изменения, которые существенно не изменяют активность или характеристики связывания полученного белка. Таким образом, специалист в данной области техники, основываясь на обзоре последовательности лизинов, предложенных в настоящей заявке, а также на своих знаниях и общедоступной информации, доступной для других полипептидов лизина, может выполнить изменения или замены аминокислот в последовательности полипептида лизина. Аминокислотные замены могут быть выполнены для перестановки или замены одной или более, одной или некоторых, одной или нескольких, от одной до пяти, от одной до десяти или некоторого другого числа аминокислот в последовательности лизина (ов), предложенного (ых) в настоящей заявке, чтобы получить мутантов или их варианты. Функция таких мутантов или их вариантов может быть предсказана или их функция или способность к антибактериальной активности может быть протестирована, как описано в настоящей заявке, например, против P. aeruginosa, и/или они могут быть протестированы на наличие активности, сопоставимой с активностью лизина (ов), описанного (ых) и конкретно предложенного (ых) в настоящей заявке. Таким образом, изменения, внесенные в последовательность лизина, а также мутанты или варианты, описанные в настоящей заявке, могут быть протестированы с использованием анализов и способов, известных в данной области техники и описанных в настоящей заявке. Специалист в данной области техники, на основе доменной структуры лизина (ов) согласно настоящему изобретению, может предсказать одну или более, одну или несколько аминокислот, подходящих для замены или перестановки, и/или одну или более аминокислот, которые не подходят для замены или перестановки, включая целесообразные консервативные или неконсервативные замены.
[78] Согласно некоторым вариантам реализации настоящего изобретения выделенные полипептиды согласно настоящему изобретению содержат активные фрагменты лизинов или производные. Термин «активный фрагмент» относится к части полноразмерного лизина, которая сохраняет один или более видов биологической активности референсного лизина. Таким образом, в настоящей заявке активный фрагмент лизина или вариант лизина ингибирует рост или уменьшает количество, или приводит к уничтожению P. aeruginosa и необязательно по меньшей мере одного вида грамотрицательных бактерий, описанных в настоящей заявке, в отсутствие или в присутствии, или как в отсутствие, так и в присутствии сыворотки человека. Подходящие активные фрагменты лизинов включают, но не ограничиваются ими, те, которые описаны в WO2017/049233, который полностью включен в настоящую заявку посредством ссылки. Активные фрагменты лизина, как правило, сохраняют α-спиральный домен. Примеры активных фрагментов лизина включают фрагменты лизина GN4 (SEQ ID NO: 74), представленные в SEQ ID NO: 127-130.
[79] Согласно некоторым вариантам реализации настоящего изобретения лизин, вариант лизина, его активный фрагмент или производное, включенные в выделенные полипептиды согласно настоящему изобретению, выбраны из группы, состоящей из GN217 (SEQ ID NO: 8), варианта GN316 (SEQ ID NO: 24) GN316 (SEQ ID NO: 22), GN329 (SEQ ID NO: 26), GN333 (SEQ ID NO: 28), GN394 (SEQ ID NO: 48), GN396 (SEQ ID NO: 50), GN408 (SEQ ID NO: 52), (SEQ ID NO: 54), GN424 (SEQ ID NO: 56), GN425 (SEQ ID NO: 58), GN428 (SEQ ID NO: 60), GN431 (SEQ ID NO: 64), GN486 (SEQ ID NO: 66), GN485 (SEQ ID NO: 68), лизина PaP2_gp17 (SEQ ID NO: 96) GN123 (SEQ ID NO: 173) и GN121 (SEQ ID NO: 175) или активного фрагмента указанного лизина, причем указанный лизин или его активный фрагмент ингибирует рост или уменьшает количество, или приводит к уничтожению P. aeruginosa и необязательно по меньшей мере одного другого вида грамотрицательных бактерий, описанных в настоящей заявке, в отсутствие или в присутствии, или как в отсутствие, так и в присутствии сыворотки человека. Согласно некоторым вариантам реализации настоящего изобретения лизин или его активный фрагмент содержит по меньшей мере одну аминокислотную замену, делецию или вставку относительно по меньшей мере одной из SEQ ID NO: 8, 24, 22, 26, 28, 48, 50, 52, 54, 56, 58, 60, 64, 66, 68, 96, 173 или 175. Согласно определенным вариантам реализации настоящего изобретения по меньшей мере одна аминокислотная замена представляет собой консервативную аминокислотную замену.
[80] Согласно некоторым вариантам реализации настоящего изобретения лизин согласно настоящему изобретению выбран из группы, состоящей из GN329 (SEQ ID NO: 26), GN333 (SEQ ID NO: 28), GN424 (SEQ ID NO: 56), GN425 (SEQ ID NO: 58), GN428 (SEQ ID NO: 60), GN431 (SEQ ID NO: 64), GN485 (SEQ ID NO: 68) и лизина PaP2_gp17 (SEQ ID NO: 96) или активного фрагмента указанного лизина, причем указанный лизин или его активный фрагмент ингибирует рост или уменьшает количество, или приводит к уничтожению P. aeruginosa и необязательно по меньшей мере одного другого вида грамотрицательных бактерий, описанных в настоящей заявке, в отсутствие или в присутствии, или как в отсутствие, так и в присутствии сыворотки человека. Согласно некоторым вариантам реализации настоящего изобретения лизин, его производное или активный фрагмент содержит по меньшей мере одну модификацию путем замены, делеции или вставки относительно SEQ ID NO: 26, 28, 56, 58, 60, 64, 68 или 96. Согласно определенным вариантам реализации настоящего изобретения по меньшей мере одна аминокислотная замена представляет собой консервативную аминокислотную замену.
[81] Согласно некоторым вариантам реализации настоящего изобретения выделенная полипептидная последовательность содержит лизин, выбранный из группы, состоящей из лизина GN217 (SEQ ID NO: 8), лизина GN394 (SEQ ID NO: 48), лизина GN396 (SEQ ID NO: 50), лизина GN408 (SEQ ID NO: 52), лизина GN418 (SEQ ID NO: 54) и GN486 (SEQ ID NO: 66) или активного фрагмента указанного лизина, причем указанный лизин или его активный фрагмент ингибирует рост или уменьшает количество, или приводит к уничтожению P. aeruginosa и необязательно по меньшей мере одного другого вида грамотрицательных бактерий, описанных в настоящей заявке, в отсутствие или в присутствии, или как в отсутствие, так и в присутствии сыворотки человека. Согласно некоторым вариантам реализации настоящего изобретения лизин или его активный фрагмент содержит по меньшей мере одну модификацию путем замены, делеции или вставки относительно SEQ ID NO: 8, 48, 50, 52, 54 или 66. Согласно определенным вариантам реализации настоящего изобретения по меньшей мере одна аминокислотная замена представляет собой консервативную аминокислотную замену.
Противомикробные пептиды
[82] Согласно некоторым вариантам реализации настоящего изобретения полипептиды согласно настоящему изобретению содержат полипептидные конструкции лизин-противомикробный пептид (AMP). Полипептидные конструкции лизин-AMP содержат выделенный полипептид, содержащий лизин, вариант лизина, его активный фрагмент или производное, описанные в настоящей заявке, а также противомикробный пептид или его фрагмент. В настоящей заявке термин «противомикробный пептид» (AMP) относится к представителю широкого ряда коротких (обычно от 3 до 50 остатков аминокислот в длину) кодируемых генами пептидов, как правило, антибиотиков, которые могут быть обнаружены практически в каждом организме. Термин включает спиральные пептиды, β-складчатые пептиды и пептиды, которые демонстрируют в значительной степени неупорядоченные случайные спиральные структуры. AMP включают дефензины, кателицидины, sushi-пептиды, катионные пептиды, поликатионные пептиды, амфипатические пептиды, гидрофобные пептиды и/или AMP-подобные пептиды, например, пептиды амурина, описанные в настоящей заявке. В этот термин также включены фрагменты AMP, варианты AMP и производные AMP.
[83] В настоящей заявке термин «активность AMP» включает способность AMP или его фрагмента приводить к уничтожению бактерий, уменьшать количество бактерий или ингибировать рост бактерий, например, путем проникновения через внешнюю мембрану грамотрицательных бактерий в присутствии и/или в отсутствие сыворотки человека. Как правило, транслокация AMP инициируется первичным электростатическим взаимодействием с липополисахаридной частью внешней мембраны с последующим смещением катионов, дезорганизацией мембраны и образованием кратковременных отверстий, а в некоторых случаях интернализацией AMP.
[84] Активность AMP дополнительно включает способность AMP или его фрагмента уменьшать минимальную ингибирующую концентрацию (МИК) антибиотика в присутствии и/или в отсутствие сыворотки человека. Подходящие способы оценки способности AMP и их фрагментов согласно настоящему изобретению проникать через внешнюю мембрану грамотрицательных бактерий, а также способы определения уменьшения МИК антибиотика в присутствии и в отсутствие сыворотки известны в данной области техники и включают способы, описанные выше для лизинов, их производных и активных фрагментов согласно настоящему изобретению.
[85] Согласно некоторым вариантам реализации настоящего изобретения AMP согласно настоящему изобретению представляют собой варианты AMP, имеющие по меньшей мере 80%, например, по меньшей мере 85%, например, по меньшей мере 90%, например, по меньшей мере 95%, например, по меньшей мере 98% или, например, по меньшей мере 99% идентичность последовательности с любым из AMP, описанных в настоящей заявке, причем указанный вариант AMP сохраняет активность AMP.
[86] Согласно некоторым вариантам реализации настоящего изобретения AMP согласно настоящему изобретению содержат спиральный домен, такой как α-спиральный домен. Согласно некоторым вариантам реализации настоящего изобретения α-спиральный домен охватывает большую часть молекулы. См., например, Chp1 и Chp4 на ФИГ. 1. Согласно другим вариантам реализации настоящего изобретения α-спиральный домен либо прерван (например, Chp2), либо усечен (например, Chp6 и Osp1). Размер α-спирального домена AMP согласно настоящему изобретению, таких как Chp, описанных в настоящей заявке, варьируется от приблизительно 3 до 32 аминокислот, более типично от приблизительно 10 до 25 остатков аминокислот. Обычно спиральные домены необходимы для активности и, как правило, должны сохраняться при гибридизации с C- или N-концом лизина.
[87] Как правило, спиральные пептиды демонстрируют амфипатические характеристики и содержат значительную долю (например, 50%) гидрофобных остатков, часто возникающих в виде повторяющихся структур. При образовании α-спиральной структуры гидрофильные остатки, как правило, оказываются на одной стороне спирали, что приводит к зависимой от конформации амфифильности. Часто эти пептиды являются неструктурированными в водной среде, но при контакте с липидными мембранами принимают спиральную конформацию. Пептиды, принадлежащие к этой группе, как правило, демонстрируют общий положительный заряд, варьирующийся от +2 до +11, и обычно приводят к уничтожению микробов, таких как грамотрицательные бактерии, создавая дефекты мембраны, что приводит к потере градиентов электролитов, сигнальных веществ и других факторов.
[88] Согласно некоторым вариантам реализации настоящего изобретения AMP согласно настоящему изобретению представляют собой «AMP-подобные» пептиды, включая литические агенты фага, называемые в настоящей заявке пептидами фага Chlamydia (Chp) или пептидами амурина. Пептиды амурина согласно настоящему изобретению отличаются от амуринов. Как известно в данной области техники, амурины, которые получают из оцДНК или оцРНК фагов (Microviridae и Leviviridae, соответственно), представляют собой интегральные мембранные белки с предполагаемой доменной структурой, включающей внутренний LS-дипептид, непосредственно перед которым расположен участок из 10-17 гидрофобных остатков. Примеры амуринов включают амурин белок E из фага <pX174 (семейство Microviridae, род Microvints), который представляет собой мембранный белок из 91 аминокислоты, который вызывает лизис путем ингибирования бактериальной транслоказы Mra Y, важного встроенного в мембрану фермента, который катализирует образование предшественника муреина, липида I; капсидный белок А2 фага Q~ (семейство Leviviridae, род Allolevivirus), который представляет собой структурный белок из 420 аминокислот, который вызывает лизис путем нарушения активности MurA и нарушения регуляции процесса биосинтеза пептидогликана; амурин белок L фага MS2 (семейство Levivirdae, род Levivirus), который представляет собой интегральный мембранный белок из 75 аминокислот, который вызывает лизис с использованием механизма, который нуждается в активности шаперона DnaJ хозяина. Как правило, амурины не могут быть очищены и не подходят для применения в качестве антибактериальных терапевтических средств.
[89] В отличие от амуринов пептиды амурина согласно настоящему изобретению представляют собой небольшие катионные пептиды с предсказанными α-спиральными структурами, подобными таковым AMP, полученные из систем врожденного иммунитета различных позвоночных (но с аминокислотными последовательностями, отличными от AMP). Пептиды амурина в основном обнаруживаются у микровирусов Chlamydia и, в меньшей степени, у других родственных представителей подсемейства Gokushovirinae. Пептиды амурина из различных фагов Microviridae проявляют 30-100% идентичность друг с другом и не имеют гомологии с другими пептидами. В отличие от амуринов Microviridae, которые имеют цитоплазматические мишени в аппарате биосинтеза клеточной стенки, и, соответственно, они могут не быть легкодоступны для внесенных извне белков, пептиды амурина согласно настоящему изобретению можно применять в очищенной форме для осуществления бактерицидной активности «извне».
[90] Пептиды амурина, подходящие для применения в полипептидных конструкциях лизин-AMP согласно настоящему изобретению, включают пептиды, описанные в предварительной заявке США № 62/650235, которая была подана 29 марта 2018 г. и которая полностью включена в настоящую заявку посредством ссылки. Согласно некоторым вариантам реализации настоящего изобретения можно применять пептиды амурина, такие как литические агенты, происходящие из фага хламидий (Chp). Такие литические агенты, происходящие из Chp, включают Chp1 (референсная последовательность NCBI: NP_044319.1, SEQ ID NO: 133), Chp2 (референсная последовательность NCBI: NP_0546521.1, SEQ ID NO: 70), CPAR39 (референсная последовательность NCBI: NP_063898.1, SEQ ID NO: 135), Chp3 (референсная последовательность NCBI: YP_022484.1, SEQ ID NO: 137), Chp4 (референсная последовательность NCBI: YP_338243.1, SEQ ID NO: 102), Chp6 (референсная последовательность NCBI: NP_510878.1, SEQ ID NO: 106), Chp7 (референсная последовательность NCBI: CRH73061.1, SEQ ID NO: 139), Chp8 (референсная последовательность NCBI: CRH64983.1, SEQ ID NO: 141), Chp9 (референсная последовательность NCBI: CRH84960.1, SEQ ID NO: 143), Chp10 (референсная последовательность NCBI: CRH73061.1, SEQ ID NO: 145), Chp11 (референсная последовательность NCBI: CRH59954.1, SEQ ID NO: 147) и Chp12 (референсная последовательность NCBI: CRH59965.1, SEQ ID NO: 149).
[91] Дополнительные подходящие представители семейства Chp включают Gkh1 (референсная последовательность NCBI: YP_008798245.1, SEQ ID NO: 151), Gkh2 (референсная последовательность NCBI: YP_009160382.1, SEQ ID NO: 90), Unp1 (референсная последовательность NCBI: CDL66944.1, SEQ ID NO: 153), Ecp1 (референсная последовательность NCBI: WP_100756432.1, SEQ ID NO: 155), Ecp2 (референсная последовательность NCBI: OAC1404.1, SEQ ID NO: 104), Tma1 (референсная последовательность NCBI: SHG47122.1, SEQ ID NO: 157), Osp1 (референсная последовательность NCBI: SFP13761.1, SEQ ID NO: 108), Unp2 (референсная последовательность NCBI: CDL65918.1, SEQ ID NO: 159), Unp3 (референсная последовательность NCBI: CDL65808.1, SEQ ID NO: 161), Gkh3 (референсная последовательность NCBI: AGT39941.1, SEQ ID NO: 163), Unp5 (референсная последовательность NCBI: AGT39924.1, SEQ ID NO: 165), Unp6 (референсная последовательность NCBI: AGT39915.1, SEQ ID NO: 167), Spi1 (референсная последовательность NCBI: NP_598337.1, SEQ ID NO: 169) и Spi2 (референсная последовательность NCBI: NP_598336.1, SEQ ID NO: 171), Ecp3 (референсная последовательность NCBI: WP_105269219.1, SEQ ID NO: 177), Ecp4 (референсная последовательность NCBI: WP_105466506.1, SEQ ID NO: 179), ALCES1 (референсная последовательность NCBI: AXB22573.1, SEQ ID NO: 181), AVQ206 (референсная последовательность NCBI: AVQ10236.1, SEQ ID NO: 183), AVQ244 (референсная последовательность NCBI: AVQ10244.1, SEQ ID NO: 185), CDL907 (референсная последовательность NCBI: CDL65907.1, SEQ ID NO: 187), AGT915 (референсная последовательность NCBI: AGT39915.1, SEQ ID NO: 189), HH3930 (референсная последовательность NCBI: CCH66548.1, SEQ ID NO: 191), Fen7875 (референсная последовательность NCBI: YP_009160399.1, SEQ ID NO: 193), SBR77 (референсная последовательность NCBI: AOT25441, SEQ ID NO: 195), Bdp1 референсная последовательность NCBI: NP_073546.1, SEQ ID NO: 197), LVP1 (референсная последовательность NCBI: NP_042306.1, SEQ ID NO: 199) и Lvp2 (референсная последовательность NCBI: NP_085469.1, SEQ ID NO: 201).
[92] Более типично AMP выбраны из одного или более из следующих пептидов амурина Chp2 (SEQ ID NO: 70), Gkh2 (SEQ ID NO: 90), Chp4 (SEQ ID NO: 102), Ecp2 (SEQ ID NO: 104), Chp6 (SEQ ID NO: 106) и Osp1 (SEQ ID NO: 108).
[93] Согласно некоторым вариантам реализации настоящего изобретения пептиды амурина модифицированы для получения вариантов пептидов амурина. Как описано в настоящей заявке, пептиды амурина, как правило, содержат спиральный домен, такой как α-спиральный домен. Как правило, варианты пептидов амурина сохраняют α-спиральный домен. Сохранение α-спирального домена в любом варианте пептида амурина, как правило, точно идентифицировано с использованием различных компьютерных программ, таких как Jpred4 (compio.dundee.ac.uk/jpred), Helical Wheel (hael.net/helical.htm), HeliQuest (zhanglab.ccmb.med.umich.edu/I-TASSER/) и PEP-FOLD 3 (bioserv.rpbs.univ-paris-diderot.fr/services/PEP-FOLD3). Согласно некоторым вариантам реализации настоящего изобретения варианты пептида амурина модифицируют путем превращения (=) заряженных остатков, таких как аргинин и лизин, в пептиде амурина в «D»-форму аминокислоты. Применимость превращений в D-форму описана в литературе, например, Manabe et al., Sci. Rep., 2017, pages 1-10, которая полностью включена в настоящую заявку посредством ссылки. Варианты AMP могут быть получены в соответствии с любым способом, известным в данной области техники, включая способы, описанные выше в настоящей заявке для лизинов, вариантов, их активных фрагментов и производных.
[94] Согласно некоторым вариантам реализации настоящего изобретения AMP для применения в полипептидных конструкциях лизин-AMP согласно настоящему изобретению включают фрагмент более крупного AMP, который сохраняет антибактериальную активность. Например, согласно определенным вариантам реализации настоящего изобретения часть AMP полипептидной конструкции лизин-AMP может содержать фрагмент свиного миелоидного противомикробного пептида-36 («PMAP-36», SEQ ID NO: 136), который сохраняет антибактериальную активность. PMAP-36 представляет собой родственный кателицидину AMP, полученный из кДНК свиного миелоида, с амфипатической α-спиральной конформацией на N-конце. Соответственно, подходящие фрагменты PMAP-36, как правило, выбраны с N-конца, чтобы получить фрагменты, сохраняющие антибактериальную активность. Согласно некоторым вариантам реализации настоящего изобретения фрагмент PMAP-36 согласно настоящему изобретению содержит гидрофобную аминокислоту (Trp) в положении 23. Согласно другим вариантам реализации настоящего изобретения C-концевую случайную спираль исключают из фрагмента PMAP-36, чтобы уменьшить или устранить гемолиз, который может быть вызван PMAP-36. Другие признаки фрагментов PMAP-36 описаны, например, в Lyu et al., Scientific Reports, 2016, 6, pages 1-12, которая полностью включена в настоящую заявку посредством ссылки.
[96] Особенно желательные фрагменты PMAP-36 включают RI12 (SEQ ID NO: 88), RI18 (SEQ ID NO: 92) и TI15 (SEQ ID NO: 94). Другие подходящие фрагменты AMP включают фрагменты из эскулентина (референсная последовательность NCBI: P40843.1), такие как фрагмент, представленный в SEQ ID NO: 80, и изоформу 2 фактора, направленного против липополисахарида (референсная последовательность NCBI: AFU61125.1), например, фрагмент, представленный в SEQ ID NO: 76.
[96] Согласно некоторым вариантам реализации настоящего изобретения AMP согласно настоящему изобретению включают синтетические пептиды. Согласно некоторым вариантам реализации настоящего изобретения синтетический пептид уменьшает минимальную ингибирующую концентрацию (МИК) антибиотика, что приводит к предотвращению видимого роста бактерии, но сам не проявляет антибактериальную активность. Особенно желательный синтетический пептид для применения с полипептидными конструкциями лизин-AMP согласно настоящему изобретению включает пептидомиметик FIRL (SEQ ID NO: 114). Не ограничиваясь какой-либо теорией, FIRL (SEQ ID NO: 114), который является родственным последовательности белка, участвующего в биогенезе белков внешней мембраны, BamD, по-видимому, увеличивает проницаемость внешней мембраны для антибиотиков. Дополнительную информацию относительно предложенного механизма можно найти, например, в Mori et al., Journal of Antimicrobial Chemotherapy, 2012, 67: 2173-2181, которая полностью включена в настоящую заявку посредством ссылки.
[97] Другие синтетические пептиды, которые можно применять для сенсибилизации грамотрицательных бактерий к антибиотикам, которые могут быть включены в полипептидную конструкцию лизин-AMP согласно настоящему изобретению, включают катионный пептид KFFKFFKFFK (SEQ ID NO: 120), описанный в Vaara and Porro, Antimicrobial agents and Chemotherapy, 1996, 1801-1805, которая полностью включена в настоящую заявку посредством ссылки.
[98] Согласно некоторым вариантам реализации настоящего изобретения синтетические пептиды устойчивы к солям и инактивации в сыворотке, как описано, например, в Monhanram et al., Biopolymers, 2016, 106: 345-346, которая полностью включена в настоящую заявку посредством ссылки. Особенно желательные устойчивые к соли и сыворотке синтетические пептиды включают RR12Whydro (SEQ ID NO: 110) и производное пептида RI18 (SEQ ID NO: 133).
Компоненты, стабилизирующие структуру
[99] Согласно некоторым вариантам реализации настоящего изобретения полипептидные конструкции лизин-AMP согласно настоящему изобретению дополнительно содержат по меньшей мере один стабилизирующий структуру компонент для поддержания по меньшей мере части структуры первого и/или второго компонента в конструкции, например, лизина и/или AMP, по существу такой же, как в неконъюгированном лизине и/или AMP. Согласно некоторым вариантам реализации настоящего изобретения стабилизирующая структура представляет собой линкер. Как правило, по меньшей мере один стабилизирующий структуру компонент, такой как линкер, позволяет лизину и AMP по существу сохранять трехмерную структуру первой и/или второй белковых групп таким образом, что сохраняется по меньшей мере один вид биологической активности лизина и/или AMP.
[100] Подходящие линкеры для соединения двух полипептидов известны в данной области техники. Согласно определенным вариантам реализации настоящего изобретения линкер представляет собой пептид, такой как пептид, содержащий остатки глицина и серина. Конкретные подходящие линкеры включают, но не ограничиваются ими, линкер TAGGTAGG (SEQ ID NO: 72), линкер IGEM GGSGSGSGSGSP (BBa_K1485002) (SEQ ID NO: 82). GGGSGGGGSGGGS (BBA_K1486037, (SEQ ID NO: 86) или линкер, описанный в Briers et al., mBio, 2014, 5:e01379-14, которая полностью включена в настоящую заявку посредством ссылки, т. е. AGAGAGAGAGAGAGAGAS (SEQ ID NO: 122).
[101] Согласно некоторым вариантам реализации настоящего изобретения стабилизирующий структуру компонент представляет собой пептидную группу, например, группу RPP или PP. Такие пептидные группы могут быть включены в полипептидные конструкции лизин-AMP согласно настоящему изобретению, чтобы способствовать поддержанию структуры белковых групп лизина и/или AMP. Например, аминокислоты RPP или PP могут быть вставлены на C-конце или N-конце линкера, например, на N-конце линкера BBA_K1486037 (RPPGGGSGGGGSGGGS остатки с 126 по 141 SEQ ID NO: 12), на N-конце линкера BBA_K1486037 (PPGGGSGGGGSGGGS, остатки 144-158 SEQ ID NO: 16), на N-конце линкера TAGGTAGG (SEQ ID NO: 72), например, изображенного в остатках 137-144 SEQ ID NO: 18) или на С-конце линкера BBA_K1486037 (GGGSGGGGSGGGSPP, остатки 135-149 SEQ ID NO: 20).
[102] Согласно другим вариантам реализации настоящего изобретения пептиды MIDR (SEQ ID NO: 112) и/или NPTH (SEQ ID NO: 116) включены в конструкцию, чтобы способствовать поддержанию структуры белковых групп лизина и/или AMP. Например, согласно некоторым вариантам реализации настоящего изобретения структура AMP, такого как FIRL (SEQ ID NO: 114), поддерживается путем добавления MIDR (SEQ ID NO: 112) и/или NPTH (SEQ ID NO: 116), как показано в остатках 1-12 SEQ ID NO: 46 (MIDRFIRLNPTH) и остатках 1-26 SEQ ID NO: 44.
Примеры полипептидных конструкций лизин-AMP
[103] Согласно некоторым вариантам реализации настоящего изобретения конструкция лизин-AMP содержит: (a) первый компонент, содержащий (i) по меньшей мере один лизин, выбранный из группы, состоящей из GN76 (SEQ ID NO: 203), GN4 (SEQ ID NO: 74), GN146 (SEQ ID NO: 78), GN14 (SEQ ID NO: 124), GN37 (SEQ ID NO: 84), необязательно с одиночной мутацией, повышающей pI, GN316 (SEQ ID NO: 22), необязательно с одиночной точечной мутацией, лизина Pap2_gp17 (SEQ ID NO: 96), GN329 (SEQ ID NO: 26), GN424 (SEQ ID NO: 56), GN202 (SEQ ID NO: 118), GN425 (SEQ ID NO: 58), GN428 (SEQ ID NO: 60), GN431 (SEQ ID NO: 64), GN486 (SEQ ID NO: 66), GN333 (SEQ ID NO: 28), GN485 (SEQ ID NO: 68), GN123 (SEQ ID NO: 173) и GN121 (SEQ ID NO: 175), или (ii) полипептид, обладающий активностью лизина и имеющий по меньшей мере 80%, например, по меньшей мере 85%, например, по меньшей мере 90%, например, по меньшей мере 95%, например, по меньшей мере 98% или, например, по меньшей мере 99% идентичность последовательности с полипептидной последовательностью любой из SEQ ID NO: 203, 74, 78, 124, 84, 22, 96, 26, 56, 118, 58, 60, 64, 66, 28, 68, 173 или 175; или (iii) активный фрагмент лизина, причем указанный фрагмент содержит одиночные точечные мутации и/или одиночные мутации, повышающие pI, если таковые имеются; (b) второй компонент, содержащий (i) по меньшей мере один противомикробный пептид (AMP), выбранный из группы, состоящей из Chp1 (SEQ ID NO: 133), Chp2 (SEQ ID NO: 70), CPAR39 (SEQ ID NO: 135), Chp3 (SEQ ID NO: 137), Chp4 (SEQ ID NO: 102), Chp6 (SEQ ID NO: 106), Chp7 (SEQ ID NO: 139), Chp8 (SEQ ID NO: 141), Chp9 (SEQ ID NO: 143), Chp10 (SEQ ID NO: 145), Chp11 (SEQ ID NO: 147), Chp12 (SEQ ID NO: 149), Gkh1 (SEQ ID NO: 151), Gkh2 (SEQ ID NO: 90), Unp1 (SEQ ID NO: 153), Ecp1 (SEQ ID NO: 155), Ecp2 (SEQ ID NO: 104), Tma1 (SEQ ID NO: 157), Osp1 (SEQ ID NO: 108), Unp2 (SEQ ID NO: 159), Unp3 (SEQ ID NO: 161), Gkh3 (SEQ ID NO: 163), Unp5 (SEQ ID NO: 165), Unp6 (SEQ ID NO: 167), Spi1 (SEQ ID NO: 169), Spi2 (SEQ ID NO: 171), Ecp3 (SEQ ID NO: 177), Ecp4 (SEQ ID NO: 179), ALCES1 (SEQ ID NO: 181), AVQ206 (SEQ ID NO: 183), AVQ244 (SEQ ID NO: 185), CDL907 (SEQ ID NO: 187), AGT915 (SEQ ID NO: 189), HH3930 (SEQ ID NO: 191), Fen7875 (SEQ ID NO: 193), SBR77 (SEQ ID NO: 195), Bdp1 (SEQ ID NO: 197), LVP1 (SEQ ID NO: 199), Lvp2 (SEQ ID NO: 201), фрагмента эскулентина (SEQ ID NO: 80), RI12 (SEQ ID NO: 88), TI15 (SEQ ID NO: 94), RI18 (SEQ ID NO: 92), FIRL (SEQ ID NO: 114), фрагмента ЛПС-связывающего белка (SEQ ID NO: 76), RR12Whydro (SEQ ID NO: 110), производного пептида RI18 (SEQ ID NO: 131) и катионного пептида (SEQ ID NO: 120), или (ii) полипептид, обладающий активностью AMP, причем указанный полипептид по меньшей мере на 80% идентичен по меньшей мере одной из SEQ ID NO: 133, 70, 135, 137, 102, 106, 139, 141, 143, 145, 147, 149, 151, 90, 153, 155, 104, 157, 108, 159, 161, 163, 165, 167, 169, 171, 177, 179, 181, 183, 185, 187, 189, 191, 193, 195, 197, 199, 201, 80, 88, 94, 92, 114, 76, 110, 131 и 120.
[104] Как правило, любой из вариантов AMP, имеющих по меньшей мере 80% идентичность или более с раскрытыми AMP или их фрагментами, сохраняет свою альфа-спиральную структуру и любые остатки, ассоциированные с активностью. Например, как отмечено выше, фрагменты PMAP-36 (SEQ ID NO: 136), как правило, сохраняют гидрофобную аминокислоту (Trp) в положении 23.
[105] Согласно некоторым вариантам реализации настоящего изобретения GN37 (SEQ ID NO: 84) содержит одиночную мутацию, повышающую pI, причем указанный GN37 (SEQ ID NO: 84) с одиночной мутацией, повышающей pI, представляет собой GN217 (SEQ ID NO: 8). Согласно некоторым вариантам реализации настоящего изобретения GN316 (SEQ ID NO: 22) содержит одиночную точечную мутацию, причем указанный GN37 (SEQ ID NO: 84) с одиночной точечной мутацией представляет собой GN396 (SEQ ID NO: 50), GN408 (SEQ ID NO: 52), GN418 (SEQ ID NO: 54) и/или GN394 (SEQ ID NO: 48).
[106] Согласно некоторым вариантам реализации настоящего изобретения конструкция дополнительно содержит по меньшей мере один стабилизирующий структуру компонент. Согласно некоторым вариантам реализации настоящего изобретения по меньшей мере один стабилизирующий структуру компонент представляет собой пептидный линкер, такой как пептид, содержащий остатки глицина и серина. Согласно определенным вариантам реализации настоящего изобретения пептидный линкер выбран из группы, состоящей из TAGGTAGG (SEQ ID NO: 72), IGEM (BBa_K1485002) (SEQ ID NO: 82), PPTAGGTAGG (SEQ ID NO: 98), IGEM +PP (остатки 44-58 SEQ ID NO: 16) и AGAGAGAGAGAGAGAGAS (SEQ ID NO: 122).
[107] Согласно некоторым вариантам реализации настоящего изобретения полипептидная конструкция лизин-AMP выбрана из по меньшей мере одного из лизина GN168 (SEQ ID NO: 2), лизина GN176 (SEQ ID NO: 4), лизина GN178 (SEQ ID NO: 6), лизина GN218 (SEQ ID NO: 10), лизина GN223 (SEQ ID NO: 12), лизина GN239 (SEQ ID NO: 14), лизина GN243 (SEQ ID NO: 16), лизина GN280 (SEQ ID NO: 18), лизина GN281 (SEQ ID NO: 20), лизина GN349 (SEQ ID NO: 30), лизина GN351 (SEQ ID NO: 32), лизина GN352 (SEQ ID NO: 34), лизина GN353 (SEQ ID NO: 36), лизина GN357 (SEQ ID NO: 38), лизина GN359 (SEQ ID NO: 40), лизина GN369 (SEQ ID NO: 42), лизина GN370 (SEQ ID NO: 44), лизина GN371 (SEQ ID NO: 46) или лизина GN 93 (SEQ ID NO: 62), или полипептида, обладающего активностью лизина и имеющего по меньшей мере 80%, например, по меньшей мере 85%, например, по меньшей мере 90%, например, по меньшей мере 95%, например, по меньшей мере 98% или, например, по меньшей мере 99% идентичность последовательности с полипептидной последовательностью по меньшей мере одной из SEQ ID NO: 2, 4, 6, 10, 12, 14, 16, 18, 20, 30, 32, 34, 36, 38, 40, 42, 44, 46 или 62.
[108] Более конкретно, согласно некоторым вариантам реализации настоящего изобретения полипептидная конструкция лизин-AMP содержит полипептид амурина Chp2 (SEQ ID NO: 70) и линкер TAGGTAGG (SEQ ID NO: 72), введенные на N-конце лизина GN4 (SEQ ID NO: 74) с получением лизина GN168 (SEQ ID NO: 2) или полипептида, обладающего активностью лизина и имеющего по меньшей мере 80%, например, по меньшей мере 85%, например, по меньшей мере 90%, например, по меньшей мере 95%, например, по меньшей мере 98% или, например, по меньшей мере 99% идентичность последовательности с SEQ ID NO: 2.
[109] Согласно некоторым вариантам реализации настоящего изобретения кодируемая полипептидная конструкция лизин-AMP содержит фрагмент ЛПС-связывающего белка (SEQ ID NO: 76) и линкер TAGGTAGG (SEQ ID NO: 72), введенные на N-конце лизина GN146 (SEQ ID NO: 78) с получением лизина GN176 (SEQ ID NO: 4) или полипептида, обладающего активностью лизина и имеющего по меньшей мере 80%, например, по меньшей мере 85%, например, по меньшей мере 90%, например, по меньшей мере 95%, например, по меньшей мере 98% или, например, по меньшей мере 99% идентичность последовательности с SEQ ID NO: 4.
[110] Согласно некоторым вариантам реализации настоящего изобретения полипептидная конструкция лизин-AMP содержит фрагмент эскулентина (SEQ ID NO: 80) и линкер IGEM (SEQ ID NO: 82), введенные на N-конце лизина GN146 (SEQ ID NO: 78) с получением лизина GN178 (SEQ ID NO: 6) или полипептида, имеющего по меньшей мере 80%, например, по меньшей мере 85%, например, по меньшей мере 90%, например, по меньшей мере 95%, например, по меньшей мере 98% или, например, по меньшей мере 99% идентичность последовательности с SEQ ID NO: 6.
[111] Согласно некоторым вариантам реализации настоящего изобретения кодируемая полипептидная конструкция лизин-AMP содержит линкер IGEM (SEQ ID NO: 86) и противомикробный пептид RI12 (SEQ ID NO: 88), введенные на С-конце лизина GN37 (SEQ ID NO: 84) с получением лизина GN218 (SEQ ID NO: 10) или полипептида, обладающего активностью лизина и имеющего по меньшей мере 80%, например, по меньшей мере 85%, например, по меньшей мере 90%, например, по меньшей мере 95%, например, по меньшей мере 98% или, например, по меньшей мере 99% идентичность последовательности с SEQ ID NO: 10.
[112] Согласно некоторым вариантам реализации настоящего изобретения полипептидная конструкция лизин-AMP содержит фрагмент RPP, линкер IGEM (SEQ ID NO: 86) и противомикробный пептид амурина Gkh2 (SEQ ID NO: 90), введенные на С-конце лизина GN37 (SEQ ID NO: 84) с получением лизина GN223 (SEQ ID NO: 12) или полипептида, обладающего активностью лизина и имеющего по меньшей мере 80%, например, по меньшей мере 85%, например, по меньшей мере 90%, например, по меньшей мере 95%, например, по меньшей мере 98% или, например, по меньшей мере 99% идентичность последовательности с SEQ ID NO: 12.
[113] Согласно некоторым вариантам реализации настоящего изобретения полипептидная конструкция лизин-AMP содержит линкер IGEM (SEQ ID NO: 86) и пептид RI18 (SEQ ID NO: 92), введенные на С-конце лизина GN37 (SEQ ID NO: 84) с получением лизина GN239 (SEQ ID NO: 14) или полипептида, обладающего активностью лизина и имеющего по меньшей мере 80%, например, по меньшей мере 85%, например, по меньшей мере 90%, например, по меньшей мере 95%, например, по меньшей мере 98% или, например, по меньшей мере 99% идентичность последовательности с SEQ ID NO: 14.
[114] Согласно некоторым вариантам реализации настоящего изобретения полипептидная конструкция лизин-AMP содержит аминокислотную группу PP, линкер IGEM (SEQ ID NO: 86) и пептид TI15 (SEQ ID NO: 94), введенные на С-конце лизина GN37 (SEQ ID NO: 84) с получением лизина GN243 (SEQ ID NO: 16) или полипептида, обладающего активностью лизина и имеющего по меньшей мере 80%, например, по меньшей мере 85%, например, по меньшей мере 90%, например, по меньшей мере 95%, например, по меньшей мере 98% или, например, по меньшей мере 99% идентичность последовательности с SEQ ID NO: 16.
[115] Согласно некоторым вариантам реализации настоящего изобретения полипептидная конструкция лизин-AMP содержит противомикробный пептид RI18 (SEQ ID NO: 92), линкер, имеющий аминокислотную последовательность PPTAGGTAGG (SEQ ID NO: 98), и противомикробный пептид TI15 (SEQ ID NO: 94), введенные на С-конце лизина PaP2_gp17 (SEQ ID NO: 96) с получением лизина GN280 (SEQ ID NO: 18) или полипептида, обладающего активностью лизина и имеющего по меньшей мере 80%, например, по меньшей мере 85%, например, по меньшей мере 90%, например, по меньшей мере 95%, например, по меньшей мере 98% или, например, по меньшей мере 99% идентичность последовательности с SEQ ID NO: 18.
[116] Согласно некоторым вариантам реализации настоящего изобретения полипептидная конструкция лизин-AMP содержит пептид RI18 (SEQ ID NO: 92), линкер IGEM (SEQ ID NO: 86), аминокислотную группу PP (добавленную для поддержания структуры лизина и/или AMP) и пептид TI15 (SEQ ID NO: 94), введенные на С-конце лизина PaP2_gp17 (SEQ ID NO: 96) с получением лизина GN281 (SEQ ID NO: 20) или полипептида, обладающего активностью лизина и имеющего по меньшей мере 80%, например, по меньшей мере 85%, например, по меньшей мере 90%, например, по меньшей мере 95%, например, по меньшей мере 98% или, например, по меньшей мере 99% идентичность последовательности с SEQ ID NO: 20.
[117] Согласно некоторым вариантам реализации настоящего изобретения полипептидная конструкция лизин-AMP содержит линкер, имеющий аминокислотную последовательность TAGGTAGG (SEQ ID NO: 72), и пептид амурина Chp4 (SEQ ID NO: 102), введенные на С-конце лизина GN316 (SEQ ID NO: 22) с получением лизина GN349 (SEQ ID NO: 30) или полипептида, обладающего активностью лизина и имеющего по меньшей мере 80%, например, по меньшей мере 85%, например, по меньшей мере 90%, например, по меньшей мере 95%, например, по меньшей мере 98% или, например, по меньшей мере 99% идентичность последовательности с SEQ ID NO: 30.
[118] Согласно некоторым вариантам реализации настоящего изобретения полипептидная конструкция лизин-AMP содержит линкер, имеющий аминокислотную последовательность TAGGTAGG (SEQ ID NO: 72), и пептид амурина Ecp2 (SEQ ID NO: 104), введенные на С-конце лизина GN316 (SEQ ID NO: 22) с получением лизина GN351 (SEQ ID NO: 32) или полипептида, обладающего активностью лизина и имеющего по меньшей мере 80%, например, по меньшей мере 85%, например, по меньшей мере 90%, например, по меньшей мере 95%, например, по меньшей мере 98% или, например, по меньшей мере 99% идентичность последовательности с SEQ ID NO: 32.
[119] Согласно некоторым вариантам реализации настоящего изобретения полипептидная конструкция лизин-AMP содержит линкер, имеющий аминокислотную последовательность TAGGTAGG (SEQ ID NO: 72), и пептид амурина Chp7 (SEQ ID NO: 139), введенные на С-конце лизина GN316 (SEQ ID NO: 22) с получением лизина GN352 (SEQ ID NO: 34) или полипептида, обладающего активностью лизина и имеющего по меньшей мере 80%, например, по меньшей мере 85%, например, по меньшей мере 90%, например, по меньшей мере 95%, например, по меньшей мере 98% или, например, по меньшей мере 99% идентичность последовательности с SEQ ID NO: 34.
[120] Согласно некоторым вариантам реализации настоящего изобретения полипептидная конструкция лизин-AMP содержит линкер, имеющий аминокислотную последовательность TAGGTAGG (SEQ ID NO: 72), и пептид амурина Osp1 (SEQ ID NO: 108), введенные на С-конце лизина GN316 (SEQ ID NO: 22) с получением лизина GN353 (SEQ ID NO: 36) или полипептида, обладающего активностью лизина и имеющего по меньшей мере 80%, например, по меньшей мере 85%, например, по меньшей мере 90%, например, по меньшей мере 95%, например, по меньшей мере 98% или, например, по меньшей мере 99% идентичность последовательности с SEQ ID NO: 36.
[121] Согласно некоторым вариантам реализации настоящего изобретения полипептидная конструкция лизин-AMP содержит линкер, имеющий аминокислотную последовательность TAGGTAGG (SEQ ID NO: 72), и RR12Whydro (SEQ ID NO: 110), введенные на С-конце лизина GN316 (SEQ ID NO: 22) с получением лизина GN357 (SEQ ID NO: 38) или полипептида, обладающего активностью лизина и имеющего по меньшей мере 80%, например, по меньшей мере 85%, например, по меньшей мере 90%, например, по меньшей мере 95%, например, по меньшей мере 98% или, например, по меньшей мере 99% идентичность последовательности с SEQ ID NO: 38.
[122] Согласно некоторым вариантам реализации настоящего изобретения полипептидная конструкция лизин-AMP содержит линкер, имеющий аминокислотную последовательность TAGGTAGG (SEQ ID NO: 72), и производное пептида TI15 из PMAP-36 (SEQ ID NO: 94), введенные на С-конце лизина GN316 (SEQ ID NO: 22) с получением лизина GN359 (SEQ ID NO: 40) или полипептида, обладающего активностью лизина и имеющего по меньшей мере 80%, например, по меньшей мере 85%, например, по меньшей мере 90%, например, по меньшей мере 95%, например, по меньшей мере 98% или, например, по меньшей мере 99% идентичность последовательности с SEQ ID NO: 40.
[123] Согласно некоторым вариантам реализации настоящего изобретения полипептидная конструкция лизин-AMP содержит RR18 (SEQ ID NO: 92), введенный на С-конце лизина GN316 (SEQ ID NO: 22) с получением лизина GN369 (SEQ ID NO: 42) или полипептида, обладающего активностью лизина и имеющего по меньшей мере 80%, например, по меньшей мере 85%, например, по меньшей мере 90%, например, по меньшей мере 95%, например, по меньшей мере 98% или, например, по меньшей мере 99% идентичность последовательности с SEQ ID NO: 42.
[124] Согласно некоторым вариантам реализации настоящего изобретения полипептидная конструкция лизин-AMP содержит группу MIDR (SEQ ID NO: 112), группу FIRL (SEQ ID NO: 114) и группу NPTH (SEQ ID NO: 116), введенные на N-конце лизина GN202 (SEQ ID NO: 118) с получением лизина GN370 (SEQ ID NO: 44) или полипептида, обладающего активностью лизина и имеющего по меньшей мере 80%, например, по меньшей мере 85%, например, по меньшей мере 90%, например, по меньшей мере 95%, например, по меньшей мере 98% или, например, по меньшей мере 99% идентичность последовательности с SEQ ID NO: 44.
[125] Согласно некоторым вариантам реализации настоящего изобретения полипептидная конструкция лизин-AMP содержит группу MIDR (SEQ ID NO: 112), FIRL (SEQ ID NO: 114) и группу NPTH (SEQ ID NO: 116), введенные на С-конце лизина GN146 (SEQ ID NO: 78) с получением лизина GN371 (SEQ ID NO: 46) или полипептида, обладающего активностью лизина и имеющего по меньшей мере 80%, например, по меньшей мере 85%, например, по меньшей мере 90%, например, по меньшей мере 95%, например, по меньшей мере 98% или, например, по меньшей мере 99% идентичность последовательности с SEQ ID NO: 46.
[126] Согласно некоторым вариантам реализации настоящего изобретения полипептидная конструкция лизин-AMP содержит катионный пептид (SEQ ID NO: 120) и линкерный домен (SEQ ID NO: 122), введенные на N-конце лизина GN14 (SEQ ID NO: 124) с получением лизина GN93 (SEQ ID NO: 62) или полипептида, обладающего активностью лизина и имеющего по меньшей мере 80%, например, по меньшей мере 85%, например, по меньшей мере 90%, например, по меньшей мере 95%, например, по меньшей мере 98% или, например, по меньшей мере 99% идентичность последовательности с SEQ ID NO: 62.
[127] В таблице 1 ниже представлены конкретные примеры лизинов и конструкций лизин-AMP, описанных в настоящей заявке. Часть AMP конструкции выделена двойным подчеркиванием для GN168 (SEQ ID NO: 2), GN176 (SEQ ID NO: 4), GN178 (SEQ ID NO: 6), GN370 (SEQ ID NO: 44), GN371 (SEQ ID NO: 46) и GN93 (SEQ ID NO: 62). Для всех остальных конструкций двойное подчеркивание соответствует лизину. Компоненты, стабилизирующие структуру, такие как линкеры, выделены курсивом. Метка для очистки для GN486 (SEQ ID NO: 66) выделена курсивом и жирным шрифтом. Одиночные точечные мутации выделены жирным шрифтом.
Таблица 1
[128] Согласно некоторым вариантам реализации настоящего изобретения лизины и/или полипептидные конструкции лизин-AMP согласно настоящему изобретению химически модифицированы. Химическая модификация включает, но не ограничивается этим, добавление химических групп, создание новых связей и удаление химических групп. Химические модификации могут происходить в любом месте лизина и/или полипептидной конструкции лизин-AMP, включая боковые цепи аминокислот, а также амино- или карбоксильные концы. Например, согласно определенным вариантам реализации настоящего изобретения лизин или полипептидная конструкция лизин-AMP содержит N-концевую модификацию путем ацетилирования. Согласно определенным вариантам реализации настоящего изобретения лизин или полипептидная конструкция лизин-AMP содержит C-концевую модификацию путем амидирования. Такая модификация может присутствовать более чем в одном месте в лизине и/или полипептидной конструкции лизин-AMP.
[129] Кроме того, одна или более боковых групп или концевых групп лизина и/или полипептидной конструкции лизин-AMP могут быть защищены с помощью защитных групп, известных обычному специалисту в данной области техники.
[130] Согласно некоторым вариантам реализации настоящего изобретения лизины и/или полипептидные конструкции лизин-AMP конъюгированы с группой, увеличивающей продолжительность действия. Согласно некоторым вариантам реализации настоящего изобретения группа, увеличивающая продолжительность действия, представляет собой полиэтиленгликоль. Полиэтиленгликоль («ПЭГ») применяют для получения терапевтических полипептидов с увеличенной продолжительностью действия (Zalipsky, S., Bioconjugate Chemistry, 6:150-165 (1995); Mehvar, R., J. Pharm. Pharmaceut. Sci., 3:125-136 (2000), которая полностью включена в настоящую заявку посредством ссылки). Остов ПЭГ, (CH2CH2-0-)n, где n представляет собой число повторяющихся мономеров, является гибким и амфифильным. При присоединении к другой химической частице, такой как лизин и/или полипептидная конструкция лизин-AMP, полимерные цепи ПЭГ могут защищать такие полипептиды от иммунного ответа и других механизмов клиренса. В результате пегилирование может привести к улучшению эффективности и безопасности за счет оптимизации фармакокинетики, увеличения биодоступности и снижения иммуногенности, а также величины дозы и/или частоты ее введения.
ПОЛИНУКЛЕОТИДЫ
[131] Согласно одному аспекту настоящее изобретение относится к выделенному полинуклеотиду, содержащему молекулу нуклеиновой кислоты, кодирующую лизин, вариант лизина, его активный фрагмент или производное, описанные в настоящей заявке. Согласно некоторым вариантам реализации настоящего изобретения выделенная полинуклеотидная последовательность представляет собой последовательность ДНК. Согласно другим вариантам реализации настоящего изобретения выделенный полинуклеотид представляет собой последовательность кДНК.
[132] Согласно некоторым вариантам реализации настоящего изобретения выделенный полинуклеотид содержит молекулу нуклеиновой кислоты, кодирующую полипептид, имеющий по меньшей мере 80%, например, по меньшей мере 85%, например, по меньшей мере 90%, например, по меньшей мере 95%, например, по меньшей мере 98% или, например, по меньшей мере 99% идентичность последовательности с лизином, вариантом лизина, его активным фрагментом или производным, описанными в настоящей заявке, причем указанный кодируемый полипептид ингибирует рост или уменьшает количество, или приводит к уничтожению P. aeruginosa и необязательно по меньшей мере одного другого вида грамотрицательных бактерий, описанных в настоящей заявке, в отсутствие или в присутствии, или как в отсутствие, так и в присутствии сыворотки человека.
[133] Согласно некоторым вариантам реализации настоящего изобретения выделенный полинуклеотид содержит молекулу нуклеиновой кислоты, кодирующую лизин, выбранный из GN217 (SEQ ID NO: 8), варианта GN316 (SEQ ID NO: 24) GN316 (SEQ ID NO: 22), GN329 (SEQ ID NO: 26), GN333 (SEQ ID NO: 28), GN394 (SEQ ID NO: 48), GN396 (SEQ ID NO: 50), GN408 (SEQ ID NO: 52), GN418 (SEQ ID NO: 54), GN424 (SEQ ID NO: 56), GN425 (SEQ ID NO:58), GN428 (SEQ ID NO: 60), GN431 (SEQ ID NO: 64), GN486 (SEQ ID NO: 66), GN485 (SEQ ID NO: 68), лизина PaP2_gp17 (SEQ ID NO: 96), GN123 (SEQ ID NO: 173) или GN121 (SEQ ID NO: 175) или варианта, или активного фрагмента указанного лизина, или производного, причем указанный вариант лизина или его активный фрагмент или производное, кодируемое выделенным полинуклеотидом, ингибирует рост или уменьшает количество, или приводит к уничтожению P. aeruginosa и необязательно по меньшей мере одного другого вида грамотрицательных бактерий в отсутствие или в присутствии, или как в отсутствие, так и в присутствии сыворотки человека. Согласно определенным вариантам реализации настоящего изобретения выделенный полинуклеотид содержит молекулу нуклеиновой кислоты, кодирующую лизин, вариант или его активный фрагмент или производное, которое содержит по меньшей мере одну модификацию относительно по меньшей мере одной из SEQ ID NO: 8, 24, 22, 26, 28, 48, 50, 52, 54, 56, 58, 60, 64, 66, 68, 96, 173 и 175, такую как по меньшей мере одна аминокислотная замена, вставка или делеция. Согласно определенным вариантам реализации настоящего изобретения выделенный полинуклеотид содержит последовательность нуклеиновой кислоты, выбранную из группы, состоящей из SEQ ID NO: 7, 23, 21, 25, 27, 47, 49, 51, 53, 55, 57, 59, 63, 65, 67 95, 172 и 174, соответственно, их комплементарных последовательностей или последовательности нуклеиновой кислоты, имеющей по меньшей мере 80%, например, по меньшей мере 85%, например, по меньшей мере 90%, например, по меньшей мере 95%, например, по меньшей мере 98%, или, например, по меньшей мере 99% идентичность последовательности с одной из SEQ ID NO: 7, 23, 21, 25, 27, 47, 49, 51, 53, 55, 57, 59, 63, 65, 67, 95, 172 и 174, или их комплементарными последовательностями, причем указанный кодируемый полипептид ингибирует рост или уменьшает количество, или приводит к уничтожению P. aeruginosa и необязательно по меньшей мере одного другого вида грамотрицательных бактерий в отсутствие или в присутствии, или как в отсутствие, так и в присутствии сыворотки человека.
[134] Согласно некоторым вариантам реализации настоящего изобретения выделенный полинуклеотид содержит молекулу нуклеиновой кислоты, кодирующую лизин, выбранный из по меньшей мере одного из лизина GN217 (SEQ ID NO: 8), лизина GN394 (SEQ ID NO: 48), лизина GN396 (SEQ ID NO: 50), лизина GN408 (SEQ ID NO: 52), лизина GN418 (SEQ ID NO: 54) и GN486 (SEQ ID NO: 66) или варианта, или активного фрагмента указанного лизина, или производного. Согласно определенным вариантам реализации настоящего изобретения полинуклеотид содержит последовательность нуклеиновой кислоты, выбранную из группы, состоящей из SEQ ID NO: 7, 47, 49, 51, 53 и 65, их комплементарных последовательностей или последовательности нуклеиновой кислоты, имеющей по меньшей мере 80%, например, по меньшей мере 85%, например, по меньшей мере 90%, например, по меньшей мере 95%, например, по меньшей мере 98% или, например, по меньшей мере 99% идентичность последовательности с одной из SEQ ID NO: 77, 47, 49, 51, 53 или 65, или их комплементарными последовательностями, причем указанный кодируемый полипептид ингибирует рост или уменьшает количество, или приводит к уничтожению P. aeruginosa и необязательно по меньшей мере одного другого вида грамотрицательных бактерий в отсутствие или в присутствии, или как в отсутствие, так и в присутствии сыворотки человека.
[135] Согласно некоторым вариантам реализации настоящего изобретения выделенный полинуклеотид содержит молекулу нуклеиновой кислоты, кодирующую лизин, выбранный из по меньшей мере одного из: GN316 (SEQ ID NO: 22), GN329 (SEQ ID NO: 26), GN333 (SEQ ID NO: 28), GN424 (SEQ ID NO: 56), GN425 (SEQ ID NO:58), GN428 (SEQ ID NO: 60), GN431 (SEQ ID NO: 64), GN485 (SEQ ID NO: 68) или варианта, или активного фрагмента указанного лизина, или производного, причем указанный кодируемый полипептид ингибирует рост или уменьшает количество, или приводит к уничтожению P. aeruginosa и необязательно по меньшей мере одного другого вида грамотрицательных бактерий в отсутствие или в присутствии, или как в отсутствие, так и в присутствии сыворотки человека. Согласно определенным вариантам реализации настоящего изобретения вариант, его активный фрагмент или производное содержит по меньшей мере одну модификацию относительно по меньшей мере одной из SEQ ID NO: 22, 26, 28, 56, 58, 60, 64 или 68, такую как по меньшей мере одна аминокислотная замена, вставка или делеция. Согласно определенным вариантам реализации настоящего изобретения полинуклеотид содержит последовательность нуклеиновой кислоты, выбранную из группы, состоящей из SEQ ID NO: 21, 25, 27, 55, 57, 59, 63 и 67, их комплементарных последовательностей или последовательности нуклеиновой кислоты, имеющей по меньшей мере 80%, например, по меньшей мере 85%, например, по меньшей мере 90%, например, по меньшей мере 95%, например, по меньшей мере 98% или, например, по меньшей мере 99% идентичность последовательности с одной из SEQ ID NO: 21, 25, 27, 55, 57, 59, 63 или 67, или их комплементарными последовательностями, причем указанный кодируемый полипептид ингибирует рост или уменьшает количество, или приводит к уничтожению P. aeruginosa и необязательно по меньшей мере одного другого вида грамотрицательных бактерий в отсутствие или в присутствии, или как в отсутствие, так и в присутствии сыворотки человека.
[136] Согласно другому аспекту настоящее изобретение относится к выделенному полинуклеотиду, содержащему молекулу нуклеиновой кислоты, кодирующую полипептидную конструкцию лизин-AMP, содержащую:
(a) первую молекулу нуклеиновой кислоты, кодирующую первый компонент, содержащий: (i) лизин, выбранный из группы, состоящей из GN76 (SEQ ID NO: 203), GN4 (SEQ ID NO: 74), GN146 (SEQ ID NO: 78), GN14 (SEQ ID NO: 124), GN37 (SEQ ID NO: 84), необязательно с одиночной мутацией, повышающей pI, GN316 (SEQ ID NO: 22), необязательно с одиночной точечной мутацией, лизина Pap2_gp17 (SEQ ID NO: 96), GN329 (SEQ ID NO: 26), GN424 (SEQ ID NO: 56), GN202 (SEQ ID NO: 118), GN425 (SEQ ID NO: 58), GN428 (SEQ ID NO: 60), GN431 (SEQ ID NO: 64), GN486 (SEQ ID NO: 66), GN333 (SEQ ID NO: 28) и GN485 (SEQ ID NO: 68), GN123 (SEQ ID NO: 173) и GN121 (SEQ ID NO: 175); или (ii) полипептид, обладающий активностью лизина, причем указанный полипептид по меньшей мере на 80% идентичен по меньшей мере одной из SEQ ID NO: 203, 74, 78, 124, 84, 22, 96, 26, 56, 118, 58, 60, 64, 66, 28, 68, 173 или 175; или (iii) активный фрагмент лизина;
(b) вторую молекулу нуклеиновой кислоты, кодирующую второй компонент, содержащий: (i) по меньшей мере один противомикробный пептид (AMP), выбранный из группы, состоящей из Chp1 (SEQ ID NO: 133), Chp2 (SEQ ID NO: 70), CPAR39 (SEQ ID NO: 135), Chp3 (SEQ ID NO: 137), Chp4 (SEQ ID NO: 102), Chp6 (SEQ ID NO: 106), Chp7 (SEQ ID NO: 139), Chp8 (SEQ ID NO: 141), Chp9 (SEQ ID NO: 143), Chp10 (SEQ ID NO: 145), Chp11 (SEQ ID NO: 147), Chp12 (SEQ ID NO: 149), Gkh1 (SEQ ID NO: 151), Gkh2 (SEQ ID NO: 90), Unp1 (SEQ ID NO: 153), Ecp1 (SEQ ID NO: 155), Ecp2 (SEQ ID NO: 104), Tma1 (SEQ ID NO: 157), Osp1 (SEQ ID NO: 108), Unp2 (SEQ ID NO: 159), Unp3 (SEQ ID NO: 161), Gkh3 (SEQ ID NO: 163), Unp5 (SEQ ID NO: 165), Unp6 (SEQ ID NO: 167), Spi1 (SEQ ID NO: 169), Spi2 (SEQ ID NO: 171), Ecp3 (SEQ ID NO: 177), Ecp4 (SEQ ID NO: 179), ALCES1 (SEQ ID NO: 181), AVQ206 (SEQ ID NO: 183), AVQ244 (SEQ ID NO: 185), CDL907 (SEQ ID NO: 187), AGT915 (SEQ ID NO: 189), HH3930 (SEQ ID NO: 191), Fen7875 (SEQ ID NO: 193), SBR77 (SEQ ID NO: 195), Bdp1 (SEQ ID NO: 197), LVP1 (SEQ ID NO: 199), Lvp2 (SEQ ID NO: 201), фрагмент эскулентина (SEQ ID NO: 80), RI12 (SEQ ID NO: 88), TI15 (SEQ ID NO: 94), RI18 (SEQ ID NO: 92), FIRL (SEQ ID NO: 114), фрагмента ЛПС-связывающего белка (SEQ ID NO: 76), RR12Whydro (SEQ ID NO: 110), производного пептида RI18 (SEQ ID NO: 131) и катионного пептида (SEQ ID NO: 120), или (ii) полипептид, обладающий активностью AMP, причем указанный полипептид по меньшей мере на 80% идентичен по меньшей мере одной из SEQ ID NO: 133, 70, 135, 137, 102, 106, 139, 141, 143, 145, 147, 149, 151, 90, 153, 155, 104, 157, 108, 159, 161, 163, 165, 167, 169, 171, 177, 179, 181, 183, 185, 187, 189, 191, 193, 195, 197, 199, 201, 80, 88, 94, 92, 114, 76, 110, 131 и 120.
[137] Согласно некоторым вариантам реализации настоящего изобретения выделенные полинуклеотиды согласно настоящему изобретению содержат молекулу нуклеиновой кислоты, кодирующую первый компонент конструкции лизин-AMP, причем указанный первый компонент выбран из группы, состоящей из GN394 (SEQ ID NO: 48), GN396 (SEQ ID NO: 50), GN408 (SEQ ID NO: 52) и GN418 (SEQ ID NO: 54).
[138] Согласно некоторым вариантам реализации настоящего изобретения выделенные полинуклеотиды согласно настоящему изобретению содержат молекулу нуклеиновой кислоты, кодирующую второй компонент конструкции лизин-AMP, причем указанный второй компонент выбран из группы, состоящей из Chp1 (SEQ ID NO: 133), Chp2 (SEQ ID NO: 70), CPAR39 (SEQ ID NO: 135), Chp3 (SEQ ID NO: 137), Chp4 (SEQ ID NO: 102), Chp6 (SEQ ID NO: 106), Chp7 (SEQ ID NO: 139), Chp8 (SEQ ID NO: 141), Chp9 (SEQ ID NO: 143), Chp10 (SEQ ID NO: 145), Chp11 (SEQ ID NO: 147), Chp12 (SEQ ID NO: 149), Gkh1 (SEQ ID NO: 151), Gkh2 (SEQ ID NO: 90), Unp1 (SEQ ID NO: 153), Ecp1 (SEQ ID NO: 155), Ecp2 (SEQ ID NO: 104), Tma1 (SEQ ID NO: 157), Osp1 (SEQ ID NO: 108), Unp2 (SEQ ID NO: 159), Unp3 (SEQ ID NO: 161), Gkh3 (SEQ ID NO: 163), Unp5 (SEQ ID NO: 165), Unp6 (SEQ ID NO: 167), Spi1 (SEQ ID NO: 169), Spi2 (SEQ ID NO: 171), Ecp3 (SEQ ID NO: 177), Ecp4 (SEQ ID NO: 179), ALCES1 (SEQ ID NO: 181), AVQ206 (SEQ ID NO: 183), AVQ244 (SEQ ID NO: 185), CDL907 (SEQ ID NO: 187), AGT915 (SEQ ID NO: 189), HH3930 (SEQ ID NO: 191), Fen7875 (SEQ ID NO: 193), SBR77 (SEQ ID NO: 195), Bdp1 (SEQ ID NO: 197), LVP1 (SEQ ID NO: 199), Lvp2 (SEQ ID NO: 201), фрагмента эскулентина (SEQ ID NO: 80), RI12 (SEQ ID NO: 88), TI15 (SEQ ID NO: 94), RI18 (SEQ ID NO: 92), FIRL (SEQ ID NO: 114) фрагмента ЛПС-связывающего белка (SEQ ID NO: 76), RR12Whydro (SEQ ID NO: 110), производного пептида RI18 (SEQ ID NO: 131) и катионного пептида (SEQ ID NO: 120), или (ii) полипептида, обладающего активностью AMP, причем указанный полипептид по меньшей мере на 80% идентичен по меньшей мере одной из SEQ ID NO: 133, 70, 135, 137, 102, 106, 139, 141, 143, 145, 147, 149, 151, 90, 153, 155, 104, 157, 108, 159, 161, 163, 165, 167, 169, 171, 177, 179, 181, 183, 185, 187, 189, 191, 193, 195, 197, 199, 201, 80, 88, 94, 92, 114, 76, 110, 131 и 120.
[139] Согласно некоторым вариантам реализации настоящего изобретения выделенные полинуклеотиды согласно настоящему изобретению также содержат молекулу нуклеиновой кислоты, кодирующую по меньшей мере один стабилизирующий структуру компонент полипептидной конструкции лизин-AMP для поддержания по меньшей мере части структуры первого и/или второго компонента в конструкции по существу такой же, как в неконъюгированном лизине и/или AMP. Согласно некоторым вариантам реализации настоящего изобретения выделенные полинуклеотиды согласно настоящему изобретению содержат молекулу нуклеиновой кислоты, кодирующую по меньшей мере один стабилизирующий структуру компонент, причем указанный по меньшей мере один стабилизирующий структуру компонент представляет собой пептид, такой как пептид, содержащий остатки глицина и/или серина. Согласно одному варианту реализации настоящего изобретения пептид выбран из группы, состоящей из TAGGTAGG (SEQ ID NO: 72), IGEM (BBa_K1485002) (SEQ ID NO: 82), PPTAGGTAGG (SEQ ID NO: 98), IGEM +PP (остатки 44-58 SEQ ID NO: 16) и AGAGAGAGAGAGAGAGAS (SEQ ID NO: 122).
[140] Более конкретно, согласно некоторым вариантам реализации настоящего изобретения выделенный полинуклеотид содержит молекулу нуклеиновой кислоты, кодирующую полипептидную конструкцию лизин-AMP, причем указанная полипептидная конструкция лизин-AMP представляет собой лизин GN168 (SEQ ID NO: 2) или полипептид, обладающий активностью лизина и имеющий по меньшей мере 80%, например, по меньшей мере 85%, например, по меньшей мере 90%, например, по меньшей мере 95%, например, по меньшей мере 98% или, например, по меньшей мере 99% идентичность последовательности с SEQ ID NO: 2.
[141] Согласно некоторым вариантам реализации настоящего изобретения молекула нуклеиновой кислоты, кодирующая лизин GN168, содержит последовательность нуклеиновой кислоты SEQ ID NO: 1, ее комплементарную последовательность или последовательность нуклеиновой кислоты, кодирующую полипептид, обладающий активностью лизина, и имеющую по меньшей мере 80%, например, по меньшей мере 85%, например, по меньшей мере 90%, например, по меньшей мере 95%, например, по меньшей мере 98% или, например, по меньшей мере 99% идентичность последовательности с SEQ ID NO: 1 или ее комплементарной последовательностью.
[142] Согласно некоторым вариантам реализации настоящего изобретения выделенный полинуклеотид содержит молекулу нуклеиновой кислоты, кодирующую полипептидную конструкцию лизин-AMP, причем указанная полипептидная конструкция лизин-AMP представляет собой лизин GN176 (SEQ ID NO: 4), или молекулу нуклеиновой кислоты, кодирующую полипептид, обладающий активностью лизина и имеющий по меньшей мере 80%, например, по меньшей мере 85%, например, по меньшей мере 90%, например, по меньшей мере 95%, например, по меньшей мере 98% или, например, по меньшей мере 99% идентичность последовательности с SEQ ID NO: 4.
[143] Согласно некоторым вариантам реализации настоящего изобретения молекула нуклеиновой кислоты, кодирующая лизин GN176, содержит последовательность нуклеиновой кислоты SEQ ID NO: 3, ее комплементарную последовательность или последовательность нуклеиновой кислоты, кодирующую полипептид, обладающий активностью лизина, и имеющую по меньшей мере 80%, например, по меньшей мере 85%, например, по меньшей мере 90%, например, по меньшей мере 95%, например, по меньшей мере 98% или, например, по меньшей мере 99% идентичность последовательности с SEQ ID NO: 3 или ее комплементарной последовательностью.
[144] Согласно некоторым вариантам реализации настоящего изобретения выделенный полинуклеотид содержит молекулу нуклеиновой кислоты, кодирующую полипептидную конструкцию лизин-AMP, причем указанная полипептидная конструкция лизин-AMP представляет собой лизин GN178 (SEQ ID NO: 6), или последовательность нуклеиновой кислоты, кодирующую полипептид, имеющий по меньшей мере 80%, например, по меньшей мере 85%, например, по меньшей мере 90%, например, по меньшей мере 95%, например, по меньшей мере 98% или, например, по меньшей мере 99% идентичность последовательности с SEQ ID NO: 6.
[145] Согласно некоторым вариантам реализации настоящего изобретения молекула нуклеиновой кислоты, кодирующая лизин GN178, содержит последовательность нуклеиновой кислоты SEQ ID NO: 5, ее комплементарную последовательность или последовательность нуклеиновой кислоты, кодирующую полипептид, обладающий активностью лизина, и имеющую по меньшей мере 80%, например, по меньшей мере 85%, например, по меньшей мере 90%, например, по меньшей мере 95%, например, по меньшей мере 98% или, например, по меньшей мере 99% идентичность последовательности с SEQ ID NO: 5 или ее комплементарной последовательностью.
[146] Согласно некоторым вариантам реализации настоящего изобретения выделенный полинуклеотид содержит молекулу нуклеиновой кислоты, кодирующую полипептидную конструкцию лизин-AMP, причем указанная полипептидная конструкция лизин-AMP представляет собой лизин GN218 (SEQ ID NO: 10), или молекулу нуклеиновой кислоты, кодирующую полипептид, обладающий активностью лизина и имеющий по меньшей мере 80%, например, по меньшей мере 85%, например, по меньшей мере 90%, например, по меньшей мере 95%, например, по меньшей мере 98% или, например, по меньшей мере 99% идентичность последовательности с SEQ ID NO: 10.
[147] Согласно некоторым вариантам реализации настоящего изобретения молекула нуклеиновой кислоты, кодирующая лизин GN218, содержит последовательность нуклеиновой кислоты SEQ ID NO: 9, ее комплементарную последовательность или последовательность нуклеиновой кислоты, кодирующую полипептид, обладающий активностью лизина, и имеющую по меньшей мере 80%, например, по меньшей мере 85%, например, по меньшей мере 90%, например, по меньшей мере 95%, например, по меньшей мере 98% или, например, по меньшей мере 99% идентичность последовательности с SEQ ID NO: 9 или ее комплементарной последовательностью.
[148] Согласно некоторым вариантам реализации настоящего изобретения выделенный полинуклеотид содержит молекулу нуклеиновой кислоты, кодирующую полипептидную конструкцию лизин-AMP, причем указанная полипептидная конструкция лизин-AMP представляет собой лизин GN223 (SEQ ID NO: 12), или молекулу нуклеиновой кислоты, кодирующую полипептид, обладающий активностью лизина и имеющий по меньшей мере 80%, например, по меньшей мере 85%, например, по меньшей мере 90%, например, по меньшей мере 95%, например, по меньшей мере 98% или, например, по меньшей мере 99% идентичность последовательности с SEQ ID NO: 12.
[149] Согласно некоторым вариантам реализации настоящего изобретения молекула нуклеиновой кислоты, кодирующая лизин GN223, содержит последовательность нуклеиновой кислоты SEQ ID NO: 11, ее комплементарную последовательность или последовательность нуклеиновой кислоты, кодирующую полипептид, обладающий активностью лизина, и имеющую по меньшей мере 80%, например, по меньшей мере 85%, например, по меньшей мере 90%, например, по меньшей мере 95%, например, по меньшей мере 98% или, например, по меньшей мере 99% идентичность последовательности с SEQ ID NO: 11 или ее комплементарной последовательностью.
[150] Согласно некоторым вариантам реализации настоящего изобретения выделенный полинуклеотид содержит молекулу нуклеиновой кислоты, кодирующую полипептидную конструкцию лизин-AMP, причем указанная полипептидная конструкция лизин-AMP представляет собой лизин GN239 (SEQ ID NO: 14), или молекулу нуклеиновой кислоты, кодирующую полипептид, обладающий активностью лизина и имеющий по меньшей мере 80%, например, по меньшей мере 85%, например, по меньшей мере 90%, например, по меньшей мере 95%, например, по меньшей мере 98% или, например, по меньшей мере 99% идентичность последовательности с SEQ ID NO: 14.
[151] Согласно некоторым вариантам реализации настоящего изобретения молекула нуклеиновой кислоты, кодирующая лизин GN239, содержит последовательность нуклеиновой кислоты SEQ ID NO: 13, ее комплементарную последовательность или последовательность нуклеиновой кислоты, кодирующую полипептид, обладающий активностью лизина, и имеющую по меньшей мере 80%, например, по меньшей мере 85%, например, по меньшей мере 90%, например, по меньшей мере 95%, например, по меньшей мере 98% или, например, по меньшей мере 99% идентичность последовательности с SEQ ID NO: 13 или ее комплементарной последовательностью.
[152] Согласно некоторым вариантам реализации настоящего изобретения выделенный полинуклеотид содержит молекулу нуклеиновой кислоты, кодирующую полипептидную конструкцию лизин-AMP, причем указанная полипептидная конструкция лизин-AMP представляет собой лизин GN243 (SEQ ID NO: 16), или молекулу нуклеиновой кислоты, кодирующую полипептид, обладающий активностью лизина и имеющий по меньшей мере 80%, например, по меньшей мере 85%, например, по меньшей мере 90%, например, по меньшей мере 95%, например, по меньшей мере 98% или, например, по меньшей мере 99% идентичность последовательности с SEQ ID NO: 16.
[153] Согласно некоторым вариантам реализации настоящего изобретения молекула нуклеиновой кислоты, кодирующая лизин GN243, содержит последовательность нуклеиновой кислоты SEQ ID NO: 15, ее комплементарную последовательность или последовательность нуклеиновой кислоты, кодирующую полипептид, обладающий активностью лизина, и имеющую по меньшей мере 80%, например, по меньшей мере 85%, например, по меньшей мере 90%, например, по меньшей мере 95%, например, по меньшей мере 98% или, например, по меньшей мере 99% идентичность последовательности с SEQ ID NO: 15 или ее комплементарной последовательностью.
[154] Согласно некоторым вариантам реализации настоящего изобретения выделенный полинуклеотид содержит молекулу нуклеиновой кислоты, кодирующую полипептидную конструкцию лизин-AMP, причем указанная полипептидная конструкция лизин-AMP представляет собой лизин GN280 (SEQ ID NO: 18), или молекулу нуклеиновой кислоты, кодирующую полипептид, обладающий активностью лизина и имеющий по меньшей мере 80%, например, по меньшей мере 85%, например, по меньшей мере 90%, например, по меньшей мере 95%, например, по меньшей мере 98% или, например, по меньшей мере 99% идентичность последовательности с SEQ ID NO: 18.
[155] Согласно некоторым вариантам реализации настоящего изобретения молекула нуклеиновой кислоты, кодирующая лизин GN280, содержит последовательность нуклеиновой кислоты SEQ ID NO: 17, ее комплементарную последовательность или последовательность нуклеиновой кислоты, кодирующую полипептид, обладающий активностью лизина, и имеющую по меньшей мере 80%, например, по меньшей мере 85%, например, по меньшей мере 90%, например, по меньшей мере 95%, например, по меньшей мере 98% или, например, по меньшей мере 99% идентичность последовательности с SEQ ID NO: 17 или ее комплементарной последовательностью.
[156] Согласно некоторым вариантам реализации настоящего изобретения выделенный полинуклеотид содержит молекулу нуклеиновой кислоты, кодирующую полипептидную конструкцию лизин-AMP, причем указанная полипептидная конструкция лизин-AMP представляет собой лизин GN281 (SEQ ID NO: 20), или молекулу нуклеиновой кислоты, кодирующую полипептид, обладающий активностью лизина и имеющий по меньшей мере 80%, например, по меньшей мере 85%, например, по меньшей мере 90%, например, по меньшей мере 95%, например, по меньшей мере 98% или, например, по меньшей мере 99% идентичность последовательности с SEQ ID NO: 20.
[157] Согласно некоторым вариантам реализации настоящего изобретения молекула нуклеиновой кислоты, кодирующая лизин GN281, содержит последовательность нуклеиновой кислоты SEQ ID NO: 19, ее комплементарную последовательность или последовательность нуклеиновой кислоты, кодирующую полипептид, обладающий активностью лизина, и имеющую по меньшей мере 80%, например, по меньшей мере 85%, например, по меньшей мере 90%, например, по меньшей мере 95%, например, по меньшей мере 98% или, например, по меньшей мере 99% идентичность последовательности с SEQ ID NO: 19 или ее комплементарной последовательностью.
[158] Согласно некоторым вариантам реализации настоящего изобретения выделенный полинуклеотид содержит молекулу нуклеиновой кислоты, кодирующую полипептидную конструкцию лизин-AMP, причем указанная полипептидная конструкция лизин-AMP представляет собой лизин GN349 (SEQ ID NO: 30), или молекулу нуклеиновой кислоты, кодирующую полипептид, обладающий активностью лизина и имеющий по меньшей мере 80%, например, по меньшей мере 85%, например, по меньшей мере 90%, например, по меньшей мере 95%, например, по меньшей мере 98% или, например, по меньшей мере 99% идентичность последовательности с SEQ ID NO: 30.
[159] Согласно некоторым вариантам реализации настоящего изобретения молекула нуклеиновой кислоты, кодирующая лизин GN349, содержит последовательность нуклеиновой кислоты SEQ ID NO: 29, ее комплементарную последовательность или последовательность нуклеиновой кислоты, кодирующую полипептид, обладающий активностью лизина, и имеющую по меньшей мере 80%, например, по меньшей мере 85%, например, по меньшей мере 90%, например, по меньшей мере 95%, например, по меньшей мере 98% или, например, по меньшей мере 99% идентичность последовательности с SEQ ID NO: 29 или ее комплементарной последовательностью.
[160] Согласно некоторым вариантам реализации настоящего изобретения выделенный полинуклеотид содержит молекулу нуклеиновой кислоты, кодирующую полипептидную конструкцию лизин-AMP, причем указанная полипептидная конструкция лизин-AMP представляет собой лизин GN351 (SEQ ID NO: 32), или молекулу нуклеиновой кислоты, кодирующую полипептид, обладающий активностью лизина и имеющий по меньшей мере 80%, например, по меньшей мере 85%, например, по меньшей мере 90%, например, по меньшей мере 95%, например, по меньшей мере 98%, или, например, по меньшей мере 99% идентичность последовательности с SEQ ID NO: 32.
[161] Согласно некоторым вариантам реализации настоящего изобретения молекула нуклеиновой кислоты, кодирующая лизин GN351, содержит последовательность нуклеиновой кислоты SEQ ID NO: 31, ее комплементарную последовательность или последовательность нуклеиновой кислоты, кодирующую полипептид, обладающий активностью лизина, и имеющую по меньшей мере 80%, например, по меньшей мере 85%, например, по меньшей мере 90%, например, по меньшей мере 95%, например, по меньшей мере 98% или, например, по меньшей мере 99% идентичность последовательности с SEQ ID NO: 31 или ее комплементарной последовательностью.
[162] Согласно некоторым вариантам реализации настоящего изобретения выделенный полинуклеотид содержит молекулу нуклеиновой кислоты, кодирующую полипептидную конструкцию лизин-AMP, причем указанная полипептидная конструкция лизин-AMP представляет собой лизин GN352 (SEQ ID NO: 34), или молекулу нуклеиновой кислоты, кодирующую полипептид, обладающий активностью лизина и имеющий по меньшей мере 80%, например, по меньшей мере 85%, например, по меньшей мере 90%, например, по меньшей мере 95%, например, по меньшей мере 98% или, например, по меньшей мере 99% идентичность последовательности с SEQ ID NO: 34.
[163] Согласно некоторым вариантам реализации настоящего изобретения молекула нуклеиновой кислоты, кодирующая лизин GN352, содержит последовательность нуклеиновой кислоты SEQ ID NO: 33, ее комплементарную последовательность или последовательность нуклеиновой кислоты, кодирующую полипептид, обладающий активностью лизина, и имеющую по меньшей мере 80%, например, по меньшей мере 85%, например, по меньшей мере 90%, например, по меньшей мере 95%, например, по меньшей мере 98% или, например, по меньшей мере 99% идентичность последовательности с SEQ ID NO: 33 или ее комплементарной последовательностью.
[164] Согласно некоторым вариантам реализации настоящего изобретения выделенный полинуклеотид содержит молекулу нуклеиновой кислоты, кодирующую полипептидную конструкцию лизин-AMP, причем указанная полипептидная конструкция лизин-AMP представляет собой лизин GN353 (SEQ ID NO: 36), или молекулу нуклеиновой кислоты, кодирующую полипептид, обладающий активностью лизина и имеющий по меньшей мере 80%, например, по меньшей мере 85%, например, по меньшей мере 90%, например, по меньшей мере 95%, например, по меньшей мере 98% или, например, по меньшей мере 99% идентичность последовательности с SEQ ID NO: 36.
[165] Согласно некоторым вариантам реализации настоящего изобретения молекула нуклеиновой кислоты, кодирующая лизин GN353, содержит последовательность нуклеиновой кислоты SEQ ID NO: 35, ее комплементарную последовательность или последовательность нуклеиновой кислоты, кодирующую полипептид, обладающий активностью лизина, и имеющую по меньшей мере 80%, например, по меньшей мере 85%, например, по меньшей мере 90%, например, по меньшей мере 95%, например, по меньшей мере 98% или, например, по меньшей мере 99% идентичность последовательности с SEQ ID NO: 35 или ее комплементарной последовательностью.
[166] Согласно некоторым вариантам реализации настоящего изобретения выделенный полинуклеотид содержит молекулу нуклеиновой кислоты, кодирующую полипептидную конструкцию лизин-AMP, причем указанная полипептидная конструкция лизин-AMP представляет собой лизин GN357 (SEQ ID NO: 38), или молекулу нуклеиновой кислоты, кодирующую полипептид, обладающий активностью лизина и имеющий по меньшей мере 80%, например, по меньшей мере 85%, например, по меньшей мере 90%, например, по меньшей мере 95%, например, по меньшей мере 98% или, например, по меньшей мере 99% идентичность последовательности с SEQ ID NO: 38.
[167] Согласно некоторым вариантам реализации настоящего изобретения молекула нуклеиновой кислоты, кодирующая лизин GN357, содержит последовательность нуклеиновой кислоты SEQ ID NO: 37, ее комплементарную последовательность или последовательность нуклеиновой кислоты, кодирующую полипептид, обладающий активностью лизина, и имеющую по меньшей мере 80%, например, по меньшей мере 85%, например, по меньшей мере 90%, например, по меньшей мере 95%, например, по меньшей мере 98% или, например, по меньшей мере 99% идентичность последовательности с SEQ ID NO: 37 или ее комплементарной последовательностью.
[168] Согласно некоторым вариантам реализации настоящего изобретения выделенный полинуклеотид содержит молекулу нуклеиновой кислоты, кодирующую полипептидную конструкцию лизин-AMP, причем указанная полипептидная конструкция лизин-AMP представляет собой лизин GN359 (SEQ ID NO: 40), или молекулу нуклеиновой кислоты, кодирующую полипептид, обладающий активностью лизина и имеющий по меньшей мере 80%, например, по меньшей мере 85%, например, по меньшей мере 90%, например, по меньшей мере 95%, например, по меньшей мере 98% или, например, по меньшей мере 99% идентичность последовательности с SEQ ID NO: 40.
[169] Согласно некоторым вариантам реализации настоящего изобретения молекула нуклеиновой кислоты, кодирующая лизин GN359, содержит последовательность нуклеиновой кислоты SEQ ID NO: 39, ее комплементарную последовательность или последовательность нуклеиновой кислоты, кодирующую полипептид, обладающий активностью лизина, и имеющую по меньшей мере 80%, например, по меньшей мере 85%, например, по меньшей мере 90%, например, по меньшей мере 95%, например, по меньшей мере 98% или, например, по меньшей мере 99% идентичность последовательности с SEQ ID NO: 39 или ее комплементарной последовательностью.
[170] Согласно некоторым вариантам реализации настоящего изобретения выделенный полинуклеотид содержит молекулу нуклеиновой кислоты, кодирующую полипептидную конструкцию лизин-AMP, причем указанная полипептидная конструкция лизин-AMP представляет собой лизин GN369 (SEQ ID NO: 42), или молекулу нуклеиновой кислоты, кодирующую полипептид, обладающий активностью лизина и имеющий по меньшей мере 80%, например, по меньшей мере 85%, например, по меньшей мере 90%, например, по меньшей мере 95%, например, по меньшей мере 98% или, например, по меньшей мере 99% идентичность последовательности с SEQ ID NO: 42.
[171] Согласно некоторым вариантам реализации настоящего изобретения молекула нуклеиновой кислоты, кодирующая лизин GN369, содержит последовательность нуклеиновой кислоты SEQ ID NO: 41, ее комплементарную последовательность или последовательность нуклеиновой кислоты, кодирующую полипептид, обладающий активностью лизина, и имеющую по меньшей мере 80%, например, по меньшей мере 85%, например, по меньшей мере 90%, например, по меньшей мере 95%, например, по меньшей мере 98% или, например, по меньшей мере 99% идентичность последовательности с SEQ ID NO: 41 или ее комплементарной последовательностью.
[172] Согласно некоторым вариантам реализации настоящего изобретения выделенный полинуклеотид содержит молекулу нуклеиновой кислоты, кодирующую полипептидную конструкцию лизин-AMP, причем указанная полипептидная конструкция лизин-AMP представляет собой лизин GN370 (SEQ ID NO: 44), или молекулу нуклеиновой кислоты, кодирующую полипептид, обладающий активностью лизина и имеющий по меньшей мере 80%, например, по меньшей мере 85%, например, по меньшей мере 90%, например, по меньшей мере 95%, например, по меньшей мере 98% или, например, по меньшей мере 99% идентичность последовательности с SEQ ID NO: 44.
[173] Согласно некоторым вариантам реализации настоящего изобретения молекула нуклеиновой кислоты, кодирующая лизин GN370, содержит последовательность нуклеиновой кислоты SEQ ID NO: 43, ее комплементарную последовательность или последовательность нуклеиновой кислоты, кодирующую полипептид, обладающий активностью лизина, и имеющую по меньшей мере 80%, например, по меньшей мере 85%, например, по меньшей мере 90%, например, по меньшей мере 95%, например, по меньшей мере 98% или, например, по меньшей мере 99% идентичность последовательности с SEQ ID NO: 43 или ее комплементарной последовательностью.
[174] Согласно некоторым вариантам реализации настоящего изобретения выделенный полинуклеотид содержит молекулу нуклеиновой кислоты, кодирующую полипептидную конструкцию лизин-AMP, причем указанная полипептидная конструкция лизин-AMP представляет собой лизин GN371 (SEQ ID NO: 46), или молекулу нуклеиновой кислоты, кодирующую полипептид, обладающий активностью лизина и имеющий по меньшей мере 80%, например, по меньшей мере 85%, например, по меньшей мере 90%, например, по меньшей мере 95%, например, по меньшей мере 98% или, например, по меньшей мере 99% идентичность последовательности с SEQ ID NO: 46.
[175] Согласно некоторым вариантам реализации настоящего изобретения молекула нуклеиновой кислоты, кодирующая лизин GN371, содержит последовательность нуклеиновой кислоты SEQ ID NO: 45, ее комплементарную последовательность или последовательность нуклеиновой кислоты, кодирующую полипептид, обладающий активностью лизина, и имеющую по меньшей мере 80%, например, по меньшей мере 85%, например, по меньшей мере 90%, например, по меньшей мере 95%, например, по меньшей мере 98% или, например, по меньшей мере 99% идентичность последовательности с SEQ ID NO: 45 или ее комплементарной последовательностью.
[176] Согласно некоторым вариантам реализации настоящего изобретения выделенный полинуклеотид содержит молекулу нуклеиновой кислоты, кодирующую полипептидную конструкцию лизин-AMP, причем указанная полипептидная конструкция лизин-AMP представляет собой лизин GN93 (SEQ ID NO: 62), или молекулу нуклеиновой кислоты, кодирующую полипептид, обладающий активностью лизина и имеющий по меньшей мере 80%, например, по меньшей мере 85%, например, по меньшей мере 90%, например, по меньшей мере 95%, например, по меньшей мере 98% или, например, по меньшей мере 99% идентичность последовательности с SEQ ID NO: 62.
[177] Согласно некоторым вариантам реализации настоящего изобретения молекула нуклеиновой кислоты, кодирующая GN93, содержит последовательность нуклеиновой кислоты SEQ ID NO: 61, ее комплементарную последовательность или последовательность нуклеиновой кислоты, кодирующую полипептид, обладающий активностью лизина, и имеющую по меньшей мере 80%, например, по меньшей мере 85%, например, по меньшей мере 90%, например, по меньшей мере 95%, например, по меньшей мере 98% или, например, по меньшей мере 99% идентичность последовательности с SEQ ID NO: 61 или ее комплементарной последовательностью.
Векторы и клетки-хозяева
[178] Согласно другому аспекту настоящее изобретение относится к вектору, содержащему выделенный полинуклеотид, содержащий молекулу нуклеиновой кислоты, кодирующую любой из полипептидов лизин-AMP, полипептидов лизина, вариантов, их активных фрагментов или производных, раскрытых в настоящей заявке, или комплементарную последовательность выделенных полинуклеотидов согласно настоящему изобретению. Согласно некоторым вариантам реализации настоящего изобретения вектор представляет собой плазмиду или космиду. Согласно другим вариантам реализации настоящего изобретения вектор представляет собой вирусный вектор, причем в вирусный вектор могут быть лигированы дополнительные сегменты ДНК. Согласно некоторым вариантам реализации настоящего изобретения вектор может автономно реплицироваться в клетке-хозяине, в которую он введен. Согласно некоторым вариантам реализации настоящего изобретения вектор может быть интегрирован в геном клетки-хозяина после введения в клетку-хозяина и может реплицироваться таким образом вместе с геномом хозяина.
[179] Согласно некоторым вариантам реализации настоящего изобретения конкретные векторы, называемые в настоящей заявке «рекомбинантными векторами экспрессии» или «векторами экспрессии», могут контролировать экспрессию генов, с которыми они функционально связаны. Полинуклеотидная последовательность является «функционально связанной», когда она находится в функциональной взаимосвязи с другой нуклеотидной последовательностью. Например, промоторная или регуляторная последовательность ДНК называется «функционально связанной» с последовательностью ДНК, которая кодирует РНК и/или белок, если две последовательности функционально связаны или расположены так, что промоторная или регуляторная последовательность ДНК влияет на уровень экспрессии кодирующей или структурной последовательности ДНК. Функционально связанные последовательности ДНК, как правило, но не обязательно, являются смежными.
[180] Обычно любую систему или вектор, подходящие для поддержания, увеличения количества или экспрессии полипептида у хозяина, можно применять для экспрессии полипептидов лизин-AMP, полипептидов лизина, вариантов, их активных фрагментов или производных согласно настоящему изобретению. Соответствующая последовательность ДНК/полинуклеотида может быть вставлена в систему экспрессии с помощью любой из множества хорошо известных и обычных методик, таких как, например, изложенные в Sambrook et al., eds., Molecular Cloning: A Laboratory Manual (3 изд.), Vols. 1-3, Cold Spring Harbor Laboratory (2001). Кроме того, к полипептидам лизин-AMP, полипептидам лизина, вариантам, их активным фрагментам или производным согласно настоящему изобретению могут быть добавлены метки, чтобы обеспечить удобные способы выделения, например, c-myc, биотин, поли-His и т. д. Наборы для таких систем экспрессии доступны коммерчески.
[181] При экспрессии полинуклеотидных последовательностей, кодирующих полипептиды лизин-AMP, полипептиды лизина, варианты, их активные фрагменты или производные согласно настоящему изобретению, можно применять широкий спектр комбинаций хозяин/вектор экспрессии. Большое количество подходящих векторов известно специалистам в данной области техники и доступно коммерчески. Примеры подходящих векторов представлены, например, в Sambrook et al, eds., Molecular Cloning: A Laboratory Manual (3 изд.), Vols. 1-3, Cold Spring Harbor Laboratory (2001). Такие векторы включают, помимо прочего, векторы, происходящие из хромосом, эписом и вирусов, например, векторы, происходящие из бактериальных плазмид, из бактериофага, из транспозонов, из эписом дрожжей, из вставляемых элементов, из хромосомных элементов дрожжей, из вирусов, таких как бакуловирусы, паповавирусы, такие как SV40, вирусов осповакцины, аденовирусов, вирусов оспы птиц, вирусов псевдобешенства и ретровирусов, а также векторы, происходящие из их комбинаций, например, те, которые происходят из генетических элементов плазмид и бактериофагов, такие как космиды и фагмиды.
[182] Кроме того, векторы могут обеспечивать конститутивную или индуцируемую экспрессию полипептидов лизин-AMP, полипептидов лизина, вариантов, их активных фрагментов или производных согласно настоящему изобретению. Подходящие векторы включают, но не ограничиваются ими, производные SV40 и известные бактериальные плазмиды, например, плазмиды E. coli colEl, pCRl, pBR322, pMB9 и их производные, плазмиды, такие как RP4, pBAD24 и pBAD-TOPO; ДНК фага, например, многочисленные производные фага A, например, NM989, и ДНК других фагов, например, M13 и одноцепочечную ДНК нитчатого фага; плазмиды дрожжей, такие как плазмида 2D или ее производные; векторы, которые можно применять в эукариотических клетках, такие как векторы, которые можно применять в клетках насекомых или млекопитающих; векторы, происходящие из комбинаций плазмид и фаговых ДНК, такие как плазмиды, которые были модифицированы для применения фаговой ДНК или других последовательностей, контролирующих экспрессию; и тому подобное. Многие из упомянутых выше векторов коммерчески доступны от поставщиков, таких как New England Biolabs Inc., Addgene, Takara Bio Inc., ThermoFisher Scientific Inc. и т. д.
[183] Кроме того, векторы могут содержать различные регуляторные элементы (включая промотор, сайт связывания рибосомы, терминатор, энхансер, различные цис-элементы для контроля уровня экспрессии), причем указанный вектор сконструирован в соответствии с клеткой-хозяином. Любая из широкого спектра последовательностей, контролирующих экспрессию (последовательностей, которые контролируют экспрессию полинуклеотидной последовательности, функционально связанной с ними), может применяться в этих векторах для экспрессии полинуклеотидных последовательностей, кодирующих полипептиды лизин-AMP, полипептиды лизина, варианты, их активные фрагменты или производные согласно настоящему изобретению. Подходящие контролирующие последовательности включают, но не ограничиваются ими: ранние или поздние промоторы SV40, ЦМВ, вируса осповакцины, вируса полиомы или аденовируса, систему lac, систему trp, систему TAC, систему TRC, систему LTR, основные области оператора и промотора фага A, области контроля белка оболочки fd, промотор 3-фосфоглицераткиназы или других гликолитических ферментов, промоторы кислой фосфатазы (например, Pho5), промоторы факторов спаривания дрожжей, промотор E. coli для экспрессии в бактериях и другие промоторные последовательности, которые, как известно, контролируют экспрессию генов прокариотических или эукариотических клеток или их вирусов, и различные их комбинации. Как правило, полинуклеотидные последовательности, кодирующие полипептиды лизин-AMP, полипептиды лизина, варианты, их активные фрагменты или производные, функционально связаны с гетерологичным промотором или регуляторным элементом.
[184] Согласно другому аспекту настоящее изобретение относится к клетке-хозяину, содержащей любой из векторов, раскрытых в настоящей заявке, включая векторы экспрессии, содержащие полинуклеотидные последовательности, кодирующие полипептиды лизин-AMP, полипептиды лизина, варианты, их активные фрагменты или производные согласно настоящему изобретению. При экспрессии полипептидов согласно настоящему изобретению можно применять широкий спектр клеток-хозяев. Неограничивающие примеры клеток-хозяев, подходящих для экспрессии полипептидов согласно настоящему изобретению, включают хорошо известных эукариотических и прокариотических хозяев, таких как штаммы E. coli, Pseudomonas, Bacillus, Streptomyces, грибки, такие как дрожжи, и клетки животных, такие как клетки CHO, Rl.l, B-W и L-M, клетки почки африканской зеленой мартышки (например, COS 1, COS 7, BSCl, BSC40 и BMT10), клетки насекомых (например, Sf9), а также клетки человека и клетки растений в культуре ткани. Несмотря на то, что хозяином для экспрессии может быть любая известная клетка-хозяин для экспрессии, в типичном варианте реализации хозяин для экспрессии представляет собой один из штаммов E. coli. Эти штаммы включают, но не ограничиваются ими, коммерчески доступные штаммы E. coli, такие как Top10 (ThermoFisher Scientific, Inc.), DH5a (Thermo Fisher Scientific, Inc.), XLI-Blue (Agilent Technologies, Inc.), SCSllO (Agilent Technologies, Inc.), JM109 (Promega, Inc.), LMG194 (ATCC) и BL21 (Thermo Fisher Scientific, Inc.).
[185] Применение E. coli в качестве системы-хозяина имеет несколько преимуществ, включая: быструю кинетику роста, при которой в оптимальных условиях окружающей среды время удвоения составляет приблизительно 20 минут (Sezonov et al., J. Bacterial. 189 8746-8749 (2007)), легкое получение культур высокой плотности, легкую и быструю трансформацию экзогенной ДНК и т. д. Подробная информация, касающаяся экспрессии белка в E. coli, включая отбор плазмид, а также отбор штаммов, подробно обсуждается Rosano, G. and Ceccarelli, E., Front Microbiol., 5: 172 (2014).
[186] Эффективная экспрессия полипептидов лизин-AMP, полипептидов лизина, вариантов, их активных фрагментов или производных согласно настоящему изобретению зависит от множества факторов, таких как оптимальные сигналы экспрессии (как на уровне транскрипции, так и трансляции), правильное складывание белка и характеристики роста клеток. В отношении способов конструирования вектора и способов трансдукции сконструированного рекомбинантного вектора в клетку-хозяина можно применять обычные способы, известные в данной области техники. Поскольку понятно, что не все векторы, последовательности, контролирующие экспрессию, и хозяева будут одинаково хорошо функционировать для экспрессии полинуклеотидных последовательностей, кодирующих полипептиды лизин-AMP, полипептиды лизина, варианты, их активные фрагменты или производные согласно настоящему изобретению, специалист в данной области техники сможет выбрать подходящие векторы, последовательности, контролирующие экспрессию, и хозяев без излишних экспериментов, чтобы достичь целевой экспрессии, не отступая от объема настоящего изобретения.
[187] Согласно некоторым вариантам реализации авторы настоящего изобретения обнаружили корреляцию между уровнем экспрессии и активностью экспрессированного полипептида; в частности, в системах экспрессии в E. coli при умеренных уровнях экспрессии (например, от приблизительно 1 до 10 мг/литр) вырабатываются полипептиды лизин-AMP, полипептиды лизина, варианты, их активные фрагменты или производные с более высокими уровнями активности, чем те, которые экспрессируются при более высоких уровнях в E. coli (например, от приблизительно 20 до приблизительно 100 мг/л), причем в последнем случае иногда вырабатываются полностью неактивные полипептиды.
[188] Полипептиды лизин-AMP, полипептиды лизина, варианты, их активные фрагменты или производные согласно настоящему изобретению могут быть выделены и очищены из рекомбинантных клеточных культур с помощью хорошо известных способов, включая осаждение сульфатом аммония или этанолом, экстракцию кислотой, анионообменную или катионообменную хроматографию, фосфоцеллюлозную хроматографию, хроматографию гидрофобного взаимодействия, аффинную хроматографию, гидроксилапатитную хроматографию и лектиновую хроматографию. Для очистки полипептида лизина также можно применять высокоэффективную жидкостную хроматографию.
[189] В качестве альтернативы векторная система, применяемая для получения полипептидов лизин-AMP, полипептидов лизина, их вариантов, активных фрагментов или производных согласно настоящему изобретению, может представлять собой бесклеточную систему экспрессии. Различные бесклеточные системы экспрессии доступны коммерчески, включая, но не ограничиваясь ими, системы, доступные от Promega, LifeTechnologies, Clonetech и т. д.
[190] Как указано выше, существует множество вариантов получения и очистки белка. Примеры подходящих способов и стратегий, которые следует рассматривать при получении и очистке белка, представлены в WO 2017/049233, который полностью включен в настоящую заявку посредством ссылки, а также представлены в Structural Genomics Consortium et al., Nat. Methods., 5(2): 135-146 (2008).
Фармацевтические композиции
[191] Согласно другому аспекту настоящее изобретение относится к фармацевтической композиции, содержащей эффективное количество полипептидов лизин-AMP, полипептидов лизина, вариантов, их активных фрагментов или производных, описанных в настоящей заявке, и фармацевтически приемлемый носитель. Согласно некоторым вариантам реализации настоящего изобретения фармацевтическая композиция согласно настоящему изобретению обладает по меньшей мере одним видом активности, выбранным из ингибирования роста бактерий P. aeruginosa, уменьшения количества бактерий P. aeruginosa и/или уничтожения P. aeruginosa в отсутствие и/или в присутствии сыворотки человека.
[192] Согласно некоторым вариантам реализации настоящего изобретения фармацевтические композиции согласно настоящему изобретению также содержат один или более антибиотиков, подходящих для лечения инфекций, вызванных грамотрицательными бактериями. Типичные антибиотики включают один или более из цефтазидима, цефепима, цефоперазона, цефтобипрола, ципрофлоксацина, левофлоксацина, аминогликозидов, имипенема, меропенема, дорипенема, гентамицина, тобрамицина, амикацина, пиперациллина, тикарциллина, пенициллина, рифампицина, полимиксина B и колистина. Дополнительные подходящие антибиотики описаны в таблице 3.
[193] Согласно некоторым вариантам реализации настоящего изобретения фармацевтическая композиция представляет собой раствор, суспензию, эмульсию, порошок для ингаляции, аэрозоль или спрей. Фармацевтические композиции согласно настоящему изобретению могут быть в виде растворов, суспензий, эмульсий, таблеток, пилюль, гранул, капсул, содержащих жидкости капсул, порошков, составов с длительным высвобождением, суппозиториев, эмульсий для применения с помощью тампонов, аэрозолей, спреев, суспензий, пастилок, лепешек, конфет, инъекционных форм, жевательных резинок, мазей, мазков, пластырей с замедленным высвобождением, впитывающих жидкость салфеток и их комбинаций.
[194] Введение фармацевтических композиций согласно настоящему изобретению может быть местным, т. е. фармацевтическую композицию наносят непосредственно в том месте, где необходимо ее действие (например, непосредственно на рану). Композиции для местного применения согласно настоящему изобретению также могут содержать фармацевтически или физиологически приемлемый носитель, такой как дерматологически или отически приемлемый носитель. Такие носители, в случае дерматологически приемлемых носителей, предпочтительно совместимы с кожей, ногтями, слизистыми оболочками, тканями и/или волосами и могут содержать любой обычно используемый дерматологический носитель, соответствующий этим требованиям. В случае отически приемлемых носителей такой носитель предпочтительно совместим со всеми частями уха. Такие носители могут быть легко выбраны обычным специалистом в данной области техники.
[195] Носители для местного введения лизина, его активного фрагмента и/или полипептидной конструкции лизин-AMP согласно настоящему изобретению включают, но не ограничиваются ими, минеральное масло, жидкий вазелин, белый вазелин, пропиленгликоль, соединения полиоксиэтилена и/или полиоксипропилена, эмульгирующий воск, моностеарат сорбитана, полисорбат 60, воск сложных цетиловых эфиров, цетеариловый спирт, 2-октилдодеканол, бензиловый спирт и воду. При изготовлении кожных мазей активные компоненты согласно настоящему изобретению могут быть изготовлены на масляной углеводородной основе, безводной абсорбирующей основе, абсорбирующей основе «вода в масле», основе с удаляемой водой «масло в воде» и/или водорастворимой основе. При изготовлений отических композиций активные компоненты согласно настоящему изобретению могут быть изготовлены в виде водной полимерной суспензии, включая такие носители как декстраны, полиэтиленгликоли, поливинилпирролидон, полисахаридные гели, Gelrite®, полимеры целлюлозы, такие как гидроксипропилметилцеллюлоза, и карбоксисодержащие полимеры, такие как полимеры или сополимеры акриловой кислоты, а также другие полимерные смягчающие агенты.
[196] Композиции для местного применения в соответствии с настоящим изобретением могут быть в любом виде, подходящем для местного применения, включая водные, водно-спиртовые или масляные растворы; лосьон или сывороточные дисперсии; водные, безводные или масляные гели; эмульсии, полученные путем диспергирования жирной фазы в водной фазе (OAV или масло в воде) или наоборот (W/O или вода в масле), микроэмульсии или, в другом варианте, микрокапсулы, микрочастицы или дисперсии липидных везикул ионного и/или неионного типа, кремы, лосьоны, гели, пены (для которых обычно применяют баллон под давлением, подходящий аппликатор, эмульгатор и инертный пропеллент), эссенции, молочные смеси, суспензии или пластыри. Композиции для местного применения согласно настоящему изобретению также могут содержать адъюванты, такие как гидрофильные или липофильные гелеобразующие агенты, гидрофильные или липофильные активные агенты, консервирующие агенты, антиоксиданты, растворители, ароматизаторы, наполнители, солнцезащитные кремы, поглотители запахов и красители. Согласно другому аспекту композиции для местного применения могут быть введены в сочетании с устройствами, такими как трансдермальные пластыри, повязки, прокладки, манжеты, матриксы и бандажи, которые могут быть приклеены или иным образом ассоциированы с кожей или другой тканью субъекта, способными доставлять терапевтически эффективное количество одного или более антибактериальных пептидов в соответствии с настоящим изобретением.
[197] Согласно одному варианту реализации настоящего изобретения композиции для местного применения согласно настоящему изобретению дополнительно содержат один или более компонентов, применяемых для лечения местных ожогов. Такие компоненты, как правило, включают, но не ограничиваются ими, гидрогель пропиленгликоля; комбинацию гликоля, производного целлюлозы и водорастворимой соли алюминия; антисептик; антибиотик; и кортикостероид. Также могут быть добавлены увлажнители (такие как твердые или жидкие сложные восковые эфиры), усилители всасывания (такие как гидрофильные глины или крахмалы), агенты, повышающие вязкость, и агенты для защиты кожи. Составы для местного применения могут быть в виде полосканий, таких как жидкость для полоскания рта. См., например, WO 2004/004650.
[198] Согласно некоторым вариантам реализации настоящего изобретения введение фармацевтических композиций согласно настоящему изобретению может быть системным. Системное введение может быть энтеральным или пероральным, т. е. вещество вводят через пищеварительный тракт, парентеральным, т. е. вещество вводят другими путями, отличными от пищеварительного тракта, например, путем инъекции или ингаляции. Таким образом, полипептиды, включая полипептиды лизин-AMP, полипептиды лизина, варианты, их активные фрагменты или производные согласно настоящему изобретению, могут быть введены субъекту перорально, парентерально, путем ингаляции, местно, ректально, назально, буккально или через имплантированный резервуар или любым другим известным способом. Полипептиды лизин-AMP, полипептиды лизина, варианты, их активные фрагменты или производные согласно настоящему изобретению также могут быть введены с помощью лекарственных форм с длительным высвобождением.
[199] Для перорального введения полипептиды лизин-AMP, полипептиды лизина, варианты, их активные фрагменты или производные согласно настоящему изобретению могут быть изготовлены в виде твердых или жидких препаратов, например, таблеток, капсул, порошков, растворов, суспензий и дисперсий. Лизин, его активный фрагмент и/или полипептидные конструкции лизин-AMP могут быть изготовлены со вспомогательными веществами, такими как, например, лактоза, сахароза, кукурузный крахмал, желатин, картофельный крахмал, альгиновая кислота и/или стеарат магния.
[200] Для получения твердых композиций, таких как таблетки и пилюли, полипептиды лизин-AMP, полипептиды лизина, варианты, их активные фрагменты или производные согласно настоящему изобретению смешивают с фармацевтическим вспомогательным веществом с получением твердой предварительной композиции. Если необходимо, таблетки могут быть покрыты сахаром или кишечнорастворимым покрытием с помощью стандартных методик. Таблетки или пилюли могут быть покрыты оболочкой или комбинированы иным образом, чтобы получить лекарственную форму, обеспечивающую преимущество пролонгированного действия. Например, таблетка или пилюля может содержать внутренний компонент лекарственной формы и внешний компонент лекарственной формы, причем последний представлен в виде оболочки над первым. Два компонента лекарственной формы могут быть разделены кишечнорастворимым слоем, который обеспечивает устойчивость к разрушению в желудке и позволяет внутреннему компоненту проходить неповрежденным в двенадцатиперстную кишку или отсрочивает его высвобождение. Для таких кишечнорастворимых слоев или покрытий можно применять различные материалы, такие материалы включают ряд полимерных кислот и смесей полимерных кислот с такими материалами как шеллак, цетиловый спирт и ацетат целлюлозы.
[201] Фармацевтические композиции согласно настоящему изобретению также могут быть введены путем инъекции. Например, фармацевтические композиции могут быть введены внутримышечно, интратекально, субдермально, подкожно или внутривенно для лечения инфекций, вызванных грамотрицательными бактериями, более конкретно инфекций, вызванных P. aeruginosa. Фармацевтически приемлемый носитель может состоять из дистиллированной воды, физиологического солевого раствора, альбумина, сыворотки или любых их комбинаций. Кроме того, фармацевтические композиции для парентеральных инъекций могут содержать растворы, контролирующие pH, адъюванты (например, консерванты, смачивающие агенты, эмульгирующие агенты и диспергирующие агенты), липосомальные составы, наночастицы, дисперсии, суспензии или эмульсии, а также стерильные порошки для восстановления с получением стерильных растворов или дисперсий для инъекции непосредственно перед применением.
[202] В тех случаях, когда выбранный способ введения представляет собой парентеральную инъекцию, предпочтительным является применение изотонического состава. Обычно добавки для придания изотоничности могут включать хлорид натрия, декстрозу, маннит, сорбит и лактозу. В некоторых случаях предпочтительными являются изотонические растворы, такие как фосфатно-солевой буфер. Стабилизаторы могут включать желатин и альбумин. В состав может быть добавлен сосудосуживающий агент. Фармацевтические препараты в соответствии с этим типом применения обеспечивают стерильными и апирогенными.
[203] Согласно другому варианту реализации настоящего изобретения фармацевтические композиции согласно настоящему изобретению представляют собой композиции для ингаляции. Согласно некоторым вариантам реализации настоящего изобретения фармацевтические композиции согласно настоящему изобретению предпочтительно изготовлены в виде сухого порошка для ингаляции. В конкретных вариантах реализации фармацевтические композиции согласно настоящему изобретению также могут быть изготовлены с пропеллентом для аэрозольной доставки. Примеры подходящих пропеллентов включают, но не ограничиваются ими: дихлордифторметан, трихлорфторметан, дихлортетрафторэтан и диоксид углерода. Согласно определенным вариантам реализации настоящего изобретения составы могут быть распылены.
[204] Поверхностно-активное вещество может быть добавлено к фармацевтической композиции для ингаляции согласно настоящему изобретению для того чтобы снизить поверхностное и межфазное натяжение между лекарственными средствами и пропеллентом. Поверхностно-активное вещество может представлять собой любое подходящее нетоксичное соединение, которое не реагирует с полипептидами согласно настоящему изобретению.
[205] Примеры подходящих поверхностно-активных веществ включают, но не ограничиваются ими: олеиновую кислоту; триолеат сорбитана; хлорид цетилпиридиния; соевый лецитин; монолаурат полиоксиэтилен (20)-сорбитана; полиоксиэтилен (10)-стеариловый простой эфир; полиоксиэтилен (2)-олеиловый простой эфир; блок-сополимеры полиоксипропилена-полиоксиэтилена и этилендиамина; моностеарат полиоксиэтилен (20)-сорбитана; моноолеат полиоксиэтилен (20)-сорбитана; блок-сополимеры полиоксипропилена и полиоксиэтилена; этоксилат касторового масла; и их комбинации.
[206] Согласно некоторым вариантам реализации настоящего изобретения фармацевтические композиции для ингаляции содержат вспомогательные вещества. Примеры подходящих вспомогательных веществ включают, но не ограничиваются ими: лактозу, крахмал, сложные диэфиры пропиленгликоля и среднецепочечных алифатических кислот; сложные триэфиры глицерина и среднецепочечных, короткоцепочечных или длинноцепочечных алифатических кислот, или любую их комбинацию; перфтордиметилциклобутан; перфторциклобутан; полиэтиленгликоль; ментол; лаурогликоль; простой моноэтиловый эфир диэтиленгликоля; полигликолизированные глицериды среднецепочечных алифатических кислот; спирты; эвкалиптовое масло; короткоцепочечные алифатические кислоты; и их комбинации.
[207] Согласно некоторым вариантам реализации настоящего изобретения композиции согласно настоящему изобретению содержат назальные составы. Назальные составы включают, например, назальные спреи, назальные капли, назальные мази, назальные жидкости, назальные инъекции, назальные тампоны, бронхиальные спреи и ингаляторы, или непрямое нанесение путем применения леденцов для горла, жидкостей для полоскания ротовой полости или растворов для полоскания рта или горла, или путем применения мазей, наносимых на ноздри носа или лицо, или любую комбинацию этих и подобных способов применения.
[208] Согласно другому варианту реализации настоящего изобретения фармацевтические композиции согласно настоящему изобретению содержат дополнительный агент, включая один или более противомикробных агентов и/или один или более обычных антибиотиков. Чтобы ускорить лечение инфекции или повысить антибактериальный эффект, терапевтический агент, содержащий полипептиды лизин-AMP, полипептиды лизина, варианты, их активные фрагменты или производные согласно настоящему изобретению, также может содержать по меньшей мере один дополнительный агент, который также может усиливать бактерицидную активность пептида. Дополнительный агент может представлять собой один или более антибиотиков, применяемых для лечения инфекций, вызванных грамотрицательными бактериями. Согласно одному варианту реализации настоящего изобретения дополнительный агент представляет собой антибиотик или противомикробный агент, применяемый для лечения инфекций, вызванных P. aeruginosa.
[209] Фармацевтические композиции согласно настоящему изобретению могут быть представлены в стандартной лекарственной форме и могут быть получены с помощью любых способов, хорошо известных в данной области техники. Количество активных ингредиентов, которые могут быть объединены с материалом носителя с получением однократной лекарственной формы, будет варьироваться в зависимости от хозяина, которого лечат, продолжительности воздействия инфекционных бактерий на реципиента, размера и массы субъекта, а также конкретного способа введения. Количество активных ингредиентов, которые могут быть объединены с материалом носителя с получением однократной лекарственной формы, обычно будет представлять собой такое количество каждого соединения, которое вызывает терапевтический эффект. Обычно из ста процентов общее количество будет варьироваться от приблизительно 1 процента до приблизительно девяноста девяти процентов активных ингредиентов, предпочтительно от приблизительно 5 процентов до приблизительно 70 процентов, наиболее предпочтительно от приблизительно 10 процентов до приблизительно 30 процентов.
Дозировка и введение
[210] Вводимые дозировки зависят от ряда факторов, включая активность инфекции, которую лечат; возраст, состояние здоровья и общее физическое состояние субъекта, подлежащего лечению; активность конкретного полипептида лизин-AMP, полипептида лизина, варианта, его активного фрагмента или производного, характера и активности антибиотика, если таковой присутствует, с которым полипептид лизин-AMP, полипептид лизина, вариант, его активный фрагмент или производное в соответствии с настоящим раскрытием вводят в паре, а также комбинированного эффекта такой пары. Обычно ожидается, что эффективные количества полипептида лизин-AMP, полипептида лизина, варианта, его активного фрагмента или производного согласно настоящему изобретению, подлежащего введению, находятся в пределах диапазона 1-50 мг/кг (или от 1 до 50 мкг/мл) при введении 1-4 раза в сутки в течение периода до 14 дней. Антибиотик, если он также применяется, будет введен согласно стандартным схемам дозирования или в меньших количествах с учетом синергии. Однако все такие дозировки и схемы (будь то полипептида лизин-AMP, полипептида лизина, варианта, его активного фрагмента или производного, или любого антибиотика, вводимого вместе с ними) подлежат оптимизации. Оптимальные дозировки могут быть определены путем выполнения пробных экспериментов по оценке эффективности in vitro и in vivo, известных специалистам в данной области техники, но с учетом настоящего изобретения.
[211] Предусмотрено, что полипептиды лизин-AMP, полипептиды лизина, варианты, их активные фрагменты или производные согласно настоящему изобретению обеспечивают бактерицидный и, при применении в меньших количествах, бактериостатический эффект и активны против ряда устойчивых к антибиотикам бактерий и не ассоциированы с развивающейся устойчивостью. На основании настоящего изобретения в клинических условиях полипептиды лизин-AMP, полипептиды лизина, варианты, их активные фрагменты или производные согласно настоящему изобретению могут быть эффективной альтернативой (или добавкой, или компонентом) композиций для лечения инфекций, возникающих из-за бактерий с лекарственной и множественной лекарственной устойчивостью, по отдельности или вместе с антибиотиками (включая антибиотики, к которым развилась устойчивость). Существующие механизмы устойчивости грамотрицательных бактерий не должны отрицательно влиять на чувствительность к литической активности полипептидов согласно настоящему изобретению.
[212] Согласно некоторым вариантам реализации настоящего изобретения время воздействия полипептидов лизин-AMP, полипептидов лизина, вариантов, их активных фрагментов или производных согласно настоящему изобретению может влиять на целевую концентрацию единиц активного полипептида на мл. Носители, которые классифицируются как носители с «длительным» или «медленным» высвобождением (такие как, например, определенные назальные спреи или пастилки), могут иметь или обеспечивать более низкую концентрацию единиц полипептида на мл, но в течение более длительного периода времени, в то время как носитель с «коротким» или «быстрым» высвобождением (такой как, например, раствор для полоскания рта и горла) может иметь или обеспечивать высокую концентрацию единиц полипептида (мкг) на мл, но в течение более короткого периода времени. Существуют обстоятельства, при которых желательной может быть более высокая дозировка единиц/мл или более низкая дозировка единиц/мл.
[213] Для любого полипептида согласно настоящему изобретению терапевтически эффективная доза может быть первоначально оценена либо в анализах на культуре клеток, либо в моделях на животных, обычно на мышах, кроликах, собаках или свиньях. Модель на животных также можно применять для достижения целевого диапазона концентраций и пути введения. Полученную информацию затем можно применять для определения эффективных доз, а также путей введения у человека. Дозировку и введение далее можно корректировать, чтобы обеспечить достаточные уровни активного ингредиента или поддержать целевой эффект. Дополнительные факторы, которые могут быть приняты во внимание, включают степень тяжести патологического состояния, возраст, массу и пол пациента; рацион, целевую продолжительность лечения, способ введения, время и частоту введения, комбинацию (и) лекарственных средств, чувствительность реакции, а также толерантность/ответ на терапию и заключение лечащего врача.
[214] Схема лечения может включать ежедневное введение (например, однократно, дважды, трижды и т. д. ежедневно), один раз в два дня (например, однократно, дважды, трижды и т. д. через день), два раза в неделю, еженедельно, один раз в две недели, один раз в месяц и т. д. Согласно одному варианту реализации настоящего изобретения лечение можно проводить в виде непрерывной инфузии. Стандартные дозы могут быть введены несколько раз. Интервалы также могут быть нерегулярными, согласно показаниям на основании мониторинга клинических симптомов. В качестве альтернативы стандартная доза может быть введена в виде состава с длительным высвобождением, и в этом случае требуется менее частое введение. Дозировка и частота могут варьироваться в зависимости от пациента. Специалист в данной области техники поймет, что такие руководящие принципы будут корректироваться для локализованного введения, например, интраназального, ингаляционного, ректального и т. д., или для системного введения, например, перорального, ректального (например, через клизму), в/м (внутримышечного), в/б (внутрибрюшинного), в/в (внутривенного), п/к (подкожного), трансуретрального и т. п.
Способы
[215] Полипептиды лизин-AMP, полипептиды лизина, варианты, их активные фрагменты или производные согласно настоящему изобретению можно применять in vivo, например, для лечения бактериальных инфекций, вызванных грамотрицательными бактериями, такими как P. aeruginosa, у субъекта, а также in vitro, например, для уменьшения уровня бактериального загрязнения, например, на поверхности, например, медицинского устройства.
[216] Например, согласно некоторым вариантам реализации настоящего изобретения полипептиды лизин-AMP, полипептиды лизина, варианты, их активные фрагменты или производные согласно настоящему изобретению можно применять для предотвращения, контроля, разрушения и лечения бактериальной биопленки, образованной грамотрицательными бактериями, такими как P. aeruginosa. Образование биопленки происходит, когда микробные клетки прилипают друг к другу и внедряются в матрикс из внеклеточного полимерного вещества (EPS) на поверхности. Рост микробов в такой защищенной среде, которая обогащена биомакромолекулами (например, полисахаридами, нуклеиновыми кислотами и белками) и питательными веществами, обеспечивает усиленное взаимодействие микробов и повышенную вирулентность. Биопленка может образовываться в любой поддерживающей среде, включая живые и неживые поверхности, такие как слизистые пробки легких при муковисцидозе, загрязненные катетеры, контактные линзы и т. д. (Sharma et al. Biologicals, 42(1):1-7 (2014), которая полностью включена в настоящую заявку посредством ссылки). Таким образом, согласно одному варианту реализации настоящего изобретения полипептиды лизин-AMP, полипептиды лизина, варианты, их активные фрагменты или производные согласно настоящему изобретению можно применять для предотвращения, контроля, разрушения и лечения бактериальных инфекций, вызванных грамотрицательными бактериями, такими как P. aeruginosa, когда бактерии защищены бактериальной биопленкой.
[217] Согласно одному аспекту настоящее изобретение относится к способу лечения бактериальной инфекции, вызванной P. aeruginosa и необязательно одним или более дополнительными видами грамотрицательных бактерий, описанных в настоящей заявке, включающему введение субъекту, у которого диагностирована, который подвержен риску или который демонстрирует симптомы бактериальной инфекции, фармацевтической композиции, описанной в настоящей заявке.
[218] Термины «инфекция» и «бактериальная инфекция» предназначены для включения инфекций дыхательных путей (RTI), таких как инфекции дыхательных путей у пациентов с муковисцидозом (МВ), инфекции нижних дыхательных путей, такие как острый рецидив хронического бронхита (ACEB), острый синусит, внебольничная пневмония (CAP), внутрибольничная пневмония (HAP) и внутрибольничные инфекции дыхательных путей; заболеваний, передающихся половым путем, таких как гонококковый цервицит и гонококковый уретрит; инфекций мочевыводящих путей; острого отита среднего уха; сепсиса, включая неонатальную септицемию и связанный с катетером сепсис; и остеомиелита. Также предусмотрены инфекции, вызванные бактериями с лекарственной устойчивостью и бактериями с множественной лекарственной устойчивостью.
[219] Неограничивающие примеры инфекций, вызванных P. aeruginosa, включают: A) Внутрибольничные инфекции: 1. Инфекции дыхательных путей, в частности, у пациентов с муковисцидозом и пациентов с искусственной вентиляцией легких; 2. Бактериемию и сепсис; 3. Раневые инфекции, в частности, у пострадавших от ожогов; 4. Инфекции мочевыводящих путей; 5. Послеоперационные инфекции на инвазивных устройствах; 6. Эндокардит в результате внутривенного введения загрязненных лекарственных растворов; 7. Инфекции у пациентов с синдромом приобретенного иммунодефицита, получающих противораковую химиотерапию, стероидную терапию, имеющих гематологические злокачественные новообразования, после трансплантации органа, заместительной почечной терапии и имеющих другие состояния с тяжелой нейтропенией. B) Внебольничные инфекции: 1. Внебольничные инфекции дыхательных путей; 2. Менингит; 3. Фолликулит и инфекции слухового прохода, вызванные загрязненной водой; 4. Злокачественный отит наружного уха у пожилых людей и диабетиков. 5. Остеомиелит пяточной кости у детей; 6. Глазные инфекции, обычно ассоциированные с загрязненной контактной линзой; 7. Кожные инфекции, такие как инфекции ногтей, у людей, руки которых часто подвергаются воздействию воды; 8. Инфекции желудочно-кишечного тракта; и 9. Инфекции костно-мышечной системы.
[220] Один или более дополнительных видов грамотрицательных бактерий в соответствии со способами согласно настоящему изобретению могут включать любой из дополнительных видов грамотрицательных бактерий, описанных в настоящей заявке. Как правило, дополнительные виды грамотрицательных бактерий выбраны из одного или более из Acinetobacter baumannii, Acinetobacter haemolyticus, Actinobacillus actinomycetemcomitans, Aeromonas hydrophila, Bacteroides spp., например, Bacteroides fragilis, Bacteroides theataioatamicron, Bacteroides distasonis, Bacteroides ovatus, Bacteroides vulgatus, Bartonella Quintana, Bordetella pertussis, Brucella spp., например, Brucella melitensis, Burkholderia spp, например, Burkholderia cepacia, Burkholderia pseudomallei и Burkholderia mallei, Fusobacterium, Prevotella corporis, Prevotella intermedia, Prevotella endodontalis, Porphyromonas asaccharolytica, Campylobacter jejuni, Campylobacter fetus, Campylobacter coli, Chlamydia spp., например Chlamydia pneumoniae и Chlamydia trachomatis, Citrobacter freundii, Citrobacter koseri, Coxiella burnetii, Edwarsiella spp., например, Edwarsiella tarda, Eikenella corrodens, Enterobacter spp., например, Enterobacter cloacae, Enterobacter aerogenes и Enterobacter agglomerans, Escherichia coli, Francisella tularensis, Haemophilus influenzae, Haemophilus ducreyi, Helicobacter pylori, Kingella kingae, Klebsiella spp., например, Klebsiella pneumoniae, Klebsiella oxytoca, Klebsiella rhinoscleromatis и Klebsiella ozaenae, Legionella penumophila, Moraxella spp., например, Moraxella catarrhalis, Morganella spp., например, Morganella morganii, Neisseria gonorrhoeae, Neisseria meningitidis, P. aeruginosa, Pasteurella multocida, Plesiomonas shigelloides, Proteus mirabilis, Proteus vulgaris, Proteus penneri, Proteus myxofaciens, Providencia spp., например, Providencia stuartii, Providencia rettgeri, Providencia alcalifaciens, Pseudomonas fluorescens, Salmonella typhi, Salmonella typhimurium, Salmonella paratyphi, Serratia spp., например, Serratia marcescens, Shigella spp., например, Shigella flexneri, Shigella boydii, Shigella sonnei и Shigella dysenteriae, Stenotrophomonas maltophilia, Streptobacillus moniliformis, Vibrio cholerae, Vibrio parahaemolyticus, Vibrio vulnificus, Vibrio alginolyticus, Yersinia enterocolitica, Yersinia pestis, Yersinia pseudotuberculosis, Chlamydia pneumoniae, Chlamydia trachomatis, Ricketsia prowazekii, Coxiella burnetii, Ehrlichia chafeensis и/или Bartonella hensenae.
[221] Более типично по меньшей мере один другой вид грамотрицательных бактерий выбран из одного или более из Acinetobacter baumannii, Bordetella pertussis, Burkholderia cepacia, Burkholderia pseudomallei, Burkholderia mallei, Campylobacter jejuni, Campylobacter coli, Enterobacter cloacae, Enterobacter aerogenes, Escherichia coli, Francisella tularensis, Haemophilus influenzae, Haemophilus ducreyi, Helicobacter pylori, Klebsiella pneumoniae, Legionella penumophila, Moraxella catarrhalis, Morganella morganii, Neisseria gonorrhoeae, Neisseria meningitidis, Pasteurella multocida, Proteus mirabilis, Proteus vulgaris, Salmonella typhi, Serratia marcescens, Shigella flexneri, Shigella boydii, Shigella sonnei, Shigella dysenteriae, Stenotrophomonas maltophilia, Vibrio cholerae и/или Chlamydia pneumoniae.
[222] Еще более типично по меньшей мере один другой вид грамотрицательных бактерий выбран из одного или более из Salmonella typhimurium, Salmonella typhi, Shigella spp., Escherichia coli, Acinetobacter baumanii, Klebsiella pneumonia, Neisseria gonorrhoeae, Neisseria meningitides, Serratia spp. Proteus mirabilis, Morganella morganii, Providencia spp., Edwardsiella spp., Yersinia spp., Haemophilus influenza, Bartonella quintana, Brucella spp., Bordetella pertussis, Burkholderia spp., Moraxella spp., Francisella tularensis, Legionella pneumophila, Coxiella burnetii, Bacteroides spp., Enterobacter spp. и/или Chlamydia spp.
[223] Еще более типично один или более дополнительных видов грамотрицательных бактерий представляют собой Klebsiella spp., Enterobacter spp., Escherichia coli, Citrobacter freundii, Salmonella typhimurium, Yersinia pestis и/или Franciscella tulerensis.
[224] Согласно некоторым вариантам реализации настоящего изобретения инфекция, вызванная грамотрицательными бактериями, приводит к локализованной инфекции, такой как местная бактериальная инфекция, например, кожная рана. Согласно другим вариантам реализации настоящего изобретения бактериальная инфекция представляет собой системную патогенную бактериальную инфекцию. Распространенные грамотрицательные патогены и ассоциированные инфекции перечислены в таблице 2 настоящего раскрытия. Они предназначены для применения в качестве примеров бактериальных инфекций, которые можно лечить, облегчать или предотвращать с помощью лизинов, их активных фрагментов и полипептидных конструкций лизин-AMP согласно настоящему изобретению, и не предназначены для ограничения.
Таблица 2. Важные с медицинской точки зрения грамотрицательные бактерии и ассоциированные с ними заболевания.
[225] Согласно некоторым вариантам реализации настоящего изобретения полипептиды лизин-AMP, полипептиды лизина, варианты, их активные фрагменты или производные согласно настоящему изобретению применяют для лечения субъекта, подверженного риску заражения инфекцией, вызванной P. aeruginosa и/или другой грамотрицательной бактерией. Субъекты, подверженные риску заражения P. aeruginosa или другой инфекцией, вызванной грамотрицательными бактериями, включают, например, пациентов с муковисцидозом, пациентов с нейтропенией, пациентов с некротическим энтероколитом, жертв ожогов, пациентов с раневыми инфекциями и, в более общем смысле, пациентов в больничных условиях, в частности, хирургических пациентов и пациентов, которых лечат с применением имплантируемого медицинского устройства, такого как катетер, например, центральный венозный катетер, устройства Хикмана или электрофизиологических сердечных устройств, например, кардиостимуляторов и имплантируемых дефибрилляторов. Другие группы пациентов, подверженных риску инфекции, вызванной грамотрицательными бактериями, включая P. aeruginosa, включают, но не ограничиваются ими, пациентов с имплантированными протезами, такими как полная замена сустава (например, полная замена коленного сустава или тазобедренного сустава).
[226] Согласно другому аспекту настоящее изобретение относится к способу предотвращения или лечения бактериальной инфекции, включающему совместное введение субъекту, у которого диагностирована, который подвержен риску или который демонстрирует симптомы бактериальной инфекции, комбинации первого эффективного количества композиции, содержащей эффективное количество полипептида лизин-AMP, полипептида лизина, варианта, активного фрагмента указанного лизина или производного, описанных в настоящей заявке, и второго эффективного количества антибиотика, подходящего для лечения инфекции, вызванной грамотрицательными бактериями.
[227] Полипептиды лизин-AMP, полипептиды лизина, варианты, их активные фрагменты или производные согласно настоящему изобретению могут быть введены совместно с антибиотиками стандартного ухода или с антибиотиками крайней меры, по отдельности или в различных комбинациях, как известно специалистам в данной области техники. Стандартные антибиотики, применяемые против P. aeruginosa, описаны в таблице 3. Антибиотики для других грамотрицательных бактерий, таких как Klebsiella spp., Enterobacter spp., Escherichia coli, Citrobacter freundii, Salmonella typhimurium, Yersinia pestis и Franciscella tulerensis, аналогичны тем, которые представлены в таблице 3 для P. aeruginosa.
Таблица 3. Антибиотики, применяемые для лечения Pseudomonas aeruginosa
Пиперациллин-тазобактам
Цефепим
Цефоперазон
Левофлоксацин
Меропенем
Дорипенем
Тобрамицин
Амикацин
Полимиксин B
[228] В более конкретных вариантах реализации антибиотик выбран из одного или более из цефтазидима, цефепима, цефоперазона, цефтобипрола, ципрофлоксацина, левофлоксацина, аминогликозидов, имипенема, меропенема, дорипенема, гентамицина, тобрамицина, амикацина, пиперациллина, тикарциллина, пенициллина, рифампицина, полимиксина B и колистина.
[229] Комбинирование полипептидов лизин-AMP, полипептидов лизина, вариантов, их активных фрагментов или производных согласно настоящему изобретению с антибиотиками обеспечивает эффективную антибактериальную схему. Согласно некоторым вариантам реализации настоящего изобретения совместное введение полипептидов лизин-AMP, полипептидов лизина, вариантов, их активных фрагментов или производных согласно настоящему изобретению с одним или более антибиотиками можно осуществлять при уменьшенных дозах и количествах либо полипептидов лизин-AMP, полипептидов лизина, вариантов, их активных фрагментов или производных, либо антибиотика, либо и того, и другого, и/или с уменьшенной частотой, и/или продолжительностью лечения с повышенной бактерицидной и бактериостатической активностью, уменьшенным риском развития устойчивости к антибиотикам и с уменьшенным риском вредных неврологических или почечных побочных эффектов (таких как те, которые ассоциированы с применением колистина или полимиксина B). Предыдущие исследования показали, что общая кумулятивная доза колистина ассоциирована с повреждением почек, это свидетельствует о том, что снижение дозировки или уменьшение продолжительности лечения с применением комбинированной терапии полипептидами лизин-AMP, полипептидами лизина, вариантами, их активными фрагментами или производными может снизить частоту нефротоксичности (Spapen et al. Ann Intensive Care. 1: 14 (2011), которая полностью включена в настоящую заявку посредством ссылки). В настоящей заявке термин «уменьшенная доза» относится к дозе одного активного ингредиента в комбинации по сравнению с монотерапией этим же активным ингредиентом. Согласно некоторым вариантам реализации настоящего изобретения доза лизинов, их активных фрагментов и полипептидных конструкций лизин-AMP или антибиотика в комбинации может быть субоптимальной или даже подпороговой по сравнению с соответствующей монотерапией.
[230] Согласно некоторым вариантам реализации настоящего изобретения предложен способ повышения антибиотической активности одного или более антибиотиков против грамотрицательных бактерий по сравнению с активностью указанных антибиотиков, применяемых по отдельности, путем введения субъекту одного или более полипептидов лизин-AMP, полипептидов лизина, вариантов, их активных фрагментов или производных, раскрытых в настоящей заявке, вместе с антибиотиком, представляющим интерес. Комбинация эффективна против бактерий и позволяет преодолеть устойчивость к антибиотику и/или применять антибиотик в более низких дозах, уменьшая нежелательные побочные эффекты, такие как нефротоксические и нейротоксические эффекты полимиксина B.
[231] Полипептиды лизин-AMP, полипептиды лизина, варианты, их активные фрагменты или производные, необязательно в комбинации с антибиотиками согласно настоящему изобретению, также можно комбинировать с дополнительными агентами, повышающими проницаемость внешней мембраны грамотрицательных бактерий, включая, но не ограничиваясь ими, хелаторы металлов, такие как, например, ЭДТА, трис, молочная кислота, лактоферрин, полимиксины, лимонная кислота (Vaara M. Microbial Rev. 56(3):395-441 (1992), которая полностью включена в настоящую заявку посредством ссылки).
[232] Согласно еще одному аспекту настоящее изобретение относится к способу ингибирования роста или уменьшения количества, или уничтожения по меньшей мере одного вида грамотрицательных бактерий, причем указанный способ включает приведение бактерий в контакт с композицией, содержащей эффективное количество полипептидов лизин-AMP, полипептидов лизина, вариантов, их активных фрагментов или производных, описанных в настоящей заявке, причем указанные полипептиды лизин-AMP, полипептиды лизина, варианты, их активные фрагменты или производные ингибируют рост или уменьшают количество, или приводят к уничтожению P. aeruginosa и необязательно по меньшей мере одного другого вида грамотрицательных бактерий.
[233] Согласно некоторым вариантам реализации настоящего изобретения ингибирование роста или уменьшение количества, или уничтожение по меньшей мере одного вида грамотрицательных бактерий включает приведение бактерий в контакт с лизинами, их активными фрагментами и/или полипептидными конструкциями лизин-AMP, описанными в настоящей заявке, причем указанные бактерии присутствуют на поверхности, например, медицинских устройств, полов, лестниц, стен и столешниц в больницах и других зданиях, связанных со здравоохранением или общественным использованием, и поверхностях оборудования в операционных комнатах, отделениях неотложной помощи, больничных палатах, клиниках, ванных комнатах и т. п.
[243] Примеры медицинских устройств, которые могут быть защищены с применением полипептидов лизин-AMP, полипептидов лизина, вариантов, их активных фрагментов или производных, описанных в настоящей заявке, включают, но не ограничиваются ими, трубки и другие устройства, контактирующие с поверхностью тела, такие как мочевые катетеры, катетеры для извлечения слизистой, отсасывающие катетеры, пупочные канюли, контактные линзы, внутриматочные устройства, интравагинальные и внутрикишечные устройства, эндотрахеальные трубки, бронхоскопы, зубные протезы и ортодонтические устройства, хирургические инструменты, стоматологические инструменты, трубки, стоматологические водопроводы, ткани, бумагу, индикаторные полоски (например, бумажные индикаторные полоски или пластиковые индикаторные полоски), клеи (например, гидрогелевые клеи, термоплавкие клеи или клеи на основе растворителей), бандажи, тканевые повязки или заживляющие устройства и окклюзионные пластыри, а также любые другие устройства, контактирующие с поверхностью тела, используемые в области медицины. Устройства могут включать электроды, внешние протезы, фиксирующие ленты, компрессионные бандажи и мониторы различных типов. Медицинские устройства также могут включать любое устройство, которое может быть помещено в место вставки или имплантации, такое как кожа рядом с местом вставки или имплантации, и которое может иметь по меньшей мере одну поверхность, которая восприимчива к колонизации грамотрицательными бактериями.
ПРИМЕРЫ
Пример 1. Активность лизинов и полипептидных конструкций лизин-AMP в среде с добавлением сыворотки человека.
Материалы и методы
[235] Грамотрицательные бактерии, например, P. aeruginosa, культивировали и тестировали в средах с казаминовыми кислотами (CAA) (5 г/л казаминовых кислот, Ameresco/VWR; 5,2 мМ K2HPO4, Sigma-Aldrich; 1 мМ MgSO4, Sigma-Aldrich), CAA с добавлением 150 мМ NaCl или CAA с добавлением 2,5% сыворотки человека (тип AB, мужская, объединенная; Sigma-Aldrich).
Определение минимальных ингибирующих концентраций (МИК)
[236] Значения МИК определяли с использованием модификации стандартного референсного метода микроразведения в бульоне, определенного Институтом клинических и лабораторных стандартов (CLSI), CLSI. 2015. Methods for Dilution Antimicrobial Susceptibility Tests for Bacteria That Grow Aerobically; Approved Standard-10 изд. Clinical and Laboratory Standards Institute, Уэйн, Пенсильвания. Модификация была основана на замене бульона Мюллера-Хинтона либо средами CAA (с NaCl и без него), либо CAA с добавлением 2,5% сыворотки человека. МИК представляет собой минимальную концентрацию пептида, достаточную для подавления по меньшей мере 80% роста бактерий по сравнению с контролем.
Результаты
[237] Результаты этих экспериментов обобщены в таблице 4 ниже. В таблице 4 также представлена молекулярная масса и изоэлектрическая точка полипептидов согласно настоящему изобретению. Эффект конкретной структурной модификации на изоэлектрическую точку (более высокая pI способствует проникновению через внешнюю мембрану) и активность (согласно оценке МИК) можно определить путем сравнения последовательностей и компонентов различных полипептидов.
[238] Например, можно наблюдать эффекты одиночных точечных мутаций на GN316 (SEQ ID NO: 22). GN394 (SEQ ID NO: 48) имеет более низкую pI и более высокую активность в CAA, но более низкую активность в CAA с сывороткой человека. Уменьшение активности в сыворотке человека меньше для GN396 (SEQ ID NO: 50), в то время как GN408 (SEQ ID NO: 52) является значительно более активным как в присутствии, так и в отсутствие сыворотки человека. С другой стороны, GN418 (SEQ ID NO: 54) теряет активность в средах CAA без добавок, но приобретает активность в присутствии сыворотки человека.
[239] Одиночная точечная мутация в GN217 (SEQ ID NO: 8) улучшает его активность по сравнению с GN37 как в отсутствие, так и в присутствии сыворотки человека. Модификации GN37 (SEQ ID NO: 84), которые позволяют получить GN218 (SEQ ID NO: 10), GN223 (SEQ ID NO: 12), GN239 (SEQ ID NO: 14) и GN243 (SEQ ID NO: 16), приводят к очень сильной активности в присутствии сыворотки человека. Аналогичные наблюдения могут быть сделаны на основе сравнения последовательности и компонентов других полипептидов.
Пример 2. Синергия между антибиотиками и лизинами или полипептидными конструкциями лизин-AMP.
[240] Синергию между GN76 (SEQ ID NO: 203), GN121 (SEQ ID NO: 175), GN123 (SEQ ID NO: 173), GN351 (SEQ ID NO: 32), GN370 (SEQ ID NO: 44) и GN428 (SEQ ID NO: 60) и 12 различными антибиотиками исследовали в анализах методом «шахматной доски» с использованием среды CAA, дополненной сывороткой человека, как описано в настоящей заявке, с использованием устойчивого к карбапенему клинического штамма WC-452. Значения индекса фракционной ингибирующей концентрации (FICI) определяли для всех комбинаций; значения <0,5 указывают на синергию.
[241]Как показано в таблице 5 ниже, упомянутые выше лизины и конструкции лизин-AMP являются синергическими для широкого ряда антибиотиков. Для имипенема синергия соответствует повторной сенсибилизации к карбапенемовому антибиотику.
Пример 3. Повторная сенсибилизация клинических штаммов, устойчивых к карбапенему, с применением антибиотиков в комбинации с лизинами.
[242] Способность GN121 (SEQ ID NO: 175) или GN123 (SEQ ID NO: 173) повторно сенсибилизировать устойчивые к карбапенему штаммы P. aeruginosa к карбапенемам оценивали путем комбинирования каждого из упомянутых выше лизинов с двумя карбапенемами, т. е. имипенемом (IPM) или меропенемом (MEM). Оценивали до семи изолятов, устойчивых к карбапенему. Повторная сенсибилизация происходит в синергических комбинациях, в которых значения МИК карбапенема уменьшаются ниже установленных пограничных значений, например, значение МИК≤2 для чувствительных к карбапенему изолятов, значение МИК равное 4 для изолятов с промежуточной чувствительностью к карбапенему и значение МИК≥8 для устойчивых к карбапенему изолятов. См. Институт клинических и лабораторных стандартов (CLSI), CLSI. 2019. M100 Performance Standards for Antimicrobial Susceptibility Testing; 29 изд. Clinical and Laboratory Standards Institute, Уэйн, Пенсильвания.
[243] Как указано в таблицах 6-9, синергические комбинации с GN123 (SEQ ID NO: 173) или GN121 (SEQ ID NO: 175) продемонстрировали уменьшение МИК IPM и MEM до значений ниже пограничного значения для каждого из семи исследованных карбапенемов. Эти наблюдения согласуются с повторной сенсибилизацией.
Пример 4. Повторная сенсибилизация клинических штаммов, устойчивых к карбапенему, с применением антибиотиков в комбинации с дополнительными лизинами или конструкциями лизин-AMP.
[244] Способность GN351 (SEQ ID NO: 32), GN370 (SEQ ID NO: 44) или GN428 (SEQ ID NO: 60) повторно сенсибилизировать устойчивые к карбапенему клинические штаммы к карбапенемам оценивали путем комбинирования каждого из упомянутых выше лизинов или полипептидных конструкций лизин-AMP с IPM или MEM. Оценивали WC-452, устойчивый к карбапенему изолят. Как отмечено в примере 3 выше, повторная сенсибилизация происходит в синергических комбинациях, в которых значения МИК карбапенема уменьшаются ниже пограничных значений, описанных ранее.
[245] Как показано в таблице 10, синергические комбинации с GN351 (SEQ ID NO: 32), GN370 (SEQ ID NO: 44) или GN428 (SEQ ID NO: 60) продемонстрировали уменьшение МИК IPM и MEM до значений ниже пограничного значения для WC-452. Эти наблюдения согласуются с повторной сенсибилизацией.
[246] Результаты в примерах 3 и 4 свидетельствуют о том, что лизины и полипептидные конструкции лизин-AMP, описанные в настоящей заявке, могут повторно сенсибилизировать P. aeruginosa к карбапенемовым антибиотикам, уменьшая МИК ниже пограничных значений in vitro. Эта новая способность лизинов и полипептидных конструкций лизин-AMP повторно сенсибилизировать устойчивые к антибиотикам штаммы к обычным антибиотикам указывает на преимущество этих биопрепаратов в качестве терапевтических средств для борьбы и обращения устойчивости к противомикробным агентам.
Таблица 4. Чувствительность лизинов или полипептидных конструкций лизин-AMP в сыворотке человека
Таблица 5. Синергия между антибиотиками и лизинами или полипептидными конструкциями лизин-AMP
(МИК)
(МИК)
(МИК)
(МИК)
(МИК)
Таблица 6. Повторная сенсибилизация грамотрицательных бактерий с применением комбинации имипенема и GN123 (SEQ ID NO: 173)
(R) = устойчивый (S) = чувствительный
Таблица 7. Повторная сенсибилизация грамотрицательных бактерий с применением комбинации меропенема и GN123 (SEQ ID NO: 173)
(R) = устойчивый (S) = чувствительный
Таблица 8. Повторная сенсибилизация грамотрицательных бактерий с применением комбинации имипенема и GN121 (SEQ ID NO: 175)
(R) = устойчивый (S) = чувствительный
Таблица 9. Повторная сенсибилизация грамотрицательных бактерий с применением комбинации меропенема и GN121 (SEQ ID NO: 175)
(R) = устойчивый; (S) = чувствительный
Таблица 10. Повторная сенсибилизация грамотрицательных бактерий с применением комбинаций MEM или IPM и GN351 (SEQ ID NO: 32), GN370 (SEQ ID NO: 44) или GN428 (SEQ ID NO: 60)
--->
Перечень последовательностей
<110> CONTRAFECT CORPORATION
<120> ПОЛИПЕПТИДНЫЕ КОНСТРУКЦИИ ЛИЗИН-ПРОТИВОМИКРОБНЫЙ ПЕПТИД (AMP), ЛИЗИНЫ, ВЫДЕЛЕННЫЕ ПОЛИНУКЛЕОТИДЫ, КОДИРУЮЩИЕ ИХ, А ТАКЖЕ ВАРИАНТЫ ИХ ПРИМЕНЕНИЯ
<130> 0341.0003-PCT
<140>
<141>
<150> 62/722,793
<151> 2018-08-24
<150> 62/721,969
<151> 2018-08-23
<150> 62/650,235
<151> 2018-03-29
<160> 203
<170> PatentIn, версия 3.5
<210> 1
<211> 636
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический полинуклеотид
<220>
<223> Лизин GN168
<220>
<221> CDS
<222> (28)..(612)
<400> 1
gtttaacttt aagaaggaga attcacc atg agg tta aaa atg gca cga aga aga 54
Met Arg Leu Lys Met Ala Arg Arg Arg
1 5
tac aga ctt ccg cga cgt aga agt cga aga ctt ttt tca aga act gca 102
Tyr Arg Leu Pro Arg Arg Arg Ser Arg Arg Leu Phe Ser Arg Thr Ala
10 15 20 25
ttg agg atg cat cca aga aat agg ctt cga aga att atg cgt ggc ggc 150
Leu Arg Met His Pro Arg Asn Arg Leu Arg Arg Ile Met Arg Gly Gly
30 35 40
att agg ttc acc gcg ggc ggc acc gcg ggc ggc cgt aca tcc caa cga 198
Ile Arg Phe Thr Ala Gly Gly Thr Ala Gly Gly Arg Thr Ser Gln Arg
45 50 55
ggc atc gac ctc atc aaa tcc ttc gag ggc ctg cgc ctg tcc gct tac 246
Gly Ile Asp Leu Ile Lys Ser Phe Glu Gly Leu Arg Leu Ser Ala Tyr
60 65 70
cag gac tcg gtg ggt gtc tgg acc ata ggt tac ggc acc act cgg ggc 294
Gln Asp Ser Val Gly Val Trp Thr Ile Gly Tyr Gly Thr Thr Arg Gly
75 80 85
gtc acc cgc tac atg acg atc acc gtc gag cag gcc gag cgg atg ctg 342
Val Thr Arg Tyr Met Thr Ile Thr Val Glu Gln Ala Glu Arg Met Leu
90 95 100 105
tcg aac gac att cag cgc ttc gag cca gag cta gac agg ctg gcg aag 390
Ser Asn Asp Ile Gln Arg Phe Glu Pro Glu Leu Asp Arg Leu Ala Lys
110 115 120
gtg cca ctg aac cag aac cag tgg gat gcc ctg atg agc ttc gtg tac 438
Val Pro Leu Asn Gln Asn Gln Trp Asp Ala Leu Met Ser Phe Val Tyr
125 130 135
aac ctg ggc gcg gcc aat ctg gcg tcg tcc acg ctg ctc gac ctg ctg 486
Asn Leu Gly Ala Ala Asn Leu Ala Ser Ser Thr Leu Leu Asp Leu Leu
140 145 150
aac aag ggt gac tac cag gga gca gcg gac cag ttc ccg cat tgg gtg 534
Asn Lys Gly Asp Tyr Gln Gly Ala Ala Asp Gln Phe Pro His Trp Val
155 160 165
aat gcg ggc ggt aag cgc ttg gat ggt ctg gtt aag cgt cga gca gcc 582
Asn Ala Gly Gly Lys Arg Leu Asp Gly Leu Val Lys Arg Arg Ala Ala
170 175 180 185
gag cgt gcg ctg ttc ctg gag cca cta tcg tgataaaagc ttggctgttt 632
Glu Arg Ala Leu Phe Leu Glu Pro Leu Ser
190 195
tggc 636
<210> 2
<211> 195
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический полипептид
<400> 2
Met Arg Leu Lys Met Ala Arg Arg Arg Tyr Arg Leu Pro Arg Arg Arg
1 5 10 15
Ser Arg Arg Leu Phe Ser Arg Thr Ala Leu Arg Met His Pro Arg Asn
20 25 30
Arg Leu Arg Arg Ile Met Arg Gly Gly Ile Arg Phe Thr Ala Gly Gly
35 40 45
Thr Ala Gly Gly Arg Thr Ser Gln Arg Gly Ile Asp Leu Ile Lys Ser
50 55 60
Phe Glu Gly Leu Arg Leu Ser Ala Tyr Gln Asp Ser Val Gly Val Trp
65 70 75 80
Thr Ile Gly Tyr Gly Thr Thr Arg Gly Val Thr Arg Tyr Met Thr Ile
85 90 95
Thr Val Glu Gln Ala Glu Arg Met Leu Ser Asn Asp Ile Gln Arg Phe
100 105 110
Glu Pro Glu Leu Asp Arg Leu Ala Lys Val Pro Leu Asn Gln Asn Gln
115 120 125
Trp Asp Ala Leu Met Ser Phe Val Tyr Asn Leu Gly Ala Ala Asn Leu
130 135 140
Ala Ser Ser Thr Leu Leu Asp Leu Leu Asn Lys Gly Asp Tyr Gln Gly
145 150 155 160
Ala Ala Asp Gln Phe Pro His Trp Val Asn Ala Gly Gly Lys Arg Leu
165 170 175
Asp Gly Leu Val Lys Arg Arg Ala Ala Glu Arg Ala Leu Phe Leu Glu
180 185 190
Pro Leu Ser
195
<210> 3
<211> 567
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический полинуклеотид
<220>
<223> Лизин GN176
<220>
<221> CDS
<222> (28)..(543)
<400> 3
gtttaacttt aagaaggaga attcacc atg agc ttt aac gtg acc ccg aaa ttt 54
Met Ser Phe Asn Val Thr Pro Lys Phe
1 5
aaa cgc tgg cag ctg tat ttt cgc ggc cgc atg tgg acc gcg ggc ggc 102
Lys Arg Trp Gln Leu Tyr Phe Arg Gly Arg Met Trp Thr Ala Gly Gly
10 15 20 25
acc gcg ggc ggc cgt aca tcc caa cga ggc atc gac ctc atc aaa tcc 150
Thr Ala Gly Gly Arg Thr Ser Gln Arg Gly Ile Asp Leu Ile Lys Ser
30 35 40
ttc gag ggc ctg cgc ctg tcc gct tac cag gac tcg gtg ggt gtc tgg 198
Phe Glu Gly Leu Arg Leu Ser Ala Tyr Gln Asp Ser Val Gly Val Trp
45 50 55
acc ata ggt tac ggc acc act cgg ggc gtc acc cgc tac atg acg atc 246
Thr Ile Gly Tyr Gly Thr Thr Arg Gly Val Thr Arg Tyr Met Thr Ile
60 65 70
acc gtc gag cag gcc gag cgg atg ctg tcg aac gac att cag cgc ttc 294
Thr Val Glu Gln Ala Glu Arg Met Leu Ser Asn Asp Ile Gln Arg Phe
75 80 85
gag cca gag cta gac agg ctg gcg aag gtg cca ctg aac cag aac cag 342
Glu Pro Glu Leu Asp Arg Leu Ala Lys Val Pro Leu Asn Gln Asn Gln
90 95 100 105
tgg gat gcc ctg atg agc ttc gtg tac aac ctg ggc gcg gcc aat ctg 390
Trp Asp Ala Leu Met Ser Phe Val Tyr Asn Leu Gly Ala Ala Asn Leu
110 115 120
gcg tcg tcc acg ctg ctc gac ctg ctg aac aag ggt gac tac cag gga 438
Ala Ser Ser Thr Leu Leu Asp Leu Leu Asn Lys Gly Asp Tyr Gln Gly
125 130 135
gca gcg gac cag ttc ccg cat tgg gtg aat gcg ggc ggt aag cgc ttg 486
Ala Ala Asp Gln Phe Pro His Trp Val Asn Ala Gly Gly Lys Arg Leu
140 145 150
gat ggt ctg gtt aag cgt cga gca gcc gag cgt gcg ctg ttc ctg gag 534
Asp Gly Leu Val Lys Arg Arg Ala Ala Glu Arg Ala Leu Phe Leu Glu
155 160 165
cca cta tcg tgataaaagc ttggctgttt tggc 567
Pro Leu Ser
170
<210> 4
<211> 172
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический полипептид
<400> 4
Met Ser Phe Asn Val Thr Pro Lys Phe Lys Arg Trp Gln Leu Tyr Phe
1 5 10 15
Arg Gly Arg Met Trp Thr Ala Gly Gly Thr Ala Gly Gly Arg Thr Ser
20 25 30
Gln Arg Gly Ile Asp Leu Ile Lys Ser Phe Glu Gly Leu Arg Leu Ser
35 40 45
Ala Tyr Gln Asp Ser Val Gly Val Trp Thr Ile Gly Tyr Gly Thr Thr
50 55 60
Arg Gly Val Thr Arg Tyr Met Thr Ile Thr Val Glu Gln Ala Glu Arg
65 70 75 80
Met Leu Ser Asn Asp Ile Gln Arg Phe Glu Pro Glu Leu Asp Arg Leu
85 90 95
Ala Lys Val Pro Leu Asn Gln Asn Gln Trp Asp Ala Leu Met Ser Phe
100 105 110
Val Tyr Asn Leu Gly Ala Ala Asn Leu Ala Ser Ser Thr Leu Leu Asp
115 120 125
Leu Leu Asn Lys Gly Asp Tyr Gln Gly Ala Ala Asp Gln Phe Pro His
130 135 140
Trp Val Asn Ala Gly Gly Lys Arg Leu Asp Gly Leu Val Lys Arg Arg
145 150 155 160
Ala Ala Glu Arg Ala Leu Phe Leu Glu Pro Leu Ser
165 170
<210> 5
<211> 582
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический полинуклеотид
<220>
<223> Лизин GN178
<220>
<221> CDS
<222> (28)..(558)
<400> 5
gtttaacttt aagaaggaga attcacc atg cca cca att ttt agc aaa ctg gcg 54
Met Pro Pro Ile Phe Ser Lys Leu Ala
1 5
ggc aaa aaa att aaa aac ctg ctg att agc ggc ctg aaa ggc ggt agc 102
Gly Lys Lys Ile Lys Asn Leu Leu Ile Ser Gly Leu Lys Gly Gly Ser
10 15 20 25
ggc agc ggt agc ggt agc ggc agc ccg cgt aca tcc caa cga ggc atc 150
Gly Ser Gly Ser Gly Ser Gly Ser Pro Arg Thr Ser Gln Arg Gly Ile
30 35 40
gac ctc atc aaa tcc ttc gag ggc ctg cgc ctg tcc gct tac cag gac 198
Asp Leu Ile Lys Ser Phe Glu Gly Leu Arg Leu Ser Ala Tyr Gln Asp
45 50 55
tcg gtg ggt gtc tgg acc ata ggt tac ggc acc act cgg ggc gtc acc 246
Ser Val Gly Val Trp Thr Ile Gly Tyr Gly Thr Thr Arg Gly Val Thr
60 65 70
cgc tac atg acg atc acc gtc gag cag gcc gag cgg atg ctg tcg aac 294
Arg Tyr Met Thr Ile Thr Val Glu Gln Ala Glu Arg Met Leu Ser Asn
75 80 85
gac att cag cgc ttc gag cca gag cta gac agg ctg gcg aag gtg cca 342
Asp Ile Gln Arg Phe Glu Pro Glu Leu Asp Arg Leu Ala Lys Val Pro
90 95 100 105
ctg aac cag aac cag tgg gat gcc ctg atg agc ttc gtg tac aac ctg 390
Leu Asn Gln Asn Gln Trp Asp Ala Leu Met Ser Phe Val Tyr Asn Leu
110 115 120
ggc gcg gcc aat ctg gcg tcg tcc acg ctg ctc gac ctg ctg aac aag 438
Gly Ala Ala Asn Leu Ala Ser Ser Thr Leu Leu Asp Leu Leu Asn Lys
125 130 135
ggt gac tac cag gga gca gcg gac cag ttc ccg cat tgg gtg aat gcg 486
Gly Asp Tyr Gln Gly Ala Ala Asp Gln Phe Pro His Trp Val Asn Ala
140 145 150
ggc ggt aag cgc ttg gat ggt ctg gtt aag cgt cga gca gcc gag cgt 534
Gly Gly Lys Arg Leu Asp Gly Leu Val Lys Arg Arg Ala Ala Glu Arg
155 160 165
gcg ctg ttc ctg gag cca cta tcg tgataaaagc ttggctgttt tggc 582
Ala Leu Phe Leu Glu Pro Leu Ser
170 175
<210> 6
<211> 177
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический полипептид
<400> 6
Met Pro Pro Ile Phe Ser Lys Leu Ala Gly Lys Lys Ile Lys Asn Leu
1 5 10 15
Leu Ile Ser Gly Leu Lys Gly Gly Ser Gly Ser Gly Ser Gly Ser Gly
20 25 30
Ser Pro Arg Thr Ser Gln Arg Gly Ile Asp Leu Ile Lys Ser Phe Glu
35 40 45
Gly Leu Arg Leu Ser Ala Tyr Gln Asp Ser Val Gly Val Trp Thr Ile
50 55 60
Gly Tyr Gly Thr Thr Arg Gly Val Thr Arg Tyr Met Thr Ile Thr Val
65 70 75 80
Glu Gln Ala Glu Arg Met Leu Ser Asn Asp Ile Gln Arg Phe Glu Pro
85 90 95
Glu Leu Asp Arg Leu Ala Lys Val Pro Leu Asn Gln Asn Gln Trp Asp
100 105 110
Ala Leu Met Ser Phe Val Tyr Asn Leu Gly Ala Ala Asn Leu Ala Ser
115 120 125
Ser Thr Leu Leu Asp Leu Leu Asn Lys Gly Asp Tyr Gln Gly Ala Ala
130 135 140
Asp Gln Phe Pro His Trp Val Asn Ala Gly Gly Lys Arg Leu Asp Gly
145 150 155 160
Leu Val Lys Arg Arg Ala Ala Glu Arg Ala Leu Phe Leu Glu Pro Leu
165 170 175
Ser
<210> 7
<211> 429
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический полинуклеотид
<220>
<223> Лизин GN217
<220>
<221> CDS
<222> (28)..(405)
<400> 7
gtttaacttt aagaaggaga attcacc atg acc tac acc ctg tct aaa cgt tct 54
Met Thr Tyr Thr Leu Ser Lys Arg Ser
1 5
ctg gac aac ctg aaa ggt gtt cac ccg gac ctg gtt gct gtt gtt cac 102
Leu Asp Asn Leu Lys Gly Val His Pro Asp Leu Val Ala Val Val His
10 15 20 25
cgt gct atc cag ctg acc ccg gtt gac ttc gct gtt atc gaa ggt ctg 150
Arg Ala Ile Gln Leu Thr Pro Val Asp Phe Ala Val Ile Glu Gly Leu
30 35 40
cgt tct gtt tct cgt cag aaa gaa ctg gtt gct gct ggt gct tct aaa 198
Arg Ser Val Ser Arg Gln Lys Glu Leu Val Ala Ala Gly Ala Ser Lys
45 50 55
acc atg aac tct cgt cac ctg acc ggt cac gct gtt gac ctg gct gct 246
Thr Met Asn Ser Arg His Leu Thr Gly His Ala Val Asp Leu Ala Ala
60 65 70
tac gtt aac ggt atc cat tgg gac tgg ccg ctg tac gac gct atc gct 294
Tyr Val Asn Gly Ile His Trp Asp Trp Pro Leu Tyr Asp Ala Ile Ala
75 80 85
gtt gct gtt aaa gct gct gct aaa gaa ctg ggt gtt gct atc gtt tgg 342
Val Ala Val Lys Ala Ala Ala Lys Glu Leu Gly Val Ala Ile Val Trp
90 95 100 105
ggt ggt gac tgg acc acc ttc aaa gac ggt ccg cac ttc gaa ctg gac 390
Gly Gly Asp Trp Thr Thr Phe Lys Asp Gly Pro His Phe Glu Leu Asp
110 115 120
cgt tct aaa tac cgt taataaaagc ttggctgttt tggc 429
Arg Ser Lys Tyr Arg
125
<210> 8
<211> 126
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический полипептид
<400> 8
Met Thr Tyr Thr Leu Ser Lys Arg Ser Leu Asp Asn Leu Lys Gly Val
1 5 10 15
His Pro Asp Leu Val Ala Val Val His Arg Ala Ile Gln Leu Thr Pro
20 25 30
Val Asp Phe Ala Val Ile Glu Gly Leu Arg Ser Val Ser Arg Gln Lys
35 40 45
Glu Leu Val Ala Ala Gly Ala Ser Lys Thr Met Asn Ser Arg His Leu
50 55 60
Thr Gly His Ala Val Asp Leu Ala Ala Tyr Val Asn Gly Ile His Trp
65 70 75 80
Asp Trp Pro Leu Tyr Asp Ala Ile Ala Val Ala Val Lys Ala Ala Ala
85 90 95
Lys Glu Leu Gly Val Ala Ile Val Trp Gly Gly Asp Trp Thr Thr Phe
100 105 110
Lys Asp Gly Pro His Phe Glu Leu Asp Arg Ser Lys Tyr Arg
115 120 125
<210> 9
<211> 501
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический полинуклеотид
<220>
<223> Лизин GN218
<220>
<221> CDS
<222> (28)..(477)
<400> 9
gtttaacttt aagaaggaga attcacc atg acc tac acc ctg tct aaa cgt tct 54
Met Thr Tyr Thr Leu Ser Lys Arg Ser
1 5
ctg gac aac ctg aaa ggt gtt cac ccg gac ctg gtt gct gtt gtt cac 102
Leu Asp Asn Leu Lys Gly Val His Pro Asp Leu Val Ala Val Val His
10 15 20 25
cgt gct atc cag ctg acc ccg gtt gac ttc gct gtt atc gaa ggt ctg 150
Arg Ala Ile Gln Leu Thr Pro Val Asp Phe Ala Val Ile Glu Gly Leu
30 35 40
cgt tct gtt tct cgt cag aaa gaa ctg gtt gct gct ggt gct tct aaa 198
Arg Ser Val Ser Arg Gln Lys Glu Leu Val Ala Ala Gly Ala Ser Lys
45 50 55
acc atg aac tct cgt cac ctg acc ggt cac gct gtt gac ctg gct gct 246
Thr Met Asn Ser Arg His Leu Thr Gly His Ala Val Asp Leu Ala Ala
60 65 70
tac gtt aac ggt atc cgt tgg gac tgg ccg ctg tac gac gct atc gct 294
Tyr Val Asn Gly Ile Arg Trp Asp Trp Pro Leu Tyr Asp Ala Ile Ala
75 80 85
gtt gct gtt aaa gct gct gct aaa gaa ctg ggt gtt gct atc gtt tgg 342
Val Ala Val Lys Ala Ala Ala Lys Glu Leu Gly Val Ala Ile Val Trp
90 95 100 105
ggt ggt gac tgg acc acc ttc aaa gac ggt ccg cac ttc gaa ctg gac 390
Gly Gly Asp Trp Thr Thr Phe Lys Asp Gly Pro His Phe Glu Leu Asp
110 115 120
cgt tct aaa tac ggc ggt ggc tct gga ggt ggt ggg tcc ggc ggt ggc 438
Arg Ser Lys Tyr Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly
125 130 135
tct cgc ctg aaa aaa att ggc aaa gtg ctg aaa tgg att taataaaagc 487
Ser Arg Leu Lys Lys Ile Gly Lys Val Leu Lys Trp Ile
140 145 150
ttggctgttt tggc 501
<210> 10
<211> 150
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический полипептид
<400> 10
Met Thr Tyr Thr Leu Ser Lys Arg Ser Leu Asp Asn Leu Lys Gly Val
1 5 10 15
His Pro Asp Leu Val Ala Val Val His Arg Ala Ile Gln Leu Thr Pro
20 25 30
Val Asp Phe Ala Val Ile Glu Gly Leu Arg Ser Val Ser Arg Gln Lys
35 40 45
Glu Leu Val Ala Ala Gly Ala Ser Lys Thr Met Asn Ser Arg His Leu
50 55 60
Thr Gly His Ala Val Asp Leu Ala Ala Tyr Val Asn Gly Ile Arg Trp
65 70 75 80
Asp Trp Pro Leu Tyr Asp Ala Ile Ala Val Ala Val Lys Ala Ala Ala
85 90 95
Lys Glu Leu Gly Val Ala Ile Val Trp Gly Gly Asp Trp Thr Thr Phe
100 105 110
Lys Asp Gly Pro His Phe Glu Leu Asp Arg Ser Lys Tyr Gly Gly Gly
115 120 125
Ser Gly Gly Gly Gly Ser Gly Gly Gly Ser Arg Leu Lys Lys Ile Gly
130 135 140
Lys Val Leu Lys Trp Ile
145 150
<210> 11
<211> 573
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический полинуклеотид
<220>
<223> Лизин GN223
<220>
<221> CDS
<222> (28)..(549)
<400> 11
gtttaacttt aagaaggaga attcacc atg acc tac acc ctg tct aaa cgt tct 54
Met Thr Tyr Thr Leu Ser Lys Arg Ser
1 5
ctg gac aac ctg aaa ggt gtt cac ccg gac ctg gtt gct gtt gtt cac 102
Leu Asp Asn Leu Lys Gly Val His Pro Asp Leu Val Ala Val Val His
10 15 20 25
cgt gct atc cag ctg acc ccg gtt gac ttc gct gtt atc gaa ggt ctg 150
Arg Ala Ile Gln Leu Thr Pro Val Asp Phe Ala Val Ile Glu Gly Leu
30 35 40
cgt tct gtt tct cgt cag aaa gaa ctg gtt gct gct ggt gct tct aaa 198
Arg Ser Val Ser Arg Gln Lys Glu Leu Val Ala Ala Gly Ala Ser Lys
45 50 55
acc atg aac tct cgt cac ctg acc ggt cac gct gtt gac ctg gct gct 246
Thr Met Asn Ser Arg His Leu Thr Gly His Ala Val Asp Leu Ala Ala
60 65 70
tac gtt aac ggt atc cgt tgg gac tgg ccg ctg tac gac gct atc gct 294
Tyr Val Asn Gly Ile Arg Trp Asp Trp Pro Leu Tyr Asp Ala Ile Ala
75 80 85
gtt gct gtt aaa gct gct gct aaa gaa ctg ggt gtt gct atc gtt tgg 342
Val Ala Val Lys Ala Ala Ala Lys Glu Leu Gly Val Ala Ile Val Trp
90 95 100 105
ggt ggt gac tgg acc acc ttc aaa gac ggt ccg cac ttc gaa ctg gac 390
Gly Gly Asp Trp Thr Thr Phe Lys Asp Gly Pro His Phe Glu Leu Asp
110 115 120
cgt tct aaa tac cgt cca cca ggc ggt ggc tct gga ggt ggt ggg tcc 438
Arg Ser Lys Tyr Arg Pro Pro Gly Gly Gly Ser Gly Gly Gly Gly Ser
125 130 135
ggc ggt ggc tct tcg aag aag gcg tcg agg aag agt ttt act aag ggt 486
Gly Gly Gly Ser Ser Lys Lys Ala Ser Arg Lys Ser Phe Thr Lys Gly
140 145 150
gcc gtt aag gtt cat aag aaa aat gtt cct act cgt gtt cct atg cgt 534
Ala Val Lys Val His Lys Lys Asn Val Pro Thr Arg Val Pro Met Arg
155 160 165
ggc ggt att agg ctt taataaaagc ttggctgttt tggc 573
Gly Gly Ile Arg Leu
170
<210> 12
<211> 174
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетическая
<400> 12
Met Thr Tyr Thr Leu Ser Lys Arg Ser Leu Asp Asn Leu Lys Gly Val
1 5 10 15
His Pro Asp Leu Val Ala Val Val His Arg Ala Ile Gln Leu Thr Pro
20 25 30
Val Asp Phe Ala Val Ile Glu Gly Leu Arg Ser Val Ser Arg Gln Lys
35 40 45
Glu Leu Val Ala Ala Gly Ala Ser Lys Thr Met Asn Ser Arg His Leu
50 55 60
Thr Gly His Ala Val Asp Leu Ala Ala Tyr Val Asn Gly Ile Arg Trp
65 70 75 80
Asp Trp Pro Leu Tyr Asp Ala Ile Ala Val Ala Val Lys Ala Ala Ala
85 90 95
Lys Glu Leu Gly Val Ala Ile Val Trp Gly Gly Asp Trp Thr Thr Phe
100 105 110
Lys Asp Gly Pro His Phe Glu Leu Asp Arg Ser Lys Tyr Arg Pro Pro
115 120 125
Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Ser Ser Lys Lys
130 135 140
Ala Ser Arg Lys Ser Phe Thr Lys Gly Ala Val Lys Val His Lys Lys
145 150 155 160
Asn Val Pro Thr Arg Val Pro Met Arg Gly Gly Ile Arg Leu
165 170
<210> 13
<211> 519
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический полинуклеотид
<220>
<223> Лизин GN239
<220>
<221> CDS
<222> (28)..(495)
<400> 13
gtttaacttt aagaaggaga attcacc atg acc tac acc ctg tct aaa cgt tct 54
Met Thr Tyr Thr Leu Ser Lys Arg Ser
1 5
ctg gac aac ctg aaa ggt gtt cac ccg gac ctg gtt gct gtt gtt cac 102
Leu Asp Asn Leu Lys Gly Val His Pro Asp Leu Val Ala Val Val His
10 15 20 25
cgt gct atc cag ctg acc ccg gtt gac ttc gct gtt atc gaa ggt ctg 150
Arg Ala Ile Gln Leu Thr Pro Val Asp Phe Ala Val Ile Glu Gly Leu
30 35 40
cgt tct gtt tct cgt cag aaa gaa ctg gtt gct gct ggt gct tct aaa 198
Arg Ser Val Ser Arg Gln Lys Glu Leu Val Ala Ala Gly Ala Ser Lys
45 50 55
acc atg aac tct cgt cac ctg acc ggt cac gct gtt gac ctg gct gct 246
Thr Met Asn Ser Arg His Leu Thr Gly His Ala Val Asp Leu Ala Ala
60 65 70
tac gtt aac ggt atc cgt tgg gac tgg ccg ctg tac gac gct atc gct 294
Tyr Val Asn Gly Ile Arg Trp Asp Trp Pro Leu Tyr Asp Ala Ile Ala
75 80 85
gtt gct gtt aaa gct gct gct aaa gaa ctg ggt gtt gct atc gtt tgg 342
Val Ala Val Lys Ala Ala Ala Lys Glu Leu Gly Val Ala Ile Val Trp
90 95 100 105
ggt ggt gac tgg acc acc ttc aaa gac ggt ccg cac ttc gaa ctg gac 390
Gly Gly Asp Trp Thr Thr Phe Lys Asp Gly Pro His Phe Glu Leu Asp
110 115 120
cgt tct aaa tac ggc ggt ggc tct gga ggt ggt ggg tcc ggc ggt ggc 438
Arg Ser Lys Tyr Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly
125 130 135
tct cgt aaa aaa acc cgt aaa cgt ctg aaa aaa atc ggt aaa gtt ctg 486
Ser Arg Lys Lys Thr Arg Lys Arg Leu Lys Lys Ile Gly Lys Val Leu
140 145 150
aaa tgg atc taataaaagc ttggctgttt tggc 519
Lys Trp Ile
155
<210> 14
<211> 156
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический полипептид
<400> 14
Met Thr Tyr Thr Leu Ser Lys Arg Ser Leu Asp Asn Leu Lys Gly Val
1 5 10 15
His Pro Asp Leu Val Ala Val Val His Arg Ala Ile Gln Leu Thr Pro
20 25 30
Val Asp Phe Ala Val Ile Glu Gly Leu Arg Ser Val Ser Arg Gln Lys
35 40 45
Glu Leu Val Ala Ala Gly Ala Ser Lys Thr Met Asn Ser Arg His Leu
50 55 60
Thr Gly His Ala Val Asp Leu Ala Ala Tyr Val Asn Gly Ile Arg Trp
65 70 75 80
Asp Trp Pro Leu Tyr Asp Ala Ile Ala Val Ala Val Lys Ala Ala Ala
85 90 95
Lys Glu Leu Gly Val Ala Ile Val Trp Gly Gly Asp Trp Thr Thr Phe
100 105 110
Lys Asp Gly Pro His Phe Glu Leu Asp Arg Ser Lys Tyr Gly Gly Gly
115 120 125
Ser Gly Gly Gly Gly Ser Gly Gly Gly Ser Arg Lys Lys Thr Arg Lys
130 135 140
Arg Leu Lys Lys Ile Gly Lys Val Leu Lys Trp Ile
145 150 155
<210> 15
<211> 570
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический полинуклеотид
<220>
<223> Лизин GN243
<220>
<221> CDS
<222> (28)..(546)
<400> 15
gtttaacttt aagaaggaga attcacc atg acc tac acc ctg tct aaa cgt tct 54
Met Thr Tyr Thr Leu Ser Lys Arg Ser
1 5
ctg gac aac ctg aaa ggt gtt cac ccg gac ctg gtt gct gtt gtt cac 102
Leu Asp Asn Leu Lys Gly Val His Pro Asp Leu Val Ala Val Val His
10 15 20 25
cgt gct atc cag ctg acc ccg gtt gac ttc gct gtt atc gaa ggt ctg 150
Arg Ala Ile Gln Leu Thr Pro Val Asp Phe Ala Val Ile Glu Gly Leu
30 35 40
cgt tct gtt tct cgt cag aaa gaa ctg gtt gct gct ggt gct tct aaa 198
Arg Ser Val Ser Arg Gln Lys Glu Leu Val Ala Ala Gly Ala Ser Lys
45 50 55
acc atg aac tct cgt cac ctg acc ggt cac gct gtt gac ctg gct gct 246
Thr Met Asn Ser Arg His Leu Thr Gly His Ala Val Asp Leu Ala Ala
60 65 70
tac gtt aac ggt atc cgt tgg gac tgg ccg ctg tac gac gct atc gct 294
Tyr Val Asn Gly Ile Arg Trp Asp Trp Pro Leu Tyr Asp Ala Ile Ala
75 80 85
gtt gct gtt aaa gct gct gct aaa gaa ctg ggt gtt gct atc gtt tgg 342
Val Ala Val Lys Ala Ala Ala Lys Glu Leu Gly Val Ala Ile Val Trp
90 95 100 105
ggt ggt gac tgg acc acc ttc aaa gac ggt ccg cac ttc gaa ctg gac 390
Gly Gly Asp Trp Thr Thr Phe Lys Asp Gly Pro His Phe Glu Leu Asp
110 115 120
cgt tct aaa tac cgt aaa aaa acc cgt aaa cgt ctg aaa aaa atc ggt 438
Arg Ser Lys Tyr Arg Lys Lys Thr Arg Lys Arg Leu Lys Lys Ile Gly
125 130 135
aaa gtt ctg aaa tgg atc cca cca ggc ggt ggc tct gga ggt ggt ggg 486
Lys Val Leu Lys Trp Ile Pro Pro Gly Gly Gly Ser Gly Gly Gly Gly
140 145 150
tcc ggc ggt ggc tct acc cgc aaa cgc ctg aaa aaa att ggc aaa gtg 534
Ser Gly Gly Gly Ser Thr Arg Lys Arg Leu Lys Lys Ile Gly Lys Val
155 160 165
ctg aaa tgg att taataaaagc ttggctgttt tggc 570
Leu Lys Trp Ile
170
<210> 16
<211> 173
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический полипептид
<400> 16
Met Thr Tyr Thr Leu Ser Lys Arg Ser Leu Asp Asn Leu Lys Gly Val
1 5 10 15
His Pro Asp Leu Val Ala Val Val His Arg Ala Ile Gln Leu Thr Pro
20 25 30
Val Asp Phe Ala Val Ile Glu Gly Leu Arg Ser Val Ser Arg Gln Lys
35 40 45
Glu Leu Val Ala Ala Gly Ala Ser Lys Thr Met Asn Ser Arg His Leu
50 55 60
Thr Gly His Ala Val Asp Leu Ala Ala Tyr Val Asn Gly Ile Arg Trp
65 70 75 80
Asp Trp Pro Leu Tyr Asp Ala Ile Ala Val Ala Val Lys Ala Ala Ala
85 90 95
Lys Glu Leu Gly Val Ala Ile Val Trp Gly Gly Asp Trp Thr Thr Phe
100 105 110
Lys Asp Gly Pro His Phe Glu Leu Asp Arg Ser Lys Tyr Arg Lys Lys
115 120 125
Thr Arg Lys Arg Leu Lys Lys Ile Gly Lys Val Leu Lys Trp Ile Pro
130 135 140
Pro Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Ser Thr Arg
145 150 155 160
Lys Arg Leu Lys Lys Ile Gly Lys Val Leu Lys Trp Ile
165 170
<210> 17
<211> 528
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический полинуклеотид
<220>
<223> Лизин GN280
<220>
<221> CDS
<222> (28)..(504)
<400> 17
gtttaacttt aagaaggaga attcacc atg aaa ctc agc gaa aaa cga gca ctg 54
Met Lys Leu Ser Glu Lys Arg Ala Leu
1 5
ttc acc cag ctg ctt gcc cag tta att ctt tgg gca gga act cag gat 102
Phe Thr Gln Leu Leu Ala Gln Leu Ile Leu Trp Ala Gly Thr Gln Asp
10 15 20 25
cga gtg tca gta gcc ttg gat caa gtg aaa agg aca cag gct gaa gct 150
Arg Val Ser Val Ala Leu Asp Gln Val Lys Arg Thr Gln Ala Glu Ala
30 35 40
gat gcc aat gct aag tct gga gca ggc att agg aac tct ctc cat cta 198
Asp Ala Asn Ala Lys Ser Gly Ala Gly Ile Arg Asn Ser Leu His Leu
45 50 55
ctg gga tta gcc ggt gat ctt atc ctc tac aag gat ggt aaa tac atg 246
Leu Gly Leu Ala Gly Asp Leu Ile Leu Tyr Lys Asp Gly Lys Tyr Met
60 65 70
gat aag agc gag gat tat aag ttc ctg gga gat tac tgg aag agt ctc 294
Asp Lys Ser Glu Asp Tyr Lys Phe Leu Gly Asp Tyr Trp Lys Ser Leu
75 80 85
cat cct ctt tgt cgg tgg ggc gga gat ttt aaa agc cgt cct gat ggt 342
His Pro Leu Cys Arg Trp Gly Gly Asp Phe Lys Ser Arg Pro Asp Gly
90 95 100 105
aat cat ttc tcc ttg gaa cac gaa gga gtg caa cgt aaa aaa acc cgt 390
Asn His Phe Ser Leu Glu His Glu Gly Val Gln Arg Lys Lys Thr Arg
110 115 120
aaa cgt ctg aaa aaa atc ggt aaa gtt ctg aaa tgg atc cca cca acc 438
Lys Arg Leu Lys Lys Ile Gly Lys Val Leu Lys Trp Ile Pro Pro Thr
125 130 135
gcg ggc ggc acc gcg ggc ggc acc cgc aaa cgc ctg aaa aaa att ggc 486
Ala Gly Gly Thr Ala Gly Gly Thr Arg Lys Arg Leu Lys Lys Ile Gly
140 145 150
aaa gtg ctg aaa tgg att taataaaagc ttggctgttt tggc 528
Lys Val Leu Lys Trp Ile
155
<210> 18
<211> 159
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический полипептид
<400> 18
Met Lys Leu Ser Glu Lys Arg Ala Leu Phe Thr Gln Leu Leu Ala Gln
1 5 10 15
Leu Ile Leu Trp Ala Gly Thr Gln Asp Arg Val Ser Val Ala Leu Asp
20 25 30
Gln Val Lys Arg Thr Gln Ala Glu Ala Asp Ala Asn Ala Lys Ser Gly
35 40 45
Ala Gly Ile Arg Asn Ser Leu His Leu Leu Gly Leu Ala Gly Asp Leu
50 55 60
Ile Leu Tyr Lys Asp Gly Lys Tyr Met Asp Lys Ser Glu Asp Tyr Lys
65 70 75 80
Phe Leu Gly Asp Tyr Trp Lys Ser Leu His Pro Leu Cys Arg Trp Gly
85 90 95
Gly Asp Phe Lys Ser Arg Pro Asp Gly Asn His Phe Ser Leu Glu His
100 105 110
Glu Gly Val Gln Arg Lys Lys Thr Arg Lys Arg Leu Lys Lys Ile Gly
115 120 125
Lys Val Leu Lys Trp Ile Pro Pro Thr Ala Gly Gly Thr Ala Gly Gly
130 135 140
Thr Arg Lys Arg Leu Lys Lys Ile Gly Lys Val Leu Lys Trp Ile
145 150 155
<210> 19
<211> 543
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический полинуклеотид
<220>
<223> Лизин GN281
<220>
<221> CDS
<222> (28)..(519)
<400> 19
gtttaacttt aagaaggaga attcacc atg aaa ctc agc gaa aaa cga gca ctg 54
Met Lys Leu Ser Glu Lys Arg Ala Leu
1 5
ttc acc cag ctg ctt gcc cag tta att ctt tgg gca gga act cag gat 102
Phe Thr Gln Leu Leu Ala Gln Leu Ile Leu Trp Ala Gly Thr Gln Asp
10 15 20 25
cga gtg tca gta gcc ttg gat caa gtg aaa agg aca cag gct gaa gct 150
Arg Val Ser Val Ala Leu Asp Gln Val Lys Arg Thr Gln Ala Glu Ala
30 35 40
gat gcc aat gct aag tct gga gca ggc att agg aac tct ctc cat cta 198
Asp Ala Asn Ala Lys Ser Gly Ala Gly Ile Arg Asn Ser Leu His Leu
45 50 55
ctg gga tta gcc ggt gat ctt atc ctc tac aag gat ggt aaa tac atg 246
Leu Gly Leu Ala Gly Asp Leu Ile Leu Tyr Lys Asp Gly Lys Tyr Met
60 65 70
gat aag agc gag gat tat aag ttc ctg gga gat tac tgg aag agt ctc 294
Asp Lys Ser Glu Asp Tyr Lys Phe Leu Gly Asp Tyr Trp Lys Ser Leu
75 80 85
cat cct ctt tgt cgg tgg ggc gga gat ttt aaa agc cgt cct gat ggt 342
His Pro Leu Cys Arg Trp Gly Gly Asp Phe Lys Ser Arg Pro Asp Gly
90 95 100 105
aat cat ttc tcc ttg gaa cac gaa gga gtg caa cgt aaa aaa acc cgt 390
Asn His Phe Ser Leu Glu His Glu Gly Val Gln Arg Lys Lys Thr Arg
110 115 120
aaa cgt ctg aaa aaa atc ggt aaa gtt ctg aaa tgg atc ggc ggt ggc 438
Lys Arg Leu Lys Lys Ile Gly Lys Val Leu Lys Trp Ile Gly Gly Gly
125 130 135
tct gga ggt ggt ggg tcc ggc ggt ggc tct cca cca acc cgc aaa cgc 486
Ser Gly Gly Gly Gly Ser Gly Gly Gly Ser Pro Pro Thr Arg Lys Arg
140 145 150
ctg aaa aaa att ggc aaa gtg ctg aaa tgg att taataaaagc ttggctgttt 539
Leu Lys Lys Ile Gly Lys Val Leu Lys Trp Ile
155 160
tggc 543
<210> 20
<211> 164
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический полипептид
<400> 20
Met Lys Leu Ser Glu Lys Arg Ala Leu Phe Thr Gln Leu Leu Ala Gln
1 5 10 15
Leu Ile Leu Trp Ala Gly Thr Gln Asp Arg Val Ser Val Ala Leu Asp
20 25 30
Gln Val Lys Arg Thr Gln Ala Glu Ala Asp Ala Asn Ala Lys Ser Gly
35 40 45
Ala Gly Ile Arg Asn Ser Leu His Leu Leu Gly Leu Ala Gly Asp Leu
50 55 60
Ile Leu Tyr Lys Asp Gly Lys Tyr Met Asp Lys Ser Glu Asp Tyr Lys
65 70 75 80
Phe Leu Gly Asp Tyr Trp Lys Ser Leu His Pro Leu Cys Arg Trp Gly
85 90 95
Gly Asp Phe Lys Ser Arg Pro Asp Gly Asn His Phe Ser Leu Glu His
100 105 110
Glu Gly Val Gln Arg Lys Lys Thr Arg Lys Arg Leu Lys Lys Ile Gly
115 120 125
Lys Val Leu Lys Trp Ile Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly
130 135 140
Gly Gly Ser Pro Pro Thr Arg Lys Arg Leu Lys Lys Ile Gly Lys Val
145 150 155 160
Leu Lys Trp Ile
<210> 21
<211> 852
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический полинуклеотид
<220>
<223> Лизин GN316
<400> 21
gaattcacca tgggatccca tcatcaccac catcatggtg ccattttaaa gattggcagc 60
aaaggtctgg aagttaagaa tcttcagacc agtctcaaca aaatcgggtt caatctggtt 120
gccgatggca tatttggtaa agcgactgac aacgccgtca gggcagttca ggcaggtgcc 180
ggactggtcg ttgatggtat tgctggcccc aagaccatgt atgcgattcg caacgcaggg 240
gagtctcatc aggatcatct gactgaggct gacttgattg acgctgctcg tgaattgtct 300
gttgaccttg ctagcatcaa ggcagtcaac caagtagaat cgcgcggtac tggcttcacc 360
aagtctggta agatcaagac attgtttgaa cgccacatca tgtacaaaaa gctgaatgcc 420
aagttcggtc aggcaaaagc caatgctctg gcccagcttt acccgacgtt ggttaacgcc 480
aaagccgggg gatacacagg tggggacgcg gagttggaac gactccatgg tgcaatagcg 540
atcgataaag attgcgccta cgagagcgct tcctacgggt tattccagat catggggttc 600
aactgcgtta tttgtggata tgacaatgcc gaggagatgt tcaacgactt tctcactggt 660
gaacgtgctc agctcatggc atttgtcaag ttcatcaagg ctgacgccaa tctgtggaaa 720
gcattgaagg acaagaattg ggctgagttt gctcggcgtt acaatggccc ggcgtatgca 780
cagaaccagt acgacaccaa gctggctgca gcatacaaat cattcagtta gtaaaagctt 840
ggctgttttg gc 852
<210> 22
<211> 264
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический полипептид
<400> 22
Met Ala Ile Leu Lys Ile Gly Ser Lys Gly Leu Glu Val Lys Asn Leu
1 5 10 15
Gln Thr Ser Leu Asn Lys Ile Gly Phe Asn Leu Val Ala Asp Gly Ile
20 25 30
Phe Gly Lys Ala Thr Asp Asn Ala Val Arg Ala Val Gln Ala Gly Ala
35 40 45
Gly Leu Val Val Asp Gly Ile Ala Gly Pro Lys Thr Met Tyr Ala Ile
50 55 60
Arg Asn Ala Gly Glu Ser His Gln Asp His Leu Thr Glu Ala Asp Leu
65 70 75 80
Ile Asp Ala Ala Arg Glu Leu Ser Val Asp Leu Ala Ser Ile Lys Ala
85 90 95
Val Asn Gln Val Glu Ser Arg Gly Thr Gly Phe Thr Lys Ser Gly Lys
100 105 110
Ile Lys Thr Leu Phe Glu Arg His Ile Met Tyr Lys Lys Leu Asn Ala
115 120 125
Lys Phe Gly Gln Ala Lys Ala Asn Ala Leu Ala Gln Leu Tyr Pro Thr
130 135 140
Leu Val Asn Ala Lys Ala Gly Gly Tyr Thr Gly Gly Asp Ala Glu Leu
145 150 155 160
Glu Arg Leu His Gly Ala Ile Ala Ile Asp Lys Asp Cys Ala Tyr Glu
165 170 175
Ser Ala Ser Tyr Gly Leu Phe Gln Ile Met Gly Phe Asn Cys Val Ile
180 185 190
Cys Gly Tyr Asp Asn Ala Glu Glu Met Phe Asn Asp Phe Leu Thr Gly
195 200 205
Glu Arg Ala Gln Leu Met Ala Phe Val Lys Phe Ile Lys Ala Asp Ala
210 215 220
Asn Leu Trp Lys Ala Leu Lys Asp Lys Asn Trp Ala Glu Phe Ala Arg
225 230 235 240
Arg Tyr Asn Gly Pro Ala Tyr Ala Gln Asn Gln Tyr Asp Thr Lys Leu
245 250 255
Ala Ala Ala Tyr Lys Ser Phe Ser
260
<210> 23
<211> 879
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический полинуклеотид
<220>
<223> Модифицированный лизин GN316
<400> 23
gaattcacca tgggatccca tcatcaccac catcatggtg ccggatccca tcatcaccac 60
catcatggta ttttaaagat tggcagcaaa ggtctggaag ttaagaatct tcagaccagt 120
ctcaacaaaa tcgggttcaa tctggttgcc gatggcatat ttggtaaagc gactgacaac 180
gccgtcaggg cagttcaggc aggtgccgga ctggtcgttg atggtattgc tggccccaag 240
accatgtatg cgattcgcaa cgcaggggag tctcatcagg atcatctgac tgaggctgac 300
ttgattgacg ctgctcgtga attgtctgtt gaccttgcta gcatcaaggc agtcaaccaa 360
gtagaatcgc gcggtactgg cttcaccaag tctggtaaga tcaagacatt gtttgaacgc 420
cacatcatgt acaaaaagct gaatgccaag ttcggtcagg caaaagccaa tgctctggcc 480
cagctttacc cgacgttggt taacgccaaa gccgggggat acacaggtgg ggacgcggag 540
ttggaacgac tccatggtgc aatagcgatc gataaagatt gcgcctacga gagcgcttcc 600
tacgggttat tccagatcat ggggttcaac tgcgttattt gtggatatga caatgccgag 660
gagatgttca acgactttct cactggtgaa cgtgctcagc tcatggcatt tgtcaagttc 720
atcaaggctg acgccaatct gtggaaagca ttgaaggaca agaattgggc tgagtttgct 780
cggcgttaca atggcccggc gtatgcacag aaccagtacg acaccaagct ggctgcagca 840
tacaaatcat tcagttagta aaagcttggc tgttttggc 879
<210> 24
<211> 273
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический полипептид
<400> 24
Met Gly Ser His His His His His His Gly Ala Ile Leu Lys Ile Gly
1 5 10 15
Ser Lys Gly Leu Glu Val Lys Asn Leu Gln Thr Ser Leu Asn Lys Ile
20 25 30
Gly Phe Asn Leu Val Ala Asp Gly Ile Phe Gly Lys Ala Thr Asp Asn
35 40 45
Ala Val Arg Ala Val Gln Ala Gly Ala Gly Leu Val Val Asp Gly Ile
50 55 60
Ala Gly Pro Lys Thr Met Tyr Ala Ile Arg Asn Ala Gly Glu Ser His
65 70 75 80
Gln Asp His Leu Thr Glu Ala Asp Leu Ile Asp Ala Ala Arg Glu Leu
85 90 95
Ser Val Asp Leu Ala Ser Ile Lys Ala Val Asn Gln Val Glu Ser Arg
100 105 110
Gly Thr Gly Phe Thr Lys Ser Gly Lys Ile Lys Thr Leu Phe Glu Arg
115 120 125
His Ile Met Tyr Lys Lys Leu Asn Ala Lys Phe Gly Gln Ala Lys Ala
130 135 140
Asn Ala Leu Ala Gln Leu Tyr Pro Thr Leu Val Asn Ala Lys Ala Gly
145 150 155 160
Gly Tyr Thr Gly Gly Asp Ala Glu Leu Glu Arg Leu His Gly Ala Ile
165 170 175
Ala Ile Asp Lys Asp Cys Ala Tyr Glu Ser Ala Ser Tyr Gly Leu Phe
180 185 190
Gln Ile Met Gly Phe Asn Cys Val Ile Cys Gly Tyr Asp Asn Ala Glu
195 200 205
Glu Met Phe Asn Asp Phe Leu Thr Gly Glu Arg Ala Gln Leu Met Ala
210 215 220
Phe Val Lys Phe Ile Lys Ala Asp Ala Asn Leu Trp Lys Ala Leu Lys
225 230 235 240
Asp Lys Asn Trp Ala Glu Phe Ala Arg Arg Tyr Asn Gly Pro Ala Tyr
245 250 255
Ala Gln Asn Gln Tyr Asp Thr Lys Leu Ala Ala Ala Tyr Lys Ser Phe
260 265 270
Ser
<210> 25
<211> 612
<212> ДНК
<213> Фаг Pseudomonas KPP10
<220>
<223> Лизин GN329
<220>
<221> CDS
<222> (28)..(588)
<400> 25
gtttaacttt aagaaggaga attcacc atg atc acc gac aga gag tat cag caa 54
Met Ile Thr Asp Arg Glu Tyr Gln Gln
1 5
gct gct gag atg ttg gga gta gat gtc cca gcg atc aag gca gtg acc 102
Ala Ala Glu Met Leu Gly Val Asp Val Pro Ala Ile Lys Ala Val Thr
10 15 20 25
aag gtg gag gcc ccg gta ggg ggc ttc cag cct aca gga gag cca acg 150
Lys Val Glu Ala Pro Val Gly Gly Phe Gln Pro Thr Gly Glu Pro Thr
30 35 40
atc ctc tac gag cgt cac cag atg tac cga cag ctc cag gcc aaa ggg 198
Ile Leu Tyr Glu Arg His Gln Met Tyr Arg Gln Leu Gln Ala Lys Gly
45 50 55
ctc cca acg gaa ggt cat ccc cca gac ctg gta aat aag gta gct ggt 246
Leu Pro Thr Glu Gly His Pro Pro Asp Leu Val Asn Lys Val Ala Gly
60 65 70
ggg tat gga aaa tac agc gag caa cac gct aaa ctg gcc cgt gcc gta 294
Gly Tyr Gly Lys Tyr Ser Glu Gln His Ala Lys Leu Ala Arg Ala Val
75 80 85
aag atc gac agg gac agc gcc ctg gag tcc tgc tcc tgg ggg atg ttc 342
Lys Ile Asp Arg Asp Ser Ala Leu Glu Ser Cys Ser Trp Gly Met Phe
90 95 100 105
cag atc atg ggc tac cac tgg aag ctg atg ggg tac cct acc ctt caa 390
Gln Ile Met Gly Tyr His Trp Lys Leu Met Gly Tyr Pro Thr Leu Gln
110 115 120
gct ttc gta aac gcc atg tac gcc agc gaa gga gcc cag atg gac gcc 438
Ala Phe Val Asn Ala Met Tyr Ala Ser Glu Gly Ala Gln Met Asp Ala
125 130 135
ttc tgc cgg ttc atc aag gca caa ccc acc acg cat gct gcc ttg aaa 486
Phe Cys Arg Phe Ile Lys Ala Gln Pro Thr Thr His Ala Ala Leu Lys
140 145 150
gcc cat gat tgg gcc aag ttt gcc aga ctg tac aac ggt cca ggc tac 534
Ala His Asp Trp Ala Lys Phe Ala Arg Leu Tyr Asn Gly Pro Gly Tyr
155 160 165
gcc aag aac aag tat gac gtg aaa ttg gag aaa gca tat gct gaa gct 582
Ala Lys Asn Lys Tyr Asp Val Lys Leu Glu Lys Ala Tyr Ala Glu Ala
170 175 180 185
agt ggc tgataaaagc ttggctgttt tggc 612
Ser Gly
<210> 26
<211> 187
<212> БЕЛОК
<213> Фаг Pseudomonas KPP10
<220>
<223> Лизин GN329
<400> 26
Met Ile Thr Asp Arg Glu Tyr Gln Gln Ala Ala Glu Met Leu Gly Val
1 5 10 15
Asp Val Pro Ala Ile Lys Ala Val Thr Lys Val Glu Ala Pro Val Gly
20 25 30
Gly Phe Gln Pro Thr Gly Glu Pro Thr Ile Leu Tyr Glu Arg His Gln
35 40 45
Met Tyr Arg Gln Leu Gln Ala Lys Gly Leu Pro Thr Glu Gly His Pro
50 55 60
Pro Asp Leu Val Asn Lys Val Ala Gly Gly Tyr Gly Lys Tyr Ser Glu
65 70 75 80
Gln His Ala Lys Leu Ala Arg Ala Val Lys Ile Asp Arg Asp Ser Ala
85 90 95
Leu Glu Ser Cys Ser Trp Gly Met Phe Gln Ile Met Gly Tyr His Trp
100 105 110
Lys Leu Met Gly Tyr Pro Thr Leu Gln Ala Phe Val Asn Ala Met Tyr
115 120 125
Ala Ser Glu Gly Ala Gln Met Asp Ala Phe Cys Arg Phe Ile Lys Ala
130 135 140
Gln Pro Thr Thr His Ala Ala Leu Lys Ala His Asp Trp Ala Lys Phe
145 150 155 160
Ala Arg Leu Tyr Asn Gly Pro Gly Tyr Ala Lys Asn Lys Tyr Asp Val
165 170 175
Lys Leu Glu Lys Ala Tyr Ala Glu Ala Ser Gly
180 185
<210> 27
<211> 609
<212> ДНК
<213> Delftia sp.
<220>
<221> CDS
<222> (28)..(585)
<400> 27
gtttaacttt aagaaggaga attcacc atg gct cta act gag caa gac ttc caa 54
Met Ala Leu Thr Glu Gln Asp Phe Gln
1 5
tcg gct gcc gat gat ctc gga gtc gat gtt gcc agt gta aag gcc gtc 102
Ser Ala Ala Asp Asp Leu Gly Val Asp Val Ala Ser Val Lys Ala Val
10 15 20 25
act aaa gta gag agt cgt ggg agc ggc ttt cta ctt tct ggc gtc cct 150
Thr Lys Val Glu Ser Arg Gly Ser Gly Phe Leu Leu Ser Gly Val Pro
30 35 40
aag att cta ttc gaa agg cac tgg atg ttc aag ctt ctc aaa agg aag 198
Lys Ile Leu Phe Glu Arg His Trp Met Phe Lys Leu Leu Lys Arg Lys
45 50 55
cta ggt cgt gac cct gaa ata aac gac gtt tgc aac cct aaa gct gga 246
Leu Gly Arg Asp Pro Glu Ile Asn Asp Val Cys Asn Pro Lys Ala Gly
60 65 70
gga tac ctc ggc gga caa gcg gag cac gaa cgt cta gat aaa gca gtc 294
Gly Tyr Leu Gly Gly Gln Ala Glu His Glu Arg Leu Asp Lys Ala Val
75 80 85
aag atg gat aga gac tgc gca ctt caa agt gcc tct tgg ggc cta ttc 342
Lys Met Asp Arg Asp Cys Ala Leu Gln Ser Ala Ser Trp Gly Leu Phe
90 95 100 105
cag att atg gga ttc cat tgg gag gca cta ggt tat gcg agt gtt cag 390
Gln Ile Met Gly Phe His Trp Glu Ala Leu Gly Tyr Ala Ser Val Gln
110 115 120
gca ttt gtc aat gcc cag tac gct agc gag gga tcg caa cta aac act 438
Ala Phe Val Asn Ala Gln Tyr Ala Ser Glu Gly Ser Gln Leu Asn Thr
125 130 135
ttt gtg cgc ttc atc aag acc aac ccg gca att cac aaa gct tta aag 486
Phe Val Arg Phe Ile Lys Thr Asn Pro Ala Ile His Lys Ala Leu Lys
140 145 150
tct aag gac tgg gca gaa ttc gca aga agg tat aac ggg ccg gat tac 534
Ser Lys Asp Trp Ala Glu Phe Ala Arg Arg Tyr Asn Gly Pro Asp Tyr
155 160 165
aag aaa aac aac tac gat gtt aag cta gca gaa gcc tat caa tcc ttc 582
Lys Lys Asn Asn Tyr Asp Val Lys Leu Ala Glu Ala Tyr Gln Ser Phe
170 175 180 185
aag taataaaagc ttggctgttt tggc 609
Lys
<210> 28
<211> 186
<212> БЕЛОК
<213> Delftia sp.
<220>
<223> Лизин GN333
<400> 28
Met Ala Leu Thr Glu Gln Asp Phe Gln Ser Ala Ala Asp Asp Leu Gly
1 5 10 15
Val Asp Val Ala Ser Val Lys Ala Val Thr Lys Val Glu Ser Arg Gly
20 25 30
Ser Gly Phe Leu Leu Ser Gly Val Pro Lys Ile Leu Phe Glu Arg His
35 40 45
Trp Met Phe Lys Leu Leu Lys Arg Lys Leu Gly Arg Asp Pro Glu Ile
50 55 60
Asn Asp Val Cys Asn Pro Lys Ala Gly Gly Tyr Leu Gly Gly Gln Ala
65 70 75 80
Glu His Glu Arg Leu Asp Lys Ala Val Lys Met Asp Arg Asp Cys Ala
85 90 95
Leu Gln Ser Ala Ser Trp Gly Leu Phe Gln Ile Met Gly Phe His Trp
100 105 110
Glu Ala Leu Gly Tyr Ala Ser Val Gln Ala Phe Val Asn Ala Gln Tyr
115 120 125
Ala Ser Glu Gly Ser Gln Leu Asn Thr Phe Val Arg Phe Ile Lys Thr
130 135 140
Asn Pro Ala Ile His Lys Ala Leu Lys Ser Lys Asp Trp Ala Glu Phe
145 150 155 160
Ala Arg Arg Tyr Asn Gly Pro Asp Tyr Lys Lys Asn Asn Tyr Asp Val
165 170 175
Lys Leu Ala Glu Ala Tyr Gln Ser Phe Lys
180 185
<210> 29
<211> 984
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический полинуклеотид
<220>
<223> Лизин GN349
<220>
<221> CDS
<222> (28)..(957)
<400> 29
gtttaacttt aagaaggaga attcacc atg gcc att tta aag att ggc agc aaa 54
Met Ala Ile Leu Lys Ile Gly Ser Lys
1 5
ggt ctg gaa gtt aag aat ctt cag acc agt ctc aac aaa atc ggg ttc 102
Gly Leu Glu Val Lys Asn Leu Gln Thr Ser Leu Asn Lys Ile Gly Phe
10 15 20 25
aat ctg gtt gcc gat ggc ata ttt ggt aaa gcg act gac aac gcc gtc 150
Asn Leu Val Ala Asp Gly Ile Phe Gly Lys Ala Thr Asp Asn Ala Val
30 35 40
agg gca gtt cag gca ggt gcc gga ctg gtc gtt gat ggt att gct ggc 198
Arg Ala Val Gln Ala Gly Ala Gly Leu Val Val Asp Gly Ile Ala Gly
45 50 55
ccc aag acc atg tat gcg att cgc aac gca ggg gag tct cat cag gat 246
Pro Lys Thr Met Tyr Ala Ile Arg Asn Ala Gly Glu Ser His Gln Asp
60 65 70
cat ctg act gag gct gac ttg att gac gct gct cgt gaa ttg tct gtt 294
His Leu Thr Glu Ala Asp Leu Ile Asp Ala Ala Arg Glu Leu Ser Val
75 80 85
gac ctt gct agc atc aag gca gtc aac caa gta gaa tcg cgc ggt act 342
Asp Leu Ala Ser Ile Lys Ala Val Asn Gln Val Glu Ser Arg Gly Thr
90 95 100 105
ggc ttc acc aag tct ggt aag atc aag aca ttg ttt gaa cgc cac atc 390
Gly Phe Thr Lys Ser Gly Lys Ile Lys Thr Leu Phe Glu Arg His Ile
110 115 120
atg tac aaa aag ctg aat gcc aag ttc ggt cag gca aaa gcc aat gct 438
Met Tyr Lys Lys Leu Asn Ala Lys Phe Gly Gln Ala Lys Ala Asn Ala
125 130 135
ctg gcc cag ctt tac ccg acg ttg gtt aac gcc aaa gcc ggg gga tac 486
Leu Ala Gln Leu Tyr Pro Thr Leu Val Asn Ala Lys Ala Gly Gly Tyr
140 145 150
aca ggt ggg gac gcg gag ttg gaa cga ctc cat ggt gca ata gcg atc 534
Thr Gly Gly Asp Ala Glu Leu Glu Arg Leu His Gly Ala Ile Ala Ile
155 160 165
gat aaa gat tgc gcc tac gag agc gct tcc tac ggg tta ttc cag atc 582
Asp Lys Asp Cys Ala Tyr Glu Ser Ala Ser Tyr Gly Leu Phe Gln Ile
170 175 180 185
atg ggg ttc aac tgc gtt att tgt gga tat gac aat gcc gag gag atg 630
Met Gly Phe Asn Cys Val Ile Cys Gly Tyr Asp Asn Ala Glu Glu Met
190 195 200
ttc aac gac ttt ctc act ggt gaa cgt gct cag ctc atg gca ttt gtc 678
Phe Asn Asp Phe Leu Thr Gly Glu Arg Ala Gln Leu Met Ala Phe Val
205 210 215
aag ttc atc aag gct gac gcc aat ctg tgg aaa gca ttg aag gac aag 726
Lys Phe Ile Lys Ala Asp Ala Asn Leu Trp Lys Ala Leu Lys Asp Lys
220 225 230
aat tgg gct gag ttt gct cgg cgt tac aat ggc ccg gcg tat gca cag 774
Asn Trp Ala Glu Phe Ala Arg Arg Tyr Asn Gly Pro Ala Tyr Ala Gln
235 240 245
aac cag tac gac acc aag ctg gct gca gca tac aaa tca ttc agt acc 822
Asn Gln Tyr Asp Thr Lys Leu Ala Ala Ala Tyr Lys Ser Phe Ser Thr
250 255 260 265
gcg ggc ggc acc gcg ggc ggc gca cga aga tac aga ctt tcg cga cgc 870
Ala Gly Gly Thr Ala Gly Gly Ala Arg Arg Tyr Arg Leu Ser Arg Arg
270 275 280
aga agt cga cga ctt ttt tca aga act gca tta aga atg cat cga aga 918
Arg Ser Arg Arg Leu Phe Ser Arg Thr Ala Leu Arg Met His Arg Arg
285 290 295
aat aga ctt cga aga att atg cgt ggc ggc att agg ttt tagtaataaa 967
Asn Arg Leu Arg Arg Ile Met Arg Gly Gly Ile Arg Phe
300 305 310
agcttggctg ttttggc 984
<210> 30
<211> 310
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический полипептид
<400> 30
Met Ala Ile Leu Lys Ile Gly Ser Lys Gly Leu Glu Val Lys Asn Leu
1 5 10 15
Gln Thr Ser Leu Asn Lys Ile Gly Phe Asn Leu Val Ala Asp Gly Ile
20 25 30
Phe Gly Lys Ala Thr Asp Asn Ala Val Arg Ala Val Gln Ala Gly Ala
35 40 45
Gly Leu Val Val Asp Gly Ile Ala Gly Pro Lys Thr Met Tyr Ala Ile
50 55 60
Arg Asn Ala Gly Glu Ser His Gln Asp His Leu Thr Glu Ala Asp Leu
65 70 75 80
Ile Asp Ala Ala Arg Glu Leu Ser Val Asp Leu Ala Ser Ile Lys Ala
85 90 95
Val Asn Gln Val Glu Ser Arg Gly Thr Gly Phe Thr Lys Ser Gly Lys
100 105 110
Ile Lys Thr Leu Phe Glu Arg His Ile Met Tyr Lys Lys Leu Asn Ala
115 120 125
Lys Phe Gly Gln Ala Lys Ala Asn Ala Leu Ala Gln Leu Tyr Pro Thr
130 135 140
Leu Val Asn Ala Lys Ala Gly Gly Tyr Thr Gly Gly Asp Ala Glu Leu
145 150 155 160
Glu Arg Leu His Gly Ala Ile Ala Ile Asp Lys Asp Cys Ala Tyr Glu
165 170 175
Ser Ala Ser Tyr Gly Leu Phe Gln Ile Met Gly Phe Asn Cys Val Ile
180 185 190
Cys Gly Tyr Asp Asn Ala Glu Glu Met Phe Asn Asp Phe Leu Thr Gly
195 200 205
Glu Arg Ala Gln Leu Met Ala Phe Val Lys Phe Ile Lys Ala Asp Ala
210 215 220
Asn Leu Trp Lys Ala Leu Lys Asp Lys Asn Trp Ala Glu Phe Ala Arg
225 230 235 240
Arg Tyr Asn Gly Pro Ala Tyr Ala Gln Asn Gln Tyr Asp Thr Lys Leu
245 250 255
Ala Ala Ala Tyr Lys Ser Phe Ser Thr Ala Gly Gly Thr Ala Gly Gly
260 265 270
Ala Arg Arg Tyr Arg Leu Ser Arg Arg Arg Ser Arg Arg Leu Phe Ser
275 280 285
Arg Thr Ala Leu Arg Met His Arg Arg Asn Arg Leu Arg Arg Ile Met
290 295 300
Arg Gly Gly Ile Arg Phe
305 310
<210> 31
<211> 984
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический полинуклеотид
<220>
<223> Лизин GN351
<220>
<221> CDS
<222> (28)..(957)
<400> 31
gtttaacttt aagaaggaga attcacc atg gcc att tta aag att ggc agc aaa 54
Met Ala Ile Leu Lys Ile Gly Ser Lys
1 5
ggt ctg gaa gtt aag aat ctt cag acc agt ctc aac aaa atc ggg ttc 102
Gly Leu Glu Val Lys Asn Leu Gln Thr Ser Leu Asn Lys Ile Gly Phe
10 15 20 25
aat ctg gtt gcc gat ggc ata ttt ggt aaa gcg act gac aac gcc gtc 150
Asn Leu Val Ala Asp Gly Ile Phe Gly Lys Ala Thr Asp Asn Ala Val
30 35 40
agg gca gtt cag gca ggt gcc gga ctg gtc gtt gat ggt att gct ggc 198
Arg Ala Val Gln Ala Gly Ala Gly Leu Val Val Asp Gly Ile Ala Gly
45 50 55
ccc aag acc atg tat gcg att cgc aac gca ggg gag tct cat cag gat 246
Pro Lys Thr Met Tyr Ala Ile Arg Asn Ala Gly Glu Ser His Gln Asp
60 65 70
cat ctg act gag gct gac ttg att gac gct gct cgt gaa ttg tct gtt 294
His Leu Thr Glu Ala Asp Leu Ile Asp Ala Ala Arg Glu Leu Ser Val
75 80 85
gac ctt gct agc atc aag gca gtc aac caa gta gaa tcg cgc ggt act 342
Asp Leu Ala Ser Ile Lys Ala Val Asn Gln Val Glu Ser Arg Gly Thr
90 95 100 105
ggc ttc acc aag tct ggt aag atc aag aca ttg ttt gaa cgc cac atc 390
Gly Phe Thr Lys Ser Gly Lys Ile Lys Thr Leu Phe Glu Arg His Ile
110 115 120
atg tac aaa aag ctg aat gcc aag ttc ggt cag gca aaa gcc aat gct 438
Met Tyr Lys Lys Leu Asn Ala Lys Phe Gly Gln Ala Lys Ala Asn Ala
125 130 135
ctg gcc cag ctt tac ccg acg ttg gtt aac gcc aaa gcc ggg gga tac 486
Leu Ala Gln Leu Tyr Pro Thr Leu Val Asn Ala Lys Ala Gly Gly Tyr
140 145 150
aca ggt ggg gac gcg gag ttg gaa cga ctc cat ggt gca ata gcg atc 534
Thr Gly Gly Asp Ala Glu Leu Glu Arg Leu His Gly Ala Ile Ala Ile
155 160 165
gat aaa gat tgc gcc tac gag agc gct tcc tac ggg tta ttc cag atc 582
Asp Lys Asp Cys Ala Tyr Glu Ser Ala Ser Tyr Gly Leu Phe Gln Ile
170 175 180 185
atg ggg ttc aac tgc gtt att tgt gga tat gac aat gcc gag gag atg 630
Met Gly Phe Asn Cys Val Ile Cys Gly Tyr Asp Asn Ala Glu Glu Met
190 195 200
ttc aac gac ttt ctc act ggt gaa cgt gct cag ctc atg gca ttt gtc 678
Phe Asn Asp Phe Leu Thr Gly Glu Arg Ala Gln Leu Met Ala Phe Val
205 210 215
aag ttc atc aag gct gac gcc aat ctg tgg aaa gca ttg aag gac aag 726
Lys Phe Ile Lys Ala Asp Ala Asn Leu Trp Lys Ala Leu Lys Asp Lys
220 225 230
aat tgg gct gag ttt gct cgg cgt tac aat ggc ccg gcg tat gca cag 774
Asn Trp Ala Glu Phe Ala Arg Arg Tyr Asn Gly Pro Ala Tyr Ala Gln
235 240 245
aac cag tac gac acc aag ctg gct gca gca tac aaa tca ttc agt acc 822
Asn Gln Tyr Asp Thr Lys Leu Ala Ala Ala Tyr Lys Ser Phe Ser Thr
250 255 260 265
gcg ggc ggc acc gcg ggc ggc gct cgt tcc cgt aga cgt atg tct aag 870
Ala Gly Gly Thr Ala Gly Gly Ala Arg Ser Arg Arg Arg Met Ser Lys
270 275 280
cgt tct tcc cgc cgt tcg ttc cgc aag tat gcg aag tcg cat aag aag 918
Arg Ser Ser Arg Arg Ser Phe Arg Lys Tyr Ala Lys Ser His Lys Lys
285 290 295
aac ttt aaa gcc cgc tca atg cgt ggc ggt atc cgt tta tgataataaa 967
Asn Phe Lys Ala Arg Ser Met Arg Gly Gly Ile Arg Leu
300 305 310
agcttggctg ttttggc 984
<210> 32
<211> 310
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический полипептид
<400> 32
Met Ala Ile Leu Lys Ile Gly Ser Lys Gly Leu Glu Val Lys Asn Leu
1 5 10 15
Gln Thr Ser Leu Asn Lys Ile Gly Phe Asn Leu Val Ala Asp Gly Ile
20 25 30
Phe Gly Lys Ala Thr Asp Asn Ala Val Arg Ala Val Gln Ala Gly Ala
35 40 45
Gly Leu Val Val Asp Gly Ile Ala Gly Pro Lys Thr Met Tyr Ala Ile
50 55 60
Arg Asn Ala Gly Glu Ser His Gln Asp His Leu Thr Glu Ala Asp Leu
65 70 75 80
Ile Asp Ala Ala Arg Glu Leu Ser Val Asp Leu Ala Ser Ile Lys Ala
85 90 95
Val Asn Gln Val Glu Ser Arg Gly Thr Gly Phe Thr Lys Ser Gly Lys
100 105 110
Ile Lys Thr Leu Phe Glu Arg His Ile Met Tyr Lys Lys Leu Asn Ala
115 120 125
Lys Phe Gly Gln Ala Lys Ala Asn Ala Leu Ala Gln Leu Tyr Pro Thr
130 135 140
Leu Val Asn Ala Lys Ala Gly Gly Tyr Thr Gly Gly Asp Ala Glu Leu
145 150 155 160
Glu Arg Leu His Gly Ala Ile Ala Ile Asp Lys Asp Cys Ala Tyr Glu
165 170 175
Ser Ala Ser Tyr Gly Leu Phe Gln Ile Met Gly Phe Asn Cys Val Ile
180 185 190
Cys Gly Tyr Asp Asn Ala Glu Glu Met Phe Asn Asp Phe Leu Thr Gly
195 200 205
Glu Arg Ala Gln Leu Met Ala Phe Val Lys Phe Ile Lys Ala Asp Ala
210 215 220
Asn Leu Trp Lys Ala Leu Lys Asp Lys Asn Trp Ala Glu Phe Ala Arg
225 230 235 240
Arg Tyr Asn Gly Pro Ala Tyr Ala Gln Asn Gln Tyr Asp Thr Lys Leu
245 250 255
Ala Ala Ala Tyr Lys Ser Phe Ser Thr Ala Gly Gly Thr Ala Gly Gly
260 265 270
Ala Arg Ser Arg Arg Arg Met Ser Lys Arg Ser Ser Arg Arg Ser Phe
275 280 285
Arg Lys Tyr Ala Lys Ser His Lys Lys Asn Phe Lys Ala Arg Ser Met
290 295 300
Arg Gly Gly Ile Arg Leu
305 310
<210> 33
<211> 981
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический полинуклеотид
<220>
<223> Лизин GN352
<220>
<221> CDS
<222> (28)..(954)
<400> 33
gtttaacttt aagaaggaga attcacc atg gcc att tta aag att ggc agc aaa 54
Met Ala Ile Leu Lys Ile Gly Ser Lys
1 5
ggt ctg gaa gtt aag aat ctt cag acc agt ctc aac aaa atc ggg ttc 102
Gly Leu Glu Val Lys Asn Leu Gln Thr Ser Leu Asn Lys Ile Gly Phe
10 15 20 25
aat ctg gtt gcc gat ggc ata ttt ggt aaa gcg act gac aac gcc gtc 150
Asn Leu Val Ala Asp Gly Ile Phe Gly Lys Ala Thr Asp Asn Ala Val
30 35 40
agg gca gtt cag gca ggt gcc gga ctg gtc gtt gat ggt att gct ggc 198
Arg Ala Val Gln Ala Gly Ala Gly Leu Val Val Asp Gly Ile Ala Gly
45 50 55
ccc aag acc atg tat gcg att cgc aac gca ggg gag tct cat cag gat 246
Pro Lys Thr Met Tyr Ala Ile Arg Asn Ala Gly Glu Ser His Gln Asp
60 65 70
cat ctg act gag gct gac ttg att gac gct gct cgt gaa ttg tct gtt 294
His Leu Thr Glu Ala Asp Leu Ile Asp Ala Ala Arg Glu Leu Ser Val
75 80 85
gac ctt gct agc atc aag gca gtc aac caa gta gaa tcg cgc ggt act 342
Asp Leu Ala Ser Ile Lys Ala Val Asn Gln Val Glu Ser Arg Gly Thr
90 95 100 105
ggc ttc acc aag tct ggt aag atc aag aca ttg ttt gaa cgc cac atc 390
Gly Phe Thr Lys Ser Gly Lys Ile Lys Thr Leu Phe Glu Arg His Ile
110 115 120
atg tac aaa aag ctg aat gcc aag ttc ggt cag gca aaa gcc aat gct 438
Met Tyr Lys Lys Leu Asn Ala Lys Phe Gly Gln Ala Lys Ala Asn Ala
125 130 135
ctg gcc cag ctt tac ccg acg ttg gtt aac gcc aaa gcc ggg gga tac 486
Leu Ala Gln Leu Tyr Pro Thr Leu Val Asn Ala Lys Ala Gly Gly Tyr
140 145 150
aca ggt ggg gac gcg gag ttg gaa cga ctc cat ggt gca ata gcg atc 534
Thr Gly Gly Asp Ala Glu Leu Glu Arg Leu His Gly Ala Ile Ala Ile
155 160 165
gat aaa gat tgc gcc tac gag agc gct tcc tac ggg tta ttc cag atc 582
Asp Lys Asp Cys Ala Tyr Glu Ser Ala Ser Tyr Gly Leu Phe Gln Ile
170 175 180 185
atg ggg ttc aac tgc gtt att tgt gga tat gac aat gcc gag gag atg 630
Met Gly Phe Asn Cys Val Ile Cys Gly Tyr Asp Asn Ala Glu Glu Met
190 195 200
ttc aac gac ttt ctc act ggt gaa cgt gct cag ctc atg gca ttt gtc 678
Phe Asn Asp Phe Leu Thr Gly Glu Arg Ala Gln Leu Met Ala Phe Val
205 210 215
aag ttc atc aag gct gac gcc aat ctg tgg aaa gca ttg aag gac aag 726
Lys Phe Ile Lys Ala Asp Ala Asn Leu Trp Lys Ala Leu Lys Asp Lys
220 225 230
aat tgg gct gag ttt gct cgg cgt tac aat ggc ccg gcg tat gca cag 774
Asn Trp Ala Glu Phe Ala Arg Arg Tyr Asn Gly Pro Ala Tyr Ala Gln
235 240 245
aac cag tac gac acc aag ctg gct gca gca tac aaa tca ttc agt acc 822
Asn Gln Tyr Asp Thr Lys Leu Ala Ala Ala Tyr Lys Ser Phe Ser Thr
250 255 260 265
gcg ggc ggc acc gcg ggc ggc aaa cgt aga aaa atg aca aga aaa ggt 870
Ala Gly Gly Thr Ala Gly Gly Lys Arg Arg Lys Met Thr Arg Lys Gly
270 275 280
tct aag cgt ctt ttt act gca act gct gat aaa act aaa tct atc aat 918
Ser Lys Arg Leu Phe Thr Ala Thr Ala Asp Lys Thr Lys Ser Ile Asn
285 290 295
act gcc ccg ccg cca atg cgt ggc ggt atc cgg ttg tagtaataaa 964
Thr Ala Pro Pro Pro Met Arg Gly Gly Ile Arg Leu
300 305
agcttggctg ttttggc 981
<210> 34
<211> 309
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический полипептид
<400> 34
Met Ala Ile Leu Lys Ile Gly Ser Lys Gly Leu Glu Val Lys Asn Leu
1 5 10 15
Gln Thr Ser Leu Asn Lys Ile Gly Phe Asn Leu Val Ala Asp Gly Ile
20 25 30
Phe Gly Lys Ala Thr Asp Asn Ala Val Arg Ala Val Gln Ala Gly Ala
35 40 45
Gly Leu Val Val Asp Gly Ile Ala Gly Pro Lys Thr Met Tyr Ala Ile
50 55 60
Arg Asn Ala Gly Glu Ser His Gln Asp His Leu Thr Glu Ala Asp Leu
65 70 75 80
Ile Asp Ala Ala Arg Glu Leu Ser Val Asp Leu Ala Ser Ile Lys Ala
85 90 95
Val Asn Gln Val Glu Ser Arg Gly Thr Gly Phe Thr Lys Ser Gly Lys
100 105 110
Ile Lys Thr Leu Phe Glu Arg His Ile Met Tyr Lys Lys Leu Asn Ala
115 120 125
Lys Phe Gly Gln Ala Lys Ala Asn Ala Leu Ala Gln Leu Tyr Pro Thr
130 135 140
Leu Val Asn Ala Lys Ala Gly Gly Tyr Thr Gly Gly Asp Ala Glu Leu
145 150 155 160
Glu Arg Leu His Gly Ala Ile Ala Ile Asp Lys Asp Cys Ala Tyr Glu
165 170 175
Ser Ala Ser Tyr Gly Leu Phe Gln Ile Met Gly Phe Asn Cys Val Ile
180 185 190
Cys Gly Tyr Asp Asn Ala Glu Glu Met Phe Asn Asp Phe Leu Thr Gly
195 200 205
Glu Arg Ala Gln Leu Met Ala Phe Val Lys Phe Ile Lys Ala Asp Ala
210 215 220
Asn Leu Trp Lys Ala Leu Lys Asp Lys Asn Trp Ala Glu Phe Ala Arg
225 230 235 240
Arg Tyr Asn Gly Pro Ala Tyr Ala Gln Asn Gln Tyr Asp Thr Lys Leu
245 250 255
Ala Ala Ala Tyr Lys Ser Phe Ser Thr Ala Gly Gly Thr Ala Gly Gly
260 265 270
Lys Arg Arg Lys Met Thr Arg Lys Gly Ser Lys Arg Leu Phe Thr Ala
275 280 285
Thr Ala Asp Lys Thr Lys Ser Ile Asn Thr Ala Pro Pro Pro Met Arg
290 295 300
Gly Gly Ile Arg Leu
305
<210> 35
<211> 978
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический полинуклеотид
<220>
<223> Лизин GN353
<220>
<221> CDS
<222> (28)..(951)
<400> 35
gtttaacttt aagaaggaga attcacc atg gcc att tta aag att ggc agc aaa 54
Met Ala Ile Leu Lys Ile Gly Ser Lys
1 5
ggt ctg gaa gtt aag aat ctt cag acc agt ctc aac aaa atc ggg ttc 102
Gly Leu Glu Val Lys Asn Leu Gln Thr Ser Leu Asn Lys Ile Gly Phe
10 15 20 25
aat ctg gtt gcc gat ggc ata ttt ggt aaa gcg act gac aac gcc gtc 150
Asn Leu Val Ala Asp Gly Ile Phe Gly Lys Ala Thr Asp Asn Ala Val
30 35 40
agg gca gtt cag gca ggt gcc gga ctg gtc gtt gat ggt att gct ggc 198
Arg Ala Val Gln Ala Gly Ala Gly Leu Val Val Asp Gly Ile Ala Gly
45 50 55
ccc aag acc atg tat gcg att cgc aac gca ggg gag tct cat cag gat 246
Pro Lys Thr Met Tyr Ala Ile Arg Asn Ala Gly Glu Ser His Gln Asp
60 65 70
cat ctg act gag gct gac ttg att gac gct gct cgt gaa ttg tct gtt 294
His Leu Thr Glu Ala Asp Leu Ile Asp Ala Ala Arg Glu Leu Ser Val
75 80 85
gac ctt gct agc atc aag gca gtc aac caa gta gaa tcg cgc ggt act 342
Asp Leu Ala Ser Ile Lys Ala Val Asn Gln Val Glu Ser Arg Gly Thr
90 95 100 105
ggc ttc acc aag tct ggt aag atc aag aca ttg ttt gaa cgc cac atc 390
Gly Phe Thr Lys Ser Gly Lys Ile Lys Thr Leu Phe Glu Arg His Ile
110 115 120
atg tac aaa aag ctg aat gcc aag ttc ggt cag gca aaa gcc aat gct 438
Met Tyr Lys Lys Leu Asn Ala Lys Phe Gly Gln Ala Lys Ala Asn Ala
125 130 135
ctg gcc cag ctt tac ccg acg ttg gtt aac gcc aaa gcc ggg gga tac 486
Leu Ala Gln Leu Tyr Pro Thr Leu Val Asn Ala Lys Ala Gly Gly Tyr
140 145 150
aca ggt ggg gac gcg gag ttg gaa cga ctc cat ggt gca ata gcg atc 534
Thr Gly Gly Asp Ala Glu Leu Glu Arg Leu His Gly Ala Ile Ala Ile
155 160 165
gat aaa gat tgc gcc tac gag agc gct tcc tac ggg tta ttc cag atc 582
Asp Lys Asp Cys Ala Tyr Glu Ser Ala Ser Tyr Gly Leu Phe Gln Ile
170 175 180 185
atg ggg ttc aac tgc gtt att tgt gga tat gac aat gcc gag gag atg 630
Met Gly Phe Asn Cys Val Ile Cys Gly Tyr Asp Asn Ala Glu Glu Met
190 195 200
ttc aac gac ttt ctc act ggt gaa cgt gct cag ctc atg gca ttt gtc 678
Phe Asn Asp Phe Leu Thr Gly Glu Arg Ala Gln Leu Met Ala Phe Val
205 210 215
aag ttc atc aag gct gac gcc aat ctg tgg aaa gca ttg aag gac aag 726
Lys Phe Ile Lys Ala Asp Ala Asn Leu Trp Lys Ala Leu Lys Asp Lys
220 225 230
aat tgg gct gag ttt gct cgg cgt tac aat ggc ccg gcg tat gca cag 774
Asn Trp Ala Glu Phe Ala Arg Arg Tyr Asn Gly Pro Ala Tyr Ala Gln
235 240 245
aac cag tac gac acc aag ctg gct gca gca tac aaa tca ttc agt acc 822
Asn Gln Tyr Asp Thr Lys Leu Ala Ala Ala Tyr Lys Ser Phe Ser Thr
250 255 260 265
gcg ggc ggc acc gcg ggc ggc aga aag cga atg tct aag cgt gtt gac 870
Ala Gly Gly Thr Ala Gly Gly Arg Lys Arg Met Ser Lys Arg Val Asp
270 275 280
aag aag gtg ttc cgt cgt act gcc gca tct gcc aag aag att aac att 918
Lys Lys Val Phe Arg Arg Thr Ala Ala Ser Ala Lys Lys Ile Asn Ile
285 290 295
gac ccc aag att tac cgt gga ggt att cgc cta tgataataaa agcttggctg 971
Asp Pro Lys Ile Tyr Arg Gly Gly Ile Arg Leu
300 305
ttttggc 978
<210> 36
<211> 308
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический полипептид
<400> 36
Met Ala Ile Leu Lys Ile Gly Ser Lys Gly Leu Glu Val Lys Asn Leu
1 5 10 15
Gln Thr Ser Leu Asn Lys Ile Gly Phe Asn Leu Val Ala Asp Gly Ile
20 25 30
Phe Gly Lys Ala Thr Asp Asn Ala Val Arg Ala Val Gln Ala Gly Ala
35 40 45
Gly Leu Val Val Asp Gly Ile Ala Gly Pro Lys Thr Met Tyr Ala Ile
50 55 60
Arg Asn Ala Gly Glu Ser His Gln Asp His Leu Thr Glu Ala Asp Leu
65 70 75 80
Ile Asp Ala Ala Arg Glu Leu Ser Val Asp Leu Ala Ser Ile Lys Ala
85 90 95
Val Asn Gln Val Glu Ser Arg Gly Thr Gly Phe Thr Lys Ser Gly Lys
100 105 110
Ile Lys Thr Leu Phe Glu Arg His Ile Met Tyr Lys Lys Leu Asn Ala
115 120 125
Lys Phe Gly Gln Ala Lys Ala Asn Ala Leu Ala Gln Leu Tyr Pro Thr
130 135 140
Leu Val Asn Ala Lys Ala Gly Gly Tyr Thr Gly Gly Asp Ala Glu Leu
145 150 155 160
Glu Arg Leu His Gly Ala Ile Ala Ile Asp Lys Asp Cys Ala Tyr Glu
165 170 175
Ser Ala Ser Tyr Gly Leu Phe Gln Ile Met Gly Phe Asn Cys Val Ile
180 185 190
Cys Gly Tyr Asp Asn Ala Glu Glu Met Phe Asn Asp Phe Leu Thr Gly
195 200 205
Glu Arg Ala Gln Leu Met Ala Phe Val Lys Phe Ile Lys Ala Asp Ala
210 215 220
Asn Leu Trp Lys Ala Leu Lys Asp Lys Asn Trp Ala Glu Phe Ala Arg
225 230 235 240
Arg Tyr Asn Gly Pro Ala Tyr Ala Gln Asn Gln Tyr Asp Thr Lys Leu
245 250 255
Ala Ala Ala Tyr Lys Ser Phe Ser Thr Ala Gly Gly Thr Ala Gly Gly
260 265 270
Arg Lys Arg Met Ser Lys Arg Val Asp Lys Lys Val Phe Arg Arg Thr
275 280 285
Ala Ala Ser Ala Lys Lys Ile Asn Ile Asp Pro Lys Ile Tyr Arg Gly
290 295 300
Gly Ile Arg Leu
305
<210> 37
<211> 903
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический полинуклеотид
<220>
<223> Лизин GN357
<220>
<221> CDS
<222> (28)..(879)
<400> 37
gtttaacttt aagaaggaga attcacc atg gcc att tta aag att ggc agc aaa 54
Met Ala Ile Leu Lys Ile Gly Ser Lys
1 5
ggt ctg gaa gtt aag aat ctt cag acc agt ctc aac aaa atc ggg ttc 102
Gly Leu Glu Val Lys Asn Leu Gln Thr Ser Leu Asn Lys Ile Gly Phe
10 15 20 25
aat ctg gtt gcc gat ggc ata ttt ggt aaa gcg act gac aac gcc gtc 150
Asn Leu Val Ala Asp Gly Ile Phe Gly Lys Ala Thr Asp Asn Ala Val
30 35 40
agg gca gtt cag gca ggt gcc gga ctg gtc gtt gat ggt att gct ggc 198
Arg Ala Val Gln Ala Gly Ala Gly Leu Val Val Asp Gly Ile Ala Gly
45 50 55
ccc aag acc atg tat gcg att cgc aac gca ggg gag tct cat cag gat 246
Pro Lys Thr Met Tyr Ala Ile Arg Asn Ala Gly Glu Ser His Gln Asp
60 65 70
cat ctg act gag gct gac ttg att gac gct gct cgt gaa ttg tct gtt 294
His Leu Thr Glu Ala Asp Leu Ile Asp Ala Ala Arg Glu Leu Ser Val
75 80 85
gac ctt gct agc atc aag gca gtc aac caa gta gaa tcg cgc ggt act 342
Asp Leu Ala Ser Ile Lys Ala Val Asn Gln Val Glu Ser Arg Gly Thr
90 95 100 105
ggc ttc acc aag tct ggt aag atc aag aca ttg ttt gaa cgc cac atc 390
Gly Phe Thr Lys Ser Gly Lys Ile Lys Thr Leu Phe Glu Arg His Ile
110 115 120
atg tac aaa aag ctg aat gcc aag ttc ggt cag gca aaa gcc aat gct 438
Met Tyr Lys Lys Leu Asn Ala Lys Phe Gly Gln Ala Lys Ala Asn Ala
125 130 135
ctg gcc cag ctt tac ccg acg ttg gtt aac gcc aaa gcc ggg gga tac 486
Leu Ala Gln Leu Tyr Pro Thr Leu Val Asn Ala Lys Ala Gly Gly Tyr
140 145 150
aca ggt ggg gac gcg gag ttg gaa cga ctc cat ggt gca ata gcg atc 534
Thr Gly Gly Asp Ala Glu Leu Glu Arg Leu His Gly Ala Ile Ala Ile
155 160 165
gat aaa gat tgc gcc tac gag agc gct tcc tac ggg tta ttc cag atc 582
Asp Lys Asp Cys Ala Tyr Glu Ser Ala Ser Tyr Gly Leu Phe Gln Ile
170 175 180 185
atg ggg ttc aac tgc gtt att tgt gga tat gac aat gcc gag gag atg 630
Met Gly Phe Asn Cys Val Ile Cys Gly Tyr Asp Asn Ala Glu Glu Met
190 195 200
ttc aac gac ttt ctc act ggt gaa cgt gct cag ctc atg gca ttt gtc 678
Phe Asn Asp Phe Leu Thr Gly Glu Arg Ala Gln Leu Met Ala Phe Val
205 210 215
aag ttc atc aag gct gac gcc aat ctg tgg aaa gca ttg aag gac aag 726
Lys Phe Ile Lys Ala Asp Ala Asn Leu Trp Lys Ala Leu Lys Asp Lys
220 225 230
aat tgg gct gag ttt gct cgg cgt tac aat ggc ccg gcg tat gca cag 774
Asn Trp Ala Glu Phe Ala Arg Arg Tyr Asn Gly Pro Ala Tyr Ala Gln
235 240 245
aac cag tac gac acc aag ctg gct gca gca tac aaa tca ttc agt acc 822
Asn Gln Tyr Asp Thr Lys Leu Ala Ala Ala Tyr Lys Ser Phe Ser Thr
250 255 260 265
gcg ggc ggc acc gcg ggc ggc cgc cgc ctg att cgc ctg tgg ctg cgc 870
Ala Gly Gly Thr Ala Gly Gly Arg Arg Leu Ile Arg Leu Trp Leu Arg
270 275 280
ctg ctg cgc taataaaagc ttggctgttt tggc 903
Leu Leu Arg
<210> 38
<211> 284
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический полипептид
<400> 38
Met Ala Ile Leu Lys Ile Gly Ser Lys Gly Leu Glu Val Lys Asn Leu
1 5 10 15
Gln Thr Ser Leu Asn Lys Ile Gly Phe Asn Leu Val Ala Asp Gly Ile
20 25 30
Phe Gly Lys Ala Thr Asp Asn Ala Val Arg Ala Val Gln Ala Gly Ala
35 40 45
Gly Leu Val Val Asp Gly Ile Ala Gly Pro Lys Thr Met Tyr Ala Ile
50 55 60
Arg Asn Ala Gly Glu Ser His Gln Asp His Leu Thr Glu Ala Asp Leu
65 70 75 80
Ile Asp Ala Ala Arg Glu Leu Ser Val Asp Leu Ala Ser Ile Lys Ala
85 90 95
Val Asn Gln Val Glu Ser Arg Gly Thr Gly Phe Thr Lys Ser Gly Lys
100 105 110
Ile Lys Thr Leu Phe Glu Arg His Ile Met Tyr Lys Lys Leu Asn Ala
115 120 125
Lys Phe Gly Gln Ala Lys Ala Asn Ala Leu Ala Gln Leu Tyr Pro Thr
130 135 140
Leu Val Asn Ala Lys Ala Gly Gly Tyr Thr Gly Gly Asp Ala Glu Leu
145 150 155 160
Glu Arg Leu His Gly Ala Ile Ala Ile Asp Lys Asp Cys Ala Tyr Glu
165 170 175
Ser Ala Ser Tyr Gly Leu Phe Gln Ile Met Gly Phe Asn Cys Val Ile
180 185 190
Cys Gly Tyr Asp Asn Ala Glu Glu Met Phe Asn Asp Phe Leu Thr Gly
195 200 205
Glu Arg Ala Gln Leu Met Ala Phe Val Lys Phe Ile Lys Ala Asp Ala
210 215 220
Asn Leu Trp Lys Ala Leu Lys Asp Lys Asn Trp Ala Glu Phe Ala Arg
225 230 235 240
Arg Tyr Asn Gly Pro Ala Tyr Ala Gln Asn Gln Tyr Asp Thr Lys Leu
245 250 255
Ala Ala Ala Tyr Lys Ser Phe Ser Thr Ala Gly Gly Thr Ala Gly Gly
260 265 270
Arg Arg Leu Ile Arg Leu Trp Leu Arg Leu Leu Arg
275 280
<210> 39
<211> 912
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический полинуклеотид
<220>
<223> Лизин GN359
<220>
<221> CDS
<222> (28)..(888)
<400> 39
gtttaacttt aagaaggaga attcacc atg gcc att tta aag att ggc agc aaa 54
Met Ala Ile Leu Lys Ile Gly Ser Lys
1 5
ggt ctg gaa gtt aag aat ctt cag acc agt ctc aac aaa atc ggg ttc 102
Gly Leu Glu Val Lys Asn Leu Gln Thr Ser Leu Asn Lys Ile Gly Phe
10 15 20 25
aat ctg gtt gcc gat ggc ata ttt ggt aaa gcg act gac aac gcc gtc 150
Asn Leu Val Ala Asp Gly Ile Phe Gly Lys Ala Thr Asp Asn Ala Val
30 35 40
agg gca gtt cag gca ggt gcc gga ctg gtc gtt gat ggt att gct ggc 198
Arg Ala Val Gln Ala Gly Ala Gly Leu Val Val Asp Gly Ile Ala Gly
45 50 55
ccc aag acc atg tat gcg att cgc aac gca ggg gag tct cat cag gat 246
Pro Lys Thr Met Tyr Ala Ile Arg Asn Ala Gly Glu Ser His Gln Asp
60 65 70
cat ctg act gag gct gac ttg att gac gct gct cgt gaa ttg tct gtt 294
His Leu Thr Glu Ala Asp Leu Ile Asp Ala Ala Arg Glu Leu Ser Val
75 80 85
gac ctt gct agc atc aag gca gtc aac caa gta gaa tcg cgc ggt act 342
Asp Leu Ala Ser Ile Lys Ala Val Asn Gln Val Glu Ser Arg Gly Thr
90 95 100 105
ggc ttc acc aag tct ggt aag atc aag aca ttg ttt gaa cgc cac atc 390
Gly Phe Thr Lys Ser Gly Lys Ile Lys Thr Leu Phe Glu Arg His Ile
110 115 120
atg tac aaa aag ctg aat gcc aag ttc ggt cag gca aaa gcc aat gct 438
Met Tyr Lys Lys Leu Asn Ala Lys Phe Gly Gln Ala Lys Ala Asn Ala
125 130 135
ctg gcc cag ctt tac ccg acg ttg gtt aac gcc aaa gcc ggg gga tac 486
Leu Ala Gln Leu Tyr Pro Thr Leu Val Asn Ala Lys Ala Gly Gly Tyr
140 145 150
aca ggt ggg gac gcg gag ttg gaa cga ctc cat ggt gca ata gcg atc 534
Thr Gly Gly Asp Ala Glu Leu Glu Arg Leu His Gly Ala Ile Ala Ile
155 160 165
gat aaa gat tgc gcc tac gag agc gct tcc tac ggg tta ttc cag atc 582
Asp Lys Asp Cys Ala Tyr Glu Ser Ala Ser Tyr Gly Leu Phe Gln Ile
170 175 180 185
atg ggg ttc aac tgc gtt att tgt gga tat gac aat gcc gag gag atg 630
Met Gly Phe Asn Cys Val Ile Cys Gly Tyr Asp Asn Ala Glu Glu Met
190 195 200
ttc aac gac ttt ctc act ggt gaa cgt gct cag ctc atg gca ttt gtc 678
Phe Asn Asp Phe Leu Thr Gly Glu Arg Ala Gln Leu Met Ala Phe Val
205 210 215
aag ttc atc aag gct gac gcc aat ctg tgg aaa gca ttg aag gac aag 726
Lys Phe Ile Lys Ala Asp Ala Asn Leu Trp Lys Ala Leu Lys Asp Lys
220 225 230
aat tgg gct gag ttt gct cgg cgt tac aat ggc ccg gcg tat gca cag 774
Asn Trp Ala Glu Phe Ala Arg Arg Tyr Asn Gly Pro Ala Tyr Ala Gln
235 240 245
aac cag tac gac acc aag ctg gct gca gca tac aaa tca ttc agt acc 822
Asn Gln Tyr Asp Thr Lys Leu Ala Ala Ala Tyr Lys Ser Phe Ser Thr
250 255 260 265
gcg ggc ggc acc gcg ggc ggc acc cgc aaa cgc ctg aaa aaa att ggc 870
Ala Gly Gly Thr Ala Gly Gly Thr Arg Lys Arg Leu Lys Lys Ile Gly
270 275 280
aaa gtg ctg aaa tgg att taataaaagc ttggctgttt tggc 912
Lys Val Leu Lys Trp Ile
285
<210> 40
<211> 287
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический полипептид
<400> 40
Met Ala Ile Leu Lys Ile Gly Ser Lys Gly Leu Glu Val Lys Asn Leu
1 5 10 15
Gln Thr Ser Leu Asn Lys Ile Gly Phe Asn Leu Val Ala Asp Gly Ile
20 25 30
Phe Gly Lys Ala Thr Asp Asn Ala Val Arg Ala Val Gln Ala Gly Ala
35 40 45
Gly Leu Val Val Asp Gly Ile Ala Gly Pro Lys Thr Met Tyr Ala Ile
50 55 60
Arg Asn Ala Gly Glu Ser His Gln Asp His Leu Thr Glu Ala Asp Leu
65 70 75 80
Ile Asp Ala Ala Arg Glu Leu Ser Val Asp Leu Ala Ser Ile Lys Ala
85 90 95
Val Asn Gln Val Glu Ser Arg Gly Thr Gly Phe Thr Lys Ser Gly Lys
100 105 110
Ile Lys Thr Leu Phe Glu Arg His Ile Met Tyr Lys Lys Leu Asn Ala
115 120 125
Lys Phe Gly Gln Ala Lys Ala Asn Ala Leu Ala Gln Leu Tyr Pro Thr
130 135 140
Leu Val Asn Ala Lys Ala Gly Gly Tyr Thr Gly Gly Asp Ala Glu Leu
145 150 155 160
Glu Arg Leu His Gly Ala Ile Ala Ile Asp Lys Asp Cys Ala Tyr Glu
165 170 175
Ser Ala Ser Tyr Gly Leu Phe Gln Ile Met Gly Phe Asn Cys Val Ile
180 185 190
Cys Gly Tyr Asp Asn Ala Glu Glu Met Phe Asn Asp Phe Leu Thr Gly
195 200 205
Glu Arg Ala Gln Leu Met Ala Phe Val Lys Phe Ile Lys Ala Asp Ala
210 215 220
Asn Leu Trp Lys Ala Leu Lys Asp Lys Asn Trp Ala Glu Phe Ala Arg
225 230 235 240
Arg Tyr Asn Gly Pro Ala Tyr Ala Gln Asn Gln Tyr Asp Thr Lys Leu
245 250 255
Ala Ala Ala Tyr Lys Ser Phe Ser Thr Ala Gly Gly Thr Ala Gly Gly
260 265 270
Thr Arg Lys Arg Leu Lys Lys Ile Gly Lys Val Leu Lys Trp Ile
275 280 285
<210> 41
<211> 897
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический полинуклеотид
<220>
<223> Лизин GN369
<220>
<221> CDS
<222> (28)..(873)
<400> 41
gtttaacttt aagaaggaga attcacc atg gcc att tta aag att ggc agc aaa 54
Met Ala Ile Leu Lys Ile Gly Ser Lys
1 5
ggt ctg gaa gtt aag aat ctt cag acc agt ctc aac aaa atc ggg ttc 102
Gly Leu Glu Val Lys Asn Leu Gln Thr Ser Leu Asn Lys Ile Gly Phe
10 15 20 25
aat ctg gtt gcc gat ggc ata ttt ggt aaa gcg act gac aac gcc gtc 150
Asn Leu Val Ala Asp Gly Ile Phe Gly Lys Ala Thr Asp Asn Ala Val
30 35 40
agg gca gtt cag gca ggt gcc gga ctg gtc gtt gat ggt att gct ggc 198
Arg Ala Val Gln Ala Gly Ala Gly Leu Val Val Asp Gly Ile Ala Gly
45 50 55
ccc aag acc atg tat gcg att cgc aac gca ggg gag tct cat cag gat 246
Pro Lys Thr Met Tyr Ala Ile Arg Asn Ala Gly Glu Ser His Gln Asp
60 65 70
cat ctg act gag gct gac ttg att gac gct gct cgt gaa ttg tct gtt 294
His Leu Thr Glu Ala Asp Leu Ile Asp Ala Ala Arg Glu Leu Ser Val
75 80 85
gac ctt gct agc atc aag gca gtc aac caa gta gaa tcg cgc ggt act 342
Asp Leu Ala Ser Ile Lys Ala Val Asn Gln Val Glu Ser Arg Gly Thr
90 95 100 105
ggc ttc acc aag tct ggt aag atc aag aca ttg ttt gaa cgc cac atc 390
Gly Phe Thr Lys Ser Gly Lys Ile Lys Thr Leu Phe Glu Arg His Ile
110 115 120
atg tac aaa aag ctg aat gcc aag ttc ggt cag gca aaa gcc aat gct 438
Met Tyr Lys Lys Leu Asn Ala Lys Phe Gly Gln Ala Lys Ala Asn Ala
125 130 135
ctg gcc cag ctt tac ccg acg ttg gtt aac gcc aaa gcc ggg gga tac 486
Leu Ala Gln Leu Tyr Pro Thr Leu Val Asn Ala Lys Ala Gly Gly Tyr
140 145 150
aca ggt ggg gac gcg gag ttg gaa cga ctc cat ggt gca ata gcg atc 534
Thr Gly Gly Asp Ala Glu Leu Glu Arg Leu His Gly Ala Ile Ala Ile
155 160 165
gat aaa gat tgc gcc tac gag agc gct tcc tac ggg tta ttc cag atc 582
Asp Lys Asp Cys Ala Tyr Glu Ser Ala Ser Tyr Gly Leu Phe Gln Ile
170 175 180 185
atg ggg ttc aac tgc gtt att tgt gga tat gac aat gcc gag gag atg 630
Met Gly Phe Asn Cys Val Ile Cys Gly Tyr Asp Asn Ala Glu Glu Met
190 195 200
ttc aac gac ttt ctc act ggt gaa cgt gct cag ctc atg gca ttt gtc 678
Phe Asn Asp Phe Leu Thr Gly Glu Arg Ala Gln Leu Met Ala Phe Val
205 210 215
aag ttc atc aag gct gac gcc aat ctg tgg aaa gca ttg aag gac aag 726
Lys Phe Ile Lys Ala Asp Ala Asn Leu Trp Lys Ala Leu Lys Asp Lys
220 225 230
aat tgg gct gag ttt gct cgg cgt tac aat ggc ccg gcg tat gca cag 774
Asn Trp Ala Glu Phe Ala Arg Arg Tyr Asn Gly Pro Ala Tyr Ala Gln
235 240 245
aac cag tac gac acc aag ctg gct gca gca tac aaa tca ttc agt cgt 822
Asn Gln Tyr Asp Thr Lys Leu Ala Ala Ala Tyr Lys Ser Phe Ser Arg
250 255 260 265
aaa aaa acc cgt aaa cgt ctg aaa aaa atc ggt aaa gtt ctg aaa tgg 870
Lys Lys Thr Arg Lys Arg Leu Lys Lys Ile Gly Lys Val Leu Lys Trp
270 275 280
atc tagtaaaagc ttggctgttt tggc 897
Ile
<210> 42
<211> 282
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический полипептид
<400> 42
Met Ala Ile Leu Lys Ile Gly Ser Lys Gly Leu Glu Val Lys Asn Leu
1 5 10 15
Gln Thr Ser Leu Asn Lys Ile Gly Phe Asn Leu Val Ala Asp Gly Ile
20 25 30
Phe Gly Lys Ala Thr Asp Asn Ala Val Arg Ala Val Gln Ala Gly Ala
35 40 45
Gly Leu Val Val Asp Gly Ile Ala Gly Pro Lys Thr Met Tyr Ala Ile
50 55 60
Arg Asn Ala Gly Glu Ser His Gln Asp His Leu Thr Glu Ala Asp Leu
65 70 75 80
Ile Asp Ala Ala Arg Glu Leu Ser Val Asp Leu Ala Ser Ile Lys Ala
85 90 95
Val Asn Gln Val Glu Ser Arg Gly Thr Gly Phe Thr Lys Ser Gly Lys
100 105 110
Ile Lys Thr Leu Phe Glu Arg His Ile Met Tyr Lys Lys Leu Asn Ala
115 120 125
Lys Phe Gly Gln Ala Lys Ala Asn Ala Leu Ala Gln Leu Tyr Pro Thr
130 135 140
Leu Val Asn Ala Lys Ala Gly Gly Tyr Thr Gly Gly Asp Ala Glu Leu
145 150 155 160
Glu Arg Leu His Gly Ala Ile Ala Ile Asp Lys Asp Cys Ala Tyr Glu
165 170 175
Ser Ala Ser Tyr Gly Leu Phe Gln Ile Met Gly Phe Asn Cys Val Ile
180 185 190
Cys Gly Tyr Asp Asn Ala Glu Glu Met Phe Asn Asp Phe Leu Thr Gly
195 200 205
Glu Arg Ala Gln Leu Met Ala Phe Val Lys Phe Ile Lys Ala Asp Ala
210 215 220
Asn Leu Trp Lys Ala Leu Lys Asp Lys Asn Trp Ala Glu Phe Ala Arg
225 230 235 240
Arg Tyr Asn Gly Pro Ala Tyr Ala Gln Asn Gln Tyr Asp Thr Lys Leu
245 250 255
Ala Ala Ala Tyr Lys Ser Phe Ser Arg Lys Lys Thr Arg Lys Arg Leu
260 265 270
Lys Lys Ile Gly Lys Val Leu Lys Trp Ile
275 280
<210> 43
<211> 558
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический полинуклеотид
<220>
<223> Лизин GN370
<220>
<221> CDS
<222> (28)..(534)
<400> 43
gtttaacttt aagaaggaga attcacc atg atc gac cgt ttc att cgt ctg aat 54
Met Ile Asp Arg Phe Ile Arg Leu Asn
1 5
ccg acc cat ggt ccg cgt cgt ccg cgt cgt ccg ggt cgt cgt gct ccg 102
Pro Thr His Gly Pro Arg Arg Pro Arg Arg Pro Gly Arg Arg Ala Pro
10 15 20 25
gtt cgt aca tcc caa cga ggc atc gac ctc atc aaa tcc ttc gag ggc 150
Val Arg Thr Ser Gln Arg Gly Ile Asp Leu Ile Lys Ser Phe Glu Gly
30 35 40
ctg cgc ctg tcc gct tac cag gac tcg gtg ggt gtc tgg acc ata ggt 198
Leu Arg Leu Ser Ala Tyr Gln Asp Ser Val Gly Val Trp Thr Ile Gly
45 50 55
tac ggc acc act cgg ggc gtc acc cgc tac atg acg atc acc gtc gag 246
Tyr Gly Thr Thr Arg Gly Val Thr Arg Tyr Met Thr Ile Thr Val Glu
60 65 70
cag gcc gag cgg atg ctg tcg aac gac att cag cgc ttc gag cca gag 294
Gln Ala Glu Arg Met Leu Ser Asn Asp Ile Gln Arg Phe Glu Pro Glu
75 80 85
cta gac agg ctg gcg aag gtg cca ctg aac cag aac cag tgg gat gcc 342
Leu Asp Arg Leu Ala Lys Val Pro Leu Asn Gln Asn Gln Trp Asp Ala
90 95 100 105
ctg atg agc ttc gtg tac aac ctg ggc gcg gcc aat ctg gcg tcg tcc 390
Leu Met Ser Phe Val Tyr Asn Leu Gly Ala Ala Asn Leu Ala Ser Ser
110 115 120
acg ctg ctc gac ctg ctg aac aag ggt gac tac cag gga gca gcg gac 438
Thr Leu Leu Asp Leu Leu Asn Lys Gly Asp Tyr Gln Gly Ala Ala Asp
125 130 135
cag ttc ccg cat tgg gtg aat gcg ggc ggt aag cgc ttg gat ggt ctg 486
Gln Phe Pro His Trp Val Asn Ala Gly Gly Lys Arg Leu Asp Gly Leu
140 145 150
gtt aag cgt cga gca gcc gag cgt gcg ctg ttc ctg gag cca cta tcg 534
Val Lys Arg Arg Ala Ala Glu Arg Ala Leu Phe Leu Glu Pro Leu Ser
155 160 165
tgataaaagc ttggctgttt tggc 558
<210> 44
<211> 169
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический полипептид
<400> 44
Met Ile Asp Arg Phe Ile Arg Leu Asn Pro Thr His Gly Pro Arg Arg
1 5 10 15
Pro Arg Arg Pro Gly Arg Arg Ala Pro Val Arg Thr Ser Gln Arg Gly
20 25 30
Ile Asp Leu Ile Lys Ser Phe Glu Gly Leu Arg Leu Ser Ala Tyr Gln
35 40 45
Asp Ser Val Gly Val Trp Thr Ile Gly Tyr Gly Thr Thr Arg Gly Val
50 55 60
Thr Arg Tyr Met Thr Ile Thr Val Glu Gln Ala Glu Arg Met Leu Ser
65 70 75 80
Asn Asp Ile Gln Arg Phe Glu Pro Glu Leu Asp Arg Leu Ala Lys Val
85 90 95
Pro Leu Asn Gln Asn Gln Trp Asp Ala Leu Met Ser Phe Val Tyr Asn
100 105 110
Leu Gly Ala Ala Asn Leu Ala Ser Ser Thr Leu Leu Asp Leu Leu Asn
115 120 125
Lys Gly Asp Tyr Gln Gly Ala Ala Asp Gln Phe Pro His Trp Val Asn
130 135 140
Ala Gly Gly Lys Arg Leu Asp Gly Leu Val Lys Arg Arg Ala Ala Glu
145 150 155 160
Arg Ala Leu Phe Leu Glu Pro Leu Ser
165
<210> 45
<211> 516
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический полинуклеотид
<220>
<223> Лизин GN371
<220>
<221> CDS
<222> (28)..(492)
<400> 45
gtttaacttt aagaaggaga attcacc atg atc gac cgt ttc att cgt ctg aat 54
Met Ile Asp Arg Phe Ile Arg Leu Asn
1 5
ccg acc cat cgt aca tcc caa cga ggc atc gac ctc atc aaa tcc ttc 102
Pro Thr His Arg Thr Ser Gln Arg Gly Ile Asp Leu Ile Lys Ser Phe
10 15 20 25
gag ggc ctg cgc ctg tcc gct tac cag gac tcg gtg ggt gtc tgg acc 150
Glu Gly Leu Arg Leu Ser Ala Tyr Gln Asp Ser Val Gly Val Trp Thr
30 35 40
ata ggt tac ggc acc act cgg ggc gtc acc cgc tac atg acg atc acc 198
Ile Gly Tyr Gly Thr Thr Arg Gly Val Thr Arg Tyr Met Thr Ile Thr
45 50 55
gtc gag cag gcc gag cgg atg ctg tcg aac gac att cag cgc ttc gag 246
Val Glu Gln Ala Glu Arg Met Leu Ser Asn Asp Ile Gln Arg Phe Glu
60 65 70
cca gag cta gac agg ctg gcg aag gtg cca ctg aac cag aac cag tgg 294
Pro Glu Leu Asp Arg Leu Ala Lys Val Pro Leu Asn Gln Asn Gln Trp
75 80 85
gat gcc ctg atg agc ttc gtg tac aac ctg ggc gcg gcc aat ctg gcg 342
Asp Ala Leu Met Ser Phe Val Tyr Asn Leu Gly Ala Ala Asn Leu Ala
90 95 100 105
tcg tcc acg ctg ctc gac ctg ctg aac aag ggt gac tac cag gga gca 390
Ser Ser Thr Leu Leu Asp Leu Leu Asn Lys Gly Asp Tyr Gln Gly Ala
110 115 120
gcg gac cag ttc ccg cat tgg gtg aat gcg ggc ggt aag cgc ttg gat 438
Ala Asp Gln Phe Pro His Trp Val Asn Ala Gly Gly Lys Arg Leu Asp
125 130 135
ggt ctg gtt aag cgt cga gca gcc gag cgt gcg ctg ttc ctg gag cca 486
Gly Leu Val Lys Arg Arg Ala Ala Glu Arg Ala Leu Phe Leu Glu Pro
140 145 150
cta tcg tgataaaagc ttggctgttt tggc 516
Leu Ser
155
<210> 46
<211> 155
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический полипептид
<400> 46
Met Ile Asp Arg Phe Ile Arg Leu Asn Pro Thr His Arg Thr Ser Gln
1 5 10 15
Arg Gly Ile Asp Leu Ile Lys Ser Phe Glu Gly Leu Arg Leu Ser Ala
20 25 30
Tyr Gln Asp Ser Val Gly Val Trp Thr Ile Gly Tyr Gly Thr Thr Arg
35 40 45
Gly Val Thr Arg Tyr Met Thr Ile Thr Val Glu Gln Ala Glu Arg Met
50 55 60
Leu Ser Asn Asp Ile Gln Arg Phe Glu Pro Glu Leu Asp Arg Leu Ala
65 70 75 80
Lys Val Pro Leu Asn Gln Asn Gln Trp Asp Ala Leu Met Ser Phe Val
85 90 95
Tyr Asn Leu Gly Ala Ala Asn Leu Ala Ser Ser Thr Leu Leu Asp Leu
100 105 110
Leu Asn Lys Gly Asp Tyr Gln Gly Ala Ala Asp Gln Phe Pro His Trp
115 120 125
Val Asn Ala Gly Gly Lys Arg Leu Asp Gly Leu Val Lys Arg Arg Ala
130 135 140
Ala Glu Arg Ala Leu Phe Leu Glu Pro Leu Ser
145 150 155
<210> 47
<211> 846
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический полинуклеотид
<220>
<223> Лизин GN394
<220>
<221> CDS
<222> (28)..(819)
<400> 47
gtttaacttt aagaaggaga attcacc atg gcc att tta aag att ggc agc aaa 54
Met Ala Ile Leu Lys Ile Gly Ser Lys
1 5
ggt ctg gaa gtt aag aat ctt cag acc agt ctc aac aaa atc ggg ttc 102
Gly Leu Glu Val Lys Asn Leu Gln Thr Ser Leu Asn Lys Ile Gly Phe
10 15 20 25
aat ctg gtt gcc gat ggc ata ttt ggt aaa gcg act gac aac gcc gtc 150
Asn Leu Val Ala Asp Gly Ile Phe Gly Lys Ala Thr Asp Asn Ala Val
30 35 40
agg gca gtt cag gca ggt gcc gga ctg gtc gtt gat ggt att gct ggc 198
Arg Ala Val Gln Ala Gly Ala Gly Leu Val Val Asp Gly Ile Ala Gly
45 50 55
ccc aag acc atg tat gcg att cgc aac gca ggg gag tct cat cag gat 246
Pro Lys Thr Met Tyr Ala Ile Arg Asn Ala Gly Glu Ser His Gln Asp
60 65 70
cat ctg act gag gct gac ttg att gac gct gct cgt gaa ttg tct gtt 294
His Leu Thr Glu Ala Asp Leu Ile Asp Ala Ala Arg Glu Leu Ser Val
75 80 85
gac ctt gct agc atc aag gca gtc aac caa gta gaa tcg cgc ggt act 342
Asp Leu Ala Ser Ile Lys Ala Val Asn Gln Val Glu Ser Arg Gly Thr
90 95 100 105
ggc ttc acc aag tct ggt aag atc aag aca ttg ttt gaa cgc cac atc 390
Gly Phe Thr Lys Ser Gly Lys Ile Lys Thr Leu Phe Glu Arg His Ile
110 115 120
atg tac aaa aag ctg aat gcc aag ttc ggt cag gca aaa gcc aat gct 438
Met Tyr Lys Lys Leu Asn Ala Lys Phe Gly Gln Ala Lys Ala Asn Ala
125 130 135
ctg gcc cag ctt tac ccg acg ttg gtt aac gcc aaa gcc ggg gga tac 486
Leu Ala Gln Leu Tyr Pro Thr Leu Val Asn Ala Lys Ala Gly Gly Tyr
140 145 150
aca ggt ggg gac gcg gag ttg gaa cga ctc cat ggt gca ata gcg atc 534
Thr Gly Gly Asp Ala Glu Leu Glu Arg Leu His Gly Ala Ile Ala Ile
155 160 165
gat aaa gat tgc gcc tac gag agc gct tcc tac ggg tta ttc cag atc 582
Asp Lys Asp Cys Ala Tyr Glu Ser Ala Ser Tyr Gly Leu Phe Gln Ile
170 175 180 185
atg ggg ttc aac tgc gtt att tgt gga tat gac aat gcc gag gag atg 630
Met Gly Phe Asn Cys Val Ile Cys Gly Tyr Asp Asn Ala Glu Glu Met
190 195 200
ttc aac gac ttt ctc act ggt gaa cgt gct cag ctc atg gca ttt gtc 678
Phe Asn Asp Phe Leu Thr Gly Glu Arg Ala Gln Leu Met Ala Phe Val
205 210 215
gac ttc atc aag gct gac gcc aat ctg tgg aaa gca ttg aag gac aag 726
Asp Phe Ile Lys Ala Asp Ala Asn Leu Trp Lys Ala Leu Lys Asp Lys
220 225 230
aat tgg gct gag ttt gct cgg cgt tac aat ggc ccg gcg tat gca cag 774
Asn Trp Ala Glu Phe Ala Arg Arg Tyr Asn Gly Pro Ala Tyr Ala Gln
235 240 245
aac cag tac gac acc aag ctg gct gca gca tac aaa tca ttc agt 819
Asn Gln Tyr Asp Thr Lys Leu Ala Ala Ala Tyr Lys Ser Phe Ser
250 255 260
tagtaataaa agcttggctg ttttggc 846
<210> 48
<211> 264
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический полипептид
<400> 48
Met Ala Ile Leu Lys Ile Gly Ser Lys Gly Leu Glu Val Lys Asn Leu
1 5 10 15
Gln Thr Ser Leu Asn Lys Ile Gly Phe Asn Leu Val Ala Asp Gly Ile
20 25 30
Phe Gly Lys Ala Thr Asp Asn Ala Val Arg Ala Val Gln Ala Gly Ala
35 40 45
Gly Leu Val Val Asp Gly Ile Ala Gly Pro Lys Thr Met Tyr Ala Ile
50 55 60
Arg Asn Ala Gly Glu Ser His Gln Asp His Leu Thr Glu Ala Asp Leu
65 70 75 80
Ile Asp Ala Ala Arg Glu Leu Ser Val Asp Leu Ala Ser Ile Lys Ala
85 90 95
Val Asn Gln Val Glu Ser Arg Gly Thr Gly Phe Thr Lys Ser Gly Lys
100 105 110
Ile Lys Thr Leu Phe Glu Arg His Ile Met Tyr Lys Lys Leu Asn Ala
115 120 125
Lys Phe Gly Gln Ala Lys Ala Asn Ala Leu Ala Gln Leu Tyr Pro Thr
130 135 140
Leu Val Asn Ala Lys Ala Gly Gly Tyr Thr Gly Gly Asp Ala Glu Leu
145 150 155 160
Glu Arg Leu His Gly Ala Ile Ala Ile Asp Lys Asp Cys Ala Tyr Glu
165 170 175
Ser Ala Ser Tyr Gly Leu Phe Gln Ile Met Gly Phe Asn Cys Val Ile
180 185 190
Cys Gly Tyr Asp Asn Ala Glu Glu Met Phe Asn Asp Phe Leu Thr Gly
195 200 205
Glu Arg Ala Gln Leu Met Ala Phe Val Asp Phe Ile Lys Ala Asp Ala
210 215 220
Asn Leu Trp Lys Ala Leu Lys Asp Lys Asn Trp Ala Glu Phe Ala Arg
225 230 235 240
Arg Tyr Asn Gly Pro Ala Tyr Ala Gln Asn Gln Tyr Asp Thr Lys Leu
245 250 255
Ala Ala Ala Tyr Lys Ser Phe Ser
260
<210> 49
<211> 846
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический полинуклеотид
<220>
<223> Лизин GN396
<220>
<221> CDS
<222> (28)..(819)
<400> 49
gtttaacttt aagaaggaga attcacc atg gcc att tta aag att ggc agc aaa 54
Met Ala Ile Leu Lys Ile Gly Ser Lys
1 5
ggt ctg gaa gtt aag aat ctt cag acc agt ctc aac aaa atc ggg ttc 102
Gly Leu Glu Val Lys Asn Leu Gln Thr Ser Leu Asn Lys Ile Gly Phe
10 15 20 25
aat ctg gtt gcc gat ggc ata ttt ggt aaa gcg act gac aac gcc gtc 150
Asn Leu Val Ala Asp Gly Ile Phe Gly Lys Ala Thr Asp Asn Ala Val
30 35 40
agg gca gtt cag gca ggt gcc gga ctg gtc gtt gat ggt att gct ggc 198
Arg Ala Val Gln Ala Gly Ala Gly Leu Val Val Asp Gly Ile Ala Gly
45 50 55
ccc aag acc atg tat gcg att cgc aac gca ggg gag tct cat cag gat 246
Pro Lys Thr Met Tyr Ala Ile Arg Asn Ala Gly Glu Ser His Gln Asp
60 65 70
cat ctg act gag gct gac ttg att gac gct gct cgt gaa ttg tct gtt 294
His Leu Thr Glu Ala Asp Leu Ile Asp Ala Ala Arg Glu Leu Ser Val
75 80 85
gac ctt gct agc atc aag gca gtc aac caa gta gaa tcg cgc ggt act 342
Asp Leu Ala Ser Ile Lys Ala Val Asn Gln Val Glu Ser Arg Gly Thr
90 95 100 105
ggc ttc acc aag tct ggt aag atc aag aca ttg ttt gaa cgc cac atc 390
Gly Phe Thr Lys Ser Gly Lys Ile Lys Thr Leu Phe Glu Arg His Ile
110 115 120
atg tac aaa aag ctg aat gcc aag ttc ggt cag gca aaa gcc aat gct 438
Met Tyr Lys Lys Leu Asn Ala Lys Phe Gly Gln Ala Lys Ala Asn Ala
125 130 135
ctg gcc cag ctt tac ccg acg ttg gtt aac gcc aaa gcc ggg gga tac 486
Leu Ala Gln Leu Tyr Pro Thr Leu Val Asn Ala Lys Ala Gly Gly Tyr
140 145 150
aca ggt ggg gac gcg gag ttg gaa cga ctc cat ggt gca ata gcg atc 534
Thr Gly Gly Asp Ala Glu Leu Glu Arg Leu His Gly Ala Ile Ala Ile
155 160 165
gat aaa gat tgc gcc tac gag agc gct tcc tac ggg tta ttc cag atc 582
Asp Lys Asp Cys Ala Tyr Glu Ser Ala Ser Tyr Gly Leu Phe Gln Ile
170 175 180 185
atg ggg ttc aac tgc gtt att tgt gga tat gac aat gcc gag gag atg 630
Met Gly Phe Asn Cys Val Ile Cys Gly Tyr Asp Asn Ala Glu Glu Met
190 195 200
ttc aac gac ttt ctc act ggt gaa cgt gct cag ctc atg gca ttt gtc 678
Phe Asn Asp Phe Leu Thr Gly Glu Arg Ala Gln Leu Met Ala Phe Val
205 210 215
aag ttc atc aag gct gac gcc aat ctg tgg gac gca ttg aag gac aag 726
Lys Phe Ile Lys Ala Asp Ala Asn Leu Trp Asp Ala Leu Lys Asp Lys
220 225 230
aat tgg gct gag ttt gct cgg cgt tac aat ggc ccg gcg tat gca cag 774
Asn Trp Ala Glu Phe Ala Arg Arg Tyr Asn Gly Pro Ala Tyr Ala Gln
235 240 245
aac cag tac gac acc aag ctg gct gca gca tac aaa tca ttc agt 819
Asn Gln Tyr Asp Thr Lys Leu Ala Ala Ala Tyr Lys Ser Phe Ser
250 255 260
tagtaataaa agcttggctg ttttggc 846
<210> 50
<211> 264
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический полипептид
<400> 50
Met Ala Ile Leu Lys Ile Gly Ser Lys Gly Leu Glu Val Lys Asn Leu
1 5 10 15
Gln Thr Ser Leu Asn Lys Ile Gly Phe Asn Leu Val Ala Asp Gly Ile
20 25 30
Phe Gly Lys Ala Thr Asp Asn Ala Val Arg Ala Val Gln Ala Gly Ala
35 40 45
Gly Leu Val Val Asp Gly Ile Ala Gly Pro Lys Thr Met Tyr Ala Ile
50 55 60
Arg Asn Ala Gly Glu Ser His Gln Asp His Leu Thr Glu Ala Asp Leu
65 70 75 80
Ile Asp Ala Ala Arg Glu Leu Ser Val Asp Leu Ala Ser Ile Lys Ala
85 90 95
Val Asn Gln Val Glu Ser Arg Gly Thr Gly Phe Thr Lys Ser Gly Lys
100 105 110
Ile Lys Thr Leu Phe Glu Arg His Ile Met Tyr Lys Lys Leu Asn Ala
115 120 125
Lys Phe Gly Gln Ala Lys Ala Asn Ala Leu Ala Gln Leu Tyr Pro Thr
130 135 140
Leu Val Asn Ala Lys Ala Gly Gly Tyr Thr Gly Gly Asp Ala Glu Leu
145 150 155 160
Glu Arg Leu His Gly Ala Ile Ala Ile Asp Lys Asp Cys Ala Tyr Glu
165 170 175
Ser Ala Ser Tyr Gly Leu Phe Gln Ile Met Gly Phe Asn Cys Val Ile
180 185 190
Cys Gly Tyr Asp Asn Ala Glu Glu Met Phe Asn Asp Phe Leu Thr Gly
195 200 205
Glu Arg Ala Gln Leu Met Ala Phe Val Lys Phe Ile Lys Ala Asp Ala
210 215 220
Asn Leu Trp Asp Ala Leu Lys Asp Lys Asn Trp Ala Glu Phe Ala Arg
225 230 235 240
Arg Tyr Asn Gly Pro Ala Tyr Ala Gln Asn Gln Tyr Asp Thr Lys Leu
245 250 255
Ala Ala Ala Tyr Lys Ser Phe Ser
260
<210> 51
<211> 846
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический полинуклеотид
<220>
<223> Лизин GN408
<220>
<221> CDS
<222> (28)..(819)
<400> 51
gtttaacttt aagaaggaga attcacc atg gcc att tta aag att ggc agc aaa 54
Met Ala Ile Leu Lys Ile Gly Ser Lys
1 5
ggt ctg gaa gtt aag aat ctt cag acc agt ctc aac aaa atc ggg ttc 102
Gly Leu Glu Val Lys Asn Leu Gln Thr Ser Leu Asn Lys Ile Gly Phe
10 15 20 25
aat ctg gtt gcc gat ggc ata ttt ggt aaa gcg act gac aac gcc gtc 150
Asn Leu Val Ala Asp Gly Ile Phe Gly Lys Ala Thr Asp Asn Ala Val
30 35 40
agg gca gtt cag gca ggt gcc gga ctg gtc gtt gat ggt att gct ggc 198
Arg Ala Val Gln Ala Gly Ala Gly Leu Val Val Asp Gly Ile Ala Gly
45 50 55
ccc aag acc atg tat gcg att cgc aac gca ggg gag tct cat cag gat 246
Pro Lys Thr Met Tyr Ala Ile Arg Asn Ala Gly Glu Ser His Gln Asp
60 65 70
cat ctg act gag gct gac ttg att gac gct gct cat gaa ttg tct gtt 294
His Leu Thr Glu Ala Asp Leu Ile Asp Ala Ala His Glu Leu Ser Val
75 80 85
gac ctt gct agc atc aag gca gtc aac caa gta gaa tcg cgc ggt act 342
Asp Leu Ala Ser Ile Lys Ala Val Asn Gln Val Glu Ser Arg Gly Thr
90 95 100 105
ggc ttc acc aag tct ggt aag atc aag aca ttg ttt gaa cgc cac atc 390
Gly Phe Thr Lys Ser Gly Lys Ile Lys Thr Leu Phe Glu Arg His Ile
110 115 120
atg tac aaa aag ctg aat gcc aag ttc ggt cag gca aaa gcc aat gct 438
Met Tyr Lys Lys Leu Asn Ala Lys Phe Gly Gln Ala Lys Ala Asn Ala
125 130 135
ctg gcc cag ctt tac ccg acg ttg gtt aac gcc aaa gcc ggg gga tac 486
Leu Ala Gln Leu Tyr Pro Thr Leu Val Asn Ala Lys Ala Gly Gly Tyr
140 145 150
aca ggt ggg gac gcg gag ttg gaa cga ctc cat ggt gca ata gcg atc 534
Thr Gly Gly Asp Ala Glu Leu Glu Arg Leu His Gly Ala Ile Ala Ile
155 160 165
gat aaa gat tgc gcc tac gag agc gct tcc tac ggg tta ttc cag atc 582
Asp Lys Asp Cys Ala Tyr Glu Ser Ala Ser Tyr Gly Leu Phe Gln Ile
170 175 180 185
atg ggg ttc aac tgc gtt att tgt gga tat gac aat gcc gag gag atg 630
Met Gly Phe Asn Cys Val Ile Cys Gly Tyr Asp Asn Ala Glu Glu Met
190 195 200
ttc aac gac ttt ctc act ggt gaa cgt gct cag ctc atg gca ttt gtc 678
Phe Asn Asp Phe Leu Thr Gly Glu Arg Ala Gln Leu Met Ala Phe Val
205 210 215
aag ttc atc aag gct gac gcc aat ctg tgg aaa gca ttg aag gac aag 726
Lys Phe Ile Lys Ala Asp Ala Asn Leu Trp Lys Ala Leu Lys Asp Lys
220 225 230
aat tgg gct gag ttt gct cgg cgt tac aat ggc ccg gcg tat gca cag 774
Asn Trp Ala Glu Phe Ala Arg Arg Tyr Asn Gly Pro Ala Tyr Ala Gln
235 240 245
aac cag tac gac acc aag ctg gct gca gca tac aaa tca ttc agt 819
Asn Gln Tyr Asp Thr Lys Leu Ala Ala Ala Tyr Lys Ser Phe Ser
250 255 260
tagtaataaa agcttggctg ttttggc 846
<210> 52
<211> 264
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический полипептид
<400> 52
Met Ala Ile Leu Lys Ile Gly Ser Lys Gly Leu Glu Val Lys Asn Leu
1 5 10 15
Gln Thr Ser Leu Asn Lys Ile Gly Phe Asn Leu Val Ala Asp Gly Ile
20 25 30
Phe Gly Lys Ala Thr Asp Asn Ala Val Arg Ala Val Gln Ala Gly Ala
35 40 45
Gly Leu Val Val Asp Gly Ile Ala Gly Pro Lys Thr Met Tyr Ala Ile
50 55 60
Arg Asn Ala Gly Glu Ser His Gln Asp His Leu Thr Glu Ala Asp Leu
65 70 75 80
Ile Asp Ala Ala His Glu Leu Ser Val Asp Leu Ala Ser Ile Lys Ala
85 90 95
Val Asn Gln Val Glu Ser Arg Gly Thr Gly Phe Thr Lys Ser Gly Lys
100 105 110
Ile Lys Thr Leu Phe Glu Arg His Ile Met Tyr Lys Lys Leu Asn Ala
115 120 125
Lys Phe Gly Gln Ala Lys Ala Asn Ala Leu Ala Gln Leu Tyr Pro Thr
130 135 140
Leu Val Asn Ala Lys Ala Gly Gly Tyr Thr Gly Gly Asp Ala Glu Leu
145 150 155 160
Glu Arg Leu His Gly Ala Ile Ala Ile Asp Lys Asp Cys Ala Tyr Glu
165 170 175
Ser Ala Ser Tyr Gly Leu Phe Gln Ile Met Gly Phe Asn Cys Val Ile
180 185 190
Cys Gly Tyr Asp Asn Ala Glu Glu Met Phe Asn Asp Phe Leu Thr Gly
195 200 205
Glu Arg Ala Gln Leu Met Ala Phe Val Lys Phe Ile Lys Ala Asp Ala
210 215 220
Asn Leu Trp Lys Ala Leu Lys Asp Lys Asn Trp Ala Glu Phe Ala Arg
225 230 235 240
Arg Tyr Asn Gly Pro Ala Tyr Ala Gln Asn Gln Tyr Asp Thr Lys Leu
245 250 255
Ala Ala Ala Tyr Lys Ser Phe Ser
260
<210> 53
<211> 846
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический полинуклеотид
<220>
<223> Лизин GN418
<220>
<221> CDS
<222> (28)..(819)
<400> 53
gtttaacttt aagaaggaga attcacc atg gcc att tta aag att ggc agc aaa 54
Met Ala Ile Leu Lys Ile Gly Ser Lys
1 5
ggt ctg gaa gtt aag aat ctt cag acc agt ctc aac gac atc ggg ttc 102
Gly Leu Glu Val Lys Asn Leu Gln Thr Ser Leu Asn Asp Ile Gly Phe
10 15 20 25
aat ctg gtt gcc gat ggc ata ttt ggt aaa gcg act gac aac gcc gtc 150
Asn Leu Val Ala Asp Gly Ile Phe Gly Lys Ala Thr Asp Asn Ala Val
30 35 40
agg gca gtt cag gca ggt gcc gga ctg gtc gtt gat ggt att gct ggc 198
Arg Ala Val Gln Ala Gly Ala Gly Leu Val Val Asp Gly Ile Ala Gly
45 50 55
ccc aag acc atg tat gcg att cgc aac gca ggg gag tct cat cag gat 246
Pro Lys Thr Met Tyr Ala Ile Arg Asn Ala Gly Glu Ser His Gln Asp
60 65 70
cat ctg act gag gct gac ttg att gac gct gct cgt gaa ttg tct gtt 294
His Leu Thr Glu Ala Asp Leu Ile Asp Ala Ala Arg Glu Leu Ser Val
75 80 85
gac ctt gct agc atc aag gca gtc aac caa gta gaa tcg cgc ggt act 342
Asp Leu Ala Ser Ile Lys Ala Val Asn Gln Val Glu Ser Arg Gly Thr
90 95 100 105
ggc ttc acc aag tct ggt aag atc aag aca ttg ttt gaa cgc cac atc 390
Gly Phe Thr Lys Ser Gly Lys Ile Lys Thr Leu Phe Glu Arg His Ile
110 115 120
atg tac aaa aag ctg aat gcc aag ttc ggt cag gca aaa gcc aat gct 438
Met Tyr Lys Lys Leu Asn Ala Lys Phe Gly Gln Ala Lys Ala Asn Ala
125 130 135
ctg gcc cag ctt tac ccg acg ttg gtt aac gcc aaa gcc ggg gga tac 486
Leu Ala Gln Leu Tyr Pro Thr Leu Val Asn Ala Lys Ala Gly Gly Tyr
140 145 150
aca ggt ggg gac gcg gag ttg gaa cga ctc cat ggt gca ata gcg atc 534
Thr Gly Gly Asp Ala Glu Leu Glu Arg Leu His Gly Ala Ile Ala Ile
155 160 165
gat aaa gat tgc gcc tac gag agc gct tcc tac ggg tta ttc cag atc 582
Asp Lys Asp Cys Ala Tyr Glu Ser Ala Ser Tyr Gly Leu Phe Gln Ile
170 175 180 185
atg ggg ttc aac tgc gtt att tgt gga tat gac aat gcc gag gag atg 630
Met Gly Phe Asn Cys Val Ile Cys Gly Tyr Asp Asn Ala Glu Glu Met
190 195 200
ttc aac gac ttt ctc act ggt gaa cgt gct cag ctc atg gca ttt gtc 678
Phe Asn Asp Phe Leu Thr Gly Glu Arg Ala Gln Leu Met Ala Phe Val
205 210 215
aag ttc atc aag gct gac gcc aat ctg tgg aaa gca ttg aag gac aag 726
Lys Phe Ile Lys Ala Asp Ala Asn Leu Trp Lys Ala Leu Lys Asp Lys
220 225 230
aat tgg gct gag ttt gct cgg cgt tac aat ggc ccg gcg tat gca cag 774
Asn Trp Ala Glu Phe Ala Arg Arg Tyr Asn Gly Pro Ala Tyr Ala Gln
235 240 245
aac cag tac gac acc aag ctg gct gca gca tac aaa tca ttc agt 819
Asn Gln Tyr Asp Thr Lys Leu Ala Ala Ala Tyr Lys Ser Phe Ser
250 255 260
tagtaataaa agcttggctg ttttggc 846
<210> 54
<211> 264
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический полипептид
<400> 54
Met Ala Ile Leu Lys Ile Gly Ser Lys Gly Leu Glu Val Lys Asn Leu
1 5 10 15
Gln Thr Ser Leu Asn Asp Ile Gly Phe Asn Leu Val Ala Asp Gly Ile
20 25 30
Phe Gly Lys Ala Thr Asp Asn Ala Val Arg Ala Val Gln Ala Gly Ala
35 40 45
Gly Leu Val Val Asp Gly Ile Ala Gly Pro Lys Thr Met Tyr Ala Ile
50 55 60
Arg Asn Ala Gly Glu Ser His Gln Asp His Leu Thr Glu Ala Asp Leu
65 70 75 80
Ile Asp Ala Ala Arg Glu Leu Ser Val Asp Leu Ala Ser Ile Lys Ala
85 90 95
Val Asn Gln Val Glu Ser Arg Gly Thr Gly Phe Thr Lys Ser Gly Lys
100 105 110
Ile Lys Thr Leu Phe Glu Arg His Ile Met Tyr Lys Lys Leu Asn Ala
115 120 125
Lys Phe Gly Gln Ala Lys Ala Asn Ala Leu Ala Gln Leu Tyr Pro Thr
130 135 140
Leu Val Asn Ala Lys Ala Gly Gly Tyr Thr Gly Gly Asp Ala Glu Leu
145 150 155 160
Glu Arg Leu His Gly Ala Ile Ala Ile Asp Lys Asp Cys Ala Tyr Glu
165 170 175
Ser Ala Ser Tyr Gly Leu Phe Gln Ile Met Gly Phe Asn Cys Val Ile
180 185 190
Cys Gly Tyr Asp Asn Ala Glu Glu Met Phe Asn Asp Phe Leu Thr Gly
195 200 205
Glu Arg Ala Gln Leu Met Ala Phe Val Lys Phe Ile Lys Ala Asp Ala
210 215 220
Asn Leu Trp Lys Ala Leu Lys Asp Lys Asn Trp Ala Glu Phe Ala Arg
225 230 235 240
Arg Tyr Asn Gly Pro Ala Tyr Ala Gln Asn Gln Tyr Asp Thr Lys Leu
245 250 255
Ala Ala Ala Tyr Lys Ser Phe Ser
260
<210> 55
<211> 858
<212> ДНК
<213> Burkholderia pseudomultivorans
<220>
<223> Лизин GN424
<220>
<221> CDS
<222> (28)..(834)
<400> 55
gtttaacttt aagaaggaga attcacc atg aat acc ctt cgt ttc aac agt cgc 54
Met Asn Thr Leu Arg Phe Asn Ser Arg
1 5
ggc gcc gaa gtc ggc gtg ctg cag caa cgg ctc gtg cgc gcc ggc tat 102
Gly Ala Glu Val Gly Val Leu Gln Gln Arg Leu Val Arg Ala Gly Tyr
10 15 20 25
ccg atc gac gtc acg cat ctc tat gac gaa gcg acg gag cag gcc gtg 150
Pro Ile Asp Val Thr His Leu Tyr Asp Glu Ala Thr Glu Gln Ala Val
30 35 40
aag gcg ttg cag gca gcg gcc gga atc gtc gtc gac gga atc gcc ggc 198
Lys Ala Leu Gln Ala Ala Ala Gly Ile Val Val Asp Gly Ile Ala Gly
45 50 55
ccg aac acc tat gcc gtg ttg tcg gcc ggc cag cgc gac cgc aag cac 246
Pro Asn Thr Tyr Ala Val Leu Ser Ala Gly Gln Arg Asp Arg Lys His
60 65 70
ttg acc gaa gcg gac atc gcc cgc gcc gca gac aag ctc ggt gtc tcg 294
Leu Thr Glu Ala Asp Ile Ala Arg Ala Ala Asp Lys Leu Gly Val Ser
75 80 85
ccg gca tgc gtc cgc gcc gtc aac gaa gtc gag tca cgc ggc tcg ggc 342
Pro Ala Cys Val Arg Ala Val Asn Glu Val Glu Ser Arg Gly Ser Gly
90 95 100 105
ttt ctg gcg gac ggc cgg ccc gtg att ctc ttc gag cgg cac gtg atg 390
Phe Leu Ala Asp Gly Arg Pro Val Ile Leu Phe Glu Arg His Val Met
110 115 120
tac aac cgc ctc gtc gcg gcg aag cgt gcc gtc gac gca gcg agc gca 438
Tyr Asn Arg Leu Val Ala Ala Lys Arg Ala Val Asp Ala Ala Ser Ala
125 130 135
gcg cag cgc ttt ccg aac gtc gtc agc gcg aag ccg ggc gga tac cag 486
Ala Gln Arg Phe Pro Asn Val Val Ser Ala Lys Pro Gly Gly Tyr Gln
140 145 150
ggc ggc gca gcc gaa tat gtg cga ctc gac acc gcc gcg cgc atc gat 534
Gly Gly Ala Ala Glu Tyr Val Arg Leu Asp Thr Ala Ala Arg Ile Asp
155 160 165
gcg gca atc gcg tac gaa tcg gcg agc tgg ggc gca ttt cag gtg atg 582
Ala Ala Ile Ala Tyr Glu Ser Ala Ser Trp Gly Ala Phe Gln Val Met
170 175 180 185
ggc tat cac tgg gaa cgc ctg ggc tac tcg agc atc gac gag ttc gtt 630
Gly Tyr His Trp Glu Arg Leu Gly Tyr Ser Ser Ile Asp Glu Phe Val
190 195 200
gcc cgg atg gag acg agc gaa ggc gaa cag ctc gac gcg ttt gtg cgg 678
Ala Arg Met Glu Thr Ser Glu Gly Glu Gln Leu Asp Ala Phe Val Arg
205 210 215
ttc gtc gcc gcc gac tcg tcg ctg cgc acg gcg ctg aaa aac cgg aag 726
Phe Val Ala Ala Asp Ser Ser Leu Arg Thr Ala Leu Lys Asn Arg Lys
220 225 230
tgg gct gca ttc gcg aag ggc tac aac ggc ccg gac tat gcg cgc aac 774
Trp Ala Ala Phe Ala Lys Gly Tyr Asn Gly Pro Asp Tyr Ala Arg Asn
235 240 245
ctc tac gac gcg aag ctc gcc cag gcg tac gaa cgg tat gcc ggc acg 822
Leu Tyr Asp Ala Lys Leu Ala Gln Ala Tyr Glu Arg Tyr Ala Gly Thr
250 255 260 265
aag gcg gcc gcg tgataaaagc ttggctgttt tggc 858
Lys Ala Ala Ala
<210> 56
<211> 269
<212> БЕЛОК
<213> Burkholderia pseudomultivorans
<220>
<223> Лизин GN424
<400> 56
Met Asn Thr Leu Arg Phe Asn Ser Arg Gly Ala Glu Val Gly Val Leu
1 5 10 15
Gln Gln Arg Leu Val Arg Ala Gly Tyr Pro Ile Asp Val Thr His Leu
20 25 30
Tyr Asp Glu Ala Thr Glu Gln Ala Val Lys Ala Leu Gln Ala Ala Ala
35 40 45
Gly Ile Val Val Asp Gly Ile Ala Gly Pro Asn Thr Tyr Ala Val Leu
50 55 60
Ser Ala Gly Gln Arg Asp Arg Lys His Leu Thr Glu Ala Asp Ile Ala
65 70 75 80
Arg Ala Ala Asp Lys Leu Gly Val Ser Pro Ala Cys Val Arg Ala Val
85 90 95
Asn Glu Val Glu Ser Arg Gly Ser Gly Phe Leu Ala Asp Gly Arg Pro
100 105 110
Val Ile Leu Phe Glu Arg His Val Met Tyr Asn Arg Leu Val Ala Ala
115 120 125
Lys Arg Ala Val Asp Ala Ala Ser Ala Ala Gln Arg Phe Pro Asn Val
130 135 140
Val Ser Ala Lys Pro Gly Gly Tyr Gln Gly Gly Ala Ala Glu Tyr Val
145 150 155 160
Arg Leu Asp Thr Ala Ala Arg Ile Asp Ala Ala Ile Ala Tyr Glu Ser
165 170 175
Ala Ser Trp Gly Ala Phe Gln Val Met Gly Tyr His Trp Glu Arg Leu
180 185 190
Gly Tyr Ser Ser Ile Asp Glu Phe Val Ala Arg Met Glu Thr Ser Glu
195 200 205
Gly Glu Gln Leu Asp Ala Phe Val Arg Phe Val Ala Ala Asp Ser Ser
210 215 220
Leu Arg Thr Ala Leu Lys Asn Arg Lys Trp Ala Ala Phe Ala Lys Gly
225 230 235 240
Tyr Asn Gly Pro Asp Tyr Ala Arg Asn Leu Tyr Asp Ala Lys Leu Ala
245 250 255
Gln Ala Tyr Glu Arg Tyr Ala Gly Thr Lys Ala Ala Ala
260 265
<210> 57
<211> 864
<212> ДНК
<213> Pseudomonas flexibilis
<220>
<223> Лизин GN425
<220>
<221> CDS
<222> (28)..(840)
<400> 57
gtttaacttt aagaaggaga attcacc atg acc ctg cgc ctc gat gac gtc ggc 54
Met Thr Leu Arg Leu Asp Asp Val Gly
1 5
ctc gac gtg ctc cat ctg cag aag cgc ctc aac gag ctg ggc gcg aat 102
Leu Asp Val Leu His Leu Gln Lys Arg Leu Asn Glu Leu Gly Ala Asn
10 15 20 25
ccg cgg ctg ctg ccc gat ggc cag ttc ggc gag gtc acc gag cgc gcc 150
Pro Arg Leu Leu Pro Asp Gly Gln Phe Gly Glu Val Thr Glu Arg Ala
30 35 40
gtg cgg gcc ttc cag caa cgt gcc ggc ctg gtg gtc gat ggc gtg gcc 198
Val Arg Ala Phe Gln Gln Arg Ala Gly Leu Val Val Asp Gly Val Ala
45 50 55
gga ccc aag acg atg gcc gcc ctg tcc ggc cat tcc acc agc cgc ctg 246
Gly Pro Lys Thr Met Ala Ala Leu Ser Gly His Ser Thr Ser Arg Leu
60 65 70
ctc ggc cag cgc gac ctg caa cgc gcc gcc gac cgc ttg ggc gtg ccg 294
Leu Gly Gln Arg Asp Leu Gln Arg Ala Ala Asp Arg Leu Gly Val Pro
75 80 85
ctg gcc agc gtc atg gcc ctc aat gcc gtg gaa agt cgc ggc gag ggc 342
Leu Ala Ser Val Met Ala Leu Asn Ala Val Glu Ser Arg Gly Glu Gly
90 95 100 105
ttc gcc gcc aat ggc cgg ccg gtg atc ctg ttc gag cgg cac gtg atg 390
Phe Ala Ala Asn Gly Arg Pro Val Ile Leu Phe Glu Arg His Val Met
110 115 120
cac gaa cgc ttg cag gtc aac ggc ctg agc gaa gcc gag gcg gac gcc 438
His Glu Arg Leu Gln Val Asn Gly Leu Ser Glu Ala Glu Ala Asp Ala
125 130 135
ctg gcg gca cgc cac ccc ggc ctg gtg agt cgc cgg cca ggc ggc tac 486
Leu Ala Ala Arg His Pro Gly Leu Val Ser Arg Arg Pro Gly Gly Tyr
140 145 150
gtc ggc gac acc gcc gag cat cag cgc ctg gcc aat gcc cgc ctg ttg 534
Val Gly Asp Thr Ala Glu His Gln Arg Leu Ala Asn Ala Arg Leu Leu
155 160 165
cat gac acc gct gcc ctg gaa tcc gcc agt tgg gga ctg ttc cag gtg 582
His Asp Thr Ala Ala Leu Glu Ser Ala Ser Trp Gly Leu Phe Gln Val
170 175 180 185
atg ggc tac cac tgg cag gcc ctg ggc tac gac acc acc cag gac ttc 630
Met Gly Tyr His Trp Gln Ala Leu Gly Tyr Asp Thr Thr Gln Asp Phe
190 195 200
acc gag cgc atg gcc cgc cac gaa gcc gag cac ctg gaa gcg ttc gtg 678
Thr Glu Arg Met Ala Arg His Glu Ala Glu His Leu Glu Ala Phe Val
205 210 215
cgc ttc atc gaa gcc gat ccg gca ctg cac aag gca ctc aag ggc cgt 726
Arg Phe Ile Glu Ala Asp Pro Ala Leu His Lys Ala Leu Lys Gly Arg
220 225 230
aag tgg gcc gag ttc gcc cgc cgc tac aac ggc ccg gcc tac gcc cgc 774
Lys Trp Ala Glu Phe Ala Arg Arg Tyr Asn Gly Pro Ala Tyr Ala Arg
235 240 245
aat ttg tac gac gtg aag ctg gct cgg gca ttc gag caa ttc agc gac 822
Asn Leu Tyr Asp Val Lys Leu Ala Arg Ala Phe Glu Gln Phe Ser Asp
250 255 260 265
gca ctg cag gcc gcc gca tgataaaagc ttggctgttt tggc 864
Ala Leu Gln Ala Ala Ala
270
<210> 58
<211> 271
<212> БЕЛОК
<213> Pseudomonas flexibilis
<220>
<223> Лизин GN425
<400> 58
Met Thr Leu Arg Leu Asp Asp Val Gly Leu Asp Val Leu His Leu Gln
1 5 10 15
Lys Arg Leu Asn Glu Leu Gly Ala Asn Pro Arg Leu Leu Pro Asp Gly
20 25 30
Gln Phe Gly Glu Val Thr Glu Arg Ala Val Arg Ala Phe Gln Gln Arg
35 40 45
Ala Gly Leu Val Val Asp Gly Val Ala Gly Pro Lys Thr Met Ala Ala
50 55 60
Leu Ser Gly His Ser Thr Ser Arg Leu Leu Gly Gln Arg Asp Leu Gln
65 70 75 80
Arg Ala Ala Asp Arg Leu Gly Val Pro Leu Ala Ser Val Met Ala Leu
85 90 95
Asn Ala Val Glu Ser Arg Gly Glu Gly Phe Ala Ala Asn Gly Arg Pro
100 105 110
Val Ile Leu Phe Glu Arg His Val Met His Glu Arg Leu Gln Val Asn
115 120 125
Gly Leu Ser Glu Ala Glu Ala Asp Ala Leu Ala Ala Arg His Pro Gly
130 135 140
Leu Val Ser Arg Arg Pro Gly Gly Tyr Val Gly Asp Thr Ala Glu His
145 150 155 160
Gln Arg Leu Ala Asn Ala Arg Leu Leu His Asp Thr Ala Ala Leu Glu
165 170 175
Ser Ala Ser Trp Gly Leu Phe Gln Val Met Gly Tyr His Trp Gln Ala
180 185 190
Leu Gly Tyr Asp Thr Thr Gln Asp Phe Thr Glu Arg Met Ala Arg His
195 200 205
Glu Ala Glu His Leu Glu Ala Phe Val Arg Phe Ile Glu Ala Asp Pro
210 215 220
Ala Leu His Lys Ala Leu Lys Gly Arg Lys Trp Ala Glu Phe Ala Arg
225 230 235 240
Arg Tyr Asn Gly Pro Ala Tyr Ala Arg Asn Leu Tyr Asp Val Lys Leu
245 250 255
Ala Arg Ala Phe Glu Gln Phe Ser Asp Ala Leu Gln Ala Ala Ala
260 265 270
<210> 59
<211> 843
<212> ДНК
<213> Вирус Escherichia
<220>
<223> Лизин GN428
<220>
<221> CDS
<222> (28)..(819)
<400> 59
gtttaacttt aagaaggaga attcacc atg gcc att cta aaa ctt ggc aac cga 54
Met Ala Ile Leu Lys Leu Gly Asn Arg
1 5
ggt tct gaa gtc aaa gca ctt caa caa agc ctc aac aaa atc ggt ttc 102
Gly Ser Glu Val Lys Ala Leu Gln Gln Ser Leu Asn Lys Ile Gly Phe
10 15 20 25
tct ctt aca gcc gat ggc ata ttt ggt aag gca aca gag aat gcc gtc 150
Ser Leu Thr Ala Asp Gly Ile Phe Gly Lys Ala Thr Glu Asn Ala Val
30 35 40
aaa tcc gtt cag gca ggt gct gga ttg gtt att gat ggt att gct ggg 198
Lys Ser Val Gln Ala Gly Ala Gly Leu Val Ile Asp Gly Ile Ala Gly
45 50 55
cca aag acc ttc tat gct atc cgc aac gct gga gac gct cac cag gaa 246
Pro Lys Thr Phe Tyr Ala Ile Arg Asn Ala Gly Asp Ala His Gln Glu
60 65 70
cat ctg acc gaa gcg gac ttg gtt gac gca gca cgt gaa ctt ggt gtt 294
His Leu Thr Glu Ala Asp Leu Val Asp Ala Ala Arg Glu Leu Gly Val
75 80 85
gag ctg gcc agt atg aaa gcg gtg aac cag gta gaa tcc cgt ggt acg 342
Glu Leu Ala Ser Met Lys Ala Val Asn Gln Val Glu Ser Arg Gly Thr
90 95 100 105
ggt ttt acc aaa act ggc aag atc aaa act ctg ttt gag cgc cac atc 390
Gly Phe Thr Lys Thr Gly Lys Ile Lys Thr Leu Phe Glu Arg His Ile
110 115 120
atg tac aaa aag gtg acg gcc aaa ttc ggg caa gca aga gcc aat gct 438
Met Tyr Lys Lys Val Thr Ala Lys Phe Gly Gln Ala Arg Ala Asn Ala
125 130 135
ctg tac caa ctc tac cca aca ttg gtt aac ccc aat tct ggc ggg tat 486
Leu Tyr Gln Leu Tyr Pro Thr Leu Val Asn Pro Asn Ser Gly Gly Tyr
140 145 150
atc ggc gga gac gcg gag ttg gaa cgc ctt cag ggt gca atc gcc ctt 534
Ile Gly Gly Asp Ala Glu Leu Glu Arg Leu Gln Gly Ala Ile Ala Leu
155 160 165
gac gag gac tgc gct tac gag agt gct tcc tac ggc cta ttc cag atc 582
Asp Glu Asp Cys Ala Tyr Glu Ser Ala Ser Tyr Gly Leu Phe Gln Ile
170 175 180 185
atg ggg ttc aac tgc caa atc tgt ggc tat tca aat gcc aaa gag atg 630
Met Gly Phe Asn Cys Gln Ile Cys Gly Tyr Ser Asn Ala Lys Glu Met
190 195 200
ttc act gat ttc ctg act ggt gaa cgc gct cat ctt ctg gca ttt gtc 678
Phe Thr Asp Phe Leu Thr Gly Glu Arg Ala His Leu Leu Ala Phe Val
205 210 215
aag ttc atc aag gct gat gcc aat atg tgg aaa gcc ctg aag aac aag 726
Lys Phe Ile Lys Ala Asp Ala Asn Met Trp Lys Ala Leu Lys Asn Lys
220 225 230
aat tgg gcc gag ttt gct cgt cgg tac aat ggt ccg gca tat gcg aaa 774
Asn Trp Ala Glu Phe Ala Arg Arg Tyr Asn Gly Pro Ala Tyr Ala Lys
235 240 245
aac cag tat gat act aaa ctg gcg gca gca tac aag agt ttc tgt 819
Asn Gln Tyr Asp Thr Lys Leu Ala Ala Ala Tyr Lys Ser Phe Cys
250 255 260
taataaaagc ttggctgttt tggc 843
<210> 60
<211> 264
<212> БЕЛОК
<213> Вирус Escherichia
<220>
<223> Лизин GN428
<400> 60
Met Ala Ile Leu Lys Leu Gly Asn Arg Gly Ser Glu Val Lys Ala Leu
1 5 10 15
Gln Gln Ser Leu Asn Lys Ile Gly Phe Ser Leu Thr Ala Asp Gly Ile
20 25 30
Phe Gly Lys Ala Thr Glu Asn Ala Val Lys Ser Val Gln Ala Gly Ala
35 40 45
Gly Leu Val Ile Asp Gly Ile Ala Gly Pro Lys Thr Phe Tyr Ala Ile
50 55 60
Arg Asn Ala Gly Asp Ala His Gln Glu His Leu Thr Glu Ala Asp Leu
65 70 75 80
Val Asp Ala Ala Arg Glu Leu Gly Val Glu Leu Ala Ser Met Lys Ala
85 90 95
Val Asn Gln Val Glu Ser Arg Gly Thr Gly Phe Thr Lys Thr Gly Lys
100 105 110
Ile Lys Thr Leu Phe Glu Arg His Ile Met Tyr Lys Lys Val Thr Ala
115 120 125
Lys Phe Gly Gln Ala Arg Ala Asn Ala Leu Tyr Gln Leu Tyr Pro Thr
130 135 140
Leu Val Asn Pro Asn Ser Gly Gly Tyr Ile Gly Gly Asp Ala Glu Leu
145 150 155 160
Glu Arg Leu Gln Gly Ala Ile Ala Leu Asp Glu Asp Cys Ala Tyr Glu
165 170 175
Ser Ala Ser Tyr Gly Leu Phe Gln Ile Met Gly Phe Asn Cys Gln Ile
180 185 190
Cys Gly Tyr Ser Asn Ala Lys Glu Met Phe Thr Asp Phe Leu Thr Gly
195 200 205
Glu Arg Ala His Leu Leu Ala Phe Val Lys Phe Ile Lys Ala Asp Ala
210 215 220
Asn Met Trp Lys Ala Leu Lys Asn Lys Asn Trp Ala Glu Phe Ala Arg
225 230 235 240
Arg Tyr Asn Gly Pro Ala Tyr Ala Lys Asn Gln Tyr Asp Thr Lys Leu
245 250 255
Ala Ala Ala Tyr Lys Ser Phe Cys
260
<210> 61
<211> 660
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический полинуклеотид
<220>
<223> Лизин GN93
<220>
<221> CDS
<222> (13)..(639)
<400> 61
ggagaattca cc atg aaa ttc ttt aag ttc ttt aag ttt ttt aaa gcc ggc 51
Met Lys Phe Phe Lys Phe Phe Lys Phe Phe Lys Ala Gly
1 5 10
gca gga gct ggt gca gga gct ggt gca gga gct ggt gca gga gct agc 99
Ala Gly Ala Gly Ala Gly Ala Gly Ala Gly Ala Gly Ala Gly Ala Ser
15 20 25
aat aac gaa ctt cct tgg gta gcc gaa gcc cga aag tat atc ggc ctt 147
Asn Asn Glu Leu Pro Trp Val Ala Glu Ala Arg Lys Tyr Ile Gly Leu
30 35 40 45
cgc gaa gac act tcg aag act tcg cat aac ccg aaa ctt ctt gcc atg 195
Arg Glu Asp Thr Ser Lys Thr Ser His Asn Pro Lys Leu Leu Ala Met
50 55 60
ctt gac cgc atg ggc gaa ttt tcc aac gaa tcc cgc gct tgg tgg cac 243
Leu Asp Arg Met Gly Glu Phe Ser Asn Glu Ser Arg Ala Trp Trp His
65 70 75
gac gac gaa acg cct tgg tgc gga ctg ttc gtc ggc tat tgc ttg ggc 291
Asp Asp Glu Thr Pro Trp Cys Gly Leu Phe Val Gly Tyr Cys Leu Gly
80 85 90
gtt gcc ggg cgc tac gtc gtc cgc gaa tgg tac agg gcg cgg gca tgg 339
Val Ala Gly Arg Tyr Val Val Arg Glu Trp Tyr Arg Ala Arg Ala Trp
95 100 105
gaa gcc ccg cag ctt acg aag ctt gac cgg ccc gca tac ggc gcg ctt 387
Glu Ala Pro Gln Leu Thr Lys Leu Asp Arg Pro Ala Tyr Gly Ala Leu
110 115 120 125
gtg acc ttc acg cga agc ggc ggc ggc cac gtc ggt ttt att gtg ggc 435
Val Thr Phe Thr Arg Ser Gly Gly Gly His Val Gly Phe Ile Val Gly
130 135 140
aag gat gcg cgc gga aat ctt atg gtt ctt ggc ggt aat cag tcg aac 483
Lys Asp Ala Arg Gly Asn Leu Met Val Leu Gly Gly Asn Gln Ser Asn
145 150 155
gcc gta agt atc gca ccg ttc gca gta tcc cgc gta acc ggc tat ttc 531
Ala Val Ser Ile Ala Pro Phe Ala Val Ser Arg Val Thr Gly Tyr Phe
160 165 170
tgg ccg tcg ttc tgg cga aac aag acc gca gtt aaa agc gtt ccg ttt 579
Trp Pro Ser Phe Trp Arg Asn Lys Thr Ala Val Lys Ser Val Pro Phe
175 180 185
gaa gaa cgt tat tcg ctg ccg ctg ttg aag tcg aac ggc gaa ctt tcg 627
Glu Glu Arg Tyr Ser Leu Pro Leu Leu Lys Ser Asn Gly Glu Leu Ser
190 195 200 205
acg aat gaa gcg taataagctt ggctgttttg g 660
Thr Asn Glu Ala
<210> 62
<211> 209
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический полипептид
<400> 62
Met Lys Phe Phe Lys Phe Phe Lys Phe Phe Lys Ala Gly Ala Gly Ala
1 5 10 15
Gly Ala Gly Ala Gly Ala Gly Ala Gly Ala Gly Ala Ser Asn Asn Glu
20 25 30
Leu Pro Trp Val Ala Glu Ala Arg Lys Tyr Ile Gly Leu Arg Glu Asp
35 40 45
Thr Ser Lys Thr Ser His Asn Pro Lys Leu Leu Ala Met Leu Asp Arg
50 55 60
Met Gly Glu Phe Ser Asn Glu Ser Arg Ala Trp Trp His Asp Asp Glu
65 70 75 80
Thr Pro Trp Cys Gly Leu Phe Val Gly Tyr Cys Leu Gly Val Ala Gly
85 90 95
Arg Tyr Val Val Arg Glu Trp Tyr Arg Ala Arg Ala Trp Glu Ala Pro
100 105 110
Gln Leu Thr Lys Leu Asp Arg Pro Ala Tyr Gly Ala Leu Val Thr Phe
115 120 125
Thr Arg Ser Gly Gly Gly His Val Gly Phe Ile Val Gly Lys Asp Ala
130 135 140
Arg Gly Asn Leu Met Val Leu Gly Gly Asn Gln Ser Asn Ala Val Ser
145 150 155 160
Ile Ala Pro Phe Ala Val Ser Arg Val Thr Gly Tyr Phe Trp Pro Ser
165 170 175
Phe Trp Arg Asn Lys Thr Ala Val Lys Ser Val Pro Phe Glu Glu Arg
180 185 190
Tyr Ser Leu Pro Leu Leu Lys Ser Asn Gly Glu Leu Ser Thr Asn Glu
195 200 205
Ala
<210> 63
<211> 843
<212> ДНК
<213> Фаг Dickeya phiD3
<220>
<223> Лизин GN431
<220>
<221> CDS
<222> (28)..(819)
<400> 63
gtttaacttt aagaaggaga attcacc atg gcc att cta aaa ctt ggc aac cgt 54
Met Ala Ile Leu Lys Leu Gly Asn Arg
1 5
ggc act gaa gtg aag gca ctt cag gat agc ctc aac aaa atc ggc ttc 102
Gly Thr Glu Val Lys Ala Leu Gln Asp Ser Leu Asn Lys Ile Gly Phe
10 15 20 25
acc ctc gtc gct gac ggc atc ttt ggt aag gca aca gag aac gct gtc 150
Thr Leu Val Ala Asp Gly Ile Phe Gly Lys Ala Thr Glu Asn Ala Val
30 35 40
aag acc gtt cag gcg ggt gcg ggg ctt gtc att gat ggt atc gtg ggt 198
Lys Thr Val Gln Ala Gly Ala Gly Leu Val Ile Asp Gly Ile Val Gly
45 50 55
cca aag acc tcc tat gct att cgc aac gcc ggg gaa gcg cat cag gat 246
Pro Lys Thr Ser Tyr Ala Ile Arg Asn Ala Gly Glu Ala His Gln Asp
60 65 70
cac ctg act gag gct gac ctt atc gag gcg gcc aat cag ctg ggc gtc 294
His Leu Thr Glu Ala Asp Leu Ile Glu Ala Ala Asn Gln Leu Gly Val
75 80 85
gac ctc gct tct gtg aag gca gtc aac cag gtt gaa tcc cgt ggc aca 342
Asp Leu Ala Ser Val Lys Ala Val Asn Gln Val Glu Ser Arg Gly Thr
90 95 100 105
ggc ttc acc aag tca ggc aag atc aag aca ttg ttc gag cgt cac atc 390
Gly Phe Thr Lys Ser Gly Lys Ile Lys Thr Leu Phe Glu Arg His Ile
110 115 120
atg tat aag aaa ctg atg gca aag ttc gga cag gct cga gcg aat gcc 438
Met Tyr Lys Lys Leu Met Ala Lys Phe Gly Gln Ala Arg Ala Asn Ala
125 130 135
atg ggt cag atg tat ccg act ctg gtc agc ccg gtt gca ggc ggg tac 486
Met Gly Gln Met Tyr Pro Thr Leu Val Ser Pro Val Ala Gly Gly Tyr
140 145 150
acg gga ggt gac gca gaa ttg gat cga ctc cac gca gcg atc aac atc 534
Thr Gly Gly Asp Ala Glu Leu Asp Arg Leu His Ala Ala Ile Asn Ile
155 160 165
gac gag gat tgt gcg tac gag agc gct tca tac ggc ctc ttc cag atc 582
Asp Glu Asp Cys Ala Tyr Glu Ser Ala Ser Tyr Gly Leu Phe Gln Ile
170 175 180 185
atg ggc ttc aac tgc cag gtc tgc ggg tat gcc aac gcc aag gag atg 630
Met Gly Phe Asn Cys Gln Val Cys Gly Tyr Ala Asn Ala Lys Glu Met
190 195 200
ttc aat gac ttc ctg acg gga gaa cgt gct cac ctg atg gca ttc gtg 678
Phe Asn Asp Phe Leu Thr Gly Glu Arg Ala His Leu Met Ala Phe Val
205 210 215
aag ttc atc aag gct gat gcc aag ctc tgg cag gct ctg aag gac aag 726
Lys Phe Ile Lys Ala Asp Ala Lys Leu Trp Gln Ala Leu Lys Asp Lys
220 225 230
aat tgg gct gag ttc gcg cgg cgc tat aat ggt ccg gcg tat acc aag 774
Asn Trp Ala Glu Phe Ala Arg Arg Tyr Asn Gly Pro Ala Tyr Thr Lys
235 240 245
aac cag tac gac acg aag ctc gca gca gca tac aac agc ttc aat 819
Asn Gln Tyr Asp Thr Lys Leu Ala Ala Ala Tyr Asn Ser Phe Asn
250 255 260
taataaaagc ttggctgttt tggc 843
<210> 64
<211> 264
<212> БЕЛОК
<213> Фаг Dickeya phiD3
<220>
<223> Лизин GN431
<400> 64
Met Ala Ile Leu Lys Leu Gly Asn Arg Gly Thr Glu Val Lys Ala Leu
1 5 10 15
Gln Asp Ser Leu Asn Lys Ile Gly Phe Thr Leu Val Ala Asp Gly Ile
20 25 30
Phe Gly Lys Ala Thr Glu Asn Ala Val Lys Thr Val Gln Ala Gly Ala
35 40 45
Gly Leu Val Ile Asp Gly Ile Val Gly Pro Lys Thr Ser Tyr Ala Ile
50 55 60
Arg Asn Ala Gly Glu Ala His Gln Asp His Leu Thr Glu Ala Asp Leu
65 70 75 80
Ile Glu Ala Ala Asn Gln Leu Gly Val Asp Leu Ala Ser Val Lys Ala
85 90 95
Val Asn Gln Val Glu Ser Arg Gly Thr Gly Phe Thr Lys Ser Gly Lys
100 105 110
Ile Lys Thr Leu Phe Glu Arg His Ile Met Tyr Lys Lys Leu Met Ala
115 120 125
Lys Phe Gly Gln Ala Arg Ala Asn Ala Met Gly Gln Met Tyr Pro Thr
130 135 140
Leu Val Ser Pro Val Ala Gly Gly Tyr Thr Gly Gly Asp Ala Glu Leu
145 150 155 160
Asp Arg Leu His Ala Ala Ile Asn Ile Asp Glu Asp Cys Ala Tyr Glu
165 170 175
Ser Ala Ser Tyr Gly Leu Phe Gln Ile Met Gly Phe Asn Cys Gln Val
180 185 190
Cys Gly Tyr Ala Asn Ala Lys Glu Met Phe Asn Asp Phe Leu Thr Gly
195 200 205
Glu Arg Ala His Leu Met Ala Phe Val Lys Phe Ile Lys Ala Asp Ala
210 215 220
Lys Leu Trp Gln Ala Leu Lys Asp Lys Asn Trp Ala Glu Phe Ala Arg
225 230 235 240
Arg Tyr Asn Gly Pro Ala Tyr Thr Lys Asn Gln Tyr Asp Thr Lys Leu
245 250 255
Ala Ala Ala Tyr Asn Ser Phe Asn
260
<210> 65
<211> 510
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический полинуклеотид
<220>
<223> Лизин GN486
<220>
<221> CDS
<222> (10)..(510)
<400> 65
gaattcacc atg gga tcc cat cat cac cac cat cat ggt ggt ccg cgt cgt 51
Met Gly Ser His His His His His His Gly Gly Pro Arg Arg
1 5 10
ccg cgt cgt ccg ggt cgt cgt gct ccg gtt cgt acc tct cag cgt ggt 99
Pro Arg Arg Pro Gly Arg Arg Ala Pro Val Arg Thr Ser Gln Arg Gly
15 20 25 30
atc gac ctg atc aaa tct ttc gaa ggt ctg cgt ctg tct gct tac cag 147
Ile Asp Leu Ile Lys Ser Phe Glu Gly Leu Arg Leu Ser Ala Tyr Gln
35 40 45
gac tct gtt ggt gtt tgg acc atc ggt tac ggt acc acc cgt ggt gtt 195
Asp Ser Val Gly Val Trp Thr Ile Gly Tyr Gly Thr Thr Arg Gly Val
50 55 60
acc cgt tac atg acc atc acc gtt gaa cag gct gaa cgt atg ctg tct 243
Thr Arg Tyr Met Thr Ile Thr Val Glu Gln Ala Glu Arg Met Leu Ser
65 70 75
aac gac atc cag cgt ttc gaa ccg gaa ctg gac cgt ctg gct aaa gtt 291
Asn Asp Ile Gln Arg Phe Glu Pro Glu Leu Asp Arg Leu Ala Lys Val
80 85 90
ccg ctg aac cag aac cag tgg gac gct ctg atg tct ttc gtt tac aac 339
Pro Leu Asn Gln Asn Gln Trp Asp Ala Leu Met Ser Phe Val Tyr Asn
95 100 105 110
ctg ggt gct gct aac ctg gct tct tct acc ctg ctg aaa ctg ctg aac 387
Leu Gly Ala Ala Asn Leu Ala Ser Ser Thr Leu Leu Lys Leu Leu Asn
115 120 125
aaa ggt gac tac cag ggt gct gct gac cag ttc ccg cgt tgg gtt aac 435
Lys Gly Asp Tyr Gln Gly Ala Ala Asp Gln Phe Pro Arg Trp Val Asn
130 135 140
gct ggt ggt aaa cgt ctg gac ggt ctg gtt aaa cgt cgt gct gct gaa 483
Ala Gly Gly Lys Arg Leu Asp Gly Leu Val Lys Arg Arg Ala Ala Glu
145 150 155
cgt gct ctg ttc ctg gaa ccg ctg tct 510
Arg Ala Leu Phe Leu Glu Pro Leu Ser
160 165
<210> 66
<211> 167
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический полипептид
<400> 66
Met Gly Ser His His His His His His Gly Gly Pro Arg Arg Pro Arg
1 5 10 15
Arg Pro Gly Arg Arg Ala Pro Val Arg Thr Ser Gln Arg Gly Ile Asp
20 25 30
Leu Ile Lys Ser Phe Glu Gly Leu Arg Leu Ser Ala Tyr Gln Asp Ser
35 40 45
Val Gly Val Trp Thr Ile Gly Tyr Gly Thr Thr Arg Gly Val Thr Arg
50 55 60
Tyr Met Thr Ile Thr Val Glu Gln Ala Glu Arg Met Leu Ser Asn Asp
65 70 75 80
Ile Gln Arg Phe Glu Pro Glu Leu Asp Arg Leu Ala Lys Val Pro Leu
85 90 95
Asn Gln Asn Gln Trp Asp Ala Leu Met Ser Phe Val Tyr Asn Leu Gly
100 105 110
Ala Ala Asn Leu Ala Ser Ser Thr Leu Leu Lys Leu Leu Asn Lys Gly
115 120 125
Asp Tyr Gln Gly Ala Ala Asp Gln Phe Pro Arg Trp Val Asn Ala Gly
130 135 140
Gly Lys Arg Leu Asp Gly Leu Val Lys Arg Arg Ala Ala Glu Arg Ala
145 150 155 160
Leu Phe Leu Glu Pro Leu Ser
165
<210> 67
<211> 219
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический полинуклеотид
<220>
<223> Лизин GN485
<220>
<221> CDS
<222> (1)..(216)
<400> 67
atg ccg ggt ctg tct ggt ttc atc cgt aac gct gac acc ccg gtt acc 48
Met Pro Gly Leu Ser Gly Phe Ile Arg Asn Ala Asp Thr Pro Val Thr
1 5 10 15
tct ctg ggt tct gct ggt cac gtt cac gtt ccg gaa ggt ccg ctg atc 96
Ser Leu Gly Ser Ala Gly His Val His Val Pro Glu Gly Pro Leu Ile
20 25 30
cgt atc aac ccg gac tgc ctg ctg ggt acc ccg ttc aaa ttc ttc aag 144
Arg Ile Asn Pro Asp Cys Leu Leu Gly Thr Pro Phe Lys Phe Phe Lys
35 40 45
ttc ttc aag ttc ttc aag ttc ttt aag ttc ttt aag ttt ttc aag ttc 192
Phe Phe Lys Phe Phe Lys Phe Phe Lys Phe Phe Lys Phe Phe Lys Phe
50 55 60
ttc aag aac gaa tgc gtt ctg ctg taa 219
Phe Lys Asn Glu Cys Val Leu Leu
65 70
<210> 68
<211> 72
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический полипептид
<220>
<223> Лизин GN485
<400> 68
Met Pro Gly Leu Ser Gly Phe Ile Arg Asn Ala Asp Thr Pro Val Thr
1 5 10 15
Ser Leu Gly Ser Ala Gly His Val His Val Pro Glu Gly Pro Leu Ile
20 25 30
Arg Ile Asn Pro Asp Cys Leu Leu Gly Thr Pro Phe Lys Phe Phe Lys
35 40 45
Phe Phe Lys Phe Phe Lys Phe Phe Lys Phe Phe Lys Phe Phe Lys Phe
50 55 60
Phe Lys Asn Glu Cys Val Leu Leu
65 70
<210> 69
<211> 132
<212> ДНК
<213> Фаг Chlamydia 2
<400> 69
atgaggttaa aaatggcacg aagaagatac agacttccgc gacgtagaag tcgaagactt 60
ttttcaagaa ctgcattgag gatgcatcca agaaataggc ttcgaagaat tatgcgtggc 120
ggcattaggt tc 132
<210> 70
<211> 44
<212> БЕЛОК
<213> Фаг Chlamydia 2
<400> 70
Met Arg Leu Lys Met Ala Arg Arg Arg Tyr Arg Leu Pro Arg Arg Arg
1 5 10 15
Ser Arg Arg Leu Phe Ser Arg Thr Ala Leu Arg Met His Pro Arg Asn
20 25 30
Arg Leu Arg Arg Ile Met Arg Gly Gly Ile Arg Phe
35 40
<210> 71
<211> 24
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический олигонуклеотид
<220>
<223> Линкер
<400> 71
accgcgggcg gcaccgcggg cggc 24
<210> 72
<211> 8
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический пептид
<400> 72
Thr Ala Gly Gly Thr Ala Gly Gly
1 5
<210> 73
<211> 435
<212> ДНК
<213> Фаг Pseudomonas PAJU2
<220>
<223> GN4
<400> 73
atgcgtacat cccaacgagg catcgacctc atcaaatcct tcgagggcct gcgcctgtcc 60
gcttaccagg actcggtggg tgtctggacc ataggttacg gcaccactcg gggcgtcacc 120
cgctacatga cgatcaccgt cgagcaggcc gagcggatgc tgtcgaacga cattcagcgc 180
ttcgagccag agctagacag gctggcgaag gtgccactga accagaacca gtgggatgcc 240
ctgatgagct tcgtgtacaa cctgggcgcg gccaatctgg cgtcgtccac gctgctcaag 300
ctgctgaaca agggtgacta ccagggagca gcggaccagt tcccgcgctg ggtgaatgcg 360
ggcggtaagc gcttggatgg tctggttaag cgtcgagcag ccgagcgtgc gctgttcctg 420
gagccactat cgtga 435
<210> 74
<211> 144
<212> БЕЛОК
<213> Фаг Pseudomonas PAJU2
<400> 74
Met Arg Thr Ser Gln Arg Gly Ile Asp Leu Ile Lys Ser Phe Glu Gly
1 5 10 15
Leu Arg Leu Ser Ala Tyr Gln Asp Ser Val Gly Val Trp Thr Ile Gly
20 25 30
Tyr Gly Thr Thr Arg Gly Val Thr Arg Tyr Met Thr Ile Thr Val Glu
35 40 45
Gln Ala Glu Arg Met Leu Ser Asn Asp Ile Gln Arg Phe Glu Pro Glu
50 55 60
Leu Asp Arg Leu Ala Lys Val Pro Leu Asn Gln Asn Gln Trp Asp Ala
65 70 75 80
Leu Met Ser Phe Val Tyr Asn Leu Gly Ala Ala Asn Leu Ala Ser Ser
85 90 95
Thr Leu Leu Lys Leu Leu Asn Lys Gly Asp Tyr Gln Gly Ala Ala Asp
100 105 110
Gln Phe Pro Arg Trp Val Asn Ala Gly Gly Lys Arg Leu Asp Gly Leu
115 120 125
Val Lys Arg Arg Ala Ala Glu Arg Ala Leu Phe Leu Glu Pro Leu Ser
130 135 140
<210> 75
<211> 63
<212> ДНК
<213> Penaeus chinensis
<400> 75
atgagcttta acgtgacccc gaaatttaaa cgctggcagc tgtattttcg cggccgcatg 60
tgg 63
<210> 76
<211> 21
<212> БЕЛОК
<213> Penaeus chinensis
<400> 76
Met Ser Phe Asn Val Thr Pro Lys Phe Lys Arg Trp Gln Leu Tyr Phe
1 5 10 15
Arg Gly Arg Met Trp
20
<210> 77
<211> 438
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический полинуклеотид
<220>
<223> Модифицированный лизин GN4, GN146
<400> 77
atgcgtacat cccaacgagg catcgacctc atcaaatcct tcgagggcct gcgcctgtcc 60
gcttaccagg actcggtggg tgtctggacc ataggttacg gcaccactcg gggcgtcacc 120
cgctacatga cgatcaccgt cgagcaggcc gagcggatgc tgtcgaacga cattcagcgc 180
ttcgagccag agctagacag gctggcgaag gtgccactga accagaacca gtgggatgcc 240
ctgatgagct tcgtgtacaa cctgggcgcg gccaatctgg cgtcgtccac gctgctcgac 300
ctgctgaaca agggtgacta ccagggagca gcggaccagt tcccgcattg ggtgaatgcg 360
ggcggtaagc gcttggatgg tctggttaag cgtcgagcag ccgagcgtgc gctgttcctg 420
gagccactat cgtgataa 438
<210> 78
<211> 144
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический полипептид
<400> 78
Met Arg Thr Ser Gln Arg Gly Ile Asp Leu Ile Lys Ser Phe Glu Gly
1 5 10 15
Leu Arg Leu Ser Ala Tyr Gln Asp Ser Val Gly Val Trp Thr Ile Gly
20 25 30
Tyr Gly Thr Thr Arg Gly Val Thr Arg Tyr Met Thr Ile Thr Val Glu
35 40 45
Gln Ala Glu Arg Met Leu Ser Asn Asp Ile Gln Arg Phe Glu Pro Glu
50 55 60
Leu Asp Arg Leu Ala Lys Val Pro Leu Asn Gln Asn Gln Trp Asp Ala
65 70 75 80
Leu Met Ser Phe Val Tyr Asn Leu Gly Ala Ala Asn Leu Ala Ser Ser
85 90 95
Thr Leu Leu Asp Leu Leu Asn Lys Gly Asp Tyr Gln Gly Ala Ala Asp
100 105 110
Gln Phe Pro His Trp Val Asn Ala Gly Gly Lys Arg Leu Asp Gly Leu
115 120 125
Val Lys Arg Arg Ala Ala Glu Arg Ala Leu Phe Leu Glu Pro Leu Ser
130 135 140
<210> 79
<211> 57
<212> ДНК
<213> Pelophylax esculentus
<400> 79
atttttagca aactggcggg caaaaaaatt aaaaacctgc tgattagcgg cctgaaa 57
<210> 80
<211> 19
<212> БЕЛОК
<213> Pelophylax esculentus
<400> 80
Ile Phe Ser Lys Leu Ala Gly Lys Lys Ile Lys Asn Leu Leu Ile Ser
1 5 10 15
Gly Leu Lys
<210> 81
<211> 36
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический олигонуклеотид
<220>
<223> BBa_K1485002
<400> 81
ggcggtagcg gcagcggtag cggtagcggc agcccg 36
<210> 82
<211> 12
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический пептид
<400> 82
Gly Gly Ser Gly Ser Gly Ser Gly Ser Gly Ser Pro
1 5 10
<210> 83
<211> 381
<212> ДНК
<213> Micavibrio aeruginosavorus
<220>
<223> GN37
<400> 83
atgacataca ccctgagcaa aagaagcctg gataacctaa aaggcgttca tcccgatctg 60
gttgccgttg tccatcgcgc catccagctt acaccggttg atttcgcggt gatcgaaggc 120
ctgcgctccg tatcccgcca aaaggaactg gtggccgccg gcgccagcaa gaccatgaac 180
agccgacacc tgacaggcca tgcggttgat ctagccgctt acgtcaatgg catccgctgg 240
gactggcccc tgtatgacgc catcgccgtg gctgtgaaag ccgcagcaaa ggaattgggt 300
gtggccatcg tgtggggcgg tgactggacc acgtttaagg atggcccgca ctttgaactg 360
gatcggagca aatacagatg a 381
<210> 84
<211> 126
<212> БЕЛОК
<213> Micavibrio aeruginosavorus
<400> 84
Met Thr Tyr Thr Leu Ser Lys Arg Ser Leu Asp Asn Leu Lys Gly Val
1 5 10 15
His Pro Asp Leu Val Ala Val Val His Arg Ala Ile Gln Leu Thr Pro
20 25 30
Val Asp Phe Ala Val Ile Glu Gly Leu Arg Ser Val Ser Arg Gln Lys
35 40 45
Glu Leu Val Ala Ala Gly Ala Ser Lys Thr Met Asn Ser Arg His Leu
50 55 60
Thr Gly His Ala Val Asp Leu Ala Ala Tyr Val Asn Gly Ile Arg Trp
65 70 75 80
Asp Trp Pro Leu Tyr Asp Ala Ile Ala Val Ala Val Lys Ala Ala Ala
85 90 95
Lys Glu Leu Gly Val Ala Ile Val Trp Gly Gly Asp Trp Thr Thr Phe
100 105 110
Lys Asp Gly Pro His Phe Glu Leu Asp Arg Ser Lys Tyr Arg
115 120 125
<210> 85
<211> 39
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический олигонуклеотид
<220>
<223> Линкер IGEM (BBA_K1486037)
<400> 85
ggcggtggct ctggaggtgg tgggtccggc ggtggctct 39
<210> 86
<211> 13
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический пептид
<400> 86
Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Ser
1 5 10
<210> 87
<211> 36
<212> ДНК
<213> Sus scrofa
<400> 87
cgcctgaaaa aaattggcaa agtgctgaaa tggatt 36
<210> 88
<211> 12
<212> БЕЛОК
<213> Sus scrofa
<400> 88
Arg Leu Lys Lys Ile Gly Lys Val Leu Lys Trp Ile
1 5 10
<210> 89
<211> 102
<212> ДНК
<213> Неидентифицированная последовательность
<220>
<223> Описание неидентифицированной последовательности: последовательность Gokushovirinae
<220>
<223> gkh2
<400> 89
atgtcgaaga aggcgtcgag gaagagtttt actaagggtg ccgttaaggt tcataagaaa 60
aatgttccta ctcgtgttcc tatgcgtggc ggtattaggc tt 102
<210> 90
<211> 34
<212> БЕЛОК
<213> Неидентифицированная последовательность
<220>
<223> Описание неидентифицированной последовательности:последовательность Gokushovirinae
<400> 90
Met Ser Lys Lys Ala Ser Arg Lys Ser Phe Thr Lys Gly Ala Val Lys
1 5 10 15
Val His Lys Lys Asn Val Pro Thr Arg Val Pro Met Arg Gly Gly Ile
20 25 30
Arg Leu
<210> 91
<211> 54
<212> ДНК
<213> Sus scrofa
<400> 91
cgtaaaaaaa cccgtaaacg tctgaaaaaa atcggtaaag ttctgaaatg gatc 54
<210> 92
<211> 18
<212> БЕЛОК
<213> Sus scrofa
<400> 92
Arg Lys Lys Thr Arg Lys Arg Leu Lys Lys Ile Gly Lys Val Leu Lys
1 5 10 15
Trp Ile
<210> 93
<211> 45
<212> ДНК
<213> Sus scrofa
<400> 93
acccgcaaac gcctgaaaaa aattggcaaa gtgctgaaat ggatt 45
<210> 94
<211> 15
<212> БЕЛОК
<213> Sus scrofa
<400> 94
Thr Arg Lys Arg Leu Lys Lys Ile Gly Lys Val Leu Lys Trp Ile
1 5 10 15
<210> 95
<211> 348
<212> ДНК
<213> Фаг Pseudomonas PaP2
<400> 95
atgaaactca gcgaaaaacg agcactgttc acccagctgc ttgcccagtt aattctttgg 60
gcaggaactc aggatcgagt gtcagtagcc ttggatcaag tgaaaaggac acaggctgaa 120
gctgatgcca atgctaagtc tggagcaggc attaggaact ctctccatct actgggatta 180
gccggtgatc ttatcctcta caaggatggt aaatacatgg ataagagcga ggattataag 240
ttcctgggag attactggaa gagtctccat cctctttgtc ggtggggcgg agattttaaa 300
agccgtcctg atggtaatca tttctccttg gaacacgaag gagtgcaa 348
<210> 96
<211> 116
<212> БЕЛОК
<213> Фаг Pseudomonas PaP2
<400> 96
Met Lys Leu Ser Glu Lys Arg Ala Leu Phe Thr Gln Leu Leu Ala Gln
1 5 10 15
Leu Ile Leu Trp Ala Gly Thr Gln Asp Arg Val Ser Val Ala Leu Asp
20 25 30
Gln Val Lys Arg Thr Gln Ala Glu Ala Asp Ala Asn Ala Lys Ser Gly
35 40 45
Ala Gly Ile Arg Asn Ser Leu His Leu Leu Gly Leu Ala Gly Asp Leu
50 55 60
Ile Leu Tyr Lys Asp Gly Lys Tyr Met Asp Lys Ser Glu Asp Tyr Lys
65 70 75 80
Phe Leu Gly Asp Tyr Trp Lys Ser Leu His Pro Leu Cys Arg Trp Gly
85 90 95
Gly Asp Phe Lys Ser Arg Pro Asp Gly Asn His Phe Ser Leu Glu His
100 105 110
Glu Gly Val Gln
115
<210> 97
<211> 30
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический олигонуклеотид
<220>
<223> Линкер
<400> 97
ccaccaaccg cgggcggcac cgcgggcggc 30
<210> 98
<211> 10
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический пептид
<400> 98
Pro Pro Thr Ala Gly Gly Thr Ala Gly Gly
1 5 10
<210> 99
<211> 27
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический олигонуклеотид
<220>
<223> Метка для очистки GSHHHHHHG
<400> 99
ggatcccatc atcaccacca tcatggt 27
<210> 100
<211> 9
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический пептид
<400> 100
Gly Ser His His His His His His Gly
1 5
<210> 101
<211> 120
<212> ДНК
<213> Фаг Chlamydia 4
<400> 101
atggcacgaa gatacagact ttcgcgacgc agaagtcgac gacttttttc aagaactgca 60
ttaagaatgc atcgaagaaa tagacttcga agaattatgc gtggcggcat taggttttag 120
<210> 102
<211> 39
<212> БЕЛОК
<213> Фаг Chlamydia 4
<400> 102
Met Ala Arg Arg Tyr Arg Leu Ser Arg Arg Arg Ser Arg Arg Leu Phe
1 5 10 15
Ser Arg Thr Ala Leu Arg Met His Arg Arg Asn Arg Leu Arg Arg Ile
20 25 30
Met Arg Gly Gly Ile Arg Phe
35
<210> 103
<211> 126
<212> ДНК
<213> Escherichia coli
<400> 103
atggctcgtt cccgtagacg tatgtctaag cgttcttccc gccgttcgtt ccgcaagtat 60
gcgaagtcgc ataagaagaa ctttaaagcc cgctcaatgc gtggcggtat ccgtttatga 120
taataa 126
<210> 104
<211> 39
<212> БЕЛОК
<213> Escherichia coli
<400> 104
Met Ala Arg Ser Arg Arg Arg Met Ser Lys Arg Ser Ser Arg Arg Ser
1 5 10 15
Phe Arg Lys Tyr Ala Lys Ser His Lys Lys Asn Phe Lys Ala Arg Ser
20 25 30
Met Arg Gly Gly Ile Arg Leu
35
<210> 105
<211> 114
<212> ДНК
<213> Chlamydia trachomatis
<400> 105
aaacgtagaa aaatgacaag aaaaggttct aagcgtcttt ttactgcaac tgctgataaa 60
actaaatcta tcaatactgc cccgccgcca atgcgtggcg gtatccggtt gtag 114
<210> 106
<211> 37
<212> БЕЛОК
<213> Chlamydia trachomatis
<400> 106
Lys Arg Arg Lys Met Thr Arg Lys Gly Ser Lys Arg Leu Phe Thr Ala
1 5 10 15
Thr Ala Asp Lys Thr Lys Ser Ile Asn Thr Ala Pro Pro Pro Met Arg
20 25 30
Gly Gly Ile Arg Leu
35
<210> 107
<211> 114
<212> ДНК
<213> Oscillibacter sp. PC13
<400> 107
atgagaaagc gaatgtctaa gcgtgttgac aagaaggtgt tccgtcgtac tgccgcatct 60
gccaagaaga ttaacattga ccccaagatt taccgtggag gtattcgcct atga 114
<210> 108
<211> 37
<212> БЕЛОК
<213> Oscillibacter sp. PC13
<400> 108
Met Arg Lys Arg Met Ser Lys Arg Val Asp Lys Lys Val Phe Arg Arg
1 5 10 15
Thr Ala Ala Ser Ala Lys Lys Ile Asn Ile Asp Pro Lys Ile Tyr Arg
20 25 30
Gly Gly Ile Arg Leu
35
<210> 109
<211> 36
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический олигонуклеотид
<220>
<223> RR12
<400> 109
cgccgcctga ttcgcctgtg gctgcgcctg ctgcgc 36
<210> 110
<211> 12
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический пептид
<400> 110
Arg Arg Leu Ile Arg Leu Trp Leu Arg Leu Leu Arg
1 5 10
<210> 111
<211> 12
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический олигонуклеотид
<220>
<223> Структурная группа
<400> 111
atgatcgacc gt 12
<210> 112
<211> 4
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический пептид
<400> 112
Met Ile Asp Arg
1
<210> 113
<211> 12
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический олигонуклеотид
<220>
<223> Группа (связывающийся с внешней мембранной пептид из PMID: 22628248)
<400> 113
ttcattcgtc tg 12
<210> 114
<211> 4
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический пептид
<400> 114
Phe Ile Arg Leu
1
<210> 115
<211> 12
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический олигонуклеотид
<220>
<223> Структурная группа
<400> 115
aatccgaccc at 12
<210> 116
<211> 4
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический пептид
<400> 116
Asn Pro Thr His
1
<210> 117
<211> 477
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический полинуклеотид
<220>
<223> Лизин GN202
<400> 117
ggtccgcgtc gtccgcgtcg tccgggtcgt cgtgctccgg ttcgtacatc ccaacgaggc 60
atcgacctca tcaaatcctt cgagggcctg cgcctgtccg cttaccagga ctcggtgggt 120
gtctggacca taggttacgg caccactcgg ggcgtcaccc gctacatgac gatcaccgtc 180
gagcaggccg agcggatgct gtcgaacgac attcagcgct tcgagccaga gctagacagg 240
ctggcgaagg tgccactgaa ccagaaccag tgggatgccc tgatgagctt cgtgtacaac 300
ctgggcgcgg ccaatctggc gtcgtccacg ctgctcgacc tgctgaacaa gggtgactac 360
cagggagcag cggaccagtt cccgcattgg gtgaatgcgg gcggtaagcg cttggatggt 420
ctggttaagc gtcgagcagc cgagcgtgcg ctgttcctgg agccactatc gtgataa 477
<210> 118
<211> 158
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический полипептид
<400> 118
Met Gly Pro Arg Arg Pro Arg Arg Pro Gly Arg Arg Ala Pro Val Arg
1 5 10 15
Thr Ser Gln Arg Gly Ile Asp Leu Ile Lys Ser Phe Glu Gly Leu Arg
20 25 30
Leu Ser Ala Tyr Gln Asp Ser Val Gly Val Trp Thr Ile Gly Tyr Gly
35 40 45
Thr Thr Arg Gly Val Thr Arg Tyr Met Thr Ile Thr Val Glu Gln Ala
50 55 60
Glu Arg Met Leu Ser Asn Asp Ile Gln Arg Phe Glu Pro Glu Leu Asp
65 70 75 80
Arg Leu Ala Lys Val Pro Leu Asn Gln Asn Gln Trp Asp Ala Leu Met
85 90 95
Ser Phe Val Tyr Asn Leu Gly Ala Ala Asn Leu Ala Ser Ser Thr Leu
100 105 110
Leu Asp Leu Leu Asn Lys Gly Asp Tyr Gln Gly Ala Ala Asp Gln Phe
115 120 125
Pro His Trp Val Asn Ala Gly Gly Lys Arg Leu Asp Gly Leu Val Lys
130 135 140
Arg Arg Ala Ala Glu Arg Ala Leu Phe Leu Glu Pro Leu Ser
145 150 155
<210> 119
<211> 30
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический олигонуклеотид
<220>
<223> Катионный пептид
<400> 119
aaattcttta agttctttaa gttttttaaa 30
<210> 120
<211> 10
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический пептид
<400> 120
Lys Phe Phe Lys Phe Phe Lys Phe Phe Lys
1 5 10
<210> 121
<211> 54
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический олигонуклеотид
<220>
<223> Линкер
<400> 121
gccggcgcag gagctggtgc aggagctggt gcaggagctg gtgcaggagc tagc 54
<210> 122
<211> 18
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический пептид
<400> 122
Ala Gly Ala Gly Ala Gly Ala Gly Ala Gly Ala Gly Ala Gly Ala Gly
1 5 10 15
Ala Ser
<210> 123
<211> 543
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический полинуклеотид
<220>
<223> Лизин GN14
<400> 123
aataacgaac ttccttgggt agccgaagcc cgaaagtata tcggccttcg cgaagacact 60
tcgaagactt cgcataaccc gaaacttctt gccatgcttg accgcatggg cgaattttcc 120
aacgaatccc gcgcttggtg gcacgacgac gaaacgcctt ggtgcggact gttcgtcggc 180
tattgcttgg gcgttgccgg gcgctacgtc gtccgcgaat ggtacagggc gcgggcatgg 240
gaagccccgc agcttacgaa gcttgaccgg cccgcatacg gcgcgcttgt gaccttcacg 300
cgaagcggcg gcggccacgt cggttttatt gtgggcaagg atgcgcgcgg aaatcttatg 360
gttcttggcg gtaatcagtc gaacgccgta agtatcgcac cgttcgcagt atcccgcgta 420
accggctatt tctggccgtc gttctggcga aacaagaccg cagttaaaag cgttccgttt 480
gaagaacgtt attcgctgcc gctgttgaag tcgaacggcg aactttcgac gaatgaagcg 540
taa 543
<210> 124
<211> 180
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический полипептид
<400> 124
Asn Asn Glu Leu Pro Trp Val Ala Glu Ala Arg Lys Tyr Ile Gly Leu
1 5 10 15
Arg Glu Asp Thr Ser Lys Thr Ser His Asn Pro Lys Leu Leu Ala Met
20 25 30
Leu Asp Arg Met Gly Glu Phe Ser Asn Glu Ser Arg Ala Trp Trp His
35 40 45
Asp Asp Glu Thr Pro Trp Cys Gly Leu Phe Val Gly Tyr Cys Leu Gly
50 55 60
Val Ala Gly Arg Tyr Val Val Arg Glu Trp Tyr Arg Ala Arg Ala Trp
65 70 75 80
Glu Ala Pro Gln Leu Thr Lys Leu Asp Arg Pro Ala Tyr Gly Ala Leu
85 90 95
Val Thr Phe Thr Arg Ser Gly Gly Gly His Val Gly Phe Ile Val Gly
100 105 110
Lys Asp Ala Arg Gly Asn Leu Met Val Leu Gly Gly Asn Gln Ser Asn
115 120 125
Ala Val Ser Ile Ala Pro Phe Ala Val Ser Arg Val Thr Gly Tyr Phe
130 135 140
Trp Pro Ser Phe Trp Arg Asn Lys Thr Ala Val Lys Ser Val Pro Phe
145 150 155 160
Glu Glu Arg Tyr Ser Leu Pro Leu Leu Lys Ser Asn Gly Glu Leu Ser
165 170 175
Thr Asn Glu Ala
180
<210> 125
<211> 471
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический полинуклеотид
<220>
<223> GN156
<400> 125
ggtccgcgtc gtccgcgtcg tccgggtcgt cgtgctccgg ttcgtacctc tcagcgtggt 60
atcgacctga tcaaatcttt cgaaggtctg cgtctgtctg cttaccagga ctctgttggt 120
gtttggacca tcggttacgg taccacccgt ggtgttaccc gttacatgac catcaccgtt 180
gaacaggctg aacgtatgct gtctaacgac atccagcgtt tcgaaccgga actggaccgt 240
ctggctaaag ttccgctgaa ccagaaccag tgggacgctc tgatgtcttt cgtttacaac 300
ctgggtgctg ctaacctggc ttcttctacc ctgctgaaac tgctgaacaa aggtgactac 360
cagggtgctg ctgaccagtt cccgcgttgg gttaacgctg gtggtaaacg tctggacggt 420
ctggttaaac gtcgtgctgc tgaacgtgct ctgttcctgg aaccgctgtc t 471
<210> 126
<211> 157
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический полипептид
<400> 126
Gly Pro Arg Arg Pro Arg Arg Pro Gly Arg Arg Ala Pro Val Arg Thr
1 5 10 15
Ser Gln Arg Gly Ile Asp Leu Ile Lys Ser Phe Glu Gly Leu Arg Leu
20 25 30
Ser Ala Tyr Gln Asp Ser Val Gly Val Trp Thr Ile Gly Tyr Gly Thr
35 40 45
Thr Arg Gly Val Thr Arg Tyr Met Thr Ile Thr Val Glu Gln Ala Glu
50 55 60
Arg Met Leu Ser Asn Asp Ile Gln Arg Phe Glu Pro Glu Leu Asp Arg
65 70 75 80
Leu Ala Lys Val Pro Leu Asn Gln Asn Gln Trp Asp Ala Leu Met Ser
85 90 95
Phe Val Tyr Asn Leu Gly Ala Ala Asn Leu Ala Ser Ser Thr Leu Leu
100 105 110
Lys Leu Leu Asn Lys Gly Asp Tyr Gln Gly Ala Ala Asp Gln Phe Pro
115 120 125
Arg Trp Val Asn Ala Gly Gly Lys Arg Leu Asp Gly Leu Val Lys Arg
130 135 140
Arg Ala Ala Glu Arg Ala Leu Phe Leu Glu Pro Leu Ser
145 150 155
<210> 127
<211> 39
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический полипептид
<220>
<223> PGN4
<400> 127
Asn Lys Gly Asp Tyr Gln Gly Ala Ala Asp Gln Phe Pro Arg Trp Val
1 5 10 15
Asn Ala Gly Gly Lys Arg Leu Asp Gly Leu Val Lys Arg Arg Ala Ser
20 25 30
Gln Ser Arg Glu Ser Gln Cys
35
<210> 128
<211> 42
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический полипептид
<220>
<223> FGN4-1
<400> 128
Asn Lys Gly Asp Tyr Gln Gly Ala Ala Asp Gln Phe Pro Arg Trp Val
1 5 10 15
Asn Ala Gly Gly Lys Arg Leu Asp Gly Leu Val Lys Arg Arg Ala Ala
20 25 30
Glu Arg Ala Leu Phe Leu Glu Pro Leu Ser
35 40
<210> 129
<211> 31
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический полипептид
<220>
<223> FGN4-2
<400> 129
Asn Lys Gly Asp Tyr Gln Gly Ala Ala Asp Gln Phe Pro Arg Trp Val
1 5 10 15
Asn Ala Gly Gly Lys Arg Leu Asp Gly Leu Val Lys Arg Arg Ala
20 25 30
<210> 130
<211> 54
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический олигонуклеотид
<220>
<223> RI18
<400> 130
cgtaaaaaaa cccgtaaacg tctgaaaaaa atcggtaaag ttctgaaatg gatc 54
<210> 131
<211> 18
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический пептид
<400> 131
Arg Lys Lys Thr Arg Lys Arg Leu Lys Lys Ile Gly Lys Val Leu Lys
1 5 10 15
Trp Ile
<210> 132
<211> 111
<212> ДНК
<213> Вирус Chlamydia Chp1
<400> 132
atggttcgta gaagacgttt gagaagaaga ataagtagaa gaatttttag aagaacagta 60
gctagagttg gtagaaggcg aaggtctttt cgtggtggta ttagatttta a 111
<210> 133
<211> 36
<212> БЕЛОК
<213> Вирус Chlamydia Chp1
<400> 133
Met Val Arg Arg Arg Arg Leu Arg Arg Arg Ile Ser Arg Arg Ile Phe
1 5 10 15
Arg Arg Thr Val Ala Arg Val Gly Arg Arg Arg Arg Ser Phe Arg Gly
20 25 30
Gly Ile Arg Phe
35
<210> 134
<211> 108
<212> ДНК
<213> Вирус Chlamydia CPAR39
<400> 134
ttgtgcaaaa aagtgtgcaa aaaatgccca aaaaaagggc caaaaaatgc ccccaaaatc 60
ggagcatttt acgagagaaa aacacctaga cttaaacagt ctacttga 108
<210> 135
<211> 35
<212> БЕЛОК
<213> Вирус Chlamydia CPAR39
<400> 135
Met Cys Lys Lys Val Cys Lys Lys Cys Pro Lys Lys Gly Pro Lys Asn
1 5 10 15
Ala Pro Lys Ile Gly Ala Phe Tyr Glu Arg Lys Thr Pro Arg Leu Lys
20 25 30
Gln Ser Thr
35
<210> 136
<211> 135
<212> ДНК
<213> Фаг Chlamydia 3
<400> 136
atgaggttaa aaatggcacg aagaagatac agacttccgc gacgtagaag tcgaagactt 60
ttttcaagaa ctgcattaag gatgcatcca agaaataggc ttcgaagaat tatgcgtggc 120
ggcattaggt tctag 135
<210> 137
<211> 44
<212> БЕЛОК
<213> Фаг Chlamydia 3
<400> 137
Met Arg Leu Lys Met Ala Arg Arg Arg Tyr Arg Leu Pro Arg Arg Arg
1 5 10 15
Ser Arg Arg Leu Phe Ser Arg Thr Ala Leu Arg Met His Pro Arg Asn
20 25 30
Arg Leu Arg Arg Ile Met Arg Gly Gly Ile Arg Phe
35 40
<210> 138
<211> 117
<212> ДНК
<213> Chlamydia trachomatis
<400> 138
atgaaacgta gaaaaatgac aagaaaaggt tctaagcgtc tttttactgc aactgctgat 60
aaaactaaat ctatcaatac tgccccgccg ccaatgcgtg gcggtatccg gttgtaa 117
<210> 139
<211> 38
<212> БЕЛОК
<213> Chlamydia trachomatis
<400> 139
Met Lys Arg Arg Lys Met Thr Arg Lys Gly Ser Lys Arg Leu Phe Thr
1 5 10 15
Ala Thr Ala Asp Lys Thr Lys Ser Ile Asn Thr Ala Pro Pro Pro Met
20 25 30
Arg Gly Gly Ile Arg Leu
35
<210> 140
<211> 120
<212> ДНК
<213> Chlamydia trachomatis
<400> 140
atgtctaaaa agcgttctcg catgtctcgc cgccgttcta agaagttgtt ctcgaaaacg 60
gctctccgca cgaagagtgt caacacccgt ccgcctatgc gcggagggtt ccggttctga 120
<210> 141
<211> 39
<212> БЕЛОК
<213> Chlamydia trachomatis
<400> 141
Met Ser Lys Lys Arg Ser Arg Met Ser Arg Arg Arg Ser Lys Lys Leu
1 5 10 15
Phe Ser Lys Thr Ala Leu Arg Thr Lys Ser Val Asn Thr Arg Pro Pro
20 25 30
Met Arg Gly Gly Phe Arg Phe
35
<210> 142
<211> 123
<212> ДНК
<213> Chlamydia trachomatis
<400> 142
atgtctcttc gtcgtcataa gctttctcgt aaggcgtcta agcgtatttt tcgtaaaggt 60
gcatcacgca cgaagacttt gaatactcgt gctacgccta tgcgcggcgg tttccgtatt 120
taa 123
<210> 143
<211> 40
<212> БЕЛОК
<213> Chlamydia trachomatis
<400> 143
Met Ser Leu Arg Arg His Lys Leu Ser Arg Lys Ala Ser Lys Arg Ile
1 5 10 15
Phe Arg Lys Gly Ala Ser Arg Thr Lys Thr Leu Asn Thr Arg Ala Thr
20 25 30
Pro Met Arg Gly Gly Phe Arg Ile
35 40
<210> 144
<211> 117
<212> ДНК
<213> Chlamydia trachomatis
<400> 144
gtgaaacgtc gtaaactgtc caaaaagaaa tctcgcaaga ttttcactcg cggtgctgta 60
aatgtgaaaa agcgtaacct tcgcgctcgc ccaatgcgcg gcggtttccg gatctaa 117
<210> 145
<211> 38
<212> БЕЛОК
<213> Chlamydia trachomatis
<400> 145
Met Lys Arg Arg Lys Leu Ser Lys Lys Lys Ser Arg Lys Ile Phe Thr
1 5 10 15
Arg Gly Ala Val Asn Val Lys Lys Arg Asn Leu Arg Ala Arg Pro Met
20 25 30
Arg Gly Gly Phe Arg Ile
35
<210> 146
<211> 114
<212> ДНК
<213> Chlamydia trachomatis
<400> 146
atggctaaaa aaatgactaa aggcaaggat cgtcaggttt ttcgtaaaac cgctgatcgt 60
actaagaaac tcaatgttag accgttgtta tatcgaggag gtatcagatt atga 114
<210> 147
<211> 37
<212> БЕЛОК
<213> Chlamydia trachomatis
<400> 147
Met Ala Lys Lys Met Thr Lys Gly Lys Asp Arg Gln Val Phe Arg Lys
1 5 10 15
Thr Ala Asp Arg Thr Lys Lys Leu Asn Val Arg Pro Leu Leu Tyr Arg
20 25 30
Gly Gly Ile Arg Leu
35
<210> 148
<211> 120
<212> ДНК
<213> Chlamydia trachomatis
<400> 148
atggcaggaa aaaaaatggt atcaaaagga aaagatagac agattttccg aaaaactgct 60
gatcgcacta aaaaaatgaa tgtgcgcccg ctattatatc gtggaggtat tagattatga 120
<210> 149
<211> 39
<212> БЕЛОК
<213> Chlamydia trachomatis
<400> 149
Met Ala Gly Lys Lys Met Val Ser Lys Gly Lys Asp Arg Gln Ile Phe
1 5 10 15
Arg Lys Thr Ala Asp Arg Thr Lys Lys Met Asn Val Arg Pro Leu Leu
20 25 30
Tyr Arg Gly Gly Ile Arg Leu
35
<210> 150
<211> 126
<212> ДНК
<213> Морской гокашовирус
<400> 150
atgagaagac caagaaaaat gaactataaa aaatcaaaaa gaatgttttc acgcacagca 60
gcgagaacac acagaaaaaa ctctctaaga ggtagccgac ctatgagagg cggaatacgt 120
ctttaa 126
<210> 151
<211> 41
<212> БЕЛОК
<213> Морской гокашовирус
<400> 151
Met Arg Arg Pro Arg Lys Met Asn Tyr Lys Lys Ser Lys Arg Met Phe
1 5 10 15
Ser Arg Thr Ala Ala Arg Thr His Arg Lys Asn Ser Leu Arg Gly Ser
20 25 30
Arg Pro Met Arg Gly Gly Ile Arg Leu
35 40
<210> 152
<211> 108
<212> ДНК
<213> Неидентифицированная последовательность
<220>
<223> Описание неидентифицированной последовательности: бактерии; последовательность образца из окружающей среды
<400> 152
atgaaaatgc gtaagcggac ggacaagcga gtgtttaccc gcaccgctgc taagtccaag 60
aaagtgaaca ttgccccgaa aatttttaga ggaggtatcc gtctgtga 108
<210> 153
<211> 35
<212> БЕЛОК
<213> Неидентифицированная последовательность
<220>
<223> Описание неидентифицированной последовательности: бактерии; последовательность образца из окружающей среды
<400> 153
Met Lys Met Arg Lys Arg Thr Asp Lys Arg Val Phe Thr Arg Thr Ala
1 5 10 15
Ala Lys Ser Lys Lys Val Asn Ile Ala Pro Lys Ile Phe Arg Gly Gly
20 25 30
Ile Arg Leu
35
<210> 154
<211> 120
<212> ДНК
<213> Escherichia sp.
<400> 154
atggctcgtt ctcgccgtcg tatgtccaag cgttcttccc gtcgttcgtt ccgtaagtac 60
gcaaagacgc ataaacgtaa ctttaaagcc cgctctatgc gtggtggaat tcgtctttga 120
<210> 155
<211> 39
<212> БЕЛОК
<213> Escherichia sp.
<400> 155
Met Ala Arg Ser Arg Arg Arg Met Ser Lys Arg Ser Ser Arg Arg Ser
1 5 10 15
Phe Arg Lys Tyr Ala Lys Thr His Lys Arg Asn Phe Lys Ala Arg Ser
20 25 30
Met Arg Gly Gly Ile Arg Leu
35
<210> 156
<211> 144
<212> ДНК
<213> Cognatishimia maritima
<400> 156
atggaaagcc cgaacagccg cagccagctg ggcattaccc tgtatctgct gagcaccatt 60
tttccggatg cgtgctttcg ctatcgccgc gaactgccgt atccgctggt gatttggggc 120
gtggcgaccc tgtgcctgca gtaa 144
<210> 157
<211> 47
<212> БЕЛОК
<213> Cognatishimia maritima
<400> 157
Met Glu Ser Pro Asn Ser Arg Ser Gln Leu Gly Ile Thr Leu Tyr Leu
1 5 10 15
Leu Ser Thr Ile Phe Pro Asp Ala Cys Phe Arg Tyr Arg Arg Glu Leu
20 25 30
Pro Tyr Pro Leu Val Ile Trp Gly Val Ala Thr Leu Cys Leu Gln
35 40 45
<210> 158
<211> 114
<212> ДНК
<213> Неидентифицированная последовательность
<220>
<223> Описание неидентифицированной последовательности: бактерии; последовательность образца из окружающей среды
<400> 158
atgagacgtc gtcgtctatc ccgcagaact tcccgccgtt ttttccgtaa aggacttaag 60
gttcgccgtc gtaacctccg cgcgagaccc atgagaggcg gattcagaat ttga 114
<210> 159
<211> 37
<212> БЕЛОК
<213> Неидентифицированная последовательность
<220>
<223> Описание неидентифицированной последовательности: бактерии; последовательность образца из окружающей среды
<400> 159
Met Arg Arg Arg Arg Leu Ser Arg Arg Thr Ser Arg Arg Phe Phe Arg
1 5 10 15
Lys Gly Leu Lys Val Arg Arg Arg Asn Leu Arg Ala Arg Pro Met Arg
20 25 30
Gly Gly Phe Arg Ile
35
<210> 160
<211> 120
<212> ДНК
<213> Неидентифицированная последовательность
<220>
<223> Описание неидентифицированной последовательности: бактерии; последовательность образца из окружающей среды
<400> 160
atggcacgac gcaagaagat gaaaggcaag cgggataaac gggtgtttaa gcagacagcc 60
aacaaaacca aggctatcaa catcagccca aaaaacatga gagggggtac gagactgtga 120
<210> 161
<211> 39
<212> БЕЛОК
<213> Неидентифицированная последовательность
<220>
<223> Описание неидентифицированной последовательности: бактерии; последовательность образца из окружающей среды
<400> 161
Met Ala Arg Arg Lys Lys Met Lys Gly Lys Arg Asp Lys Arg Val Phe
1 5 10 15
Lys Gln Thr Ala Asn Lys Thr Lys Ala Ile Asn Ile Ser Pro Lys Asn
20 25 30
Met Arg Gly Gly Thr Arg Leu
35
<210> 162
<211> 162
<212> ДНК
<213> Морской гокашовирус
<400> 162
atgttaactg tgtggagtga cacccctacc ataaaaagga gaaaagacat gtatagaaag 60
agaatgtcaa gaaagaaaag taaaaaggtt tttgcaaaaa ccgcaatgaa agtaaataaa 120
agaaaccacg ttaaacctat gcgtggtgga tatagaatat aa 162
<210> 163
<211> 53
<212> БЕЛОК
<213> Морской гокашовирус
<400> 163
Met Leu Thr Val Trp Ser Asp Thr Pro Thr Ile Lys Arg Arg Lys Asp
1 5 10 15
Met Tyr Arg Lys Arg Met Ser Arg Lys Lys Ser Lys Lys Val Phe Ala
20 25 30
Lys Thr Ala Met Lys Val Asn Lys Arg Asn His Val Lys Pro Met Arg
35 40 45
Gly Gly Tyr Arg Ile
50
<210> 164
<211> 120
<212> ДНК
<213> Морской гокашовирус
<400> 164
atgatgaagt acagaaaaaa aatgagcgct aaaagtagcc gaaagcaatt tacaaaaggc 60
gccatgaaag tgaagggtaa aaacttcaca aaaccaatgc gcggaggcat ccgtctatag 120
<210> 165
<211> 39
<212> БЕЛОК
<213> Морской гокашовирус
<400> 165
Met Met Lys Tyr Arg Lys Lys Met Ser Ala Lys Ser Ser Arg Lys Gln
1 5 10 15
Phe Thr Lys Gly Ala Met Lys Val Lys Gly Lys Asn Phe Thr Lys Pro
20 25 30
Met Arg Gly Gly Ile Arg Leu
35
<210> 166
<211> 117
<212> ДНК
<213> Морской гокашовирус
<400> 166
atgcgacgtt acaatgtaaa taaaggtaaa tctgctaaga agtttcgaaa gcaggtaagt 60
aagacgaagg ttgcaaacct acgttctaat ccaatgcgag gtggttggag actctaa 117
<210> 167
<211> 38
<212> БЕЛОК
<213> Морской гокашовирус
<400> 167
Met Arg Arg Tyr Asn Val Asn Lys Gly Lys Ser Ala Lys Lys Phe Arg
1 5 10 15
Lys Gln Val Ser Lys Thr Lys Val Ala Asn Leu Arg Ser Asn Pro Met
20 25 30
Arg Gly Gly Trp Arg Leu
35
<210> 168
<211> 87
<212> ДНК
<213> Вирус Spiroplasma SpV4
<400> 168
atggcttatc gtggttttaa aacgagtcgt gttgtaaaac atagagtacg tagaagatgg 60
tttaatcata gaagacgtta tagatag 87
<210> 169
<211> 28
<212> БЕЛОК
<213> Вирус Spiroplasma SpV4
<400> 169
Met Ala Tyr Arg Gly Phe Lys Thr Ser Arg Val Val Lys His Arg Val
1 5 10 15
Arg Arg Arg Trp Phe Asn His Arg Arg Arg Tyr Arg
20 25
<210> 170
<211> 117
<212> ДНК
<213> Вирус Spiroplasma SpV4
<400> 170
gtgagacgca aggttaagaa cacaaagcgt catcagtgga ggttgactca ttctgcacgt 60
tcaattaaac gtgctaatat aatgccgtca aatcctcgtg gtggacgtcg tttttag 117
<210> 171
<211> 38
<212> БЕЛОК
<213> Вирус Spiroplasma SpV4
<400> 171
Met Arg Arg Lys Val Lys Asn Thr Lys Arg His Gln Trp Arg Leu Thr
1 5 10 15
His Ser Ala Arg Ser Ile Lys Arg Ala Asn Ile Met Pro Ser Asn Pro
20 25 30
Arg Gly Gly Arg Arg Phe
35
<210> 172
<211> 798
<212> ДНК
<213> Фаг Pseudomonas PhiPA3
<400> 172
atgacattac tgaagaaagg cgacaagggt gacgccgtaa aacaactaca gcagaaactc 60
aaagaccttg ggtataccct gggtgtcgat ggcaacttcg gtaatggcac cgatactgtc 120
gttcgttctt tccaaaccaa aatgaagctt agtgttgatg gtgtggttgg taatggtact 180
atgagtacta ttgactctac tctagcaggc attaaagcgt ggaagactag tgtacctttc 240
cctgcgacga acaaatcccg agcaatggca atgccaacgt tgactgaaat aggtcgactg 300
acaaacgttg atcctaaatt gctagcgaca ttctgttcta tcgaaagcgc gtttgattac 360
acagctaaac cctacaagcc cgatggcaca gtgtacagct ccgccgaagg ttggttccag 420
ttcctggatg caacatggga tgacgaagtg cgtaaacacg gtaagcaata tagcttccct 480
gttgatcctg gtcgttcttt gcgtaaagat ccacgggcta atggcttgat gggcgctgag 540
ttcctcaaag ggaatgctgc tattctgcgg ccagtactgg gtcatgaacc gagcgacaca 600
gatctttatc tagcccattt catgggagca ggtggcgcaa aacagttcct tatggccgat 660
caaaataaat tggctgccga attgttccct ggtccagcta aggctaatcc taacatcttc 720
tataaatccg gaaatattgc ccgcacttta gcagaggtct atgcagtcct cgatgctaag 780
gtagccaagc atagagct 798
<210> 173
<211> 266
<212> БЕЛОК
<213> Фаг Pseudomonas PhiPA3
<400> 173
Met Thr Leu Leu Lys Lys Gly Asp Lys Gly Asp Ala Val Lys Gln Leu
1 5 10 15
Gln Gln Lys Leu Lys Asp Leu Gly Tyr Thr Leu Gly Val Asp Gly Asn
20 25 30
Phe Gly Asn Gly Thr Asp Thr Val Val Arg Ser Phe Gln Thr Lys Met
35 40 45
Lys Leu Ser Val Asp Gly Val Val Gly Asn Gly Thr Met Ser Thr Ile
50 55 60
Asp Ser Thr Leu Ala Gly Ile Lys Ala Trp Lys Thr Ser Val Pro Phe
65 70 75 80
Pro Ala Thr Asn Lys Ser Arg Ala Met Ala Met Pro Thr Leu Thr Glu
85 90 95
Ile Gly Arg Leu Thr Asn Val Asp Pro Lys Leu Leu Ala Thr Phe Cys
100 105 110
Ser Ile Glu Ser Ala Phe Asp Tyr Thr Ala Lys Pro Tyr Lys Pro Asp
115 120 125
Gly Thr Val Tyr Ser Ser Ala Glu Gly Trp Phe Gln Phe Leu Asp Ala
130 135 140
Thr Trp Asp Asp Glu Val Arg Lys His Gly Lys Gln Tyr Ser Phe Pro
145 150 155 160
Val Asp Pro Gly Arg Ser Leu Arg Lys Asp Pro Arg Ala Asn Gly Leu
165 170 175
Met Gly Ala Glu Phe Leu Lys Gly Asn Ala Ala Ile Leu Arg Pro Val
180 185 190
Leu Gly His Glu Pro Ser Asp Thr Asp Leu Tyr Leu Ala His Phe Met
195 200 205
Gly Ala Gly Gly Ala Lys Gln Phe Leu Met Ala Asp Gln Asn Lys Leu
210 215 220
Ala Ala Glu Leu Phe Pro Gly Pro Ala Lys Ala Asn Pro Asn Ile Phe
225 230 235 240
Tyr Lys Ser Gly Asn Ile Ala Arg Thr Leu Ala Glu Val Tyr Ala Val
245 250 255
Leu Asp Ala Lys Val Ala Lys His Arg Ala
260 265
<210> 174
<211> 426
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический полинуклеотид
<220>
<223> GN37 и RI18
<400> 174
atgacataca ccctgagcaa aagaagcctg gataacctaa aaggcgttca tcccgatctg 60
gttgccgttg tccatcgcgc catccagctt acaccggttg atttcgcggt gatcgaaggc 120
ctgcgctccg tatcccgcca aaaggaactg gtggccgccg gcgccagcaa gaccatgaac 180
agccgacacc tgacaggcca tgcggttgat ctagccgctt acgtcaatgg catccgctgg 240
gactggcccc tgtatgacgc catcgccgtg gctgtgaaag ccgcagcaaa ggaattgggt 300
gtggccatcg tgtggggcgg tgactggacc acgtttaagg atggcccgca ctttgaactg 360
gatcggagca aatacagacg taaaaaaacc cgtaaacgtc tgaaaaaaat cggtaaagtt 420
ctgaaa 426
<210> 175
<211> 142
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический полипептид
<400> 175
Met Thr Tyr Thr Leu Ser Lys Arg Ser Leu Asp Asn Leu Lys Gly Val
1 5 10 15
His Pro Asp Leu Val Ala Val Val His Arg Ala Ile Gln Leu Thr Pro
20 25 30
Val Asp Phe Ala Val Ile Glu Gly Leu Arg Ser Val Ser Arg Gln Lys
35 40 45
Glu Leu Val Ala Ala Gly Ala Ser Lys Thr Met Asn Ser Arg His Leu
50 55 60
Thr Gly His Ala Val Asp Leu Ala Ala Tyr Val Asn Gly Ile Arg Trp
65 70 75 80
Asp Trp Pro Leu Tyr Asp Ala Ile Ala Val Ala Val Lys Ala Ala Ala
85 90 95
Lys Glu Leu Gly Val Ala Ile Val Trp Gly Gly Asp Trp Thr Thr Phe
100 105 110
Lys Asp Gly Pro His Phe Glu Leu Asp Arg Ser Lys Tyr Arg Arg Lys
115 120 125
Lys Thr Arg Lys Arg Leu Lys Lys Ile Gly Lys Val Leu Lys
130 135 140
<210> 176
<211> 120
<212> ДНК
<213> Escherichia sp.
<400> 176
atggctcgtt ctcgtcgtcg tatgtctaaa cgttcttctc gtcgttcttt tcgtaaatat 60
gctaaaactc ataaaaaaaa ttttaaagct cgttctatgc gtggaggaat tcgtttataa 120
<210> 177
<211> 39
<212> БЕЛОК
<213> Escherichia sp.
<400> 177
Met Ala Arg Ser Arg Arg Arg Met Ser Lys Arg Ser Ser Arg Arg Ser
1 5 10 15
Phe Arg Lys Tyr Ala Lys Thr His Lys Lys Asn Phe Lys Ala Arg Ser
20 25 30
Met Arg Gly Gly Ile Arg Leu
35
<210> 178
<211> 117
<212> ДНК
<213> Escherichia coli
<400> 178
atggcgcgca gccgccgccg catgagcaaa cgcagcagcc gccgcagctt tcgcaaatat 60
gcgaaaagcc ataaaaaaaa ctttaaagcg cgcagcatgc gcggcggcat tcgcctg 117
<210> 179
<211> 39
<212> БЕЛОК
<213> Escherichia coli
<400> 179
Met Ala Arg Ser Arg Arg Arg Met Ser Lys Arg Ser Ser Arg Arg Ser
1 5 10 15
Phe Arg Lys Tyr Ala Lys Ser His Lys Lys Asn Phe Lys Ala Arg Ser
20 25 30
Met Arg Gly Gly Ile Arg Leu
35
<210> 180
<211> 117
<212> ДНК
<213> Микровирус MP12 5423, ассоциированный с фекалиями Alces alces
<400> 180
atggcaaaga aaattagaaa caaagcacgt gatagacgta tcttcacaag aacagcttca 60
cgcatgcaca aggcaaaccg cacaccaaga tttatgagag gcggtattag gttatga 117
<210> 181
<211> 38
<212> БЕЛОК
<213> Микровирус MP12 5423, ассоциированный с фекалиями Alces alces
<400> 181
Met Ala Lys Lys Ile Arg Asn Lys Ala Arg Asp Arg Arg Ile Phe Thr
1 5 10 15
Arg Thr Ala Ser Arg Met His Lys Ala Asn Arg Thr Pro Arg Phe Met
20 25 30
Arg Gly Gly Ile Arg Leu
35
<210> 182
<211> 117
<212> ДНК
<213> Неидентифицированная последовательность
<220>
<223> Описание неидентифицированной последовательности: последовательность Gokushovirinae из образца из окружающей среды
<400> 182
atgcgtcgta aaaaaatgtc acgcggtaaa tcaaaaaaac tctttcgccg aacagcaaaa 60
cgcgttcatc gaaaaaacct acgagctcgc ccaatgcgtg gcggcatacg catgtag 117
<210> 183
<211> 38
<212> БЕЛОК
<213> Неидентифицированная последовательность
<220>
<223> Описание неидентифицированной последовательности: последовательность Gokushovirinae из образца из окружающей среды
<400> 183
Met Arg Arg Lys Lys Met Ser Arg Gly Lys Ser Lys Lys Leu Phe Arg
1 5 10 15
Arg Thr Ala Lys Arg Val His Arg Lys Asn Leu Arg Ala Arg Pro Met
20 25 30
Arg Gly Gly Ile Arg Met
35
<210> 184
<211> 120
<212> ДНК
<213> Неидентифицированная последовательность
<220>
<223> Описание неидентифицированной последовательности: последовательность Gokushovirinae из образца из окружающей среды
<400> 184
atggcgaagc gacacaaaat cccgcaacgc gcgtcacaac attccttcac gcgccatgcg 60
caaaaggtcc accctaagaa cgttccccgc ctgccaatgc gaggcggtat ccgtctctaa 120
<210> 185
<211> 39
<212> БЕЛОК
<213> Неидентифицированная последовательность
<220>
<223> Описание неидентифицированной последовательности: последовательность Gokushovirinae из образца из окружающей среды
<400> 185
Met Ala Lys Arg His Lys Ile Pro Gln Arg Ala Ser Gln His Ser Phe
1 5 10 15
Thr Arg His Ala Gln Lys Val His Pro Lys Asn Val Pro Arg Leu Pro
20 25 30
Met Arg Gly Gly Ile Arg Leu
35
<210> 186
<211> 114
<212> ДНК
<213> Неидентифицированная последовательность
<220>
<223> Описание неидентифицированной последовательности: последовательность некультивированной бактерии
<400> 186
atgcgtaaaa aaatgcacaa atcattagac aagcgagtgt ttaaccgcac tgcaaaaaaa 60
tcaaaaaaaa taaatgttaa tcctgtagtt tatcgtggag gtattagatt atga 114
<210> 187
<211> 37
<212> БЕЛОК
<213> Неидентифицированная последовательность
<220>
<223> Описание неидентифицированной последовательности: последовательность некультивированной бактерии
<400> 187
Met Arg Lys Lys Met His Lys Ser Leu Asp Lys Arg Val Phe Asn Arg
1 5 10 15
Thr Ala Lys Lys Ser Lys Lys Ile Asn Val Asn Pro Val Val Tyr Arg
20 25 30
Gly Gly Ile Arg Leu
35
<210> 188
<211> 117
<212> ДНК
<213> Морской гокашовирус
<400> 188
atgcgacgtt acaatgtaaa taaaggtaaa tctgctaaga agtttcgaaa gcaggtaagt 60
aagacgaagg ttgcaaacct acgttctaat ccaatgcgag gtggttggag actctaa 117
<210> 189
<211> 38
<212> БЕЛОК
<213> Морской гокашовирус
<400> 189
Met Arg Arg Tyr Asn Val Asn Lys Gly Lys Ser Ala Lys Lys Phe Arg
1 5 10 15
Lys Gln Val Ser Lys Thr Lys Val Ala Asn Leu Arg Ser Asn Pro Met
20 25 30
Arg Gly Gly Trp Arg Leu
35
<210> 190
<211> 126
<212> ДНК
<213> Richelia intracellularis HH01
<400> 190
atgcgtccag ttaaaagatc aagagtaaat aaggcccgat ctgcaggcaa gtttcgtaag 60
caggtcggta aaacaaagat ggcaaatctg cgtagtaatc cgatgcgcgg cggatggcgg 120
ctgtga 126
<210> 191
<211> 41
<212> БЕЛОК
<213> Richelia intracellularis HH01
<400> 191
Met Arg Pro Val Lys Arg Ser Arg Val Asn Lys Ala Arg Ser Ala Gly
1 5 10 15
Lys Phe Arg Lys Gln Val Gly Lys Thr Lys Met Ala Asn Leu Arg Ser
20 25 30
Asn Pro Met Arg Gly Gly Trp Arg Leu
35 40
<210> 192
<211> 126
<212> ДНК
<213> Gokushovirinae Fen7875_21
<400> 192
atgaagccat tgaagcgtaa gccggttcag aaggcgcggt cagcagccaa gttccgtcga 60
aatgtgtcta ccgttaaggc tgccaatatg gcggtgaagc cgatgcgcgg cggttggcgg 120
ttctga 126
<210> 193
<211> 41
<212> БЕЛОК
<213> Gokushovirinae Fen7875_21
<400> 193
Met Lys Pro Leu Lys Arg Lys Pro Val Gln Lys Ala Arg Ser Ala Ala
1 5 10 15
Lys Phe Arg Arg Asn Val Ser Thr Val Lys Ala Ala Asn Met Ala Val
20 25 30
Lys Pro Met Arg Gly Gly Trp Arg Phe
35 40
<210> 194
<211> 135
<212> ДНК
<213> Фаг Mycobacterium BabyRay
<400> 194
atgaccaaga gagacatcga gtaccggaaa gctttggggc tcaacccatc tgagccgctc 60
ccgaagattg tgggtgccgt cacccgccac ggggccactc tgaaacgccc acgggtcacc 120
gcactggccc gatag 135
<210> 195
<211> 44
<212> БЕЛОК
<213> Фаг Mycobacterium BabyRay
<400> 195
Met Thr Lys Arg Asp Ile Glu Tyr Arg Lys Ala Leu Gly Leu Asn Pro
1 5 10 15
Ser Glu Pro Leu Pro Lys Ile Val Gly Ala Val Thr Arg His Gly Ala
20 25 30
Thr Leu Lys Arg Pro Arg Val Thr Ala Leu Ala Arg
35 40
<210> 196
<211> 117
<212> ДНК
<213> Фаг Bdellovibrio phiMH2K
<400> 196
atgaaaagaa aaccaatgag ccgcaaggcc tctcaaaaaa ccttcaaaaa gaacacaggc 60
gttcaacgca tgaaccatct caacccacgc gccatgcgtg gtggcattag actataa 117
<210> 197
<211> 38
<212> БЕЛОК
<213> Фаг Bdellovibrio phiMH2K
<400> 197
Met Lys Arg Lys Pro Met Ser Arg Lys Ala Ser Gln Lys Thr Phe Lys
1 5 10 15
Lys Asn Thr Gly Val Gln Arg Met Asn His Leu Asn Pro Arg Ala Met
20 25 30
Arg Gly Gly Ile Arg Leu
35
<210> 198
<211> 168
<212> ДНК
<213> Фаг Pseudomonas PP7
<400> 198
ttgtcgtcaa ccttgtgccg ctgggccgtt aaggccctgc ggtgtacccg tgtgtataag 60
gagtttatat ggaaaccctt agtagcgctc agttacgtga cgttgtatct tctgagctcg 120
gtcttcctgt cccaactcag ctaccccatc gggagctggg cggtgtag 168
<210> 199
<211> 55
<212> БЕЛОК
<213> Фаг Pseudomonas PP7
<400> 199
Met Ser Ser Thr Leu Cys Arg Trp Ala Val Lys Ala Leu Arg Cys Thr
1 5 10 15
Arg Val Tyr Lys Glu Phe Ile Trp Lys Pro Leu Val Ala Leu Ser Tyr
20 25 30
Val Thr Leu Tyr Leu Leu Ser Ser Val Phe Leu Ser Gln Leu Ser Tyr
35 40 45
Pro Ile Gly Ser Trp Ala Val
50 55
<210> 200
<211> 108
<212> ДНК
<213> Фаг Acinetobacter AP205
<400> 200
atgaagaaaa ggacaaaagc cttgcttccc tatgcggttt tcatcatact cagctttcaa 60
ctaacattgt tgactgcctt gtttatgtat taccattata ccttttag 108
<210> 201
<211> 35
<212> БЕЛОК
<213> Фаг Acinetobacter AP205
<400> 201
Met Lys Lys Arg Thr Lys Ala Leu Leu Pro Tyr Ala Val Phe Ile Ile
1 5 10 15
Leu Ser Phe Gln Leu Thr Leu Leu Thr Ala Leu Phe Met Tyr Tyr His
20 25 30
Tyr Thr Phe
35
<210> 202
<211> 558
<212> ДНК
<213> Фаг Acinetobacter vB_AbaP_CEB1
<400> 202
atgattctga ctaaagatgg gtttggtatt atccgtaatg aactattcgg aggtaagtta 60
gatcaaactc aagtagatgc aataaacttt attgtagaga aagctactga gtctggttta 120
tcttatccag aggcagccta tttactagct accatctatc atgagactgg tctaccaagc 180
ggttatcgaa ctatgcaacc tattaaagaa gctggttctg ataactacct tcgatctaag 240
aagtactacc cgtacattgg ttatggttat gtacagttaa cttggaagga gaactatgga 300
cggattggta aacttattgg aattgaccta attaagaatc ctgagaaagc gctagaacct 360
ttaattgcta ttcagattgc tatcaaaggc atgttgaatg gttggttcac aggtgttgga 420
ttccgacgta aacgtccagt tagtaaatac aacaaacagc agtacatagc tgcgcgtaat 480
atcattaatg ggaaagataa ggctgagctt atagcgaagt acgctattat ctttgaacgc 540
gctctacgga gcttataa 558
<210> 203
<211> 185
<212> БЕЛОК
<213> Фаг Acinetobacter vB_AbaP_CEB1
<400> 203
Met Ile Leu Thr Lys Asp Gly Phe Gly Ile Ile Arg Asn Glu Leu Phe
1 5 10 15
Gly Gly Lys Leu Asp Gln Thr Gln Val Asp Ala Ile Asn Phe Ile Val
20 25 30
Glu Lys Ala Thr Glu Ser Gly Leu Ser Tyr Pro Glu Ala Ala Tyr Leu
35 40 45
Leu Ala Thr Ile Tyr His Glu Thr Gly Leu Pro Ser Gly Tyr Arg Thr
50 55 60
Met Gln Pro Ile Lys Glu Ala Gly Ser Asp Asn Tyr Leu Arg Ser Lys
65 70 75 80
Lys Tyr Tyr Pro Tyr Ile Gly Tyr Gly Tyr Val Gln Leu Thr Trp Lys
85 90 95
Glu Asn Tyr Gly Arg Ile Gly Lys Leu Ile Gly Ile Asp Leu Ile Lys
100 105 110
Asn Pro Glu Lys Ala Leu Glu Pro Leu Ile Ala Ile Gln Ile Ala Ile
115 120 125
Lys Gly Met Leu Asn Gly Trp Phe Thr Gly Val Gly Phe Arg Arg Lys
130 135 140
Arg Pro Val Ser Lys Tyr Asn Lys Gln Gln Tyr Ile Ala Ala Arg Asn
145 150 155 160
Ile Ile Asn Gly Lys Asp Lys Ala Glu Leu Ile Ala Lys Tyr Ala Ile
165 170 175
Ile Phe Glu Arg Ala Leu Arg Ser Leu
180 185
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ ХИМИЧЕСКИХ ПРОДУКТОВ ТОНКОГО СИНТЕЗА С ПОМОЩЬЮ CORYNEBACTERIUM, СЕКРЕТИРУЮЩЕЙ МОДИФИЦИРОВАННЫЕ α-1,6-ГЛЮКОЗИДАЗЫ | 2018 |
|
RU2763317C2 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ ДЛЯ ЛЕЧЕНИЯ И/ИЛИ ПРЕДУПРЕЖДЕНИЯ ЗЛОКАЧЕСТВЕННОЙ ОПУХОЛИ | 2017 |
|
RU2766586C2 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ ДЛЯ ЛЕЧЕНИЯ И/ИЛИ ПРОФИЛАКТИКИ ЗЛОКАЧЕСТВЕННОЙ ОПУХОЛИ | 2019 |
|
RU2781542C2 |
| МАТЕРИАЛЫ И МЕТОДЫ, ИСПОЛЬЗУЕМЫЕ ДЛЯ ЛЕЧЕНИЯ РЕСПИРАТОРНЫХ ЗАБОЛЕВАНИЙ У СОБАК | 2020 |
|
RU2811752C2 |
| ИММУНОИНДУЦИРУЮЩЕЕ СРЕДСТВО | 2016 |
|
RU2744843C2 |
| ВИРУС ГРИППА, СПОСОБНЫЙ ИНФИЦИРОВАТЬ СОБАЧЬИХ, И ЕГО ПРИМЕНЕНИЕ | 2020 |
|
RU2802222C2 |
| ГЕННАЯ ТЕРАПИЯ ГИПОФОСФАТЕМИЧЕСКИХ ЗАБОЛЕВАНИЙ, СВЯЗАННЫХ С ФАКТОРОМ РОСТА ФИБРОБЛАСТОВ 23 | 2020 |
|
RU2815545C2 |
| ГОМОЛОГ ГЛИЦЕРОЛ-3-ФОСФАТ-АЦИЛТРАНСФЕРАЗЫ И ЕГО ИСПОЛЬЗОВАНИЕ | 2011 |
|
RU2545375C2 |
| АНТИТЕЛО К CD73 ЧЕЛОВЕКА | 2017 |
|
RU2754058C2 |
| СПОСОБ ПОЛУЧЕНИЯ L-АМИНОКИСЛОТ С ПОМОЩЬЮ КОРИНЕБАКТЕРИЙ С ПРИМЕНЕНИЕМ СИСТЕМЫ РАСЩЕПЛЕНИЯ ГЛИЦИНА | 2015 |
|
RU2713298C2 |
Изобретение относится к области биотехнологии, конкретно к полипептидным конструкциям лизин-противомикробный пептид (AMP), и может быть использовано в медицине для лечения инфекций, вызванных грамотрицательными бактериями. Предложена полипептидная конструкция лизин-AMP, обладающая антибактериальной активностью против грамотрицательной бактерии, содержащая ее фармацевтическая композиция и комбинация, а также ее использование для лечения бактериальной инфекции, вызванной грамотрицательными бактериями, для ингибирования роста или уменьшения количества, или уничтожения по меньшей мере одного вида грамотрицательных бактерий и для повышения терапевтического эффекта антибиотика. Предложенная полипептидная конструкция лизин-AMP может быть получена рекомбинантным путем. Изобретение обеспечивает получение антибактериальных агентов, способных к нацеливанию на MDR P. aeruginosa и другие грамотрицательные бактерии, с сохранением активности в матриксах крови человека. 10 н. и 28 з.п. ф-лы, 1 ил., 10 табл., 4 пр.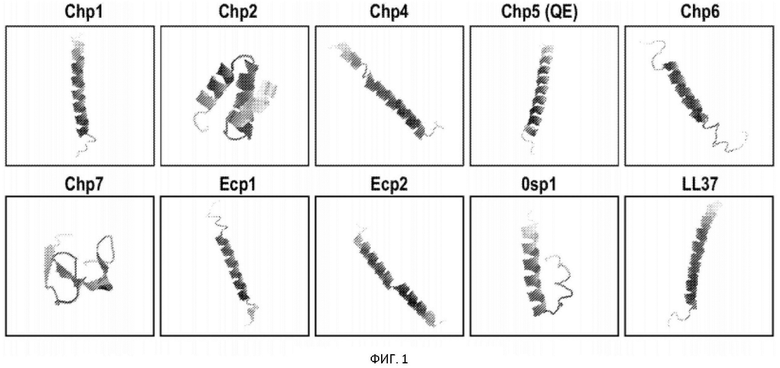
1. Полипептидная конструкция лизин-противомикробный пептид (AMP), обладающая антибактериальной активностью против грамотрицательной бактерии, содержащая:
(a) первый компонент, содержащий полипептидную последовательность:
(i) лизина SEQ ID NO: 118; или
(ii) полипептида, обладающего литической активностью и имеющего по меньшей мере 80% идентичность последовательности с полипептидной последовательностью лизина SEQ ID NO: 118; или
(iii) активного фрагмента указанного лизина последовательности SEQ ID NO: 118, с сохраненным C-концевым α-спиральным доменом; и
(b) второй компонент, содержащий полипептидную последовательность:
(i) SEQ ID NO: 114.
2. Полипептидная конструкция лизин-AMP по п. 1, характеризующаяся тем, что указанная конструкция дополнительно содержит по меньшей мере один стабилизирующий структуру компонент для поддержания по меньшей мере части структуры указанного первого и/или второго компонента в указанной конструкции по существу такой же, как в неконъюгированном лизине и/или AMP.
3. Полипептидная конструкция лизин-AMP по п. 2, характеризующаяся тем, что указанный по меньшей мере один стабилизирующий структуру компонент представляет собой пептид.
4. Полипептидная конструкция лизин-AMP по п. 3, характеризующаяся тем, что указанный пептид выбран из группы, состоящей из SEQ ID NO: 112, SEQ ID NO: 116, SEQ ID NO: 72, SEQ ID NO: 82, SEQ ID NO: 98, остатков 44-58 из SEQ ID NO: 16 и SEQ ID NO: 122.
5. Полипептидная конструкция лизин-AMP по п. 1, характеризующаяся тем, что указанная полипептидная конструкция лизин-AMP содержит (i) полипептидную последовательность SEQ ID NO: 44 или (ii) полипептид, обладающий литической активностью и по меньшей мере 80% идентичностью с полипептидной последовательностью SEQ ID NO: 44.
6. Выделенный полинуклеотид для кодирования полипептидной конструкции лизин-противомикробный пептид (AMP), обладающей антибактериальной активностью против грамотрицательной бактерии, причем указанный выделенный полинуклеотид содержит:
(a) первую молекулу нуклеиновой кислоты, кодирующую первый компонент, содержащий:
(i) SEQ ID NO: 118; или
(ii) полипептид, обладающий литической активностью, причем указанный полипептид по меньшей мере на 80% идентичен SEQ ID NO: 118; или
(iii) активный фрагмент указанного лизина последовательности SEQ ID NO: 118 с сохраненным C-концевым α-спиральным доменом;
(b) a вторую молекулу нуклеиновой кислоты, кодирующую второй компонент, содержащий полипептидную последовательность SEQ ID NO: 114.
7. Выделенный полинуклеотид по п. 6, характеризующийся тем, что указанная молекула нуклеиновой кислоты дополнительно содержит (c) третью молекулу нуклеиновой кислоты, кодирующую третий компонент, содержащий по меньшей мере один стабилизирующий структуру компонент, причем указанный по меньшей мере один стабилизирующий структуру компонент поддерживает по меньшей мере часть структуры указанного первого и/или второго компонента в указанной конструкции по существу такой же, как в неконъюгированном лизине и/или AMP.
8. Выделенный полинуклеотид по п. 7, характеризующийся тем, что указанный по меньшей мере один стабилизирующий структуру компонент содержит пептид.
9. Выделенный полинуклеотид по п. 8, характеризующийся тем, что указанный пептид выбран из группы, состоящей из SEQ ID NO: 112, SEQ ID NO: 116, SEQ ID NO: 72, SEQ ID NO: 82, SEQ ID NO: 98, остатков 44-58 из SEQ ID NO: 16 и SEQ ID NO: 122.
10. Выделенный полинуклеотид по п. 6, характеризующийся тем, что указанная молекула нуклеиновой кислоты кодирует полипептидную конструкцию лизин-AMP, содержащую
(i) SEQ ID NO: 44; или
(ii) молекулу нуклеиновой кислоты, кодирующую полипептид, обладающий активностью лизина и имеющий по меньшей мере 90% идентичность последовательности с полипептидной последовательностью с SEQ ID NO: 44.
11. Выделенный полинуклеотид по п. 6, характеризующийся тем, что указанный выделенный полинуклеотид содержит ДНК.
12. Выделенный полинуклеотид по п. 6, характеризующийся тем, что указанный выделенный полинуклеотид содержит кДНК.
13. Рекомбинантный вектор для экспрессии полипептидной конструкции лизин-противомикробный пептид (AMP), обладающей антибактериальной активностью против грамотрицательной бактерии, содержащий выделенную полинуклеотидную последовательность по п. 6.
14. Рекомбинантный вектор по п. 13, характеризующийся тем, что указанная выделенная полинуклеотидная последовательность функционально связана с гетерологичным промотором.
15. Рекомбинантный вектор по любому из пп. 13, 14, характеризующийся тем, что указанный рекомбинантный вектор представляет собой рекомбинантный вектор экспрессии.
16. Выделенная клетка-хозяин для экспрессии полипептидной конструкции лизин-противомикробный пептид (AMP), обладающей антибактериальной активностью против грамотрицательной бактерии, содержащая рекомбинантный вектор по п. 13.
17. Фармацевтическая композиция для лечения инфекции, вызванной грамотрицательными бактериями, содержащая полипептидную конструкцию лизин-противомикробный пептид (AMP), обладающую антибактериальной активностью против грамотрицательной бактерии, и фармацевтически приемлемый носитель,
причем указанная полипептидная конструкция лизин-AMP содержит:
(a) первый компонент, содержащий полипептидную последовательность
(i) SEQ ID NO: 118; или
(ii) полипептида, обладающего литической активностью и имеющего по меньшей мере 80% идентичность последовательности с полипептидной последовательностью SEQ ID NO: 118; или
(iii) активного фрагмента указанного лизина последовательности SEQ ID NO: 118 с сохраненным C-концевым α-спиральным доменом; и
(b) второй компонент, содержащий полипептидную последовательность SEQ ID NO: 114.
18. Фармацевтическая композиция по п. 17, характеризующаяся тем, что указанная полипептидная конструкция лизин-AMP дополнительно содержит по меньшей мере один стабилизирующий структуру компонент для поддержания по меньшей мере части структуры указанного первого и/или второго компонента в указанной конструкции по существу такой же, как в неконъюгированном лизине и/или AMP.
19. Фармацевтическая композиция по п. 18, характеризующаяся тем, что указанный по меньшей мере один стабилизирующий структуру компонент представляет собой пептид.
20. Фармацевтическая композиция по п. 19, характеризующаяся тем, что указанный пептид выбран из группы, состоящей из SEQ ID NO: 112, SEQ ID NO: 116, SEQ ID NO: 72, SEQ ID NO: 82, SEQ ID NO: 98, остатков 44-58 из SEQ ID NO: 16 и SEQ ID NO: 122.
21. Фармацевтическая композиция по п. 17, характеризующаяся тем, что указанная полипептидная конструкция лизин-AMP содержит полипептидную последовательность SEQ ID NO: 44 или полипептидную последовательность, обладающую литической активностью и по меньшей мере 80% идентичностью с SEQ ID NO: 44.
22. Фармацевтическая композиция по п. 17, характеризующаяся тем, что указанная фармацевтическая композиция изготовлена в виде раствора, суспензии, эмульсии, порошка для ингаляции, аэрозоля или спрея.
23. Комбинация для лечения инфекции, вызванной грамотрицательными бактериями, содержащая фармацевтическую композицию по п. 17, и антибиотик, подходящий для лечения инфекции, вызванной грамотрицательными бактериями.
24. Способ лечения бактериальной инфекции, вызванной грамотрицательными бактериями, причем указанный способ включает:
введение субъекту, у которого диагностирована, который подвержен риску или который демонстрирует симптомы бактериальной инфекции, вызванной грамотрицательными бактериями, эффективного количества фармацевтической композиции по п. 17.
25. Способ по п. 24, характеризующийся тем, что указанная бактериальная инфекция, вызванная грамотрицательными бактериями, представляет собой местную или системную патогенную бактериальную инфекцию.
26. Способ предотвращения или лечения бактериальной инфекции, вызванной грамотрицательными бактериями, включающий:
введение субъекту, у которого диагностирована, который подвержен риску или который демонстрирует симптомы бактериальной инфекции, вызванной грамотрицательными бактериями, эффективного количества комбинации по п. 23.
27. Способ повышения терапевтического эффекта антибиотика, подходящего для лечения инфекции, вызванной грамотрицательными бактериями, включающий:
совместное введение эффективного количества указанного антибиотика в комбинации с композицией, содержащей эффективное количество полипептидной конструкции лизин-противомикробный пептид (AMP), обладающей антибактериальной активностью против грамотрицательной бактерии,
причем указанная полипептидная конструкция лизин-AMP содержит:
(a) первый компонент, содержащий полипептидную последовательность
(i) SEQ ID NO: 118; или
(ii) полипептида, обладающего литической активностью и имеющего по меньшей мере 80% идентичность последовательности с полипептидной последовательностью SEQ ID NO: 118; или
(iii) активного фрагмента указанного лизина последовательности SEQ ID NO: 118 с сохраненным C-концевым α-спиральным доменом; и
(b) второй компонент, содержащий полипептидную последовательность SEQ ID NO: 114, и
при этом введение указанной комбинации является более эффективным в ингибировании роста или уменьшении количества, или уничтожении грамотрицательных бактерий в присутствии или в отсутствие, или как в присутствии, так и в отсутствие сыворотки человека, чем введение либо указанного антибиотика, либо указанного лизина, либо указанной полипептидной конструкции лизин-AMP по отдельности.
28. Способ ингибирования роста или уменьшения количества, или уничтожения по меньшей мере одного вида грамотрицательных бактерий, при этом указанный способ включает:
приведение указанных грамотрицательных бактерий в контакт с композицией, содержащей эффективное количество полипептидной конструкции лизин-противомикробный пептид (AMP), обладающей антибактериальной активностью против грамотрицательной бактерии,
причем указанная полипептидная конструкция лизин-AMP содержит:
(a) первый компонент, содержащий полипептидную последовательность
(i) SEQ ID NO: 118; или
(ii) полипептида, обладающего литической активностью и имеющего по меньшей мере 80% идентичность последовательности с полипептидной последовательностью SEQ ID NO: 118; или
(iii) активного фрагмента указанного лизина последовательности SEQ ID NO: 118 с сохраненным C-концевым α-спиральным доменом; и
(b) второй компонент, содержащий полипептидную последовательность SEQ ID NO: 114.
29. Способ по любому из пп. 24, 25, 26 и 28, характеризующийся тем, что указанная грамотрицательная бактерия выбрана из группы, состоящей из Pseudomonas aeruginosa, Klebsiella spp., Enterobacter spp., Escherichia coli, Citrobacter freundii, Salmonella typhimurium, Yersinia pestis и Franciscella tulerensis.
30. Способ по п. 26 или 27 или фармацевтическая композиция по п. 23, характеризующиеся тем, что указанный антибиотик выбран из одного или более из цефтазидима, цефепима, цефоперазона, цефтобипрола, ципрофлоксацина, левофлоксацина, аминогликозидов, имипенема, меропенема, дорипенема, гентамицина, тобрамицина, амикацина, пиперациллина, тикарциллина, пенициллина, рифампицина, полимиксина B и колистина.
31. Полипептидная конструкция лизин-AMP по п.1, выделенный полинуклеотид по п. 6, рекомбинантный вектор по п. 13, выделенная клетка-хозяин по п. 16, фармацевтическая композиция по п. 17 или способы по любому из пп. 24-28, причем указанная конструкция лизин-AMP характеризуется по меньшей мере одной активностью, выбранной из ингибирования роста бактерий P. aeruginosa, уменьшения количества P. aeruginosa или уничтожения P. aeruginosa в отсутствие и/или в присутствии сыворотки человека.
32. Полипептидная конструкция лизин-AMP по п. 1, выделенный полинуклеотид по п. 6, рекомбинантный вектор по п. 13, выделенная клетка-хозяин по п. 16 фармацевтическая композиция по п. 17, причем указанная грамотрицательная бактерия выбрана из группы, состоящей из Pseudomonas aeruginosa, Klebsiella spp., Enterobacter spp., Escherichia coli, Citrobacter freundii, Salmonella typhimurium, Yersinia pestis и Franciscella tulerensis.
33. Полипептидная конструкция лизин-AMP по п. 1, выделенный полинуклеотид по п. 6, рекомбинантный вектор по п. 13, выделенная клетка-хозяин по п. 16, фармацевтическая композиция по п. 17 или способы по любому из пп. 24-28, причем указанная полипептидная конструкция лизин-AMP повторно сенсибилизирует P. aeruginosa к антибиотику.
34. Полипептидная конструкция лизин-AMP по п. 1, выделенный полинуклеотид по п. 6, рекомбинантный вектор по п. 13, выделенная клетка-хозяин по п. 16, фармацевтическая композиция по п. 17 или способы по любому из пп. 24-28, характеризующиеся тем, что конструкция лизин-противомикробный пептид (AMP) повторно сенсибилизирует P. aeruginosa к антибиотику, и указанный антибиотик представляет собой карбапенем.
35. Полипептидная конструкция лизин-AMP по п. 1, характеризующаяся тем, что первый компонент (a) содержит полипептидную последовательность (ii) полипептида, обладающего литической активностью, причем полипептид по меньшей мере на 99% идентичен SEQ ID NO: 118; и второй компонент (b) содержит полипептидную конструкцию SEQ ID NO: 114.
36. Полипептидная конструкция лизин-AMP по п. 1, характеризующаяся тем, что указанная полипептидная конструкция лизин-AMP содержит модификацию в форме N-концевого ацетилирования и/или модификацию в форме C-концевого амидирования.
37. Полипептидная конструкция лизин-AMP по п. 1, выделенный полинуклеотид по п. 6, рекомбинантный вектор по п. 13, выделенная клетка-хозяин по п. 16, фармацевтическая композиция по п. 17 или способы по любому из пп. 24-28, причем указанная полипептидная конструкция лизин-AMP содержит полипептид, обладающий литической активностью, и представляет собой SEQ ID NO: 44.
38. Полипептидная конструкция лизин-AMP по п. 1, выделенный полинуклеотид по п. 6, рекомбинантный вектор по п. 13, выделенная клетка-хозяин по п. 16, фармацевтическая композиция по п. 17 или способы по любому из пп. 24-28, причем указанная полипептидная конструкция лизин-AMP содержит полипептид, обладающий литической активностью и имеющий по меньшей мере 99% идентичность последовательности с SEQ ID NO: 44 и содержит одну делецию аминокислоты по сравнению с SEQ ID NO: 44.
| WO 2010149792 A2, 29.12.2010, US 2013344055 A1, 26.12.2013, WO 2017049233 A2, 23.03.2017, CA 2998484 A1, 23.03.2017, US 2014120074 A1, 01.05.2014, RU 2393224 C2, 27.06.2010, KONTERMANN R | |||
| E | |||
| et al., Bispecific antibodies, Drug Discovery Today, 2015, v | |||
| Способ восстановления хромовой кислоты, в частности для получения хромовых квасцов | 1921 |
|
SU7A1 |
| Прибор для промывания газов | 1922 |
|
SU20A1 |
| et al., Site-directed mutagenesis of the hinge region of nisinZ | |||
Авторы
Даты
2023-09-06—Публикация
2019-03-29—Подача