ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННЫЕ ЗАЯВКИ
По настоящей заявке испрашивается приоритет по предварительной заявке U.S. № 62/755679, поданной 5 ноября 2018 г., полное содержание которой включено в настоящее изобретение в качестве ссылки.
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
В настоящем изобретении описаны новые соединения или их фармацевтически приемлемые соли, содержащие их фармацевтические композиции и их применение в медицине. Соединения, предлагаемые в настоящем изобретении, обладают активностью, как ингибиторы киназы Janus (JAK), и применимы для лечения зуда или борьбы с зудом, связанным с аллергическим дерматитом или атопическим дерматитом у животных, и других нарушений и заболеваний, когда желательна иммуносупрессия/иммуномодуляция. В настоящем изобретении также описаны способы лечения зуда или атопического дерматита путем введения соединения, предлагаемые в настоящем изобретении, которые являются ингибиторами JAK.
УРОВЕНЬ ТЕХНИКИ
Зуд определяется, как неприятное ощущение, которое приводит к чесотке, а именно, к желанию чесаться. Зуд, как и боль, является одним из основных защитных механизмов организма. Фундаментальной биологической функцией зуда является предупреждение животного о наличии потенциально опасных токсинов или других опасностей, таких как переносящие заболевание насекомые, и стимулирование рефлекса, направленного на избавление от этих опасностей. Зуд может проявляться активно, как рефлекс для удаления блох и других паразитов. Альтернативно, хронический зуд, такой как боль, сам по себе может стать упорным и патологическим. Хронический зуд приводит к чрезмерному стимулированию периферических и центральных нервов, что приводит к активации и пролиферации опосредующих зуд нервных волокон. Показано, что сенсибилизированные нервные волокна легче стимулируют зуд. Для хронического зуда необходимо более, чем симптоматическое лечение, требующее тщательной диагностики для выявления лежащей в основе причины, и многомодальной терапии для лечения постепенно развивающихся эффектов.
Протеинкиназы являются семейством ферментов, которые катализируют фосфорилирование специфических остатков в белках, в широком смысле разделяющимися на тирозин- и серин/треонинкиназы. Несоответствующая активность киназы, обусловленная мутацией, сверхэкспрессией или несоответствующей регуляцией, дисрегуляцией или дерегуляцией, а также чрезмерное или недостаточное продуцирование факторов роста или цитокинов участвует во многих заболеваниях, включая, но не ограничиваясь только ими, рак, сердечно-сосудистые заболевания, аллергии, астму и другие респираторные заболевания, аутоиммунные заболевания, воспалительные заболевания, заболевания костей, метаболические нарушения и неврологические и нейродегенеративные нарушения, такие как болезнь Альцгеймера. Несоответствующая активность киназы приводит к запуску множества биологических клеточных ответов, относящихся к росту клеток, дифференциации, выживанию, апоптозу, митагенезу клеток, регулированию клеточного цикла и подвижности клеток, участвующим в указанных выше и родственных заболеваниях. Таким образом, протеинкиназы стали важным классом ферментов, являющихся мишенями для терапевтического вмешательства. В частности, семейство клеточных протеинтирозинкиназ JAK (JAK-1, JAK-2, JAK-3, и Tyk-2) играет центральную роль в передаче сигналов цитокинов (Kisseleva et al, Gene, 2002, 285, 1; Yamaoka et al. Genome Biology 2004, 5, 253)). При связывании со своими рецепторами цитокины активируют JAK, которая затем фосфорилирует цитокиновый рецептор, тем самым образуя стыковочные сайты для сигнальных молекул, а именно, представителей семейства передатчиков сигналов и активаторов транскрипции (STAT), которые в конечном случае приводят к экспрессии гена, который стимулирует биологические ответы, такие как сигнал зуда. Активация пути JAK-STAT также приводит к проявлению нескольких других типов биологической активности, которые способствуют процессам воспаления и зуда, которые вносят вклад в острую аллергию у животных, но могут и обострять клинические признаки и способствовать хронической аллергии.
Существует значительная необходимость в безопасных и эффективных средствах борьбы с атопическим дерматитом у животных, включая млекопитающих, птиц и рыб. Примеры млекопитающих включают, но не ограничиваются только ими, людей, крупный рогатый скот, овец, коз, лам, альпак, свиней, лошадей, ослов, собак, кошек и другой домашний скот или домашних млекопитающих. Примеры птиц включают индеек, циплят, страусов и другой домашгий скот или домашних птиц. На рынке средств лечения атопического дерматита у животных в настоящее время преобладают кортикостероиды, которые вызывают боль и нежелательные побочные эффекты у животных, в особенности у животных-спутников, таких как собаки. Также используют антигистамины но они малоэффективны. Препарат циклоспорина (ATOPICA™) в настоящее время продается для лечения атопического дерматита у собак и кошек, но он является дорогим и его эффективность проявляется медленно. Кроме того, ATOPICA™ плохо переносится в желудочно-кишечном тракте. В WO 2010/020905 раскрыты ингибиторы JAK для лечения зуда.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Соединения, предлагаемые в настоящем изобретении, являются новыми ингибиторами JAK, обладающими эффективностью по отношению к JAK, включая JAK 1. Эти соединения будут являться альтернативой применению стероида и ингибиторы JAK уже имеются в продаже и обеспечивают борьбу с хроническим зудом и воспалением, которое или продолжает протекать при атопическом дерматите, или медленно регрессирует после удаления аллергена или являющегося причиной агента, такого как, например, блохи при вызванном блохами аллергическом дерматите.
Одним вариантом осуществления настоящего изобретения является соединение формулы I или его фармацевтическая или ветеринарная соль:
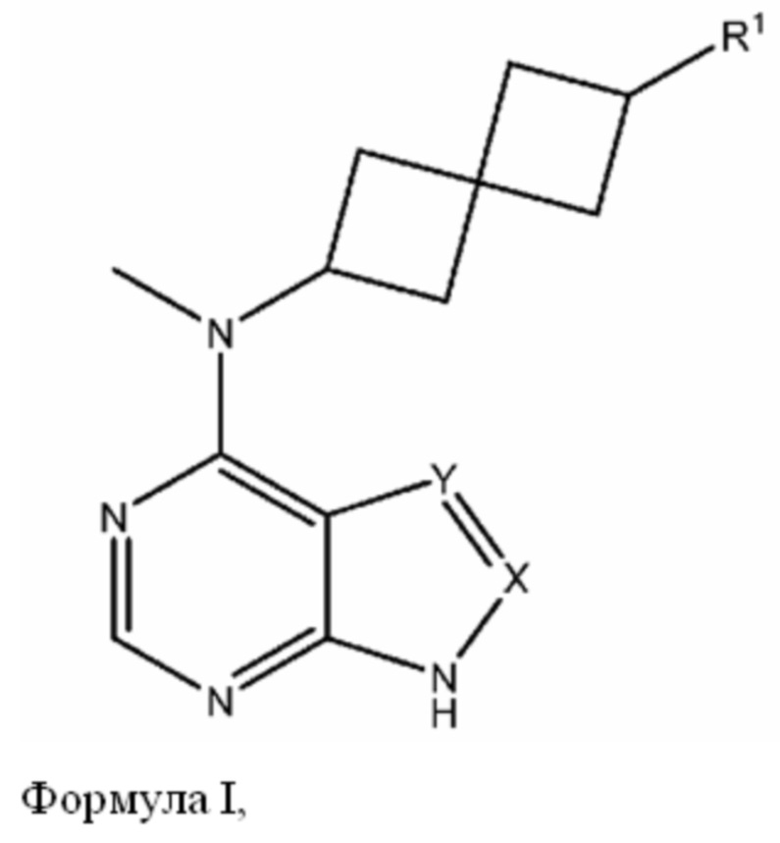
где
X означает N, CH или CR3;
Y означает N, CH или CR3;
R1 означает (CH2)nSO2N(R2)2, (CH2)mNHSO2R2, (CH2)nCON(R2)2 или (CH2)mNHCOR2
n равно 0, 1, 2, 3 или 4;
m равно 0, 1, 2, 3 или 4;
каждый R2 независимо означает водород, C1-6 алкил, C1-6 галогеналкил, C2-6 алкенил, C2-6 галогеналкенил, C2-6 алкинил, C2-6 галогеналкинил, незамещенный или замещенный циклоалкил, незамещенный или замещенный арил, или незамещенный или замещенный гетероарил; или
два R2 могут объединяться с атомом азота, к которому они присоединены, с образованием незамещенного или замещенного 5- - 7-членного кольца, которое может включать один или большее количество дополнительных гетероатомов, выбранных из группы, включающей N, O или S, и которое может включать одну или большее количество кратных связей;
и
каждый R3 независимо означает C1-6 алкил, C1-6 галогеналкил, C2-6 алкенил, C2-6 галогеналкенил, C2-6 алкинил, C2-6 галогеналкинил, гидроксигруппу, C1-6 алкоксигруппу, C1-6 галогеналкилоксигруппу, C1-6 алкилсульфонил, C1-6 тиоалкил, меркаптогруппу, галоген, нитрогруппу, цианогруппу, аминогруппу, C1-6 алкиламиногруппу, незамещенный или замещенный циклоалкил, незамещенный или замещенный арил, или незамещенный или замещенный гетероарил,
если X означает CR3 и Y означает CR3, каждый CR3 может объединяться с атомами, к которым они присоединены, с образованием конденсированного 5- - 7-членного кольца.
В одном варианте осуществления X означает CH. В одном варианте осуществления Y означает CH. В одном варианте осуществления оба X и Y означают CH.
В одном варианте осуществления один или большее количество из X и Y означает CR3, где каждый R3 означает галоген, цианогруппу или C1-6 алкил.
В одном варианте осуществления R1 означает (CH2)nSO2NHR2 или (CH2)mNHSO2R2.
В одном варианте осуществления n равно 0 или 1. В одном варианте осуществления m равно 0 или 1.
В одном варианте осуществления R2 означает C1-6 алкил, C1-6 галогеналкил, незамещенный или замещенный циклоалкил, или незамещенный или замещенный арил. В одном варианте осуществления R2 означает C1-6 алкил, C1-6 галогеналкил, или незамещенный или замещенный циклоалкил.
В одном варианте осуществления настоящее изобретение включает соединения формулы (I), где R1 означает (CH2)nSO2NHR2. В одном варианте осуществления настоящее изобретение включает соединения формулы (I), где n равно 0. В одном варианте осуществления настоящее изобретение включает соединения формулы (I), где n равно 1. В одном варианте осуществления настоящее изобретение включает соединения формулы (I), где R2 означает C1-6 алкил. В одном варианте осуществления настоящее изобретение включает соединения формулы (I), где R2 означает незамещенный или замещенный циклоалкил. В одном варианте осуществления настоящее изобретение включает соединения формулы (I), где R2 означает C1-6 галогеналкил. В одном варианте осуществления настоящее изобретение включает соединения формулы (I), где R2 означает незамещенный или замещенный арил. В одном варианте осуществления настоящее изобретение включает соединения формулы (I), где R2 означает арил, замещенный одним или большим количеством следующих: галоген, C1-6 алкил, C1-6 галогеналкил, C2-6 алкенил, C2-6 галогеналкенил, C2-6 алкинил, C2-6 галогеналкинил, CN, NO2, NH2, N(C1-6 алкил)2, OH или OC1-6 алкил.
В одном варианте осуществления настоящее изобретение включает соединения формулы (I), где R1 означает (CH2)mNHSO2R2. В одном варианте осуществления настоящее изобретение включает соединения формулы (I), где m равно 0. В одном варианте осуществления настоящее изобретение включает соединения формулы (I), где m равно 1. В одном варианте осуществления настоящее изобретение включает соединения формулы (I), где R2 означает C1-6 алкил. В одном варианте осуществления настоящее изобретение включает соединения формулы (I), где R2 означает незамещенный или замещенный циклоалкил. В одном варианте осуществления настоящее изобретение включает соединения формулы (I), где R2 означает галогеналкил. В одном варианте осуществления настоящее изобретение включает соединения формулы (I), где R2 означает незамещенный или замещенный арил. В одном варианте осуществления настоящее изобретение включает соединения формулы (I), где R2 означает арил, замещенный одним или большим количеством следующих: галоген, C1-6 алкил, C1-6 галогеналкил, C2-6 алкенил, C2-6 галогеналкенил, C2-6 алкинил, C2-6 галогеналкинил, CN, NO2, NH2, N(C1-6 алкил)2, OH или OC1-6 алкил.
Один вариант осуществления включает соединение, выбранное из группы, включающей:
N-метил-6-[метил(7H-пирроло[2,3-d]пиримидин-4-ил)амино]спиро[3.3]гептан-2-сульфонамид;
N-этил-6-[метил(7H-пирроло[2,3-d]пиримидин-4-ил)амино]спиро[3.3]гептан-2-сульфонамид;
6-[метил(7H-пирроло[2,3-d]пиримидин-4-ил)амино]-N-пропилспиро[3.3]гептан-2-сульфонамид;
N-изопропил-6-[метил(7H-пирроло[2,3-d]пиримидин-4-ил)амино]спиро[3.3]гептан-2-сульфонамид;
N-циклопропил-6-[метил(7H-пирроло[2,3-d]пиримидин-4-ил)амино]спиро[3.3]гептан-2-сульфонамид;
6-[метил(7H-пирроло[2,3-d]пиримидин-4-ил)амино]-N-(2,2,2-трифторэтил)спиро[3.3]гептан-2-сульфонамид;
N-изобутил-6-[метил(7H-пирроло[2,3-d]пиримидин-4-ил)амино]спиро[3.3]гептан-2-сульфонамид;
N-трет-бутил-6-[метил(7H-пирроло[2,3-d]пиримидин-4-ил)амино]спиро[3.3]гептан-2-сульфонамид;
N-циклобутил-6-[метил(7H-пирроло[2,3-d]пиримидин-4-ил)амино]спиро[3.3]гептан-2-сульфонамид;
N-циклопентил-6-[метил(7H-пирроло[2,3-d]пиримидин-4-ил)амино]спиро[3.3]гептан-2-сульфонамид;
N-[2-[метил(7H-пирроло[2,3-d]пиримидин-4-ил)амино]спиро[3.3]гептан-6-ил]бензолсульфонамид;
2-хлор-N-[2-[метил(7H-пирроло[2,3-d]пиримидин-4-ил)амино]спиро[3.3]гептан-6-ил]бензолсульфонамид;
4-хлор-N-[2-[метил(7H-пирроло[2,3-d]пиримидин-4-ил)амино]спиро[3.3]гептан-6-ил]бензолсульфонамид;
N-[2-[метил(7H-пирроло[2,3-d]пиримидин-4-ил)амино]спиро[3.3]гептан-6-ил]-4-(трифторметил)бензолсульфонамид;
N-[2-[метил(7H-пирроло[2,3-d]пиримидин-4-ил)амино]спиро[3.3]гептан-6-ил]метансульфонамид;
N-[2-[метил(7H-пирроло[2,3-d]пиримидин-4-ил)амино]спиро[3.3]гептан-6-ил]этансульфонамид;
N-[2-[метил(7H-пирроло[2,3-d]пиримидин-4-ил)амино]спиро[3.3]гептан-6-ил]пропан-1-сульфонамид;
N-[2-[метил(7H-пирроло[2,3-d]пиримидин-4-ил)амино]спиро[3.3]гептан-6-ил]пропан-2-сульфонамид;
2-метил-N-[2-[метил(7H-пирроло[2,3-d]пиримидин-4-ил)амино]спиро[3.3]гептан-6-ил]пропан-1-сульфонамид;
N-[2-[метил(7H-пирроло[2,3-d]пиримидин-4-ил)амино]спиро[3.3]гептан-6-ил]циклопентансульфонамид;
3,3,3-трифтор-N-[2-[метил(7H-пирроло[2,3-d]пиримидин-4-ил)амино]спиро[3.3]гептан-6-ил]пропан-1-сульфонамид;
N-((6-(метил(7H-пирроло[2,3-d]пиримидин-4-ил)амино)спиро[3.3]гептан-2-ил)метил)метансульфонамид;
N-((6-(метил(7H-пирроло[2,3-d]пиримидин-4-ил)амино)спиро[3.3]гептан-2-ил)метил)этансульфонамид;
N-метил-6-[метил(9H-пурин-6-ил)амино]спиро[3.3]гептан-2-сульфонамид;
(энантиомер A)-N-метил-6-[метил(7H-пирроло[2,3-d]пиримидин-4-ил)амино]спиро[3.3]гептан-2-сульфонамид;
(энантиомер B)-N-метил-6-[метил(7H-пирроло[2,3-d]пиримидин-4-ил)амино]спиро[3.3]гептан-2-сульфонамид;
6-[метил(7H-пирроло[2,3-d]пиримидин-4-ил)амино]спиро[3.3]гептан-2-сульфонамид;
N,N-диметил-6-[метил(7H-пирроло[2,3-d]пиримидин-4-ил)амино]спиро[3.3]гептан-2-сульфонамид;
N-метил-N-(2-пирролидин-1-илсульфонилспиро[3.3]гептан-6-ил)-7H-пирроло[2,3-d]пиримидин-4-амин;
или его ветеринарно или фармацевтически приемлемая соль.
В одном варианте осуществления настоящее изобретение включает композицию, содержащую соединение, предлагаемое в настоящем изобретении, и фармацевтически или ветеринарно приемлемый носитель.
В одном варианте осуществления настоящее изобретение включает комбинацию, содержащую соединение, предлагаемое в настоящем изобретении, и одно или большее количество других фармацевтически или ветеринарно активных веществ.
В одном варианте осуществления настоящее изобретение включает способ лечения зуда или атопического дерматита, включающий введение нуждающемуся в нем субъекту эффективного количества соединения, предлагаемого в настоящем изобретении. В одном варианте осуществления субъектом является животное, включая млекопитающих, птиц и рыб. Примеры млекопитающих включают, но не ограничиваются только ими, людей, крупный рогатый скот, овец, коз, лам, альпак, свиней, лошадей, ослов, собак, кошек и другой домашний скот, домашних млекопитающих или млекопитающих-спутников. Примеры птиц включают индеек, цыплят, страусов и другой домашний скот или домашних птиц. В другом варианте осуществления субъектом является млекопитающее. В другом варианте осуществления субъектом является животное-спутник.
В одном варианте осуществления настоящее изобретение включает соединение, предлагаемое в настоящем изобретении для применения в медицине.
В одном варианте осуществления настоящее изобретение включает соединение, предлагаемое в настоящем изобретении для приготовления лекарственного средства для лечения зуда или атопического дерматита.
В одном варианте осуществления настоящее изобретение включает применение соединения, предлагаемого в настоящем изобретении, для лечения зуда или атопического дерматита.
Один или большее количество объектов и вариантов осуществления можно включить в другой вариант осуществления, даже если они специально не описаны. Таким образом, все объекты и варианты осуществления можно объединять любым образом или в комбинацию.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Соединения, предлагаемые в настоящем изобретении, являются новыми ингибиторами JAK, обладающими эффективностью по отношению к JAK, включая JAK 1. Эти соединения будут являться альтернативой применению стероида и ингибиторы JAK уже имеются в продаже и обеспечивают борьбу с хроническим зудом и воспалением, которое или продолжает протекать при атопическом дерматите, или медленно регрессирует после удаления аллергена или являющегося причиной агента, такого как, например, блохи при вызванном блохами аллергическом дерматите.
Определения
Применительно к соединениям, раскрытым в настоящем изобретении, приведенные ниже термины обладают следующим значениями, если не указано иное. Приведенные ниже термины предназначены для разъяснения, а не для ограничения определенных терминов. Если конкретный термин, использующийся в настоящем изобретении, специально не определен, такой термин не следует считать не определенным. Напротив, термины используются в их общепринятых значениях.
При использовании в настоящем изобретении "алкил" означает одновалентные насыщенные алифатические гидрокарбильные группы, содержащие от 1 до 20 атомов углерода, предпочтительно 1-8 атомов углерода, предпочтительно 1-6 атомов углерода. Углеводородная цепь может быть линейной или разветвленной. Иллюстративные алкильные группы включают метил, этил, н-пропил, изопропил, н-бутил, изобутил и трет-бутил. Аналогичным образом, "алкенильная" группа означает алкильную группу, содержащую одну или большее количество двойных связей в цепи, и "алкинильная" группа означает алкильную группу, содержащую одну или большее количество тройных связей в цепи.
При использовании в настоящем изобретении "арил" означает карбоциклическую ароматическую кольцевую систему, отдельную или конденсированную, такую как фенил, нафтил, тетрагидронафтил, индан или бифенил.
При использовании в настоящем изобретении "циклоалкил" означает ненасыщенное или частично насыщенное углеводородное кольцо, содержащее от 3 до 6 кольцевых атомов. Иллюстративные циклоалкильные группы включают циклопропил, циклобутил, циклопентил, циклогексил, а также их частично насыщенные варианты, такие как циклогексенил и циклогексадиенил.
При использовании в настоящем изобретении "галоген" означает галоген. В некоторых вариантах осуществления галогеном предпочтительно является Br, Cl или F.
При использовании в настоящем изобретении "галогеналкил", "галогеналкенил" и "галогеналкинил" каждый соответственно означает гидрокарбильную группу, содержащую от 1 до 20 атомов углерода, предпочтительно 1-8 атомов углерода, предпочтительно 1-6 атомов углерода, где по меньшей мере один атом водорода замещен галогеном, включая, но не ограничиваясь только ими, пергалогенированные группы, в которые все атомы водорода замещены атомами галогенов. Цепь может быть линейной или разветвленной. Иллюстративные галогеналкильные группы включают трифторметил, трихлорметил, трифторэтил, трифторпропил, трифторбутил и пентафторэтил. Аналогичным образом, "галогеналкенильная" группа означает галогеналкильную группу, содержащую одну или большее количество двойных связей в цепи, и "галогеналкенильная" группа означает галогеналкильную группу, содержащую одну или большее количество тройных связей в цепи.
Термин "гетероарил" или "гетероароматическая" означает ароматические кольцевые группы, содержащие от 5 до 14 кольцевых атомов, выбранных из группы, включающей углерод и по меньшей мере один (обычно 1-4, чаще 1 или 2) гетероатом (например, кислород, азот или серу). Они включают моноциклические кольца и полициклические кольца, в которых моноциклическое гетероароматическое кольцо сконденсировано с одним или большим количеством других карбоциклических ароматических или гетероароматических колец. Примеры моноциклических гетероарильных групп включают фуранил (например, 2-фуранил, 3-фуранил), имидазолил (например, N-имидазолил, 2-имидазолил, 4-имидазолил, 5-имидазолил), изоксазолил(например, 3-изоксазолил, 4-изоксазолил, 5-изоксазолил), оксадиазолил (например, 2-оксадиазолил, 5-оксадиазолил), оксазолил (например, 2-оксазолил, 4-оксазолил, 5-оксазолил), пиразолил (например, 3-пиразолил, 4-пиразолил), пирролил (например, 1-пирролил, 2-пирролил, 3-пирролил), пиридил (например, 2-пиридил, 3-пиридил, 4-пиридил), пиримидинил (например, 2-пиримидинил, 4-пиримидинил, 5-пиримидинил), пиридазинил (например, 3-пиридазинил), тиазолил (например, 2-тиазолил, 4-тиазолил, 5-тиазолил), триазолил (например, 2-триазолил, 5-триазолил), тетразолил (например, тетразолил) и тиенил (например, 2-тиенил, 3-тиенил. Примеры моноциклических 6-членных азотсодержащих гетероарильных групп включают пиримидинил, пиридинил и пиридазинил. Примеры полициклических ароматических гетероарильных групп включают карбазолил, бензимидазолил, бензотиенил, бензофуранил, индолил, хинолинил, бензотриазолил, бензотиазолил, бензоксазолил, бензимидазолил, изохинолинил, индолил, изоиндолил, акридинил или бензизоксазолил.
При использовании в настоящем изобретении "необязательно замещенный" означает замещение атома водорода, который в противном случае будет находиться в заместителе. При обсуждении кольцевых систем оптимальным является замещение с помощью 1, 2 или 3 заместителей, заменяющих обычно содержащийся водород. Однако при указании линейных и разветвленных фрагментов количество заместителей может быть больше, обычно их вводят, когда содержится водород. Заместители могут быть одинаковыми или разными. Иллюстративные заместители включают нитрогруппу, -NR'R'', цианогруппу, -NR'COR''', алкил, алкенил, -C(O), -SO2R''', -NR'SO2R''', -SO2NR'R', -CONR'R'', -CONHC6H5, гидроксигруппу, алкоксигруппу, алкилсульфонил, галогеналкил, галогеналкенил, галогеналкоксигруппу, меркаптогруппу (-SH), тиоалкил, галоген, циклоалкил, гетероциклил, арил или гетероарил, которые все известны в данной области техники и где R' и R'' являются одинаковыми или разными и каждый означает водород или алкил; или если R' и R'' оба присоединены к атому азота, они могут образовать насыщенное или ненасыщенное гетероциклическое кольцо, содержащее от 4 до 6 кольцевых атомов, и где R''' означает алкил или галогеналкил.
При использовании в настоящем изобретении выражение ветеринарная или ветеринарно, или фармацевтическая или фармацевтически приемлемая соль означает любую соль соединения, раскрытого в настоящем изобретении, которая сохраняет свои биологические характеристики и не является токсичной или в другом отношении нежелательной для применения в ветеринарии или медицине. Такие соли можно образовать из множества органических и неорганических противоионов, известных в данной области техники. Такие соли включают соли присоединения с кислотами, образованные с органическими или неорганическими кислотами, такими как хлористоводородная, бромистоводородная, серная, азотная, фосфорная, сульфаминовая, уксусная, трифторуксусная, трихлоруксусная, пропионовая, гексановая, циклопентилпропионовая, гликолевая, глутаровая, пировигонрадная, молочная, малоновая, янтарная, сорбиновая, аскорбиновая, яблочная, малеиновая, фумаровая, винная, лимонная, безойная, 3-(4-гидроксибензоил)безойная, пикриновая, коричная, миндальная, фталевая, лауриновая, метансульфоновая, этансульфоновая, 1,2-этандисульфоновая, 2-гидроксиэтансульфоновая, бензолсульфоновая, 4-хлорбензолсульфоновая, 2-нафталинульфоновая, 4-толуолульфоновая, камфорная, камфорульфоновая, 4-метилбицикло[2.2.2]-окт-2-ен-1-карбоновая, глюкопептоновая, 3-фенилпропионовая, триметилуксусная, трет-бутилуксусная, лаурилсерная, глюконовая, безойная, глутаминовая, гидроксинафтойная, салициловая, стеариновая, циклогексилсульфаминовая, хинная, муконовая кислота и аналогичные кислоты.
Соли дополнительно включают, только в качестве примера, соли нетоксичных органических или неорганических кислот, такие как галогениды, такие как, хлорид и бромид, сульфат, фосфат, сульфамат, нитрат, ацетат, трифторацетат, трихлорацетат, пропионат, гексаноат, циклопентилпропионат, гликолят, глутарат, пируват, лактат, малонат, сукцинат, сорбат, аскорбат, малат, малеат, фумарат, тартрат, цитрат, бензоат, 3-(4-гидроксибензоил)бензоат, пикрат, циннамат, манделат, фталат, лаурат, метансульфонат (мезилат), этансульфонат, 1,2-этан-дисульфонат, 2-гидроксиэтансульфонат, бензолсульфонат (безилат), 4-хлорбензолсульфонат, 2-нафталинсульфонат, 4-толуолсульфонат, камфорат, камфорсульфонат, 4-метилбицикло[2.2.2]-окт-2-ен-1-карбоксилат, глюкогептонат, 3-фенилпропионат, триметилацетат, трет-бутилацетат, лаурилсульфат, глюконат, бензоат, глутамат, гидроксинафтоат, салицилат, стеарат, циклогексилсульфамат, хинат, муконат и т. п.
Примеры неорганических оснований, которые можно использовать для получения солей присоединения с основаниями, включают, но не ограничиваются только ими, гидроксиды металлов, такие как гидроксид лития, гидроксид натрия и гидроксид калия; амиды металлов, такие как амид лития и амид натрия; карбонаты металлов, такие как карбонат лития, карбонат натрия, и карбонат калия; и аммониевые основания, такие как гидроксид аммония и карбонат аммония.
Примеры органических оснований, которые можно использовать для получения солей присоединения с основаниями, включают, но не ограничиваются только ими, алкоксиды металлов, такие как алкоксиды лития, натрия и калия, включая метоксид лития, метоксид натрия, метоксид калия, этоксид лития, этоксид натрия, этоксид калия и трет-бутоксид калия; гидроксиды четвертичного аммония, такие как гидроксид холина; и амины, включая, но не ограничиваясь только ими, алифатические амины (т. е. алкиламины, алкениламины, алкиниламины и алициклические амины), гетероциклические амины, ариламины, гетероариламины, основные аминокислоты, аминосахара и полиамины.
В вариантах осуществления настоящего изобретения, основанием может быть гидроксид четвертичного аммония, где одна или большее количество алкильных групп четвертичного аммониевого иона необязательно замещенна одним или большим количеством подходящих заместителей. Предпочтительно, по меньшей мере одна алкильная группа замещена одной или большим количеством гидроксигрупп. Неограничивающие примеры гидроксидов четвертичного аммония, которые можно использовать в соответствии с настоящим изобретением, включают гидроксид холина, гидроксид триметилэтиламмония, гидроксид тетраметиламмония и предпочтительно гидроксид холина. В вариантах осуществления настоящего изобретения алкиламин может быть замещенным или незамещенным. Неограничивающие примеры незамещенных алкиламинов, которые можно использовать в соответствии с настоящим изобретением включают метиламин, этиламин, диэтиламин и триэтиламин. Замещенный алкиламин предпочтительно замещен одной или большим количеством гидроксигрупп и предпочтительно одной - тремя гидроксигруппами. Неограничивающие примеры замещенных алкиламинов, которые можно использовать в соответствии с настоящим изобретением, включают 2-(диэтиламино)этанол, N,N-диметилэтаноламин (2-диметиламиноэтанол), трометамин, этаноламин и диоламин.
В некоторых случаях указанные заместители могут вносить вклад в оптическую и/или стереоизомерию. Соединения, обладающие одинаковой молекулярной формулой, но различающиеся по характеру или последовательности связывания их атомов или по расположению их атомов в пространстве, называются "изомерами". Изомеры, которые различаются по расположению их атомов в пространстве, называются "стереоизомерами". Стереоизомеры, которые не являются зеркальными изображениями друг друга, называются "диастереоизомерами" и не которые не являются налагающимися зеркальными изображениями друг друга, называются "энантиомерами". Если соединение содержит асимметрический центр, например, если он связан с четырьмя разными группами, возможна пара энантиомеров. Энантиомер можно описать абсолютной конфигурацией его асимметрического центра и обозначить, как (R) или (S), в соответствии с правилами Кана и Прелога (Cahn et al., 1966, Angew. Chem. 78: 413-447, Angew. Chem., Int. Ed. Engl. 5: 385-414 (errata: Angew. Chem., Int. Ed. Engl. 5:511); Prelog and Helmchen, 1982, Angew. Chem. 94: 614-631, Angew. Chem. Internat. Ed. Eng. 21: 567-583; Mata and Lobo, 1993, Tetrahedron: Asymmetry 4: 657-668) или можно описать тем, каким образом молекула вращает плоскость поляризованного света и обознаичть, как правовращающий или левовращающий (а именно, как (+)- или (-)-изомеры соответственно). Хиральное соединение может существовать в виде отдельного энантиомера или в виде их смеси. Смесь, содержащую одинаковые доли энантиомеров, называют "рацемической смесью".
В некоторых вариантах осуществления соединения, раскрытые в настоящем изобретении, могут обладать одним или большим количеством асимметрических центров; и поэтому такие соединения можно получить в виде отдельных (R)- или (S)-энантиомеров или в виде их смеси. Если не указано иное, например, путем указания стереохимической конфигурации в любом положении формулы, предполагается, что описание или название конкретного соединения в описании и формуле изобретения включает и индивидуальные энантиомеры, и их смеси, рацемические или иные. Методики определения стереохимической конфигурации и разделения стереоизомеров хорошо известны в данной области техники.
В некоторых вариантах осуществления соединения, раскрытые в настоящем изобретении, являются "стереохимически чистым". Стереохимически чистое соединение обладает степенью стереохимической чистоты, при которой специалисты в данной области техники должны признать его "чистым". Разумеется, эта степень чистоты может составлять менее 100%. В некоторых вариантах осуществления "стереохимически чистое" означает соединение, которое в основном не содержит альтернативных изомеров, т. е. содержит не менее примерно 85% или более основного изомера. В предпочтительных вариантах осуществления соединение содержит не менее примерно 85%, примерно 90%, примерно 91%, примерно 92%, примерно 93%, примерно 94%, примерно 95%, примерно 96%, примерно 97%, примерно 98%, примерно 99%, примерно 99,5% или примерно 99,9% основного изомера.
При использовании в настоящем изобретении термины "субъект" и "пациент" используются взаимозаменяемым образом. Термины "субъект" и "субъекты" означают человека. В одном варианте осуществления субъектом является животное-спутник, такое как собака или кошка. В другом варианте осуществления субъектом является важное для сельского хозяйства животное, такое как овца, корова, лошадь, коза, рыба, свинья или домашняя птица (такая как цыпленок, индейка, утка или гусь). В другом варианте осуществления субъектом является примат, такой как обезьяна, такая как макак-крабоед, шимпанзе и человек или животное, не являющееся приматом.
Кроме того, фармацевтически приемлемое пролекарство соединения, описывающегося формулой (I), также включены в настоящее изобретение. Фармацевтически приемлемое пролекарство означает соединение, содержащее группу, которая может превратиться в аминогруппу, гидроксигруппу, карбоксигруппу и т. п. путем сольволиза или при физиологических условиях. Примеры групп, образующих пролекарство, включают описанные в Prog. Med., 5, 2157-2161 (1985) или "Pharmaceutical Research and Development" (Hirokawa Publishing Company, 1990), vol. 7, Drug Design, 163-198. Термин пролекарство используется в описании для описания любой фармацевтически приемлемой формы соединения, которая после введения пациенту дает активное соединение. Фармацевтически приемлемые пролекарства означают соединение, которое подвергается метаболизму, например, гидролизуется или окисляется в хозяине с образованием соединения, предлагаемого в настоящем изобретении. Типичные примеры пролекарств включают соединения, которые обладают биологически лабильной защитной группой в функциональном фрагменте активного соединения. Пролекарства включают соединения, которые можно окислить, восстановить, аминировать, дезаминировать, гидроксилировать, дегидроксилировать, гидролизовать, дегидролизовать, алкилировать, деалкилировать, ацилировать, деацилировать, фосфорилировать, дефосфорилировать с образованием активного соединения.
Настоящее изобретение включает все фармацевтически приемлемые изотопно-меченые соединения, предлагаемые в настоящем изобретении, в которых один или большее количество атомов заменены атомами, обладающим таким же атомным номером, но атомной массой или массовым числом, не таким, как атомная масса или массовое число, обычно обнаруживающееся в природе. Примеры изотопов, подходящих для включения в соединения, предлагаемые в настоящем изобретении, включают изотопы водорода, такие как 2H и 3H, углерода, такие как 11C, 13C и 14C, хлора, такие как 36Cl, фтора, такие как 18F, йода, такие как 123I и 125I, азота, такие как 13N и 15N, кислорода, такие как 15O, 17O и 18O, фосфора, такие как 32P, и сены, такие как 35S. Некоторые изотопно-меченые соединения, предлагаемые в настоящем изобретении, такие как включающие радиоактивный изотоп, можно использовать для изучения распределения лекарственного средства или субстрата в ткани. Радиоактивные изотопы тритий, т. е. 3H, и углерод-14, т. е. 14C, являются особенно подходящими для этой цели вследствие легкости включения и простых методик детектирования. Замещение более тяжелыми изотопами, такими как дейтерий, т. е. 2H, может обеспечить некоторые терапевтические преимущества, обусловленные большей метаболической стабильностью, например, увеличенным временем полувыведения in vivo или возможностью использования меньших доз и поэтому в некоторых случаях может быть предпочтительным. Замещение излучающими позитроны изотопами, такими как 11C, 18F, 15O и 13N, может быть полезно при исследованиях с помощью позитронной эмиссионной топографии (PET) для изучения занятости рецепторов субстрата. Изотопно-меченые соединения, предлагаемые в настоящем изобретении, обычно можно получить по обычным методикам, известным специалистам в данной области техники, или по методикам, аналогичным описанным в прилагаемых примерах и синтезах с использованием подходящего изотопно-меченого реагента вместо использовавшегося ранее немеченого реагента.
Композиции и методики введения
Соединения формулы (I), применяющиеся в способах, раскрытых в настоящем изобретении, можно вводить в некоторых вариантах осуществления с использованием ветеринарных или фармацевтических композиций, содержащих по меньшей мере одно соединение формулы (I), при необходимости в форме соли по отдельности или в виде комбинации с одним или большим количеством совместимых и ветеринарно или фармацевтически приемлемых носителей, таких как разбавители или вспомогательные вещества, или с другим агентом. Предложены композиции, которые содержат производное формулы (I) или его соль и приемлемый инертный наполнитель, носитель или разбавитель. Композиция также может находиться во множестве форм, которые включают, но не ограничиваются только ими, пероральные препараты, препараты для инъекции и местные, кожные или подкожные препараты.
Композиция может находиться в форме, подходящей для перорального применения, например, в виде пищевых добавок, лепешек, пастилок, жевательных таблеток, таблеток, твердых или мягких капсул, эмульсий, водных или масляных суспензий, водных или масляных растворов, диспергирующихся порошков или гранул, сиропов или эликсиров. Композиции, предназначенные для перорального применения можно получить по любой методике, известной в данной области техники для получения ветеринарных или фармацевтических композиций, и такие композиции могут содержать один или большее количество агентов, выбранных из группы, состоящей из следующих: подсластители, придающие горечь агенты, вкусовые агенты, окрашивающие агенты и консерванты для получения привлекательных и обладающих привлекательным вкусом препаратов.
Пастилками являются твердые композиции, содержащие один или большее количество активных ингредиентов, предназначенные для медленного растворения или разрыхления в полости рта путем пассивного выдерживания в полости рта или активной обработки путем рассасывания или жевания. Их можно использовать для системного воздействия, если лекарственное средство всасывается через выстилку щеки или пищевода, или проглатывается. В частности, мягкие пастилки можно разжевать или дать им медленно раствориться во рту. Эти дозированные формы обладают тем преимуществом, что они ароматизированы и поэтому их легко вводить людям и животным; их состав легко изменить и подобрать специально для данного пациента; с их помощью можно доставить точные количества активного ингредиента в полость рта и пищеварительную систему; и они обеспечивают взаимодействие лекарственного средства с полостью рта и пищевода в течение продолжительного времени.
Таблетки могут содержать активный ингредиент в смеси с нетоксичными фармацевтически приемлемыми инертными наполнителями, которые являются подходящими для приготовления таблеток. Эти инертные наполнители могут представлять собой, например, инертные разбавители, такие как карбонат кальция, карбонат натрия, лактоза, фосфат кальция или фосфат натрия; гранулирующие и разрыхляющие агенты, например, кукурузный крахмал или альгиновая кислота; связующие агенты, например, крахмал, желатин или камедь акации, и смазывающие агенты, например, стеарат магния, стеариновая кислота или тальк. Таблетки могут быть без покрытия или на них можно нанести покрытие по известным методикам для задержки разрыхления и всасывания в желудочно-кишечном тракте и тем самым обеспечения пролонгированного действия в течение длительного времени.
Препараты для перорального применения могут представлять собой твердые желатиновые капсулы, в которых активный ингредиент смешан с инертным твердым разбавителем, например, карбонатом кальция, фосфатом кальция или каолином. Капсулы также могут представлять собой мягкие желатиновые капсулы, в которых активный ингредиент смешат с водой или смешивающимися растворителями, такими как пропиленгликоль, PEGs и этанол, или масляной средой, такой как арахисовое масло, жидкий парафин, или оливковое масло.
Композиции также могут находиться в форме эмульсии типа масло-в-воде или вода-в-масле. Масляной фазой может быть растительное масло, например, оливковое масло или арахисовое масло, или минеральное масло, например, жидкий парафин, или их смеси. Подходящими эмульгирующими агентами могут быть природные фосфатиды, например, соя, лецитин и сложные эфиры или неполные сложные эфиры, образованные из жирных кислот и ангидридов гексита, например, сорбитанмоноолеат, и продукты конденсации указанных неполных сложных эфиров с этиленоксидом, например, полиоксиэтиленсорбитанмоноолеат. Эмульсии также могут содержать подсластители, придающие горечь агенты, вкусовые агенты и консерванты.
В одном варианте осуществления препарата композиция находится в форме микроэмульсии. Микроэмульсии хорошо подходят для использования в качестве жидкого носителя. Микроэмульсии являются четырехкомпонентными системами, содержащими водную фазу, масляную фазу, поверхностно-активное вещество и вспомогательное поверхностно-активное вещество. Они являются полупрозрачными и изотропными жидкостями. Микроэмульсии состоят из стабильной дисперсии микрокапелек водной фазы в масляной фазе или, наоборот, микрокапелек масляной фазы в водной фазе. Размер этих микрокапелек равен менее 200 нм (от 1000 до 100000 нм для эмульсии). Межфазная пленка состоит из чередующихся поверхностно-активных (SA) и вспомогательных поверхностно-активных (Co-SA) молекул, что вследствие снижения межфазного натяжения обеспечивает самопроизвольное образование микроэмульсии. В одном варианте осуществления масляной фазы масляную фазу можно образовать из минеральных или растительных масел, из ненасыщенных полигликозилированных глицеридов или из триглицеридов, или, альтернативно, из смесей таких соединений. В одном варианте осуществления масляной фазы масляная фаза состоит из триглицеридов; в другом варианте осуществления масляной фазы триглицериды являются триглицеридами с цепью средней длины, например, триглицериды C8-C10 каприловой/каприновой кислоты. В другом варианте осуществления содержание масляной фазы в % об./об. находится в диапазоне, выбранном из группы, состоящей из следующих: от примерно 2 до примерно 15%; от примерно 7 до примерно 10%; и от примерно 8 до примерно 9% об./об. в пересчете на микроэмульсию. Водная фаза включает, например, воду или производные гликоля, такие как пропиленгликоль, простые эфиры гликоля, полиэтиленгликоли или глицерин. В одном варианте осуществления производных гликоля гликоль выбран из группы, состоящей из следующих: пропиленгликоль, моноэтиловый эфир диэтиленгликоля, моноэтиловый эфир дипропиленгликоля и их смеси. Обычно водная фаза составляет от примерно 1 до примерно 4% об./об. в пересчете на микроэмульсию. Поверхностно-активные вещества для микроэмульсии включают моноэтиловый эфир диэтиленгликоля, димонометиловый эфир пропиленгликоля, полигликозилированные C8-C10 глицериды или полиглицерил-6-диолеат. В дополнение к этим поверхностно-активным веществам вспомогательные поверхностно-активные вещества включают спирты с короткими цепями, такие как этанол и пропанол. Некоторые соединения входят в три компонента, рассмотренные выше, например, водную фазу, поверхностно-активное вещество и вспомогательное поверхностно-активное вещество. Однако опытный практик хорошо знает, что в разных компонентах одного и того же препарата следует использовать разные соединения. В одном варианте осуществления в количестве поверхностно-активного вещества/вспомогательного поверхностно-активного вещества, отношение количества вспомогательного поверхностно-активного вещества к количеству поверхностно-активного вещества составляет от примерно 1/7 до примерно 1/2.
В другом варианте осуществления в количестве вспомогательного поверхностно-активного вещества в микроэмульсии содержится от примерно 25 до примерно 75% об./об. поверхностно-активного вещества и от примерно 10 до примерно 55% об./об. вспомогательного поверхностно-активного вещества.
Масляные суспензии можно приготовить путем суспендирования активного ингредиента в растительном масле, таком как арахисовое масло, оливковое масло, кунжутное масло или кокосовое масло, или в минеральном масле, таком как жидкий парафин. Масляные суспензии могут содержать загущающий агент, например, пчелиный воск, твердый парафин или цетиловый спирт. Подсластители, такие как сахароза, сахарин или аспартам, придающие горечь агенты, и вкусовые агенты можно добавить и получить вкусный пероральный препарат. Эти композиции можно консервировать путем добавления антиоксиданта, такого как аскорбиновая кислота, или другие известные консерванты.
Водные суспензии могут содержать активное вещество в смеси с инертными наполнителями, подходящими для приготовления водных суспензий. Такими инертными наполнителями являются суспендирующие агенты, например, натриевая соль карбоксиметилцеллюлозы, метилцеллюлоза, гидроксипропилметилцеллюлоза, альгинат натрия, поливинилпирролидон, трагакантовая камедь и камедь акации; диспергирующие или смачивающие агенты могут представлять собой природный фосфатид, например, лецитин, или продукты конденсации алкиленоксида с жирными кислотами, например, полиоксиэтиленстеарат, или продукты конденсации этиленоксида с длинноцепочечными алифатическими спиртами, например, гептадекаэтиленоксицетанол, или продукты конденсации этиленоксида с неполными сложными эфирами, образованными из жирных кислот и гексита, такие как полиоксиэтиленсорбитмоноолеат, или продукты конденсации этиленоксида с неполными сложными эфирами, образованными из жирных кислот и ангидридов гексита, например, полиэтиленсорбитанмоноолеат. Водные суспензии также могут содержать один или большее количество консервантов, например, этил, или н-пропил, п-гидроксибензоат, один или большее количество окрашивающих агентов, один или большее количество вкусовых агентов и один или большее количество подсластителей и/или придающих горечь агентов, таких как указанные выше.
Диспергирующиеся порошки и гранулы подходящие для получения водной суспензии путем добавления воды, содержат активный ингредиент в смеси с диспергирующим или смачивающим агентом, суспендирующии агентом и одним или большим количеством консервантов. Примерами подходящих диспергирующих или смачивающих агентов и суспендирующих агентов являются уже указанные выше. Также могут содержаться дополнительные инертные наполнители, например, подсластители, придающие горечь, вкусовые и окрашивающие агенты.
Сиропы и эликсиры можно приготовить с подсластителями, такими как глицерин, пропиленгликоль, сорбит или сахароза. Такие препараты также могут содержать смягчающий агент, консервант, вкусовое вещество (вещества) и окрашивающий агент (агенты).
Композиции может находиться в форме стерильной водной или масляной суспензии для инъекции. Эту суспензию можно приготовить по известным методикам с использованием подходящих диспергирующих или смачивающих агентов и суспендирующих агентов, указанных выше. Стерильный препарат для инъекции также может быть стерильным раствором или суспензией для инъекции в нетоксичном парентерально приемлемом разбавителе или растворителе, например, в виде раствора в 1,3-бутандиоле. В число приемлемых разбавителей и растворителей, которые можно использовать, входят вода, раствор Рингера и изотонический раствор хлорида натрия. Также можно использовать сорастворители, такие как этанол, пропиленгликоль или полиэтиленгликоли. Можно использовать консерванты, такие как фенол или бензиловый спирт.
Кроме того, стерильные нелетучие масла обычно используют в качестве растворителя или суспендирующей среды. Для этой цели можно использовать любое светлое нелетучее масло, включая синтетические моно- или диглицериды. Кроме того, для получения препаратов для инъекции используют жирные кислоты, такие как олеиновая кислота.
Местные, кожные и подкожные препараты могут включать эмульсии, кремы, мази, гели или пасты.
Органические растворители, которые можно использовать в настоящем изобретении, включают, но не ограничиваются только ими: ацетилтрибутилцитрат, эфиры жирных кислот, такие как диметиловый эфир, диизобутиладипат, ацетон, ацетонитрил, бензиловый спирт, бутилдигликоль, диметилацетамид, диметилформамид, н-бутиловый эфир дипропиленгликоля, этанол, изопропанол, метанол, этиленгликольмоноэтил ether, монометиловый эфир этиленгликоля, монометилацетамид, димонометиловый эфир пропиленгликоля, жидкие полиоксиэтиленгликоли, пропиленгликоль, 2-пирролидон (например, N-метилпирролидон), моноэтиловый эфир диэтиленгликоля, этиленгликоль и диэтилфталат, или смесь по меньшей мере двух из этих растворителей.
Растворитель или разбавитель для композиций, предлагаемых в настоящем изобретении, может включать растительные масла такие как, но не ограничиваясь только ими соевое масло, арахисовое масло, касторовое масло, кукурузное масло, хлопковое масло, оливковое масло, масло из виноградных косточек, подсолнечное масло и т. п.; минеральные масла такие как, но не ограничиваясь только ими, вазелиновое масло, парафин, силикон и т. п.; алифатические или циклические углеводороды, или, альтернативно, например, триглицериды с цепью средней длины (такой как C8-C12).
Дозированные формы могут содержать от примерно 0,5 мг до примерно 5 г активного средства.
В одном варианте осуществления настоящего изобретения активное средство содержится в препарате в концентрации, равной примерно от 0,05 до 10% мас./об.
Соединения формулы (I) можно использовать по отдельности или в виде их препаратов или составов в виде комбинаций.
Соединения формулы (I), предлагаемые в настоящем изобретении, можно объединить с одним или большим количеством средств, обладающих такой же областью активности, например, для увеличения активности, или с веществами, обладающими другим спектром активности, например, для расширения диапазона активности. Установлено, что соединения формулы (I) обладают активностью, как ингибиторы JAK. Таким образом, соединения, предлагаемые в настоящем изобретении, также можно объединить с другими средствами, которые ингибируют активность JAK. Такие ингибиторы JAK могут включать малые молекулы, нуклеиновые кислоты, например, антисмысловые нуклеиновые кислоты JAK, аминокислоты, пептиды, углеводы и антитела к JAK. Такие средства предпочтительно объединять с фармацевтически приемлемым растворителем или носителем для доставки. Примеры антител к JAK включают, например, поликлональные, моноклональные, гуманизированные, антиидиотипические, химерные или одноцепочечные антитела, Fab, F(ab')2 и библиотечные фрагменты для экспрессии Fab, молекулы scFV и их связывающие антигенную детерминанту фрагменты. Антисмысловые олигонуклеотиды, направленные на ген JAK или mRNA для ингибирования ее экспрессии, получают по стандартным методикам (см., например, Agrawal et al., Methods in Molecular Biology: Protocols for Oligonucleotides and Analogs, Vol. 20, (1993)). Для антител к JAK предпочтительная доза обычно равна от 0,2 мг/кг до 20 мг/кг массы тела. Обычно частично гуманизированные антитела и полные антитела человека обладают более значительным периодом полувыведения из тела человека, чем другие антитела. Соответственно, возможны меньшие дозы и менее частое введение. Модификации, такие как липидизация, можно использовать для стабилизации антител и увеличения потребления и проникновения в ткань. Методика липидизации антител описана в Cruikshank et al., J. Acquired Immune Deficiency Syndromes Hum. Retrovirol. 14: 193, (1997).
Соединения формулы (I), предлагаемые в настоящем изобретении, можно объединить с одним или большим количеством средств, которые модулируют иммунную систему млекопитающих, или с противовоспалительными средствами. Эти средства могут включать, но не ограничиваются только ими, циклоспорин A, например, сандиммун® или неорал®, рапамицин, FK-506 (такролимус), лефлуномид, дезоксиспергуалин, микофенолят, например, целлцепт®, азатиоприн, например, имуран®, даклизумаб, например, зенапакс®, OKT3, например, ортоколон®, атгам, аспирин, ацетаминофен, ибупрофен, напроксен, пироксикам и противовоспалительные стероиды, например, преднизолон или дексаметазон. Эти средства можно вводить в качестве частей препаратов или отдельных дозированных форм, по тому же или разным путям введения, и в одном или разных режимах введения в соответствии со стандартной фармацевтической практикой, известной специалисту в данной области техники.
Фармацевтический препарат, содержащий соединения формулы (I), для введения человеку или другому млекопитающему, предпочтительно находится в разовой дозированной форме, в которой препарат разделен на разовые дозы, содержащие соответствующее количество активного компонента. Разовая дозированная форма может представлять собой упакованный препарат, содержащий отдельные количества препарата, такие как упакованные таблетки, капсулы и порошки во флаконах или ампулах. Кроме того, разовая дозированная форма может представлять собой саму капсулу, таблетку или лепешку или может представлять собой соответствующее количество этих упакованных форм.
Количество активного компонента в разовой дозе препарата может меняться или устанавливаться равным от примерно 0,1 мг до примерно 1000 мг в зависимости от конкретного применения и активности активного компонента. Композиция при желании также может содержать другие совместимые терапевтические средства.
При терапевтическом применении для лечения или облегчения зуда, связанного с аллергическим дерматитом и атопическим дерматитом у человека или другого млекопитающего, соединения, использующиеся в способе лечения, вводят в начальной дозе, равной от примерно 0,1 мг/кг до примерно 100 мг/кг за интервал, от примерно 0,1 мг/кг до примерно 50,0 мг/кг за интервал, от примерно 0,1 мг/кг до примерно 10,0 мг/кг за интервал, от примерно 0,1 мг/кг до примерно 5,0 мг/кг за интервал, от примерно 0,1 мг/кг до примерно 2,5 мг/кг за интервал, от примерно 0,1 мг/кг до примерно 2,0 мг/кг за интервал, от примерно 0,1 мг/кг до примерно 1,0 мг/кг за интервал, от примерно 0,4 мг/кг до примерно 1,0 мг/кг за интервал или от примерно 0,4 мг/кг до примерно 0,6 мг/кг за интервал. Предпочтительными интервалами могут быть день, неделя, месяц, квартал, полугодие или год. Дозы могут меняться в зависимости от требований пациента, например, массы подвергающегося лечению человека или млекопитающего, тяжести подвергающегося лечению патологического состояния, пути введения и активности использующегося соединения (соединений). Определение надлежащей дозировки и пути введения в конкретном случае входит в компетенцию практикующего врача. Обычно лечение начинают с меньших доз, которые меньше оптимальной дозы соединения, которые можно увеличивать с небольшими шагами до обеспечения оптимально эффекта при конкретных особенностях патологического состояния. Для удобства при желании полную суточную дозу можно разделить и вводить порциями в течение суток.
При терапевтическом применении соединения формулы (I) применимы для приготовления лекарственного средства для способа лечения волчанки, рассеянного склероза, ревматоидного артрита, псориаза, диабета типа I и осложнение диабета, рака, астмы, атопического дерматита, аутоиммунных нарушений щитовидной железы, язвенного колита, болезни Крона, болезни Альцгеймера, лейкоза, остеоартрита, борьбы с зудом, хронического респираторного заболевания и при других показаниях, когда желательна иммуносупрессия/иммуномодуляция.
Соединения формулы (I) можно, в частности, использовать в областях ветеринарии, скотоводства и, в частности, теплокровных позвоночных, включая животных-спутников, таких как собаки и кошки, лошади, домашний скот и птица.
Соединения, предлагаемые в настоящем изобретении, их стереоизомеры и их ветеринарно или фармацевтически приемлемые соли, и композиции, содержащие соединения, предлагаемые в настоящем изобретении, вместе по меньшей мере с одним другим ветеринарным средством являются особенно ценными для борьбы с зудом и атопическим дерматитом у животных-спутников, в особенности у собак и кошек, домашнего скота и птиц.
Любые из соединений, предлагаемых в настоящем изобретении, или подходящую комбинацию соединения, предлагаемого в настоящем изобретении, и необязательно, по меньшей мере с одним дополнительным ветеринарным средством можно вводить прямо животному и/или косвенно путем его введения в локальную среду, в которой находится животное (такую как подстилка, ограда и т. п.). Прямое введение включает соприкосновение кожи, меха или перьев животного с соединением (соединениями) или введение с кормом или путем инъекции соединений животному.
Предполагается, что соединение формулы (I), его стереоизомер и его ветеринарно приемлемая соль в комбинации по меньшей мере с одним дополнительным ветеринарным средством, описанным в настоящем изобретении, является ценным для лечения и борьбы с разными симптомами, связанными с зудом и атопическим дерматитом.
Настоящее изобретение также относится к способу введения соединения, предлагаемого в настоящем изобретении, по отдельности или в комбинации по меньшей мере с одним дополнительным ветеринарным средством и необязательно ветеринарно приемлемым инертным наполнителем, разбавителем или носителем, животным с хорошим состоянием здоровья, включающему введение указанному животному для ослабления или устранения симптомов, связанных с зудом и атопическим дерматитом.
Настоящее изобретение явно включает соединения, приведенные в таблице 1. Композиция, содержащая терапевтически приемлемое количество любого из этих соединений, также входит в объем настоящего изобретения. Композиция может дополнительно содержать ветеринарно приемлемый инертный наполнитель, разбавитель, носитель или их смесь. Такую композицию можно вводить нуждающемуся в ней животному для лечения зуда или атопического дерматита или борьбы с ними. Композиция может дополнительно содержать дополнительное ветеринарное средство, описанное в настоящем изобретении.
Экспериментальные методики
ПРИМЕРЫ
В приведенных ниже примерах представлено более подробное описание условий получения соединения, предлагаемые в настоящем изобретении. Однако следует понимать, что настоящее изобретение, полностью описанное и изложенное в формуле изобретения, не ограничивается подробностями приведенных ниже схем или режимами получения.
Синтез
Обычно соединения, предлагаемые в настоящем изобретении, можно приготовить, выделить или получить по любой методике, очевидной для специалистов в данной области техники. Типичные методики получения проиллюстрированы на приведенных ниже схемах.
Схема 1 (пример 1, как иллюстративный):
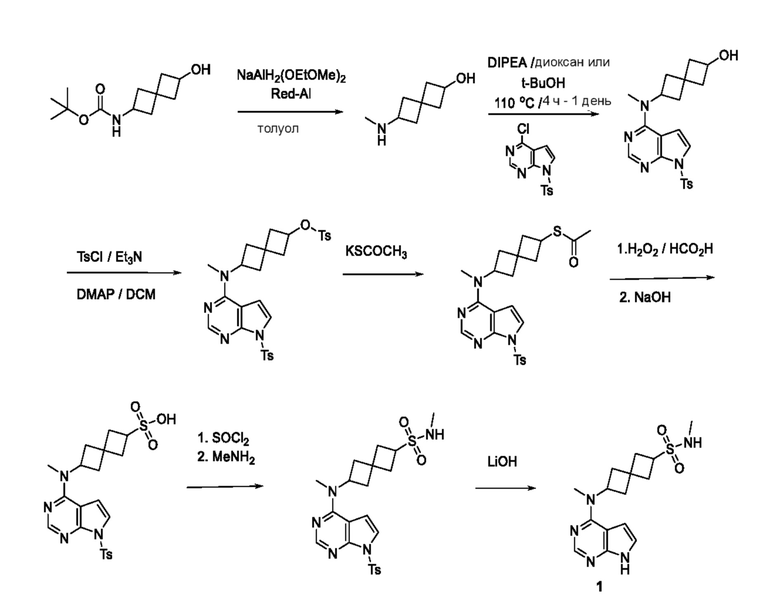
Пример 1
Соединение 1: N-метил-6-[метил(7H-пирроло[2,3-d]пиримидин-4-ил)амино]спиро[3.3]гептан-2-сульфонамид
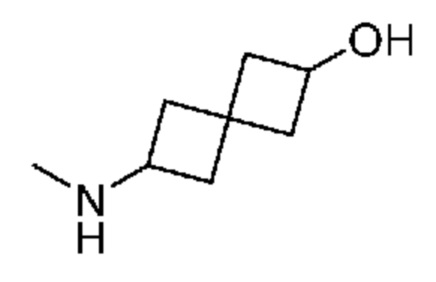
Промежуточный продукт 1: 6-(метиламино)спиро[3.3]гептан-2-ол. В колбу объемом 1 л добавляли трет-бутил-N-(2-гидроксиспиро[3.3]гептан-6-ил)карбамат (16,0 г, 70 ммоля) и толуол (200 мл). Red-Al (116 мл, 420 ммоля, 70% в толуоле) по каплям добавляли в течение 2 ч и поддерживали внутреннюю температуру ниже 35°C. После добавления смесь медленно нагревали до 130°C и перемешивали при этой температуре в течение примерно 4 ч. Затем ее охлаждали до <5°C. Реакцию останавливали, по каплям добавляя насыщенный раствор Na2SO4 (~200 мл). Поддерживали внутреннюю температуру ниже 20°C. Твердое вещество отфильтровывали и водный раствор экстрагировали с помощью DCM (3×200 мл). Объединенный раствор сушили над MgSO4. После фильтрования и концентрирования в вакууме получали вязкое масло (9,0 г, 75%). 1H NMR (400 MHz, метанол-d4) δ част./млн 1,69-1,88 (m, 4 H) 2,09-2,37 (m, 8 H) 2,97-3,05 (m, 0,5 H) 3,23-3,32 (m, 8 H) 3,36-3,40 (m, 1 H) 3,42-3,48 (m, 1 H) 3,57-3,62 (m, 4 H) 3,99-4,07 (m, 0,5 H). LCMS (M/Z): 142 (M+H).
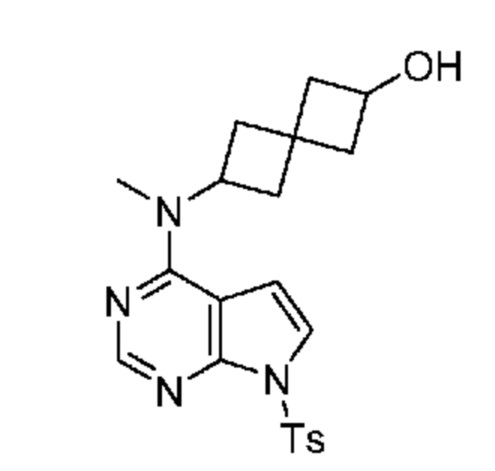
Промежуточный продукт 2: 6-[метил-[7-(п-толилсульфонил)пирроло[2,3-d]пиримидин-4-ил]амино]спиро[3.3]гептан-2-ол.
К раствору 6-(метиламино)спиро[3.3]гептан-2-ола (8,46 г, ~60 ммоля) в t-BuOH (140 мл) добавляли DIPEA (32 мл, 180 ммоля) и 4-хлор-7-(п-толилсульфонил)пирроло[2,3-d]пиримидин (18,4 г, 60 ммоля). Смесь нагревали при 110°C в течение 1 дня. Растворитель удаляли в вакууме. Остаток очищали на колонке ISCO (330 г при элюировании с помощью EtOAc и гептаном). После концентрирования получали почти белое твердое вещество (17,0 г, 79,4%). 1H NMR (400 MHz, DMSO-d6) δ част./млн 1,82 (ddd, J=15,03, 10,93, 7,81 Hz, 2 H) 2,06-2,24 (m, 5 H) 2,29-2,40 (m, 4 H) 3,10-3,14 (m, 3 H) 3,18-3,27 (m, 1 H) 3,90-3,99 (m, 1 H) 4,88 (d, J=6,25 Hz, 1 H) 4,97 (br t, J=8,59 Hz, 1 H) 6,85 (d, J=4,10 Hz, 1 H) 7,39 (m, J=8,00 Hz, 2 H) 7,57 (d, J=4,10 Hz, 1 H) 7,93 (m, J=8,20 Hz, 2 H) 8,19 (s, 1 H); LCMS (M/Z): 413 (M+H).
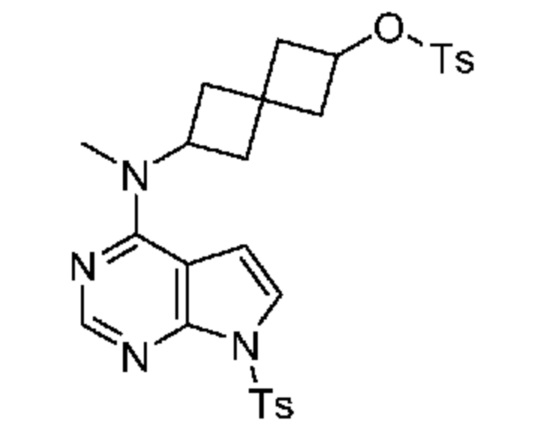
Промежуточный продукт 3: [6-[метил-[7-(п-толилсульфонил)пирроло[2,3-d]пиримидин-4-ил]амино]спиро[3.3]гептан-2-ил]-4-метилбензолсульфонат. В круглодонную колбу объемом 1 л добавляли 6-[метил-[7-(п-толилсульфонил)пирроло[2,3-d]пиримидин-4-ил]амино]спиро[3.3]гептан-2-ол (~22,3 г, 54,1 ммоля), DCM (200 мл), DMAP (1,31 г, 10,8 ммоля), Et3N (15,3 мл, 108,2 ммоля) и TsCl (11,9 г, 62,2 ммоля). Реакцию проводили при комнатной температуре в течение примерно 20 ч с мониторингом посредством LCMS, затем смесь обрабатывали водой (100 мл). Водный раствор экстрагировали с помощью DCM (100 мл×2). Объединенный органический раствор сушили над Na2SO4. После фильтрования и концентрирования получали светло-коричневое твердое вещество (38,3 г). Неочищенное вещество очищали с помощью ISCO (колонка 330 г) и элюировали с помощью EtOAc и гептаном. Получали светло-желтое твердое вещество (29,4 г, 96%). 1H NMR (400 MHz, DMSO-d6) δ част./млн) 1,20 (s, 1 H) 1,99-2,25 (m, 7 H) 2,32 (s, 4 H) 2,40 (s, 4 H) 3,09 (s, 3 H) 4,69 (t, J=7,22 Hz, 1 H) 4,92 (s, 1 H) 5,72 (s, 1 H) 6,84 (d, J=4,10 Hz, 1 H) 7,36-7,47 (m, 5 H) 7,56 (d, J=4,30 Hz, 1 H) 7,75 (d, J=8,40 Hz, 2 H) 7,92 (d, J=8,40 Hz, 2 H) 8,17 (s, 1 H); LCMS (M/Z): 567 (M+H).
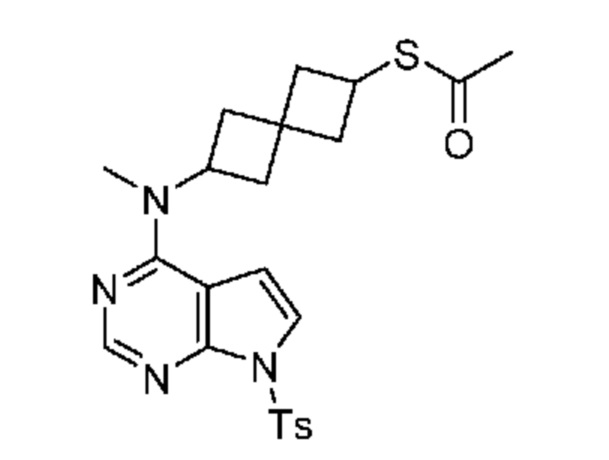
Промежуточный продукт 4: S-[6-[метил-[7-(п-толилсульфонил)пирроло[2,3-d]пиримидин-4-ил]амино]спиро[3.3]гептан-2-ил]этантиоат. В круглодонную колбу объемом 1 л, содержащую соединение 6-[метил-[7-(п-толилсульфонил)пирроло[2,3-d]пиримидин-4-ил]амино]спиро[3.3]гептан-2-ил]-4-метилбензолсульфонат (29,4 г, ~51,9 ммоля) добавляли DMSO (200 мл) и тиоацетат калия (~33,1 г, 289 ммоля). Реакционную смесь нагревали при 60°C в течение 20 ч с мониторингом посредством LCMS. Затем ее обрабатывали с помощью 5% NaHCO3 (200 мл) и экстрагировали с помощью EtOAc (3×200 мл). Объединенный органический раствор сушили над Na2SO4. После фильтрования и концентрирования получали светло-коричневатое твердое вещество (25,3 г, ~100%). LCMS (M/Z): 471 (M+H). Его использовали на следующей стадии без обработки без дополнительной очистки.
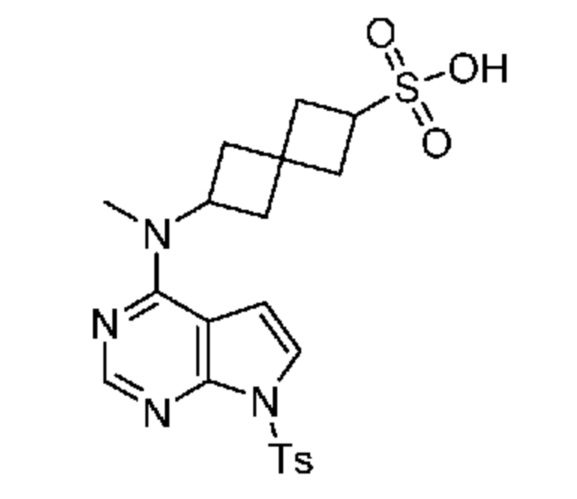
Промежуточный продукт 5: 6-[метил-[7-(п-толилсульфонил)пирроло[2,3-d]пиримидин-4-ил]амино]спиро[3.3]гептан-2-сульфоновая кислота. В трехгорлую колбу объемом 1 л, снабженную термометром, капельной воронкой и патрубком для подачи азота, добавляли S-[6-[метил-[7-(п-толилсульфонил)пирроло[2,3-d]пиримидин-4-ил]амино]спиро[3.3]гептан-2-ил]этантиоат (~9,8 г, ~20 ммоля) и муравьиную кислоту (80 мл). Затем добавляли H2O2 (30% в воде, ~25 мл) в течение 1,5 ч. Его охлаждали на бане из воды со льдом так, как необходимо для поддержания температуры ниже 35°C. После добавления реакционную смесь охлаждали до комнатной температуры и перемешивали при комнатной температуре в течение 30 мин. После охлаждения до 0-5°C реакцию останавливали с помощью NaHSO3 и Na2S2O5 (33% в воде, ~100 мл), добавляемых порциями, поддерживая температуру ниже 35°C. Водный раствор NaOH (33%) добавляли при 0-5°C до установления pH=4-5 (поддерживали внутреннюю температуру <35°C). Полученное белое твердое вещество отфильтровывали и сушили насосом в течение ночи. Получали желтовато-коричневое твердое вещество (~16,6 г, содержит соли, 60% чистота). 1H NMR (400 MHz, метанол-d4) δ част./млн 2,21-2,39 (m, 4 H) 2,40 (s, 3 H) 2,42-2,50 (m, 3 H) 2,51-2,57 (m, 1 H) 3,22-3,24 (s, 3 H) 3,51 (квинтет, J=8,36 Hz, 1 H) 4,92-5,01 (m, 1 H) 6,85 (d, J=4,15 Hz, 1 H) 7,37 (d, J=8,54 Hz, 2 H) 7,56 (d, J=4,15 Hz, 1 H) 7,95-8,00 (m, 2 H) 8,20 (s, 1 H) 8,42 (s, 2 H, HCO2Na); LCMS (M/Z): 477 (M+H).
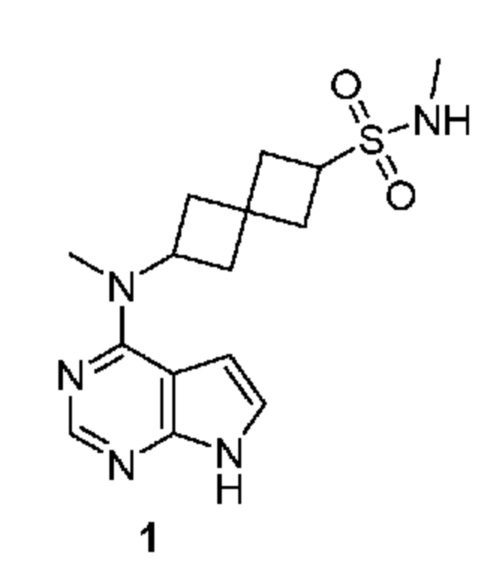
N-Метил-6-[метил(7H-пирроло[2,3-d]пиримидин-4-ил)амино]спиро[3.3]гептан-2-сульфонамид.
Соединение 1. Промежуточный продукт 5,6-[метил-[7-(п-толилсульфонил)пирроло[2,3-d]пиримидин-4-ил]амино]спиро[3.3]гептан-2-сульфоновая кислота (~476 мг, неочищенная, содержит соли, ~0,66 ммоля) суспендировали в DCM (4 мл). Затем добавляли SOCl2 (4 мл), затем 4 капли DMF. Затем реакционную смесь кипятили с обратным холодильником в течение 4 ч (температура нагревательного блока равнялась 55-60°C. Затем реакционную смесь охлаждали до комнатной температуры. К раствору добавляли сухой толуол. Растворитель удаляли в вакууме. Остаток переносили в THF (2 мл) и добавляли избыток CH3NH2 (2M в THF, 4 мл). Реакционную смесь перемешивали в течение ночи. Затем реакционную смесь обрабатывали водой (~10 мл) и экстрагировали с помощью EtOAc (3×20 мл). После удаления растворителя остаток дополнительно очищали на колонке C18 ISCO (50 г) и элюировали с помощью MeOH и воды. После удаления растворителя получали белое твердое вещество (~274 мг, ~85%).
К раствору сульфонамида (274 мг, ~0,54 ммоля) в изопропаноле (4 мл) и воде (3 мл) добавляли LiOH.H2O (419 мг, 10 ммоля). Смесь перемешивали при 50-55°C в течение 4 ч и при комнатной температуре в течение ночи. После удаления растворителя остаток растворяли в воде (~2 мл) и MeOH (~1 мл). Его очищали на колонке C18 ISCO (50 г) и элюировали с помощью MeOH и воды. После концентрирования получали белое твердое вещество (128 мг, 71%). 1H NMR (400 MHz, метанол-d4) δ част./млн 2,27-2,42 (m, 4 H) 2,42-2,61 (m, 4 H) 2,68 (s, 3 H) 3,27 (s, 3 H) 3,86 (квинтет, J=8,25 Hz, 1 H) 5,05 (квинтет, J=8,54 Hz, 1 H) 6,61 (d, J=3,51 Hz, 1 H) 7,07 (d, J=3,51 Hz, 1 H) 8,07 (s, 1 H); LCMS (M/Z): 336 (M+H).
По аналогичным методикам также получали следующие соединения.
Пример 2:
Соединение 2: N-этил-6-[метил(7H-пирроло[2,3-d]пиримидин-4-ил)амино]спиро[3.3]гептан-2-сульфонамид
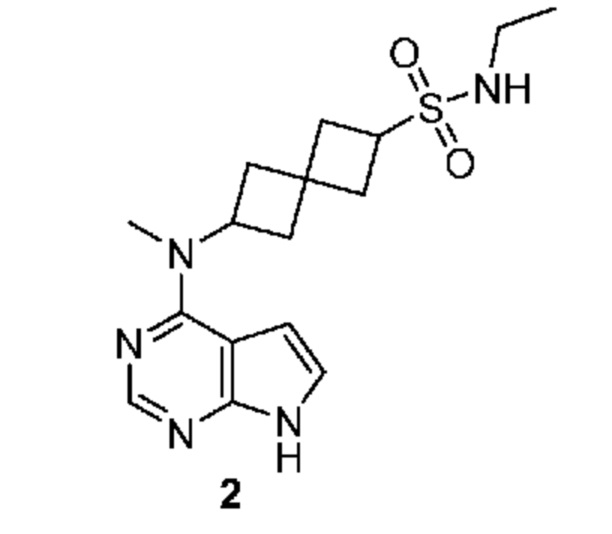
N-этил-6-[метил(7H-пирроло[2,3-d]пиримидин-4-ил)амино]спиро[3.3]гептан-2-сульфонамид 2: 1H NMR (400 MHz, метанол-d4) δ част./млн 1,15 (t, J=7,22 Hz, 3 H) 2,26-2,60 (m, 9 H) 3,07 (q, J=7,22 Hz, 2 H) 3,82 (квинтет, J=8,30 Hz, 1 H) 4,99-5,13 (m, 1 H) 6,61 (d, J=3,51 Hz, 1 H) 7,08 (d, J=3,71 Hz, 1 H) 8,07 (s, 1 H); LCMS (M/Z): 350 (M+H).
Пример 3:
Соединение 3: 6-[метил(7H-пирроло[2,3-d]пиримидин-4-ил)амино]-N-пропилспиро[3.3]гептан-2-сульфонамид
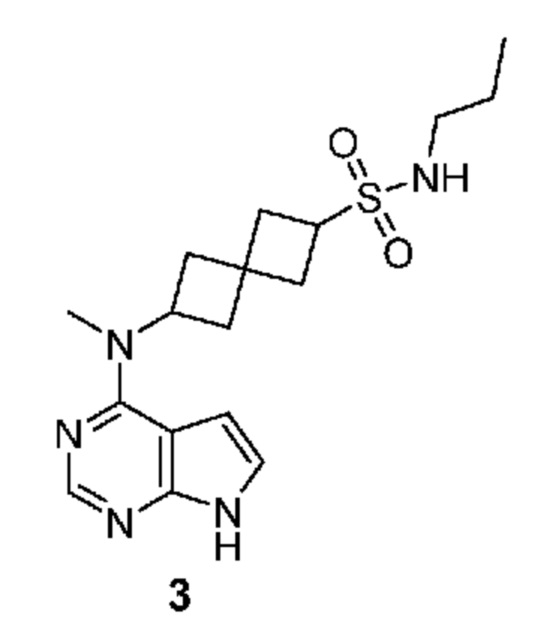
6-[метил(7H-пирроло[2,3-d]пиримидин-4-ил)амино]-N-пропилспиро[3.3]гептан-2-сульфонамид 3: 1H NMR (400 MHz, метанол-d4) δ част./млн 0,93 (t, J=7,32 Hz, 3 H) 1,53 (sxt, J=7,26 Hz, 2 H) 2,26-2,57 (m, 8 H) 2,98 (t, J=7,13 Hz, 2 H) 3,75-3,89 (m, 1 H) 4,96-5,12 (m, 1 H) 6,61 (d, J=3,71 Hz, 1 H) 7,08 (d, J=3,71 Hz, 1 H) 8,07 (s, 1 H); LCMS (M/Z): 364 (M+H).
Пример 4:
Соединение 4: N-изопропил-6-[метил(7H-пирроло[2,3-d]пиримидин-4-ил)амино]спиро[3.3]гептан-2-сульфонамид
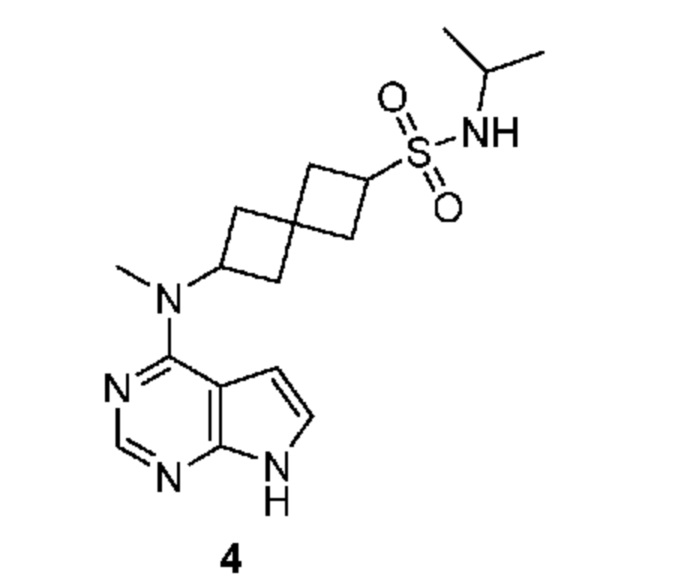
N-изопропил-6-[метил(7H-пирроло[2,3-d]пиримидин-4-ил)амино]спиро[3.3]гептан-2-сульфонамид 4: 1H NMR (400 MHz, метанол-d4) δчаст./млн 1,17 (d, J=6,64 Hz, 6 H) 2,23-2,60 (m, 8 H) 3,51 (dt, J=13,18, 6,49 Hz, 1 H) 3,72-3,87 (m, 1 H) 5,00-5,13 (m, 1 H) 6,61 (d, J=3,71 Hz, 1 H) 7,08 (d, J=3,51 Hz, 1 H) 8,07 (s, 1 H); LCMS (M/Z): 364 (M+H).
Пример 5:
Соединение 5: N-циклопропил-6-[метил(7H-пирроло[2,3-d]пиримидин-4-ил)амино]спиро[3.3]гептан-2-сульфонамид
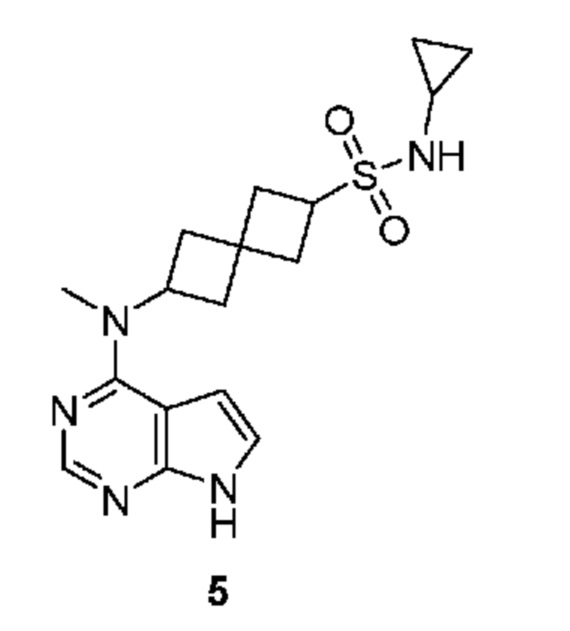
N-циклопропил-6-[метил(7H-пирроло[2,3-d]пиримидин-4-ил)амино]спиро[3.3]гептан-2-сульфонамид 5: 1H NMR (400 MHz, метанол-d4) δ част./млн 0,52-0,72 (m, 4 H) 2,25-2,65 (m, 10 H) 3,93 (квинтет, J=8,30 Hz, 1 H) 4,98-5,13 (m, 1 H) 6,62 (d, J=3,71 Hz, 1 H) 7,08 (d, J=3,51 Hz, 1 H) 8,07 (s, 1 H); LCMS (M/Z): 362 (M+H).
Пример 6:
Соединение 6: 6-[метил(7H-пирроло[2,3-d]пиримидин-4-ил)амино]-N-(2,2,2-трифторэтил)спиро[3.3]гептан-2-сульфонамид
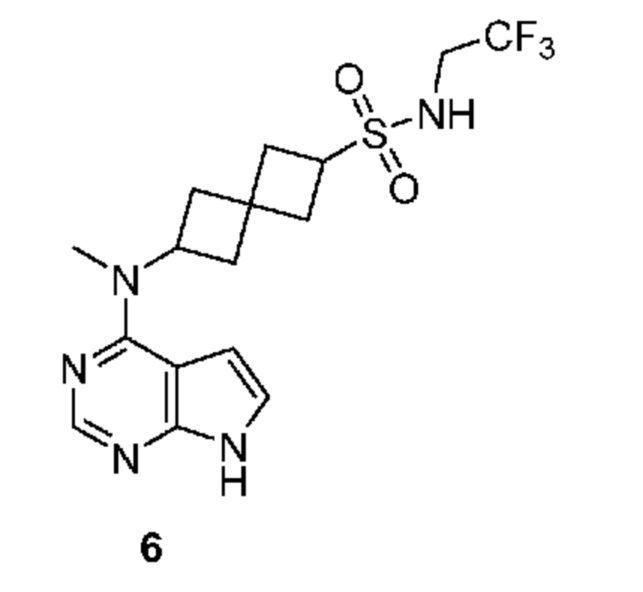
6-[метил(7H-пирроло[2,3-d]пиримидин-4-ил)амино]-N-(2,2,2-трифторэтил)спиро[3.3]гептан-2-сульфонамид 6: 1H NMR (400 MHz, метанол-d4) δ част./млн 2,24-2,61 (m, 8 H) 3,72 (q, J=9,18 Hz, 2 H) 3,84 (квинтет, J=8,25 Hz, 1 H) 4,98-5,13 (m, 1 H) 6,61 (d, J=3,71 Hz, 1 H) 7,08 (d, J=3,71 Hz, 1 H) 8,07 (s, 1 H); LCMS (M/Z): 404 (M+H).
Пример 7:
Соединение 7: N-изобутил-6-[метил(7H-пирроло[2,3-d]пиримидин-4-ил)амино]спиро[3.3]гептан-2-сульфонамид
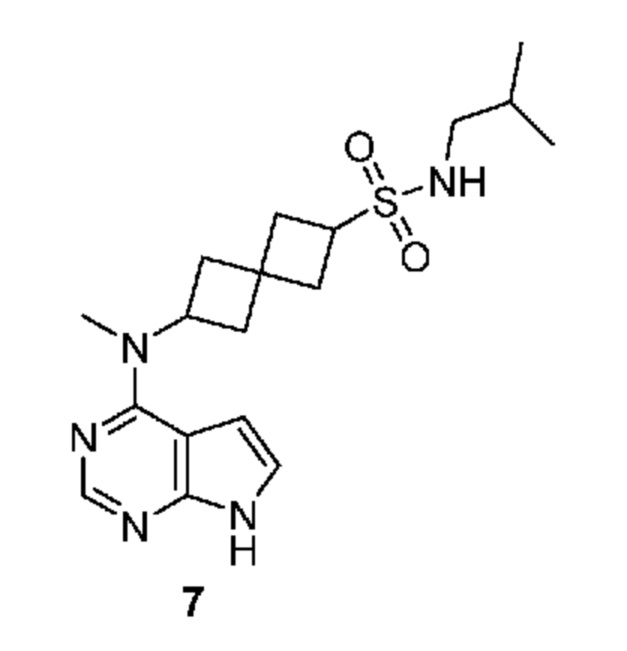
N-изобутил-6-[метил(7H-пирроло[2,3-d]пиримидин-4-ил)амино]спиро[3.3]гептан-2-сульфонамид 7: 1H NMR (400 MHz, метанол-d4) δ част./млн 0,92 (d, J=6,83 Hz, 6 H) 1,71 (dt, J=13,47, 6,74 Hz, 1 H) 2,28-2,57 (m, 8 H) 2,83 (d, J=6,83 Hz, 2 H) 3,81 (t, J=8,30 Hz, 1 H) 4,98-5,15 (m, 1 H) 6,61 (d, J=3,51 Hz, 1 H) 7,08 (d, J=3,71 Hz, 1 H) 8,07 (s, 1 H); LCMS (M/Z): 378 (M+H).
Пример 8:
Соединение 8: N-трет-бутил-6-[метил(7H-пирроло[2,3-d]пиримидин-4-ил)амино]спиро[3.3]гептан-2-сульфонамид
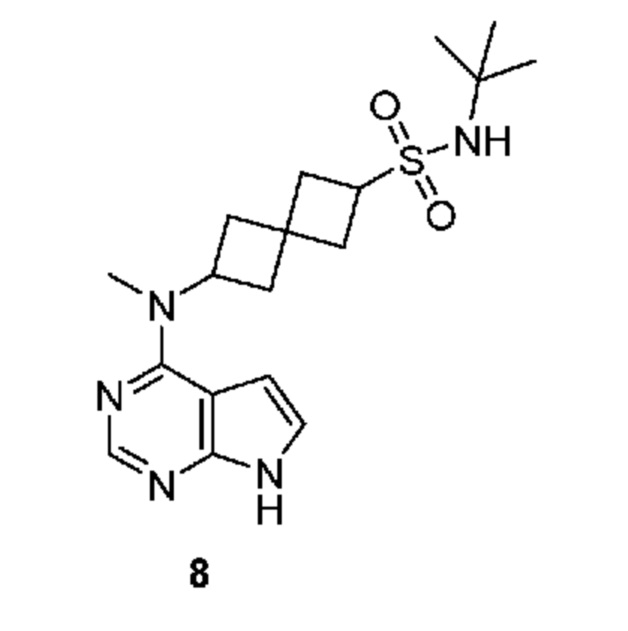
N-трет-бутил-6-[метил(7H-пирроло[2,3-d]пиримидин-4-ил)амино]спиро[3.3]гептан-2-сульфонамид 8: 1H NMR (400 MHz, метанол-d4) δ част./млн 1,34 (s, 9 H) 2,31-2,43 (m, 4 H) 2,47-2,61 (m, 4 H) 3,80 (квинтет, J=8,29 Hz, 1 H) 5,04-5,13 (m, 1 H) 6,65 (d, J=3,66 Hz, 1 H) 7,11 (d, J=3,66 Hz, 1 H) 8,11 (s, 1 H); LCMS (M/Z): 378 (M+H).
Пример 9:
Соединение 9: N-циклобутил-6-[метил(7H-пирроло[2,3-d]пиримидин-4-ил)амино]спиро[3.3]гептан-2-сульфонамид
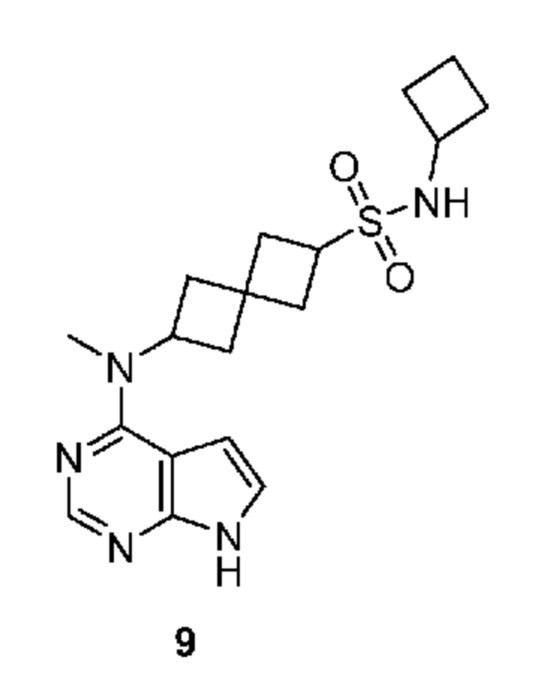
N-циклобутил-6-[метил(7H-пирроло[2,3-d]пиримидин-4-ил)амино]спиро[3.3]гептан-2-сульфонамид 9: 1H NMR (400 MHz, метанол-d4) δ част./млн 1,53-1,72 (m, 2 H) 1,99 (ddd, J=10,92, 9,21, 1,83 Hz, 2 H) 2,28-2,47 (m, 8 H) 2,48-2,56 (m, 3 H) 2,86 (s, 1 H) 3,30-3,31 (m, 3 H) 3,73 (t, J=8,29 Hz, 1 H) 3,84 (dd, J=8,78, 7,81 Hz, 1 H) 4,91-5,12 (m, 1 H) 6,65 (d, J=3,66 Hz, 1 H) 7,11 (d, J=3,66 Hz, 1 H) 8,11 (s, 1 H); LCMS (M/Z): 376 (M+H).
Пример 10:
Соединение 10: N-циклопентил-6-[метил(7H-пирроло[2,3-d]пиримидин-4-ил)амино]спиро[3.3]гептан-2-сульфонамид
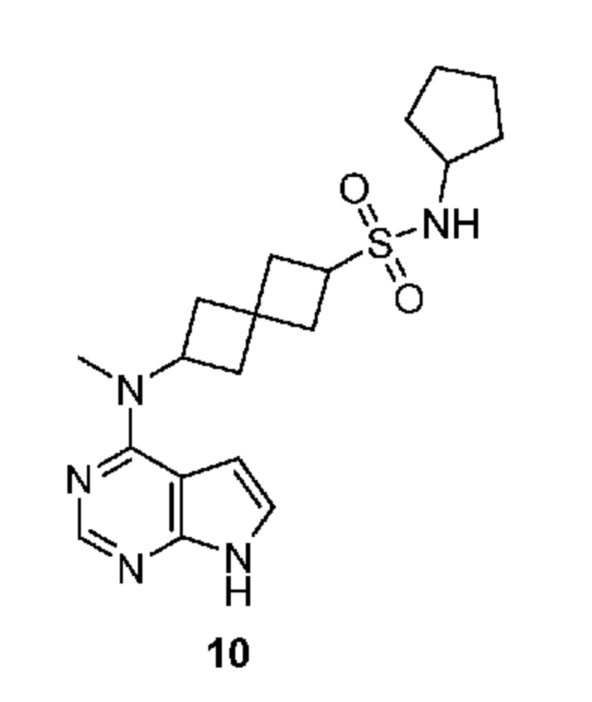
N-циклопентил-6-[метил(7H-пирроло[2,3-d]пиримидин-4-ил)амино]спиро[3.3]гептан-2-сульфонамид 10: 1H NMR (400 MHz, метанол-d4) δ част./млн 1,46-1,64 (m, 5 H) 1,68-1,77 (m, 2 H) 1,90-2,00 (m, 2 H) 2,33-2,44 (m, 4 H) 2,47-2,61 (m, 4 H) 3,66-3,73 (m, 1 H) 3,84 (квинтет, J=8,29 Hz, 1 H) 5,04-5,13 (m, 1 H) 6,65 (d, J=3,66 Hz, 1 H) 7,11 (d, J=3,66 Hz, 1 H) 8,11 (s, 1 H); LCMS (M/Z): 390 (M+H).
Пример 11:
Соединение 11: N-[2-[метил(7H-пирроло[2,3-d]пиримидин-4-ил)амино]спиро[3.3]гептан-6-ил]бензолсульфонамид
Схема 2 (пример 11, как иллюстративный):
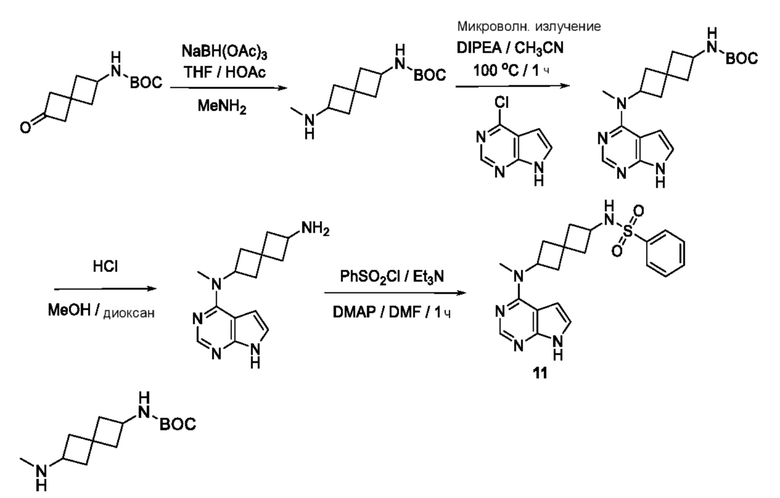
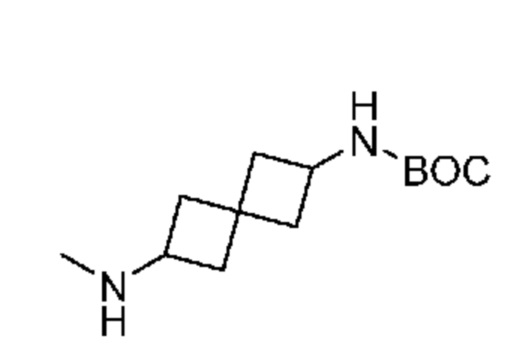
Промежуточный продукт 1: трет-бутил-N-[6-(метиламино)спиро[3.3]гептан-2-ил]карбамат. К раствору трет-бутил-N-(2-оксоспиро[3.3]гептан-6-ил)карбамата (2,08 г, 9,2 ммоля) в THF (50 мл) добавляли MeNH2 (13 мл, 26 ммоля). Смесь перемешивали примерно при -20°C в течение 3 ч и затем при комнатной температуре в течение выходных дней. После охлаждения примерно до -20°C и перемешивания в течение 2 ч добавляли NaBH(OAc)3 (6,32 г, 30 ммоля). Смесь перемешивали в течение 1 ч и обрабатывали с помощью 10% NaHCO3 (30 мл). Затем ее обрабатывали с помощью 10% NaOH до pH= ~11. Ее экстрагировали с помощью DCM (3×40 мл). Объединенный органический раствор сушили над Na2SO4. После фильтрования и концентрирования получали продукт в виде бесцветного масла (~2,40 г, 100%). LCMS (M/Z): 241 (M+H). Вещество использовали сразу на следующей стадии без очистки.
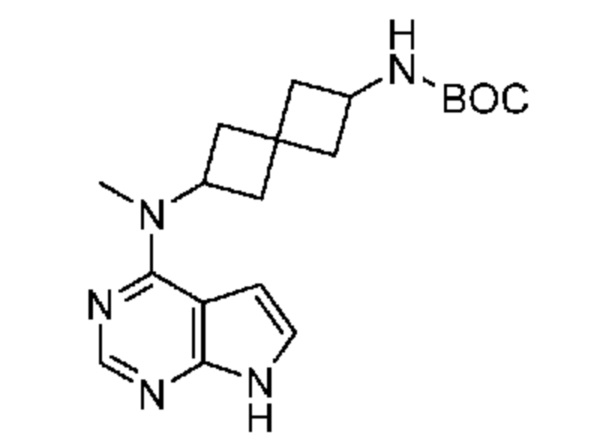
Промежуточный продукт 2: трет-бутил-N-[2-[метил(7H-пирроло[2,3-d]пиримидин-4-ил)амино]спиро[3.3]гептан-6-ил]карбамат. В сосуд для микроволновой печи добавляли трет-бутил-N-[6-(метиламино)спиро[3.3]гептан-2-ил]карбамат (0,96 г, 4,0 ммоля, неочищенный), 4-хлор-7H-пирроло[2,3-d]пиримидин (0,61 г, 4,0 ммоля), DIPEA (1,03 мл, 8,0 ммоля) и CH3CN (6 мл). Смесь нагревали при 100°C в течение 1 ч в микроволновой печи (75 Вт и 250 фунт-сила/дюйм2). Реакционную смесь охлаждали до комнатной температуры и выдерживали. Твердое вещество (продукт) отфильтровывали и промывали с помощью CH3CN. Фильтрат концентрировали и сушили в вакууме. Объединенные твердые вещества представляли собой почти белое твердое вещество (~ 0,66 г, 46%). 1H NMR (400 MHz, метанол-d4) δ част./млн 1,41 (s, 9 H) 1,89-2,08 (m, 2 H) 2,20-2,37 (m, 4 H) 2,38-2,57 (m, 2 H) 3,27 (s, 3 H) 3,94 (br. s., 1 H) 4,97-5,15 (m, 1 H) 6,60 (d, J=3,71 Hz, 1 H) 7,07 (d, J=3,71 Hz, 1 H) 8,07 (s, 1 H); LCMS (M/Z): 358 (M+H).
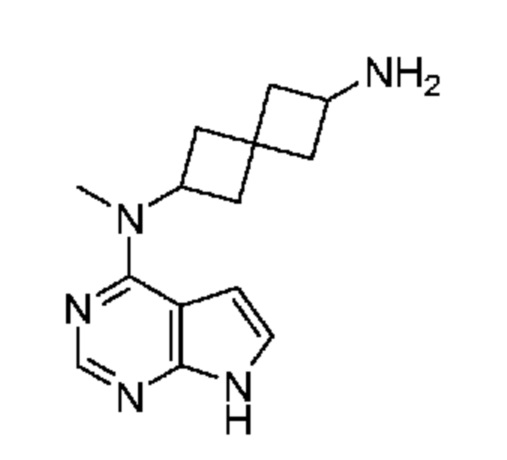
Промежуточный продукт 3: N2-метил-N2-(7H-пирроло[2,3-d]пиримидин-4-ил)спиро[3.3]гептан-2,6-диамин. В сосуд объемом 40 мл, содержащий трет-бутил-N-[2-[метил(7H-пирроло[2,3-d]пиримидин-4-ил)амино]спиро[3.3]гептан-6-ил]карбамат (~18 мг, 0,05 ммоля) добавляли MeOH (0,5 мл), затем 4M HCl в диоксане (1 мл). Смесь перемешивали при КТ в течение 1 ч. После концентрирования получали продукт в виде белого твердого вещества (~13 мг, ~89%). LCMS (M/Z): 258 (M+H). Смесь использовали сразу без очистки.
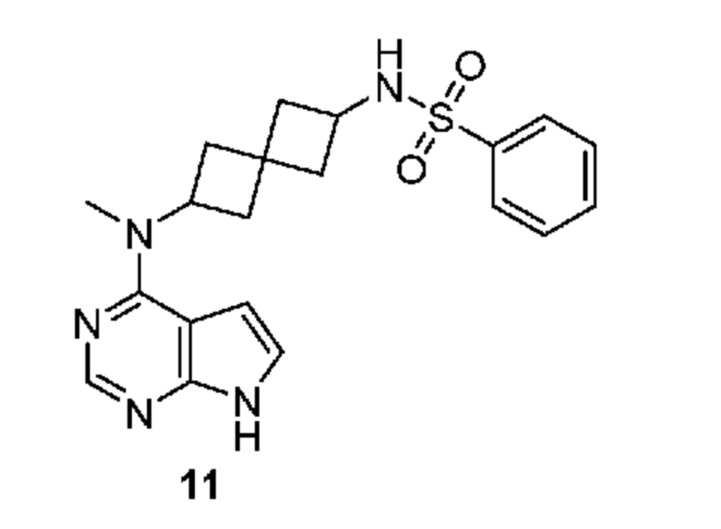
N-[2-[метил(7H-пирроло[2,3-d]пиримидин-4-ил)амино]спиро[3.3]гептан-6-ил]бензолсульфонамид 11. В сосуд объемом 40 мл, содержащий N2-метил-N2-(7H-пирроло[2,3-d]пиримидин-4-ил)спиро[3.3]гептан-2,6-диамин (~13 мг, 0,051 ммоля) добавляли DMF (1,5 мл), DMAP (~6,1 мг, 0,050 ммоля), DIPEA (~87 мкл, 0,50 ммоля) и PhSO2Cl (~13 мг в 0,13 мл DMF, 0,075 ммоля). Смесь перемешивали при комнатной температуре в течение 30 мин с мониторингом посредством LCMS. Еще через 30 мин смесь обрабатывали водой (0,2 мл), DIPEA удаляли в вакууме и оставшийся раствор в DMF хроматографировали на колонке C18 ISCO (50 г), при элюировании с помощью MeOH и воды. После концентрирования и лиофилизации получали продукт в виде белого твердого вещества (~11 мг, 52%). 1H NMR (400 MHz, метанол-d4) δ част./млн 1,75-1,95 (m, 2 H) 2,01-2,41 (m, 6 H) 3,22 (s, 3 H) 3,66 (t, J=8,00 Hz, 1 H) 4,91-5,04 (m, 1 H) 6,56 (d, J=3,51 Hz, 1 H) 7,05 (d, J=3,51 Hz, 1 H) 7,50-7,68 (m, 3 H) 7,80-7,88 (m, 2 H) 8,04 (s, 1 H); LCMS (M/Z): 398 (M+H).
По аналогичным методикам получали следующие соединения.
Пример 12:
Соединение 12: 2-хлор-N-[2-[метил(7H-пирроло[2,3-d]пиримидин-4-ил)амино]спиро[3.3]гептан-6-ил]бензолсульфонамид
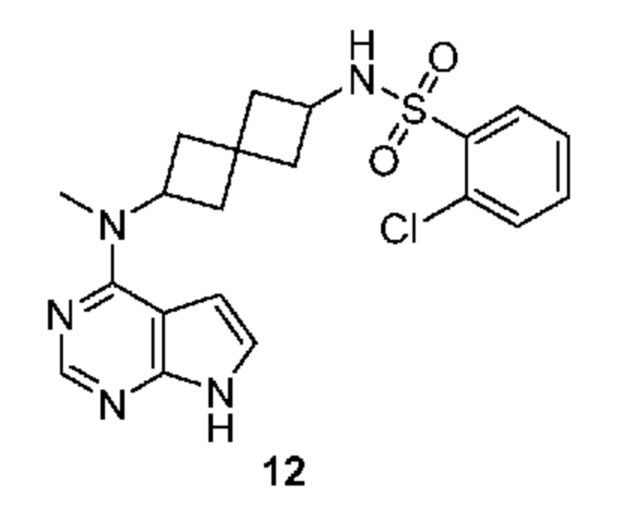
2-хлор-N-[2-[метил(7H-пирроло[2,3-d]пиримидин-4-ил)амино]спиро[3.3]гептан-6-ил]бензолсульфонамид 12: 1H NMR (400 MHz, метанол-d4) δ част./млн 1,94-2,09 (m, 3 H) 2,12-2,37 (m, 5 H) 3,21 (s, 3 H) 3,65 (квинтет, J=8,20 Hz, 1 H) 4,90-5,03 (m, 1
H) 6,56 (d, J=3,51 Hz, 1 H) 7,05 (d, J=3,51 Hz, 1 H) 7,42-7,53 (m, 1 H) 7,58 (d, J=3,71 Hz, 2 H) 8,00-8,09 (m, 2 H); LCMS (M/Z): 432 (M+H).
Пример 13:
Соединение 13: 4-хлор-N-[2-[метил(7H-пирроло[2,3-d]пиримидин-4-ил)амино]спиро[3.3]гептан-6-ил]бензолсульфонамид
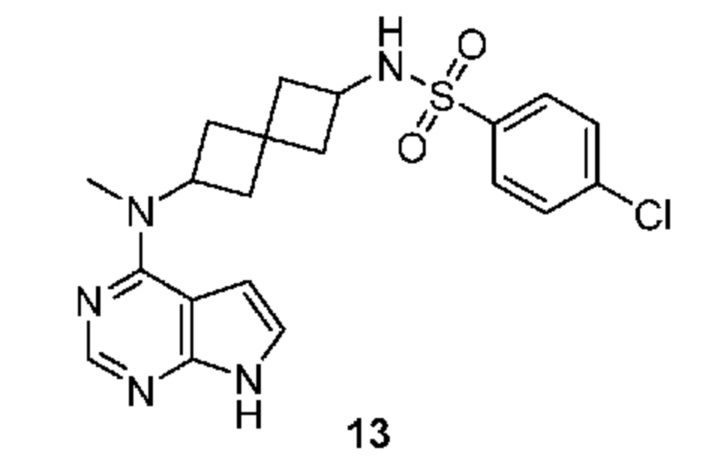
4-хлор-N-[2-[метил(7H-пирроло[2,3-d]пиримидин-4-ил)амино]спиро[3.3]гептан-6-ил]бензолсульфонамид 13: 1H NMR (400 MHz, метанол-d4) δчаст./млн 1,73-1,96 (m, 2 H) 2,04-2,28 (m, 4 H) 2,28-2,42 (m, 2 H) 3,22 (s, 3 H) 3,67 (квинтет, J=8,15 Hz, 1 H) 4,91-5,06 (m, 1 H) 6,56 (d, J=3,71 Hz, 1 H) 7,06 (d, J=3,51 Hz, 1 H) 7,57 (d, J=8,59 Hz, 2 H) 7,81 (d, J=8,59 Hz, 2 H) 8,04 (s, 1 H); LCMS (M/Z): 432 (M+H).
Пример 14:
Соединение 14: N-[2-[метил(7H-пирроло[2,3-d]пиримидин-4-ил)амино]спиро[3.3]гептан-6-ил]-4-(трифторметил)бензолсульфонамид
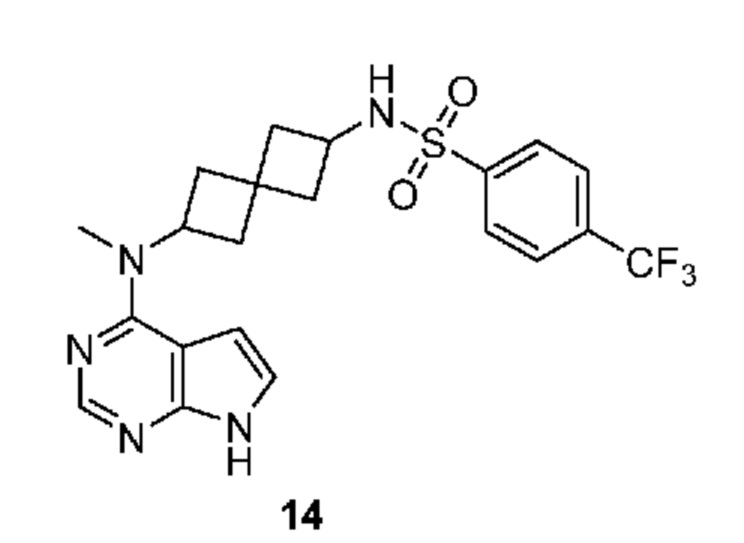
N-[2-[метил(7H-пирроло[2,3-d]пиримидин-4-ил)амино]спиро[3.3]гептан-6-ил]-4-(трифторметил)бензолсульфонамид 14: 1H NMR (400 MHz, метанол-d4) δ част./млн 1,79-1,97 (m, 2 H) 2,07-2,29 (m, 4 H) 2,29-2,42 (m, 2 H) 3,22 (s, 3 H) 3,72 (квинтет, J=8,15 Hz, 1H) 4,92-5,04 (m, 1 H) 6,57 (d, J=3,71 Hz, 1 H) 7,05 (d, J=3,51 Hz, 1 H) 7,88 (d, J=8,20 Hz, 2 H) 7,99-8,07 (m, 3 H); LCMS (M/Z): 466 (M+H).
Пример 15:
Соединение 15: N-[2-[метил(7H-пирроло[2,3-d]пиримидин-4-ил)амино]спиро[3.3]гептан-6-ил]метансульфонамид
Схема 3 (пример 15, как иллюстративный):
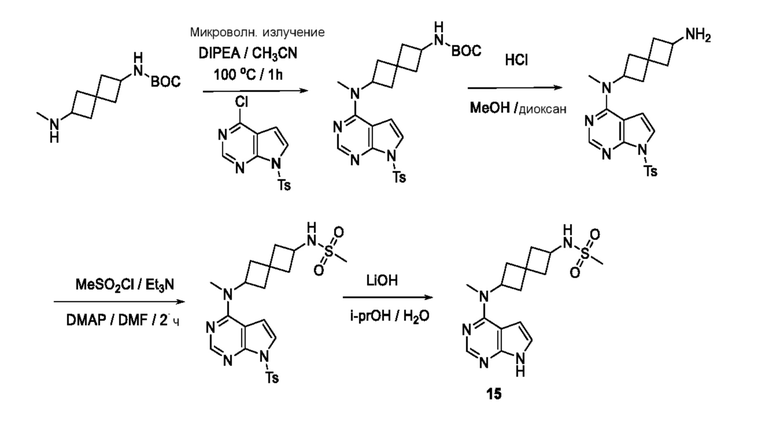
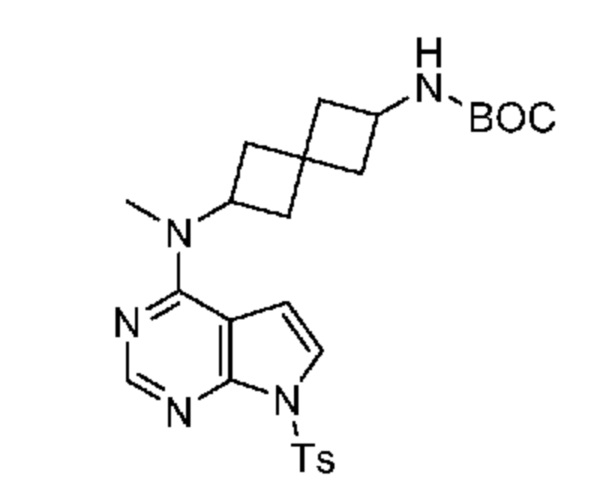
Промежуточный продукт 1: трет-бутил-N-[2-[метил-[7-(п-толилсульфонил)пирроло[2,3-d]пиримидин-4-ил]амино]спиро[3.3]гептан-6-ил]карбамат. В сосуд для микроволновой печи добавляли трет-бутил-N-[6-(метиламино)спиро[3.3]гептан-2-ил]карбамат (0,48 г, 2,0 ммоля, неочищенный), 4-хлор-7-(п-толилсульфонил)пирроло[2,3-d]пиримидин (0,61 г, 2,0 ммоля), DIPEA (0,5 мл) и CH3CN (5 мл). Смесь нагревали при 100°C в течение 1 ч в микроволновой печи (75 Вт и 250 фунт-сила/дюйм2). Затем ее охлаждали до комнатной температуры. После удаления растворителя ее очищали на колонке ISCO с диоксидом кремния и элюировали с помощью DCM и MeOH. После концентрирования получали почти белое твердое вещество (~0,64 г, 62,7%). LCMS (M/Z): 512 (M+H).
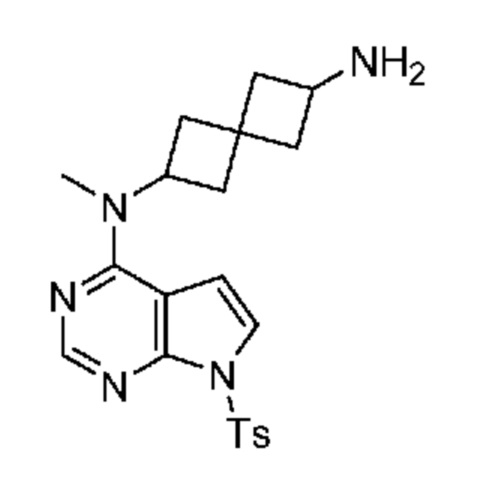
Промежуточный продукт 2: N2-метил-N2-[7-(п-толилсульфонил)пирроло[2,3-d]пиримидин-4-ил]спиро[3.3]гептан-2,6-диамин. В сосуд объемом 40 мл, содержащий трет-бутил-N-[2-[метил-[7-(п-толилсульфонил)пирроло[2,3-d]пиримидин-4-ил]амино]спиро[3.3]гептан-6-ил]карбамат (~1,24 г, 2,2 ммоля), добавляли MeOH (1 мл), затем 4M HCl в диоксане (4 мл). Смесь перемешивали при комнатной температуре в течение 1 ч. После концентрирования получали продукт в виде светло-желтого твердого вещества (1,12 г, ~100%). LCMS (M/Z): 412 (M+H). Смесь сразу использовали без очистки.
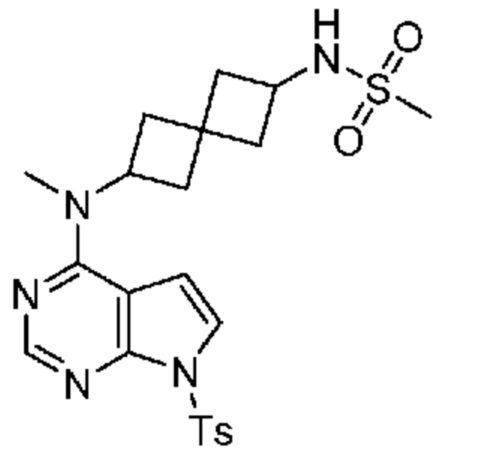
Промежуточный продукт 3: N-[2-[метил-[7-(п-толилсульфонил)пирроло[2,3-d]пиримидин-4-ил]амино]спиро[3.3]гептан-6-ил]метансульфонамид. В сосуд объемом 40 мл, содержащий N2-метил-N2-[7-(п-толилсульфонил)пирроло[2,3-d]пиримидин-4-ил]спиро[3.3]гептан-2,6-диамин (~20 мг, 0,05 ммоля) добавляли DCM (1,5 мл), DMAP (~6,1 мг, 0,05 ммоля), DIPEA (~87 мкл, 0,05 ммоля) и MeSO2Cl (2 капли). Смесь перемешивали при комнатной температуре в течение 2 ч. После удаления растворителя неочищенное вещество (~20 мг, ~100%) сразу использовали на следующей стадии. LCMS (M/Z): 490 (M+H).
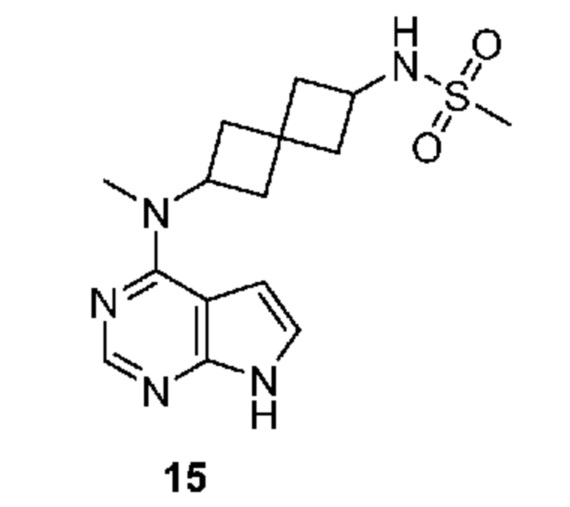
N-[2-[метил(7H-пирроло[2,3-d]пиримидин-4-ил)амино]спиро[3.3]гептан-6-ил]метансульфонамид 15. К раствору сульфонамида (~20 мг, ~0,05 ммоля) в изопропаноле (1 мл) и воде (1 мл) добавляли LiOH.H2O (42 мг, 1 ммоля). Смесь перемешивали при 50-55°C в течение 2 ч и при комнатной температуре в течение ночи. После удаления растворителя ее очищали на колонке C18 ISCO (50 г) и элюировали с помощью MeOH и воды. После концентрирования получали белое твердое вещество (1,5 мг, 9,0%). 1H NMR (400 MHz, метанол-d4) δчаст./млн 1,20 (d, J=6,83 Hz, 1 H) 2,00-2,15 (m, 2 H) 2,20-2,52 (m, 5 H) 2,55-2,67 (m, 1 H) 2,87 (s, 3 H) 3,75-3,86 (m, 1 H) 4,99-5,15 (m, 1 H) 6,61 (d, J=3,71 Hz, 1 H) 7,08 (d, J=3,71 Hz, 1 H) 8,07 (s, 1 H); LCMS (M/Z): 336 (M+H).
По аналогичным методикам получали следующие соединения.
Пример 16:
Соединение 16: N-[2-[метил(7H-пирроло[2,3-d]пиримидин-4-ил)амино]спиро[3.3]гептан-6-ил]этансульфонамид
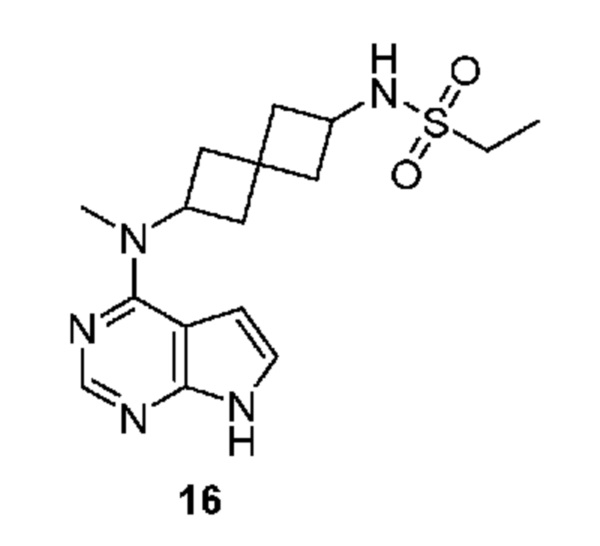
N-[2-[метил(7H-пирроло[2,3-d]пиримидин-4-ил)амино]спиро[3.3]гептан-6-ил]этансульфонамид 16. 1H NMR (400 MHz, метанол-d4) δчаст./млн 1,29 (t, J=7,42 Hz, 3 H) 2,01-2,15 (m, 2 H) 2,23-2,48 (m, 5 H) 2,53-2,66 (m, 1 H) 2,97 (q, J=7,42 Hz, 2 H) 3,22-3,28 (m, 3 H) 3,73-3,82 (m, 1 H) 5,02-5,11 (m, 1 H) 6,61 (d, J=3,51 Hz, 1 H) 7,08 (d, J=3,51 Hz, 1 H) 8,07 (s, 1 H); LCMS (M/Z): 350 (M+H).
Пример 17:
Соединение 17: N-[2-[метил(7H-пирроло[2,3-d]пиримидин-4-ил)амино]спиро[3.3]гептан-6-ил]пропан-1-сульфонамид
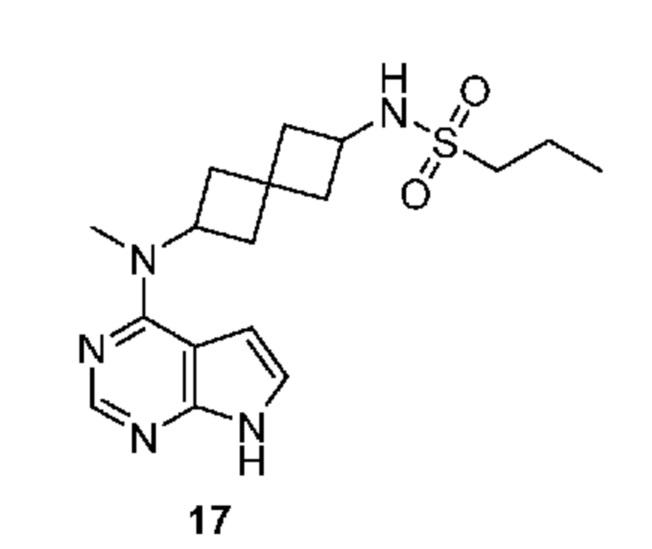
N-[2-[метил(7H-пирроло[2,3-d]пиримидин-4-ил)амино]спиро[3.3]гептан-6-ил]пропан-1-сульфонамид 17. 1H NMR (400 MHz, метанол-d4) δчаст./млн 1,04 (t, J=7,42 Hz, 3 H) 1,72-1,82 (m, 2 H) 2,01-2,15 (m, 2 H) 2,23-2,48 (m, 5 H) 2,56-2,63 (m, 1 H) 2,91-2,97 (m, 2 H) 3,22-3,27 (m, 3 H) 3,73-3,82 (m, 1 H) 5,02-5,12 (m, 1 H) 6,61 (d, J=3,71 Hz, 1 H) 7,08 (d, J=3,71 Hz, 1 H) 8,07 (s, 1 H); LCMS (M/Z): 364 (M+H).
Пример 18:
Соединение 18: N-[2-[метил(7H-пирроло[2,3-d]пиримидин-4-ил)амино]спиро[3.3]гептан-6-ил]пропан-2-сульфонамид
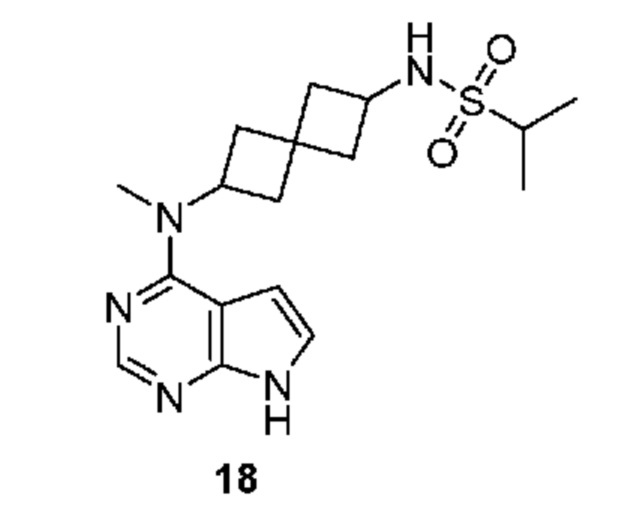
N-[2-[метил(7H-пирроло[2,3-d]пиримидин-4-ил)амино]спиро[3.3]гептан-6-ил]пропан-2-сульфонамид 18. 1H NMR (400 MHz, метанол-d4) δчаст./млн 1,22-1,36 (m, 6 H) 2,08-2,20 (m, 2 H) 2,26-2,49 (m, 5 H) 2,54-2,72 (m, 1 H) 3,04 (s, 1 H) 3,12 (квинтет, J=6,83 Hz, 1 H) 3,34-3,47 (m, 1 H) 3,71-3,87 (m, 1 H) 5,10 (ddd, J=9,45, 7,75, 1,83 Hz, 1 H) 6,64 (d, J=3,69 Hz, 1 H) 7,11 (d, J=3,42 Hz, 1 H) 8,10 (s, 1 H); LCMS (M/Z): 364 (M+H).
Пример 19:
Соединение 19: 2-метил-N-[2-[метил(7H-пирроло[2,3-d]пиримидин-4-ил)амино]спиро[3.3]гептан-6-ил]пропан-1-сульфонамид
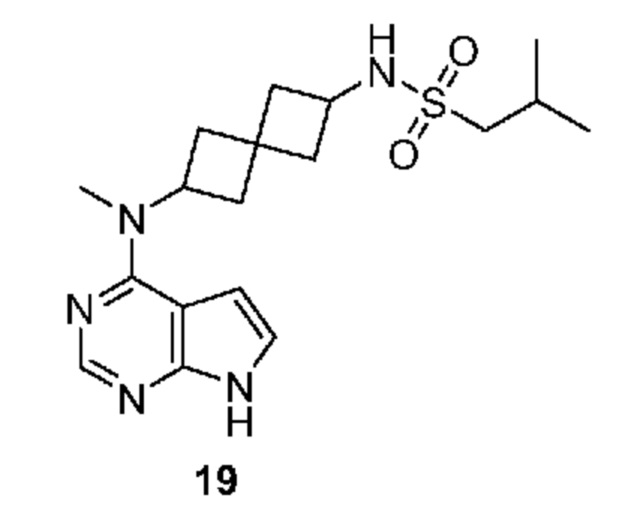
2-метил-N-[2-[метил(7H-пирроло[2,3-d]пиримидин-4-ил)амино]спиро[3.3]гептан-6-ил]пропан-1-сульфонамид 19. 1H NMR (400 MHz, метанол-d4) δ част./млн 1,11 (dd, J=6,83, 0,73 Hz, 6 H) 2,06-2,24 (m, 3 H) 2,26-2,42 (m, 4 H) 2,45-2,51 (m, 1 H) 2,63 (ddd, J=10,98, 7,07, 5,61 Hz, 1 H) 2,89 (d, J=6,34 Hz, 2 H) 3,30-3,31 (m, 3 H) 3,77-3,85 (m, 1 H) 5,06-5,14 (m, 1 H) 6,64 (d, J=3,66 Hz, 1 H) 7,11 (d, J=3,42 Hz, 1 H) 8,10 (s, 1 H); LCMS (M/Z): 378 (M+H).
Пример 20:
Соединение 20: N-[2-[метил(7H-пирроло[2,3-d]пиримидин-4-ил)амино]спиро[3.3]гептан-6-ил]циклопентансульфонамид

N-[2-[метил(7H-пирроло[2,3-d]пиримидин-4-ил)амино]спиро[3.3]гептан-6-ил]циклопентансульфонамид 20. 1H NMR (400 MHz, метанол-d4) δ част./млн 1,59-1,73 (m, 2 H) 1,73-1,84 (m, 2 H) 1,88-2,05 (m, 4 H) 2,05-2,21 (m, 3 H) 2,27-2,42 (m, 4 H) 2,44-2,50 (m, 1 H) 2,55-2,71 (m, 2 H) 3,27-3,31 (m, 3 H) 3,34-3,40 (m, 1 H) 3,40-3,51 (m, 1 H) 3,79-3,87 (m, 1 H) 5,05-5,15 (m, 1 H) 6,61-6,67 (m, 1 H) 7,11 (d, J=3,66 Hz, 1 H) 8,08-8,12 (m, 1 H); LCMS (M/Z): 390 (M+H).
Пример 21:
Соединение 21: 3,3,3-трифтор-N-[2-[метил(7H-пирроло[2,3-d]пиримидин-4-ил)амино]спиро[3.3]гептан-6-ил]пропан-1-сульфонамид
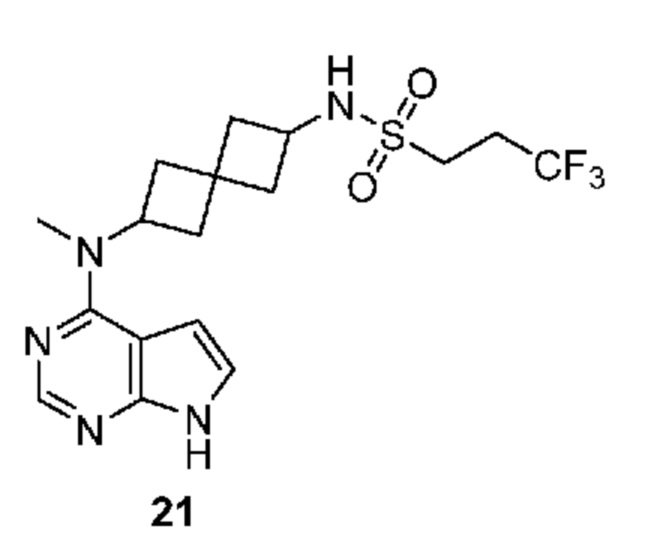
3,3,3-трифтор-N-[2-[метил(7H-пирроло[2,3-d]пиримидин-4-ил)амино]спиро[3.3]гептан-6-ил]пропан-1-сульфонамид 21. 1H NMR (400 MHz, метанол-d4) δ част./млн 2,04-2,18 (m, 2 H) 2,27-2,44 (m, 4 H) 2,47-2,52 (m, 1 H) 2,59-2,71 (m, 3 H) 3,17-3,28 (m, 2 H) 3,30-3,31 (m, 3 H) 3,81-3,89 (m, 1 H) 5,06-5,15 (m, 1 H) 6,64 (d, J=3,66 Hz, 1 H) 7,11 (d, J=3,42 Hz, 1 H) 8,10 (s, 1 H); LCMS (M/Z): 418 (M+H).
Пример 22:
Соединение 22: N-((6-(метил(7H-пирроло[2,3-d]пиримидин-4-ил)амино)спиро[3.3]гептан-2-ил)метил)метансульфонамид
Схема 4 (пример 22, как иллюстративный):
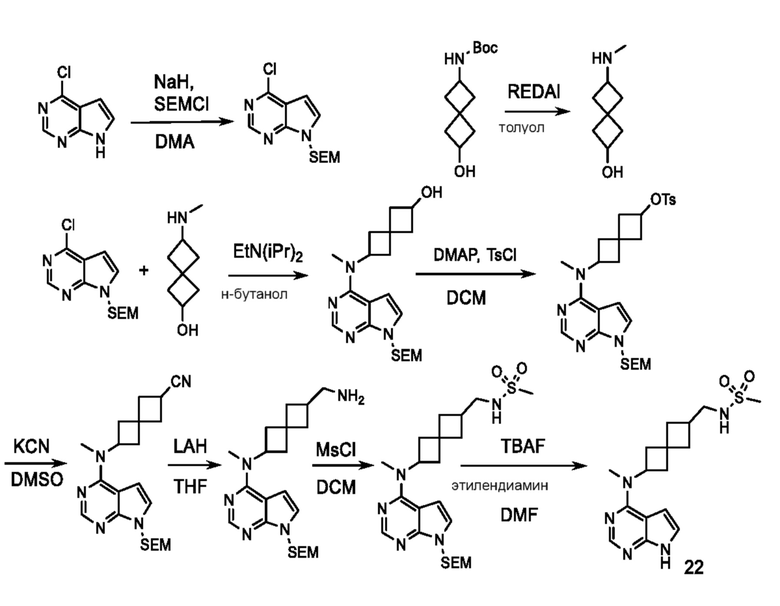
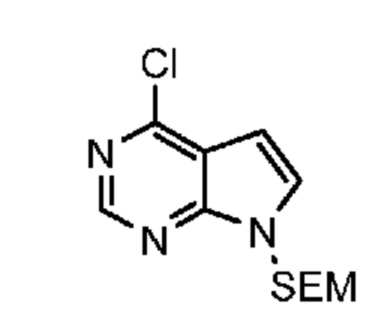
Промежуточный продукт 1: 4-хлор-7-((2-(триметилсилил)этокси)метил)-7H-пирроло[2,3-d]пиримидин. К охлажденной (0°C) суспензии NaH (1,56 г, 39,1 ммоля, 60% в минеральном масле) в DMA (40 мл) с помощью канюли добавляли раствор 4-хлор-7H-пирроло[2,3-d]пиримидин (5,00 г, 32,6 ммоля) в DMA (40 мл) с такой скоростью, чтобы регулировать избыточное образование газа. После завершения добавления с помощью канюли реакционную смесь перемешивали в бане со льдом в течение 30 мин, затем по каплям добавляли раствор SEMCl (6,92 мл, 39,1 ммоля) в DMA (20 мл). После завершения добавления по каплям реакционную смесь извлекали из бани со льдом и перемешивали при комнатной температуре в течение 1 ч. Реакционную смесь медленно выливали в воду (100 мл) и смесь экстрагировали с помощью 3×150 мл EtOAc. Объединенные органические фракции промывали 1×100 мл насыщенным водным раствором NaCl, сушили над Na2SO4 фильтровали и концентрировали в вакууме. Полученный остаток хроматографировали на силикагеле (330 г, колонка Isco, от 0 до 25% EtOAc в гептане в течение 35,4 мин) и получали 8,23 г (89%) 4-хлор-7-((2-(триметилсилил)этокси)метил)-7H-пирроло[2,3-d]пиримидина в виде бесцветного масла. 1H NMR (400 MHz, DMSO-d6) δ = 8,66 (s, 1H), 7,85 (d, J=3,7 Hz, 1H), 6,69 (d, J=3,7 Hz, 1H), 5,62 (s, 2H), 3,52-3,46 (m, 2H), 0,82-0,75 (m, 2H), -0,12 - -0,16 (m, 9H). LC/MS RT=1,49 мин, 284,2 [M+H]+.

Промежуточный продукт 2: 6-(метиламино)спиро[3.3]гептан-2-ол. К охлажденной (13°C) суспензии трет-бутил (6-гидроксиспиро[3.3]гептан-2-ил)карбамата (2,50 г, 11,0 ммоля) в толуоле (26 мл) в круглодонной трехгорлой колбе объемом 0,25 л, снабженной обратным холодильником, патрубком подачи N2, мембраной и каналом для ввода термопары, по каплям в течение 25 мин добавляли раствор REDAl (19,0 мл, 68,4 ммоля, 3,60 М) в толуоле, поддерживая внутреннюю температуру ниже 30°C. После завершения добавления реакционную смесь кипятили с обратным холодильником в течение 1 ч, затем ее охлаждали до 2°C. Реакцию останавливали путем медленного добавления насыщенного водного раствора Na2SO4 (40 мл). Полученную смесь фильтровали с помощью воронки Бюхнера и твердые вещества промывали с помощью 10 мл DCM. Органический слой отделяли и водный слой экстрагировали с помощью 4×20 мл DCM. Объединенные органические фракции сушили над MgSO4 фильтровали и концентрировали в вакууме и получали 1,08 г (70%) 6-(метиламино)спиро[3.3]гептан-2-ола в виде бесцветного масла. 1H NMR (400 MHz, метанол-d4) δ = 4,08 (квинтет, J=7,4 Hz, 1H), 3,10-2,98 (m, 1H), 2,43-2,34 (m, 1H), 2,31-2,12 (m, 6H), 1,95-1,84 (m, 2H), 1,77 (td, J=8,4, 10,9 Hz, 2H). LC/MS RT=1,49 мин, 284,2 [M+H]+.
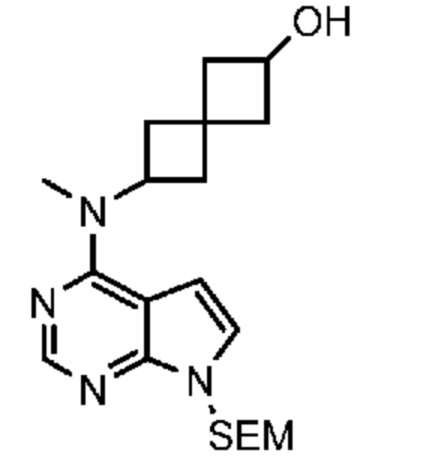
Промежуточный продукт 3: 6-(метил(7-((2-(триметилсилил)этокси)метил)-7H-пирроло[2,3-d]пиримидин-4-ил)амино)спиро[3.3]гептан-2-ол. Смесь 4-хлор-7-((2-(триметилсилил)этокси)метил)-7H-пирроло[2,3-d]пиримидина (2,17 г, 7,65 ммоля), 6-(метиламино)спиро[3.3]гептан-2-ола (1,08 г, 7,65 ммоля) и EtN(i-Pr)2 (4,00 мл, 22,9 ммоля) в н-бутаноле (15 мл) нагревали при 110°C в течение 18 ч. Раствор охлаждали до комнатной температуры, концентрировали в вакууме и полученный остаток хроматографировали на силикагеле (120 г, колонка Isco, от 0 до 100% EtOAc в гептане в течение 36 мин, затем 100% EtOAc в течение 10 мин) и получали 1,30 г (44%) 6-(метил(7-((2-(триметилсилил)этокси)метил)-7H-пирроло[2,3-d]пиримидин-4-ил)амино)спиро[3.3]гептан-2-ола в виде желтовато-коричневого твердого вещества. 1H NMR (400 MHz, DMSO-d6) δ = 8,13 (s, 1H), 7,29 (d, J=3,7 Hz, 1H), 6,61 (d, J=3,7 Hz, 1H), 5,47 (s, 2H), 5,16-5,05 (m, 1H), 4,90 (d, J=6,4 Hz, 1H), 4,03-3,93 (m, 1H), 3,48-3,42 (m, 2H), 3,18 (s, 3H), 2,44-2,36 (m, 1H), 2,26-2,16 (m, 4H), 2,16-2,08 (m, 1H), 1,91-1,79 (m, 2H), 0,82-0,75 (m, 2H), -0,08 - -0,14 (m, 9H). LC/MS RT=0,90 мин, 389,2 [M+H]+.
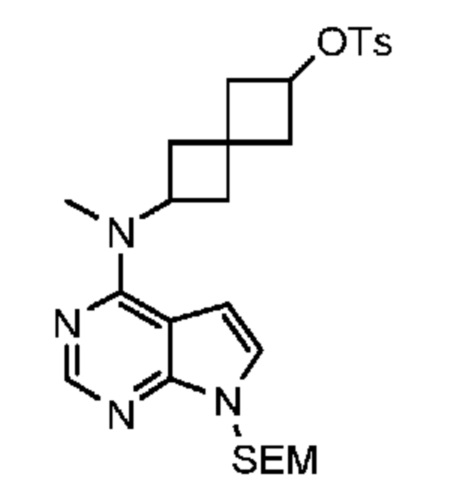
Промежуточный продукт 4: 6-(метил(7-((2-(триметилсилил)этокси)метил)-7H-пирроло[2,3-d]пиримидин-4-ил)амино)спиро[3.3]гептан-2-ил-4-метилбензолсульфонат. К раствору 6-(метил(7-((2-(триметилсилил)этокси)метил)-7H-пирроло[2,3-d]пиримидин-4-ил)амино)спиро[3.3]гептан-2-ола (1,30 г, 3,35 ммоля), DMAP (82,0 мг, 0,669 ммоля) и NEt3 (1,50 мл, 10,7 ммоля) в DCM (17 мл) добавляли TsCl (1,08 г, 5,69 ммоля). Реакционную смесь перемешивали при комнатной температуре в течение 16 ч, затем реакционную смесь выливали в воду (15 мл). Органический слой отделяли и водный слой экстрагировали с помощью 3×10 мл EtOAc. Объединенные органические слои промывали 1×10 мл насыщенным водным раствором NaHCO3, 1×10 мл насыщенным водным раствором NaCl, сушили над Na2SO4, фильтровали и концентрировали в вакууме. Полученный остаток хроматографировали на силикагеле (40 г, колонка Isco, от 0 до 75% EtOAc в гептане в течение 19 мин) и получали 1,70 г (94%) 6-(метил(7-((2-(триметилсилил)этокси)метил)-7H-пирроло[2,3-d]пиримидин-4-ил)амино)спиро[3.3]гептан-2-ил-4-метилбензолсульфоната в виде коричневого масла. 1H NMR (400 MHz, DMSO-d6) δ = 8,12 (s, 1H), 7,76 (d, J=8,4 Hz, 2H), 7,46 (d, J=8,2 Hz, 2H), 7,28 (d, J=3,7 Hz, 1H), 6,60 (d, J=3,7 Hz, 1H), 5,46 (s, 2H), 5,04 (t, J=8,1 Hz, 1H), 4,77-4,66 (m, 1H), 3,48-3,41 (m, 2H), 3,14 (s, 3H), 2,45-2,39 (m, 4H), 2,29-2,09 (m, 6H), 2,05 (dd, J=7,5, 12,0 Hz, 1H), 0,81-0,75 (m, 2H), -0,10 - -0,14 (m, 9H). LC/MS RT=1,55 мин, 543,2 [M+H]+.
Промежуточный продукт 5: 6-(метил(7-((2-(триметилсилил)этокси)метил)-7H-пирроло[2,3-d]пиримидин-4-ил)амино)спиро[3.3]гептан-2-карбонитрил. Смесь 6-(метил(7-((2-(триметилсилил)этокси)метил)-7H-пирроло[2,3-d]пиримидин-4-ил)амино)спиро[3.3]гептан-2-ил-4-метилбензолсульфоната (0,300 г, 0,553 ммоля) и KCN (108 мг, 1,66 ммоля) разбавляли безводным DMSO (2 мл) и реакционную смесь нагревали при 90×C в течение 27 ч. Реакционной смеси давали охладиться до комнатной температуры, выливали в воду (10 мл) и экстрагировали 4×5 мл EtOAc. Объединенные органические фракции промывали 1×3 мл воды, 1×3 мл насыщенным водным раствором NaCl, сушили над Na2SO4 фильтровали и концентрировали в вакууме. Полученный остаток хроматографировали на силикагеле (24 г, колонка Isco, от 0 до 100% EtOAc в гептане в течение 15 мин) и получали 115 мг (52%) 6-(метил(7-((2-(триметилсилил)этокси)метил)-7H-пирроло[2,3-d]пиримидин-4-ил)амино)спиро[3.3]гептан-2-карбонитрила в виде желтовато-коричневого твердого вещества. 1H NMR (400 MHz, DMSO-d6) δ = 8,14 (s, 1H), 7,30 (d, J=3,7 Hz, 1H), 6,63 (d, J=3,7 Hz, 1H), 5,47 (s, 2H), 5,12-5,01 (m, 1H), 3,48-3,42 (m, 2H), 3,24 (t, J=8,4 Hz, 1H), 3,18 (s, 3H), 2,57-2,50 (m, 1H), 2,44-2,21 (m, 7H), 0,81-0,76 (m, 2H), -0,12 (s, 9H). LC/MS RT=1,09 мин, 398,3 [M+H]+.
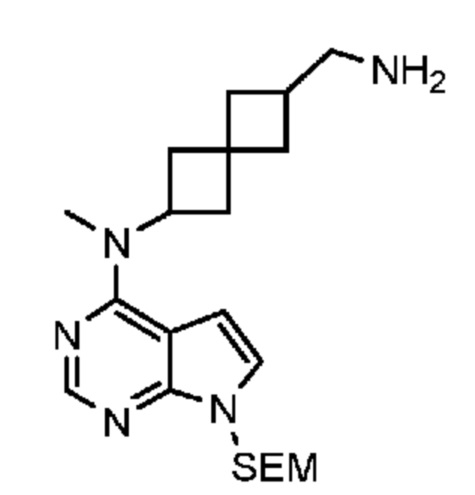
Промежуточный продукт 6: N-(6-(аминометил)спиро[3.3]гептан-2-ил)-N-метил-7-((2-(триметилсилил)этокси)метил)-7H-пирроло[2,3-d]пиримидин-4-амин. К охлажденному (0°C) раствору 6-(метил(7-((2-(триметилсилил)этокси)метил)-7H-пирроло[2,3-d]пиримидин-4-ил)амино)спиро[3.3]гептан-2-карбонитрила (115 мг, 0,289 ммоля) в THF (2,4 мл) добавляли LAH (27 мг, 0,72 ммоля). Реакционную смесь перемешивали в течение 2 ч при 0°C, затем реакцию останавливали с помощью Na2SO4⋅10H2O (350 мг, добавляли порциями). Перемешивание продолжали до прекращения выделения газа и смесь разбавляли с помощью DCM (10 мл) и фильтровали через целит с помощью воронки Бюхнера. Маточный раствор концентрировали в вакууме и получали 115 мг N-(6-(аминометил)спиро[3.3]гептан-2-ил)-N-метил-7-((2-(триметилсилил)этокси)метил)-7H-пирроло[2,3-d]пиримидин-4-амина в виде бесцветного масла, которое использовали без дополнительной очистки. 1H NMR (400 MHz, метанол-d4) δ = 8,13 (s, 1H), 7,19 (d, J=3,7 Hz, 1H), 6,67 (d, J=3,7 Hz, 1H), 5,53 (s, 2H), 5,04 (квинтет, J=8,5 Hz, 1H), 3,54-3,48 (m, 2H), 3,27 (s, 3H), 2,63 (d, J=6,8 Hz, 2H), 2,48-2,40 (m, 1H), 2,33-2,24 (m, 4H), 2,15-2,06 (m, 1H), 1,74 (dd, J=6,8, 12,1 Hz, 1H), 1,61-1,53 (m, 2H), 0,87-0,80 (m, 2H), -0,08 - -0,12 (m, 9H). LC/MS RT=0,61 мин, 402,2 [M+H]+.
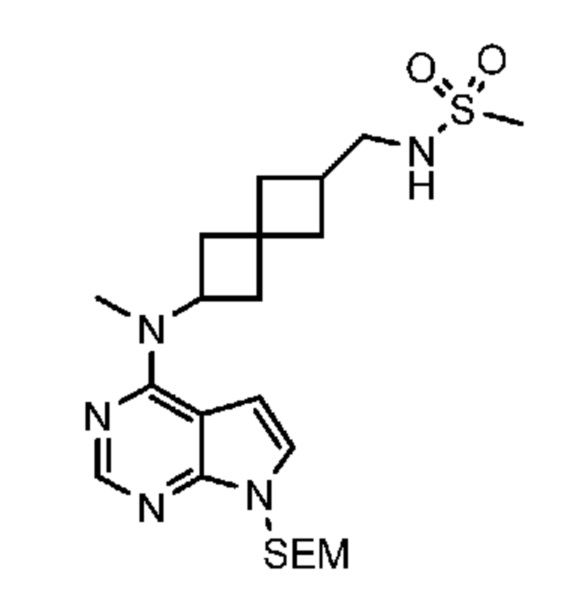
Промежуточный продукт 7: N-((6-(метил(7-((2-(триметилсилил)этокси)метил)-7H-пирроло[2,3-d]пиримидин-4-ил)амино)спиро[3.3]гептан-2-ил)метил)метансульфонамид. К раствору N-(6-(аминометил)спиро[3.3]гептан-2-ил)-N-метил-7-((2-(триметилсилил)этокси)метил)-7H-пирроло[2,3-d]пиримидин-4-амина (57 мг, 0,14 ммоля) и NEt3 (59 мл, 0,43 ммоля) в DCM (1,4 мл) добавляли метансульфонилхлорид (13 мл, 0,17 ммоля). Реакционную смесь перемешивали в течение 2,75 ч, затем ее концентрировали в вакууме и остаток хроматографировали на силикагеле (12 г, колонка Isco, от 0 до 100% EtOAc в гептане в течение 16 мин) и получали 38 мг (56%) N-((6-(метил(7-((2-(триметилсилил)этокси)метил)-7H-пирроло[2,3-d]пиримидин-4-ил)амино)спиро[3.3]гептан-2-ил)метил)метансульфонамида в виде белого твердого вещества. 1H NMR (400 MHz, метанол-d4) δ = 8,14 (s, 1H), 7,21 (d, J=3,7 Hz, 1H), 6,69 (d, J=3,7 Hz, 1H), 5,53 (s, 2H), 5,06-4,95 (m, 1H), 3,55-3,48 (m, 2H), 3,27 (s, 3H), 3,05 (d, J=7,2 Hz, 2H), 2,92-2,87 (m, 3H), 2,49-2,36 (m, 2H), 2,35-2,25 (m, 4H), 2,11 (ddd, J=3,5, 8,0, 11,5 Hz, 1H), 1,95-1,78 (m, 2H), 0,87-0,81 (m, 2H), -0,07 - -0,11 (m, 9H). LC/MS RT=1,08 мин, 480,2 [M+H]+.
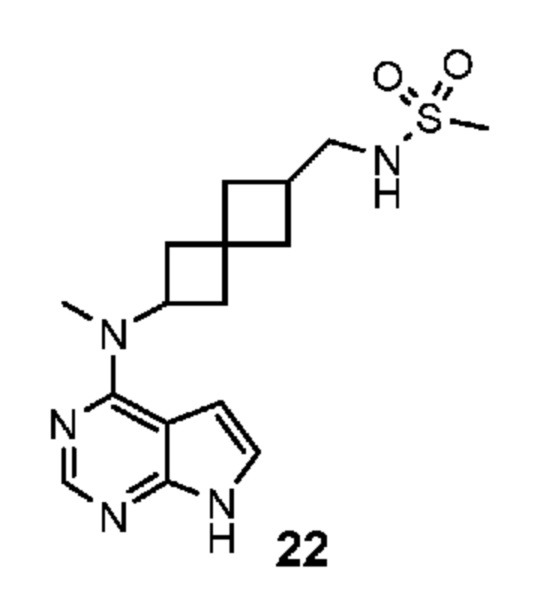
N-((6-(метил(7H-пирроло[2,3-d]пиримидин-4-ил)амино)спиро[3.3]гептан-2-ил)метил)метансульфонамид 22. К раствору N-((6-(метил(7-((2-(триметилсилил)этокси)метил)-7H-пирроло[2,3-d]пиримидин-4-ил)амино)спиро[3.3]гептан-2-ил)метил)метансульфонамида (38 мг, 0,079 ммоля) в DMF (1 мл) добавляли этилендиамин (11 мл, 0,16 ммоля) и раствор TBAF (0,16 мл, 0,16 ммоля, 1 М) в THF. Реакционную смесь нагревали при 60°C в течение 24 ч, затем дополнительно добавляли TBAF (0,32 мл, 0,32 ммоля, 1 М) в THF. Температуру реакционной смеси повышали до 90°C и перемешивали в течение еще 72 ч, затем раствор концентрировали в вакууме и полученный остаток хроматографировали на колонке C18 с обращенной фазой (43 г, колонка C18 Isco, 100% воды 1 в течение мин, затем от 0 до 100% MeOH в воде в течение 15 мин) и получали 18 мг (64%) N-((6-(метил(7H-пирроло[2,3-d]пиримидин-4-ил)амино)спиро[3.3]гептан-2-ил)метил)метансульфонамида 22 в виде белого твердого вещества. 1H NMR (400 MHz, метанол-d4) δ = 8,07 (s, 1H), 7,07 (d, J=3,7 Hz, 1H), 6,60 (d, J=3,7 Hz, 1H), 5,05 (квинтет, J=8,6 Hz, 1H), 3,27 (s, 3H), 3,05 (d, J=7,2 Hz, 2H), 2,90 (s, 3H), 2,48-2,36 (m, 2H), 2,34-2,24 (m, 4H), 2,11 (ddd, J=3,4, 8,1, 11,6 Hz, 1H), 1,92 (dd, J=7,4, 10,9 Hz, 1H), 1,82 (dd, J=7,7, 11,8 Hz, 1H). LC/MS RT=0,32 мин, 350,2 [M+H]+
По аналогичным методикам получали следующие соединения.
Пример 23:
Соединение 23: N-((6-(метил(7H-пирроло[2,3-d]пиримидин-4-ил)амино)спиро[3.3]гептан-2-ил)метил)этансульфонамид
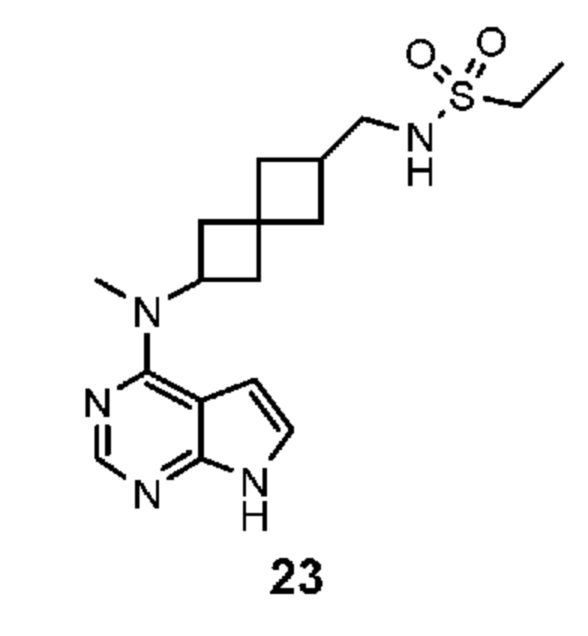
N-((6-(метил(7H-пирроло[2,3-d]пиримидин-4-ил)амино)спиро[3.3]гептан-2-ил)метил)этансульфонамид 23. 1H NMR (400 MHz, метанол-d4) δ = 8,07 (s, 1H), 7,07 (d, J=3,7 Hz, 1H), 6,60 (d, J=3,5 Hz, 1H), 5,05 (квинтет, J=8,6 Hz, 1H), 3,27 (s, 3H), 3,06-2,98 (m, 4H), 2,47-2,36 (m, 2H), 2,35-2,24 (m, 4H), 2,11 (ddd, J=3,7, 8,1, 11,5 Hz, 1H), 1,91 (dd, J=7,3, 10,8 Hz, 1H), 1,81 (dd, J=7,5, 11,6 Hz, 1H), 1,29 (t, J=7,3 Hz, 3H). LC/MS RT=0,39 мин, 364,2 [M+H]+.
Пример 24:
Соединение 24: N-метил-6-[метил(9H-пурин-6-ил)амино]спиро[3.3]гептан-2-сульфонамид
Схема 5 (пример 24, как иллюстративный)
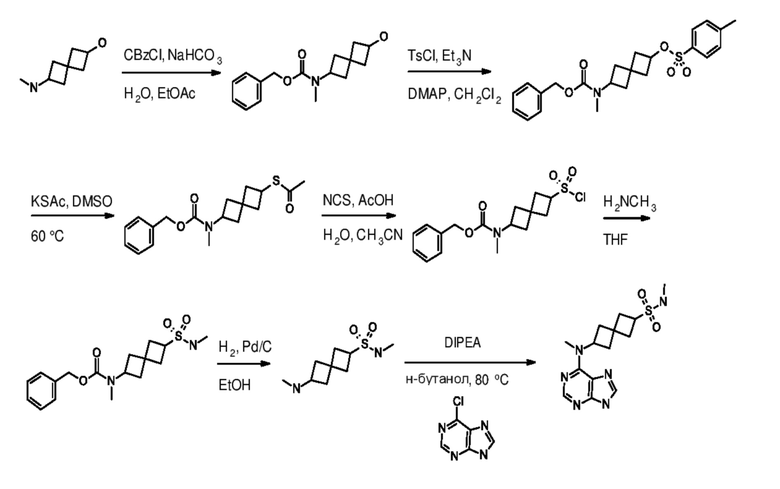
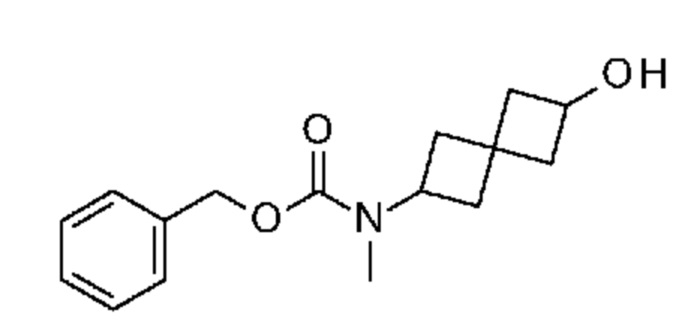
Промежуточный продукт 1: Бензил-N-(2-гидроксиспиро[3.3]гептан-6-ил)-N-метилкарбамат. Бензилхлорформиат (1,50 мл, 10,5 ммоля) при перемешивании добавляли к раствору 6-(метиламино)спиро[3.3]гептан-2-ола (1,59 г, 10,5 ммоля), водному раствору карбоната натрия (21,1 мл, 21,1 ммоля 1 н. раствора) и EtOAc (10,5 мл) при 0°C. После завершения добавления баню из воды со льдом удаляли и реакционную смесь перемешивали при температуре окружающей среды в течение 4 ч, затем слои разделяли и водный слой промывали с помощью EtOAc (2×10 мл). Органические слои объединяли, промывали рассолом (1×10 мл), сушили (Na2SO4), фильтровали и концентрировали и получали бесцветное масло (2,46 г, 85%). 1H NMR (400 MHz, хлороформ-d): δ част./млн 1,91 (dt, J=11,42, 6,98 Hz, 2H), 2,03 (s, 1H), 2,05-2,21 (m, 4H), 2,27 (dt, J=11,66, 5,98 Hz, 1H), 2,43-2,51 (m, 1H), 2,82 (s, 3H), 4,18 (квинтет, J=7,22 Hz, 1H), 5,10 (s, 2H), 7,31-7,38 (m, 5H); m/z 276 [M+H]+.
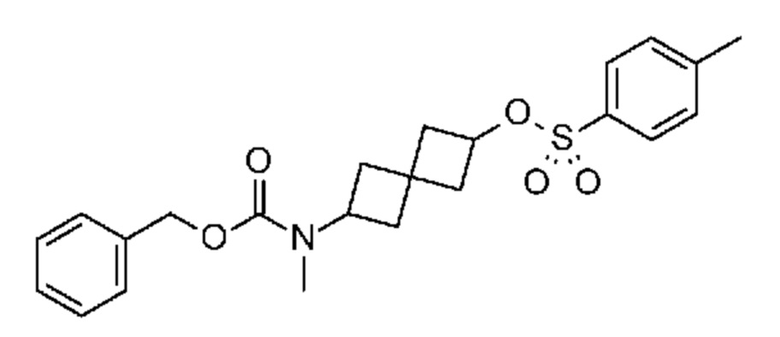
Промежуточный продукт 2: [6-[Бензилоксикарбонил(метил)амино]спиро[3.3]гептан-2-ил]-4-метилбензолсульфонат. п-Толуолсульфонилхлорид (2,09 г, 11,0 ммоля) при перемешивании добавляли к раствору бензил-N-(2-гидроксиспиро[3.3]гептан-6-ил)-N-метилкарбамата (2,35 г, 8,55 ммоля), триэтиламина (2,66 мл, 19,1 ммоля), DMAP (233 мг, 1,91 ммоля) и CH2Cl2 (35 мл). Реакционную смесь перемешивали в течение 18 ч, затем раствор выливали в воду (50 мл) и слои разделяли. Водный слой экстрагировали с помощью EtOAc (2×50 мл). Органические слои объединяли, промывали рассолом (1×50 мл), сушили (Na2SO4) фильтровали, концентрировали и очищали с помощью хроматографии на силикагеле с использованием градиентного режима от 0 до 75% EtOAc в гептане и получали искомое соединение в виде бесцветного масла (3,14 г, 86%). 1H NMR (400 MHz, хлороформ-d): δ част./млн 2,17-2,34 (m, 3H), 2,37-2,64 (m, 6H), 2,78 (d, J=5,27 Hz, 3H), 3,18 (s, 3H), 3,74 (квинтет, J=8,30 Hz, 1H), 3,95 (q, J=5,08 Hz, 1H), 4,94-5,06 (m, 1H), 6,59 (d, J=4,10 Hz, 1H), 7,27 (s, 2H), 7,44 (d, J=4,10 Hz, 1H), 8,03 (d, J=8,39 Hz, 2H), 8,37 (s, 1H); m/z 430 [M+H]+.
Промежуточный продукт 3: S-[6-[Бензилоксикарбонил(метил)амино]спиро[3.3]гептан-2-ил]этантиоат. Тиоацетат калия (6,62 г, 58,0 ммоля) при перемешивании добавляли к раствору [6-[бензилоксикарбонил(метил)амино]спиро[3.3]гептан-2-ил]-4-метилбензолсульфоната (5,00 г, 11,6 ммоля) и DMSO (50 мл). Наружную температуру повышали до 60°C и сначала гетерогенный раствор становился гомогенным. Через 17 ч при 60°C раствор охлаждали и реакционную смесь разбавляли с помощью EtOAc (50 мл) и водным раствором NaHCO3 (75 мл). Слои разделяли и водный слой экстрагировали с помощью EtOAc (2×50 мл). Органические слои объединяли, промывали рассолом (1×50 мл), сушили (Na2SO4) фильтровали, концентрировали и очищали с помощью хроматографии на силикагеле с использованием градиентного режима от 0 до 40% EtOAc в гептане и получали искомое соединение в виде бесцветного масла (3,26 г, 84%). 1H NMR (400 MHz, хлороформ-d): δ част./млн 1,98-2,20 (m, 5H), 2,25 (s, 3H), 2,29-2,44 (m, 2H), 2,56 (ddd, J=11,47, 7,66, 3,90 Hz, 1H), 2,81 (s, 3H), 3,93 (квинтет, J=8,35 Hz, 1H), 4,15-4,64 (m, 1H), 5,09 (s, 2H), 7,26-7,37 (m, 4H); m/z 334 [M+H]+.
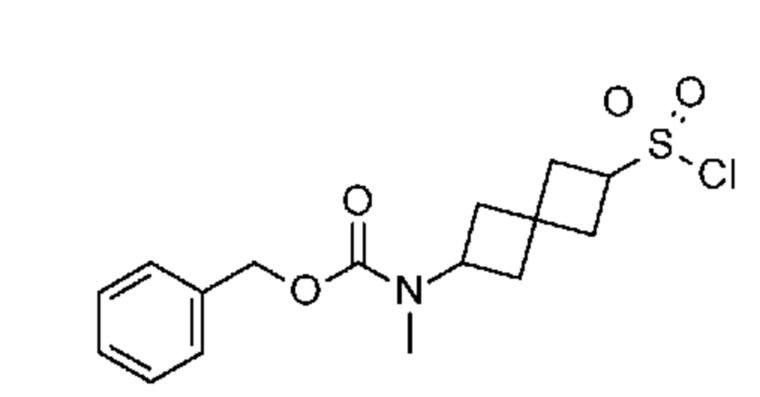
Промежуточный продукт 4: Бензил-N-(2-хлорсульфонилспиро[3.3]гептан-6-ил)-N-метилкарбамат. Раствор S-[6-[бензилоксикарбонил(метил)амино]спиро[3.3]гептан-2-ил]этантиоата и ацетонитрила (11 мл) медленно по каплям добавляли при перемешивании к раствору NCS (2,87 г, 20,9 ммоля), смеси уксусная кислота:H2O (0,80 мл 1:1 раствора по объему) и ацетонитрила (12 мл) при температуре окружающей среды при такой скорости, чтобы внутренняя температура раствора не превышала 30°C. Через 15 мин смесь разбавляли с помощью EtOAc (80 мл), промывали насыщенным водным раствором NaHCO3 (1×20 мл), промывали рассолом (1×20 мл), сушили (Na2SO4) фильтровали, концентрировали и очищали с помощью хроматографии на силикагеле с использованием градиентного режима от 0 до 40% EtOAc в гептане и получали искомое соединение в виде белого твердого вещества (1,53 г, 61%). 1H NMR (400 MHz, хлороформ-d): δ част./млн 2,17-2,26 (m, 2H), 2,27-2,38 (m, 2H), 2,45 (ddd, J=12,45, 8,74, 3,22 Hz, 1H), 2,57-2,65 (m, 1H), 2,66-2,81 (m, 3H), 2,82 (s, 3H), 4,29 (квинтет, J=8,20 Hz, 1H), 4,35-4,55 (m, 1H), 5,10 (s, 2H), 7,28-7,38 (m, 6H); m/z 358 [M+H]+.
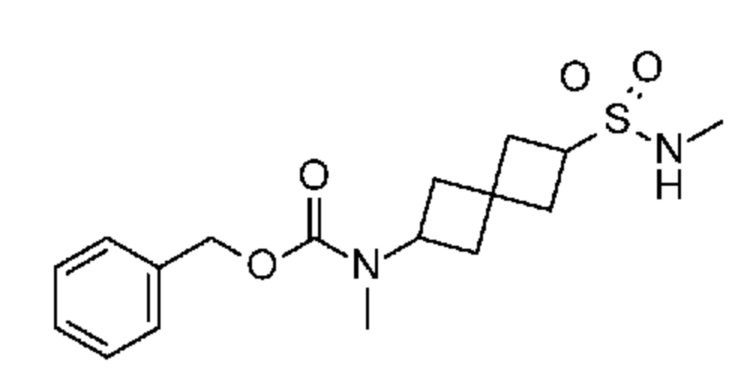
Промежуточный продукт 5: Бензил-N-метил-N-[2-(метилсульфамоил)спиро[3.3]гептан-6-ил]карбамат. Метиламин (10,7 мл, 4,28 ммоля 2M раствора в THF) по каплям добавляли к раствору бензил-N-(2-хлорсульфонилспиро[3.3]гептан-6-ил)-N-метилкарбамата (1,53 г, 4,28 ммоля) и THF (12,2 мл) при 0°C. Реакционной смеси давали нагреться до температуры окружающей среды при перемешивании в течение ночи. Через 17 ч раствор выливали в воду (50 мл) и экстрагировали с помощью EtOAc (3×50 мл). Органические экстракты объединяли, промывали рассолом (1×30 мл), сушили (Na2SO4) фильтровали, концентрировали и очищали с помощью хроматографии на силикагеле с использованием градиентного режима от 0 до 100% EtOAc в гептане и получали искомое соединение в виде белого твердого вещества (1,19 г, 79%). 1H NMR (400 MHz, хлороформ-d): δ част./млн 2,09-2,17 (m, 2H), 2,18-2,34 (m, 3H), 2,35-2,43 (m, 1H), 2,44-2,55 (m, 2H), 2,76 (d, J=5,47 Hz, 3H), 2,81 (s, 3H), 3,70 (квинтет, J=8,39 Hz, 1H), 3,97 (q, J=4,95 Hz, 1H), 5,09 (s, 2H), 7,28-7,38 (m, 5H); m/z 353 [M+H]+.
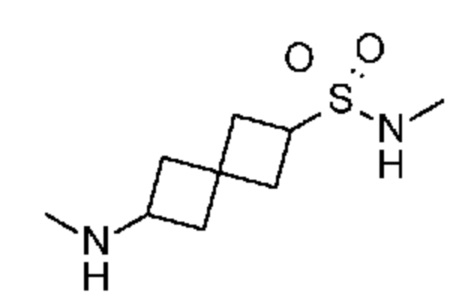
Промежуточный продукт 6: N-Метил-6-(метиламино)спиро[3.3]гептан-2-сульфонамид. В круглодонную колбу объемом 500 мл, которую продули азотом, помещали влажный 5% Pd/C (700 мг); небольшое количество EtOAc использовали для промывки горла колбы. Добавляли бензил-N-метил-N-[2-(метилсульфамоил)спиро[3.3]гептан-6-ил]карбамат (700 мг, 1,99 ммоля) и EtOH (70 мл). Воздух откачивали и заменяли водородом. Через 18 ч атмосферу заменяли азотом и смесь фильтровали через слой целита при элюировании большим количеством EtOAc. Фильтрат концентрировали и получали искомое соединение в виде белого твердого вещества (395 мг, 91%). 1H NMR (400 MHz, метанол-d4): δ част./млн 1,78-1,90 (m, 2H), 2,20-2,32 (m, 5H), 2,35-2,48 (m, 4H), 2,65 (s, 3H), 3,05-3,16 (m, 1H), 3,81 (квинтет, J=8,30 Hz, 1 H); m/z 219 [M+H]+.
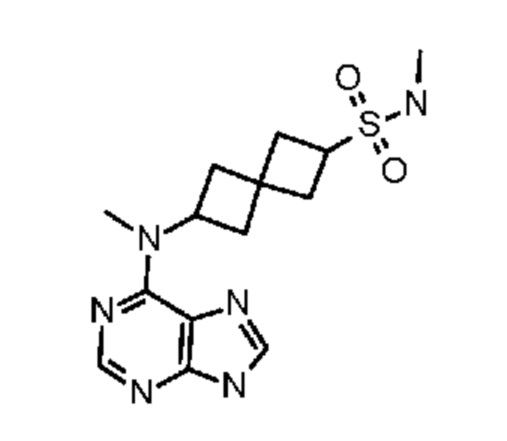
Соединение 24: N-метил-6-[метил(9H-пурин-6-ил)амино]спиро[3.3]гептан-2-сульфонамид.
В сосуде Wheaton объемом 5 мл 6-хлор-9H-пурин (0,34 ммоля, 87,0 мг) и N-метил-6-(метиламино)спиро[3.3]гептан-2-сульфонамид (0,34 ммоля, 52,0 мг) растворяли в н-бутаноле (3,0 мл). К нему добавляли N, N-диизопропилэтиламин (0,29 мл, 1,7 ммоля). Реакционную смесь перемешивали при 80°C в течение 16 ч. Охлаждали и реакционную смесь концентрировали. Неочищенную смесь растирали с ацетонитрилом (2×2,0 мл) и получали 67 мг продукта (чистота 85%). Его дополнительно очищали с помощью препаративной HPLC с использованием смеси вода/метанол в качестве элюента и получали продукт чистотой 93%. LC-MS 337 (M+H); 1H-NMR (400 MHz, DMSO-d6) δ част./млн 2,11-2,43 (m, 8 H) 2,49-2,58 (m, 3 H) 3,31-3,36 (m, 2 H) 3,69-3,89 (m, 1 H) 5,24-6,04 (m, 1 H) 6,62 -6,93 (m, 1 H) 7,88-8,12 (m, 1 H) 8,13-8,29 (m, 1 H) 11,86-13,35 (m, 1 H);
По аналогичным методикам получали следующие соединения.
Пример 25:
Соединение 25: N-метил-6-[метил(1H-пиразоло[3,4-d]пиримидин-4-ил)амино]спиро[3.3]гептан-2-сульфонамид
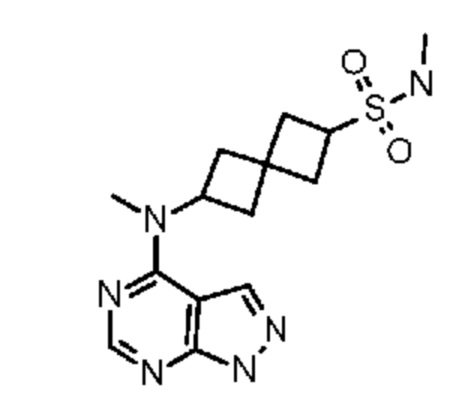
N-метил-6-[метил(1H-пиразоло[3,4-d]пиримидин-4-ил)амино]спиро[3.3]гептан-2-сульфонамид. LC-MS 337 (M+H); 1H NMR (400 MHz, DMSO-d6) δ част./млн 2,08-2,44 (m, 7 H) 2,51-2,58 (m, 3 H) 3,17-3,24 (m, 3 H) 3,60-3,92 (m, 1 H) 4,68-5,48 (m, 1 H) 6,40 -
7,01 (m, 1 H) 8,16 (d, J=18,35 Hz, 2 H) 12,55-13,69 (m, 1 H).
Примеры 26 и 27:
Соединения 26 и 27: Разделение энантиомеров N-метил-6-[метил(7H-пирроло[2,3-d]пиримидин-4-ил)амино]спиро[3.3]гептан-2-сульфонамида.
Рацемическое вещество растворяли в MeOH. Разделение энантиомеров A и B проводили на полупрепаративной колонке Chiral Tech Chiralpak IF (30×250 мм, 5 мкм) при элюировании в изократическом режиме растворителем (70% EtOH и 30% гексана). Энантиомер A собирали в период от 11,1 до 12,1 мин. Энантиомер B собирали в период от 12,7 до 14,1 мин. Энантиомеры A и B анализировали на аналитической колонке Chiral Tech Chiralpak IF-3 (4,6×150 мм, 3 мкм) при элюировании в изократическом режиме растворителем (60% EtOH и 40% гексана).
Соединение 26: Энантиомер A: 1H NMR (400 MHz, метанол-d4) δ част./млн 2,30-2,41 (m, 4 H) 2,44-2,59 (m, 4 H) 2,68 (s, 3 H) 3,27 (s, 3 H, перекрывался с MeOH-d4) 3,87 (квинтет, J=8,30 Hz, 1 H) 5,01-5,10 (m, 1 H) 6,61 (d, J=3,71 Hz, 1 H) 7,08 (d, J=3,71 Hz, 1 H) 8,07 (s, 1 H); LCMS (M/Z): 336 (M+H); время удерживания на колонке Chiralpak IF-3: 6,56 мин.
Соединение 27: Энантиомер B: 1H NMR (400 MHz, метанол-d4) δ част./млн 2,30-2,41 (m, 4 H), 2,44-2,59 (m, 4 H) 2,68 (s, 3 H) 3,27 (s, 3 H, перекрывался с MeOH-d4) 3,87 (квинтет, J=8,30 Hz, 1 H) 5,01-5,10 (m, 1 H) 6,61 (d, J=3,51 Hz, 1 H) 7,08 (d, J=3,71 Hz, 1 H) 8,07 (s, 1 H); LCMS (M/Z): 336 (M+H); время удерживания на колонке Chiralpak IF-3: 8,59 мин (широкий пик).
По методикам, аналогичным приведенным в предшествующих примерах, получали следующее.
Пример 28:
Соединение 28: 6-[метил(7H-пирроло[2,3-d]пиримидин-4-ил)амино]спиро[3.3]гептан-2-сульфонамид
6-[метил(7H-пирроло[2,3-d]пиримидин-4-ил)амино]спиро[3.3]гептан-2-сульфонамид: 1H NMR (400 MHz, метанол-d4) δ част./млн 8,07 (s, 1H), 7,08 (d, J=3,7 Hz, 1H), 6,62 (d, J=3,7 Hz, 1H), 5,13-5,00 (m, 1H), 3,83-3,72 (m, 1H), 3,28 (s, 3H, перекрывался с MeOH-d4), 2,63-2,22 (m, 9H); LCMS (M/Z): 322 (M+H).
Пример 29:
Соединение 29: N, N-диметил-6-[метил(7H-пирроло[2,3-d]пиримидин-4-ил)амино]спиро[3.3]гептан-2-сульфонамид
N, N-диметил-6-[метил(7H-пирроло[2,3-d]пиримидин-4-ил)амино]спиро[3.3]гептан-2-сульфонамид: 1H NMR (400 MHz, метанол-d4) δ част./млн 8,07 (s, 1H), 7,08 (d, J=3,5 Hz, 1H), 6,62 (d, J=3,7 Hz, 1H), 5,13-5,01 (m, 1H), 3,93 (t, J=8,4 Hz, 1H), 3,28 (s, 3H), 2,82 (s, 6H), 2,65-2,46 (m, 4H), 2,41-2,26 (m, 4H); LCMS (M/Z): 350 (M+H).
Пример 30:
Соединение 30: N-метил-N-(2-пирролидин-1-илсульфонилспиро[3.3]гептан-6-ил)-7H-пирроло[2,3-d]пиримидин-4-амин
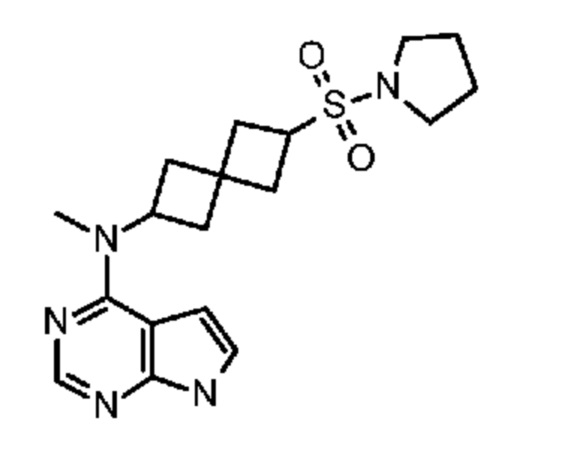
N-метил-N-(2-пирролидин-1-илсульфонилспиро[3.3]гептан-6-ил)-7H-пирроло[2,3-d]пиримидин-4-амин: 1H NMR (400 MHz, метанол-d4) δ част./млн 8,08 (br s, 1H), 7,08 (d, J=3,5 Hz, 1H), 6,62 (d, J=3,7 Hz, 1H), 5,16-4,95 (m, 1H), 3,96 (квинтет, J=8,4 Hz, 1H), 3,27 (s, 3H, перекрывался с MeOH-d4), 2,69-2,21 (m, 8H), 1,97-1,83 (m, 4H); LCMS (M/Z): 376 (M+H).
Аббревиатуры:
DCM= дихлорметан
DMA=диметилацетамид
DMF=диметилформамид
DMAP=4-диметиламинопиридин
LAH=алюмогидрид лития
NaH=гидрид натрия
REDAl=гидрид бис(2-метоксиэтокси)алюминия-натрия
SEMCl=2-(Триметилсилил)этоксиметилхлорид
TBAF=тетрабутилфторид аммония
THF=тетрагидрофуран
TsCl=п-толуолсульфонилхлорид
Исследование
Биологическую активность соединений, предлагаемых в настоящем изобретении, исследовали по методикам, описанным ниже.
Для типичных соединений проводили скрининг активности по отношению к Jak1 с использованием Thermo Fisher Scientific с применениемих протокола Z'-Lyte™, описанного ниже. Скрининг селективности по отношению к другим киназам можно провести по аналогичным методикам.
Условия проведения анализа Z′-LYTE: Исследуемые соединения подвергали скринингу в 1% DMSO (конечная) в лунках. При скрининге использовали три концентрации (10, 100 и 1000 нМ) исследуемых соединений.
Смеси пептид/киназа: Все смеси пептид/киназа разводят до 2× рабочей концентрации в подходящем для киназы буфере (для JAK1, смесь 2× JAK1/Tyr 06 готовили в 50 мМ HEPES pH 6,5, 0,01% BRIJ-35, 10 мМ MgCl2, 1 мМ EGTA, 0,02% NaN3. Конечные 10 мкл реакционной смеси для киназы содержали 21,2-91,5 нг JAK1 и 2 мкМ Tyr 06 в 50 мМ HEPES pH 7,0, 0,01% BRIJ-35, 10 мМ MgCl2, 1 мМ EGTA, 0,01% NaN3. После инкубирования реакционной смеси для киназы в течение 1 ч добавляют 5 мкл 1:128 разведения проявляющего реагента A.).
Раствор ATP: Все растворы ATP разводят до 4× рабочей концентрации в буфере для киназы (50 мМ HEPES pH 7,5, 0,01% BRIJ-35, 10 мМ MgCl2, 1 мМ EGTA).
ATP: Значение кажущейся Km определено ранее с использованием анализа Z'-LYTE.
10× Новая смесь липидов PKC: 2 мг/мл фосфатидилсерин, 0,2 мг/мл DAG в 20 мМ HEPES, pH 7,4, 0,3% CHAPS.
Для приготовления 5 мл 10× новой смеси липидов PKC:
1. В стеклянную пробирку помещают 10 мг фосфатидилсерина (Avanti Polar Lipids Part# 8400032C или 840039C) и 1 мг DAG (Avanti Polar Lipids Part# 800811C).
2. Из смеси липидов удаляют хлороформ путем выпаривания в потоке азота до образования тонкой прозрачной пленки. Непрерывное вращение пробирки под таким углом, чтобы обеспечить максимальную площадь поверхности раствора липида, способствует образованию наиболее тонкой пленки.
3. К высушенной смеси липидов добавляют 5 мл буфера для повторного суспендирования, 20 мМ HEPES, 0,3% CHAPS, pH 7,4
4. Осторожно нагревают до 50-60°C в течение 1-2 мин и встряхивают с небольшими промежутками, пока липиды не растворятся с образованием прозрачного или немного мутного раствора. Липиды обычно переходят в раствор после 2-3 циклов нагревание/встряхивание.
5.Аликвоту в одном объеме для использования охлаждают до комнатной температуры и хранят при -20°C.
Протокол исследования Bar-coded Corning, малообъемный NBS, черный 384-луночный планшет (Corning Cat. #4514)
1. 100 нл - 100× исследуемого соединения в 100% DMSO
2. 2,4 мкл - буфер для киназы
3. 5 мкл - 2× смесь пептид/киназа
4. 2,5 мкл - 4× раствор ATP
5. Планшет встряхивают в течение 30 с
6. Реакционную смесь с киназой инкубируют в течение 60 мин при комнатной температуре
7. 5 мкл - Раствора проявляющего реагента
8. Планшет встряхивают в течение 30 с
9. Проводят инкубацию реакции проявления в течение 60 мин при комнатной температуре
10. Считывают на устройстве считывания сигнала флуоресценции планшетов и анализируют данные.
Варианты осуществления настоящего изобретения включают:
1. Соединение формулы I или его фармацевтическая или ветеринарная соль
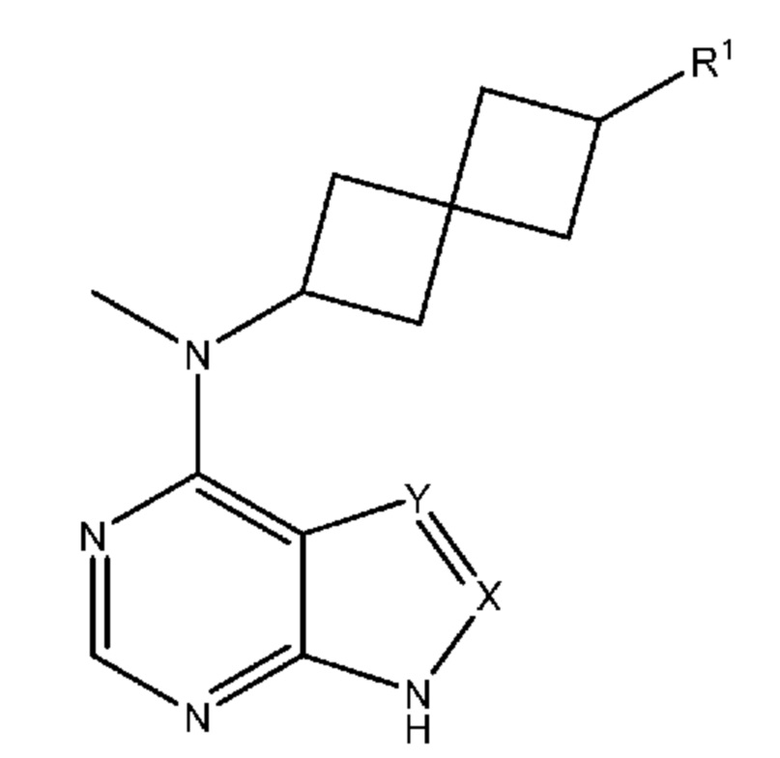
Формула I,
где
X означает N, CH или CR3;
Y означает N, CH или CR3;
R1 означает (CH2)nSO2N(R2)2, (CH2)mNHSO2R2, (CH2)nCON(R2)2 или (CH2)mNHCOR2
n равно 0, 1, 2, 3 или 4;
m равно 0, 1, 2, 3 или 4;
каждый R2 независимо означает водород, C1-6 алкил, C1-6 галогеналкил, C2-6 алкенил, C2-6 галогеналкенил, C2-6 алкинил, C2-6 галогеналкинил, незамещенный или замещенный циклоалкил, незамещенный или замещенный арил, или незамещенный или замещенный гетероарил; или
два R2 могут объединяться с атомом азота, к которому они присоединены, с образованием незамещенного или замещенного 5- - 7-членного кольца, которое может включать один или большее количество дополнительных гетероатомов, выбранных из группы, включающей N, O или S, и которое может включать одну или большее количество кратных связей;
и
каждый R3 независимо означает C1-6 алкил, C1-6 галогеналкил, C2-6 алкенил, C2-6 галогеналкенил, C2-6 алкинил, C2-6 галогеналкинил, гидроксигруппу, C1-6 алкоксигруппу, C1-6 галогеналкилоксигруппу, C1-6 алкилсульфонил, C1-6 тиоалкил, меркаптогруппу, галоген, нитрогруппу, цианогруппу, аминогруппу, C1-6 алкиламиногруппу, незамещенный или замещенный циклоалкил, незамещенный или замещенный арил, или незамещенный или замещенный гетероарил,
если X означает CR3 и Y означает CR3, каждый CR3 может объединяться с атомами, к которым они присоединены, с образованием конденсированного 5- - 7-членного кольца.
2. Соединение по параграфу 1, где R1 означает (CH2)nSO2NHR2 или (CH2)mNHSO2R2.
3. Соединение по параграфу 1 или 2, где R1 означает (CH2)nSO2NHR2.
4. Соединение по одному из параграфов 1-3, где n равно 0.
5. Соединение по одному из параграфов 1-3, где n равно 1.
6. Соединение по любому из параграфов 1-5, где R2 означает C1-6 алкил, незамещенный или замещенный циклоалкил, C1-6 галогеналкил, или незамещенный или замещенный арил.
7. Соединение по параграфу 6, где указанный циклоалкил или арил замещен одним или большим количеством следующих: галоген, C1-6 алкил, C1-6 галогеналкил, C2-6 алкенил, C2-6 галогеналкенил, C2-6 алкинил, C2-6 галогеналкинил, CN, NO2, NH2, N(C1-6 алкил)2, OH или OC1-6 алкил.
8. Соединение по параграфу 1 или 2, где R1 означает (CH2)mNHSO2R2.
9. Соединение по одному из параграфов 1, 2 или 8, где m равно 0.
10. Соединение по одному из параграфов 1, 2 или 9, где m равно 1.
11. Соединение по любому из параграфов 1, 2 или 8-10, где R2 означает C1-6 алкил, незамещенный или замещенный циклоалкил, C1-6 галогеналкил, или незамещенный или замещенный арил.
12. Соединение по параграфу 11, где указанный циклоалкил или арил замещен одним или большим количеством следующих: галоген, C1-6 алкил, C1-6 галогеналкил, C2-6 алкенил, C2-6 галогеналкенил, C2-6 алкинил, C2-6 галогеналкинил, CN, NO2, NH2, N(C1-6 алкил)2, OH или OC1-6 алкил.
13. Соединение по любому из параграфов 1-12, где X означает CH.
14. Соединение по любому из параграфов 1-13, где Y означает CH.
15. Соединение по любому из параграфов 1-12, где один или большее количество из X и Y означает CR3, где каждый R3 означает галоген, цианогруппу или C1-6 алкил.
16. Соединение, выбранное из группы, включающей:
N-метил-6-[метил(7H-пирроло[2,3-d]пиримидин-4-ил)амино]спиро[3.3]гептан-2-сульфонамид;
N-этил-6-[метил(7H-пирроло[2,3-d]пиримидин-4-ил)амино]спиро[3.3]гептан-2-сульфонамид;
6-[метил(7H-пирроло[2,3-d]пиримидин-4-ил)амино]-N-пропилспиро[3.3]гептан-2-сульфонамид;
N-изопропил-6-[метил(7H-пирроло[2,3-d]пиримидин-4-ил)амино]спиро[3.3]гептан-2-сульфонамид;
N-циклопропил-6-[метил(7H-пирроло[2,3-d]пиримидин-4-ил)амино]спиро[3.3]гептан-2-сульфонамид;
6-[метил(7H-пирроло[2,3-d]пиримидин-4-ил)амино]-N-(2,2,2-трифторэтил)спиро[3.3]гептан-2-сульфонамид;
N-изобутил-6-[метил(7H-пирроло[2,3-d]пиримидин-4-ил)амино]спиро[3.3]гептан-2-сульфонамид;
N-трет-бутил-6-[метил(7H-пирроло[2,3-d]пиримидин-4-ил)амино]спиро[3.3]гептан-2-сульфонамид;
N-циклобутил-6-[метил(7H-пирроло[2,3-d]пиримидин-4-ил)амино]спиро[3.3]гептан-2-сульфонамид;
N-циклопентил-6-[метил(7H-пирроло[2,3-d]пиримидин-4-ил)амино]спиро[3.3]гептан-2-сульфонамид;
N-[2-[метил(7H-пирроло[2,3-d]пиримидин-4-ил)амино]спиро[3.3]гептан-6-ил]бензолсульфонамид;
2-хлор-N-[2-[метил(7H-пирроло[2,3-d]пиримидин-4-ил)амино]спиро[3.3]гептан-6-ил]бензолсульфонамид;
4-хлор-N-[2-[метил(7H-пирроло[2,3-d]пиримидин-4-ил)амино]спиро[3.3]гептан-6-ил]бензолсульфонамид;
N-[2-[метил(7H-пирроло[2,3-d]пиримидин-4-ил)амино]спиро[3.3]гептан-6-ил]-4-(трифторметил)бензолсульфонамид;
N-[2-[метил(7H-пирроло[2,3-d]пиримидин-4-ил)амино]спиро[3.3]гептан-6-ил]метансульфонамид;
N-[2-[метил(7H-пирроло[2,3-d]пиримидин-4-ил)амино]спиро[3.3]гептан-6-ил]этансульфонамид;
N-[2-[метил(7H-пирроло[2,3-d]пиримидин-4-ил)амино]спиро[3.3]гептан-6-ил]пропан-1-сульфонамид;
N-[2-[метил(7H-пирроло[2,3-d]пиримидин-4-ил)амино]спиро[3.3]гептан-6-ил]пропан-2-сульфонамид;
2-метил-N-[2-[метил(7H-пирроло[2,3-d]пиримидин-4-ил)амино]спиро[3.3]гептан-6-ил]пропан-1-сульфонамид;
N-[2-[метил(7H-пирроло[2,3-d]пиримидин-4-ил)амино]спиро[3.3]гептан-6-ил]циклопентансульфонамид;
3,3,3-трифтор-N-[2-[метил(7H-пирроло[2,3-d]пиримидин-4-ил)амино]спиро[3.3]гептан-6-ил]пропан-1-сульфонамид;
N-((6-(метил(7H-пирроло[2,3-d]пиримидин-4-ил)амино)спиро[3.3]гептан-2-ил)метил)метансульфонамид;
N-((6-(метил(7H-пирроло[2,3-d]пиримидин-4-ил)амино)спиро[3.3]гептан-2-ил)метил)этансульфонамид;
N-метил-6-[метил(9H-пурин-6-ил)амино]спиро[3.3]гептан-2-сульфонамид;
(энантиомер A)-N-метил-6-[метил(7H-пирроло[2,3-d]пиримидин-4-ил)амино]спиро[3.3]гептан-2-сульфонамид;
(энантиомер B)-N-метил-6-[метил(7H-пирроло[2,3-d]пиримидин-4-ил)амино]спиро[3.3]гептан-2-сульфонамид;
6-[метил(7H-пирроло[2,3-d]пиримидин-4-ил)амино]спиро[3.3]гептан-2-сульфонамид;
N,N-диметил-6-[метил(7H-пирроло[2,3-d]пиримидин-4-ил)амино]спиро[3.3]гептан-2-сульфонамид; и
N-метил-N-(2-пирролидин-1-илсульфонилспиро[3.3]гептан-6-ил)-7H-пирроло[2,3-d]пиримидин-4-амин,
или его ветеринарная или фармацевтическая соль.
17. Композиция, содержащая соединение по любому из параграфов 1-16 и фармацевтически или ветеринарно приемлемый носитель.
18. Комбинация, содержащая соединение по любому из параграфов 1-16 и одно или большее количество других фармацевтически или ветеринарно активных веществ.
19. Способ лечения зуда или атопического дерматита, включающий:
введение нуждающемуся в нем субъекту эффективного количества соединения по любому из параграфов 1-16.
20. Способ по параграфу 19, где субъектом является млекопитающее.
21. Способ по параграфу 20, где млекопитающее выбрано из группы, состоящей из следующих: люди, крупный рогатый скот, овцы, козы, ламы, альпаки, свиньи, лошади, ослы, собаки, кошки, домашний скот-млекопитающие, домашние млекопитающих или млекопитающие-спутники.
22. Соединение по любому из параграфов 1-16 для применения в медицине.
23. Соединение по любому из параграфов 1-16 для приготовления лекарственного средства для лечения зуда или атопического дерматита.
24. Применение соединения по любому из параграфов 1-16 для лечения зуда или атопического дерматита.
Все публикации, патенты и заявки ан патенты, цитированные в настоящем описании, включены в настоящее изобретение в качестве ссылки для положений, для которых используется такое цитирование.
Исследуемые соединения в экспериментах, описанных в настоящем изобретении, использовались в свободной форме или в форме соли.
Конкретные наблюдающиеся ответы могут меняться в соответствии с конкретным выбранным активным соединением и в зависимости от него и от того содержатся ли носители, а также использованного типа препарата и режима введения, и такие ожидаемые изменения или различия результатов рассматриваются в соответствии с практикой настоящего изобретения.
Хотя конкретными вариантами осуществления настоящего изобретения являются проиллюстрированные и подробно описанные в настоящем изобретении, настоящее изобретение не ограничивается только ими. Приведенное выше подробное описание представлено, как типичное для настоящего изобретения и его не следует рассматривать, как вводящее какое-либо ограничение настоящего изобретения. Модификации очевидны для специалистов в данной области техники и все модификации, которые не отклоняются от сущности настоящего изобретения, предназначены для включения в объем прилагаемой формулы изобретения.
| название | год | авторы | номер документа |
|---|---|---|---|
| {3-[(7H-ПИРРОЛО[2,3-d]ПИРИМИДИН-4-ИЛ)АЗОЛИЛ]АЗЕТИДИН-3-ИЛ}АЦЕТОНИТРИЛЫ В КАЧЕСТВЕ ИНГИБИТОРОВ ЯНУС КИНАЗ | 2015 |
|
RU2601410C1 |
| БИЦИКЛИЧЕСКИЕ АМИНЫ В КАЧЕСТВЕ НОВЫХ ИНГИБИТОРОВ JAK-КИНАЗЫ | 2018 |
|
RU2764980C2 |
| ИНГИБИТОРЫ GCN2 И ИХ ПРИМЕНЕНИЕ | 2019 |
|
RU2811408C2 |
| Ингибиторы рецептора эпидермального фактора роста | 2022 |
|
RU2821531C2 |
| ПИРРОЛО[2,3-В]ПИРАЗИНЫ В КАЧЕСТВЕ ИНГИБИТОРОВ SYK | 2013 |
|
RU2656853C2 |
| БИ-АРИЛ-МЕТА-ПИРИМИДИНОВЫЕ ИНГИБИТОРЫ КИНАЗ | 2006 |
|
RU2589878C2 |
| БИ-АРИЛ-МЕТА-ПИРИМИДИНОВЫЕ ИНГИБИТОРЫ КИНАЗ | 2006 |
|
RU2597364C2 |
| ПРОИЗВОДНЫЕ ЦИКЛИЧЕСКОГО ЦИАНОЕНОНА КАК МОДУЛЯТОРЫ KEAP1 | 2021 |
|
RU2822828C1 |
| ТИАЗОЛОПИРИМИДИНОНЫ В КАЧЕСТВЕ МОДУЛЯТОРОВ АКТИВНОСТИ РЕЦЕПТОРОВ NMDA | 2014 |
|
RU2703273C2 |
| НОВОЕ ПРОИЗВОДНОЕ ПИРРОЛА, ИМЕЮЩЕЕ В КАЧЕСТВЕ ЗАМЕСТИТЕЛЕЙ УРЕИДОГРУППУ, АМИНОКАРБОНИЛЬНУЮ ГРУППУ И БИЦИКЛИЧЕСКУЮ ГРУППУ, У КОТОРЫХ МОГУТ БЫТЬ ЗАМЕСТИТЕЛИ | 2009 |
|
RU2500669C2 |
Группа изобретений относится к органической химии и включает N-метил-6-[метил(7H-пирроло[2,3-d]пиримидин-4-ил)амино]спиро[3.3]гептан-2-сульфонамид, композицию и комбинацию на его основе, способ лечения зуда и атопического дерматита, применение. Технический результат - N-метил-6-[метил(7H-пирроло[2,3-d]пиримидин-4-ил)амино]спиро[3.3]гептан-2-сульфонамид, обладающий ингибирующей активностью в отношении JAK 1 и применяемый для лечения зуда и атопического дерматита. 5 н. и 3 з.п. ф-лы, 2 табл., 30 пр.
1. Соединение, которое представляет собой:
N-метил-6-[метил(7H-пирроло[2,3-d]пиримидин-4-ил)амино]спиро[3.3]гептан-2-сульфонамид.
2. Композиция для лечения зуда и атопического дерматита, содержащая эффективное количество соединения по п. 1 и фармацевтически или ветеринарно приемлемый носитель.
3. Комбинация для лечения зуда и атопического дерматита, содержащая эффективное количество соединения по п. 1 и одного или большее количество других фармацевтически или ветеринарно активных веществ.
4. Способ лечения зуда и атопического дерматита, включающий введение нуждающемуся в нем субъекту эффективного количества соединения по п. 1.
5. Способ по п. 4, где субъектом является млекопитающее.
6. Способ по п. 5, где млекопитающее выбрано из группы, состоящей из следующего: люди, крупный рогатый скот, овцы, козы, ламы, альпаки, свиньи, лошади, ослы, собаки, кошки, домашний скот-млекопитающие, домашние млекопитающие или млекопитающие-спутники.
7. Соединение по п. 1 для приготовления лекарственного средства для лечения зуда и атопического дерматита.
8. Применение соединения по п. 1 для лечения зуда и атопического дерматита.
| WO 9965908 A1, 23.12.1999 | |||
| US 9549929 B2, 24.01.2017 | |||
| US 20160045508 А1, 18.02.2016 | |||
| Michael L | |||
| Vazquez et al., Identification of N-{ cis -3-[Methyl(7H-pyrrolo[2,3- d ]pyrimidin-4-yl)amino]cyclobutyl} propane-1-sulfonamide (PF-04965842): a selective JAK1 clinical candidate for the treatment of autoimmune diseases | |||
| Journal of medicinal chemistry, |
Авторы
Даты
2023-09-19—Публикация
2019-11-04—Подача