Область техники
Изобретение относится к методам анализа, в частности к определению специфической активности вируса гриппа, при реакции одиночной радиальной иммунодиффузии (ОРИД). Изобретение включает тест-систему с образцами, предназначенными для проведения ОРИД.
Предшествующий уровень техники
Вирус гриппа является одним из самых распространенных сезонных заболеваний, в частности, вирусы гриппа A и B вызывают сезонные эпидемии у людей. По статистике Всемирной организации здравоохранения (ВОЗ), от респираторных заболеваний, связанных с сезонным гриппом, в Европейском регионе ВОЗ ежегодно умирает более 44 000 человек, а в масштабах мира число таких случаев смерти доходит до 650 000 в год. В связи с этим особенное значение имеет профилактика против сезонного гриппа. В целях профилактики используют вакцины различного типа, например, живые вакцины, инактивированные вакцины и субъединичные вакцины. Широкое распространение получили живые и инактивированные вакцины. Они представляют собой вирус гриппа искусственно ослабленный (живая вакцина) или убитый, т.е. прошедший инактивацию и очистку (инактивированная вакцина). При этом, специфическая активность такой вакцины и ее способность индуцировать антитела при введении в организм может быть различаться и зависеть от способа ее получения. Однако, несмотря на различные технологии культивирования штаммов гриппа, получения антигенов и их выделения и очистки, все вакцины против гриппа содержат иммуногенные белки: гемагглютинин и нейраминидазу, которые и определяют специфическую активность вакцины. В связи с этим особенное значение имеет стандартизация вакцин и определение их специфической активности.
Кроме того, каждый год штаммы сезонного гриппа меняются, т.к. вирус гриппа достаточно легко мутирует и разносится, в т.ч. птицами. В связи с этим, вакцина от гриппа представляет собой препарат, содержащий антигены гриппа сезонных штаммов, и в этом случае невозможно разработать вакцину с определенным штаммовым составом, который был бы стандартизован и закреплен в течение нескольких лет.
Таким образом, при разработке и получении антигенов вируса гриппа и вакцин, их содержащих, необходимы качественные и надежные методы анализа на специфическую активность.
Как правило, для стандартизации противогриппозных вакцин используются показатели: специфическая активность, содержание общего белка, содержание овальбумина, иммуногенность и реактогенность. Для исследования специфической активности применяют реакцию одиночной радиальной иммунодиффузии (ОРИД). Однако, в связи с тем, что реакция ОРИД проводится с применением стандартного антигена вируса гриппа и моноспецифической сыворотки, полученной из крови иммунизированного животного, качество такой реакции и, соответственно, специфическая активность противогриппозной вакцины может сильно зависеть от качества применяемых стандартов, стандартных образцов. В настоящее время доступны несколько коммерческих тест-систем для проведения ОРИД: система стандартов Национального института биологических стандартов и контроля (NIBSC, Великобритания) или TGA (Австралия). Данные системы включают стандарт антигена вируса гриппа и сыворотку к гемагглютинину вируса гриппа, позволяющие определить специфическую активность полученной вакцины, содержащей инактивированный антиген вируса гриппа. Так, данные стандарты, в частности, стандарт моноспецифической сыворотки гриппа получен на основе овечьей крови. Кроме того, данные стандарты производятся иностранными компаниями, и способ их получения не указан в прилагаемой спецификации. Таким образом, существует возможность замены стандартных тестов на другие без уведомления потребителей, что может отражаться на контроле качества инактивированных гриппозных вакцин.
В настоящем изобретении предложена тест-система для определения специфической активности вируса гриппа или инактивированной гриппозной вакцины, содержащая стандартный антиген гриппа, стандарт моноспецифической сыворотки к гемагглютинину вируса гриппа.
Описание изобретения
Согласно изобретению, предложен способ получения стандартного гемагглютинина вируса гриппа, включающий стадии:
- получение разбавленного вирусного концентрата, включающего очищенный вирусный концентрат и фосфатно- буферный раствор;
- стабилизация разбавленного вирусного концентрата путем добавления раствора бычьего сывороточного альбумина с концентрацией 1-5%;
- получение стандартного гемаагглютинина вируса гриппа с концентрацией не менее 60 мкг/мл.
В одном из вариантов реализации способ получения стандартного гемагглютинина вируса гриппа дополнительно включает розлив и лиофилизацию полученного стандартного гемагглютинина вируса грипп. В другом варианте реализации способ получения стандартного гемагглютинина вируса гриппа включает стадию получения разбавленного вирусного концентрата с помощью добавления раствора бычьего сывороточного альбумина с концентрацией 1%.
Также, согласно способу по изобретению, предложен способ получения стандарта моноспецифической сыворотки к гемагглютинину вируса гриппа, включающий стадии:
- обработка ферментом бромелаином очищенного вирусного концентрата;
- очистка полученного вирусного концентрата эксклюзионной хроматографией на сорбентах с диапазоном фракционирования от 10 до 1500 кДа;
- неоднократная иммунизация овец или кроликов антигеном, полученным способом, приведенным выше, в комбинации с адъювантом Фрейнда;
- получение нативной иммунной сыворотки путем неоднократной иммунизации животных, с титром антигена не менее 1:8 в иммунодиффузии по Оухтерлони.
В одном из вариантов реализации способ получения стандарта моноспецифической сыворотки к гемагглютинину вируса гриппа включает трехкратную иммунизацию кроликов с интервалом в 7 дней, и отбор крови на 28 день после последней иммунизации.
В другом варианте реализации, способ получения стандарта моноспецифической сыворотки к гемагглютинину вируса гриппа включает пятикратную иммунизацию овец с интервалом в 7 дней, и отбор крови на 35 день после последней иммунизации.
В еще одном варианте реализации, способ получения стандарта моноспецифической сыворотки к гемагглютинину вируса гриппа включает лиофилизацию стандарта моноспецифической сыворотки к гемааглютинину вируса гриппа после получения.
Также предложена тест-система для определения специфической активности вируса гриппа, включающая:
- стандартный гемагглютинин вируса гриппа, полученный способом, описанным выше;
- стандарт моноспецифической сыворотки к гемагглютинину вируса гриппа, полученный способом, описанным выше.
Также предложено применение тест-системы согласно изобретению для определения специфической активности гриппозной вакцины, в т.ч. инактивированной.
Описание фигур
На Фиг. 1 представлена пластинка с проведенным анализом ОРИД (пример 4). Обозначения: 3, 7 - стандартные образцы; 1, 2, 5, 6, - моновалентная вакцина; 4, 8 - квадривалентная вакцина.
На Фиг. 2 показана типовая схема получения стандартного антигена вируса гриппа согласно изобретению.
На Фиг. 3 показана типовая схема получения стандарта моноспецифической сыворотки к гемагглютинину вируса гриппа.
На Фиг. 4 приведены результаты анализа ОРИД при сравнении стандартного антигена вируса гриппа и стандарта моноспецифической сыворотки согласно изобретению и образцов TGA на примере сыворотки овец.
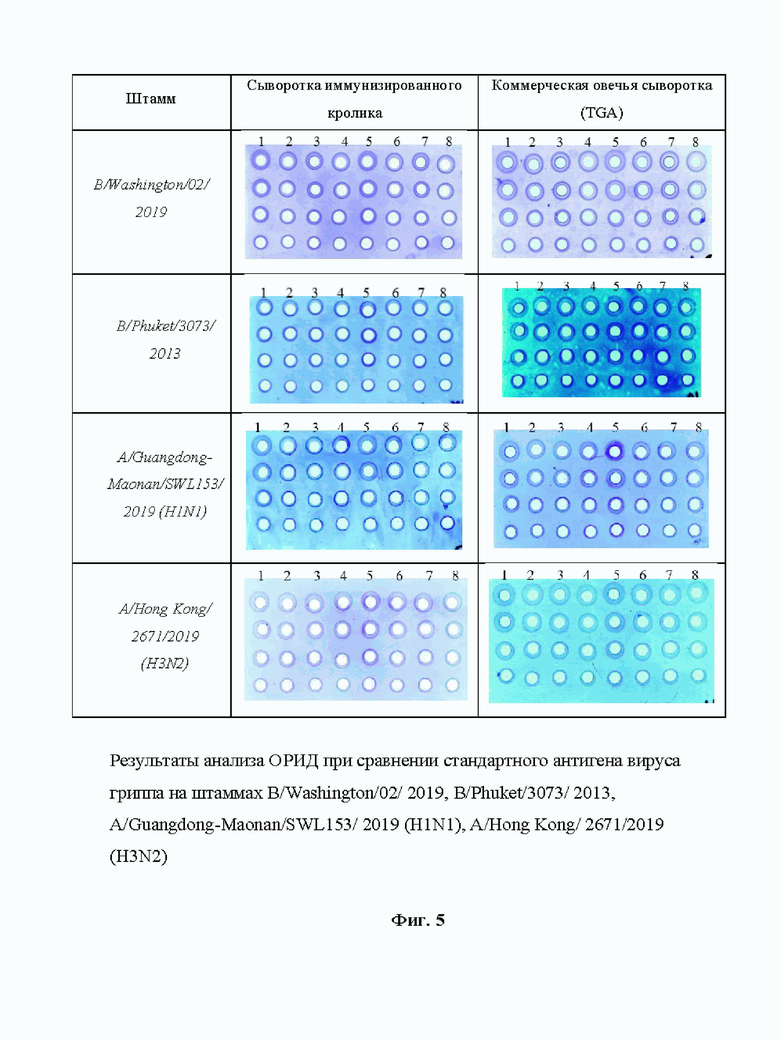
На Фиг. 5 приведены результаты анализа ОРИД при сравнении стандартного антигена вируса гриппа и стандарта моноспецифической сыворотки согласно изобретению и образцов TGA на примере сыворотки кроликов.
Подробное описание изобретения
При производстве противогриппозных (гриппозных) вакцин, в т.ч. полученных методом инактивации, для определения их активности применяют различные методы анализа. Одним из методом анализа по определению специфической активности вируса гриппа или антигена, входящего в состав вакцины, является реакция одиночной радиальной иммунодиффузии (ОРИД). В ОРИД может быть использован международный стандарт моноспецифической сыворотки к гемагглютинину вируса гриппа производства Национального института биологических стандартов и контроля (NIBSC, Великобритания) или Управления по контролю за оборотом лекарственных средств и изделий медицинского назначения (TGA, Австралия). Реакцию проводят в агарозном геле, с применением для разведения стандартного образца антигена (гемаагглютинина, ГА) и сыворотки буфера, например, фосфатно-буферным раствором. Суть метода заключается в следующем: гемагглютинин (ГА), диффундируя из лунок агарозного геля в радиальном направлении, реагирует со специфическими антителами сыворотки, находящейся в агарозе, и образует в геле зону преципитации. Размеры окружающей лунку зоны преципитации находятся в прямой зависимости от количества антигена, внесенного в лунку. При этом, имеет значение активность самого стандарта гемагглютинина и анализируемой субстанции (активного вещества вакцины), в противном случае результаты будет сложно сравнить между собой. Таким образом, для анализа ОРИД имеет значение качество стандартных образцов гемагглютинина и сыворотки, используемой для проведения ОРИД.
Техническим результатом изобретения является получение стандартных образцов: стандартного гемагглютинина вируса гриппа и стандарта моноспецифической сыворотки к гемагглютинину вируса гриппа для использования в методике анализа ОРИД для определения специфической активности, в т.ч. в тест-системе, при этом стандартные образцы имеют качество, сравнимое или повышенное относительно предшествующего уровня техники, имеют доказанную эффективность, и для их получения можно использовать животных различных видов.
Технический результат достигается за счет получения стандартных образцов гемагглютина и стандарта моноспецифической сыворотки из крови овец или кроликов по способу согласно изобретению, при этом стандартные образцы используются для определения специфической активности гриппозной вакцины, например, инактивированной гриппозной вакцины, имеют качественные и количественные анализы, сравнимые или превосходящие стандартные образцы предшествующего уровня техники.
Согласно изобретению, предложен способ получения стандартного гемагглютинина вируса гриппа, включающий стадии:
- получение разбавленного вирусного концентрата, включающего очищенный вирусный концентрат и фосфатно-буферный раствор;
- стабилизация разбавленного вирусного концентрата путем добавления раствора альбумина с концентрацией 1-5%;
- получение стандартного гемагглютинина вируса гриппа, с концентрацией не менее 60 мкг/мл.
Вирусный концентрат может быть получен различными методами, описанными в предшествующем уровне техники. Например, вирусный концентрат может быть получен путем заражения вирусом гриппа куриных эмбрионов с последующим выделением вирусно-аллантоисной жидкости и инвактивации вируса различными агентами, согласно патенту RU 2535153 или RU 2754398. Используемые разбавленные вирусные концентраты должны иметь следующие показатели: содержание Белка (по методике Лоури) 500±100 мкг/мл, и/или содержание гемагглютинина -150±7,5 мкг/мл по методу ОРИД или по денситометрии. Разбавленный вирусный концентрат получают из очищенного вирусного концентрата путем его разбавления фосфатно-буферным раствором. Фосфатно-буферный раствор готовят различными известными способами, раствор имеет рН от 7,2 до 7,6. Для получения разбавленного вирусного концентрата в очищенный вирусный концентрат добавляют заранее рассчитанное количество фосфатно-буферного раствора. В данной области техники известны методики расчета при добавлении фосфатно-буферного раствора. Объем очищенного вирусного концентрата, объема фосфатно-буферного раствора рассчитывается для каждой серии стандарта антигена вируса гриппа в зависимости от значений концентрации белка исходного очищенного вирусного концентрата и штамма актуального вируса гриппа. При этом, содержание гемагглютинина в очищенном вирусном концентрате зависит от штамма вируса гриппа, и влияет на способность индуцировать антитела в организме пациента при введении, а также влияет на проведение реакции ОРИД.
Далее, для стабилизации полученного разбавленного вирусного концентрата используют раствор сывороточного бычьего альбумина с концентрацией 1-5% масс. или масс/об., более предпочтительно с концентрацией 1% масс. Раствор бычьего сывороточного альбумина получают известными методами, в т.ч. растворением коммерчески доступного порошка сывороточного альбумина в фосфатно-буферном растворе с рН 7,4 ± 0,1 в расчетном количестве до необходимой концентрации.
Далее, получают стандартный гемагглютинин вируса гриппа с концентрацией не менее 60 мкг/мл. В случае, если после стабилизации раствором бычьего сывороточного альбумина и разбавлением фосфатно-буферным раствором концентрация гемагглютинина в полученном разбавленном вирусном концентрате ниже 60 мкг/мл, то проводят концентрирование полученного разбавленного вирусного концентрата, или добавляют очищенный вирусный концентрат до получения стандартного гемагглютинина вируса гриппа с концентрацией не менее 60 мкг/мл. Методы получения концентратов, в т.ч. с определенной концентрацией гемагглютинина известны специалисты в данной области техники.
После получения стандартного гемагглютинина вируса гриппа для пролонгирования срока хранения раствор может быть разлит во флаконы для лиофилизации полученного стандартного гемагглютинина вируса гриппа. Как правило, для лиофилизации разливают водный раствор в специальные флаконы для замораживания, неплотно укупоривают, замораживают и далее проводят лиофильную сушку при пониженном давлении. Такой вид сушки позволяет сохранить активность стандартного образца антигена вируса гриппа на длительный период.
Также, согласно способу по изобретению, предложен способ получения стандарта моноспецифической сыворотки к гемагглютинину вируса гриппа, включающий стадии:
- обработка ферментом бромелаином очищенного вирусного концентрата;
-очистка полученного вирусного концентрата эксклюзионной хроматографией на сорбентах с диапазоном фракционирования от 10 до 1500 кДа;
- неоднократная иммунизация овец или кроликов антигеном, полученным способом, приведенным выше, в комбинации с адъювантом Фрейнда;
- получение нативной иммунной сыворотки путем неоднократной иммунизации животных, с титром антигена не менее 1:8 в иммунодиффузии по Оухтерлони.
Обработка ферментом бромелаином проводится в виде добавления раствора бромелаина с концентрацией 0,06-10 мг/мл, предпочтительно с концентрацией от 0,06 - 4 мг/мл. Данный раствор получают известными методами, например, растворением заранее рассчитанного количества коммерчески доступного бромелаина в воде. Подбор оптимального соотношения белок/фермент (бромелаин) проводят отдельно для каждого серотипа вируса гриппа при различных штаммах. Проводят серию экспериментов по подбору соотношений «белок - фермент», с учетом выбранной концентрации. Оценку эффективности выделения гемагглютинина вируса гриппа проводят методом денситометрии. За оптимальное соотношение принимают соотношение «белок - фермент», в котором интенсивность линии на уровне HA0 будет наибольшей по сравнению с остальными.
Дополнительно после стадии обработки ферментом может быть выполнена стадия концентрирования и очистки при помощи хроматографии гидрофобных взаимодействий. Используемые сорбенты могут иметь октил-, бутил-, фенил-привитую фазу на основе сефарозы, предпочтительно - фенилсефарозы. Могут быть использованы Butyl Sepharose 6 FF, Capto Bytyl ImpRes, Phenyl Sepharose 6 FF (Low Sub), Phenyl Sepharose 6 FF (High Sub), Octyl Sepharose 4 FF, Phenyl SepFast High Res. Для выполнения стадии к образцу после ферментативного расщепления добавляют сульфат аммония до концентрации 1,4 М. И проводят нанесение на хроматографическую колонку заполненную сорбентом (Phenyl Sepharose 6 FF (High Sub)), после окончания нанесения колонку промывают 5 CV буфером нанесения (1,4 М Аммония сульфат, 10 мМ фосфат натрия pH=7.5) и элюируют 5 CV буфером элюирования (10 мМ фосфат натрия pH=7.5). Собирают Пик после элюирования и проводят очистку методом эксклюзионной хроматографии. Выход пика контролируют спектрофотометрически, при длине волны 215 и 280 нм.
Далее, после обработки ферментом проводят очистку полученного вирусного концентрата с помощью эксклюзионной хроматографии. Для этого может быть использован различный сорбент, но предпочтительно использование сорбентов с диапазоном фракционирования от 10 до 1500 кДа, апример Sephacryl S-300, Sephacryl S-200, WorkBeads 40/1000 SEC, Macro-Prep SE 1000, Superose 6, Superdex 200 и другие. После очистки полученный вирусный концентрат имеет показатель: общий белок (метод с реагентом Бредфорд) - не менее 50 мкг/мл. При отклонении от данного показателя проводят добавление очищенного вирусного концентрата, полученного в другой партии или серии, или проводят концентрирование очищенного вирусного концентрата до достижения желаемого показателя. Далее, полученный вирусный концентрат используют для иммунизации животных, из которых потом получают нативную иммунную сыворотку. Иммунизация включает неоднократную иммунизацию овец или кроликов и отбор у них крови методом кровопускания. Неоднократная иммунизация подразумевает введение антигена от трех до пяти раз с интервалом не менее 3 дней после проведения иммунизации, предпочтительно, не менее 7 дней между иммунизациями. При этом, иммунизация, схема иммунизации, перерыв между иммунизациями, доза вводимого антигена, а также метод отбора крови зависят от типа животного, его массы и других факторов, влияющих на содержание антигена в крови. Согласно изобретению, предпочтительно, чтобы в качестве иммунизированных животных использовались овцы или кролики, с неоднократной иммунизацией, в разрывом между введением антигена в 7 дней. Отбор крови осуществляют не ранее чем на 28 день после последней иммунизации, например, в случае кроликов, и не ранее, чем на 35 день после последней иммунизации в случае овец.
В одном из вариантов реализации способ получения стандарта моноспецифической сыворотки к гемагглютинину вируса гриппа включает трехкратную иммунизацию кроликов с интервалом в 7 дней, и отбор крови на 28 день после последней иммунизации. В другом варианте реализации, способ получения стандарта моноспецифической сыворотки к гемагглютинину вируса гриппа включает пятикратную иммунизацию овец с интервалом в 7 дней, и отбор крови на 35 день после последней иммунизации.
Получение нативной сыворотки можно проводить путем кровопускания у животного и центрифугирования полученной крови с отделением сыворотки после центрифугирования. Специалисту известны и другие способы отделения сыворотки из крови. Полученная сыворотка должна иметь титр антигена не менее 1:8 в иммунодиффузии по Оухтерлони. В противном случае, кровь у иммунизированных животных отбирают заново, спустя не менее 3 дней от даты последнего отбора, и снова проводят выделение сыворотки.
Дополнительно, способ получения стандарта моноспецифической сыворотки к гемагглютинину вируса гриппа включает лиофилизацию стандарта моноспецифической сыворотки после получения, в случае, если необходимо пролонгировать срок хранения стандарта моноспецифической сыворотки.
Также изобретение предлагает тест-систему для определения специфической активности вируса гриппа, включающая:
- стандартный гемагглютинин вируса гриппа, полученный способом, описанным выше;
- стандарт моноспецифической сыворотки к гемагглютинину вируса гриппа, полученный способом, описанным выше.
При этом, в качестве стандартов могут быть использованы как готовые к применению растворы, так и лиофилизаты стандартов с последующим восстановлением их в раствор с добавленим растворителя (например, фосфатно-буферного раствора).
Также предложено применение тест-системы согласно изобретению для определения специфической активности гриппозной вакцины, в т.ч. инактивированной гриппозной вакцины.
Следует иметь в виду, что в контексте настоящего изобретения при использовании терминов может подразумеваться следующее. В случае употребления общепринятых терминов они интерпретируются в общеизвестном смысле. В контексте настоящего описании термины «антиген гриппа», «антиген вируса гриппа» и «гемагглютинин вируса гриппа» могут использоваться взаимозаменяемо до определенной степени, если не указано иное. Все указанные значения показателей, и диапазоны показателей должны пониматься как значения и диапазоны, с отступлением в верхней и нижней границы на предел погрешности, для данного показателя. Так, например, если указана концентрация 1-5% масс., то с учетом погрешности в 5% данный диапазон концентрации ограничен 0,95-5,05% масс.
Далее, в целях иллюстрации настоящего изобретения ниже будут приведены примеры по его реализации, которые никоим образом не ограничивают объем настоящего изобретения.
Примеры
Пример 1
Получение стандартного антигена (гемагглютинина) вируса гриппа
Очищенный вирусный концентрат (ОВК) получали по способу, раскрытом в патенте RU 2535153 (Способ получения высокоочищенных вирионных концентратов).
В стеклянную бутыль вместимостью 250 мл помещали расчетное количество очищенного вирусного концентрата (ОВК) и расчетное количество фосфатно-буферного раствора (ФБР) рН 7,4, перемешивали в течение 10 мин. Рассчитывали объем ФБР рН 7,4, который нужно добавить к 1-3 мл ОВК для получения разбавленного вирусного концентрата (РВК) в объеме (50 ± 5) мл с концентрацией по белку (500 ± 100 мкг/мл). Отбирали по 5 мл полученного РВК для стандартизации и 2 мл для определения контроля по параметру содержание белка.
Далее, проводили стабилизацию разбавленного вирусного концентрата. Для этого к разбавленному вирусному концентрату, полученному на предыдущей стадии добавляли 1/9 часть по объему 1-5% раствора бычьего сывороточного альбумина (БСА) и перемешивали в течение 10 мин.
Далее, разливали полученный антиген в заранее подготовленные флаконы и укупоривали пробками, замораживали с помощью криозаморозки. Флаконы выдержали в слое азота 5-10 мин. Замороженные флаконы со стандартным антигеном устанавливали в камеру лиофильной сушки и сушили при температуре минус (48±2)°С и остаточное давление 8Па в течение 20 часов. Полученный стандартный гемагглютинин вируса гриппа хранили при минус 20°С, в течение 1 года.
Стандарт антигена получали на основе штаммов гриппа, объявленных Всемирной организацией здравоохранения, как эпидемиологические на период 2019-2020 гг: A/Guangdong-Maonan/SWL1536/2019 (H1N1), A/Hong Kong/2671/2019 (H3N2), B/Washington/02/2019 В/California/12/2015 (BX-59B) (B/Phuket/3073/2013-like).
Полученный стандарт антигена имел следующие показатели:
Пример 2
Получение стандарта моноспецифической сыворотки к гемагглютинину вируса гриппа после иммунизации овец
Очищенный вирусный концентрат (ОВК) получали по способу, раскрытом в патенте RU 2535153 (Способ получения высокоочищенных вирионных концентратов). Проводили обработку ОВК ферментом бромелаином: в подготовленную стеклянную бутыль объемом 0,25 л помещали 50 мл ОВК и 50 мл раствора бромелаина с различной концентрацией от 0,06 - 10 мг/мл, предпочтительно от 0,06 - 4 мг/мл. Полученную смесь помещали с содержимым в термостат и инкубировали при 37°С в течение 24 ч. Далее, проводили выделение антигена (гемагглютинина) вируса гриппа. Полученный на предыдущей стадии надосадочный раствор центрифугировали при 61 000 g в течение 5 мин и охлаждали до 4°С. Декантат переносили в емкость для фильтрационных модулей Viva flow (Ф-14) с размером пор 10 кДа, добавляли трехкратный объем буферного раствора ФБР рН 7,4 (45 мл) и концентрировали в режиме диафильтрации до объема равного 1/3 от первоначального объема (5 мл). Полученный раствор выделенного антигена (гемагглютинина) вируса гриппа помещали в стеклянную бутыль. Содержание белка в полученном концентрате субъединиц вируса гриппа было в интервале от 2,0 мг/мл до 4,0 мг/мл.
Далее проводили хроматографическую очистку полученного раствора выделенного антигена (гемагглютинина) вируса гриппа. Очистку проводили с применением колонки хроматографической XК 16/20 (ХК-15), упакованной сорбентом «Sephacryl®-S300 HR», подключенной к системе хроматографической установки NGC, BioRad (Х-16). На колонку наносили не более 5,0 мл раствора выделенного антигена (гемагглютинина) вируса гриппа и элюировали ФБР рН 7,2 со скоростью 2 мл/мин. Детекцию проводили при 280 нм (и 215 нм). Сбор фракций осуществляли по 2,5 мл. Проводили 4-6 последовательных цикла хроматографической очистки. В стеклянной бутыли вместимостью 0,25 л объединяли три фракции, соответствующие максимуму пика при элюции 0,5-0,7 объемов колонки (Cv) и оптической плотности от 0,1 ое. до 1,0 ое. Содержание общего белка в объединенных фракциях антигена (гемагглютина) вируса гриппа составило не менее 50 мкг/мл, без содержания нейроминидазы по результатам электрофореза. Полученные стандарты антигена (гемагглютина) вируса гриппа хранили при температуре 5°С. Срок годности составил не менее 2 мес.
При необходимости возможно проведение концентрирования объединенных фракций очищенного антигена (гемагглютинина) вируса гриппа. Объединенные фракции очищенного антигена (гемагглютинина) вируса гриппа переносили в емкость для фильтрационных модулей Viva flow (Ф-14) с размером пор 10 кДа, концентрировали до объема равного 2/3 от первоначального объема (10 мл).
Помещали 50 мл раствора очищенного антигена вируса гриппа, полученного ранее, в стеклянную бутыль объемом 0,25 л и добавляли 50 мл ФБР рН 7,4, и перемешивали содержимое бутыли, далее проводили стерилизующую фильтрацию полученного раствора очищенного антигена. Непосредственно перед иммунизацией животного к полученному раствору добавляли адъювант Фрейнда в соотношении 1:1, и перемешивали до получения однородной эмульсии.
Далее, вводили антиген животных - овцам. Для получения сыворотки использовали овец породы Волжские грубошерстные, Романовские, не моложе 2 лет, массой не менее 40,0 кг.
В период карантирования проводили клинический осмотр всех животных. Все животные были клинически здоровыми. Содержание животных (овец) осуществляли в загонах без применения подстилки. В рационе лабораторных животных использовали специализированный корм, а также сено и морковь. Доступ к свежей воде был без ограничений.
Проведение иммунизации овец проводили в виде подкожной инъекции в 2 точки, вводя препарат в объеме по 1,0 мл (200 мкг ГА), перед проведением иммунизации место инъекции обрабатывали ватным тампоном, смоченным спиртом этиловым.
Далее, на 7 день после последней иммунизации проводили повторную иммунизацию овец. Проводили внутримышечную инъекцию в 2 точки, вводя препарат в объеме по 1,0 мл (200 мкг ГА) в левую и правую мышцы задней ноги. Далее, на 14 день после последней иммунизации проводили третью иммунизацию, подкожной инъекцией в 2 точки, вводя препарат в объеме по 1,0 мл (200 мкг ГА), перед проведением иммунизации место инъекции обрабатывали ватным тампоном.
Далее, в случае необходимости, проводили четвертую иммунизацию на 21 день после последней иммунизации. Иммунизацию проводили подкожной инъекцией в 2 точки, вводя препарат в объеме по 1,0 мл (всего 200 мкг ГА) в левую и правую мышцы задней ноги, перед проведением иммунизации место инъекции обрабатывали ватным тампоном, спиртом этиловым. Также возможно, при необходимости, проведение пятой иммунизации на 28 день после последней иммунизации. Проводили внутривенную инъекцию в 1 точку, вводя препарат в объеме 2,0 мл (200 мкг ГА) в яремную вену. Перед проведением иммунизации место инъекции обрабатывали ватным тампоном, смоченным спиртом этиловым.
После проведения иммунизации по схеме выше проводили забор крови у животного. Забор крови у животного-продуцента (кролика) проводили на 28 и 35 день после последней иммунизации. После забора крови проводили получение нативной иммунной сыворотки.
Кровь иммунизированных животных (овец) помещали в центрифужных пробирках в термостат при температуре 37°С на 30 минут. После завершения термостатирования проводили отделение сыворотки с помощью, подготовленной хирургической (скорняжной) иглы от стенок центрифужных стаканов. Центрифужные стаканы с содержимым помещали в холодильник и выдерживали при температуре 5°С в течение 20 часов. После завершения выдержки, проводили центрифугирование сыворотки на центрифуге в течение 3 мин. Отделяли сыворотку от сгустка крови и помещали её в чистую бутыль вместимостью 0,25 л. Добавляли азид натрия в количестве, необходимом для обеспечения 0,5 % раствора по азиду натрия. Хранили полученную сыворотку при температуре 5°С. Срок годности составил 3 мес.
Нативную иммунную сыворотку, полученную ранее, центрифугировали в течение 3 мин. Отделяли сыворотку от осадка и помещали её в чистую бутыль объемом 0,25 л. Нативную иммунную сыворотку разливают по флаконам, флаконы предукупоривают пробками, так, чтобы оставалось отверстие для доступа воздуха между флаконом и пробкой. Флаконы с моноспецифической сывороткой замораживали в течение 18 ч. или проводили криозаморозку при помощи жидкого азота. Далее проводили сушку полученной сыворотки стандартной моноспецифической к гемагглютинину вируса гриппа.
Полученную моноспецифическую сыворотку к гемагглютинину вируса гриппа в флаконах лиофильно сушили при минус 80°С и остаточном давлении (6±2) Па, в течение 20 часов. Полученный стандарт моноспецифической сыворотки к гемагглютинину вируса гриппа имел следующие показатели (на примере стандартов антигена определенных штаммов вируса гриппа):
Пример 3
Получение стандарта моноспецифической сыворотки к гемагглютинину вируса гриппа после иммунизации кроликов
Очищенный вирусный концентрат (ОВК) получали по способу, раскрытом в патенте RU 2535153 (Способ получения высокоочищенных вирионных концентратов). Проводили обработку ОВК ферментом: в подготовленную стеклянную бутыль объемом 0,25 л помещали 50 мл ОВК и 50 мл раствора бромелайна с различной концентрацией от 0,06 - 4 мг/мл. Полученную смесь помещали с содержимым в термостат и инкубировали при 37°С в течение 24 часов. Далее, проводили выделение антигена (гемагглютинина) вируса гриппа. Полученный на предыдущей стадии надосадочный раствор центрифугировали при 61 000 g в течение 5 мин и охлаждали до 4°С. Декантат переносили в емкость для фильтрационных модулей Viva flow (Ф-14) с размером пор 10 кДа, добавляли трехкратный объем буферного раствора ФБР рН 7,4 (45 мл) и концентрировали в режиме диафильтрации до объема равного 1/3 от первоначального объема (5 мл). Полученный раствор выделенного антигена (гемагглютинина) вируса гриппа помещали в стеклянную бутыль. Содержание белка в полученном концентрате субъединиц вируса гриппа было в интервале от 2,0 мг/мл до 4,0 мг/мл.
Далее проводили хроматографическую очистку полученного раствора выделенного антигена (гемагглютинина) вируса гриппа. Очистку проводили с применением колонки хроматографической XК 16/20 (ХК-15), упакованной сорбентом «Sephacryl®-S300 HR», подключенной к системе хроматографической установки NGC, BioRad (Х-16). На колонку наносили не более 5,0 мл раствора выделенного антигена (гемагглютинина) вируса гриппа и элюировали ФБР рН 7,2 со скоростью 2 мл/мин. Детекцию проводили при 280 нм (и 215 нм). Сбор фракций осуществляли по 2,5 мл. Проводили 4-6 последовательных цикла хроматографической очистки. В стеклянной бутыли вместимостью 0,25 л объединяли три фракции, соответствующие максимуму пика при элюции 0,5-0,7 объемов колонки (Cv) и оптической плотности от 0,1 ое. до 1,0 ое. Содержание общего белка в объединенных фракциях антигена (гемагглютина) вируса гриппа составило не менее 50 мкг/мл, без содержания нейроминидазы по результатам электрофореза. Полученные стандарты антигена (гемагглютина) вируса гриппа хранили при температуре 5°С. Срок годности составил не менее 2 мес.
При необходимости возможно проведение концентрирования объединенных фракций очищенного антигена (гемагглютинина) вируса гриппа. Объединенные фракции очищенного антигена (гемагглютинина) вируса гриппа переносили в емкость для фильтрационных модулей Viva flow (Ф-14) с размером пор 10 кДа, концентрировали до объема равного 2/3 от первоначального объема (10 мл).
Помещали 50 мл раствора очищенного антигена вируса гриппа, полученного ранее, в стеклянную бутыль объемом 0,25 л и добавляли 50 мл ФБР рН 7,4, и перемешивали содержимое бутыли, далее проводили стерилизующую фильтрацию полученного раствора очищенного антигена. Непосредственно перед иммунизацией животного к полученному раствору добавляли адъювант Фрейнда в соотношении 1:1, и перемешивали до получения однородной эмульсии.
Далее, вводили антиген животным - кроликам. Для получения сыворотки использовали кроликов породы «Советская шиншилла», не моложе 2 месяцев и не старше 1 года лет, массой не менее 2,5 кг.
В период карантирования проводили клинический осмотр всех животных. Все животные были клинически здоровыми. Содержание животных (кроликов) осуществляли в стандартных условиях вивария в клетках на стеллажах без применения подстилки. В рационе лабораторных животных использовали специализированный корм, а также сено и морковь. Доступ к свежей воде был без ограничений.
Проведение иммунизации кроликов проводили в виде внутримышечной инъекции в 2 точки, вводя препарат в объеме по 0,5 мл (50 мкг ГА), перед проведением иммунизации место инъекции обрабатывали ватным тампоном, смоченным 70 % спиртом этиловым.
Далее, на 7 день после последней иммунизации проводили повторную иммунизацию кроликов. Проводили внутримышечную инъекцию в 2 точки, вводя препарат в объеме по 0,5 мл (500 мкг ГА) в левую и правую мышцы задней ноги. Далее, на 14 день после последней иммунизации проводили третью иммунизацию, внутривенной инъекцией в ушную артерию, вводя препарат в объеме 0,5 мл (50 мкг ГА), перед проведением иммунизации место инъекции обрабатывали ватным тампоном.
После проведения иммунизации по схеме выше проводили забор крови у животного. Забор крови у животного-продуцента (кроликов) проводили на 28 день после последней иммунизации. После забора крови проводили получение нативной иммунной сыворотки.
Кровь иммунизированных животных (кроликов) помещали в центрифужных пробирках в термостат при температуре 37°С на 30 минут. После завершения термостатирования проводили отделение сыворотки с помощью, подготовленной хирургической (скорняжной) иглы от стенок центрифужных стаканов. Центрифужные стаканы с содержимым помещали в холодильник и выдерживали при температуре 5°С в течение 20 часов. После завершения выдержки, проводили центрифугирование сыворотки на центрифуге в течение 3 мин. Отделяли сыворотку от сгустка крови и помещали её в чистую бутыль вместимостью 0,05 л. Добавляли азид натрия в количестве, необходимом для обеспечения 0,5 % раствора по азиду натрия. Хранили полученную сыворотку при температуре 5°С. Срок годности составил 3 мес.
Нативную иммунную сыворотку, полученную ранее, центрифугировали в течение 3 мин. Отделяли сыворотку от осадка и помещали её в чистую бутыль объемом 0,05 л. Нативную иммунную сыворотку разливают по флаконам, флаконы предукупоривают пробками, так, чтобы оставалось отверстие для доступа воздуха между флаконом и пробкой. Флаконы с моноспецифической сывороткой замораживали в течение 18 часа или проводили криозаморозку при помощи жидкого азота. Далее проводили сушку полученной сыворотки стандартной моноспецифической к гемагглютинину вируса гриппа. Замороженную сыворотку стандартную моноспецифическую к гемагглютинину вируса гриппа в флаконах лиофильно сушили при минус 80°С и остаточном давление (6±2) Па, в течение 20 часов.
Полученный стандарт моноспецифической сыворотки к гемагглютинину вируса гриппа имел следующие показатели (на примере стандартов антигена вируса определенных штаммов):
Пример 4
Проведение анализа по определению вируса гриппа
Готовили 10 % раствора детергента, с помощью детергента Zwittergent. Готовили агарозу с конечной концентрацией 1,0 - 1,2 %, с помощью ФБР. Далее готовили раствор для обесцвечивания гелей: смешивали 200,0 мл ледяной уксусной кислоты и 500,0 мл 96 % этилового спирта, объем доводили до 1 л водой очищенной, вновь перемешивали. Также готовили 0,3 % раствора красителя в растворе для обесцвечивания гелей. Для этого вносили 1,5 г красителя Кумасси бриллиантового голубого R-250, 500,0 мл раствора для обесцвечивания гелей, перемешивали до полного растворения. Готовили фосфатно-солевого буферного раствора (ФБР, рН 7,2 - 7,6). Для анализа использовали стандартную моноспецифическую сыворотку к гемагглютинину вируса гриппа, полученную способом согласно изобретению. При необходимости, проводили восстановление стандартной моноспецифичной сыворотки из лиофилизата. Далее, получали стандартный антиген (ГА) вируса гриппа, в т.ч. восстановлением стандартного антигена из лиофилизата.
Приготовление иммунопластин с агарозой
После расплавления агарозу охлаждали до 56°С на водяной бане в течение 30 минут. При температуре 56°С к агарозе прибавляли предварительно подогретую моноспецифическую сыворотку. Оптимальным количеством сыворотки считалось такое, при котором вокруг всех лунок образуются видимые зоны преципитации с четкими, не размытыми краями, и визуально наблюдается зависимость диаметров колец преципитации от разведения образца. Агарозу с сывороткой тщательно перемешивали, не допуская образования пузырьков воздуха. Расплавленную агарозу с сывороткой быстро и равномерно наносили на пластины, помещенные на столик с уровнем, и оставить на 30 минут при комнатной температуре.
Перед проведением испытаний в застывшей агарозе, пробойником из нержавеющей стали диаметром 3 - 4 мм, сделали 6 или 8 рядов лунок по 4 лунки в каждом ряду. Расстояние между лунками было не менее 1 см. Агарозу из прорезанных лунок удаляли под небольшим разряжением (например, используя резиновую грушу).
Проведение испытания
Определение проводили на двух пластинах. На каждой пластине исследовали стандарт и две/три серии пробы, отводя под каждый образец по два параллельных ряда лунок. Были использованы стандартные образцы антигена гриппа (для калибровки), а также образцы гриппозной вакцины: моновакцины и вакцины, содержащей 4 различных штамма вируса гриппа. Все вакцины были получены способом по патенту RU 2535153. На второй пластине проверяли те же образцы, но расположение проб и стандарта произвольно меняли.
Предварительно, в микропробирках готовили смесь детергента и антигенов, объем детергента - 10%, объем антигена - 90%. Смесь детергента и антигенов инкубировали при комнатной температуре в течение 30 минут. В лунки вносили следующее количество проинкубированной смеси антигена с детергентом: начиная с первой лунки ряда по 20, 15, 10, 5 мкл, соответственно. Через 30 минут, после полного впитывания в агарозу, пластины помещали во влажную камеру и оставляли при комнатной температуре в течение не менее 6 часов. После этого слой геля покрывали смоченной в ФБР фильтровальной бумагой или безворсовой салфеткой, избегая образования воздушных пузырьков на поверхности геля, затем покрывали несколькими слоями сухой фильтровальной бумаги и помещали под груз (не более 10 г на 1 см2 поверхности). Бумагу, за исключением первого слоя, меняли через каждые 10 - 15 мин до тех пор, пока она не переставала впитывать влагу из агарозы. После удаляли фильтровальную бумагу и, для дальнейшего высушивания, пластины помещали под вентилятор. Высушивали до полного высыхания агарозного геля. Заливали пластины окрашивающим раствором и окрашивали не менее 30 минут. После окрашивания обесцвечивали в растворе для обесцвечивания гелей до проявления четких колец преципитации на слабо окрашенном фоне. Отмытые пластины помещали под вентилятор до полного высыхания геля. После высушивания, для измерения диаметров колец преципитации и обработки полученных данных, применяли программно-аппаратный комплекс «Сканер для гелей Artix Scan F2 Microtek» и программное обеспечение SiamsSrid®.
Обработка результатов
При использовании программно-аппаратного комплекса «Сканер для гелей Artix Scan F2 Microtek» и программного обеспечения окрашенную пластину подвергали сканированию и дальнейшей обработке, следуя инструкции по эксплуатации данного комплекса. Результаты анализа одной пластины приведены на Фиг. 1. (3, 7 - стандартные образцы; 1, 2, 5, 6, - моновалентная вакцина; 4, 8 - квадривалентная вакцина).
Пример 5
Сравнение результатов определения концентрации гемагглютинина, полученных при использовании сывороток овец и коммерческих овечьих сывороток
Оценку правильности проводили на моновалентных вакцинах каждого штамма, а также, для оценки возможной кросс-реактивности сыворотки было проведено определение содержания гемагглютининов актуальных штаммов в сравнении с коммерческими сыворотками в модельной квадривалентной вакцине с закладкой 17,5±2,5 мкг/дозу. Определение проводилось по стандартной методике ОРИД. В качестве стандартных образцов использовались лабораторные стандартные образцы, полученные по способу по изобретению, и коммерческие стандартные образцы TGA. Оценку содержания гемагглютинина актуальных штаммов при использовании сывороток кроликов вели относительно лабораторных стандартных образцов ФГУП СПбНИИВС ФМБА России. Оценку содержания гемагглютинина актуальных штаммов при использовании коммерческих сывороток овец TGA (для штамма B/Phuket/3073/2013 - производство сывороток NIBSC) вели относительно лабораторных стандартных образцов ФГУП СПбНИИВС ФМБА России и стандартных образцов TGA (для штамма B/Phuket/3073/2013 - производство стандартов NIBSC). Исследование проводили как на моновалентной вакцине, так и на поливалентной вакцине (содержит несколько разных штаммов вируса гриппа).
Результаты представлены на Фиг. 4 и в таблице ниже:
Исходя из полученных данных видно, визуальное соответствие пластин полученных при использовании коммерческих овечьих сывороток и сывороток, полученных по настоящему изобретению. В свою очередь вариабильность получаемых результатов относительно коммерческих реагентов не превышала ±5,0%, что указывает на возможность применения данных стандартов для анализов.
Пример 6
Сравнение результатов определения концентрации гемагглютинина, полученных при использовании сывороток кроликов и коммерческих овечьих сывороток
Оценку правильности проводили на моновалентных вакцинах каждого штамма, а также, для оценки возможной кросс-реактивности сыворотки было проведено определение содержания гемагглютининов актуальных штаммов в сравнении с коммерческими сыворотками в модельной квадривалентной вакцине с закладкой 17,5±2,5 мкг/дозу. Определение проводилось по стандартной методике ОРИД. В качестве стандартных образцов использовались лабораторные стандартные образцы, полученные по способу по изобретению, и коммерческие стандартные образцы TGA. Оценку содержания гемагглютинина актуальных штаммов при использовании сывороток кроликов вели относительно лабораторных стандартных образцов ФГУП СПбНИИВС ФМБА России. Оценку содержания гемагглютинина актуальных штаммов при использовании коммерческих сывороток овец TGA (для штамма B/Phuket/3073/2013 - производство сывороток NIBSC) вели относительно лабораторных стандартных образцов ФГУП СПбНИИВС ФМБА России и стандартных образцов TGA (для штамма B/Phuket/3073/2013 - производство стандартов NIBSC).
Результаты представлены на Фиг. 5 и в таблице ниже:
Исходя из полученных данных видно, визуальное соответствие пластин полученных при использовании коммерческих овечьих сывороток и сывороток, полученных по настоящему изобретению. В свою очередь вариабильность получаемых результатов относительно коммерческих реагентов не превышала ±7,0%, что указывает на возможность применения данных стандартов для анализов.
На основании вышеприведенных примеров можно сделать выводы, что предложенный способ получения стандартных образцов антигена гриппа и сыворотки к антигену гриппа имеют высокое качество, доказанную эффективность, и для их получения могут быть использованы различные виды животных.
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ получения антигена или антигенов для производства противогриппозной вакцины и вакцина на его основе | 2019 |
|
RU2710239C1 |
| СПОСОБ ПОЛУЧЕНИЯ АНТИГЕНОВ ДЛЯ ВАКЦИНЫ ПРОТИВ ВИРУСОВ ГРИППА | 2005 |
|
RU2283139C1 |
| СПОСОБ ПОЛУЧЕНИЯ КОНЦЕНТРАТА ВИРУСА ГРИППА ДЛЯ ПОЛУЧЕНИЯ ВАКЦИНЫ | 2023 |
|
RU2839314C2 |
| СПОСОБ ПРОИЗВОДСТВА ЧЕТЫРЕХВАЛЕНТНОЙ СУБЪЕДИНИЧНОЙ ВАКЦИНЫ ПРОТИВ ГРИППА БЕЗ АДЪЮВАНТОВ | 2020 |
|
RU2741003C1 |
| ВАКЦИНА ПРОТИВ ГРИППА | 2014 |
|
RU2546861C1 |
| ВАКЦИНА ГРИППОЗНАЯ ИНАКТИВИРОВАННАЯ РАСЩЕПЛЕННАЯ И СПОСОБ ЕЕ ПОЛУЧЕНИЯ | 2015 |
|
RU2584594C1 |
| Способ получения четырехвалентной вакцины для профилактики гриппа | 2020 |
|
RU2754398C1 |
| СПОСОБ ПОЛУЧЕНИЯ ТЕТРАВАЛЕНТНОЙ СУБЪЕДИНИЧНОЙ ПРОТИВОГРИППОЗНОЙ ВАКЦИНЫ | 2019 |
|
RU2740751C1 |
| Пентавалентная субъединичная вакцина против респираторных инфекций и способ ее получения | 2022 |
|
RU2804948C2 |
| СПОСОБ ПОЛУЧЕНИЯ ВЫСОКООЧИЩЕННЫХ ВИРИОННЫХ КОНЦЕНТРАТОВ | 2013 |
|
RU2535153C1 |



Изобретение относится к биотехнологии. Описан способ получения стандартного гемагглютинина вируса гриппа. Получают разбавленный вирусный концентрат, включающий очищенный вирусный концентрат и фосфатно-буферный раствор. Стабилизируют разбавленный вирусный концентрат путем добавления раствора бычьего сывороточного альбумина. Получают стандартный гемагглютинин вируса гриппа с концентрацией не менее 60 мкг/мл. Также описан способ получения стандарта моноспецифической сыворотки к гемагглютинину вируса гриппа. Обрабатывают ферментом бромелаином очищенный вирусный концентрат. Проводят очистку полученного вирусного концентрата эксклюзионной хроматографией на сорбентах с диапазоном фракционирования от 10 до 1500 кДа. Осуществляют неоднократную иммунизацию овец или кроликов антигеном, полученным способом, приведенным выше, в комбинации с адъювантом Фрейнда. Получают нативную иммунную сыворотку путем неоднократной иммунизации животных, с титром антигена не менее 1:8 в иммунодиффузии по Оухтерлони. Также представлена тест-система для определения специфической активности вируса гриппа или для определения специфической активности гриппозной вакцины. Изобретение позволяет получить стандартные образцы: стандартного гемагглютинина вируса гриппа и стандарта моноспецифической сыворотки к гемагглютинину вируса гриппа для использования в методике анализа ОРИД для определения специфической активности, в т.ч. в тест-системе. При этом стандартные образцы имеют качество, сравнимое или повышенное относительно предшествующего уровня техники, имеют доказанную эффективность, и для их получения можно использовать животных различных видов. 4 н. и 6 з.п. ф-лы, 5 ил., 5 табл., 5 пр.
1. Способ получения стандартного гемагглютинина вируса гриппа, включающий стадии:
- получение разбавленного вирусного концентрата, включающего очищенный вирусный концентрат и фосфатно-буферный раствор;
- стабилизация разбавленного вирусного концентрата путем добавления раствора бычьего сывороточного альбумина;
- получение стандартного гемагглютинина вируса гриппа с концентрацией не менее 60 мкг/мл.
2. Способ по п. 1, дополнительно включающий розлив и лиофилизацию полученного стандартного гемагглютинина вируса гриппа.
3. Способ по п. 1, отличающийся тем, что для получения разбавленного вирусного концентрата добавляют раствор альбумина с концентрацией 1-5%.
4. Способ получения стандарта моноспецифической сыворотки к гемагглютинину вируса гриппа, включающий стадии:
- обработка ферментом бромелаином очищенного вирусного концентрата;
- очистка обработанного вирусного концентрата эксклюзионной хроматографией на сорбентах с диапазоном фракционирования от 10 до 1500 кДа;
- выделение гемагглютинина вируса гриппа из обработанного и очищенного вирусного концентрата;
- неоднократная иммунизация овец или кроликов выделенным гемагглютинином в комбинации с адъювантом Фрейнда;
- получение нативной иммунной сыворотки путем неоднократной иммунизации животных, с титром антигена не менее 1:8 в иммунодиффузии по Оухтерлони.
5. Способ по п. 4, отличающийся тем, что неоднократная иммунизация включает трехкратную иммунизацию кроликов с интервалом в 7 дней и отбор крови на 28 день после последней иммунизации.
6. Способ по п. 5, отличающийся тем, что неоднократная иммунизация овец включает пятикратную иммунизацию овец с интервалом в 7 дней и отбор крови на 35 день после последней иммунизации.
7. Способ по п. 5, отличающийся тем, что после получения стандарт моноспецифической сыворотки лиофилизируют.
8. Тест-система для определения специфической активности вируса гриппа, включающая:
- стандартный гемагглютинина вируса гриппа, полученный способом по п. 1;
- стандарт моноспецифической сыворотки к гемагглютинину вируса гриппа, полученный по п. 4.
9. Применение тест-системы по п. 8 для определения специфической активности гриппозной вакцины.
10. Применение тест-системы по п. 9, отличающееся тем, что гриппозная вакцина представляет собой инактивированную гриппозную вакцину.
| Фармакопейная статья, Вакцина гриппозная инактивированная, найдено в интернет 31.10.2022, размещена 20.03.2016 https://studfile.net/preview/6052640/page:5/ | |||
| СПОСОБ ПОЛУЧЕНИЯ ВЫСОКООЧИЩЕННЫХ ВИРИОННЫХ КОНЦЕНТРАТОВ | 2013 |
|
RU2535153C1 |
| https://med-std.ru/22806892-1.html найдено в интернет 01.11.2022, опубликовано 23.01.2022 согласно интернет архиву Wayback machine | |||
| ПОЛУЧЕНИЕ ДИАГНОСТИЧЕСКИХ | |||
Авторы
Даты
2023-09-26—Публикация
2022-05-20—Подача