1. ОБЛАСТЬ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
[0001] В настоящем описании представлены композиции, способы и варианты применения антител, которые специфически связываются с нектином-4 человека и обнаруживают уровень экспрессии нектина-4.
2. ПЕРЕКРЕСТНЫЕ ССЫЛКИ НА РОДСТВЕННЫЕ ЗАЯВКИ
[0002] По настоящей заявке испрашивается приоритет предварительной заявки США № 62/515454, поданной 5 июня 2017 года, полное содержание которой включено в настоящий документ в качестве ссылки.
3. ССЫЛКА НА ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ, ПОДАННЫЙ В ЭЛЕКТРОННОМ ВИДЕ
[0003] Настоящая заявка включает ссылку на перечень последовательностей в машинно-читаемой форме (CRF) в текстовом формате ASCII, поданной вместе с настоящей заявкой, обозначенном как 14369-208-228_SEQ_LISTING.txt, созданном 31 мая 2018 года и имеющем размер 37280 байт.
4. УРОВЕНЬ ТЕХНИКИ
[0004] Нектин-4, также известный как белок, связанный с рецептором полиовируса, 4 (PVRL4), представляет собой одиночный трансмембранный белок типа I размером около 52 кДа, который принадлежит семейству нектинов молекул клеточной адгезии. Нектины опосредуют независимую от Ca2+ межклеточную адгезию при адгезионных контактах посредством гомофильного взаимодействия, при котором один нектин-4 взаимодействует с другим нектином-4, и посредством гетерофильного взаимодействия, при котором нектин-4 взаимодействует с другим белком из семейства нектинов, таким как нектин-1, нектин-2 или нектин-3. (Miyoshi J et al, 2007, Am J Nephrol 27:590-604; Takai et al, 2003, Cancer Sci 94:655-667; Reymond N. et al, 2001, Journal of Biological Chemistry, 276:43205-15). Внеклеточный домен нектина-4 имеет три Ig-подобных субдомена, обозначенных как V, C1 и C2. Было показано, что домен С1 в нектине-2 отвечает за гомофильные взаимодействия, в то время как домены V большинства молекул нектина участвуют в гетерофильных взаимодействиях и в межклеточной адгезии. (Miyoshi J et al, 2007, Am J Nephrol 27:590-604; Takai et al, 2003, Cancer Sci 94:655-667; Reymond N. et al, 2001, Journal of Biological Chemistry, 276:43205 15).
[0005] Нектины экспрессируются в различных тканях, включая, например, гематопоэтические, нейрональные, эндотелиальные и эпителиальные клетки. (Mendelsohn C et al, 1989, Cell 56:855-865; Lope; 72:9992-10002; Takahashi K. et al., 1999, Journal of Cell Biology 145:539-549; Miyoshi J et al., 2007, Am J Nephrol 27:590-604; Takai et al., 2003, Cancer Sci 94:655-667).
[0006] Кроме того, что нектины опосредуют межклеточные адгезии путем гомофильных взаимодействий или гетерофильных взаимодействий с другими белками семейства нектинов, они могут рекрутировать другие молекулы клеточной адгезии, такие как кадгерины, или другие рецепторы клеточной поверхности, такие как рецептор пролактина. Рекрутируя другие рецепторы клеточной поверхности, нектины также могут играть роль стимулирующего корецептора и, таким образом, осуществлять сигнальную функцию. Например, в молочной железе мыши нектин-4 взаимодействует с рецептором пролактина посредством своего внеклеточного и трансмембранного домена и связывается с супрессором сигнального пути цитокина 1 (SOCS-1), который обычно ингибирует киназную активность Янус-киназы 2 (JAK2), тем самым усиливая пролактин-индуцированную активацию JAK2 и передачу сигналов. (Maruoka et al., 2017, Journal of Biological Chemistry, doi: 10.1074/jbc.M116.769091, jbc.M116.769091, Epub Ahead of Print; Kitayama et al., 2016, Journal of Biological Chemistry 291:5817-5831). Нектины также могут взаимодействовать с кадгеринами, индуцируя и затем быстро подавляя активности Rac1 на начальных стадиях межклеточной адегезии. (Khameeka et al., 2011, PLoS ONE 6: e17841).
[0007] До настоящего времени все попытки создания антител против нектина-4 для специфического обнаружения и оценки экспрессии нектина-4 в различных биологических образцах были тщетны. Таким образом, существует необходимость в создании антитела против нектина-4, которое может специфически обнаруживать и оценивать экспрессию нектина-4 в биологических образцах.
5. КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
[0008] В настоящем описании раскрыты белки, которые связываются с нектином-4 (например, нектином-4 человека, SEQ ID NO:43), в том числе связывающие белки, например, антитела, которые связываются с нектином-4. Такие связывающие белки, включая антитела, могут связываться с полипептидом нектина-4, фрагментом нектина-4 и/или эпитопом нектина-4.
[0009] В настоящем описании также раскрыты, в некоторых вариантах осуществления, связывающие белки, включая антитела или их фрагменты, которые специфически связываются с клеткой, экспрессирующей нектин-4.
[0010] В настоящем документе также раскрыты полинуклеотиды и векторы, содержащие последовательности, кодирующие такие антитела, клетки (например, клетки-хозяева), содержащие такие полинуклеотиды или векторы, и композиции, реагенты и наборы, содержащие такие антитела. В еще одном аспекте, в настоящем документе раскрыты способы модуляции активности Нектина-4 (например, активация сигнального пути Нектина-4) или уровней экспрессии Нектина-4, диагностические способы и применение таких антител против Нектина-4.
[0011] В некоторых вариантах осуществления связывающий белок (например, антитело против Нектина-4) содержит шесть определяющих комплементарность областей (CDR) или менее шести CDR. В других вариантах осуществления, связывающий белок (например, антитело против нектина-4) содержит одну, две, три, четыре, пять или шесть CDR, выбранных из: CDR1 вариабельной области тяжелой цепи (VH), CDR2 VH и CDR3 VH, CDR1 вариабельной области легкой цепи (VL), CDR2 VL и/или CDR3 VL. В некоторых вариантах осуществления связывающий белок (например, антитело против нектина-4) содержит одну, две, три, четыре, пять или шести CDR, выбранных из: CDR1 VH, CDR2 VH, CDR3 VH, CDR1 VL, CDR2 VL и/или CDR VL моноклонального антитела, обозначенного как М22-321b41.1, как описано в настоящем документе, или его гуманизированного варианта. В некоторых вариантах осуществления, связывающий белок (например, антитело против нектина-4) дополнительно содержит скелетную область или каркасную область (FR), в том числе FR1 VH, FR2 VH, FR3 VH, FR4 VH, FR1 VL, FR2 VL, FR3 VL и /или FR4 VL аминокислотной последовательности иммуноглобулина человека или его варианта.
[0012] В некоторых вариантах осуществления антитело или его антигенсвязывающий фрагмент содержит VL, содержащую CDR1 VL, CDR2 VL и CDR3 VL антитела M22-321b41.1, как указано в Таблице 1.
[0013] В других вариантах осуществления антитело или его антигенсвязывающий фрагмент содержит VH, содержащую CDR1 VH, CDR2 VH и CDR3 VH антитела M22-321b41.1, как указано в Таблице 1.
[0014] В других вариантах осуществления антитело или его антигенсвязывающий фрагмент содержит:
(a) VL содержащую FR1 VL, FR2 VL, FR3 VL и FR4 VL антитела M22- 321b41.1, как указано в Таблице 2; и
(b) VH содержащую FR1 VH, FR2 VH, FR3 VH и FR4 VH антитела M22- 321b41.1, как указано в Таблице 2.
[0015] В некоторых вариантах осуществления CDR1 VL, CDR2 VL и CDR3 VL антитела или его антигенсвязывающего фрагмента содержат аминокислотные последовательности SEQ ID NO:7, 10 и 12, соответственно, и CDR1 VH, CDR2 VH и CDR3 VH антитела или его антигенсвязывающего фрагмента содержат аминокислотные последовательности SEQ ID NO:15, 19 и 23, соответственно.
[0016] В еще одном варианте осуществления антитело или его антигенсвязывающий фрагмент содержит VL, содержащую аминокислотную последовательность SEQ ID NO:3. В некоторых вариантах осуществления аминокислотная последовательность содержит одну или несколько консервативных модификаций.
[0017] В конкретных вариантах осуществления антитело или его антигенсвязывающий фрагмент содержит VH, содержащую аминокислотную последовательность SEQ ID NO:4. В некоторых вариантах осуществления аминокислотная последовательность содержит одну или несколько консервативных модификаций.
[0018] В конкретных вариантах осуществления антитело или его антигенсвязывающий фрагмент содержит: (а) VL, содержащую аминокислотную последовательность SEQ ID NO:3; и (b) VH, содержащую аминокислотную последовательность SEQ ID NO:4.
[0019] В некоторых вариантах осуществления антитело содержит Fc-фрагмент IgG1 человека. В других вариантах осуществления антитело содержит мутантный вариант Fc-фрагмента IgG1 человека.
[0020] В конкретных вариантах осуществления антитело или его антигенсвязывающий фрагмент содержит константную область легкой цепи, содержащую аминокислотную последовательность SEQ ID NO:33.
[0021] В других вариантах осуществления антитело или его антигенсвязывающий фрагмент содержит Fc-фрагмент тяжелой цепи, содержащий аминокислотную последовательность SEQ ID NO:35.
[0022] В еще одном варианте осуществления антитело или его антигенсвязывающий фрагмент дополнительно содержит константную область легкой цепи, содержащую аминокислотную последовательность SEQ ID NO:33; и Fc-фрагмент тяжелой цепи, содержащий аминокислотную последовательность SEQ ID NO:35.
[0023] В некоторых вариантах осуществления антитело или его антигенсвязывающий фрагмент содержит легкую цепь, содержащую аминокислотную последовательность SEQ ID NO:5.
[0024] В конкретных вариантах осуществления антитело или его антигенсвязывающий фрагмент, при связывании с нектином-4, связывается по меньшей мере с одним из остатков 31-346 в пределах аминокислотной последовательности SEQ ID NO:1. В некоторых вариантах осуществления антитело или его антигенсвязывающий фрагмент, при связывании с нектином-4, связывается по меньшей мере с одним из остатков 31-150 в пределах аминокислотной последовательности SEQ ID NO:1. В конкретных вариантах осуществления антитело или его антигенсвязывающий фрагмент, при связывании с нектином-4, связывается по меньшей мере с одним из остатков 1-150 в пределах аминокислотной последовательности SEQ ID NO:1.
[0025] В одном из вариантов осуществления эпитоп нектина-4 человека отличается от лиганд-связывающего сайта нектина-4.
[0026] В одном из аспектов, в настоящем описании раскрыто антитело или его антигенсвязывающий фрагмент, которое связывается с эпитопом нектина-4 человека, где антитело или его антигенсвязывающий фрагмент специфически связывается с клеткой, экспрессирующей нектин-4.
[0027] В одном из вариантов осуществления антитело или его антигенсвязывающий фрагмент, которое связывается с эпитопом нектина-4 человека, используют для оценки экспрессии нектина-4 в образце ткани индивида с подозрением на злокачественное новообразование, включающей: (a) приведение указанного образца ткани в контакт с антителом или его антигенсвязывающим фрагментом; (b) обнаружение связывания указанного антитела или его антигенсвязывающего фрагмента с указанным образцом ткани; и (c) определение экспрессии нектина-4 в образце ткани, где уровень экспрессии нектина-4 в образце ткани сравнивают с эталонным уровнем экспрессии нектина-4.
[0028] В конкретных вариантах осуществления антитело является моноклональным антителом. В некоторых вариантах осуществления антитело представляет собой гуманизированное, человеческое или химерное антитело. В еще одном варианте осуществления гуманизированное антитело представляет собой деиммунизированное антитело или композитное антитело человека. В конкретных вариантах осуществления антитело является гуманизированным антителом. В конкретных вариантах осуществления, антитело представляет собой гуманизированное антитело, которое специфически связывается с нектином-4 человека.
[0029] В некоторых вариантах осуществления антитело или его антигенсвязывающий фрагмент представляет собой Fab, Fab', F(ab') 2, Fv, scFv, dsFv, диатело, триатело или тетратело. В некоторых вариантах осуществления, антитело или его антигенсвязывающий фрагмент представляет собой мультиспецифическое антитело, полученное из фрагментов антитела.
[0030] В некоторых вариантах осуществления антитело или его антигенсвязывающий фрагмент конъюгировано с агентом. В одном из вариантов осуществления агент представляет собой радиоизотоп, хелатор металла, фермент, флуоресцентное соединение, биолюминесцентное соединение или хемилюминесцентное соединение.
[0031] В настоящем документе также раскрыта композиция, содержащая антитело или его антигенсвязывающий фрагмент по настоящему изобретению. В некоторых вариантах осуществления композиция дополнительно содержит фармацевтически приемлемый носитель.
[0032] Также в настоящем документе раскрыт полинуклеотид, содержащий нуклеотидные последовательности, кодирующие VH, VL или обе области, VH и VL, антитела по настоящему изобретению.
[0033] В настоящем описании также раскрыт, в некоторых вариантах осуществления, полинуклеотид, содержащий нуклеотидные последовательности, кодирующие тяжелую цепь, легкую цепь или обе цепи, тяжелую и легкую, антитела по настоящему изобретению.
[0034] В некоторых вариантах осуществления полинуклеотид функционально связан с промотором.
[0035] В настоящем описании также раскрыта популяция полинуклеотидов, содержащая: (a) первый полинуклеотид, содержащий нуклеотидные последовательности, кодирующие VH или тяжелую цепь антитела по настоящему изобретению, и (b) второй полинуклеотид, содержащий нуклеотидные последовательности, кодирующие VL или легкую цепь антитела по настоящему изобретению. В некоторых вариантах осуществления первый полинуклеотид функционально связан с первым промотором, и второй полинуклеотид функционально связан со вторым промотором.
[0036] Также в настоящем описании раскрыт вектор, содержащий полинуклеотид по настоящему изобретению.
[0037] В настоящем описании также раскрыта, в некоторых вариантах осуществления, популяция векторов, содержащая: (a) первый вектор, содержащий нуклеотидные последовательности, кодирующие VH или тяжелую цепь антитела по настоящему изобретению, и (b) второй вектор, содержащий нуклеотидные последовательности, кодирующие VL или легкую цепь антитела по настоящему изобретению.
[0038] В настоящем описании дополнительно раскрыта, в некоторых вариантах осуществления, популяция векторов, содержащая: (a) первый вектор, содержащий нуклеотидные последовательности, кодирующие VH или тяжелую цепь антитела по настоящему изобретению, функционально связанный с первым промотором, и (b) второй вектор, содержащий нуклеотидные последовательности, кодирующие VL или легкую цепь антитела по настоящему изобретению, функционально связанный со вторым промотором.
[0039] Описание настоящей заявки, в некоторых вариантах осуществления, раскрывает клетку, содержащую полинуклеотид или популяцию полинуклеотидов по настоящему изобретению.
[0040] Описание настоящей заявки также раскрывает, в некоторых вариантах осуществления, клетку, содержащую вектор или популяцию векторов по настоящему изобретению.
[0041] Описание настоящей заявки дополнительно раскрывает, в некоторых вариантах осуществления, выделенную клетку, продуцирующую антитело или его антигенсвязывающий фрагмент по настоящему изобретению.
[0042] В настоящем описании также раскрыта популяция клеток, содержащая: (a) первую клетку-хозяин, содержащую полинуклеотид, содержащий нуклеотидную последовательность, кодирующую VH или тяжелую цепь антитела по настоящему изобретению, и (b) вторую клетку-хозяин, содержащую полинуклеотид, содержащий нуклеотидную последовательность, кодирующую VL или легкую цепь антитела по настоящему изобретению.
[0043] В настоящем описании дополнительно раскрыта популяция клеток, содержащая: (a) первую клетку-хозяин, содержащую полинуклеотид, содержащий нуклеотидную последовательность, кодирующую VH или тяжелую цепь антитела по настоящему изобретению, функционально связанную с первый промотором, и (b) вторую клетку-хозяин, содержащую полинуклеотид, содержащий нуклеотидную последовательность, кодирующую VL или легкую цепь антитела по настоящему изобретению, функционально связанную со вторым промотором.
[0044] Также в настоящем документе раскрыт набор, содержащий антитело или его антигенсвязывающий фрагмент по настоящему изобретению.
[0045] Также в настоящем документе раскрыт способ получения антитела или его антигенсвязывающего фрагмента, которое специфически связывается с эпитопом нектина-4 человека. В некоторых вариантах осуществления способ включает культивирование клетки по настоящему изобретению для экспрессии антитела или его антигенсвязывающего фрагмента. В других вариантах осуществления способ включает экспрессию полинуклеотида по настоящему изобретению. В одном из вариантов осуществления эпитоп нектина-4 человека отличается от лиганд-связывающего сайта нектина-4.
6. КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
[0046] На фигуре 1 показан результат эксперимента, показывающий, что все злокачественные клетки были положительно окрашены в анализе окрашивания IHC нектин-4 мРНК-позитивного ксенотрансплантата AG-B1 с помощью 2,5 мкг/мл M22-321b41.1.
[0047] На фигуре 2 представлен результат эксперимента, показывающий, что все злокачественные клетки были положительно окрашены в анализе окрашивания IHC нектин-4 мРНК-позитивного ксенотрансплантата AG-B1 с помощью 2,5 мкг/мл M22-244b3.1.1.1.
[0048] На фигуре 3 представлен результат эксперимента, показывающий, что все клетки не были окрашены в анализе окрашивания IHC нектин-4 мРНК-негативного ксенотрансплантата AG-К24 с помощью 2,5 мкг/мл M22-321b41.1.
[0049] На фигуре 4 представлен результат эксперимента, показывающий, что большинство клеток положительно окрашивались в анализе окрашивания IHC нектин-4 мРНК-негативного ксенотрансплантата AG-К24 с помощью 2,5 мкг/мл M22-244b3.1.1.1.
[0050] На фигуре 5 представлен результат эксперимента, показывающий, что все клетки не были окрашены в анализе окрашивания IHC нектин-4 мРНК-негативного ксенотрансплантата MDA-MB-231-MFP-XCL с 2,5 мкг/мл M22-321b41.1.
[0051] На фигуре 6 представлен результат эксперимента, показывающий, что большинство клеток были позитивно окрашены в анализе окрашивания IHC нектин-4 мРНК-негативного ксенотрансплантата MDA-MB-231-MFP-XCL с 2,5 мкг/мл M22-244b3.1.1.1. [0052] На фигуре 7 представлен результат эксперимента, показывающий, что все клетки не были окрашены в анализе окрашивания IHC нектин-4 мРНК-негативного ксенотрансплантата AG-В1 с 2,5 мкг/мл негативным контрольным антителом IgG2a.
[0053] На фигуре 8 показан результат эксперимента, показывающий, что все злокачественные клетки были положительно окрашены в анализе окрашивания IHC нектин-4 мРНК-позитивного ксенотрансплантата AG-L16 с помощью 2,5 мкг/мл M22-321b41.1.
[0054] На фигуре 9 показан результат эксперимента, показывающий, что большинство злокачественных клеток были положительно окрашены в анализе окрашивания IHC нектин-4 мРНК-позитивного ксенотрансплантата AG-B11 с помощью 2,5 мкг/мл M22-321b41.1.
[0055] На фигуре 10 представлен результат эксперимента, показывающий сильное окрашивание нектина-4 в анализе окрашивания IHC уротелиальной карциномы с помощью М22-321b41.1.
[0056] На фигуре 11 представлен результат эксперимента, показывающий гетерогенность окрашивания нектина-4 в анализе окрашивания IHC карциномы молочной железы с помощью М22-321b41.1.
[0057] На фигуре 12А представлены результаты эксперимента Вестерн-блоттинга, показывающие специфическое обнаружение полосы нектина-4 только в тех клетках и ксенотрансплантатах, которые экспрессируют нектин-4.
[0058] На фигуре 12B приведены результаты контрольного эксперимента FACS, показывающие, что клетки Rat1(E)-нектин-4, которые положительно окрашены с помощью M22-321b41.1 на фигуре 12.A, экспрессировали высокие уровни нектина-4; а другие клетки Rat1(E), которые отрицательно окрашивались с помощью M22-321b41.1 на фигуре 12A, экспрессировали высокие уровни нектина-1, нектина-2 и нектина-3, что указывает на то, что M22-321b41.1 специфично в отношении нектина-4.
[0059] На фигуре 13 представлены результаты эксперимента Вестент-блоттинга, показывающие, что антитело M22-321b41.1 распознает белковую полосу, содержащую V-фрагмент/домен (аминокислотные остатки 1-150) нектина-4. На верхней панели, антитело М22-321b41.1 тестрировали в анализе Вестерн-блот в отношении лизатов клеток, экспрессирующих нативный полноразмерный (wt) белок, V-фрагмент/домен (V), V и С1-фрагмент/домен (V/С1), С1 и С2-фрагмент/домен, С2-фрагмент/домен, и отрицательный контроль (neo). В нижней панели в качестве контрольной загрузки использовали GAPDH.
7. ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
[0060] В настоящем документе раскрыты связывающие белки, такие как антитела, которые связываются с нектином-4, включая нектин-4 человека. В одном из вариантов осуществления антитела против нектина-4 связываются с нектином-4 человека. В некоторых вариантах осуществления анализ связывания антител против нектина-4 с нектином-4 осуществляют in vitro. В других вариантах осуществления анализ связывания антител против нектина-4 с нектином-4 осуществляют in vivo. В некоторых вариантах осуществления анализы включают иммуногистохимические анализы (IHC), анализ флуоресцентной сортировки клеток (FACS), ELISA, иммуноблоттинг (например, вестерн-блоттинг, дот-блоттинг или вестерн-блоттинг в клетке) и другие иммуноанализы.
[0061] В конкретных вариантах осуществления связывающие белки, такие как антитела, которые связываются с нектином- 4, описанные в настоящем документе, имеют общий признак - способность конкурировать друг с другом за связывание с нектином-4. Это конкурентное ингибирование может указывать на то, что каждое антитело связывается с одной и той же областью нектина-4 (например, с одним и тем же эпитопом), тем самым проявляя сходные эффекты. В некоторых вариантах осуществления антитела против нектина-4, описанные в настоящем документе, включают гуманизированные антитела против нектина-4, такие как антитела, полученные из антитела M22-321b41.1, или основанные на нем. В других вариантах осуществления антитела против нектина-4, описанные в настоящем документе, конкурируют за связывание с антителом, полученным из антитела M22-321b41.1 или основанном на нем. В некоторых вариантах осуществления антитела против нектина-4 имеют последовательности CDR, как описано в таблице 1. В некоторых вариантах осуществления антитела против нектина-4 связываются со специфическим доменом нектина-4 человека (например, остатки 31-346, 1-150 или 31-150 в аминокислотной последовательности SEQ ID NO:1). Кроме того, такое связывание может быть в значительной степени связано с определенными аминокислотными остатками в пределах этой области, которые содержат эпитоп, распознаваемый антителами против нектина-4, описанными в настоящем документе. Вместе эти результаты, описанные в настоящем документе, говорят о том, что эффекты, наблюдаемые для антитела против нектина-4, которое получено из антитела M22-321b41.1 или основано на нем, включая антитело с одним или нескольким CDR, описанными в Таблице 1, могут быть экстраполированы на другие антитела против нектина-4, описанные в настоящем документе, имеющие такую же или подобную эпитопную специфичность (например, те же или подобные CDR).
[0062] В некоторых вариантах осуществления настоящего изобретения связывающие белки, такие как антитела против нектина-4, могут содержать вариабельные области иммуноглобулина, которые содержат один или несколько CDR, как описано в таблице 1. В таких связывающих белках (например, антителах против нектина-4) CDR могут быть соединены с одной или несколькими скелетными областями или каркасными областями (FR), такими, как описано в таблице 2, которые ориентируют один или несколько CDR так, что успешно реализуются должные антигенсвязывающие свойства одного или нескольких CDR. Такие связывающие белки, включая антитела против нектина-4, как описано в настоящем документе, могут связываться с нектином-4 в различных анализах.
7.1 Общие методики
[0063] Методики и процедуры, описанные или указываемые в настоящем документе, включают методики и процедуры, которые хорошо известны и/или обычно используются с применением обычной методологии специалистами в данной области, такой как, например, широко используемые методологии, описанные в Sambrook et al., Molecular Cloning: A Laboratory Manual (3d ed.2001); Current Protocols in Molecular Biology (Ausubel et al. eds., 2003); Therapeutic Monoclonal Antibodies: From Bench to Clinic (An ed.2009); Monoclonal Antibodies: Methods and Protocols (Albitar ed.2010); и Antibody Engineering, том 1 и 2 (Kontermann and Dübel eds., 2d ed.2010).
7.2 Терминология
[0064] Если не указано иного, то все технические и научные термины, используемые в настоящем документе, имеют значения, которые хорошо известны специалисту в данной области. Для толкования описания настоящей заявки использованы следующие определения терминов, и, если необходимо, термины, используемые в единственном числе, также включают множественное число и vice versa. Все патенты, заявки, опубликованные заявки и другие публикации включены путем ссылки в полном объеме. В случае, если описание какого-либо из перечисленных терминов вступает в противоречие с любым из документов, включенных в настоящее описание путем ссылки, то описание терминов, представленное ниже, следует рассматривать как контрольное.
[0065] Термины «нектин-4», «полипептид нектина-4» или «белок нектина-4» включают полипептид («полипептид» и «белок» используются в настоящем описании взаимозаменяемо), включая любой нативный полипептид из любого позвоночного в качестве источника, включая млекопитающих, например, приматов (например, человек и яванский макак (cyno), собаки и грызуны (например, мышь и крыса), если не указано иное. В некоторых вариантах осуществления термины включают «полипептиды, относящиеся к нектину-4», в том числе их варианты SNP. Термин «нектин-4» также включает «полноразмерный» непроцессированный нектин-4, а также любую форму нектина-4, которая образуется после процессинга в клетке. В некоторых вариантах осуществления нектин-4 имеет аминокислотную последовательность SEQ ID NO:1. Под номером доступа в GenBank™ NM_030916 (мРНК), NG_028109 (геномная ДНК), Gene ID 81607 (ген), NP_112178 (аминокислотные последовательности предшественника) зарегистрирован еще один вариант нуклеиновых кислот или аминокислотных последовательностей нектина-4 человека. Пример аминокислотной последовательности нектина-4 человека приведен ниже:
[0066] MPLSLGAEMWGPEAWLLLLLLLASFTGRCPAGELETSDVVTVVLGQDAKLPC FYRGDSGEQVGQVAWARVDAGEGAQELALLHSKYGLHVSPAYEGRVEQPPPPRNPLDGSVLLRNAVQADEGEYECRVSTFPAGSFQARLRLRVLVPPLPSLNPGPALEEGQGLTLAASCTAEGSPAPSVTWDTEVKGTTSSRSFKHSRSAAVTSEFHLVPSRSMNGQPLTCVVSHPGLLQDQRITHILHVSFLAEASVRGLEDQNLWHIGREGAMLKCLSEGQPPPSYNWTRLDGPLPSGVRVDGDTLGFPPLTTEHSGIYVCHVSNEFSSRDSQVTVDVLDPQEDSGKQVDLVSASVVVVGVIAALLFCLLVVVVVLMSRYHRRKAQQMTQKYEEELTLTRENSIRRLHSHHTDPRSQPEESVGLRAEGHPDSLKDNSSCSVMSEEPEGRSYSTLTTVREIETQTELLSPGSGRAEEEEDQDEGIKQAMNHFVQENGTLRAKPTGNGIYINGRGHLV (SEQ ID NO:1).
[0067] По номеру доступа в GenBank™ NM_030916 дает информацию еще об одном варианте последовательности нуклеиновой кислоты нектин-4 человека:
[0068] atgcccctgtccctgggagccgagatgtgggggcctgaggcctggctgctgc tgctgctactgctggcatcatttacaggccggtgccccgcgggtgagctggagacctcagacgtggtaactgtggtgctgggccaggacgcaaaactgccctgcttctaccgaggggactccggcgagcaagtggggcaagtggcatgggctcgggtggacgcgggcgaaggcgcccaggaactagcgctactgcactccaaatacgggcttcatgtgagcccggcttacgagggccgcgtggagcagccgccgcccccacgcaaccccctggacggctcagtgctcctgcgcaacgcagtgcaggcggatgagggcgagtacgagtgccgggtcagcaccttccccgccggcagcttccaggcgcggctgcggctccgagtgctggtgcctcccctgccctcactgaatcctggtccagcactagaagagggccagggcctgaccctggcagcctcctgcacagctgagggcagcccagcccccagcgtgacctgggacacggaggtcaaaggcacaacgtccagccgttccttcaagcactcccgctctgctgccgtcacctcagagttccacttggtgcctagccgcagcatgaatgggcagccactgacttgtgtggtgtcccatcctggcctgctccaggaccaaaggatcacccacatcctccacgtgtccttccttgctgaggcctctgtgaggggccttgaagaccaaaatctgtggcacattggcagagaaggagctatgctcaagtgcctgagtgaagggcagccccctccctcatacaactggacacggctggatgggcctctgcccagtggggtacgagtggatggggacactttgggctttcccccactgaccactgagcacagcggcatctacgtctgccatgtcagcaatgagttctcctcaagggattctcaggtcactgtggatgttcttgacccccaggaagactctgggaagcaggtggacctagtgtcagcctcggtggtggtggtgggtgtgatcgccgcactcttgttctgccttctggtggtggtggtggtgctcatgtcccgataccatcggcgcaaggcccagcagatgacccagaaatatgaggaggagctgaccctgaccagggagaactccatccggaggctgcattcccatcacacggaccccaggagccagccggaggagagtgtagggctgagagccgagggccaccctgatagtctcaaggacaacagtagctgctctgtgatgagtgaagagcccgagggccgcagttactccacgctgaccacggtgagggagatagaaacacagactgaactgctgtctccaggctctgggcgggccgaggaggaggaagatcaggatgaaggcatcaaacaggccatgaaccattttgttcaggagaatgggaccctacgggccaagcccacgggcaatggcatctacatcaatgggcggggacacctggtctga (SEQ ID NO:36).
[0069] Под номером доступа в GenBank™ AF472510, NM_027893, XM_203738, NM_001122680 зарегистрирован вариант нуклеиновых кислоты и аминокислотных последовательности нектина-4 мыши; под номерами доступа GenBank™ XM_005541220 и XM_005541223 даны примеры нуклеиновых кислот и аминокислотных последовательностей нектина-4 обезьяны.
[0070] «Родственные полипептиды нектина-4» включают аллельные варианты (например, варианты SNP); варианты сплайсинга; фрагменты; производные; варианты с заменами, делециями и вставками; слитые полипептиды; и межвидовые гомологи, которые могут сохранять активность нектина-4. Как понятно специалистам в данной области, антитело против нектина-4, раскрытое в настоящем описании, может связываться с полипептидом нектина-4, фрагментом полипептида нектина-4, антигеном нектина-4 и/или эпитопом нектина-4. «Эпитоп» может быть частью более крупного антигена нектина-4, который может быть частью более крупного фрагмента полипептида нектина-4, который, в свою очередь, может быть частью более крупного полипептида нектина-4. Нектин-4 может существовать в нативной или денатурированной форме. Описанные в настоящем документе полипептиды нектина-4 могут быть выделены из различных источников, таких как различные типы тканей человека или другие источники, или получены рекомбинантными или синтетическими методами. Ортологи полипептида нектина-4 также хорошо известны в данной области техники.
[0071] «Лиганд нектина-4» относится к молекуле, которая связывается или иным образом взаимодействует с нектином-4. Нектин-4 может гомофильно взаимодействовать с другой молекулой нектина-4 и гетерофильно взаимодействовать с другими белками семейства нектинов, такими как нектин-1, нектин-2 и нектин-3. Нектин-4 может также взаимодействовать с другими молекулами адгезии на клеточной поверхности, например, кадгеринами, и с другими рецепторами на клеточной поверхности, например, рецепторы пролактина. Нектин-4 может также взаимодействовать с вирусными частицами и вирусными белками на вирусных частицах, например, вирусами кори и полиовирусами. Следовательно, лиганды нектина-4 могут включать нектин-1, нектин-2, нектин-3 или нектин-4 или фрагменты любого из белков семейства нектинов. Лиганды нектина-4 могут также включать домены или полноразмерные молекулы других рецепторов клеточной поверхности, таких как кадгерины или их фрагменты, или рецепторы пролактина или их фрагменты. Лиганды нектина-4 могут дополнительно включать вирусные частицы, капсидные белки вирусов, поверхностные белки вирусов и фрагменты любых вирусных белков, которые могут связываться с нектином-4. Не ограничивающие примеры лиганда нектина-4, кроме природных лигандов, описанных в настоящем документе, или известных специалисту в данной области, включают искусственные лиганды, например, лиганды, улученные путем скрининга библиотеки пептидов на лиганды, которые могут связываться с нектином-4.
[0072] Термины «активность нектина-4» и «сигнальный путь нектина» означает биологический эффект или биологический ответ, вызванный связыванием лиганда нектина-4 и нектина-4, например, in vivo или in vitro. Термины также относятся к сходному эффекту или ответу, вызванному молекулами, которые могут имитировать функцию лиганда нектина-4. Такие миметики лиганда нектина-4 индуцируют биологический ответ или биологические эффекты, которые в ином случае были бы результатом связывания лиганда нектина-4.
[0073] Термин «связывающий белок» относится к белку, содержащему часть (например, одну или несколько связывающих областей, таких как CDR), которая связывается с нектином-4, и, необязательно, часть скелета или каркаса (например, одну или несколько областей склета или каркаса), которая обеспечивает связывающей части принимать конформацию, которая способствует связыванию связывающего белка с полипептидом, фрагментом или эпитопом нектина-4. Примеры таких связывающих белков включают антитела, такие как антитело человека, гуманизированное антитело, химерное антитело, рекомбинантное антитело, одноцепочечное антитело, диатело, триатело, тетратело, Fab-фрагмент, F(ab')2-фрагмент, антитело IgD, антитело IgE, антитело IgM, антитело IgG1, антитело IgG2, антитело IgG3 или антитело IgG4 и их фрагменты. Связывающий белок может содержать, например, альтернативный белковый каркас или искусственный каркас с привитыми CDR или производными CDR. Такие каркасы включают, но не ограничиваются ими, каркасы, полученные из антител, содержащие мутации, введенные, например, для стабилизации трехмерной структуры связывающего белка, а также полностью синтетические каркасы, содержащие, например, биосовместимый полимер. См., например, Korndorfer et al., 2003, Proteins: Structure, Function, and Bioinformatics 53(1):121-29; and Roque et al., 2004, Biotechnol. Prog.20:639-54. Кроме того, могут быть использованы антитела-миметики с пептидной структурой («PAM»), а также каркасы на основе антител-миметиков, используя компоненты фибронектина в качестве каркаса. В контексте настоящего раскрытия считается, что связывающий белок специфически связывается или селективно связывается с нектином-4.
[0074] Термин «антитело», «иммуноглобулин» или «Ig» используется в настоящем описании взаимозаменяемо и в самом широком смысле и конкретно включает, например, индивидуальные моноклональные антитела против нектина-4 (включая полноразмерные или интактные моноклональные антитела), композиции антител против Нектина-4 с полиэпитопической или моноэпитопической специфичностью, поликлональные или моновалентные антитела, поливалентные антитела, образованные по меньшей мере из двух интактных антител, одноцепочечные антитела против нектина-4 и фрагменты антител против нектина-4, как описано ниже. Антитело может быть человеческим, гуманизированным, химерным и/или с антителом с созревшей аффинностью, а также антителом других видов, например, мышиным и кроличьим и тому подобное. Под термин «антитело» следует понимать полипептидный продукт В-клеток в пределах иммуноглобулинового класса полипептидов, который способен связываться со специфическим молекулярным антигеном и состоит из двух идентичных пар полипептидных цепей, причем каждая пара имеет одну тяжелую цепь (около 50-70 кДА) и одну легкую цепь (около 25 кДА), амино-концевая часть каждой цепи включает вариабельную область, длиной от примерно 100 до примерно 130 или более аминокислот, и карбокси-концевая часть каждой цепи включает константную область. См., например, Antibody Engineering (Borrebaeck ed., 2d ed.1995); and Kuby, Immunology (3d ed.1997). В конкретных вариантах осуществления специфический молекулярный антиген может быть связан с антителом по настоящему изобретению, включая полипептид нектина-4, фрагмент нектина-4 или эпитоп нектина-4. Антитела также включают, но не ограничиваются ими, синтетические антитела, рекомбинантные антитела, камелизованные антитела, интра-антитела, антиидиотипические (анти-Id) антитела и функциональные фрагменты (например, антигенсвязывающие фрагменты, такие как нектин-4-связывающие фрагменты) любого из вышеперечисленных вариантов, которые относятся к части полипептида тяжелой или легкой цепи антитела, которая сохраняет некоторую или всю связывающую активность антитела, из которого был получен фрагмент. Не ограничивающие примеры функциональных фрагментов (например, антигенсвязывающих фрагментов, таких как нектин-4-связывающих фрагментов) включают одноцепочечные Fv (scFv), Fab-фрагменты, F(ab')-фрагменты, F(ab)2-фрагменты и F(аb')2-фрагменты, связанные дисульфидной связью Fv (dsFv), Fd-фрагменты, Fv-фрагменты, диатело, триатело, тетратело и минитело. В частности, антитела по настоящему изобретению включают молекулы иммуноглобулинов и иммунологически активных частей молекул иммуноглобулинов, например, антигенсвязывающие домены или молекулы, которые содержат антигенсвязывающий сайт, который связывается с антигеном нектина-4 (например, один или несколько CDR антитела против нектина-4). Такие фрагменты антител можно найти, например, Harlow and Lane, Antibodies: A Laboratory Manual (1989); Mol. Biology and Biotechnology: A Comprehensive Desk Reference (Myers ed., 1995); Huston et al., 1993, Cell Biophysics 22:189-224; Plückthun and Skerra, 1989, Meth. Enzymol.178:497-515; and Day, Advanced Immunochemistry (2d ed.1990). Антитела по настоящему изобретению могут быть молекулами иммуноглобулина любого класса (например, IgG, IgE, IgM, IgD и IgA) или любого подкласса (например, IgG1, IgG2, IgG3, IgG4, IgA1 и IgA2).
[0075] «Антиген» представляет собой заранее определенный антиген, с которым антитело может селективно связываться. Мишеневый антиген может представлять собой полипептид, углевод, нуклеиновую кислоту, липид, гаптен или другое природное или синтетическое соединение. В некоторых вариантах осуществления мишеневый антиген представляет собой полипептид.
[0076] Термины «антигенсвязывающий фрагмент», «антигенсвязывающий домен2, «антигенсвязывающая область» и аналогичные термины относятся к той части антитела, которая содержит аминокислотные остатки, взаимодействующие с антигеном и придающие связующему агенту специфичность и сродство к антигену (например, CDR).
[0077] Термины «связывает» или «связывание» относятся к взаимодействию между молекулами, включая, например, образование комплекса. Взаимодействия могут быть, например, нековалентными взаимодействиями, включая водородные связи, ионные связи, гидрофобные взаимодействия и/или Ван-дер-ваальсовы взаимодействия. Комплекс может также включать связывание двух или более молекул, удерживаемых вместе ковалентными или нековалентными связями, взаимодействиями или силами. Сила полного нековалентного взаимодействия между единственным антигенсвязывающим сайтом на антителе и единственным эпитопом мишеневой молекулы, такой как нектин-4, является связыванием антитела или функционального фрагмента с этим эпитопом. Отношение скорости диссоциации (koff) и скорости ассоциации (kon) антитела к моновалентному антигену (koff/kon) представляет собой константу диссоциации KD, которая обратно связана с аффинностью. The lower the KDvalue, the higher the affinity of the antibody. Величина KD изменяется в зависимости от комплексов антитела и антигена и зависит как от kon, так и от koff. Константа диссоциации KD антитела по настоящему изобретению может быть определена с использованием любого метода по настоящему изобретению или любого другого метода, хорошо известного специалистам в данной области. Аффинность в одном месте связывания не всегда отражает истинную силу взаимодействия между антителом и антигеном. Если сложные антигены, содержащие множественные, повторяющиеся антигенные детерминанты, такие как поливалентный нектин-4, вступают в контакт с антителами, содержащими множественные сайты связывания, то взаимодействие антитела с антигеном на одном сайте повышает вероятность реакции на втором сайте. Сила такого множественного взаимодействия между мультивалентным антителом и антигеном называется авидностью. Авидность антитела может быть оптимальной мерой его связывающей способности, чем сродство его отдельных сайтов связывания. Например, высокая авидность может компенсировать низкое сродство, как это иногда встречается у пентамерных антител IgM, которые могут иметь более низкое сродство, чем IgG, но высокая авидность IgM, обусловленная его мультивалентностью, позволяет ему эффективно связываться с антигеном.
[0078] Термины «антитела, которые специфически связываются с нектином-4», «антитела, которые специфически связываются с эпитопом нектина-4» и аналогичные термины также используются в настоящем описании взаимозаменяемо и относятся к антителам, которые специфически связываются с полипептидом нектина-4, таким как антиген нектина-4, или фрагмент, или эпитоп (например, нектин-4 человека, такой как полипептид нектина-4 человека, антиген или эпитоп). Антитело, которое специфически связывается с нектином-4 (например, нектин-4 человека), может связываться с внеклеточным доменом или пептидом, полученным из внеклеточного домена нектина-4. Антитело, которое специфически связывается с антигеном нектина-4 (например, нектин-4 человека), может перекрестно взаимодействовать с родственными антигенами (например, нектином-4 яванского макака). В некоторых вариантах осуществления антитело, которое специфически связывается с антигеном нектина-4, не вступает в перекрестную реакцию с другими антигенами, такими как нектин-1, нектин-2 и/или нектин-3. Антитело, которое специфически связывается с антигеном нектина-4, может быть идентифицировано, например, с помощью иммуноанализа, Biacore® или других методов, известных специалистам в данной области.
[0079] Антитело, которое “связывается с интересующим антигеном” (например, с мишеневым антигеном, таким как нектин-4), представляет собой антитело, которое связывается с достаточной аффинностью с антигеном для использования его в качестве агента для нацеливания или обнаружения клетки или ткани, экспрессирующей этот антиген, и, по существу, перекрестно не взаимодействует с другими белками. В таких вариантах осуществления степень связывания антитела с «немишеневым» белком будет меньше примерно на 10% связывания антитела с его конкретным мишеневым белком, например, как определено анализом флуоресцентной сортировки клеток активированных клеток (FACS) или RIA. Что касается связывания антитела с мишеневой молекулой, то термин «специфическое связывание», «специфически связывается» или «специфично в отношении» конкретного полипептида или эпитопа на конкретном мишеневом полипептиде означает связывание, которое значительно отличается от неспецифического связывания. Специфическое связывание может быть измерено, например, путем определения связывания с молекулой по сравнению со связыванием с контрольной молекулой, которая обычно представляет собой молекулу аналогичной структуры, но не обладающую связывающей активностью. Например, специфическое связывание может определяться конкуренцией с контрольной молекулой, которая аналогична мишени, например, как избыток немеченой мишени. В этом случае на специфическое связывание указывает конкурентное ингибирование связывания меченной мишени с зондом по избытку меченной мишени. Термин «антитело против нектина-4'' или» антитело, которое связывается с нектином-4 «включает антитело, которое способно связываться с нектин-4 с аффиностью, достаточной для использования антитела, например, в качестве диагностического средства с нацеливанием на нектин-4. Термин «специфическое связывание», «специфически связывается» или «является специфичным в отношении» конкретного полипептида или эпитопа на конкретном мишеневом полипептиде, как используется в настоящем описании, относится к связыванию, при котором молекула связывается с конкретным полипептидом или эпитопом на конкретном полипептиде, существенно не связываясь с любым другим полипептидом или эпитопом полипептида. В настоящем описании раскрыто антитело против нектина-4, которое специфически связывается с нектином-4. Также в настоящем описании раскрыто антитело против нектина-4, которое специфически связывается с нектином-4 по сравнению с нектином-1, нектином-2 и/или нектином-3.
[0080] Антитело специфически связывается с антигеном нектина-4, если оно связывается с антигеном нектина-4 с более высоким сродством, чем с любым перекрестно-взаимодействующим антигеном, что определяют с помощью экспериментальных методик, таких как радиоиммуноанализ (RIA) и иммуноферментный анализ (ELISA). Обычно специфическая или селективная реакция по меньшей мере в два раза выше фонового сигнала или шума, и может быть более чем в 10 раз выше фоновой. См, например, Fundamental Immunology 332-36 (Paul ed., 2d ed.1989), где дана информация о связывании антитела. Альтернативно, специфичность антитела может быть определена качественно, например, в анализе IHC. В таком анализе IHC антитело специфически связывается с антигеном нектина-4 или обладает специфичностью в отношении антигена нектина-4, если антитело связывается, например, иммуногистохимически окрашивается, с клетками, экспрессирующими нектин-4, но по существу не связывается, например, по существу не окрашивает клетки, экспрессирующие нектин-4. Например, антитело по существу не связывается с клеткой, например, не окрашивается, с клеткой при IHC, если антитело связывается, например, с клеткой, например, иммуногистохимически окрашивается, уровне, по существу сходном с уровнем связывания, наблюдаемым при контроле с иммуноглобулиновым изотипом.
[0081] Термины «полностью человеческое антитело» или «антитело человека» используются в настоящем описании взаимозаменяемо и относятся к антителу, которое содержит вариабельную область человека и, например, константную область человека. В конкретных вариантах осуществления эти термины относятся к антителу, которое содержит вариабельную область и константную область человеческого происхождения. «Полностью человеческие» антитела против нектина-4, в некоторых вариантах осуществления, могут также включать антитела, которые связываются с полипептидами нектина-4 и кодируются последовательностями нуклеиновых кислот, которые являются природными соматическими вариантами последовательности нуклеиновых кислот иммуноглобулина зародышевой линии человека. В конкретном варианте осуществления антитела против нектина-4, раскрытые в настоящем описании, являются полностью человеческими антителами. Термин «полностью человеческое антитело» включает антитела с вариабельными и константными областями, соответствующими последовательностям иммуноглобулинов зародышевой линии человека, как описано Kabat et al. (См. Kabat et al. (1991) Sequences of Proteins of Immunological Interest, Fifth Edition, U.S. Department of Health and Human Services, NIH Publication No.91-3242). Примеры способов получения полностью человеческих антител представлены, например, в приведенных в настоящем описании примерах, но может быть использован любой метод, известный в данной области.
[0082] Фраза «рекомбинантное антитело человека» включает антитела человека, которые получают, экспрессируют, создают или выделяют рекомбинантными способами, такие как антитела, экспрессируемые с помощью рекомбинантного вектора экспрессии, трансфицированного в клетку-хозяина, антитела, выделенные из рекомбинантной, комбинаторной библиотеки антител человека, антитела, выделенные из животного (например, мыши или коровы), которое является трансгенным и/или трансхромосомным для генов иммуноглобулина человека (см., например, Taylor, L. D. et al. (1992) Nucl. Acids Res 20:6287-6295) или антитела, полученные, экспрессированные, созданные или выделенные любым другим способом, который включает сплайсинг последовательностей генов иммуноглобулинов до других последовательностей ДНК. Такие рекомбинантные антитела человека могут иметь вариабельные и константные области, полученные из последовательностей иммуноглобулинов зародышевой линии человека (См. Kabat et al. (1991) Sequences of Proteins of Immunological Interest, Fifth Edition, U.S. Department of Health and Human Services, NIH Publication No.91-3242). В некоторых вариантах осуществления, однако, такие рекомбинантные антитела человека подвергаются in vitro мутагенезу (или, если используется животное, трансгенное для последовательностей Ig человека, то in vivo соматическому мутагенезу) и, таким образом, аминокислотные последовательности областей VH и VL рекомбинантных антител располагаются таким образом, что при получении из зародышевой линии человека и по сравнению с последовательностями VH и VL зародышевой линии человека, могут природно не существовать в репертуаре зародышевой линии антител человека in vivo.
[0083] Термин «конкуренция», при использовании в контексте антител против нектина-4 (например, антител и связывающих белков, которые связываются с нектином-4 и конкурируют за один и тот же эпитоп или связывающий сайт на мишени), означает конкуренцию, которую определяют в анализе, в котором исследуемое антитело (или связывающий фрагмент) предотвращает или ингибирует специфическое связывание эталонной молекулы (например, эталонного лиганда или эталонного антигенсвязывающего белка, такого как эталонное антитело) с общим антигеном (например, нектином-4 или его фрагментом). Для определения того, конкурирует ли исследуемое антитело с эталонным антителом за связывание с нектином-4 (например, с нектином-4 человека), можно использовать различные варианты конкурентных анализов связывания. Примеры анализов, которые можно использовать, включают твердофазный прямой или непрямой RIA, твердофазный прямой или непрямой иммуноферментный анализ (EIA), конкурентный сэндвич-анализ (см., например, Stahli et al., 1983, Methods in Enzymology 9: 242-53), твердофазный прямой биотин-авидин EIA (см., например, Kirkland et al., 1986, J. Immunol.137:3614-19), твердофазный прямой анализ с меткой, твердофазный прямой сэндвич-анализ с меткой (см., например, Harlow and Lane, Antibodies, A Laboratory Manual (1988)), твердофазный RIA с меткой, используя метку I-125 (см., например, Morel et al., 1988, Mol. Immunol.25:7-15) и прямой RIA с меткой (Moldenhauer et al., 1990, Scand. J. Immunol.32:77-82). Обычно такой анализ включает использование очищенного антигена (например, нектина-4, такого как нектин-4 человека), связанного с твердой поверхностью, или клеток, несущих либо немеченый исследуемый антигенсвязывающий белок (например, исследуемое антитело против нектина-4), либо меченый эталонный антигенсвязывающий белок (например, эталонное антитело против нектина-4). Другие примеры конкурентных анализов связывания, которые могут быть использованы, включают ELISA, FACS, анализы клеточной адгезии (например, как описано в Humphries et al. Methods Mol Biol. 2009;522:203-10), поверхностный плазмонный резонанс (SPR) или другие конкурентные анализы связывания, известные специалисту в данной области. Конкурентное ингибирование может быть измерено путем определения количества метки, связанной с твердой поверхностью или клетками в присутствии исследуемого антигенсвязывающего белка. Обычно тестируемый антиген-связывающий белок присутствует в избытке. Антитела, идентифицированные конкурентным анализом (конкурирующие антитела), включают антитела, связывающиеся с тем же эпитопом, что и эталонное антитело, и/или антитела, связывающиеся с соседним эпитопом, эпитопом, расположенным достаточно близко к эпитому, связываемому эталонным антителом, чтобы возникала стерическая помеха для антител. В настоящем документе эти методы определения конкурентного связывания описаны более подобно. Обычно, если конкурирующее антитело-белок присутствует в избытке, то оно ингибирует специфическое связывание эталонного антитела с общим антигеном по меньшей мере на 30%, например 40%, 45%, 50%, 55%, 60%, 65%, 70%, или 75%. В некоторых случаях связывание ингибируется по меньшей мере на 80%, 85%, 90%, 95%, 96%, 97%, 98%, 99%, или даже больше.
[0084] как используется в настоящем описании, термин “в комбинации” в контексте введения других видов терапевтических средств относится к использованию более чем одного терапевтического средства. Использование термина «в комбинации» не ограничивает порядок, в котором индивиду с инфекцией назначают терапевтические средства. Первое терапевтическое средство можно вводить до (например, за 1 минуту, за 45 минут, за 30 минут, за 45 минут, за 1 час, за 2 часа, за 4 часа, за 6 часов, за 12 часов, за 24 часа, за 48 часов, за 72 часа, за 96 часов, за 1 неделю, за 2 недели, за 3 недели, за 4 недели, за 5 недель, за 6 недель, за 8 недель или за 12 недель), одновременно или после (например, через 1 минуту, через 45 минут, через 30 минут, через 45 минут, через 1 час, через 2 часа, через 4 часа, через 6 часов, через 12 часов, через 24 часа, через 48 часов, через 72 часа, через 96 часов, через 1 неделю, через 2 недели, через 3 недели, через 4 недели, через 5 недель, через 6 недель, через 8 недель или через 12 недель) после введения второго терапевтического средства индивиду, который страдал, страдает или подвержен заболеванию, опосредованному нектином-4. Любое дополнительное терапевтическое средство может быть введено в любом порядке с другими дополнительными терапевтическими средствами. В некоторых вариантах осуществления антитела по настоящему изобретению можно вводить в комбинации с одним или несколькими терапевтическими средствами (например, терапевтическими средствами, которые не являются антителами по настоящему изобретению, которые в настоящее время используются для профилактики, лечения, контроля и/или улучшения заболевания, опосредованного нектином-4. Неограничивающие примеры терапевтических средств, которые можно вводить в комбинации с антителом по настоящему изобретению включают анальгетики, анестетики, антибиотики или иммуномодулирующие средства или любое другие средства, указанные в U.S. Pharmacopoeia и/или Physician's Desk Reference.
[0085] «Выделенное» антитело по существу свободно от клеточного материала или других загрязняющих белков из источника клеток или тканей и/или других загрязняющих компонентов, из которых получено антитело, или по существу свободно от химических предшественников или других химических веществ при химическом синтезе. Термин «по существу свободный от клеточного материала» включает препараты антитела, в которых антитело отделено от клеточных компонентов клеток, из которых оно выделено или рекомбинантным образом получено. Таким образом, антитело, которое по существу не содержит клеточного материала, включает препараты антитела, которые содержат менее чем на примерно 30%, 25%, 20%, 15%,10%, 5%, или 1% (по сухому весу) гетерологичного белка (также называемого в данном случае «загрязняющим белком»). В некоторых вариантах осуществления, если антитело получают рекомбинантным методом, то оно по существу свободно от культуральной среды, например, культуральная среда составляет менее чем примерно 20%, 15%, 10%, 5% или 1% от объема белкового препарата. В некоторых вариантах осуществления, если антитело получают химическим синтезом, то оно по существу не содержит химических предшественников или других химических веществ, например, оно отделено от химических предшественников или других химических веществ, участвующих в синтезе белка. Соответственно такие препараты антитела содержат менее чем примерно 30%, 25%, 20%, 15%, 10%, 5% или 1% (по сухому весу) химических предшественников или соединений, отличных от интересующего антитела. Загрязняющие компоненты могут также включать, но не ограничиваются ими, вещества, которые оказывают негативное влияние на терапевтическое применение антитела, и могут включать ферменты, гормоны и другие белковые или небелковые растворенные вещества. В некоторых вариантах осуществления антитело очищено (1) до более чем 95% по массе антитела, что определяют методом Lawry (Lowry et al., 1951, J. Bio. Chem.193: 265-75), например 96%, 97%, 98% или 99%, (2) до степени, достаточной для получения по меньшей мере 15 остатков N-концевой или внутренней аминокислотной последовательности путем секвенатора c вращающейся чашкой, или (3) до гомогенности с помощью SDS-PAGE в восстановливающих или невосстанавливающих условиях, используя Кумасси синий или окрашивание серебром. Выделенное антитело включает антитело in situ в рекомбинантных клетках, поскольку по крайней мере один компонент природного окружения антитела не будет присутствовать. Обычно, выделенное антитело получают по крайней мере одной стадией очистки. В конкретных вариантах осуществления антитела по настоящему изобретению являются выделенными.
[0086] Единица антитела из 4-х цепей представляет собой гетеротетрамерный гликопротеин, состоящий из двух идентичных легких (L) цепей и двух идентичных тяжелых (H) цепей. В случае IgG, единица из 4-х цепей обычно имеет размер примерно 150000 Дальтон. Каждая цепь L связана с цепью H одной ковалентной дисульфидной связью, в то время как две цепи H связаны друг с другом одной или несколькими дисульфидными связями в зависимости от изотипа цепи H. Каждая цепь H и L также имеет регулярно расположенные внутрицепочечные дисульфидные мостики. Каждая цепь H имеет на N-конце вариабельный домен (VH), за которой следуют три констатный домен (CH) для каждой α и γ цепи и четыре домена CH для изотипов μ и ε. Каждая цепь L имеет на N-конце вариабельный домен (VL), за которым следует константный домен (CL) на другом конце. VL выровнен с VH, а CL выровнен с первым константным доменом тяжелой цепи (CH1). Считается, что определенные аминокислотные остатки образуют поверхность между вариабельными доменами легкой цепи и тяжелой цепи. Образование пары VH и VL дает единый антигенсвязывающий сайт. Описание структуры и свойств различных классов антител см., например, Basic and Clinical Immunology 71 (Stites et al. eds., 8th ed.1994).
[0087] Термин «вариабельная область», «вариабельный домен», «V-область» или «V-домен» относится к части легких или тяжелых цепей антитела, которая обычно расположена на амино-конце легкой или тяжелой цепи и имеет длину около 120-130 аминокислот в тяжелой цепи и около 100-110 аминокислот в легкой цепи, и используются в контексте связывания и специфичности каждого конкретного антитела в отношении его конкретного антигена. Вариабельная область тяжелой цепи может быть обозначена как «VH». Вариабельная область легкой цепи может быть обозначена как «VL». Термин «вариабельность» относится к тому факту, что определенные сегменты вариабельных областей сильно различаются по последовательности у разных антител. V-область опосредует связывание антигена и определяет специфичность конкретного антитела в отношении его конкретного антигена. Однако вариабельность не равномерно распределена на протяжении 110-аминокислотного промежутка вариабельных областей. Вместо этого V-области состоят из менее вариабельных (например, относительно инвариантных) участков, называемых каркасными областями (FR) длиной около 15-30 аминокислот, разделенных более короткими областями с большей изменчивостью (например, экстремально вариабельных), называемых «гипервариабельными областями», каждая из которых имеет длину около 9-12 аминокислот. Каждая вариабельная область тяжелой и легкой цепи включает четыре FR, в основном принимая конфигурацию β-складчатости, соединенные тремя гипервариабельными областями, которые образуют петли, соединяющие и в некоторых случаях формирующие часть структуры β-складчатости. Гипервариабельные области каждой цепи удерживаются вместе в непосредственной близости друг от друга и вместе с гипервариабельными областями другой цепи способствуют образованию антигенсвязывающего сайта антител (см., например, Kabat et al., Sequences of Proteins of Immunological Interest (5th ed.1991)). Константные области не участвуют непосредственно в связывании антитела с антигеном, но проявляют различные эффекторные функции, такие как участие антитела в антитело-зависимой клеточной цитотоксичности (ADCC) и комплемент-зависимой цитотоксичности (CDC). Вариабельные области значительно различаются по последовательности у разных антител. В конкретных вариантах осуществления вариабельная область является вариабельной областью человека.
[0088] Термин «нумерация остатков вариабельной области по Кэбату» или «нумерация аминокислотных остатков по Кэбату» и их варианты относится к системе нумерации, используемой для вариабельных областей тяжелой цепи или вариабельных областей легкой цепи при компоновке антител по Kabat et al., выше. Используя эту систему нумерации, фактическая линейная аминокислотная последовательность может содержать меньшее количество или дополнительные аминокислоты, соответствующие укорочению или вставке в FR или CDR вариабельного домена. Например, вариабельный домен тяжелой цепи может включать в себя одну аминокислотную вставку (остаток 52a по Кэбату) после остатка 52 и три вставленных остатка (например, остатки 82a, 82b и 82c и тому подобное по Кэбату) после остатка 82. Нумерация остатков по Кэбату может быть определена для заданного антитела путем выравнивания в областях гомологии последовательности антитела со «стандартной» последовательностью по Кэбату. Система нумерации по Кэбату обычно используется для ссылки на остаток в вариабельном домене (примерно остатки 1-107 легкой цепи и остатки 1-113 тяжелой цепи) (например, Kabat et al., выше.) «Система нумерации ЕС» или «индекс ЕС» обычно используются для ссылки на остаток в константной области тяжелой цепи иммуноглобулина (например, индекс ЕС, как описано в Kabat et al., выше.) «Индекс ЕС по Кэбату» ссылается на нумерацию остатков IgG 1 человека антитела EU. Были описаны другие системы нумерации, например, AbM, Chothia, Contact, IMGT и AHon и они хорошо известны среднему специалисту в данной области.
[0089] «Интактным» антителом является антитело, содержащее антигенсвязывающий сайт, а также CL и по меньшей мере константные области тяжелой цепи, CH1, CH2 и CH3. Константные области могут содержать константные области человека или их варианты аминокислотных последовательностей. В некоторых вариантах осуществления интактное антитело обладает одной или несколькими эффекторными функциями.
[0090] «Фрагменты антитела» включают часть интактного антитела, такую как антигенсвязывающая или вариабельная область интактного антитела. Примеры фрагментов антител включают, но ими не ограничиваются, Fab, Fab', F (ab')2 и Fv-фрагменты; диатела и ди-диатела (см., например, Holliger et al., 1993, Proc. Natl. Acad. Sci.90:6444-48; Lu et al., 2005, J. Biol. Chem. 280:19665-72; Hudson et al., 2003, Nat. Med.9:129-34; WO 93/11161; и патенты США №№ 5837242 и 6492123); молекулы одноцепочечных антител (см., например, патенты США №№ 4946778; 5260203; 5482858; и 5476786); антитела с двойным вариабельным доменом (см., например, патент США № 7612181); антитела с одним вариабельным доменом (sdAb) (см., например, Woolven et al., 1999 г., Immunogenetics 50: 98-101; и Streltsov et al., 2004, Proc Natl Acad Sci USA.101:12444-49); и мультиспецифичные антитела, образованные из фрагментов антител.
[0091] «Функциональный фрагмент», «связывающий фрагмент» или «антигенсвязывающий фрагмент» терапевтического антитела проявляет по меньшей мере одну, если не все, биологические функции, характерные для интактного антитела, причем функция включает по меньшей мере связывание с мишеневым антигеном (например, связывающий фрагмент нектина-4 или фрагмент, который связывается с нектином-4).
[0092] Термин «слитый белок», как используется в настоящем документе, относится к полипептиду, который содержит аминокислотную последовательность антитела и аминокислотную последовательность гетерологичного полипептида или белка (например, полипептид или белок, который обычно не является частью антитела (например, антигенсвязывающее антитело, которое не нацелено на нектин-4). Термин «слитый», как используется отношении нектина-4 или антитела против нектина-4, относится к соединению пептида или полипептида, или его фрагмента, варианта и/или производного с гетерологичным пептидом или полипептидом. В некоторых вариантах осуществления слитый белок сохраняет биологическую активность нектина-4 или антитела против нектина-4. В некоторых вариантах осуществления слитый белок содержит область VH, область VL, CDR VH (один, два или три CDR VH) и/или CDR VL (один, два или три CDR VL) антитела против нектина-4, где слитый белок связывается с эпитопом нектина-4, фрагментом нектина-4 и/или полипептидом нектина-4.
[0093] Термин «тяжелая цепь», как используется в отношении антитела, относится к полипептидной цепи размером примерно 50-70 кДа, в которой амино-концевая часть включает вариабельную область длиной примерно от 120 до 130 или более аминокислот, а карбокси-концевая часть включает константную область. Константная область может быть одной из пяти различных типов (например, изотипов), называемых альфа (α), дельта (δ), эпсилон (ε), гамма (γ) и мю (μ), на основе аминокислотной последовательности константной области тяжелой цепи. Разные тяжелые цепи различаются по размеру: α, δ и γ содержат приблизительно 450 аминокислот, в то время как μ и ε содержат приблизительно 550 аминокислот. При комбинировании с легкой цепью, эти различные типы тяжелых цепей дают пять известных классов (например, изотипов) иммуноглобулинов, иммуноглобулины IgA, IgD, IgE, IgG и IgM, соответственно, в том числе четыре подкласса IgG, а именно: IgG1, IgG2, IgG3 и IgG4. Тяжелая цепь может быть тяжелой цепью человека.
[0094] Термин «легкая цепь», как используется в отношении антитела, относится к полипептидной цепи размером примерно 25 кДа, в которой амино-концевая часть включает вариабельную область длиной примерно от 100 до 110 или более аминокислот, а карбокси-концевая часть включает константную область. Примерная длина легкой цепи составляет от 211 до 217 аминокислот. Существует два различных типа, обозначаемых как (κ) или лямбда (λ), основанных на аминокислотной последовательности константных доменов. Аминокислотные последовательности легкой цепи хорошо известны в данной области. Легкая цепь может быть легкой цепью человека.
[0095] Термин «хозяин», как используется в настоящем документе, относится к животному, такому как млекопитающее (например, человек).
[0096] Термин «клетка-хозяин», как используется в настоящем документе, относится к конкретной рассматриваемой клетке, которая может быть трансфицирована молекулой нуклеиновой кислоты, и к потомству или возможному потомству такой клетки. Потомство такой клетки может не быть идентичным родительской клетке, трансфицированной молекулой нуклеиновой кислоты из-за мутаций или воздействия окружающей среды, которые могут возникнуть в последующих поколениях или из-за интеграции молекулы нуклеиновой кислоты в геном клетки-хозяина.
[0097] Термин «моноклональное антитело», как используется в настоящем документе, относится к антителу, полученному из популяции по существу однородных антител, например, индивидуальные антитела, составляющие популяцию, идентичны, за исключением возможных природных мутаций, которые могут присутствовать в незначительных количествах, и каждое моноклональное антитело обычно распознает один эпитоп на антигене. В конкретных вариантах осуществления «моноклональное антитело», используемое в настоящем документе, представляет собой антитело, продуцируемое одной гибридомой или другими клетками, где антитело связывается только с эпитопом нектина-4, как определяют, например, методом ELISA или другим антигенсвязывающим или конкурентным связывающим анализом, известным в данной области. Термин «моноклональное» не ограничивается каким-либо конкретным способом получения антитела. Например, моноклональные антитела, которые можно использовать согласно описанию, могут быть получены с помощью гибридомной методики, впервые описанной Kohler et al., 1975, Nature 256: 495, или могут быть получены методами рекомбинантных ДНК в бактериальных или эукариотических клетках животных или растений (см., например, патент США 4816567). «Моноклональные антитела» также могут быть выделены из библиотек фаговых антител, используя методы, описанные Clackson et al., 1991, Nature 352: 624-28 и Marks et al., 1991, J. Mol. Biol.222:581-97, например. Другие способы получения клональных клеточных линий и моноклональных антител, экспрессируемых ими, хорошо известны в данной области. См., например, Short Protocols in Molecular Biology (Ausubel et al. eds., 5th ed. 2002). Примеры способов получения моноклональных антител приведены в разделе «Примеры» настоящего описания.
[0098] Термин «нативный», как используется в связи с биологическими веществами, такими как молекулы нуклеиновых кислот, полипептиды, клетки-хозяева и тому подобное, относится к веществам, которые являются природными и не подвергаются манипулированию, модификации и/или изменению (например, выделению, очищению, отбору) человеком.
[0099] Антитела по настоящему изобретению могут включать «химерные» антитела, в которых часть тяжелой и/или легкой цепи идентична или гомологична соответствующим последовательностям антител, полученных из определенного вида или принадлежащих определенному классу или подклассу антител, в то время как остальная часть цепи(ей) идентична или гомологична соответствующим последовательностям антител, полученных из другого вида или принадлежащих другому классу или подклассу антител, а также фрагментам таких антител, если они проявляют желаемую биологическую активность (см., патент США № 4816567; и Morrison et al., 1984, Proc. Natl. Acad. Sci. USA 81:6851-55).
[00100] «Гуманизированные» формы антител, которые не являются человеческими (например, мышиные), представляют собой химерные антитела, которые включают иммуноглобулины человека (например, рецепиентное антитело), в которых нативные остатки CDR заменяют остатками соответствующего CDR из видов, не относящихся к человеку (например, донорное антитело), таких как мышь, крыса, кролик или примат, не являющийся человеком, обладающих желаемой специфичностью, аффинностью и возможностями. В некоторых случаях один или несколько остатков области FR иммуноглобулина человека заменяют соответствующими остатками, не являющимися человеческими. Кроме того, гуманизированные антитела могут содержать остатки, которые не обнаружены в реципиентном антителе или в донорном антителе. Эти изменения сделаны для более тонких настроек свойств антител. Тяжелая или легкая цепь гуманизированного антитела может содержать по существу все по меньшей мере одну или более вариабельных областей, в которых все или по существу все CDR соответствуют CDR иммуноглобулина, не являющегося человеческим, и все или по существу все FR являются FR последовательности иммуноглобулина человека. В некоторых вариантах осуществления гуманизированное антитело будет содержать по меньшей мере часть константной области иммуноглобулина (Fc), как правило, иммуноглобулина человека. Для получения дополнительной информации см. Jones et al., 1986, Nature 321: 522-25; Riechmann et al., 1988, Nature 332: 323-29; Presta, 1992, Curr. Op. Struct. Biol.2:593-96; Carter et al., 1992, Proc. Natl. Acad. Sci. USA 89:4285-89; патент США №№ 6800738; 6719971; 6639055; 6407213; и 6054297.
[00101] «Aнтитело человека» представляет собой такое антитело, которое обладает аминокислотной последовательностью, которая соответствует последовательности антитела, продуцируемого человеком и/или полученного с использованием любого способа получения антител человека, описанных в настоящем документе. Такое определение антитела человека исключает гуманизированное антитело, содержащее антигенсвязывающие остатки, не являющиеся человеческими. Антитела человека могут быть получены с использованием различных методик, известных в данной области, включая библиотеки фаговых дисплеев (Hoogenboom and Winter, 1991, J. Mol. Biol.227:381; Marks et al., 1991, J. Mol. Biol. 222:581) и библиотеки дрожжевых дисплеев (Chao et al., 2006, Nature Protocols 1: 755-68). Также доступны способы получения моноклональных антител человека, описанные в Cole et al., Monoclonal Antibodies and Cancer Therapy 77 (1985); Boerner et al., 1991, J. Immunol. 147(1):86-95; and van Dijk and van de Winkel, 2001, Curr. Opin. Pharmacol.5: 368-74. Антитела человека могут быть получены путем введения антигена трансгенному животному, которое было модифицировано на продукцию таких антител в ответ на стимуляцию антигеном, но эндогенные локусы которого были отключены, например, мышам (см., например, Jakobovits, 1995, Curr. Opin. Biotechnol.6(5):561- 66; Brüggemann and Taussing, 1997, Curr. Opin. Biotechnol.8(4):455-58; и патент США №№ 6075181 и 6150584, касающиеся XENOMOUSE<TM>). См. также, например, Li et al., 2006, Proc. Natl. Acad. Sci. USA 103:3557-62, касающуюся антител человека, полученных гибридомными технологиями на основе В-клеток человека.
[00102] Термин «CDR» относится к одной из трех гипервариабельных областей (H1, H2 или H3) в пределах не-каркасной области VH иммуноглобулина (Ig или антитела) со β-складчатой структурой или к одной из трех гипервариабельных областей (L1, L2 или L3) в пределах не-каркасной области VL антитела с β-складчатой структурой. Соответственно, CDR представляют собой последовательности вариабельной области, строенные в пределах последовательностей каркасных областей. Области CDR хорошо известны специалистам в данной области и были определены, например, по Кэбат как области наибольшей гипервариабельности в пределах вариабельных доменов антитела (V) (Кэбат et al., 1997, J. Biol. Chem.252:6609-16; Кэбат, 1978, Adv. Prot. Chem.32:1-75). Последовательности CDR также были структурно определены по Chothia как последовательности, остатки которых не являются частью консервативной β-складчаой структуры, и таким образом, как способные принимать различные конформации (Chothia and Lesk, 1987, J. Mol. Biol.196:901-17). Обе термина хорошо известны в данной области. Последовательности CDR также были определены с помощью AbM, Contact и IMGT. Положения CDR в пределах канонической вариабельной области антитела определены путем сравнения многочисленных структур (Al-Lazikani et al., 1997, J. Mol. Biol. 273:927-48; Morea et al., 2000, Methods 20:267-79). Поскольку количество остатков в пределах гипервариабельной области изменяется в разных антителах, дополнительные остатки к каноническим положениям обычно нумеруют как a, b, c и тому подобное рядом с номером остатка, определенным по схеме нумерации канонических вариабельных областей (Al-Lazikani et al., выше.) Такая номенклатура также хорошо известна специалистам в данной области.
[00103] Термин «гипервариабельная область», «HVR» или «HV», как используется в настоящем описании, относится к вариабельным областям антитела, которые являются гипервариабельными в последовательности и/или образуют структурно определенные петли. Как правило, антитела содержат шесть гипервариабельных областей, три в VH (H1, H2, H3) и три в VL (L1, L2, L3). Настоящее описание охватывает и использует ряд изображений гипервариабельных областей. Определяющие комплементарность области по Кэбат (CDR) основаны на вариативности последовательностей и наиболее часто используются (см., например, Кэбат et al., выше.) Вместо этого по Chothia указывает на расположение структурных петель (см., например, Chothia and Lesk, 1987, J. Mol. Biol.196:901-17). Конец петли CDR-Н1 по Chothia, при использованиии нумерации по Кэбат, изменяется у H32 и H34 и в зависимости от длины петли (это из-за того, что схема нумерации по Кэбат помещает инсерции H35A и H35B; если ни один из 35A и 35B не присутствует, то петля заканчивается на 32; если присутствует только 35А, то петля заканчивается на 33; если присутствует и 35А, и 35B, то петля заканчивается на 34). Гипервариабельные области AbM представляют собой компромисс между CDR по Кэбату и структурными петлями по Chothia и используются в программных средствах моделирования антител Oxford Molecular's AbM (см., например, Antibody Engineering Vol.2 (Kontermann and Dübel eds., 2d ed.2010)). «Контактные» гипервариабельные области основаны на анализе имеющихся сложных кристаллических структур. Остатки каждой из этих гипервариабельных областей или CDR отмечены ниже.
[00104] Недавно была разработана и широко используется универсальная система нумерации, ImMunoGeneTics (IMGT) Information System® (Lafranc et al., 2003, Dev. Comp. Immunol. 27(1):55-77). IMGT представляет собой интегрированную информационную систему, специализирующуюся на иммуноглобулинах (IG), Т-клеточных рецепторах (TCR) и главном комплексе гистосовместимости (MHC) человека и других позвоночных. В данном случае, CDR указываются в терминах как аминокислотной последовательности, так и расположения в легкой или тяжелой цепи. Поскольку «расположение» CDR в структуре вариабельного домена иммуноглобулина сохраняется у разных видов и присутствует в структурах, называемых петлями, то с помощью систем нумерации, которые выравнивают последовательности вариабельных доменов в соответствии со структурными признаками, CDR и остатки каркаса легко идентифицировать. Эта информация может быть использована при пересадке и замене остатков CDR иммуноглобулинов одного вида в акцепторную структуру из, как правило, антитела человека. Дополнительная система нумерации (AHon) была разработана Honegger and Plückthun, 2001, J. Mol. Biol.309: 657-70. Соответствие между системой нумерации, включая, например, нумерацию Кэбат и уникальную систему нумерации IMGT, хорошо известно специалисту в данной области (см., например, Кэбат, выше; Chothia and Lesk, выше; Martin, выше; Lefranc et al., выше).
[00105] Гипервариабельные области могут содержать «расширенные гипервариабельные области» следующим образом: 24-36 или 24-34 (L1), 46-56 или 50-56 (L2), и 89-97 or 89-96 (L3) в VL, и 26-35 или 26-35A (H1), 50-65 или 49-65 (H2), и 93-102, 94-102, или 95-102 (H3) в VH. В настоящем документе термины «HVR» и «CDR» используются взаимозаменяемо.
[00106] Термин «константная область» или «константный домен» относится к карбокси-концевой части легкой и тяжелой цепи, которая не участвует непосредственно в связывании антитела с антигеном, но проявляет различные эффекторные функции, такие как взаимодействие с Fc-рецептором. Термин относится к части молекулы иммуноглобулина, имеющей более консервативную аминокислотную последовательность по сравнению с другой частью иммуноглобулина, то есть вариабельной областью, которая содержит сайт связывания антигена. Константная область может содержать области CH1, CH2 и CH3 тяжелой цепи и область CL легкой цепи.
[00107] Термин «каркас» или «FR» относится к остаткам вариабельной области, которые фланкируют CDR. Остатки FR присутствуют, например, в химерных, гуманизированных, человеческих, доменных антителах, диателах, линейных антителах и биспецифических антителах. Остатки FR представляют собой остатки вариабельных доменов, которые отличаются от остатков гипервариабельной области или остатков CDR.
[00108] Антитело с «созревшей аффинностью» представляет собой антитело с одним или несколькими изменениями (например, вариантами аминокислотных последовательностей, включая изменения, добавления и/или делеции) в одном или нескольких HVR, которые приводят к улучшению сродства антитела к антигену по сравнению с родительским антителом, у которого нет такого изменения(ий). Антитела с созревшей аффиностью могут иметь наномолярное и даже пикомолярное средство в отношении мишеневого антигена. Антитела с созревшей аффиностью получают методиками, известными в данной области. Обзор представлен в Hudson and Souriau, 2003, Nature Medicine 9:129-34; Hoogenboom, 2005, Nature Biotechnol.23:1105-16; Quiroz and Sinclair, 2010, Revista Ingeneria Biomedia 4:39-51.
[00109] «Аффинность связывания» обычно относится к силе суммарного нековалентного взаимодействия между единственным сайтом связывания молекулы (например, связывающим белком, таким как антитело) и ее партнером по связыванию (например, антигеном). Если не указано иное, как используется в настоящем документе, «аффнность связывания» относится к внутреннему сродству связывания, которое отражает взаимодействие 1:1 между членами связывающей пары (например, антитело и антиген). Аффинность связывающей молекулы X к ее партнеру связывания Y обычно может быть представлено константой диссоциации (KD). Аффинность может быть измерена обычными методами, известными в данной области техники, в том числе описанными в настоящем документе. Низкоаффинные антитела обычно связываются с антигеном медленно и имеют тенденцию легко диссоциировать, тогда как высокоаффинные антитела обычно связываются с антигеном быстрее и, как правило, остаются связанными дольше. В данной области техники известны различные способы измерения аффинности связывания, любой из них может использоваться для целей настоящего описания. Конкретные иллюстративные варианты осуществления включают следующее. В одном из вариантов осуществления «KD» или «значение KD» могут быть измерены с помощью анализов, известных в данной области, например, с помощью анализа связывания. KD можно измерить в RIA, например, осуществляя анализ с Fab-вариантом интересующего антитела и его антигена (Chen et al., 1999, J. Mol Biol 293: 865-81). KD or значение KD также может быть измерено с помощью анализа поверхностного плазмонного резонанса Biacore®, используя, например, Biacore®TM-2000 или Biacore®TM-3000, или с помощью биолокационной интерферометрии, используя, например, систему Octet®QK384. «Скорость прямой реакции» или «скорость ассоциации» или «kon» также можно определить теми же способами поверхностного плазмонного резонанса или биослойной интерферометрией, описанными выше, используя, например, Biacore®TM-2000 или Biacore®TM-3000, или системы Octet®QK384.
[00110] Фраза «по существу сходный” или» по существу аналогичный» обозначает достаточно высокую степень сходства между двумя числовыми значениями или сигналами (например, сигналами окрашивания IHC) двух изображений (например, одного, связанного с антителом по настоящему изобретению, а другого, связанного с эталонным антителом), так что специалист в данной области будет считать разницу между двумя значениями или двумя изображениями незначительной или вообще не имеющей биологической и/или статистической значимости в контексте биологической характеристики, измеряемой значениями (например, значениями KD). Например, разница между этими двумя значениями может быть меньше, чем примерно 50%, меньше, чем примерно 40%, меньше, чем примерно 30%, меньше, чем примерно 20%, меньше, чем примерно 10% или меньше, чем примерно 5%, в зависимости от значения эталонного антитела.
[00110] Фраза «по существу повышен» или «по существу понижен», как используется в настоящем описании, обозначает достаточно высокую степень различия между двумя числовыми значениями или сигналами (например, сигналами окрашивания IHC) двух изображений (например, одного, связанного с антителом по настоящему изобретению, а другого, связанного с эталонным антителом), так что специалист в данной области будет считать разницу между двумя значениями или двумя изображениями незначительной в контексте биологической характеристики, измеряемой значениями. Например, разница между указанными двумя значениями может быть больше, чем примерно 10%, больше, чем примерно 20%, больше, чем примерно 30%, больше, чем примерно 40% или больше, чем примерно 50%, в зависимости от значения для эталонного антитела.
[00112] «Эффекторные функции» антитела относятся к тем биологическим активностям, которые связывают с Fc-областью (например, с нативной последовательностью Fc-области или аминокислотной последовательностью варианта Fc-области) антитела и изменяются в зависимости от изотипа антитела. Примеры эффекторных функций антител включают в себя: связывание C1q; CDC; Fc-рецепторное связывание; ADCC; фагоцитоз; и B-клеточную активацию.
[00113] Термин «эффективное количество», как используется в настоящем описании, относится к количеству антитела или фармацевтической композиции по настоящей заявке, которое является достаточным для достижения желаемого результата.
[00114] Термин «Fc-область» используется в настоящем описании для определения C-концевой области тяжелой цепи иммуноглобулина, включая, например, нативные последовательности Fc-областей, рекомбинантных Fc-областей и вариантных Fc-областей. Хотя границы Fc-области тяжелой цепи иммуноглобулина могут различаться, Fc-область тяжелой цепи IgG человека часто определяют по протяженности от аминокислотного остатка в положении Cys226, или от Pro230, до карбокси-конца. C-концевой лизин (остаток 447 в соответствии с системой нумерации ЕС) Fc-области может быть удален, например, во получения или очистки антитела, или рекомбинантными методами на основе нуклеиновой кислоты, кодирующей тяжелую цепь антитела. Соответственно, композиция интактных антител может содержать популяции антител со всеми удаленными остатками К447, популяции антител без удаленных остатков К447 и популяции антител, содержащие смесь антител с остатком К447 и без него.
[00115] «Функциональная Fc-область» обладает «эффекторной функцией» природной последовательности Fc-области. Пример «эффекторных функций» включает связывание C1q; CDC; Fc-рецепторное связывание; ADCC; фагоцитоз; и тому подобное. Такие эффекторные функции обычно требуют объединения области Fc с областью связывания или доменом связывания (например, вариабельной областью или доменом антитела) и может быть оценена с использованием различных анализов, как описано.
[00116] «Нативная последовательность Fc-области» включает аминокислотную последовательность, идентичную природной аминокислотной последовательности Fc-области, которая не подвергалась манипуляциям, модификациям и/или изменениям (например, выделение, очистка, отбор, включение или объединение с другими последовательностями, такими как последовательности вариабельных областей) человека. Нативные последовательности Fс-областей IgG1 человека включают нативную последовательность Fc-области IgG1 человека (не-А и аллотипы А); нативную последовательность Fc-области IgG2 человека; нативную последовательность Fc-области IgG3 человека; и нативную последовательность Fc-области IgG4 человека, а также их природные варианты. Например, нативная аминокислотная последовательность Fc-области IgG1 человека представлена ниже (SEQ ID NO: 35).
[00117] «Вариант Fc-области» содержит аминокислотную последовательность, которая отличается от нативной последовательности Fc-области по меньшей мере одной аминокислотной модификацией (например, заменой, добавлением или делецией). В некоторых вариантах вариант Fc-области имеет по крайней мере одну аминокислотную замену по сравнению с нативной последовательностью Fс-области или по сравнению с Fc-областью родительского полипептида, например, от примерно одного до примерно десяти аминокислотных замен, или от около одной до около пяти аминокислотных замен в последовательности Fc-области или в Fc-области родительского полипептида. Вариант Fc-области по настоящему изобретению может обладать по меньшей мере примерно 80% гомологией с нативной последовательностью Fc-области и/или с Fc-областью родительского полипептида, или по меньшей мере около 90% гомологией, например, по меньшей мере около 95% гомологией.
[00118] Термин «вариант» при использовании в отношении нектина-4 или антитела против нектина-4 может относиться к пептиду или полипептиду, содержащему одну или несколько (так, например, от 1 до 25, от 1 до 20, от 1 до 15, от 1 до 10 или от 1 до 5) замен, делеций и/или добавлений в аминокислотной последовательности по сравнению с нативной или немодифицированной последовательностью. Например, вариант нектина-4 может быть результатом одного или нескольких (та, например, от 1 до 25, от 1 до 20, от 1 до 15, от 1 до 10 или от 1 до 5) изменений в аминокислотной последовательности нативного нектина-4. Также в качестве примера, вариант антитела против нектина-4 может быть результатом одного или нескольких (так, например, от 1 до 25, от 1 до 20, от 1 до 15, от 1 до 10 или от 1 до 5) изменений в аминокислотной последовательности нативного или ранее немодифицированного антитела против нектина-4. Варианты могут быть природными, такими как аллельные или сплайсинговые варианты, или могут быть искусственно сконструированы. Полипептидные варианты могут быть получены из соответствующих молекул нуклеиновых кислот, кодирующих эти варианты. В конкретных вариантах осуществления вариант нектина-4 или вариант антитела против нектина-4, по меньшей мере, сохраняет специфическое связывание с нектином-4 по сравнению с эталонным антителом. В некоторых вариантах осуществления вариант кодируется вариантом с однонуклеотидным полиморфизмом (SNP) молекулы нуклеиновой кислоты, которая кодирует области VH или VL или подобласти, такие как один или несколько CDR, нектина-4 или антитела против нектина-4.
[00119] Термин «вектор» относится к веществу, которое используется для переноса или встраивания последовательности нуклеиновой кислоты, включая, например, последовательность нуклеиновой кислоты, кодирующую антитело против нектина-4, как описано в настоящем описании, для введения последовательности нуклеиновой кислоты в клетку-хозяина. Векторы, которые можно использовать, включают, например, векторы экспрессии, плазмиды, фаговые векторы, вирусные векторы, эписомы и искусственные хромосомы, которые могут включать последовательности для селекции или маркеры, функциональные для стабильной интеграции в хромосому клетки-хозяина. Кроме того, векторы могут включать один или несколько маркерных генов селекции и соответствующие последовательности контроля экспрессии. Маркерные гены селекции, которые могут быть включены, например, придают устойчивость к антибиотикам или токсинам, дополняют ауксотрофный дефицит или обеспечивают критические питательные вещества, не содержащиеся в питательной среде. Последовательности контроля экспрессии могут включать конститутивные и индуцибельные промоторы, энхансеры транскрипции, терминаторы транскрипции и тому подобное, которые хорошо известны в данной области. Если две или более молекул нуклеиновой кислоты должны быть экспрессированы вместе (например, как тяжелая, так и легкая цепи антитела или VH и VL антитела), обе молекулы нуклеиновой кислоты могут быть встроены, например, в один вектор экспрессии или в разные векторы экспрессии. Для экспрессии одного вектора кодирующие нуклеиновые кислоты могут быть функционально связаны с одной общей последовательностью контроля экспрессии или связаны с разными последовательностями контроля экспрессии, такими как один индуцибельный промотор и один конститутивный промотор. Введение молекул нуклеиновых кислот в клетку-хозяина может быть подтверждено методами, хорошо известными в данной области. Такие способы включают, например, анализ нуклеиновых кислот, такой как Нозерн-блот или амплификация мРНК полимеразной цепной реакцией (ПЦР), иммуноблоттинг для экспрессии продуктов генов, или другие подходящие аналитические методы для тестирования экспрессии введенной последовательности нуклеиновой кислоты или соответствующего ей генного продукта. Специалистам в данной области техники будет понятно, что молекулы нуклеиновых кислот экспрессируются в достаточном количестве для получения желаемого продукта (например, антитела против нектина-4, как описано в настоящем документе), и также будет понятно, что уровни экспрессии могут быть оптимизированы для получения экспрессии на достаточном уровне, используя методы, хорошо известные в данной области техники.
[00120] Полипептид «внеклеточного домена» или «ECD» нектина-4 относится к форме полипептида нектина-4, который по существу свободен от трансмембранных и цитоплазматических доменов. Например, в полипептиде ECD нектина-4 может присутствовать по меньшей мере 1% таких трансмембранных и/или цитоплазматических доменов и может присутствовать менее 0,5% таких доменов.
[00121] Термин «идентичность» относится к взаимосвязи между последовательностями двух или более полипептидных молекул или двух или более молекул нуклеиновых кислот, которую определяют путем выравнивания и сравнения последовательностей». Процент (%) идентичности аминокислотных последовательностей» по сравнению к эталонной полипептидной последовательностью определяется как процент аминокислотных остатков в последовательности-кандидате, которые идентичны аминокислотным остаткам в эталонной полипептидной последовательности, после выравнивания последовательностей и введения пропусков, если это необходимо, для достижения максимальной процентной идентичности последовательностей и без учета каких-либо консервативных замен в контексте идентичности последовательности. Выравнивание для целей определения процента идентичности аминокислотных последовательностей можно осуществлять различными способами, которые находятся в рамках специальных значений в данной области, например, с помощью общедоступного компьютерного программного обеспечения, такого как программное обеспечение BLAST, BLAST-2, ALIGN или MEGALIGN (DNAStar, Inc.). Специалисты в данной области могут определять соответствующие параметры для выравнивания последовательностей, включая любые алгоритмы, необходимые для достижения максимального выравнивания по всей длине сравниваемых последовательностей.
[00122] «Модификация» аминокислотного остатка/положения относится к изменению первичной аминокислотной последовательности по сравнению с исходной аминокислотной последовательностью, причем изменение является результатом изменения последовательности, содержащей указанный аминокислотный остаток/положение. Например, типичные модификации включают замену остатка другой аминокислотой (например, консервативная или неконсервативная замена), вставку одной или нескольких (например, обычно менее 5, 4 или 3) аминокислот рядом с указанным остатком/положением и/или удаление указанного остатка/положения.
[00123] «Эпитоп» представляет собой участок на поверхности молекулы антигена, с которым связывается одна молекула антитела, например, локализованная область на поверхности антигена, такая как полипептид нектина-4, фрагмент полипептида нектина-4, который способен связываться с одним или несколькими антигенсвязывающими областями антитела и который обладает антигенной или иммуногенной активностью у животного, такого как млекопитающее (например, человек), который способен вызывать иммунный ответ. Эпитоп, обладающий иммуногенной активностью, представляет собой часть полипептида, который вызывает ответ антитела у животного. Эпитоп, обладающий антигенной активностью, представляет собой часть полипептида, с которой связывается антитело, как определено любым способом, хорошо известным в данной области, включая, например, иммуноанализ. Антигенные эпитопы не обязательно должны быть иммуногенными. Эпитопы зачастую состоят из химически активных поверхностных групп молекул, таких как боковые цепи аминокислот или сахаров и обычно имеют специфические трехмерные структурные характеристики, а также специфические характеристики заряда. Эпитопы антител могут быть линейными или конформационными эпитопами. Линейные эпитопы образованы непрерывной последовательностью аминокислот в белке. Конформационные эпитопы образуются из аминокислот, которые прерываются в последовательности белка, но которые объединяются при сворачивании белка в трехмерную структуру. Индуцированные эпитопы образуются, когда трехмерная структура белка находится в измененной конформации, такой как последующая активация или связывание другого белка или лиганда. В некоторых вариантах осуществления эпитоп нектина-4 является трехмерным поверхностным признаком полипептида нектина-4. В других вариантах осуществления эпитоп Nectin-4 является линейным признаком полипептида нектина-4. Обычно антиген имеет несколько или много разных эпитопов и может взаимодействовать со многими различными антителами.
[00124] Антитело связывается с «эпитопом», «по существу с тем же эпитопом» или «с тем же эпитопом», что и эталонное антитело, если два антитела распознают идентичные, перекрывающиеся или смежные эпитопы в трехмерном пространстве. Наиболее широко используемыми и быстрыми методами определения связывания двух антител с идентичными, перекрывающимися или смежными эпитопами в трехмерном пространстве, являются конкурентные анализы, которые могут быть сконфигурированы в ряде различных форматов, например, используя либо меченный антиген, либо меченное антитело. В некоторых анализах антиген иммобилизован на 96-луночном планшете или экспрессируется на поверхности клетки, и способность немеченых антител блокировать связывание меченых антител измеряется с использованием радиоактивных, флуоресцентных или ферментных меток.
[00125] «Эпитопное картирование» представляет собой процесс идентификации сайтов связывания или эпитопов антител с их антигенами-мишенями. «Эпитоп-специфическая сортировка» представляет собой процесс группировки антител на основе распознаваемых ими эпитопов. Более конкретно, эпитоп-специфическая сортировка включает способы и системы для проведения различий между свойствами распознавания эпитопов различных антител, используя конкурентные анализы в сочетании с вычислительными процессами для кластеризации антител на основе их свойств распознавания эпитопов и идентификации антител, имеющих различную специфичность связывания.
[001] Термин «носители», используемый в настоящем документе, включает фармацевтически приемлемые носители, вспомогательные вещества или стабилизаторы, которые нетоксичны для клетки или млекопитающего, на которое воздействуют этими веществами, в применяемых дозировках и концентрациях. Часто физиологически приемлемый носитель представляет собой водный рН-буферный раствор. Примеры физиологически приемлемых носителей включают буферы, такие как фосфат, цитрат и другие органические кислоты; антиоксиданты, в том числе аскорбиновая кислота; полипептид с низкой молекулярной массой (например, менее чем около 10 аминокислотных остатков); белки, такие как сывороточный альбумин, желатин или иммуноглобулины; гидрофильные полимеры, такие как поливинилпирролидон; аминокислоты, такие как глицин, глутамин, аспарагин, аргинин или лизин; моносахариды, дисахариды и другие углеводы, включая глюкозу, маннозу или декстрины; хелатообразующие агенты, такие как EDTA; сахарные спирты, такие как маннит или сорбит; солеобразующие противоионы, такие как натрий; и/или неионные поверхностно-активные вещества, такие как TWEEN™, полиэтиленгликоль (PEG) и PLURONICS™. Термин «носитель» может также относиться к разбавителю, адъюванту (например, адъюванту Фрейнда (полный или неполный)), наполнителю или носителю лекарственного средства. Такие носители могут представлять быть стерильными жидкостями, такими как вода и масла, в том числе нефтяного, животного, растительного или синтетического происхождения, такие как арахисовое масло, соевое масло, минеральное масло, кунжутное масло и тому подобное. Вода является характерным носителем, если композицию (например, фармацевтическую композицию) вводят внутривенно. Физиологические растворы и водные растворы декстрозы и глицерина также могут быть использованы в качестве жидких носителей, в частности, для инъекционных растворов. Подходящие вспомогательные вещества (например, фармацевтические вспомогательные вещества) включают крахмал, глюкозу, лактозу, сахарозу, желатин, солод, рис, муку, мел, силикагель, стеарат натрия, моностеарат глицерина, тальк, хлорид натрия, сухое обезжиренное молоко, глицерин, пропиленгликоль, воду, этанол и тому подобное. Композиция, при желании, может также содержать незначительные количества смачивающих или эмульгирующих средств или рН-буферирующих агентов. Композиции могут принимать форму растворов, суспензий, эмульсий, таблеток, пилюль, капсул, порошков, составов с замедленным высвобождением и тому подобного. Пероральные композиции, включая составы, могут включать стандартные носители, такие как маннит, лактоза, крахмал, стеарат магния, сахарин натрия, целлюлоза, карбонат магния фармацевтической степени чистоты и тому подобное. Примеры подходящих фармацевтических носителей описаны в Remington и Gennaro, Remington's Pharmaceutical Sciences (18th ed.1990). Композиции, включая фармацевтические композиции, могут содержать антитело против нектина-4, например, выделенное или очищенное, вместе с подходящим количеством носителей.
[00126] Термин «фармацевтически приемлемый», используемый в настоящему документе, означает одобренный регулирующим федеральным органом правительства или правительством штата, или внесенный в список United States Pharmacopeia, European Pharmacopeia или другой хорошо известной и общепринятой фармакопеи для применения у животных и, в частности, у человека.
[00127] «Поликлональные антитела» в контексте настоящего описания относятся к популяции антител, получаемой в результате иммуногенного ответа на белок с множеством эпитопов, и, таким образом, включают множество различных антител, направленных на один и тот же или разные эпитопы белка. Способы получения поликлональных антител известны в данной области (см., например, Short Protocols in Molecular Biology (Ausubel et al. Eds., 5th ed.2002)).
[00128] «Выделенная нуклеиновая кислота» представляет собой нуклеиновую кислоту, например, РНК, ДНК или смешанную нуклеиновую кислоту, которая по существу отделена от других последовательностей генома ДНК, а также от белков или комплексов, таких как рибосомы и полимеразы, которые находятся вместе с нативной последовательностью в природе. «Выделенная» молекула нуклеиновой кислоты представляет собой молекулу, которая отделена от других молекул нуклеиновой кислоты, которые присутствуют в природном источнике молекулы нуклеиновой кислоты. Кроме того, «выделенная» молекула нуклеиновой кислоты, такая как молекула кДНК, может быть по существу свободной от другого клеточного материала или культуральной среды, если она получена рекомбинантными способами, или, по существу, может не содержать химических предшественников или других химических веществ, если она синтезирована химически. В конкретном варианте осуществления одну или несколько молекул нуклеиновой кислоты, кодирующих антитело, как описано в настоящем документе, выделяют или очищают. Термин включает последовательности нуклеиновых кислот, которые были извлечены из их естественной среды, и включает рекомбинантные или клонированные изоляты ДНК и химически синтезированные аналоги или аналоги, биологически синтезированные гетерологичными системами. По существу чистая молекула может включать в себя выделенные формы молекулы.
[00129] «Полинуклеотид» или «нуклеиновая кислота», как используется в настоящем документе взаимозаменяемо, относятся к нуклеотидным полимерам любой длины и к ним относятся ДНК и РНК. Нуклеотиды могут быть дезоксирибонуклеотидами, рибонуклеотидами, модифицированными нуклеотидами или основаниями и/или их аналогами или любым субстратом, который может быть включен в полимер ДНК или РНК-полимеразой. Полинуклеотид может содержать модифицированные нуклеотиды, такие как метилированные нуклеотиды и их аналоги. Как используется в настоящем документе, термин «олигонуклеотид» относится к коротким, как правило, одноцепочечным синтетическим полинуклеотидам, длина которых, как правило, но не обязательно, меньше примерно 200 нуклеотидов. Термины «олигонуклеотид» и «полинуклеотид» не являются взаимоисключающими. Описание полинуклеотидов выше в равной степени и полностью относится к олигонуклеотидам. Клетка, которая продуцирует антитело против нектина-4 по настоящему изобретению, может представлять собой родительскую клетку гибридомы, а также бактериальные и эукариотические клетки-хозяева, в которые были введены нуклеиновые кислоты, кодирующие антитела. Подходящие клетки-хозяева описаны ниже.
[00130] Если не указано иное, левый конец любой одноцепочечной полинуклеотидной последовательности, описанной в настоящем документе, является 5'-концом; направление движения влево по двухцепочечной полинуклеотидной последовательности называется 5'-направлением. Направление от 5' к 3' при добавлении образующихся РНК-транскриптов называется направлением транскрипции; области последовательностей на цепи ДНК, имеющие ту же последовательность, что и РНК, и являющиеся 5'-концевыми относительно 5'-конца РНК-транскрипта называются «последовательностями слева (или в направлении 5'-конца)», а области последовательностей на цепи ДНК, имеющие ту же последовательность, что и РНК, и являющиеся 3'-концевыми относительно 3'-конца РНК-транскрипта, называются «последовательностями справа (или в направлении 3'-конца)».
[00131] Термин «рекомбинантное антитело» относится к антителу, которое получают, экспрессируют, создают или выделяют рекомбинантным способом. Рекомбинантные антитела могут быть антителами, экспрессируемыми с использованием рекомбинантного вектора экспрессии, трансфицированного в клетку-хозяина, антителами, выделенными из рекомбинантной библиотеки комбинаторных антител, антителами, выделенными от животного (например, мыши или коровы), которое является трансгенным и/или трансхромосомным для генов иммуноглобулинов человека (см., например, Taylor et al., 1992, Nucl. Acids Res.20:6287-95), или антитела, полученные, экспрессированные, созданные или выделенные любым другим способом, который включает сплайсинг последовательностей гена иммуноглобулина с другими последовательностями ДНК. Такие рекомбинантные антитела могут иметь вариабельные и константные области, в том числе полученные из последовательностей иммуноглобулина зародышевой линии человека (см. Кэбат et al., выше). Однако, в некоторых вариантах осуществления такие рекомбинантные антитела могут подвергаться in vitro мутагенезу (или, если используется трансгенное животное для последовательностей Ig человека, то in vivo соматическому мутагенезу), так, чтобы аминокислотные последовательности областей VH и VL рекомбинантных антител представляли собой последовательности, которые, несмотря на то, что они выделены из последовательностей VH и VL зародышевой линии человека или связаны с ними, которые могут существовать в естественных условиях в репертуаре антител зародышевой линии человека in vivo.
[00132] Термины «индивид» и «пациент» могут использоваться взаимозаменяемо. Как используется в настоящем документе, в определенных вариантах осуществления индивид является млекопитающим, таким как не примат (например, корова, свинья, лошадь, кошка, собака, крыса и тому подобное) или примат (например, обезьяна и человек). В некоторых вариантах осуществления индивидом является человек. В одном из вариантов осуществления индивидом является млекопитающее, например, человек, у которого диагностировано состояние или расстройство, описанное в настоящем документе. В другом варианте осуществления индивидом является млекопитающее, например человек, подверженным имеющий риск развития состояния или заболевания, описанного в настоящем документе.
[00133] «По существу все» относится по меньшей мере примерно к 60%, по меньшей мере примерно к 65%, по меньшей мере примерно к 70%, по меньшей мере примерно к 75%, по меньшей мере примерно к 80%, по меньшей мере примерно к 85%, по меньшей мере примерно к 90%, по меньшей мере примерно к 95%, по меньшей мере к примерно 98%, по меньшей мере примерно к 99% или примерно к 100%.
[00134] Термин «детектируемый зонд» относится к веществу, которое дает детектируемый сигнал. Термин включает, но ими не ограничивается, любой флуорофор, хромофор, радиоактивную метку, фермент, антитело или фрагмент антитела и тому подобное, которые обеспечивают детектируемый сигнал посредством своей активности.
[00135] Термин «детектируемый агент» относится к веществу, которое можно использовать для определения наличия или присутствия желаемой молекулы, такой как антитело против нектина-4, как описано в настоящем документе, в образце или у индивида. Детектируемый агент может представлять собой вещество, которое можно визуализировать, или вещество, которое может быть определено и/или измерено иным образом (например, путем количественного определения).
[00136] Термин «диагностическое средство» относится к веществу, вводимому индивиду, которое облегчает диагностику заболевания, расстройства или состояний. Такие вещества могут быть использованы для выявления, обнаружения и/или определения локализации процесса, вызывающего заболевание. В некоторых вариантах осуществления диагностическое средство включает антитело против нектина-4 или его фрагмент, как описано в настоящем документе, которое, самостоятельно или как конъюгат с веществом, вводится индивиду или контактирует с образцом индивида, облегчает диагностику нектин-4-опосредованного заболевания.
[00137] Термин «кодирующая нуклеиновая кислота» или ее грамматические эквиваленты в том виде, как он используется в отношении молекулы нуклеиновой кислоты, относится к молекуле нуклеиновой кислоты в ее нативном состоянии или полученной способами, хорошо известными специалистам в данной области, которая может транскрибироваться с получением мРНК, которая затем транслируется в полипептид и/или его фрагмент. Антисмысловая цепь является комплементарной цепью такой нуклеиновой кислоты, и из нее может быть выделена кодирующая последовательность.
[00138] Термин «вспомогательное вещество» относится к инертному веществу, которое обычно используется в качестве разбавителя, носителя лекарственного средства, консерванта, связующего или стабилизирующего агента, и включает, но не ограничивается ими, белки (например, сывороточный альбумин и тому подобное), аминокислоты (например, аспарагиновая кислота, глутаминовая кислота, лизин, аргинин, глицин, гистидин и тому подобное), жирные кислоты и фосфолипиды (например, алкилсульфонаты, каприлат и тому побобное), поверхностно-активные вещества (например, SDS, полисорбат, неионное поверхностно-активное вещество и тому подобное), сахариды (например, сахароза, мальтоза, трегалоза и тому подобное) и полиолы (например, маннит, сорбит и тому подобное). См. также Remington and Gennaro, Remington's Pharmaceutical Sciences (18th ed. 1990), который полностью включен в настоящее описание в качестве ссылки.
[00139] В контексте пептида или полипептида, термин «фрагмент» в контексте настоящего описания относится к пептиду или полипептиду, который содержит аминокислотную последовательность, меньше чем полноразмерная. Такой фрагмент может возникать, например, в результате усечения на аминоконце, усечения на карбоксиконце и/или в результате внутренней делеции остатка(ов) аминокислотной последовательности. Фрагменты могут, например, образовываться в результате альтернативного сплайсинга РНК или активности протеазы in vivo. В некоторых вариантах осуществления фрагменты нектина-4 или фрагменты антител против нектина-4 включают полипептиды, содержащие аминокислотную последовательность, состоящую из по меньшей мере 5 смежных аминокислотных остатков, по меньшей мере 10 смежных аминокислотных остатков, по меньшей мере 15 смежных аминокислотных остатков, по меньшей мере 20 смежных аминокислотных остатков, по меньшей менее 25 смежных аминокислотных остатков, по меньшей мере 30 смежных аминокислотных остатков, по меньшей мере 40 смежных аминокислотных остатков, по меньшей мере 50 смежных аминокислотных остатков, по меньшей мере 60 смежных аминокислотных остатков, по меньшей мере 70 смежных аминокислотных остатков по меньшей мере 80 смежных аминокислотных остатков, по меньшей мере 90 смежных аминокислотных остатков, по меньшей мере 100 смежных аминокислотных остатков, по меньшей мере 125 смежных аминокислотных остатков, по меньшей мере 150 смежных аминокислотных остатков, по меньшей мере 175 смежных аминокислотных остатков, по меньшей мере, 200 смежных аминокислотных остатков, по меньшей мере 225, по меньшей мере 250, по меньшей мере 275, по меньшей мере 300, по меньшей мере 325, по меньшей мере 350, по меньшей мере 375, по меньшей мере 400, по меньшей мере 425, по меньшей мере 450, по меньшей мере 475, по меньшей мере 500, по меньшей мере 525 или по меньшей мере 550 смежных аминокислотных остатков аминокислотной последовательности полипептида нектина-4 или антитела против нектина-4. В конкретном варианте осуществления фрагмент полипептида нектина-4 или антитела против нектина-4 сохраняет по меньшей мере 1, по меньшей мере 2, по меньшей мере 3 или более функций полипептида или антитела.
[00140] Термины «примерно» и «приблизительно» означают в пределах 20%, в пределах 15%, в пределах 10%, в пределах 9%, в пределах 8%, в пределах 6%, в пределах 5%, в пределах 4%, в пределах 3%, в пределах 2%, в пределах 1% или менее от заданного значения или диапазона.
[00141] «Введение» или «вводить» относится к акту инъекции проведения инъекции или другой физической доставки вещества, если оно находится вне организма (например, антитела против нектина-4, как описано в настоящем документе), пациенту, например, чрезслизистой, внутрикожной, внутривенной, внутримышечной доставкой и/или любым другим способом физической доставки, как описано в настоящем документе или известно в данной области.
[00142] В контексте полипептида термин «аналог», как используется в настоящем описании, относится к полипептиду, который обладает аналогичной или идентичной функцией полипептида нектина-4, фрагмента полипептида нектина-4 или антитела против нектина-4, но не обязательно содержит сходную или идентичную аминокислотную последовательность полипептида нектина-4, фрагмента полипептида нектина-4 или антитела против нектина-4, или обладает сходной или идентичной структурой полипептида нектина-4, фрагмента полипептида нектина-4 или антитела против нектина-4. Полипептид, который имеет сходную аминокислотную последовательность, относится к полипептиду, который удовлетворяет, по меньшей мере, одному из следующих условий: (а) полипептид имеет аминокислотную последовательность, которая по меньшей мере на 30%, по меньшей мере на 35%, по меньшей мере на 40%, по меньшей мере на 45%, по меньшей мере на 50%, по меньшей мере на 55%, по меньшей мере на 60%, по меньшей мере на 65%, по меньшей мере на 70%, по меньшей мере на 75%, по меньшей мере на 80%, по меньшей мере на 85%, по меньшей мере на 90%, по меньшей мере на 95% или по меньшей мере на 99% идентичны аминокислотной последовательности полипептида нектина-4, фрагмента полипептида нектина-4 или антитела против нектина-4, описанного в настоящем документе; (b) полипептид кодируется нуклеотидной последовательностью, которая гибридизуется в строгих условиях с нуклеотидной последовательностью, кодирующей полипептид нектина-4, фрагмент полипептида нектина-4 или антитело против нектина-4 (или его область VH или VL), как описано в настоящем изобретении, состоящей по меньшей мере из 5 аминокислотных остатков, по меньшей мере из 10 аминокислотных остатков, по меньшей мере из 15 аминокислотных остатков, по меньшей мере из 20 аминокислотных остатков, по меньшей мере из 25 аминокислотных остатков, по меньшей мере из 30 аминокислотных остатков, по меньшей мере из 40 аминокислот остатки, по меньшей мере из 50 аминокислотных остатков, по меньшей мере из 60 аминокислотных остатков, по меньшей мере из 70 аминокислотных остатков, по меньшей мере из 80 аминокислотных остатков, по меньшей мере из 90 аминокислотных остатков, по меньшей мере из 100 аминокислотных остатков, по меньшей мере из 125 аминокислотных остатков или по меньшей мере из 150 аминокислотных остатков (см., например, Sambrook et al., Molecular Cloning: A Laboratory Manual (2001); и Maniatis et al., Molecular Cloning: A Laboratory Manual (1982)); или (c) полипептид кодируется нуклеотидной последовательностью, которая по меньшей мере на 30%, по меньшей мере на 35%, по меньшей мере на 40%, по меньшей мере на 45%, по меньшей мере на 50%, по меньшей мере на 55%, по меньшей мере на 60%, по меньшей мере на 65%, по меньшей мере на 70%, по меньшей мере на 75%, по меньшей мере на 80%, по меньшей мере на 85%, по меньшей мере на 90%, по меньшей мере на 95% или по меньшей мере на 99% идентичны нуклеотидной последовательности, кодирующей полипептид нектина-4, фрагмент полипептида нектина-4 или антитела против нектина-4 (или его области VH или VL), описанного в настоящем документе. Полипептид со структурой, аналогичной полипептиду нектина-4, фрагменту полипептида нектина-4 или антителу против нектина-4, как описано в настоящем документе, относится к полипептиду, который имеет сходную вторичную, третичную или четвертичную структуру полипептида нектина-4, фрагмента полипептида нектина-4 или антитела против нектина-4, описанного в настоящем документе. Структура полипептида может быть определена способами, известными специалистам в данной области, включая, но не ограничиваясь ими, рентгеновскую кристаллографию, ядерно-магнитный резонанс и кристаллографическую электронную микроскопию.
[00143] В контексте полипептида, термин «производное», как используется в настоящем описании, относится к полипептиду, который содержит аминокислотную последовательность полипептида нектина-4, фрагмента полипептида нектина-4 или антитела, которое связывается с полипептидом нектина-4, который изменен путем введения замены, делеции или добавления аминокислотного остатка. Как используется в настоящем описании, термин «производное» также относится к полипептиду нектина-4, фрагменту полипептида нектина-4 или антителу, которое связывается с полипептидом нектина-4, который химически модифицирован, например, путем ковалентного присоединения любой тип молекулы к полипептиду. Например, но ими не ограничиваясь, полипептид нектина-4, фрагмент полипептида нектина-4 или антитело против нектина-4 могут быть химически модифицированы, например, путем гликозилирования, ацетилирования, ПЭГилирования, фосфорилирования, амидирования, путем введение функциональных групп с известными защитными/блокирующими группами, протеолитическим расщеплением, химическим расщеплением, приготовлением состава, метаболическим синтезом туникамицина, связыванием с клеточным лигандом или другим белком и тому подобное. Производные модифицированы так, что отличаются от природного или исходного пептида или полипептидов либо по типу, либо по расположению присоединенных молекул. Производные дополнительно включают делецию одной или нескольких химических групп, которые естественным образом присутствуют в пептиде или полипептиде. Кроме того, производное полипептида нектина-4, фрагмента полипептида нектина-4 или антитела против нектина-4 может содержать одну или несколько неклассических аминокислот. Полипептидное производное обладает аналогичной или идентичной функцией как и полипептид нектина-4, фрагмент полипептида нектина-4 или антитело против нектина-4, описанные в настоящем документе.
[00144] Под термином «композиция» следует понимать продукт, содержащий указанные ингредиенты (например, антитело по настоящему изобретению) необязательно в указанных количествах.
[00145] Как используется в настоящем документе, термины «предотвращать», «предотвращение» и «профилактика» относятся к полному или частичному ингибированию развития, рецидива, возникновению или прогрессирования заболевания, связанного с нектином-4 и/или с ним связанного симптома, в результате введения терапевтического средства или комбинации терапевтических средств по настоящему изобретению (например, комбинация профилактических или терапевтических средств, таких как антитело по настоящему изобретению).
[00146] Как используется в настоящем документе, термин «профилактическое средство» относится к любому средству, которое может полностью или частично ингибировать развитие, рецидив, возникновение или прогрессирование заболевания, связанного с нектином-4, и/или с ним связанного симптома, у индивида. В определенных вариантах осуществления термин «профилактическое средство» относится к антителу по настоящему изобретению. В некоторых других вариантах осуществления термин «профилактическое средство» относится к средству, отличному от антитела по настоящему изобретению. В некоторых вариантах осуществления профилактическое средство представляет собой средство, о котором известно, что оно может использоваться или использовалось, или используется в настоящее время, для профилактики заболевания, связанного с нектином-4, и/или связанного с ним симптома, или для препятствования возникновения, развития, прогрессирования и/или усиления тяжести заболевания, связанного с нектином-4, и/или с ним связанного симптома. В конкретных вариантах осуществления профилактическое средство представляет собой полностью человеческое антитело против нектина-4, такое как полностью человеческое моноклональное антитело против нектина-4.
[00147] В определенных вариантах осуществления «профилактически эффективный титр сыворотки» представляет собой титр сыворотки у индивида, такого как человек, который полностью или частично ингибирует развитие, рецидив, возникновение или прогрессирование заболевания, связанного с нектином-4, и/или связанного с ним симптома, у указанного индивида.
[00148] «Заболевание, связанное с нектином-4» и «расстройство, связанное с нектином-4» используются в настоящем документе взаимозаменяемо и относятся к любому заболеванию, которое полностью или частично вызвано, является результатом или коррелирует с нектином-4. В некоторых вариантах осуществления нектин-4 может быть патологически (например, с высокой активностью) экспрессироваться на поверхности клетки. В некоторых вариантах осуществления нектин-4 может быть патологически активирован на конкретном типе клеток. В других вариантах осуществления нормальная, патологическая или чрезмерная активации сигналов клетками обусловлена связыванием нектина-4 с лигандом нектина-4. В некоторых вариантах осуществления заболевание, связанное снектином-4, представляет собой заболевание, при котором нектин-4 можно использовать в качестве биомаркера у пациента, например, у человека. В некоторых вариантах осуществления заболевание, связанное с нектином-4, представляет собой заболевание, при котором экспрессия нектина-4 может отражать прогрессирование или прогноз заболевания у индивида, например, у человека. В некоторых вариантах осуществления изобретения лиганд нектина-4 представляет собой, например, рецептор нектина-4, который экспрессируется на поверхности клетки.
[00149] Термин «титр сыворотки», как используется в настоящем описании, относится к среднему титру сыворотки в популяции, составляющей по меньшей мере 10, по меньшей мере 20, по меньшей мере 30 или по меньшей мере 40 индивидов до примерно 100, 1000 или более.
[00150] Как используется в настоящем документе, термин «побочные эффекты» включает нежелательные и неблагоприятные эффекты терапии (например, профилактического или терапевтического средства). Нежелательные эффекты не обязательно являются неблагоприятными. Неблагоприятный эффект терапии (например, профилактического или терапевтического средства) может быть вредным или вызывать неприятные ощущения или риск осложнений. Примеры побочных эффектов включают диарею, кашель, гастроэнтерит, хрипы, тошноту, рвоту, анорексию, спазмы в животе, лихорадку, боль, потерю массы тела, дегидратацию, алопецию, одышку, бессонницу, головокружение, мукозит, нервные и мышечные эффекты, усталость, сухость во рту и потерю аппетита, сыпь или припухлости на месте введения, симптомы гриппа, такие как лихорадка, озноб и усталость, пищеварительные расстройства и аллергические реакции. Другие нежелательные эффекты, испытываемые пациентами, включают множество других эффектов и хорошо известны в данной области. Многие из них описаны в Physician's Desk Reference (60th end., 2006).
[00151] Как используется в настоящем документе, термин «терапевтическое средство» относится к любому агенту, который можно использовать для лечения, контроля или уменьшения заболевания, связанного с нектином-4 и/или связанного с ним симптом. В некоторых вариантах осуществления термин «терапевтическое средство» относится к антителу по настоящему изобретению. В некоторых других вариантах осуществления термин «терапевтическое средство» относится к средству, отличному от антитела по настоящему изобретению. В некоторых вариантах осуществления терапевтическое средство представляет собой средство, которое, как известно, может быть использовано или использовалось, или используется в настоящее время, для лечения, контроля или уменьшения заболевания, связанного с нектином-4, или одного или нескольких связанных с ним симптомов.
[00152] Терапевтическая комбинация (например, применение профилактических или терапевтических средств), которая является более эффективной, чем аддитивные эффекты любых двух или более отдельных терапевтических средств, например, синергетический эффект комбинации профилактических и/или терапевтических средств является более эффективной, чем единственный агент, и/или позволяет использовать более низкие дозы одного или нескольких средств и/или реже вводить указанные средства индивиду, страдающему заболеванием, связанным с нектином-4. Возможность использовать более низкие дозы профилактических или терапевтических средств и/или вводить указанные лекарственные средства не так часто снижает токсичность, связанную с введением указанных лекарственных средств индивиду, не снижая эффективность указанных лекарственных средств для профилактики, лечения, контроля или улучшения состояния заболевания, связанного с нектином-4. Кроме того, синергетический эффект может приводить к повышению эффективности терапии при профилактики или лечении, контроле или улучшении заболевания, связанного с нектином-4. Наконец, синергетический эффект терапевтической комбинации (например, профилактических или терапевтических средств) может позволить избежать или уменьшить неблагоприятные или нежелательные побочные эффекты, связанные с применением любого из этих лекарственных средство по отдельности.
[00153] В некоторых вариантах осуществления «терапевтически эффективный титр сыворотки» представляет собой титр сыворотки у индивида, такого как человек, который снижает тяжесть, продолжительность и/или симптомы, связанные с заболеванием, связанным с нектиномом-4, у указанного индивида.
[00154] Используемый в настоящем описании термин «терапия» относится к любому протоколу, способу и/или средству, которое можно использовать для профилактики, лечения, контроля и/или улучшения состояния, связанного с нектином-4. В некоторых вариантах осуществления термины «терапия» и «лекарственные средств» относятся к биотерапии, поддерживающей терапии и/или другим способам лечения, которые могут использоваться для профилактики, лечения, контроля и/или улучшения состояния при заболевании, связанном с нектином-4, известном специалисту в данной области, например, медицинскому персоналу.
[00155] Как используется в настоящем документе, термины «лечить» и «лечение» относятся к уменьшению или снижению прогрессирования, тяжести и/или продолжительности заболевания, связанного с нектиномом-4, в результате введения одного или несколько лекарственных средств (включая, но не ограничиваясь ими, введение одного или нескольких профилактических или терапевтических средств, таких как антитело по настоящему изобретению).
[00156] Как используется в настоящем документе, термины «контроль» и «контролировать» относятся к благоприятным эффектам, которые индивид получает от терапии (например, профилактического или терапевтического средства), которые не приводят к излечению состояния, связанного с нектином-4. В определенных вариантах осуществления индивиду вводят один или несколько лекарственных средств (например, профилактические или терапевтические средства, такие как антитело по настоящему изобретению) для «контроля» над состоянием или заболеванием, описанным в настоящем документе, одним или несколькими его симптомами, для предотвращения прогрессирования или ухудшения состояния или заболевания.
[00157] Как используется в настоящем документе, термины «профилактика» и «предотвращение» относятся к полному или частичному ингибированию развития, рецидива, возникновения или прогрессирования заболевания, связанного с нектином-4, и/или связанного с ним симптома, в результате введения лекарственного средства или терапевтической комбинации, описанной в настоящем описании (например, комбинации профилактических или терапевтических средств, таких как антитело по настоящему изобретению).
[00158] Как используется в настоящем документе, термин «введение» или «вводить» или «проводить» относится к акту осуществления инъекции или другой физической доставки вещества (например, антитела против нектина-4 по настоящему изобретению или его антигенсвязывающего фрагмента) индивиду или пациенту (например, человеку), такому как чрезслизистая, местная, внутрикожная, парентеральная, внутривенная, подкожная, внутримышечная доставка и/или любой другой способ физической доставки, как описано в настоящем документе или известно в данной области.
[00159] Как используется в настоящем документе термины «эффективное количество» или «терапевтически эффективное количество» относятся к количеству лекарственного средства (например, антитела или фармацевтической композиции по настоящему изобретению), которое является достаточным для снижения и/или уменьшения тяжести и/или длительность указанного состояния, расстройства или заболевания и/или связанного с ним симптома. Эти термины также включают количество, необходимое для уменьшения, замедления, или замедления развития или прогрессирования указанного заболевания, уменьшения, замедления или уменьшения вероятности рецидива, прогрессирования или возникновения указанного заболевания и/или для улучшения или усиления профилактического или терапевтического(их) действие(й) другого лекарственного средства (например, лекарственного средства, отличного от антитела против нектина-4 по настоящему изобретению). В некоторых вариантах осуществления «эффективное количество», как используется в настоящему документе, также относится к количеству антитела по настоящему изобретению для достижения указанного результата.
[00160] Термины «стабильность» и «стабильный», как используется в настоящем документе в контексте жидкой композиции, содержащей антитело, которое иммуноспецифически связывается с антигеном нектином-4, относятся к устойчивости антитела в композиции к поддержанию конформации при термическом и химическом воздействии, агрегации, деградации или фрагментации при имеющихся условиях производства, получения, транспортировки и хранения. «Стабильные» составы по настоящему изобретению сохраняют биологическую активность, равную или превышающую 80%, 85%, 90%, 95%, 98%, 99% или 99,5% при имеющихся условиях производства, получения транспортировки и хранения. Стабильность антитела можно оценивать по степени агрегации, деградации или фрагментации способами, известными специалистам в данной области, включая, но не ограничиваясь ими, электрофорез в капиллярном геле (rCGE), электрофорез в полиакриламидном геле с додецилсульфатом натрия (SDS-PAGE) и HPSEC в сравнении с эталонным антителом. Общая стабильность композиции, содержащей антитело, которое иммуноспецифически связывается с антигеном нектином-4, может быть оценено различными иммунологическими анализами, включая, например, ELISA и радиоиммуноанализ, используя специфический эпитоп нектина-4. В некоторых характерных составах, антитело против нектина-4 может быть стабильным в течение двух месяцев, четырех месяцев, шести месяцев, восьми месяцев, десяти месяцев, в течение одного года, восемнадцати месяцев, двух лет, трех лет или дольше.
[00161] Как используется в настоящем документе, термин «по существу не содержит поверхностно-активного вещества» относится к составу антитела, который иммуноспецифически связывается с антигеном нектином-4, где указанный препарат содержит менее 0,0005%, менее 0,0003% или менее 0,0001% поверхностно-активных веществ и/или менее 0,0005%, менее 0,0003% или менее 0,0001% поверхностно-активных веществ.
[00162] Как используется в настоящем документе, «по существу не содержит соли» относится к составу антитела, которое иммуноспецифически связывается с антигеном нектином-4, где указанный состав содержит менее 0,0005%, менее 0,0003% или менее 0,0001% неорганических солей.
[00163] Как используется в настоящем документе, термин «неорганическая соль» относится к любым соединениям, не содержащим углерода, которые возникают в результате замены части или всего водорода кислотной группы или кислотной группы металлом или группой, действующей как металл, и которые, как правило, используют в качестве регулирующих тоничность соединений в фармацевтических композициях и препаратах биологических веществ. Наиболее распространенными неорганическими солями являются NaCl, KCl, NaH2PO4 и тому подобное.
[00164] Как используется в настоящем документе, термин «поверхностно-активное вещество» относится к органическим веществам, имеющим амфипатические структуры; а именно, они состоят из групп с противоположными свойствами растворимости, как правило, из групп с масляно-растворимой углеводородной цепью и водорастворимой ионной группой. Поверхностно-активные вещества можно классифицировать в зависимости от заряда поверхностно-активного компонента на анионные, катионные и неионные поверхностно-активные вещества. Поверхностно-активные вещества часто используются в качестве смачивающих, эмульгирующих, солюбилизирующих и диспергирующих агентов для различных фармацевтических композиций и препаратов биологических веществ.
8. Композиции и способы их изготовления.
[00165] Настоящее изобретение относится к антителам, которые иммуноспецифично связываются с полипептидом нектина-4, фрагментом полипептида нектина-4 или этипопом нектина-4. Также изобретение относится к выделенным нуклеиновым кислотам, кодирующим антитела, которые иммуноспецифично связываются с полипептидом нектина-4, фрагментом полипептида нектина-4 или этипопом нектина-4. Кроме того, изобретение относится к векторам и клеткам-хозяевам, содержащим нуклеиновые кислоты, кодирующие антитела, которые иммуноспецифично связываются с полипептидом нектина-4, фрагментом полипептида нектина-4 или эпитопом нектина-4. Также предоставлены способы получения антител, которые иммуноспецифично связываются с полипептидом нектина-4, фрагментом полипептида нектина-4 или эпитопом нектина-4.
[00166] В определенных вариантах осуществления антитела по настоящему изобретению связываются с нектином-4 человека и/или яванского макака. В одном из вариантов осуществления, антитела против нектина-4 связываются с нектином-4 человека. В одном из вариантов осуществления антитела против нектина-4 связываются с нектином-4 яванского макака. В одном из вариантов осуществления антитела против нектина-4 связываются как с нектином-4 человека, так и с нектином-4 яванского макака. В других вариантах осуществления антитела по настоящему изобретению не связываются с нектином-4 грызунов.
[00167] В некоторых вариантах осуществления антитела против нектина-4 связываются с внеклеточным доменом (ECD) нектина-4. В некоторых вариантах осуществления антитела против нектина-4 связываются с эпитопом в ECD нектина-4, который отличается от сайта связывания нектина-4 с лигандом.
[00168] Также в описании раскрыты антитела, которые конкурентно блокируют связывание антитела против нектина-4 по настоящему изобретению с полипептидом нектина-4.
[00169] Также предоставлены антитела, которые конкурируют с антителом против нектина-4 по настоящему изобретению за связывание с полипептидом нектина-4.
[00170] В некоторых вариантах осуществления антитела против нектина-4 не блокируют связывание лиганда нектина-4 с полипептидом нектина-4.
[00171] В некоторых вариантах осуществления антитела против нектина-4 не конкурируют с лигандом нектина-4 за связывание с полипептидом нектина-4.
[00172] В некоторых вариантах осуществления связывание лиганда нектина-4 с нектином-4 не ингибируется антителом.
[00173] Антитела против нектина-4 по настоящему изобретению также могут быть конъюгированы или рекомбинантно слиты, например, с диагностическим агентом, детектируемым агентом и/или другим агентом. Кроме того, в настоящем описании раскрыты композиции, содержащие антитело против нектина-4.
[00174] Также в настоящем документе представлены выделенные молекулы нуклеиновой кислоты, кодирующие тяжелую цепь, легкую цепь, область VH, область VL, CDR1 VH, CDR2 VH, CDR3 VH, CDR1 VL, CDR2 VL и/или CDR3 VL антител против нектина-4, которые связываются с полипептидом нектина-4, фрагментом полипептида нектина-4, пептидом нектина-4 или эпитопом нектина-4.
[00175] Кроме того, в настоящем описании представлены векторы и клетки-хозяева, содержащие молекулы нуклеиновой кислоты, кодирующие антитела против нектина-4, которые связываются с полипептидом нектина-4, фрагментом полипептида нектина-4, пептидом нектина-4 или эпитопом нектина-4. Также предоставлены способы получения антител, которые связываются с полипептидом нектина-4, фрагментом полипептида нектина-4, пептидом нектина-4 или эпитопом нектина-4.
[00176] В одном из вариантов осуществления настоящее изобретение относится к антителам против нектина-4, которые могут найти применение в качестве диагностических средств. Примеры антител включают поликлональные, моноклональные, гуманизированные, человеческие и гетероконъюгатные антитела, а также их варианты с улучшенной аффинностью или другими свойствами.
9. Антитела против нектина-4
[00177] Антитела по настоящему изобретению представляют собой, но не ограничиваясь ими, синтетические антитела, моноклональные антитела, рекомбинантные антитела, человеческие антитела, гуманизированные антитела, химерные антитела, биспецифичные антитела, внутренние антитела, одноцепочечные Fv (scFv), верблюжьи антитела, Fab-фрагменты, F(ab')-фрагменты, дисульфидсвязанные Fv (sdFv), антиидиотипические (анти-Id) антитела и эпитоп-связывающие фрагменты любого из вышеуказанного варианта.
[00178] В частности, антитела по настоящему изобретению включают молекулы иммуноглобулина и иммунологически активные части молекул иммуноглобулина, то есть молекулы, которые содержат антигенсвязывающий сайт, который иммуноспецифично связывается с антигеном нектина-4. Молекулы иммуноглобулина по настоящему изобретению могут быть любым типом (например, IgG, IgE, IgM, IgD, IgA и IgY), классом (например, IgG1, IgG2, IgG3, IgG4, IgA1 и IgA2) или подклассом молекулы иммуноглобулина. В конкретном варианте осуществления антитело по настоящему изобретению представляет собой антитело IgG, такое как антитело IgG1.
[00179] Варианты и производные антител включают фрагменты антител, которые сохраняют способность специфически связываться с эпитопом. Примеры фрагментов включают Fab-фрагменты (фрагмент антитела, который содержит антигенсвязывающий домен и содержит легкую цепь и часть тяжелой цепи, связанные мостиковой дисульфидной связью); Fab' (фрагмент антитела, содержащий один анти-связывающий домен, содержащий Fab и дополнительную часть тяжелой цепи, соединенные шарнирной областью); F(ab')2 (две молекулы Fab', соединенные межцепочечными дисульфидными связями в шарнирных областях тяжелых цепей; молекулы Fab' могут быть направлены к одинаковым или разным эпитопам); одноцепочечная цепь Fab, содержащая вариабельную область, также известную как sFv (вариабельная антигенсвязывающая детерминантная область одной легкой и тяжелой цепи антитела, связанных вместе цепочкой из 10-25 аминокислот); дисульфид-связанный Fv или dsFv (вариабельная антигенсвязывающая детерминантная область одной легкой и тяжелой цепи антитела, связанных вместе дисульфидной связью); верблюжий VH (вариабельная, антигенсвязывающая детерминантная область одной тяжелой цепи антитела, в которой некоторые аминокислоты на границе VH являются аминокислотами, обнаруживаемым в тяжелой цепи природных антител верблюда); диатело (димеризованный sFv образуется когда домен VH первого sFv соединяется с доменом VL второго sFv, и домен VL первого sFv соединяется с доменом VH второго sFv; две антигенсвязывающие области диатела могут быть направлено на одни и те же или разные эпитопы); и триатело (тримеризованный sFv, образованный способом, подобным диателу, но в котором три антигенсвязывающих домена собираются в один комплекс; три антигенсвязывающих домена могут быть направлены к одинаковым или разным эпитопам). Производные антител также включают одну или несколько последовательностей CDR сайта объединения антител. Последовательности CDR могут быть связаны вместе на каркасе, если присутствуют две или более последовательности CDR. В определенных вариантах осуществления антитело по настоящему изобретению содержит одноцепочечный Fv («scFv»). scFv представляют собой фрагменты антитела, содержащие домены VH и VL антитела, где эти домены присутствуют в одной полипептидной цепи. Обычно, полипептид scFv также содержит полипептидный линкер между доменами VH и VL, который позволяет scFv образовывать желаемую структуру для связывания антигена. Обзор scFv представлен в Pluckthun in The Pharmacology of Monoclonal Antibodies, vol. 113, Rosenburg and Moore eds. Springer-Verlag, New York, pp. 269-315 (1994).
[00180] Антитела по настоящему изобретению могут иметь любое животное происхождение, включая птиц и млекопитающих (например, человек, мышь, осел, овца, кролик, коза, морская свинка, верблюд, лошадь или курица). В определенных вариантах осуществления антитела по настоящему изобретению представляют собой человеческие или гуманизированные моноклональные антитела. Как используется в настоящем изобретении, «человеческие» антитела включают антитела с аминокислотной последовательностью иммуноглобулина человека, и включают антитела, выделенные из библиотек иммуноглобулина человека или из мышей, которые экспрессируют антитела из человеческих генов.
[00181] В некоторых вариантах осуществления антитела представляют собой полностью человеческие антитела, такие как полностью человеческие антитела, которые иммуноспецифически связываются с полипептидом нектина-4, фрагментом полипептида нектина-4 или эпитопом нектина-4. Такие полностью человеческие антитела будут иметь преимущество перед полностью мышиными (или другими полностью или частично нечеловеческими антителами), гуманизированными антителами или химерными антителами, с точки зрения максимального уменьшения развития нежелательных или ненужных побочных эффектов, таких как иммунные ответы, направленные на неполностью человеческие антитела (например, антитела против нектина-4, полученные из других видов) при введении индивиду.
[00182] В одном из вариантов осуществления антитело по настоящему изобретению может включать биспецифическое антитело или его антигенсвязывающий фрагмент, имеющее два антитела или его антигенсвязывающих фрагмента, каждое из которых направлено на различные эпитопы нектина-4.
[00183] В некоторых вариантах осуществления антитела по настоящему изобретению являются моноспецифичными для данного эпитопа полипептида нектина-4 и не обладают иммуноспецифическим связыванием с другими эпитопами.
[00184] В некоторых вариантах осуществления антитела по настоящему изобретению представляют собой антитела, которые связываются с нектином-4, включая полипептид нектина-4, фрагмент полипептида нектина-4, пептид нектина-4 или эпитоп нектина-4. В одном из вариантов осуществления антитело по настоящему изобретению связывается с нектином-4 человека. В другом варианте осуществления антитело по настоящему изобретению связывается с нектином-4 яванского макака. В другом варианте осуществления антитело по настоящему изобретению связывается с нектином-4 человека и нектином-4 яванского макака. В некоторых вариантах осуществления антитела против нектина-4 не блокируют связывание лиганда нектина-4 с полипептидом нектина-4. В других вариантах осуществления антитела против нектина-4 представляют собой гуманизированные антитела (например, содержащие константные области человека), которые связываются с нектином-4, включая полипептид нектина-4, фрагмент полипептида нектина-4, пептид нектина-4 или эпитоп нектин-4.
[00185] В одном из вариантов осуществления антитела из композиций, содержащих антитела, и способы применения антител по настоящему изобретению, включают антитело M22-321b41.1. В настоящем описании также раскрыты гибридомы, которые продуцируют антитело M22-321b41.1. В некоторых вариантах осуществления антитело M22-321b41.1 получают из линии клеток гибридомы M22-321b41.1. В некоторых вариантах осуществления антитело M22-321b41.1 имеет изотип IgG2a/каппа мыши.
[00186] M22-321b41.1 представляет собой линию клеток гибридомы мышиного происхождения. Линия гибридомных клеток M22-321b41.1 была депонирована 13 июня 2017 года (номер доступа в ATCC - PTA-124245).
[00187] В некоторых вариантах осуществления антитело против нектина-4 содержит область VH, область VL, СDR1 VH, CDR2 VH, CDR3 VH, CDR1 VL, CDR2 VL и/или CDR3 VL моноклонального антитела мыши, описанного в настоящем документе, такой как аминокислотная последовательность, изображенная в Таблице 1. Соответственно, в некоторых вариантах осуществления выделенное антитело или его функциональный фрагмент по настоящему изобретению содержит одну, две и/или три CDR тяжелой цепи и/или одну, две и/или три CDR легкой цепи из антитела против нектина-4 M22-321b41.1.
Таблица 1: Последовательности CDR антитела M22-321b411
(SEQ ID NO:7)
(SEQ ID NO:7)
(SEQ ID NO:8)
(SEQ ID NO:9)
(SEQ ID NO:10)
(SEQ ID NO:10)
(SEQ ID NO:11)
(SEQ ID NO:12)
(SEQ ID NO:12)
(SEQ ID NO:12)
(SEQ ID NO:13)
(SEQ ID NO:14)
(SEQ ID NO:15)
(SEQ ID NO:16)
(SEQ ID NO:17)
(SEQ ID NO:18)
(SEQ ID NO:19)
(SEQ ID NO:20)
(SEQ ID NO:21)
(SEQ ID NO:22)
(SEQ ID NO:23)
(SEQ ID NO:23)
(SEQ ID NO:24)
DIVMTQAAFSNPVTLGTSASISCRSSKSLLHSNGITYLYWYLQKPGQSPQLLIYHMSNLASGVPDRFTSSGSGTDFTLRISRVEAEDVGVYYCAQNLELPFTFGGGTKLETKRADAAPTVSIFPPSSEQLTSG (SEQ ID NO: 3)
QVQLQQSGAELARPGASVKLSCKASGYTFTTYWMQWVKQRPGQGLEWIGSIYPGDGDTRYTQKFKGKATLTADKSSSTAYIQLSTLASEDSAVYYCAREYYGLDYWGQGTTLTVSSAKTTAPSVYPLAPVCGDTTG (SEQ ID NO: 4)
[00188] В некоторых вариантах осуществления антитело по настоящему изобретению содержит или состоит из шести CDR, например, CDR1 VH, CDR2 VH, CDR3 VH, CDR1 VL, CDR2 VL и/или CDR3 VL, указанных в Таблице 1. В некоторых вариантах осуществления антитело по настоящему изобретению может содержать менее шести CDR. В некоторых вариантах осуществления антитело содержит или состоит из одного, двух, трех, четырех или пяти CDR, выбранных из группы, состоящей из CDR1 VH, CDR2 VH, CDR3 VH, CDR1 VL, CDR2 VL и/или CDR3 VL, указанных в Таблице 1. В некоторых вариантах осуществления антитело содержит или состоит из одного, двух, трех, четырех или пяти CDR, выбранных из группы, состоящей из CDR1 VH, CDR2 VH, CDR3 VH, CDR1 VL, CDR2 VL и/или CDR3 VL моноклонального антитела М22-321b41.1.
[00189] В некоторых вариантах осуществления антитела по настоящему изобретению содержат один или несколько (например, один, два или три) CDR VH, перечисленные в Таблице 1. В других вариантах осуществления антитела по настоящему изобретению содержат один или несколько (например, один, два или три) CDR VL, перечисленные в Таблице 1. В других вариантах осуществления антитела по настоящему изобретению содержат один или несколько (например, один, два или три) VH CDR, перечисленные в Таблице 1, и один или несколько CDR VL, перечисленные в Таблице 1. Соответственно, в некоторых вариантах осуществления антитела содержат CDR1 VH с аминокислотной последовательностью, выбранной из группу выбранной из группы, состоящей из Кэбат CDR1 VH (SEQ ID NO:15), Chothia CDR1 VH (SEQ ID NO:16), Contact CDR1 VH (SEQ ID NO:17) и, в качестве примера, CDR1 VH (SEQ ID NO:14). В некоторых вариантах осуществления, антитела содержат CDR2 VH с аминокислотной последовательностью, выбранной из группы, состоящей из Кэбат CDR2 VH (SEQ ID NO:19), Chothia CDR2 VH (SEQ ID NO:20), Contact CDR2 VH (SEQ ID NO:21) и, в качестве примера, CDR2 VH (SEQ ID NO:18). В некоторых вариантах осуществления, антитела содержат CDR3 VH с аминокислотной последовательностью, выбранной из группы, состоящей из Кэбат CDR3 VH (SEQ ID NO:23), Chothia CDR3 VH (SEQ ID NO:23), Contact CDR3 VH (SEQ ID NO:24) и, в качестве примера, CDR3 VH (SEQ ID NO:22). В некоторых вариантах осуществления, антитела содержат CDR1 VH и/или CDR2 VH и/или CDR3 VH, независимо выбранные из одной из аминокислотных последовательностей CDR1 VH, CDR2 VH, CDR3 VH, как указано в Таблице 1. В некоторых вариантах осуществления, антитела содержат CDR1 VL с аминокислотной последовательностью, выбранной из группы, состоящей из Кэбат CDR1 VL (SEQ ID NO:7), Chothia CDR1 VL (SEQ ID NO:7), Contact CDR1 VL (SEQ ID NO:8) и, в качестве примера, CDR1 VL (SEQ ID NO:7). В еще одном варианте осуществления, антитела содержат CDR2 VL с аминокислотной последовательностью, выбранной из группы, состоящей из Кэбат CDR2 VL (SEQ ID NO:10), Chothia CDR2 VL (SEQ ID NO:10), Contact CDR2 VL (SEQ ID NO:11) и, в качестве примера, CDR2 VL (SEQ ID NO:9). В некоторых вариантах осуществления, антитела содержат CDR3 VL с аминокислотной последовательностью, выбранной из группы, состоящей из Кэбат CDR3 VL (SEQ ID NO:12), Chothia CDR3 VL (SEQ ID NO:12), Contact CDR3 VL (SEQ ID NO:13) и, в качестве примера, CDR3 VL (SEQ ID NO:12). В некоторых вариантах осуществления, антитела содержат CDR1 VL и/или CDR2 VL и/или CDR3 VL, независимо выбранные из одной из аминокислотных последовательностей CDR1 VL, CDR2 VL, CDR3 VL, как показано в Таблице 1.
[00190] В некоторых вариантах осуществления, антитела по настоящему изобретению, содержат область VH, содержащую: (1) CDR1 VH с аминокислотной последовательностью, выбранной из группы, состоящей из Кэбат CDR1 VH (SEQ ID NO:15), Chothia CDR1 VH (SEQ ID NO:16), Contact CDR1 VH (SEQ ID NO:17) и, в качестве примера, CDR1 VH (SEQ ID NO:14); (2) CDR2 VH с аминокислотной последовательностью, выбранной из группы, состоящей из Кэбат CDR2 VH (SEQ ID NO:19), Chothia CDR2 VH (SEQ ID NO:20), Contact CDR2 VH (SEQ ID NO:21) и, в качестве примера, CDR2 VH (SEQ ID NO:18); и (3) CDR3 VH с аминокислотной последовательностью, выбранной из группы, состоящей из Кэбат CDR3 VH (SEQ ID NO:23), Chothia CDR3 VH (SEQ ID NO:23), Contact CDR3 VH (SEQ ID NO:24) и, в качестве примера, CDR3 VH (SEQ ID NO:22); и область VL, содержащую: (1) CDR1 VL с аминокислотной последовательностью, выбранной из группы, состоящей из Кэбат CDR1 VL (SEQ ID NO:7), Chothia CDR1 VL (SEQ ID NO:7), Contact CDR1 VL (SEQ ID NO:8) и, в качестве примера, CDR1 VL (SEQ ID NO:7); (2) CDR2 VL с аминокислотной последовательностью, выбранной из группы, состоящей из Кэбат CDR2 VL (SEQ ID NO:10), Chothia CDR2 VL (SEQ ID NO:10), Contact CDR2 VL (SEQ ID NO:11) и, в качестве примера, CDR2 VL (SEQ ID NO:9); и (3) CDR3 VL с аминокислотной последовательностью, выбранной из группы, состоящей из Кэбат CDR3 VL (SEQ ID NO:12), Chothia CDR3 VL (SEQ ID NO:12), Contact CDR3 VL (SEQ ID NO:13) и, в качестве примера, CDR3 VL (SEQ ID NO:12).
[00191] В некоторых вариантах осуществления, антитела по настоящему изобретению содержат область VH, содержащую: (1) CDR1 VH с аминокислотной последовательностью, выбранной из группы, состоящей из Кэбат CDR1 VH (SEQ ID NO:15), Chothia CDR1 VH (SEQ ID NO:16), Contact CDR1 VH (SEQ ID NO:17) и, в качестве примера, CDR1 VH (SEQ ID NO:14); (2) CDR2 VH с аминокислотной последовательностью, выбранной из группы, состоящей из Кэбат CDR2 VH (SEQ ID NO:19), Chothia CDR2 VH (SEQ ID NO:20), Contact CDR2 VH (SEQ ID NO:21) и, в качестве примера, CDR2 VH (SEQ ID NO:18); и (3) CDR3 VH с аминокислотной последовательностью, выбранной из группы, состоящей из Кэбат CDR3 VH (SEQ ID NO:23), Chothia CDR3 VH (SEQ ID NO:23), Contact CDR3 VH (SEQ ID NO:24) и, в качестве примера, CDR3 VH (SEQ ID NO:22).
[00192] В других вариантах осуществления the antibodies provided herein comprise a VL region comprising: (1) CDR1 VL с аминокислотной последовательностью, выбранной из группы, состоящей из Кэбат CDR1 VL (SEQ ID NO:7), Chothia CDR1 VL (SEQ ID NO:7), Contact CDR1 VL (SEQ ID NO:8) и, в качестве примера, CDR1 VL (SEQ ID NO:7); (2) CDR2 VL с аминокислотной последовательностью, выбранной из группы, состоящей из Кэбат CDR2 VL (SEQ ID NO:10), Chothia CDR2 VL (SEQ ID NO:10), Contact CDR2 VL (SEQ ID NO:11) и, в качестве примера, CDR2 VL (SEQ ID NO:9); and (3) CDR3 VL с аминокислотной последовательностью, выбранной из группы, состоящей из Кэбат CDR3 VL (SEQ ID NO:12), Chothia CDR3 VL (SEQ ID NO:12), Contact CDR3 VL (SEQ ID NO:13) и, в качестве примера, CDR3 VL (SEQ ID NO:12).
[00193] Также настоящее изобретение относится к антителам, содержащим один или несколько (например, один, два или три) CDR VH и один или несколько (например, один, два или три) CDR VL, перечисленные в Таблице 1. В частности, настоящее изобретение относится к антителу, содержащему CDR1 VH с аминокислотной последовательностью, выбранной из группы, состоящей из Кэбат CDR1 VH (SEQ ID NO:15), Chothia CDR1 VH (SEQ ID NO:16), Contact CDR1 VH (SEQ ID NO:17) и, в качестве примера, CDR1 VH (SEQ ID NO:14); и CDR1 VL с аминокислотной последовательностью, выбранной из группы, состоящей из Кэбат CDR1 VL (SEQ ID NO:7), Chothia CDR1 VL (SEQ ID NO:7), Contact CDR1 VL (SEQ ID NO:8) и, в качестве примера, CDR1 VL (SEQ ID NO:7). В одном из вариантов осуществления, антитело содержит CDR1 VH с аминокислотной последовательностью, выбранной из группы, состоящей из Кэбат CDR1 VH (SEQ ID NO:15), Chothia CDR1 VH (SEQ ID NO:16), Contact CDR1 VH (SEQ ID NO:17) и, в качестве примера, CDR1 VH (SEQ ID NO:14); и CDR2 VL с аминокислотной последовательностью, выбранной из группы, состоящей из Кэбат CDR2 VL (SEQ ID NO:10), Chothia CDR2 VL (SEQ ID NO:10), Contact CDR2 VL (SEQ ID NO:11) и, в качестве примера, CDR2 VL (SEQ ID NO:9). В других вариантах осуществления, антитело содержит CDR1 VH с аминокислотной последовательностью, выбранной из группы, состоящей из Кэбат CDR1 VH (SEQ ID NO:15), Chothia CDR1 VH (SEQ ID NO:16), Contact CDR1 VH (SEQ ID NO:17) и, в качестве примера, CDR1 VH (SEQ ID NO:14); и CDR3 VL с аминокислотной последовательностью, выбранной из группы, состоящей из Кэбат CDR3 VL (SEQ ID NO:12), Chothia CDR3 VL (SEQ ID NO:12), Contact CDR3 VL (SEQ ID NO:13) и, в качестве примера, CDR3 VL (SEQ ID NO:12). В еще одном варианте осуществления, антитело содержит CDR2 VH с аминокислотной последовательностью, выбранной из группы, состоящей из Кэбат CDR2 VH (SEQ ID NO:19), Chothia CDR2 VH (SEQ ID NO:20), Contact CDR2 VH (SEQ ID NO:21) и, в качестве примера, CDR2 VH (SEQ ID NO:18); и CDR1 VL с аминокислотной последовательностью, выбранной из группы, состоящей из Кэбат CDR1 VL (SEQ ID NO:7), Chothia CDR1 VL (SEQ ID NO:7), Contact CDR1 VL (SEQ ID NO:8) и, в качестве примера, CDR1 VL (SEQ ID NO:7). В некоторых вариантах осуществления, антитело содержит CDR2 VH с аминокислотной последовательностью, выбранной из группы, состоящей из Кэбат CDR2 VH (SEQ ID NO:19), Chothia CDR2 VH (SEQ ID NO:20), Contact CDR2 VH (SEQ ID NO:21) и, в качестве примера, CDR2 VH (SEQ ID NO:18); и CDR2 VL с аминокислотной последовательностью, выбранной из группы, состоящей из Кэбат CDR2 VL (SEQ ID NO:10), Chothia CDR2 VL (SEQ ID NO:10), Contact CDR2 VL (SEQ ID NO:11) и, в качестве примера, CDR2 VL (SEQ ID NO:9). В одном из вариантов осуществления, антитело содержит CDR2 VH с аминокислотной последовательностью, выбранной из группы, состоящей из Кэбат CDR2 VH (SEQ ID NO:19), Chothia CDR2 VH (SEQ ID NO:20), Contact CDR2 VH (SEQ ID NO:21) и, в качестве примера, CDR2 VH (SEQ ID NO:18); и CDR3 VL с аминокислотной последовательностью, выбранной из группы, состоящей из Кэбат CDR3 VL (SEQ ID NO:12), Chothia CDR3 VL (SEQ ID NO:12), Contact CDR3 VL (SEQ ID NO:13) и, в качестве примера, CDR3 VL (SEQ ID NO:12). В еще одном варианте осуществления, антитело содержит CDR3 VH с аминокислотной последовательностью, выбранной из группы, состоящей из Кэбат CDR3 VH (SEQ ID NO:23), Chothia CDR3 VH (SEQ ID NO:23), Contact CDR3 VH (SEQ ID NO:24) и, в качестве примера, CDR3 VH (SEQ ID NO:22); и CDR1 VL с аминокислотной последовательностью, выбранной из группы, состоящей из Кэбат CDR1 VL (SEQ ID NO:7), Chothia CDR1 VL (SEQ ID NO:7), Contact CDR1 VL (SEQ ID NO:8) и, в качестве примера, CDR1 VL (SEQ ID NO:7). В других вариантах осуществления антитело содержит CDR3 VH с аминокислотной последовательностью, выбранной из группы, состоящей из Кэбат CDR3 VH (SEQ ID NO:23), Chothia CDR3 VH (SEQ ID NO:23), Contact CDR3 VH (SEQ ID NO:24) и, в качестве примера, CDR3 VH (SEQ ID NO:22); и CDR2 VL с аминокислотной последовательностью, выбранной из группы, состоящей из Кэбат CDR2 VL (SEQ ID NO:10), Chothia CDR2 VL (SEQ ID NO:10), Contact CDR2 VL (SEQ ID NO:11) и, в качестве примера, CDR2 VL (SEQ ID NO:9). В некоторых вариантах осуществления, антитело содержит CDR3 VH с аминокислотной последовательностью, выбранной из группы, состоящей из Кэбат CDR3 VH (SEQ ID NO:23), Chothia CDR3 VH (SEQ ID NO:23), Contact CDR3 VH (SEQ ID NO:24) и, в качестве примера, CDR3 VH (SEQ ID NO:22); и CDR3 VL с аминокислотной последовательностью, выбранной из группы, состоящей из Кэбат CDR3 VL (SEQ ID NO:12), Chothia CDR3 VL (SEQ ID NO:12), Contact CDR3 VL (SEQ ID NO:13) и, в качестве примера, CDR3 VL (SEQ ID NO:12). В еще одном варианте осуществления, антитело содержит CDR1 VH с аминокислотной последовательностью, выбранной из группы, состоящей из Кэбат CDR1 VH (SEQ ID NO:15), Chothia CDR1 VH (SEQ ID NO:16), Contact CDR1 VH (SEQ ID NO:17) и, в качестве примера, CDR1 VH (SEQ ID NO:14); CDR2 VH с аминокислотной последовательностью, выбранной из группы, состоящей из Кэбат CDR2 VH (SEQ ID NO:19), Chothia CDR2 VH (SEQ ID NO:20), Contact CDR2 VH (SEQ ID NO:21) и, в качестве примера, CDR2 VH (SEQ ID NO:18); и CDR1 VL с аминокислотной последовательностью, выбранной из группы, состоящей из Кэбат CDR1 VL (SEQ ID NO:7), Chothia CDR1 VL (SEQ ID NO:7), Contact CDR1 VL (SEQ ID NO:8) и, в качестве примера, CDR1 VL (SEQ ID NO:7). В одном из вариантов осуществления, антитело содержит CDR1 VH с аминокислотной последовательностью, выбранной из группы, состоящей из Кэбат CDR1 VH (SEQ ID NO:15), Chothia CDR1 VH (SEQ ID NO:16), Contact CDR1 VH (SEQ ID NO:17) и, в качестве примера, CDR1 VH (SEQ ID NO:14); CDR2 VH с аминокислотной последовательностью, выбранной из группы, состоящей из Кэбат CDR2 VH (SEQ ID NO:19), Chothia CDR2 VH (SEQ ID NO:20), Contact CDR2 VH (SEQ ID NO:21) и, в качестве примера, CDR2 VH (SEQ ID NO:18); и CDR2 VL с аминокислотной последовательностью, выбранной из группы, состоящей из Кэбат CDR2 VL (SEQ ID NO:10), Chothia CDR2 VL (SEQ ID NO:10), Contact CDR2 VL (SEQ ID NO:11) и, в качестве примера, CDR2 VL (SEQ ID NO:9). В других вариантах осуществления антитело содержит CDR1 VH с аминокислотной последовательностью, выбранной из группы, состоящей из Кэбат CDR1 VH (SEQ ID NO:15), Chothia CDR1 VH (SEQ ID NO:16), Contact CDR1 VH (SEQ ID NO:17) и, в качестве примера, CDR1 VH (SEQ ID NO:14); CDR2 VH с аминокислотной последовательностью, выбранной из группы, состоящей из Кэбат CDR2 VH (SEQ ID NO:19), Chothia CDR2 VH (SEQ ID NO:20), Contact CDR2 VH (SEQ ID NO:21) и, в качестве примера, CDR2 VH (SEQ ID NO:18); и CDR3 VL с аминокислотной последовательностью, выбранной из группы, состоящей из Кэбат CDR3 VL (SEQ ID NO:12), Chothia CDR3 VL (SEQ ID NO:12), Contact CDR3 VL (SEQ ID NO:13) и, в качестве примера, CDR3 VL (SEQ ID NO:12). В еще одном варианте осуществления, антитело содержит CDR2 VH с аминокислотной последовательностью, выбранной из группы, состоящей из Кэбат CDR2 VH (SEQ ID NO:19), Chothia CDR2 VH (SEQ ID NO:20), Contact CDR2 VH (SEQ ID NO:21) и, в качестве примера, CDR2 VH (SEQ ID NO:18); CDR3 VH с аминокислотной последовательностью, выбранной из группы, состоящей из Кэбат CDR3 VH (SEQ ID NO:23), Chothia CDR3 VH (SEQ ID NO:23), Contact CDR3 VH (SEQ ID NO:24) и, в качестве примера, CDR3 VH (SEQ ID NO:22); и CDR1 VL с аминокислотной последовательностью, выбранной из группы, состоящей из Кэбат CDR1 VL (SEQ ID NO:7), Chothia CDR1 VL (SEQ ID NO:7), Contact CDR1 VL (SEQ ID NO:8) и, в качестве примера, CDR1 VL (SEQ ID NO:7). В некоторых вариантах осуществления, антитело содержит CDR2 VH с аминокислотной последовательностью, выбранной из группы, состоящей из Кэбат CDR2 VH (SEQ ID NO:19), Chothia CDR2 VH (SEQ ID NO:20), Contact CDR2 VH (SEQ ID NO:21) и, в качестве примера, CDR2 VH (SEQ ID NO:18); CDR3 VH с аминокислотной последовательностью, выбранной из группы, состоящей из Кэбат CDR3 VH (SEQ ID NO:23), Chothia CDR3 VH (SEQ ID NO:23), Contact CDR3 VH (SEQ ID NO:24) и, в качестве примера, CDR3 VH (SEQ ID NO:22); и CDR2 VL с аминокислотной последовательностью, выбранной из группы, состоящей из Кэбат CDR2 VL (SEQ ID NO:10), Chothia CDR2 VL (SEQ ID NO:10), Contact CDR2 VL (SEQ ID NO:11) и, в качестве примера, CDR2 VL (SEQ ID NO:9). В одном из вариантов осуществления, антитело содержит CDR2 VH с аминокислотной последовательностью, выбранной из группы, состоящей из Кэбат CDR2 VH (SEQ ID NO:19), Chothia CDR2 VH (SEQ ID NO:20), Contact CDR2 VH (SEQ ID NO:21) и, в качестве примера, CDR2 VH (SEQ ID NO:18); CDR3 VH с аминокислотной последовательностью, выбранной из группы, состоящей из Кэбат CDR3 VH (SEQ ID NO:23), Chothia CDR3 VH (SEQ ID NO:23), Contact CDR3 VH (SEQ ID NO:24) и, в качестве примера, CDR3 VH (SEQ ID NO:22); и CDR3 VL с аминокислотной последовательностью, выбранной из группы, состоящей из Кэбат CDR3 VL (SEQ ID NO:12), Chothia CDR3 VL (SEQ ID NO:12), Contact CDR3 VL (SEQ ID NO:13) и, в качестве примера, CDR3 VL (SEQ ID NO:12). В еще одном варианте осуществления, антитело содержит CDR1 VH с аминокислотной последовательностью, выбранной из группы, состоящей из Кэбат CDR1 VH (SEQ ID NO:15), Chothia CDR1 VH (SEQ ID NO:16), Contact CDR1 VH (SEQ ID NO:17) и, в качестве примера, CDR1 VH (SEQ ID NO:14); CDR3 VH с аминокислотной последовательностью, выбранной из группы, состоящей из Кэбат CDR3 VH (SEQ ID NO:23), Chothia CDR3 VH (SEQ ID NO:23), Contact CDR3 VH (SEQ ID NO:24) и, в качестве примера, CDR3 VH (SEQ ID NO:22); и CDR1 VL с аминокислотной последовательностью, выбранной из группы, состоящей из Кэбат CDR1 VL (SEQ ID NO:7), Chothia CDR1 VL (SEQ ID NO:7), Contact CDR1 VL (SEQ ID NO:8) и, в качестве примера, CDR1 VL (SEQ ID NO:7). В других вариантах осуществления антитело содержит CDR1 VH с аминокислотной последовательностью, выбранной из группы, состоящей из Кэбат CDR1 VH (SEQ ID NO:15), Chothia CDR1 VH (SEQ ID NO:16), Contact CDR1 VH (SEQ ID NO:17) и, в качестве примера, CDR1 VH (SEQ ID NO:14); CDR3 VH с аминокислотной последовательностью, выбранной из группы, состоящей из Кэбат CDR3 VH (SEQ ID NO:23), Chothia CDR3 VH (SEQ ID NO:23), Contact CDR3 VH (SEQ ID NO:24) и, в качестве примера, CDR3 VH (SEQ ID NO:22); и CDR2 VL с аминокислотной последовательностью, выбранной из группы, состоящей из Кэбат CDR2 VL (SEQ ID NO:10), Chothia CDR2 VL (SEQ ID NO:10), Contact CDR2 VL (SEQ ID NO:11) и, в качестве примера, CDR2 VL (SEQ ID NO:9). В некоторых вариантах осуществления, антитело содержит CDR1 VH с аминокислотной последовательностью, выбранной из группы, состоящей из Кэбат CDR1 VH (SEQ ID NO:15), Chothia CDR1 VH (SEQ ID NO:16), Contact CDR1 VH (SEQ ID NO:17) и, в качестве примера, CDR1 VH (SEQ ID NO:14); CDR3 VH с аминокислотной последовательностью, выбранной из группы, состоящей из Кэбат CDR3 VH (SEQ ID NO:23), Chothia CDR3 VH (SEQ ID NO:23), Contact CDR3 VH (SEQ ID NO:24) и, в качестве примера, CDR3 VH (SEQ ID NO:22); и CDR3 VL с аминокислотной последовательностью, выбранной из группы, состоящей из Кэбат CDR3 VL (SEQ ID NO:12), Chothia CDR3 VL (SEQ ID NO:12), Contact CDR3 VL (SEQ ID NO:13) и, в качестве примера, CDR3 VL (SEQ ID NO:12). В еще одном варианте осуществления, антитело содержит CDR1 VH с аминокислотной последовательностью, выбранной из группы, состоящей из Кэбат CDR1 VH (SEQ ID NO:15), Chothia CDR1 VH (SEQ ID NO:16), Contact CDR1 VH (SEQ ID NO:17) и, в качестве примера, CDR1 VH (SEQ ID NO:14); CDR1 VL с аминокислотной последовательностью, выбранной из группы, состоящей из Кэбат CDR1 VL (SEQ ID NO:7), Chothia CDR1 VL (SEQ ID NO:7), Contact CDR1 VL (SEQ ID NO:8) и, в качестве примера, CDR1 VL (SEQ ID NO:7); и CDR2 VL с аминокислотной последовательностью, выбранной из группы, состоящей из Кэбат CDR2 VL (SEQ ID NO:10), Chothia CDR2 VL (SEQ ID NO:10), Contact CDR2 VL (SEQ ID NO:11) и, в качестве примера, CDR2 VL (SEQ ID NO:9). В одном из вариантов осуществления, антитело содержит CDR1 VH с аминокислотной последовательностью, выбранной из группы, состоящей из Кэбат CDR1 VH (SEQ ID NO:15), Chothia CDR1 VH (SEQ ID NO:16), Contact CDR1 VH (SEQ ID NO:17) и, в качестве примера, CDR1 VH (SEQ ID NO:14); CDR1 VL с аминокислотной последовательностью, выбранной из группы, состоящей из Кэбат CDR1 VL (SEQ ID NO:7), Chothia CDR1 VL (SEQ ID NO:7), Contact CDR1 VL (SEQ ID NO:8) и, в качестве примера, CDR1 VL (SEQ ID NO:7); и CDR3 VL с аминокислотной последовательностью, выбранной из группы, состоящей из Кэбат CDR3 VL (SEQ ID NO:12), Chothia CDR3 VL (SEQ ID NO:12), Contact CDR3 VL (SEQ ID NO:13) и, в качестве примера, CDR3 VL (SEQ ID NO:12). В других вариантах осуществления антитело содержит CDR1 VH с аминокислотной последовательностью, выбранной из группы, состоящей из Кэбат CDR1 VH (SEQ ID NO:15), Chothia CDR1 VH (SEQ ID NO:16), Contact CDR1 VH (SEQ ID NO:17) и, в качестве примера, CDR1 VH (SEQ ID NO:14); CDR2 VL с аминокислотной последовательностью, выбранной из группы, состоящей из Кэбат CDR2 VL (SEQ ID NO:10), Chothia CDR2 VL (SEQ ID NO:10), Contact CDR2 VL (SEQ ID NO:11) и, в качестве примера, CDR2 VL (SEQ ID NO:9); и CDR3 VL с аминокислотной последовательностью, выбранной из группы, состоящей из Кэбат CDR3 VL (SEQ ID NO:12), Chothia CDR3 VL (SEQ ID NO:12), Contact CDR3 VL (SEQ ID NO:13) и, в качестве примера, CDR3 VL (SEQ ID NO:12). В еще одном варианте осуществления, антитело содержит CDR2 VH с аминокислотной последовательностью, выбранной из группы, состоящей из Кэбат CDR2 VH (SEQ ID NO:19), Chothia CDR2 VH (SEQ ID NO:20), Contact CDR2 VH (SEQ ID NO:21) и, в качестве примера, CDR2 VH (SEQ ID NO:18);, CDR1 VL с аминокислотной последовательностью, выбранной из группы, состоящей из Кэбат CDR1 VL (SEQ ID NO:7), Chothia CDR1 VL (SEQ ID NO:7), Contact CDR1 VL (SEQ ID NO:8) и, в качестве примера, CDR1 VL (SEQ ID NO:7); и CDR2 VL с аминокислотной последовательностью, выбранной из группы, состоящей из Кэбат CDR2 VL (SEQ ID NO:10), Chothia CDR2 VL (SEQ ID NO:10), Contact CDR2 VL (SEQ ID NO:11) и, в качестве примера, CDR2 VL (SEQ ID NO:9). В некоторых вариантах осуществления, антитело содержит CDR2 VH с аминокислотной последовательностью, выбранной из группы, состоящей из . Кэбат CDR2 VH (SEQ ID NO:19), Chothia CDR2 VH (SEQ ID NO:20), Contact CDR2 VH (SEQ ID NO:21) и, в качестве примера, CDR2 VH (SEQ ID NO:18); CDR1 VL с аминокислотной последовательностью, выбранной из группы, состоящей из Кэбат CDR1 VL (SEQ ID NO:7), Chothia CDR1 VL (SEQ ID NO:7), Contact CDR1 VL (SEQ ID NO:8) и, в качестве примера, CDR1 VL (SEQ ID NO:7); и CDR3 VL с аминокислотной последовательностью, выбранной из группы, состоящей из Кэбат CDR3 VL (SEQ ID NO:12), Chothia CDR3 VL (SEQ ID NO:12), Contact CDR3 VL (SEQ ID NO:13) и, в качестве примера, CDR3 VL (SEQ ID NO:12). В одном из вариантов осуществления, антитело содержит CDR2 VH с аминокислотной последовательностью, выбранной из группы, состоящей из Кэбат CDR2 VH (SEQ ID NO:19), Chothia CDR2 VH (SEQ ID NO:20), Contact CDR2 VH (SEQ ID NO:21) и, в качестве примера, CDR2 VH (SEQ ID NO:18); CDR2 VL с аминокислотной последовательностью, выбранной из группы, состоящей из Кэбат CDR2 VL (SEQ ID NO:10), Chothia CDR2 VL (SEQ ID NO:10), Contact CDR2 VL (SEQ ID NO:11) и, в качестве примера, CDR2 VL (SEQ ID NO:9); и CDR3 VL с аминокислотной последовательностью, выбранной из группы, состоящей из Кэбат CDR3 VL (SEQ ID NO:12), Chothia CDR3 VL (SEQ ID NO:12), Contact CDR3 VL (SEQ ID NO:13) и, в качестве примера, CDR3 VL (SEQ ID NO:12). В еще одном варианте осуществления, антитело содержит CDR3 VH с аминокислотной последовательностью, выбранной из группы, состоящей из Кэбат CDR3 VH (SEQ ID NO:23), Chothia CDR3 VH (SEQ ID NO:23), Contact CDR3 VH (SEQ ID NO:24) и, в качестве примера, CDR3 VH (SEQ ID NO:22); CDR1 VL с аминокислотной последовательностью, выбранной из группы, состоящей из Кэбат CDR1 VL (SEQ ID NO:7), Chothia CDR1 VL (SEQ ID NO:7), Contact CDR1 VL (SEQ ID NO:8) и, в качестве примера, CDR1 VL (SEQ ID NO:7); и CDR2 VL с аминокислотной последовательностью, выбранной из группы, состоящей из Кэбат CDR2 VL (SEQ ID NO:10), Chothia CDR2 VL (SEQ ID NO:10), Contact CDR2 VL (SEQ ID NO:11) и, в качестве примера, CDR2 VL (SEQ ID NO:9). В других вариантах осуществления антитело содержит CDR3 VH с аминокислотной последовательностью, выбранной из группы, состоящей из Кэбат CDR3 VH (SEQ ID NO:23), Chothia CDR3 VH (SEQ ID NO:23), Contact CDR3 VH (SEQ ID NO:24) и, в качестве примера, CDR3 VH (SEQ ID NO:22); CDR1 VL с аминокислотной последовательностью, выбранной из группы, состоящей из Кэбат CDR1 VL (SEQ ID NO:7), Chothia CDR1 VL (SEQ ID NO:7), Contact CDR1 VL (SEQ ID NO:8) и, в качестве примера, CDR1 VL (SEQ ID NO:7); и CDR3 VL с аминокислотной последовательностью, выбранной из группы, состоящей из Кэбат CDR3 VL (SEQ ID NO:12), Chothia CDR3 VL (SEQ ID NO:12), Contact CDR3 VL (SEQ ID NO:13) и, в качестве примера, CDR3 VL (SEQ ID NO:12). В некоторых вариантах осуществления, антитело содержит CDR3 VH с аминокислотной последовательностью, выбранной из группы, состоящей из Кэбат CDR3 VH (SEQ ID NO:23), Chothia CDR3 VH (SEQ ID NO:23), Contact CDR3 VH (SEQ ID NO:24) и, в качестве примера, CDR3 VH (SEQ ID NO:22); CDR2 VL с аминокислотной последовательностью, выбранной из группы, состоящей из Кэбат CDR2 VL (SEQ ID NO:10), Chothia CDR2 VL (SEQ ID NO:10), Contact CDR2 VL (SEQ ID NO:11) и, в качестве примера, CDR2 VL (SEQ ID NO:9); и CDR3 VL с аминокислотной последовательностью, выбранной из группы, состоящей из Кэбат CDR3 VL (SEQ ID NO:12), Chothia CDR3 VL (SEQ ID NO:12), Contact CDR3 VL (SEQ ID NO:13) и, в качестве примера, CDR3 VL (SEQ ID NO:12). В еще одном варианте осуществления, антитело содержит CDR1 VH с аминокислотной последовательностью, выбранной из группы, состоящей из Кэбат CDR1 VH (SEQ ID NO:15), Chothia CDR1 VH (SEQ ID NO:16), Contact CDR1 VH (SEQ ID NO:17) и, в качестве примера, CDR1 VH (SEQ ID NO:14); CDR2 VH с аминокислотной последовательностью, выбранной из группы, состоящей из . Кэбат CDR2 VH (SEQ ID NO:19), Chothia CDR2 VH (SEQ ID NO:20), Contact CDR2 VH (SEQ ID NO:21) и, в качестве примера, CDR2 VH (SEQ ID NO:18); CDR3 VH с аминокислотной последовательностью, выбранной из группы, состоящей из Кэбат CDR3 VH (SEQ ID NO:23), Chothia CDR3 VH (SEQ ID NO:23), Contact CDR3 VH (SEQ ID NO:24) и, в качестве примера, CDR3 VH (SEQ ID NO:22); и CDR1 VL с аминокислотной последовательностью, выбранной из группы, состоящей из Кэбат CDR1 VL (SEQ ID NO:7), Chothia CDR1 VL (SEQ ID NO:7), Contact CDR1 VL (SEQ ID NO:8) и, в качестве примера, CDR1 VL (SEQ ID NO:7). В одном из вариантов осуществления, антитело содержит CDR1 VH с аминокислотной последовательностью, выбранной из группы, состоящей из Кэбат CDR1 VH (SEQ ID NO:15), Chothia CDR1 VH (SEQ ID NO:16), Contact CDR1 VH (SEQ ID NO:17) и, в качестве примера, CDR1 VH (SEQ ID NO:14); CDR2 VH с аминокислотной последовательностью, выбранной из группы, состоящей из Кэбат CDR2 VH (SEQ ID NO:19), Chothia CDR2 VH (SEQ ID NO:20), Contact CDR2 VH (SEQ ID NO:21) и, в качестве примера, CDR2 VH (SEQ ID NO:18); CDR3 VH с аминокислотной последовательностью, выбранной из группы, состоящей из Кэбат CDR3 VH (SEQ ID NO:23), Chothia CDR3 VH (SEQ ID NO:23), Contact CDR3 VH (SEQ ID NO:24) и, в качестве примера, CDR3 VH (SEQ ID NO:22); и CDR2 VL с аминокислотной последовательностью, выбранной из группы, состоящей из Кэбат CDR2 VL (SEQ ID NO:10), Chothia CDR2 VL (SEQ ID NO:10), Contact CDR2 VL (SEQ ID NO:11) и, в качестве примера, CDR2 VL (SEQ ID NO:9). В других вариантах осуществления антитело содержит CDR1 VH с аминокислотной последовательностью, выбранной из группы, состоящей из Кэбат CDR1 VH (SEQ ID NO:15), Chothia CDR1 VH (SEQ ID NO:16), Contact CDR1 VH (SEQ ID NO:17) и, в качестве примера, CDR1 VH (SEQ ID NO:14); CDR2 VH с аминокислотной последовательностью, выбранной из группы, состоящей из Кэбат CDR2 VH (SEQ ID NO:19), Chothia CDR2 VH (SEQ ID NO:20), Contact CDR2 VH (SEQ ID NO:21) и, в качестве примера, CDR2 VH (SEQ ID NO:18); CDR3 VH с аминокислотной последовательностью, выбранной из группы, состоящей из Кэбат CDR3 VH (SEQ ID NO:23), Chothia CDR3 VH (SEQ ID NO:23), Contact CDR3 VH (SEQ ID NO:24) и, в качестве примера, CDR3 VH (SEQ ID NO:22); и CDR3 VL с аминокислотной последовательностью, выбранной из группы, состоящей из Кэбат CDR3 VL (SEQ ID NO:12), Chothia CDR3 VL (SEQ ID NO:12), Contact CDR3 VL (SEQ ID NO:13) и, в качестве примера, CDR3 VL (SEQ ID NO:12). В еще одном варианте осуществления, антитело содержит CDR1 VH с аминокислотной последовательностью, выбранной из группы, состоящей из Кэбат CDR1 VH (SEQ ID NO:15), Chothia CDR1 VH (SEQ ID NO:16), Contact CDR1 VH (SEQ ID NO:17) и, в качестве примера, CDR1 VH (SEQ ID NO:14); CDR2 VH с аминокислотной последовательностью, выбранной из группы, состоящей из Кэбат CDR2 VH (SEQ ID NO:19), Chothia CDR2 VH (SEQ ID NO:20), Contact CDR2 VH (SEQ ID NO:21) и, в качестве примера, CDR2 VH (SEQ ID NO:18); CDR1 VL с аминокислотной последовательностью, выбранной из группы, состоящей из Кэбат CDR1 VL (SEQ ID NO:7), Chothia CDR1 VL (SEQ ID NO:7), Contact CDR1 VL (SEQ ID NO:8) и, в качестве примера, CDR1 VL (SEQ ID NO:7); и CDR2 VL с аминокислотной последовательностью, выбранной из группы, состоящей из Кэбат CDR2 VL (SEQ ID NO:10), Chothia CDR2 VL (SEQ ID NO:10), Contact CDR2 VL (SEQ ID NO:11) и, в качестве примера, CDR2 VL (SEQ ID NO:9). В некоторых вариантах осуществления, антитело содержит CDR1 VH с аминокислотной последовательностью, выбранной из группы, состоящей из Кэбат CDR1 VH (SEQ ID NO:15), Chothia CDR1 VH (SEQ ID NO:16), Contact CDR1 VH (SEQ ID NO:17) и, в качестве примера, CDR1 VH (SEQ ID NO:14); CDR2 VH с аминокислотной последовательностью, выбранной из группы, состоящей из Кэбат CDR2 VH (SEQ ID NO:19), Chothia CDR2 VH (SEQ ID NO:20), Contact CDR2 VH (SEQ ID NO:21) и, в качестве примера, CDR2 VH (SEQ ID NO:18); CDR1 VL с аминокислотной последовательностью, выбранной из группы, состоящей из Кэбат CDR1 VL (SEQ ID NO:7), Chothia CDR1 VL (SEQ ID NO:7), Contact CDR1 VL (SEQ ID NO:8) и, в качестве примера, CDR1 VL (SEQ ID NO:7); и CDR3 VL с аминокислотной последовательностью, выбранной из группы, состоящей из Кэбат CDR3 VL (SEQ ID NO:12), Chothia CDR3 VL (SEQ ID NO:12), Contact CDR3 VL (SEQ ID NO:13) и, в качестве примера, CDR3 VL (SEQ ID NO:12). В одном из вариантов осуществления, антитело содержит CDR1 VH с аминокислотной последовательностью, выбранной из группы, состоящей из Кэбат CDR1 VH (SEQ ID NO:15), Chothia CDR1 VH (SEQ ID NO:16), Contact CDR1 VH (SEQ ID NO:17) и, в качестве примера, CDR1 VH (SEQ ID NO:14); CDR2 VH с аминокислотной последовательностью, выбранной из группы, состоящей из . Кэбат CDR2 VH (SEQ ID NO:19), Chothia CDR2 VH (SEQ ID NO:20), Contact CDR2 VH (SEQ ID NO:21) и, в качестве примера, CDR2 VH (SEQ ID NO:18); CDR2 VL с аминокислотной последовательностью, выбранной из группы, состоящей из Кэбат CDR2 VL (SEQ ID NO:10), Chothia CDR2 VL (SEQ ID NO:10), Contact CDR2 VL (SEQ ID NO:11) и, в качестве примера, CDR2 VL (SEQ ID NO:9); и CDR3 VL с аминокислотной последовательностью, выбранной из группы, состоящей из Кэбат CDR3 VL (SEQ ID NO:12), Chothia CDR3 VL (SEQ ID NO:12), Contact CDR3 VL (SEQ ID NO:13) и, в качестве примера, CDR3 VL (SEQ ID NO:12). В еще одном варианте осуществления, антитело содержит CDR1 VH с аминокислотной последовательностью, выбранной из группы, состоящей из Кэбат CDR1 VH (SEQ ID NO:15), Chothia CDR1 VH (SEQ ID NO:16), Contact CDR1 VH (SEQ ID NO:17) и, в качестве примера, CDR1 VH (SEQ ID NO:14); CDR3 VH с аминокислотной последовательностью, выбранной из группы, состоящей из Кэбат CDR3 VH (SEQ ID NO:23), Chothia CDR3 VH (SEQ ID NO:23), Contact CDR3 VH (SEQ ID NO:24) и, в качестве примера, CDR3 VH (SEQ ID NO:22); CDR1 VL с аминокислотной последовательностью, выбранной из группы, состоящей из Кэбат CDR1 VL (SEQ ID NO:7), Chothia CDR1 VL (SEQ ID NO:7), Contact CDR1 VL (SEQ ID NO:8) и, в качестве примера, CDR1 VL (SEQ ID NO:7); и CDR2 VL с аминокислотной последовательностью, выбранной из группы, состоящей из Кэбат CDR2 VL (SEQ ID NO:10), Chothia CDR2 VL (SEQ ID NO:10), Contact CDR2 VL (SEQ ID NO:11) и, в качестве примера, CDR2 VL (SEQ ID NO:9);. В других вариантах осуществления антитело содержит CDR1 VH с аминокислотной последовательностью, выбранной из группы, состоящей из Кэбат CDR1 VH (SEQ ID NO:15), Chothia CDR1 VH (SEQ ID NO:16), Contact CDR1 VH (SEQ ID NO:17) и, в качестве примера, CDR1 VH (SEQ ID NO:14); CDR3 VH с аминокислотной последовательностью, выбранной из группы, состоящей из Кэбат CDR3 VH (SEQ ID NO:23), Chothia CDR3 VH (SEQ ID NO:23), Contact CDR3 VH (SEQ ID NO:24) и, в качестве примера, CDR3 VH (SEQ ID NO:22); CDR1 VL с аминокислотной последовательностью, выбранной из группы, состоящей из Кэбат CDR1 VL (SEQ ID NO:7), Chothia CDR1 VL (SEQ ID NO:7), Contact CDR1 VL (SEQ ID NO:8) и, в качестве примера, CDR1 VL (SEQ ID NO:7); и CDR3 VL с аминокислотной последовательностью, выбранной из группы, состоящей из Кэбат CDR3 VL (SEQ ID NO:12), Chothia CDR3 VL (SEQ ID NO:12), Contact CDR3 VL (SEQ ID NO:13) и, в качестве примера, CDR3 VL (SEQ ID NO:12). В некоторых вариантах осуществления, антитело содержит CDR1 VH с аминокислотной последовательностью, выбранной из группы, состоящей из Кэбат CDR1 VH (SEQ ID NO:15), Chothia CDR1 VH (SEQ ID NO:16), Contact CDR1 VH (SEQ ID NO:17) и, в качестве примера, CDR1 VH (SEQ ID NO:14); CDR3 VH с аминокислотной последовательностью, выбранной из группы, состоящей из Кэбат CDR3 VH (SEQ ID NO:23), Chothia CDR3 VH (SEQ ID NO:23), Contact CDR3 VH (SEQ ID NO:24) и, в качестве примера, CDR3 VH (SEQ ID NO:22); CDR2 VL с аминокислотной последовательностью, выбранной из группы, состоящей из Кэбат CDR2 VL (SEQ ID NO:10), Chothia CDR2 VL (SEQ ID NO:10), Contact CDR2 VL (SEQ ID NO:11) и, в качестве примера, CDR2 VL (SEQ ID NO:9); и CDR3 VL с аминокислотной последовательностью, выбранной из группы, состоящей из Кэбат CDR3 VL (SEQ ID NO:12), Chothia CDR3 VL (SEQ ID NO:12), Contact CDR3 VL (SEQ ID NO:13) и, в качестве примера, CDR3 VL (SEQ ID NO:12). В еще одном варианте осуществления, антитело содержит CDR2 VH с аминокислотной последовательностью, выбранной из группы, состоящей из Кэбат CDR2 VH (SEQ ID NO:19), Chothia CDR2 VH (SEQ ID NO:20), Contact CDR2 VH (SEQ ID NO:21) и, в качестве примера, CDR2 VH (SEQ ID NO:18); CDR3 VH с аминокислотной последовательностью, выбранной из группы, состоящей из Кэбат CDR3 VH (SEQ ID NO:23), Chothia CDR3 VH (SEQ ID NO:23), Contact CDR3 VH (SEQ ID NO:24) и, в качестве примера, CDR3 VH (SEQ ID NO:22); CDR1 VL с аминокислотной последовательностью, выбранной из группы, состоящей из Кэбат CDR1 VL (SEQ ID NO:7), Chothia CDR1 VL (SEQ ID NO:7), Contact CDR1 VL (SEQ ID NO:8) и, в качестве примера, CDR1 VL (SEQ ID NO:7); и CDR2 VL с аминокислотной последовательностью, выбранной из группы, состоящей из Кэбат CDR2 VL (SEQ ID NO:10), Chothia CDR2 VL (SEQ ID NO:10), Contact CDR2 VL (SEQ ID NO:11) и, в качестве примера, CDR2 VL (SEQ ID NO:9). В одном из вариантов осуществления, антитело содержит CDR2 VH с аминокислотной последовательностью, выбранной из группы, состоящей из Кэбат CDR2 VH (SEQ ID NO:19), Chothia CDR2 VH (SEQ ID NO:20), Contact CDR2 VH (SEQ ID NO:21) и, в качестве примера, CDR2 VH (SEQ ID NO:18); CDR3 VH с аминокислотной последовательностью, выбранной из группы, состоящей из Кэбат CDR3 VH (SEQ ID NO:23), Chothia CDR3 VH (SEQ ID NO:23), Contact CDR3 VH (SEQ ID NO:24) и, в качестве примера, CDR3 VH (SEQ ID NO:22); CDR1 VL с аминокислотной последовательностью, выбранной из группы, состоящей из Кэбат CDR1 VL (SEQ ID NO:7), Chothia CDR1 VL (SEQ ID NO:7), Contact CDR1 VL (SEQ ID NO:8) и, в качестве примера, CDR1 VL (SEQ ID NO:7); и CDR3 VL с аминокислотной последовательностью, выбранной из группы, состоящей из Кэбат CDR3 VL (SEQ ID NO:12), Chothia CDR3 VL (SEQ ID NO:12), Contact CDR3 VL (SEQ ID NO:13) и, в качестве примера, CDR3 VL (SEQ ID NO:12). В других вариантах осуществления антитело содержит CDR2 VH с аминокислотной последовательностью, выбранной из группы, состоящей из Кэбат CDR2 VH (SEQ ID NO:19), Chothia CDR2 VH (SEQ ID NO:20), Contact CDR2 VH (SEQ ID NO:21) и, в качестве примера, CDR2 VH (SEQ ID NO:18); CDR3 VH с аминокислотной последовательностью, выбранной из группы, состоящей из Кэбат CDR3 VH (SEQ ID NO:23), Chothia CDR3 VH (SEQ ID NO:23), Contact CDR3 VH (SEQ ID NO:24) и, в качестве примера, CDR3 VH (SEQ ID NO:22);a CDR2 VL с аминокислотной последовательностью, выбранной из группы, состоящей из Кэбат CDR2 VL (SEQ ID NO:10), Chothia CDR2 VL (SEQ ID NO:10), Contact CDR2 VL (SEQ ID NO:11) и, в качестве примера, CDR2 VL (SEQ ID NO:9); и CDR3 VL с аминокислотной последовательностью, выбранной из группы, состоящей из Кэбат CDR3 VL (SEQ ID NO:12), Chothia CDR3 VL (SEQ ID NO:12), Contact CDR3 VL (SEQ ID NO:13) и, в качестве примера, CDR3 VL (SEQ ID NO:12). В еще одном варианте осуществления, антитело содержит CDR1 VH с аминокислотной последовательностью, выбранной из группы, состоящей из Кэбат CDR1 VH (SEQ ID NO:15), Chothia CDR1 VH (SEQ ID NO:16), Contact CDR1 VH (SEQ ID NO:17) и, в качестве примера, CDR1 VH (SEQ ID NO:14); CDR2 VH с аминокислотной последовательностью, выбранной из группы, состоящей из Кэбат CDR2 VH (SEQ ID NO:19), Chothia CDR2 VH (SEQ ID NO:20), Contact CDR2 VH (SEQ ID NO:21) и, в качестве примера, CDR2 VH (SEQ ID NO:18); CDR3 VH с аминокислотной последовательностью, выбранной из группы, состоящей из Кэбат CDR3 VH (SEQ ID NO:23), Chothia CDR3 VH (SEQ ID NO:23), Contact CDR3 VH (SEQ ID NO:24) и, в качестве примера, CDR3 VH (SEQ ID NO:22); CDR1 VL с аминокислотной последовательностью, выбранной из группы, состоящей из Кэбат CDR1 VL (SEQ ID NO:7), Chothia CDR1 VL (SEQ ID NO:7), Contact CDR1 VL (SEQ ID NO:8) и, в качестве примера, CDR1 VL (SEQ ID NO:7); и CDR2 VL с аминокислотной последовательностью, выбранной из группы, состоящей из Кэбат CDR2 VL (SEQ ID NO:10), Chothia CDR2 VL (SEQ ID NO:10), Contact CDR2 VL (SEQ ID NO:11) и, в качестве примера, CDR2 VL (SEQ ID NO:9). В некоторых вариантах осуществления, антитело содержит CDR1 VH с аминокислотной последовательностью, выбранной из группы, состоящей из Кэбат CDR1 VH (SEQ ID NO:15), Chothia CDR1 VH (SEQ ID NO:16), Contact CDR1 VH (SEQ ID NO:17) и, в качестве примера, CDR1 VH (SEQ ID NO:14); CDR2 VH с аминокислотной последовательностью, выбранной из группы, состоящей из Кэбат CDR2 VH (SEQ ID NO:19), Chothia CDR2 VH (SEQ ID NO:20), Contact CDR2 VH (SEQ ID NO:21) и, в качестве примера, CDR2 VH (SEQ ID NO:18); CDR3 VH с аминокислотной последовательностью, выбранной из группы, состоящей из Кэбат CDR3 VH (SEQ ID NO:23), Chothia CDR3 VH (SEQ ID NO:23), Contact CDR3 VH (SEQ ID NO:24) и, в качестве примера, CDR3 VH (SEQ ID NO:22); CDR1 VL с аминокислотной последовательностью, выбранной из группы, состоящей из Кэбат CDR1 VL (SEQ ID NO:7), Chothia CDR1 VL (SEQ ID NO:7), Contact CDR1 VL (SEQ ID NO:8) и, в качестве примера, CDR1 VL (SEQ ID NO:7); и CDR3 VL с аминокислотной последовательностью, выбранной из группы, состоящей из Кэбат CDR3 VL (SEQ ID NO:12), Chothia CDR3 VL (SEQ ID NO:12), Contact CDR3 VL (SEQ ID NO:13) и, в качестве примера, CDR3 VL (SEQ ID NO:12). В одном из вариантов осуществления, антитело содержит CDR1 VH с аминокислотной последовательностью, выбранной из группы, состоящей из Кэбат CDR1 VH (SEQ ID NO:15), Chothia CDR1 VH (SEQ ID NO:16), Contact CDR1 VH (SEQ ID NO:17) и, в качестве примера, CDR1 VH (SEQ ID NO:14); CDR2 VH с аминокислотной последовательностью, выбранной из группы, состоящей из Кэбат CDR2 VH (SEQ ID NO:19), Chothia CDR2 VH (SEQ ID NO:20), Contact CDR2 VH (SEQ ID NO:21) и, в качестве примера, CDR2 VH (SEQ ID NO:18); CDR3 VH с аминокислотной последовательностью, выбранной из группы, состоящей из Кэбат CDR3 VH (SEQ ID NO:23), Chothia CDR3 VH (SEQ ID NO:23), Contact CDR3 VH (SEQ ID NO:24) и, в качестве примера, CDR3 VH (SEQ ID NO:22); CDR2 VL с аминокислотной последовательностью, выбранной из группы, состоящей из Кэбат CDR2 VL (SEQ ID NO:10), Chothia CDR2 VL (SEQ ID NO:10), Contact CDR2 VL (SEQ ID NO:11) и, в качестве примера, CDR2 VL (SEQ ID NO:9); и CDR3 VL с аминокислотной последовательностью, выбранной из группы, состоящей из Кэбат CDR3 VL (SEQ ID NO:12), Chothia CDR3 VL (SEQ ID NO:12), Contact CDR3 VL (SEQ ID NO:13) и, в качестве примера, CDR3 VL (SEQ ID NO:12). В еще одном варианте осуществления, антитело содержит CDR1 VH с аминокислотной последовательностью, выбранной из группы, состоящей из Кэбат CDR1 VH (SEQ ID NO:15), Chothia CDR1 VH (SEQ ID NO:16), Contact CDR1 VH (SEQ ID NO:17) и, в качестве примера, CDR1 VH (SEQ ID NO:14); CDR2 VH с аминокислотной последовательностью, выбранной из группы, состоящей из Кэбат CDR2 VH (SEQ ID NO:19), Chothia CDR2 VH (SEQ ID NO:20), Contact CDR2 VH (SEQ ID NO:21) и, в качестве примера, CDR2 VH (SEQ ID NO:18); CDR1 VL с аминокислотной последовательностью, выбранной из группы, состоящей из Кэбат CDR1 VL (SEQ ID NO:7), Chothia CDR1 VL (SEQ ID NO:7), Contact CDR1 VL (SEQ ID NO:8) и, в качестве примера, CDR1 VL (SEQ ID NO:7); CDR2 VL с аминокислотной последовательностью, выбранной из группы, состоящей из Кэбат CDR2 VL (SEQ ID NO:10), Chothia CDR2 VL (SEQ ID NO:10), Contact CDR2 VL (SEQ ID NO:11) и, в качестве примера, CDR2 VL (SEQ ID NO:9); и CDR3 VL с аминокислотной последовательностью, выбранной из группы, состоящей из Кэбат CDR3 VL (SEQ ID NO:12), Chothia CDR3 VL (SEQ ID NO:12), Contact CDR3 VL (SEQ ID NO:13) и, в качестве примера, CDR3 VL (SEQ ID NO:12). В других вариантах осуществления антитело содержит CDR1 VH с аминокислотной последовательностью, выбранной из группы, состоящей из Кэбат CDR1 VH (SEQ ID NO:15), Chothia CDR1 VH (SEQ ID NO:16), Contact CDR1 VH (SEQ ID NO:17) и, в качестве примера, CDR1 VH (SEQ ID NO:14); CDR3 VH с аминокислотной последовательностью, выбранной из группы, состоящей из Кэбат CDR3 VH (SEQ ID NO:23), Chothia CDR3 VH (SEQ ID NO:23), Contact CDR3 VH (SEQ ID NO:24) и, в качестве примера, CDR3 VH (SEQ ID NO:22); CDR1 VL с аминокислотной последовательностью, выбранной из группы, состоящей из Кэбат CDR1 VL (SEQ ID NO:7), Chothia CDR1 VL (SEQ ID NO:7), Contact CDR1 VL (SEQ ID NO:8) и, в качестве примера, CDR1 VL (SEQ ID NO:7); CDR2 VL с аминокислотной последовательностью, выбранной из группы, состоящей из Кэбат CDR2 VL (SEQ ID NO:10), Chothia CDR2 VL (SEQ ID NO:10), Contact CDR2 VL (SEQ ID NO:11) и, в качестве примера, CDR2 VL (SEQ ID NO:9); и CDR3 VL с аминокислотной последовательностью, выбранной из группы, состоящей из Кэбат CDR3 VL (SEQ ID NO:12), Chothia CDR3 VL (SEQ ID NO:12), Contact CDR3 VL (SEQ ID NO:13) и, в качестве примера, CDR3 VL (SEQ ID NO:12). В некоторых вариантах осуществления, антитело содержит CDR2 VH с аминокислотной последовательностью, выбранной из группы, состоящей из Кэбат CDR2 VH (SEQ ID NO:19), Chothia CDR2 VH (SEQ ID NO:20), Contact CDR2 VH (SEQ ID NO:21) и, в качестве примера, CDR2 VH (SEQ ID NO:18); CDR3 VH с аминокислотной последовательностью, выбранной из группы, состоящей из Кэбат CDR3 VH (SEQ ID NO:23), Chothia CDR3 VH (SEQ ID NO:23), Contact CDR3 VH (SEQ ID NO:24) и, в качестве примера, CDR3 VH (SEQ ID NO:22); CDR1 VL с аминокислотной последовательностью, выбранной из группы, состоящей из Кэбат CDR1 VL (SEQ ID NO:7), Chothia CDR1 VL (SEQ ID NO:7), Contact CDR1 VL (SEQ ID NO:8) и, в качестве примера, CDR1 VL (SEQ ID NO:7); CDR2 VL с аминокислотной последовательностью, выбранной из группы, состоящей из Кэбат CDR2 VL (SEQ ID NO:10), Chothia CDR2 VL (SEQ ID NO:10), Contact CDR2 VL (SEQ ID NO:11) и, в качестве примера, CDR2 VL (SEQ ID NO:9); и CDR3 VL с аминокислотной последовательностью, выбранной из группы, состоящей из Кэбат CDR3 VL (SEQ ID NO:12), Chothia CDR3 VL (SEQ ID NO:12), Contact CDR3 VL (SEQ ID NO:13) и, в качестве примера, CDR3 VL (SEQ ID NO:12). В еще одном варианте осуществления, антитело содержит CDR1 VH с аминокислотной последовательностью, выбранной из группы, состоящей из Кэбат CDR1 VH (SEQ ID NO:15), Chothia CDR1 VH (SEQ ID NO:16), Contact CDR1 VH (SEQ ID NO:17) и, в качестве примера, CDR1 VH (SEQ ID NO:14); CDR1 VL с аминокислотной последовательностью, выбранной из группы, состоящей из Кэбат CDR1 VL (SEQ ID NO:7), Chothia CDR1 VL (SEQ ID NO:7), Contact CDR1 VL (SEQ ID NO:8) и, в качестве примера, CDR1 VL (SEQ ID NO:7); CDR2 VL с аминокислотной последовательностью, выбранной из группы, состоящей из Кэбат CDR2 VL (SEQ ID NO:10), Chothia CDR2 VL (SEQ ID NO:10), Contact CDR2 VL (SEQ ID NO:11) и, в качестве примера, CDR2 VL (SEQ ID NO:9); и CDR3 VL с аминокислотной последовательностью, выбранной из группы, состоящей из Кэбат CDR3 VL (SEQ ID NO:12), Chothia CDR3 VL (SEQ ID NO:12), Contact CDR3 VL (SEQ ID NO:13) и, в качестве примера, CDR3 VL (SEQ ID NO:12). В одном из вариантов осуществления, антитело содержит CDR2 VH с аминокислотной последовательностью, выбранной из группы, состоящей из Кэбат CDR2 VH (SEQ ID NO:19), Chothia CDR2 VH (SEQ ID NO:20), Contact CDR2 VH (SEQ ID NO:21) и, в качестве примера, CDR2 VH (SEQ ID NO:18); CDR1 VL с аминокислотной последовательностью, выбранной из группы, состоящей из Кэбат CDR1 VL (SEQ ID NO:7), Chothia CDR1 VL (SEQ ID NO:7), Contact CDR1 VL (SEQ ID NO:8) и, в качестве примера, CDR1 VL (SEQ ID NO:7); CDR2 VL с аминокислотной последовательностью, выбранной из группы, состоящей из Кэбат CDR2 VL (SEQ ID NO:10), Chothia CDR2 VL (SEQ ID NO:10), Contact CDR2 VL (SEQ ID NO:11) и, в качестве примера, CDR2 VL (SEQ ID NO:9); и CDR3 VL с аминокислотной последовательностью, выбранной из группы, состоящей из Кэбат CDR3 VL (SEQ ID NO:12), Chothia CDR3 VL (SEQ ID NO:12), Contact CDR3 VL (SEQ ID NO:13) и, в качестве примера, CDR3 VL (SEQ ID NO:12). В других вариантах осуществления антитело содержит CDR3 VH с аминокислотной последовательностью, выбранной из группы, состоящей из Кэбат CDR3 VH (SEQ ID NO:23), Chothia CDR3 VH (SEQ ID NO:23), Contact CDR3 VH (SEQ ID NO:24) и, в качестве примера, CDR3 VH (SEQ ID NO:22); CDR1 VL с аминокислотной последовательностью, выбранной из группы, состоящей из Кэбат CDR1 VL (SEQ ID NO:7), Chothia CDR1 VL (SEQ ID NO:7), Contact CDR1 VL (SEQ ID NO:8) и, в качестве примера, CDR1 VL (SEQ ID NO:7); CDR2 VL с аминокислотной последовательностью, выбранной из группы, состоящей из Кэбат CDR2 VL (SEQ ID NO:10), Chothia CDR2 VL (SEQ ID NO:10), Contact CDR2 VL (SEQ ID NO:11) и, в качестве примера, CDR2 VL (SEQ ID NO:9); и CDR3 VL с аминокислотной последовательностью, выбранной из группы, состоящей из Кэбат CDR3 VL (SEQ ID NO:12), Chothia CDR3 VL (SEQ ID NO:12), Contact CDR3 VL (SEQ ID NO:13) и, в качестве примера, CDR3 VL (SEQ ID NO:12). В еще одном варианте осуществления, антитело содержит любую комбинацию CDR VH и CDR VL, перечисленных в Таблице 1.
[00194] Каркасные области, описанные в настоящем документе, определяются по границам системы нумерации CDR. Другими словами, если CDR определяются, например, по Кэбат, IMGT или Chothia, то каркасные области представляют собой аминокислотные остатки, окружающие CDR в вариабельной области в формате, от N-конца до C-конца: FR1-CDR1-FR2-CDR2-FR3-CDR3-FR4. Например, FR1 определяется как аминокислотные остатки от N-конца до аминокислотных остатков CDR1, как определено, например, по системе нумерации Кэбат, системе нумерации IMGT или системе нумерации Chothia, FR2 определяется как аминокислотные остатки между аминокислотными остатками CDR1 и CDR2, как определено, например, по системе нумерации Кэбат, системе нумерации IMGT или системе нумерации Chothia, FR3 определяется как аминокислотные остатки между аминокислотными остатками CDR2 и CDR3, как определено, например, по системе нумерации Кэбат, системе нумерации IMGT или системе нумерации Chothia, и FR4 определяется как аминокислотные остатки от С-конца до аминокислотных остатков CDR3, как определено, например, по системе нумерации Кэбат, системе нумерации IMGT или системе нумерации Chothia.
[00195] В некоторых вариантах осуществления выделенное антитело или его функциональный фрагмент по настоящему изобретению дополнительно содержит один, два, три и/или четыре FR легкой цепи антитела M22-321b41.1, как показано в Таблице 2.
Таблица 2. Аминокислотные последовательности FR VL и VH M22-321b41.1
PVTLGTSASISC
(SEQ ID NO:25)
QLLIY
(SEQ ID NO:26)
DFTLRISRVEAED
VGVYYC
(SEQ ID NO:27)
(SEQ ID NO:28)
LARPGASVKLS
CKASGYTFT
(SEQ ID NO:29)
EWIG
(SEQ ID NO:30)
(SEQ ID NO:31)
(SEQ ID NO:32)
[00196] В некоторых вариантах осуществления выделенное антитело или его функциональный фрагмент по настоящему изобретению дополнительно содержит один, два, три и/или четыре FR тяжелой цепи антитела M22-321b41.1, как показано в Таблице 2. В некоторых вариантах осуществления один или несколько FR тяжелой цепи антитела получен из антитела M22-321b41.1.
[00197] В некоторых вариантах осуществления выделенное антитело или его функциональный фрагмент по настоящему изобретению дополнительно содержит один, два, три и/или четыре FR легкой цепи антитела M22-321b41.1, как показано в Таблице 2. В некоторых вариантах осуществления FR легкой цепи антитела получен из антитела M22-321b41.1.
[00198] В определенных вариантах осуществления антитело или его фрагмент по настоящему изобретению, содержит область VH, которая содержит: (1) FR1 VH с аминокислотой последовательностью SEQ ID NO: 29; (2) FR2 VH c аминокислотной последовательностью SEQ ID NO: 30; (3) FR3 VH c аминокислотной последовательностью SEQ ID NO: 31; и/или (4) FR4 VH с аминокислотной последовательностью SEQ ID NO: 32. В конкретных вариантах осуществления антитело содержит область VH, содержащую все четыре вышеуказанные FR1 VH, FR2 VH, FR3 VH и FR4 VH.
[00199] Таким образом, в одном из вариантов осуществления гуманизированное антитело содержит область VH, которая содержит FR1 VH с аминокислотной последовательностью SEQ ID NO:29. В некоторых вариантах осуществления гуманизированное антитело содержит область VH, которая содержат FR2 VH с аминокислотной последовательностью SEQ ID NO:30. В одном из вариантов осуществления гуманизированное антитело содержит область VH, которая содержаит FR3 VH с аминокислотной последовательностью SEQ ID NO:31. В других вариантах осуществления гуманизированное антитело содержит область VH, которая содержит FR4 VH с аминокислотной последовательностью SEQ ID NO:32.
[00200] В некоторых вариантах осуществления область VL содержит: (1) FR1 VL с аминокислотной последовательностью SEQ ID NO:25; (2) FR2 VL с аминокислотной последовательностью SEQ ID NO:26; (3) FR3 VL с аминокислотной последовательностью SEQ ID NO:27; и/или (4) FR4 VL с аминокислотной последовательностью SEQ ID NO:28.
[00201] Таким образом, в некоторых вариантах осуществления гуманизированное антитело содержит область VL, которая включает FR1 VL с аминокислотной последовательностью SEQ ID NO:25. В некоторых вариантах осуществления гуманизированное антитело содержит область VL, которая включает FR2 VL с аминокислотной последовательностью SEQ ID NO:26. В одном из вариантов осуществления гуманизированное антитело содержит область VL, которая включает FR3 VL с аминокислотной последовательностью SEQ ID NO:27. В других вариантах осуществления гуманизированное антитело содержит область VL, которая включает FR4 VL с аминокислотной последовательностью SEQ ID NO:28.
[00202] В некоторых вариантах осуществления антитело или его фрагмент содержит область VH и область VL, где область VH содержит: (1) FR1 VH с аминокислотной последовательностью SEQ ID NO:29; (2) FR2 VH с аминокислотной последовательностью SEQ ID NO:30; (3) FR3 VH с аминокислотной последовательностью SEQ ID NO:31; и/или (4) FR4 VH с аминокислотной последовательностью SEQ ID NO:32; и где область VL содержит: (1) FR1 VL с аминокислотной последовательностью SEQ ID NO:25; (2) FR2 VL с аминокислотной последовательностью SEQ ID NO:26; (3) FR3 VL с аминокислотной последовательностью SEQ ID NO:27; и/или (4) FR4 VL с аминокислотной последовательностью SEQ ID NO:28. В некоторых вариантах осуществления антитело содержит область VH, содержащую все четыре вышеуказанные FR1 VH, FR2 VH, FR3 VH и FR4 VH. В других вариантах осуществления антитело содержит область VL, содержащую все четыре вышеуказанные VL FR1, VL FR2, VL FR3 и VL FR4. В других вариантах осуществления антитело содержит область VH, содержащую все четыре вышеуказанные FR1 VH, FR2 VH, FR3 VH и FR4 VH и область VL, содержащую все четыре вышеуказанные VL FR1, VL FR2, VL FR3 и VL FR4.
[00203] Также в настоящем описании раскрыты антитела, содержащие один или более (например, один, два, три или четыре) FR VH и один или более (например, один, два, три или четыре) FR VL, перечисленные в Таблице 2. В частности, в настоящем описании раскрыто антитело, содержащее FR1 VH (SEQ ID NO:29) и FR1 VL (SEQ ID NO:25). В одном из вариантов осуществления антитело содержит FR1 VH (SEQ ID NO:29) и FR2 VL (SEQ ID NO:26). В некоторых вариантах осуществления антитело содержит FR1 VH (SEQ ID NO:29) и FR3 VL (SEQ ID NO:27). В еще одном варианте осуществления антитело содержит FR1 VH (SEQ ID NO:29) и FR4 VL (SEQ ID NO:28). В других вариантах осуществления антитело содержит FR2 VH (SEQ ID NO:30) и FR1 VL (SEQ ID NO:25). В одном из вариантов осуществления антитело содержит FR2 VH (SEQ ID NO:30) и FR2 VL (SEQ ID NO:26). В некоторых вариантах осуществления антитело содержит FR2 VH (SEQ ID NO:30) и FR3 VL (SEQ ID NO:27). В еще одном варианте осуществления антитело содержит FR2 VH (SEQ ID NO:30) и FR4 VL (SEQ ID NO:28). В одном из вариантов осуществления антитело содержит FR3 VH (SEQ ID NO:31) и FR1 VL (SEQ ID NO:25). В других вариантах осуществления антитело содержит FR3 VH (SEQ ID NO:31) и FR2 VL (SEQ ID NO:26). В еще одном варианте осуществления антитело содержит FR3 VH (SEQ ID NO:31) и FR3 VL (SEQ ID NO:27). В некоторых вариантах осуществления антитело содержит FR3 VH (SEQ ID NO:31) и FR4 VL (SEQ ID NO:28). В одном из вариантов осуществления антитело содержит FR4 VH (SEQ ID NO:32) и FR1 VL (SEQ ID NO:25). В еще одном варианте осуществления антитело содержит FR4 VH (SEQ ID NO:32) и FR2 VL (SEQ ID NO:26). В одном из вариантов осуществления антитело содержит FR4 VH (SEQ ID NO:32) и FR3 VL (SEQ ID NO:27). В некоторых вариантах осуществления антитело содержит FR4 VH (SEQ ID NO:32) и FR4 VL (SEQ ID NO:28). В еще одном варианте осуществления антитело содержит FR1 VH (SEQ ID NO:29), FR2 VH (SEQ ID NO:30) и FR1 VL (SEQ ID NO:25). В других вариантах осуществления антитело содержит FR1 VH (SEQ ID NO:29), FR2 VH (SEQ ID NO:30) и FR2 VL (SEQ ID NO:26). В одном из вариантов осуществления антитело содержит FR1 VH (SEQ ID NO:29), FR2 VH (SEQ ID NO:30) и FR3 VL (SEQ ID NO:27). В еще одном варианте осуществления антитело содержит FR1 VH (SEQ ID NO:29), FR2 VH (SEQ ID NO:30) и FR4 VL (SEQ ID NO:28). В некоторых вариантах осуществления антитело содержит FR2 VH (SEQ ID NO:30), FR3 VH (SEQ ID NO:31) и FR1 VL (SEQ ID NO:25). В одном из вариантов осуществления антитело содержит FR2 VH (SEQ ID NO:30), FR3 VH (SEQ ID NO:31) и FR2 VL (SEQ ID NO:26). В еще одном варианте осуществления антитело содержит FR2 VH (SEQ ID NO:30), FR3 VH (SEQ ID NO:31) и FR3 VL (SEQ ID NO:27). В других вариантах осуществления антитело содержит FR2 VH (SEQ ID NO:30), FR3 VH (SEQ ID NO:31) и FR4 VL (SEQ ID NO:28). В некоторых вариантах осуществления антитело содержит FR1 VH (SEQ ID NO:29), FR1 VL (SEQ ID NO:25) и FR2 VL (SEQ ID NO:26). В еще одном варианте осуществления антитело содержит FR1 VH (SEQ ID NO:29), FR1 VL (SEQ ID NO:25) и FR3 VL (SEQ ID NO:27). В одном из вариантов осуществления антитело содержит FR1 VH (SEQ ID NO:29), FR1 VL (SEQ ID NO:25) и FR4 VL (SEQ ID NO:28). В одном из вариантов осуществления антитело содержит FR1 VH (SEQ ID NO:29), FR2 VL (SEQ ID NO:26) и FR3 VL (SEQ ID NO:27). В еще одном варианте осуществления антитело содержит FR1 VH (SEQ ID NO:29), FR2 VL (SEQ ID NO:26) и FR4 VL (SEQ ID NO:28). В некоторых вариантах осуществления антитело содержит FR1 VH (SEQ ID NO:29), FR3 VL (SEQ ID NO:27) и FR4 VL (SEQ ID NO:28). В других вариантах осуществления антитело содержит FR2 VH (SEQ ID NO:30), FR1 VL (SEQ ID NO:25) и FR2 VL (SEQ ID NO:26). В еще одном варианте осуществления антитело содержит FR2 VH (SEQ ID NO:30), FR1 VL (SEQ ID NO:25) и FR3 VL (SEQ ID NO:27). В одном из вариантов осуществления антитело содержит FR2 VH (SEQ ID NO:30), FR1 VL (SEQ ID NO:25) и FR4 VL (SEQ ID NO:28). В некоторых вариантах осуществления антитело содержит FR2 VH (SEQ ID NO:30), FR2 VL (SEQ ID NO:26) и FR3 VL (SEQ ID NO:27). В еще одном варианте осуществления антитело содержит FR2 VH (SEQ ID NO:30), FR2 VL (SEQ ID NO:26) и FR4 VL (SEQ ID NO:28). В одном из вариантов осуществления антитело содержит FR2 VH (SEQ ID NO:30), FR3 VL (SEQ ID NO:27) и FR4 VL (SEQ ID NO:28). В еще одном варианте осуществления антитело содержит FR3 VH (SEQ ID NO:31), FR1 VL (SEQ ID NO:25) и FR2 VL (SEQ ID NO:26). В других вариантах осуществления антитело содержит FR3 VH (SEQ ID NO:31), FR1 VL (SEQ ID NO:25) и FR3 VL (SEQ ID NO:27). В некоторых вариантах осуществления антитело содержит FR3 VH (SEQ ID NO:31), FR1 VL (SEQ ID NO:25) и FR4 VL (SEQ ID NO:28). В еще одном варианте осуществления антитело содержит FR3 VH (SEQ ID NO:31), FR2 VL (SEQ ID NO:26) и FR3 VL (SEQ ID NO:27). В одном из вариантов осуществления антитело содержит FR3 VH (SEQ ID NO:31), FR2 VL (SEQ ID NO:26) и FR4 VL (SEQ ID NO:28). В одном из вариантов осуществления антитело содержит FR3 VH (SEQ ID NO:31), FR3 VL (SEQ ID NO:27) и FR4 VL (SEQ ID NO:28). В еще одном варианте осуществления антитело содержит FR4 VH (SEQ ID NO:32), FR1 VL (SEQ ID NO:25) и FR2 VL (SEQ ID NO:26). В некоторых вариантах осуществления антитело содержит FR4 VH (SEQ ID NO:32), FR1 VL (SEQ ID NO:25) и FR3 VL (SEQ ID NO:27). В других вариантах осуществления антитело содержит FR4 VH (SEQ ID NO:32), FR1 VL (SEQ ID NO:25) и FR4 VL (SEQ ID NO:28). В еще одном варианте осуществления антитело содержит FR4 VH (SEQ ID NO:32), FR2 VL (SEQ ID NO:26) и FR3 VL (SEQ ID NO:27). В одном из вариантов осуществления антитело содержит FR4 VH (SEQ ID NO:32), FR2 VL (SEQ ID NO:26) и FR4 VL (SEQ ID NO:28). В некоторых вариантах осуществления антитело содержит FR4 VH (SEQ ID NO:32), FR3 VL (SEQ ID NO:27) и FR4 VL (SEQ ID NO:28). В еще одном варианте осуществления антитело содержит FR1 VH (SEQ ID NO:29), FR2 VH (SEQ ID NO:30), FR3 VH (SEQ ID NO:31) и FR1 VL (SEQ ID NO:25). В одном из вариантов осуществления антитело содержит FR1 VH (SEQ ID NO:29), FR2 VH (SEQ ID NO:30), FR3 VH (SEQ ID NO:31) и FR2 VL (SEQ ID NO:26). В других вариантах осуществления антитело содержит FR1 VH (SEQ ID NO:29), FR2 VH (SEQ ID NO:30), FR3 VH (SEQ ID NO:31) и FR3 VL (SEQ ID NO:27). В еще одном варианте осуществления антитело содержит FR1 VH (SEQ ID NO:29), FR2 VH (SEQ ID NO:30), FR3 VH (SEQ ID NO:31) и FR4 VL (SEQ ID NO:28). В некоторых вариантах осуществления антитело содержит FR1 VH (SEQ ID NO:29), FR2 VH (SEQ ID NO:30), FR4 VH (SEQ ID NO:32) и FR1 VL (SEQ ID NO:25). В одном из вариантов осуществления антитело содержит FR1 VH (SEQ ID NO:29), FR2 VH (SEQ ID NO:30), FR4 VH (SEQ ID NO:32) и FR2 VL (SEQ ID NO:26). В еще одном варианте осуществления антитело содержит FR1 VH (SEQ ID NO:29), FR2 VH (SEQ ID NO:30), FR4 VH (SEQ ID NO:32) и FR3 VL (SEQ ID NO:27). В одном из вариантов осуществления антитело содержит FR1 VH (SEQ ID NO:29), FR2 VH (SEQ ID NO:30), FR4 VH (SEQ ID NO:32) и FR4 VL (SEQ ID NO:28). В некоторых вариантах осуществления антитело содержит FR1 VH (SEQ ID NO:29), FR3 VH (SEQ ID NO:31), FR4 VH (SEQ ID NO:32) и FR1 VL (SEQ ID NO:25). В еще одном варианте осуществления антитело содержит FR1 VH (SEQ ID NO:29), FR3 VH (SEQ ID NO:31), FR4 VH (SEQ ID NO:32) и FR2 VL (SEQ ID NO:26). В других вариантах осуществления антитело содержит FR1 VH (SEQ ID NO:29), FR3 VH (SEQ ID NO:31), FR4 VH (SEQ ID NO:32) и FR3 VL (SEQ ID NO:27). В одном из вариантов осуществления антитело содержит FR1 VH (SEQ ID NO:29), FR3 VH (SEQ ID NO:31), FR4 VH (SEQ ID NO:32) и FR4 VL (SEQ ID NO:28). В еще одном варианте осуществления антитело содержит FR2 VH (SEQ ID NO:30), FR3 VH (SEQ ID NO:31), FR4 VH (SEQ ID NO:32) и FR1 VL (SEQ ID NO:25). В некоторых вариантах осуществления антитело содержит FR2 VH (SEQ ID NO:30), FR3 VH (SEQ ID NO:31), FR4 VH (SEQ ID NO:32) и FR2 VL (SEQ ID NO:26). В одном из вариантов осуществления антитело содержит FR2 VH (SEQ ID NO:30), FR3 VH (SEQ ID NO:31), FR4 VH (SEQ ID NO:32) и FR3 VL (SEQ ID NO:27). В еще одном варианте осуществления антитело содержит FR2 VH (SEQ ID NO:30), FR3 VH (SEQ ID NO:31), FR4 VH (SEQ ID NO:32) и FR4 VL (SEQ ID NO:28). В других вариантах осуществления антитело содержит FR1 VH (SEQ ID NO:29), FR2 VH (SEQ ID NO:30), FR1 VL (SEQ ID NO:25) и FR2 VL (SEQ ID NO:26). В некоторых вариантах осуществления антитело содержит FR1 VH (SEQ ID NO:29), FR2 VH (SEQ ID NO:30), FR1 VL (SEQ ID NO:25) и FR3 VL (SEQ ID NO:27). В еще одном варианте осуществления антитело содержит FR1 VH (SEQ ID NO:29), FR2 VH (SEQ ID NO:30), FR1 VL (SEQ ID NO:25) и FR4 VL (SEQ ID NO:28). В одном из вариантов осуществления антитело содержит FR1 VH (SEQ ID NO:29), FR2 VH (SEQ ID NO:30), FR2 VL (SEQ ID NO:26) и FR3 VL (SEQ ID NO: 27). В одном из вариантов осуществления антитело содержит FR1 VH (SEQ ID NO:29), FR2 VH (SEQ ID NO:30), FR2 VL (SEQ ID NO:26) и FR4 VL (SEQ ID NO:28). В еще одном варианте осуществления антитело содержит FR1 VH (SEQ ID NO:29), FR2 VH (SEQ ID NO:30), FR3 VL (SEQ ID NO:27) и FR4 VL (SEQ ID NO:28). В некоторых вариантах осуществления антитело содержит FR1 VH (SEQ ID NO:29), FR3 VH (SEQ ID NO:31), FR1 VL (SEQ ID NO:25) и FR2 VL (SEQ ID NO:26). В других вариантах осуществления антитело содержит FR1 VH (SEQ ID NO:29), FR3 VH (SEQ ID NO:31), FR1 VL (SEQ ID NO:25) и FR3 VL (SEQ ID NO:27). В еще одном варианте осуществления антитело содержит FR1 VH (SEQ ID NO:29), FR3 VH (SEQ ID NO:31), FR1 VL (SEQ ID NO:25) и FR4 VL (SEQ ID NO:28). В одном из вариантов осуществления антитело содержит FR1 VH (SEQ ID NO:29), FR3 VH (SEQ ID NO:31), FR2 VL (SEQ ID NO:26) и FR3 VL (SEQ ID NO:27). В некоторых вариантах осуществления антитело содержит FR1 VH (SEQ ID NO:29), FR3 VH (SEQ ID NO:31), FR2 VL (SEQ ID NO:26) и FR4 VL (SEQ ID NO:28). В еще одном варианте осуществления антитело содержит FR1 VH (SEQ ID NO:29), FR3 VH (SEQ ID NO:31), FR3 VL (SEQ ID NO:27) и FR4 VL (SEQ ID NO:28). В одном из вариантов осуществления антитело содержит FR1 VH (SEQ ID NO:29), FR4 VH (SEQ ID NO:32), FR1 VL (SEQ ID NO:25) и FR2 VL (SEQ ID NO:26). В других вариантах осуществления антитело содержит FR1 VH (SEQ ID NO:29), FR4 VH (SEQ ID NO:32), FR1 VL (SEQ ID NO:25) и FR3 VL (SEQ ID NO:27). В еще одном варианте осуществления антитело содержит FR1 VH (SEQ ID NO:29), FR4 VH (SEQ ID NO:32), FR1 VL (SEQ ID NO:25) и FR4 VL (SEQ ID NO:28). В некоторых вариантах осуществления антитело содержит FR1 VH (SEQ ID NO:29), FR4 VH (SEQ ID NO:32), FR2 VL (SEQ ID NO:26) и FR3 VL (SEQ ID NO:27). В одном из вариантов осуществления антитело содержит FR1 VH (SEQ ID NO:29), FR4 VH (SEQ ID NO:32), FR2 VL (SEQ ID NO:26) и FR4 VL (SEQ ID NO:28). В еще одном варианте осуществления антитело содержит FR1 VH (SEQ ID NO:29), FR4 VH (SEQ ID NO:32), FR3 VL (SEQ ID NO:27) и FR4 VL (SEQ ID NO:28). В одном из вариантов осуществления антитело содержит FR2 VH (SEQ ID NO:30), FR3 VH (SEQ ID NO:31), FR1 VL (SEQ ID NO:25) и FR2 VL (SEQ ID NO:26). В некоторых вариантах осуществления антитело содержит FR2 VH (SEQ ID NO:30), FR3 VH (SEQ ID NO:31), FR1 VL (SEQ ID NO:25) и FR3 VL (SEQ ID NO:27). В еще одном варианте осуществления антитело содержит FR2 VH (SEQ ID NO:30), FR3 VH (SEQ ID NO:31), FR1 VL (SEQ ID NO:25) и FR4 VL (SEQ ID NO:28). В других вариантах осуществления антитело содержит FR2 VH (SEQ ID NO:30), FR3 VH (SEQ ID NO:31), FR2 VL (SEQ ID NO:26) и FR3 VL (SEQ ID NO:27). В одном из вариантов осуществления антитело содержит FR2 VH (SEQ ID NO:30), FR3 VH (SEQ ID NO:31), FR2 VL (SEQ ID NO:26) и FR4 VL (SEQ ID NO:28). В еще одном варианте осуществления антитело содержит FR2 VH (SEQ ID NO:30), FR3 VH (SEQ ID NO:31), FR3 VL (SEQ ID NO:27) и FR4 VL (SEQ ID NO:28). В некоторых вариантах осуществления антитело содержит FR2 VH (SEQ ID NO:30), FR4 VH (SEQ ID NO:32), FR1 VL (SEQ ID NO:25) и FR2 VL (SEQ ID NO:26). В одном из вариантов осуществления антитело содержит FR2 VH (SEQ ID NO:30), FR4 VH (SEQ ID NO:32), FR1 VL (SEQ ID NO:25) и FR3 VL (SEQ ID NO:27). В еще одном варианте осуществления антитело содержит FR2 VH (SEQ ID NO:30), FR4 VH (SEQ ID NO:32), FR1 VL (SEQ ID NO:25) и FR4 VL (SEQ ID NO:28). В других вариантах осуществления антитело содержит FR2 VH (SEQ ID NO:30), FR4 VH (SEQ ID NO:32), FR2 VL (SEQ ID NO:26) и FR3 VL (SEQ ID NO:27). В некоторых вариантах осуществления антитело содержит FR2 VH (SEQ ID NO:30), FR4 VH (SEQ ID NO:32), FR2 VL (SEQ ID NO:26) и FR4 VL (SEQ ID NO:28). В еще одном варианте осуществления антитело содержит FR2 VH (SEQ ID NO:30), FR4 VH (SEQ ID NO:32), FR3 VL (SEQ ID NO:27) и FR4 VL (SEQ ID NO:28). В одном из вариантов осуществления антитело содержит FR3 VH (SEQ ID NO:31), FR4 VH (SEQ ID NO:32), FR1 VL (SEQ ID NO:25) и FR2 VL (SEQ ID NO:26). В одном из вариантов осуществления антитело содержит FR3 VH (SEQ ID NO:31), FR4 VH (SEQ ID NO:32), FR1 VL (SEQ ID NO:25) и FR3 VL (SEQ ID NO:27). В еще одном варианте осуществления антитело содержит FR3 VH (SEQ ID NO:31), FR4 VH (SEQ ID NO:32), FR1 VL (SEQ ID NO:25) и FR4 VL (SEQ ID NO:28). В некоторых вариантах осуществления антитело содержит FR3 VH (SEQ ID NO:31), FR4 VH (SEQ ID NO:32), FR2 VL (SEQ ID NO:26) и FR3 VL (SEQ ID NO:27). В других вариантах осуществления антитело содержит FR3 VH (SEQ ID NO:31), FR4 VH (SEQ ID NO:32), FR2 VL (SEQ ID NO:26) и FR4 VL (SEQ ID NO:28). В еще одном варианте осуществления антитело содержит FR3 VH (SEQ ID NO:31), FR4 VH (SEQ ID NO:32), FR3 VL (SEQ ID NO:27) и FR4 VL (SEQ ID NO:28). В одном из вариантов осуществления антитело содержит FR1 VH (SEQ ID NO:29), FR1 VL (SEQ ID NO:25), FR2 VL (SEQ ID NO:26) и FR3 VL (SEQ ID NO:27). В некоторых вариантах осуществления антитело содержит FR1 VH (SEQ ID NO:29), FR1 VL (SEQ ID NO:25), FR2 VL (SEQ ID NO:26) и FR4 VL (SEQ ID NO:28). В еще одном варианте осуществления антитело содержит FR1 VH (SEQ ID NO:29), FR1 VL (SEQ ID NO:25), FR3 VL (SEQ ID NO:27) и FR4 VL (SEQ ID NO:28). В одном из вариантов осуществления антитело содержит FR1 VH (SEQ ID NO:29), FR2 VL (SEQ ID NO:26), FR3 VL (SEQ ID NO:27) и FR4 VL (SEQ ID NO:28). В других вариантах осуществления антитело содержит FR2 VH (SEQ ID NO:30), FR1 VL (SEQ ID NO:25), FR2 VL (SEQ ID NO:26) и FR3 VL (SEQ ID NO:27). В еще одном варианте осуществления антитело содержит FR2 VH (SEQ ID NO:30), FR1 VL (SEQ ID NO:25), FR2 VL (SEQ ID NO:26) и FR4 VL (SEQ ID NO:28). В некоторых вариантах осуществления антитело содержит FR2 VH (SEQ ID NO:30), FR1 VL (SEQ ID NO:25), FR3 VL (SEQ ID NO:27) и FR4 VL (SEQ ID NO:28). В одном из вариантов осуществления антитело содержит FR2 VH (SEQ ID NO:30), FR2 VL (SEQ ID NO:26), FR3 VL (SEQ ID NO:27) и FR4 VL (SEQ ID NO:28). В еще одном варианте осуществления антитело содержит FR3 VH (SEQ ID NO:31), FR1 VL (SEQ ID NO:25), FR2 VL (SEQ ID NO:26) и FR3 VL (SEQ ID NO:27). В одном из вариантов осуществления антитело содержит FR3 VH (SEQ ID NO:31), FR1 VL (SEQ ID NO:25), FR2 VL (SEQ ID NO:26) и FR4 VL (SEQ ID NO:28). В некоторых вариантах осуществления антитело содержит FR3 VH (SEQ ID NO:31), FR1 VL (SEQ ID NO:25), FR3 VL (SEQ ID NO:27) и FR4 VL (SEQ ID NO:28). В еще одном варианте осуществления антитело содержит FR3 VH (SEQ ID NO:31), FR2 VL (SEQ ID NO:26), FR3 VL (SEQ ID NO:27) и FR4 VL (SEQ ID NO:28). В других вариантах осуществления антитело содержит FR4 VH (SEQ ID NO:32), FR1 VL (SEQ ID NO:25), FR2 VL (SEQ ID NO:26) и FR3 VL (SEQ ID NO:27). В одном из вариантов осуществления антитело содержит FR4 VH (SEQ ID NO:32), FR1 VL (SEQ ID NO:25), FR2 VL (SEQ ID NO:26) и FR4 VL (SEQ ID NO:28). В еще одном варианте осуществления антитело содержит FR4 VH (SEQ ID NO:32), FR1 VL (SEQ ID NO:25), FR3 VL (SEQ ID NO:27) и FR4 VL (SEQ ID NO:28). В некоторых вариантах осуществления антитело содержит FR4 VH (SEQ ID NO:32), FR2 VL (SEQ ID NO:26), FR3 VL (SEQ ID NO:27) и FR4 VL (SEQ ID NO:28). В одном из вариантов осуществления антитело содержит FR1 VH (SEQ ID NO:29), FR2 VH (SEQ ID NO:30), FR3 VH (SEQ ID NO:31), FR4 VH (SEQ ID NO:32) и FR1 VL (SEQ ID NO:25). В еще одном варианте осуществления антитело содержит FR1 VH (SEQ ID NO:29), FR2 VH (SEQ ID NO:30), FR3 VH (SEQ ID NO:31), FR4 VH (SEQ ID NO:32) и FR2 VL (SEQ ID NO:26). В других вариантах осуществления антитело содержит FR1 VH (SEQ ID NO:29), FR2 VH (SEQ ID NO:30), FR3 VH (SEQ ID NO:31), FR4 VH (SEQ ID NO:32) и FR3 VL (SEQ ID NO:27). В некоторых вариантах осуществления антитело содержит FR1 VH (SEQ ID NO:29), FR2 VH (SEQ ID NO:30), FR3 VH (SEQ ID NO:31), FR4 VH (SEQ ID NO:32) и FR4 VL (SEQ ID NO:28). В еще одном варианте осуществления антитело содержит FR1 VH (SEQ ID NO:29), FR2 VH (SEQ ID NO:30), FR3 VH (SEQ ID NO:31), FR1 VL (SEQ ID NO:25) и FR2 VL (SEQ ID NO:26). В одном из вариантов осуществления антитело содержит FR1 VH (SEQ ID NO:29), FR2 VH (SEQ ID NO:30), FR3 VH (SEQ ID NO:31), FR1 VL (SEQ ID NO:25) и FR3 VL (SEQ ID NO:27). В одном из вариантов осуществления антитело содержит FR1 VH (SEQ ID NO:29), FR2 VH (SEQ ID NO:30), FR3 VH (SEQ ID NO:31), FR1 VL (SEQ ID NO:25) и FR4 VL (SEQ ID NO:28). В еще одном варианте осуществления антитело содержит FR1 VH (SEQ ID NO:29), FR2 VH (SEQ ID NO:30), FR3 VH (SEQ ID NO:31), FR2 VL (SEQ ID NO:26) и FR3 VL (SEQ ID NO:27). В некоторых вариантах осуществления антитело содержит FR1 VH (SEQ ID NO:29), FR2 VH (SEQ ID NO:30), FR3 VH (SEQ ID NO:31), FR2 VL (SEQ ID NO:26) и FR4 VL (SEQ ID NO:28). В других вариантах осуществления антитело содержит FR1 VH (SEQ ID NO:29), FR2 VH (SEQ ID NO:30), FR3 VH (SEQ ID NO:31), FR3 VL (SEQ ID NO:27) и FR4 VL (SEQ ID NO:28). В еще одном варианте осуществления антитело содержит FR1 VH (SEQ ID NO:29), FR2 VH (SEQ ID NO:30), FR4 VH (SEQ ID NO:32), FR1 VL (SEQ ID NO:25) и FR2 VL (SEQ ID NO:26). В одном из вариантов осуществления антитело содержит FR1 VH (SEQ ID NO:29), FR2 VH (SEQ ID NO:30), FR4 VH (SEQ ID NO:32), FR1 VL (SEQ ID NO:25) и FR3 VL (SEQ ID NO:27). В некоторых вариантах осуществления антитело содержит FR1 VH (SEQ ID NO:29), FR2 VH (SEQ ID NO:30), FR4 VH (SEQ ID NO:32), FR1 VL (SEQ ID NO:25) и FR4 VL (SEQ ID NO:28). В еще одном варианте осуществления антитело содержит FR1 VH (SEQ ID NO:29), FR2 VH (SEQ ID NO:30), FR4 VH (SEQ ID NO:32), FR2 VL (SEQ ID NO:26) и FR3 VL (SEQ ID NO:27). В одном из вариантов осуществления антитело содержит FR1 VH (SEQ ID NO:29), FR2 VH (SEQ ID NO:30), FR4 VH (SEQ ID NO:32), FR2 VL (SEQ ID NO:26) и FR4 VL (SEQ ID NO:28). В других вариантах осуществления антитело содержит FR1 VH (SEQ ID NO:29), FR2 VH (SEQ ID NO:30), FR4 VH (SEQ ID NO:32), FR3 VL (SEQ ID NO:27) и FR4 VL (SEQ ID NO:28). В еще одном варианте осуществления антитело содержит FR1 VH (SEQ ID NO:29), FR3 VH (SEQ ID NO:31), FR4 VH (SEQ ID NO:32), FR1 VL (SEQ ID NO:25) и FR2 VL (SEQ ID NO:26). В некоторых вариантах осуществления антитело содержит FR1 VH (SEQ ID NO:29), FR3 VH (SEQ ID NO:31), FR4 VH (SEQ ID NO:32), FR1 VL (SEQ ID NO:25) и FR3 VL (SEQ ID NO:27). В одном из вариантов осуществления антитело содержит FR1 VH (SEQ ID NO:29), FR3 VH (SEQ ID NO:31), FR4 VH (SEQ ID NO:32), FR1 VL (SEQ ID NO:25) и FR4 VL (SEQ ID NO:28). В еще одном варианте осуществления антитело содержит FR1 VH (SEQ ID NO:29), FR3 VH (SEQ ID NO:31), FR4 VH (SEQ ID NO:32), FR2 VL (SEQ ID NO:26) и FR3 VL (SEQ ID NO:27). В одном из вариантов осуществления антитело содержит FR1 VH (SEQ ID NO:29), FR3 VH (SEQ ID NO:31), FR4 VH (SEQ ID NO:32), FR2 VL (SEQ ID NO:26) и FR4 VL (SEQ ID NO:28). В некоторых вариантах осуществления антитело содержит FR1 VH (SEQ ID NO:29), FR3 VH (SEQ ID NO:31), FR4 VH (SEQ ID NO:32), FR3 VL (SEQ ID NO:27) и FR4 VL (SEQ ID NO:28). В еще одном варианте осуществления антитело содержит FR2 VH (SEQ ID NO:30), FR3 VH (SEQ ID NO:31), FR4 VH (SEQ ID NO:32), FR1 VL (SEQ ID NO:25) и FR2 VL (SEQ ID NO:26). В других вариантах осуществления антитело содержит FR2 VH (SEQ ID NO:30), FR3 VH (SEQ ID NO:31), FR4 VH (SEQ ID NO:32), FR1 VL (SEQ ID NO:25) и FR3 VL (SEQ ID NO:27). В одном из вариантов осуществления антитело содержит FR2 VH (SEQ ID NO:30), FR3 VH (SEQ ID NO:31), FR4 VH (SEQ ID NO:32), FR1 VL (SEQ ID NO:25) и FR4 VL (SEQ ID NO:28). В еще одном варианте осуществления антитело содержит FR2 VH (SEQ ID NO:30), FR3 VH (SEQ ID NO:31), FR4 VH (SEQ ID NO:32), FR2 VL (SEQ ID NO:26) и FR3 VL (SEQ ID NO:27). В некоторых вариантах осуществления антитело содержит FR2 VH (SEQ ID NO:30), FR3 VH (SEQ ID NO:31), FR4 VH (SEQ ID NO:32), FR2 VL (SEQ ID NO:26) и FR4 VL (SEQ ID NO:28). В одном из вариантов осуществления антитело содержит FR2 VH (SEQ ID NO:30), FR3 VH (SEQ ID NO:31), FR4 VH (SEQ ID NO:32), FR3 VL (SEQ ID NO:27) и FR4 VL (SEQ ID NO:28). В еще одном варианте осуществления антитело содержит FR1 VH (SEQ ID NO:29), FR2 VH (SEQ ID NO:30), FR1 VL (SEQ ID NO:25), FR2 VL (SEQ ID NO:26) и FR3 VL (SEQ ID NO:27). В других вариантах осуществления антитело содержит FR1 VH (SEQ ID NO:29), FR2 VH (SEQ ID NO:30), FR1 VL (SEQ ID NO:25), FR2 VL (SEQ ID NO:26) и FR4 VL (SEQ ID NO:28). В некоторых вариантах осуществления антитело содержит FR1 VH (SEQ ID NO:29), FR2 VH (SEQ ID NO:30), FR1 VL (SEQ ID NO:25), FR3 VL (SEQ ID NO:27) и FR4 VL (SEQ ID NO:28). В еще одном варианте осуществления антитело содержит FR1 VH (SEQ ID NO:29), FR2 VH (SEQ ID NO:30), FR2 VL (SEQ ID NO:26), FR3 VL (SEQ ID NO:27) и FR4 VL (SEQ ID NO:28). В одном из вариантов осуществления антитело содержит FR1 VH (SEQ ID NO:29), FR3 VH (SEQ ID NO:31), FR1 VL (SEQ ID NO:25), FR2 VL (SEQ ID NO:26) и FR3 VL (SEQ ID NO:27). В одном из вариантов осуществления антитело содержит FR1 VH (SEQ ID NO:29), FR3 VH (SEQ ID NO:31), FR1 VL (SEQ ID NO:25), FR2 VL (SEQ ID NO:26) и FR4 VL (SEQ ID NO:28). В еще одном варианте осуществления антитело содержит FR1 VH (SEQ ID NO:29), FR3 VH (SEQ ID NO:31), FR1 VL (SEQ ID NO:25), FR3 VL (SEQ ID NO:27) и FR4 VL (SEQ ID NO:28). В некоторых вариантах осуществления антитело содержит FR1 VH (SEQ ID NO:29), FR3 VH (SEQ ID NO:31), FR2 VL (SEQ ID NO:26), FR3 VL (SEQ ID NO:27) и FR4 VL (SEQ ID NO:28). В других вариантах осуществления антитело содержит FR1 VH (SEQ ID NO:29), FR4 VH (SEQ ID NO:32), FR1 VL (SEQ ID NO:25), FR2 VL (SEQ ID NO:26) и FR3 VL (SEQ ID NO:27). В еще одном варианте осуществления антитело содержит FR1 VH (SEQ ID NO:29), FR4 VH (SEQ ID NO:32), FR1 VL (SEQ ID NO:25), FR2 VL (SEQ ID NO:26) и FR4 VL (SEQ ID NO:28). В одном из вариантов осуществления антитело содержит FR1 VH (SEQ ID NO:29), FR4 VH (SEQ ID NO:32), FR1 VL (SEQ ID NO:25), FR3 VL (SEQ ID NO:27) и FR4 VL (SEQ ID NO:28). В некоторых вариантах осуществления антитело содержит FR1 VH (SEQ ID NO:29), FR4 VH (SEQ ID NO:32), FR2 VL (SEQ ID NO:26), FR3 VL (SEQ ID NO:27) и FR4 VL (SEQ ID NO:28). В еще одном варианте осуществления антитело содержит FR2 VH (SEQ ID NO:30), FR3 VH (SEQ ID NO:31), FR1 VL (SEQ ID NO:25), FR2 VL (SEQ ID NO:26) и FR3 VL (SEQ ID NO:27). В одном из вариантов осуществления антитело содержит FR2 VH (SEQ ID NO:30), FR3 VH (SEQ ID NO:31), FR1 VL (SEQ ID NO:25), FR2 VL (SEQ ID NO:26) и FR4 VL (SEQ ID NO:28). В других вариантах осуществления антитело содержит FR2 VH (SEQ ID NO:30), FR3 VH (SEQ ID NO:31), FR1 VL (SEQ ID NO:25), FR3 VL (SEQ ID NO:27) и FR4 VL (SEQ ID NO:28). В еще одном варианте осуществления антитело содержит FR2 VH (SEQ ID NO:30), FR3 VH (SEQ ID NO:31), FR2 VL (SEQ ID NO:26), FR3 VL (SEQ ID NO:27) и FR4 VL (SEQ ID NO:28). В некоторых вариантах осуществления антитело содержит FR2 VH (SEQ ID NO:30), FR4 VH (SEQ ID NO:32), FR1 VL (SEQ ID NO:25), FR2 VL (SEQ ID NO:26) и FR3 VL (SEQ ID NO:27). В одном из вариантов осуществления антитело содержит FR2 VH (SEQ ID NO:30), FR4 VH (SEQ ID NO:32), FR1 VL (SEQ ID NO:25), FR2 VL (SEQ ID NO:26) и FR4 VL (SEQ ID NO:28). В еще одном варианте осуществления антитело содержит FR2 VH (SEQ ID NO:30), FR4 VH (SEQ ID NO:32), FR1 VL (SEQ ID NO:25), FR3 VL (SEQ ID NO:27) и FR4 VL (SEQ ID NO:28). В одном из вариантов осуществления антитело содержит FR2 VH (SEQ ID NO:30), FR4 VH (SEQ ID NO:32), FR2 VL (SEQ ID NO:26), FR3 VL (SEQ ID NO:27) и FR4 VL (SEQ ID NO:28). В некоторых вариантах осуществления антитело содержит FR3 VH (SEQ ID NO:31), FR4 VH (SEQ ID NO:32), FR1 VL (SEQ ID NO:25), FR2 VL (SEQ ID NO:26) и FR3 VL (SEQ ID NO:27). В еще одном варианте осуществления антитело содержит FR3 VH (SEQ ID NO:31), FR4 VH (SEQ ID NO:32), FR1 VL (SEQ ID NO:25), FR2 VL (SEQ ID NO:26) и FR4 VL (SEQ ID NO:28). В других вариантах осуществления антитело содержит FR3 VH (SEQ ID NO:31), FR4 VH (SEQ ID NO:32), FR1 VL (SEQ ID NO:25), FR3 VL (SEQ ID NO:27) и FR4 VL (SEQ ID NO:28). В одном из вариантов осуществления антитело содержит FR3 VH (SEQ ID NO:31), FR4 VH (SEQ ID NO:32), FR2 VL (SEQ ID NO:26), FR3 VL (SEQ ID NO:27) и FR4 VL (SEQ ID NO:28). В еще одном варианте осуществления антитело содержит FR1 VH (SEQ ID NO:29), FR1 VL (SEQ ID NO:25), FR2 VL (SEQ ID NO:26), FR3 VL (SEQ ID NO:27) и FR4 VL (SEQ ID NO:28). В некоторых вариантах осуществления антитело содержит FR2 VH (SEQ ID NO:30), FR1 VL (SEQ ID NO:25), FR2 VL (SEQ ID NO:26), FR3 VL (SEQ ID NO:27) и FR4 VL (SEQ ID NO:28). В одном из вариантов осуществления антитело содержит FR3 VH (SEQ ID NO:31), FR1 VL (SEQ ID NO:25), FR2 VL (SEQ ID NO:26), FR3 VL (SEQ ID NO:27) и FR4 VL (SEQ ID NO:28). В еще одном варианте осуществления антитело содержит FR4 VH (SEQ ID NO:32), FR1 VL (SEQ ID NO:25), FR2 VL (SEQ ID NO:26), FR3 VL (SEQ ID NO:27) и FR4 VL (SEQ ID NO:28). В других вариантах осуществления антитело содержит FR1 VH (SEQ ID NO:29), FR2 VH (SEQ ID NO:30), FR3 VH (SEQ ID NO:31), FR4 VH (SEQ ID NO:32), FR1 VL (SEQ ID NO:25) и FR2 VL (SEQ ID NO:26). В некоторых вариантах осуществления антитело содержит FR1 VH (SEQ ID NO:29), FR2 VH (SEQ ID NO:30), FR3 VH (SEQ ID NO:31), FR4 VH (SEQ ID NO:32), FR1 VL (SEQ ID NO:25) и FR3 VL (SEQ ID NO:27). В еще одном варианте осуществления антитело содержит FR1 VH (SEQ ID NO:29), FR2 VH (SEQ ID NO:30), FR3 VH (SEQ ID NO:31), FR4 VH (SEQ ID NO:32), FR1 VL (SEQ ID NO:25) и FR4 VL (SEQ ID NO:28). В одном из вариантов осуществления антитело содержит FR1 VH (SEQ ID NO:29), FR2 VH (SEQ ID NO:30), FR3 VH (SEQ ID NO:31), FR4 VH (SEQ ID NO:32), FR2 VL (SEQ ID NO:26) и FR3 VL (SEQ ID NO:27). В одном из вариантов осуществления антитело содержит FR1 VH (SEQ ID NO:29), FR2 VH (SEQ ID NO:30), FR3 VH (SEQ ID NO:31), FR4 VH (SEQ ID NO:32), FR2 VL (SEQ ID NO:26) и FR4 VL (SEQ ID NO:28). В еще одном варианте осуществления антитело содержит FR1 VH (SEQ ID NO:29), FR2 VH (SEQ ID NO:30), FR3 VH (SEQ ID NO:31), FR4 VH (SEQ ID NO:32), FR3 VL (SEQ ID NO:27) и FR4 VL (SEQ ID NO:28). В некоторых вариантах осуществления антитело содержит FR1 VH (SEQ ID NO:29), FR2 VH (SEQ ID NO:30), FR3 VH (SEQ ID NO:31), FR1 VL (SEQ ID NO:25), FR2 VL (SEQ ID NO:26) и FR3 VL (SEQ ID NO:27). В других вариантах осуществления антитело содержит FR1 VH (SEQ ID NO:29), FR2 VH (SEQ ID NO:30), FR3 VH (SEQ ID NO:31), FR1 VL (SEQ ID NO:25), FR2 VL (SEQ ID NO:26) и FR4 VL (SEQ ID NO:28). В еще одном варианте осуществления антитело содержит FR1 VH (SEQ ID NO:29), FR2 VH (SEQ ID NO:30), FR3 VH (SEQ ID NO:31), FR1 VL (SEQ ID NO:25), FR3 VL (SEQ ID NO:27) и FR4 VL (SEQ ID NO:28). В одном из вариантов осуществления антитело содержит FR1 VH (SEQ ID NO:29), FR2 VH (SEQ ID NO:30), FR3 VH (SEQ ID NO:31), FR2 VL (SEQ ID NO:26), FR3 VL (SEQ ID NO:27) и FR4 VL (SEQ ID NO:28). В некоторых вариантах осуществления антитело содержит FR1 VH (SEQ ID NO:29), FR2 VH (SEQ ID NO:30), FR4 VH (SEQ ID NO:32), FR1 VL (SEQ ID NO:25), FR2 VL (SEQ ID NO:26) и FR3 VL (SEQ ID NO:27). В еще одном варианте осуществления антитело содержит FR1 VH (SEQ ID NO:29), FR2 VH (SEQ ID NO:30), FR4 VH (SEQ ID NO:32), FR1 VL (SEQ ID NO:25), FR2 VL (SEQ ID NO:26) и FR4 VL (SEQ ID NO:28). В одном из вариантов осуществления антитело содержит FR1 VH (SEQ ID NO:29), FR2 VH (SEQ ID NO:30), FR4 VH (SEQ ID NO:32), FR1 VL (SEQ ID NO:25), FR3 VL (SEQ ID NO:27) и FR4 VL (SEQ ID NO:28). В других вариантах осуществления антитело содержит FR1 VH (SEQ ID NO:29), FR2 VH (SEQ ID NO:30), FR4 VH (SEQ ID NO:32), FR2 VL (SEQ ID NO:26), FR3 VL (SEQ ID NO:27) и FR4 VL (SEQ ID NO:28). В еще одном варианте осуществления антитело содержит FR1 VH (SEQ ID NO:29), FR3 VH (SEQ ID NO:31), FR4 VH (SEQ ID NO:32), FR1 VL (SEQ ID NO:25), FR2 VL (SEQ ID NO:26) и FR3 VL (SEQ ID NO:27). В некоторых вариантах осуществления антитело содержит FR1 VH (SEQ ID NO:29), FR3 VH (SEQ ID NO:31), FR4 VH (SEQ ID NO:32), FR1 VL (SEQ ID NO:25), FR2 VL (SEQ ID NO:26) и FR4 VL (SEQ ID NO:28). В одном из вариантов осуществления антитело содержит FR1 VH (SEQ ID NO:29), FR3 VH (SEQ ID NO:31), FR4 VH (SEQ ID NO:32), FR1 VL (SEQ ID NO:25), FR3 VL (SEQ ID NO:27) и FR4 VL (SEQ ID NO:28). В еще одном варианте осуществления антитело содержит FR1 VH (SEQ ID NO:29), FR3 VH (SEQ ID NO:31), FR4 VH (SEQ ID NO:32), FR2 VL (SEQ ID NO:26), FR3 VL (SEQ ID NO:27) и FR4 VL (SEQ ID NO:28). В одном из вариантов осуществления антитело содержит FR2 VH (SEQ ID NO:30), FR3 VH (SEQ ID NO:31), FR4 VH (SEQ ID NO:32), FR1 VL (SEQ ID NO:25), FR2 VL (SEQ ID NO:26) и FR3 VL (SEQ ID NO:27). В некоторых вариантах осуществления антитело содержит FR2 VH (SEQ ID NO:30), FR3 VH (SEQ ID NO:31), FR4 VH (SEQ ID NO:32), FR1 VL (SEQ ID NO:25), FR2 VL (SEQ ID NO:26) и FR4 VL (SEQ ID NO:28). В еще одном варианте осуществления антитело содержит FR2 VH (SEQ ID NO:30), FR3 VH (SEQ ID NO:31), FR4 VH (SEQ ID NO:32), FR1 VL (SEQ ID NO:25), FR3 VL (SEQ ID NO:27) и FR4 VL (SEQ ID NO:28). В других вариантах осуществления антитело содержит FR2 VH (SEQ ID NO:30), FR3 VH (SEQ ID NO:31), FR4 VH (SEQ ID NO:32), FR2 VL (SEQ ID NO:26), FR3 VL (SEQ ID NO:27) и FR4 VL (SEQ ID NO:28). В одном из вариантов осуществления антитело содержит FR1 VH (SEQ ID NO:29), FR2 VH (SEQ ID NO:30), FR1 VL (SEQ ID NO:25), FR2 VL (SEQ ID NO:26), FR3 VL (SEQ ID NO:27) и FR4 VL (SEQ ID NO:28). В еще одном варианте осуществления антитело содержит FR1 VH (SEQ ID NO:29), FR3 VH (SEQ ID NO:31), FR1 VL (SEQ ID NO:25), FR2 VL (SEQ ID NO:26), FR3 VL (SEQ ID NO:27) и FR4 VL (SEQ ID NO:28). В некоторых вариантах осуществления антитело содержит FR1 VH (SEQ ID NO:29), FR4 VH (SEQ ID NO:32), FR1 VL (SEQ ID NO:25), FR2 VL (SEQ ID NO:26), FR3 VL (SEQ ID NO:27) и FR4 VL (SEQ ID NO:28). В одном из вариантов осуществления антитело содержит FR2 VH (SEQ ID NO:30), FR3 VH (SEQ ID NO:31), FR1 VL (SEQ ID NO:25), FR2 VL (SEQ ID NO:26), FR3 VL (SEQ ID NO:27) и FR4 VL (SEQ ID NO:28). В еще одном варианте осуществления антитело содержит FR2 VH (SEQ ID NO:30), FR4 VH (SEQ ID NO:32), FR1 VL (SEQ ID NO:25), FR2 VL (SEQ ID NO:26), FR3 VL (SEQ ID NO:27) и FR4 VL (SEQ ID NO:28). В других вариантах осуществления антитело содержит FR3 VH (SEQ ID NO:31), FR4 VH (SEQ ID NO:32), FR1 VL (SEQ ID NO:25), FR2 VL (SEQ ID NO:26), FR3 VL (SEQ ID NO:27) и FR4 VL (SEQ ID NO:28). В некоторых вариантах осуществления антитело содержит FR1 VH (SEQ ID NO:29), FR2 VH (SEQ ID NO:30), FR3 VH (SEQ ID NO:31), FR4 VH (SEQ ID NO:32), FR1 VL (SEQ ID NO:25), FR2 VL (SEQ ID NO:26) и FR3 VL (SEQ ID NO:27). В еще одном варианте осуществления антитело содержит FR1 VH (SEQ ID NO:29), FR2 VH (SEQ ID NO:30), FR3 VH (SEQ ID NO:31), FR4 VH (SEQ ID NO:32), FR1 VL (SEQ ID NO:25), FR2 VL (SEQ ID NO:26) и FR4 VL (SEQ ID NO:28). В одном из вариантов осуществления антитело содержит FR1 VH (SEQ ID NO:29), FR2 VH (SEQ ID NO:30), FR3 VH (SEQ ID NO:31), FR4 VH (SEQ ID NO:32), FR1 VL (SEQ ID NO:25), FR3 VL (SEQ ID NO:27) и FR4 VL (SEQ ID NO:28). В одном из вариантов осуществления антитело содержит FR1 VH (SEQ ID NO:29), FR2 VH (SEQ ID NO:30), FR3 VH (SEQ ID NO:31), FR4 VH (SEQ ID NO:32), FR2 VL (SEQ ID NO:26), FR3 VL (SEQ ID NO:27) и FR4 VL (SEQ ID NO:28). В еще одном варианте осуществления антитело содержит FR1 VH (SEQ ID NO:29), FR2 VH (SEQ ID NO:30), FR3 VH (SEQ ID NO:31), FR1 VL (SEQ ID NO:25), FR2 VL (SEQ ID NO:26), FR3 VL (SEQ ID NO:27) и FR4 VL (SEQ ID NO:28). В некоторых вариантах осуществления антитело содержит FR1 VH (SEQ ID NO:29), FR2 VH (SEQ ID NO:30), FR4 VH (SEQ ID NO:32), FR1 VL (SEQ ID NO:25), FR2 VL (SEQ ID NO:26), FR3 VL (SEQ ID NO:27) и FR4 VL (SEQ ID NO:28). В других вариантах осуществления антитело содержит FR1 VH (SEQ ID NO:29), FR3 VH (SEQ ID NO:31), FR4 VH (SEQ ID NO:32), FR1 VL (SEQ ID NO:25), FR2 VL (SEQ ID NO:26), FR3 VL (SEQ ID NO:27) и FR4 VL (SEQ ID NO:28). В одном из вариантов осуществления антитело содержит FR2 VH (SEQ ID NO:30), FR3 VH (SEQ ID NO:31), FR4 VH (SEQ ID NO:32), FR1 VL (SEQ ID NO:25), FR2 VL (SEQ ID NO:26), FR3 VL (SEQ ID NO:27) и FR4 VL (SEQ ID NO:28). В некоторых вариантах осуществления антитело содержит любую комбинацию FR VH (SEQ ID NO:29-32) и FR VL (SEQ ID NO:25-28), перечисленных в Таблице 2.
[00204] В некоторых вариантах осуществления антитела по настоящему изобретению содержат область VH или домен VH. В других вариантах осуществления антитела по настоящему изобретению содержат область VL или домен VL. В некоторых вариантах осуществления антитела по настоящему изобретению содержат комбинацию (i) домена VH или области VH; и/или (ii) домена VL или области VL. В других вариантах осуществления антитела по настоящему изобретению содержат комбинацию (i) домена VH или области VH; и/или (ii) домена VL или области VL, выбранную из группы, состоящей из SEQ ID NO:3 и 4, как указано в Таблице 1.
[00205] В некоторых вариантах осуществления антитела по настоящему изобретению содержат область VH, содержащую: (1) CDR1 VH с аминокислотной последовательностью SEQ ID NO:15; (2) CDR2 VH с аминокислотной последовательностью SEQ ID NO:19; и (3) CDR3 VH с аминокислотной последовательностью SEQ ID NO:23; и область VL, выбраную из группы, состоящей из SEQ ID NO:3, как указано в Таблице 1.
[00206] В других вариантах осуществления антитела по настоящему изобретению содержат область VH, выбранную из группы, состоящей из SEQ ID NO:4, как указано в Таблице 1; и область VL, содержащую: (1) CDR1 VL с аминокислотной последовательностью SEQ ID NO:7; (2) CDR2 VL с аминокислотной последовательностью SEQ ID NO:10; и (3) CDR3 VL с аминокислотной последовательностью SEQ ID NO:12.
[00207] Также в настоящем документе представлены выделенные молекулы нуклеиновой кислоты, кодирующие тяжелую цепь, легкую цепь, область VH, область VL, CDR1 VH, CRD2 VH, CDR3 VH, CDR1 VL, CDR2 VL и/или CDR3 VL иммуноглобулина антитела против нектина-4, которое связываются с полипептидом нектина-4, фрагментом полипептида нектина-4, пептидом нектина-4 или эпитопом нектина-4. Характерные последовательности нуклеиновых кислот области VL, легкой цепи, области VH и тяжелой цепи антитела M22-321b41.1 показаны в Таблицах 3-4.
Таблица 3. Последовательности нуклеиновых кислот VL
область VL
(SEQ ID NO:39)
Таблица 4. Последовательности нуклеиновых кислот VH
[00208] В некоторых вариантах осуществления антитело по настоящему изобретению имеет аминокислотные последовательности VH и VL антитела M22-321b41.1. В некоторых вариантах осуществления антитело содержит VH с аминокислотной последовательностью SEQ ID NO:4 и VL с аминокислотной последовательностью SEQ ID NO:3.
[00209] В некоторых вариантах осуществления антитело или его антигенсвязывающий фрагмент по настоящему изобретению, которое специфически связывается с полипептидом нектина-4 (например, ECD нектина-4, например, нектина-4 человека), содержит легкую цепь и тяжелую цепь, где легкая цепь содержит констатную область с аминокислотной последовательностью:
GASVVCFLNNFYPKDINVKWKIDGSERQNGVLNSWTDQDSKDSTYSMSSTLTLTKDEYERHNSYTCEATHKTSTSPIVKTFNRNEC (SEQ ID NO:33).
[00210] В некоторых вариантах осуществления антитело или его антигенсвязывающий фрагмент по настоящему изобретению, которое специфически связывается с полипептидом нектина-4 (например, ECD нектина-4, например, нектина-4 человека), содержит легкую цепь и тяжелую цепь, где тяжелая цепь содержит констатную область с аминокислотной последовательностью:
SSVTLGCLVKGYFPEPVTLTWNSGSLSSGVHTFPAVLQSDLYTLSSSVTVTSSTWPSQSITCNVAHPASSTKVDKKIEPRGPTIKPCPPCKCPAPNLLGGPSVFIFPPKIKDVLMISLSPIVTCVVVDVSEDDPDVQISWFVNNVEVHTAQTQTHREDYNSTLRVVSALPIQHQDWMSGKEFKCKVNNKDLPAPIERTISKPKGSVRAPQVYVLPPPEEEMTKKQVTLTCMVTDFMPEDIYVEWTNNGKTELNYKNTEPVLDSDGSYFMYSKLRVEKKNWVERNSYSCSVVHEGLHNHHTTKSFSRTPGK (SEQ ID NO:34).
[00211] В других вариантах осуществления антитело или его антигенсвязывающий фрагмент по настоящему изобретению, которое специфически связывается с полипептидом нектина-4 (например, ECD нектина-4, например, нектина-4 человека), содержит легкую цепь и тяжелую цепь, где тяжелая цепь содержит Fc-область IgG1 человека с аминокислотной последовательностью:
PRGPTIKPCPPCKCPAPNLLGGPSVFIFPPKIKDVLMISLSPIVTCVVVDVSEDDPDVQISWFVNNVEVHTAQTQTHREDYNSTLRVVSALPIQHQDWMSGKEFKCKVNNKDLPAPIERTISKPKGSVRAPQVYVLPPPEEEMTKKQVTLTCMVTDFMPEDIYVEWTNNGKTELNYKNTEPVLDSDGSYFMYSKLRVEKKNWVERNSYSCSVVHEGLHNHHTTKSFSRTPGK (SEQ ID NO:35).
[00212] В некоторых вариантах осуществления антитело или его антигенсвязывающий фрагмент по настоящему изобретению, которое специфически связывается с полипептидом нектина-4 (например, ECD нектина-4, например, нектина-4 человека), содержит легкую цепь и тяжелую цепь, где тяжелая цепь не содержит Fc-область IgG1 человека с аминокислотной последовательностью SEQ ID NO:35.
[00213] В еще одном варианте осуществления, антитело или его антигенсвязывающий фрагмент по настоящему изобретению, которое специфически связывается с полипептидом нектина-4 (например, ECD нектина-4, например, нектина-4 человека), содержит легкую цепь и тяжелую цепь, где легкая цепь содержит констатную область с аминокислотной последовательностью SEQ ID NO:33; и тяжелая цепь содержит Fc-область с аминокислотной последовательностью SEQ ID NO:35.
[00214] В некоторых вариантах осуществления антитело по настоящему изобретению, которое специфически связывается с полипептидом нектина-4 (например, ECD нектина-4, например, нектина-4 человека), содержит легкую цепь и тяжелую цепь, где легкая цепь содержит следующую аминокислотную последовательность:
DIVMTQAAFSNPVTLGTSASISCRSSKSLLHSNGITYLYWYLQKPGQSPQLLIYHMSNLASGVPDRFTSSGSGTDFTLRISRVEAEDVGVYYCAQNLELPFTFGGGTKLETKRADAAPTVSIFPPSSEQLTSGGASVVCFLNNFYPKDINVKWKIDGSERQNGVLNSWTDQDSKDSTYSMSSTLTLTKDEYERHNSYTCEATHKTSTSPIVKTFNRNEC (SEQ ID NO:5).
[00215] В некоторых вариантах осуществления антитело по настоящему изобретению, которое специфически связывается с полипептидом нектина-4 (например, ECD нектина-4, например, нектина-4 человека), содержит легкую цепь и тяжелую цепь, где тяжелая цепь содержит следующую аминокислотную последовательность:
QVQLQQSGAELARPGASVKLSCKASGYTFTTYWMQWVKQRPGQGLEWIGSIYPGDGDTRYTQKFKGKATLTADKSSSTAYIQLSTLASEDSAVYYCAREYYGLDYWGQGTTLTVSSAKTTAPSVYPLAPVCGDTTGSSVTLGCLVKGYFPEPVTLTWNSGSLSSGVHTFPAVLQSDLYTLSSSVTVTSSTWPSQSITCNVAHPASSTKVDKKIEPRGPTIKPCPPCKCPAPNLLGGPSVFIFPPKIKDVLMISLSPIVTCVVVDVSEDDPDVQISWFVNNVEVHTAQTQTHREDYNSTLRVVSALPIQHQDWMSGKEFKCKVNNKDLPAPIERTISKPKGSVRAPQVYVLPPPEEEMTKKQVTLTCMVTDFMPEDIYVEWTNNGKTELNYKNTEPVLDSDGSYFMYSKLRVEKKNWVERNSYSCSVVHEGLHNHHTTKSFSRTPGK (SEQ ID NO:6).
[00217] В еще одном аспекте предоставлены антитела, которые конкурируют с одним из приведенных в качестве примеров антител или функциональных фрагментов за связывание с нектином-4. Такие антитела могут также связываться с тем же эпитопом, что и одно из приведенных в настоящем описании примеров антител, или с перекрывающимся эпитопом. Предполагается, что антитела и фрагменты, которые конкурируют за связывание или связываются с тем же эпитопом, что и приведенные в качестве примера антитела, демонстрируют сходные функциональные свойства. Приведенные в качестве примера антигенсвязывающие белки и их фрагменты включают белки с областями VH и VL и с CDR, представленными в настоящем документе, включая те, которые приведены в Таблице 1. Таким образом, в качестве конкретного примера предоставленные антитела включают антитела, которые конкурируют с антителом, содержащим: (а) 1, 2, 3, 4, 5 или все 6 CDR, перечисленные для антитела, как указано в Таблице 1; (b) VH и VL, выбранные из областей VH и VL, перечисленных для антитела, как указнао в Таблице 1; или (c) две легкие цепи и две тяжелые цепи, содержащие VH и VL, как указано для антитела в Таблице 1. В некоторых вариантах осуществления антитело представляет собой антитело M22-321b41.1.
[00218] В определенных вариантах осуществления антитело, описанное в настоящем документе, или его антигенсвязывающий фрагмент, содержит аминокислотные последовательности с определенным процентом идентичности по сравнению с антителом M22-321b41.1.
[00219] Определение процента идентичности двух последовательностей (например, аминокислотных последовательностей или последовательностей нуклеиновых кислот) можно осуществлять с помощью математического алгоритма. Предпочтительным неограничивающим примером математического алгоритма, используемого для сравнения двух последовательностей, является алгоритм Karlin and Altschul, 1990, Proc. Natl. Acad. Sci. U.S.A 87:2264 2268, модифицированный, как Karlin and Altschul, 1993, Proc. Natl. Acad. Sci. U.S.A 90:58735877. Такой алгоритм включен в программы NBLAST и XBLAST Altschul et al., 1990, J. Mol. Biol. 215:403. Поиск нуклеотидов в BLAST может быть осуществлен с набором параметров программы NBLAST для нуклеотидов, например, для балла=100, длина слова=12, с получением нуклеотидных последовательностей, гомологичных молекулам нуклеиновой кислоты, описанным в настоящем описании. Поиск белка в BLAST может быть осуществлен с установленными параметрами программы XBLAST, например, для балла 50, длина слова=3, для получения аминокислотных последовательностей, гомологичных описанной в настоящем описании молекуле белка. Для выравнивания с пробелами для целей сравнения можно использовать Gapped BLAST, как описано в Altschul et al., 1997, Nucleic Acids Res.25: 3389 3402. Альтернативно, PSI BLAST можно использовать для осуществления итеративного поиска, который обнаруживает отдаленные связи между молекулами (Id.). При использовании программ BLAST, Gapped BLAST и PSI Blast можно использовать параметры по умолчанию соответствующих программ (например, XBLAST и NBLAST) (см., например, National Center for Biotechnology Information (NCBI) на сайте в интернете: ncbi.nlm.nih.gov). Другим предпочтительным неограничивающим примером математического алгоритма, используемого для сравнения последовательностей, является алгоритм Myers and Miller, 1988, CABIOS 4:11 17. Такой алгоритм включен в программу ALIGN (версия 2.0), которая является частью пакета программного обеспечения для выравнивания последовательностей GCG. При использовании программы ALIGN для сравнения аминокислотных последовательностей можно использовать таблицу значимости остатков PAM120, штраф за длину пробела 12 и штраф за пробел 4.
[00220] Процентная идентичность двух последовательностей может быть определена с использованием методик, аналогичных описанным выше, с учетом или без учета пропусков. При расчете процента идентичности обычно учитываются только полные совпадения.
[00221] В некоторых вариантах осуществления антитело, описанное в настоящем документе, или его антигенсвязывающий фрагмент, содержит домен VL, последовательность которого по меньшей мере на 80%, по меньшей мере на 85%, по меньшей мере на 90%, по меньшей мере на 95% или по меньшей мере на 98% идентична аминокислотной последовательности SEQ ID NO:3, где антитело иммуноспецифично связывается с нектином-4. В определенных вариантах осуществления антитело по настоящему изобретению или его антигенсвязывающий фрагмент содержит домен VL, последовательность которого по меньшей мере на 80%, по меньшей мере на 85%, по меньшей мере на 90%, по меньшей мере на 95% или по меньшей мере на 98% идентична аминокислотной последовательности SEQ ID NO:3, где антитело иммуноспецифично связывается с нектином-4, и где антитело содержит CDR (например, CDR VL 1-3), которые идентичны CDR (например, CDR VL 1-3) антитела М22-321b41.1.
[00222] В определенных вариантах осуществления антитело, описанное в настоящем документе, или его антигенсвязывающий фрагмент, содержит домен VL, содержащий каркасные области VL, последовательность которых по меньшей мере на 80%, по меньшей мере на 85%, по меньшей мере на 90%, по меньшей мере на 95% или по меньшей мере на 98% идентична аминокислотной последовательности каркасных областей SEQ ID NO:3, где антитело иммуноспецифично связывается с нектином-4. В конкретном варианте осуществления антитело содержит CDR VL, которые идентичны CDR VL антитела M22-321b41.1.
[00223] В определенных вариантах осуществления антитело по настоящему изобретению или его антигенсвязывающий фрагмент содержит домен VH, последовательность которого по меньшей мере на 80%, по меньшей мере на 85%, по меньшей мере на 90%, по меньшей мере на 95% или по меньшей мере на 98% идентична аминокислотной последовательности SEQ ID NO:4, где антитело иммуноспецифично связывается с нектином-4. В некоторых вариантах осуществления антитело по настоящему изобретению или его антигенсвязывающий фрагмент содержит домен VH, последовательность которого по меньшей мере на 80%, по меньшей мере на 85%, по меньшей мере на 90%, по меньшей мере на 95% или по меньшей мере на 98% идентична аминокислотной последовательности SEQ ID NO:4, где антитело иммуноспецифично связывается с нектином-4, и где антитело содержит CDR (например, VH CDR 1-3), которые идентичны CDR (например, VH CDR 1-3) антитело М22-321b41.1.
[00224] В определенных вариантах осуществления антитело по настоящему изобретению или его антигенсвязывающий фрагмент, содержит домен VH, содержащий каркасные области VH, последовательность которых по меньшей мере на 80%, по меньшей мере на 85%, по меньшей мере на 90%, по меньшей мере на 95% или по меньшей мере на 98% идентична аминокислотной последовательности каркасных областей SEQ ID NO:4, где антитело иммуноспецифично связывается с нектином-4. В конкретных вариантах осуществления такое антитело содержит CDR (например, VH CDR 1-3), идентичные CDR (например, VH CDR 1-3) антитела M22-321b41.1.
[00225] В определенных вариантах осуществления антитело по настоящему изобретению или его антигенсвязывающий фрагмент содержит (i) домен VL, последовательность которого по меньшей мере на 80%, по меньшей мере на 85%, по меньшей мере на 90%, по меньшей мере на 95% или по меньшей мере на 98% идентична аминокислотной последовательности SEQ ID NO:3 и (ii) домен VH, последовательность которого по меньшей мере на 80%, по меньшей мере на 85%, по меньшей мере на 90%, по меньшей мере на 95% или по меньшей мере на 98% идентична аминокислотной последовательности SEQ ID NO:4, соответственно, где антитело иммуноспецифично связывается с нектином-4. В конкретных вариантах осуществления такое антитело или его антигенсвязывающий фрагмент содержит CDR (например, CDR VL 1-3 и/или CDR VH 1-3), идентичные CDR (например, CDR VL 1-3 и/или CDR VH 1-3) антитела М22-321b41.1.
[00226] В еще одном аспекте антитела или их антигенсвязывающие фрагменты по настоящему изобретению связываются с областью, в том числе с эпитопом, нектина-4 человека. Например, в некоторых вариантах осуществления антитело по настоящему изобретению связывается с областью нектина-4 человека (SEQ ID NO:1), содержащей аминокислотные остатки 31-346 (SEQ ID NO:2), областью нектина-4 человека (SEQ ID NO:1), содержащей аминокислотные остатки 1-150 (SEQ ID NO:45), или с область нектина-4 человека (SEQ ID NO:1), содержащей аминокислотные остатки 31-150 (SEQ ID NO:46) нектина-4 человека. В еще одном аспекте антитела по настоящему изобретению связываются со специфическим эпитопом нектина-4 человека. Аминокислотная последовательность аминокислотных остатков 31-346 нектина-4 человека (SEQ ID NO:1) представляет собой:
AGELETSDVVTVVLGQDAKLPCFYRGDSGEQVGQVAWARVDAGEGAQELALLHSKYGLHVSPAYEGRVEQPPPPRNPLDGSVLLRNAVQADEGEYECRVSTFPAGSFQARLRLRVLVPPLPSLNPGPALEEGQGLTLAASCTAEGSPAPSVTWDTEVKGTTSSRSFKHSRSAAVTSEFHLVPSRSMNGQPLTCVVSHPGLLQDQRITHILHVSFLAEASVRGLEDQNLWHIGREGAMLKCLSEGQPPPSYNWTRLDGPLPSGVRVDGDTLGFPPLTTEHSGIYVCHVSNEFSSRDSQVTVDVLDPQEDSGKQVDLV (SEQ ID NO:2). Аминокислотная последовательность аминокислотных остатков 1-150 нектина-4 человека (SEQ ID NO:1) представляет собой: MPLSLGAEMWGPEAWLLLLLLLASFTGRCPAGELETSDVVTVVLGQDAKLPCFYRGDSGEQVGQVAWARVDAGEGAQELALLHSKYGLHVSPAYEGRVEQPPPPRNPLDGSVLLRNAVQADEGEYECRVSTFPAGSFQARLRLRVLVPPL (SEQ ID NO:45). Аминокислотная последовательность аминокислотных остатков 31-150 нектина-4 человека (SEQ ID NO:1) представляет собой:
AGELETSDVVTVVLGQDAKLPCFYRGDSGEQVGQVAWARVDAGEGAQELALLHSKYGLHVSPAYEGRVEQPPPPRNPLDGSVLLRNAVQADEGEYECRVSTFPAGSFQARLRLRVLVPPL (SEQ ID NO:46).
[00227] В некоторых вариантах осуществления антитела по настоящему изобретению связываются с эпитопом нектина-4, который является трехмерным поверхностным признаком полипептида нектина-4 (например, в мультимерной форме полипептида нектина-4). Область полипептида нектина-4, входящая в состав эпитопа, может представлять собой смежные аминокислоты полипептида, или эпитоп возникать в результате объединения двух или более несмежных областей полипептида. Эпитоп нектина-4 может присутствовать в (а) мультимерной форме («мультимерный эпитоп нектина-4») нектина-4, (b) мономерной форме («мономерный эпитоп нектина-4») нектина-4, (c) как мультимерная, так и мономерная форма нектина-4, (d) мультимерная форма, но не мономерная форма нектина-4, или (e) мономерная форма, но не мультимерная форма нектина-4. Например, в некоторых вариантах осуществления эпитоп присутствует или доступен только для связывания в мультимерной (нативной) форме, но отсутствует или не доступен для связывания в мономерной (денатурированной) форме антитела против нектина-4. В других вариантах осуществления эпитоп нектина-4 является линейным признаком полипептида нектина-4 (например, в мультимерной форме или мономерной форме полипептида нектина-4). Антитела по настоящему изобретению могут иммуноспецифически связываться с (а) эпитопом мономерной формы нектина-4, (b) эпитопом мультимерной форме нектина-4, (с) эпитопом мономерной, но не мультимерной формы нектина-4, (d) эпитопом мультимерной, но не мономерной формы нектина-4, или (е) как с мономерной формой, так и с мультимерной формой нектина-4.
[00228] В настоящем документе также раскрыты антитела, которые связываются с одним и тем же или перекрывающимся эпитопом нектина-4 (например, эпитопом, расположенным в ECD нектина-4 человека), как и антитело M22-321b41.1, описанное в настоящем документе, например, антитела которые конкурируют (например, зависимым от дозы образом) за связывание с нектином-4 (например, ECD нектином-4 человека) с антителом M22- 321b41.1, описанным в настоящем документе, или которые конкурентно ингибируют (например, зависимым от дозы образом) антитело M22-321b41.1, описанное в настоящем документе, от связывания с нектином-4 (например, с эпитопом, расположенным на ECD нектина-4 человека).
[00229] В конкретном аспекте в настоящем документе также раскрыты антитела, которые связываются с тем же или перекрывающимся эпитопом нектина-4 (например, эпитопом, расположенным в ECD нектина-4 человека), что и антитело M22-321b41.1.
[00230] Антитела, которые связываются с одинаковыми или перекрывающимися эпитопами нектина-4 (например, эпитопом, расположенный в ECD нектина-4 человека), могут быть идентифицированы с использованием рутинных методик, таких как методики, которые используются в примерах, представленных в настоящем документе. Иммуноанализ, например, используется для демонстрации способности одного антитела блокировать связывание другого антитела с антигеном-мишенью, т.е. анализ конкурентного связывания. Анализы конкурентного связывания также можно использовать для определения того, имеют ли два антитела сходную специфичность связывания в отношении эпитопа. Конкурентное связывание может быть определено в анализе, в котором тестируемый иммуноглобулин ингибирует специфическое связывание эталонного антитела с общим антигеном, таким как нектин-4. Известны многочисленные типы анализов конкурентного связывания, например: твердофазный прямой или непрямой радиоиммуноанализ (RIA), твердофазный прямой или непрямой иммуноферментный анализ (EIA), анализ сэндвич-конкуренции (см. Stahli et al., (1983) Methods in Enzymology 9:242); твердофазный прямой биотин-авидин EIA (см. Kirkland et al., (1986) J. Immunol.137: 3614); твердофазный прямой анализ с меткой, твердофазный прямой сэндвич-анализ с меткой (см. Harlow and Lane, (1988) Antibody: A Laboratory Manual, Cold Spring Harbor Press); твердофазный прямой анализ RIA с использованием метки I-125 (см. Morel et al., (1988) Mol. Immunol.25 (1): 7); твердофазный прямой EIA с биотином-авидином (Cheung et al., (1990) Virology 176: 546); и прямой анализ RIA с меткой (Moldenhauer et al., (1990) Scand J. Immunol.32:77). Как правило, такой анализ включает использование очищенного антигена (например, нектина-4, такого как ECD нектин-4 человека), связанного с твердой поверхностью или клетками, несущими любой из них, немеченый тестируемый иммуноглобулин и меченый контрольный иммуноглобулин. Конкурентное ингибирование измеряют путем определения количества метки, связанной с твердой поверхностью, или с клетками, в присутствии тестируемого антитела. Обычно тестируемый иммуноглобулин присутствует в избытке. Обычно, когда конкурирующее антитело присутствует в избытке, то оно ингибирует специфическое связывание эталонного антитела с общим антигеном по меньшей мере на 50-55%, 55-60%, 60-65%, 65-70%, 70-75% или больше. Анализ конкурентного связывания может быть сконфигурирован в большом количестве различных форматов с использованием либо меченого антигена, либо меченого антитела. В обычной версии такого анализа антиген иммобилизуют на 96-луночный планшет. Затем измеряют способность немеченых антител блокировать связывание меченых антител с антигеном, используя радиоактивные или ферментные метки. Более подробное описание приведено, например, Wagener et al., J. Immunol., 1983, 130:2308-2315; Wagener et al., J. Immunol. Methods, 1984, 68:269-274; Kuroki et al., Cancer Res., 1990, 50:4872-4879; Kuroki et al., Immunol. Invest., 1992, 21:523-538; Kuroki et al., Hybridoma, 1992, 11:391-407, и «Using Antibodies: A Laboratory Manual: Ed Harlow and David Lane (Clod Springs Harbor Laboratory Press, Clod Springs Harbor, N.Y., 1999), pp.386-389.
[00231] В некоторых аспектах анализы конкурентного связывания можно использовать для определения того, конкурентно ли ингибируется связывание антитела, например, зависимым от дозы, другим антителом, тем самым указывая на то, что антитела связываются по существу с одним и тем же эпитопом или перекрывающимися эпитопами, например, стерически перекрывающимися эпитопами. Такие анализы конкурентного связывания могут включать, например, конкурентные анализы ELISA, которые могут быть сконфигурированы во всех различных форматах с использованием либо меченого антигена, либо меченого антитела. В конкретном варианте осуществления антитело может быть протестировано в анализах конкурентного связывания с антителом M22-321b41.1, описанным в настоящем документе, или с его химерным вариантом или Fab-антителом, или антителом, содержащим CDR VH и CDR VL антитела M22-321b41.1.
[00232] В конкретных аспектах в настоящем описании раскрыто антитело, которое конкурентно блокирует (например, зависимым от дозы образом) связывание антител, содержащих аминокислотные последовательности, описанные в настоящем документе, для специфического связывания с полипептидом нектина-4 (например, ECD нектина-4, например, нектин-4 человека), как определено с помощью анализов, известных специалисту в данной области или описанных в настоящем документе (например, конкурентные анализы ELISA). В конкретных аспектах в настоящем описании раскрыто антитело, которое конкурирует (например, зависимым от дозы образом) за специфическое связывание с полипептидом нектина-4 (например, ECD нектина-4, например, нектина-4 человека) с антителом, содержащий аминокислотные последовательности, описанные в настоящем документе (например, аминокислотные последовательности VL и/или VH антитела M22-321b41.1), как определено с использованием анализов, известных специалисту в данной области или описанных в настоящем документе (например, конкурентные анализы ELISA).
[00233] В конкретных аспектах настоящее изобретение относится к антителу, которое конкурирует (например, зависимым от дозы образом) за специфическое связывание с полипептидом нектина-4 (например, ECD нектина-4, например, нектина-4 человека), с антителом M22-321b41.1.
[00234] В конкретных аспектах настоящее изобретение относится к антителу, которое конкурирует (например, зависимым от дозы образом) за специфическое связывание с полипептидом нектина-4 (например, ECD нектина-4, например, человеческого нектина-4), с антителом, содержащим VL с аминокислотной последовательностью SEQ ID NO:3, и VH с аминокислотной последовательностью SEQ ID NO:4.
[00235] В конкретном аспекте в настоящем документе также раскрыты антитела (i), которые конкурируют (например, зависимым от дозы образом) с любым антителом M22-321b41.1 за специфическое связывание с эпитопом полипептида нектина-4 (например, эпитопом ECD нектина-4 человека), и (ii) которые способны специфически связываться с нектином-4 в анализе IHC.
[00236] В конкретном варианте осуществления, антитело по настоящему изобретению представляет собой антитело, которое конкурентно блокируется (например, зависимым от дозы образом) антителом, которое специфически связывается с нектином-4 и содержит VL с аминокислотной последовательностью SEQ ID NO:3 и VH с аминокислотной последовательностью SEQ ID NO: 4, в отношении специфического связывания с полипептидом нектина-4 (например, ECD нектина-4, например, нектина-4 человека).
[00237] В конкретном аспекте в настоящем документе также раскрыты антитела (i), которые конкурентно блокируются (например, в зависимости от дозы) антителом M22-321b41.1 в отношении специфического связывания с эпитопом полипептида нектина-4 (например, эпитопом ECD нектина-4 человека) и (ii), которые способны специфически связываться с нектином-4 в анализе IHC.
[00238] В конкретных аспектах в настоящем документе раскрыто антитело или его антигенсвязывающий фрагмент, которое иммуноспецифически связывается с тем же эпитопом, что и антитело M22-321b41.1, содержащее аминокислотные последовательности, описанные в настоящем документе, в отношении специфического связывания с полипептидом нектина-4 (например, ECD нектина-4, например, нектина-4 человека). Анализы, известные специалисту в данной области или описанные в настоящем документе (например, анализы ELISA), можно использовать для определения, связываются ли два антитела с одним и тем же эпитопом или нет.
[00239] В конкретном варианте осуществления антитело, описанное в данном документе, или его антигенсвязывающий фрагмент, иммуноспецифично связывается с тем же эпитопом, что и антитело антитела M22- 321b41.1, которое специфически связывает нектин-4 и содержит VL с аминокислотной последовательностью SEQ ID NO:3, и VH с аминокислотной последовательностью SEQ ID NO:4.
[00240] В конкретном аспекте в настоящем документе также раскрыты антитела (i), которые иммуноспецифически связываются с тем же эпитопом полипептида нектина-4 (например, эпитопом ECD нектина-4 человека), что и антитело M22-321b41.0,1; и (ii) которые способны специфически связываться с нектином-4 в анализе IHC.
[00241] В некоторых вариантах осуществления антитело или его антигенсвязывающий фрагмент при связывании с нектином-4 связывается по меньшей мере с одним из остатков 31-346 в аминокислотной последовательности SEQ ID NO:1. В некоторых вариантах осуществления антитело или его антигенсвязывающий фрагмент при связывании с нектином-4 связывается по меньшей мере с одним из остатков 31-75 в аминокислотной последовательности SEQ ID NO:1. В других вариантах осуществления антитело или его антигенсвязывающий фрагмент при связывании с нектином-4 связывается по меньшей мере с одним из остатков 75-125 в аминокислотной последовательности SEQ ID NO:1. В некоторых вариантах осуществления антитело или его антигенсвязывающий фрагмент при связывании с нектином-4 связывается по меньшей мере с одним из остатков 100-150 в аминокислотной последовательности SEQ ID NO:1. В других вариантах осуществления антитело или его антигенсвязывающий фрагмент при связывании с нектином-4 связывается по меньшей мере с одним из остатков 125-175 в аминокислотной последовательности SEQ ID NO:1. В некоторых вариантах осуществления антитело или его антигенсвязывающий фрагмент при связывании с нектином-4 связывается по меньшей мере с одним из остатков 150-200 в аминокислотной последовательности SEQ ID NO:1. В других вариантах осуществления антитело или его антигенсвязывающий фрагмент при связывании с нектином-4 связывается по меньшей мере с одним из остатков 175-225 в аминокислотной последовательности SEQ ID NO:1. В некоторых вариантах осуществления антитело или его антигенсвязывающий фрагмент при связывании с нектином-4 связывается по меньшей мере с одним из остатков 200-250 в аминокислотной последовательности SEQ ID NO:1. В других вариантах осуществления антитело или его антигенсвязывающий фрагмент при связывании с нектином-4 связывается по меньшей мере с одним из остатков 225-275 в аминокислотной последовательности SEQ ID NO:1. В некоторых вариантах осуществления антитело или его антигенсвязывающий фрагмент при связывании с нектином-4 связывается по меньшей мере с одним из остатков 250-300 в аминокислотной последовательности SEQ ID NO:1. В других вариантах осуществления антитело или его антигенсвязывающий фрагмент при связывании с нектином-4 связывается по меньшей мере с одним из остатков 275-325 в аминокислотной последовательности SEQ ID NO:1. В некоторых вариантах осуществления антитело или его антигенсвязывающий фрагмент при связывании с нектином-4 связывается по меньшей мере с одним из остатков 300-346 в аминокислотной последовательности SEQ ID NO:1.
[00242] В некоторых вариантах осуществления антитело или его антигенсвязывающий фрагмент при связывании с нектином-4 связывается по меньшей мере с одним из остатков 1-150 в аминокислотной последовательности SEQ ID NO:1. В некоторых вариантах осуществления антитело или его антигенсвязывающий фрагмент при связывании с нектином-4 связывается по меньшей мере с одним из остатков 31-150 в аминокислотной последовательности SEQ ID NO:1. В других вариантах осуществления антитело или его антигенсвязывающий фрагмент при связывании с нектином-4 связывается по меньшей мере с одним из остатков 1-10 в аминокислотной последовательности SEQ ID NO:1. В некоторых вариантах осуществления антитело или его антигенсвязывающий фрагмент при связывании с нектином-4 связывается по меньшей мере с одним из остатков 5-15 в аминокислотной последовательности SEQ ID NO:1. В других вариантах осуществления антитело или его антигенсвязывающий фрагмент при связывании с нектином-4 связывается по меньшей мере с одним из остатков 10-20 в аминокислотной последовательности SEQ ID NO: 1. В некоторых вариантах осуществления антитело или его антигенсвязывающий фрагмент при связывании с нектином-4 связывается по меньшей мере с одним из остатков 15-25 в аминокислотной последовательности SEQ ID NO: 1. В других вариантах осуществления антитело или его антигенсвязывающий фрагмент при связывании с нектином-4 связывается по меньшей мере с одним из остатков 20-30 в аминокислотной последовательности SEQ ID NO: 1. В некоторых вариантах осуществления антитело или его антигенсвязывающий фрагмент при связывании с нектином-4 связывается по меньшей мере с одним из остатков 25-35 в аминокислотной последовательности SEQ ID NO: 1. В других вариантах осуществления антитело или его антигенсвязывающий фрагмент при связывании с нектином-4 связывается по меньшей мере с одним из остатков 30-40 в аминокислотной последовательности SEQ ID NO: 1. В некоторых вариантах осуществления антитело или его антигенсвязывающий фрагмент при связывании с нектином-4 связывается по меньшей мере с одним из остатков 35-45 в аминокислотной последовательности SEQ ID NO: 1. В других вариантах осуществления антитело или его антигенсвязывающий фрагмент при связывании с нектином-4 связывается по меньшей мере с одним из остатков 40-50 в аминокислотной последовательности SEQ ID NO: 1. В некоторых вариантах осуществления антитело или его антигенсвязывающий фрагмент при связывании с нектином-4 связывается по меньшей мере с одним из остатков 45-55 в аминокислотной последовательности SEQ ID NO: 1. В других вариантах осуществления антитело или его антигенсвязывающий фрагмент при связывании с нектином-4 связывается по меньшей мере с одним из остатков 50-60 в аминокислотной последовательности SEQ ID NO: 1. В некоторых вариантах осуществления антитело или его антигенсвязывающий фрагмент при связывании с нектином-4 связывается по меньшей мере с одним из остатков 65-75 в аминокислотной последовательности SEQ ID NO: 1. В других вариантах осуществления антитело или его антигенсвязывающий фрагмент при связывании с нектином-4 связывается по меньшей мере с одним из остатков 70-80 в аминокислотной последовательности SEQ ID NO: 1. В некоторых вариантах осуществления антитело или его антигенсвязывающий фрагмент при связывании с нектином-4 связывается по меньшей мере с одним из остатков 75-85 в аминокислотной последовательности SEQ ID NO: 1. В других вариантах осуществления антитело или его антигенсвязывающий фрагмент при связывании с нектином-4 связывается по меньшей мере с одним из остатков 80-90 в аминокислотной последовательности SEQ ID NO: 1. В некоторых вариантах осуществления антитело или его антигенсвязывающий фрагмент при связывании с нектином-4 связывается по меньшей мере с одним из остатков 85-95 в аминокислотной последовательности SEQ ID NO: 1. В других вариантах осуществления антитело или его антигенсвязывающий фрагмент при связывании с нектином-4 связывается по меньшей мере с одним из остатков 90-100 в аминокислотной последовательности SEQ ID NO: 1. В некоторых вариантах осуществления антитело или его антигенсвязывающий фрагмент при связывании с нектином-4 связывается по меньшей мере с одним из остатков 95-105 в аминокислотной последовательности SEQ ID NO: 1. В других вариантах осуществления антитело или его антигенсвязывающий фрагмент при связывании с нектином-4 связывается по меньшей мере с одним из остатков 100-110 в аминокислотной последовательности SEQ ID NO: 1. В некоторых вариантах осуществления антитело или его антигенсвязывающий фрагмент при связывании с нектином-4 связывается по меньшей мере с одним из остатков 105-115 в аминокислотной последовательности SEQ ID NO: 1. В других вариантах осуществления антитело или его антигенсвязывающий фрагмент при связывании с нектином-4 связывается по меньшей мере с одним из остатков 110-120 в аминокислотной последовательности SEQ ID NO: 1. В некоторых вариантах осуществления антитело или его антигенсвязывающий фрагмент при связывании с нектином-4 связывается по меньшей мере с одним из остатков 115-125 в аминокислотной последовательности SEQ ID NO: 1. В других вариантах осуществления антитело или его антигенсвязывающий фрагмент при связывании с нектином-4 связывается по меньшей мере с одним из остатков 120-130 в аминокислотной последовательности SEQ ID NO: 1. В некоторых вариантах осуществления антитело или его антигенсвязывающий фрагмент при связывании с нектином-4 связывается по меньшей мере с одним из остатков 125-135 в аминокислотной последовательности SEQ ID NO: 1. В других вариантах осуществления антитело или его антигенсвязывающий фрагмент при связывании с нектином-4 связывается по меньшей мере с одним из остатков 130-140 в аминокислотной последовательности SEQ ID NO: 1. В некоторых вариантах осуществления антитело или его антигенсвязывающий фрагмент при связывании с нектином-4 связывается по меньшей мере с одним из остатков 135-145 в аминокислотной последовательности SEQ ID NO: 1. В других вариантах осуществления антитело или его антигенсвязывающий фрагмент при связывании с нектином-4 связывается по меньшей мере с одним из остатков 140-150 в аминокислотной последовательности SEQ ID NO: 1.
[00243] Также рассматривается любая комбинация из двух, трех, четырех, пяти, шести, семи, восьми, девяти, десяти или более вышеуказанных аминокислотных сайтов связывания нектина-4.
[00244] В определенных вариантах осуществления антитела специфически связываются с эпитопом ECD нектина-4 человека, который отличается от сайта связывания лиганда нектина-4. В некоторых вариантах осуществления связывание лиганда нектина-4 не ингибируется антителом.
[00245] В одном аспекте в настоящем документе представлены антитела, которые специфически связываются с нектином-4. В определенных вариантах осуществления в настоящем документе представлены антитела, которые специфически связываются с ECD нектина-4 человека.
[00246] В некоторых вариантах осуществления антитела, которые специфически связываются с нектином-4, связываются с ECD нектина-4 человека или эпитопом ECD нектина-4 человека. В некоторых вариантах осуществления антитела специфически связываются с эпитопом ECD нектина-4 человека, который отличается от сайта связывания лиганда нектина-4.
[00247] Активность нектина-4 может относиться к любой активности нектина-4, такой как активность, известная или описанная в данной области. Неограничивающие примеры активности нектина-4 включают: димеризацию рецептора нектина-4, гетеродимеризацию рецептора нектина-4 с другими рецепторами, фосфорилирование рецептора нектина-4, передачу сигналов в сигнальном пути рецептора нектина-4, клеточную пролиферацию, такую как лиганд-нектин-4-индуцированное усиление пролиферации клеток (например, пролиферация злокачественных клеток) или выживание клеток (например, злокачественных клеток), антиапоптоз, индуцированный лигандом нектина-4. Активность нектина-4 или функция нектина-4 используются в настоящем описании взаимозаменяемо. В определенных аспектах активность нектина-4 индуцируется связыванием лиганда нектина-4 с рецептором нектина-4. В некоторых вариантах осуществления может происходить повышение активности или передачи сигналов нектина-4 в отсутствие связывающего лиганд нектина-4 рецептора нектина-4 вследствие высокой (или сверхэкспрессии) экспрессии рецепторов нектина-4. Высокая или сверхэкспрессия нектина-4 в клетке относится к уровню экспрессии, который составляет по меньшей мере приблизительно 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90%, 100%, На 150%, 200%, 250%, 300%, 400% или на 500% больше, чем уровень экспрессии эталонной клетки, о которой известно, что она имеет нормальную экспрессию нектина-4 или активность нектина-4, или больше, чем средний уровень экспрессии нектина-4 в популяции клеток или образцов, о которых известно, что они имеют нормальную экспрессию нектина-4 или активность нектина-4. Уровни экспрессии нектина-4 могут быть оценены способами, описанными в настоящем документе или известными специалисту в данной области (например, Вестерн-блоттинг, ELISA или IHC).
10. Поликлональные антитела
[00248] Антитела по настоящему изобретению могут относится к поликлональным антителам. Способы получения поликлональных антител известны специалисту в данной области. Поликлональные антитела могут быть получены у млекопитающего, например, путем одной или нескольких инъекций иммунизирующего агента и, если желательно, адъюванта. Обычно иммунизирующий агент и/или адъювант вводят млекопитающему путем множественных подкожных или внутрибрюшинных инъекций. Иммунизирующий агент может включать полипептид нектин-4 или его слитый белок. Может быть целесообразно конъюгировать иммунизирующий агент с белком, который, как известно, является иммуногенным для иммунизируемого млекопитающего, или иммунизировать млекопитающее белком и одним или несколькими адъювантами. Примеры таких иммуногенных белков включают, но не ограничиваются ими, гемоцианин лимфы улитки, сывороточный альбумин, бычий тироглобулин и ингибитор трипсина сои. Примеры адъювантов, которые можно использовать, включают в себя Ribi, CpG, Poly 1C, полный адъювант Фрейнда и адъювант MPL-TDM (монофосфориллипид A, синтетический дикориномиколат трегалозы). Протокол иммунизации может быть выбран специалистом в данной области без чрезмерного экспериментирования. Затем у млекопитающего можно взять кровь и проанализировать сыворотку на титр антител против нектина-4. При желании, млекопитающему можно стимулировать до тех пор, пока титр антител не увеличится или не выйдет на плато. Дополнительно или альтернативно, лимфоциты могут быть получены у иммунизированного животного для проведения слияния и получения моноклональных антител из гибридомы, как описано ниже.
11. Моноклональные антитела
[00249] Антитела по настоящему изобретению могут альтернативно представлять собой моноклональные антитела. Моноклональные антитела могут быть получены с помощью гибридомной технологии, впервые описанной Kohler et al., 1975, Nature 256:495-97, или могут быть получены способами рекомбинантной ДНК (см., например, патент США № 4816567).
[00250] При гибридомной технологии мышь или другое подходящее животное-хозяин, такое как хомяк, иммунизируют, как описано выше, для индукции продукции лимфоцитов, которые продуцируют или способны давать антитела, которые специфически связываются с белком, используемым для иммунизации. Альтернативно, лимфоциты могут быть иммунизированы in vitro. После иммунизации лимфоциты выделяют и затем сливают с клеточной линией миеломы, используя подходящий агент слияния, такой как полиэтиленгликоль, с образованием гидридомных клеток (Goding, Monoclonal Antibodies: Principles and Practice 59-103 (1986)).
[00251] Полученные таким образом клетки гибридомы высевают и выращивают в подходящей культуральной среде, которая в определенных вариантах осуществления содержит одно или несколько веществ, которые ингибируют рост или выживание клеток родительской миеломы, которые не были слиты (также называются партнеры слиянию). Например, если в клетках родительской миеломы отсутствует фермент гипоксантин-гуанин-фосфорибозилтрансфераза (HGPRT или HPRT), то селективная культуральная среда для гибридомы обычно включает гипоксантин, аминоптерин и тимидин (среда HAT), которая предотвращает рост клеток, дефицитных по HGPRT.
[00252] Типичными клетками миеломы, которые являются партнерами слияния, являются клетки, которые эффективно сливаются, поддерживают стабильную высокоэффективную продукцию антител выбранными антитело-продуцирующими клетками и чувствительны к селективной среде, которая селективна в отношении неслитых родительских клеток. Типичными клеточными линиями миеломы являются линии миеломы мыши, такие как SP-2 и производные, например, клетки X63-Ag8-653, доступные из Американской коллекции типовых культур (Manassas, VA), и клетки, полученные из мышиных опухолей MOPC-21 и MPC-11, доступные в центре "the Salk Institute Cell Distribution Center" (San Diego, CA). Для получения моноклональных антител человека также были описаны клеточные линии миеломы человека и клеточные линии гетеромиеломы мышь-человек (Kozbor, 1984, Immunol.133:3001-05; and Brodeur et al., Monoclonal Antibody Production Techniques and Applications 51-63 (1987)).
[00253] Культуральную среду, в которой растут клетки гибридомы, анализируют на продукцию моноклональных антител против антигена. Специфичность связывания моноклональных антител, продуцируемых клетками гибридомы, определяют с помощью иммунопреципитации или анализа связывания in vitro, такого как RIA или ELISA. Аффинность связывания моноклонального антитела можно, например, определить с помощью анализа Скэтчарда, описанного в Munson et al., 1980, Anal. Biochem.107:220-39.
[00254] Как только клетки гибридомы, которые продуцируют антитела желаемой специфичности, аффинности и/или активности, идентифицированы, клоны могут быть субклонированы процедурами на основе ограниченного разведения и выращены стандартными методами (Goding, выше). Подходящие культуральные среды для этой цели включают, например, среду DMEM или RPMI-1640. Кроме того, клетки гибридомы могут быть выращены in vivo как асцитные опухоли у животного, например, путем внутрибрюшинной инъекции мышам клеток.
[00255] Моноклональные антитела, секретируемые субклонами, соответствующим образом отделяют от культуральной среды, асцитной жидкости или сыворотки обычными процедурами очистки антител, такими как, например, аффинная хроматография (например, используя белок A или белок G-сефарозы) или ионно-обменная хроматография, гидроксилапатитная хроматография, гель-электрофорез, диализ и тому подобное.
[00256] ДНК, кодирующая моноклональные антитела, может быть легко выделена и секвенирована с использованием обычных процедур (например, с использованием олигонуклеотидных зондов, способных специфически связываться с генами, кодирующими тяжелые и легкие цепи антител мыши). Клетки гибридомы могут служить источником такой ДНК. После выделения ДНК может быть помещена в векторы экспрессии, которые затем трансфицируют в клетки-хозяева, такие как клетки E. coli, клетки обезьяньего COS, клетки яичника китайского хомяка (CHO) или клетки миеломы, которые в противном случае не продуцируют белок антитела, с обеспечением синтеза моноклональных антител в рекомбинантных клетках-хозяевах. Обзорные статьи о рекомбинантной экспрессии ДНК, кодирующей антитело, в бактериях включают Skerra et al., 1993, Curr. Opinion in Immunol.5:256-62 and Plückthun, 1992, Immunol. Revs.130: 151-88.
[00257] В некоторых вариантах осуществления антитело, которое связывается с эпитопом нектин-4, содержит аминокислотную последовательность домена VH и/или аминокислотную последовательность домена VL, кодируемую нуклеотидной последовательностью, которая гибридизуется с (1) комплементарной нуклеотидной последовательностью, кодирующей любой из доменов VH и/или VL, описанных в настоящем документе, в строгих условиях (например, гибридизация с ДНК, связанной с фильтром, в 6х хлорид натрия/цитрат натрия (SSC) при температуре около 45°C с последующей одной или несколькими промывками в 0,2х SSC/0,1% SDS при примерно 50-65°C), в очень строгих условиях (например, гибридизация с нуклеиновой кислотой, связанной с фильтром, в 6х SSC при примерно 45°C с последующей одной или несколькими промывками в 0,1х SSC/0,2% SDS при температуре около 68°С) или в других строгих условиях гибридизации, которые известны специалистам в данной области. См., например, Current Protocols in Molecular Biology Vol. I, 6.3.1-6.3.6 and 2.10.3 (Ausubel et al. eds., 1989).
[00258] В некоторых вариантах осуществления антитело, которое связывается с эпитопом нектин-4, содержит аминокислотную последовательность CDR VH или аминокислотную последовательность CDR VL, кодируемую нуклеотидной последовательностью, которая гибридизуется с комплементарной нуклеотидной последовательностью, кодирующей любую CDR VH и/или CDR VL, как указано в таблице 1, в строгих условиях (например, гибридизация с ДНК, связанной с фильтром, в 6х SSC при температуре около 45°C с последующей одной или несколькими промывками в 0,2х SSC/0,1% SDS при примерно 50-65°C), в очень строгих условиях (например, гибридизация с нуклеиновой кислотой, связанной с фильтром, в 6х SSC при примерно 45°C с последующей одной или несколькими промывками в 0,1х SSC/0,2% SDS при температуре около 68°С) или в других строгих условиях гибридизации, которые известны специалистам в данной области (см., например, Ausubel et al., supra).
[00259] В дополнительном варианте осуществления моноклональные антитела или фрагменты антител могут быть выделены из фаговых библиотек антитела, полученных с использованием методик, описанных, например, в «Antibody Phage Display: Methods and Protocols (O'Brien and Aitken eds., 2002). В методах фагового дисплея функциональные домены антитела "отображаются" на поверхности фаговых частиц, которые несут кодирующие их полинуклеотидные последовательности. Примеры методов фагового дисплея, которые можно использовать для получения антител, описанных в настоящем документе, включают способы, раскрытые в Brinkman et al., 1995, J. Immunol. Methods 182:41-50; Ames et al., 1995, J. Immunol. Methods 184:177- 186; Kettleborough et al., 1994, Eur. J. Immunol.24:952-958; Persic et al., 1997, Gene 187:9- 18; Burton et al., 1994, Advances in Immunology 57:191-280; заявка PCT РСТ/GB91/01134; Международная публикация WO 90/02809, WO 91/10737, WO 92/01047, WO 92/18619, WO 93/11236, WO 95/15982, WO 95/20401 и WO97/13844; и патенты США 5698426, 5223409, 5403484, 5580717, 5427908, 5750753, 5821047, 5571698, 5427908, 5516637, 5780225, 5658727, 5733743 и 5969108.
[00260] В принципе, клоны синтетических антител отбирают путем скрининга фаговых библиотек, содержащих фаги, которые «отображают» различные фрагменты вариабельной области антитела (Fv), слитые с белком оболочки фага. Такие фаговые библиотеки подвергают скринингу на желаемый антиген. Клоны, экспрессирующие фрагменты Fv, способные связываться с желаемым антигеном, адсорбируются на антигене и, таким образом, отделяются от несвязывающихся клонов в библиотеке. Затем связывающие клоны элюируют с антигена и, необязательно, дополнительно насыщают дополнительными циклами антигенная адсорбция/элюирование.
[00261] Вариабельные домены могут быть функционально «отображаться» на фаге либо как одноцепочечные фрагменты Fv (scFv), в которых VH и VL ковалентно связаны посредством короткого гибкого пептида, либо как фрагменты Fab, в которых каждый слит с константным доменом и нековалентно связан, как описано, например, в Winter et al., 1994, Ann. Rev. Immunol.12:433-55.
[00262] Репертуары генов VH и VL могут быть клонированы независимо с помощью ПЦР и случаным образом рекомбинированы в фаговых библиотеках, в которых затем можно проводить поиск антиген-связывающих клонов, как описано в Winter et al., выше. Библиотеки из иммунизированных источников дают высокоаффинные антитела против иммуногена без необходимости создания гибридом. Альтернативно, можно клонировать репертуар «наивных» последовательностей с получением одного источника антител человека против широкого спектра чужеродных антигенов и аутоантигенов без иммунизации, как описано Griffiths et al., EMBO J, 12: 725-734 (1993). Наконец, библиотеки «наивных» последовательностей также можно получать путем синтеза, клонируя сегменты неранжированных V-генов стволовых клеток, и используя праймеры ПЦР, содержащие случайные последовательности, для кодирования областей CDR3 с высокой вариабельностью и осуществления реаранжировки in vitro, как описано, например, Hoogenboom and Winter, J. Mol. Biol.227:381-88.
[00263] Скрининг библиотек может осуществляться различными методиками, известными в данной области. Например, нектин-4 (например, полипептид нектина-4, фрагмент или эпитоп) можно использоваться для нанесения на лунки адсорбционных планшетов, экспрессировать на клетках-хозяевах, фиксированных на адсорбционных планшетах, или использовать в клеточном сортинге, конъюгировать с биотином для захвата гранулами, покрытыми стрептавидином, или использовать в любом другом методе для библиотек дисплея на основе «пэннинга». Отбор антител с медленной кинетикой диссоциации (например, сильной аффинностью связывания) можно усиливать с помощью промывок в течение длительного времени и моновалентного фагового дисплея, как описано Bass et al., 1990, Proteins 8: 309-14 и WO 92/09690, и используя антиген с низкой плотностью покрытия, как описано в Marks et al., 1992, Biotechnol.10:779-83.
[00264] Антитела против нектина-4 могут быть получены путем создания подходящей процедуры антигенного скрининга для отбора интересующего клона фага с последующим конструированием полноразмерного клона антитела против нектина-4, используя последовательности VH и/или VL (например, последовательности Fv) или различные последовательности CDR последовательностей VH и VL, из представляющего интерес клона фага и подходящие последовательности константной области (например, Fc), описанные Kabat et al., supra.
[00265] Антитела, описанные в настоящем документе, также могут, например, включать химерные антитела. Химерное антитело представляет собой молекулу, в которой разные части антитела получены из разных молекул иммуноглобулина. Например, химерное антитело может содержать вариабельную область моноклонального антитела мыши или крысы, слитую с константной областью антитела человека. Способы получения химерных антител известны в данной области. См., например, Morrison, 1985, Science 229:1202; Oi et al., 1986, BioTechniques 4:214; Gillies et al., 1989, J. Immunol. Methods 125:191-202; и патенты США №№ 5807715, 4816567, 4816397 и 6331415.
[00266] Антитела или антигенсвязывающие фрагменты, полученные с использованием методик, описанных в настоящем документе, могут быть выделены стандартными, хорошо известными методами. Например, антитела или антигенсвязывающие фрагменты могут быть подходящим образом отделены, например, от культуральной среды, асцитной жидкости, сыворотки, лизата клеток, реакционного материала синтеза или тому подобное, обычными процедурами очистки иммуноглобулина, такими как, например, белок А-сефароза, гидроксилапатитная хроматография, гель-электрофорез, диализ или аффинная хроматография. Как используется в настоящем описании, «выделенное» или «очищенное» антитело по существу не содержит клеточного материала или других белков из источника клеток или ткани, из которого получено антитело, или по существу не содержит химических предшественников или других химических веществ при химическом синтезе.
12. Фрагменты антитела
[00267] Настоящее описание раскрывает антитела и фрагменты антител, которые связываются с нектином-4. При определенных обстоятельствах, предпочтительно использовать фрагменты антител, а не полноразмерные антитела. Меньший размер фрагментов дает быстрый клиренс и может обеспечивать улучшенный доступ к клеткам, тканям или органам. Обзор некоторых фрагментов антител дан в Hudson et al., 2003, Nature Med.9:129-34.
[00268] Для получения фрагментов антител были созданы различные методики. Обычно, фрагменты получали путем протеолитического расщепления интактных антител (см., например, Morimoto et al., 1992, J. Biochem. Biophys. Methods 24:107-17; and Brennan et al., 1985, Science 229:81-83). Однако, фрагменты в настоящее время могут быть получены напрямую с помощью рекомбинантных клеток-хозяев. Все фрагменты антител Fab, Fv и scFv могут экспрессироваться и секретироваться из клеток E.coli или дрожжей, что упрощает получение больших количества этих фрагментов. Фрагменты антител могут быть выделены из фаговых библиотек антител, описанных выше. Альтернативно, фрагменты Fab'-SH могут быть непосредственно выделены из E.coli и химически связаны с образованием фрагментов F(ab')2 (Carter et al., 1992, Bio/Technology 10:163-67). Согласно другому подходу фрагменты F(ab')2 могут быть выделены непосредственно из культуры рекомбинантных клеток-хозяев. Фрагмент Fab и F(ab') 2 с повышенным периодом полувыведения in vivo, содержащий остатки эпитопа, связывающего рецептор спасения, описан, например, в патенте США № 5869046. Другие методики получения фрагментов антител будут очевидны специалисту в данной области. В некоторых вариантах осуществления антитело представляет собой одноцепочечный фрагмент Fv (scFv) (см., например, WO 93/16185; патент США №№ 5571894 и 5587458). Fv и scFv имеют интактные сайты объединения, лишенные константных областей; таким образом, они могут использоваться для снижения неспецифического связывания в случае применения in vivo. Слитые белки scFv могут быть сконструированы так, чтобы обеспечить слияние эффекторного белка на амино- или карбокси-конце scFv (см., например, Borrebaeck ed., выше). Фрагмент антитела также может представлять собой «линейное антитело», например, как описано в ссылках, приведенных выше.
[00269] Небольшие структуры, полученные из антител, представляют собой отдельные вариабельные домены (V-домены), также называемые однодоменными антителами (sdAb). У некоторых организмов, верблюды и хрящевые рыбы, часть иммуннной системы представлена высокоаффинными V-подобными однодоменными структурами, находящимися на эквивалентном Fc-домене. (Woolven et al., 1999, Immunogenetics 50: 98-101; and Streltsov et al., 2004, Proc Natl Acad Sci USA.101:12444-49). V-подобные домены (называемые VhH верблюдов и V-NAR акул) обычно имеют длинные поверхностные петли, которые обеспечивают проникновение в полости антигенов-мишеней. Они также стабилизируют выделенные домены VH, закрывая гидрофобные участки на поверхности.
[00270] Эти домены VhH и V-NAR были использованы для создания sdAb. Варианты V-домена человека были сконструированы, используя отбор из фаговых библиотек и другие подходы, которые привели к получению стабильных высокоэффективных связывающих доменов, полученных из VL- и VH-доменов.
[00271] Антитела, описанные в настоящем документе, включают, но ими не ограничиваются, молекулы иммуноглобулина и активные части молекул иммуноглобулина, например, молекулы, которые содержат антиген-связывающий сайт, который связывается с эпитопом нектина-4. Молекулы иммуноглобулина, описанные в настоящем документе, могут быть молекулами любого класса (например, IgG, IgE, IgM, IgD и IgA) или молекулами иммуноглобулина любого подкласса (например, IgG1, IgG2, IgG3, IgG4, IgA1 и IgA2).
[00272] Варианты и производные антител включают функциональные фрагменты антител, которые сохраняют способность связываться с эпитопом нектина-4. Характерные функциональные фрагменты включают Fab-фрагменты (например, фрагмент антитела, который содержит антигенсвязывающий домен и содержит легкую цепь и часть тяжелой цепи, соединенные мостиковую дисульфидной связью); Fab' (например, фрагмент антитела, содержащий один антигенсвязывающий домен, содержащий Fab и дополнительную часть тяжелой цепи, соединенные через шарнирную область); F(ab')2 (например, две молекулы Fab', соединенные межцепочечными дисульфидными связями в шарнирных областях тяжелых цепей; молекулы Fab' могут быть направлены на одинаковые или разные эпитопы); одну цепь, содержащую вариабельную область, также известную как scFv (например, вариабельная антигенсвязывающая детерминантная область одной легкой и тяжелой цепи антитела, связанные вместе цепью из 10-25 аминокислот); дисульфид-связанный Fv или dsFv (например, вариабельная антигенсвязывающая детерминантная область одной легкой и тяжелой цепи антитела, связанные вместе дисульфидной связью); верблюжий VH (например, вариабельная антигенсвязывающая детерминантная область одной тяжелой цепи антитела, в которой некоторые аминокислоты на границе VH, представляют собой аминокислоты, которые обнаружены в тяжелой цепи природных антител верблюда).
13. Гуманизированные антитела
[00273] Антитела, описанные в настоящем документе, могут, например, включать гуманизированные антитела, например, деиммунизированные или составные антитела человека.
[00274] Гуманизированное антитело может содержать последовательности константной области человека. В конкретных вариантах осуществления, гуманизированное антитело может быть выбрано из любого класса иммуноглобулинов, включая IgM, IgG, IgD, IgA и IgE, и любой изотип, включая IgG1, IgG2, IgG3 и IgG4. В определенных вариантах осуществления гуманизированное антитело может содержать константные последовательности легкой цепи каппа или лямбда.
[00275] Гуманизированные антитела могут быть получены с использованием различных методик, известных в данной области, включая, но не ограничиваясь ими, CDR-пересадка (европейский патент № ЕР 239400; международная публикация № WO91/09967; и патенты США №№ 5225539, 5530101 и 5585089), венирование или изменение поверхности (европейские патенты ЕР 592106 и ЕР 519596; Padlan, 1991, Molecular Immunology 28(4/5):489-498; Studnicka et al., 1994, Protein Engineering 7(6):805-814; и Roguska et al., 1994, PNAS 91:969-973), "перетасовка" цепей (патент США № 5565322) и способы, описанные, например, в патенте США № № 6407213, патент США № 5766886, WO9317105, Tan et al., J. Immunol.169:111925 (2002), Caldas et al., Protein Eng.13(5):353-60 (2000), Morea et al., Methods 20(3):26779 (2000), Baca et al., J. Biol. Chem.272(16):10678-84 (1997), Roguska et al., Protein Eng.9(10):895904 (1996), Couto et al., Cancer Res.55 (23 Supp):5973s- 5977s (1995), Couto et al., Cancer Res.55(8):1717-22 (1995), Sandhu JS, Gene 150(2):409-10 (1994), и Pedersen et al., J. Mol. Biol.235(3):959-73 (1994). См. также патентную публикацию США № US2005/0042664 A1 (февраль24-2005), каждый источник включен в настоящий документ посредством ссылки в полном объеме.
[00276] В некоторых вариантах осуществления антитела по настоящему изобретению могут быть гуманизированными антителами, которые связываются с нектином-4, включая нектин-4 человека. Например, гуманизированные антитела по настоящему изобретению могут содержать одну или несколько CDR, как показано в Таблице 1. В данной области известны различные способы гуманизации нечеловеческих антител. Например, гуманизированное антитело может иметь один или несколько аминокислотных остатков, введенных в него из источника, не относящемуся к человеку. Эти аминокислотные остатки, не являются человеческими, часто называют «импортными» остатками, которые обычно берут из «донорного» вариабельного домена. Гуманизация может быть выполнена, например, по методу Jones et al., 1986, Nature 321: 522-25; Riechmann et al., 1988, Nature 332: 323-27; и Verhoeyen et al., 1988, Science 239: 1534-36) путем замены последовательностей гипервариабельных областей соответствующими последовательностями антитела человека.
[00277] В некоторых случаях гуманизированные антитела конструируют путем CDR-пересадки, когда аминокислотные последовательности шести CDR родительского антитела, не являющегося человеческим (например, грызуна), пересаживают на каркас антитела человека. Например, Padlan et al. определили, что лишь приблизительно треть остатков в CDR действительно связывается с антигеном, и назвали их "определяющими специфичность остатками" или SDR (Padlan et al., 1995, FASEB J.9:133-39). При методике пересадки SDR только остатки SDR пересаживают на каркас антитела человека (см., например, Kashmiri et al., 2005, Methods 36:25-34).
[00278] Выбор вариабельных доменов человека, как легких, так и тяжелых, для использования при получении гуманизированных антител может быть важным для снижения антигенности. Например, согласно так называемому методу «наилучшего соответствия» последовательность вариабельного домена антитела, не являющегося человеческим (например, грызуна), подвергают скринингу во всей библиотеки известных последовательностей вариабельного домена человека. Последовательность человека, наиболее близкая к последовательности грызуна, может быть выбрана в качестве человеческого каркаса для гуманизированного антитела (Sims et al., 1993, J. Immunol.151:2296-308; и Chothia et al., 1987, J. Mol. Biol.196:901-17). В другом методе используется конкретный каркас, полученный из консенсусной последовательности всех антител человека из конкретной подгруппы легких или тяжелых цепей. Один и тот же каркас может быть использован для нескольких различных гуманизированных антител (Carter et al., 1992, Proc. Natl. Acad. Sci. USA 89:4285-89; и Presta et al., 1993, J. Immunol. 151:2623-32). В некоторых случаях каркас получен из консенсусных последовательностей наиболее распространенных подклассов человека, подгруппы I VL6 (VL6I) и подгруппы VH III (VHIII). В другом методе гены зародышевой линии человека используются в качестве источника каркасных областей.
[00279] В альтернативной парадигме, основанной на сравнении CDR, называемой супергуманизацией, гомология FR не имеет значения. Метод состоит в сравнении последовательности, не являющейся человеческой, с функциональным репертуаром генов зародышевой линии человека. Затем отбирают гены, кодирующие одинаковые или близкородственные канонические структуры с мышиными последовательностями. Затем, из генов, имеющих общие канонические структуры с антителами, не являющимися человеческими, в качестве доноров FR отбирают гены, которые обладают самой высокой гомологией в CDR. Наконец, CDR, не являющиеся человеческими, пересаживают на эти FR (см., например, Tan et al., 2002, J. Immunol.169:1119-25).
[00280] Кроме того, обычно желательно, чтобы антитела были гуманизированы с сохранением их сродства к антигену и других предпочтительных биологических свойств. Для достижения этой цели, согласно одному из способов, гуманизированные антитела получают с помощью процесса анализа родительских последовательностей и различных концептуальных гуманизированных продуктов, используя трехмерные модели родительских и гуманизированных последовательностей. Трехмерные модели иммуноглобулинов являются общедоступными и известны специалистам в данной области. Доступны компьютерные программы, которые иллюстрируют и показывают возможные трехмерные конформационные структуры выбранных последовательностей иммуноглобулинов-кандидатов. К ним относятся, например, WAM (Whitelegg and Rees, 2000, Protein Eng.13:819-24), Modeller (Sali and Blundell, 1993, J. Mol. Biol.234:779-815), и Swiss PDB Viewer (Guex and Peitsch, 1997, Electrophoresis 18:2714-23). Изучение этих дисплеев позволяет анализировать вероятную роль остатков в функционировании последовательности иммуноглобулина-кандидата, например, анализ остатков, которые влияют на способность иммуноглобулина-кандидата связываться с своим антигеном. Таким образом, остатки FR могут быть выбраны из последовательностей реципиента и донора и объединены с получением желаемой характеристики антитела, такой как повышенная аффинность в отношении антигена(ам)-мишени(ям). В целом, остатки гипервариабельной области непосредственно и наиболее существенно влияют на связывание антигена.
[00281] Еще один способ гуманизации антител основан на системе показателей "очеловеченности" антител, называемой Human String Content (HSC). Этот метод сравнивает последовательность мыши с репертуаром генов зародышевой линии человека, и различия оцениваются как HSC. Последовательность-мишень затем гуманизируют путем приведения к максимальному значению ее HSC, без использования глобальной системы идентификации с получением множества разнообразных гуманизированных вариантов (Lazar et al., 2007, Mol. Immunol.44:1986-98).
[00282] Кроме методов, описанным выше, для создания и отбора гуманизированных антител можно использовать эмпирические методы. Эти методы включают методы, которые основаны на создании больших библиотек гуманизированных вариантов и отборе лучших клонов, используя технологий обогащения или методов высокоэффективного скринига. Варианты антител могут быть выделены из фаговой, рибосомной и дрожжевой библиотек, а также путем скрининга бактериальных колоний (см., например, Hoogenboom, 2005, Nat. Biotechnol.23:1105-16; Dufner et al., 2006, Trends Biotechnol.24:523-29; Feldhaus et al., 2003, Nat. Biotechnol.21:163-70; и Schlapschy et al., 2004, Protein Eng. Des. Sel.17:847-60).
[00283] В подходе с использованием библиотеки FR коллекцию вариантов остатков вводят в определенные положения в FR, а затем осуществляют скрининг библиотеки для отбора FR, которые наилучшим образом сохраняют пересаженную CDR. Остатки, которые должны быть замещены, могут включать некоторые или все остатки «Vernier», идентифицированные как возможно улучшающие структуру CDR (см., например, Foote and Winter, 1992, J. Mol. Biol.224:487-99) или из более ограниченного набора остатков-мишеней, идентифицированных Baca et al. (1997, J. Biol. Chem.272:10678-84).
[00284] При "перетасовке" FR полноразмерные FR комбинировали с CDR, не являющимися человеческими, вместо создания комбинаторных библиотек выбранных вариантов остатков (см., например, Dall'Acqua et al., 2005, Methods 36:43-60). Библиотеки могут быть подвергнуты скринингу на связывание в двухстадийном процессе, сначала гуманизируя VL, а затем VH. Альтернативно, можно использовать одностадийный процесс "перетасовки" FR. Было показано, что такой процесс более эффективен, чем двухстадийный скрининг, поскольку полученные антитела демонстрируют улучшенные биохимические и физико-химические свойства, включая повышенную экспрессию, повышенную аффинность и термическую стабильность (см., например, Damschroder et al., 2007, Mol. Immunol.44:3049-60).
[00285] Метод «очеловечивания» основан на экспериментальной идентификации основных детерминант минимальной специфичности (MSD) и на последовательной замене фрагментов, не являющихся человеческими, в библиотеке человеческих FR и оценке связывания. Он начинается с областей CDR3 цепей VH и VL, отличных от человеческих, и постепенно заменяет другие области нечеловеческого антитела на FR человека, включая CDR1 и CDR2 как VH, так и VL. Эти методы обычно приводят к сохранению эпитопа и идентификации антител из нескольких подклассов с различными CDR V-сегментов человека. "Очеловечивание" позволяет выделять антитела, которые на 91-96% гомологичны генам антител зародышевой линии человека (см., например, Alfenito, Cambridge Healthtech Institute's Third Annual PEGS, The Protein Engineering Summit, 2007).
[00286] Способ «инженерии с учетом данных о последовательностях человека» включает изменение антитела или фрагмента антитела, отличного от человеческого, такого как мышиное, или химерного антитела или фрагмента антитела, путем внесения специфических изменений в аминокислотную последовательность антитела с получением модифицированного антитела с пониженной иммуногенностью для человека, которое при этом сохраняет желательные свойства связывания исходных антител, не являющихся человеческими. Как правило, методика включает классификацию аминокислотных остатков антитела, не являющегося человеческим (например, мышиного), на остатки «низкого риска», «среднего риска» или «высокого риска». Классификацию осуществляют с помощью расчета общего риска/пользы, на основании которого оценивают прогнозируемую выгоду от проведения конкретной замены (например, иммуногенность у людей) по сравнению с риском того, что замена повлияет на сворачивание получаемого антитела. Конкретный аминокислотный остаток человека, подлежащий замене в заданном положении (например, низкий или умеренный риск) последовательности антитела, не являющегося человеческим (например, мышиным), может быть выбран путем выравнивания аминокислотной последовательности вариабельных областей антитела, не являющегося человеческим, и соответствующей области специфической или консенсусной последовательности антитела человека. Аминокислотные остатки в положениях низкого или умеренного риска в последовательности, не являющейся человеческой, могут быть заменены соответствующими остатками последовательности антитела человека согласно этому выравниванию. Методики получения белков с помощью инженерии на основе данных о последовательностях человека, более подробно описаны в Studnicka et al., 1994, Protein Engineering 7: 805-14; патент США №№ 5766886; 5770196; 5821123; и 5869619; и в публикации РСТ WO93/11794.
[00287] Составное антитело человека может быть получено с использованием, например, технологии составного антитела человека (Composite Human Antibody™, Antitope Ltd., Cambridge, United Kingdom). Для создания составных антител человека последовательности вариабельной области конструируют из фрагментов последовательностей вариабельной области множества антител человека, избегая Т-клеточных эпитопов, тем самым минимизируя иммунногенность получаемого антитела. Такие антитела могут содержать последовательности константной области человека, например константные области легкой цепи и/или тяжелой цепи человека.
[00288] Деиммунизированное антитело представляет собой антитело, в котором удалены Т-клеточные эпитопы. Способы получения деиммунизированных антител описаны. См., например, Jones et al., Methods Mol Biol.2009;525:405-23, xiv, и De Groot et al., Cell. Immunol.244:148-153(2006)). Деиммунизированные антитела содержат вариабельные области, в которых отсутствуют эпитопы Т-клеток, и константные области человека. Коротко, VH и VL антитела клонируют, и эпитопы Т-клеток затем идентифицируют путем тестирования перекрывающихся пептидов, полученных из VH и VL антитела, в анализе пролиферации Т-клеток. Т-клеточные эпитопы идентифицируют посредством методов in silico для идентификации связывания пептида с MHC класса II человека. Введение мутаций в VH и VL прекращает связывание с MHC класса II. Затем мутированные VH и VL используются для создания деиммунизированного антитела.
14. Антитела человека
[00289] В конкретных вариантах осуществления антитело является полностью человеческим антителом. Полностью человеческие антитела могут быть получены любым способом, известным в данной области. Антитела против нектина-4 могут быть сконструированы путем объединения последовательности(ей) вариабельного домена клона Fv, выбранных из библиотек фагового дисплея человека, с известной(ыми) последовательностью(ями) константного домена человека, как описано выше. Альтернативно, моноклональные антитела человека против нектина-4 по настоящему изобретению могут быть получены гибридомным методом. Клеточные линии миеломы человека и гетеромиеломы мышь-человек для получения моноклональных антител человека были описаны, например, в Kozbor, 1984, J. Immunol.133:3001-05; Brodeur et al., Monoclonal Antibody Production Techniques and Applications 51-63 (1987); and Boerner et al., 1991, J. Immunol.147:86-95.
[00290] Также можно получать трансгенных животных (например, мышей), которые способны после иммунизации продуцировать полный репертуар антител человека, не продуцируя при этом эндогенный иммуноглобулин. Для создания высокоаффинных моноклональных антител с человеческой последовательностью против широкого спектра возможных терапевтических мишеней используются трансгенные мышей, которые экспрессируют репертуары антител человека (см., например, Jakobovits A., 1995, Curr. Opin. Biotechnol. 6(5):561-66; Brüggemann and Taussing, 1997, Curr. Opin. Biotechnol.8(4):455-58; патент США №№ 6075181 и 6150584; и Lonberg et al., 2005, Nature Biotechnol.23:1117-25).
[00291] Альтернативно, антитело человека может быть получено посредством иммортализации В-лимфоцитов человека, продуцирующих антитело, нацеленное на антиген-мишень (например, такие В-лимфоциты могут быть выделены у индивидуума или могут быть иммунизированы in vitro) (см., например, Cole et al., Monoclonal Antibodies and Cancer Therapy (1985); Boerner et al., 1991, J. Immunol. 147(1):86-95; и патент США № 5750373).
[00292] Для получения антител человека из антител, не являющихся человеческими, например, из антител грызунов, в случае, если антитело человека имеет сходную аффинность и специфичность по сравнению с исходным антителом, не являющегося человеческим, можно использовать "перетасовку" генов. В соответствии с этим способом, который также называется «импринтинг эпитопа» или «управляемая селекция», вариабельная область тяжелой или легкой цепи фрагмента антитела, не являющегося человеческим, полученная методами фагового дисплея, как описано в настоящем документе, заменяется репертуаром генов V-доменов человека, создавая популяцию цепь, не являющаяся человеческой/человеческая цепь scFv или Fab химер. Отбор с помощью антигена приводит к выделению химерного scFv или Fab с цепью, не являющейся человеческой/человеческой цепью, в котором человеческая цепь восстанавливает антигенсвязывающий сайт, разрушенный при удалении соответствующей цепи, не являющейся человеческой, в первичном клоне фагового дисплея (например, управляемая селекция (импрининг эпитопа) партнера цепи, не являющейся человеческой). Если процесс повторяют для замены оставшейся цепи, не являющейся человеческой, то получают человеческое антитело (см., например, PCT WO 93/06213; и Osbourn et al., 2005, Methods 36:61-68). В отличие от традиционной гуманизации антител, не являющихся человеческими, путем CDR-пересадки, эта методика позволяет получать полностью человеческие антитела, которые не имеют остатков FR или CDR нечеловеческого происхождения. Примеры "управляемой селекции" для гуманизации антител мыши против антигенов клеточной поверхности включают фолат-связывающий белок, присутствующий на злокачественных клетках яичников (см., например, Figini et al., 1998, Cancer Res.58:991-96) и CD147, который обладает высокой экспрессией на клетках гепатоцеллюлярной карциномы (см., например, Bao et al., 2005, Cancer Biol. Ther.4:1374-80).
[00293] Возможные недостаток подхода "управляемой селекции" заключается в том, что перетасовка одной цепи антитела при сохранении другой может привести к дрейфу эпитопа. Для сохранения эпитопа, распознаваемого антителами, не являющимися человеческими, можно использовать сохранение CDR (см., например, Klimka et al., 2000, Br. J. Cancer.83:252-60; и Beiboer et al., 2000, J. Mol. Biol. 296:833-49). В этом способе CDR3 VH, не являющаяся человеческой, обычно сохраняется, так как этот CDR может находиться в центре антиген-связывающего сайта и может быть наиболее важной областью антитела для распознавания антигена. Однако, в некоторых случаях CDR3 VH и CDR3 VL, а также CDR2 VH, CDR2 VL и CDR1 VL антитела, не являющегося человеческим, могут быть сохранены.
15. Мультсивалентные антитела
[00294] Мультивалентное антитело может быстрее захватываться (и/или катаболизироваться) клеткой, экспрессирующей антиген, с которым связываются антитела, чем двухвалентное антитело. Антитела по настоящему изобретению могут быть мультивалентными антителами (отличными от антител класса IgM) с тремя или более антигенсвязывающими сайтами (например, четырехвалентными антителами), которые могут быть легко получены путем рекомбинантной экспрессии нуклеиновой кислоты, кодирующей полипептидные цепи антитела. Мультивалентное антитело может содержать домен димеризации и три или более антигенсвязывающих сайтов. В определенных вариантах осуществления домен димеризации содержит (или состоит из) Fc-область или шарнирную область. При таком сценарии антитело будет содержать область Fc и три или более антигенсвязывающих сайта, в направлении аминоконцевой области по отношению к области Fc. В конкретных вариантах осуществления мультивалентное антитело содержит (или состоит из) от трех до приблизительно восьми антигенсвязывающих сайтов. В одном из таких вариантов осуществления мультивалентное антитело содержит (или состоит из) четырех антигенсвязывающих сайтов. Мультивалентное антитело содержит по меньшей мере одну полипептидную цепь (например, две полипептидные цепи), где полипептидная цепь(и) содержит два или более вариабельных домена. Например, полипептидная цепь(и) может содержать VD1-(X1)n-VD2-(X2)n-Fc, где VD1 представляет собой первый вариабельный домен, VD2 представляет собой второй вариабельный домен, Fc представляет собой одну полипептидную цепь области Fc, X1 и X2 представляют собой аминокислоту или полипептид, и n равно 0 или 1. Например, полипептидная цепь(цепи) может содержать: цепь VH-CH1-гибкий линкер-VH-CH1-Fc-область; или цепь VH-CH1-VH-CH1-Fc-область. Мультивалентное антитело по настоящему изобретению может дополнительно содержать по меньшей мере два (например, четыре) полипептида вариабельного домена легкой цепи. Мультивалентное антитело по настоящему изобретению может, например, содержать от примерно двух до примерно восьми полипептидов вариабельного домена легкой цепи. Описанные в настоящем документе полипептиды вариабельного домена легкой цепи содержат вариабельный домен легкой цепи и, необязательно, дополнительно содержат домен CL.
16. Конструирование Fc
[00295] Может быть желательным модифицировать антитело против нектина-4 по настоящему изобретению путем конструирования Fc. В некоторых вариантах осуществления модификация Fc-области антитела приводит к снижению или исчезновению эффекторной функции антитела. В некоторых вариантах осуществления эффекторной функцией является ADCC, ADCP и/или CDC. В некоторых вариантах осуществления эффекторной функцией является ADCC. В других вариантах осуществления эффекторной функцией является ADCP. В других вариантах осуществления эффекторная функция представляет собой CDC. В одном из вариантов осуществления эффекторной функцией является ADCC и ADCP. В одном из вариантов осуществления эффекторная функция представляет собой ADCC и CDC. В одном из вариантов осуществления эффекторной функцией является ADCP и СDC. В одном из вариантов осуществления эффекторная функция представляет собой ADCC, ADCP и CDC. Модификация может быть осуществлена путем введения одной или нескольких аминокислотных замен в Fc-область антитела.
[00296] Для повышения периода полужизни антитела в сыворотке в антитело (особенно во фрагмент антитела) можно включить эпитоп, связывающийся с рецептором спасения, например, как описано в патенте США № 5739277. Термин «эпитоп, связывающися с рецептором спасения» относится к эпитопу Fc-области молекулы IgG (например, IgG1, IgG2, IgG3 или IgG4), который отвечает за повышение периода полужизни в сыворотке in vivo молекулы IgG.
17. Альтернативные связующие агенты
[00297] Настоящее описание раскрывает связывающие агенты, не являющиеся иммуноглобулинами, которые специфически связываются с тем же эпитопом, что и антитело против нектина-4, раскрытое в настоящем описании. В некоторых вариантах осуществления изобретения связывающее средство, не являющееся иммуноглобулином, определено как средство, которое замещает или замещается антителом против нектина-4 по настоящему изобретению в конкурентном анализе связывания. Эти альтернативные связующие агенты могут включать, например, любые сконструированные белковые каркасы, известные в данной области. Такие каркасы могут содержать один или несколько CDR, как показано в Таблице 1. Такие каркасы включают, например, антикалины, которые основаны на липокалиновом каркасе, белковую структуру, характеризующуюся жесткой бета-складчатой структурой, которая поддерживает четыре гипервариабельные петли, которые образуют лигандсвязывающий сайт. Новые свойства специфичности связывания могут быть сконструированы с помощью нацеленного случайного мутагенеза в петлевых областях в сочетании с функциональным «отображением» и «управляемой селекцией» (см., например, Skerra, 2008, FEBS J.275:2677-83). Другие подходящие каркасы могут включать, например, аднектины или монотела на основе десятого внеклеточного домена фибронектина III человека (см., например, Koide and Koide, 2007, Methods Mol. Biol.352: 95-109); аффитела, основанные на Z-домене стафилококкового белка A (см., например, Nygren et al., 2008, FEBS J. 275:2668-76); DARPины, основанные на анкириновых повторяющихся белках (см., например, Stumpp et al., 2008, Drug. Discov. Today 13: 695-701); финомеры, основанные на SH3-домене протеинкиназы Fyn человека (см., например, Grabulovski et al., 2007, J. Biol. Chem.282: 3196-204); аффитины, основанные на Sac7d из Sulfolobus acidolarius (см., например, Kprebrink et al., 2008, J. Mol. Biol.383: 1058-68); аффилины, основанные на y-В-кристаллине (см., например, Ebersbach et al., 2007, J. Mol. Biol. 372: 172-85); авимеры, основанные на А-домене белков мембранных рецепторов (см., например, Silverman et al., 2005, Biotechnol.23: 1556-61); богатые цистеином кноттиновые пептиды (см., например, Kolmar, 2008, FEBS J.275: 2684-90); и сконструированные ингибиторы типа Kunitz (см., например, Nixon and Wood, 2006, Curr. Opin. Drug. Discov. Dev.9:261-68). Обзор приведен, например, в Gebauer and Skerra, 2009, Curr. Opin. Chem. Biol.13:245-55.
18. Скрининг на нектин-4-специфические антитела
[00298] Способы получения антител были описаны выше. Антитела могут быть дополнительно скринированы или отобраны по определенным биологическим характеристикам, таким как специфичность связывания с нектином-4, если требуется. Скрининг антител, специфичных к антигену-мишени, включает два аспекта. Во-первых, скрининг антител для выявления антител, которые не связываются или имеют низкое сродство связывания с образцом, который не содержит нектин-4. В этом аспекте скрининга определяют антитела, которые специфично распознают и связываются с нектином-4, но по существу не распознают или связываются с молекулами, отличными от нектина-4. Во-вторых, скрининг антител для определения тех, которые сильно или с высокой аффинностью связываются с образцом, который содержит нектин-4 В этом аспекте скрининга определяют антитела, которые имеют высокое сродство к нектину-4 и могут давать сильные сигналы детекции в различных анализах, как описано ниже. Скрининг антител в обоих аспектах может быть осуществлен иммуноанализом, дополнительно описанным ниже.
[00299] В определенных вариантах осуществления сначала проводят скрининг антител с помощью ELISA, в котором микротитрационные планшеты покрывают белком нектин-4 или его фрагментом. Клоны антител, которые не связываются или связываются с иммобилизованным нектином-4 со слабой аффиностью, удаляют. В некоторых вариантах осуществления антитела, которые связываются с нектином-4, могут дополнительно подвергаться скринингу на реактивность в иммуноанализе, например, анализе на основе ELISA или анализе Вестерн-блоттинг, в отношению других изоформ нектина, например, используя микротитровальные планшеты, покрытые нектином-1, нектином-2 или нектином-3. Клоны антител, которые взаимодействуют с другой изоформой нектина, удаляют, и клоны антител, которые взаимодействуют только с нектином-4, могут быть отобраны для дальнейшего скрининга.
[00300] Антитела против нектина-4 можно дополнительно подвергать скринингу на их связывание с отрицательными контролями, которые не экспрессируют или экспрессируют нектин-4 на низком уровне. Для такого скрининга связывание различных клонов антител и отрицательных контролей может быть определено с помощью иммуноанализа, например, анализа IHC, анализа ELISA или анализа иммуноблоттинга. Клоны антител, которые взаимодействуют с любыми отрицательными контролями, удаляют. Различные отрицательные контроли (например, разные ткани или клеточные линии, отрицательные по экспрессии нектина-4) могут содержать различный набор молекул, поэтому можно использовать несколько отрицательных контролей для гарантии того, что вероятные антитела против нектина-4 отобраны против разнообразного набора молекул, не являющихся нектином-4.
[00301] Антитела против нектина-4 можно дополнительно подвергать скринингу на связывание с положительными контролями, которые, как известно, экспрессируют нектин-4. Для такого скрининга связывание различных клонов антител и положительных контролей может быть определено с помощью иммуноанализа, например, анализа IHC, анализа ELISA или анализа иммуноблоттинга. Отбирают клоны антител, которые имеют обладают сильным связыванием с положительными контролями. Антитело против нектина-4, которое сильно связывается с положительным контролем и слабо с отрицательным контролем, может быть отобрано в качестве антитела, специфичного в отношении нектина-4. Различия между количеством антитела против нектина-4, связанного с положительным и отрицательным контролем, заключается в специфическом связывании этого антитела против нектина-4 с нектином-4. Специфичное связывание может быть использовано как один из критериев отбора специфичных антител против нектина-4. Специфичное антитело обеспечивает высокоспецифичное связывание в иммуноанализе, как подробно описано ниже.
[00302] В некоторых вариантах осуществления специфичность антитела против нектина-4 можно определить путем корреляции или сравнения антитела против нектина-4, связывающегося с отрицательным и положительным эталонами, имеющими известные уровни экспрессии нектина-4 в этих эталонах, которые определены другими способами. Эталонная экспрессия нектина-4 может быть положительным контролем нектина-4 или отрицательным контролем нектина-4, как описано ниже. Связывание специфического антитела против нектина-4 с образцом или эталоном может коррелировать или быть пропорциональным экспрессии нектина-4 в образце или эталоне. То есть, специфическое антитело против нектина-4 высокоэффективно связывается с образцом или эталоном, который экспрессирует нектин-4 на высоком уровне, умеренно связывается в случае промежуточного уровня экспрессии, слабо связывается в случае низкого уровня экспрессии и минимально связывается (например, связывается примерно на том же уровне, при котором связывалось бы антитело изотипического контроля), которое не экспрессирует нектин-4. Известная экспрессия нектина-4 в отрицательном или положительном контроле может быть определена независимо с помощью анализа кПЦР, как подробно описано ниже. Известная экспрессия нектина-4 также может быть независимо определена с помощью любого нижеописанного иммуноанализа с антителом против нектина-4, которое ранее было определено как специфичное в отношении нектина-4. Подходящие иммуноанализы для подтверждения экспрессии нектина-4 в отрицательном и положительном контролях включают, в качестве примера и без каких-либо ограничений, анализ IHC, анализ иммуноблоттинга, анализ FACS или ELISA, как подробно описано ниже. В некоторых вариантах осуществления уровень мРНК нектина-4 может отличаться не быть нулевым в отрицательном контроле из-за фонового шума анализа или из-за биологически незначительного низкого уровня сохранившегося нектина-4, как описано ниже. Отрицательный контроль нектина-4 можно считать отрицательным для нектина-4, например, если уровень мРНК нектина-4 в анализе кПЦР по существу аналогичен уровню мРНК, обнаруженному с помощью набора неспецифических праймеров, или если уровень мРНК нектина-4 является биологически незначительным в виду уровня мРНК нектина-4 в положительном контроле нектина-4. Аналогично, нектин-4, обнаруживаемый иммуноанализами с использованием другого специфического антитела к нектину-4 в отрицательном контроле, может не быть нулевым из-за фонового шума анализа или из-за биологически незначительного низкого уровня сохранившегося нектина-4. Фоновый шум может быть вызван неспецифическим связыванием реагентов анализа, не являющихся антителом против нектина-4, с образцами. Отрицательный контроль нектина-4 можно считать отрицательным в отношении нектина-4, например, если уровень нектина-4 в отрицательном контроле, обнаруженному с помощью специфического антитела против нектина-4, по существу сходен с уровнем, обнаруженным с помощью антитела изотипического контроля в том же анализе. В некоторых анализах фоновый шум может составлять значительную долю обнаруженного сигнала в положительном контроле.
[00303] Кроме того, положительный и отрицательный контроли были определены и опубликованы специалистами в данной области, включая положительные и/или отрицательные ткани, клетки (включая, например, клеточные линии) и патологические образцы. Такие литературные источники могут быть легко найдены путем поиска в базах данных, таких как Pubmed (например, используя поиск термина, такого как нектин-4, экспрессия, положительный, отрицательный и/или распространение) и анализом результатов поиска.
[00304] Соответственно, относительное количество антитела, специфичного для нектина-4, или его антигенсвязывающего фрагмента, связанного с клеткой отрицательного контроля, не экспрессирующей нектин-4, может составлять примерно 50%, 40%, 30%, 20%, 10%. 5%, 4%, 3%, 2%, 1%, 0,5%, 0,3%, 0,2%, 0,1%, 0,05%, 0,03%, 0,01%, 0,001% или меньше по сравнению с количеством антитела или антигенсвязывающего фрагмента, связанного с клеткой положительного контроля, экспрессирующей нектин-4.
[00305] В некоторых вариантах осуществления антитела или его антигенсвязывающего фрагмента по настоящему изобретению, отрицательную или положительную экспрессию нектина-4 в контрольных клетках независимо определяют с помощью анализа кПЦР, анализа IHC со вторым антителом, анализа иммуноблоттинга со вторым антителом, анализ FACS со вторым антителом или ELISA со вторым антителом.
[00306] В некоторых вариантах осуществления антитела или его антигенсвязывающего фрагмента по настоящему изобретению, количество антитела или его антигенсвязывающего фрагмента, связанного с клетками, определяют путем анализа IHC, анализа иммуноблоттинга, анализа FACS или ELISA. 19. Варианты антител
[00307] В некоторых вариантах осуществления рассматриваются модификация(и) аминокислотной последовательности антител, которые связываются с нектином-4, или которые описаны в настоящем документе. Например, может быть желательно улучшить аффинность связывания и/или другие биологические свойства антитела, включая, но не ограничиваясь этим, специфичность, термостабильность, уровень экспрессии, эффекторные функции, гликозилирование, пониженную иммуногенность или растворимость. Таким образом, кроме антител против нектина-4, описанных в настоящем документе, предполагается, что могут быть получены варианты антител против нектина-4. Например, варианты антител против нектина-4 могут быть получены путем введения соответствующих нуклеотидных изменений в кодирующую ДНК и/или путем синтеза желаемого антитела или полипептида. Специалистам в данной области понятно, что аминокислотные замены могут изменять посттрансляционные процессы антитела против нектина-4, например, изменение количества или положения сайтов гликозилирования или изменение характеристик заякоревания на мембране.
[00308] В некоторых вариантах осуществления глутамин в первом остатке может быть замещен пироглутаматом в любом из антител по настоящему изобретению, к которым также относится полипептид, имеющий первый глутамин в своей последовательности. Такое замещение происходит в природе в физиологических условиях, или in vitro или ex vivo в буфере с pH, равным примерно 7. Такое замещение можно осуществлять, помещая антитело, которое содержит полипептид, содержащий первый глутамин, в условия, благоприятные для циклизация первого глутамина глутаминила с образованием пироглутамата, например, в раствор слабой кислоты, такой как ацетат и трифторацетат.
[00309] В некоторых вариантах осуществления антитела по настоящему изобретению химически модифицированы, например, путем ковалентного связывания молекулы любого типа с антителом. Производные антител могут включать антитела, которые были химически модифицированы, например, путем гликозилирования, ацетилирования, ПЭГилирования, фосфорилирования, амидирования, изменены с помощью известных защитных/блокирующих групп, протеолитическым расщеплением, связыванием с клеточным лигандом или другим белком, и тому подобное. Известными методами, включая, но не ограничиваясь ими, специфичное химическое расщепление, ацетилирование, формилирование, метаболический синтез туникамицина, и тому подобное может быть осуществлена любая из множества химических модификаций. Кроме того, антитела могут содержать одну или более неклассических аминокислот.
[00310] Варианты могут представлять собой замену, делецию или вставку одного или нескольких кодонов, кодирующих антитело или полипептид, что приводит к изменению аминокислотной последовательности по сравнению с антителом или полипептидом с нативной последовательностью. Аминокислотные замены могут быть результатом замены одной аминокислоты другой аминокислотой со сходными структурными и/или химическими свойствами, такой как замена лейцина серином, например консервативные аминокислотные замены. Для введения мутаций в нуклеотидную последовательность, кодирующую молекулу по настоящему изобретению, можно использовать любые стандартные методики, известные специалистам в данной области, включая, например, сайт-направленный мутагенез и ПЦР-опосредованный мутагенез, что приводит к аминокислотным заменам. Инсерции или делеции могут необязательно находиться в диапазоне от 1 до 5 аминокислот. В некоторых вариантах осуществления замена, делеция или вставка включает менее 25 аминокислотных замен, менее 20 аминокислотных замен, менее 15 аминокислотных замен, менее 10 аминокислотных замен, менее 5 аминокислотных замен, менее 4 аминокислотных замен, менее 3 аминокислотных замен или менее 2 аминокислотных замен по сравнению с исходной молекулой. В конкретном варианте осуществления замена представляет собой консервативную аминокислотную замену, выполненную в одном или нескольких спрогнозированных заменимых аминокислотных остатках. Допустимое отклонение может быть определено путем систематического осуществления аминокислотных вставок, делеций или замен в последовательности и тестирования полученных вариантов на активность, проявляемую полноразмерной последовательностью или зрелой нативной последовательностью.
[00311] Вставки в аминокислотную последовательность включают N- и/или C-концевые слитые варианты длиной от одного остатка до полипептидов, содержащих сто или более остатков, а также вставки одного или нескольких аминокислотных остатков внутри последовательности. Примеры концевых вставок включают антитело с N-концевым остатком метионина. Другие варианты вставок молекулы антитела включают слияние на N- или C-конце антитела с ферментом (например, терапия, основанная на пролекарственном ферменте, нацеливаемом антителом) или полипептидом, что повышает период полужизни антитела в сыворотке.
[00312] «Консервативная аминокислотная замена» представляет собой замену, при которой аминокислотный остаток заменяется аминокислотным остатком с боковой цепью, имеющей сходный заряд. В уровне техники были определены семейства аминокислотных остатков, имеющие боковые цепи со сходными зарядами. Эти семьи включают аминокислотные остатки с основными боковыми цепями (например, лизин, аргинин, гистидин), с кислотными боковыми цепями (например, аспарагиновая кислота, глутаминовая кислота), с незаряженными полярными боковыми цепями (например, глицин, аспарагин, глутамин, серин, треонин, тирозин, цистеин), с неполярными боковыми цепями (например, аланин, валин, лейцин, изолейцин, пролин, фенилаланин, метионин, триптофан), с бета-разветвленными боковыми цепями (например, треонин, валин, изолейцин) и с ароматическими боковыми цепями (например, тирозин, фенилаланин, триптофан, гистидин). В качестве альтернативы, мутации могут быть введены случайным образом по всей или части кодирующей последовательности, например, путем насыщающего мутагенеза, и полученные мутанты могут быть подвергнуты скринингу на биологическую активность для выявления мутантов, сохранивших активность. После мутагенеза кодируемый белок может быть экспрессирован и может быть определена активность белка.
[00313] Существенные модификации биологических свойств антитела осуществляются путем выбора замен, которые существенно различаются по своему воздействию на сохранение (а) структуры полипептидного скелета в области замены, например, в виде складчатости или спиральной конформации, (b) заряда или гидрофобности молекулы в мишеневом сайте или (c) размера боковой цепи. Альтернативно, могут быть сделаны консервативные (например, в пределах аминокислотной группы со сходными свойствами и/или боковыми цепями) замены для сохранения свойств или для предотвращения их существенных изменений. Аминокислоты могут быть сгруппированы по сходству в свойствах их боковых цепей (см., например, Lehninger, Biochemistry 73-75 (2d ed.1975)): (1) неполярные: Ala (A), Val (V), Leu (L), Ile (I), Pro (P), Phe (F), Trp (W), Met (M); (2) незаряженные полярные: Gly (G), Ser (S), Thr (T), Cys (C), Tyr (Y), Asn (N), Gln (Q); (3) кислотные: Asp (D), Glu (E); и (4) основные: Lys (K), Arg (R), His(H).
[00314] Альтернативно, природные остатки могут быть разделены на группы на основе общих свойств боковой цепи: (1) гидрофобные: норлейцин, Met, Ala, Val, Leu, Ile; (2) нейтральные гидрофильные: Cys, Ser, Thr, Asn, Gln; (3) кислые: Asp, Glu; (4) основные: His, Lys, Arg; (5) остатки, которые влияют на ориентацию цепи: Gly, Pro; и (6) ароматические: Trp, Tyr, Phe.
[00315] Неконсервативные замены приводят к замене члена одного из этих классов на член другого класса. Такие замещенные остатки также могут быть введены в консервативные сайты замещения или в оставшиеся (неконсервативные) сайты. Соответственно, в одном из вариантов осуществления, антитело или его фрагмент, которое связывается с эпитопом нектина-4, содержит аминокислотную последовательность, которая по меньшей мере на 35%, по меньшей мере на 40%, по меньшей мере на 45%, по меньшей мере на 50%, по меньшей мере на 55% , по меньшей мере на 60%, по меньшей мере на 65%, по меньшей мере на 70%, по меньшей мере на 75%, по меньшей мере на 80%, по меньшей мере на 85%, по меньшей мере на 90%, по меньшей мере на 95% или по меньшей мере на 99% идентичны аминокислотной последовательности моноклонального антитела мыши, как описано в настоящем документе. В одном из вариантов осуществления антитело или его фрагмент, которое связывается с эпитопом нектина-4, содержит аминокислотную последовательность, которая по меньшей мере на 35% идентична аминокислотной последовательности моноклонального антитела мыши, как описано в настоящем документе. В одном из вариантов осуществления антитело или его фрагмент, которое связывается с эпитопом нектина-4, содержит аминокислотную последовательность, которая по меньшей мере на 40% идентична аминокислотной последовательности моноклонального антитела мыши, как описано в настоящем документе. В одном из вариантов осуществления антитело или его фрагмент, которое связывается с эпитопом нектина-4, содержит аминокислотную последовательность, которая по меньшей мере на 45% идентична аминокислотной последовательности моноклонального антитела мыши, как описано в настоящем документе. В одном из вариантов осуществления антитело или его фрагмент, которое связывается с эпитопом нектина-4, содержит аминокислотную последовательность, которая по меньшей мере на 50% идентична аминокислотной последовательности моноклонального антитела мыши, как описано в настоящем документе. В одном из вариантов осуществления антитело или его фрагмент, которое связывается с эпитопом нектина-4, содержит аминокислотную последовательность, которая по меньшей мере на 55% идентична аминокислотной последовательности моноклонального антитела мыши, как описано в настоящем документе. В одном из вариантов осуществления антитело или его фрагмент, которое связывается с эпитопом нектина-4, содержит аминокислотную последовательность, которая по меньшей мере на 60% идентична аминокислотной последовательности моноклонального антитела мыши, как описано в настоящем документе. В одном из вариантов осуществления антитело или его фрагмент, которое связывается с эпитопом нектина-4, содержит аминокислотную последовательность, которая по меньшей мере на 65% идентична аминокислотной последовательности моноклонального антитела мыши, как описано в настоящем документе. В одном из вариантов осуществления антитело или его фрагмент, которое связывается с эпитопом нектина-4, содержит аминокислотную последовательность, которая по меньшей мере на 70% идентична аминокислотной последовательности моноклонального антитела мыши, как описано в настоящем документе. В одном из вариантов осуществления антитело или его фрагмент, которое связывается с эпитопом нектина-4, содержит аминокислотную последовательность, которая по меньшей мере на 75% идентична аминокислотной последовательности моноклонального антитела мыши, как описано в настоящем документе. В одном из вариантов осуществления антитело или его фрагмент, которое связывается с эпитопом нектина-4, содержит аминокислотную последовательность, которая по меньшей мере на 80% идентична аминокислотной последовательности моноклонального антитела мыши, как описано в настоящем документе. В одном из вариантов осуществления антитело или его фрагмент, которое связывается с эпитопом нектина-4, содержит аминокислотную последовательность, которая по меньшей мере на 85% идентична аминокислотной последовательности моноклонального антитела мыши, как описано в настоящем документе. В одном из вариантов осуществления антитело или его фрагмент, которое связывается с эпитопом нектина-4, содержит аминокислотную последовательность, которая по меньшей мере на 90% идентична аминокислотной последовательности моноклонального антитела мыши, как описано в настоящем документе. В одном из вариантов осуществления антитело или его фрагмент, которое связывается с эпитопом нектина-4, содержит аминокислотную последовательность, которая по меньшей мере на 95% идентична аминокислотной последовательности моноклонального антитела мыши, как описано в настоящем документе. В одном из вариантов осуществления антитело или его фрагмент, которое связывается с эпитопом нектина-4, содержит аминокислотную последовательность, которая по меньшей мере на 99% идентична аминокислотной последовательности моноклонального антитела мыши, как описано в настоящем документе.
[00316] В одном из вариантов осуществления, антитело или его фрагмент, которое связывается с эпитопом нектина-4, содержит аминокислотную последовательность, которая по меньшей мере на 35%, по меньшей мере на 40%, по меньшей мере на 45%, по меньшей мере на 50%, по меньшей мере на 55% , по меньшей мере на 60%, по меньшей мере на 65%, по меньшей мере на 70%, по меньшей мере на 75%, по меньшей мере на 80%, по меньшей мере на 85%, по меньшей мере на 90%, по меньшей мере на 95% или по меньшей мере на 99% идентичны аминокислотной последовательности, приведенной таблицах 1-2. В одном из вариантов осуществления антитело или его фрагмент, которое связывается с эпитопом нектина-4, содержит аминокислотную последовательность, которая по меньшей мере на 35% идентична аминокислотной последовательности, приведенной в таблицах 1-2. В одном из вариантов осуществления антитело или его фрагмент, которое связывается с эпитопом нектина-4, содержит аминокислотную последовательность, которая по меньшей мере на 40% идентична аминокислотной последовательности, приведенной в таблицах 1-2. В одном из вариантов осуществления антитело или его фрагмент, которое связывается с эпитопом нектина-4, содержит аминокислотную последовательность, которая по меньшей мере на 45% идентична аминокислотной последовательности, приведенной в таблицах 1-2. В одном из вариантов осуществления антитело или его фрагмент, которое связывается с эпитопом нектина-4, содержит аминокислотную последовательность, которая по меньшей мере на 50% идентична аминокислотной последовательности, как приведенной в таблицах 1-2. В одном из вариантов осуществления антитело или его фрагмент, которое связывается с эпитопом нектина-4, содержит аминокислотную последовательность, которая по меньшей мере на 55% идентична аминокислотной последовательности, приведенной в таблицах 1-2. В одном из вариантов осуществления антитело или его фрагмент, которое связывается с эпитопом нектина-4, содержит аминокислотную последовательность, которая по меньшей мере на 60% идентична аминокислотной последовательности, приведенной в таблицах 1-2. В одном из вариантов осуществления антитело или его фрагмент, которое связывается с эпитопом нектина-4, содержит аминокислотную последовательность, которая по меньшей мере на 65% идентична аминокислотной последовательности, приведенной в таблицах 1-2. В одном из вариантов осуществления антитело или его фрагмент, которое связывается с эпитопом нектина-4, содержит аминокислотную последовательность, которая по меньшей мере на 70% идентична аминокислотной последовательности, приведенной в таблицах 1-2. В одном из вариантов осуществления антитело или его фрагмент, которое связывается с эпитопом нектина-4, содержит аминокислотную последовательность, которая по меньшей мере на 75% идентична аминокислотной последовательности, приведенной в таблицах 1-2. В одном из вариантов осуществления антитело или его фрагмент, которое связывается с эпитопом нектина-4, содержит аминокислотную последовательность, которая по меньшей мере на 80% идентична аминокислотной последовательности, приведенной в таблицах 1-2. В одном из вариантов осуществления антитело или его фрагмент, которое связывается с эпитопом нектина-4, содержит аминокислотную последовательность, которая по меньшей мере на 85% идентична аминокислотной последовательности, приведенной в таблицах 1-2. В одном из вариантов осуществления антитело или его фрагмент, которое связывается с эпитопом нектина-4, содержит аминокислотную последовательность, которая по меньшей мере на 90% идентична аминокислотной последовательности, приведенной в таблицах 1-2. В одном из вариантов осуществления антитело или его фрагмент, которое связывается с эпитопом нектина-4, содержит аминокислотную последовательность, которая по меньшей мере на 95% идентична аминокислотной последовательности, приведенной в таблицах 1-2. В одном из вариантов осуществления антитело или его фрагмент, которое связывается с эпитопом нектина-4, содержит аминокислотную последовательность, которая по меньшей мере на 99% идентична аминокислотной последовательности, приведенной в таблицах 1-2.
[00317] В еще одном варианте осуществления антитело или его фрагмент, которое связывается с эпитопом нектина-4, содержит аминокислотную последовательность CDR VH и/или CDR VL, которая по меньшей мере на 35%, по меньшей мере на 40%, по меньшей мере на 45% , по меньшей мере на 50%, по меньшей мере на 55%, по меньшей мере на 60%, по меньшей мере на 65%, по меньшей мере на 70%, по меньшей мере на 75%, по меньшей мере на 80%, по меньшей мере на 85%, по меньшей мере на 90%, по меньшей мере на 95% или по меньшей мере на 99% идентична аминокислотной последовательности CDR VH, приведенной в таблице 1, и/или аминокислотной последовательности CDR VL, приведенной в таблице 1. В еще одном варианте осуществления антитело или его фрагмент, которое связывается с эпитопом нектина-4, содержит аминокислотную последовательность CDR VH и/или CDR VL, которая по меньшей мере на 35% идентична аминокислотной последовательности CDR VH, приведенной в таблице 1, и/или аминокислотной последовательности CDR VL, приведенной в таблице 1. В еще одном варианте осуществления антитело или его фрагмент, который связывается с эпитопом нектина-4, содержит аминокислотную последовательность VH CDR и/или CDR VL, которая по меньшей мере на 40% идентична аминокислотной последовательности CDR VH, приведенной в таблице 1, и/или аминокислотной последовательности CDR VL, приведенной в таблице 1. В еще одном варианте осуществления антитело или его фрагмент, которое связывается с эпитопом нектина-4, содержит аминокислотную последовательность CDR VH и/или CDR VL, которая по меньшей мере на 45% идентична аминокислотной последовательности CDR VH, приведенной в таблице 1, и/или аминокислотной последовательности CDR VL, приведенной в таблице 1. В еще одном варианте осуществления антитело или его фрагмент, которое связывается с эпитопом нектина-4, содержит аминокислотную последовательность CDR VH и/или CDR VL, которая по меньшей мере на 50% идентична аминокислотной последовательности CDR VH, приведенной в таблице 1, и/или аминокислотной последовательности CDR VL, приведенной в таблице 1. В еще одном варианте осуществления антитело или его фрагмент, который связывается с эпитопом нектина-4, содержит аминокислотную последовательность VH CDR и/или CDR VL, которая по меньшей мере на 55% идентична аминокислотной последовательности CDR VH, приведенной в таблице 1, и/или аминокислотной последовательности CDR VL, приведенной в таблице 1. В еще одном варианте осуществления антитело или его фрагмент, который связывается с эпитопом нектина-4, содержит аминокислотную последовательность VH CDR и/или CDR VL, которая по меньшей мере на 60% идентична аминокислотной последовательности CDR VH, приведенной в таблице 1, и/или аминокислотной последовательности CDR VL, приведенной в таблице 1. В еще одном варианте осуществления антитело или его фрагмент, которое связывается с эпитопом нектина-4, содержит аминокислотную последовательность CDR VH и/или CDR VL, которая по меньшей мере на 65% идентична аминокислотной последовательности CDR VH, приведенной в таблице 1, и/или аминокислотной последовательности CDR VL, приведенной в таблице 1. В еще одном варианте осуществления антитело или его фрагмент, которое связывается с эпитопом нектина-4, содержит аминокислотную последовательность CDR VH и/или CDR VL, которая по меньшей мере на 70% идентична аминокислотной последовательности CDR VH, приведенной в таблице 1, и/или аминокислотной последовательности CDR VL, приведенной в таблице 1. В еще одном варианте осуществления антитело или его фрагмент, который связывается с эпитопом нектина-4, содержит аминокислотную последовательность VH CDR и/или CDR VL, которая по меньшей мере на 75% идентична аминокислотной последовательности CDR VH, приведенной в таблице 1, и/или аминокислотной последовательности CDR VL, приведенной в таблице 1. В еще одном варианте осуществления антитело или его фрагмент, который связывается с эпитопом нектина-4, содержит аминокислотную последовательность VH CDR и/или CDR VL, которая по меньшей мере на 80% идентична аминокислотной последовательности CDR VH, приведенной в таблице 1, и/или аминокислотной последовательности CDR VL, приведенной в таблице 1. В еще одном варианте осуществления антитело или его фрагмент, которое связывается с эпитопом нектина-4, содержит аминокислотную последовательность CDR VH и/или CDR VL, которая по меньшей мере на 85% идентична аминокислотной последовательности CDR VH, приведенной в таблице 1, и/или аминокислотной последовательности CDR VL, приведенной в таблице 1. В еще одном варианте осуществления антитело или его фрагмент, которое связывается с эпитопом нектина-4, содержит аминокислотную последовательность CDR VH и/или CDR VL, которая по меньшей мере на 90% идентична аминокислотной последовательности CDR VH, приведенной в таблице 1, и/или аминокислотной последовательности CDR VL, приведенной в таблице 1. В еще одном варианте осуществления антитело или его фрагмент, которое связывается с эпитопом нектина-4, содержит аминокислотную последовательность CDR VH и/или CDR VL, которая по меньшей мере на 95% идентична аминокислотной последовательности CDR VH, приведенной в таблице 1, и/или аминокислотной последовательности CDR VL, приведенной в таблице 1. В еще одном варианте осуществления антитело или его фрагмент, которое связывается с эпитопом нектина-4, содержит аминокислотную последовательность CDR VH и/или CDR VL, которая по меньшей мере на 99% идентична аминокислотной последовательности CDR VH, приведенной в таблице 1, и/или аминокислотной последовательности CDR VL, приведенной в таблице 1.
[00318] Варианты могут быть сделаны с использованием способов, известных в данной области, таких как олигонуклеотид-опосредованный (сайт-направленный) мутагенез, аланиновое сканирование и ПЦР-мутагенез. Сайт-направленный мутагенез (см., например, Carter, 1986, Biochem J.237:1-7; и Zoller et al., 1982, Nucl. Acids Res.10: 6487-500), кассетный мутагенез (см., например, Wells et al., 1985, Gene 34: 315-23) или другие известные методики могут быть применены к клонированной ДНК для получения варианта ДНК антитела против нектина-4.
[00319] Любой остаток цистеина, не участвующий в поддержании правильной конформации антитела против нектина-4, также может быть замещен, например, другой аминокислотой, такой как аланин или серин, для улучшения окислительной стабильности молекулы и для предотвращения аберрантного сшивания. И наоборот, цистеиновую связь(и) можно добавить к антителу против нектина-4 для улучшения его стабильности (например, если антитело представляет собой фрагмент антитела, такой как Fc-фрагмент).
[00320] В некоторых вариантах осуществления молекула антитела против нектина-4 по настоящему изобретению представляет собой «деиммунизированное» антитело. «Деиммунизированное» антитело против нектина-4 представляет собой антитело, полученное из гуманизированного или химерного антитела против нектина-4, которое имеет одно или несколько изменений в своей аминокислотной последовательности, что приводит к снижению иммуногенности антитела по сравнению с соответствующим исходным неиммунизированным антителом. Одна из процедур получения таких мутантов антител включает идентификацию и удаление Т-клеточных эпитопов молекулы антитела. На первой стадии иммуногенность молекулы антитела может быть определена несколькими методами, например, путем определения T-клеточных эпитопов in vitro или прогнозирования таких эпитопов in vitro, что известно в данной области. Как только критические остатки для функционирования Т-клеточного эпитопа были идентифицированы, могут быть сделаны мутации для удаления иммуногенности и сохранения активности антител. Обзор дан, например, в Jones et al., 2009, Methods in Molecular Biology 525: 405-23.
20. Созревание аффинности in vitro
[00321] В некоторых вариантах осуществления варианты антител, обладающие улучшенными свойствами, такими как аффинность, стабильность или уровень экспрессии, по сравнению с исходным антителом, могут быть получены путем созревания аффинности in vitro. Как и природный прототип, созревание аффинности in vitro основано на принципах мутации и отбора. Библиотеки антител отображаются как Fab-, scFv-фрагменты или фрагменты V-доменов или на поверхности организма (например, фага, бактерии, дрожжевой клетки или клетки млекопитающего) или как связывание (например, ковалентное или нековалентное) с их кодирующей мРНК или ДНК. Аффинная селекция отображаемых антител позволяет выделить организмы или комплексы, несущие генетическую информацию, кодирующую антитела. Два или три раунда мутации и селекции с использованием таких методов на основе дисплея, таких как фаговый дисплей, обычно приводит к фрагментам антител со сродством в низком наномолярном диапазоне. Антитела со зрелой аффинностью могут иметь наномолярное или даже пикомолярное сродство к мишеневому антигену.
[00322] Фаговый дисплей представляет собой широко распространенный метод на основе дисплея и отбора антител. Антитела располагаются на поверхность бактериофагов Fd или M13 как слитые конструкции с белком оболочки бактериофага. Селекция включает воздействие антигена для возможности антител, располагающимся на фаге, связываться с их мишенями, этот процесс называется «пэннинг». Фаг, связанный с антигеном, извлекают и используют для заражения бактериями и получения фагов для дальнейших циклов селекции. Обзор приведен, например, в Hoogenboom, 2002, Methods. Mol. Biol.178: 1-37; и Bradbury and Marks, 2004, J. Immunol. Methods 290: 29-49.
[00323] В системе дрожжевого дисплея (см., например, Boder et al., 1997, Nat. Biotech.15: 553-57; и Chao et al., 2006, Nat. Protocols 1: 755-68), антитело может располагаться в виде одноцепочечных вариабельных слитых конструкций (scFv), в которых тяжелые и легкие цепи связаны гибким линкером. ScFv слит с адгезионной субъединицей дрожжевого белка агглютинина Aga2p, который прикрепляется к клеточной стенке дрожжей посредством дисульфидных связей с Aga1p. Расположение белка с помощью Aga2p проецирует белок в сторону, противоположную от поверхности клетки, сводя к минимуму возможные взаимодействия с другими молекулами на клеточной стенке дрожжей. Магнитное разделение и проточная цитометрия используют для скрининга библиотеки для селекции антител с улучшенной аффинностью или стабильностью. Связывание с представляющим интерес растворимым антигеном определяют с помощью мечения дрожжей биотинилированным антигеном и вторичным реагентом, таким как стрептавидин, конъюгированный с флуорофором. Изменения в поверхностной экспрессии антитела могут быть измерены с помощью иммунофлуоресцентного мечения либо гемагглютинина, либо тага эпитопа c-Myc, фланкирующего scFv. Было показано, что экспрессия коррелирует со стабильностью представленного на поверхности белка, и, таким образом, антитела могут быть отобраны по улучшенной стабильности, а также аффинности (см., например, Shusta et al., 1999, J. Mol. Biol.292:949-56). Дополнительное преимущество дрожжевого дисплея заключается в том, что представляемые белки сворачиваются в эндоплазматическом ретикулуме эукариотических дрожжевых клеток, используя преимущества шаперонов эндоплазматического ретикулума и механизм контроля качества. После окончания созревание, аффинность антитела можно удобным образом «титровать», пока антитело находится на поверхности дрожжей, что устраняет необходимость в экспрессии и очистке каждого клона. Теоретическим ограничением дрожжевого дисплея является потенциально меньший размер рабочей библиотеки по сравнению с другими методами дисплея; однако в недавнем подходе использовали систему спаривания дрожжевых клеток для создания комбинаторного разнообразия, размер которого был оценен в 10 14 (см., например, патентную публикацию США 2003/0186374; и Blaise et al., 2004, Gene 342: 211-18).
[00324] При рибосомном дисплее комплексы антитело-рибосома-мРНК (ARM) создают для селекции в бесклеточной системе. Библиотека ДНК, кодирующая конкретную библиотеку антител, генетически гибридируют со спейсерной последовательностью, в которой отсутствует стоп-кодон. Эта спейсерная последовательность, если транслируется, остается прикрепленной к пептидильной тРНК и занимает рибосомный туннель что, таким образом, позволяет представляющему интерес белку выступать из рибосомы и сворачиваться. Полученный комплекс мРНК, рибосомы и белка может связываться с поверхностно-связанным лигандом, что позволяет одновременно выделять антитело и его кодирующую мРНК посредством аффинного захвата с лигандом. Связанную с рибосомами мРНК затем транскрибируют обратно в кДНК, которую затем можно подвернуть мутагенезу и использовать в следующем раунде селекции (см., например, Fukuda et al., 2006, Nucleic Acids Res. 34:e127). При мРНК дисплее ковалентная связь между антителом и мРНК устанавливается с использованием пуромицина в качестве молекулы-адаптера (Wilson et al., 2001, Proc. Natl. Acad. Sci. USA 98:3750-55).
[00325] Поскольку эти способы осуществляют полностью in vitro, они обеспечивают два основных преимущества по сравнению с другими технологиями селекции. Во-первых, разнообразие библиотеки не ограничивается эффективностью трансформации бактериальных клеток, а только количеством рибосом и различных молекул мРНК, находящихся в аналитической пробирке. Во-вторых, случайные мутации могут быть легко введены после каждого раунда селекции, например, с помощью некорректирующих полимераз, поскольку ни одна библиотека не должна трансформироваться после любой стадии диверсификации.
[00326] В системе дисплея на основе клеток млекопитающих (см., например, Bowers et al., 2011, Proc Natl Acad Sci USA.108:20455-60), библиотека полностью человеческих IgG конструируют на основе последовательности зародышевой линии сегментов V-гена, соединенных с предварительно рекомбинированными областями D(J). Проводят сборку полноразмерных V-областей тяжелой цепи и легкой цепи вместе с константными областями тяжелой цепи и легкой цепи человека и трансфицируют в клеточную линию млекопитающих (например, HEK293). Трансфицированную библиотеку увеличивают и подвергают нескольким раундам отрицательной селекции против стрептавидина (SA) на магнитных шариках, после чего проводят раунд положительной селекции против SA на магнитных шариков, покрытых биотинилированным мишеневым белком, пептидным фрагментом или эпитопом. Клетки, отобранные при положительной селекции, увеличивают в количестве, а затем сортируют с помощью раундов FACS для выделения клонов отдельных клеток, содержащих антитела, которые специфически связываются с мишеневым белком, пептидным фрагментом или эпитопом. Пары тяжелых и легких цепей этих одноклеточных клонов ретрансфицируют с помощью AID для дальнейшего созревания. Несколько раундов дисплея на основе клеток млекопитающих в сочетании с соматической гипермутацией, вызванной AID, дают антитела с высокой специфичностью и высокой аффинностью.
[00327] Разнообразие также может быть введено в CDR или целые V-гены библиотек антител нацеленным образом или путем случайного введения. Этот подход включает последовательный прицельный мутагенез на высоком или низком уровне на все CDR антитела или прицельное воздействие на "горячие точки" соматических гипермутаций (см., например, Ho et al., 2005, J. Biol. Chem.280: 607-17) или на остатки, предположительно влияющие на сродство, на экспериментальной основе или по структурным причинам. Разнообразие также может быть получено путем замены областей, которые различаются в природе, посредством перетасовки ДНК или аналогичных методов (см., например, Lu et al., 2003, J. Biol. Chem. 278:43496-507; патент США №№5565332 и 6989250). Альтернативные методы направлены на гипервариабельные петли, распространяющиеся в остатки каркасной области (см., например, Bond et al., 2005, J. Mol. Biol.348:699-709), используя делецию петель и вставки в CDR или диверсификацию на основе гибридизации (см., например, патентная публикация США № №2004/0005709). Дополнительные методы получения различий в CDR описаны, например, в патенте США № 7985840. Другие способы, которые можно использовать для создания библиотек антител и/или созревания аффинности антител, раскрыты, например, в патентах США №№ 8685987 и 8603990, а также в публикациях США №№ 2014/0170705, 2014/0094392, 2012/0028301, 2011/0183855 и 2009/0075378, каждый документ включен в настоящий документ в качестве ссылки.
[00328] Скрининг библиотек может осуществляться различными методиками, известными в данной области. Например, нектин-4 может быть иммобилизован на твердых подложках, колонках, стрежнях или целлюлозно-поли(винилиденфторидных) мембранах/других фильтрах, экспрессирован на клетках-хозяевах, фиксированных на адсорбционных пластинах, или использован при сортировке клеток, или конъюгирован с биотином для захвата гранулами, покрытыми стрептавидином или использован в любом другом методе для пэнинга библиотек дисплея.
[00329] Обзор методов созревания аффинности in vitro представлен, например, в Hoogenboom, 2005, Nature Biotechnology 23: 1105-16; Quiroz and Sinclair, 2010, Revista Ingeneria Biomedia 4: 39-51; и приводится в качестве ссылки в настоящем документе.
21. Модификации антител против нектина-4.
[00330] Ковалентные модификации антител против нектина-4 включены в объем настоящего изобретения. Ковалентные модификации включают взаимодействие мишеневых аминокислотных остатков антитела против нектина-4 с агентом, содержащим функциональные органические группы, который способен реагировать с выбранными боковыми цепями или N- или С-концевыми остатками антитела против нектина-4. Другие модификации включают дезамидирование глутаминильных и аспарагинильных остатков до соответствующих глутамильных и аспартильных остатков, соответственно, гидроксилирование пролина и лизина, фосфорилирование гидроксильных групп серильных или треонильных остатков, метилирование α-аминогрупп боковой цепи лизина, аргинина и гистидина (см., например, Creighton, Proteins: Structure and Molecular Properties 79-86 (1983)), ацетилирование N-концевого амина и амидирование любой C-концевой карбоксильной группы.
[00331] Другие типы ковалентной модификации антитела против нектина-4, включенные в объем настоящего изобретения, включают изменение нативного характера гликозилирования антитела или полипептида (см., например, Beck et al., 2008, Curr. Pharm. Biotechnol.9:482-501; and Walsh, 2010, Drug Discov. Today 15:773-80) и связывание антитела с одним из множества непротеиновых полимеров, например, полиэтиленгликолем (PEG), полипропиленгликолем или полиоксиалкиленами, способом, изложенным, например, в патентах США №№ 4640835; 4496689; 4301144; 4670417; 4791192; или 4179337.
[00332] Антитело против нектина-4 по настоящему изобретению также может быть модифицировано с образованием химерных молекул, содержащих антитело против нектина-4, слитых с другим, гетерологичным полипептидом или аминокислотной последовательностью, например, с тагом эпитопа (см. например, Terpe, 2003, Appl. Microbiol. Biotechnol.60:523-33) или Fc-областью молекулы IgG (см., например, Aruffo, Antibody Fusion Proteins 221-42 (Chamow and Ashkenazi eds., 1999)).
[00333] Настоящее описание также раскрывает слитые белки, содержащие антитело по настоящему изобретению, которое связывается с антигеном нектином-4 и гетерологичным полипептидом. В некоторых вариантах осуществления гетерологичный полипептид, с которым слито антитело, может быть эффективно для нацеливания антитела на клетки c экспрессированным на клеточной поверхности нектином-4.
[00334] В настоящем описании также раскрыты панели антител, которые связываются с антигеном нектином-4. В конкретных вариантах осуществления панели антител имеют разные скорости ассоциации, разные скорости диссоциации, разное средство к антигену нектину-4 и/или разную специфичность для антигена нектина-4. В некоторых вариантах осуществления панели содержат или состоят из около 10, около 25, около 50, около 75, около 100, около 125, около 150, около 175, около 200, около 250, около 300, около 350, около 400, около 450, около 500, около 550, около 600, около 650, около 700, около 750, около 800, около 850, около 900, около 950 или около 1000 антител или более. Панели антител можно использовать, например, в 96-луночных или 384-луночных планшетах для анализов, таких как ELISA.
22. Получение антител против нектина-4
[00335] Антитела против нектина-4 могут быть получены путем культивирования клеток, трансформированных или трансфицированных вектором, содержащим нуклеиновые кислоты, кодирующие антитела против нектина-4.
Последовательности полинуклеотидов, полипептидные компоненты антитела по настоящему изобретению, можно получать стандартными методами рекомбинации. Желаемые последовательности полинуклеотидов можно выделять и секвенировать из клеток, продуцирующих антитела, таких как гибридомные клетки. Альтернативно, полинуклеотиды можно синтезировать с помощью синтезатора нуклеотидов или методом ПЦР. После получения последовательности, кодирующие полипептиды, встраивают в рекомбинантный вектор, способный реплицироваться и экспрессировать гетерологичные полинуклеотиды в клетках-хозяевах. Большое число векторов, которые доступны и известны в данной области, можно использовать для целей настоящего описания. Селекция подходящего вектора зависит главным образом от размера нуклеиновых кислот, которые будут встроены в вектор, и конкретной клетки-хозяина, которая должна быть трансформирована с помощью вектора. Клетки-хозяева, подходящие для экспрессии антител по настоящему изобретению, включают прокариоты, такие как Archaebacteria и Eubacteria, включая грамотрицательные или грамположительные организмы, эукариотические микроорганизмы, такие как нитчатые грибы или дрожжи, клетки беспозвоночных, такие как клетки насекомых или растений, и клетки позвоночных, такие как линии клеток-хозяев млекопитающих. Клетки-хозяева трансформируют описанными выше векторами экспрессии и культивируют в обычных питательных средах, модифицированных, если необходимо, для индукции промоторов, выбора трансформантов или амплификации генов, кодирующих желаемые последовательности. Антитела, продуцируемые клетками-хозяевами, очищают с использованием стандартных способов очистки белка, известных в данной области.
[00336] Способы получения антител, включая конструирование вектора, экспрессию и очистку, дополнительно описаны в Plückthun et al., Antibody Engineering: Producing antibodies in Escherichia coli: From PCR to fermentation 203-52 (McCafferty et al. eds., 1996); Kwong and Rader, E. coli Expression and Purification of Fab Antibody Fragments, in Current Protocols in Protein Science (2009); Tachibana and Takekoshi, Production of Antibody Fab Fragments in Escherischia coli, in Antibody Expression and Production (Al-Rubeai ed., 2011); and Therapeutic Monoclonal Antibodies: From Bench to Clinic (An ed., 2009).
[00337] Разумеется, предполагается, что альтернативные способы, которые хорошо известны в данной области, можно использовать для получения антител против нектина-4. Например, подходящая аминокислотная последовательность или ее части могут быть получены прямым пептидным синтезом с использованием твердофазных методов (см., например, Stewart et al., Solid-Phase Peptide Synthesis (1969); и Merrifield, 1963, J. Am Chem. Soc.85:2149-54). Синтез белка in vitro может быть осуществлен, используя автоматизированные или не автоматизированные методы. Различные части антитела против нектина-4 могут быть химически синтезированы отдельно и объединены с использованием химических или ферментативных методов для получения желаемого антитела против нектина-4. Альтернативно, антитела могут быть очищены от клеток или биологических жидкостей, таких как молоко, трансгенного животного, сконструированного для экспрессии антитела, как описано, например, в патенте США №№ 5545807 и 5827690.
23. Иммуноконъюгаты
[00338] В настоящем описании также раскрыты конъюгаты, содержащие любое антитело против нектина-4 по настоящему изобретению, ковалентно связанное синтетическим линкером с одним или несколькими агентами, не являющимися антителами.
[00339] В некоторых вариантах осуществления антитела по настоящему изобретению конъюгированы или рекомбинантно слиты, например, с диагностической или обнаруживаемой молекулой. Конъюгированные или рекомбинантно слитые антитела можно использовать, например, для мониторинга или прогнозирования начала, развития, прогрессирования и/или тяжести нектин-4-опосредованного заболевания.
[00340] Такая диагностика и детекция может быть осуществлена, например, путем присоединения антитела к детектируемому веществу включая, но ими не ограничиваясь, различные ферменты, такие как, но ими не ограничиваясь, пероксидаза хрена, щелочная фосфатаза, бета-галактозидаза или ацетилхолинэстераза; к простетическим группам, таким как, но ими не ограничиваясь, стрептовидин/биотин или авидин/биотин; к флуоресцентным веществам, таким как, но ими не ограничиваясь, умбеллиферон, флуоресцеин, изотиоцинат флуоресцеина, родамин, дихлортриазиниламин флуоресцеин, дансилхлорид или фикоэритрин; к люминесцентным веществам, таким как, но ими не ограничиваясь, люминол; к биолюминесцентным веществам, таким как, но ими не ограничиваясь, люцифераза, люциферин или экворин; к хемилюминесцентным веществам, таким как, но ими не ограничиваясь, соединение на основе акридиния или HALOTAG; к радиоактивным соединениям, таким как, но ими не ограничиваясь, йод (131I, 125I, 123I, and 121I,), углерод 14C), сера (35S), тритий (3H), индий (115In, 113In, 112In и 111In), технеций (99Tc), таллий (201Ti), галлий (68Ga и 67Ga), палладий (103Pd), молибден (99Mo), ксенон (133Xe), фтор (18F), 153Sm, 177Lu, 159Gd, 149Pm, 140La, 175Yb, 166Ho, 90Y, 47Sc, 186Re, 188Re, 142Pr, 105Rh, 97Ru, 68Ge, 57Co, 65Zn, 85Sr, 32P, 153Gd, 169Yb, 51Cr, 54Mn, 75Se, 113Sn или 117Sn; к позитронно-активным металлам, используя различные позитронно-эмиссионные томографы; и к нерадиоактивным ионам парамагнитного металла.
[00341] В описании также раскрыты антитела, которые рекомбинантно слиты или химически конъюгированы (ковалентно или нековалентно связаны) с гетерологичным белком или полипептидом (или его фрагментом, например, с полипептидом длиной примерно 10, примерно 20, примерно 30, примерно 40, примерно 50, примерно 60, примерно 70, примерно 80, примерно 90 или примерно 100 аминокислот) для получения слитых белков, а также их применения. В частности, в описании раскрыты слитые белки, содержащие антигенсвязывающий фрагмент антитела по настоящему изобретению (например, Fab-фрагмент, Fc-фрагмент, Fv-фрагмент, F(ab)2-фрагмент, VH-домен, CDR VH, VL-домен или CDR VL) и гетерологичный белок, полипептид или пептид. В одном из вариантов осуществления гетерологичный белок, полипептид или пептид, с которым слито антитело, может использоваться для нацеливания антитела на конкретный тип клеток, например, на клетки, которые экспрессирует нектин-4. Например, антитело, которое связывается с рецептором клеточной поверхности, экспрессируемым конкретным типом клеток, может быть слитым или конъюгированным с модифицированным антителом по настоящему изобретению.
[00342] Кроме того, антитела по настоящему изобретению могут быть слиты с маркерными или «таг» последовательностями, такими как пептид, для облегчения очистки. В конкретных вариантах осуществления аминокислотная последовательность маркера или тага представляет собой гекса-гистидиновый пептид, такой как таг, введенный в вектор pQE (см., например, QIAGEN, Inc.), помимо прочего, большинство из которых являются коммерчески доступными. Например, как описано в Gentz et al., 1989, Proc. Natl. Acad. Sci. USA 86:821-24, гексагистидин обеспечивает удобную очистку слитого белка. Другие пептидные таги, используемые для очистки, включают, но не ограничиваются ими, гемагглютининовый таг («HA»), который соответствует эпитопу, полученному из белка гемагглютинина гриппа (Wilson et al., 1984, Cell 37:767-78), связывающий пептид стрепатвидин/авидин и таг "FLAG".
[00343] Известны способы получения слитых конструкций или конъюгирования (в том числе полипептидов) с антителами (см., например, Arnon et al., Monoclonal Antibodies for Immunotargeting of Drugs in Cancer Therapy, in Monoclonal Antibodies and Cancer Therapy 243-56 (Reisfeld et al. eds., 1985); Hellstrom et al., Antibodies for Drug Delivery, in Controlled Drug Delivery 623-53 (Robinson et al. eds., 2d ed.1987); Thorpe, Antibody Carriers of Cytotoxic Agents in Cancer Therapy: A Review, in Monoclonal Antibodies: Biological and Clinical Applications 475-506 (Pinchera et al. eds., 1985); Analysis, Results, and Future Prospective of the Therapeutic Use of Radiolabeled Antibody in Cancer Therapy, in Monoclonal Antibodies for Cancer Detection and Therapy 303-16 (Baldwin et al. eds., 1985); Thorpe et al., 1982, Immunol. Rev.62:119-58; патент США Nos.5,336,603; 5622929; 5359046; 5349053; 5447851; 5723125; 5783181; 5908626; 5844095; и 5112946; ЕР 307344; EP 367,166; EP 394827; Публикации РСТ WO 91/06570, WO 96/04388, WO 96/22024, WO 97/34631 и WO 99/04813; Ashkenazi et al., 1991, Proc. Natl. Acad. Sci. USA, 88: 10535-39; Traunecker et al., 1988, Nature, 331:84-86; Zheng et al., 1995, J. Immunol.154:5590-600; and Vil et al., 1992, Proc. Natl. Acad. Sci. USA 89:11337-41).
[00344] Слитые белки могут быть получены, например, с помощью методов перетасовки генов, перетасовки мотивов, перетасовки экзонов и/или перетасовки кодонов (вместе называются «перетасовка ДНК»). Перетасовка ДНК может быть использована для изменения активности антител против нектина-4, как предусмотрено в настоящем документе, включая, например, антитела с более высоким сродством и более низкой скоростью диссоциации (см., например, патент США № 5605793; 5811238; 5830721; 5834252; и 5837458; Patten et al., 1997, Curr. Opinion Biotechnol.8:724-33; Harayama, 1998, Trends Biotechnol.16(2):76-82; Hansson et al., 1999, J. Mol. Biol.287:265-76; and Lorenzo and Blasco, 1998, Biotechniques 24(2):308-13). Антитела или кодируемые антитела могут быть изменены за счет случайного мутагенеза посредством ПЦР с ошибками, вставок случайных нуклеотидов или других методов перед рекомбинацией. Полинуклеотид, кодирующий антитело по настоящему изобретению, может быть рекомбинирован с одним или несколькими компонентами, мотивами, секциями, частями, доменами, фрагментами и тому подобное, одной или нескольких гетерологичных молекул.
[00345] Антитело по настоящему изобретению также может быть конъюгировано со вторым антителом, образуя гетероконъюгат антитела, как описано, например, в патенте США № 4676980.
[00346] Антитела, которые связываются с нектином-4, также могут быть присоединены к твердым носителям, которые особенно удобно использовать для иммунологических анализов или очистки мишеневого антигена. Такие твердые носители включают, но не ограничиваются ими, стекло, целлюлозу, полиакриламид, нейлон, полистирол, поливинилхлорид или полипропилен.
[00347] Линкер может представлять собой «расщепляемый линкер», способствующий высвобождению конъюгированного агента в клетку, но настоящее изобретение также включает нерасщепляемые линкеры. Линкеры для использования в конъюгатах по настоящему изобретению включают, но ими не ограничиваются, лабильные кислотные линкеры (например, гидразоновые линкеры), дисульфид-содержащие линкеры, чувствительные к пептидазе линкеры (например, пептидные линкеры, содержащие аминокислоты, например, валин и/или цитруллин, такой как цитруллин-валин или фенилаланин-лизин), фотолабильные линкеры, диметиловые линкеры (см., например, Chari et al., 1992, Cancer Res.52:127-31; и патент США № 5208020), тиоэфирные линкеры или гидрофильные линкеры, созданные против возникновения мультилекарственной резистентности, опосредованной переносчиком лекарственных средств (см., например, Kovtun et al., 2010, Cancer Res. 70: 2528-37).
[00348] Конъюгаты антитела и агента могут быть получены с использованием множества бифункциональных белковых связующих агентов, таких как BMPS, EMCS, GMBS, HBVS, LC-SMCC, MBS, MPBH, SBAP, SIA, SIAB, SMCC, SMPB, SMPH, сульфо-EMCS, сульфо-GMBS, сульфо-KMUS, сульфо-MBS, сульфо-SIAB, сульфо-SMCC, сульфо-SMPB и SVSB (сукцинимидил-(4-винилсульфон)бензоат). Настоящее описание также предусматривает, что конъюгаты антител и агентов могут быть получены с использованием любых подходящих способов, которые раскрыты в данной области (см., например, Bioconjugate Techniques (Hermanson ed., 2d ed.2008)).
[00349] Обычные стратегии конъюгирования антител и агентов основаны на случайной химии конъюгации, включая ε-аминогруппу остатков Lys или тиольную группу остатков Cys, что дает гетерогенные конъюгаты. Недавно разработанные методы обеспечивает сайт-специфическое конъюгирование с антителами, что приводит к равномерной нагрузке и позволяет избежать субпопуляций конъюгатов с измененной антигенсвязывающей или фармакокинетической активностью. К ним относится конструирование «тиоMab», содержащих замены цистеина в положениях на тяжелых и легких цепях, что обеспечивает реактивные тиоловые группы и не нарушает скручивание и сборку иммуноглобулинов или не изменяет антигенное связывание (см., например, Junutula et al., 2008, J. Immunol. Meth.332: 41-52; and Junutula et al., 2008, Nature Biotechnol.26:925-32). В другом способе селеноцистеин котрансляционно встраивают в последовательность антитела путем перекодирования UGA стоп-кодона от конца к вставке селеноцистеина, что обеспечивает сайт-специфическую ковалентную конъюгацию на нуклеофильной селеноловой группе селеноцистеина в присутствии других природных аминокислот (см., например, Hofer et al., 2008, Proc. Natl. Acad. Sci. USA 105:12451-56; and Hofer et al., 2009, Biochemistry 48(50):12047-57).
[00350] В еще одном варианте осуществления в настоящем изобретении раскрыты антитела, конъюгированные или рекомбинантно слиты с терапевтической молекулой (или одной или несколькими терапевтическими молекулами). Антитело может быть конъюгировано или рекомбинантно слито с терапевтической молекулой, такой как цитотоксин, например, цитостатический или цитоцидный агент, терапевтическое средство или ион радиоактивного металла, например альфа-излучатели. Цитотоксин или цитотоксический агент включает любой агент, который оказывает негативное воздействие на клетки. Терапевтические фрагменты включают, но не ограничиваются ими, антиметаболиты (например, метотрексат, 6-меркаптопурин, 6-тиогуанин, цитарабин, 5-фторурацил декарбазин); алкилирующие агенты (например, мехлоретамин, тиоэпа, хлорамбуцил, мелфалан, кармустин (BCNU) и ломустин (CCNU), циклофосфамид, бусульфан, дибромоманнитол, стрептозотоцин, митомицин C и цис-дихлордиамин платин) (II); антрациклины (например, даунорубицин (ранее дауномицин) и доксорубицин); антибиотики (например, актиномицин (ранее актиномицин), блеомицин, митрамицин и антрамицин (АМС)); ауристатиновые молекулы (например, ауристатин PHE, бриостатин 1, и соластатин 10; см. Woyke et al., Antimicrob. Agents Chemother. 46:3802-8 (2002), Woyke et al., Antimicrob. Agents Chemother. 45:3580-4 (2001), Mohammad et al., Anticancer Drugs 12:735-40 (2001), Wall et al., Biochem. Biophys. Res. Commun. 266:76-80 (1999), Mohammad et al., Int. J. Oncol. 15:367-72 (1999), все включены в настоящее описание в качестве ссылки); гормоны (например, глюкокортикоиды, прогестеины, андрогены и эстрогены), ингибиторы ДНК-восстанавливающих ферментов (например, этопозид или топотекан), ингибиторы киназы (например, соединение ST1571, иматиниб мезилат (Kantarjian et al., Clin Cancer Res. 8(7):2167-76 (2002)); цитотоксические средства (например, паклитаксел, цитохалазин B, грамицидин D, бромид этидия, эметин, митомицин, этопозид, тенопозид, винкристин, винбластин, колхицин, доксорубицин, даунорубицин, дигидроксиантрацин дион, митоксантрон, митрамицин, актиномицин D, 1-дегидротестостерон, глюкокортикоиды, прокаин, тетракаин, лидокаин, пропранолол и пуромицин и их аналоги и соединения, описанные в патентах США 6245759, 6399633, 6383790, 6335156, 6271242, 6242196, 6218410, 6218372, 6057300, 6034053, 5985877, 5958769, 5925376, 5922844, 5911995, 5872223, 5863904, 5840745, 5728868, 5648239, 5587459); ингибиторы фарнезилтрансферазы (например, R115777, BMS-214662 и соединения, описанные, например, в патентах США: 6458935, 6451812, 6440974, 6436960, 6432959, 6420387, 6414145, 6410541, 6410539, 6403581, 6399615, 6387905, 6372747, 6369034, 6362188, 6342765, 6342487, 6300501, 6268363, 6265422, 6248756, 6239140, 6232338, 6228865, 6228856, 6225322, 6218406, 6211193, 6187786, 6169096, 6159984, 6143766, 6133303, 6127366, 6124465, 6124295, 6103723, 6093737, 6090948, 6080870, 6077853, 6071935, 6066738, 6063930, 6054466, 6051582, 6051574 и 6040305); ингибиторы топоизомеразы (например, каптотецин; иринотекан; SN-38; топотекан; 9-аминокамптотецин; GG-211 (GI 147211); DX-8951f; IST-622; рубитекан; риазолоакридин; XR-5000; саинтопин; UCE6; UCE1022; TAN-1518A; TAN 1518B; KT6006; KT6528; ED-110; NB-506; ED-110; NB-506; и ребеккамциин); булгареин; связующие вещества с малой бороздкой ДНК, такие как краситель Hoescht 33342 и краситель Hoechst 33258; нитидин; фагаронини; эпиберберин; коралин; бета-лапакон; ВС-4-1; бисфосфонаты (например, алендронат, цимадронт, клодронат, тилудронат, этидронат, ибандронат, неридронат, олпандронат, ризедронат, пиридронат, памидронат, золендронат) ингибиторы HMG-CoA-редуктазы, (например, ловаставатин, цвастататин) лексол, люпитор, розувастатин и аторвастатин); антисмысловые олигонуклеотиды (например, раскрытые в патентах США 6277832, 5998596, 5885834, 5734033 и 5618709); ингибиторы аденозиндеаминазы (например, флударабинфосфат и 2-хлородезоксиаденозин); ибритумомаб тиуксетан (Zevalin®); тозитумомаб (Bexxar®)) и его фармацевтически приемлемые соли, сольваты, клатраты и пролекарства.
[00351] Кроме того, антитело по настоящему изобретению может быть конъюгировано или рекомбинантно слито с терапевтической молекулой или молекулой лекарственного средства, которое модифицирует заданный биологический ответ. Терапевтические молекулы или молекулы лекарственного средства не должны рассматриваться как ограниченные классическими химическими терапевтическими средства. Например, молекула лекарственного средства может представлять собой белок, пептид или полипептид с желательной биологической активностью. Такие белки могут включать, например, токсин, такой как абрин, рицин А, экзотоксин синегнойной палочки, токсин холеры или токсин дифтерии; белок, такой как фактор некроза опухоли, γ-интерферон, α-интерферон, фактор роста нервов, фактор роста, полученный из тромбоцитов, активатор тканевого плазминогена, апоптотический агент, например TNF-γ, TNF-γ, AIM I (см. международную публикацию WO 97/33899), AIM II (см. международную публикацию WO 97/34911), лиганд Fas (Takahashi et al., 1994, J. Immunol., 6: 1567-1574) и VEGF (см. международную публикацию WO 99/23105), антиангиогенное средство, например ангиостатин, эндостатин или компонент пути коагуляции (например, тканевой фактор); или модификатор биологического ответа, такой как, например, лимфокин (например, гамма-интерферон, интерлейкин-1 («IL-1»), интерлейкин-2 («IL-2»), интерлейкин-5 («IL-5»), интерлейкин-6 («IL-6»), интерлейкин-7 («IL-7»), интерлейкин 9 («IL-9»), интерлейкин-10 («IL-10»), интерлейкин-12 («IL-12»), интерлейкин-15 («IL-15»), интерлейкин-23 («IL-23»), гранулоцитарный макрофагальный колониестимулирующий фактор («GM-CSF») и гранулоцитарный колониестимулирующий фактор («G-CSF»)), или фактор роста (например, гормон роста («GН»)), или агент коагуляции (например, кальций, витамин K, тканевые факторы, такие как, но не ограничиваясь ими, фактор Хагемана (фактор XII) высокомолекулярный кининоген (HMWK), прекалликреин (PK), коагуляционные белки-факторы II (протромбин), фактор V, XIIa, VIII, XIIIa, XI, XIa, IX, IXa, X, фосфолипид и мономер фибрина).
[00352] Терапевтическая молекула или лекарственное средство, конъюгированное или рекомбинантно слитое с антителом по настоящему изобретению, которое иммуноспецифически связывается с антигеном нектина-4, следует выбирать для достижения желаемого профилактического или терапевтического(ых) эффекта(ов). В определенных вариантах осуществления антитело представляет собой модифицированное антитело. При принятии решения о том, какую терапевтическую молекулу или молекулу лекарственного средства следует выбрать для конъюгирования или рекомбинантного слияния с антителом по настоящему изобретению, следует учитывать: природу заболевания, тяжесть заболевания и состояние пациента.
[00353] Используемый в настоящем документе термин «конъюгат антитела против нектина-4 и лекарственного средства» или «ADC антитела против нектина-4» относится к антителу против нектина-4 или его антигенсвязывающему фрагменту, конъюгированному или рекомбинантно слитому с терапевтической молекулой (или с одним или несколькими терапевтическими молекулами) или к антителу против нектина-4 или его антигенсвязывающему фрагменту, конъюгированному или рекомбинантно слитому с терапевтической молекулой или молекулой лекарственного средства, которое модифицирует заданный биологический ответ, как описано выше.
[00354] В настоящем документе описан ADC антитела против нектина-4, в том числе антитела против нектина-4, которое специфически связывается с нектином-4. В данном документе также раскрыто ADC антитела против нектина-4, в том числе антитела против нектина-4 или его антигенсвязывающего фрагмента, по настоящему изобретению.
24. Способы использования антител и композиций.
[00355] В одном из аспектов в настоящем документе раскрыт способ ингибирования (например, уменьшения скорости удвоения числа клеток, замедления скорости увеличения числа клеток или блокирования или предотвращения увеличения числа клеток) пролиферации клетки, включающей приведение клетки в контакт с эффективным количеством ADC антитела против нектина-4 по настоящему изобретению.
[00356] В одном из аспектов в настоящем документе раскрыты способы ингибирования пролиферации клетки, включающие приведение клеток в контакт с ADC антитела против нектина-4, в том числе антитела против нектина-4, которое специфически связывается с нектином-4 (например, ECD нектина-4 человека или эпитопом ECD нектина-4 человека) по настоящему изобретению. В определенных вариантах осуществления клетки приводят в контакт с эффективным количеством ADC антитела против нектина-4, как описано в настоящем документе. В некоторых вариантах осуществления ADC антитела против нектина-4 связывается с ECD нектина-4 человека. В некоторых вариантах осуществления ADC антитела против нектина-4 связывается с эпитопом ECD нектина-4 человека. В некоторых вариантах осуществления ADC антитела против нектина-4 специфически связывается с эпитопом ECD нектина-4 человека, который отличается от сайта связывания с лигандом нектина-4. В некоторых вариантах осуществления пролиферация клеток ингибируется по меньшей мере примерно на 10%. В некоторых вариантах осуществления пролиферация клеток ингибируется по меньшей мере примерно на 15%. В некоторых вариантах осуществления пролиферация клетки ингибируется по меньшей мере примерно на 20%. В некоторых вариантах осуществления пролиферация клетки ингибируется по меньшей мере примерно на 25%. В некоторых вариантах осуществления пролиферация клетки ингибируется по меньшей мере примерно на 30%. В некоторых вариантах осуществления пролиферация клетки ингибируется по меньшей мере примерно на 35%. В некоторых вариантах осуществления пролиферация клетки ингибируется по меньшей мере примерно на 40%. В некоторых вариантах осуществления пролиферация клетки ингибируется по меньшей мере примерно на 45%. В некоторых вариантах осуществления пролиферация клетки ингибируется по меньшей мере примерно на 50%. В некоторых вариантах осуществления пролиферация клетки ингибируется по меньшей мере примерно на 55%. В некоторых вариантах осуществления пролиферация клетки ингибируется по меньшей мере примерно на 60%. В некоторых вариантах осуществления пролиферация клетки ингибируется по меньшей мере примерно на 65%. В некоторых вариантах осуществления пролиферация клетки ингибируется по меньшей мере примерно на 70%. В некоторых вариантах осуществления пролиферация клетки ингибируется по меньшей мере примерно на 75%. В некоторых вариантах осуществления пролиферация клетки ингибируется по меньшей мере примерно на 80%. В некоторых вариантах осуществления пролиферация клетки ингибируется по меньшей мере примерно на 85%. В некоторых вариантах осуществления пролиферация клетки ингибируется по меньшей мере примерно на 90%. В некоторых вариантах осуществления пролиферация клетки ингибируется по меньшей мере примерно на 95%. В некоторых вариантах осуществления пролиферация клетки ингибируется по меньшей мере примерно на 98%. В некоторых вариантах осуществления пролиферация клетки ингибируется по меньшей мере примерно на 99%. В некоторых вариантах осуществления пролиферация клетки ингибируется по меньшей мере примерно на 100%. В определенных вариантах осуществления пролиферация клетки ингибируется по меньшей мере от примерно 25% до примерно 65%. В конкретных вариантах осуществления ингибирование пролиферации клетки оценивают способами, описанными в настоящем документе. В некоторых вариантах осуществления ингибирование пролиферации клеток оценивают способами, известными специалисту в данной области. В некоторых вариантах осуществления ингибирование пролиферации клеток связано с ингибированием пролиферации клеток, которые не контактируют с ADC антитела против нектина-4. В некоторых вариантах осуществления ингибирование пролиферации клеток связано с ингибированием пролиферации клеток, которые контактируют с неродственным антителом (например, антителом, которое специфически не связывается с нектином-4), с ADC неродственного антитела или с неконъюгированным антителом против нектина-4.
25. Фармацевтические композиции
[00357] В одном из аспектов настоящее изобретение дополнительно относится к фармацевтическим композициям, содержащим по меньшей мере один ADC антитела против нектина-4 по настоящему изобретению. В некоторых вариантах осуществления фармацевтическая композиция содержит 1) антитело против нектина-4 и 2) фармацевтически приемлемый носитель.
[00358] Фармацевтические композиции, содержащие ADC антитела против нектина-4 получают для хранения путем смешивания ADC антитела против нектина-4 ADC c желаемой степенью чистоты, с необязательными физиологически приемлемыми носителями, наполнителями или стабилизаторами (см., например, Remington, Remington's Pharamceutical Science (18-е издантие1980)) в виде водных растворов или лиофилизированных или других высушенных форм.
[00359] Антитела по настоящему изобретению могут быть включены в состав в любой подходящей форме для доставки к мишеневой клетке/ткани, например, в виде микрокапсул или макроэмульсий (Remington, supra; Park et al., 2005, Molecules 10: 146-61; Malik et al., 2007, Curr. Drug. Deliv.4:141-51), в виде составов с замедленным высвобождением (Putney and Burke, 1998, Nature Biotechnol.16:153-57) или в липосомах (Maclean et al., 1997, Int. J. Oncol.11:325-32; Kontermann, 2006, Curr. Opin. Mol. Ther.8:39-45).
[00360] ADC антитела против нектина-4 по настоящему изобретению также может быть захвачен в микрокапсулу, полученную, например, методами коацервации или межфазной полимеризации, например, микрокапсулы из гидроксиметилцеллюлозы или желатиновые микрокапсулы и микрокапсулы из поли(метилметацилат), соответственно, в коллоидных системах доставки лекарственных средств (например, липосомы, альбуминовые микросферы, микроэмульсии, наночастицы и нанокапсулы) или в макроэмульсиях. Такие методики описаны, например, в Remington, supra.
[00361] Известны различные композиции и системы доставки и они могут использоваться с ADC антитела против нектина-4, который связывается с нектином-4, как описано в настоящем документе, включая, но не ограничиваясь ими, инкапсуляцию в липосомы, микрочастицы, микрокапсулы, рекомбинантные клетки, способные к экспрессии ADC антитела против нектина-4, рецептор-опосредованному эндоцитозу (см., например, Wu and Wu, 1987, J. Biol. Chem.262:4429-32), конструирование нуклеиновой кислоты в качестве составной части в ретровирусного или другого вектора, и так далее. В другом варианте осуществления композиция может находится в виде системы с контролируемым или замедленным высвобождением. В одном из вариантов осуществления для достижения контролируемого или длительного высвобождения может использоваться насос (см., например, Langer, supra; Sefton, 1987, Crit. Ref. Biomed. Eng.14: 201-40; Buchwald et al., 1980, Surgery 88: 507-16; и Saudek et al., 1989, N. Engl. J. Med.321:569-74). В еще одном варианте осуществления полимерные материалы могут быть использованы для достижения контролируемого или замедленного высвобождения профилактического или терапевтического средства (например, ADC антитела против нектина-4, как описано в настоящем документе) или композиции по настоящему изобретению (см., например, Medical Applications of Controlled Release (Langer and Wise eds., 1974); Controlled Drug Bioavailability, Drug Product Design and Performance (Smolen and Ball eds., 1984); Ranger и Peppas, 1983, J. Macromol. Sci. Rev. Macromol. Chem.23:61-126; Levy et al., 1985, Science 228:190-92; During et al., 1989, Ann. Neurol. 25:351-56; Howard et al., 1989, J. Neurosurg.71:105-12; патенты США 5679377; 5916597; 5912015; 5989463; и 5128326; PCT публикации номер WO 99/15154 и WO 99/20253). Примеры полимеров, используемых в составах с замедленным высвобождением, включают, но не ограничиваются ими, поли(2-гидроксиэтилметакрилат), поли(метилметакрилат), поли(акриловая кислота), поли(этилен-со-винилацетат), поли(метакриловая кислота), полигликолиды (PLG), полиангидриды, поли(N-винилпирролидон), поли(виниловый спирт), полиакриламид, поли(этиленгликоль), полилактиды (PLA), поли(лактид-со-гликолиды) (PLGA) и полиортоэфиры. В одном варианте осуществления полимер, используемый в композиции с замедленным высвобождением, является инертным, свободным от выщелачиваемых примесей, стабильным при хранении, стерильным и биоразлагаемым.
[00362] В еще одном варианте осуществления система с контролируемым или замедленным высвобождением может быть размещена в непосредственной близости от конкретной мишеневой ткани, например, носовых ходах или легких, таким образом, уменьшая системную дозу до части (см., например, Goodson, Medical Applications of Controlled Release Vol.2, 115-38 (1984)). Системы с контролируемым высвобождением описаны, например, в Langer, 1990, Science 249:1527-33. Любая методика, известная специалисту в данной области, может быть использована для получения составов с замедленным высвобождением, содержащих одно или несколько антител, которые связываются с нектином-4, как описано в настоящем документе (см., например, патент США 4526938, публикация PCT WO 91/05548 и WO 96/20698, Ning et al., 1996, Radiotherapy & Oncology 39:179-89; Song et al., 1995, PDA J. of Pharma. Sci. & Tech.50:372-97; Cleek et al., 1997, Pro. Int'l. Symp. Control. Rel. Bioact. Mater.24:853-54; и Lam et al., 1997, Proc. Int'l. Symp. Control Rel. Bioact. Mater. 24:759-60).
[00363] Терапевтические составы, содержащие одно или несколько антител по настоящему изобретению, могут быть получены для хранения путем смешивания ADC антитела против нектина-4 с желаемой степенью чистоты, вместе с необязательными физиологически приемлемыми носителями, вспомогательными веществами или стабилизаторами (Remington's Pharmaceutical Sciences (1990)). Mack Publishing Co., Easton, PA), в форме лиофилизированных составов или водных растворов. Приемлемые носители, вспомогательные вещества или стабилизаторы являются нетоксичными для реципиентов в используемых дозировках и концентрациях, и включают буферы, такие как фосфат, цитрат и другие органические соли; антиоксиданты, включая аскорбиновую кислоту и метионин; консерванты (например, хлорид октадецилдиметилбензиламмония; хлорид гексаметония; хлорид бензалкония; хлорид бензэтония; фенол; бутиловый или бензиловый спирт; алкилпарабены, например, метил- или пропилпарабен; катехол; резорцин; циклогексанол; 3-пентанол; и m-крезол); низкомолекулярные (содержащие менее 10 остатков) полипептиды; белки, например, сывороточный альбумин, желатин или иммуноглобулины; гидрофильные полимеры, например, поливинилпирролидон; аминокислоты, например, глицин, глутамин, аспарагин, гистидин, аргинин или лизин; моносахариды, дисахариды и другие углеводы, включая глюкозу, маннозу или декстрины; хелатирующие агенты, например, EDTA; сахара, например, сахарозу, маннит, трегалозу или сорбит; солеобразующие противоионы, например, натрия; металлсодержащие комплексы (например, комплексы на основе Zn-белка); и/или неионогенные поверхностно-активные вещества, например, TWEEN™, PLURONICS™ или полиэтиленгликоль (PEG).
[00364] Антитела по настоящему изобретению также могут, например, быть составлены в липосомы. Липосомы, содержащие интересующую молекулу, получают способами, известными в данной области, такими как описано в Epstein et al. (1985) Proc. Natl. Acad. Sci. USA 82:3688; Hwang et al. (1980) Proc. Natl. Acad. Sci. USA 77:4030; и патенты США 4485045 и 4544545. Липосомы с увеличенным временем циркуляции раскрыты в патенте США 5013556.
[00365] Особенно эффективные иммунолипосомы могут быть получены методом испарения с обращенной фазой с липидной композицией, содержащей фосфатидилхолин, холестерин и PEG-производное фосфатидилэтаноламина (PEG-PE). Липосомы экструдируют через фильтры с определенным размером пор с получением липосом с желаемым диаметром. Fab'-фрагменты ADC антитела против нектина-4 по настоящему изобретению могут быть конъюгированы с липосомами, как описано в Martin et al. (1982) J. Biol. Chem.257:286-288 посредством реакции дисульфидного обмена. В липосоме необязательно содержится химиотерапевтическое средство (такое как доксорубицин); см. Gabizon et al., (1989) J. National Cancer Inst.81(19):1484.
[00366] Составы, например описанные в настоящем документе, также могут содержать более одного активного соединения, что необходимо для конкретного показания для лечения. В определенных вариантах осуществления составы содержат ADC антитело против нектина-4 по настоящему изобретению и одно или несколько активных соединений с комплементарными активностями, которые не оказывают негативного воздействия друг на друга. Такие молекулы подходящим образом присутствуют в комбинации в количествах, которые эффективны для предполагаемой цели. Например, ADC антитела против нектина-4 по настоящему документу можно комбинировать с одним или несколькими другими терапевтическими средствами. Такая комбинированная терапия может проводиться пациенту серийно, одновременно или последовательно.
[00367] ADC антитела против нектина-4 по настоящему изобретению также может быть захвачен в микрокапсулу, полученную, например, методами коацервации или межфазной полимеризации, например, микрокапсулы из гидроксиметилцеллюлозы или желатиновые микрокапсулы и микрокапсулы из поли(метилметацилат), соответственно, в коллоидных системах доставки лекарственных средств (например, липосомы, альбуминовые микросферы, микроэмульсии, наночастицы и нанокапсулы) или в макроэмульсиях. Такие методики описаны в Remington's Pharmaceutical Sciences (1990) Mack Publishing Co., Easton, PA.
[00368] Составы для применения in vivo могут быть стерильными. Стерильность легко получить путем фильтрации через мембраны, например, стерильные фильтрационные мембраны.
[00369] Также могут быть получены препараты с замедленным высвобождением. Подходящие примеры препаратов замедленного высвобождения включают полупроницаемые матрицы твердых гидрофобных полимеров, содержащих ADC антитело против нектина-4, причем матрицы находятся в форме формованных изделий, например пленок или микрокапсул. Примеры матриц с замедленным высвобождением включают сложные полиэфиры, гидрогели (например, поли(2-гидроксиэтилметакрилат) или поли(виниловый спирт)), полилактиды (патент США № 3773919), сополимеры L-глутаминовой кислоты и этил-L- глутамата, неразлагаемый этилен-винилацетат, разлагаемые сополимеры молочной кислоты и гликолевой кислоты, такие как LUPRON DEPOT™ (вводимые инъекцией микросферы, состоящие из сополимера молочной кислоты-гликолевой кислоты и ацетата лейпролида) и поли-D-(-)-3- гидроксимасляная кислота. Хотя такие полимеры, как этилен-винилацетат и молочная кислота-гликолевая кислота, позволяют высвобождать молекулы в течение более 100 дней, некоторые гидрогели высвобождают белки в течение более коротких периодов времени. Когда инкапсулированные антитела остаются в организме в течение длительного времени, они могут денатурировать или агрегировать в результате воздействия влаги при 37°С, что приводит к потере биологической активности и возможным изменениям в иммуногенности. Для стабилизации могут быть разработаны рациональные стратегии в зависимости от используемого механизма. Например, если обнаружено, что механизм агрегации заключается в образовании межмолекулярной S-S-связи посредством тиодисульфидного обмена, стабилизация может быть достигнута путем модификации сульфгидрильных остатков, лиофилизации из кислых растворов, контроля содержания влаги, использования соответствующих добавок и разработки специфических полимерных матриксных композиции.
[00370] Фармацевтические композиции, представленные в настоящем документе, содержат терапевтически эффективные количества одного или нескольких антител по настоящему изобретению и, необязательно, один или несколько дополнительных профилактических или терапевтических средств в фармацевтически приемлемом носителе. Такие фармацевтические композиции можно использовать для профилактики, лечения, контроля или ослабления нектин-4-опосредованного заболевания или одного или нескольких его симптомов.
[00371] Фармацевтические носители, подходящие для введения соединений по настоящему изобретению включают любые такие носители, известные специалистам в данной области, которые подходят для конкретного способа введения.
[00372] Кроме того, антитела по настоящему изобретению могут быть включены в состав как единственный фармацевтически активный ингредиент композиции или могут быть объединены с другими активными ингредиентами (такими как один или несколько других профилактических или терапевтических агентов).
[00373] Композиции могут содержать одно или несколько антител по настоящему изобретению. В одном из вариантов осуществления антитела находятся в составе подходящих фармацевтических препаратов, таких как растворы, суспензии, таблетки, диспергируемые таблетки, пилюли, капсулы, порошки, составы с замедленным высвобождением или эликсиры, для перорального введения или стерильные растворы или суспензии для парентерального введения, а также трансдермальный пластырь и ингаляторы для сухого порошка. В одном из вариантов осуществления антитела, описанные выше, вводят в состав фармацевтических композиций с помощью методик и процедур, хорошо известных в данной области (см., например, Ansel (1985), Introduction to Pharmaceutical Dosage Forms, 4-ое издание, стр.126).
[00374] В композициях эффективные концентрации одного или нескольких антител или их производных смешиваются с подходящим фармацевтическим носителем. Концентрации соединений в композициях эффективны для доставки количества, при введении, которое необходимо для лечения, профилактики или ослабления нектин-4 опосредованного заболевания или его симптома.
[00375] В одном из вариантов осуществления композиции составлены для однократного введения. Для получения композиции массовую долю соединения растворяют, суспендируют, диспергируют или смешивают иным образом в выбранном носителе в эффективной концентрации, так что состояние, в отношении которого проводится лечение, облегчается, предотвращается или один или несколько его симптомов улучшаются.
[00376] ADC антитела против нектина-4 по настоящему изобретению включен в фармацевтически приемлемый носитель в эффективном количестве, достаточном для оказания терапевтически полезного эффекта в отсутствие нежелательных побочных эффектов для пациента, лечение которого проводят. Терапевтически эффективную концентрацию можно определить эмпирически, проведя тесты соединения в системах in vitro и in vivo, используя обычные методы, а затем экстраполируя их на дозы для человека.
[00377] Концентрация ADC антитела против нектина-4 в фармацевтической композиции зависит, например, от физико-химических характеристик ADC антитела против нектина-4, графика введения доз и количества введений, а также от других факторов, известных специалистам в данной области.
[00378] В одном из вариантов осуществления терапевтически эффективная доза дает сывороточную концентрацию ADC антитела против нектина-4 от примерно 0,1 нг/мл до примерно 50-100 мкг/мл. Фармацевтические композиции в другом варианте осуществления обеспечивают дозу от примерно 0,001 мг до примерно 2000 мг ADC антитела против нектина-4 на килограмм массы тела в день. Фармацевтические стандартные лекарственные формы могут быть получены для обеспечения от примерно 0,01 мг, 0,1 мг или 1 мг до примерно 500 мг, 1000 мг или 2000 мг и, в одном из вариантов осуществления, от примерно 10 мг до примерно 500 мг ADC антитела против нектина-4 и/или комбинации других необязательных основных ингредиентов на единицу лекарственной формы.
[00379] ADC антитела против нектина-4 можно вводить сразу или можно разделить на несколько меньших доз, вводимых через определенные промежутки времени. Необходимо понимать, что точная доза и продолжительность лечения является функцией заболевания, в отношении которого проводится лечение, и может быть определена эмпирически с применением известных протоколов тестирования или экстраполяцией на основе данных тестирования in vivo или in vitro. Дополнительно, следует отметить, что концентрация и значения дозы могут варьировать в зависимости от тяжести состояния, которое следует облегчить. Кроме того, необходимо понимать, что для любого конкретного пациента, конкретные режимы введения доз должны быть скорректированы через некоторое время согласно индивидуальной потребности и на усмотрение медицинского работника, который осуществляет введение или контролирует введение композиций, и что диапазоны концентрации, приведенные в данном описании, приведены только в качестве примера и не предназначены для ограничения объема или практики заявленных композиций.
[00380] После смешивания или добавления ADC антитела против нектина-4 полученная смесь может представлять собой раствор, суспензию, эмульсию или тому подобное. Форма полученной смеси зависит от ряда факторов, включая предполагаемый путь введения и растворимость соединения в выбранном носителе. Эффективная концентрация достаточна для ослабления симптомов заболевания, расстройства или состояния, в отношении которого проводят лечение, и может быть определена эмпирически.
[00381] Фармацевтические композиции предназначены для введения людям и животным в стандартных лекарственных формах, таких как таблетки, капсулы, пилюли, порошки, гранулы, стерильные парентеральные растворы или суспензии, а также пероральные растворы или суспензии и эмульсии масло-в-воде, содержащие подходящие количества соединений или их фармацевтически приемлемых производных. ADC антитела против нектина-4, в одном из вариантов осуществления, вводят в состав и вводят в стандартных лекарственных формах или многократных дозированных формах. Используемые в настоящем описании формы единичной дозы относятся к физически дискретным единицам, подходящим для людей и животных и упакованным индивидуально, как известно в данной области. Каждая единичная доза содержит заранее определенное количество ADC антитела против нектина-4, достаточное для получения желаемого терапевтического эффекта, в сочетании с требуемым фармацевтическим носителем, наполнителем или разбавителем. Примеры единичных дозированных форм включают ампулы и шприцы и индивидуально упакованные таблетки или капсулы. Формы единичной дозы можно вводить в виде фракций или кратных значений. Форма многократных доз представляет собой множество форм единичных доз, упакованных в один контейнер, для введения в отдельной форме единичных доз. Примеры форм многократных доз включают флаконы, флаконы с таблетками или капсулами или флаконы с пинтами или галлонами. Следовательно, форма многократной дозы представляет собой множество единичных доз, которые не разделены в упаковке.
[00382] В некоторых вариантах осуществления одно или несколько антител против нектина-4 по настоящему изобретению находятся в жидком фармацевтическом составе. Жидкие фармацевтически вводимые композиции можно, например, получить путем растворения, диспергирования или иного смешивания активного соединения, как описано выше, и необязательных фармацевтических адъювантов в носителе, таком как, например, вода, физиологический раствор, водная декстроза, глицерин, гликоли, этанол и тому подобное, образуя, тем самым раствор или суспензию. При желании фармацевтическая композиция для введения может также содержать незначительные количества нетоксичных вспомогательных веществ, таких как смачивающие агенты, эмульгирующие агенты, солюбилизирующие агенты, рН-буферные агенты и тому подобное, например, ацетат, цитрат натрия, производные циклодекстрина, сорбит монолаурат, триэтаноламин натрий ацетат, триэтаноламин олеат и другие подобные агенты.
[00383] Используемые в настоящее время способы получения таких дозированных форм известны или очевидны для специалистов в данной области; например, см. Remington's Pharmaceutical Sciences (1990) Mack Publishing Co., Easton, PA.
[00384] Могут быть получены лекарственные формы или композиции, содержащие ADC антитела против нектина-4 в диапазоне от 0,005% до 100%, уравновешивая с нетоксичным носителем. Способы получения таких композиций известны специалистам в данной области.
[00385] Пероральные фармацевтические лекарственные формы являются либо твердыми, либо жидкими, либо на основе геля. Твердые лекарственные формы представляют собой таблетки, капсулы, гранулы и сыпучие порошки. Типы пероральных таблеток включают спрессованные, жевательные пастилки и таблетки, которые могут быть покрыты энтеросолюбильной оболочной, оболочкой из сахара или пленкой. Капсулы могут быть твердыми или мягкими желатиновыми капсулами, а гранулы и порошки могут быть предоставлены в не шипучей или шипучей форме в сочетании с другими ингредиентами, известными специалистам в данной области.
[00386] В определенных вариантах осуществления составы представляют собой твердые лекарственные формы. В определенных вариантах осуществления составы представляют собой капсулы или таблетки. Таблетки, пилюли, капсулы, пастилки и тому подобное могут содержать один или несколько из следующих ингредиентов или соединений сходной природы: связующее вещество; смазывающие вещества; разбавитель; вещество, обеспечивающее скольжение; дезинтегрирующий агент; краситель; подсластитель; ароматизатор; смачивающий агент; рвотное покрытие; и пленочное покрытие. Примеры связующих веществ включают микрокристаллическую целлюлозу, трагакантовую камедь, раствор глюкозы, слизь акации, раствор желатина, мелассу, полвинилпирролидин, повидон, кросповидоны, сахарозу и крахмальную пасту. Смазывающие вещества включают тальк, крахмал, стеарат магния или кальция, ликоподий и стеариновую кислоту. Разбавители включают, например, лактозу, сахарозу, крахмал, каолин, соль, маннит и фосфат дикальция. Вещества, обеспечивающие скольжение, включают, но не ограничиваются ими, коллоидный кремния диоксид. Разрыхлители включают кроскармеллозу натрия, натрий крахмал гликолят, альгиновую кислоту, кукурузный крахмал, картофельный крахмал, бентонит, метилцеллюлозу, агар и карбоксиметилцеллюлозу. Красители включают, например, любой из утвержденных сертифицированных водорастворимых красителей FD и C, их смеси; и водонерастворимые красители FD и C, суспендированные на гидрате оксида алюминия. Подсластители включают сахарозу, лактозу, маннит и искусственные подсластители, такие как сахарин, и любое количество ароматизаторов, высушенных распылением. Ароматизаторы включают натуральные ароматизаторы, экстрагируемые из растений, например, из фруктов, и синтетические смеси соединений, которые вызывают приятные ощущения, такие как, но не ограничиваясь ими, мята перечная и метилсалицилат. Смачивающие агенты включают моностеарат пропиленгликоля, моноолеат сорбитана, монолаурат диэтиленгликоля и полиоксиэтиленлауральный эфир. Рвотные покрытия включают жирные кислоты, жиры, воски, шеллак, аммонизированный шеллак и целлюлоза ацетат фталаты. Пленочные покрытия включают гидроксиэтилцеллюлозу, натрий карбоксиметилцеллюлозу, полиэтиленгликоль 4000 и целлюлоза ацетат фталат.
[00387] Антитела могут быть предоставлены в композиции, которая защищает их от кислой среды желудка. Например, композиция может быть представлена в виде смеси с энтеросолюбильной оболочкой, которая сохраняет свою целостность в желудке и высвобождает активное соединение в кишечнике. Композиция также может быть в виде состава в комбинации с антацидом или другим подобным ингредиентом.
[00388] Если стандартная лекарственная форма представляет собой капсулу, она может содержать, помимо материала вышеуказанного типа, жидкий носитель, такой как жирное масло. Кроме того, стандартные лекарственные формы могут содержать различные другие вещества, которые модифицируют физическую форму стандартной лекарственной формы, например, покрытия из сахара и других энтеросолюбильных агентов. Соединения также можно вводить в качестве компонента эликсира, суспензии, сиропа, вафли, сыпучего состава, жевательной резинки или тому подобного. Сироп может содержать кроме активных соединений сахарозу в качестве подсластителя и некоторые консерванты, красители и ароматизаторы.
[00389] ADC антитела против нектина-4 также можно смешивать с другими активными веществами, которые не ухудшают желаемое действие, или с веществами, которые дополняют желаемое действие, такими как антациды, блокаторы H2 и диуретики. Активный ингредиент представляет собой ADC антитела против нектниа-4 или его фармацевтически приемлемое производное, как описано в настоящем документе. Могут быть включены более высокие концентрации, примерно до 98 масс.% активного ингредиента.
[00390] Во всех вариантах осуществления таблетки и капсулы могут быть покрыты оболочкой, как известно специалистам в данной области, для модификации или поддержания растворения активного ингредиента. Так, например, они могут быть покрыты обычным энтеросолюбильным покрытием, таким как фенилсалицилат, воски и целлюлоза ацетат фталат.
[00391] В некоторых вариантах осуществления составы представляют собой жидкие лекарственные формы. Жидкие пероральные лекарственные формы включают водные растворы, эмульсии, суспензии, растворы и/или суспензии, восстановленные из шипучих гранул, и шипучие препараты, восстановленные из шипучих гранул. Водные растворы включают, например, эликсиры и сиропы. Эмульсии бывают либо эмульсиями "масло-в-воде" или "вода-в-масле".
[00392] Эликсиры представляют собой прозрачные, подслащенные водно-спиртовые препараты. Фармацевтически приемлемые носители, используемые в эликсирах, включают растворители. Сиропы представляют собой концентрированные водные растворы сахара, например сахарозы, и могут содержать консервант. Эмульсия представляет собой двухфазную систему, в которой одна жидкость диспергирована в форме маленьких шариков в другой жидкости. Фармацевтически приемлемые носители, используемые в эмульсиях, представляют собой неводные жидкости, эмульгаторы и консерванты. Суспензии используют фармацевтически приемлемые суспендирующие агенты и консерванты. Фармацевтически приемлемые вещества, используемые в нешипучих гранулах для восстановления в жидкую пероральную лекарственную форму, включают разбавители, подсластители и смачивающие агенты. Фармацевтически приемлемые вещества, используемые в шипучих гранулах для разведения в жидкую пероральную лекарственную форму, включают органические кислоты и источник углекислого газа. Красители и ароматизаторы используются во всех вышеперечисленных лекарственных формах.
[00393] Растворители включают глицерин, сорбит, этиловый спирт и сироп. Примеры консервантов включают глицерин, метил и пропилпарабен, бензойную кислоту, натрий бензоат и спирт. Примеры неводных жидкостей, используемых в эмульсиях, включают минеральное масло и хлопковое масло. Примеры эмульгирующих агентов включают желатин, акацию, трагакант, бентонит и поверхностно-активные вещества, такие как полиоксиэтилен сорбит моноолеат. Суспендирующие агенты включают натрий карбоксиметилцеллюлозы, пектин, трагакант, вигум и акацию. Подсластители включают сахарозу, сиропы, глицерин и искусственные подсластители, такие как сахарин. Смачивающие агенты включают пропиленгликоль моностеарат, сорбит моноолеат, диэтиленгликоль монолаурат и полиоксиэтилен лауриловый эфир. Органические кислоты включают лимонную и винную кислоты. Источники углекислого газа включают бикарбонат натрия и карбонат натрия. Красители включают любой одобренный сертифицированный водорастворимый краситель FD и C и их смеси. Ароматизаторы включают натуральные ароматизаторы, экстрагированные из растений, таких как фрукты, и синтетические смеси соединений, которые вызывают приятные вкусовые ощущения.
[00394] Для твердой лекарственной формы, раствор или суспензия, например, в пропиленкарбонате, растительных маслах или триглицеридах, в одном из вариантов осуществления заключены в желатиновую капсулу. Такие растворы, а также их получение и инкапсулирование, описаны в патентах США №№ 4328245; 4409239; и 4410545. Для жидкой лекарственной формы раствор, например, в полиэтиленгликоле, может быть разведен достаточным количеством фармацевтически приемлемого жидкого носителя, например, водой, для более легкого его измерения при введении.
[00395] Альтернативно, жидкие или полутвердые пероральные составы могут быть получены путем растворения или диспергирования активного соединения или соли в растительных маслах, гликолях, триглицеридах, сложных эфирах пропиленгликоля (например, пропиленкарбонате) и других таких носителях, и инкапсулирования этих растворов или суспензии в оболочки твердых или мягких желатиновых капсул. Другие эффективные составы включают составы, приведенные в патентах США №№ RE28819 и 4358603. Коротко, такие составы включают, но не ограничиваются ими, составы, которые содержат соединение по настоящему изобретению, диалкилированный моно- или полиалкиленгликоль, включая, но не ограничиваясь ими, 1,2-диметоксиметан, диглим, триглим, тетраглим, полиэтиленгликоль-350-диметиловый эфир, полиэтиленгликоль-550-диметиловый эфир, полиэтиленгликоль-750-диметиловый эфир, где 350, 550 и 750 относятся к приблизительной средней молекулярной массе полиэтиленгликоля, и один или несколько антиоксидантов, таких как бутилированный гидрокситолуол (ВНТ), бутилированный гидроксианизол (ВНА), пропилгаллат, витамин Е, гидрохинон, гидроксикумарины, этаноламин, лецитин, цефалин, аскорбиновая кислота, яблочная кислота, сорбит, фосфорная кислота, тиодипропионовая кислота и ее сложные эфиры, а также дитиокарбаматы.
[00396] Другие составы включают, но не ограничиваются ими, водно-спиртовые растворы, включая фармацевтически приемлемый ацеталь. Спирты, используемые в этих составах, представляют собой любые фармацевтически приемлемые смешивающиеся с водой растворители, имеющие одну или несколько гидроксильных групп, включая, но не ограничиваясь этим, пропиленгликоль и этанол. Ацетали включают, но не ограничиваются ими, ди(низший алкил)ацеталь низших алкильных альдегидов, таких как ацетальдегид диэтилацеталь.
[00397] Парентеральное введение, в одном из вариантов осуществления, характеризуется инъекцией, подкожной, внутримышечной или внутривенной, которые также раскрыты в настоящем описании. Инъецируемые препараты могут быть получены в обычных формах, либо в виде жидких растворов или суспензий, твердых форм, подходящих для раствора или суспензии в жидкости перед инъекцией, либо в виде эмульсий. Инъецируемые растворы и эмульсии также содержат один или несколько наполнителей. Подходящие эксципиенты представляют собой, например, воду, физиологический раствор, декстрозу, глицерин или этанол. Кроме того, при желании фармацевтические композиции для введения могут также содержать незначительные количества нетоксичных вспомогательных веществ, таких как смачивающие или эмульгирующие агенты, рН-буферные агенты, стабилизаторы, усилители растворимости и другие такие агенты, как, например, ацетат натрия, сорбит монолаурат, триэтаноламин олеат и циклодекстрины.
[00398] Имплантация системы с медленным или длительным высвобождением, так что поддерживается постоянный уровень дозы (см., например, патент США № 3710795), также раскрыта в настоящем документе. Коротко, соединение по настоящему изобретению, диспергировано в твердой внутренней матрице, например, полиметилметакрилат, полибутилметакрилат, пластифицированный или непластифицированный поливинилхлорид, пластифицированный нейлон, пластифицированный полиэтилентерефталат, натуральный каучук, полиизопрен, полиизобутилен, полибутадиен, полиэтилен, сополимеры этилена-винилацетата, силиконовый каучук, полидиметилсилоксаны, силикон-карбонатные сополимеры, гидрофильные полимеры, такие как гидрогели сложных эфиров акриловой и метакриловой кислоты, коллаген, сшитый поливиниловый спирт и сшитый частично гидролизованный поливинилацетат, который окружен внешней полимерной мембраной, например, полиэтилен, полипропилен, сополимеры этилена/пропилена, сополимеры этилена/этилакрилата, сополимеры этилена/ винилацетата, силиконовый каучук, полидиметилсилоксаны, неопреновый каучук, хлорированный полиэтилен, поливинилхлорид, сополимеры винилхлорида и винилацетата, винилиден хлорид, этилен и пропилен, иономер, полиэтилен терефталат, бутил каучуковые эпихлоргидриновые каучуки, сополимер этилена/винилового спирта, терполимер этилена/винилацетата/винилового спирта и сополимер этилена/винилоксиэтанола, нерастворимый в жидкостях организма. ADC антитела против нектина-4 диффундирует через внешнюю полимерную мембрану на стадии контроля скорости высвобождения. Количество ADC антитела против нектина-4, содержащегося в таких парентеральных композициях, строго зависит от его конкретной природы, а также от активности соединения и потребностей пациента.
[00399] Препараты для парентерального введения включают стерильные растворы, готовые для инъекции, стерильные сухие растворимые продукты, такие как лиофилизированные порошки, готовые к объединению с растворителем непосредственно перед использованием, включая таблетки для подкожных инъекций, стерильные суспензии, готовые для инъекции, стерильные сухие нерастворимые продукты, готовые к использованию вместе с транспортным средством непосредственно перед использованием и стерильными эмульсиями. Растворы могут быть либо водными, либо неводными.
[00400] При внутривенном введении подходящие носители включают физиологический солевой раствор или забуференный фосфатом физиологический раствор (PBS) и растворы, содержащие загущающие и солюбилизирующие агенты, такие как глюкоза, полиэтиленгликоль и полипропиленгликоль, и их смеси.
[00401] Фармацевтически приемлемые носители, используемые в парентеральных препаратах, включают водные носители, неводные носители, антимикробные агенты, изотонические агенты, буферы, антиоксиданты, местные анестетики, суспендирующие и диспергирующие агенты, эмульгирующие агенты, изолирующие или хелатирующие агенты и другие фармацевтически приемлемые вещества.
[00402] Примеры водных носителей включают инъекцию хлорида натрия, инъекцию Рингера, инъекцию изотонической декстрозы, инъекцию стерильной воды, инъекцию декстрозы и лактата Рингера. Неводные парентеральные носители включают жирные масла растительного происхождения, хлопковое масло, кукурузное масло, кунжутное масло и арахисовое масло. Противомикробные агенты в бактериостатических или фунгистатических концентрациях могут быть добавлены к парентеральным препаратам, упакованным в контейнеры с множеством доз, которые включают фенолы или крезолы, ртутные вещества, бензиловый спирт, сложные эфиры хлорбутанола, метил и пропил п-гидроксибензойной кислоты, тимеросал, бензалконий хлорид и бензэтония хлорид. Изотонические агенты включают хлорид натрия и декстрозу. Буферы включают фосфат и цитрат. Антиоксиданты включают бисульфат натрия. Местные анестетики включают прокаин гидрохлорид. Суспендирующие и диспергирующие агенты включают натрий карбоксиметилцеллюлозу, гидроксипропил метилцеллюлозу и поливинилпирролидон. Эмульгирующие агенты включают Полисорбат 80 (TWEEN 80). Изолирующий или хелатообразующий агент ионов металлов включает EDTA. Фармацевтические носители также включают этиловый спирт, полиэтиленгликоль и пропиленгликоль для смешивающихся с водой носителей; и гидроксид натрия, соляную кислоту, лимонную кислоту или молочную кислоту для регулирования рН.
[00403] Концентрация фармацевтически активного соединения регулируется таким образом, чтобы инъекция обеспечивала эффективное количество для получения желаемого фармакологического эффекта. Точная доза зависит от возраста, веса и состояния пациента или животного, как известно в данной области.
[00404] Стандартные парентеральные препараты могут быть упакованы в ампулу, флакон или шприц с иглой. Как известно и используется на практике в данной области, все препараты для парентерального введения должны быть стерильными.
[00405] В качестве примера, внутривенная или внутриартериальная инфузия стерильного водного раствора, содержащего активное соединение, представляет собой эффективный способ введения. Другим вариантом осуществления является стерильный водный или масляный раствор или суспензия, содержащая активное вещество, вводимое по мере необходимости для получения желаемого фармакологического эффекта.
[00406] Препараты для инъекций предназначены для местного и системного введения. В одном из вариантов осуществления терапевтически эффективную дозу вводят в состав так, чтобы имела концентрацию, по меньшей мере от примерно 0,1% масс./масс. до примерно 90% масс./масс. или более, в некоторых вариантах осуществления более 1% масс./масс. активного соединения к обрабатываемой ткани(ям).
[00407] ADC антитела против нектина-4 может быть суспендирован в микронизированной или другой подходящей форме. Форма полученной смеси зависит от ряда факторов, включая предполагаемый путь введения и растворимость соединения в выбранном носителе. Эффективная концентрация достаточна для ослабления симптомов состояния и может быть определена эмпирически.
[00408] В других вариантах осуществления фармацевтические препараты представляют собой лиофилизированные порошки, которые могут быть восстановлены для введения в виде растворов, эмульсий и других смесей. Они также могут быть восстановлены и находится в составах в виде твердых веществ или гелей.
[00409] Лиофилизированный порошок готовят путем растворения ADC антитела против нектина-4 по настоящему изобретению или его фармацевтически приемлемого производного в подходящем растворителе. В некоторых вариантах осуществления лиофилизированный порошок является стерильным. Растворитель может содержать эксципиент, который улучшает стабильность или другие фармакологические компоненты порошка или восстановленного раствора, полученного из порошка. Вспомогательные вещества, которые могут быть использованы, включают, но не ограничиваются ими, декстрозу, сорбит, фруктозу, кукурузный сироп, ксилит, глицерин, глюкозу, сахарозу или другой подходящий агент. Растворитель также может содержать буфер, такой как цитратный буфер, буфер на основе фосфата натрия или калия, или другой буфер, известный специалистам в данной области, в одном из вариантов осуществления имеющий приблизительно нейтральное значение pH.
[00410] Последующая стерильная фильтрация раствора с последующей лиофилизацией в стандартных условиях, известных специалистам в данной области, дает желаемый состав. В одном из вариантов осуществления полученный раствор распределяют во флаконы для лиофилизации. Каждый флакон содержит одну дозу или несколько доз соединения. Лиофилизированный порошок можно хранить в подходящих условиях, таких как температура от примерно 4°С до комнатной температуры. [00410] Восстановление лиофилизированного порошка водой для инъекций дает препарат для парентерального применения. Для восстановления лиофилизированный порошок добавляют в стерильную воду или другой подходящий носитель. Точное количество зависит от выбранного соединения. Такое количество может быть определено эмпирически.
[00411] Смеси для местного применения готовят, как описано для местного и системного введения. Полученная смесь может представлять собой раствор, суспензию, эмульсию или тому подобное и может быть составлена в виде кремов, гелей, мазей, эмульсий, растворов, эликсиров, лосьонов, суспензий, настоек, паст, пен, аэрозолей, ирригационных средств, спреев, суппозиториев, повязок, кожных пластырей или любых других составов, подходящих для местного применения.
[00412] Антитела по настоящему изобретению могут быть получены в виде аэрозолей для местного применения, например, для ингаляции (см., например, патенты США №№ 4044126, 4414209 и 4364923, в которых описаны аэрозоли для доставки стероидных препаратов, эффективных для лечения воспалительных заболеваний, в частности, астмы). Эти составы для введения в дыхательные пути могут быть в форме аэрозоля или раствора для небулайзера или в виде мелкодисперсного порошка для инсуффляций, отдельно или в комбинации с инертным носителем, таким как лактоза. В таком случае частицы состава будут, в одном варианте осуществления, иметь диаметр менее 50 микрон, в одном из вариантов осуществления - менее 10 микрон.
[00413] Соединения могут находится в составе для местного или локального применения, например, для местного применения на коже и слизистых оболочках, таких как глаза, в форме гелей, кремов и лосьонов и для нанесения на глаза или для интрацистернального или интраспинального применения. Местное введение предусматривается для трансдермальной доставки, а также для введения в глаза или слизистую оболочку или для ингаляционной терапии. Назальные растворы активного соединения отдельно или в комбинации с другими фармацевтически приемлемыми наполнителями также могут быть введены.
[00414] Эти растворы, особенно те, которые предназначены для офтальмологического применения, могут быть составлены в виде 0,01-10% изотонических растворов c рН примерно 5-7, с соответствующими солями.
[00415] В настоящем документе также раскрыты другие пути введения, такие как трансдермальные пластыри, включая ионофоретические и электрофоретические устройства, и ректальное введение.
[00416] Чрескожные пластыри, в том числе изофоретические и электрофоретические устройства, хорошо известны специалистам в данной области. Например, такие пластыри раскрыты в патентах США 6267983, 6261595, 6256533, 6167301, 6024975, 6010715, 5985317, 5983134, 5948433 и 5860957.
[00417] Например, фармацевтические лекарственные формы для ректального введения представляют собой ректальные суппозитории, капсулы и таблетки для системного действия. Ректальные суппозитории, используемые в настоящем документе, означают твердые тела для введения в прямую кишку, которые плавятся или размягчаются при температуре тела, высвобождая один или несколько фармакологически или терапевтически активных ингредиентов. Фармацевтически приемлемые вещества, используемые в ректальных суппозиториях, представляют собой основы или носители и агенты для повышения температуры плавления. Примеры основ включают масло какао (какао-масло), глицерин-желатин, карбовакс (полиоксиэтиленгликоль) и соответствующие смеси моно-, ди- и триглицеридов жирных кислот. Можно использовать комбинации различных оснований. Агенты для повышения температуры плавления суппозиториев включают спермацет и воск. Суппозитории для ректального введения могут быть получены способом прессования или формования. Вес ректального суппозитория, в одном из вариантов осуществления, составляет примерно от 2 до 3 граммов.
[00418] Таблетки и капсулы для ректального введения могут быть получены с использованием того же фармацевтически приемлемого вещества и теми же способами, что и для составов для перорального введения.
[00419] Антитела и другие композиции по настоящему изобретению также могут быть составлены для нацеливания на конкретную ткань, рецептор или другую область тела пациента, получающего лечение. Многие такие способы нацеливания хорошо известны специалистам в данной области. Все такие способы нацеливания рассматриваются в настоящем документе для использования в быстрорастворимых композициях. В качестве не ограничивающих примеров методов нацеливания, см., например, патент США №№ 6316652, 6274552, 6271359, 6253872, 6139865, 6131570, 6120751, 6071495, 6060082, 6048736, 6039975, 6004534, 5985307, 5972366, 5900252, 5840674, 5759542 и 5709874. В некоторых вариантах осуществления антитела против нектина-4 по настоящему изобретению нацелены (или иным образом введены) на толстую кишку, например, у пациента, страдающего или имеющего риск возникновения заболевания, опосредованного нектином-4.
[00420] В одном варианте осуществления липосомные суспензии, включая липосомы, нацеленные на ткани, такие как липосомы, нацеленные на опухоли, также могут быть подходящими в качестве фармацевтически приемлемых носителей. Они могут быть получены в соответствии со способами, известными специалистам в данной области. Например, липосомные составы могут быть получены, как описано в патенте США № 4522811. Коротко, липосомы, такие как многослойные везикулы (MLV), могут быть образованы путем высушивания яичного фосфатидилхолина и мозгового фосфатидилсерина (молярное соотношение 7: 3) внутри колбы. Добавляют раствор соединения по настоящему изобретению в фосфатно-солевом буфере, в котором отсутствуют двухвалентные катионы (PBS), и колбу встряхивают до тех пор, пока липидная пленка не диспергируется. Полученные везикулы промывают для удаления неинкапсулированного соединения, осаждают центрифугированием и затем ресуспендируют в PBS.
26. Методы введения и дозирования
[00421] В конкретном варианте осуществления в настоящем документе предложена композиция для применения для профилактики, контроля, лечения и/или улучшения нектин-4-опосредованного заболевания, содержащая ADC антитела против нектина-4 по настоящему изобретению. В одном из вариантов осуществления в настоящем документе предложена композиция для применения для профилактики нектин-4-опосредованного заболевания, где композиция содержит ADC антитела против нектина-4 по настоящему изобретению. В одном из вариантов осуществления в настоящем документе представлена композиция для применения для контроля нектин-4-опосредованного заболевания, где композиция содержит ADC антитела против нектина-4 по настоящему изобретению. В одном из вариантов осуществления в настоящем документе предложена композиция для применения для лечения нектин-4-опосредованного заболевания, где композиция содержит ADC антитела против нектина-4 по настоящему изобретению. В одном из вариантов осуществления в настоящем документе предложена композиция для применения для улучшения нектин-4-опосредованного заболевания, где композиция содержит ADC антитела против нектина-4 по настоящему изобретению. В определенных вариантах осуществления пациентом является пациент, нуждающимся в таких эффектах. В некоторых вариантах осуществления пациент страдает нектин-4 опосредованным заболеванием. В других вариантах осуществления пациент подвержен риску возникновения заболевания, опосредованного нектином-4. В некоторых вариантах осуществления введение приводит к профилактике, контролю, лечению или улучшению нектин-4-опосредованного заболевания. В одном варианте осуществления ADC антитела против нектина-4 представляет собой ADC, в котором антитело против нектина-4 представляет собой антитело M22-321b41.1.
[00422] В одном из вариантов осуществления в настоящем документе предложена композиция для применения для профилактики, контроля, лечения и/или улучшения симптома нектин-4-опосредованного заболевания, содержащая ADC антитела против нектина-4 по настоящему изобретению. В одном из вариантов осуществления в настоящем документе предложена композиция для применения для профилактики симптома нектин-4-опосредованного заболевания, где композиция содержит ADC антитела против нектина-4 по настоящему изобретению. В одном из вариантов осуществления в настоящем документе представлена композиция для применения для контроля симптома нектин-4-опосредованного заболевания, где композиция содержит ADC антитела против нектина-4 по настоящему изобретению. В одном из вариантов осуществления в настоящем документе предложена композиция для применения для лечения симптома нектин-4-опосредованного заболевания, где композиция содержит ADC антитела против нектина-4 по настоящему изобретению. В одном из вариантов осуществления в настоящем документе предложена композиция для применения для улучшения симптома нектин-4-опосредованного заболевания, где композиция содержит ADC антитела против нектина-4 по настоящему изобретению. В определенных вариантах осуществления пациентом является пациент, нуждающимся в таких эффектах. В некоторых вариантах осуществления пациент страдает нектин-4 опосредованным заболеванием. В других вариантах осуществления пациент подвержен риску возникновения заболевания, опосредованного нектином-4. В некоторых вариантах осуществления введение приводит к профилактике, контролю, лечению или улучшению симптома нектин-4-опосредованного заболевания. В одном из вариантов осуществления антитело против нектина-4 представляет собой антитело M22-321b41.1.
[00423] В другом варианте осуществления в настоящем документе представлен способ профилактики, контроля, лечения и/или улучшения заболевания, опосредованного нектином-4, у пациента, включающий введение эффективного количества ADC антитела против нектина-4 по настоящему изобретению. В одном из вариантов осуществления в настоящем документе представлен способ профилактики нектин-4-опосредованного заболевания у пациента, включающий введение эффективного количества ADC антитела против нектина-4 по настоящему изобретению. В одном из вариантов осуществления в настоящем документе представлен способ контроля заболевания, опосредованного нектином-4, у пациента, включающий введение эффективного количества ADC антитела против нектина-4 по настоящему изобретению. В одном из вариантов осуществления в настоящем документе представлен способ лечения нектин-4-опосредованного заболевания у пациента, включающий введение эффективного количества ADC антитела против нектина-4 по настоящему изобретению. В одном из вариантов осуществления в настоящем документе представлен способ улучшения нектин-4-опосредованного заболевания у пациента, включающий введение эффективного количества ADC антитела против нектина-4 по настоящему изобретению. В определенных вариантах осуществления пациентом является пациент, нуждающимся в таких эффектах. В некоторых вариантах осуществления пациент страдает нектин-4 опосредованным заболеванием. В других вариантах осуществления пациент подвержен риску возникновения заболевания, опосредованного нектином-4. В некоторых вариантах осуществления введение приводит к профилактике, контролю, лечению или улучшению нектин-4-опосредованного заболевания. В одном варианте осуществления ADC антитела против нектина-4 представляет собой ADC, в котором антитело против нектина-4 представляет собой антитело M22-321b41.1.
[00424] В другом варианте осуществления в настоящем документе представлен способ профилактики, контроля, лечения и/или улучшения симптома заболевания, опосредованного нектином-4, у пациента, включающий введение эффективного количества ADC антитела против нектина-4 по настоящему изобретению. В одном из вариантов осуществления в настоящем документе представлен способ профилактики симптома нектин-4-опосредованного заболевания у пациента, включающий введение эффективного количества ADC антитела против нектина-4 по настоящему изобретению. В одном из вариантов осуществления в настоящем документе представлен способ контроля симптома заболевания, опосредованного нектином-4, у пациента, включающий введение эффективного количества ADC антитела против нектина-4 по настоящему изобретению. В одном из вариантов осуществления в настоящем документе представлен способ лечения симптома нектин-4-опосредованного заболевания у пациента, включающий введение эффективного количества ADC антитела против нектина-4 по настоящему изобретению. В одном из вариантов осуществления в настоящем документе представлен способ улучшения симптома нектин-4-опосредованного заболевания у пациента, включающий введение эффективного количества ADC антитела против нектина-4 по настоящему изобретению. В определенных вариантах осуществления пациентом является пациент, нуждающимся в таких эффектах. В некоторых вариантах осуществления пациент страдает нектин-4 опосредованным заболеванием. В других вариантах осуществления пациент подвержен риску возникновения заболевания, опосредованного нектином-4. В некоторых вариантах осуществления введение приводит к профилактике, контролю, лечению или улучшению симптома нектин-4-опосредованного заболевания. В одном варианте осуществления ADC антитела против нектина-4 представляет собой ADC, в котором антитело против нектина-4 представляет собой антитело M22-321b41.1.
[00425] Антитела по настоящему изобретению также можно использовать, например, для очистки, детекции и нацеливания на антигены нектина-4 как в диагностических, так и в терапевтических способах in vitro и in vivo. Например, модифицированные антитела используют в иммуноанализах для качественного и количественного измерения уровней нектина-4 в биологических образцах. См., например, Harlow et al., Antibodies: A Laboratory Manual, (Cold Spring Harbor Laboratory Press, 2-е издание1988) (полностью включено в настоящее описание посредством ссылки).
[00426] В настоящем документе также раскрыты способы профилактики, контроля, лечения и/или улучшения состояния, связанного с нектином-4, путем введения пациенту эффективного количества ADC антитела против нектина-4 или фармацевтической композиции, содержащей ADC антитела против нектина-4 по настоящему изобретению. В одном из аспектов ADC антитела против нектина-4 является по существу очищенным (то есть, по существу свободным от веществ, которые ограничивают его действие или вызывают нежелательные побочные эффекты). В определенных вариантах осуществления ADC антитела против нектина-4 представляет собой полностью человеческое моноклональное антитело, такое как полностью человеческое моноклональное антитело. Пациентом, которому проводят терапию, может быть млекопитающее, такое как не примат (например, коровы, свиньи, лошади, кошки, собаки, крысы и тому подобное) или примат (например, обезьяна, такая как яванский макак или человек). В одном из вариантов осуществления пациентом является человек. В другом варианте осуществления пациентом является человека с нектин-4-опосредованным заболеванием.
[00427] Различные системы доставки известны и могут использоваться для введения профилактического или терапевтического средства (например, ADC антитела против нектина-4 по настоящему изобретению), включая, но не ограничиваясь ими, инкапсуляцию в липосомы, микрочастицы, микрокапсулы, рекомбинантные клетки, способные экспрессировать ADC антитела против нектина-4, рецептор-опосредованный эндоцитоз (см., например, Wu and Wu, J. Biol. Chem.262:4429-4432 (1987)), конструирование нуклеиновой кислоты в качестве составной части ретровирусного или другого вектора и тому подобное. Способы введения профилактического или терапевтического средства (например, ADC антитела против нектина-4 по настоящему изобретению) или фармацевтической композиции включают, но не ограничиваются ими, парентеральное введение (например, внутрикожное, внутримышечное, внутрибрюшинное, внутривенное и подкожное), эпидуральное и введение в слизистые оболочки (например, интраназальный и пероральный пути). В конкретном варианте осуществления профилактическое или терапевтическое средство (например, ADC антитела против нектина-4 по настоящему изобретению) или фармацевтическую композицию вводят интраназально, внутримышечно, внутривенно или подкожно. Профилактические или терапевтические средства или композиции могут вводиться любым удобным путем, например, путем инфузии или болюсной инъекции, путем абсорбции через эпителиальную или слизистую оболочку (например, слизистую оболочку полости рта, слизистую оболочку полости рта, слизистую оболочку прямой кишки и кишечника и тому подобное) и может вводиться вместе с другими биологически активными веществами. Введение может быть системным или местным. Кроме того, может быть использовано пульмональное введение, например, с помощью ингалятора или небулайзера и рецептуры с распыляющим агентом. См., например, патенты США №№ 6019688, 5985320, 5985309, 5934272, 5874064, 5855913, 5290540 и 4880078; и публикации РСТ WO 92/19244, WO 97/32572, WO 97/44013, WO 98/31346 и WO 99/66903, каждая из которых включена в настоящий документ посредством ссылки в полном объеме.
[00428] В конкретном варианте осуществления может быть желательным введение профилактического или терапевтического средства или фармацевтической композиции по настоящему изобретению локально в область, нуждающуюся в лечении. Это может быть достигнуто, например, без ограничения, локальной инфузией, местным введением (например, интраназальным спреем), инъекцией или имплантатом, причем указанный имплантат является пористым, непористым или желатиновым материалом, включая мембраны, такие как сиаластические мембраны, или волокна. В некоторых вариантах осуществления при введении ADC антитела против нектина-4 по настоящему изобретению необходимо соблюдать осторожность при использовании веществ, которые не абсорбируют ADC антитела против нектина-4.
[00429] В другом варианте осуществления профилактическое или терапевтическое средство или композиция по настоящему изобретению, представленная в настоящем документе, могут быть доставлены в везикуле, в частности в липосоме (см. Langer, 1990, Science 249:1527-1533; Treat et al., in Liposomes in the Therapy of Infectious Disease and Cancer, Lopez-Berestein and Fidler (eds.), Liss, New York, pp.353- 365 (1989); Lopez-Berestein, ibid., pp.317-327; см. общее описание там же).
[00430] В другом варианте осуществления профилактическое или терапевтическое средство или композиция по настоящему изобретению могут быть доставлены в системе с контролируемым высвобождением или с замедленным высвобождением. В одном из вариантов осуществления для достижения контролируемого или длительного высвобождения может использоваться насос (см., Langer, supra; Sefton, 1987, Crit. Ref. Biomed. Eng.14:20; Buchwald et al., 1980, Surgery 88:507; Saudek et al., 1989, N. Engl. J. Med.321:574). В еще одном варианте осуществления полимерные вещества могут быть использованы для достижения контролируемого или замедленного высвобождения профилактического или терапевтического средства (например, ADC антитела против нектина-4 по настоящему изобретению) или композиции по настоящему изобретению (см., например, Medical Applications of Controlled Release, Langer and Wise (eds.), CRC Pres., Boca Raton, Florida (1974); Controlled Drug Bioavailability, Drug Product Design and Performance, Smolen and Ball (eds.), Wiley, New York (1984); Ranger and Peppas, 1983, J., Macromol. Sci. Rev. Macromol. Chem.23:61; см. также Levy et al., 1985, Science 228:190; During et al., 1989, Ann. Neurol.25:351; Howard et al., 1989, J. Neurosurg.71: 105); патент США № 5679377; патент США № 5916597; патент США № 5912015; патент США № 5989463; патент США № 5128326; публикацию РСТ № WO99/15154; и публикацию PCT WO 99/20253. Примеры полимеров, используемых в составах с замедленным высвобождением, включают, но не ограничиваются ими, поли(2-гидроксиэтилметакрилат), поли(метилметакрилат), поли(акриловая кислота), поли(этилен-со-винилацетат), поли(метакриловая кислота), полигликолиды (PLG), полиангидриды, поли(N-винилпирролидон), поли(виниловый спирт), полиакриламид, поли(этиленгликоль), полилактиды (PLA), поли(лактид-со-гликолиды) (PLGA) и полиортоэфиры. В одном из вариантов осуществления полимер, используемый в композиции с замедленным высвобождением, является инертным, свободным от выщелачиваемых примесей, стабильным при хранении, стерильным и биоразлагаемым. В еще одном варианте осуществления система с контролируемым высвобождением может быть размещена в непосредственной близости от терапевтической мишени, то есть, носовых проходов или легких, при этом требуется только часть системной дозы (см., например, Goodson, in Medical Applications of Controlled Release, supra, vol. 2, pp. 115-138 (1984)). Могут быть использованы системы с контролируемым высвобождением, описанные в обзоре Langer (1990, Science 249:1527-1533). Любая методика, известная специалисту в данной области, может быть использована для получения составов с замедленным высвобождением, содержащих одно или несколько антител по настоящему изобретению. См., например, патент США №4526938, публикацию PCT WO 91/05548, публикацию PCT WO 96/20698, Ning et al., 1996,“Intratumoral Radioimmunotherapy of a Human Colon Cancer Xenograft Using a Sustained-Release Gel,” Radiotherapy & Oncology 39:179- 189, Song et al., 1995,“Antibody Mediated Lung Targeting of Long-Circulating Emulsions,” PDA Journal of Pharmaceutical Science & Technology 50:372- 397, Cleek et al., 1997,“Biodegradable Polymeric Carriers for a bFGF Antibody for Cardiovascular Application,” Pro. Int'l. Symp. Control. Rel. Bioact. Mater.24:853-854, и Lam et al., 1997, “Microencapsulation of Recombinant Humanized Monoclonal Antibody for Local Delivery,” Proc. Int'l. Symp. Control Rel. Bioact. Mater.24:759-760, каждый из которых включен в настоящий документ посредством ссылки во всей своей полноте.
[00431] В конкретном варианте осуществления, где композиция по настоящему изобретению, представляет собой нуклеиновую кислоту, кодирующую профилактическое или терапевтическое средство (например, ADC антитела против нектина-4 по настоящему изобретению), нуклеиновую кислоту можно вводить in vivo для стимуляции экспрессии кодируемого профилактического или терапевтического средства путем конструирования ее как части соответствующего вектора экспрессии нуклеиновой кислоты и введения ее таким образом, чтобы она стала внутриклеточной, например, путем использования ретровирусного вектора (см. патент США № 4980286) или путем прямой инъекции, или путем использования бомбардировки микрочастицами (например, генная пушка; Biolistic, Dupont) или покрытия липидами или рецепторами клеточной поверхности или трансфицирующими агентами, или путем введения вместе с гомеобокс-подобным пептидом, который, как известно, проникает в ядро (см. например, Joliot et al., 1991, Proc. Natl. Acad. Sci. USA 88:1864-1868), тому подобное. В качестве альтернативы, нуклеиновая кислота может быть введена внутриклеточно и включена в ДНК клетки-хозяина для экспрессии путем гомологичной рекомбинации.
[00432] В конкретном варианте осуществления композиция по настоящему изобретению содержит одно, два или более антител по настоящему изобретению. В другом варианте осуществления композиция по настоящему изобретению содержит одно, два или более антител по настоящему изобретению и профилактическое или терапевтическое средство, отличное от ADC антитела против нектина-4 по настоящему изобретению. В одном из вариантов осуществления средства представляют собой средства, известные как эффективные для профилактики, контроля, лечения и/или улучшения состояния, связанного с нектином-4, или используемые для этого в настоящий момент. Кроме профилактических или терапевтических средств композиции по настоящему изобретению также могут содержать носитель.
[00433] Композиции по настоящему изобретению включают основное вещество композиций лекарственных средств, используемую при изготовлении фармацевтических композиций (например, композиции, которые подходят для введения пациенту или индивиду), которые можно использовать для получения стандартных лекарственных форм. В одном из вариантов осуществления композиция по настоящему изобретению представляет собой фармацевтическую композицию. Такие композиции содержат профилактически или терапевтически эффективное количество одного или нескольких профилактических или терапевтических средств (например, антитела по настоящему изобретению, или другого профилактического или терапевтического средства) и фармацевтически приемлемый носитель. Фармацевтические композиции могут быть включены в составы так, чтобы быть подходящими для соответствующего пути введения пациенту.
[00434] В конкретном варианте осуществления термин «носитель» относится к разбавителю, адъюванту (например, адъюванту Фрейнда (полный и неполный)), вспомогательному веществу или носителю, вместе с которым вводят терапевтическое средство. Такие фармацевтические носители могут представлять собой стерильные жидкости, такие как вода и масла, в том числе масло нефтяного, животного, растительного или синтетического происхождения, такие как арахисовое масло, соевое масло, минеральное масло, кунжутное масло и тому подобное. Вода является характерным носителем, если фармацевтическую композицию вводят внутривенно. Физиологические растворы и водные растворы декстрозы и глицерина также могут быть использованы в качестве жидких носителей, в частности, в растворах для инъекций. Подходящие фармацевтические вспомогательные вещества включают крахмал, глюкозу, лактозу, сахарозу, желатин, солод, рис, муку, мел, силикагель, стеарат натрия, моностеарат глицерина, тальк, хлорид натрия, сухое обезжиренное молоко, глицерин, пропиленгликоль, воду, этанол и тому подобное. Композиция, при желании, может также содержать незначительные количества смачивающих или эмульгирующих средств или рН-буферирующих агентов. Эти композиции могут принимать форму растворов, суспензий, эмульсий, таблеток, пилюль, капсул, порошков, составов с замедленным высвобождением и тому подобного. Препарат для перорального введения может включать стандартные носители, такие как маннит, лактоза, крахмал, стеарат магния, сахарин натрия, целлюлоза, карбонат магния фармацевтической степени чистоты и тому подобное. Примеры подходящих фармацевтических носителей описаны в Remington's Pharmaceutical Sciences (1990) Mack Publishing Co., Easton, PA. Такие композиции содержат профилактически или терапевтически эффективное количество ADC антитела против нектина-4, например в очищенной форме, вместе с подходящим количеством носителя, для придания формы, удобной для введения пациенту. Состав должен соответствовать способу введения.
[00435] В одном из вариантов осуществления композиция введена в состав в соответствии с рутинными процедурами в виде фармацевтической композиции, адаптированной для внутривенного введения людям. Как правило, композиции для внутривенного введения представляют собой растворы в стерильном изотоническом водном буферном растворе. При необходимости композиция может также включать солюбилизирующий агент и местный анестетик, такой как лидокаин, для облегчения боли в месте инъекции. Такие композиции, однако, могут вводиться путем, отличным от внутривенного.
[00436] Обычно ингредиенты композиций по настоящему изобретению поставляются либо по отдельности, либо в виде смеси в составе стандартной лекарственной формы, например, в виде сухого лиофилизированного порошка или безводного концентрата в герметически закрытом контейнере, таком как ампула или саше, с указанием количества активного агента. Если композиция подлежит введению путем инфузии, она может быть помещена, например, в инфузионную бутылку, содержащую стерильную воду или физиологический раствор фармацевтической степени чистоты. Если композиция подлежит введению путем инъекции, может быть предоставлена ампула со стерильной водой для инъекций или с физиологическим раствором, так что ингредиенты могут быть смешаны перед введением.
[00437] Антитело или ADC антитела против нектина-4 по настоящему изобретению могут быть упакованы в герметически закрытый контейнер, такой как ампула или саше, с указанием количества антитела или ADC антитела против нектина-4. В одном из вариантов осуществления антитело или ADC антитела против нектина-4 поставляются в виде сухого стерилизованного лиофилизированного порошка или безводного концентрата в герметически закрытом контейнере и их можно восстановить, например, в воде или солевом растворе до подходящей концентрации для введения пациенту. В некоторых вариантах осуществления антитело или ADC антитела против нектина-4 поставляют в виде сухого стерильного лиофилизированного порошка в герметически закрытом контейнере при стандартной дозировке по меньшей мере 0,1 мг, по меньшей мере 0,5 мг, по меньшей мере 1 мг, по меньшей мере 2 мг или по меньшей мере 3 мг, например по меньшей мере 5 мг, по меньшей мере 10 мг, по меньшей мере 15 мг, по меньшей мере 25 мг, по меньшей мере 30 мг, по меньшей мере 35 мг, по меньшей мере 45 мг, по меньшей мере 50 мг, при по меньшей мере 60 мг, по меньшей мере 75 мг, по меньшей мере 80 мг, по меньшей мере 85 мг, по меньшей мере 90 мг, по меньшей мере 95 мг или по меньшей мере 100 мг. Лиофилизированный ADC антитела против нектина-4 можно хранить при температуре от 2 до 8°C в оригинальной упаковке, и ADC антитела против нектина-4 можно вводить в течение 12 часов, например, в течение 6 часов, в течение 5 часов, в течение 3 часов или в течение 1 часа после восстановления. В альтернативном варианте осуществления антитело или ADC антитела против нектина-4 поставляются в жидкой форме в герметически закрытом контейнере с указанием количества и концентрации антитела или ADC антитела против нектина-4. В некоторых вариантах осуществления жидкая форма антитела или ADC антитела против нектина-4 поставляется в герметически закрытом контейнере, по меньшей мере 0,1 мг/мл, по меньшей мере 0,5 мг/мл или по меньшей мере 1 мг/мл и, например, по меньшей мере 5 мг/мл, по меньшей мере 10 мг/мл, по меньшей мере 15 мг/мл, по меньшей мере 25 мг/мл, по меньшей мере 30 мг/мл, по меньшей мере 40 мг/мл, по меньшей мере 50 мг/мл, по меньшей мере 60 мг/мл, по меньшей мере 70 мг/мл, по меньшей мере 80 мг/мл, по меньшей мере 90 мг/мл или по меньшей мере 100 мг/мл.
[00438] Композиции по настоящему изобретению могут быть введены в состав в виде нейтральных или солевых форм. Фармацевтически приемлемые соли включают соли, образованные с анионами, такими как соли, полученные с соляной, фосфорной, уксусной, щавелевой, винной кислотой и тому подобное, и соли, образованные с катионами, такими как соли, полученные с натрием, калием, аммонием, кальцием, гидроксидами железа, изопропиламином, триэтиламином, 2-этиламиноэтанолом, гистидином, прокаином и тому подобное.
[00439] Количество профилактического или терапевтического средства (например, ADC антитела против нектина-4 по настоящему изобретению) или композиции по настоящему изобретению, которое будет эффективным для профилактики, контроля, лечения и/или улучшения нектин-4-опосредованного заболевания может быть определено стандартными клиническими методами.
[00440] Соответственно, доза ADC антитела против нектина-4 или композиции, которая дает титр сыворотки от примерно 0,1 мкг/мл до примерно 450 мкг/мл и в некоторых вариантах осуществления по меньшей мере 0,1 мкг/мл, при по меньшей мере 0,2 мкг/мл, по меньшей мере 0,4 мкг/мл, по меньшей мере 0,5 мкг/мл, по меньшей мере 0,6 мкг/мл, по меньшей мере 0,8 мкг/мл, по меньшей мере 1 мкг/мл, по меньшей мере 1,5 мкг/мл, например, по меньшей мере 2 мкг/мл, по меньшей мере 5 мкг/мл, по меньшей мере 10 мкг/мл, по меньшей мере 15 мкг/мл, по меньшей мере 20 мкг/мл, по меньшей мере 25 мкг/мл, по меньшей мере 30 мкг/мл, по меньшей мере 35 мкг/мл, по меньшей мере 40 мкг/мл, по меньшей мере 50 мкг/мл, по меньшей мере 75 мкг/мл, по меньшей мере 100 мкг/мл, по меньшей мере 125 мкг/мл, по меньшей мере 150 мкг/мл, по меньшей мере 200 мкг/мл, по меньшей мере 250 мкг/мл, по меньшей мере 300 мкг/мл, по меньшей мере 350 мкг/мл, по меньшей мере 400 мкг/мл или по меньшей мере 450 мкг/мл можно вводить человеку для профилактики, контроля, лечения и/или улучшения нектин-4-опосредованного заболевания. Кроме того, необязательно, в качестве вспомогательных средств для определения оптимальных диапазонов доз могут быть использованы in vitro анализы. Точная доза, которую следует использовать в составе, также будет зависеть от пути введения и тяжести заболевания, расстройства или состояния, и ее следует выбирать в соответствии с мнением практикующего врача и обстоятельствами каждого пациента.
[00441] Эффективные дозы могут быть экстраполированы из кривых доза-ответ, полученных из тест-систем in vitro или на животных моделях.
[00442] Для антител по настоящему изобретению доза, вводимая пациенту, обычно составляет от 0,1 мг/кг до 100 мг/кг массы тела пациента. В некоторых вариантах осуществления доза, вводимая пациенту, составляет от примерно 1 мг/кг до примерно 75 мг/кг массы тела пациента. В некоторых вариантах осуществления доза, вводимая пациенту, составляет от 1 мг/кг до 20 мг/кг массы тела пациента, например от 1 мг/кг до 5 мг/кг массы тела пациента. Как правило, человеческие антитела имеют более длительный период полужизни в организме человека, чем антитела, происходящие от других видов, что связано с иммунным ответом на чужеродные полипептиды. Таким образом, чаще можно использовать более низкие дозы человеческих антител и вводить их реже. Кроме того, доза и частота введения антител по настоящему изобретению может быть уменьшена путем усиления поглощения и проникновения антител в ткани посредством модификаций, таких как, например, липидирование.
[00443] В одном из вариантов осуществления вводят приблизительно 100 мг/кг или менее, приблизительно 75 мг/кг или менее, приблизительно 50 мг/кг или менее, приблизительно 25 мг/кг или менее, приблизительно 10 мг/кг или менее, приблизительно 5 мг/кг или менее, приблизительно 1 мг/кг или менее, приблизительно 0,5 мг/кг или менее или приблизительно 0,1 мг/кг или менее ADC антитела против нектина-4 5 раз, 4 раза, 3 раза, 2 раза или 1 раз для лечения нектин-4-опосредованного заболевания. В некоторых вариантах осуществления ADC антитела нектина-4 по настоящему изобретению вводят примерно 1-12 раз, причем дозы можно вводить по мере необходимости, например, еженедельно, раз в две недели, ежемесячно, раз в два месяца, три месяца и тому подобное, как определено врачом. В некоторых вариантах осуществления более низкую дозу (например, 1-15 мг/кг) можно вводить чаще (например, 3-6 раз). В других вариантах осуществления более высокую дозу (например, 25-100 мг/кг) можно вводить реже (например, 1-3 раза). Однако, как будет очевидно для специалистов в данной области, другие количества и графики введения доз легко определить и он находятся в пределах объема настоящего описания.
[00444] В конкретном варианте осуществления, вводят приблизительно 100 мг/кг, приблизительно 75 мг/кг или менее, приблизительно 50 мг/кг или менее, приблизительно 25 мг/кг или менее, приблизительно 10 мг/кг или менее, приблизительно 5 мг/кг или менее, приблизительно 1 мг/кг или менее, приблизительно 0,5 мг/кг или менее, приблизительно 0,1 мг/кг или менее ADC антитела против нектина-4 в составе с замедленным высвобождением пациенту, такому как человек, для профилактики, контроля, лечения и/или улучшения нектин-4-опосредованного заболевания. В другом конкретном варианте осуществления вводят приблизительно 100 мг/кг, приблизительно 75 мг/кг или менее, приблизительно 50 мг/кг или менее, приблизительно 25 мг/кг или менее, приблизительно 10 мг/кг или менее, приблизительно 5 мг/кг или менее, приблизительно 1 мг/кг или менее, приблизительно 0,5 мг/кг или менее или приблизительно 0,1 мг/кг или менее болюса ADC антитела против нектина-4, не входящего в состав с замедленным высвобождением, пациенту, такому как человека, для профилактики, контроля, лечения и/или улучшения заболевания, опосредованного нектином-4, и через определенный промежуток времени вводят приблизительно 100 мг/кг, приблизительно 75 мг/кг или менее, приблизительно 50 мг/кг или менее, приблизительно 25 мг/кг или менее, приблизительно 10 мг/кг или менее, приблизительно 5 мг/кг или менее, приблизительно 1 мг/кг или менее, приблизительно 0,5 мг/кг или менее или приблизительно 5 мг/кг или менее ADC антитела против нектина-4 по настоящему изобретению в виде пролонгированного высвобождения указанному пациенту (например, интраназально или внутримышечно) два, три или четыре раза (например, один раз). В соответствии с этим вариантом осуществления определенный период времени может составлять от 1 до 5 дней, недели, двух недель или месяца.
[00445] В некоторых вариантах осуществления единичную дозу ADC антитела против нектина-4 по настоящему изобретению вводят пациенту для профилактики, контроля, лечения и/или улучшения состояния, опосредованного нектином-4, два, три, четыре, пять, шесть, семь, восемь, девять, десять, одиннадцать, двенадцать раз, тринадцать, четырнадцать, пятнадцать, шестнадцать, семнадцать, восемнадцать, девятнадцать, двадцать, двадцать один, двадцать два, двадцать три, двадцать четыре, двадцать пять или двадцать шесть с двухнедельными (например, около 14 дней) интервалами в течение года, где доза выбрана из группы, состоящей из примерно 0,1 мг/кг, примерно 0,5 мг/кг, примерно 1 мг/кг, около 5 мг/кг, около 10 мг/кг, около 15 мг/кг, около 20 мг/кг, около 25 мг/кг, около 30 мг/кг, около 35 мг/кг, около 40 мг/кг, около 45 мг/кг, около 50 мг/кг, около 55 мг/кг, около 60 мг/кг, около 65 мг/кг, около 70 мг/кг, около 75 мг/кг, около 80 мг/кг, около 85 мг/кг, около 90 мг/кг, около 95 мг/кг, около 100 мг/кг или их комбинации (то есть каждая доза месячной дозы может идентичной или нет).
[00446] В другом варианте осуществления единичную доза ADC против нектина-4 по настоящему изобретению вводят пациенту для профилактики, контроля, лечения и/или улучшения состояния, опосредованного нектином-4, два, три, четыре, пять, шесть семь, восемь, девять, десять, одиннадцать или двенадцать раз с интервалом примерно в месяц (например, около 30 дней) в течение года, где доза выбрана из группы, состоящей из примерно 0,1 мг/кг, примерно 0,5 мг/кг, примерно 1 мг/кг, примерно 5 мг/кг, примерно 10 мг/кг, примерно 15 мг/кг, примерно 20 мг/кг, примерно 25 мг/кг, примерно 30 мг/кг, около 35 мг/кг, примерно 40 мг/кг, примерно 45 мг/ кг, примерно 50 мг/кг, примерно 55 мг/кг, примерно 60 мг/ кг, примерно 65 мг/кг, примерно 70 мг/кг, примерно 75 мг/кг, примерно 80 мг/кг, примерно 85 мг/кг, примерно 90 мг/кг, примерно 95 мг/кг, примерно 100 мг/кг или их комбинации (то есть, каждая доза ежемесячной дозы может быть идентичной или нет).
[00447] В одном их вариантов осуществления, единичную дозу ADC против нектина-4 по настоящему изобретению вводят пациенту для профилактики, контроля, лечения и/или улучшения состояния, опосредованного нектином-4, два, три, четыре, пять, или шесть раз с интервалом примерно в два месяца (например, около 60 дней) в течение года, где доза выбрана из группы, состоящей из примерно 0,1 мг/кг, примерно 0,5 мг/кг, примерно 1 мг/кг, около 5 мг/кг, около 10 мг/кг, около 15 мг/кг, около 20 мг/кг, около 25 мг/кг, около 30 мг/кг, около 35 мг/кг, около 40 мг/кг, около 45 мг/кг, около 50 мг/кг, около 55 мг/кг, около 60 мг/кг, около 65 мг/кг, около 70 мг/кг, около 75 мг/кг, около 80 мг/кг, около 85 мг/кг, около 90 мг/кг, около 95 мг/кг, около 100 мг/кг или их комбинации (то есть, каждая двухмесячная доза может быть идентичной или нет).
[00448] В некоторых вариантах осуществления единичную дозу ADC антитела против нектина-4 по настоящему изобретению вводят пациенту для профилактики, контроля, лечения и/или улучшения состояния, опосредованного нектином-4, два, три или четыре раза с трехнедельными (например, около 120 дней) интервалами в течение годового курса, где доза выбрана из группы, состоящей из примерно 0,1 мг/кг, примерно 0,5 мг/кг, примерно 1 мг/кг, около 5 мг/кг, около 10 мг/кг, около 15 мг/кг, около 20 мг/кг, около 25 мг/кг, около 30 мг/кг, около 35 мг/кг, около 40 мг/кг, около 45 мг/кг, около 50 мг/кг, около 55 мг/кг, около 60 мг/кг, около 65 мг/кг, около 70 мг/кг, около 75 мг/кг, около 80 мг/кг, около 85 мг/кг, около 90 мг/кг, около 95 мг/кг, около 100 мг/кг или их комбинации (то есть каждая трехмесячная доза может идентичной или нет).
[00449] В некоторых вариантах осуществления путь ведения дозы ADC антитела против нектина-4 по настоящему изобретению пациенту является интраназальным, внутримышечным, внутривенным или их комбинацией, но другие пути, описанные в данном документе, также приемлемы. Каждая доза может вводиться тем же путем введения или другим. В некоторых вариантах осуществления ADC антитела против нектина-4 по настоящему изобретению можно вводить несколькими путями введения одновременно или последовательно в разных дозах того же или другого ADC антитела против нектина-4 по настоящему изобретению.
[00450] В определенных вариантах осуществления ADC антитела против нектина-4 по настоящему изобретению вводят пациенту профилактически или терапевтически. ADC антитела против нектина-4 по настоящему изобретению можно профилактически или терапевтически вводить пациенту для профилактики, уменьшения или ослабления опосредованного нектином-4 заболевания или его симптома.
27. Генная терапия
[00451] В конкретном варианте осуществления нуклеиновые кислоты, содержащие последовательности, кодирующие антитела или их функциональные производные, вводят пациенту для использования в способе по настоящему изобретению, например, для профилактики, контроля, лечения и/или улучшения опосредованного нектином-4 заболевания, расстройства или состояния посредством генной терапии. Такая терапия включает терапию, осуществляемую введением пациенту экспрессированной или экспрессируемой нуклеиновой кислоты. В одном из вариантов осуществления нуклеиновые кислоты продуцируют кодируемое антитело, которое может быть конъюгировано для получения ADC антитела против нектина-4, и антитело или ADC антитела против нектина-4 дает профилактический или терапевтический эффект.
[00452] Может быть использован любой из способов экспрессии рекомбинантного гена (или генной терапии), доступных в данной области. Примеры способов описаны ниже и приведены в разделе «Примеры».
[00453] Общий обзор методов генной терапии см. Goldspiel et al., 1993, Clinical Pharmacy 12: 488-505; Wu and Wu, 1991, Biotherapy 3: 87-95; Tolstoshev, 1993, Ann. Rev. Pharmacol. Toxicol.32:573-596; Mulligan, 1993, Science 260:926-932; and Morgan and Anderson, 1993, Ann. Rev. Biochem.62:191-217; May, 1993, TIBTECH 11(5):155-215.
Методы, общеизвестные в области технологии рекомбинантных ДНК, которые могут быть использованы, описаны в Ausubel et al. (eds.), Current Protocols in Molecular Biology, John Wiley & Sons, NY (1993); and Kriegler, Gene Transfer and Expression, A Laboratory Manual, Stockton Press, NY (1990).
[00454] В конкретном варианте осуществления композиция содержит нуклеиновые кислоты, кодирующие антитело против нектина-4 по настоящему изобретению, причем нуклеиновые кислоты являются частью вектора экспрессии, который экспрессирует антитело или химерные белки или тяжелые или легкие цепи, или терапевтическое средство или лекарственное средство в подходящем хозяине. В частности, такие нуклеиновые кислоты имеют промоторы, такие как гетерологичные промоторы, функционально связанные с кодирующей областью антитела против нектина-4, причем промотор является индуцибельным или конститутивным и, необязательно, тканеспецифичным. В другом конкретном варианте осуществления используют молекулы нуклеиновой кислоты, в которых последовательности, кодирующие антитело против нектина-4, и любые другие желаемые последовательности фланкированы областями, которые способствуют гомологичной рекомбинации в нужном сайте в геноме, обеспечивая таким образом внутрихромосомную экспрессию нуклеиновой кислоты, кодирующей антитело против нектина-4 (Koller and Smithies, 1989, Proc. Natl. Acad. Sci. USA 86:8932-8935; Zijlstra et al., 1989, Nature 342:435-438). В некоторых вариантах осуществления экспрессированная молекула антитела против нектина-4 содержит одноцепочечное антитело; альтернативно, последовательности нуклеиновой кислоты включают последовательности, кодирующие как тяжелую, так и легкую цепи или их фрагменты в антителе против нектина-4.
[00455] Доставка нуклеиновых кислот пациенту может быть либо непосредственной, в этом случае пациент подвергается непосредственному воздействию нуклеиновой кислоты или векторов, несущих нуклеиновую кислоту, либо косвенной, и в этом случае клетки сначала трансформируют нуклеиновыми кислотами in vitro, а затем трансплантируют пациенту. Эти два подхода известны соответственно как генная терапия in vivo или ex vivo.
[00456] В конкретном варианте осуществления последовательности нуклеиновых кислот вводят непосредственно in vivo, где последовательности экспрессируются с получением кодируемого продукта. Это может быть осуществлено любым из многочисленных способов, известных в данной области, например, путем конструирования их как части подходящего вектора экспрессии нуклеиновой кислоты и введения вектора таким образом, что последовательности становятся внутриклеточными, например, путем инфицирования с использованием дефектных или ослабленных ретровирусов или других вирусных векторов (см. патент США № 4980286), либо путем прямой инъекции "голой" ДНК, либо путем бомбардировки микрочастицами (например, генной пушкой; Biolistic, Dupont), либо путем нанесения липидов или рецепторов клеточной поверхности или трансфицирующих агентов, капсулирования в липосомах, микрочастицах или микрокапсулах или путем введения их в связи с пептидом, который, как известно, проникает в ядро, путем введения его при соединении с лигандом, захватываемым рецептор-опосредованным эндоцитозом (см., например, Wu and Wu, 1987, J. Biol. Chem.262: 4429-4432) (который может использоваться для нацеливания на типы клеток, специфически экспрессирующие рецепторы) и тому подобное. В другом варианте осуществления могут быть образованы комплексы нуклеиновая кислота-лиганд, в которых лиганд содержит фузогенный вирусный пептид для разрушения эндосом, что позволяет нуклеиновой кислоте избежать лизосомальной деградации. В еще одном варианте осуществления нуклеиновая кислота может быть нацелена in vivo для специфического клеточного захвата и экспрессии путем нацеливания на конкретный рецептор (см., например, публикации PCT WO 92/06180; WO 92/22635; WO 92/20316; WO 93/14188 WO 93/20221). Альтернативно, нуклеиновая кислота может быть введена внутриклеточно и включена в ДНК клетки-хозяина для экспрессии путем гомологичной рекомбинации (Koller and Smithies, 1989, Proc. Natl. Acad. Sci. USA 86:8932-8935; и Zijlstra et al., 1989, Nature 342:435-438).
[00457] В конкретном варианте осуществления используются вирусные векторы, которые содержат последовательности нуклеиновых кислот, кодирующие антитело против нектина-4. Например, может быть использован ретровирусный вектор (см. Miller et al., 1993, Meth. Enzymol.217:581-599). Эти ретровирусные векторы содержат компоненты, необходимые для правильной упаковки вирусного генома и интеграции в ДНК клетки-хозяина. Последовательности нуклеиновых кислот, кодирующие антитело против нектина-4, предназначенное для использования в генной терапии, могут быть клонированы в один или несколько векторов, что облегчает доставку гена пациенту. Более подробно о ретровирусных векторах можно найти в Boesen et al., 1994, Biotherapy 6: 291-302, в котором описано использование ретровирусного вектора для доставки гена mdr 1 в гематопоэтические стволовые клетки для повышения устойчивости стволовых клеток к химиотерапии. Другими ссылками, примерами использования ретровирусных векторов в генной терапии, являются: Clowes et al., 1994, J. Clin. Invest.93:644-651; Klein et al., 1994, Blood 83:1467-1473; Salmons and Gunzberg, 1993, Human Gene Therapy 4:129-141; and Grossman and Wilson, 1993, Curr. Opin. in Genetics and Devel.3:110-114.
[00458] Аденовирусы представляют собой другие вирусные векторы, которые можно использовать при рекомбинантной продукции антител. Аденовирусы являются особенно удобными носителями для доставки генов в респираторный эпителий. Аденовирусы естественным образом инфицируют респираторный эпителий, где они вызывают заболевание средней тяжести. Другими мишенями для систем доставки на основе аденовирусов являются печень, центральная нервная система, эндотелиальные клетки и мышцы. Преимущество аденовирусов заключается в способности заражать неделящиеся клетки. В статье Kozarsky and Wilson, 1993, Current Opinion in Genetics and Development 3: 499-503 представлен обзор генной терапии на основе аденовирусов. В статье Bout et al., 1994, Human Gene Therapy 5:3-10 показано использование аденовирусных векторов для переноса генов в респираторный эпителий макак-резусов. Другие примеры использования аденовирусов в генной терапии приведены в Rosenfeld et al., 1991, Science 252: 431-434; Rosenfeld et al., 1992, Cell 68: 143-155; Mastrangeli et al., 1993, J. Clin. Invest.91:225-234; PCT публикация W094/12649; и Wang et al., 1995, Gene Therapy 2:775-783. В конкретном варианте осуществления используются векторы аденовируса.
[00459] Также можно использовать аденоассоциированный вирус (AAV) (Walsh et al., 1993, Proc. Soc. Exp. Biol. Med.204:289-300; и патент США № 5436146). В конкретном варианте осуществления векторы AAV используют для экспрессии ADC антитела против нектина-4 по настоящему изобретению. В определенных вариантах осуществления AAV содержит нуклеиновую кислоту, кодирующую домен VH. В других вариантах осуществления AAV содержит нуклеиновую кислоту, кодирующую домен VL. В определенных вариантах осуществления AAV содержит нуклеиновую кислоту, кодирующую домен VH и домен VL. В некоторых вариантах осуществления способов по настоящему изобретению пациенту вводят AAV, содержащую нуклеиновую кислоту, кодирующую домен VH, и AAV, содержащую нуклеиновую кислоту, кодирующую домен VL. В других вариантах осуществления пациенту вводят AAV, содержащую нуклеиновую кислоту, кодирующую домен VH и домен VL. В определенных вариантах осуществления домены VH и VL сверхэкспрессированы.
[00460] Другой подход генной терапии включает перенос гена в клетки в культуре ткани такими способами, как электропорация, липофекция, трансфекция, опосредованная фосфатом кальция, или вирусная инфекция. Обычно метод переноса включает перенос селектируемого маркера в клетки. Затем клетки подвергают селекции для выделения тех клеток, которые захватили и экспрессируют перенесенный ген. Эти клетки затем доставляются пациенту.
[00461] В этом варианте осуществления нуклеиновую кислоту вводят в клетку перед введением in vivo полученной рекомбинантной клетки. Такое введение может быть осуществлено любым способом, известным в данной области, включая, но не ограничиваясь этим, трансфекцию, электропорацию, микроинъекцию, инфицирование вирусным или бактериофаговым вектором, содержащим последовательности нуклеиновой кислоты, слияние клеток, хромосом-опосредованный перенос генов, микроцеллюлозный перенос генов слияние сферопластов и тому подобное. В данной области техники известны многочисленные способы введения чужеродных генов в клетки (см., например, Loeffler and Behr, 1993, Meth. Enzymol.217:599-618; Cohen et al., 1993, Meth. Enzymol.217:618-644; Clin. Pharma. Ther.29:69-92 (1985)) и может использоваться в соответствии со способами по настоящему изобретению, при условии, что необходимые для развития и физиологических функций клеток-реципиентов не нарушаются. Методика должна обеспечивать стабильный перенос нуклеиновой кислоты в клетку, чтобы нуклеиновая кислота экспрессировалась клеткой, например наследуемая и экспрессируемая ее клеточным потомством.
[00462] Полученные рекомбинантные клетки могут быть доставлены пациенту различными способами, известными в данной области. Рекомбинантные клетки крови (например, гематопоэтические стволовые клетки или клетки-предшественники) можно вводить внутривенно. Количество клеток, предполагаемое для использования, зависит от желаемого эффекта, состояния пациента и тому подобное, и может быть определено специалистом в данной области.
[00463] Клетки, в которые нуклеиновая кислота может быть введена для целей генной терапии, включают любой желаемый доступный тип клеток и включают, но не ограничиваются ими, эпителиальные клетки, эндотелиальные клетки, кератиноциты, фибробласты, мышечные клетки, гепатоциты; лимфоидные и миелоидные клетки, такие как Т-лимфоциты, В-лимфоциты, моноциты, макрофаги, нейтрофилы, эозинофилы, мегакариоциты, гранулоциты; различные стволовые или прогениторные клетки, в частности гематопоэтические стволовые или прогениторные клетки, например, полученные из костного мозга, пуповинной крови, периферической крови, печени плода и тому подобное.
[00464] В конкретном варианте осуществления клетка, используемая для генной терапии, является аутологичной для пациента.
[00465] В варианте осуществления, в котором рекомбинантные клетки используются в генной терапии, последовательности нуклеиновых кислот, кодирующие антитело против нектина-4, вводят в клетки таким образом, что они экспрессируются клетками или их потомством, и затем рекомбинантные клетки вводят in vivo для терапевтического эффекта. В конкретном варианте осуществления используются стволовые или клетки-предшественники. Любые стволовые и/или клетки-предшественники, которые могут быть выделены и сохранены in vitro, можно потенциально использовать в соответствии с этим вариантом осуществления способов по настоящему изобретению (см., например, публикацию PCT WO 94/08598; Stemple and Anderson, 1992, Cell 71:973-985; Rheinwald, 1980, Meth. Cell Bio. 21A: 229; и Pittelkow and Scott, 1986, Mayo Clinic Proc.61:771).
[00466] В конкретном варианте осуществления нуклеиновая кислота, которая должна быть введена для целей генной терапии, содержит индуцибельный промотор, функционально связанный с кодирующей областью, так что экспрессия нуклеиновой кислоты контролируется путем контроля наличия или отсутствия соответствующего индуктора транскрипции.
28. Полинуклеотиды, кодирующие антитело
[00467] Также раскрыты полинуклеотиды, содержащие нуклеотидную последовательность, кодирующую антитело по настоящему изобретению, которое иммуноспецифично связывается с эпитопом нектина-4. В настоящем документе также раскрыты полинуклеотиды, которые гибридизуются в условиях гибридизации высокой строгости, средней или более низкой строгости, например, как определено выше, с полинуклеотидами, которые кодируют модифицированное антитело по настоящему изобретению.
[00468] Полинуклеотиды могут быть получены, и нуклеотидная последовательность полинуклеотидов может быть определена любым способом, известным в данной области. Поскольку аминокислотные последовательности некоторых антител против нектина-4 по настоящему изобретению известны, то нуклеотидные последовательности, кодирующие эти антитела, и модифицированные варианты таких антител могут быть определены с использованием методов, хорошо известных в данной области техники, то есть, собраны нуклеотидные кодоны, которые, как известно, кодируют конкретные аминокислоты так, чтобы получить нуклеиновую кислоту, которая кодирует антитело. Такой полинуклеотид, кодирующий антитело, может быть собран из химически синтезированных олигонуклеотидов (например, как описано в Kutmeier et al., 1994, BioTechniques 17: 242), что, коротко, включает синтез перекрывающихся олигонуклеотидов, содержащих части последовательности, кодирующей антитело фрагменты или их варианты, отжиг и лигирование этих олигонуклеотидов, а затем амплификацию лигированных олигонуклеотидов с помощью ПЦР.
[00469] Альтернативно, полинуклеотид, кодирующий антитело по настоящему изобретению, может быть получен из нуклеиновой кислоты из подходящего источника (например, гибридомы M22-321b41.1, как раскрыто в настоящем документе, имеющей инвентарный номер ATCC PTA-124245, дата депонирования 13 июня 2017 года). Если клон, содержащий нуклеиновую кислоту, кодирующую конкретное антитело, недоступен, но последовательность молекулы антитела известна, нуклеиновую кислоту, кодирующую иммуноглобулин, можно химически синтезировать или получить из подходящего источника (например, библиотеки кДНК антитела или библиотеки кДНК, созданной из нуклеиновой кислоты, такой как поли-А+ РНК, выделенной из любой ткани или клеток, экспрессирующих антитело, таких как клетки гибридомы, отобранные для экспрессии антитела по настоящему изобретению путем амплификации ПЦР с использованием синтетических праймеров, гибридизующихся с 3'- и 5'-концами последовательности или путем клонирования с использованием олигонуклеотидного зонда, специфичного для конкретной последовательности гена, для идентификации, например, клона кДНК из библиотеки кДНК, которая кодирует антитело. Амплифицированные нуклеиновые кислоты, полученные с помощью ПЦР, затем могут быть клонированы в реплицируемые клонирующие векторы с использованием любого метода, хорошо известного в данной области.
[00470] В определенных вариантах осуществления молекулы нуклеиновой кислоты по настоящему изобретению содержат или состоят из последовательности нуклеиновой кислоты любой из SEQ ID NO: 38 (кодирующая VH) и/или SEQ ID NO: 37 (кодирующая VL), или любую их комбинацию (например, в виде нуклеотидной последовательности, кодирующей антитело по настоящему изобретению, например, полноразмерное антитело, тяжелую и/или легкую цепь антитела или одноцепочечное антитело по настоящему изобретению).
[00471] В определенных аспектах в настоящем документе представлены полинуклеотиды, содержащие нуклеотидную последовательность, кодирующую антитело по настоящему изобретению, или его фрагмент (например, вариабельную область легкой цепи и/или вариабельную область тяжелой цепи), которое иммуноспецифически связывается с антигеном нектина-4, и векторы, например векторы, содержащие такие полинуклеотиды для рекомбинантной экспрессии в клетках-хозяевах (например, в клетках E.coli и клетках млекопитающих). В определенных аспектах в настоящем документы раскрыты клетки (например, клетки-хозяева). В настоящем документе также представлены способы получения антител и антигенсвязывающих фрагментов, описанных в настоящем описании.
[00472] В определенных аспектах в настоящем документе представлены полинуклеотиды, содержащие нуклеотидную последовательность, кодирующую легкую цепь или тяжелую цепь антитела по настоящему изобретению. В определенных вариантах осуществления в настоящем документе представлены полинуклеотиды, содержащие нуклеотидную последовательность, кодирующую легкую цепь и тяжелую цепь антитела по настоящему изобретению. Полинуклеотиды могут содержать нуклеотидные последовательности, кодирующие легкую цепь, содержащую FR VL и CDR антител по настоящему изобретению (см., например, таблицы 1-2, соответственно). Полинуклеотиды могут содержать нуклеотидные последовательности, кодирующие тяжелую цепь, содержащую FR VH и CDR антител по настоящему изобретению (см., например, таблицы 1-2, соответственно). В конкретных вариантах осуществления полинуклеотид по настоящему изобретению кодирует область цепи VL, содержащую аминокислотную последовательность SEQ ID NO: 37. В конкретных вариантах осуществления полинуклеотид по настоящему изобретению кодирует область цепи VH, содержащую аминокислотную последовательность любой из SEQ ID NO: 38.
[00473] В конкретных вариантах осуществления в настоящем документе раскрыты полинуклеотиды, содержащие нуклеотидную последовательность, кодирующую антитело против нектина-4, содержащее три CDR цепи VL, например, содержащие CDR1 VL, CDR2 VL и CDR3 VL антитела M22-321b41.1 (например, см. таблицу 1). В конкретных вариантах осуществления в настоящем документе представлены полинуклеотиды, содержащие три CDR цепи VH, например, содержащие CDR1 VH, CDR2 VH и CDR3 VH антитела M22-321b41.1 (например, см. таблицу 1).
[00474] В конкретных вариантах осуществления в данном документе представлены полинуклеотиды, содержащие нуклеотидную последовательность, кодирующую антитело против нектина-4, содержащее область цепи VL, например, содержащую FR1-CDR1-FR2-CDR2-FR3-CDR3-FR4, содержащую аминокислоту последовательности, описанные в настоящем документе (например, см. таблицы 1-2). В конкретных вариантах осуществления в настоящем документе раскрыты полинуклеотиды, содержащие нуклеотидную последовательность, кодирующую антитело против нектина-4, содержащее область цепи VH, например, содержащую FR1-CDR1-FR2-CDR2-FR3-CDR3-FR4, содержащую аминокислотную последовательность, описанную в настоящем документе (например, см. таблицы 1-2).
[00475] В некоторых вариантах осуществления полинуклеотид, описанный в настоящем документе, содержит нуклеотидную последовательность, кодирующую антитело по настоящее изобретение, содержащее вариабельную область легкой цепи (VL), содержащую аминокислоту, описанную в настоящем документе (например, см. таблицу 1), где антитело иммуноспецифично связывается с полипептидом нектина-4.
[00476] В определенных вариантах осуществления полинуклеотид по настоящему изобретению содержит нуклеотидную последовательность, кодирующую антитело по настоящему изобретению, содержащую вариабельную область тяжелой цепи (VH), содержащую аминокислотную последовательность, описанную в настоящем документе (например, см. таблицу 1), где антитело иммуноспецифично связывается с полипептидом нектина-4.
[00477] В определенных аспектах полинуклеотид содержит нуклеотидную последовательность, кодирующую антитело, описанное в настоящем документе, включающую область цепи VL, содержащую один или несколько FR VL, имеющих аминокислотную последовательность, описанную в настоящем документе (например, см. таблицу 2), где антитело иммуноспецифично связывается с полипептидом нектина-4. В определенных аспектах полинуклеотид содержит нуклеотидную последовательность, кодирующую антитело по настоящему изобретению, содержащее область цепи VH, содержащую один или несколько FR VH, имеющих аминокислотную последовательность, описанную в настоящем документе (например, см. таблицу 2), где антитело иммуноспецифично связывается с полипептидом нектина-4, например, полипептидом нектина-4 человека.
[00478] В конкретных вариантах осуществления полинуклеотид по настоящему изобретению содержит нуклеотидную последовательность, кодирующую антитело по настоящему изобретению, содержащее каркасные области (например, каркасные области домена VL и домена VH), которые являются человеческими каркасными областями, где антитело иммуноспецифично связывается с полипептидом нектина-4.
[00479] В определенном варианте осуществления полинуклеотид по настоящему изобретению содержит нуклеотидную последовательность, описанную в таблице 3, кодирующую VH или VL, соответственно, антитела M22-321b41.1, описанного в настоящем документе, которое иммуноспецифично связывается с полипептидом нектина-4.
Рекомбинантная продукция антитела
[00480] Рекомбинантная экспрессия антитела по настоящему изобретению (например, полноразмерного антитела, тяжелой и/или легкой цепи антитела или антитела с одной цепью, как описано в настоящем документе), которое иммуноспецифически связывается с антигеном нектина-4, требует конструирования вектора экспрессии, содержащего полинуклеотид, кодирующий антитело. После получения полинуклеотида, кодирующего молекулу антитела, тяжелую или легкую цепь антитела или его фрагмента (такого как, но не обязательно, фрагмента содержащего вариабельный домен тяжелой и/или легкой цепи) по настоящему изобретению, вектор для продукции молекулы антитела может быть получен с помощью технологии рекомбинантных ДНК с использованием методов, хорошо известных в данной области. Так, в настоящем документе описаны способы получения белка путем экспрессии полинуклеотида, содержащего нуклеотидную последовательность, кодирующую антитело. Способы, хорошо известные специалистам в данной области, можно применять для конструирования векторов экспрессии, содержащих последовательности, кодирующие антитело, и соответствующие сигналы для контроля транскрипции и трансляции. Эти способы включают, например, методики технологии рекомбинантной ДНК in vitro, методики синтеза и генетическую рекомбинацию in vivo. Также раскрыты реплицируемые векторы, содержащие нуклеотидную последовательность, кодирующую молекулу антитела по настоящему изобретению, тяжелую или легкую цепь антитела, вариабельный домен тяжелой или легкой цепи антитела или его фрагмента или CDR тяжелой или легкой цепи, функционально связанные с промотером. Такие векторы могут включать нуклеотидную последовательность, кодирующую константную область молекулы антитела (см., например, международные публикации WO 86/05807 и WO 89/01036; и патент США № 5124644), и вариабельный домен антитела может быть клонирован в такой вектор для экспрессии всей тяжелой цепи, всей легкой цепи или обоих - тяжелой и легкой цепей.
[00481] Вектор экспрессии трансфицируют в клетку-хозяин обычными способами, и затем трансфицированные клетки культивируют обычными способами с получением антитела по настоящему изобретению. Таким образом, в настоящем документе также раскрыты клетки-хозяева, содержащие полинуклеотид, кодирующий антитело по настоящему изобретению или его фрагменты, или его тяжелую или легкую цепь, или его фрагмент, или одноцепочечное антитело по настоящему изобретению, функционально связанные с гетерологичным промотором. В некоторых вариантах осуществления для экспрессии антител с двойной цепью векторы, кодирующие тяжелые и легкие цепи, могут совместно экспрессироваться в клетке-хозяине для экспрессии всей молекулы иммуноглобулина, как подробно описано ниже.
[00482] Для экспрессии молекул антител, представленных в настоящем документе, можно использовать различные векторные системы экспрессии в хозяине (см., например, патент США № 5807155). Такие системы экспрессии в хозяина представляют собой носители, с помощью которых интересующие кодирующие последовательности могут быть получены и впоследствии очищены, но также представляют собой клетки, которые могут при трансформации или трансфекции соответствующими нуклеотидными кодирующими последовательностями экспрессировать молекулу антитела, описанную в настоящем документе, in situ. К ним относятся, но ими не ограничиваются, микроорганизмы, такие как бактерии (например, E.coli и B. subtilis), трансформированные рекомбинантными бактериофаговыми ДНК, плазмидными ДНК или векторами экспрессии космидной ДНК, содержащими кодирующие последовательности антител; дрожжи (например, Saccharomyces Pichia), трансформированные рекомбинантными дрожжевыми векторами экспрессии, содержащими кодирующие последовательности антител; системы клеток насекомых, инфицированные векторами экспрессии рекомбинантного вируса (например, бакуловируса), содержащие кодирующие последовательности антител; системы растительных клеток, инфицированные векторами экспрессии рекомбинантного вируса (например, вируса мозаики цветной капусты, CaMV, вируса табачной мозаики, TMV) или трансформированные векторами экспрессии на основе рекомбинантной плазмиды (например, плазмиды Ti), содержащей кодирующие последовательности антител; или клеточные системы млекопитающих (например, клетки COS, CHO, BHK, 293, NS0 и 3T3), несущие рекомбинантные конструкции экспрессии, содержащие промоторы, полученные из генома клеток млекопитающих (например, промотор металлотионеина) или из вирусов млекопитающих (например, поздний аденовирус; промотор вируса коровьей оспы 7.5К). Для экспрессии молекулы рекомбинантного антитела можно использовать бактериальные клетки, такие как Escherichia coli, или эукариотические клетки, особенно для экспрессии молекулы всего рекомбинантного антитела. Например, клетки млекопитающих, такие как клетки яичника китайского хомяка (СНО), в сочетании с вектором, таким как основной промежуточный ранний ранний промоторный элемент гена из цитомегаловируса человека, является эффективной системой экспрессии антител (Foecking et al., 1986, Gene 45:101 и Cockett et al., 1990, Bio/Technology 8:2). В некоторых вариантах осуществления антитела по настоящему изобретению продуцируются в клетках СНО. В конкретном варианте осуществления экспрессия нуклеотидных последовательностей, кодирующих антитела по настоящему изобретению, которые иммуноспецифически связываются с антигеном нектина-4, регулируется конститутивным промотором, индуцибельным промотором или тканеспецифичным промотором.
[00483] В бактериальных системах ряд векторов экспрессии может быть преимущественно выбран в зависимости от применения, предназначенного для экспрессируемой молекулы антитела. Например, если необходимо продуцировать большое количество такого антитела получения фармацевтической композиции на основе молекулы антитела, могут быть желательными векторы, контролирующие экспрессию больших количеств гибридных белковых продуктов, которые легко очистить. Такие векторы включают, но не ограничиваются ими, вектор экспрессии pUR278 E.coli (Ruther et al., 1983, EMBO 12:1791), в котором кодирующая последовательность антитела может быть лигирована индивидуально в вектор в рамке с кодирующей областью lacZ, так что образуется слитый белок; векторы pIN (Inouye & Inouye, 1985, Nucleic Acids Res.13:3101-3109; Van Heeke & Schuster, 1989, J. Biol. Chem. 24:5503-5509); и аналогичные pGEX-векторы также можно использовать для экспрессии чужеродных полипептидов в виде слитых белков с глутатион-S-трансферазой (GST). В общем случае такие гибридные белки растворимы, и их легко очистить от лизированных клеток путем адсорбции и связывания с гранулами из глутатион-агарозного матрикса с последующим элюированием в присутствии свободного глутатиона. Конструкция pGEX-векторов предусматривает включение сайтов расщепления тромбина или протеазы фактора Xa, что позволяет отщепить клонированный целевой продукт гена от GST-группы.
[00484] В системе насекомого Autographa californica в качестве вектора для экспрессии чужеродных генов используют вирус ядерного полиэдроза (AcNPV). Вирус растет в клетках Spodoptera frugiperda. Последовательность, кодирующую антитело, можно отдельно клонировать в несущественных областях (например, гене полиэдрина) вируса и поместить под контроль промотора AcNPV (например, промотора полиэдрина).
[00485] В клетках-хозяевах млекопитающих можно использовать ряд систем экспрессии на основе вирусов. При использовании аденовируса в качестве вектора экспрессии интересующую кодирующую последовательность антитела можно лигировать с комплексом контроля транскрипции/трансляции аденовируса, например, последовательностью позднего промотора и трехчастного лидера. Затем этот химерный ген можно встроить в геном аденовируса посредством рекомбинации in vitro или in vivo. Встраивание в несущественную область вирусного генома (например, область E1 или E3) приведет к получению рекомбинантного вируса, который является жизнеспособным и способен экспрессировать молекулу антитела в инфицированных хозяевах (например, см. Logan & Shenk, 1984, Proc. Natl. Acad. Sci. USA 81:355-359). Для эффективной трансляции внедренных последовательностей, кодирующих антитело, также могут потребоваться специфические сигналы инициации. Эти сигналы включают инициирующий кодон ATG и смежные последовательности. Кроме того, инициирующий кодон должен быть синхронизирован с рамкой считывания желательной кодирующей последовательности для обеспечения трансляции всей вставленной последовательности. Эти экзогенные сигналы контроля трансляции и кодоны инициации могут иметь различное происхождение - как природное, так и синтетическое. Эффективность экспрессии может быть повышена путем включения соответствующих энхансерных элементов транскрипции, терминаторов транскрипции и тому подобное (см., например, Bittner et al., 1987, Methods in Enzymol.153:51-544).
[00486] Кроме того, можно выбрать такой штамм клетки-хозяина, который модулирует экспрессию вставленных последовательностей или модифицирует и осуществляет процессинг продукта гена желаемым определенным образом. Такие модификации (например, гликозилирование) и процессинг (например, расщепление) белковых продуктов могут иметь важное значение для функции белка. Различные клетки-хозяева обладают характерными и специфическими механизмами посттрансляционного процессинга и модификации белков и продуктов генов. Для гарантии правильной модификации и процессинга экспрессированного чужеродного белка можно выбрать соответствующие линии клеток или системы хозяев. В связи с этим можно использовать эукариотические клетки-хозяева, обладающие клеточными механизмами для правильного процессинга первичного транскрипта, гликозилирования и фосфорилирования продукта гена. Такие клетки-хозяева млекопитающих включают, но не ограничиваются ими, CHO, VERY, BHK, Hela, COS, MDCK, 293, 3T3, W138, BT483, Hs578T, HTB2, BT2O и T47D, NS0 (клеточная линия мышиной миеломы, которая не продуцирует эндогенно любые цепи иммуноглобулина), клетки CRL7O3O и HsS78Bst. В некоторых вариантах осуществления полностью человеческие моноклональные антитела против нектина-4 по настоящему изобретению продуцируются в клетках млекопитающих, таких как клетки СНО.
[00487] Для долгосрочного получения рекомбинантных белков с высоким выходом может быть использована стабильная экспрессия. Например, могут быть сконструированы клеточные линии, которые стабильно экспрессируют молекулу антитела. Вместо использования векторов экспрессии, содержащих вирусные сайты инициации репликации, клетки-хозяева можно трансформировать ДНК, контролируемой подходящими регуляторными элементами экспрессии (например, последовательностями промотора, энхансера, терминаторами транскрипции, сайтами полиаденилирования и тому подобное) и селективным маркером. После введения вектора клеткам можно дать возможность расти в течение 1-2 дней в обогащенной среде, а затем перенести их на селективную среду. Селективный маркер в рекомбинантной плазмиде придает устойчивость к отбору и позволяет клеткам стабильно интегрировать эту плазмиду в их хромосомы и расти с образованием очагов, которые, в свою очередь, можно клонировать и размножить в линии клеток. Этот метод может преимущественно использоваться для конструирования клеточных линий, которые экспрессируют молекулу антитела. Такие сконструированные клеточные линии могут быть особенно полезны для скрининга и оценки композиций, которые прямо или косвенно взаимодействуют с молекулой антитела.
[00488] Можно использовать ряд систем отбора, включая, но не ограничиваясь этим, тимидинкиназу вируса простого герпеса (Wigler et al., 1977, Cell 11: 223), гипоксантингуанинфосфорибозилтрансферазу (Szybalska & Szybalski, 1992, Proc. Natl. Acad. Sci. USA 48: 202), и гены аденинфосфорибозилтрансферазы (Lowy et al., 1980, Cell 22: 8-17) можно использовать в tk-, hgprt- или aprt-клетках, соответственно. Также устойчивость к антиметаболитам можно использовать в качестве основы для отбора следующих генов: dhfr, который придает устойчивость к метотрексату (Wigler et al., 1980, Natl. Acad. Sci. USA 77:357; O'Hare et al., 1981, Proc. Natl. Acad. Sci. USA, 78:1527); gpt, придающему устойчивость к микофеноловой кислоте (Mulligan & Berg, 1981, Proc. Natl. Acad. Sci. USA, 78:2072); neo, придающему устойчивость к аминогликозиду G-418 (Wu and Wu, Biotherapy, 3:87-95 (1991); Tolstoshev, 1993, Ann. Rev. Pharmacol. Toxicol.32:573- 596; Mulligan, 1993, Science 260:926-932; and Morgan and Anderson, 1993, Ann. Rev. Biochem.62:191-217; May, 1993, TIB TECH 11(5):155-215); и hygro, придающему устойчивость к гигромицину (Santerre et al., 1984, Gene 30:147). Способы, общеизвестные в области технологии рекомбинантных ДНК, могут обычно использоваться для выбора желаемого рекомбинантного клона, и такие методы описаны, например, в Ausubel et al. (eds.), Current Protocols in Molecular Biology, John Wiley & Sons, NY (1993); Kriegler, Gene Transfer and Expression, A Laboratory Manual, Stockton Press, NY (1990); and in Chapters 12 and 13, Dracopoli et al. (eds.), Current Protocols in Human Genetics, John Wiley & Sons, NY (1994); Colberre-Garapin et al., 1981, J. Mol. Biol.150:1, полностью включенных в настоящий документ посредством ссылок.
[00489] Уровни экспрессии молекулы антитела могут быть повышены посредством векторной амплификации (обзор см. В Bebbington and Hentschel. The use of vectors based on gene amplification for the expression of cloned genes in mammalian cells in DNA cloning, Vol.3 (Academic Press, New York, 1987)). Если маркер в векторной системе, экспрессирующей антитело, является амплифицируемым, повышение уровня ингибитора в культуре клеток-хозяев приведет к увеличению количества копий маркерного гена. Поскольку амплифицированная область связана с геном антитела, то продукция антитела также будет увеличиваться (Crouse et al., 1983, Mol. Cell. Biol.3:257).
[00490] Клетка-хозяин может совместно трансфицироваться двумя представленными здесь векторами экспрессии: первым вектором, кодирующим полипептид, полученный из тяжелой цепи, и вторым вектором, кодирующим полипептид, полученный из легкой цепи. Два вектора могут содержать идентичные селектируемые маркеры, которые обеспечивают равную экспрессию полипептидов тяжелой и легкой цепи. Альтернативно, можно использовать один вектор, который кодирует и способен экспрессировать полипептиды как тяжелой, так и легкой цепи. В таких ситуациях легкую цепь следует поместить перед тяжелой цепью, чтобы избежать избытка токсичной свободной тяжелой цепи (Proudfoot, 1986, Nature 322: 52; и Kohler, 1980, Proc. Natl. Acad. Sci. USA 77:2197-2199). Последовательности, кодирующие тяжелые и легкие цепи, могут содержать кДНК или геномную ДНК.
[00491] Как только молекула антитела по настоящему изобретению получена рекомбинантной экспрессией, она может быть очищена любым способом, известным в данной области техники, для очистки молекулы иммуноглобулина, например, хроматографией (например, ионный обмен, аффинность, в частности, аффинностью в отношении специфического антигена белка А, и калибровочная хроматография), центрифугированием, разной растворимостью или с помощью любой другой стандартной методики очистки белков. Кроме того, антитела по настоящему изобретению могут быть слиты с гетерологичными полипептидными последовательностями, описанными в настоящем документе, или другими способами, известными в данной области, для облегчения очистки.
29. Диагностические тесты и способы детекции
[00492] В одном из аспектов антитела против нектина-4 и их фрагменты по настоящему изобретению можно использовать для детекции нектина-4 в биологическом образце. Такие антитела против нектина-4 могут включать антитела, которые связываются с нектином-4 человека, но не индуцируют сигнальную активность нектина-4. Термин «детекция» или «детектирование», используемое в настоящем документе, включает количественное или качественное обнаружение и относится к использованию показаний или результатов анализа для определения наличия/отсутствия нектина-4 в образце, относительного уровня экспрессии нектина-4 в образце (например, относительно одного или нескольких эталонных значений, относительно других образцов или относительно одной или нескольких шкал экспрессии) или концентрации нектина-4 в образце. Обнаруженные результаты анализа могут представлять собой числовые данные, например результаты кПЦР, результаты иммуноанализов или измеренную концентрацию белка; обнаруженное считывание может быть нечисловыми данными, например, окрашивание клеток или тканей антителами против нектина-4 на микроскопических изображениях или окрашивание нектина-4 в визуализирующей проточной цитометрии; или обнаруженное показание может быть любыми экспериментальными данными, которые могут быть использованы в качестве прокси для экспрессии нектина-4, как это хорошо известно специалисту в данной области, например интенсивность флуоресценции, интенсивность люминесценции, колориметрические показания и спектроскопия поглощения/испускания. Обнаруженное показание в анализах упоминается в данном документе как сигнал анализа.
[00493] Как предусмотрено в настоящем документе, биологический образец представляет собой образцы или вещества, которые имеют биологическое происхождение. Биологические образцы включают биологическую жидкость, образец клетки или ткани. В некоторых вариантах осуществления клетка может представлять собой культивируемую клеточную линию, сконструированные клетки, культуру клеток in vitro или ex vivo, полученные у индивида, например человека, или клетки, полученные у индивида. В других вариантах осуществления образцы ткани могут включать жидкость организма или ткань организма, полученную у индивида, включая человека. В некоторых вариантах осуществления образцы ткани включают образцы из области пациента с подозрением на заболевание. Такие образы ткани могут быть, но не ограничиваются ими, тканями, биологической жидкостью, тканевыми фракциями и/или клетками, выделенными из организма, такого как млекопитающее, в частности человек. В конкретном варианте осуществления из образцов ткани делают срезы, которые фиксируют в формалине и заливают парафином (FFPE). Клетки, жидкость организма и/или ткань могут быть получены у индивида, например человека, способами, хорошо известными специалисту в данной области, например, биопсией (включая жидкую биопсию), хирургическими процедурами, мазком клеток и кровопусканием.
[00494] В одном из аспектов в настоящем документе раскрыт способ детекции нектина-4 в биологическом образце. В некоторых вариантах осуществления способ включает приведением биологического образца в контакт с антителом против нектина-4 в условиях, благоприятных для связывания антитела против нектина-4 с нектином-4, и обнаружение связывания антитела против нектина-4 и нектина-4.
[00495] Как хорошо известно специалисту в данной области, количество антитела, связанного с антигеном в биологическом образце, коррелирует с количеством антигена в биологическом образце. Следовательно, количество связывающего антитела против нектин-4 по настоящему изобретению с нектином-4 в биологическом образце можно использовать для измерения количества или уровня экспрессии нектина-4 в биологическом образце. В некоторых вариантах осуществления количество нектина-4 в биологическом образце определяется в диапазоне линейного обнаружения антитела против нектина-4. «Линейный диапазон обнаружения» относится к диапазону количества или концентрации антигена, в пределах которого связанное антитело линейно коррелирует с количеством или концентрацией антигена в биологическом образце. Такой линейный диапазон зависит от таких факторов, как сродство антитела к антигену, концентрация антитела, используемого для связывания антитело-антиген, и условий, используемых для связывания антитело-антиген.
[00496] Концентрация антитела, используемого для связывания антитело-антиген, может быть оценена в экспериментах по титрованию. В одном из вариантов осуществления таких экспериментов по титрованию концентрацию антитела последовательно разбавляют в два, три, пять или десять раз, и каждый из серийно разведенных антител связывают с контрольными образцами с известным количеством соответствующего антигена. В одном из вариантов осуществления желаемой концентрацией антитела является концентрация, при которой количество связывающегося антитела различается в самом широком линейном диапазоне обнаружения.
[00497] Экспрессия нектина-4 в биологическом образце относится к количеству нектина-4 в биологическом образце в данный момент времени. Измеренная экспрессия нектина-4 отражает накопление нектина-4 в биологическом образце в течение определенного периода времени и может включать продукты разложения или модификации, такие как полноразмерный нектин-4, фрагменты нектина-4 и природно модифицированный, например гликозилированный, нектин-4. Поскольку белки транслируются из мРНК, то уровни мРНК в биологических образцах можно использовать в качестве прокси для экспрессии нектина-4 в биологических образцах.
[00498] В настоящем документе раскрыты способы оценки экспрессии нектина-4 в образце ткани у индивида с подозрением на злокачественное новообразование, включающие: (а) приведение указанного образца ткани в контакт с антителом или его антигенсвязывающим фрагментом, по настоящему изобретению; (b) детекцию связывания указанного антитела или его антигенсвязывающего фрагмента с указанным образцом ткани; (c) определение экспрессии нектина-4 в образце ткани, где уровень экспрессии нектина-4 в образце ткани сравнивают с контрольным уровнем экспрессии нектина-4.
[00499] В настоящем документе также представлены способы оценки экспрессии нектина -4 в образце ткани индивида с подозрением на злокачественное новообразование, включающие: (a) проведение анализа IHC на образце ткани с антителом или его антигенсвязывающим фрагментом по настоящему изобретению; (b) определение экспрессии нектина-4 в образце ткани, где уровень экспрессии нектина-4 в образце ткани сравнивают с контрольным уровнем экспрессии нектина-4.
[00500] В настоящем документе также раскрыты способы оценки восприимчивости пациента со злокачественным заболеванием к противоопухолевому терапевтическому средству, причем указанный способ основан на экспрессии нектина-4 в образце ткани указанного пациента, включающий: (а) приведение указанного образца ткани в контакт с антителом или его антигенсвязывающим фрагментом по настоящему изобретению; (b) обнаружение связывания указанного антитела или его антигенсвязывающего фрагмента с указанным образцом ткани; (c) определение экспрессии нектина-4 в образце ткани, где уровень экспрессии нектина-4 в образце ткани сравнивают с контрольным уровнем экспрессии нектина-4; где повышенный уровень экспрессии Nectin-4 по сравнению с контрольным указывает на восприимчивость к указанной противоопухолевой терапии.
[00501] В настоящем документе также раскрыты способы оценки восприимчивости пациента со злокачественным заболеванием к противоопухолевому терапевтическому средству, причем указанный способ основан на экспрессии нектина-4 в образце ткани указанного пациента, включающий: (а) осуществление анализа IHC на образце ткани пациента с антителом или его антигенсвязывающим фрагментом по настоящему изобретению; (b) определение экспрессии нектина-4 в образце ткани, где уровень экспрессии нектина-4 в образце ткани сравнивают с контрольным уровнем экспрессии нектина-4; где повышенный уровень экспрессии нектина-4 в образце ткани по сравнению с контрольным указывает на восприимчивость к указанной противоопухолевой терапии.
[00502] В настоящем документе раскрыты способы лечения злокачественного новообразования у пациента, включающие (а) определение уровня экспрессии нектина-4 в образце ткани пациента с помощью антитела или его антигенсвязывающего фрагмента по настоящему изобретению, где уровень экспрессии нектина-4 в образце ткани выше, чем контрольный уровень экспрессии нектина-4; (b) введение противоопухолевого терапевтического средства пациенту.
[00503] В настоящем документе раскрыты способы лечения злокачественного новообразования у индивида включающие (a) приведение образца ткани индивида в контакт с антителом или его антигенсвязывающим фрагментом по настоящему изобретению; (b) определение уровня экспрессии нектина-4 в образце ткани пациента с помощью антитела или его антигенсвязывающего фрагмента по настоящему изобретению, где уровень экспрессии нектина-4 в образце ткани выше, чем контрольный уровень экспрессии нектина-4; (с) введение противоопухолевого терапевтического средства пациенту.
[00504] В настоящем документе представлены способы лечения злокачественного новообразования у индивида, включающие (а) получение образца ткани пациента; (b) приведение образца ткани пациента в контакт с антителом или его антигенсвязывающим фрагментом по настоящему изобретению; (c) определение уровня экспрессии нектина-4 в образце ткани пациента с помощью антитела или его антигенсвязывающего фрагмента по настоящему изобретению, где уровень экспрессии нектина-4 в образце ткани выше, чем контрольный уровень экспрессии нектина-4; (d) введение противоопухолевого терапевтического средства пациенту.
[00505] Пациентом в любом способе по настоящему изобретению может быть человек, и у пациента может быть любое злокачественное новообразование, для которого может быть осуществлено определение экспрессии нектина-4 и/или для которого экспрессия нектина-4 может обеспечить диагностическое, прогностическое или прогностическое значение. Примеры злокачественных новообразований включают: острый лимфобластный лейкоз; острая лимфобластная лимфома; острый лимфоцитарный лейкоз; острый миелобластный лейкоз; острый миелоидный лейкоз (взрослых/детей); адренокортикальная карцинома; злокачественная опухоль, связанная со СПИДом; лимфома, связанная со СПИДом; рак анального канала; рак аппендикса; астроцитома; атипичная тератоидная/рабдоидная опухоль; базально-клеточный рак; рак желчных протоков, внепеченочный (холангиокарцинома); рак мочевого пузыря; остеосаркома костей/злокачественная фиброзная гистиоцитома; рак мозга (у взрослых/детей); опухоль головного мозга, мозжечковая астроцитома (у взрослых/детей); опухоль головного мозга, церебральная астроцитома/злокачественная глиома головного мозга; опухоль головного мозга, эпендимома; опухоль головного мозга, медуллобластома; опухоль головного мозга, супратенториальные примитивные нейроэктодермальные опухоли; опухоль головного мозга, зрительных путей и глиома гипоталамуса; глиома ствола мозга; рак молочной железы; бронхиальные аденомы/карциноиды; бронхиальная опухоль; лимфома Беркитта; злокачественные опухоли детей; карциноид желудочно-кишечного тракта; карциноид; карцинома у взрослых, неизвестный первичный сайт; карцинома с неизвестным первичным сайтом; эмбриональная опухоль центральной нервной системы; лимфома центральной нервной системы, первичная; рак шейки матки; адренокортикальная карцинома у детей; злокачественные опухоли у детей; детская церебральная астроцитома; хордома у детей; хронический лимфоцитарный лейкоз; хронический миелогенный лейкоз; хронический миелоидный лейкоз; хронические миелопролиферативные нарушения; рак толстой кишки; колоректальный рак; краниофарингиома; кожная Т-клеточная лимфома; десмопластическая мелкоклеточная опухоль; эмфизема; рак эндометрия; эпендимобластома; эпендимома; рак пищевода; саркома Юинга в семействе опухолей Юинга; экстракраниальная эмбрионально-клеточная опухоль; внегонадальная эмбрионально-клеточная опухоль; рак внепеченочных желчных протоков; рак желчного пузыря; рак желудка; карциноид желудка; желудочно-кишечные карциноиды; гастроинтестинальная стромальная опухоль; опухоль зародышевой клетки: экстракраниальная, внегонадальная или трофобластическая опухоль яичников; гестационная трофобластическая опухоль, неизвестный первичный сайт; глиома; глиома ствола мозга; глиома зрительных путей у детей и гипоталамуса; волосатоклеточный лейкоз; рак головы и шеи; рак сердца; гепатоцеллюлярный (печеночный) рак; лимфома Ходжкина; гипофарингиальный рак; глиома гипоталамуса и зрительного пути; внутриглазная меланома; карцинома островковых клеток (эндокринная поджелудочной железы); саркома Капоши; рак почки (почечно-клеточный рак); гистоцитоз клеток Лангерганса; рак гортани; рак губ и полости рта; липосаркома; рак печени (первичный); рак легкого; лимфома, первичная центральная нервная система; макроглобулинемия, Вальденстрема; рак молочной железы у мужчин; злокачественная фиброзная гистиоцитома кости/остеосаркома; медуллобластома; медуллоэпителиома; меланома; меланома, внутриглазная (глазная); рак клеток Меркель; карцинома кожи Меркель; мезотелиома; мезотелиома, злокачественная опухоль у взрослых; метастатический плоскоклеточный рак шеи с неизвестной первичной локализацией; рак рта; синдром множественной эндокринной неоплазии; множественная миелома/новообразование плазмоцитов; грибовидные микозы, миелодиспластические синдромы; миелодиспластические/миелопролиферативные заболевания; миелогенный лейкоз, хронический; миелоидный лейкоз, острый у взрослых; миелоидный лейкоз, острый у детей; миелома множественная (рак костного мозга); миелопролиферативные нарушения, хронические; рак полости носа и околоносовых пазух; рак носоглотки; нейробластома, немелкоклеточный рак легких; неходжкинская лимфофома; олигодендроглиома; рак ротовой полости; рак полости рта; рак ротоглотки; остеосаркома/злокачественная фиброзная гистиоцитома кости; рак яичника; эпителиальный рак яичников (поверхностно-эпителиально-стромальная опухоль); опухоль зародышевых клеток яичника; опухоль яичника с низким злокачественным потенциалом; рак поджелудочной железы; рак поджелудочной железы, островковые клетки; папилломатоз; рак околоносовых пазух и полости носа; рак паращитовидной железы; рак полового члена; назофарингеальный рак; феохромоцитома; шишковидная астроцитома; герминома шишковидной железы; опухоли паренхимы шишковидной железы средней степени дифференцировки; пинеобластома и супратенториальные примитивные нейроэктодермальные опухоли; опухоль гипофиза; аденома гипофиза; неоплазия клеток плазмы/множественная миелома; плевропульмональная бластома; первичная лимфома центральной нервной системы; рак предстательной железы; рак прямой кишки; почечно-клеточный рак (рак почки); переходно-клеточный рак почечной лоханки и мочеточника; карцинома дыхательных путей с участием гена NUT на хромосоме 15; ретинобластома; рабдомиосаркома, у детей; рак слюнных желез; саркома, семейство опуохлей Юинга; синдром Сезари; рак кожи (меланома); рак кожи (немеланома); мелкоклеточный рак легкого; рак тонкой кишки; саркома мягких тканей; саркома мягких тканей; опухоль спинного мозга; плоскоклеточная карцинома; плоскоклеточный рак шеи с неизвестной первичной локализацией, метастатический; рак желудка; супратенториальная примитивная нейроэктодермальная опухоль; кожная Т-клеточная лимфома (фунгоидная гранулема и синдром Сезари); рак яичка; рак горла; тимома; тимома и карцинома тимуса; рак щитовидной железы; рак щитовидной железы, у детей; переходно-клеточный рак почечной лоханки и мочеточника; рак уретры; рак матки, эндометрия; рак мочеиспускательного канала, рак мочевого пузыря, рак мочеточника, рак мочеиспускательного канала и рак мочевого пузыря, саркома матки; рак влагалища; рак вульвы; опухоль Вилмса; и другие виды рака эпителиального происхождения, при которых экспрессируется нектин-4.
[00506] В некоторых вариантах осуществления способов по настоящему изобретению у пациента, например человека, подозревают злокачественное новообразование, выбранное из группы, состоящей из рака эндометрия, уротелиального рака, рака мочевого пузыря, рака мочеточника, рака мочеиспускательного канала, рака легкого, рак яичников, рака молочной железы, рака пищевода, рака поджелудочной железы, рака головы и шеи, рака предстательной железы, рака полового члена, рака анального канала, рака вульвы, рака первичного мочевого протока (урахуса), и другие виды рака эпителиального происхождения, при которых экспрессируется нектин-4.
[00507] Используемый в настоящем документе термин «восприимчивость» относится к вероятности того, что клетка или пациент, или индивид, ответят или будут иметь реакцию на лечение противоопухолевым терапевтическим средством. Восприимчивость может включать в себя вероятность широкого спектра реакций на противоопухолевое терапевтическое средство, например, но ими не ограничиваясь, уменьшение пролиферации или роста злокачественных клеток, повышение гибели злокачественных клеток, уменьшение количества злокачественных клеток или размера опухоли, уменьшение скорости увеличения размера опухоли, замедление прогрессирования стадий злокачественного новообразования, регрессию стадий злокачественного новообразования или размера опухоли, уменьшение экспрессии маркеров злокачественного новообразования, уменьшение метастазирования злокачественного новообразования и/или улучшенный результат у пациента, такой как восстановление массы тела пациента, выживаемость пациента в течение 6, 1, 2, 3 или 5 лет, и/или продолжительность выживания пациентов. В определенных вариантах осуществления восприимчивость может быть масштабирована как отсутствие чувствительности (то есть, небольшая вероятность ответа), чувствительная (ответ вероятен) и/или неопределенная воприимчивость. В определенных вариантах осуществления клетка или ткань, или индивидуум, или пациент, с большей вероятностью отвечают на противоопухолевое терапевтическое средство, если клетка, ткань, пациент или индивид обладают значительной экспрессией нектина-4 в опухоли или злокачественной клетке. В некоторых вариантах осуществления восприимчивость повышается с повышением уровня нектина-4 в опухоли или злокачественных клетках/тканях. В некоторых вариантах осуществления восприимчивость коррелирует с уровнем экспрессии нектина-4 в опухоли или злокачественных клетках/тканях. В некоторых вариантах осуществления восприимчивость линейно пропорциональна уровню экспрессии нектина-4 в опухоли или злокачественных клетках/тканях. В других вариантах осуществления восприимчивость клетки, ткани, пациента или индивида к противоопухолевому средству может составлять 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90%, 100%, 120%, 150%, 200%, 250%, 300%, 400%, 500%, 750%, в 10 раз, 15 раз, 20 раз, 30 раз, 40 раз, 50 раз, 60 раз, В 70, 80, 90, 100 или больше, чем для клеток, негативных по экспрессии нектина-4.
[00508] Как используется в настоящем документе термин «показатель восприимчивости» относится к прогнозу того, что восприимчивость будет выше в клетке, ткани, у человека или индивида, по сравнению с другой клеткой, тканью, человеком или индивидом. Такие прогнозы делаются на основе определенных критериев. В некоторых вариантах осуществления прогноз на восприимчивость сделан на основе уровня экспрессии нектина-4 в клетке, ткани, опухоли, у человека или индивида. Как описано выше, в определенных вариантах осуществления прогнозируется, что клетка или ткань, или индивидуум, или пациент, с большей вероятностью отвечают на противоопухолевое терапевтическое средство, если клетка, ткань, пациент или индивид обладают значительной экспрессией нектина-4 в опухоли или злокачественной клетке. В некоторых вариантах осуществления прогнозируется, что восприимчивость повышается с повышением уровня нектина-4 в опухоли или злокачественных клетках/тканях. В некоторых вариантах осуществления прогнозируется, что восприимчивость коррелирует с уровнем экспрессии нектина-4 в опухоли или злокачественных клетках/тканях. В некоторых вариантах осуществления прогнозируется, что восприимчивость линейно пропорциональна уровню экспрессии нектина-4 в опухоли или злокачественных клетках/тканях. В других вариантах осуществления прогнозируется, что восприимчивость клетки, ткани, пациента или индивида к противоопухолевому средству может составлять 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90%, 100%, 120%, 150%, 200%, 250%, 300%, 400%, 500%, 750%, в 10 раз, 15 раз, 20 раз, 30 раз, 40 раз, 50 раз, 60 раз, В 70, 80, 90, 100 или больше, чем для клеток, негативных по экспрессии нектина-4.
[00509] Противоопухолевое терапевтическое средство может представлять собой любое противоопухолевое терапевтическое средство или любую противоопухолевую терапию, для которой экспрессия нектина-4 может обеспечивать диагностическую, прогностическую или прогностическую ценность. В некоторых вариантах осуществления терапевтическое средство представляет собой средство, которое нацелено на биологические процессы, например сигнальный путь, метаболический путь или путь синтеза/деградации белка, в котором играет роль нектин-4. В некоторых вариантах осуществления терапевтическое средство представляет собой средство, которое нацелено на активность нектина-4, передачу сигналов нектина-4 или на опосредованные нектином-4 заболевания. В конкретных вариантах осуществления терапевтическое средство представляет собой антитело против нектина-4 или конъюгат антитела против нектина-4 и лекарственного средства.
[00510] Для определения экспрессии нектина-4 в образце ткани уровень экспрессии нектина-4 в образце ткани сравнивают или коррелируют с контрольным уровнем экспрессии нектина-4. Как используется в настоящем описании «контрольный уровень экспрессии» относится к уровню экспрессии в контрольном образце, который при сравнении с уровнем экспрессии нектина-4 в тестовом образце дает относительную информацию об экспрессии нектина-4 в тестовом образце. Контрольный уровень экспрессии может быть известным уровнем экспрессии, например экспрессией в контрольном образце, в котором известно количество, концентрация и/или молярное количество нектина-4. Например, контрольный уровень экспрессии может быть экспрессией Nectin-4 в клеточной линии, в которой клетки трансфицированы или иным образом сконструированы для экспрессии известного количества нектина-4. В некоторых вариантах осуществления контрольный уровень экспрессии может представлять собой экспрессию нектина-4 в клетке, в которой экспрессия нектина-4 была количественно оценена способами, раскрытыми в настоящем документе или известными специалисту в данной области, такими как ELISA, SDS-PAGE, количественная иммунопреципитация и/или количественный Вестерн-блоттинг. В других вариантах осуществления контрольный уровень экспрессии включает более одного контрольного значения, например, 2, 3, 4, 5, 6, 7, 8, 9, 10, 12, 14, 16, 18, 20, 25, 30, 35, 40 45, 50, 75, 100 и более. В одном из вариантов осуществления контрольный уровень имеет 4 значения: один отрицательный в отношении экспрессии нектина-4, один для слабой экспрессии нектина-4, один для средней экспрессии нектина-4 и один для высокой/сильной экспрессии нектина-4.
[00511] Альтернативно, контрольный уровень экспрессии может быть уровнем, при котором точная концентрация или количество нектина-4 неизвестно, но известно состояние, активность и/или функция контрольного образца. В некоторых вариантах осуществления контрольные уровни экспрессии могут быть уровнями незлокачественной клетки того же пациента с подозрением на злокачественное новообразование. В таких вариантах осуществления сравнение экспрессии нектина-4 в тестируемом образце и экспрессии в контрольном образце позволяет определить экспрессию нектина-4 в тестируемом образце относительно (например, выше, ниже или, по существу, такая же) экспрессии нектина-4 в незлокачественных клетках. В других вариантах осуществления контрольные уровни экспрессии могут быть уровнями для злокачественной клетки, где путем сравнения экспрессии нектина-4 в тестовом образце и экспрессии в контрольном образце можно определить экспрессию нектина-4 в тестируемом образце относительно (например, выше, ниже или, по существу, такая же) экспрессии нектина-4 в злокачественных клетках. В других вариантах осуществления контрольные уровни экспрессии могут быть уровнями клетки второго индивида, где путем сравнения экспрессии нектина-4 в тестовом образце с экспрессией в контрольном образце можно определить экспрессию нектина-4 в тестовом образце относительно (например, выше, ниже или, по существу, такая же) экспрессии нектина-4 в клетках от второго индивида. Второй индивид может быть обычным человеком, не страдающим злокачественным новообразованием, человеком, страдающим тем же видом злокачественного новообразования, пациентом с подозрением на злокачественное новообразование или человеком, страдающим злокачественным новообразованием, отличным от того, который подозревают у пациента.
[00512] Контрольный образец и контрольные клетки, как описано в настоящем документе, могут представлять собой клеточную линию, культуру in vitro или ex vivo клеток, полученных у пациента с подозрением на злокачественное новообразование, клеток, полученных у пациента с подозрением на злокачественное новообразование, культуру in vitro или ex vivo клеток, полученных у второго индивида, клетки, полученные у второго индивида.
[00513] Следовательно, в некоторых вариантах осуществления способов по настоящему изобретению контрольный уровень экспрессии нектина-4 может быть уровнем экспрессии нектина-4 в злокачественных клетках, незлокачественных клетках указанного пациента или незлокачественных клетках второго индивида.
[00514] Как описано выше, в некоторых вариантах осуществления экспрессия нектина-4 в образце может быть определена путем корреляции или сравнения связывания антитела против нектина-4 с образцом и связывания антитела против нектина-4 с отрицательным и положительным контролем, где уровни экспрессии нектина-4 в контроле известны. Контрольная экспрессия нектина-4 может быть положительным контролем нектина-4 или отрицательным контролем нектина-4. Как используется в настоящем документе термин «положительный контроль нектина-4» или «положительный контроль» относится к клетке, ткани, опухоли, человеку и/или индивиду, для которого известно, что он экспрессирует значительное количество нектина-4. «Отрицательный контроль нектина-4» или «отрицательный контроль» относится к клеткам и/или тканям, о которых известно, что они не экспрессируют нектин-4 или экспрессируют низкий уровень нектина-4, так что нектин-4 в клетках или тканях не является биологически значимым. Уровень нектина-4 является биологически незначимым, если (1) специалист в данной области посчитает уровень экспрессии нектина-4 низким в свете белкового продукта гена домашнего хозяйства; (2) наличие или отсутствие небольшого количества нектина-4 не имеет биологической разницы для клетки или ткани; и (3) если это незначительное количество нектина-4 удаляется из клеток или тканей, клетки или ткани будут продолжать функционировать по существу так же, как и до такого удаления. Известная экспрессия нектина-4 может быть определена независимо с помощью анализа кПЦР. Известная экспрессия нектина-4 также может быть независимо определена с использованием любого нижеописанного иммуноанализа с антителом против нектина-4, которое было определено как специфичное для нектина-4 (например, специфичное для нектина-4 антитело, идентифицированное в способах скрининга специфичности), как описано выше). Подходящие иммуноанализы включают, в качестве примера и без каких-либо ограничений, анализ IHC, анализ иммуноблоттинга, анализ FACS или ELISA. В некоторых вариантах осуществления уровень мРНК нектина-4 может отличаться не быть нулевым в отрицательном контроле из-за фонового шума анализа или из-за биологически незначительного низкого уровня сохранившегося нектина-4. Отрицательный контроль нектина-4 можно считать отрицательным для нектина-4, например, если уровень мРНК нектина-4 в анализе кПЦР по существу аналогичен уровню мРНК, обнаруженному с помощью набора неспецифических праймеров, или если уровень мРНК нектина-4 является биологически незначительным в виду уровня мРНК нектина-4 в положительном контроле нектина-4. Аналогично, нектин-4, обнаруживаемый иммуноанализами с использованием другого специфического антитела к нектину-4 в отрицательном контроле, может не быть нулевым из-за фонового шума анализа или из-за биологически незначительного низкого уровня сохранившегося нектина-4. Фоновый шум может быть вызван неспецифическим связыванием реагентов анализа, не являющихся антителом против нектина-4, с образцами. Отрицательный контроль нектина-4 можно считать отрицательным в отношении нектина-4, например, если уровень нектина-4 в отрицательном контроле, обнаруженному с помощью антитела против нектина-4, по существу сходен с уровнем, обнаруженным с помощью антитела изотипического контроля в том же анализе. В некоторых анализах фоновый шум может составлять значительную долю обнаруженного сигнала экспрессии нектина-4.
[00515] Кроме того, положительный и отрицательный контроли были определены и опубликованы специалистами в данной области, включая положительные и/или отрицательные ткани, клетки (включая, например, клеточные линии) и патологические образцы. Такие литературные источники могут быть легко найдены путем поиска в базах данных, таких как Pubmed (например, используя поиск термина, такого как нектин-4, экспрессия, положительный, отрицательный и/или распространение) и анализом результатов поиска.
[00516] Соответственно, относительное количество антитела или его антигенсвязывающего фрагмента, связанного с клеткой отрицательного контроля, не экспрессирующей нектин-4, может составлять примерно 50%, 40%, 30%, 20%, 10%. 5%, 4%, 3%, 2%, 1%, 0,5%, 0,3%, 0,2%, 0,1%, 0,05%, 0,03%, 0,01%, 0,001% или меньше по сравнению с количеством антитела или антигенсвязывающего фрагмента, связанного с образом клетки, экспрессирующей нектин-4.
[00517] Поэтому в некоторых вариантах осуществления способов по настоящему изобретению, контрольный уровень экспрессии нектина-4 представляет собой уровень экспрессии нектина-4 в отрицательном контроле, где экспрессия нектина-4 в отрицательном контроле независимо определяют с помощью анализа кПЦР, анализа IHC со вторым антителом, анализа иммуноблоттинга со вторым антителом, анализа FACS со вторым антителом или ELISA со вторым антителом.
[00518] В других вариантах осуществления способов по настоящему изобретению контрольный уровень экспрессии нектина-4 представляет собой уровень экспрессии нектина-4 в клетке положительного контроля, экспрессирующей нектин-4, где экспрессия нектина-4 в положительном контроле определяется независимо с помощью анализа кПЦР, анализа IHC со вторым антителом, анализа иммуноблоттинга со вторым антителом, анализа FACS со вторым антителом или ELISA со вторым антителом.
[00519] Уровень экспрессии нектина-4 в образце может отличаться от уровня экспрессии в положительном контроле. Относительное количество антитела или его антигенсвязывающего фрагмента, связанного с образцом ткани, может составлять примерно 5%, 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90%, 100%, 120%, 150%, 200%, 250%, 300%, 400%, 500%, 750%, в 10 раз, 15 раз, 20 раз, 30 раз, 40 раз, 50 раз, 60 раз, 70 раз , 80, 90, 100, 200, 500 или выше количества антитела или его антигенсвязывающего фрагмента, связанного с клеткой положительного контроля, экспрессирующей нектин-4.
[00520] В данной области известно множество различных протоколов ПЦР или кПЦР и они приведены в качестве примера ниже в настоящем документе, и их можно непосредственно использовать или адаптировать для определения уровня мРНК нектина-4 в образцах или контролях, которые можно использовать в качестве прокси для уровней экспрессии белка нектина-4 в образцах или контролях. Количественная ПЦР (кПЦР) (также называемая ПЦР в реальном времени) используется и адаптируется в некоторых вариантах осуществления, поскольку она дает не только количественное измерение, но также сокращает время и загрязнение. Как используется в настоящем изобретении термин «количественная ПЦР» (или «кПЦР») относится к непосредственному мониторингу прогресса амплификации ПЦР в том виде, в каком он происходит, без необходимости повторного отбора проб продуктов реакции. В количественной ПЦР продукты реакции можно контролировать с помощью сигнального механизма (например, флуоресценции), поскольку они генерируются и отслеживаются после того, как сигнал поднимается выше фонового уровня, но до того, как реакция достигает плато. Количество циклов, необходимых для достижения обнаруживаемого или «порогового» уровня флуоресценции, напрямую зависит от концентрации амплифицируемых мишеней в начале процесса ПЦР, что позволяет измерять интенсивность сигнала, чтобы обеспечить измерение количества мишеневой нуклеиновой кислоты в образце в реальном времени. Когда для определения уровня экспрессии мРНК используется кПЦР, перед анализом кПЦР выполняют дополнительную стадию обратной транскрипции мРНК в ДНК. Примеры методов ПЦР можно найти в литературе (Wong et al., BioTechniques 39:75-85 (2005); D'haene et al., Methods 50:262-270 (2010)), которая включена в настоящий документ посредством ссылки в полном объеме. Примеры анализов ПЦР можно найти в патенте США № 6927024, который полностью включен в настоящее описание в качестве ссылки. Примеры методов ОТ-ПЦР можно найти в патенте США № 712799, который полностью включен в настоящее описание посредством ссылки. Способ флуоресцентной ПЦР in situ описан в патенте США № 7186507, который полностью включен в настоящее описание посредством ссылки.
[00521] В одном из конкретных вариантов осуществления, кПЦР может быть осуществлена для определения или измерения уровней мРНК нектина-4 следующим образом. Коротко, определяют средние значения Ct (пороговое значение цикла) (или называемые взаимозаменяемо как Cq (цикл количественного определения)) повторных реакций кПЦР для нектина-4 и одного или нескольких генов домашнего хозяйства. Средние значения Ct для нектина-4 могут быть затем нормализованы к значениям Ct для генов домашнего хозяйства с использованием следующей примерной формулы: нектин-4-ΔCt = (среднее значение Ct для нектина-4 - среднее значение Ct для гена А домашнего хозяйства). Относительный нектин-4-ΔCt можно затем использовать для определения относительного уровня мРНК нектина-4, например, с помощью формулы экспрессии мРНК=2-ΔCt. Сумма значений Ct и Cq приведена в руководстве MIQE (Bustin et al., The MIQE Guidelines: Minimum Information for Publication of Quantitative Real-Time PCR Experiments, Clinical Chemistry 55:4 (2009)).
[00522] Также можно использовать другие общеизвестные способы, известные в данной области, для количественного определения экспрессии мРНК в образце, включая нозерн-блоттинг и гибридизацию in situ (Parker & Barnes, Methods in Molecular Biology 106: 247-283 (1999)); анализы защиты РНКазы (Hod, Biotechniques 13: 852-854 (1992)); микрочипы (Hoheisel et al., Nature Reviews Genetics 7: 200-210 (2006); Jaluria et al., Microbial Cell Factories 6: 4 (2007)); и полимеразную цепную реакцию (ПЦР) (Weis et al., Trends in Genetics 8: 263-264 (1992)). Альтернативно, уровни экспрессии мРНК могут быть определены методами секвенирования. Характерные способы анализа экспрессии генов на основе секвенирования включают последовательный анализ экспрессии генов (SAGE) и анализ экспрессии генов с помощью массивно-параллельного секвенирования сигнатур (MPSS).
[00523] Как раннее указано, образы ткани могут быть, но не ограничиваются ими, тканями, биологической жидкостью, тканевыми фракциями и/или клетками, выделенными из организма, такого как млекопитающее, в частности человек. Следовательно, образцы ткани могут быть получены из различных органов индивида, включая человека. В некоторых вариантах осуществления образцы ткани получают из органов, в которых подозревают наличие заболевания, дисфункции или расстройства, такого как злокачественное новообразование. В других вариантах осуществления образцы ткани получают из нормальных органов пациента, на котором проводят тест, или у второго человека.
[00524] В определенных вариантах осуществления способов по настоящему изобретению ткань включает ткань мочевого пузыря, мочеточника, молочной железы, легкого, толстой кишки, прямой кишки, яичника, маточной трубы, пищевода, шейки матки, эндометрия матки, кожи, гортани, костного мозга, слюны железа, почки, предстательной железы, мозга, спинного мозга, плаценты, надпочечника, поджелудочной железы, околощитовидной железы, гипофиза, яичка, щитовидной железы, селезенки, миндалины, тимуса, сердца, желудка, тонкой кишки, печени, скелетных мышц, периферического нерва, мезотелия или глаза.
[00525] Антитела против нектина-4, связанные с образцами, могут быть обнаружены с помощью различных иммуноанализов, известных в данной области, включая анализ IHC, анализ иммуноблоттинга, анализ FACS и ELISA.
[00526] Нектин-4 может быть обнаружен с помощью антитела против нектина-4 в различных анализах IHC. Показано, что окрашивание с помощью IHC срезов тканей является надежным методом оценки или обнаружения белков в образце. Методики IHC используют антитело для зондирования и визуализации клеточных антигенов in situ, обычно хромогенными или флуоресцентными методами. Первичные антитела или антисыворотки, такие как поликлональные антисыворотки и моноклональные антитела, которые специфически нацелены на нектин-4, можно использовать для детекции экспрессии в анализе IHC. В некоторых вариантах осуществления образец ткани приводят в контакт с первичным антителом для конкретной мишени в течение периода времени, достаточного для того, чтобы произошло связывание антитела с мишенью. Как подробно обсуждалось ранее, антитела могут быть обнаружены с помощью прямых меток на самих антителах, например, радиоактивных меток, флуоресцентных меток, гаптеновых меток, таких как биотин, или фермента, такого как пероксидаза хрена или щелочная фосфатаза. Альтернативно, немеченое первичное антитело используется в сочетании с меченым вторичным антителом, содержащим антисыворотку, поликлональную антисыворотку или моноклональное антитело, специфичное к первичному антителу. Протоколы и наборы IHC хорошо известны в данной области и коммерчески доступны. Автоматизированные системы для получения слайдов и обработки IHC имеются в продаже. Система Leica BOND Autostainer и Leica Bond Refine Detection являются примером такой автоматизированной системы.
[00527] В некоторых вариантах осуществления анализ IHC проводят с немеченым первичным антителом в сочетании с меченым вторичным антителом в непрямом анализе. В непрямом анализе используются два антитела для обнаружения белков-мишеней, таких как нектин-4, в образце ткани. Сначала неконъюгированное первичное антитело наносили на ткань (первый слой), которая реагирует с мишеневым антигеном в образце ткани. Затем наносят фермент-меченное вторичное антитело, которое специфически распознает изотип антитела первичного антитела (второй слой). Вторичное антитело реагирует с первичным антителом с последующим нанесением субстрата-хромогена. Антитело второго слоя может быть мечено ферментом, таким как пероксидаза, который реагирует с хромогеном 3,3-диаминобензидином (DAB) с образованием коричневого осадка на месте реакции. Этот метод чувствителен и универсален из-за сильного усиления сигнала посредством системы усиления сигнала.
[00528] В некоторых вариантах осуществления для повышения чувствительности обнаружения может использоваться система усиления сигнала."Система усиления сигнала", как используется в настоящем документе, означает систему реагентов и способов, которые можно использовать для усиления сигнала при обнаружении связанного первичного или вторичного антитела. Система усиления сигнала повышает чувствительность детекции мишеневого белка, повышает обнаруженный сигнал и уменьшает нижнюю границу пределов обнаружения. Существует несколько типов систем усиления сигнала, включая систему мечения ферментом и систему макромечения. Эти системы/подходы не являются взаимоисключающими и могут использоваться в комбинации для аддитивного эффекта.
[00529] Макромечение или система макромечения представляют собой наборы меток, насчитывающих десятки (например, фикобилипротеины) и миллионы (например, флуоресцентные микросферы), прикрепленные или встроенные в общий каркас. Каркас может быть связан с мишеневым специфическим аффинным реагентом, таким как антитело, и, таким образом, встроенные метки вместе связываются с мишенью при связывании. Метки в макрометках могут быть любыми метками, описанными в настоящем документе, такими как флуорофоры, гаптены, ферменты и/или радиоизотопы. В одном из вариантов осуществления системы амплификации сигнала используют меченный полимер, конъюгированный со вторым антителом. В полимерной технологии используют инертную молекулу "иглу" декстрана, меченую ферментом HRP, к которой может быть присоединено 1, 2, 3, 4, 5, 6, 7, 8, 910, 15, 20, 25, 30, 50 или более молекул второго антитела, что делает систему еще более чувствительной.
[00530] Система амплификации сигнала, основанная на системе мечения ферментов, использует каталитическую активность ферментов, таких как пероксидаза хрена (HRP) или щелочная фосфатаза, для получения высокой плотности мечения мишеневого белка или последовательности нуклеиновой кислоты in situ. В одном из вариантов осуществления для увеличения сигнала HRP можно использовать тирамид. В такой системе HRP ферментативно превращает меченое производное тирамида в высокореактивные, короткоживущие тирамидные радикалы. Меченые активные тирамидные радикалы затем ковалентно связываются с остатками (главным образом, фенольным остатком белковых остатков тирозина) в непосредственной близости от сайта взаимодействия HRP-антитело-мишень, что приводит к амплификации числа меток на сайте с минимальной потерей, связанной с диффузией, сигнальной локализации. Следовательно, сигнал может быть усилен в 1, 2, 3, 4, 5, 6, 7, 8, 910, 15, 20, 25, 30, 50, 75 или 100 раз. Как известно специалисту в данной области, метки на тирамиде могут быть любыми метками, описанными в настоящем документе, включая флуорофоры, ферменты, гаптены, радиоизотопы и/или фотофоры. Другие ферментативные реакции также могут быть использованы для усиления сигнала. Например, усиление ферментативно-меченой флуоресценции (ELF) доступно для щелочной фосфатазы, где щелочная фосфатаза ферментативно расщепляет слабо синий флуоресцентный субстрат (фосфат ELF 97) и превращает его в ярко-желто-зеленый флуоресцентный осадок, который демонстрирует необычно большой Стоксовский сдвиг и отличную фотостабильность. И система усиления сигнала на основе тирамида, и система усиления сигнала ELF являются коммерчески доступными, например, от ThermoFisher Scientific (Waltham, MA USA 02451).
[00531] Таким образом, в некоторых вариантах осуществления способов по настоящему изобретению, уровень экспрессии нектина-4 определяют с помощью системы усиления сигнала.
[00532] В некоторых вариантах осуществления образец затем контрастируют для идентификации клеточных и субклеточных элементов.
[00533] В некоторых вариантах осуществления детекцию уровеня экспрессии нектина-4 также можно осуществлять с помощью антител, описанных в настоящем документе, используя анализ иммуноблоттинга. В некоторых вариантах осуществления анализа иммуноблоттинга белки часто (но не обязательно) разделяют с помощью электрофореза и переносят на мембраны (обычно нитроцеллюлозную или PVDF-мембрану). По аналогии с анализами IHC, первичные антитела или антисыворотки, такие как поликлональные антисыворотки и моноклональные антитела, которые специфически нацелены на нектин-4, можно использовать для детекции белковой экспрессии. В некоторых вариантах осуществления мембрана контактирует с первичным антителом для конкретной мишени в течение периода времени, достаточного для связывания антитела-антигена, и связанные антитела могут быть обнаружены с помощью прямых меток на самих первичных антителах, например, с помощью радиоактивных меток флуоресцентных меток, гаптеновых метоки, таких как биотин, или ферменты, такие как пероксидаза хрена или щелочная фосфатаза. В других вариантах осуществления немеченое первичное антитело используют в непрямом анализе, как описано выше, в сочетании с меченым вторым антителом, специфичным в отношении первого антитела. Как описано в настоящем документе, вторые антитела могут быть мечены, например, ферментами или другими обнаруживаемыми метками, такими как флуоресцентные метки, люминесцентные метки, колориметрические метки или радиоизотопы. Протоколы и наборы для иммуноблотинга хорошо известны в данной области и коммерчески доступны. Автоматизированные системы для иммуноблоттинга, например, iBind Western Systems для вестерн-блоттинга (ThermoFisher, Waltham, MA USA 02451), представлены в продаже. Иммуноблоттинг включает, но не ограничивается ими, Вестерн-блот, внутриклеточный Вестерн-блот и дот-блот. Дот-блот является упрощенной процедурой, при которой образцы белка не разделяются электрофорезом, а помещаются непосредственно на мембрану. Во внутриклеточном Вестерн-блоттинге проводят посев клеток в микротитровальные планшеты, фиксацию/пермеабилизацию клеток и последующую детекцию с помощью первого меченого антитела или немеченого первого антитела, а затем с помощью меченого второго антитела, как описано в настоящем документе.
[00534] В других вариантах осуществления уровни экспрессии нектина-4 также можно детектировать с помощью антител, описанных в настоящем документе, в анализе проточной цитометрии, включая анализ с сортировкой активированных флуоресценцией клеток (FACS). По аналогии с анализами IHC или иммуноблотингом, первые антитела или антисыворотку, такую как поликлональная антисыворотка и моноклональные антитела, которые специфически нацелены на нектин-4, можно использовать для детекции белковой экспрессии в анализе FACS. В некоторых вариантах осуществления клетки окрашивают первыми антителами против специфического мишеневого белка в течение времени, достаточного для осуществления связывание антитела-антигена, и связанные антитела могут быть обнаружены с помощью прямых меток на первичных антителах, например, флуоресцентных меток или гаптеновых меток, таких как биотин на первых антителах. В других вариантах осуществления немеченое первичное антитело используют в непрямом анализе, как описано выше, в сочетании с флуоресцентно меченым вторым антителом, специфичным в отношении первого антитела. FACS обеспечивает способ сортировки или анализа смеси биологических клеток с флуоресцентной меткой, по одной клетке за раз, на основе конкретных характеристик рассеяния света и флуоресценции каждой клетки. Таким образом, проточный цитометр обнаруживает и сообщает интенсивность меченного флуорихромом антитела, что указывает на уровень экспрессии мишеневого белка. Следовательно, уровень экспрессии поверхностных белков (таких как нектин-4) может быть обнаружен с использованием антител против мишеневого белка. Нефлуоресцентные цитоплазматические белки также можно наблюдать путем окрашивания пермеабилизованных клеток. Способы проведения окрашивания и анализа FACS хорошо известны специалисту в данной области техники и описаны Тeresa S. Hawley and Robert G. Hawley in Flow Cytometry Protocols, Humana Press, 2011 (ISBN 1617379506, 9781617379505).
[00535] В других вариантах осуществления уровни экспрессии нектина-4 также могут быть обнаружены с помощью иммуноанализов, таких как ферментный иммунный анализ (EIA) или ELISA. Анализы EIA и ELISA известны в данной области, например, для анализа широкого спектра тканей и образцов, включая кровь, плазму, сыворотку или костный мозг. Доступен широкий спектр форматов для анализа ELISA, см., например, патент США №№ 4016043, 4424279 и 4018653, которые полностью включены в настоящее описание посредством ссылки. Они включают в себя как односайтовые, так и двухсайтовые или «сэндвичевые» анализы неконкурентных типов, а также в традиционные конкурентные анализы связывания. Эти анализы также включают прямое связывание меченого антитела с мишеневым белком. Сэндвич-анализы являются обычно используемыми анализами. Существует ряд вариантов сэндвич-анализа. Например, в характерном прямом анализе немеченое антитело иммобилизовано на твердой подложке, и тестируемый образец приводят в контакт со связанной молекулой. После достаточного периода инкубации, в течение времени, достаточного для образования комплекса антитело-антиген, добавляют второе антитело, специфичное в отношении антигена, меченное репортерной молекулой, способной давать детектируемый сигнал, и инкубируют в течение времени, достаточного для образования еще одного комплекса антитело-антиген-меченое антитело. Любой непрореагировавшее вещество отмывают, и присутствие антигена определяют путем наблюдения за сигналом репортерной молекулой. Результаты могут быть либо качественными, путем простого наблюдения видимого сигнала, либо могут быть количественно оценены путем сравнения с контрольным образцом, содержащим известные количества мишеневого белка.
[00536] В некоторых вариантах осуществления анализов EIA или ELISA фермент конъюгируют со вторым антителом. В других вариантах осуществления флуоресцентно меченные вторые антитела могут быть использованы вместо меченого ферментом второго антитела с получением детектируемого сигнала в формате анализа ELISA. При активации лучом света определенной длины волны меченное флуорохромом антитело поглощает энергию света, вызывая в молекуле состояние возбудимости, а затем излучение света с характерным цветом, визуально обнаруживаемым с помощью светового микроскопа. Как и в EIA и ELISA, флуоресцентно меченое антитело может связываться с комплексом первое антитело-мишеневый белок. После промывки несвязавшегося реагента оставшийся третичный комплекс затем подвергают воздействию света соответствующей длины волны, наблюдаемая флуоресценция указывает на присутствие мишеневого интересующего белка. Способы иммунофлуоресценции и EIA широко известны в данной области и описаны в настоящем документе.
[00537] Для иммуноанализов, описанных в настоящем документе, может быть использована любая ферментная или неферментная метка, при условии, что может быть обнаружена ферментативная активность, или неферментная метка, соответственно. Таким образом, фермент дает детектируемый сигнал, который можно использовать для обнаружения мишеневого белка. Особенно эффективными обнаруживаемыми сигналами являются хромогенные или флуорогенные сигналы. Соответственно, особенно эффективные ферменты для использования в качестве метки включают метки, для которых доступен хромогенный или флуорогенный субстрат. Такие хромогенные или флуорогенные субстраты могут быть превращены ферментативной реакцией в легко обнаруживаемый хромогенный или флуоресцентный продукт, который можно легко обнаружить и/или количественно определить с помощью микроскопии или спектроскопии. Такие ферменты хорошо известны специалистам в данной области, включая, но не ограничиваясь ими, пероксидазу хрена, щелочную фосфатазу, бета-галактозидазу, глюкозооксидазу и тому подобное (см. Hermanson, Bioconjugate Techniques, Academic Press, San Diego (1996)). Другие ферменты, которые имеют хорошо известные хромогенные или флуорогенные субстраты, включают различные пептидазы, где хромогенные или флуорогенные пептидные субстраты могут быть использованы для выявления реакций протеолитического расщепления. Применение хромогенных и флуорогенных субстратов также хорошо известно в области бактериальной диагностике, включая, но не ограничиваясь ими, применение α- и β-галактозидазы, β-глюкуронидазы, 6-фосфо-β-D-галактозидазы, 6-фосфогалактогидролазы, β-глюкозидазы, α-глюкозидазы, амилазы, нейраминидазы, эстераз, липаз, и тому подобное (Manafi et al., Microbiol. Rev.55: 335-348 (1991)), и такие ферменты с известными хромогенными или флуорогенными субстратами могут быть легко адаптированы для применения в способах по настоящему изобретению.
[00538] Различные хромогенные или флуорогенные субстраты для получения детектируемых сигналов хорошо известны специалистам в данной области и являются коммерчески доступными. Примеры субстратов, которые могут быть использованы для получения детектируемых сигналов включают, но не ограничиваются ими, 3,3'-диаминобензидин (DAB), 3,3',5,5'-тетраметилбензидин (ТМB), хлорнафтол (4-CN)(4-хлор-1-нафтол), 2,2'-азино-бис(3-этилбензотиазолин-6-сульфоновая кислота) (ABTS), о-фенилендиамин дигидрохлорид (OPD) и 3-амино-9-этилкарбазол (AEC) для пероксидазы хрена; 5-бром-4-хлор-3-индолил-1-фосфат (BCIP), нитросиний тетразолий (NBT), Fast красный (Fast Red TR/AS-МХ), и п-нитрофенил фосфат (PNPP) для щелочной фосфатазы; 1-метил-3-индолил-β-D-галактопиранозид и 2-метокси-4-(2-нитровинил)фенил β-D-галактопиранозид для β-галактозидазы; 2-метокси-4-(2-нитровинил)фенил β-D-глюкопиранозид для β-глюкозидазы; и тому подобное. Примеры флуорогенных субстратов включают, но не ограничиваются ими, 4-(трифторметил)умбеллиферилфосфат для щелочной фосфатазы; 4-метилумбеллиферилфосфат бис (2-амино-2-метил-1,3-пропандиол), 4-метилумбеллиферилфосфат бис (циклогексиламмоний) и 4-метилумбеллиферилфосфат для фосфатаз; QuantaBlu™ и QuantaRed™ для пероксидазы хрена; 4-метилумбеллиферил β-D-галактопиранозид, флуоресцеин ди(β-D-галактопиранозид) и нафтофлуоресцеин ди-(β-D-галактопиранозид) для β-галактозидазы; 3-ацетилумбеллиферил β-D-глюкопиранозид и 4-метилумбеллиферил-β-D-глюкопиранозид для β-глюкозидазы; и 4-метилумбеллиферил-α-D-галактопиранозид для α-галактозидазы. Примеры ферментов и субстратов для получения детектируемого сигнала также описаны, например, в публикации США 2012/0100540. Различные обнаруживаемые ферментные субстраты, включая хромогенные или флуорогенные субстраты, хорошо известны и коммерчески доступны (Pierce, Rockford IL; Santa Cruz Biotechnology, Dallas TX; Invitrogen, Carlsbad CA; 42 Life Science; Biocare). Как правило, субстраты превращаются в продукты, образующие осадки, которые осаждаются на месте расположения мишеневой нуклеиновой кислоты. Другие примеры субстратов включают, но не ограничиваются ими, HRP-Green (42 Life Science), бетазоид DAB, кардассиан DAB, Romulin AEC, Bajoran Purple, Vina Green, Deep Space Black™, Warp Red™, Vulcan Fast Red и Ferangi Blue других производителей (Concord CA; biocare.net/products/detection/chromogens).
[00539] В некоторых вариантах осуществления иммуноанализа обнаруживаемая метка может быть непосредственно связана либо с первым антителом, либо со вторым антителом, которое детектирует немеченное первое антитело. Примеры обнаруживаемых меток хорошо известны специалистам в данной области, включая, но не ограничиваясь ими, хромогенные или флуоресцентные метки (см. Hermanson, Bioconjugate Techniques, Academic Press, San Diego (1996)). Примеры флуорофоров, которые могут использоваться в качестве меток, включают, но не ограничиваются ими, производные родамина, например тетраметилродамин, родамин В, родамин 6G, сульфородамин В, Texas Red (сульфородамин 101), родамин 110 и их производные, такие как тетраметилродамин-5-(или 6), лиссамин родамин В и тому подобное; 7-нитробенз-2-окса-1,3-диазол (NBD); флуоресцеин и его производные; нафталины, такие как дансил (5-диметиламинонапталин-1-сульфонил); производные кумарина, такие как 7-амино-4-метилкумарин-3-уксусная кислота (AMCA), 7-диэтиламино-3-[(4'-(йодацетил)амино)фенил]-4-метилкумарин (DCIA), флуоресцентные красители Alexa (Molecular Probes) и тому подобное; 4,4-дифтор-4-бор-3а,4а-диаза-s-индацен (BODIPY™) и его производные (leMolcular Probes; Eugene Oreg.); пирены и сульфированные пирены, такие как Cascade Blue™ и их производные, включая 8-метоксипирен-1,3,6-трисульфоновая кислота, и тому подобное; производные пиридилоксазола и производные дапоксила (Molecular Probes); Люцифер Lucifer Yellow (3,6-дисульфонат-4-аминонафталимид) и их производные; флуоресцентные красители CyDye™ (Amersham/GE Healthcare Life Sciences; Piscataway NJ) и тому подобное. Примеры хромофоров включают, но не ограничиваются ими, фенолфталеин, малахитовый зеленый, нитроароматические вещества, такие как нитрофенил, диазокрасители, дабсил (4-диметиламиноазобензол-4'-сульфонил) и тому подобное.
[00540] Методы, хорошо известные специалисту в данной области, такие как микроскопия или спектроскопия, могут быть использованы для визуализации хромогенных или флуоресцентных детектируемых сигналов, связанных со связанными первым или вторым антителами.
[00541] «Определение экспрессии нектина-4» относится к помещению экспрессии нектина-4 в тестируемом биологическом образце в контрольную систему (или контрольную шкалу), чтобы человек, знакомый с контрольной системой, мог определить относительную экспрессию нектина-4 в тестируемом образце по сравнению с другими образцами, которые расположены в указанной системе. Следовательно, такое определение включает сравнение экспрессии нектина-4 в исследуемом образце ткани с контрольным уровнем экспрессии нектина-4.
[00542] В некоторых вариантах осуществления указанная система может представлять собой количественную систему, в которой фактическую молярную концентрацию или мольное количество нектина-4 в исследуемом образце сравнивают с молярной концентрацией или мольным количеством контрольных уровней экспрессии. В некоторых вариантах осуществления могут использоваться другие суррогатные численные измерения, которые линейно пропорциональны молярной концентрации или количеству молей. Примеры этих суррогатных измерений включают измерения интенсивности флуоресценции связанных антител, измерения интенсивности люминесценции связанных антител, измерения радиоактивности связанных антител и/или колориметрические или хромогенные измерения связанных антител.
[00543] В других вариантах осуществления указанная система может быть системой категоризации. Система категоризации может иметь всего 2 категории и целых 3, 4, 5, 6, 7, 8, 9, 10, 12, 14, 16, 18, 20, 25, 30, 35, 40, 45, 50, 75, 100 или более категорий. В одном из вариантов осуществления указанная система имеет положительную категорию для образцов, которые являются положительными по экспрессии нектина-4 (позитивные), и отрицательную категорию для образцов, которые являются отрицательными по экспрессии нектина-4 (негативные). В такой системе категоризации определение экспрессии нектина-4 в тестируемом образце включает сравнение экспрессии нектина-4 в тестируемом образце с экспрессией нектина-4 положительного контрольного образца и/или с отрицательным контролем и помещение тестового образца в положительную категорию, если тестовый образец экспрессирует нектин-4 на том же или более высоком уровне, чем положительный контроль. В другом варианте осуществления система категоризации имеет 3 категории, например, категории с отрицательной, средней и высокой экспрессией. В другом варианте осуществления система категоризации имеет 4 категории, например категорию отрицательной, низкой/слабой, средней/умеренной и высокой/сильной экспрессии. В некоторых аспектах определение экспрессии нектина-4 в тестовом образце включает сравнение экспрессии нектина-4 в тестовом образце с одним или несколькими контролями экспрессии нектина-4 известных категорий и помещение тестового образца в категории в соответствии с его относительной экспрессией по отношению к контролю(ям).
[00544] В некоторых вариантах осуществления указанная система может быть системой оценки. Система подсчета баллов может быть аналогична системе категоризации, за исключением того, что категории заменяются баллами. Например, система негативной и позитивной экспрессии нектина-4 в 2 категориях может представлять собой систему баллов 0 и 1, где 0 означает негативную, а 1 означает позитивную. В другом варианте осуществления система 3 категорий может представлять собой систему оценки 0, 1 и 2, где 0 - отрицательная, 1 - низкая/слабая экспрессия, а 2 - умеренная/средняя и высокая/сильная экспрессия. В другом варианте осуществления система 4 категорий может представлять собой систему оценки 0, 1, 2 и 3, где 0 - отрицательная, 1 - низкая/слабая, 2 - умеренное/среднее, а 3 - высокая/сильная экспрессия. Аналогично системе категоризации, определение экспрессии нектина-4 в тестируемом образце в системе подсчета баллов предусматривает сравнение экспрессии нектина-4 в тестируемом образце с одним или несколькими контролями экспрессии нектина-4, имеющими известный показатель, и присвоединие тестовому образцу балл в соответствии с его относительной экспрессией по сравнению с контрольной. Система подсчета баллов, тем не менее, может иметь баллы с дискретными числами (например, система 0, 2, 4, 6, 8 и 10 или система 1, 4, 6, 11, 13 и 19), с дробями (например, 1, 1,5, 2, 2,5, 3, 3,5 и тому подобное), отрицательными числами, числами, начинающимися с любого числа (например, 1000, 2000, 3000 и тому подобное), и любой набор чисел, который можно использовать для отслеживания относительной экспрессии белка в биологических образцах.
[00545] В некоторых вариантах осуществления указанная система может представлять собой процентное содержание клеток в сочетании с системами категоризации или подсчета баллов. Комбинация процента клеток с системой категоризации или оценки баллов дает более точную градацию образцов. В такой комбинированной системе каждой клетке биологического образца присваивается значение или она помещается в систему категоризации или оценки баллов, и определяется приблизительный процент клеток тестового образца в каждой категории или с одним баллом. В одном из примеров измерение процентного содержания клеток можно сочетать с системой 2 категорий - позитивной и негативной экспрессии нектина-4, где образец не измеряется в целом, а разбивается на процент клеток, позитивных по экспрессии нектина-4, и на процент клеток, негативных по экспрессии нектина-4. Например, в системе 2 категорий позитивная и негативная экспрессия нектина-4, тестовый образец может быть негативным по экспрессии нектина-4, если он помещен в систему 2 категории, но иметь 10% клеток, позитивных по экспрессии нектина-4, и 90% клеток, негативных по экспрессии нектина-4. В одном из вариантов осуществления указанная система включает в себя процент клеток в сочетании с системой 2 категорий или 2 баллов. В одном из вариантов осуществления указанная система включает в себя процент клеток в сочетании с системой 3 категорий или 3 баллов. В одном из вариантов осуществления указанная система включает процент клеток в сочетании с системой 4 категорий или 4 баллов. В одном из вариантов осуществления указанная система включает в себя процент клеток в сочетании с системой 5 категорий или 5 баллов. В одном из вариантов осуществления указанная система включает в себя процент клеток в сочетании с системой 6 категорий или 6 баллов. В одном из вариантов осуществления указанная система включает в себя процент клеток в сочетании с системой 7 категорий или 7 баллов. В одном из вариантов осуществления указанная система включает процент клеток в сочетании с системой 8 категорий или 8 баллов. В одном из вариантов осуществления указанная система включает процент клеток в сочетании с системой 9 категорий или 9 баллов. В одном из вариантов осуществления указанная система включает в себя процент клеток в сочетании с системой 10 категорий или 10 баллов. В одном из вариантов осуществления указанная система включает в себя проценты клеток в сочетании с любой категоризацией или любой системой оценки баллов. В одном из вариантов осуществления указанная система включает процент клеток в сочетании с 4 балльной системой, включающей 0 (негативная по нектину-4), 1 (низкая/слабая экспрессия нектина-4), 2 (средняя/умеренная экспрессия нектина-4) и 3 (высокая/сильная экспрессия нектина-4).
[00546] В некоторых аспектах ссылочная система может представлять собой отношение экспрессии нектина-4 к экспрессии по меньшей мере одного контрольного белка. В некоторых вариантах осуществления это отношение может быть отношением количественных измерений экспрессии нектина-4 и измерений контрольного белка, где количественные измерения включают в себя измерения, описанные в настоящем документе, такие как молярная концентрация, количество молей, измерения интенсивности флуоресценции связанных антител, измерения интенсивности люминесценции связанных антител, измерения радиоактивности связанных антител и/или колориметрические или хромогенные измерения связанных антител. В других вариантах осуществления это отношение также может быть отношением баллов, присвоенных экспрессии нектина-4 и контрольного белка, в соответствии с любой системой оценки, представленной в настоящем документе. Контрольный белок может представлять собой белок с обычной функцией клеток, такой как актин, GAPDH, GDI или любой белок, экспрессируемый ген домашнего хозяйства. Например, если тестируемый образец имеет 3 балла по экспрессии нектина-4 и 1 балла по экспрессии актина, соотношение может быть определено как 3.
[00547] В других аспектах контрольная система может использовать результаты математической функции, используя в качестве входных данных одну или несколько категорий, оценок, соотношений, процентов и количественных измерений. В некоторых вариантах осуществления математическая функция использует сложение, прибавление, умножение или комбинацию этих операторов для объединения различных входных данных для получения результатов, которые дают более подробную информацию об экспрессии нектина-4 в образце и/или более точной градации экспрессии нектина-4 в масштабе. В одном из вариантов осуществления математическая функция вычисляет баллы H на основе комбинации процентной и четырех-балльной системы. Например, баллы H рассчитывают путем суммирования произведений процента клеток (0-100), имеющих каждый показатель экспрессии нектина-4 (0=отрицательная, 1=низкая/слабая, 2=умеренная/средняя и 3=высокая/сильная). Например: образец с 10% клетками с баллом 3, 30% клеток баллом 2, 20% клеток с баллом 1 и 40% клеток с баллом 0 будет иметь балл H (3×10) + (2×30) + (1×20) + (0×40) = 110.
[00548] Следовательно, как рассматривается в настоящем документе, уровень экспрессии нектина-4 может быть определен с использованием системы категоризации, системы оценки баллов, отношения экспрессии нектина-4 к экспрессии по меньшей мере одного контрольного белка, процентного содержания клеток в указанной системе категоризации или оценки баллов, количественного измерения окрашивающего сигнала нектина-4 или результата математической функции, использующей одно или несколько из упомянутой категоризации, оценки балов, соотношения, процента и количественного измерения входных данных.
[00549] Большинство фиксированных формалином тканей требуют стадии выделения антигена перед иммуногистохимическим окрашиванием. Метиленовые мостики образуются при фиксации поперечных связей белков и закрывают эпитопы антигенов. В способах поиска антигена проводят разрушение эти метиленовые мостики и обнажают эпитопы, позволяя антителам связываться. В некоторых вариантах осуществления изобретения антигены получают методом индуцированного нагреванием эпитопа (HIER). В других вариантах осуществления антигены выделяют методом ферментативного поиска (например, протеолитического расщепления). Для HIER срезы тканей, фиксированных в формалине и парафине (FFPE), можно нагревать при 50, 55, 60, 65, 70, 75, 80, 85°C, 90°С, 95°С, 100°С, 105°С, 110°С, 115°С, 120°С, 125°С или 130°С. Срезы тканей FFPE можно нагревать при любой из этих температур в течение 5, 10, 15, 20, 25, 30, 35, 40, 45, 50, 55, 60, 65, 70, 75, 80, 85, 90, 95 , 100, 105, 110, 115, 120, 150, 180, 240, 300, 360, 420, 480, 540, 600, 660, 720, 780, 840, 900, 960, 1020, 1080, 1140, 1200, 1260 1320, 1380 и 1440 минут. Процедура HIER при любой из вышеуказанных температур и в течение любой из вышеупомянутых периодов времени может быть осуществлена в растворе с рН 2, 2,5, 3, 3,5, 4, 4,5, 5, 5,2, 5,4, 5,6, 5,8, 6,0, 6,2, 6,4, 6,6, 6,8, 7, 7,2, 7,4, 7,6, 7,8, 8, 8,2, 8,4, 8,6, 8,8, 9, 9,2, 9,4, 9,6, 9,8, 10, 10,2, 10,4, 10,6, 10,8, 11, 11,5 или 12. В некоторых вариантах осуществления HIER может проводиться при температуре, выбранной из группы, состоящей из 80°C, 85°C, 90°C, 95°C, 100°C, 105°C, 110°C, 115°C, в течение времени, выбранного из группы, состоящей из 5, 10, 15, 20, 25, 30, 35, 40 и при рН, выбранном из группы, состоящей из 8, 8,2, 8,4, 8,6, 8,8, 9, 9,2, 9,4 9,6, 9,8, 10, 10,2, 10,4.
[00550] Таким образом, способы по настоящему изобретению дополнительно включают стадию выделения эпитопа нектина-4 путем индуцированного нагреванием выделения эпитопа (HIER).
[00551] Немеченые антитела, меченые антитела и их производные и их аналоги, которые иммуноспецифически связываются с антигеном нектина-4, могут быть использованы в диагностических целях для выявления, диагностики или мониторинга нектин-4-опосредованного заболевания. Таким образом, в настоящем документе представлены способы обнаружения нектин-4-опосредованного заболевания, включающие: (а) анализ экспрессии антигена нектина-4 в клетках или образце ткани индивида с использованием одного или нескольких антител по настоящему изобретению, которые иммуноспецифически связываются с антигеном нектина-4; и (b) сравнение уровня антигена нектина-4 с контрольным уровнем, например с уровнями в образцах нормальной ткани (например, в образцах ткани пациента, не имеющего нектин-4-опосредованного заболевания, в образцах ткани того же пациента перед началом заболевания, нормальной клетки в образцах ткани того же пациента или образцах нормальной ткани нормального органа того же пациента), в результате чего повышение анализируемого уровеня антигена нектина-4 по сравнению с контрольным уровнем антигена нектина-4 является показателем нектин-4-опосредованного заболевания.
[00552] В настоящем документе также представлен диагностический анализ для диагностики нектин-4-опосредованного заболевания, включающий: (а) анализ уровня антигена нектина-4 в клетках или образце ткани индивидуума с использованием одного или нескольких антител по настоящему изобретению, которые иммуноспецифически связываются с антигеном нектина-4; и (b) сравнение уровня антигена нектина-4 с контрольным уровнем, например уровнями в образцах нормальной ткани, при этом повышение уровня анализируемого антигена нектина-4 по сравнению с контрольным уровнем антигена нектина-4 является показательным нектин-4-опосредованного заболевания. В некоторых вариантах осуществления в настоящем документе представлен способ лечения нектин-4-опосредованного заболевания у пациента, включающий: (a) анализ уровня антигена нектина-4 в клетках или образце ткани пациента с использованием одного или нескольких антител по настоящему изобретению, которые иммуноспецифично связываются с антигеном нектина-4; и (b) сравнение уровня антигена нектина-4 с контрольным уровнем, например уровнями в образцах нормальной ткани, при этом повышение уровня анализируемого антигена нектина-4 по сравнению с контрольным уровнем антигена нектина-4 является показательным нектин-4-опосредованного заболевания. В некоторых вариантах осуществления способ дополнительно включает (с) введение эффективного количества антитела по настоящему изобретению пациенту, идентифицированному как страдающий нектин-4-опосредованным заболеванием. Более точный диагноз нектин-4-опосредованного заболевания может позволить медицинским работникам использовать профилактические меры или агрессивное лечение на более ранней стадии, тем самым предотвращая развитие или дальнейшее прогрессирование нектин-4-опосредованного заболевания.
[00553] Антитела по настоящему изобретению можно использовать для анализа уровней антигена нектина-4 в биологическом образце с использованием классических иммуногистологических методов, как описано в настоящем документе, или как известно специалистам в данной области (например, см. Jalkanen et al., 1985, J. Cell. Biol.101: 976-985; и Jalkanen et al., 1987, J. Cell Biol.105:3087-3096). Другие основанные на антителах методы, которые можно использоваться для обнаружения экспрессии гена белка, включают иммуноанализы, такие как ELISA и радиоиммуноанализ (RIA). Подходящие анализы на основе меченных антител известны в данной области и включают ферментативные метки, такие как глюкозаоксидаза; радиоизотопы, такие как йод (125I, 121I), углерод (14C), сера (35S), тритий (3H), индий (121In) и технеций (99Tc); люминесцентные метки, такие как люминол; и флуоресцентные метки, такие как флуоресцеин и родамин, и биотин.
[00554] Одним аспектом, представленным в данном документе, является обнаружение и диагностика нектин-4-опосредованного заболевания у человека. В одном из вариантов осуществления диагностика включает: а) введение (например, парентерально, подкожно или внутрибрюшинно) пациенту эффективного количества меченого антитела, которое иммуноспецифически связывается с антигеном нектина-4; b) ожидание в течение промежутка времени после введения, обеспечивая возможность меченому антителу концентрироваться в участках пациента, в которых экспрессируется антиген нектина-4 (и для исчезновения несвязавшейся меченой молекулы до фонового уровня); c) определение фонового уровня; и d) обнаружение меченого антитела у пациента, так что обнаружение меченого антитела выше фонового уровня указывает на то, что у пациента имеется нектин-4-опосредованное заболевание. Уровень фона может быть определен различными способами, включая сравнение количества обнаруженной меченой молекулы со стандартным значением, предварительно определенным для конкретной системы.
[00555] В данной области известно, что размер пациента и используемая система формирования изображения могут определять количество фрагментов формирования изображения, необходимых для получения диагностических изображений. В случае радиоактивного изотопного фрагмента для человека количество применяемой радиоактивности обычно составляет от 5 до 20 милликюридов 99Tc. Меченое антитело затем будет накапливаться в месте расположения клеток, которые содержат специфический белок. Визуализация опухоли in vivo описана в S.W. Burchiel et al.,“Immunopharmacokinetics of Radiolabeled Antibodies and Their Fragments.” (Chapter 13 in Tumor Imaging: The Radiochemical Detection of Cancer, S.W. Burchiel and B.A. Rhodes, eds., Masson Publishing Inc. (1982).
[00556] В зависимости от нескольких переменных, включая тип используемой метки и способ введения, временной интервал после индивида и для очистки несвязанного меченого антитела до фонового уровня составляет от 6 до 48 часов или от 6 до 24 часов или от 6 до 12 часов. В другом варианте осуществления интервал времени после введения составляет от 5 до 20 дней или от 5 до 10 дней.
[00557] В одном из вариантов осуществления контроль нектин-4-опосредованного заболевания проводят путем повторения способа диагностики нектин-4-опосредованного заболевания, например, через один месяц после первоначальной диагностики, через шесть месяцев после первоначальной диагностики, один год после первоначального диагноза и тому подобное.
[00558] Меченная молекула может быть обнаружено у пациента с помощью способов, известных в данной области, для сканирования in vivo. Эти методы зависят от типа используемой метки.
Специалист в данной области сможет определить подходящий способ для обнаружения конкретной метки. Способы и устройства, которые могут использоваться в диагностических способах по настоящему изобретению включают, но не ограничиваются ими, компьютерную томографию (КТ), сканирование всего тела, такое как томография с эмиссионной томографией (PET), магнитно-резонансная томография (МРТ) и сонография.
[00559] В конкретном варианте осуществления молекула мечена радиоизотопом и обнаруживается у пациента с использованием хирургического инструмента, чувствительного к излучению (Thurston et al., патент США № 5441,050). В другом варианте осуществления молекула мечена флуоресцентным соединением и обнаруживается у пациента с использованием флуоресцентно-чувствительного сканирующего инструмента. В другом варианте осуществления молекула мечена излучающим позитрон металлом и обнаружена у пациента с помощью позитронно-эмиссионной томографии. В еще одном варианте осуществления молекула мечена парамагнитной меткой и обнаружена у пациента с использованием магнитно-резонансной томографии (МРТ). 30. Наборы
[00560] В настоящем описании также раскрыты наборы, содержащие антитело (например, антитело против нектина-4) по настоящему изобретению или его композицию (например, фармацевтическую композицию), упакованную в подходящий упаковочный материал. Набор необязательно содержит этикетку или упаковочный вкладыш, включающий описание компонентов или инструкцию по применению in vitro, in vivo или ex vivo компонентов набора.
[00561] Термин «упаковочный материал» относится к физической структуре, в которой размещены компоненты набора. Упаковочный материал может содержать компоненты в стерильном состоянии и может быть изготовлен из материала, обычно используемого для таких целей (например, бумаги, гофрированного волокна, стекла, пластика, фольги, ампул, флаконов, пробирок и тому подобное).
[00562] Наборы по настоящему изобретению могут содержать этикетки или вкладыши. Этикетки или вкладыши включают «печатные материалы», например бумагу или картон, отдельно или прикрепленные к компоненту, комплекту или упаковочному материалу (например, коробке) или прикрепленные, например, к ампуле, пробирке или флакону, содержащему компонент набора. Этикетки или вкладыши могут дополнительно включать в себя считываемый компьютером носитель, такой как диск (например, жесткий диск, карта или диск памяти), оптический диск, такой как CD- или DVD-ROM/RAM, DVD, MP3, магнитную ленту или электрическое запоминающее устройство, такие как RAM и ROM, или их гибриды, такие как магнитные/оптические запоминающие устройства, флэш-носители или карты памяти. Этикетки или вкладыши могут включать информацию о производителе, номере партий, местоположении производителя и дате.
[00563] Наборы по настоящему изобретению могут дополнительно включать другие компоненты. Каждый компонент набора может находится в отдельном контейнере, и все различные контейнеры могут быть в одной упаковке. Наборы также могут быть созданы для хранения в условиях холода. Кроме того, может быть создан набор, содержащий антитела по настоящему изобретению или клетки, которые содержат нуклеиновые кислоты, кодирующие антитела по настоящему изобретению. Клетки в наборе могут храниться при соответствующих условиях хранения перед применением. Дополнительные компоненты могут включать, в качестве примера, положительный или отрицательный контрольный образец (например, образцы ткани от пациента, у которого, как известно, имеется нектин-4-опосредованное заболевание, образцы ткани пациента, не имеющего нектин-4 опосредованного заболевания, образцы ткани одного и того же пациента перед началом заболевания, образцы нормальных клеток в ткани пациента с нектин-4 опосредованным заболеванием или образцы нормальной ткани от нормального органа одного и того же пациента), буферы, промывочные растворы, реагенты для обнаружение антител и/или реагенты для усиления сигнала.
[00564] В настоящем описании также раскрыты панели антител, которые иммуноспецифически связываются с антигеном нектина-4. В конкретных вариантах раскрытые в настоящем документе панели антител имеют разные константы скорости ассоциации, разные константы скорости диссоциации, разное средство к антигену нектину-4 и/или разную специфичность в отношении антигена нектина-4. В некоторых вариантах осуществления панели по настоящему изобретению содержат или состоят из около 10, предпочтительно, около 25, около 50, около 75, около 100, около 125, около 150, около 175, около 200, около 250, около 300, около 350, около 400, около 450, около 500, около 550, около 600, около 650, около 700, около 750, около 800, около 850, около 900, около 950 или около 1000 антител или более. Панели антител можно использовать, например, в 96-луночных или 384-луночных планшетах, таких как планшеты для анализов, таких как ELISA.
[00565] Если не указано иное, все технические и научные термины, используемые в настоящем описании, имеют такое же значение, которое обычно подразумевается специалистом в области техники, к которой относится настоящее изобретение. Хотя способы и материалы, подобные или эквивалентные описанным в настоящем документе, могут быть использованы на практике или при тестировании настоящего изобретения, в настоящем документе описаны подходящие способы и материалы.
[00566] Все заявки, публикации, патенты и другие ссылки, ссылки на GenBank и ATCC, упомянутые здесь, включены в качестве ссылки в полном объеме. В случае противоречий следует руководствоваться настоящим описанием, содержащим определения.
[00567] Как здесь используется, формы единственного числа включают множественное число, если контекст явно не указывает на иное. Таким образом, например, ссылка на «пептидную последовательность» включает в себя множество таких последовательностей и так далее.
[00568] Как используется в настоящем документе, числовые значения часто представлены в формате диапазона по всему этому документу. Использование формата диапазона просто для удобства и краткости и не должно рассматриваться как жесткое ограничение объема изобретения, если контекст явно не указывает на иное. Соответственно, использование диапазона явно включает в себя все возможные поддиапазоны, все отдельные числовые значения в этом диапазоне и все числовые значения или числовые диапазоны, включая целые числа в таких диапазонах и доли значений или целые числа в диапазонах, если контекст явно не указывает на иное. Эта конструкция применяется независимо от широты диапазона и во всех контекстах этого патентного документа. Так, например, ссылка на диапазон 90-100% включает 91-99%, 92-98%, 93-95%, 91-98%, 91-97%, 91-96%, 91-95%, 91-94%, 91-93% и тому подобное. Ссылка на диапазон 90-100% также включает 91%, 92%, 93%, 94%, 95%, 95%, 97% и тому подобное, а также 91,1%, 91,2%, 91,3%, 91,4%, 91,5% и тому подобное, 92,1%, 92,2%, 92,3%, 92,4%, 92,5% и тому подобное, и так далее.
[00569] Кроме того, ссылка на диапазон 1-3, 3-5, 5-10, 10-20, 20-30, 30-40, 40-50, 50- 60, 60-70, 70-80 80-90, 90-100, 100-110, 110-120, 120-130, 130-140, 140-150, 150-160, 160-170, 170-180, 180-190, 190-200, 200 -225, 225-250 включает в себя 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20 и тому подобное. В дополнительном примере ссылка на диапазон 25-250, 250-500, 500-1000, 1000-2500, 2500-5000, 5000-25000, 25 000-50 000 включает в себя любое числовое значение или диапазон в пределах или охватывающих такие значения, например , 25, 26, 27, 28, 29… 250, 251, 252, 253, 254… 500, 501, 502, 503, 504… и тому подобное.
[00570] Как также используется в настоящем документе, ряд диапазонов раскрыт в настоящем документе. Применение ряда диапазонов включает комбинации верхнего и нижнего диапазонов для обеспечения другого диапазона. Эта конструкция применяется независимо от широты диапазона и во всех контекстах этого патентного документа. Так, например, ссылка на ряд диапазонов, таких как 5-10, 10-20, 20-30, 30-40, 40-50, 50-75, 75-100, 100-150, включает такие диапазоны, как 5 -20, 5-30, 5-40, 5-50, 5-75, 5-100, 5-150 и 10-30, 10-40, 10-50, 10-75, 10-100, 10- 150 и 20-40, 20-50, 20- 75, 20-100, 20-150 и так далее.
[00571] Для краткости, в настоящем документе используются некоторые сокращения. Одним из примеров является однобуквенное сокращение для аминокислотных остатков. Аминокислоты и их соответствующие трехбуквенные и однобуквенные сокращения следующие:
аланин Ala (A)
аргинин Arg (R)
аспарагин Asn (N)
аспарагиновая кислота Asp (D)
цистеин Cys (C)
глутаминовая кислота Glu (E)
глутамин Gln (Q) глицин Gly (G)
гистидин His (H)
изолейцин Ile (I)
лейцин Leu (L)
лизин Lys (K)
метионин Met (М)
фенилаланин Phe (F)
пролин Pro (P)
серин Ser (S)
треонин Thr (T)
триптофан Trp (W)
тирозин Tyr (Y)
валин Val (V)
[00572] Изобретение, как правило, раскрывается в настоящем документе с использованием утвердительного выражения для описания многочисленных вариантов осуществления. Изобретение также, в частности, включает варианты осуществления, которые не относятся к конкретному объекту, полностью или частично, такому как вещества или материалы, стадии и условия способа, протоколы, процедуры, анализы или анализ. Таким образом, даже несмотря на то, что изобретение в целом не выражено в настоящем документе в терминах "изобретение не включает в себя", аспекты, которые явно не включены в изобретение, тем не менее, раскрыты в данном документе.
[00573] Описан ряд вариантов осуществления изобретения. Тем не менее, будет понятно, что могут быть сделаны различные модификации без отклонения от сущности и объема изобретения. Соответственно, следующие примеры предназначены для иллюстрации, но не для ограничения объема изобретения, описанного в формуле изобретения. ПРИМЕРЫ
[00574] Примеры этого раздела предлагаются в качестве иллюстрации, а не в качестве ограничения.
ПРИМЕР 1: Получение антигена
[00575] Для последующих экспериментов иммунизации был создан и использовался в качестве антигена фрагмент нектина-4 человека, например фрагмент, содержащий аминокислотную последовательность 31-346 (SEQ ID NO: 2) нектина-4 человека (SEQ ID NO:1).
[00576] 6×HN-меченый нектин 4 (а.к.31-346) получали с использованием коммерчески доступных векторов экспрессии pET. Экспрессию осуществляли в клетках E.col BL21 (DE3) в соответствии с инструкциями производителя и очищали очисткой на основе IMAC (аффинная хроматография с иммобилизованным металлом). Очищенный нектин 4 (а.к. 31-346) использовали в качестве иммуногена.
[00577] Рекомбинантный нектин-4 (а.к. (1-348) для скрининга антител получали в клетках 293FT, используя модифицированный вектор экспрессии pTag5/mychis в соответствии с инструкциями производителя. Белок очищали с помощью стандартной очистки на основе IMAC.
ПРИМЕР 2: ПОЛУЧЕНИЕ АНТИТЕЛ
А. Получение и продукция антител
[00578] Моноклональное антитело M22-321b41.1 получали иммунизацией мышей Balb/C рекомбинантным фрагментом (31-346; SEQ ID NO:2) внеклеточного домена белка нектина-4 человека, продуцируемого бактериями, используя стандартные гибридомные методы, описанные первоначально в Kohler and Milstein, Eur. J. Immunol.6, 511 (1976). Гибридома M22-321b41 была субклонирована как M22-321b41.1, которая продуцирует мышиное каппа-антитело IgG2a, которое специфически связывается с рекомбинантным внеклеточным доменом белка нектина-4 человека с помощью ELISA. Кроме того, было показано, что очищенное антитело белка A M22-321b41.1 окрашивает специфически тестируемые ткани, которые экспрессируют нектин-4, с помощью IHC.
[00579] Клетки гибридомы M22-321b41.1 затем выращивали, размножали и живые клетки замораживали для длительного хранения в жидком азоте. B. Секвенирование гибридомы
[00580] Гены тяжелой и легкой цепи антитела гибридомы M22-321b41.1 секвенировали с использованием ОТ-ПЦР.
ПРИМЕР 3: СКРИНИНГ И ОТБОР АНТИТЕЛ
А. Анализы скрининга (или анализы связывания)
[00581] Первичный ELISA-анализ проводили с фрагментом внеклеточного домена нектина-4 (аминокислотные остатки 31-346), полученным, как описано выше.
[00582] Вторичный анализ ELISA проводили с фрагментом внеклеточного домена нектина-4 (аминокислотные остатки 31-346), продуцируемым в E.coli, фрагмент внеклеточного домена Nectin-4 (аминокислотные остатки 1-346), продуцированный в клетках 293FT, нектин-4-tag5 и два контрольных белка (один, полученный с помощью pET, и один, полученный с помощью tag5). B. Отбор антител
[00583] Антитела сначала отбирали, если они демонстрировали окрашивание в рекомбинантных клетках 3T3-нектин-4 и не окрашивались в контролях. Затем первоначально отобранные антитела тестировали на панели тканей положительного и отрицательного контроля с известной экспрессией мРНК нектина-4, определенной по показателям кПЦР. Антитела тестировали в различных концентрациях и с различными протоколами поиска антигена. Антитела отбирали, если они давали специфическое окрашивание в нектин-4-мРНК-позитивных тканях, не окрашивались в нектин-4-мРНК-негативных тканях и были лучше, чем контрольные антитела против нектина-4, протестированные с точки зрения интенсивности окрашивания, соотношения окрашенные клетки и неспецифическое фоновое окрашивание.
ПРИМЕР 4. Скрининг антител, специфичных к нектину-4.
[00584] Антитела, полученные как описано выше, подвергали скринингу для отбора антител, специфичных к нектину-4. Скрининг проводили, например, с использованием анализа IHC. Коротко, ткани с ксенотрансплантатом рака человека различного происхождения, например, мочевого пузыря, молочной железы, яичника, поджелудочной железы, почки, кожи, легкого и толстой кишки, впервые были протестированы в кПЦР для определения уровня экспрессии нектина-4 в этих тканях.
[00585] Количественный ПЦР-анализ в реальном времени (кПЦР) использовали для определения относительных уровней экспрессии мРНК нектина-4. Анализ кПЦР проводили с использованием системы ПЦР в реальном времени Bio-Rad CFX384 с SsoFast EvaGreen Supermix (Bio-Rad) и 5 нг РНК-эквивалента матрицы кДНК. Уровни экспрессии мРНК нектина-4 рассчитывали по отношению к уровням экспрессии GAPDH, гена домашнего хозяйства, с использованием модифицированного метода delta Cq со следующей формулой: 10000х2-(Cq нектин-4-Cq GAPDH); относительную экспрессию нектина-4 описывали относительно единиц GAPDH.
[00586] Праймеры, используемые в анализе кПЦР нектина-4, включают: прямой праймер 191P4D12.1: 5'- GGCTGGAGTTCAATGAGGTTTATTT -3' (SEQ ID NO:41); и обратный праймер 191P4D12.2: 5'- TCCAGCAGATTTCAGACTAAGAAGA -3' (SEQ ID NO:42). Праймеры, используемые в анализе кПЦР GAPDH, включают: прямой праймер GAPDH.1: 5'- AGAACATCATCCCTGCCTCTACTG -3' (SEQ ID NO:43) ; и обратный праймер GAPDH.2: 5'- AAATGAGCTTGACAAAGTGGTCGT -3 '(SEQ ID NO: 44).
[00587] Матрицу кДНК для кПЦР синтезировали с использованием набора для синтеза кДНК Bio-Rad iScript Advanced из РНК, выделенной из образцов ткани или клеточной линии, с использованием метода экстракции РНК TRIzol с последующей очисткой РНК и расщеплением ДНКазой I, используя набор Qiagen RNeasy Cleanup.
[00588] Типичные ткани ксенотрансплантата человека показаны в таблице 5. Антитела против нектина-4, полученные выше, затем использовали в анализе IHC для окрашивания тканей с известными уровнями экспрессии нектина-4. Анализы IHC проводили аналогично тому, как подробно описано в примере 5 ниже. Окрашивание IHC нектина-4 в различных тканях коррелировало с уровнями мРНК нектина-4 в этих тканях. Антитело отбирали как нектин-4-специфическое антитело, когда оно давало сигнал окрашивания IHC, который коррелировал с уровнями мРНК нектина-4, например сильное окрашивание в тканях с высоким уровнем мРНК нектина-4, умеренный сигнал окрашивания IHC в тканях со средним уровнем мРНК нектина-4, низкий сигнал окрашивания IHC в тканях с низким уровнем мРНК нектина-4 и отсутствие сигнала окрашивания IHC в тканях, не экспрессирующих мРНК нектина-4. Всего было проведен скрининг не менее 283 клонов антител, что привело к идентификации нектин-4-специфических антител M22-321b41.1 и M22-244b3.1.1.1
ПРИМЕР 5: ФУНКЦИОНАЛЬНЫЕ АНАЛИЗЫ: ИММУНОХИСТОХИМИческое окрашиванием ксенографических ТКАНЕЙ
[00589] Антитела, полученные, подвергнутые скринингу, экспрессированные и очищенные, например, как описано в настоящем документе, дополнительно оценивали по их способности специфически окрашивать ткани ксенотрансплантата человека, экспрессирующие нектин-4, в анализе IHC. Например, два мышиных моноклональных антитела против нектина-4, M22-244b3.1.1.1 и M22-321b41.1 (изотипы IgG1 и IgG2a, соответственно), тестировали в анализе IHC. Получали антитела М22-244b3.1.1.1 и М22-321b41.1 в концентрации 1,54 мг/мл и 1,3 мг/мл в фосфатно-солевом буфере, рН 7,4. В качестве отрицательного контроля коммерческий мышиный контроль изотипа IgG2a из мышиной миеломы (клон: UPC10, Sigma-Aldrich, St. Louis, MO) контактировал с β-2,6-фруктозаном, который не связывается с нектином-4 человека или использовали другие антигены млекопитающих.
[00591] Окрашивание IHC проводили в соответствии со следующими примерными протоколами. Коротко, использовали непрямой IHC для обнаружения нектина-4 в анализе IHC. Образцы фиксировали в 10% забуференном нейтральном формалине, обрабатывали и заливали парафиновым воске и готовили в виде тканевых срезов 4 мкм. После депарафинизации и повторной гидратации срезы обрабатывали и антиген извелекали. Эпитопы антигена нектина-4 получали, например, путем нагревания срезов тканей в водной среде, обычно называемой процедурой термического восстановления эпитопов (HIER). Например, антигенные эпитопы нектина-4 получены путем нанесения Epitope Retrieval 2 (ER2, буфер на основе EDTA при pH 8,9-9,1) на автоматизированной платформе Leica в течение 20 минут при 100°C. Срезы ткани после выделения антигена затем инкубировали с первым антителом мыши M22-321b41.1, M22-244b3.1.1.1 или IgG2a (контрольное антитело). Срезы ткани, связанные с первым антителом, промывали и детектировали с помощью меченного ферментом, например, меченного пероксидазой, второго антитела. Связанное второе антитело давало цвет, например, при использовании системы детектирования полимеров Leica Bond Refine, которая может использовать реакцию между пероксидазой и хромогеном 3,3'-диаминобензидином (DAB) с образованием коричневого осадка на месте реакции. Затем окрашенные срезы ткани сканировали, визуализировали и оценивали с помощью световой микроскопии, например, с использованием Aperio ScanScope CS (Aperio, Vista, CA).
[00592] Для оценки уровня экспрессии нектина-4 в срезах тканей по уровню окрашивания антителами окрашенные срезы тканей исследовали, оценивали, классифицировали и регистрировали по различным категориям или баллам в соответствии с интенсивностью окрашивания IHC и соотношением раковых клеток. Категории включают сильные («3» или взаимозаменяемо с «3+»), умеренные («2» или взаимозаменяемо с «2+») и слабые («1» или взаимозаменяемо с «1+»). Отсутствие специфического окрашивания было записано как отрицательное («0» или взаимозаменяемо с «-»). [00593] Тестировали ткани ксенотрансплантата рака человека различного происхождения, например мочевого пузыря, молочной железы, яичника, поджелудочной железы, почки, кожи, легкого и толстой кишки, с известными уровнями экспрессии мРНК нектина-4. Уровни мРНК нектина-4 в этих характерных тканях ксенотрансплантата человека сначала оценивали с помощью кПЦР и они показаны в таблице 5.
Таблица 5. Ткани для эксперимента по титрованию антител
[00594] Для того, чтобы найти подходящую концентрацию окрашивания для антител, антитела M22-321b41.1 и M22-244b3.1.1.1 сначала титровали при 2,5 мкг/мл, 5,0 мкг/мл и 7,5 мкг/мл, используя примеры тканей ксенотрансплантата, указанные в таблице 5, в анализе окрашивания IHC, как описано выше. Результаты приведены в таблице 6.
Таблица 6. Итоги результатов титрования M22-321b41.1 и M22-244b3.1.1.1
мл)
[00595] Оптимальную концентрацию для окрашивания IHC анти-нектин-4-антитела определяли как концентрацию, при которой окрашивание IHC-антитела против нектина-4 наблюдали в тканях, экспрессирующих мРНК нектина-4, но не в нектин-4 -отрицательных тканях. При концентрации 2,5 мкг/мл антитела как M22-321b41.1, так и M22-244b3.1.1.1 показали положительное окрашивание в тканях ксенотрансплантата человека, положительное в отношении мРНК нектина-4 (фиг. 1 и фиг. 2), и показали наименьшее фоновое окрашивание в тканях отрицательного контроля. Таблица 6 и подробные результаты окрашивания в Таблице 7 показывают, что концентрация 2,5 мкг/мл была примерной оптимальной концентрацией для обоих антител.
Таблица 7. Подробные результаты окрашивания для титрования М22-321b41.1 и М22-244b3.1.1.1
трансплантат
(мкм/мл)
[00596] Антитело M22-321b41.1 в концентрации 2,5 мкг/мл не давало окрашивания в тканях, отрицательных по мРНК нектина-4 AG-K24 и MDAMB-231-MFP-XCL (фиг. 3 и фиг. 5); тогда как M22-244b3.1.1.1 имел неспецифическое окрашивание в ксенотрансплантатных раковых клетках негативных по мРНК нектина-4 AG-K24 (фиг. 4) и MDAMB-231-MFP-XCL (фиг. 6). Окрашивание не наблюдали на срезах, инкубированных с антителом отрицательного контроля IgG2a мыши (фиг.7). Следовательно, ткани M22-321b41.1, специфически окрашенные, которые экспрессируют мРНК нектина-4 и не вызывают окрашивания или дают окрашивание настолько низкое, как у контроля изотипа IgG, для тканей, которые не экспрессируют мРНК нектина-4.
[00597] Специфичность M22-321b41.1 дополнительно тестировали в расширенной панели тканей положительного и отрицательного контроля, как показано в таблице 8. Результаты показали, что антитело в концентрации 2,5 мкг/мл было специфичным для тканей и клеток, экспрессирующих мРНК нектина-4, включая AG-B1, AG-UTS, AG-L16 (фиг. 8), AG-Br29, AG-B11 (фиг. 9), AG-OV35, AG-Panc3, AG-C16, AG-C6, Rat1(E)-нектин-4 и T47D. Результаты также показали, что антитело было отрицательным для тканей и 231-MFPXCL (FIG 5), AG-Mel5, AG-K31, CALU-1, MDA-MB-231, UG-K3, Rat1(E)-neo, Rat1(E)-нектин-1, Rat1(E)-нектин-2, Rat1(E)-нектин-3, JMSU-1, Hep3B и ACHN. Эти данные продемонстрировали, что M22-321b41.1 был специфичен в отношении нектина-4 в анализе IHC, потому что для всех тканей и клеток, протестированных в настоящем описании, M22-321b41.1 положительно окрашивали ткани и клетки, которые экспрессировали мРНК нектина-4, и окрашивали отрицательно те, которые не экспрессировали. (Таблица 8 и Таблица 9).
Таблица 8: Данные экспрессии нектина-4 в расширенной панели образцов FFPE с использованием M22-321b41.1 при 2,5 мкг/мл
(окрашивание
M22-321b41.1)
Таблица 9. Результаты окрашивания M22-244b3.1.1.1 расширенной панели
мыши
нектина 4 (кПЦР)
(мкг/мл)
[00598] Антитела против нектина-4, полученные и прошедшие скрининг, как описано выше, дополнительно сравнивали с другими коммерческими антителами против нектина-4 в анализе IHC. Например, антитело против нектина-4/PVRL4 (называемое «антителом Novus PVRL4») от Novus Biologicals (номер по каталогу NBP1-82829), кроличье поликлональное антитело против нектина-4, было получено и протестировано на его способность специфически окрашивать нектин-4 в анализе IHC в различных тканях ксенотрансплантата, в которых уровни мРНК нектина-4 были определены с помощью КПЦР. В экспериментах, где антитело Novus PVRL4 титровали при 2 мкг/мл, 1,5 мкг/мл, 1 мкг/мл и 0,5 мкг/мл, антитело Novus PVRL4 давало специфическое окрашивание нектином-4 слабее, чем окрашивание, производимое M22-244b3. 1.1.1.1 антитела и давало неспецифическое окрашивание при всех концентрациях в ксенотрансплантате MDA-MB-231, который не экспрессировал мРНК нектина-4, как показано в таблице 10. Таким образом, антитело Novus PVRL4 было неспецифичным в отношении нектина-4.
Таблица 10: Результаты окрашивания антител Novus PVRL4 при различных концентрациях
[00599] Антитело Novus PVRL4 дополнительно тестировали в анализе IHC против более широкой панели тканей, в которой уровни мРНК нектина-4 определяли с помощью кПЦР. Фоновое цитоплазматическое окрашивание наблюдалось в большинстве протестированных ксенотрансплантатов, независимо от уровней мРНК Nectin-4, как показано в таблице 11.
Таблица 11: Результаты окрашивания антител Novus PVRL4 на более широкой панели тканей ксенотрансплантата
мыши
[00600] Поскольку антитело Novus PVRL4 представляет собой истощаемое поликлональное антитело с возможной вариабельностью от партии к партии, то было получено и протестировано другое кроличье поликлональное антитело против нектина PA5-30837 от ThermoFischer Scientific («антитело Thermo PVRL4»). и его сравнивали в анализе IHC в трех различных тканях ксенотрансплантата, в которых уровни мРНК нектина-4 определяли с помощью кПЦР. Три протестированных ткани ксенотрансплантата включали AG-B1 (+) PS26 с уровнем мРНК нектина-4, равным 478, AG-OV35P3 с уровнем мРНК нектина-4, равным 78 и AG-Mel5 P17, не экспрессирующим мРНК нектина-4. Антитело Thermo PVRL4 вызывало слабое/умеренное окрашивание IHC в AG-B1 и отрицательное окрашивание IHC в AG-OV35.
[00601] Следовательно, ни антитело Novus PVRL4, ни антитело Thermo PVRL4 не были настолько специфичными в отношении нектина-4 в анализе IHC, как антитела M22-244b3.1.1.1.1 или M22-321b41.1, полученные и отобранные в данном случае.
[00602] Два других коммерческих антитела (моноклональное мышиное антитело против нектина-4 MAB2659 и козье поликлональное антитело против нектина-4 AF2659), оба от R&D Systems, также были получены и протестированы в анализе IHC в трех различных тканях ксенотрансплантата, в которых уровни мРНК нектина-4 определяли с помощью кПЦР. Три протестированных ткани ксенотрансплантата включали AG-B1 (+) PS26 с уровнем мРНК нектина-4, равным 478, AG-OV35P3 с уровнем мРНК нектина-4, равным 78 и AG-Mel5 P17 без мРНК нектина-4. Антитело MAB2659 при использовании в концентрации 1 мкг/мл или 5 мкг/мл давало грязно-пунктирное/цитоплазматическое окрашивание на периферии опухоли в AG-B1 и AG-OV35. Козье поликлональное антитело против Nectin-4 AF2659 давало сильное окрашивание мембраны с фоновым стромальным окрашиванием в AG-B1 и AG-OV35 при 5 мкг/мл, но слабое окрашивание при 1 мкг/мл. Следовательно, антитело AF2659 дополнительно оценивали при 2,5 мкг/мл в других тканях. Антитело AF2659, однако, вызывало фоновое окрашивание в ксенотрансплантатах MDA-MB-231, которые не экспрессируют мРНК нектина-4. Следовательно, ни антитело MAB2659, ни антитело AF2659 не были такими специфичными, как антитело M22-321b41.1, полученное и прошедшее скрининг в данном случае.
ПРИМЕР 6: ФУНКЦИОНАЛЬНЫЕ АНАЛИЗЫ: ИММУНОХИСТОХИМИЧЕСКОЕ ОКРАШИВАНИЕ ПЕРВИЧНЫХ ТКАНЕЙ
[00603] Антитела, например антитело против нектина-4 M22-321b41.1, полученное, прошедшее скрининг, экспрессированное и очищенное, например, как описано в примерах в настоящем документе, дополнительно оценивали на способность специфически окрашивать первичные ткани человека, экспрессирующие нектин-4, в анализе IHC.
[00604] Анализ IHC проводили, например, с использованием косвенной методики IHC. В методе косвенного IHC использовали два антитела для обнаружения тканевых антигенов. Сначала неконъюгированное первичное антитело наносили на ткань (первый слой), которая реагирует с тканевым антигеном. Затем наносили меченное ферментом второе антитело, которое нацелено против IgG тех видов животных, у которых было получено антитело (второй слой). Вторичное антитело реагирует с первичным антителом с последующим нанесением субстрата-хромогена. Антитело второго слоя может быть мечено ферментом пероксидазой, которая реагирует с хромогеном 3,3'-диаминобензидином (DAB) с образованием коричневого осадка на месте реакции. Этот метод является чувствительным и универсальным благодаря сильной амплификации сигнала посредством реакций нескольких вторых антител с различными антигенными участками первого антитела.
[00605] В качестве примера для дальнейшего повышения чувствительности теста использовали второе антитело, конъюгированное с меченым полимером. В полимерной технологии использовали инертную молекулу "иглу" декстрана, меченую ферментом HRP, к которой может быть присоединено вплоть до 10 молекул второго антитела, что делает систему еще более чувствительной.
[00606] Образец затем контрастировали для идентификации клеточных и субклеточных элементов.
6.А. Процедура окрашивания
[00607] Анализ IHC проводили в соответствии со следующим протоколом, приводимым в качестве примера. Коротко, образцы фиксировали, обрабатывали и заливали парафиновым воске и готовили в виде тканевых срезов. Затем предметные стекла инкубировали в печи при 60±5° С в течение 1-2 часов, вынимали из печи и оставляли охлаждаться до комнатной температуры (КТ) перед тем как продолжить эксперимент. После обычной депарафинизации и регидратации образцов ткани проводили поиск антигена для обратного сшивания белков, которое происходило после фиксации формалином. Извлечение антигена было достигнуто либо путем протеолитического расщепления тканей в растворах протеаз, либо путем подачи тепла на срезы тканей в водной среде, обычно называемой процедурой HIER. Для этого анализа использовали Epitope Retrieval 2 (ER2, буфер на основе EDTA при pH 8,9-9,1) на автоматизированной платформе Leica в течение 20 минут при 100° C.
[00608] Окрашивание было запрограммировано для работы на инструментах Bond с использованием автостейнеров Leica Bond при комнатной температуре, если не указано иное. Коротко, в качестве протокола окрашивания на автостеколах Leica Bond были запрограммированы следующие стадии: (1) процедура получения эпитопа 2 (ER2): 20 минут при 100°C (раствор для извлечения эпитопа Bond 2 (Leica), часть № AR9640); (2) 3× промывка связавшегося комплекса: 0 мин (раствор для промывки связавшегося комплекса (Leica), часть № AR9590); (3) маркер: 15 минут (окрашивание моноклональным мышиным антителом против нектина-4 M22-321b41.1 или отрицательным контрольным мышиным IgG2a (BD Biosciences), часть № 550339, в растворе первого антитела связывания (Leica), часть № AR9352); (4) 3× промывка связавшегося комплекса: 0 минут (раствор для промывки связавшегося комплекса (Leica), часть № AR9590); (5) после первого: 8 минут (кроличьи анти-мышиные IgG2a); (6) 3× промывка связавшегося комплекса: 2 минуты (раствор для промывки связавшегося комплекса (Leica), часть № AR9590); (7) полимер: 8 минут (антикроличье поли-HRP-IgG от Bond Polymer Refine Detection (Leica), часть № DS9800); (8) 2× промывка связавшегося комплекса: 0 мин, 2 мин; (9) 1× DI вода: 0 минут; (10) блокирование перекисью: 5 минут (3-4% перекись водорода) и 3х промывка связавшегося комплекса: 0 минут; (11) 2 × DI вода: 0 минут; (12) смешанная DAB очистка: 0 минут (66 мМ 3,3-диаминобензидин тетрагидрохлорид и ≤0,1% перекись водорода от Bond Polymer Refine Detection (Leica), часть № DS9800); (13) смешенная DAB очистка: 10 минут (66 мМ 3,3-диаминобензидин тетрагидрохлорид и ≤0,1% перекись водорода от Bond Polymer Refine Detection (Leica), часть № DS9800); (14) 3× DI вода: 0 минут; (15) гематоксилин: 15 минут (<0,1% гематоксилин от Bind Polymer Refine Detection (Leica), часть # DS9800); (16) 1 × DI вода: 0 минут; (17) 1× промывка: 0 минут; (18) 1× DI вода: 0 минут. Как указано в методике, для каждого тестируемого образца использовали мышиный контрольный реагент IgG2a от BD Biosciences, чтобы оценить наличие неспецифического (фонового) окрашивания. Наличие фонового окрашивания также было критерием для принятия/отклонения конкретного анализа.
6.B Образцы тканей
[00609] Положительные и отрицательные контрольные образцы были использованы для проверки и контроля всех этапов анализа IHC. Для этого анализа в качестве контроля использовали мышь/человек ксенотрансплантаты опухоли с изменяющимися уровнями экспрессии нектина-4.
[00610] Фиксированные формалином образцы парафина в ткани человека были получены в качестве остаточного материала в результате хирургического вмешательства или вскрытия из Institutional Review Board-approved sources, for example government repositories (e.g., Cooperative Human Tissue Network), благодаря академическому сотрудничеству (e.g., UCLA, UC Irvine), и из коммерческих источников, в том числе, например, нормальные уротелиальные клетки и клетки переходно-клеточного рака человека (BL802) и нормальный (FDA999) тканевый микрочип (TMA), Biomax USA. Образцы тканей тестировали на экспрессию нектина-4, используя протокол, описанный в Примере 6.A. Также тестировали четыре мышь/человек ксенотрансплантата опухоли, которые включают один отрицательный (X14-126), один слабо положительный (X14-33), один умеренно положительный (X14-139) и один сильно положительный (X14-43) по экспрессии нектина-4.
6.C Титрование концентрации антитела против нектина-4 для окрашивания
[00611] Оптимальный титр первого антитела определяли путем проведения анализа титрования на срезах ткани ксенотрансплантатов, например, используя протокол, описанный в примерах 4 и 5. Анализ титрования для образцов в парафине был выполнен с целью определения оптимальной концентрации антител для анализов IHC. Для проведения анализа титрования готовили 2-кратные серийные разведения, заключающие в себе оптимальную концентрацию (2,5 мкг/мл), определенную в примере 5, и тестировали с соответствующими им срезами ткани отрицательного контроля.
[00612] Антитело против нектина-4 M22-321b41.1 и соответствующее антитело с отрицательным контролем наносили на срезы ткани в соответствии с соответствующим протоколом IHC для образцов, залитых парафином, как указано в примерах 4 и 5. Результаты оценивали и сравнивали исследователями-патологами с помощью световой микроскопии. Патологи исследования определили оптимальный титр (оптимальная концентрация антитела) как самый низкий титр (самая низкая концентрация антитела), который давал наибольшую интенсивность окрашивания без значительного фонового окрашивания. В этом примере, как показано в таблице 12, концентрация антител, равная 2,5 мкг/мл была выбрана и использована в последующих анализах IHC.
Таблица 12: Определение оптимальной концентрации антител для антитела против нектина-4 M22-321b41.1.
6.D. Оценка окрашивания нектина-4 в анализе IHC
[00613] Оценка окрашивания IHC была выполнена сертифицированными патологоанатомами. Интенсивность окрашивания оценивали и сообщали как 0 (отрицательная), 1+ (слабая), 2+ (умеренная) и 3+ (сильная). Приблизительный процент клеток, окрашенных на каждом уровне интенсивности, или положительно окрашенных клеток в целом оценивали и присваивали им значение от 0 до 100%.
[00614] Для сравнения окрашивания среди тканей различные параметры оценки окрашивания нектином-4 либо сравнивали непосредственно, либо результаты окрашивания нектином-4 дополнительно обрабатывали, например, рассчитывали как балл Н, который учитывает как интенсивность окрашивания, так и процентное соотношение клеток окрашенных в определенном диапазоне интенсивностей. Например, балл H был рассчитан путем суммирования произведений процента клеток, окрашенных с заданной интенсивностью окрашивания (0-100), и интенсивности окрашивания (0-3). Например: образец с 10% клетками с баллом 3+, 30% клеток баллом 2+, 20% клеток с баллом 1+ и 40% неокрашенных клеток будет иметь балл H (3×10)+(2×30)+(1×20)+(0×40)=110.
[00615] Коэффициент вариации (CV) использовали для оценки внутри-экспериментального отклонения или точности в балле H. Точность анализа в ходе проведения определяли по пяти отдельным экспериментам, используя три положительные образца ксенотрансплантата. Качественно, точность внутриэкспериментальных процессов считается приемлемой по общепринятой схеме окрашивания каждой ткани, протестированной в трех отдельных экспериментах. CV рассчитывали следующим образом:
CV=стандартное отклонение/среднее × 100
[00616] Например, CV, меньшее или равное 35%, считалось приемлемым.
[00617] Как показано в таблице 13 для оценки внутриэкспериментальной точности процессов, характеристики (комбинации 3+, 2+, 1+) интенсивности окрашивания согласовывали для каждой ткани в течение пяти повторов. Кроме того, CV для всех тканей были менее 35%, что находится в пределах примерного приемлемого диапазона. Таким образом, M22-321b41.1 обеспечивал точность обнаружения нектина-4 в анализе IHC нектина-4.
[00618]
Таблица 13 Точность определения антитела против нектина-4 M22-321b41.1 в анализах IHC
суб
%
суб
суб
[00619] Воспроизводимость результатов анализов при их проведении определяли в пяти отдельных экспериментах, используя те же образцы ксенотрансплантата, что и в предыдущем анализе. Качественно, точность внутриэкспериментальных процессов считается приемлемой по общепринятой схеме окрашивания каждой ткани, протестированной в пяти отдельных экспериментах. Как показано в таблице 14 для оценки внутриэкспериментальной точности воспроизводимости, характеристики (комбинации 3+, 2+, 1+) интенсивности окрашивания согласовывали для каждой ткани в течение трех повторов. Кроме того, CV для всех тканей были менее 35%, что находится в пределах примерного приемлемого диапазона. Таким образом, M22-321b41.1 обеспечивал точность воспроизведения обнаружения нектина-4 в анализе IHC нектина-4.
Таблица 14: Внутриэкспериментальная воспроизводимость антитела против нектина-4 M22-321b41.1 в анализах IHC
Доступа поиска
и платформа
контроль
%
окрашив.
Bond Max
Bond Max
Bond III
результаты
окрашивание
[00620] Параметры и результаты 6.А-6.D суммированы в нижеследующей таблице 15:
Таблица 15: Примеры параметров, результатов и их диапазоны.
2=среднее и 3=сильное
% окрашенных клеток
6.E Чувствительность и специфичность окрашивания нектина-4 IHC.
[00621] Анализ IHC нектина-4 считали чувствительным, например, если он положительно окрашивал ткани, которые экспрессировали антиген нектина-4. Анализ IHC нектина-4 считали специфичным, например, если дифференциальное окрашивание наблюдалось в различных типах тканей и окрашивание NHTIN-4 IHC коррелировало с известной экспрессией антигена нектина-4 в окрашенных тканях. Поскольку исследования специфичности и чувствительности не были взаимоисключающими, то анализ часто давал информацию как о чувствительности, так и о специфичности.
[00622] Чувствительность и специфичность анализа IHC нектина-4 с M22-321b41.1 определяли с помощью TMA из 60 уникальных образцов карциномы мочевого пузыря и 20 нормальных тканей уротелия, 4 мышиных ксенотрансплантатов опухоли человека и 13 срезов цельной ткани человека (WTS) различных карцином, включая карциному мочевого пузыря, легких и груди. Суммированные данные чувствительности и специфичности антитела M22-321b41.1 в отношении окрашивания нектина-4 в анализах IHC приведено в таблице 16 и таблице 17 ниже. В этих и некоторых других примерах анализов образцы ткани разделяли по H-баллам на одну из четырех категорий: высокая (201-300), средняя (101-200), низкая (1-100), отрицательная (0).
Таблица 16. Суммированные данные чувствительности окрашивания ткани
H-баллов
(201-300)
(101-200)
(1-100)
(<=0)
Таблица 17. Суммированные данные специфичности окрашивания тканей
H-баллов
(201-300)
(101-200)
(1-100)
Следующие результаты были отрицательными во всех повторах: мозг (N), мозжечок (N), надпочечник (N), яичники, поджелудочная железа, паращитовидная железа, гипофиз, яичко, щитовидная железа, селезенка, миндалины, тимус, сердечная мышца, желудок, тонкая кишка, толстая кишка, печень, скелетные мышцы, периферический нерв, мезотелий и глаз
[00623] В некоторых примерах анализов для оценки специфичности и чувствительности M22-321b41.1, сравнивали H-баллы для 13-и WTS карцином, полученные при окрашивании либо антителом X, которое, как известно, является специфичным для нектина-4, либо антителом против нектина-4 M22-321b41.1 при 2,5 мкг/мл, соответственно. Сравнение, показанное в Таблице 18 ниже, выявило, что окрашивание IHC с M22-321b41.1 соответствовало известной экспрессии нектина-4, как показано окрашиванием антителом X в подавляющем большинстве случаев.
Таблица 18. Корреляция между окрашиванием IHC с M22-321b41.1 и окрашиванием IHC с антителом X
[0064] Результаты, показанные в таблице 18 выше, повторно классифицировали на позитивное и негативное окрашивание нектина-4 для определения корреляции позитивности окрашивания между антителом X и антителом против нектина-4 M22-321b41.1. Ткань считалась позитивной, если H-балл был ≥150. Общие результаты, приведенные в таблице 19 ниже, показали, процент соответствия, равный 89% для антитела X и антитела против нектина-4 M22-321b41.1 в случае позитивно окрашенных тканей, коэффициент соответствия, равный 100% для негативно окрашенных тканей, и общий уровень совпадения, равный 94%. Таким образом, существует высокая степень корреляции между окрашиванием IHC нектина-4 с M22-321b41.1 и экспрессией нектина-4 в ткани. Поэтому, анализ IHC нектина -4 с M22-321b41.1 является чувствительным и специфичным.
Таблица 19. Антитело Х против нектина-4 в сравнении с M22-321b41.1 Если порог составляет H-балл ≥ 150
[00625] Чувствительность и специфичность M22-321b41.1 дополнительно определяли, используя больший набор образцов тканей, включая TMA из 60 уникальных образцов карциномы мочевого пузыря и 20 нормальных тканей уротелия, 4 мышиных ксенотрансплантатов опухоли человека и 13 срезов цельной ткани человека (WTS) различных карцином, включая карциному мочевого пузыря, легких и груди. В общей сложности оценивали 94 случаев и в суммарно нектина-4 обнаруживали в 95% случаях (82% в WTS и 98% в TMA) с помощью анализов IHC с антителом Х. Репрезентативное окрашивание карциномы IHC с помощью M22-321b41.1 показано на фигурах 10 и 11. Субклеточная локализация была в основном мембранной и цитоплазматической, с некоторым апикальным окрашиванием, которое считалось мембранным. Результаты, представленные в таблице 20, дополнительно показали чувствительность и специфичность анализов IHC нектина-4 с M22-321b41.1, потому что процент положительного окрашивания в образцах опухоли с M22-321b41.1 соответствовал известной экспрессии нектина-4 в карциномах, как показано в анализах IHC с антителом Х. Поэтому, анализ IHC нектина -4 с M22-321b41.1 был как чувствительным, так и специфичным.
Таблица 20 Чувствительность антитела против нектина-4 M22-321b41.1 при окрашивании IHC различных тканей.
Таблица 20 - часть I.
тип
ткани
тип.
контр.
балл
мышц.
роб
ласт
восп.
1172A
0626B
0696A
1177A
1228A
1247A
1824
желез. (IDC)
железа (IDC)
железа (IDC)
внутрипроточный
Таблица 20-часть II.
доступа
TMA
Нек
тин-4
до
телий
муск.
ро
бласт
восп.
адипоз.
ткань
воспал.
слизист.)
воспал.
слизист.)
ткань
и кров.
сосуды)
разрушена
G=уровень
[00626] Специфичность и чувствительность M22-321b41.1 были дополнительно определены во всех 33 нормальных образцах человека, содержащихся в трех повторах в FDA999d. Как показано в таблице 21, окрашивание IHC антителом против нектина-4 M22-321b41.1 соответствовало экспрессии нектина-4 в нормальных клетках, о которых сообщалось в литературе (Rabet et al., 2016.), за исключением того, что здоровая грудь показала частичную и слабую или умеренную иммунореактивность. Эритроциты окрашивались на нектин-4 с умеренной интенсивностью. Сквамозный эпителий окрашивался сильно, а базальный слой не окрашивался.
Таблица 21. Чувствительность антитела против нектина-4 M22-321b41.1 при окрашивании IHC различных тканей.
доступа
теста
TMA
Ткань
и-типа
4
муск.
восп.
%
суб
%
sub
%
sub
%
(НОT)
кишеч. (N)
серозные клетки+ клетки протоков
в основном апикально
матки
(НОT)
матки
(НОT)
матки (НОT)
экто-цервикал. базальн.
(N)
Кожа
базальный слой
базальный слой.
[00627] Следовательно, анализ IHC на экспрессию нектина-4, основанный на M22-321b41.1 является чувствительным и специфичным для экспрессии нектина-4. Анализ IHC с M22-321b41.1 показал превосходную точность и воспроизводимость.
ПРИМЕР 7: ФУНКЦИОНАЛЬНЫЙ АНАЛИЗ: ИММУНОБЛОТИНГ
[00628] Функциональные свойства и специфичность mAb M22-321b41.1 дополнительно оценивали с помощью иммуноблоттинга, например, вестерн-блоттинга. Коротко, лизаты белка, полученные из различных мРНК-положительных нектин-4 и мРНК-отрицательных образцов нектина-4, подвергали SDS-PAGE, переносили на нитроцеллюлозную мембрану и добавляли зонд M22-321b41.1. Антитело против GAPDH человека использовали в качестве контроля, чтобы подтвердить, что подходящие и равные количества общего клеточного лизата разделены на каждой дорожке геля в SDS-PAGE. Как показано на фиг. 12A, M22-321b1.1 распознал и блоттировал специфическую полосу ~58-60 кДа, в соответствии с прогнозируемой молекулярной массой нектина-4 человека, в лизатах мРНК нектин-4-позитивных по NCI H322M, AG-B1 и Rat1(E) клетках, сконструированных как сверхэкспрессирующие нектин-4. Меньшие по размеру продукты расщепления нектина-4 обнаруживали в образцах ксенотрансплантата AG-B1, а также в клеточной линии NCIH322M, что согласуется с сообщениями о нахождении нектина-4. (Buchanan et al., 2017.) В клетках, не содержащих мРНК нектина-4 MDA-MB-231 и Rat1(E)-Neo, полос обнаружено не было. M22-321b41.1 также не обнаружил ни одного из нектина-1, нектина-2 и нектин-3, сверхэкспрессируемых сконструированными клетками Rat1(E) при вестерн-блоттинге, хотя все члены семейства нектина (нектин 1-4) были сверхэкспрессированы в сконструированных клетках Rat1(E), как показано с помощью FACS на фиг.12B. Следовательно, M22-321b41.1 специфически обнаруживал нектин-4 в анализе иммуноблоттинга.
ПРИМЕР 8: КАРТИРОВАНИЕ ЭПИТОПОВ
[00629] Для дальнейшего картирования эпитопов на нектине-4, распознаваемого антителом M22-321b41.1, различные фрагменты нектина-4 клонировали, трансфицировали в клетки и экспрессировали в клетках. Клетки, экспрессирующие различные фрагменты нектина-4, культивировали и лизировали в буфере RIPA. Суммарную концентрацию белка в лизатах RIPA определяли количественно с использованием стандарта BSA, и в общей сложности 20 мкг восстановленных (50 мМ TCEP) лизатов подвергали SDS-PAGE на 4-12% BT 15-полосном геле в 1x буфере MES, перенесенном с I -blot на нитроцеллюлозную мембрану, блокированную с помощью блокирующего буфера LI-COR, добавляли зонд 2 мкг/мл антитела M22-321b41.1 в 1:1 блокирующем буфере LI-COR. Разведение 1:10000 α-GAPDH антитела (Chicken pAb, Millipore) использовали для выявления GAPDH в качестве контроля. Антитела, связанные с белковыми полосами, затем детектировали в разведении 1:5000 козьего анти-мышиного антитела, конъюгированного с IRDye 680 (Odyssey), или 1:5000 ослиного анти-α-цыпленка, конъюгированного с IRDye 800 (Odyssey), и визуализировали в системе Odyssey. Антитело M22-321b41.1 распознало фрагмент V нектина-4 (аминокислотные остатки 1-150) (фигура 13). Следовательно, антитело M22-321b41.1 распознало эпитоп, расположенный в аминокислотных остатках 1-150 (SEQ ID NO: 45) нектина-4 человека. Кроме того, поскольку антитело M22-321b41.1 было получено против фрагмента нектина-4 из аминокислотных остатков 31-346 (SEQ ID NO: 2) нектина-4 человека, как показано в примерах 1, 2 и 3, то антитело M22-321b41.1 может распознавать эпитоп, расположенный в аминокислотных остатках 31-150 (SEQ ID NO: 46) нектина-4 человека (перекрывающаяся область фрагмента 1-150 и фрагмента 31-346).
ПРИМЕР 9: Диагностическое и прогностическое использование анализа IHC нектина-4
[00630] Экспрессия нектина-4 была впервые исследована в образцах нормальной ткани с помощью окрашивания IHC с антителом M22-321b41.1. Изменяющаяся, но в основном слабая или умеренная, экспрессия нектина-4 была обнаружена в коже (эпидермисе, потовых железах и волосяных фолликулах), переходном эпителии мочевого пузыря, слюнных железах (протоках), пищеводе, молочной железе и желудке. Для корреляции экспрессии нектина-4 с различными видами рака экспрессию нектина-4 затем исследовали в различных образцах опухолей, используя окрашивание IHC с антителом M22-321b41.1. Нектин-4 был высоко экспрессирован в клетках рака мочевого пузыря и более умеренно в микроматрицах тканей молочной железы, поджелудочной железы, легких и яичников (ТМА). Изучение корреляции между экспрессией нектина-4 и раком мочевого пузыря с использованием того же анализа IHC показало, что 83% (434 из 524) случаев рака мочевого пузыря на TMA были положительными, а 60% были сильно или умеренно окрашены IHC с M22-321b41.1.
[00631] Эффективность экспрессии нектина-4 в ткани пациента, определяемая по окрашиванию IHC с M22-321b41.1, для прогнозирования реакции пациента на противоопухолевую терапию (например, противоопухолевую терапию с использованием антитела против нектина-4, конъюгированного с цитотоксическим или цитостатическим средством), затем оценивали, например, путем проведения анализа ответа на противоопухолевую терапию у пациентов, которые удовлетворяют следующим критериям: (1) имеют истологически подтвержденные метастатические раковые солидные опухоли (исключая саркому), которые резистентны или рецидивируют; (2) имеют опухоли, позитивные по экспрессии нектина-4, и H-балл анализа IHC нектина-4 равен или превышает 150; (3) не получивших эффект ни в одной из предшествующих схем химиотерапии метастатического заболевания (пациенты с раком мочеиспускательного канала и мочевого пузыря могут иметь эффект в предшествующей схеме химиотерапии, если они считаются подходящими для проведения химиотерапии, основанной на цисплатине) (Galsky et al., Journal of Clinical Oncology, том 29, № 17, 2432-2438 (2011)); (4) имеют задокументированное прогрессирование заболевания, если самым последним системным лечением был исследуемый иммунотерапевтический препарат; (5) имеют статус Eastern Cooperative Oncology Group (ECOG) 0 или 1; (7) имеют измеряемое заболевание согласно RECIST (версия 1.1) (Eisenhauer, et. Al. European Journal of Cancer; 45(2): 228-247 (2009)). В общей сложности 184 образца клинических испытаний были исследованы на предмет экспрессии нектина-4, используя анализ IHC с антителом M22-321b41.1; из 184 исследованных образцов 180 (98%) образцов клинических испытаний имели Н-балл выше 0; и 171 (93%) имели умеренную или высокую экспрессию нектина-4 (H-балл был ≥150). Всего 44 клинических субъекта соответствовали критериям включения. Расположение опухоли и/или метастазов у этих 44 пациентов перечислено в таблице 22.
Таблица 22. Место нахождения первичных опухолей и метастазов
[00632] Этим 44 пациентам с умеренной или высокой экспрессией нектина-4 (H-балл был ≥150) вводили противоопухолевое терапевтическое средство, содержащее полностью человеческое антитело против нектина-4 (IgG1κ), конъюгированное с монометилауристатином-E, разрушающим микротрубочки. Все пациенты получали однократную 30-минутную инфузию ADC антитела против нектина-4 один раз в неделю в течение 3 недель каждого 4-недельного цикла (например, в дни 1, 8 и 15) до прогрессирования заболевания, возникновения непереносимости терапии, до решения исследователя или отзыва информированного согласия. Вводимыми дозами были 0,5 мг/кг, 0,75 мг/кг, 1 мг/кг и 1,25 мг/кг. Ответ пациента оценивали исследователем с помощью RECIST версии 1.1 один раз каждые 8 недель (±7 дней) (RECIST, как описано в Eisenhauer, et al. European Journal of Cancer; 45(2): 228-247 (2009)). Всего 36 пациентов показали результаты, которые можно было оценить.
[00633] ADC антитела против нектина-4 вызывал противоопухолевую активность у пациентов, которые получали лечение, у всех у них были опухоли, экспрессирующие нектин-4. Десять из 36 пациентов имели частичные ответы, 27,8% уровень ответа (при этом частичный или полный ответ считался ответом). ADC антитела против нектина-4 также вызывал противоопухолевую активность у 4 из 10 пациентов с метастазами в печени (частота ответа 40%) и у 3 из 12 пациентов, ранее получавших ингибиторы контрольной точки (уровень ответа 25%).
[00634] Следовательно, ADC антитела против нектина-4 вызывал противоопухолевую активность у пациентов c опухолями, экспрессирующими нектин-4.
ПРИМЕР 10: Диагностическое и прогностическое использование анализов IHC нектина-4 - отличающаяся когорта А
[00635] Эффективность экспрессии нектина-4 в ткани пациента, определяемая по окрашиванию IHC с M22-321b41.1, для прогнозирования реакции пациента на противоопухолевую терапию (например, противоопухолевую терапию с использованием антитела против нектина-4, конъюгированного с цитотоксическим или цитостатическим средством), затем оценивали, например, путем проведения анализа ответа на противоопухолевую терапию у пациентов другой когорты, которые удовлетворяют следующим критериям: (1) имеют гистологически подтвержденные метастатические раковые солидные опухоли, включая уротелиальный рак; (2) имеют опухоли, позитивные по экспрессии нектина-4, и H-балл анализа IHC нектина-4 равен или превышает 150; (3) не получивших эффект ни в одной из предшествующих схем химиотерапии метастатического заболевания и/или пациенты с уротелиальным раком которые не пригодны для проведения химиотерапии, основанной на цисплатине (Galsky et al., Journal of Clinical Oncology, том 29, № 17, 2432-2438 (2011)); (4) имеют задокументированное прогрессирование заболевания после проведения терапии ингибитором иммунной контрольной точки (CPI) сразу до исследования; (5) имеют статус Eastern Cooperative Oncology Group (ECOG) 0 или 1; (7) имеют измеряемое заболевание согласно RECIST (версия 1.1) (Eisenhauer, et. Al. European Journal of Cancer; 45(2): 228-247 (2009)). В общей сложности 295 образца клинических испытаний были исследованы на предмет экспрессии нектина-4, используя анализ IHC с антителом M22-321b41.1; из 295 исследованных образцов 278 (94%) образцов клинических испытаний имели Н-балл равный или выше 1; и 245 (83%) имели умеренную или высокую экспрессию нектина-4 (H-балл был ≥150). В целом, 58 клинических субъекта соответствовали критериям включения. Расположение опухоли и/или метастазов у этих 58 пациентов перечислено в таблице 23.
Таблица 23. Место нахождения первичных опухолей и метастазов
[00636] Этим 58 пациентам с умеренной или высокой экспрессией нектина-4 (H-балл был ≥150) вводили противоопухолевое терапевтическое средство, содержащее полностью человеческое антитело против нектина-4 (IgG1κ), конъюгированное с монометилауристатином-E, разрушающим микротрубочки. Все пациенты получали однократную 30-минутную инфузию ADC антитела против нектина-4 один раз в неделю в течение 3 недель каждого 4-недельного цикла (например, в дни 1, 8 и 15) до прогрессирования заболевания, возникновения непереносимости терапии, до решения исследователя или отзыва информированного согласия. Вводимыми дозами были 0,5 мг/кг, 0,75 мг/кг, 1 мг/кг и 1,25 мг/кг. Ответ пациента оценивали исследователем с помощью RECIST версии 1.1 один раз каждые 8 недель (± 7 дней) (RECIST, как описано в Eisenhauer, et al. European Journal of Cancer; 45(2): 228-247 (2009)). Всего 49 пациентов показали результаты, которые можно было оценить.
[00637] ADC антитела против нектина-4 вызывал противоопухолевую активность у пациентов, которые получали лечение, у всех у них были опухоли, экспрессирующие нектин-4. У одного пациента был полный ответ, и у 17 пациентов были частичные ответы, в результате чего общая частота ответа составила 36,7% (при этом частичный и полный ответ считался ответом). В группе, получавшей 1,25 мг/кг ADC антитела против нектина-4, был ответ у 10 из 17 пациентов, частота ответа составила 58,8%. ADC антитела против нектина-4 также вызывал противоопухолевую активность у 5 из 12 пациентов с метастазами в печени (частота ответа 41,7%), у 6 из 16 пациентов, ранее получавших ингибиторы контрольной точки (частота ответа 37,5%), и у 8 из 20 пациентов, ранее получавших таксаны (частота ответа 40%).
[00638] Следовательно, ADC антитела против нектина-4 вызывал противоопухолевую активность у пациентов c опухолями, экспрессирующими нектин-4.
ПРИМЕР 11: Терапевтическое применение ADC антитела против нектина-4.
[00639] Эффективность ADC антитела против нектина-4 по настоящему изобреетнию при лечении пациентов с различными видами рака оценивали, например, путем сравнения результатов лечения пациентов ADC антитела против нектина-4, включая человеческое или гуманизированное антитело M22-321b41.1, и контроль с пациентами, получавшими лечение изотипическим антителом-плацебо. Вкратце, пациентов рандомизировали и распределяли на контрольную группу или группу лечения. Пациенты в группе лечения получали ADC антитела против нектина-4 в диапазоне доз, которые определяли в соответствии с диапазоном мг (антител) на кг (массы тела) доз, оптимизированных на моделях на животных и/или в примере 9 и 10. Инъекцию проводили один или несколько раз за период времени. Результаты лечения пациентов периодически анализировали и сравнивали между группой лечения и группой плацебо.
[00640] Результат улучшался у пациентов, получавших ADC антитела против нектина-4, по сравнению с пациентами, получавшими плацебо. По сравнению с лечением плацебо, лечение ADC антителом против нектина-4 приводит к более высокой выживаемости через 6 месяцев, 1 год, 2 года, 3 года или 5 лет, увеличению продолжительности выживания, снижению уровня маркеров рака, снижению среднего или среднего размер опухоли и/или к более медленному прогрессированию рака.
ПРИМЕР 12: Дополнительное диагностическое и прогностическое применение анализов IHC нектина-4.
[00641] Эффективность экспрессии нектина-4 в ткани пациента, определяемая по окрашиванию IHC с M22-321b41.1, для прогнозирования реакции пациента на противоопухолевую терапию (например, противоопухолевую терапию с использованием антитела против нектина-4, конъюгированного с цитотоксическим или цитостатическим средством), оценивали, например, путем корреляции ответа пациентов на лечение рака с экспрессией нектина-4 в опухолевых тканях пациента, определенной по окрашиванию IHC специфическим антителом против нектина-4. Вкратце, у всех пациентов проводят один и тот же режим лечения рака, и уровни экспрессии нектина-4 в тканях пациентов, страдающих раком, определяют в анализах IHC с использованием антитела M22-321b41.1, как описано в настоящем документе. Пациенты разделяют на две, три, четыре или более групп в соответствии с экспрессией нектина-4 в их опухолевых тканях. Например, при разделении на четыре группы, в первую группу помещают пациентов с высокой экспрессией нектина-4 в опухолевых тканях, вторую группу - с умеренной экспрессией, третью группу - с низкой экспрессией и четвертую группу - с отсутствием экспрессии. Ответ на схему лечения рака, которая отражается на результате лечения пациента, таком как масса тела пациента, размер опухоли у пациентов, коэффициенте выживаемости у пациента, равном 6 месяцев, 1 год, 2 года, 3 года или 5 лет, или продолжительности выживаемости пациентов в каждой группе суммируются и коррелируют с экспрессией нектина-4 у пациентов в каждой группе. Корреляцию осуществляют с использованием среднего или медианного значения для каждой группы или проводят для каждого пациента в каждой группе.
[00642] Экспрессия нектина-4 в опухолевых тканях пациента указывает на то, как пациент отвечает на схему противоопухолевого лечения, например, противоопухолевое лечение с помощью антитела против нектина-4, конъюгированного с цитотоксическими или цитостатическими средствами (называемого ADC антитела против нектина-4). Пациенты с более высокой экспрессией нектина-4 в опухолевых тканях лучше отвечают на режим противоопухолевое лечение, имеют более высокую выживаемость, равную 6 месяцев, 1 год, 2 года, 3 года или 5 лет и/или живут дольше, чем пациенты с пониженной экспрессией нектина-4 в опухолевых тканях. Чем выше экспрессия нектина-4 в опухолевых тканях пациента, тем более эффективна противоопухолевая терапия, например терапия ADC антитела против нектина-4, для пациента.
--->
ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> ЭДЖЕНСИС, ИНК.
<120> БЕЛКИ, СВЯЗЫВАЮЩИЕ НЕКТИН-4, И СПОСОБЫ ИХ ПРИМЕНЕНИЯ
<130> 14369-208-228
<140> Будет присвоен
<141> здесь
<150> 62/515,454
<151> 2017-06-05
<160> 46
<170> PatentIn version 3.5
<210> 1
<211> 510
<212> Белок
<213> Homo sapiens
<220>
<223> Номер доступа в GenBank NP_112178
<400> 1
Met Pro Leu Ser Leu Gly Ala Glu Met Trp Gly Pro Glu Ala Trp Leu
1 5 10 15
Leu Leu Leu Leu Leu Leu Ala Ser Phe Thr Gly Arg Cys Pro Ala Gly
20 25 30
Glu Leu Glu Thr Ser Asp Val Val Thr Val Val Leu Gly Gln Asp Ala
35 40 45
Lys Leu Pro Cys Phe Tyr Arg Gly Asp Ser Gly Glu Gln Val Gly Gln
50 55 60
Val Ala Trp Ala Arg Val Asp Ala Gly Glu Gly Ala Gln Glu Leu Ala
65 70 75 80
Leu Leu His Ser Lys Tyr Gly Leu His Val Ser Pro Ala Tyr Glu Gly
85 90 95
Arg Val Glu Gln Pro Pro Pro Pro Arg Asn Pro Leu Asp Gly Ser Val
100 105 110
Leu Leu Arg Asn Ala Val Gln Ala Asp Glu Gly Glu Tyr Glu Cys Arg
115 120 125
Val Ser Thr Phe Pro Ala Gly Ser Phe Gln Ala Arg Leu Arg Leu Arg
130 135 140
Val Leu Val Pro Pro Leu Pro Ser Leu Asn Pro Gly Pro Ala Leu Glu
145 150 155 160
Glu Gly Gln Gly Leu Thr Leu Ala Ala Ser Cys Thr Ala Glu Gly Ser
165 170 175
Pro Ala Pro Ser Val Thr Trp Asp Thr Glu Val Lys Gly Thr Thr Ser
180 185 190
Ser Arg Ser Phe Lys His Ser Arg Ser Ala Ala Val Thr Ser Glu Phe
195 200 205
His Leu Val Pro Ser Arg Ser Met Asn Gly Gln Pro Leu Thr Cys Val
210 215 220
Val Ser His Pro Gly Leu Leu Gln Asp Gln Arg Ile Thr His Ile Leu
225 230 235 240
His Val Ser Phe Leu Ala Glu Ala Ser Val Arg Gly Leu Glu Asp Gln
245 250 255
Asn Leu Trp His Ile Gly Arg Glu Gly Ala Met Leu Lys Cys Leu Ser
260 265 270
Glu Gly Gln Pro Pro Pro Ser Tyr Asn Trp Thr Arg Leu Asp Gly Pro
275 280 285
Leu Pro Ser Gly Val Arg Val Asp Gly Asp Thr Leu Gly Phe Pro Pro
290 295 300
Leu Thr Thr Glu His Ser Gly Ile Tyr Val Cys His Val Ser Asn Glu
305 310 315 320
Phe Ser Ser Arg Asp Ser Gln Val Thr Val Asp Val Leu Asp Pro Gln
325 330 335
Glu Asp Ser Gly Lys Gln Val Asp Leu Val Ser Ala Ser Val Val Val
340 345 350
Val Gly Val Ile Ala Ala Leu Leu Phe Cys Leu Leu Val Val Val Val
355 360 365
Val Leu Met Ser Arg Tyr His Arg Arg Lys Ala Gln Gln Met Thr Gln
370 375 380
Lys Tyr Glu Glu Glu Leu Thr Leu Thr Arg Glu Asn Ser Ile Arg Arg
385 390 395 400
Leu His Ser His His Thr Asp Pro Arg Ser Gln Pro Glu Glu Ser Val
405 410 415
Gly Leu Arg Ala Glu Gly His Pro Asp Ser Leu Lys Asp Asn Ser Ser
420 425 430
Cys Ser Val Met Ser Glu Glu Pro Glu Gly Arg Ser Tyr Ser Thr Leu
435 440 445
Thr Thr Val Arg Glu Ile Glu Thr Gln Thr Glu Leu Leu Ser Pro Gly
450 455 460
Ser Gly Arg Ala Glu Glu Glu Glu Asp Gln Asp Glu Gly Ile Lys Gln
465 470 475 480
Ala Met Asn His Phe Val Gln Glu Asn Gly Thr Leu Arg Ala Lys Pro
485 490 495
Thr Gly Asn Gly Ile Tyr Ile Asn Gly Arg Gly His Leu Val
500 505 510
<210> 2
<211> 316
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид
<400> 2
Ala Gly Glu Leu Glu Thr Ser Asp Val Val Thr Val Val Leu Gly Gln
1 5 10 15
Asp Ala Lys Leu Pro Cys Phe Tyr Arg Gly Asp Ser Gly Glu Gln Val
20 25 30
Gly Gln Val Ala Trp Ala Arg Val Asp Ala Gly Glu Gly Ala Gln Glu
35 40 45
Leu Ala Leu Leu His Ser Lys Tyr Gly Leu His Val Ser Pro Ala Tyr
50 55 60
Glu Gly Arg Val Glu Gln Pro Pro Pro Pro Arg Asn Pro Leu Asp Gly
65 70 75 80
Ser Val Leu Leu Arg Asn Ala Val Gln Ala Asp Glu Gly Glu Tyr Glu
85 90 95
Cys Arg Val Ser Thr Phe Pro Ala Gly Ser Phe Gln Ala Arg Leu Arg
100 105 110
Leu Arg Val Leu Val Pro Pro Leu Pro Ser Leu Asn Pro Gly Pro Ala
115 120 125
Leu Glu Glu Gly Gln Gly Leu Thr Leu Ala Ala Ser Cys Thr Ala Glu
130 135 140
Gly Ser Pro Ala Pro Ser Val Thr Trp Asp Thr Glu Val Lys Gly Thr
145 150 155 160
Thr Ser Ser Arg Ser Phe Lys His Ser Arg Ser Ala Ala Val Thr Ser
165 170 175
Glu Phe His Leu Val Pro Ser Arg Ser Met Asn Gly Gln Pro Leu Thr
180 185 190
Cys Val Val Ser His Pro Gly Leu Leu Gln Asp Gln Arg Ile Thr His
195 200 205
Ile Leu His Val Ser Phe Leu Ala Glu Ala Ser Val Arg Gly Leu Glu
210 215 220
Asp Gln Asn Leu Trp His Ile Gly Arg Glu Gly Ala Met Leu Lys Cys
225 230 235 240
Leu Ser Glu Gly Gln Pro Pro Pro Ser Tyr Asn Trp Thr Arg Leu Asp
245 250 255
Gly Pro Leu Pro Ser Gly Val Arg Val Asp Gly Asp Thr Leu Gly Phe
260 265 270
Pro Pro Leu Thr Thr Glu His Ser Gly Ile Tyr Val Cys His Val Ser
275 280 285
Asn Glu Phe Ser Ser Arg Asp Ser Gln Val Thr Val Asp Val Leu Asp
290 295 300
Pro Gln Glu Asp Ser Gly Lys Gln Val Asp Leu Val
305 310 315
<210> 3
<211> 133
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид
<400> 3
Asp Ile Val Met Thr Gln Ala Ala Phe Ser Asn Pro Val Thr Leu Gly
1 5 10 15
Thr Ser Ala Ser Ile Ser Cys Arg Ser Ser Lys Ser Leu Leu His Ser
20 25 30
Asn Gly Ile Thr Tyr Leu Tyr Trp Tyr Leu Gln Lys Pro Gly Gln Ser
35 40 45
Pro Gln Leu Leu Ile Tyr His Met Ser Asn Leu Ala Ser Gly Val Pro
50 55 60
Asp Arg Phe Thr Ser Ser Gly Ser Gly Thr Asp Phe Thr Leu Arg Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Ala Gln Asn
85 90 95
Leu Glu Leu Pro Phe Thr Phe Gly Gly Gly Thr Lys Leu Glu Thr Lys
100 105 110
Arg Ala Asp Ala Ala Pro Thr Val Ser Ile Phe Pro Pro Ser Ser Glu
115 120 125
Gln Leu Thr Ser Gly
130
<210> 4
<211> 136
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид
<400> 4
Gln Val Gln Leu Gln Gln Ser Gly Ala Glu Leu Ala Arg Pro Gly Ala
1 5 10 15
Ser Val Lys Leu Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Thr Tyr
20 25 30
Trp Met Gln Trp Val Lys Gln Arg Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Ser Ile Tyr Pro Gly Asp Gly Asp Thr Arg Tyr Thr Gln Lys Phe
50 55 60
Lys Gly Lys Ala Thr Leu Thr Ala Asp Lys Ser Ser Ser Thr Ala Tyr
65 70 75 80
Ile Gln Leu Ser Thr Leu Ala Ser Glu Asp Ser Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Glu Tyr Tyr Gly Leu Asp Tyr Trp Gly Gln Gly Thr Thr Leu
100 105 110
Thr Val Ser Ser Ala Lys Thr Thr Ala Pro Ser Val Tyr Pro Leu Ala
115 120 125
Pro Val Cys Gly Asp Thr Thr Gly
130 135
<210> 5
<211> 219
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид
<400> 5
Asp Ile Val Met Thr Gln Ala Ala Phe Ser Asn Pro Val Thr Leu Gly
1 5 10 15
Thr Ser Ala Ser Ile Ser Cys Arg Ser Ser Lys Ser Leu Leu His Ser
20 25 30
Asn Gly Ile Thr Tyr Leu Tyr Trp Tyr Leu Gln Lys Pro Gly Gln Ser
35 40 45
Pro Gln Leu Leu Ile Tyr His Met Ser Asn Leu Ala Ser Gly Val Pro
50 55 60
Asp Arg Phe Thr Ser Ser Gly Ser Gly Thr Asp Phe Thr Leu Arg Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Ala Gln Asn
85 90 95
Leu Glu Leu Pro Phe Thr Phe Gly Gly Gly Thr Lys Leu Glu Thr Lys
100 105 110
Arg Ala Asp Ala Ala Pro Thr Val Ser Ile Phe Pro Pro Ser Ser Glu
115 120 125
Gln Leu Thr Ser Gly Gly Ala Ser Val Val Cys Phe Leu Asn Asn Phe
130 135 140
Tyr Pro Lys Asp Ile Asn Val Lys Trp Lys Ile Asp Gly Ser Glu Arg
145 150 155 160
Gln Asn Gly Val Leu Asn Ser Trp Thr Asp Gln Asp Ser Lys Asp Ser
165 170 175
Thr Tyr Ser Met Ser Ser Thr Leu Thr Leu Thr Lys Asp Glu Tyr Glu
180 185 190
Arg His Asn Ser Tyr Thr Cys Glu Ala Thr His Lys Thr Ser Thr Ser
195 200 205
Pro Ile Val Lys Thr Phe Asn Arg Asn Glu Cys
210 215
<210> 6
<211> 446
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид
<400> 6
Gln Val Gln Leu Gln Gln Ser Gly Ala Glu Leu Ala Arg Pro Gly Ala
1 5 10 15
Ser Val Lys Leu Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Thr Tyr
20 25 30
Trp Met Gln Trp Val Lys Gln Arg Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Ser Ile Tyr Pro Gly Asp Gly Asp Thr Arg Tyr Thr Gln Lys Phe
50 55 60
Lys Gly Lys Ala Thr Leu Thr Ala Asp Lys Ser Ser Ser Thr Ala Tyr
65 70 75 80
Ile Gln Leu Ser Thr Leu Ala Ser Glu Asp Ser Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Glu Tyr Tyr Gly Leu Asp Tyr Trp Gly Gln Gly Thr Thr Leu
100 105 110
Thr Val Ser Ser Ala Lys Thr Thr Ala Pro Ser Val Tyr Pro Leu Ala
115 120 125
Pro Val Cys Gly Asp Thr Thr Gly Ser Ser Val Thr Leu Gly Cys Leu
130 135 140
Val Lys Gly Tyr Phe Pro Glu Pro Val Thr Leu Thr Trp Asn Ser Gly
145 150 155 160
Ser Leu Ser Ser Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Asp
165 170 175
Leu Tyr Thr Leu Ser Ser Ser Val Thr Val Thr Ser Ser Thr Trp Pro
180 185 190
Ser Gln Ser Ile Thr Cys Asn Val Ala His Pro Ala Ser Ser Thr Lys
195 200 205
Val Asp Lys Lys Ile Glu Pro Arg Gly Pro Thr Ile Lys Pro Cys Pro
210 215 220
Pro Cys Lys Cys Pro Ala Pro Asn Leu Leu Gly Gly Pro Ser Val Phe
225 230 235 240
Ile Phe Pro Pro Lys Ile Lys Asp Val Leu Met Ile Ser Leu Ser Pro
245 250 255
Ile Val Thr Cys Val Val Val Asp Val Ser Glu Asp Asp Pro Asp Val
260 265 270
Gln Ile Ser Trp Phe Val Asn Asn Val Glu Val His Thr Ala Gln Thr
275 280 285
Gln Thr His Arg Glu Asp Tyr Asn Ser Thr Leu Arg Val Val Ser Ala
290 295 300
Leu Pro Ile Gln His Gln Asp Trp Met Ser Gly Lys Glu Phe Lys Cys
305 310 315 320
Lys Val Asn Asn Lys Asp Leu Pro Ala Pro Ile Glu Arg Thr Ile Ser
325 330 335
Lys Pro Lys Gly Ser Val Arg Ala Pro Gln Val Tyr Val Leu Pro Pro
340 345 350
Pro Glu Glu Glu Met Thr Lys Lys Gln Val Thr Leu Thr Cys Met Val
355 360 365
Thr Asp Phe Met Pro Glu Asp Ile Tyr Val Glu Trp Thr Asn Asn Gly
370 375 380
Lys Thr Glu Leu Asn Tyr Lys Asn Thr Glu Pro Val Leu Asp Ser Asp
385 390 395 400
Gly Ser Tyr Phe Met Tyr Ser Lys Leu Arg Val Glu Lys Lys Asn Trp
405 410 415
Val Glu Arg Asn Ser Tyr Ser Cys Ser Val Val His Glu Gly Leu His
420 425 430
Asn His His Thr Thr Lys Ser Phe Ser Arg Thr Pro Gly Lys
435 440 445
<210> 7
<211> 16
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид
<400> 7
Arg Ser Ser Lys Ser Leu Leu His Ser Asn Gly Ile Thr Tyr Leu Tyr
1 5 10 15
<210> 8
<211> 7
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид
<400> 8
Ile Thr Tyr Leu Tyr Trp Tyr
1 5
<210> 9
<211> 11
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид
<400> 9
Leu Leu Ile Tyr His Met Ser Asn Leu Ala Ser
1 5 10
<210> 10
<211> 7
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид
<400> 10
His Met Ser Asn Leu Ala Ser
1 5
<210> 11
<211> 10
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид
<400> 11
Leu Leu Ile Tyr His Met Ser Asn Leu Ala
1 5 10
<210> 12
<211> 9
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид
<400> 12
Ala Gln Asn Leu Glu Leu Pro Phe Thr
1 5
<210> 13
<211> 8
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид
<400> 13
Ala Gln Asn Leu Glu Leu Pro Phe
1 5
<210> 14
<211> 10
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид
<400> 14
Gly Tyr Thr Phe Thr Thr Tyr Trp Met Gln
1 5 10
<210> 15
<211> 5
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид
<400> 15
Thr Tyr Trp Met Gln
1 5
<210> 16
<211> 7
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид
<400> 16
Gly Tyr Thr Phe Thr Thr Tyr
1 5
<210> 17
<211> 6
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид
<400> 17
Thr Thr Tyr Trp Met Gln
1 5
<210> 18
<211> 20
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид
<400> 18
Trp Ile Gly Ser Ile Tyr Pro Gly Asp Gly Asp Thr Arg Tyr Thr Gln
1 5 10 15
Lys Phe Lys Gly
20
<210> 19
<211> 17
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид
<400> 19
Ser Ile Tyr Pro Gly Asp Gly Asp Thr Arg Tyr Thr Gln Lys Phe Lys
1 5 10 15
Gly
<210> 20
<211> 6
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид
<400> 20
Tyr Pro Gly Asp Gly Asp
1 5
<210> 21
<211> 13
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид
<400> 21
Trp Ile Gly Ser Ile Tyr Pro Gly Asp Gly Asp Thr Arg
1 5 10
<210> 22
<211> 9
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид
<400> 22
Ala Arg Glu Tyr Tyr Gly Leu Asp Tyr
1 5
<210> 23
<211> 7
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид
<400> 23
Glu Tyr Tyr Gly Leu Asp Tyr
1 5
<210> 24
<211> 8
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид
<400> 24
Ala Arg Glu Tyr Tyr Gly Leu Asp
1 5
<210> 25
<211> 23
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид
<400> 25
Asp Ile Val Met Thr Gln Ala Ala Phe Ser Asn Pro Val Thr Leu Gly
1 5 10 15
Thr Ser Ala Ser Ile Ser Cys
20
<210> 26
<211> 15
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид
<400> 26
Trp Tyr Leu Gln Lys Pro Gly Gln Ser Pro Gln Leu Leu Ile Tyr
1 5 10 15
<210> 27
<211> 32
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид
<400> 27
Gly Val Pro Asp Arg Phe Thr Ser Ser Gly Ser Gly Thr Asp Phe Thr
1 5 10 15
Leu Arg Ile Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys
20 25 30
<210> 28
<211> 11
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид
<400> 28
Phe Gly Gly Gly Thr Lys Leu Glu Thr Lys Arg
1 5 10
<210> 29
<211> 30
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид
<400> 29
Gln Val Gln Leu Gln Gln Ser Gly Ala Glu Leu Ala Arg Pro Gly Ala
1 5 10 15
Ser Val Lys Leu Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr
20 25 30
<210> 30
<211> 14
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид
<400> 30
Trp Val Lys Gln Arg Pro Gly Gln Gly Leu Glu Trp Ile Gly
1 5 10
<210> 31
<211> 32
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид
<400> 31
Lys Ala Thr Leu Thr Ala Asp Lys Ser Ser Ser Thr Ala Tyr Ile Gln
1 5 10 15
Leu Ser Thr Leu Ala Ser Glu Asp Ser Ala Val Tyr Tyr Cys Ala Arg
20 25 30
<210> 32
<211> 11
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид
<400> 32
Trp Gly Gln Gly Thr Thr Leu Thr Val Ser Ser
1 5 10
<210> 33
<211> 86
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид
<400> 33
Gly Ala Ser Val Val Cys Phe Leu Asn Asn Phe Tyr Pro Lys Asp Ile
1 5 10 15
Asn Val Lys Trp Lys Ile Asp Gly Ser Glu Arg Gln Asn Gly Val Leu
20 25 30
Asn Ser Trp Thr Asp Gln Asp Ser Lys Asp Ser Thr Tyr Ser Met Ser
35 40 45
Ser Thr Leu Thr Leu Thr Lys Asp Glu Tyr Glu Arg His Asn Ser Tyr
50 55 60
Thr Cys Glu Ala Thr His Lys Thr Ser Thr Ser Pro Ile Val Lys Thr
65 70 75 80
Phe Asn Arg Asn Glu Cys
85
<210> 34
<211> 310
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид
<400> 34
Ser Ser Val Thr Leu Gly Cys Leu Val Lys Gly Tyr Phe Pro Glu Pro
1 5 10 15
Val Thr Leu Thr Trp Asn Ser Gly Ser Leu Ser Ser Gly Val His Thr
20 25 30
Phe Pro Ala Val Leu Gln Ser Asp Leu Tyr Thr Leu Ser Ser Ser Val
35 40 45
Thr Val Thr Ser Ser Thr Trp Pro Ser Gln Ser Ile Thr Cys Asn Val
50 55 60
Ala His Pro Ala Ser Ser Thr Lys Val Asp Lys Lys Ile Glu Pro Arg
65 70 75 80
Gly Pro Thr Ile Lys Pro Cys Pro Pro Cys Lys Cys Pro Ala Pro Asn
85 90 95
Leu Leu Gly Gly Pro Ser Val Phe Ile Phe Pro Pro Lys Ile Lys Asp
100 105 110
Val Leu Met Ile Ser Leu Ser Pro Ile Val Thr Cys Val Val Val Asp
115 120 125
Val Ser Glu Asp Asp Pro Asp Val Gln Ile Ser Trp Phe Val Asn Asn
130 135 140
Val Glu Val His Thr Ala Gln Thr Gln Thr His Arg Glu Asp Tyr Asn
145 150 155 160
Ser Thr Leu Arg Val Val Ser Ala Leu Pro Ile Gln His Gln Asp Trp
165 170 175
Met Ser Gly Lys Glu Phe Lys Cys Lys Val Asn Asn Lys Asp Leu Pro
180 185 190
Ala Pro Ile Glu Arg Thr Ile Ser Lys Pro Lys Gly Ser Val Arg Ala
195 200 205
Pro Gln Val Tyr Val Leu Pro Pro Pro Glu Glu Glu Met Thr Lys Lys
210 215 220
Gln Val Thr Leu Thr Cys Met Val Thr Asp Phe Met Pro Glu Asp Ile
225 230 235 240
Tyr Val Glu Trp Thr Asn Asn Gly Lys Thr Glu Leu Asn Tyr Lys Asn
245 250 255
Thr Glu Pro Val Leu Asp Ser Asp Gly Ser Tyr Phe Met Tyr Ser Lys
260 265 270
Leu Arg Val Glu Lys Lys Asn Trp Val Glu Arg Asn Ser Tyr Ser Cys
275 280 285
Ser Val Val His Glu Gly Leu His Asn His His Thr Thr Lys Ser Phe
290 295 300
Ser Arg Thr Pro Gly Lys
305 310
<210> 35
<211> 232
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид
<400> 35
Pro Arg Gly Pro Thr Ile Lys Pro Cys Pro Pro Cys Lys Cys Pro Ala
1 5 10 15
Pro Asn Leu Leu Gly Gly Pro Ser Val Phe Ile Phe Pro Pro Lys Ile
20 25 30
Lys Asp Val Leu Met Ile Ser Leu Ser Pro Ile Val Thr Cys Val Val
35 40 45
Val Asp Val Ser Glu Asp Asp Pro Asp Val Gln Ile Ser Trp Phe Val
50 55 60
Asn Asn Val Glu Val His Thr Ala Gln Thr Gln Thr His Arg Glu Asp
65 70 75 80
Tyr Asn Ser Thr Leu Arg Val Val Ser Ala Leu Pro Ile Gln His Gln
85 90 95
Asp Trp Met Ser Gly Lys Glu Phe Lys Cys Lys Val Asn Asn Lys Asp
100 105 110
Leu Pro Ala Pro Ile Glu Arg Thr Ile Ser Lys Pro Lys Gly Ser Val
115 120 125
Arg Ala Pro Gln Val Tyr Val Leu Pro Pro Pro Glu Glu Glu Met Thr
130 135 140
Lys Lys Gln Val Thr Leu Thr Cys Met Val Thr Asp Phe Met Pro Glu
145 150 155 160
Asp Ile Tyr Val Glu Trp Thr Asn Asn Gly Lys Thr Glu Leu Asn Tyr
165 170 175
Lys Asn Thr Glu Pro Val Leu Asp Ser Asp Gly Ser Tyr Phe Met Tyr
180 185 190
Ser Lys Leu Arg Val Glu Lys Lys Asn Trp Val Glu Arg Asn Ser Tyr
195 200 205
Ser Cys Ser Val Val His Glu Gly Leu His Asn His His Thr Thr Lys
210 215 220
Ser Phe Ser Arg Thr Pro Gly Lys
225 230
<210> 36
<211> 1533
<212> ДНК
<213> Homo sapiens
<220>
<223> Номер доступа в GenBank NM_030916
<400> 36
atgcccctgt ccctgggagc cgagatgtgg gggcctgagg cctggctgct gctgctgcta
60
ctgctggcat catttacagg ccggtgcccc gcgggtgagc tggagacctc agacgtggta
120
actgtggtgc tgggccagga cgcaaaactg ccctgcttct accgagggga ctccggcgag
180
caagtggggc aagtggcatg ggctcgggtg gacgcgggcg aaggcgccca ggaactagcg
240
ctactgcact ccaaatacgg gcttcatgtg agcccggctt acgagggccg cgtggagcag
300
ccgccgcccc cacgcaaccc cctggacggc tcagtgctcc tgcgcaacgc agtgcaggcg
360
gatgagggcg agtacgagtg ccgggtcagc accttccccg ccggcagctt ccaggcgcgg
420
ctgcggctcc gagtgctggt gcctcccctg ccctcactga atcctggtcc agcactagaa
480
gagggccagg gcctgaccct ggcagcctcc tgcacagctg agggcagccc agcccccagc
540
gtgacctggg acacggaggt caaaggcaca acgtccagcc gttccttcaa gcactcccgc
600
tctgctgccg tcacctcaga gttccacttg gtgcctagcc gcagcatgaa tgggcagcca
660
ctgacttgtg tggtgtccca tcctggcctg ctccaggacc aaaggatcac ccacatcctc
720
cacgtgtcct tccttgctga ggcctctgtg aggggccttg aagaccaaaa tctgtggcac
780
attggcagag aaggagctat gctcaagtgc ctgagtgaag ggcagccccc tccctcatac
840
aactggacac ggctggatgg gcctctgccc agtggggtac gagtggatgg ggacactttg
900
ggctttcccc cactgaccac tgagcacagc ggcatctacg tctgccatgt cagcaatgag
960
ttctcctcaa gggattctca ggtcactgtg gatgttcttg acccccagga agactctggg
1020
aagcaggtgg acctagtgtc agcctcggtg gtggtggtgg gtgtgatcgc cgcactcttg
1080
ttctgccttc tggtggtggt ggtggtgctc atgtcccgat accatcggcg caaggcccag
1140
cagatgaccc agaaatatga ggaggagctg accctgacca gggagaactc catccggagg
1200
ctgcattccc atcacacgga ccccaggagc cagccggagg agagtgtagg gctgagagcc
1260
gagggccacc ctgatagtct caaggacaac agtagctgct ctgtgatgag tgaagagccc
1320
gagggccgca gttactccac gctgaccacg gtgagggaga tagaaacaca gactgaactg
1380
ctgtctccag gctctgggcg ggccgaggag gaggaagatc aggatgaagg catcaaacag
1440
gccatgaacc attttgttca ggagaatggg accctacggg ccaagcccac gggcaatggc
1500
atctacatca atgggcgggg acacctggtc tga
1533
<210> 37
<211> 399
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетический полинуклеотид
<400> 37
gatattgtga tgacgcaggc tgcattctcc aatccagtca ctcttggaac atcagcttcc
60
atctcctgca ggtctagtaa gagtctccta catagtaatg gcatcactta tttgtattgg
120
tatctgcaga agccaggcca gtctcctcag ctcctgattt atcatatgtc caaccttgcc
180
tcaggagtcc cagacaggtt cactagcagt gggtcaggaa ctgatttcac actgagaatc
240
agcagagtgg aggctgagga tgtgggtgtt tattactgcg ctcaaaatct agaacttccg
300
ttcacgttcg gaggggggac caagctggaa acaaaacggg ctgatgctgc accaactgta
360
tccatcttcc caccatccag tgagcagtta acatctgga
399
<210> 38
<211> 408
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетический полинуклеотид
<400> 38
caggttcagc tccagcagtc tggggctgag ctggcaagac ctggggcttc agtgaaattg
60
tcctgcaagg cttctggcta tacctttact acctactgga tgcagtgggt aaaacagagg
120
cctggacagg gtctggaatg gattgggtct atttatcctg gagatggtga tactaggtac
180
actcagaagt tcaagggcaa ggccacattg actgcagata aatcctccag cacagcctac
240
attcaactca gcaccttggc atctgaggac tctgcggtct attactgtgc aagagaatac
300
tacggtcttg actactgggg ccaaggcacc actctcacag tctcctcagc caaaacaaca
360
gccccatcgg tctatccact ggcccctgtg tgtggagata caactggc
408
<210> 39
<211> 657
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетический полинуклеотид
<400> 39
gatattgtga tgacgcaggc tgcattctcc aatccagtca ctcttggaac atcagcttcc
60
atctcctgca ggtctagtaa gagtctccta catagtaatg gcatcactta tttgtattgg
120
tatctgcaga agccaggcca gtctcctcag ctcctgattt atcatatgtc caaccttgcc
180
tcaggagtcc cagacaggtt cactagcagt gggtcaggaa ctgatttcac actgagaatc
240
agcagagtgg aggctgagga tgtgggtgtt tattactgcg ctcaaaatct agaacttccg
300
ttcacgttcg gaggggggac caagctggaa acaaaacggg ctgatgctgc accaactgta
360
tccatcttcc caccatccag tgagcagtta acatctggag gtgcctcagt cgtgtgcttc
420
ttgaacaact tctaccccaa agacatcaat gtcaagtgga agattgatgg cagtgaacga
480
caaaatggcg tcctgaacag ttggactgat caggacagca aagacagcac ctacagcatg
540
agcagcaccc tcacgttgac caaggacgag tatgaacgac ataacagcta tacctgtgag
600
gccactcaca agacatcaac ttcacccatt gtcaagacct tcaacaggaa tgagtgt
657
<210> 40
<211> 1338
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетический полинуклеотид
<400> 40
caggttcagc tccagcagtc tggggctgag ctggcaagac ctggggcttc agtgaaattg
60
tcctgcaagg cttctggcta tacctttact acctactgga tgcagtgggt aaaacagagg
120
cctggacagg gtctggaatg gattgggtct atttatcctg gagatggtga tactaggtac
180
actcagaagt tcaagggcaa ggccacattg actgcagata aatcctccag cacagcctac
240
attcaactca gcaccttggc atctgaggac tctgcggtct attactgtgc aagagaatac
300
tacggtcttg actactgggg ccaaggcacc actctcacag tctcctcagc caaaacaaca
360
gccccatcgg tctatccact ggcccctgtg tgtggagata caactggctc ctcggtgact
420
ctaggatgcc tggtcaaggg ttatttccct gagccagtga ccttgacctg gaactctgga
480
tccctgtcca gtggtgtgca caccttccca gctgtcctgc agtctgacct ctacaccctc
540
agcagctcag tgactgtaac ctcgagcacc tggcccagcc agtccatcac ctgcaatgtg
600
gcccacccgg caagcagcac caaggtggac aagaaaattg agcccagagg gcccacaatc
660
aagccctgtc ctccatgcaa atgcccagca cctaacctct tgggtggacc atccgtcttc
720
atcttccctc caaagatcaa ggatgtactc atgatctccc tgagccccat agtcacatgt
780
gtggtggtgg atgtgagcga ggatgaccca gatgtccaga tcagctggtt tgtgaacaac
840
gtggaagtac acacagctca gacacaaacc catagagagg attacaacag tactctccgg
900
gtggtcagtg ccctccccat ccagcaccag gactggatga gtggcaagga gttcaaatgc
960
aaggtcaaca acaaagacct cccagcgccc atcgagagaa ccatctcaaa acccaaaggg
1020
tcagtaagag ctccacaggt atatgtcttg cctccaccag aagaagagat gactaagaaa
1080
caggtcactc tgacctgcat ggtcacagac ttcatgcctg aagacattta cgtggagtgg
1140
accaacaacg ggaaaacaga gctaaactac aagaacactg aaccagtcct ggactctgat
1200
ggttcttact tcatgtacag caagctgaga gtggaaaaga agaactgggt ggaaagaaat
1260
agctactcct gttcagtggt ccacgagggt ctgcacaatc accacacgac taagagcttc
1320
tcccggactc cgggtaaa
1338
<210> 41
<211> 25
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетический полинуклеотид
<400> 41
ggctggagtt caatgaggtt tattt
25
<210> 42
<211> 25
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетический полинуклеотид
<400> 42
tccagcagat ttcagactaa gaaga
25
<210> 43
<211> 24
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетический полинуклеотид
<400> 43
agaacatcat ccctgcctct actg
24
<210> 44
<211> 24
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетический полинуклеотид
<400> 44
aaatgagctt gacaaagtgg tcgt
24
<210> 45
<211> 150
<212> Белок
<213> Homo sapiens
<400> 45
Met Pro Leu Ser Leu Gly Ala Glu Met Trp Gly Pro Glu Ala Trp Leu
1 5 10 15
Leu Leu Leu Leu Leu Leu Ala Ser Phe Thr Gly Arg Cys Pro Ala Gly
20 25 30
Glu Leu Glu Thr Ser Asp Val Val Thr Val Val Leu Gly Gln Asp Ala
35 40 45
Lys Leu Pro Cys Phe Tyr Arg Gly Asp Ser Gly Glu Gln Val Gly Gln
50 55 60
Val Ala Trp Ala Arg Val Asp Ala Gly Glu Gly Ala Gln Glu Leu Ala
65 70 75 80
Leu Leu His Ser Lys Tyr Gly Leu His Val Ser Pro Ala Tyr Glu Gly
85 90 95
Arg Val Glu Gln Pro Pro Pro Pro Arg Asn Pro Leu Asp Gly Ser Val
100 105 110
Leu Leu Arg Asn Ala Val Gln Ala Asp Glu Gly Glu Tyr Glu Cys Arg
115 120 125
Val Ser Thr Phe Pro Ala Gly Ser Phe Gln Ala Arg Leu Arg Leu Arg
130 135 140
Val Leu Val Pro Pro Leu
145 150
<210> 46
<211> 120
<212> Белок
<213> Homo sapiens
<400> 46
Ala Gly Glu Leu Glu Thr Ser Asp Val Val Thr Val Val Leu Gly Gln
1 5 10 15
Asp Ala Lys Leu Pro Cys Phe Tyr Arg Gly Asp Ser Gly Glu Gln Val
20 25 30
Gly Gln Val Ala Trp Ala Arg Val Asp Ala Gly Glu Gly Ala Gln Glu
35 40 45
Leu Ala Leu Leu His Ser Lys Tyr Gly Leu His Val Ser Pro Ala Tyr
50 55 60
Glu Gly Arg Val Glu Gln Pro Pro Pro Pro Arg Asn Pro Leu Asp Gly
65 70 75 80
Ser Val Leu Leu Arg Asn Ala Val Gln Ala Asp Glu Gly Glu Tyr Glu
85 90 95
Cys Arg Val Ser Thr Phe Pro Ala Gly Ser Phe Gln Ala Arg Leu Arg
100 105 110
Leu Arg Val Leu Val Pro Pro Leu
115 120
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| Анти-LAG-3 антитела | 2016 |
|
RU2760582C2 |
| АНТИТЕЛА ДЛЯ ЛЕЧЕНИЯ ИНФЕКЦИИ ГЕПАТИТОМ В И СВЯЗАННЫХ С НЕЙ ЗАБОЛЕВАНИЙ | 2018 |
|
RU2765878C2 |
| АНТИТЕЛА, СПЕЦИФИЧНЫЕ К НЕКТИНУ-4 ЧЕЛОВЕКА | 2019 |
|
RU2825839C2 |
| АНТИТЕЛА К ПОВЕРХНОСТНЫМ ДЕТЕРМИНАНТАМ S. AUREUS | 2013 |
|
RU2698131C2 |
| АНТИТЕЛА К ПОВЕРХНОСТНЫМ ДЕТЕРМИНАНТАМ S. AUREUS | 2013 |
|
RU2808018C2 |
| Выделенное антитело к CD45RC человека, нуклеиновая кислота, вектор экспрессии, клетка, фармацевтическая композиция, их применение, in vitro способ обнаружения hCD45RC | 2019 |
|
RU2826421C2 |
| АНТИТЕЛА К C10ORF54 И ИХ ПРИМЕНЕНИЯ | 2015 |
|
RU2714232C2 |
| АНТИТЕЛА К C10ORF54 И ИХ ПРИМЕНЕНИЯ | 2015 |
|
RU2819627C1 |
| Связывающие белки и способы их применения | 2015 |
|
RU2701434C2 |
| БИБЛИОТЕКИ СИНТЕТИЧЕСКИХ ПОЛИПЕПТИДОВ И СПОСОБЫ ПОЛУЧЕНИЯ ВАРИАНТОВ ПОЛИПЕПТИДОВ С ЕСТЕСТВЕННЫМ РАЗНООБРАЗИЕМ | 2010 |
|
RU2562163C2 |
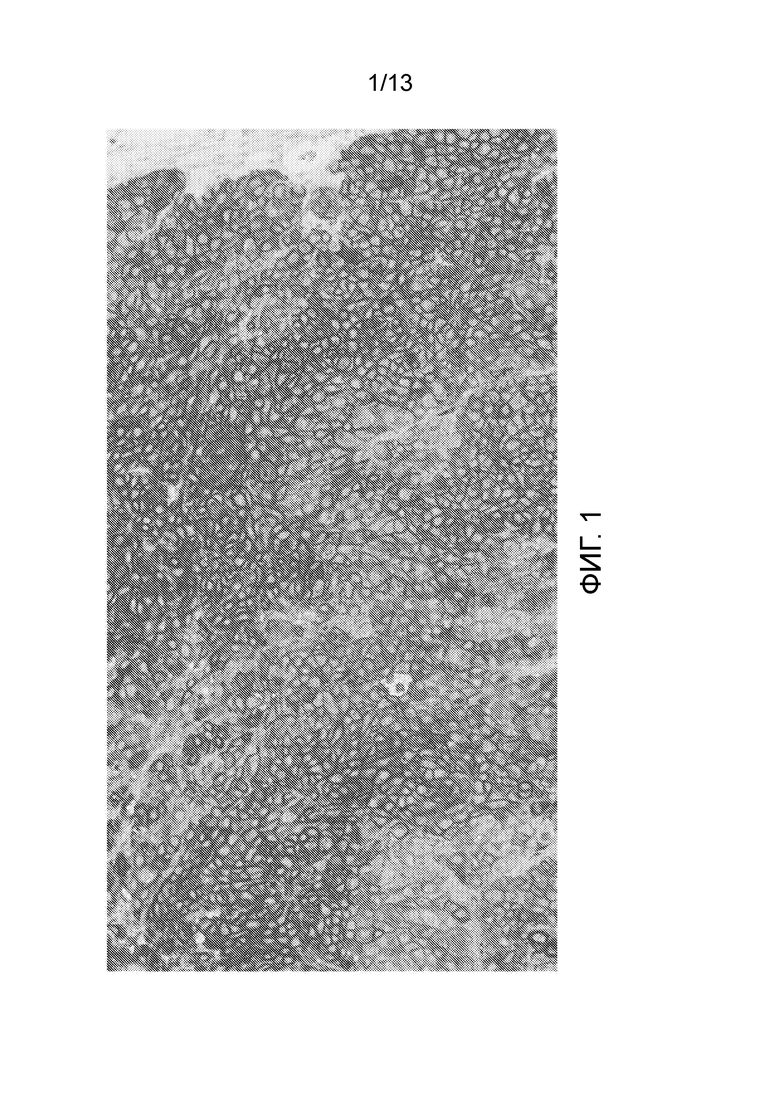
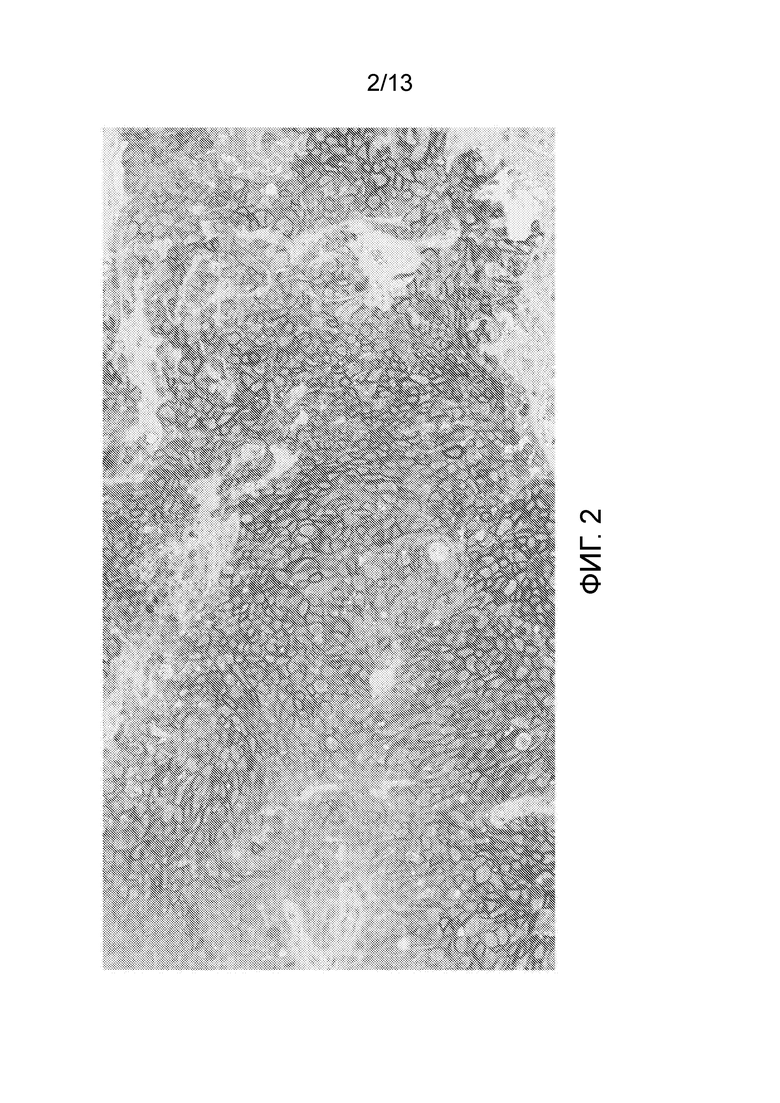

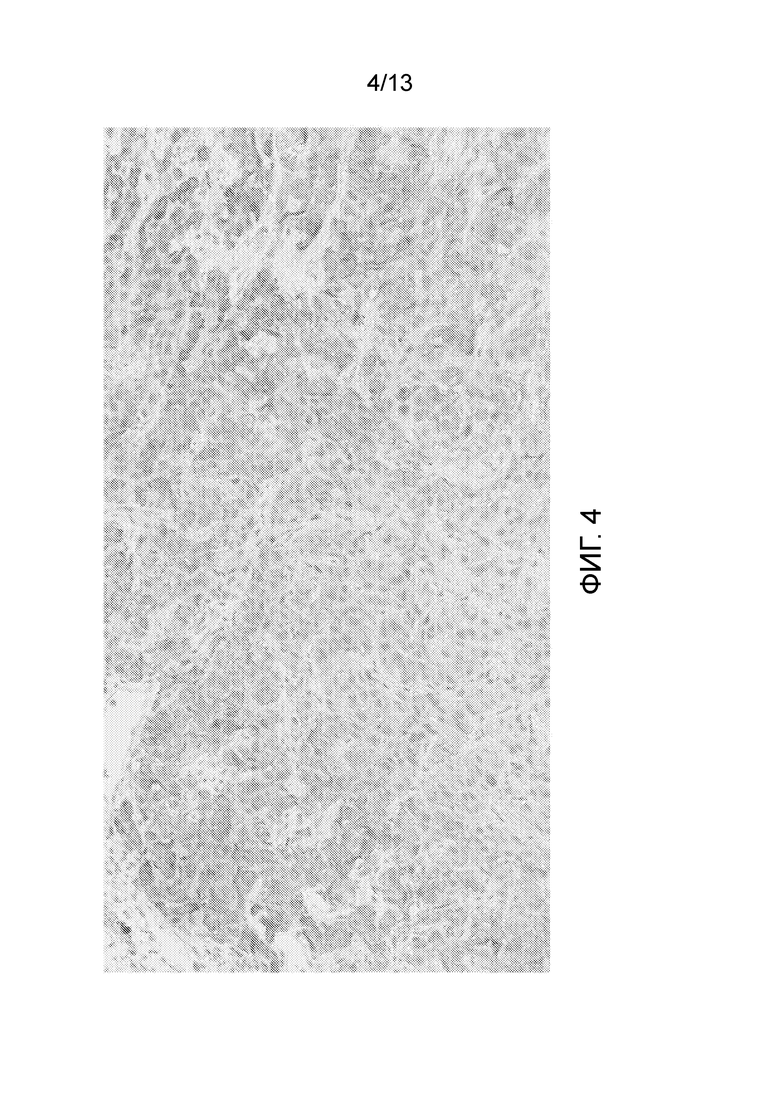



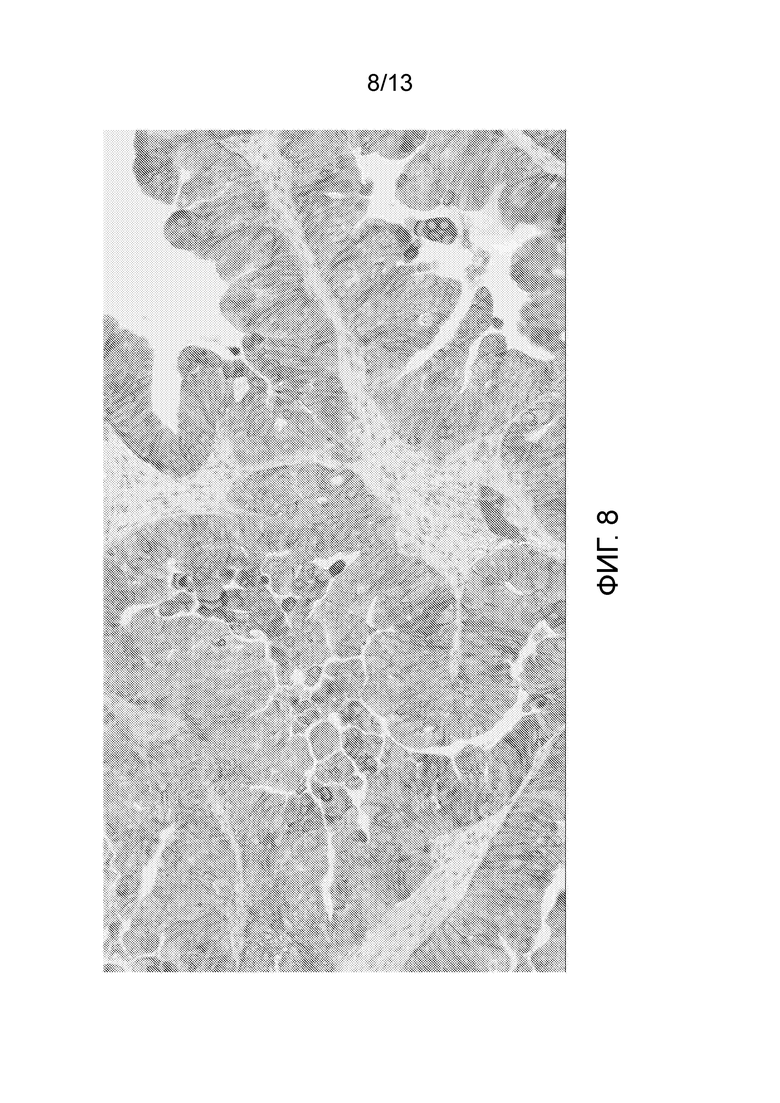
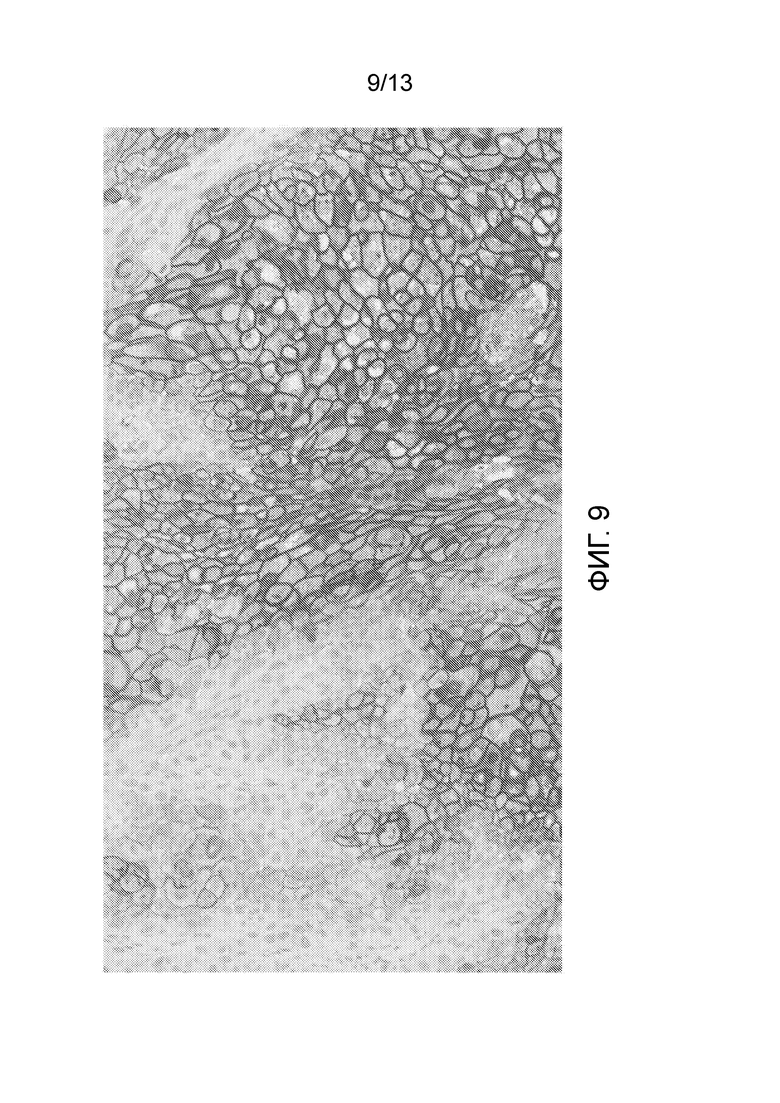
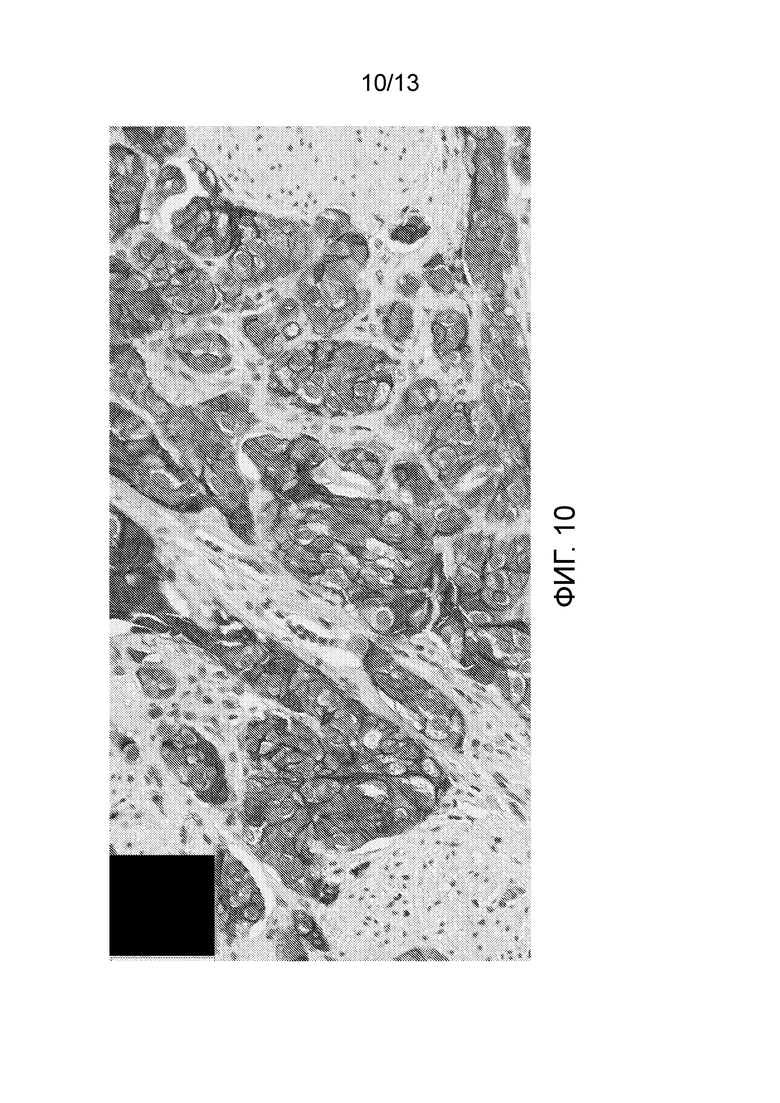

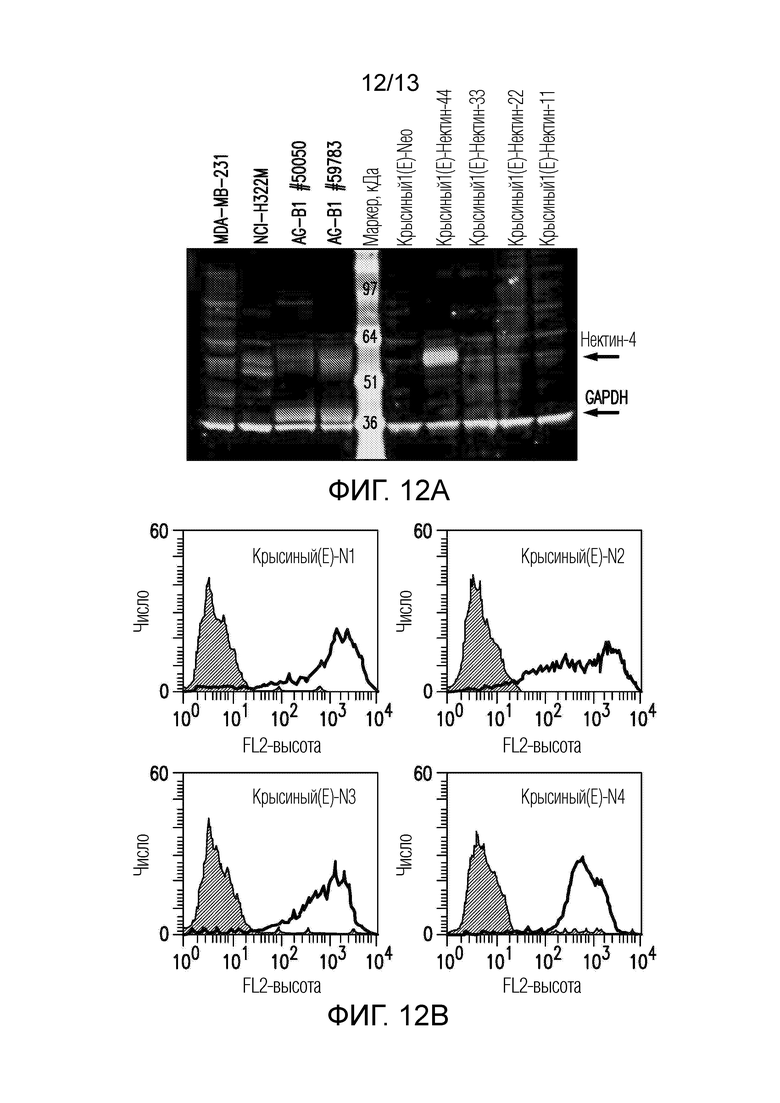
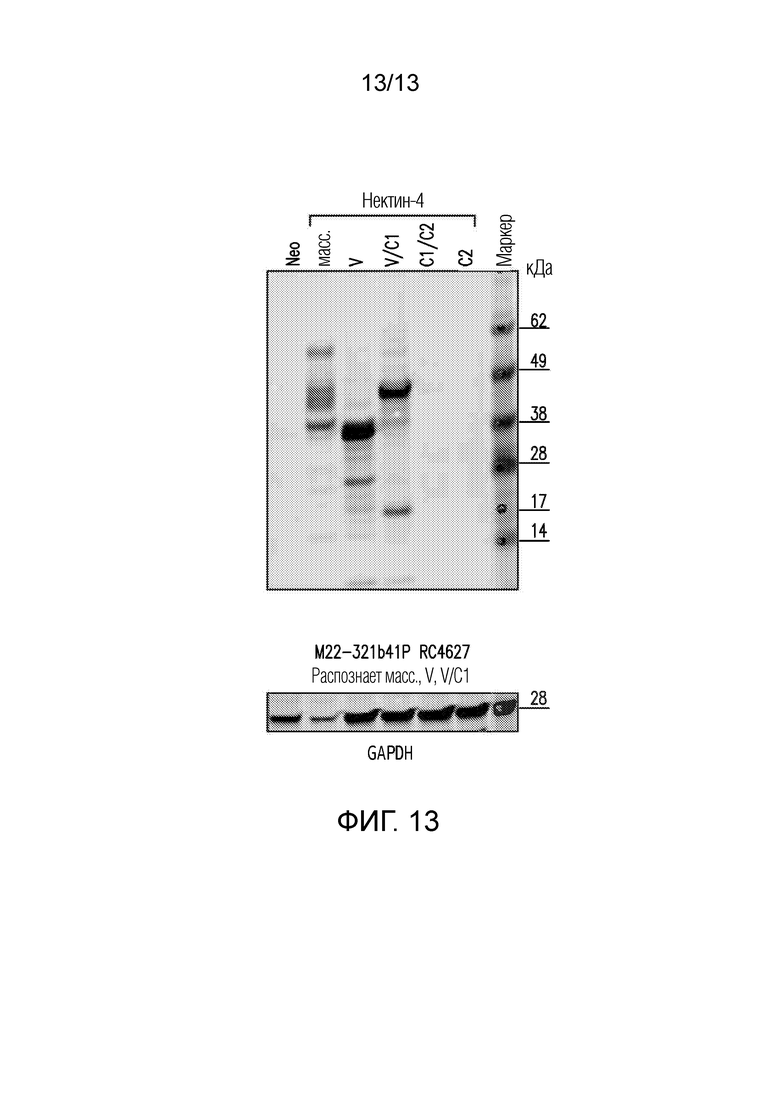
Изобретение относится к области биохимии, в частности к антителу или его антигенсвязывающему фрагменту, которые связываются с нектином-4 человека. Также раскрыты полинуклеотид, кодирующий указанное антитело; вектор и клетка, содержащие указанный полинуклеотид; набор, содержащий, указанное антитело. Раскрыты способ получения указанного антитела; способ определения экспрессии нектина-4 с помощью указанного антитела; способ оценки восприимчивости индивида со злокачественным заболеванием к противоопухолевому терапевтическому средству с помощью указанного антитела. Изобретение позволяет эффективно оценивать восприимчивость индивида со злокачественным заболеванием к противоопухолевому терапевтическому средству. 15 н. и 15 з.п. ф-лы, 12 пр., 23 табл., 13 ил.
1. Антитело или его антигенсвязывающий фрагмент, которые связываются с нектином-4 человека, содержащие
(а) вариабельную область легкой цепи (VL), содержащую:
(1) CDR1 VL с аминокислотной последовательностью SEQ ID NO: 7 или SEQ ID NO: 8;
(2) CDR2 VL с аминокислотной последовательностью SEQ ID NO: 9, SEQ ID NO: 10 или SEQ ID NO: 11; и
(3) CDR3 VL с аминокислотной последовательностью SEQ ID NO: 12 или SEQ ID NO: 13;
и
(b) вариабельную область тяжелой цепи (VH), содержащую:
(1) CDR1 VH с аминокислотной последовательностью SEQ ID NO: 14, SEQ ID NO: 15, SEQ ID NO: 16 или SEQ ID NO: 17;
(2) CDR2 VH с аминокислотной последовательностью SEQ ID NO: 18, SEQ ID NO: 19, SEQ ID NO: 20 или SEQ ID NO: 21; и
(3) CDR3 VH с аминокислотной последовательностью SEQ ID NO: 22, SEQ ID NO: 23 или SEQ ID NO: 24.
2. Антитело или его антигенсвязывающий фрагмент по п.1, где:
(a) VL содержит
каркас 1 VL (FR1), содержащий аминокислотную последовательность SEQ ID NO: 25,
FR2 VL, содержащий аминокислотную последовательность SEQ ID NO: 26,
FR3 VL, содержащий аминокислотную последовательность SEQ ID NO: 27, и
FR4 VL, содержащий аминокислотную последовательность SEQ ID NO: 28; и/или
(b) VH содержит
каркас 1 VH (FR1), содержащий аминокислотную последовательность SEQ ID NO: 29,
FR2 VH, содержащий аминокислотную последовательность SEQ ID NO: 30,
FR3 VH, содержащий аминокислотную последовательность SEQ ID NO: 31, и
FR4 VH, содержащий аминокислотную последовательность SEQ ID NO: 32.
3. Антитело или его антигенсвязывающий фрагмент по п.1 или 2, где
CDR1 VL, CDR2 VL и CDR3 VL содержат аминокислотные последовательности SEQ ID NO: 7, 10 и 12 соответственно и
CDR1 VH, CDR2 VH и CDR3 VH содержат аминокислотные последовательности SEQ ID NO: 15, 19 и 23 соответственно.
4. Антитело или его антигенсвязывающий фрагмент по любому из пп.1-3, где
VL содержит аминокислотную последовательность SEQ ID NO: 3 и/или
VН содержит аминокислотную последовательность SEQ ID NO: 4.
5. Антитело или его антигенсвязывающий фрагмент по любому из пп.1-4, где антитело или его антигенсвязывающий фрагмент содержат:
а) Fc-фрагмент IgG2 мыши, Fc-фрагмент IgG1 человека или его мутированный вариант;
b) Fc-фрагмент тяжелой цепи, содержащий аминокислотную последовательность SEQ ID NO: 35, и/или
константный участок легкой цепи, содержащий аминокислотную последовательность SEQ ID NO: 33; и/или
c) легкую цепь, содержащую аминокислотную последовательность SEQ ID NO: 5, и/или
тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 6.
6. Антитело или его антигенсвязывающий фрагмент по любому из пп.1-5, где нектин-4 человека экспрессируется клеткой и антитело или его антигенсвязывающий фрагмент связываются с клеткой.
7. Антитело или его антигенсвязывающий фрагмент по п.6, где клетка представляет собой злокачественную клетку ткани.
8. Антитело или его антигенсвязывающий фрагмент по п.7, где антитело или его антигенсвязывающий фрагмент связываются с указанной злокачественной клеткой на более высоком уровне по сравнению со связыванием их с контрольной клеткой.
9. Антитело или его антигенсвязывающий фрагмент по п.8, где контрольная клетка представляет собой незлокачественную клетку той же ткани.
10. Антитело или антигенсвязывающий фрагмент по п.7, где указанная ткань включает ткань мочевого пузыря, мочеточника, молочной железы, легкого, толстой кишки, прямой кишки, яичника, фаллопиевой трубы, пищевода, шейки матки, эндометрия матки, кожи, гортани, костного мозга, слюнной железы, почки, предстательной железы, мозга, спинного мозга, плаценты, надпочечника, поджелудочной железы, околощитовидной железы, гипофиза, яичка, щитовидной железы, селезенки, миндалины, тимуса, сердца, желудка, тонкой кишки, печени, скелетных мышц, периферического нерва, мезотелия или глаза.
11. Антитело или его антигенсвязывающий фрагмент по любому из пп.1-10, где
i) антитело представляет собой
а) моноклональное антитело и/или
b) гуманизированное антитело, антитело человека или химерное антитело; и/или
ii) антигенсвязывающий фрагмент представляет собой Fab, Fab', F(ab')2, вариабельный фрагмент (Fv), одноцепочечный вариабельный фрагмент (scFv) или вариабельный фрагмент с дисульфидной связью (dsFv).
12. Полинуклеотид для кодирования полипептида, содержащий нуклеотидную последовательность, кодирующую VH антитела или его антигенсвязывающего фрагмента по любому из пп.1-11.
13. Полинуклеотид для кодирования полипептида, содержащий нуклеотидную последовательность, кодирующую VL антитела или его антигенсвязывающего фрагмента по любому из пп.1-11.
14. Полинуклеотид для кодирования полипептида, содержащий первую нуклеотидную последовательность, кодирующую VH, и вторую нуклеотидную последовательность, кодирующую VL антитела или его антигенсвязывающего фрагмента по любому из пп.1-11.
15. Полинуклеотид для кодирования полипептида, содержащий нуклеотидную последовательность, кодирующую тяжелую цепь антитела или его антигенсвязывающий фрагмент по любому из пп.1-11.
16. Полинуклеотид для кодирования полипептида, содержащий нуклеотидную последовательность, кодирующую легкую цепь антитела или его антигенсвязывающий фрагмент по любому из пп.1-11.
17. Полинуклеотид для кодирования полипептида, содержащий первую нуклеотидную последовательность, кодирующую тяжелую цепь, и вторую нуклеотидную последовательность, кодирующую легкую цепь антитела или его антигенсвязывающего фрагмента по любому из пп.1-11.
18. Вектор для введения нуклеиновой кислоты в клетку-хозяин, содержащий полинуклеотид по любому из пп.12-17.
19. Клетка для экспрессии полинуклеотида, содержащая полинуклеотид по любому из пп.12-17 или вектор по п.18.
20. Способ получения антитела или его антигенсвязывающего фрагмента по любому из пп.1-11, включающий культивирование клетки, содержащей полинуклеотид, содержащий
а) нуклеотидную последовательность, кодирующую VH антитела или его антигенсвязывающий фрагмент по любому из пп.1-11, и
b) нуклеотидную последовательность, кодирующую VL антитела или его антигенсвязывающий фрагмент по любому из пп.1-11,
для экспрессии антитела или его антигенсвязывающего фрагмента.
21. Набор для прогнозирования восприимчивости больного злокачественным новообразованием на противоопухолевую терапию, содержащий антитело или его антигенсвязывающий фрагмент по пп.1-11 и этикетку или вкладыш.
22. Набор по п.16, где больной злокачественным новообразованием прогнозируется как восприимчивый к противоопухолевой терапии, если раковая клетка этого пациента является положительной на экспрессию нектина-4 и/или если уровень экспрессии нектина-4 в образце ткани выше, чем контрольный уровень экспрессии нектина-4.
23. Способ определения экспрессии нектина-4 в образце ткани индивида, у которого подозревают наличие злокачественного новообразования, включающий:
(а) приведение образца ткани в контакт с антителом или его антигенсвязывающим фрагментом по любому из пп.1-11;
(b) обнаружение связывания антитела или его антигенсвязывающего фрагмента с этим образцом ткани; и
(c) определение экспрессии нектина-4 в образце ткани.
24. Способ определения экспрессии нектина-4 в образце ткани индивида, у которого подозревают наличие злокачественного новообразования, включающий:
(а) проведение иммуногистохимического (IHC) анализа образца ткани с антителом или его антигенсвязывающим фрагментом по любому из пп.1-11; и
(b) определение экспрессии нектина-4 в образце ткани.
25. Способ оценки восприимчивости индивида со злокачественным заболеванием к противоопухолевому терапевтическому средству, включающий:
(а) приведение образца ткани индивида со злокачественным заболеванием в контакт с антителом или его антигенсвязывающим фрагментом по любому из пп.1-11;
(b) обнаружение связывания антитела или его антигенсвязывающего фрагмента с образцом ткани;
(c) определение уровня экспрессии нектина-4 в образце ткани; и
(d) сравнение уровня экспрессии нектина-4 в образце ткани, определенного на стадии (с), с контрольным уровнем экспрессии нектина-4, где повышенный уровень экспрессии нетина-4, определенный на стадии (с) по сравнению контролем указывает на восприимчивость индивида к противоопухолевой терапии.
26. Способ оценки восприимчивости индивида со злокачественным заболеванием к противоопухолевому терапевтическому средству, включающий:
(а) проведение иммуногистохимического анализа (IHC) образца ткани индивида со злокачественной опухолью с антителом или его антигенсвязывающим фрагментом по любому из пп.1-11;
(b) определение уровня экспрессии нектина-4 в образце ткани; и
(c) сравнение уровня экспрессии нектина-1 в образце ткани, измеренного на стадии (b), c контрольным уровнем экспрессии нектина-4, где повышенный уровень экспрессии нетина-4 в образце ткани по сравнению с контролем указывает на восприимчивость к указанной противоопухолевой терапии.
27. Способ по п.25 или 26, где противоопухолевое терапевтическое средство содержит антитело против нектина-4 или конъюгат антитело-лекарственное средство, содержащий антитело против нектина-4.
28. Способ по любому из пп.23-27, где злокачественное новообразование выбрано из группы, состоящей из рака эндометрия, уротелиального рака, рака мочевого пузыря, рака мочеточника, рака мочеиспускательного канала, рака легкого, рак яичников, рака молочной железы, рака пищевода, рака поджелудочной железы, рака головы и шеи, рака предстательной железы, рака полового члена, рака анального канала, рака вульвы, рака первичного мочевого протока (урахуса) и видов рака эпителиального происхождения, при которых экспрессируется нектин-4.
29. Способ по любому из пп.25-28, где контрольный уровень экспрессии нектина-4 представляет собой уровень экспрессии нектина-4 в незлокачественных клетках индивида или в незлокачественных клетках другого индивида.
30. Способ по любому из пп.23-29, где индивидом является человек.
| WO 2011079257 A3, 18.08.2011 | |||
| WO 2012028622 A3, 05.07.2012 | |||
| ГУМАНИЗИРОВАННОЕ АНТИ-ЭПИРЕГУЛИН-АНТИТЕЛО И ПРОТИВОРАКОВЫЙ ТЕРАПЕВТИЧЕСКИЙ АГЕНТ, СОДЕРЖАЩИЙ УКАЗАННОЕ АНТИТЕЛО, В КАЧЕСТВЕ АКТИВНОГО ИНГРЕДИЕНТА | 2012 |
|
RU2634383C2 |
Авторы
Даты
2023-10-13—Публикация
2018-06-04—Подача