ОБЛАСТЬ ТЕХНИКИ
Настоящее изобретение относится к инъекционным фармацевтическим композициям, содержащим урсодезоксихолевую кислоту (UDCA) и сульфобутиловый эфир-β-циклодекстрина, а также к способу их получения и применения, например, для лечения расстройств и заболеваний, которые терапевтически чувствительны к урсодезоксихолевой кислоте.
УРОВЕНЬ ТЕХНИКИ
Урсодезоксихолевая кислота - это препарат, который широко используется в терапии в качестве литолитика (растворение и профилактика желчных камней), а также при лечении различных патологических состояний печени, таких как печеночный холестаз, первичный билиарный цирроз. Также сообщалось о применении урсодезоксихолевой кислоты для лечения неалкогольного стеатогепатита (NASH). Кроме того, было обнаружено, что урсодезоксихолевая кислота также особенно полезна при лечении патологических состояний печени у пациентов, для которых пероральное введение невозможно или затруднено. Урсодезоксихолевая кислота продается в США под торговым названием Actigall® (капсулы для перорального приема по 300 мг) для лечения путем растворения камней в желчном пузыре и профилактики образования камней в желчном пузыре, и назначается в дозе 8-10 мг/кг/сут в виде 2 или 3 дробных доз и 600 мг/сут (2 дробные дозы) соответственно. Кроме того, урсодезоксихолевая кислота продается под торговым названием Urso® (таблетки для перорального приема по 250 мг и 500 мг) компанией Allergan, а рекомендуемая доза для лечения первичного билиарного цирроза составляет 13-15 мг/кг/сут, вводимая в виде двух - четырех дробных доз с пищей.
В настоящее время на рынке недоступны инъекционные фармацевтические составы на основе урсодезоксихолевой кислоты, поскольку их получение представляет проблемы вследствие физико-химических свойств урсодезоксихолевой кислоты и введения ее высоких доз.
Урсодезоксихолевая кислота - слабая кислота, практически нерастворимая в воде; ее растворимость значительно возрастает в присутствии сильных оснований, таких как гидроксид натрия и гидроксид калия. Однако водные растворы, состоящие исключительно из урсодезоксихолевой кислоты и сильного основания, не подходят для внутривенного введения, поскольку даже небольшое изменение количества сильного основания в препарате приводит к последующему изменению рН инъекционного раствора, что часто несовместимо с внутривенным введением.
Кроме того, урсодезоксихолевая кислота является поверхностно-активным соединением, которое вызывает пенообразование при добавлении к водному раствору для внутривенной перфузии.
Для разработки стабильного хорошо забуференного раствора для внутривенного введения, подходящего для внутривенного введения, авторы патента США №5955456 разработали инъекционные составы на основе урсодезоксихолевой кислоты, содержащие сильное основание, совместимое с внутривенным введением, и трометамол. Далее в US '456 раскрыто предпочтительное использование гидроксида натрия или калия в качестве сильных оснований, при этом такие основания используются в стехиометрически эквивалентном количестве по отношению к используемой кислоте (урсодезоксихолевая кислота), и более предпочтительно приблизительно 1% масс/об. гидроксида натрия. В US '456 используется большое количество сильного основания в равном стехиометрическом соотношении с урсодезоксихолевой кислотой, недостатки которого заключаются в том, что оно не подходит для внутривенного введения, поскольку приводит к изменению рН.
В патенте ЕР №ЕР1147779 В1 раскрыт способ преобразования урсодезоксихолевой кислоты в растворимую форму, и, в частности, пример 4 описывает инъекционные составы на основе урсодезоксихолевой кислоты и β-циклодекстрина, растворенных в воде в соотношении 1:2, для приготовления 2 мг/мл внутривенного раствора урсодезоксихолевой кислоты. Инъекционный раствор для внутривенного введения с β-циклодекстрином, содержащий 2 мг/мл урсодезоксихолевой кислоты, требует большого объема жидкости для внутривенного введения (приблизительно 300 мл для профилактики образования камней в желчном пузыре).
Для преодоления вышеуказанных недостатков существует потребность в разработке инъекционной фармацевтической композиции для внутривенного введения со значительно уменьшенным объемом (более высокая безопасность для пациентов, детей, пациентов с ограничением приема жидкости и т.д.), содержащей урсодезоксихолевую кислоту, стабильной при внутривенном введении, не вызывающей изменений уровня рН.
РАСКРЫТИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к композиции на основе урсодезоксихолевой кислоты, пригодной для внутривенного введения, которая стабильна в условиях окружающей среды и/или в условиях охлаждения, характеризуется значительно уменьшенным объемом для внутривенного введения и может обеспечить полностью растворенную урсодезоксихолевую кислоту без необходимости использования больших количеств сильных оснований. Как описано в настоящем документе, композиции, подходящие для парентерального введения, включают урсодезоксихолевую кислоту и производное циклодекстрина, выбранное из группы, состоящей из гидроксипропил-β-циклодекстрина и сульфобутилового эфира-β-циклодекстрина.
Настоящее изобретение направлено на инъекционную фармацевтическую композицию, содержащую урсодезоксихолевую кислоту, производное циклодекстрина, выбранное из группы, состоящей из гидроксипропил-β-циклодекстрина и сульфобутилового эфира-β-циклодекстрина, и, опционально, буфер.
Настоящее изобретение также направлено на инъекционную фармацевтическую композицию, содержащую от приблизительно 10 мг/мл до приблизительно 50 мг/мл урсодезоксихолевой кислоты, от приблизительно 100 мг/мл до приблизительно 300 мг/мл производного циклодекстрина, выбранного из группы, состоящей из гидроксипропил-β-циклодекстрина и сульфобутилового эфира-β-циклодекстрина, и, опционально, буфер.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Настоящее изобретение обеспечивает инъекционную фармацевтическую композицию, содержащую урсодезоксихолевую кислоту и производное циклодекстрина, выбранное из группы, состоящей из гидроксипропил-β-циклодекстрина и сульфобутилового эфира-β-циклодекстрина. Наиболее предпочтительно производное циклодекстрина, используемое в настоящем изобретении, представляет собой сульфобутиловый эфир-β-циклодекстрина.
В предпочтительном варианте осуществления настоящее изобретение обеспечивает инъекционную фармацевтическую композицию, содержащую (а) урсодезоксихолевую кислоту и (b) сульфобутиловый эфир-β-циклодекстрина.
В дополнительном варианте осуществления настоящее изобретение обеспечивает инъекционную фармацевтическую композицию, содержащую (а) урсодезоксихолевую кислоту и (b) сульфобутиловый эфир-β-циклодекстрина, при этом такая композиция не содержит больших количеств сильных оснований (предпочтительно гидроксид натрия и гидроксид калия), присутствующих в количестве, стехиометрически эквивалентном урсодезоксихолевой кислоте.
В одном варианте осуществления настоящее изобретение обеспечивает внутривенную фармацевтическую композицию, содержащую урсодезоксихолевую кислоту, производное циклодекстрина, выбранное из группы, состоящей из гидроксипропил-β-циклодекстрина и сульфобутилового эфира-β-циклодекстрина, и, опционально, буфер.
В другом варианте осуществления настоящее изобретение обеспечивает стабильную инъекционную фармацевтическую композицию, содержащую урсодезоксихолевую кислоту, производное циклодекстрина, выбранное из группы, состоящей из гидроксипропил-β-циклодекстрина и сульфобутилового эфира-β-циклодекстрина, и, опционально, буфер.
В другом варианте осуществления настоящее изобретение обеспечивает инъекционную фармацевтическую композицию, содержащую от приблизительно 10 мг/мл до приблизительно 50 мг/мл урсодезоксихолевой кислоты, более предпочтительно от приблизительно 15 мг/мл до приблизительно 40 мг/мл урсодезоксихолевой кислоты и наиболее предпочтительно приблизительно 25 мг/мл урсодезоксихолевой кислоты.
В дополнительном варианте осуществления настоящее изобретение обеспечивает инъекционную фармацевтическую композицию, содержащую от приблизительно 100 мг/мл до приблизительно 300 мг/мл сульфобутилового эфира-β-циклодекстрина, более предпочтительно от приблизительно 150 мг/мл до приблизительно 250 мг/мл сульфобутилового эфира-β-циклодекстрина.
В другом варианте осуществления настоящее изобретение обеспечивает инъекционную фармацевтическую композицию, содержащую (а) от приблизительно 10 мг/мл до приблизительно 50 мг/мл урсодезоксихолевой кислоты и (b) от приблизительно 150 мг/мл до приблизительно 250 мг/мл сульфобутилового эфира-β-циклодекстрина.
В еще одном дополнительном варианте осуществления настоящее изобретение обеспечивает инъекционную фармацевтическую композицию, содержащую (а) от приблизительно 10 мг/мл до приблизительно 50 мг/мл урсодезоксихолевой кислоты и (b) от приблизительно 150 мг/мл до приблизительно 250 мг/мл сульфобутилового эфира-β-циклодекстрина, при этом такая композиция не содержит больших количеств сильных оснований (предпочтительно гидроксид натрия и гидроксид калия), присутствующих в количестве, стехиометрически эквивалентном урсодезоксихолевой кислоте.
В вариантах осуществления изобретения настоящее изобретение обеспечивает инъекционную фармацевтическую композицию, содержащую (а) от приблизительно 10 мг/мл до приблизительно 50 мг/мл урсодезоксихолевой кислоты, (b) от приблизительно 150 мг/мл до приблизительно 250 мг/мл производного циклодекстрина, выбранного из группы, состоящей из гидроксипропил-β-циклодекстрина и сульфобутилового эфира-β-циклодекстрина, и, опционально, буфер.
В дополнительных вариантах осуществления изобретения настоящее изобретение обеспечивает стабильную инъекционную фармацевтическую композицию, состоящую по существу из (а) от приблизительно 10 мг/мл до приблизительно 50 мг/мл урсодезоксихолевой кислоты, (b) от приблизительно 100 мг/мл до приблизительно 300 мг/мл производного циклодекстрина, выбранного из группы, состоящей из гидроксипропил-β-циклодекстрина и сульфобутилового эфира-β-циклодекстрина, и, опционально, буфера.
В еще одном дополнительном варианте осуществления изобретения настоящее изобретение обеспечивает стабильную инъекционную фармацевтическую композицию, состоящую по существу из приблизительно 25 мг/мл урсодезоксихолевой кислоты и от приблизительно 150 мг/мл до приблизительно 250 мг/мл производного циклодекстрина, выбранного из группы, состоящей из гидроксипропил-β-циклодекстрина и сульфобутилового эфира-β-циклодекстрина.
В другом варианте осуществления изобретения настоящее изобретение обеспечивает стабильную инъекционную фармацевтическую композицию, состоящую по существу из приблизительно 25 мг/мл урсодезоксихолевой кислоты и от приблизительно 150 мг/мл до приблизительно 250 мг/мл производного циклодекстрина, выбранного из группы, состоящей из гидроксипропил-β-циклодекстрина и сульфобутилового эфира-β-циклодекстрина, используемую для лечения различных патологических состояний печени, таких как печеночный холестаз, первичный билиарный цирроз и неалкогольный стеатогепатит (NASH).
В другом варианте осуществления изобретения настоящее изобретение обеспечивает стабильную инъекционную фармацевтическую композицию, содержащую урсодезоксихолевую кислоту, производное циклодекстрина, выбранное из группы, состоящей из гидроксипропил-β-циклодекстрина и сульфобутилового эфира-β-циклодекстрина, опционально, агент для регулирования уровня рН, и воду.
Настоящие инъекционные фармацевтические композиции опционально дополнительно содержат агенты для регулирования уровня рН. Агенты для регулирования уровня рН, используемые в настоящем изобретении, выбраны из группы, состоящей из гидроксида натрия и соляной кислоты. Уровень рН инъекционной композиции в соответствии с настоящим изобретением составляет от приблизительно 2,0 до приблизительно 8,0. Уровень рН инъекционной композиции, предпочтительно используемой в настоящем изобретении, составляет от приблизительно 2,0 до приблизительно 4,0.
В еще одном дополнительном варианте осуществления настоящее изобретение обеспечивает инъекционную фармацевтическую композицию, содержащую урсодезоксихолевую кислоту, производное циклодекстрина, выбранное из группы, состоящей из гидроксипропил-β-циклодекстрина и сульфобутилового эфира-β-циклодекстрина, опционально, агент для регулирования уровня рН и воду, при этом уровень рН композиции составляет от приблизительно 2,0 до приблизительно 8,0.
В другом варианте осуществления настоящее изобретение обеспечивает инъекционную фармацевтическую композицию, содержащую (а) урсодезоксихолевую кислоту, (b) сульфобутиловый эфир-β-циклодекстрина, (с) воду и (d) опционально, агент для регулирования уровня рН.
В дополнительном варианте осуществления настоящее изобретение обеспечивает инъекционную фармацевтическую композицию, содержащую (а) от приблизительно 10 мг/мл до приблизительно 50 мг/мл урсодезоксихолевой кислоты, (b) от приблизительно 150 мг/мл до приблизительно 250 мг/мл сульфобутилового эфира-β-циклодекстрина, (с) воду и (d) опционально, агент для регулирования уровня рН.
В другом варианте осуществления настоящее изобретение обеспечивает инъекционную фармацевтическую композицию, состоящую из (а) от приблизительно 10 мг/мл до приблизительно 50 мг/мл урсодезоксихолевой кислоты, (b) от приблизительно 150 мг/мл до приблизительно 250 мг/мл сульфобутилового эфира-β-циклодекстрина, (с) воды, при этом уровень рН композиции составляет от приблизительно 2,0 до приблизительно 4,0.
Осмоляльность композиции можно определить методом понижения температуры замерзания, но также можно использовать любой другой подходящий метод. В соответствии с одним вариантом осуществления осмоляльность композиции в соответствии с настоящим изобретением находится в диапазоне от приблизительно 180 мОсм/кг до приблизительно 900 мОсм/кг, предпочтительно от приблизительно 600 мОсм/кг до приблизительно 800 мОсм/кг.
Настоящее изобретение дополнительно обеспечивает инъекционную фармацевтическую композицию, состоящую из (а) от приблизительно 10 мг/мл до приблизительно 50 мг/мл урсодезоксихолевой кислоты, (b) от приблизительно 150 мг/мл до приблизительно 250 мг/мл сульфобутилового эфира-β-циклодекстрина, (с) воды, при этом уровень рН композиции составляет от приблизительно 2,0 до приблизительно 4,0, и при этом осмоляльность композиции составляет от приблизительно 600 мОсм/кг до приблизительно 800 мОсм/кг.
Согласно другому из аспектов настоящее изобретение относится к применению урсодезоксихолевой кислоты для приготовления инъекционных составов, подходящих для лечения патологических состояний печени, таких как холестаз печени, первичный билиарный цирроз и неалкогольный стеатогепатит (NASH).
В вариантах осуществления изобретения изобретение относится к инъекционному составу на основе урсодезоксихолевой кислоты для внутривенного введения, в частности, путем медленной перфузии. В дополнительных вариантах осуществления изобретения инъекционный состав на основе урсодезоксихолевой кислоты разбавляют в растворе для внутривенной перфузии с целью введения путем медленной перфузии. Особенно предпочтительным раствором для внутривенной перфузии является обычный изотонический раствор (содержащий 0,9% хлорида натрия).
Продолжительность лечения, включающего медленную внутривенную перфузию урсодезоксихолевой кислоты, вводимой предпочтительно в виде состава, составляющего предмет изобретения, варьируется в зависимости от подлежащих лечению патологических состояний. Обычно указанная продолжительность варьируется от 1 до 30 суток, преимущественно от 3 до 10 суток и предпочтительно от 5 до 7 суток. При необходимости можно провести несколько циклов лечения.
Обычно суточная доза урсодезоксихолевой кислоты, вводимая согласно настоящему изобретению, составляет от 2 до 30 мг/кг массы тела, преимущественно от 4 до 20 мг/кг и предпочтительно от 8 до 15 мг/кг. Для взрослого человека нормальной конституции суточная доза составляет от 500 до 2000 мг.
Таким образом, стандартные дозы могут содержать от 100 до 2000 мг урсодезоксихолевой кислоты. Согласно одному предпочтительному аспекту стандартные дозы содержат 250 мг, 500 мг или 625 мг урсодезоксихолевой кислоты в объемах 10 мл, 20 мл и 25 мл соответственно.
Следующие примеры приведены для иллюстрации настоящего изобретения. Однако следует понимать, что изобретение не ограничено конкретными условиями или деталями, описанными в приведенном ниже примере. Пример не следует рассматривать как ограничивающий изобретение, поскольку примеры лишь обеспечивают конкретную методологию, полезную для понимания и практического применения изобретения и его различных аспектов. Хотя некоторые предпочтительные и альтернативные варианты осуществления изобретения были изложены в целях раскрытия изобретения, модификации раскрытых вариантов осуществления могут прийти на ум специалистам в данной области техники.
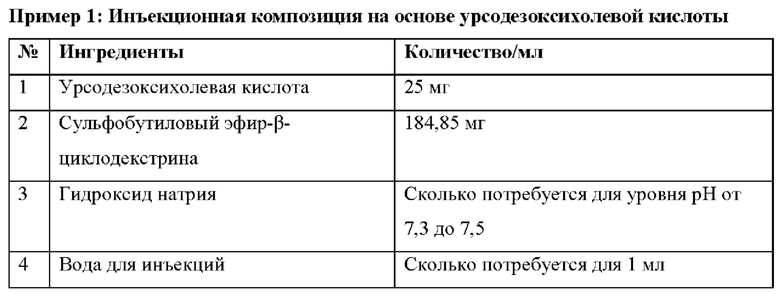
Процесс приготовления:
Сульфобутиловый эфир-β-циклодекстрина растворяют в необходимом количестве воды для инъекций, затем растворяют урсодезоксихолевую кислоту и доводят уровень рН с помощью гидроксида натрия до 7,3-7,5 с получением конечного раствора, который фильтруют и стерилизуют посредством асептической фильтрации и/или путем автоклавирования.
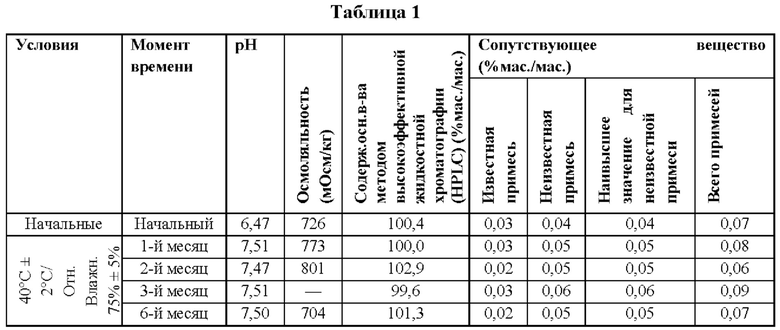
Инъекционную фармацевтическую композицию, приготовленную в примере 1, хранят при температуре 40°С и относительной влажности 75% в течение приблизительно шести месяцев, при этом уровень рН, осмоляльность, содержание основного вещества и сопутствующие вещества представлены в таблице 1.
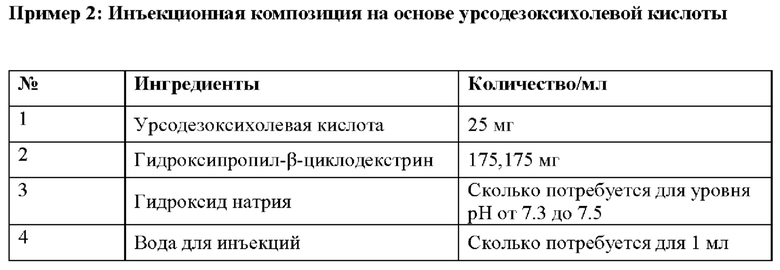
Процесс приготовления:
Гидроксипропил-β-циклодекстрин растворяют в необходимом количестве воды для инъекций, затем растворяют урсодезоксихолевую кислоту и доводят уровень рН с помощью гидроксида натрия до 7,3-7,5 с получением конечного раствора, который фильтруют и стерилизуют посредством асептической фильтрации и/или путем автоклавирования.
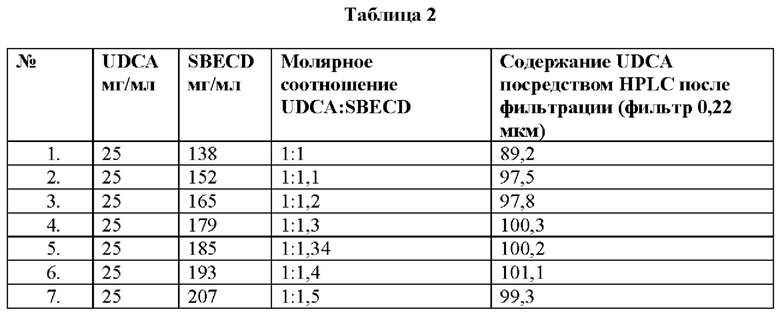
Пример 3: Растворимость урсодезоксихолевой кислоты в сульфобутиловом эфире-β-циклодекстрина (SBECD).
Урсодезоксихолевую кислоту смешивали с сульфобутиловым эфиром-β-циклодекстрина в воде и полученные растворы фильтровали через фильтр 0,22 мкм, и прозрачный раствор фильтрата анализировали с помощью HPLC. Содержание урсодезоксихолевой кислоты представлено в таблице 2.
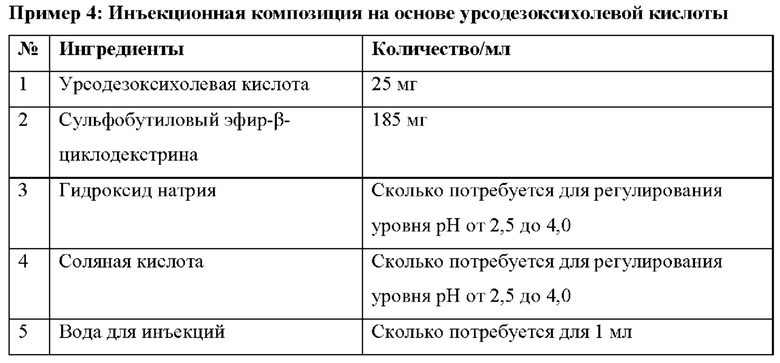
Процесс приготовления
Сульфобутиловый эфир-β-циклодекстрина растворяют в необходимом количестве воды для инъекций, затем растворяют урсодезоксихолевую кислоту и доводят уровень рН с помощью гидроксида натрия или соляной кислоты до 2,5-4,0 с получением конечного раствора, который фильтруют и стерилизуют посредством асептической фильтрации и/или путем автоклавирования в стеклянных флаконах, при этом каждый стеклянный флакон содержит 25 мл готового раствора (содержащего 625 мг UDCA). Инъекционную фармацевтическую композицию, приготовленную в примере 4, хранят при температуре 40°С и относительной влажности 75% в течение приблизительно трех месяцев, при этом уровень рН, осмоляльность, содержание основного вещества и сопутствующие вещества представлены в таблице 3.
| название | год | авторы | номер документа |
|---|---|---|---|
| КОМПОЗИЦИИ, СОДЕРЖАЩИЕ ЭПОТИЛОН, И СПОСОБЫ ИХ ПОЛУЧЕНИЯ | 2005 |
|
RU2416407C2 |
| ПАРЕНТЕРАЛЬНЫЙ ЖИДКИЙ ПРЕПАРАТ, ВКЛЮЧАЮЩИЙ КАРБАМАТНОЕ СОЕДИНЕНИЕ | 2017 |
|
RU2761041C2 |
| КОМПЛЕКС ИНГИБИТОРА RAS-ФАРНЕЗИЛТРАНСФЕРАЗЫ, КОМПОЗИЦИЯ ИНГИБИТОРА RAS-ФАРНЕЗИЛТРАНСФЕРАЗЫ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 1999 |
|
RU2230062C2 |
| СОСТАВЫ ВНУТРИВЕННЫХ РАСТВОРОВ ПОЗАКОНАЗОЛА, СТАБИЛИЗИРОВАННЫЕ ПОСРЕДСТВОМ ЗАМЕЩЕННОГО БЕТА-ЦИКЛОДЕКСТРИНА | 2011 |
|
RU2575768C2 |
| ВОДНАЯ КОМПОЗИЦИЯ, СОДЕРЖАЩАЯ ДАНТРОЛЕН | 2016 |
|
RU2729043C2 |
| СОСТАВ ИНГИБИТОРА BCL-2 НА ОСНОВЕ ЦИКЛОДЕКСТРИНА | 2019 |
|
RU2804366C2 |
| СПОСОБЫ ЛЕЧЕНИЯ ЭПИЛЕПСИИ ИЛИ ЭПИЛЕПТИЧЕСКОГО СТАТУСА | 2013 |
|
RU2824132C2 |
| СПОСОБЫ ЛЕЧЕНИЯ ЭПИЛЕПСИИ ИЛИ ЭПИЛЕПТИЧЕСКОГО СТАТУСА | 2013 |
|
RU2667010C2 |
| КОМПОЗИЦИИ БЕНДАМУСТИНА И ЦИКЛОПОЛИСАХАРИДА | 2010 |
|
RU2734236C2 |
| СТАБИЛИЗИРОВАННАЯ КОМПОЗИЦИЯ ВОРИКОНАЗОЛА | 2011 |
|
RU2566262C2 |
Группа изобретений относится к области медицины и раскрывает инъекционную фармацевтическую композицию для лечения патологического состояния печени, содержащую: (a) 25 мг/мл урсодезоксихолевой кислоты и (b) от 179 мг/мл до 248 мг/мл сульфобутилового эфира-β-циклодекстрина (варианты). Техническим результатом группы изобретений является обеспечение композиции на основе урсодезоксихолевой кислоты, пригодной для внутривенного введения, которая стабильна в условиях окружающей среды и/или в условиях охлаждения, характеризуется значительно уменьшенным объемом для внутривенного введения и может обеспечить полностью растворенную урсодезоксихолевую кислоту без необходимости использования больших количеств сильных оснований. 2 н. и 3 з.п. ф-лы, 3 табл., 4 пр.
1. Инъекционная фармацевтическая композиция для лечения патологического состояния печени, содержащая:
(a) 25 мг/мл урсодезоксихолевой кислоты и
(b) от 179 мг/мл до 248 мг/мл сульфобутилового эфира-β-циклодекстрина.
2. Композиция по п. 1, отличающаяся тем, что она не содержит больших количеств сильных оснований, присутствующих в количестве, стехиометрически эквивалентном урсодезоксихолевой кислоте.
3. Композиция по п. 1, отличающаяся тем, что патологическое состояние печени представляет собой холестаз печени, первичный билиарный цирроз или неалкогольный стеатогепатит (NASH).
4. Композиция по п. 1, отличающаяся тем, что она представлена в форме водного раствора, подходящего для внутривенной инъекции или инфузии.
5. Инъекционная фармацевтическая композиция для лечения патологического состояния печени, содержащая:
(a) 25 мг/мл урсодезоксихолевой кислоты,
(b) от 179 мг/мл до 248 мг/мл сульфобутилового эфира-β-циклодекстрина,
(c) воду и
(d) агент для регулирования уровня pH.
| Фильерный комплект к машине для формования химических волокон | 1983 |
|
SU1147779A1 |
| WO 2014108791 A1, 17.07.2014 | |||
| CN 104623676 A, 20.05.2015 | |||
| WO 2018026781 A1, 08.02.2018 | |||
| ПОЛУЧЕНИЕ ВОДНОГО ПРОЗРАЧНОГО РАСТВОРА ЛЕКАРСТВЕННЫХ ФОРМ С ЖЕЛЧНЫМИ КИСЛОТАМИ | 2001 |
|
RU2277913C2 |
| US 5955456 A1, 21.09.1999. | |||
Авторы
Даты
2023-10-13—Публикация
2020-11-19—Подача