Изобретение относится к области сельскохозяйственной биотехнологии и может быть использовано для оздоровления от вирусов растений картофеля.
Для повышения продуктивности картофелеводства актуальной задачей является обеспечение высокого качества семенного материала, поскольку только здоровый посадочный материал способен реализовать биологический потенциал сорта. Современное семеноводство картофеля невозможно без производства оздоровленного от вирусов посадочного материала.
В соответствии с ГОСТ 33996-2016 «Межгосударственный стандарт. Картофель семенной. Технические условия и методы определения качества» [1] регламентируется контроль наличия в посадочном материале следующих вирусов: X вирус картофеля (ХВК, PVX), S вирус картофеля (SBK, PVS); М вирус картофеля (МВК, PVM); Y вирус картофеля (YBK, PVY); вирус скручивания листьев картофеля (ВСЛК, PLRV). Наличие вирусных инфекций контролируется на основе показателей лабораторного тестирования методами полимеразной цепной реакции (ПЦР) и иммуноферментного анализа (ИФА).
Первый этап семеноводства картофеля - оздоровление от фитопатогенов - является максимально ресурсо- и энергозатратным во всей отрасли картофелеводства, что обусловливает актуальность оптимизации и повышения эффективности процесса получения и воспроизводства оздоровленного материала картофеля. В основе современного оригинального и элитного семеноводства картофеля лежит использование методов биотехнологии, в частности клонального микроразмножения.
В качестве методов оздоровления растений от вирусной инфекции, в том числе картофеля, используют: культуру верхушечных меристем, термотерапию, химиотерапию, реже криотерапию и электротерапию, а также комбинированные схемы терапий, включающие сочетание нескольких способов.
Метод освобождения от вирусов растений с использованием культуры апикальных меристем основан на уменьшении концентрации фитопатогена или его отсутствии в точках роста. Вычленение меристем крайне малых размеров (100-300 мкм), с одной стороны, приводит к увеличению эффективности оздоровления, с другой, к низкой приживаемости эксплантов - до 30% [2]. Также к недостаткам можно отнести трудоемкость, обязательное использование бинокулярного микроскопа, а также наличие квалифицированного персонала с опытом работы по вычленению меристем.
Использование химиотерапии как способа оздоровления подразумевает обработку инфицированных растений веществами с противовирусной активностью, в числе которых ингибиторы синтеза нуклеиновых кислот вирусов, бактериальная эндонуклеаза РНКаза, стимуляторы роста, фенольные соединения и ряд лекарственных противовирусных препаратов (римантадин, виразол, хитозан, интерферон, умифеновир и т.д.) [3]. Недостатком данного метода является наличие фитотоксического действия, используемых химических веществ [4]. Например, фитотоксичность рибавирина - наиболее часто используемого препарата при химиотерапии, возрастает при увеличении его концентрации в питательной среде [5]. Большой спектр применяемых химических веществ при оздоровлении влечет за собой трудности в подборе эффективно действующих концентраций, при этом не приводящих к мутационным изменениям. Необходимая после химиотерапии оценка сортовых особенностей оздоровленных растений по хозяйственно значимым признакам может занимать достаточно длительное время.
Менее распространенным методом оздоровления растений является электротерапия. Суть метода заключается в том, что электрический ток подается в ткани растений с целью разрушения вирусного нуклеопротеина и устранения его вирулентной активности [6-8]. Зарубежные коллеги заявляют о следующей эффективности: оздоровление 34,5% образцов от PLRV и 33,6% - от вироида веретеновидности клубней (PSTVd) [9]; 12,5% - от PVY и PVA [10]; единичные случаи от PVX [11]. К недостаткам данного метода можно отнести невысокую эффективность оздоровления, нестабильность получаемых результатов и необходимость работы со специфическим оборудованием - источником переменного тока.
Отечественными исследователями запатентован способ оздоровления посадочного картофеля и устройство для его осуществления [12], в котором описывается метод оздоровления от вирусных, вироидных и микоплазменных инфекций картофеля с использованием электрического тока, но не приводятся данные подтверждающие данное заключение: отсутствует перечень выявляемых патогенов, метод их идентификации, количественные и качественные показатели эффективности оздоровления.
Известен способ оздоровления от вирусов растений, выращиваемых in vitro, магнитным полем [13], в котором используются магнитно-импульсные установки. Недостатком данного способа является его апробация только на одном вирусе PVS и необходимость работы со специфическим оборудованием.
Криотерапия как метод оздоровления, подразумевающий погружение в жидкий азот (-196°С) апексов растений достаточно крупных размеров (до 4 мм). При этом жизнеспособность сохраняют только клетки в зоне апикальных меристем (Apical Dome = AD) и первых двух листовых примордиев, которые потенциально свободны от вирусов. Таким образом, криотерапия «работает» как микроскальпель, отсекая пораженные вирусом более крупные и гидратированные клетки вне меристемной зоны, погибающие из-за травм, вызванных криозамораживанием [14, 15]. Эффективность подобного метода отличается в разных исследованиях: для PLRV, PVY - 80-95% [16, 17], для PVY - 38,6% [18]. Данные по другим вирусам не приводятся. У этого метода существует ряд недостатков: наличие в лаборатории потенциально опасного вещества - жидкого азота, необходимость в специальном оборудовании и спецодежде, требования к площади помещения и вентиляции, навыкам работы персонала.
Наиболее распространенной среди исследователей является термотерапия, суть которой заключается в действии высоких температур на растение в течение определенного времени. Данный метод является базовым и менее трудоемким, не требует высокой квалификации сотрудников, имеет среднюю эффективность оздоровления (40-60%) от ряда картофельных вирусов [16].
Комбинирование методов может несколько повышать долю оздоровленного материала, однако увеличение трудозатрат и времени не всегда соответствует полученному результату, что, несомненно, является недостатком используемых схем оздоровления. Накопленные данные показывают, что комбинирование термотерапии с другими методом оздоровления более эффективны, по сравнению с использованием только температурного фактора [17, 19]. Чаще всего метод термотерапии совмещают с технологией апикальных меристем.
Наиболее близким предлагаемому изобретению является способ оздоровления картофеля с использованием термотерапии микрорастений, полученных in vitro. Для этого пробирки с растениями с 4-5 междоузльями размещают в специализированной климатической камере с фотопериодом 10 часов и регулируемым температурным режимом: изначально при 28°С с ежедневным повышением температуры на 1-2°С до достижения температурного максимума (38°С). Продолжительность экспозиции при 38°С составляет 10 суток. После прохождения термотерапии у растений из верхнего черенка под микроскопом с 300-350-кратным увеличением вычленяют апикальную меристему. Эффективность получения меристемного материала составляет в среднем 36% (по 2-13 шт. регенерантов, в зависимости от сорта). При этом количество свободных от вирусов (PVS, PVM, PVY, PVX) образцов варьировало от 1 до 3 шт. [20].
Подобная комплексная схема оздоровления, сочетающая термотерапию и культуру меристем, имеет ряд недостатков: низкая регенерационная способность меристем, а также невысокая эффективность оздоровления.
Задача, на решение которой направлено изобретение, - увеличение эффективности оздоровления картофеля от вирусов PVS, PVM, PVA, PVY, PVX при клональном микроразмножении.
Технический результат достигается с использованием термотерапии при температуре 38,0±0,5°С и фотопериоде 16/8, объектом термотерапии являются микроклубни in vitro, в качестве эксплантов используются ростки (0,2-2 мм) или верхушки ростков (0,2-2 мм), сформированные в процессе оздоровления в течение 20-25 дней. Увеличение регенерационной способности эксплантов осуществляется за счет исключения процесса стерилизации после термотерапии и отсутствия дополнительного метода оздоровления - культуры апикальных меристем, а также усиление эффективности освобождения от вирусов за счет увеличения времени экспозиции высокой температуры до 25 суток.
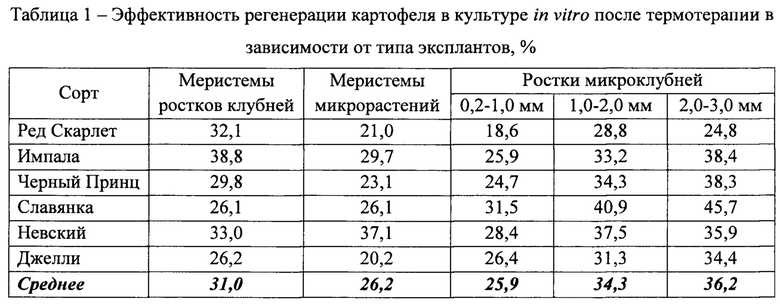
Предлагаемый способ оздоровления картофеля при микроклональном размножении от вирусной инфекции заключается в использовании в качестве объекта терапии микроклубней, сформированных в условиях in vitro (Фиг. 1). Для этого инициировали клубнеобразование путем культивирования микрорастений на питательной среде по прописи Мурасиге-Скуга [21], обогащенной сахарозой (6%), ИМК 1 мг/л и кинетином 1 мг/л [22] при 12-часовом фотопериоде, температуре 21±0,5°С. Для эксперимента были использованы сорта Ред Скарлет, Импала, Черный Принц, Славянка, Невский, Джелли.
Для оздоровления пробирки с микрорастениями и сформировавшимися на них микроклубнями, переносят в климатическую камеру с установленным фотопериодом 16 (день) / 8 (ночь). В течение 2-2,5 недель растения in vitro адаптируют к высоким температурам. Для этого каждые 2 дня повышают температуру в камере на 1,5-2,0°С до 38,0°С. С момента достижения температурного максимума (38,0°С) начинается процесс оздоровления, который длится 20-25 суток, в зависимости от сорта. Например, для микроклубней сорта Ред Скарлет, относящейся к группе раннеспелых сортов картофеля, максимальная продолжительность терапии составила 20-22 суток, тогда как, среднепоздний сорт Славянка выдерживал температуру 38,0±0,5°С в течении 25 дней.
В процессе термотерапии на микроклубнях формировались ростки (Фиг. 2). Впоследствии ростки (0,2-2 мм) или верхушки ростков (0,2-2 мм) отделяли от микроклубней и переносили на свежую питательную среду Мурасиге-Скуга, дополненную 30 г/л сахарозы и 0,5 мг/л кинетина (Фиг. 3).
Дальнейшее регенерация проходила в условиях культуральной комнаты, на стеллажах, при температуре 21±0,5°С и 16-часовом фотопериоде.
Тестирование исходного материала и ретестирование регенерантов картофеля на наличие вирусов проводили методом ПЦР в режиме Real-time с использованием наборов для диагностики вирусов PVS, PVA, PVM, PVX и PVY (Синтол, Россия). РНК выделяли набором DiamondDNA (Россия), согласно представленной производителем инструкции. Исследование проводили на ДНК-амплификаторе в реальном времени QuantStudio5. Режимы работы амплификатора устанавливали согласно инструкции производителя наборов для анализа. Степень оздоровления картофеля от вирусов PVS, PVA, PVM, PVX и PVY не имела генотипической зависимости. Эффективность освобождения от фитопатогенов зависела от вируса и его количественного содержания в растительных тканях.
Эффективность регенерации картофеля в культуре in vitro после термотерапии и использования в качестве эксплантов ростков (0,2-2 мм) или верхушек ростков (0,2-2 мм) микроклубней составила в среднем 30,1%. (Табл. 1).
Термотерапия микроклубней и использование в качестве эксплантов ростков (0,2-2 мм) или верхушек ростков (0,2-2 мм) позволило оздоровить от вирусов, в среднем, 25,0-75,0% образцов. Полученные результаты превосходили эффективность оздоровления при комплексной терапии - термотерапия + культура меристемы. Культивирование ростков или верхушек ростков размером больше 2,0 мм существенно снижали эффективность оздоровления картофеля. (Табл. 2).
Примеры осуществления способа. Пример 1.
В качестве эксплантов использовали меристемы, которые вычленяли из этиолированных проростков клубней картофеля после термотерапии. Условия термотерапии следующие: максимальная температура 38±0,5°С, фотопериод 16/8, длительность 18-20 суток. Более длительное воздействие высокой температурой приводило к увяданию ростков клубней, что снижало жизнеспособность эксплантов.
Частота регенерации составляет в среднем 31,0%. Эффективность оздоровления от вирусов составила: PVM - 17,6% и PVY - 50%, тогда как для других фитопатогенов (PVS, PVA, PVX) подобная схема и тип эксплантов оказались не эффективными.
Пример 2.
В качестве эксплантов использовали меристемы, которые вычленяли из микрорастений картофеля после термотерапии. Условия термотерапии следующие: температурный максимум - 38±0,5°С, фотопериод 16/8, длительность 10-12 суток. Более длительное воздействие высокой температуры приводило к увяданию микрорастений, что снижало жизнеспособность эксплантов.
Частота регенерации варьировала от 20,2 до 37,1, в среднем составляя 26,2%. Эффективность оздоровления от вирусов составила: PVS - 6,7%, PVA - 19,4%, PVM - 33,3%, PVX - 23,8% и 50% для вируса картофеля Y (PVY).
Пример 3.
В качестве эксплантов использовали ростки (0,2-1 мм) или верхушки ростков (0,2-1 мм), которые вычленяли из микроклубней картофеля после термотерапии. Условия термотерапии следующие: температурный максимум - 38±0,5°С, длительность 20-25 суток, в зависимости от сорта. Более длительное воздействие высокой температурой приводило к увяданию ростков микроклубней, что снижало жизнеспособность эксплантов.
Частота регенерации варьировала от 18,6 до 31,5, в среднем составляя 25,9%. Эффективность оздоровления от вирусов составила: PVS - 38,3%, PVA - 52,8%, PVM -34,7%, PVX - 43,2% и 75,0% для вируса картофеля Y (PVY).
Пример 4.
В качестве эксплантов использовали ростки (1,0-2,0 мм) или верхушки ростков (1,0-2,0 мм), которые вычленяли из микроклубней картофеля после термотерапии. Условия термотерапии следующие: температурный максимум - 38±0,5°С, длительность 20-25 суток, в зависимости от сорта. Более длительное воздействие высокой температурой приводило к увяданию ростков микроклубней, что снижало жизнеспособность эксплантов.
Частота регенерации варьировала от 28,8 до 40,9, в среднем составляя 26,2%. Эффективность оздоровления от вирусов составила: PVS - 25,8%, PVA - 25,0%, PVM -34,7%, PVX - 38,6% и 75% для вируса картофеля Y (PVY).
Пример 5.
В качестве эксплантов использовали ростки (2,0-3,0 мм) или верхушки ростков (2,0-3,0 мм), которые вычленяли из микроклубней картофеля после термотерапии. Условия термотерапии следующие: температурный максимум - 38±0,5°С, длительность 20-25 суток, в зависимости от сорта. Более длительное воздействие высокой температурой приводило к увяданию ростков микроклубней, что снижало жизнеспособность эксплантов.
Частота регенерации варьировала от 24,8 до 45,7, в среднем составляя 36,2%. Эффективность оздоровления от вирусов составила: PVS - 3,8%, PVA - 15,5%, PVM - 14,5%, PVX - 25,0% и 12,5%о для вируса картофеля Y (PVY).
Список литературы
1. ГОСТ 33996-2016. Межгосударственный стандарт. Картофель семенной. Технические условия и методы определения качества утвержден и введен в действие Приказом Федерального агентства по техническому регулированию и метрологии от 20 января 2017 г. №19-ст: дата введения 2018-01-01: - Москва: Стандартинформ, 2017. - 41 с.
2. Упадышев М.Т. Вирусные болезни и современные методы оздоровления плодовых и ягодных культур: автореф. дис. … док. с. -х. наук. - Москва, 2011. - 46 с.
3. Ухатова Ю.В. Совершенствование методов криоконсервации и оздоровления от вирусных болезней образцов вегетативно размножаемых культур: дис. … канд. биол. наук. - Санкт-Петербург, 2017.-137 с.
4. Muñoz F., Caracciolo Р.С, Daleo G., Abraham G.A., Guevara M.G. Evaluation of in vitro cytotoxic activity of mono-PEGylated StAP3 (Solanum tuberosum aspartic protease 3) forms // Biotechnol Rep (Amst)., 2014. - Vol.3. - P. 1-7. doi: 10.1016/j.btre.2014.05.007
5. Danci О. Erdei L., Vidacs L., Danci M., Baciu A., David I., Berbentea F. Influence of ribavirin on potato plants regeneration and virus eradication // J. of Horticulture, Forestry and Biotechnology, 2009. - Vol.13. - P. 421-425
6. Hull R. Induction of disease: Virus movement through the plant and effect on plant metabolism // Matthew's Plant Virology, 2002. - Ed. 4. - P. 373-411
7. Mahmoud S.Y.M., Hosseny M.H., AbdelGhaffar M.H. Evaluation of some therapies to eliminate potato Y potyvirus from potato plants // International Journal of Virology, 2009. - Vol.5.-P. 64-76
8. Svetleva D., Velcheva M., Bhowmik G. Biotechnology as a useful tool in common bean (Phaseolus vulgaris L.) improvement // Euphytica, 2003. - Vol.131. - P. 189-200
9. Singh В., Kaur A. In vitro production of PLRV and PSTVd-free plants of potato using electrotherapy // J. Crop Sci. Biotechnol, 2016. - Vol.19. - P. 285-294 https://doi.org/10.1007/s12892-016-0028-1
10. Meybodi D. E., Mozafari J., Babaeiyan N., Rahimian H. Application of Electrotherapy for the Elimination of Potato Potyviruses // J. Agr. Sci. Tech., 2011. - Vol.13. - P. 921-927
11. Bădărău C.L., Florentina D., Chiru N. Effects of some electrotherapy treatments of pvx infected potato plantlets cv. Roclas, on several biological development indicators // Journal of Horticulture, Forestry and Biotechnology, 2014. - Vol.18(3). - P. 25-29
12. Патент №2494604 Российская Федерация, МПК A01F 25/00(2006.01) Способ оздоровления посадочного картофеля и устройство для его осуществления: заявл. 2012.05.10: опубл.: 2013.10.10 / Кучумов Н.Н., Каликин А.С, Гумаргалиева К.З. И др.; заявитель ФГБУН «Институт химической физики им. Н.Н. Семенова РАН». - 8 с.
13. Патент №2761498 Российская Федерация, МПК A01G 7/04 (2006.01), А01С 1/00 (2006.01) Способ оздоровления растений картофеля от вирусных инфекций: заявл. 09.03.2021: опубл.: 08.12.2021 / Шевченко С.Н., Глущенков В.А., Милехин А.В. и др.; заявитель ФГБУН «Самарский ФИЦ РАН», ФГАОУ ВО «Самарский национальный исследовательский университет им. академика С.П. Королева». - 5 с.
14. Wang Q.C., Panis В., Engelmann F., Lambardi M., Valkonen J.P.Т. Cryotherapy of shoot tips: a technique for pathogen eradication to produce healthy planting materials and prepare healthy plant genetic resources for cryopreservation // Ann. Appl. Biol., 2009. - Vol.154. - P. 351-363
15. Wang В., Wang R.-R., Cui Z.-H., Bi W.-L., Li J.-W., Li B.-Q., Ozudogru E.A., Volk G.M., Wang Q.-C. Potential applications of cryogenic technologies to plant genetic improvement and pathogen eradication // Biotechnology Advances, 2014. - Vol.32. - P. 583-595
16. Wang Q.C., Liu Y., Xie Y.H., You M. Cryotherapy of potato shoot tips for efficient elimination of Potato leaf roll virus (PLRV) and Potato Virus Y (PVY) // Potato Res., 2006. - Vol.49.-Pp.119-129 DOI: 10.1007/sl 1540-006-9011-4
17. Ухатова Ю.В., Антонова О.Ю., Гавриленко Т.А. Оздоровление от вируса скручивания листьев картофеля чилийских образцов Solanum tuberosum с использованием методов криотерапии и комплексной химио-, термотерапии // Достижения науки и техники АПК, 2016. - Т. 30. - №10. - С. 56-60
18. Kushnarenko S., Romadanova N., Aralbayeva M., Zholamanova S., Alexandrova A., Karpova O. Combined ribavirin treatment and cryotherapy for efficient Potato virus M and Potato virus S eradication in potato {Solanum tuberosum L.) in vitro shoots // In Vitro Cellular & Developmental Biology - Plant, 2017. -№53. -P. 425-432. DOI: 10.1007/s11627-017-9839-0
19. Wang M.-R., Cui Zh.-H., Li J.-W., Hao X.-Y., Zhao L., Wang Q.-Ch. In vitro thermotherapy based methods for plant virus eradication // Plant Methods, 2018. - No 14. 87 https://doi.org/10.1186/s13007-018-0355-y
20. Овэс E.B., Гаитова H.A. Новые элементы технологии оздоровления и получения базовых клонов перспективных сортов и гибридов картофеля // Достижения науки и техники АПК, 2016. - Т. 30. - №11. - С. 60-62
21. Murashige Т., Skoog F.A revised medium for rapid growth and bio-assays with tobacco tissue cultures // Physiologia Plantarum, 1962. - №15 (3). - P. 473-497. doi:10.1111/j.1399-3054.1962.tb08052.x
22. Сомова E.H., Маркова М.Г., Власевская E.A. Получение микроклубней картофеля на основе оптимизации условий культивирования in vitro II Аграрная наука Евро-Северо-Востока, 2021. -№5. - С. 682-688.
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ оздоровления картофеля от вирусных инфекций in vitro | 2023 |
|
RU2805356C1 |
| Способ оздоровления растений картофеля от вирусных инфекций | 2021 |
|
RU2761498C1 |
| СПОСОБ СТИМУЛЯЦИИ ПРОРАСТАНИЯ МИКРОКЛУБНЕЙ КАРТОФЕЛЯ IN VITRO С ПОМОЩЬЮ УЛЬТРАЗВУКА БЕЗ НАРУШЕНИЯ СТЕРИЛЬНОСТИ | 2021 |
|
RU2760213C1 |
| Способ получения безвирусного, генетически однородного посадочного материала батата (Ipomoea Batatas L.) in vitro | 2021 |
|
RU2783183C1 |
| Способ микроклонального размножения in vitro микрорастений картофеля сорта СОЛНЕЧНЫЙ | 2023 |
|
RU2814473C1 |
| СПОСОБ МИКРОКЛОНАЛЬНОГО РАЗМНОЖЕНИЯ КАРТОФЕЛЯ IN VITRO СОРТА КАРТОФЕЛЯ "ЕРМАК" | 2016 |
|
RU2632938C2 |
| СПОСОБ МИКРОКЛОНАЛЬНОГО РАЗМНОЖЕНИЯ КАРТОФЕЛЯ IN VITRO СОРТА КАРТОФЕЛЯ АЛЕНА | 2016 |
|
RU2637361C1 |
| СПОСОБ МИКРОКЛОНАЛЬНОГО РАЗМНОЖЕНИЯ КАРТОФЕЛЯ IN VITRO СОРТА ХОЗЯЮШКА | 2022 |
|
RU2789460C1 |
| СПОСОБ КОНСЕРВАЦИИ ОЗДОРОВЛЕННОГО IN VITRO МАТЕРИАЛА КАРТОФЕЛЯ | 2019 |
|
RU2728684C1 |
| Способ микроклонального размножения картофеля в культуре in vitro | 2022 |
|
RU2788851C1 |
Изобретение относится к области биотехнологии и может быть использовано для оздоровления от вирусов растений картофеля. Изобретение представляет собой способ оздоровления картофеля от вирусов PVS, PVM, PVA, PVY, PVX при клональном микроразмножении, включающий термотерапию микроклубней in vitro при температуре 38,0±0,5°С, фотопериоде 16/8. Изобретение позволяет повысить регенерационную способность эксплантов за счет исключения процесса стерилизации после термотерапии и отсутствия дополнительного метода оздоровления - культуры апикальных меристем, а также усилить эффективность освобождения от вирусов за счет увеличения времени экспозиции высокой температуры до 25 суток. 3 ил., 2 табл.
Способ оздоровления картофеля от вирусов при клональном микроразмножении, включающий термотерапию при температуре, которая достигается повышением на 1,5-2,0°С каждые 2 дня, начиная от 21,0±0,5°С до 38,0±0,5°С, фотопериоде 16/8, отличающийся тем, что оздоровление осуществляется от вирусов PVS, PVA, PVM, PVX, PVY, объектом термотерапии являются микрорастения с микроклубнями in vitro, в качестве эксплантов для последующей регенерации используются ростки микроклубней размером 0,2-2,0 мм, сформированные в процессе терапии в течение 20-25 дней.
| ОВЭС E.B., и др., Новые элементы технологии оздоровления и получения базовых клонов перспективных сортов и гибридов картофеля // Достижения науки и техники АПК, 2016 | |||
| - Т | |||
| Способ обработки медных солей нафтеновых кислот | 1923 |
|
SU30A1 |
| - С | |||
| Способ получения молочной кислоты | 1922 |
|
SU60A1 |
| WANG Q.C., et al, Cryotherapy of potato shoot tips for efficient elimination of Potato leaf roll virus (PLRV) and Potato Virus Y (PVY), Potato Res., | |||
Авторы
Даты
2023-10-13—Публикация
2022-12-20—Подача