Изобретение относится к области биологически активных соединений и касается лекарственного средства, содержащего 5,7-ди(тиофен-2-ил)-4,5-дигидро-[1,2,4]триазоло[1,5-а]пиримидин, проявляющего антикоагулянтную (ингибитор IIa фактора), антитромботическую и противовоспалительную активности, предназначенного для лечения и профилактики тромбозов и тромбоз-ассоциированных заболеваний, и может быть использовано в лечебных учреждениях, научно-исследовательских лабораториях.
По данным ВОЗ, тромбоз-ассоциированные заболевания занимают одну из лидирующих позиций в структуре заболеваемости и смертности населения всего мира. Венозный тромбоз и его наиболее опасное осложнение - тромбоэмболия лёгочных артерий - одни из наиболее частых патологических состояний, которым подвержены многие пациенты [Schulman S., Ageno W., Konstantinides S.V. Venous thromboembolism: Past, present and future.//Thromb Haemost..- 2017.-117(7).-P.219-1229]. К наиболее весомым факторам риска относят хирургические вмешательства и травмы, злокачественные новообразования, длительную иммобилизацию и паралич конечностей, беременность, послеродовой период, приём оральных контрацептивов, гормоно-заместительную терапию, наличие варикозно-расширенных вен нижних конечностей, фибрилляцию предсердий, хроническую сердечную недостаточность, ожирение, вирусные и бактериальные инфекции, установку внутривенных катетеров и пожилой возраст [Friedman A.M. Introduction: Obstetric venous thromboemboembolism//Semin Perinatol.-2019.-43(4).-P.187-188; Spehlmann M.E., Frey N., Müller O. J. Herz J. Prevention and treatment of venous thromboembolism in cancer patients. - 2020.- 45(7). - P.652-658; Tritschler T., Aujesky D. Venous thromboembolism in the elderly: A narrative review//Thromb Res. -2017.-155.-P.140-147]. Также усиление внутрисосудистой коагуляции возникает при сепсисе, который является одним из тяжелых осложнений различных микробных и вирусных инфекций, в том числе COVID-19 (SARS-CoV-2). [Mitchell W.B. ThromboinflammationinCOVID-19 acute lung injury //Paediatric Respiratory Reviews.-2020).-35.- P. 20-24; Skeik N., Smith J.E., Patel L., Mirza A.K, Manunga J.M., Beddow D. Risk and Management of Venous Thromboembolism in Patients with COVID-19//Ann. Vasc. Surg.-2021/-73/-P.78-85]. В норме это так называемая иммунокоагуляция является частью врожденного иммунитета и может служить первой линией защиты от инфекции. Известно, что коагуляция может быть активирована внешними и внутренними путями, в результате чего образуется фибрин. Доклиническими и клиническими исследованиями подтверждена патологическая роль инициатора внешнего пути - тканевого фактора в возникновении эндотоксемии [Wu, C. etal. (2019) Inflammasome activation triggers blood clotting and host death through pyroptosis. Immunity 50, 1401-1411; Pawlinski, R. et al. (2004) Role of tissue factor and proteaseactivated receptors in a mouse model of endotoxemia. Blood 103, 1342-1347].
Среди средств для предотвращения тромбозов лидирующее место занимают антикоагулянты. До недавнего времени антагонисты витамина K были единственными доступными пероральными антикоагулянтами, и варфарин остается наиболее часто назначаемым пероральным антикоагулянтом во всем мире [Witt D.M., Clark N.P., Kaatz S., Schnurr T., Ansell J.E. Guidance for the practical management of warfarin therapy in the treatment of venous thromboembolism//J. Thromb Thrombolysis. 2016 Jan; 41(1):187-205]. Однако его серьезным недостатком является медленное развитие эффекта, длительный эффект восстановления свертывания и небольшая широта терапевтического действия, которые требуют постоянного контроля степени коагуляции [Krylov A.I. Shulutko A.M., Prasolov N. V., Petrovskaia A. A., Khmyrova S.E. Coagulological aspects of treatment of complications of prolonged therapy with warfarin// Angiol Sosud Khir. - 2016.-22(3).-P.33-41].
В настоящее время в качестве новых оральных антикоагулянтов (НОАК) используют непрямые и прямые ингибиторы фактора IIa и Xа фактора. Дабигатран является пероральным прямым ингибитором тромбина/фактора IIa [Antonijevic N.M., Zivkovic I.D., Jovanovic L.M., Matic D.M., Kocica M.J. et al Dabigatran - Metabolism, Pharmacologic Properties and Drug Interactions// Curr Drug Metab. - 2017.-18(7). -P.622-635]. Три других препарата ривароксабан, апиксабан и эдоксабан являются пероральными селективными ингибиторами фактора Xa [ Reiffel J.A. Novel oral anticoagulants// Am J Med.-2014.-127(4). -P.16-7; Chan N.C., Weitz J.I. Rivaroxaban for prevention and treatment of venous thromboembolis//Future Cardiol. - 2019.-15(2).-Р.63-77]. Их антикоагулянтный эффект более предсказуем и стабилен и не требует рутинного лабораторного мониторинга. Как класс новые оральные антикоагулянты демонстрируют сопоставимую эффективность и значительно более низкий риск кровотечений по сравнению с варфарином [Hulle T., Kooiman J., Exter P.L., Dekkers O.M., F.A. Klok et al., Effectiveness and safety of novel oral anticoagulants as compared with vitamin K antagonists in the treatment of acute symptomatic venous thromboembolism: a systematic review and meta-analysis //J Thromb Harmost .-2014.- 12:.-P.320-8]. Однако данная группа препаратов имеет свои недостатки, так как вступает в нежелательные фармакодинамические взаимодействия с пищевыми продуктами, растительными добавками и лекарственными средствами [Frigerio B., Spadarella G., Ravani A., Sansaro D., Amato M. et al., Old and new oral anticoagulants: Food, herbal medicines and drug interactions// Blood Reviews.-2017.-32(4). -P.193-203]. Кроме того, большинство используемых в настоящее время лекарств для предотвращения тромбоза производится за рубежом.
В качестве изобретения предлагается лекарственное средство, содержащее биологически активную составляющую, обладающую антикоагулянтной (ингибитор IIa фактора), антитромботической, противовоспалительной активностями, и представляющую собой 5,7-ди(тиофен-2-ил)-4,5-дигидро-[1,2,4]триазоло[1,5-а]пиримидин формулы (1). Кроме соединения (1) лекарственное средство может содержать фармацевтически приемлемые компоненты: наполнители, разбавители и/или другие вспомогательные вещества.
Для оценки антикоагулянтной, антитромботической, противовоспалительной активностей in vitro и in vivo без и в условиях сепсиса 5,7-диметил-4,5-дигидро-[1,2,4]триазоло[1,5-a]пиримидина (1) и лекарственного средства на его основе использовали препарат сравнения - дабигатрана этиксилат (Берингер Ингельхайм Фарма ГмбХ и Ко., Германия) - прямое антикоагулянтное средство для перорального приема и ингибитор тромбина (фактор IIa).
Соединение (1) получено путём взаимодействия 7-(тиофен-2-ил)-[1,2,4]триазоло[1,5-a]пиримидина (2) с тиофен-2-илмагний бромидом (3).
Соединение (1) представляет собой бледно-бежевый порошок, растворимый в этаноле, диметилсульфоксиде, малорастворимое в этаноле и этилацетате, нерастворимое в гексане.
Данные элементного анализа и ЯМР 1Н Соединения (1) полностью соответствуют приписываемому строению (см. Пример 1).
Лекарственное средство может быть использовано либо перорально, либо с помощью парентеральных инъекций в растворе. Оно может применяться самостоятельно, например, в форме микрокапсул, либо с подходящими вспомогательными средствами и/или наполнителями. Подходящие твердые или жидкие лекарственные формы включают, к примеру, гранулы, порошки, покрытые оболочкой таблетки, микрокапсулы, суппозитории, сиропы, эликсиры, суспензии, эмульсии, капли или инъекционные растворы, а также препараты с целевой доставкой активной субстанции, в производстве которых обычно используются вспомогательные вещества, такие как наполнители, дезинтеграторы, связующие, создающие оболочку агенты, разрыхлители, смазочные добавки, отдушки или подсластители. Подходящими вспомогательными веществами являются, например, диоксид титана, лактоза, маннитол и другие сахара, тальк, молочный альбумин, желатин, мука, целлюлоза и ее производные, животные и растительные масла, полиэтиленгликоли и растворители, такие как стерильная вода, и моноатомные и полиатомные спирты, например глицерин.
Пример 1. Синтез
В колбе, снабжённой магнитной мешалкой, термометром, обратным холодильником, создают инертную, сухую атмосферу и помещают 36,5 мг магния (1,5 ммоль), свежеперегнанный тетрагидрофуран (ТГФ) и 145,0 мкл 2-бромтиофена (1,5 ммоль). После растворения магния реакционную смесь охлаждают до 0°С и вносят 226,0 мг 7-(тиофен-2-ил)-[1,2,4]триазоло[1,5-a]пиримидина (1 ммоль), нагревают до 50°С за 2 часа. Затем, сохраняя инертную атмосферу, реакционную смесь нейтрализуют раствором 107,0 мг (2 ммоль) хлорида аммония в 2 мл воды и удаляют ТГФ на ротационном испарителе. Образовавшийся осадок соединения 1 фильтруют и перекристаллизовывают из этилового спирта. Выход 223,6 мг (78,1%) в виде кристаллического светло-бежевого осадка с температурой плавления 206°С, не растворимого в воде, растворимого в горячем этаноле и диметилсульфооксиде (ДМСО).
5,7-ди(тиофен-2-ил)-4,5-дигидро-[1,2,4]триазоло[1,5-a]пиримидин - Соединение (1) имеет следующие физико-химические характеристики: 1H ЯМР (500 МГц, ДМСО-d6) δ 8,44 (с, 1H, NH), 7,75 (д, J = 3,7 Гц, 1H, C=CH-CH), 7,67 (д, J = 5,1 Гц, 1H, CH=CH-S), 7,63 (с, 1H, N=CH-N), 7,47 (д, J = 5,0 Гц, 1H, CH=CH-S), 7,13 (т, J = 4,4 Гц, 1H, CH=CH-S), 7,06 (д, J = 3,5 Гц, 1H, C=CH-CH), 7,01 (т, J = 4,4 Гц, 1H, CH=CH-S), 5,83 (д, J = 5,3 Гц, 1H, NH-CH-CH), 5,73 (д, J = 5,5 Гц, 1H, NH-CH-CH). 13C ЯМР (126 МГц, ДМСО-d6) δ 152,8; 149,5; 147,5; 132,3; 129,0; 128,3; 128,2; 127,3; 127,1; 125,8; 124,3; 105,0; 49,5. Вычислено для C13H10N4S2 (286,37): C: 54,52; H: 3,52; N: 19,56 Найдено: C: 54,44; H: 3,48; N: 19,60.
Физико-химические характеристики Соединения (1) полностью соответствуют приписываемой структуре.
Пример 2. Изучение цитотоксичности
Изучение проводили на клетках линии HepG2 (гепатоцеллюлярной карциномы человека) (CLS Cell Lines Service), которые культивировались в культуральном флаконе в полной ростовой среде F-12 в СО2-инкубаторе при температуре 37°С в атмосфере 5% СО2. Для промывания монослоя использовали раствор Хенкса, для снятия монослоя использовали раствор трипсина-ЭДТА 0,05% (5 мин). Клеточную суспензию засевали в 24-луночный планшет с последующей инкубацией в течение 24 часов для адгезии клеток ко дну планшета. По истечении времени инкубации и смены ростовой среды производилось внесение Соединения (1) и препарата сравнения в лунки (n=3-5) в конечных концентрациях 0,01-100 мкМ (кратность ×10). В контрольные лунки вносился только эквивалентный объем полной ростовой среды. Инкубация соединений проводилась в течение 48 ч., после чего соединения удалялись вместе с ростовой средой, и вносился реагент МТТ (инкубация 2 часа). Для солюбилизации образовавшихся кристаллов формазана использовался ДМСО в планшетном термошейкере (5 мин, 24°С, 1200RPM).
С использованием планшетного ридера по данным оптической плотности определялась жизнеспособность клеток, коррелирующая с активностью митоходриальных дегидрогеназ. Измерение абсорбции производили при 555 нм.
Оценивали цитотоксичность Соединения (1) и препарата сравнения дабигатрана этексилата в концентрациях 10 нМ, 0,1мкМ, 1 мкМ, 10 мкМ и 100 мкМ.
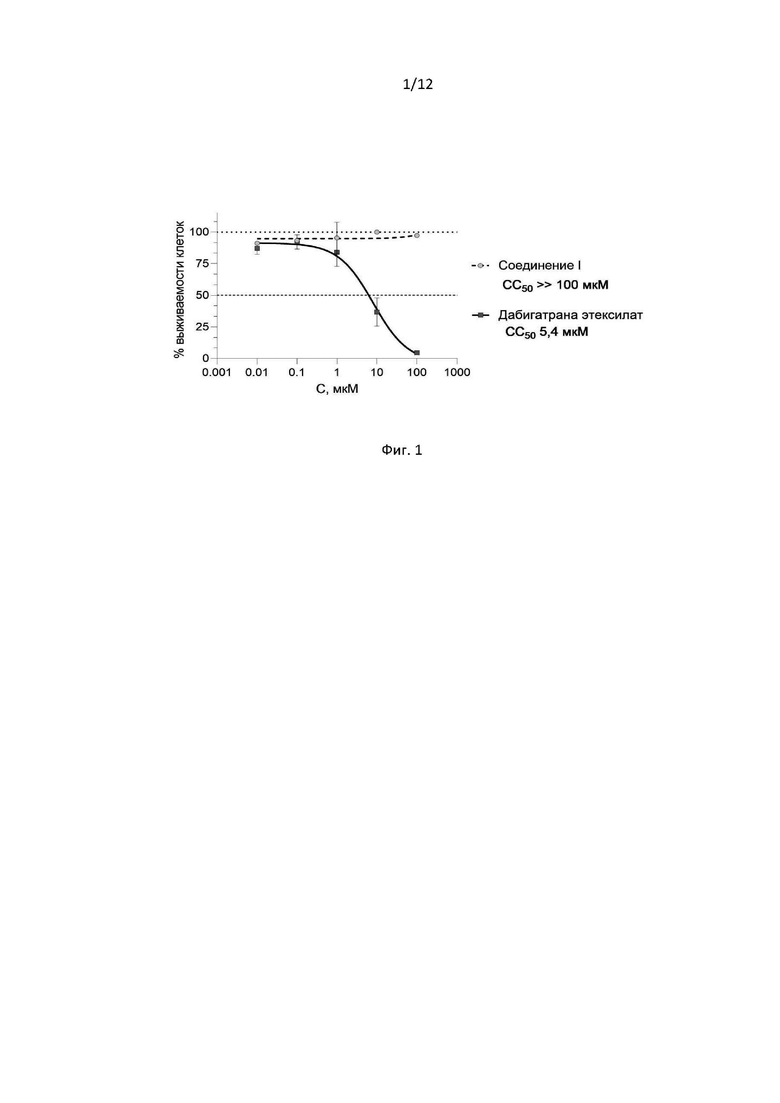
В ходе проведенного исследования получены значения абсорбции при 555 нм (референсная λ = 650 нм), отражающие количественную оценку конвертированного МТТ-реагента в формазан митохондриальными дегидрогеназами. По результатам проведенного исследования, относительно контроля (только клетки с полной ростовой средой F-12) рассчитан процент метаболической активности клеток, отражающий количество жизнеспособных клеток (выживаемости) в % относительно контрольных значений (Фиг. 1).
В результате исследования установлено, что для Соединения (1) в диапазоне исследованных концентраций 0,01-100 мкМ не характерно статистически значимого влияния на выживаемость клеток линии HepG2 при 48 часовой инкубации. Полученные данные позволяют сделать вывод об отсутствии цитотоксических свойств у данного вещества в диапазоне концентраций 0,01-100 мкМ, уровень СС50>>100 мкМ.
Для препарата сравнения дабигатрана этексилата было выявлено дозозависимое влияние на выживаемость клеток HepG2 в диапазоне концентраций 1-100 мкМ. В концентрациях 0,01 и 0,1 мкМ статистически значимого цитотоксического действия для препарата дабигатрана этексилата не выявлено.
Полученные данные для суспензии препарата дабигатрана этексилата позволили рассчитать концентрацию, вызывающую 50% цитотоксический эффект относительно интактных клеток (СС50), которая составила 5,4±1,2 мкМ (R2=0,92).
Полученные данные соответствуют отсутствию изменений в морфологической картине клеток после 48 часовой инкубации в максимальной исследованной концентрации 100 мкМ с образцами Соединения (1), но не гранулятом препарата дабигатран (Фиг. 2). Целостность клеточной структуры при инкубации с последнем не прослеживается.
Данные о цитотоксичности Соединения (1) и дабигатрана этексилата позволили рассчитать их условный терапевтический индекс. Для препарата сравнения он составил 3,8, а для Соединения (1) - >>80,0 (Табл. 1).
п/п
Таким образом, по значению условного терапевтического индекса Соединение (1) превосходит более чем в 21 раз препарат сравнения дабигатрана этексилат.
Пример 3.
1. Изучение влияния Соединения (1) на параметр коагулограммы - тромбиновое время in vitro.
Исследование выполняли на кроликах породы «Шиншилла». Анализ проводили хронометрически, на гемокоагулометре «SOLAR» (Белоруссия) с использованием наборов реактивов производства («Технология-стандарт», Россия). Материалом для исследования являлась бедная тромбоцитами плазма животных, которую получали путем центрифугирования, забранной из ушной вены кролика крови при 3000 об/мин в течение 15 минут. Для стабилизации крови использовали 3,8% водный раствор цитрата натрия (pH 6,0) в соотношении 9:1. Для определения тромбинового времени 100 мкл исследуемой, бедной тромбоцитами плазмы и магнитный якорь вносили в кювету. После инкубации пробы (120 секунд при 37°С) в нее добавляли 100 мкл стандартизированного по активности рабочего раствора тромбина. Для исследования влияния на активность тромбина Соединение (1) в объеме 10 мкл вносили в кювету коагулометра содержащую 100 мкл рабочего раствора тромбина и инкубировали в течение 5 минут при комнатной температуре. Cоединение I и дабигатрана этексилат исследовали в диапазоне концентраций 10-0,1 мкМ с расчетом EC50 и условного терапевтического индекса (УТИ). В качестве растворителя Соединения (1) и препарата сравнения использовали дистиллированную воду, а в качестве растворителя реагентов - физиологический раствор.
Показатель тромбинового времени в контроле составил 11,65 секунд. Препарат сравнения дабигатрана этексилат в концентрации 10 мкМ достоверно удлинял данный показатель до о 46,8 секунд, что соответствует достоверному увеличению его относительно контроля на 302,0% (табл.1). При дальнейшем уменьшении концентрации до 5 и 1 мкМ тромбиновое время также статистически значимо пролонгировалось на 176,1 и 42,3% соответственно. В концентрации 0,1 мкМ дабигитрана этексилат не оказывал влияние на данный параметр. ЕC50 антитромбиновой активности препарата сравнения составило 1,4 мкМ (табл.2).
Соединение (1) в концентрации 10 мкМ достоверно удлиняло показатель тромбинового времени до 66 секунд, что относительно контроля составило на 467,1 % больше. При снижении концентрации вещества до 5 и 1 мкМ тромбиновое время также уменьшалось до 34,3 и 16,6 секунд, но при этом статистически значимо увеличивалось относитель контрольных значений на 194,1 и 46,5% соответственно. В концентрации 0,1 мкМ Соединение (1) не влияло на данный параметр. ЕC50 антитромбиновой активности при этом было равно 1,25 мкМ (табл.2).
относительно контроля
этексилат
* -данные достоверны относительно контроля, критерий ANOVA (p<0,05);
# - (р≤0,05) изменения статистически значимы по отношению к препарату сравнения дабигатранаэтексилату, критерий ANOVA;
n - число тестируемых животных.
2. Изучение влияния Соединения (1) на параметры коагулограммы in vivo.
Исследования выполняли на 25 белых беспородных крысах самцах. Препарат сравнения дабигатрана этексилат изучали в дозе 12 мг/кг (доза, эквивалентная дозе для человека с учетом межвидового коэффициента пересчета). Соединение (1) исследовали в дозе, эквимолярной дозе препарату сравнения, которая составила 5,5 мг/кг. Для выявления времени наступления наибольшей антитромбиновой активности у Соединения (1) его вводили однократно внутрижелудочно за 1; 2 и 4 часа до начала эксперимента. Дабигатрана этексилат вводили за 2 часа (время наступления максимальной концентрации в крови) до исследования. В качестве растворителя использовали дистиллированную воду. Кровь забирали из брюшной аорты крыс, которых предварительно наркотизировали (хлоралгидрат 400 мг/кг внутрибрюшинно). Для стабилизации крови использовали 3,8 % водный раствор цитрата натрия (pH 6,0) в соотношении 9:1. Все исследования производили на бедной тромбоцитами плазме крыс, которую получали вышеописанным способом. Измерения параметров коагулограммы проводили на коагулометре «SOLAR» по вышеописанным методикам.
В результате проведенных исследований в контроле показатель АЧТВ составил 38,3 секунды (табл.3). При этом дабигатрана этексилат в дозе 12 мг/кг достоверно удлинял данный показатель в 3,6 раза. Соединение (1) в дозе 5,5 мг/кг через 1 и через 2 часа после введения достоверно увеличивало данный показатель по отношению к контролю в 1,3 и 1,5 раза соответственно, а через 4 часа влияния на данный параметр выявлено не было (табл.3).
Тромбиновое время в крови крыс в контроле составило 57,7 минут. Препарат сравнения дабигатрана этексилат увеличивал данный показатель в 10,5 раз. Под действием Cоединения I через 1 час после его введения тромбиновое время удлинялось в 4,4 раза, через два часа после введения в 5,6 раза, а через 4 часа данный показатель соответствовал контрольным значениям. Показатель протромбинового времени не изменялся ни под действием Соединения (1), ни под влиянием дабигатрана этексилата (табл.3).
образец
забора
крови, ч
1 - доза, полученная путем перерасчета с использованием межвидового коэффициента;
2 - доза, эквимолярная дозе дабигатрана этексилата 12,0 мг/кг;
* - данные достоверны относительно контроля, критерий ANOVA (p<0,05).
3. Изучение влияния Соединения (1) на способность связывать фактора IIa на хромогенном субстрате S-2238 in vivo.
Исследования выполняли на 35 белых беспородных крысах самцах. Соединение (1) вводили однократно внутрижелудочно в дозах 2,5; 5,5 и 11 мг/кг. Препарат сравнения дабигатрана этексилат был исследован в дозах 3,0; 6,0 и 12,0 мг/кг. Кровь забирали из брюшной аорты крыс, которых предварительно наркотизировали (хлоралгидрат 400 мг/кг внутрибрюшинно) через 2 часа после введения тестируемых образцов. Полученную кровь собирали в пробирку для взятия крови и центрифугировали при комнатной температуре в течение 15 минут при 3000 об/мин (1200g). Отбирали плазму и повторно центрифугировали в тех же условиях. Для анализа использовали только верхнюю треть плазмы. Анализ выполняли согласно инструкции к набору «Ренапарин - плазма тест». Проводили оценку степени связывания исследуемых веществ с IIa фактором.
Способность связывать фактор IIa (тромбин) на хромогенном субстрате Соединения (1) и препарата сравнения дабигатрана этексилат представлена в таблице 4.
Соединение (1) в дозе 2,5 мг/кг не связывало IIa фактор, так как уровень свечения на хромогенном субстрате соответствовал уровню свечения плазмы-калибратора S1 - 0,36. При увеличении дозы исследуемого соединения до 5,5 мг/кг уровень свечения уменьшался до 0,31, при этом связывание тромбина составило 44,7 %. В дозе 11,0 мг/кг уровень свечения составил 0,25, что соответствовало взаимодействию Соединения (1) с IIa фактором на 67%. При этом ED50 данного соединения составила 9,9 мг/кг (табл.4).
При исследовании влияния дабигатрана этексилата на связывание тромбина в дозе 3,0 мг/кг уровень свечения составил 0,46, что указывает на отсутствие эффекта. При увеличении дозы препарата сравнения до 6,0 мг/кг уровень свечения соответствовал свечению плазмы-калибратора S2, что соответствовало 25% связывания тромбина. В дозе 12 мг/кг происходило связывания с тромбином на 64,5 %. Согласно полученным данным показатель ED50 дабигатрана этексилата составил 8,1 мг/кг (табл. 4). Таким образом, Соединение (1) обладает способностью связывать IIa фактор на хромогенном субстрате S2238, что подтверждает его антитромбиновую активность.
п/п
+
Соединение (1)
+
дабигатрана этексилат
4. Изучение влияния Соединения (1) на выживаемость мышей в условиях тромбин-индуцированного тромбоза легких.
Исследование выполняли на 30 белых беспородных мышах самцах. Введение растворов Соединения (1) и препарата сравнения осуществляли однократно внутрижелудочно за 2 часа до моделирования тромбоза в дозах 13,0 и 27,0 мг/кг соответственно. Контрольной группе животных вводился растворитель (дистиллированная вода). Моделирование острого тромбоза у мышей проводилось согласно методу [Зяблицкий, Р.М. К патогенезу острого внутрисосудистого свертывания крови / Р.М.Зяблицкий, Д.П. Павловский, О.Ю.Токарев //Патологическая физиология и экспериментальная терапия. -1983. -№2 С. 33-35]. Мышей фиксировали в специализированном домике с доступом к хвосту и в хвостовую вену инсулиновым шприцом подавали тромбин в дозе 40 ед., растворенный в физиологическом растворе. Оценивали поведение животных (подвижность наличие судорог и др.). У животных проводили забор легких для гистологической оценки. За группой выживших животных наблюдали в течение 7 суток на предмет отдаленной гибели.
Морфологическое исследование проводили следующим образом: извлеченный материал (образцы тканей легкого) помещался в 10%-й раствор нейтрального забуференного формалина (pH 7,4). От момента извлечения органов до погружения образца ткани в фиксатор проходило менее 2 мин. Время пребывания в фиксаторе составляло 1-2 суток при 4°С. После фиксации, производили вырезку материала. В дальнейшем материал проводили по общепринятой гистологической методике через батарею спиртов возрастающей концентрации, хлороформ и заливали в парафин. Затем на роторном микротоме изготавливали срезы толщиной 4 мкм и монтировали их на предметные стекла.
В дальнейшем окрашивали гематоксилином и эозином по общепринятым гистологическим методикам (депарафинизация в ксилоле, проводка по спиртам убывающей концентрации до воды, окраска гематоксилином Гарриса, дифференцировка солянокислым спиртом, окраска эозином, проводка по спиртам возрастающей концентрации до абсолютного этанола, просветление в кислоте, заключение в монтирующую среду) [Саркисов Д.С., Перов Ю.Л. Микроскопическая техника: руководство для врачей и лаборантов. - М.: Медицина 1996. - 542 с.], а также использовали методику трихромной окраски Carstairs для выявления фибрина [Eitzman DT, Bodary PF, Shen Y, Khairallah CG, Wild SR, Abe A, Shaffer-Hartman J, Shayman JA Fabry disease in mice is associated with age-dependent susceptibility to vascular thrombosis. / J Am Soc Nephrol. // 2003 Feb; 14(2):298-302.]. Для анализа морфологических показателей производили микрофотосъемку цифровой камерой Axiocam 105 color (CarlZeiss, Германия) на базе микроскопа Axiocamplus (CarlZeiss, Германия) с использованием объективов х10; х40. Полученные фотографии обрабатывали с помощью программы ZENpro 2012 (ZEISS, Германия).
Данные исследований антитромботической активности Соединения (1) и дабигатрана этексилата представлены в таблице 5.
В результате проведенных экспериментов в группе контрольных животных из 10 погибали 7. Таким образом, выживаемость мышей составила 30%. При этом были отмечены характерные признаки нарушения дыхательной функции легких: наблюдалось увеличение частоты и поверхностный характер дыхания, тетанические судороги, парез задних конечностей, животные принимали характерную позу, при которой задние лапы были выпрямлены и отведены назад. В течение 10 -15 минут после внутривенного введения тромботического агента тромбина в дозе 40 ед. животные погибали.
Дабигатрана этексилат при однократном внутрижелудочном введении предотвращал гибель 60% животных по сравнению с контрольной группой. Соединение (1) по антитромботической активности было сравнимо с дабигатраном этексилатом. Животные, которые погибали на фоне введения исследуемых препаратов, при визуальном наблюдении после поступления в их организм тромботических агентов, были более активны, чем погибающие животные контрольной группы. У них наблюдалось уменьшение выраженности двигательных нарушений, при этом внешние проявления генерализованного тромбоза развивались постепенно (в течение 15-30 минут) в отличие от контрольной группы (10-15 минут). За группой выживших животных наблюдали в течение 7 суток на предмет отдаленной гибели. Таким образом, по антитромботической активности на модели тромбин-индуцированного тромбоза Соединение (1) проявило одинаковое действие с препаратом сравнения дабигатраном этексилатом.
п/п
мг/кг1
тестируемых
животных
животных
животные, %
(физ. раствор)
1 - доза, полученная путем перерасчета с использованием межвидового коэффициента;
2 - доза, эквимолярная дозе дабигатранаэтексилата 12,0 мг/кг.
Примечание: n - число животных.
4.1. Морфологическое исследование легких
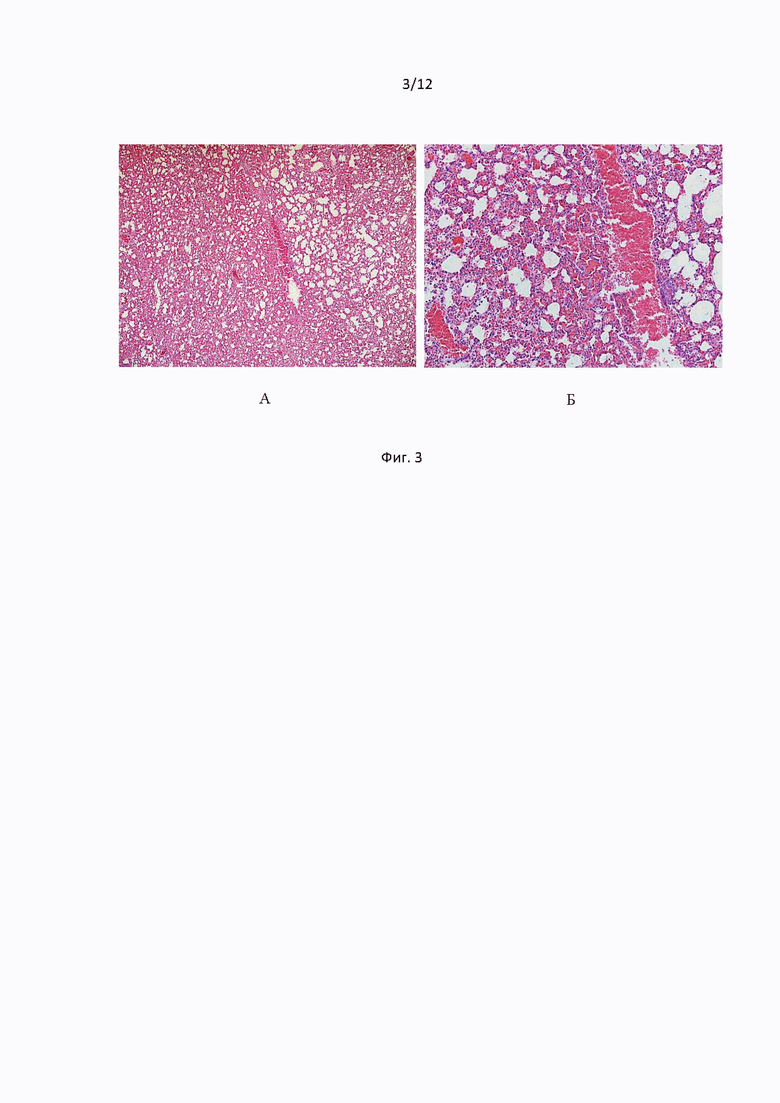
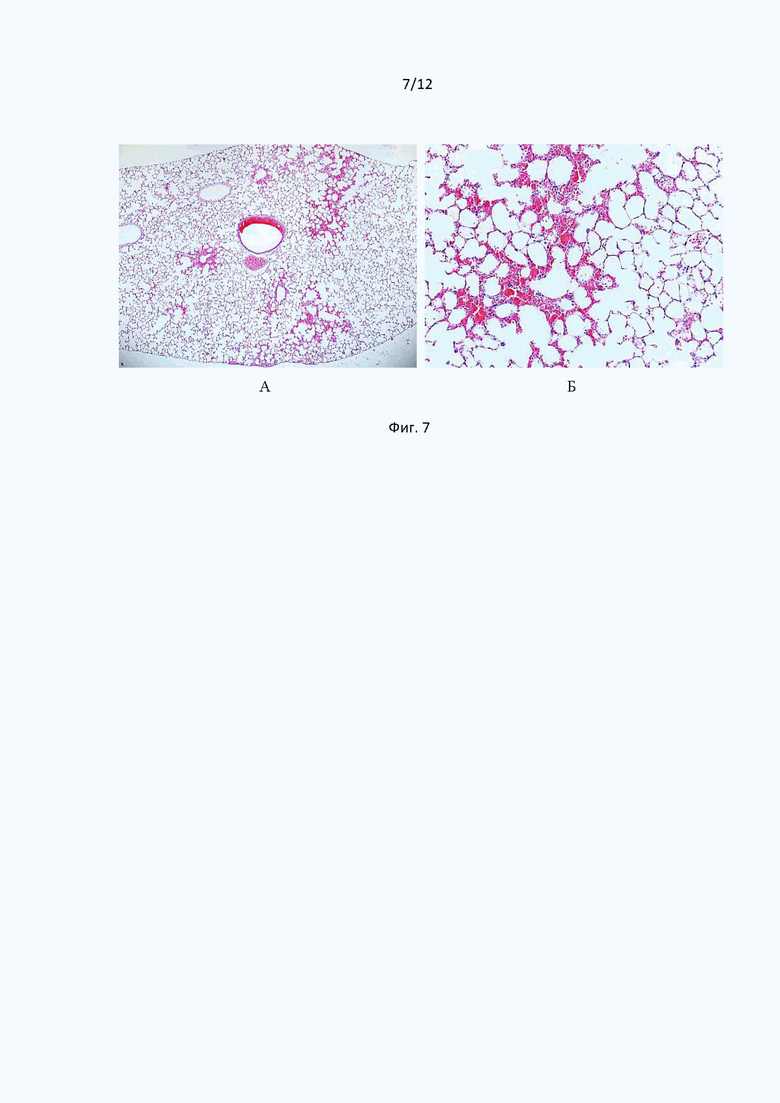
Микроскопическое исследование легочной ткани через 24 часа после введения тромботического агента показало, что у подопытных мышей развивались кровоизлияния очагового характера. В значительной части сосудов микроциркуляторного русла были обнаружены эритроцитарные сладжи, отмечали расширение капилляров межальвеолярных перегородок, а также геморрагический экссудат в стенках и просветах альвеол. Преобладали альвеолы мелких и средних размеров, присутствовали явления дистелектаза (Фиг. 3).
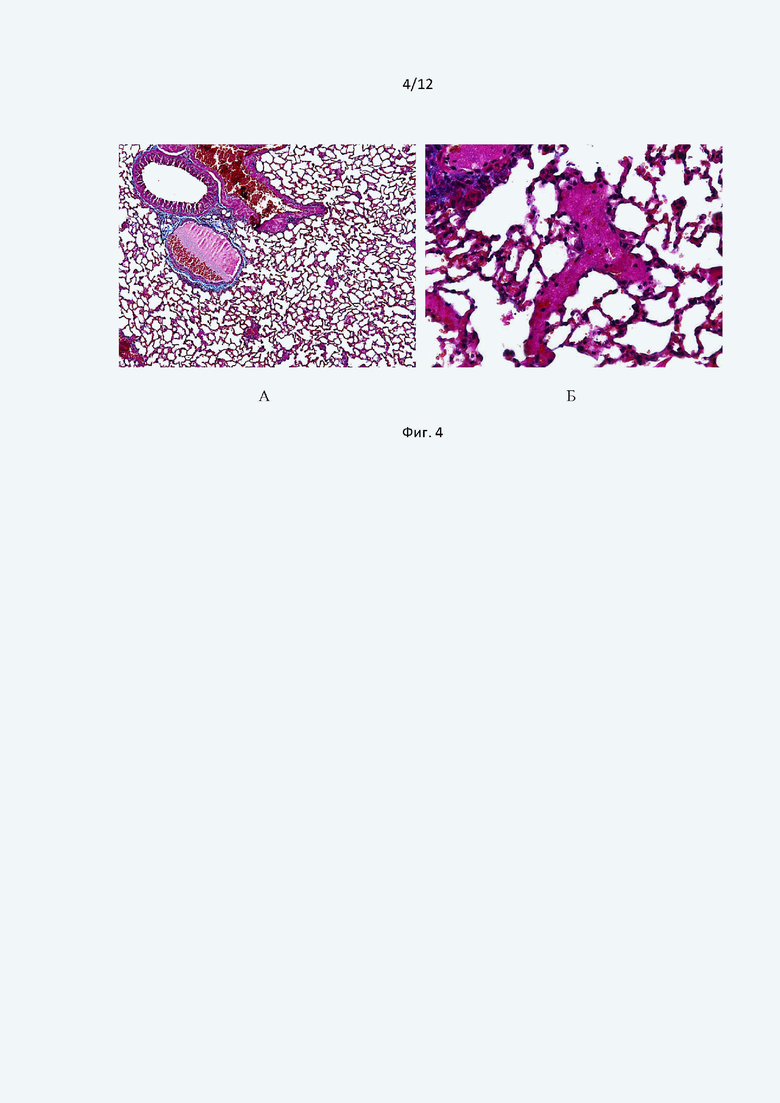
При изучении парафиновых срезов легочной ткани, окрашенных по Carstair, выявляли красные тромбы, состоявшие, преимущественно, из адгезированных эритроцитов и нитей фибрина как в просветах крупных, так и мелких сосудов (Фиг. 4А). Кроме того, отмечено наличие нитей фибрина и в просвете альвеол в составе экссудата (Фиг. 4Б).
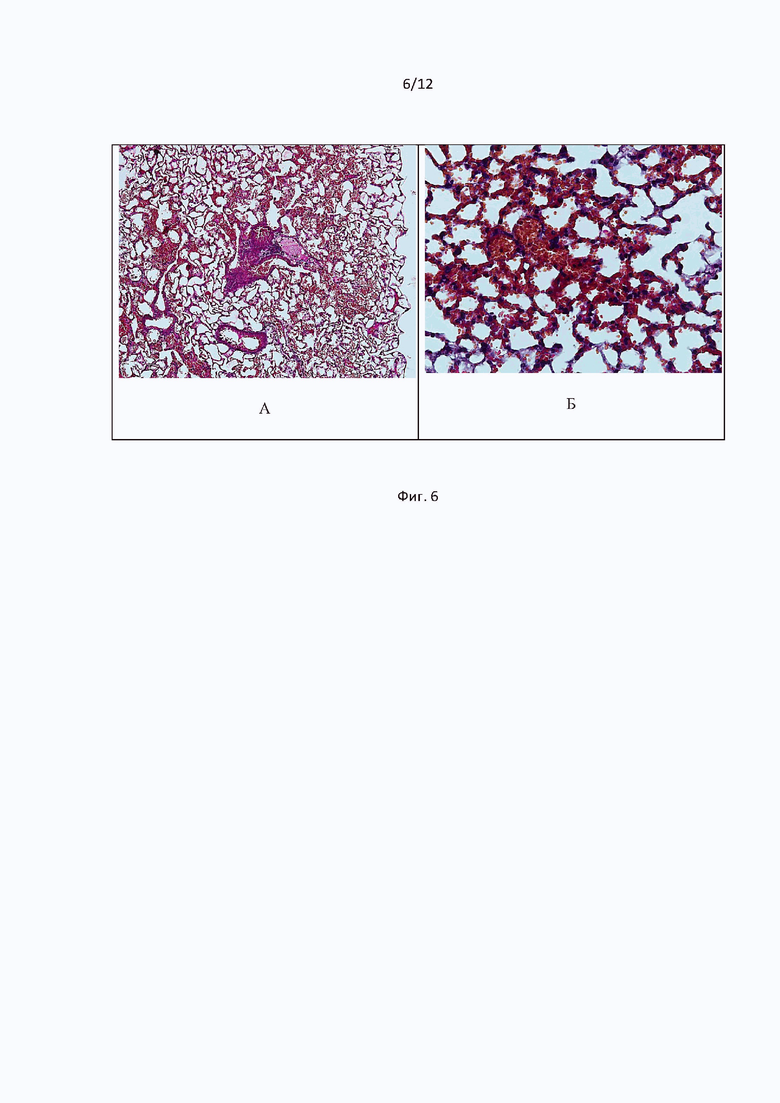
При микроскопическом исследовании ткани легких мышей, получавших дабигатрана этексилат, были выявлены кровоизлияния очагового характера, а также эритростазы в капиллярах межальвеолярных перегородок. При этом толщина большей части межальвеолярных перегородок соответствовала толщине нормальных альвеол. Кроме того, регистрировали адгезированные к сосудистой стенке сладжированные эритроциты (Фиг. 7).
Таким образом, согласно результатам морфологического исследования препараты сравнения дабигатрана этексилата и Соединения (1) на модели тромбин-индуцированного тромбоза способствовали коррекции модельных нарушений реологических свойств крови, тормозя процесс образования внтурисосудистых фибриновых тромбов.
5. Изучение антитромботической активности Соединения (1) на модели тромбоза нижней полой вены.
Исследования выполняли на 45 крысах самцах согласно методике [Peter K., Henke et al. Fibrotic injury after inperimental deep vein thrombosisis determined by the mechanism of thrombogenesis//Thromb.Haemost.- 2007.-98.-P.1045-1055]. У крыс, наркотизированных хлоралгидратом (400 мг/кг) выделяли нижнюю полую вену и осуществляли ее перевязку на 1 см выше места бифуркации. Брюшная часть аорты должна быть незатронутой. Брюшную полость ушивали и через 24 часа крыс повторно наркотизировали и производили лапаротомию с последующим изъятием тромбов из нижней полой вены. Тестируемые образцы вводили однократно внутрижелудочно в вышеуказанных дозах за 2 часа до перевязки нижней полой вены. Контрольной группе животных вводился растворитель в эквивалентном объеме. Группе ложно-оперированных животных также вводился растворитель, проводилась лапаротомия и ушивание брюшной полости, с целью исключения влияния хирургической манипуляции на образование тромба. Оценку антитромботической активности проводили путем взвешивания изъятых тромбов.
Исследование антитромботической активности Соединения (1) на модели венозного тромбоза показало, что оно достоверно способно предотвращать венозный тромбоз нижней полой вены.
Группа ложно-оперированных животных была необходима для того, чтобы показать, что операционные манипуляции с животными не вызывают образование тромба в нижней полой вене. Это было подтверждено проведенными экспериментами (табл. 6). В группе контрольных животных после перевязки нижней полой вены через сутки наблюдалось образование тромбов, средняя масса которых составила 82,3 мг. В опытной группе животных, которым за два часа до перевязки нижней полой вены вводился дабигатрана этексилат в дозе 12,0 мг/кг, средняя масса тромбов была достоверно ниже относительно значений, полученных в контроле на 98,7%. Средняя масса тромбов, изъятых из вен животных, получивших Соединение (1) также была статистически значимо меньше контрольных значений на 82,2% (табл. 6).
Для определения дозозависимой активности препарата сравнения дабигатрана этексилата и Соединения (1), с целью расчета ED50 они были дополнительно исследованы в дозах 3,0; 6,0 мг/кг и 1,25; 2,5; 11,0 мг/кг соответственно. Массы тромбов вен в группе животных, получавших препарат сравнения в дозах 3,0 и 6,0 мг/кг, были достоверно меньше контрольных значений на 86,6% и 30,5% соответственно (табл. 6). При этом ED50 антитромботической активности дабигатрана этексилата составила 3,8 мг/кг.
В группе животных, получавших Соединение (1) в дозе 11 мг/кг, тромбы не обнаруживались. После снижения эквимолярной дабигатрану этексилату дозы в два раза до 2,5 мг/кг, массы тромбов вен достоверно снижались на 74,2%. При дальнейшем уменьшении дозы исследуемого вещества еще в два раза до 1,25 мг/кг, средняя масса тромбов, изъятых из вен животных статистически значимо снижалась относительно группы контрольных животных на 39,3%. ED50 антитромботической активности Соединения (1) составила 1,5 мг/кг.
п/п
образец
тромбов, мг
1 - доза, эквивалентные дозам, используемым для человека в клинической практике, с учетом межвидового коэффициента пересчета;
2 - доза, эквимолярная дозе дабигатрана этексилата.
Примечание: n -количество животных в группе.
Следовательно, по способности уменьшать массу тромба, полученного путем перевязки нижней полой вены и, в частности, по величине ED50 Соединение (1), проявляющее антикоагулянтную активность in vitro и in vivo превосходит известный антикоагулянт прямого действия дабигатрана этексилат в 2,5 раза.
6. Изучение антитромботической активности Соединения (1) на модели тромбоза бедренной вены крыс, индуцированного аппликацией хлорида железа.
Исследования выполнены на 35 крысах самцах. Модель венозного тромбоза бедренной вены у крыс, вызванного поверхностной аппликацией 50% раствора хлорида железа (III) воспроизводили согласно методике [Röttger C., Madlener K., Heil M., Gerriets T., Walberer M., Wessels T. et al., Is heparin treatment the optimal management for cerebral venous thrombosis? Effect of abciximab, recombinant tissue plasminogen activator, and enoxaparin in experimentally induced superior sagittal sinus thrombosis// Stroke. - 2005.-36(4). - P.841], спустя 2 часа после внутрижелудочного однократного введения тестируемых соединений в вышеуказанных дозах. Группе контрольных животных вводился растворитель в эквивалентном объеме. Крыс наркотизировали хлоралгидратом (400 мг/кг внутрибрюшинно) и выделяли бедренную вену, на которую накладывали ватный диск, смоченный 50% раствором хлорида железа (III). Для исследования использовался ультразвуковой доплерограф «Минимакс-Допплер-К» (Санкт-Петербург). Регистрацию кровотока проводили до полной окклюзии сосуда. Об антитромботической активности тестируемых образцов судили по показателю времени образования тромба (время остановки кровотока). (Δ%) пролонгирования времени образования тромба рассчитывался по формуле:
Δ% пролонгирования = (В/А) × 100%-100;
где А - время образования тромба (контрольный образец);
В - время образования тромба при введении опытных образцов.
При обработке бедренной вены крыс раствором хлористого железа (III) происходит образование тромба, показателем которого является время полной окклюзии сосуда (остановка кровотока).
Среднее время окклюзии бедренной вены в контрольной группе животных, которым вводился растворитель, составило 9,3 мин. Антитромботическое действие тестируемых образцов, введенных за 2 часа до начала моделирования тромбоза в эквимолярных дозах представлено в таблице 7.
При этом дабигатрана этексилат в дозе 3 мг/кг увеличивал время наступления окклюзии бедренной вены до 13,3 мин, что на 42,5 % больше значений, полученных в контрольной группе животных. При увеличении дозы препарата сравнения до 6 и 12 мг/кг время окклюзии составило 18,3 и 29,7 минут соответственно. Таким образом, в дозе 6 мг/кг дабигатрана этексилат пролонгировал время образования тромба на 96,2% относительно контрольной группы животных, а при повышении дозы до 12 мг/кг - на 219%. ED50 антитромботической активности дабигатрана этексилата составила 3,5 мг/кг.
Соединение (1) в дозе 1,25 мг/кг удлиняло время образования тромба до 12,8 минут, что на 37,1% больше контрольных показателей. В дозе 2,5 мг/кг тестируемое Соединение (1) увеличивало время наступления полной окклюзии бедренной вены до 18,8 минут, а в дозе 5,5 мг/кг - до 24,1 минуты. При этом время образования тромба Соединение (1) в дозах 2,5 и 5,5 мг/кг пролонгировалось на 101,6 и 158,1 % соответственно. ED50 антитромботической активности тестируемого соединения составила 1,4 мг/кг.
Таким образом, на модели тромбоза бедренной вены, индуцированного 50% хлоридом железа Соединение (1) по показателю ED50 антитромботической активности, превосходило препарат сравнения в 2,5 раза.
образец
бедренной вены, мин
времени окклюзии
бедренной вены
1 - доза, эквивалентные дозам, используемым для человека в клинической практике, с учетом межвидового коэффициента пересчета;
2 - доза, эквимолярная дозе дабигатрана этексилата.
Примечание: n - количество животных в группе.
7. Изучение влияния Соединения (1) на параметры коагулограммы в условиях гиперцитокинемии in vitro и in vivo.
Исследование выполняли на 6 кроликах породы «Шиншилла». Анализ проводили хронометрически, на гемокоагулометре «SOLAR» (Белоруссия) с использованием наборов реактивов производства («Технология-стандарт», Россия). Гиперцитокинемию воспроизводили путем инкубации липополисахарида (ЛПС, E. coli O111:B4; Sigma, CША) с цельной кровью до получения опытных образцов бедной тромбоцитами плазмы в конечной концентрации 10 мкМ и после чего производили измерения по вышеописанным методикам. Cоединение I и дабигатрана этексилат исследовали в диапазоне концентраций 10-0,1 мкМ с расчетом EC50 и условного терапевтического индекса (УТИ).
Опыты in vivo выполняли на 20 крысах самцах. Гиперцитокинемию создавали внутривенным введением ЛПС в дозе 2 мг/кг [QunFu H., Yang T., Xiao W., Fan L., Wu Y., Terrando N., Long Wang T. Prolonged Neuroinflammation after Lipopolysaccharide Exposure in Aged Rats. PLoS One. 2014; 9(8):106331] в хвостовую вену крысы через 2 часа после введения Соединения (1) и препарата сравнения в дозах 5,5 и 12,0 мг/кг соответственно. Через 4 часа после введения ЛПС производили забор крови из брюшной аорты и выполняли оценку антикоагулянтной активности согласно вышеописанным методикам.
Показатель тромбинового времени в контрольных образцах крови, обработанной ЛПС составил 9,3 секунд, что достоверно ниже этих данных в группе интактной крови (см. п 2.1). Препарат сравнения дабигатрана этексилат в концентрации 10 мкМ достоверно удлинял данный показатель до 27,2 секунд, что соответствует достоверному увеличению его относительно контроля на 292,0% (табл.8). При дальнейшем уменьшении концентрации до 5 и 1 мкМ тромбиновое время также статистически значимо пролонгировалось на 208,6 и 51,7% соответственно. В концентрации 0,1 мкМ дабигитрана этексилат не оказывал влияние на данный параметр. ЕC50 антитромбиновой активности препарата сравнения в условиях гиперцитокинемии составило 0,76 мкМ (табл.8).
Соединение (1) в концентрации 10 мкМ достоверно удлиняло показатель тромбинового времени до 33 секунд, что относительно контроля составило на 354,1% больше. При снижении концентрации вещества до 5 и 1 мкМ тромбиновое время статистически значимо увеличивалось относительно контрольных значений на 194,1 и 46,5% соответственно. В концентрации 0,1 мкМ Соединение (1) не влияло на данный параметр. ЕC50 антитромбиновой активности в условиях гиперцитокинемии при этом было равно 0,78 мкМ (табл.8).
Таким образом, в условиях гиперцитокинемии по ЕC50 антитромбиновой активности Соединения (1) и дабигатрана этексилат были сравнимы. Также было показано, что в условиях системной воспалительной реакции данная активность Соединения (1) и дабигатрана этексилата превосходила таковую на интактной крови в 1,6 и 1,8 раза соответственно. По условному терапевтическому индексу Соединение (1) превосходит дабигатрана этексилат в 18 раз (табл.9).
относительно контроля
этексилат
* - данные достоверны относительно контроля, критерий ANOVA (p<0,05);
# - (р≤0,05) изменения статистически значимы по отношению к препарату сравнения дабигатрана этексилату, критерий ANOVA;
n - число тестируемых животных.
п/п
Данные об антикоагулянтной активности in vivo в условиях гиперцитокинемии Соединения (1) представлены в таблице 10.
Показатели коагулограммы достоверно изменялись в условиях системной воспалительной реакции. АЧТВ снижалось в 2,1 раза по отношению к контролю интактных животных, а также уменьшалось тромбиновое время в 1,3 раза, что свидетельствует об активации коагуляционного гемостаза у крыс.
Препарат сравнения достоверно уменьшал АЧТВ относительно контрольной крови крыс, которым вводили ЛПС в 2,2 раза. При этом тромбиновое время статистически значимо удлинялось в 12,8 раза. Соединение (1) также достоверно пролонгировало АЧТВ в 1,6 раза. При этом тромбиновое время крови крыс увеличивалось в 14,5 раза. Соединение (1) и дабигатрана этексилат не оказывали влияния на протромбиновое время. Таким образом, в условиях системной воспалительной реакции Соединение (1) проявляет более выраженное антитромбиновое действие, чем в ее отсутствие, что свидетельствует о действии данного вещества на воспалительные компоненты крови.
1 - доза, полученная путем перерасчета с использованием межвидового коэффициента;
2 - доза, эквимолярная дозе дабигатрана этексилата 12,0 мг/кг;
* - данные достоверны относительно контроля с LPS, критерий ANOVA (p<0,05);
# - данные, достоверны относительно контроля (физ. раствор).
8. Изучение влияния Соединения (1) на образования внеклеточных ловушек нейтрофилов.
Определение внеклеточных нейтрофильных ловушек, индуцированных ЛПС-стимулированными тромбоцитами, проводили по методу [Clark S. R. и соавт. Platelet TLR4 activates neutrophil extracellular traps to ensnare bacteria in septic blood // Nature medicine. - 2007. - Т. 13. - №. 4. - С. 463-469]. Использовали кровь, стабилизированную 3,8% цитратом натрия (1:10). Кровь центрифугировали при 1000 g 10 мин, богатую тромбоцитами плазму отделяли и приводили до концентрации 1,0×106 клеток/мл в аутологичной плазме. тромбоциты и лейкоциты градиентным центрифугированием на Ficoll (GE Healthcare) плотностью 1,077 г/мл и 1,091 г/мл (1:1). Тромбоциты с исследуемыми соединениями или ДМСО и 10 мкг/мл ЛПС E. coli O26:B6 инкубировали 30 мин. В качестве растворителя использовали 1% раствор водный ДМСО. Активированные тромбоциты соединяли с аутологичными лейкоцитами в слайд-флаконе. Фиксировали по Май-Грюнвальду и окрашивали по Романовскому-Гимзе. Считали количество нейтрофильных ловушек на 100 нейтрофилов при увеличении ×400.
Инкубация покоящихся нейтрофилов с аутологичными тромбоцитами не приводит к образованию ими внеклеточных ловушек. В то же время при инкубации с ЛПС-стимулированными тромбоцитами наблюдается время-зависимое увеличение доли нейтрофилов, выпустивших ловушки (Таблица 11). При предварительной обработке клеток Соединением (1) выявлено почти полное подавление образования нейтрофильных ловушек через 1 час инкубации с ЛПС-стимулированными тромбоцитами. Через 2 часа инкубации доля нейтрофилов с ловушками значимо не отличается от проб с ЛПС. Препарат сравнения дабигатрана этексилат в тех же условиях подавляет образование внеклеточных ловушек в обеих временных точках.
п/п
9. Изучение влияния Соединения (1) на образования тканевого фактора ЛПС-стимулированными моноцитами
Кровь, стабилизированную 3,8% цитратом натрия (1:10), центрифугировали при 1000 g 10 мин. и отбирали плазму. В пробирки с 5 мл цельной крови вносили растворы исследуемых соединений в 1% ДМСО или только ДМСО в равной концентрации и ЛПС E. coli O26:B6 до концентрации 1 мкг/мл. Пробы инкубировали 4 часа при 37 °С в орбитальном шейкере ES-20/60 (Biosan, Латвия). Моноциты выделяли путем наслаивания на Phicoll (GE Healthcare) плотностью 1,077 г/мл [Drake T. A. et al. Functional tissue factor is entirely cell surface expressed on lipopolysaccharide-stimulated human blood monocytes and a constitutively tissue factor-producing neoplastic cell line // The Journal of cell biology. - 1989. - Т. 109. - №. 1. - С. 389-395]. Гомогенат вносили по 100 мкл в 96-луночный прозрачный планшет, добавляли 100 мкл 25 мМ раствора кальция хлорида и 100 мкл плазмы крови, бедной тромбоцитами. Активность тканевого фактора на моноцитах оценивали по кинетике полимеризации фибрина при длине волны 365 нм с помощью микропланшетного ридера Infinite M200 PRO (Tecan, Австрия) [Miserez R., Jungi T. W. LPS-induced, but not interferon-gamma-induced procoagulant activity of suspended human macrophages is followed by a refractory state of low procoagulant expression // Thrombosis research. - 1992. - Т. 65. - №. 6. - С. 733-744].
Моноцитарные клетки периферической крови под действием ЛПС экспрессировали активный тканевой фактор (ТФ, также известный как фактор коагуляции VIIa), что отражается в ускорении образования нитей фибрина (снижение показателя T1/2 в два раза). Инкубация моноцитов в присутствии дабигатрана этексилата и Соединения (1) вела к существенному замедлению ТФ-опосредованной полимеризации фибрина, что характеризуется увеличением показателя T1/2 в 5,5 и 10,1 раза относительно пробы с ЛПС, соответственно (Таблица 12).
п/п
T1/2 - время полумаксимальной полимеризации фибрина;
95% Д.И. - 95% доверительный интервал.
10. Изучение влияние Соединения (1) на синтез оксида азота тромбин-стимулированными макрофагами
Перитонеальные макрофаги (ПМ) выделяли из перитонеального экссудата белых беспородных мышей после введения 1 мл 3% раствора пептона. Концентрацию клеток доводили до 1,0×106 клеток/мл в полной питательной среде DMEM (Gibco), дополненной 2 мМ L-глутамина (Gibco), 10% инактивированной нагреванием фетальной бычьей сывороткой (BioClot, Германия), с добавлением 100 ЕД/мл пенициллина и 100 мг/мл стрептомицина (Gibco). Высевали 200 мкл/лунку в 96-луночные прозрачные планшеты (SPL Life Sciences Co., Ltd., Корея). Оставляли на 2 ч при 37°С в увлажненной атмосфере с 5% СО2, после чего лунки промывали для удаления неадгезивных клеток. После 24 часов инкубации отбирали 20 мкл супернатанта и вносили 20 мкл растворов исследуемых соединений в 1% ДМСО или только ДМСО в равной концентрации. Определение оксида азота в супернатантах определяли с помощью стандартного метода Грисса [Weissman B. A., Gross S. S. Measurement of NO and NO synthase // Current Protocols in Neuroscience. - 1998. - Т. 5. - №. 1. - С. 7.13. 1-7.13. 22].
Стимуляция макрофагов тромбином ведет к их провоспалительной активации, одним из следствий которой служит синтез и накопление в культуральной среде оксида азота. Преинкубация с Соединением (1) ведет к концентрационно-зависимому ингибированию синтеза оксида азота в ответ на стимуляцию тромбином. Дабигатрана этексилат не обладает таким эффектом. Соединение (1) и препарат сравнения не проявили в эксперименте цитотоксических свойств в виде снижения метаболической активности или нарушения целостности цитоплазматической мембраны (Таблица 13).
п/п
Определение цитотоксичности на перитонеальных макрофагах
Для определения активности лактатдегидрогеназы 10 мкл супернатантов, отобранных спустя 24 часа после инкубации ПМ с исследуемыми соединениями и ЛПС, смешивали с 250 мкл 0,194 нМ/л раствора NADH растворенного в 54 мМ фосфатном буферном растворе, pH 7,5 и добавляли 25 мкл 6,48 мМ раствора пирувата натрия. Определяли оптическую плотность при длине волны 340 нм в течении 20 мин. с помощью микропланшетного ридера Infinite M200 PRO (Tecan, Австрия) [Cummings B. S., Schnellmann R. G. Measurement of cell death in mammalian cells // Current protocols in pharmacology. - 2004. - Т. 25. - №. 1. - С. 12.8. 1-12.8. 22]. После 24 инкубации клеток с тестируемыми соединениями в каждую лунку вносили 20 мкл раствора МТТ, инкубировали в течение 4 часов при 37 °С в увлажненной атмосфере, содержащей 5% СО2. Культуральную среду удаляли, клетки лизировали и растворяли кристаллы формазана в 150 мкл ДМСО. Планшеты встряхивали при комнатной температуре в течение 10 мин. и измеряли оптическую плотность при длине волны 565 нм в микропланшетном ридере Infinite M200 PRO (Tecan, Австрия) [Ehrich M., Sharova L. In vitro methods for detecting cytotoxicity // Current protocols in toxicology. - 2000. - Т. 3. - №. 1. - С. 2.6. 1-2.6. 27].
11. Изучение влияния Соединения (1) на выживаемость мышей при моделировании ЛПС-индуцированного тромбоза легких на мышах.
Исследование выполняли на 30 белых беспородных мышах самцах. Введение растворов Соединения (1) и препарата сравнения осуществляли однократно внутрижелудочно за 2 часа до моделирования тромбоза в дозах 13,0 и 27,0 мг/кг соответственно. Контрольной группе животных вводился растворитель (дистиллированная вода). Моделирование острого тромбоза у мышей проводилось путем введения ЛПС в дозе 2 мг/кг, который растворяли в физиологическом растворе. Контрольной группе животных вводился растворитель (дистиллированная вода). У умерших животных проводили забор легких для гистологической оценки. За группой выживших животных наблюдали в течение 7 суток на предмет отдаленной гибели.
Морфологическое исследование ткани легких осуществляли по вышеописанному методу.
В результате выполненных исследований в группе контрольных животных наблюдалась гибель 100% мышей (табл. 14). При этом перед смертью у животных наблюдалось учащение дыхания, появлялись судороги, животные принимали характерную позу, при которой задние лапы были выпрямлены и отведены назад. В течение суток после внутривенного введения ЛПС в дозе 2 мг/кг животные погибали.
Оценку влияния Соединения (1) и дабигатрана этексилата, которые вводили за 2 часа до создания гиперцитокинемии, проводили через сутки после введения ЛПС. Дабигатрана этексилат при однократном внутрижелудочном введении достоверно предотвращал гибель 6 животных из 10 по сравнению с контрольной группой, в которой погибло 10 мышей. В группе животных, получавших Соединение (1) погибло 2 мыши из 10 (табл.14).
Животные, которые погибали на фоне введения исследуемых соединений, при визуальном наблюдении после поступления в их организм тромботических агентов, были более активны, чем погибающие животные контрольной группы. У них наблюдалось уменьшение выраженности двигательных нарушений по сравнению с контрольной группой. За группой выживших животных наблюдали в течение 7 суток на предмет отдаленной гибели.
п/п
мг/кг1
животных
животные, %
(физ. раствор)
1 - доза, полученная путем перерасчета с использованием межвидового коэффициента;
2 - доза, эквимолярная дозе дабигатрана этексилата 12,0 мг/кг.
Примечание: n - число животных.
Морфологическое исследование легких
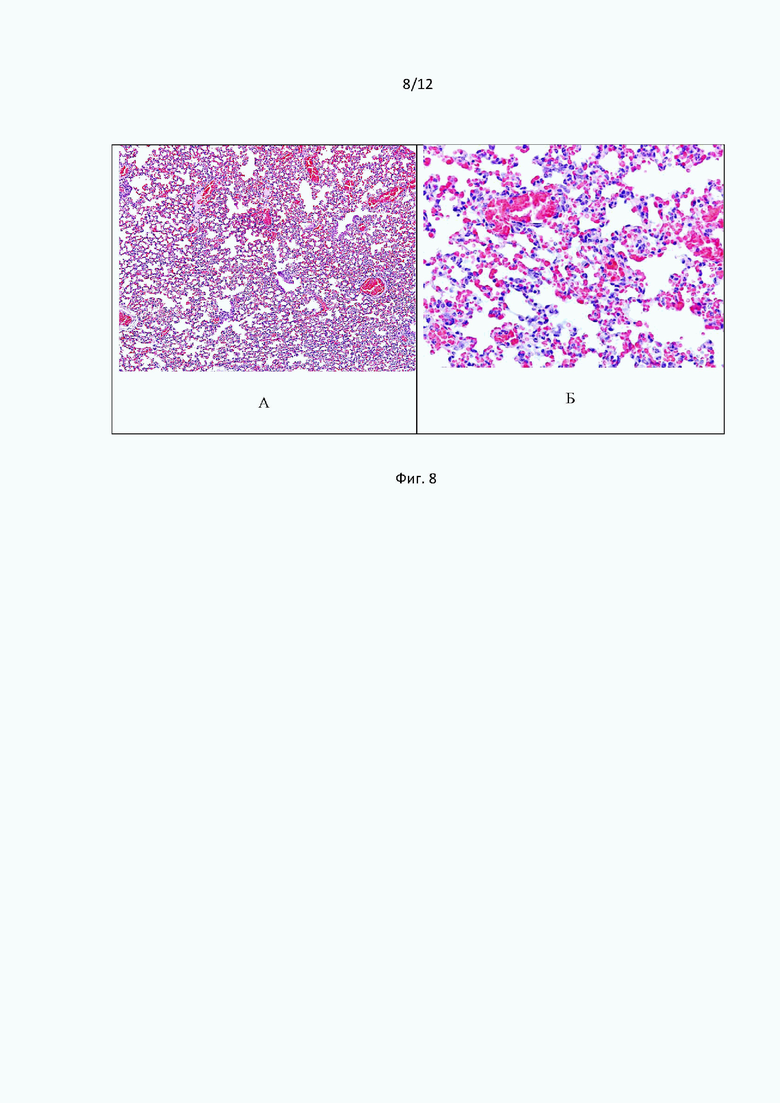
Микроскопическое исследование легочной ткани мышей через 24 часа после внутривенного введения бактериального липополисахарида в дозе 2 мг/кг показало, что в органе преобладали нарушения кровообращения, реализованные кровоизлияниями очагового характера, венозным полнокровием, геморрагическим и геморрагически-серозным экссудатом в стенках и просветах альвеол. Присутствовали признаки дистелектаза. В значительной части сосудов микроциркуляторного русла были обнаружены эритроцитарные сладжи (Фиг. 8).
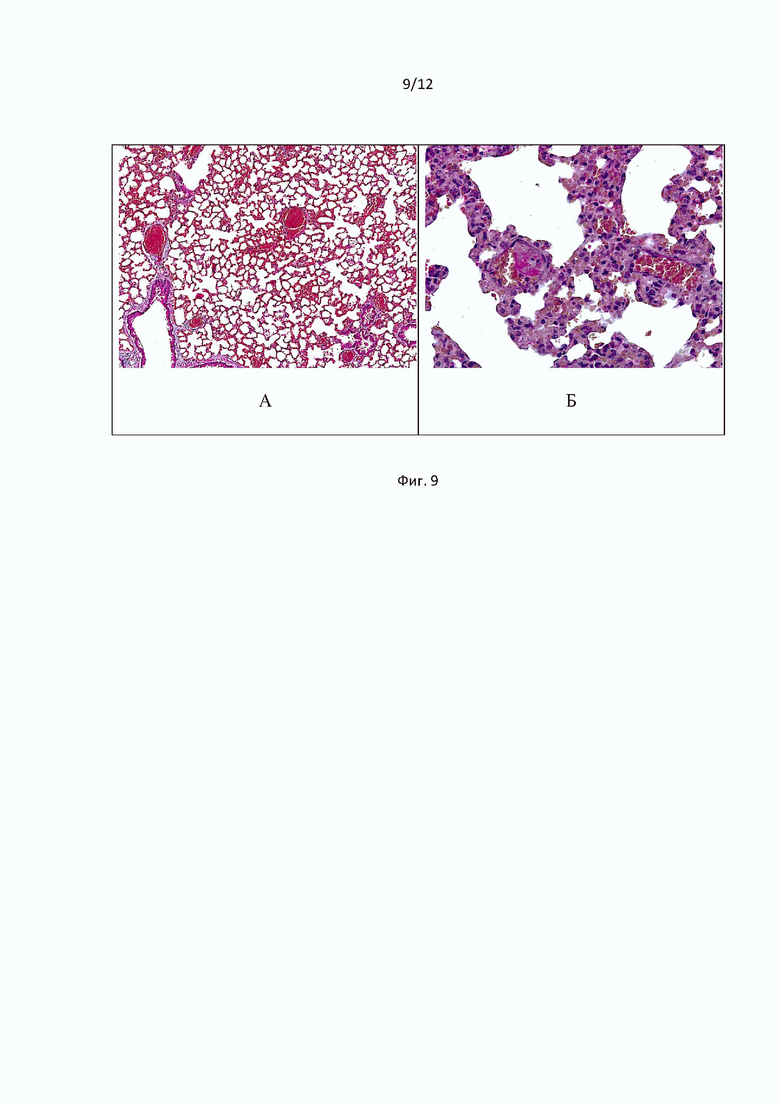
При изучении парафиновых срезов легочной ткани мышей, окрашенных по Carstair, через 24 часа после внутривенного введения бактериального липополисахарида в дозе 2 мг/кг, регистрировали венозное полнокровие и сладжированные эритроциты, формирующие первичные красные тромбы, обтурирующие просветы крупных и мелких сосудов (Фиг. 9А). В пристеночной части сосудов обнаруживались адгезированные сформированные фибриновые сгустки, в составе которых определялся незначительный коллагеновый компонент. Кроме того, небольшие депозиты фибрина откладывались в стенках альвеол (Фиг. 9Б).
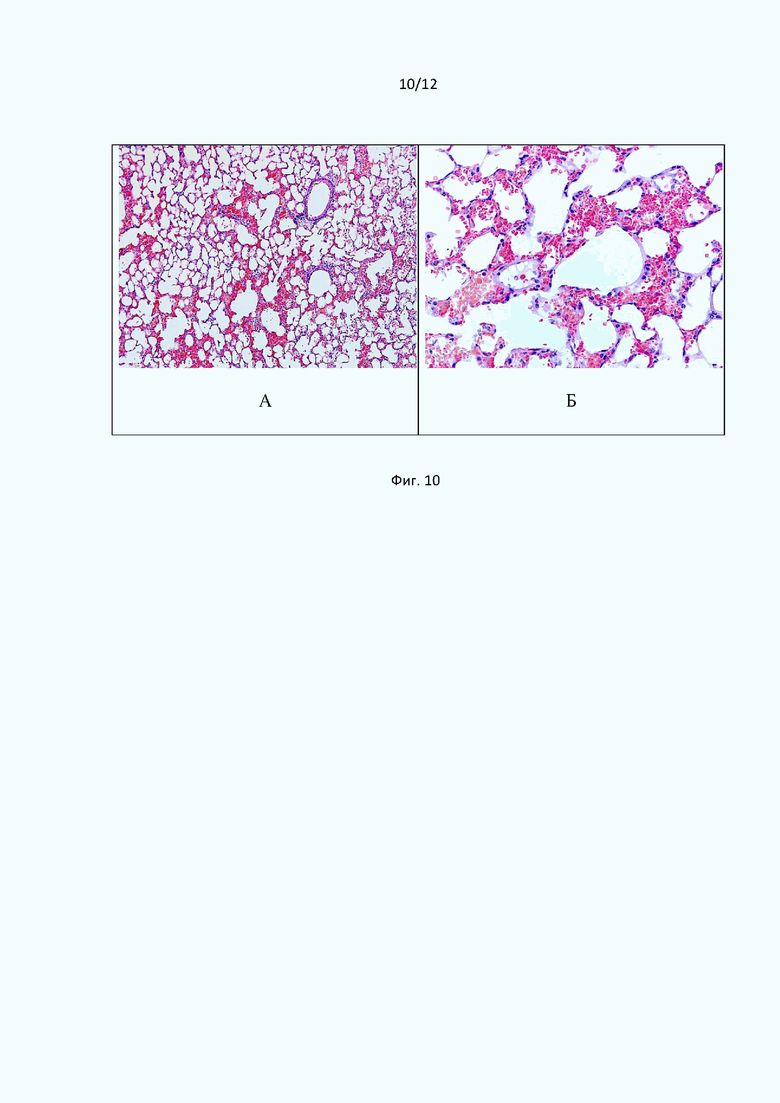
При микроскопическом исследовании ткани легких мышей, получавших Соединение (1) в дозе 13 мг/кг на фоне ЛПС-индуцированного генерализованного острого повреждения, у большинства подопытных животных патологический процесс был менее выражен и характеризовался преимущественно диапедезом эритроцитов в межальвеолярные перегородки, в полости альвеол, очаговыми мелкими кровоизлияниями и явлениями дистелектаза. В альвеолярных полостях присутствовал геморрагический экссудат (Фиг. 10). В то же время общая гистоархитектоника легочной ткани была сохранена.
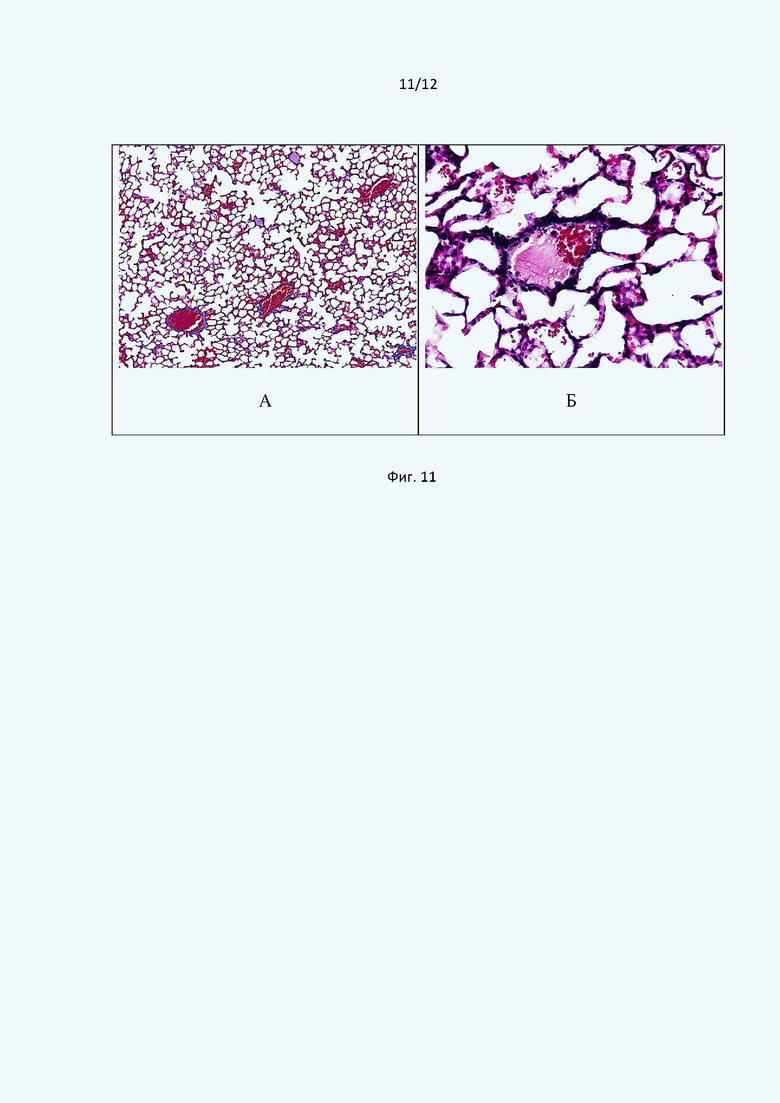
Окрашивание парафиновых срезов легочной ткани подопытных мышей трихромной окраской по Carstair показало, что в большинстве случаев тромбы были представлены сладжированными эритроцитами, обтурирующими просветы крупных сосудов (Фиг. 11А). При этом в отдельных случаях в просвете мелких сосудов выявлялся фибриновый компонент в виде тонких нитей (Фиг. 11Б).
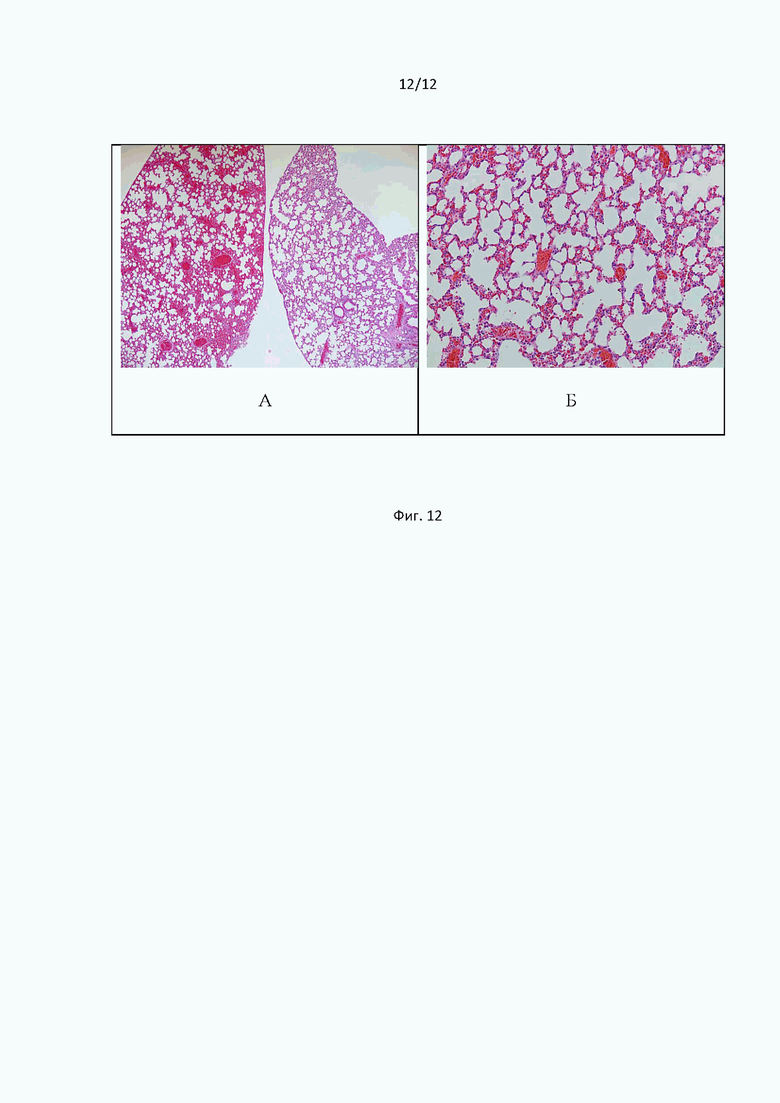
При микроскопическом исследовании ткани легких мышей, получавших дабигатрана этексилат, у половины подопытных животных были выявлены кровоизлияния очагового и сливного характера, а также полнокровие капилляров межальвеолярных перегородок и венозное полнокровие. В альвеолярных полостях присутствовал геморрагический экссудат. Просветы мелких и крупных сосудов были практически полностью закрыты склеенными эритроцитами (Фиг. 12А).
У второй половины животных патологический процесс был менее выражен и характеризовался, преимущественно, диапедезом эритроцитов в межальвеолярные перегородки, в полости альвеол, очаговыми мелкими кровоизлияниями и явлениями дистелектаза. Сладжированные эритроциты обтурировали просветы мелких сосудов (Фиг. 12Б).
Согласно результатам морфологического исследования, однократное введение дабигатрана этексилата и Соединения (1) при остром ЛПС-индуцированном повреждении легких слабо способствовало восстановлению нарушенного кровообращения в легочной ткани, но защищало альвеолы от острого повреждения. При этом наибольшим потенциалом обладало Соединение (1).
Таким образом, лекарственное средство, содержащее в качестве активного компонента Соединение (10) - 5,7-ди(тиофен-2-ил)-4,5-дигидро-[1,2,4]триазоло[1,5-а]пиримидин, обладает антикоагулянтной (ингибитор IIa фактора), антитромботической и противовоспалительной активностью, превышающей активность известных лекарственных средств, и может быть использовано для лечения и профилактики тромбозов и тромбоз-ассоциированных заболеваний.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
Фиг. 1 иллюстрирует влияние Соединения (1) и препарата сравнения дабигатрана этексилата на метаболическую активность (жизнеспособность) клеток линии HepG2 при 48 часовой инкубации в МТТ-тесте.
Фиг. 2 приводит микрофотографии клеток линии HepG2 после 48 часовой инкубации с образцами Соединения (1) и препарата дабигатрана этексилата в концентрации 100 мкМ (фазовоконтрастная микроскопия, ×400): А - Контроль, ростовая среда F-12; Б - Соединение (1), 100мкМ; В - Дабигатрана этексилат (гранулят), 100мкМ.
Фиг. 3 иллюстрирует срезы гистологических образцов легких мышей контрольной группы после введения тромботического агента. Окраска гематоксилин-эозином. Общее увеличение ×50 (А); ×200 (Б).
Фиг. 4 иллюстрирует cрезы гистологических образцов легких мышей контрольной группы после введения тромботического агента. Трихромная окраска по Carstair. Общее увеличение ×100 (А); ×400 (Б).
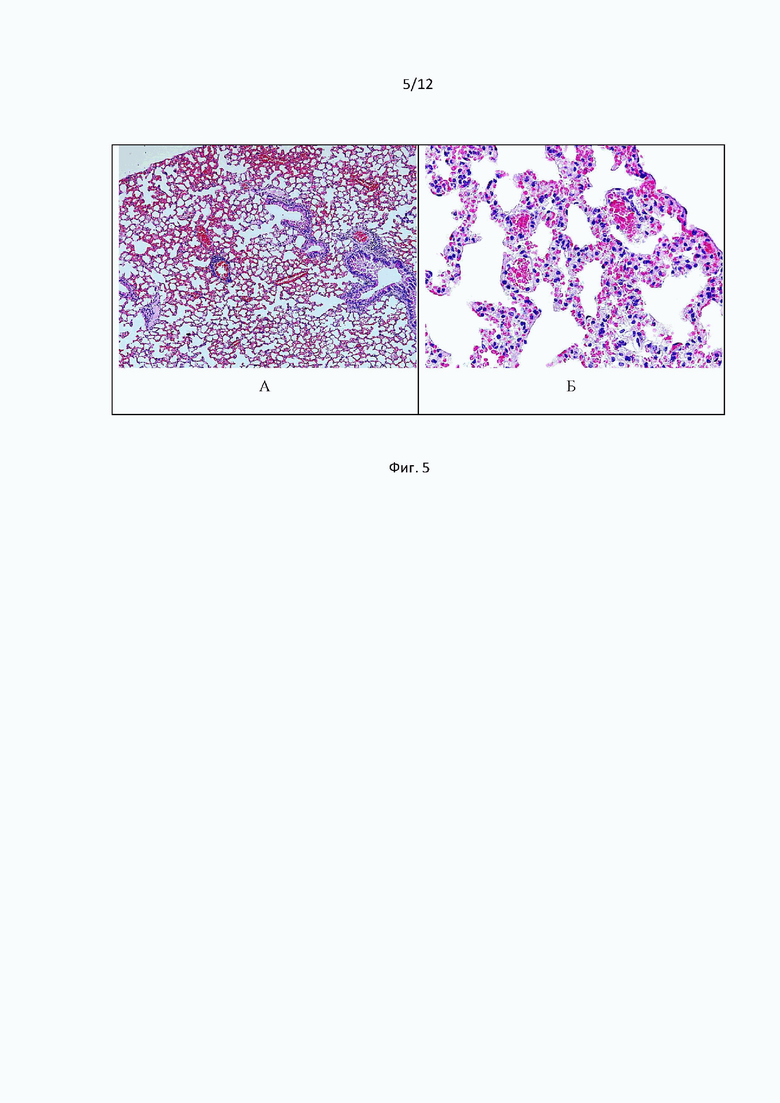
Фиг. 5 иллюстрирует cрезы гистологических образцов легких мышей, получавших Соединение (1) на модели тромбин-индуцированного тромбоза легких. Окраска гематоксилин-эозином. Общее увеличение ×100 (А); ×400 (Б).
Фиг. 6 иллюстрирует cрезы гистологических образцов легких мышей, при однократном внутрижелудочном введении Соединения (1) на модели тромбин-индуцированного тромбоза легких. Трихромная окраска по Carstair. Общее увеличение ×100 (А); ×200 (Б).
Фиг. 7 иллюстрирует cрезы гистологических образцов легких мышей при однократном внутрижелудочном введении дабигатрана этексилата на модели тромбин-индуцированного тромбоза легких. Окраска гематоксилин-эозином. Общее увеличение ×50 (А); ×200 (Б).
Фиг. 8 иллюстрирует срезы гистологических образцов легких контрольной группы мышей через 24 часа после введения ЛПС в дозе 2 мг/кг. Окраска гематоксилин-эозином. Общее увеличение ×100 (А); ×400 (Б).
Фиг. 9 иллюстрирует срезы гистологических образцов легких контрольной группы мышей через 24 часа после введения ЛПС в дозе 2 мг/кг. Трихромная окраска по Carstair. Общее увеличение ×100 (А); ×400 (Б).
Фиг. 10 иллюстрирует срезы гистологических образцов легких мышей при однократном внутрижелудочном введении Соединения (1) на фоне интоксикации липополисахаридом. Окраска гематоксилин-эозином. Общее увеличение ×100 (А); ×400 (Б).
Фиг. 11 иллюстрирует срезы гистологических образцов легких мышей при однократном внутрижелудочном введении Соединения (1) на фоне интоксикации липополисахаридом. Трихромная окраска по Carstair. Общее увеличение ×100 (А); ×400 (Б).
Фиг. 12 иллюстрирует срезы гистологических образцов легких мышей при однократном внутрижелудочном введении дабигатрана этексилата на фоне интоксикации липополисахаридом. Окраска гематоксилин-эозином. Общее увеличение ×50 (А); ×200 (Б).
| название | год | авторы | номер документа |
|---|---|---|---|
| Диметил 7-метил-2-n-толил-4-фенилпирроло[2,1-f] [2,1,4]триазин-5,6-дикарбоксилат, обладающий антикоагулянтным действием | 2022 |
|
RU2790375C1 |
| Антикоагулянтное лекарственное средство, представляющее собой синтетический дипептид Ac-Trp-Arg-Pip ⋅HCl, фармацевтическая композиция, включающая это антикоагулянтное лекарственное средство | 2019 |
|
RU2712194C1 |
| СРЕДСТВО, ОБЛАДАЮЩЕЕ АНТИАГРЕГАНТНОЙ И АНТИКОАГУЛЯНТНОЙ АКТИВНОСТЬЮ | 2015 |
|
RU2601407C1 |
| АНТИТРОМБОТИЧЕСКОЕ СРЕДСТВО ИЗ ЦЕЛЛЮЛОЗЫ ПИХТЫ СИБИРСКОЙ | 2014 |
|
RU2571555C1 |
| СРЕДСТВО, ОБЛАДАЮЩЕЕ АНТИАГРЕГАНТНОЙ И АНТИКОАГУЛЯНТНОЙ АКТИВНОСТЬЮ | 2014 |
|
RU2573379C1 |
| СПОСОБ ИНГИБИРОВАНИЯ ТРОМБООБРАЗОВАНИЯ И УСКОРЕНИЯ ФИБРИНОЛИЗА С ПОМОЩЬЮ ДНК АПТАМЕРОВ, ИНГИБИРУЮЩИХ АКТИВНОСТЬ ТРОМБИНА, В ЭКСПЕРИМЕНТЕ | 2014 |
|
RU2559545C1 |
| Применение икаритина для получения лекарственных средств | 2021 |
|
RU2806093C1 |
| СРЕДСТВО С АНТИТРОМБОТИЧЕСКОЙ АКТИВНОСТЬЮ | 2016 |
|
RU2627435C1 |
| (2S,4S)-4-Амино-N-(4-фторфенил)пироглутаминовая кислота, обладающая церебропротекторным, ноотропным и антитромботическим действием | 2021 |
|
RU2769521C1 |
| СРЕДСТВО, ПРОЯВЛЯЮЩЕЕ АНТИАГРЕГАНТНУЮ И АНТИТРОМБОГЕННУЮ АКТИВНОСТИ | 2010 |
|
RU2453312C1 |

Изобретение относится к области медицины, а именно к лекарственному средству, обладающему антикоагулянтной, антитромботической, противовоспалительной активностями. Лекарственное средство, обладающее антикоагулянтной – ингибитор IIa фактора, антитромботической и противовоспалительной активностями и содержащее 5,7-ди(тиофен-2-ил)-4,5-дигидро-[1,2,4]триазоло[1,5-а]пиримидин. Вышеуказанное изобретение позволяет расширить арсенал лекарственных средств для предотвращения тромбоза. 12 ил., 14 табл., 3 пр.
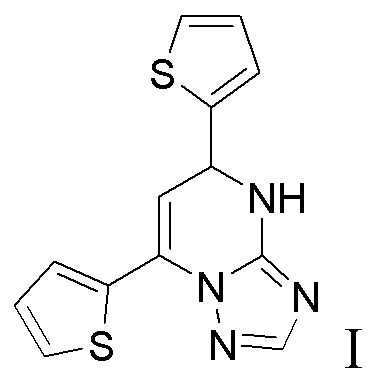
Лекарственное средство, обладающее антикоагулянтной – ингибитор IIa фактора, антитромботической и противовоспалительной активностями и содержащее 5,7-ди(тиофен-2-ил)-4,5-дигидро-[1,2,4]триазоло[1,5-а]пиримидин формулы I
| ПРОИЗВОДНЫЕ [1,2,4]ТРИАЗОЛО[1,5-a]ПИРИМИДИН-2-ИЛМОЧЕВИНЫ И ЕГО ПРИМЕНЕНИЕ | 2004 |
|
RU2348636C2 |
| 7-(4-Метоксифенил)-5-фенил-4,5-дигидро-[1,2,4]триазоло[1,5-а]пиримидин как активатор глюкокиназы и ингибитор дипептидилпептидазы типа 4 и способ его получения | 2017 |
|
RU2642432C1 |
| Способ бактериального извлечения марганца из руд | 1985 |
|
SU1407985A1 |
| ПОЛИКАРЧУК В.А | |||
| и др | |||
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| Химия гетероциклических соединений | |||
| Способ восстановления спиралей из вольфрамовой проволоки для электрических ламп накаливания, наполненных газом | 1924 |
|
SU2020A1 |
Авторы
Даты
2023-06-23—Публикация
2022-07-07—Подача