ОБЛАСТЬ ТЕХНИКИ
Изобретение относится к технологиям специфической сорбции отдельных компонентов плазмы крови, применяемых для медицинских целей, а именно для экстракорпоральной терапии больных с онкологическими заболеваниями.
УРОВЕНЬ ТЕХНИКИ
Циркулирующая плазма содержит различные клеточные, субклеточные и молекулярные компоненты. В здоровом организме состав компонентов плазмы относительно стабилен, развитие различных заболеваний может сопровождаться качественными или количественными изменениями состава плазмы крови. В медицине широко используются различные технологии экстракорпоральной коррекции состава циркулирующий плазмы, включающие методы терапевтического плазамафереза или плазмасорбции. Исходной технологией можно считать метод терапевтического плазмафереза, суть которого заключается в удалении (замещении) определенного объёма плазмы, содержащей как патогенные, так и жизненно необходимые компоненты. Развиваются и находят клиническое применение различные технологии специфичного удаления определенных компонентов плазмы, которая затем «возвращается» в кровяное русло пациента. Например, использование сорбентов с определенными характеристиками поверхности (Патент РФ: RU2641924 С1) или иммобилизованного на поверхности инертной матрицы лизоцима (Патент РФ: RU2684639C1) позволяет удалять бактериальные токсины, a использование бензойного альдегида в качестве лиганда, иммобилизированного на поверхности биосовместимой агарозной матрицы, позволяет удалять из плазмы атерогенные липиды и С-реактивный белок (Патент РФ: RU2700605C1). В целом, технологии экстракорпоральной терапии развиваются в направлении повышения специфичности и контролируемости сорбции компонентов плазмы (1,2).
Внеклеточные везикулы (пузырьки) секретируются всеми клетками организма во внеклеточное пространство. Внеклеточные нановезикулы (ВНВ), размером 50-120 нм, которые образуются в процессе формирования в клеточной цитоплазме «мультивезикулярных телец» (МВЦ) и секретируются путем слияния мембраны МВЦ и плазматической мембраны клетки, принято называть «экзосомами». Биохимический состав ВНВ близок к составу клеток-продуцентов, биологическая роль включает выделение из клеток и межклеточный транспорт различных молекулярных субстанций (3). Биологические жидкости организма содержат ВНВ, секретируемые различными, преимущественно анатомически близлежащими, клетками. Циркулирующая плазма содержит ВНВ, секретируемые всеми клетками организма, хотя основной вклад вносят клетки крови и эндотелия. Концентрация ВНВ в плазме зависит от технологии их выделения и количественной оценки и составляет 1010–1011 везикул/мл, концентрация везикулярных белков в плазме оценивается в диапазоне 0,5–5 мг/мл (4). ВНВ являются значимым компонентом плазмы крови, в области клинической онкологии их анализ имеет большой диагностический потенциал (5), а выделение и возможности терапевтической модификации открывают перспективы разработки новых лечебных технологий (6,7). Но существующие методы выделения ВНВ технически нетривиальны из-за малого размера и отсутствия у ВНВ выраженных физических или биохимических особенностей, на основе которых можно было бы разработать эффективные методы выделения (8). Кроме того, плазма является сложной по составу жидкостью, в состав которой входят различные компоненты, близкие по размеру, плотности или биохимическому составу к ВНВ. Разработано множество технологий выделения ВНВ из плазмы для решения аналитических задач (т.е. ex vivo) (8), многие защищены патентами РФ (RU2556825C1, RU 2741776C1, RU2741638C1). Но эти технологии применимы для работы с образцами плазмы и не могут быть использованы в рамках методов экстракорпоральной терапии.
Плазма пациентов с онкологическими заболеваниями содержит пул нормальных ВНВ и фракцию везикул, секретируемых клетками опухоли. Патогенный характер ВНВ, секретируемых клетками злокачественных опухолей, показан авторами многих экспериментальных исследований и включает, например, эффекты стимуляции метастатической диссеминации (9), угнетения противоопухолевого иммунитета (10). В ряде исследований было показано, что не только ВНВ, секретируемые клетками опухоли, но все ВНВ плазмы оказывают стимулирующий эффект на злокачественные клетки и потенциируют образование метастазов (11). С учетом отсутствия надежных методов удаления из плазмы отдельных популяций ВНВ, идея удаления всех везикул плазмы в рамках процедуры экстракорпоральной сорбции была предложена еще в 2013 году (12). За последние годы актуальность разработки технологии экстракорпоральной сорбции ВНВ подтвердилась результатами исследований, показавших, что ВНВ снижают эффективность действия многих противоопухолевых лекарственных средств, включая традиционные цитостатики (13), таргетные препараты (т.н. “small drug”) (14) и моноклональные антитела (15).
Аналогом изобретения является технология, описанная патентом США (US8288172B2: Extracorporeal removal of microvesicular particles). Эта технология предполагает сорбцию микровезикул непосредственно из плазмы с помощью протеинов растительного происхождения (лектинов), для которых характерна способность взаимодействия с углеводами в составе различных гликопротеинов и в составе гликокаликса клеточной и, вероятно, везикулярной поверхности. Сорбция ВНВ происходит на сорбирующей поверхности, модифицированной лектинами. Для применения в клинической практике плоские сорбирующие элементы укомплектованы в картридж, который «включается» в контур экстракорпоральной плазмасорбции. Предполагается, что микровезикулы плазмы сорбируются на компонентах картриджа, затем плазма объединяется с клеточными элементами и возвращается в кровяное русло. Технология была реализована компанией Aethlon Medical Inc. в форме аппарата для плазмасорбции (Hemopurifier), предполагаемые области применения: онкологические и инфекционные болезни (например, геморрагическая лихорадка Эбола) (16). Клиническая эффективность технологии еще не доказана, в настоящее время проходит клинические испытание метод терапии пациентов с плоскоклеточными опухолями головы и шеи (head and neck cancer, HNC), который предполагает применение моноклонального антитела, ингибирующего рецептор PD-1 (Пембролизумаб / pembrolizumab) после процедуры плазмофильтрации с помощью аппарата Hemopurifier (NCT04453046). Основным недостатком описанного метода является использование лектинов в качестве лигандов, что неизбежно должно приводить к сорбции гликозилированных белков. Следствием этого будет нежелательное изменение состава белков плазмы и снижение эффективности сорбции ВНВ. Кроме того, плоские сорбирующие элементы имеют относительно малую площадь поверхности. Микросферы являются альтернативным вариантом матрицы, который позволит увеличить площадь сорбирующей поверхности.
Прототипом изобретения является способ выделения экзосом из плазмы крови (RU2741638C1), который относится к области биотехнологии и диагностической медицины и предполагает использование суперпарамагнитных частиц (СПМЧ) и иммобилизированных на их поверхности ДНК-аптамеров (СА ССС САС СТС GCT ССС GTG АСА СТА ATG СТА), аффинно взаимодействующих с маркерным белком везикулярной мембраны – тетраспанином CD63. Способ может быть использован при разработке диагностических методик (IVD, in vitro diagnostic), но не подходит для выделения ВНВ в потоке плазмы в рамках методов экстракорпоральной терапии по ряду причин. Во-первых, использование СПМЧ в количествах, необходимых для создания сорбционной колонки (100 – 150 мл) экономически не оправдано. Во-вторых, поверхность СПМЧ и технология иммобилизации к ней ДНК-аптамеров (через биотин-стрептавидин) не предполагает контакт плазмой, которая возвращается в кровоток пациента (in vivo). В-третьих, использование ДНК-аптамера, который связывает лишь один тип маркерных белков везикулярной мембраны (тетраспанин CD63) не обеспечивает достаточной эффективности сорбции ВНВ.
ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Задачей изобретения являлось создание такого способа эффективной и специфической сорбции ВНВ из плазмы, который может быть использован в рамках методов эфферентной терапии.
Техническим результатом является разработка биосовместимого сорбента на основе микросфер (например, полистерольных), поверхность которых модифицирована ДНК-аптамерами через карбамидную связь.
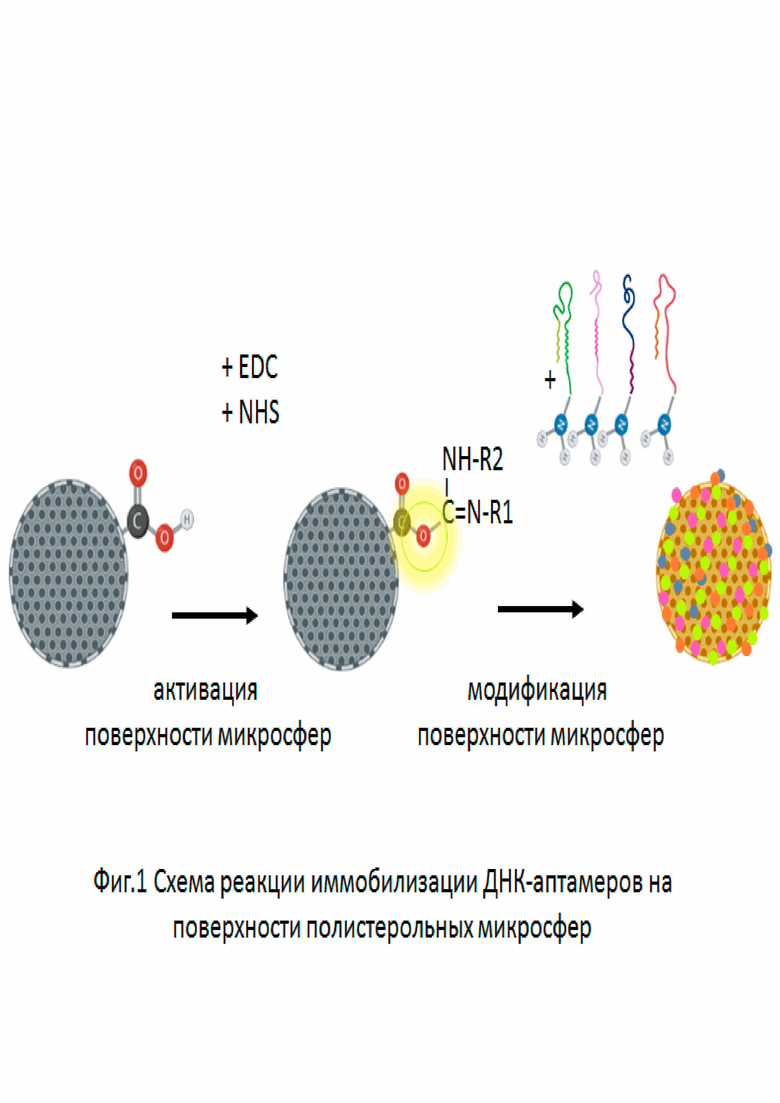
Для решения задачи были использованы карбоксилированные полистерольные микросферы размером 800-1000 мкм. Частицы могут быть получены в рамках промышленного производства или путем суспензионной полимеризации в соответствии с любым из доступных протоколов (17,18). Размер и морфология микросфер должны быть оценены с помощью трансмиссионной электронной микроскопии, эффективность карбоксилирования поверхности – с помощью ЯМР-спектроскопии и/или ИК-Фурье спектроскопии. В качества лигандов используются четыре типа ДНК-аптамеров, структура (5’ → 3’) которых представлена в Таблице 1. ДНК-аптамеры получаются стандартным методом химического синтеза, модификация аминогруппой (-NH2) проводится по 3'-концу, продукт синтеза требует очистки путем элекстрофореза в полиакриламидном геле (ПААГ) и с помощью обращенно-фазовой высоко эффективной жидкостной хроматографии (ВЭЖХ).
Таблица 1. Последовательности ДНК-аптамеров
Присоединение ДНК-аптамеров к поверхности полистерольных микросфер происходит в результате взаимодействия карбоксильной группы (-COOH) на поверхности микросфер и аминогруппы (-NH2) на 3'-конце ДНК-аптамеров и образования карбамидной связи. Для этого микросферы трижды отмываются деионизованной и свободной от ДНКаз водой, избыток воды удаляется. К суспензии микросфер (100 мл - 10 мг/л) добавляется раствор EDC, 1-(3-dimethylaminopropyl)-3-ethylcarbodimide hydrochloride (200 мл–400 ммоль/л) и раствор NHS, N-hydroxysulfosuccinimide (200 мл–200 ммоль/л), инкубация при комнатной температуре при медленном перемешивании в течение 20 минут приводит к «активации» поверхности микросфер. Затем частицы вновь трижды отмываются деионизованной и свободной от ДНКаз водой и смешиваются с раствором ДНК-аптамеров (100 мл–1 мг/мл), содержащим четыре аптамера в эквимолярном (равном по количеству молекул) соотношении. Инкубация проводится при комнатной температуре при медленном помешивании в течение 6 часов. После модификации микросферы дважды отмываются деионизованной и свободной от ДНКаз водой и один раз физиологическим раствором (0,9% NaCl). Схема реакции модификации микросфер представлена на Фигуре 1. Суспензия модифицированных частиц нагревается до 90°С и быстро охлаждается до комнатной температуры для формирования вторичной структуры ДНК-аптамеров. Суспензия микросфер помещается в герметичный картридж, имеющий два соединения по типу «Луер-Лок», отделенных от основного объёма мембранными фильтрами с диаметром пор 500-600 мкм, и предполагающий возможность «включения» в трансфузионный контур. Микросферы должны занимать 70-80% объёма картриджа, остальной объём заполняется физиологическим раствором. Готовые к использованию картриджи герметично упаковываются и стерилизуются с помощью источника ионизирующего излучения на основе, например, радионуклида Кобальт-60 (гамма излучение).
Для стендовых экспериментов, целью которых было определение соотношения объёма суспензии модифицированных микросфер, объёма и скорости тока плазмы, был сформирован миниатюрный прототип картриджа, объёмом 2 мл, заполненный модифицированными микросферами на 80% объёма. Схема и фото представлены на Фигуре 2.
Эксперимент 1
С целью оценки сорбционной емкости миниатюрного картриджа ВНВ были выделены из 300 мл донорской плазмы стандартным методом ультра-центрифугирования (19) и ресуспендированы в 300 мл физиологического раствора. Концентрация ВНВ была оценена с помощью анализа траекторий нано-частиц (NTA, nanoparticle tracking analysis) и составила 1011 / мл. Суспензия ВНВ проходила (снизу-вверх) через картридж, содержащий суспензию модифицированных микросфер со скоростью 1 мл / мин. Каждый пятый миллилитр суспензии ВНВ, профильтрованной через картридж, использовался для измерения концентрации ВНВ, результаты представлены в Таблице 2. Полученные результаты показали, что сатурация сорбирующий активности картриджа объёмом 2 мл (заполненного модифицированными микросферами) наступает после фильтрации 30 мл суспензии ВНВ при скорости фильтрации 1 мл/мин, т.е. максимальный объём суспензии, который может быть эффективно профильтрован при заданных условиях составляет 30 мл.
Таблица 2. Оценка сорбирующий емкости картриджа (V max)
Эксперимент был выполнен шесть раз, разброс результатов (концентрации ВНВ, после 30 мин / 30 мл фильтрации) наблюдался в диапазоне 1*105 - 5*105, что позволило сделать вывод о достаточной воспроизводимости результатов.
Эксперимент 2
С целью определения максимальной скорости эффективной фильтрации суспензии ВНВ через сорбирующий картридж, ВНВ были выделены из 300 мл донорской плазмы стандартным методом ультра-центрифугирования (19) и ресуспендированы в 300 мл физиологического раствора. Концентрация ВНВ была оценена с помощью анализа траекторий нано-частиц (NTA, nanoparticle tracking analysis) и составила 1011 / мл. Суспензия ВНВ объёмом 30 мл проходила (снизу-вверх) через картридж, содержащий суспензию модифицированных микросфер с разной скоростью, в каждом случае проводилось измерение концентрации ВНВ в последнем (тридцатом мл). Результаты представлены в Таблице 3. Полученные результаты показали, что эффективная сорбция ВНВ из 30 мл суспензии наблюдалась в случаях, когда фильтрация этого объёма суспензии проводилась в течение 30 мин (скорость - 1 мл/мин), 20 мин (скорость 1,5 мл/мин), 15 мин (скорость 2 мл/мин) и 10 мин (скорость 3 мл/мин). При более высокой скорости фильтрации наблюдался рост количества ВНВ в составе суспензии после «прохождения» через картридж.
Таблица 3. Определение максимально допустимой скорости фильтрации
Эксперимент был выполнен шесть раз, разброс результатов (концентрации ВНВ, после фильтрации 30 мл со скоростью 3 мл/мин) наблюдался в диапазоне 0,9*105 - 8*105, что позволило сделать вывод о достаточной воспроизводимости результатов.
Использование модельной системы (взвесь ВНВ в физиологическом растворе) позволило определить оптимальные условия сорбции, следующим этапом эти условия были воспроизведены с использованием донорской плазмы.
Эксперимент 3
Концентрация ВНВ непосредственно в плазме не может быть определена, т.к. в состав плазмы входят различные компоненты сходного размера и биохимического состава. Для оценки концентрации ВНВ в плазме с помощью стандартной технологии анализа наночастиц, ВНВ должны быть выделены любым доступным способом. Для оценки эффективности сорбции ВНВ из плазмы ранее описанный эксперимент был воспроизведен, но вместо суспензии ВНВ была использована донорская плазма. После фильтрации 30 мл плазмы, следующий (31-ый) мл был использован для выделения ВНВ с помощью двухфазной полимерной системы (20), которая обеспечивает минимальные потери везикул. Результаты представлены в Таблице 4.
Таблица 4. Анализ параметров фильтрации плазмы
Полученные результаты отражают закономерные «потери» ВНВ в процессе выделения: количество ВНВ выделенных из плазмы оказывается на порядок ниже, чем в ранее описанных экспериментах. Тем не менее, представленные результаты показывают зависимость количества ВНВ в «профильтрованной» плазме от скорости фильтрации, причем стабильный уровень концентрации наблюдался, когда фильтрация 30 мл плазмы проводилась в течение 30 мин (скорость - 1 мл/мин), 20 мин (скорость 1,5 мл/мин) и 15 мин (скорость 2 мл/мин). Дальнейшее увеличение скорости фильтрации сопровождалось ростом концентрации ВНВ в плазме, или снижением эффективности сорбции ВНВ модифицированными микросферами. Таким образом, сатурация сорбирующий активности картриджа при фильтрации плазмы наступает быстрее, чем при фильтрации суспензии ВНВ в физиологическом растворе, что, вероятно, отражает неспецифическое связывание аптамеров с «невезикулярными» компонентами плазмы.
Экстраполяция полученных результатов на объёмы плазмы, подлежащие фильтрации в рамках процедуры эфферентной терапии (около 1,5 литров, или 30 мл × 50), позволяет предполагать, что для эффективной сорбции ВНВ объём картриджа должен быть в 50 раз больше, или 2 мл × 50 = 100 мл. Такой размер картриджа соответствует размерам обычных сорбционных колонок, используемых в клинической практике. Для оценки безопасности, оптимизации условий и анализа эффективности удаления ВНВ и изучения клинического эффекта процедуры в целом необходимо изготовление полноразмерного прототипа разработанного картриджа и проведения технических, до клинических и клинических испытаний.
Цитируемая литература:
1. Морозов АС, Бессонов ИВ, Нуждина АВ, Писарев ВМ. Сорбенты для экстракорпорального удаления токсических веществ и молекул с нежелательной биологической активностью (обзор). Общая реаниматология. 2016;12(6).
2. Clark WR, Ferrari F, La Manna G, Ronco C. Extracorporeal Sorbent Technologies: Basic Concepts and Clinical Application. In 2017. p. 43–57. Available from: https://www.karger.com/Article/FullText/468911
3. Тамкович СН, Тутанов ОС, Лактионов ПП, Tamkovich SN, Tutanov OS, Laktionov PP. Экзосомы: механизмы возникновения, состав, транспорт, биологическая активность, использование в диагностике. Биологические мембраны Журнал мембранной и клеточной биологии [Internet]. 2016;33(3):163–75. Available from: http://elibrary.ru/item.asp?doi=10.7868/S0233475516020122
4. Li W-J, Chen H, Tong M-L, Niu J-J, Zhu X-Z, Lin L-R. Comparison of the yield and purity of plasma exosomes extracted by ultracentrifugation, precipitation, and membrane-based approaches. Open Chem [Internet]. 2022 Mar 8;20(1):182–91. Available from: https://www.degruyter.com/document/doi/10.1515/chem-2022-0139/html
5. Whiteside TL. The potential of tumor-derived exosomes for noninvasive cancer monitoring: an update. Expert Rev Mol Diagn [Internet]. 2018 Dec 2;18(12):1029–40. Available from: https://www.tandfonline.com/doi/full/10.1080/14737159.2018.1544494
6. Melzer C, Rehn V, Yang Y, Bähre H, von der Ohe J, Hass R. Taxol-Loaded MSC-Derived Exosomes Provide a Therapeutic Vehicle to Target Metastatic Breast Cancer and Other Carcinoma Cells. Cancers (Basel) [Internet]. 2019 Jun 9;11(6):798. Available from: https://www.mdpi.com/2072-6694/11/6/798
7. Gong C, Tian J, Wang Z, Gao Y, Wu X, Ding X, et al. Functional exosome-mediated co-delivery of doxorubicin and hydrophobically modified microRNA 159 for triple-negative breast cancer therapy. J Nanobiotechnology [Internet]. 2019 Dec 3;17(1):93. Available from: https://jnanobiotechnology.biomedcentral.com/articles/10.1186/s12951-019-0526-7
8. Konoshenko MY, Lekchnov EA, Vlassov A V., Laktionov PP. Isolation of Extracellular Vesicles: General Methodologies and Latest Trends. Biomed Res Int [Internet]. 2018;2018:1–27. Available from: https://www.hindawi.com/journals/bmri/2018/8545347/
9. Bai S, Wang Z, Wang M, Li J, Wei Y, Xu R, et al. Tumor-Derived Exosomes Modulate Primary Site Tumor Metastasis. Front Cell Dev Biol [Internet]. 2022 Mar 2;10. Available from: https://www.frontiersin.org/articles/10.3389/fcell.2022.752818/full
10. Hosseini R, Asef-Kabiri L, Yousefi H, Sarvnaz H, Salehi M, Akbari ME, et al. The roles of tumor-derived exosomes in altered differentiation, maturation and function of dendritic cells. Mol Cancer [Internet]. 2021 Dec 2;20(1):83. Available from: https://molecular-cancer.biomedcentral.com/articles/10.1186/s12943-021-01376-w
11. Shtam T, Naryzhny S, Samsonov R, Karasik D, Mizgirev I, Kopylov A, et al. Plasma exosomes stimulate breast cancer metastasis through surface interactions and activation of FAK signaling. Breast Cancer Res Treat [Internet]. 2019 Feb 27;174(1):129–41. Available from: http://link.springer.com/10.1007/s10549-018-5043-0
12. Marleau AM, Chen C-S, Joyce JA, Tullis RH. Exosome removal as a therapeutic adjuvant in cancer. J Transl Med [Internet]. 2012 Dec 27;10(1):134. Available from: https://translational-medicine.biomedcentral.com/articles/10.1186/1479-5876-10-134
13. Samuel P, Mulcahy LA, Furlong F, McCarthy HO, Brooks SA, Fabbri M, et al. Cisplatin induces the release of extracellular vesicles from ovarian cancer cells that can induce invasiveness and drug resistance in bystander cells. Philos Trans R Soc B Biol Sci [Internet]. 2018 Jan 5;373(1737):20170065. Available from: https://royalsocietypublishing.org/doi/10.1098/rstb.2017.0065
14. Jing C, Cao H, Qin X, Yu S, Wu J, Wang Z, et al. Exosome‑mediated gefitinib resistance in lung cancer HCC827 cells via delivery of miR‑21. Oncol Lett [Internet]. 2018 Apr 27; Available from: http://www.spandidos-publications.com/10.3892/ol.2018.8604
15. Feng Q, Zhang C, Lum D, Druso JE, Blank B, Wilson KF, et al. A class of extracellular vesicles from breast cancer cells activates VEGF receptors and tumour angiogenesis. Nat Commun [Internet]. 2017 Apr 16;8(1):14450. Available from: http://www.nature.com/articles/ncomms14450
16. Inc AM. https://www.aethlonmedical.com/
17. Lee SG, Ha J-W. Synthesis of highly carboxylated monodisperse polystyrene microspheres by dispersion polymerization in fluorinated alcohol. Macromol Res [Internet]. 2016 Aug 23;24(8):675–83. Available from: http://link.springer.com/10.1007/s13233-016-4093-6
18. Zhang B, Lu J, Liu X, Jin H, He G, Guo X. Synthesis of Controllable Carboxylated Polystyrene Microspheres by Two-Step Dispersion Polymerization with Hydrocarbon Alcohols. Int J Polym Sci [Internet]. 2018 Oct 31;2018:1–8. Available from: https://www.hindawi.com/journals/ijps/2018/8702597/
19. Théry C, Amigorena S, Raposo G, Clayton A. Isolation and Characterization of Exosomes from Cell Culture Supernatants and Biological Fluids. Curr Protoc Cell Biol. 2006;
20. Slyusarenko M, Nikiforova N, Sidina E, Nazarova I, Egorov V, Garmay Y, et al. Formation and Evaluation of a Two-Phase Polymer System in Human Plasma as a Method for Extracellular Nanovesicle Isolation. Polymers (Basel) [Internet]. 2021 Jan 31;13(3):458. Available from: https://www.mdpi.com/2073-4360/13/3/458
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ДИАГНОСТИКИ КОЛОРЕКТАЛЬНОГО РАКА | 2021 |
|
RU2772203C1 |
| СПОСОБ ВЫДЕЛЕНИЯ ЭКЗОСОМ ИЗ ПЛАЗМЫ КРОВИ | 2020 |
|
RU2741638C1 |
| СПОСОБ ДИАГНОСТИКИ ЛИМФОМЫ ХОДЖКИНА | 2021 |
|
RU2782326C1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ РИСКА ЗЛОКАЧЕСТВЕННОЙ ТРАНСФОРМАЦИИ КЛЕТОК ПРЕДСТАТЕЛЬНОЙ ЖЕЛЕЗЫ | 2022 |
|
RU2806518C1 |
| Способ анализа микроРНК в образцах биологического материала | 2021 |
|
RU2783509C1 |
| СПОСОБ ВЫДЕЛЕНИЯ И АНАЛИЗА ЭКЗОСОМ | 2022 |
|
RU2788198C1 |
| СПОСОБ ВЫДЕЛЕНИЯ ЭКЗОСОМ ИЗ ПЛАЗМЫ КРОВИ | 2020 |
|
RU2741776C1 |
| Способ применения гидроксихлорохина и его производных для доставки химиотерапевтического лекарственного препарата в очаг ракового заболевания (варианты) | 2023 |
|
RU2834400C2 |
| Способ выделения целевых фрагментов ДНК из многокомпонентной смеси | 2024 |
|
RU2832884C1 |
| СМЕННЫЙ МИКРОФЛЮИДНЫЙ МОДУЛЬ ДЛЯ АВТОМАТИЗИРОВАННОГО ВЫДЕЛЕНИЯ И ОЧИСТКИ НУКЛЕИНОВЫХ КИСЛОТ ИЗ БИОЛОГИЧЕСКИХ ОБРАЗЦОВ И СПОСОБ ВЫДЕЛЕНИЯ И ОЧИСТКИ НУКЛЕИНОВЫХ КИСЛОТ С ЕГО ИСПОЛЬЗОВАНИЕМ | 2008 |
|
RU2380418C1 |

Изобретение относится к области биотехнологии. Описан способ удаления внеклеточных наноразмерных везикул из плазмы крови. Способ отличается использованием в качестве лигандов для сорбции везикул ковалентно иммобилизированные на поверхности биосовместимой матрицы ДНК-аптамеры, пространственная структура которых обеспечивает специфическое и эффективное связывание компонентов поверхностной мембраны нано-везикул. Изобретение расширяет арсенал способов для удаления внеклеточных нано-везикул из плазмы крови для применения в области технологий эфферентной терапии или терапевтической плазмасорбции. 1 з.п. ф-лы, 2 ил., 4 табл., 3 пр.
1. Способ удаления внеклеточных наноразмерных везикул из плазмы крови, отличающийся тем, что в качестве лигандов для сорбции везикул используются ковалентно иммобилизированные на поверхности биосовместимой матрицы ДНК-аптамеры, пространственная структура которых обеспечивает специфическое и эффективное связывание компонентов поверхностной мембраны нано-везикул.
2. Способ по п. 1, характеризующийся тем, что в качестве биосовместимой матрицы используются микросферы из биосовместимого полимера, что обеспечивает возможность применения способа в рамках процедур экстракорпоральной терапии.
| Способ выделения внеклеточных везикул из биологических жидкостей | 2018 |
|
RU2678988C1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ СОСТАВА ИНДИВИДУАЛЬНЫХ ВНЕКЛЕТОЧНЫХ ВЕЗИКУЛ В КРОВИ ЧЕЛОВЕКА | 2014 |
|
RU2583940C1 |
| Способ и устройство для выделения внеклеточных везикул из биологических жидкостей с помощью каскадной ультрафильтрации | 2017 |
|
RU2745613C1 |
| СПОСОБ ВЫДЕЛЕНИЯ И АНАЛИЗА ЭКЗОСОМ | 2022 |
|
RU2788198C1 |
| US 20200164284 A1 28.05.2020 | |||
| МАЛЕК АНАСТАСИЯ ВАЛЕРЬЕВНА, ВОЗМОЖНОСТИ ПРИМЕНЕНИЯ НАНОВЕЗИКУЛЯРНЫХ ТЕХНОЛОГИЙ В ОНКОЛОГИИ, ДИССЕРТАЦИЯ на соискание ученой степени доктора медицинских наук, Санкт-Петербург, 2021. | |||
Авторы
Даты
2023-10-31—Публикация
2022-08-10—Подача