Изобретение относится к области молекулярной биологии и диагностической медицины и может быть использовано для выделения внеклеточных везикул из биологических жидкостей.
Внеклеточные везикулы (ВВ) биологических жидкостей представляют собой гетерогенную группу покрытых мембраной микрочастиц различного размера, которые продуцируются клетками разных органов и тканей. В составе ВВ обнаружены поверхностные рецепторы, мембранные и растворимые белки, липиды и нуклеиновые кислоты (1, 2). ВВ принимают участие в межклеточной коммуникации за счет горизонтального переноса белков, нуклеиновых кислот и других биологически активных молекул (3). ВВ были обнаружены во всех биологических жидкостях организма: крови, моче, слюне, семенной жидкости, бронхоальвеолярном лаваже, желчи, асците, грудном молоке, спинномозговой жидкости и т.д. (4, 5). ВВ отличаются стабильностью в биологических жидкостях, распространяются с током жидкостей по органам и тканям, иммунологически инертны, и, в силу небольшого размера, способны проходить через биологические барьеры.
Содержимое ВВ отражает тип и функциональное состояние родительских клеток, и, в зависимости от состава, ВВ могут оказывать разное влияние на клетки-мишени (6). Созревание эритроцитов, адгезия тромбоцитов, лизис клеток, презентация антигенов - вот далеко не полный список процессов, в которых ВВ играют роль посредников (7). Большое значение имеют ВВ при прогрессии опухолевого процесса, перенося онкогенный материал. Кроме того, ВВ участвуют в патогенезе множества заболеваний: нейродегенеративных и аутоиммунных, кардиоваскулярных нарушениях, вирусных инфекциях, прионных болезнях и т.д. (8, 9). ВВ являются перспективным источником биомаркеров различных заболеваний, например микроРНК, и могут представлять собой интерес с точки зрения неинвазивной/малоинвазивной диагностики, оценки эффективности противоопухолевой терапии и прогноза заболевания (10).
Основным препятствием на пути использования ВВ биологических жидкостей в качестве источника диагностических молекул, является низкая эффективность выделения ВВ, а также высокое содержание примесей в виде биополимеров и иных биологических молекул (белки, липопротеины, липиды и их комплексы), которые ингибируют ферменты, используемые в последующем анализе содержимого микровезикул (например, ПЦР) или затрудняют последующий белковый анализ (например, масс-спектроскопия).
Стандартные методы выделения ВВ, такие как ультрацентрифугирование, требуют дорогостоящего оборудования, они отличаются трудоемкостью, длительностью процедуры выделения и не пригодны для масштабных клинических исследований или использования в диагностических лабораториях.
Таким образом, разработка простых, эффективных, экономичных и производительных методов выделения ВВ, пригодных для последующего анализа (ОТ-ПЦР, микрочиповый анализ, полногеномное секвенирование, масспектрометрия и протеомные исследования) является актуальной задачей современной молекулярной биологии и диагностической медицины.
Известен способ выделения ВВ из биологических жидкостей, включающий центрифугирование образца при 100.000-200.000 g в течение приблизительно 140 минут. Полученный после ультрацентрифугирования осадок ВВ ресуспендируют в физиологическом растворе (11).
Известен способ выделения ВВ из клеточных культур путем ультрафильтрации, суть которой заключается в использовании фильтров с размером пор 0.8 мкм, 0.45 мкм, 0.22 мкм, 0.1 мкм, позволяющих задерживать частицы диаметром более 800 нм, 450 нм, 200 нм и 100 нм соответственно. Таким образом, концентрируется фракция везикул определенного размера (12).
Основными недостатками вышеназванных способов являются высокая стоимость, низкая производительность, трудоемкость процесса выделения, зависимость результата выделения от квалификации исполнителя и сложность автоматизации процесса выделения ВВ.
Наиболее близким к предлагаемому способу - прототипом, является способ выделения ВВ из сыворотки крови, включающий этап удаления из исследуемого образца клеток и клеточного дебриса, добавление к полученному супернатанту 50% раствора гидрофильного полимера полиэтиленгликоля (ПЭГ) с мол. массой 6000 Да для снижения растворимости и агрегации ВВ, инкубацию смеси в течение 30 минут и последующее осаждение ВВ при помощи низкоскоростного центрифугирования (1500g). Полученный осадок ВВ ресуспензируют в воде и используют для определения концентрации соответствующего биомаркера, например, микроРНК (13). Время выделения целевого продукта составляет 1 час.
Недостатками прототипа являются недостаточный выход и чистота целевого продукта, а также высокая стоимость его выделения (при использовании коммерческих наборов реактивов, например, ExoQuick). Как следствие, полученные результаты о содержании микроРНК в составе ВВ являются недостоверными.
Задачей изобретения является сокращение длительности способа, увеличение выхода ВВ, сокращение материальных затрат на выделение ВВ.
Технический результат: повышение выхода целевого продукта, сокращение длительности способа.
Поставленная задача достигается предлагаемым способом, заключающимся в следующем.
Для уменьшения загрязнения препарата невезикулярными частицами (клетки, клеточный дебрис, апоптические тельца) на первом этапе образец биологической жидкости подвергают низкоскоростному
центрифугированию сначала при 300-400g в течение 20 минут и 800g в течение 20 минут, затем центрифугированию при 16.000-18.000g в течение 20 минут для крови или 300-400g в течение 20 минут и 16.000-18.000g в течение 20 минут для мочи. Отбирают супернатант и переносят в новую емкость. Затем к полученному супернатанту последовательно добавляют раствор NaCl до концентрации 0,154-0,3М для выделения из мочи или 0,48-0,6М для выделения из плазмы крови, далее добавляют раствор, содержащий 1М TrisHCl рН 7.0 до конечной концентрации 50 мМ, затем раствор декстрана синего (Dextran Blue) с мол. массой 2000 кДа до конечной концентрации 4-8 мкг/мл и полиэтиленгликоль (ПЭГ) с мол. массой 20 кДа до концентрации 1,5-5%. Смесь перемешивают после добавления каждого компонента, инкубируют в течение 20 минут при 4°С и центрифугируют при 16.000-18.000g в течение 20 минут. Полученный супернатант удаляют, осадок ресуспендируют в PBS и используют для определения концентрации (количественного анализа) требуемых биомаркеров, например, микроРНК. Время выделения ВВ после пробоподготовки, включающей осаждение клеток и клеточного дебриса, составляет 50 минут. Для дальнейшего использования в диагностических тестах из препаратов ВВ выделяют белки, либо мРНК или микроРНК любым пригодным методом.
Количественный анализ ДНК, мРНК или микроРНК в препаратах ВВ также проводят любым известным методом исследования нуклеиновых кислот, как то: обычная, количественная ПЦР или ОТ-ПЦР, метод измерения концентрации нуклеиновых кислот при помощи флуоресцентных красителей (RiboGreen, SYBR Green II и т.д.). Для определения белков используют как исходный препарат ВВ, так и препараты ВВ, обработанные детергентами. Измерения белков выполняют при помощи стандартных биохимических, иммунохимических методов, методов масс-спектрометрического анализа или цитофлуорометрии.
Определяющими отличительными признаками предлагаемого способа, по сравнению с прототипом, являются:
К полученному супернатанту последовательно добавляют раствор, содержащий NaCl до конечной концентрации 0,15-0,3М (в моче) или 0,48-0,6М (в плазме крови), затем раствор, содержащий 1М Tris HQ рН 7.0 до конечной концентрации 50 мМ, далее к полученному раствору добавляют декстран синий (Dextran Blue) с мол. массой 2000 кДа до конечной концентрации 4-8 мкг/мл, и полиэтиленгликоль (ПЭГ) с мол. массой 20 кДа до конечной концентрации 1,5-5,0%, что позволяет сократить длительность выделения на 16.67% по сравнению с прототипом, повысить выход и чистоту целевого продукта.
Добавление к полученному супернатанту раствора, содержащего NaCl позволяет уменьшить количество агрегатов и исключить их соосаждение на последующих этапах выделения микрочастиц. Последующее добавление к супернатанту раствора, содержащего 1М Tris HCl рН 7.0, создает оптимальные условия для осаждения ВВ. Использование Dextran Blue с мол. массой 2000 кДа инициирует агрегацию микрочастиц, что позволяет в дальнейшем более эффективно осаждать мембран-покрытые частицы, по сравнению с не содержащими мембран микрочастицами, крупными биополимерами и надмолекулярными комплексами, добавлением в смесь ПЭГ с мол. массой 20 кДа в более низкой концентрации по сравнению с прототипом, позволяет эффективно преципитировать ВВ биологических жидкостей в присутствие Dextran Blue при помощи низкоскоростного центрифугирования и уменьшить соосаждение высокополимерных белков, протеогликанов и надмолекулярных комплексов биополимеров.
Таким образом, предлагаемый способ позволяет быстро и эффективно выделять ВВ из плазмы крови и мочи.
Изобретение иллюстрируется следующими примерами конкретного выполнения способа.
Пример 1. Выделение ВВ из мочи.
Образец мочи (30 мл) подвергали низкоскоростному центрифугированию сначала при 300g в течение 20 минут, затем при 16.000 g в течение 20 мин. Отбирали супернатант и переносили в новую пробирку. К 5 мл супернатанта добавляли 2 мл раствора, содержащего 0,54 М NaCl (рН=8,7), 175 мМ TrisHCl рН 7.0, затем добавляли Dextran Blue с мол. массой 2000 кДа с концентрацией 14 мкг/мл и 5.25% ПЭГ с мол. массой 20 кДа, при этом конечные концентрации компонентов осаждающего раствора составляли: 0,154М NaCl, 50 мМ TrisHCl, 4 мкг/мл Dextran Blue (2000 кДа), 1,5% ПЭГ (20 кДа). Полученный раствор перемешивали на встряхивателе в течение 3-5 секунд и инкубировали в течение 20 минут при 4°С. Затем ВВ осаждали из получившегося преципитата центрифугированием при 16.000 g (Eppendorf 5810 г) в течение 20 минут. Супернатант удаляли, осадок растворяли в 500 мкл раствора PBS (фосфатный буферный раствор).
Для того, чтобы оценить эффективность выделения ВВ из мочи, в полученном препарате (целевой продукт) определяли концентрацию микроРНК.
МикроРНК из ВВ выделяли по описанной ранее методике (14) и переосаждали в присутствие гликогена (конечная концентрация 112 мкг/мл) 2-х кратным объемом изопропанола (30 минут при -20°С, центрифугирование при 13000 g (Eppendorf 5810 г) в течение 15 мин при 4°С). Осадок последовательно промывали 75% и 96% этанолом, сушили на воздухе и растворяли в 30 мкл воды.
Далее, выделенные микроРНК анализировали методом ОТ-ПЦР в реальном времени (15), позволяющим селективно выявлять микроРНК с высокой чувствительностью и специфичностью. Метод ОТ-ПЦР включает в себя обратную транскрипцию микроРНК с помощью праймера со шпилькой, с последующей детекцией полученной кДНК с помощью ПЦР в реальном времени.
Для обратной транскрипции использовали праймеры RT: RT 5'-GTCGTATCCAGTGCAGGGTCCGAGGTATTCGCACTGGATACGACTCAGTT-3' (hsa-miR-19b) и ревертазу (Fermentas, Vilnius, Lithuania).
Условия обратной транскрипции: 16°С - 30 мин, 42°С - 30 мин, 70°С - 10 мин.
Для ПЦР использовали: Universal Reverse Primer 5'-GTGCAGGGTCCGAGGT-3', Forward: 5'-CGCTGTGCAAATCCATGCAA-3' Probe: 5'-(FAM)-GCACTGGATACGACTCAGTT-(FQ)-3' (hsa-miR-19b).
После первоначальной денатурации при 95°С в течение 3 мин, реакции проводили в течение 50 циклов при 95°С в течение 15 с и 60°С в течение 45 с. Праймеры и зонды для обратной транскрипции и TaqMan qPCR были синтезированы в лаборатории медицинской химии ИХБФМ СО РАН, Новосибирск.
Пример 2. Выделение ВВ из мочи.
Образец мочи (30 мл) подвергали низкоскоростному центрифугированию сначала при 400g в течение 20 минут, затем при 18.000 g в течение 20 мин. Отбирали супернатант и переносили в новую пробирку. К 5 мл супернатанта добавляли 2 мл раствора, содержащего 1.05 М NaCl (рН=8,7), 175 мМ TrisHCl рН 7.0, затем добавляли Dextran Blue с мол. массой 2000 кДа с концентрацией 28 мкг/мл и 17.5% ПЭГ с мол. массой 20 кДа, при этом конечные концентрации компонентов осаждающего раствора составляли: 0,3M NaCl, 50 мМ TrisHCl, 8 мкг/мл Dextran Blue (2000 кДа), 5,0% ПЭГ (20 кДа).
Полученный раствор перемешивали на встряхивателе в течение 3-5 секунди инкубировали в течение 20 минут при 4°С. Затем ВВ осаждали из получившегося преципитата центрифугированием при 16.000-18.000 g (Eppendorf 5810r) в течение 20 минут. Супернатант удаляли, осадок растворяли в 500 мкл раствора PBS.
Далее выделяли микроРНК и проводили ОТ-ПЦР аналогично примеру 1.
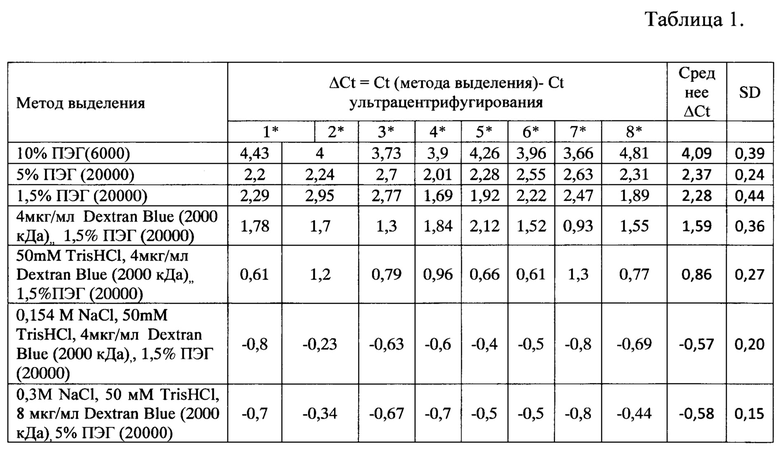
Сравнительный анализ эффективности выделения микроРНК из фракции микрочастиц мочи, полученной заявляемым способом, способом-прототипом (выделение ВВ с помощью ПЭГ (6000 Да), а также с различными растворами для осаждения ВВ, представлен в таблице 1, где Ct - значение порогового цикла, ΔCt - разница значений пороговых циклов, SD - стандартное отклонение, * - номер донора. Чем меньше разница значений пороговых циклов, тем больше микроРНК содержится в образце и соответственно выше выход.
Из таблицы 1 следует, что наиболее оптимально удаление ингибиторов PCR и выделение ВВ из мочи происходит при следующем составе осаждающего раствора: 0,154М NaCl, 50 мМ TrisHCl, 4 мкг/мл Dextran Blue (2000 кДа), 1,5% ПЭГ (20 кДа) и 0,3 М NaCl, 50 мМ TrisHCl, 8 мкг/мл Dextran Blue (2000 кДа), 5,0% ПЭГ (20 кДа).
Предлагаемый способ имеет следующие преимущества по сравнению с прототипом: позволяет выделять ВВ из мочи с большей эффективностью по сравнению с прототипом и ультрацентрифугированием; позволяет сократить время выделения ВВ на 16.67% по сравнению с прототипом и на 65% по сравнению с ультрацентрифугированием.
Пример 3. Выделение ВВ из плазмы крови.
Образец крови (8 мл) подвергали низкоскоростному центрифугированию сначала при 400g в течение 20 минут, затем 800g в течение 20 минут и далее при 16.000 g в течение 20 мин. Отбирали плазму крови и переносили в новую пробирку.
К 2 мл плазмы крови здоровых доноров добавляли 8 мл раствора, содержащего 2.4М NaCl, 250 мМ TrisHCl рН 7.0, Dextran Blue (20 мкг/мл) и 7.5% раствора ПЭГ(20кДа), при этом конечные концентрации компонентов осаждающего раствора составляли: 0,48М NaCl, 50 мМ TrisHCl, Dextran Blue - 4 мкг/мл, а ПЭГ (20 кДа), - 1,5%. Полученный раствор перемешивали на встряхивателе в течение 3-5 секунд, полученный раствор инкубировали в течение 30 минут при 4°С и осаждали получившийся преципитат центрифугированием при 18.000 g (Eppendorf 5810 г) в течение 20 минут. Супернатант удаляли, осадок растворяли в 500 мкл раствора PBS.
Для того, чтобы оценить эффективность выделения ВВ из плазмы крови, в полученном препарате определяли концентрацию микроРНК. МикроРНК из ВВ выделяли по описанной ранее методике (14) и переосаждали в присутствие гликогена (конечная концентрация 112 мкг/мл) 2-х кратным объемом изопропанола (30 минут при -20°С, центрифугирование при 13000 g (Eppendorf 5810 г) в течение 15 мин при 4°С). Осадок последовательно промывали 75% и 96% этанолом, сушили на воздухе и растворяли в 30 мкл воды.
Далее проводили ОТ-ПЦР аналогично примеру 1.
Пример 4. Выделение ВВ из плазмы крови.
Образец крови (8 мл) подвергали низкоскоростному центрифугированию сначала при 400g в течение 20 минут, затем 800g в течение 20 минут и далее при 16.000-18.000 g в течение 20 мин. Отбирали плазму крови и переносили в новую пробирку.
К 2 мл плазмы крови здоровых доноров добавляли 8 мл раствора, содержащего 3М NaCl, 250 мМ TrisHCl рН 7.0, Dextran Blue (40 мкг/мл) и 25% раствора ПЭГ (20 кДа), при этом конечные концентрации компонентов осаждающего раствора составляли: 0,6М NaCl, 50 мМ TrisHCl, Dextran Blue - 8 мкг/мл, а ПЭГ (20 кДа) - 5,0%. Полученный раствор перемешивали на встряхивателе в течение 3-5 секунд и инкубировали в течение 30 минут при 4°С и осаждали получившийся преципитат центрифугированием при 18.000 g (Eppendorf 5810 г) в течение 20 минут. Супернатант удаляли, осадок растворяли в 500 мкл раствора PBS.
После добавления каждого компонента смесь тщательно перемешивали на встряхивателе и инкубировали в течение 30 минут при 4°С. Затем ВВ осаждали из получившегося преципитата центрифугированием при 18.000 g (Eppendorf 5810 г) в течение 20 минут. Супернатант удаляли, осадок растворяли в 500 мкл раствора PBS. Далее выделяли микроРНК и проводили ОТ-ПЦР аналогично примеру 3.
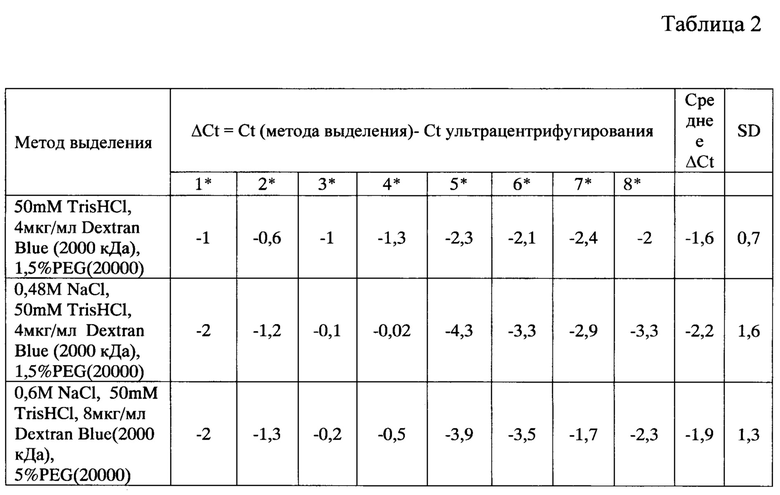
В таблице 2 представлен сравнительный анализ эффективности выделения микроРНК из ВВ (фракции микрочастиц) плазмы крови, полученных разными способами, где: Ct - значение порогового цикла, ΔCt - разница значений пороговых циклов, SD - стандартное отклонение, * - номер донора. В таблице представлена относительная экспрессия микроРНК во фракциях микрочастиц, полученных заявляемым способом и способом-прототипом.
Из таблицы 2, следует, что наиболее оптимально удаление ингибиторов PCR и выделение ВВ из плазмы крови происходит при следующем составе осаждающего раствора: 0,48М NaCl, 50 мМ TrisHCl, 4 мкг/мл Dextran Blue (2000 кДа), 1,5% ПЭГ (20 кДа) и 0,6М NaCl, 50 мМ TrisHCl, 8 мкг/мл Dextran Blue (2000 кДа), 5,0% ПЭГ (20 кДа).
Предлагаемый способ позволяет выделять ВВ из плазмы крови с большей эффективностью и позволяет сократить время выделения ВВ на 16.67% по сравнению с прототипом и на 65% по сравнению с ультрацентрифугированием.
Источники информации
1. Camussi G, Deregibus MC, Bruno S, Grange C, Fonsato V, Tetta C. Exosome/microvesicle-mediated epigenetic reprogramming of cells. Am J Cancer Res. 2011; 1:98-110.
2. Abels ER, Breakefield XO. Introduction to extracellular vesicles: biogenesis, RNA cargo selection, content, release, and uptake. Cell Mol Neurobio. 2016; 36:301-12.
3. Borges FT, Melo SA,  ВС, Kato N, Revuelta I, Miller CA, Gattone VH, LeBleu VS, Kalluri R. TGF-bl-containing exosomes from injured epithelial cells activate fibroblasts to initiate tissue regenerative responses and fibrosis. J Am Soc Nephrol. 2013; 24:385-392.
ВС, Kato N, Revuelta I, Miller CA, Gattone VH, LeBleu VS, Kalluri R. TGF-bl-containing exosomes from injured epithelial cells activate fibroblasts to initiate tissue regenerative responses and fibrosis. J Am Soc Nephrol. 2013; 24:385-392.
4. Hu G, Drescher KM, MingChen X. Exosomal miRNAs: biological properties and therapeutic potential. Frontiers in genetics. 2012; 3:56.
5. Gonda DD, Akers JC, Kim R, Kalkanis SN, Hochberg FH, Chen CC, Carter BS. Neuro-oncologic applications of exosomes, microvesicles, and other nano-sized extracellular particles. Neurosurgery. 2013; 72:4.
6.  M, Siljander PR, Andreu Z., et. Al., Biological properties of extracellular vesicles and their physiological functions. J Extracell Vesicles. 2015; 14:27066.
M, Siljander PR, Andreu Z., et. Al., Biological properties of extracellular vesicles and their physiological functions. J Extracell Vesicles. 2015; 14:27066.
7. Kaur A, Leishangthem GD, Bhat P, Mahajan V, Dev Singh N, Banga HS. Role of Exosomes in Pathology. J of Pathol and Toxicol. 2014; 1:7-11.
8. Iraci N, Leonardi T, Gessler F, Vega B, Pluchino S. Focus on extracellular vesicles: physiological role and signaling properties of extracellular membrane vesicles. Int J Mol Sci. 2016; 17:171.
9. Boukouris S, Mathivanan S. Exosomes in bodily fluids are a highly stable resource of disease biomarkers. Proteomics Clin Appl. 2015; 9:358-367.
10. Thery C, Amigorena S, Raposo G, Clayton A. Isolation and characterization of exosomes from cell culture supernatants and biological fluids. Curr Protoc Cell Biol. 2006; 3:3.22.
11. Witwer KW, Buzas EI, Bemis LT, et. Al. Standardization of sample collection, isolation and analysis methods in extracellular vesicle research. J Extracell Vesicles. 2013; 2:1-25.
12. Crescitelli R, Lasser C, Szabo GT, Kittel A, Eldh M, Dianzani I, Buza EI, Lotvall J. Distinct RNA profiles in subpopulations of extracellular vesicles: apoptotic bodies, microvesicles and exosomes. J of Extracell Vesicles. 2013; 2:20677.
13. Andreu Z, Rivas E, Sanguino-Pascual A, Lamana A, Marazuela M, Gonzalez-Alvaro I, Sanchez-Madrid F, de la Fuente H, Yanez-Mo M. Comparative analysis of EV isolation procedures for miRNAs detection in serum samples. J of Extracell Vesicles. 2016; 5:31655.
14. Lekchnov EA, Zaporozhchenko IA, Morozkin ES, Bryzgunova OE, Vlassov VV, Laktionov PP. Protocol for miRNA isolation from biofluids. Anal Biochem. 2016; 499: 78-84.
15. Chen C, Ridzon DA, Broomer AJ, Zhou Z, Lee DH, Nguyen JT, Barbisin M, Xu NL, Mahuvakar VR, Andersen MR, Lao KQ, Livak KJ, Guegler KJ. Real-time quantification of microRNAs by stem-loop RT-PCR. Nucleic Acids Res., 33 (2005), p. E179
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ВЫДЕЛЕНИЯ МИКРОРНК ИЗ БИОЛОГИЧЕСКИХ ЖИДКОСТЕЙ | 2015 |
|
RU2585232C1 |
| СПОСОБ ВЫДЕЛЕНИЯ ЭКЗОСОМ ИЗ ПЛАЗМЫ КРОВИ | 2020 |
|
RU2741776C1 |
| Способ выделения экзосом из кондиционированной среды культуры клеток | 2020 |
|
RU2750928C1 |
| Набор для выделения экзосом | 2023 |
|
RU2824663C1 |
| СПОСОБ ВЫДЕЛЕНИЯ КОРОТКИХ РНК ИЗ БИОЛОГИЧЕСКИХ ЖИДКОСТЕЙ | 2014 |
|
RU2558292C1 |
| СПОСОБ ПОЛУЧЕНИЯ ЭКЗОСОМ ИЗ КРОВИ | 2014 |
|
RU2556825C1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ РИСКА ЗЛОКАЧЕСТВЕННОЙ ТРАНСФОРМАЦИИ КЛЕТОК ПРЕДСТАТЕЛЬНОЙ ЖЕЛЕЗЫ | 2022 |
|
RU2806518C1 |
| Применение домена белка S-слоя из Lactobacillus brevis в качестве компонента системы для экспонирования слитых белков на поверхности клеток молочнокислых бактерий | 2016 |
|
RU2639246C1 |
| Способ выделения ДНК из парафиновых блоков с гистологическим биоматериалом | 2016 |
|
RU2637360C1 |
| ВАРИАНТНАЯ ФОРМА УРАТ-ОКСИДАЗЫ И ЕЕ ИСПОЛЬЗОВАНИЕ | 2006 |
|
RU2435847C2 |
Изобретение относится к способу выделения внеклеточных везикул из биологических жидкостей, включающему отделение из образца клеток и клеточного дебриса путем центрифугирования, добавление к полученному супернатанту полиэтиленгликоля, перемешивание и инкубацию смеси, осаждение целевого продукта центрифугированием. Способ характеризуется тем, что к полученному супернатанту последовательно добавляют раствор, содержащий NaCl до конечной концентрации 0,15-0,3М в моче или 0,48-0,6М в плазме крови, затем раствор, содержащий 1М Tris HCl pH 7.0 до конечной концентрации 50 мМ, далее к полученному раствору добавляют декстран синий с мол. массой 2000 кДа до конечной концентрации 4-8 мкг/мл, и полиэтиленгликоль с мол. массой 20 кДа до конечной концентрации 1,5-5,0%. Технический результат: сокращение длительности способа, повышение выхода целевого продукта. 1 з.п. ф-лы, 2 табл., 4 пр.
1. Способ выделения внеклеточных везикул из биологических жидкостей, включающий отделение из образца клеток и клеточного дебриса путем центрифугирования, добавление к полученному супернатанту полиэтиленгликоля, перемешивание и инкубацию смеси, осаждение целевого продукта центрифугированием, отличающийся тем, что к полученному супернатанту последовательно добавляют раствор, содержащий NaCl до конечной концентрации 0,15-0,3М в моче или 0,48-0,6М в плазме крови, затем раствор, содержащий 1М Tris HCl pH 7.0 до конечной концентрации 50 мМ, далее к полученному раствору добавляют декстран синий с мол. массой 2000 кДа до конечной концентрации 4-8 мкг/мл, и полиэтиленгликоль с мол. массой 20 кДа до конечной концентрации 1,5-5,0%.
2. Способ по п. 1, отличающийся тем, что целевой продукт осаждают центрифугированием смеси при 16000-18000 g в течение 20 минут.
| СПОСОБ ОПРЕДЕЛЕНИЯ СОСТАВА ИНДИВИДУАЛЬНЫХ ВНЕКЛЕТОЧНЫХ ВЕЗИКУЛ В КРОВИ ЧЕЛОВЕКА | 2014 |
|
RU2583940C1 |
| CN 106289927 A, 04.01.2017 | |||
| WO 2015166414 A1, 05.11.2015 | |||
| EP 3246703 A1, 22.11.2017. | |||
Авторы
Даты
2019-02-05—Публикация
2018-03-05—Подача