Изобретение относится к медицине, точнее к онкологии, и может найти применение при лечении злокачественных новообразований.
В настоящее время известно три группы инструментальных методов оценки непосредственных результатов лечения: 1) методы, связанные с оценкой линейных размеров опухолевых очагов; 2) методы оценки метаболического ответа опухоли; 3) методы, связанные с волюметрией опухолевых очагов. Каждый из них может сочетаться с оценкой молекулярно-биологических факторов, связанных с биологическими процессами, ассоциированными с канцерогенезом, и отражающих степень повреждения опухоли и его микроокружения (Frontiers in Oncology. 2022; 25 (12): 982983).
К первой группе относятся критерии ВОЗ, RECIST (Response Evaluation Criteria in Solid Tumors, критерии оценки ответа солидных опухолей) и их модификации (таблица 1).
Organization Offset Publication No. 48; Geneva (Switzerland), 1979. Cancer 1981; 47:
207-214
RECIST (Response Evaluation Criteria in Solid Tumors) - критерии оценки ответа солидных опухолей
Для оценки ответа опухоли на лечение в 1981г. Всемирная Организация Здравоохранения (ВОЗ) предложила критерии, которые включали четыре варианта ответа: полный ответ (CR) - полное исчезновение всех очагов на срок не менее 4 недель; частичный ответ (PR) - уменьшение всех или отдельных опухолевых очагов более чем на 50% при отсутствии прогрессирования остальных; стабилизация заболевания (SD) - уменьшение менее чем на 50% или увеличение менее чем на 25% при отсутствии новых очагов поражения; прогрессирование (PD) - увеличение более чем на 25% одного или нескольких очагов, либо появление новых (WHO Handbook for Reporting Results of Cancer Treatment. World Health Organization Offset Publication No. 48; Geneva (Switzerland), 1979. Cancer 1981; 47: 207-214).
В 2000 году в связи с внедрением в широкую клиническую практику компьютерной томографии (КТ) были предложены критерии RECIST v. 1.0, были введены понятия измеряемых, не измеряемых и маркерных очагов (J. Natl. Cancer Inst. 2000; 92: 205-216).
Измеряемые очаги - очаги, имеющие размер в аксиальной плоскости более или равный 10 см при спиральной компьютерной томографии с толщиной срезов при реконструкции в 5 мм или более, или равный 20 мм при шаговой компьютерной томографии с толщиной среза 10 мм.
Не измеряемые очаги: мелкие (до 10 мм), костные метастазы, лептоменингеальные метастазы, перикардиальный и плевральный выпоты, очаги с кистозной или некротической трансформацией, лимфогенный канцероматоз кожи и легких.
Маркерные (таргетные, целевые) очаги - очаги наибольшего диаметра (до 5 на орган, до 10 суммарно), пригодные для точного повторного измерения. Остальные относятся к не маркерным. Критерии ответа по RECIST: полный ответ (CR) - полное исчезновение всех маркерных очагов; частичный ответ (PR) - уменьшение более чем на 30% суммы максимальных размеров очагов; стабилизация заболевания (SD) - уменьшение менее чем на 30% или увеличение менее чем на 20% при отсутствии новых очагов поражения; прогрессирование (PD) - появление нового очага или увеличение суммы наибольших размеров более чем на 20%.
С появлением таргетных препаратов изменился характер динамики опухоли в процессе лечения. В 2009 году появилась модифицированная версия критериев ответа - RECIST v 1.1 (Eur. J. Cancer. 2009; 45: 228-247), согласно которым при анализе КТ выделяют таргетные очаги - очаги наибольшего диаметра, пригодные для точного повторного измерения.
Появление новой генерации препаратов, направленных на микроокружение опухоли, привело к необходимости пересмотра разработанных ранее критериев оценки непосредственных результатов лечения опухолей. Основные проблемы были связаны со стабилизацией и прогрессированием заболевания. При проведении цитотоксической химиотерапии большинство исследователей не рассматривало стабилизацию как индикатор клинического ответа. В то же время, механизм действия таргетных и иммунопрепаратов не предполагает быстрой циторедукции, поэтому длительная стабилизация свидетельствует о достижении клинического успеха (J. Clin. Oncol. 2004; 22: 4442-4445. Annu. Rev. Immunol. 2009; 27: 83-117).
Иммуноонкологические препараты в настоящее время являются наиболее интенсивно изучаемой и перспективной группой лекарственных средств для лечения различных опухолей. Мишенями для них выступают ко-ингибирующие молекулы и их лиганды. Большинство зарегистрированных препаратов относятся к ингибиторам PD-1/PD-L1.
PD-1 - ко-ингибирующая молекула, регулирующая функции компонентов врожденного и адаптивного иммунного ответа. Она экспрессируется на поверхности Т-лимфоцитов, В - лимфоцитов, МФ (макрофаги), моноцитов, DC (дендритные клетки). В физиологических условиях она способствует формировании толерантности к аутоантигенам, в микроокружении опухоли - опухолевой иммунологической толерантности (Blood. 2009; 114 (8): 1537-1544). Лиганд PD-1 (PD-L1) - трансмембранный белок, который экспрессируется как на опухолевых, так и на иммунокомпетентных клетках (Т, В - лимфоциты, DC, МФ). Взаимодействие PD-1/PD-L1 приводит к деактивации Т-лимфоцитов, активации Т-регуляторных клеток и персистированию опухолевых клеток (Immunogenetics. 2018; 70 (2): 73-86). Экспрессия PD-L1 на опухолевых клетках является предиктором благоприятного прогноза и маркером чувствительности к химиотерапии. Экспрессия PD-L1 на лимфоцитах в микроокружении является маркером чувствительности к блокаторам ко-ингибирующих молекул и показанием к их применению.
В настоящее время в Российской Федерации используются пять препаратов, относящихся к ингибиторам PD-1/PD-L1: Пембролизумаб, Ниволумаб, Атезолизумаб, Авелумаб, Дюрвалюмаб.
Пембролизумаб (Китруда) - IgG4 - анти - PD1 антитело. Зарегистрирован более, чем в 60 странах мира. Применяется у больных раком легкого, злокачественной меланомой и почечно-клеточным раком. В отдельных случаях может применятся при местно-распространённым и метастатическим переходно-клеточным раком мочевого пузыря во второй линии после прогрессирования на фоне платино-содержащих химиотерапевтических режимов и в первой линии при наличии противопоказаний к использованию препаратов платины и экспрессии PD-L1 на иммунных клетках.
Атезлизумаб (Тецентрик) - гуманизированное IgG1 анти-PD-L1 моноклональное антитело. Применяется у больных со злокачественной меланомой, печеночно-клеточным раком, почечно-клеточным раком, местно-распространённым и метастатическим переходно-клеточным раком по тем же показаниям, что и Пембролизумаб. В ряде случаев по решению лечащего врача и врачебной комиссии при других патологиях.
Ниволумаб (Опдиво) - гуманизированное IgG4 анти-PD-1 моноклональное антитело. Применяется у больных со злокачественной меланомой, почечно-клеточным и раком легкого.
Дюрвалюмаб (Инфинзи) - гуманизированное IgG4 анти-PD-L1 моноклональное антитело. Применяется у больных местно-распространенным и метастатическим переходно-клеточным раком во II линии, а также при опухолях легкого.
Авелумаб (Бавенцио) - гуманизированное IgG1 анти-PD-L1 моноклональное антитело. Применяется у больных местно-распространенным и метастатическим переходно-клеточным раком во II линии и меланомой.
К настоящему времени известно несколько групп методов, определяющих чувствительность к иммуноонкологическим препаратам. Среди них выделяется две группы. Первая связана с оценкой экспрессии молекулы - мишени на поверхности опухолевых или клеток микроокружения, а также показателями, отражающими возможность образования неоантигенов: мутационная нагрузка и микросателлитная нестабильность. Вторая связана с оценкой баланса иммуностимулирующих и иммуносупрессивных компонентов в микроокружении опухоли или в крови.
Предиктором эффективности и показанием к применению иммуноонкологических препаратов является степень экспрессии PD-L1 на поверхности клеток микроокружения и/или опухолевых клеток. Экспрессия более, чем на 5% клеток микроокружения или более чем на 10% опухолевых является предиктором эффективности лечения (N. Engl. J. Med. 2016; 375 (18): 1767-1778). В некоторых случаях оценка экспрессии PD-L1 осуществляется в баллах с использованием тест-системы 22С3 (DAKO PharmaDx), в которой учитывается отношение PD-L1 на опухолевых клетках, лимфоцитах и макрофагах к общему числу детектируемых опухолевых клеток, помноженное на 100 (CPS, combined positive score). В этом случае предиктором эффективности является CPS ≥ 10 (Lancet Oncol. 2020; 21 (1): 44-59).
В 2004 - 2005 годах 200 экспертов разных специальностей (онкологи, иммунологи, радиологи) провели серию семинаров, посвященных применению иммунотерапевтических агентов у онкологических больных, в результате чего был сделан ряд заключений: 1) противоопухолевые эффекты иммунотерапевтических препаратов реализуются дольше, чем химиопрепаратов; 2) ответ на иммунотерапию без смены препаратов может отмечаться после периода прогрессирования; 3) не рекомендуется менять тактику и прекращать иммунотерапию при выявлении признаков прогрессирования без подтверждения при последующем обследованиям по критериям RECIST v 1.1; 4) появление новых мелких очагов на фоне уменьшения существующих должно рассматриваться как клинически не значимое прогрессирование; 5) длительная стабилизация должна рассматриваться как индикатор клинического ответа (J. Immunother. 2007; 30: 1-15). На основе рекомендаций рабочей группы были разработаны и валидированы на группе из 487 больных иммуноспецифические критерии ответа опухоли на лечение (irRC, immune-specific related response criteria). Как и в случае критериев ВОЗ, в iRC использовалось два измерения, новые очаги не рассматривались как однозначный признак прогрессирования и требовали подтверждения при последующих исследованиях (Clin. Cancer Res. 2009; 15 (23): 7412-7420).
Измерения в двух перпендикулярных плоскостях отличаются большой вариабельностью, когда в них участвуют разные специалисты. В связи с этим, Nishini N. с соавторами предложили модифицировать шкалу iRC, заменив два перпендикулярных размера на один. Была создана и на группе из 57 больных валидирована шкала irRECIST (immune-related Response Evaluation Criteria in Solid Tumors, связанные с иммунитетом критерии оценки ответа солидных опухолей). Авторы отмечают высокую конкордантность обоих шкал (коэффициент корреляции Спирмена - 0,965), а также лучшую воспроизводимость irRECIST (95% доверительный интервал -16,1%; 5,8%) по сравнению с irRC (95% доверительный интервал -31,3%; 19,7%; Clin. Cancer Res. 2013; 19 (14): 3936-3943).
Несмотря на явные преимущества iRECIST по сравнению с RECIST v.1.1, она не была валидирована на больших популяциях и не нашла широкого применения в клинической практике. В большинстве исследований, в которых оценивалась эффективность и безопасность современных иммунотерапевтических препаратов в период с 2010 по 2017 годы, использовали RECIST v.1.1. Недостатки ее четко проявились после того, как при ряде опухолей было описано псевдопрогрессирование - феномен, при котором на фоне лечения появляются признаки прогрессирования заболевания, подтверждаемые инструментальными методами, а при продолжении лечения без смены препаратов наблюдается частичный или полный ответ (World. J. Urol. 2018; 36:1703-1709. J.Clin. Oncol. 2015; 33 (31): 3541-3543).
Точного объяснения феномена псевдопрогрессирования в настоящее время не существует. В литературе есть несколько гипотез, основанных на особенностях взаимодействия опухоли и иммунной системы на фоне лечения. Первая основана на том, что иммунной системе нужно много времени, чтобы перестроится на фоне стимуляции или снижения супрессорных влияний. Это приводит к клиническим эффектам, которые реализуются позже, чем интервал между периодами обследований. Вторая гипотеза основана на предположении, что на первом этапе для реализации клинического эффекта необходима гиперинфильтрация опухолевых очагов иммунными клетками. При компьютерно-томографическом исследовании это воспринимается как прогрессирование. Эта гипотеза подтверждена в нескольких исследованиях, где проводилась биопсия метастазов при прогрессировании. По данным разных авторов, частота псевдопрогрессирования у больных c разными нозологическими формами от 1,3 до 9,1 %, достигая 15 -17 % при почечно-клеточном раке и меланоме (Frontiers in Oncology. 2022; 25 (12): 982983).
Вторая проблема, с которой сталкиваются рентгенологи - это иммуно-диссоциированный ответ, при котором одни очаги увеличиваются, а другие уменьшаются. Частота этого феномена составляет 3,3 - 9,2 %. Он может быть связан с разным составом микроокружения в метастатических очагах или с иммуно-опосредованными побочными эффектами, когда в паренхиматозных органах возникают конгломераты, сходные по морфологии с метастатическими очагами (саркоидоз - подобные реакции). Иммуно-диссоциироанный ответ и псевдопрогрессирование являются наиболее серьезными препятствиями для определения адекватной тактики лечения, связанный с продолжением лечения в прежнем режиме или назначением других препаратов (Eur. J. Nucl. Med. Mol. Imaging. 2020; 47(5):1158-1167).
Третья проблема, с которой сталкиваются рентгенологи при оценке непосредственных результатов лечения - феномен гиперпрогрессирования (частота - от 4% до 29%), при котором отмечается резкое увеличение размеров и/или числа метастатических очагов на фоне применения иммуноонкологических препаратов. Связан он, скорее всего, с избыточной экспрессией мишеней для иммунотерапии на эффекторных, а не на иммуносупрессорных клетках. Точного алгоритма дифференциальной диагностики прогрессирования и гиперпрогрессирования не существует. В то же время, терапевтическая тактика должна различаться существенно. При прогрессировании возможно продолжение лечения в прежнем режиме с учетом возможности псевдопрогрессирования, а при гиперпрогрессировании требуется срочная отмена препарата (Trends Cancer. 2020; 6(3):181-191).
Рабочая группа по модификации RECIST, включавшая онкологов, иммунологов, рентгенологов и представителей регулятора в период с 2015 по 2016 годы разработала и создала план валидации шкалы iRECIST (Immunotherapy Response Evaluation Criteria in Solid Tumors; иммунотерапевтические критерии оценки ответа солидных опухолей). Основные параметры iRECIST и RECIST совпадают, но в iRECIST для выявления случаев псевдопрогрессирования были введены понятия «не подтвержденное прогрессирование» (iUPD) и «подтвержденное прогрессирование» (iCPD). iUPD - впервые выявленные признаки прогрессирования заболевания в виде увеличения размеров и/или числа измеряемых (целевых и не целевых) и не измеряемых очагов. Для подтверждения прогрессирования требуется повторное обследование, которое проводится в сроки 4 - 8 недель после первичного. Исключение составляют опухоли, у которых, по данным литературы, отмечается высокая частота псевдопрогрессирования (почечно-клеточный рак, меланома). В этом случае повторное обследование может быть проведено в более поздние сроки (12 - 24 недели). В случае стабилизации (iSD, иммунологическая стабилизация), уменьшения (iPR, иммунологический частичный ответ) или полного исчезновения вновь выявленных очагов (iCR, иммунологический полный ответ) рекомендуется продолжить лечение в прежнем режиме. В тех случаях, когда при повторном исследовании констатируется iCPD, рекомендуется изменить тактику лечения.
При использовании iRECIST частота обследования обычно составляет один раз в 6 - 12 недель при положительной динамике очагов в процессе лечения. В рутинной клинической практике оценивается не более пяти целевых очагов. Оценка большего объема практикуется в научных исследованиях (Lancet Oncol. 2017; 18 (3): e143-e152).
Hodi F.S. с соавторами в 2018 году предложили еще один модифицированный вариант критериев ответа для тех случаев, когда оценивается эффективность и безопасность иммунотропных препаратов нового поколения - imRECIST (immune-Modified Response Evaluation Criteria in Solid Tumors; иммуномодифицированные критерии оценки ответа солидных опухолей; J. Clin. Oncol. 2018; 36: 850-858). Модель создана на основе анализа данных, полученных при оценке эффективности и безопасности атезолизумаба у больных раком легкого, мочевого пузыря, почки и меланомы.
С точки зрения критериев оценки очагов imRECIST в целом сходна с другими шкалами, в которых используется одно измерение. Отличия касаются интерпретации динамики измеряемых и не измеряемых очагов, что, в конечном итоге, приводит к более адекватному определению выживаемости без прогрессирования.
Кроме изменения размеров учитывается реверсия измеряемых в не измеряемые очаги и наоборот. Исчезновение не измеряемых очагов вместе с измеряемыми свидетельствует о полном ответе на лечение. В то же время их увеличение не говорит о прогрессировании заболевания в целом. Как и в других критериях оценки требуется подтверждение прогрессирования через 4-8 недель. При этом при достижении стабилизации, частичного или полного ответа при повторной оценке факт прогрессирования не учитывался при расчете показателей выживаемости без прогрессирования.
При сравнении RECIST v 1.1 и imRECIST частота достижения наилучшего общего ответа была на 2% выше, частота контроля заболевания на 8-13% выше, а медиана выживаемости без прогрессирования на 1,5 месяца больше по критериям imRECIST. При этом медиана общей выживаемости была больше при появлении новых не таргетных очагов была меньше при использовании критериев imRECIST. Таким образом, критерии imRECIST по сравнению со стандартными обладают большей точностью в оценке отдаленных результатов лечения (таблица 2).
2требуется подтверждение в период 4 -8 недель после первичного прогрессирования;
3требуется подтверждение в период 4 -8 недель после первичного прогрессирования.
iUPD (immune unconfirmed progressive disease) - не подтвержденное прогрессирование (иммунотерапия);
iCPD (immune unconfirmed progressive disease) - подтвержденное прогрессирование (иммунотерапия);
irRECIST (immune-related Response Evaluation Criteria in Solid Tumors) - связанные с иммунитетом критерии оценки ответа солидных опухолей;
iRECIST (Immunotherapy Response Evaluation Criteria in Solid Tumors) - иммунотерапевтические критерии оценки ответа солидных опухолей;
irRC (immune-specific related response criteria) - иммуноcпецифические критерии ответа;
imRECIST (immune-Modified Response Evaluation Criteria in Solid Tumors) - иммуномодифицированные критерии оценки ответа солидных опухолей
Несмотря на то, что методы оценки эффективности непосредственных лечения, основанные на линейных измерениях, в настоящее время являются стандартными, а современные их модификации позволяют учитывать возможность псевдопрогрессирования, по мнению большинства экспертов - рентгенологов, они имеют ряд существенных недостатков.
Во-первых, во всех шкалах осуществляется отбор целевых очагов, и решение о характере клинического ответа (частичный ответ, прогрессирование, стабилизация), в основном, принимается на основании их динамики. При наличии множественных мелких, а также не измеряемых очагов, их суммарный объем может оказаться больше, чем целевых. Поэтому отдаленные результаты лечения в этом случае определяются динамикой опухолевой массы, не включенной в основные измерения.
Во-вторых, перечисленные методы предполагают высокую степень субъективности оценки. Границы очагов оцениваются исследователями по-разному, особенно в тех случаях, когда они существенно различаются по квалификации и опыту. Подобные различия могут особенно сильно сказаться на оценке результатов лечения в пограничных ситуациях, когда нужно провести дифференциальную диагностику между стабилизацией и прогрессированием.
В-третьих, максимальные размеры очагов могут зависеть не только от реальной динамики объема опухолевой массы, но и от положения больного во время исследования, а также от дыхательных движений.
В-четвертых, измерения линейных размеров и заключение о динамики размеров опухоли строятся на предположении о сферичности метастатических очагов и равномерности их роста. В то же время, современные исследования показывают, что это не соответствует действительности. Большинство очагов имеют не правильную форму и увеличиваются не равномерно.
В-пятых, компьютерно-томографические методы, как указывалось выше, не позволяют четко разграничить прогрессирование и гиперрпрогрессирование, а дифференциальный диагноз псевдопрогрессирования и прогрессирования требует длительного времени (4 - 6 недель), что приводит к задержке в выборе адекватной тактики, и, как следствие, ухудшению отдаленных результатов лечения.
Известна группа методов оценки непосредственных результатов лечения опухолей, связанных с молекулярной визуализацией метаболических процессов - позитронно-эмиссионная томография (ПЭТ, PET, Positron Emission Tomography). При использовании ПЭТ оценивается распределение каких-либо биомаркеров опухолевых клеток или поглощение глюкозы (18F- ФДГ - ПЭТ), что отражает интенсивность метаболизма, и, как следствие, степень агрессивности опухоли (Semin. Nucl. Med. 2007; 37: 400-419). При проведении иммунотерапии на первом этапе нарушается метаболизм опухолевых клеток, а на втором выявляются морфологические изменения. В настоящее время предложено несколько методов оценки непосредственных результатов лечения, основанных на изменении метаболизма опухоли в процессе лечения (таблица 3).
iCPD (immune unconfirmed progressive disease) - подтвержденное прогрессирование (иммунотерапия); EORTC (European Organization for Research and Treatment Cancer) - Европейская организация по изучению и лечению рака; PERCIST (Positron Emission Tomography (PET) Response Criteria in Solid Tumors) - ПЭТ критерии для оценки солидных опухолей; PECRIT ( PET/KT Criteria for Early Prediction of Response to Immune Checkpoint Inhibitior Therapy) - ПЭТ/КТ критерии раннего предсказания ответа на ингибиторы контрольных точек; PERCIMT( PET Response Evaluation Criteria for immunotherapy) - ПЭТ критерии оценки ответа на иммунотерапию; imRECIST5 (immune-Modified Positron Emission Tomography (PET) Response Criteria in Solid Tumors) - иммуномодифицированные ПЭТ критерии оценки ответа солидных опухолей; iPERCIST ( immune Positron Emission Tomography Response Criteria in Solid Tumors) - иммунологические ПЭТ критерии для оценки солидных опухолей. SUV (standardized uptake value) - стандартизованный уровень захвата; SUL (lean body mass-normalized standardized uptake value) - стандартизованная единица поглощения в пересчете на мышечную массу тела.
В 1999 году Европейская организация по изучению и лечению рака (EORTC, European Organization for Research and Treatment of Cancer) предложила критерии оценки метаболического ответа, основанные на поглощении 18F- ФДГ и использовании критерия SUV (standartized uptake value; стандартизованный уровень захвата) (Eur. J. Cancer. 1999; 35(13):1773-1782). Через 10 лет эти критерии были трансформированы в PERCIST (Positron Emission Tomography (PET) Response Criteria in Solid Tumors; ПЭТ критерии для оценки солидных опухолей), которые были основаны на использовании SUL (lean body mass-normalized standardized uptake value; стандартизованная единица поглощения в пересчете на мышечную массу тела) (J. Nucl. Med. 2009; 50 (Suppl 1):122S-150S). Оба метода не получили широкого клинического распространения, так как корреляции с полным и частичным ответом по данным компьютерно-томографического исследования, на больших группах больных не получено (Med. 2020; 99(51): e23815).
В 2017 году на основе анализа результатов лечения небольшой группы больных меланомой, было предложено комбинировать критерии RECIST 1.1 и PERCIST, в результате чего были разработаны критерии ответа PECRIT (PET/KT Criteria for Early Prediction of Response to Immune Checkpoint Inhibitior Therapy, ПЭТ/КТ критерии раннего предсказания ответа на ингибиторы контрольных точек), которые продемонстрировали 100% чувствительность и 93% специфичность на изучаемой группе (J. Nucl. Med. 2017; 58(9):1421-1428). На больших популяциях в дальнейшем чувствительность и специфичность этих критериев не оценивалась.
В 2018 году были предложены критерии PERCIMT (PET Response Evaluation Criteria for immunotherapy, ПЭТ критерии оценки ответа на иммунотерапию), которые представляют собой модифицированные критерии EORTC. Они разработаны на группе больных с меланомой, получавших лечение ипилимумабом. По сравнению с EORTC критерии PERCIMT обладают лучшей чувствительностью (93,6%) и специфичностью (87,8%). На больших популяциях в дальнейшем чувствительность и специфичность этих критериев не оценивалась (Eur. J. Nucl. Med. Mol. Imaging. 2018; 45(8):1289-1296).
В 2019 году были предложены критерии imRECIST5 (immune-Modified Positron Emission Tomography (PET) Response Criteria in Solid Tumors; иммуномодифицированные ПЭТ критерии оценки ответа солидных опухолей), которые основаны на оценке динамики суммы пиковых SUL пяти очагов. Метод разработан при анализе результатов лечения 60 больных меланомой. Он продемонстрировал хорошие результаты по оценке раннего ответа с последующей коррекцией тактики, что привело к достоверному повышению показателей общей выживаемости на 35%. На больших популяциях в дальнейшем чувствительность и специфичность этих критериев не оценивалась (J. Nucl. Med. 2019; 60(3):335-341).
В 2019 году были предложены критерии iPERCIST (immune Positron Emission Tomography Response Criteria in Solid Tumors, иммунологические ПЭТ критерии для оценки солидных опухолей). Принципиальным отличием от других методов является необходимость подтверждения прогрессирования в течение 4 - 8 недель после появления новых очагов. Метод разработан при анализе результатов лечения больных немелкоклеточным раком легкого. На больших популяциях в дальнейшем чувствительность и специфичность этих критериев не оценивалась (EJNMMI Res. 2019; 9: 8).
Общий недостаток разрабатываемых методов оценки непосредственного ответа, основанных на метаболических параметрах, связан с тем, что они нацелены на опухоли с активным метаболизмом, которые составляют лишь небольшой процент от общего числа злокачественных заболеваний. Все предложенные методы разработаны на небольших группах больных меланомой, и лишь iPERCIST - на группе с немелкоклеточным раком легкого. На других патологиях, характеризующихся менее выраженным поглощением глюкозы, эти методы валидированы не были. Активный метаболизм характерен также для эффекторных клеток микроокружения опухоли. Поэтому снижение поглощения глюкозы не может быть однозначно интерпретировано как положительный эффект от лечения. Кроме того, эта группа методов не позволяет решить проблемы, с псевдопрогрессированием, гиперпрогрессированием и иммуно-дисоциированным ответом. Все эти не решенные вопросы препятствуют широкому внедрению в стандарты диагностики методов метаболической оценки ответа (Eur. J. Nucl. Med. Mol. Imaging. 2022;.49(7): 2323-2241).
Известна группа методов оценки непосредственных результатов лечения, связанная с измерением объемов опухолевых очагов - волюметрия, которая может проводится в автоматическом, полуавтоматическом или ручном режимах. При автоматической волюметрии расчеты полностью производятся компьютером. При полуавтоматическом режиме после этапа расчета объема происходит ручная коррекция с целью точной дифференцировки очагов, расположенных вблизи анатомических структур. В режиме ручного оконтуривания выделение очагов осуществляется исследователем.
Волюметрия представляет собой значительно менее субъективный метод по сравнению с методами линейной оценки. Кроме того, с его помощью можно оценить период полу удвоения объемов очагов, что является важным прогностическим фактором. С технической точки главная задача волюметрии - идентификация вокселей (элемент объемного изображения, содержащий значение элемента растра в трехмерном пространстве; аналог двумерных пикселей для трехмерного пространства), расположенных на границе тканей с различной рентгеновской плотностью тканей (примерно 500 единиц Хаунсфилда).
Несмотря на перспективность волюметрии, существует ряд технических сложностей, препятствующих стандартизации и широкому внедрению этого метода в клиническую практику.
1. Факторы, связанные с морфологическими особенностями очагов: размеры очагов, их плотность, близость к анатомическим структурам. При небольших линейных размерах очагов (менее 6 мм) уменьшается воспроизводимость измерений. Это связно, прежде всего, с соотношением размеров вокселя и очага. Kuhnigk J.M. с соавторами продемонстрировали, 41% объема опухоли содержаться в 27 вокселах. Остальные вокселы содержат как опухолевую, так и нормальную ткань, что затрудняет их отнесение к той или иной категории (IEEE Trans. Med. Imaging 2006;25(4):417-434). Дифференцированная плотность очагов также является фактором, затрудняющем волюметрию, особенно в тех случаях, когда используется автоматический режим. В нескольких работах продемонстрировано, что вариабельность двух исследований одной анатомической области при наличии очагов с неравномерной рентгеновской плотностью повышает вариабельность волюметрии до 50% (Eur. Radiol. 2015;25(4):1040-1047). Очаги, расположенные возле сосудов и плевры, значительно труднее дифференцировать, чем внутрипаренхиматозные. Вариабельность их оценки в четыре раза выше. В этих случаях, как правило, требуется применение ручного оконтуривания (Radiology. 2008;248(2):625-631).
2. Факторы, связанные с пациентом - дыхательные движения и эмфизема. Объем легких пациента изменяется при каждом дыхательном движении даже в том случае, когда происходит задержка дыхания во время исследования. Оценка объема при этом может варьировать от -19% до +26% (Eur. Radiol. 2009;19(4):800-808). Эмфизема также может оказывать влияние на точность волюметрии опухолевых очагов (Radiology. 2013;268(2):563-571).
3. Факторы, связанные с техническими аспектами исследования: программное обеспечение, число и тип датчиков, контрастное вещество, толщина среза и тип кернеля конволюции. Программное обеспечение разных производителей, используемое для волюметрии, основано на разных алгоритмах. De Hoop B. с соавторами продемонстрировали, что при использовании разных алгоритмов реконструкции 95% доверительный интервал измерений составляет: 16 - 22% (Eur. Radiol. 2009; 19(4):800-808). В другом исследовании этот показатель достиг 50% (Acta Radiol. 2014;55(6):691-698). Das M. с соавторами выявили, что точность волюметрии достоверно различается при использовании 16- и 64- срезовых томографов (Eur. Radiol. 2007; 17(8):1979- 1984). В более позднем исследовании выявлено различие в оценке очагов (± 18,2%) при использовании 64-срезовых аппаратов разных производителей (Br. J. Radiol. 2013;86(1029):20130160). Honda O. С соавторами продемонстрировали, что использование разных контрастных веществ сопровождается изменением измеряемого объема на 20% и более (Radiology. 2007; 245(3):881-887). Позже эти данные были подтверждены в другом исследовании (Am. J. Roentgenol. 2010;195(1):149- 154). Petrou M. соавторами опубликовали данные, согласно которым объемы очагов, рассчитанные при использовании тонких срезов (1,25 мм), на 40% больше, чем при использовании толстых (5 мм. Am. J. Roentgenol. 2007;188(2):306-312). Аналогичные данные были получены в более поздних исследованиях (Radiology. 2008;247(2):400-408. Acad. Radiol. 2013;20(2):173-180). Кернел конволюции, используемый при реконструкции изображений из исходных данных, определяет отношение между пространственным разрешением и шумом в изображении. Шум ограничивает разрешение контраста и тем самым возможность дифференцировать объекты, ослабление которых может очень мало отличаться от ослабления окружающего фона. Кернели конволюции высокого разрешения улучшают пространственное разрешение, но также диспропорционально увеличивают шум. Мягкие, или сглаживающие, кернели ведут к одновременному уменьшению шума и пространственного разрешения. В ряде исследованиях было показано, что точность оценки и воспроизводимость при оценке очагов лучше при использовании кернелей высокого разрешения (Radiology. 2007; 245(3):881-887. Eur. Radiol. 2010;20(5):1180-1187).
В современных работах, посвященных волюметрии опухолевых очагов, предпринимаются попытки решить две главные задачи, возникающие при использовании волюметрии: 1) расчет ошибки измерений, которая возникает вследствие влияния большого числа факторов, перечисленных выше; 2) вычисление предельного уровня изменений объемов, который позволяет дифференцировать стабилизацию с прогрессированием или частичным ответом (World J. Clin. Onol. 2020;11(2):53-73).
Оценка систематической погрешности измерений при волюметрии является принципиальным моментом в стандартизации этого метода. Во всех работах, где отражены данные по сравнению одно- и двумерных измерений и волюметрии, проводится ошибка измерений, а в некоторых публикациях приводится математический аппарат для ее оценки.
Xie X. с соавторами в исследовании с антропоморфными фантомами на двух разных томографах (Sensation 64, Siemens; Brilliance 64, Phillips) продемонстрировали, что систематическая погрешность измерений меньше при использовании полуавтоматического режима (7,6%) по сравнению с ручным (26,4%). При этом достоверных различий в волюметрии между двумя аппаратами, за исключение толщины среза 3 мм, не выявлено. 95% доверительный интервал межсканерной вариабельности составляет ± 41,6%; ± 18,2%; ± 4,9 % для очагов 3, 5 и ≥ 8 мм. 95% доверительный интервал интрасканерной вариабельности составляет ± 28,6%; ± 13,4%; ± 2,6 % для очагов 3, 5 и ≥ 8 мм (Br. J. Radiol. 2013;86:20130160).
Doo K. с соавторами изучали зависимость систематической погрешности в зависимости от характера обработки изображений. В своей работе они использовали фантомы диаметрами 5, 8, 10 и 12 мм, моделирующие очаги типа «матовое стекло» и плотные очаги (на 100 единиц Хаунсфилда больше). Использовались различные параметры сканирования: 10, 20, 30 и 50 mAs. При построении изображения использовались различные фильтры и итеративная реконструкция. Абсолютная процентная ошибка для всех узлов была достоверно меньше при использовании итеративной реконструкции по сравнению с фильтрами (7,5 ± 4,7%; 7 ± 6,9% соответственно, p<0,001). Положительный эффект итеративной реконструкции более выражен на маленьких узлах (p<0,001). Абсолютная процентная ошибка достоверно меньше при обработке узлов типа «матовое стекло» при использовании итеративной реконструкции по сравнению с фильтрами (2,9 ± 2%; 4,5 ± 2% соответственно, p<0,001), и эта разница более выражена при минимальном времени сканирования (11,8 ± 5,9%; 21,3 ± 6,1 % соответственно, p <0,001. Br. J. Radiol. 2014;87:20130644).
Gavrielides M.A. с соавторами изучили зависимость погрешности измерений от структуры оцениваемых очагов. В исследовании использовались восемь синтетических фантомов округлой формы с разными размерами и плотностью центральной и периферической области (20 мм/10 мм; 10 мм/5 мм;100 HU (единиц Хаунсфилда) /-630 HU; 10 HU /-630 HU; -630 HU /100 HU; -630 HU /-10 HU). Фантомы помещались в антропоморфный фантом, после чего производилось исследование с разными параметрами сканирования. Погрешность измерений при толщине срезов менее 5 мм составила от -5,1% до 6,6% для наружного слоя и от -12,6% до 5,7% для внутренней области. Согласно модели, построенной на основе одномерного анализа, на величину погрешности измерений достоверно влияют: размер очага, толщина среза, кернел инволюции (J. Med. Imag. 2016;3(1):013504).
Hwang E.J. с соавторами разработали и валидировали модель, предсказывающую злокачественность очагов, включающую различные параметры волюметрии. В и исследование были включены 50 больных (26 мужчин и 24 женщины) со средним возрастом 62,6 года (от 32 до 82 лет), находившихся под наблюдением с ноября 2013 года по апрель 2014 года. Критериями включения были: 1) наличие метастатических очагов в легких; 2) компьютерно-томографическое исследование без контрастного усиления; 3) отсутствие симптомов легочного поражения. В исследование включены больные почечно-клеточным раком (13 человек), раком щитовидной железы (8 человек), легкого (6 человек), колоректальным раком (4 человека); с лейомиомой, опухолями головы и шеи, печеночно-клеточным раком - по 3 человека; с меланомой, раком желчного пузыря, хондросаркомой, опухолью тимуса, раком эндометрия, раком молочной железы, гистиоцитомой - по 1 человеку. У троих больных первичная опухоль не была выявлена. Каждому больному проводилось два последовательных сканирования с использованием 64 - срезового томографа (Brilliance 64, Philips, Нидерланды) на спине при полном вдохе. Волюметрии подвергались очаги, удовлетворяющие следующим критериям: 1) солидные структуры диаметром от 4 до 15 мм. 2) отсутствие полости и кальцификации; 3) выявляемые при обоих сканированиях в процессе исследования; 4) хирургически удалимые. Всего было проанализировано 111 очагов, удовлетворяющих данным критериям.
В процессе исследования авторы выявили, что на точность измерений оказывают влияние 4 расчётных параметра: абсолютная процентная ошибка (APE), сферичность, доля поверхностных вокселей (SVP), доля пограничных вокселей (AP). Объем очагов рассчитывался автоматически. Абсолютная процентная ошибка (APE) рассчитывалась по формуле:
APE=|V1 - V2 |/ Vm x 100, где V1 и V2 - объемы при двух последовательных исследованиях, Vm - среднее значение объема.
Под термином «сферичность» авторы подразумевают степень приближенности исследуемого очага к сфере. Она принимала значение от 0 до 1.
Доля поверхностных вокселей (SVP) по мнению авторов, играет ключевую роль в генерации ошибок в процессе волюметрии. Она рассчитывалась по формуле:
SVP = число поверхностных вокселей/общее число вокселей сегмента.
Доля пограничных вокселей (AP) отражает ошибки, связанные с дифференцировкой очага и окружающих структур. Она рассчитывалась по формуле:
AP = число внешних вокселей > - 400 HU / общее число внешних вокселей. HU - единицы седиментации Хаунсфилда.
С целью оценки диагностической значимости модели, авторы оценивали чувствительность и специфичность двух различных методик, используемых для оценки роста метастатических очагов: 1) 25% изменение объема очагов (стандартный метод); 2) индивидуализированная оценка с использованием 95% процентиля APE. Волюметрия индикаторных очагов проводилась при двух последовательных исследованиях. Если увеличение объема превышало значение порога индивидуальной вариабельности, соответствующего 95% процентилю APE, очаг рассматривался как растущий (положительный тест), если меньше - как стабильный (отрицательный тест).
Для валидации модели использовалась группа пациентов, удовлетворяющих следующим критериям отбора: 1) больным проводилась метастазэктомия из легких в период с января 2013 по октябрь 2015 года; 2) в течение года до операции больным проводилось компьютерно-томографическое исследование легких; 3) имелась техническая возможность сопоставить удаленные узлы с рентгенологической картиной. В эту группу был включен 41 больной: 25 мужчин и 16 женщин со средним возрастом 52 года (от 16 до 77 лет). Из 82 компьютерно-томографических исследований 17 (20, 73%) проводились с контрастным усилением. Средний интервал времени между двумя компьютерно-томографическими исследованиями составил 52 дня, а между вторым исследованием и оперативным вмешательством - 11 дней.
После проведения оперативного лечения и гистологического исследования удаленных очагов результаты исследований классифицировались как положительный золотой стандарт (метастатическое поражение) или отрицательный золотой стандарт (не опухолевая ткань). Для оценки 95% процентиля APE с помощью однофакторной квантильной регрессии в качестве независимых переменных были включены следующие параметры: среднее значение объема поражения (Vm), размер вокселя, SVP, AP, сферичность.
В результате однофакторного анализа выявлено, что для оценки 95% процентиля APE значимыми параметрами являются: SVP, AP, Vm (таблица 4: результаты однофакторной квантильной регрессии для оценки 95% процентиля процентной ошибки). При проведении многофакторного анализа (многофакторная квантильная регрессия) для оценки 95% процентиля APE значимыми параметрами оказались SVP и AP - доля пограничных вокселей. Формула регрессии:
95 % процентиль APE = 37,82 х SVP + 48,6 х AP - 10,87
Валидация модели, проведенная после оперативного вмешательства, что разработанный метод имеет преимущество по сравнению стандартным методом в отношении оценки прогрессирующих очагов в легких. Разработанная модель с высокой точностью позволяет дифференцировать метастатические и не метастатические очаги (Eur. Radiol. 2017;27:3257- 3265).
В настоящее время известно три способа определения границ изменений объема очагов, позволяющих дифференцировать стабилизацию с прогрессированием или частичным ответом. Первый способ основан на предположении о сферичности очагов. Радиус очага рассчитывается как среднее значение радиуса максимального линейного размера очага и перпендикулярного к нему. Объем рассчитывается по стандартной формуле: 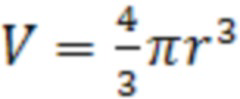 , где V - объем очага, r - радиус очага. Пороговые значения прогрессирования и частичного ответа рассчитываются в соответствии с критериями RECIST: Уменьшение суммы максимальных размеров на 30% (частичный ответ) соответствует уменьшению объема опухоли на 65%; увеличение суммы максимальных размеров на 20% (прогрессирование) соответствует увеличению объема опухоли на 73% (Radiology. 2002; 225:416-419. Acta Radiol. 2004; 11:1355-1360. Radiol. Med. 2006; 111:365-375). Второй способ связан с расчетом эффективного диаметра очага, который вычисляется автоматически в процессе волюметрии как расстояние между двумя вокселами с одинаковыми характеристиками (Acta Radiol. 2004; 11:1355-1360). Третий способ предполагает использование специальных математических методов для оценки границы, дифференцирующей стабилизацию, частичный ответ и прогрессирование (Eur. Radiol. 2007;17:2561-2571. Cancer Imaging. 2015;15:17).
, где V - объем очага, r - радиус очага. Пороговые значения прогрессирования и частичного ответа рассчитываются в соответствии с критериями RECIST: Уменьшение суммы максимальных размеров на 30% (частичный ответ) соответствует уменьшению объема опухоли на 65%; увеличение суммы максимальных размеров на 20% (прогрессирование) соответствует увеличению объема опухоли на 73% (Radiology. 2002; 225:416-419. Acta Radiol. 2004; 11:1355-1360. Radiol. Med. 2006; 111:365-375). Второй способ связан с расчетом эффективного диаметра очага, который вычисляется автоматически в процессе волюметрии как расстояние между двумя вокселами с одинаковыми характеристиками (Acta Radiol. 2004; 11:1355-1360). Третий способ предполагает использование специальных математических методов для оценки границы, дифференцирующей стабилизацию, частичный ответ и прогрессирование (Eur. Radiol. 2007;17:2561-2571. Cancer Imaging. 2015;15:17).
Prasad S.R. с соавторами опубликовали результаты исследования, в котором сравнивались измерения одного, двух размеров очага и данных расчётной волюметрии для оценки непосредственных результатов лечения. Из 38 больных, включенных в исследование, у 12 по данным измерения одного размера и у 13 по результатам двух измерений получены дискордантные результаты по отношению к волюметрии. У 6 больных с частичным ответом по данным одного и двух измерений после волюметрии ответ был расклассифицирован на стабилизацию. У 2 больных со стабилизацией по данным линейных измерений по данным волюметрии был констатирован частичный ответ. У 4 больных с прогрессированием по данным линейных измерений ответ был изменен на стабилизацию после оценки объемов. Авторы пришли к выводу о том, что волюметрия обладает лучшей классифицирующей способностью по сравнению с линейными измерениями (Radiology. 2002; 225:416-419). К аналогичным выводам позднее пришли еще несколько групп исследователей (Acta Radiol. 2004; 11:1355-1360. Radiol. Med. 2006; 111:365-375).
Dicken V. с соавторами проели исследование, в котором сравнивалась эффективность различных методов измерения размеров очага в оценке непосредственных результатов лечения. Исследование проводилось на группе больных метастатическим почечно-клеточным раком (174 человека), которые получали иммунотерапию препаратами интерферона-α в рамках второй фазы клинических испытаний. Всего проведено 726 компьютерно-томографических исследования. В процессе работы проводилось измерение диаметров очагов с использованием трех алгоритмов: а) ручное измерение максимальных размеров очагов; б) автоматические измерение размеров; в) оценка эффективного диаметра. По данным авторов, использование эффективного диаметра для оценки динамики характеризуется максимальным числом совпадений при участии двух исследователей (87,6%) по сравнению с автоматическим (86,2%) и ручным измерениями (63,9%). Кроме того, из всех вариантов измерений только эффективный диаметр позволяет точно оценивать минимальную динамику размеров очагов (10% или 1 мм). Авторы приходят к выводу о необходимости интеграции этого вида измерений в современные шкалы оценки непосредственных результатов лечения (Acta Radiol. 2004; 11:1355-1360).
Marten K. c соавторами опубликовали результаты исследования, в котором проведен расчет предельных значений изменений объемов очагов с использованием метода Бланда-Альтмана (Stat. Meth. Med. Res. 1999; 8:135-160). В нем приняли участие 50 больных с различными опухолями, включая рак пищевода (13 человек), не мелкоклеточный рак легкого (10 человек), колоректальный рак (7 человек), меланому (3 человека), переходно-клеточный рак мочевого пузыря (3 человек), хондросаркому (2 человека), почечно-клеточный рак (2 человека) и по одному человеку с раком желудка, глотки, молочной железы, гистиоцитомой, лейомиосаркомой, остеоаркомой, хорионкарциномой, саркомой плевры, синовиальной саркомой, и саркомой неизвестной этиологии, у которых было оценено 202 метастатических очага (от 1 до 5 у каждого больного).
Медиана объема до начала лечения составила 182,22 мм3(от 3,16 до 5159,13 мм3) и 124,79 мм3 (от 0 до 6359,23 мм3) после лечения. В исследовании проводилась автоматическая волюметрия двумя специалистами. В 7 солидных узлах в двух сериях измерений (1,7%) потребовалась ручная коррекция в связи с их расположением возле анатомических структур (сосуды, плевра). Вариабельность измерений при сопоставлении результатов, полученных обоими специалистами, составила от -17,9 д 13,2 % для первого и от -11,1 до 4,8 % для второго. Вариабельность при двух измерениях одним специалистом через короткий интервал времени составила от - 16,9 до 13,2 % для первого и от - 21,3% до 3,9 % для второго.
В процессе исследования на первом этапе проводилась оценка непосредственных результатов лечения при использовании различных границ, определяющих область стабилизации: от 70% до 20% с шагом 5%. На втором этапе использованием метода Бланда-Альтмана определялось оптимальное значение границ, характеризующих стабилизацию заболевания.
Всего у 50 больных проведено 400 оценок (2 исследователя по 2 исследования) непосредственных результатов лечения. При использовании в качестве границы стабилизации 70% у 13 больных констатировано прогрессирование заболевания, у 28 - стабилизация, у 7 - частичный ответ и у 2 - полный ответ. По мере уменьшения границы число больных со стабилизацией уменьшалось, а с прогрессированием и частичным ответом увеличивалось. При использовании в качестве границы 20% уровня только у 9 больных (уменьшение на 67,9%) констатирована стабилизация, у 21 (увеличение на 61,5%) - прогрессирование и у 18 (увеличение на 157,1%) - частичный ответ. При использовании границы 60% и 65% классификации ответа обоими исследователями в двух сериях измерений были идентичными.
На втором этапе исследователями проведено вычисление оптимальной границы оценки (≥ 35%). При этом при числе метастазов ≥ 3 достигается набольшие значения согласованности в классификации непосредственных результатов лечения (стабилизация, прогрессирование, частичный ответ) с RECIST (Eur. Radiol. 2007;17:2561-2571).
Beaumont H. С соавторами для оценки оптимальной границы, определяющей стабилизацию, частичный ответ и прогрессирование при волюметрии, провели исследование, основанное на данных альянса числовых биомаркеров визуализации (QIBA, Quantitative Imaging Biomarker Alliance) и с использованием мультипараметрической математической модели, основанной на трансформации Geary-Hinkel (Radiology. 2011;258:906-914. Biometrika. 1969;56:635-639. Manage Sci. 1975; 21:1338-41. Am Stat. 1993; 47:259-64).
Модель была разработана с использованием 10000 образцов волюметрии очагов из базы альянса числовых биомаркеров визуализации и валидирована на реальной ретроспективной клинической группе из 10 больных, принимавших участие в многоцентровых исследованиях, в отношении которых имелись данные о 5 и более последовательных компьютерно-томографических исследованиях.
Толщина сканов варьировала от 1 до 7 мм. Чаще всего сканирование проводилось с толщиной 5 мм (87%). Исследование проводилось на 10 томографах различных производителей (Siemens, General Electric, Toshiba). Размеры вокселей варьировали от 0,5 до 1 мм. Медиана, минимальное и максимальное значение линейных размеров очагов в группе составили 40 мм, 11 мм и 117 мм соответственно. Динамика объемов оценивалась в полуавтоматическом режиме; после этапа автоматической волюметрии проводилась ручная коррекция оконтуривания. Всего было оценено 426 очагов. В 68 случаев диагностирован частичный ответ на лечение, в 67 - прогрессирование; в остальных случаях стабилизация. Среднее значение объема поражений в исследовании составило 29,446 см3, медиана - 30,719 см3(диапазон от 0,195 см3 до 380,976 см3). Размеры большинства очагов варьировали от 1 до 100 см3.
Рассчитанные согласно модели границы стабилизации при волюметрии составили -35%; +55%. При этом соответствующие границы размеров эффективного диаметра составили -13%; +16%. Прогрессирование заболевания констатировалось при увеличении объема на 55% или увеличении эффективного диаметра на 16%; частичный ответ - при уменьшении на 35% и 16% соответственно. Согласованность модели оценивалась при помощи симуляции Монте Карло (R Foundation for Statistical Computing; 2011. p. 409). На реальной клинической группе 97,1% оценок совпадало с предложенной моделью (Cancer Imaging. 2015;15:17).
В нашем центре разработан способ оценки непосредственных результатов лечения диссеминированных форм почечно-клеточного рака, основанный на волюметрии метастатических очагов в легких (Пат. 2751086 Российская Федерация, А61В 6/03. Способ оценки непосредственных результатов лечения почечно-клеточного рака / О.Е.Молчанов, Д.Н.Майстренко, Д.А.Гранов, Е.В.Розенгауз, Д.В.Нестеров (РФ) // Заявл. 9.10.2019; Опубл. 28.12.2020. Заявка № 2020143529). В предложенном способе у больного рассчитывают объем метастатического поражения легких по формулам:
V1 =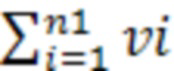 ; V2 =
; V2 =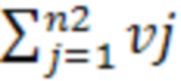 ;
;
где V1 - суммарный объем исходного метастатического поражения, i - номер очага при исходном исследовании, vi - объем очага при исходном исследовании, n1 - число очагов при исходном исследовании, V2 - суммарный объем метастатического поражения после цикла лечения, j - номер очага при исследовании после цикла лечения, vj - объем очага при исследовании после цикла лечения, n2 - число очагов после цикла лечения;
выбирают наибольшее (Vmax) и наименьшее (Vmin) значения из этих объёмов и рассчитывают значение функций объемов с учетом системной ошибки по формулам:
Fmax =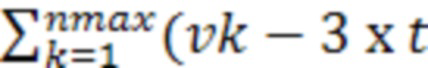 +183/dк + 49);
+183/dк + 49);
Fmin =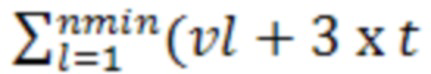 +183/dl + 49),
+183/dl + 49),
где, Fmaх - значение функции наибольшего суммарного объема метастатического поражения при двух последовательных измерениях, Fmin - значение функции наименьшего суммарного объема метастатического поражения при двух последовательных измерениях, 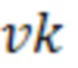 - объем очага в измерении с наибольшим суммарным объемом метастатического поражения при двух последовательных измерениях,
- объем очага в измерении с наибольшим суммарным объемом метастатического поражения при двух последовательных измерениях, 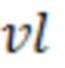 - объем очага в измерении с наименьшим суммарным объемом метастатического поражения при двух последовательных измерениях, nmax - число метастатических очагов в измерении с наибольшим суммарным объемом метастатического поражения при двух последовательных измерениях, nmin - число метастатических очагов в измерении с наименьшим суммарным объемом метастатического поражения при двух последовательных измерениях, dк - диаметр очага в измерении с наибольшим суммарным объемом метастатического поражения при двух последовательных измерениях, dl - диаметр очага в измерении с наименьшим суммарным объемом метастатического поражения при двух последовательных измерениях,
- объем очага в измерении с наименьшим суммарным объемом метастатического поражения при двух последовательных измерениях, nmax - число метастатических очагов в измерении с наибольшим суммарным объемом метастатического поражения при двух последовательных измерениях, nmin - число метастатических очагов в измерении с наименьшим суммарным объемом метастатического поражения при двух последовательных измерениях, dк - диаметр очага в измерении с наибольшим суммарным объемом метастатического поражения при двух последовательных измерениях, dl - диаметр очага в измерении с наименьшим суммарным объемом метастатического поражения при двух последовательных измерениях, 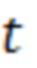 - толщина среза,
- толщина среза,
и если Fmaх - Fmin > 0 и V1 > V2 , то это расценивается как частичный ответ на лечение, если Fmaх - Fmin > 0 и V1 < V2, то это расценивается как прогрессирование, если Fmaх - Fmin < 0 при любых соотношениях V1 и V2 - как стабилизацию процесса.
Способ позволяет повысить точность оценки непосредственных результатов лечения больных диссеминированным почечно-клеточным раком за счет минимизации ошибки, связанной с техническими аспектами исследования (толщина среза, программное обеспечение, тип томографа) и отсутствия необходимости рассчитывать предельные значения изменения объемов для дифференциальной диагностики прогрессирования, стабилизации и частичного ответа. Ограничения этого способа связаны с тем, что он валидирован лишь в группе больных почечно-клеточным раком. Он хорошо позволяет дифференцировать прогрессирование и псевдопрогрессирование, но не может служить критерием коррекции тактики при подозрении на гипепрогрессирование и иммуно-диссоциированный ответ.
Модели оценки непосредственных результатов лечения, основанные на волюметрии очагов, обладают рядом преимуществ по сравнению с критериями, основанными на линейных измерениях. Они позволяют свести к минимуму субъективность оценки (увеличивается воспроизводимость результата) и оценивать динамику не сферичных очагов. Но несмотря на это, модели с оценкой объемов обладают рядом недостатков. Во-первых, в предложенных к настоящему времени моделях расчета пределов, дифференцирующих стабилизацию, прогрессирование и частичный ответ, отсутствует оценка влияния толщины срезов, кернеля инволюции и используемого программного обеспечения. И наоборот, в исследованиях, где оценивается ошибка, связанная с техническими аспектами исследования, используются данные, полученные при пересчете критериев RECIST с учетом предположения о сферичности очагов. Это создает условия для существенных ошибок при проведении волюметрии и оценке непосредственных результатов лечения. Во-вторых, в большинстве моделей учитываются объемы лишь небольшого числа очагов. Но даже в тех нескольких работах, где проводится полная волюметрия с ручной коррекцией, точность измерений резко повышается при уменьшении числа и увеличении размеров оцениваемых метастазов. Это, безусловно, отрицательно сказывается на диагностической ценности подобного подхода. По данным ряда авторов, в том числе и по нашим, наибольшей скоростью роста характеризуются мелкие очаги. В-третьих, в предложенных моделях не прослежена взаимосвязь непосредственных результатов лечения с отдаленными в сравнении с критериями, где используются линейные измерения, в то время как среди последних подобные сопоставления проводились (imRECIST. Clin. Oncol. 2018; 36: 850-858).
Еще одна группа методов оценки непосредственных результатов лечения связана с поиском молекулярных биомаркеров, которые помогли бы с большей точностью, чем рентгенологические методы, дифференцировать истинное прогрессирование с псевдопрогрессированием, гиперпрогрессированием и иммуно-диссоциированным ответом. К этой группе относится и предлагаемое изобретение. В литературе есть указания на множество молекулярно-биологических компонентов, с помощью которых можно было бы осуществлять мониторинг лечения онкологических больных. Они связаны с оценкой гистологических, серологических маркеров, циркулирующих иммунных клеток, а также использованием методов «жидкостной биопсии», при которой оценивается циркулирующая ДНК и/или циркулирующие опухолевые клетки. Большинство публикаций связаны с теоретическим обоснованием возможности использования тех или иных маркеров у онкологических больных (Clin. Cancer Res. 2017; 23 (17): 5074 - 5081. J. Hematol. Oncol. 2014: 70).
Принципиально рассматриваются четыре направления исследований:
- Оценка биологического потенциала опухоли:
a. Биомаркеры опухолевых клеток - PD-L1, PD-L2, опухоль-ассоциированные антигены. Маркеры субпопуляций опухоль-инфильтрирующих лимфоцитов: CD3, CD4, CD8, PD-1, CTLA, CD25, CD45RO, CD11b, CD57, CD68, LAG-3.
b. Геномные маркеры: неоантигены, гены микросателлитной нестабильности. Геном опухоль-инфильтрирующих лимфоцитов: глубокий сиквенс Т и В - рецепторов.
c. Транскриптомный и эпигеномный анализ опухолевых клеток и опухоль-инфильтрирующих лимфоцитов.
d. Оценка функциональных маркеров: Ki-67, гранзим В.
- Исследование клеток крови и ДНК:
a. Опухолевые биомаркеры: длинные и короткие цепи ДНК (ctDNA, ctRNA, miRNA), экзосомы. Биомаркеры опухоль-инфильтрирующих лимфоцитов: miRNA, аутоантитела, цитокины и хемокины, HLA гаплотип.
b. Оценка циркулирующих опухолевых и иммунокомпетентных клеток.
- Проточная цитометрия:
a. Фенотипическая и функциональная характеристика иммунных клеток: активированных (CD3, CD4, CD8, Ki-67, CTLA-4, PD-1, LAG-3, ICOS, TIM-3); регуляторных (CD3, CD4, CD25, FOXP3, CD127, Ki-67, CD45 RA); клеток памяти (CD45 RO); миелоидных клеток супрессорного происхождения (CD14+ HLADRlow).
b. Детекция и функциональная характеристика циркулирующих опухолевых клеток (СTC).
- Антиген-специфический мониторинг Т-лимфоцитов: связывание, клональная активация, характеристика т-клеточного рецептора и HLA.
Наиболее близким к предлагаемому является способ оценки непосредственных результатов лечения с использованием критериев RECIST v 1.1 (Eur. J. Cancer. 2009; 45: 228-247), согласно которым при анализе КТ выделяют таргетные очаги - очаги наибольшего диаметра, пригодные для точного повторного измерения. Всего оценивают не более пяти очагов (не более двух на орган). Таргетные очаги должны быть не менее 10 мм в диаметре в органах, не менее 10 мм по протяженности при поражении костей (литические или смешанные очаги) и не менее 15 мм при поражении лимфатических узлов. Остальные очаги относятся к не таргетным. Для оценки размеров метастазов в паренхиматозных органах и костях используется наибольший диаметр очага в аксиальной плоскости, а для лимфатических узлов - размер очага по короткой оси.
Категории общего ответа на лечение по RECIST v 1.1: полный ответ (CR), частичный ответ (PR), стабилизация (SD), прогрессирование (PD), оценка невозможна (NE).
Оценка динамики таргетных очагов осуществляется путем расчета суммы их максимальных диаметров (и наименьшего диаметра при поражении лимфатических узлов):
1. Полный ответ (CR) - исчезновение всех экстралимфатических таргетных очагов; уменьшение всех патологических лимфатических узлов до размера по короткой оси менее 10 мм.
2. Частичный ответ (PR) - уменьшение суммы максимальных диаметров очагов как минимум на 30% по сравнению с первичным исследованием.
3. Прогрессирование (PD) - увеличение суммы максимальных диаметров как минимум на 20% по сравнению с наименьшей суммой максимальных диаметров (надиром), рассчитанной при каком-либо из исследований (в том числе и первичном). Сумма максимальных диаметров должна увеличится как минимум на 5 мм.
4. Стабилизация (SD) - отсутствие динамики суммы максимальных диаметров, а также ее увеличение или уменьшение, не соответствующее критериям PR или PD.
Оценка не таргетных очагов:
1. Полный ответ (CR) - исчезновение всех экстралимфатических не таргетных очагов. Уменьшение всех патологических лимфатических узлов до размера по короткой оси менее 10 мм. Нормализация опухолевых маркеров.
2. Неполный ответ/ отсутствие прогрессирования - сохранение как минимум одного не таргетного очага или сохранение опухолевых маркеров выше нормы.
3. Прогрессирование (PD) - достоверное прогрессирование существующих не таргетных очагов.
Общий ответ на лечение оценивают при сопоставлении динамики таргетных и не таргетных очагов (таблица 4): оценка непосредственных результатов лечения опухоли по критериям RECIST v 1.1).
CR - полный ответ, PR - частичный ответ, SD - стабилизация, PD - прогрессирование, NE - невозможно определить.
Таким образом, способ-прототип, как и аналогичные вышеописанные стандартные методы оценки эффективности непосредственных лечения, основанные на линейных измерениях, имеют ряд недостатков и не обладают достаточной информативностью и точностью.
Технический результат настоящего изобретения состоит в повышении точности оценки непосредственных результатов лечения больных диссеминированными формами злокачественных опухолей за счет использования иммунологических параметров крови и микроокружения Этот результат достигается тем, что в известном способе оценки непосредственных результатов лечения, включающем компьютерно-томографическую оценку метастатических очагов, согласно изобретению, дополнительно, у больного в крови (КР) и в микроокружении опухоли (М) определяют уровень спонтанной продукции IL-8 (IL-8-КР1, IL-8-M) и IL-10 (IL-10-КР1, IL-10-M) и индуцированной продукции IL-12 (IL-12-КР1, IL-12-M) до начала каждого цикла лечения иммуноонкологическими препаратами, а также оценивают эти же показатели в крови (IL-8-КР2, IL-10-КР2, IL-12-КР2) после каждого цикла лечения и по полученным значениям рассчитывают коэффициенты:
K1= IL-8-M/ IL-8-КР1 - IL-8-M/ IL-8-КР2;
K2 = IL-10-M/ IL-10-КР1 - IL-10-M/ IL-10-КР2;
K3 = IL-12-M/ IL-12-КР2 - IL-12-M/ IL-12-КР1;
и при значении хотя бы одного из коэффициентов, равном или выше 1,7, это расценивается как ранний признак прогрессирования.
Занимаясь профессионально в течение ряда лет лечением больных ПКР, мы оценивали отдаленные и непосредственные результаты лечения больных, используя при этом различные критерии оценки, включая RECIST и RECIST v 1.1, различные варианты иммунотерапии, а также фундаментальные и клинические аспекты взаимодействия опухоли и иммунной системы. На первом этапе нами предварительно проводилась оценка динамики иммунологических показателей с различными непосредственными результатами лечения. С 2016 года в клинической практике стали появляться иммуноонкологические препараты из группы ингибиторов PD-1 и PD-L1: Пембролизумаб, Ниволумаб, Атезолизумаб, Авелумаб, Дюрвалюмаб. Показаниями для их применения является экспрессия молекул-мишеней (PD-1/PD-L1) в опухолевой ткани или в, ряде случаев, даже без подтверждения экспрессии, когда это предполагается стандартами лечения.
Мы изучали динамику иммунологических показателей в крови, а также особенности микроокружения опухоли у больных с различными непосредственными результатами лечения.
С 2017 года у больных с диссеминированными формами различных опухолей (почечно-клеточный рак, рак мочевого пузыря, меланома, рак молочной железы) изучали иммунный статус и содержание иммунокомпетентых клеток в микроокружении опухоли с целью оценки прогностической, предсказательной значимости различных параметров. У больных в крови оценивалось содержание лимфоцитов, их субпопуляций и цитокинов. Анализы проводились в иммунологической лаборатории ФГУЗ ВЦЭРМ им. А.М.Никифорова МЧС России на лазерном проточном цитометре Cytomics FC 500 (BECKMAN COULTER Inc., USA) с использованием моноклональных антител и расходных материалов компаний BECKMAN COULTER Inc., IMMUNOTECH S.A.S., ООО «Протеиновый контур» и ООО «Цитокин». Спектр исследуемых параметров и их референсные интервалы отражены в таблицах 5 (субпопуляции лимфоцитов периферической крови) и 6 (параметры цитокинового профиля).
Уровень лимфоцитов и их субпопуляций оценивался в периферической крови. Анализ цитокинового профиля проводился в два этапа. На первом этапе определялась сывороточная концентрация. На втором проводилось исследование в культуре клеток, где определялся их потенциал путем оценки спонтанной и индуцированной продукции цитокинов. Оценка лимфоцитов, их субпопуляций и цитокинового профиля проводилась в одно и то же время суток, чтобы избежать влияния циркадных колебаний.
В микроокружении опухоли иммунологический профиль оценивался однократно, что связано с доступностью материала для анализа. Референсных интервалов для определения концентрации иммунокомпетентных клеток, а также концентрации, спонтанной и индуцированной продукции цитокинов в микроокружении в настоящее время не существует.
Опухолевый материал объемом около 10 мм3 помещался в два флакона, в одном из которых находилась питательная среда DMEM-F12 для определения спонтанной продукции, а в другом - та же питательная среда с комплексом поликлональных активаторов (фитогемагглютинин 4 мкг/мл, конканавалин А 4 мкг/мл, липополисахарид 2 мкг/мл). Далее происходило инкубирование при 37°С в течение 72 часов. Клетки опухоли осаждали центрифугированием при 2000 об/мин в течение 15 мин. После осаждения клеток иммуноферментным методом определяли концентрацию цитокинов и факторов роста.
Алгоритм разработки способа оценки непосредственных результатов лечения больных с диссеминированными формами опухолей включал три этапа. Значения показателей исследовались одновременно с оценкой результатов по RECIST 1.1. Заключение о характере ответа на лечение подтверждалось в процессе длительного наблюдения за больными. В случае, если результаты непосредственной оценки в дальнейшем оказывались ошибочными, сопоставление динамики иммунологических показателей проводилось с учетом вновь полученных данных. На первом этапе проводился однофакторный анализ, где в качестве переменных были включены все иммунологические параметры, которые оценивались в микроокружении опухоли до начала лечения, а также в периферической крови до лечения и после каждого цикла (таблицы 5, 6). На втором этапе проводился многофакторный анализ, в котором исключались взаимовлияющие компоненты. На третьем этапе в многофакторный анализ были включены коэффициенты, отражающими отношение внутриопухолевой продукции цитокинов и продукции в культуре лимфоцитов пациента. Значения коэффициентов K1, K2, K2 определялись методами предельных значений параметров и точностью модели. Результаты однофакторного и многофакторного анализа приведены в таблице 7.
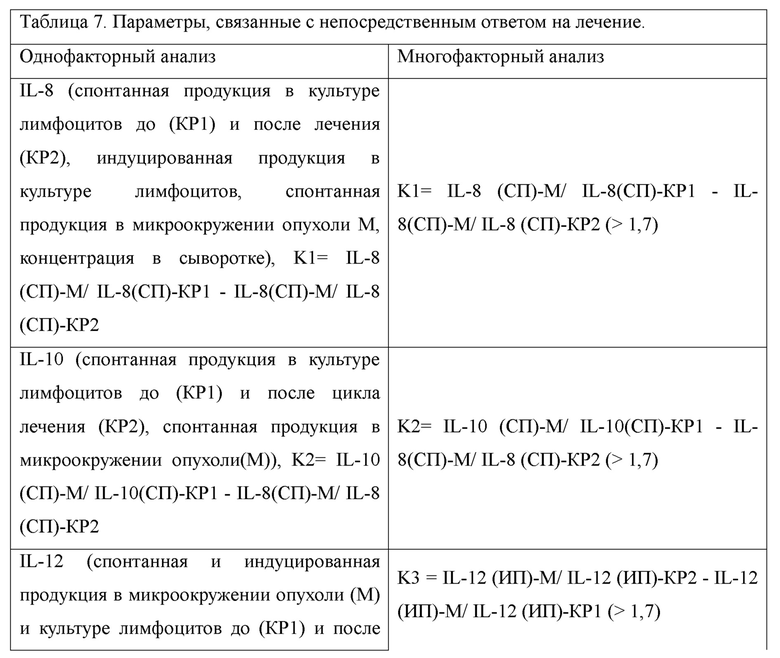
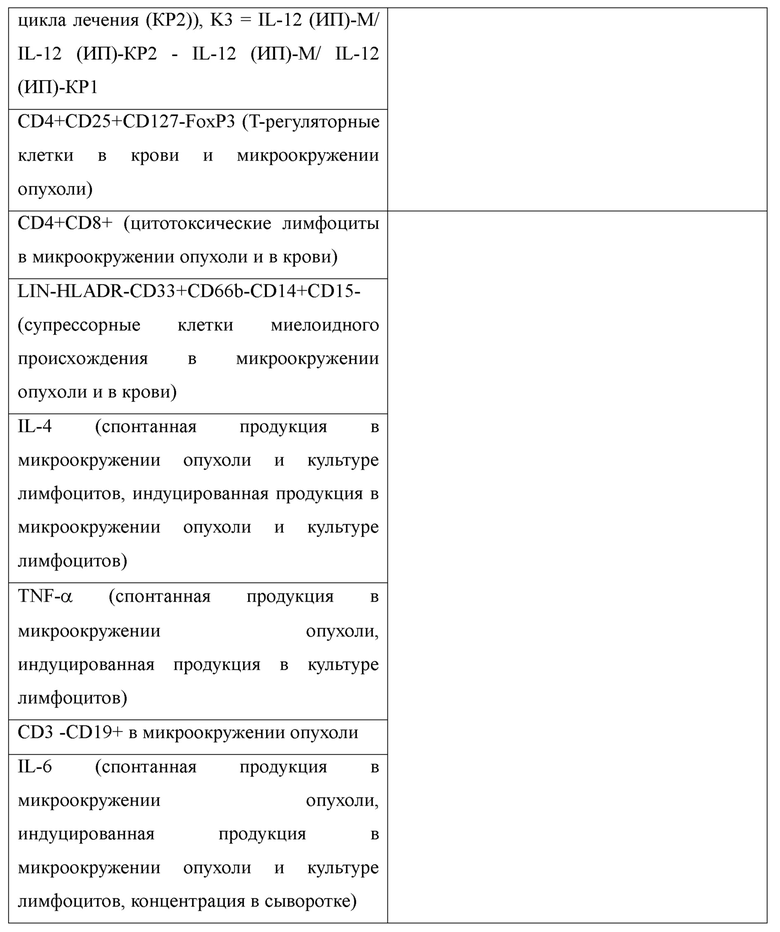
СП - спонтанная продукция; ИП - индуцированная продукция.
Для разработки метода использованы данные 79 больных с разными нозологическими формами, включая почечно-клеточный (17 больных), меланому (18 больных), трижды негативный рак молочной железы (21 больная), инвазивный рак мочевого пузыря (23 больных). Для валидации использовалась группа клинически отслеженных больных (77 человек) с теми же нозологическими формами: почечно-клеточный (22 больных), меланому (12 больных), трижды негативный рак молочной железы (17 больных), инвазивный рак мочевого пузыря (26 больных) (таблица 8). Алгоритм валидации включал оценку непосредственных результатов лечения с использованием критериев RECIST 1.1.; оценку непосредственных результатов лечения разработанным методом, сопоставление результатов обоих методов с учетом данных последующего клинического наблюдения (таблица 8).
N
способ, N
(448 определение непосредственного результата)
17 человек
CR - полный ответ, PR - частичный ответ, SD - стабилизация, PD - прогрессирование, ПКР - почечно-клеточный рак, РМП - рак мочевого пузыря, ТНРМЖ - трижды негативный рак молочной железы, N - число оценок непосредственных результатов лечения, K - число ошибок.
В группе валидации (77 человек, 288 исследований) частота ошибок оценки непосредственных результатов лечения с помощью критериев RECIST 1.1. составила 20,1 %; в подгруппе с прогрессированием заболевания - 27,1%; в подгруппе с объективным ответом (сумма полных, частичных ответов и стабилизации) - 17,9%. Частота ошибок оценки непосредственных результатов лечения с помощью разработанного способа составила 3,8 % в группе в целом; в подгруппе с прогрессированием заболевания - 4,6 %; в подгруппе с объективным ответом -3,3%, что достоверно меньше по сравнению с RECIST v 1.1.
Сущность способа заключатся в следующем.
Больному с диссеминированой формой опухоли перед проведением лечения в микроокружении опухоли (М) и в крови (КР) определяют уровень спонтанной продукции IL-8 (IL-8-КР1, IL-8-M) и IL-10 (IL-10-КР1, IL-10-M) и индуцированной продукции IL-12 (IL-12-КР1, IL-12-M), после каждого цикла лечения и оценивают эти же показатели в крови (IL-8-КР2, IL-10-КР2, IL-12-КР2), затем по полученным значениям рассчитывают коэффициенты K1= IL-8-M/ IL-8-КР1 - IL-8-M/ IL-8-КР2; K2 = IL-10-M/ IL-10-КР1 - IL-10-M/ IL-10-КР2; K3 = IL-10-M/ IL-10-КР2 - IL-10-M/ IL-10-КР1. Если хотя бы один из коэффициентов больше 1,7, то это расценивается как ранний признак прогрессирования. Параллельно у больного оцениваются непосредственные результаты лечения с использованием критериев RECIST v. 1.1.
Далее больной получает лечения согласно принятым стандартам. Данные, полученные при использовании предлагаемого способа, могут быть учтены при коррекции тактики лечения по решению лечащего врача или врачебной комиссии.
Способ по сравнению с известными аналогами имеет ряд существенных преимуществ:
1. Позволяет точнее оценивать непосредственные результаты лечения онкологических больных иммуноонкологическими препаратами.
2. Основан на использовании современных достижений молекулярной биологии и клеточной иммунологии.
3. Позволяет повысить эффективность лечения за счет выбора наиболее адекватного варианта терапии.
Способ оценки непосредственных результатов лечения больных с диссеминированными формами опухолей разработан в группе молекулярно-биологического прогнозирования и индивидуализации лечения ФГБУ «РНЦРХТ им. акад. А.М. Гранова» МЗ РФ и к настоящему времени прошел клиническую апробацию у 156 пациентов с положительным результатом.
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ оценки непосредственных результатов лечения диссеминированного почечно-клеточного рака | 2020 |
|
RU2751086C1 |
| Способ лечения диссеминированного почечно-клеточного рака | 2019 |
|
RU2715567C1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ СТЕПЕНИ РЕГРЕССИИ МЕСТНО-РАСПРОСТРАНЕННОГО РАКА ЖЕЛУДКА ПОСЛЕ ПРОВЕДЕНИЯ НЕОАДЪЮВАНТНОЙ ХИМИОТЕРАПИИ МЕТОДОМ КОМПЬЮТЕРНОЙ ТОМОГРАФИИ | 2020 |
|
RU2749359C1 |
| Способ лечения почечно-клеточного рака | 2019 |
|
RU2712454C1 |
| Способ диагностики лечебного ответа у пациентов с метастазами в печень колоректального рака | 2022 |
|
RU2800325C1 |
| Способ определения тактики лечения больных с метастатическими формами и рецидивами трижды негативного рака молочной железы | 2023 |
|
RU2818730C1 |
| Способ прогнозирования длительности безрецидивного периода у больных резектабельным трижды негативным раком молочной железы | 2021 |
|
RU2780922C1 |
| Способ оценки чувствительности опухоли к иммуноонкологическим препаратам | 2021 |
|
RU2771760C1 |
| Способ прогнозирования развития метастазов у больных нерезектабельным трижды негативным раком молочной железы | 2023 |
|
RU2802141C1 |
| Способ терапии метастатического рака с использованием вируса Сендай | 2017 |
|
RU2662916C1 |
Изобретение относится к медицине, а именно к онкологии, и может быть использовано для оценки чувствительности опухоли к иммуноонкологическим препаратам. У больного в крови (КР) и в микроокружении опухоли (М) определяют уровень спонтанной продукции IL-8 (IL-8-КР1, IL-8-M) и IL-10 (IL-10-КР1, IL-10-M) и индуцированной продукции IL-12 (IL-12-КР1, IL-12-M) до начала каждого цикла лечения иммуноонкологическими препаратами, а также оценивают эти же показатели в крови (IL-8-КР2, IL-10-КР2, IL-12-КР2) после каждого цикла лечения. По полученным значениям рассчитывают коэффициенты:
K1= IL-8-M/ IL-8-КР1 - IL-8-M/ IL-8-КР2;
K2 = IL-10-M/ IL-10-КР1 - IL-10-M/ IL-10-КР2;
K3 = IL-12-M/ IL-12-КР2 - IL-12-M/ IL-12-КР1. При значении хотя бы одного из коэффициентов, равном или выше 1,7, это расценивается как ранний признак прогрессирования. Способ обеспечивает возможность повышения точности оценки непосредственных результатов лечения больных диссеминированными формами злокачественных опухолей за счет использования иммунологических параметров крови и микроокружения. 8 табл.
Способ оценки чувствительности опухоли к иммуноонкологическим препаратам, отличающийся тем, что дополнительно у больного в крови (КР) и в микроокружении опухоли (М) определяют уровень спонтанной продукции IL-8 (IL-8-КР1, IL-8-M) и IL-10 (IL-10-КР1, IL-10-M) и индуцированной продукции IL-12 (IL-12-КР1, IL-12-M) до начала каждого цикла лечения иммуноонкологическими препаратами, а также оценивают эти же показатели в крови (IL-8-КР2, IL-10-КР2, IL-12-КР2) после каждого цикла лечения и по полученным значениям рассчитывают коэффициенты:
K1= IL-8-M/ IL-8-КР1 - IL-8-M/ IL-8-КР2;
K2 = IL-10-M/ IL-10-КР1 - IL-10-M/ IL-10-КР2;
K3 = IL-12-M/ IL-12-КР2 - IL-12-M/ IL-12-КР1;
и при значении хотя бы одного из коэффициентов, равном или выше 1,7, это расценивается как ранний признак прогрессирования.
| Способ оценки чувствительности опухоли к иммуноонкологическим препаратам | 2021 |
|
RU2771760C1 |
| RU 2015151348 A, 30.11.2015 | |||
| СПОСОБ ПРОГНОЗИРОВАНИЯ ЭФФЕКТИВНОСТИ АДЪЮВАНТНОЙ ИНТЕРФЕРОНОТЕРАПИИ МЕЛАНОМЫ КОЖИ | 2019 |
|
RU2722403C1 |
| СПОСОБ ОЦЕНКИ РИСКА ПРОГРЕССИРОВАНИЯ НЕМЕЛКОКЛЕТОЧНОГО РАКА ЛЕГКОГО ПОСЛЕ ХИРУРГИЧЕСКОГО ЛЕЧЕНИЯ | 2011 |
|
RU2472161C1 |
| СПОСОБ ОЦЕНКИ ЭФФЕКТИВНОСТИ НЕОАДЪЮВАНТНОЙ ХИМИОТЕРАПИИ РАКА МОЧЕВОГО ПУЗЫРЯ | 2009 |
|
RU2430374C2 |
| СПОСОБ ПРОГНОЗИРОВАНИЯ ТЯЖЕСТИ ТЕЧЕНИЯ И ЭФФЕКТИВНОСТИ ЛЕЧЕНИЯ ЛИМФОМ | 2007 |
|
RU2345367C1 |
| Способ прогнозирования течения онкологических заболеваний | 2016 |
|
RU2622756C1 |
| WO 2018225062 A1, 13.12.2018 | |||
| US 20210396759 A1, 23.12.2021 | |||
| ZHANG L | |||
| et al | |||
| Топка с несколькими решетками для твердого топлива | 1918 |
|
SU8A1 |
Авторы
Даты
2023-11-01—Публикация
2023-01-12—Подача