Изобретение относится к медицине, а именно к экспериментальной патофизиологии, эндокринологии, кардиологии, гастроэнтерологии, онкологиии, и может быть использовано для эффективной коррекции метаболических и провоспалительных нарушений на примере экспериментальной фруктоз-индуцированной модели метаболического синдрома.
Метаболический синдром является значимым фактором риска развития сердечно-сосудистой патологии, артериальной гипертензии, неалкогольной жировой болезни печени, и даже гепато-целлюлярной карциномы, рака молочной железы и многих других онкопатологий, возникающих на фоне хронического воспалительного процесса, сопровождающего метаболический синдром.
Метаболический синдром (МС) включает заболевания, связанные с сахарным диабетом 2 типа, инсулинорезистентностью, абдоминальным ожирением, гиперлипидемией и артериальной гипертензией (Wiernsperger N., Diabetes Metab Syndr Obes. 2013;6:379-388).
На сегодняшний день одной из самых приоритетных и значимых проблем в медицине является изучение механизмов формирования и коррекции сахарного диабета 2 типа (СД 2 типа) как одной из наиболее распространенных патологий, ассоциированной с метаболическим синдромом. Увеличение распространенности неалкогольной жировой болезни печени (НАЖБП), которая охватывает около 25% населения мира, происходит параллельно с эпидемией ожирения и МС (Бабенко А.Ю., Лаевская М.Ю. Неалкогольная жировая болезнь печени - взаимосвязи с метаболическим синдромом. Русский Медицинский Журнал. 2018; 1(1):34-40). Печень постепенно проходит стадии неалкогольного стеатоза, который прогрессирует в алкогольный стеатогепатоз и неалкогольный цирроз печени или гепатоцеллюлярную карциному (Архипходжаева Ф.З. Терапевтические аспекты неалкогольной жировой болезни печени при метаболическом синдроме. Журнал теоретической и клинической медицины. 2020;3:44-48).
Ключевую роль в поддержании энергетического равновесия клетки и ее жизнедеятельности играют PPARs - совокупность гормонально зависимых внутриядерных рецепторов, регулирующих работу множества транскрипционных факторов. PPARs контролируют ядерно-рецепторный комплекс, ответственный за чувствительность жировых клеток к инсулину, их созревание, окисление жирных кислот (ЖК), а также метаболизм жиров и углеводов в целом. Экспрессия PPARs тесно связана с работой GLUT4 - основного трансопртера глюкозы 4 типа, который отвечает за транспорт глюкозы внутрь клетки, прежде всего в скелетных мышцах, жировой ткани и в кардиомиоцитах, отвечает за стимулированное инсулином поглощение глюкозы в перечисленных клетках (James D.E., Strube М., Mueckler М. Molecular cloning and characterization of an insulin-regulatable glucose transporter. Nature: journal. 1989;338(6210):83-87; Shao D., R. Tian Glucose Transporters in Cardiac Metabolism and Hypertrophy. Compr. Physiol. - 2015;6(1):331-351).
Известен противовоспалительный эффект PPARα, который связан с подавлением активности провоспалительных медиаторов - интерлейкинов, молекул адгезии и белков экстрацеллюлярного матрикса. Экспрессия PPARα в ядрах макрофагов прерывает сигнализацию ядерного фактора каппа би (NF-kb), что препятствует прогрессированию атеросклероза сосудистой стенки in vivo (С. Lenahan, L. Huang, Z.D. Travis. Scavenger Receptor Class В Type 1 (SR-B1) and the modifiable risk factors of stroke. Chin Neurosurg Jl. 2019;5:30). Стимуляция PPARs наиболее эффективна в плане снижения хронического воспаления, и в меньшей степени - при остром воспалительном процессе.
Значительный риск развития воспалительной реакции на фоне метаболического синдрома предполагает использование фармакологических средств для лечения МС с существенно более высокими критериями безопасности.
Некоторые фармацевтические препараты выступают в роли активаторов PPARs, среди них - глитазоны, фибраты, а также некоторые блокаторы рецепторов ангиотензина 1-типа (БРА-1), которые широко используются в лечении пациентов с артериальной гипертензией (АГ) и СД 2 типа (Y. Xi, Y. Zhang, S.Zhu. PPAR-Mediated Toxicology and Applied Pharmacology. Cells. 2020;9(2):352).
На сегодняшний день нет утвержденных общепринятых подходов к коррекции МС, в особенности провоспалительных изменений на его фоне.
Изменение образа жизни имеет решающее значение при любой попытке изменить течение МС, а целью терапии является резистентность к инсулину и окислительный стресс. Однако, эффективность большинства видов лечения остается неопределенной, или эффекты отменяются, когда варианты лечения прекращают.
В качестве альтернативного подхода к коррекции метаболических и воспалительных нарушений в настоящее время используются фитотерапевтические препараты в виде растительных экстрактов, полифенолов, содержащих в своем составе целый ряд веществ, способных корригировать те или иные проявления МС. (S.O. Upadhyay, 2014; А.Т. Singh, 2018). Предполагается, что комплекс соединений с лечебными свойствами, присутствующий в одном растении, способен воздействовать одновременно на разные патофизиологические звенья развития МС.
Лечение метаболического синдрома в современных рекомендациях включает комплексное применение как немедикаментозныех средств, так и фармакологических препаратов, с целью коррекции отдельных компонентов МС, таких как инсулинорезистентность, дислипидемия, артериальная гипертензия, ожирение, нарушения углеводного обмена (Оганов Р.Г., Мамедов М.Н. Национальные клинические рекомендации. Диагностика и лечение метаболического синдрома. М.: «МЕДИ Экспо» 2009:261-269).
Однако, используемые на сегодняшний день схемы терапии не позволяют коррегировать МС в целом, и достичь желаемого результата.
Наличие выраженных побочных эффектов у существующих препаратов для лечения воспалительных реакций, ассоциированных с МС, целый ряд противопоказаний, вероятность развития осложнений, невозможность их использования в качестве профилактических средств, а также ограничения по использованию фитопрепаратов ввиду их недостаточной эффективности или сложности производства, диктуют необходимость поиска новых средств для лечения и профилактики метаболических нарушений.
Известен способ лечения метаболического синдрома (патент РФ №2457834, опубл. 10.08.2012), включающий антигипертензивную диету и индивидуально подобранные аэробную физическую нагрузку, введение метформина по 500 мг два раза в сутки и мелаксена, курсом 12 недель.
К недостаткам способа относятся противопоказания и побочные эффекты, характерные для метформина и мелаксена, необходимость использования специального физиотерапевтического оборудования, низкая комплаентность больных МС к соблюдению диеты.
Известен способ лечения метаболического синдрома (Патент RU 2334523 С2, опубл. 27.09.2008), включающий применение композиции на основе растительного сырья, содержащей экстракт зеленого чая, экстракт Coleus forskholii, экстракт Yerba Mate, экстракт Betula alba, с определенным содержанием биологически активных веществ, взятых в определенном количестве.
К недостаткам данного способа относятся такие, как невысокая эффкективность, что обусловлено влиянием только на один параметр метаболического синдрома - избыточную массу тела или ожирение, а также, несмотря на значительное снижение массы тела, жировой ткани и повышения интенсивности метаболизма в покое, композиция по данному изобретению обладает эффективностью только в сочетании с низкокалорийной диетой.
Известен способ лечения и профилактики неалкогольной жировой болезни печени на фоне метаболического синдрома в эксперименте (Патент РФ 2644282, опубл. 11.01.2018) путем применения средства на основе водного извлечения листьев подорожника наибольшего (Plantago maxima Juss. et Jacq), выполненного в форме раствора для перорального применения, сиропа, геля, инкапсулированной или таблетированной формы.
Однако, данный способ имеет ряд недостатков: используемое средство не обладает способностью к снижению массы тела, а также, использование водного экстракта в эксперименте предполагало постоянное употребление лабораторными животными указанного средства в составе питьевой воды, в то время как подобный подход не может быть реализован в реальной жизни человека.
Таким образом, приведенные аналоги не решают проблему поиска новых средств для лечения и профилактики метаболического синдрома, характеризующихся достаточной эффективностью на фоне низкой токсичности и отсутствия или незначительного количества побочных эффектов.
В качестве прототипа выбран способ лечения метаболического синдрома (Патент РФ №2338519, опубл. 20.11.2008), заключающийся в назначении индивидуально подобранной гипокалорийной диеты и введении препарата метопролол в дозе 100 мг утром в течение 24 недель.
Недостатками данного способа являются недостаточно высокая эффективность, полученный результат возможен только в комбинации с низкокалорийной диетой, неустойчивая стабилизация веса после завершения курса лечения, соблюдение в последующем рекомендаций для поддержания первичного гемостаза в оптимальном режиме функционирования.
Проведенный патентно-информационный поиск не выявил способов коррекции экспериментального метаболического синдрома с существенными признаками заявляемого способа.
Исходя из вышеприведенного уровня техники, при коррекции метаболического синдрома проблемой является низкая эффективность метаболического и противовоспалительного воздействия, высокая частота побочных эффектов.
Технический результат заключается в повышении эффективности лечения воспалительного процесса на фоне экспериментального метаболического синдрома при уменьшении побочных реакций.
Разработка способа коррекции метаболического синдрома путем создания модели метаболического синдрома, наиболее полно воспроизводящей клиническую картину данной патологии, и использованием комбинации двух препаратов с большей эффективностью и меньшей токсичностью, даст возможность наиболее эффективно в зависимости от степени и сроков развития воспалительной реакции проводить лечение, что является основой для дальнейшего изучения методов коррекции хронического ассоциированного воспаления при различных иммунных, обменных, сердечно-сосудистых заболеваниях, и позволяет решить вышеуказанную проблему.
В заявляемом способе авторами впервые предлагается сочетанное использование комбинации двух препаратов, а именно сартана и полифенольного концентрата, обеспечивающих более эффективное воздействие одновременно на разные патофизиологические звенья развития МС, чем каждый из препаратов отдельно, и оказывающих совместно сверхсуммарное противовоспалительное воздействие в экспериментальной фруктоз-индуцированной модели метаболического синдрома.
Предлагается, как и в прототипе, использовать антигипертензивное лекарственное средство.
Сущность заявляемого изобретения заключается в том, что в способе коррекции метаболического синдрома в эксперименте путем использования антигипертензивного лекарственного средства, согласно изобретению, в качестве антигипертензивного средства применяют препарат Азилсартан в дозе 1,5 мг/кг массы тела животного в сутки и дополнительно используют безалкогольный полифенольный препарат переработки винограда Фэнокор в дозе 2 мг/кг массы тела животного в сутки, вводимого перорально с помощью зонда.
Причинно-следственная связь между совокупностью существенных признаков и обеспечиваемым изобретением техническим результатом, состоит в следующем: применение комбинации Азилсартана и полифенольного препарата Фэнокора позволяет повысить эффективность коррекции проявлений МС за счет оказания максимального положительного метаболического и противовоспалительного действия с минимально выраженными побочными реакциями; Фэнокор способствует повышению антиоксидантного потенциала, улучшает обмен веществ, нормализует биохимические показатели крови, за счет высокого содержания полифенолов на единицу объема в препарате увеличивается концентрации полифенолов в плазме крови, что позволяет оказывать воздействие на органы и ткани; использование препарата Азилсартана, относящегося к группе БРА-1 типа, позволяет активировать внутриядерные рецепторы типа PPAR-y, что способствует нормализации углеводно-липидного обмена на молекулярном, биохимическом и клиническом уровне, при этом эффективно снижаются проявления дисметаболических и острофазных реакций; при сочетанном применении Фэнокора и Азилсортана продемонстрирован потенциал влияния на различные звенья патогенеза МС согласно результатам лабораторных и клинических испытаний.
Использование комбинации приведенных препаратов позволяет снизить их суточную дозировку для исключения негативных проявлений, к которым может привести передозировка каждого из ингредиентов в отдельности.
В заявляемом способе лечения используют комплекс немедикаментозной и медикаментозной терапии, в котором эмпирически подобрано рациональное сочетание режимов введения препарата сартана и полифенольного продукта переработки винограда, что обеспечивает значительное снижение массы тела и уменьшение инсулинорезистентности у данной группы животных, а также позволяет снизить частоту побочных реакций.
Включение в комплекс препарата Фэнокор, обладающего выраженной биологической активностью, является обоснованным, так как позволяет обеспечить коррекцию адаптационных систем организма и метаболических нарушений в короткие сроки, оказывает седативное влияние.
Подобранные опытным путем предлагаемые режимы сочетанного использования препарата Азилсартана и препарата Фэнокор, такие как количество, кратность приема, являются оптимальными и позволяют получить синергетический эффект в процессе проведения коррекции экспериментального МС, и обеспечить достижение заявленного технического результата.
Фэнокор является виноградным пищевым концентратом из плодов винограда с высоким содержанием полифенольных веществ разработан Всероссийским национальным научно-исследовательский институтом виноградарства и виноделия РАН, РФ и производится в Республике Крым ООО "Рессфуд" из винограда по ТУ 9168-003-1149102052978-14. Фэнокор - безалкогольная жидкость темно-коричневого цвета с терпким привкусом и слабым винным ароматом, содержит суммарные полифенолы винограда не менее 80 г/л. Препарат Фэнокор препятствует активации неспецифических протеаз и активных форм кислорода, а также способствует укреплению ингибиторного и антиокислительного потенциала. Экспериментально подтверждено, что использование Фэнокора способствует сохранению структуры миокарда (Kubyshkin A., Ogai Yu., Fomochkina I., Chemousova I., Zaitsev G., Shramko Yu. Polyphenols of red grape wines and alcohol-free food concentrates in rehabilitation technologies. Polyphenols Open access peer-reviewed edited volume. London, 2018 Издательство: IntechOpen c. 99-120).
Азилсартана медоксомил является пролекарством, антигипертензивным средством, специфическим антагонистом рецепторов ангиотензина II типа 1 (AT1). Быстро превращается в активную молекулу азилсартана, которая избирательно препятствует развитию эффектов ангиотензина II путем блокирования его связывания с рецепторами AT1 в различных тканях. Ангиотензин II является первичным вазоактивным гормоном РААС с эффектами, включающими вазоконстрикцию, сердечную стимуляцию, стимуляцию синтеза и высвобождение альдостерона, и, как следствие, почечную реабсорбцию натрия. Блокада рецепторов AT1 ингибирует отрицательный регулирующий ответ ангиотензина II на секрецию ренина, но итоговое повышение в плазме активности ренина и уровня циркулирующего ангиотензина II не подавляет антигипертензивный эффект азилсартана.
Сартаны являются блокаторами ангиотензиновых рецепторов, располагающихся в сосудистых структурах и отвечающих за восприятие сигналов, которые стимулируются в результате влияния вещества при его выработке. Ключевое отличие механизма действия сартанов от схожих ингибиторов АПФ заключается в блокировании конечной фазы реакции - организм не воспринимает сигналы от влияния ангиотензина на сосуды, что препятствует их спазмированию и повышению АД. Ингибиторы АПФ снижают саму скорость синтеза вещества, снижается его концентрация, что и приводит к нормализации артериального давления.
Способ осуществляют следующим образом.
Экспериментальное исследование выполнено на 36 белых крысах-самцах линии Wistar категории SPF (питомник ФИБХ РАН «Пущино»), массой тела 285-305 г возрастом 2-3 мес. Протокол эксперимента был одобрен биоэтическим комитетом в соответствие с указанием Директивы Совета Европейских сообществ от 24 ноября 1986 г. (86/609 /ЕСС). Крысы содержались в клетках по шесть в каждой в помещении с контролируемой температурой (20±2°С), относительной влажностью 60±5% и световым циклом (12 ч свет/темнота) со свободным доступом к пище и воде. На протяжении 14 дней до начала эксперимента был выдержан соответствующий период акклиматизации животных.
Для индукции метаболического синдрома была выбрана фруктозная модель с помощью кормления крыс с 60%-м твердым фруктозным кормом на протяжении 24 недель (С. Chou, Y. Lai, Т. Lin. Renin inhibition improves metabolic syndrome, and reduces angiotensin II levels and oxidative stress in visceral fat tissues in fructose-fed rats. P LoS One. 2017; 12(7):e0180712).
Развитие МС оценивали с помощью критериев Международной Диабетической Федерации (МДФ, 2005), которая включает в себя абдоминальное ожирение как центральный признак и наличие дополнительно двух факторов из следующих четырех: повышение уровня триглицеридов (ТГ) более 1,7 ммоль/л; снижение уровня липопротеидов низкой плотности (ЛПВП) менее 1,03 ммоль/л для мужчин и менее 1,29 ммоль/л для женщин; гипергликемия натощак при значении более 5,6 ммоль/л (100 мг/дл) или ранее установленный диагноз СД 2 типа; артериальная гипертензия (АГ) - САД >130 мм рт.ст. или ДАД >85 мм рт.ст., или гипотензивная терапия.
Для диагностики обменных, воспалительных нарушений и оценки эффективности терапии определялись уровни PPARγ, GLUT 4, для диагностики нарушений углеводно-липидного обмена использовалась оценка биохимических маркеров - глюкоза, общий холестеин (ОХС), ТГ, ЛПВП, а для диагностики реакции ассоциированного воспаления было предложено определение уровней концентрации TLR 4 и СРБ в плазме крови лабораторных животных с экспериментальным МС с применением метода иммуноферментного анализа (ИФА).
Для коррекции метаболических нарушений применяли препарат азилсартан медоксомил, например, препарат Эдарби, производитель «Такеда», Япония, в дозе 1,5 мг/кг массы тела животного в сутки в комбинации с безалкогольным полифенольным препаратом переработки винограда Фэнокором (производитель Всероссийский национальный научно-исследовательский институт виноградарства и виноделия РАН, РФ) в дозе 2 мг/кг массы тела животного в сутки, который вводили перорально с помощью зонда, ежедневно, начиная с 14-й недели фруктозной диеты.
В соответствии с целью исследования было сформировано 3 группы животных (n=12 в каждой).
1 группа контрольная - интактные животные со стандратной диетой (Lab Rodent 5001, 0,30% фруктозы).
2 группа - кормление 60%-м фруктозным кормом в течение 24 недель на фоне коррекции по заявляемому способу с 14-й недели кормления.
3 группа сравнения - кормление крыс фруктозной диетой в течение 24 недель без коррекции.
Для регистрации результатов эксперимента использовались такие методы исследования как соматометрические, включающие исследование массы висцеральной жировой клетчатки крыс, например, при помощи весов лабораторных электронных ВЛТЭ-500, биохимические, заключающиеся в определении уровня глюкозы венозной крови натощак, липидов - общего холестерина (ОХС), триглицеридов (ТГ), липопротеидов низкой плотности (ЛПВП), а также уровня мочевой кислоты в плазме крови, например, при помощи автоматичесого биохимического анализатора ERBA XL-180 («Erba Lachema», Чехия).
Уровень концентрации TLR 4 (свободная растворимая форма), С-реактивного белка (СРБ), а также PPARγ в плазме крови определялся с помощью ИФА, например, тест-системами «CUSABIO BIOTECH Co., Ltd» (США) в соответствии со стандартными инструкциями производителя. Концентрация TLR4 выражалась в нг/мл, уровень концентрации СРБ - в мг/мл, диапазон детекции - 0,625-40 нг/мл, чувствительность - 0,146 нг/мл, время анализа 1-5 ч, объем образца составлял 50-100 мкл, длина волны детекции - 450 нм. Концентрация TLR 4, а также содержание уровня СРБ в плазме крови оценивалась на 14-й неделе до начала применения препаратов и в конце эксперимента - на 24-й неделе после эвтаназии животных.
Для иммуноферментного анализа использовались, например, микропланшетный анализатор Multiskan FC, микропланшетный промыватель W600, термошейкер для микропланшетов PST-60HL, вспомогательное оборудование, необходимое для проведения твердофазного иммуноферментного анализа.
Для исследования глюкозы крови в ммоль/л использовалась венозная кровь путем пункции хвостовой вены до начала кормления фруктозным кормом, затем каждые 4 недели эксперимента, а также во время декапитации - 24-я неделя. Нестабилизированную кровь предварительно охлаждали, а затем центрифугировали в течение 15 минут при 3000 об/мин (604 g) для получения сыворотки.
Биохимический анализ крови выполняли согласно общепринятой методике. Плазма крови замораживалась в жидком азоте и хранилась при -80°С для дальнейшего анализа. Для определения уровней глюкозы крови, ОХС, ТГ, ЛПВП и мочевой кислоты (ммоль/л) использовался, например, автоматический биохимический анализатор ERBA XL-180 («Erba Lachema», Чехия).
Эвтаназию крыс осуществляли на 24-й неделе эксперимента после 12-часового периода голодания путем декапитации под эфирным наркозом. После производился забор внутренних органов и висцеральной жировой клетчатки, которая извлекалась из брыжейки тонкой кишки, сальника и забрюшинного пространства. Для взвешивания использовались весы лабораторные электронные ВЛТЭ-500.
Морфологическое исследование печени и кишечника выполнялось с помощью световой микроскопии с последующим морфометрическим подсчетом. В конце эксперимента (24 недели фруктозной диеты) забранные органы после аутопсии - печень и кишечник (по 4 образца в каждой группе, размером 1x1x0,5 см) фиксировались в 10%-м нейтральном забуференном формалине, далее помещались в парафиновые блоки, которые после нарезались и окрашивались (краситель - гематоксилин и эозин).
Для морфологического исследования использовались, например, LEEC ltd (Leica, Германия - гибридный гистологический процессор LOGOS (Millestone, Италия), микротом с автоматическим вращением Leica RM 2255 (Leica, Германия), лабораторный микроскоп Leica DM2000 (Leica, Германия), модульный центр заполнения Leica EG 1140 (Leica, Германия), иммуногистостер Bond Max (Leica, Германия), цифровой сканер Aperio CS2 (Leica, Германия).
Для количественной оценки изменений использовался морфометрический анализ с помощью Aperio - ImageScope, полученные данные обрабатывались статистически.
Статистический анализ производился с помощью программного обеспечения Statistica 6.0 (StatSoft, Inc., США) с использованием параметрических (Т-критерий Стьюдента) и непараметрических критериев (W-критерий Вилкоксона) в зависимости от распределения данных (использовался коэффициент нормальности Колмогорова-Смирнова и Лиллиефорса). Достоверными считался уровень различий данных при р<0,05. Количественные параметры величин представляли в виде среднего значения и стандартной ошибки (М±m). Для анализа корреляции данных использовался ранговый коэффициент корреляции r-Спирмена (при непараметрическом анализе) и коэффициент корреляции r-Пирсона (при нормальном распределении данных) с автоматическим вычислением достоверности (р). При положительном значении определялась прямая взаимосвязь - зависимость между определяемыми величинами расценивалась как прямо-пропорциональная, при получении отрицательного результата - как обратно-пропорциональная.
В результате эксперимента установлено, что кормление крыс с 60%-м фруктозным кормом приводит к развитию классических проявлений МС, а именно: висцеральному ожирению, гипергликемии, дислипидемии - повышению уровня ОХС, ТГ и снижению ЛПВП), а также повышению уровня мочевой кислоты в плазме крови (р<0,001).
Результаты ИФА показали, что развитие фруктоз-индуцированного МС сопровождалось выраженным повышением уровня GLUT 4 - уже к 14-й недели эксперимента концентрация данного маркера возросла в 2,4 раза по сравнению с контролем к 24-й-недели концентрация увеличилась в 6,7 раз по сравнению с контролем (р<0,001). Уровень PPARγ достоверно значимо не изменился в группе МС без коррекции по сравнению с контролем, однако была выявлена тенденция к увеличению уровня PPARγ (нг/мл) на 17,2% по сравнению с контролем.
Развитие МС также сопровождалось развитием хронической субклинической воспалительной реакции. Это подтверждалось увеличением концентрации TLR 4, о чем свидетельствовало повышение его концентрации в 5,8 раз по сравнению с контролем (р<0,001), при этом уровень С-реактивного белка возрос более чем в 2,5 раза по сравнению с контрольными значениями (р<0,001).
В таблице 1 показаны уровни GLUT 4 и PPARγ (нг/мл) при фруктоз-индуцированном МС на фоне коррекции по заявляемому способу (М±m).
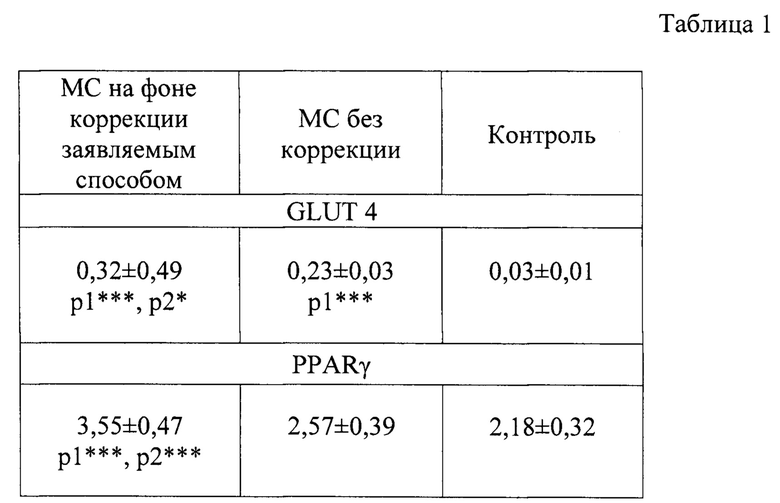

Коррекция по заявляемому способу с 14-й недели фруктозной диеты сопровождалась повышением концентрации PPARγ - уровень данного маркера превысил контроль на 61,6% (р<0,001) (Таблица 1).
Также применение коррекции по заявляемому способу приводило к увеличению уровня GLUT 4 в 8,89 раз по сравнению с контролем (р<0,001). Повышение уровня данных маркеров может свидетельствовать о способности Азилсартана оказывать эффект агониста PPARγ, активируя ряд транскрипционных внутриядерных факторов, отвечающих за углеводно-липидный обмен внутри клетки, активируя транспорт глюкозы внутрь клетки через основного транспортера глюкозы GLUT 4.
В таблице 2 приведены уровни TLR 4 (нг/мл) и СРБ (мкг/мл) при экспериментальном МС и на фоне коррекции по заявляемому способу (М±m).

Использование комбинации Азилсартана и Фэнокора в качестве патогенетической коррекции приводило к снижению уровня TLR 4 на 14,6% по сравнению с аналогичным показателем в группе МС без лечения (р<0,05) и предотвращало повышение уровня СРБ - его уровень был в 1,62 раза ниже по отношению к группе МС без коррекции (р<0,001) (Таблица 2). Это свидетельствует о выраженном противовоспалительном эффекте применения комбинации Азилсартана и Фэнокора.
При моделировании экспериментального МС в печени выявлялись признаки, характерные для неалкогольной жировой болезни печени (НАЖБП). При световой микроскопии срезов печени клетки печени незначительно увеличиваются в размере, двуядерные клетки встречаются как в центральной, так и периферической зоне, клеточный состав неоднороден. В центральной зоне дольки липидные включения в цитоплазме гепатоцитов крупнее, склонны к слиянию, а на периферии более мелкие, участками пылевидные.
Также было выявлено нарушение балочной структуры долек с хаотичным беспорядочным расположением клеток. Наблюдалось умеренно выраженное внутридольковое воспаление, отек клеток, гепатоцеллюлярная зернистая дистрофия, перисинусоидальный фиброз.
Гистологическая структура ворсинок кишечника крыс контрольной группы соответствовала норме. В ворсинках кишечника крыс с индуцированным фруктозой метаболическим синдромом выявлена деструкция апикальной части эпителиоцитов ворсинок и выход содержимого в просвет кишки, отечность и признаки воспаления.
При коррекции МС по заявляемому способу наблюдалась нормализация балочной структуры долек печени, уменьшение воспалительных изменений, устранение отека и перисинусоидального фиброза.
Проведенный статистический анализ морфометрических данных продемонстрировал достоверность полученных данных.
Использование при фруктоз-индуцированном МС комбинации препаратов Азилсартана в дозе 1,5 мг/кг и Фэнокора в дозе 2 мг/кг приводит к активации PPARγ, что в свою очередь приводит к активации GLUT 4, что способствует транспорту глюкозы внутрь клетки и нормализации углеводно-липидного обмена, а также оказывает выраженный противовоспалительный эффект и устраняет дистрофические и воспалительные изменения в печени и кишечнике, что расширяет показания для использования данных препаратов для эффективной коррекции метаболических нарушений при МС, а также вспомогательной противовоспалительной терапии при обменных нарушениях и ассоциированном воспалении.
В соответствии с исследованиями на животных данный способ коррекции позволяет эффективно снизить воспалительные проявления при МС, способствует получению стойкого результата, характеризуется отсутствием значительных побочных эффектов.
Заявляемый способ может быть использован для коррекции обменных и воспалительных нарушений, возникающих на фоне метаболического синдрома и других заболеваниях, сопровождающихся ассоциированным воспалением, с минимальными побочными реакциями.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ДИАГНОСТИКИ РАЗВИТИЯ ВОСПАЛЕНИЯ НА ФОНЕ МЕТАБОЛИЧЕСКОГО СИНДРОМА В ЭКСПЕРИМЕНТЕ | 2022 |
|
RU2813621C2 |
| СПОСОБ РЕАБИЛИТАЦИИ БОЛЬНЫХ С ИШЕМИЧЕСКОЙ БОЛЕЗНЬЮ СЕРДЦА НА САНАТОРНО-КУРОРТНОМ ЭТАПЕ | 2021 |
|
RU2790237C1 |
| СПОСОБ ПРОФИЛАКТИКИ ПОСЛЕОПЕРАЦИОННЫХ ОСЛОЖНЕНИЙ У СТОМАТОЛОГИЧЕСКИХ БОЛЬНЫХ С ПОСТКОВИДНЫМ СИНДРОМОМ | 2023 |
|
RU2823132C1 |
| Способ коррекции метаболических нарушений и системы антиоксидантной защиты при метаболическом синдроме с жировым поражением печени | 2019 |
|
RU2701159C1 |
| ПРОИЗВОДНЫЕ ДОКОЗАГЕКСАЕНОВОЙ КИСЛОТЫ И ИХ ПРИМЕНЕНИЕ В КАЧЕСТВЕ ЛЕКАРСТВЕННЫХ СРЕДСТВ | 2006 |
|
RU2441061C2 |
| СПОСОБ ЛЕЧЕНИЯ НЕАЛКОГОЛЬНОЙ ЖИРОВОЙ БОЛЕЗНИ ПЕЧЕНИ У ПАЦИЕНТОВ С МЕТАБОЛИЧЕСКИМ СИНДРОМОМ ПРИ НЕДОСТАТОЧНОСТИ ВИТАМИНА D | 2018 |
|
RU2694842C1 |
| КОМПОЗИЦИЯ ДЛЯ ПРЕДОТВРАЩЕНИЯ ИЛИ ЛЕЧЕНИЯ ЖИРОВЫХ БОЛЕЗНЕЙ ПЕЧЕНИ | 2015 |
|
RU2664696C2 |
| СПОСОБ ЛЕЧЕНИЯ НЕАЛКОГОЛЬНОЙ ЖИРОВОЙ БОЛЕЗНИ ПЕЧЕНИ ПРИ МЕТАБОЛИЧЕСКОМ СИНДРОМЕ | 2018 |
|
RU2686042C1 |
| КОМПОЗИЦИЯ ДЛЯ КОРРЕКЦИИ МЕТАБОЛИЧЕСКОГО СИНДРОМА | 2016 |
|
RU2616241C1 |
| КОМПОЗИЦИЯ ДЛЯ ПРОФИЛАКТИКИ И ЛЕЧЕНИЯ ОЖИРЕНИЯ И АССОЦИИРОВАННЫХ МЕТАБОЛИЧЕСКИХ НАРУШЕНИЙ | 2020 |
|
RU2763348C2 |
Изобретение относится к медицине, а именно к экспериментальной патофизиологии, эндокринологии, кардиологии, гастроэнтерологии, онкологиии, и может быть использовано для эффективной коррекции метаболического синдрома. Для этого применяют препарат Азилсартан в дозе 1,5 мг/кг массы тела животного в сутки. Дополнительно используют безалкогольный полифенольный препарат переработки винограда Фэнокор в дозе 2 мг/кг массы тела животного в сутки, вводимый перорально с помощью зонда. Препараты вводят ежедневно, начиная с 14-й недели фруктозной диеты, до 24 недели. Изобретение позволяет осуществлять эффективную коррекцию обменных и воспалительных нарушений, возникающих на фоне метаболического синдрома и других заболеваний, сопровождающихся ассоциированным воспалением, с минимальными побочными реакциями. 2 табл.
Способ коррекции метаболического синдрома в эксперименте, включающий использование антигипертензивного лекарственного средства, заключающийся в том, что в качестве антигипертензивного средства применяют препарат Азилсартан в дозе 1,5 мг/кг массы тела животного в сутки и дополнительно используют безалкогольный полифенольный препарат переработки винограда Фэнокор в дозе 2 мг/кг массы тела животного в сутки, вводимый перорально с помощью зонда, препараты вводят ежедневно, начиная с 14-й недели фруктозной диеты, до 24 недели.
| СПОСОБ КОРРЕКЦИИ МЕТАБОЛИЧЕСКИХ НАРУШЕНИЙ У ЖЕНЩИН В ПЕРИМЕНОПАУЗЕ | 2021 |
|
RU2767879C1 |
| Способ коррекции метаболических нарушений и системы антиоксидантной защиты при метаболическом синдроме с жировым поражением печени | 2019 |
|
RU2701159C1 |
| ПЕРЕПЕЧ Н.Б | |||
| и др | |||
| Эффективность и безопасность азилсартана медоксомила в различных дозах и режимах назначения у пациентов с метаболическими нарушениями по данным исследования CONSTANT / Системные гипертензии, 2021; 18 (3), стр | |||
| Реверсивный дисковый культиватор для тросовой тяги | 1923 |
|
SU130A1 |
| ТАРИМОВ К.О | |||
| и др | |||
| СРАВНИТЕЛЬНЫЙ АНАЛИЗ КОРРЕКЦИИ | |||
Авторы
Даты
2023-11-08—Публикация
2022-11-03—Подача