ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Настоящее изобретение относится к антителу или фрагменту антитела, специфическим в отношении CD38, применимым в лечении и/или профилактике аутоиммунных заболеваний, опосредованных аутоантителами (AD). В частности, настоящее изобретение предусматривает способы снижения титров аутоантител за счет истощения клеток, секретирующих антитела, с применением антитела к CD38 отдельно или в комбинации с одним или несколькими иммуносупрессивными лекарственными средствами. В соответствии с настоящим изобретением антитело к CD38, отдельно или в комбинации, может быть эффективным в лечении и/или профилактике мембранозной нефропатии, положительной в отношении антител к PLA2R (aMN). Антитело к CD38 включает без ограничения MOR202.
ПРЕДПОСЫЛКИ ИЗОБРЕТЕНИЯ
Аутоиммунные заболевания и аутоантитела
Аутоиммунные заболевания (AD) включают более 70 различных нарушений, поражающих примерно 5% населения западных стран (Lleo et al. Autoimmunity Reviews 2010 Mar; 9(5): A259-66). AD представляет собой клиническое состояние, вызванное активацией аутореактивных Т-клеток, или аутореактивных В-клеток, или их обоих. Определенные AD характеризуются образованием патогенных аутоантител. Аутоантитела представляют собой иммуноглобулины, которые реагируют с собственными антигенами. Такие собственные антигены могут включать белки, нуклеиновые кислоты, углеводы, липиды или их различные комбинации и могут присутствовать во всех клетках (например ДНК) или могут быть сильно ограничены конкретным типом клеток в одном органе организма. При гуморальном AD, опосредованном аутоантителами, аутоантитела обычно встречаются с высокими титрами в образцах сыворотки крови пациентов. Для многих AD доказана однозначная и четкая связь образования, специфичности и патогенеза аутоантител (Suurmond and Diamond, J Clin Invest. 2015 Jun 1; 125(6): 2194-2202). Патогенные аутоантитела влияют на путь заболевания несколькими способами, включая накопление иммунных комплексов (IC) и воспаление, стимуляцию или подавление функций рецепторов, стимуляцию или подавление функций ферментов, облегчение захвата антигена, лизис клеток, микротромбоз и активацию нейтрофилов (Ludwig et al. Front. Immunol. 2017 May; 8:603).
Системная красная волчанка (SLE) Системная красная волчанка (SLE), например, представляет собой мультигенное аутоиммунное нарушение с распространенностью, составляющей приблизительно 50 случаев на 100000 человек, причем женщины поражаются чаще, чем мужчины. Центральным иммунологическим нарушением у пациентов с SLE является ненадлежащая активация и пролиферация аутореактивных В-клеток памяти, ведущая к повышению количества клеток, секретирующих антитела, и образованию различных аутоантител. Доминирующими собственными антигенами при SLE являются компоненты ядра, такие как ДНК или рибонуклеопротеины (RNP), и аутоантитела, реагирующие с этими антигенами, характеризуются высокой аффинностью, соматически мутированы и относятся к изотипу IgG. У пациентов с SLE наблюдаются высокие уровни антинуклеарных антител (ANA) в сыворотке крови. Также могут присутствовать аутоантитела к цитоплазматическим антигенам, антигенам клеточных мембран, фосфолипид-ассоциированным антигенам, клеткам крови, эндотелиальным клеткам, антигенам нервной системы, белкам плазмы крови, белкам матрикса и различным антигенам (фиг. 12). При SLE многие из этих аутоантител приводят к образованию IC, которые, по-видимому, являются непосредственно патогенными после накопления в нескольких тканях.
Варианты лечения SLE включают противомалярийный препарат, стероидные и нестероидные противовоспалительные средства, иммуносупрессивные лекарственные средства (в том числе циклофосфамид (СТХ), азатиоприн (AZA), микофеноловую кислоту (MMF) и метотрексат (МТХ)), а также средства терапии, нацеливающиеся на клетки иммунной системы (Yildirim-Toruner С, Allergy Clin Immunol. 2011 Feb; 127(2):303-12).
Такие иммуносупрессивные или цитотоксические лекарственные средства и опосредованное антителами KCD20 истощение В-клеток могут вызывать ремиссии у пациентов с SLE. Однако современные протоколы лечения часто не позволяют предотвратить рецидивы (Stichweh, D. Curr. Opin. Rheumatol. 2004 16:577-587.5).
Болезнь Грейвса (Базедова болезнь)
Болезнь Грейвса, также известная как токсический диффузный зоб, представляет собой аутоиммунное заболевание, которое поражает щитовидную железу. Болезнь Грейвса разовьется у приблизительно 0,5% мужчин и 3% женщин (Burch НВ, Cooper DS, 2015, JAMA 314 (23): 2544-54). Это часто приводит к гипертиреозу и является наиболее частой его причиной в США (от приблизительно 50 до 80% случаев). Симптомы гипертиреоза могут включать раздражительность, мышечную слабость, проблемы со сном, учащенное сердцебиение, плохую переносимость тепла, диарею, необъяснимое снижение веса, утолщение кожи на голенях, известное как претибиальная микседема, и выпуклость глаз, состояние, вызванное офтальмопатией Грейвса. Непосредственной причиной болезни Грейвса являются аутоантитела, направленные против рецептора, связывающего тиреостимулирующий гормон (рецептора тиреостимулирующего гормона (TSHR)). Также могут вырабатываться аутоантитела к тиреоглобулину и гормонам щитовидной железы Т3 и Т4. Аутоантитела к TSHR имитируют TSH и активируют TSHR нерегулируемым образом, таким образом вызывая гипертиреоз. Варианты лечения болезни Грейвса включают антитиреоидные (тионамидные) лекарственные средства, абляцию щитовидной железы радиоактивным йодом и хирургическое вмешательство (тиреоидэктомия). Однако при лечении болезни Грейвса остается проблема подавления развития или продолжающегося образования аутоантител к TSHR.
Миастения граеис (MG) Миастения гравис (MG) поражает от 50 до 200 человек на миллион человек. Каждый год ее диагностируют у 3-30 человек на миллион. MG представляет собой продолжительное нервно-мышечное AD, которое приводит к различным степеням слабости скелетных мышц и аномальной утомляемости и вызвано наличием аутоантител, реагирующих на компоненты постсинаптической замыкательной пластинки мышцы, локализованной в нервно-мышечном соединении (соединении между нервом и мышцей). В частности, эти аутоантитела блокируют или разрушают никотиновые рецепторы ацетилхолина, что в свою очередь не позволяет нервным импульсам запускать мышечные сокращения. Другие аутоантитела обнаружены против родственного белка, называемого MuSK, специфической в отношении мышц киназы и белков LRP4, агрина и титина. Обычно MG подвергают лечению с помощью лекарственных средств, известных как ингибиторы ацетилхолинэстеразы, например неостигмин и пиридостигмин. Также часто используются иммуносупрессанты, такие как преднизон или азатиоприн. В определенных случаях хирургическое удаление вилочковой железы может улучшить симптомы заболевания. Плазмаферез и высокие дозы внутривенного иммуноглобулина (IVIG) могут использоваться во время внезапных обострений состояния для удаления предполагаемых аутоантител из кровотока или для разбавления и связывания циркулирующих антител соответственно. Оба этих вида лечения имеют относительно кратковременные эффекты, обычно измеряемые неделями, и часто ассоциированы с высокими затратами. Если возникает значительная слабость дыхательных мышц, то может потребоваться искусственная вентиляция легких.
Мембранозный гломерулонефрит, положительный е отношении антител к PLA2R (aMN)
Мембранозная нефропатия, опосредованная аутоантителами к PLA2R (aMN), исторически часто называемая идиопатическим мембранозным гломерулонефритом или идиопатической мембранозной нефропатией (IMN), является первичной мембранозной нефропатией и ведущей причиной нефротического синдрома у взрослых (Ronco Р, Debiec Н. 2015 May 16; 385(9981):1983-92). Приблизительно 80% мембранозных нефропатий являются идиопатическими, в то время как 20% связаны с другими заболеваниями или воздействиями. Общая глобальная заболеваемость оценивается в 1,2 случая на 100000 в год. Хотя заболевание обычно прогрессирует медленно, примерно у 30-40% пациентов в конечном итоге развивается терминальная стадия почечной недостаточности. Пациенты с MN с нефротическими проявлениями характеризуются повышенным риском тромбоэмболических и сердечно-сосудистых явлений. Однако несмотря на то, что не все аспекты патогенеза MN изучены, заболевание больше нельзя считать идиопатическим. Рецептор фосфолипазы А2 М-типа (PLA2R), трансмембранный белок, экспрессируемый на подоцитах, был определен как основной аутоантиген при MN (Beck LH Jr et al. N Engl J Med. 2009 Jul 2; 361 (1):11-21). Аутоантитела, связывающиеся с антигеном PLA2R, являются высокоспецифическими в отношении первичной MN. В недавних исследованиях выявлено наличие аутоантител к PLA2R у примерно 75% пациентов с IMN, что в значительной степени коррелирует с активностью заболевания (Bomback AS, Clin J Am Soc Nephrol. 2018 May 7;13(5):784-786). Тот факт, что заболевание, определяющее изменения в основании клубочков, включает как белок PLA2R, так и накопления комплекса антител, свидетельствует о том, что антитела к PLA2R играют главную причинную роль в MN. Кроме того, 5% пациентов, у которых отсутствуют антитела к PLA2R, имеют антитела к другому антигену подоцитов - тромбоспондину типа 1, содержащему домен 7А (Tomas NM et al. N Engl J Med 2014; 371: 2277-2287). В редких случаях MN у новорожденных нейтральная эндопептидаза (NEP), расположенная на мембране ножек подоцитов и щеточной кайме почечных канальцев, была идентифицирована как соответствующий антиген (Ronco Р et al. J Am Soc Nephrol. (2005) 16:1205-13. В совокупности приблизительно 80% пациентов с IMN имеют антитела, направленные против специфического идентифицируемого антигена подоцитов. Симптомы мембранозной нефропатий включают без ограничения отечность ног и лодыжек, повышенное содержание белка в моче, отек, гипоальбуминемию, повышенный уровень липидов в сыворотке крови, в частности высокий уровень холестерина. Таким образом, аутоиммунная мембранозная нефропатия представляет собой иммуноопосредованное гломерулярное заболевание, которое характеризуется наличием аутоантител к PLA2R и/или аутоантител к THSD7A. При аутоиммунной MN у новорожденных присутствуют аутоантитела к NEP, переданные от матери. В настоящее время не существует утвержденного стандартного лечения MN. Современная схема лечения главным образом включает применение не по назначению различных неиммуносупрессивных и иммуносупрессивных лекарственных средств. Пациенты с диагнозом MN и протеинурией более 3,5 г в день первоначально получают поддерживающую терапию с применением комбинации ингибиторов ангиотензинпревращающего фермента (ACEi) или блокаторов рецептора ангиотензина II (ARB), статинов и диуретиков в соответствии с современным клиническим стандартом. Если не наблюдается значительного снижения протеинурии в течение месяцев, то назначается переход на иммуносупрессивную терапию (1ST). Средства иммуносупрессивной терапии включают кортикостероиды, чередующиеся с алкилирующими средствами (например циклофосфамидом), и ингибиторы кальциневрина (CNI, например, циклоспорин А, такролимус (FK506)), микофенолат-мофетил (MMF) или ритуксимаб, хотя ни одно из этих лекарственных средств не одобрено для применения при MN. В меньшей степени используется адренокортикотропин (АСТН). Эффекты лечения с помощью этих комбинаций лекарственных средств, по-видимому, схожи: ремиссию протеинурии можно ожидать у приблизительно 50-60% пациентов в первый год и у приблизительно 70-80% в течение 2-3 лет по сравнению с частотой ремиссии, составляющей приблизительно 30% в контрольных группах, получавших только поддерживающую терапию (спонтанная ремиссия).
Из всех пациентов с первичной мембранозной нефропатией, не получающих IST, от 30% до 40% прогрессируют до терминальной стадии почечной недостаточности через 10 лет после начала заболевания. 1ST снижает частоту прогрессирования до 10% или меньше. Рецидивы протеинурии наблюдаются у приблизительно 25% пациентов, ранее подвергавшихся лечению с применением IST. В таких случаях как правило проводится повторное лечение с помощью другой комбинации IST. Недостатком описанных выше IST является то, что они проявляют значительную степень токсичности и ассоциированы со значительными нежелательными явлениями и высокой частотой рецидивов. 25% пациентов, подвергавшихся лечению циклофосфамидом, демонстрируют нежелательные явления, которые включают инфекцию, бесплодие, гематологическую токсичность и злокачественное новообразование в более позднем возрасте. Недостатки CNI включают долговременную нефротоксичность, необходимость тщательного мониторинга уровней лекарственного средства и повышенный риск гипертензии и диабета. Частота рецидивов при применении ингибиторов кальциневрина, по-видимому, выше, чем при применении циклофосфамида (40-50% против 25%). Ввиду значительных доказательств, демонстрирующих, что антитела к PLA2R коррелируют с активностью заболевания, ранее установленные алгоритмы терапии подвергаются изменениям.
Недавно введенная терапия с применением не по назначению терапевтического антитела ритуксимаба к CD20 обеспечивает более специфический подход при IST за счет истощения популяций В-клеток, участвующих в качестве предшественников в продуцировании причинных аутоантител к PLA2R. Значения частоты ответа на ритуксимаб, по-видимому, аналогичны таковым на алкилирующие средства и CNI, тогда как побочные эффекты, по-видимому, проявляются менее часто, чем при применении других лекарственных средств, используемых в IST. Однако CD20, мишень ритуксимаба, не присутствует на зрелых долгоживущих плазматических клетках, секретирующих антитела (которые являются основным источником эндогенных иммуноглобулинов). На ранних плазмобластах наблюдается только незначительная остаточная экспрессия CD20 по сравнению с экспрессией CD20 на зрелых В-клетках. Это возможное объяснение субоптимальной эффективности терапии ритуксимабом у пациентов с MN с высокими титрами антител к PLA2R.
В этом отношении непосредственное нацеливание на плазмобласты, а также плазматические клетки, должно приводить к более выраженному снижению уровня иммуноглобулинов в целом и, следовательно, также к снижению уровня аутоантител. Существенная часть антител к PLA2R при aMN, возможно, продуцируется пулом долгоживущих плазматических клеток с отрицательным в отношении CD20, но положительным в отношении CD38 иммунофенотипом, который не зависит от постоянного пополнения дифференцирующихся В-клеток. Таким образом, стратегия непосредственного нацеливания на плазматические клетки может иметь более глубокий эффект в отношении подавления патогенных аутоантител. В частности, это важно для пациентов с неадекватным ответом на терапию ритуксимабом (к CD20), у которых сохраняются высокие уровни титров аутоантител несмотря на истощение В-клеток.
Пузырчатка
Обыкновенная пузырчатка представляет собой аутоиммунное интраэпидермальное слизисто-кожное нарушение кожи и рта, приводящее к образованию волдырей. Поражения возникают с повышением заболеваемости от 0,5 до 3,2 случая на 100000 человек каждый год. Эти поражения преимущественно возникают в возрасте от 40 до 60 лет с одинаковой тендерной предрасположенностью. Пациенты с пузырчаткой характеризуются наличием циркулирующих аутоантител к антигенам пузырчатки (десмоглеин 3, десмоглеин 1, десмоколлины, плакоглобин) на эпителиальных кератиноцитах. Нарушение этих антигенов посредством реакции антиген-аутоантитело оказывает заметное влияние на целостность эпидермиса, приводя к отслоению клеток (акантолизу), надбазилярному расщеплению и последующему образованию пузырей. Связывание аутоантител с кератиноцитами также приводит к высвобождению протеазы и активатора плазминогена (превращает плазминоген в плазмин) из клеток, дополнительно усиливая акантолиз. Варианты лечения поражений тяжелой степени включают системные глюкокортикоиды и комбинации кортикостероидов, иммуносупрессивные средства, пульс-терапию, фотофорез и плазмафорез.
Синдром Шегрена
Синдром Шегрена представляет собой системное аутоиммунное заболевание, характеризующееся очаговой инфильтрацией лимфоцитов в экзокринные железы и слезные железы, что приводит к сухости во рту (ксеростомия) и сухости глаз (сухой кератоконъюнктивит) соответственно. При синдроме Шегрена присутствие поражений ассоциировано с хроническими воспалительными инфильтратами с высвобождением аутоантител к эпителиальным клеткам слюнных желез. Другие аутоантитела при синдроме Шегрена направлены против рибонуклеопротеиновых аутоантигенов Ro/SS-A и La/SS-B, молекул, содержащих суперспирали, представителей семейства гольджинов, поли(ADP)рибозополимеразы (PARP) и мускаринового рецептора 3 типа. В настоящее время направленное лечение синдрома Шегрена недоступно и современные терапевтические подходы являются только симптоматическими, заключающимися в лечении симптомов сухости и усталости, например, с помощью пилокарпина, бромгексина и гидроксихлорохина соответственно.
Энцефалит, обусловленный антителами к NMDA
Наиболее распространенным острым аутоиммунным энцефалитом, опосредованным антителами, является энцефалит, обусловленный антителами к рецептору N-метил-D-аспартата (NMDAR) (Granerod J et al. Lancet Infect Dis 2010, 10:835-44). Заболеваемость оценивается в 3-5 случаев на 1000000 населения в год. Энцефалит, обусловленный антителами к NMDA, представляет собой модельное заболевание для группы синдромов, характеризующихся выявлением аутоантител, нацеливающихся на синаптические структуры. Наиболее часто встречаются антитела к NMDAR, за ними следуют антитела к богатому лейцином инактивированному белку 1 глиомы (LGI1). Антитела к белку 2, подобному контактин-ассоциированному белку (Caspr2), антитела к рецептору α-амино-3-гидрокси-5-метил-4-изоксазолепропионовой кислоты (AMPAR), антитела к рецепторам -А и -В гамма-аминомасляной кислоты (GABA), антитела к дипептидилпептидаза-подобному белку-6 (DPPX) и антитела к рецептору глицина (GlyR) являются другими примерами антител поверхности нервных клеток. Энцефалит, обусловленный антителами к NMDAR, преимущественно встречается у молодых взрослых и детей, преимущественно у женщин (80%). Примерно у 70% пациентов развиваются продромальные симптомы (например, головная боль, лихорадка, быстрое изменение поведения, беспокойство, галлюцинации и психоз). Следствием этого являются аномальные движения (например, орофациальные дискинезии, хорея и стереотипные движения) и снижение сознания, кома и тяжелая глобальная автономная дисрегуляция (иногда приводящая к гиповентиляции и асистолии). Судороги и эпилептический статус могут возникнуть на любой стадии заболевания. Примерно 50% пациентов хорошо отвечают на IVIG, стероиды или пламообмен, а другим 50% требуется ритуксимаб отдельно или в комбинации с циклофосфамидом. Однако у некоторых пациентов выздоровление является неполным, может занять годы, а смертность вследствие осложнений интенсивной терапии может достигать 7%.
Присутствие патогенных аутоантител при аутоиммунных заболеваниях, опосредованных аутоантителами, проиллюстрированных выше, является следствием недостаточности или нарушения толерантности центральных и/или периферических В-клеток к соответствующим собственным антигенам.
Толерантность центральных и периферических В-клеток
Развитие В-клеток начинается в костном мозге. Здесь репертуар формирующихся связанных с мембраной В-клеточных рецепторов (BCR) генерируется посредством соматической рекомбинации генных сегментов тяжелой и легкой цепи иммуноглобулина. Обратной стороной получения такого огромного разнообразия в раннем репертуаре BCR посредством случайной соматической рекомбинации V(D)J является одновременное образование аутоантител, которые потенциально могут быть патогенными. Существует по меньшей мере три механизма предупреждения развития аутоиммунитета. Во-первых, самореактивные В-клетки удаляются посредством апоптоза. Во-вторых, аутореактивные В-клетки снижают самореактивные аффинности своих BCR за счет изменений доменов VL посредством вторичной рекомбинации легкой цепи lg, процесса, называемого редактированием рецептора. Третий механизм подавления самореактивных В-клеток - анергия, которая делает такие клетки невосприимчивыми к антигену. Эти центральные механизмы толерантности имеют место в костном мозге. Таким образом, аутореактивность репертуара образующихся антител предотвращается посредством апоптоза, редактирования рецепторов и индукции анергии в В-клетках, экспрессирующих аутореактивные антитела (Wardemann and Nussenzweig, Adv Immunol. 2007; 95:83-110).
В ходе дифференцировки В-клеток переходные В-клетки, образующиеся в костном мозге, продолжают созревать в периферических лимфоидных органах (например, в селезенке, лимфатических узлах), где действуют дополнительные периферические механизмы толерантности. Точные механизмы периферической толерантности все еще исследуются, но известно, что задействовано распознавание лиганда (антигена) посредством BCR, подобно центральным контрольным точкам толерантности в костном мозге. Они также могут включать контролируемую миграцию и ограниченную доступность BAFF, CD22, Siglec-G, miRNA и фолликулярных регуляторных Т-клеток (Treg). Конечными продуктами дифференцировки В-клеток являются плазматические клетки, секретирующие антитела. После активации антигеном зрелые наивные В-клетки либо развиваются напрямую (независимо от Т-клеток) в клетки, секретирующие антитела, либо дифференцируются в ходе зависимых от Т-клеток иммунных ответов в зародышевом центре посредством пролиферации пре-плазмобластов и плазмобластов в неподвижные неделящиеся плазматические клетки или В-клетки памяти. Как плазмобласты, так и плазматические клетки продуцируют и секретируют антитела и таким образом обеспечивают гуморальный иммунитет. Если они происходят из самореактивных В-клеток, то плазмобласты и плазматические клетки способствуют выработке аутоантител (Hiepe and Radbruch, Nat Rev Nephrol. 2016 Apr; 12(4):232-40).
Нарушение одного или нескольких центральных и/или периферических механизмов толерантности приводит к повышению количества циркулирующих самореактивных В-клеток (т.е. В-клеток, экспрессирующих аутоантитела) и самореактивных плазмобластов и плазматических клеток (т.е. клеток, экспрессирующих и секретирующих аутоантитела), что благоприятствует развитию AD, опосредованного аутоантителами. После того, как начинается продуцирование аутоантител, уровень их продуцирования поддерживается либо посредством непрерывной активации аутореактивных В-кпеток, приводящей к непрерывному образованию ко рот кожи в у щих плазматических клеток, либо посредством образования долгоживущих плазматических клеток, либо и тех, и других (Manz RA et al, Annu Rev Immunol (2005) 23:367-86).
Поскольку аутоантитела часто являются основной причиной аутоиммунной патологии, В-клетки, плазмобласты и плазматические клетки являются многообещающими терапевтическими мишенями при AD. Короткоживущие плазматические клетки отвечают на традиционные иммуносупрессивные лекарственные средства, которые непосредственно подавляют пролиферирующие плазмобласты и В-клетки. Непролиферирующие короткоживущие плазматические клетки исчезают в течение нескольких дней после начала приема данных средств терапии, поскольку они больше не пополняются. Средства терапии, нацеливающиеся на В-клетки, например антитело к CD20 (ритуксимаб) и антитело к BAFF (белимумаб) (см., например, WO2002002641, WO2009052293A1), снижают уровни В-клеток у пациентов, нуждающихся в таком снижении, и, следовательно, ослабляют образование короткоживущих плазмобластов и плазматических клеток, но такие средства терапии не влияют на компартмент долгоживущих плазматических клеток памяти. В случаях, при которых эта терапевтическая стратегия не влияет на выработку аутоантител, следует учитывать, что аутоантитела потенциально секретируются долгоживущими плазматическими клетками памяти. Более того, можно предположить, что блокада факторов или клеток, которые стимулируют аутореактивные В-клетки, например, посредством нацеливания на интерферон I типа (IFN), ТН-клетки или регуляторные Т-клетки (Treg), будет предупреждать развитие короткоживущих плазмобластов и плазматических клеток, но не плазматических клеток памяти.
У людей популяция долгоживущих плазматических клеток, происходящих из костного мозга, фенотипически определяется как CD19-, CD38hi, CD138+ (Halliley JL et al. Immunity. 2015 Jul 21; 43(1): 132-45). CD20, широко известный общий маркер пан-В-клеток, как правило, не экспрессируется на плазмобластах человека (Ellebedy АН et al. Nat Immunol. 2016 Oct; 17(10): 1226-34) или долгоживущих плазматических клетках человека (Halliley JL et al. Immunity. 2015 Jul 21; 43(1): 132-45).
Потенциальные механизмы, лежащие в основе поддержания длительных ответов с образованием антител, можно в целом разделить на модели, зависимые от В-клеток памяти, и модели, независимые от В-клеток памяти. На животной модели резусов было показано, что после хирургического удаления потенциальных резервуаров В-клеток из твердых тканей (например селезенки и лимфатических узлов), а также истощения всех выявляемых специфических в отношении столбняка В-клеток памяти из кровотока с применением антитела к CD20, титры специфических в отношении столбняка антител в сыворотке крови продолжали поддерживаться выше защитного порога в течение жизни иммунного хозяина с кинетикой скорости распада, которая была неотличима от необработанных контролей (Hammarlund Е et al. Nat Commun. 2017; 8: 1781). Таким образом, ответы с образованием антител после вакцинации против столбняка являются долговременными и обеспечивают пожизненный защитный иммунитет против этого заболевания. Дальнейший анализ плазматических клеток, специфических в отношении столбняка, продемонстрировал, что через 10 лет после иммунизации долгоживущие плазматические клетки, индуцированные вакциной, преимущественно идентифицировались в определенных компартментах костного мозга. В целом, эти исследования обеспечивают основу, при которой поддержание долговременных ответов с образованием антител в сыворотке крови, по-видимому, поддерживается долгоживущими плазматическими клетками независимо от В-клеток памяти.
Как описано выше, современные варианты лечения AD включают системную иммуносупрессию (т.е. с применением высоких доз кортикостероидов, таких как дексаметазон). Было показано, что цитотоксическое лекарственное средство циклофосфамид (Endoxan®) подавляет функции Т-хелперных клеток с длительным снижением количества В-клеток из-за более медленной скорости восстановления В-лимфоцитов от алкилирующего средства и, таким образом, циклофосфамид подавляет активацию В-клеток. Другие иммуносупрессивные лекарственные средства включают без ограничения азатиоприн, микофеноловую кислоту и метотрексат. Было показано, что ингибиторы протеасом, такие как бортезомиб, истощают короткоживущие и долгоживущие плазматические клетки, и первые клинические испытания применения бортезомиба для лечения SLE и тромботической тромбоцитопенической пурпуры являются многообещающими (Alexander Т et al. Ann Rheum Dis (2015) 74:1474-8; Patriquin et al. Br J Haematol (2016) 173: 779-85).
В WO2012092612 раскрыты антитела к CD38 и заявлено об их возможном терапевтическом применении при многих аутоиммунных заболеваниях. Фактически, в WO2012092612 определен ответ против столбняка на мышиной модели HuScid и продемонстрированы эксперименты, проведенные с суррогатным мышиным антителом к CD38 на модели индуцированного коллагеном артрита и только аутоиммунной мышиной модели SLE. В WO2012092612 ничего не говорится об определении титров антител в образцах от человека после терапии антителом к CD38 и не упоминаются или не приводятся какие-либо данные об мембранозной нефропатий, положительной в отношении антител к PLA2R, которую нужно лечить антителом к CD38.
В Schuetz С et al. (Blood Adv. 2018; 2(19):2550-2553) описано применение антитела к CD38 даратумумаба для лечения аутоиммунной гемолитической анемии. В Cole S et al. Arthritis Res Ther. 2018; 20(1):85 оценен потенциал даратумумаба в лечении пациентов с RA и SLE. В Beck LH et al. (J Am Soc Nephrol. 2011; 22(8):1543-50) раскрыто применение антитела к CD20 ритуксимаба для истощения В-клеток у пациентов с идиопатической мембранозной нефропатией. В этом раскрытии не указано и не предполагается истощение плазматических клеток с антителом к CD38 у этих пациентов.
Тем не менее, пациенты с AD по-прежнему страдают высокой заболеваемостью и повышенной смертностью. Несмотря на прогресс в разработке новых антиаутоиммунных средств (таких как бортезомиб), многие AD, опосредованные аутоантителами, которые наиболее вероятно связаны с положительными в отношении CD38 клетками, секретирующими аутоантитела, по-прежнему характеризуются плохим прогнозом. Все вышеупомянутые варианты лечения имеют недостатки, побочные эффекты или их применение ограничено определенными типами групп пациентов.
Таким образом, все еще существует высокая и неудовлетворенная медицинская потребность в новых и улучшенных способах лечения пациентов, страдающих AD, опосредованными аутоантителами.
Авторы настоящего изобретения определили, что CD38 представляет собой отличный и проверенный антиген для непосредственного нацеливания на клетки, секретирующие антитела, такие как плазмобласты и плазматические клетки, при аутоиммунных нарушениях, опосредованных аутоантителами (например, SLE, aMN). Во-первых, CD38 демонстрирует очень высокую экспрессию на плазмобластах и плазматических клетках (фиг. 4), а во-вторых, CD38 не характеризуется или характеризуется значительно более низкой экспрессией на других типах клеток по сравнению с плазмобластами и плазматическими клетками. Таким образом, применение антитела к CD38 обеспечивает нацеливание на источник патогенных аутоантител в качестве устойчивого терапевтического подхода с потенциально долгосрочными эффектами за счет устранения короткоживущих и долгоживущих плазматических клеток. По сути, такое нацеливание можно обобщить следующим образом: пациенту вводятся антитела, специфические в отношении поверхностного антигена CD38 клеток, секретирующих антитела. Эти антитела к CD38 специфически связываются с антигеном CD38 клеток, секретирующих антитела, продуцирующих как нормальные антитела, так и патогенные аутоантитела. Антитело, связанное с поверхностным антигеном CD38, затем приводит к разрушению и истощению этих клеток. Независимо от подхода, основная цель состоит в снижении количества клеток, продуцирующих аутоантитела.
Титр эндогенных антител против столбняка в качестве маркера для оценки влияния MOR202 на функцию плазматических клеток
Долговременные исследования на мышах (Manz RA, et al. Nature. 1997; 388: 133-134) и человеке (Hammarlund E et al. Nat Med. 2003 Sep; 9(9):1131-7) подчеркивают преимущества индукции и поддержания эффективных концентраций антител в сыворотке крови (титры антител), которые постоянно присутствуют и сохраняют защитную функцию в течение длительных периодов времени, вплоть до времени жизни иммунной системы. Защитный гуморальный иммунитет обеспечивается стабильными титрами специфических антител, например, генерируемых посредством рутинных вакцинаций против, например, кори, эпидемического паротита, столбняка, дифтерии или оспы. Плазматические клетки и их непосредственные предшественники известны как клеточная основа такого гуморального иммунитета, и поскольку титры антител, специфических в отношении сыворотки крови, являются ценными маркерами гуморального иммунитета, они могут использоваться в качестве индикатора присутствия и/или активности плазматических клеток, продуцирующих такие антитела. Исследования на мышах с применением лечения, направленного на CD20, для истощения наивных В-клеток и В-клеток памяти, продемонстрировали, что потеря В-клеток не оказывала значительного влияния на пул плазматических клеток даже после длительного периода времени (Ahuja A et al. Proc Natl Acad Sci USA. 2008 Mar 25; 105(12):4802-7). Сходным образом у людей, подвергающихся видам терапии посредством абляции В-клеток, сохраняются титры антител к обычным антигенам в сыворотке крови в течение по меньшей мере одного года (Cambridge G et al. Arthritis Rheum. 2006 Mar; 54(3):723-32.). Таким образом, эти отчеты указывают на то, что (долгоживущие) плазматические клетки являются важными компонентами длительной гуморальной памяти у мышей и людей. Хорошо известно, что плазматические клетки могут сохраняться в течение продолжительных периодов времени даже без участия недавно активированных наивных В-клеток или В-клеток памяти. В данном документе изобретатели впервые демонстрируют, что введение MOR202 приводит к снижению титров эндогенных антител к столбнячному анатоксину у субъектов-людей, и описывают в примерах как лечение мембранозной нефропатий, опосредованной аутоантителами, в частности аутоиммунной MN, положительной в отношении антител к PLAR2, с помощью MOR202, применяется на практике.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
В настоящем изобретении предусмотрены антитела или фрагменты антител, специфические в отношении CD38, для применения в лечении и/или предупреждении аутоиммунных заболеваний, опосредованных аутоантителами, и сходных состояний. В частности, антитело или фрагмент антитела к CD38 предназначены для применения в лечении и/или предупреждении идиопатического мембранозного гломерулонефрита. Предпочтительно, антитело или фрагмент антитела к CD38 предназначены для применения в лечении и/или предупреждения мембранозного гломерулонефрита, положительного в отношении антител к PLA2R. В некоторых аспектах антитело или фрагмент антитела к CD38 предназначены для применения в лечении и/или предупреждении системной красной волчанки (SLE).
Кроме того, в настоящем изобретении предусмотрены фармацевтические композиции, содержащие терапевтически эффективное количество антитела или фрагмента антитела, специфических в отношении CD38, для применения в лечении и/или предупреждении аутоиммунных заболеваний, опосредованных аутоантителами. В частности, антитело или фрагмент антитела KCD38 в фармацевтической композиции предназначены для применения в лечении и/или предупреждении идиопатического мембранозного гломерулонефрита. Предпочтительно, антитело или фрагмент антитела к CD38 в фармацевтической композиции предназначены для применения в лечении и/или предупреждении мембранозного гломерулонефрита, положительного в отношении антител к PLA2R. В некоторых аспектах антитело или фрагмент антитела к CD38 в фармацевтической композиции предназначены для лечения и/или предупреждения системной красной волчанки (SLE).
MOR202, моноклональное человеческое антитело к CD38, нацеливается на клетки, секретирующие антитела, такие как плазмобласты и плазматические клетки, главным образом посредством антителозависимой клеточноопосредованной цитотоксичности (ADCC) и антителозависимого кпеточноопосредованного фагоцитоза (ADCP). В ходе клинического испытания с MOR202 было продемонстрировано эффективное уничтожение опухолевых плазматических клеток (т.е. клеток множественной миеломы), а также доброкачественных плазматических клеток. У пациентов, страдающих множественной миеломой (ММ), истощение плазматических клеток посредством MOR202 приводит к значительному снижению уровня М-белка. М-белок, также известный как М-компонент, спайковый белок М, спайковый белок, парапротеин или миеломный белок, представляет собой иммуноглобулин (антитело) или его фрагмент, секретируемые злокачественным клоном опухолевых плазматических клеток. Вследствие аномальной моноклональной пролиферации злокачественных плазматических клеток в ММ М-белок продуцируется в большом избытке, что приводит к множеству вредных влияний на организм, характерных для ММ (например, нарушение функции иммунной системы, аномально высокая вязкость крови и повреждение почек). MOR202 является эффективным в истощении плазматических клеток, которые являются источником М-белка, что, следовательно, приводит к снижению титров М-белка.
Действие MOR202 на плазматические клетки показано посредством оценки титра антител к столбнячному анатоксину (антитела к ТТ) в сыворотке крови в качестве маркера истощения специфических плазматических клеток. После введения MOR202 уровни антител к ТТ в сыворотке крови значительно снижались по сравнению с исходным уровнем до введения MOR202.
В целом авторы настоящего изобретения демонстрируют, что MOR202 эффективно снижает уровни злокачественных (М-белок) и/или защитных антител (антитела к ТТ) в сыворотке крови человека, что указывает на долговременное истощение плазмобластов и плазматических клеток. Ожидается, что в отличие от других антител к CD38 MOR202 сохранит клетки с низкой экспрессией CD38 (например NK-клетки) и, следовательно, обеспечит оптимальный профиль безопасности.
Этот наблюдаемый эффект MOR202 на снижение титров антител в сыворотке крови является новым и в предшествующем уровне техники не учитывается, не предлагается или не предусматривается какое-либо рациональное применение MOR202 для лечения AD, опосредованного аутоантителами.
В конкретном аспекте настоящего изобретения антитело или фрагмент антитела содержат область HCDR1 аминокислотной последовательности под SEQ ID NO: 1, область HCDR2 аминокислотной последовательности под SEQ ID NO: 2, область HCDR3 аминокислотной последовательности под SEQ ID NO: 3, область LCDR1 аминокислотной последовательности под SEQ ID NO: 4, область LCDR2 аминокислотной последовательности под SEQ ID NO: 5 и область LCDR3 аминокислотной последовательности под SEQ ID NO: 6 для применения в лечении и/или предупреждении аутоиммунных заболеваний, опосредованных аутоантителами, в частности для применения в лечении и/или предупреждении системной красной волчанки (SLE) или идиопатического мембранозного гломерулонефрита, предпочтительно для применения в лечении и/или предупреждении мембранозного гломерулонефрита, положительного в отношении антител к PLA2R.
Настоящее изобретение также предусматривает фармацевтические композиции, содержащие антитело или фрагмент антитела, специфические в отношении CD38, и подходящий фармацевтический носитель, вспомогательное вещество или разбавитель для применения в профилактике и/или лечении аутоиммунных заболеваний, опосредованных аутоантителами.
В дополнительном конкретном аспекте фармацевтические композиции могут дополнительно содержать дополнительные терапевтически активные ингредиенты, подходящие для применения в комбинации с антителом или фрагментами антитела по настоящему изобретению. В более конкретном аспекте дополнительный терапевтически активный ингредиент представляет собой средство для лечения аутоиммунных заболеваний, опосредованных аутоантителами.
В одном аспекте настоящего изобретения настоящее изобретение предусматривает способ профилактики и/или лечения AD, опосредованного аутоантителами, у субъекта, нуждающегося в этом, в частности людей, при этом способ включает введение указанному субъекту эффективного количества фармацевтической композиции, содержащей антитело или фрагмент антитела к CD38.
Настоящее изобретение также предусматривает способ профилактики и/или лечения идиопатического мембранного гломерулонефрита (IMN) у субъекта, нуждающегося в этом, при этом указанный способ включает стадию введения указанному субъекту эффективного количества фармацевтической композиции, содержащей антитело или фрагмент антитела к CD38.
В частности, настоящее изобретение предусматривает способ профилактики и/или лечения мембранозного гломерулонефрита, положительного в отношении антител к PLA2R (aMN), у субъекта, нуждающегося в этом, при этом указанный способ включает стадию введения указанному субъекту эффективного количества фармацевтической композиции, содержащей антитело или фрагмент антитела к CD38.
В одном аспекте настоящее изобретение предусматривает способ профилактики и/или лечения системной красной волчанки (SLE) у субъекта, нуждающегося в этом, при этом указанный способ включает стадию введения указанному субъекту эффективного количества фармацевтической композиции, содержащей антитело или фрагмент антитела к CD38.
В одном аспекте настоящее изобретение предусматривает антитело или фрагмент антитела, специфические в отношении CD38, для применения в профилактике и/или лечении AD, опосредованного аутоантителами, у млекопитающих, в частности людей, страдающих указанным аутоиммунным заболеванием.
Другие цели и преимущества станут очевидными для специалистов в данной области техники из рассмотрения последующего подробного описания.
Более того, антитела или фрагменты антител, специфические в отношении CD38, используемые в фармацевтических композициях и способах лечения, раскрытых в данном документе, являются фармацевтически приемлемыми в том виде, в каком они получены и использованы.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
На фигуре 1 схематически показаны основные типы клеток при дифференцировке В-клеток и уровень экспрессии CD19, CD20 и CD38. Экспрессия CD38 в ходе развития В-клеток строго регулируется: CD38 присутствует на предшественниках В-клеток костного мозга, но утрачивается на зрелых В-клетках. На В-клетках зародышевого центра CD38 защищает от апоптоза, но при выходе из зародышевого центра В-клетки памяти лишены антигена или характеризуются только низкими уровнями антигена. На терминально дифференцированных короткоживущих и долгоживущих плазматических клетках, которые являются клетками, секретирующими антитела, CD38 является одним из немногих присутствующих поверхностных антигенов и экспрессируется на высоком уровне (Hamblin TJ, Blood 2003 102:1939-1940).
На фигуре 2 схематически показаны основные типы В-клеток, на которые нацеливаются средства терапии, представляющие собой антитела KCD20, истощающие В-клетки (например лечение с помощью ритуксимаба).
На фигуре 3 схематически показаны основные типы клеток, секретирующих антитела, на которые нацеливаются средства терапии, представляющие собой антитела KCD38 (например лечение с помощью MOR202).
На фигуре 4 показан высокий уровень экспрессии CD38 на плазматических клетках здоровых индивидуумов и пациентов с множественной миеломой, определенный посредством FACS.
На фигуре 5 показано изменение (в %) титров антител к столбнячному анатоксину (антител к ТТ) у субъектов после введения MOR202 на день 15 цикла 1 (т.е. через 2 недели после начала лечения с помощью MOR202) по сравнению с исходным уровнем.
На фигуре 6 показано изменение (в %) титров антител к столбнячному анатоксину (антител к ТТ) у субъектов после введения MOR202 на день 15 цикла 2 (т.е. через 6 недели после начала лечения с помощью MOR202) по сравнению с исходным уровнем.
На фигуре 7 показано изменение (в %) уровней М-белка в когорте пациентов, подвергавшихся лечению один раз в неделю с помощью MOR202 в комбинации с дексаметазоном, по сравнению с исходным уровнем (лучший ответ).
На фигуре 8 показано изменение (в %) уровней М-белка в когорте пациентов, подвергавшихся лечению один раз в неделю с помощью MOR202 в комбинации с леналидомидом/дексаметазоном, по сравнению с исходным уровнем (лучший ответ).
На фигуре 9 показано изменение (в %) уровней М-белка в когорте пациентов, подвергавшихся лечению один раз в неделю с помощью MOR202 в комбинации с помалидомидом/дексаметазоном, по сравнению с исходным уровнем (лучший ответ).
На фигуре 10 показано специфическое уничтожение линии плазматических клеток множественной миеломы с высоким уровнем экспрессии CD38 с помощью MOR202 при сохранении NK-клетокс низким уровнем экспрессии CD38 по сравнению с антителами KCD38 даратумумабом (Dara) и изатуксимабом.
На фигуре 11 показана схема клинических испытаний MOR202, протестированная на субъектах с aMN.
На фигуре 12 проиллюстрированы различные аутоантитела, которые могут быть выявлены у пациентов с системной красной волчанкой (SLE).
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Определения
Следующие термины имеют значения, представленные вместе с ними ниже, и применимы для понимания настоящего описания и предполагаемого объема настоящего изобретения.
При описании настоящего изобретения, которое может включать антитела, фрагменты антител, фармацевтические композиции, содержащие такие антитела или фрагменты антител, и способы применения таких антител, фрагментов антител и композиций, следующие термины, если они присутствуют, имеют следующие значения, если не указано иное.
Формы единственного числа могут использоваться в данном документе для обозначения одного или более чем одного (т.е. по меньшей мере одного) из грамматических объектов, указанных в единственном числе. Например, "аналог" означает один аналог или более чем один "аналог".
Термин "CD38" относится к белку, известному как CD38, имеющему следующие синонимы: ADP-рибозилциклаза 1, cADPr-гидролаза 1, гидролаза 1 циклической ADP-рибозы, Т10.
CD38 человека (UniProt Р28907) характеризуется следующей аминокислотной последовательностью:

CD38 представляет собой трансмембранный гликопротеин типа II и пример антигена, который характеризуется высоким уровнем экспрессии на клетках, секретирующих антитела (включая плазмобласты и плазматические клетки, секретирующие аутоантитела). Функции, приписываемые CD38, включают как рецептор-опосредованную адгезию и события передачи сигнала, так и (экто-) ферментативную активность. В качестве эктофермента CD38 использует NAD+в качестве субстрата для образования циклической ADP-рибозы (cADPR) и ADPR, а также никотинамидадениндинуклеотидфосфата и адениндинуклеотидфосфата никотиновой кислоты (NAADP). Было показано, что cADPR и NAADP выступают в качестве вторичных мессенджеров для мобилизации Са2+. Посредством превращения NAD+ в cADPR CD38 регулирует концентрацию внеклеточного NAD+ и, следовательно, выживание клеток посредством модуляции NAD-индуцированной гибели клеток (NCID). Помимо передачи сигнала посредством Са2+ передача сигнала с участием CD38 происходит посредством перекрестной связи с комплексами антиген-рецептор на Т- и В-клетках или другими типами рецепторных комплексов, например молекулами МНС, и таким образом участвует в нескольких клеточных ответных реакциях, а также в переключении и секреции антител IgG.
Термин "антитело KCD38", используемый в данном документе, включает CD38-связывающие молекулы в самом широком смысле; в том числе любую молекулу, которая специфически связывается с CD38 или подавляет активность или функцию CD38 или каким-либо другим образом оказывает терапевтический эффект на CD38. В том числе любую молекулу, которая препятствует функциональности CD38 или подавляет ее. Термин "антитело к CD38" включает без ограничения антитела, специфически связывающиеся с CD38, альтернативные белковые каркасы (например, фибронектиновые каркасы, анкирины, макситела/авимеры, молекулы, полученные из белка А, антикалины, аффилины, миметики белковых эпитопов (РЕМ) и т.п.), связывающиеся с CD38, нуклеиновые кислоты (включая аптамеры), специфические в отношении CD38, или малые органические молекулы, специфические в отношении CD38.
Антитела, специфические в отношении CD38, описаны, например, в W0199962526 (Мауо Foundation); WO200206347 (Crucell Holland); US2002164788 (Jonathan Ellis), который включен посредством ссылки во всей своей полноте; WO2005103083 (MorphoSys AG), патент США под серийным №10/588568, который включен посредством ссылки во всей своей полноте, WO2006125640 (MorphoSys AG), патент США с серийным №11/920830, который включен посредством ссылки во всей своей полноте, и WO2007042309 (MorphoSys AG), патент США с серийным №12/089806, который включен посредством ссылки во всей своей полноте; WO2006099875 (Genmab), патент США с серийным №11/886932, который включен посредством ссылки во всей своей полноте; и WO2008047242 (Sanofi-Aventis), патент США с серийным №12/441466, который включен посредством ссылки во всей своей полноте.
Комбинации антител, специфических в отношении CD38, и других средств описаны, например, в WO200040265 (Research Development Foundation); W02006099875 и WO2008037257 (Genmab); а также в WO2010061360, WO2010061359, WO2010061358 и WO2010061357 (Sanofi Aventis), все из которых включены посредством ссылки во всей своей полноте.
Предпочтительно антитело к CD38 для применения, как описано в данном документе, представляет собой антитело, специфическое в отношении CD38. Более предпочтительно, антитело к CD38 представляет собой антитело или фрагмент антитела, например моноклональное антитело, специфически связывающееся с CD38 и удаляющее клетки, секретирующие антитела. Такое антитело может быть любого типа, например, представлять собой мышиное, крысиное, химерное, гуманизированное или человеческое антитело.
Используемые в данном документе термины "человеческое антитело" или "фрагмент человеческого антитела" представляют собой антитело или фрагмент антитела, содержащие вариабельные области, в которых как каркасные, так и CDR-области получены из последовательностей человеческого происхождения. Если антитело содержит константную область, то константная область также получена из таких последовательностей. Источники человеческого происхождения включают без ограничения человеческие последовательности зародышевой линии или мутантные версии человеческих последовательностей зародышевой линии или антитела, содержащего консенсусные каркасные последовательности, полученные в результате анализа человеческих каркасных последовательностей, например, как описано в Knappik et al., (2000) J Mol Biol 296:57-86). Человеческие антитела могут быть выделены, например, из синтетических библиотек или от трансгенных мышей (например Xenomouse). Антитело или фрагмент антитела является человеческим, если его последовательность является человеческой, независимо от вида, от которого это антитело физически получено, выделено или произведено.
Структуры и местоположения вариабельных доменов иммуноглобулинов, например CDR, можно определять с применением широко известных схем нумерации, например, схемы нумерации по Kabat, схемы нумерации по Chothia или комбинации схем по Kabat и Chothia (см., например, Sequences of Proteins of Immunological Interest, U.S. Department of Health and Human Services (1991), eds. Kabat etal.; Lazikani et al., (1997) J. Mol. Bio. 273:927-948); Kabat et al., (1991) Sequences of Proteins of Immunological Interest, 5th edit., NIH Publication no. 91-3242 U.S. Department of Health and Human Services; Chothia et al., (1987) J. Mol. Biol. 196:901-917; Chothia et al., (1989) Nature 342:877-883; и Al-Lazikani et al., (1997) J. Mol. Biol. 273:927-948.
В данном документе термины "гуманизированное антитело" или "фрагмент гуманизированного антитела" определены как молекула антитела, которая содержит константные области антитела, полученные из последовательностей человеческого происхождения, и при этом вариабельные области антитела и их части или только CDR получены от другого вида. Например, гуманизированное антитело может содержать привитые CDR, где CDR вариабельного домена характеризуются происхождением, отличным от человеческого, тогда как один или несколько каркасов вариабельного домена характеризуются человеческим происхождением, и константный домен (если таковой имеется) характеризуется человеческим происхождением.
Термины "химерное антитело" или "фрагмент химерного антитела" определены в данном документе как молекула антитела, которая содержит константные области антитела, полученные из последовательностей, встречающихся у одного вида, или соответствующие им, и вариабельные области антитела, полученные от другого вида. Предпочтительно константные области антитела получены из последовательностей, встречающихся у человека, или соответствуют им, а вариабельные области антитела (например, VH-, VL-, CDR- или FR-области) получены из последовательностей, встречающихся у животного, отличного от человека, например, мыши, крысы, кролика или хомяка.
Термин "выделенное антитело" относится к антителу или фрагменту антитела, которые практически не содержат других антител или фрагментов антител, характеризующихся другой антигенной специфичностью. Более того, выделенное антитело или фрагмент антитела может практически не содержать другой клеточный материал и/или химические вещества. Таким образом, в некоторых аспектах предусмотренные антитела представляют собой выделенные антитела, которые были отделены от антител с другой специфичностью. Выделенное антитело может представлять собой моноклональное антитело. Выделенное антитело может представлять собой рекомбинантное моноклональное антитело. Выделенное антитело, которое специфически связывается с эпитопом, изоформой или вариантом мишени, может, однако, характеризоваться перекрестной реактивностью с другими родственными антигенами, например из других видов (например видов-гомологов).
Используемый в данном документе термин "моноклональное антитело" относится к препарату молекул антител одного молекулярного состава. Состав моноклонального антитела демонстрирует уникальный сайт связывания, характеризующийся уникальной специфичностью связывания и аффинностью к определенным эпитопам.
Кроме того, используемый в данном документе термин "иммуноглобулин" (lg) определен в данном документе как белок, принадлежащий к классу IgG, IgM, IgE, IgA или IgD (или любому их подклассу), и включает все общеизвестные антитела и их функциональные фрагменты. Предпочтительным классом иммуноглобулинов для применения в настоящем изобретении является IgG.
Используемая в данном документе фраза "фрагмент антитела" относится к одной или нескольким частям антитела, которые сохраняют способность специфически взаимодействовать (например, посредством связывания, стерического несоответствия, стабилизирующего пространственного распределения) с антигеном. Примеры связывающих фрагментов включают без ограничения Fab-фрагмент, моновалентный фрагмент, состоящий из доменов VL, VH, CL и СН1; F(ab)2-фрагмент, бивалентный фрагмент, содержащий два Fab-фрагмента, связанных дисульфидным мостиком в шарнирном участке; Fd-фрагмент, состоящий из доменов VH и СН1; Fv-фрагмент, состоящий из доменов VL и VH одного плеча антитела; dAb-фрагмент (Ward et al., (1989) Nature 341:544-546), который состоит из домена VH; и выделенную область, определяющую комплементарность (CDR). Более того, несмотря на то, что два домена Fv-фрагмента, VL и VH, кодируются отдельными генами, их можно соединить с применением рекомбинантных способов с помощью синтетического линкера, который позволяет им образовывать единую белковую цепь, в которой области VL и VH соединяются попарно с образованием моновалентных молекул (известных как "одноцепочечный фрагмент (scFv)"; см., например, Bird et al., (1988) Science 242:423-426; и Huston et al., (1988) Proc. Natl. Acad. Sci. 85:5879-5883). Подразумевается, что такие одноцепочечные антитела также охватываются термином "фрагмент антитела". Эти фрагменты антител получают, используя традиционные методики, известные специалистам в данной области техники, и фрагменты подвергают скринингу в отношении применимости также, как и интактные антитела. Фрагменты антител также могут быть включены в однодоменные антитела, макситела, минитела, интратела, диатела, триатела, тетратела, v-NAR и бис-scFv (см., например, Hollinger and Hudson, (2005) Nature Biotechnology 23:1126-1136). Фрагменты антител можно прививать к остовам на основе полипептидов, таких как фибронектин типа III (Fn3) (см. патент США №6703199, в котором описаны монотела на основе полипептида, представляющего собой фибронектин). Фрагменты антител могут быть включены в одноцепочечные молекулы, содержащие пару тандемных Fv-сегментов (VH-CH1-VH-CH1), которые вместе с комплементарными полипептидами легкой цепи образуют пару антигенсвязывающих сайтов (Zapata et al., (1995) Protein Eng. 8:1057-1062; и патент США №5641870).
В настоящем изобретении предусмотрены терапевтические способы, включающие введение терапевтически эффективного количества раскрытого антитела к CD38 субъекту, нуждающемуся в таком лечении. Используемые в данном документе термины "терапевтически эффективное количество" или "эффективное количество" относятся к количеству антитела, специфического в отношении CD38, необходимому для индукции требуемого биологического ответа. В соответствии с настоящим описанием терапевтически эффективное количество представляет собой количество антитела, специфического в отношении CD38, необходимое для лечения и/или предупреждения аутоиммунных заболеваний, опосредованных аутоантителами, и симптомов, ассоциированных с указанным AD. Эффективное количество для конкретного индивидуума может варьироваться в зависимости от таких факторов, как состояние, подвергаемое лечению, общее состояние здоровья пациента, способ, путь и доза для введения, а также тяжесть побочных эффектов (Maynard, et al. (1996) A Handbook of SOPs for Good Clinical Practice, Interpharm Press, Boca Raton, Fla.; Dent (2001) Good Laboratory and Good Clinical Practice, London, UK).
Используемые в данном документе термины "лечить", "лечение" и т.п. означают облегчение симптомов, устранение причины симптомов, либо на временной, либо на постоянной основе, или предупреждение или замедление проявления симптомов упомянутых нарушения или состояния.
"Предупреждать" или "предупреждение" относятся к снижению риска приобретения или развития заболевания или нарушения (т.е. предупреждение развития хотя бы одного из клинических симптомов заболевания у субъекта, который может подвергаться воздействию фактора, вызывающего заболевание, или характеризуется предрасположенностью к заболеванию до начала заболевания. "Предупреждение" относится к способам, которые направлены на предупреждение начала проявления заболевания или его симптомов или которые обеспечивают задержку начала проявления заболевания или его симптомов.
Термин "профилактика" связан с "предупреждением" и относится к мере или процедуре, целью которых является предупреждение, а не лечение или излечение заболевания. Неограничивающие примеры профилактических мер могут включать введение вакцин; введение гепарина с низкой молекулярной массой госпитализированным больным, имеющим риск тромбоза, например, вследствие иммобилизации; введение противомалярийного средства, такого как хлорохин, перед посещением географического региона, где малярия является эндемической, или где высок риск заражения малярией.
"Смягчение" одного или нескольких симптомов AD, опосредованного аутоантителами, означает снижение степени одного или нескольких нежелательных клинических проявлений у индивидуума или популяции индивидуумов с AD, опосредованным аутоантителами.
"Вводимый" или "введение" включают без ограничения доставку лекарственного средства с помощью инъекционной формы, такой как, например, для внутривенного, внутримышечного, внутрикожного, подкожного пути или чресслизистого пути, например, в виде назального спрея или аэрозоля для ингаляции или в виде принимаемых внутрь раствора, капсулы или таблетки. Предпочтительным является введение с помощью инъекционной формы.
Используемые в данном документе термины "субъект", "субъект, нуждающийся в этом" и т.п.означают человека или животное, отличное от человека, у которых проявляются один или несколько симптомов или признаков аутоиммунного заболевания, опосредованного аутоантителами, и/или у которых было диагностировано аутоиммунное заболевание, опосредованное аутоантителами. Предпочтительно субъект является приматом, наиболее предпочтительно пациентом-человеком, у которого было диагностировано аутоиммунное заболевание, опосредованное аутоантителами.
Используемые в контексте данного документа термины "субъект" или "вид" относятся к любому млекопитающему, включая грызунов, таких как мышь или крыса, и приматов, таких как макак-крабоед (Масаса fascicularis), макак-резус (Масаса mulatta) или люди (Homo sapiens). Предпочтительно субъектом является примат, наиболее предпочтительно человек.
Используемый в данном документе термин "аутоиммунные заболевания, опосредованные аутоантителами" включает "аутоиммунные заболевания, ассоциированные с аутоантителами" и относится к группе заболеваний, которые характеризуются наличием аутоантител (положительные в отношении аутоантител), при которых либо имеют место (i) причинная корреляция и непосредственный вклад аутоантител в патогенез заболевания и ассоциированных с ним симптомов, или (ii) причинная корреляция и непосредственный вклад аутоантител в патогенез заболевания и ассоциированных с ним симптомов менее ясны, но могут иметь место. Аутоиммунные заболевания, опосредованные аутоантителами, включают без ограничения заболевания, примеры которых перечислены в таблице 1.




Используемый в данном документе термин "приблизительно" при применении по отношению к конкретному приведенному числовому значению означает, что значение может отличаться от приведенного значения на не более чем 1%. Например, используемое в данном документе выражение "приблизительно 100" включает 99 и 101, а также все значения между ними (например, 99,1, 99,2, 99,3, 99,4 и т.д.).
"Фармакокинетика" или "PK" в контексте данного документа описывает, как организм воспринимает конкретное лекарственное средство после введения посредством таких механизмов, как всасывание и распределение, а также метаболические изменения лекарственного средства в организме, эффекты и пути выведения метаболитов лекарственного средства. Фармакокинетические свойства лекарственных средств могут зависеть от пути введения и дозы введенного лекарственного средства.
"Фармацевтически приемлемый" означает одобренный или заслуживающий одобрения регулирующим агентством федерального правительства, или правительства штата, или соответствующего агентства в странах, отличных от США, или который включен в Фармакопею США или другую общепризнанную фармакопею для применения у животных и, более конкретно, у людей.
"Фармацевтически приемлемая среда-носитель" относится к разбавителю, адъюванту, вспомогательному веществу или носителю, с которым вводится антитело или фрагмент антитела.
В данном описании, если контекст не требует иного, слова "содержать", "иметь" и "включать" и их соответствующие вариации, такие как "содержит", "содержащий", "имеет", "имеющий", "включает" и " включающий" будут пониматься как подразумевающие включение указанного элемента, или целого числа, или группы элементов или целых чисел, но не исключение любого другого элемента, или целого числа, или группы элементов или целых чисел.
"MOR202" представляет собой антитело к CD38, также известное как "MOR03087" или "MOR3087". В настоящем изобретении данные термины используются взаимозаменяемо. MOR202 содержит Fc-область lgG1.
Аминокислотная последовательность HCDR1 MOR202 в соответствии с Kabat представляет собой
SYYMN (SEQ ID NO: 1)
Аминокислотная последовательность HCDR2 MOR202 в соответствии с Kabat представляет собой
GISGDPSNTYYADSVKG (SEQ ID NO: 2)
Аминокислотная последовательность HCDR3 MOR202 в соответствии с Kabat представляет собой
DLPLVYTGFAY (SEQ ID NO: 3)
Аминокислотная последовательность LCDR1 MOR202 в соответствии с Kabat представляет собой
SGDNLRHYYVY (SEQ ID NO: 4)
Аминокислотная последовательность LCDR2 MOR202 в соответствии с Kabat представляет собой
GDSKRPS (SEQ ID NO: 5)
Аминокислотная последовательность LCDR3 MOR202 представляет собой QTYTGGASL (SEQ ID NO: 6)
Аминокислотная последовательность вариабельного домена тяжелой цепи MOR202 представляет собой

Аминокислотная последовательность вариабельного домена легкой цепи MOR202 представляет собой
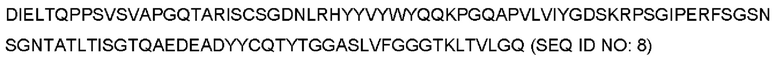
Последовательность ДНК, кодирующая вариабельный домен тяжелой цепи MOR202, представляет собой

Последовательность ДНК, кодирующая вариабельный домен легкой цепи MOR202, представляет собой 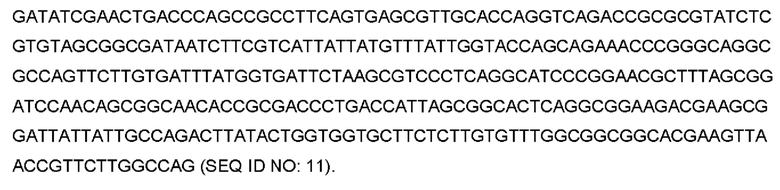
НАСТОЯЩЕЕ ИЗОБРЕТЕНИЕ
Настоящее изобретение относится к антителу или фрагменту антитела, специфическим в отношении CD38, применимым в профилактике и/или лечении аутоиммунного заболевания, опосредованного аутоантителами. В некоторых аспектах антитело представляет собой MOR202, и AD, опосредованное аутоантителами, представляет собой любое заболевание, выбранное из таблицы 1. В одном аспекте антитело представляет собой MOR202, и AD, опосредованное аутоантителами, представляет собой SLE. В конкретном аспекте антитело представляет собой MOR202, и AD, опосредованное аутоантителами, представляет собой идиопатический мембранозный гломерулонефрит, предпочтительно мембранозный гломерулонефрит, положительный в отношении антител к PLA2R.
Настоящее изобретение также предусматривает способы профилактики и/или лечения аутоиммунного заболевания, опосредованного аутоантителами, включающие введение субъекту, нуждающемуся в этом, антитела или фрагмента антитела, специфических в отношении CD38. В некоторых аспектах антитело или фрагмент антитела, специфические в отношении CD38, используемые в указанном способе, представляют собой MOR202, и AD, опосредованное аутоантителами, представляет собой любое, выбранное из таблицы 1. В одном аспекте антитело или фрагмент антитела, специфические в отношении CD38, используемые в указанном способе, представляют собой MOR202, и AD, опосредованное аутоантителами, представляет собой SLE. В конкретном аспекте антитело или фрагмент антитела, специфические в отношении CD38, используемые в указанном способе, представляют собой MOR202, и AD, опосредованное аутоантителами, представляет собой идиопатический мембранозный гломерулонефрит, предпочтительно мембранозный гломерулонефрит, положительный в отношении антител к PLA2R.
Настоящее изобретение также предусматривает фармацевтические композиции, содержащие указанные антитело или фрагмент антитела, специфические в отношении CD38, и способы профилактики и/или лечения аутоиммунного заболевания, опосредованного аутоантителами, посредством введения указанных антитела или фрагмента антитела, специфических в отношении CD38.
ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ
При применении в качестве фармацевтического средства антитело или фрагмент антитела, специфические в отношении CD38, как правило, вводятся в фармацевтической композиции. Такие композиции могут быть получены способом, хорошо известным в области фармацевтики, и содержат антитело или фрагмент антитела, специфические в отношении CD38. Как правило, антитело или фрагмент антитела, специфические в отношении CD38, вводятся в эффективном количестве. Количество фактически вводимых антитела или фрагмента антитела, специфических в отношении CD38, обычно будет определяться врачом в свете соответствующих обстоятельств, включая состояние, подлежащее лечению, выбранный путь введения, фактические вводимые антитело или фрагмент антитела, возраст, вес и ответ отдельного пациента, тяжесть симптомов пациента и т.п.
Композиции по настоящему изобретению предпочтительно представляют собой фармацевтические композиции, содержащие MOR202 и фармацевтически приемлемый носитель, разбавитель или вспомогательное вещество, для лечения аутоиммунных заболеваний, опосредованных аутоантителами.
Фармацевтически приемлемый носитель должен подходить для внутривенного, внутримышечного, подкожного, парентерального, спинального или эпидермального введения (например путем инъекции или инфузии). Фармацевтические носители усиливают или стабилизируют композицию или облегчают получение композиции. Фармацевтически приемлемые носители включают растворители, дисперсионные среды, покрытия, антибактериальные и противогрибковые средства, изотонические средства и средства, замедляющие всасывание, и т.п., которые являются физиологически совместимыми.
Композиция должна быть стерильной и жидкой. Надлежащую текучесть можно поддерживать, например, за счет применения покрытия, такого как лецитин, посредством поддержания требуемого размера частиц в случае дисперсии и за счет применения поверхностно-активных веществ. Во многих случаях предпочтительно включать в композицию изотонические средства, например сахара, многоатомные спирты, такие как маннит или сорбит, и хлорид натрия. Длительное всасывание композиций для инъекций может быть достигнуто посредством включения в композицию средства, которое замедляет всасывание, например моностеарата алюминия или желатина.
Фармацевтическую композицию по настоящему изобретению можно вводить посредством множества путей, известных из уровня техники. Выбранные пути введения антител или фрагментов антител по настоящему изобретению включают внутривенный, внутримышечный, внутрикожный, интраперитонеальный, подкожный, спинальный или другие парентеральные пути введения, например путем инъекции или инфузии. Парентеральное введение может представлять собой способы введения, отличные от энтерального и местного введения, как правило путем инъекции, и включает без ограничения внутривенные, внутримышечные, внутриартериальные, интратекальные, внутрикапсулярные, внутриглазничные, внутрисердечные, внутрикожные, интраперитонеальные, транстрахеальные, подкожные, субкутикулярные, внутрисуставные, субкапсулярные, субарахноидальные, интраспинальные, эпидуральные, интрацеребральные, внутриочаговые и внутригрудинные инъекцию и инфузию. В качестве альтернативы, композицию по настоящему изобретению можно вводить непарентеральным путем, таким как местный, эпидермальный, кожный или чресслизистый путь введения, например, интраназально, перорально, вагинально, ректально, сублингвально, трансдермально или местно. Кроме того, антитела или фрагменты антител можно вводить в виде состава с замедленным высвобождением, и в этом случае требуется менее частое введение. Кроме того, можно также использовать легочное введение, например, с применением ингалятора или распылителя и состава со средством в виде аэрозоля.
Антитело или фрагмент антитела, специфические в отношении CD38, предпочтительно составляются в виде композиции для инъекций. В предпочтительных аспектах антитело к CD38 по настоящему изобретению вводится внутривенно. В других аспектах антитело к CD38 по настоящему изобретению вводится подкожно, внутрисуставным путем или интраспинально.
В зависимости от пути введения активное соединение, т.е. антитело, фрагмент антитела, биспецифическая и полиспецифическая молекула, может быть покрыто материалом для защиты соединения от действия кислот и других естественных условий, которые способны инактивировать соединение.
Композиции для инъекций, как правило, основаны на стерильном солевом растворе для инъекций или фосфатно-солевом буферном растворе или других носителях для инъекций, известных из уровня техники. Аналогично вышеуказанному, антитело или фрагмент антитела, специфические в отношении CD38, в таких композициях обычно являются незначительным компонентом, часто составляющим от приблизительно 0,05 до 10% по весу, а остальная часть представляет собой носитель для инъекций и т.п. При необходимости композиция может также содержать солюбилизирующее средство и местный анестетик, такой каклидокаин, для облегчения боли в месте инъекции.
В одном аспекте настоящее изобретение направлено на композицию, содержащую антитело к CD38, для применения в лечении AD, опосредованного аутоантителами, при этом указанная композиция дополнительно содержит один или несколько фармацевтически приемлемых носителей и/или разбавителей.
Важным аспектом настоящего изобретения является фармацевтическая композиция, которая способна опосредовать уничтожение С038-экспрессирующих клеток, секретирующих антитела (например, плазмобластов, плазматических клеток), посредством ADCC и ADCP.
СПОСОБЫ ЛЕЧЕНИЯ
В одном варианте осуществления настоящее изобретение предусматривает антитело или фрагмент антитела, специфические в отношении CD38, или фармацевтические композиции, содержащие антитело или фрагмент антитела, специфические в отношении CD38, для применения в профилактике и/или лечении аутоиммунного заболевания, опосредованного аутоантителами.
В одном варианте осуществления настоящее изобретение предусматривает антитело или фрагмент антитела, специфические в отношении CD38, или фармацевтические композиции, содержащие антитело или фрагмент антитела, специфические в отношении CD38, для применения в профилактике и/или лечении системной красной волчанки (SLE).
В другом варианте осуществления настоящее изобретение предусматривает антитело или фрагмент антитела, специфические в отношении CD38, или фармацевтические композиции, содержащие антитело или фрагмент антитела, специфические в отношении CD38, для применения в профилактике и/или лечении идиопатической мембранозной нефропатий.
В одном варианте осуществления настоящее изобретение предусматривает антитело или фрагмент антитела, специфические в отношении CD38, или фармацевтические композиции, содержащие антитело или фрагмент антитела, специфические в отношении CD38, для применения в профилактике и/или лечении аутоиммунной мембранозной нефропатий.
В конкретном варианте осуществления настоящее изобретение предусматривает антитело или фрагмент антитела, специфические в отношении CD38, или фармацевтические композиции, содержащие антитело или фрагмент антитела, специфические в отношении CD38, для применения в профилактике и/или лечении мембранозной нефропатий, положительной в отношении антител к PLA2R.
В другом аспекте настоящее изобретение предусматривает антитело или фрагмент антитела, специфические в отношении CD38, или фармацевтические композиции, содержащие антитело или фрагмент антитела, специфические в отношении CD38, для применения в профилактике и/или лечении мембранозной нефропатий у пациентов с титрами антител к PLA2R.
В другом варианте осуществления настоящее изобретение предусматривает антитело или фрагмент антитела, специфические в отношении CD38, или фармацевтические композиции, содержащие антитело или фрагмент антитела, специфические в отношении CD38, для применения в изготовлении лекарственного препарата для применения в профилактике и/или лечении аутоиммунного заболевания, опосредованного аутоантителами.
В одном аспекте настоящее изобретение предусматривает применение антитела к CD38 в получении лекарственного препарата для лечения и/или профилактики системной красной волчанки (SLE).
В другом аспекте настоящее изобретение предусматривает применение антитела к CD38 в получении лекарственного препарата для лечения и/или профилактики идиопатической мембранозной нефропатий.
В другом аспекте настоящее изобретение предусматривает применение антитела к CD38 в получении лекарственного препарата для лечения и/или профилактики мембранозной нефропатий, опосредованной аутоантителами.
В предпочтительном аспекте настоящее изобретение предусматривает применение антитела к CD38 в получении лекарственного препарата для лечения и/или профилактики мембранозной нефропатий, положительной в отношении антител к PLA2R.
В других аспектах настоящее изобретение предусматривает применение MOR202 в получении лекарственного препарата в лечении и/или профилактике аутоиммунного заболевания, опосредованного аутоантителами.
В других аспектах настоящее изобретение предусматривает применение MOR202 в получении лекарственного препарата в лечении и/или профилактике системной красной волчанки (SLE).
В других аспектах настоящее изобретение предусматривает применение MOR202 в получении лекарственного препарата в лечении и/или профилактике идиопатической мембранозной нефропатий.
В других аспектах настоящее изобретение предусматривает применение MOR202 в получении лекарственного препарата в лечении и/или профилактике мембранозной нефропатий, опосредованной аутоантителами.
В предпочтительном аспекте настоящее изобретение предусматривает применение MOR202 в получении лекарственного препарата для лечения и/или профилактики мембранозной нефропатий, положительной в отношении антител к PLA2R.
В одном варианте осуществления настоящее изобретение предусматривает антитело или фрагмент антитела, специфические в отношении CD38, и другое терапевтическое средство или фармацевтические композиции, содержащие антитело или фрагмент антитела, специфические в отношении CD38, и другое терапевтическое средство, для применения в профилактике и/или лечении аутоиммунного заболевания, опосредованного аутоантителами, предпочтительно мембранозной нефропатий, опосредованной аутоантителами.
В другом варианте осуществления настоящее изобретение предусматривает антитело или фрагмент антитела, специфические в отношении CD38, и другое терапевтическое средство или фармацевтические композиции, содержащие антитело или фрагмент антитела, специфические в отношении CD38, или другое терапевтическое средство для применения в профилактике и/или лечении системной красной волчанки (SLE).
В другом варианте осуществления настоящее изобретение предусматривает антитело или фрагмент антитела, специфические в отношении CD38, и другое терапевтическое средство или фармацевтические композиции, содержащие антитело или фрагмент антитела, специфические в отношении CD38, или другое терапевтическое средство для применения в профилактике и/или лечении идиопатической мембранозной нефропатий.
В предпочтительном варианте осуществления настоящее изобретение предусматривает антитело или фрагмент антитела, специфические в отношении CD38, и другое терапевтическое средство или фармацевтические композиции, содержащие антитело или фрагмент антитела, специфические в отношении CD38, или другое терапевтическое средство для применения в профилактике и/или лечении мембранозной нефропатий, положительной в отношении антител к PLA2R.
В одном варианте осуществления настоящее изобретение предусматривает антитело или фрагмент антитела, специфические в отношении CD38, и другое терапевтическое средство или фармацевтические композиции, содержащие антитело или фрагмент антитела, специфические в отношении CD38, и другое терапевтическое средство, для применения в изготовлении лекарственного препарата для применения в профилактике и/или лечении аутоиммунного заболевания, опосредованного аутоантителами, предпочтительно мембранозной нефропатий, опосредованной аутоантителами.
В других аспектах настоящее изобретение предусматривает применение антитела к CD38 и другого терапевтического средства или фармацевтических композиций, содержащих антитело или фрагмент антитела к CD38, в получении лекарственного препарата для лечения и/или профилактики аутоиммунного заболевания, опосредованного аутоантителами, предпочтительно мембранозной нефропатий, опосредованной аутоантителами.
В предпочтительных аспектах настоящее изобретение предусматривает применение антитела к CD38 и другого терапевтического средства или фармацевтических композиций, содержащих антитело или фрагмент антитела к CD38, в получении лекарственного препарата для лечения и/или профилактики системной красной волчанки (SLE).
В предпочтительных аспектах настоящее изобретение предусматривает применение антитела к CD38 и другого терапевтического средства или фармацевтических композиций, содержащих антитело или фрагмент антитела к CD38, в получении лекарственного препарата для лечения и/или профилактики идиопатической мембранозной нефропатий.
В других аспектах настоящее изобретение предусматривает применение MOR202 и другого терапевтического средства или фармацевтических композиций, содержащих MOR202, в получении лекарственного препарата для лечения и/или профилактики аутоиммунного заболевания, опосредованного аутоантителами, предпочтительно мембранозной нефропатий, опосредованной аутоантителами.
В одном аспекте настоящее изобретение предусматривает применение MOR202 и другого терапевтического средства или фармацевтических композиций, содержащих MOR202, в получении лекарственного препарата для лечения и/или профилактики системной красной волчанки (SLE).
В конкретном аспекте настоящее изобретение предусматривает применение MOR202 и другого терапевтического средства или фармацевтических композиций, содержащих MOR202, в получении лекарственного препарата для лечения и/или профилактики идиопатической мембранозной нефропатий.
В конкретном аспекте настоящее изобретение предусматривает применение MOR202 и другого терапевтического средства или фармацевтических композиций, содержащих MOR202, в получении лекарственного препарата для лечения и/или профилактики мембранозной нефропатий, положительной в отношении антител к PLA2R.
В конкретном варианте осуществления указанное другое терапевтическое средство представляет собой средство для лечения аутоиммунного заболевания. В конкретном варианте осуществления указанное средство представляет собой иммуносупрессивное средство и выбрано из группы, включающей стероиды (например, пропионат клобетазола, дезоксиметазон, гидрокортизон, метилпреднизолон, преднизон, преднизолон, будесонид или дексаметазон), ингибиторы протеасом (например бортезомиб), цитостатики (например, циклофосфамид, азатиоприн, метотрексат), лекарственные средства, действующие на иммунофилины (например, циклоспорин, такролимус, сиролимус), и другие иммуносупрессанты.
В дополнительном способе аспектов лечения настоящее изобретение предусматривает способы профилактики и/или лечения млекопитающего, страдающего аутоиммунным заболеванием, опосредованным аутоантителами, при этом способы включают введение эффективного количества антитела или фрагмента антитела, специфических в отношении CD38, или одной или нескольких фармацевтических композиций, описанных в данном документе, для лечения и/или профилактики указанного состояния.
В одном аспекте настоящее изобретение предусматривает способ лечения AD, опосредованного аутоантителами, предпочтительно мембранозной нефропатий, опосредованной аутоантителами, включающий введение указанному субъекту антитела к CD38.
В одном варианте осуществления настоящее изобретение предусматривает способы профилактики и/или лечения млекопитающего, страдающего аутоиммунным заболеванием, опосредованным аутоантителами, где указанные способы включают введение другого терапевтического средства с антителом или фрагментом антитела, специфическими в отношении CD38. В конкретном варианте осуществления указанное другое терапевтическое средство представляет собой средство для лечения аутоиммунного заболевания. В конкретном варианте осуществления указанное средство представляет собой иммуносупрессивное средство.
В способе лечения или применения, описанном в данном документе, аутоиммунное заболевание представляет собой, в частности, аутоиммунное заболевание, опосредованное аутоантителами (например, SLE, болезнь Грейвса, миастения гравис, обыкновенная пузырчатка, аутоиммунный энцефалит, идиопатический мембранозный гломерулонефрит, мембранозный гломерулонефрит, положительный в отношении антител к PLA2R).
В конкретном аспекте настоящее изобретение предусматривает способ лечения и/или профилактики мембранозного гломерулонефрита, положительного в отношении антител к PLA2R, у субъекта, при этом указанный способ включает введение указанному субъекту антитела к CD38.
В одном варианте осуществления настоящее изобретение предусматривает способы профилактики и/или лечения субъекта, страдающего AD, опосредованным аутоантителами, от умеренной до тяжелой степени, при этом способы включают введение эффективного количества антитела или фрагмента антитела, специфических в отношении CD38, или одной или нескольких фармацевтических композиций, описанных в данном документе, для лечения и/или профилактики указанного состояния.
В некоторых вариантах осуществления настоящее изобретение предусматривает способы профилактики и/или лечения субъектов, страдающих AD, опосредованным аутоантителами, где указанный субъект устойчив к лечению другими средствами иммуносупрессивной терапии, включая кортикостероиды или ингибиторы кальциневрина, или средствами терапии, направленными на истощение В-клеток (например, с помощью ритуксимаба или любого другого антитела к CD20 или антитела к BAFF), при этом способы включают введение эффективного количества антитела или фрагмента антитела, специфических в отношении CD38, или одной или нескольких фармацевтических композиций, описанных в данном документе, для лечения и/или профилактики указанного состояния.
В одном аспекте настоящее изобретение предусматривает способы применения антитела или фрагмента антитела к CD38 для достижения профилактической или терапевтической пользы у пациентов с аутоиммунным заболеванием, опосредованным аутоантителами, предпочтительно мембранозной нефропатией, опосредованной аутоантителами.
В другом аспекте в данном документе предусмотрены способы применения антитела к CD38 для лечения и/или предупреждения симптомов, опосредованных аутоиммунным заболеванием, опосредованным аутоантителами.
В другом аспекте в данном документе предусмотрены способы снижения частоты проявления симптомов заболевания, опосредованного аутоантителами, ослабления симптомов заболевания, опосредованного аутоантителами, подавления симптомов заболевания, опосредованного аутоантителами, смягчения симптомов заболевания, опосредованного аутоантителами, и/или задержки начала, развития или прогрессирования заболевания, опосредованного аутоантителами, у субъекта, при этом указанный способ включает введение субъекту эффективного количества антитела KCD38.
В предпочтительных вариантах осуществления настоящее изобретение предусматривает способы лечения пациентов, у которых проявляются повышенные уровни специфичности одного или нескольких аутоантител, ассоциированных с аутоиммунным заболеванием.
В других аспектах настоящее изобретение предусматривает способ лечения и/или предупреждения SLE, вызванной присутствием антинуклеарных аутоантител, или аутоантител к ДНК, или любого другого аутоантитела при SLE, как перечислено на фигуре 12.
В еще одних аспектах настоящее изобретение предусматривает способ лечения и/или предупреждения SLE, ассоциированной с присутствием антинуклеарных аутоантител, или аутоантител к ДНК, или любого другого аутоантитела при SLE, как перечислено на фигуре 12.
В других аспектах настоящее изобретение предусматривает способ лечения и/или предупреждения заболевания, вызванного присутствием аутоантител к рецептору фосфолипазы А2 (PLA2R). В еще одних аспектах настоящее изобретение предусматривает способ лечения и/или предупреждения заболевания, ассоциированного с присутствием аутоантител к рецептору фосфолипазы А2 (PLA2R).
В других аспектах настоящее изобретение предусматривает способ лечения и/или предупреждения заболевания, вызванного присутствием аутоантител ктромбоспондину типа 1, содержащему домен 7А. В еще одних аспектах настоящее изобретение предусматривает способ лечения и/или предупреждения заболевания, ассоциированного с присутствием аутоантител ктромбоспондину типа 1, содержащему домен 7А.
В других вариантах осуществления настоящее изобретение предусматривает способы снижения титров аутоантител в сыворотке крови субъектов, страдающих аутоиммунным заболеванием, опосредованным аутоантителами, при этом способы включают введение эффективного количества антитела или фрагмента антитела, специфических в отношении CD38, или одной или нескольких фармацевтических композиций, описанных в данном документе.
В предпочтительном варианте осуществления настоящее изобретение предусматривает способы снижения титров в сыворотке крови субъектов, страдающих идиопатическим мембранозным гломерулонефритом, при этом способы включают введение эффективного количества антитела или фрагмента антитела, специфических в отношении CD38, или одной или нескольких фармацевтических композиций, описанных в данном документе. Например, способы, предусмотренные в данном документе, включают введение антитела к CD38 пациентам с повышенными уровнями аутоантител к PLA2R или к тромбоспондину типа 1, содержащему домен 7А.
В одном варианте осуществления снижение (изменение) титров аутоантител в сыворотке крови субъектов, страдающих мембранозным гломерулонефритом, положительным в отношении антител к PLA2R, составляет по меньшей мере 5%, по меньшей мере 10%, по меньшей мере 15%, по меньшей мере 20%, по меньшей мере 25%, по меньшей мере 30%, по меньшей мере 35%, по меньшей мере 40%, по меньшей мере 45% или по меньшей мере 50% по сравнению с исходным уровнем после введения антитела или фрагмента антитела, специфических в отношении CD38, или одной или нескольких фармацевтических композиций, описанных в данном документе.
В другом варианте осуществления настоящее изобретение предусматривает способы лечения и/или профилактики протеинурии, ассоциированной с мембранозным гломерулонефритом, положительным в отношении антител к PLA2R, у индивидуума, при этом способы включают введение эффективного количества антитела или фрагмента антитела, специфических в отношении CD38, или одной или нескольких фармацевтических композиций, описанных в данном документе.
В другом аспекте настоящее изобретение предусматривает способы предупреждения снижения функции почек у индивидуума с мембранозной нефропатией, положительной в отношении антител к PLA2R, при этом способы включают введение эффективного количества антитела или фрагмента антитела, специфических в отношении CD38, или одной или нескольких фармацевтических композиций, описанных в данном документе.
В другом аспекте настоящее изобретение предусматривает способы лечения и/или профилактики гиперхолестеринемии (высокого уровня холестерина) у индивидуума с мембранозной нефропатией, при этом способы включают введение эффективного количества антитела или фрагмента антитела, специфических в отношении CD38, или одной или нескольких фармацевтических композиций, описанных в данном документе.
В одном варианте осуществления настоящее изобретение относится к применению антитела или фрагмента антитела, специфических в отношении CD38, для лечения аутоиммунного заболевания, опосредованного аутоантителами, где указанные антитело или фрагмент антитела связываются с плазматической клеткой, экспрессирующей CD38.
В дополнительных вариантах осуществления настоящее изобретение относится к способу лечения аутоиммунного заболевания, опосредованного аутоантителами, у субъекта, включающему введение субъекту фармацевтической композиции, содержащей антитело или фрагмент антитела, которые связываются с клеткой, экспрессирующей CD38, и приводят к истощению такой клетки, экспрессирующей CD38.
В предпочтительном варианте осуществления настоящее изобретение относится к способу лечения аутоиммунного заболевания, опосредованного аутоантителами, у субъекта, включающему введение субъекту фармацевтической композиции, содержащей антитело или фрагмент антитела, которые связываются с клеткой, секретирующей антитела и экспрессирующей CD38, и приводят к истощению такой клетки, секретирующей антитела и экспрессирующей CD38, при сохранении других (не секретирующих антитела) клеток с низкой экспрессией CD38, таких как NK-клетки или им подобные.
В конкретном предпочтительном варианте осуществления настоящее изобретение относится к способу лечения аутоиммунного заболевания, опосредованного аутоантителами, у субъекта, включающему введение субъекту фармацевтической композиции, содержащей антитело или фрагмент антитела, которые связываются с клеткой, секретирующей антитела и экспрессирующей CD38, и приводят к истощению такой клетки, секретирующей антитела и экспрессирующей CD38, при сохранении NK-клеток, т.е. где антитело демонстрирует значительно более высокоспецифическое уничтожение клеток на клетках, секретирующих антитела, чем на NK-клетках.
В одном варианте осуществления настоящее изобретение относится к способу лечения аутоиммунного заболевания, опосредованного аутоантителами, у субъекта, включающему введение субъекту фармацевтической композиции, содержащей антитело или фрагмент антитела, которые связываются с клеткой, секретирующей антитела и экспрессирующей CD38, и приводят к истощению такой клетки, секретирующей антитела и экспрессирующей CD38, при сохранении других (не секретирующих антитела) клеток с низкой экспрессией CD38, таких как NK-клетки и им подобные, где специфическое уничтожение клеток, направленное на плазматическую клетку, секретирующую антитела, составляет по меньшей мере 10%, по меньшей мере 15%, по меньшей мере 20%, по меньшей мере 25%, по меньшей мере 30%, по меньшей мере 35%, по меньшей мере 40%, и где специфическое уничтожение клеток, направленное на NK-клетки, не секретирующие антитела, составляет менее 30%, менее 25%, менее 20% или менее 15%, как определено в стандартном анализе ADCC.
Антитело или фрагмент антитела, специфические в отношении CD38, можно вводить в качестве единственного активного средства или их можно вводить в комбинации с другими терапевтическими средствами. В конкретном варианте осуществления совместное введение двух (или более) средств позволяет использовать значительно более низкие дозы каждого, таким образом снижая наблюдаемые побочные эффекты.
В одном варианте осуществления антитело или фрагмент антитела, специфические в отношении CD38, или фармацевтическая композиция, содержащая антитело или фрагмент антитела, специфические в отношении CD38, вводятся как лекарственный препарат. В конкретном варианте осуществления указанная фармацевтическая композиция дополнительно содержит дополнительный активный ингредиент.
Совместное введение включает любые способы доставки двух или более терапевтических средств пациенту в рамках одного и того же режима лечения, как будет очевидно специалисту в данной области техники. Хотя два или более средств можно вводить одновременно в одном составе, т.е. в виде одной фармацевтической композиции, это не является существенным. Средства можно вводить в разных составах и в разное время.
Средства терапии (например профилактические или терапевтические средства) в составе комбинированных средств терапии по настоящему изобретению можно вводить субъекту одновременно или последовательно.
Средство терапии (например профилактические или терапевтические средства) в составе комбинированных средств терапии по настоящему изобретению также можно вводить циклически. Циклическая терапия включает введение первого средства терапии (например первого профилактического или терапевтического средства) в течение определенного периода времени с последующим введением второго средства терапии (например второго профилактического или терапевтического средства) в течение определенного периода времени и повторение этого последовательного введения, т.е. цикла, с целью снизить развитие устойчивости к одному из средств терапии (например средств), чтобы избежать побочных эффектов одного из средств терапии (например средств) или снизить их и/или улучшить эффективность средств терапии.
Средства терапии (например профилактические или терапевтические средства) в составе комбинированных средств терапии по настоящему изобретению можно вводить субъекту одновременно. Термин "одновременно" не ограничивается введением средств терапии (например профилактических или терапевтических средств) точно в одно и то же время, а скорее означает, что фармацевтическая композиция, содержащая антитела или фрагменты антител по настоящему изобретению, вводится субъекту последовательно и в пределах определенного временного интервала таким образом, что антитела по настоящему изобретению могут действовать вместе с другим средством(средствами) терапии с целью обеспечить повышенную пользу, чем если бы они были введены иным образом. АНТИТЕЛО
В некоторых вариантах осуществления настоящего изобретения антитело или фрагмент антитела, специфические в отношении CD38, в соответствии с настоящим изобретением содержат вариабельную область тяжелой цепи, вариабельную область легкой цепи, тяжелую цепь, легкую цепь и/или CDR, содержащие любую из аминокислотных последовательностей антител, специфических в отношении CD38, как указано в WO2007/042309.
В одном варианте осуществления указанные антитело или фрагмент антитела, специфические в отношении CD38, содержат область HCDR1, содержащую аминокислотную последовательность под SEQ ID NO: 1, область HCDR2, содержащую аминокислотную последовательность под SEQ ID NO: 2, область HCDR3, содержащую аминокислотную последовательность под SEQ ID NO: 3, область LCDR1, содержащую аминокислотную последовательность под SEQ ID NO: 4, область LCDR2, содержащую аминокислотную последовательность под SEQ ID NO: 5, и область LCDR3, содержащую аминокислотную последовательность под SEQ ID NO: 6.
В одном варианте осуществления указанные антитело или фрагмент антитела, специфические в отношении CD38, содержат область HCDR1 под SEQ ID NO: 1, область HCDR2 под SEQ ID NO: 2, область HCDR3 под SEQ ID NO: 3, область LCDR1 под SEQ ID NO: 4, область LCDR2 под SEQ ID NO: 5 и область LCDR3 под SEQ ID NO: 6.
В одном варианте осуществления указанные антитело или фрагмент антитела, специфические в отношении CD38, содержат вариабельную область тяжелой цепи под SEQ ID NO: 7 и вариабельную область легкой цепи под SEQ ID NO: 8.
В другом варианте осуществления указанные антитело или фрагмент антитела содержат вариабельную область тяжелой цепи под SEQ ID NO: 7 и вариабельную область легкой цепи под SEQ ID NO: 8 или вариабельную область тяжелой цепи и вариабельную область легкой цепи, которые характеризуются по меньшей мере 60%, по меньшей мере 70%, по меньшей мере 80%, по меньшей мере 90% или по меньшей мере 95% идентичностью с вариабельной областью тяжелой цепи под SEQ ID NO: 7 и вариабельной областью легкой цепи под SEQ ID NO: 8.
Иллюстративные антитело или фрагмент антитела, содержащие вариабельную область тяжелой цепи, содержащую аминокислотную последовательность под SEQ ID NO: 7, и вариабельную область легкой цепи, содержащую аминокислотную последовательность под SEQ ID NO: 8, представляют собой человеческое антитело KCD38, известное как MOR202.
В одном варианте осуществления настоящее изобретение относится к композиции на основе нуклеиновой кислоты, содержащей последовательность нуклеиновой кислоты или множество последовательностей нуклеиновой кислоты, кодирующих указанные антитело или фрагмент антитела, специфические в отношении CD38, где указанные антитело или фрагмент антитела содержат область HCDR1 под SEQ ID NO: 1, область HCDR2 под SEQ ID NO: 2, область HCDR3 под SEQ ID NO: 3, область LCDR1 под SEQ ID NO: 4, область LCDR2 под SEQ ID NO: 5 и область LCDR3 под SEQ ID NO: 6.
В другом варианте осуществления настоящее изобретение относится к нуклеиновой кислоте, кодирующей выделенное моноклональное антитело или его фрагмент, где нуклеиновая кислота содержит VH под SEQ ID NO: 10 и VL под SEQ ID NO: 11.
В одном варианте осуществления раскрытые антитело или фрагмент антитела, специфические в отношении CD38, представляют собой моноклональное антитело или фрагмент антитела.
В одном варианте осуществления раскрытые антитело или фрагмент антитела, специфические в отношении CD38, представляют собой человеческое, гуманизированное или химерное антитело.
В определенных вариантах осуществления указанные антитело или фрагмент антитела, специфические в отношении CD38, представляют собой выделенные антитело или фрагмент антитела.
В другом варианте осуществления указанные антитело или фрагмент антитела представляют собой рекомбинантное антитело или фрагмент антитела.
В дополнительном варианте осуществления указанные антитело или фрагмент антитела представляют собой рекомбинантное человеческое антитело или фрагмент антитела.
В дополнительном варианте осуществления указанные рекомбинантное человеческое антитело или фрагмент антитела представляют собой выделенные рекомбинантное человеческое антитело или фрагмент антитела.
В дополнительном варианте осуществления указанные рекомбинантное человеческое антитело или фрагмент антитела или выделенные рекомбинантное человеческое антитело или фрагмент антитела являются моноклональными.
В одном варианте осуществления раскрытые антитело или фрагмент антитела относятся к изотипу lgG.
В другом варианте осуществления указанное антитело представляет собой lgG1.
В одном варианте осуществления указанный фрагмент антитела представляет собой фрагмент бивалентного антитела.
В конкретных аспектах настоящего изобретения антитело к CD38 представляет собой MOR202.
В одном варианте осуществления настоящее изобретение относится к фармацевтической композиции, содержащей MOR202 или его фрагмент, специфические в отношении CD38, и фармацевтически приемлемый носитель или вспомогательное вещество.
В определенных вариантах осуществления антитело или фрагмент антитела, специфические в отношении CD38, представляют собой антитело или фрагмент антитела, которые специфически связывают CD38.
В определенных вариантах осуществления указанные антитело или фрагмент антитела, специфические в отношении CD38, представляют собой антитело или фрагмент антитела, которые специфически связываются с человеческим CD38.
В определенных вариантах осуществления указанные антитело или фрагмент антитела, специфические в отношении CD38, представляют собой выделенное моноклональное антитело или фрагмент антитела, которые специфически связываются с человеческим CD38.
В другом варианте осуществления настоящее изобретение предусматривает антитело или фрагмент антитела, специфические в отношении CD38, которые обеспечивают истощение клеток, секретирующих антитела и экспрессирующих CD38.
В предпочтительном аспекте настоящее изобретение предусматривает средство для предупреждения и/или терапевтическое средство для снижения уровней аутоантител в сыворотке крови у субъектов с SLE, при этом указанное средство содержит антитело KCD38 в качестве активного ингредиента.
В предпочтительном аспекте настоящее изобретение предусматривает средство для предупреждения и/или терапевтическое средство для снижения уровней аутоантител в сыворотке крови у субъектов с aMN, при этом указанное средство содержит антитело к CD38 в качестве активного ингредиента.
В конкретном аспекте настоящее изобретение предусматривает средство для предупреждения и/или терапевтическое средство для снижения уровней аутоантител к PLA2R в сыворотке крови у субъектов с aMN, при этом указанное средство содержит антитело к CD38 в качестве активного ингредиента.
В другом аспекте настоящее изобретение предусматривает средство для предупреждения и/или терапевтическое средство для снижения уровня аутоантител к PLA2R, депонированных в почках субъектов с aMN, при этом указанное средство содержит антитело к CD38 в качестве активного ингредиента.
В дополнительном аспекте настоящее изобретение предусматривает средство для предупреждения и/или терапевтическое средство для снижения протеинурии у субъектов с aMN, при этом указанное средство содержит антитело к CD38 в качестве активного ингредиента.
В другом аспекте настоящее изобретение предусматривает средство для предупреждения и/или терапевтическое средство для снижения гиперлипидемии (например, гиперхолестеринемии, высокого уровня холестерина) у субъектов с aMN, при этом указанное средство содержит антитело к CD38 в качестве активного ингредиента.
В другом аспекте настоящее изобретение предусматривает средство для предупреждения и/или терапевтическое средство для восстановления, улучшения или нормализации функции почек, на что указывает скорость гломерулярной фильтрации (eGFR) на основании уравнения CKD-epi у субъектов с aMN, при этом указанное средство содержит антитело к CD38 в качестве активного ингредиента.
ДЕМОНСТРАЦИОННЫЕ ПРИМЕРЫ
Иллюстративное антитело, специфическое в отношении CD38, используемое в следующих примерах, представляет собой человеческое антитело MOR202.
Пример 1. Эффективность MOR202 в отношении ранее существовавших титров антител к столбнячному анатоксину в качестве вакцинного антигена.
Чтобы оценить влияние лечения с помощью MOR202 на ранее существовавшие титры антител авторы настоящего изобретения определяли титры антител к столбнячному анатоксину в сыворотке крови человека, собранной от субъектов в определенные моменты времени после введения MOR202.
1.1. Схема исследования
Следующая биоаналитическая оценка является частью открытого многоцентрового клинического исследования с повышением дозы для характеристики безопасности и предварительной эффективности человеческого антитела к CD38 MOR03087 у взрослых пациентов с рецидивирующей/рефрактерной множественной миеломой. Целью настоящего эксперимента было количественное определение титров антител IgG к столбнячному анатоксину (антител к ТТ) в образцах сыворотки крови человека, полученных в ходе исследования, чтобы продемонстрировать, что моноклональное антитело kCD38 (MOR03087=MOR202) является эффективным для снижения ранее существовавших титров антител. Образцы сыворотки крови человека анализировали в отношении уровней IgG к столбнячному анатоксину (антитела к ТТ) посредством ELISA (таблица 4).
1.2. Определение антител IgG к столбнячному анатоксину посредством количественного ELISA
Образцы сыворотки крови хранили при -75±15°С до анализа. Для определения IgG к столбнячному анатоксину в образцах использовали коммерчески доступный набор для иммуноанализа (VaccZyme™, Binding Site, код продукта MK010). Перед анализом образцов анализ квалифицировали в биоаналитическом испытательном центре и все измерения выполняли в соответствии с рекомендациями производителя. В набор входили два образца для контроля качества (QC) с целевыми значениями и диапазонами для каждой партии. Целевые значения QC (высокое значение QC/низкое значение QC): 1,31/0,22 МЕ/мл (партия 1), 1,32/0,23 МЕ/мл (партия 2), 1,39/0,25 МЕ/мл (партия 3), 1,3/0,25 МЕ/мл (партия 4), 1,27/0,28 МЕ/мл (партия 5). В ходе анализов квалификации оценивали 3 дополнительных уровня концентрации в соответствии с результатами анализов квалификации: ULOQ (7 МЕ/мл), LLOQ (0,01 МЕ/мл), HQC (2,8-3,5 МЕ/мл) (ULOQ: верхний предел количественного определения, LLOQ: нижний предел количественного определения, HQC: высокий контроль качества). Стандартные калибровочные образцы поставлялись в наборе, готовом к применению. Один набор калибровочных стандартов состоял из: 0,01, 0,03, 0,09, 0,26, 0,78, 2,33, 7 МЕ/мл.
1.2.1. Проведение измерения
Образцы анализировали как повторности в анализах (один анализ=один 96-луночный планшет) вместе с одним набором стандартных калибровочных образцов и двумя наборами образцов для QC, как предусмотрено в наборе для анализа. Для проведения ELISA в отношении антител IgG к ТТ подготовка образцов не требуется. Образцы измеряли после разбавления (минимально необходимое разбавление составляет 1:101) разбавителем для образцов.
1.2.2. Принцип теста
Набор для иммуноферментного анализа VaccZyme™ антител IgG к столбнячному анатоксину представляет собой двухстадийный твердофазный иммуноферментный анализ. Лунки, разбитые по 12 на 8 рядов с лунками, покрывают столбнячным анатоксином из Clostridium tetani. Образцы для калибровки, контроли и разбавленные образцы сыворотки крови добавляются в лунки и антитела, распознающие антиген, представляющий собой столбнячный анатоксин, связываются в ходе первой инкубации. После промывания лунок для удаления всех несвязавшихся белков добавляется очищенный меченый пероксидазой конъюгат кроличьих антител к человеческому IgG (специфических в отношении гамма-цепи). Конъюгат связывается с захваченным человеческим антителом и избыток несвязавшегося конъюгата удаляется посредством дополнительной стадии промывания. Связанный конъюгат визуализируется с помощью субстрата 3,3',5,5'-тетраметилбензидина (ТМВ), который приводит к образованию продукта реакции синего цвета, интенсивность которого пропорциональна концентрации антитела в образце. В каждую лунку добавляется фосфорная кислота для остановки реакции. Это приводит к желтому цвету в конечной точке, который считывается при 450 нм.
1.2.3 Оценка данных
Обработку данных, полученных с помощью микропланшет-ридера, выполняли с применением программного обеспечения Magellan™ версии 6.6 от TECAN Austria GmbH с применением 4-параметрической логистической модели. Оптическую плотность образцов для контроля качества и исследуемых образцов конвертировали в значения концентрации (МЕ/мл) с применением стандартной кривой. Проводили экстраполяцию (коэффициент экстраполяции составляет 1,1), с целью вычисления значений концентрации, близких к верхнему и нижнему пределам количественного определения. Все измеренные и рассчитанные данные о концентрации представлены 3 значащими цифрами.
1.2.4. Результаты
Образцы сыворотки крови человека анализировали в 22 анализах. Данные о точности и прецизионности между анализами оценивали на основе стандартных калибровочных образцов в 22 принятых анализах. Данные о точности (выраженной в виде систематической ошибки) и прецизионности (выраженной в виде коэффициента вариации; CV) показаны в таблице 2.
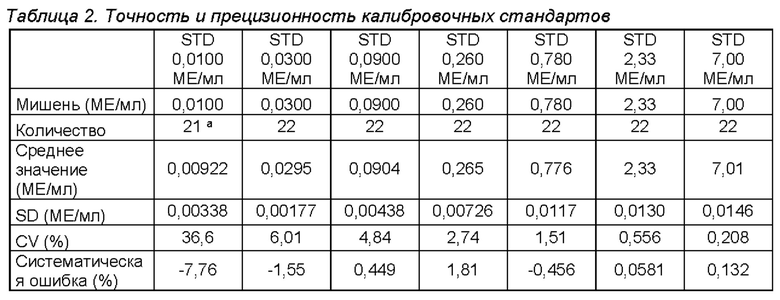
Данные о точности и прецизионности между анализами оценивали для максимально 22 наборов образцов для QC в 22 принятых анализах. Данные о точности (выраженной в виде систематической ошибки) и прецизионности (выраженной в виде коэффициента вариации; CV) показаны в таблице 3.
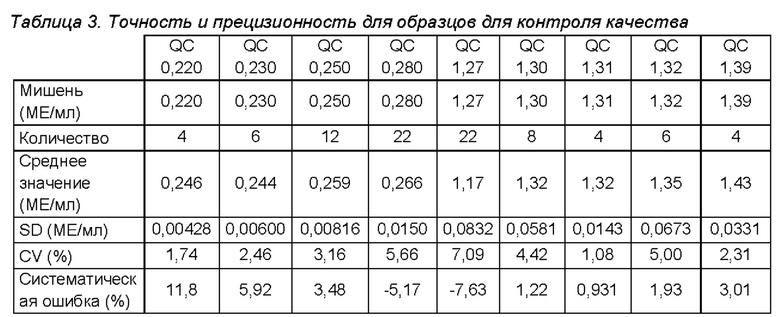
Концентрация антител к ТТ (МЕ/мл) в образцах сыворотки крови от 74 субъектов, для которых были доступны исходные данные и по меньшей мере одна из точек данных "цикл 1, день 15" или "цикл 2, день 15", показана в таблице 4. Субъектов, которые принимали сопутствующий препарат в ходе клинического исследования (например, введение IVIG или бустерная вакцинация), не включали в анализ, поскольку такие факторы приема сопутствующего препарата приводят к получению результатов с систематической ошибкой.
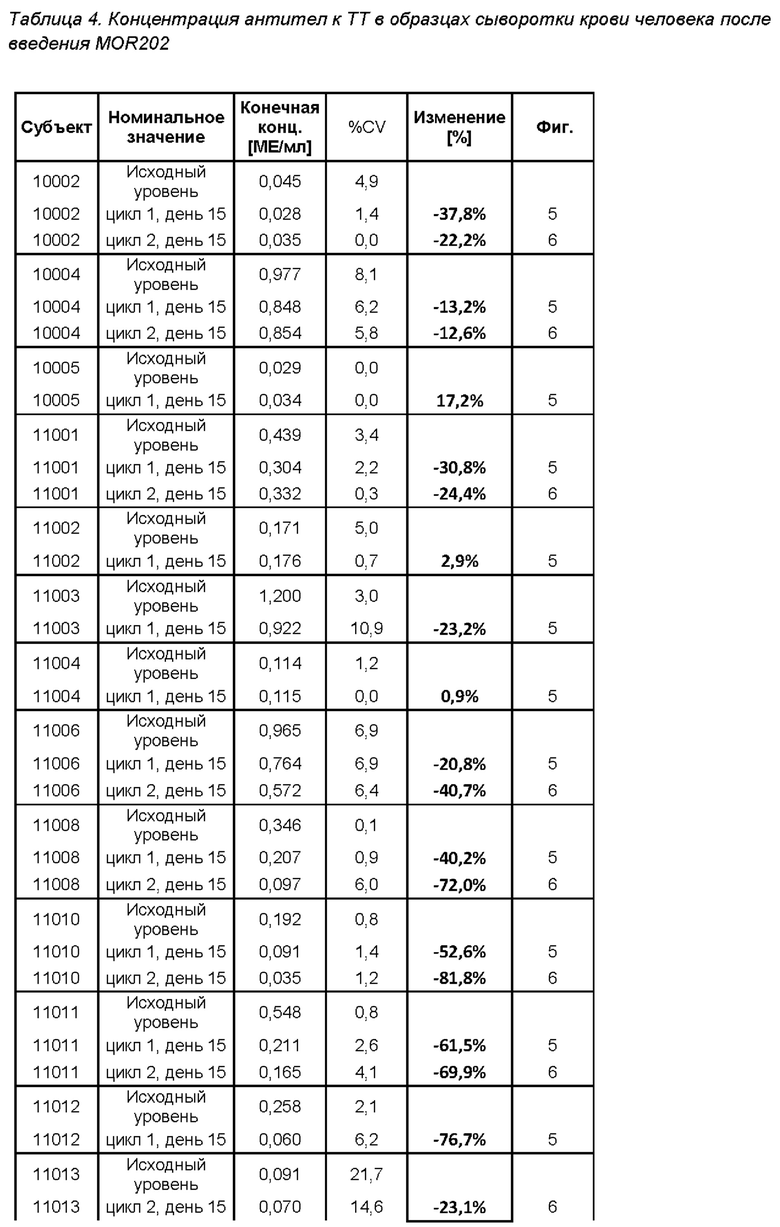
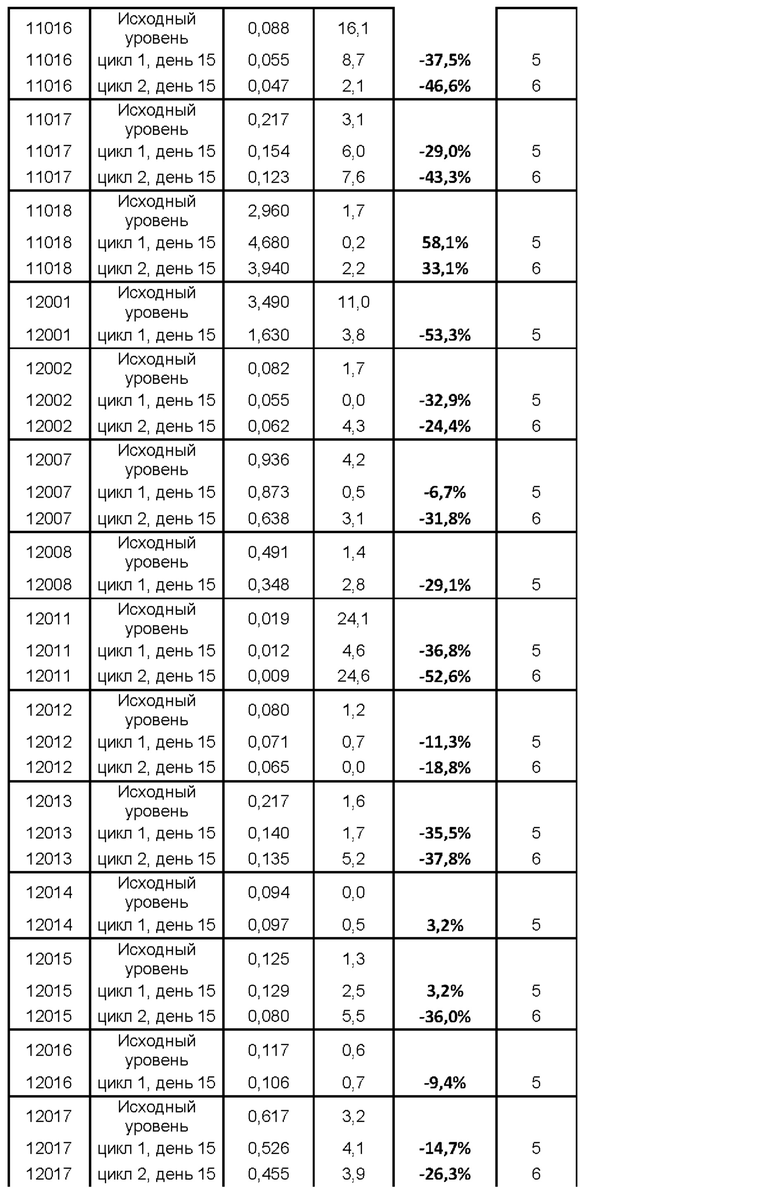
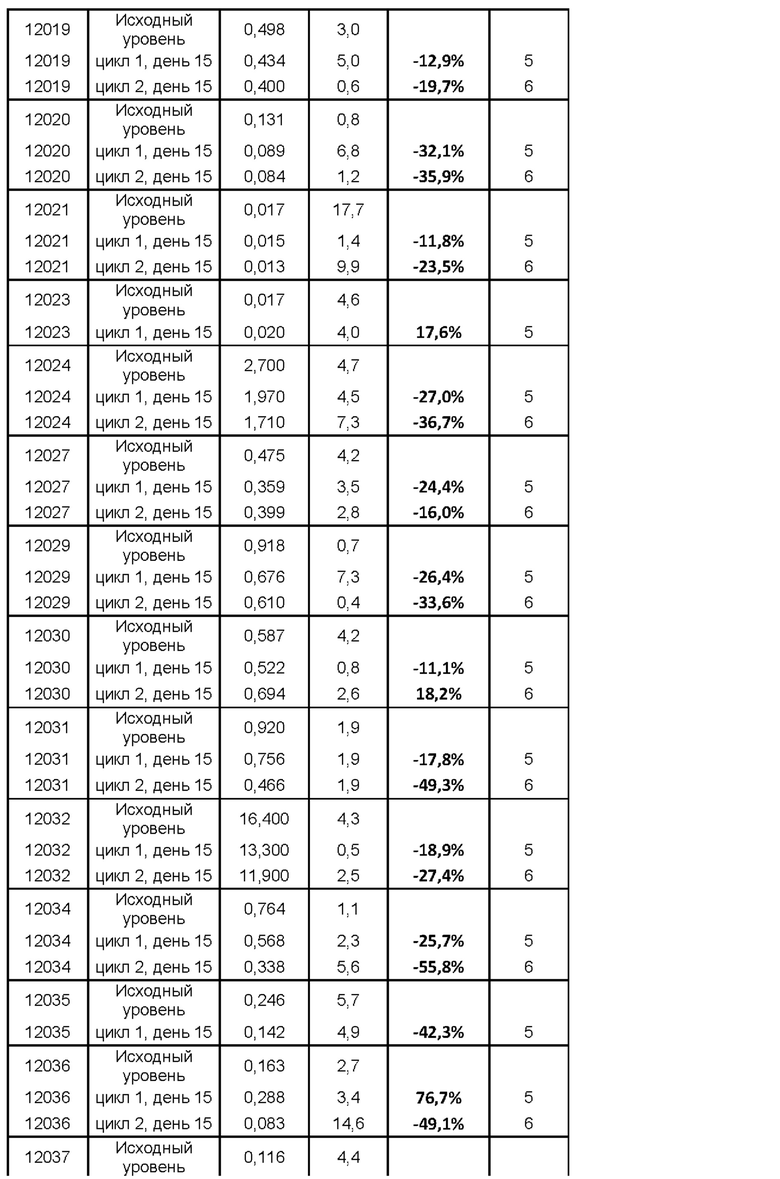
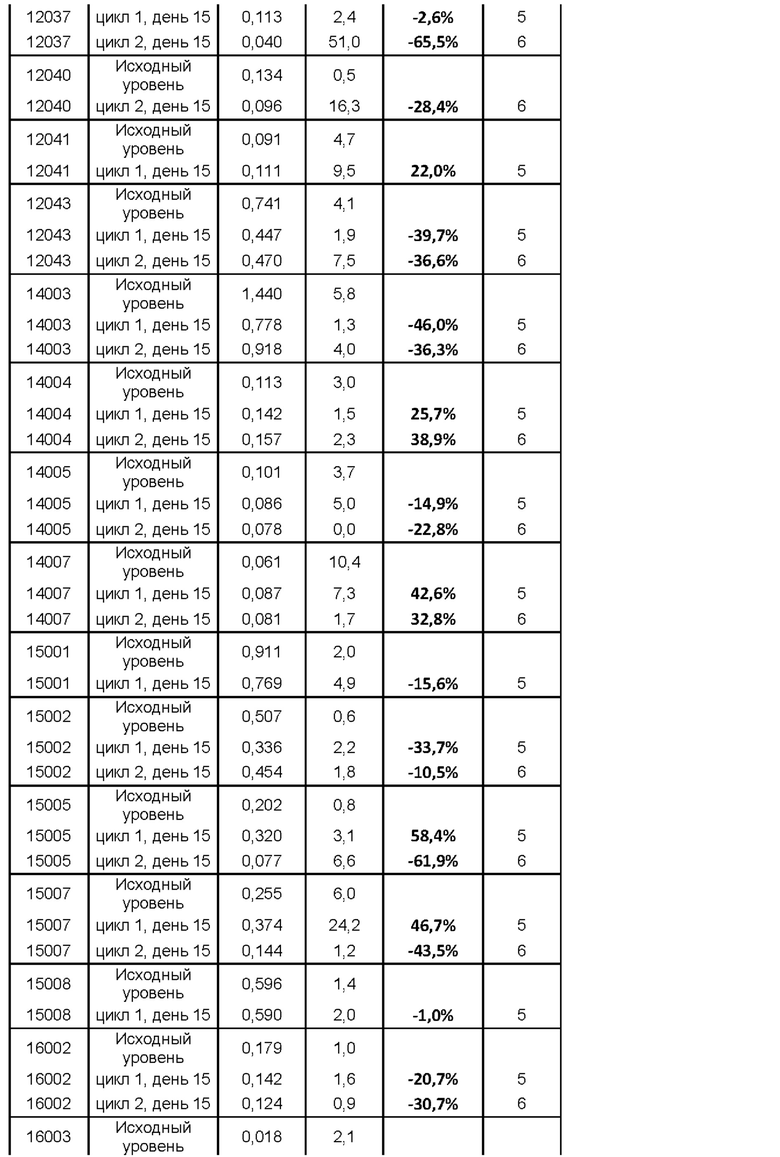
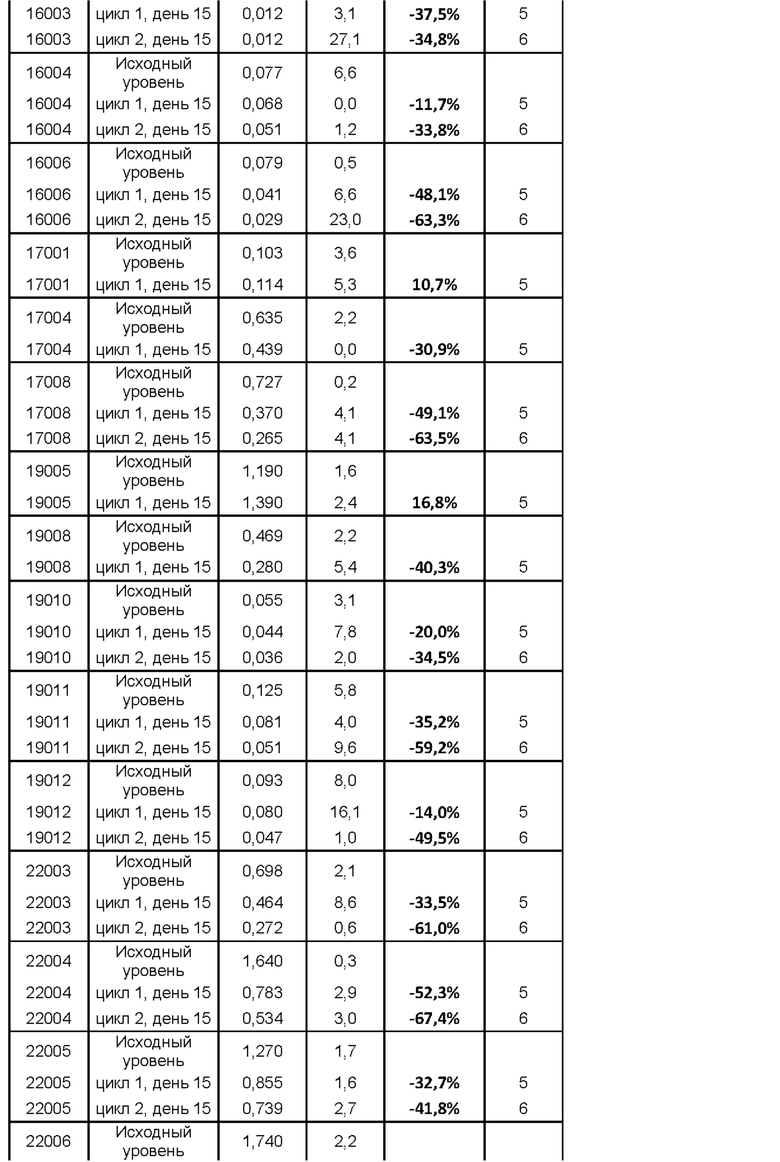
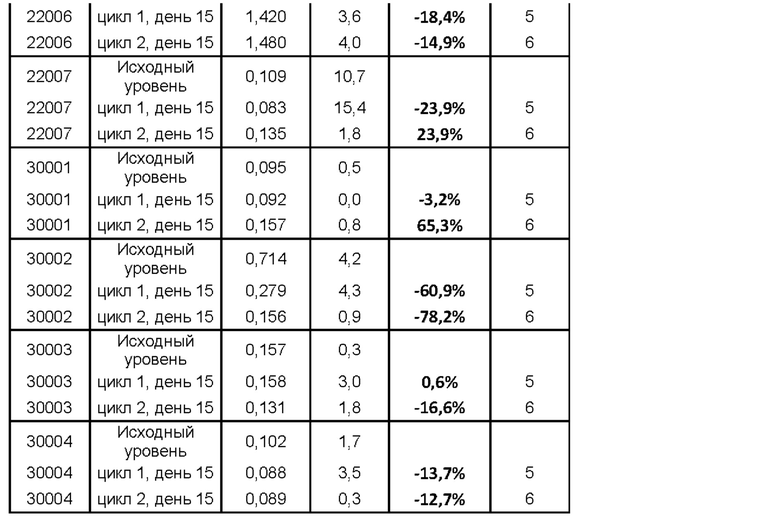
Чтобы определить влияние MOR202 на титры антител к ТТ анализировали образцы сыворотки крови, полученные в день 0 (до лечения с помощью MOR202, обозначен как "исходный уровень" в таблице 4), день 15 (цикл 1) и день 43 (=цикл 2, день 15) после введения MOR202. В день 15 цикла 1 после лечения с помощью MOR202 у большинства субъектов наблюдалось значительное снижение титров антител к ТТ по сравнению с исходным уровнем в день 0. % изменения концентраций антител к ТТ в образцах с "исходным уровнем", полученных в день 0, по сравнению с образцами, полученными в день 15 цикла 1 (обозначены как "цикл 1, день 15"), показан на фигуре 5. % изменения концентраций антител к ТТ в образцах с "исходным уровнем", полученных в день 0, по сравнению с образцами, полученными в день 15 цикла 2 (обозначены как "цикл 2, день 15"), показан на фигуре 6. У большинства субъектов, подвергавшихся лечению с помощью MOR202, титры антител к ТТ дополнительно снижались (т.е. более высокое процентное изменение от цикла 1, дня 15 к циклу 2, дню 15), что свидетельствует о долговременном влиянии MOR202 на титры антител.
В заключение, эти данные демонстрируют, что MOR202 является эффективным для снижения титров антител в сыворотке крови. Следовательно, эффективное лечение и/или профилактика AD, опосредованного аутоантителами, с применением антитела к CD38 (например MOR202) являются весьма вероятными.
Пример 2. Определение уровней М-белка
2.1. Схема исследования
Уровни М-белка в образцах сыворотки крови пациентов с множественной миеломой (участвовавших в испытании из примера 1) количественно определяли посредством анализов с применением капиллярного электрофореза (СЕ), в частности электрофореза белков сыворотки крови (SPEP) и электрофореза белков мочи (UPEP).
2.2. Капиллярный электрофорез - принцип теста
Заряженные молекулы разделяются по их электрофоретической подвижности при определенном рН в щелочном буфере. Разделение происходит в зависимости от рН электролита и электроосмотического потока. Каждый образец разбавляется в буфере для разбавления и капилляры заполняются буфером для разделения; затем образцы вводятся посредством аспирации в анодный конец капилляра. Затем следует разделение белков под высоким напряжением. Впоследствии непосредственное выявление и количественное определение различных белковых фракций выполняются при определенной длине волны на катодном конце капилляра.
Дополнительные анализы для оценки уровней М-белка включают без ограничения электрофорез с иммунофиксацией (IFE), анализ свободной легкой цепи в сыворотке крови (sFLC) и определение уровня общего белка (Keren DF and Schroeder L, Clin Chem Lab Med. 2016 Jun 1;54(6):947-61). Кроме того, может быть проведен анализ REFLEX на основе IFE, как описано в WO/2017/149122.
2.3 Результаты:
на фигуре 7 показано выраженное в процентах [%] изменение уровней М-белка у пациентов с множественной миеломой после лечения с помощью MOR202.
Эффект MOR202 в отношении снижения уровня М-белка опосредованно указывает на разрушение и истощение злокачественных плазматических клеток, продуцирующих М-белок. В дополнение к результатам из примера 1, показанным на фигурах 5 и 6, снижение уровней М-белка после введения MOR202 (фигуры 7-9) обеспечивает дополнительное доказательство того, что MOR202 является эффективным для снижения титров антител.
Пример 3. Оценка ADCC, опосредованной клетками, представляющими собой естественные киллеры (NK)
3.1 Экспериментальная модель
Для тестирования эффекта специфического уничтожения MOR202, даратумумаба и изатуксимаба (SAR650984), опосредованного клетками, представляющими собой естественные киллеры, на (i) линии клеток множественной миеломы с высоким уровнем экспрессии CD38 (NCI-H929) и (ii) NK-клетках человека с низким уровнем экспрессии CD38, выполняли анализ ADCC. NK-клетки очищали от крови человека посредством MACS (Miltenyi Biotec, номер по каталогу: 130-092-657). Чистоту NK-клеток оценивали посредством FACS с применением CD3/CD16+CD56/CD45 TritestTM (Becton Dickinson, номер по каталогу: 342411). Целевые клетки NCI-H929 инкубировали с соответствующим антителом при определенных концентрациях и соотношении эффектор:клетки-мишени, составляющим 3:1, в течение 2-4 ч при 37°С. Целевые NK-клетки инкубировали в течение 2-4 ч при 37°С только с соответствующим антителом, как и для модели NK-клетка:NK-клетка, с тем же соотношением целевых и эффекторных клеток. Для определения цитотоксичности к клеточному образцу добавляли йодид пропидия (PI) после инкубации и немедленно оценивали захват PI мертвыми клетками посредством проточной цитометрии.
3.2 Результаты
Результаты специфического уничтожения клеток [%] для MOR202, даратумумаба и исатуксимаба на NCI-929 и NK-клетках показаны на фигуре 10.
Пример 4. Оценка безопасности и эффективности MOR202 у субъектов с мембранозной нефропатией, положительной в отношении антител к PLA2R (aMN)
4.1 Схема исследования
Целями исследования являются оценка безопасности, переносимости и эффективности человеческого антитела MOR202 к CD38 у пациентов с мембранозной нефропатией, положительной в отношении антител к PLA2R (aMN), и оценка влияния MOR202 на уровни антител к PLA2R в сыворотке крови.
Дозирование MOR202 основано на результатах клинического исследования из примера 1 при множественной миеломе (ММ), а также подходе, заключающемся в моделировании PK/PD. В данном примере MOR202 вводили по схеме с повышением дозы с 0,1 до 16 мг/кг внутривенно один раз в неделю (QW) или один раз в две недели (Q2W), включая загрузочную дозу в день 4 цикла 1. MOR202 применяли либо как отдельное средство (монотерапия), либо в комбинации с DEX, POM/DEX или LEN/DEX. Общая продолжительность лечения была основана на клиническом ответе с непрерывным лечением максимум до 3 лет.По результатам была установлена популяционная модель PK/PD с учетом разных уровней целевой экспрессии между субъектами с ММ и aMN. Модель использовали для имитации воздействия лекарственного средства, как ожидалось в этом исследовании (т.е. введение дозы, составляющей 16 мг/кг: 4 х QW, а затем 5 х Q4W), и результаты сравнивали сданными исследования из примера 1, учитывая тот же период лечения. 6 пациентам вводили дозу в течение по меньшей мере 24 недель в исследовании из примера 1 при 16 мг/кг QW, включая загрузочную дозу в день 4. Это должно привести к 2,4-кратному превышению воздействия MOR202 по сравнению с ожидаемой дозой и режимом введения дозы в текущем исследовании со сходными максимальными значениями концентрации в сыворотке крови. Целью испытания является оценка безопасности и эффективности человеческого антитела MOR202 к CD38 у пациентов с мембранозной нефропатией, положительной в отношении антител к PLA2R (aMN), которые впервые соответствуют критериям для включения в исследование иммуносупрессивной терапии или которые не ответили на иммуносупрессивную терапию(IST), включая терапию ритуксимабом (антителом к CD20).
Пример 5. M-PLACE: многоцентровое открытое исследование фазы Ib/IIa для лечения двух когорт пациентов с aMN с помощью MOR202 (NCT04145440)
Открытое многоцентровое клиническое испытание фазы Ib/IIa для оценки безопасности и эффективности человеческого антитела MOR202 к CD38 при мембранозной нефропатий, положительной в отношении антител к PLA2R (aMN), с предполагаемым набором 30 участников, было начато и проводится в по меньшей мере 14 центрах в 6 местах в США и Европе. Идентификатор ClinicalTrials.gov (номер NCT): NCT04145440.
5.1. Схема исследования
Целями исследования являются оценка безопасности, переносимости и эффективности человеческого антитела MOR202 к CD38 у пациентов с мембранозной нефропатией, положительной в отношении антител к PLA2R (aMN), и оценка влияния MOR202 на уровни антител к PLA2R в сыворотке крови.
Основным аргументом в пользу лечения является снижение уровня антител к PLA2R, специфических для заболевания мембранозной нефропатий (MN), посредством целенаправленного истощения плазматических клеток, продуцирующих аутоантитела, с помощью антитела MOR202 к CD38.
Популяция пациентов, подлежащих лечению, включает взрослых субъектов с подтвержденной посредством биопсии MN, положительной в отношении антител к PLA2R. Возраст, соответствующий критериям включения в исследование: от 18 до 80 лет (взрослые, пожилые люди). Пациенты любого пола соответствуют критериям включения в исследование.
Ключевые критерии включения:
• соотношение уровня белка и уровня креатинина в моче составляет 3,0 г/г или больше (как измерено посредством сбора мочи в течение 24 ч).
• Расчетная скорость клубочковой фильтрации составляет 50 мл/мин/1,73 м2 или больше, или более 30 и менее 50 мл/мин/1,73 м2, и показатель интерстициального фиброза и канальцевой атрофии составляет менее 25% при биопсии почки, полученной в течение последних 6 месяцев до начала скрининга.
• Поддерживающее лечение ингибитором ангиотензинпревращающего фермента или блокатором рецептора ангиотензина II в течение по меньшей мере 4 недель до скрининга при достижении стабильной дозы.
• Систолическое BP составляет 150 мм рт. ст. или меньше, и диастолическое BP составляет 100 мм рт. ст. или меньше.
• Вакцинация против пневмококка в течение последних 3 лет до даты подписания информированного согласия (субъекты могут быть вакцинированы во время скрининга, чтобы соответствовать этому критерию; интервал до введения первой дозы MOR202 должен составлять по меньшей мере 14 дней).
• Когорта 1а (пациенты с впервые установленным диагнозом): уровень антител к PLA2R в сыворотке крови составляет 150,0 единиц ответа (RU)/мл или больше, определенный при скрининге посредством ELISA Euroimmun.
• Когорта 1b, пациенты с рецидивом: должны характеризоваться полной иммунологической и/или клинической ремиссией по мнению исследователя и уровнем антител к PLA2R в сыворотке крови, составляющим 50,0 RU/мл или больше, определенным при скрининге посредством ELISA Euroimmun.
• Когорта 2: неудача при прохождении предыдущей терапии, т.е. субъект ни разу не достиг полной иммунологической и/или клинической ремиссии по мнению исследователя в ходе или после завершения признанной IST, включающей циклоспорин А, такролимус, микофенолят-мофетил, АСТН, или алкилирующие средства (например циклофосфамид), или ритуксимаб. Уровень антител к PLA2R в сыворотке крови составляет 20,0 RU/мл или больше, определенный при скрининге посредством ELISA Euroimmun.
Ключевые критерии исключения:
• уровень гемоглобина составляет менее 90 г/л.
• Тромбоцитопения: Уровень тромбоцитов составляет менее 100,0x109/л.
• Нейтропения: Уровень нейтрофилов составляет менее 1,5х109/л.
• Лейкопения: Уровень лейкоцитов составляет менее 3,0x109/л.
• Гипогаммаглобулинемия: Уровень иммуноглобулинов в сыворотке крови составляет 5,0 г/л или меньше.
• Вторичная причина MN (например, системная красная волчанка, лекарственные препараты, злокачественные новообразования)
• сопутствующее заболевание почек, отличное от MN (например, диабетическое заболевание почек, волчаночный нефрит, нефропатия, вызванная IgA).
Когорта 1 включает примерно 20 пациентов с aMN, стабильно подвергающихся поддерживающему лечению с помощью ACEI/ARB при скрининге с неблагоприятными прогностическими признаками, такими как протеинурия (более 5 г/24 ч) и высокие и стабильные титры антител к PLA2R в сыворотке крови (150,00 единиц ответа (RU)/мл или больше, Euroimmun ELISA), подходящих для 1ST, или субъектов, у которых наблюдается рецидив после полного или частичного ответа на протеинурию, включая титр антител к PLA2R в сыворотке крови, составляющий менее 20 RU/мл в течение по меньшей мере 6 месяцев. Субъекты могут подвергаться повторной диагностике (когорта 1а) или могут характеризоваться рецидивом (когорта 1b) после предшествующей протеинурии и иммунологического ответа на IST.
Когорта 2 включает примерно 10 пациентов с aMN, которым требуется IST 2-й или 3-й линии, которые иммунологически не ответили на последнюю предшествующую линию терапии и, таким образом, считаются рефрактерными.
Неудача при предыдущей терапии, т.е. субъект ни разу не достиг снижения титров антител к PLA2R в сыворотке крови до уровня ниже 20 RU/мл в ходе или после завершения признанной IST, включающей CSA, такролимус, MMF, АСТН, или алкилирующие средства (например циклофосфамид), или ритуксимаб, определенная через по меньшей мере 6 месяцев после начала терапии.
Критериями исключения как для когорты 1, так и для когорты 2 являются активная инфекция, вторичная причина MN (например, SLE, лекарственные препараты, злокачественные новообразования), сахарный диабет 1 или 2 типа, беременность или кормление грудью, известная или предполагаемая гиперчувствительность к исследуемым лекарственным средствам и их вспомогательным веществам.
Лечение с помощью MOR202 в качестве монотерапии двух когорт представляет собой фазу лечения, длящуюся более 24 недель, после чего следует фаза последующего наблюдения, длящаяся 28 недель (фигура 11).
5.2. Введение MOR202 (MOR03087)
MOR202 поставляется в виде лиофилизированного порошка для восстановления в стеклянных флаконах с этикетками. MOR202 необходимо хранить при 2-8°С до применения. Для получения лекарственного средства каждый флакон необходимо восстановить с помощью 4,8 мл воды для инъекций (WFI). После восстановления каждый флакон содержит 325 мг MOR202 (MOR03087) в экстрагируемом объеме, составляющем 5 мл (65 мг/мл). Для инфузии его будут разбавлять в 250 мл 0,9% раствора хлорида натрия.
Все субъекты будут подвергаться лечению в течение 24 недель при распределении на шесть 28-дневных циклов лечения. Всего будет введено 9 доз MOR202 в следующие дни лечения: цикл 1, день 1, 8, 15 и 22, и в день 1 циклов 2-6 (фигура 11). В первом цикле лечения MOR202 будут вводить в дозе 16 мг/кг один раз в неделю (т.е. всего 4 дозы в течение цикла 1). В циклах лечения 2-6 MOR202 будут вводить в дозе 16 мг/кг один раз в 4 недели в первый день каждого цикла (т.е. C2D1, C3D1,…; всего 5 доз в течение циклов 2-6).
Первая внутривенная инфузия MOR202 будет медленной (примерно 90 минут, приблизительно 3 мл/мин). Если реакции на инфузию не возникают, время инфузии может быть сокращено до 1 часа или меньше при последующих инфузиях, но ограничено этапами сокращения, указанными в таблице 5. Время инфузии не должно быть короче 30 минут.Рекомендуется премедикация субъектов антигистаминными и жаропонижающими лекарственными средствами (например парацетамолом/ацетаминофеном) в качестве профилактики реакций, связанных с инфузией (IRR). Применение сопутствующего препарата для профилактики IRR посредством внутривенного введения дексаметазона (или эквивалентных глюкокортикоидов, вводимых внутривенно) примерно за 30 минут до начала инфузии MOR202 является обязательным для первых 3 применений, как указано в таблице 5.
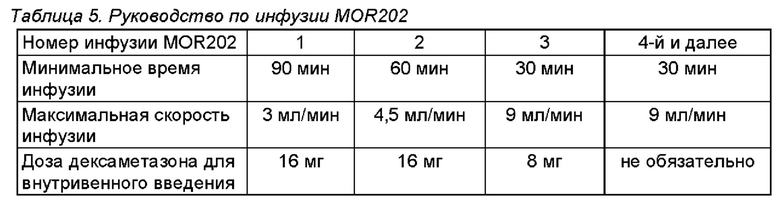
5.3. Оценка безопасности, иммуногенности и фармакокинетики
Безопасность будет оцениваться с точки зрения физикального обследования, показателей жизнедеятельности, насыщения кислородом, электрокардиограмм, гематологических и биохимических тестов, нежелательных явлений и иммуногенности. Нежелательные явления будут оцениваться в соответствии с NCI СТСАЕ, версия 4.03. Для мониторинга иммуногенности и фармакокинетики в ходе исследования будут оцениваться присутствие антител к MOR202 (антител к лекарственному средству) и значения концентрации MOR202 в сыворотке крови, соответственно, в выбранные моменты времени.
5.4. Оценки эффективности
Основные оценки эффективности включают: (i) уровни антител к PLA2R в сыворотке крови, измеренные посредством ELISA для отслеживания хода иммунологического ответа до, в ходе и после терапии с помощью MOR202. (ii) Протеинурия на основании UPCR мочи, собранной в течение 24 ч/разовой порции мочи, измеренная в ходе и после терапии с помощью MOR202. (iii) Функция почек, определенная до, в ходе и после терапии с помощью MOR202 посредством оценки скорости клубочковой фильтрации (eGFR) на основании уравнения CKD-epi. (iV) Экскреция натрия с мочой, определенная в моче, собранной в течение 24 ч.
5.5. Биомаркер
Присутствие и титр антител к PLA2R в выбранные моменты времени (т.е. кинетика титров антител к PLA2R) будут определяться для всех субъектов в ходе исследования. Необязательно, в выбранные моменты времени можно подвергать мониторингу титры дополнительных аутоантител (например, антител к тромбоспондину типа 1, содержащему домен 7А, антител к THSD7A), антител к столбнячному анатоксину и/или антител к EBV. Значения концентрации общих IgG, IgA и IgM в сыворотке крови можно оценить посредством ELISA. Количественное определение NK-клеток, В-клеток, Т-клеток (включая регуляторные Т-клетки), плазмобластов, количеств плазматических клеток в выбранные моменты времени можно определить посредством цитометрии периферического кровотока или анализов ELISPOT.
5.6. KDQOL-36
Для оценки качества жизни (QoL) используется определение качества жизни при заболеваниях почек (KDQOL-36™), определяемое как изменение показателя по сравнению с исходным уровнем у пациентов с аутоиммунной мембранозной нефропатией, подвергавшихся лечению с помощью MOR202.
Пример 6. Определение уровней антител к PLA2R
Уровни антител к рецептору фосфолипазы А2 (PLA2R) в образцах сыворотки крови человека будут определяться количественно посредством моноспецифического ELISA (иммуноферментный анализ с одним антигеном, Euroimmune, номер для заказа ЕА 1254-G) в соответствии с инструкциями производителя. Вкратце, полистироловый микропланшет из соединенных в ряд пробирок, покрытый очищенными антигенами PLA2R, используется в качестве твердой фазы. Будут получать разбавления сыворотки крови, составляющие 1:101, и инкубировать с антигеном, связанным с лунками микропланшета. Если образец положительный, специфические антитела в разбавленном образце сыворотки крови взаимодействуют с антигеном PLA2R, связанным с твердой фазой. Несвязавшиеся антитела вымываются и на следующей стадии провзаимодействовавшие антитела, специфические в отношении PLA2R, выявляются с помощью меченых пероксидазой антител к человеческому IgG. Связанные антитела становятся видимыми с применением раствора хромоген/субстрат, который способен стимулировать цветную реакцию. Интенсивность полученного окрашивания пропорциональна концентрации антител в образце сыворотки крови.
--->
ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> MORPHOSYS AG
<120> АНТИТЕЛА К CD38 И ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ НА ИХ ОСНОВЕ ДЛЯ
ЛЕЧЕНИЯ АУТОИММУННОГО ЗАБОЛЕВАНИЯ, ОПОСРЕДОВАННОГО АУТОАНТИТЕЛАМИ
<130> MS289PCT
<140>
<141>
<160> 11
<170> PatentIn версия 3.5
<210> 1
<211> 5
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический пептид"
<400> 1
Ser Tyr Tyr Met Asn
1 5
<210> 2
<211> 17
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический пептид"
<400> 2
Gly Ile Ser Gly Asp Pro Ser Asn Thr Tyr Tyr Ala Asp Ser Val Lys
1 5 10 15
Gly
<210> 3
<211> 11
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический пептид"
<400> 3
Asp Leu Pro Leu Val Tyr Thr Gly Phe Ala Tyr
1 5 10
<210> 4
<211> 11
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический пептид"
<400> 4
Ser Gly Asp Asn Leu Arg His Tyr Tyr Val Tyr
1 5 10
<210> 5
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический пептид"
<400> 5
Gly Asp Ser Lys Arg Pro Ser
1 5
<210> 6
<211> 9
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический пептид"
<400> 6
Gln Thr Tyr Thr Gly Gly Ala Ser Leu
1 5
<210> 7
<211> 120
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 7
Gln Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Tyr Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Gly Ile Ser Gly Asp Pro Ser Asn Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Asp Leu Pro Leu Val Tyr Thr Gly Phe Ala Tyr Trp Gly Gln
100 105 110
Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 8
<211> 109
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 8
Asp Ile Glu Leu Thr Gln Pro Pro Ser Val Ser Val Ala Pro Gly Gln
1 5 10 15
Thr Ala Arg Ile Ser Cys Ser Gly Asp Asn Leu Arg His Tyr Tyr Val
20 25 30
Tyr Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Val Leu Val Ile Tyr
35 40 45
Gly Asp Ser Lys Arg Pro Ser Gly Ile Pro Glu Arg Phe Ser Gly Ser
50 55 60
Asn Ser Gly Asn Thr Ala Thr Leu Thr Ile Ser Gly Thr Gln Ala Glu
65 70 75 80
Asp Glu Ala Asp Tyr Tyr Cys Gln Thr Tyr Thr Gly Gly Ala Ser Leu
85 90 95
Val Phe Gly Gly Gly Thr Lys Leu Thr Val Leu Gly Gln
100 105
<210> 9
<211> 300
<212> БЕЛОК
<213> Homo sapiens
<400> 9
Met Ala Asn Cys Glu Phe Ser Pro Val Ser Gly Asp Lys Pro Cys Cys
1 5 10 15
Arg Leu Ser Arg Arg Ala Gln Leu Cys Leu Gly Val Ser Ile Leu Val
20 25 30
Leu Ile Leu Val Val Val Leu Ala Val Val Val Pro Arg Trp Arg Gln
35 40 45
Gln Trp Ser Gly Pro Gly Thr Thr Lys Arg Phe Pro Glu Thr Val Leu
50 55 60
Ala Arg Cys Val Lys Tyr Thr Glu Ile His Pro Glu Met Arg His Val
65 70 75 80
Asp Cys Gln Ser Val Trp Asp Ala Phe Lys Gly Ala Phe Ile Ser Lys
85 90 95
His Pro Cys Asn Ile Thr Glu Glu Asp Tyr Gln Pro Leu Met Lys Leu
100 105 110
Gly Thr Gln Thr Val Pro Cys Asn Lys Ile Leu Leu Trp Ser Arg Ile
115 120 125
Lys Asp Leu Ala His Gln Phe Thr Gln Val Gln Arg Asp Met Phe Thr
130 135 140
Leu Glu Asp Thr Leu Leu Gly Tyr Leu Ala Asp Asp Leu Thr Trp Cys
145 150 155 160
Gly Glu Phe Asn Thr Ser Lys Ile Asn Tyr Gln Ser Cys Pro Asp Trp
165 170 175
Arg Lys Asp Cys Ser Asn Asn Pro Val Ser Val Phe Trp Lys Thr Val
180 185 190
Ser Arg Arg Phe Ala Glu Ala Ala Cys Asp Val Val His Val Met Leu
195 200 205
Asn Gly Ser Arg Ser Lys Ile Phe Asp Lys Asn Ser Thr Phe Gly Ser
210 215 220
Val Glu Val His Asn Leu Gln Pro Glu Lys Val Gln Thr Leu Glu Ala
225 230 235 240
Trp Val Ile His Gly Gly Arg Glu Asp Ser Arg Asp Leu Cys Gln Asp
245 250 255
Pro Thr Ile Lys Glu Leu Glu Ser Ile Ile Ser Lys Arg Asn Ile Gln
260 265 270
Phe Ser Cys Lys Asn Ile Tyr Arg Pro Asp Lys Phe Leu Gln Cys Val
275 280 285
Lys Asn Pro Glu Asp Ser Ser Cys Thr Ser Glu Ile
290 295 300
<210> 10
<211> 360
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полинуклеотид"
<400> 10
caggtgcaat tggtggaaag cggcggcggc ctggtgcaac cgggcggcag cctgcgtctg
60
agctgcgcgg cctccggatt taccttttct tcttattata tgaattgggt gcgccaagcc
120
cctgggaagg gtctcgagtg ggtgagcggt atctctggtg atcctagcaa tacctattat
180
gcggatagcg tgaaaggccg ttttaccatt tcacgtgata attcgaaaaa caccctgtat
240
ctgcaaatga acagcctgcg tgcggaagat acggccgtgt attattgcgc gcgtgatctt
300
cctcttgttt atactggttt tgcttattgg ggccaaggca ccctggtgac ggttagctca
360
<210> 11
<211> 327
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полинуклеотид"
<400> 11
gatatcgaac tgacccagcc gccttcagtg agcgttgcac caggtcagac cgcgcgtatc
60
tcgtgtagcg gcgataatct tcgtcattat tatgtttatt ggtaccagca gaaacccggg
120
caggcgccag ttcttgtgat ttatggtgat tctaagcgtc cctcaggcat cccggaacgc
180
tttagcggat ccaacagcgg caacaccgcg accctgacca ttagcggcac tcaggcggaa
240
gacgaagcgg attattattg ccagacttat actggtggtg cttctcttgt gtttggcggc
300
ggcacgaagt taaccgttct tggccag
327
<---
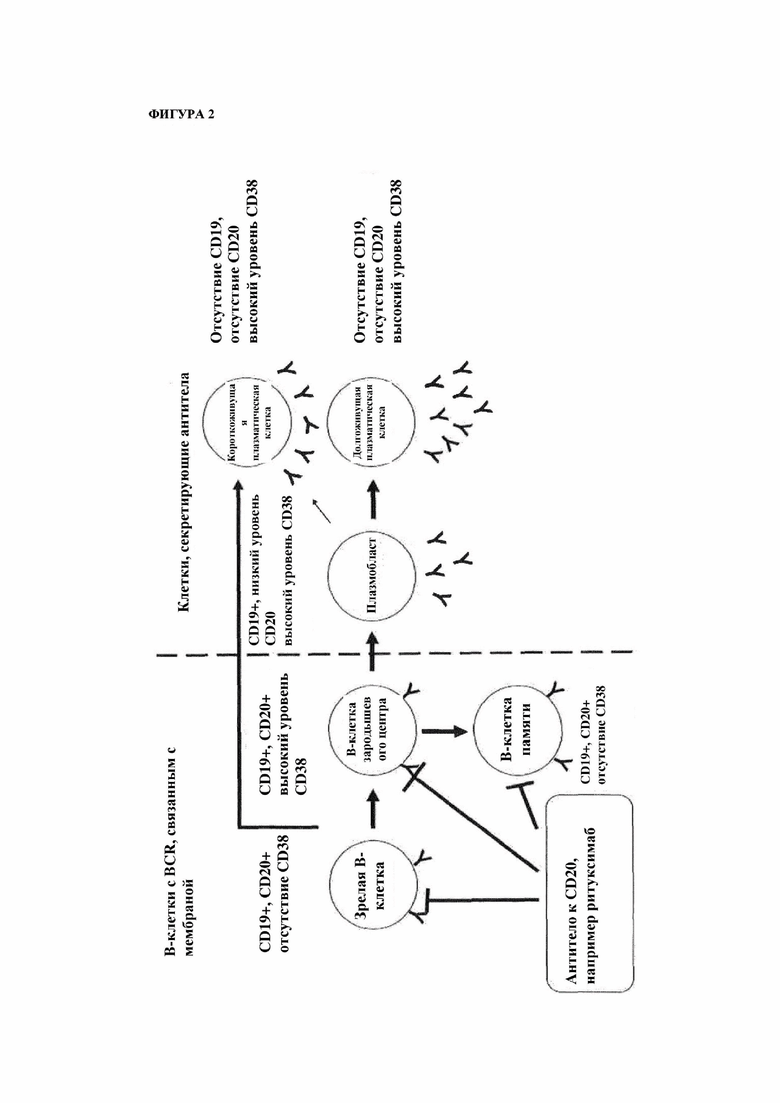
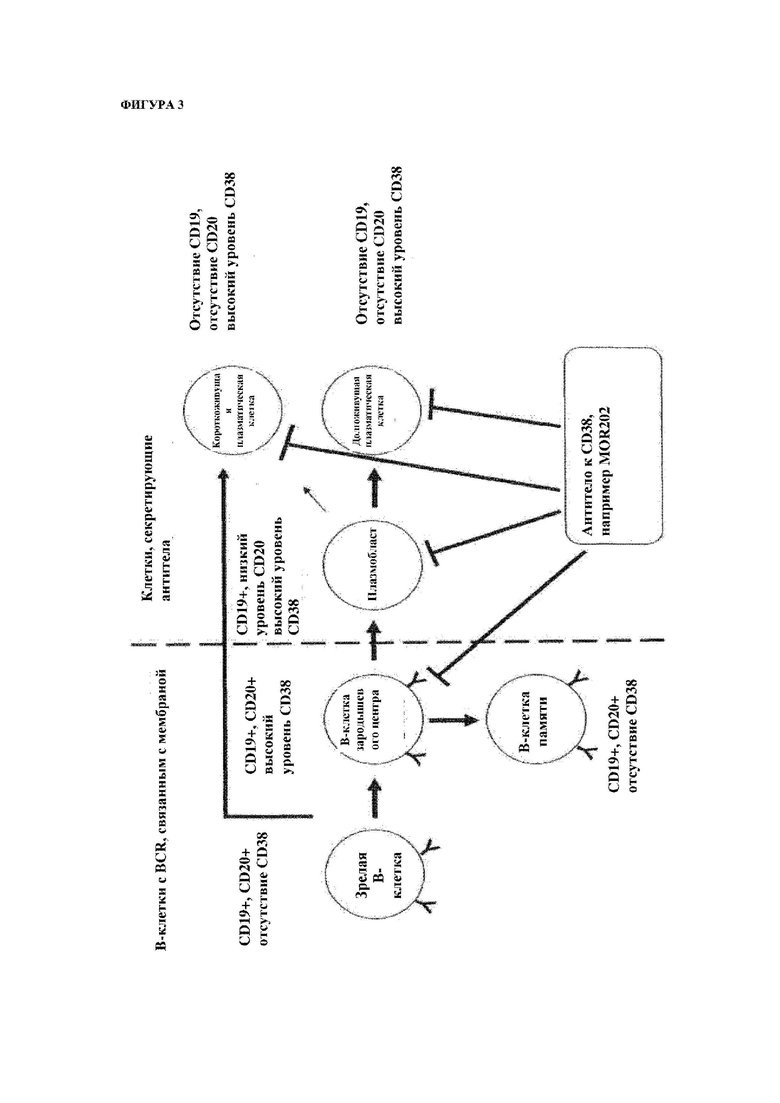
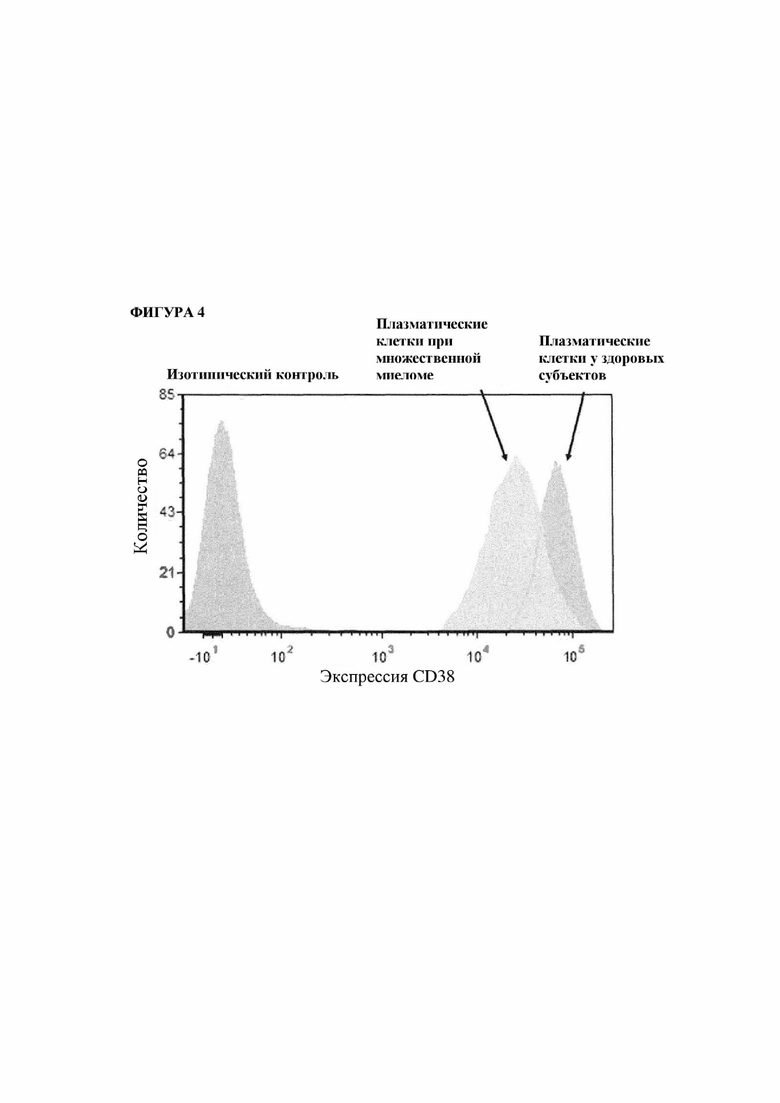
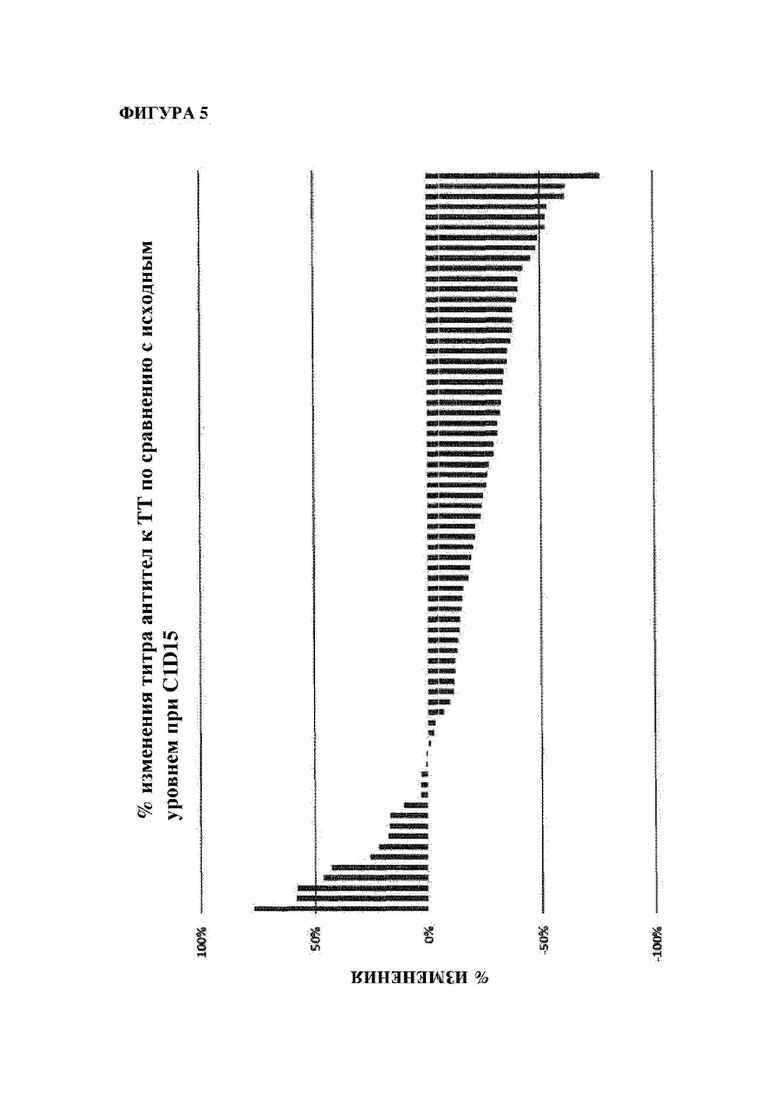
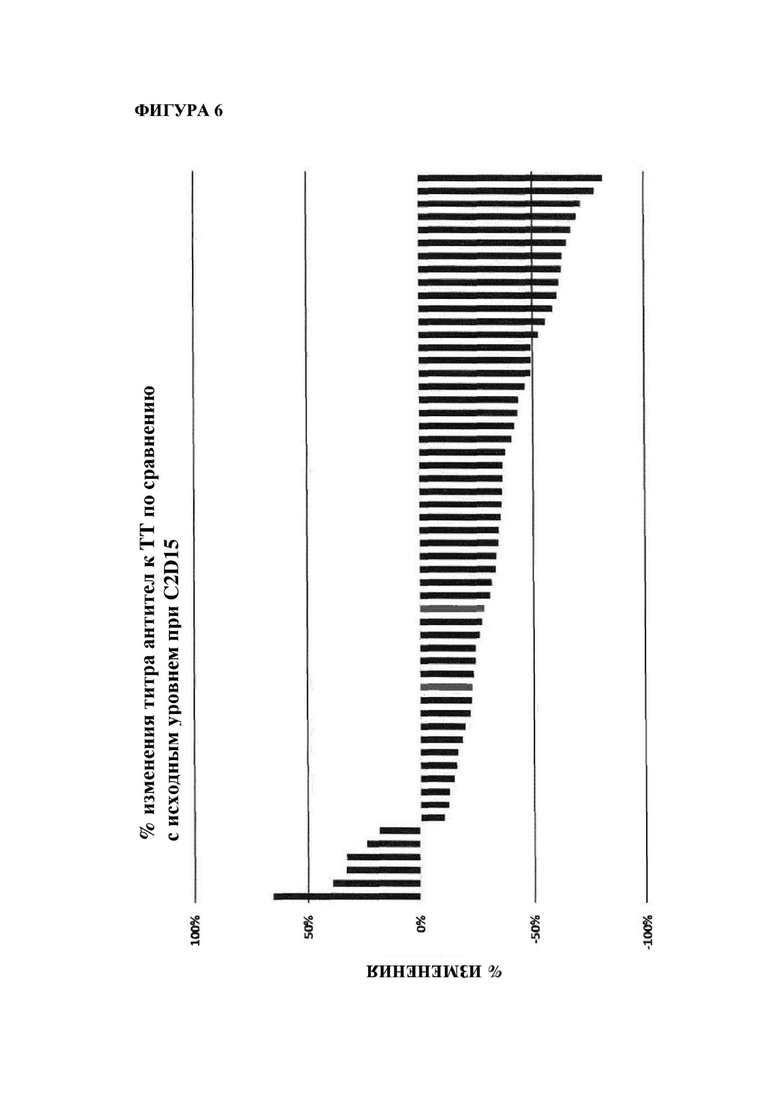
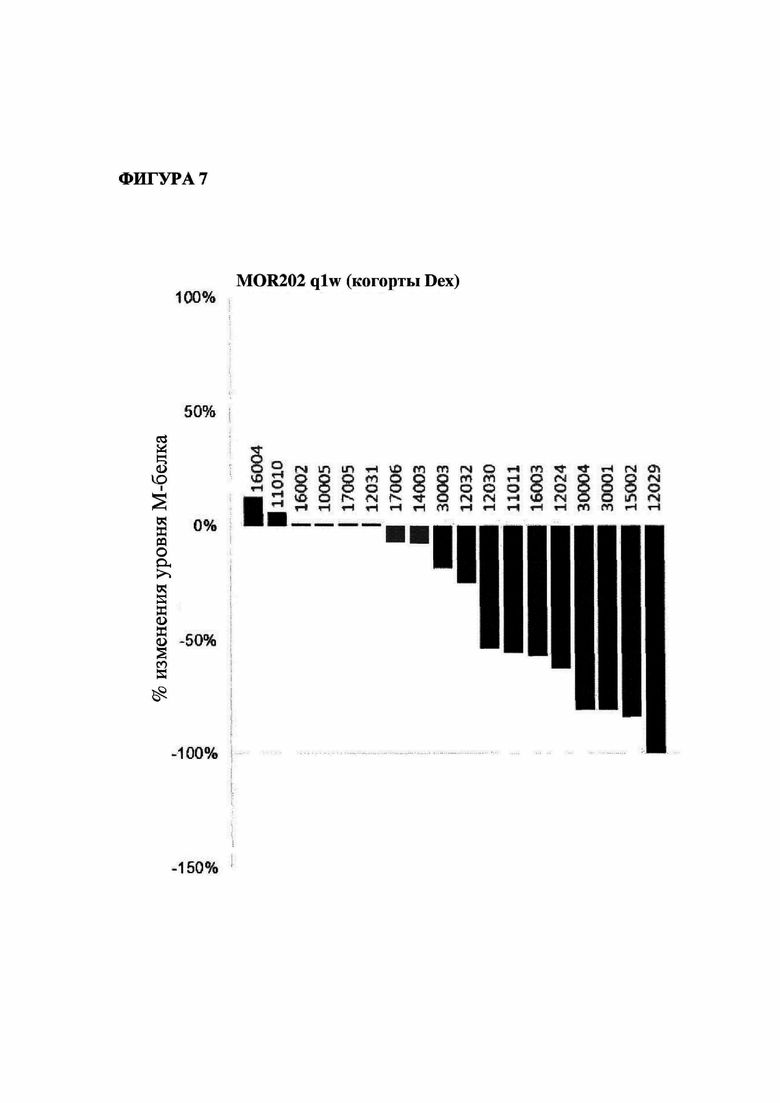
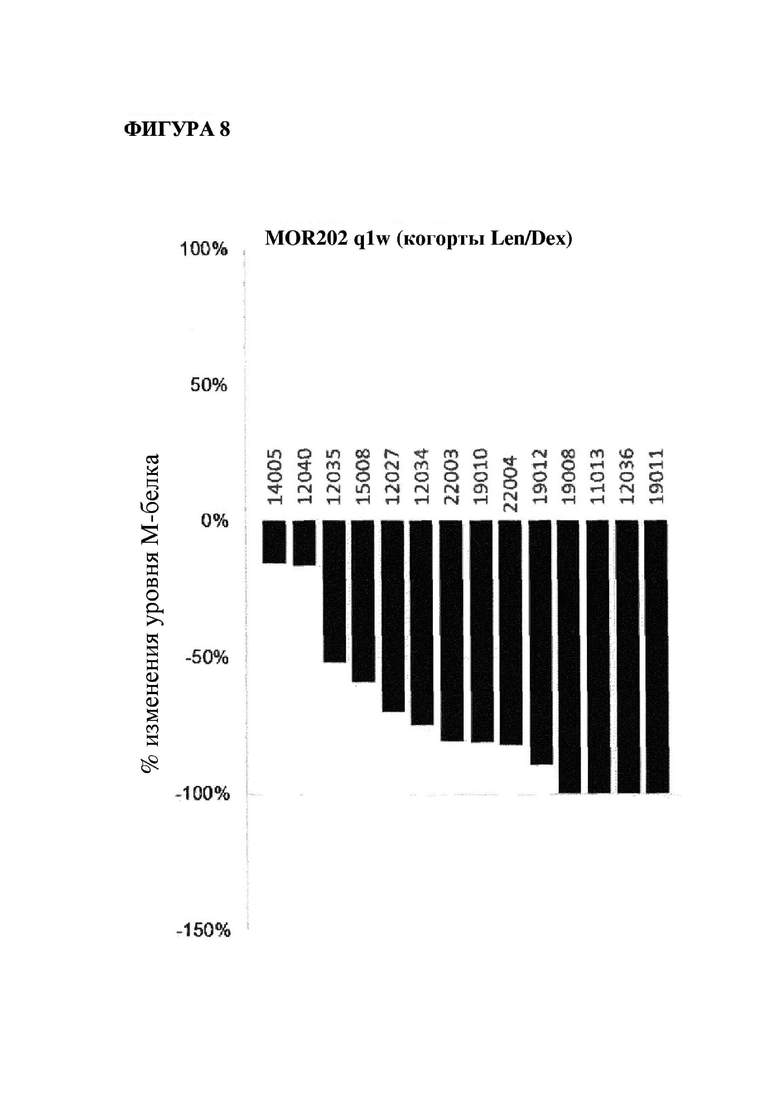
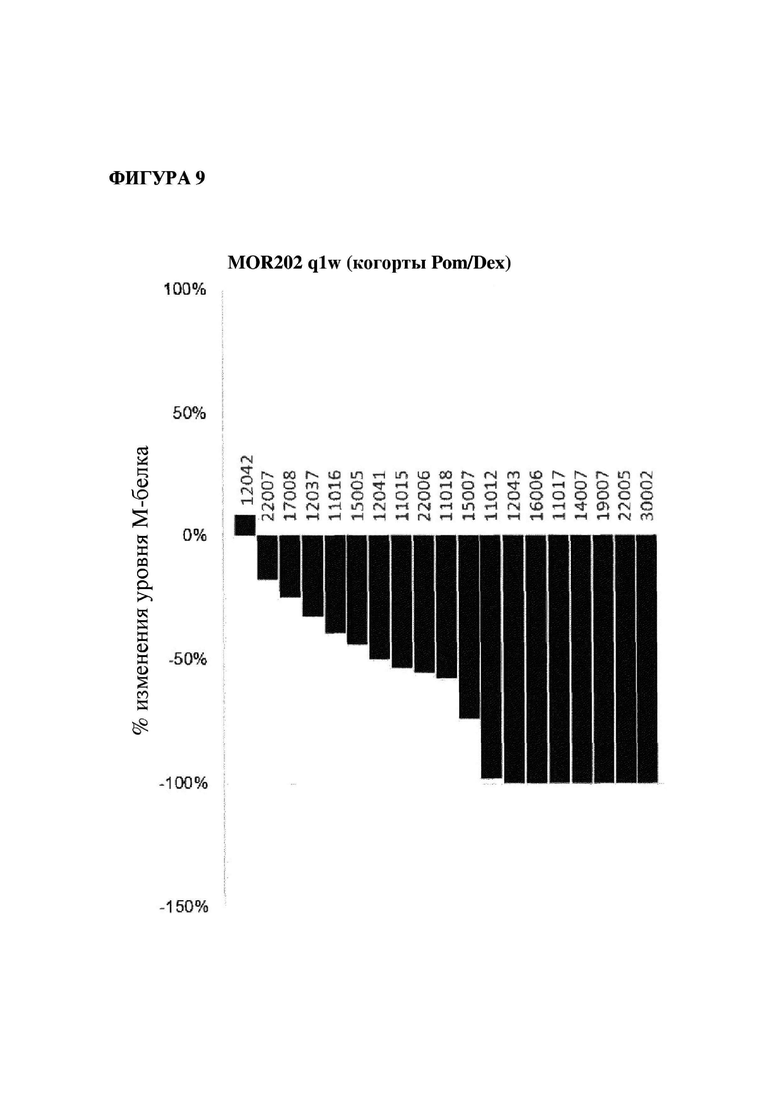
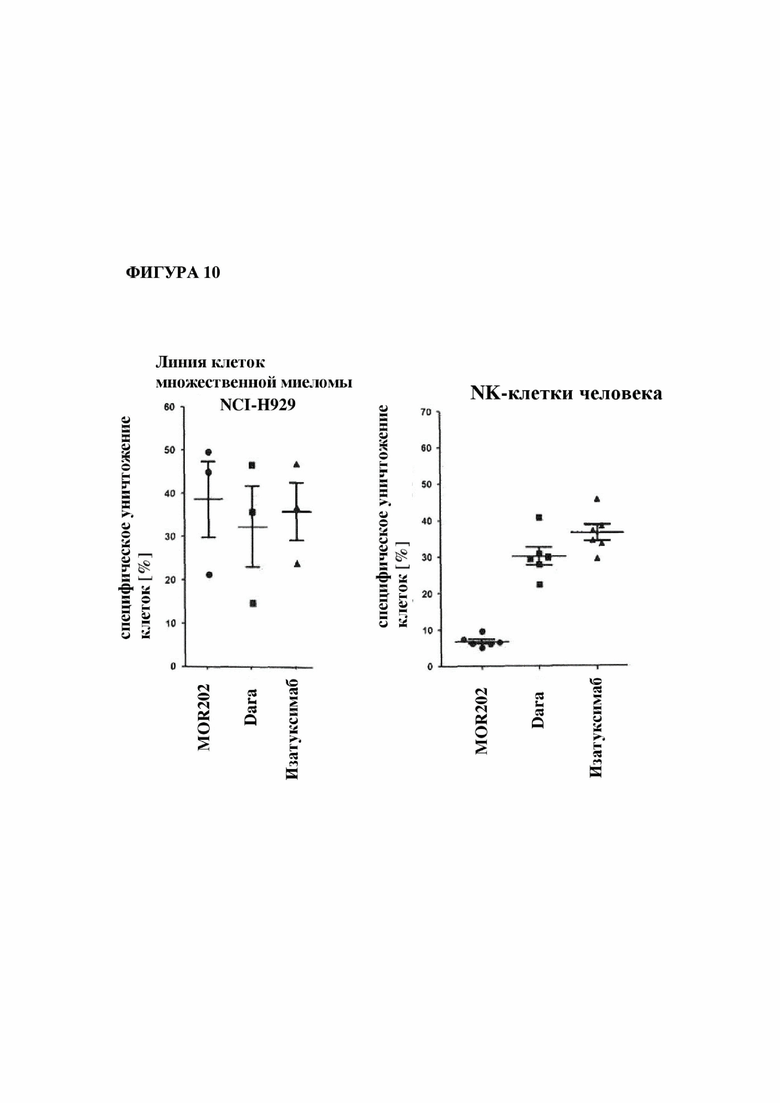
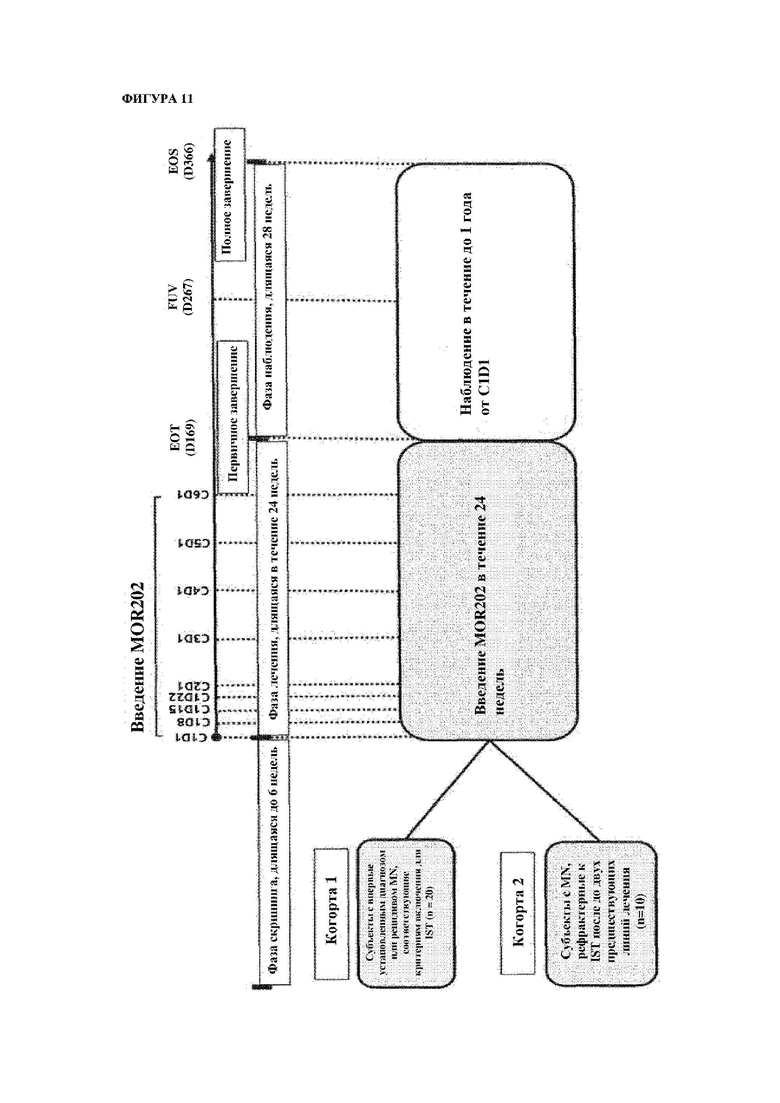
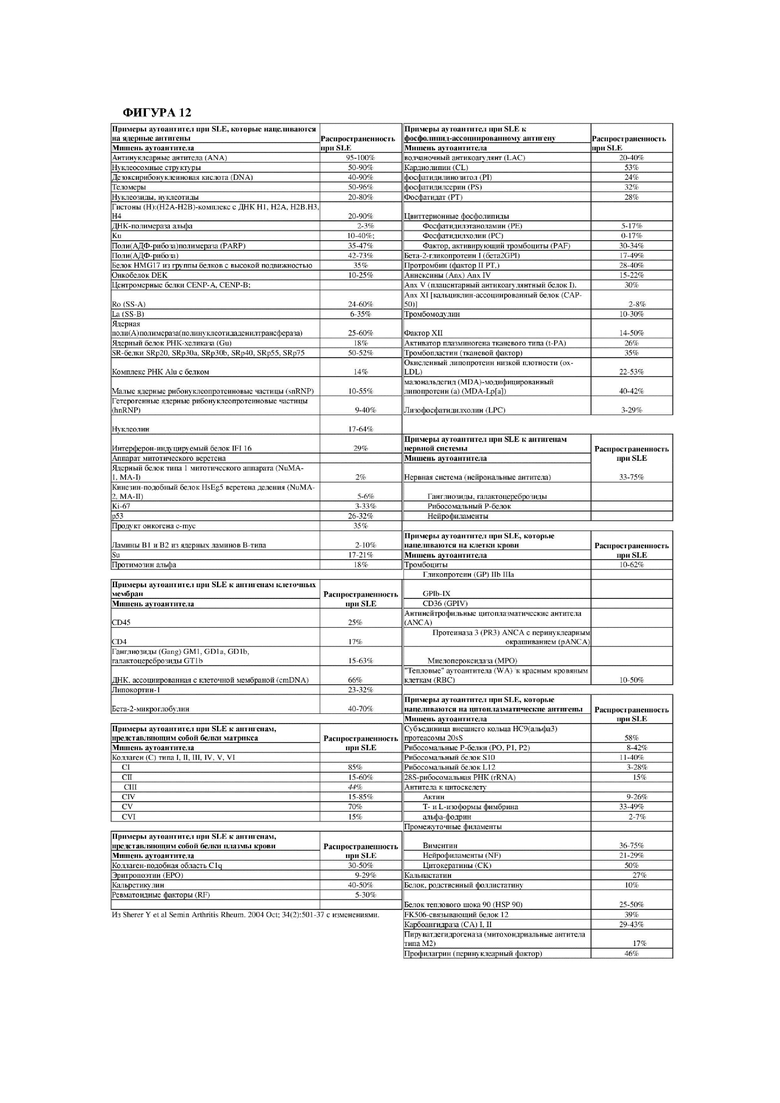
Настоящее изобретение относится к биотехнологии. Раскрыто применение антитела или фрагмента антитела, специфических в отношении CD38, в профилактике или лечении аутоиммунного заболевания, опосредованного аутоантителами. Изобретение является эффективным в лечении мембранозной нефропатии. 13 з.п. ф-лы, 12 ил., 5 табл., 6 пр.
1. Применение антитела или фрагмента антитела, специфических в отношении CD38, в лечении мембранозной нефропатии, опосредованной аутоантителами, где антитело содержит область HCDR1 аминокислотной последовательности под SEQ ID NO: 1, область HCDR2 аминокислотной последовательности под SEQ ID NO: 2, область HCDR3 аминокислотной последовательности под SEQ ID NO: 3 и область LCDR1 аминокислотной последовательности под SEQ ID NO: 4, область LCDR2 аминокислотной последовательности под SEQ ID NO: 5 и область LCDR3 аминокислотной последовательности под SEQ ID NO: 6.
2. Применение по п. 1, где мембранозная нефропатия, опосредованная аутоантителами, представляет собой мембранозную нефропатию, положительную в отношении антител к PLA2R и/или антител к THSD7A.
3. Применение по любому из предыдущих пунктов, где антитело или фрагмент антитела обеспечивает истощение плазматических клеток посредством ADCC и/или ADCP.
4. Применение по любому из предыдущих пунктов, где антитело или фрагмент антитела демонстрирует значительно более высокоспецифическое уничтожение клеток в отношении плазматических клеток, чем в отношении клеток с низким уровнем экспрессии CD38.
5. Применение по любому из предыдущих пунктов, где введение антитела или фрагмента антитела приводит к снижению титров эндогенных аутоантител.
6. Применение по п. 5, где указанные титры эндогенных аутоантител включают аутоантитела к PLA2R и/или к THSD7A.
7. Применение по любому из предыдущих пунктов, где указанные антитело или фрагмент антитела, специфические в отношении CD38, представляют собой человеческое антитело.
8. Применение по любому из предыдущих пунктов, где указанные антитело или фрагмент антитела, специфические в отношении CD38, представляют собой IgG1.
9. Применение по любому из предыдущих пунктов, где указанные антитело или фрагмент антитела, специфические в отношении CD38, содержат вариабельную область тяжелой цепи под SEQ ID NO: 7 и вариабельную область легкой цепи под SEQ ID NO: 8.
10. Применение по любому из предыдущих пунктов, где указанные антитело или фрагмент антитела применяют в комбинации с дополнительным терапевтическим средством.
11. Применение по п. 10, где дополнительное терапевтическое средство представляет собой средство для профилактики и/или лечения аутоиммунного заболевания, опосредованного аутоантителами.
12. Применение по п. 11, где дополнительное терапевтическое средство представляет собой иммуносупрессивное лекарственное средство, такое как дексаметазон, азатиоприн, микофеноловая кислота, метотрексат или ингибитор протеасом, такой как бортезомиб.
13. Применение по любому из предыдущих пунктов, где антитело или фрагмент антитела вводятся внутривенно.
14. Применение по любому из предыдущих пунктов, где антитело или фрагмент антитела будут вводиться в первом цикле лечения в дозе, составляющей 16 мг/кг, один раз в неделю.
| LAURENCE H | |||
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| Машина для добывания торфа и т.п. | 1922 |
|
SU22A1 |
| Топка с несколькими решетками для твердого топлива | 1918 |
|
SU8A1 |
| Насос для откачивания жидкости из буровых скважин | 1923 |
|
SU1543A1 |
| PIERO RUGGENENTI ET AL.: "Treatment of membranous nephropathy: time for a paradigm shift", NATURE REVIEWS | |||
| NEPHROLOGY, vol | |||
| Насос | 1917 |
|
SU13A1 |
Авторы
Даты
2023-12-13—Публикация
2020-03-13—Подача