УРОВЕНЬ ТЕХНИКИ
[0001] Аутоиммунные заболевания, которые возникают при выработке иммунной системой организма аутоантител, к сожалению, широко распространены. Например, согласно оценкам, от аутоиммунных заболеваний страдают свыше 23 миллионов американцев. В настоящее время известно более 80 аутоиммунных заболеваний. Конкретные примеры аутоиммунных заболеваний включают системную красную волчанку, миозит, первичный синдром Шегрена, рассеянный склероз, увеит, псориаз и ревматоидный артрит.
[0002] Системная красная волчанка (SLE) характеризуется болью в суставах, опуханием лимфатических узлов и появлением сыпи в форме бабочки на щеках. При SLE аутоантитела против здоровых тканей, вырабатываемые иммунной системой пациента, атакуют их, что приводит к возникновению воспаления. На клеточном уровне у пациентов с SLE имеются аутореактивные Т- и В-клетки, управляемые дендритными клетками (Palucka A.K. et al. Immunology and Cell Biology (2002) 80: 484-488). Синдром Шегрена характеризуется системным хроническим воспалением экзокринных органов, что приводит к возникновению дисфункции органов (Holdgate N. and St. Clair E.W., F1000 Research. 1412 10.12688/f1000research.8352.1).
[0003] Рассеянный склероз (MS) характеризуется демиелинизацией нервных клеток в головном и спинном мозге и воспалением центральной нервной системы (CNS). Псориаз представляет собой аутоиммунное заболевание, которое проявляется в виде красных зудящих участков кожи. Ревматоидный артрит (RA) представляет собой воспалительное нарушение синовиальной ткани сустава, характеризующееся стойким синовитом и разрушением хрящевой и костной ткани сустава. Повреждение может прогрессировать, влияя на многочисленные системы организма. Волчаночный нефрит связан с системной красной волчанкой и приводит к развитию воспаления почек. При воспалении почки пропускают белок и в конечном итоге может развиться их недостаточность. Увеит представляет собой группу воспалительных заболеваний, при которых происходит поражение и, возможно, разрушение тканей глаза, что приводит к потере зрения.
[0004] Кроме того, острые и хронические провоспалительные состояния были ассоциированы с множеством заболеваний у людей и могут быть причиной их развития. Конкретные примеры заболеваний, которые, как полагают, связаны с хроническим воспалением, включают диабет 1-го типа и 2-го типа, хроническое заболевание почек (CKD), в том числе, например, CKD, развившееся на фоне диабета, диабетической нефропатии и высокого кровяного давления; атеросклероз, болезнь Альцгеймера, рак и ассоциированные осложнения таких заболеваний, в том числе заболевание сердца, гипертония, анемия, перикардит, почечная остеодистрофия и другие. Аналогично аутоиммунным заболеваниям при заболеваниях, ассоциированных с хроническим воспалением, организм, по-видимому, осуществляет избыточную продолжительную провоспалительную реакцию, что может привести к развитию истощающих и зачастую летальных сопутствующих заболеваний.
[0005] Причины возникновения аутоиммунных заболеваний не достаточно хорошо изучены. С точки зрения механизма в основе каждого аутоиммунного заболевания лежит продолжающаяся аутоиммунная реакция, которая стимулируется (и/или не подавляется) сложными регуляторными системами, которые постоянно восполняют количество аутореактивных иммунных клеток. Схожий механизм, по-видимому, имеет место и при не относящихся к аутоиммунным хронических воспалительных заболеваниях. По этой причине терапевтические вмешательства при аутоиммунных заболеваниях и при хроническом воспалении направлены на множество регуляторных систем, сигнальных каскадов и их составных компонентов.
[0006] Один класс предполагаемых терапевтических мишеней включает рецепторные тирозинкиназы (TKR), которые являются трансмембранными рецепторами, связывающими различные факторы роста и белки, с регулированием клеточного гомеостаза. Более пятидесяти известных человеческих TKR подразделяют на 20 различных классов, определяемых их генетической филогенией (Robins D.R., et al. Oncogene. (2000) 19: 5548-5557; Lemmon M.A., and Schlessinger J. Cell. (2010) 141: 1117-1134). TKR III класса характеризуются наличием от пяти до семи иммуноглобулиноподобных доменов во внеклеточном участке, содержащем от 70 до 100 гидрофильных остатков. Среди TKR III класса подобная продукту протоонкогена вируса саркомы кошек штамма McDonough (FMS) рецепторная тирозинкиназа 3 (FLT3) представляет собой мембраносвязанный рецептор, экспрессируемый на стволовых клетках человека, гемопоэтических клетках-предшественниках, дендритных клетках, активированных T- и B-клетках, моноцитах и клетках микроглии. FLT3 связывает лиганд FLT3 (FLT3L), представляющий собой гематопоэтический цитокин, экспрессируемый множеством типов клеток, в том числе активированными Т-клетками, активированным эндотелием и стромальными клетками костного мозга. FLT3L экспрессируется как на поверхности клетки, так и в виде секретируемого гомодимера и передает сигналы посредством своего когнатного рецептора, представляющего собой FLT3. FLT3 экспрессируется на клеточной поверхности в виде мономера и активируется при лигировании с FLT3L. После лигирования с FLT3L FLT3 подвергается димеризации, аутофосфорилированию и активирует сигнальные пути, в том числе RAS/регулируемую внеклеточными сигналами киназу (ERK), фосфатидилинозитид-3-киназу (PI3K) и переносчики сигнала и активаторы транскрипции (STAT) 3 и 5. После аутофосфорилирования димеризованный FLT3 интернализируется и разрушается.
[0007] FLT3L вырабатывается в ответ на воспалительные сигналы, в частности на следующие цитокины с γ-цепью: IL-2, IL-7 и IL-15, а его взаимодействие с FLT3 запускает воспалительный процесс главным образом за счет его роли в дифференцировке, пролиферации и выживании DC. Также предполагается роль передачи сигналов с участием FLT3 в выживании Т- и В-клеток после активации, при этом сообщается, что оба типа клеток временно повышают экспрессию данного рецептора (Astier AL et al., J. Immunology. 2010 v184: 685-93 и Tobon et al. Arthritis & Rheumatism. 2010; 62(11): 3447-56). Кроме того, полагают, что выживаемость NK-клетки опосредованно зависит от FLT3L ввиду ее потребности в IL-15, происходящем из DC, хотя это наблюдение основано на данных, полученных на мышах (Guimond M et al., J. Immunology 2010; 184: 2769-75), и еще не было продемонстрировано у людей.
[0008] DC представляют особый интерес при воспалении, поскольку они являются стражами иммунной системы, мигрирующими из места воспаления в лимфатический узел и инициирующими адаптивный иммунный ответ, который, в конечном итоге, необходим для развития аутоиммунного заболевания. В общих чертах, существует две субпопуляции DC: миелоидные/классические дендритные клетки (cDC) и плазмоцитоидные дендритные клетки (pDC). cDC вырабатывают воспалительные цитокины (например, IFNI-III, IL-23, IL-12, IL-6 и IL-1β), презентируют антиген Т-клеткам в контексте костимуляции и секретируют хемокины, которые рекрутируют клетки в место воспаления и обеспечивают их совместную локализацию, необходимую для важных межклеточных взаимодействий. Посредством этих механизмов клетки cDC стимулируют нейтрофилы, B-клетки, T-клетки и NK-клетки, что приводит к нетозу, выработке аутоантител, выработке IL-17 и дополнительной выработке воспалительных цитокинов. pDC являются основным источником IFN I типа, представляющего собой ключевой цитокин в развитии врожденного ответа, который усиливает активацию всех веток иммунной системы.
[0009] Слюнные железы пациентов с синдромом Шегрена характеризуются экспрессией FLT3 и FLT3L на инфильтрирующих В-клетках (Tobon et al. Arthritis & Rheumatism. (2010) 62(11): 3447-3456). Кроме того, пациенты с синдромом Шегрена характеризуются повышенной частотой встречаемости B-клеток, экспрессирующих FLT3, в кровотоке, и их выживаемость повышается при совместном культивировании с экспрессирующими FLT3L клетками слюнных желез человека. У индивидуумов с MS белок FLT3 экспрессируется в хронических и активных очагах поражения, а также в сером и белом веществе (DeBoy C.A. et al. Exp Mol Pathol. (2010); 89(2): 109-116). Кроме того, FLT3 совместно локализуется с незрелыми DC в периваскулярном пространстве головного мозга, что свидетельствует об инфильтрации FLT3-положительных DC в головной мозг индивидуумов с MS (Deboy et al.). При RA уровни FLT3L в синовиальной жидкости повышены по сравнению со здоровыми индивидуумами. Вдобавок, моноциты, NK-клетки и DC от пациентов с RA характеризуются высоким уровнем экспрессии FLT3L (Ramos M. et al. Arthritis Res Ther. (2013) 15(6): R209).
[0010] Более того, сообщалось о повышенных уровнях FLT3L в сыворотке крови и в месте воспаления при SLE, миозите, первичном синдроме Шегрена, MS, увеите и RA (Andersson et al. PLoS One (2012) 7: e47668; DeBoy et al. Exp and Mol Path (2010) 89: 109-16).
[0011] Следовательно, хотя FLT3-опосредованное провоспалительное выживание (например, с участием pDC и mDC) является эффективным физиологическим ответом у здоровых людей, оно, вероятно, оказывает отрицательные эффекты при аутоиммунных заболеваниях. Таким образом, нарушение или ослабление функционирования сигнального пути FLT3/FLT3L может оказаться важным инструментом для борьбы с аутоиммунными заболеваниями и другими воспалительными заболеваниями, а также для уменьшения воспаления.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
[0012] В данном документе предусмотрены новые связывающие FLT3L антитела для осуществления контроля аутоиммунных заболеваний и других острых и/или хронических воспалительных заболеваний.
[0013] В первом аспекте в настоящем изобретении предусмотрено выделенное антитело или его антигенсвязывающий фрагмент, которые специфически связываются с FLT3L, содержащие группу определяющих комплементарность областей (CDR): HCDR1, HCDR2, HCDR3, LCDR1, LCDR2 и LCDR3, где HCDR1, HCDR2, HCDR3, LCDR1, LCDR2 и LCDR3 содержат аминокислотные последовательности: (a) под SEQ ID NO: 29, 30, 31, 32, 33 и 34 соответственно; или (b) под SEQ ID NO: 29, 30, 31, 35, 33 и 34 соответственно; или (c) под SEQ ID NO: 29, 36, 37, 32, 33 и 38 соответственно.
[0014] В одном варианте осуществления первого аспекта выделенное антитело или его антигенсвязывающий фрагмент предусматривают вариабельную область тяжелой цепи (VH) и вариабельную область легкой цепи (VL), характеризующиеся по меньшей мере 95%, 96%, 97%, 98% или 99% идентичностью последовательности с: (a) SEQ ID NO: 1 и SEQ ID NO: 2 соответственно; или (b) SEQ ID NO: 3 и SEQ ID NO: 4 соответственно; или (c) SEQ ID NO: 5 и SEQ ID NO: 6 соответственно. В другом варианте осуществления VH и VL предусматривают (a) SEQ ID NO: 1 и SEQ ID NO: 2 соответственно; или (b) SEQ ID NO: 3 и SEQ ID NO: 4 соответственно; или (c) SEQ ID NO: 5 и SEQ ID NO: 6 соответственно. В дополнительном варианте осуществления выделенное антитело или антигенсвязывающий фрагмент предусматривают (a) область тяжелой цепи, содержащую SEQ ID NO: 61, и область легкой цепи, содержащую SEQ ID NO: 62; или (b) область тяжелой цепи, содержащую SEQ ID NO: 65, и область легкой цепи, содержащую SEQ ID NO: 66; или (c) область тяжелой цепи, содержащую SEQ ID NO: 69, и область легкой цепи, содержащую SEQ ID NO: 70. В одном варианте осуществления выделенное антитело или его антигенсвязывающий фрагмент подавляют FLT3L-опосредованную активацию FLT3. В другом варианте осуществления выделенное антитело или его антигенсвязывающий фрагмент не вступают в перекрестную реакцию со структурно схожими молекулами-лигандами TKR. В одном варианте осуществления выделенное антитело или его антигенсвязывающий фрагмент не вступают в перекрестную реакцию с по меньшей мере одним из huSCF и huCSF1. В дополнительном варианте осуществления выделенное антитело или его антигенсвязывающий фрагмент не вступают в перекрестную реакцию ни с huSCF, ни с huCSF1. В одном варианте осуществления выделенное антитело или его антигенсвязывающий фрагмент представляют собой моноклональное антитело, рекомбинантное антитело, человеческое антитело, гуманизированное антитело или химерное антитело. В одном варианте осуществления выделенное антитело или антигенсвязывающий фрагмент содержат константный домен тяжелой цепи иммуноглобулина, выбранный из группы, состоящей из: (a) константного домена IgA; (b) константного домена IgD; (c) константного домена IgE; (d) константного домена IgG1; (e) константного домена IgG2; (f) константного домена IgG3; (g) константного домена IgG4 и (h) константного домена IgM. В одном варианте осуществления выделенное антитело или антигенсвязывающий фрагмент содержат константный домен IgG1. В другом варианте осуществления выделенное антитело или антигенсвязывающий фрагмент содержат константный домен легкой цепи иммуноглобулина, выбранный из группы, состоящей из: (a) константного домена каппа-цепи Ig и (b) константного домена лямбда-цепи Ig. В одном варианте осуществления антигенсвязывающий белок содержит константный домен IgG1 человека и константный домен лямбда-цепи человека. В одном варианте осуществления константный домен IgG1 предусматривает одну или несколько аминокислотных замен, выбранных из группы, состоящей из L234F, L235E и P331S, пронумерованных в соответствии с системой нумерации EU согласно Kabat (Edelman et al., Proc. Natl. Acad. Sci., 63:78-85 (1969)).
[0015] Во втором аспекте в настоящем изобретении предусмотрена выделенная молекула нуклеиновой кислоты, кодирующая выделенное антитело или его антигенсвязывающий фрагмент в соответствии с первым аспектом и/или его вариантами осуществления. В одном варианте осуществления второго аспекта молекула нуклеиновой кислоты функционально связана с контролирующей последовательностью.
[0016] В третьем аспекте в настоящем изобретении предусмотрен вектор, содержащий молекулу нуклеиновой кислоты в соответствии со вторым аспектом и/или его вариантами осуществления.
[0017] В четвертом аспекте в настоящем изобретении предусмотрена клетка-хозяин, трансформированная молекулой нуклеиновой кислоты в соответствии со вторым аспектом и/или его вариантами осуществления или вектором в соответствии с третьим аспектом. В одном варианте осуществления клетка-хозяин представляет собой клетку-хозяина млекопитающего. В другом варианте осуществления клетка-хозяин представляет собой клетку HEK293, клетку мышиной миеломы NS0 или клетку яичника китайского хомяка (CHO).
[0018] В пятом аспекте в настоящем изобретении предусмотрена гибридома, продуцирующая антитело или антигенсвязывающий фрагмент согласно любому из предыдущих аспектов или их вариантов осуществления.
[0019] В шестом аспекте в настоящем изобретении предусмотрена выделенная клетка-хозяин, продуцирующая антитело или антигенсвязывающий фрагмент согласно любому из предыдущих аспектов или их вариантов осуществления.
[0020] В седьмом аспекте в настоящем изобретении предусмотрен способ получения антитела или его антигенсвязывающего фрагмента в соответствии с любым из предыдущих аспектов или их вариантов осуществления, включающий (a) культивирование клетки-хозяина, экспрессирующей указанные антитело или антигенсвязывающий фрагмент, или культивирование клетки-хозяина согласно третьему аспекту или его варианту осуществления или гибридомы согласно четвертому аспекту и (b) выделение указанных антитела или его антигенсвязывающего фрагмента из указанной культивируемой клетки-хозяина.
[0021] В восьмом аспекте в настоящем изобретении предусмотрены антитело или его антигенсвязывающий фрагмент, полученные согласно способу согласно шестому аспекту.
[0022] В девятом аспекте в настоящем изобретении предусмотрена фармацевтическая композиция, содержащая антитело или его антигенсвязывающий фрагмент в соответствии с любым из предыдущих аспектов или их вариантов осуществления и фармацевтически приемлемое вспомогательное вещество. В одном варианте осуществления фармацевтическая композиция предусмотрена для применения в качестве лекарственного препарата.
[0023] В десятом аспекте в настоящем изобретении предусмотрен способ лечения острого или хронического воспалительного заболевания, включающий введение нуждающемуся в этом субъекту фармацевтически эффективного количества выделенного антитела или его фрагмента в соответствии с любым из предыдущих аспектов или их вариантов осуществления. В одном варианте осуществления воспалительное заболевание включает хроническое заболевание почек (CKD), в том числе, например, CKD, развившееся на фоне диабета, диабетической нефропатии и высокого кровяного давления.
[0024] В одиннадцатом аспекте в настоящем изобретении предусмотрен способ лечения аутоиммунного заболевания, включающий введение нуждающемуся в этом субъекту фармацевтически эффективного количества выделенного антитела или его фрагмента в соответствии с любым из предыдущих аспектов или их вариантов осуществления. В одном варианте осуществления аутоиммунное заболевание включает системную красную волчанку, миозит, первичный синдром Шегрена, рассеянный склероз, увеит, псориаз или ревматоидный артрит.
[0025] Эти и другие признаки и преимущества настоящего изобретения будут более понятны из последующего подробного описания настоящего изобретения совместно с прилагаемой формулой изобретения. Следует отметить, что объем формулы изобретения определяется приведенными в ней формулировками, а не конкретным рассмотрением признаков и преимуществ, изложенных в настоящем описании.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
[0026] Фиг. 1A-1C. Отбор антител-лидеров. На фиг. 1A изображен способ чередующегося пэннинга с применением huFLT3L и muFLT3L и полученное в результате обогащение фаговых библиотек BMV, CS, DP47 и Dyax. На фиг. 1B изображен способ, с помощью которого продукты пэннинга встраивали в вектор для последующего конкурентного HTRF-анализа. На фиг. 1C изображены результаты конкурентного HTRF-анализа (гомогенной флуоресценции с временным разрешением) для кандидатов-лидеров.
[0027] Фиг. 2A-2C. Экспрессия FLT3L в клеточных линиях. На фиг. 2A продемонстрирована повышенная экспрессия FLT3 в клеточной линии RS4;11 в сравнении с клеточными линиями EOL-1, MOLM13 и MV4-11. На фиг. 2B приведены результаты, подтверждающие, что рекомбинантный FLT3L связывается с FLT3 на клетках RS4;11 дозозависимым образом. На фиг. 2C продемонстрировано, что понижающую регуляцию FLT3 на поверхности клеток RS4;11 можно надежно обнаружить с помощью коммерчески доступного антитела к FLT3 с применением проточного цитометрического анализа и такая понижающая регуляция происходит в ответ на лигирование с FLT3L дозозависимым образом.
[0028] Фиг. 3A и 3B. Получение EC80 и последующее тестирование. На фиг. 3A продемонстрирована кривая титрования FLT3L, использованная для получения концентрации, при которой на понижающей регуляции подвергнуто 80% FLT3 на клеточной поверхности клеток RS4;11 (EC80). На фиг. 3B продемонстрирован профиль ингибирования для коммерчески доступного антитела к FLT3L и рекомбинантной конструкции рецептора FLT3 (FLT3-Fc) относительно 96 пМ рекомбинантного FLT3L, который в ином случае приводил бы к 80% понижающей регуляции FLT3 на клеточной поверхности клеток RS4;11.
[0029] Фиг. 4A - 4C. Ингибирование sFLT3 человека и яванского макака кандидатными антителами-лидерами. На фиг. 4A продемонстрированы профили ингибирования для пяти кандидатов-лидеров в отношении 96 пМ FLT3L человека. На фиг. 4В продемонстрированы профили ингибирования для пяти кандидатов-лидеров в отношении 96 пМ FLT3L яванского макака. На фиг. 4С продемонстрированы профили ингибирования для пяти кандидатов-лидеров в отношении FLT3L мыши.
[0030] Фиг. 5A-C. Ингибирование FLT3 на клеточной поверхности кандидатами-лидерами. На фиг. 5A продемонстрирована способность антител-лидеров связывать FLT3L человека, экспрессируемый на поверхности трансдуцированных линий клеток CHO. На фиг. 5B продемонстрировано связывание антител-лидеров с FLT3L яванского макака на клеточной поверхности. На фиг. 5С продемонстрировано связывание антител-лидеров с FLT3L мыши на клеточной поверхности.
[0031] Фиг. 6A-C. Связывание кандидатов-лидеров с эндогенным FLT3L человека. На фиг. 6A продемонстрирована экспрессия FLT3L на первичных Т-клетках человека через 7 дней после стимуляции посредством IL-2. На фиг. 6B продемонстрирована способность всех кандидатов-лидеров связывать эндогенный FLT3L на первичных T-клетках человека, за исключением клона 5D9. На фиг. 6C продемонстрировано, что повышение авидности CAT5D9 путем димеризации перед инкубацией с первичными T-клетками делало возможным обнаружение дозозависимого связывания клона с эндогенным FLT3L на поверхности Т-клеток.
[0032] Фиг. 7A и 7B. Подавление передачи сигналов на клеточной поверхности кандидатами-лидерами. На фиг. 7A продемонстрирована кривая зависимости дозы от ответа для клеток RS4;11 относительно FLT3L-экспрессирующих клеток CHO, определяющая 1000 клеток CHO на лунку как оптимальное количество для индукции 80% понижающей регуляции FLT3 на поверхности клеток RS4;11. На фиг. 7B продемонстрировано, что все кандидаты-лидеры обладают способностью до некоторой степени ингибировать FLT3L на клеточной поверхности клеток CHO.
[0033] Фиг. 8A и 8B. Активация и нейтрализация сигнальных путей ERK. На фиг. 8A продемонстрированы результаты исследования по проверке концепции, показывающие активацию под действием FLT3L передачи сигнала с участием ERK у клеток RS4;11. На фиг. 8B продемонстрировано подавление с помощью коммерчески доступного антитела FLT3L-индуцированной активации ERK.
[0034] Фиг. 9A и 9B. Блокировка кандидатами-лидерами передачи сигналов далее по сигнальному пути с участием MEK 1/2 и ERK. На фиг. 9A продемонстрирована функциональная активность кандидатных клонов-лидеров в отношении индуцированного посредством FLT3L фосфорилирования MEK 1/2 у первичных CD133+ стволовых клеток человека. На фиг. 9B представлено дополнительное подтверждение функциональной активности клонов-лидеров в отношении индуцированной посредством FLT3L передачи сигнала у первичных CD133+ стволовых клеток человека с использованием фосфорилирования ERK в качестве результата считывания.
[0035] Фиг. 10A и 10B. Специфичность в отношении мишени и кинетика связывания кандидатов-лидеров. На фиг. 10A показана фаза III сортировки кандидатных клонов-лидеров и FLT3-Fc относительно клона 5D9. На фиг. 10B показана фаза III сортировки всех клонов-лидеров и FLT3-Fc относительно CAT8 в качестве представителя всех клонов, отличных от CAT5D9.
[0036] Фиг. 11A и 11B. Перекрестная реактивность кандидатов-лидеров с huSCF и huCSF. На фиг. 11A продемонстрировано, что кандидаты-лидеры не связываются со структурным гомологом huSCF. На фиг. 11В продемонстрировано, что кандидаты-лидеры не связываются со структурным гомологом huCSF.
[0037] Фиг. 12A и 12B. Оптимизация клонов. На фиг. 12A продемонстрированы результаты первого раунда оптимизации клонов при сравнении исходного CAT5D9 с клоном 6 (C06) с использованием анализа понижающей регуляции FLT3 у RS4;11 в качестве результата считывания. На фиг. 12В продемонстрированы результаты второго раунда оптимизации клонов при сравнении исходного CAT5D9 с клоном 6 (C06) и окончательными кандидатами-лидерами: AM40 и SC4017.
[0038] Фиг. 13A и 13B. Эффективная нейтрализация эндогенного FLT3L на клеточной поверхности. На фиг. 13A показана понижающая регуляция FLT3 у RS4:11 в ответ на серийное разведение FLT3L-экспрессирующих CD4+ T-клеток. На фиг. 13B показано, что клоны-лидеры полностью нейтрализуют активность FLT3L на клеточной поверхности CD4+ T-клеток.
[0039] Фиг. 14. Схема исследования в отношении нейтрализации FLT3L у здоровых яванских макаков. Трем группам самцов яванских макаков (n=4 на группу) вводили 0,03, 1 или 30 мг/кг AM40 (MEDI1116) в пяти еженедельных дозах в течение месяца, как указано. Для определения сохранения вводимого антитела и его эффекта в отношении популяции DC-клеток в кровотоке использовали восьминедельный период последующего наблюдения после введения последней дозы.
[0040] Фиг. 15A и 15B. Концентрация белка FLT3L в сыворотке крови и частота встречаемости DC в кровотоке после введения антитела к FLT3L (AM40/MEDI1116). На фиг. 15A показано взаимодействие MEDI1116 с мишенью при измерении уровней свободного FLT3L в сыворотке крови после введения в количестве 0,03, 1,0 и 30 мг/кг. В дни 1-8 проводили ежедневные измерения в сыворотке крови, после чего до дня 85 проводили еженедельные измерения. На фиг. 15B изображено снижение и восстановление частоты встречаемости CD1c+ (классических DC) в кровотоке (слева) и частоты встречаемости плазмоцитоидных DC (справа), измеренные как процент от исходного уровня, после обработки посредством MEDI1116.
[0041] Фиг. 16A-16D. Результаты измерения экспрессии FLT3L и корреляция показателя SLEDAI у пациентов с SLE при сравнении результатов измерения в сыворотке крови и результатов проточного цитометрического анализа Т-клеток. На фиг. 16A изображены уровни FLT3L в сыворотке крови здоровых доноров (HD) и пациентов с SLE. На фиг. 16B изображена корреляция между уровнями FLT3L в сыворотке крови и показателями SLEDAI. На фиг. 16C изображена частота встречаемости FLT3L+T-клеток в кровотоке у здоровых доноров (HD) и у пациентов с SLE. На фиг. 16D изображена корреляция между FLT3L+ CD4+ T-клетками и показателями SLEDAI.
[0042] Фиг. 17A-17C. Экспрессия FLT3L в субпопуляциях CD4+ T-клеток и показатели SLEDAI. На фиг. 17A изображен процент CD4 Tnaive-клеток, экспрессирующих FLT3L, у HD-пациентов и пациентов с SLE. В нижней части изображена корреляция CD4 Tnaive-клеток, экспрессирующих FLT3L, у пациентов с SLE в сравнении с показателем SLEDAI. На фиг. 17В изображен процент CD4 TMEM-клеток, экспрессирующих FLT3L, у HD-пациентов и пациентов с SLE. В нижней части изображена корреляция CD4 TMEM-клеток, экспрессирующих FLT3L, у пациентов с SLE в сравнении с показателем SLEDAI. На фиг. 17С изображен процент CD4 TCM-клеток, экспрессирующих FLT3L, у HD-пациентов и пациентов с SLE. В нижней части изображена корреляция CD4 Tnaive-клеток, экспрессирующих FLT3L, у пациентов с SLE в сравнении с показателем SLEDAI.
[0043] Фиг. 18A-18C. Экспрессия FLT3L в субпопуляциях CD4 PBMC от индивидуумов с миозитом. На фиг. 18A изображен процент CD4 Tnaive-клеток, экспрессирующих FLT3L, у HD-пациентов и пациентов с миозитом. На фиг. 18В изображен процент CD4 TMEM-клеток, экспрессирующих FLT3L, у HD-пациентов и пациентов с миозитом. На фиг. 18С изображен процент CD4 TCM-клеток, экспрессирующих FLT3L, у HD-пациентов и пациентов с миозитом.
[0044] Фиг. 19A-19B. Показатели протеинурии и нефрита у мышей MRL. На фиг. 19A изображены значения снижения степени протеинурии через 17 недель после введения антитела к FLT3L. На фиг. 19В изображены показатели степени нефрита через 18 недель после введения антитела к FLT3L.
[0045] Фиг. 20A-20C. Популяции селезеночных дендритных клеток у мышей MRL. На фиг. 20A изображены изменения частоты встречаемости CD11+ siglec-H+pDC после введения антитела к FLT3L. На фиг. 20В изображена частота встречаемости CD11c+CD11b+mDC после введения антитела к FLT3L. На фиг. 20С изображена частота встречаемости CD11c+CD8+mDC после введения антитела к FLT3L.
[0046] Фиг. 21A и 21B. Показатель патологии слюнных желез в мышиной модели синдрома Шегрена NOD.H2h4. На фиг. 21A показаны изменения в отношении патологии слюнных желез в мышиной модели синдрома Шегрена NOD.H2h4 после введения терапевтической дозы антитела к FLT3L в сравнении с изотипическим контролем. На фиг. 21В показаны изменения в отношении патологии слюнных желез в мышиной модели синдрома Шегрена NOD.H2h4 после введения профилактической дозы антитела к FLT3L в сравнении с изотипическим контролем.
[0047] Фиг. 22A-22D. Изменения в отношении наличия дендритных клеток после введения антитела к FLT3L. На фиг. 22A и 22B изображены изменения частоты встречаемости плазмоцитоидных DC (B220+CD11c+Siglec-H+) после введения антитела к FLT3L, которые показаны по результатам проточной цитометрии (A) и количественной оценки (B). На фиг. 22С и 22D изображены изменения частоты встречаемости классических DC (B220negCD11cHI) после введения антитела к FLT3L, которые показаны по результатам проточной цитометрии (C) и количественной оценки (D).
[0048] Фиг. 23A-23C. PK-данные в отношении антитела к FLT3L (MEDI1116) у яванских макаков коррелируют с функциональной нейтрализацией FLT3L, что подтверждается подавлением и возвратом количества pDC. Как показано стрелочками, антитело к FLT3L (MEDI1116) вводили яванским макакам один раз в неделю в дни 1, 8, 15, 22, 29. На фиг. 23A изображены PK-данные в отношении антитела к FLT3L (MEDI1116). На фиг. 23B изображены уровни растворимого FLT3L при дозах антитела к FLT3L (MEDI1116), составляющих 0,03 мг/кг, 1,0 мг/кг и 30 мг/кг. На фиг. 23С изображена частота встречаемости pDC, измеренная как процент от исходного уровня, при дозах антитела к FLT3L (MEDI1116), составляющих 0,03 мг/кг, 1,0 мг/кг и 30 мг/кг.
[0049] Фиг. 24A-24C. Модель введения человеку дозы антитела к FLT3L (MEDI1116) прогнозирует введение доз Q4W. На фиг. 24A изображены PK-данные в отношении антитела к FLT3L (MEDI1116) у яванских макаков. На фиг. 24В изображены PD-данные в отношении антитела к FLT3L (MEDI1116) у яванских макаков. На фиг. 24C изображены спрогнозированные PD-данные в отношении антитела к FLT3L (MEDI1116) у людей.
[0050] Фиг. 25A-25B. Моноклональное антитело к FLT3L (LFC-1) эффективно нейтрализует FLT3L на протяжении всего курса обработки и приводит к накоплению в кровотоке комплекса лекарственное средство/лиганд. На фиг. 25A изображены уровни свободного FLT3L в сыворотке крови после введения антитела к FLT3L и антитела изотипического контроля. Уровни свободного FLT3L измеряли с использованием FT3L-IgG в качестве захватного и меченного сульфогруппами поликлонального антитела к FLT3L мыши в качестве реагента для выявления. На фиг. 25В изображены уровни общего (свободного и связанного) FLT3L в сыворотке крови после введения антитела к FLT3L и антитела изотипического контроля. Уровни общего FLT3L измеряли с использованием поликлонального антитела к FLT3L мыши для захвата и выявления.
[0051] Фиг. 26A-26D. Блокировка FLT3L подавляет активацию Т-клеток в селезенке и дренирующем в SG лимфатическом узле (LN) у пожилых мышей NOD-H2h4. Блокировка FLT3L посредством моноклонального антитела к FLT3L (LFC-1) приводит к снижению частоты встречаемости подвергнутых действию антигена CD44HI CD4+ и CD8+ T-клеток в селезенке и дренирующем слюнную железу LN (в конце исследования в возрасте 24-26 недель). Гистограммы построены по результатам анализа проточной цитометрии селезенки и дренирующего LN. Каждый столбец представляет собой среднее +/- стандартная ошибка среднего (SEM) для n=4-5 мышей. На фиг. 26A изображены популяции CD44HI CD4+ Т-клеток в селезенке после введения антитела к FLT3L и антитела изотипического контроля. На фиг. 26В изображены популяции CD44HI CD4+ Т-клеток в LN после введения антитела к FLT3L и антитела изотипического контроля. На фиг. 26С изображены популяции CD44HI CD8+ Т-клеток в селезенке после введения антитела к FLT3L и антитела изотипического контроля. На фиг. 26D изображены популяции CD44HI CD8+ Т-клеток в LN после введения антитела к FLT3L и антитела изотипического контроля.
[0052] Фиг. 27. Терапевтическая блокировка антителами к FLT3L селективно снижает специфичности двух сывороточных аутоантител IgG. Соответствующие образцы сыворотки крови измеряли с помощью анализа на аутоантитела IgG UTSW.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
[0053] В настоящем изобретении предусмотрены выделенные антитела или их антигенсвязывающие фрагменты, которые специфически связываются с FLT3L. В некоторых аспектах такие молекулы представляют собой антитела и их антигенсвязывающие фрагменты, которые специфически связываются с FLT3L. В одном варианте осуществления раскрытые в данном документе антитела к FLT3L можно применять для подавления или снижения связывания FLT3/FLT3L для подавления активации воспалительных сигнальных путей. Такой подход является преимущественным, поскольку он воздействует на воспаление в источнике сигнала, обеспечивая более сильный противовоспалительный эффект лечения. Также предусмотрены родственные полинуклеотиды, векторы, фармацевтические композиции, содержащие антитела к FLT3L или их антигенсвязывающие фрагменты. Также предусмотрены способы получения, а также способы применения раскрытых в данном документе антител к FLT3L и антигенсвязывающих фрагментов, например, способы лечения аутоиммунных и/или хронических воспалительных заболеваний у субъекта (в качестве непосредственной терапии, вспомогательной терапии или в комбинированной терапии).
[0054] Для более легкого понимания настоящего изобретения сначала приведены определения некоторых терминов. Дополнительные определения изложены в подробном описании.
[0055] Определения
[0056] Перед подробным описанием настоящего изобретение следует понять, что данное изобретение не ограничено конкретными композициями или стадиями способа, поскольку таковые могут варьировать. Если не указано иное, все используемые в данном документе технические и научные термины имеют значения, обычно понимаемые специалистом в области техники, к которой относится настоящее изобретение. В следующих источниках для специалиста приведено общее определение многих терминов, используемых в настоящем изобретения: Singleton et al., Dictionary of Microbiology and Molecular Biology (2nd ed. 1994); The Cambridge Dictionary of Science and Technology (Walker ed., 1988); The Glossary of Genetics, 5th Ed., R. Rieger et al. (eds.), Springer Verlag (1991) и Hale & Marham, The Harper Collins Dictionary of Biology (1991). Используемые в данном документе последующие термины имеют предписываемые ниже значения, если не указано иное.
[0057] Термин "антитело" (или его фрагмент, вариант или производное), используемый в настоящем изобретении, относится к по меньшей мере минимальной части антитела, которая способна связываться с антигеном, например, к по меньшей мере вариабельному домену тяжелой цепи (VH) и вариабельному домену легкой цепи (VL) в контексте типичного антитела, вырабатываемого В-клеткой. Основные структуры антител в системах позвоночных относительно хорошо изучены. См., например, Harlow et al., Antibodies: A Laboratory Manual, (Cold Spring Harbor Laboratory Press, 2nd ed., 1988). Антитела или их антигенсвязывающие фрагменты, варианты или производные включают без ограничения поликлональные, моноклональные, человеческие, гуманизированные или химерные антитела, эпитоп-связывающие фрагменты (например, Fab, F(ab′)2, Fv, одноцепочечные Fv (scFv), одноцепочечные антитела, связанные дисульфидными связями Fv (sdFv), фрагменты, содержащие либо VL, либо VH домен (Fd), фрагменты, получаемые с помощью библиотеки экспрессируемых последовательностей Fab и другие фрагменты антител и их комбинации, которые сохраняют антигенсвязывающую функцию, т. е. способность специфически связывать, например, FLT3L.
[0058] Типичное антитело содержит по меньшей мере две тяжелые (Н) цепи и две легкие (L) цепи, связанные дисульфидными связями. Каждая тяжелая цепь состоит из вариабельной области тяжелой цепи (сокращенно обозначаемой в данном документе как VH или VH) и константной области тяжелой цепи. Константная область тяжелой цепи состоит из трех доменов: CHI, CH2 и CH3. Каждая легкая цепь состоит из вариабельной области легкой цепи (сокращенно обозначаемой в данном документе как VL или VL) и константной области легкой цепи. Константная область легкой цепи состоит из одного домена, представляющего собой CL. Области VH и VL можно дополнительно подразделить на области гипервариабельности, называемые определяющими комплементарность областями (CDR), перемежающиеся с областями, которые являются более консервативными, называемыми каркасными областями (FW). Каждая VH и VL состоит из трех CDR и четырех FW, расположенных от аминоконца к карбоксиконцу в следующем порядке: FW1, CDR1, FW2, CDR2, FW3, CDR3, FW4. Вариабельные области тяжелой и легкой цепей составляют связывающий домен, который взаимодействует с антигеном. Константные области антител могут опосредовать связывание иммуноглобулина с тканями или факторами хозяина, в том числе с различными клетками иммунной системы (например, эффекторными клетками) и первым компонентом (Clq) классической системы комплемента. К иллюстративным антителам по настоящему изобретению относятся антитела к FLT3L (первоначальные и модифицированные на уровне генов зародышевой линии), клоны с оптимизированной аффинностью, оптимизированные антитела без ADCC, конъюгированные антитела (например, ADC) и другие оптимизированные антитела (например, антитела с оптимизированным периодом полужизни в сыворотке крови, включающие, например, мутации YTE, см Dall'Acqua et al., J. Biol. Chem. 281:23514-24 (2006) и патент США № 7083784, которые таким образом включены посредством ссылки во всей своей полноте).
[0059] В определенных вариантах осуществления CDR VH (HCDR1, HCDR2 и HCDR3) и CDR VL (LCDR1, LCDR2 и LCDR3) состоят из аминокислотных последовательностей: (a) под SEQ ID NO: 29, 30, 31, 32, 33 и 34 соответственно; или (b) под SEQ ID NO: 29, 30, 31, 35, 33 и 34 соответственно; или (c) под SEQ ID NO: 29, 36, 37, 32, 33 и 38 соответственно.
[0060] Антитело может относиться к любому из пяти основных классов иммуноглобулинов: IgA, IgD, IgE, IgG и IgM или их подклассам (изотипам) (например, IgG1, IgG2, IgG3, IgG4, IgA1 и IgA2), исходя из идентичности их константных доменов тяжелой цепи, называемых альфа, дельта, эпсилон, гамма и мю соответственно. Различные классы иммуноглобулинов имеют разные и хорошо известные структуры субъединиц и трехмерные конфигурации. Антитела могут быть "оголенными" или конъюгированными с другими молекулами, такими как токсины, радиоизотопы и т.д., с образованием ADC.
[0061] "Блокирующее" антитело или "антагонистическое" антитело представляет собой антитело, которое подавляет или снижает биологическую активность антигена, который оно связывает, такого как FLT3L. В определенном аспекте блокирующие антитела или антагонистические антитела существенно или полностью подавляют биологическую активность антигена. Например, FLT3L-опосредованную активацию FLT3 можно снизить на по меньшей мере 10%, на по меньшей мере 15%, на по меньшей мере 20%, на по меньшей мере 25%, на по меньшей мере 30%, на по меньшей мере 35%, на по меньшей мере 40%, на по меньшей мере 45%, на по меньшей мере 50%, на по меньшей мере 55%, на по меньшей мере 60%, на по меньшей мере 65%, на по меньшей мере 70%, на по меньшей мере 75%, на по меньшей мере 80%, на по меньшей мере 85%, на по меньшей мере 90%, на по меньшей мере 95% или даже на 100%.
[0062] Термины "антитело против FLT3L", "антитело, которое связывается с FLT3L" или "антитело к FLT3L" относятся к антителу или его антигенсвязывающему фрагменту, которые способны связывать FLT3L с достаточной аффинностью, вследствие чего молекула является применимой в качестве терапевтического средства или диагностического реагента при целенаправленном воздействии на FLT3L. Термин "антитело к FLT3L" также широко охватывает молекулы, содержащие, например, CDR раскрытых в данном документе антител, включенные в каркас.
[0063] Термин "модифицирование на уровне генов зародышевой линии" означает, что аминокислоты в определенных положениях в антителе мутированы обратно в аминокислоты, которые встречаются на уровне зародышевой линии.
[0064] "Вариабельная область" антитела относится к вариабельной области легкой цепи антитела или вариабельной области тяжелой цепи антитела, отдельно или в комбинации. Вариабельная область каждой из тяжелой и легкой цепей состоит из четырех областей FW, соединенных тремя областями CDR. CDR в каждой цепи удерживаются вместе в непосредственной близости посредством областей FW и вместе с CDR из другой цепи способствуют образованию антигенсвязывающего сайта антител. Существует по меньшей мере две методики определения CDR: (1) подход, основанный на межвидовой вариабельности последовательностей (т.е. Kabat et al. Sequences of Proteins of Immunological Interest, (5th ed., 1991, National Institutes of Health, Bethesda Md.)); и (2) подход, основанный на кристаллографических исследованиях комплексов антиген-антитело (Al-lazikani et al. (1997) J. Molec. Biol. 273:927-948)). Кроме того, в данной области техники для определения CDR иногда применяют сочетания этих двух подходов.
[0065] Систему нумерации согласно Kabat обычно применяют для обозначения остатка в вариабельном домене (примерно остатков 1-107 легкой цепи и остатков 1-113 тяжелой цепи) (например, Kabat et al., Sequences of Immunological Interest, 5th Ed. Public Health Service, National Institutes of Health, Bethesda, Md. (1991)).
[0066] Фразы "нумерация аминокислотных положений согласно Kabat" или "положение согласно Kabat" и т.п. относятся к системе нумерации, применяемой для вариабельных доменов тяжелой цепи или вариабельных доменов легкой цепи компиляции антител в Kabat et al., 1991).
[0067] Термины "антигенсвязывающий домен", "антигенсвязывающий фрагмент" и "связывающий фрагмент" относятся к части молекулы антитела, которая содержит аминокислоты, отвечающие за специфическое связывание антитела с антигеном. Вариабельная область обеспечивает возможность антителу или антигенсвязывающему фрагменту селективно распознавать и специфически связывать эпитопы на антигенах. То есть домен VH и VL или подгруппа определяющих комплементарность областей (CDR) антитела объединяются с образованием вариабельной области, которая определяет трехмерный сайт связывания антигена. Конкретнее, антигенсвязывающий домен определяется тремя CDR на каждой из цепей VH и VL. Часть молекулы антигена, которая ответственна за специфические взаимодействия с антигенсвязывающим доменом, как используется в данном документе, называется "эпитопом". Антигенсвязывающий домен обычно содержит вариабельную область легкой цепи антитела и вариабельную область тяжелой цепи антитела, однако он не всегда включает их обе. Например, так называемый фрагмент антитела "Fd" состоит только из домена VH, но все еще сохраняет некоторую антигенсвязывающую функцию интактного антитела.
[0068] Связывающие фрагменты антитела получают с помощью методик рекомбинантной ДНК или с помощью ферментативного или химического расщепления интактных антител. Связывающие фрагменты включают Fab, Fab', F(ab')2, Fv и одноцепочечные антитела. Расщепление антител с помощью фермента, называемого папаином, приводит к получению двух идентичных антигенсвязывающих фрагментов, известных также как фрагменты "Fab", и "Fc" фрагмента, не обладающего антигенсвязывающей активностью, но обладающего способностью к кристаллизации. Расщепление антител с помощью фермента, называемого пепсином, приводит к получению фрагмента F(ab')2, у которого два плеча молекулы антитела остаются связанными и содержат два антигенсвязывающих сайта. F(ab')2 фрагмент обладает способностью сшивать антиген. "Fv" при использовании в данном документе обозначает минимальный фрагмент антитела, который сохраняет как антигенраспознающие, так и антигенсвязывающие сайты. "Fab" при использовании в данном документе обозначает фрагмент антитела, который содержит константный домен легкой цепи и домен CH1 тяжелой цепи.
[0069] Fc-область, как используется в данном документе, включает полипептиды, содержащие константную область антитела, за исключением первого иммуноглобулинового домена константной области. Таким образом, Fc относится к последним двум доменам константной области иммуноглобулинов IgA, IgD и IgG и к последним трем доменам константной области иммуноглобулинов IgE и IgM, а также к гибкому шарниру, который находится со стороны N-конца этих доменов. В случае IgA и IgM Fc может включать J-цепь. В случае IgG Fc содержит иммуноглобулиновые домены C-гамма-2 и C-гамма-3 (Cy2 и Cy3) и шарнир между C-гамма-1 (Cy1) и C-гамма-2 (Cy2). Несмотря на то, что границы области Fc могут варьировать, область Fc тяжелой цепи человеческого IgG обычно определяют как содержащую остатки C226 или P230 в направлении ее карбоксильного конца, причем нумерация соответствует системе EU, как указано в Kabat et al., 1991.
[0070] "Моноклональное антитело" относится к однородной популяции антител, вовлеченных в высокоспецифичное распознавание и связывание единственной антигенной детерминанты или эпитопа. Это отличает их от поликлональных антител, которые, как правило, включают различные антитела, направленные против различных антигенных детерминант.
[0071] Термин "моноклональное антитело" охватывает как интактные, так и полноразмерные моноклональные антитела, а также фрагменты антител (такие как Fab, Fab', F(ab')2, Fv), одноцепочечные вариабельные фрагменты (scFv), гибридные белки, содержащие часть антитела и любую другую модифицированную иммуноглобулиновую молекулу, содержащую антигенраспознающий сайт. Более того, "моноклональное антитело" относится к таким антителам, которые получены любым из ряда способов, включая без ограничения гибридому, фаговый отбор, рекомбинантную экспрессию и трансгенных животных (например, экспрессию человеческого антитела у трансгенной мыши).
[0072] Термин "гуманизированное антитело" обозначает антитело, полученное из отличного от человеческого (например, мышиного) иммуноглобулина, который был сконструирован с увеличением сходства с вариантами антител, вырабатываемыми у людей.
[0073] Термин "человеческое антитело" обозначает антитело, продуцируемое организмом человека, или антитело, характеризующееся аминокислотной последовательностью, соответствующей продуцируемому организмом человека антителу, полученное с помощью известной в данной области техники методики (например, рекомбинантной экспрессией в клеточных культурах или экспрессией в трансгенных животных). Таким образом, термин человеческое антитело также охватывает антитело, характеризующееся аминокислотной последовательностью, соответствующей антителу, которое изначально продуцировалось организмом человека (или его сконструированный вариант или производное), но которое экспрессируется в отличной от человека системе (например, получаемое с помощью химического синтеза; рекомбинантно экспрессируемое клетками микроорганизмов, млекопитающих или насекомых; или экспрессируемое в организме субъекта-животного). Соответственно, человеческим антителом считают антитело, полученное от субъекта-человека или из клеток человека (например, гибридомы или клеточной линии, экспрессирующей рекомбинантное антитело или его фрагмент), а впоследствии экспрессируемое в организме животного, например, мышей. Это определение человеческого антитела включает интактные или полноразмерные антитела, их фрагменты и/или антитела, содержащие по меньшей мере один полипептид человеческой тяжелой и/или легкой цепи, такие как, например, антитело, содержащее полипептиды мышиной легкой цепи и человеческой тяжелой цепи.
[0074] Термин "химерное антитела" обозначает антитела, где аминокислотная последовательность молекулы иммуноглобулина происходит от двух или более видов животных. Как правило, вариабельная область как легкой, так и тяжелой цепей соответствует вариабельной области антител, происходящих от одного вида млекопитающих (например, мыши, крысы, кролика и т.д.), с требуемой специфичностью, и/или аффинностью, и/или способностью, тогда как константные области являются гомологичными последовательностям в антителах, происходящих от другого вида (обычно человека), во избежание развития иммунного ответа у этого вида.
[0075] Подразумевается, что термин "полинуклеотид" охватывает отдельно взятую нуклеиновую кислоту, а также совокупность нуклеиновых кислот и обозначает выделенную молекулу нуклеиновой кислоты или конструкцию на ее основе, например, матричную РНК (мРНК) или плазмидную ДНК (pDNA). Полинуклеотид может предусматривать традиционную фосфодиэфирную связь или нетрадиционную связь (например, амидную связь, такую как встречающаяся в пептидо-нуклеиновых кислотах (PNA)). Термин "нуклеиновая кислота" относится к одному или нескольким сегментам нуклеиновых кислот, например, фрагментам ДНК или РНК, присутствующим в полинуклеотиде. Под "выделенными" нуклеиновой кислотой или полинуклеотидом подразумевают молекулу нуклеиновой кислоты, т.е. ДНК или РНК, которая была удалена из ее естественного окружения. Например, рекомбинантный полинуклеотид, кодирующий полипептидную субъединицу, содержащийся в векторе, считают выделенным, как раскрыто в данном документе. Дополнительные примеры выделенного полинуклеотида включают рекомбинантные полинуклеотиды, содержащиеся в гетерологичных клетках-хозяевах, или очищенные (частично или существенно) полинуклеотиды в растворе. Выделенные молекулы РНК включают in vivo или in vitro РНК-транскрипты полинуклеотидов. Выделенные полинуклеотиды или нуклеиновые кислоты дополнительно включают такие молекулы, которые получены с помощью синтеза. Кроме того, полинуклеотид или нуклеиновая кислота могут представлять собой или могут включать регуляторный элемент, такой как промотор, сайт связывания рибосомы или терминатор транскрипции.
[0076] В определенных вариантах осуществления полинуклеотид или нуклеиновая кислота представляет собой ДНК. В случае ДНК полинуклеотид, содержащий нуклеиновую кислоту, которая кодирует полипептид, в норме может включать промотор и/или другие управляющие транскрипцией или трансляцией элементы, функционально ассоциированные с одной или несколькими кодирующими областями. Функциональная ассоциация или связь имеет место, когда область, кодирующая генный продукт, например полипептид, ассоциирована с одной или несколькими регуляторными последовательностями таким образом, чтобы поместить экспрессию генного продукта под влияние или управление регуляторной(-ых) последовательности(-ей). Два фрагмента ДНК (такие как кодирующая полипептид область и ассоциированный с нею промотор) являются "функционально ассоциированными" или "функционально связанными", если индукция промоторной функции приводит к транскрипции мРНК, кодирующей требуемый генный продукт, и если природа связи между двумя фрагментами ДНК не оказывает отрицательного эффекта в отношении способности регулирующих экспрессию последовательностей управлять экспрессией генного продукта или не оказывает отрицательного эффекта в отношении способности транскрибировать ДНК-матрицу. Таким образом, промоторная область будет функционально ассоциирована с нуклеиновой кислотой, кодирующей полипептид, если промотор будет способен осуществлять транскрипцию этой нуклеиновой кислоты. Промотор может представлять собой специфический для типа клеток промотор, который запускает существенную транскрипцию ДНК только у заданных клеток. Для запуска клеточноспецифической транскрипции с полинуклеотидом, помимо промотора, могут быть функционально связаны и другие управляющие транскрипцией элементы, например, энхансеры, операторы, репрессоры и сигналы терминации транскрипции. В данном документе раскрыты подходящие промоторы и другие управляющие транскрипцией области.
[0077] В других вариантах осуществления полинуклеотид может представлять собой РНК, например, в виде матричной РНК (мРНК).
[0078] "Вектор" представляет собой молекулу нуклеиновой кислоты, введенную в клетку-хозяина, с получением таким образом трансформированной клетки-хозяина. Вектор может включать последовательности нуклеиновых кислот, которые позволяют ему реплицироваться в клетке-хозяине, такие как точка начала репликации. Вектор также может включать один или несколько селектируемых маркерных генов и другие генетические элементы, известные в данной области техники.
[0079] "Трансформированная" клетка или "клетка-хозяин" представляет собой клетку, в которую с помощью методик молекулярной биологии была введена молекула нуклеиновой кислоты. Используемый в данном документе термин трансформация охватывает все методики, с помощью которых молекулу нуклеиновой кислоты можно ввести в такую клетку, в том числе трансфекцию вирусными векторами, трансформацию плазмидными векторами и введение депротеинизированной ДНК путем электропорации, липофекции и внедрения на частицах, ускоренных с помощью генной пушки. Трансформированная клетка или клетка-хозяин могут быть бактериальной клеткой или эукариотической клеткой.
[0080] Используемый в данном документе термин "FLT3L" обозначает лиганд подобной продукту протоонкогена вируса саркомы кошек штамма McDonough (FMS) тирозинкиназы 3, представляющий собой полипептид, который является гематопоэтическим цитокином, связывающимся с рецептором, представляющим собой FMS-подобную рецепторную тирозинкиназу 3 (FLT3). FLT3L изначально экспрессируется в виде мембраносвязанного белка, перед его расщеплением ферментами в растворимую форму. В определение FLT3L включены как мембраносвязанный (mFLT3L), так и секретируемый (sFLT3L).
[0081] В данном описании "предусматривает", "предусматривающий", "содержащий" и "имеющий" и т. п. могут иметь значения, предписываемые им в Патентном законе США, и могут означать "включает", "включающий" и т.п.; "по сути состоящий из" или "по сути состоит из" аналогично имеет значение, предписываемое в Патентном законе США, и данный термин является открытым, что допускает наличие большего количества элементов, чем конкретно перечислено, при условии, что основные или новые характеристики того, что перечислено, не изменяются при наличии большего количества элементов, чем перечислено, но исключает варианты осуществления предшествующего уровня техники.
[0082] Используемые в данном документе термины "определение", "оценка", "анализ", "измерение" и "обнаружение" относятся как к количественным, так и к качественным определениям, и вследствие этого термин "определение" в данном документе можно использовать взаимозаменяемо с терминами "анализ", "измерение" и т. п. Если подразумевают количественное определение, можно использовать фразу "определение количества" аналита и т.п. Если подразумевают качественное и/или количественное определение, используют фразу "определение уровня" аналита или "обнаружение" аналита.
[0083] Термины "идентичный" или "процент идентичности" в контексте двух или более нуклеиновых кислот или полипептидов относятся к двум или более последовательностям или подпоследовательностям, которые являются одинаковыми или характеризуются определенным процентом нуклеотидов или аминокислотных остатков, которые являются одинаковыми при сравнении и выравнивании (с введением гэпов, при необходимости) для достижения максимального соответствия без рассмотрения каких-либо консервативных аминокислотных замен как части идентичности последовательностей. Процент идентичности можно измерить с помощью программного обеспечения или алгоритмов для сравнения последовательностей или путем визуальной оценки. В данной области техники известны различные алгоритмы и программное обеспечение, которые можно использовать для получения результатов выравнивания аминокислотных или нуклеотидных последовательностей (см. например, Karlin et al., 1990, Proc. Natl. Acad. Sci., 87:2264-2268, которые модифицированы в Karlin et al., 1993, Proc. Natl. Acad. Sci., 90:5873-5877, и включены в программы NBLAST и XBLAST (Altschul et al., 1991, Nucleic Acids Res., 25:3389-3402). В определенных вариантах осуществления можно использовать Gapped BLAST, который описан в Altschul et al., 1997, Nucleic Acids Res. 25:3389-3402. BLAST-2, WU-BLAST-2 (Altschul et al., 1996, Methods in Enzymology, 266:460-480), ALIGN, ALIGN-2 (Genentech, Южный Сан-Франциско, Калифорния) или Megalign (DNASTAR).
[0084] Термин "выделенный" относится к молекуле, которая не находится в своей природной среде. Какого-либо конкретного уровня очистки не требуется. Например, выделенное антитело представляет собой антитело, которое не продуцируется или не находится в своем естественном или природном окружении. Биологические материалы, получаемые рекомбинантным способом, считаются выделенными, как раскрыто в данном документе, также как и материалы, которые продуцируются в не характеризующейся естественным происхождением клетке, такой как гибридома. Вещество, например, выделенный белок, такой как антитело, также считают "выделенным", если оно было отделено, фракционировано или частично или существенно очищено с помощью любой подходящей методики. Например, антитело считают "выделенным", если оно по сути не содержит клеточного материала или других белков из клеточного или тканевого источника, из которого оно происходит.
[0085] Термин "специфически связывает" относится к средству (например, лиганду или антителу), которое распознает и связывает молекулу (например, рецептор или эпитоп), и при этом такое связывание определяется некоторой комплементарностью между средством (например, антителом) и молекулой (например, лигандом). Согласно данному определению утверждают, что антитело "специфически связывается" с лигандом, если оно связывается с этим лигандом легче, чем оно будет связываться со случайной неродственной молекулой. Термин "специфичность" в данном документе используют для качественной оценки относительной аффинности, с которой определенное антитело связывается с определенным лигандом. Например, можно считать, что антитело "A" обладает более высокой специфичностью в отношении данного лиганда (например, FLT3L), чем антитело "B".
[0086] Используемый в данном документе термин "аффинность" относится к показателю силы связывания индивидуального эпитопа с CDR антитела. См., например, Harlow et al., Antibodies: A Laboratory Manual, (Cold Spring Harbor Laboratory Press), 2nd ed. 1988) на страницах 27-28. Используемый в данном документе термин "авидность" относится к общей стабильности комплекса между популяцией антител и антигеном, то есть к функциональной силе объединения смеси антител с антигеном. См., например, Harlow на страницах 39-34. Авидность имеет отношение как к аффинности индивидуальных антител в популяции с конкретными эпитопами, так и к валентности антител и антигена.
[0087] Термины "ингибировать" или "блокировать" используют в данном документе взаимозаменяемо, и они относятся к любому статистически значимому снижению биологической активности, в том числе к полной блокировке активности. Например, "ингибирование" может обозначать снижение биологической активности приблизительно на 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90% или 100%.
[0088] Термин "эффекторная функция" относится к видам активности антител, которые являются следствием взаимодействия их Fc-компонентов с Fc-рецепторами или компонентами системы комплемента. К таким видам активности относятся, например, антителозависимая клеточно-опосредованная цитотоксичность (ADCC), комплементзависимая цитотоксичность (CDC) и антителозависимый клеточный фагоцитоз (ADCP). Таким образом, антигенсвязывающий белок (например, антитело или его антигенсвязывающий фрагмент) с измененной эффекторной функцией обозначает антигенсвязывающий белок (например, антитело или его антигенсвязывающий фрагмент), который содержит изменение в Fc-области (например, аминокислотную замену, делецию или добавление или изменение в олигосахариде), которое изменяет активность по меньшей мере одной эффекторной функции (например, ADCC, CDC и/или ADCP). Антигенсвязывающий белок (например, антитело или его антигенсвязывающий фрагмент) с улучшенной эффекторной функцией обозначает антигенсвязывающий белок (например, антитело или его антигенсвязывающий фрагмент), который содержит изменение в Fc-области (например, аминокислотную замену, делецию или добавление или изменение в олигосахариде), которое повышает активность по меньшей мере одной эффекторной функции (например, ADCC, CDC и/или ADCP).
[0089] Термин "субъект" относится к любому животному (например, млекопитающему), включая без ограничения людей, отличных от человека приматов, грызунов и т.п., которое должно быть реципиентом конкретного средства лечения. Как правило, термины "субъект", и "пациент", и "индивидуум" используют в данном документе взаимозаменяемо. Дополнительные примеры субъектов включают отличных от человека млекопитающих, таких как относящиеся к крупному рогатому скоту, лошадям, собакам, овцам или кошкам.
[0090] Термин "фармацевтическая композиция" обозначает препарат, который представлен в таком виде, который обеспечивает эффективность биологической активности активного ингредиента (например, раскрытого в данном документе антитела к FLT3L) и который не содержит дополнительных компонентов, являющихся неприемлемо токсичными для субъекта, которому будут вводить данную композицию. Такая композиция может быть стерильной.
[0091] "Эффективное количество" антитела к FLT3L, раскрытого в данном документе, представляет собой количество, достаточное для осуществления конкретно заявляемой цели. "Эффективное количество" можно определить эмпирически и посредством стандартного способа в зависимости от заявляемой цели.
[0092] Термины "терапевтически эффективное количество" и "фармацевтически эффективное количество" относятся к количеству раскрытого в данном документе антитела к FLT3L или другого лекарственного средства, которое эффективно для "лечения" заболевания или нарушения у субъекта.
[0093] Такие термины, как "проведение лечения", или "лечение", или "лечить", или "уменьшение выраженности", или "уменьшать выраженность" относятся как к (1) терапевтическим мерам, которые обеспечивают излечивание, замедление, уменьшение симптомов и/или остановку прогрессирования диагностированного патологического состояния или нарушения, так и к (2) профилактическим или превентивным мерам, которые обеспечивают предупреждение и/или замедление развития целевого патологического состояния или нарушения. Таким образом, нуждающиеся в лечении включают тех, у кого уже есть нарушение; тех, кто склонен к развитию нарушения; и тех, у которых необходимо предупредить развитие нарушения. В определенных аспектах субъект успешно подвергается "лечению" от аутоиммунного или воспалительного заболевания в соответствии со способами по настоящему изобретению, если у пациента наблюдается, например, полное, частичное или временное уменьшение симптомов, ассоциированных с аутоиммунным или воспалительным заболеванием.
[0094] Представленные в данном документе диапазоны понимают в качестве сокращенной записи для всех значений в пределах диапазона. Например, диапазон от 1 до 50 понимают как включающий любое число, комбинацию чисел или поддиапазон из группы, состоящей из 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49 или 50.
[0095] Используемые в данном документе термины "лечить", "проведение лечения", "лечение" и т.п. относятся к уменьшению и/или облегчению нарушения и/или ассоциированных с ним симптомов. Будет понятно, хотя и не исключается, что лечение нарушения или состояния не нуждается в полном устранении нарушения, состояния или ассоциированных с ним симптомов. Например, как предусмотрено в данном документе, лечение нарушения включает предупреждение обострения симптомов нарушения.
[0096] Используемый в данном документе термин "или" понимают как включающий, если обратное специально не указано или не очевидно из контекста. Используемые в данном документе формы единственного числа понимают как формы единственного или множественного числа, если обратное специально не указано или не очевидно из контекста.
[0097] Более того, "и/или" при использовании в данном документе следует рассматривать как конкретное раскрытие каждого из двух или более указанных признаков или компонентов совместно с другим компонентом или без него. Таким образом, термин "и/или", используемый в такой фразе, как "A и/или B", в данном документе подразумевают как включающий "A и B", "A или B", "A" (в отдельности) и "B" (в отдельности). Аналогично, термин "и/или", используемый в такой фразе, как "A, B и/или C", подразумевают как охватывающий каждый из следующих вариантов осуществления: A, B и C; A, B или C; A или C; A или B; B или C; A и C; A и B; B и C; а также A (в отдельности); B (в отдельности); а также C (в отдельности).
[0098] Если специально не указано иное или иное не очевидно из контекста, используемый в данном документе термин "приблизительно" понимают как находящийся в пределах диапазона нормальных допусков в данной области техники, например, в пределах 2 стандартных отклонений от среднего значения. "Приблизительно" можно понимать как отклоняющийся в большую или меньшую сторону в пределах 10%, 9%, 8%, 7%, 6%, 5%, 4%, 3%, 2%, 1%, 0,5%, 0,1%, 0,05% или 0,01% от указанного значения. Если не указано иное, все приведенные в данном документе числовые значения считаются подразумеваемым образом модифицированными термином "приблизительно".
[0099] FLT3L изначально экспрессируется в виде мембраносвязанного белка, перед его расщеплением ферментами в растворимую форму. Как мембраносвязанная (mFLT3L), так и секретируемая (sFLT3L) формы являются функционально активными. Область связывания FLT3L является до такой степени высококонсервативной среди разных видов, что имеет место межвидовая реактивность, наблюдаемая среди сочетаний лиганд/рецептор у человека, грызуна и яванского макака. Тем не менее, полагают, что отсутствие межвидовой реактивности у нейтрализующих антител, продуцируемых в отношении FLT3L, объясняется ключевыми мутациями вокруг сайта связывания. Нейтрализующие антитела к FLT3L могут воздействовать на популяции классических и плазмоцитоидных DC, снижая способность иммунной системы индуцировать и поддерживать пролонгированный воспалительный ответ. Вторичные эффекты могут включать уменьшение NK-клеток в кровотоке и сниженную активацию T- и B-клеток, что приводит к снижению выживаемости клеток обоих типов. В совокупности понижающая регуляция этих сигнальных путей может уменьшить аутоиммунное воспаление.
[00100] В одном варианте осуществления предусмотрено, что нейтрализующее антитело к FLT3L способствует иммунному гомеостазу путем подавления связывания FLT3L с FLT3. Стратегия использования антител к FLT3L направлена на лиганд, а не на рецептор, с тем, чтобы избежать риска неожиданной димеризации рецептора или передачи сигнала от него. В отличие от своего рецептора, у мембраносвязанного FLT3L отсутствует ассоциированный с ним сигнальный домен.
[00101] Антитела к FLT3L
[00102] В настоящем изобретении в предпочтительном варианте осуществления предусмотрены выделенные FLT3L-связывающие молекулы, например антитела и их антигенсвязывающие фрагменты, которые специфически связывают FLT3L, например FLT3L человека. Полноразмерные аминокислотные и нуклеотидные последовательности для FLT3L известны из уровня техники (см., например, в UniProt под № дост. P36888 для FLT3L человека или в UniProt под № дост. Q00342 для FLT3L мыши). Антитела к FLT3L по настоящему изобретению подавляют FLT3L-опосредованную активацию FLT3 и таким образом снижают передачу провоспалительных сигналов и уменьшают воспаление у субъекта.
[00103] В предпочтительном варианте осуществления антитела к FLT3L не вступают в перекрестную реакцию со схожими по структуре гомологами TKR, представляющими собой фактор стволовых клеток человека (huSCF) или колониестимулирующий фактор человека (huCSF1). Специалист в данной области техники поймет, что SCF и CSF являются лигандами, которые также связывают рецепторные тирозинкиназы. Неспецифические ингибиторы FLT3, которые связывают дополнительные представители семейства тирозинкиназ, вызывают токсичность из-за глобального подавления передачи сигналов с участием тирозинкиназ. Соответственно, крайне важно, чтобы антитела к FLT3L связывали только FLT3L, а не схожие по структуре гомологи. Многие антитела к FLT3L и его ингибиторы не обладают специфичностью и связывают широкий спектр рецепторных тирозинкиназ. Таким образом, в предпочтительном варианте осуществления антитело к FLT3L должно демонстрировать высокую аффинность в отношении FLT3L и его специфическое связывание.
[00104] В одном варианте осуществления антитела к FLT3L по настоящему изобретению представляют собой моноклональные антитела, рекомбинантные антитела, человеческие антитела, гуманизированные антитела и/или химерные антитела.
[00105] В некоторых аспектах FLT3L-связывающие молекулы включают Fab, Fab', F(ab')2, Fd, одноцепочечный Fv или scFv, связанный дисульфидной связью Fv, домен V-NAR, IgNar, интраантитело, CH2 IgG, миниантитело, F(ab')3, тетраантитело, триантитело, диатело, однодоменное антитело, DVD-Ig, Fcab, mAb2, (scFv)2 или scFv-Fc. В некоторых аспектах антитела к FLT3L относятся к типу IgG, например к типу IgG1 (включает константный домен тяжелой цепи иммуноглобулина IgG1). В других вариантах осуществления антитела к FLT3L имеют константный домен тяжелой цепи иммуноглобулина IgA, IgD, IgE, IgG2, IgG3, IgG4 или IgM.
[00106] В некоторых вариантах осуществления константная область IgG может содержать константную область легкой цепи, выбранную из группы, состоящей из константного домена (области) каппа-цепи Ig и константного домена лямбда-цепи Ig. В одном конкретном варианте осуществления антитела к FLT3L содержат константный домен IgG1 человека и константный домен лямбда-цепи человека. В другом конкретном варианте осуществления антитела к FLT3L имеют формат IgG1-TM, так чтобы целенаправленные мутации в Fc-области приводили к замене лейцина в положении 243 на фенилаланин (L243F), лейцина в положении 235 на глутаминовую кислоту (L235E) и пролина в положении 331 на серин (P331S); при этом нумерация аминокислот приведена в соответствии с системой EU. Такие целенаправленные мутации снижают связывание FcR и ADCC-эффекторную функцию (см. Organesyan et al., Acta Crystallogr D Biol Crystallogr. 2008 Jun 1; 64(Pt 6): 700-4 и WO 2009100309 A2, которая включена посредством ссылки).
[00107] В некоторых аспектах антитела к FLT3L являются антителами человека (например, антитела CAT5D9, SC4017, AM40, CAT8, CAT26, DTAX3 и DYAX5).
[00108] Антитело CAT5D9
[00109] В одном варианте осуществления антитело CAT5D9 относится к антителу, которое специфически связывается с FLT3L и предусматривает определяющие комплементарность области (CDR): HCDR1, HCDR2, HCDR3, LCDR1, LCDR2 и LCDR3. HCDR1, HCDR2, HCDR3, LCDR1, LCDR2 и LCDR3 предусматривают аминокислотные последовательности под SEQ ID NO: 29, 36, 37, 32, 33 и 38 соответственно.
[00110] В другом варианте осуществления антитело CAT5D9 относится к антителу, которое специфически связывается с FLT3L и предусматривает два домена VL, характеризующихся по меньшей мере 95%, 96%, 97%, 98% или 99% идентичностью последовательности с аминокислотной последовательностью под SEQ ID NO: 6, и два домена VH, характеризующихся по меньшей мере 95%, 96%, 97%, 98% или 99% идентичностью последовательности с аминокислотной последовательностью под SEQ ID NO: 5.
[00111] В дополнительном варианте осуществления антитело CAT5D9 относится к антителу, которое предусматривает два домена VL, характеризующихся аминокислотной последовательностью под SEQ ID NO: 6, и два домена VH, характеризующихся аминокислотной последовательностью под SEQ ID NO: 5.
[00112] В другом варианте осуществления антитело CAT5D9 относится к антителу, которое предусматривает два домена VL, кодируемые последовательностью нуклеиновой кислоты под SEQ ID NO: 20, и два домена VH, кодируемые последовательностью нуклеиновой кислоты под SEQ ID NO: 19.
[00113] В одном варианте осуществления антитело CAT5D9 относится к антителу IgG1, которое специфически связывается с FLT3L и предусматривает легкую цепь, характеризующуюся аминокислотной последовательностью под SEQ ID NO: 70, и тяжелую цепь, характеризующуюся аминокислотной последовательностью под SEQ ID NO: 69.
[00114] В другом варианте осуществления антитело CAT5D9 относится к антителу, которое предусматривает легкую цепь, кодируемую последовательностью нуклеиновой кислоты под SEQ ID NO: 72, и тяжелую цепь, кодируемую последовательностью нуклеиновой кислоты под SEQ ID NO: 71.
[00115] Антитело SC4017
[00116] В одном варианте осуществления антитело SC4017 относится к антителу, которое специфически связывается с FLT3L и предусматривает определяющие комплементарность области (CDR): HCDR1, HCDR2, HCDR3, LCDR1, LCDR2 и LCDR3. HCDR1, HCDR2, HCDR3, LCDR1, LCDR2 и LCDR3 предусматривают аминокислотные последовательности под SEQ ID NO: 29, 30, 31, 35, 33 и 34 соответственно.
[00117] В другом варианте осуществления антитело SC4017 относится к антителу, которое специфически связывается с FLT3L и предусматривает два домена VL, характеризующихся по меньшей мере 95%, 96%, 97%, 98% или 99% идентичностью последовательности с аминокислотной последовательностью под SEQ ID NO: 4, и два домена VH, характеризующихся по меньшей мере 95%, 96%, 97%, 98% или 99% идентичностью последовательности с аминокислотной последовательностью под SEQ ID NO: 3.
[00118] В дополнительном варианте осуществления антитело SC4017 относится к антителу, которое предусматривает два домена VL, характеризующихся аминокислотной последовательностью под SEQ ID NO: 4, и два домена VH, характеризующихся аминокислотной последовательностью под SEQ ID NO: 3.
[00119] В другом варианте осуществления антитело SC4017 относится к антителу, которое предусматривает два домена VL, кодируемые последовательностью нуклеиновой кислоты под SEQ ID NO: 18, и два домена VH, кодируемые последовательностью нуклеиновой кислоты под SEQ ID NO: 17.
[00120] В одном варианте осуществления антитело SC4017 относится к антителу IgG1, которое специфически связывается с FLT3L и предусматривает легкую цепь, характеризующуюся аминокислотной последовательностью под SEQ ID NO: 66, и тяжелую цепь, характеризующуюся аминокислотной последовательностью под SEQ ID NO: 65.
[00121] В другом варианте осуществления антитело SC4017 относится к антителу, которое предусматривает легкую цепь, кодируемую последовательностью нуклеиновой кислоты под SEQ ID NO: 68, и тяжелую цепь, кодируемую последовательностью нуклеиновой кислоты под SEQ ID NO: 67.
[00122] Антитело AM40 (MEDI1116)
[00123] В одном варианте осуществления антитело AM40 относится к антителу, которое специфически связывается с FLT3L и предусматривает определяющие комплементарность области (CDR): HCDR1, HCDR2, HCDR3, LCDR1, LCDR2 и LCDR3. HCDR1, HCDR2, HCDR3, LCDR1, LCDR2 и LCDR3 предусматривают аминокислотные последовательности под SEQ ID NO: 29, 30, 31, 32, 33 и 34 соответственно.
[00124] В другом варианте осуществления антитело AM40 относится к антителу, которое специфически связывается с FLT3L и предусматривает два домена VL, характеризующихся по меньшей мере 95%, 96%, 97%, 98% или 99% идентичностью последовательности с аминокислотной последовательностью под SEQ ID NO: 2, и два домена VH, характеризующихся по меньшей мере 95%, 96%, 97%, 98% или 99% идентичностью последовательности с аминокислотной последовательностью под SEQ ID NO: 1.
[00125] В дополнительном варианте осуществления антитело AM40 относится к антителу, которое предусматривает два домена VL, характеризующихся аминокислотной последовательностью под SEQ ID NO: 2, и два домена VH, характеризующихся аминокислотной последовательностью под SEQ ID NO: 1.
[00126] В другом варианте осуществления антитело AM40 относится к антителу, которое предусматривает два домена VL, кодируемые последовательностью нуклеиновой кислоты под SEQ ID NO: 16, и два домена VH, кодируемые последовательностью нуклеиновой кислоты под SEQ ID NO: 15.
[00127] В одном варианте осуществления антитело AM40 относится к антителу IgG1, которое специфически связывается с FLT3L и предусматривает легкую цепь, характеризующуюся аминокислотной последовательностью под SEQ ID NO: 62, и тяжелую цепь, характеризующуюся аминокислотной последовательностью под SEQ ID NO: 61.
[00128] В другом варианте осуществления антитело AM40 относится к антителу, которое предусматривает легкую цепь, кодируемую последовательностью нуклеиновой кислоты под SEQ ID NO: 64, и тяжелую цепь, кодируемую последовательностью нуклеиновой кислоты под SEQ ID NO: 63.
[00129] Антитело CAT8
[00130] В одном варианте осуществления антитело CAT8 относится к антителу, которое специфически связывается с FLT3L и предусматривает определяющие комплементарность области (CDR): HCDR1, HCDR2, HCDR3, LCDR1, LCDR2 и LCDR3. HCDR1, HCDR2, HCDR3, LCDR1, LCDR2 и LCDR3 предусматривают аминокислотные последовательности под SEQ ID NO: 39, 40, 41, 42, 43 и 44 соответственно.
[00131] В другом варианте осуществления антитело CAT8 относится к антителу, которое специфически связывается с FLT3L и предусматривает два домена VL, характеризующихся по меньшей мере 95%, 96%, 97%, 98% или 99% идентичностью последовательности с аминокислотной последовательностью под SEQ ID NO: 8, и два домена VH, характеризующихся по меньшей мере 95%, 96%, 97%, 98% или 99% идентичностью последовательности с аминокислотной последовательностью под SEQ ID NO: 7.
[00132] В дополнительном варианте осуществления антитело CAT8 относится к антителу, которое предусматривает два домена VL, характеризующихся аминокислотной последовательностью под SEQ ID NO: 8, и два домена VH, характеризующихся аминокислотной последовательностью под SEQ ID NO: 7.
[00133] В другом варианте осуществления антитело CAT8 относится к антителу, которое предусматривает два домена VL, кодируемые последовательностью нуклеиновой кислоты под SEQ ID NO: 22, и два домена VH, кодируемые последовательностью нуклеиновой кислоты под SEQ ID NO: 21.
[00134] В одном варианте осуществления антитело CAT8 относится к антителу IgG1, которое специфически связывается с FLT3L и предусматривает легкую цепь, характеризующуюся аминокислотной последовательностью под SEQ ID NO: 74, и тяжелую цепь, характеризующуюся аминокислотной последовательностью под SEQ ID NO: 73.
[00135] В другом варианте осуществления антитело CAT8 относится к антителу, которое предусматривает легкую цепь, кодируемую последовательностью нуклеиновой кислоты под SEQ ID NO: 76, и тяжелую цепь, кодируемую последовательностью нуклеиновой кислоты под SEQ ID NO: 75.
[00136] Антитело CAT26
[00137] В одном варианте осуществления антитело CAT26 относится к антителу, которое специфически связывается с FLT3L и предусматривает определяющие комплементарность области (CDR): HCDR1, HCDR2, HCDR3, LCDR1, LCDR2 и LCDR3. HCDR1, HCDR2, HCDR3, LCDR1, LCDR2 и LCDR3 предусматривают аминокислотные последовательности под SEQ ID NO: 45, 40, 46, 47, 48 и 49 соответственно.
[00138] В другом варианте осуществления антитело CAT26 относится к антителу, которое специфически связывается с FLT3L и предусматривает два домена VL, характеризующихся по меньшей мере 95%, 96%, 97%, 98% или 99% идентичностью последовательности с аминокислотной последовательностью под SEQ ID NO: 10, и два домена VH, характеризующихся по меньшей мере 95%, 96%, 97%, 98% или 99% идентичностью последовательности с аминокислотной последовательностью под SEQ ID NO: 9.
[00139] В дополнительном варианте осуществления антитело CAT26 относится к антителу, которое предусматривает два домена VL, характеризующихся аминокислотной последовательностью под SEQ ID NO: 10, и два домена VH, характеризующихся аминокислотной последовательностью под SEQ ID NO: 9.
[00140] В другом варианте осуществления антитело CAT26 относится к антителу, которое предусматривает два домена VL, кодируемые последовательностью нуклеиновой кислоты под SEQ ID NO: 24, и два домена VH, кодируемые последовательностью нуклеиновой кислоты под SEQ ID NO: 23.
[00141] В одном варианте осуществления антитело CAT26 относится к антителу IgG1, которое специфически связывается с FLT3L и предусматривает легкую цепь, характеризующуюся аминокислотной последовательностью под SEQ ID NO: 78, и тяжелую цепь, характеризующуюся аминокислотной последовательностью под SEQ ID NO: 77.
[00142] В другом варианте осуществления антитело CAT26 относится к антителу, которое предусматривает легкую цепь, кодируемую последовательностью нуклеиновой кислоты под SEQ ID NO: 80, и тяжелую цепь, кодируемую последовательностью нуклеиновой кислоты под SEQ ID NO: 79.
[00143] Антитело DYAX3
[00144] В одном варианте осуществления антитело Dyax3 относится к антителу, которое специфически связывается с FLT3L и предусматривает определяющие комплементарность области (CDR): HCDR1, HCDR2, HCDR3, LCDR1, LCDR2 и LCDR3. HCDR1, HCDR2, HCDR3, LCDR1, LCDR2 и LCDR3 предусматривают аминокислотные последовательности под SEQ ID NO: 50, 51, 52, 53, 54 и 55 соответственно.
[00145] В другом варианте осуществления антитело Dyax3 относится к антителу, которое специфически связывается с FLT3L и предусматривает два домена VL, характеризующихся по меньшей мере 95%, 96%, 97%, 98% или 99% идентичностью последовательности с аминокислотной последовательностью под SEQ ID NO: 82, и два домена VH, характеризующихся по меньшей мере 95%, 96%, 97%, 98% или 99% идентичностью последовательности с аминокислотной последовательностью под SEQ ID NO: 81.
[00146] В дополнительном варианте осуществления антитело Dyax3 относится к антителу, которое предусматривает два домена VL, характеризующихся аминокислотной последовательностью под SEQ ID NO: 12, и два домена VH, характеризующихся аминокислотной последовательностью под SEQ ID NO: 11.
[00147] В другом варианте осуществления антитело Dyax3 относится к антителу, которое предусматривает два домена VL, кодируемые последовательностью нуклеиновой кислоты под SEQ ID NO: 26, и два домена VH, кодируемые последовательностью нуклеиновой кислоты под SEQ ID NO: 25.
[00148] В одном варианте осуществления антитело Dyax3 относится к антителу IgG1, которое специфически связывается с FLT3L и предусматривает легкую цепь, характеризующуюся аминокислотной последовательностью под SEQ ID NO: 82, и тяжелую цепь, характеризующуюся аминокислотной последовательностью под SEQ ID NO: 81.
[00149] В другом варианте осуществления антитело Dyax3 относится к антителу, которое предусматривает легкую цепь, кодируемую последовательностью нуклеиновой кислоты под SEQ ID NO: 84, и тяжелую цепь, кодируемую последовательностью нуклеиновой кислоты под SEQ ID NO: 83.
[00150] Антитело DYAX5
[00151] В одном варианте осуществления антитело Dyax5 относится к антителу, которое специфически связывается с FLT3L и предусматривает определяющие комплементарность области (CDR): HCDR1, HCDR2, HCDR3, LCDR1, LCDR2 и LCDR3. HCDR1, HCDR2, HCDR3, LCDR1, LCDR2 и LCDR3 предусматривают аминокислотные последовательности под SEQ ID NO: 56, 57, 52, 58, 59 и 60 соответственно.
[00152] В другом варианте осуществления антитело Dyax5 относится к антителу, которое специфически связывается с FLT3L и предусматривает два домена VL, характеризующихся по меньшей мере 95%, 96%, 97%, 98% или 99% идентичностью последовательности с аминокислотной последовательностью под SEQ ID NO: 86, и два домена VH, характеризующихся по меньшей мере 95%, 96%, 97%, 98% или 99% идентичностью последовательности с аминокислотной последовательностью под SEQ ID NO: 85.
[00153] В дополнительном варианте осуществления антитело Dyax5 относится к антителу, которое предусматривает два домена VL, характеризующихся аминокислотной последовательностью под SEQ ID NO: 14, и два домена VH, характеризующихся аминокислотной последовательностью под SEQ ID NO: 13.
[00154] В другом варианте осуществления антитело Dyax5 относится к антителу, которое предусматривает два домена VL, кодируемые последовательностью нуклеиновой кислоты под SEQ ID NO: 28, и два домена VH, кодируемые последовательностью нуклеиновой кислоты под SEQ ID NO: 27.
[00155] В одном варианте осуществления антитело Dyax5 относится к антителу IgG1, которое специфически связывается с FLT3L и предусматривает легкую цепь, характеризующуюся аминокислотной последовательностью под SEQ ID NO: 86, и тяжелую цепь, характеризующуюся аминокислотной последовательностью под SEQ ID NO: 85.
[00156] В другом варианте осуществления антитело Dyax5 относится к антителу, которое предусматривает легкую цепь, кодируемую последовательностью нуклеиновой кислоты под SEQ ID NO: 88, и тяжелую цепь, кодируемую последовательностью нуклеиновой кислоты под SEQ ID NO: 87.
[00157] В определенных вариантах осуществления предусмотрено антитело или его антигенсвязывающий фрагмент, которые специфически связываются с FLT3L, содержащие группу определяющих комплементарность областей (CDR): HCDR1, HCDR2, HCDR3, LCDR1, LCDR2 и LCDR3, где HCDR1, HCDR2, HCDR3, LCDR1, LCDR2 и LCDR3 содержат аминокислотные последовательности: (a) под SEQ ID NO: 29, 30, 31, 32, 33 и 34 соответственно; или (b) под SEQ ID NO: 29, 30, 31, 35, 33 и 34 соответственно; или (c) под SEQ ID NO: 29, 36, 37, 32, 33 и 38 соответственно.
[00158] В определенных вариантах осуществления антитело или его антигенсвязывающий фрагмент содержат вариабельную область тяжелой цепи (VH) и вариабельную область легкой цепи (VL), где каждая из VH и VL содержит три CDR и четыре каркасные области (FW), расположенные от аминоконца к карбоксиконцу в следующем порядке: FW1, CDR1, FW2, CDR2, FW3, CDR3 и FW4.
[00159] В определенных аспектах области VH и VL характеризуются аминокислотной последовательностью, характеризующейся по меньшей мере 95%, 96%, 97%, 98% или 99% идентичностью последовательности с: (a) SEQ ID NO: 1 и SEQ ID NO: 2 соответственно; или (b) SEQ ID NO: 3 и SEQ ID NO: 4 соответственно; или (c) SEQ ID NO: 5 и SEQ ID NO: 6 соответственно.
[00160] В определенных аспектах CDR VH (HCDR1, HCDR2 и HCDR3) и CDR VL (LCDR1, LCDR2 и LCDR3) состоят из аминокислотных последовательностей: (a) под SEQ ID NO: 29, 30, 31, 32, 33 и 34 соответственно; или (b) под SEQ ID NO: 29, 30, 31, 35, 33 и 34 соответственно; или (c) под SEQ ID NO: 29, 36, 37, 32, 33 и 38 соответственно.
[00161] В таблице 1 представлена сводная таблица последовательностей антител к FLT3L.
[00162] Таблица 1. Сводная таблица последовательностей антител к FLT3L
Таблица 1A
(SEQ ID NO: 1)
(SEQ ID NO: 2)
(SEQ ID NO: 3)
(SEQ ID NO: 4)
(SEQ ID NO: 5)
(SEQ ID NO: 6)
(SEQ ID NO: 7)
(SEQ ID NO: 8)
(SEQ ID NO: 9)
(SEQ ID NO: 10)
(SEQ ID NO: 11)
(SEQ ID NO: 12)
(SEQ ID NO: 13)
(SEQ ID NO: 14)
ТАБЛИЦА 1B
(SEQ ID NO: 15)
(SEQ ID NO: 16)
(SEQ ID NO: 17)
(SEQ ID NO: 18)
(SEQ ID NO: 19)
(SEQ ID NO: 20)
(SEQ ID NO: 21)
(SEQ ID NO: 22)
(SEQ ID NO: 23)
(SEQ ID NO: 24)
(SEQ ID NO: 25)
(SEQ ID NO: 26)
(SEQ ID NO: 27)
(SEQ ID NO: 28)
ТАБЛИЦА 1C
(SEQ ID NO: 29)
(SEQ ID NO: 30)
(SEQ ID NO: 31)
(SEQ ID NO: 32)
(SEQ ID NO: 33)
(SEQ ID NO: 34)
(SEQ ID NO: 29)
(SEQ ID NO: 30)
(SEQ ID NO: 31)
(SEQ ID NO: 35)
(SEQ ID NO: 33)
(SEQ ID NO: 34)
(SEQ ID NO: 29)
(SEQ ID NO: 36)
(SEQ ID NO: 37)
(SEQ ID NO: 32)
(SEQ ID NO: 33)
(SEQ ID NO: 38)
(SEQ ID NO: 39)
(SEQ ID NO: 40)
(SEQ ID NO: 41)
(SEQ ID NO: 42)
(SEQ ID NO: 43)
(SEQ ID NO: 44)
(SEQ ID NO: 45)
(SEQ ID NO: 40)
(SEQ ID NO: 46)
(SEQ ID NO: 47)
(SEQ ID NO: 48)
(SEQ ID NO: 49)
(SEQ ID NO: 50)
(SEQ ID NO: 51)
(SEQ ID NO: 52)
(SEQ ID NO: 53)
(SEQ ID NO: 54)
(SEQ ID NO: 55)
(SEQ ID NO: 56)
(SEQ ID NO: 57)
(SEQ ID NO: 52)
(SEQ ID NO: 58)
(SEQ ID NO: 59)
(SEQ ID NO: 60)
ТАБЛИЦА 1D
(аминокислотная)
(SEQ ID NO: 61)
(SEQ ID NO: 62)
(SEQ ID NO: 63)
(SEQ ID NO: 64)
(SEQ ID NO: 65)
(SEQ ID NO: 66)
(SEQ ID NO: 67)
(SEQ ID NO: 68)
(SEQ ID NO: 69)
(SEQ ID NO: 70)
(SEQ ID NO: 71)
(SEQ ID NO: 72)
[00163] Производные
[00164] Антитела к FLT3L по настоящему изобретению могут предусматривать варианты представленных последовательностей, которые сохраняют способность специфически связывать FLT3L. Такие варианты могут быть получены специалистом в данной области из последовательностей антител с помощью методик, хорошо известных в данной области техники. Например, в FR-области и/или в CDR антител к FLT3L можно вносить аминокислотные замены, делеции или добавления, которые предотвращают связывание антител с их эпитопами. Тогда как изменения в FR обычно предназначены для улучшения стабильности и иммуногенности антигенсвязывающего домена, изменения в CDR обычно предназначены для увеличения аффинности антигенсвязывающего домена в отношении его мишени. Варианты FR также включают встречающиеся в природе аллотипы иммуноглобулинов. Такие повышающие аффинность изменениям можно определить эмпирически с помощью стандартных методик, которые предусматривают изменение CDR и тестирование аффинности антигенсвязывающего домена в отношении его мишени. Например, консервативные аминокислотные замены можно вносить в любую из раскрытых CDR. Различные изменения можно вносить в соответствии со способами, описанными в Antibody Engineering, 2nd ed., Oxford University Press, ed. Borrebaeck, 1995. Такие изменения включают без ограничения нуклеотидные последовательности, которые изменены путем замены различных кодонов, которые кодируют функционально эквивалентный аминокислотный остаток в пределах последовательности, таким образом получая "молчащее" изменение. Например, неполярные аминокислоты включают аланин, лейцин, изолейцин, валин, пролин, фенилаланин, триптофан и метионин. Полярные нейтральные аминокислоты включают глицин, серин, треонин, цистеин, тирозин, аспарагин и глутамин. Положительно заряженные (основные) аминокислоты включают аргинин, лизин и гистидин. Отрицательно заряженные (кислые) аминокислоты включают аспарагиновую кислоту и глутаминовую кислоту.
[00165] Производные и аналоги антител по настоящему изобретению можно получать с помощью различных методик, хорошо известных в данной области техники, в том числе с помощью рекомбинантных способов и способов синтеза (Maniatis (1990) Molecular Cloning, A Laboratory Manual, 2nd ed., Cold Spring Harbor Laboratory, Cold Spring Harbor, N.Y. и Bodansky et al. (1995) The Practice of Peptide Synthesis, 2nd ed., Spring Verlag, Berlin, Germany).
[00166] В одном варианте осуществления способ получения домена VH, который представляет собой вариант аминокислотной последовательности домена VH по настоящему изобретению, предусматривает стадию добавления, делетирования, замены или вставки одной или нескольких аминокислот в аминокислотной последовательности домена VH по настоящему изобретению, необязательно объединение полученного таким образом домена VH с одним или несколькими доменами VL и тестирование домена VH или комбинации или комбинаций VH/VL в отношении специфического связывания с антигеном. Можно использовать аналогичный способ, в котором один или несколько вариантов последовательности домена VL, раскрытых в данном документе, объединяют с одним или несколькими доменами VH.
[00167] Аналогичные методики перетасовки или комбинирования также описаны у Stemmer (Nature (1994) 370: 389-391), у которого описана методика в отношении гена β-лактамазы, но отмечается, что этот подход можно применять для создания антител.
[00168] В дополнительных вариантах осуществления можно создавать новые области VH или VL, несущие одну или несколько последовательностей, полученных из раскрытых в данном документе последовательностей, с использованием случайного мутагенеза одного или нескольких выбранных генов VH и/или VL. Одна такая методика, представляющая собой подверженную ошибкам PCR (ПЦР), описана у Gram et al. (Proc. Nat. Acad. Sci. U.S.A. (1992) 89: 3576-3580).
[00169] Другой способ, который можно применять, заключается в направленном мутагенезе CDR в генах VH или VL. Такие методики раскрыты у Barbas et al. (Proc. Nat. Acad. Sci. U.S.A. (1994) 91: 3809-3813) и Schier et al. (J. Mol. Biol. (1996) 263: 551-567).
[00170] Аналогично, одну, две или все три CDR антигенсвязывающего домена можно прививать в репертуар доменов VH или VL, который затем подвергают скринингу для обнаружения антигенсвязывающего фрагмента, специфичного в отношении FLT3L.
[00171] Часть вариабельного домена иммуноглобулина, пригодная для использования согласно данному документу, может содержать по меньшей мере одну из CDR, которая является такой, как по сути изложено в данном документе, и необязательно промежуточные каркасные области из фрагментов scFv, как изложено в данном документе. Эта часть может включать по меньшей мере приблизительно 50% любого одного или обоих из FR1 и FR4, причем 50% составляют С-концевые 50% FR1 и N-концевые 50% FR4. Дополнительные остатки на N-конце или С-конце существенной части вариабельного домена могут быть остатками, которые в норме не ассоциированы со встречающимися в природе областями вариабельного домена. Например, конструирование антител посредством методик с использованием рекомбинантной ДНК может привести к введению N- или C-концевых остатков, кодируемых линкерами, введенными для облегчения клонирования или других операционных стадий. Другие операционные стадии предусматривают введение линкеров для присоединения вариабельных доменов к дополнительным белковым последовательностям, включая константные области тяжелой цепи иммуноглобулина, другие вариабельные домены (например, при получении диател) или белковые метки, которые более подробно рассмотрены ниже.
[00172] Описываемые в данном документе антигенсвязывающие домены по настоящему изобретению можно соединять с другой функциональной молекулой, например, другим пептидом или белком (альбумином, другим антителом и т.д.). Например, антигенсвязывающие домены можно связать химическим сшиванием или с помощью рекомбинантных способов. Антигенсвязывающие домены также можно связать с одним из ряда небелковых полимеров, например полиэтиленгликолем, полипропиленгликолем или полиоксиалкиленами, посредством способов, изложенных в патентах США №№ 4640835, 4496689, 4301144, 4670417, 4791192 или 4179337. Антигенсвязывающие домены можно химически модифицировать путем ковалентного конъюгирования с полимером, например, для повышения периода их полужизни в кровотоке. Иллюстративные полимеры и способы их присоединения также показаны в патентах США №№ 4766106, 4179337, 4495285 и 4609546.
[00173] Раскрываемые антитела также можно изменять так, чтобы они характеризовались паттерном гликозилирования, который отличается от природного паттерна. Например, можно удалять один или несколько углеводных фрагментов и/или можно добавлять один или несколько сайтов гликозилирования. Добавление сайтов гликозилирования к раскрываемым в настоящем изобретении фрагментам антител можно осуществлять путем изменения аминокислотной последовательности так, чтобы она содержала известные из уровня техники консенсусные последовательности сайтов гликозилирования. Другие средства увеличения количества углеводных фрагментов на фрагментах антител заключаются в химическом или ферментативном связывании гликозидов с аминокислотными остатками антитела. Такие способы описаны в WO 87/05330 и в Aplin et al. (1981) CRC Crit. Rev. Biochem., 22: 259-306. Удаление любых углеводных фрагментов из антител можно осуществлять химическими или ферментативными способами, например, как описано у Hakimuddin et al. (1987) Arch. Biochem. Biophys., 259: 52 и Edge et al. (1981) Anal. Biochem., 118: 131, а также у Thotakura et al. (1987) Meth. Enzymol., 138: 350. Фрагменты антител также можно метить детектируемой или функциональной меткой. Детектируемые метки включают радиоактивные метки, такие как 131I или 99Tc, которые также можно присоединять к фрагментам антител с помощью традиционных химических способов. Детектируемые метки также включают ферментативные метки, такие как пероксидаза хрена или щелочная фосфатаза. Детектируемые метки дополнительно включают химические фрагменты, такие как биотин, которые можно детектировать путем связывания с конкретным когнатным детектируемым фрагментом, например меченым авидином.
[00174] Объемом настоящего изобретения охватываются антигенсвязывающие домены, у которых последовательности CDR отличаются лишь несущественно от изложенных в данном документе. Как правило, аминокислоту заменяют родственной аминокислотой, имеющей схожие зарядовые, гидрофобные или стереохимические характеристики. Такие замены будут в компетенции специалиста в данной области техники. В отличие от CDR, в FR можно вносить более существенные изменения без отрицательного эффекта в отношении свойств связывания антитела. Изменения в FR включают без ограничения гуманизирование определенных остатков не относящихся к человеческим или сконструированных каркасов, которые важны для контакта с антигеном или для стабилизации сайта связывания, например, изменение класса или подкласса константной области, изменение конкретных аминокислотных остатков, которые могут изменять эффекторную функцию, такую как связывание с Fc-рецептором, например, как описано в патенте США №№ 5624821 и 5648260, а также в Lund et al. (1991) J. Immun. 147: 2657-2662 и в Morgan et al. (1995) Immunology 86: 319-324, или изменение вида, из которого получена константная область.
[00175] Специалист в данной области техники поймет, что описанные выше модификации, которые могут быть применены к описываемым в данном документе белковым субъединицам, не являются всеобъемлющими, и что для специалиста в данной области техники в свете идей настоящего изобретения имеется возможность осуществления многих других модификаций.
[00176] Аффинность и специфичность антитела к FLT3L
[00177] Специалист в данной области техники поймет, что антитела к FLT3L для применения при аутоиммунном заболевании должны обладать высокоаффинным связыванием, но при этом не должны обладать токсичностью, которая препятствует их применению у людей. Структурно схожие гомологи FLT3L включают фактор стволовых клеток (SCF, также известный как KIT-лиганд) и колониестимулирующий фактор 1 (CSF1, также известный как макрофагальный колониестимулирующий фактор "M-CSF"). Неспецифическое антитело к FLT3L, которое связывает FLT3L, а также связывает SCF и CSF1, может привести к развитию обусловленной нецелевым действием токсичности. Поэтому антитела к FLT3L по настоящему изобретению сохраняют специфичность связывания только в отношении FLT3L, но не со структурно схожими цитокинами, такими как SCF и CSF1. Специалист в данной области будет знать, как использовать без ограничения характеристики кинетики связывания, в том числе Kon, Koff и KD, в качестве показателей специфичности связывания.
[00178] Уровень FLT3L в сыворотке крови и количество pDC в кровотоке являются биомаркерами, которые можно применять в качестве индикатора токсичности, ассоциированной с клонами-лидерами антител к FLT3L. Быстрое снижение количества pDC при нейтрализации FLT3L указывает на подавление FLT3L-опосредованной передачи сигналов, которая усиливает иммунный ответ. Быстрое восстановление частоты встречаемости pDC в присутствии свободного FLT3L может отражать отсутствие токсичности у антитела к FLT3L. В предпочтительном варианте осуществления антитело к FLT3L нейтрализует FLT3L и обеспечивает обратимое уменьшение количества cDC и pDC при возвращении свободного FLT3L. Специалист в данной области техники поймет, что падение количества дендритных клеток при нейтрализации FLT3L с последующим возвратом к исходному уровню свидетельствует о низкой токсичности клона-лидера.
[00179] Получение антитела к FLT3L
[00180] Реализация на практике настоящего изобретения предусматривает использование, если не указано иное, методик молекулярной биологии (в том числе рекомбинантных методик), микробиологии, клеточной биологии, биохимии и иммунологии, которые находятся в компетенции специалиста в данной области техники. Такие методики полностью рассмотрены в литературе, такой как "Molecular Cloning: A Laboratory Manual", second edition (Sambrook, 1989); "Oligonucleotide Synthesis" (Gait, 1984); "Animal Cell Culture" (Freshney, 1987); "Methods in Enzymology" "Handbook of Experimental Immunology" (Weir, 1996); "Gene Transfer Vectors for Mammalian Cells" (Miller and Calos, 1987); "Current Protocols in Molecular Biology" (Ausubel, 1987); "PCR: The Polymerase Chain Reaction", (Mullis, 1994); "Current Protocols in Immunology" (Coligan, 1991). Данные методики применимы для получения полипептидов по настоящему изобретению и, следовательно, могут рассматриваться при создании и реализации на практике настоящего изобретения. Особенно применимые методики для конкретных вариантов осуществления будут рассмотрены в примерах.
[00181] В одном варианте осуществления выделенная молекула нуклеиновой кислоты, кодирующая антитело к FLT3L или его антигенсвязывающий фрагмент, функционально связана с одной или несколькими контролирующими последовательностями для обеспечения экспрессии в клетке-хозяине. Выделенную нуклеиновую кислоту можно с помощью рекомбинантных способов включать в вектор, которым, в свою очередь, трансфицируют клетку-хозяина с использованием известных методик.
[00182] В одном варианте осуществления в данном документе предусмотрены клетки-хозяева, трансформированные выделенной молекулой нуклеиновой кислоты, кодирующей антитело к FLT3L или его антигенсвязывающий фрагмент, которая функционально связана с одной или несколькими контролирующими последовательностями. Примеры предусматриваемых клеток-хозяев включают клетки млекопитающих, такие как клетки HEK293, клетки мышиной миеломы NS0 или клетки яичника китайского хомяка (CHO).
[00183] В одном варианте осуществления моноклональные антитела к FLT3L (например, CAT5D9, SC4017 или AM40) и их антигенсвязывающие фрагменты можно получать с помощью гибридомных способов, таких как описанные у Kohler and Milstein (1975) Nature 256:495. При использовании гибридомного способа мышь, хомяка или другое подходящее животное-хозяина иммунизируют, как описано выше, для индукции выработки лимфоцитами антител, которые будут специфически связываться с иммунизирующим антигеном.
[00184] В другом варианте осуществления лимфоциты также можно иммунизировать in vitro. После иммунизации лимфоциты выделяют и подвергают слиянию с подходящей линией миеломных клеток с применением, например, полиэтиленгликоля с получением гибридомных клеток, которые затем можно подвергать отбору с отделением от не подвергнувшихся слиянию лимфоцитов и миеломных клеток. Гибридомы, которые вырабатывают моноклональные антитела, специфически направленные на выбранный антиген, что определяют с помощью иммунопреципитации, иммуноблоттинга или с помощью анализа связывания in vitro (например, радиоиммуноанализа (RIA); иммуноферментного анализа (ELISA)), затем можно размножать либо в in vitro культуре с помощью стандартных способов (Coding, Monoclonal Antibodies: Principles and Practice, Academic Press, 1986), либо in vivo в виде асцитных опухолей у животного. Затем моноклональные антитела можно очищать от культуральной среды или асцитной жидкости, как описано выше для поликлональных антител.
[00185] Альтернативно, моноклональные антитела к FLT3L (например, CAT5D9, SC4017 или AM40) и их антигенсвязывающие фрагменты также можно получать с использованием способов рекомбинантной ДНК, как описано, например, в патенте США № 4816567. Полинуклеотиды, кодирующие моноклональное антитело, выделяют из зрелых В-клеток или гибридомных клеток, как, например, с помощью RT-PCR с применением олигонуклеотидных праймеров, которые специфично амплифицируют гены, кодирующие тяжелые и легкие цепи антитела, и определяют их последовательность с помощью стандартных процедур. Затем выделенные полинуклеотиды, кодирующие тяжелые и легкие цепи, клонируют в подходящие векторы экспрессии, при этом после трансфекции клеток-хозяев, таких как клетки E. coli, обезьяньи клетки COS, клетки яичника китайского хомяка (CHO) или миеломные клетки, которые в ином случае не вырабатывают иммуноглобулиновый белок, клетками-хозяевами продуцируются моноклональные антитела. Также рекомбинантные моноклональные антитела к FLT3L или их антигенсвязывающие фрагменты требуемого вида можно выделять из библиотек фагового дисплея, экспрессирующих CDR требуемого вида, как описано (McCafferty et al., 1990, Nature, 348:552-554; Clarkson et al., 1991, Nature, 352:624-628 и Marks et al., 1991, J. Mol. Biol., 222:581-597).
[00186] Полинуклеотид(-ы), кодирующие антитело к FLT3L или его антигенсвязывающий фрагмент, можно дополнительно модифицировать рядом различных способов с применением технологии рекомбинантной ДНК для создания альтернативных антител. В некоторых аспектах константные домены легкой и тяжелой цепей, например, мышиного моноклонального антитела можно заменить (1) на соответствующие области, например, человеческого антитела с получением химерного антитела или (2) на не являющийся иммуноглобулином полипептид с получением слитого антитела. В некоторых аспектах константные области подвергают усечению или удалению с получением требуемого фрагмента моноклонального антитела. Для оптимизации специфичности, аффинности и т.д. моноклонального антитела в отношении вариабельной области можно применять сайт-направленный мутагенез или мутагенез высокой плотности.
[00187] В определенных аспектах антитело к FLT3L или его антигенсвязывающий фрагмент представляют собой человеческое антитело или его антигенсвязывающий фрагмент. Человеческие антитела можно непосредственно получать с использованием различных методик, известных из уровня техники. Можно получать иммортализованные В-лимфоциты человека, иммунизированные in vitro или выделенные от иммунизированного индивидуума, которые продуцируют антитело, направленное на целевой антиген (см, например, Cole et al., Monoclonal Antibodies and Cancer Therapy, Alan R. Liss, p. 77 (1985); Boemer et al., 1991, J. Immunol., 147 (l):86-95 и патент США № 5750373).
[00188] Также, человеческое антитело к FLT3L или его антигенсвязывающий фрагмент можно отбирать из фаговой библиотека, при этом такая фаговая библиотека экспрессирует человеческие антитела, как описано, например, в Vaughan et al., 1996, Nat. Biotech., 14:309-314, Sheets et al., 1998, Proc. Nat'l. Acad. Sci., 95:6157-6162, Hoogenboom and Winter, 1991, J. Mol. Biol., 227:381 и Marks et al., 1991, J. Mol. Biol., 222:581). Методики создания и применения фаговых библиотек антител также описаны в патентах США №№ 5969108, 6172197, 5885793, 6521404; 6544731; 6555313; 6582915; 6593081; 6300064; 6653068; 6706484 и 7264963 и в Rothe et al., 2007, J. Mol. Bio., doi:10.1016/j.jmb.2007.12.018 (каждый из которых включен посредством ссылки во всей своей полноте).
[00189] Стратегии созревания аффинности и стратегии перетасовки цепей (Marks et al., 1992, Bio/Technology 10:779-783, включенная посредством ссылки во всей своей полноте) известны из уровня техники, и их можно использовать для создания высокоаффинных антител человека или их антигенсвязывающих фрагментов.
[00190] В некоторых аспектах моноклональное антитело к FLT3L может представлять собой гуманизированное антитело. Также можно использовать способы конструирования, гуманизации или изменения поверхности антител, отличных от человеческих, и антител человека, и они хорошо известны в данной области техники. Гуманизированное, подвергнутое изменению поверхности или аналогичным образом сконструированное антитело может иметь один или несколько аминокислотных остатков, происходящих из источника, который не относится к человеку, например, без ограничения из мыши, крысы, кролика, отличного от человека примата или другого млекопитающего. Эти отличные от человеческих аминокислотные остатки заменяют остатками, которые зачастую называют "импортными" остатками, которые обычно взяты из "импортного" вариабельного, константного или другого домена известной человеческой последовательности. Такие импортированные последовательности можно применять для уменьшения иммуногенности или уменьшения, усиления или модификации связывания, аффинности, скорости ассоциации, скорости диссоциации, авидности, специфичности, периода полужизни или любой другой подходящей характеристики, как известно в данной области техники. В целом, остатки в CDR непосредственно и наиболее существенно вовлечены в оказание влияния на связывание с FLT3L. Следовательно, сохраняют часть или все отличные от человеческих или человеческие последовательности CDR, тогда как отличные от человеческих последовательности вариабельной и константной областей можно заменять человеческими или другими аминокислотами.
[00191] Антитела также необязательно могут быть гуманизированными, подвергнутыми изменению поверхности, сконструированными или антителами человека, сконструированными с сохранением высокой аффинности в отношении антигена FLT3L и других благоприятных биологических свойств. Для достижения этой цели гуманизированные (или человеческие) или сконструированные антитела к FLT3L и подвергнутые изменению поверхности антитела можно необязательно получать в ходе процедуры анализа исходных последовательностей и различных концептуальных гуманизированных и сконструированных продуктов с использованием трехмерных моделей исходных, сконструированных и гуманизированных последовательностей. Трехмерные модели иммуноглобулинов являются общедоступными и известны специалистам в данной области техники. Доступны компьютерные программы, которые иллюстрируют и отображают возможные трехмерные конформационные структуры выбранных последовательностей кандидатных иммуноглобулинов. Оценка этих отображений делает возможным анализ вероятной роли остатков в функционировании последовательности кандидатного иммуноглобулина, т.е. анализ остатков, которые влияют на способность кандидатного иммуноглобулина связывать свой антиген, такой как FLT3L. Таким образом можно отбирать остатки каркасной (FW) области и объединять их с остатками из консенсусной и импортной последовательностей, так чтобы достигалась требуемая характеристика антитела, такая как повышенная аффинность в отношении целевого(-ых) антигена(-ов).
[00192] Гуманизацию, изменение поверхности или конструирование антител к FLT3L или их антигенсвязывающих фрагментов можно проводить с помощью любого известного способа, как, например, без ограничения описанные в Jones et al., Nature 321:522 (1986); Riechmann et al., Nature 332:323 (1988); Verhoeyen et al., Science 239: 1534 (1988)), Sims et al., J. Immunol. 151 : 2296 (1993); Chothia and Lesk, J. Mol. Biol. 196:901 (1987), Carter et al., Proc. Natl. Acad. Sci. U.S.A. 89:4285 (1992); Presta et al., J. Immunol. 151:2623 (1993), патентах США №№ 5639641, 5723323; 5976862; 5824514; 5817483; 5814476; 5763192; 5723323; 5766886; 5714352; 5955358; 6204023; 6180370; 6331431; 5693762; 5530101; 5585089; 5225539; 4816567; 5969108; 7635666; 7723270; 7557189; 7538195 и 7342110; международных патентных заявках №№ PCT/US98/16280; PCT/US91/05939; PCT/US94/01234; PCT/GB92/01755; публикациях международных патентных заявок №№ WO90/14443; WO90/14424; WO90/14430 и публикации заявки на европейский патент № EP 229246; каждая из которых полностью включена в данный документ посредством ссылки, в том числе упомянутые в них ссылочные материалы.
[00193] Гуманизированные антитела к FLT3L и их антигенсвязывающие фрагменты также можно получать в организме трансгенных мышей, содержащих иммуноглобулиновые локусы человека, которые способны при иммунизации продуцировать полный репертуар антител человека при отсутствии продуцирования эндогенных иммуноглобулинов. Этот подход описан в патентах США №№ 5545807; 5545806; 5569825; 5625126; 5633425 и 5661016.
[00194] В определенных аспектах предусмотрен фрагмент антитела к FLT3L. Известны различные методики получения фрагментов антител. Традиционно эти фрагменты получают путем протеолитического расщепления интактных антител (например, Morimoto et al., 1993, Journal of Biochemical and Biophysical Methods 24: 107-117; Brennan et al., 1985, Science, 229:81). В определенных аспектах фрагменты антитела к FLT3L получают рекомбинантным способом. Все из Fab, Fv и scFv могут экспрессироваться у E. coli и секретироваться из нее или других клеток-хозяев, что позволяет получать большие количества этих фрагментов. Такие фрагменты антитела к FLT3L также можно выделять из рассмотренных выше фаговых библиотек антител. Фрагменты антитела к FLT3L также могут представлять собой линейные антитела, как описано в патенте США № 5641870. Для специалиста в данной области техники будут очевидны и другие методики получения фрагментов антител, например химический синтез.
[00195] Согласно настоящему изобретению методики можно адаптировать для получения одноцепочечных антител, специфичных в отношении FLT3L (см, например, патент США № 4946778). Кроме того, способы можно адаптировать для конструирования библиотек экспрессии Fab (см, например, Huse et al., Science 246: 1275-1281 (1989)) с целью обеспечения быстрой и эффективной идентификации моноклональных Fab-фрагментов с требуемой специфичностью в отношении FLT3L или их производных, фрагментов, аналогов или гомологов. С помощью известных в данной области техники методик можно получать фрагменты антител, включая без ограничения (а) F(ab')2-фрагмент, получаемый путем пепсинового расщепления молекулы антитела; (b) Fab-фрагмент, получаемый путем восстановления дисульфидных мостиков фрагмента F(ab')2, (c) Fab-фрагмент, получаемый путем обработки молекулы антитела папаином и восстановителем, и (d) Fv-фрагменты.
[00196] Антитело к FLT3L или его антигенсвязывающий фрагмент, раскрытые в данном документе, можно модифицировать с целью увеличения их периода полужизни в сыворотке. Это можно осуществлять, например, путем включения эпитопа связывания рецептора реутилизации в антитело или фрагмент антитела посредством мутирования соответствующей области в антителе или фрагменте антитела или посредством включения эпитопа в пептидную метку, которую затем сливают с антителом или фрагментом антитела либо на конце, либо в середине (например, посредством синтеза ДНК или пептидного синтеза), или посредством мутации YTE. В данной области техники известны и другие способы увеличения периода полужизни антитела или его антигенсвязывающего фрагмента в сыворотке крови, например, конъюгация с гетерологичной молекулой, такой как PEG.
[00197] Фармацевтические композиции
[00198] Настоящее изобретение также направлено на фармацевтические композиции, содержащие раскрытые в данном документе антитела к FLT3L или их антигенсвязывающие фрагменты. В определенных вариантах осуществления в настоящем изобретении предусмотрено применение раскрытого в данном документе антитела к FLT3L или его антигенсвязывающего фрагмента в изготовлении лекарственного препарата для лечения субъекта.
[00199] Следует вводить эффективное количество фармацевтической композиции по настоящему изобретению, при этом "эффективное количество" определяют как количество, которое является достаточным для получения требуемого профилактического, терапевтического или облегчающего ответа у субъекта. Эффективное количество будет варьировать в зависимости от видовой принадлежности и массы субъекта, в отношении которого выполняется введение, но его можно установить с помощью стандартных методик.
[00200] В определенных аспектах в настоящем изобретении предусмотрены терапевтические и профилактические композиции для применения у нуждающихся в этом субъектов при лечении или предупреждении (уменьшения вероятности) развития аутоиммунных заболеваний, в том числе без ограничения системной красной волчанки, миозита, первичного синдрома Шегрена, рассеянного склероза, увеита, псориаза или ревматоидного артрита.
[00201] В некоторых вариантах осуществления фармацевтическая композиция по настоящему изобретению содержит раскрытые в данном документе антитело к FLT3L или его антигенсвязывающий фрагмент и один или несколько фармацевтически приемлемых носителей, разбавителей или вспомогательных веществ. В этом отношении "фармацевтически приемлемые носители, разбавители или вспомогательные вещества" включают без ограничения любые вспомогательное средство, носитель, вспомогательное вещество, вещество, способствующее скольжению, подслащивающее средство, разбавитель, консервант, краситель/красящее вещество, усилитель вкуса, поверхностно-активное вещество, смачивающее средство, диспергирующее средство, суспендирующее средство, стабилизатор, средство для обеспечения изотоничности, растворитель или эмульгатор, которые могли быть одобрены или не одобрены Управлением по контролю за продуктами и лекарствами США как приемлемые для применения у людей или домашних животных. Например, подходящие носители известны специалистам в данной области техники и включают стабилизаторы, разбавители и буферы. Подходящие стабилизаторы включают углеводы, такие как сорбит, лактоза, маннит, крахмал, сахароза, декстран и глюкоза, а также белки, такие как альбумин или казеин. Подходящие разбавители включают солевой раствор, сбалансированный солевой раствор Хенкса и раствор Рингера. Подходящие буферы включают фосфат щелочного металла, карбонат щелочного металла или карбонат щелочноземельного металла.
[00202] В определенных аспектах фармацевтические композиции по настоящему изобретению могут дополнительно содержать одно или несколько вспомогательных материалов, таких как один или несколько липидов, фосфолипидов, углеводов и липополисахаридов. В некоторых вариантах осуществления фармацевтические композиции по настоящему изобретению необязательно содержат одно или несколько дополнительных активных веществ.
[00203] В определенных случаях фармацевтические композиции по настоящему изобретению можно получать посредством методик, известных специалистам в данной области техники. Общие подходы в отношении составления и/или изготовления фармацевтических композиций можно найти, например, в Remington: The Science and Practice of Pharmacy 21st ed., Lippincott Williams & Wilkins, 2005 (включенной в данный документ посредством ссылки во всей своей полноте). Как правило, антитело к FLT3L или его антигенсвязывающий фрагмент по настоящему изобретению смешивают с носителем с получением раствора, суспензии или эмульсии. Одну или несколько из рассматриваемых в данном документе добавок можно добавлять в носитель или можно добавить впоследствии. Фармацевтические композиции по настоящему изобретению могут представлять собой водный раствор, эмульсию или суспензию или могут быть представлены в виде высушенного препарата. В определенных аспектах фармацевтические композиции по настоящему изобретению в целях хранения или составления можно подвергать десикации или лиофилизации, например, путем сублимационной сушки или распылительной сушки. Затем их можно растворять с получением жидких композиций путем добавления подходящего жидкого носителя или вводить в сухом составе с помощью способов, известных специалистам в данной области техники.
[00204] Фармацевтические композиции по настоящему изобретению можно вводить субъекту различными известными в данной области техники способами. Иллюстративные пути введения таких фармацевтических композиций включают пероральный, чрезслизистый, местный, трансдермальный, ингаляционный, парентеральный, подъязычный, трансбуккальный, ректальный, вагинальный и интраназальный. Так, в определенных вариантах осуществления фармацевтическую композицию по настоящему изобретению составляют для введения путями, выбранными из группы, состоящей из перорального, местного, трансдермального, ингаляционного, парентерального, подъязычного, трансбуккального, ректального, вагинального и интраназального путей. Термин парентеральный, используемый в данном документе, включает методики подкожных инъекций, внутривенных, внутримышечных, интрастернальных инъекций или инфузий. В определенных аспектах фармацевтические композиции по настоящему изобретению составляют таким образом, чтобы содержащееся в нем антитело к FLT3L или его антигенсвязывающий фрагмент по настоящему изобретению были биодоступными при введении субъекту.
[00205] Выбор способа введения фармацевтической композиции будет зависеть от выбранного состава. Фармацевтические композиции по настоящему изобретению вводят способом, совместимым с дозированным составом, и в таком количестве, которое будет терапевтически эффективным. В определенных аспектах фармацевтическую композицию по настоящему изобретению составляют в виде препаратов в твердой, полутвердой, жидкой или газообразной форме, включая без ограничения таблетки, капсулы, порошки, гранулы, мази, растворы, суппозитории, препараты для инъекции, препараты для ингаляции, гели, микросферы и аэрозоли.
[00206] В определенных случаях фармацевтическая композиция, содержащая раскрытые в данном документе антитело к FLT3L или его антигенсвязывающий фрагмент, может быть представлена в форме твердого вещества или жидкости. В некоторых аспектах носитель(-и) представлен(-ы) в виде частиц, так что композиции представлены, например, в виде таблетки или порошка. В других аспектах носитель(-и) являются жидкими, причем композиция представляет собой, например, пероральный сироп, инъекционную жидкость или аэрозоль, который применим, например, при ингаляционном введении. Если она предназначена для перорального введения, фармацевтическая композиция, содержащая раскрытые в данном документе антитело к FLT3L или его антигенсвязывающий фрагмент, представлена либо в твердой, либо в жидкой форме, при этом в рассматриваемые в данном документе в качестве либо твердой, либо жидкой формы включены полутвердые, полужидкие, суспензионные и гелевые формы.
[00207] В определенных аспектах в качестве твердой композиции для перорального введения фармацевтическую композицию, содержащую раскрытые в данном документе антитело к FLT3L или его антигенсвязывающий фрагмент, можно составлять в виде порошка, гранулы, спрессованной таблетки, пилюли, капсулы, жевательной резинки, облатки или аналогичной формы. В некоторых случаях такая твердая композиция обычно будет содержать один или несколько инертных разбавителей или пищевых носителей. В определенных вариантах осуществления дополнительно может присутствовать одно или несколько из следующего: связующих, таких как карбоксиметилцеллюлоза, этилцеллюлоза, микрокристаллическая целлюлоза, трагакантовая камедь или желатин; вспомогательных веществ, таких как крахмал, лактоза или декстрины, разрыхлителей, таких как альгиновая кислота, альгинат натрия, примогель, кукурузный крахмал и т.п.; смазывающих веществ, таких как стеарат магния или стеротекс; веществ, способствующих скольжению, таких как коллоидный диоксид кремния; подслащивающих средств, таких как сахароза или сахарин; ароматизатора, такого как мята перечная, метилсалицилат или апельсиновый ароматизатор; а также красящего средства.
[00208] Такие композиции могут быть представлены в форме микросфер, растворов, суспензий, таблеток, пилюль, капсул, составов с замедленным высвобождением или порошков и содержать от приблизительно 0,001 до 95% раскрытого в данном документе антитела к FLT3L или его антигенсвязывающего фрагмента. Некоторые лекарственные формы могут содержать от 50 мкг до 250 мкг антитела к FLT3L или его антигенсвязывающего фрагмента.
[00209] В некоторых аспектах, если фармацевтическая композиция по настоящему изобретению представлена в форме капсулы, например желатиновой капсулы, то она может содержать, помимо раскрытых в данном документе материалов, жидкий носитель, такой как полиэтиленгликоль или масло. Пероральные составы могут также включать обычно используемые вспомогательные вещества, такие как, например, фармацевтические сорта сахарина, целлюлозы и карбоната магния.
[00210] В других аспектах фармацевтическая композиция по настоящему изобретению представлена в форме жидкости, например, эликсира, сиропа, раствора, эмульсии или суспензии. В определенных вариантах осуществления жидкость может предназначаться для перорального введения или для доставки путем инъекции. В определенных вариантах осуществления, в случае если фармацевтические композиции по настоящему изобретению предназначены для перорального введения, они содержат, помимо раскрытых в данном документе антитела к FLT3L или его антигенсвязывающего фрагмента, одно или несколько из подслащивающего средства, консервантов, пигмента/красящего вещества и усилителя вкуса. В определенных аспектах в фармацевтическую композицию, предназначенную для введения с помощью инъекции, можно включать одно или несколько из поверхностно-активного вещества, консерванта, смачивающего средства, диспергирующего средства, суспендирующего средства, буфера, стабилизатора и средства для обеспечения изотоничности.
[00211] В определенных случаях жидкие фармацевтические композиции, содержащие раскрытые в данном документе антитело к FLT3L или его антигенсвязывающий фрагмент, независимо от того, представляют ли они собой растворы, суспензии или другие подобные формы, могут включать один или несколько из следующих компонентов: стерильные разбавители, такие как вода для инъекций, солевой раствор, например физиологический раствор, раствор Рингера, изотонический раствор хлорида натрия, нелетучие масла, такие как синтетические моно- или диглицериды, которые могут служить в качестве растворителя или суспендирующей среды, полиэтиленгликоли, глицерин, пропиленгликоль или другие растворители; противобактериальные средства, такие как бензиловый спирт или метилпарабен; антиоксиданты, такие как аскорбиновая кислота или бисульфит натрия; хелатирующие средства, такие как этилендиаминтетрауксусная кислота; буферы, такие как ацетаты, цитраты или фосфаты, и средства для корректировки тоничности, такие как хлорид натрия или декстроза. В некоторых случаях препарат может быть заключен в ампулы, одноразовые шприцы или флаконы с многократными дозами, выполненные из стекла или пластика. В некоторых вариантах осуществления инъекционная фармацевтическая композиция предпочтительно является стерильной.
[00212] В других вариантах осуществления фармацевтическая композиция, содержащая раскрытые в данном документе антитело к FLT3L или его антигенсвязывающий фрагмент, может быть предназначена для местного применения, в случае чего носитель может предпочтительно представлять собой основу в виде раствора, эмульсии, мази или геля. В определенных аспектах основа, например, может содержать одно или несколько из следующего: вазелин, ланолин, полиэтиленгликоли, пчелиный воск, минеральное масло, разбавители, такие как вода и спирт, а также эмульгаторы и стабилизаторы. В других аспектах в фармацевтической композиции для местного применения могут присутствовать загустители. В определенных вариантах осуществления, в случае если фармацевтическая композиция предназначена для трансдермального введения, фармацевтическую композицию на основе раскрытых в данном документе антитела к FLT3L или его антигенсвязывающего фрагмента можно включать в трансдермальный пластырь или устройство для ионтофореза.
[00213] В еще других вариантах осуществления фармацевтическая композиция, содержащая раскрытые в данном документе антитело к FLT3L или его антигенсвязывающий фрагмент, предназначена для ректального введения в форме, например, суппозитория. В случае суппозиториев связующие и носители могут включать, например, полиалкиленгликоли или триглицериды. В определенных случаях композиция для ректального введения содержит маслянистую основу в качестве подходящего нераздражающего вспомогательного вещества. Такие основы включают без ограничения ланолин, какао-масло или полиэтиленгликоль.
[00214] В других аспектах фармацевтическая композиция, содержащая раскрытые в данном документе антитело к FLT3L или его антигенсвязывающий фрагмент, содержит дозированные единицы, которые можно вводить в виде аэрозоля. Термин аэрозоль применяют для обозначения множества систем, начиная с систем коллоидной природы и заканчивая системами, состоящими из упаковок под давлением. В определенных вариантах осуществления доставку осуществляют с помощью сжиженного или сжатого газа или подходящей насосной системы, которая дозирует активные ингредиенты. В некоторых вариантах осуществления для доставки активного(-ых) ингредиента(-ов) аэрозоли раскрытого в данном документе антитела к FLT3L или его антигенсвязывающего фрагмента можно доставлять в однофазной, двухфазной или трехфазной системах. В других вариантах осуществления доставка аэрозоля предусматривает наличие необходимой емкости, активаторов, клапанов, подъемкостей и тому подобного, которые совместно могут образовывать набор. Специалист в данной области техники без труда сможет определить конкретные аэрозольные составы и способы их доставки.
[00215] Фармацевтические композиции по настоящему изобретению можно вводить в подходящем нетоксичном фармацевтическом носителе, они могут содержаться в микрокапсулах, микрогранулах и/или могут содержаться в имплантате с замедленным высвобождением.
[00216] В других аспектах фармацевтическая композиция по настоящему изобретению включает материалы, которые образуют покрывающую оболочку вокруг активных ингредиентов. В некоторых случаях материалы, которые образуют покрывающую оболочку, как правило, являются инертными и могут быть выбраны, например, из сахара, шеллака и других энтеросолюбильных средств для нанесения покрытия.
[00217] В еще других аспектах фармацевтические композиции по настоящему изобретению в твердой или жидкой форме включают средство, которое связывается с раскрытыми в данном документе антителом к FLT3L или его антигенсвязывающим фрагментом и тем самым способствует доставке антитела к FLT3L или его антигенсвязывающего фрагмента. В определенных случаях подходящие средства, которые действуют таким образом, включают белок или липосому.
[00218] В определенных аспектах фармацевтические композиции, которые будут вводиться субъекту, представлены в форме одной или нескольких дозированных единиц, при этом, например, одну дозированную единицу может представлять собой таблетка, а емкость с раскрытыми в данном документе антителом к FLT3L или его антигенсвязывающим фрагментом в форме аэрозоля может содержать множество дозированных единиц. Актуальные способы получения таких лекарственных форм известны или будут очевидны для специалистов в данной области техники; например, см. Remington: The Science and Practice of Pharmacy, 20th Edition (Philadelphia College of Pharmacy and Science, 2000). Подлежащая введению композиция в любом случае будет содержать терапевтически эффективное количество раскрытых в данном документе антитела к FLT3L или его антигенсвязывающего фрагмента или их фармацевтически приемлемой соли для содействия в лечении представляющего интерес заболевания или состояния в соответствии с раскрытыми в данном документе идеями.
[00219] В определенных вариантах осуществления фармацевтические композиции по настоящему изобретению содержат одно или несколько дополнительных терапевтически активных веществ. В других вариантах осуществления терапевтически эффективную дозу фармацевтических композиций по настоящему изобретению вводят нуждающемуся в этом субъекту в комбинации с одним или несколькими дополнительными терапевтически активными веществами. Используемый в данном документе термин "комбинация" относится к комбинации, содержащей раскрытые в данном документе антитело к FLT3L или его антигенсвязывающий фрагмент и одно или несколько дополнительных терапевтически активных веществ, каждое из которых можно вводить периодически (последовательно), параллельно или одновременно.
[00220] Для поддержания терапевтических уровней может потребоваться выполнение введения фармацевтических композиций по настоящему изобретению за несколько интервалов. Фармацевтические композиции по настоящему изобретению можно применять в сочетании с другими бактериоцидными или бактериостатическими способами.
[00221] Несмотря на то, что представленные в данном документе описания фармацевтических композиций в основном относятся к фармацевтическим композициям, которые подходят для введения людям, специалисту в данной области техники будет понятно, что такие композиции в целом подходят для введения любым другим субъектам. В определенных аспектах субъект представляет собой млекопитающее. В определенных аспектах млекопитающее включает приматов, таких как люди, нечеловекообразные и человекообразные обезьяны, и отличных от приматов животных, таких как одомашненные животные, в том числе лабораторные животные и домашние животные-компаньоны, а также сельскохозяйственные животные (например, кошки, собаки, свиньи, крупный рогатый скот, овца, козы, лошади, кролики), и отличные от домашних животные, такие как дикие животные, птицы или т.п.
[00222] Противоаутоиммунная/противовоспалительная терапия
[00223] В настоящем изобретении также предусмотрены композиции и способы, которые применимы для лечения аутоиммунных и/или других воспалительных заболеваний (т.е. заболеваний, связанных со сверхреактивной и/или ненадлежащим образом функционирующей иммунной системой), предусматривающие антитела к FLT3L, такие как описанные выше. В различных вариантах осуществления антитела к FLT3L можно вводить в комбинации с другими иммунорегуляторными лекарственными средствами, предназначенными для подавления или ослабления активности иммунной системы субъекта или специфического иммунного ответа на конкретный антиген или группу антигенов и, тем самым, уменьшения или предупреждения развития аутоиммунного или другого воспалительного заболевания.
[00224] Дополнительно, в данном документе представлены способы лечения аутоиммунного и/или других воспалительных заболеваний, включающие введение одного или нескольких антител к FLT3L. Как показано в данном документе, введение антител к FLT3L может приводить к по меньшей мере одному из снижения иммунного ответа, экспрессии участников одного или нескольких иммунологических сигнальных каскадов или уменьшения популяций иммунных клеток. В определенных аспектах пациенту или субъекту, страдающему аутоиммунным заболеванием или другим воспалительным заболеванием, вводят антитело к FLT3L.
[00225] Лечение средством терапии аутоиммунного и/или другого воспалительного заболевания, предусматривающее применение антитела к FLT3L, приводит, например, к уменьшению скорости прогрессирования аутоиммунного заболевания или воспалительного заболевания, замедлению или стабилизации пролиферации иммунных клеток, уменьшению размера очага поражения (например, как в случае пациентов с MS) и/или регрессу заболевания. В некоторых аспектах показатели, с помощью которых измеряют уменьшение или замедление развития аутоиммунного заболевания или воспалительного заболевания (например, уменьшенное воспаление, уменьшенные уровни воспалительных цитокинов, популяций иммунных клеток и/или связанного с ними повреждения, такого как очаги поражения тканей), могут быть статистически значимыми. Уменьшение показателей аутоиммунного заболевания или воспалительного заболевания можно измерять путем сравнения с уровнем показателей пациента на исходном уровне (до начала лечения) относительно ожидаемого уровня прогрессирования заболевания у индивидуума, относительно ожидаемого уровня прогрессирования заболевания на основе большой группы пациентов, или относительно ожидаемого уровня прогрессирования заболевания у контрольной группы.
[00226] В одном варианте осуществления предусмотренный в данном документе способ лечения включает применение или введение FLT3L-связывающей молекулы, антитела или его антигенсвязывающего фрагмента, варианта или производного по настоящему изобретению, выполняемые в отношении субъекта или пациента, или применение или введение FLT3L-связывающей молекулы, выполняемые в отношении выделенной ткани или клеточной линии от субъекта или пациента, где у субъекта или пациента присутствует заболевание, симптом заболевания или предрасположенность к развитию заболевания.
[00227] Предусматриваемые заболевания включают острые или хронические воспалительные заболевания, в том числе диабет 1-го типа и 2-го типа, CKD, в том числе, например, CKD, развившееся на фоне диабета, диабетической нефропатии и высокого кровяного давления; атеросклероз, болезнь Альцгеймера, рак и ассоциированные осложнения таких заболеваний, в том числе заболевание сердца, гипертония, анемия, перикардит, почечная остеодистрофия и другие. Дополнительные предусматриваемые заболевания включают аутоиммунные заболевания, включая без ограничения системную красную волчанку, миозит, первичный синдром Шегрена, рассеянный склероз, увеит, псориаз и ревматоидный артрит.
[00228] В другом варианте осуществления лечение также предусматривает применение или введение фармацевтической композиции, содержащей FLT3L-связывающую молекулу, например антитело или его антигенсвязывающий фрагмент, вариант или производное по настоящему изобретению, выполняемые в отношении субъекта или пациента, или применение или введение фармацевтической композиции, содержащей FLT3L-связывающую молекулу, выполняемые в отношении выделенной ткани или клеточной линии от субъекта или пациента, у которого присутствует заболевание, симптом заболевания или предрасположенность к развитию заболевания.
[00229] В соответствии со способами по настоящему изобретению по меньшей мере одно антитело к FLT3L, определение которому дано в других разделах данного документа, применяют для стимулирования положительного терапевтического ответа в отношении аутоиммунного или воспалительного заболевания. Термин "положительный терапевтический ответ" обозначает уменьшение симптомов, связанных с аутоиммунным или воспалительным заболеванием. Так, например, улучшение течения заболевания может характеризоваться полным ответом. Под "полным ответом" подразумевают отсутствие клинически выявляемого заболевания с нормализацией всех ранее полученных результатов проведенных тестов. Альтернативно, улучшение течения заболевания можно категоризировать как частичный ответ. "Положительный терапевтический ответ" охватывает уменьшение или подавление прогрессирования и/или продолжительности течения аутоиммунного или воспалительного заболевания, уменьшение или облегчения тяжести аутоиммунного или воспалительного заболевания и/или облегчение одного или нескольких их симптомов, происходящие в результате введения раскрытой в данном документе FLT3L-связывающей молекулы.
[00230] В определенных вариантах осуществления предусмотрен способ лечения первичного синдрома Шегрена, включающий введение нуждающемуся в этом субъекту фармацевтически эффективного количества раскрытых в данном документе антитела или его антигенсвязывающего фрагмента.
[00231] В других вариантах осуществления предусмотрен способ лечения миозита, включающий введение нуждающемуся в этом субъекту фармацевтически эффективного количества раскрытых в данном документе антитела или его антигенсвязывающего фрагмента.
[00232] В определенных вариантах осуществления предусмотрен способ лечения системной красной волчанки (SLE), включающий введение нуждающемуся в этом субъекту фармацевтически эффективного количества раскрытых в данном документе антитела или его антигенсвязывающего фрагмента. В некоторых аспектах субъект характеризуется повышенными уровнями FLT3L в сыворотке крови, измеренными по частоте встречаемости FLT3L-экспрессирующих CD4+ T-клеток, по сравнению со здоровым субъектом.
[00233] В некоторых вариантах осуществления предусмотрен способ диагностики системной красной волчанки (SLE) у субъекта, включающий (а) измерение уровней FLT3L в сыворотке крови или (b) измерение частоты встречаемости FLT3L-экспрессирующих CD4+ T-клеток, где повышенные уровни FLT3L в сыворотке крови или повышенная частота встречаемости FLT3L-экспрессирующих CD4+ T-клеток у субъекта по сравнению со здоровым донором указывает на то, что у субъекта имеется SLE. В определенных аспектах CD4+ T-клетки представляют собой эффекторные клетки памяти (TEM).
[00234] В некоторых вариантах осуществления предусмотрен способ нейтрализации мембраносвязанного FLT3L у нуждающегося в этом субъекта, при этом способ включает введение субъекту фармацевтически эффективного количества раскрытых в данном документе антитела или его антигенсвязывающего фрагмента. В определенных аспектах FLT3L обратимо нейтрализуют, с тем чтобы активность мембраносвязанного FLT3L могла вернуться к "имеющимся до осуществления введения" уровням.
[00235] В других вариантах осуществления предусмотрен способ нейтрализации растворимого FLT3L у нуждающегося в этом субъекта, при этом способ включает введение субъекту фармацевтически эффективного количества раскрытых в данном документе антитела к FLT3L или его антигенсвязывающего фрагмента. В определенных аспектах FLT3L обратимо нейтрализуют, с тем чтобы уровни растворимого FLT3L могли вернуться к "имеющимся до осуществления введения" уровням.
[00236] В конкретных вариантах осуществления способ нейтрализации растворимого FLT3L дополнительно включает подкожное введение субъекту антитела к FLT3L или его антигенсвязывающего фрагмента один раз в неделю в диапазоне от приблизительно 0,03 мг/кг до приблизительно 30 мг/кг. В других вариантах осуществления способ дополнительно включает подкожное введение субъекту антитела к FLT3L или его антигенсвязывающего фрагмента один раз в четыре недели в дозе приблизительно 150 мг/кг.
[00237] В других вариантах осуществления предусмотрен способ уменьшения популяций классических дендритных клеток (cDC) и плазмоцитоидных дендритных клеток (pDC) в кровотоке у нуждающегося в этом субъекта, при этом способ включает введение субъекту фармацевтически эффективного количества раскрытых в данном документе антитела или его антигенсвязывающего фрагмента. В определенных аспектах популяции cDC и pDC подвергают обратимому уменьшению, с тем чтобы популяции cDC и pDC были способны вернуться к имевшимся до осуществления введения уровням.
[00238] В определенных вариантах осуществления предусмотрен способ уменьшения экспрессии FLT3L на поверхности CD4+ T-клеток, включающий введение нуждающемуся в этом субъекту фармацевтически эффективного количества раскрытых в данном документе антитела или его антигенсвязывающего фрагмента.
[00239] В других вариантах осуществления предусмотрен способ уменьшения процентной доли CD4+ T-клеток, экспрессирующих FLT3L, включающий введение нуждающемуся в этом субъекту фармацевтически эффективного количества раскрытых в данном документе антитела или его антигенсвязывающего фрагмента.
[00240] В других вариантах осуществления предусмотрен способ уменьшения передачи сигналов ERK в лимфобласте, включающий приведение лимфобласта в контакт с раскрытыми в данном документе антителом или его антигенсвязывающим фрагментом.
[00241] В определенных вариантах осуществления предусмотрен способ уменьшения уровня фосфорилирования MEK 1/2 в первичных CD133+ стволовых клетках человека, включающий приведение стволовых клеток в контакт с раскрытыми в данном документе антителом или его антигенсвязывающим фрагментом.
[00242] Последующие примеры приведены с целью предоставления специалистам в данной области техники полного раскрытия и описания того, как создавать и применять способы анализа, скрининга и лечения по настоящему изобретению, и они не предназначены для ограничения объема того, что авторы настоящего изобретения считают своим изобретением.
ПРИМЕРЫ
[00243] Настоящее изобретение описано со ссылкой на последующие примеры. Примеры являются лишь иллюстративными, и настоящее изобретение никоим образом не следует истолковывать как ограниченное этими примерами, а скорее следует истолковывать как охватывающее все без исключения варианты, которые становятся очевидными в результате представленных в данном документе идей.
[00244] ПРИМЕР № 1. СОЗДАНИЕ АНТИТЕЛА К FLT3L
[00245] Обзор
[00246] FLT3L представляет собой не связанный дисульфидными связями гомодимерный гликопротеин весом 65 кДа. Ниже в таблице 2 показана гомология последовательностей лиганда и рецептора у людей, отличных от человека приматов и мыши.
Таблица 2. Идентичность с FLT3 и FLT3L человека
[00247] Хотя гомология полноразмерного белка FLT3L мыши составляет всего 73%, его сайт связывания с FLT3 высоко консервативен среди различных видов. Действительно, FLT3L человека связывает и активирует FLT3 мыши и наоборот. FLT3L обладает структурной гомологией с фактором стволовых клеток (SCF или KIT-лиганд) и колониестимулирующим фактором 1 (CSF1), но не обладает значительной гомологией последовательности с другими цитокинами человека. Рецепторы этих двух лигандов, c-KIT и CSF1R соответственно, также являются TKR III класса, которые обычно взаимодействуют с ингибиторами FLT3, приводя к возникновению нежелательной нецелевой токсичности при клиническом применении. С учетом этих соображений производили поиск антител к FLT3L, которые не будут вступать в перекрестную реакцию с SCF или CSF1, обеспечивая высокоспецифичное подавление сигнального пути FLT3/FLT3L.
[00248] Антитела-лидеры отбирали и тестировали с помощью чередующихся процедур отбора с использованием растворимого FLT3-L человека и мыши. Первичные биохимические высокоэффективные скрининги проводили с использованием результатов конкурентных анализов FLT3/FLT3L человека с гомогенной флуоресценцией с временным разрешением (HTRF). Все случаи соответствия для одноцепочечного вариабельного фрагмента с областью кристаллизующегося фрагмента (scFv-Fc) преобразовывали в формат IgG1 TM, а затем применяли функциональный скрининговый анализ с использованием понижающей регуляции FLT3 на поверхности целевой клетки для подтверждения ингибирующей активности антител-лидеров. Перекрестную реактивность у мыши и яванского макака и селективность в отношении FLT3L, а также исключение других представителей семейства, таких как фактор стволовых клеток (scf), подтверждали с помощью ELISA и функциональных анализов.
[00249] Соединения-лидеры дополнительно оценивали с использованием анализов передачи сигналов с участием FLT3 в линиях клеток RS4;11 и первичных CD133+ стволовых клетках человека. Связывание с эндогенным FLT3L подтверждали с использованием первичных Т-клеток человека. Сайт специфичного связывания и значения аффинности связывания определяли с помощью соответственно Octet и BIAcore. Полученный в резульате клон антитела-лидера отбирали для дополнительной оптимизации, как описано ниже.
[00250] КАМПАНИЯ ПО ВЫЯВЛЕНИЮ КАНДИДАТНЫХ АНТИТЕЛ-ЛИДЕРОВ (C5, B10-11)
[00251] Антитела-лидеры для исследований связывания с FLT3L получали прежде всего путем скрининга фаговых библиотек, как показано на фиг. 1. Библиотеки фагового дисплея, представляющие собой библиотеку клеток костного мозга Vaughan (BMV), объединенную библиотеку клеток селезенки (CS), библиотеку DP47 (DP47) и библиотеку антител человека Dyax, подвергали пэннингу (альтернативному пэннингу или конкурентному пэннингу) в отношении FLT3L человека (huFLT3L) и/или FLT3L мыши (muFLT3L). Вкратце, самостоятельно полученный FLT3L метили биотином с применением набора для мечения биотином EZ-Link Sulfo-NHS-LC-Biotin (Thermo Scientific) в качестве антигена для пэннинга. Пэннинг проводили в течение двух-трех раундов с использованием самостоятельно полученных библиотек scFv, как описано (Xiao X et al., 2017 mAbs 542 9, 996-1006 (2017)). Для усиления перекрестной реактивности между человеком и яванским макаком в некоторых процедурах отбора в качестве антигена для пэннинга поочередно использовали рекомбинантный FLT3L человека и яванского макака. Для отбора антител, подавляющих взаимодействия FLT3L/FLT3, в некоторых экспериментах использовали конкурентный пэннинг. В случае конкурентного пэннинга в качестве антигена для пэннинга использовали FLT3L человека, в то время как в качестве средства для элюирования из фага вместо обычного трипсина использовали избыток (> 100X) FLT3-Fc (Xiao X et al. mAbs 542 9, 996-1006 (2017)).
[00252] Библиотеку BMV обогащали 100-кратно, библиотеку CS обогащали 350-кратно, а библиотеку DP47 обогащали 250-кратно; библиотеку Dyax не подвергали обогащению. В третий раз пэннингу подвергали только фаговые библиотеки BMV и Dyax, что приводило к 100-кратному обогащению фаговой библиотеки BMV и 50-кратному обогащению библиотеки Dyax по сравнению со вторым раундом пэннинга (фиг. 1A).
[00253] Для оценки процентной доли антигенспецифических фагов после каждого раунда отбора проводили ELISA моноклональных фагов. Для высокопроизводительного скрининга обрабатывали только те результаты отбора, которые достигали по меньшей мере 20% положительного показателя. С таким набором критериев продукты третьего раунда пэннинга BMV вместе с продуктами второго раунда пэннинга CS и DP47 встраивали в векторы pSplice V4 и pdLG или pmLG и преобразовывали либо в формат scFv-Fc (Xiao X, et al., PLoS One, 2015 Oct 15;10(10):e0140691. doi: 10.1371/ journal.pone.0140691), либо в формат IgG (Xiao X, et al. mAbs 542 9, 996-1006 (2017)) для функциональных скринингов путем конкурентного HTRF-анализа.
[00254] В случае функционального скрининга клетки FreeStyle 293 (Thermo Scientific) сначала трансфицировали либо конструкциями scFv-Fc, либо конструкциями IgG, преобразованными из продуктов пэннинга. Полученный в результате супернатант использовали непосредственно в анализах подавления взаимодействия FLT3L/FLT3 на основе HTRF. В случае HTRF-анализа 10 нМ меченного биотином FLT3L, 20 нМ криптата европия со стрептавидином (Cisbio), 10 нМ FLT3-mFc и 20 нМ A647 к mFc (Cisbio) смешивали с 10 мкл полученного после трансфекции супернатанта в общем объеме 20 мкл/лунка в 384-луночном планшете Greiner. Результаты считывания при 665 нМ и 620 нМ регистрировали через пять минут после смешивания, а затем с интервалом в один час до стабилизации результатов считывания. Затем рассчитывали соотношения 665 нМ/620 нМ. Уменьшение соотношения указывало на подавление взаимодействия FLT3L/FLT3.
[00255] Продукты пэннинга, полученные при прямом или чередующемся пэннинге антигена, преобразовывали в scFv-Fc, и более 4000 колоний отбирали для высокопроизводительного скрининга (HTS) в HTRF-анализе подавления взаимодействия FLT3L/FLT3-Fc. Выявляли десять антител-лидеров, подвергали преобразованию в IgG-TM и экспрессировали. Антитела повторно тестировали во втором HTRF-анализе подавления взаимодействия, и выявляли десять лидеров. Параллельно, более семисот случаев соответствия по результатам конкурентного пэннинга преобразовывали в PmIgG и экспрессировали в клетках млекопитающих. Преобразованные клоны подвергали тому же HTRF-анализу подавления взаимодействия FLT3L/FLT3-Fc, и были выявлены два лидера (фиг. 1B).
[00256] Десять лидеров, полученных в результате чередующегося пэннинга антигенов, и два лидера, полученных в результате конкурентного пэннинга, экспрессировали и очищали в миллиграммовых количествах для дополнительного тестирования. Дополнительное тестирование включало HTRF-анализ подавления взаимодействия FLT3L/FLT3-Fc, анализы понижающей модуляции рецепторов и подавления передачи сигналов. Лидеры также подвергали эпитоп-специфической сортировке и определению аффинности. В ходе скрининговой кампании выявляли пять антител-лидеров, которые подвергали дополнительному изучению: Dyax3, Dyax5, CAT8, CAT26 и CAT5D9. Результаты конкурентного HTRF-анализа для антител-лидеров показаны на фиг. 1C.
[00257] ПРИМЕР № 2. СКРИНИНГОВЫЙ АНАЛИЗ ПОНИЖАЮЩЕЙ РЕГУЛЯЦИИ FLT3
[00258] После лигирования с FLT3L рецептор FLT3 подвергается димеризации, аутофосфорилированию и активирует передачу сигналов далее по сигнальным путям. В ходе этого поверхностный FLT3 интернализируется и разрушается. Данную характеристику интернализации использовали для разработки анализа для скрининга кандидатных клонов антител-лидеров к FLT3L. Экспрессию FLT3 на клеточной поверхности можно измерять с помощью проточной цитометрии, а подавление связывания рецептора с лигандом можно определять путем количественной оценки изменений уровней экспрессии FLT3 на клеточной поверхности.
[00259] Линии клеток RS4;11, EOL-1, MOLM13 и MV4-11 конститутивно экспрессируют FLT3. Данные клетки культивировали в нормальных условиях и через 2-24 часа культивирования подвергали скринингу в отношении относительного уровня экспрессии FLT3. Для измерения экспрессии FLT3 использовали проточную цитометрию. Вкратце, в экспериментах с проточной цитометрией использовали коммерчески доступный клон BV10A4H2 к CD135 (к FLT3) (Biolegend), а в качестве показателя экспрессии FLT3 регистрировали среднюю интенсивность флуоресценции (MFI). Во всех анализах в качестве положительного контроля для эффективной нейтрализации активности FLT3L применяли коммерчески доступное мышиное моноклональное антитело к FLT3L человека (R&D) или самостоятельно полученную конструкцию huFLT3-Fc.
[00260] RS4;11, линия клеток острого лейкоза (pro-B), характеризовалась постоянной и высокой экспрессией FLT3 в культуре по сравнению с другими коммерчески доступными линиями, которые согласно сообщениям экспрессируют FLT3 (фиг. 2A). Непосредственное связывание FLT3L с FLT3 на клеточной поверхности подтверждали с помощью серийного разведения биотинилированного рекомбинантного huFLT3L (rhuFLT3L), который, после 30 минут инкубации с клетками RS4;11 при 4°C можно детектировать в физически связанном с клеточной поверхностью состоянии с помощью BV421-стрептавидина с последующим анализом проточной цитометрией для определения средней интенсивности флуоресценции (фиг. 2B).
[00261] Наконец, способность rhuFLT3L индуцировать детектируемую понижающую регуляцию FLT3 на клеточной поверхности клеток RS4;11 подтверждали путем инкубации клеток RS4;11 с серийными разведениями FLT3L при 37°C в течение 2 часов. Стабильность условий оценивали с применением 2 различных концентраций клеток RS4;11 (50000 (50 тыс.) и 100000 (100 тыс.) клеток). Понижающую регуляцию FLT3 на клеточной поверхности определяли с применением меченного флуоресцентной меткой антитела к CD135 (клона BV10A4H2). При обоих значениях плотности клеток наблюдали дозозависимую понижающую регуляцию FLT3 на клеточной поверхности через 2 часа после инкубации с huFLT3L. MFI аллофикоцианина (APC), служащий в качестве показателя экспрессии FLT3, подвергался 25-кратному снижению по сравнению с диапазоном huFLT3L, использованным в данном анализе (фиг. 2C). Эти результаты свидетельствовали, что скрининговый анализ был эффективен при измерении дозозависимого ответа биодоступного FLT3L и будет применим для тестирования способности кандидатных клонов функционально нейтрализовать FLT3L. Ответ значимо не отличался независимо от того, использовали ли 50 или 100 тысяч клеток на лунку.
[00262] ОПТИМИЗАЦИЯ СКРИНИНГОВОГО АНАЛИЗА
[00263] Условия скринингового анализа подвергали дополнительному уточнению с целью определения идеальных условий культивирования клеток для оценки кандидатных клонов антител к FLT3L. Конечными условиями были следующие: 50000 клеток RS4;11 на лунку в течение 2 часов в увлажняемом термостате с установленной температурой 37°C, 5% CO2, инкубировали с 96 пМ rhuFLT3L, с кандидатными клонами mAb к FLT3L или без них, в полной среде Roswell Park Memorial Institute (RPMI) с одним процентом бычьего сывороточного альбумина (BSA). Последующую понижающую регуляцию экспрессии FLT3 определяли с помощью проточной цитометрии, результаты измерения которой представляли либо как исходное значение MFI, либо как % понижающей регуляции. Была выбрана концентрация, составляющая 96 пМ rhuFLT3L (EC80), так как это точка, в которой начиналась экспоненциальная фаза кривой зависимости дозы от ответа, и в связи с этим она обеспечивала немедленное отражение любого функционального ингибирования rhuFLT3L по изменениям уровня понижающей регуляции FLT3 на клеточной поверхности клеток RS4;11. (фиг. 3A). Эффективность анализа подтверждали с помощью контроля, который представлял собой коммерчески доступное мышиное антитело к huFLT3L (MAB608, R&D Systems) (фиг. 3B). Ввиду межвидовой реактивности FLT3 со своим лигандом данный анализ, несмотря на то, что его проводили на линии клеток человека, был эффективен для тестирования клонов против FLT3L человека, яванского макака и грызуна. В случае FLT3L мыши EC80 составляла 36 пМ.
[00264] ПРИМЕР № 3. НЕЙТРАЛИЗУЮЩАЯ АКТИВНОСТЬ КАНДИДАТНЫХ АНТИТЕЛ-ЛИДЕРОВ, НАПРАВЛЕННЫХ НА РАСТВОРИМЫЙ FLT3L
[00265] После лигирования FLT3L с FLT3 рецептор подвергается димеризации, аутофосфорилированию и обеспечивает распространение сигнального каскада после интернализации. Этот процесс, измеряемый по понижающей регуляции FLT3, можно подавлять посредством антител, связывающихся с FLT3L. Поэтому кандидаты-лидеры тестировали в отношении их способности подавлять понижающую регуляцию FLT3 на клетках RS4;11 путем связывания растворимого FLT3L (sFLT3L) человека, мыши или яванского макака (макака). Для тестирования нейтрализующей способности кандидатов-лидеров использовали оптимизированный скрининговый анализ. Как описано, клетки RS4;11 (50000 клеток на лунку) инкубировали в течение двух часов в полной RPMI с одним процентом BSA в присутствии FLT3L (96 пМ) либо человека, либо макака или sFLT3L мыши (36 пМ). Вносили серийные разведения каждого клона, а в качестве положительных контролей использовали либо растворимую конструкцию FLT3-Fc, либо коммерчески доступное антитело человека к FLT3L. Экспрессию FLT3 на клетках RS4;11 определяли с помощью проточной цитометрии и регистрировали как MFI.
[00266] Как видно на фиг. 4A и 4B, все клоны антител-лидеров демонстрировали способность в некоторой степени ингибировать sFLT3L как человека, так и макака. Для всех из CAT8, CAT26, Dyax3 и Dyax5 наблюдали схожий уровень ингибирования sFLT3L человека и sFLT3L макака. Хотя и показаны в приведенной ниже таблице 3, значения IC50 для CAT8, CAT26, Dyax3 и Dyax5 не являются адекватными, поскольку значение ICMAX ни в одном из случаев не достигалось.
[00267] В отличие от этого, CAT5D9 достигало показателя ICMAX и обеспечивало получение S-образной кривой, ожидаемой для ингибирования FLT3L (фиг. 4A и 4B). Значения IC50 для CAT5D9, представленные в таблице 3, указывали на перекрестную реактивность с FLT3L человека и макака, но не с FLT3L мыши (фиг. 4C).
ТАБЛИЦА 3. IC50 (нМ) кандидатных антител-лидеров, направленных против 96 пМ sFLT3L человека, макака или мыши.
[00268] ПРИМЕР № 4. СВЯЗЫВАЮЩАЯ АКТИВНОСТЬ КАНДИДАТНЫХ АНТИТЕЛ-ЛИДЕРОВ, НАПРАВЛЕННЫХ ПРОТИВ FLT3L НА КЛЕТОЧНОЙ ПОВЕРХНОСТИ
[00269] FLT3L экспрессируется в виде белка на клеточной мембране и после отщепления циркулирует в кровотоке в виде растворимого белка. Как мембраносвязанная, так и растворимая формы являются биологически активными. Для эффективной блокировки FLT3-опосредованных путей передачи сигналов кандидатные антитела-лидеры должны связывать как растворимые, так и мембраносвязанные формы FLT3L.
[00270] В соответствии с этим связывание на клеточной поверхности с FLT3L человека, макака и мыши оценивали путем трансфекции клеток яичника китайского хомяка (СНО) соответствующим для каждого вида полноразмерным белком. Клоны-лидеры инкубировали с линиями FLT3L-экспрессирующих клеток в течение 1 часа при 4°C перед двукратной промывкой для удаления несвязанного антитела. Затем клетки инкубировали с меченным посредством PE вторичным детектирующим pAb козы к IgG человека для количественной оценки связанного антитела, которое измеряли с помощью анализа проточной цитометрией сигнала от PE. Конструкцию huFLT3-Fc на остове IgG человека использовали в качестве положительного контрольного реагента для экспрессии FLT3L, поскольку она, помимо реакции с лигандом человека, перекрестно реагирует с лигандом макака и мыши.
[00271] Все кандидаты-лидеры связывали FLT3L человека (фиг. 5A), и все, за исключением DYAX5, связывались с FLT3L макака (фиг. 5B). В отличие от этого лишь у Dyax5 и в меньше степени у Dyax3 наблюдали перекрестную реактивность с FLT3L мыши (фиг. 5C).
[00272] Таким образом, у всех кандидатов-лидеров наблюдали способность межвидового связывания FLT3L, хотя и с различной эффективностью. Поскольку различия в степени занятости рецепторов для каждого клона были очевидны, отмечали и учитывали при окончательной оценке как EC50, так и максимальную занятость (выраженную в процентах относительно FLT3-Fc). В таблице 4 представлены результаты для FLT3L человека, макака и мыши, экспрессируемого в клетках CHO.
Таблица 4. EC50 (нМ) и максимальная занятость (% относительно FLT3-Fc)
[00273] ПРИМЕР № 5. СВЯЗЫВАНИЕ КАНДИДАТНЫХ АНТИТЕЛ-ЛИДЕРОВ С ЭНДОГЕННЫМ FLT3L ЧЕЛОВЕКА
[00274] FLT3L экспрессируется на поверхности первичных Т-клеток при стимуляции посредством цитокинов с γ-цепью, а именно IL-2, IL-7 или IL-15, независимо от участия TCR. В примере № 4 кандидатные антитела-лидеры демонстрировали способность связываться с клетками CHO, трансфицированными белком FLT3L человека. Следующей стадией было обеспечение того, чтобы они могли связывать эндогенный FLT3L из линии первичных клеток человека. Поэтому кандидатные антитела-лидеры тестировали в отношении их способности связывать huFLT3L на простимулированных посредством IL-2 первичных T-клетках, полученных от людей-доноров.
[00275] Для индукции экспрессии FLT3L на клеточной поверхности свежевыделенные Т-клетки человека стимулировали посредством 50 нг/мл IL-2 в отсутствие антитела к CD3 (активация Т-клеток антителом к CD3 приводила бы к сбрасыванию FLT3L с клеточной поверхности) в течение 5 дней. После этого периода времени экспрессию на T-клетках подтверждали с применением конструкции на основе человеческого FLT3-Fc (фиг. 6A). Затем серийные разведения каждого клона инкубировали с простимулированными посредством IL-2 T-клетками (100 тыс./лунка) в течение 30 минут при 4°C. Избыточное количество антител удаляли путем промывания буфером, а связанное на поверхностности антитело детектировали с помощью АРС-меченного антитела к IgG человека. Все клоны-лидеры, за исключением CAT5D9, связывали эндогенный FLT3L на первичных T-клетках человека (фиг. 6B). Связывание CAT5D9 с эндогенным FLT3L первоначально не было детектируемым ввиду его низкой аффинности связывания. Тем не менее при димеризации CAT5D9 с антителом к IgG (меченым посредством АРС) до инкубации с Т-клетками его авидность в достаточной степени усиливалась для подтверждения дозозависимого связывания с эндогенным FLT3L (фиг. 6C).
[00276] ПРИМЕР № 6. ИНГИБИРОВАНИЕ КАНДИДАТНЫМИ АНТИТЕЛАМИ-ЛИДЕРАМИ FLT3L НА КЛЕТОЧНОЙ ПОВЕРХНОСТИ
[00277] Способность кандидатов-лидеров связывать FLT3L на клеточной поверхности предоставляла ограниченное понимание касательно функционального ингибирования лиганда. В идеале, связывание кандидатов-лидеров с FLT3L на клеточной поверхности должно снижать сигнальную активность комплекса лиганд-рецептор.
[00278] Для того, чтобы протестировать это, 1000 экспрессирующих huFLT3L клеток СНО/лунка высевали для прикрепления в течение ночи. На следующий день удаляли культуральную среду для СНО, клетки аккуратно промывали посредством RPMI и добавляли серийные разведения антител на 30 минут перед добавлением FLT3+ RS4;11 (100 тыс./лунка). После 2 ч инкубации при 36°C клетки RS4;11 переносили в новый 96-луночный планшет на льду для окрашивания с целью выявления понижающей регуляции FLT3. В дополнение к красителю, используемому для проводимых авторами настоящего изобретения стандартных анализов понижающей регуляции FLT3 на RS4;11, включали антитело к CD19 для исключения каких-либо контаминирующих клеток СНО. Понижающую регуляцию FLT3 измеряли с помощью проточной цитометрии.
[00279] Результаты анализа блокирования кандидатными антителами-лидерами свидетельствовали, что все кандидаты-лидеры обладали способностью до некоторой степени ингибировать FLT3L на клеточной поверхности, хотя все кандидаты проявляли относительно низкую активность по сравнению с коммерческим контрольным антителом, что отражало низкую аффинность (фиг. 7).
[00280] ПРИМЕР № 7. ПОДАВЛЕНИЕ КЛОНАМИ-ЛИДЕРАМИ FLT3L-ИНДУЦИРОВАННОЙ ПЕРЕДАЧИ СИГНАЛОВ FLT3
[00281] Аутофосфорилирование FLT3 приводит к активации сетей передачи сигналов в основном посредством PI3K и каскада RAS, что в свою очередь приводит к активации AKT (протеинкиназы B, PKB), MEK и ERK. Сигнальный каскад в конечном итоге приводит к транскрипции генов, способствующих выживанию и пролиферации клеток. Для подтверждения того, что кандидатные антитела-лидеры блокируют последующую передачу сигналов FLT3, индуцируемую FLT3L у первичных клеток человека, измеряли фосфорилирование ERK и MEK у CD133+ стволовых клеток с помощью наборов Mesoscale MSD Phospho-ERK1/2 и Phosphor MEK1/2 Whole Cell Lysate.
[00282] Валидацию анализа проводили с использованием клеточной линии RS4;11 с активацией ERK, индуцируемой с помощью FLT3L, осуществляемой дозозависимым образом (фиг. 8A). Серийные разведения FLT3L инкубировали с 300000 клеток RS4;11 на лунку в течение 8 минут при 36°C. Затем клетки собирали, лизировали и анализировали в отношении фосфорилированной ERK в соответствии с инструкциями производителя. Как и в более ранних анализах, определяли EC80 (476 пМ) для активации ERK посредством FLT3L и использовали ее для тестирования ингибирующей активности кандидатных клонов антител к FLT3L. Пригодность анализа подтверждали с использованием коммерчески доступного мышиного антитела к FLT3L человека в качестве положительного контроля для эффективной нейтрализации (фиг. 8B).
[00283] Применяя данные установленные параметры, клоны-лидеры тестировали с применением in vitro размноженных первичных CD133+ стволовых клеток, которые перед использованием валидировали в отношении экспрессии FLT3. Клоны-лидеры предварительно инкубировали с 476 пМ FLT3L в течение 30 минут, затем их добавляли к CD133+ стволовым клеткам. После инкубации в течение 8 минут при 36°C клетки собирали, лизировали и анализировали в отношении фосфорилированных ERK и MEK с помощью анализов MSD согласно инструкциям производителя. В качестве положительного контроля применяли коммерчески доступное мышиное антитело к FLT3L человека.
[00284] Как представляется, все кандидатные клоны подавляли индукцию MEK (фиг. 9A) и ERK (фиг. 9B) посредством FLT3L. Тем не менее только CAT5D9 достигал ICMAX и обеспечивал ожидаемую S-образную кривую зависимости дозы от ответа (таблица 5). В совокупности, результаты, представленные в примерах, позволяли предположить, что CAT5D9 был наилучшим клоном из кандидатов-лидеров, и его следует использовать для дальнейшей оптимизации, основанной на биофизической оценке аффинности и сайта связывания с эпитопом.
Таблица 5. IC50 (нМ) для связывания с 0,476 нМ FLT3L
[00285] ПРИМЕР № 8. ПОДТВЕРЖДЕНИЕ СПЕЦИФИЧНОСТИ В ОТНОШЕНИИ МИШЕНИ
[00286] Согласно результатам функциональной оценки в биологических анализах CAT5D9, по всей видимости, был наилучшим кандидатом-лидером. Для определения области связывания CAT5D9 в отношении рецептора FLT3 использовали эпитоп-специфическую сортировку с использованием системы Octet.
[00287] Эпитоп-специфическую сортировку применяли для определения антител-лидеров, которые имеют одну и ту же область связывания с FLT3L, что рецептор FLT3. Сортировку осуществляли в ходе трех фаз. На I фазе проводили связывание комплекса биотин-FLT3L с авидиновым зондом. На II фазе с комплексом биотин-FLT3L связывали отдельные антитела. На III фазе к антителу из II фазы добавляли каждое из тестируемых антител. Любое выявленное дополнительное связывание свидетельствовало о наличии у двух антител неконкурентных сайтов связывания с FLT3L-мишенью. В качестве отрицательного и положительного контролей использовали только буфер без добавления антител на III фазе и FLT3-Fc соответственно. Если на III фазе добавляли только буфер, получаемая кинетика диссоциации антитела с FLT3L отражала характерную аффинность клона в отношении мишени.
[00288] Только CAT5D9, добавленное в 1x и 2x концентрациях, подавляло связывание с FLT3-Fc, что свидетельствовало, что CAT5D9 воздействовало на требуемый целевой сайт на FLT3L (т. е. оно имело такой же или перекрывающийся эпитоп, что и у FLT3-Fc) (фиг. 10A). Важно отметить, что в отличие от этого остальные четыре кандидатных клона не подвергались ингибированию посредством CAT5D9, что свидетельствовало о том, что они связывались с другим эпитопом FLT3 (фиг. 10A). Кроме того, быстрая скорость диссоциации при добавлении только буфера подтверждала полученные в предыдущем эксперименте результаты, свидетельствуя, что аффинность у CAT5D9 является низкой (что означает, что его потенциал по улучшению эффективности посредством оптимизации был высоким). В соответствии с этим, если каждый из 4 оставшихся клонов связывался на II фазе (CAT8 показан в качестве репрезентативного графика, представленного на фиг. 10B), на III фазе можно детектировать дополнительное связывание CAT5D9 и FLT3-Fc, что отражает наличие у них различных сайтов связывания. Также наблюдали, что каждый из 4 остальных клонов сортировался совместно и что при добавлении только буфера скорость их диссоциации была относительно низкой.
[00289] Совместно эти данные подтверждают, что только CAT5D9 непосредственно конкурировал с FLT3 за область связывания FLT3L и, судя по всему, делал это с низкоаффинным связыванием, что свидетельствовало о его потенциале для оптимизации. С другой стороны, все оставшиеся клоны взаимодействовали с сайтом, который, исходя из функциональных данных, непосредственно не конкурировал с FLT3. Их медленная скорость диссоциации свидетельствовала о том, что они уже связывались с достаточной аффинностью в отношении FLT3L и обладали бы незначительным потенциалом для оптимизации. Ингибирование, изначально имевшее место в первоначальных скрининговых анализах, вероятно было связано со стерическим затруднением или частичной блокировкой сайта связывания в рецепторе.
[00290] ПРИМЕР № 9. КИНЕТИКА СВЯЗЫВАНИЯ ПО BIACORE (C9)
[00291] Анализ Biacore использовали для определения кинетики связывания антител-лидеров и подтверждения данных анализа Octet, которые свидетельствовали, что CAT5D9 обладало низкой аффинностью в отношении FLT3L. Кинетику связывания антигенсвязывающего фрагмента антитела к FLT3L и FLTL3 человека и яванского макака определяли на CAT8, CAT26, Dyax3 и Dyax5 человека. В дополнение, кинетику связывания антигена с фрагментом CAT5D9 определяли как для FLT3L человека, так и для FLT3L яванского макака.
[00292] Результаты представлены в таблице 6. Равновесная константа диссоциации (KD) была более чем в 50 раз выше у CAT5D9 человека и яванского макака в сравнении с остальными антителами-лидерами. CAT5D9 характеризовался низкоэффективной быстрой кинетикой диссоциации (чел. = 70,72, макак = 70,66). В результате, для проверки кинетических данных KD получали данные по равновесному связыванию. Равновесное связывание подтверждало результаты по кинетическому связыванию, демонстрируя схожие значения (таблица 3). Эти данные подтверждали низкую аффинность CAT5D9 и его потенциал по улучшению эффективности посредством оптимизации.
Таблица 6. Кинетика связывания антител-лидеров к FLT3L
(xE+5/Мс)
(xE-3/с)
(нМ)
(нМ)
Fab=антигенсвязывающий фрагмент; чел.=человек; макак=яванский макак; kon=константа ассоциации в ходе связывания; Koff=константа диссоциации в ходе связывания; KD=равновесная константа диссоциации.
[00293] ПРИМЕР № 10. ОТСУТСТВИЕ ПЕРЕКРЕСТНОЙ РЕАКТИВНОСТИ У CAT5D9
[00294] В дополнение к подтверждению того, что CAT5D9 связывается с надлежащим эпитопом FLT3L, было также важно подтвердить, что он не будет связываться с близкими по структуре гомологами FLT3L, представляющими собой фактор стволовых клеток (SCF) и колониестимулирующий фактор (CSF1). Оба фактора являются лигандами для рецепторных протеинтирозинкиназ (c-Kit и CSFR1 соответственно), которые являются основными подвергаемыми нецелевому воздействию молекулами для низкомолекулярных ингибиторов FLT3, применяемых в настоящее время в случае онкологии для контроля злокачественного новообразования, возникающего в результате приводящей к конститутивной активации мутации FLT3-IT9D.
[00295] Для того, чтобы это протестировать, планшет для ELISA покрывали 2 мкг рекомбинантного человеческого SCF или CSF1. После промывания планшет блокировали 3% молоком в солевом трис-фосфатном буферном растворе (TPBS) и добавляли антитела-лидеры в серийном (х2) разведении, начиная с 50 мкг/мл. После инкубации несвязанное антитело удаляли путем промывания, а связанное антитело выявляли с применением конъюгированного с HRP антитела к человеческому IgG в комбинации с субстратом в виде TMB для проявления цвета. В качестве положительных контролей связывания использовали коммерчески доступные pAb козы к SCF и mAb мыши к CSF1.
[00296] Ни один из кандидатов-лидеров не реагировал перекрестно с huSCF (фиг. 11A) или huCSF1 (фиг. 11B). Важно отметить, что из этих результатов видна селективность CAT5D9 в связывании только FLT3L, но не структурно схожих молекул лиганда TKR.
[00297] ПРИМЕР № 11. ОПТИМИЗАЦИЯ АФФИННОСТИ CAT5D9
[00298] Как рассмотрено выше, CAT5D9 связывалось с FLT3L с низкой аффинностью и поэтому демонстрировало потенциал по улучшению эффективности посредством оптимизации аффинности. Желательную KD, составляющую 300 пМ, задавали по результатам PK-моделирования. Кампания по оптимизации была предназначена для достижения 10000-кратного улучшения KD.
[00299] После модифицирования каркасных областей на уровне генов зародышевой линии использовали две параллельные стратегии - экономный мутагенез и блок-мутагенез. Экономный мутагенез подвергает мутации каждое положение во всех 6 CDR для всех 20 аминокислот, по одной за один раз. Клоны подвергали скринингу с помощью высокоэффективных способов, и отдельные полезные мутации объединяли. Блок-мутагенез подвергает мутациям непрерывные участки размером от 5 до 6 положений в CDR перекрывающимся паттерном, и полученные библиотеки из приблизительно 1E6-1E7 клонов сначала обогащают с помощью методик пэннинга фагового дисплея, а затем подвергают скринингу с помощью высокоэффективных способов.
[00300] После первого раунда оптимизации тестировали в формате IgG 30 клонов, полученных в результате экономного мутагенеза, и 24 клона, полученных в результате блок-мутагенеза. С помощью методик молекулярного моделирования авторы настоящего изобретения идентифицировали и объединяли наилучшие мутации, в результате чего был получен клон 5D9-клон 6, который достигал KD 1610 нМ (по результатам измерения с помощью Biacore), что соответствует 700-кратному улучшению аффинности по сравнению с исходным 5D9 (см. таблицу 7). Аффинность клонов-лидеров SC4017 и AM40 превышала критерии CDTP (<300 пМ). Кроме того, оба оптимизированных клона связывались с эндогенным FLTL на клеточной поверхности и нейтрализовывали его, связывали эндогенный растворимый FLT3L в сыворотке крови человека и связывались с FLT3L макака и нейтрализовали его.
Таблица 7. Сводные данные в отношении связывания для клонов-лидеров, полученных в результате оптимизации CAT5D9
(1E+5/Мс)
(1E-4/с)
(пМ)
[00301] Такое увеличение аффинности приравнивалось к >1000-кратному улучшению функциональной активности по результатам измерения понижающей регуляции FLT3, выполненной на клетках RS4;11 (фиг. 12A) с использованием способа, описанного для более ранних процедур отбора клонов.
[00302] Для достижения аффинности, равной 300 пМ, проводили второй раунд оптимизации аффинности. Подвергали мутации клон 6 (С06), а полученных мутантов подвергали скринингу таким же образом, как и в первом раунде оптимизации. Как часть фагового пэннинга в ходе блок-мутагенеза клон 6 использовали в формате IgG в качестве конкурента для обогащения клонов с существенно более высокой аффинностью. Наилучшим клоном, полученным в результате блок-мутагенеза, был клон AM40 с KD=170 пМ. Объединяли несколько комбинаторных клонов AM40 и мутаций, полученных в результате второго раунда экономного мутагенеза, и получали один превосходящий клон, представляющий собой SC4017 с KD=37 пМ. Такая более высокая аффинность снова отражалась в улучшенном функциональном ингибировании FLT3L, что продемонстрировано понижающей регуляцией FLT3 на клетках RS4;11 (фиг. 12B). Тем не менее по результатам дополнительного анализа превосходная эффективность SC4017 объяснялась одним дополнительным триптофаном, введенным рядом со связывающей областью. Это представляло риск для разработки с учетом уязвимости в отношении окисления открытых для окружающей среды остатков триптофана. По этой причине AM40 выбирали в качестве клона-лидера IgG. Несмотря на немного более низкую аффинность (170 пМ) по сравнению с SC4017 (37 пМ), AM40 все еще обеспечивал превышение первоначального целевого значения, составляющего 300 пМ, и был определен как характеризующийся более низким риском для разработки.
[00303] Наконец, авторы настоящего изобретения подтвердили, что оба клона могли нейтрализовать эндогенный FLT3L на клеточной поверхности, путем разработки анализа с применением первичных Т-клеток, простимулированных 20 нг/мл IL-7 в течение 7 дней (было обнаружено, что это является наиболее эффективным протоколом для индукции экспрессии FLT3L на клеточной поверхности у первичных Т-клеток) в совместной культуре с FLT3+ RS4;11. Вкратце, простимулированные посредством IL-7 CD4+ T-клетки инкубировали с клетками RS4;11 в течение ночи в соотношении 15:1 (ответ в зависимости от дозового соотношения, показанный на фиг. 13A) либо отдельно, либо в присутствии серийного разведения кандидатных клонов SC4017 и AM40. Понижающую регуляцию FLT3 измеряли с помощью проточной цитометрии, как описано ранее. Было показано, что оба клона со схожей эффективностью полностью предупреждали понижающую регуляцию FLT3 на клетках RS4;11 в концентрациях выше 1 нМ (фиг. 13B).
[00304] ПРИМЕР № 12. НЕЙТРАЛИЗАЦИЯ FLT3L У ЗДОРОВЫХ ОТЛИЧНЫХ ОТ ЧЕЛОВЕКА ПРИМАТОВ
[00305] Для определения безопасности и стабильности АМ40 при нейтрализации FLT3L проводили исследование токсичности в течение периода, составлявшего один месяц, с многократным введением еженедельных доз. Для отслеживания прогресса у животных в исследование включали восьминедельный период последующего наблюдения после обработки. Схема исследования изображена на фиг. 14. Как показано на фиг. 15A, уровни свободного растворимого FLT3L резко снижались после первого введения AM40 при всех дозах, но дозы 0,3 мг/кг было недостаточно для поддержания целевого взаимодействия на протяжении всей недели. Группы с более высокой дозировкой (1 мг/кг и 30 мг/кг) характеризовались полным взаимодействием с целевыми молекулами (выраженным как свободный растворимый FLT3L ниже BLQ) последовательно до дня 57, после чего уровни растворимого FLT3L возвращались к исходному уровню в группе с 1,0 мг/кг.
[00306] Аналогично, измерение частоты встречаемости DC в кровотоке (% от общего количества CD45+ клеток, детектированных с помощью проточной цитометрии и выраженных в процентах от исходных уровней до исследования) позволяло выявить устойчивое снижение частоты встречаемости CD1c+ (классических) DC и плазмоцитоидных DC до дня 22 в группах с 1,0 и 30 мг/кг (фиг. 15B). Показатель частоты встречаемости CD1c+ DC в кровотоке оставался пониженным до дня 50 и дня 85 в случае группы с 1 мг/кг и группы с 30 мг/кг соответственно. Частота встречаемости pDC в кровотоке оставалась сниженной до дня 71 и дня 85 в случае группы с 1 мг/кг и группы с 30 мг/кг соответственно. Восстановление уровня популяций DC в группе с 1,0 мг/кг коррелировало с восстановлением уровня свободного FLT3L в сыворотке крови, что имело место в некоторый момент времени в промежутке от дня 57 до дня 85. Эти результаты указывают на то, что уровни популяций DC уменьшались при нейтрализации FLT3L посредством AM40, но быстро возвращались к исходному уровню, когда становился доступным свободный FLT3L.
[00307] ПРИМЕР № 13. ЭКСПРЕССИЯ FLT3L КОРРЕЛИРУЕТ С ТЯЖЕСТЬЮ СИСТЕМНОЙ КРАСНОЙ ВОЛЧАНКИ (SLE)
[00308] SLE является аутоиммунным заболеванием, характеризующимся хроническим воспалением, и может затронуть почти каждый орган в организме и во всех возрастных группах. SLE обычно затрагивает суставы, кожу, почки, легкие, сердце и головной мозг. С учетом его роли в передаче провоспалительных сигналов исследовали экспрессию FLT3L у индивидуумов с SLE в поиске корреляции между уровнями FLT3L и степенью тяжести заболевания. Опубликованные к настоящему времени результаты исследований в значительной степени были основаны на уровнях FLT3L в сыворотке крови при выведении корреляции с заболеванием, и, хотя это наиболее практичный показатель в клинических условиях, он обладает присущим недостатком в том, что является отражением продуцирования за вычетом того, что поглощается DC-клетками и другими активированными FLT3L-потребляющими клетками. В условиях воспаления количество FLT3-экспрессирующих клеток и их потребление FLT3L будут сильно различаться, и это, вероятно, поясняет различия в результатах, полученных в ходе различных исследований, и почему ни в одном из них не была продемонстрирована прямая корреляция между сывороточным FLT3L и клиническими показателями прогрессирования заболевания. Учитывая то, что Т-клетки являются одним из преобладающих источников FLT3L в условиях воспаления, авторами настоящего изобретения был разработан анализ для измерения экспрессии FLT3L непосредственно на поверхности Т-клеток с использованием свежевыделенных мононуклеаров периферической крови (РВМС).
[00309] Сыворотку крови и PBMC выделяли от индивидуумов с SLE (n=24) и здоровых доноров (HD; n=15). Сывороточный FLT3L измеряли с помощью ELISA (R&D Systems) в соответствии с инструкциями производителя, а частоту встречаемости FLT3L-экспрессирующих CD4+ T-клеток определяли с использованием самостоятельно разработанного анализа проточной цитометрией, при этом FLT3L выявляли с помощью меченного флуоресцентной меткой клона антитела к FLT3L, MAB608 (R&D Systems). Для определения активности волчанки у одних и тех же людей использовали индекс активности заболевания SLE (SLEDAI). Значимость определяли с помощью корреляции Манна-Уитни и Спирмена для сравнения когорт здоровых и пораженных заболеванием и показателями корреляции со SLEDAI соответственно.
[00310] В соответствии с предыдущими данными из литературы уровни FLT3L в сыворотке крови оценивали у доноров SLE в сравнении с HD (p<0,05; фиг. 16A), но значимая корреляция с активностью заболевания обнаружена не была (SLEDAI) (p<0,07; фиг. 16B). Напротив, при измерении продуцирования FLT3L по частоте встречаемости FLT3L-экспрессирующих CD4+ T-клеток наблюдали крайне значимое увеличение у доноров с SLE по сравнению с HD (p<0,0001; фиг. 16C) и сильную корреляцию с показателями SLEDAI (r=0,7045; p<0,0001; фиг. 16D). Эти данные свидетельствуют, что измерение экспрессии FLT3L на Т-клетках может быть особенно уместным в условиях заболевания.
[00311] После обнаружения корреляции между показателями SLEDAI и FLT3L-экспрессирующими CD4+ T-клетками исследовали субпопуляции CD4+ клеток с целью определения, сопоставима ли (1) экспрессия FLT3L в субпопуляциях CD4+ T-клеток от страдающих SLE пациентов с известной биологией, и (2) коррелирует ли экспрессии в субпопуляциях с показателями SLEDAI. Исследуемыми субпопуляциями CD4+ клеток были наивные Т-клетки (Tnaive), эффекторные клетки памяти (TEM) и центральные клетки памяти (TCM). Для изучения экспрессии и корреляций использовали те же протоколы и уровни значимости, которые описаны выше.
[00312] Экспрессия FLT3L в субпопуляциях CD4+ Т-клеток была сопоставима с известной биологией экспрессии FLT3L. В частности, экспрессию FLT3L обычно не наблюдали на Tnaive-клетках у HD, хотя имелось небольшое, но значимое повышение у доноров с SLE (фиг. 17A, верхняя часть). Экспрессия FLT3L на Tnaive-клетках от доноров с SLE значимо коррелировала с показателями SLEDAI (фиг. 17A, нижняя часть; r=0,6629; p=0,0004). Важно отметить, что экспрессию FLT3L наблюдали на CD4+ TEM-клетках как у HD-субъектов, так и у субъектов с SLE, что и следовало ожидать для этой популяции, которая захватывает недавно активированные T-клетки, которые будут подвергнуты воздействию цитокинов с γ-цепью, о которых известно, что они индуцируют экспрессию FLT3L. Хотя данный ответ наблюдали как у HD-доноров, так и у доноров с SLE, он был значимо повышен у последних, и, опять же, экспрессия у доноров с SLE коррелировала с SLEDAI (фиг. 17B, нижняя часть; r=0,6201; p=0,0012). Наконец, экспрессия FLT3L снижалась у здоровых CD4+ T-клеток по мере того, как они дифференцировались из TEM в TCM, но сохранялась у PBMC от доноров с SLE (фиг. 17C, верхняя часть; p<0,0001). Опять же существует значимая корреляция между частотой встречаемости FLT3L+ T-клеток и показателями SLEDAI, что свидетельствует о том, что экспрессия в этой группе является отражением хронического воспалительного состояния.
[00313] В совокупности из результатов данных исследований видно, что экспрессия FLT3L на поверхности CD4+ T-клеток пациентов с SLE значимо повышена по сравнению с экспрессией у HD-пациентов. Более того, повышенная экспрессия FLT3L сильно коррелировала с показателями SLEDAI. Таким образом, введение антител к FLT3L пациентам с SLE является разумной терапевтической стратегией для уменьшения популяций FLT3L-экспрессирующих Т-клеток с целью уменьшения воспаления у пациентов с SLE.
[00314] Применяемый выше способ валидировали с использованием выявления in situ согласно способу PrimeFlow IC РНК FLT3L и подтверждали с использованием конъюгированных с APC AM40.
[00315] ПРИМЕР № 14. ЭКСПРЕССИЯ FLT3L ПРИ МИОЗИТЕ
[00316] Миозит представляет собой хроническое мышечное воспаление, которое характеризуется слабостью, отеканием и мышечной болью. На клеточном уровне миозит характеризуется повышенными уровнями белков интерферона 1-го типа и pDC. Миозит может быть ассоциирован с SLE и другими провоспалительными состояниями. Поэтому исследовали экспрессию FLT3L у индивидуумов с миозитом в поиске корреляции между уровнями FLT3L и степенью тяжести заболевания.
[00317] С использованием FACS исследовали PBMC от индивидуумов с миозитом и HD в отношении FLT3L-экспрессирующих CD4+ T-клеток. CD4+ T-клетки разделяли на субпопуляции Tnaive, TEM и TCM. Значимость между выборками с миозитом и HD определяли с помощью анализа Манна-Уитни.
[00318] Как видно на фиг. 18А и 18В, экспрессия FLT3L у РВМС от индивидуумов с миозитом соответствовала результатам, полученным от пациентов с SLE, поскольку они характеризовались значимым увеличением процентной доли CD4+ Т-клеток, положительных в отношении FLT3L (Tnaive (p<0,05; фиг. 18A), TEM (p<0,0001; фиг. 18B) и TCM (p<0,0001; фиг. 18C)). В свете данных результатов введение антител к FLT3L пациентам с миозитом является разумной терапевтической стратегией для уменьшения популяций FLT3L-экспрессирующих Т-клеток с целью уменьшения воспаления у пациентов с миозитом.
[00319] ПРИМЕР № 15. ЭКСПРЕССИЯ FLT3L ПРИ НЕФРИТЕ
[00320] Нефрит представляет собой иммунное нарушение, которое поражает почки и связанные с ними почечные структуры. Данное патологическое состояние может возникать вследствие SLE, определенных токсинов или определенных инфекций. Нефрит может привести к необратимой утрате функции почек, что может быть смертельным. Было показано, что дендритные клетки инфильтрируются в почку при волчаночном нефрите (Fiore et al., (2008) Mol Immunology v45: 259-265) и, как считается, играют определенную роль в запуске воспаления в почке, поэтому было высказано предположение, что блокировка FLT3L может подавлять DC и предупреждать прогрессирующую утрату функции почек.
[00321] Для изучения влияния блокировки FLT3L на уровни протеинурии и показатель нефрита использовали мышиную модель нефрита на линии Murphy Roths Large/lymphoproliferative (MRL.lpr) и мышиное суррогатное антитело к FLT3L (LFC-1). Включали изотипический контроль, а также группу обработки антителами к IFNAR. Мыши, которым вводили антитело к FLT3L, демонстрировали значимое уменьшение показателей протеинурии через 17 недель после введения (фиг. 19A). В дополнение, у мышей, которым вводили антитело к FLT3L, показатели нефрита через 18 недель снижались по сравнению с изотипическими контролями (фиг. 19B). Важно отметить, что показатели протеинурии и нефрита у мышей, которым вводили антитело к FLT3L, были ниже, чем у мышей, которым вводили контроль. Эти результаты подтверждали роль FLT3L-опосредованного воспаления при нефрите. В свете данных результатов введение антител к FLT3L пациентам с нефритом является разумной терапевтической стратегией для уменьшения популяций FLT3L-экспрессирующих Т-клеток с целью уменьшения воспаления у пациентов с нефритом.
[00322] Также исследовали популяции DC селезенки для получения представления о FLT3L-ассоциированных изменениях в популяциях лейкоцитов при нефрите. Извлекали селезенку из мышей с MRL через 18 недель, и исследовали изменения в популяциях DC селезенки. Обработка антителом к FLT3L значимо уменьшала количества DC в кровотоке у мышей с MRL (фиг. 20A-C). В частности, после введения антитела к FLT3L количество Siglec-H+-pDC значимо уменьшалось в сравнении с изотипическими контролями (фиг. 20A). Аналогично, значимые уменьшения в количестве наблюдали у CD11b+ cDC (эквивалентны человеческих CD1c+ DC) и CD8+ cDC (эквивалентны человеческих CD141+ DC) (фиг. 20B и 20C). Кроме того, у мышей, обработанных антителом к FLT3L, не наблюдали каких-либо случаев дерматита по сравнению с обычной 30-40% частотой у мышей без обработки. Следовательно, обработка антителом к FLT3L сокращала популяции DC в кровотоке и улучшала вторичную патологию (дерматит) в модели нефрита. В свете данных результатов введение антител к FLT3L пациентам с нефритом может уменьшать воспаление и повреждение тканей путем подавления популяций DC.
[00323] ПРИМЕР № 16. ЭКСПРЕССИЯ FLT3L ПРИ СИНДРОМЕ ШЕГРЕНА
[00324] Первичный синдром Шегрена (pSS) представляет собой аутоиммунное состояние, характеризующееся обширной сухостью глаз и слюнных желез. В дополнение, данное патологическое состояние может вызывать полиорганную дисфункцию. Данный синдром возникает самостоятельно или при наличии дополнительных аутоиммунных заболеваний, таких как волчанка или ревматоидный артрит. У индивидуумов с pSS повышены уровни FLT3L в сыворотке крови, и имеются свидетельства локальной экспрессии как FLT3L, так и его рецептора в воспаленной слюнной железе (Tobon et al., (2010) Arthritis and Rheumatism v62: 344).
[00325] Для изучения патологии слюнных желез после пролонгированной обработки антителом к FLT3L (LFC-1) использовали мышиную модель синдрома Шегрена NOD.H2h4. В возрасте 16 недель у этих мышей развиваются третичные лимфоидные структуры (TLS) в слюнной железе (SG), которые преимущественно содержат DC, B220+ B-клетки и CD3+ T-клетки, что, таким образом, крайне похоже на патологические изменения, наблюдаемые у людей. Данному повреждению ткани предшествует выработка аутоантител и образование спонтанных зародышевых центров в селезенке (Mahmoud et al., 2016 Science Translational Medicine, v8 361ra137). Мышей обрабатывали с использованием либо профилактического (начиная с 5-недельного возраста), либо терапевтического (начиная с 17-недельного возраста) протокола изотипическими IgG-контролями (5 мг/кг), антителом к FLT3L (5 мг/кг). В случае обоих протоколов обработка продолжалась посредством введения дозы два раза в неделю до конца исследования (26 недель). Моноклональное антитело к FLT3L (LFC-1) эффективно нейтрализовало FLT3L на протяжении всего курса обработки (фиг. 25A) и приводило к накоплению в кровотоке комплекса лекарственное средство/лиганд (фиг. 25B).
[00326] Для оценки изменений в популяциях периферических иммунных клеток собирали лимфоидные органы, а также собирали слюнные железы (SG) и оценивали их в отношении патологии тканей (частоту TLS). Хотя ранее сообщалось, что профилактические процедуры лечения могут предупреждать возникновение заболевания, на данный момент существует ограниченное количество публикаций в отношении того, что после возникновения заболевания с помощью терапевтического вмешательства можно замедлить или предупредить повреждение ткани. Моноклональное антитело к FLT3L (LFC-1) снижало частоту встречаемости подвергнутых действию антигена CD44HI CD4+ и CD8+ T-клеток в селезенке и в дренирующих слюнную железу LN (в конце исследования в возрасте 24-26 недель) (фиг. 26A - 26D), а также избирательно снижало уровни специфических аутоантител к коллагену IV и экстракту тромбоцитов (фиг. 27).
[00327] Как и ожидалось, животные, получавшие изотипический IgG-контроль, имели повышенное образование TLS в слюнной железе (измеренное как частота встречаемости на мм2 ткани) к возрасту 26 недель, что свидетельствовало о повреждении слюнных желез. У мышей, обработанных антителом к FLT3L, даже при введении терапевтических доз имело место значимое снижение повреждения ткани SG (фиг. 21A), и развитие заболевания предупреждали полностью при введении профилактических доз (фиг. 21B). Популяции DC-клеток, измеренные в селезенке, были значительно подавлены, хотя и не полностью устранены (фиг. 22A-D). И все же этого было достаточно, чтобы оказать существенное влияние на возникновение и прогрессирование заболевания путем уменьшения воспалительной инфильтрации в слюнную железу. Эти результаты подтверждали, что воспаление при pSS управляется FLT3L-опосредованными механизмами. В свете этих результатов введение антител к FLT3L является разумной терапевтической стратегией для лечения pSS у субъектов-людей.
Из приведенного выше описания будет очевидно, что в настоящее изобретение, описанное в данном документе, могут быть внесены изменения и модификации для адаптации его к различным вариантам применения и условиям. Такие варианты осуществления также входят в объем приведенной далее формулы изобретения. Указание перечня элементов в любом определении переменной в данном документе включает определения этой переменной как любого отдельного элемента или комбинации (или подкомбинации) перечисленных элементов. Указание варианта осуществления в данном документе включает такой вариант осуществления в качестве любого отдельного варианта осуществления или в комбинации с любыми другими вариантами осуществления или его частями. Все упомянутые в данном описании патенты и публикации включены в данный документ посредством ссылки в той же степени, как если бы каждый независимый патент и каждая независимая публикация были специально и индивидуально указаны как включенные посредством ссылки.
--->
ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> Viela Bio, Inc.
<120> АНТИТЕЛА К ЛИГАНДУ РЕЦЕПТОРНОЙ ТИРОЗИНКИНАЗЫ 3, ПОДОБНОЙ ПРОДУКТУ
ПРОТООНКОГЕНА ВИРУСА САРКОМЫ КОШЕК (FMS) ШТАММА MCDONOUGH (FLT3L), И
ВАРИАНТЫ ИХ ПРИМЕНЕНИЯ ДЛЯ ЛЕЧЕНИЯ АУТОИММУННЫХ И ВОСПАЛИТЕЛЬНЫХ
ЗАБОЛЕВАНИЙ
<130> 054493-502001WO
<150> US 62/630,571
<151> 2018-02-14
<160> 72
<170> PatentIn версия 3.5
<210> 1
<211> 120
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> "AM40_VH"
<400> 1
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ser
1. 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Gly Thr Phe Ser Ser Tyr
20 25 30
Ala Leu Ser Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Thr Arg Pro Pro Thr Ser Arg Thr Ala Ser Tyr Ala Gln Lys Phe
50 55 60
Gln Gly Arg Val Thr Ile Thr Val Asp Glu Ser Thr Ser Thr Gly Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Ser Asn Asp Phe Val Tyr Gly Ser Tyr Arg Phe Trp Gly Gln Gly
100 105 110
Thr Thr Val Thr Val Ser Ser Ala
115 120
<210> 2
<211> 111
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> "AM40_VL"
<400> 2
Asn Phe Met Leu Thr Gln Pro His Ser Val Ser Glu Ser Pro Gly Lys
1. 5 10 15
Thr Val Thr Ile Ser Cys Thr Arg Thr Ser Gly Asn Ile Ala Gly Tyr
20 25 30
Phe Val Gln Trp Tyr Gln Gln Arg Pro Gly Ser Ser Pro Thr Thr Val
35 40 45
Ile Tyr Glu Asp Tyr Gln Arg Pro Ser Gly Val Pro Asp Arg Phe Ser
50 55 60
Gly Ser Ile Asp Ser Ser Ser Asn Ser Ala Ser Leu Thr Ile Ser Gly
65 70 75 80
Leu Lys Thr Glu Asp Glu Ala Asp Tyr Tyr Cys Gln Ser Tyr Asp Asp
85 90 95
Tyr Arg Arg Ala Ala Phe Gly Gly Gly Thr Lys Leu Thr Val Leu
100 105 110
<210> 3
<211> 119
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> "SC4017_VH"
<400> 3
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ser
1. 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Gly Thr Phe Ser Ser Tyr
20 25 30
Ala Leu Ser Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Thr Arg Pro Pro Thr Ser Arg Thr Ala Ser Tyr Ala Gln Lys Phe
50 55 60
Gln Gly Arg Val Thr Ile Thr Val Asp Glu Ser Thr Ser Thr Gly Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Ser Asn Asp Phe Val Tyr Gly Ser Tyr Arg Phe Trp Gly Gln Gly
100 105 110
Thr Thr Val Thr Val Ser Ser
115
<210> 4
<211> 111
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> "SC4017_VL"
<400> 4
Asn Phe Met Leu Thr Gln Pro His Ser Val Ser Glu Ser Pro Gly Lys
1. 5 10 15
Thr Val Thr Ile Ser Cys Thr Arg Thr Ser Gly Trp Ile Ala Gly Tyr
20 25 30
Phe Val Gln Trp Tyr Gln Gln Arg Pro Gly Ser Ser Pro Thr Thr Val
35 40 45
Ile Tyr Glu Asp Tyr Gln Arg Pro Ser Gly Val Pro Asp Arg Phe Ser
50 55 60
Gly Ser Ile Asp Ser Ser Ser Asn Ser Ala Ser Leu Thr Ile Ser Gly
65 70 75 80
Leu Lys Thr Glu Asp Glu Ala Asp Tyr Tyr Cys Gln Ser Tyr Asp Asp
85 90 95
Tyr Arg Arg Ala Ala Phe Gly Gly Gly Thr Lys Leu Thr Val Leu
100 105 110
<210> 5
<211> 119
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> "CAT5D9_VH"
<400> 5
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ser
1. 5 10 15
Ser Val Lys Val Ser Cys Lys Ile Ser Gly Gly Thr Phe Ser Ser Tyr
20 25 30
Ala Leu Ser Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Gly Ile Ile Pro Val Phe Arg Thr Ala Ser Tyr Ala Gln Lys Phe
50 55 60
Gln Gly Arg Val Thr Ile Thr Val Asp Glu Ser Ala Ser Thr Gly Tyr
65 70 75 80
Ile Glu Leu Ser Ser Leu Lys Ser Glu Asp Thr Ala Thr Tyr Tyr Cys
85 90 95
Ala Ser Asn Asn Tyr Val Trp Gly Ser Tyr Arg Phe Trp Gly Gln Gly
100 105 110
Thr Thr Val Thr Val Ser Ser
115
<210> 6
<211> 111
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> "CAT5D9_VL"
<400> 6
Asn Phe Met Leu Thr Gln Pro His Ser Val Ser Glu Ser Pro Gly Lys
1. 5 10 15
Thr Val Thr Ile Ser Cys Thr Arg Thr Ser Gly Asn Ile Ala Gly Tyr
20 25 30
Phe Val Gln Trp Tyr Gln Gln Arg Pro Gly Ser Ser Pro Thr Thr Val
35 40 45
Ile Tyr Glu Asp Tyr Gln Arg Pro Ser Gly Val Pro Asp Arg Phe Ser
50 55 60
Gly Ser Ile Asp Arg Ser Ser Asn Ser Ala Ser Leu Thr Ile Ser Gly
65 70 75 80
Leu Lys Pro Asp Asp Glu Ala Asp Tyr Tyr Cys Gln Ser Tyr Asp Asp
85 90 95
Thr Ser Gln Gly Val Phe Gly Ala Gly Thr Lys Val Thr Val Leu
100 105 110
<210> 7
<211> 120
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> "CAT8_VH"
<400> 7
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1. 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Ala Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ala Ile Ser Gly Ser Gly Gly Ser Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Ser Ser Gly Tyr Tyr Gly Ala Asn Phe Asp Phe Trp Gly Gln
100 105 110
Gly Thr Thr Val Thr Val Ser Ser
115 120
<210> 8
<211> 109
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> "CAT8_VL"
<400> 8
Gln Ser Val Leu Thr Gln Pro Pro Ser Ala Ser Gly Thr Pro Gly Gln
1. 5 10 15
Arg Val Ala Ile Ser Cys Ser Gly Ser Ser Ser Asn Ile Gly Ser Gly
20 25 30
Tyr Val Tyr Trp Tyr Gln Gln Val Pro Gly Thr Ala Pro Thr Leu Leu
35 40 45
Ile His Arg Asn Asn Gln Arg Pro Ser Gly Val Pro Asp Arg Phe Ser
50 55 60
Gly Ser Lys Ser Gly Thr Ser Ala Ser Leu Ala Ile Ser Gly Leu Arg
65 70 75 80
Ser Glu Asp Glu Ala Asp Tyr Tyr Cys Ala Ala Trp Asp Asp Ser Leu
85 90 95
Ser Gly Tyr Val Phe Gly Thr Gly Thr Lys Val Thr Val
100 105
<210> 9
<211> 123
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> "CAT26_VH"
<400> 9
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1. 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Ala Val Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ala Ile Ser Gly Ser Gly Gly Ser Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Val Lys Asp Ala Tyr Gly Ser Ser Trp Tyr Phe Tyr Tyr Phe Asp Tyr
100 105 110
Trp Gly Gln Gly Thr Met Val Thr Val Ser Ser
115 120
<210> 10
<211> 110
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> "CAT26_VL"
<400> 10
Gln Ser Val Leu Thr Gln Pro Pro Ser Ala Ser Gly Thr Pro Gly Gln
1. 5 10 15
Arg Val Thr Ile Ser Cys Ser Gly Ser Ser Ser Asn Ile Gly Ile Asn
20 25 30
Pro Val Asn Trp Tyr Gln Gln Leu Pro Gly Thr Ala Pro Lys Val Leu
35 40 45
Ile Tyr Ser Asp Lys Tyr Arg Pro Ser Gly Val Ala Asp Arg Phe Ser
50 55 60
Gly Ser Lys Ser Gly Thr Ser Ala Ser Leu Ala Ile Ser Gly Leu Gln
65 70 75 80
Ser Glu Asp Glu Ala Asp Tyr Phe Cys Ala Ala Trp Asp Asp Ser Leu
85 90 95
Asn Gly Arg Val Phe Gly Thr Gly Thr Lys Leu Thr Val Leu
100 105 110
<210> 11
<211> 126
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> "DYAX3_VH"
<400> 11
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1. 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Met Tyr
20 25 30
Glu Met Arg Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Val Ile Pro Ser Gly Gly Lys Thr Phe Tyr Ala Asp Ser Val Lys
50 55 60
Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr Leu
65 70 75 80
Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys Ala
85 90 95
Arg Tyr Ser Arg Trp Phe Gly Gln Leu Gly Phe Tyr Ser His Tyr Ala
100 105 110
Met Asp Val Trp Ser Gln Gly Thr Thr Val Thr Val Ser Ser
115 120 125
<210> 12
<211> 108
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> "DYAX3_VL"
<400> 12
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1. 5 10 15
Asp Arg Val Ala Ile Thr Cys Arg Ala Ser Gln Ser Ile Asp Thr Tyr
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Ala Ala Ser Lys Leu Glu Asp Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Thr Gly Thr Asp Phe Thr Leu Thr Ile Arg Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Ser Tyr Phe Cys Gln Gln Ser Tyr Ser Ser Pro Gly
85 90 95
Ile Thr Phe Gly Pro Gly Thr Lys Val Glu Ile Lys
100 105
<210> 13
<211> 127
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> "DYAX5_VH"
<400> 13
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1. 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Ile Met Val Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ser Ile Tyr Ser Ser Gly Gly Ser Thr Ser Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Thr Arg Tyr Ser Arg Trp Phe Gly Gln Leu Gly Phe Tyr Ser His Tyr
100 105 110
Ala Met Asp Val Trp Ser Gln Gly Thr Thr Val Thr Val Ser Ser
115 120 125
<210> 14
<211> 108
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> "DYAX5_VL"
<400> 14
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1. 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Ser Ile Ser Ser Tyr
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Ala Ala Ser Ser Leu Gln Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Ser Tyr Ser Thr Pro Pro
85 90 95
Trp Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105
<210> 15
<211> 360
<212> ДНК
<213> Искусственная последовательность
<220>
<223> "AM40_VH"
<400> 15
caggtgcagc tggtgcagtc tggggctgag gtgaagaagc ctgggtcctc ggtgaaggtc 60
tcctgcaagg cttctggagg caccttcagc agttatgctc ttagctgggt gcgacaggcc 120
cctggacaag ggcttgagtg gatgggaacg cggccgccga cctcccggac agcaagctac 180
gcacagaaat ttcagggcag agtcacgatt accgtggacg aatccacgag cacaggctac 240
atggagctga gcagcctgag atctgaggac acggccgtgt attactgtgc gtcaaacgac 300
ttcgtgtacg ggagttatcg tttctggggc caagggacca cggtcaccgt ctcctcagcg 360
<210> 16
<211> 333
<212> ДНК
<213> Искусственная последовательность
<220>
<223> "AM40_VL"
<400> 16
aattttatgc tgactcagcc ccactctgtg tcggagtctc cggggaagac ggtaaccatc 60
tcctgcaccc gcaccagtgg gaacattgcc ggctactttg tgcagtggta ccagcagcgc 120
ccgggcagtt cccccaccac tgtgatctat gaggattacc aacgaccctc tggggtccct 180
gatcggttct ctggctccat cgacagctcc tccaactctg cctccctcac catctctgga 240
ctgaagactg aggacgaggc tgactactat tgtcagtctt atgatgacta ccggcgggcg 300
gcgttcggcg gagggaccaa gctgaccgtc cta 333
<210> 17
<211> 357
<212> ДНК
<213> Искусственная последовательность
<220>
<223> "SC4017_VH"
<400> 17
caggtgcagc tggtgcagtc tggggctgag gtgaagaagc ctgggtcctc ggtgaaggtc 60
tcctgcaagg cttctggagg caccttcagc agttatgctc ttagctgggt gcgacaggcc 120
cctggacaag ggcttgagtg gatgggaacg cggccgccga cctcccggac agcaagctac 180
gcacagaaat ttcagggcag agtcacgatt accgtggacg aatccacgag cacaggctac 240
atggagctga gcagcctgag atctgaggac acggccgtgt attactgtgc gtcaaacgac 300
ttcgtgtacg ggagttatcg tttctggggc caagggacca cggtcaccgt ctcctca 357
<210> 18
<211> 333
<212> ДНК
<213> Искусственная последовательность
<220>
<223> "SC4017_VL"
<400> 18
aattttatgc tgactcagcc ccactctgtg tcggagtctc cggggaagac ggtaaccatc 60
tcctgcaccc gcaccagtgg gtggattgcc ggctactttg tgcagtggta ccagcagcgc 120
ccgggcagtt cccccaccac tgtgatctat gaggattacc aacgaccctc tggggtccct 180
gatcggttct ctggctccat cgacagctcc tccaactctg cctccctcac catctctgga 240
ctgaagactg aggacgaggc tgactactat tgtcagtctt atgatgacta ccggcgggcg 300
gcgttcggcg gagggaccaa gctgaccgtc cta 333
<210> 19
<211> 357
<212> ДНК
<213> Искусственная последовательность
<220>
<223> "CAT5D9_VH"
<400> 19
caggtgcagc tggtgcagtc tggggctgag gtgaagaagc ctgggtcctc ggtgaaggtc 60
tcctgcaaga tttctggagg caccttcagc agttatgctc ttagctgggt gcgacaggcc 120
cctggacaag ggcttgagtg gatgggaggg atcatccctg tctttcggac agcaagctac 180
gcacagaaat ttcagggcag agtcacgatt accgtggacg aatccgcgag cacaggctac 240
atagaactga gcagcctgaa atctgaggac acggccacat attactgtgc gtcaaataat 300
tacgtttggg ggagttatcg tttctggggc caggggacca cggtcaccgt ctcctca 357
<210> 20
<211> 333
<212> ДНК
<213> Искусственная последовательность
<220>
<223> "CAT5D9_VL"
<400> 20
aattttatgc tgactcagcc ccactctgtg tcggagtctc cggggaagac ggtcaccatc 60
tcctgcaccc gcaccagtgg gaacattgcc ggctactttg tgcagtggta ccagcagcgc 120
ccgggcagtt cccccaccac tgtgatctat gaggattacc aacgaccctc tggggtccct 180
gatcggttct ctggctccat cgacaggtcc tccaactctg cctccctcac catctctgga 240
ctgaagcctg acgacgaggc tgactactat tgtcagtctt atgatgacac ctctcaaggt 300
gtgttcggcg cagggaccaa ggtcaccgtc cta 333
<210> 21
<211> 360
<212> ДНК
<213> Искусственная последовательность
<220>
<223> "CAT8_VH"
<400> 21
gaggtgcagc tgttggagtc tgggggaggc ttggtacagc ctggggggtc cctgagactc 60
tcctgtgcag cctctggatt cacctttagc agctatgcca tgagctgggt ccgccaggct 120
ccagggaagg ggctggagtg ggtctcagct attagtggta gtggtggtag cacatactac 180
gcagactccg tgaagggccg gttcaccatc tccagagaca attccaagaa cacgctgtat 240
ctgcaaatga acagcctgag agccgaggac acggccgtgt attactgtgc gagaagcagc 300
ggctactacg gggccaattt tgacttctgg gggcagggga ccacggtcac cgtctcgagt 360
<210> 22
<211> 327
<212> ДНК
<213> Искусственная последовательность
<220>
<223> "CAT8_VL"
<400> 22
cagtctgtgc tgacgcagcc gccctcagcg tccgggaccc ccgggcagag ggtcgccatc 60
tcttgttctg gaagcagctc caacatcgga agtggttatg tatactggta tcagcaggtc 120
ccaggaacgg cccccacact cctcatccat aggaataatc agcggccctc aggggtccct 180
gaccgattct ctggctccaa gtctggcacc tcagcctccc tggccatcag tgggctccgg 240
tccgaggatg aggctgatta ttactgtgca gcgtgggatg acagcctgag tggttatgtc 300
ttcggaactg ggaccaaggt caccgtc 327
<210> 23
<211> 369
<212> ДНК
<213> Искусственная последовательность
<220>
<223> "CAT26_VH"
<400> 23
gaggtgcagc tgttggagtc tgggggaggc ttggtacagc ctggggggtc cctgagactc 60
tcctgtgcag cctctggatt cacctttagc agctatgccg tgagctgggt ccgccaggct 120
ccagggaagg ggctggagtg ggtctcagct attagtggta gtggtggtag cacatactac 180
gcagactccg tgaagggccg gttcaccatc tccagagaca attccaagaa cacgctgtat 240
ctgcaaatga acagcctgag agccgaggac acggccgtgt attactgtgt gaaagacgca 300
tatggcagca gctggtactt ttactacttt gactactggg gccaagggac aatggtcacc 360
gtctcgagt 369
<210> 24
<211> 330
<212> ДНК
<213> Искусственная последовательность
<220>
<223> "CAT26_VL"
<400> 24
cagtctgtgt tgacgcagcc gccttcagcg tctgggaccc ccgggcagag ggtcaccatc 60
tcttgttctg gaagcagctc caacatcgga atcaatcctg tgaactggta ccaacaactc 120
cccggaacgg cccccaaagt cctcatttat agtgataaat accggccctc aggggtcgct 180
gaccgcttct ctggctccaa gtctggaacc tcagcctccc tggccatcag tggcctccag 240
tctgaggatg aggctgatta cttctgtgca gcatgggatg acagcctgaa tggtcgcgtc 300
ttcggaactg ggaccaagct gaccgtccta 330
<210> 25
<211> 378
<212> ДНК
<213> Искусственная последовательность
<220>
<223> "DYAX3_VH"
<400> 25
gaagttcaat tgttagagtc tggtggcggt cttgttcagc ctggtggttc tttacgtctt 60
tcttgcgctg cttccggatt cactttctct atgtacgaga tgcgttgggt tcgccaagct 120
cctggtaaag gtttggagtg ggtttctgtt atcccttctg gtggcaagac tttttatgct 180
gactccgtta aaggtcgctt cactatctct agagacaact ctaagaatac tctctacttg 240
cagatgaaca gcttaagggc tgaggacacg gccgtgtatt actgtgcgag atacagcaga 300
tggttcgggc agctagggtt ttactcccac tacgctatgg acgtctggag ccaagggacc 360
acggtcaccg tctcaagc 378
<210> 26
<211> 324
<212> ДНК
<213> Искусственная последовательность
<220>
<223> "DYAX3_VL"
<400> 26
gacatccaga tgacccagtc tccatcctcc ctgtctgcat ctgtgggaga cagagtcgcc 60
atcacttgcc gcgcaagtca gagcatcgac acctatttaa attggtatca gcagaaacca 120
gggaaagccc ctaaactcct gatctatgct gcatccaagt tggaagacgg ggtcccatca 180
agattcagtg gcagtggaac tgggacagat ttcactctca ccatcagaag tctgcaacct 240
gaagattttg caagttattt ctgtcaacag agctactcta gtccagggat cactttcggc 300
cctgggacca aggtggagat caaa 324
<210> 27
<211> 381
<212> ДНК
<213> Искусственная последовательность
<220>
<223> "DYAX5_VH"
<400> 27
gaagttcaat tgttagagtc tggtggcggt cttgttcagc ctggtggttc tttacgtctt 60
tcttgcgctg cttccggatt cactttctct tcttacatta tggtttgggt tcgccaagct 120
cctggtaaag gtttggagtg ggtttcttct atctattctt ctggtggctc tacttcttat 180
gctgactccg ttaaaggtcg cttcactatc tctagagaca actctaagaa tactctctac 240
ttgcagatga acagcttaag ggctgaggac acagccgtgt attactgtac gagatacagc 300
agatggttcg ggcagctagg gttttactcc cactacgcta tggacgtctg gagccaaggg 360
accacggtca ccgtctcaag c 381
<210> 28
<211> 324
<212> ДНК
<213> Искусственная последовательность
<220>
<223> "DYAX5_VL"
<400> 28
gacatccaga tgacccagtc tccatcctcc ctgtctgcat ctgtaggaga cagagtcacc 60
atcacttgcc gggcaagtca gagcattagc agctatttaa attggtatca gcagaaacca 120
gggaaagccc ctaagctcct gatctatgct gcatccagtt tgcaaagtgg ggtcccatca 180
aggttcagtg gcagtggatc tgggacagat ttcactctca ccatcagcag tctgcaacct 240
gaagattttg caacttacta ctgtcaacag agttacagta cccctccgtg gacgttcggc 300
caagggacca aggtggaaat caaa 324
<210> 29
<211> 5
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> "AM40 и SC4017 и CAT5D9_HCDR1"
<400> 29
Ser Tyr Ala Leu Ser
1. 5
<210> 30
<211> 17
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> "AM40 и SC4017_HCDR2"
<400> 30
Thr Arg Pro Pro Thr Ser Arg Thr Ala Ser Tyr Ala Gln Lys Phe Gln
1. 5 10 15
Gly
<210> 31
<211> 10
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> "AM40 и SC4017_HCDR3"
<400> 31
Asn Asp Phe Val Tyr Gly Ser Tyr Arg Phe
1. 5 10
<210> 32
<211> 13
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> "AM40 и CAT5D9_LCDR1"
<400> 32
Thr Arg Thr Ser Gly Asn Ile Ala Gly Tyr Phe Val Gln
1. 5 10
<210> 33
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> "AM40 и SC4017 и CAT5D9_LCDR2"
<400> 33
Glu Asp Tyr Gln Arg Pro Ser
1. 5
<210> 34
<211> 10
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> "AM40 и SC4017_LCDR3"
<400> 34
Gln Ser Tyr Asp Asp Tyr Arg Arg Ala Ala
1. 5 10
<210> 35
<211> 13
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> "SC4017_LCDR1"
<400> 35
Thr Arg Thr Ser Gly Trp Ile Ala Gly Tyr Phe Val Gln
1. 5 10
<210> 36
<211> 17
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> "CAT5D9_HCDR2"
<400> 36
Gly Ile Ile Pro Val Phe Arg Thr Ala Ser Tyr Ala Gln Lys Phe Gln
1. 5 10 15
Gly
<210> 37
<211> 10
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> "CAT5D9_HCDR3"
<400> 37
Asn Asn Tyr Val Trp Gly Ser Tyr Arg Phe
1. 5 10
<210> 38
<211> 10
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> "CAT5D9_LCDR3"
<400> 38
Gln Ser Tyr Asp Asp Thr Ser Gln Gly Val
1. 5 10
<210> 39
<211> 5
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> "CAT8_HCDR1"
<400> 39
Ser Tyr Ala Met Ser
1. 5
<210> 40
<211> 17
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> "CAT8 и CAT26_HCDR2"
<400> 40
Ala Ile Ser Gly Ser Gly Gly Ser Thr Tyr Tyr Ala Asp Ser Val Lys
1. 5 10 15
Gly
<210> 41
<211> 11
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> "CAT8_HCDR3"
<400> 41
Ser Ser Gly Tyr Tyr Gly Ala Asn Phe Asp Phe
1. 5 10
<210> 42
<211> 13
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> "CAT8_LCDR1"
<400> 42
Ser Gly Ser Ser Ser Asn Ile Gly Ser Gly Tyr Val Tyr
1. 5 10
<210> 43
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> "CAT8_LCDR2"
<400> 43
Arg Asn Asn Gln Arg Pro Ser
1. 5
<210> 44
<211> 11
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> "CAT8_LCDR3"
<400> 44
Ala Ala Trp Asp Asp Ser Leu Ser Gly Tyr Val
1. 5 10
<210> 45
<211> 5
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> "CAT26_HCDR1"
<400> 45
Ser Tyr Ala Val Ser
1. 5
<210> 46
<211> 14
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> "CAT26_HCDR3"
<400> 46
Asp Ala Tyr Gly Ser Ser Trp Tyr Phe Tyr Tyr Phe Asp Tyr
1. 5 10
<210> 47
<211> 13
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> "CAT26_LCDR1"
<400> 47
Ser Gly Ser Ser Ser Asn Ile Gly Ile Asn Pro Val Asn
1. 5 10
<210> 48
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> "CAT26_LCDR2"
<400> 48
Ser Asp Lys Tyr Arg Pro Ser
1. 5
<210> 49
<211> 11
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> "CAT26_LCDR3"
<400> 49
Ala Ala Trp Asp Asp Ser Leu Asn Gly Arg Val
1. 5 10
<210> 50
<211> 5
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> "DYAX3_HCDR1"
<400> 50
Met Tyr Glu Met Arg
1. 5
<210> 51
<211> 16
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> "DYAX3_HCDR2"
<400> 51
Val Ile Pro Ser Gly Gly Lys Thr Phe Tyr Ala Asp Ser Val Lys Gly
1. 5 10 15
<210> 52
<211> 18
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> "DYAX3 и DYAX5_HCDR3"
<400> 52
Tyr Ser Arg Trp Phe Gly Gln Leu Gly Phe Tyr Ser His Tyr Ala Met
1. 5 10 15
Asp Val
<210> 53
<211> 11
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> "DYAX3_LCDR1"
<400> 53
Arg Ala Ser Gln Ser Ile Asp Thr Tyr Leu Asn
1. 5 10
<210> 54
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> "DYAX3_LCDR2"
<400> 54
Ala Ala Ser Lys Leu Glu Asp
1. 5
<210> 55
<211> 10
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> "DYAX3_LCDR3"
<400> 55
Gln Gln Ser Tyr Ser Ser Pro Gly Ile Thr
1. 5 10
<210> 56
<211> 5
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> "DYAX5_HCDR1"
<400> 56
Ser Tyr Ile Met Val
1. 5
<210> 57
<211> 17
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> "DYAX5_HCDR2"
<400> 57
Ser Ile Tyr Ser Ser Gly Gly Ser Thr Ser Tyr Ala Asp Ser Val Lys
1. 5 10 15
Gly
<210> 58
<211> 11
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> "DYAX5_LCDR1"
<400> 58
Arg Ala Ser Gln Ser Ile Ser Ser Tyr Leu Asn
1. 5 10
<210> 59
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> "DYAX_LCDR2"
<400> 59
Ala Ala Ser Ser Leu Gln Ser
1. 5
<210> 60
<211> 10
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> "DYAX_LCDR3"
<400> 60
Gln Gln Ser Tyr Ser Thr Pro Pro Trp Thr
1. 5 10
<210> 61
<211> 449
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> "AM40_HC"
<400> 61
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ser
1. 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Gly Thr Phe Ser Ser Tyr
20 25 30
Ala Leu Ser Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Thr Arg Pro Pro Thr Ser Arg Thr Ala Ser Tyr Ala Gln Lys Phe
50 55 60
Gln Gly Arg Val Thr Ile Thr Val Asp Glu Ser Thr Ser Thr Gly Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Ser Asn Asp Phe Val Tyr Gly Ser Tyr Arg Phe Trp Gly Gln Gly
100 105 110
Thr Thr Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe
115 120 125
Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu
130 135 140
Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp
145 150 155 160
Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu
165 170 175
Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser
180 185 190
Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro
195 200 205
Ser Asn Thr Lys Val Asp Lys Arg Val Glu Pro Lys Ser Cys Asp Lys
210 215 220
Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Phe Glu Gly Gly Pro
225 230 235 240
Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser
245 250 255
Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp
260 265 270
Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn
275 280 285
Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val
290 295 300
Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu
305 310 315 320
Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Ser Ile Glu Lys
325 330 335
Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr
340 345 350
Leu Pro Pro Ser Arg Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr
355 360 365
Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu
370 375 380
Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu
385 390 395 400
Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys
405 410 415
Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu
420 425 430
Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly
435 440 445
Lys
<210> 62
<211> 217
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> "AM40_LC"
<400> 62
Asn Phe Met Leu Thr Gln Pro His Ser Val Ser Glu Ser Pro Gly Lys
1. 5 10 15
Thr Val Thr Ile Ser Cys Thr Arg Thr Ser Gly Asn Ile Ala Gly Tyr
20 25 30
Phe Val Gln Trp Tyr Gln Gln Arg Pro Gly Ser Ser Pro Thr Thr Val
35 40 45
Ile Tyr Glu Asp Tyr Gln Arg Pro Ser Gly Val Pro Asp Arg Phe Ser
50 55 60
Gly Ser Ile Asp Ser Ser Ser Asn Ser Ala Ser Leu Thr Ile Ser Gly
65 70 75 80
Leu Lys Thr Glu Asp Glu Ala Asp Tyr Tyr Cys Gln Ser Tyr Asp Asp
85 90 95
Tyr Arg Arg Ala Ala Phe Gly Gly Gly Thr Lys Leu Thr Val Leu Gly
100 105 110
Gln Pro Lys Ala Ala Pro Ser Val Thr Leu Phe Pro Pro Ser Ser Glu
115 120 125
Glu Leu Gln Ala Asn Lys Ala Thr Leu Val Cys Leu Ile Ser Asp Phe
130 135 140
Tyr Pro Gly Ala Val Thr Val Ala Trp Lys Ala Asp Ser Ser Pro Val
145 150 155 160
Lys Ala Gly Val Glu Thr Thr Thr Pro Ser Lys Gln Ser Asn Asn Lys
165 170 175
Tyr Ala Ala Ser Ser Tyr Leu Ser Leu Thr Pro Glu Gln Trp Lys Ser
180 185 190
His Arg Ser Tyr Ser Cys Gln Val Thr His Glu Gly Ser Thr Val Glu
195 200 205
Lys Thr Val Ala Pro Thr Glu Cys Ser
210 215
<210> 63
<211> 1347
<212> ДНК
<213> Искусственная последовательность
<220>
<223> "AM40_HC"
<400> 63
caggtgcagc tggtgcagtc tggggctgag gtgaagaagc ctgggtcctc ggtgaaggtc 60
tcctgcaagg cttctggagg caccttcagc agttatgctc ttagctgggt gcgacaggcc 120
cctggacaag ggcttgagtg gatgggaacg cggccgccga cctcccggac agcaagctac 180
gcacagaaat ttcagggcag agtcacgatt accgtggacg aatccacgag cacaggctac 240
atggagctga gcagcctgag atctgaggac acggccgtgt attactgtgc gtcaaacgac 300
ttcgtgtacg ggagttatcg tttctggggc caagggacca cggtcaccgt ctcctcagcg 360
tcgaccaagg gcccatccgt cttccccctg gcaccctcct ccaagagcac ctctgggggc 420
acagcggccc tgggctgcct ggtcaaggac tacttccccg aaccggtgac ggtgtcctgg 480
aactcaggcg ctctgaccag cggcgtgcac accttcccgg ctgtcctaca gtcctcagga 540
ctctactccc tcagcagcgt ggtgaccgtg ccctccagca gcttgggcac ccagacctac 600
atctgcaacg tgaatcacaa gcccagcaac accaaggtgg acaagagagt tgagcccaaa 660
tcttgtgaca aaactcacac atgcccaccg tgcccagcac ctgaattcga ggggggaccg 720
tcagtcttcc tcttcccccc aaaacccaag gacaccctca tgatctcccg gacccctgag 780
gtcacatgcg tggtggtgga cgtgagccac gaagaccctg aggtcaagtt caactggtac 840
gtggacggcg tggaggtgca taatgccaag acaaagccgc gggaggagca gtacaacagc 900
acgtaccgtg tggtcagcgt cctcaccgtc ctgcaccagg actggctgaa tggcaaggag 960
tacaagtgca aggtctccaa caaagccctc ccagcctcca tcgagaaaac catctccaaa 1020
gccaaagggc agccccgaga accacaggtc tacaccctgc ccccatcccg ggaggagatg 1080
accaagaacc aggtcagcct gacctgcctg gtcaaaggct tctatcccag cgacatcgcc 1140
gtggagtggg agagcaatgg gcagccggag aacaactaca agaccacgcc tcccgtgctg 1200
gactccgacg gctccttctt cctctatagc aagctcaccg tggacaagag caggtggcag 1260
caggggaacg tcttctcatg ctccgtgatg catgaggctc tgcacaacca ctacacgcag 1320
aagagcttaa gcctgtctcc gggtaaa 1347
<210> 64
<211> 651
<212> ДНК
<213> Искусственная последовательность
<220>
<223> "AM40_LC"
<400> 64
aattttatgc tgactcagcc ccactctgtg tcggagtctc cggggaagac ggtaaccatc 60
tcctgcaccc gcaccagtgg gaacattgcc ggctactttg tgcagtggta ccagcagcgc 120
ccgggcagtt cccccaccac tgtgatctat gaggattacc aacgaccctc tggggtccct 180
gatcggttct ctggctccat cgacagctcc tccaactctg cctccctcac catctctgga 240
ctgaagactg aggacgaggc tgactactat tgtcagtctt atgatgacta ccggcgggcg 300
gcgttcggcg gagggaccaa gctgaccgtc ctaggtcagc ccaaggcggc gccctcggtc 360
actctgttcc cgccctcctc tgaggagctt caagccaaca aggccacact ggtgtgtctc 420
ataagtgact tctacccggg agccgtgaca gtggcctgga aggcagatag cagccccgtc 480
aaggcgggag tggagaccac cacaccctcc aaacaaagca acaacaagta cgcggccagc 540
agctacctga gcctgacgcc tgagcagtgg aagtcccaca gaagctacag ctgccaggtc 600
acgcatgaag ggagcaccgt ggagaagaca gtggccccta cagaatgttc a 651
<210> 65
<211> 449
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> "SC4017_HC"
<400> 65
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ser
1. 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Gly Thr Phe Ser Ser Tyr
20 25 30
Ala Leu Ser Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Thr Arg Pro Pro Thr Ser Arg Thr Ala Ser Tyr Ala Gln Lys Phe
50 55 60
Gln Gly Arg Val Thr Ile Thr Val Asp Glu Ser Thr Ser Thr Gly Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Ser Asn Asp Phe Val Tyr Gly Ser Tyr Arg Phe Trp Gly Gln Gly
100 105 110
Thr Thr Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe
115 120 125
Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu
130 135 140
Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp
145 150 155 160
Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu
165 170 175
Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser
180 185 190
Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro
195 200 205
Ser Asn Thr Lys Val Asp Lys Arg Val Glu Pro Lys Ser Cys Asp Lys
210 215 220
Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Phe Glu Gly Gly Pro
225 230 235 240
Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser
245 250 255
Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp
260 265 270
Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn
275 280 285
Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val
290 295 300
Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu
305 310 315 320
Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Ser Ile Glu Lys
325 330 335
Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr
340 345 350
Leu Pro Pro Ser Arg Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr
355 360 365
Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu
370 375 380
Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu
385 390 395 400
Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys
405 410 415
Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu
420 425 430
Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly
435 440 445
Lys
<210> 66
<211> 217
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> "SC4017_LC"
<400> 66
Asn Phe Met Leu Thr Gln Pro His Ser Val Ser Glu Ser Pro Gly Lys
1. 5 10 15
Thr Val Thr Ile Ser Cys Thr Arg Thr Ser Gly Trp Ile Ala Gly Tyr
20 25 30
Phe Val Gln Trp Tyr Gln Gln Arg Pro Gly Ser Ser Pro Thr Thr Val
35 40 45
Ile Tyr Glu Asp Tyr Gln Arg Pro Ser Gly Val Pro Asp Arg Phe Ser
50 55 60
Gly Ser Ile Asp Ser Ser Ser Asn Ser Ala Ser Leu Thr Ile Ser Gly
65 70 75 80
Leu Lys Thr Glu Asp Glu Ala Asp Tyr Tyr Cys Gln Ser Tyr Asp Asp
85 90 95
Tyr Arg Arg Ala Ala Phe Gly Gly Gly Thr Lys Leu Thr Val Leu Gly
100 105 110
Gln Pro Lys Ala Ala Pro Ser Val Thr Leu Phe Pro Pro Ser Ser Glu
115 120 125
Glu Leu Gln Ala Asn Lys Ala Thr Leu Val Cys Leu Ile Ser Asp Phe
130 135 140
Tyr Pro Gly Ala Val Thr Val Ala Trp Lys Ala Asp Ser Ser Pro Val
145 150 155 160
Lys Ala Gly Val Glu Thr Thr Thr Pro Ser Lys Gln Ser Asn Asn Lys
165 170 175
Tyr Ala Ala Ser Ser Tyr Leu Ser Leu Thr Pro Glu Gln Trp Lys Ser
180 185 190
His Arg Ser Tyr Ser Cys Gln Val Thr His Glu Gly Ser Thr Val Glu
195 200 205
Lys Thr Val Ala Pro Thr Glu Cys Ser
210 215
<210> 67
<211> 1486
<212> ДНК
<213> Искусственная последовательность
<220>
<223> "SC4017_HC"
<400> 67
atgggatgga gctgtatcat cctcttcttg gtagcaacag ctacaggtaa ggggctcaca 60
gtagcaggct tgaggtctag acatatatat gggtgacaat gacatccact ttgcctttct 120
ctccacaggt gtacactccc aggtgcagct ggtgcagtct ggggctgagg tgaagaagcc 180
tgggtcctcg gtgaaggtct cctgcaaggc ttctggaggc accttcagca gttatgctct 240
tagctgggtg cgacaggccc ctggacaagg gcttgagtgg atgggaacgc ggccgccgac 300
ctcccggaca gcaagctacg cacagaaatt tcagggcaga gtcacgatta ccgtggacga 360
atccacgagc acaggctaca tggagctgag cagcctgaga tctgaggaca cggccgtgta 420
ttactgtgcg tcaaacgact tcgtgtacgg gagttatcgt ttctggggcc aagggaccac 480
ggtcaccgtc tcctcagcgt cgaccaaggg cccatccgtc ttccccctgg caccctcctc 540
caagagcacc tctgggggca cagcggccct gggctgcctg gtcaaggact acttccccga 600
accggtgacg gtgtcctgga actcaggcgc tctgaccagc ggcgtgcaca ccttcccggc 660
tgtcctacag tcctcaggac tctactccct cagcagcgtg gtgaccgtgc cctccagcag 720
cttgggcacc cagacctaca tctgcaacgt gaatcacaag cccagcaaca ccaaggtgga 780
caagagagtt gagcccaaat cttgtgacaa aactcacaca tgcccaccgt gcccagcacc 840
tgaattcgag gggggaccgt cagtcttcct cttcccccca aaacccaagg acaccctcat 900
gatctcccgg acccctgagg tcacatgcgt ggtggtggac gtgagccacg aagaccctga 960
ggtcaagttc aactggtacg tggacggcgt ggaggtgcat aatgccaaga caaagccgcg 1020
ggaggagcag tacaacagca cgtaccgtgt ggtcagcgtc ctcaccgtcc tgcaccagga 1080
ctggctgaat ggcaaggagt acaagtgcaa ggtctccaac aaagccctcc cagcctccat 1140
cgagaaaacc atctccaaag ccaaagggca gccccgagaa ccacaggtct acaccctgcc 1200
cccatcccgg gaggagatga ccaagaacca ggtcagcctg acctgcctgg tcaaaggctt 1260
ctatcccagc gacatcgccg tggagtggga gagcaatggg cagccggaga acaactacaa 1320
gaccacgcct cccgtgctgg actccgacgg ctccttcttc ctctatagca agctcaccgt 1380
ggacaagagc aggtggcagc aggggaacgt cttctcatgc tccgtgatgc atgaggctct 1440
gcacaaccac tacacgcaga agagcttaag cctgtctccg ggtaaa 1486
<210> 68
<211> 651
<212> ДНК
<213> Искусственная последовательность
<220>
<223> "SC4017_LC"
<400> 68
aattttatgc tgactcagcc ccactctgtg tcggagtctc cggggaagac ggtaaccatc 60
tcctgcaccc gcaccagtgg gtggattgcc ggctactttg tgcagtggta ccagcagcgc 120
ccgggcagtt cccccaccac tgtgatctat gaggattacc aacgaccctc tggggtccct 180
gatcggttct ctggctccat cgacagctcc tccaactctg cctccctcac catctctgga 240
ctgaagactg aggacgaggc tgactactat tgtcagtctt atgatgacta ccggcgggcg 300
gcgttcggcg gagggaccaa gctgaccgtc ctaggtcagc ccaaggcggc gccctcggtc 360
actctgttcc cgccctcctc tgaggagctt caagccaaca aggccacact ggtgtgtctc 420
ataagtgact tctacccggg agccgtgaca gtggcctgga aggcagatag cagccccgtc 480
aaggcgggag tggagaccac cacaccctcc aaacaaagca acaacaagta cgcggccagc 540
agctacctga gcctgacgcc tgagcagtgg aagtcccaca gaagctacag ctgccaggtc 600
acgcatgaag ggagcaccgt ggagaagaca gtggccccta cagaatgttc a 651
<210> 69
<211> 449
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> "CAT5D9_HC"
<400> 69
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ser
1. 5 10 15
Ser Val Lys Val Ser Cys Lys Ile Ser Gly Gly Thr Phe Ser Ser Tyr
20 25 30
Ala Leu Ser Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Gly Ile Ile Pro Val Phe Arg Thr Ala Ser Tyr Ala Gln Lys Phe
50 55 60
Gln Gly Arg Val Thr Ile Thr Val Asp Glu Ser Ala Ser Thr Gly Tyr
65 70 75 80
Ile Glu Leu Ser Ser Leu Lys Ser Glu Asp Thr Ala Thr Tyr Tyr Cys
85 90 95
Ala Ser Asn Asn Tyr Val Trp Gly Ser Tyr Arg Phe Trp Gly Gln Gly
100 105 110
Thr Thr Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe
115 120 125
Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu
130 135 140
Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp
145 150 155 160
Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu
165 170 175
Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser
180 185 190
Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro
195 200 205
Ser Asn Thr Lys Val Asp Lys Arg Val Glu Pro Lys Ser Cys Asp Lys
210 215 220
Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Phe Glu Gly Gly Pro
225 230 235 240
Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser
245 250 255
Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp
260 265 270
Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn
275 280 285
Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val
290 295 300
Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu
305 310 315 320
Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Ser Ile Glu Lys
325 330 335
Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr
340 345 350
Leu Pro Pro Ser Arg Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr
355 360 365
Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu
370 375 380
Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu
385 390 395 400
Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys
405 410 415
Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu
420 425 430
Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly
435 440 445
Lys
<210> 70
<211> 217
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> "CAT5D9_LC"
<400> 70
Asn Phe Met Leu Thr Gln Pro His Ser Val Ser Glu Ser Pro Gly Lys
1. 5 10 15
Thr Val Thr Ile Ser Cys Thr Arg Thr Ser Gly Asn Ile Ala Gly Tyr
20 25 30
Phe Val Gln Trp Tyr Gln Gln Arg Pro Gly Ser Ser Pro Thr Thr Val
35 40 45
Ile Tyr Glu Asp Tyr Gln Arg Pro Ser Gly Val Pro Asp Arg Phe Ser
50 55 60
Gly Ser Ile Asp Arg Ser Ser Asn Ser Ala Ser Leu Thr Ile Ser Gly
65 70 75 80
Leu Lys Pro Asp Asp Glu Ala Asp Tyr Tyr Cys Gln Ser Tyr Asp Asp
85 90 95
Thr Ser Gln Gly Val Phe Gly Ala Gly Thr Lys Val Thr Val Leu Gly
100 105 110
Gln Pro Lys Ala Ala Pro Ser Val Thr Leu Phe Pro Pro Ser Ser Glu
115 120 125
Glu Leu Gln Ala Asn Lys Ala Thr Leu Val Cys Leu Ile Ser Asp Phe
130 135 140
Tyr Pro Gly Ala Val Thr Val Ala Trp Lys Ala Asp Ser Ser Pro Val
145 150 155 160
Lys Ala Gly Val Glu Thr Thr Thr Pro Ser Lys Gln Ser Asn Asn Lys
165 170 175
Tyr Ala Ala Ser Ser Tyr Leu Ser Leu Thr Pro Glu Gln Trp Lys Ser
180 185 190
His Arg Ser Tyr Ser Cys Gln Val Thr His Glu Gly Ser Thr Val Glu
195 200 205
Lys Thr Val Ala Pro Thr Glu Cys Ser
210 215
<210> 71
<211> 1346
<212> ДНК
<213> Искусственная последовательность
<220>
<223> "CAT5D9_HC"
<400> 71
aggtgcagct ggtgcagtct ggggctgagg tgaagaagcc tgggtcctcg gtgaaggtct 60
cctgcaaggc ttctggaggc accttcagca gttatgctct tagctgggtg cgacaggccc 120
ctggacaagg gcttgagtgg atgggaacgc ggccgccgac ctcccggaca gcaagctacg 180
cacagaaatt tcagggcaga gtcacgatta ccgtggacga atccacgagc acaggctaca 240
tggagctgag cagcctgaga tctgaggaca cggccgtgta ttactgtgcg tcaaacgact 300
tcgtgtacgg gagttatcgt ttctggggcc aagggaccac ggtcaccgtc tcctcagcgt 360
cgaccaaggg cccatccgtc ttccccctgg caccctcctc caagagcacc tctgggggca 420
cagcggccct gggctgcctg gtcaaggact acttccccga accggtgacg gtgtcctgga 480
actcaggcgc tctgaccagc ggcgtgcaca ccttcccggc tgtcctacag tcctcaggac 540
tctactccct cagcagcgtg gtgaccgtgc cctccagcag cttgggcacc cagacctaca 600
tctgcaacgt gaatcacaag cccagcaaca ccaaggtgga caagagagtt gagcccaaat 660
cttgtgacaa aactcacaca tgcccaccgt gcccagcacc tgaattcgag gggggaccgt 720
cagtcttcct cttcccccca aaacccaagg acaccctcat gatctcccgg acccctgagg 780
tcacatgcgt ggtggtggac gtgagccacg aagaccctga ggtcaagttc aactggtacg 840
tggacggcgt ggaggtgcat aatgccaaga caaagccgcg ggaggagcag tacaacagca 900
cgtaccgtgt ggtcagcgtc ctcaccgtcc tgcaccagga ctggctgaat ggcaaggagt 960
acaagtgcaa ggtctccaac aaagccctcc cagcctccat cgagaaaacc atctccaaag 1020
ccaaagggca gccccgagaa ccacaggtct acaccctgcc cccatcccgg gaggagatga 1080
ccaagaacca ggtcagcctg acctgcctgg tcaaaggctt ctatcccagc gacatcgccg 1140
tggagtggga gagcaatggg cagccggaga acaactacaa gaccacgcct cccgtgctgg 1200
actccgacgg ctccttcttc ctctatagca agctcaccgt ggacaagagc aggtggcagc 1260
aggggaacgt cttctcatgc tccgtgatgc atgaggctct gcacaaccac tacacgcaga 1320
agagcttaag cctgtctccg ggtaaa 1346
<210> 72
<211> 651
<212> ДНК
<213> Искусственная последовательность
<220>
<223> "CAT5D9_LC"
<400> 72
aattttatgc tgactcagcc ccactctgtg tcggagtctc cggggaagac ggtcaccatc 60
tcctgcaccc gcaccagtgg gaacattgcc ggctactttg tgcagtggta ccagcagcgc 120
ccgggcagtt cccccaccac tgtgatctat gaggattacc aacgaccctc tggggtccct 180
gatcggttct ctggctccat cgacaggtcc tccaactctg cctccctcac catctctgga 240
ctgaagcctg acgacgaggc tgactactat tgtcagtctt atgatgacac ctctcaaggt 300
gtgttcggcg cagggaccaa ggtcaccgtc ctaggtcagc ccaaggcggc gccctcggtc 360
actctgttcc cgccctcctc tgaggagctt caagccaaca aggccacact ggtgtgtctc 420
ataagtgact tctacccggg agccgtgaca gtggcctgga aggcagatag cagccccgtc 480
aaggcgggag tggagaccac cacaccctcc aaacaaagca acaacaagta cgcggccagc 540
agctacctga gcctgacgcc tgagcagtgg aagtcccaca gaagctacag ctgccaggtc 600
acgcatgaag ggagcaccgt ggagaagaca gtggccccta cagaatgttc a 651
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| АНТИТЕЛА И КОМПОЗИЦИИ ПРОТИВ FLT3 | 2021 |
|
RU2836004C1 |
| УЛУЧШЕННЫЕ АНТИ-FLT3 АНТИГЕНСВЯЗЫВАЮЩИЕ БЕЛКИ | 2019 |
|
RU2830982C2 |
| АНТИТЕЛА, СПЕЦИФИЧНЫЕ К FLT3, И ИХ ПРИМЕНЕНИЯ | 2018 |
|
RU2758513C2 |
| ХИМЕРНЫЕ АНТИГЕННЫЕ РЕЦЕПТОРЫ, НАЦЕЛЕННЫЕ НА FLT3 | 2018 |
|
RU2820859C2 |
| БИФУНКЦИОНАЛЬНЫЕ БЕЛКИ, КОМБИНИРУЮЩИЕ БЛОКАДУ КОНТРОЛЬНОЙ ТОЧКИ, ДЛЯ ТАРГЕТНОЙ ТЕРАПИИ | 2019 |
|
RU2756899C1 |
| ИММУНОЦИТОКИНЫ И ИХ ПРИМЕНЕНИЕ | 2021 |
|
RU2818371C1 |
| АНТИ-PD-1 АНТИТЕЛА | 2019 |
|
RU2788095C2 |
| ПРОКОАГУЛЯНТНЫЕ АНТИТЕЛА | 2018 |
|
RU2810094C2 |
| АНТИТЕЛО К B7-H4, ЕГО АНТИГЕНСВЯЗЫВАЮЩИЙ ФРАГМЕНТ И ЕГО ФАРМАЦЕВТИЧЕСКОЕ ПРИМЕНЕНИЕ | 2019 |
|
RU2792748C2 |
| АНТИ-PCSK9 АНТИТЕЛО, ЕГО АНТИГЕНСВЯЗЫВАЮЩИЙ ФРАГМЕНТ И ИХ МЕДИЦИНСКОЕ ПРИМЕНЕНИЕ | 2016 |
|
RU2739208C2 |
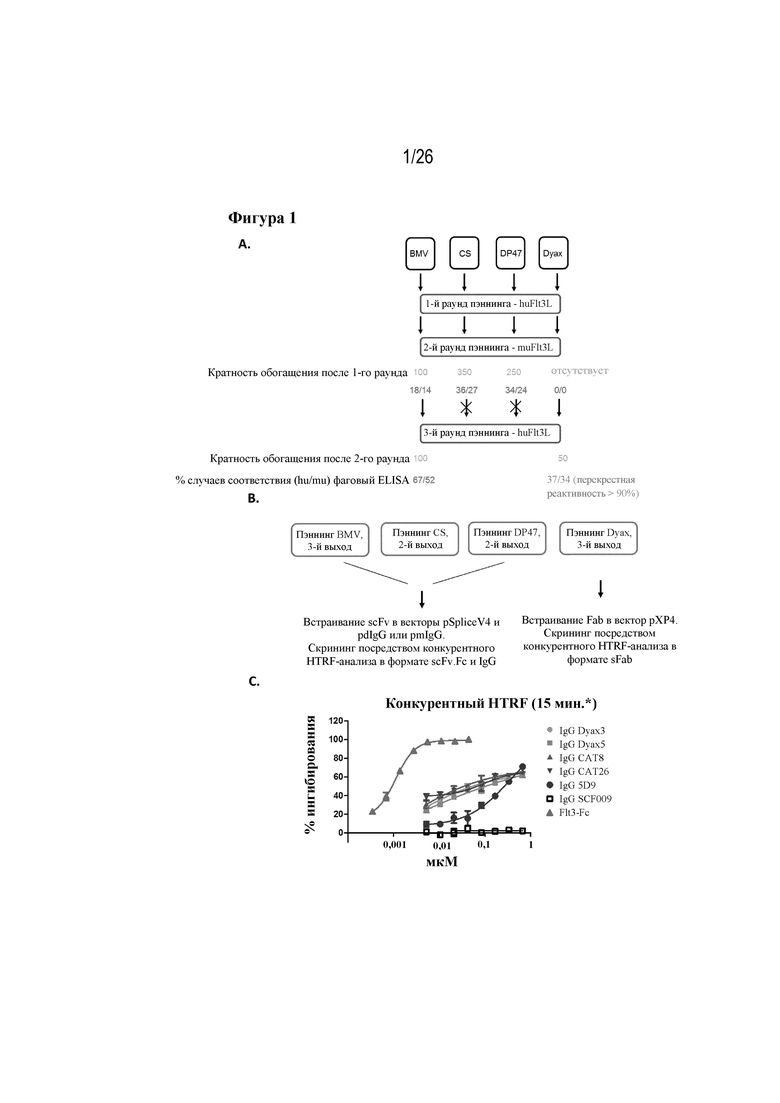
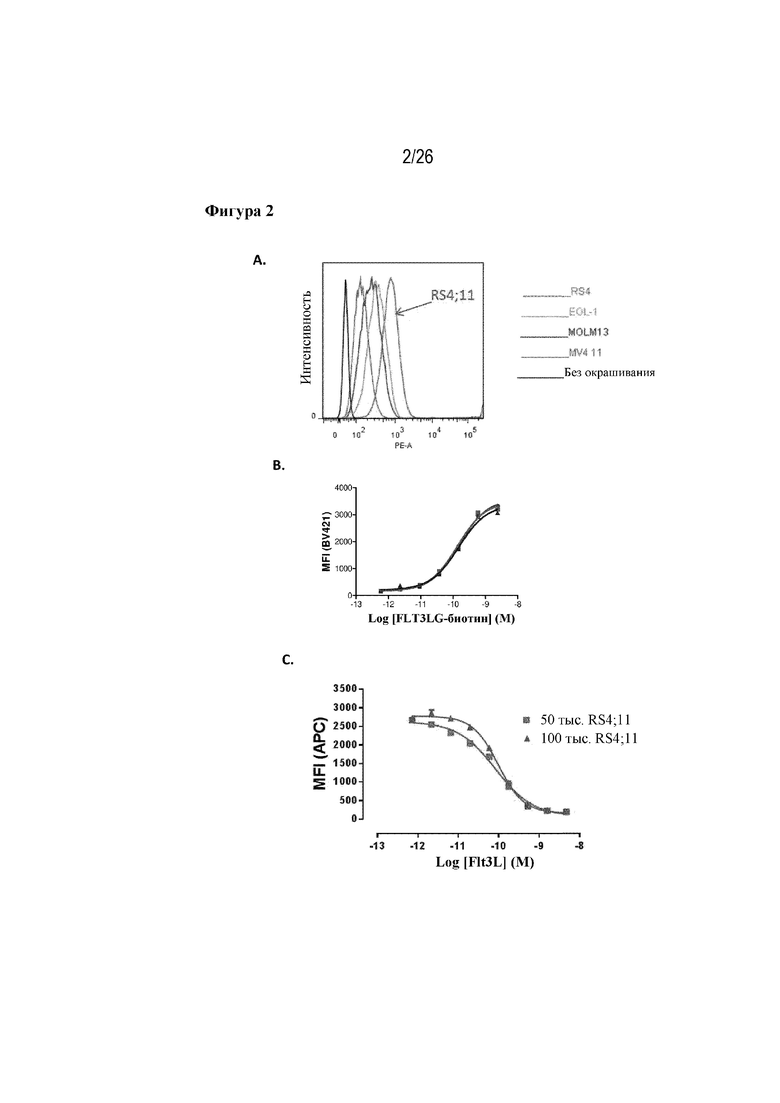
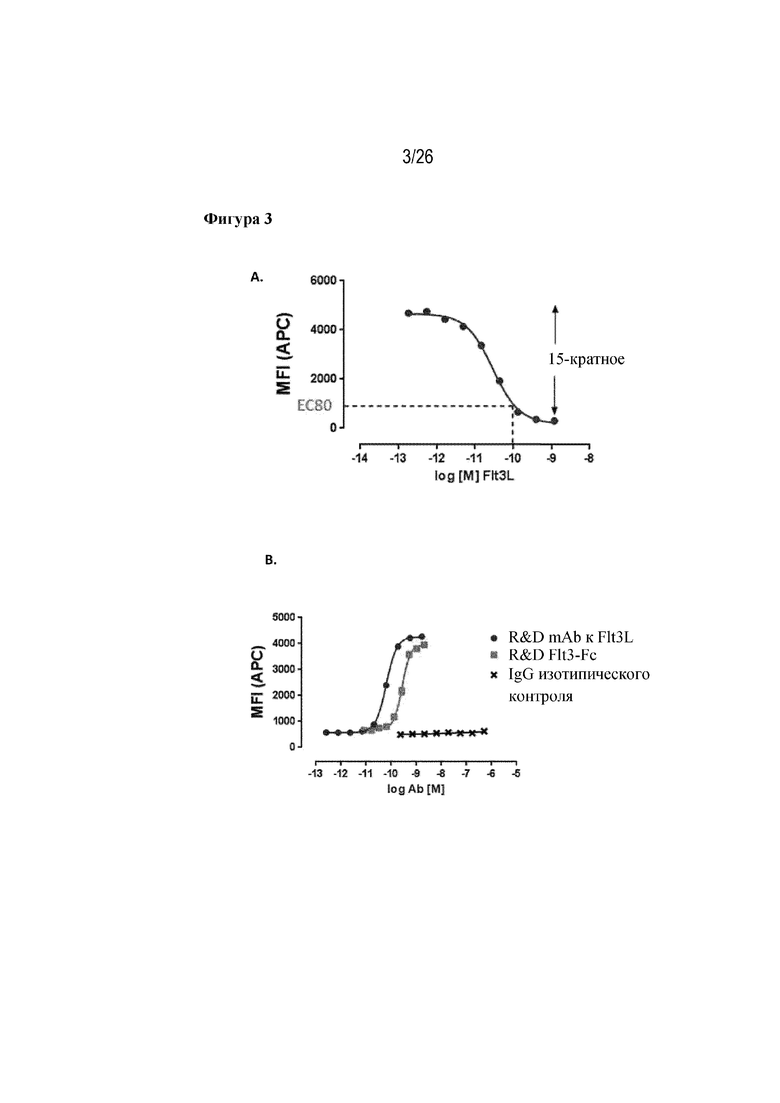
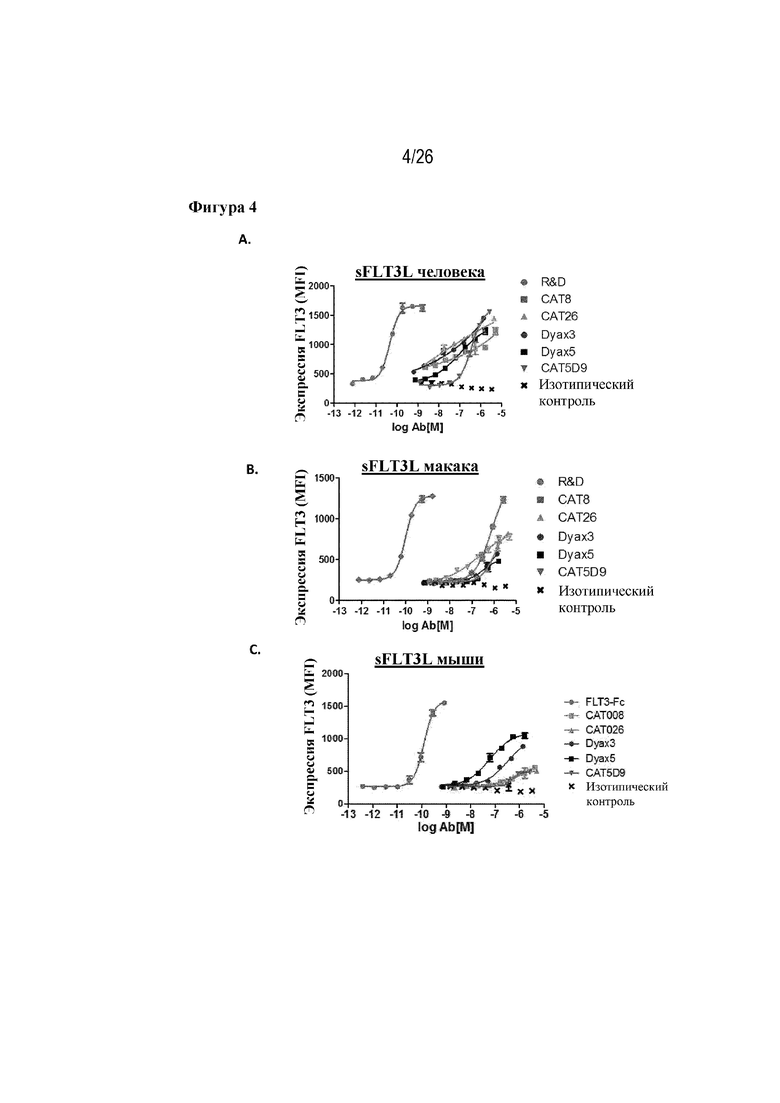
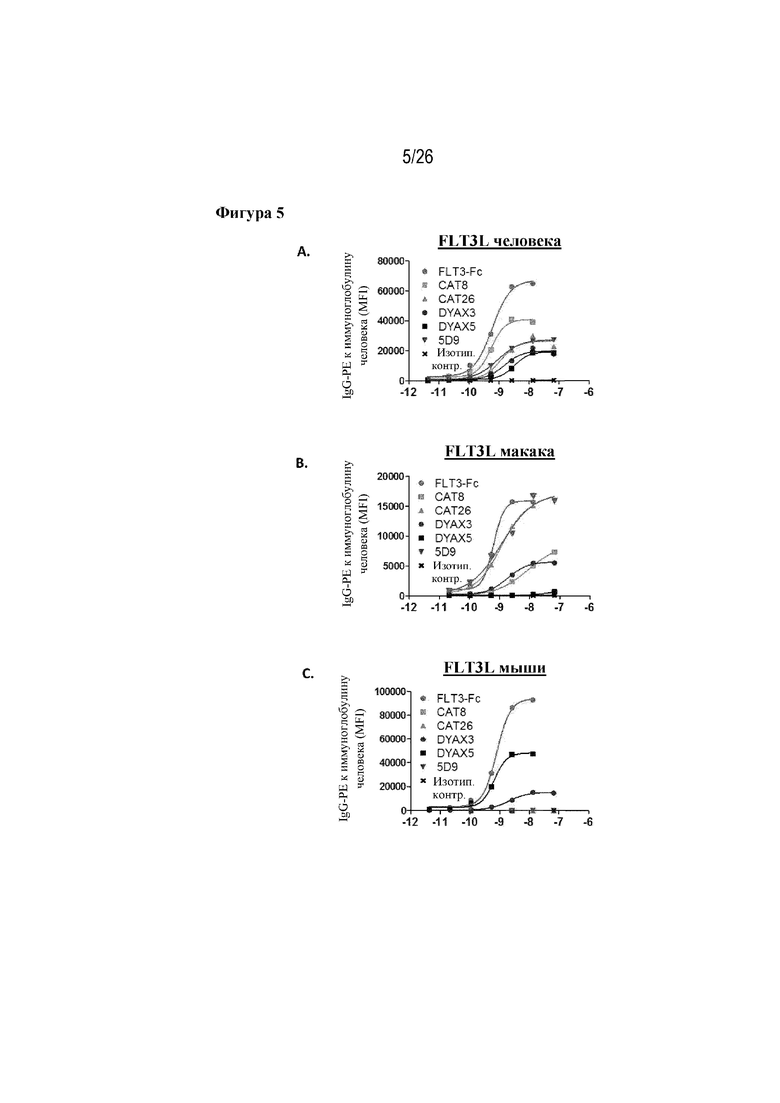
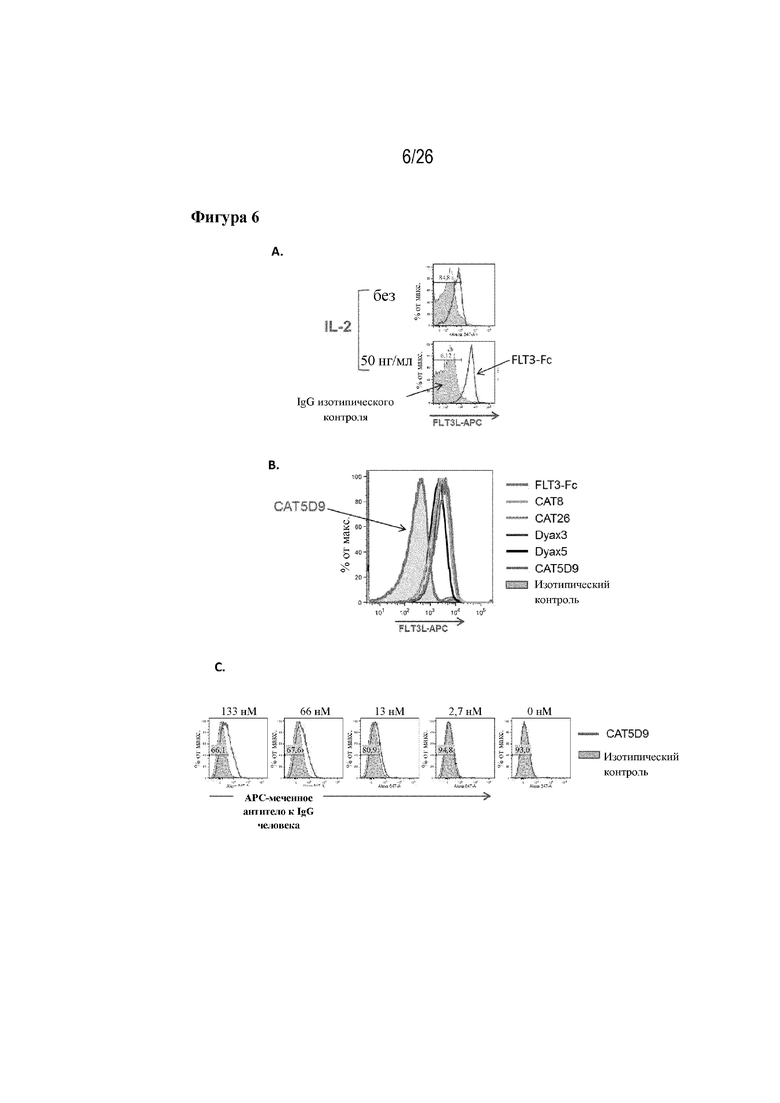
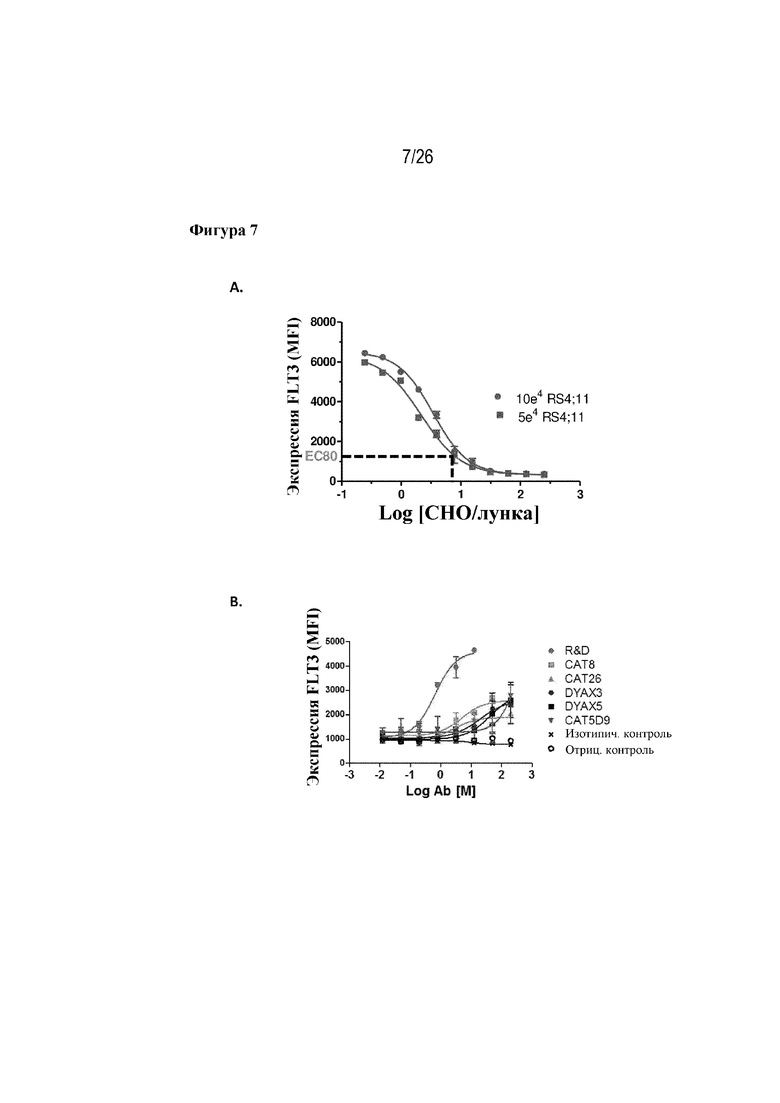
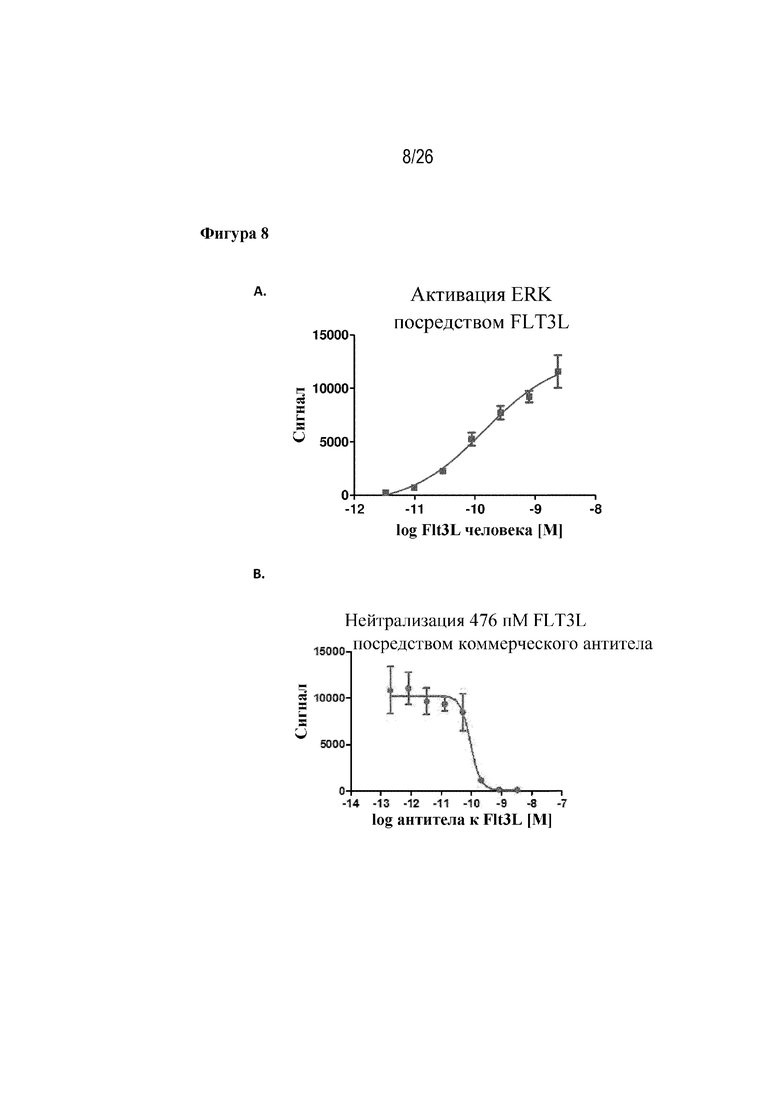
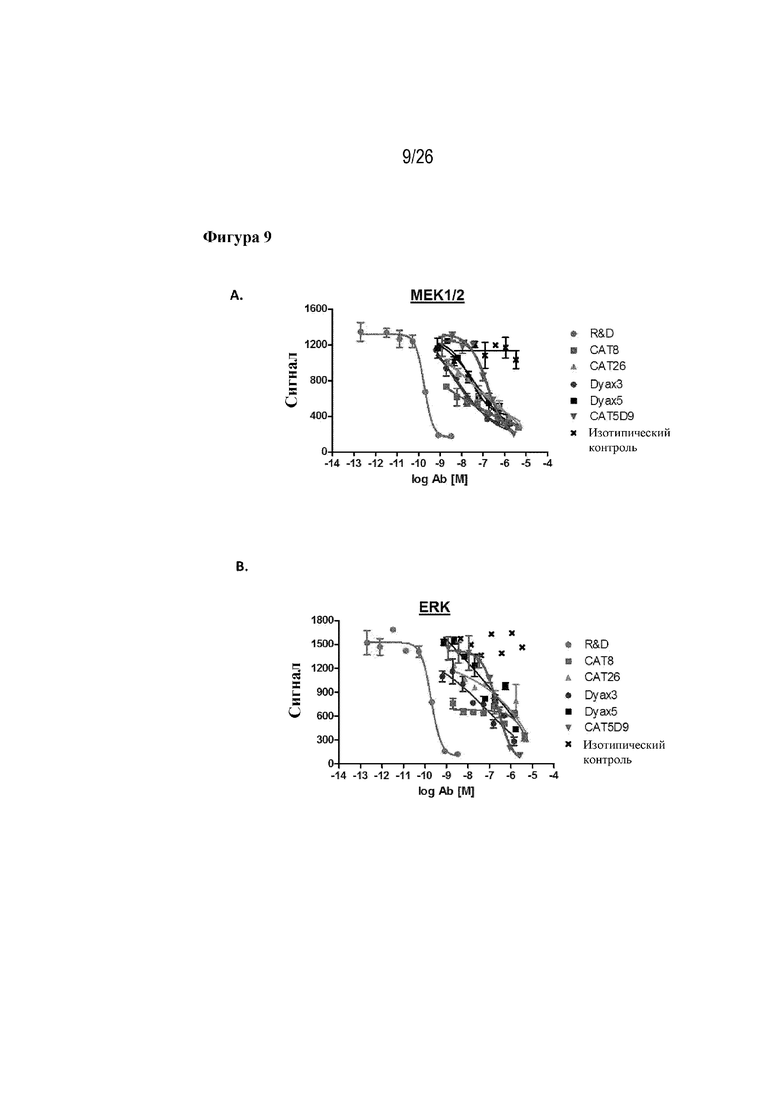
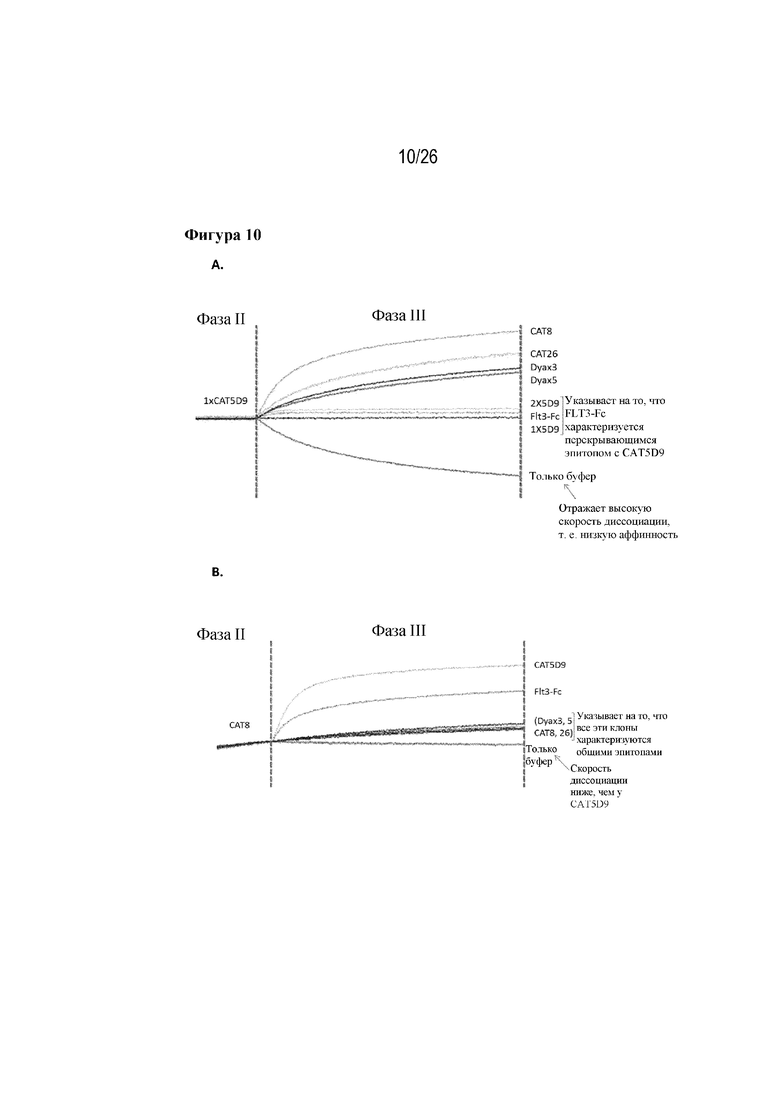
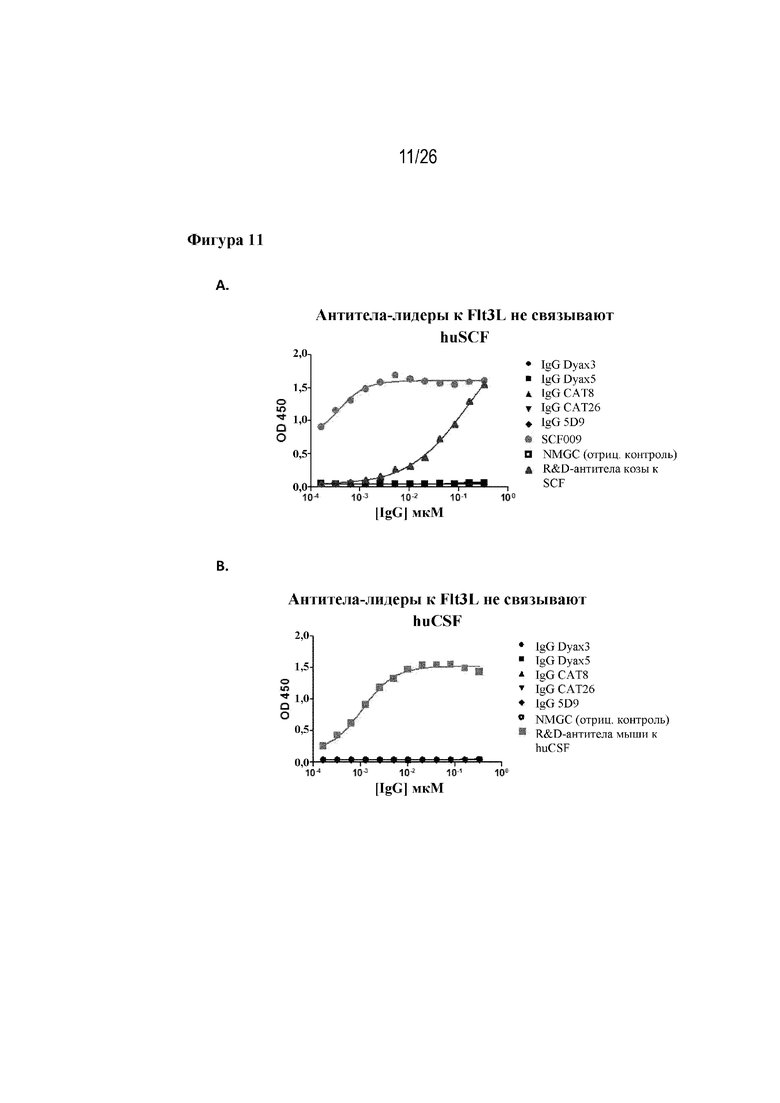
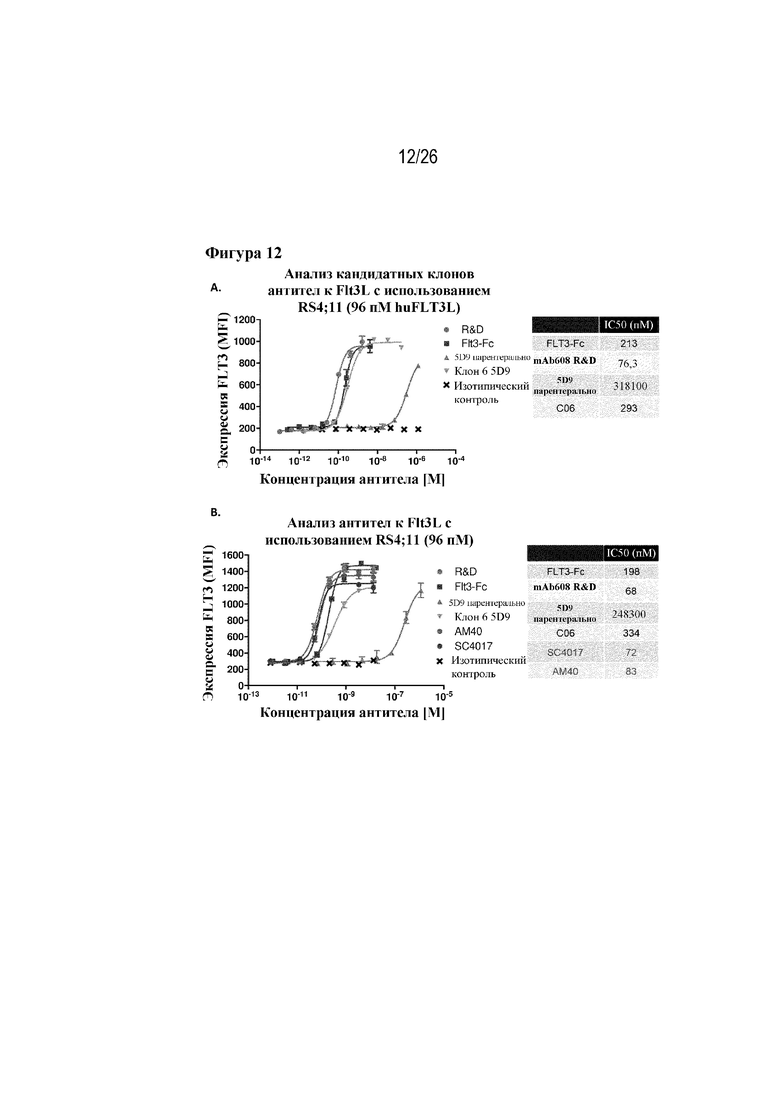
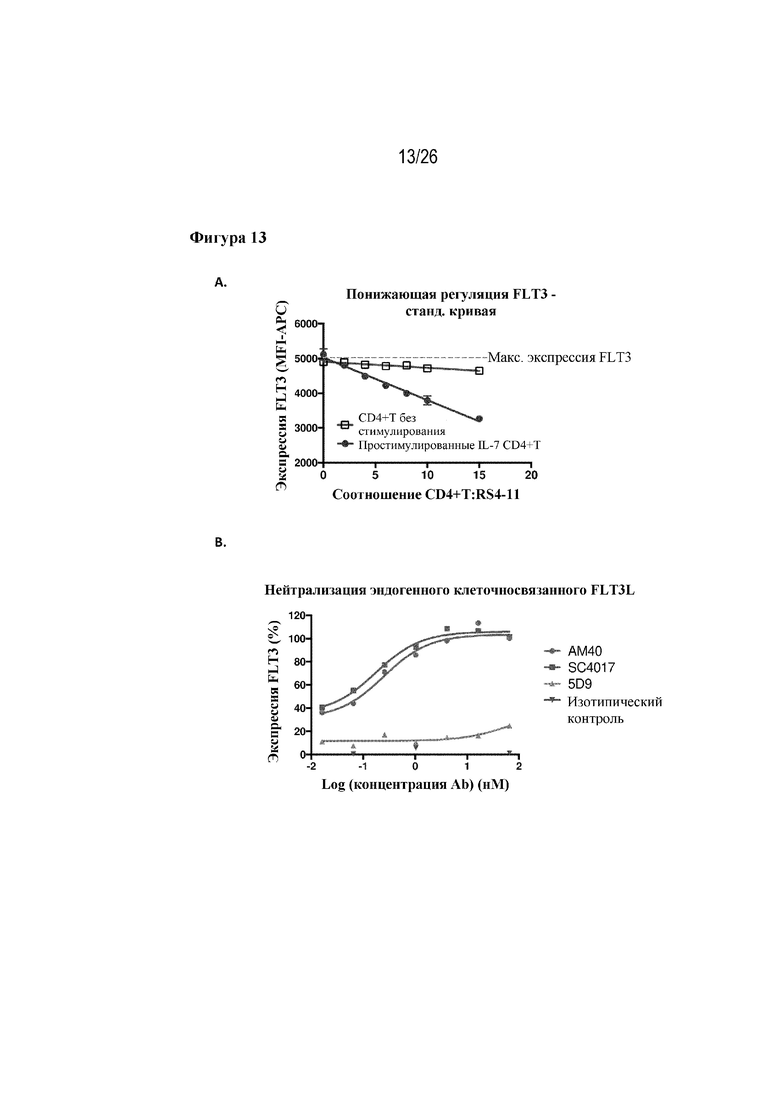
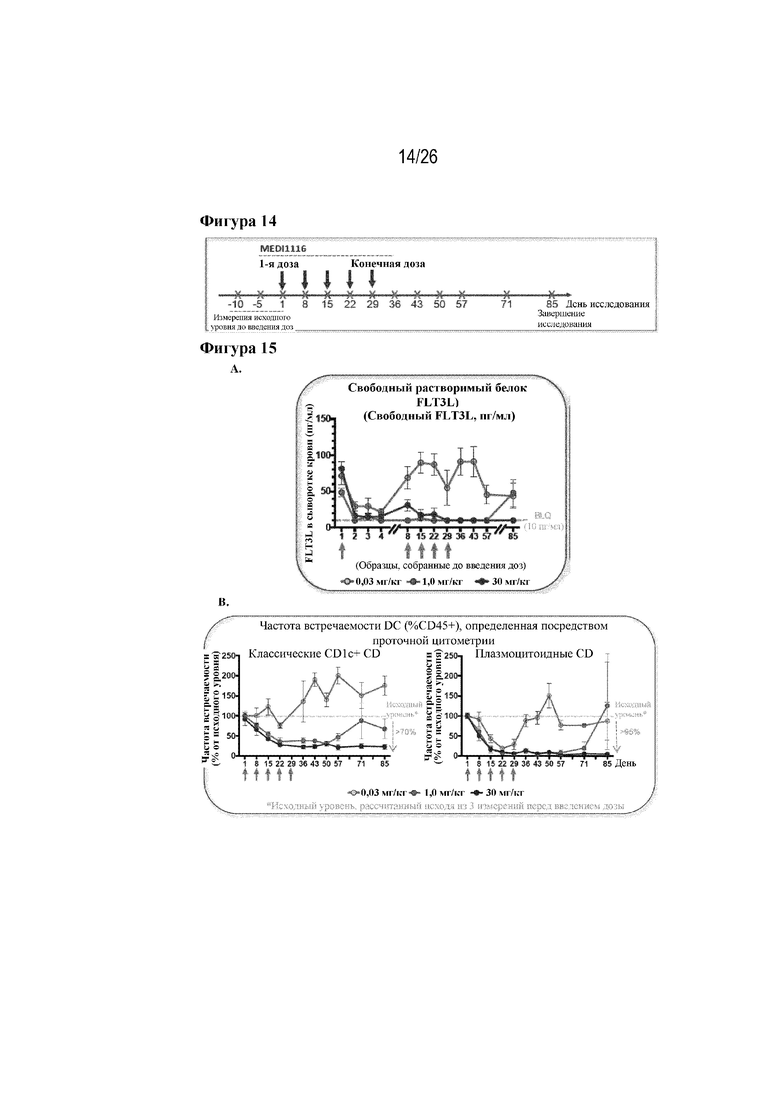
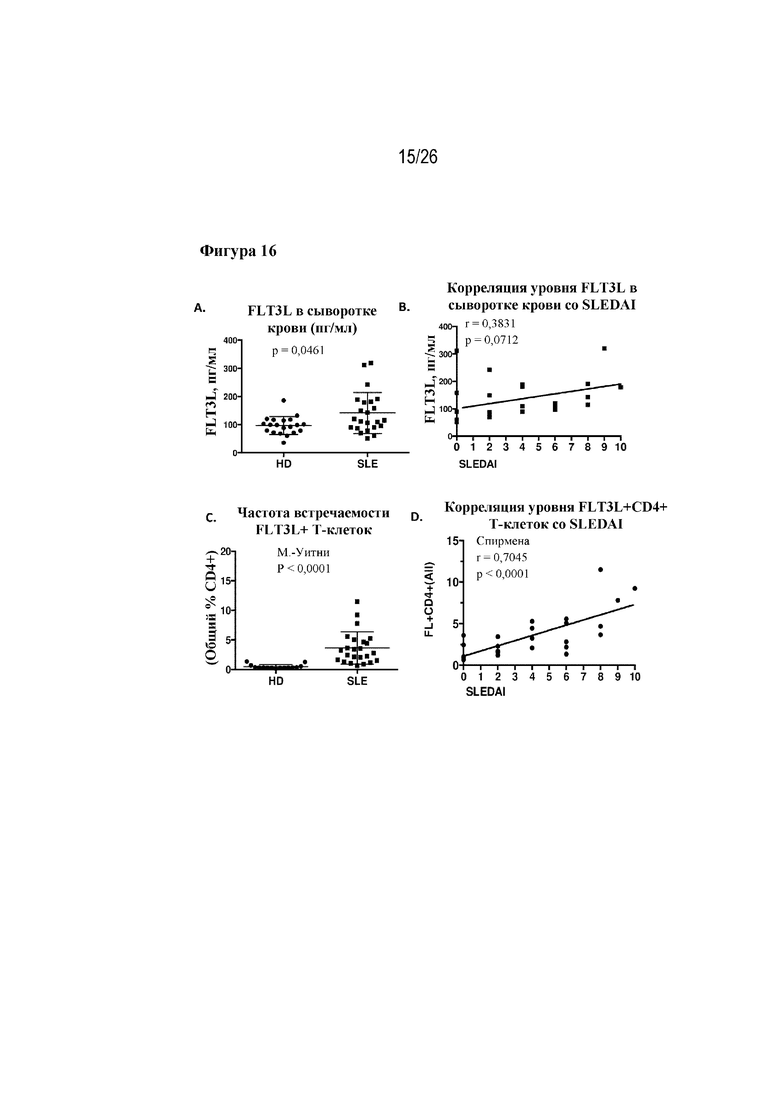
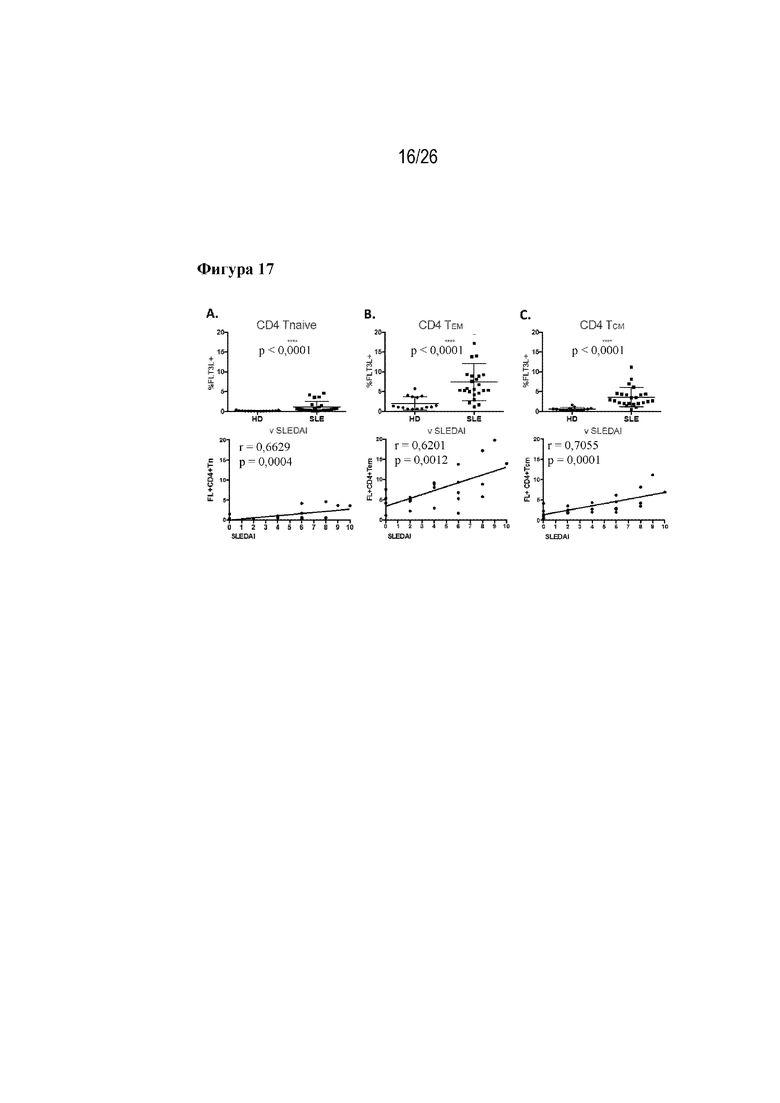
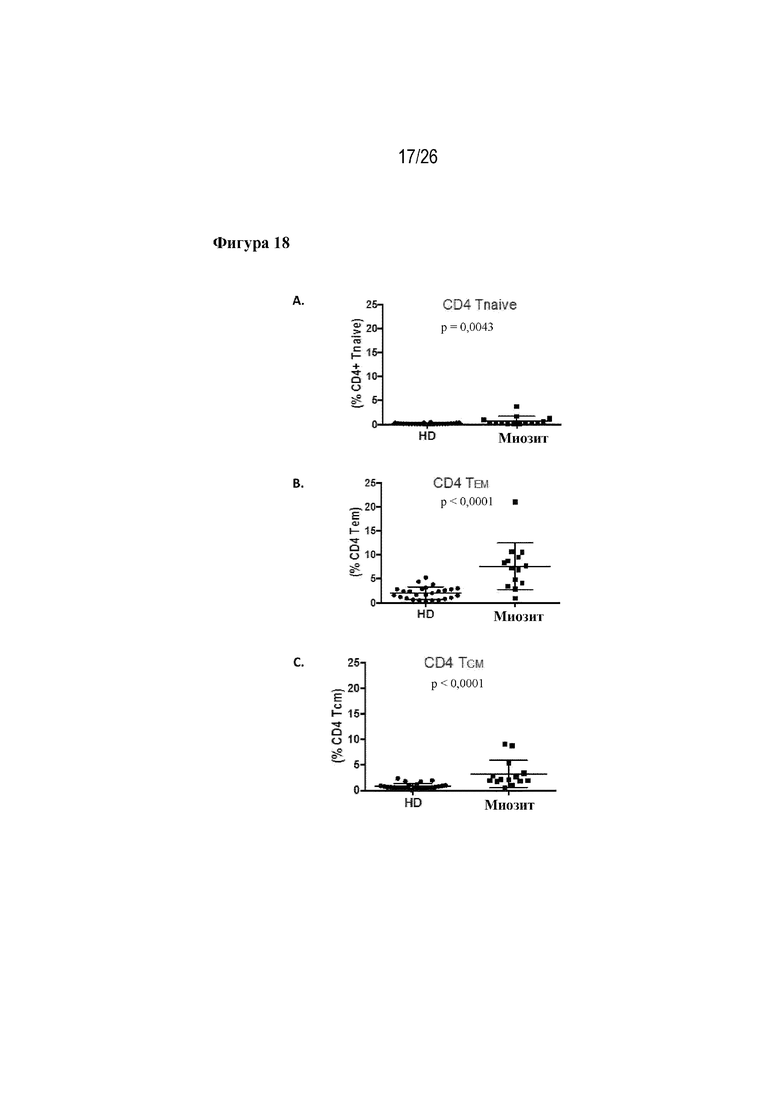
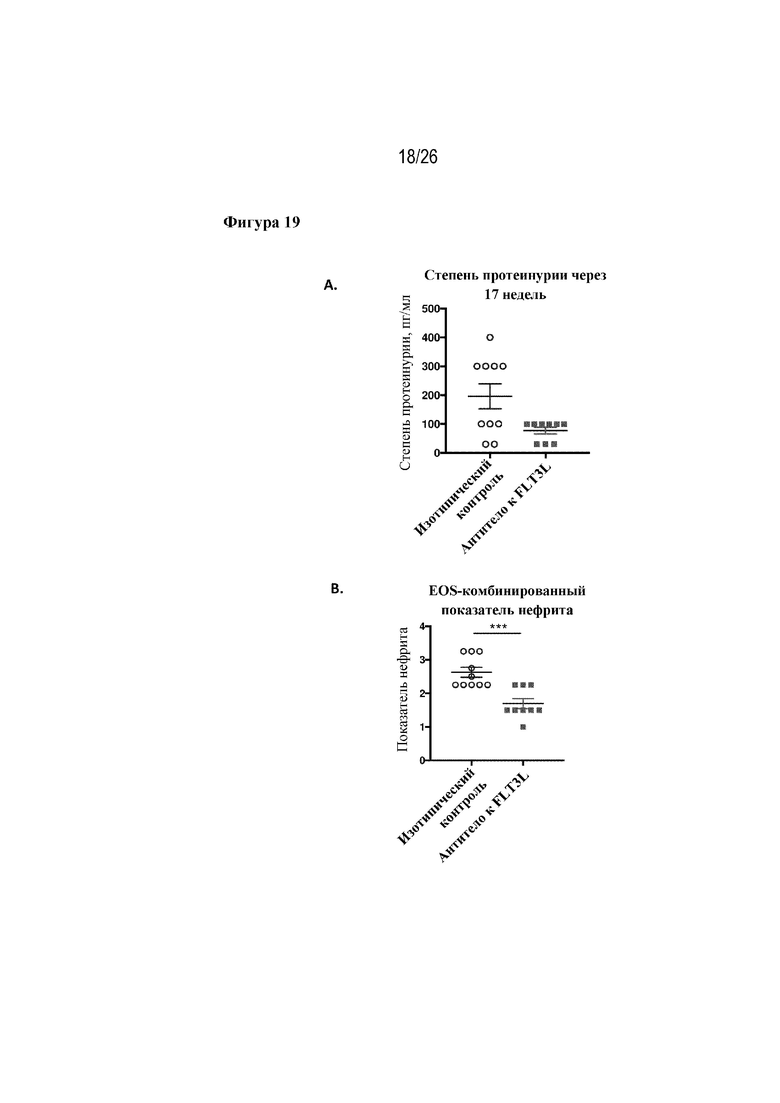

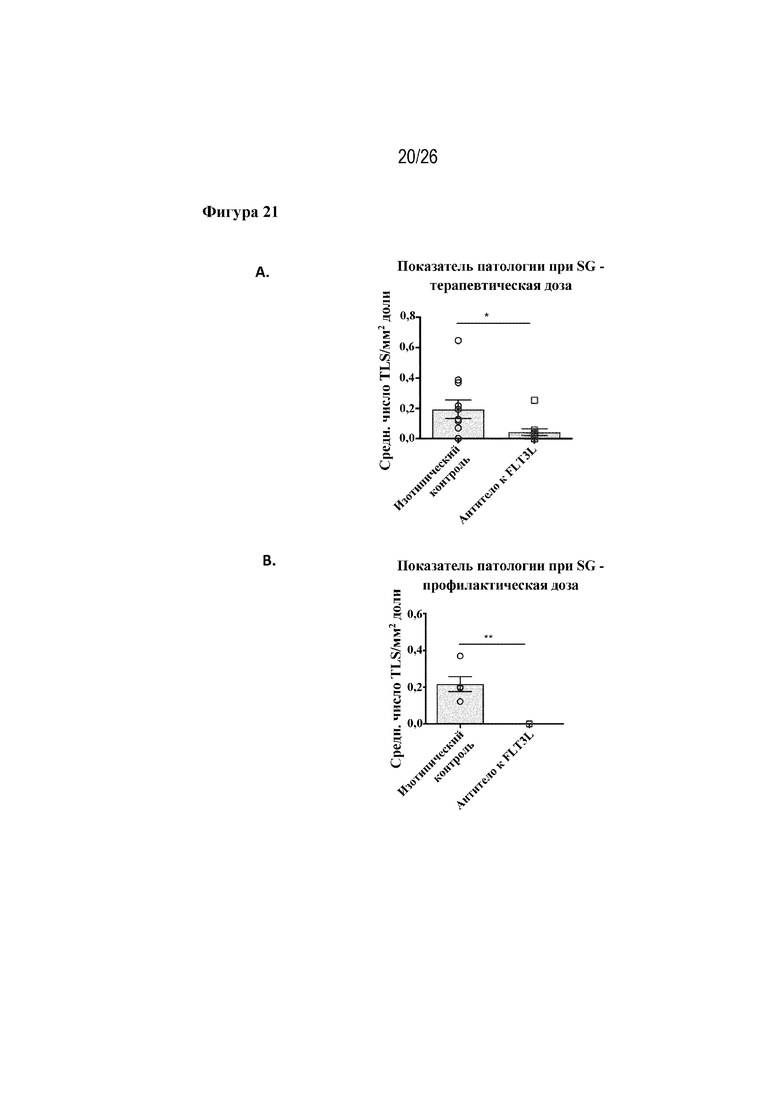
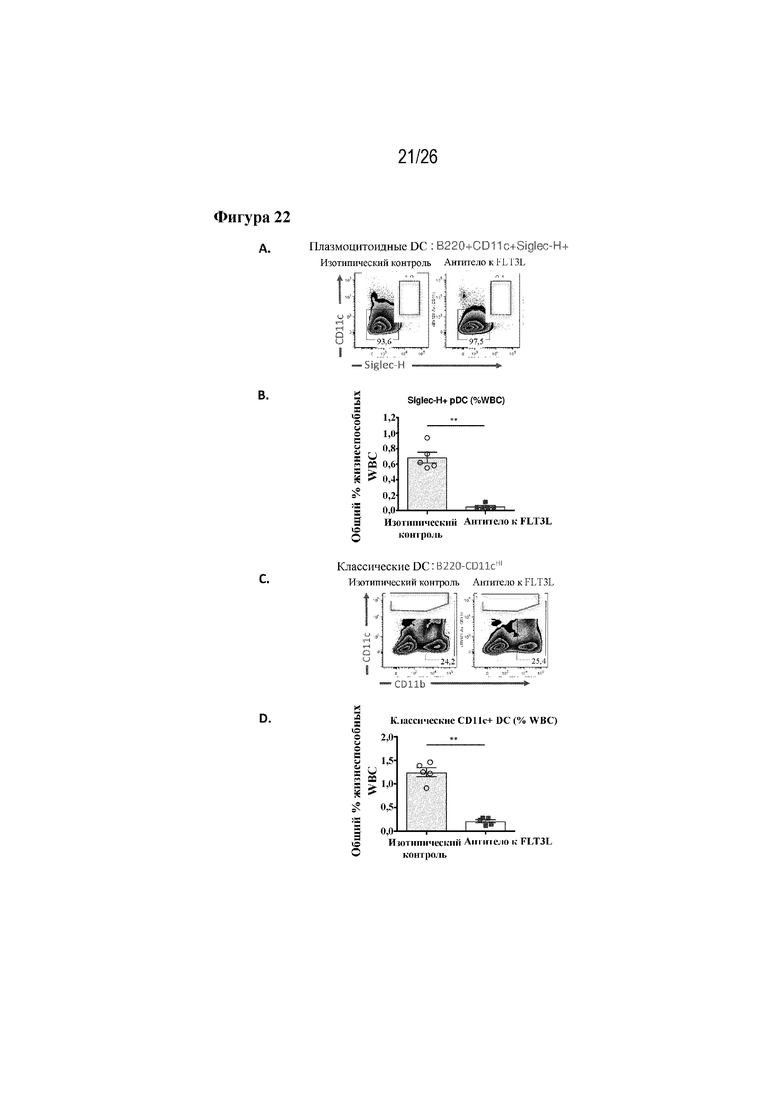
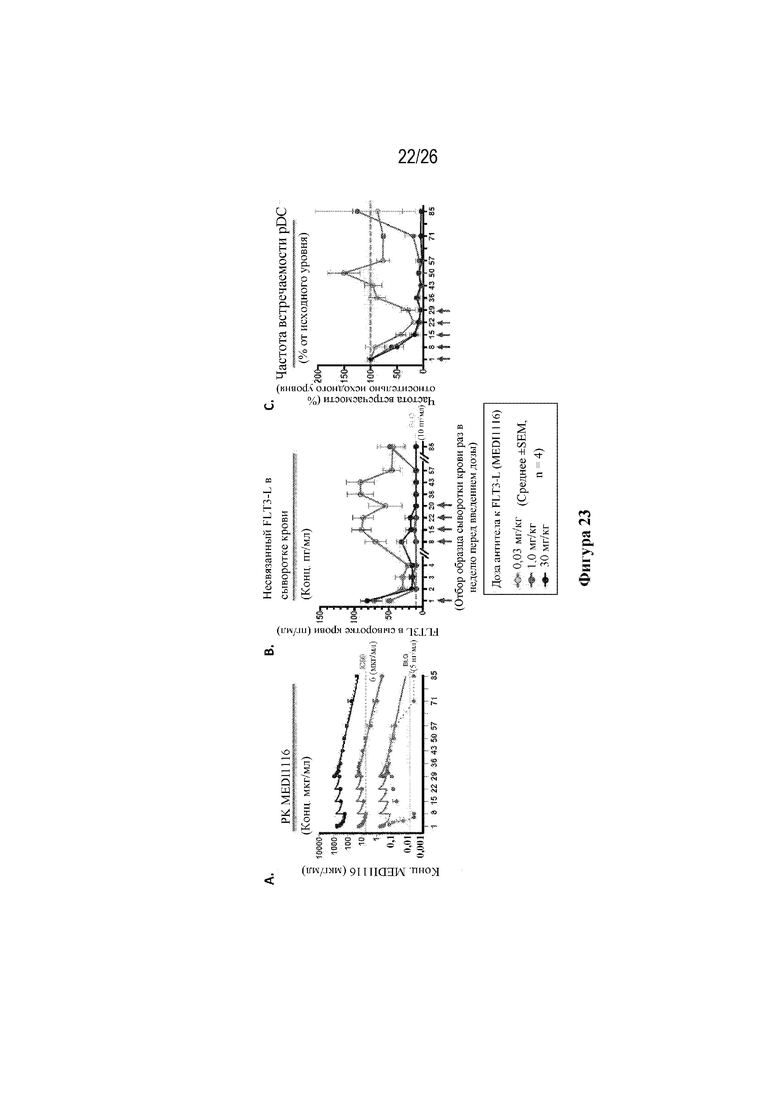
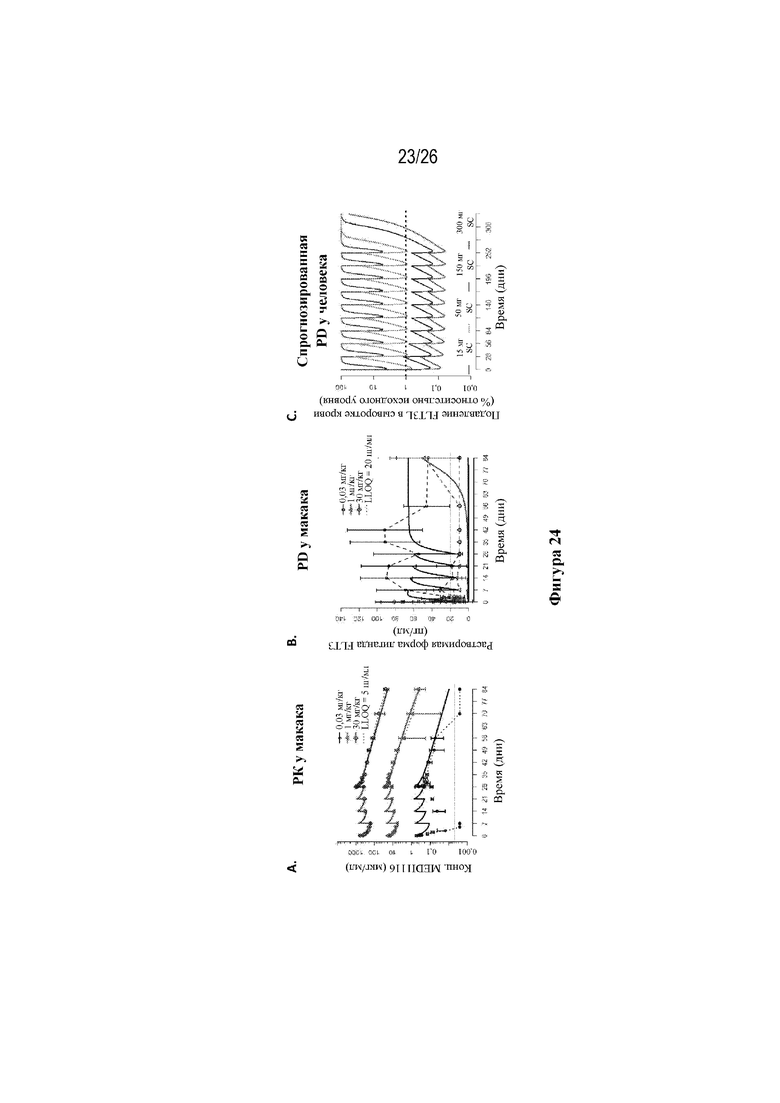
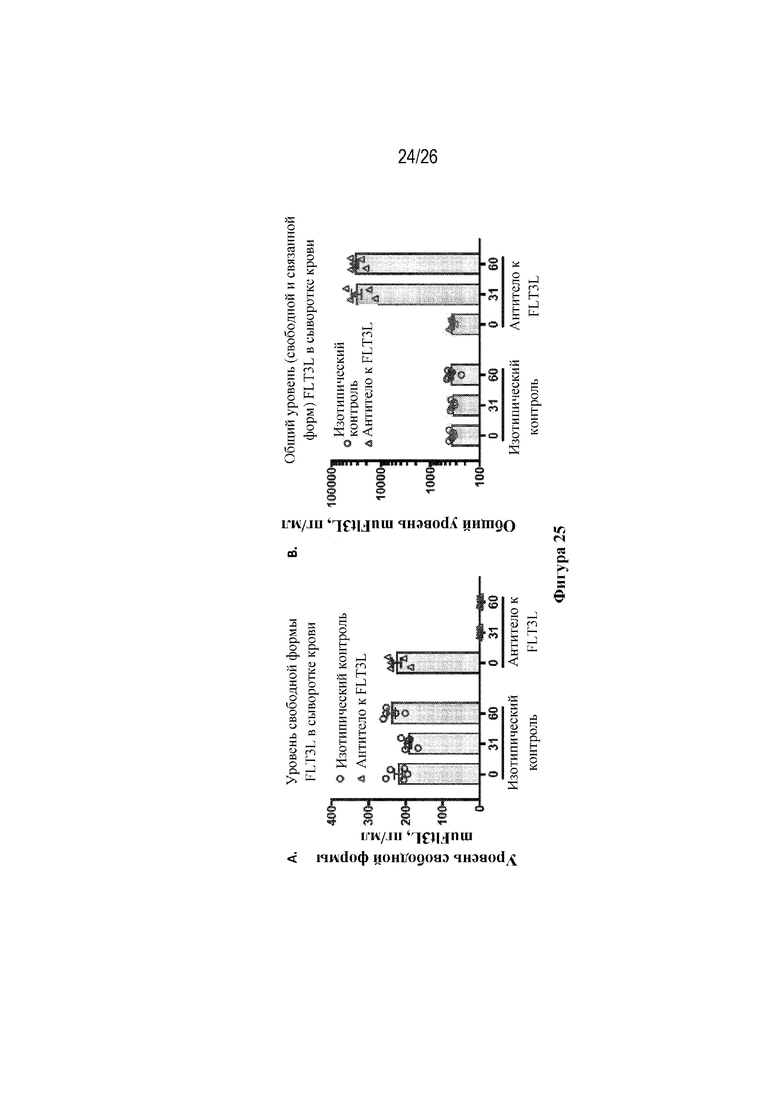
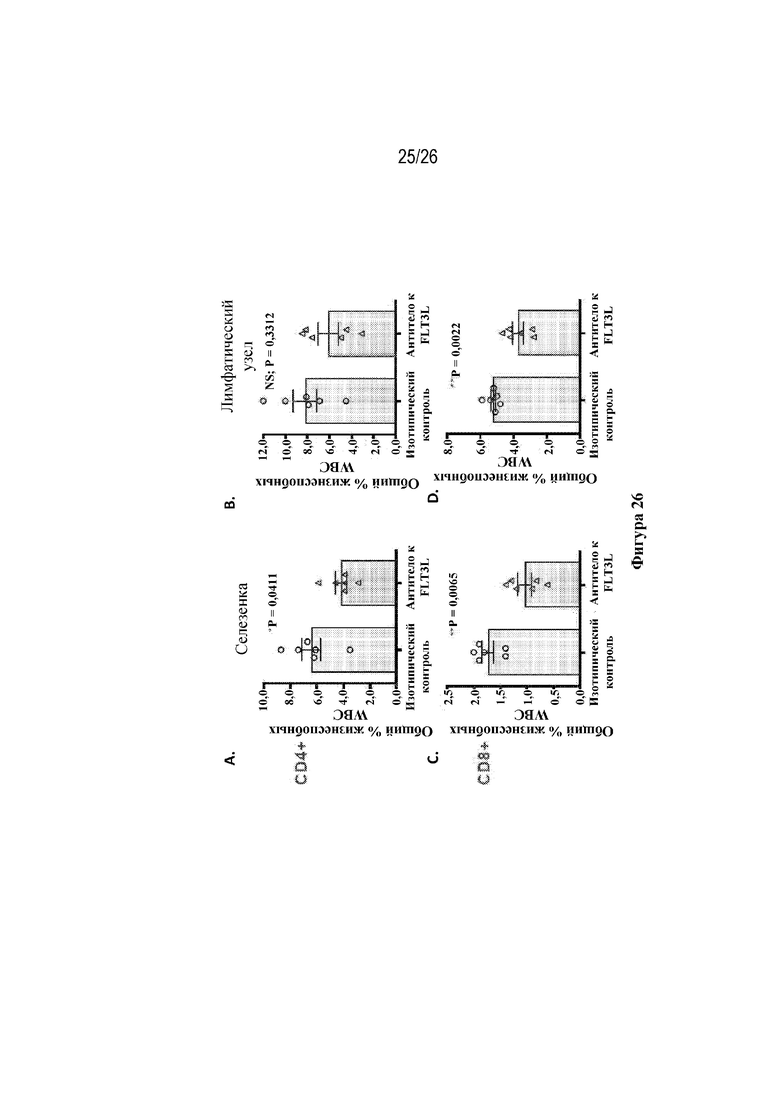
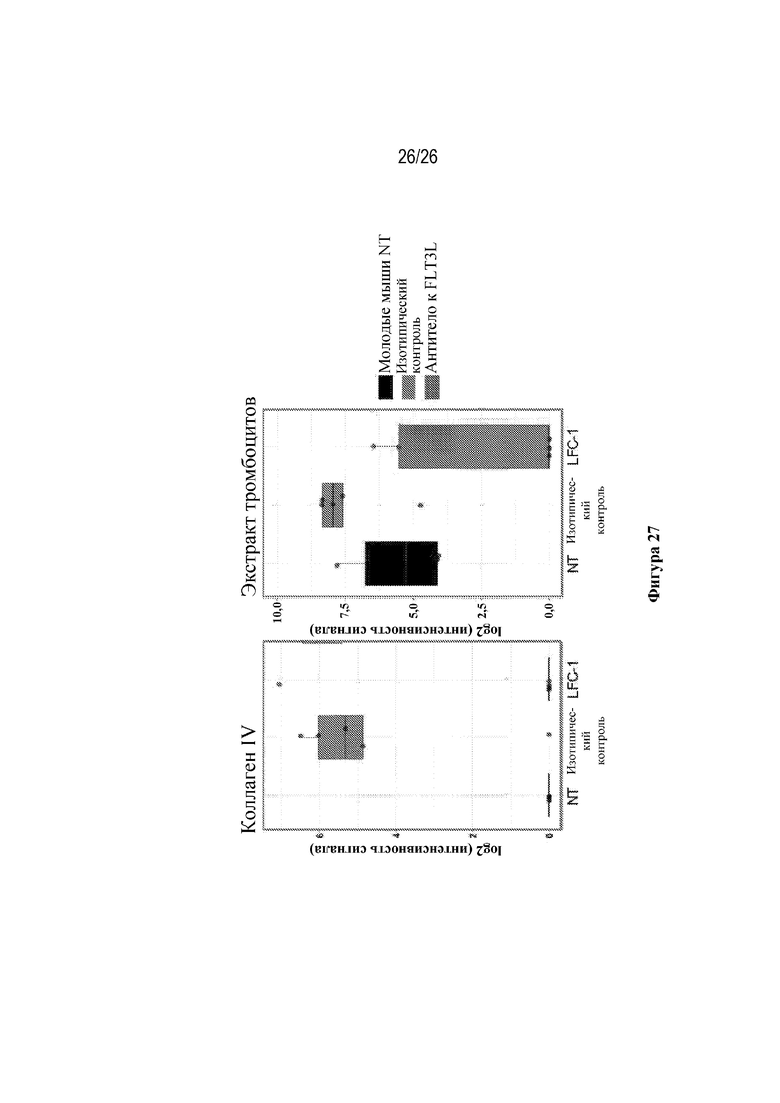
Изобретение относится к биотехнологии. Предложено антитело или его антигенсвязывающий фрагмент, которые специфически связываются с лигандом рецепторной тирозинкиназы 3, подобной продукту протоонкогена вируса саркомы кошек (FMS) штамма McDonough (FLT3L). Также предложены полинуклеотид, кодирующий указанное антитело, вектор экспрессии и гибридома, содержащие указанный полинуклеотид, фармацевтическая композиция, содержащая указанное антитело. Предложены также способ получения антитела и применение антитела для лечения или профилактики аутоиммунного заболевания. Изобретение обеспечивает уменьшение воспаления при аутоиммунных заболеваниях. 15 н. и 11 з.п. ф-лы, 27 ил., 7 табл., 16 пр.
1. Антитело или его антигенсвязывающий фрагмент, которые специфически связываются с лигандом рецепторной тирозинкиназы 3, подобной продукту протоонкогена вируса саркомы кошек (FMS) штамма McDonough (FLT3L), содержащие определяющие комплементарность области (CDR): HCDR1, HCDR2, HCDR3, LCDR1, LCDR2 и LCDR3,
где HCDR1, HCDR2, HCDR3, LCDR1, LCDR2 и LCDR3 содержат аминокислотные последовательности SEQ ID NO:29, 30, 31, 32, 33 и 34, соответственно.
2. Антитело или его антигенсвязывающий фрагмент по п.1, содержащие вариабельную область тяжелой цепи (VH) и вариабельную область легкой цепи (VL), где области VH и VL содержат аминокислотную последовательность, которая по меньшей мере на 95%, 96%, 97%, 98% или 99% идентична последовательности SEQ ID NO:1 и SEQ ID NO:2, соответственно.
3. Антитело или его антигенсвязывающий фрагмент по п.2, где VH и VL состоят из SEQ ID NO:1 и SEQ ID NO:2, соответственно.
4. Антитело или его антигенсвязывающий фрагмент по п.1, где антитело или его антигенсвязывающий фрагмент представляют собой рекомбинантное антитело, выбранное из группы, состоящей из моноклонального антитела, антитела человека, гуманизированного антитела и химерного антитела.
5. Антитело или его антигенсвязывающий фрагмент по п.1, где антитело или антигенсвязывающий фрагмент содержат константный домен тяжелой цепи иммуноглобулина, выбранный из группы, состоящей из:
(a) константного домена IgA;
(b) константного домена IgD;
(c) константного домена IgE;
(d) константного домена IgG1;
(e) константного домена IgG2;
(f) константного домена IgG3;
(g) константного домена IgG4 и
(h) константного домена IgM.
6. Антитело или его антигенсвязывающий фрагмент по п.5, где константный домен тяжелой цепи иммуноглобулина представляет собой IgG1, где константный домен тяжелой цепи иммуноглобулина IgG1 предусматривает одну или несколько аминокислотных замен, выбранных из группы, состоящей из L234F, L235E и P331S, пронумерованных в соответствии с системой нумерации EU согласно Kabat.
7. Антитело или его антигенсвязывающий фрагмент по п.1, где антитело или антигенсвязывающий фрагмент содержат константный домен легкой цепи иммуноглобулина, выбранный из группы, состоящей из:
(a) константного домена каппа-цепи Ig и
(b) константного домена лямбда-цепи Ig.
8. Антитело или его антигенсвязывающий фрагмент по п.7, где константный домен легкой цепи иммуноглобулина представляет собой константный домен каппа лямбда IgG.
9. Полинуклеотид, кодирующий антитело или его антигенсвязывающий фрагмент по любому из пп.1-8.
10. Вектор экспрессии, содержащий полинуклеотид по п.9.
11. Гибридома, которая продуцирует антитело или антигенсвязывающий фрагмент по любому из пп.1-8, где гибридома содержит полинуклеотид по п.9.
12. Фармацевтическая композиция для лечения или профилактики аутоиммунного заболевания, где композиция содержит антитело или его антигенсвязывающий фрагмент по любому из пп.1-8 и носитель.
13. Способ получения антитела или его антигенсвязывающего фрагмента по любому из пп.1-8, включающий
(а) культивирование клетки-хозяина, экспрессирующей антитело или его антигенсвязывающий фрагмент; и
(b) выделение антитела или его антигенсвязывающего фрагмента из культивируемой клетки-хозяина.
14. Применение антитела или его антигенсвязывающего фрагмента, специфичных в отношении FLT3L, для лечения или профилактики аутоиммунного заболевания,
где антитело или его антигенсвязывающий фрагмент содержат: определяющие комплементарность области (CDR): HCDR1, HCDR2, HCDR3, LCDR1, LCDR2 и LCDR3,
где HCDR1, HCDR2, HCDR3, LCDR1, LCDR2 и LCDR3 содержат аминокислотные последовательности SEQ ID NO:29, 30, 31, 32, 33 и 34, соответственно.
15. Применение по п.14, где аутоиммунное заболевание выбрано из группы, состоящей из системной красной волчанки, миозита, синдрома Шегрена, рассеянного склероза, увеита, псориаза, нефрита и ревматоидного артрита.
16. Применение по п.14, где заболевание выбрано из группы, состоящей из диабета 1 типа, диабета 2 типа и хронического заболевания почек.
17. Применение антитела или его антигенсвязывающего фрагмента по любому из пп.1-8 в способе нейтрализации мемебраносвязанного FLT3L.
18. Применение антитела или антигенсвязывающего фрагмента по любому из пп.1-8 в способе уменьшения популяций классических дендритных клеток (cDC) и плазмоцитоидных дендритных клеток (pDC) в кровотоке.
19. Применение антитела или его антигенсвязывающего фрагмента по любому из пп.1-8 в способе уменьшения экспрессии FLT3L на поверхности CD4+ T-клеток.
20. Применение антитела или его антигенсвязывающего фрагмента по любому из пп.1-8 в способе уменьшения процентной доли CD4+ T-клеток, экспрессирующих FLT3L.
21. Применение антитела или его антигенсвязывающего фрагмента по любому из пп.1-8 в способе уменьшения передачи сигналов ERK в лимфобласте.
22. Применение антитела или его антигенсвязывающего фрагмента по любому из пп.1-8 в способе уменьшения уровня фосфорилирования MEK 1/2 в первичных CD133+ стволовых клетках человека.
23. Моноклональное антитело, которое специфически связывается с FLT3L, где антитело содержит:
i. определяющие комплементарность области (CDR) HCDR1, HCDR2, HCDR3, LCDR1, LCDR2 и LCDR3,
где HCDR1, HCDR2, HCDR3, LCDR1, LCDR2 и LCDR3 содержат аминокислотные последовательности SEQ ID NO: 29, 30, 31, 32, 33 и 34, соответственно;
ii. константный домен тяжелой цепи IgG1 человека; и
iii. константный домен легкой цепи Ig лямбда человека.
24. Моноклональное антитело по п.23, содержащее вариабельную область тяжелой цепи (VH) и вариабельную область легкой цепи (VL),
где области VH и VL содержат аминокислотную последовательность, которая по меньшей мере на 95%, 96%, 97%, 98% или 99% идентична последовательности SEQ ID NO:1 и SEQ ID NO:2, соответственно.
25. Моноклональное антитело по п.24, содержащее тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO:61, и легкую цепь, содержащую аминокислотную последовательность SEQ ID NO:62.
26. Клетка-хозяин для получения антитела или его антиген-связывающего фрагмента по любому из пп.1-8, где клетка содержит полинуклеотид по п.9 или вектор по п.10.
| US 20090263474 A1, 22.10.2009 | |||
| US 2013156764 A1, 20.06.2013 | |||
| WHARTENBY K.A | |||
| et al., FLT3 inhibitors for the treatment of autoimmune disease | |||
| Expert Opin Investig Drugs | |||
| Станок для изготовления деревянных ниточных катушек из цилиндрических, снабженных осевым отверстием, заготовок | 1923 |
|
SU2008A1 |
| Печь-кухня, могущая работать, как самостоятельно, так и в комбинации с разного рода нагревательными приборами | 1921 |
|
SU10A1 |
| СПОСОБЫ ЛЕЧЕНИЯ АУТОИММУННЫХ ЗАБОЛЕВАНИЙ АНТАГОНИСТАМИ DLL4 | 2011 |
|
RU2587620C2 |
Авторы
Даты
2023-01-17—Публикация
2019-02-13—Подача