Область техники
Изобретение относится к области микробиологии и медицинской биотехнологии и может быть использовано в производстве бактериальных препаратов, содержащих живые прокариотические клетки, предназначенных для проведения трансплантации фекальной микробиоты с возможностью низкотемпературного хранения препарата. Изобретение описывает способ приготовления препарата из свежих фекалий человека с использованием сахарозы в концентрации 10% в качестве защитной среды. Способ прост, экономичен, доступен и может быть эффективно применен в лабораторных условиях.
Изобретение относится к области микробиологии и биотехнологии, а именно к способу получения лиофильно высушенного препарата фекалий для проведения трансплантации фекальной микробиоты и возможности низкотемпературного хранения трансплантата. За счет добавления защитной среды сахароза в концентрации 10% достигается сохранение жизнеспособности микроорганизмов, относящихся к нормальной микрофлоре кишечника, а именно бактерий рода Bifidobacterium, Lactobacillus, Escherichia, семейства Enterobacterales, максимально соответствующее по количеству жизнеспособных микроорганизмов препаратам для трансплантации фекальной микробиоты, полученных из свежих фекалий. Предложенный способ получения трансплантата также сохраняет молярные соотношения мажорных короткоцепочечных жирных кислот (ацетата, пропионата и бутирата) равными препаратам, полученным из свежих фекалий. Лиофилизат по своим физическим характеристикам удобен для наполнения капсул для проведения фекальной трансплантации.
Предшествующий уровень техники
К настоящему моменту эффективность восстановления бактериального разнообразия кишечника посредством трансплантации фекальной микробиоты (ТФМ) при лечении различных патологий ЖКТ не вызывает сомнений [1]. Применение ТФМ в большинстве случаев приводит к колонизации кишечника донорской микробиотой, увеличению разнообразия генов микробиома и восстановлению нормальной микрофлоры кишечника. Спектр применения метода постоянно расширяется. Сегодня его используют в составе комплексной терапии воспалительных заболеваний кишечника [2], коррекции микробиоты после антибактериальной терапии [3], а также в качестве экспериментальной методики при нейродегенеративных расстройствах [4, 5].
Методика проведения ТФМ очень проста. Однако ее практическая реализация зачастую существенно усложняется из-за логистических барьеров, связанных с согласованием сроков подбора и обследования донора, сбора и подготовки донорского фекального материала и подготовкой пациента к процедуре. Эти и другие организационные барьеры преодолеваются посредством использования замороженного кала [6, 7]
Препараты фекалий доставляют как через нижние отделы ЖКТ (клизма, колоноскопия), так и верхние (эндоскопия, пероральные капсулы). Общим недостатком инструментальных методов введения (эндоскопия, колоноскопия) является их инвазивность, связанная с риском перфорации кишечника и применением анестезии. Пероральные капсулы, заполненные лиофилизированными фекалиями, минимально инвазивны, удобны и более эстетичны, поэтому при отсутствии противопоказаний врачи и пациенты все чаще отдают предпочтение этому способу доставки препарата [8, 9].
Основной вопрос, связанный с использованием замороженного кала - это жизнеспособность микроорганизмов, входящих в его состав, по сравнению с исходным материалом. В процессе лиофилизации клетки микроорганизмов подвергаются действию стрессовых факторов, таких как низкие температуры, кристаллизация воды, осмотический стресс, изменения рН растворов, дегидратация. Чтобы снизить вероятность клеточных повреждений при лиофилизации используют защитные среды - главный из варьируемых факторов, влияющий на выживание бактерий при низкотемпературном высушивании [10].
Известен способ подготовки фекалий для трансплантации фекальной микробиоты заключающийся в разведении фекалий в 4-кратном объеме физраствора (NaCl, 0,9%), гомогенизации и фильтрации [11, 12]. Недостатком данного способа является то, что при такой пробоподготовке фекалий возможно только инструментальное введение жидкого трансплантата, зачастую инвазивное для пациента. Кроме того, возможно использование только свежеприготовленного трансплантата без возможности низкотемпературного хранения.
Известен способ подготовки фекалий для трансплантации фекальной микробиоты, предусматривающий низкотемпературное хранение заключающийся в разведении фекалий в 4-кратном объеме физраствора (NaCl, 0,9%), гомогенизации, фильтрации и добавлении раствора глицерина в качестве защитной среды до конечной концентрации 10% и замораживании при -80 С° [11, 12]. Данный способ подготовки фекального трансплантата предусматривает его низкотемпературное хранение, однако возможность только инструментального введения жидкого трансплантата проблему снижения инвазивности процедуры для пациента не преодолевает.
Раскрытие сущности изобретения
Суть заявляемого способа подготовки фекалий для трансплантации фекальной микробиоты и низкотемпературного хранения заключается в следующем. Свежий образец фекалий разводят в 3-кратном по объему фосфатном буфере 0,1 М, рН 7,4. Для получения гомогенной массы используют погружной блендер. Гомогенизацию проводят в течении 1 мин. Полученную суспензию фильтруют через сито (диаметр отверстий 1-2 мм). К фильтрату добавляют рассчитанное количество сахарозы для достижения процентной концентрации сахарозы 10%. Объем смеси доводят до конечного объемного соотношения фекалии:буфер 1:4. Смесь разливают в стеклянные стаканы (высота столба жидкости 1 см) и замораживают при -80°С для последующей лиофилизации. Лиофилизацию проводят при температуре образца -20°С, температуре конденсатора -40-50°С и вакууме 20-40 Па в течение 48 часов.
Краткое описание фигур и таблиц
Рисунок 1.
Газохроматографический анализ содержания короткоцепочечных жирных кислот в образцах фекалий
A) свежий фекалии
B) лиофилизированные фекалии с защитной средой сахароза 10%
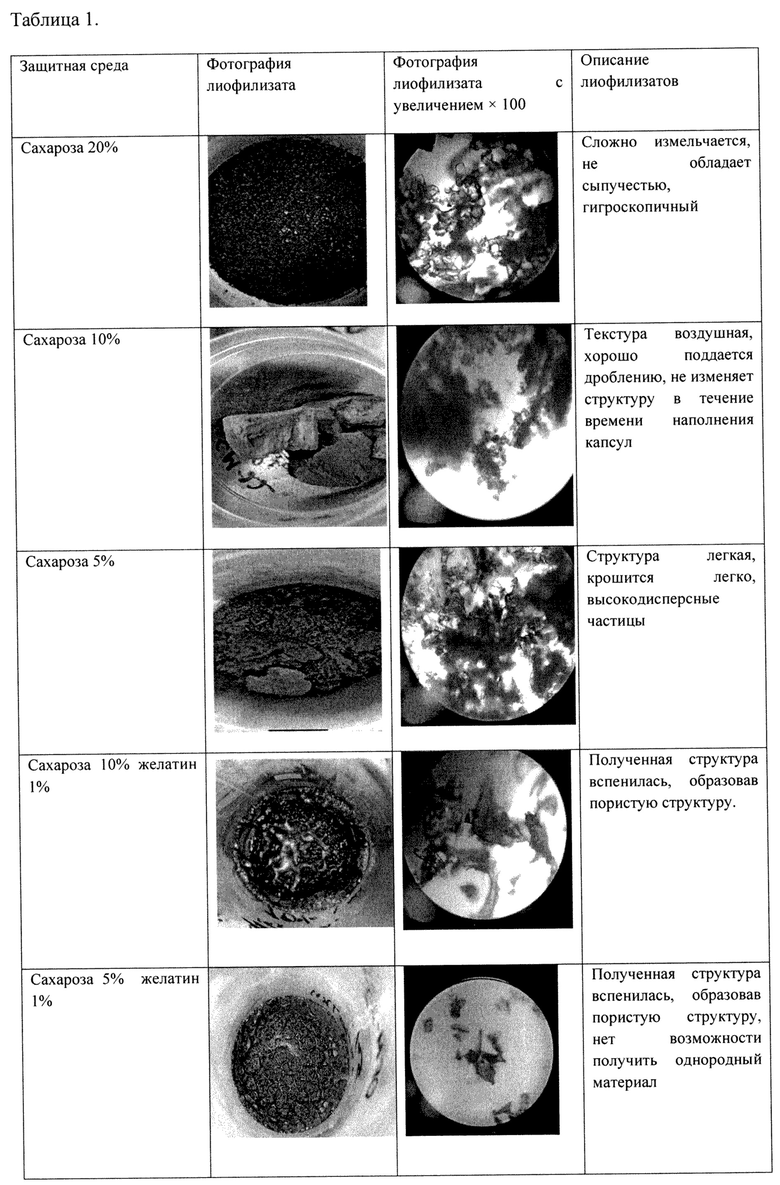
Таблица 1.
Визуальная оценка структуры лиофилизатов с защитными средами и их комбинациями для их практической пригодности для ручного наполнения капсул
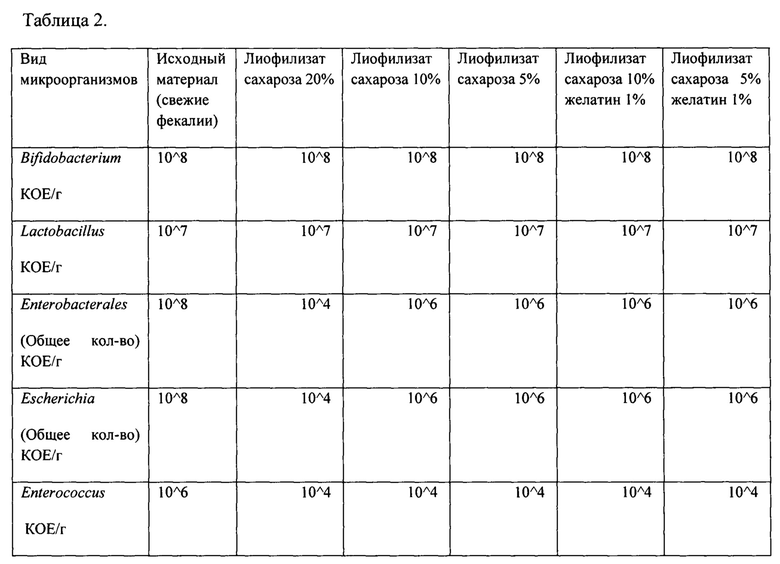
Таблица 2
Бактериологическое исследование лиофилизатов с защитными средами и их комбинациями
Осуществление изобретения (с примерами)
Изобретение поясняется следующими примерами.
Пример 1
Подготовка фекалий для трансплантации фекальной микробиоты и низкотемпературного хранения с использованием защитной среды сахароза 10%
Свежий образец фекалий (40 г.) разводят в 3-кратном по объему фосфатном буфере 0,1 М, рН 7,4(120 мл). Для получения гомогенной массы используют погружной блендер с объемом измельчителя 0,7 л. Гомогенизацию проводят в течении 1 мин. Полученную суспензию фильтруют через сито (диаметр отверстий 1-2 мм). К фильтрату добавляют рассчитанное количество сахарозы (20 г.) для достижения процентной концентрации сахарозы 10%. Объем смеси доводят до конечного объемного соотношения фекалии : буфер 1:4 (200 мл). Смесь разливают в стеклянные стаканы (высота столба жидкости 1 см) и замораживают при -80°С для последующей лиофилизации. Лиофилизацию проводят при температуре образца -20°С, температуре конденсатора -40-50°С и вакууме 20-40 Па в течение 48 часов.
Пример 2
Подготовка фекалий для трансплантации фекальной микробиоты и низкотемпературного хранения с использованием защитной среды сахароза 5%
Подготовку фекалий для трансплантации фекальной микробиоты и низкотемпературного хранения с использованием защитной среды сахароза 5% проводят по примеру 1. К фильтрату добавляют рассчитанное количество сахарозы (10 г.) для достижения процентной концентрации сахарозы 5%, финальный объем доводят до 200 мл фосфатным буфером 0,1 М, рН 7,4. Лиофилизацию проводят по примеру 1.
Пример 3
Подготовка фекалий для трансплантации фекальной микробиоты и низкотемпературного хранения с использованием защитной среды сахароза 20%
Подготовку фекалий для трансплантации фекальной микробиоты и низкотемпературного хранения с использованием защитной среды сахароза 20% проводят по примеру 1. К фильтрату добавляют рассчитанное количество сахарозы (40 г.) для достижения процентной концентрации сахарозы 5%, финальный объем доводят до 200 мл фосфатным буфером 0,1 М, рН 7,4. Лиофилизацию проводят по примеру 1.
Пример 4
Подготовка фекалий для трансплантации фекальной микробиоты и низкотемпературного хранения с использованием комбинации защитных сред сахароза 10% и желатин пищевой 1%
Свежий образец фекалий (40 г.) разводят в 3-кратном по объему (120 мл), фосфатном буфере 0,1 М, рН 7,4 содержащем 1% желатина (1,5 г. желатина предварительно оставляют в 150 мл фосфатного буфера 0,1 М, рН 7,4 для набухания на 30 мин., затем нагревают до 60°С до полного растворения). Для получения гомогенной массы используют погружной блендер с объемом измельчителя 0.7 л. Гомогенизацию проводят в течении 1 мин. Полученную суспензию фильтруют через сито (диаметр отверстий 1-2 мм). К фильтрату добавляют рассчитанное количество сахарозы (20 г.) для достижения процентной концентрации сахарозы 10%. Объем смеси доводят до конечного объемного соотношения фекалии : буфер 1:4 (200 мл). Смесь разливают в стеклянные стаканы (высота столба жидкости 1 см) и замораживают при -80°С для последующей лиофилизации. Лиофилизацию проводят по примеру 1.
Пример 5
Подготовка фекалий для трансплантации фекальной микробиоты и низкотемпературного хранения с использованием комбинации защитных сред сахароза 5% и желатин пищевой 1%
Подготовку фекалий для трансплантации фекальной микробиоты и низкотемпературного хранения с использованием комбинации защитных сред сахароза 5% и желатин пищевой 1% проводят по примеру 4. К фильтрату добавляют рассчитанное количество сахарозы (10 г.) для достижения процентной концентрации сахарозы 5%, финальный объем доводят до 200 мл фосфатным буфером 0,1 М, рН 7,4. Лиофилизацию проводят по примеру 1.
Пример 6
Оценка структуры лиофилизатов с защитными средами и их комбинациями для их практической пригодности для наполнения капсул
Оценку структуры полученных лиофилизатов для их практической пригодности для наполнения капсул проводили визуальную. Результаты, представленные в Таблице 1 показали, что образцы с защитной средой сахароза 5 и 10% обладали воздушной текстурой, хорошо поддающейся дроблению в мелкодисперсные частицы, напоминающие «кофейный порошок» удобной для дальнейшего технологического использования (наполнения капсул). Образец с защитной средой сахароза 20% сыпучестью не обладал и плохо дробился, в связи с чем был признан непригодным для дальнейшего технологического использования (наполнения капсул). Образцы лиофилизатов с комбинацией защитных сред сахароза (5% и 10%) и желатин 1% частично вспенивались, образуя пористую структуру, непригодную для дробления в однородный порошок и дальнейшего технологического использования (наполнения капсул) (Табл. 1).
Пример 7
Бактериологическое исследование лиофилизатов с защитными средами и их комбинациями
Бактериологическое исследование лиофилизатов с защитными средами и их комбинациями проводили согласно методическим рекомендациям [13, 14]. Оценивали количество живых бактерий рода Bifidobacterium, Lactobacillus, Escherichia, а также семейства Enterobacterales в целом. Согласно полученным данным в лиофилизированных образцах количественная представленность бифидобактерий и лактобактерий не изменялась по сравнению с исходным материалом (свежими фекалиями) (Табл. 2). Представленность других бактерий - энтеробактерий, энтерококков и кишечной палочки снижалась существенно (в среднем на 2 порядка), что связано с различной чувствительность микроорганизмов к перепадам температуры (замораживанию-размораживанию). Согласно литературным данным, грамотрицательные бактерии зачастую более чувствительны к замораживанию, чем грамположительные, что, объясняется особенностями строения клеточной стенки [15]. Несмотря на то, что бактериальный состав в лиофилизатах содержащих защитную среду сахароза 5 и 10% оказался практически идентичным, для дальнейшей отработки методики и последующего технологического использования было решено использовать лиофилизат с содержанием сахарозы 10%, так как такая концентрация лиопротектора по литературным данным более традиционна для лиофилизации бактерий [16].
Пример 8
Оценка молярных соотношений короткоцепочечных жирных кислот (КЖК) в исходном образце свежих фекалий и лиофилизате с защитной средой сахароза 10%
Оценку молярных соотношений короткоцепочечных жирных кислот (КЖК) в исходном образце свежих фекалий и лиофилизате с защитной средой сахароза 10%, отобранном для дальнейшей отработки методики и последующего технологического использования, газохроматографически по методу, описанному в работе [17]. Как видно из Рисунка 1 сопоставление пиков мажорных короткоцепочечных жирных кислот (КЖК) ацетата, пропионата и бутирата на хроматограммах исходного образца фекалий и лиофилизата с защитной средой сахароза 10% показало их идентичность.
В результате исследований предложен состав защитной среды, в которой лиофилизированные препараты фекалий максимально соответствуют препаратам для трансплантации фекальной микробиоты, полученным из свежих фекалий по количеству жизнеспособных микроорганизмов и по молярным соотношениям мажорных короткоцепочечных жирных кислот (ацетата, пропионата и бутирата). Лиофилизат с защитной средой сахароза 10% по своим физическим характеристикам удобен для наполнения капсул для проведения фекальной трансплантации. Способ прост, экономичен, доступен и может быть эффективно применен в лабораторных условиях.
Литература
1. Lin Z, Iqbal Z, Ortiz JF, Khan SA, Jahan N. (2020) Fecal Microbiota Transplantation in Recurrent Clostridium Difficile Infection: Is it Superior to Other Conventional Methods? Cureus. 12(8). e9653. DOI: 10.7759/cureus.9653.
2. Tan P, Li X, Shen J, Feng Q. (2020). Fecal Microbiota Transplantation for the Treatment of Inflammatory Bowel Disease: An Update. Front Pharmacol. 11. 574533. DOI: 10.3389/fphar.2020.574533.
3. Taur Y., Coyte K., Schluter J., Robilotti E., Figueroa C, Gjonbalaj M., Littmann E.R., Ling L., Miller L., Gyaltshen Y., Fontana E., Morjaria S., Gyurkocza В., Perales M.A., Castro-Malaspina H., Tamari R., Ponce D., Koehne G., Barker J., Jakubowski A., Papadopoulos E., Dahi P., Sauter C, Shaffer В., Young J.W., Peled J., Meagher R.C., Jenq R.R., van den Brink M.R.M., Giralt S.A., Pamer E.G., Xavier J.B. (2018) Reconstitution of the gut microbiota of antibiotic-treated patients by autologous fecal microbiota transplant. Sci Transl Med. 10(460) eaap9489. DOI: 10.1126/scitranslmed.aap9489.
4. Kang D-W., Adams J.B., Gregory A.C., Borody Т., Chittick L., Fasano A., Khoruts A., Geis E., Maldonado J., McDonough-Means S., Pollard E.L., Roux S., Sadowsky M.J., Schwarzberg Lipson K., Sullivan M.B., Caporaso G.J. Krajmalnik-Brown R. (2017). Microbiota Transfer Therapy alters gut ecosystem and improves gastrointestinal and autism symptoms: an open-label study. Microbiome, 5(1), 10. DOI: 10.1186/s40168-016-0225-7.
5. Evrensel A., Ceylan M.E. (2011). Fecal Microbiota Transplantation and Its Usage in Neuropsychiatric Disorders. Clin. Phychopharmacol. Neurosci., 14(3), 231-237. DOI: 10.9758/cpn.2016.14.3.231.
6. Jiang ZD, Ajami NJ, Petrosino JF, Jun G, Hanis CL, Shah M, Hochman L, Ankoma-Sey V, DuPont AW, Wong MC, Alexander A, Ke S, DuPont HL (2017). Randomised clinical trial: faecal microbiota transplantation for recurrent Clostridum difficile infection - fresh, or frozen, or lyophilised microbiota from a small pool of healthy donors delivered by colonoscopy. Aliment Pharmacol Ther. 45(7), 899-908. DOI: 10.111 l/apt.13969.
7. Lee CH, Steiner T, Petrof EO, Smieja M, Roscoe D, Nematallah A, Weese JS, Collins S, Moayyedi P, Crowther M, Ropeleski MJ, Jayaratne P, Higgins D, Li Y, Rau NV, Kim PT (2016). Frozen vs Fresh Fecal Microbiota Transplantation and Clinical Resolution of Diarrhea in Patients with Recurrent Clostridium difficile Infection: A Randomized Clinical Trial. JAMA. 315(2), 142-9. DOI: 10.1001/jama.2015.18098.
8. Kao D, Roach B, Silva M, Beck P, Rioux K, Kaplan GG, Chang HJ, Coward S, Goodman KJ, Xu H, Madsen K, Mason A, Wong GK, Jovel J, Patterson J, Louie T (2017). Effect of Oral Capsule- vs Colonoscopy-Delivered Fecal Microbiota Transplantation on Recurrent Clostridium difficile Infection: A Randomized Clinical Trial. JAMA. 318(20). 1985-1993. DOI: 10.1001/jama.2017.17077
9. Zipursky JS, Sidorsky TI, Freedman CA, Sidorsky MN, Kirkland KB. (2012). Patient attitudes toward the use of fecal microbiota transplantation in the treatment of recurrent Clostridium difficile infection. Clin Infect Dis. 5(12). 1652-8. DOI: 10.1093/cid/cis809
10. Peiren J., Buyse J., De Vos P., Lang E., Clermont D., Hamon S.,  E., Bizet C, Pascual J., Ruvira M.A.,
E., Bizet C, Pascual J., Ruvira M.A., M.C., Arahal D.R. (2015). Improving survival and storage stability of bacteria recalcitrant to freeze-drying: a coordinated study by European culture collections. Arahal. Appl. Microbiol. Biotechnol. 99(8), 3559-71. DOI: 10.1007/s00253-015-6476-6.
M.C., Arahal D.R. (2015). Improving survival and storage stability of bacteria recalcitrant to freeze-drying: a coordinated study by European culture collections. Arahal. Appl. Microbiol. Biotechnol. 99(8), 3559-71. DOI: 10.1007/s00253-015-6476-6.
11. Щербаков П.Л. Белова Н.Д., Генерозов Э.В., Жгун Е.С., Иванова О.И., Ильина Е.Н., Калачнюк Т.Н., Павленко А.В., Подгорский В.В., Манолов А.И., Маторин Р.И., Олехнович Е.И., Щербакова М.Ю. (2019) Применение фекальной трансплантации в лечении заболеваний пищеварительного тракта (первый клинический опыт). Доктор.Ру. 3(158), 40-46
12. Bakken J.S., Borody Т., Brandt.LJ., Brill J.V., Demarco D.C., Franzos M.A., Kelly C, Khoruts A., Louie Т., Martinelli L.P., Moore T. A., Russell G., Surawicz C. (2011) Treating Clostridium difficile infection with fecal microbiota transplantation. Clin Gastroenterol Hepatol. 9(12): 1044-1049
13. Методические рекомендации «Бактериологическая диагностика дисбактериоза», утвержденные Министерством здравоохранения России 14.04.1997
14. Методические рекомендации «Бактериологическая диагностика заболеваний, вызываемых энтеробактериями», утвержденные Министерством здравоохранения России 2001
15. И.В. Грачева, А.В. Осин, (2016) Механизмы повреждений бактерий при лиофилизации и протективное действие защитных сред. Пробл. особо опасных инф.; 3: 5-12. DOI: 10.21055/0370-1069-2016-3-5-12.
16. Tymczyszyn Е.Е.,  M.R.,
M.R.,  A., Disalvo Е.А. (2007). Volume recovery, surface properties and membrane integrity of Lactobacillus delbrueckii subsp.bulgaricus dehydrated in the presence of trehalose or sucrose. J. Appl. Microbiol. 103(6), 2410-9.
A., Disalvo Е.А. (2007). Volume recovery, surface properties and membrane integrity of Lactobacillus delbrueckii subsp.bulgaricus dehydrated in the presence of trehalose or sucrose. J. Appl. Microbiol. 103(6), 2410-9.
17. E.C. Жгун, Ю.В. Кислун, Т.Н. Калачнюк, В.А. Веселовский, А.С.Урбан, Конанов Д., Тихонова П., Павленко А.В., Ильченко Г.Н., Ильина Е.Н. (2020) Оценка уровня метаболитов в фекалиях пациентов с воспалительными заболеваниями кишечника. Биомедицинская химия, 66(3), 233-240. DOI: 10.18097/РВМС20206603233.
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ выделения и сохранения тотальной микробиоты кишечника человека для трансплантации | 2019 |
|
RU2727444C1 |
| Способ приготовления аутопробиотика на основе анаэробного консорциума бактерий | 2018 |
|
RU2734896C2 |
| СПОСОБ КОРРЕКЦИИ СОСТАВА МИКРОФЛОРЫ КИШЕЧНИКА У ДЕТЕЙ | 2022 |
|
RU2801611C1 |
| КОМПОЗИЦИЯ ФЕКАЛЬНОЙ МИКРОБИОТЫ ДЛЯ ПРИМЕНЕНИЯ ДЛЯ УМЕНЬШЕНИЯ ИНДУЦИРОВАННОГО ЛЕЧЕНИЕМ ВОСПАЛЕНИЯ | 2019 |
|
RU2816462C2 |
| Питательная среда для выделения строго анаэробных, крайне чувствительных к кислороду микроорганизмов-продуцентов короткоцепочечных жирных кислот, в том числе Faecalibacterium prausnitzii (варианты) | 2024 |
|
RU2833071C1 |
| ИСПОЛЬЗОВАНИЕ МИКРОБНЫХ СООБЩЕСТВ ДЛЯ ЛЕЧЕНИЯ ЧЕЛОВЕКА И ЖИВОТНЫХ | 2017 |
|
RU2823233C2 |
| СПОСОБ ТЕРАПИИ МЕТАБОЛИЧЕСКОГО СИНДРОМА С ИСПОЛЬЗОВАНИЕМ АУТОПРОБИОТИКОВ | 2024 |
|
RU2839320C1 |
| СПОСОБ ОЦЕНКИ ЭФФЕКТИВНОСТИ ТРАНСПЛАНТАЦИИ ФЕКАЛЬНОЙ МИКРОБИОТЫ У ПАЦИЕНТОВ С ИММУННОЙ РЕАКЦИЕЙ ПОСЛЕ ТРАНСПЛАНТАЦИИ ГЕМОПОЭТИЧЕСКИХ СТВОЛОВЫХ КЛЕТОК | 2019 |
|
RU2728241C1 |
| ИСПОЛЬЗОВАНИЕ МИКРОБНЫХ СООБЩЕСТВ ДЛЯ ЛЕЧЕНИЯ ЧЕЛОВЕКА И ЖИВОТНЫХ | 2017 |
|
RU2758387C2 |
| Штамм бактерий Bifidobacterium longum 174 для приготовления регион-специфичных пробиотических препаратов для профилактики и персонализированного лечения заболеваний желудочно-кишечного тракта у жителей Карачаево-Черкесской республики и/или для обогащения традиционного кисломолочного напитка "Гыпы айран" на основе индигенных кефирных зерен | 2023 |
|
RU2803350C1 |

Изобретение относится к микробиологии и медицинской биотехнологии. Предложен способ получения лиофильно высушенного препарата фекалий человека для трансплантации фекальной микробиоты, включающий разведение свежего образца фекалий в 3-кратном по объему фосфатном буфере 0,1 М, рН 7,4, гомогенизацию массы в течение 1 мин с последующей фильтрацией. К фильтрату добавляют сахарозу до концентрации 10% в объеме смеси; объем смеси доводят до конечного объемного соотношения фекалии : буфер 1:4; смесь разливают в стеклянные стаканы и замораживают при -80°С для последующей лиофилизации при температуре образца -20°С, температуре конденсатора -40-50°С и вакууме 20-40 Па в течение 48 ч. Изобретение обеспечивает расширение арсенала способов получения лиофилизированных препаратов фекалий, максимально соответствующих свежим фекалиям по количеству жизнеспособных микроорганизмов и по молярным соотношениям мажорных короткоцепочечных жирных кислот. 1 ил., 2 табл., 8 пр.
Способ получения лиофильно высушенного препарата фекалий человека для трансплантации фекальной микробиоты, включающий разведение свежего образца фекалий в 3-кратном по объему фосфатном буфере 0,1 М, рН 7,4, гомогенизацию массы в течение 1 мин с использованием погружного блендера; полученную суспензию фильтруют через сито с диаметром отверстий 1-2 мм; к фильтрату добавляют рассчитанное количество сахарозы до достижения процентной концентрации 10% в объеме смеси, затем объем смеси доводят до конечного объемного соотношения фекалии : буфер 1:4; смесь разливают в стеклянные стаканы - высота столба жидкости 1 см, и замораживают при -80°С для последующей лиофилизации при температуре образца -20°С, температуре конденсатора -40-50°С и вакууме 20-40 Па в течение 48 ч.
| ЧАПЛИН А.В | |||
| и др | |||
| "Изучение видового разнообразия бактерий рода Bifidobacterium кишечной микрофлоры с использованием метода MALDI-TOF масс-спектрометрии"; Вестник РАМН, 2015, N 70(4), с.437 | |||
| BAKKEN J.S | |||
| et al | |||
| "Treating Clostridium difficile infection with fecal microbiota transplantation"; Clinical gastroenterology and hepatology, 2011, N 9, |
Авторы
Даты
2023-12-15—Публикация
2021-12-09—Подача