ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Настоящее изобретение относится к новым хинолиноновым соединениям, к фармацевтическим композициям, содержащим указанные соединения, к способам получения указанных соединений и к применению указанных соединений в качестве ингибиторов FGFR (рецептора фактора роста фибробластов) и к их применению в лечении заболеваний, например, рака.
ПРЕДПОСЫЛКИ К СОЗДАНИЮ ИЗОБРЕТЕНИЯ
Было продемонстрировано, что сигнальные пути фактора роста фибробластов (FGF) играют критическую роль в процессах, начиная с эмбриогенеза и заживления ран, а также обнаружена их сильная связь с несколькими признаками рака. Генные изменения в представителях семейства FGFR связывают с ростом опухоли, метастазированием, ангиогенезом и выживанием. Разнообразные ингибиторы FGFR проходят клинические испытания, и к настоящему времени они показали клинический ответ у пациентов с аберрациями FGFR. Однако сообщалось, что мутации, затрагивающие аминокислоты в FGFR, например, FGFR1, 2 или 3, могут вызывать устойчивость к ингибиторам FGFR или снижать чувствительность к ингибиторам FGFR. Развитие вторичных мутаций киназного домена FGFR при лечении ингибиторами FGFR является важным механизмом приобретенной устойчивости к ингибированию FGFR. При онкологических заболеваниях также происходят de novo эквивалентные точковые мутации FGFR. О мутациях привратника сообщалось, что они представляют собой один из основных механизмов, приводящих к устойчивости к ингибиторам тирозинкиназы. Мутации привратника включают FGFR3 V555L/V555M, FGFR1 V561M, FGFR2 V564F/V564I/V564M и FGFR4 V550L. Устойчивые мутации FGFR были зарегистрированы в клинических испытаниях и в клеточных системах in vitro. Следовательно, новые (второго поколения) ингибиторы FGFR необходимы для более длительного воздействия при онкологических заболеваниях, для которых характерны изменения сигнальных путей FGFR, чтобы преодолеть клиническую приобретенную устойчивость к терапии ингибитором FGFR первого поколения. Ингибиторы FGFR второго поколения необходимы для преодоления снижения активности, наблюдаемого в случае ингибиторов FGFR первого поколения, направленной против FGFR, несущих вышеуказанные мутации привратника, и, следовательно, для поддержания активности, ингибирующей FGFR.
Было обнаружено, что соединения данного изобретения проявляют активность против мутировавших FGFR, в частности, против FGFR, несущих мутации привратника, или против мутировавшего FGFR1, или мутировавшего FGFR2, или мутировавшего FGFR3, в частности, против FGFR3 V555L, FGFR3 V555M, FGFR1 V561M и FGFR2 V564I, особенно против FGFR3 V555L и FGFR3 V555M.
В каждой из заявок WO2002/022598, WO2003/087095, WO2004/018419, WO2004/043389, WO2005/046589 раскрыт ряд производных хинолинона.
ОПИСАНИЕ ИЗОБРЕТЕНИЯ
В данном изобретении предложены соединения формулы (I):
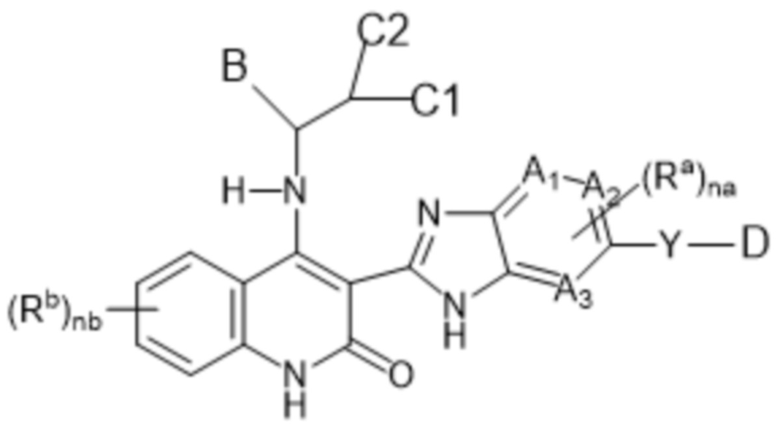 (I),
(I),
в том числе любая его таутомерная и стереохимически изомерная форма, где
Каждый из A1, A2 и A3 независимо представляет собой атом углерода или атом азота;
C1 представляет собой водород или C1-4алкил;
C2 представляет собой водород, C1-4алкил, гидроксил или C1-4алкокси-группу;
или C1 и C2, взятые вместе, образуют C3-6циклоалкил вместе в атомом углерода, к которому они присоединены;
Y представляет собой одинарную связь, -O-, C(=O), NRy, S(=O)2 или C1-4алкил;
Ry представляет собой водород или C1-4алкил;
каждый Ra независимо представляет собой водород, C1-6алкил, галогенC1-6алкил, галоген, C1-6алкокси-группу, карбоксил, C1-6алкоксикарбонил, C2-6алкенил, C2-6алкинил, циано-группу, цианоC1-6алкил, гидроксиC1-6алкил, -C(=O)-NH2, -C(=O)-NH(C1-4алкил), -C(=O)-N(C1-4алкил)2 или 3-6-членный моноциклический насыщенный гетероциклил, содержащий не менее одного гетероатома, выбранного из N, O или S;
nа представляет целое число, равное 1 или 2;
каждый Rb независимо представляет собой водород, C1-6алкил, галогенC1-6алкил, галоген, C1-6алкокси-группу, C1-6алкоксикарбонил, C2-6алкенил, C2-6алкинил, циано-группу, цианоC1-6алкил, гидроксиC1-6алкил,
-C(=O)-NH2, -C(=O)-NH(C1-4алкил), -C(=O)-N(C1-4алкил)2, C3-6циклоалкил, фенил, 3-6-членный моноциклический гетероциклил, содержащий не менее одного гетероатома, выбранного из N, O или S, или C1-6алкил, замещенный C3-6циклоалкилом, или фенилом, или 3-6-членным моноциклическим гетероциклилом, содержащим не менее одного гетероатома, выбранного из N, O или S;
nb представляет целое число, равное 1 или 2;
D представляет собой 3-12-членный моноциклический гетероциклил, содержащий не менее одного гетероатома, выбранного из N, O или S, причем указанный гетероциклил необязательно замещен 1-5 заместителями Rc;
каждый Rc независимо представляет собой оксо-, галоген, C1-6алкил, C1-6алкокси-группу, гидроксиC1-6алкил, галогенC1-6алкил, галогенC1-6алкокси-группу, карбоксильную группу, HOOC-C1-6алкил-, C1-6алкил, замещенный -C(=O)-O-C1-6алкилом, C1-6алкил-O-C(=O)-, циано-группу, цианоC1-6алкил, C1-6алкил-C(=O)-, -SO2-C1-6алкил, C3-6циклоалкил, фенил, 3-6-членный моноциклический насыщенный гетероциклил, содержащий не менее одного гетероатома, выбранного из N, O или S, или 5-6-членный моноциклический гетероциклил, содержащий не менее одного гетероатома, выбранного из N, O или S;
B представляет собой 3-12-членный карбоциклил или 3-12-членный гетероциклил, содержащий не менее одного гетероатома, выбранного из N, O или S, причем каждый из указанных карбоциклила и гетеороциклила необязательно замещены 1-5 заместителями R;
каждый R независимо представляет собой C1-6алкил, циано-группу, галоген, C1-6алкокси-группу, галогенC1-6алкокси-группу, гидроксил, гидроксиC1-6алкил, галогенC1-6алкил, оксо-, -SO2-NH2, -SO2-NH(C1-4алкил), -SO2-N(C1-4алкил)2,
-NH-C(=O)-C2-6алкенил, -C(=O)-C1-6алкил, -C(=O)-C2-6алкенил, C1-6алкил-O-C(=O)-, C3-6циклоалкил, фенил, или 3-6-членный моноциклический гетероциклил, содержащий не менее одного гетероатома, выбранного из N, O или S;
или их фармацевтически приемлемые соли или их сольваты.
В данном изобретении также предложены соединения формулы (I):
 (I),
(I),
в том числе любая его таутомерная и стереохимически изомерная форма, где
каждый из A1, A2 и A3 независимо представляет собой атом углерода или атом азота;
C1 представляет собой водород или C1-4алкил;
C2 представляет собой водород или C1-4алкил или гидроксил;
или C1 и C2, взятые вместе, образуют C3-6циклоалкил вместе в атомом углерода, к которому они присоединены;
Y представляет собой одинарную связь, -O-, C(=O), NRy, S(=O)2 или C1-4алкил;
Ry представляет собой водород или C1-4алкил;
каждый Rа независимо представляет собой водород, C1-6алкил, галогенC1-6алкил, галоген, C1-6алкокси-группу, карбоксил, C1-6алкоксикарбонил, C2-6алкенил, C2-6алкинил, циано-группу, цианоC1-6алкил, гидроксиC1-6алкил,
-C(=O)-NH2, -C(=O)-NH(C1-4алкил), -C(=O)-N(C1-4алкил)2, или 3-6-членный моноциклический насыщенный гетероциклил, содержащий не менее одного гетероатома, выбранного из N, O или S;
nа представляет целое число, равное 1 или 2;
каждый Rb независимо представляет собой водород, C1-6алкил, галогенC1-6алкил, галоген, C1-6алкокси-группу, C1-6алкоксикарбонил, C2-6алкенил, C2-6алкинил, циано-группу, цианоC1-6алкил, гидроксиC1-6алкил,
-C(=O)-NH2, -C(=O)-NH(C1-4алкил), -C(=O)-N(C1-4алкил)2, C3-6циклоалкил, фенил, 3-6-членный моноциклический гетероциклил, содержащий не менее одного гетероатома, выбранного из N, O или S, или C1-6алкил, замещенный C3-6циклоалкилом, или фенилом, или 3-6-членным моноциклическим гетероциклилом, содержащим не менее одного гетероатома, выбранного из N, O или S;
nb представляет целое число, равное 1 или 2;
D представляет собой 3-12-членный моноциклический гетероциклил, содержащий не менее одного гетероатома, выбранного из N, O или S, причем указанный гетероциклил необязательно замещен 1-5 заместителями Rc;
каждый Rc независимо представляет собой оксо, C1-6алкил, гидроксиC1-6алкил, галогенC1-6алкил, галогенC1-6алкилокси, карбоксильную группу, HOOC-C1-6алкил-, C1-6алкил, замещенный -C(=O)-O-C1-6алкилом, C1-6алкил-O-C(=O)-, циано-группу, цианоC1-6алкил, C1-6алкил-C(=O)-, -SO2-C1-6алкил, C3-6циклоалкил, фенил, 3-6-членный моноциклический насыщенный гетероциклил, содержащий не менее одного гетероатома, выбранного из N, O или S, или 5-6-членный моноциклический ароматический гетероциклил, содержащий не менее одного гетероатома, выбранного из N, O или S;
B представляет собой 3-12-членный карбоциклил или 3-12-членный гетероциклил, содержащий не менее одного гетероатома, выбранного из N, O или S, причем каждый из указанных карбоциклила и гетеороциклила необязательно замещены 1-5 заместителями R;
каждый R независимо представляет собой C1-6алкил, циано-группу, галоген, C1-6алкокси-группу, галогенC1-6алкокси-группу, гидроксил, гидроксиC1-6алкил, галогенC1-6алкил, оксо-, -SO2-NH2, -SO2-NH(C1-4алкил), -SO2-N(C1-4алкил)2,
-NH-C(=O)-C2-6алкенил, -C(=O)-C1-6алкил, -C(=O)-C2-6алкенил, C1-6алкил-O-C(=O)-, C3-6циклоалкил, фенил, или 3-6-членный моноциклический гетероциклил, содержащий не менее одного гетероатома, выбранного из N, O или S;
или их фармацевтически приемлемые соли или их сольваты.
В другом аспекте предложен способ профилактики или лечения болезненного состояния или состояния, опосредованного киназой FGFR, который включает введение субъекту, нуждающемуся в этом, соединения формулы (I), как определено в настоящем описании, или его фармацевтически приемлемой соли или сольвата.
В дополнительном аспекте предложено соединение формулы (I), как оно определено в данном описании, или его фармацевтически приемлемая соль или его сольват для применения в профилактике или лечении болезненного состояния или состояния, опосредованного киназой FGFR.
В еще одном дополнительном аспекте предложено применение соединения формулы (I), как оно определено в данном описании, или его фармацевтически приемлемой соли или его сольвата для производства лекарственного средства для профилактики или лечения болезненного состояния или состояния, опосредованного киназой FGFR.
В другом аспекте предложен способ профилактики или лечения онкологического заболевания, который включает введение субъекту, нуждающемуся в этом, соединения формулы (I), как определено в настоящем описании, или его фармацевтически приемлемой соли или сольвата. В частности, онкологическое заболевание представляет собой онкологическое заболевание, опосредованное киназой FGFR.
В дополнительном аспекте предложено соединение формулы (I), как оно определено в данном описании, или его фармацевтически приемлемая соль или его сольват для применения в профилактике или лечении онкологического заболевания. В частности, онкологическое заболевание представляет собой онкологическое заболевание, опосредованное киназой FGFR.
В еще одном дополнительном аспекте предложено применение соединения формулы (I), как оно определено в данном описании, или его фармацевтически приемлемой соли или его сольвата для производства лекарственного средства для профилактики или лечения онкологического заболевания. В частности, онкологическое заболевание представляет собой онкологическое заболевание, опосредованное киназой FGFR.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Если в контексте не указывается иное, упоминания формулы (I) во всех разделах настоящего документа (в том числе в применении, способах и других аспектах данного изобретения) включают в себя упоминания всех других подформул (например, (I-a), (I-A), (I-A-a), (I-B), (I-B-a), (I-C), (I-C-a), (I-D), (I-D-a)), подгрупп, ссылок, вариантов осуществления и примеров, определенных в настоящем документе.
Приставка "Cx-y" (где x и y представляют собой целые числа), используемая в данном документе, относится к числу атомов углерода в данной группе. Таким образом, C1-6алкильная группа содержит от 1 до 6 атомов углерода, C3-6циклоалкильная группа содержит от 3 до 6 атомов углерода, C1-4алкокси-группа содержит от 1 до 4 атомов углерода и т. д.
Термины "галоген" или "галогенид" в данном контексте означают атом фтора, хлора, брома и йода.
Термин "C1-4алкил" или "C1-6алкил" в данном документе используется в качестве группы или части группы, относящейся к линейной или разветвленной насыщенной углеводородной группе, содержащей от 1 до 4 или от 1 до 6 атомов углерода. Примеры таких групп включают в себя метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил, трет-бутил, н-пентил, изопентил, неопентил или гексил и т. п.
Термин "C2-4алкенил" или "C2-6алкенил" в данном документе используется в качестве группы или части группы, относящейся к линейной или разветвленной углеводородной группе, имеющей от 2 до 4 или от 2 до 6 атомов углерода и содержащей углерод-углеродную двойную связь.
Термин "C2--4алкинил" или "C2-6алкинил" в данном документе используется в качестве группы или части группы, относящейся к линейной или разветвленной углеводородной группе, имеющей от 2 до 4 или от 2 до 6 атомов углерода и содержащей углерод-углеродную тройную связь.
Термин "C1-4алкокси-группа" или "C1-6алкокси-группа" в данном документе используется в качестве группы или части группы, относящейся к группе -O-C1-4алкила или группе -O-C1-6алкила, где C1-4алкил и C1-6алкил такие, как определены в данном документе. Примеры таких групп включают метокси, этокси, пропокси, бутокси и т.п.
Термин "C3-6циклоалкил" в данном документе относится к насыщенному моноциклическому углеводородному кольцу из 3-6 атомов углерода. Примеры таких групп включают в себя циклопропил, циклобутил, циклопентил или циклогексил.
Термин "гидрокси-C1-4алкил" или "гидрокси-C1-6алкил" в данном документе используется в качестве группы или части группы, относящейся к C1-4алкильной или C1-6алкильной группе, определенной в данном документе, где один или более чем один атом водорода замещен гидроксильной группой. Поэтому термины "гидрокси-C1-4алкил" или "гидрокси-C1-6алкил" включают в себя моногидрокси-C1-4алкил, моногидрокси-C1-6алкил, а также полигидрокси-C1-4алкил и полигидрокси-C1-6алкил. Гидроксильной группой могут быть замещены один, два, три или больше атомов водорода, таким образом, гидрокси-C1-4алкил или гидрокси-C1-6алкил может иметь одну, две, три или более гидроксильных групп. Примеры таких групп включают гидроксиметил, гидроксиэтил, гидроксипропил и т. п.
Термин "галогенC1-4алкил" или "галогенC1-6алкил" в данном документе используется в качестве группы или части группы, относящейся к C1-4алкильной или C1-6алкильной группе, определенной в данном документе, где один или более чем один атом водорода замещен атомом галогена. Поэтому термин "галогенC1-4алкил" или "галогенC1-6алкил" включает в себя моногалогенC1-4алкил, моногалогенC1-6алкил, а также полигалогенC1-4алкил и полигалогенC1-6алкил. Галогеном могут быть замещены один, два, три или более атомов водорода, таким образом, галогенC1-4алкил или галогенC1-6алкил может содержать один, два, три или более атомов галогенов. Примеры таких групп включают фторэтил, фторметил, трифторметил или трифторэтил и т. п.
Термин "галогенC1-4алкокси-группа" или "галогенC1-6алкокси-группа" в данном документе используется в качестве группы или части группы, относящейся к группе -O-C1-4алкила или группе -O-C1-6алкила, определенной в данном документе, где один или более чем один атом водорода замещен атомом галогена. Поэтому термины "галогенC1-4алкокси-группа" или "галогенC1-6алкокси-группа" включают в себя моногалогенC1-4алкокси-группу, моногалогенC1-6алкокси-группу, а также полигалогенC1-4алкокси-группу и полигалогенC1-6алкокси-группу. Галогеном могут быть замещены один, два, три или более атомов водорода, таким образом, галогенC1-4алкокси-группа или галогенC1-6алкокси-группа может содержать один, два, три или более атомов галогенов. Примеры таких групп включают фторэтилокси, дифторметокси или трифторметокси и т.п.
Термин цианоC1-4алкил или цианоC1-6алкил в данном контексте относится к группе C1-4алкила или группе C1-4алкила, определенной в данном документе, которая замещена одной или двумя цианогруппами, в частности одной цианогруппой.
Термин "гетероциклил" в данном контексте, если не указано иное, включает как ароматические, так и неароматические кольцевые системы. Так например, термин "гетероциклил" включает в свой объем ароматические, неароматические, ненасыщенные, частично насыщенные и полностью насыщенные гетероциклильные кольцевые системы. В общем, если контекст не указывает на иное, такие кольцевые системы могут быть моноциклическими, или бициклическими, или мостиковыми и могут содержать, например, от 3 до 12 членов кольца или от 4 до 10 членов кольца, или, как правило, от 5 до 10 членов кольца. Ссылка на 4-7-членные кольца включает 4, 5, 6 или 7 атомов в кольце, ссылка на 3-6-членные кольца включает 3, 4, 5 или 6 атомов в кольце, а ссылка на 4-6-членные кольца включает 4, 5 или 6 атомов в кольце. Примерами моноциклических гетероциклильных кольцевых систем являются кольцевые системы, содержащие 3, 4, 5, 6, 7 или 8 членов кольца, как правило - от 3 до 7, и предпочтительно - 4, 5, 6 или 7 членов кольца, более предпочтительно - 5 или 6 членов кольца. Примерами бициклических гетероциклильных кольцевых систем являются те, которые содержат 8, 9, 10, 11 или 12 членов кольца, а как правило - 9 или 10 членов кольца. Гетероциклильные кольцевые системы содержат не менее одного гетероатома, обычно выбранного из азота, кислорода или серы, в частности, содержат до 5, до 4, до 3, до 2 гетероатомов или один гетероатом. Когда в данном документе встречается ссылка на гетероциклильную кольцевую систему, то гетероциклильное кольцо может быть, если контекст не указывает на иное, необязательно замещено (т.е. быть незамещенным или замещенным) одним или несколькими заместителями, как обсуждается в данном документе.
Гетероциклильные кольцевые системы могут быть гетероарильными кольцевыми системами, содержащими от 5 до 12 членов кольца, чаще от 5 до 10 членов кольца. Термин "гетероарил" используется здесь для обозначения гетероциклильной кольцевой системы, имеющей ароматический характер. Термин "гетероарил" охватывает полициклические (например, бициклические) кольцевые системы, в которых одно или несколько колец не являются ароматическими, при условии, что по меньшей мере одно кольцо является ароматическим. В таких полициклических системах кольцевая система может быть присоединена к остальной части соединения по ароматическому кольцу или неароматическому кольцу.
Примерами гетероарильных групп являются моноциклические и бициклические группы, содержащие от пяти до двенадцати членов кольца, а как правило - от пяти до десяти членов кольца. Гетероарильной группой может быть, например, пятичленное или шестичленное моноциклическое кольцо или бициклическая структура, образованная из конденсированных пяти- и шестичленных колец, или двух конденсированных шестичленных колец, или двух конденсированных пятичленных колец. Гетероарильная кольцевая система может содержать до примерно пяти гетероатомов, обычно выбранных из азота, кислорода и серы. Обычно гетероарильное кольцо будет содержать до 4 гетероатомов, более типично - до 3 гетероатомов, как правило - до 2, например, один гетероатом. В одном варианте осуществления гетероарильное кольцо содержит не менее одного атома азота в кольце. Атомы азота в гетероарильных кольцах могут быть основными, как в случае имидазола или пиридина, или, по существу, неосновными, как в случае индольного или пиррольного азота. Обычно число основных атомов азота, присутствующих в гетероарильной группе, включая любые заместители-аминогруппы в кольце, будет меньше пяти.
Примеры пятичленных гетероарильных групп включают, но не ограничиваются ими, группы пирролила, фуранила, тиенила, имидазолила, оксазолила, оксадиазолила, оксатриазола, изоксазолила, тиазолила, тиадиазолила, изотиазолила, пиразолила, триазолила и тетразола. В частности, примеры пятичленных гетероарильных групп включают, но не ограничиваются ими, группы пирролила, фуранила, тиенила, имидазолила, оксазолила, оксадиазолила, изоксазолила, тиазолила, тиадиазолила, изотиазолила, пиразолила и триазолила.
Примеры шестичленных гетероарильных групп включают, но не ограничиваются ими, пиридил, пиразинил, пиридазинил, пиримидинил и триазинил.
Бициклической гетероарильной группой может быть, например, группа, выбранная из:
а) бензольного кольца, конденсированного с 5- или 6-членным кольцом, содержащим 1, 2 или 3 гетероатома в кольце;
b) пиридинового кольца, конденсированного с 5- или 6-членным кольцом, содержащим 1, 2 или 3 гетероатома в кольце;
с) пиримидинового кольца, конденсированного с 5- или 6-членным кольцом, содержащим 0, 1 или 2 гетероатома в кольце;
d) пиррольного кольца, конденсированного с 5- или 6-членным кольцом, содержащим 0, 1, 2 или 3 гетероатома в кольце;
е) пиразольного кольца, конденсированного с 5- или 6-членным кольцом, содержащим 0, 1 или 2 гетероатома в кольце;
f) имидазольного кольца, конденсированного с 5- или 6-членным кольцом, содержащим 0, 1 или 2 гетероатома в кольце;
g) оксазольного кольца, конденсированного с 5- или 6-членным кольцом, содержащим 0, 1 или 2 гетероатома в кольце;
h) изоксазольного кольца, конденсированного с 5- или 6-членным кольцом, содержащим 0, 1 или 2 гетероатома в кольце;
i) тиазольного кольца, конденсированного с 5- или 6-членным кольцом, содержащим 0, 1 или 2 гетероатома в кольце;
j) изотиазольного кольца, конденсированного с 5- или 6-членным кольцом, содержащим 0, 1 или 2 гетероатома в кольце;
k) тиофенового кольца, конденсированного с 5- или 6-членным кольцом, содержащим 0, 1, 2 или 3 гетероатома в кольце;
l) фуранового кольца, конденсированного с 5- или 6-членным кольцом, содержащим 0, 1, 2 или 3 гетероатома в кольце;
m) циклогексильного кольца, конденсированного с 5- или 6-членным ароматическим кольцом, содержащим 1, 2 или 3 гетероатома в кольце;
n) циклопентильного кольца, конденсированного с 5- или 6-членным ароматическим кольцом, содержащим 1, 2 или 3 гетероатома в кольце.
Конкретные примеры бициклических гетероарильных групп, содержащих пятичленное кольцо, конденсированное с другим пятичленным кольцом, включают, но не ограничиваются этим, имидазотиазолил (например, имидазо[2,1-b]тиазол) и имидазоимидазолил (например, имидазо[1,2-а]имидазол).
Конкретные примеры бициклических гетероарильных групп, содержащих шестичленное кольцо, конденсированное с пятичленным кольцом, включают группы, но не ограничиваются ими, бензофуранила, бензотиофенила, бензимидазолила, бензоксазолила, изобензоксазолила, бензизоксазолила, бензтиазолила, изобензоксазолила, бензизоксазолила, бензтиазолила, бензизотиазолила, изобензофуранила, индолила, изоиндолила, индолизинила, индолинила, изоиндолинила, пуринила, индазолила, пиразопиримидинила (например, пиразоло[1,5-a]пиримидин), триазолопиримидинила (например, [1,2,4]триазоло[1,5-a]пиримидин), бензодиоксолила, имидазопиразинила, имидазопиридазинила, имидазопиридинила и пиразолопиридинила (например, пиразоло[1,5-a]пиридин).
Конкретные примеры бициклических гетероарильных групп, содержащих шестичленное кольцо, конденсированное с пятичленным кольцом, включают, но не ограничиваются ими, группы бензофуранила, бензотиофенила, бензимидазолила, бензоксазолила, бензизоксазолила, бензтиазолила, изобензоксазолила, бензизоксазолила, бензтиазолила, бензизотиазолила, индолила, изоиндолила, индолизинила, индолинила, изоиндолинила, индазолила, пиразопиримидинила (например, пиразоло[1,5-a]пиримидин), триазолопиримидилила (например, [1,2,4]триазоло[1,5-a]пиримидин), имидазопиразинила, имидазопиридазинила, имидазопиридинила и пиразолопиридинила (например, пиразоло[1,5-a]пиридин).
Конкретные примеры бициклических гетероарильных групп, содержащих шестичленное кольцо, конденсированное с пятичленным кольцом, включают, но не ограничиваются ими, группы бензофуранила, бензотиофенила, бензимидазолила, бензтиазолила, индолила, изоиндолила, индолизинила, индолинила.
Конкретные примеры бициклических гетероарильных групп, содержащих два конденсированных шестичленных кольца, включают, но не ограничиваются ими, группы хинолизинила, хинолинила, изохинолинила, циннолинила, хроманила, изохроманила, тиохроманила, бензопиранила, бензодиоксанила, бензоксазинила, пиридопиридинила, хиноксалинила, хиназолинила, фталазинила, нафтиридинила и птеридинила.
Конкретные примеры бициклических гетероарильных групп, содержащих два конденсированных шестичленных кольца, включают, но не ограничиваются ими, группы хинолизинила, хинолинила, изохинолинила, бензопиранила, бензодиоксанила, бензоксазинила, пиридопиридинила, хиноксалинила, хиназолинила, фталазинила, нафтиридинила и птеридинила.
Конкретные примеры бициклических гетероарильных групп, содержащих два конденсированных шестичленных кольца, включают, но не ограничиваются ими, группы хинолизинила, хинолинила, изохинолинила, хиноксалинила, хиназолинила, фталазинила, нафтиридинила и птеридинила.
Примеры полициклических гетероарильных групп, содержащих ароматическое кольцо и неароматическое кольцо, включают тетрагидроизохинолинил, тетрагидрохинолинил, дигидробензотиенил, дигидробензофуранил, 2,3-дигидробензо[1,4]диоксинил, бензо[1,3]диоксолил, 4,5,6,7-тетрагидробензофуранил, тетрагидротриазолопиразинил (например, 5,6,7,8-тетрагидро-[1,2,4]триазоло[4,3-a]пиразинил) и индолинил.
Азотсодержащее гетероарильное кольцо должно содержать не менее одного атома азота в кольце. Кроме этого, каждое кольцо может содержать до четырех других гетероатомов, обычно выбранных из азота, серы и кислорода. Обычно гетероарильное кольцо будет содержать до 3 гетероатомов, например, 1, 2 или 3, чаще до 2 атомов азота, например, один атом азота. Атомы азота в гетероарильных кольцах могут быть основными, как в случае имидазола или пиридина, или, по существу, неосновными, как в случае индольного или пиррольного азота. Обычно число основных атомов азота, присутствующих в гетероарильной группе, включая любые заместители-аминогруппы в кольце, будет меньше пяти.
Примеры азотсодержащих гетероарильных групп включают, но не ограничиваются ими, пиридил, пирролил, имидазолил, оксазолил, оксадиазолил, тиадиазолил, оксатриазолил, изоксазолил, тиазолил, изотиазолил, пиразолил, пиразинил, пиримидинил, пиридазинил, триазинил, триазолил (например, 1,2,3-триазолил, 1,2,4-триазолил), тетразолил, хинолинил, изохинолинил, бензимидазолил, бензоксазолил, бензизоксазолил, бензтиазолил и бензизотиазол, индолил, 3H-индолил, изоиндолил, индолизинил, изоиндолинил, пуринил, индазолил, хинолизинил, бензоксазинил, пиридопиридинил, хиноксалинил, хиназолинил, циннолинил, фталазинил, нафтиридинил и птеридинил.
Примеры азотсодержащих полициклических гетероарильных групп, содержащих ароматическое кольцо и неароматическое кольцо, включают тетрагидроизохинолинил, тетрагидрохинолинил и индолинил.
Термин "неароматическая группа" охватывает, если в контексте не указано иное, ненасыщенные кольцевые системы, не имеющие ароматический характер, частично насыщенные и полностью насыщенные гетероциклильные кольцевые системы. Термины "ненасыщенный" и "частично насыщенный" относятся к кольцам, в которых кольцевая структура(ы) содержит атомы, которые имеют более чем одну общую валентною связь, т.е. кольцо содержит по меньшей мере одну кратную связь, например, связь C=C, C≡C или N=C. Термин "полностью насыщенный" относится к кольцам, где кратные связи между атомами кольца отсутствуют. Насыщенные гетероциклильные группы включают пиперидин, морфолин, тиоморфолин, пиперазин. Частично насыщенные гетероциклильные группы включают пиразолины, например, 2-пиразолин и 3-пиразолин.
Примерами неароматических гетероциклильных групп являются группы, имеющие от 3 до 12 членов кольца, как правило - от 5 до 10 членов кольца. Такие группы могут быть, например, моноциклическими или бициклическими, и обычно имеют в кольце от 1 до 5 гетероатомов (как правило, 1, 2, 3 или 4 гетероатома - членов кольца), которые обычно выбраны из азота, кислорода и серы. Гетероциклильные группы могут содержать, например, циклические эфирные фрагменты (например, как в тетрагидрофуране и диоксане), циклические тиоэфирные фрагменты (например, как в тетрагидротиофене и дитиане), циклические аминные фрагменты (например, как в пирролидине) и их комбинации (например, тиоморфолин).
Конкретные примеры включают морфолинил, тиоморфолинил, пиперидинил (например, 1-пиперидинил, 2-пиперидинил, 3-пиперидинил и 4-пиперидинил), пирролидинил (например, 1-пирролидинил, 2-пирролидинил и 3-пирролидинил), азетидинил, пиранил (2H-пиранил или 4Н-пиранил), дигидротиофенил, дигидропиранил, дигидрофуранил, дигидротиазолил, тетрагидрофуранил, тетрагидротиофенил, диоксанил, диоксоланил, тетрагидропиранил, имидазолинил, оксазолинил, оксазолидинил, оксетанил, тиазолинил, 2-пиразолинил, пиразолидинил и пиперазинил. Обычно предпочтительные неароматические гетероциклильные группы включают насыщенные группы, такие как пиперидинил, пирролидинил, азетидинил, морфолинил и пиперазинил.
Конкретные примеры включают морфолинил, тиоморфолинил, пиперидинил (например, 1-пиперидинил, 2-пиперидинил, 3-пиперидинил и 4-пиперидинил), пирролидинил (например, 1-пирролидинил, 2-пирролидинил и 3-пирролидинил), пиранил (2H-пиранил или 4Н-пиранил), дигидротиофенил, дигидропиранил, дигидрофуранил, дигидротиазолил, тетрагидрофуранил, тетрагидротиофенил, диоксанил, тетрагидропиранил, имидазолинил, оксазолинил, оксазолидинил, 2-пиразолинил, пиразолидинил и пиперазинил. Обычно предпочтительные неароматические гетероциклильные группы включают насыщенные группы, такие как пиперидинил, пирролидинил, азетидинил, морфолинил и пиперазинил.
В азотсодержащем неароматическом гетероциклильном кольце последнее должно содержать по меньшей мере один кольцевой атом азота.
Конкретные примеры азотсодержащих неароматических гетероциклильных групп включают азиридинил, морфолинил, тиоморфолинил, пиперидинил (например, 1-пиперидинил, 2-пиперидинил, 3-пиперидинил и 4-пиперидинил), пирролидинил (например, 1-пирролидинил, 2-пирролидинил и 3-пирролидинил), дигидротиазолил, имидазолинил, оксазолинил, тиазолинил, 2-пиразолинил, 3-пиразолинил, пиразолидинил и пиперазинил.
Конкретные примеры 3-6-членных моноциклических насыщенных гетероциклилов представляют собой кольцевые системы, включающие морфолинил, тиоморфолинил, диоксанил, пиперидинил (например, 1-пиперидинил, 2-пиперидинил, 3-пиперидинил и 4-пиперидинил), пиперазинил, пирролидинил (например, 1-пирролидинил, 2-пиррол 3-пирролидинил), имидазолидинил, пиразолидинил, оксазолидинил, изоксазолидинил, тиазолидинил, изотиазолидинил, диоксоланил, дитиоланил, тетрагидрофуранил, тетрагидротиофенил, тетрагидропиранил (например, 4-тетрагидропиранил), дитианил, триоксанил, тритианил, азиридинил, оксиранил, тииранил, диазиридинил, диоксаринил, оксетанил, азетидинил, тиетанил, диоксетанил.
Конкретные примеры 3-6-членных моноциклических насыщенных гетероциклилов представляют собой кольцевые системы, включающие морфолинил, тиоморфолинил, диоксанил, пиперидинил (например, 1-пиперидинил, 2-пиперидинил, 3-пиперидинил и 4-пиперидинил), пиперазинил, пирролидинил (например, 1-пирролидинил, 2-пиррол 3-пирролидинил), имидазолидинил, пиразолидинил, оксазолидинил, изоксазолидинил, тиазолидинил, изотиазолидинил, диоксоланил, тетрагидрофуранил, тетрагидротиофенил, тетрагидропиранил (например, 4-тетрагидропиранил), оксиранил, азетидинил.
Конкретные примеры 3-6-членных моноциклических насыщенных гетероциклилов представляют собой кольцевые системы, включающие морфолинил, тиоморфолинил, диоксанил, пиперидинил (например, 1-пиперидинил, 2-пиперидинил, 3-пиперидинил и 4-пиперидинил), пиперазинил, пирролидинил (например, 1-пирролидинил, 2-пиррол 3-пирролидинил), имидазолидинил, пиразолидинил, диоксоланил, тетрагидрофуранил, тетрагидротиофенил, тетрагидропиранил (например, 4-тетрагидропиранил).
Конкретные примеры 3-6-членных моноциклических гетероциклилов представляют собой кольцевые системы, включающие морфолинил, тиоморфолинил, пиперидинил (например, 1-пиперидинил, 2-пиперидинил, 3-пиперидинил и 4-пиперидинил), пирролидинил (например, 1-пирролидинил, 2-пирролидинил и 3-пирролидинил), имидазолидинил, пиразолидинил, оксазолидинил, изоксазолидинил, тиазолидинил, изотиазолидинил, диоксоланил, дитиоланил, пиперазинил, тетрагидрофуранил, тетрагидротиофенил, диоксанил, тетрагидропиранил (например, 4-тетрагидро пиранил), дитианил, триоксанил, тритианил, азиридинил, оксиранил, тииранил, диазиридинил, диоксаринил, оксетанила, азетидинил, тиетанил, диоксетанил, азиринил, азетил, 1,2-дитиэтил, пирролил, фураниал, тиофенил, имидазолил, пиразолил, оксазолил, тиазолил, изотиазолил, триазолил, оксадиазолил, тиадиазолил, дитиазолил, пиридинил, пиранил, тиопиранил, пиримидинил, тиазинил, оксазинил, триазинил.
Конкретные примеры 3-6-членных моноциклических гетероциклилов представляют собой кольцевые системы, включающие морфолинил, тиоморфолинил, пиперидинил (например, 1-пиперидинил, 2-пиперидинил, 3-пиперидинил и 4-пиперидинил), пирролидинил (например, 1-пирролидинил, 2-пирролидинил и 3-пирролидинил), имидазолидинил, пиразолидинил, оксазолидинил, изоксазолидинил, тиазолидинил, изотиазолидинил, диоксоланил, дитиоланил, пиперазинил, тетрагидрофуранил, тетрагидротиофенил, диоксанил, тетрагидропиранил (например, 4-тетрагидро пиранил), оксиранил, оксетанил, азетидинил, пирролил, фураниал, тиофенил, имидазолил, пиразолил, оксазолил, тиазолил, изотиазолил, триазолил, оксадиазолил, тиадиазолил, дитиазолил, пиридинил, пиранил, тиопиранил, пиримидинил, тиазинил, оксазинил, триазинил.
Конкретные примеры 3-12-членных гетероциклов представляют собой кольцевые системы, включающие морфолинил, тиоморфолинил, пиперидинил (например, 1-пиперидинил, 2-пиперидинил, 3-пиперидинил и 4-пиперидинил), пирролидинил (например, 1-пирролидинил, 2-пирролидинил и 3-пирролидинил), имидазолидинил, пиразолидинил, оксазолидинил, изоксазолидинил, тиазолидинил, изотиазолидинил, диоксоланил, дитиоланил, пиперазинил, тетрагидрофуранил, тетрагидротиофенил, диоксанил, тетрагидропиранил (например, 4-тетрагидропиранил), дитианил, триоксанил, тритианил, азиридинил, оксиранил, тииранил, диазиридинил, диоксаринил, оксетанил, азетидинил, тиетанил, диоксетанил, азиринил, азетил, 1,2-дитиэтил, пирролил, фуранил, тиофенил, имидазолил, пиразолил, оксазолил, тиазолил, изотиазолил, триазолил, оксадиазолил, триазинил, азепанил, оксепанил, тиепанил, 1,2-диазепанил, 1,4-диазепанил, диазепинил, тиазепинил, азоканил, азоцинил, имидазотиазолил (например, имидазо[2,1-b]тиазолил), имидазоимидазолил (например, имидазо[1,2-а]имидазолил), бензофуранил, бензотиофенил, бензимидазолил, бензоксазолил, изобензоксазолил, бензизоксазолил, бензтиазолил, бензизотиазолил, изобензофуранил, индолил, изоиндолил, индолизинил, индолинил, изоиндолинил, пуринил, индазолил, пиразолопиримидинил (например, пиразоло[1,5-а]пиримидинил), триазолопиримидинил (например, [1,2,4]триазоло[1,5-а]пиримидинил), бензодиоксолил, имидазопиридинил и пиразолопиридинил (например, пиразоло[1,5-а]пиридинил), хинолинил, изохинолинил, хроманил, тиохроманил, изохроманил, бензодиоксанил, хинолизинил, бензоксазинил, пиридопиридинил, хиноксалинил, хиназолинил, циннолинил, фталазинил, нафтиридинил, птеридинил, 2,3-дигидробензо[1,4]диоксинил, бензо[1,3]диоксолил, 4,5,6,7-тетрагидробензофуранил, тетрагидротриазолопиразинил (например, 5,6,7,8-тетрагидро[1,2,4]триазоло[4,3-а]пиразинил),
8-окса-3-азабицикло[3.2.1]октанил, 2-окса-5-азабицикло[2.2.1]гептанил, 3-окса-8-азабицикло[3.2.1]октанил, 3,6-диазабицикло[3.1.1]гептанил.
Конкретные примеры 3-12-членных гетероциклов представляют собой кольцевые системы, включающие морфолинил, тиоморфолинил, пиперидинил (например, 1-пиперидинил, 2-пиперидинил, 3-пиперидинил и 4-пиперидинил), пирролидинил (например, 1-пирролидинил, 2-пирролидинил и 3-пирролидинил), имидазолидинил, пиразолидинил, оксазолидинил, изоксазолидинил, тиазолидинил, изотиазолидинил, диоксоланил, пиперазинил, тетрагидрофуранил, тетрагидротиофенил, диоксанил, тетрагидропиранил (например, 4-тетрагидропиранил), оксиранил, оксетанил, азетидинил, пирролил, фураниал, тиофенил, имидазолил, пиразолил, оксазолил, тиазолил, изотиазолил, триазолил, оксадиазолил, тиадиазолил, дитиазолил, пиридинил, пиранил, тиопиранил, пиримидинил, тиазинил, оксазинил, триазинил, имидазотиазолил (например, имидазо[2,1-b]тиазолил), имидазоимидазолил (например, имидазо[1,2-а]имидазолил), бензофуранил, бензотиофенил, бензимидазолил, бензоксазолил, изобензоксазолил, бензизоксазолил, бензтиазолил, бензизотиазолил, изобензофуранил, индолил, изоиндолил, индолизинил, индолинил, изоиндолинил, индазолил, пиразопиримидинил (например, пиразоло[1,5-a]пиримидинил), триазолопиримидинил (например, [1,2,4]триазоло[1,5-a]пиримидинил), хинолинил, изохинолинил, бензодиоксанил, хинолизинил, бензоксазинил, пиридопиридинил, хиноксалинил, хиназолинил, циннолинил, тетрагидрохинолинил, дигидробензтиенил, дидгидробензфуранил, 2,3-дигидробензо[1,4]диоксинил, бензо[1,3]диоксолил, 4,5,6,7-тетрагидробензофуранил, тетрагидротриазолопиразинил (например, 5,6,7,8-тетрагидро[1,2,4]триазоло[4,3-а]пиразинил).
Конкретные примеры 5-6-членных ароматических гетероциклов представляют собой кольцевые системы, включающие, но не ограничивающиеся этим, пирролил, фуранил, тиофенил, имидазолил, фуразанил, оксазолил, оксадиазолил, оксатриазолил, изоксазолил, тиазолил, тиадиазолил, изотиазолил, пиразолил, триазолил, тетразолил, пиридинил, пиразинил, пиридазинил, пиримидинил и триазинил.
Гетероциклильные и карбоциклильные кольца, представляющие собой заместитель B, или D, или D3 включают мостиковые кольцевые системы, такие как, например, норборнан (1,4-эндометиленциклогексан), адамантан, окса-адамантан; мостиковые морфолиновые кольца, такие как, например, 8-окса-3-азабицикло[3.2.1]октан, 2-окса-5-азабицикло[2.2.1]гептан, 3-окса-8-азабицикло[3.2.1]октан; мостиковые пиперазиновые кольца, такие как, например, 3,6-диазабицикло[3.1.1]гептан; мостиковые пиперидиновые кольца, такие как, например, 1,4-этиленпиперидин. Объяснение различия между конденсированными и мостиковыми кольцевыми системами см. в публикации Advanced Organic Chemistry, by Jerry March, 4th Edition, Wiley Interscience, стр. 131-133, 1992.
Термин "карбоциклил" в данном контексте, если не указано иное, включает как ароматические, так и неароматические углеродные кольцевые системы. Так например, термин "карбоциклил" включает в свой объем ароматические, неароматические, ненасыщенные, частично насыщенные и полностью насыщенные карбоциклильные кольцевые системы. В общем, если контекст не указывает на иное, такие кольцевые системы могут быть моноциклическими, или бициклическими, или мостиковыми и могут содержать, например, от 3 до 12 членов кольца или от 4 до 10 членов кольца, или, как правило, от 5 до 10 членов кольца. Ссылка на 4-7-членные кольца включает 4, 5, 6 или 7 атомов в кольце, а ссылка на 4-6-членные кольца включает 4, 5 или 6 атомов в кольце. Примерами моноциклических карбоциклильных кольцевых систем являются кольцевые системы, содержащие 3, 4, 5, 6, 7 и 8 членов кольца, как правило - от 3 до 7, и предпочтительно - 4, 5, 6 или 7 членов кольца, более предпочтительно 5 или 6 членов кольца. Примерами бициклических карбоциклильных кольцевых систем являются те, которые содержат 8, 9, 10, 11 и 12 членов кольца, а как правило - 9 или 10 членов кольца. Когда в данном документе встречается ссылка на карбоциклильную кольцевую систему, то карбоциклильное кольцо может быть, если контекст не указывает на иное, необязательно замещено (т.е. быть незамещенным или замещенным) одним или несколькими заместителями, как обсуждается в данном документе.
Карбоциклильные кольцевые системы могут быть арильными кольцевыми системами. Термин "арил" в данном контексте относится к карбоциклильным ароматическим группам и охватывает полициклические (например, бициклические) кольцевые системы, в которых одно или несколько колец не являются ароматическими, при условии, что по меньшей мере одно кольцо является ароматическим. В таких полициклических системах кольцевая система может быть присоединена к остальной части соединения по ароматическому кольцу или неароматическому кольцу. Термин "арил" включает в себя группы фенила, нафтила, инденила и тетрагидронафтила.
Конкретные примеры 3-12-членных карбоциклов представляют собой кольцевые системы, включающие циклопропил, циклобутил, циклопентил, циклогексил, циклогептил, циклооктил, фенилнафтил, инденил, тетрагидронафтил, азуленил, норборнан (1,4-эндометиленциклогексан), адамантан.
Линии (такие как "-" в -(Ra)na), направленные в кольцевую систему, указывают на то, что связь может быть присоединена к любому из подходящих атомов кольца.
В одном варианте осуществления, где рассматриваются два или более гетероатома, эти гетероатомы могут быть одинаковыми, или часть или все из двух или более гетероатомов могут быть разными.
Термин "необязательный" или "необязательно" означает, что событие, описанное после него, может происходить или не происходить. Этот термин охватывает случаи, когда событие может или не может произойти.
В данном контексте выражение "один или несколько" или "не менее одного" относится к не менее чем одному, например, одному, двум, трем, четырем, пяти или более, когда это возможно и в зависимости от контекста.
В соединениях формулы (I) атом углерода, обозначенный "*" в приведенной ниже формуле, представляет собой хиральный центр. Настоящее изобретение относится к соединениям формулы (I), где указанный хиральный центр имеет определенное стереохимическое строение (S или R), в частности соединения формулы (I), где указанный хиральный центр имеет S-стереохимическое строение.
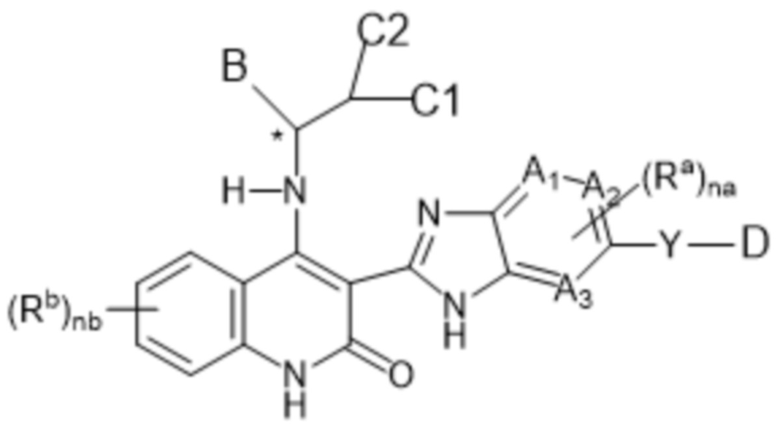
Так, в настоящем изобретении предложены соединения формулы (I-а):
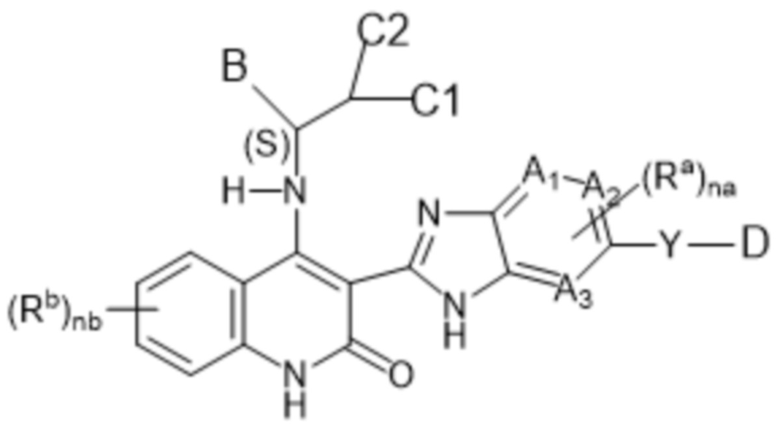 (I-a),
(I-a),
в том числе любая его таутомерная и его стереохимически изомерная форма, где
Каждый из A1, A2 и A3 независимо представляет собой атом углерода или атом азота;
C1 представляет собой водород или C1-4алкил;
C2 представляет собой водород или C1-4алкил или гидроксил;
или C1 и C2, взятые вместе, образуют C3-6циклоалкил вместе в атомом углерода, к которому они присоединены;
Y представляет собой одинарную связь, -O-, C(=O), NRy, S(=O)2 или C1-4алкил;
Ry представляет собой водород или C1-4алкил;
каждый Rа независимо представляет собой водород, C1-6алкил, галогенC1-6алкил, галоген, C1-6алкокси-группу, карбоксил, C1-6алкоксикарбонил, C2-6алкенил, C2-6алкинил, циано-группу, цианоC1-6алкил, гидроксиC1-6алкил,
-C(=O)-NH2, -C(=O)-NH(C1-4алкил), -C(=O)-N(C1-4алкил)2, или 3-6-членный моноциклический насыщенный гетероциклил, содержащий не менее одного гетероатома, выбранного из N, O или S;
nа представляет целое число, равное 1 или 2;
каждый Rb независимо представляет собой водород, C1-6алкил, галогенC1-6алкил, галоген, C1-6алкокси-группу, C1-6алкоксикарбонил, C2-6алкенил, C2-6алкинил, циано-группу, цианоC1-6алкил, гидроксиC1-6алкил,
-C(=O)-NH2, -C(=O)-NH(C1-4алкил), -C(=O)-N(C1-4алкил)2, C3-6циклоалкил, фенил, 3-6-членный моноциклический гетероциклил, содержащий не менее одного гетероатома, выбранного из N, O или S, или C1-6алкил, замещенный C3-6циклоалкилом, или фенилом, или 3-6-членным моноциклическим гетероциклилом, содержащим не менее одного гетероатома, выбранного из N, O или S;
nb представляет целое число, равное 1 или 2;
D представляет собой 3-12-членный моноциклический гетероциклил, содержащий не менее одного гетероатома, выбранного из N, O или S, причем указанный гетероциклил необязательно замещен 1-5 заместителями Rc;
каждый Rc независимо представляет собой оксо, C1-6алкил, гидроксиC1-6алкил, галогенC1-6алкил, галогенC1-6алкилокси, карбоксильную группу, HOOC-C1-6алкил-, C1-6алкил, замещенный -C(=O)-O-C1-6алкилом, C1-6алкил-O-C(=O)-, циано-группу, цианоC1-6алкил, C1-6алкил-C(=O)-, -SO2-C1-6алкил, C3-6циклоалкил, фенил, 3-6-членный моноциклический насыщенный гетероциклил, содержащий не менее одного гетероатома, выбранного из N, O или S, или 5-6-членный моноциклический ароматический гетероциклил, содержащий не менее одного гетероатома, выбранного из N, O или S;
B представляет собой 3-12-членный карбоциклил или 3-12-членный гетероциклил, содержащий не менее одного гетероатома, выбранного из N, O или S, причем каждый из указанных карбоциклила и гетеороциклила необязательно замещены 1-5 заместителями R;
каждый R независимо представляет собой C1-6алкил, циано-группу, галоген, C1-6алкокси-группу, галогенC1-6алкокси-группу, гидроксил, гидроксиC1-6алкил, галогенC1-6алкил, оксо-, -SO2-NH2, -SO2-NH(C1-4алкил),
-SO2-N(C1-4алкил)2, -NH-C(=O)-C2-6алкенил, -C(=O)-C1-6алкил, -C(=O)-C2-6алкенил,
C1-6алкил-O-C(=O)-, C3-6циклоалкил, фенил или 3-6-членный моноциклический гетероциклил, содержащий не менее одного гетероатома, выбранного из N, O или S;
или их фармацевтически приемлемые соли или их сольваты.
В настоящем изобретении предложены соединения формулы (I):
 (I-A)
(I-A)
в том числе любая его таутомерная и его стереохимически изомерная форма, где
каждый из A1, A2 и A3 независимо представляет собой атом углерода или атом азота;
C1 представляет собой водород или C1-4алкил;
C2 представляет собой водород или C1-4алкил или гидроксил;
или C1 и C2, взятые вместе, образуют C3-6циклоалкил вместе в атомом углерода, к которому они присоединены;
Y представляет собой одинарную связь, -O-, C(=O), NRy, S(=O)2 или C1-4алкил;
Ry представляет собой водород или C1-4алкил;
каждый Rа независимо представляет собой водород, C1-6алкил, галогенC1-6алкил, галоген, C1-6алкокси-группу, карбоксил, C1-6алкоксикарбонил, C2-6алкенил, C2-6алкинил, циано-группу, цианоC1-6алкил, гидроксиC1-6алкил,
-C(=O)-NH2, -C(=O)-NH(C1-4алкил), -C(=O)-N(C1-4алкил)2, или 3-6-членный моноциклический насыщенный гетероциклил, содержащий не менее одного гетероатома, выбранного из N, O или S;
nа представляет целое число, равное 1 или 2;
каждый Rb независимо представляет собой водород, C1-6алкил, галогенC1-6алкил, галоген, C1-6алкокси-группу, C1-6алкоксикарбонил, C2-6алкенил, C2-6алкинил, циано-группу, цианоC1-6алкил, гидроксиC1-6алкил,
-C(=O)-NH2, -C(=O)-NH(C1-4алкил), -C(=O)-N(C1-4алкил)2, C3-6циклоалкил, фенил, 3-6-членный моноциклический гетероциклил, содержащий не менее одного гетероатома, выбранного из N, O или S, или C1-6алкил, замещенный C3-6циклоалкилом, или фенилом, или 3-6-членным моноциклическим гетероциклилом, содержащим не менее одного гетероатома, выбранного из N, O или S;
nb представляет целое число, равное 1 или 2;
D1 представляет собой пиперазин-1-ил, где указанный пиперазин-1-ил необязательно замещен 1-5 заместителями Rc;
каждый Rc независимо представляет собой оксо, C1-6алкил, гидроксиC1-6алкил, галогенC1-6алкил, галогенC1-6алкилокси, карбоксильную группу, HOOC-C1-6алкил-, C1-6алкил, замещенный -C(=O)-O-C1-6алкилом, C1-6алкил-O-C(=O)-, циано-группу, цианоC1-6алкил, C1-6алкил-C(=O)-, -SO2-C1-6алкил, C3-6циклоалкил, фенил, 3-6-членный моноциклический насыщенный гетероциклил, содержащий не менее одного гетероатома, выбранного из N, O или S, или 5-6-членный моноциклический ароматический гетероциклил, содержащий не менее одного гетероатома, выбранного из N, O или S;
B представляет собой 3-12-членный карбоциклил или 3-12-членный гетероциклил, содержащий не менее одного гетероатома, выбранного из N, O или S, причем каждый из указанных карбоциклила и гетеороциклила необязательно замещены 1-5 заместителями R;
каждый R независимо представляет собой C1-6алкил, циано-группу, галоген, C1-6алкокси-группу, галогенC1-6алкокси-группу, гидроксил, гидроксиC1-6алкил, галогенC1-6алкил, оксо-, -SO2-NH2, -SO2-NH(C1-4алкил),
-SO2-N(C1-4алкил)2, -NH-C(=O)-C2-6алкенил, -C(=O)-C1-6алкил, -C(=O)-C2-6алкенил, C1-6алкил-O-C(=O)-, C3-6циклоалкил, фенил, или 3-6-членный моноциклический гетероциклил, содержащий не менее одного гетероатома, выбранного из N, O или S;
или их фармацевтически приемлемые соли или их сольваты.
Настоящее изобретение относится к соединениям формулы (I-А), как определено выше, имеющим S-стереоцентр, как показано в следующей формуле (I-А-a):
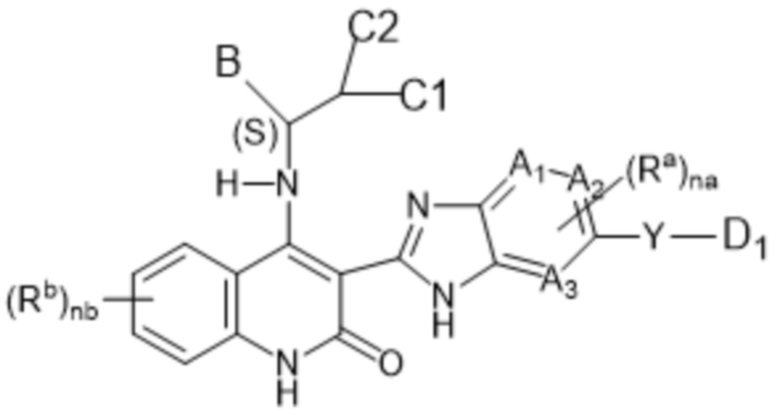 (I-A-a),
(I-A-a),
в том числе любая его таутомерная и его стереохимически изомерная форма, где
заместители являются такими, как определено выше для соединений формулы (I-А);
или их фармацевтически приемлемые соли или их сольваты.
В настоящем изобретении предложены соединения формулы (I-В):
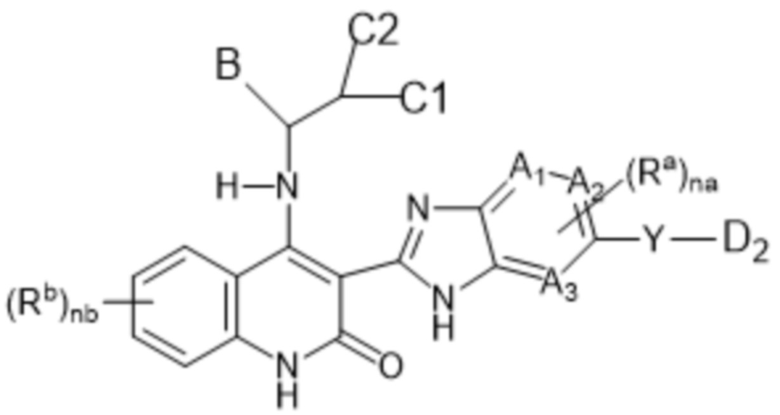 (I-B)
(I-B)
в том числе любая его таутомерная и его стереохимически изомерная форма, где
Каждый из A1, A2 и A3 независимо представляет собой атом углерода или атом азота;
C1 представляет собой водород или C1-4алкил;
C2 представляет собой водород или C1-4алкил или гидроксил;
или C1 и C2, взятые вместе, образуют C3-6циклоалкил вместе в атомом углерода, к которому они присоединены;
Y представляет собой одинарную связь, -O-, C(=O), NRy, S(=O)2 или C1-4алкил;
Ry представляет собой водород или C1-4алкил;
каждый Rа независимо представляет собой водород, C1-6алкил, галогенC1-6алкил, галоген, C1-6алкокси-группу, карбоксил, C1-6алкоксикарбонил, C2-6алкенил, C2-6алкинил, циано-группу, цианоC1-6алкил, гидроксиC1-6алкил,
-C(=O)-NH2, -C(=O)-NH(C1-4алкил), -C(=O)-N(C1-4алкил)2, или 3-6-членный моноциклический насыщенный гетероциклил, содержащий не менее одного гетероатома, выбранного из N, O или S;
nа представляет целое число, равное 1 или 2;
каждый Rb независимо представляет собой водород, C1-6алкил, галогенC1-6алкил, галоген, C1-6алкокси-группу, C1-6алкоксикарбонил, C2-6алкенил, C2-6алкинил, циано-группу, цианоC1-6алкил, гидроксиC1-6алкил,
-C(=O)-NH2, -C(=O)-NH(C1-4алкил), -C(=O)-N(C1-4алкил)2, C3-6циклоалкил, фенил, 3-6-членный моноциклический гетероциклил, содержащий не менее одного гетероатома, выбранного из N, O или S, или C1-6алкил, замещенный C3-6циклоалкилом, или фенилом, или 3-6-членным моноциклическим гетероциклилом, содержащим не менее одного гетероатома, выбранного из N, O или S;
nb представляет целое число, равное 1 или 2;
D2 представляет собой морфолин-1-ил, где указанный морфолин-1-ил необязательно замещен 1-5 заместителями Rc;
каждый Rc независимо представляет собой оксо, C1-6алкил, гидроксиC1-6алкил, галогенC1-6алкил, галогенC1-6алкилокси, карбоксильную группу, HOOC-C1-6алкил-, C1-6алкил, замещенный -C(=O)-O-C1-6алкилом, C1-6алкил-O-C(=O)-, циано-группу, цианоC1-6алкил, C1-6алкил-C(=O)-, -SO2-C1-6алкил, C3-6циклоалкил, фенил, 3-6-членный моноциклический насыщенный гетероциклил, содержащий не менее одного гетероатома, выбранного из N, O или S, или 5-6-членный моноциклический ароматический гетероциклил, содержащий не менее одного гетероатома, выбранного из N, O или S;
B представляет собой 3-12-членный карбоциклил или 3-12-членный гетероциклил, содержащий не менее одного гетероатома, выбранного из N, O или S, причем каждый из указанных карбоциклила и гетеороциклила необязательно замещены 1-5 заместителями R;
каждый R независимо представляет собой C1-6алкил, циано-группу, галоген, C1-6алкокси-группу, галогенC1-6алкокси-группу, гидроксил, гидроксиC1-6алкил, галогенC1-6алкил, оксо-, -SO2-NH2, -SO2-NH(C1-4алкил), -SO2-N(C1-4алкил)2,
-NH-C(=O)-C2-6алкенил, -C(=O)-C1-6алкил, -C(=O)-C2-6алкенил, C1-6алкил-O-C(=O)-, C3-6циклоалкил, фенил, или 3-6-членный моноциклический гетероциклил, содержащий не менее одного гетероатома, выбранного из N, O или S;
или их фармацевтически приемлемые соли или их сольваты.
Настоящее изобретение относится к соединениям формулы (I-В), как определено выше, имеющим S-стереоцентр, как показано в следующей формуле (I-В-a):
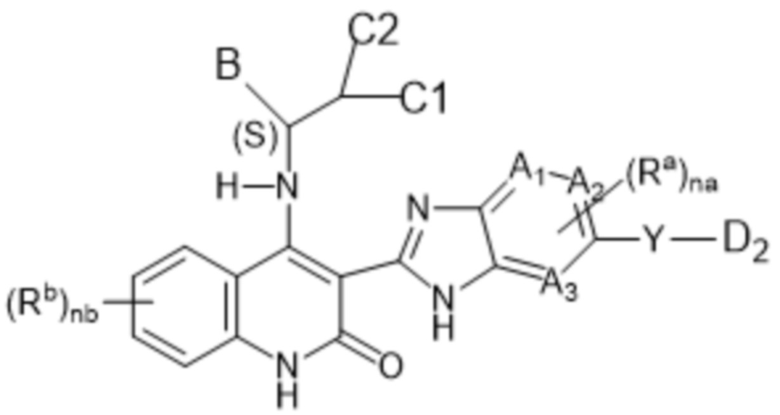 (I-B-a),
(I-B-a),
в том числе любая его таутомерная и его стереохимически изомерная форма, где
заместители являются такими, как определено выше для соединений формулы (I-В);
или их фармацевтически приемлемые соли или их сольваты.
В настоящем изобретении предложены соединения формулы (I-С):
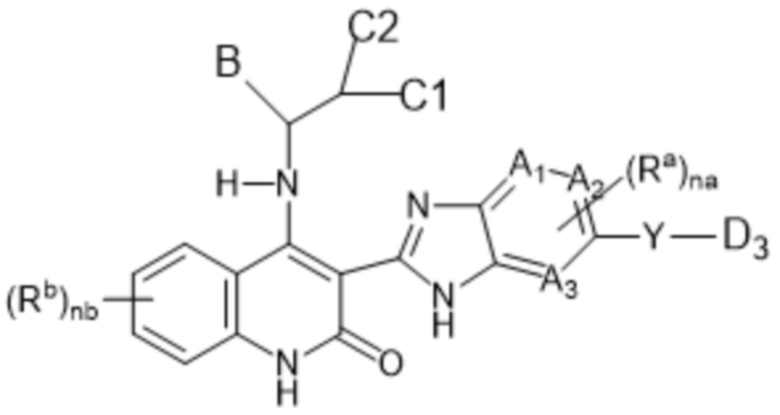 (I-C)
(I-C)
в том числе любая его таутомерная и его стереохимически изомерная форма, где
Каждый из A1, A2 и A3 независимо представляет собой атом углерода или атом азота;
C1 представляет собой водород или C1-4алкил;
C2 представляет собой водород или C1-4алкил или гидроксил;
или C1 и C2, взятые вместе, образуют C3-6циклоалкил вместе в атомом углерода, к которому они присоединены;
Y представляет собой одинарную связь, -O-, C(=O), NRy, S(=O)2 или C1-4алкил;
Ry представляет собой водород или C1-4алкил;
каждый Rа независимо представляет собой водород, C1-6алкил, галогенC1-6алкил, галоген, C1-6алкокси-группу, карбоксил, C1-6алкоксикарбонил, C2-6алкенил, C2-6алкинил, циано-группу, цианоC1-6алкил, гидроксиC1-6алкил,
-C(=O)-NH2, -C(=O)-NH(C1-4алкил), -C(=O)-N(C1-4алкил)2, или 3-6-членный моноциклический насыщенный гетероциклил, содержащий не менее одного гетероатома, выбранного из N, O или S;
nа представляет целое число, равное 1 или 2;
каждый Rb независимо представляет собой водород, C1-6алкил, галогенC1-6алкил, галоген, C1-6алкокси-группу, C1-6алкоксикарбонил, C2-6алкенил, C2-6алкинил, циано-группу, цианоC1-6алкил, гидроксиC1-6алкил,
-C(=O)-NH2, -C(=O)-NH(C1-4алкил), -C(=O)-N(C1-4алкил)2, C3-6циклоалкил, фенил, 3-6-членный моноциклический гетероциклил, содержащий не менее одного гетероатома, выбранного из N, O или S, или C1-6алкил, замещенный C3-6циклоалкилом, или фенилом, или 3-6-членным моноциклическим гетероциклилом, содержащим не менее одного гетероатома, выбранного из N, O или S;
nb представляет целое число, равное 1 или 2;
D3 представляет собой 4-, 5-, 6- или 7-членный моноциклический гетеороциклил, причем указанный гетероциклил необязательно замещен 1-5 заместителями Rc;
каждый Rc независимо представляет собой оксо, C1-6алкил, гидроксиC1-6алкил, галогенC1-6алкил, галогенC1-6алкилокси, карбоксильную группу, HOOC-C1-6алкил-, C1-6алкил, замещенный -C(=O)-O-C1-6алкилом, C1-6алкил-O-C(=O)-, циано-группу, цианоC1-6алкил, C1-6алкил-C(=O)-, -SO2-C1-6алкил, C3-6циклоалкил, фенил, 3-6-членный моноциклический насыщенный гетероциклил, содержащий не менее одного гетероатома, выбранного из N, O или S, или 5-6-членный моноциклический ароматический гетероциклил, содержащий не менее одного гетероатома, выбранного из N, O или S;
B представляет собой 3-12-членный карбоциклил или 3-12-членный гетероциклил, содержащий не менее одного гетероатома, выбранного из N, O или S, причем каждый из указанных карбоциклила и гетеороциклила необязательно замещены 1-5 заместителями R;
каждый R независимо представляет собой C1-6алкил, циано-группу, галоген, C1-6алкокси-группу, галогенC1-6алкокси-группу, гидроксил, гидроксиC1-6алкил, галогенC1-6алкил, оксо-, -SO2-NH2, -SO2-NH(C1-4алкил),
-SO2-N(C1-4алкил)2, -NH-C(=O)-C2-6алкенил, -C(=O)-C1-6алкил, -C(=O)-C2-6алкенил, C1-6алкил-O-C(=O)-, C3-6циклоалкил, фенил, или 3-6-членный моноциклический гетероциклил, содержащий не менее одного гетероатома, выбранного из N, O или S;
или их фармацевтически приемлемые соли или их сольваты.
Настоящее изобретение относится к соединениям формулы (I-C), как определено выше, имеющим S-стереоцентр, как показано в следующей формуле (I-C-a):
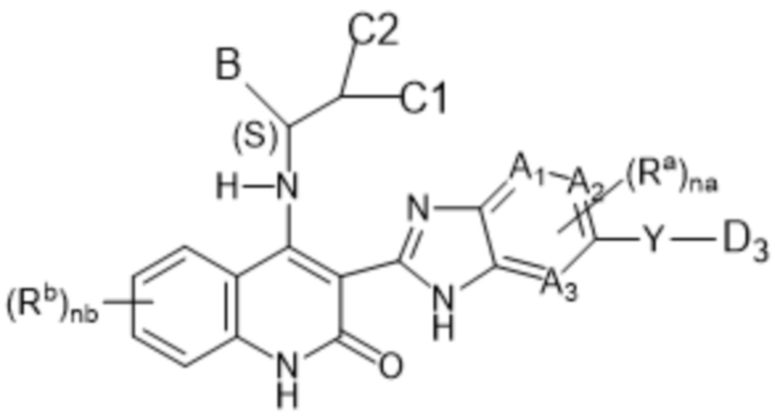 (I-C-a),
(I-C-a),
включая его любую таутомерную и стереохимически изомерную форму, где
заместители являются такими, как определено выше для соединений формулы (I-C);
или их фармацевтически приемлемым солям или их сольватам.
В данном изобретении предложены соединения формулы (I-D):
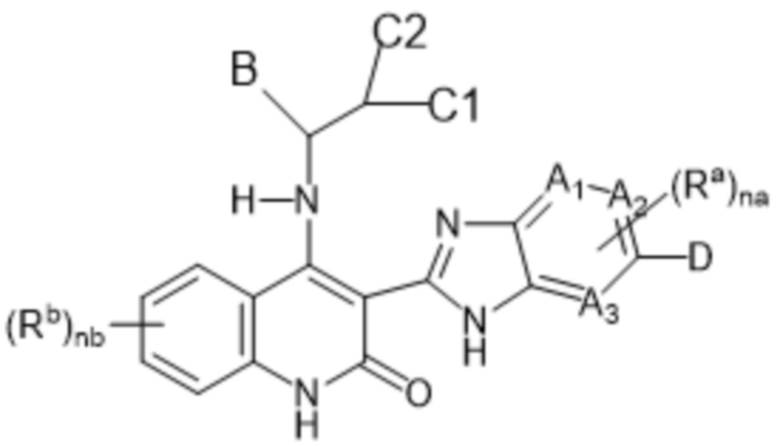 (I-D)
(I-D)
включая их любую таутомерную и их стереохимически изомерную форму, где
каждый из A1, A2 и A3 независимо представляет собой атом углерода или атом азота;
C1 представляет собой водород или C1-4алкил;
C2 представляет собой водород или C1-4алкил или гидроксил;
или C1 и C2, взятые вместе, образуют C3-6циклоалкил вместе в атомом углерода, к которому они присоединены;
каждый Rа независимо представляет собой водород, C1-6алкил, галогенC1-6алкил, галоген, C1-6алкокси-группу, карбоксил, C1-6алкоксикарбонил, C2-6алкенил, C2-6алкинил, циано-группу, цианоC1-6алкил, гидроксиC1-6алкил,
-C(=O)-NH2, -C(=O)-NH(C1-4алкил), -C(=O)-N(C1-4алкил)2, или 3-6-членный моноциклический насыщенный гетероциклил, содержащий не менее одного гетероатома, выбранного из N, O или S;
nа представляет целое число, равное 1 или 2;
каждый Rb независимо представляет собой водород, C1-6алкил, галогенC1-6алкил, галоген, C1-6алкокси-группу, C1-6алкоксикарбонил, C2-6алкенил, C2-6алкинил, циано-группу, цианоC1-6алкил, гидроксиC1-6алкил,
-C(=O)-NH2, -C(=O)-NH(C1-4алкил), -C(=O)-N(C1-4алкил)2, C3-6циклоалкил, фенил, 3-6-членный моноциклический гетероциклил, содержащий не менее одного гетероатома, выбранного из N, O или S, или C1-6алкил, замещенный C3-6циклоалкилом, или фенилом, или 3-6-членным моноциклическим гетероциклилом, содержащим не менее одного гетероатома, выбранного из N, O или S;
nb представляет целое число, равное 1 или 2;
D представляет собой 3-12-членный моноциклический гетероциклил, содержащий не менее одного гетероатома, выбранного из N, O или S, причем указанный гетероциклил необязательно замещен 1-5 заместителями Rc;
каждый Rc независимо представляет собой оксо, C1-6алкил, гидроксиC1-6алкил, галогенC1-6алкил, галогенC1-6алкилокси, карбоксильную группу, HOOC-C1-6алкил-, C1-6алкил, замещенный -C(=O)-O-C1-6алкилом, C1-6алкил-O-C(=O)-, циано-группу, цианоC1-6алкил, C1-6алкил-C(=O)-, -SO2-C1-6алкил, C3-6циклоалкил, фенил, 3-6-членный моноциклический насыщенный гетероциклил, содержащий не менее одного гетероатома, выбранного из N, O или S, или 5-6-членный моноциклический ароматический гетероциклил, содержащий не менее одного гетероатома, выбранного из N, O или S;
B представляет собой 3-12-членный карбоциклил или 3-12-членный гетероциклил, содержащий не менее одного гетероатома, выбранного из N, O или S, причем каждый из указанных карбоциклила и гетеороциклила необязательно замещены 1-5 заместителями R;
каждый R независимо представляет собой C1-6алкил, циано-группу, галоген, C1-6алкокси-группу, галогенC1-6алкокси-группу, гидроксил, гидроксиC1-6алкил, галогенC1-6алкил, оксо-, -SO2-NH2, -SO2-NH(C1-4алкил),
-SO2-N(C1-4алкил)2, -NH-C(=O)-C2-6алкенил, -C(=O)-C1-6алкил, -C(=O)-C2-6алкенил, C1-6алкил-O-C(=O)-, C3-6циклоалкил, фенил, или 3-6-членный моноциклический гетероциклил, содержащий не менее одного гетероатома, выбранного из N, O или S;
или их фармацевтически приемлемым солям или их сольватам.
Настоящее изобретение относится к соединениям формулы (I-D), как определено выше, имеющим S-стереоцентр, как показано в следующей формуле (I-D-a):
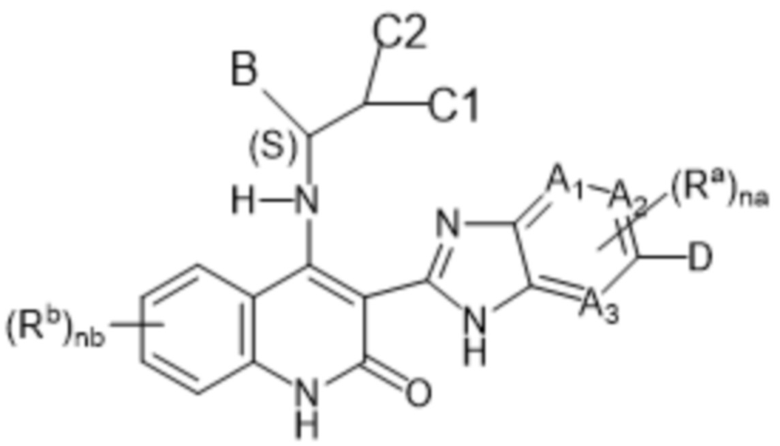 (I-D-a),
(I-D-a),
включая их любую таутомерную и их стереохимически изомерную форму, где
заместители являются такими, как определено выше для соединений формулы (I-D);
или их фармацевтически приемлемым солям или их сольватам.
В данном изобретении предложены соединения формул (I-a), (I-A), (I-A-a), (I-B), (I-B-a), (I-C), (I-C-a), (I-D) или (I-D-a), как определено выше, но где каждый Rc независимо представляет собой оксо-, галоген, C1-6алкил, C1-6алкокси-группу, гидроксиC1-6алкил, галогенC1-6алкил, галогенC1-6алкокси-группу, карбоксильную группу, HOOC-C1-6алкил-, C1-6алкил, замещенный -C(=O)-O-C1-6алкилом, C1-6алкил-O-C(=O)-, циано-группу, цианоC1-6алкил, C1-6алкил-C(=O)-, -SO2-C1-6алкил, C3-6циклоалкил, фенил, 3-6-членный моноциклический насыщенный гетероциклил, содержащий не менее одного гетероатома, выбранного из N, O или S, или 5-6-членный моноциклический гетероциклил, содержащий не менее одного гетероатома, выбранного из N, O или S.
В одном варианте осуществления в соединениях формул (I), (I-a), (I-A), (I-A-a), (I-B), (I-B-a), (I-C), (I-C-a), (I-D) или (I-D-a), A1, A2 и A3 представляют собой атом углерода.
Так, в настоящем изобретении предложены соединения формул (I), (I-a), (I-A), (I-A-a), (I-B), (I-B-a), (I-C), (I-C-a), (I-D) или (I-D-a), где  представляет собой
представляет собой  .
.
В одном варианте осуществления в соединениях формул (I), (I-a), (I-A), (I-A-a), (I-B), (I-B-a), (I-C), (I-C-a), (I-D) или (I-D-a) один из A1, A2 и A3 представляет собой атом азота, а оставшиеся заместители A являются атомами углерода.
Так, в настоящем изобретении предложены соединения формул (I), (I-a), (I-A), (I-A-a), (I-B), (I-B-a), (I-C), (I-C-a), (I-D) или (I-D-a), где  представляет собой
представляет собой 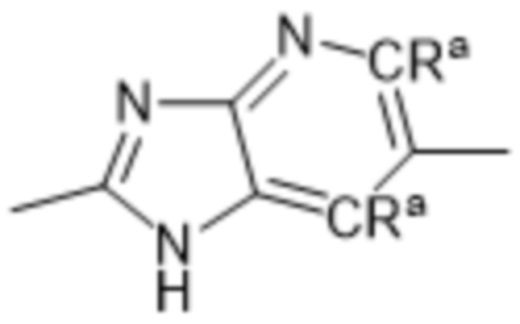 , или
, или 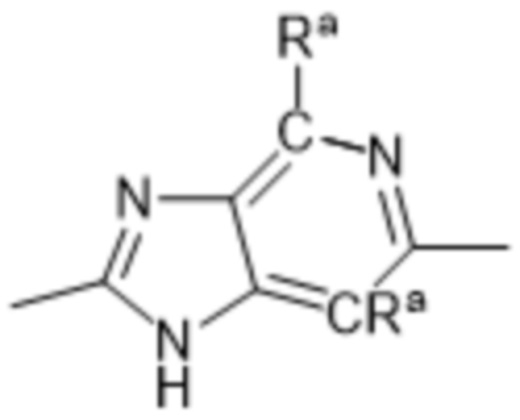 , или
, или 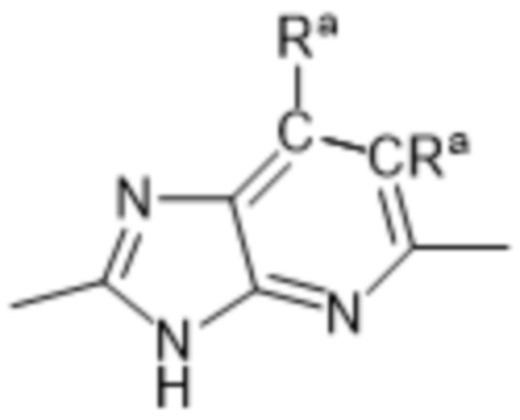 .
.
В одном варианте осуществления в соединениях формул (I), (I-a), (I-A), (I-A-a), (I-B), (I-B-a), (I-C), (I-C-a), (I-D) или (I-D-a) два из заместителей A1, A2 и A3 представляют собой атом азота, а оставшийся A является атомом углерода.
Так, в настоящем изобретении предложены соединения формул (I), (I-a), (I-A), (I-A-a), (I-B), (I-B-a), (I-C), (I-C-a), (I-D) или (I-D-a), где  представляет собой
представляет собой 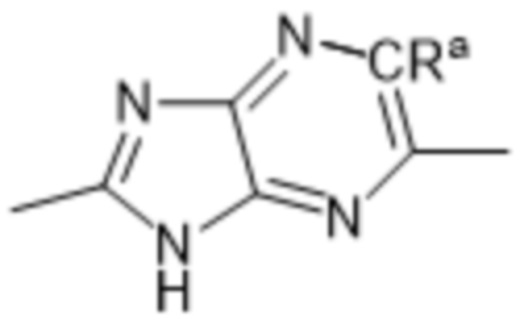 , или
, или 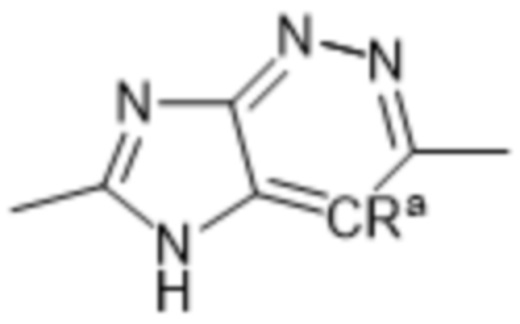 , или
, или 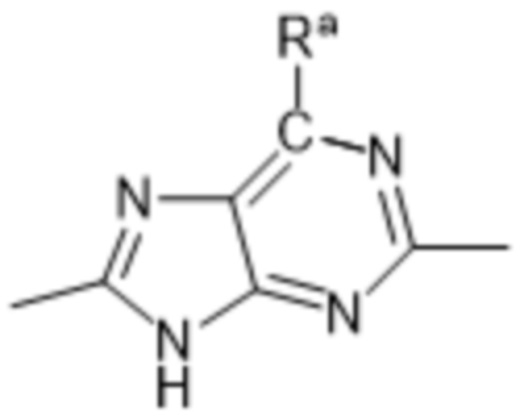 .
.
В одном варианте осуществления в соединениях формул (I), (I-a), (I-A), (I-A-a), (I-B), (I-B-a), (I-C) или (I-C-a) Y представляет собой одинарную связь.
В одном варианте осуществления в соединениях формул (I), (I-a), (I-A), (I-A-a), (I-B), (I-B-a), (I-C) или (I-C-a) Y представляет собой -O-, C(=O), NRy, S(=O)2 или C1-4алкил.
В одном варианте осуществления в соединениях формул (I), (I-a), (I-A), (I-A-a), (I-B), (I-B-a), (I-C) или (I-C-a) Y представляет собой одинарную связь, C(=O) или NRy, например, NCH3.
В одном варианте осуществления в соединениях формул (I), (I-a), (I-A), (I-A-a), (I-B), (I-B-a), (I-C), (I-C-a), (I-D) или (I-D-a) C1 представляет собой водород.
В одном варианте осуществления в соединениях формул (I), (I-a), (I-A), (I-A-a), (I-B), (I-B-a), (I-C), (I-C-a), (I-D) или (I-D-a) C2 представляет собой водород.
В одном варианте осуществления в соединениях формул (I), (I-a), (I-A), (I-A-a), (I-B), (I-B-a), (I-C), (I-C-a), (I-D) или (I-D-a) C1 представляет собой водород, а C2 представляет собой C1-4алкил.
В одном варианте осуществления в соединениях формул (I), (I-a), (I-A), (I-A-a), (I-B), (I-B-a), (I-C), (I-C-a), (I-D) или (I-D-a) C1 представляет собой водород, а C2 представляет собой гидроксил.
В одном варианте осуществления в соединениях формул (I), (I-a), (I-A), (I-A-a), (I-B), (I-B-a), (I-C), (I-C-a), (I-D) или (I-D-a) C1 и C2 вместе образуют C3-6циклоалкил вместе с атомом углерода, к которому они присоединены.
В одном варианте осуществления в соединениях формул (I), (I-a), (I-A), (I-A-a), (I-B), (I-B-a), (I-C), (I-C-a), (I-D) или (I-D-a)
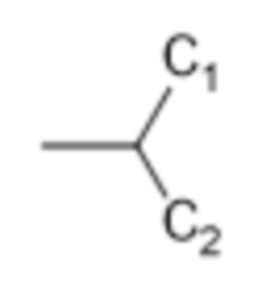 представляет собой -CH3.
представляет собой -CH3.
В одном варианте осуществления в соединениях формул (I), (I-a), (I-A), (I-A-a), (I-B), (I-B-a), (I-C), (I-C-a), (I-D) или (I-D-a)
 представляет собой -CH2(C1-4алкил), в том числе -CH2CH3 или -CH2CH2CH3.
представляет собой -CH2(C1-4алкил), в том числе -CH2CH3 или -CH2CH2CH3.
В одном варианте осуществления в соединениях формул (I), (I-a), (I-A), (I-A-a), (I-B), (I-B-a), (I-C), (I-C-a), (I-D) или (I-D-a)
 представляет собой -CH(C1-4алкил)2, в том числе -CH(CH3)2.
представляет собой -CH(C1-4алкил)2, в том числе -CH(CH3)2.
В одном варианте осуществления в соединениях формул (I), (I-a), (I-A), (I-A-a), (I-B), (I-B-a), (I-C), (I-C-a), (I-D) или (I-D-a)
 представляет собой -циклопропил.
представляет собой -циклопропил.
В одном варианте осуществления в соединениях формул (I), (I-a), (I-A), (I-A-a), (I-B), (I-B-a), (I-C) или (I-C-a) Ry представляет собой водород.
В одном варианте осуществления в соединениях формул (I), (I-a), (I-A), (I-A-a), (I-B), (I-B-a), (I-C) или (I-C-a) Ry представляет собой C1-4алкил, в том числе метил.
В одном варианте осуществления в соединениях формул (I), (I-a), (I-A), (I-A-a), (I-B), (I-B-a), (I-C), (I-C-a), (I-D) или (I-D-a) Ra представляет собой водород.
В одном варианте осуществления в соединениях формул (I), (I-a), (I-A), (I-A-a), (I-B), (I-B-a), (I-C), (I-C-a), (I-D) или (I-D-a) один Ra представляет собой водород, а другой Ra представляет собой C1-6алкил, галогенC1-6алкил, галоген, C1-6алкокси-группу, карбоксил, C1-6алкоксикарбонил, C2-6алкенил, C2-6алкинил, циано-группу, цианоC1-6алкил, гидроксиC1-6алкил, -C(=O)-NH2, -C(=O)-NH(C1-4алкил), -C(=O)-N(C1-4алкил)2, 3-6-членный моноциклический насыщенный гетероциклил, содержащий не менее одного гетероатома, выбранного из N, O или S.
В одном варианте осуществления в соединениях формул (I), (I-a), (I-A), (I-A-a), (I-B), (I-B-a), (I-C), (I-C-a), (I-D) или (I-D-a) nа представляет целое число, равное 1.
В одном варианте осуществления в соединениях формул (I), (I-a), (I-A), (I-A-a), (I-B), (I-B-a), (I-C), (I-C-a), (I-D) или (I-D-a), na представляет целое число, равное 1, и Ra представляет собой водород; C1-6алкил, в честности C1-4алкил, например, метил; галогенC1-6алкил, например трифторметил; или галоген, например, фтор.
В одном варианте осуществления в соединениях формул (I), (I-a), (I-A), (I-A-a), (I-B), (I-B-a), (I-C), (I-C-a), (I-D) или (I-D-a) Rb представляет собой водород.
В одном варианте осуществления в соединениях формул (I), (I-a), (I-A), (I-A-a), (I-B), (I-B-a), (I-C), (I-C-a), (I-D) или (I-D-a) na представляет целое число, равное 1, и Rb представляет собой C1-6алкил, галогенC1-6алкил, галоген, C1-6алкокси-группу, C1-6алкоксикарбонил, C2-6алкенил, C2-6алкинил, циано-группу, цианоC1-6алкил, гидроксиC1-6алкил, -C(=O)-NH2, -C(=O)-NH(C1-4алкил), -C(=O)-N(C1-4алкил)2, C3-6циклоалкил или фенил, или 3-6-членный моноциклический гетероциклил, содержащий не менее одного гетероатома, выбранного из N, O или S, или C1-6алкил, замещенный C3-6циклоалкилом, или фенилом, или 3-6-членным моноциклическим гетероциклилом, содержащим не менее одного гетероатома, выбранного из N, O или S.
В одном варианте осуществления в соединениях формул (I), (I-a), (I-A), (I-A-a), (I-B), (I-B-a), (I-C), (I-C-a), (I-D) или (I-D-a) nb представляет целое число, равное 1, и Rb представляет собой C1-6алкил, галогенC1-6алкил, галоген, C1-6алкокси-группу, C1-6алкоксикарбонил, C2-6алкенил, C2-6алкинил, циано-группу, цианоC1-6алкил, гидроксиC1-6алкил, -C(=O)-NH2, -C(=O)-NH(C1-4алкил) или -C(=O)-N(C1-4алкил)2.
В одном варианте осуществления в соединениях формул (I), (I-a), (I-A), (I-A-a), (I-B), (I-B-a), (I-C), (I-C-a), (I-D) или (I-D-a) nb представляет целое число, равное 1 и Rb представляет собой водород или галоген, например, хлор или фтор.
В одном варианте осуществления в соединениях формул (I), (I-a), (I-A), (I-A-a), (I-B), (I-B-a), (I-C), (I-C-a), (I-D) или (I-D-a) nb представляет целое число, равное 2.
В одном варианте осуществления в соединениях формул (I), (I-a), (I-A), (I-A-a), (I-B), (I-B-a), (I-C), (I-C-a), (I-D) или (I-D-a) каждый Rb независимо представляет собой водород, C1-6алкил, галогенC1-6алкил, галоген, C1-6алккокси-группу, C2-6алкенил, C2-6алкинил, циано-группу, цианоC1-6алкил, гидроксиC1-6алкил, -C(=O)-NH2,
-C(=O)-NH(С1-4алкил), -C(=O)-N(C1-4алкил)2, C3-6циклоалкил, фенил, 3-6-членный моноциклический гетероциклил, содержащий не менее одного гетероатома, выбранного из N, O или S, или C1-6алкил, замещенный C3-6циклоалкилом, или фенилом, или 3-6-членным моноциклическим гетероциклилом, содержащим не менее одного гетероатома, выбранного из N, O или S;
В одном варианте осуществления в соединениях формул (I), (I-a), (I-A), (I-A-a), (I-B), (I-B-a), (I-C), (I-C-a), (I-D) или (I-D-a) каждый Rb независимо представляет собой водород, C1-6алкил, галогенC1-6алкил, C1-6алкокси-группу, карбоксил, C1-6алкоксикарбонил, C2-6алкенил, C2-6алкинил, цианоC1-6алкил, гидроксиC1-6алкил, -C(=O)-NH2, -C(=O)-NH(C1-4алкил), -C(=O)-N(C1-4алкил)2, C3-6циклоалкил или фенил, или 3-6-членный моноциклический гетероциклил, содержащий не менее одного гетероатома, выбранного из N, O или S, или C1-6алкил, замещенный C3-6циклоалкилом, или фенилом, или 3-6-членным моноциклическим гетероциклилом, содержащим не менее одного гетероатома, выбранного из N, O или S.
В одном варианте осуществления в соединениях формул (I), (I-a), (I-A), (I-A-a), (I-B), (I-B-a), (I-C), (I-C-a), (I-D) или (I-D-a) D, D1, D2 или D3 является незамещенным.
В одном варианте осуществления в соединениях формул (I), (I-a), (I-A), (I-A-a), (I-B), (I-B-a), (I-C), (I-C-a), (I-D) или (I-D-a) D, D1, D2 или D3 замещен 1, 2, 3 или 4 заместителями Rc.
В одном варианте осуществления в соединениях формул (I), (I-a), (I-A), (I-A-a), (I-B), (I-B-a), (I-C), (I-C-a), (I-D) или (I-D-a) D, D1, D2 или D3 замещен 2 заместителями Rc.
В одном варианте осуществления в соединениях формул (I), (I-a), (I-A), (I-A-a), (I-B), (I-B-a), (I-C), (I-C-a), (I-D) или (I-D-a) D, D1, D2 или D3 замещен 1 или 2 заместителями Rc.
В одном варианте осуществления в соединениях формул (I), (I-a), (I-A), (I-A-a), (I-B), (I-B-a), (I-C), (I-C-a), (I-D) или (I-D-a), D, D1, D2 или D3 замещен 1 или 2 заместителями Rc, и каждый Rc независимо выбран из оксо-; C1-6алкила, в частности, C1-4алкила, например, метила; галогенC1-6алкила; галогенC1-6алкокси-группы, например, трифторметокси-группы; HOOC-C1-6алкила-, например, -CH2-COOH; карбоксильной группы; C1-6алкила, замещенного -C(=O)-O-C1-6алкилом, например, -CH2-C(=O)-O-CH2-CH3; C1-6алкил-O-C(=O)-, например, -C(=O)-O-CH3.
В одном варианте осуществления в соединениях формул (I), (I-a), (I-A), (I-A-a), (I-B), (I-B-a), (I-C), (I-C-a), (I-D) или (I-D-a), D, D1, D2 или D3 замещен 4 заместителями Rc, и каждый Rc независимо представляет собой C1-6алкил, в частности, C1-4алкил, например, метил.
В одном варианте осуществления в соединениях формул (I), (I-a), (I-C), (I-C-a), (I-D) или (I-D-a), D или D3 представляет собой мостиковый гетероциклил, например, 8-окса-3-азабицикло[3.2.1]октан.
В одном варианте осуществления в соединениях формул (I), (I-a), (I-C), (I-C-a), (I-D) или (I-D-a), D или D3 представляет собой мостиковый гетероциклил, причем мостик представляет собой -CH2-, -CH2-CH2- или -CH2-CH2-CH2-, в частности, -CH2-CH2-, как например, в 8-окса-3-азабицикло[3.2.1]октане.
В одном варианте осуществления в соединениях формул (I-C) или (I-C-a) D3 представляет собой 4-, 5-, 6- или 7-членный моноциклический насыщенный гетероциклил, содержащий не менее одного гетероатома, выбранного из N, O или S, причем указанный гетероциклил необязательно замещен 1-5 заместителями Rc, 1-4 заместителями Rc, 1-3 заместителями Rc, 1-2 заместителями Rc или 1 заместителем Rc.
В одном варианте осуществления в соединениях формул (I-C) или (I-C-a) D3 представляет собой 5- или 6-членный моноциклический гетероциклил, содержащий не менее одного гетероатома, выбранного из N, O или S, причем указанный гетероциклил необязательно замещен 1-5 заместителями Rc, в частности, 6-членный насыщенный моноциклический гетероциклил, содержащий не менее одного гетероатома, выбранного из N, O или S, причем указанный гетероциклил необязательно замещен 1-5 заместителями Rc, 1-4 заместителями Rc, 1-3 заместителями Rc, 1-2 заместителями Rc или 1 заместителем Rc.
В одном варианте осуществления в соединениях формул (I-C) или (I-C-a) D3 представляет собой 5- или 6-членный ароматический моноциклический гетероциклил, содержащий не менее одного гетероатома, выбранного из N, O или S, причем указанный гетероциклил необязательно замещен 1-5 заместителями Rc, в частности, 5-членный ароматический моноциклический гетероциклил, содержащий не менее одного гетероатома, выбранного из N, O или S, причем указанный гетероциклил необязательно замещен 1-5 заместителями Rc, 1-4 заместителями Rc, 1-3 заместителями Rc, 1-2 заместителями Rc или 1 заместителем Rc, например, необязательно замещенный пиразол.
В одном варианте осуществления в соединениях формул (I), (I-a), (I-A), (I-A-a), (I-B), (I-B-a), (I-C), (I-C-a), (I-D) или (I-D-a) каждый Rc независимо представляет собой оксо-, C1-6алкил, гидроксиC1-6алкил, галогенC1-6алкил, галогенC1-6алкилокси-группу, карбоксил, HOOC-C1-6алкил-, циано-группу, цианоC1-6алкил, C1-6алкил-C(=O)-, -SO2-C1-6алкил, C3-6циклоалкил, фенил, 3-6-членный моноциклический насыщенный гетероциклил, содержащий не менее одного гетероатома, выбранного из N, O или S, или 5- или 6-членный моноциклический ароматический гетероциклил, содержащий не менее одного гетероатома, выбранного из N, О или S.
В одном варианте осуществления в соединениях формул (I), (I-a), (I-A), (I-A-a), (I-B), (I-B-a), (I-C), (I-C-a), (I-D) или (I-D-a) B представляет собой 5- или 6-членный карбоциклил или гетероциклил, содержащий не менее одного гетероатома, выбранного из N, O или S, где каждый из указанного карбоциклила или гетероциклила необязательно замещен 1-5, в частности 1-4, или 1-3, или 1-2 заместителями R, или 1 заместителем R. В одном варианте осуществления B является незамещенным.
В одном варианте осуществления в соединениях формул (I), (I-a), (I-A), (I-A-a), (I-B), (I-B-a), (I-C), (I-C-a), (I-D) или (I-D-a) B представляет собой фенил или 5- или 6-членный ароматический гетероциклил, содержащий не менее одного гетероатома, выбранного из N, O или S, где каждый из указанного фенила или гетероциклила необязательно замещен 1-5, в частности 1-4, или 1-3, или 1-2 заместителями R, или 1 заместителем R. В одном варианте осуществления B является незамещенным.
В одном варианте осуществления в соединениях формул (I), (I-a), (I-A), (I-A-a), (I-B), (I-B-a), (I-C), (I-C-a), (I-D) или (I-D-a) B представляет собой 3-6-членный моноциклический карбоциклил или гетероциклил, содержащий не менее одного гетероатома, выбранного из N, O или S, где каждый из указанного карбоциклила или гетероциклила необязательно замещен 1-5, в частности 1-4, или 1-3, или 1-2 заместителями R, или 1 заместителем R. В одном варианте осуществления B является незамещенным.
В одном варианте осуществления в соединениях формул (I), (I-a), (I-A), (I-A-a), (I-B), (I-B-a), (I-C), (I-C-a), (I-D) или (I-D-a) B представляет собой 3-6-членный моноциклический неароматический карбоциклил или гетероциклил, содержащий не менее одного гетероатома, выбранного из N, O или S, где каждый из указанного карбоциклила или гетероциклила необязательно замещен 1-5, в частности 1-4, или 1-3, или 1-2 заместителями R, или 1 заместителем R. В одном варианте осуществления B является незамещенным.
В одном варианте осуществления в соединениях формул (I), (I-a), (I-A), (I-A-a), (I-B), (I-B-a), (I-C), (I-C-a), (I-D) или (I-D-a) B представляет собой 6-членный ароматический моноциклический гетероциклил, содержащий не менее одного гетероатома, выбранного из N, O или S, где указанный гетероциклил необязательно замещен 1-4, в частности 1-3, или 1-2 заместителями R, или 1 заместителем R. Например, B представляет собой необязательно замещенный пиридил, пиримидинил или пиразинил. В одном варианте осуществления B является незамещенным. В одном варианте осуществления B замещен 1 заместителем R. В одном варианте осуществления заместитель R выбран из C1-6алкила, C1-6алкокси-группы и C3-6циклоалкила.
В одном варианте осуществления в соединениях формул (I), (I-a), (I-A), (I-A-a), (I-B), (I-B-a), (I-C), (I-C-a), (I-D) или (I-D-a) B представляет собой 5-членный ароматический моноциклический гетероциклил, содержащий не менее одного гетероатома, выбранного из N, O или S, где указанный гетероциклил необязательно замещен 1-3, в частности 1-2 заместителями R, или 1 заместителем R. Например, B представляет собой необязательно замещенный пиразолил, оксазолил или тиазолил. В одном варианте осуществления B является незамещенным. В одном варианте осуществления B замещен 1 заместителем R. В одном варианте осуществления заместитель R выбран из C1-6алкила, C1-6алкокси-группы и C3-6циклоалкила.
В одном варианте осуществления в соединениях формул (I), (I-a), (I-A), (I-A-a), (I-B), (I-B-a), (I-C), (I-C-a), (I-D) или (I-D-a) B представляет собой 9-12-членный бициклический карбоциклил или гетероциклил, содержащий не менее одного гетероатома, выбранного из N, O или S, где каждый из указанного карбоциклила или гетероциклила необязательно замещен 1-5, в частности 1-4, или 1-3, или 1-2 заместителями R, или 1 заместителем R. В одном варианте осуществления B является незамещенным.
В одном варианте осуществления в соединениях формул (I), (I-a), (I-A), (I-A-a), (I-B), (I-B-a), (I-C), (I-C-a), (I-D) или (I-D-a) В представляет собой пиримидинил, необязательно замещенный 1-3, в частности, 1 или 2 заместителями R, или 1 заместителем R; в частности В представляет собой незамещенный пиримидинил.
В одном варианте осуществления в соединениях формул (I), (I-a), (I-A), (I-A-a), (I-B), (I-B-a), (I-C), (I-C-a), (I-D) или (I-D-a) каждый R независимо представляет собой C1-6алкил, циано-группу, галоген, C1-6алкокси-группу, галогенC1-6алкокси-группу, гидроксил, гидроксиC1-6алкил, галогенC1-6алкил, оксо-, -SO2-NH2, -SO2-NH(C1-4алкил),
-SO2-N(C1-4алкил)2, -NH-C(=O)-C2-6алкенил, -C(=O)-C1-6алкил, -C(=O)-C2-6алкенил или C1-6алкил-O-C(=O)-.
В одном варианте осуществления в соединениях формул (I), (I-a), (I-A), (I-A-a), (I-B), (I-B-a), (I-C), (I-C-a), (I-D) или (I-D-a) каждый R независимо представляет собой C1-6алкил, циано-группу, галоген, C1-6алкокси-группу, галогенC1-6алкокси-группу, гидроксил, гидроксиC1-6алкил, галогенC1-6алкил, оксо-, -SO2-NH2,
-SO2-NН(C1-4алкил)2, -SO2-N(C1-4алкил)2, -NH-C(=O)-C2-6алкенил, -C(=O)-C1-6алкил, -C(=O)-C2-6алкенил, C3-6циклоалкил, фенил, или 3-6-членный моноциклический гетероциклил, содержащий не менее одного гетероатома, выбранного из N, O или S.
В одном варианте осуществления в соединениях формул (I), (I-a), (I-A), (I-A-a), (I-B), (I-B-a), (I-C), (I-C-a), (I-D) или (I-D-a) В является незамещенным.
В одном варианте осуществления в соединениях формул (I), (I-a), (I-A), (I-A-a), (I-B), (I-B-a), (I-C), (I-C-a), (I-D) или (I-D-a) В замещен 1-5 заместителями R, в частности, 1-4 заместителями R, 1-3 заместителями R, 1-2 заместителями R, или 1 заместителем R.
В одном варианте осуществления в соединениях формул (I), (I-a), (I-A), (I-A-a), (I-B), (I-B-a), (I-C), (I-C-a), (I-D) или (I-D-a) применяются одно или несколько следующий условий, в частности, когда это возможно, применяются все следующие условия:
каждый из A1, A2 и A3 является углеродом;
С1 представляет собой водород или C1-4алкил, в частности, водород, метил или этил;
С2 представляет собой водород или C1-4алкил, в частности, водород или метил;
или C1 и C2, взятые вместе, образуют C3-6циклоалкил вместе в атомом углерода, к которому они присоединены, в частности, циклопропил;
Y представляет собой одинарную связь, C(=O) или NRy;
Ry представляет собой водород или C1-4алкил, в частности, водород или метил;
Каждый Ra независимо представляет собой водород, C1-6алкил, например, метил, галогенC1-6алкил, например трифторметил, или галоген, например, фтор;
na представляет целое число, равное 1;
каждый Rb независимо представляет собой водород или галоген, например, фтор или хлор;
nb представляет целое число, равное 1;
D представляет собой 5- или 6-членный моноциклический насыщенный или ароматический гетероциклил, содержащий не менее одного гетероатома, выбранного из N, O или S, причем указанный гетероциклил необязательно замещен 1 или 2 заместителями Rc; в частности, D представляет собой пиперазинил, морфолинил, пиперидинил, тетрагидрофуран или пиразолил, причем указанные кольцевые системы необязательно замещены 1 или 2 заместителями Rc;
D представляет собой мостиковый гетероциклил, содержащий не менее одного гетероатома, выбранного из N, O или S, где указанный гетероциклил необязательно замещен 1-2 заместителями Rc, в частности, указанный мостиковый гетероциклил является незамещенным;
каждый Rc независимо представляет собой оксо-, C1-6алкил, например, метил или изопропил, галогенC1-6алкил, галогенC1-6алкокси-группу, карбоксил, HOOC-C1-6алкил-, C1-6алкил, замещенный группой -C(=O)-O-C1-6алкил, или C1-6алкил-O-C(=O)-;
В представляет собой 5- или 6-членный ароматический моноциклический гетероциклил, содержащий не менее одного гетероатома, выбранного из N, O или S, причем указанный гетероциклил необязательно замещен 1 заместителем Rc; в частности, В представляет собой пиридил, пиримидинил, пиразинил, пиразолил, тиазолил, оксазолил;
каждый R независимо представляет собой C1-6алкил, например, метил или изопропил, C1-6алккокси-группу, например, метокси-группу, или C3-6циклоалкил, например, циклопропил.
В одном варианте осуществления соединение представляет собой соединение формулы (I-D) или (I-D-a), где применяются одно или несколько следующий условий, в частности, когда это возможно, применяются все следующие условия:
каждый из A1, A2 и A3 является углеродом;
C1 и C2 представляют собой водород; или C1 и C2 представляют собой C1-4алкил, в частности, метил;
Ra представляет собой водород;
na представляет целое число, равное 1;
Rb представляет собой водород;
nb представляет целое число, равное 1;
D представляет собой 6-членный моноциклический насыщенный гетероциклил, содержащий не менее одного гетероатома, выбранного из N, O или S, где указанный гетероциклил необязательно замещен 1 или 2 заместителями Rc; в частности, D представляет собой пиперазинил, морфолинил или пиперидинил, причем указанные кольцевые системы необязательно замещены 1 или 2 заместителями Rc; более конкретно, где D представляет собой незамещенный морфолинил; морфолинил, замещенный 1 C1-6алкилом, например, метилом; или морфолинил, замещенный 2 C1-6алкилами, например, дважды замещен метилом.
B представляет собой 6-членный ароматический моноциклический гетероциклил, содержащий не менее одного гетероатома, выбранного из N, O или S, где указанный гетероциклил необязательно замещен 1 заместителем R; в частности, B представляет собой пиридил, пиримидинил, пиразинил, необязательно замещенный 1 заместителем R, выбранным из C1-6алкила, например, метила или изопропила, C1-6алкокси-группы, например, метокси-группы, или C3-6циклоалкил, например, циклопропил; более конкретно, B представляет собой незамещенный пиримидинил.
В одном варианте осуществления соединение данного изобретения выбрано из группы
 ;
; 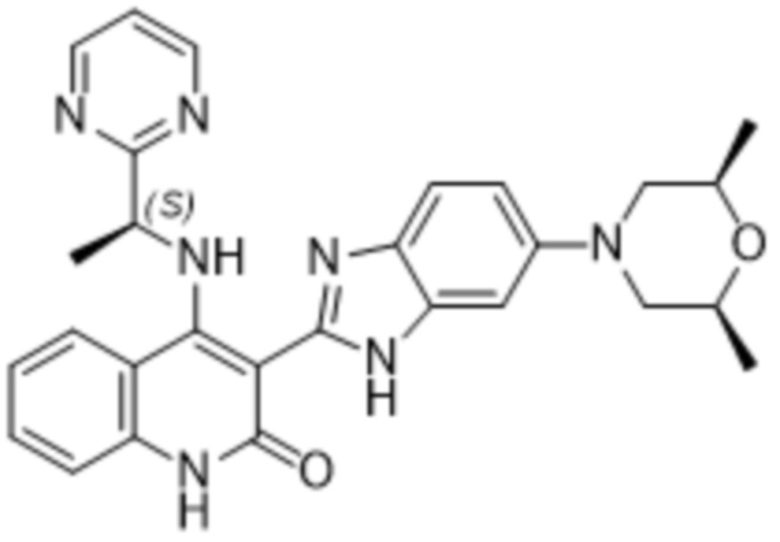 ;
;
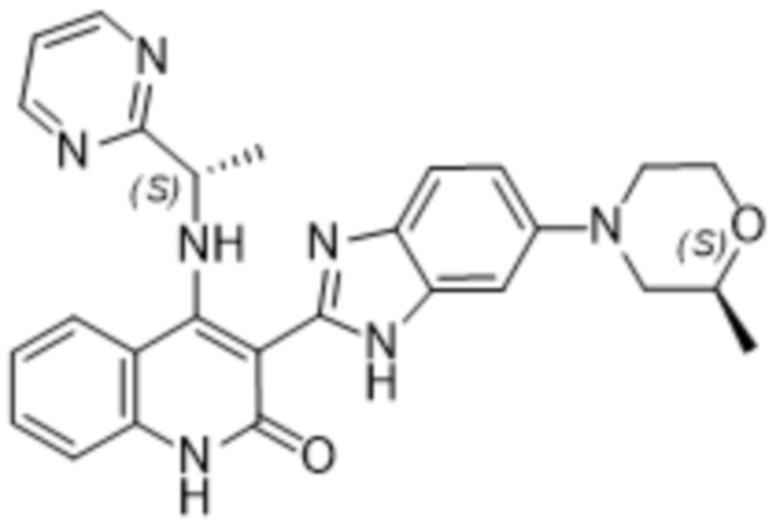 ;
;  ;
;
или их фармацевтически приемлемых солей или их сольватов.
Во избежание неясности следует учитывать, что каждое общее и конкретное предпочтение, вариант осуществления и пример для одного заместителя могут быть объединены, если это возможно с химической точки зрения, с каждым общим и конкретным предпочтением, вариантом и примером для одного или нескольких, предпочтительно всех других заместителей, определенных в настоящем документе, и что все такие варианты осуществления охватываются настоящей заявкой.
Способы получения соединений формулы (I)
В данном разделе, как и во всех других разделах настоящей заявки, если контекст не указывает иное, ссылки на формулу (I) также предусматривают все другие подгруппы и их примеры (например, (I-a), (I-A), (I-A-a), (I-B), (I-B-a), (I-C), (I-C-a), (I-D) или (I-D-a)), определенные в настоящем документе.
В целом, соединения формулы (I) могут быть получены согласно следующей реакционной Схеме 1. В Схеме 1, W1 представляет собой подходящую уходящую группу, такую как, например, галоген, например, хлор. Все другие переменные на схеме 1 определены в соответствии с настоящим изобретением.
Схема 1
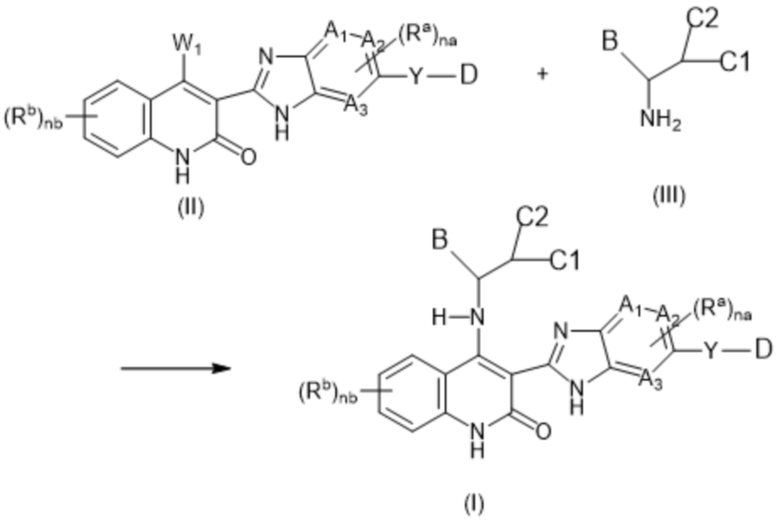
Реакционную Схему 1 выполняют в присутствии подходящего основания, такого как, например, N, N-диизопропилэтиламин, и в подходящем растворителе, таком как, например, диметилформамид.
По Схеме 1, промежуточное соединение формулы (III) может быть определенным стереоизомером, например, S-энантиомером, что дает в результате определенный стереоизомер, например, S-энантиомер, формулы (I), так, как это показано на Схеме 1a получения соединений формулы (I-a).
Схема 1a
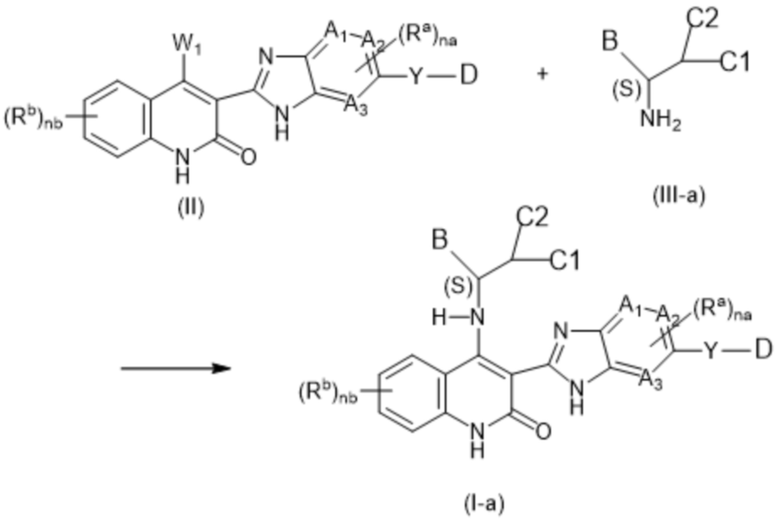
Соединения формулы (I) можно также получить в соответствии со следующей реакционной Схемой 2. В Схеме 2, W2 представляет собой подходящую уходящую группу, такую как, например, галоген, например, бром. Все другие переменные на схеме 2 определены в соответствии с настоящим изобретением.
Схема 2
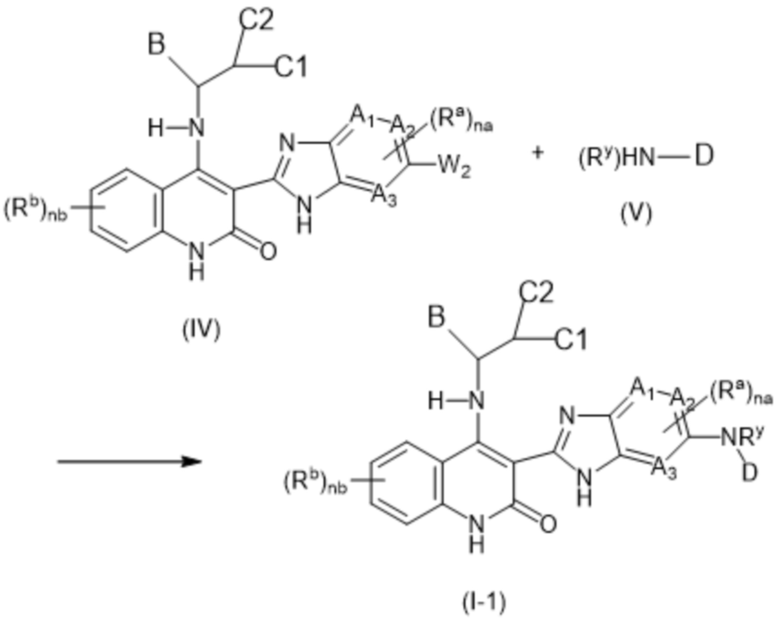
Реакционную Схему 1 выполняют в присутствии подходящего катализатора, такого как, например, палладиевый катализатор, например, Pd2(dba)3, подходящего лиганда, такого как, например, Davephos (2-дициклогексилфосфино-2'-(N, N-диметиламино)бифенил), подходящего основания, такого как, например, LiHMDS (бис(триметилсилил)амид лития), и в подходящем растворителе, таком как, например, тетрагидрофуран.
По Схеме 2, промежуточное соединение формулы (IV) может быть определенным стереоизомером, например, S-энантиомером, что дает в результате определенный стереоизомер, например, S-энантиомер, формулы (I), так, как это показано на Схеме 2a получения соединений формулы (I-a-1).
Схема 2a

Соединения формулы (I), где Y представляет собой одинарную связь, при этом указанные соединения представлены формулой (I-D), также могут быть получены согласно следующей реакционной Схеме 3. В Схеме 3, W2 представляет собой подходящую уходящую группу, такую как, например, галоген, например, бром. Все другие переменные на схеме 3 определены в соответствии с настоящим изобретением.
Схема 3
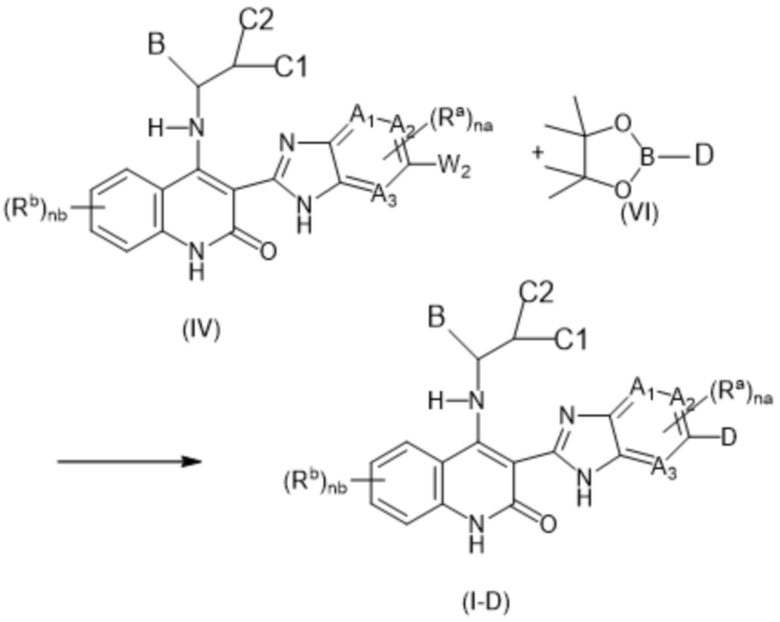
Реакцию на Схеме 3 выполняют в присутствии подходящего катализатора, такого как,
например, палладиевый катализатор, например, Pd2(dba)3, подходящего лиганда, такого как, например, PCy3 (трициклогексилфосфин), подходящего основания, такого как, например, K3PO4 (трикалия фосфат), и в подходящем растворителе, таком как, например, диоксан и вода.
По Схеме 3, промежуточное соединение формулы (IV) может быть определенным стереоизомером, например, S-энантиомером, что дает в результате определенный стереоизомер, например, S-энантиомер, формулы (I-D), так, как это показано на Схеме 3a получения соединений формулы (I-D-а).
Схема 3a
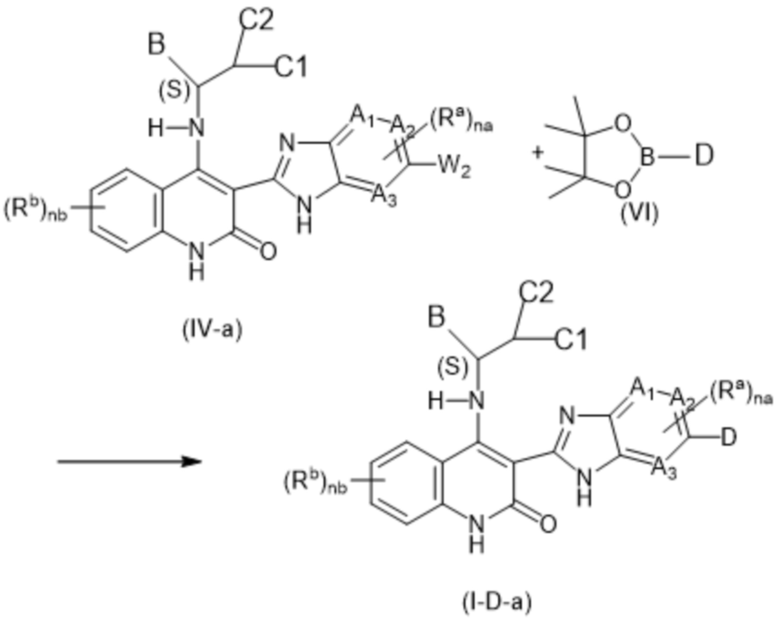
Промежуточные соединения формулы (II) можно получать в соответствии со следующей реакционной Схемой 4. В Схеме 4, W1 представляет собой подходящую уходящую группу, такую как, например, галоген, например, хлор. Все другие переменные на схеме 4 определены в соответствии с настоящим изобретением.
Схема 4
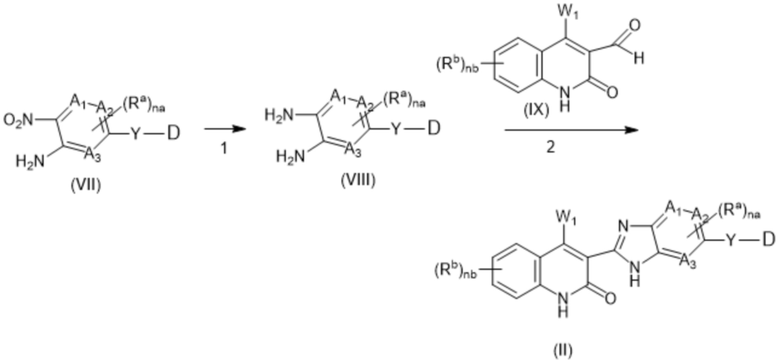
На Схеме 4 применены следующие условия реакции:
1: в присутствии подходящего восстанавливающего средства, такого как, например, H2, подходящего катализатора, такого как, например, палладий на угле, в подходящем растворителе, таком как, например, спирт, например, этанол, при подходящей температуре, такой как, например, комнатная температура.
2: в присутствии подходящего растворителя, такого как, например, спирт, например, этанол, при подходящей температуре, такой как, например, 80°C.
Промежуточные соединения формулы (IV) можно получать в соответствии со следующей реакционной Схемой 5. На схеме 5 W1 представляет собой подходящую уходящую группу, такую как, например, атом галогена, например, хлор, и W2 представляет собой подходящую уходящую группу, такую как, например, атом галогена, например, бром. Все другие переменные на схеме 5 определены в соответствии с настоящим изобретением.
Схема 5

На Схеме 5 применены следующие условия реакции:
1: в присутствии подходящего растворителя, такого как, например, спирт, например, этанол, при подходящей температуре, такой как, например, 70°C;
2: в присутствии подходящего основания, такого как, например, NaHCO3, подходящего растворителя, такого как, например, диметилформамид, при подходящей температуре, такой как,
например, 80°C.
Соединения формулы (I) можно также превращать друг в друга путем хорошо известных в этой области техники реакций или путем преобразований функциональных групп.
Например, соединения формулы (I), где Rc представляет собой C1-6алкил, замещенный -C(=O)-O-C1-6алкилом, или C1-6алкил-O-C(=O)-, можно преобразовать в соединения формулы (I), где Rc представляет собой HOOC-C1-6алкил или карбоксильную группу, в присутствии гидроксида лития и в присутствии подходящего растворителя, такого как, например, тетрагидрофуран или спирт, например, метанол.
Соединения по настоящему изобретению, полученные в описанных в данном документе способах, можно синтезировать в виде смесей энантиомеров, в частности, рацемических смесей энантиомеров, которые можно отделять друг от друга, следуя известным из уровня техники процедурам разделения. Рацемические соединения формулы (I), содержащие основный атом азота, можно превращать в соответствующие формы диастереомерных солей путем реакции с подходящей хиральной кислотой. Указанные формы диастереомерных солей затем разделяют, например, с помощью селективной или фракционной кристаллизации, и энантиомеры высвобождают оттуда с помощью щелочи. Альтернативный способ разделения энантиомерных форм соединений формулы (I) и их фармацевтически приемлемых солей присоединения и сольватов включает жидкостную хроматографию с применением хиральной неподвижной фазы, например, с помощью сверхкритической жидкостной (флюидной) хроматографии. Указанные чистые стереохимически изомерные формы также можно получать из соответствующих чистых стереохимически изомерных форм соответствующих исходных веществ при условии, что реакция протекает стереоспецифически. Если необходим определенный стереоизомер, то предпочтительно, чтобы указанное соединение синтезировали с помощью стереоспецифических способов получения. В данных способах преимущественно применяют энантиомерно чистые исходные вещества.
При получении соединений настоящего изобретения может быть необходимо обеспечить защиту удаленной функциональной группы (например, первичного или вторичного амина) в промежуточных соединениях. Необходимость в такой защите зависит от природы удаленной функциональной группы и от условий в способах получения. Подходящие защитные группы для аминогруппы (NH-PG) включают ацетил, трифторацетил, трет-бутоксикарбонил (Boc), бензилоксикарбонил (CBz) и 9-флуоренилметиленоксикарбонил (Fmoc). Необходимость такой защиты легко определит специалист в данной области техники. Для общего описания защитных групп и их применения см. T. W. Greene and P. G. M. Wuts, Protective Groups in Organic Synthesis, 4th ed., Wiley, Hoboken, New Jersey, 2007.
Во всех этих способах получения продукты реакции можно выделить из реакционной среды и, при необходимости, дополнительно очистить в соответствии с методиками, общеизвестными в данной области, такими как, например, экстракция, кристаллизация, растирание и хроматография.
Следующий аспект настоящего изобретения относится к способу получения соединения формулы (I), определенного в настоящем документе, при этом способ включает в себя:
(i) взаимодействие промежуточного соединения формулы (II)
 где W1 представляет собой подходящую уходящую группу, такую как атом галогена (например, хлора), с промежуточным соединением формулы (III)
где W1 представляет собой подходящую уходящую группу, такую как атом галогена (например, хлора), с промежуточным соединением формулы (III)
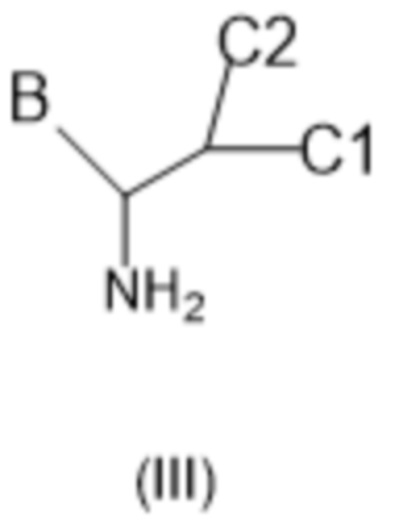
N, N-диизопропилэтиламин, в подходящем растворителе, таком как, например, диметилформамид; или
(ii) взаимодействие промежуточного соединения формулы (IV)
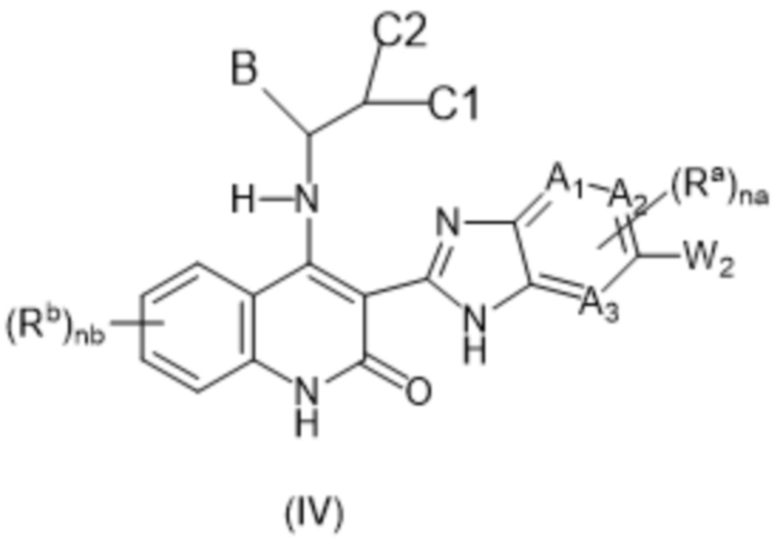 где W2 представляет собой подходящую уходящую группу, такую как атом галогена, например, брома, с промежуточным соединением формулы (V)
где W2 представляет собой подходящую уходящую группу, такую как атом галогена, например, брома, с промежуточным соединением формулы (V)
палладиевый катализатор, например, Pd2(dba)3, подходящего лиганда, такого как, например, Davephos (2-дициклогексилфосфино-2'-(N, N-диметиламино)бифенил), подходящего основания, такого как, например, LiHMDS (бис(триметилсилил)амид лития), и в подходящем растворителе, таком как, например, тетрагидрофуран; или
(iii) взаимодействие промежуточного соединения формулы (IV)
 где W2 представляет собой подходящую уходящую группу, такую как атом галогена, например, брома, с промежуточным соединением формулы (VI)
где W2 представляет собой подходящую уходящую группу, такую как атом галогена, например, брома, с промежуточным соединением формулы (VI)  в присутствии подходящего катализатора, такого как, например, палладиевый катализатор, например, Pd2(dba)3, подходящего лиганда, такого как, например, PCy3 (трициклогексилфосфин), подходящего основания, такого как, например, K3PO4 (трикалия фосфат), и в подходящем растворителе, таком как, например, диоксан и вода;
в присутствии подходящего катализатора, такого как, например, палладиевый катализатор, например, Pd2(dba)3, подходящего лиганда, такого как, например, PCy3 (трициклогексилфосфин), подходящего основания, такого как, например, K3PO4 (трикалия фосфат), и в подходящем растворителе, таком как, например, диоксан и вода;
где переменные значения определены в данном документе; и необязательно последующее превращение одного соединения формулы (I) в другое соединение формулы (I).
Фармацевтически приемлемые соли, их сольваты или производные
В данном разделе, как и во всех других разделах настоящей заявки, если в контексте не указывается иное, упоминания формулы (I) включают в себя упоминания всех других их подгрупп, предпочтений, вариантов осуществления и примеров, определенных в настоящем документе.
Если не указано иное, упоминание конкретного соединения также включает в себя его ионные формы, соли, сольваты, изомеры, таутомеры и изотопы, например, предпочтительно, его соли, или изомеры, или сольваты. Соединения формулы (I) могут существовать в форме солей, например, солей присоединения кислоты, или в некоторых случаях - солей органических и неорганических оснований, таких как карбоксилаты, сульфонаты и фосфаты. Все такие соли охвачены объемом настоящего изобретения, а упоминания соединений формулы (I) включают в себя формы солей этих соединений.
Солевые формы соединений настоящего изобретения, как правило, представляют собой фармацевтически приемлемые соли, и примеры фармацевтически приемлемых солей обсуждаются в Berge et al. (1977) "Pharmaceutically Acceptable Salts," J. Pharm. Sci., Vol. 66, pp. 1-19. Однако соли, которые не являются фармацевтически приемлемыми, также могут быть получены в виде форм промежуточных соединений, которые затем могут быть превращены в фармацевтически приемлемые соли. Такие формы не являющихся фармацевтически приемлемыми солей, которые могут быть применимы, например, в очистке или отделении соединений настоящего изобретения, также составляют часть настоящего изобретения.
Соли настоящего изобретения могут быть синтезированы из исходного соединения, которое содержит основный или кислотный фрагмент, традиционными химическими способами, такими как способы, описанные в Pharmaceutical Salts: Properties, Selection, and Use, P. Heinrich Stahl (Editor), Camille G. Wermuth (Editor), ISBN: 3-90639-026-8, Hardcover, 388 pages, August 2002. Как правило, такие соли могут быть получены путем реагирования свободных кислотных или основных форм этих соединений с подходящими основанием или кислотой в воде или в органическом растворителе, или в смеси этих двух; как правило, используют неводные среды, такие как эфир, этилацетат, этанол, изопропанол или ацетонитрил. Соединения настоящего изобретения могут существовать в виде моно- или дисолей в зависимости от pKa кислоты, из которая образована соль.
Кислотно-аддитивные соли могут быть образованы с обширным рядом кислот, как неорганических, так и органических. Примеры солей присоединения кислоты включают соли, образованные с кислотой, выбранной из группы, состоящей из уксусной, 2,2-дихлоруксусной, адипиновой, альгиновой, аскорбиновой (например, L-аскорбиновой), L-аспарагиновой, бензолсульфоновой, бензойной, 4-ацетамидобензойной, бутановой, (+)-камфорной, камфорсульфоновой, (+)-(1S)-камфор-10-сульфоновой, каприновой, капроновой, каприловой, коричной, лимонной, цикламовой, додецилсерной, этан-1,2-дисульфоновой, этансульфоновой, 2-гидроксиэтансульфоновой, муравьиной, фумаровой, галактаровой, гентизиновой, глюкогептоновой, D-глюконовой, глюкуроновой (например, D-глюкуроновой), глутаминовой (например, L-глутаминовой), α-оксоглутаровой, гликолевой, гиппуровой, бромистоводородной, хлористоводородной, йодистоводородной, изэтионовой, молочной (например, (+)-L-молочной, (±)-DL-молочной), лактобионовой, малеиновой, яблочной, (-)-L-яблочной, малоновой, (±)-DL-миндальной, метансульфоновой, нафталинсульфоновой (например, нафталин-2-сульфоновой), нафталин-1,5-дисульфоновой, 1-гидрокси-2-нафтойной, никотиновой, азотной, олеиновой, оротовой, щавелевой, пальмитиновой, памоевой, фосфорной, пропионовой, L-пироглутаминовой, пировиноградной, салициловой, 4-аминосалициловой, себациновой, стеариновой, янтарной, серной, дубильной, (+)-L-винной, тиоциановой, толуолсульфоновой (например, п-толуолсульфоновой), ундециленовой и валериановой кислоты, а также ацилированные аминокислоты и катионообменные смолы.
Одна конкретная группа солей состоит из солей, образованных из уксусной, хлористоводородной, йодистоводородной, фосфорной, азотной, серной, лимонной, молочной, янтарной, малеиновой, яблочной, изэтионовой, фумаровой, бензолсульфоновой, толуолсульфоновой, метансульфоновой (мезилата), этансульфоновой, нафталинсульфоновой, валериановой, уксусной, пропановой, бутановой, малоновой, глюкуроновой и лактобионовой кислот. Другая группа кислотно-аддитивных солей включает в себя соли, образованные из уксусной, адипиновой, аскорбиновой, аспартатной, лимонной, DL-молочной, фумаровой, глюконовой, глюкуроновой, гиппуровой, хлористоводородной, глутамовой, DL-яблочной, метансульфоновой, себациновой, стеариновой, янтарной и винной кислот.
Если соединение является анионным или имеет функциональную группу, которая может быть анионной (например, -COOH может представлять собой -COO-), то можно образовывать соль с подходящим катионом. Примеры подходящих неорганических катионов включают, без ограничения, ионы щелочных металлов, такие как Na+ и K+, катионы щелочноземельных металлов, такие как Ca2+ и Mg2+, и другие катионы, такие как Al3+. Примеры подходящих органических катионов включают без ограничения ион аммония (т.е. NH4+) и ионы замещенного аммония (например, NH2R2+, NHR3+, NR4+).
Примерами некоторых подходящих ионов замещенного аммония являются ионы, полученные из этиламина, диэтиламина, дициклогексиламина, триэтиламина, бутиламина, этилендиамина, этаноламина, диэтаноламина, пиперазина, бензиламина, фенилбензиламина, холина, меглумина и трометамина, а также аминокислот, таких как лизин и аргинин. Примером распространенного иона четвертичного аммония является N(CH3)4+.
Если соединения формулы (I) содержат функциональную группу амина, то они могут формировать соли четвертичного аммония, например, путем реакции с алкилирующим средством согласно способам, хорошо известным специалисту. Такие соединения четвертичного аммония попадают в объем формулы (I).
Соединения настоящего изобретения могут образовывать сольваты, например, с водой (т. е. гидраты) или распространенные органические растворители. Применяемый в настоящем документе термин "сольват" означает физическую связь соединений настоящего изобретения с одной или несколькими молекулами растворителя, а также их фармацевтически приемлемые соли присоединения. Эта физическая связь подразумевает различную степень ионного и ковалентного связывания, включая водородную связь. В некоторых случаях сольват легче выделять, например, когда одна или несколько молекул растворителя включены в кристаллическую решетку твердого кристаллического вещества. Подразумевается, что термин "сольват" охватывает как жидкофазные, так и изолируемые сольваты. Неограничивающие примеры подходящих сольватов включают в себя соединения настоящего изобретения в комбинации с водой (гидраты), изопропанолом, этанолом, метанолом, DMSO, этилацетатом, уксусной кислотой или этаноламином и т. п. Соединения настоящего изобретения могут проявлять свои биологические эффекты при нахождении в растворе.
Сольваты могут быть важны для способов получения вещества (например, в отношении его очистки), хранения вещества (например, его стабильности) и удобства осуществления манипуляций с веществом, и зачастую их образуют как часть стадий выделения или очистки при химическом синтезе. Специалист в данной области сможет определить посредством стандартных и длительно используемых методик, образовался ли гидрат или другой сольват при условиях выделения или условиях очистки, используемых для получения данного соединения. Примеры таких методик включают в себя термогравиметрический анализ (TGA), дифференциальную сканирующую калориметрию (DSC), рентгеновскую кристаллографию (например, монокристаллическую рентгеновскую кристаллографию или рентгеновскую порошковую дифрактометрию) и ЯМР твердого тела (SS-NMR, также известный как ЯМР с вращением образца под магическим углом или MAS-NMR). Такие методики являются такой же частью стандартного аналитического инструментария квалифицированного химика, как ЯМР, ИК, ВЭЖХ и МС. В качестве альтернативы квалифицированный специалист сможет при необходимости сформировать сольват с использованием условий кристаллизации, которые предусматривают количество растворителя, необходимое для конкретного сольвата. Впоследствии стандартные способы, описанные выше, можно использовать для установления того, образовались ли сольваты.
Кроме того, соединения настоящего изобретения могут иметь одну или несколько полиморфных (кристаллических) или аморфных форм и, эти формы как таковые охвачены объемом настоящего изобретения.
Соединения формулы (I) могут существовать в разных геометрических изомерных и таутомерных формах, и при упоминании соединений формулы (I) подразумеваются все эти формы. Во избежание неоднозначности толкования, если соединение может существовать в одной из нескольких геометрических изомерных и таутомерных форм, и только одна специально описана или показана, то все остальные, тем не менее, охватываются формулой (I). Примеры таутомерных форм включают, например, кето-, энол- и энолатную формы, например, как в следующих таутомерных парах: кето/энол (показано ниже), имин/энамин, амид/иминоспирт, амидин/эндиамины, нитрозо/оксим, тиокетон/энтиол и нитро/аци-нитро.
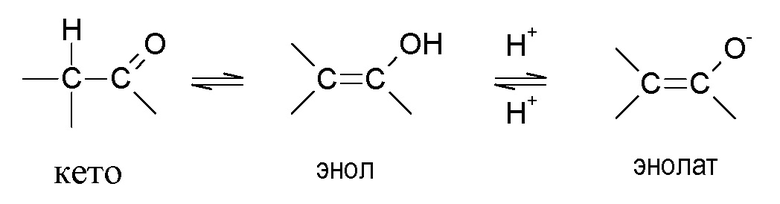
Предполагается, что такие формы, если они могут существовать, включены в объем настоящего изобретения. Из этого следует, что одно соединение может существовать как в стереоизомерной, так и в таутомерной форме.
Если соединения формулы (I) содержат один или несколько хиральных центров и могут существовать в форме двух или более оптических изомеров, то упоминания соединений формулы (I) подразумевают все их оптические изомерные формы (например, энантиомеры, эпимеры и диастереоизомеры) либо как отдельные оптические изомеры, либо как смеси (например, рацемические смеси) двух или более оптических изомеров, если контекст не требует иного. Если соединение формулы (I) содержит более чем один хиральный центр, и об одном центре говорится, что он обладает абсолютной стереоконфигурацией, как в соединениях формул (I-a), (I-A-a), (I-B-a), (I-C-a) или (I-D-a), другой(ие) хиральный(ые) центр(ы) включает(ют) все формы оптических изомеров, либо как индивидуальные оптические изомеры, либо как смеси (например, рацемические смеси) двух или более его оптических изомеров, если контекст не требует иного. Оптические изомеры могут быть охарактеризованы и идентифицированы по их оптической активности (т.е. как+и - изомеры в зависимости от направления, в котором они вращают плоскость поляризации света, или как d и l изомеры), или они могут быть охарактеризованы с точки зрения их абсолютной стереохимии с использованием номенклатуры "R и S", разработанной Cahn, Ingold и Prelog, см. Advanced Organic Chemistry by Jerry March, 4th Edition, John Wiley & Sons, New York, 1992, стр. 109-114, и см. также Cahn, Ingold & Prelog (1966) Angew. Chem. Int. Ed. Engl., 5, 385-415. Например, выделенные энантиомеры, абсолютная конфигурация которых неизвестна, могут обозначаться как (+) или (-) в зависимости от направления, в котором они вращают плоскость поляризации света.
Оптические изомеры могут быть разделены с помощью ряда методик, в том числе хиральной хроматографии (хроматографии на хиральной подложке), и такие методики хорошо известны специалисту в данной области. Как альтернатива хиральной хроматографии, оптические изомеры могут быть разделены путем формирования диастереоизомерных солей с хиральными кислотами, такими как (+)-винная кислота, (-)-пироглутаминовая кислота, (-)-ди-толуоил-L-винная кислота, (+)-миндальная кислота, (-)-яблочная кислота и (-)-камфорсульфоновая кислота, с разделением диастереоизомеров посредством предпочтительной кристаллизации, а затем растворения солей с получением отдельного энантиомера свободного основания.
Если соединения формулы (I) существуют в виде двух или более изомерных форм, то одна изомерная форма, например, один энантиомер в паре энантиомеров, может демонстрировать преимущества над другим энантиомером, например, в отношении биологической активности. Таким образом, в некоторых случаях может быть желательным применение в качестве терапевтического средства только одного из пары энантиомеров или только одного из множества диастереоизомеров. Было найдено, что если соединения, в которых хиральный центр, обозначенный *, в следующей структуре  имеет S-конфигурацию, то эти соединения проявляют более высокую биологическую активность, чем соответствующая R-конфигурация.
имеет S-конфигурацию, то эти соединения проявляют более высокую биологическую активность, чем соответствующая R-конфигурация.
Если идентифицирован конкретный стереоизомер, это означает, что указанный стереоизомер практически не содержит других стереоизомеров, т.е. ассоциирован с менее чем 50%, предпочтительно - с менее чем 20%, более предпочтительно - с менее чем 10%, еще более предпочтительно - с менее чем 5%, в частности, с менее чем 2%, и наиболее предпочтительно - с менее чем 1% других стереоизомеров. Таким образом, если соединение формулы (I), например, указано как (S), то это означает, что соединение практически не содержит изомер (R); если соединение формулы (I), например, указано как E, то это означает, что соединение практически не содержит изомер Z; если соединение формулы (I), например, указано как цис-, то это означает, что соединение практически не содержит транс-изомер.
Любая химическая формула, используемая в данном документе, связи в которой показаны только в виде сплошных линий, а не в виде сплошных клиновидных или пунктирных клиновидных связей, или иным образом показанная в какой-либо определенной конфигурации (например, R, S) вокруг одного или нескольких атомов, предусматривает каждый возможный стереоизомер или смесь двух или более стереоизомеров.
Термины "стереоизомеры", "стереоизомерные формы" или "стереохимически изомерные формы" выше или ниже в данном документе используются взаимозаменяемо.
Энантиомеры представляют собой стереоизомеры, которые являются несовпадающими при наложении друг на друга, зеркальными отображениями друг друга. Смесь пары энантиомеров 1:1 представляет собой рацемат или рацемическую смесь.
Атропизомеры (или атропоизомеры) представляют собой стереоизомеры, которые имеют конкретную пространственную конфигурацию, образованную в результате ограничения вращения вокруг одинарной связи вследствие значительного стерического затруднения. Предполагается, что все атропизомерные формы соединений формулы (I) включены в объем настоящего изобретения.
Диастереомеры (или диастереоизомеры) представляют собой стереоизомеры, которые не являются энантиомерами, т. е. они не соотносятся как зеркальные отображения. Если соединение содержит двойную связь, то заместители могут находиться в E- или Z-конфигурации. Заместители при двухвалентных циклических (частично) насыщенных радикалах могут находиться либо в цис-, либо в транс-конфигурации; например, если соединение содержит двузамещенную циклоалкильную группу, то заместители могут находиться в цис- или транс-конфигурации. Таким образом, настоящее изобретение включает энантиомеры, атропизомеры, диастереомеры, рацематы, E-изомеры, Z-изомеры, цис-изомеры, транс-изомеры и их смеси во всех случаях, когда это возможно с химической точки зрения.
Значения всех этих терминов, т. е. энантиомеров, атропизомеров, диастереомеров, рацематов, E-изомеров, Z-изомеров, цис-изомеров, транс-изомеров и их смесей, известны специалисту в данной области.
Соединения данного изобретения включают соединения с одним или несколькими изотопными замещениями, и ссылка на конкретный элемент включает в свой объем все изотопы элемента, встречающиеся в природе или полученные синтетическим путем, либо с природным содержанием изотопов, либо в обогащенной изотопами форме. Например, упоминание водорода охватывает 1H, 2H (D) и 3H (T). Подобным образом, упоминания углерода и кислорода включают в свой объем 12C, 13C и 14C и 16O и 18O соответственно. Изотопы могут быть радиоактивными или нерадиоактивными. Согласно одному варианту осуществления настоящего изобретения соединения не содержат радиоактивные изотопы. Такие соединения являются предпочтительными для терапевтического применения. Согласно другому варианту осуществления, однако, соединение может содержать один или несколько радиоизотопов. Соединения, содержащие такие радиоизотопы, могут быть применимы в диагностическом контексте. Меченные радиоактивным изотопом соединения формулы (I) могут содержать радиоактивный изотоп, выбранный из группы, состоящей из 2H, 3H, 11C, 18F, 122I, 123I, 125I, 131I, 75Br, 76Br, 77Br и 82Br. Предпочтительно радиоактивный изотоп выбран из группы из 2H, 3H, 11C и 18F. Более предпочтительно радиоактивный изотоп представляет собой 2H.
В частности, подразумевают, что дейтерированные соединения включены в объем настоящего изобретения.
Фармакология
Протеинтирозинкиназы (PTK)
Соединения настоящего изобретения, описываемые в настоящем документе, ингибируют или модулируют активность некоторых тирозинкиназ, и, таким образом, соединения будут применимы в лечении или профилактике, в частности, в лечении болезненных состояний или состояний, опосредованных этими тирозинкиназами, в частности, FGFR.
FGFR
Семейство факторов роста фибробластов (FGF) рецепторов протеинтирозинкиназы (PTK) регулирует множество различных физиологических функций, включая митогенез, заживление ран, клеточную дифференцировку и ангиогенез, и развитие. На рост как нормальных, так и опухолевых клеток, также как и на пролиферацию, воздействуют путем изменения локальной концентрации FGF, внеклеточные сигнальные молекулы которых действуют в качестве аутокринных, а также в качестве паракринных факторов. Аутокринный сигнальный путь FGF может быть особенно важным при развитии раковых заболеваний, зависимых от стероидного гормона, до независимого от гормона состояния. FGF и их рецепторы экспрессируются при повышенных уровнях в различных тканях и клеточных линиях, и считают, что повышенная экспрессия способствует злокачественному фенотипу. Кроме того, ряд онкогенов являются гомологами генов, кодирующих рецепторы фактора роста, и существует возможность аберрантной активации FGF-зависимой сигнального пути при раке поджелудочной железы у человека (Knights et al., Pharmacology and Therapeutics 2010 125:1 (105-117); Korc M. et al Current Cancer Drug Targets 2009 9:5 (639-651)).
Этими двумя прототипическими членами являются кислотный фактор роста фибробластов (aFGF или FGF1) и основный фактор роста фибробластов (bFGF или FGF2), и к настоящему времени идентифицированы по меньшей мере двадцать четко различимых членов семейства FGF. Клеточный ответ на факторы роста фибробластов передается через четыре типа высокоаффинных трансмембранных рецепторов фактора роста фибробластов протеинтирозинкиназы (FGFR), пронумерованных от 1 до 4 (от FGFR1 до FGFR4).
Разрыв пути FGFR1 должен воздействовать на пролиферацию опухолевых клеток, так как эта киназа активируется во многих типах опухолей в дополнение к пролиферации эндотелиальных клеток. Сверхэкспрессия и активация FGFR1 в связанной с опухолью сети сосудов позволили предположить роль этих молекул при ангиогенезе опухоли.
В недавнем исследовании была показана связь между экспрессией FGFR1 и онкогенностью при классических лобулярных карциномах (CLC). CLC составляют 10-15% от всех случаев форм рака молочной железы, и обычно они характеризуются недостатком экспрессии p53 и Her2, в то же время сохраняя экспрессию рецептора эстрогена. Амплификация гена 8p12-p11.2 была продемонстрирована в ~50% случаев CLC, и было показано, что это связано с повышенной экспрессией FGFR1. Предварительные исследования с siRNA, направленной против FGFR1, или с низкомолекулярным ингибитором рецептора показали, что клеточные линии, в которых происходит эта амплификация, являются особенно чувствительными к ингибированию этого сигнального пути. Рабдомиосаркома (RMS), самая распространенная саркома мягких тканей у детей, по-видимому, является результатом аномальной пролиферации и дифференцировки в процессе миогенеза скелета. FGFR1 сверхэкспрессируется при первичных опухолях рабдомиосаркомы, и это связано с гипометилированием 5' CpG-островка и аномальной экспрессией генов AKT1, NOG и BMP4.
Рецептор 2 фактора роста фибробластов имеет высокую аффинность к кислотным и/или основным факторам роста фибробластов, а также к лигандам фактора роста кератиноцитов. Рецептор 2 фактора роста фибробластов также репродуцирует мощные остеогенные эффекты фактора роста фибробластов в процессе роста остеобластов и дифференцировки. Было показано, что мутации рецептора 2 фактора роста фибробластов, приводящие к комплексным функциональным изменениям, индуцируют аномальную оссификацию швов черепа (краниосиностоз), что предполагает важную роль передачи сигнала FGFR при внутримембранном остеогенезе. Например, при синдроме Аперта (AP), характеризующемся преждевременным окостенением швов черепа, большинство случаев связаны с точковыми мутациями, порождающими приобретение функции рецептором 2 фактора роста фибробластов. Кроме того, скрининг мутации у пациентов с синдромными краниосиностозами указывает, что ряд рецидивных мутаций FGFR2 являются причиной тяжелых форм синдрома Пфейффера. Конкретные мутации FGFR2 включают в себя W290C, D321A, Y340C, C342R, C342S, C342W, N549H, K641R в FGFR2.
Ряд тяжелых нарушений при развитии скелета человека, включающих синдромы Аперта, Крузона, Джексона-Вейсса, пахидермии складчатой Бира-Стивенсона и Пфейффера, связаны с возникновением мутаций рецептора 2 фактора роста фибробластов. В большинстве, но не во всех случаях синдром Пфейффера (PS) также вызывается с самого начала мутацией гена рецептора 2 фактора роста фибробластов, и недавно было показано, что мутации рецептора 2 фактора роста фибробластов нарушают одно из основных правил регулирования лигандной специфичности. А именно, две мутантные сплайс-формы рецептора фактора роста фибробластов, FGFR2c и FGFR2b, приобрели способность связывать атипичные FGF лиганды и активироваться с помощью атипичных FGF лигандов. Эта потеря лигандной специфичности приводит к отклонению от нормального сигнального пути и предполагает, что тяжелые фенотипы этих болезненных синдромов являются результатом эктопической лиганд-зависимой активации рецептора 2 фактора роста фибробластов.
Генные нарушения в рецепторе тирозинкиназы FGFR3, такие как хромосомные транслокации или точковые мутации, приводят к эктопически экспрессируемым или разрегулированным конститутивно активным рецепторам FGFR3. Такие нарушения связаны с подгруппой множественных миелом и раком мочевого пузыря, гепатоцеллюлярным раком, плоскоклеточной карциномой полости рта и карциномами шейки матки. Соответственно, ингибиторы FGFR3 могли бы применяться при лечении множественной миеломы, карцином мочевого пузыря и шейки матки. FGFR3 также сверхэкспрессируется при раке мочевого пузыря, в частности, инвазивном раке мочевого пузыря. FGFR3 часто активируется в результате мутации при уротелиальной карциноме (UC). Повышенная экспрессия была связана с мутацией (85% мутантных опухолей характеризовались высоким уровнем экспрессии), но 42% опухолей без признаков мутации также характеризовались сверхэкспрессией, в том числе многие мышечно-инвазивные опухоли.
Сверхэкспрессию FGFR4 связывают с неблагоприятным прогнозом как при карциноме предстательной железы, так и при карциноме щитовидной железы Кроме того, полиморфизм зародышевых клеток (Gly388Arg) связывают с повышенной частотой случаев рака легкого, молочной железы, толстой кишки печени (HCC) и предстательной железы Кроме того, также было обнаружено, что процессированная форма FGFR4 (включающая киназный домен) присутствует в 40% гипофизарных опухолей, но не присутствует в нормальной ткани. Сверхэкспрессия FGFR4 была обнаружена в опухолях печени, толстой кишки и легкого. FGFR4 вовлечен в рак толстой и прямой кишок и рак печени, где экспрессия его лиганда FGF19 зачастую повышена.
Фиброзные состояния представляют собой важную медицинскую проблему, являющуюся следствием аномального или избыточного отложения фиброзной ткани. Они возникают при многих заболеваниях, включая цирроз печени, гломерулонефрит, фиброз легких, системный фиброз, ревматоидный артрит, а также естественный процесс заживления ран. Механизмы патологического фиброза пока еще полностью не изучены, но считают, что фиброз является результатом действия различных цитокинов (включая фактор некроза опухолей (TNF), фактор роста фибробластов (FGF), тромбоцитарный фактор роста (PDGF) и трансформирующий фактор роста бета (TGFβ), вовлеченных в пролиферацию фибробластов и отложение внеклеточной протеиновой матрицы (включая коллаген и фибронектин). Это приводит к изменению структуры и функции ткани и к последующей патологии.
В ряде доклинических исследований была продемонстрирована повышающая регуляция фактора роста фибробластов на предклинических моделях фиброза легких. Сообщалось, что TGFβ1 и PDGF вовлечены в фиброгенный процесс, а в последующем опубликованном исследовании предполагается, что повышение FGF и последующее усиление пролиферации фибробластов может происходить в ответ на повышенный уровень TGFβ1. Потенциальную терапевтическую важность нацеливания на фиброзный механизм при состояниях, таких как идиопатический фиброз легких (IPF), подтверждает сообщение о клиническом эффекте противофиброзного средства пирфенидона. Идиопатический фиброз легких (также называемый криптогенным фиброзирующим альвеолитом) является прогрессирующим состоянием, включающим в себя рубцевание легкого. Постепенно альвеолярные мешочки легких замещаются фиброзной тканью, которая становится более толстой, вызывая необратимую потерю способности ткани переносить кислород в кровоток. Симптомы этого состояния включают одышку, хронический сухой кашель, утомляемость, боль в груди и потерю аппетита, приводящую к быстрой потере веса. Это состояние является чрезвычайно тяжелым с примерно 50% смертностью через 5 лет.
Таким образом, соединения, которые ингибируют FGFR, будут применимыми в обеспечении средства предупреждения роста или индуцирования апоптоза в опухолях, в частности, путем ингибирования ангиогенеза. Поэтому ожидается, что соединения будут одобрены как пригодные в лечении или предупреждении пролиферативных нарушений, таких как формы рака. В частности, опухоли с активирующими мутантами рецепторных тирозинкиназ или повышающей регуляцией рецепторных тирозинкиназ могут быть особенно чувствительными к ингибиторам. Для пациентов с обсуждаемыми в настоящем документе активированными мутантами любой из изоформ специфических RTK лечение с помощью ингибиторов RTK также может иметь особенно благоприятное действие.
Как отмечается здесь и выше, разнообразные ингибиторы FGFR проходят клинические испытания, и к настоящему времени они показали клинический ответ у пациентов с аберрациями FGFR. Однако сообщалось, что мутации, затрагивающие аминокислоты в FGFR, например, FGFR1, 2 или 3, могут вызывать устойчивость к ингибиторам FGFR или снижать чувствительность к ингибиторам FGFR. Развитие вторичных мутаций киназного домена FGFR при лечении ингибиторами FGFR является важным механизмом приобретенной устойчивости к ингибированию FGFR. При раковых заболеваниях также происходят de novo эквивалентные точковые мутации FGFR. О мутациях привратника сообщалось, что они представляют собой один из основных механизмов, приводящих к устойчивости к ингибиторам тирозинкиназы. Мутации привратника включают FGFR3 V555L/V555M, FGFR1 V561M, FGFR2 V564F/V564I/V564M и FGFR4 V550L. Устойчивые мутации FGFR были зарегистрированы в клинических испытаниях и в клеточных системах in vitro. Поэтому существует потребность в новых (второго поколения) ингибиторах FGFR, которые позволят преодолеть клиническую приобретенную устойчивость к терапии ингибитором FGFR первого поколения и одновременно поддерживать активность, подавляющую активирующие мутации FGFR.
Было обнаружено, что соединения данного изобретения проявляют активность против FGFR дикого типа, в частности, против FGFR1, 2, 3 или 4, более конкретно - против FGFR3, а также против мутировавших FGFR, в частности, против FGFR, несущих мутации привратника, или против мутировавшего FGFR1, или мутировавшего FGFR2, или мутировавшего FGFR3, в частности, против FGFR3 V555L, FGFR3 V555M, FGFR1 V561M и FGFR2 V564I, особенно против FGFR3 V555L и FGFR3 V555M.
Биологическая активность и терапевтические пути применения
Соединения данного изобретения и их подгруппы обладают ингибирующей или модулирующей активностью в отношении рецептора фактора роста фибробластов (FGFR) и могут применяться для предотвращения или лечения, в частности, лечения болезненных состояний или состояний, описанных в данном документе. Кроме того, соединения настоящего изобретения и их подгруппы можно применять для предупреждения или лечения, особенно для лечения, заболеваний или состояния, опосредованных киназами. Ссылки на предотвращение, или профилактику, или лечение болезненного состояния или состояния, такого как рак, подразумевают облегчение или снижение частоты заболевания раком.
Используемый в настоящем документе термин "модулирование", применительно к активности киназы, обозначает изменение уровня биологической активности протеинкиназы. Таким образом, модулирование охватывает физиологические изменения, которые приводят к повышению или понижению соответствующей активности протеинкиназы. Во втором случае модулирование может называться "ингибированием". Модулирование может возникать в результате непосредственного или косвенного воздействия, и оно может быть опосредовано любым механизмом и на любом физиологическом уровне, включая, например, уровень экспрессии гена (включающей, например, транскрипцию, трансляцию и/или посттрансляционную модификацию), уровень экспрессии регуляторных элементов кодирующих генов, которые непосредственно или косвенно воздействуют на уровни активности киназы. Таким образом, модулирование может включать повышенную/подавленную экспрессию или избыточную или недостаточную экспрессию киназы, включая амплификацию гена (т. е. множество копий гена) и/или повышенную или пониженную экспрессию в результате транскрипционного эффекта, а также гиперактивность (или гипоактивность) и (де)активацию протеинкиназы(протеинкиназ) (включая (де)активацию) в результате мутации(ий). Термины "модулированный", "модулирование" и "модулировать" следует истолковывать соответствующим образом.
Используемый в настоящем документе термин "опосредованный", применяемый, например, в отношении описанной в настоящем документе киназы (и применяемый, например, к различным физиологическим процессам, заболеваниям, состояниям, патологическим состояниям, терапевтическим средствами, методам лечения или вмешательствам), используется ограничительно таким образом, что он применяется только к таким разнообразным процессам, заболеваниям, состояниям, патологическим состояниям, способам лечения и вмешательства, в которых киназа играет биологическую роль. В случаях, когда термин применяют к заболеванию, состоянию или патологическому состоянию, биологическая роль, которую играет киназа, может быть непосредственной или косвенной, и может быть необходимой и/или достаточной для проявления симптомов заболевания, состояния или патологического состояния (или их этиологии или развития). Таким образом, активность киназы (и, в частности, ненормальные уровни активности киназы, например, избыточная экспрессия киназы) не обязательно должна быть непосредственной причиной заболевания, состояния и патологического состояния, и более того, предполагается, что опосредованные киназой заболевания, состояния или патологические состояния включают те, которые имеют полифакториальную этиологию и комплексное развитие, и в которые соответствующая киназа вовлечена только частично. В случае, когда термин применяют к лечению, профилактике или вмешательству, выполняемая киназой роль может быть непосредственной или косвенной, и может быть необходимой и/или достаточной для проведения лечения, профилактики или результата вмешательства. Таким образом, болезненное состояние или патологическое состояние, опосредованное киназой, включает в себя развитие устойчивости к любому конкретному противораковому лекарственному средству или к противораковой терапии.
Таким образом, например, соединения настоящего изобретения могут быть применимы для облегчения или снижения частоты случаев заболевания раком.
Более конкретно, соединения формулы (I) и их подгруппы являются ингибиторами FGFR. Например, соединения настоящего изобретения обладают активностью в отношении FGFR1, FGFR2, FGFR3, и/или FGFR4, и, в частности, против FGFR1, 2 и 3. Более конкретно, соединения настоящего изобретения проявляют активность в отношении FGFR дикого типа и/или против мутировавших FGFR, в частности, FGFR с точковыми мутациями, более конкретно - против мутаций привратника. Мутации привратника включают FGFR3 V555L/V555M, FGFR1 V561M, FGFR2 V564F/V564I/V564M и FGFR4 V550L. В частности, соединения настоящего изобретения проявляют активность против FGFR1, FGFR2 и FGFR3 с мутировавшим привратником, в частности, против FGFR3 V555L, FGFR3 V555M, FGFR1 V561M и FGFR2 V564I, в частности, против FGFR3 V555L и FGF5.
Диагностирование опухолей с мутациями может быть осуществлено с использованием методик, известных специалисту в данной области и описываемых в настоящем документе, таких как RT-PCR и FISH.
Примеры видов рака, которые можно лечить (или подавлять) включают без ограничения карциному, например карциному мочевого пузыря, рак молочной железы, рак толстой кишки (например, виды рака ободочной и прямой кишки, такие как аденокарцинома толстой кишки и аденома толстой кишки), рак почек, рак уротелия, рак матки, рак эпидермиса, рак печени, рак легкого (например, мелкоклеточный рак легкого и немелкоклеточные карциномы легкого (например, аденокарциному и плоскоклеточную карциному)), рак пищевода, рак головы и шеи, рак желчного пузыря, рак яичников, рак поджелудочной железы (например, экзокринную карциному поджелудочной железы), рак желудка, рак желудочно-кишечного тракта (также известный как рак желудка) (например, гастроинтестинальные стромальные опухоли), рак шейки матки, рак эндометрия, рак щитовидной железы, рак предстательной железы или рак кожи (например, эпидермоидный рак или выбухающую дерматофибросаркому); рак гипофиза, опухоль кроветворной ткани лимфоидного происхождения, например, лейкоз, острый лимфоцитарный лейкоз, хронический лимфоцитарный лейкоз, B-клеточную лимфому (например, диффузную В-крупноклеточную лимфому), T-клеточную лимфому, лимфому Ходжкина, неходжкинскую лимфому, волосатоклеточную лимфому или лимфому Беркитта; опухоль кроветворной ткани миелоидного происхождения, например, виды лейкоза, острый и хронический виды миелоидного лейкоза, хронический миеломоноцитарный лейкоз (CMML), миелопролиферативное нарушение, миелопролиферативный синдром, миелодиспластический синдром или промиелоцитарный лейкоз; множественную миелому; фолликулярный рак щитовидной железы; гепатоцеллюлярный рак, опухоль мезенхимального происхождения (например, саркому Юинга), например, фибросаркому или рабдомиосаркому; опухоль центральной или периферической нервной системы, например астроцитому, нейробластому, глиому (такую как мультиформная глиобластома) или шванному; меланому; семиному; тератокарциному; остеосаркому; пигментную ксеродерму; кератоакантому; фолликулярный рак щитовидной железы или саркому Капоши. В частности, плоскоклеточный рак легкого, рак молочной железы, колоректальный рак, глиобластому, астроцитому, рак предстательной железы, мелкоклеточный рак легких, меланому, рак головы и шеи, рак щитовидной железы, рак матки, рак желудка, гепатоцеллюлярный рак, рак шейки матки, множественную миелому, рак мочевого пузыря, рак эндометрия, рак уротелия, рак толстой кишки, рабдомиосаркому, рак питуитарной железы, холангиокарциному.
Примеры форм рака, которые можно лечить (или ингибировать), включают в себя без ограничения рак мочевого пузыря, уротелиальный рак, метастатический уротелиальный рак, хирургически неоперабельный уротелиальный рак, рак молочной железы, глиобластому, рак легкого, немелкоклеточный рак легкого, плоскоклеточный рак легкого, аденокарциному легкого, легочную аденокарциному, мелкоклеточный рак легкого, рак яичника, эндометриальный рак, рак шейки матки, саркому мягких тканей, плоскоклеточную карциному головы и шеи, рак желудка, рак пищевода, плоскоклеточную карциному пищевода, аденокарциному пищевода, холангиокарциному, гепатоцеллюлярную карциному.
Некоторые формы рака устойчивы к лечению конкретными лекарственными средствами. Это может быть обусловлено типом опухоли или может возникать вследствие лечения с помощью соединения. В этой связи, упоминания множественной миеломы предусматривают чувствительную к бортезомибу множественную миелому или рефракторную множественную миелому. Подобным образом, упоминания хронического миелогенного лейкоза предусматривают чувствительный к имитанибу хронический миелогенный лейкоз и рефракторный хронический миелогенный лейкоз. Хронический миелогенный лейкоз также известен как хронический миелолейкоз, хронический гранулоцитарный лейкоз или CML. Подобным образом, острый миелогенный лейкоз также называют острым миелобластным лейкозом, острым гранулоцитарным лейкозом, острым нелимфоидным лейкозом или AML.
Соединения согласно настоящему изобретению можно также применять в лечении связанных с кроветворением заболеваний аномальной пролиферации клеток, либо предраковых, либо стабильных, таких как миелопролиферативные заболевания. Миелопролиферативные заболевания ("MPD") представляют собой группу заболеваний костного мозга, при котором продуцируется избыток клеток. Они связаны с миелодиспластическим синдромом и могут быть вовлечены в него. Миелопролиферативные заболевания включают истинную полицитемию, эссенциальную тромбоцитемию и первичный миелофиброз. Дополнительное гематологическое нарушение представляет собой гиперэозинофильный синдром. T-клеточные лимфопролиферативные заболевания включают таковые, происходящие от естественных клеток-киллеров.
Кроме того, соединения настоящего изобретения могут применяться в лечении рака желудочно-кишечного тракта (также известной как рак желудка), например при стромальных опухолях желудочно-кишечного тракта. Рака желудочно-кишечного тракта относится к злокачественным состояниям желудочно-кишечного тракта, включающего в себя пищевод, желудок, печень, желчную систему, поджелудочную железу, кишечник и задний проход.
Таким образом, при фармацевтических композициях, применениях или способах согласно настоящему изобретению для лечения заболевания или состояния, включающего аномальный рост клеток, заболевание или состояние, включающее аномальный рост клеток, в одном варианте осуществления представляет собой рак.
Конкретные подтипы форм рака включают в себя множественную миелому, рак мочевого пузыря, шейки матки, предстательной железы, щитовидной железы, легкого, молочной железы и толстой кишки.
Дополнительный подтип форм рака включает в себя множественную миелому, рак мочевого пузыря, гепатоцеллюлярную, плоскоклеточную карциному полости рта и карциномы шейки матки.
Соединения настоящего изобретения, обладающие ингибиторной активностью в отношении FGFR, такого как FGFR1, может быть особенно полезным при лечении или предупреждении рака молочной железы, в частности, классических лобулярных карцином (CLC), и рака легкого с амплификацией FGFR1 или мутациями в FGFR1.
Поскольку соединения настоящего изобретения обладают активностью в отношении FGFR4, они также найдут применение в лечении форм рака предстательной железы или гипофиза или найдут применение в лечении рака молочной железы, рака легкого, рака предстательной железы, рака печени (HCC) или рака легкого.
В частности, соединения настоящего изобретения как ингибиторы FGFR применимы в лечении множественной миеломы, миелопролиферативных нарушений, эндометриального рака, рака предстательной железы, рака мочевого пузыря, рака легкого, рака яичника, рака молочной железы, рака желудка, рака толстой и прямой кишок и плоскоклеточной карциномы ротовой полости.
Дополнительными подтипами рака являются множественная миелома, эндометриальный рак, рак мочевого пузыря, рак шейки матки, рак предстательной железы, рак легкого, рак молочной железы, рак толстой и прямой кишок, и карциномы щитовидной железы.
В частности, соединения настоящего изобретения применимы при лечении множественной миеломы (в частности, множественной миеломы с транслокацией t(4;14) или со сверхэкспрессией FGFR3), рака предстательной железы (гормонально-рефракторного рака предстательной железы), рака эндометрия (в частности, эндометриальных опухолей с активированными мутациями в FGFR2) и рака молочной железы (в частности, лобулярного рака молочной железы).
В частности, соединения данного изобретения полезны при лечении холангиокарциномы, в частности холангиокарциномы с транслокациями и мутациями FGFR или амплификациями FGF19.
В частности, соединения применяются для лечения лобулярных карцином, таких как CLC (классическая лобулярная карцинома).
Так как соединения обладают активностью в отношении FGFR3, они могут применяться при лечении множественной миеломы и рака мочевого пузыря.
В частности, соединения обладают активностью против опухолей с транслокацией FGFR3-TACC3, в частности, опухолей мочевого пузыря или головного мозга с транслокацией FGFR3-TACC3.
В частности, соединения могут применяться при лечении множественной миеломы с положительной транслокацией t(4;14).
Согласно одному варианту осуществления соединения могут быть применимы для лечения саркомы. Согласно одному варианту осуществления соединения применимы для лечения рака легкого, например, плоскоклеточной карциномы.
Так как соединения обладают активностью в отношении FGFR2, они могут применяться при лечении форм рака эндометрия, яичника, желудка, печеночно-клеточного рака, рака матки, шейки матки и рака толстой и прямой кишок. FGFR2 также сверхэкспрессируется при эпителиальном раке яичника, поэтому соединения настоящего изобретения могут специально применяться при лечении рака яичника, такого как эпителиальный рак яичника.
Согласно одному варианту осуществления соединения могут быть применимы для лечения рака легкого, в частности, NSCLC (немелкоклеточного рака легкого), плоскоклеточной карциномы, рака печени, рака почки, рака молочной железы, рака толстой кишки, рака толстой и прямой кишок, рака предстательной железы.
Формы рака могут представлять собой формы рака, которые чувствительны к ингибированию любого одного или нескольких FGFR, выбранных из FGFR1, FGFR2, FGFR3, FGFR4, например, одного или нескольких FGFR, выбранных из FGFR1, FGFR2 или FGFR3.
Является или не является конкретный тип рака чувствительным к ингибированию сигнального пути FGFR, можно определить с помощью анализа клеточного роста, изложенного ниже, или с помощью метода, изложенного в разделе, озаглавленном "Способы диагностирования".
Соединения данного изобретения могут быть особенно полезны при лечении или профилактике раковых заболеваний такого типа, который связан с или характеризуется повышенными уровнями FGFR.
Соединения согласно настоящему изобретению могут быть применимы в лечении других состояний, которые являются результатом нарушений пролиферации, таких как сахарный диабет II типа или инсулиннезависимый сахарный диабет, аутоимунные заболевания, травма головы, инсульт, эпилепсия, нейродегенеративные заболевания, такие как болезнь Альцгеймера, заболевание двигательных нейронов, прогрессирующий надъядерный паралич, кортико-базальная дегенерация и болезнь Пика, например, аутоимунные заболевания и нейродегенеративные заболевания.
Одна подгруппа болезненных состояний и патологических состояний, при которых могут применяться соединения настоящего изобретения, состоит из воспалительных заболеваний, сердечно-сосудистых заболеваний и заживления ран.
Также известно, что FGFR участвует в апоптозе, ангиогенезе, пролиферации, дифференцировке и транскрипции, и, таким образом, соединения согласно настоящему изобретению также могут быть пригодны в лечении следующих заболеваний, отличных от рака; хронических воспалительных заболеваний, например, системной красной волчанки, опосредованного аутоиммунным ответом гломерулонефрита, ревматоидного артрита, псориаза, воспалительного заболевания кишечника, аутоиммунного сахарного диабета, реакций гиперчувствительности в виде экземы, астмы, COPD, ринита и заболеваний верхних дыхательных путей; сердечно-сосудистых заболеваний, например, гипертрофии сердца, рестеноза, атеросклероза; нейродегенеративных нарушений, например, болезни Альцгеймера, СПИД-ассоциированной деменции, болезни Паркинсона, бокового амиотрофического склероза, пигментного ретинита, спинальной мышечной атрофии и мозжечковой дегенерации; гломерулонефрита; миелодиспластических синдромов, инфаркта миокарда, ассоциированного с ишемическим повреждением, инсульта и реперфузионного повреждения, аритмии, атеросклероза, вызванных токсинами или связанных со злоупотреблением алкоголя заболеваний печени, заболеваний органов кроветворения, например, хронической анемии и апластической анемии; дегенеративных заболеваний опорно-двигательной системы, например, остеопороза и артрита, чувствительного к аспирину риносинусита, муковисцидоза, рассеянного склероза, заболеваний почек и ассоциированной с раковым заболеванием боли.
Кроме того, мутации FGFR2 связаны с рядом тяжелых нарушений развития скелета человека, и, таким образом, соединения настоящего изобретения могли бы применяться при лечении нарушений развития скелета человека, включая аномальную оссификацию швов черепа (краниосиностоз), синдром Аперта (AP), синдром Крузона, синдром Джексона-Вейсса, синдром Биара-Стивенсона складчатой кожи и синдром Пфеффера.
Соединение настоящего изобретения, обладающее ингибирующей активностью в отношении FGFR, таких как FGFR2 или FGFR3, может быть особенно применимо при лечении или предупреждении заболеваний скелета. В частности, заболеваниями скелета являются ахондроплазия или танатофорная карликовость (также известная как танатофорная дисплазия).
Соединение настоящего изобретения, способное ингибировать FGFR, такой как FGFR1, FGFR2 или FGFR3, может быть особенно применимо при лечении или предупреждении патологий, при которых симптомом является прогрессирующий фиброз. Фиброзные состояния, при лечении которых могут применяться соединения настоящего изобретения, включают в себя заболевания, характеризующиеся аномальным или избыточным отложением фиброзной ткани, например при циррозе печени, гломерулонефрите, фиброзе легких, системном фиброзе, ревматоидном артрите, а также при естественном процессе заживления ран. В частности, соединения настоящего изобретения также могут быть применимы в лечении фиброза легких, в частности, идиопатического фиброза легких.
Сверхэкспрессия и активация FGFR и VEGFR в связанной с опухолью сосудистой системе позволяет предположить возможность использования соединений настоящего изобретения для предотвращения и блокирования инициирования опухолевого ангиогенеза. В частности, соединения настоящего изобретения могут применяться при лечении рака, метастазирования, лейкозов, таких как CLL, глазных заболеваний, таких как возрастная макулярная дистрофия, в частности, влажная форма возрастной макулярной дистрофии, ишемических пролиферативных ретинопатий, таких как ретинопатия недоношенных (ROP) и диабетическая ретинопатия, ревматоидного артрита и гемангиомы.
Активность соединений данного изобретения в качестве ингибиторов FGFR1-4, в частности, FGFR3 с точковой мутацией, таких как, например, FGFR3 V555L и FGFR3 V555M, можно измерять с помощью анализов, описанных ниже в примерах, а уровень активности, проявляемой данным соединением, может быть определен по значению IC50. Предпочтительными соединениями настоящего изобретения являются соединения, имеющие значение IC50 меньше 1 мкМ, более предпочтительно - меньше 0,1 мкМ, или меньше 0,01 мкМ, или меньше 0,001 мкМ.
Настоящее изобретение относится к соединениям, которые обладают ингибирующей или модулирующей активностью в отношении FGFR и которые могут применяться в предупреждении или лечении болезненных состояний или патологических состояний, опосредованных киназами FGFR.
Согласно одному варианту осуществления представлено соединение, определенное в данном документе для применения в терапии, для применения в качестве лекарства. Согласно следующему варианту осуществления представлено соединение, определенное в данном документе для применения в профилактике или лечении, в частности, в лечении болезненного состояния или состояния, опосредованного киназой FGFR.
Таким образом, например, соединения данного изобретения можно применять для облегчения или снижения частоты случаев заболевания раком. Таким образом, согласно следующему варианту осуществления представлено соединение, определенное в данном документе, для применения в профилактике или лечении, в частности, в лечении, рака. Согласно одному варианту осуществления соединение, определенное в данном документе, предназначено для применения в профилактике или лечении, особенно в лечении зависимого от FGFR рака. Согласно одному варианту осуществления соединение, определенное в данном документе, предназначено для применения в профилактике или лечении, особенно в лечении рака, опосредованного киназами FGFR.
Следовательно, настоящее изобретение относится, в том числе, к:
- Способу профилактики или лечения болезненного состояния или состояния, опосредованного киназой FGFR, при этом способ включает в себя введение субъекту, нуждающемуся в этом, соединения формулы (I), определенного в данном документе.
- Способу профилактики или лечения болезненного состояния или состояния, описываемых в настоящем документе, при этом способ включает в себя введение субъекту, нуждающемуся в этом, соединения формулы (I), определенного в данном документе.
- Способу профилактики или лечения рака, при этом способ включает в себя введение субъекту при необходимости этого соединения формулы (I), определенного в данном документе.
- Способу облегчения или уменьшения частоты возникновения болезненного состояния или состояния, опосредованного киназой FGFR, при этом способ включает в себя введение субъекту, нуждающемуся в этом, соединения формулы (I), определенного в данном документе.
- Способу ингибирования киназы FGFR, при этом способ включает в себя введение в контакт киназы с ингибирующим киназу соединением формулы (I), определенным в данном документе.
- Способу модулирования клеточного процесса (например, клеточного деления) путем ингибирования активности киназы FGFR с использованием соединения формулы (I), определенного в данном документе.
- Соединению формулы (I), определенному в данном документе, для применения в качестве модулятора клеточного процесса (например, клеточного деления) путем ингибирования активности киназы FGFR.
- Соединению формулы (I), определенному в данном документе, для применения в профилактике или лечении рака, в частности, лечения рака.
- Соединению формулы (I), определенному в данном документе, для применения в качестве модулятора (например, ингибитора) FGFR.
- Применению соединения формулы (I), определенного в данном документе, для изготовления лекарственного препарата для профилактики или лечения, особенно в лечении болезненного состояния или состояния, опосредованного киназой FGFR, при этом соединение соответствует формуле (I), определенной в данном документе.
- Применению соединения формулы (I), определенного в данном документе, для изготовления лекарственного препарата для профилактики или лечения болезненного состояния или состояния, как описано в данном документе.
- Применению соединения формулы (I), определенного в данном документе, для изготовления лекарственного препарата для профилактики или лечения, в частности, лечения рака.
- Применению соединения формулы (I), определенного в данном документе, для изготовления лекарственного препарата для модулирования (например, ингибирования) активности FGFR.
- Применению соединения формулы (I), определенного в данном документе, для изготовления лекарственного препарата для модулирования клеточного процесса (например, клеточного деления) путем ингибирования активности киназы FGFR.
- Применению соединения формулы (I), определенного в данном документе, для изготовления лекарственного препарата для профилактики или лечения заболевания или состояния, характеризующегося повышающей регуляцией киназы FGFR (например, FGFR1, или FGFR2, или FGFR3, или FGFR4).
- Применению соединения формулы (I), определенного в настоящем документе, для изготовления лекарственного препарата для профилактики или лечения рака, при этом раком является рак, характеризующийся повышающей регуляцией киназы FGFR (например, FGFR1, или FGFR2, или FGFR3, или FGFR4).
- Применению соединения формулы (I), определенного в настоящем документе, для изготовления лекарственного препарата для профилактики или лечения рака у пациента, выбранного из подгруппы населения, несущей в себе генные нарушения в киназе FGFR3.
- Применению соединения формулы (I), определенного в настоящем документе, для изготовления лекарственного препарата для профилактики или лечения рака у пациента, которого диагностировали как составляющего часть подгруппы населения, несущей в себе генные нарушения в киназе FGFR3.
- Способу профилактики или лечения заболевания или состояния, характеризующегося повышающей регуляцией киназы FGFR (например, FGFR1, или FGFR2, или FGFR3, или FGFR4), при этом способ включает в себя введение соединения формулы (I), определенного в данном документе.
- Способу облегчения или уменьшения частоты возникновения заболевания или состояния, характеризующегося повышающей регуляцией киназы FGFR (например, FGFR1, или FGFR2, или FGFR3, или FGFR4), при этом способ включает в себя введение соединения формулы (I), определенного в данном документе.
- Способу профилактики или лечения (или облегчения, или уменьшения частоты возникновения) рака у пациента, страдающего или предположительно страдающего раком; при этом способ включает в себя (i) проведение диагностического теста у пациента с целью выявления у пациента генных нарушений в гене FGFR3; и (ii) если у пациента обнаружен указанный вариант, то введение пациенту соединения формулы (I), определенного в данном документе, обладающего активностью ингибирования киназы FGFR3.
- Способу профилактики или лечения (или облегчения, или уменьшения частоты возникновения) болезненного состояния или состояния, характеризующегося повышающей регуляцией киназы FGFR (например, FGFR1, или FGFR2, или FGFR3, или FGFR4); при этом способ включает в себя (i) проведение диагностического теста у пациента с целью выявления маркерной характеристики повышающей регуляции киназы FGFR (например, FGFR1, или FGFR2, или FGFR3, или FGFR4); и (ii) если диагностический тест указывает на повышающую регуляцию киназы FGFR, то введение пациенту соединения формулы (I), определенного в данном документе, обладающего активностью ингибирования киназы FGFR3.
Согласно одному варианту осуществления заболеванием, опосредованным киназами FGFR, является онкологическое заболевание (например, рак). Согласно одному варианту осуществления заболеванием, опосредованным киназами FGFR, является не связанное с онкологией заболевание (например, любое заболевание, раскрываемое в данном документе, за исключением рака). Согласно одному варианту осуществления заболеванием, опосредованным киназами FGFR, является состояние, описываемое в данном документе. Согласно одному варианту осуществления заболеванием, опосредованным киназами FGFR, является скелетное состояние, описываемое в данном документе. Конкретные аномалии в развитии скелета человека включают в себя аномальную оссификацию швов черепа (краниосиностоз), синдром Аперта (AP), синдром Крузона, синдром Джексона-Вейсса, синдром пахидермии складчатой Бира-Стивенсона, синдром Пфейффера, ахондроплазию и танатофорную карликовость (также известную как танатофорная дисплазия).
Мутировавшие киназы
Как отмечается здесь и выше, мутации киназы, приводящие к ее устойчивости к воздействию лекарственных средств, могут возникать у групп пациентов, подвергавшихся лечению ингибиторами киназы. Мутации происходят частично в областях белка, которые связываются или взаимодействуют с конкретным ингибитором, применяемым при терапии. Такие мутации понижают или повышают способность ингибитора связывать и ингибировать соответствующую киназу. Это может происходить в любом из аминокислотных остатков, которые взаимодействуют с ингибитором или которые являются важными для обеспечения связывания указанного ингибитора с целью. Ингибитор, который связывает целевую киназу без необходимости взаимодействия с мутированным аминокислотным остатком, по-видимому, не будет подвержен воздействию мутации и будет оставаться эффективным ингибитором данного фермента.
Исследование образцов от пациентов с раком желудка показало присутствие двух мутаций в FGFR2 - Ser167Pro в экзоне IIIa и мутации сайта сплайсинга 940-2A-G в экзоне IIIc. Эти мутации тождественны генеративным активирующим мутациям, которые вызывают синдромы краниосиностоза и были обнаружены в 13% исследованных тканей первичного рака желудка. Кроме того, активирующие мутации в FGFR3 были обнаружены у 5% тестируемых образцов от пациентов, и сверхэкспрессия FGFR коррелировала с неблагоприятным прогнозом в этой группе пациентов.
Кроме того, существуют хромосомные транслокации или точковые мутации, обнаруженные в FGFR, что обуславливает приобретения функции, сверхэкспресию или конститутивно активные биологические состояния.
Таким образом, соединения настоящего изобретения найдут конкретное применение, связанное с формами рака, при которых экспрессируется мутантная молекулярная цель, такая как FGFR. Диагностирование опухолей с мутациями может быть осуществлено с использованием методик, известных специалисту в данной области и описываемых в настоящем документе, таких как RT-PCR и FISH.
Было сделано предположение, что мутации консервативного остатка треонина в сайте связывания АТФ FGFR могут быть причиной устойчивости к действию ингибитора. Аминокислоту валин 561 мутировали в метионин в FGFR1, что соответствует ранее описанным мутациям, обнаруженным в Abl (T315) и EGFR (T766), которые, как было показано, вызывают устойчивость к действию селективных ингибиторов. Данные анализа для V561M FGFR1 показали, что эта мутация вызывала устойчивость к действию ингибитора тирозинкиназы в отличие от немутантного типа. Другими обнаруженными мутациями являются мутации привратника FGFR3 V555L/V555M, FGFR1 V561M, FGFR2 V564F/V564I/V564M и FGFR4 V550L. Соединения данного изобретения специфически активны против мутаций привратника, в частности против FGFR3 V555L, FGFR3 V555M, FGFR1 V561M и FGFR2 V564I, особенно против FGFR3 V555L и FGFR3 V555M.
Соединения настоящего изобретения могут быть применимы для лечения взрослой группы населения. Соединения настоящего изобретения могут быть применимы для лечения детской группы населения.
Способы диагностирования
Перед введением соединения формулы (I) пациент может пройти скрининговое исследование, которое определяет, является ли заболевание или состояние, которым страдает или может страдать пациент, тем заболеванием, которое может быть подвержено лечению соединением, обладающим активностью против FGFR, в частности, против FGFR, несущего в себе точковые мутации, в частности, мутации привратника FGFR, такие как, например, FGFR3 V555L, FGFR3 V555M, FGFR1 V561M и FGFR2 V564I, в частности, FGFR3 V555L и FGFR3 V555M.
Например, биологический образец, взятый у пациента, можно проанализировать с целью определения, является ли состояние или заболевание, такое как рак, которым страдает или может страдать пациент, тем состоянием или заболеванием, которое характеризуется генетической аномалией или аномальной экспрессией белка, что приводит к повышающей регуляции уровней FGFR или его активности, или к сенсибилизации сигнального пути к нормальной активности FGFR, или к повышающей регуляции этих сигнальных путей фактора роста, такой как уровни лиганда фактора роста или активность лиганда фактора роста, или к повышающей регуляции активации биохимического пути после FGFR.
Примеры таких аномалий, которые приводят к активации или сенсибилизации сигнала FGFR, включают в себя потерю или ингибирование апоптозных путей, повышающую регуляцию рецепторов или лигандов или присутствие мутантных вариантов рецепторов или лигандов, например, вариантов PTK. Опухоли с мутантами FGFR1, FGFR2 или FGFR3, или FGFR4, или с повышенной регуляцией, в частности, со сверхэкспрессией FGFR1, или мутантами FGFR2 или FGFR3 с приобретенной функцией, могут быть особенно чувствительны к ингибиторам FGFR.
Например, при ряде состояний были идентифицированы точковые мутации, порождающие приобретенную функцию в FGFR2. В частности, активирующие мутации в FGFR2 были идентифицированы в 10% эндометриальных опухолей.
Кроме того, были выявлены генные нарушения в рецепторе тирозинкиназы FGFR3, такие как хромосомные транслокации или точковые мутации, приводящие к эктопическим экспрессированным или разрегулированным, конститутивно активным рецепторам FGFR3, и обнаружена их связь с подгруппой множественных миелом, карцином мочевого пузыря и шейки матки. Конкретная мутация T674I рецептора PDGF была идентифицирована у пациентов, подвергавшихся лечению иматинибом. Кроме того, амплификация гена 8p12-p11.2 была выявлена в ~50% случаев лобулярного рака молочной железы (CLC), и было показано, что это связано с повышенной экспрессией FGFR1. Предварительные исследования с siRNA, направленной против FGFR1, или с низкомолекулярным ингибитором рецептора показали, что клеточные линии, в которых происходит эта амплификация, являются особенно чувствительными к ингибированию этого сигнального пути.
В качестве альтернативы, взятый у пациента биологический образец может быть подвергнут анализу на предмет потери отрицательного регулятора или суппрессора FGFR. В настоящем контексте термин "потеря" охватывает делецию гена, кодирующего регулятор или суппрессор, усечение гена (например, путем мутации), усечение продуктов транскрипции гена или инактивацию продукта транскрипции (например, в результате точковой мутации) или секвестрование другим генным продуктом.
Термин повышающая регуляция включает повышенную экспрессию или сверхэкспрессию, включающую амплификацию гена (т. е. множество копий генов) и повышенную экспрессию в результате транскрипционного эффекта, и гиперактивность и активацию, в том числе активацию в результате мутаций. Таким образом, пациент может быть подвергнут диагностическому тесту с целью обнаружения маркерной характеристики повышающей регуляции FGFR. Термин диагностирование включает в себя скрининговое исследование. Под маркером авторы настоящего изобретения понимают генетические маркеры, включая, например, определение состава ДНК для идентификации мутаций FGFR. Термин маркер также включает в себя маркеры, которые являются характеристиками повышающей регуляции FGFR, включая ферментную активность, уровни фермента, состояние фермента (например, фосфорилированный или нет) и уровни mRNA упомянутых выше белков.
Диагностические тесты и скрининговые исследования обычно проводят на биологическом образце, выбранном из образцов биопсии опухоли, образцов крови (выделение и обогащение сбрасываемых опухолевых клеток), биопсии экскрементов, слюны, хромосомного анализа, плевральной жидкости, перитонеальной жидкости, буккальных соскобов, биопсии или мочи.
Способы идентификации и анализа мутаций и повышающей регуляции белков известны специалисту в данной области. Способы скринингового исследования могут предусматривать без ограничения стандартные способы, такие как полимеразная цепная реакция с обратной транскриптазой (RT-PCR) или гибридизация in-situ, такая как флуоресцентная гибридизация in situ (FISH).
Идентификация пациента, имеющего мутацию в FGFR, у может означать, что для пациента может быть особенно подходящим лечение с помощью ингибитора FGFR. Предпочтительно перед началом лечения проводить скрининг опухоли на выявление варианта FGFR. В процессе скринингового исследования, как правило, проводят прямое секвенирование, анализ олигонуклеотида на микрочипах или применяют специфическое в отношении мутанта антитело. Кроме того, диагностирование опухолей с такими мутациями может быть осуществлено с использованием методик, известных специалисту в данной области и описываемых в данном документе, таких как RT-PCR и FISH.
Кроме того, мутантные формы, например, FGFR, можно идентифицировать путем прямого секвенирования, например, образцов биопсии опухолей с помощью ПЦР и способов секвенирования ПЦР-продуктов, описываемых выше. Для специалиста в данной области будет очевидным, что в данном случае могут быть применимы все эти хорошо известные методики выявления сверхэкспрессии, активации или мутаций упомянутых выше белков.
При скрининговом исследовании с помощью RT-PCR уровень mRNA в опухоли оценивают путем создания cDNA-копии mRNA, а затем амплификации cDNA с помощью ПЦР. Способы ПЦР-амплификации, выбор праймеров и условий для амплификации известны специалисту в данной области. Манипуляции с нуклеиновой кислотой и ПЦР проводят с помощью стандартных способов, описанных, например, в Ausubel, F.M. et al., eds. (2004) Current Protocols in Molecular Biology, John Wiley & Sons Inc. или Innis, M.A. et al., eds. (1990) PCR Protocols: a guide to methods and applications, Academic Press, San Diego. Реакции и манипуляции, предусмотренные методиками, связанными с нуклеиновыми кислотами, также описываются в Sambrook et al., (2001), 3rd Ed, Molecular Cloning: A Laboratory Manual, Cold Spring Harbor Laboratory Press. В качестве альтернативы может быть использован коммерчески доступный набор для RT-PCR (например, Roche Molecular Biochemicals) или методика, описанная в патентах Соединенных Штатов Америки №№ 4666828, 4683202, 4801531, 5192659, 5272057, 5882864 и 6218529 и включенная в настоящий документ посредством ссылки. Примером методики гибридизации in situ для оценки экспрессии mRNA является флуоресцентная гибридизация in situ (FISH) (см. Angerer (1987) Meth. Enzymol., 152: 649).
Обычно гибридизация in situ включает в себя следующие основные стадии: (1) фиксацию анализируемой ткани; (2) обработку образца перед гибридизацией для повышения доступности целевой нуклеиновой кислоты и для снижения неспецифического связывания; (3) гибридизацию смеси нуклеиновых кислот с нуклеиновой кислотой в биологической структуре или ткани; (4) промывку после гибридизации для удаления фрагментов нуклеиновой кислоты, не связанных при гибридизации, и (5) выявление гибридизированных фрагментов нуклеиновой кислоты. Используемые для таких путей применения зонды обычно метят, например, с помощью радиоизотопов или флуоресцентных репортеров. Предпочтительные зонды являются достаточно длинными, например, от примерно 50, 100 или 200 нуклеотидов до примерно 1000 или больше нуклеотидов, что позволяет осуществлять специфическую гибридизацию с целевой нуклеиновой кислотой(-ами) в жестких условиях. Стандартные способы проведения FISH описаны в Ausubel, F.M. et al., eds. (2004) Current Protocols in Molecular Biology, John Wiley & Sons Inc and Fluorescence In Situ Hybridization: Technical Overview by John M. S. Bartlett in Molecular Diagnosis of Cancer, Methods and Protocols, 2nd ed.; ISBN: 1-59259-760-2; March 2004, pps. 077-088; Series: Methods in Molecular Medicine.
Способы анализа экспрессии генов описаны в (DePrimo et al. (2003), BMC Cancer, 3:3). В нескольких словах, протокол является следующим: двухнитевую cDNA синтезируют из тотальной РНК с использованием олигомера (dT)24 для инициирования синтеза первой спирали cDNA, затем синтеза второй спирали cDNA со случайными гексамерными праймерами. Двухнитевую cDNA используют в качестве матрицы для транскрипции cRNA in vitro с использованием биотинилированных рибонуклеотидов. cRNA химически фрагментируют в соответствии с протоколами, описанными у Affymetrix (Santa Clara, Калифорния, США), а затем гибридизируют в течение ночи на матрицах генома человека.
В качестве альтернативы белковые продукты, экспрессированные из mRNA, можно анализировать с помощью иммуногистохимического исследования образцов опухолей, твердофазного иммунологического анализа на микротитровальных планшетах, вестерн-блоттинга, двухмерного электрофореза в SDS-полиакриламидном геле, ELISA, проточной цитометрии и других известных в технике способов выявления специфических белков. Способы выявления могут предусматривать применение сайт-специфических антител. Для специалиста в данной области очевидно, что в данном случае для выявления повышенной регуляции FGFR или выявления вариантов или мутантов FGFR могут применяться все эти хорошо известные методики.
Аномальные уровни белков, таких как FGFR, можно измерять с помощью стандартных ферментных анализов, например, таких как описаны в данном документе. Активация или сверхэкспрессия может также быть выявлена в образце ткани, например, ткани опухоли, путем измерения активности тирозинкиназы анализом, например, разработанным компанией Chemicon International. Представляющая интерес тирозинкиназа может быть иммунопреципитирована из лизата образца, а ее активность измерена.
Альтернативные способы измерения сверхэкспрессии или активации FGFR, включая их изоформы, включают измерение плотности микрососудов. Она может, например, быть измерена с помощью способов, описанных у Orre and Rogers (Int J Cancer (1999), 84(2) 101-8).
Следовательно, все эти методики могут также быть использованы для идентификации опухолей, в частности, подходящих для лечения с помощью соединений данного изобретения.
Соединения настоящего изобретения применяются, в частности, для лечения пациента с мутировавшим FGFR. Мутация G697C в FGFR3 наблюдается в 62% случаев плоскоклеточного рака полости рта и вызывает конститутивную активацию активности киназы. Активирующие мутации FGFR3 были также идентифицированы в случаях карциномы мочевого пузыря. Эти мутации были 6 видов с различными степенями распространенности: R248C, S249C, G372C, S373C, Y375C, K652Q. Кроме того, было обнаружено, что полиморфизм Gly388Arg в FGFR4 ассоциируется с повышенной частотой возникновения и агрессивностью рака предстательной железы, толстой кишки, легкого, печени (HCC) и молочной железы. Соединения данного изобретения особенно применимы для лечения пациента с транслокацией FGFR3-TACC3.
Поэтому дополнительный аспект данного изобретения относится к применению соединения в соответствии с данным изобретением для изготовления лекарственного препарата для лечения или профилактики болезни или состояния у пациента, который прошел скрининговое исследование, и у которого было обнаружено заболевание или состояние или риск его возникновения, которое будет чувствительно к лечению соединением, действующим против FGFR.
Конкретные мутации, для обнаружения которых пациент проходит скрининговое исследование, включают в себя мутации G697C, R248C, S249C, G372C, S373C, Y373C, K652Q в FGFR3 и полиморфизм Gly388Arg в FGFR4, в частности, FGFR3 R248C, FGFR3 S249C, FGFR3 G370C или FGFR3 Y373C.
Конкретные мутации, для обнаружения которых пациент проходит скрининговое исследование, включают, в частности, мутации привратника FGFR. Мутации привратника включают FGFR3 V555L/V555M, FGFR1 V561M, FGFR2 V564F/V564I/V564M и FGFR4 V550L. Конкретные мутации, для обнаружения которых пациент проходит скрининговое исследование, включают FGFR3 V555L, FGFR3 V555M, FGFR1 V561M и FGFR2 V564I, в частности, FGFR3 V555L и FGFR3 V555M.
Другой аспект данного изобретения включает соединение данного изобретения для применения в профилактике или лечении рака у пациента, выбранного из субпопуляции, несущей в себе вариант гена FGFR (например, мутацию G697C в FGFR3 и полиморфизм Gly388Arg в FGFR4).
Соединения данного изобретения особенно применимы в лечении пациента, у которого выявлено слияние или транслокация FGFR, в частности, FGFR3:TACC3 v1; FGFR3:TACC3 v3; FGFR3:TACC3 Intron; FGFR3:BAIAP2L1; FGFR2:AFF3; FGFR2:BICC1; FGFR2:CASP7; FGFR2:CCDC6; и FGFR2:OFD1. Используются следующие сокращения: FGFR (рецептор фактора роста фибробластов); FGFR3: TACC3 (слияние генов, кодирующих FGFR3 и трансформирующий кислотный белок 3, содержащий суперспираль); FGFR3: BAIAP2L1 (слияние генов, кодирующих FGFR3 и белок 1, подобный белку 2, ассоциированному со специфичным для мозга ингибитором 1 ангиогенеза); FGFR2: AFF3 (слияние генов, кодирующих FGFR2 и член 3 семейства AF4/FMR2); FGFR2: BICC1 (слияние генов, кодирующих FGFR2 и бикаудальный C-гомолог 1); FGFR2: CASP7 (слияние генов, кодирующих FGFR2 и каспазу 7); FGFR2:CCDC6 (слияние генов, кодирующих FGFR2 и белок 6, содержащий домен суперспирали); FGFR2:OFD1 (слияние генов, кодирующих FGFR2 и белок 1 ротопальцелицевого дизостоза).
Фармацевтические композиции и комбинации
С учетом их полезных фармакологических свойств и для целей введения представленные соединения можно составлять в различные фармацевтические формы.
Согласно одному варианту осуществления фармацевтическая композиция (например, состав) содержит по меньшей мере одно активное соединение данного изобретения вместе с фармацевтически приемлемым носителем, вспомогательными средствами, формообразующими, разбавителями, наполнителями, буферами, стабилизаторами, консервантами, смазывающими средствами или другими материалами, хорошо известными специалистам в данной области техники, и, необязательно, с другими терапевтическими или профилактическими средствами.
Для получения фармацевтических композиций настоящего изобретения эффективное количество соединения настоящего изобретения в качестве активного ингредиента объединяют в однородную смесь с фармацевтически приемлемым носителем, при этом носитель может принимать широкое разнообразие форм в зависимости от формы препарата, необходимого для введения. Фармацевтические композиции могут находиться в любой форме, подходящей для перорального, парентерального, местного, интраназального, офтальмического, ушного, ректального, интравагинального или трансдермального введения. Желательно, чтобы данные фармацевтические композиции были представлены в единичной лекарственной форме, подходящей, предпочтительно для введения пероральным, ректальным, чрескожным путем или путем парентеральной инъекции. Например, при получении композиций в виде лекарственной формы для перорального введения можно использовать любые обычные фармацевтические среды, такие как, например, вода, гликоли, масла, спирты и т.п., в случае жидких препаратов для перорального введения, таких как суспензии, сиропы, эликсиры и растворы; или твердые носители, такие как крахмалы, сахара, каолин, смазывающие вещества, связующие вещества, разрыхлители и т.п., в случае порошков, пилюль, капсул и таблеток.
Вследствие простоты их введения таблетки и капсулы представляют собой наиболее преимущественную стандартную лекарственную форму для перорального введения, в случае которой, несомненно, используют твердые фармацевтические носители. В случае композиций для парентерального введения носитель, как правило, по меньшей мере в значительной степени будет включать стерильную воду, хотя может включать и другие ингредиенты, например, для улучшения растворимости. Например, можно получать инъекционные растворы, в которых носитель представляет собой физиологический раствор, раствор глюкозы или смесь физиологического раствора и раствора глюкозы. Также можно получать суспензии для инъекций, в случае которых можно использовать соответствующие жидкие носители, суспендирующие средства и т. п. В композициях, подходящих для чрескожного введения, носитель необязательно включает средство, повышающее проницаемость, и/или подходящее смачивающее средство, необязательно в комбинации с подходящими добавками любой природы в минимальных пропорциях, при этом добавки не оказывают значительного вредного воздействия на кожу. Указанные добавки могут облегчать введение в кожу и/или могут быть полезными для получения требуемых композиций. Данные композиции можно вводить различными путями, например, посредством трансдермального пластыря, путем точечного нанесения, в виде мази. Особенно предпочтительным является составление вышеупомянутых фармацевтических композиций в виде стандартной лекарственной формы для простоты введения и равномерности дозирования. "Стандартная лекарственная форма", как используется в данном документе, относится к физически дискретным единицам, пригодным в качестве стандартных доз, при этом каждая единица содержит предварительно определенное количество активного ингредиента, рассчитанное для получения необходимого терапевтического эффекта, совместно с требуемым фармацевтическим носителем. Примерами таких стандартных лекарственных форм являются таблетки (в том числе делимые таблетки или таблетки, покрытые оболочкой), капсулы, пилюли, пакеты с порошкообразным продуктом, пластинки, растворы или суспензии для инъекций, чайные ложки с верхом, столовые ложки с верхом и т. п., а также их отдельные кратные количества.
Соединение настоящего изобретения вводят в количестве, достаточном для проявления его противоопухолевой активности или для проявления эффекта ингибирования FGFR.
Специалисты в данной области смогут определить эффективное количество на основе результатов исследований, представленных ниже в данном документе. В целом, предполагается, что терапевтически эффективное количество будет составлять от 0,005 мг/кг до 100 мг/кг массы тела и, в частности, от 0,005 мг/кг до 10 мг/кг массы тела. Может оказаться целесообразным вводить требуемую дозу в виде одной, двух, трех, четырех или более частей дозы с соответствующими интервалами на протяжении дня. Указанные части дозы можно составлять в виде единичных лекарственных форм, например, содержащих от 0,5 до 500 мг, в частности, от 1 мг до 500 мг, более конкретно, от 10 мг до 500 мг активного ингредиента на единичную лекарственную форму.
В зависимости от режима введения фармацевтическая композиция будет предпочтительно содержать массовую долю от 0,05 до 99%, более предпочтительно - от 0,1 до 70%, еще более предпочтительно - от 0,1 до 50% соединения настоящего изобретения и массовую долю от 1 до 99,95%, более предпочтительно - от 30 до 99,9%, еще более предпочтительно - от 50 до 99,9% фармацевтически приемлемого носителя, все процентные соотношения даны, исходя из суммарного веса композиции.
Было обнаружено, что некоторые ингибиторы FGFR могут быть использованы в комбинации с другими противораковыми средствами. Например, может давать положительный эффект объединение ингибитора, который индуцирует апоптоз, с другим средством, которое действует на основе другого механизма, для регулирования клеточного роста, с воздействием таким образом на две из характерных особенностей развития рака. Примеры таких комбинаций изложены ниже.
В качестве другого аспекта настоящего изобретения предусмотрена комбинация соединения по настоящему изобретению с другим противораковым средством, в особенности для применения в качестве медицинского препарата, более конкретно для применения в лечении рака или родственных заболеваний, в частности состояния или заболевания, опосредованного киназой FGFR.
Для лечения вышеуказанных состояний соединения данного изобретения полезно применять в комбинации с одним или несколькими другими медицинскими средствами, более конкретно с другими противораковыми средствами или вспомогательными средствами в терапии рака. Примеры противораковых средств или вспомогательных средств (средств для поддерживающей терапии) включают без ограничения:
- координационные соединения платины, например, цисплатин, необязательно в комбинации с амифостином, карбоплатин или оксалиплатин;
- таксановые соединения, например, паклитаксел, частицы паклитаксела, связанные с белком (Abraxane™), или доцетаксел;
- ингибиторы топоизомеразы I, такие как камптотециновые соединения, например иринотекан, SN-38, топотекан, топотекан hcl;
- ингибиторы топоизомеразы II, такие как противоопухолевые производные эпиподофиллотоксинов или подофиллотоксина, например, этопозид, этопозида фосфат или тенипозид;
- противоопухолевые алкалоиды барвинка, например, винбластин, винкристин или винорелбин;
- противоопухолевые производные нуклеозидов, например, 5-фторурацил, лейковорин, гемцитабин, гемцитабин-HCl, капецитабин, кладрибин, флударабин, неларабин;
- алкилирующие средства, такие как азотистый иприт или нитрозомочевина, например, циклофосфамид, хлорамбуцил, кармустин, тиотепа, мефалан (мелфалан), ломустин, алтретамин, бусульфан, дакарбазин, эстрамустин, ифосфамид необязательно в комбинации с месной, пипоброман, прокарбазин, стрептозоцин, телозоломид, урацил;
- противоопухолевые производные антрациклина, например, даунорубицин, доксорубицин, необязательно в комбинации с дексразоксаном, доксил, идарубицин, митоксантрон, эпирубицин, эпирубицин-HCl, валрубицин;
- молекулы, которые направленно воздействуют на IGF-1-рецептор, например пикроподофилин;
- производные тетракарцина, например тетрокарцин A;
- глюкокортикоиды, например преднизон;
- антитела, например, трастузумаб (антитело к HER2), ритуксимаб (антитело к CD20), гемтузумаб, гемтузумаб-озогамицин, цетуксимаб, пертузумаб, бевацизумаб, алемтузумаб, экулизумаб, ибритумомаб тиуксетан, нофетумомаб, панитумумаб, тозитумомаб, CNTO 328;
- антагонисты эстрогеновых рецепторов, или селективные модуляторы эстрогеновых рецепторов, или ингибиторы синтеза эстрогена, например, тамоксифен, фулвестрант, торемифен, дролоксифен, фаслодекс, ралоксифен или летрозол;
- ингибиторы ароматазы, такие как эксеместан, анастрозол, летразол, тестолактон и ворозол;
- способствующие дифференциации средства, такие как ретиноиды, витамин D или ретиноевая кислота, и средства, блокирующие метаболизм ретиноевой кислоты, (RAMBA), например, аккутан;
- ингибиторы ДНК-метилтрансферазы, например, азацитидин или децитабин;
- антифолаты, например преметрексед динатрия;
- антибиотики, например, антиномицин D, блеомицин, митомицин С, дактиномицин, карминомицин, дауномицин, левамизол, пликамицин, митрамицин;
- антиметаболиты, например, клофарабин, аминоптерин, цитозина арабинозид или метотрексат, азацитидин, цитарабин, флоксуридин, пентостатин, тиогуанин;
- средства, индуцирующие апоптоз, и антиангиогенные средства, такие как ингибиторы Bcl-2, например, YC 137, BH 312, ABT 737, госсипол, HA 14-1, TW 37 или декановая кислота;
- тубулин-связывающие средства, например, комбрестатин, колхицины или нокодазол;
- ингибиторы киназы (например, ингибиторы EGFR (рецептор фактора роста эпителия), MTKI (многоцелевые ингибиторы киназы), ингибиторы mTOR, ингибиторы cmet), например, флавоперидол, иматиниба мезилат, эрлотиниб, гефитиниб, дасатиниб, лапатиниб, лапатиниба дитосилат, сорафениб, сунитиниб, сунитиниба малеат, темсиролимус, 6-{дифтор[6-(1-метил-1H-пиразол-4-ил)[1,2,4]триазоло[4,3-b]пиридазин-3-ил]метил}хинолин или его фармацевтически примелемая соль, 6-[дифтор(6-пиридин-4-ил[1,2,4]триазоло[4,3-b]пиридазин-3-ил)метил]хинолин или его фармацевтически приемлемая соль;
- ингибиторы фарнезилтрансферазы, например, типифарниб;
- ингибиторы гистондеацетилазы (HDAC), например, бутират натрия, субероиланилидгидроксамовая кислота (SAHA), депсипептид (FR 901228), NVP-LAQ824, R306465, JNJ-26481585, трихостатин А, вориностат;
- ингибиторы убиквитин-протеасомного пути, например, PS-341, MLN.41 или бортезомиб;
- йонделис;
- ингибиторы теломеразы, например теломестатин;
- ингибиторы матриксной металлопротеиназы, например батимастат, маримастат, приностат или метастат;
- рекомбинантные интерлейкины, например, альдеслейкин, денилейкин дифтитокс, интерферон-альфа 2а, интерферон-альфа 2b, пегинтерферон-альфа 2b;
- ингибиторы MAPK;
- ретиноиды, например, алитретиноин, бексаротен, третиноин;
- триоксид мышьяка;
- аспарагиназу;
- стероиды, например, дромостанолон пропионат, мегестрол ацетат, нандролон (деканоат, фенпропионат), дексаметазон;
- агонисты или антагонисты гонадотропин-высвобождающего гормона, например, абареликс, гозерелина ацетат, гистрелина ацетат, лейпролида ацетат;
- талидомид, леналидомид;
- меркаптопурин, митотан, памидронат, пегадемаза, пегаспаргаза, расбуриказа;
- миметики BH3, например, ABT-737;
- ингибиторы MEK, например, PD98059, AZD6244, CI-1040;
- аналоги колониестимулирующего фактора, например филграстим, пегфилграстим, сарграмостим; эритропоэтин или его аналоги (например, дарбепоэтин-альфа); интерлейкин-11; опрелвекин; золедронат, золедроновая кислота; фентанил; бисфосфонат; палифермин;
- стероидный ингибитор цитохром P450 17-альфа-гидроксилазы/17,20-лиазы (CYP17), например, абиратерон, абиратерона ацетат;
- антитело, которое блокирует взаимодействие между PD-1 и PD-L1.
Согласно одному варианту осуществления настоящее изобретение относится к комбинации соединения формулы (I), его фармацевтически приемлемой соли или его сольвата, или каких-либо его подгрупп и примеров, и 6-{дифтор[6-(1-метил-1H-пиразол-4-ил)[1,2,4]триазоло[4,3-b]пиридазин-3-ил]метил}хинолина или его фармацевтически приемлемой соли.
Согласно одному варианту осуществления настоящее изобретение относится к комбинации соединения формулы (I), его фармацевтически приемлемой соли или его сольвата, или каких-либо его подгрупп и примеров, и 6-[дифтор(6-пиридин-4-ил[1,2,4]триазоло[4,3-b]пиридазин-3-ил)метил]хинолина или его фармацевтически приемлемой соли.
Согласно одному варианту осуществления настоящее изобретение относится к фармацевтической композиции, содержащей соединение формулы (I), его фармацевтически приемлемую соль или его сольват, или какие-либо его подгруппы и примеры и 6-{дифтор[6-(1-метил-1H-пиразол-4-ил)[1,2,4]триазоло[4,3-b]пиридазин-3-ил]метил}хинолин или его фармацевтически приемлемую соль.
Согласно одному варианту осуществления настоящее изобретение относится к фармацевтической композиции, содержащей соединения формулы (I), его фармацевтически приемлемую соль или его сольват, или какие-либо его подгруппы и примеры, и 6-[дифтор(6-пиридин-4-ил[1,2,4]триазоло[4,3-b]пиридазин-3-ил)метил]хинолин или его фармацевтически приемлемую соль.
Соединения согласно настоящему изобретению также имеют терапевтические применения в повышении чувствительности опухолевых клеток к лучевой терапии и химиотерапии.
Таким образом, соединения согласно настоящему изобретению можно применять в качестве "радиосенсибилизатора" и/или "хемосенсибилизатора", или их можно давать в комбинации с другим "радиосенсибилизатором" и/или "хемосенсибилизатором".
Термин «радиосенсибилизатор», используемый в данном документе, определен как молекула, предпочтительно молекула с низкой молекулярной массой, которую вводят животным в терапевтически эффективных количествах для повышения чувствительности клеток к ионизирующему излучению и/или для повышения эффективности лечения заболеваний, которые поддаются лечению ионизирующим излучением.
Термин «хемосенсибилизатор», используемый в данном документе, определен как молекула, предпочтительно молекула с низкой молекулярной массой, которую вводят животным в терапевтически эффективных количествах для повышения чувствительности клеток к химиотерапии и/или повышения эффективности лечения заболеваний, которые поддаются лечению химиотерапевтическими средствами.
В литературе были предложены несколько механизмов способа действия радиосенсибилизаторов, включающих: радиосенсибилизаторы, приводящие к гипоксии клеток (например, соединения на основе 2-нитроимидазола и соединения, включающие бензотриазина диоксид), имитирующие кислород или, альтернативно, ведущие себя как биовосстанавливающие средства при гипоксии; радиосенсибилизаторы, не приводящие к гипоксии клеток (например, галогенированные пиримидины), могут быть аналогами оснований ДНК и преимущественно включаются в ДНК раковых клеток и, таким образом, способствуют индуцированному облучением разрушению молекул ДНК и/или препятствуют нормальным механизмам репарации ДНК; и различные другие возможные механизмы действия были выдвинуты в качестве гипотезы для радиосенсибилизаторов в лечении заболевания.
Во многих протоколах лечения рака в настоящее время применяют радиосенсибилизаторы совместно с облучением рентгеновскими лучами. Примеры активируемых рентгеновскими лучами радиосенсибилизаторов включают без ограничения следующие: метронидазол, мизонидазол, десметилмизонидазол, пимонидазол, этанидазол, ниморазол, митомицин C, RSU 1069, SR 4233, EO9,
RB 6145, никотинамид, 5-бромдезоксиуридин (BUdR), 5-йоддезоксиуридин (IUdR), бромдезоксицитидин, фтордезоксиуридин (FudR), гидроксимочевина, цисплатин и их терапевтически эффективные аналоги и производные.
При фотодинамической терапии (PDT) видов рака применяют видимый свет в качестве радиационного активатора сенсибилизирующего средства. Примеры фотодинамических радиосенсибилизаторов включают без ограничения следующие: производные гематопорфирина, фотофрин, производные бензопорфирина, этиопорфирин олова, феоборбид-a, бактериохлорофилл-a, нафталоцианины, фталоцианины, фталоцианин цинка и их терапевтически эффективные аналоги и производные.
Радиосенсибилизаторы можно вводить совместно с терапевтически эффективным количеством одного или нескольких других соединений, в том числе без ограничения соединений, которые способствуют включению радиосенсибилизаторов в целевые клетки; соединений, которые контролируют поступление терапевтических средств, питательных веществ и/или кислорода в целевые клетки; химиотерапевтических средств, которые действуют на опухоль с помощью дополнительного облучения или без него; или других терапевтически эффективных соединений для лечения рака или других заболеваний.
Хемосенсибилизаторы можно вводить совместно с терапевтически эффективным количеством одного или нескольких других соединений, в том числе без ограничения соединений, которые обеспечивают включение хемосенсибилизаторов в целевые клетки; соединений, которые контролируют поступление терапевтических средств, питательных веществ и/или кислорода в целевые клетки; химиотерапевтических средств, которые действуют на опухоль, или других терапевтически эффективных соединений для лечения рака или другого заболевания. Было обнаружено, что антагонисты кальция, например верапамил, являются применимыми в комбинации с противоопухолевыми средствами для придания чувствительности к химиотерапии опухолевым клеткам, устойчивым к стандартным химиотерапевтическим средствам, и для усиления эффективности таких соединений в отношении чувствительных к лекарственным средствам злокачественных новообразований.
С учетом их полезных фармакологических свойств компоненты комбинации в соответствии с настоящим изобретением, т. е. одно или несколько других медицинских средств и соединение в соответствии с настоящим изобретением, могут быть составлены в различные фармацевтические формы для целей введения. Компоненты могут быть составлены отдельно в индивидуальные фармацевтические композиции или в единую фармацевтическую композицию, содержащую все компоненты.
Поэтому настоящее изобретение также относится к фармацевтической композиции, содержащей одно или несколько других медицинских средств и соединение в соответствии с настоящим изобретением вместе с фармацевтически приемлемым носителем.
Настоящее изобретение, кроме того, относится к применению комбинации в соответствии с настоящим изобретением в изготовлении фармацевтической композиции для ингибирования роста опухолевых клеток.
Настоящее изобретение также относится к продукту, содержащему в качестве первого активного ингредиента соединение согласно настоящему изобретению и в качестве дополнительного активного ингредиента одно или несколько противораковых средств, в виде комбинированного препарата для одновременного, раздельного или последовательного применения в лечении пациентов, страдающих раком.
Одно или несколько других медицинских средств и соединение в соответствии с настоящим изобретением можно вводить одновременно (например, в отдельных или единичных композициях) или последовательно в произвольном порядке. В последнем случае два или более соединений будут вводиться на протяжении периода, а также в количестве и с помощью способа, которые являются достаточными, чтобы гарантировать достижение преимущественного или синергического эффекта. Следует иметь в виду, что предпочтительный способ и порядок введения, и соответствующие величины доз и схемы для каждого компонента комбинации будут зависеть от конкретного другого медицинского средства и соединения по настоящему изобретению, подлежащих введению, их пути введения, конкретной опухоли, подлежащей лечению, и конкретного хозяина, подлежащего лечению. Оптимальный способ и порядок введения, а также величина доз и схема могут быть легко определены специалистами в данной области техники с применением стандартных способов и с учетом информации, изложенной в данном документе.
Весовое соотношение соединения в соответствии с настоящим изобретением и одного противоракового средства или нескольких других противораковых средств, вводимых в виде комбинации, может быть определено специалистом в данной области техники. Указанное соотношение и точная дозировка и частота введения зависят от конкретного соединения в соответствии с настоящим изобретением и другого противоракового(противораковых) средства(средств), конкретного состояния, подлежащего лечению, тяжести состояния, лечение которого осуществляют, возраста, веса, пола, рациона, времени введения и общего физического состояния конкретного пациента, способа введения, а также других лекарств, которые индивидуум может принимать, как хорошо известно специалистам в данной области техники. Кроме того, очевидно, что эффективное суточное количество можно уменьшать или увеличивать в зависимости от ответа у субъекта, получающего лечение, и/или в зависимости от оценки лечащего врача, назначающего соединения по настоящему изобретению. Конкретное весовое соотношение для данного соединения формулы (I) и другого противоракового средства может находиться в пределах от 1/10 до 10/1, более конкретно - от 1/5 до 5/1, еще более конкретно - от 1/3 до 3/1.
Координационное соединение платины преимущественно вводят в дозе, составляющей от 1 до 500 мг на квадратный метр (мг/м2) площади поверхности тела, например, от 50 до 400 мг/м2, в частности для цисплатина - в дозе, составляющей примерно 75 мг/м2, и для карбоплатина - в дозе, составляющей примерно 300 мг/м2, за курс лечения.
Соединение на основе таксана преимущественно вводят в дозе, составляющей от 50 до 400 мг на квадратный метр (мг/м2) площади поверхности тела, например, от 75 до 250 мг/м2, в частности для паклитаксела - в дозе, составляющей от примерно 175 до 250 мг/м2, и для доцетаксела - в дозе, составляющей от примерно 75 до 150 мг/м2, за курс лечения.
Соединение на основе камптотецина преимущественно вводят в дозе, составляющей от 0,1 до 400 мг на квадратный метр (мг/м2) площади поверхности тела, например от 1 до 300 мг/м2, в частности для иринотекана - в дозе от примерно 100 до 350 мг/м2 и для топотекана - в дозе от примерно 1 до 2 мг/м2, за курс лечения.
Противоопухолевое производное подофиллотоксина преимущественно вводят в дозе, составляющей от 30 до 300 мг на квадратный метр (мг/м2) площади поверхности тела, например, от 50 до 250 мг/м2, в частности для этопозида - в дозе, составляющей от примерно 35 до 100 мг/м2, и для тенипозида - в дозе, составляющей от примерно 50 до 250 мг/м2, за курс лечения.
Противоопухолевый алкалоид барвинка преимущественно вводят в дозе, составляющей от 30 до 300 мг на квадратный метр (мг/м2) площади поверхности тела, в частности для винбластина - в дозе, составляющей от примерно 3 до 12 мг/м2, для винкристина - в дозе, составляющей от примерно 1 до 2 мг/м2, и для винорелбина - в дозе, составляющей от примерно 10 до 30 мг/м2, за курс лечения.
Противоопухолевое нуклеозидное производное предпочтительно вводить в дозе от 200 до 2500 мг на квадратный метр (мг/м2) площади поверхности тела, например, от 700 до 1500 мг/м2, в частности, для 5-FU - в дозе от примерно 200 до 500 мг/м2, для гемцитабина - в дозе от примерно 800 до 45 мг/м2 и для капецитабина - в дозе от примерно 1000 до 2500 мг/м2 за курс лечения.
Алкилирующие средства, такие как азотистый иприт или нитрозомочевина, предпочтительно вводить в дозе от 100 до 500 мг на квадратный метр (мг/м2) площади поверхности тела, например, от 120 до 200 мг/м2, в частности, для циклофосфамида - в дозе от примерно 100 до 500 мг/м2, для хлорамбуцила - в дозе от примерно 0,1 до 0,2 мг/кг, для кармустина - в дозе от примерно 150 до 200 мг/м2 и для ломустина - в дозе от примерно 100 до 150 мг/м2 за курс лечения.
Противоопухолевое производное антрациклина предпочтительно вводить в дозе от 10 до 75 мг на квадратный метр (мг/м2) площади поверхности тела, например, от 15 до 60 мг/м2, в частности, для доксорубицина - в дозе от примерно 40 до 75 мг/м2, для даунорубицина - в дозе от примерно 25 до 45 мг/м2 и для идарубицина - в дозе от примерно 10 до 15 мг/м2, за курс лечения.
Антиэстрогенное средство предпочтительно вводить в дозе от примерно 1 до 100 мг в сутки, в зависимости от конкретного средства и состояния, подлежащего лечению. Тамоксифен предпочтительно вводить перорально в дозе от 5 до 50 мг, предпочтительно - от 10 до 20 мг два раза в сутки, продолжая терапию в течение времени, достаточного для достижения и поддержания терапевтического эффекта. Торемифен предпочтительно вводить перорально в дозе примерно 60 мг, один раз в сутки, продолжая терапию в течение достаточного времени для достижения и поддержания терапевтического эффекта. Анастрозол предпочтительно вводить перорально в дозе примерно 1 мг, один раз в сутки. Дролоксифен предпочтительно вводить перорально в дозе от примерно 20 до 100 мг, один раз в сутки. Ралоксифен предпочтительно вводить перорально в дозе примерно 60 мг один раз в сутки. Эксеместан предпочтительно вводить перорально в дозе примерно 25 мг один раз в сутки.
Антитела предпочтительно вводить в дозе от примерно 1 до 5 мг на квадратный метр (мг/м2) площади поверхности тела или в другой дозе, как известно из уровня техники. Трастузумаб предпочтительно вводить в дозе 1-5 мг на квадратный метр (мг/м2) площади поверхности тела, в частности 2-4 мг/м2, за курс лечения.
Данные дозы можно вводить, например, один раз, два раза или более за курс лечения, который можно повторять, например, каждые 7, 14, 21 или 28 дней.
Соединения формулы (I), его фармацевтически приемлемые аддитивные соли, в частности, фармацевтически приемлемые кислотно-аддитивные соли, и стереоизомерные формы могут обладать ценными диагностическими свойствами, в том плане, что они могут быть использованы для выявления или идентификации образования комплекса между меченым соединением и другими молекулами, пептидами, белками, ферментами или рецепторами.
В способах выявления или идентификации можно применять соединения, которые являются мечеными с помощью средств для мечения, такими как радиоизотопы, ферменты, флуоресцентные вещества, люминесцентные вещества и т.д. Примеры радиоизотопов включают в себя 125I, 131I, 3H и 14C. Ферменты обычно делают детектируемыми путем конъюгации с соответствующим субстратом, который, в свою очередь, катализирует детектируемую реакцию. Примеры таковых включают, например, бета-галактозидазу, бета-глюкозидазу, щелочную фосфатазу, пероксидазу и малатдегидрогеназу, предпочтительно пероксидазу хрена. Люминесцентные вещества включают, например, люминол, производные люминола, люциферин, экворин и люциферазу.
Биологические образцы могут быть определены как ткань организма или жидкости организма. Примерами жидкостей организма являются спинномозговая жидкость, кровь, плазма, сыворотка крови, моча, мокрота, слюна и т. п.
Экспериментальная часть
Некоторые способы получения соединений данного изобретения проиллюстрированы в следующих примерах. Если не указано иное, то все исходные вещества получали от коммерческих поставщиков и применяли без дополнительной очистки.
Если стереоцентр обозначается "RS", то это означает, что получали смесь стереоизомеров с указанным центром, если не указано иное. Стереохимическая конфигурация стереоцентров в некоторых соединениях обозначена "R" или "S", и/или сплошными клиновидными или пунктирными клиновидными связями, указывая на известную абсолютную стереоконфигурацию. В некоторых соединениях, стереохимическая конфигурация в указанном стереоцентре обозначена "R*" или "S*" со связью в виде сплошной линии или со сплошной клиновидной или пунктирной клиновидной связью, обозначая абсолютную стереоконфигурацию в стереоценте, которая не определена, хотя и является абсолютной. Таким образом, стереоцентр, обозначенный S*, означает то, что это абсолютный стереоцентр, но определено, имеет ли он конфигурацию S или конфигурацию R.
Пример 1
Получение соединения 1, соединения 2 и соединения 3
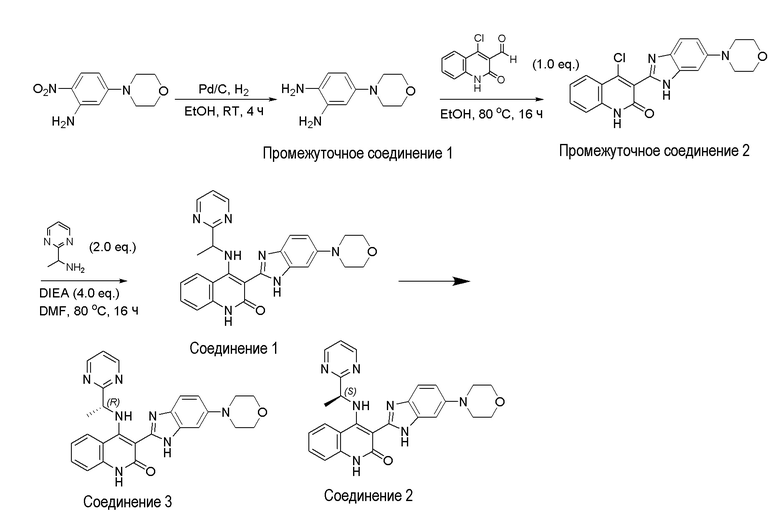
a) Получение промежуточного соединения 1
(4-морфолинобензол-1,2-диамин)
Смесь 5-морфолино-2-нитроанилина (1,0 г, 4,48 ммоль) и 10 (вес.)% палладия на угле (100 мг) в этаноле (50 мл) перемешивали при комнатной температуре под давлением газа водорода из цилиндра в течение 4 часов. Реакционную смесь сразу использовали на следующей стадии без дополнительной очистки. LC-MS (ESI) Общая процедура A, способ 1: RT=0,33 минуты, масса рассч. для C10H15N3O 193,1, масса/заряд найденное значение 194,2 [M+H]+.
b) Получение промежуточного соединения 2
(4-хлор-3-(6-морфолино-1Н-бензо[d]имидазол-2-ил)хинолин-2(1H)-он)
К смеси промежуточного соединения 1 (4-морфолинобензол-1,2-диамина) в этаноле (50 мл) добавляли 4-хлор-2-оксо-1,2-дигидрохинолин-3-карбальдегид (927 мг, 4,48 ммоль) при комнатной температуре. Смесь перемешивали при 80°C под давлением газа кислорода, поступающего из цилиндра, в течение 16 часов. После охлаждения до комнатной температуры смесь фильтровали через подушку из целита. Фильтрат концентрировали при пониженном давлении, получая остаток, который перекристаллизовывали из смеси дихлорметан : петролейный эфир, получая промежуточное соединение 2 (300 мг, выход 17,6%) в виде темного твердого вещества.
LC-MS (ESI) Общая процедура B, способ 1: RT=1,22 минуты, масса рассч. для C20H17ClN4O2380,1, масса/заряд найденное значение 381,0 [M+H]+.
c) Получение соединения 1
(3-(6-морфолино-1Н-бензо[d]имидазол-2-ил)-4-((1-(пиримидин-2-ил)этил)амино)хинолин-2(1H)-он), соединения 3 (R-энантиомер) и соединения 2 (S-энантиомер)
К раствору промежуточного соединения 2 (4-хлор-3-(6-морфолино-1Н-бензо[d]имидазол-2-ил)хинолин-2(1Н)-она) (300 мг, 0,79 ммоль) и N, N-диизопропилэтиламина (0,50 мл, 3,16 ммоль) в N, N-диметилформамиде (2 мл) добавляли 1-(пиримидин-2-ил)этанамин (194 мг, 1,58 ммоль). Смесь перемешивали при 80°C в течение 16 часов. После охлаждения до комнатной температуры реакционную смесь очищали с помощью препаративной ВЭЖХ (колонка: WatersXBridge 30*150 мм 5 мкм, расход: 20 мл/мин, подвижная фаза A: вода (0,1% NH3⋅H2O), подвижная фаза B: ацетонитрил, градиент: 35-55% (%B)). Целевую фракцию собирали и летучие вещества удаляли при пониженном давлении. Водную фазу лиофилизировали, получая соединение 1 (смесь стереоизомеров) (101 мг, выход 27,4%) в виде твердого вещества желтого цвета. Неочищенное соединение дополнительно очищали препаративной SFC (сверхкритической жидкостной (флюидной) хроматографией) (условие разделения: колонка: ChiralPak AD-H Daicel chemical Industries, Ltd, 250*30 мм внутр.диам., 5 мкм; подвижная фаза A: сверхкритический CO2, подвижная фаза B: этанол (0,1% NH3⋅H2O), A:B=60:40 при 50 мл/мин; температура колонки: 38°C; давление сопла: 100 бар; температура сопла: 60°C; температура испарителя: 20°C; температура триммера: 25°C; длина волны: 220 нм) с получением соединения 3 (34,26 мг, выход 33,92%, чистота >99%) и соединения 2 (38,57 мг, выход 38,19%, чистота >99%).
Соединение 2
((S)-3-(6-морфолино-1Н-бензо[d]имидазол-2-ил)-4-((1-(пиримидин-2-ил)этил)амино)хинолин-2(1H)-он)
LC-MS (ESI) Общая процедура A, способ 1: RT=1,19 минуты, масса рассч. для C26H25N7O2 468,2, масса/заряд найденное значение 468,4 [M+H]+.
1H ЯМР (400 МГц, DMSO-d6) Общая процедура A : δ 12,85 (d, J=14,9 Гц, 1H), 12,16 (d, J=8,1 Гц, 0,34H), 12,04 (d, J=8,3 Гц, 0,61H), 11,57 (s, 1H), 8,79 (t, J=4,1 Гц, 2H), 8,06 (d, J=8,5 Гц, 1H), 7,59-7,47 (m, 2H), 7,39-7,22 (m, 3H), 7,10 (t, J=7,8 Гц, 1H), 6,97 (t, J=9,5 Гц, 1H), 5,55 (q, 1H), 3,78 (s, 4H), 3,11 (d, J=4,5 Гц, 4H), 1,76 (t, J=7,3 Гц, 3H).
Соединение 3
((R)-3-(6-морфолино-1Н-бензо[d]имидазол-2-ил)-4-((1-(пиримидин-2-ил)этил)амино)хинолин-2(1H)-он
LC-MS (ESI) Общая процедура B, способ 2 : RT=1,19 минуты, масса рассч. для C26H25N7O2 468,2, масса/заряд найденное значение 468,4 [M+H]+.
1H ЯМР (400 МГц, DMSO-d6) Общая процедура A δ 12,86 (d, J=14,5 Гц, 1H), 12,16 (d, J=8,0 Гц, 0,34H), 12,04 (d, J=8,4 Гц, 0,42H), 11,57 (s, 1H), 8,79 (t, J=4,3 Гц, 2H), 8,06 (d, J=8,6 Гц, 1H), 7,59-7,44 (m, 2H), 7,39-7,21 (m, 3H), 7,11 (t, J=7,6 Гц, 1H), 6,97 (t, J=9,6 Гц, 1H), 5,55 (q, 1H), 3,79 (s, 4H), 3,11 (d, J=2,8 Гц, 4H), 1,76 (t, J=7,3 Гц, 3H).
Другие соединения были получены в соответствии с вышеуказанной процедурой. См. Таблицу 1.
Например, соединение 8a ((S)-3-(6-(4-метилпиперазин-1-ил)-1H-бензо[d]имидазол-2-ил)-4-((1-(пиридин-2-ил))этил)амино)хинолин-2(1Н)-он) и соединение 8b ((R)-3-(6-(4-метилпиперазин-1-ил)-1Н-бензо[d]имидазол-2-ил)- 4-((1-(пиридин-2-ил)этил)амино)хинолин-2(1Н)-он) получали следующим образом:
К раствору4-хлор-3-(6-(4-метилпиперазин-1-ил)-1Н-бензо[d]имидазол-2-ил)хинолин-2(1Н)-она (600 мг, 1,53 ммоль) и N, N-диизопропилэтиламина (0,83 мл, 4,59 ммоль) в N, N-диметилформамиде (5 мл) добавляли 1-(пиридин-2-ил)этанамин (373 мг, 3,06 ммоль). Смесь перемешивали при 80oC в течение 16 часов. После охлаждения до комнатной температуры реакционную смесь очищали с помощью препаративной ВЭЖХ (колонка: WatersXBridge 30*150 мм 5 мкм, расход: 20 мл/мин, подвижная фаза A: вода (0,1% NH3·H2O), подвижная фаза B: ацетонитрил, градиент: 35-55% (%B)). Целевую фракцию собирали и летучие вещества удаляли при пониженном давлении. Водную фазу лиофилизировали, получая соединение 8 (смесь стереоизомеров) (250 мг, выход 34%) в виде твердого вещества желтого цвета. Сырое соединение дополнительно очищали препаративной SFC (условие разделения: колонка: ChiralCel OJ-H Daicel chemical Industries, Ltd, 250*30 мм внутр. диам., 5 мкм; подвижная фаз A: сверхкритический CO2, подвижная фаза B: этанол (0,1% NH3·H2O)A:B =70:30 при 50 мл/мин, A:B=60:40 при 50 мл/мин; температура колонки: 38°C; давление сопла: 100 бар; температура сопла: 60°C; температура испарителя: 20°C; температура триммера: 25°C; длина волны: 220 нм) с получением соединения 8a (89 мг, выход 36%, чистота >99%) и соединения 8b.
Соединение 8a
LC-MS (ESI) Общая процедура A, способ 2 : RT=0,96 минуты, масса рассч. для C28H29N7O 479,24, масса/заряд найденное значение 480,5 [M+H]+.
1H ЯМР (400 МГц, DMSO-d6) Общая процедура A:δ 12,88 (d, J=15,4 Гц, 1H), 12,23 (dd, J=54,1, 8,1 Гц, 1H), 11,57 (s, 1H), 8,54 (s, 1H), 7,97 (d, J=8,4 Гц, 1H), 7,82-7,71 (m, 1H), 7,61-7,43 (m, 3H), 7,34 (d, J=8,1 Гц, 1H), 7,25 (d, J=7,0 Гц, 2H), 7,08 (dd, J=16,7, 8,9 Гц, 1H), 6,96 (t, J=10,2 Гц, 1H), 5,50 (d, J=6,5 Гц, 1H), 3,20-3,10 (m, 4H), 2,51 (s, 4H), 2,24 (s, 3H), 1,79-1,64 (m, 3H).
Например, соединение 30a (S*)-3-(6-морфолино-1H-бензо[d]имидазол-2-ил)-4-((1-(пиримидин-2-ил)пропил)амино)хинолин-2(1H)-он) и соединение 30b (R)-3-(6-морфолино-1H-бензо[d]имидазол-2-ил)-4-((1-(пиримидин-2-ил)пропил)амино)хинолин-2(1Н)-он) получали следующим образом:
К раствору 4-хлор-3-(6-морфолино-1Н-бензо[d]имидазол-2-ил)хинолин-2(1Н)-она (260 мг, 0,68 ммоль) и N, N-диизопропилэтиламина (0,5 мл, 3,03 ммоль) в N, N-диметилэтанамиде (2 мл) добавляли 1-(пиримидин-2-ил)пропан-1-амин (230 мг, 1,33 ммоль). Смесь перемешивали при 100oC в течение 2 часов. После охлаждения до комнатной температуры реакционную смесь очищали с помощью препаративной ВЭЖХ (колонка: WatersXBridge 30*150 мм 5 мкм, расход: 20 мл/мин, подвижная фаза A: вода (0,1% TFA), подвижная фаза B: ацетонитрил, градиент: 35-55% (%B)). Необходимую фракцию собирали и летучие вещества удаляли при пониженном давлении. Водную фазу лиофилизировали, получая соединение 30 (смесь стереоизомеров) (88 мг, выход 26,9%) в виде твердого вещества коричневого цвета. Сырое соединение дополнительно очищали препаративной SFC (условие разделения: колонка: ChiralPak AD-H Daicel chemical Industries, Ltd, 250*30 мм внутр. диам., 5 мкм; подвижная фаза A: сверхкритический CO2, подвижная фаза B: этанол (0,1% диэтиламин), A:B=50:50 при 50 мл/мин; температура колонки: 38°C; давление сопла: 100 бар; температура сопла: 60°C; температура испарителя: 20°C; температура триммера: 25°C; длина волны: 220 нм) с получением соединения 30a в виде соли трифторуксусной кислоты (13,80 мг, выход 15,7%, чистота >99%) и 30b в виде соли трифторуксусной кислоты.
Соединение 30a
LC-MS (ESI) Общая процедура A, способ 2: RT= 1,19 минуты, масса рассч. для C27H27N7O2 481,2, масса/заряд найденное значение 482,4[M+H]+.
1H ЯМР (400 МГц, CD3OD) Общая процедура A: δ8,74 (d, J=4,9, 2H), 8,02 (d, J=8,8, 1H), 7,60-7,00 (m, 7H), 5,28 (t, J=6,4, 1H), 3,93-3,84 (m, 4H), 3,22-3,12 (m, 4H), 2,26-2,13 (m, 2H), 0,97 (t, J=7,3, 3H).
Например, соединение 31a ((S*)-3-(6-морфолино-1H-бензо[d]имидазол-2-ил)-4-((1-(пиримидин-2-ил)бутил)амино)хинолин-2(1H)-он) и соединение 31b ((R*)-3-(6-морфолино-1H-бензо[d]имидазол-2-ил)-4-((1-(пиримидин-2-ил)бутил)амино)хинолин-2(1Н)-он) получали следующим образом:
К раствору 4-хлор-3-(6-морфолино-1Н-бензо[d]имидазол-2-ил)хинолин-2(1Н)-она (200 мг, 0,53 ммоль) и N, N-диизопропилэтиламина (1 мл, 6,06 ммоль) в N, N-диметилэтанамиде (3 мл) добавляли 1-(пиримидин-2-ил)бутан-1-амин (240 мг, 1,59 ммоль). Смесь перемешивали при 100oC в течение 4 часов. После охлаждения до комнатной температуры реакционную смесь очищали с помощью препаративной ВЭЖХ (колонка: WatersXBridge 30*150 мм 5 мкм, расход: 20 мл/мин, подвижная фаза A: вода (0,1% NH3·H2O), подвижная фаза B: ацетонитрил, градиент: 35-55% (%B)). Целевую фракцию собирали и летучие вещества удаляли при пониженном давлении. Водную фазу лиофилизировали, получая соединение 31 (смесь стереоизомеров) (50 мг, выход 19,1%) в виде твердого вещества желтого цвета. Сырое соединение дополнительно очищали препаративной SFC (условие разделения: колонка: ChiralPak AD-H Daicel chemical Industries, Ltd, 250*30 мм внутр.диам., 5 мкм; подвижная фаза A: сверхкритический CO2, подвижная фаза B: этанол (0,1% диэтиламин), A:B=50:50 при 50 мл/мин; температура колонки: 38°C; давление сопла: 100 бар; температура сопла: 60°C; температура испарителя: 20°C; температура триммера: 25°C; длина волны: 220 нм) с получением соединения 31a (6,83 мг, выход 13,7%, чистота >99%) и соединения 31b.
Соединение 31a
LC-MS (ESI) Общая процедура A, способ 2: RT= 1,27 минуты, масса рассч. для C28H29N7O2 495,2, масса/заряд найденное значение 496,4[M+H]+.
1H ЯМР (400 МГц, CD3OD) Общая процедура A : δ 8,74 (d, J=4,8, 2H), 8,01 (d, J=8,2, 1H), 7,61- 6,94 (m, 7H), 5,41-5,31 (m, 1H), 3,94-3,82 (m, 4H), 3,23-3,10 (m, 4H), 2,26-2,02 (m, 2H), 1,51-1,35 (m, 2H), 0,87 (t, J=7,3, 3H).
Например, соединение 32a (S*)-4-((2-метил-1-(пиримидин-2-ил)пропил)амино-3-(6-морфолино-1H-бензо[d]имидазол-2-ил)-4-((1-(пиримидин-2-ил)бутил)амино)хинолин-2(1H)-он) и соединение 31b ((R*)-4-((2-метил-1-(пиримидин-2-ил)пропил)амино-3-(6-морфолино-1H-бензо[d]имидазол-2-ил)-4-((1-(пиримидин-2-ил)бутил)амино)хинолин-2(1Н)-он) получали следующим образом:
К раствору 4-хлор-3-(6-морфолино-1Н-бензо[d]имидазол-2-ил)хинолин-2(1Н)-она (200 мг, 0,53 ммоль) и N, N-диизопропилэтиламина (0,8 мл, 4,85 ммоль) в N, N-диметилэтанамиде (4 мл) добавляли 2-метил-1-(пиримидин-2-ил)пропан-1-амин (240 мг, 1,59 ммоль). Смесь перемешивали при 100oC в течение 3 часов. После охлаждения до комнатной температуры реакционную смесь очищали с помощью препаративной ВЭЖХ (колонка: WatersXBridge 30*150 мм 5 мкм, расход: 20 мл/мин, подвижная фаза A: вода (0,1% NH3·H2O), подвижная фаза B: ацетонитрил, градиент: 35-55% (%B)). Целевую фракцию собирали и летучие вещества удаляли при пониженном давлении. Водную фазу лиофилизировали, получая соединение 32 (смесь стереоизомеров) (30 мг, выход 11,4%) в виде твердого вещества желтого цвета. Сырое соединение дополнительно очищали препаративной SFC (условие разделения: колонка: ChiralPak IC-H Daicel Сhemical Industries, Ltd, 250*30 мм внутр.диам., 5 мкм; подвижная фаза A: сверхкритический CO2, подвижная фаза B: этанол (0,1% диэтиламин), A:B=60:40 при 50 мл/мин; температура колонки: 38°C; давление сопла: 100 бар; температура сопла: 60°C; температура испарителя: 20°C; температура триммера: 25°C; длина волны: 220 нм) с получением соединения 32a (6,34 мг, выход 21,1%, чистота >99%) и соединения 32b.
Соединение 32a
LC-MS (ESI) Общая процедура A, способ 2: RT= 1,28 минуты, масса рассч. для C28H29N7O2 495,2, масса/заряд найденное значение 496,2[M+H]+.
1H ЯМР (400 МГц, CD3OD) Общая процедура A : δ8,87-8,78 (m, 2H), 8,01-7,91 (m, 1H), 7,62-7,46 (m, 2H), 7,42-7,28 (m, 2H), 7,17 (s, 1H), 7,15-7,00 (m, 2H), 5,22-5,15 (m, 1H), 3,98-3,82 (m, 4H), 3,22-3,12 (m, 4H), 2,64-2,49 (m, 1H), 1,06 (d, J=6,8, 3H), 0,84 (d, J=6,7, 3H).
Например, соединение 33a ((S*)-4-((циклопропил(пиримидин-2-ил)метил)амино)-3-(6-морфолино-1H-бензо[d]имидазол-2-ил)хинолин-2(1H)-он) и соединение 33b ((R*)-4-((циклопропил(пиримидин-2-ил)метил)амино-3-(6-морфолино-1H-бензо[d]имидазол-2-ил)хинолин-2(1Н)-он) получали следующим образом:
К раствору 4-хлор-3-(6-морфолино-1Н-бензо[d]имидазол-2-ил)хинолин-2(1Н)-она (200 мг, 0,53 ммоль) и N, N-диизопропилэтиламина (1,0 мл, 6,06 ммоль) в N, N-диметилэтанамиде (3 мл) добавляли циклопропил(пиримидин-2-ил)метанамин (237 мг, 1,59 ммоль). Смесь перемешивали при 100oC в течение 4 часов. После охлаждения до комнатной температуры реакционную смесь очищали с помощью препаративной ВЭЖХ (колонка: WatersXBridge 30*150 мм 5 мкм, расход: 20 мл/мин, подвижная фаза A: вода (0,1% NH3·H2O), подвижная фаза B: ацетонитрил, градиент: 35-55% (%B)). Целевую фракцию собирали и летучие вещества удаляли при пониженном давлении. Водную фазу лиофилизировали, получая соединение 33 (смесь стереоизомеров) (35 мг, выход 13,4%) в виде твердого вещества желтого цвета. Сырое соединение дополнительно очищали препаративной SFC (условие разделения: колонка: ChiralPak AD-H Daicel chemical Industries, Ltd, 250*30 мм внутр.диам., 5 мкм; подвижная фаза A: сверхкритический CO2, подвижная фаза B: этанол (0,1% диэтиламин), A:B=45:55 при 50 мл/мин; температура колонки: 38°C; давление сопла: 100 бар; температура сопла: 60°C; температура испарителя: 20°C; температура триммера: 25°C; длина волны: 220 нм) с получением соединения 33a (9,30 мг, выход 26,7%, чистота >99%) и соединения 33b.
Соединение 33a
LC-MS (ESI) Общая процедура B, способ 2: RT= 1,33 минуты, масса рассч. для C28H27N7O2 493,2, масса/заряд найденное значение 494,3 [M+H]+.
1H ЯМР (400 МГц, CD3OD) Общая процедура A δ8,72 (d, J=4,9,2H), 8,03 (d, J=8,2, 1H), 7,55 (d, J=8,9, 1H), 7,48 (t, J=7,5, 1H), 7,36-7,27 (m, 2H), 7,21 (s, 1H), 7,12 (t, J=7,6, 1H), 7,05 (dd, J=8,8, 1,9, 1H), 4,80 (d, J=8,0, 1H), 3,99-3,79 (m, 4H), 3,22-3,10 (m, 4H), 1,63-1,50 (m, 1H), 0,70-0,58 (m, 1H), 0,58-0,40 (m, 3H).
Пример 1a
Получение соединения 17
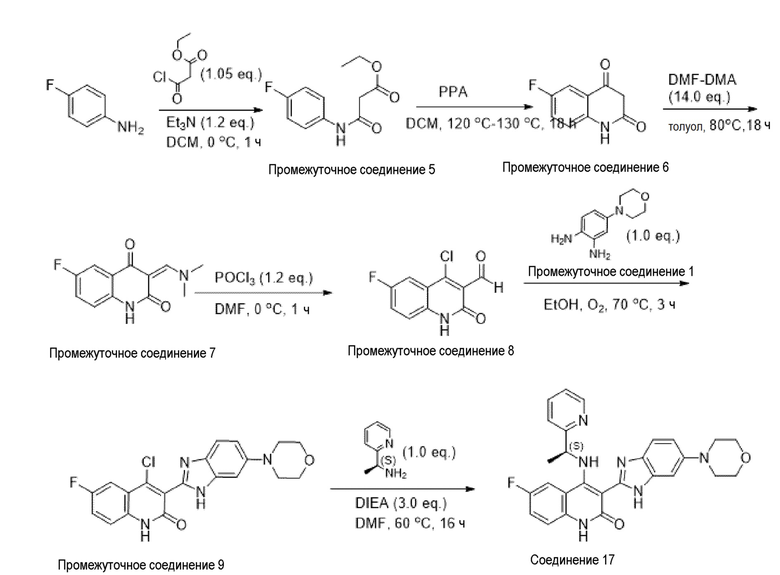
a) Получение промежуточного соединения 5
(этил-3-(4-фторфениламино)-3-оксопропаноата)
К раствору 4-фторанилина (16,65 г, 150 ммоль), триэтиламина (25,1 мл, 180 ммоль) в дихлорметане (500 мл) в атмосфере аргона при 0oC по каплям добавляли этил-3-хлор-3-оксопропаноат (19,7 мл, 158 ммоль). Реакционную смесь перемешивали при этой температуре в течение часа. Смесь промывали насыщенным водным раствором бикарбоната натрия (200 мл), насыщенным водным раствором хлорида аммония (150 мл) и соляным раствором (150 мл). Полученный раствор сушили над безводным Na2SO4, фильтровали и концентрировали при пониженном давлении, получая сырое промежуточное соединение 5 (22,5 г, выход 66,7%) в виде твердого вещества желтого цвета. LC-MS (ESI) Общая процедура B, способ 2 : RT=0,88 минуты, масса рассч. для C11H12FNO3225,1, масса/заряд найденное значение 226,1 [M+H]+.
b) Получение промежуточного соединения 6
(6-фторхинолин-2,4(1H,3H)-дион)
К горячему раствору полифосфорной кислоты (120oC) по каплям добавляли раствор промежуточного соединения 5 (этил-3-(4-фторфениламино)-3-оксопропаноат) (22,5 г, 100 ммоль) в дихлорметане (100 мл). Смесь перемешивали при 130oC в течение 18 часов. После охлаждения до комнатной температуры реакционную смесь по каплям, при перемешивании добавляли в ледяную воду (200 мл). Твердое вещество выпадало в осадок, его отфильтровывали и осадок растворяли в 2,0 М водном растворе гидроксида натрия (100 мл). Полученную смесь фильтровали. рН фильтрата доводили до 9-10 концентрированным водным раствором соляной кислоты. Твердое вещество осаждали, отфильтровывали и промывали эфиром (30 мл ×3) и сушили под вакуумом, получая промежуточное соединение 6 (8,20 г, выход 45,8%) в виде твердого вещества желтого цвета. LC-MS (ESI) Общая процедура B, способ 2 : RT=1,21 минуты, масса рассч. для C9H6FNO2179,0, масса/заряд найденное значение 180,1 [M+H]+.
c) Получение промежуточного соединения 7
((Z)-3-((диметиламино)метилен)-6-фторхинолин-2,4(1H,3H)-дион)
Смесь промежуточного соединения 6 (6-фторхинолин-2,4(1H,3H)-дион) (4,10 г, 22,9 ммоль), N, N-диметилформамида диметилацеталя (42,4 мл, 32,1 ммоль) и толуола (100 мл) перемешивали при 80oC в течение 18 часов. После охлаждения до 0oC, смесь фильтровали под вакуумом и осадок на фильтре промывали толуолом (10 мл ×2) и сушили под вакуумом, получая промежуточное соединение 7 (4,40 г, выход 82,1%) в виде твердого вещества желтого цвета. LC-MS (ESI) Общая процедура B, способ 2: RT=0,48 минуты, масса рассч. для C12H11FN2O2 234,1, масса/заряд найденное значение 235,1 [M+H]+.
d) Получение промежуточного соединения 8
(4-хлор-6-фтор-2-оксо-1,2-дигидрохинолин-3-карбальдегид)
К раствору промежуточного соединения 7 ((Z)-3-((диметиламино)метилен)-6-фторхинолин-2,4(1H,3H)-диона) (3,47 г, 14,8 ммоль) в N, N-диметилформамиде (50 мл) по каплям добавляли фосфорилтрихлорид (1,62 мл, 17,7 ммоль) при 0oC. Затем реакционную смесь перемешивали при 0oC в течение 1 часа. Полученную смесь выливали в воду со льдом (100 мл). Твердое вещество осаждали, отфильтровывали, промывали эфиром (20 мл) и сушили в вакууме, получая промежуточное соединение 8 (2,10 г, выход 63,1%) в виде твердого вещества желтого цвета. LC-MS (ESI) Общая процедура B, способ 2: RT=1,07 минуты, масса рассч. для C10H5ClFNO2 225,0, масса/заряд найденное значение 226,1 [M+H]+.1H ЯМР (400 МГц, DMSO-d6) Общая процедура A:δ12,51 (s,1H), 10,29 (s,1H), 7,82-7,79 (m, 1H), 7,68-7,63 (m, 1H), 7,48-7,44 (m, 1H).
e) Получение промежуточного соединения 9
(4-хлор-6-фтор-3-(6-морфолино-1Н-бензо[d]имидазол-2-ил)хинолин-2(1H)-он)
К смеси промежуточного соединения 1 (4-морфолинобензол-1,2-диамина) (0,84 г, 4,4 ммоль) в этаноле (100 мл) добавляли промежуточное соединение 8 (4-хлор-6-фтор-2-оксо-1,2-дигидрохинолин-3-карбальдегид (0,99 мг, 4,4 ммоль) при комнатной температуре. Смесь перемешивали при 70oC в атмосфере О2 в течение 3 часов. После охлаждения до комнатной температуры смесь концентрировали, перетирали с петролейным эфиром: этилацетатом (10: 1) и отфильтровывали, получая промежуточное соединение 9 в виде твердого вещества желтого цвета (1,0 г, выход 57%). LC-MS (ESI) Общая процедура B, способ 2: RT=1,06 минуты, масса рассч. для C20H16ClFN4O2398,0, масса/заряд найденное значение 399,1 [M+H]+.
f) Получение соединения 17
((S)-6-фтор-3-(6-морфолино-1Н-бензо[d]имидазол-2-ил)-4-((1-(пиридин-2-ил)этил)амино)хинолин-2(1H)-он)
К раствору промежуточного соединения 9 (4-хлор-6-фтор-3-(6-морфолино-1Н-бензо[d]имидазол-2-ил)хинолин-2(1Н)-она) (398 мг, 1,0 ммоль) и N, N-диизопропилэтиламина (387 мг, 3,0 ммоль) в N, N-диметилформамиде (2 мл) добавляли (S)-1-(пиридин-2-ил)этанамин (122 мг, 1,0 ммоль). Смесь перемешивали при 60oC в течение 16 часов. После охлаждения до комнатной температуры смесь очищали препаративной ВЭЖХ (колонка: WatersXBridge 30*150 мм 5 мкм, расход: 20 мл/мин, подвижная фаза A: вода (0,1% NH3·H2O), подвижная фаза B: ацетонитрил, градиент: 35-55% (%B)). Целевую фракцию собирали и летучие вещества удаляли при пониженном давлении. Водную фазу лиофилизировали, получая соединение 17 (120 мг, выход 24,8%) в виде твердого вещества желтого цвета.
LC-MS (ESI) Общая процедура B Способ 2: RT=1,34 минуты, масса рассч. для C27H25FN6O2 484,2, масса/заряд найденное значение 485,1[M+H]+.
1H ЯМР (400 МГц, DMSO-d6) Общая процедура A δ12,92-12,88 (m, 1H), 12,33 (d, J =8,0 Гц, 0,40H), 12,19 (d, J =8,0 Гц, 0,53H), 11,65 (m, 1H), 8,55 (m, 1H), 7,79-7,70 (m, 2H), 7,61-7,34 (m, 4H), 7,28-7,23 (m, 2H), 7,01-6,96 (m,1H), 5,48-5,44 (m, 1H), 3,78 (m, 4H), 3,11 (m, 4H), 1,73-1,70 (m, 3H).
Пример 2
Получение соединения 4

a) Получение промежуточного соединения 3
3-(6-бром-1Н-бензо[d]имидазол-2-ил)-4-хлорхинолин-2(1Н)-он
К смеси 4-бромбензол-1,2-диамина (5,0 г, 26,7 ммоль) в этаноле (300 мл) добавляли 4-хлор-2-оксо-1,2-дигидрохинолин-3-карбальдегид (5,5 г, 26,7 ммоль) при комнатной температуре. Смесь перемешивали при 70°C под давлением газа кислорода, поступающего из цилиндра, в течение 14 часов. После охлаждения до комнатной температуры полученное фильтровали через подушку из целита. Фильтрат концентрировали при пониженном давлении, получая остаток, который перекристаллизовывали из смеси дихлорметан : петролейный эфир, получая промежуточное соединение 3 (5,9 г, выход 59%) в виде твердого вещества желтого цвета.
LC-MS (ESI) Общая процедура A, способ 2 : RT=1,38 минуты, масса рассч. для C16H9BrClN3O 373,0, масса/заряд найденное значение374,0 [M+H]+.
b) Получение промежуточного соединения 4
(S)-3-(6-бром-1Н-бензо[d]имидазол-2-ил)-4-((1-(пиримидин-2-ил)этил)амино)хинолин-2(1H)-он
К раствору промежуточного соединения 3 (3-(6-бром-1Н-бензо[d]имидазол-2-ил)-4-хлорохинолин-2(1Н)-она) (3,00 г, 8,02 ммоль) и гидрокарбоната натрия (2,70 г, 32,08 ммоль) в N, N-диметилформамиде (20 мл) и добавляли (S)-1-(пиридин-2-ил)этанамин (1,47 г, 12,03 ммоль). Смесь перемешивали при 80°C в течение 14 часов. После охлаждения до комнатной температуры полученное фильтровали через подушку из целита. Фильтрат концентрировали при пониженном давлении, получая остаток, который перекристаллизовывали из смеси дихлорметана и петролейного эфира, получая промежуточное соединение 4 (2,50 мг, выход 68%) в виде твердого вещества желтого цвета.
LC-MS (ESI) Общая процедура B, способ 4: RT=1,26 минуты, масса рассч. для C23H18BrN5O 459,7, масса/заряд найденное значение460,1 [M+H]+.
c) Получение соединения 4
3-(6-((2S,6R)-2,6-диметилморфолино)-1H-бензо[d]имидазол-2-ил)-4-(((S)-1-(пиридин-2-ил)этил)амино)хинолин-2(1Н)-он
К дегазированной суспензии промежуточного соединения 4 (3-(6-бром-1Н-бензо[d]имидазол-2-ил)-4-((1-(пиримидин-2-ил)этил)амино)хинолин-2(1Н)-он) (200 мг, 0,43 ммоль), трис(дибензилиденацетон) дипалладия(0) (20 мг, 0,022 ммоль) и 2-дициклогексилфосфино-2'-(N, N-диметиламино)бифенила (8 мг, 0,022 ммоль) в безводном ТГФ (2 мл) добавляли (2S,6R)-2,6-диметилморфолин (100 мг, 0,87 ммоль) и 1,0 М литий-бис(триметилсилил)амид в ТГФ (8,8 мл, 8,8 ммоль) при комнатной температуре в атмосфере аргона. Смесь перемешивали при 65°C в течение часа. После охлаждения до комнатной температуры смесь концентрировали при пониженном давлении, получая остаток, который очищали хроматографией на силикагеле (дихлорметан: метанол=30 : 1) и затем дополнительно очищали препаративной ВЭЖХ (колонка: WatersXBridge 30*150 мм 5 мкм, расход: 20 мл/мин, подвижная фаза A: вода (0,1% NH3⋅H2O), подвижная фаза B: ацетонитрил, градиент: 35-55% (%B)). Целевую фракцию собирали и летучие вещества удаляли при пониженном давлении. Водную фазу лиофилизировали, получая соединение 4 (7,23 мг, выход 3,4%, чистота >99%) в виде твердого вещества желтого цвета.
LC-MS (ESI) Общая процедура A, способ 2 : RT=1,36 минуты, масса рассч. для C29H30N6O2 494,6, масса/заряд найденное значение 495,4 [M+H]+.
1H ЯМР (400 МГц, DMSO-d6) Общая процедура A : δ 12,92 (s, 0,5H), 12,89 (s, 0,5H), 12,30 (s, 0,5H), 12,17 (s, 0,5H), 11,58 (s, 1H), 8,55 (brs, 1H), 8,05-7,88 (m, 1H), 7,77 (brs, 1H), 7,66-7,19 (m, 5H), 7,18-6,87 (m, 2H), 5,50 (brs, 1H), 3,77 (s, 2H), 3,60-3,51 (m, 2H), 2,38-2,19 (m, 2H), 1,73 (s, 3H), 1,19 (s, 6H).
Другие соединения были получены в соответствии с вышеуказанной процедурой. См. Таблицу 1.
Пример 3
Получение соединения 5
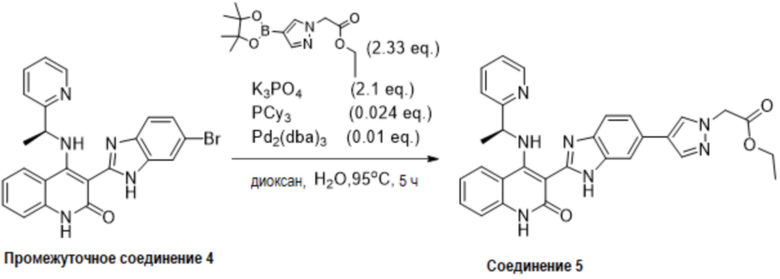
a) Получение соединения 5
(S)-этил-2-(4-(2-(2-оксо-4-((1-(пиридин-2-ил)этил)амино)-1,2-дигидрохинолин-3-ил)-1H-бензо[d]имидазол-6-ил)-1Н-пиразол-1-ил)ацетат
К смеси промежуточного соединения 4 ((S)-3-(6-бром-1Н-бензо[d]имидазол-2-ил)-4-((1-(пиридин-2-ил)этил)амино)хинолин-2(1Н)-он) (420 мг, 0,915 ммоль), фосфата калия (420 мг, 1,98 ммоль), трициклогексилфосфина (6,15 мг, 0,0220 ммоль) в диоксане (10 мл) и воде (2 мл) добавляли трис(дибензилиденацетон)дипалладий(0) (8,37 мг, 0,00915 ммоль). Смесь перемешивали при 95°C в течение 5 часов в атмосфере аргона. Смесь использовали на следующей стадии без дополнительной очистки.
LC-MS (ESI) Общая процедура B, способ 3: RT=1,45 минуты, масса рассч. для C30H27N7O3 533,2, масса/заряд найденное значение 534,3 [M+H]+.
Пример 4- Преобразование
Получение соединения 5a

Получение соединения 5a
(S)-2-(4-(2-(2-оксо-4-((1-(пиридин-2-ил)этил)амино)-1,2-дигидрохинолин-3-ил)-1H-бензо[d]имидазол-6-ил)-1Н-пиразол-1-ил)уксусная кислота
К смеси соединения 5 ((S)-этил-2-(4-(2-(2-оксо-4-((1-(пиридин-2-ил)этил)амино)-1,2-дигидрохинолин-3-ил)-1Н-бензо[d]имидазол-6-ил)-1Н-пиразол-1-ил)ацетат) (неочищенного) в тетрагидрофуране (10 мл) добавляли моногидрат гидроксида лития (820,0 мг, 19,5 ммоль) при комнатной температуре. Смесь перемешивали при комнатной температуре в течение 16 часов. Реакционную смесь очищали препаративной ВЭЖХ (колонка: Inertsil ODS-3 20*250 мм 10 мкм, расход: 20 мл/мин, подвижная фаза A: вода (0,05% TFA), подвижная фаза B: ацетонитрил, градиент: 25-40% (%B)). Целевую фракцию собирали и летучие вещества удаляли при пониженном давлении. Водную фазу лиофилизировали, получая соединение 5а (10,32 мг, выход 2,3%, чистота 97%) в виде соли трифторуксусной кислоты (твердое вещество желтого цвета).
LC-MS (ESI) Общая процедура A, способ 3: RT=0,98 минуты, масса рассч. для C28H23N7O3 505,2, масса/заряд найденное значение 506,4 [M+H]+.
1H ЯМР (400 МГц, CD3OD) Общая процедура A:δ 8,35 (d, J=8,2 Гц, 1H), 8,17 (d, J=7,2 Гц, 2H), 7,99 (s, 1H), 7,81-7,77 (m,2H), 7,76-7,66 (m, 2H), 7,60 (d, J=8,5 Гц, 1H), 7,42-7,37 (m, 2H), 7,32-7,26 (m, 2H), 5,06 (s, 2H), 4,50 (d, J=6,7 Гц, 1H), 1,58 (d, J=6,6 Гц, 3H).
Другие соединения были получены в соответствии с вышеуказанной процедурой. См. Таблицу 1.
Пример 5- Преобразование
Получение соединения 6
(S)-1-(2-(2-Оксо-4-((1-(пиридин-2-ил)этил)амино)-1,2-дигидрохинолин-3-ил)-1H-бензо[d]имидазол-6-ил)пиперидин-4-карбоновая кислота 0,5 формиат
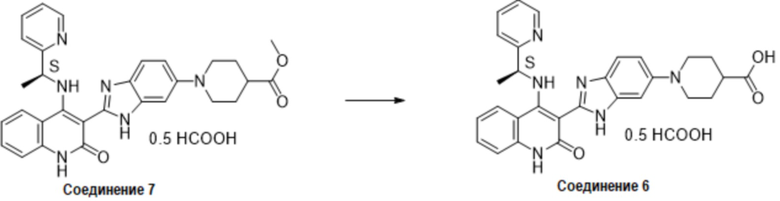
К раствору соединения 7 ((S)-метил-1-(2-(2-оксо-4-((1-(пиридин-2-ил)этил)амино)-1,2-дигидрохинолин-3-ил)-1H-бензо[d]имидазол-6-ил)пиперидин-4-карбоксилат) (60,0 мг, 0,115 ммоль) в MeOH (2 мл) добавляли 3М водный раствор LiOH (1,5 мл). Смесь перемешивали при 25°C в течение 12 часов. Реакционную смесь концентрировали под вакуумом, а полученный остаток очищали препаративной ВЭЖХ (колонка: Agela Durashell C18 150*25 5 мкм, подвижная фаза A: вода (0,225% вода ⋅ TFA, подвижная фаза B: ацетонитрил, расход: 22 мл/мин, градиент от 22% B до 52%). Очищенные фракции собирали и растворитель выпаривали под вакуумом. Водный слой лиофилизировали, получая соединение 6 в виде соли трифторуксусной кислоты, в виде твердого вещества желтого цвета (18,1 мг, чистота 96,2%, выход 28,5%).
LC-MS (ESI) Общая процедура B-2 способ 5: RT=3,822 минуты, масса рассч. для C29H28N6O3 508,22, масса/заряд найденное значение 509,0 [M+H]+.
1H ЯМР (400 МГц, DMSO-d6) Общая процедура B : δ=12,89 (br. s., 0,4H), 12,85 (br. s., 0,6H), 12,31 (d, J=8,2 Гц, 0,4H), 12,17 (d, J=8,2 Гц, 0,6H), 11,58 (br. s., 1H), 8,54 (d, J=2,9 Гц, 1H), 8,41-8,35 (m, 0,5H), 7,97 (d, J=8,4 Гц, 1H), 7,79-7,71 (m, 1H), 7,56 (d, J=8,6 Гц, 0,4H), 7,52-7,46 (m, 2,6H), 7,34 (d, J=8,6 Гц, 1H), 7,27-7,23 (m, 1,6H), 7,14-7,12 (m, 0,4H), 7,09-7,04 (m, 1H), 7,00-6,93 (m, 1H), 5,55-5,43 (m, 1H), 3,69-3,52 (m, 2H), 2,78-2,71 (m, 2H), 2,53-2,52 (m, 1H), 1,95-1,91 (m, 2H), 1,75-1,69 (m, 5H).
Пример 6- Преобразование
Получение соединения 61
(S*)-метил-4-(2-(2-оксо-4-(((S)-1-(пиридин-2-ил)этил)амино)-1,2-дигидрохинолин-3-ил)-1H-бензо[d]имидазол-6-ил)морфолин-2-карбоксилат
Соединение 59 (40,0 мг, 0,0760 ммоль) разделяли, используя сверхкритическую жидкостную хроматографию (условия для разделения: AD (250 мм x 30 мм, 10 мкм); подвижная фаза: A: сверхкритический CO2, B: 0,1%NH3H2O EtOH, A:B =45:55 при 80 мл/мин; температура колонки: 38; давление сопла: 100 бар; температура сопла: 60; температура испарителя: 20; температура триммера: 25; длина волны: 220 нм). Очищенную фракцию собирали и растворитель выпаривали под вакуумом. Остаток суспендировали в воде (10 мл) и полученную смесь лиофилизировали досуха с получением соединения 61 (20,0 мг, чистота 96,5%, выход 48,3%).
LC-MS (ESI) Общая процедура B, способ 5: RT=3,599 минуты, масса рассч. для C29H28N6O4 524,22, масса/заряд найденное значение 525,0 [M+H]+.
1H ЯМР (400 МГц, DMSO-d6) Общая процедура B: δ12,95 (br. s., 0,4H), 12,92 (br. s., 0,6H), 12,28 (d, J=8,6 Гц, 0,4H), 12,16 (d, J=7,9 Гц, 0,6H), 11,58 (br. s., 1H), 8,57-8,52 (m, 1H), 7,96 (dd, J=4,5, 8,0 Гц, 1H), 7,79-7,72 (m, 1H), 7,61 (d, J=8,6 Гц, 0,4H), 7,53 (d, J=2,4 Гц, 0,6H), 7,52-7,47 (m, 2H), 7,35 (s, 0,6H), 7,33 (s, 0,4H), 7,31 (d, J=2,2 Гц, 0,6H), 7,28-7,22 (m, 1H), 7,15 (d, J=1,8 Гц, 0,4H), 7,10-7,03 (m, 1H), 6,97 (ddd, J=2,3, 8,8, 11,0 Гц, 1H), 5,56-5,44 (m, 1H), 4,46 (dt, J=3,2, 7,4 Гц, 1H), 4,09-3,99 (m, 1H), 3,82-3,75 (m, 1H), 3,73 (d, J=3,3 Гц, 3H), 3,52-3,42 (m, 1H), 3,24 (d, J=4,2 Гц, 1H), 3,13 (dd, J=7,6, 12,0 Гц, 1H), 2,98 (dt, J=4,3, 8,0 Гц, 1H), 1,75-1,69 (m, 3H).
Следующие соединения были получены согласно реакционным протоколам одного из приведенных выше Примеров с использованием других соответственных исходных материалов. (В таблице 1, Пр. X указывает на то, что получение этого соединения описано в Примере X, или что оно получено согласно Примеру X).
Специалисту в данной области техники будет понятно, что соединения, синтезируемые с использованием указанных протоколов, могут существовать в виде сольвата, например, гидрата, и/или могут содержать остаточный растворитель или незначительные примеси. Соединения, выделенные в форме соли, могут иметь целочисленную стехиометрию, т. е. моно- или дисоли, или промежуточную стехиометрию.
Таблица 1
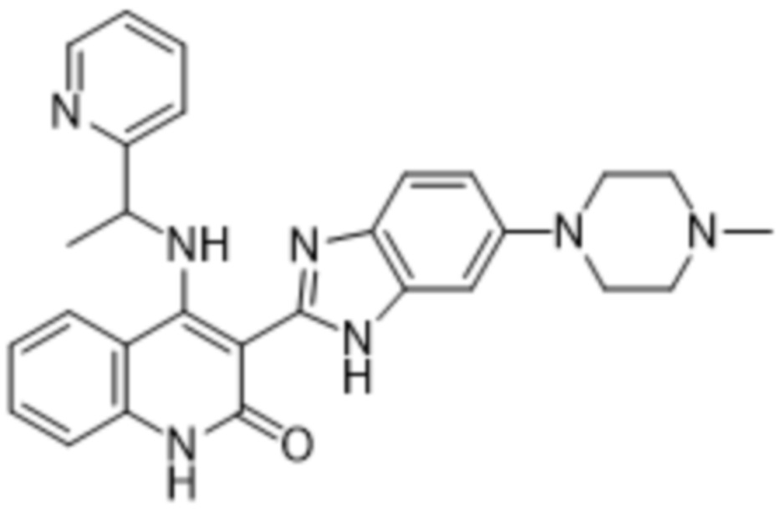
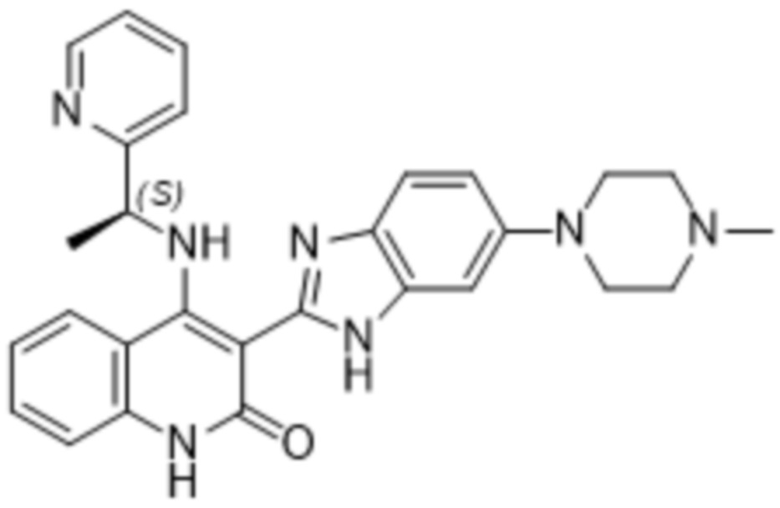
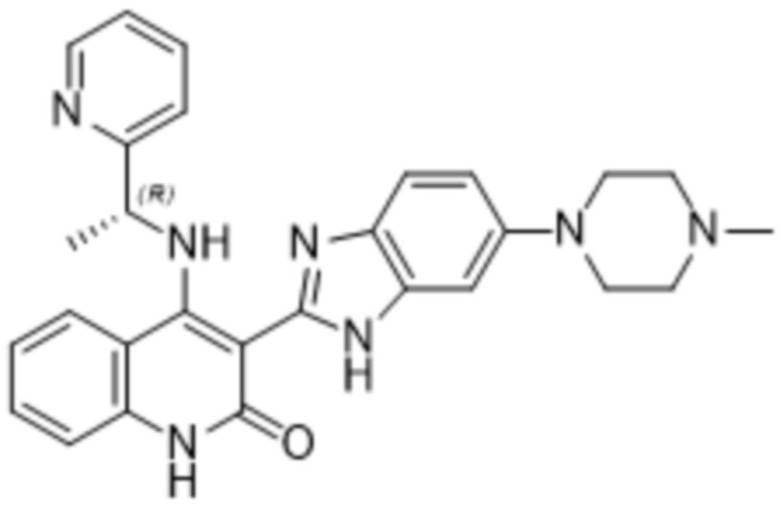
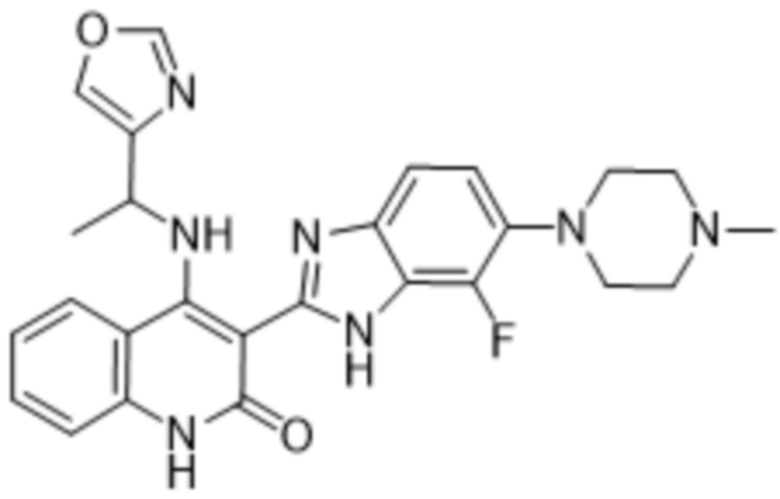
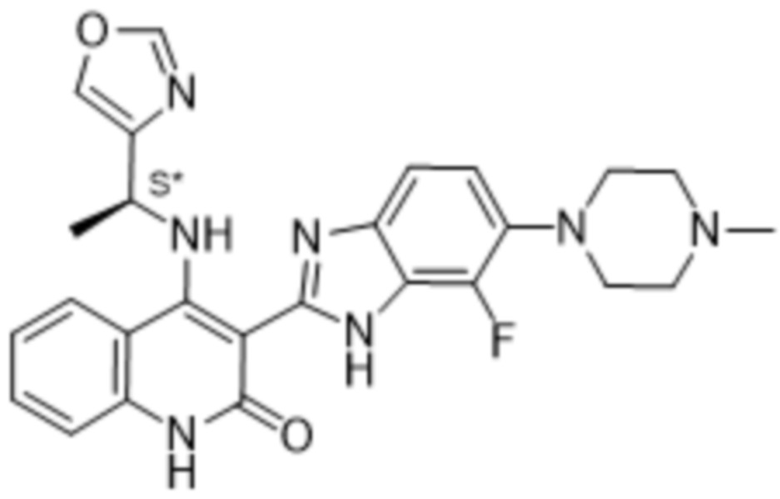
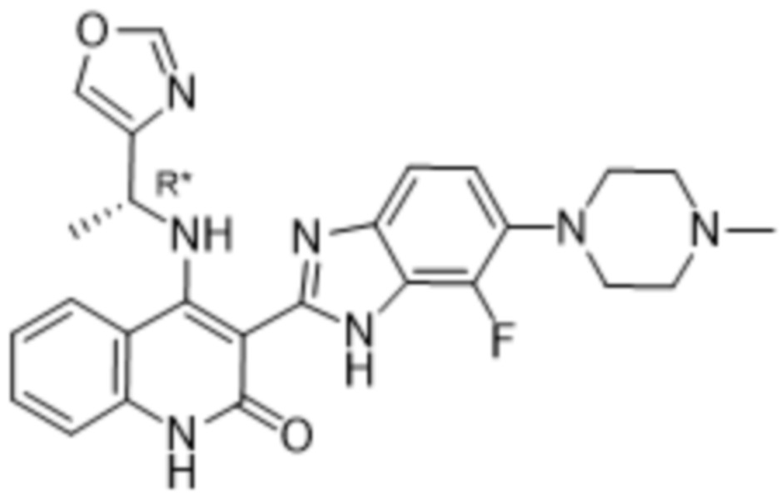
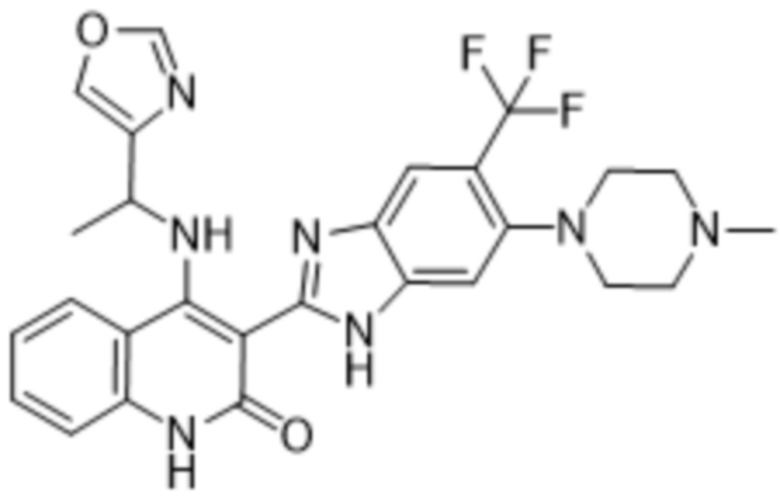

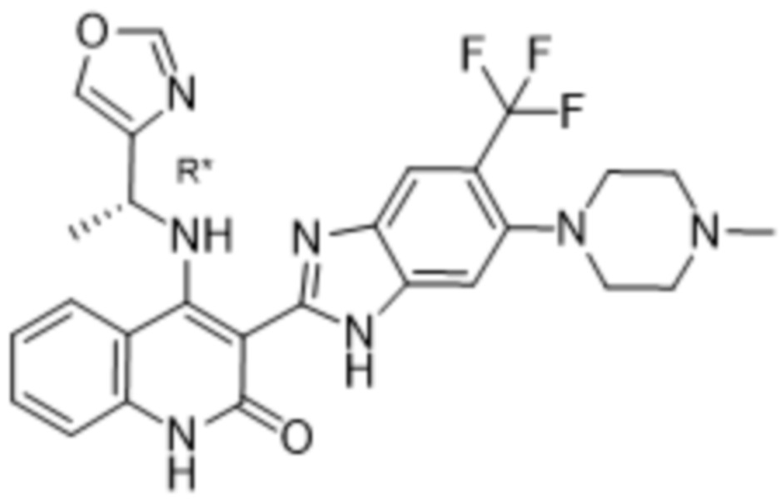
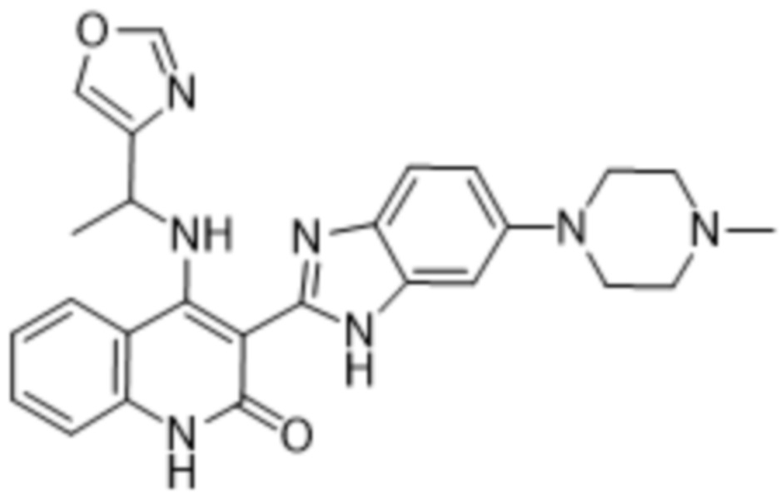
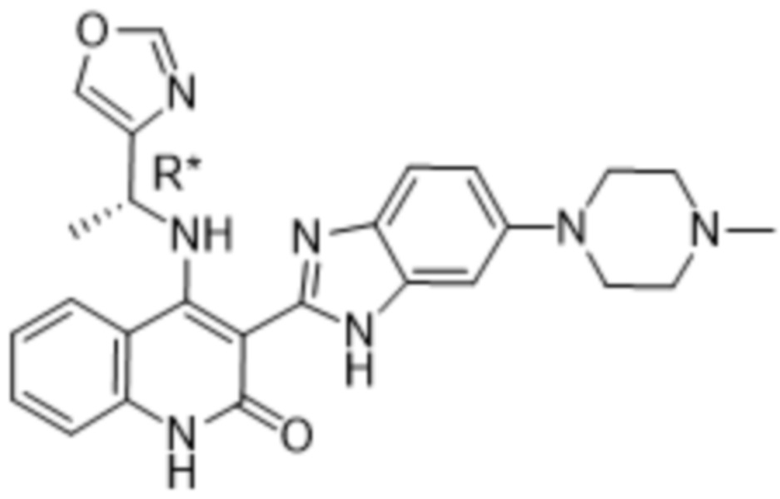

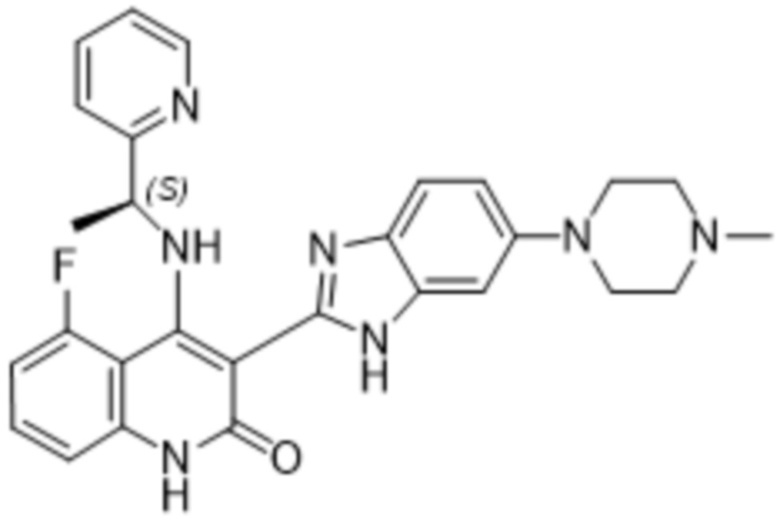

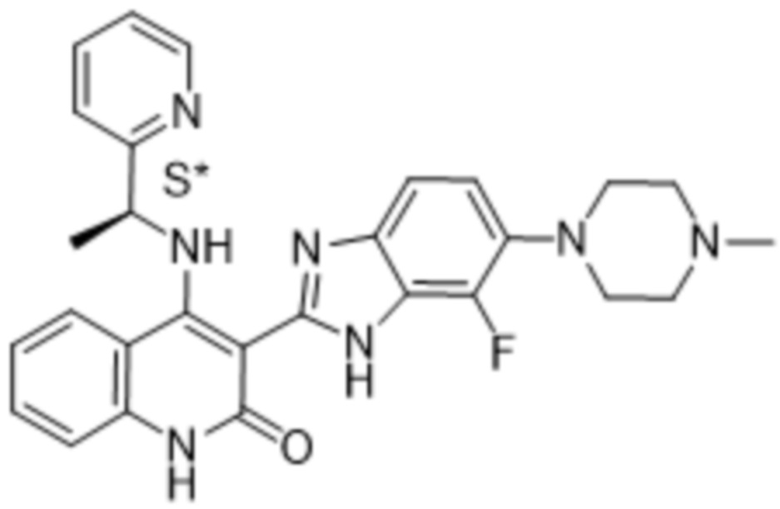
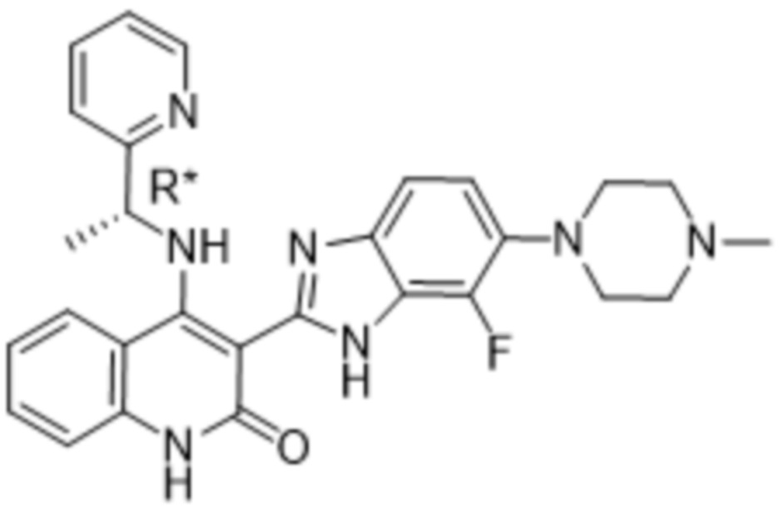
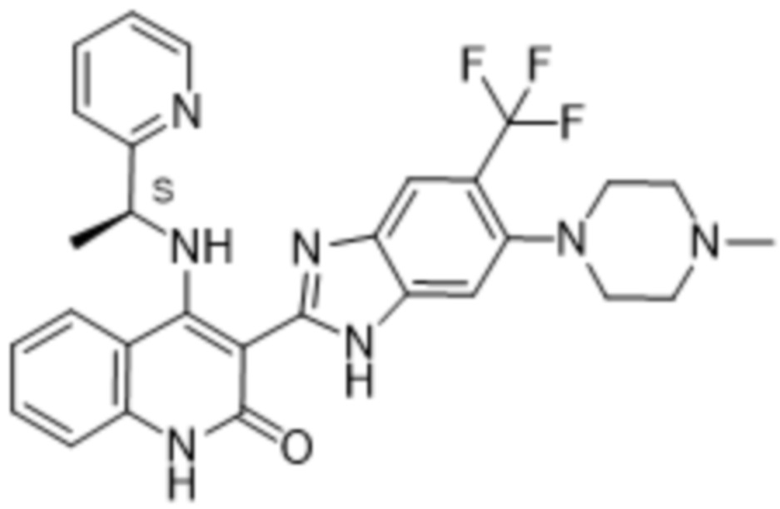
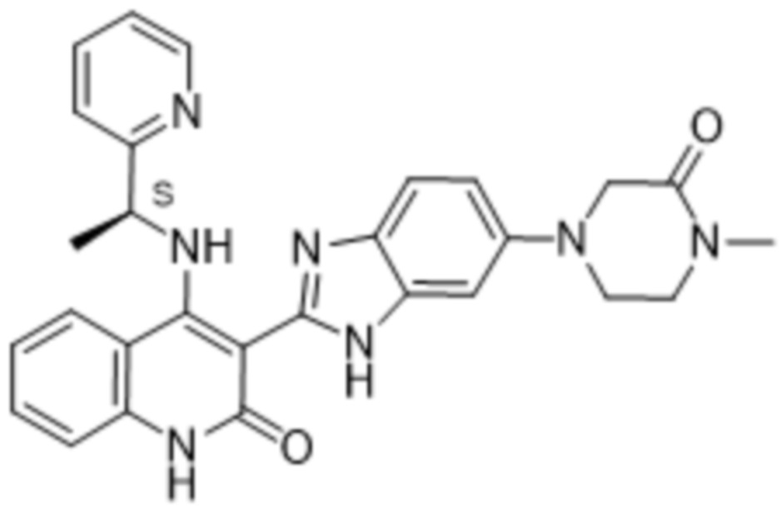
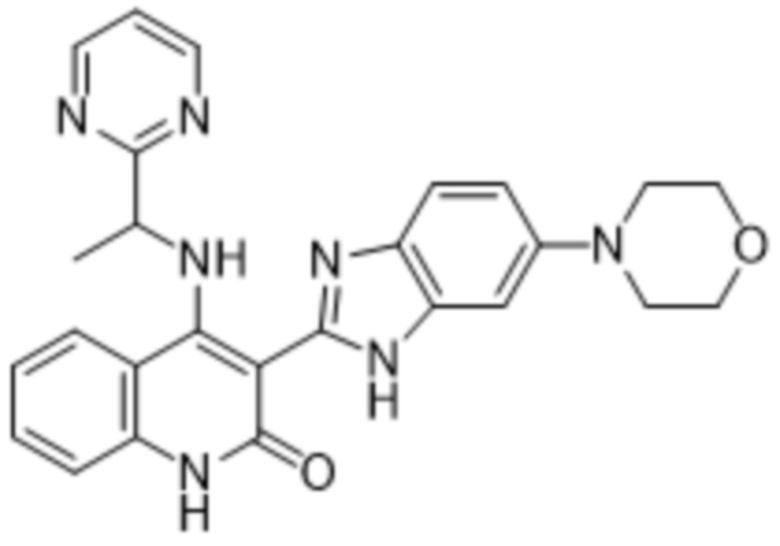
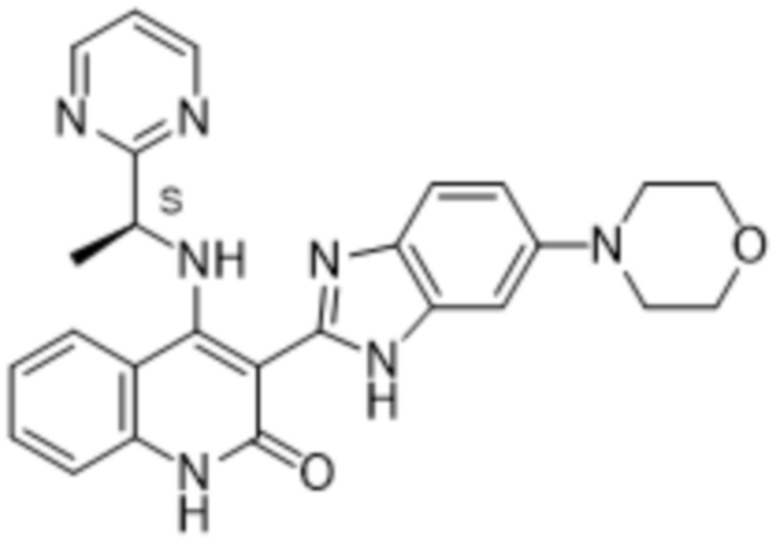
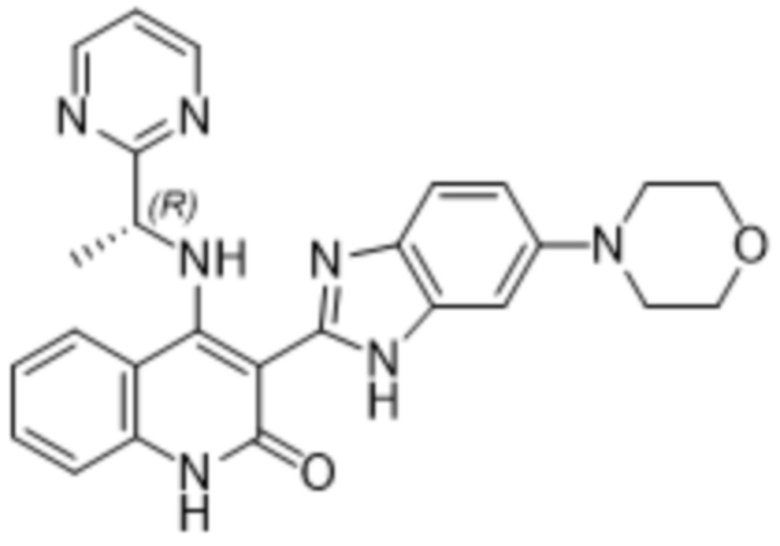
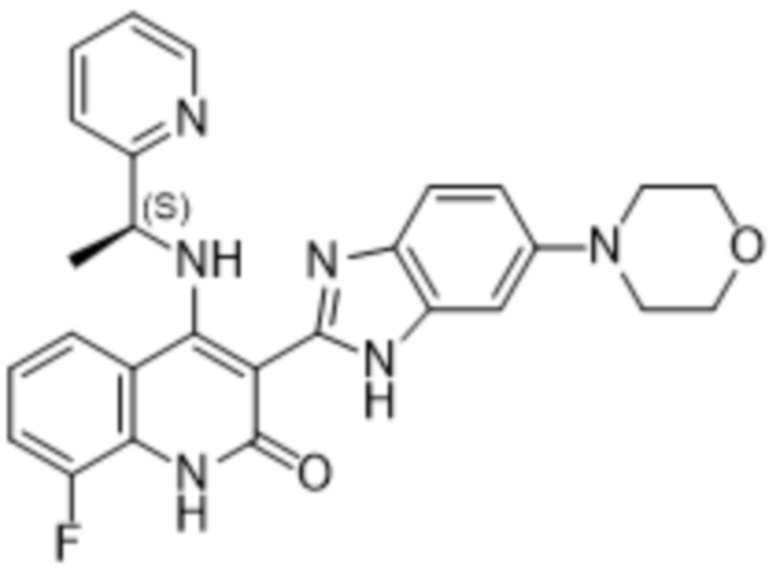

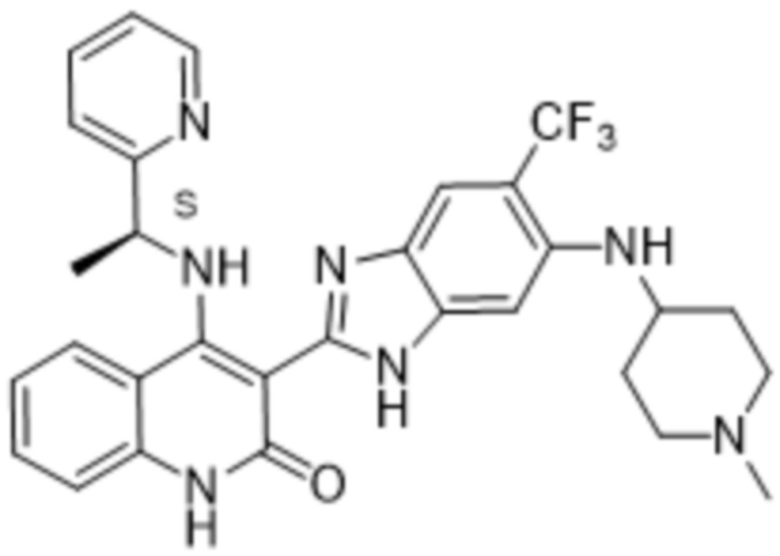
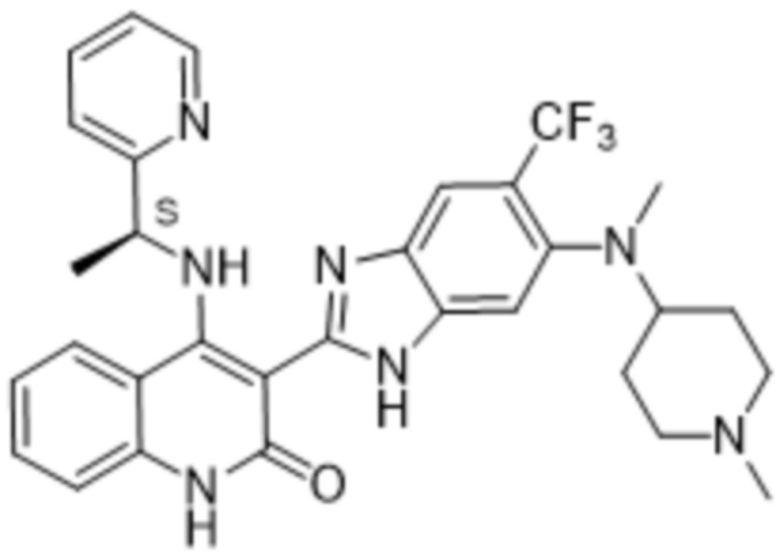
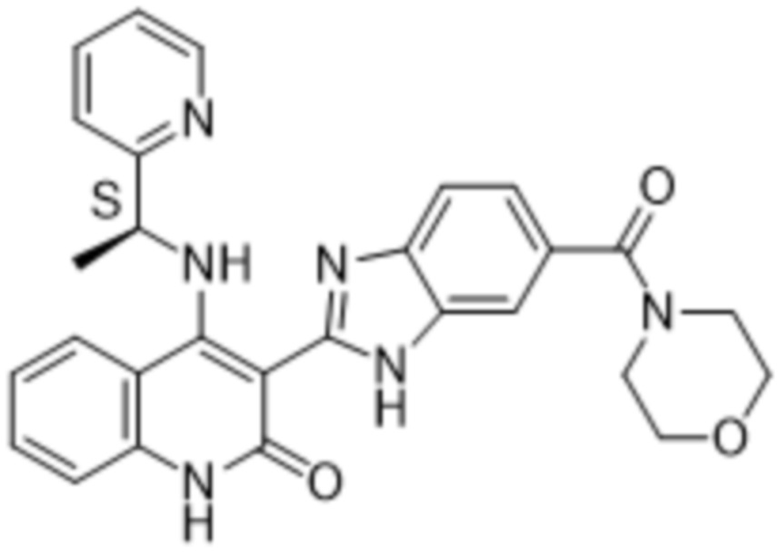
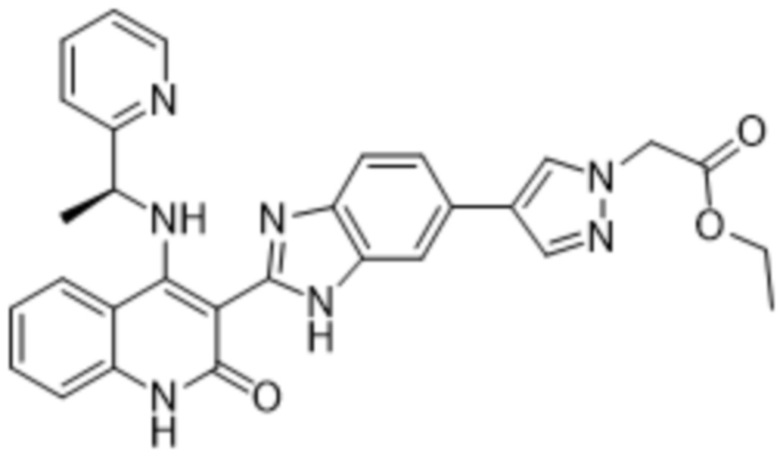
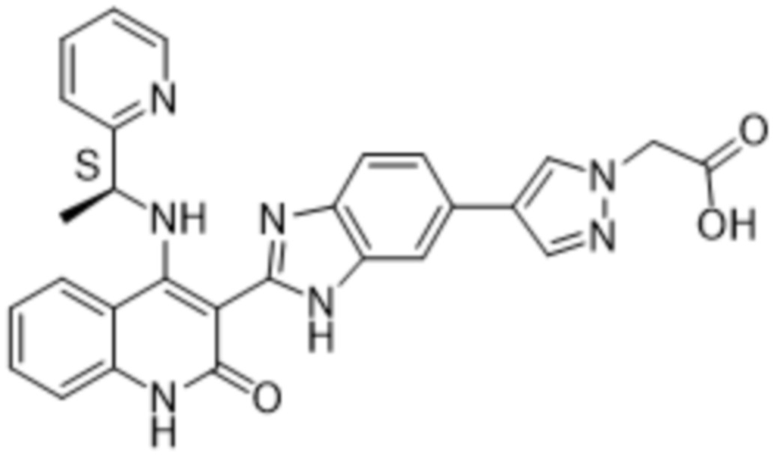 в виде соли трифторуксусной кислоты
в виде соли трифторуксусной кислоты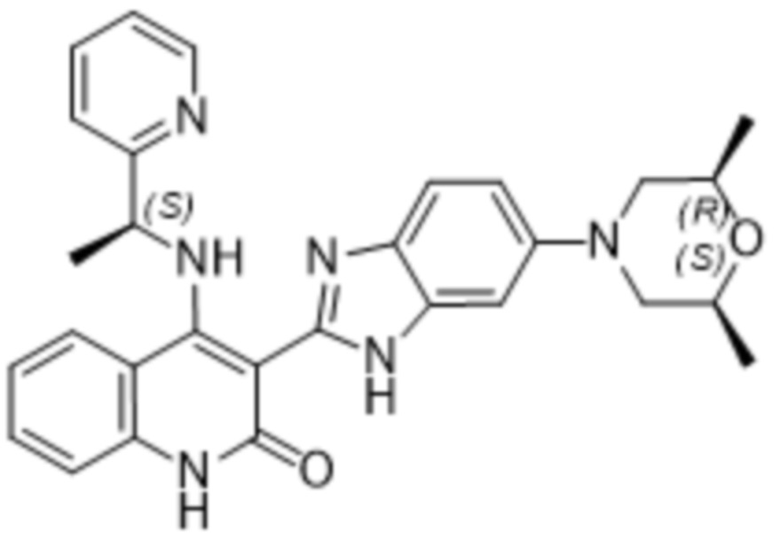
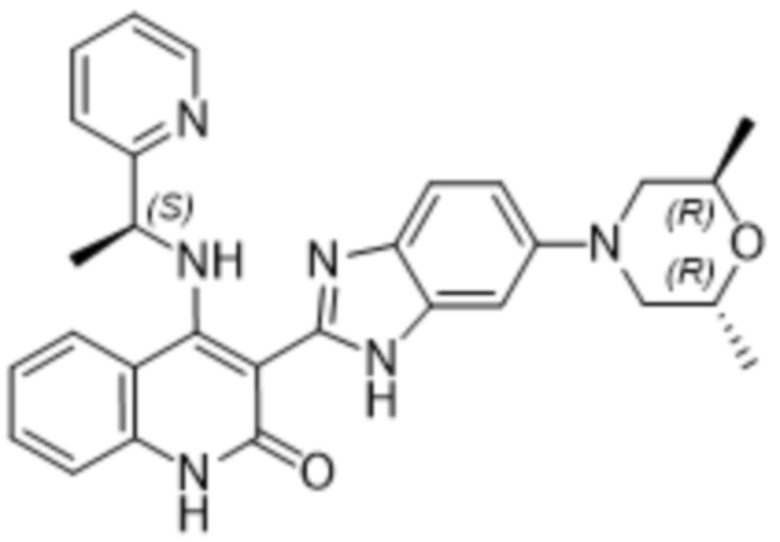
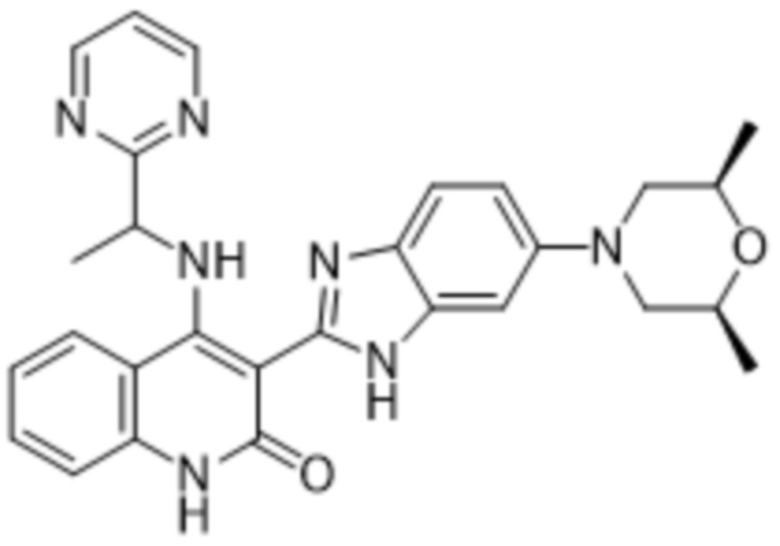
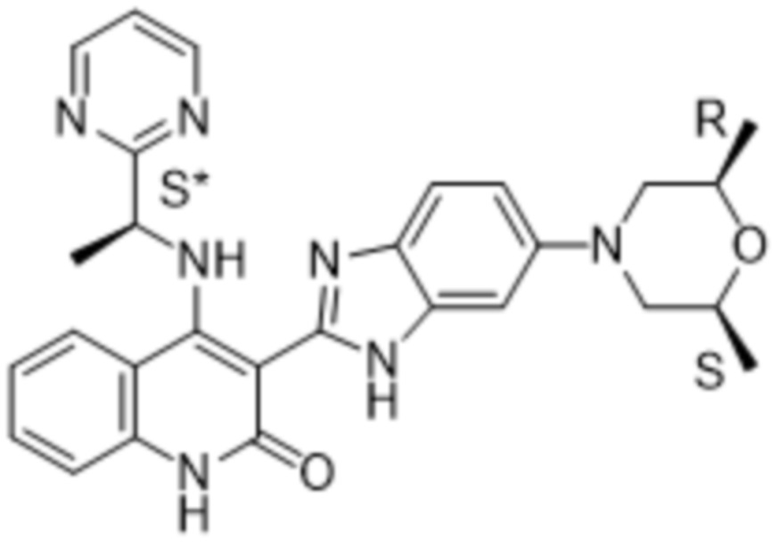
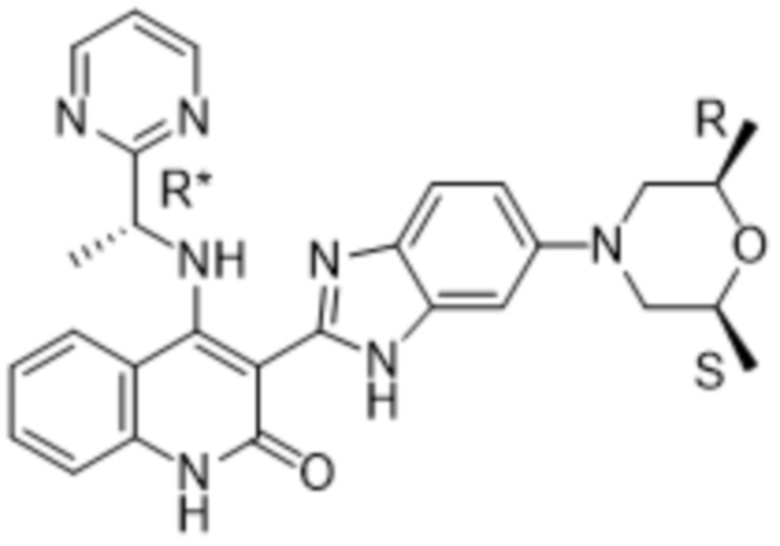
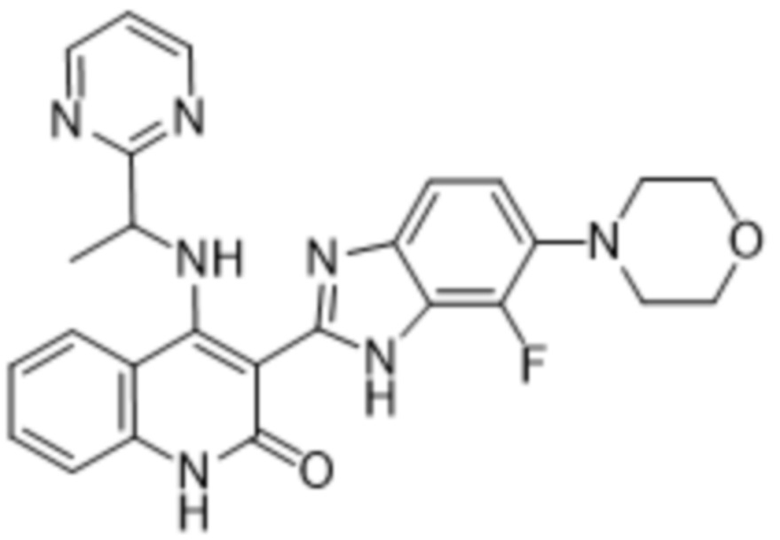
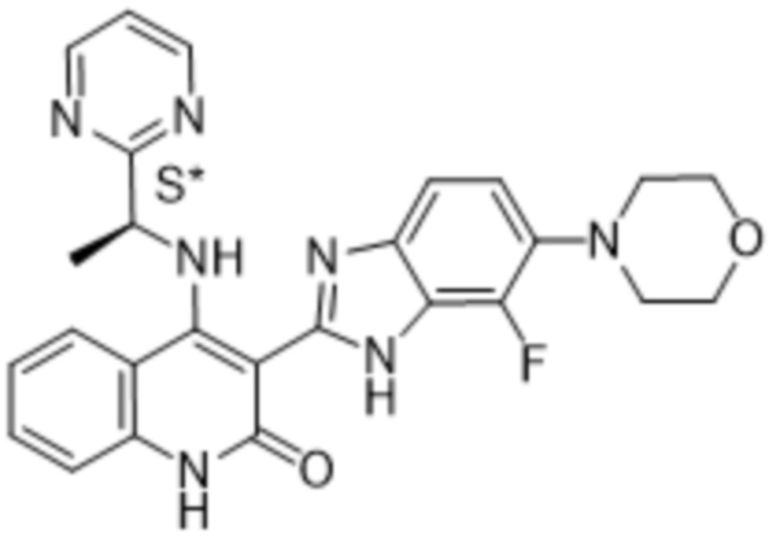
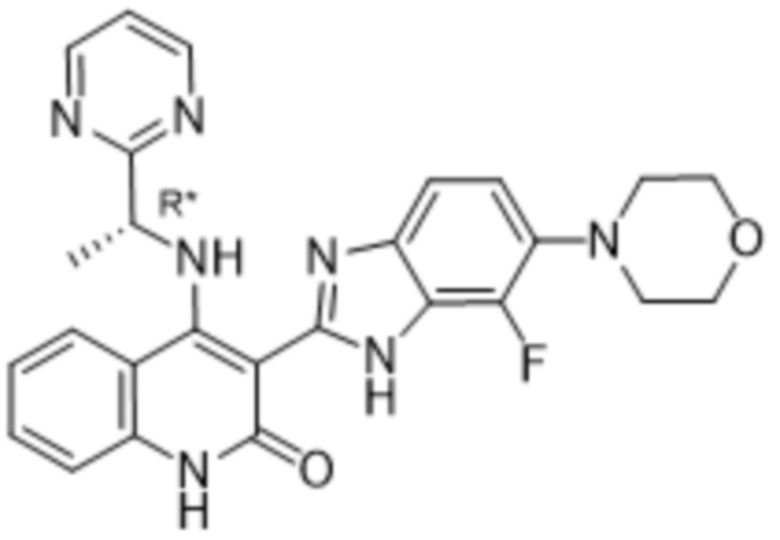
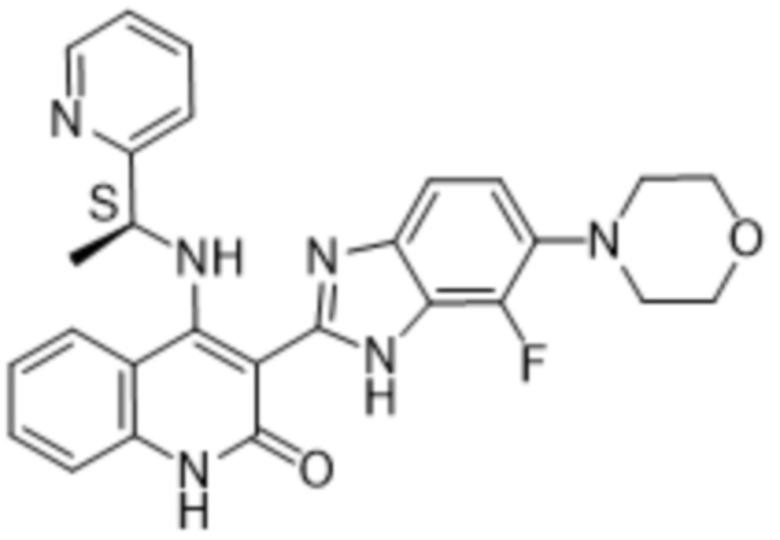
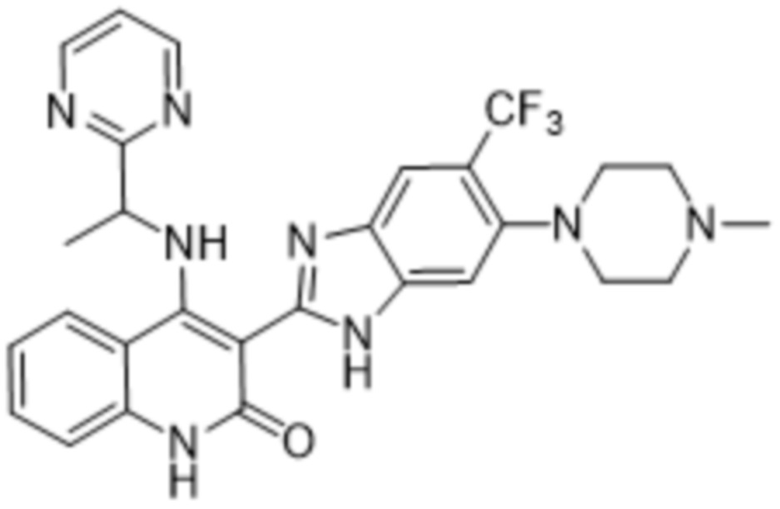
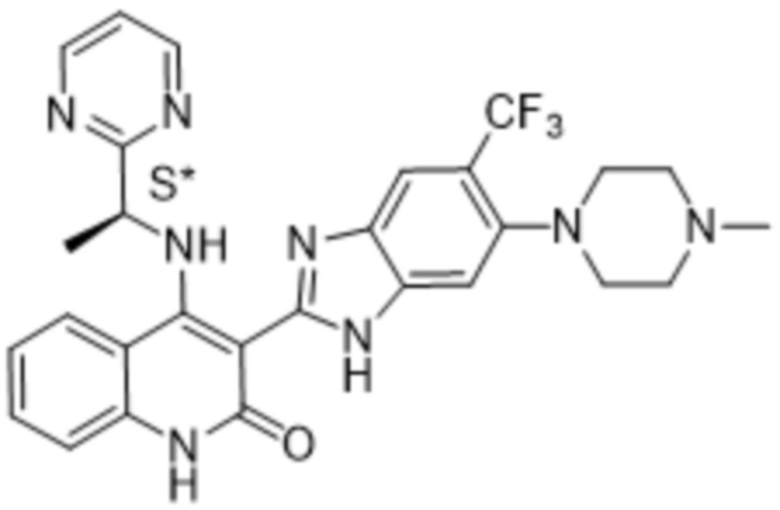
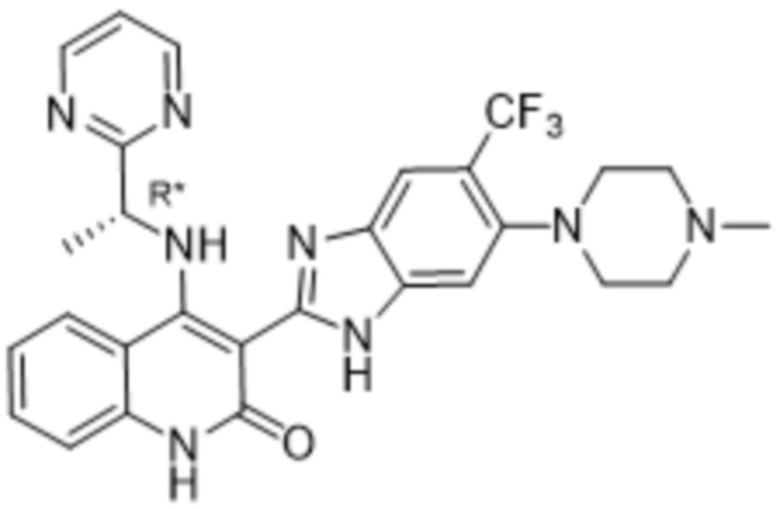



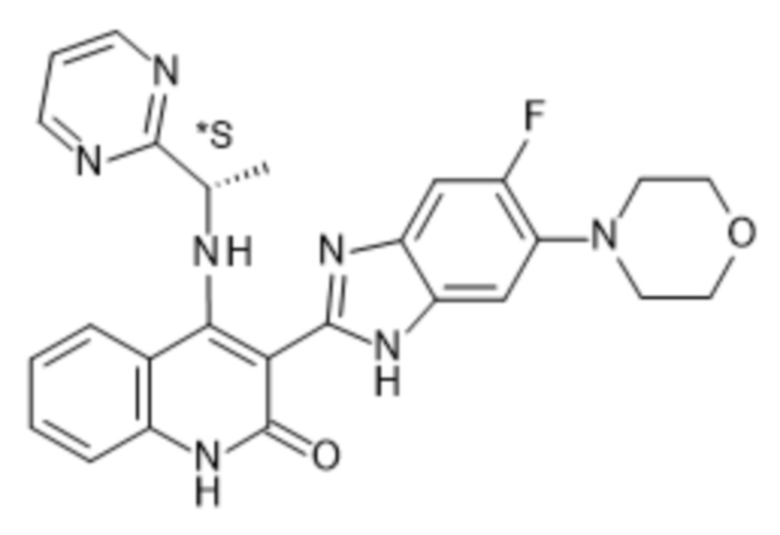
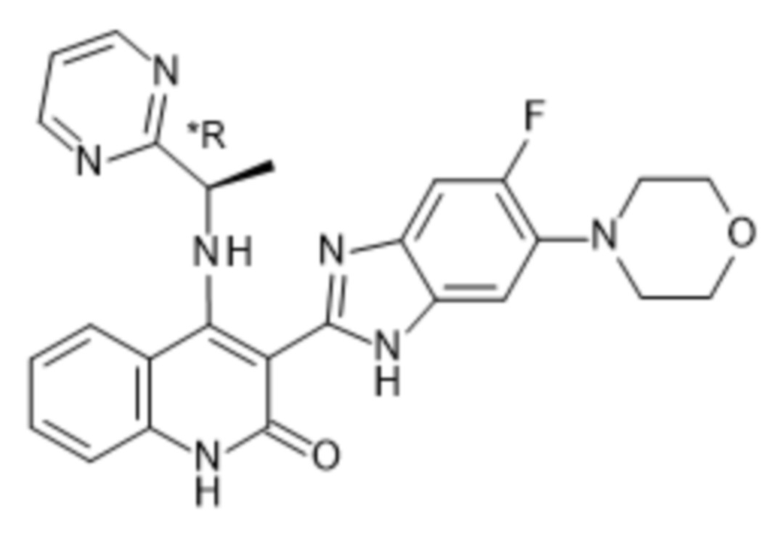
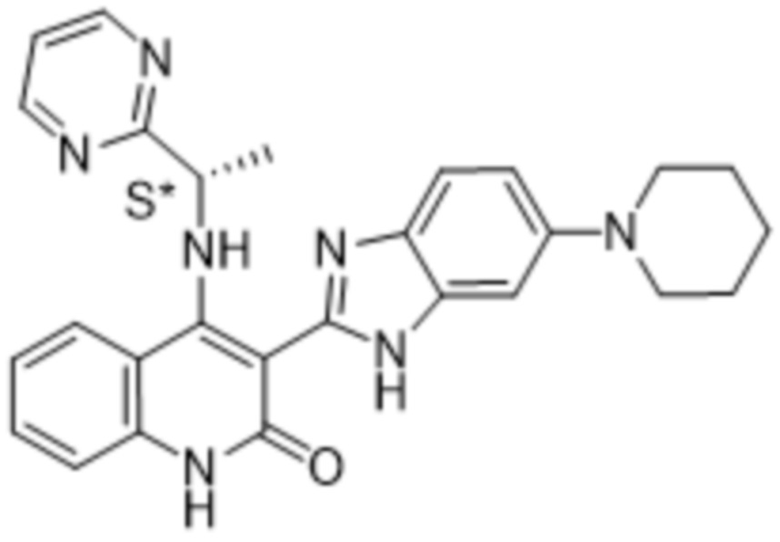
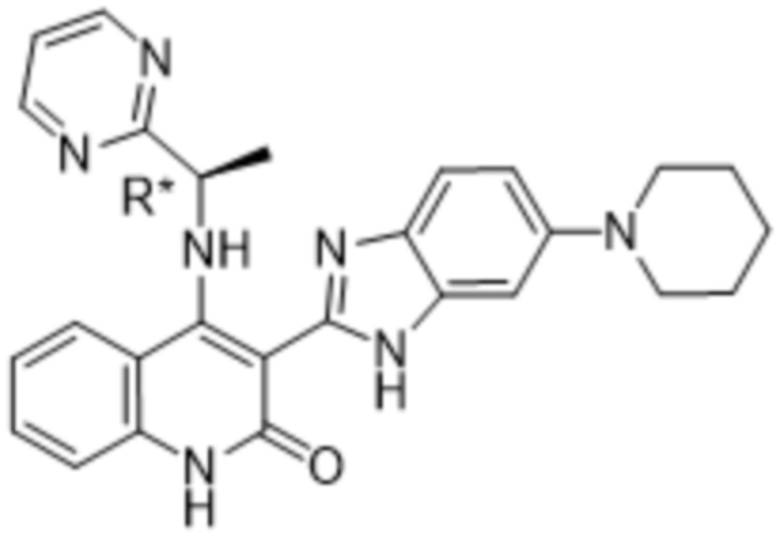
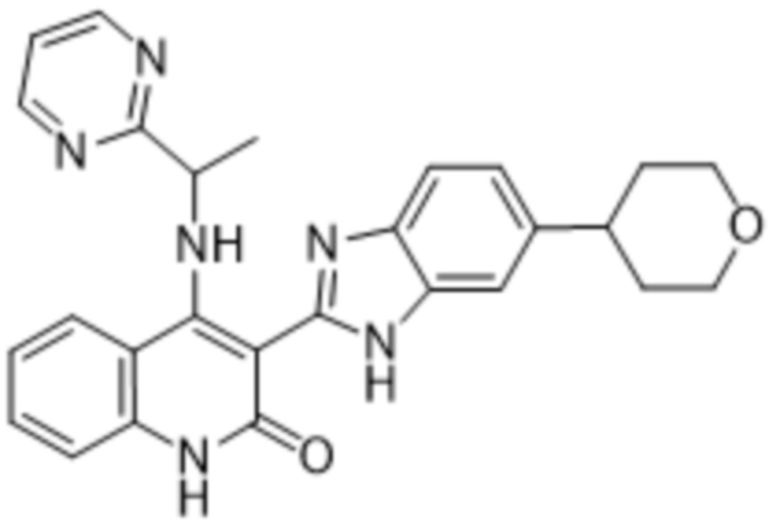

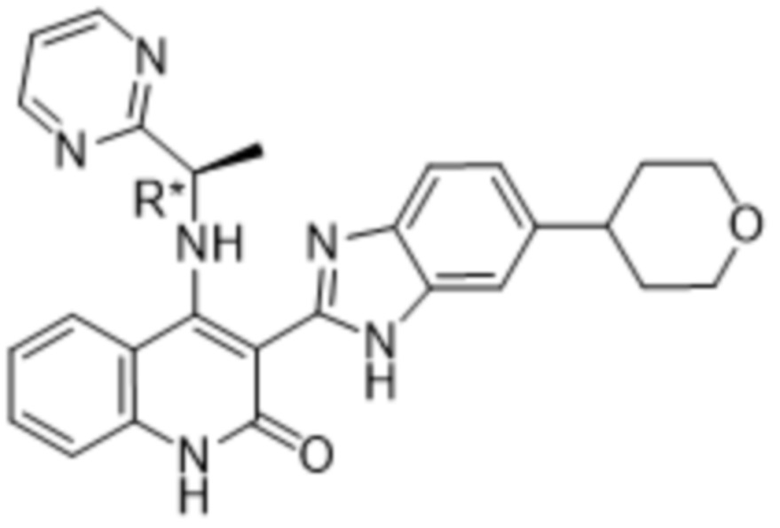
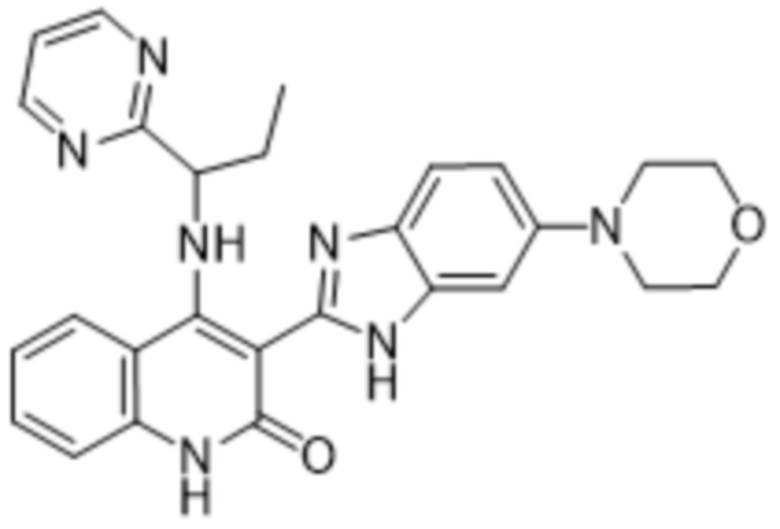
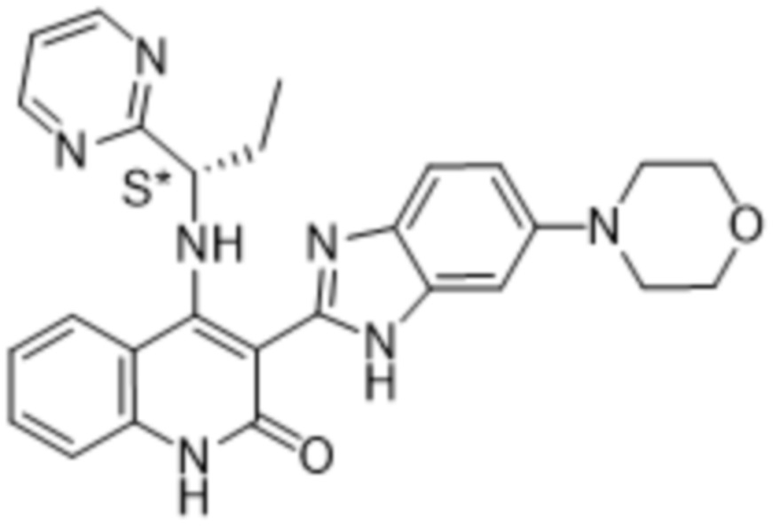 в виде соли трифторуксусной кислоты
в виде соли трифторуксусной кислоты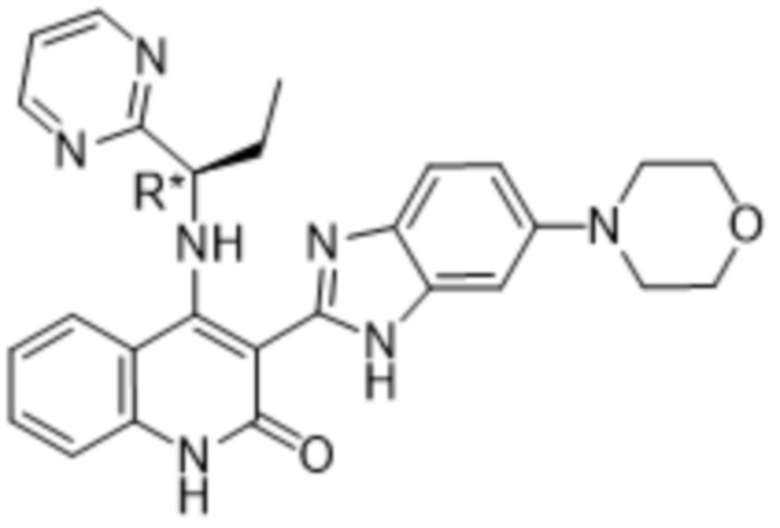 в виде соли трифторуксусной кислоты
в виде соли трифторуксусной кислоты
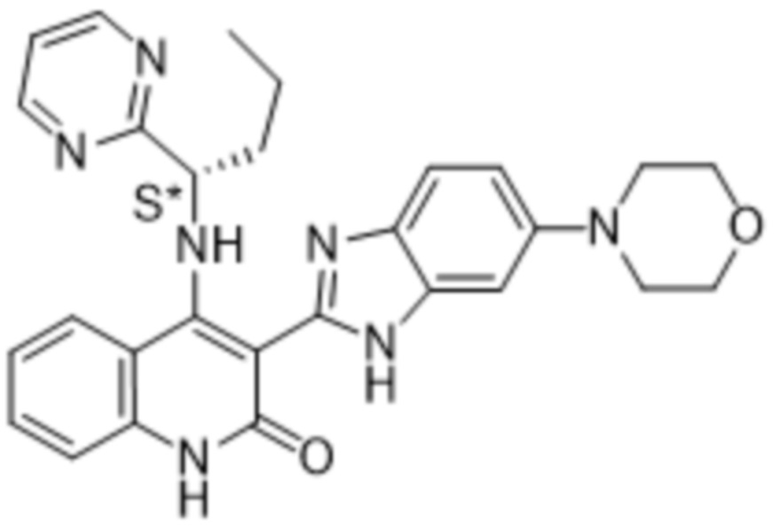

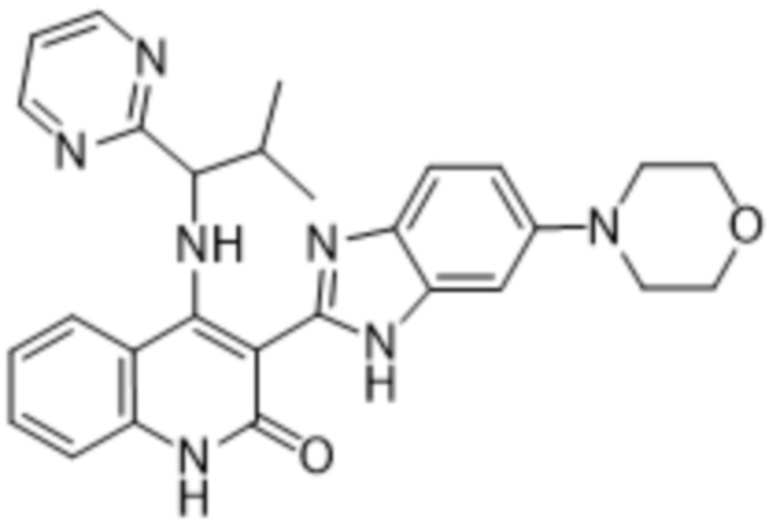

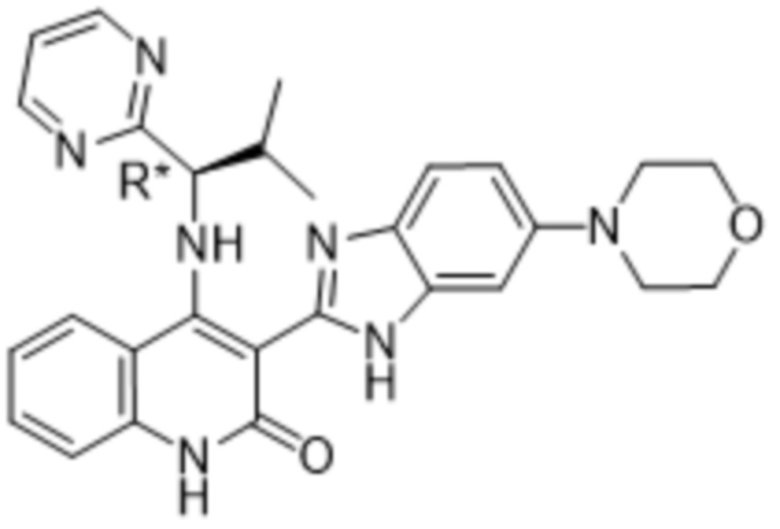
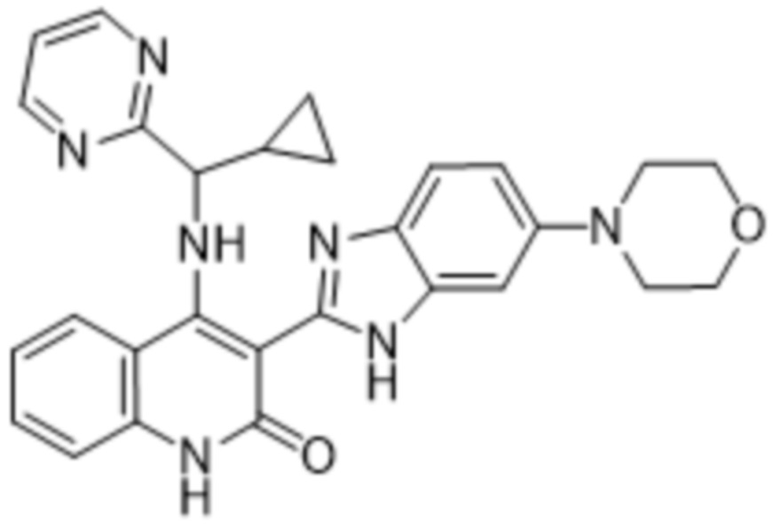

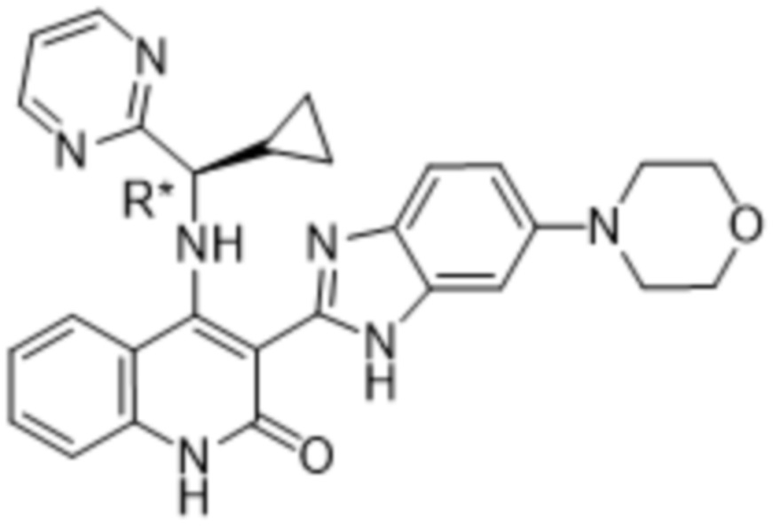
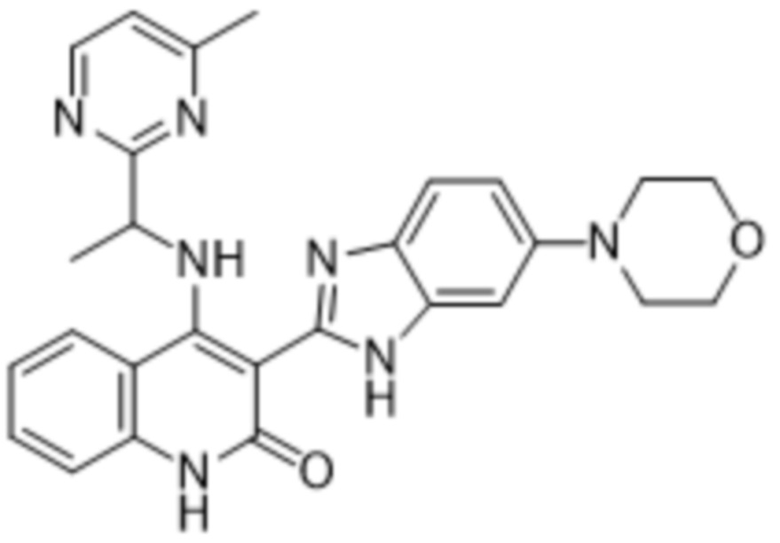
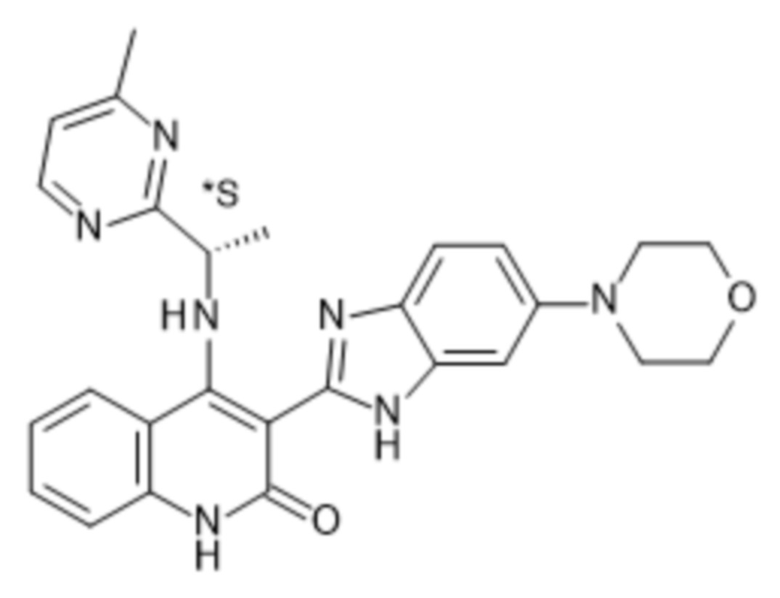
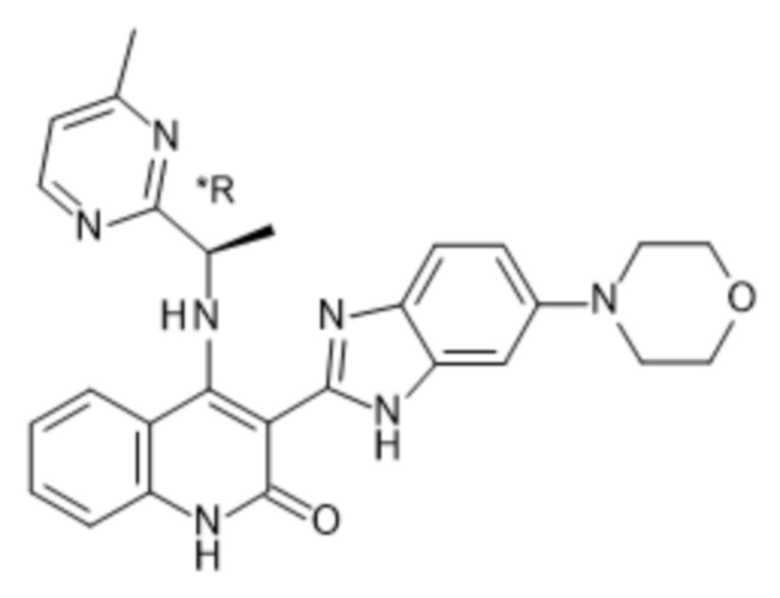
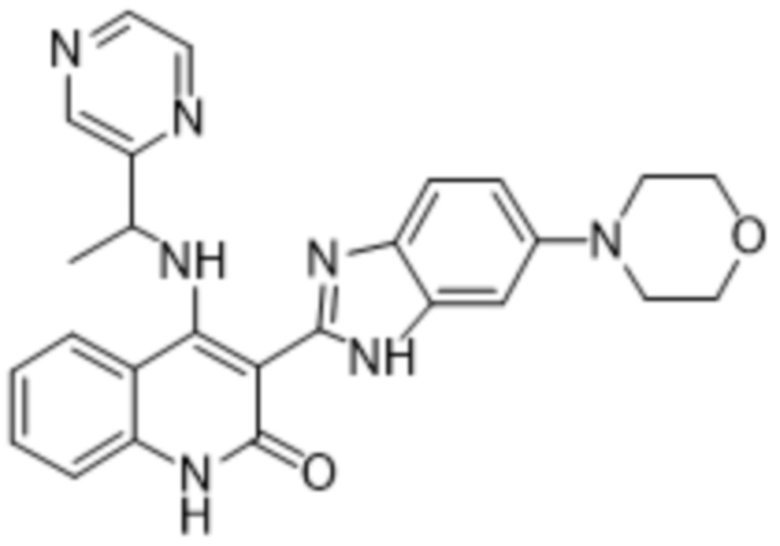
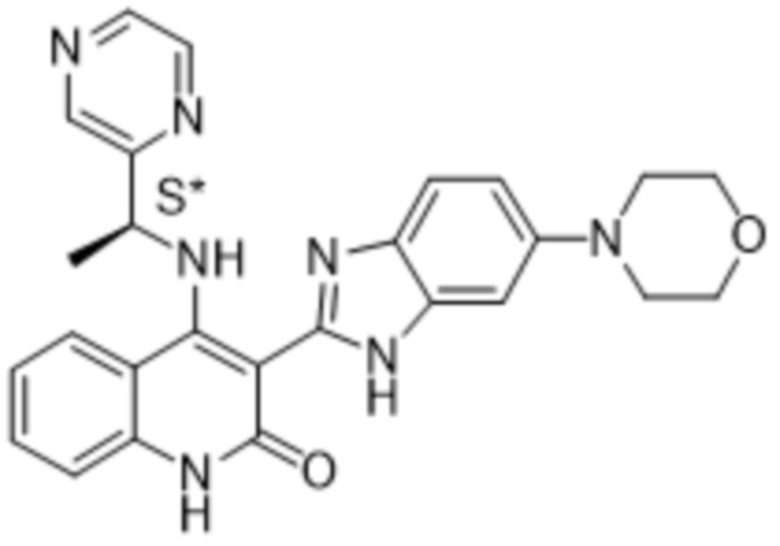
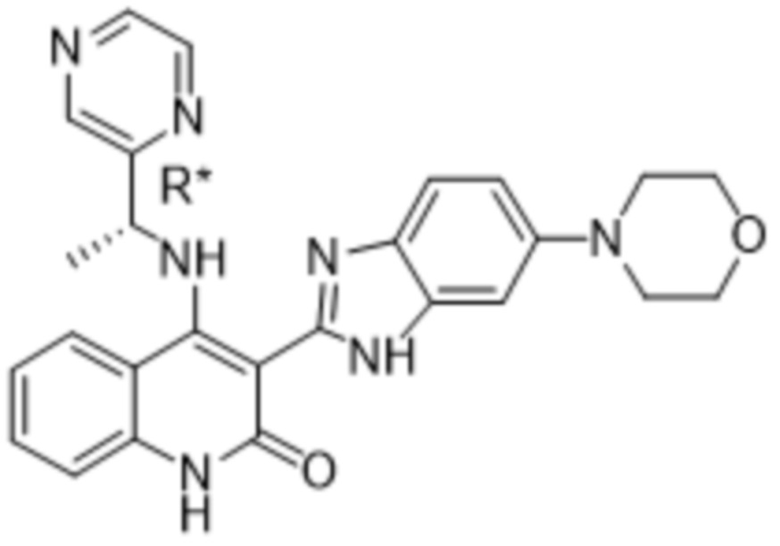

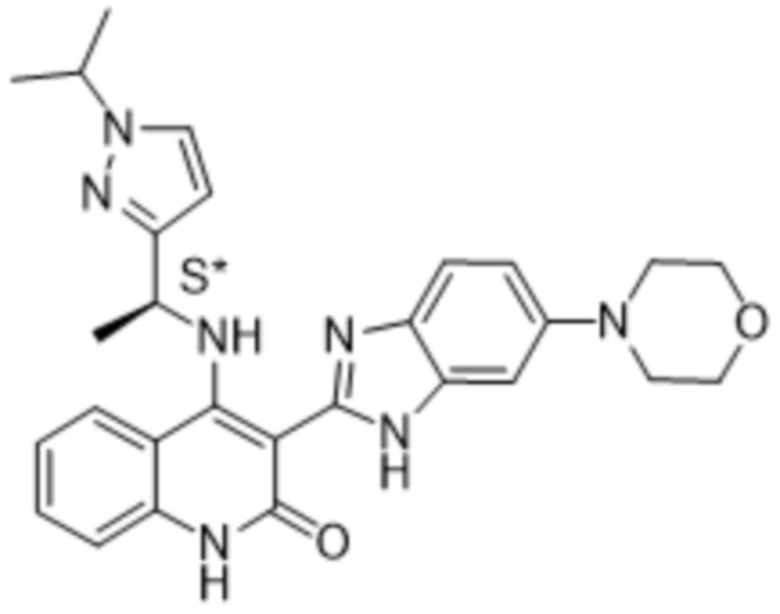

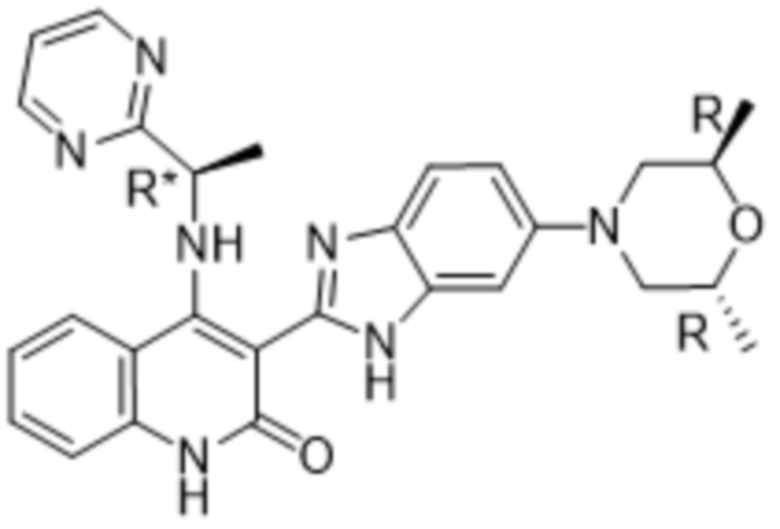
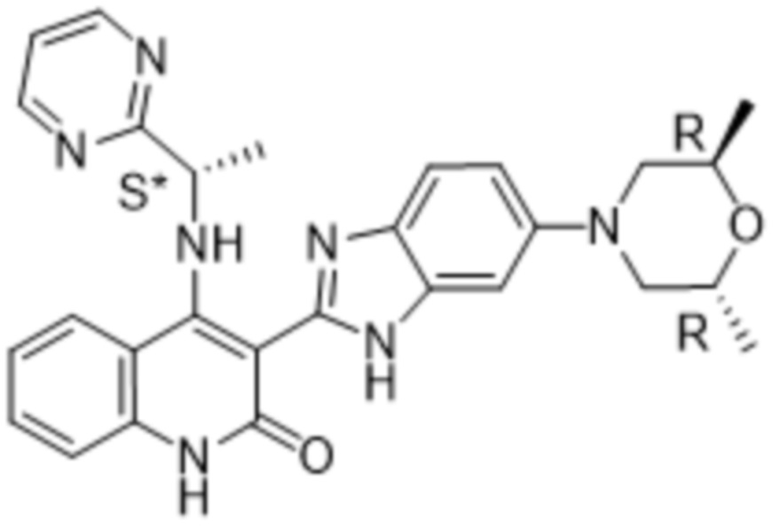
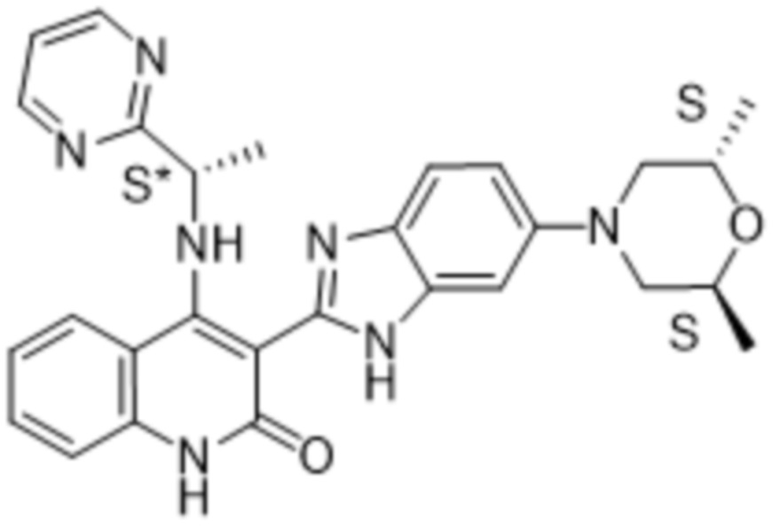

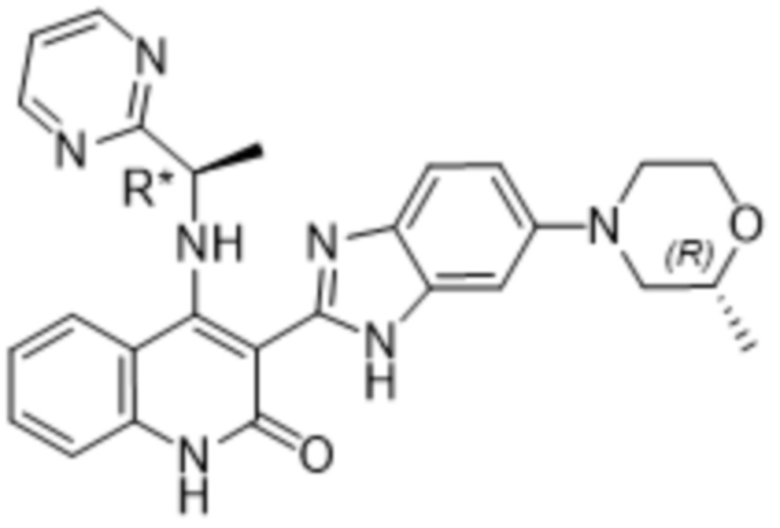
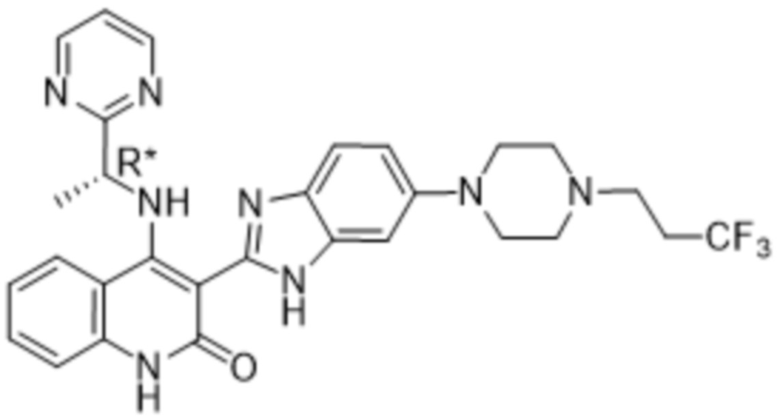
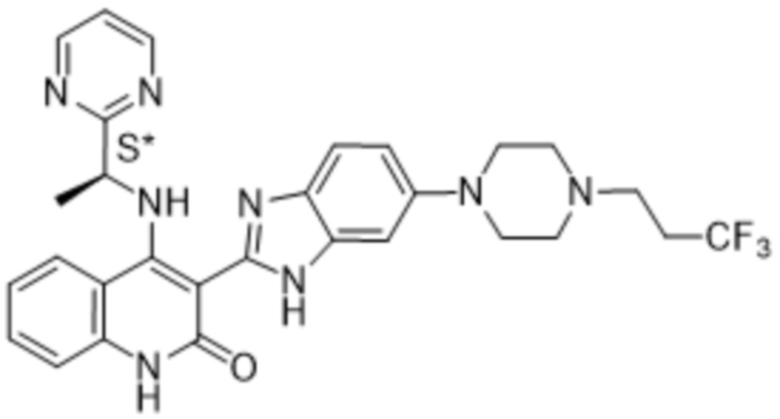
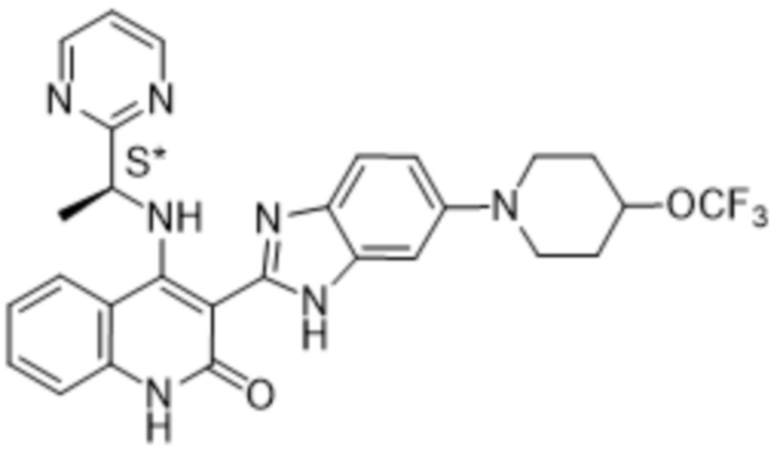
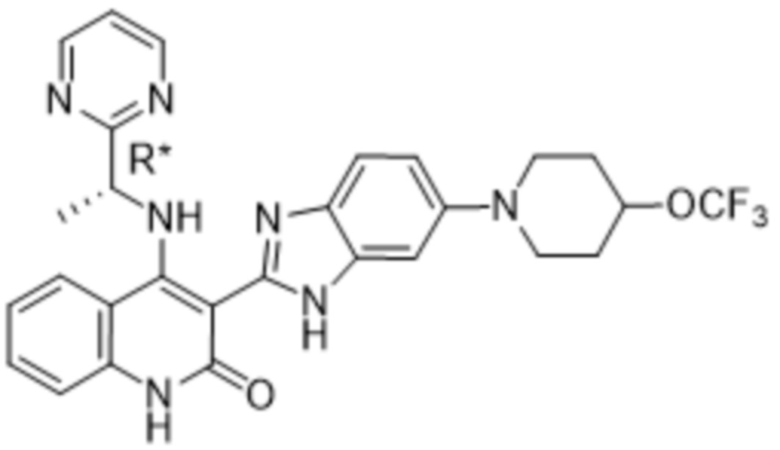
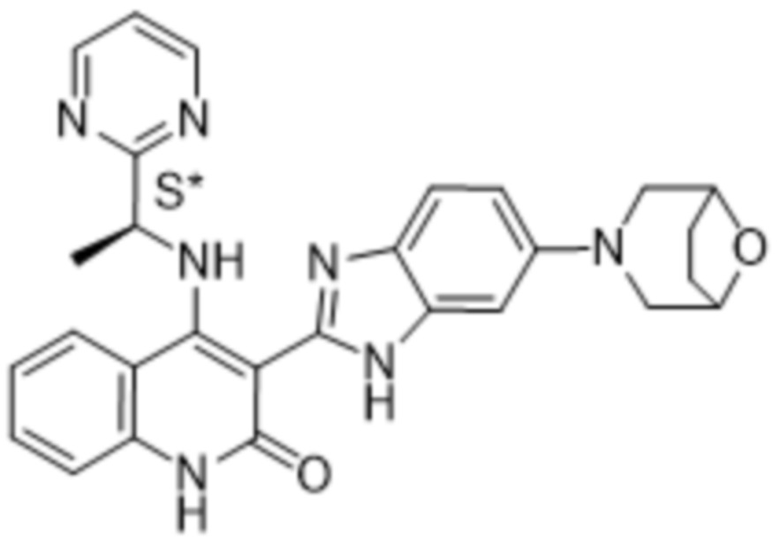


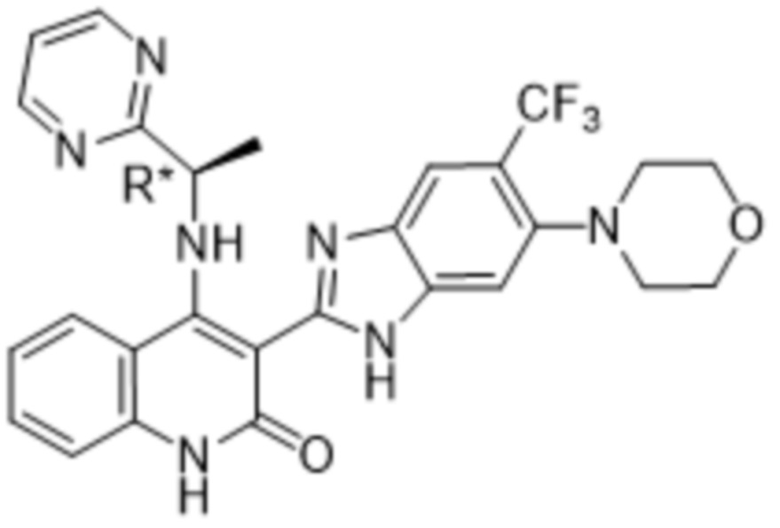
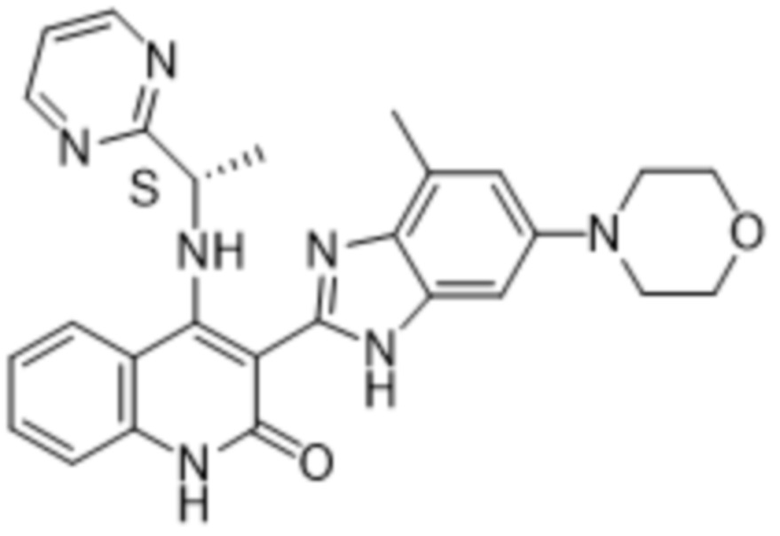

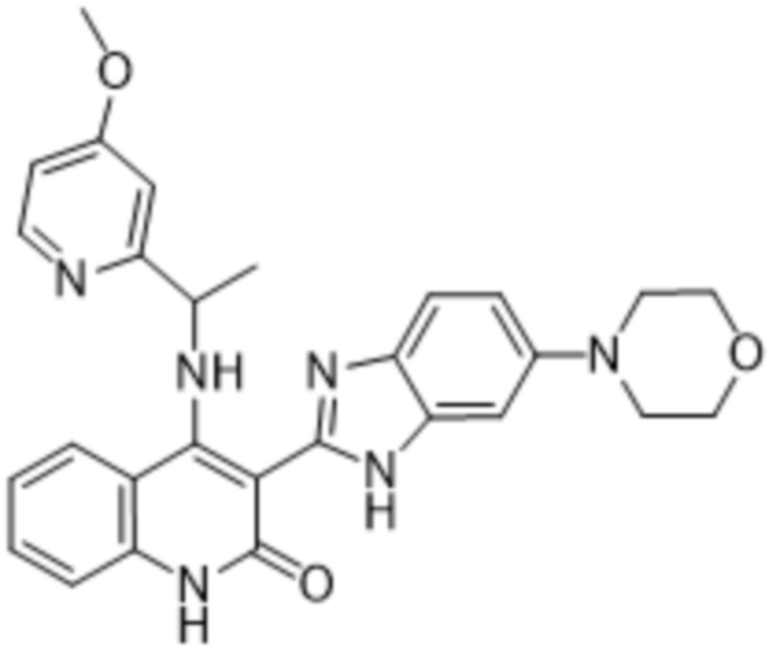
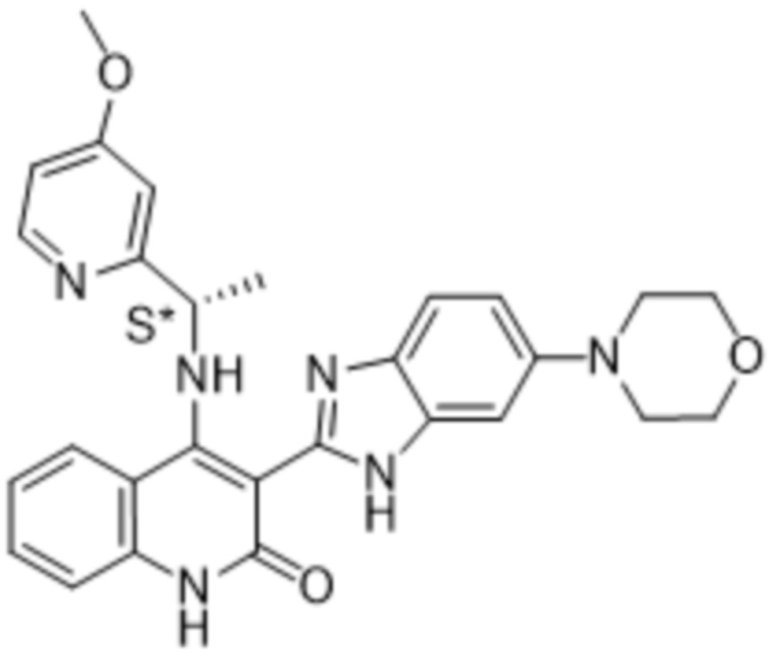
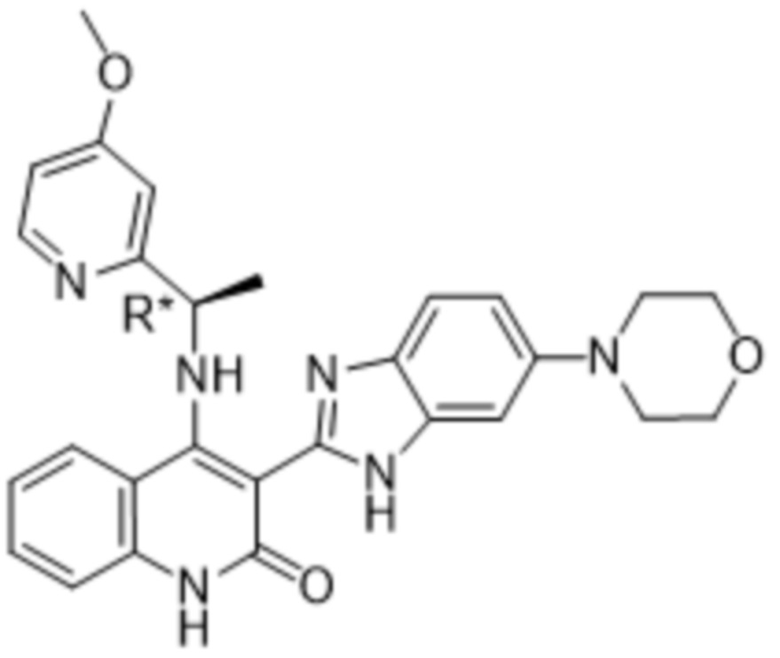
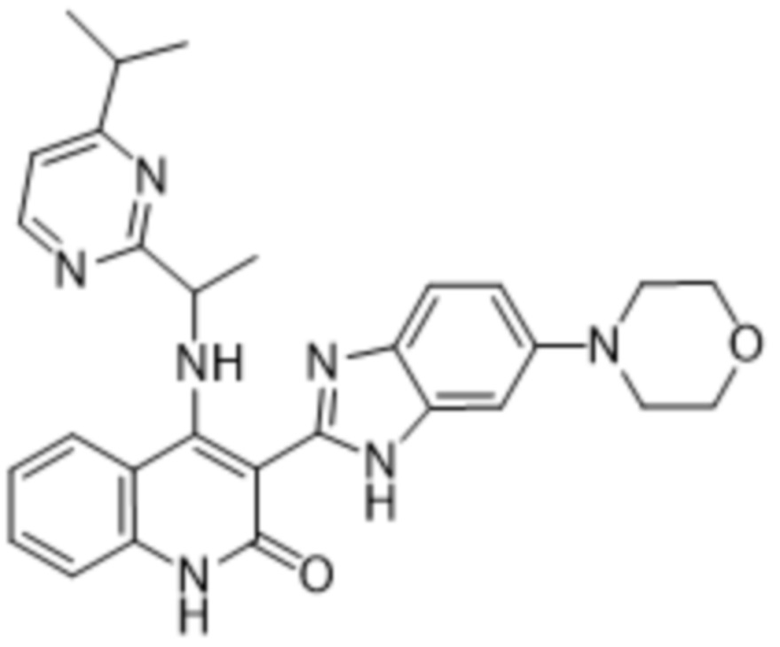
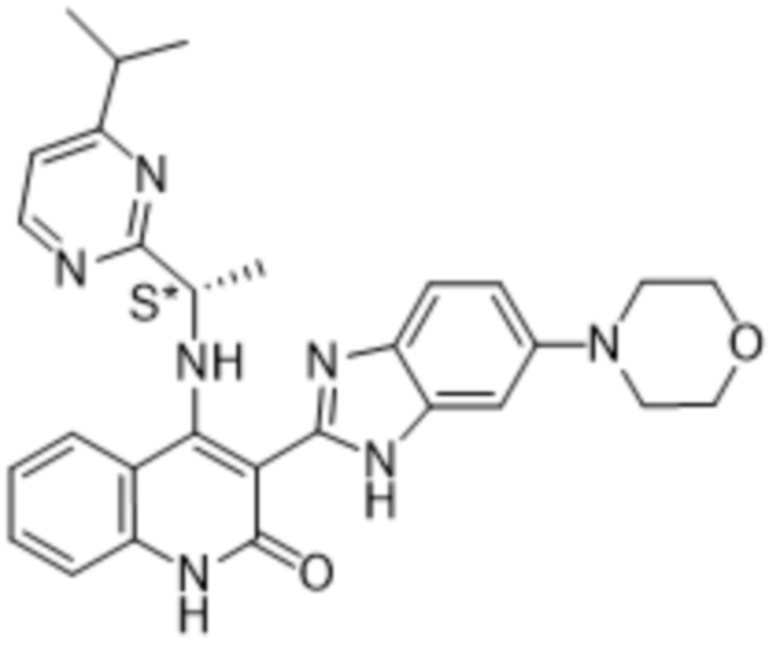
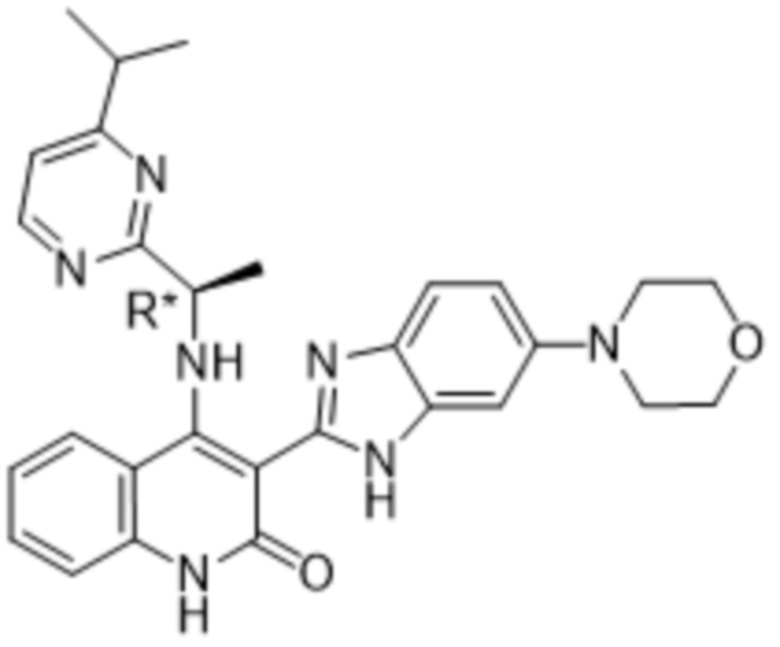
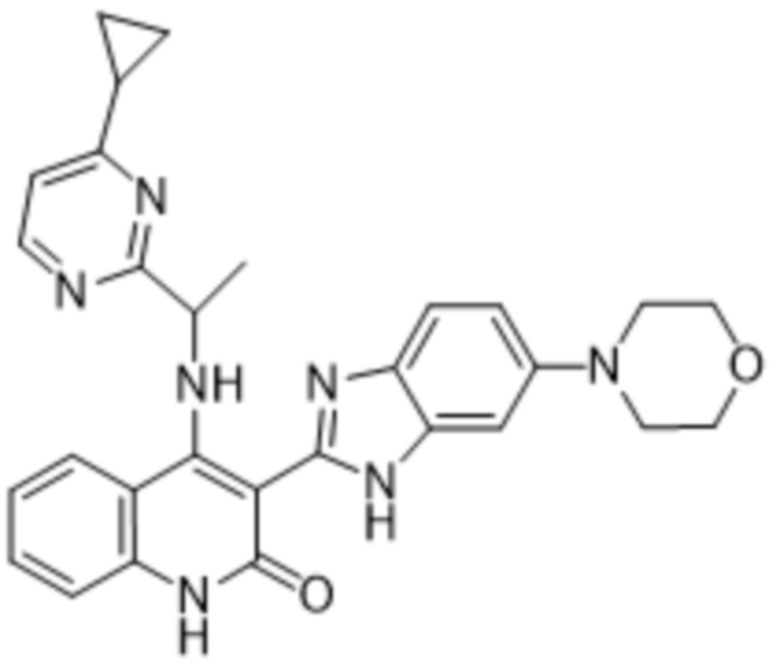

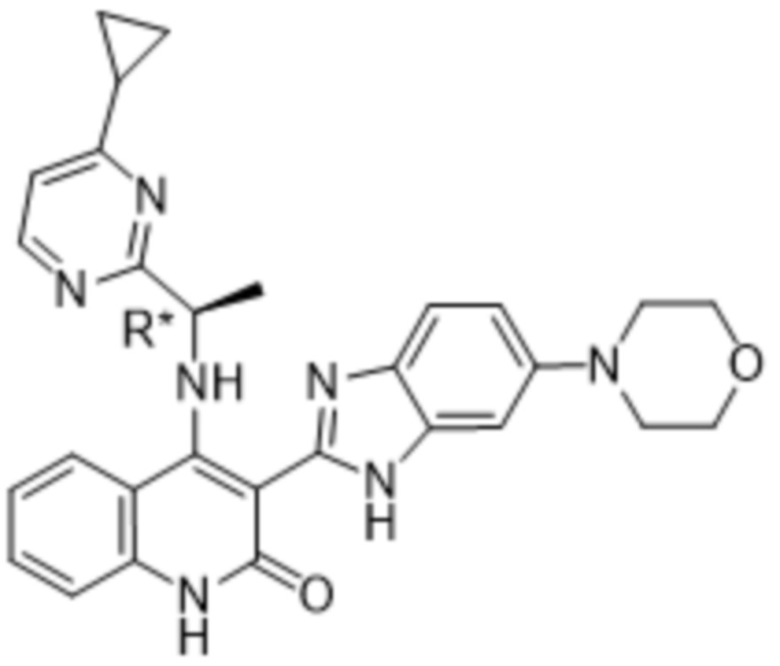
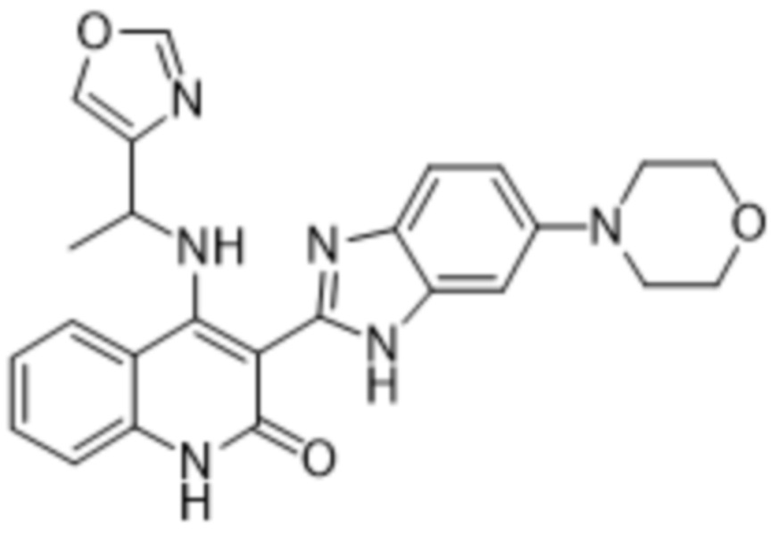
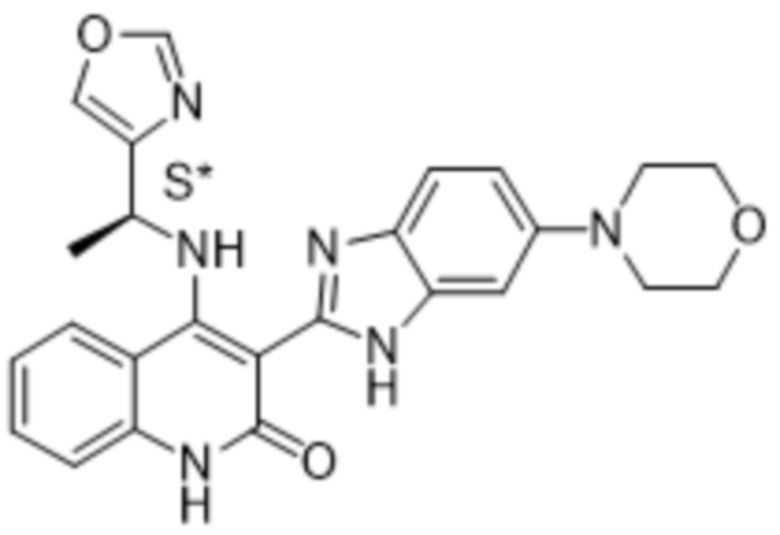
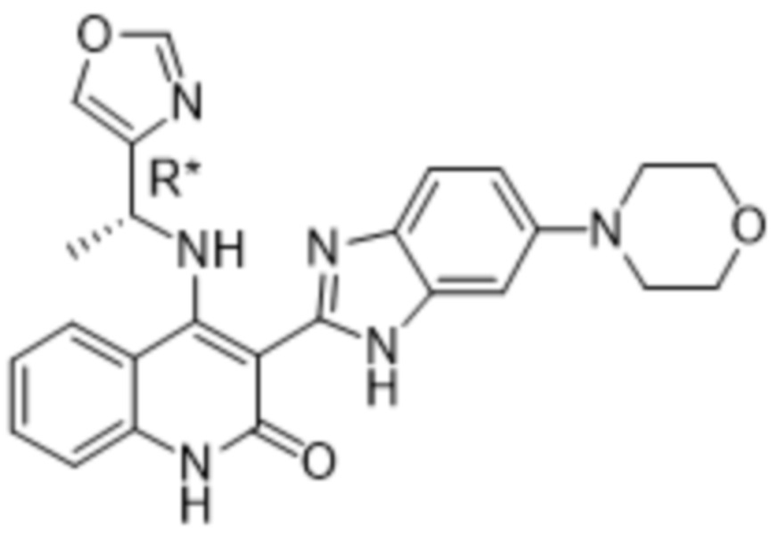
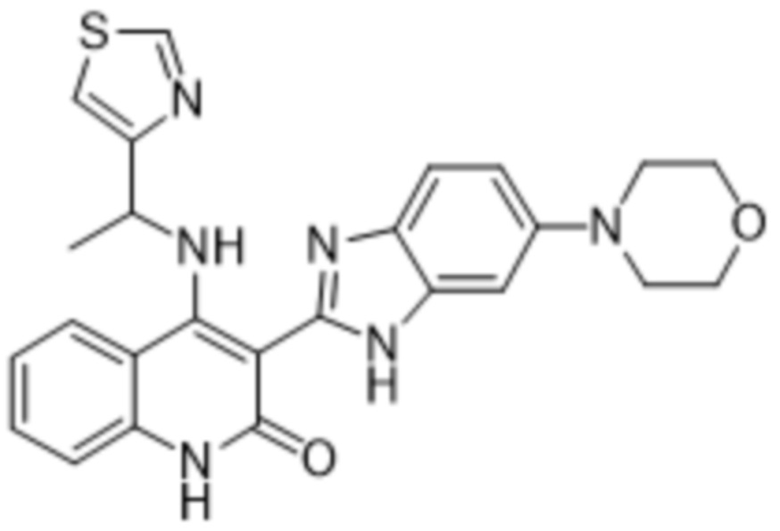
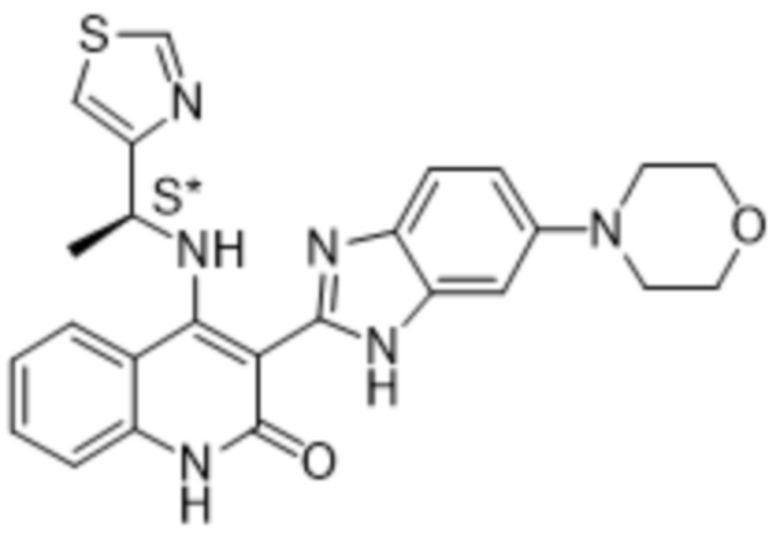
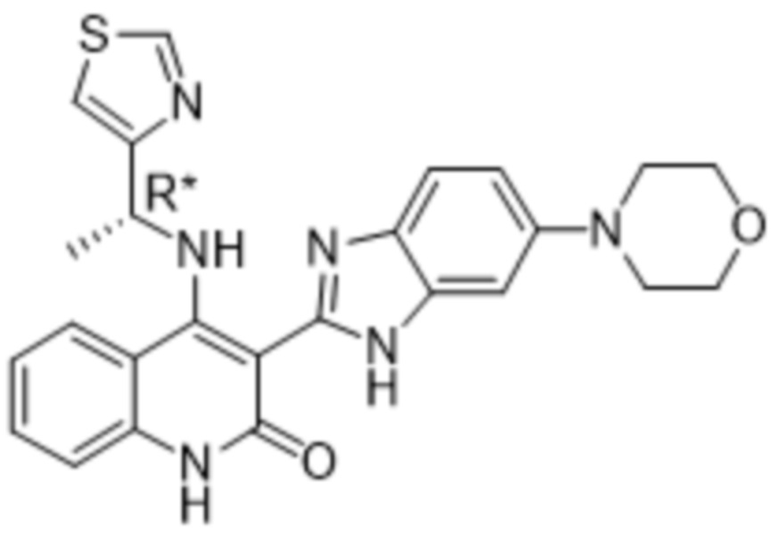
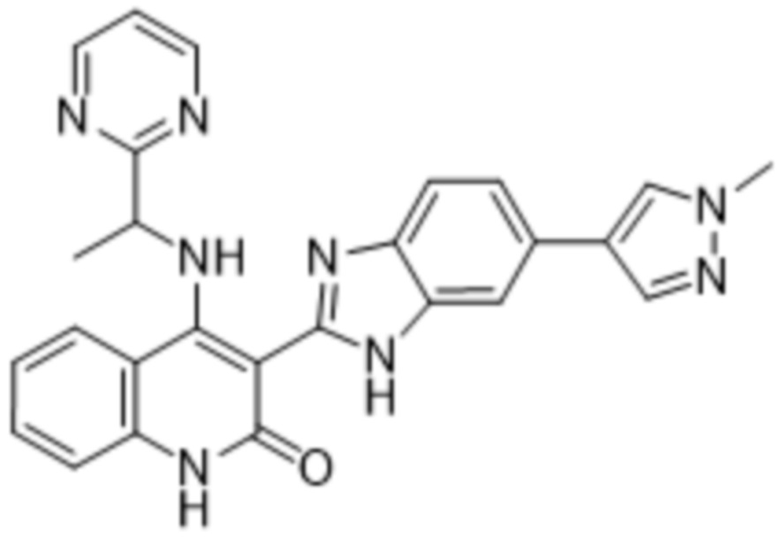
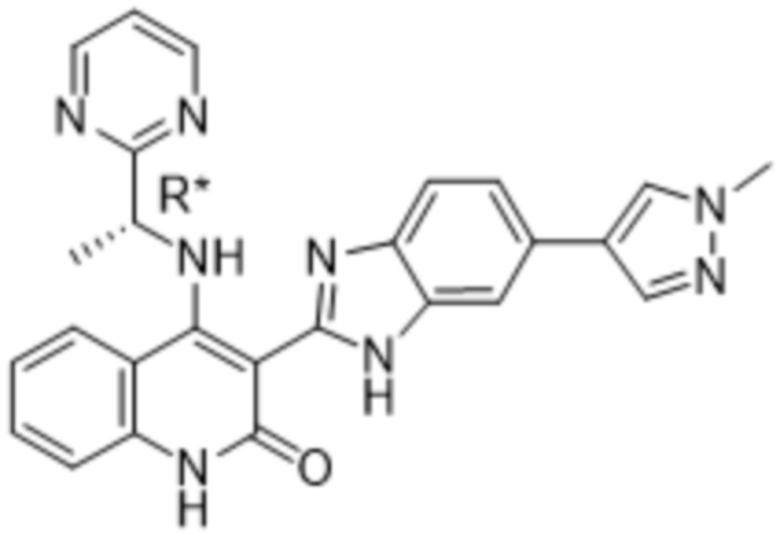
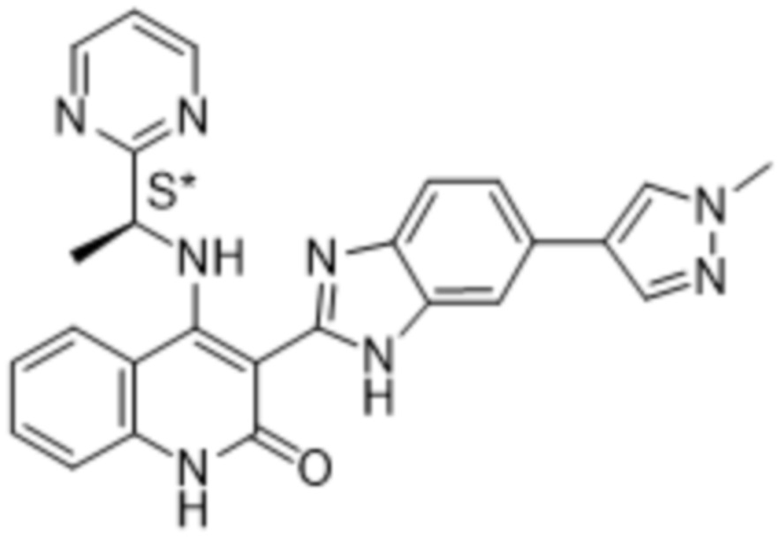
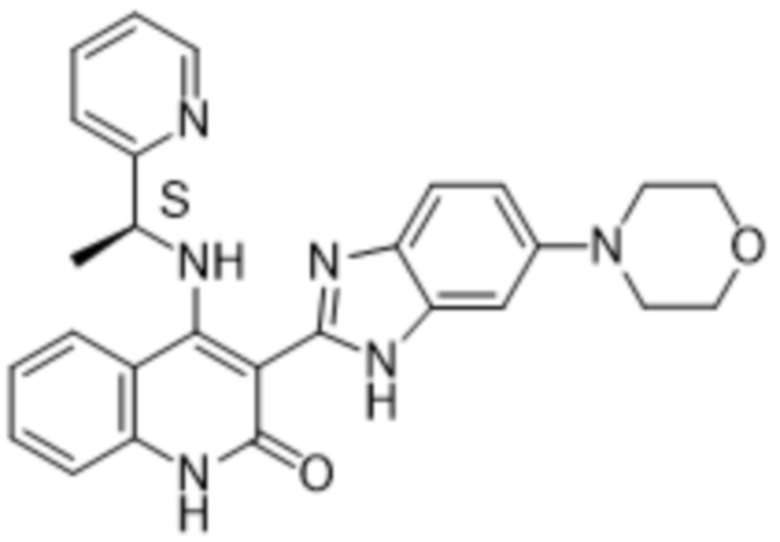
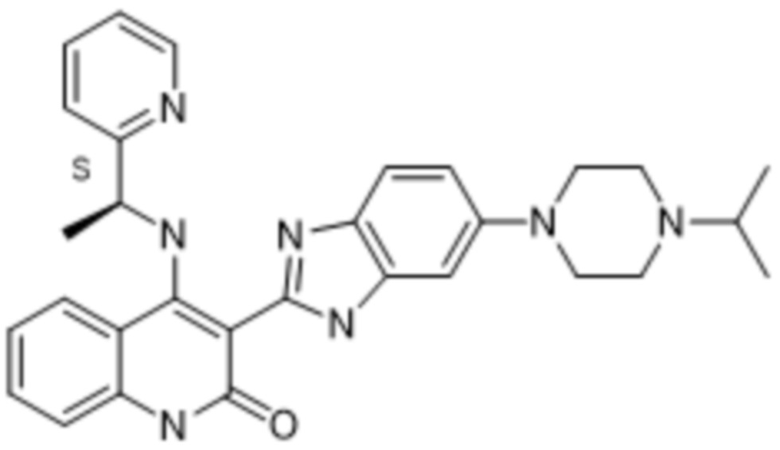
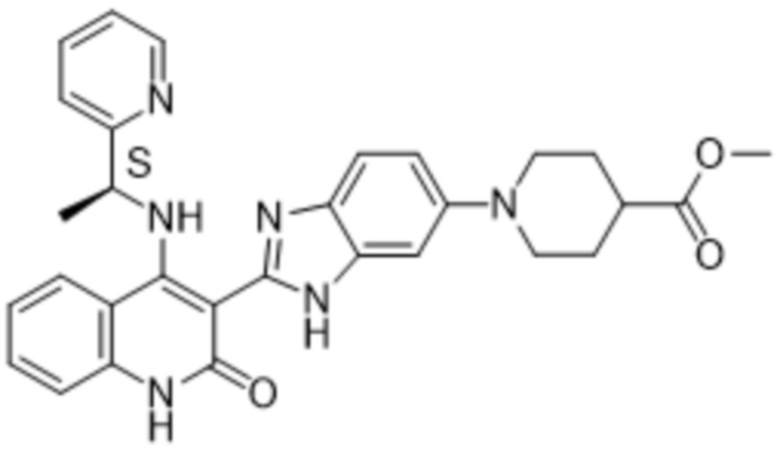
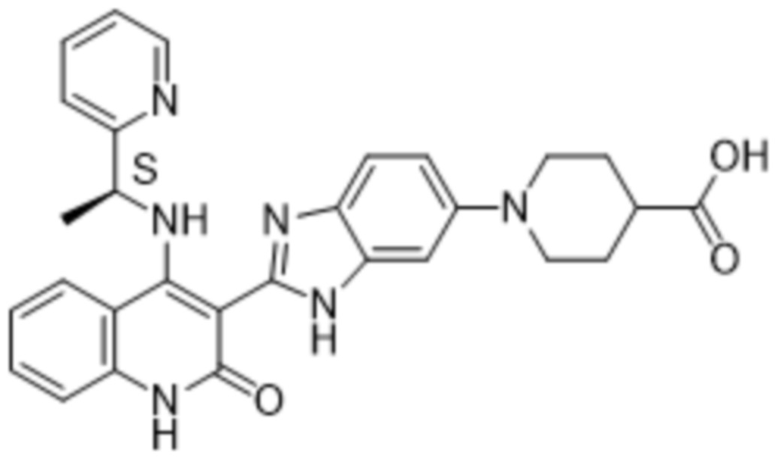 в виде соли трифторуксусной кислоты
в виде соли трифторуксусной кислоты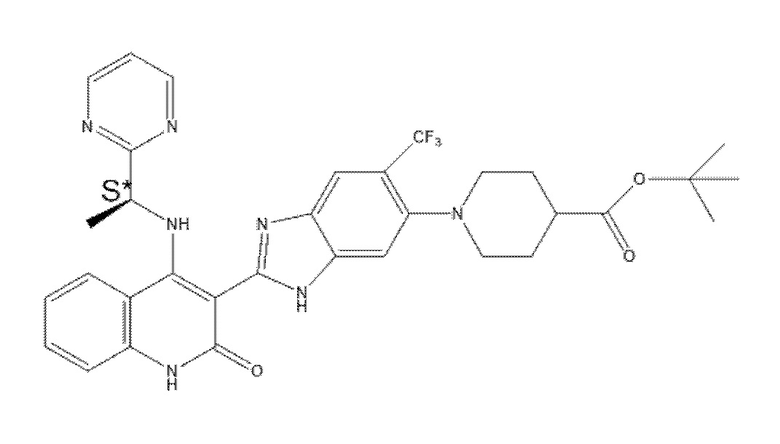

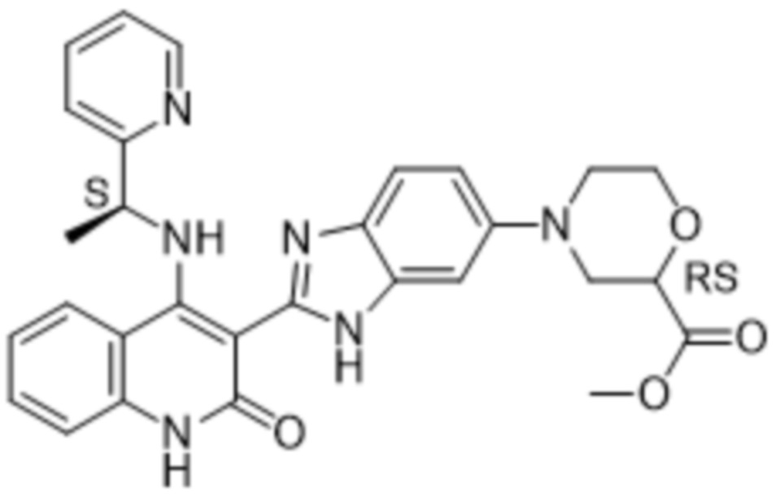
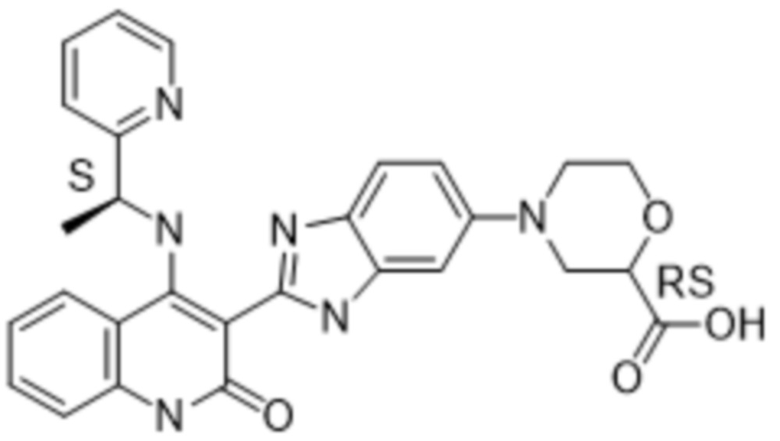
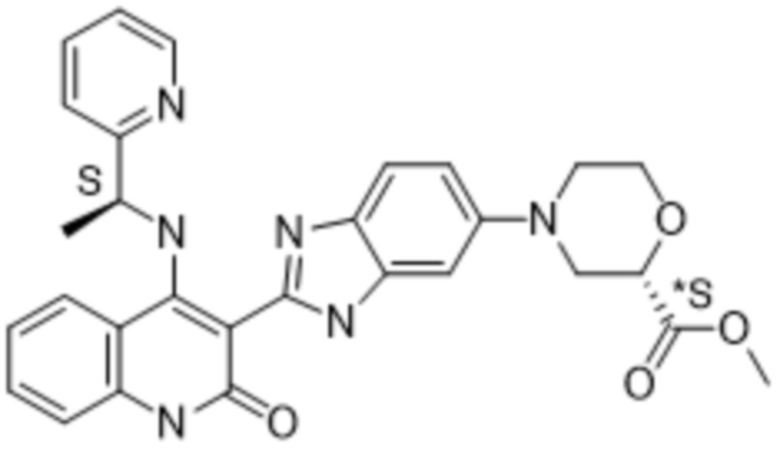
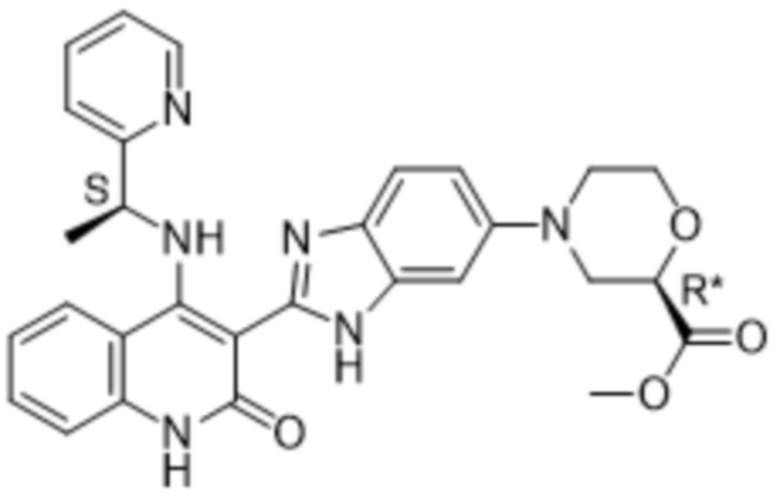


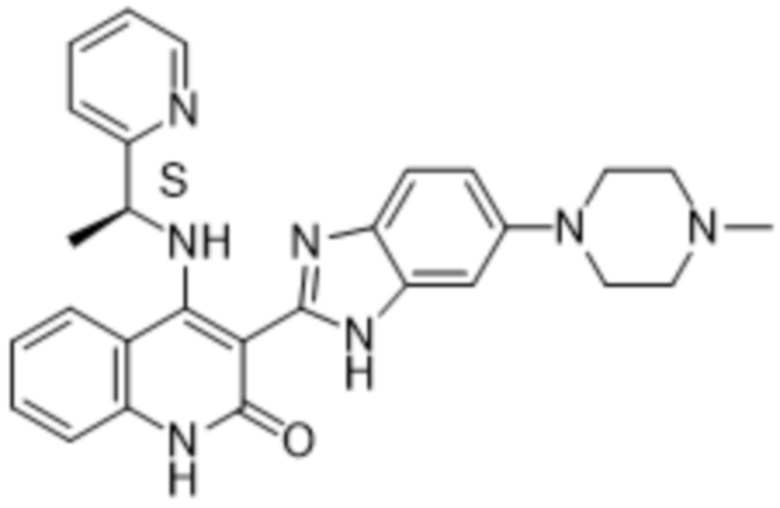
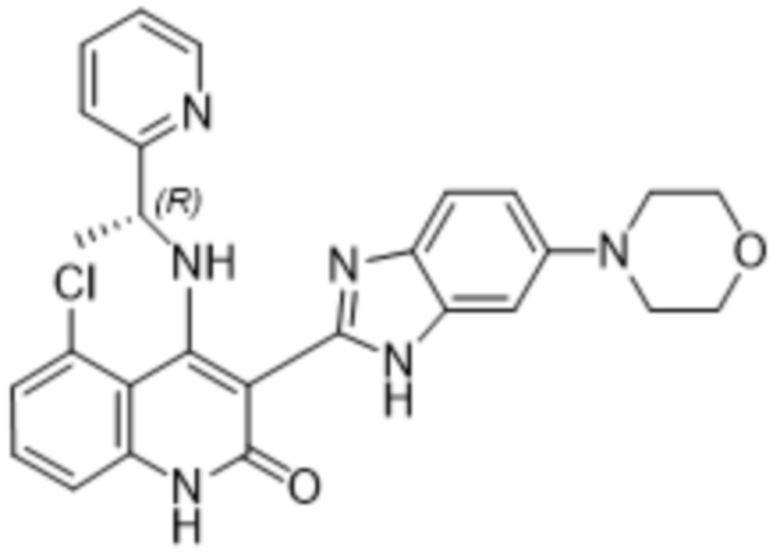
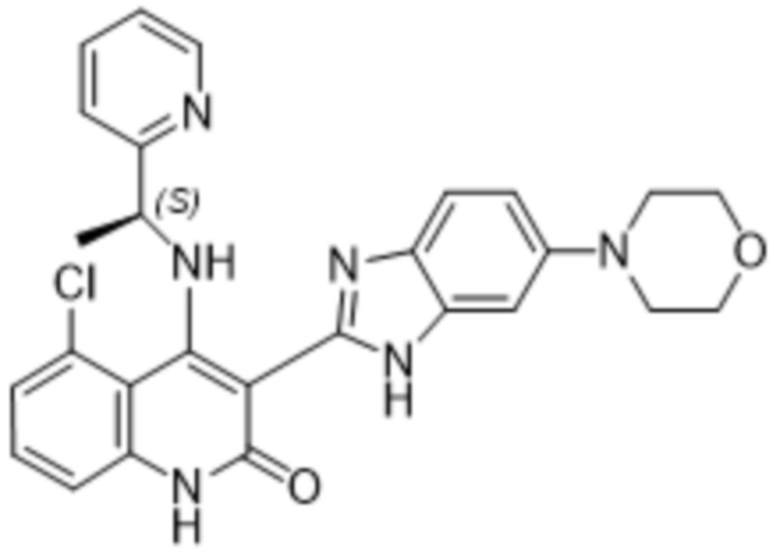
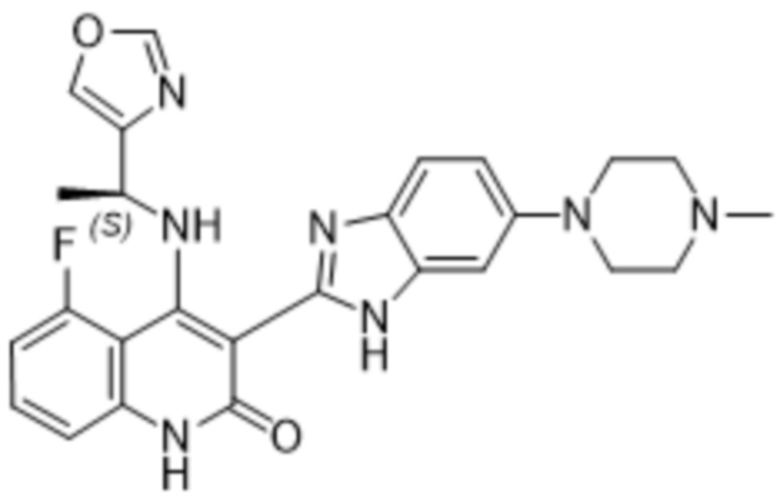
Метод очистки, ЖХ-МС и ЯМР для соединений, приготовленных в соответствии с процедурами, указанными в таблице 1
Соединение 9a
(S*)-3-(7-фтор-6-(4-метилпиперазин-1-ил)-1H-бензо[d]имидазол-2-ил)-4-((1-(оксазол-4-ил)этил)амино)хинолин-2(1H)-он и соединение 9b
(R*)-3-(7-фтор-6-(4-метилпиперазин-1-ил)-1H-бензо[d]имидазол-2-ил)-4-((1-(оксазол-4-ил)этил)амино)хинолин-2(1H)-он
Реакционную смесь очищали препаративной ВЭЖХ (колонка: WatersXBridge 30*150 мм 5 мкм, расход: 20 мл/мин, подвижная фаза A: вода (0,1% NH3⋅H2O), подвижная фаза B: ацетонитрил, градиент: 35-55% (%B)). Целевую фракцию собирали и летучие вещества удаляли при пониженном давлении. Водную фазу лиофилизировали, получая соединение 9 (смесь стереоизомеров) (260 мг, выход 55%) в виде твердого вещества желтого цвета. Неочищенное соединение дополнительно очищали препаративной SFC (условие разделения: колонка: ChiralPak AD-H Daicel chemical Industries, Ltd, 250*30 мм внутр. диам., 5 мкм; подвижная фаза A: сверхкритический CO2, подвижная фаза B: этанол (0,1% NH3.H2O), A:B=60:40 при 50 мл/мин; температура колонки: 38°C; давление сопла: 100 бар; температура сопла: 60°C; температура испарителя: 20°C; температура триммера: 25°C; длина волны: 220 нм) с получением соединения 9a (50 мг, выход 19%, чистота >99%) и соединения 9b.
LC-MS (ESI) Общая процедура A, способ 2 : RT=1,12 минуты, масса рассч. для C26H26FN7O2 487,21, масса/заряд найденное значение 488,4 [M+H]+.
1H ЯМР (400 МГц, DMSO-d6) Общая процедура A : δ 13,06 (s, 1H), 11,76 (d, J=8,4 Гц, 1H), 11,68 (s, 1H), 8,35 (s, 1H), 8,22-8,07 (m, 2H), 7,57 (t, J=7,6 Гц, 1H), 7,40 (m, J=17,7, 8,9 Гц, 2H), 7,19 (t, J=7,6 Гц, 1H), 6,98 (t, J=8,1 Гц, 1H), 5,42-5,30 (m, 1H), 3,35 (s, 4H), 3,03 (s, 4H), 2,24 (s, 3H), 1,65 (d, J=6,4 Гц, 3H).
Соединение 10b
(S*)-3-(6-(4-метилпиперазин-1-ил)-5-(трифторметил)-1H-бензо[d]имидазол-2-ил)-4-((1-(оксазол-4-ил)этил)амино)хинолин-2(1H)-он и Соединение 10a
(R*)-3-(6-(4-метилпиперазин-1-ил)-5-(трифторметил)-1H-бензо[d]имидазол-2-ил)-4-((1-(оксазол-4-ил)этил)амино)хинолин-2(1H)-он
Реакционную смесь очищали препаративной ВЭЖХ (колонка: WatersXBridge 30*150 мм 5 мкм, расход: 20 мл/мин, подвижная фаза A: вода (0,1% NH3⋅H2O), подвижная фаза B: ацетонитрил, градиент: 35-55% (%B)). Целевую фракцию собирали и летучие вещества удаляли при пониженном давлении. Водную фазу лиофилизировали, получая соединение 10 (смесь стереоизомеров) (115 мг, выход 12,4%) в виде твердого вещества желтого цвета. Неочищенное соединение дополнительно очищали препаративной SFC (условие разделения: колонка: ChiralPak IA Daicel Сhemical Industries, Ltd, 250*50 мм внутр. диам., 10 мкм; подвижная фаза A: гексан, подвижная фаза B: IPA (0,1% диэтиламин), A:B=70:30 при 60 мл/мин; температура колонки: 35°C; давление в колонке: 2,0 MПa; температура испарителя: 35°C; длина волны: 254 нм) с получением соединения 10b (16,44 мг, выход 14,30%, чистота >98%) и соединения 10a.
Соединение 10b:LC-MS (ESI) Общая процедура A, способ 1: RT=1,29 минуты, масса рассч. для C27H26F3N7O2 537,2, масса/заряд найденное значение 538,4 [M+H]+.
1H ЯМР (400 МГц, CD3OD) Общая процедура A: δ 8,15 (s, 1H), 8,11 (s, 1H), 7,93 (s, 2H), 7,77 (d, J=17,1 Гц, 1H), 7,56 (t, J=7,5 Гц, 1H), 7,35 (d, J=8,3 Гц, 1H), 7,21 (t, J=7,6 Гц, 1H), 5,38 (q, J=6,4 Гц, 1H), 3,09 (d, J=38,6 Гц, 8H), 2,69 (d, J=14,3 Гц, 3H), 1,76 (d, J=6,6 Гц, 3H).
Соединение 11b
(R*)-3-(6-(4-метилпиперазин-1-ил)-1H-бензо[d]имидазол-2-ил)-4-((1-(оксазол-4-ил)этил)амино)хинолин-2(1H)-он; и соединение 11a
(S*)-3-(6-(4-метилпиперазин-1-ил)-1H-бензо[d]имидазол-2-ил)-4-((1-(оксазол-4-ил)этил)амино)хинолин-2(1H)-он
Остаток очищали препаративной ВЭЖХ (колонка: Inertsil ODS-3 20*250 мм 10 мкм, расход: 20 мл/мин, подвижная фаза A: вода (0,05% NH3⋅H2O), подвижная фаза B: ацетонитрил, градиент: 25-40% (%B)). Целевую фракцию собирали и летучие вещества удаляли при пониженном давлении. Водную фазу лиофилизировали, получая соединение 11 (смесь стереоизомеров) (140 мг, выход 16,8%) в виде твердого вещества желтого цвета. Выделенный материал дополнительно очищали препаративной SFC (условие разделения: ChiralPak AD-H Daicel Сhemical Industries, Ltd, 250*30 мм внутр. диам., 5 мкм; подвижная фаза A: сверхкритический CO2, подвижная фаза B: этанол (0,1% NH3⋅H2O), A:B=60:40 при 50 мл/мин; температура колонки: 38°C; давление сопла: 100 бар; температура сопла: 60°C; температура испарителя: 20°C; температура триммера: 25°C; длина волны: 220 нм) с получением соединения 11b (47,82 мг, выход 5,73%, ее: >99%) и соединения 11а (47,66 мг, выход 5,71%, ее: > 99%).
Соединение 11b:
LC-MS (ESI) Общая процедура A, способ 2: RT=0,97 минуты, масса рассч. для C26H27N7O2 469,2, масса/заряд найденное значение 470,5 [M+H]+.
1H ЯМР (400 МГц, DMSO-d6) Общая процедура A:δ 12,86-12,81 (m, 1H), 11,77-11,63 (m, 2H), 8,36 (d, J=4,8 Гц, 1H), 8,12-8,07 (m, 2H), 7,57-7,38 (m, 3H), 7,23-6,92 (m, 3H), 5,29 (s, 1H), 3,33 (s, 4H), 3,21 (s, 4H), 2,24 (s, 3H),1,64 (t, J=6,4 Гц, 3H).
Соединение 11a:
LC-MS (ESI) Общая процедура A, способ 2: RT=0,97 минуты, масса рассч. для C26H27N7O2 469,2, масса/заряд найденное значение 470,5 [M+H]+.
1H ЯМР (400 МГц, DMSO-d6) Общая процедура A : δ 12,86-12,82 (m, 1H), 11,77-11,63 (m, 2H), 8,36 (d, J=5,2 Гц, 1H), 8,12-8,07 (m, 2H), 7,57-7,38 (m, 3H), 7,23-6,92 (m, 3H), 5,29 (s, 1H), 3,33 (s, 4H), 3,21 (s, 4H), 2,24 (s, 3H),1,64 (t, J=6,8 Гц, 3H).
Соединение 13b
(S*)-3-(7-фтор-6-(4-метилпиперазин-1-ил)-1H-бензо[d]имидазол-2-ил)-4-((1-(пиридин-2-ил)этил)амино)хинолин-2(1H)-он
Реакционную смесь очищали препаративной ВЭЖХ (колонка: WatersXBridge 30*150 мм 5 мкм, расход: 20 мл/мин, подвижная фаза A: вода (0,1% NH3⋅H2O), подвижная фаза B: ацетонитрил, градиент: 35-55% (%B)). Целевую фракцию собирали и летучие вещества удаляли при пониженном давлении. Водную фазу лиофилизировали, получая соединение 13 (смесь стереоизомеров) (400 мг, выход 66%) в виде твердого вещества желтого цвета. Сырое соединение дополнительно очищали препаративной SFC (условие разделения: колонка: ChiralPak AD-H Daicel chemical Industries, Ltd, 250*30 мм внутр. диам., 5 мкм; подвижная фаза A: сверхкритический CO2, подвижная фаза B: этанол (0,1% NH3.H2O), A:B=60:40 при 50 мл/мин; температура колонки: 38°C; давление сопла: 100 бар; температура сопла: 60°C; температура испарителя: 20°C; температура триммера: 25°C; длина волны: 220 нм) с получением соединения 13b (80 мг, выход 20%, чистота >99%).
LC-MS (ESI) Общая процедура A, способ 2: RT=1,11 минуты, масса рассч. для C28H28FN7O 497,23, масса/заряд найденное значение 498,4 [M+H]+.
1H ЯМР (400 МГц, DMSO-d6+D2O) Общая процедура A:δ 8,52 (d, J=3,9 Гц, 1H), 8,02 (d, J=8,4 Гц, 1H), 7,76 (t, J=7,6 Гц, 1H), 7,57-7,42 (m, 3H), 7,36 (t, J=8,9 Гц, 1H), 7,31-7,24 (m, 1H), 7,10 (t, J=7,9 Гц, 1H), 7,02 (t, J=8,1 Гц, 1H), 5,55 (m, J=6,7 Гц, 1H), 3,68 (s, 4H), 3,05 (s, 4H), 2,25 (s, 3H), 1,72 (d, J=6,3 Гц, 3H).
Соединение 14
(S)-3-(6-(4-метилпиперазин-1-ил)-5-(трифторметил)-1H-бензо[d]имидазол-2-ил)-4-((1-(пиридин-2-ил)этил)амино)хинолин-2(1H)-он
Реакционную смесь очищали препаративной ВЭЖХ (колонка: WatersXBridge 30*150 мм 5 мкм, расход: 20 мл/мин, подвижная фаза A: вода (0,1% NH3⋅H2O), подвижная фаза B: ацетонитрил, градиент: 35-55% (%B)). Целевую фракцию собирали и летучие вещества удаляли при пониженном давлении. Водную фазу лиофилизировали, получая соединение 14 (166,33 мг, выход 14,1%, чистота >98%) в виде твердого вещества желтого цвета.
LC-MS (ESI) Общая процедура A, способ 1: RT=1,26 минуты, масса рассч. для C29H28F3N7O 547,2, масса/заряд найденное значение 548,4 [M+H]+.
1H ЯМР (400 МГц, CD3OD) Общая процедура A:δ 8,50 (s, 1H), 8,03-7,86 (m, 2H), 7,80 (s, 1H), 7,75 (s, 1H), 7,58 (s, 1H), 7,50 (t, J=7,6 Гц, 1H), 7,31 (s, 1H), 7,29 (s, 1H), 7,02 (d, J=44,7 Гц, 1H), 5,50 (s, 1H), 3,03 (s, 4H), 2,65 (s, 4H), 2,38 (s, 3H), 1,82 (s, 3H).
Соединение 15
(S)-3-(6-(4-метил-3-оксопиперазин-1-ил)-1H-бензо[d]имидазол-2-ил)-4-((1-(пиридин-2-ил)этил)амино)хинолин-2(1H)-он
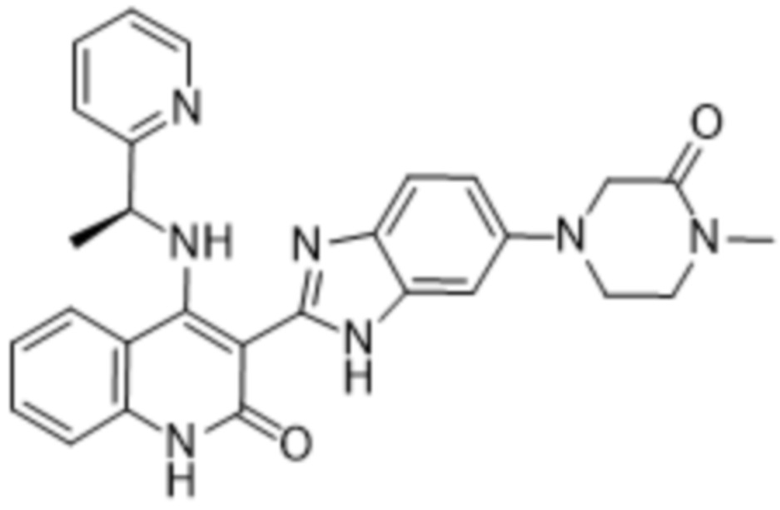
Реакционную смесь очищали препаративной ВЭЖХ (колонка: WatersXBridge 30*150 мм 5 мкм, расход: 20 мл/мин, подвижная фаза A: вода (0,1% NH3⋅H2O), подвижная фаза B: ацетонитрил, градиент: 35-55% (%B)). Целевую фракцию собирали и летучие вещества удаляли при пониженном давлении. Водную фазу лиофилизировали, получая соединение 15 (16,64 мг, выход 14,06%) в виде твердого вещества желтого цвета.
LC-MS (ESI) Общая процедура A, способ 2 : RT=1,13 минуты, масса рассч. для C28H27N7O2 493,2, масса/заряд найденное значение 494,3 [M+H]+.
1H ЯМР (400 МГц, CD3OD) Общая процедура A: δ 8,49 (s, 1H), 7,95 (d, J=8,2 Гц, 1H), 7,78-7,75 (m, 1H), 7,58 (t, J=8,3 Гц, 2H), 7,52-7,47 (m, 1H), 7,34-7,24 (m, 2H), 7,18-6,98 (m, 3H), 5,47-5,42 (m, 1H), 3,85 (s, 2H), 3,54 (s, 4H), 3,03 (s, 3H), 1,78 (d, J=6,0 Гц, 3H).
Соединение 16
(S)-8-фтор-3-(6-морфолино-1Н-бензо[d]имидазол-2-ил)-4-((1-(пиридин-2-ил)этил)амино)хинолин-2(1H)-он
Реакционную смесь очищали препаративной ВЭЖХ (колонка: WatersXBridge 30*150 мм 5 мкм, расход: 20 мл/мин, подвижная фаза A: вода (0,1% NH3⋅H2O), подвижная фаза B: ацетонитрил, градиент: 35-55% (%B)). Целевую фракцию собирали и летучие вещества удаляли при пониженном давлении. Водную фазу лиофилизировали, получая соединение 16 (25 мг, выход 10,3%) в виде твердого вещества коричневого цвета.
LC-MS (ESI) Общая процедура B, способ 2: RT=1,44 минуты, масса рассч. для C27H25FN6O2484,2, масса/заряд найденное значение 485,1 [M+H]+.
1H ЯМР (400 МГц, CD3OD) Общая процедура A : δ 8,48 (d, J=4,4 Гц, 1H), 7,81-7,77 (m, 2H), 7,58-7,53 (m, 1,5H), 7,52-7,46 (m, 0,5H), 7,36-7,24 (m, 2,5H), 7,16 (s, 0,5H), 7,06 (m, 2H), 5,48-5,38 (m, 1H), 3,96-3,84 (m, 4H), 3,18 (m, 4H), 1,78 (d, J=6,2 Гц, 3H).
Соединение 17
(S)-6-фтор-3-(6-морфолино-1Н-бензо[d]имидазол-2-ил)-4-((1-(пиридин-2-ил)этил)амино)хинолин-2(1H)-он
Смесь очищали препаративной ВЭЖХ (колонка: WatersXBridge 30*150 мм 5 мкм, расход: 20 мл/мин, подвижная фаза A: вода (0,1% NH3⋅H2O), подвижная фаза B: ацетонитрил, градиент: 35-55% (%B)). Целевую фракцию собирали и летучие вещества удаляли при пониженном давлении. Водную фазу лиофилизировали, получая соединение 17 (120 мг, выход 24,8%) в виде твердого вещества желтого цвета.
LC-MS (ESI) Общая процедура B, способ 2 : RT=1,34 минуты, масса рассч. для C27H25FN6O2 484,2, масса/заряд найденное значение 485,1[M+H]+.
1H ЯМР (400 МГц, DMSO-d6) Общая процедура A: δ12,92-12,88 (m, 1H), 12,33 (d, J =8,0 Гц, 0,40H), 12,19 (d, J =8,0 Гц, 0,53H), 11,65 (m, 1H), 8,55 (m, 1H), 7,79-7,70 (m, 2H), 7,61-7,34 (m, 4H), 7,28-7,23 (m, 2H), 7,01-6,96 (m, 1H), 5,48-5,44 (m, 1H), 3,78 (m, 4H), 3,11 (m, 4H), 1,73-1,70 (m, 3H).
Соединение 18
(S)-3-(6-((1-метилпиперидин-4-ил)амино)-5-(трифторметил)-1H-бензо[d]имидазол-2-ил)-4-((1-(пиридин-2-ил)этил)амино)хинолин-2(1H)-он
Реакционную смесь очищали препаративной ВЭЖХ (колонка: WatersXBridge 30*150 мм 5 мкм, расход: 20 мл/мин, подвижная фаза A: вода (0,1% NH3⋅H2O), подвижная фаза B: ацетонитрил, градиент: 35-55% (%B)). Целевую фракцию собирали и летучие вещества удаляли при пониженном давлении. Водную фазу лиофилизировали, получая сырое соединение, которой затем очищали, используя препаративную ТСХ (дихлорметан/метанол=8/1, Rf=0,3), получая соединение 18 (39,35 мг, выход 8,4%, чистота >99% ) в виде твердого вещества желтого цвета.
LC-MS (ESI) Общая процедура B, способ 2: RT=1,31минуты, масса рассч. для C30H30F3N7O 561,2, масса/заряд найденное значение 562,2 [M+H]+.
1H ЯМР (400 МГц, DMSO-d6) Общая процедура A: δ 13,06 (d, J=16,9 Гц, 1H), 12,18 (d, J=8,1 Гц, 0,5H), 12,06 (d, J=8,0 Гц, 0,5H), 11,62 (d, J=10,1 Гц, 1H), 8,62-8,48 (m, 1H), 2,91-7,68 (m, 3H), 7,59-7,45 (m, 2H), 7,40-7,02 (m, 4H), 5,59-5,46 (m, 1H), 4,52 (d, J=6,3 Гц, 0,5H), 4,32 (d, J=7,0 Гц, 0,5H), 3,84-3,51 (m, 3H), 3,08-2,87 (m, 2H), 2,68 (s, 3H), 2,26-2,10 (m, 2H), 1,94-1,53 (m, 5H).
Соединение 19
(S)-3-(6-(метил(1-метилпиперидин-4-ил)амино)-5-(трифторметил)-1H-бензо[d]имидазол-2-ил)-4-((1-(пиридин-2-ил)этил)амино)хинолин-2(1H)-он
Реакционную смесь очищали препаративной ВЭЖХ (колонка: WatersXBridge 30*150 мм 5 мкм, расход: 20 мл/мин, подвижная фаза A: вода (0,1% NH3⋅H2O), подвижная фаза B: ацетонитрил, градиент: 35-55% (%B)). Целевую фракцию собирали и летучие вещества удаляли при пониженном давлении. Водную фазу лиофилизировали, получая соединение 19 (2,10 мг, выход 3,7%, чистота >99%) в виде твердого вещества желтого цвета.
LC-MS (ESI) Общая процедура A, способ 2: RT=1,50 минуты, масса рассч. для C31H32F3N7O 575,2, масса/заряд найденное значение 576,4 [M+H]+.
1H ЯМР (400 МГц, CD3OD) Общая процедура A: δ 8,54-8,47 (m, 1H), 8,01-7,90 (m, 2H), 7,84-7,71 (m, 2H), 7,58 (d, J=7,9 Гц, 1H), 7,55-7,47 (m, 1H), 7,37-7,24 (m, 2H), 7,13-7,05 (m, 1H), 5,55-5,46 (m, 1H), 3,00-2,84 (m, 3H), 2,70 (s, 3H), 2,26 (s, 3H), 2,16-2,01 (m, 2H), 1,96-1,54 (m, 7H).
Соединение 20
(S)-3-(6-(морфолин-4-карбонил)-1Н-бензо[d]имидазол-2-ил)-4-((1-(пиридин-2-ил)этил)амино)хинолин-2(1H)-он
Реакционную смесь очищали препаративной ВЭЖХ (колонка: WatersXBridge 30*150 мм 5 мкм, расход: 20 мл/мин, подвижная фаза A: вода (0,1% NH3⋅H2O), подвижная фаза B: ацетонитрил, градиент: 35-55% (%B)). Целевую фракцию собирали и летучие вещества удаляли при пониженном давлении. Водную фазу лиофилизировали, получая соединение 20 (105,21 мг, выход 24,76%, чистота >99%) в виде твердого вещества желтого цвета.
LC-MS (ESI) Общая процедура B, способ 1: RT=1,48 минуты, масса рассч. для C28H26N6O3 494,2, масса/заряд найденное значение 495,2 [M+H]+.
1H ЯМР (400 МГц, DMSO-d6) Общая процедура A:δ 13,22 (d, J=3,8 Гц, 1H), 12,26 (d, J=7,8 Гц, 1H), 11,60 (s, 1H), 8,55 (s, 1H), 8,00 (d, J=8,5 Гц, 1H), 7,83-7,75 (m, 2H), 7,67 (d, J=11,0 Гц, 1H), 7,51 (d, J=7,3 Гц, 2H), 7,35 (d, J=8,2 Гц, 1H), 7,26 (d, J=7,6 Гц, 2H), 7,08 (t, J=7,5 Гц, 1H), 5,58-5,50 (m, 1H), 3,63 (s, 4H), 3,55 (s, 4H), 1,74 (d, J=4,2 Гц, 3H).
Соединение 21
3-(6-((2R,6R)-2,6-диметилморфолино)-1H-бензо[d]имидазол-2-ил)-4-(((S)-1-(пиридин-2-ил)этил)амино)хинолин-2(1Н)-он
Смесь концентрировали при пониженном давлении, получая остаток, который очищали хроматографией на силикагеле (дихлорметан: метанол=30 : 1) и затем дополнительно очищали препаративной ВЭЖХ (колонка: WatersXBridge 30*150 мм 5 мкм, расход: 20 мл/мин, подвижная фаза A: вода (0,1% NH3⋅H2O), подвижная фаза B: ацетонитрил, градиент: 35-55% (%B)). Целевую фракцию собирали и летучие вещества удаляли при пониженном давлении. Водную фазу лиофилизировали, получая соединение 21 (8,11 мг, выход 3,8%, чистота >99%) в виде твердого вещества желтого цвета.
LC-MS (ESI) Общая процедура A, способ 2: RT=1,37 минуты, масса рассч. для C29H30N6O2 494,6, масса/заряд найденное значение 495,4 [M+H]+.
1H ЯМР (400 МГц, DMSO-d6) Общая процедура A: δ 12,91 (s, 0,5H), 12,87 (s, 0,5H), 12,27 (d, J=8,4 Гц, 0,5H), 12,15 (d, J=7,8 Гц, 0,5H), 11,57 (s, 1H), 8,54 (t, J=5,1 Гц, 1H), 7,96 (t, J=7,7 Гц, 1H), 7,76 (dd, J=15,1, 7,6 Гц, 1H), 7,62-7,45 (m, 3H), 7,38-7,20 (m, 3H), 7,16-6,88 (m, 2H), 5,55-5,43 (m, 1H), 4,18-4,01 (m, 2H), 3,16 (d, J=10,8 Гц, 3H), 2,84 (dd, J=11,3, 6,0 Гц, 2H), 1,72 (t, J=7,3 Гц, 3H), 1,25 (d, J=6,1 Гц, 6H).
Соединение 22a
3-(6-((2S,6R)-2,6-диметилморфолино)-1H-бензо[d]имидазол-2-ил)-4-(((S*)-1-(пиримидин-2-ил)этил)амино)хинолин-2(1Н)-он
Реакционную смесь очищали препаративной ВЭЖХ (колонка: WatersXBridge 30*150 мм 5 мкм, расход: 20 мл/мин, подвижная фаза A: вода (0,1% NH3⋅H2O), подвижная фаза B: ацетонитрил, градиент: 35-55% (%B)). Целевую фракцию собирали и летучие вещества удаляли при пониженном давлении. Водную фазу лиофилизировали, получая соединение 22 (смесь стереоизомеров) (23 мг, выход 9,5%) в виде твердого вещества желтого цвета. Сырое соединение дополнительно очищали препаративной SFC (условие разделения: колонка: ChiralPak AD-H Daicel Сhemical Industries, Ltd, 250*30 мм внутр. диам., 5 мкм; подвижная фаза A: сверхкритический CO2, подвижная фаза B: изопропанол (0,1% диэтиламин), A:B=60:40 при 50 мл/мин; температура колонки: 38°C; давление сопла: 100 бар; температура сопла: 60°C; температура испарителя: 20°C; температура триммера: 25°C; длина волны: 220 нм) с получением соединения 22a (2,17 мг, выход 9,4%, ее: > 99%) и соединение 22b.
Соединение 22a: LC-MS (ESI) Общая процедура A, способ 2 : RT=1,16 минуты, масса рассч. для C28H29N7O2 495,2, масса/заряд найденное значение 496,4 [M+H]+.
1H ЯМР (400 МГц, CD3OD) Общая процедура A : δ 8,67 (d, J=4,9 Гц, 2H), 8,08 (d, J=8,3 Гц, 1H), 7,51 (t, J=7,3 Гц, 2H), 7,35-7,24 (m, 2H), 7,17 (m, 2H), 7,03 (d, J=8,7 Гц, 1H), 5,44 (d, J=6,7 Гц, 1H), 3,86 (s, 2H), 3,51 (d, J=11,4 Гц, 2H), 2,40 (t, J=11,0 Гц, 2H), 1,78 (d, J=6,7 Гц, 3H), 1,25 (d, J=6,2 Гц, 6H).
Соединение 23a
(S*)-3-(7-фтор-6-морфолино-1Н-бензо[d]имидазол-2-ил)-4-((1-(пиримидин-2-ил)этил)амино)хинолин-2(1H)-он)
Реакционную смесь очищали препаративной ВЭЖХ (колонка: WatersXBridge 30*150 мм 5 мкм, расход: 20 мл/мин, подвижная фаза A: вода (0,1% NH3⋅H2O), подвижная фаза B: ацетонитрил, градиент: 35-55% (%B)). Целевую фракцию собирали и летучие вещества удаляли при пониженном давлении. Водную фазу лиофилизировали, получая соединение 23 (смесь стереоизомеров) (140 мг, выход 19%) в виде твердого вещества желтого цвета. Сырое соединение дополнительно очищали препаративной SFC (условие разделения: колонка: ChiralPak AD-H Daicel chemical Industries, Ltd, 250*30 мм внутр. диам., 5 мкм; подвижная фаза A: сверхкритический CO2, подвижная фаза B: этанол (0,1% NH3.H2O), A:B=60:40 при 50 мл/мин; температура колонки: 38°C; давление сопла: 100 бар; температура сопла: 60°C; температура испарителя: 20°C; температура триммера: 25°C; длина волны: 220 нм) с получением соединения 23a (50 мг, выход 36%, чистота >99%) и соединения 23b.
Соединение 23a: LC-MS (ESI) Общая процедура A, способ 2: RT=1,56 минуты, масса рассч. для C26H24FN7O2 485,2, масса/заряд найденное значение 486,4 [M+H]+.
1H ЯМР (400 МГц, DMSO-d6) Общая процедура A ;δ 13,08 (s, 1H), 12,14 (d, J=7,9 Гц, 1H), 11,59 (s, 1H), 8,77 (d, J=4,9 Гц, 2H), 8,09 (d, J=8,3 Гц, 1H), 7,51 (t, J=7,6 Гц, 1H), 7,45 (d, J=8,5 Гц, 1H), 7,36 (m, 2H), 7,09 (t, J=7,8 Гц, 1H), 7,00 (t, J=8,0 Гц, 1H), 5,65-5,55 (m, 1H), 3,83 -3,74 (m, 4H), 3,04 (m, 4H), 1,75 (d, J=6,6 Гц, 3H).
Соединение 24
(S)-3-(7-фтор-6-морфолино-1Н-бензо[d]имидазол-2-ил)-4-((1-(пиридин-2-ил)этил)амино)хинолин-2(1H)-он)
Реакционную смесь очищали препаративной ВЭЖХ (колонка: WatersXBridge 30*150 мм 5 мкм, расход: 20 мл/мин, подвижная фаза A: вода (0,1% NH3⋅H2O), подвижная фаза B: ацетонитрил, градиент: 35-55% (%B)). Целевую фракцию собирали и летучие вещества удаляли при пониженном давлении. Водную фазу лиофилизировали, получая соединение 24 (75 мг, выход 12%, чистота >99%) в виде твердого вещества желтого цвета.
LC-MS (ESI) Общая процедура A, способ 2: RT=1,45 минуты, масса рассч. для C27H25FN6O2,484,20, масса/заряд найденное значение 485,4 [M+H]+.
1H ЯМР (400 МГц, DMSO-d6) Общая процедура A: δ 11,63 (s, 1H), 8,50 (d, J=4,9 Гц, 1H), 8,05 (d, J=8,2 Гц, 1H), 7,81 (t, J=7,8 Гц, 1H), 7,60-7,43 (m, 3H), 7,39-7,24 (m, 2H), 7,08 (m, J=16,3, 7,9 Гц, 2H), 5,42 (d, J=5,8 Гц, 1H), 3,78 (s, 4H), 3,05 (s, 4H), 1,69 (d, J=6,6 Гц, 3H).
Соединение 25a
(S*)-3-(6-(4-метилпиперазин-1-ил)-5-(трифторметил)-1H-бензо[d]имидазол-2-ил)-4-((1-(пиримидин-2-ил)этил)амино)хинолин-2(1H)-он
Реакционную смесь очищали препаративной ВЭЖХ (колонка: WatersXBridge 30*150 мм 5 мкм, расход: 20 мл/мин, подвижная фаза A: вода (0,1% NH3⋅H2O), подвижная фаза B: ацетонитрил, градиент: 35-55% (%B)). Целевую фракцию собирали и летучие вещества удаляли при пониженном давлении. Водную фазу лиофилизировали, получая соединение 25 (смесь стереоизомеров) (16 мг, выход 5,2%) в виде твердого вещества коричневого цвета. Сырое соединение дополнительно очищали препаративной SFC (условие разделения: колонка: ChiralPak AD-H Daicel chemical Industries, Ltd, 250*30 мм внутр. диам., 5 мкм; подвижная фаза A: сверхкритический CO2, подвижная фаза B: этанол (0,1% диэтиламин), A:B=60:40 при 50 мл/мин; температура колонки: 38°C; давление сопла: 100 бар; температура сопла: 60°C; температура испарителя: 20°C; температура триммера: 25°C; длина волны: 220 нм) с получением соединения 25a (3,81 мг, выход 23,8%, чистота >99%) и соединения 25b.
Соединение 25a: LC-MS (ESI) Общая процедура A, способ 2: RT=1,30 минуты, масса рассч. для C28H27F3N8O 548,2, масса/заряд найденное значение 549,3 [M+H]+.
1H ЯМР (400 МГц, CD3OD) Общая процедура A : δ 8,72 (d, J=4,9 Гц, 2H), 8,09 (d, J=8,2 Гц, 1H), 7,98-7,89 (m, 1H), 7,85-7,71 (m, 1H), 7,57-7,48 (m, 1H), 7,37-7,27 (m, 2H), 7,20-7,12 (m, 1H), 5,60-5,52 (m, 1H), 3,20-2,87 (m, 8H), 2,65 (d, J=13,3 Гц, 3H), 1,83 (d, J=6,6 Гц, 3H).
Соединение 26a
3-(6-((S)-2-метилморфолино)-1H-бензо[d]имидазол-2-ил)-4-(((S*)-1-(пиримидин-2-ил)этил)амино)хинолин-2(1Н)-он
Смесь охлаждали до комнатной температуры, а затем концентрировали при пониженном давлении. Остаток очищали с помощью хроматографии на силикагеле (дихлорметан: метанол=30: 1) и затем дополнительно очищали препаративной ВЭЖХ (колонка: WatersXBridge 30*150 мм 5 мкм, расход: 20 мл/мин, подвижная фаза A: вода (0,1% NH3⋅H2O), подвижная фаза B: ацетонитрил, градиент: 35-55% (%B)). Целевую фракцию собирали и летучие вещества удаляли при пониженном давлении. Водную фазу лиофилизировали, получая соединение 26 (смесь стереоизомеров) (45,0 мг, выход 28,3%) в виде твердого вещества желтого цвета. Сырое соединение дополнительно очищали препаративной SFC (условие разделения: колонка: ChiralCel OZ-H Daicel chemical Industries, Ltd, 250*30 мм внутр. диам., 5 мкм; подвижная фаз A: сверхкритический CO2, подвижная фаза B: изопропанол (0,1% диэтиламин), A:B=55:45 при 50 мл/мин; температура колонки: 38°C; давление сопла: 100 бар; температура сопла: 60°C; температура испарителя: 20°C; температура триммера: 25°C; длина волны: 220 нм) с получением соединения 26a (12,49 мг, выход 27,7%, чистота >99%) и соединения 26b.
Соединение 26a:
LC-MS (ESI) Общая процедура B, способ 2: RT=1,26 минуты, масса рассч. для C27H27N7O2 481,2, масса/заряд найденное значение 482,2 [M+H]+.
1H ЯМР (400 МГц, CD3OD) Общая процедура A: δ: 8,68 (d, J =4,8 Гц, 2H), 8,09 (d, J =8,4 Гц, 1H), 7,53-7,49 (m, 2H), 7,32 (d, J =8,0 Гц, 1H), 7,28-7,25 (m, 1H), 7,18-7,12 (m, 2H), 7,03 (dd, J =8,4 Гц, 1H), 5,47 (q, J =6,8 Гц, 1H), 7,01-3,98 (m, 1H), 3,86-3,80 (m, 2H), 3,53 (d, J =11,6 Гц, 1H), 3,45 (d, J =12 Гц, 1H), 2,83-2,77 (m, 1H), 2,50-2,45 (m, 1H), 1,79 (d, J =6,8 Гц, 3H), 1,25 (d, J =6,0 Гц, 3H).
Соединение 27a
(S*)-3-(5-фтор-6-морфолино-1Н-бензо[d]имидазол-2-ил)-4-((1-(пиримидин-2-ил)этил)амино)хинолин-2(1H)-он)
Реакционную смесь очищали препаративной ВЭЖХ (колонка: WatersXBridge 30*150 мм 5 мкм, расход: 20 мл/мин, подвижная фаза A: вода (0,1% NH3⋅H2O), подвижная фаза B: ацетонитрил, градиент: 35-55% (%B)). Целевую фракцию собирали и летучие вещества удаляли при пониженном давлении. Водную фазу лиофилизировали, получая соединение 27 (смесь стереоизомеров) (88 мг, выход 19,0%) в виде твердого вещества желтого цвета. Сырое соединение дополнительно очищали препаративной SFC (условие разделения: колонка: ChiralPak AD-H Daicel chemical Industries, Ltd, 250*30 мм внутр. диам., 5 мкм; подвижная фаза A: сверхкритический CO2, подвижная фаза B: этанол (0,1% диэтиламин), A:B=60:40 при 50 мл/мин; температура колонки: 38°C; давление сопла: 100 бар; температура сопла: 60°C; температура испарителя: 20°C; температура триммера: 25°C; длина волны: 254 нм) с получением соединения 27a (15,13 мг, выход 17,19%, чистота >99%) и соединения 27b.
Соединение 27a: LC-MS (ESI) Общая процедура B, способ 2: RT=1,51 минуты, масса рассч. для C26H24FN7O2 485,2, масса/заряд найденное значение 486,3 [M+H]+.
1H ЯМР (400 МГц, DMSO-d6) Общая процедура A: δ 13,00 (d, J=6,5 Гц,1H), 12,03 (d, J=7,3 Гц, 0,45H), 11,90 (d, J=6,9 Гц,0,42H), 11,58 (s, 1H), 8,80-8,77 (m, 2H), 8,05 (s, 1H), 7,53-7,46 (m 1H), 7,45-7,17 (m, 4H), 7,12-7,07 (s, 1H), 5,56-5,51 (m, 1H), 3,78 (s, 4H), 3,00 (s, 4H), 1,74 (t, J=6,9 Гц, 3H).
Соединение 28a
(S*)-3-(6-(пиперидин-1-ил)-1Н-бензо[d]имидазол-2-ил)-4-((1-(пиримидин-2-ил)этил)амино)хинолин-2(1H)-он)
Смесь охлаждали до комнатной температуры, а затем концентрировали при пониженном давлении. Остаток очищали с помощью хроматографии на силикагеле (дихлорметан: метанол=40: 1) и затем дополнительно очищали препаративной ВЭЖХ (колонка: WatersXBridge 30*150 мм 5 мкм, расход: 20 мл/мин, подвижная фаза A: вода (0,1% NH3⋅H2O), подвижная фаза B: ацетонитрил, градиент: 35-55% (%B)). Целевую фракцию собирали и летучие вещества удаляли при пониженном давлении. Водную фазу лиофилизировали, получая соединение 28 (смесь стереоизомеров) (45,0 мг, выход 32,3%) в виде твердого вещества желтого цвета. Сырое соединение дополнительно очищали препаративной SFC (условие разделения: колонка: ChiralPak AD-H Daicel Сhemical Industries, Ltd, 250*30 мм внутр. диам., 5 мкм; подвижная фаза A: сверхкритический CO2, подвижная фаза B: этанол (0,1% диэтиламин), A:B=50:50 при 50 мл/мин; температура колонки: 38°C; давление сопла: 100 бар; температура сопла: 60°C; температура испарителя: 20°C; температура триммера: 25°C; длина волны: 220 нм) с получением соединения 28a (10,53 мг, выход 23,4%, чистота >99%) и соединения 28b.
Соединение 28a: LC-MS (ESI) Общая процедура B, способ 2 : RT=1,20 минуты, масса рассч. для C27H27N7O 465,2, масса/заряд найденное значение 466,3 [M+H]+.
1H ЯМР (400 МГц, CD3OD) Общая процедура A : δ: 8,67 (d, J =4,8 Гц, 2H), 8,09 (d, J =8,4 Гц, 1H), 7,53-7,49 (m, 2H), 7,33 (d, J =8,0 Гц, 1H), 7,28 (t, J =4,8 Гц, 1H), 7,22-7,15 (m, 2H), 7,06 (dd, J1,2=1,6 Гц, J1,3 =8,8 Гц, 1H), 5,46 (q, J =6,4 Гц, 1H), 3,16 (t, J =5,2 Гц, 4H), 1,82-1,77 (m, 7H), 1,64-1,60 (m, 2H).
Соединение 29a
(S*)-4-((1-(пиримидин-2-ил)этил)амино)-3-(6-(тетрагидро-2H-пиран-4-ил)-1H-бензо[d]имидазол-2-ил)хинолин-2(1H)-он
Реакционную смесь очищали препаративной ВЭЖХ (колонка: WatersXBridge 30*150 мм 5 мкм, расход: 20 мл/мин, подвижная фаза A: вода (0,1% NH3⋅H2O), подвижная фаза B: ацетонитрил, градиент: 35-55% (%B)). Целевую фракцию собирали и летучие вещества удаляли при пониженном давлении. Водную фазу лиофилизировали, получая соединение 29 (смесь стереоизомеров) (35 мг, выход 23,7%) в виде твердого вещества желтого цвета. Неочищенное соединение дополнительно очищали препаративной SFC (условие разделения: колонка: ChiralPak AD-H Daicel chemical Industries, Ltd, 250*30 мм внутр. диам., 5 мкм; подвижная фаза A: сверхкритический CO2, подвижная фаза B: этанол (0,1% диэтиламин), A:B=50:50 при 50 мл/мин; температура колонки: 38°C; давление сопла: 100 бар; температура сопла: 60°C; температура испарителя: 20°C; температура триммера: 25°C; длина волны: 220 нм) с получением соединения 29a (6,17 мг, выход 17,63%, чистота >99%) и соединения 29b.
Соединение 29a: LC-MS (ESI) Общая процедура A, способ 2: RT=1,27 минуты, масса рассч. для C27H26N6O2 466,2, масса/заряд найденное значение 467,4 [M+H]+.
1H ЯМР (400 МГц, DMSO- d6) Общая процедура A : δ 12,96 (d, J=7,8 Гц, 1H), 12,20 (d, J=8,2 Гц, 0,5H), 12,10 (d, J=8,2 Гц, 0,5H), 11,58 (s, 1H), 8,85-8,71 (m, 2H), 8,07 (dd, J=7,9, 5,0 Гц, 1H), 7,63 (d, J=8,3 Гц, 0,5H), 7,59 (s, 0,5H), 7,55-7,45 (m, 2H), 7,39-7,33 (m, 2H), 7,13-7,08(m, 2H), 5,60-5,52 (m, 1H), 3,98 (d, J=10,7 Гц, 2H), 3,51-3,33 (m, 2H), 2,93-2,78 (m, 2H), 1,79-1,70 (m, 7H).
Соединение 34a
(S*)-4-((1-(4-метилпиримидин-2-ил)этил)амино)-3-(6-морфолино-1H-бензо[d]имидазол-2-ил)хинолин-2(1H)-он
Реакционную смесь очищали препаративной ВЭЖХ (колонка: WatersXBridge 30*150 мм 5 мкм, расход: 20 мл/мин, подвижная фаза A: вода (0,1% NH3⋅H2O), подвижная фаза B: ацетонитрил, градиент: 35-55% (%B)). Целевую фракцию собирали и летучие вещества удаляли при пониженном давлении. Водную фазу лиофилизировали, получая соединение 34 (смесь стереоизомеров) (100 мг, выход 33,0%) в виде твердого вещества желтого цвета. Сырое соединение дополнительно очищали препаративной SFC (условие разделения: колонка: ChiralPak AD-H Daicel chemical Industries, Ltd, 250*30 мм внутр. диам., 5 мкм; подвижная фаза A: сверхкритический CO2, подвижная фаза B: этанол (0,1% диэтиламин), A:B=50:50 при 50 мл/мин; температура колонки: 38°C; давление сопла: 100 бар; температура сопла: 60°C; температура испарителя: 20°C; температура триммера: 25°C; длина волны: 220 нм) с получением соединения 34a (15,14 мг, выход 15,1%, чистота >99%) и соединения 34b.
Соединение 34a: LC-MS (ESI) Общая процедура B, способ 2: RT= 1,16 минуты, масса рассч. для C27H27N7O2 481,2, масса/заряд найденное значение 482,2 [M+H]+.
1H ЯМР (400 МГц, CD3OD) Общая процедура A : δ 8,45 (d, J=5,1 Гц, 1H), 8,09 (d, J=8,4 Гц, 1H), 7,62-7,42 (m, 2H), 7,37-7,00 (m, 5H), 5,35 (q, J=6,6 Гц, 1H), 3,95-3,81 (m, 4H), 3,21-3,11 (m, 4H), 2,37 (s, 3H), 1,76 (d, J=6,6 Гц, 3H).
Соединение 35b
(S*)-3-(6-морфолино-1Н-бензо[d]имидазол-2-ил)-4-((1-(пиразин-2-ил)этил)амино)хинолин-2(1H)-он
Реакционную смесь очищали препаративной ВЭЖХ (колонка: WatersXBridge 30*150 мм 5 мкм, расход: 20 мл/мин, подвижная фаза A: вода (0,1% NH3⋅H2O), подвижная фаза B: ацетонитрил, градиент: 35-55% (%B)). Целевую фракцию собирали и летучие вещества удаляли при пониженном давлении. Водную фазу лиофилизировали, получая соединение 35 (смесь стереоизомеров) (178 мг, выход 24,1%) в виде твердого вещества желтого цвета. Неочищенное соединение дополнительно очищали препаративной SFC (условие разделения: колонка: ChiralCel OJ-H Daicel chemical Industries, Ltd, 250*30 мм внутр. диам., 5 мкм; подвижная фаз A: сверхкритический CO2, подвижная фаза B: этанол (0,1% диэтиламин), A:B=60:40 при 50 мл/мин; температура колонки: 38°C; давление сопла: 100 бар; температура сопла: 60°C; температура испарителя: 20°C; температура триммера: 25°C; длина волны: 220 нм) с получением соединения 35b (63,71 мг, выход 35,8%, чистота >99%) и соединения 35a.
Соединение 35b: LC-MS (ESI) Общая процедура A, способ 3: RT=1,01 минуты, масса рассч. для C26H25N7O2 467,21, масса/заряд найденное значение 468,2 [M+H]+.
1H ЯМР (400 МГц, CD3OD) Общая процедура A : δ 8,67 (d, J=4,8 Гц, 1H), 8,46 (d, J=8,3 Гц, 1H), 8,41 (t, J=7,4 Гц, 1H), 8,00 (m, 1H), 7,56-7,49 (m, 2H), 7,32 (s, 1H), 7,19-7,12 (m, 2H), 7,03 (m, 1H), 5,47 (d, J=6,6 Гц, 1H), 3,87 (m, 4H), 3,16 (m, 4H), 1,80 (d, J=6,6 Гц, 3H).
Соединение 36b
(S*)-4-((1-(1-изопропил-1Н-пиразол-3-ил)этил)амино)-3-(6-морфолино-1H-бензо[d]имидазол-2-ил)хинолин-2(1H)-он
Реакционную смесь очищали препаративной ВЭЖХ (колонка: WatersXBridge 30*150 мм 5 мкм, расход: 20 мл/мин, подвижная фаза A: вода (0,1% NH3⋅H2O), подвижная фаза B: ацетонитрил, градиент: 35-55% (%B)). Целевую фракцию собирали и летучие вещества удаляли при пониженном давлении. Водную фазу лиофилизировали, получая соединение 36 (смесь стереоизомеров) (110 мг, выход 13%) в виде твердого вещества желтого цвета. Неочищенное соединение дополнительно очищали препаративной SFC (условие разделения: колонка: ChiralPak AD-H Daicel Сhemical Industries, Ltd, 250*25 мм внутр. диам., 10 мкм; подвижная фаза A: сверхкритический CO2, подвижная фаза B: МеОН (0,1% диэтиламин), A:B=50:50 при 60 мл/мин; температура колонки: 25°C; давление сопла: 100 бар; температура сопла: 60°C; температура испарителя: 20°C; температура триммера: 25°C; длина волны: 220 нм) с получением соединения 36b (31,35 мг, выход 28,5%, чистота >99%) и соединения 36a.
Соединение 36b: LC-MS (ESI) Общая процедура B, способ 5: RT=1,18 минуты, масса рассч. для C26H25N7O2 497,25, масса/заряд найденное значение 498,2 [M+H]+.
1H ЯМР(400 МГц,DMSO-d6) Общая процедура A : δ 12,86 (d, J=10,8 Гц, 1H), 11,95 (d, J=8,7 Гц, 0,5H), 11,84 (d, J=8,9 Гц, 0,5), 11,56 (s, 1H), 8,23-8,15 (m, 1H), 7,67-7,61 (m, 1H), 7,60-7,45 (m, 2H), 7,36 (d, J=8,2 Гц, 1H), 7,25 (d, J=1,9 Гц, 0,6H), 7,15 (t, J=7,7 Гц, 1H), 7,10 (d, J=1,5 Гц, 0,4H), 6,97 (td, J=9,1, 1,9 Гц, 1H), 6,22 (dd, J=4,2, 2,3 Гц, 1H), 5,44-5,35 (m, 1H), 4,41 (ddd, J=17,2, 8,9, 4,6 Гц, 1H), 3,78 (s, 4H), 3,11 (d, J=3,9 Гц, 4H), 1,66 (t, J=7,4 Гц, 3H), 1,35 (dd, J=6,4, 2,9 Гц, 6H).
Соединение 37b
3-(6-((2R,6R)-2,6-диметилморфолино)-1H-бензо[d]имидазол-2-ил)-4-(((R*)-1-(пиримидин-2-ил)этил)амино)хинолин-2(1Н)-он
и соединение 37a
3-(6-((2R,6R)-2,6-диметилморфолино)-1H-бензо[d]имидазол-2-ил)-4-(((S*)-1-(пиримидин-2-ил)этил)амино)хинолин-2(1Н)-он
Реакционную смесь очищали колоночной хроматографией на силикагеле (дихлорметан : метанол=30:1), получая соединение 37 (смесь стереоизомеров) в виде твердого вещества желтого цвета (45 мг, выход 20,9%). Сырое соединение дополнительно очищали препаративной SFC (условие разделения: колонка: ChiralPak AD-H Daicel Сhemical Industries, Ltd, 250*25 мм внутр. диам., 10 мкм; подвижная фаза A: сверхкритический CO2, подвижная фаза B: EtOH/ACN/DEA=85/15/0,2, A:B=50:50 при 60 мл/мин; температура колонки: 25°C; давление сопла: 100 бар; температура сопла: 60°C; температура испарителя: 20°C; температура триммера: 25°C; длина волны: 220 нм) с получением соединения 37b (17,16 мг, выход 38,13%, чистота >96%) и соединения 37а (14,79 мг, выход 32,87%, чистота >97%).
Соединение 37b: LC-MS (ESI) Общая процедура A, способ 2: RT=1,34 минуты, масса рассч. для C28H29N7O2 495,2, масса/заряд найденное значение 496,4 [M+H]+.
1H ЯМР (400 МГц, CD3OD) Общая процедура B δ 8,67 (d, J=4,9 Гц, 2H), 8,09 (d, J=8,2 Гц, 1H), 7,52 (t, J=7,7 Гц, 2H), 7,35-7,23 (m, 2H), 7,18 (t, J=7,6 Гц, 1H), 7,11 (s, 1H), 7,00 (d, J=8,2 Гц, 1H), 5,38 (d, J=5,9 Гц, 1H), 4,23-4,12 (m, 2H), 3,21 (d, J=11,5 Гц, 2H), 2,90 (dd, J=11,5, 5,8 Гц, 2H), 1,76 (d, J=6,5 Гц, 3H), 1,33 (d, J=6,3 Гц, 6H).
Соединение 37a: LC-MS (ESI) Общая процедура A, способ 2: RT=1,34 минуты, масса рассч. для C28H29N7O2 495,2, масса/заряд найденное значение 496,4 [M+H]+.
1H ЯМР (400 МГц, CD3OD) Общая процедура A:δ 8,66 (d, J=4,9 Гц, 2H), 8,06 (d, J=8,2 Гц, 1H), 7,53-7,45 (m, 2H), 7,33-7,23 (m, 2H), 7,14 (dd, J=17,4, 9,8 Гц, 2H), 6,97 (d, J=8,6 Гц, 1H), 5,49-5,37 (m, 1H), 4,19-4,15 (m, 2H), 3,19 (d, J=9,4 Гц, 2H), 2,88 (dd, J=11,5, 5,8 Гц, 2H), 1,77 (d, J=6,6 Гц, 3H), 1,33 (d, J=6,4 Гц, 6H).
Соединение 39a
3-(6-((2S,6S)-2,6-диметилморфолино)-1H-бензо[d]имидазол-2-ил)-4-(((S*)-1-(пиримидин-2-ил)этил)амино)хинолин-2(1Н)-он
Реакционную смесь очищали колоночной хроматографией на силикагеле (дихлорметан : метанол=30:1), получая соединение 39 (смесь стереоизомеров) в виде твердого вещества желтого цвета (45 мг, выход 20,9%). Сырое соединение дополнительно очищали препаративной SFC (условие разделения: колонка: ChiralPak OZ-H Daicel Сhemical Industries, Ltd, 250*30 мм внутр. диам., 5 мкм; подвижная фаза A: сверхкритический CO2, подвижная фаза B: этанол (0,1% диэтиламин), A:B=60:40 при 50 мл/мин; температура колонки: 38°C, давление сопла: 100 бар; температура сопла: 60°C; температура испарителя: 20°C; температура триммера: 25°C; длина волны: 220 нм) с получением соединения 39a (8,96 мг, выход 19,91%, чистота >99%).
LC-MS (ESI) Общая процедура A, способ 2: RT=1,30 минуты, масса рассч. для C28H29N7O2 495,2, масса/заряд найденное значение 496,3 [M+H]+.
1H ЯМР (400 МГц, DMSO-d6) Общая процедура A : δ 12,85 (d, J=17,5 Гц, 1H), 12,09 (dd, J=45,6, 8,2 Гц, 1H), 11,57 (s, 1H), 8,86-8,74 (m, 2H), 8,06 (d, J=8,3 Гц, 1H), 7,57 (d, J=8,7 Гц, 0,6H), 7,49 (dd, J=14,9, 8,2 Гц, 1,4 H), 7,41-7,31 (m, 2H), 7,22 (d, J=2,0 Гц, 0,6 H), 7,09 (dd, J=15,1, 6,8 Гц, 1H), 6,97-6,92 (m, 1H), 5,55 (d, J=6,8 Гц, 1H), 4,12-4,08 (m, 2H), 3,16 (d, J=11,5 Гц, 2H), 2,88-2,78 (m, 2H), 1,76 (dd, J=9,7, 6,7 Гц, 3H), 1,27-1,24 (m, 6H).
Соединение 40a
Реакционную смесь очищали колоночной хроматографией на силикагеле (дихлорметан : метанол=30:1), получая соединение 40 (смесь стереоизомеров) в виде твердого вещества желтого цвета (40 мг, выход 25,5%). Сырое соединение дополнительно очищали препаративной SFC (условие разделения: колонка: ChiralPak AD-H Daicel chemical Industries, Ltd, 250*30 мм внутр. диам., 5 мкм; подвижная фаза A: сверхкритический CO2, подвижная фаза B: этанол (0,1% диэтиламин), A:B=50:50 при 50 мл/мин; температура колонки: 38°C, давление сопла: 100 бар; температура сопла: 60°C; температура испарителя: 20°C; температура триммера: 25°C; длина волны: 220 нм) с получением соединения 40a (7,17 мг, выход 17,9%, чистота >99%) и соединения 40b.
Соединение 40a:
LC-MS (ESI) Общая процедура A, способ 2: RT=1,23 минуты, масса рассч. для C27H27N7O2 481,2, масса/заряд найденное значение 482,3 [M+H]+.
1H ЯМР (400 МГц, CD3OD) Общая процедура A:δ 8,67 (d, J=4,9 Гц, 2H), 8,08 (d, J=8,3 Гц, 1H), 7,51 (t, J=7,5 Гц, 2H), 7,35-7,23 (m, 2,5H), 7,16 (t, J=7,7 Гц, 1,54H), 7,03 (d, J=8,6 Гц, 1H), 5,44 (d, J=6,7 Гц, 1H), 4,00 (d, J=9,8 Гц, 1H), 3,83 (t, J=10,3 Гц, 2H), 3,48 (dd, J=32,3, 11,4 Гц, 2H), 2,80 (d, J=3,0 Гц, 1H), 2,47 (t, J=10,9 Гц, 1H), 1,78 (d, J=6,7 Гц, 3H), 1,24 (d, J=6,2 Гц, 3H).
Соединение 41b
(R*)-4-((1-(пиримидин-2-ил)этил)амино)-3-(6-(4-(3,3,3-трифторпропил)пиперазин-1-ил)-1H-бензо[d]имидазол-2-ил)хинолин-2(1H)-он
и соединение 41a
(S*)-4-((1-(пиримидин-2-ил)этил)амино)-3-(6-(4-(3,3,3-трифторпропил)пиперазин-1-ил)-1H-бензо[d]имидазол-2-ил)хинолин-2(1H)-он
Смесь охлаждали до комнатной температуры, а затем концентрировали при пониженном давлении. Остаток очищали с помощью хроматографии на силикагеле (дихлорметан: метанол=50: 1) и затем дополнительно очищали препаративной ВЭЖХ (колонка: WatersXBridge 30*150 мм 5 мкм, расход: 20 мл/мин, подвижная фаза A: вода (0,1% NH3⋅H2O), подвижная фаза B: ацетонитрил, градиент: 35-55% (%B)). Целевую фракцию собирали и летучие вещества удаляли при пониженном давлении. Водную фазу лиофилизировали, получая соединение 41 (смесь стереоизомеров) (40,0 мг, выход 21,6%) в виде твердого вещества желтого цвета. Сырое соединение дополнительно очищали препаративной SFC (условие разделения: колонка: ChiralPak AD-H Daicel Сhemical Industries, Ltd, 250*30 мм внутр. диам., 5 мкм; подвижная фаза A: сверхкритический CO2, подвижная фаза B: этанол (0,1% диэтиламин), A:B=60:40 при 50 мл/мин; температура колонки: 38°C; давление сопла: 100 бар; температура сопла: 60°C; температура испарителя: 20°C; температура триммера: 25°C; длина волны: 220 нм) с получением соединения 41b (15,10 мг, выход 37,8%, чистота >99%) и соединения 41а (15,00 мг, выход 37,5%, чистота >99%).
Соединение 41b: LC-MS (ESI) Общая процедура B, способ 2: RT=1,08 минуты, масса рассч. для C29H29F3N8O 562,2, масса/заряд найденное значение 563,3 [M+H]+.
1H ЯМР (400 МГц, CD3OD) Общая процедура A:δ: 8,68 (d, J =4,8 Гц, 2H), 8,09 (d, J =8,4 Гц, 1H), 7,53-7,49 (m, 2H), 7,33 (d, J =8,0 Гц, 1H), 7,28-7,25 (m, 1H), 7,19-7,15 (m, 2H), 7,04-7,02 (m, 1H), 5,47 (q, J =6,8 Гц, 1H), 3,24-3,22 (m, 4H), 2,72-2,65 (m, 6H), 2,50-2,41 (m, 2H), 1,79 (d, J =6,8 Гц, 3H).
Соединение 41a: LC-MS (ESI) Общая процедура A, способ 4: RT=0,59 минуты, масса рассч. для C29H29F3N8O 562,2, масса/заряд найденное значение 563,3 [M+H]+.
1H ЯМР (400 МГц, CD3OD) Общая процедура A : δ: 8,67 (d, J =4,8 Гц, 2H), 8,09 (d, J =8,4 Гц, 1H), 7,52 (t, J =7,2 Гц, 2H), 7,32 (d, J =7,6 Гц, 1H), 7,27-7,25 (m, 1H), 7,18 (t, J =7,6 Гц, 2H), 7,04-7,01 (m, 1H), 5,47 (q, J =6,8 Гц, 1H), 3,23-3,21 (m, 4H), 2,72-2,66 (m, 6H), 2,53-2,43 (m, 2H), 1,79 (d, J =6,8 Гц, 3H).
Соединение 43a
(S*)-4-((1-(пиримидин-2-ил)этил)амино)-3-(6-(4-(трифторметокси)пиперидин-1-ил)-1H-бензо[d]имидазол-2-ил)хинолин-2(1H)-он
Смесь охлаждали до комнатной температуры, а затем концентрировали при пониженном давлении. Остаток очищали с помощью хроматографии на силикагеле (дихлорметан: метанол=30: 1) и затем дополнительно очищали препаративной ВЭЖХ (колонка: WatersXBridge 30*150 мм 5 мкм, расход: 20 мл/мин, подвижная фаза A: вода (0,1% NH3⋅H2O), подвижная фаза B: ацетонитрил, градиент: 35-55% (%B)). Целевую фракцию собирали и летучие вещества удаляли при пониженном давлении. Водную фазу лиофилизировали, получая соединение 43 (смесь стереоизомеров) (40,0 мг, выход 22,1%) в виде твердого вещества желтого цвета. Сырое соединение дополнительно очищали препаративной SFC (условие разделения: колонка: ChiralPak AD-H Daicel Сhemical Industries, Ltd, 250*30 мм внутр. диам., 5 мкм; подвижная фаза A: сверхкритический CO2, подвижная фаза B: этанол (0,1% диэтиламин), A:B=60:40 при 50 мл/мин; температура колонки: 38°C; давление сопла: 100 бар; температура сопла: 60°C; температура испарителя: 20°C; температура триммера: 25°C; длина волны: 220 нм) с получением указанного в заголовке соединения 43a (15,35 мг, выход 38,4%, чистота >99%) и соединения 43b.
Соединение 43a:
LC-MS (ESI) Общая процедура B, способ 2: RT=1,48 минуты, масса рассч. для C28H26F3N7O2 549,2, масса/заряд найденное значение 550,3 [M+H]+.
1H ЯМР (400 МГц, CD3OD) Общая процедура A : δ: 8,68 (d, J =4,8 Гц, 2H), 8,09 (d, J =8,0 Гц, 1H), 7,53-7,49 (m, 2H), 7,33 (d, J =8,0 Гц, 1H), 7,28 (t, J =8,4 Гц, 1H), 7,19-7,15 (m, 2H), 7,05-7,03 (m, 1H), 5,47 (q, J =6,8 Гц, 1H), 4,55-4,51 (m, 1H), 3,49-3,46 (m, 2H), 3,10-3,04 (m, 2H), 2,15 (m, 2H), 2,02-1,97 (m, 2H), 1,79 (d, J =6,8 Гц, 3H).
Соединение 44a
3-(6-(8-окса-3-азабицикло[3.2.1]октан-3-ил)-1H-бензо[d]имидазол-2-ил)-4-(((S*)-1-(пиримидин-2-ил)этил)амино)хинолин-2(1Н)-он
Реакционную смесь очищали колоночной хроматографией на силикагеле (дихлорметан : метанол=30:1), получая соединение 44 (смесь стереоизомеров) в виде твердого вещества желтого цвета (50 мг, выход 15,6%). Сырое соединение дополнительно очищали препаративной SFC (условие разделения: колонка: ChiralPak OZ-H Daicel chemical Industries, Ltd, 250*30 мм внутр. диам., 5 мкм. Подвижная фаза A: сверхкритический CO2, подвижная фаза B: этанол (0,1% диэтиламин), A:B=60:40 при 50 мл/мин; температура колонки: 38°C; давление сопла: 100 бар; температура сопла: 60°C; температура испарителя: 20°C; температура триммера: 25°C; длина волны: 220 нм) с получением соединения 44a (2,58 мг, выход 5,2%, чистота >98%) и соединения 44b.
Соединение 44a:
LC-MS (ESI) Общая процедура A, способ 2: RT=1,25 минуты, масса рассч. для C28H27N7O2 493,2, масса/заряд найденное значение 494,3 [M+H]+.
1H ЯМР (400 МГц, DMSO-d6) Общая процедура A : δ 8,74-8,72 (m, 2H), 8,02 (d, J=8,2 Гц, 1H), 7,51-7,44 (m, 2H), 7,33 (d, J=6,6 Гц, 2H), 7,13-7,09 (m, 1H), 7,05 (s, 0,6H), 7,05 (s, 0,4H), 6,91-6,86 (m, 1H), 5,48 (d, J=6,7 Гц, 1H), 4,43 (s, 2H), 3,37 (d, J=10,7 Гц, 3H), 2,82 (d, J=11,0 Гц, 2H), 1,90-1,81 (m, 4H), 1,74-1,71 (m, 3H).
Соединение 45
(S*)-3-(6-морфолино-5-(трифторметил)-1Н-бензо[d]имидазол-2-ил)-4-((1-(пиримидин-2-ил)этил)амино)хинолин-2(1H)-он
Смесь охлаждали при комнатной температуре и очищали препаративной ВЭЖХ (колонка: WatersXBridge 30*150 мм 5 мкм, расход: 20 мл/мин, подвижная фаза A: вода (0,1% NH3⋅H2O), подвижная фаза B: ацетонитрил, градиент: 35-55% (%B)). Целевую фракцию собирали и летучие вещества удаляли при пониженном давлении. Водную фазу лиофилизировали, получая указанное в заголовке соединение в виде смеси стереоизомеров (50,0 мг, выход 20,8%) в виде твердого вещества желтого цвета. Сырое соединение дополнительно очищали препаративной SFC (условие разделения: колонка: ChiralPak AD-H Daicel Сhemical Industries, Ltd, 250*30 мм внутр. диам., 5 мкм; подвижная фаза A: сверхкритический CO2, подвижная фаза B: этанол (0,1% диэтиламин), A:B=60:40 при 50 мл/мин; температура колонки: 38°C; давление сопла: 100 бар; температура сопла: 60°C; температура испарителя: 20°C; температура триммера: 25°C; длина волны: 220 нм) с получением соединения 45 (9,00 мг, выход 18,0%, чистота >99%) и соединения 45a.
LC-MS (ESI) Общая процедура B, способ 2: RT=1,92 минуты, масса рассч. для C27H24F3N7O2 535,1, масса/заряд найденное значение 536,2 [M+H]+.
1H ЯМР (400 МГц, CD3OD) Общая процедура A:δ: 8,72-8,70 (m, 2H), 8,11 (d, J =8,4 Гц, 1H), 7,93-7,90 (m, 1H), 7,79-7,73 (m, 1H), 7,54-7,51 (m, 1H), 7,33-7,29 (m, 2H), 7,18-7,14 (m, 1H), 5,57 (q, J =6,8 Гц, 1H), 3,84 (m, 4H), 2,98 (m, 4H), 1,83-1,81 (m, 3H).
Соединение 46
(S)-3-(4-метил-6-морфолино-1Н-бензо[d]имидазол-2-ил)-4-((1-(пиримидин-2-ил)этил)амино)хинолин-2(1H)-он
Реакционную смесь очищали препаративной ВЭЖХ (колонка: WatersXBridge 30*150 мм 5 мкм, расход: 20 мл/мин, подвижная фаза A: вода (0,1% NH3⋅H2O), подвижная фаза B: ацетонитрил, градиент: 35-55% (%B)). Целевую фракцию собирали и летучие вещества удаляли при пониженном давлении. Водную фазу лиофилизировали, получая соединение 46 (50 мг, выход 20,5%) в виде твердого вещества желтого цвета.
LC-MS (ESI) Общая процедура A, способ 3: RT =1,02 минуты, масса рассч. для C27H27N7O2 481,22, масса/заряд найденное значение 482,2 [M+H]+.
1H ЯМР (400 МГц, CD3OD) Общая процедура A : δ 8,68 (d, J=4,8 Гц, 2H), 8,10 (d, J=8,3 Гц, 1H), 7,49 (t, J=7,4 Гц, 1H), 7,35-7,24 (m, 2H), 722-7,04 (m, 1H), 6,96 (s, 1H), 6,84 (s, 1H), 5,55 (d, J=6,6 Гц, 1H), 3,87 (s, 4H), 3,20-3,02 (m, 4H), 2,64-2,52 (m, 3H), 1,82 (d, J=6,6 Гц, 3H).
Соединение 47
(S)-3-(7-метил-6-морфолино-1Н-бензо[d]имидазол-2-ил)-4-((1-(пиримидин-2-ил)этил)амино)хинолин-2(1H)-он
Реакционную смесь очищали препаративной ВЭЖХ (колонка: WatersXBridge 30*150 мм 5 мкм, расход: 20 мл/мин, подвижная фаза A: вода (0,1% NH3⋅H2O), подвижная фаза B: ацетонитрил, градиент: 35-55% (%B)). Целевую фракцию собирали и летучие вещества удаляли при пониженном давлении. Водную фазу лиофилизировали, получая указанное в заголовке соединение в виде смеси стереоизомеров (80 мг, выход 32,8%) в виде твердого вещества желтого цвета. Сырое соединение дополнительно очищали препаративной SFC (условие разделения: колонка: ChiralPak AD-H Daicel chemical Industries, Ltd, 250*30 мм внутр. диам., 5 мкм; подвижная фаза A: сверхкритический CO2, подвижная фаза B: этанол (0,1% диэтиламин), A:B=50:50 при 50 мл/мин; температура колонки: 38°C; давление сопла: 100 бар; температура сопла: 60°C; температура испарителя: 20°C; температура триммера: 25°C; длина волны: 220 нм) с получением соединения 47 (60,36 мг, выход 75,5%, чистота >99%).
LC-MS (ESI) Общая процедура A, способ 3: RT =1,13 минуты, масса рассч. для C27H27N7O2 481,22, масса/заряд найденное значение 482,3 [M+H]+.
1H ЯМР (400 МГц, CD3OD) Общая процедура A:δ 8,68 (d, J=4,8 Гц, 2H), 8,10 (d, J=8,3 Гц, 1H), 7,49 (t, J=7,4 Гц, 1H), 7,35-7,30 (m, 2H), 7,28-7,26 (m, 1H), 7,14 (s, 1H), 7,10-7,07 (s, 1H), 5,55 (d, J=6,6 Гц, 1H), 3,88 (m, 4H), 2,95 (m, 4H), 2,67-2,51 (m, 3H), 1,80 (d, J=6,6 Гц, 3H).
Соединение 48a
(S*)-4-((1-(4-метоксипиридин-2-ил)этил)амино)-3-(6-морфолино-1H-бензо[d]имидазол-2-ил)хинолин-2(1H)-он
Реакционную смесь очищали препаративной ВЭЖХ (колонка: WatersXBridge 30*150 мм 5 мкм, расход: 20 мл/мин, подвижная фаза A: вода (0,1% NH3⋅H2O), подвижная фаза B: ацетонитрил, градиент: 35-55% (%B)). Целевую фракцию собирали и летучие вещества удаляли при пониженном давлении. Водную фазу лиофилизировали, получая соединение 48 (смесь стереоизомеров) (300 мг, выход 32,9%) в виде твердого вещества коричневого цвета. Сырое соединение дополнительно очищали препаративной SFC (условие разделения: колонка: ChiralPak AD-H Daicel chemical Industries, Ltd, 250*30 мм внутр. диам., 5 мкм; подвижная фаза A: сверхкритический CO2, подвижная фаза B: этанол (0,1% диэтиламин), A:B=60:40 при 50 мл/мин; температура колонки: 38°C; давление сопла: 100 бар; температура сопла: 60°C; температура испарителя: 20°C; температура триммера: 25°C; длина волны: 220 нм) с получением соединения 48a (77,41 мг, выход 25,8%, чистота >99%) и соединения 48b.
Соединение 48a: LC-MS (ESI) Общая процедура B, способ 2: RT=1,17 минуты, масса рассч. для C28H28N6O3 496,2, масса/заряд найденное значение 497,2 [M+H]+.
1H ЯМР (400 МГц, CD3OD) Общая процедура A : δ 8,25 (d, J=5,9, 1H), 7,96 (d, J=8,2, 1H), 7,63-7,45 (m, 2H), 7,35-7,02 (m, 5H), 6,85-6,77 (m, 1H), 5,44-5,34 (m, 1H), 3,93-3,85 (m, 4H), 3,64 (s, 3H), 3,19-3,13 (m, 4H), 1,77 (d, J=6,7, 3H).
Соединение 49a
(S*)-4-((1-(4-изопропилпиримидин-2-ил)этил)амино)-3-(6-морфолино-1H-бензо[d]имидазол-2-ил)хинолин-2(1H)-он
Реакционную смесь очищали препаративной ВЭЖХ (колонка: WatersXBridge 30*150 мм 5 мкм, расход: 20 мл/мин, подвижная фаза A: вода (0,1% NH3⋅H2O), подвижная фаза B: ацетонитрил, градиент: 35-55% (%B)). Целевую фракцию собирали и летучие вещества удаляли при пониженном давлении. Водную фазу лиофилизировали, получая соединение 49 (смесь стереоизомеров) (60 мг, выход 26,1%) в виде твердого вещества коричневого цвета. Сырое соединение дополнительно очищали препаративной SFC (условие разделения: колонка: ChiralPak AD-H Daicel chemical Industries, Ltd, 250*30 мм внутр. диам., 5 мкм; подвижная фаза A: сверхкритический CO2, подвижная фаза B: этанол (0,1% диэтиламин), A:B=60:40 при 50 мл/мин; температура колонки: 38°C; давление сопла: 100 бар; температура сопла: 60°C; температура испарителя: 20°C; температура триммера: 25°C; длина волны: 220 нм) с получением указанного в заголовке соединения 49a (8,53 мг, выход 14,2%, чистота >99%) и соединения 49b.
Соединение 49a: LC-MS (ESI) Общая процедура B, способ 2: RT=1,47 минуты, масса рассч. для C29H31N7O2 509,2, масса/заряд найденное значение 510,2 [M+H]+.
1H ЯМР (400 МГц, CD3OD) Общая процедура A : δ 8,47 (d, J=5,2 Гц, 1H), 8,14 (d, J=8,4 Гц, 1H), 7,63-6,97 (m, 7H), 5,50-5,42 (m, 1H), 3,94-3,83 (m, 4H), 3,21-3,13 (m, 4H), 2,87-2,76 (m, 1H), 1,80 (d, J=6,6 Гц, 3H), 1,10 (dd, J=6,8, 2,7 Гц, 6H).
Соединение 50a
(S*)-4-((1-(4-циклопропилпиримидин-2-ил)этил)амино)-3-(6-морфолино-1H-бензо[d]имидазол-2-ил)хинолин-2(1H)-он
Реакционную смесь очищали препаративной ВЭЖХ (колонка: WatersXBridge 30*150 мм 5 мкм, расход: 20 мл/мин, подвижная фаза A: вода (0,1% NH3⋅H2O), подвижная фаза B: ацетонитрил, градиент: 35-55% (%B)). Целевую фракцию собирали и летучие вещества удаляли при пониженном давлении. Водную фазу лиофилизировали, получая соединение 50 (смесь стереоизомеров) (120 мг, выход 20,8%) в виде твердого вещества коричневого цвета. Сырое соединение дополнительно очищали препаративной SFC (условие разделения: колонка: ChiralPak AD-H Daicel chemical Industries, Ltd, 250*25 мм внутр. диам., 10 мкм; подвижная фаза A: сверхкритический CO2, подвижная фаза B: EtOH/ACN/DEA=95/5/0,2; A:B=50:50 при 70 мл/мин; температура колонки: 25°C; давление сопла: 100 бар; температура сопла: 60°C; температура испарителя: 20°C; температура триммера: 25°C; длина волны: 220 нм) с получением соединения 50a (58,16 мг, выход 48,5%, чистота >99%) и соединения 50b.
Соединение 50a: LC-MS (ESI) Общая процедура B, способ 2: RT=1,41 минуты, масса рассч. для C29H29N7O2 507,2, масса/заряд найденное значение 508,2 [M+H]+.
1H ЯМР (400 МГц, CD3OD) Общая процедура A : δ 8,34 (d, J=5,3, 1H), 8,16 (d, J=8,1, 1H), 7,59-7,50 (m, 2H), 7,33 (d, J=8,2, 1H), 7,26-7,06 (m, 4H), 5,27-5,13 (m, 1H), 3,93-3,84 (m, 4H), 3,22-3,16 (m, 4H), 1,96-1,88 (m, 1H), 1,69 (d, J=6,4, 3H), 0,98-0,78 (m, 4H).
Соединение 51a
(S*)-3-(6-морфолино-1Н-бензо[d]имидазол-2-ил)-4-((1-(оксазол-4-ил)этил)амино)хинолин-2(1H)-он
Реакционную смесь очищали препаративной ВЭЖХ (колонка: WatersXBridge 30*150 мм 5 мкм, расход: 20 мл/мин, подвижная фаза A: вода (0,1% NH3⋅H2O), подвижная фаза B: ацетонитрил, градиент: 35-55% (%B)). Целевую фракцию собирали и летучие вещества удаляли при пониженном давлении. Водную фазу лиофилизировали, получая соединение 51 (смесь стереоизомеров) (130 мг, выход 21,7%) в виде твердого вещества желтого цвета. Сырое соединение дополнительно очищали препаративной SFC (условие разделения: колонка: ChiralPak AD-H Daicel chemical Industries, Ltd, 250*30 мм внутр. диам., 5 мкм; подвижная фаза A: сверхкритический CO2, подвижная фаза B: этанол (0,1% диэтиламин), A:B=60:40 при 50 мл/мин; температура колонки: 38°C; давление сопла: 100 бар; температура сопла: 60°C; температура испарителя: 20°C; температура триммера: 25°C; длина волны: 220 нм) с получением соединения 51a (48,32 мг, выход 37,2%, чистота >99%) и соединения 51b.
Соединение 51a: LC-MS (ESI) Общая процедура A, способ 3: RT=1,10 минуты, масса рассч. для C25H24N6O3 456,19, масса/заряд найденное значение 457,2 [M+H]+.
1H ЯМР (400 МГц, CD3OD) Общая процедура A:δ 8,13 (s, 1H), 8,09 (d, J=8,3 Гц, 1H), 7,89 (t, J=7,4 Гц, 1H), 7,56-7,53 (m, 2H), 7,36-7,34 (m, 1H), 7,22-7,18 (m, 1H), 7,03-7,01 (s, 1H), 5,27 (d, J=6,6 Гц, 1H), 3,87 (m, 4H), 3,16 (m, 4H), 1,71 (d, J=6,6 Гц, 3H).
Соединение 52a
(S*)-3-(6-морфолино-1Н-бензо[d]имидазол-2-ил)-4-((1-(тиазол-4-ил)этил)амино)хинолин-2(1H)-он
Реакционную смесь очищали препаративной ВЭЖХ (колонка: WatersXBridge 30*150 мм 5 мкм, расход: 20 мл/мин, подвижная фаза A: вода (0,1% NH3⋅H2O), подвижная фаза B: ацетонитрил, градиент: 35-55% (%B)). Целевую фракцию собирали и летучие вещества удаляли при пониженном давлении. Водную фазу лиофилизировали, получая соединение 52 (смесь стереоизомеров) (110 мг, выход 17,7%) в виде твердого вещества желтого цвета. Сырое соединение дополнительно очищали препаративной SFC (условие разделения: колонка: ChiralPak OZ-H Daicel chemical Industries, Ltd, 250*30 мм внутр. диам., 5 мкм; подвижная фаза A: сверхкритический CO2, подвижная фаза B: этанол (0,1% диэтиламин), A:B=60:40 при 50 мл/мин; температура колонки: 38°C; давление сопла: 100 бар; температура сопла: 60°C; температура испарителя: 20°C; температура триммера: 25°C; длина волны: 220 нм) с получением соединения 52a (25,88 мг, выход 23,5%, чистота >99%) и соединения 52b.
Соединение 52a: LC-MS (ESI) Общая процедура A, способ 3: RT=1,12 минуты, масса рассч. для C25H24N6O2S472,17, масса/заряд найденное значение 473,2 [M+H]+.
1H ЯМР (400 МГц, CD3OD) Общая процедура A : δ 8,96 (d, J=4,8 Гц, 1H), 8,01 (d, J=8,3 Гц, 1H), 7,52 (t, J=7,4 Гц, 3H), 7,34-7,32 (d, J=8,0 Гц, 1H), 7,16-7,12 (m, 2H), 7,02 (s, 1H), 5,55 (d, J=6,6 Гц, 1H), 3,88 (m, 4H), 3,22 (m, 4H), 1,78 (d, J=6,6 Гц, 3H).
Соединение 53b
(R*)-3-(6-(1-метил-1Н-пиразол-4-ил)-1Н-бензо[d]имидазол-2-ил)-4-((1-(пиримидин-2-ил)этил)амино)хинолин-2(1H)-он
и соединение 53a
(S*)-3-(6-(1-метил-1Н-пиразол-4-ил)-1Н-бензо[d]имидазол-2-ил)-4-((1-(пиримидин-2-ил)этил)амино)хинолин-2(1H)-он
К реакционной смеси добавляли воду (20 мл) и фильтровали при пониженном давлении. Осадок на фильтре промывали диэтиловым эфиром, получая соединение 53 (смесь стереоизомеров) (200 мг, выход 12,4%) в виде твердого вещества желтого цвета. Сырое соединение дополнительно очищали препаративной SFC (условие разделения: колонка: ChiralPak OJ-H Daicel Сhemical Industries, Ltd, 250*30 мм внутр. диам., 5 мкм; подвижная фаза A: сверхкритический CO2, подвижная фаза B: метанол (0,1% диэтиламин), A:B=60:40 при 50 мл/мин; температура колонки: 38°C, давление сопла: 100 бар; температура сопла: 60°C; температура испарителя: 20°C; температура триммера: 25°C; длина волны: 220 нм) с получением соединения 53b (29,27 мг, выход 14,64%, чистота >99%) и соединения 53а (40,90 мг, выход 20,45%, чистота >99%).
Соединение 53b: LC-MS (ESI) Общая процедура A, способ 2: RT=1,29 минуты, масса рассч. для C26H22N8O 462,2, масса/заряд найденное значение 463,4 [M+H]+.
1H ЯМР (400 МГц, DMSO-d6) Общая процедура A : δ 13,02 (s, 1H), 12,13 (dd, J=23,8, 8,1 Гц, 1H), 11,60 (s, 1H), 8,79 (dd, J=4,8, 3,6 Гц, 2H), 8,17 (s, 0,5H), 8,09-8,05 (m, 1,5zH), 7,88 (d, J=17,6 Гц, 1H), 7,79 (d, J=16,2 Гц, 1H), 7,68 (d, J=8,4 Гц, 0,5H), 7,58 (d, J=8,3 Гц, 0,5H), 7,51 (t, J=7,5 Гц, 1H), 7,44-7,33 (m, 3H), 7,11 (t, J=7,6 Гц, 1H), 5,61-5,53 (m, 1H), 3,88 (d, J=4,7 Гц, 3H), 1,78 (t, J=7,0 Гц, 3H).
Соединение 53a: LC-MS (ESI) Общая процедура A, способ 2: RT=1,28 минуты, масса рассч. для C26H22N8O 462,2, масса/заряд найденное значение 463,4 [M+H]+.
1H ЯМР (400 МГц, DMSO-d6) Общая процедура A:δ 13,02 (s, 1H), 12,13 (dd, J=23,9, 8,2 Гц, 1H), 11,60 (d, J=3,6 Гц, 1H), 8,79 (dd, J=4,8, 3,5 Гц, 2H), 8,17 (s, 0,5H), 8,09-8,04 (m, 1,5H), 7,88 (d, J=17,5 Гц, 1H), 7,79 (d, J=16,0 Гц, 1H), 7,68 (d, J=8,2 Гц, 0,5H), 7,58 (d, J=8,3 Гц, 0,5H), 7,51 (t, J=7,4 Гц, 1H), 7,44-7,33 (m, 3H), 7,11 (t, J=7,6 Гц, 1H), 5,61-5,52 (m, 1H), 3,88 (d, J=4,7 Гц, 3H), 1,78 (t, J=7,0 Гц, 3H).
Соединение 55
(S)-3-(6-(морфолино-1Н-бензо[d]имидазол-2-ил)-4-((1-(пиридин-2-ил)этил)амино)хинолин-2(1H)-он
По завершении реакции реакционную смесь выливали в 20 мл воды и экстрагировали, используя ДХМ (20 мл × 3). Объединенные органические слои промывали соляным раствором (20 мл), сушили над Na2SO4 и фильтровали. Фильтрат концентрировали досуха, а затем очищали с помощью препаративной ТСХ (ДХМ : MeOH=10 : 1), получая частично очищенные материалы в виде масла коричневого цвета. Продукт разделяли между ацетонитрилом (10 мл) и водой (5 мл). Раствор лиофилизировали, получая соединение 55 (15,0 мг, чистота 98,8%, выход 13,4%) в виде твердого вещества желтого цвета.
LC-MS (ESI) Общая процедура B-2, способ 5: RT=3,360 минуты, масса рассч. для C27H26N6O2 466,21, масса/заряд найденное значение 467,0 [M+H]+.
1H ЯМР (400 МГц, DMSO-d6) Общая процедура B δ 12,92 (br. s., 0,4H), 12,89 (br. s., 0,6H), 12,31 (d, J=7,9 Гц, 0,4H), 12,18 (d, J=8,2 Гц, 0,6H), 11,61 (br. s., 1H), 8,58-8,52 (m, 1H), 7,97 (d, J=8,4 Гц, 1H), 7,81-7,72 (m, 1H), 7,59 (d, J=8,8 Гц, 0,4H), 7,54-7,45 (m, 2,6H), 7,34 (d, J=8,2 Гц, 1H), 7,29-7,22 (m, 1,6H), 7,13 (s, 0,4H), 7,10-7,03 (m, 1H), 7,02-6,93 (m, 1H), 5,55-5,45 (m, 1H), 3,81-3,73 (m, 4H), 3,18-3,04 (m, 4H), 1,76-1,68 (m, 3H).
Соединение 56
(S)-3-(6-(4-изопропилпиперазин-1-ил)-1Н-бензо[d]имидазол-2-ил)-4-((1-(пиридин-2-ил)этил)амино)хинолин-2(1H)-он
По завершении реакции реакционную смесь выливали в 45 мл воды и экстрагировали, используя ДХМ (20 мл x 3). Объединенные органические слои промывали соляным раствором (50 мл), сушили над Na2SO4 и фильтровали. Фильтрат концентрировали досуха, а затем очищали с помощью препаративной ТСХ (ДХМ : MeOH=10 : 1), получая продукт в виде масла коричневого цвета. Продукт разделяли между ацетонитрилом (10 мл) и водой (5 мл). Раствор лиофилизировали досуха, получая соединение 56 (20,0 мг, чистота 96,3%, выход 8,90%) в виде твердого вещества желтого цвета.
LC-MS (ESI) Общая процедура B-2, способ 4: RT=5,307 минуты, масса рассч. для C30H33N7O 507,27, масса/заряд найденное значение 508,1 [M+H]+.
1H ЯМР (400 МГц, DMSO-d6) Общая процедура B: δ 12,92-12,82 (m, 1H), 12,32-12,27 (m, 0,5H), 12,20-12,12 (m, 0,5H), 11,58 (br s, 1H), 8,54 (d, J=4,0 Гц, 1H), 7,97 (d, J=8,4 Гц, 1H), 7,79-7,72 (m, 1H), 7,58-7,43 (m, 3H), 7,38-7,30 (m, 1H), 7,30-7,19 (m, 1,5H), 7,12-7,02 (m, 1,5H), 7,01-6,90 (m, 1H), 5,48 (br d, J=7,3 Гц, 1H), 3,12 (br s, 4H), 2,72-2,66 (m, 1H), 2,63 (br s, 4H), 1,78-1,65 (m, 3H), 1,03 (d, J=6,4 Гц, 6H).
Соединение 7
(S)-Метил--1-(2-(2-оксо-4-((1-(пиридин-2-ил)этил)амино)-1,2-дигидрохинолин-3-ил)-1H-бензо[d]имидазол-6-ил)пиперидин-4-карбокслиат
После завершения реакции смесь концентрировали до сухого состояния, а затем очищали препаративной ВЭЖХ (колонка: Phenomenex Gemini 150*25 мм *10 мкм, подвижная фаза A: вода (0,05% гидроксида аммония об./об.), подвижная фаза B: ацетонитрил, расход: 25 мл/мин, градиент от 51% B до 81%). Чистые фракции собирали, растворитель выпаривали под вакуумом и затем лиофилизировали, получая соединение 7 (70 мг, чистота 96,62%, выход 37,7) в виде твердого вещества желтого цвета.
LC-MS (ESI) Общая процедура B-2, способ 5: RT=3,706 минуты, масса рассч. для C30H30N6O3 522,24, масса/заряд найденное значение 523,0 [M+H]+.
1H ЯМР (400 МГц, DMSO-d6) Общая процедура B:δ 12,91 (br. s., 0,4H), 12,86 (br. s., 0,6H), 12,32 (d, J=8,2 Гц, 0,4H), 12,19 (d, J=8,2 Гц, 0,6H), 11,59 (br. s., 1H), 8,58-8,52 (m, 1H), 7,96 (d, J=8,2 Гц, 1H), 7,81-7,72 (m, 1H), 7,57 (d, J=8,8 Гц, 0,4H), 7,53-7,44 (m, 2,6H), 7,34 (d, J=8,2 Гц, 1H), 7,28-7,22 (m, 1,6H), 7,13 (s, 0,4H), 7,09-7,03 (m, 1H), 7,00-6,93 (m, 1H), 5,58-5,42 (m, 1H), 3,64 (s, 3H), 3,61-3,54 (m, 2H), 2,83-2,70 (m, 2H), 2,54-2,53 (m, 1H), 1,96 (d, J=13,0 Гц, 2H), 1,80-1,65 (m, 5H).
Соединение 57
(S*)-трет-бутил-1-(2-(2-оксо-4-((1-(пиримидин-2-ил)этил)амино)-1,2-дигидрохинолин-3-ил)-5-(трифторметил)-1H-бензо[d]имидазол-6-ил)пиперидин-4-карбокслиат
Полученную смесь концентрировали досуха при пониженном давлении с получением неочищенного продукта.
Неочищенный продукт очищали с помощью преп. ВЭЖХ (колонка: Phenomenex Gemini 150 х 25 мм х 10 мкм, подвижная фаза A: вода (0,05% гидроксида аммония об./об.), подвижная фаза B: ацетонитрил, расход: 25 мл/мин, градиент от 75% B до 100%). Чистые фракции собирали и летучие вещества удаляли под вакуумом. Остаток суспендировали в воде (10 мл) и полученную смесь лиофилизировали с получением рацемических соединений (101 мг, чистота 95%, выход 33,7%) в виде твердого вещества желтого цвета. Рацемические продукты разделяли, используя сверхкритическую жидкостную (флюидную) хроматографию (условия для разделения: AD (250 мм x 30 мм, 10 мкм); подвижная фаза: A: сверхкритический CO2, B: 0,1% NH3H2OEtOH, A:B =55:45 при 80 мл/мин; температура колонки: 38; давление сопла: 100 бар; температура сопла: 60; температура испарителя: 20; температура триммера: 25; длина волны: 220 нм). Две фракции собирали и растворитель выпаривали под вакуумом. Два остатка суспендировали в воде (10 мл) и полученную смесь лиофилизировали досуха с получением соединения 57 (39,3 мг, чистота 99,9%, выход 13,2%).
LC-MS (ESI) Общая процедура B-2, способ 6: RT=5,242 минуты, масса рассч. для C33H34F3N7O3 633,27, масса/заряд найденное значение 634,0 [M+H]+.
1H ЯМР (400 МГц, DMSO-d6) Общая процедура B : δ 13,30 (br. s., 0,5H), 13,28 (br. s., 0,5H), 12,10 (d, J=7,1 Гц, 0,5H), 11,97 (d, J=7,3 Гц, 0,5H), 11,62 (s, 1H), 8,79 (s, 2H), 8,08 (s, 1H), 8,05 (s, 0,5H), 7,86 (d, J=6,0 Гц, 1H), 7,72 (s, 0,5H), 7,52 (t, J=6,8 Гц, 1H), 7,41-7,32 (m, 2H), 7,11 (t, J=7,4 Гц, 1H), 5,64-5,54 (m, 1H), 3,03-2,93 (m, 2H), 2,92-2,84 (m, 1H), 2,81-2,70 (m, 1H), 2,43-2,36 (m, 1H), 2,06-1,94 (m, 1H), 1,93-1,85 (m, 2H), 1,81-1,75 (m, 3H), 1,72-1,66 (m, 1H), 1,44 (s, 9H).
Соединение 58
(S*)-1-(2-(2-оксо-4-((1-(пиримидин-2-ил)этил)амино)-1,2-дигидрохинолин-3-ил)-5-(трифторметил)-1H-бензо[d]имидазол-6-ил)пиперидин-4-карбоновая кислота
Полученную смесь концентрировали досуха при пониженном давлении с получением неочищенного продукта. Неочищенный продукт очищали препаративной ВЭЖХ (колонка: Phenomenex Gemini C18 250×50 10 мкм, подвижная фаза A: вода (0,225% вода ⋅ TFA, подвижная фаза B: ацетонитрил, расход: 22 мл/мин, градиент от 38% B до 68%). Чистые фракции собирали и летучие вещества удаляли под вакуумом. Остаток суспендировали в воде (10 мл) и полученную смесь лиофилизировали с получением рацемических соединений (50 мг, чистота 97%) в виде твердого вещества желтого цвета. Рацемические продукты разделяли, используя сверхкритическую жидкостную (флюидную) хроматографию (условия для разделения: AD (250 мм x 30 мм, 10 мкм); подвижная фаза: A: сверхкритический CO2, B: 0,1%NH3H2O EtOH, A:B =55:45 при 80 мл/мин; температура колонки: 38; давление сопла: 100 бар; температура сопла: 60; температура испарителя: 20; температура триммера: 25; длина волны: 220 нм). Две фракции собирали и растворитель выпаривали под вакуумом. Два остатка суспендировали в воде (10 мл) и полученную смесь лиофилизировали досуха с получением соединения 58 (6,5 мг, чистота 100%, выход 12,3%).
LC-MS (ESI) Общая процедура B-2, способ 5: RT=5,147 минуты, масса рассч. для C29H26F3N7O3 577,20, масса/заряд найденное значение 578,2 [M+H]+.
1H ЯМР (400 МГц, DMSO-d6) Общая процедура B: δ 13,28 (s, 0,5H), 13,24 (s, 0,5H), 12,12 (d, J=7,7 Гц, 0,5H), 11,95 (d, J=7,9 Гц, 0,5H), 11,61 (s, 1H), 8,78 (t, J=5,3 Гц, 2H), 8,08 (s, 1H), 8,06 (s, 0,5H), 7,90-7,84 (m, 1H), 7,73 (s, 0,5H), 7,53 (t, J=7,7 Гц, 1H), 7,41-7,32 (m, 2H), 7,11 (t, J=7,6 Гц, 1H), 5,66-5,54 (m, 1H), 3,02-2,94 (m, 2H), 2,93-2,83 (m, 1H), 2,83-2,71 (m, 1,5H), 2,70-2,66 (m, 0,5H), 1,96-1,87 (m, 2H), 1,83-1,76 (m, 3H), 1,75-1,64 (m, 2H).
Соединение 59
(Rac)-метил-4-(2-(2-оксо-4-(((S)-1-(пиридин-2-ил)этил)амино)-1,2-дигидрохинолин-3-ил)-1H-бензо[d]имидазол-6-ил)морфолин-2-карбоксилат
По завершении реакции смесь подщелачивали насыщенным раствором бикарбоната натрия до pH>7. Смесь экстрагировали, используя ДХМ (дихлорметан) (10 мл х3). Объединенные органические слои промывали соляным раствором, сушили над Na2SO4 и фильтровали. Фильтрат упаривали досуха, получая соединение 59 (24 мг, чистота 96,0%, выход 89,6%) в виде твердого вещества желтого цвета.
LC-MS (ESI) Общая процедура B, способ 5: RT=3,639 минуты, масса рассч. для C29H28N6O4 524,22, масса/заряд найденное значение 525,0 [M+H]+.
1H ЯМР (400 МГц, DMSO-d6) Общая процедура B: δ12,92 (br. s., 1H), 12,12 (br. s., 1H), 11,58 (br. s., 1H), 8,53 (d, J=3,7 Гц, 1H), 7,99 (d, J=8,2 Гц, 1H), 7,76 (dt, J=1,8, 7,7 Гц, 1H), 7,55 (s, 1H), 7,53-7,45 (m, 2H), 7,34 (d, J=7,5 Гц, 1H), 7,25 (dd, J=5,2, 7,2 Гц, 2H), 7,08 (t, J=7,7 Гц, 1H), 6,98 (d, J=8,6 Гц, 1H), 5,45 (s, 1H), 4,47 (dd, J=3,1, 7,5 Гц, 1H), 4,08-3,98 (m, 1H), 3,82-3,75 (m, 1H), 3,73 (s, 3H), 3,47 (dd, J=2,8, 12,0 Гц, 1H), 3,25 (d, J=13,5 Гц, 1H), 3,14 (dd, J=7,6, 11,8 Гц, 1H), 3,03-2,93 (m, 1H), 1,71 (d, J=6,6 Гц, 3H).
Соединение 60
(Rac)-4-(2-(2-оксо-4-(((S)-1-(пиридин-2-ил)этил)амино)-1,2-дигидрохинолин-3-ил)-1H-бензо[d]имидазол-6-ил)морфолин-2-карбоновая кислота
По завершении реакции смесь экстрагировали, используя ДХМ (20 мл x 3). Затем рН объединенных водных слоев доводили до pH 5-6, используя 1M HCl (водн.). Смесь концентрировали досуха при пониженном давлении с получением неочищенного продукта, который очищали препаративной ВЭЖХ (колонка: Phenomenex Gemini C18 150×25 мм х 5 мкм, подвижная фаза A: вода (0,225% муравьиной кислоты), подвижная фаза B: ацетонитрил, расход: 22 мл/мин, градиент от 8% B до 38%). Чистые фракции собирали, растворитель выпаривали под вакуумом и затем лиофилизировали, получая соединение 60 (50,0 мг, чистота 96,6%, выход 45,5) в виде твердого вещества желтого цвета.
LC-MS (ESI) Общая процедура B, способ 5: RT=3,75 минуты, масса рассч. для C28H26N6O4510,2, масса/заряд найденное значение 511,0[M+H]+.
1H ЯМР (400 МГц, DMSO-d6) Общая процедура B : δ=12,94 (br. s., 0,4H), 12,91 (br. s., 0,6H), 12,31 (d, J=7,7 Гц, 0,4H), 12,19 (d, J=7,3 Гц, 0,6H), 11,60 (br. s., 1H), 8,54 (d, J=2,4 Гц, 1H), 8,20 (s, 0,2H), 7,96 (d, J=8,4 Гц, 1H), 7,81-7,70 (m, 1H), 7,61 (d, J=8,8 Гц, 0,4H), 7,54-7,44 (m, 2,6H), 7,37-7,28 (m, 1,6H), 7,28-7,21 (m, 1H), 7,14 (s, 0,4H), 7,07 (t, J=7,1 Гц, 1H), 7,01-6,92 (m, 1H), 5,52-5,45 (m, 1H), 4,31-4,19 (m, 1H), 4,15-4,00 (m, 1H), 3,73 (t, J=8,7 Гц, 1H), 3,53-3,49 (m, 2H), 3,07-2,84 (m, 2H), 1,78-1,66 (m, 3H)
Соединение 62
(R*)-метил-4-(2-(2-оксо-4-(((S)-1-(пиридин-2-ил)этил)амино)-1,2-дигидрохинолин-3-ил)-1H-бензо[d]имидазол-6-ил)морфолин-2-карбоксилат
По завершении реакции смесь подщелачивали насыщенным раствором бикарбоната натрия до pH>7. Смесь экстрагировали, используя ДХМ (10 мл х3). Объединенные органические слои промывали соляным раствором, сушили над Na2SO4 и фильтровали. Фильтрат упаривали досуха, получая соединение 62 (6,50 мг, чистота 95,7%, выход 60,6%) в виде твердого вещества желтого цвета.
LC-MS (ESI) Общая процедура B, способ 5: RT=3,544 минуты, масса рассч. для C29H28N6O4 524,22, масса/заряд найденное значение 525,0 [M+H]+.
1H ЯМР (400 МГц, DMSO-d6) Общая процедура B: δ12,96 (br. s., 0,4H), 12,93 (br. s., 0,6H), 12,29 (d, J=8,2 Гц, 0,4H), 12,17 (d, J=8,4 Гц, 0,6H), 11,59 (br. s., 1H), 8,57-8,52 (m, 1H), 7,96 (d, J=8,4 Гц, 1H), 7,79-7,72 (m, 1H), 7,61 (d, J=8,6 Гц, 0,4H), 7,54-7,48 (m, 2,6H), 7,35-7,30 (m, 1,6H), 7,28-7,23 (m, 1H), 7,15 (s, 0,4H), 7,06 (t, J=7,7 Гц, 1H), 6,97 (ddd, J=2,1, 9,0, 11,2 Гц, 1H), 5,55-5,44 (m, 1H), 4,47 (dt, J=3,1, 7,6 Гц, 1H), 4,10-3,97 (m, 1H), 3,82-3,75 (m, 1H), 3,75-3,70 (m, 3H), 3,50-3,43 (m, 1H), 3,25 (dd, J=3,6, 12,5 Гц, 1H), 3,13 (dd, J=7,9, 11,7 Гц, 1H), 3,03-2,94 (m, 1H), 1,75-1,70 (m, 3H).
Соединение 63
(S)-7-Фтор-3-(6-(4-метилпиперазин-1-ил)-1Н-бензо[d]имидазол-2-ил)-4-((1-(пиридин-2-ил)этил)амино)хинолин-2(1H)-он
По завершении реакции полученную смесь концентрировали под вакуумом с получением неочищенного продукта, который очищали препаративной ВЭЖХ (колонка: Phenomenex Gemini 150×25 мм х 5 мкм, подвижная фаза A: вода (0,05% гидроксида аммония, об./об.); подвижная фаза B: ацетонитрил, расход: 22 мл/мин, градиент от 42% B до 72%). Чистые фракции собирали, растворитель выпаривали под вакуумом и затем лиофилизировали, получая соединение 63 (33,3 мг, чистота 95,3%, выход 26,3) в виде твердого вещества желтого цвета.
LC-MS (ESI) Общая процедура B-2, способ 6: RT=1,986 минуты, масса рассч. для C28H28FN7O 497,23, масса/заряд найденное значение 498,0 [M+H]+.
1H ЯМР (400 МГц, DMSO-d6) Общая процедура B:δ=12,81 (br. s., 0,4H), 12,77 (br. s., 0,6H), 12,39 (d, J=8,2 Гц, 0,4H), 12,26 (d, J=7,9 Гц, 0,6H), 11,65 (br. s., 1H), 8,57-8,52 (m, 1H), 8,07-8,01 (m, 1H), 7,80-7,71 (m, 1H), 7,56 (d, J=8,8 Гц, 0,4H), 7,51-7,44 (m, 1,6H), 7,28-7,22 (m, 1,6H), 7,12-7,04 (m, 1,4H), 7,00-6,90 (m, 2H), 5,53-5,42 (m, 1H), 3,17-3,10 (m, 4H), 2,54-2,52 (m, 4H), 2,25 (s, 3H), 1,75-1,68 (m, 3H).
Соединение 64
(S)-3-(6-((1-Метилпиперидин-4-ил)окси)-1Н-бензо[d]имидазол-2-ил)-4-((1-(пиридин-2-ил)этил)амино)хинолин-2(1H)-он
По завершении реакции реакционную смесь выпаривали досуха и очищали колоночной флэш-хроматографией (ДХМ/MeOH от 100/0 до 70/30). Чистые фракции собирали и растворитель выпаривали досуха под вакуумом, а затем их дополнительно очищали препаративной ВЭЖХ (колонка: Phenomenex Gemini 150 х 25 мм х 10 мкм, подвижная фаза A: вода (0,05% гидроксида аммония, об./об.), подвижная фаза B: ацетонитрил, расход: 25 мл/мин, градиент от 40% B до 70%). Чистые фракции собирали, растворитель выпаривали под вакуумом и затем лиофилизировали, получая соединение 64 (19,2 мг, чистота 98,3%, выход 5,20) в виде твердого вещества желтого цвета.
LC-MS (ESI) Общая процедура B-2, способ 5: RT=3,107 минуты, масса рассч. для C29H30N6O2 494,24, масса/заряд найденное значение 495,1 [M+H]+.
1H ЯМР (400 МГц, DMSO-d6) Общая процедура B: δ 12,98 (br. s., 0,4H), 12,95 (br. s., 0,6H), 12,24 (d, J=8,3 Гц, 0,4H), 12,17 (d, J=8,3 Гц, 0,6H), 11,60 (br. s., 1H), 8,58-8,51 (m, 1H), 7,97 (dd, J=2,9, 8,4 Гц, 1H), 7,82-7,71 (m, 1H), 7,60 (d, J=8,8 Гц, 0,4H), 7,50 (m, 2,6H), 7,37-7,31 (m, 1,6H), 7,25 (dd, J=4,8, 6,5 Гц, 1H), 7,20 (d, J=2,3 Гц, 0,4H), 7,07 (t, J=7,7 Гц, 1H), 6,90-6,78 (m, 1H), 5,50 (t, J=7,3 Гц, 1H), 4,44-4,24 (m, 1H), 2,73-2,58 (m, 2H), 2,26-2,09 (m, 5H), 1,97 (m, 2H), 1,77-1,70 (m, 3H), 1,67 (m, 2H).
Соединение 65
(S)-3-(6-(4-метилпиперазин-1-ил)-1Н-бензо[d]имидазол-2-ил)-4-((1-(пиридин-2-ил)этил)амино)хинолин-2(1H)-он
По завершении реакции реакционную смесь выливали в 45 мл воды и экстрагировали, используя ДХМ (20 мл х 3). Объединенные органические слои промывали соляным раствором (50 мл), сушили над Na2SO4 и фильтровали. Фильтрат концентрировали досуха, а затем очищали с помощью препаративной ТСХ (ДХМ/MeOH =10/1). Продукт разделяли между ацетонитрилом (10 мл) и водой (5 мл). Раствор лиофилизировали досуха, получая соединение 65 (26,5 мг, чистота 97,5%, выход 14,2%) в виде твердого вещества желтого цвета.
LC-MS (ESI) Общая процедура B-2, способ 5: RT=2,857 минуты, масса рассч. для C28H29N7O 479,24, масса/заряд найденное значение 480,2 [M+H]+.
1H ЯМР (400 МГц, DMSO-d6) Общая процедура B: δ 12,91 (s, 0,4H), 12,87 (s, 0,6H), 12,31 (d, J=7,9 Гц, 0,4H), 12,18 (d, J=8,2 Гц, 0,6H), 11,59 (s, 1H), 8,54 (d, J=2,9 Гц, 1H), 7,97 (d, J=8,6 Гц, 1H), 7,80-7,70 (m, 1H), 7,58 (d, J=8,6 Гц, 0,4H), 7,54-7,45 (m, 2,6H), 7,34 (d, J=7,3 Гц, 1H), 7,29-7,21 (m, 1,6H), 7,12 (s, 0,4H), 7,07 (br t, J=7,7 Гц, 1H), 7,01-6,91 (m, 1H), 5,49 (br t, J=7,2 Гц, 1H), 3,19-3,07 (m, 4H), 2,60-2,52 (m, 4H), 2,27 (s, 3H), 1,79-1,66 (m, 3H).
Соединение 38b
(S)-5-хлор-3-(6-морфолино-1Н-бензо[d]имидазол-2-ил)-4-((1-(пиридин-2-ил)этил)амино)хинолин-2(1H)-он
LC-MS (ESI) Общая процедура B, способ 2: RT=1,22 минуты, масса рассч. для C27H25ClN6O2 500,1, масса/заряд найденное значение 501,1 [M+H]+.
1H ЯМР (400 МГц, CD3OD) Общая процедура A δ8,28 (d, J =4,0 Гц, 1H), 7,59 (t, J =6,8 Гц, 2H), 7,46 (t, J =8,0 Гц, 1H), 7,32-7,30 (m, 1H), 7,24-7,05 (m, 5H), 4,97 (q, J =6,8 Гц, 1H), 3,89-3,87 (m, 4H), 3,19-3,17 (m, 4H), 1,57 (d, J =6,8 Гц, 3H).
Соединение 38a
(R*)-5-хлор-3-(6-морфолино-1Н-бензо[d]имидазол-2-ил)-4-((1-(пиридин-2-ил)этил)амино)хинолин-2(1H)-он
LC-MS (ESI) Общая процедура B, способ 2: RT=1,22 минуты, масса рассч. для C27H25ClN6O2 500,1, масса/заряд найденное значение 501,1 [M+H]+.
1H ЯМР (400 МГц, CD3OD) Общая процедура A δ8,28 (d, J =4,4 Гц, 1H), 7,60 (t, J =6,8 Гц, 2H), 7,46 (t, J =8,0 Гц, 1H), 7,32-7,30 (m, 1H), 7,24-7,06 (m, 5H), 4,97 (q, J =6,8 Гц, 1H), 3,89-3,87 (m, 4H), 3,20-3,17 (m, 4H), 1,57 (d, J =6,8 Гц, 3H).
Соединение 42
(S)-5-фтор-3-(6-(4-метилпиперазин-1-ил)-1H-бензо[d]имидазол-2-ил)-4-((1-(оксазол-4-ил)этил)амино)хинолин-2(1H)-он
Реакционную смесь очищали препаративной ВЭЖХ (колонка: WatersXBridge 30*150 мм 5 мкм, расход: 20 мл/мин, подвижная фаза A: вода (0,1% NH3⋅H2O), подвижная фаза B: ацетонитрил, градиент: 35-55% (%B)). Целевую фракцию собирали и летучие вещества удаляли при пониженном давлении. Водную фазу лиофилизировали, получая соединение 42 (10 мг, выход 9%, чистота >99%) в виде твердого вещества желтого цвета.
LC-MS (ESI) Общая процедура A, способ 2: RT=1,0минуты, масса рассч. для C26H26FN7O2 487,21, масса/заряд найденное значение 488,3[M+H]+.
1H ЯМР (400 МГц, DMSO-d6) Общая процедура A δ 12,71 (d, J=22,5 Гц, 1H), 11,81 (s, 1H), 11,47 (dd, J=43,6, 9,9 Гц, 1H), 8,17 (d, J=5,4 Гц, 1H), 7,80 (d, J=8,8 Гц, 1H), 7,51 (m, J=44,7, 8,7 Гц, 2H), 7,32-7,15 (m, 2H), 7,14-6,92 (m, 2H), 4,75 (s, 1H), 3,17 (s, 4H), 2,67 (m, 2H), 2,51 (m, 2H), 2,36 (s, 3H), 1,58 (t, J=6,8 Гц, 3H).
Аналитическая часть
ЖХ-МС:
Общая процедура А для ЖХ-МС
Измерение с помощью ЖХ-МС выполняли на системе Waters UPLC-QDa, содержащей насос для четырехкомпонентных смесей, автоматический пробоотборник, колоночный термостат (установленный на 50°C, если не указано иное), детектор на фотодиодной матрице (РDA) и колонку, как указано в соответствующих методиках ниже. Часть потока из колонки отводили на MS-спектрометр. MС-детектор представлял собой QDa-детектор и был оборудован источником ионизации для электрораспыления. Масс-спектры получали сканированием от 100 до 1000. Напряжение на капиллярной игле составляло 0,8 кВ, а температуру источника поддерживали при 120°C. В качестве газа-распылителя использовали азот. Данные регистрировали с помощью системы сбора и обработки данных MassLynx-Openlynx от Waters-Micromass.
Методика 1 (95:5)
В дополнение к общей процедуре A: Обращенно-фазовую ВЭЖХ выполняли на колонке ACQUITY UPLC BEH C18 (1,7 мкм, 2,1×50 мм) с расходом 0,6 мл/мин. Две подвижные фазы (подвижная фаза С: 0,1% муравьиной кислоты в воде; подвижная фаза D: 0,1% муравьиной кислоты в ацетонитриле) использовали для поддержания 95% C и 5% D в течение 1,2 минут, затем поддерживали 5% C и 95% D в течение 0,8 минут. Объем впрыска в размере от 0,3 до 5 мкл зависел от концентрации образца. Напряжение на конусе составляло 15 В для режима положительной ионизации.
Методика 2 (90:10)
В дополнение к общей методике A: Обращенно-фазовую ВЭЖХ выполняли на колонке ACQUITY UPLC BEH C18 (1,7 мкм, 2,1×50 мм) с расходом 0,6 мл/мин. Две подвижные фазы (подвижная фаза С: 0,1% муравьиной кислоты в воде; подвижная фаза D: 0,1% муравьиной кислоты в ацетонитриле) использовали для поддержания 90% C и 10% D в течение 1,2 минуты, затем поддерживали 5% C и 95% D в течение 0,8 минуты. Объем впрыска в размере от 0,3 до 5 мкл зависел от концентрации образца. Напряжение на конусе составляло 15 В в режиме положительной ионизации.
Методика 3 (80:20)
В дополнение к общей методике A: Обращенно-фазовую ВЭЖХ выполняли на колонке ACQUITY UPLC BEH C18 (1,7 мкм, 2,1×50 мм) с расходом 0,6 мл/мин. Две подвижные фазы (подвижная фаза С: 0,1% муравьиной кислоты в воде; подвижная фаза D: 0,1% муравьиной кислоты в ацетонитриле) использовали для поддержания 80% C и 20% D в течение 1,2 минут, затем поддерживали 5% C и 95% D в течение 0,8 минут. Объем впрыска в размере от 0,3 до 5 мкл зависел от концентрации образца. Напряжение на конусе составляло 15 В для режима положительной ионизации.
Методика 4 (70:30)
В дополнение к общей методике A: Обращенно-фазовую ВЭЖХ выполняли на колонке ACQUITY UPLC BEH C18 (1,7 мкм, 2,1×50 мм) с расходом 0,6 мл/мин. Две подвижные фазы (подвижная фаза С: 0,1% муравьиной кислоты в воде; подвижная фаза D: 0,1% муравьиной кислоты в ацетонитриле) использовали для поддержания 70% C и 30% D в течение 1,2 минут, затем поддерживали 5% C и 95% D в течение 0,8 минут. Объем впрыска в размере от 0,3 до 5 мкл зависел от концентрации образца. Напряжение на конусе составляло 15 В для режима положительной ионизации.
Общая процедура В для ЖХ-МС
Измерение с помощью ЖХ-МС выполняли на системе Shimadzu LC-MS2020, содержащей насос (LC-20AD) с дегазатором (DGU-20A3), автоматический пробоотборник (SIL-20AHT), колоночный термостат (CTO-20A) (установленный на 40°C, если не указано иное), детектор на фотодиодной матрице (РDA) (SPD-M20A), испарительный детектор светорассеяния (ELSD)(Alltech 3300ELSD) и колонку, как указано в соответствующих методиках ниже. Поток из колонки разделяли для MS-спектрометра. MС-детектор был оборудован электрораспыляющим источником ионизации. Масс-спектры получали путем сканирования от 80 до 1000. В качестве газа-распылителя применяли азот. Сбор и обработку данных проводили с помощью системы обработки данных Labsolution.
Методика 1 (95:5)
В дополнение к общей методике B: Обращенно-фазовую СВЭЖХ выполняли на колонке ACQUITY UPLC BEH C18 (5 мкм 50×4,6 мм) с расходом 2,0 мл/мин. Две подвижные фазы (подвижная фаза A: 0,1% муравьиной кислоты в воде; подвижная фаза В: 0,1% муравьиной кислоты в ацетонитриле) использовали для поддержания 95% А и 5% В в течение 1,6 минуты, затем поддерживали 5% А и 95% В в течение 1,0 минуты. Объем впрыска в размере от 0,3 до 5 мкл зависел от концентрации образца. Напряжение на конусе составляло 20 В в режимах положительной и отрицательной ионизации. Масс-спектры получали сканированием от 100 до 1000 за 0,2 секунды с использованием времени задержки между сканированиями, равным 0,1 секунды.
Методика 2 (90:10)
В дополнение к общей методике B: Обращенно-фазовую СВЭЖХ выполняли на колонке ACQUITY UPLC BEH C18 (5 мкм 50×4,6 мм) с расходом 2,0 мл/мин. Две подвижные фазы (подвижная фаза A: 0,1% муравьиной кислоты в воде; подвижная фаза В: 0,1% муравьиной кислоты в ацетонитриле) использовали для поддержания 90% А и 10% В в течение 1,6 минуты, затем поддерживали 5% А и 95% В в течение 1,0 минуты. Объем впрыска в размере от 0,3 до 5 мкл зависел от концентрации образца. Напряжение на конусе составляло 20 В для режима положительной и отрицательной ионизации. Масс-спектры получали сканированием от 100 до 1000 за 0,2 секунды с использованием времени задержки между сканированиями, равным 0,1 секунды.
Методика 3 (80:20)
В дополнение к общей методике B: Обращенно-фазовую СВЭЖХ выполняли на колонке ACQUITY UPLC BEH C18 (5 мкм 50×4,6 мм) с расходом 2,0 мл/мин. Две подвижные фазы (подвижная фаза A: 0,1% муравьиной кислоты в воде; подвижная фаза В: 0,1% муравьиной кислоты в ацетонитриле) использовали для поддержания 80% А и 20% В в течение 1,6 минуты, затем поддерживали 5% А и 95% В в течение 1,0 минуты. Объем впрыска в размере от 0,3 до 5 мкл зависел от концентрации образца. Напряжение на конусе составляло 20 В для режима положительной и отрицательной ионизации. Масс-спектры получали сканированием от 100 до 1000 за 0,2 секунды с использованием времени задержки между сканированиями, равным 0,1 секунды.
Методика 4 (30:70)
В дополнение к общей методике B: Обращенно-фазовую СВЭЖХ выполняли на колонке ACQUITY UPLC BEH C18 (5 мкм 50×4,6 мм) с расходом 2,0 мл/мин. Две подвижные фазы (подвижная фаза A: 0,1% муравьиной кислоты в воде; подвижная фаза В: 0,1% муравьиной кислоты в ацетонитриле) использовали для поддержания 30% А и 70% В в течение 1,6 минуты, затем поддерживали 5% А и 95% В в течение 1,0 минуты. Объем впрыска в размере от 0,3 до 5 мкл зависел от концентрации образца. Напряжение на конусе составляло 20 В для режима положительной и отрицательной ионизации. Масс-спектры получали сканированием от 100 до 1000 за 0,2 секунды с использованием времени задержки между сканированиями, равным 0,1 секунды.
Методика 5 (70:30)
В дополнение к общей методике B: Обращенно-фазовую СВЭЖХ выполняли на колонке ACQUITY UPLC BEH C18 (5 мкм 50×4,6 мм) с расходом 2,0 мл/мин. Две подвижные фазы (подвижная фаза A: 0,1% муравьиной кислоты в воде; подвижная фаза В: 0,1% муравьиной кислоты в ацетонитриле) использовали для поддержания 70% А и 30% В в течение 1,6 минуты, затем поддерживали 5% А и 95% В в течение 1,0 минуты. Объем впрыска в размере от 0,3 до 5 мкл зависел от концентрации образца. Напряжение на конусе составляло 20 В в режимах положительной и отрицательной ионизации. Масс-спектры получали сканированием от 100 до 1000 за 0,2 секунды с использованием времени задержки между сканированиями, равным 0,1 секунды.
Общая процедура B-2
Измерение в ходе ВЭЖХ выполняли на системе HP 1200 (Agilent Technologies), включающей дегазатор, насос для двухкомпонентных смесей, автодозатор, термостат для колонок, детектор на диодной матрице (DAD) и колонку, как указано в соответствующих методиках ниже. Часть потока из DAD отводили на МС-спектрометр (Agilent 6110 или 6140) и ELSD. MС-детектор был оборудован электрораспыляющим источником ионизации. В качестве газа-распылителя применяли азот. Температуру сушащего газа поддерживали при 350°С. Напряжение капиллярной иглы составляло 2,5 В в режиме положительной ионизации и 3,0 В в режиме отрицательной ионизации. Масс-спектры получали сканированием от 100 до 1000 с шагом, равным 0,1. Продолжительность цикла составляла 0,89 сек/цикл. Регистрацию данных проводили с помощью Chemstation B.04.03
Способ 4
В дополнение к общей методике B: Обращенно-фазовую ВЭЖХ выполняли на колонке Waters XBridge Shield RP18 (50×2,1 мм 5 мкм) с расходом 0,8 мл/мин. Использовали две подвижные фазы (подвижная фаза A: вода с 0,05% NH3⋅H2O; подвижная фаза B: ацетонитрил). Сначала 100% A поддерживали в течение 1 минуты. Затем к 40% A и 60% B применяли градиент за 4 минуты, а затем - к 5% A и 95% B за 2,5 минуты. Наконец, возвращались к 100% A за 2 минуты и поддерживали 0,5 минуты. Продолжительность перерыва составляла 0,5 минуты. Температура термостата составляла 40°C. Объем впрыска составлял 2 мкл. (Полярность МС: положительная)
Методика 5
В дополнение к общей методике B: Обращенно-фазовую ВЭЖХ выполняли на колонке Phenomenex Luna-C18 (5 мкм, 2,0×50 мм) с расходом 0,8 мл/мин. Применяли две подвижные фазы (подвижная фаза A: вода с 0,1% TFA; подвижная фаза B: ацетонитрил с 0,05% TFA). 100% A поддерживали 1 минуту, градиент A от 100% A до 40%A применяли за 4 минуты, а уменьшение с 40%A до 15%A - за 2,5 минуты. Затем возвращались к 100% A за 2 минуты и поддерживали 0,5 минуты. Продолжительность перерыва составляла 0,5 минуты. Температура термостата составляла 50°C. Объем впрыска составлял 2 мкл. (Полярность МС: положительная)
Способ 6
В дополнение к общей методике B: Обращенно-фазовую ВЭЖХ выполняли на колонке Phenomenex Luna-C18 (5 мкм, 2,0×50 мм) с расходом 0,8 мл/мин. Применяли две подвижные фазы (подвижная фаза A: вода с 0,1% TFA; подвижная фаза B: ацетонитрил с 0,05% TFA). Сначала 90% A удерживали в течение 0,8 минуты. Затем градиент применяли по отношению к 20% A и 80% B в течение 3,7 минуты и удерживали в течение 3 минут. Затем возвращались к 90% A за 2 минуты и поддерживали 0,5 минуты. Продолжительность перерыва составляла 0,5 минуты. Температура термостата составляла 50°C. Объем впрыска составлял 2 мкл. (Полярность МС: положительная)
ЯМР
Общая процедура А для данных ЯМР
Приведенные ниже ЯМР-эксперименты были проведены с использованием спектрометров Bruker Avance Ⅲ400 при комнатной температуре, реализующих внутреннюю дейтериевую стабилизацию и оснащенных 5-миллиметровой измерительной головкой PABBO (1H, 13C,15N,31P,19F). Химические сдвиги (δ) приведены в миллионных долях (ppm).
Общая процедура И для данных ЯМР
Приведенные ниже ЯМР-эксперименты были проведены с использованием спектрометров Bruker Avance III 400 и спектрометров Varian 400 при комнатной температуре, реализующего внутреннюю дейтериевую стабилизацию и оснащенного измерительной головкой BBO для 400 МГц в случае Bruker Avance III 400 и измерительной головкой Varian 400 ASW PFG 4nuc(1H,13C,19F,31P) в случае Varian 400. Химические сдвиги (δ) приведены в частях на миллион (ppm).
Фармакологическая часть
Биологические анализы
Анализ сдвига подвижности FGFR3 дикого типа (ферментативный анализ)
В конечном реакционном объеме, равном 25 мкл, инкубировали 0,04 нг/мкл фермента человеческого FGFR3 дикого типа (цитоплазматический домен, от Carna Biosciences) с 75 мкМ АТФ, 1 мкМ субстрата FL-пептида 30 и 250 нл испытуемого соединения (1% ДМСО последнее) в буфере для анализа (100 мМ HEPES, рН 7,4, 10 мМ MgCl2, 0,003% Brij35, 1 мМ DTT). После инкубирования в течение 50 минут при 30°С реакцию останавливали с помощью 10 мкл 0,5 М ЭДТА, рН 8,0, а затем 25 мкл реакционной смеси переносили на планшет для считывания и измеряли на устройстве для считывания Caliper EZ II. Коэффициент конверсии субстрата-продукта использовали в качестве исходных данных для нормализации, а кривую концентрация-ответ (10 точек дозирования с 4-кратным серийным разведением, начиная с 10 мкМ) наносили на график с использованием Prism для расчета IC50 (M), pIC50 (-logIC50) и значения HillSlope.
Анализ сдвига подвижности FGFR3 V555M (ферментативный анализ)
В конечном реакционном объеме, равном 25 мкл, инкубировали 0,04 нг/мкл фермента человеческого FGFR3 V555M (цитоплазматический домен, содержащий мутацию V555M, от Carna Biosciences) с 30 мкМ АТФ, 1 мкМ субстрата FL-пептида 30 и 250 нл испытуемого соединения (1% ДМСО в конечном) в буфере для анализа (100 мМ HEPES, рН 7,4, 10 мМ MgCl2, 0,003% Brij35, 1 мМ DTT). После инкубирования в течение 45 минут при 30°С реакцию останавливали с помощью 10 мкл 0,5 М ЭДТА, рН 8,0, а затем 25 мкл реакционной смеси переносили на планшет для считывания и измеряли на устройстве для считывания Caliper EZ II. Коэффициент конверсии субстрата-продукта использовали в качестве исходных данных для нормализации, а кривую концентрация-ответ (10 точек дозирования с 4-кратным серийным разведением, начиная с 10 мкМ) наносили на график с использованием Prism для расчета IC50 (M), pIC50 (-logIC50) и значения HillSlope.
Анализ сдвига подвижности FGFR3 V555L (ферментативный анализ)
В конечном реакционном объеме, равном 25 мкл, инкубировали 0,04 нг/мкл фермента человеческого FGFR3 V555L (цитоплазматический домен, содержащий мутацию V555L, от Carna Biosciences) с 40 мкМ АТФ, 1 мкМ субстрата FL-пептида 30 и 250 нл испытуемого соединения (1% ДМСО в конечном) в буфере для анализа (100 мМ HEPES, рН 7,4, 10 мМ MgCl2, 0,003% Brij35, 1 мМ DTT). После инкубирования в течение 50 минут при 30°С реакцию останавливали с помощью 10 мкл 0,5 М ЭДТА, рН 8,0, а затем 25 мкл реакционной смеси переносили на планшет для считывания и измеряли на устройстве для считывания Caliper EZ II. Коэффициент конверсии субстрата-продукта использовали в качестве исходных данных для нормализации, а кривую концентрация-ответ (10 точек дозирования с 4-кратным серийным разведением, начиная с 10 мкМ) наносили на график с использованием Prism для расчета IC50 (M), pIC50 (-logIC50) и значения HillSlope.
Анализ пролиферации клеток NIH/3T3 FGFR3 WT-TACC3
В день 1 90 мкл клеточной суспензии (клетки NIH/3T3, сверхэкспрессирующие составной белок FGFR3 WT-TACC3) (всего 30000 клеток на лунку в питательной среде (DMEM, содержащая 1% Glutamax, 10% FBS и 1% Pen/Strep)) высевали в 96-луночный планшет и затем инкубировали в течение ночи при 37°С и 5% СО2. В день 2 в клеточные культуры добавляли 10 мкл ростовой среды, содержащей 10-кратное количество исходного раствора тестируемого соединения (9 точек дозирования с 4-кратным серийным разведением, начиная с 10 мкМ, 0,1% ДМСО последнее). После 72-часового инкубирования при 37°С и 5% СО2 в день 5 объем, равный 50 мкл, реагента CellTiter Glo (CTG) вносили в 96-луночный планшет, содержащий клетки, и планшет инкубировали при комнатной температуре в течение 10 минут перед измерением RLU (относительных световых единиц) на считывающем устройстве для микропланшетов с модулем-детектором люминесценции. Значение RLU нормализовали по %-ной выживаемости и строили кривую зависимости концентрация-ответ, используя Prism для расчета IC50 (M), pIC50 (-logIC50) и значения HillSlope.
Анализ пролиферации клеток NIH/3T3 FGFR3 V555M-TACC3
В день 1 90 мкл клеточной суспензии (клетки NIH/3T3, сверхэкспрессирующие составной белок FGFR3 V555M-TACC3) (всего 30000 клеток на лунку в питательной среде (DMEM, содержащая 1% Glutamax, 10% FBS и 1% Pen/Strep)) высевали в 96-луночный планшет и затем инкубировали в течение ночи при 37°С и 5% СО2. В день 2 в клеточные культуры добавляли 10 мкл ростовой среды, содержащей 10-кратное количество исходного раствора тестируемого соединения (9 точек дозирования с 4-кратным серийным разведением, начиная с 10 мкМ, 0,1% ДМСО последнее). После 72-часового инкубирования при 37°С и 5% СО2 в день 5 объем, равный 50 мкл, реагента CellTiter Glo (CTG) вносили в 96-луночный планшет, содержащий клетки, и планшет инкубировали при комнатной температуре в течение 10 минут перед измерением RLU (относительных световых единиц) на считывающем устройстве для микропланшетов с модулем-детектором люминесценции. Значение RLU нормализовали по %-ной выживаемости и строили кривую зависимости концентрация-ответ, используя Prism для расчета IC50 (M), pIC50 (-logIC50) и значения HillSlope.
Анализ пролиферации ложных клеток NIH/3T3
В день 1 90 мкл клеточной суспензии (клетки NIH/3T3, трансфицированные тем же контрольным вектором, что и в двух вышеупомянутых анализах пролиферации) (всего 30000 клеток на лунку в питательной среде (DMEM, содержащая 1% Glutamax, 10% FBS и 1% Pen/Strep)) высевали в 96-луночный планшет и затем инкубировали в течение ночи при 37°С и 5% СО2. В день 2 в клеточные культуры добавляли 10 мкл ростовой среды, содержащей 10-кратное количество исходного раствора тестируемого соединения (9 точек дозирования с 3-кратным серийным разведением, начиная с 30 мкМ, 0,3% ДМСО последнее). После 72-часового инкубирования при 37°С и 5% СО2 в день 5 объем, равный 50 мкл, реагента CellTiter Glo (CTG) вносили в 96-луночный планшет, содержащий клетки, и планшет инкубировали при комнатной температуре в течение 10 минут перед измерением RLU (относительных световых единиц) на считывающем устройстве для микропланшетов с модулем-детектором люминесценции. Значение RLU нормализовали по %-ной выживаемости и строили кривую зависимости концентрация-ответ, используя Prism для расчета IC50 (M), pIC50 (-logIC50) и значения HillSlope. Этот анализ служил в качестве контрольного анализа для анализа пролиферации клеток NIH/3T3 FGFR WT/VM-TACC3, чтобы показать общую токсичность исследуемых соединений, вызванную нецелевым воздействием.
Клеточный фосфо-ERK-анализ NIH/3T3 FGFR3 WT-TACC3 (анализ PD in vitro)
50 мкл клеточной суспензии (клетки NIH/3T3, сверхэкспрессирующие составной белок FGFR3 WT-TACC3) (всего 10 000 клеток на лунку в питательной среде (DMEM, содержащая 1% Glutamax, 10% FBS и 1% Pen/Strep)) высевали в 384-луночный планшет. После инкубирования в течение ночи при 37°C и 5% CO2, в клеточные культуры вносили 5,5 мкл питательной среды, содержащей 10-кратное количество тестируемого соединения (10 точек дозирования с 4-кратным серийным разведением, начиная с 10 мкМ, 0,1% ДМСО последнее). Через 1 час инкубирования при 37°C и 5% CO2 питательная среда была истощена, и для обнаружения уровня фосфо-ERK применяли аналитический набор AlphaLISA SureFire Ultra p-ERK1/2 (Thr202/Tyr204) (производитель - PerkinElmer) согласно инструкции производителя. RFU (относительные единицы флуоресценции) измеряли на считывающем устройстве для микропланшетов EnVision (возб. 680 нм, исп. 615 нм) и строили кривую зависимости концентрация-ответ, используя Prism для расчета IC50 (M), pIC50 (-logIC50) и значения HillSlope.
Клеточный фосфо-ERK-анализ NIH/3T3 FGFR3 V555M-TACC3 (анализ PD in vitro)
50 мкл клеточной суспензии (клетки NIH/3T3, сверхэкспрессирующие составной белок FGFR3 V555M-TACC3) (всего 10 000 клеток на лунку в питательной среде (DMEM, содержащая 1% Glutamax, 10% FBS и 1% Pen/Strep)) высевали в 384-луночный планшет. После инкубирования в течение ночи при 37°C и 5% CO2, в клеточные культуры вносили 5,5 мкл питательной среды, содержащей 10-кратное количество тестируемого соединения (10 точек дозирования с 4-кратным серийным разведением, начиная с 10 мкМ, 0,1% ДМСО последнее). Через 1 час инкубирования при 37°C и 5% CO2 питательная среда была истощена, и для обнаружения уровня фосфо-ERK применяли аналитический набор AlphaLISA SureFire Ultra p-ERK1/2 (Thr202/Tyr204) (производитель - PerkinElmer) согласно инструкции производителя. RFU (относительные единицы флуоресценции) измеряли на считывающем устройстве для микропланшетов EnVision (возб. 680 нм, исп. 615 нм) и строили кривую зависимости концентрация-ответ, используя Prism для расчета IC50 (M), pIC50 (-logIC50) и значения HillSlope.
Таблица 2: Фармакологические данные (IC50; единица нМ)
| название | год | авторы | номер документа |
|---|---|---|---|
| СОЕДИНЕНИЯ ТИЕНОПИРИДИНОНА | 2019 |
|
RU2827549C2 |
| СОЕДИНЕНИЯ НА ОСНОВЕ ПИРАЗОЛОПИРИДИНОНА | 2018 |
|
RU2806751C2 |
| СОЕДИНЕНИЯ НА ОСНОВЕ ПИРАЗОЛОПИРИДИНОНА | 2018 |
|
RU2806625C2 |
| НОВЫЕ СОЕДИНЕНИЯ | 2013 |
|
RU2654857C2 |
| ПРОИЗВОДНЫЕ 1,5- И 1,7-НАФТИРИДИНА, ПОЛЕЗНЫЕ ПРИ ЛЕЧЕНИИ ЗАБОЛЕВАНИЙ, ОПОСРЕДОВАННЫХ FGFR | 2012 |
|
RU2629194C2 |
| ПРОТИВОРАКОВЫЕ БЕНЗОПИРАЗИНЫ, ДЕЙСТВУЮЩИЕ ПОСРЕДСТВОМ ИНГИБИРОВАНИЯ FGFR-КИНАЗ | 2012 |
|
RU2639863C2 |
| ПТЕРИДИНЫ В КАЧЕСТВЕ FGFR ИНГИБИТОРОВ | 2013 |
|
RU2702906C2 |
| ПРОИЗВОДНЫЕ ХИНАЗОЛИНОНА, ПРИМЕНИМЫЕ В КАЧЕСТВЕ МОДУЛЯТОРОВ FGFR КИНАЗЫ | 2014 |
|
RU2701517C2 |
| ЗАМЕЩЕННЫЕ БЕНЗОПИРАЗИНОВЫЕ ПРОИЗВОДНЫЕ В КАЧЕСТВЕ ИНГИБИТОРОВ FGFR-КИНАЗ ДЛЯ ЛЕЧЕНИЯ РАКОВЫХ ЗАБОЛЕВАНИЙ | 2011 |
|
RU2602233C2 |
| ХИНОЛИНЫ В КАЧЕСТВЕ МОДУЛЯТОРОВ FGFR КИНАЗЫ | 2012 |
|
RU2625303C2 |
Группа изобретений относится к области органической химии и фармацевтики и направлена на профилактику и лечение онкологического заболевания, опосредованного киназой FGFR. Раскрывается соединение формулы I, где каждый из A1, A2 и A3 независимо представляет собой атом углерода; C1 представляет собой водород или C1-4алкил; C2 представляет собой водород или C1-4алкил; или C1 и C2, взятые вместе, образуют C3-6циклоалкил вместе с атомом углерода, к которому они присоединены; Y представляет собой одинарную связь, -O-, C(=O) или NRy ; Ry представляет собой водород или C1-4алкил; каждый Ra независимо представляет собой водород, C1-6алкил, галогенC1-6алкил или галоген; nа представляет целое число, равное 1; каждый Rb независимо представляет собой водород или галоген; nb представляет целое число, равное 1; D представляет собой 5 или 6-членный ароматический или неароматический гетероциклил, содержащий 1 или 2 гетероатома, выбранного из N или O, или мостиковый гетероциклил, содержащий 1 или 2 гетероатома, выбранного из N или O, причем указанный гетероциклил необязательно замещен 1-4 заместителями Rc; каждый Rc независимо представляет собой оксо-, C1-6алкил, галогенC1-6алкил, галогенC1-6алкокси-группу, карбоксильную группу, HOOC-C1-6алкил-, C1-6алкил, замещенный -C(=O)-O-C1-6алкилом, или C1-6алкил-O-C(=O)-; B представляет собой 5-6-членный гетероциклил, содержащий 1 или 2 гетероатома, выбранного из N, O или S, причем указанный гетероциклил необязательно замещен 1 заместителем R; каждый R независимо представляет собой C1-6алкил, C1-6алкокси-группу или C3-6циклоалкил; или его фармацевтически приемлемая соль. Кроме того, раскрывается фармацевтическая композиция, обладающая активностью ингибиторов FGFR (рецептора фактора роста фибробластов), содержащая эффективное количество указанного выше соединения, применение соединения формулы I для изготовления лекарственного препарата для профилактики или лечения болезненного состояния или состояния, опосредованного киназой FGFR, применение соединения формулы I для изготовления лекарственного препарата для профилактики или лечения онкологического заболевания, опосредованного киназой FGFR. Группа изобретений обеспечивает эффективное лечение онкологических заболеваний, опосредованных киназой FGFR. 4 н. и 18 з.п. ф-лы, 2 табл., 7 пр.
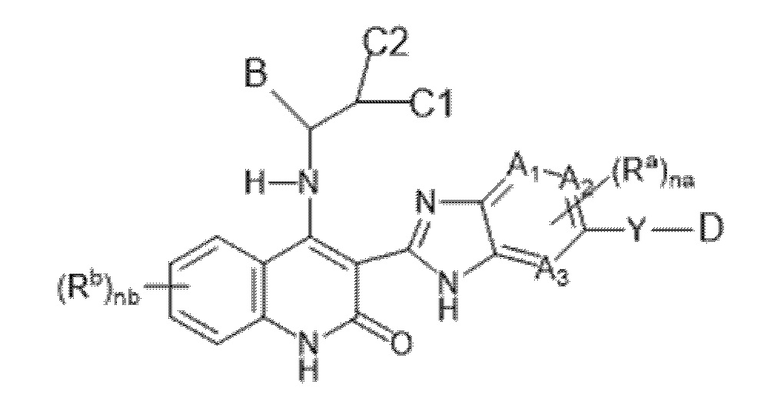
1. Соединение формулы (I)
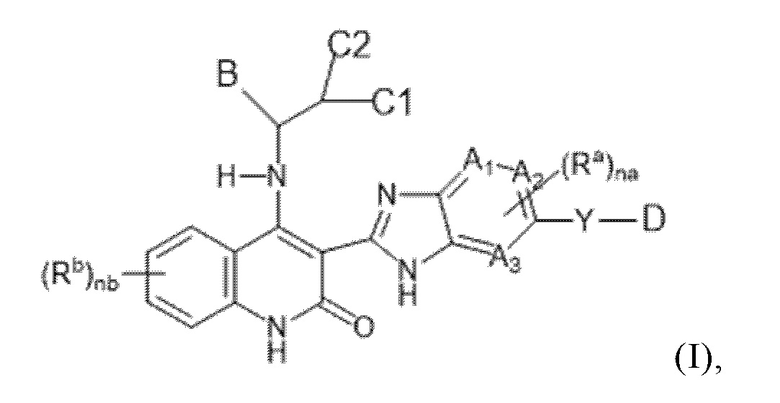
в том числе любая его стереохимически изомерная форма, где
каждый из A1, A2 и A3 независимо представляет собой атом углерода;
C1 представляет собой водород или C1-4алкил;
C2 представляет собой водород или C1-4алкил;
или C1 и C2, взятые вместе, образуют C3-6циклоалкил вместе с атомом углерода, к которому они присоединены;
Y представляет собой одинарную связь, -O-, C(=O) или NRy;
Ry представляет собой водород или C1-4алкил;
каждый Ra независимо представляет собой водород, C1-6алкил, галогенC1-6алкил или галоген;
nа представляет целое число, равное 1;
каждый Rb независимо представляет собой водород или галоген;
nb представляет целое число, равное 1;
D представляет собой 5 или 6-членный ароматический или неароматический гетероциклил, содержащий 1 или 2 гетероатома, выбранного из N или O, или мостиковый гетероциклил, содержащий 1 или 2 гетероатома, выбранного из N или O, причем указанный гетероциклил необязательно замещен 1-4 заместителями Rc;
каждый Rc независимо представляет собой оксо-, C1-6алкил, галогенC1-6алкил, галогенC1-6алкокси-группу, карбоксильную группу, HOOC-C1-6алкил-, C1-6алкил, замещенный -C(=O)-O-C1-6алкилом, или C1-6алкил-O-C(=O)-;
B представляет собой 5-6-членный гетероциклил, содержащий 1 или 2 гетероатома, выбранного из N, O или S, причем указанный гетероциклил необязательно замещен 1 заместителем R;
каждый R независимо представляет собой C1-6алкил, C1-6алкокси-группу или C3-6циклоалкил;
или его фармацевтически приемлемая соль.
2. Соединение согласно п. 1, характеризующееся формулой (I-a)
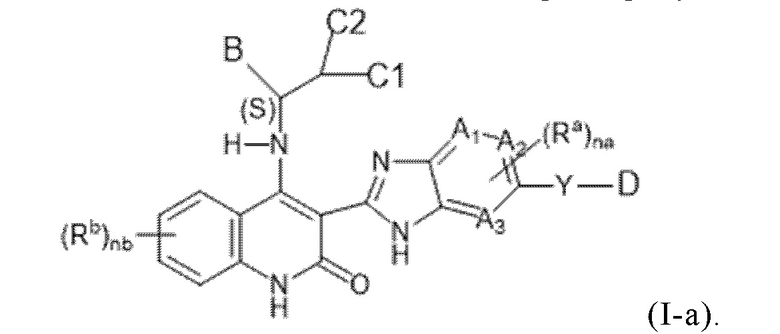
3. Соединение согласно любому из пп. 1, 2, где D представляет собой пиперазин-1-ил, где указанный пиперазин-1-ил необязательно замещен 1-4 заместителями Rc.
4. Соединение согласно любому из пп. 1, 2, где D представляет собой морфолин-1-ил, где указанный морфолин-1-ил необязательно замещен 1-4 заместителями Rc.
5. Соединение согласно любому из пп. 1, 2, где D представляет собой 5 или 6-членный моноциклический гетероциклил, причем указанный гетероциклил необязательно замещен 1-4 заместителями Rc.
6. Соединение по любому из предшествующих пунктов, где Y представляет собой одинарную связь.
7. Соединение согласно любому из пп. 1-5, где Y представляет собой -O-, C(=O) или NRy.
8. Соединение по любому из предшествующих пунктов, где C1 представляет собой водород, а C2 представляет собой C1-4алкил.
9. Соединение согласно любому из пп. 1-7, где C1 и C2, взятые вместе, образуют C3-6циклоалкил вместе с атомом углерода, к которому они присоединены.
10. Соединение согласно любому из предшествующих пунктов, где Rа представляет водород.
11. Соединение согласно любому из предшествующих пунктов, где Rb представляет водород.
12. Соединение согласно любому из предшествующих пунктов, где D необязательно замещен одним или двумя заместителями Rc, и каждый Rc независимо выбран из оксо-; C1-6алкила, в частности C1-4алкила, например, метил; галогенC1-6алкила; галогенC1-6алкокси-группы, например, трифторметокси-группа; HOOC-C1-6алкил-, например, -CH2-COOH, карбоксильной группы, C1-6алкила, замещенного группой -C(=O)-O-C1-6алкил, например, -CH2-C(=O)-O-CH2-CH3, C1-6алкил-O-C(=O)-, например, -C(=O)-O-CH3.
13. Соединение согласно любому из предшествующих пунктов, где B представляет собой 6-членный гетероциклил, содержащий 1 или 2 гетероатома, выбранного из N, O или S, причем указанный гетероциклил необязательно замещен 1 заместителем R.
14. Соединение согласно любому из предшествующих пунктов, где В представляет собой ароматический гетероциклил.
15. Соединение согласно любому из пп. 1, 2, где
каждый из A1, A2 и A3 независимо представляет собой атом углерода;
C1 представляет собой водород или C1-4алкил;
C2 представляет собой водород или C1-4алкил;
или C1 и C2, взятые вместе, образуют C3-6циклоалкил вместе с атомом углерода, к которому они присоединены;
Y представляет собой одинарную связь, C(=O) или NRy;
Ry представляет собой водород или C1-4алкил;
каждый Ra независимо представляет собой водород, C1-6алкил, галогенC1-6алкил или галоген;
na является целым числом, равным 1;
каждый Rb независимо представляет собой водород или галоген;
nb является целым числом, равным 1;
D представляет собой 5 или 6-членный моноциклический насыщенный или ароматический гетероциклил, содержащий 1 или 2 гетероатома, выбранного из N или O, причем указанный гетероциклил необязательно замещен одним или двумя заместителями Rc; или D представляет собой мостиковый гетероциклил, содержащий 1 или 2 гетероатома, выбранного из N или O, причем указанный гетероциклил необязательно замещен одним или двумя заместителями Rc;
каждый Rc независимо представляет собой оксо-, C1-6алкил, галогенC1-6алкил, галогенC1-6алкокси-группу, карбоксил, HOOC-C1-6алкил-, C1-6алкил, замещенный группой -C(=O)-O-C1-6алкил, или C1-6алкил-O-C(=O)-;
В представляет собой 5 или 6-членный моноциклический гетероциклил, содержащий 1 или 2 гетероатома, выбранного из N или O, причем указанный гетероциклил необязательно замещен одним заместителем R;
R представляет собой C1-6алкил, C1-6алкокси-группу или C3-6циклоалкил.
16. Соединение согласно п. 1, где соединение выбрано из:
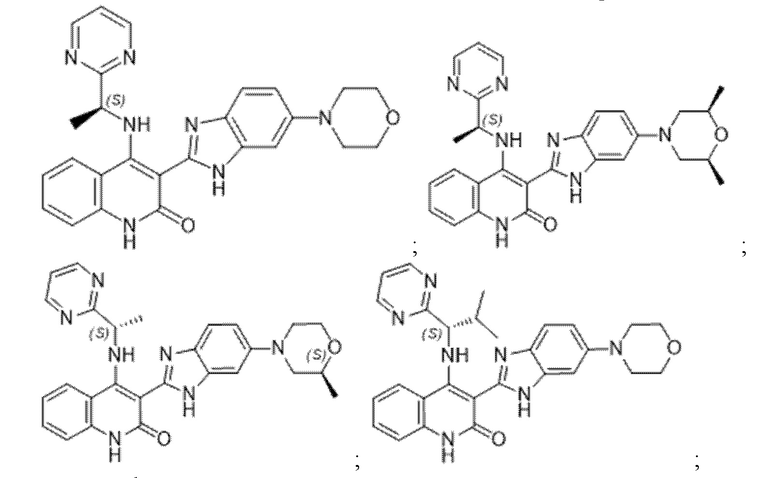
или его фармацевтически приемлемая соль.
17. Фармацевтическая композиция, обладающая активностью ингибиторов FGFR (рецептора фактора роста фибробластов), содержащая эффективное количество соединения согласно любому из пп. 1-16 и фармацевтически приемлемый носитель.
18. Соединение согласно любому из пп. 1-16 для применения в терапии в качестве ингибитора киназы FGFR.
19. Соединение согласно любому из пп. 1-16 для применения в профилактике или лечении болезненного состояния или состояния, опосредованного киназой FGFR.
20. Соединение согласно любому из пп. 1-16 для применения в профилактике или лечении онкологического заболевания, опосредованного киназой FGFR.
21. Применение соединения согласно любому из пп. 1-16 для изготовления лекарственного препарата для профилактики или лечения болезненного состояния или состояния, опосредованного киназой FGFR.
22. Применение соединения согласно любому из пп. 1-16 для изготовления лекарственного препарата для профилактики или лечения онкологического заболевания, опосредованного киназой FGFR.
| Способ приготовления мыла | 1923 |
|
SU2004A1 |
| Способ обработки целлюлозных материалов, с целью тонкого измельчения или переведения в коллоидальный раствор | 1923 |
|
SU2005A1 |
| Способ обработки целлюлозных материалов, с целью тонкого измельчения или переведения в коллоидальный раствор | 1923 |
|
SU2005A1 |
| Способ обработки целлюлозных материалов, с целью тонкого измельчения или переведения в коллоидальный раствор | 1923 |
|
SU2005A1 |
| Способ и приспособление для нагревания хлебопекарных камер | 1923 |
|
SU2003A1 |
| НОВЫЕ ПРОИЗВОДНЫЕ БЕНЗИМИДАЗОЛА И ИХ ПРИМЕНЕНИЕ В КАЧЕСТВЕ ЛЕКАРСТВЕННЫХ ПРЕПАРАТОВ | 2002 |
|
RU2294326C2 |
| КРИСТАЛЛИЧЕСКИЕ И ДРУГИЕ ФОРМЫ СОЛЕЙ, ОБРАЗОВАННЫХ ИЗ МОЛОЧНОЙ КИСЛОТЫ И 4-АМИНО-5-ФТОР-3-[6-(4-МЕТИЛПИПЕРАЗИН-1-ИЛ)-1Н-БЕНЗИМИДАЗОЛ-2-ИЛ]-1Н-ХИНОЛИН-2-ОНА | 2006 |
|
RU2425041C2 |
Авторы
Даты
2023-12-21—Публикация
2018-06-26—Подача