Изобретение относится к биоаналитической химии и может быть использовано для качественного и количественного определения растворенных белков или нуклеиновых кислот (ПК) в анализируемом образце.
Известно устройство для определения белков и НК, выполненное в виде зонда, имеющего сквозной канал с наноотверстием на конце, представляющее из себя капилляр, содержащий внутри электрод, контактирующий с вводимым раствором электролита, и соединенный с находящимися вне зонда источником электрического тока, устройством для измерения электрического сигнала и противоэлектродом, которое также содержит снаружи зонда блок его позиционирования. (Li W. et al. Single protein molecule detection by glass nanopores // ACS nano. - 2013. - T. 7. - №. 5. - C. 4129-4134).
Известное устройство содержит признаки, совпадающие с существенными признаками предлагаемого технического решения, такие как наличие у известного устройства зонда, имеющего сквозной канал с наноотверстием на конце, наличие внутри канала электрода, соединенного с находящимся вне зонда источником электрического тока, устройством для измерения электрического сигнала и противоэлектродом, а также наличие у устройства блока позиционирования зонда.
Известно устройство для определения белков и НК, выполненное в виде зонда, представляющего из себя кантилевер, содержащий внутри зонда кантилевера сквозной канал с наноотверстием на конце, содержащий внутри канала электрод, контактирующий с вводимым раствором электролита и соединенный с находящимися вне зонда источником электрического тока, устройством для измерения электрического сигнала и противоэлектродом, которое также содержит снаружи зонда блок его позиционирования (Aramesh М. et al. Localized detection of ions and biomolecules with a force-controlled scanning nanopore microscope // Nature Nanotechnology. - 2019. - T. 14. - №. 8. - C. 791-798).
Известное устройство содержит признаки, совпадающие с существенными признаками предлагаемого технического решения, такие как наличие у известного устройства зонда, имеющего сквозной канал с наноотверстием на конце, наличие внутри канала электрода, соединенного с находящимися вне зонда источником электрического тока, устройством для измерения электрического сигнала и противоэлектродом, а также наличие у устройства блока позиционирования зонда.
Наиболее близким к заявляемому является известное устройство для определения белков и НК, выполненное в виде зонда, имеющего сквозной канал с наноотверстием на конце, представляющее из себя капилляр, содержащий внутри электрод, контактирующий с вводимым раствором электролита и соединенный с находящимися вне зонда источником электрического тока, устройством для измерения электрического сигнала и противоэлектродом, которое также содержит снаружи зонда блок его позиционирования [патент США US2009/0205960 А1, МПК G01N 27/26 (2006.01)].
Известное устройство содержит признаки, совпадающие с существенными признаками предлагаемого технического решения, такие как наличие у известного устройства зонда, имеющего сквозной канал с наноотверстием на конце, наличие внутри канала электрода, соединенного с находящимся вне зонда источником электрического тока, устройством для измерения электрического сигнала и противоэлектродом, а также наличие у устройства находящегося вне зонда блока позиционирования.
Недостатками известного устройства является то, что оно позволяет специфично определять только 1 тип белка или НК ( один аналит), а при использовании смеси различных белков или НК дает возможность определять лишь их суммарное количество без идентификации их по типам, а также не обеспечивает высокую чувствительность определения белков или НК.
Технической задачей изобретения является создание устройства для определения белков и НК, лишенного вышеуказанных недостатков.
Технический результат изобретения заключается в повышении количества одновременно определяемых белков или НК, повышении чувствительности определения тестируемых веществ и обеспечении возможности их идентификации по типам.
Предварительно были проведены эксперименты с различными устройствами для определения белков и НК, которые показали, что указанные технические результаты достигаются в том случае, когда устройство для определения белков и НК, включающее зонд, имеющий сквозной канал с наноотверстием на конце, содержащее внутри канала электрод, соединенный с находящимися вне зонда источником электрического тока, устройством для измерения электрического сигнала и противоэлектродом. также содержащее блок позиционирования зонда, устройство дополнительно включает расположенную под наноотверстием канала подложку, которая содержит участки, модифицированные неразветвленным полиэлектролитом (ПЭ), связанным с одного конца с подложкой, а с противоположного конца соединенным со специфичным соединением к различным типам определяемых белков и НК.
Предлагаемое устройство является новым и не описано в патентной и научно-технической литературе.
Рассматриваемое техническое решение может быть использовано для определения биомолекул, включающих белки и НК. При этом биомолекулы могут включать в себя также антитела, онкомаркеры, олигонуклеотиды, пептиды, ферменты и т. д., но не ограничиваются ими. Размер анализируемых биомолекул при измерениях не критичен и для большинства биологических молекул составляет 5-20 нанометров (нм). При этом анализируемые соединения могут вводиться как в чистом виде, так и в виде растворов в подходящем растворителе, а также в составе любых биологических жидкостей.
Предлагаемое устройство обязательно должно включать зонд, имеющий по крайней мере один сквозной канал и содержащий наноотверстие (нанопору) на одном из концов. Диаметр внутренней части канала должен давать возможность вставлять внутрь его электрод, контактирующий с раствором, вводимым внутрь зонда.
Если предлагаемое устройство не будет содержать зонд, то оно будет неработоспособно.
Если в предлагаемом устройстве канал будет несквозным или он не будет содержать наноотверстие на одном из своих концов, или канала в устройстве вообще не будет, то данное техническое решение утратит работоспособность.
Используемые в предлагаемом техническом решении зонды могут представлять собой нанокапилляры или полые кантилеверы, используемые в жидкостной силовой микроскопии. Нанокапилляры могут быть изготовлены из различных непроводящих электрический ток материалов, например, из стекла, кварца, полимеров и т.п. Можно также использовать керамику, стеклокерамику и боросиликатное стекло. Следует отметить, что при изготовлении нанокапилляров могут использоваться различные типы стекла. Ключевой особенностью материала должна быть способность изготовленного из него капилляра вытягиваться.
Методика получения таких капилляров известна и описана в научно-технической литературе (Rodolfa K.Т. et al. Nanoscale pipetting for controlled chemistry in small arrayed water droplets using a double-barrel pipet // Nano letters. - 2006. - T. 6. - №. 2. - C. 252-257).
В качестве зонда также могут использоваться полые кантилеверы, изготовленные из различных непроводящих электрический ток материалов, например, из кремния или нитрида кремния и имеющие внутри зонда сквозной канал с наноотверстием на конце зонда кантилевера. В данном техническом решении внутренний диаметр канала зонда кантилевера может варьироваться и составлять, например, 10-100 нм. Данные кантилеверы описаны в научно-технической литературе и коммерчески доступны (Cytosurge, Швейцария).
Диаметр наноотверстия определяется в соответствии с конкретной задачей и зависит от изучаемого аналита. При этом размер нанопоры должен быть сопоставимым с гидродинамическим диаметром исследуемых биомолекул. Значительное превышение диаметра нанопоры не позволит провести измерение.
Следует отмстить, что в качестве зонда могут использоваться многоканальные зонды, которые представляют собой капилляр с двумя и более параллельными каналами (многоканальный нанокапилляр), которые имеют общую перегородку с друг другом. В каждом из капилляров должно быть наноотверстие на одном из концов. Многоканальные нанокапилляры могут быть изготовлены, например, из стеклянных капилляров (трубок) с использованием лазерного пуллера (Sutter, США). Они также коммерчески доступны (Sutter, США).
При использовании многоканальных зондов в каждом канале должен находиться электрод, соединенный с находящимся вне канала общим источником тока, устройством для измерения электрического сигнала и общим противоэлектродом.
Многоканальные зонды могут быть заполнены различными пробами для одновременного определения аналитов в пробе с целью уменьшения продолжительности анализа.
Положение зонда относительно плоскости подложки может быть любое, например, угол между зондами и плоскостью подложки может быть равен, например, 35-90°, однако предпочтительно, чтобы зонд был расположен под углом 90 градусов к плоскости подложки.
В данном техническом решении устройство должно содержать по крайней мере один электрод, помещенный внутрь канала зонда, и расположенный вне зонда противоэлектрод, необходимый для создания разности потенциалов между заполненной электролитом внутренней частью зонда и раствором вне зонда.
Следует отметить, что противоэлектрод традиционно используют при проведении электрохимических измерений. При этом электрод и противоэлектрод должны располагать по разные стороны от наноотверстия зонда.
В предлагаемом устройстве электроды могут быть изготовлены из любого электропроводящего материала, стабильного в водосодержащих растворах. В качестве электрода может выступать, например, серебряная проволока, покрытая хлоридом серебра. Если предлагаемое устройство не будет содержать электродов, то оно будет неработоспособно.
В данном техническом решении электроды должны быть соединены с источником электрического тока и устройством для измерения электрического сигнала, которые должны находиться вне зонда. В качестве источников тока могут быть использованы различные источники, например, такие, как потенциостат, гальваностат, patch-clamp усилитель и т.д. Данные источники тока должны давать возможность подавать электрическое напряжение, например, в диапазоне от -1 до 1 вольта. Устройства для измерения электрического сигнала также могут быть различны и должны давать возможность измерять изменения силы тока в диапазоне 1-100 пикоампер (пА) при базовом токе 10-100000 пА и представлять из себя, например, усилитель тока, patch-clamp усилитель, электрометр, высокоточный амперметр и т.п. Стоит отметить, что источник тока и устройство для измерения электрического сигнала могут быть заключены в один общий блок. Источник тока и устройство для измерения электрического сигнала должны быть относительно независимы от температуры или допускают компенсацию изменений температуры. При проведении измерений электрический ток должен быть преимущественно постоянным.
Устройство для измерения электрического сигнала дополнительно может быть подключено к аналого-цифровому преобразователю, который в свою очередь может быть соединен с персональным компьютером для записи и обработки полученных значений электрического сигнала в память устройства. Если в данном техническом решении источник тока и устройство для измерения электрического сигнала будут отсутствовать, то предлагаемое устройство становится неработоспособным.
В предлагаемом устройстве зонд должен быть жестко соединен с расположенным вне зонда блоком его позиционирования, обеспечивающим возможность перемещения зонда по осям X,Y,Z.
Блок позиционирования зонда позволяет контролируемо подводить зонд на различное расстояние от поверхности подложки. Контролировать положение конца зонда относительно подложки можно, например, используя принцип сканирующего ион-проводящего микроскопа (СИПМ), измеряя ионный ток, проходящий через наноотверстие зонда. Для этого внутрь канала в зонде, по крайней мере один канал которого заполнен электролитом, помещают серебряную проволоку, покрытую хлоридом серебра. При этом противоэлектрод опускают в раствор электролита, в котором находится подложка. При подаче потенциала на зонд измеряют ионный ток с помощью усилителя, например, MultiClamp 700 В (Axon Instruments, США) с коэффициентом усиления 1 мВ/пА, используя фильтр нижних частот 10 кГц. По мере приближения конца зонда к подложке ионный ток, протекающий через наноотверстие зонда, будет уменьшаться. Падение тока может выступать в качестве сигнала обратной связи для управления положением зонда относительно поверхности подложки. Таким образом, контролируя ионный ток можно определить точное положение зонда относительно поверхности и управлять им.
Обработку полученного сигнала от усилителя проводят с помощью аналого-цифрового преобразователя (АЦП), например, Axon Digidata 1550 (Axon Instruments, США) и программного обеспечения для сбора данных. С целью изоляции от внешних электромагнитных полей система сканирования может быть экранируема камерой Фарадея.
Данный блок также может обладать функцией, обеспечивающей грубое позиционирование зонда по осям XYZ, с помощью либо моторизированных сервоприводов, либо механических ручных винтов с микрометровой точностью, а также может содержать пьезоактуаторы для позиционирования зонда с более высокой точностью.
Предлагаемое устройство также может дополнительно содержать блок позиционирования подложки, позволяющий осуществлять ее перемещение в плоскости XY.
Предлагаемое устройство может дополнительно содержать систему обработки данных, которая запрограммирована таким образом, что она записывает движения зонда относительно подложки по осям XYZ. Расстояние между наноотверстием зонда и подложкой контролируется на основе изменений ионного тока, протекающего через наноотверстие зонда. Данный блок также может быть дополнительно подключен к программируемому устройству, например, к компьютеру, для ввода пользователем вручную координат расположения зонда.
Если устройство не будет содержать противоэлектрод или противоэлектрод не будет контактировать с вводимым раствором электролита, то данное устройство становится неработоспособным.
Предлагаемое устройство дополнительно содержит расположенную под наноотверстием зонда подложку. Если в процессе эксплуатации устройства подложка будет находиться не под наноотверстием зонда, а, например, в стороне от зонда, то устройство утратит работоспособность.
В данном техническом решении подложка содержит участки, модифицированные неразветвленным ПЭ с одного конца связанным с подложкой. В качестве такого ПЭ можно использовать, например, дезоксирибонулеиновую кислоту (ДНК), рибонуклеиновую кислоту (РНК), полипептид и т.п. Молекулярная масса используемого ПЭ зависит от решаемой задачи и может варьироваться и составлять, например, 5-200 килодальтон (кДа). Стоит отметить, что ПЭ должен быть неразветвленным. При использовании разветвленного ПЭ технический результат не достигается. Технический результат также не достигается, если на подложку будет нанесен ПЭ, который с одного конца не связан с подложкой.
Используемый ПЭ обязательно должен быть связан с противоположного конца с соединением, специфично связывающим анализируемый белок или НК. В качестве соединения, чувствительного к определяемым аналитам, могут выступать НК (включая генные фрагменты, кольцевая ДНК, рибозимы и аптамеры), антитела, белки, полипептиды, пептиды, хелаторы и т.д. Если используемый ПЭ не будет связан с противоположного конца с соединением, специфично связывающим анализируемый белок или НК, то данное устройство будет неработоспособным.
Аптамеры представляют собой олигонуклеотиды (ДНК или РНК), которые могут связываться с высоким сродством и специфичностью с широким спектром целевых молекул, таких как лекарственные препараты, белки или другие органические или неорганические молекулы. Аптамеры генерируются процессом отбора in vitro, называемым SELEX (систематическая эволюция лигандов путем экспоненциального обогащения). Метод SELEX позволил идентифицировать уникальные молекулы РНК / ДНК из очень больших популяций олигомеров со случайной последовательностью (библиотеки ДНК или РНК), которые связываются с целевой молекулой с очень высоким сродством и специфичностью. В качестве аптамеров с различным количеством нуклеотидных звеньев в цепи могут быть использованы, например, такие коммерчески доступные нуклеотиды, производимые компанией "ДНК- синтез" (http://www.oligos.ru/ ), имеющие, например, последовательность звеньев (SEQ ID NO.1 5'-AGGTCGCCGCCCTTTTTTTTGCTGGATGTCACCGGATTGTCGGACATCGGATTGTCTGAGTCATATGACACATCCAGC-3'), (SEQ ID NO.2 5'-AGGTCGCCGCCCTTTTTTTTGCT GGATGTTGACCTTTACAGATCGGATTCTGTGGGGCGTTAAACTGAC AC ATCCAGC-3'), (SEQ ID NO.3 (5'-GGTTGGTGTGGTTGG-3') и т.д., где буква А обозначает аденин, Т - тимин, G - гуанин и С - цитозин, которые являются нуклеотидными звеньями.
В качестве твердой подложки могут быть использованы, например, стекло, кремний, золото, мембранные фильтры, гидрогели на основе полиакриламида, различные полимерные материалы. Модификация подложки молекулами ПЭ по типу связи может быть ковалентной и нековалентной. При нековалентной иммобилизации ПЭ могут удерживаться на подложке за счет специфических или неспецифических (как правило, электростатических) взаимодействий, например, электростатическое взаимодействие отрицательных зарядов фосфатных остатков в олигонуклеотидах с положительными зарядами протонированных аминогрупп подложек, модифицированных, например, (3-аминопропил)триэтоксисиланом. Примером специфичного нековалентного взаимодействия является образование комплекса биотина с авидином (или стрептавидином). В то же время, учитывая чрезвычайную прочность такого комплекса, данное взаимодействие мало чем отличается от обычной ковалентной связи.
Химические реакции, используемые при иммобилизации ПЭ на подложке, могут быть различными, например, это может быть образование амидных или фосфамидных связей, протекающих в присутствии разнообразных конденсирующих агентов (например, водорастворимого гидрохлорида 1-этил-3-(3- диметиламинопропил)карбодиимида (EDC) или образование связей, основанных на реакции нуклеофильных групп (- NH2, -NHNH2, -SH и др.) с такими электрофилами, как эпокси-группы, изотиоцианатные группы и малеимидные фрагменты. Для формирования связей между двумя нуклеофильными группами, одна из которых находится на поверхности подложки, а вторая присоединена к фрагменту ПЭ, могут использоваться гомобифункциональные агенты, например, диглицидиловый эфир 1,4-бутандиола, бисмалеимидогексан, гидрохлорид диметиладипимидата, дисукцинимидилглутарат и т.п. или гетеробифункциональные агенты, например, такие как (N-сукцинимидил-3-(2-пиридилдитио)пропионат, сукцинимидил-(4-иодоацетил)аминобензоат и т.п.
Измерения с помощью предложенного устройства осуществляют следующим образом.
Зонд устройства заполняют электролитом, в качестве которого можно использовать, например, водный раствор LiCl, KСl, NaCl, водный буферный раствор трис(гидроксиметил)аминометана и т.д, но не ограничиваются ими. При этом можно использовать как водные растворы индивидуальной соли, так и смеси разных солей. Типичные ионы, содержащиеся в растворе, могут включат литий, натрий, калий, кальций и магний, а также хлорид, фосфат и бикарбонат. Эти составляющие ионы могут быть неорганическими, такими как хлорид (Сl-), а также органическими, такими как ацетат (СН3СОО), и одноатомными ионами, такими как фторид (F-), а также многоатомными ионами, такими как сульфат (SO42-).
Если в процессе эксплуатации зонда не использовать электропроводящие растворы, то проведение измерений будет невозможно.
Исследуемый материал сам по себе может представлять собой электролит, такой как человеческая плазма, слюна, моча или другие жидкости организма, растворы и т. д.
Раствор используемого электролита должен проводить ионный ток, при этом концентрация соли в растворе может варьироваться и составлять, например, от 10 милимоль/л (мМ) до 4 моль/л (М), предпочтительно около 100 мМ катионов и анионов. При этом целесообразно использовать один и тот же электролит как для заполнения канала зонда, так и для внешнего раствора. При этом аналит должен находиться только либо внутри, либо снаружи канала зонда. Если в процессе эксплуатации устройства аналит будет находиться как внутри, так и снаружи зонда, то устройство утратит работоспособность. Анализируемый раствор можно нанести, например, на рабочую часть подложки, содержащую привитой ПЭ. При большом количестве анализируемого раствора определение белков или НК может осуществляться в емкости, на дне которой находится подложка.
Анализируемым раствором можно также заполнить канал зонда устройства, при этом молекулы анализируемого вещества сначала будут выходить из наноотверстия на конце зонда за счет приложения к системе разности потенциалов, после чего будут связываться со специфичными соединениями, иммобилизированными на подложке.
После этого с помощью блока позиционирования зонда заполненный аналитом зонд опускают в раствор электролита, а затем зонд подводят к поверхности подложки. Следует отметить, что чем меньше расстоянии между наноотверстием зонда и поверхностью подложки, гем меньше будет регистрируемый ток. Падение тока может выступать как сигнал обратной связи для управления расстоянием между концом зонда и подложкой.
После позиционирования зонда над поверхностью подложки происходит вытекание раствора аналита из наноотверствия зонда, аналит связывается со соединением, специфично связывающим его на подложке. Если раствор аналита уже нанесен на подложку, то связывание с вышеуказанным соединением происходит сразу после нанесения раствора на подложку. Стоит отметить, что на разные участки подложки могут быть нанесены соединения, которые специфичны к различным биомолекулам. Таким образом, позиционируя зонд в областях, модифицированных ПЭ, связанным с соединением, специфичным к разным биомолекулам, возможно специфичное определение различных биомолекул в жидкостях, в том числе биологических, содержащих смесь из большого количества побочных веществ. Сканирование участка подложки осуществляют в прыжковом режиме, в ходе которого связанный со специфичным соединением аналит проникает внутрь наноотверстия зонда, после чего наблюдается кратковременное увеличение или уменьшение ионного тока (транслокация), которое связано с прохождением анализируемый биомолекулы через наноотверстие зонда.
Если при проведении эксперимента по определению белков или НК происходит их связывание со специфичным соединением, иммобилизированным с помощью ПЭ на подложке, и прохождение комплекса аналит-специфичное соединение через отверстие зонда, то происходит изменение ионного тока в система, данное событие регистрируется, определяются параметры изменения ионного тока, такие как продолжительность, форма и амплитуда. Продолжительность и амплитуда транслокации могут быть различными, зависеть от формы, размера, заряда и молекулярной массы определяемой молекулы. Она может составлять, например, от 0,2 до 40 милисекунд (мс) и зависит от скорости движения зонда от подложки. Амплитуда транслокации при осуществлении обнаружения различных типов белков может быть различна и зависит от многих факторов, например, от размера, заряда и конформации белка. После приближения зонда к подложке с последующим наблюдением транслокации, зонд контролируемо отводят от поверхности подложки таким образом, чтобы продолжительность транслокации комплекса анализируемая биомолекула-конъюгат на подложке значительно превышало продолжительность первичной транслокации во время подведения зонда к подложке.
Полученный электрический сигнал обрабатывают с использованием специального программного обеспечения с последующим определением продолжительности, амплитуды, формы транслокации. На основании полученных данных определяется тип молекулы.
Для получения достоверных данных определение биомолекул проводят на разных участках одной подложки с целью обнаружения большего количества молекул аналита. По итогам проведения измерения проводят статистическую обработку полученных сигналов, сравнивая среднюю продолжительность, амплитуду транслокации молекул НК или белков с данными, полученными при проведении измерений на контрольной подложке, которая не содержит соединений, специфичных к определяемому аналиту. Таким образом, делают вывод о наличии исследуемого аналита в системе.
В случае, если в системе присутствует смесь белков или НК, используют подложку, которая содержит несколько участков, модифицированных ПЭ со специфичными соединениями к различным типам белков или НК. Таким образом, последовательно сканируя различные участки подложки, можно сделать вывод о составе анализируемой смеси.
В случае проведения количественного обнаружения белков или НК предварительно осуществляют построение калибровочной кривой с использованием растворов с известными концентрациями белков или НК. При проведении измерений с помощью калибровочной кривой осуществляют расчет концентрации белка или НК в исследуемом растворе.
Предлагаемое устройство универсально и дает возможность для определения с высокой чувствительностью белков и НК в режиме реального времени.
Преимущества предлагаемого устройства иллюстрируют следующие примеры.
Пример 1 (контрольный, по прототипу)
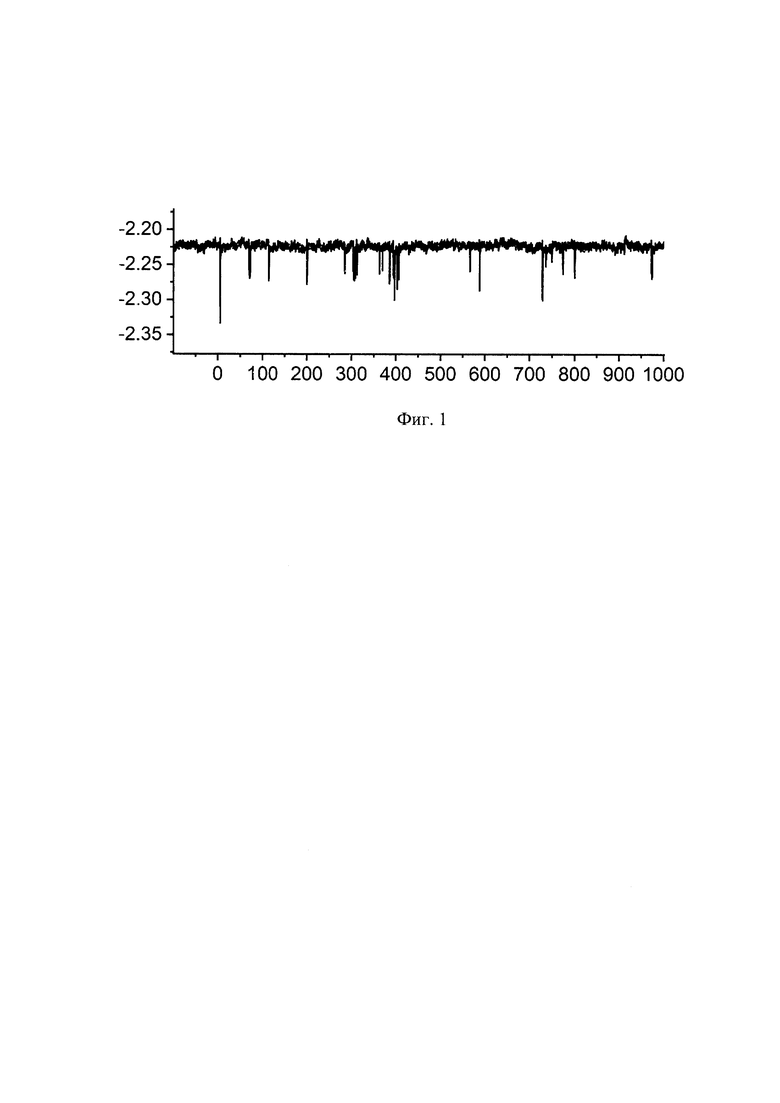
В опыте используют устройство, включающее зонд, имеющий сквозной канал с наноотверстием на конце и содержащий внутри канала электрод, соединенный с находящимися вне зонда источником электрического тока (потенциостат), устройством для измерения электрического сигнала (потенциометр) и противоэлектродом. Используемое устройство также содержит находящиеся вне зонда блок его позиционирования.
Зонд представляет собой капилляр с наноотверстием на одном из концов, изготовленный из одноканального кварцевого капилляра с наружным диаметром 1,2 мм и внутренним диаметром 0,9 мм (Sutter Instrument, США), который был подвергнут вытягиванию с использованием лазерного пуллера P-2000 (Sutter Instrument, США.) с целью получения капилляра с наноотверстием диаметром 5 нм на одном из концов. Для заполнения канала в капилляре используют иглу для шприца MicroFil (World Precision Instruments, США). Затем канал заполняют водным буферным раствором электролита, содержащим 10 мМ трис(гидроксиметил)аминометана и 100 мМ KСl, имеющим pH=8.
В заполненный электролитом канал помещают электрод, представляющий собой серебряную проволоку, покрытую хлоридом серебра. При этом противоэлектрод был таким же и был опущен в емкость с анализируемым раствором. В качестве анализируемого объекта был выбран белок альфа-тромбин.
Обнаружение целевого аналита проводят следующим образом. Раствор белка в вышеназванном электролите с концентрацией 100 пикомоль/л (пМ) помещают в емкость для анализа. После чего с помощью блока позиционирования, представляющего пьезоактуатор, конец капилляра с наноотверстием на конце опускают в жидкость. Напряжение в системе составило - 200 миливольт. При прохождении постоянного электрического тока аналит проникал внутрь отверстия зонда, после чего наблюдалось кратковременное уменьшение ионного тока (транслокация), что было связано с прохождением анализируемой биомолекулы через наноотверстие зонда.
Результаты опыта показаны на Фиг. 1, у которой ось абсцисс соответствует продолжительности времени, прошедшего с начала измерения, в милисекундах (мс), а ось ординат показывает величину ионного тока, протекающего через отверстие зонда, в наноамперах (нА). Отрицательные значения тока обусловлены полярностью поданного напряжения.
Результаты обработки данных показаны на Фиг. 2, на которой оси абсцисс и ординат, а также их размерность аналогичны указанным на Фиг. 1. Из Фиг. 2 видно, что полученный график содержит апериодические транслокации, что свидетельствует о том, что тестируемый белок обнаружен.
Пример 2 (контрольный, по прототипу)
Опыт проводят аналогично примеру 1, однако используют раствор белка с концентрацией 50 пМ. Результаты компьютерной обработки данных показаны на Фиг. 3, на которой оси абсцисс и ординат, а также их размерность аналогичны указанным на Фиг. 1. Из Фиг. 3 видно, что полученный график не содержит транслокации, свидетельствующих об обнаружении в растворе тестируемого белка. Это говорит о том, что при концентрации белка 50 пМ предел обнаружения еще не достигнут.
Пример 3 (контрольный, по прототипу)
Опыт проводят аналогично примеру 1, однако в качестве аналита используют лямбда-ДНК, взятую в концентрации 350 пМ.
Компьютерная обработка полученных результатов показала, что график зависимости силы ионного тока, протекающего через наноотверстие зонда, от продолжительности времени, прошедшего с начала измерений, содержит апериодичные транслокации, отличающиеся от полученных в примере 1, что свидетельствует о том, что тестируемая лямбда-ДНК обнаружена.
Пример 4 (контрольный, по прототипу)
Опыт проводят аналогично примеру 3, однако используют раствор, тестируемой лямбда-ДНК с концентрацией 200 пМ.
Компьютерная обработка полученных результатов показала отсутствие транслокаций. Из этого следует, что при концентрации лямбда- ДНК 200 пМ предел обнаружения аналита еще не достигнут.
Пример 5 (контрольный, по прототипу)
В опыте используют изготовленный из боросиликатного стекла капилляр с внешним диаметром 1,2 мм и внутренним диаметром 0,9 мм, конец которого вытянут и содержит наноотверстие диаметром 10 нм. В устройстве в качестве источников электрического тока был использован гальваностат, и раствор аналита в процессе опыта был введен внутрь капилляра.
Опыт проводят аналогично примеру 1, однако в качестве аналита используют смесь S и N белков SARS-CoV-2, каждый из которых взят в концентрации 200 пМ в водном растворе электролита LiCl, используемом в концентрации 4 М.
Результаты компьютерной обработки полученных в ходе опыта данных показаны на Фиг. 4, на которой оси абсцисс и ординат, а также их размерность аналогичны указанным на Фиг. 1. Из Фиг. 4 видно, что полученный график содержит транслокации, что свидетельствует о том, что тестируемая смесь белков обнаружена. Однако, известное устройство не дает возможности одновременного определения более одного анализа и в случае смеси нескольких белков не позволяет идентифицировать их по типам.
Пример 6 (контрольный, по прототипу)
Опыт проводят аналогично примеру 1, однако в качестве аналита используют смесь двух нуклеиновых кислот лямбда ДНК и ДНК личинки тли, каждая из которых взята в концентрации 400 пМ в водном растворе NaCl, используемом с концентрацией 100 мМ. В опыте используют хлорсеребрянные электроды, а также кантилевер, имеющий сквозной канал с наноотверстием на конце зонда кантилевера диаметром 20 нм. В устройстве в качестве источника электрического тока используют patch- clamp усилитель, и раствор аналита был введен внутрь канала кантилевера.
Компьютерная обработка полученных результатов показала, что на графике зависимости регистрируемого тока от времени присутствуют транслокации, свидетельствующие о том, что смесь двух НК в аналите обнаружена. Однако, известное устройство не дает возможности одновременного определения более одного аналита и в случае смеси нескольких НК не позволяет идентифицировать их по типам.
Пример 7 (контрольный, по прототипу)
В опыте используют нанокапилляр, имеющий сквозной канал с наноотверстием на конце диаметром 30 нм. В устройстве в качестве источников электрического тока был использован patch-clamp усилитель, и раствор аналита был введен внутрь канала нанокапилляра.
Опыт проводят аналогично примеру 1, однако в качестве аналита используют смесь лямбда ДНК и белка альфа-тромбина, каждый из аналитов был взят в концентрации 350 пМ в водном растворе КС1 с концентрацией 10 мМ.
Компьютерная обработка полученных результатов показала, что на графике зависимости регистрируемого тока от времени присутствуют транслокации одного типа, которые отличаются от транслокаций, регистрируемых при исследовании растворов только лямбда-ДНК (пример 3) и белка альфа-тромбин (пример 1).
Из примера видно, что известное устройство не дает возможности одновременного определения более одного аналита и в случае смеси белка и НК не позволяет идентифицировать их по типам.
Пример 8 (по изобретению)
Опыт проводят аналогично примеру 1, однако используемое устройство дополнительно включает расположенную под наноотверстием зонда подложку, выполненную из кварцевого стекла размером 1x1 см и толщиной 2 мм, содержащую 2 участка. Один участок модифицирован неразветвленным полиэлектролитом ДНК с молекулярной массой 100 кДа, связанной с одного конца с подложкой, а с противоположного конца соединенной со специфичным соединением к определяемому белку альфа- тромбину - аптамером в этому белку. Другой участок модифицирован неразветвленным ПЭ полилизином с молекулярной массой 50 к Да, связанным с одного конца с подложкой, а с противоположного конца соединенным одноцепочечной ДНК - специфичным соединением к определяемой лямбда-ДНК.
В опыте в качестве аналита используют раствор, содержащий смесь белка альфа-тромбина и лямбда-ДНК, взятых в концентрации в 20 и 100 пМ соответственно.
В процессе опыта наноотверстие зонда поочередно подводят к одному из вышеописанных участков подложки. Подают на электроды напряжение, записывают электрический сигнал, затем перемещают зонд на другой участок и проводят аналогичные операции.
Результаты компьютерной обработки полученных в ходе опыта данных показаны на Фиг. 5, на которой оси абсцисс и ординат, а также их размерность аналогичны указанным на Фиг. 1. Из Фиг. 5 видно, что полученный график содержит транслокации, что свидетельствует о том, что тестируемый белок обнаружен.
Компьютерная обработка полученных результатов показала, что транс локации были выявлены в каждом из участков.
Таким образом, предложенное устройство в отличие от прототипа ( пример 7) позволяет одновременно определять и тестируемый белок, и тестируемую НК, увеличивая гем самым количество определяемых аналитов, а также снижает предел обнаружения белка альфа-тромбина со 100 до 20 пМ ( ср. пример 1) и снижает предел обнаружения лямбда-ДНК с 200 до 100 пМ ( ср. пример 3), тем самым, повышая чувствительность определения тестируемых веществ и обеспечивает возможность их идентификации по типам (ср. пример 7).
Пример 9 (по изобретению)
Опыт проводят аналогично примеру 8, однако использованная подложка содержит не 2, а 4 участка, первый и второй из которых аналогичен участкам примера 8. Третий участок подложки модифицирован неразветвленным полиэлектролитом РНК с молекулярной массой 50 кДа, соединенной с одного конца с подложкой, а с противоположного конца соединенной со специфичным соединением к определяемому S-белку SARS-CoV-2 - антителом к этому белку. Четвертый участок подложки модифицирован неразветвленным ПЭ - РНК с молекулярной массой 50 кДа, связанной с одного конца с подложкой, а с противоположного конца соединенной со специфичным соединением к определяемому N-белку SARS-CoV-2 - антителом к этому белку. В качестве аналита в опыте используют раствор, содержащий смесь лямбда- ДНК с тремя белками альфа-тромбином и S-,N- белкам SARS-CoV-2, взятыми с концентрацией 100 пМ, 20 пМ, 200 пМ, 200 пМ соответственно.
В процессе опыта наноотверстие зонда подводят к одному из вышеуказанных участков пластины, подают на электроды напряжение, проводят необходимые измерения, записывают полученные результаты, после чего с помощью блока позиционирования подложки ее перемещают так, чтобы наноотверстие оказалось над другим участком пластины, с другим иммобилизованным на ней модифицированным полиэлектролитом. Затем подают на электроды напряжение, проводят необходимые измерения и записывают полученные результаты.
Обработка данных показала, что каждый из полученных графиков зависимости ионного тока от времени содержит транслокации, свидетельствующие о наличии в растворе не только определяемой НК, но и каждого из трех определяемых белков.
Таким образом, предлагаемое устройство в отличие от прототипа позволяет определять не только НК, но и повышает количество одновременно определяемых белков, а также обеспечивает возможность одновременной идентификации по типам.
Пример 10 (по изобретению)
Опыт проводят аналогично примеру 8, однако кроме двух указанных участков подложка дополнительно содержит еще два участка, один из которых модифицирован неразветвленным полиэлектролитом ДНК с молекулярной массой 150 кДа, связанной с одного конца с подложкой, а с противоположного конца соединенной одноцепочечной ДНК - специфичным соединением к определяемой ДНК личинки тли. Четвертый участок модифицирован неразветвленным ПЭ полилизином с молекулярной массой 100 кДа, связанным с одного конца с подложкой, а с противоположного конца соединенным одноцепочечной ДНК - специфичным соединением к определяемой РНК SARS-CoV-2.
В опыте в качестве аналита используют раствор, содержащий смесь белка альфа-тромбина, лямбда-ДНК, ДНК личинки тли, РНК SARS-CoV-2, взятых в концентрации в 20, 100, 100, 100 пМ соответственно.
В процессе опыта наноотверстие зонда поочередно подводят к одному из вышеописанных участков подложки. Подают на электроды напряжение, записывают электрический сигнал, затем перемещают зонд на другой участок и проводят аналогичные операции.
Компьютерная обработка полученных результатов показала, что транслокации были выявлены в каждом из участков и по форме были различны, что позволило идентифицировать каждый из используемых аналитов по типам.
Таким образом, предложенное устройство в отличие от прототипа позволяет одновременно определять белок и три различные НК.
Из приведенных примеров видно, что предлагаемое устройство действительно повышает количество одновременно определяемых белков или НК, повышает чувствительность определения тестируемых веществ и обеспечивает возможность их идентификации по типам.
Пример 11 (по изобретению)
Опыт проводят аналогично примеру 4, однако используемое устройство дополнительно содержит под наноотверстием зонда подложку, покрытую золотом толщиной 5 мкм, изготовленную в виде пластины размером 1×1 см, толщиной 5 мм и модифицированную стрептавидином для обеспечения связывания полиэлектролита с пластиной. Часть поверхности подложки имеет с одного конца связанный с ней с помощью биотина с ней неразветвленный полиэлектролит ДНК с молекулярной массой 150 к Да, который с противоположного конца имеет одноцепочечный (липкий) конец, комплементарный одноцепочечному концу лямбда-ДНК. Другой участок поверхности подложки имеет с одного конца связанный с ней с помощью биотина неразветвленный полиэлектролит ДНК с молекулярной массой 150 кДа, который с противоположного конца имеет одноцепочечный конец, комплементарный одноцепочечному концу ДНК личинки тли.
В процессе опыта наноотверстие зонда подводят к одному из вышеуказанных участков пластины, подают на электроды напряжение, проводят необходимые измерения, записывают полученные результаты, после чего с помощью блока позиционирования зонда его перемещают так, чтобы наноотверстие оказалось над другим участком пластины, с другим иммобилизованным на ней модифицированным полиэлектролитом. Затем подают на электроды напряжение, проводят необходимые измерения и записывают полученные результаты.
Обработка данных показала, что каждые из полученных графиков содержат транс локации, свидетельствующие о наличии в растворе вышеуказанных НК.
Таким образом, предлагаемое устройство в отличие от прототипа позволяет повысить количество одновременно определяемых НК. При дальнейшем увеличении числа различных зон на подложке количество одновременно определяемых НК будет увеличиваться.
Пример 12 (по изобретению)
Опыт проводят аналогично примеру 11, однако используют подложку, содержащую не только вышеуказанные участки, но еще три участка, первый из которых содержит двуцепочечную ДНК, связанную с одноцепочечной ДНК, имеющей последовательно нуклеотидов на конце (SEQ ID NO.6 5`-AATTTGGGGTTTAAA-3`). Второй участок содержит двуцепочечную ДНК, связанную с одноцепочечной ДНК, имеющей последовательность нуклеотидов на конце (SEQ ID NO.7 5`-TTTGGGAAATTT-3`). Третий участок содержит двуцепочечную ДНК, связанную с одноцепочечной ДНК, имеющей последовательность нуклеотидов на конце (SEQ ID NO. 8 5`-AAAGGGTTTAAATTTGG-3`).
В процессе опыта наноотверстие зонда поочередно подводят к каждому вышеописанному участку подложки. Подают на электроды напряжение, записывают электрический сигнал, затем перемещают зонд на другой участок подложки и проводят аналогичные операции.
Компьютерная обработка полученных результатов показала, что транслокации были выявлены только в зонах, имеющих концевые участки одноцепочечной ДНК, комплементарной к одноцепочечным концам лямбда-ДНК и ДНК тли.
Таким образом, предложенное устройство в отличие от прототипа при использовании смеси НК дает возможность идентифицировать их по видам. При дальнейшем увеличении числа различных зон на подложке количество одновременно определяемых белков будет увеличиваться.
Пример 13 (контрольный, по прототипу)
Опыт проводят аналогично примеру 1, однако в качестве аналита используют смесь лямбда ДНК и белка альфа-тромбина, каждый из аналитов был взят в концентрации 350 пМ в водном растворе KCl с концентрацией 10 мМ. В опыте используют нанокапилляр, имеющий сквозной канал с наноотверстием на конце диаметром 30 нм.
В устройстве в качестве источников электрического тока был использован patch-clamp усилитель, и раствор аналита был введен внутрь канала нанокапилляра.
Компьютерная обработка полученных результатов показала, что на графике зависимости регистрируемого тока от времени присутствуют транслокации одного типа, которые отличаются от транслокаций, регистрируемых при исследовании растворов только лямбда-ДНК (пример 7) и белка альфа-тромбин (пример 1).
Однако, известное устройство не дает возможности одновременного определения более одного аналита и в случае смеси нескольких НК не позволяет идентифицировать их по видам.
Пример 14 (по изобретению)
Опыт проводят аналогично примеру 13, однако используемое устройство дополнительно содержит под наноотверстием зонда кремниевую подложку, изготовленную в виде пластины размером 1×1 см толщиной 5 мм. На одной части поверхности подложка имеет с одного конца ковалетно связанный с ней неразветвленный полиэлектролит РНК с молекулярной массой 50 кДа, конъюгированный с противоположного конца антителами к альфа-тромбину, а на другой части поверхности подложка содержит ковалентно связанную с ней одноцепочечную ДНК, имеющую последовательность нуклеотидов, комплементарную к одноцепочечному концу лямбда-ДИК.
В процессе опыта наноотверстие зонда подводят к одному из вышеуказанных участков пластины, подают на электроды напряжение, проводят необходимые измерения, записывают полученные результаты, после чего с помощью блока позиционирования подложки ее перемещают так, чтобы наноотверстие оказалось над другим участком пластины. С другим иммобилизованным на ней модифицированным полиэлектролитом. Затем подают на электроды напряжение, проводят необходимые измерения и записывают полученные результаты.
Обработка данных показала, что каждые из полученных графиков содержат транслокации, свидетельствующих о наличие в растворе белка и НК.
Таким образом, из приведенных примеров видно, что предлагаемое устройство действительно повышает количество одновременно определяемых белков или НК, повышает чувствительность определения тестируемых веществ и обеспечивает возможность их идентификации по видам.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ КОНТРОЛИРУЕМОГО ВВЕДЕНИЯ ВЕЩЕСТВ В МИКРООБЪЕКТЫ | 2013 |
|
RU2552298C2 |
| ЭЛЕКТРОФОРЕТИЧЕСКИЙ ЧИП ДЛЯ ПРИМЕНЕНИЯ В ОБЛАСТИ ЭЛЕКТРОФОРЕЗА | 2017 |
|
RU2756014C2 |
| СПОСОБ ГИБРИДИЗАЦИИ НК | 2009 |
|
RU2423522C2 |
| Устройство для тестирования эффективности биологически активных веществ на клетках | 2021 |
|
RU2777971C1 |
| МУЛЬТИПЛЕКСНЫЕ АНАЛИЗЫ НА ОСНОВЕ АПТАМЕРОВ | 2013 |
|
RU2666989C2 |
| АНАЛИЗ МНОЖЕСТВА АНАЛИТОВ С ИСПОЛЬЗОВАНИЕМ ОДНОГО АНАЛИЗА | 2019 |
|
RU2824049C2 |
| Способ автоматизации параллельной безметочной детекции биологического маркера и устройство для его реализации | 2020 |
|
RU2762360C1 |
| СПОСОБ ДЕТЕКЦИИ БЕЛКОВ | 2012 |
|
RU2606852C2 |
| ЭЛЕКТРОХИМИЧЕСКАЯ СИСТЕМА ДЛЯ ОПРЕДЕЛЕНИЯ КОНЦЕНТРАЦИИ АНАЛИТА В ПРОБЕ, ЭЛЕКТРОХИМИЧЕСКАЯ СЕНСОРНАЯ ПОЛОСКА И СПОСОБ ПОВЫШЕНИЯ ТОЧНОСТИ КОЛИЧЕСТВЕННОГО ОПРЕДЕЛЕНИЯ АНАЛИТА | 2005 |
|
RU2415410C2 |
| ТЕСТ-СИСТЕМА ДЛЯ ОПРЕДЕЛЕНИЯ РНК ИНТЕРФЕРОНА λ, ИНТЕРЛЕЙКИНА IL23 И ПРОТИВОВИРУСНОГО БЕЛКА MxA | 2016 |
|
RU2627179C1 |




Изобретение относится к биоаналитической химии и может быть использовано для качественного и количественного определения растворенных белков или нуклеиновых кислот в анализируемом образце. Устройство для определения белков и нуклеиновых кислот включает зонд, имеющий сквозной канал с наноотверстием на конце, и размещенный внутри канала электрод, соединенный с находящимися вне зонда источником электрического тока, устройством для измерения электрического сигнала и противоэлектродом. Устройство содержит блок позиционирования зонда и дополнительно включает расположенную под наноотверстием канала подложку. Подложка с одного конца содержит связанный с ней неразветвленный полиэлектролит, конъюгированный с противоположного конца с соединением, связывающим белок или нуклеиновую кислоту. Технический результат изобретения заключается в повышении количества одновременно определяемых белков или НК, повышении чувствительности определения тестируемых веществ и обеспечении возможности их идентификации по типам. 5 ил.
Устройство для определения белков и нуклеиновых кислот, включающее зонд, имеющий сквозной канал с наноотверстием на конце, содержащее внутри канала электрод, соединенный с находящимися вне зонда источником электрического тока, устройством для измерения электрического сигнала и противоэлектродом, также содержащее блок позиционирования зонда, отличающееся тем, что устройство дополнительно включает расположенную под наноотверстием канала подложку, которая содержит участки, модифицированные неразветвленным полиэлектролитом, связанным с одного конца с подложкой, а с противоположного конца соединенным со специфичным соединением к различным типам определяемых белков и нуклеиновых кислот.
| US 2009205960 A1, 20.08.2009 | |||
| ОСАЖДЕНИЕ И ОЧИСТКА БЕЛКОВ ПОЛИЭЛЕКТРОЛИТАМИ | 2008 |
|
RU2474585C2 |
| УСТРОЙСТВО И СПОСОБ ДЛЯ ПРОВЕДЕНИЯ ИММУНОФЛУОРЕСЦЕНТНЫХ АНАЛИЗОВ | 1998 |
|
RU2194972C2 |
| СЕНСОР ДЛЯ ДЕТЕКЦИИ МАКРОМОЛЕКУЛ | 2002 |
|
RU2229118C1 |
| СИСТЕМА ДАТЧИКОВ | 2014 |
|
RU2670660C9 |
| ПЛАНАРНЫЙ ТВЕРДОФАЗНЫЙ ОПТИЧЕСКИЙ СЕНСОР ДЛЯ ОПРЕДЕЛЕНИЯ БЕЛКОВЫХ СОЕДИНЕНИЙ МЕТОДОМ СПЕКТРОСКОПИИ ГИГАНТСКОГО КОМБИНАЦИОННОГО РАССЕЯНИЯ И ЕГО ПРИМЕНЕНИЕ ДЛЯ ДЕТЕКТИРОВАНИЯ БЕЛКОВЫХ СОЕДИНЕНИЙ | 2016 |
|
RU2659987C2 |
| ЛЕПРЙГОТОВЛЕНИЯ | 0 |
|
SU196226A1 |
Авторы
Даты
2023-12-22—Публикация
2022-04-29—Подача