ОБЛАСТЬ ПРИМЕНЕНИЯ
Предлагаемые изобретения относятся к области фармацевтики и касаются фармацевтических композиций и твердых пероральных лекарственных форм, обладающих нейромодулирующим, противопаркинсоническим, нейропротективным и антиспастическим действием, замедляющих и тормозящих глутаматергическую нейротрансмиссию и прогрессирование нейродегенеративных процессов, способов получения таких фармацевтических композиций и твердых пероральных лекарственных форм и применения указанных фармацевтических композиций и твердых пероральных лекарственных форм для терапии когнитивных нарушений сосудистого происхождения.
УРОВЕНЬ ТЕХНИКИ
На современном рынке фармацевтический препаратов актуальным и все больше востребованным направлением является направление, связанное с разработкой различных лекарственных форм, используемых, преимущественно, для терапии когнитивных нарушений сосудистого происхождения, а именно, для улучшения памяти, для профилактики и лечения церебральной ишемии, для лечения расстройств нервной системы, последствий черепно-мозговой травмы и ишемического и геморрагического инсульта, для профилактики или лечения диабетической невропатии, а также для лечения всех видов деменции, в том числе, болезни Альцгеймера, от легкой до умеренной степени тяжести, препаратов, обладающих нейромодулирующим, противопаркинсоническим, нейропротективным и антиспастическим действием, которые замедляют или тормозят глутаматергическую нейротрансмиссию и прогрессирование нейродегенеративных процессов.
Известно, что в качестве действующего вещества для разработки современных препаратов для профилактики и лечения вышеуказанных терапевтических нарушений, достаточно активно используют такое вещество, как цитиколин (цитидин-дифосфат-холин, цитидин-5′-дифосфохолин, CDP-холин, Нейроколин), или 5'-O-[гидрокси({гидрокси[2-(триметиламмонио)этокси]фосфорил}окси)фосфорил]цитидин, – вещество формулы (I) с ноотропным действием, природное эндогенное соединение, которое является промежуточным метаболитом в синтезе фосфатидилхолина – одного из основных структурных компонентов клеточной мембраны.
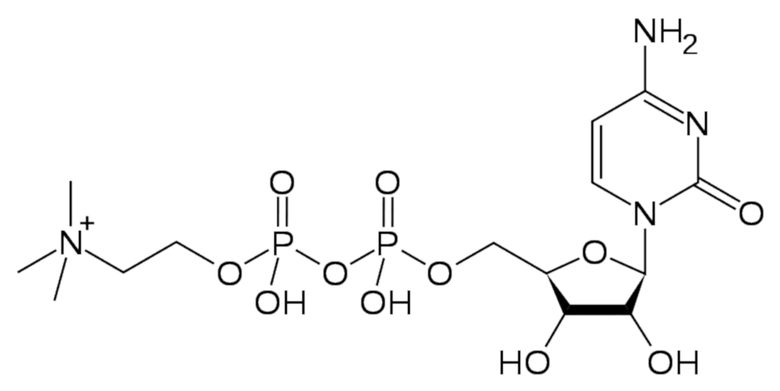 (I)
(I)
Известно изобретение [1] по патенту РФ № 2429851, опубликован 27.09.2011, в котором описан способ улучшения интеллекта у субъекта, заключающийся во введении указанному субъекту фармацевтической композиции, содержащей (а) полиненасыщенную жирную кислоту, выбранную из омега-3 жирной кислоты или омега-6 жирной кислоты, (b) уридин и (с) соль холина. В частных вариантах осуществления изобретения [1] уридин представляет собой ацильную производную уридина, уридинфосфат или цитидин-5′-дифосфохолин (CDP-холин). Кроме того, в патенте [1] описана фармацевтическая композиция для улучшения интеллекта у субъекта, которая содержит: (а) полиненасыщенную жирную кислоту, выбранную из омега-3 жирной кислоты или омега-6 жирной кислоты, (b) уридин и (с) соль холина, при этом в частных вариантах осуществления изобретения уридин представляет собой ацильную производную уридина, уридинфосфат или цитидин-5′-дифосфохолин (CDP-холин).
Также известно изобретение, раскрытое в патенте РФ № 2603470, опубликован 27.11.2016 [2], относящееся к способу улучшения обучаемости или памяти объекта, включающий введение объекту фармацевтической композиции, содержащей (а) омега-3 жирную кислоту, омега-6 жирную кислоту или их комбинации; (b) уридин, его ацильное производное, уридин фосфат или цитидин 5-дифосфохолин (CDP-холин) и (с) холин, его метаболический предшественник или соль холина. При этом в п. 6 формулы изобретения уточняется, что уридин представляет собой ацильную производную уридина, уридинфосфат или цитидин-5′-дифосфохолин (CDP-холин).
Патент [2] раскрывает также фармацевтическую композицию для улучшения обучаемости или памяти у объекта, содержащую (а) омега-3 жирную кислоту, омега-6 жирную кислоту или их комбинацию; (b) уридин и (с) соль холина. В частных вариантах осуществления изобретения [3] уридин представляет собой ацильную производную уридина, уридинфосфат или цитидин-5′-дифосфохолин (CDP-холин).
Аналоги [1] и [2] описывают фармацевтические композиции, которые обеспечивают улучшение интеллекта у субъекта за счет синергического действия компонентов композиции, включающей CDP-холин (цитиколин), в отношении увеличения концентрации фосфолипидов мозга, но не воздействуют на глутаматергическую систему. Напротив, композиция, предлагаемая в настоящем изобретении, в отличие от решений [1] и [2], обеспечивает терапевтический эффект не только за счет увеличения концентрации фосфолипидов мозга, но и за счет модулирующего действия на глутаматергическую систему.
Кроме того, известно изобретение по патенту РФ № 2605339, опубликован 20.12.2016 [3], в котором описано лекарственное средство на основе амантадина сульфата для купирования глутамат-индуцированного апоптоза и ингибирования NMDA-рецепторов для лечения расстройств нервной системы, последствий черепно-мозговой травмы и ишемического и геморрагического инсульта, характеризующееся тем, что содержит в качестве действующего вещества терапевтически эффективное количество амантадина сульфата и цитидин 5′-дифосфохолин, а также, по меньшей мере, одно вспомогательное вещество, выбранное из группы, включающей, стабилизаторы, пролонгаторы, буферирующие добавки, растворители, наполнители, консерванты, при следующем соотношении компонентов, мас.%:
Амантадина сульфат 0,001-0,25
Цитидин 5′-дифосфохолин 5,0-25,0
Вспомогательное вещество – до 100.
Патент описывает также применение указанного лекарственного средства для купирования глутамат-индуцированного апоптоза и ингибирования N-метил-D-аспартат-рецепторов для лечения расстройств нервной системы, последствий черепно-мозговой травмы и ишемического и геморрагического инсульта.
Аналог [3] описывает лекарственное средство для купирования глутамат-индуцированного апоптоза и ингибирования NMDA-рецепторов. Лекарственное средство согласно аналогу [3] не оказывает воздействия на концентрацию фосфолипидов головного и спинного мозга. Напротив, заявляемое в настоящем изобретении решение, в отличие от лекарственного средства согласно аналогу [3], оказывает дополнительный терапевтический эффект за счет увеличения концентрации фосфолипидов головного и спинного мозга.
В качестве второго действующего вещества в рамках настоящего изобретения был выбран мемантин, или 3,5-диметил-1-адамантанамин, – неконкурентный антагонист глутаматных NMDA-рецепторов формулы (II), обладающий нейромодулирующим, противопаркинсоническим, нейропротективным и антиспастическим действием, который тормозит глутаматергическую нейротрансмиссию и прогрессирование нейродегенеративных процессов.
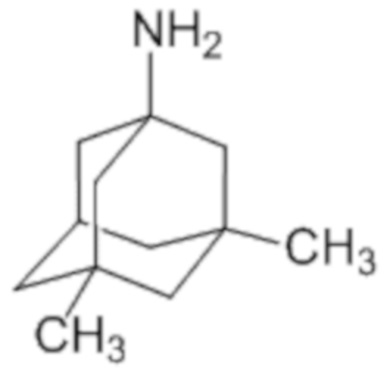 (II)
(II)
Мемантин (II) может также применяться в виде фармацевтически приемлемой соли, например, в виде мемантина гидрохлорида (гидрохлоридной соли).Так, из патента РФ № 2371173, опубликованного 27.10.2009 [4], известен способ лечения болезни Альцгеймера различной степени тяжести, от легкой до умеренной, заключающийся во введении нуждающемуся в этом субъекту эффективного количества мемантина или его фармацевтически приемлемой соли, такой как гидрохлоридная соль, при этом мемантин или его фармацевтически приемлемую соль, согласно [4], вводят в начальной дозе 5 мг в сутки с увеличением на 5 мг в сутки каждую неделю до конечной дозы 20 мг в сутки. Также из патента [4] известен способ лечения болезни Альцгеймера от легкой до умеренной степени тяжести у субъектов, которых ранее лечили ингибитором ацетилхолинэстеразы (AChEI), где способ заключается во введении нуждающемуся в этом субъекту эффективного количества мемантина или его фармацевтически приемлемой соли. [4] описывает способ лечения лишь одной из форм деменции (болезни Альцгеймера) с использованием мемантина или его фармацевтически приемлемой соли, но не подразумевает использование мемантина или его фармацевтически приемлемой соли для лечения других форм деменции (в частности, сосудистой, как в заявляемом решении).
Известно изобретение по патенту РФ № 2326660, опубликован 20.06.2008 [5], в котором описан пероральный препарат в виде твердой лекарственной формы, содержащей мемантин в качестве действующего вещества, отличающийся тем, что лекарственная форма представляет собой капсулы, причем мемантин входит в терапевтически эффективном количестве в состав заполняющей эти капсулы массы, которая является смесью порошков.
Также в патенте [5] описаны:
- пероральный препарат в виде твердой лекарственной формы, содержащей мемантин в качестве действующего вещества, отличающийся тем, что лекарственная форма представляет собой капсулы, причем мемантин входит в терапевтически эффективном количестве в состав заполняющей эти капсулы массы, которая является гранулятом;
- способ получения перорального препарата в виде твердой лекарственной формы, содержащей мемантин в качестве действующего вещества, заключающийся в том, что порошки мемантина и вспомогательных веществ - дезинтегранта, антифрикционного вещества и носителя - просеивают, взвешивают и смешивают в соотношениях компонентов, мас. %:
после чего массой в виде смеси порошков заполняют капсулы;
- способ получения перорального препарата в виде твердой лекарственной формы, содержащей мемантин в качестве действующего вещества, заключающийся в том, что в качестве вспомогательных веществ используют наполнитель и, в случае необходимости, дезинтегрант и антифрикционное вещество, при этом порошки мемантина и наполнителя или, в случае необходимости, также порошки дезинтегранта и антифрикционного вещества просеивают, взвешивают и смешивают в указанных массовых пропорциях, мас. %:
или
затем смесь порошков гранулируют методом сухой или влажной грануляции, после чего наполняют гранулятом капсулы.
Также из уровня техники известно изобретение по патенту РФ № 2404750, опубликован 27.11.2010 [6], относящееся к фармацевтической композиции, содержащей мемантин или его фармацевтически приемлемую соль, предназначенной для применения в лечении деменций, где указанный мемантин или его фармацевтически приемлемая соль присутствуют в лекарственной форме с пролонгированным высвобождением и подлежит введению без использования режима с повышением дозы, на фармацевтическую композицию, содержащую мемантин или его фармацевтически приемлемую соль и компонент пролонгированного высвобождения для применения в лечении деменций, где указанное лечение приводит к терапевтически эффективной постоянной концентрации мемантина в плазме в пределах 20 дней с момента введения композиции пациенту, на фармацевтическую композицию в форме капсулы, содержащую мемантин или его фармацевтически приемлемую соль, где указанный мемантин или его фармацевтически приемлемая соль имеют отношение Cmax/Cmean от примерно 2,5 до примерно 1 по меньшей мере 6 ч после введения композиции пациенту, на фармацевтическую композицию, содержащую пероральный препарат с пролонгированным высвобождением, включающий:
а) мемантин и полимер, выбранный из гидроксипропилцеллюлозы, поливинилпирролидона, гидроксипропилметилцеллюлозы и полиэтиленгликоля; и
б) покрытие, содержащее нерастворимый матричный полимер и водорастворимое вещество.
Из уровня техники известно также изобретение по патенту РФ № 2483715, опубликован 10.06.2013 [7], относящееся к средству противопаркинсонического действия и к содержащей указанное средство к твердой быстро дезинтегрируемой лекарственной форме, где указанная лекарственная форма содержит в качестве действующего вещества мемантин и/или мемантин гидрохлорид и целевые добавки, отличающейся тем, что в качестве целевых добавок указанная лекарственная форма содержит целлюлозу II при следующем соотношении ингредиентов, мас.%:
Аналоги [5], [6] и [7] описывают монопрепараты мемантина или его фармацевтически приемлемой соли – мемантина гидрохлорида. В то же время, использования мемантина или его фармацевтически приемлемой соли в качестве единственного терапевтического агента в ряде случаев может быть недостаточно для оказания эффекта при всем многообразии когнитивных нарушений, обусловленных иными формами деменции, помимо сосудистых.
Из уровня техники известно также изобретение по патенту РФ №2390354, опубликован 27.05.2010 [8], который раскрывает композицию матричного типа с замедленным высвобождением, содержащую:
(1) гидрохлорид донепезила и/или гидрохлорид мемантина;
(2) растворимый в кишечнике полимер, который является, по меньшей мере, одним выбранным из группы, состоящей из сополимера метакриловой кислоты-этилакрилата, сополимера метакриловой кислоты-метилметакрилата, фталата гидроксипропилметил-целлюлозы и ацетата сукцината гидроксипропилметилцеллюлозы; и
(3) водонерастворимый полимер, который является, по меньшей мере, одним выбранным из группы, состоящей из этилцеллюлозы, сополимера аминоалкилметакрилата RS и сополимера этилакрилата-метилметакрилата.
Патент [8] раскрывает также способ получения композиции матричного типа с замедленным высвобождением, включающий стадии:
смешивания (1) гидрохлорида донепезила и/или гидрохлорида мемантина; (2) растворимого в кишечнике полимера, который является, по меньшей мере, одним выбранным из группы, состоящей из сополимера метакриловой кислоты-этилакрилата, сополимера метакриловой кислоты-метилметакрилата, фталата гидроксипропилметил-целлюлозы и ацетата сукцината гидроксипропилметилцеллюлозы; и (3) водонераство-римого полимера, который является, по меньшей мере, одним выбранным из группы, состоящей из этилцеллюлозы, сополимера аминоалкилметакрилата RS и сополимера этилакрилата-метилметакрилата и компрессионного формования смеси, полученной на стадии смешивания.
Согласно патенту [8], гидрохлорид мемантина упоминается как средство, используемое при деменции вследствие болезни Альцгеймера (см. патент [8], стр. 15 описания, раздел «Лучший способ осуществления изобретения»). В то же время, известны и другие области применения мемантина и его фармацевтически приемлемых солей, в частности, сосудистая деменция (Cerebrovascular disease, cognitive impairment and dementia. – in: Cerebrovascular disease and dementia (Second edition) / Edited by J. O'Brien, D. Ames, L. Gustafson et al. London: Martin Dunitz, 2004).
При анализе рынка препаратов, предназначенных для терапии когнитивных нарушений сосудистого происхождения, обладающих нейромодулирующим, противопаркинсоническим, нейропротективным и антиспастическим действием, замедляющих и тормозящих глутаматергическую нейротрансмиссию и прогрессирование нейродегенеративных процессов, становится очевидной необходимость создания фармацевтической композиции и лекарственной формы на ее основе, обеспечивающих повышение терапевтической активности заявленного количественного и качественного состава ингредиентов (фармацевтической композиции), эффективного, при введении его нуждающемуся пациенту, для терапии когнитивных нарушений сосудистого происхождения, а также обладающего нейромодулирующим, противопаркинсоническим, нейропротективным и антиспастическим действием, замедляющего и тормозящего глутаматергическую нейротрансмиссию и прогрессирование нейродегенеративных процессов.
Технические результаты, достигаемые заявляемой группой изобретений, включают в себя:
- повышение терапевтической активности цитиколина или его фармацевтически приемлемой соли за счет сверхсуммарного (синергического) эффекта при совместном использовании цитиколина или его фармацевтически приемлемой соли с мемантином или его фармацевтически приемлемой солью, а также за счет мгновенного начала действия и последующего эффективного и продолжительного действия предлагаемой фармацевтической композиции и лекарственной формы;
- упрощение терапии когнитивных нарушений сосудистого происхождения благодаря использованию предлагаемых в настоящем изобретении фармацевтической композиции и лекарственной формы, содержащей указанную композицию;
- обеспечение фармацевтической композиции и лекарственной формы мемантина или его фармацевтически приемлемой соли и цитиколина или его фармацевтически приемлемой соли, лишенных побочных эффектов, и при этом устойчивых при изготовлении и стабильных при хранении.
Кроме того, технические результаты, достигаемые заявляемой группой изобретений, включают в себя:
- повышение терапевтической активности фармацевтической композиции и лекарственного препарата, предназначенных для терапии когнитивных нарушений сосудистого происхождения, обладающих нейромодулирующим, противопаркинсоническим, нейропротективным и антиспастическим действием, замедляющей и тормозящей глутаматергическую нейротрансмиссию и прогрессирование нейродегенеративных процессов, за счет синергического эффекта, достигаемого благодаря совместному использованию мемантина или его фармацевтически приемлемой соли и цитиколина или его фармацевтически приемлемой соли, а также за счет мгновенного начала действия указанного лекарственного препарата и последующего эффективного и продолжительного действия;
- упрощение схемы лечения (коррекции, смягчения или замедления развития) когнитивных нарушений сосудистого происхождения,
- а также упрощение и снижение себестоимости изготовления лекарственной формы и фармацевтической композиции, предназначенных для терапии когнитивных нарушений сосудистого происхождения, обладающей нейромодулирующим, противопаркинсоническим, нейропротективным и антиспастическим действием, замедляющей и тормозящей глутаматергическую нейротрансмиссию и прогрессирование нейродегенеративных процессов.
Кроме того, техническим результатом является увеличение ассортиментного перечня фармацевтических композиций и лекарственных форм, предназначенных для терапии когнитивных нарушений сосудистого происхождения и обладающих нейромодулирующим, противопаркинсоническим, нейропротективным и антиспастическим действием, замедляющих и тормозящих глутаматергическую нейротрансмиссию и прогрессирование нейродегенеративных процессов.
РАСКРЫТИЕ ИЗОБРЕТЕНИЯ
Технические результаты достигаются предложенной в настоящем изобретении фармацевтической композицией, предназначенной для терапии когнитивных нарушений сосудистого происхождения, обладающей нейромодулирующим, противопаркинсоническим, нейропротективным и антиспастическим действием, замедляющей и тормозящей глутаматергическую нейротрансмиссию и прогрессирование нейродегенеративных процессов, включающей от 5,00 до 20,00 мг мемантина или его фармацевтически приемлемой соли и от 450 до 550 мг цитиколина или его фармацевтически приемлемой соли, а также предложенной в настоящем изобретении пероральной твердой лекарственной формой, изготовленной на основе вышеуказанной фармацевтической композиции, включающей в качестве действующих веществ мемантин или его фармацевтически приемлемую соль в количестве от 5,00 до 20,00 мг и цитиколин или его фармацевтически приемлемую соль в количестве от 450 до 550 мг, выполненной в форме таблетки модифицированного высвобождения, покрытой пленочной оболочкой. Также технический результат, относящийся к упрощению и снижению себестоимости лекарственной формы, достигается предложенным в настоящем изобретении способом получения пероральной твердой лекарственной формы, изготовленной на основе вышеуказанной фармацевтической композиции.
Предлагаемая в настоящем изобретении фармацевтическая композиция и лекарственная форма, помимо мемантина или его фармацевтически приемлемой соли и цитиколина или его фармацевтически приемлемой соли, содержат также вспомогательные компоненты, включая фармацевтически приемлемый наполнитель, гидроксипропилметилцеллюлозу, коллоидный диоксид кремния и фармацевтически приемлемое смазывающее вещество (лубрикант).
В предпочтительных (неограничивающих) вариантах осуществления изобретения, фармацевтически приемлемый наполнитель выбран из микрокристаллической целлюлозы, крахмала, глюкозы, сахарозы, лактозы, магния карбоната основного, желатина, метилцеллюлозы, натрий-карбоксиметилцеллюлозы, кальция карбоната, глицина, декстрина, сорбита и маннита. В наиболее предпочтительном варианте осуществления изобретения, фармацевтически приемлемый наполнитель представляет собой микрокристаллическую целлюлозу.
Также в предпочтительных (неограничивающих) вариантах осуществления изобретения, фармацевтически приемлемое смазывающее вещество представляет собой фармацевтически приемлемую соль стеариновой кислоты, например (без ограничения), магния стеарат или кальция стеарат. Специалисту понятно, что может использоваться и иное фармацевтически приемлемое смазывающее вещество, в том числе, иная фармацевтически приемлемая соль стеариновой кислоты.
В соответствии с настоящим изобретением, мемантин может применяться в виде основания или в виде фармацевтически приемлемой соли. В частных (неограничивающих) вариантах осуществления настоящего изобретения, мемантин может также применяться в виде фармацевтически приемлемой соли неорганической кислоты, например, в виде гидрохлорида мемантина, гидробромида мемантина, сульфата мемантина, гидрогенсульфата мемантина и дигидрогенсульфата мемантина, и т.п. В других (неограничивающих) вариантах осуществления настоящего изобретения, мемантин может применяться в виде фармацевтически приемлемой соли органической кислоты, например, в виде оксалата мемантина, цитрата мемантина, сукцината мемантина, малеата мемантина, фумарата мемантина, малата мемантина, тартрата мемантина и т.п., либо в виде сульфоната, например (без ограничения), в виде метансульфоната (мезилата) мемантина, бензолсульфоната (безилата) мемантина или толуолсульфоната (тозилата) мемантина. В других частных (неограничивающих) вариантах осуществления настоящего изобретения, мемантин может также применяться в виде гидройодида мемантина, перхлората мемантина, ацетата мемантина, пропионата мемантина, гликолята мемантина, лактата мемантина, пирувата мемантина, малоната мемантина, бензоата мемантина, карбоната мемантина, циннамата мемантина, манделата мемантина, этансульфоната мемантина, гидроксиэтансульфоната мемантина, p-толуолсульфоната мемантина, циклогексансульфамата мемантина, салицилата мемантина, p-аминосалицилата мемантина, 2-феноксибензоата мемантина или 2-ацетоксибензоата мемантина.
Наиболее предпочтительно (без ограничения), мемантин в соответствии с настоящим изобретением используют в виде мемантина гидрохлорида.
В свою очередь, в соответствии с настоящим изобретением, цитиколин может применяться в виде основания или в виде фармацевтически приемлемой соли. В частных (неограничивающих) вариантах осуществления настоящего изобретения, цитиколин может также применяться в виде фармацевтически приемлемой соли неорганической кислоты, такой как соляная или фосфорная кислота, или в виде фармацевтически приемлемой соли органической кислоты, такой как уксусная, щавелевая, тартаровая, миндальная и т.п. кислоты, а также в виде фармацевтически приемлемой соли, образованной свободными карбоксигруппами с неорганическими ионами, включая ионы натрия, калия, аммония, кальция, гидроксиды железа, а также с органическими основаниями, такими как изопропиламин, триметиламин, 2-этиламиноэтанол, гистидин, прокаин и т.д.
Наиболее предпочтительно (без ограничения), цитиколин в соответствии с настоящим изобретением используют в виде мононатриевой соли цитиколина (также указывается в настоящем описании как цитиколин мононатрия).
Согласно предлагаемому в настоящем изобретении способу, лубрикант, цитиколин или его фармацевтически приемлемую соль, мемантин или его фармацевтически приемлемую соль, фармацевтически приемлемый наполнитель, гидроксипропилметилцеллюлозу, кремния диоксид коллоидный, просеивают через сито с диаметром ячейки не более 0,5 мм, затем загружают в миксер-гранулятор или аналогичное перемешивающее устройство цитиколина мононатриевую соль, целлюлозу микрокристаллическую и гидроксипропилметилцеллюлозу, перемешивают до однородного состояния при скорости перемешивания 160-240 об/мин, и времени перемешивания в интервале от 2 до 10 минут, далее при постоянном перемешивании смеси увлажняют смесь водой очищенной, при этом скорость перемешивания должна быть в пределах 150-400 об/мин, а время перемешивания - не более 5 минут, после чего полученный гранулят подвергают сушке в условиях псевдоожиженного слоя с поддержанием следующих параметров: температура входящего воздуха 45-65°С, остаточная влажность гранулята от 2,5 до 4,5 %, полученный гранулят просеивают через сито с диаметром ячейки не более 1,0 мм, далее полученную смесь опудривают кремния диоксидом коллоидным в течение от 3 до 5 минут, затем к смеси добавляют часть гидроксипропилметилцеллюлозы , перемешивают еще от 8 до 10 минут, затем добавляют магния стеарат и перемешивают еще 2-3 мин Полученную смесь для таблетирования подвергают таблетированию на роторном таблеточном прессе, используя пресс-инструмент диаметром от 10 до 15 мм, процесс таблетирования контролируют по следующим параметрам: твердость – 150-290 Н, истираемость – не более 1,0%, высота – не более 7,0 мм, далее на полученные ядра таблеток наносят пленочную оболочку I, представляющую собой смесь гидроксипропилметилцеллюлозы, титана диоксид и макрогола; в процессе растворения пленочной оболочки I добавляют частями фармацевтическую субстанцию мемантина гидрохлорид и перемешивают до образования однородной суспензии, после чего осуществляют нанесение полученной оболочки при температуре ядра таблетки 35-40°С и периодическом перемешивании, в том числе, в барабане коатера, затем готовят раствор пленочной оболочки II из смеси поливинилового спирта, талька, макрогола, оксидов железа и титана диоксида, после получения раствора пленкообразователя, получая таким образом пленочную оболочку II. Пленочную оболочку II наносят на таблетки поверх пленочной оболочки I при тех же условиях, что и пленочную оболочку I.
В отдельных предпочтительных (неограничивающих) вариантах осуществления изобретения, пленочная оболочка I и/или пленочная оболочка II также могут содержать действующие вещества, выбранные из мемантина или его фармацевтически приемлемой соли и цитиколина или его фармацевтически приемлемой соли. В наиболее предпочтительном варианте осуществления изобретения, пленочная оболочка I содержит фармацевтически приемлемую соль мемантина, например, мемантина гидрохлорид, тогда как пленочная оболочка II содержит фармацевтически приемлемую соль цитиколина, например, цитиколин мононатриевую соль. В другом предпочтительном варианте осуществления изобретения, пленочная оболочка I, наоборот, содержит фармацевтически приемлемую соль цитиколина, например, цитиколин мононатриевую соль, тогда как пленочная оболочка II содержит фармацевтически приемлемую соль мемантина, например, мемантина гидрохлорид.
В предпочтительном (неограничивающем) варианте осуществления изобретения, целлюлоза микрокристаллическая представляет собой коммерчески доступную целлюлозу микрокристаллическую марки 101. Также В предпочтительном (неограничивающем) варианте осуществления изобретения, гидроксипропилметилцеллюлоза представляет собой гидроксипропилметилцеллюлозу с молекулярной массой 1000000 Да, например (без ограничения), гипромеллозу типа 2208 (К100М) или аналогичную. Наконец, в предпочтительном (неограничивающем) варианте осуществления изобретения, кремния диоксид коллоидный представляет собой кремния диоксид коллоидный марки А 200.
Технические результаты также достигаются в настоящем изобретении тем, что предложена фармацевтическая композиция, обеспечивающая повышение терапевтической активности количественного и качественного состава ингредиентов, эффективного для терапии когнитивных нарушений сосудистого происхождения, обладающая нейромодулирующим, противопаркинсоническим, нейропротективным и антиспастическим действием, замедляющая и тормозящая глутаматергическую нейротрансмиссию и прогрессирование нейродегенеративных процессов, включающая от 5 до 20 мг мемантина или его фармацевтически приемлемой соли и от 450 до 550 мг цитиколина или его фармацевтически приемлемой соли. Иллюстративный количественный и качественный пример состава фармацевтической композиции представлен в Таблице 1. Другие иллюстративные примеры количественного и качественного состава ингредиентов фармацевтической композиции представлены в Таблице 2. Специалисту в данной области понятно, что данные примеры являются иллюстративными (неограничивающими) и приводятся для целей иллюстрации настоящего изобретения, а не для ограничения объема притязаний.
Таблица 1. Количественный и качественный состав ингредиентов фармацевтической композиции
В предпочтительном (неограничивающем) варианте осуществления изобретения, целлюлоза микрокристаллическая представляет собой целлюлозу микрокристаллическую марки 101. Специалисту в данной области понятно, что могут быть использованы и другие разновидности целлюлозы микрокристаллической, обладающие сходными характеристиками, например, целлюлозу микрокристаллическую марки 105, 102, 103, 302, 200, 50 М, 90 М или аналогичные.
Предпочтительно (без ограничения), гидроксипропилметилцеллюлоза представляет собой гидроксипропилметилцеллюлозу с молекулярной массой 1000000. Наиболее предпочтительно (также без ограничения), гидроксипропилметилцеллюлоза представляет собой гипромеллозу типа 2208 (К100М). Специалисту в данной области понятно, что могут быть использованы и другие разновидности гидроксипропилметилцеллюлозы, обладающие сходными характеристиками, например, гипромеллоза тип 2208 К100М DC, К200М или аналогичные
Также в предпочтительном (неограничивающем) варианте осуществления изобретения, кремния диоксид коллоидный представляет собой кремния диоксид коллоидный марки А 200. Специалисту в данной области понятно, что могут быть использованы и другие разновидности кремния диоксида коллоидного, обладающие сходными характеристиками, например, кремния диоксид коллоидный марки А 300, А 380, R 972 или аналогичные.
Также в предпочтительном (неограничивающем) варианте осуществления изобретения, пленочная оболочка I выполнена из коммерчески доступной смеси гидроксипропилметилцеллюлозы, титана диоксида и макрогола. В наиболее предпочтительном (неограничивающем) варианте осуществления изобретения, пленочная оболочка I выполнена из коммерчески доступной смеси "Opadry 03F180011 white". Специалисту в данной области понятно, что для пленочной оболочки I могут быть использованы и другие коммерчески доступные смеси для изготовления пленочных оболочек, обладающие сходными характеристиками, например, Opadry на основе гидроксипропилметилцеллюлозы, включающие в свой состав и другие вспомогательные компоненты или аналогичные, а также Opadry II на основе гидроксипропилметилцеллюлозы, включающие в свой состав и другие вспомогательные компоненты или аналогичные.
Также в предпочтительном (неограничивающем) варианте осуществления изобретения, пленочная оболочка II выполнена из коммерчески доступной смеси поливинилового спирта, талька, макрогола, оксидов железа и титана диоксида.
В наиболее предпочтительном (неограничивающем) варианте осуществления изобретения, пленочная оболочка II выполнена из коммерчески доступной смеси "Opadry II 85F 200062 purple". Специалисту в данной области понятно, что для пленочной оболочки II могут быть использованы и другие коммерчески доступные смеси для изготовления пленочных оболочек, обладающие сходными характеристиками, например, Opadry на основе поливинилового спирта, включающие в свой состав и другие вспомогательные компоненты или аналогичные, а также Opadry II на основе гидроксипропилметилцеллюлозы, включающие в свой состав и другие вспомогательные компоненты или аналогичные.
Также вышеуказанные технические результаты достигаются в настоящем изобретении тем, что предложена фармацевтическая композиция, обеспечивающая повышение терапевтической активности количественного и качественного состава ингредиентов, эффективного для терапии когнитивных нарушений сосудистого происхождения, обладающая нейромодулирующим, противопаркинсоническим, нейропротективным и антиспастическим действием, замедляющая и тормозящая глутаматергическую нейротрансмиссию и прогрессирование нейродегенеративных процессов, выполненная в виде таблетки, покрытой пленочной оболочкой и включающей от 5 до 20 мг мемантина гидрохлорида и от 450 до 550 мг цитиколина мононатриевой соли, а также вспомогательные вещества, включая целлюлозу микрокристаллическую, гидроксипропилметилцеллюлозу с молекулярной массой 1000000, кремния диоксид коллоидный и магния стеарат, при следующем соотношении количественного и качественного состава ингредиентов фармацевтической композиции, мас.%:
В предпочтительном (неограничивающем) варианте осуществления изобретения, целлюлоза микрокристаллическая представляет собой целлюлозу микрокристаллическую марки 101.
Также в предпочтительном (неограничивающем) варианте осуществления изобретения, гидроксипропилметилцеллюлоза представляет собой гидроксипропилметилцеллюлозу с молекулярной массой 1000000 Да. Наиболее предпочтительно (также без ограничения), гидроксипропилметилцеллюлоза представляет собой гипромеллозу типа 2208 (К100М). Специалисту в данной области понятно, что могут быть использованы и другие разновидности гидроксипропилметилцеллюлозы, обладающие сходными характеристиками.
Также в предпочтительном (неограничивающем) варианте осуществления изобретения, кремния диоксид коллоидный представляет собой кремния диоксид коллоидный марки А 200. Специалисту в данной области понятно, что могут быть использованы и другие разновидности кремния диоксида коллоидного, обладающие сходными характеристиками.
Также в предпочтительном (неограничивающем) варианте осуществления изобретения, пленочная оболочка I выполнена из коммерчески доступной смеси гидроксипропилметилцеллюлозы, титана диоксида и макрогола. В наиболее предпочтительном (неограничивающем) варианте осуществления изобретения, пленочная оболочка I выполнена из коммерчески доступной смеси "Opadry 03F180011 white".
Также в предпочтительном (неограничивающем) варианте осуществления изобретения, пленочная оболочка II выполнена из коммерчески доступной смеси поливинилового спирта, талька, макрогола, оксидов железа и титана диоксида.
В наиболее предпочтительном (неограничивающем) варианте осуществления изобретения, пленочная оболочка II выполнена из коммерчески доступной смеси "Opadry II 85F 200062 purple".
Специалисту в данной области понятно, что и для пленочной оболочки I, и для пленочной оболочки II могут быть использованы и другие коммерчески доступные смеси, хорошо известные специалисту в данной области.
Также вышеуказанные технические результаты достигаются в настоящем изобретении тем, что предложена фармацевтическая композиция, обеспечивающая повышение терапевтической активности количественного и качественного состава ингредиентов, эффективного для терапии когнитивных нарушений сосудистого происхождения, обладающая нейромодулирующим, противопаркинсоническим, нейропротективным и антиспастическим действием, замедляющая и тормозящая глутаматергическую нейротрансмиссию и прогрессирование нейродегенеративных процессов, включающая от 5 до 20 мг мемантина или его фармацевтически приемлемой соли, и от 450 до 550 мг цитиколина или его фармацевтически приемлемой соли, при следующем соотношении количественного и качественного состава ингредиентов фармацевтической композиции, мг:
В наиболее предпочтительном (неограничивающем) варианта осуществления данного изобретения, фармацевтически приемлемая соль цитиколина представляет собой цитиколина мононатриевую соль. Также в наиболее предпочтительном (неограничивающем) варианта осуществления данного изобретения, фармацевтически приемлемая соль мемантина представляет собой мемантина гидрохлорид.
В предпочтительном (неограничивающем) варианте осуществления изобретения, целлюлоза микрокристаллическая представляет собой целлюлозу микрокристаллическую марки 101.
Также в предпочтительном (неограничивающем) варианте осуществления изобретения, гидроксипропилметилцеллюлоза представляет собой гидроксипропилметилцеллюлозу с молекулярной массой 1000000 Да. Наиболее предпочтительно (также без ограничения), гидроксипропилметилцеллюлоза представляет собой гипромеллозу типа 2208 (К100М). Специалисту в данной области понятно, что могут быть использованы и другие разновидности гидроксипропилметилцеллюлозы, обладающие сходными характеристиками.
Также в предпочтительном (неограничивающем) варианте осуществления изобретения, кремния диоксид коллоидный представляет собой кремния диоксид коллоидный марки А 200. Специалисту в данной области понятно, что могут быть использованы и другие разновидности кремния диоксида коллоидного, обладающие сходными характеристиками.
Также в предпочтительном (неограничивающем) варианте осуществления изобретения, пленочная оболочка I выполнена из коммерчески доступной смеси гидроксипропилметилцеллюлозы, титана диоксида и макрогола. В наиболее предпочтительном (неограничивающем) варианте осуществления изобретения, пленочная оболочка I выполнена из коммерчески доступной смеси "Opadry 03F180011 white".
Также в предпочтительном (неограничивающем) варианте осуществления изобретения, пленочная оболочка II выполнена из коммерчески доступной смеси поливинилового спирта, талька, макрогола, оксидов железа и титана диоксида.
В наиболее предпочтительном (неограничивающем) варианте осуществления изобретения, пленочная оболочка II выполнена из коммерчески доступной смеси "Opadry II 85F 200062 purple". Специалисту в данной области понятно, что и для пленочной оболочки I, и для пленочной оболочки II могут быть использованы и другие коммерчески доступные смеси, хорошо известные специалисту в данной области.
Таблица 2. Примеры количественного и качественного состава ингредиентов фармацевтической композиции
В предпочтительном (неограничивающем) варианте осуществления изобретения, целлюлоза микрокристаллическая представляет собой целлюлозу микрокристаллическую марки 101.
Также в предпочтительном (неограничивающем) варианте осуществления изобретения, гидроксипропилметилцеллюлоза представляет собой гидроксипропилметилцеллюлозу с молекулярной массой 1000000 Да. Наиболее предпочтительно (также без ограничения), гидроксипропилметилцеллюлоза представляет собой гипромеллозу типа 2208 (К100М). Специалисту в данной области понятно, что могут быть использованы и другие разновидности гидроксипропилметилцеллюлозы, обладающие сходными характеристиками.
Также в предпочтительном (неограничивающем) варианте осуществления изобретения, кремния диоксид коллоидный представляет собой кремния диоксид коллоидный марки А 200. Специалисту в данной области понятно, что могут быть использованы и другие разновидности кремния диоксида коллоидного, обладающие сходными характеристиками.
Также в предпочтительном (неограничивающем) варианте осуществления изобретения, пленочная оболочка I выполнена из коммерчески доступной смеси гидроксипропилметилцеллюлозы, титана диоксида и макрогола. В наиболее предпочтительном (неограничивающем) варианте осуществления изобретения, пленочная оболочка I выполнена из коммерчески доступной смеси "Opadry 03F180011 white".
Также в предпочтительном (неограничивающем) варианте осуществления изобретения, пленочная оболочка II выполнена из коммерчески доступной смеси поливинилового спирта, талька, макрогола, оксидов железа и титана диоксида.
В наиболее предпочтительном (неограничивающем) варианте осуществления изобретения, пленочная оболочка II выполнена из коммерчески доступной смеси "Opadry II 85F 200062 purple". При этом специалисту в данной области понятно, что и для пленочной оболочки I, и для пленочной оболочки II могут быть использованы и другие коммерчески доступные смеси, хорошо известные специалисту в данной области.
Технический результат достигается также тем, что на основе вышеуказанной фармацевтической композиции предложена пероральная твердая лекарственная форма, обеспечивающая повышение терапевтической активности количественного и качественного состава ингредиентов, эффективного для терапии когнитивных нарушений сосудистого происхождения, обладающая нейромодулирующим, противопаркинсоническим, нейропротективным и антиспастическим действием, замедляющая и тормозящая глутаматергическую нейротрансмиссию и прогрессирование нейродегенеративных процессов, включающая в качестве действующих веществ от 5,00 до 20,00 мг мемантина или его фармацевтически приемлемой соли, такой как мемантина гидрохлорид, и от 450 до 550 мг цитиколина или его фармацевтически приемлемой соли, такой как цитиколина мононатриевая соль, где указанная пероральная твердая лекарственная форма выполнена в форме таблетки модифицированного высвобождения, покрытой пленочной оболочкой. Количественный и качественный состав ингредиентов указанной лекарственной формы (в пересчете на 1 таблетку) представлен в Таблице 3. Неограничивающие (иллюстративные) примеры количественного и качественного состава ингредиентов лекарственной формы в пересчете на 1 таблетку представлены в Таблице 4:
Таблица 3. Количественный и качественный состав ингредиентов лекарственной формы в пересчете на 1 таблетку:
Таблица 4. Примеры количественного и качественного состава ингредиентов лекарственной формы в пересчете на 1 таблетку:
В предпочтительном (неограничивающем) варианте осуществления изобретения, целлюлоза микрокристаллическая представляет собой целлюлозу микрокристаллическую марки 101.
Также в предпочтительном (неограничивающем) варианте осуществления изобретения, гидроксипропилметилцеллюлоза представляет собой гидроксипропилметилцеллюлозу с молекулярной массой 1000000 Да. Наиболее предпочтительно (также без ограничения), гидроксипропилметилцеллюлоза представляет собой гипромеллозу типа 2208 (К100М). Специалисту в данной области понятно, что могут быть использованы и другие разновидности гидроксипропилметилцеллюлозы, обладающие сходными характеристиками.
Также в предпочтительном (неограничивающем) варианте осуществления изобретения, кремния диоксид коллоидный представляет собой кремния диоксид коллоидный марки А 200. Специалисту в данной области понятно, что могут быть использованы и другие разновидности кремния диоксида коллоидного, обладающие сходными характеристиками.
Также в предпочтительном (неограничивающем) варианте осуществления изобретения, пленочная оболочка I выполнена из коммерчески доступной смеси гидроксипропилметилцеллюлозы, титана диоксида и макрогола. В наиболее предпочтительном (неограничивающем) варианте осуществления изобретения, пленочная оболочка I выполнена из коммерчески доступной смеси "Opadry 03F180011 white".
Также в предпочтительном (неограничивающем) варианте осуществления изобретения, пленочная оболочка II выполнена из коммерчески доступной смеси поливинилового спирта, талька, макрогола, оксидов железа и титана диоксида.
В наиболее предпочтительном (неограничивающем) варианте осуществления изобретения, пленочная оболочка II выполнена из коммерчески доступной смеси "Opadry II 85F 200062 purple". При этом специалисту в данной области понятно, что и для пленочной оболочки I, и для пленочной оболочки II могут быть использованы и другие коммерчески доступные смеси, хорошо известные специалисту в данной области.
Также технические результаты достигаются в настоящем изобретении тем, что предложена пероральная твердая лекарственная форма, обеспечивающая повышение терапевтической активности количественного и качественного состава ингредиентов, эффективного для терапии когнитивных нарушений сосудистого происхождения, обладающая нейромодулирующим, противопаркинсоническим, нейропротективным и антиспастическим действием, замедляющая и тормозящая глутаматергическую нейротрансмиссию и прогрессирование нейродегенеративных процессов, включающая в качестве действующих веществ мемантин или его фармацевтически приемлемую соль, в количестве от 5,00 до 20,00 мг, и цитиколин или его фармацевтически приемлемую соль, в количестве от 450 до 550 мг, причем указанная пероральная твердая лекарственная форма выполнена в форме таблетки модифицированного высвобождения, покрытой пленочной оболочкой, при следующем количественном и качественном составе ингредиентов лекарственной формы в пересчете на 1 таблетку, мас. %:
В наиболее предпочтительном (неограничивающем) варианта осуществления данного изобретения, фармацевтически приемлемая соль цитиколина представляет собой цитиколина мононатриевую соль, а фармацевтически приемлемая соль мемантина представляет собой мемантина гидрохлорид.
Также предпочтительном (неограничивающем) варианте осуществления изобретения, целлюлоза микрокристаллическая представляет собой целлюлозу микрокристаллическую марки 101.
Также в предпочтительном (неограничивающем) варианте осуществления изобретения, гидроксипропилметилцеллюлоза представляет собой гидроксипропилметилцеллюлозу с молекулярной массой 1000000 Да. Наиболее предпочтительно (также без ограничения), гидроксипропилметилцеллюлоза представляет собой гипромеллозу типа 2208 (К100М). Специалисту в данной области понятно, что могут быть использованы и другие разновидности гидроксипропилметилцеллюлозы, обладающие сходными характеристиками.
Также в предпочтительном (неограничивающем) варианте осуществления изобретения, кремния диоксид коллоидный представляет собой кремния диоксид коллоидный марки А 200. Специалисту в данной области понятно, что могут быть использованы и другие разновидности кремния диоксида коллоидного, обладающие сходными характеристиками.
Также в предпочтительном (неограничивающем) варианте осуществления изобретения, пленочная оболочка I выполнена из коммерчески доступной смеси гидроксипропилметилцеллюлозы, титана диоксида и макрогола. В наиболее предпочтительном (неограничивающем) варианте осуществления изобретения, пленочная оболочка I выполнена из коммерчески доступной смеси "Opadry 03F180011 white".
Также в предпочтительном (неограничивающем) варианте осуществления изобретения, пленочная оболочка II выполнена из коммерчески доступной смеси поливинилового спирта, талька, макрогола, оксидов железа и титана диоксида.
В наиболее предпочтительном (неограничивающем) варианте осуществления изобретения, пленочная оболочка II выполнена из коммерчески доступной смеси "Opadry II 85F 200062 purple". При этом специалисту в данной области понятно, что и для пленочной оболочки I, и для пленочной оболочки II могут быть использованы и другие коммерчески доступные смеси, хорошо известные специалисту в данной области.
Также технические результаты достигаются в настоящем изобретении тем, что предложена пероральная твердая лекарственная форма, обеспечивающая повышение терапевтической активности количественного и качественного состава ингредиентов, эффективного для терапии когнитивных нарушений сосудистого происхождения, обладающая нейромодулирующим, противопаркинсоническим, нейропротективным и антиспастическим действием, замедляющая и тормозящая глутаматергическую нейротрансмиссию и прогрессирование нейродегенеративных процессов, включающая в качестве действующих веществ мемантин или его фармацевтически приемлемую соль, например, мемантина гидрохлорид, в количестве от 5,00 до 20,00 мг и цитиколин или его фармацевтически приемлемую соль, в количестве от 450 до 550 мг, выполненная в форме таблетки модифицированного высвобождения, покрытой пленочной оболочкой, при следующем количественном и качественном составе ингредиентов лекарственной формы в пересчете на 1 таблетку, мг.:
или его фармацевтически приемлемая соль
В наиболее предпочтительном (неограничивающем) варианта осуществления данного изобретения, фармацевтически приемлемая соль цитиколина представляет собой цитиколина мононатриевую соль, а фармацевтически приемлемая соль мемантина представляет собой мемантина гидрохлорид.
Также предпочтительном (неограничивающем) варианте осуществления изобретения, целлюлоза микрокристаллическая представляет собой целлюлозу микрокристаллическую марки 101.
Также в предпочтительном (неограничивающем) варианте осуществления изобретения, гидроксипропилметилцеллюлоза представляет собой гидроксипропилметилцеллюлозу с молекулярной массой 1000000 Да. Наиболее предпочтительно (также без ограничения), гидроксипропилметилцеллюлоза представляет собой гипромеллозу типа 2208 (К100М). Специалисту в данной области понятно, что могут быть использованы и другие разновидности гидроксипропилметилцеллюлозы, обладающие сходными характеристиками.
Также в предпочтительном (неограничивающем) варианте осуществления изобретения, кремния диоксид коллоидный представляет собой кремния диоксид коллоидный марки А 200. Специалисту в данной области понятно, что могут быть использованы и другие разновидности кремния диоксида коллоидного, обладающие сходными характеристиками.
Также в предпочтительном (неограничивающем) варианте осуществления изобретения, пленочная оболочка I выполнена из коммерчески доступной смеси гидроксипропилметилцеллюлозы, титана диоксида и макрогола. В наиболее предпочтительном (неограничивающем) варианте осуществления изобретения, пленочная оболочка I выполнена из коммерчески доступной смеси "Opadry 03F180011 white".
Также в предпочтительном (неограничивающем) варианте осуществления изобретения, пленочная оболочка II выполнена из коммерчески доступной смеси поливинилового спирта, талька, макрогола, оксидов железа и титана диоксида.
В наиболее предпочтительном (неограничивающем) варианте осуществления изобретения, пленочная оболочка II выполнена из коммерчески доступной смеси "Opadry II 85F 200062 purple". При этом специалисту в данной области понятно, что и для пленочной оболочки I, и для пленочной оболочки II могут быть использованы и другие коммерчески доступные смеси, хорошо известные специалисту в данной области.
Таблица 4. Примеры количественного и качественного состава ингредиентов лекарственной формы в пересчете на 1 таблетку:
В предпочтительном (неограничивающем) варианте осуществления изобретения, целлюлоза микрокристаллическая представляет собой целлюлозу микрокристаллическую марки 101.
Также в предпочтительном (неограничивающем) варианте осуществления изобретения, гидроксипропилметилцеллюлоза представляет собой гидроксипропилметилцеллюлозу с молекулярной массой 1000000 Да. Наиболее предпочтительно (также без ограничения), гидроксипропилметилцеллюлоза представляет собой гипромеллозу типа 2208 (К100М). Специалисту в данной области понятно, что могут быть использованы и другие разновидности гидроксипропилметилцеллюлозы, обладающие сходными характеристиками.
Также в предпочтительном (неограничивающем) варианте осуществления изобретения, кремния диоксид коллоидный представляет собой кремния диоксид коллоидный марки А 200. Специалисту в данной области понятно, что могут быть использованы и другие разновидности кремния диоксида коллоидного, обладающие сходными характеристиками.
Также в предпочтительном (неограничивающем) варианте осуществления изобретения, пленочная оболочка I выполнена из коммерчески доступной смеси гидроксипропилметилцеллюлозы, титана диоксида и макрогола. В наиболее предпочтительном (неограничивающем) варианте осуществления изобретения, пленочная оболочка I выполнена из коммерчески доступной смеси "Opadry 03F180011 white".
Также в предпочтительном (неограничивающем) варианте осуществления изобретения, пленочная оболочка II выполнена из коммерчески доступной смеси поливинилового спирта, талька, макрогола, оксидов железа и титана диоксида.
В наиболее предпочтительном (неограничивающем) варианте осуществления изобретения, пленочная оболочка II выполнена из коммерчески доступной смеси "Opadry II 85F 200062 purple". При этом специалисту в данной области понятно, что и для пленочной оболочки I, и для пленочной оболочки II могут быть использованы и другие коммерчески доступные смеси, хорошо известные специалисту в данной области.
Технический результат, относящийся к упрощению и снижению себестоимости лекарственной формы и фармацевтической композиции, предназначенных для терапии когнитивных нарушений сосудистого происхождения, обладающей нейромодулирующим, противопаркинсоническим, нейропротективным и антиспастическим действием, замедляющей и тормозящей глутаматергическую нейротрансмиссию и прогрессирование нейродегенеративных процессов, достигается в настоящем изобретении также тем, что предложен способ получения лекарственной формы на основе фармацевтической композиции, в котором магния стеарат, цитиколина мононатриевую соль, мемантина гидрохлорид, целлюлозу микрокристаллическую, в том числе, марки 101, гидроксипропилметилцеллюлозу, кремния диоксид коллоидный, в том числе, марки А 200, просеивают через сито с диаметром ячейки не более 0,5 мм, затем загружают в миксер-гранулятор или аналогичное перемешивающее устройство цитиколина мононатриевую соль, целлюлозу микрокристаллическую и гидроксипропилметилцеллюлозу, перемешивают до однородного состояния при скорости перемешивания 160-240 об/мин, и времени перемешивания в интервале от 2 до 10 минут, далее при постоянном перемешивании в течение не более чем 5 минут при скорости перемешивания, составляющей от 150 до 400 об/мин., увлажняют смесь водой очищенной, после чего полученный гранулят подвергают сушке в условиях псевдоожиженного слоя с поддержанием следующих параметров: температура входящего воздуха 45-65°С, остаточная влажность гранулята от 2,5 до 4,5 %, далее полученную смесь опудривают кремния диоксидом коллоидным, затем полученную смесь подвергают таблетированию на роторном таблеточном прессе, используя пресс-инструмент диаметром от 10 до 15 мм, процесс таблетирования контролируют по следующим параметрам: твердость – 150-250 Н, истираемость – не более 1,0%, высота – не более 7,0 мм, далее на полученные таблетки-ядра наносят оболочку, в процессе растворения пленочной оболочки смеси гидроксипропилметилцеллюлозы, титана диоксид и макрогола добавляют частями фармацевтическую субстанцию мемантина гидрохлорид и перемешивают до образования однородной суспензии, после чего осуществляют нанесение полученной оболочки при температуре ядра таблетки 35-40°С и периодическом перемешивании, в том числе, в барабане коатера, затем готовят раствор пленочной оболочки из смеси поливинилового спирта, талька, макрогола, оксидов железа и титана диоксида, после получения раствора пленкообразователя, его наносят на таблетки при тех же условиях что и предыдущее покрытие. Предпочтительный количественный и качественный состав ингредиентов лекарственной формы в пересчете на 1 таблетку представлен в Таблице 3. Предпочтительные (неограничивающие) примеры количественного и качественного состава ингредиентов лекарственной формы в пересчете на 1 таблетку представлены в Таблице 4:
Технический результат, относящийся к упрощению и снижению себестоимости лекарственной формы и фармацевтической композиции, предназначенных для терапии когнитивных нарушений сосудистого происхождения, обладающей нейромодулирующим, противопаркинсоническим, нейропротективным и антиспастическим действием, замедляющей и тормозящей глутаматергическую нейротрансмиссию и прогрессирование нейродегенеративных процессов, достигается также тем, что в рамках настоящего изобретения предложен способ получения лекарственной формы на основе фармацевтической композиции, обеспечивающей повышение терапевтической активности количественного и качественного состава ингредиентов, эффективного для терапии когнитивных нарушений сосудистого происхождения, а также обладающей нейромодулирующим, противопаркинсоническим, нейропротективным и антиспастическим действием, замедляющей и тормозящей глутаматергическую нейротрансмиссию и прогрессирование нейродегенеративных процессов, в соответствии с которым магния стеарат, цитиколин или его фармацевтически приемлемую соль, мемантин или его фармацевтически приемлемую соль, целлюлозу микрокристаллическую, гидроксипропилметилцеллюлозу, кремния диоксид коллоидный, просеивают через сито с диаметром ячейки не более 0,5 мм, затем загружают в миксер-гранулятор или аналогичное перемешивающее устройство цитиколин или его фармацевтически приемлемую соль, целлюлозу микрокристаллическую и гидроксипропилметилцеллюлозу, перемешивают до однородного состояния при скорости перемешивания 160-240 об/мин, и времени перемешивания в интервале от 2 до 10 минут, далее при постоянном перемешивании смеси увлажняют смесь водой очищенной, при этом скорость перемешивания должна быть в интервалах значений 150-400 об/мин, а время перемешивания - не более 5 минут, после чего полученный гранулят подвергают сушке в условиях псевдоожиженного слоя с поддержанием следующих параметров: температура входящего воздуха 45-65°С, остаточная влажность гранулята от 2,5 до 4,5 %, далее полученную смесь опудривают кремния диоксидом коллоидным, затем полученную смесь подвергают таблетированию на роторном таблеточном прессе, используя пресс-инструмент диаметром от 10 до 15 мм, процесс таблетирования контролируют по следующим параметрам: твердость – 150-250 Н, истираемость – не более 1,0%, высота – не более 7,0 мм, далее на полученные таблетки-ядра наносят оболочку, в процессе растворения пленочной оболочки смеси гидроксипропилметилцеллюлозы, титана диоксид и макрогола добавляют частями фармацевтическую субстанцию мемантина или его фармацевтически приемлемой соли и перемешивают до образования однородной суспензии, после чего осуществляют нанесение полученной оболочки при температуре ядра таблетки 35-40°С и периодическом перемешивании, в том числе, в барабане коатера, затем готовят раствор пленкообразователя для пленочной оболочки II из смеси поливинилового спирта, талька, макрогола, оксидов железа и титана диоксида, после получения раствора пленкообразователя для пленочной оболочки II, его наносят на таблетки при тех же условиях что и предыдущее покрытие, при следующем количественном и качественном составе ингредиентов лекарственной формы в пересчете на 1 таблетку, мас. %:
В наиболее предпочтительном (неограничивающем) варианта осуществления данного изобретения, фармацевтически приемлемая соль цитиколина представляет собой цитиколина мононатриевую соль, а фармацевтически приемлемая соль мемантина представляет собой мемантина гидрохлорид.
В предпочтительном (неограничивающем) варианте осуществления способа по изобретению, целлюлоза микрокристаллическая представляет собой целлюлозу микрокристаллическую марки 101.
Также в предпочтительном (неограничивающем) варианте осуществления способа по изобретению, гидроксипропилметилцеллюлоза представляет собой гидроксипропилметилцеллюлозу с молекулярной массой 1000000 Да. Наиболее предпочтительно (также без ограничения), гидроксипропилметилцеллюлоза представляет собой гипромеллозу типа 2208 (К100М). Специалисту в данной области понятно, что могут быть использованы и другие разновидности гидроксипропилметилцеллюлозы, обладающие сходными характеристиками.
Также в предпочтительном (неограничивающем) варианте осуществления способа по изобретению, кремния диоксид коллоидный представляет собой кремния диоксид коллоидный марки А 200. Специалисту в данной области понятно, что могут быть использованы и другие разновидности кремния диоксида коллоидного, обладающие сходными характеристиками.
Также в предпочтительном (неограничивающем) варианте осуществления способа по изобретению, пленочная оболочка I выполнена из коммерчески доступной смеси гидроксипропилметилцеллюлозы, титана диоксида и макрогола. В наиболее предпочтительном (неограничивающем) варианте осуществления изобретения, пленочная оболочка I выполнена из коммерчески доступной смеси "Opadry 03F180011 white".
Также в предпочтительном (неограничивающем) варианте осуществления способа по изобретению, пленочная оболочка II выполнена из коммерчески доступной смеси поливинилового спирта, талька, макрогола, оксидов железа и титана диоксида.
В наиболее предпочтительном (неограничивающем) варианте осуществления изобретения, пленочная оболочка II выполнена из коммерчески доступной смеси "Opadry II 85F 200062 purple". При этом специалисту в данной области понятно, что и для пленочной оболочки I, и для пленочной оболочки II могут быть использованы и другие коммерчески доступные смеси, хорошо известные специалисту в данной области.
Технический результат, относящийся к упрощению и снижению себестоимости лекарственной формы и фармацевтической композиции, предназначенных для терапии когнитивных нарушений сосудистого происхождения, обладающей нейромодулирующим, противопаркинсоническим, нейропротективным и антиспастическим действием, замедляющей и тормозящей глутаматергическую нейротрансмиссию и прогрессирование нейродегенеративных процессов, достигается также тем, что в рамках настоящего изобретения предложен способ получения лекарственной формы на основе фармацевтической композиции, обеспечивающей повышение терапевтической активности количественного и качественного состава ингредиентов, эффективного для терапии когнитивных нарушений сосудистого происхождения, а также обладающей нейромодулирующим, противопаркинсоническим, нейропротективным и антиспастическим действием, замедляющей и тормозящей глутаматергическую нейротрансмиссию и прогрессирование нейродегенеративных процессов, включающей от 5 до 20 мг мемантина или его фармацевтически приемлемой соли, например, мемантина гидрохлорида, и от 450 до 550 мг цитиколина или его фармацевтически приемлемой соли, например, цитиколина мононатрия, причем, согласно указанному способу, магния стеарат, цитиколин или его фармацевтически приемлемую соль, мемантин или его фармацевтически приемлемую соль, целлюлозу микрокристаллическую, гидроксипропилметилцеллюлозу и кремния диоксид коллоидный просеивают через сито с диаметром ячейки не более 0,5 мм, затем загружают в миксер-гранулятор или аналогичное перемешивающее устройство цитиколина мононатриевую соль, целлюлозу микрокристаллическую и гидроксипропилметилцеллюлозу, перемешивают до однородного состояния при скорости перемешивания 160-240 об/мин, и времени перемешивания в интервале от 2 до 10 минут, далее при постоянном перемешивании смеси увлажняют смесь водой очищенной, при этом скорость перемешивания должна быть в интервалах значений 150-400 об/мин, а время перемешивания - не более 5 минут, после чего полученный гранулят подвергают сушке в условиях псевдоожиженного слоя с поддержанием следующих параметров: температура входящего воздуха 45-65°С, остаточная влажность гранулята от 2,5 до 4,5 %, полученный гранулят просеивают через сито с диаметром ячейки не более 1,0 мм, далее полученную смесь опудривают кремния диоксидом коллоидным в течение от 3 до 5 минут, затем к смеси добавляют часть гидроксипропилметилцеллюлозы , перемешивают еще от 8 до 10 минут, затем добавляют магния стеарат и перемешивают еще 2-3 мин. Полученную смесь для таблетирования подвергают таблетированию на роторном таблеточном прессе, используя пресс-инструмент диаметром от 10 до 15 мм, процесс таблетирования контролируют по следующим параметрам: твердость – 150-290 Н, истираемость – не более 1,0%, высота – не более 7,0 мм, далее на полученные таблетки-ядра наносят оболочку, в процессе растворения пленочной оболочки смеси гидроксипропилметилцеллюлозы, титана диоксид и макрогола добавляют частями фармацевтическую субстанцию мемантина гидрохлорид и перемешивают до образования однородной суспензии, после чего осуществляют нанесение полученной оболочки при температуре ядра таблетки 35-40°С и периодическом перемешивании, в том числе, в барабане коатера, затем готовят раствор пленочной оболочки из смеси поливинилового спирта, талька, макрогола, оксидов железа и титана диоксида, после получения раствора пленкообразователя, его наносят на таблетки при тех же условиях что и предыдущее покрытие, при следующем количественном и качественном составе ингредиентов лекарственной формы в пересчете на 1 таблетку, мг:
В наиболее предпочтительном (неограничивающем) варианта осуществления данного изобретения, фармацевтически приемлемая соль цитиколина представляет собой цитиколина мононатриевую соль, а фармацевтически приемлемая соль мемантина представляет собой мемантина гидрохлорид.
В предпочтительном (неограничивающем) варианте осуществления способа по изобретению, целлюлоза микрокристаллическая представляет собой целлюлозу микрокристаллическую марки 101.
Также в предпочтительном (неограничивающем) варианте осуществления способа по изобретению, гидроксипропилметилцеллюлоза представляет собой гидроксипропилметилцеллюлозу с молекулярной массой 1000000 Да. Наиболее предпочтительно (также без ограничения), гидроксипропилметилцеллюлоза представляет собой гипромеллозу типа 2208 (К100М). Специалисту в данной области понятно, что могут быть использованы и другие разновидности гидроксипропилметилцеллюлозы, обладающие сходными характеристиками.
Также в предпочтительном (неограничивающем) варианте осуществления способа по изобретению, кремния диоксид коллоидный представляет собой кремния диоксид коллоидный марки А 200. Специалисту в данной области понятно, что могут быть использованы и другие разновидности кремния диоксида коллоидного, обладающие сходными характеристиками.
Также в предпочтительном (неограничивающем) варианте осуществления способа по изобретению, пленочная оболочка I выполнена из коммерчески доступной смеси гидроксипропилметилцеллюлозы, титана диоксида и макрогола. В наиболее предпочтительном (неограничивающем) варианте осуществления изобретения, пленочная оболочка I выполнена из коммерчески доступной смеси "Opadry 03F180011 white".
Также в предпочтительном (неограничивающем) варианте осуществления способа по изобретению, пленочная оболочка II выполнена из коммерчески доступной смеси поливинилового спирта, талька, макрогола, оксидов железа и титана диоксида.
В наиболее предпочтительном (неограничивающем) варианте осуществления изобретения, пленочная оболочка II выполнена из коммерчески доступной смеси "Opadry II 85F 200062 purple". При этом специалисту в данной области понятно, что и для пленочной оболочки I, и для пленочной оболочки II могут быть использованы и другие коммерчески доступные смеси, хорошо известные специалисту в данной области.
Кроме того, технические результаты достигаются в настоящем изобретении также тем, что предложен лекарственный препарат в форме таблетки с модифицированным высвобождением, включающий цитиколин или его фармацевтически приемлемую соль и мемантин или его фармацевтически приемлемую соль в качестве фармацевтических субстанций, целлюлозу микрокристаллическую в качестве наполнителя, гипромеллозу в качестве матричного агента, кремния диоксид коллоидный в качестве глиданта, магния стеарат в качестве лубриканта, пленочную оболочку, в качестве оболочки изолирующей (Пленочная оболочка I), защитной (Пленочная оболочка II) и носителя (Пленочная оболочка Ia), при следующем количественном и качественном составе ингредиентов лекарственной формы в пересчете на 1 таблетку, мас.%:
(66,93)
В наиболее предпочтительном (неограничивающем) варианта осуществления данного изобретения, фармацевтически приемлемая соль цитиколина представляет собой цитиколина мононатриевую соль, а фармацевтически приемлемая соль мемантина представляет собой мемантина гидрохлорид.
Также предпочтительном (неограничивающем) варианте осуществления лекарственного препарата (таблетки с модифицированным высвобождением) по изобретению, целлюлоза микрокристаллическая представляет собой целлюлозу микрокристаллическую марки 101.
Также в предпочтительном (неограничивающем) варианте осуществления лекарственного препарата (таблетки с модифицированным высвобождением) по изобретению, гидроксипропилметилцеллюлоза представляет собой гидроксипропилметилцеллюлозу с молекулярной массой 1000000 Да. Наиболее предпочтительно (также без ограничения), гидроксипропилметилцеллюлоза представляет собой гипромеллозу типа 2208 (К100М). Специалисту в данной области понятно, что могут быть использованы и другие разновидности гидроксипропилметилцеллюлозы, обладающие сходными характеристиками.
Также в предпочтительном (неограничивающем) варианте осуществления лекарственного препарата (таблетки с модифицированным высвобождением) по изобретению, кремния диоксид коллоидный представляет собой кремния диоксид коллоидный марки А 200. Специалисту в данной области понятно, что могут быть использованы и другие разновидности кремния диоксида коллоидного, обладающие сходными характеристиками.
Также в предпочтительном (неограничивающем) варианте осуществления лекарственного препарата (таблетки с модифицированным высвобождением) по изобретению, пленочная оболочка I выполнена из коммерчески доступной смеси гидроксипропилметилцеллюлозы, титана диоксида и макрогола. В наиболее предпочтительном (неограничивающем) варианте осуществления изобретения, пленочная оболочка I выполнена из коммерчески доступной смеси "Opadry 03F180011 white".
Также в предпочтительном (неограничивающем) варианте осуществления лекарственного препарата (таблетки с модифицированным высвобождением) по изобретению, пленочная оболочка II выполнена из коммерчески доступной смеси поливинилового спирта, талька, макрогола, оксидов железа и титана диоксида.
В наиболее предпочтительном (неограничивающем) варианте осуществления изобретения, пленочная оболочка II выполнена из коммерчески доступной смеси "Opadry II 85F 200062 purple". При этом специалисту в данной области понятно, что и для пленочной оболочки I, и для пленочной оболочки II могут быть использованы и другие коммерчески доступные смеси, хорошо известные специалисту в данной области.
Кроме того, технические результаты настоящего изобретения достигаются также тем, что предложен лекарственный препарат, выполненный в форме таблетки с модифицированным высвобождением, включающий цитиколин или его фармацевтически приемлемую соль, например, цитиколин мононатрия, и мемантин или его фармацевтически приемлемую соль, например, мемантина гидрохлорид, в качестве действующих веществ, целлюлозу микрокристаллическую в качестве наполнителя, гипромеллозу в качестве матричного агента, кремния диоксид коллоидный в качестве глиданта, магния стеарат в качестве лубриканта, пленочную оболочку, в качестве оболочки и носителя, при следующем количественном и качественном составе ингредиентов лекарственной формы в пересчете на 1 таблетку, мг:
(500,00)
В наиболее предпочтительном (неограничивающем) варианта осуществления данного изобретения, фармацевтически приемлемая соль цитиколина представляет собой цитиколина мононатриевую соль, а фармацевтически приемлемая соль мемантина представляет собой мемантина гидрохлорид.
В предпочтительном (неограничивающем) варианте осуществления лекарственного препарата (таблетки с модифицированным высвобождением) по изобретению, целлюлоза микрокристаллическая представляет собой целлюлозу микрокристаллическую марки 101.
Также в предпочтительном (неограничивающем) варианте осуществления лекарственного препарата (таблетки с модифицированным высвобождением) по изобретению, гидроксипропилметилцеллюлоза представляет собой гидроксипропилметилцеллюлозу с молекулярной массой 1000000 Да. Наиболее предпочтительно (также без ограничения), гидроксипропилметилцеллюлоза представляет собой гипромеллозу типа 2208 (К100М). Специалисту в данной области понятно, что могут быть использованы и другие разновидности гидроксипропилметилцеллюлозы, обладающие сходными характеристиками.
Также в предпочтительном (неограничивающем) варианте осуществления лекарственного препарата (таблетки с модифицированным высвобождением) по изобретению, кремния диоксид коллоидный представляет собой кремния диоксид коллоидный марки А 200. Специалисту в данной области понятно, что могут быть использованы и другие разновидности кремния диоксида коллоидного, обладающие сходными характеристиками.
Также в предпочтительном (неограничивающем) варианте осуществления лекарственного препарата (таблетки с модифицированным высвобождением) по изобретению, пленочная оболочка I выполнена из коммерчески доступной смеси гидроксипропилметилцеллюлозы, титана диоксида и макрогола. В наиболее предпочтительном (неограничивающем) варианте осуществления изобретения, пленочная оболочка I выполнена из коммерчески доступной смеси "Opadry 03F180011 white".
Также в предпочтительном (неограничивающем) варианте осуществления лекарственного препарата (таблетки с модифицированным высвобождением) по изобретению, пленочная оболочка II выполнена из коммерчески доступной смеси поливинилового спирта, талька, макрогола, оксидов железа и титана диоксида.
В наиболее предпочтительном (неограничивающем) варианте осуществления изобретения, пленочная оболочка II выполнена из коммерчески доступной смеси "Opadry II 85F 200062 purple". При этом специалисту в данной области понятно, что и для пленочной оболочки I, и для пленочной оболочки II могут быть использованы и другие коммерчески доступные смеси, хорошо известные специалисту в данной области.
Таблица 5. Примеры количественного и качественного состава ингредиентов в пересчете на 1 таблетку, включающую мемантина гидрохлорид (эквивалент 5 мг основания мемантина) и цитиколин натрия (эквивалент 500 мг основания цитиколина) в качестве действующих веществ.
(500,00)
Purple)
Кроме того, технические результаты настоящего изобретения достигаются также тем, что предложен лекарственный препарат в форме таблетки с модифицированным высвобождением, включающий цитиколин или его фармацевтически приемлемую соль, например, цитиколин натрия, и мемантин или его фармацевтически приемлемую соль, например, мемантина гидрохлорид, в качестве действующих веществ, целлюлозу микрокристаллическую в качестве наполнителя, гипромеллозу в качестве матричного агента, кремния диоксид коллоидный в качестве глиданта, магния стеарат в качестве лубриканта, пленочную оболочку, в качестве оболочки и носителя, при следующем количественном и качественном составе ингредиентов лекарственной формы в пересчете на 1 таблетку, мас.%:
(64,77)
Purple)
Кроме того, технические результаты настоящего изобретения достигаются также тем, что предложен лекарственный препарат в форме таблетки с модифицированным высвобождением, включающий цитиколин или его фармацевтически приемлемую соль, например, цитиколин натрия и мемантин или его фармацевтически приемлемую соль, например, мемантина гидрохлорид, в качестве действующих веществ, целлюлозу микрокристаллическую в качестве наполнителя, гипромеллозу в качестве матричного агента, кремния диоксид коллоидный в качестве глиданта, магния стеарат в качестве лубриканта, пленочную оболочку, в качестве оболочки и носителя, при следующем количественном и качественном составе ингредиентов лекарственной формы в пересчете на 1 таблетку, мг:
(500,00)
Purple (Поливиниловый спирт, Титана диоксид, Макрогол, Тальк, Оксид железа красный, Оксид железа черный)
Таблица 6. Примеры количественного и качественного состава ингредиентов в пересчете на 1 таблетку, включающую мемантина в количестве 10 мг и цитиколина в количестве 500 мг в качестве действующих веществ.
(500,00)
Purple (Поливиниловый спирт, Титана диоксид, Макрогол, Тальк, Оксид железа красный, Оксид железа черный)
Кроме того, технические результаты настоящего изобретения достигаются также тем, что предложен способ получения лекарственного препарата в форме таблетки с модифицированным высвобождением, содержащих в качестве действующих веществ цитиколин натрия и мемантина гидрохлорид, а также целлюлозу микрокристаллическую в качестве наполнителя, гипромеллозу в качестве матричного агента, кремния диоксид коллоидный в качестве глиданта, магния стеарат в качестве лубриканта, пленочную оболочку в качестве оболочки и носителя, при следующем количественном и качественном составе ингредиентов лекарственной формы в пересчете на 1 таблетку, мг:
(500,00)
Purple (Поливиниловый спирт, Титана диоксид, Макрогол, Тальк, Оксид железа красный, Оксид железа черный)
отличающийся тем, что указанный способ включает:
просев сырья, при котором магния стеарат просеивают вручную через сито 0,5 мм, остатки на сите протирают вручную, затем цитиколин натрия просеивают на установке для просеивания, например, на вибросите CISA RP 200 N через сито 0,50 мм, в то время, как мемантина гидрохлорид просеивают, например, на Вибросите CISA RP 200 N через сито 0,075 мм, целлюлозу микрокристаллическую 101, гипромеллозу К100М, кремния диоксид коллоидный просеивают, например, на вибросите CISA RP 200 N через сито 0,5 мм.
взвешивание сырья, при котором каждое наименование сырья взвешивают в отдельные чистые емкости, маркируют и передают на следующие стадии,
процесс приготовление раствора увлажнителя, где в качестве раствора увлажнителя используют воду очищенную, при этом количество воды очищенной рассчитывают в зависимости от массы сухой смеси при соотношении смеси к воде, составляющем 3,4: 1,
процесс приготовления смеси для таблетирования, при котором в миксер-гранулятор загружают цитиколин натрия просеянный, целлюлозу микрокристаллическую, например, маркировки 101 просеянную, и гипромеллозу, в том числе, тип 2208, затем осуществляют перемешивание компонентов до однородного состояния при визуальном контроле, при этом параметры перемешивания зависят от объема лабораторной серии.
В частности,
Параметры для лабораторной серии 500 таблеток:
Объем чаши – 3,0 л.
Скорость перемешивания – 200,0 об/мин.
Время перемешивания – 120 c,
далее осуществляют процесс гранулирования, при котором при постоянном перемешивании смеси в миксере-грануляторе вносят раствор увлажнителя, осуществляют перемешивание до образования мелкого рассыпчатого гранулята (контроль визуальный), параметры гранулирования зависят от объема лабораторной серии, в том числе,
Параметры для лабораторной серии 500 таблеток:
Скорость перемешивания – 200,0-350,0 об/мин.
Время перемешивания – 60 c,
затем осуществляют сушку гранулята, где гранулят сушат в сушильном шкафу (сушилке с псевдоожиженным слоем), параметры процесса сушки зависят от используемого оборудования и объема лабораторной серии, в том числе,
Параметры для лабораторной серии 500 таблеток:
после чего осуществляют калибровку гранулята, а именно, гранулят просеивают, например, на вибросите CISA RP 200 N через сито 1,0 мм (0,710 мм), а остатки протирают через сито 1,0 мм (0,710 мм) вручную,
далее осуществляют опудривание, при котором, в смеситель вносят гранулят и кремния диоксид коллоидный просеянный, осуществляют перемешивание до однородного состояния (контроль визуальный), параметры перемешивания зависят от типа оборудования и объема лабораторной серии, в том числе,
Параметры для лабораторной серии 500 таблеток:
Объем чаши – 3,0 л
Время перемешивания – 300 с,
причем, при наличии агломератов кремния диоксида коллоидного допускается проводить просев смеси через сито 1,0 мм, агломераты кремния диоксида коллоидного протирают через сито вручную., в смеситель вносят гипромеллозу, в том числе, тип 2208, просеянную и продолжают перемешивание до однородного состояния (контроль визуальный), параметры перемешивания зависят от типа оборудования и объема лабораторной серии, в том числе,
Параметры для лабораторной серии 500 таблеток:
Объем чаши – 3,0 л
Время перемешивания – 600 с,
в смеситель загружают магния стеарат просеянный и перемешивают компоненты до однородного состояния (контроль визуальный), параметры перемешивания зависят от типа оборудования и объема лабораторной серии, в том числе,
Параметры для лабораторной серии 500 таблеток:
Объем чаши – 3,0 л
Время перемешивания – от 120 до 180 с,
смесь для таблетирования выгружают в маркированную емкость, отбирают репрезентативную пробу для проведения контроля, согласно спецификации, затем осуществляют процесс таблетирования, который осуществляют на таблеточном прессе, например (без ограничения), Futorque X-1, процесс таблетирования осуществляют на круглом пресс-инструменте с геометрией 12,00 мм, в начале процесса проводят настройку таблеточного пресса на производство таблеток со средней массой, в том числе, 700,0 мг.
после настройки средней массы таблеток, осуществляют настройку таблеточного пресса по остальным показателям:
твердость – 200-290 Н;
истираемость – не более 1,0%;
высота – не более 6,0 мм;
отклонения от средней массы 20 таблеток - отклонения от средней массы отдельных таблеток не должно превышать 5 %,
после настройки таблеточного пресса осуществляют процесс таблетирования до полного расходования смеси для таблетирования, в процессе таблетирования, не реже одного раза за 10 минут осуществляют контроль:
средней массы таблеток;
твердость таблеток.
В течение процесса таблетирования таблетки собирают в маркированные емкости; после окончания процесса емкости закрывают, осуществляют репрезентативный отбор таблеток для проведения промежуточного контроля согласно спецификации, затем осуществляют процесс покрытия таблеток пленочной оболочкой, который включает приготовление пленочной суспензии, а именно, в процессе нанесения пленочной оболочки используют 18% пленочную суспензию, устанавливают перемешивание воды очищенной так, чтобы образовалась воронка на поверхности воды, вносят постепенно сухую пленочную оболочку, не допуская образования агломератов на поверхности раствора, затем после снижают скорость перемешивания так, чтобы не происходило пенообразование, и оставляют раствор перемешиваться 45 минут, далее осуществляют нанесение оболочки, который осуществляют на коатере модульной установки, например, BOSCH Solidlab 1, перед проведением процесса нанесения оболочки нагревают таблетки до 37-39°С при периодическом перемешивании в барабане коатера, по достижении температуры таблеток начинают распыление пленочной суспензии, процесс нанесения осуществляется при температуре продукта 35-40°С, в процессе контролируют внешний вид таблеток и привес оболочки, процесс нанесения оболочки осуществляют до получения средней массы таблеток, в том числе, 710,00 мг, при достижении заданной массы таблеток процесс останавливают и охлаждают таблетки до температуры не выше 33 °С., после окончания процесса емкости закрывают, далее осуществляют репрезентативный отбор таблеток для проведения промежуточного контроля, таблетки, покрытые оболочкой, хранят в закрытых емкостях, после чего осуществляют процесс покрытия таблеток оболочкой, включающей фармацевтическую субстанцию мемантина гидрохлорид, в процессе нанесения пленочной оболочки используют, в том числе, 15% пленочную суспензию, например, такую как Opadry 03F180011 или Opadry II 85F200062, устанавливают перемешивание воды очищенной так, чтобы образовалась воронка на поверхности воды, вносят фармацевтическую субстанцию мемантина гидрохлорид, просеянную и перемешивают до полного растворения при визуальном контроле, далее вносят постепенно сухую пленочную оболочку, не допуская образования агломератов на поверхности раствора, затем снижают скорость перемешивания так, чтобы не происходило пенообразование, и оставляют раствор перемешиваться 45 минут, затем осуществляют на коатере модульной установки процесс нанесения пленочной оболочки, который осуществляют на коатере модульной установки, в том числе, BOSCH Solidlab 1, перед проведением процесса нанесения оболочки нагревают таблетки до 37-39°С при периодическом перемешивании в барабане коатера; по достижении температуры таблеток начинают распыление пленочной суспензии. Процесс нанесения проводится при температуре продукта 35-40°С, в процессе контролируют внешний вид таблеток и привес оболочки, процесс нанесения оболочки проводят до получения средней массы таблеток, в том числе, 735,00 мг/760,00 мг, при достижении заданной массы таблеток процесс останавливают и охлаждают таблетки до температуры не выше 33 °С., после окончания процесса емкости закрывают, осуществляют репрезентативный отбор таблеток для проведения промежуточного контроля, таблетки, покрытые оболочкой, хранят в закрытых емкостях, затем осуществляют процесс покрытия таблеток конечной оболочкой, в процессе нанесения пленочной оболочки используют 18% пленочную суспензию, устанавливают перемешивание воды очищенной так, чтобы образовалась воронка на поверхности воды, вносят постепенно сухую пленочную оболочку, не допуская образования агломератов на поверхности раствора, затем снижают скорость перемешивания так, чтобы не происходило пенообразование, и оставляют раствор перемешиваться в течение не менее 45 минут, нанесение оболочки осуществляют на коатере модульной установки, например, BOSCH Solidlab 1, перед проведением процесса нанесения оболочки нагревают таблетки до 35-45°С при периодическом перемешивании в барабане коатера, по достижении температуры таблеток начинают распыление пленочной суспензии, процесс нанесения проводится при температуре продукта 35-40°С, в процессе контролируют внешний вид таблеток и привес оболочки ,процесс нанесения оболочки проводят до получения средней массы таблеток , в том числе,747,00 мг/772,00 мг, при достижении заданной массы таблеток процесс останавливают и охлаждают таблетки до температуры не выше 33 °С, после окончания процесса емкости закрывают, осуществляют репрезентативный отбор таблеток для проведения промежуточного контроля, согласно спецификации, таблетки, покрытые оболочкой, хранят в закрытых емкостях, упаковку таблеток, покрытых пленочной оболочкой, осуществляют путем размещения, например, в блистер ПВХ/Алю на автоматической блистерной машине DPP260ki-2, параметры формования ячеек блистера:
Давление – 6 бар;
Температура формования – 110 - 120°С
Параметры запайки:
Температура запайки – 130 - 140°С;
Давление – 6 бар;
Скорость – 18 циклов/мин;
Температура охлаждающей жидкости - 10°С,
после чего проводят контроль герметичности блистеров при помощи, например, тестера Erweka VDT/S, обязательному контролю герметичности подлежат первые и последние полученные блистеры.
Сравнительное изучение специфической фармакологической активности фармацевтической композиции, предложенной в настоящем изобретении, в сравнении с монопрепаратом цитиколин проводили на модели ишемического инсульта у крыс. Для этого, на основании руководства по проведению доклинических исследований под редакцией А.Н. Миронова [9], была выбрана модель глобальной преходящей ишемии головного мозга при помощи перевязки общих сонных артерий. Долговременную память оценивали при помощи теста «водный лабиринт Морриса» (Morris R., "J Neurosci Methods", 1984, Vol. 11, No 1. ‒ P. 47-60 [10]).
Таблица. Влияние исследуемых препаратов на долговременную память у крыс в тесте «водный лабиринт Морриса».
Неожиданного оказалось, что добавление к терапии мемантина, имеющего известное из уровня техники показание для терапии когнитивных нарушений (деменции) Альцгеймеровского типа, привело к выраженному нейропротективному и прокогнитивному эффектам в коррекции когнитивных нарушений, вызванных совершенно другой причиной, а именно ишемией. Терапия исследуемыми препаратами способствовала успешному воспроизведению навыка на этапе оценки долговременной памяти. Значимое снижение латентного периода (ЛП) нахождения целевого сектора (по сравнению с животными с патологией без лечения) отмечено во всех группах, получавших фармацевтическую композицию, предлагаемую в настоящем изобретении, вне зависимости от дозы препарата. В группах, получавшей Цитиколин или Мемантин, аналогичный эффект наблюдался только в группе, получавшей препарат в максимальных исследованных дозах
Вышеописанные примеры иллюстрируют, но не ограничивают применение указанных составов и способов заявляемых изобретений.
Разработанные составы фармацевтических композиций, а также предлагаемая лекарственная форма, изготавливаемая описанным способом на основе предлагаемых составов, обеспечивают достижение технических результатов настоящего изобретения: повышение терапевтической активности цитиколина или его фармацевтически приемлемой соли за счет обеспечения его сверхсуммарного (синергического) взаимодействия с мемантином или его фармацевтически приемлемой солью, а также за счет его мгновенного начала действия и последующего эффективного и продолжительного действия; упрощение терапии когнитивных нарушений сосудистого происхождения, обеспечение лишенных побочных эффектов, устойчивых при получении и стабильных при хранении лекарственных форм мемантина или его фармацевтически приемлемой соли и цитиколина или его фармацевтически приемлемой соли, обеспечение доступного и недорогого способа получения лекарственных форм мемантина или его фармацевтически приемлемой соли и цитиколина или его фармацевтически приемлемой соли.
Полученная лекарственная форма обеспечивает устойчивость, стабильность при хранении и практическое отсутствие побочных эффектов.
Благодаря предлагаемым изобретениям, которые легли в основу изготавливаемых по указанному способу лекарственных форм, можно повысить терапевтическую эффективность заявленного состава посредством:
- лекарственной формы модифицированного высвобождения, изготовленной на основе фармацевтической композиции,
- эффективного периода действия лекарственной формы на основе заявленного состава,
- посредством упрощения схемы воздействия применяемой лекарственной формы. Все представленные изобретения промышленно применимы, прошли лабораторные испытания, реализуемы практически и найдут широкое применение в фармацевтической промышленности, а именно подтверждено:
- применение вышеуказанной фармацевтической композиции,
- применение предложенной лекарственной формы,
- применение способа получения предложенной лекарственной формы на основе фармацевтической композиции.
Каждое из предлагаемых изобретений промышленно применимо в области фармацевтики, обеспечивает устойчивость заявленных свойств, сохранение стабильности свойств на срок не менее 3 лет.
Применение предлагаемых изобретений увеличивает ассортиментный перечень лекарственных форм.
Кроме того, предложенный способ получения лекарственной формы обеспечивает устойчивость свойств лекарственной формы, сохранение стабильности свойств на срок не менее 3 лет.
Таким образом, достигнут желаемый технический результат предложенная группа изобретений, включающая фармацевтическую композицию, обладающую нейромодулирующим, противопаркинсоническим, нейропротективным и антиспастическим действием, предназначенную для терапии когнитивных нарушений сосудистого происхождения, замедляющую и тормозящую глутаматергическую нейротрансмиссию и прогрессирование нейродегенеративных процессов,
- фармацевтической композицией, обеспечивающей повышение терапевтической активности заявленного количественного и качественного состава ингредиентов за счет мгновенного начала действия и за счет эффективного и продолжительного действия состава ингредиентов, для терапии когнитивных нарушений сосудистого происхождения, обладающей нейромодулирующим, противопаркинсоническим, нейропротективным и антиспастическим действием, замедляющей и тормозящей глутаматергическую нейротрансмиссию и прогрессирование нейродегенеративных процессов,
- лекарственной формы, посредством которой обеспечено, при введении указанного фармацевтического состава, упрощение схемы воздействия заявляемого качественного и количественного состава ингредиентов для терапии когнитивных нарушений сосудистого происхождения, а также обладающей нейромодулирующим, противопаркинсоническим, нейропротективным и антиспастическим действием, замедляющей и тормозящей глутаматергическую нейротрансмиссию и прогрессирование нейродегенеративных процессов,
- а также способа получения указанной лекарственной формы на основе предлагаемой фармацевтической композиции, предназначенного для получения таблеток для терапии когнитивных нарушений сосудистого происхождения, а также обладающих нейромодулирующим, противопаркинсоническим, нейропротективным и антиспастическим действием, замедляющих и тормозящих глутаматергическую нейротрансмиссию и прогрессирование нейродегенеративных процессов,
Кроме того, техническим результатом является увеличение ассортиментного перечня лекарственных форм, предназначенных для терапии когнитивных нарушений сосудистого происхождения, обладающих нейромодулирующим, противопаркинсоническим, нейропротективным и антиспастическим действием, замедляющих и тормозящих глутаматергическую нейротрансмиссию и прогрессирование нейродегенеративных процессов.
Предлагаемая группа изобретений промышленно применима, реализована на практике, о чём свидетельствуют предоставленные примеры осуществления группы изобретений, которые найдут широкое применение в фармацевтике, как в России, так и за ее пределами для фармацевтических композиций и лекарственных форм, обладающих нейромодулирующим, противопаркинсоническим, нейропротективным и антиспастическим действием, замедляющих и тормозящих глутаматергическую нейротрансмиссию и прогрессирование нейродегенеративных процессов, и предназначенных для терапии когнитивных нарушений сосудистого происхождения..
ИСТОЧНИКИ ИНФОРМАЦИИ:
1. Патент РФ на изобретение №2429851 «КОМПОЗИЦИИ, СОДЕРЖАЩИЕ PUFA И/ИЛИ УРИДИН, И СПОСОБЫ ИХ ПРИМЕНЕНИЯ», патентообладатель: "МАССАЧУСЕТС ИНСТИТЬЮТ ОФ ТЕКНОЛОДЖИ" (US), опубликован: 27.09.2011, МПК: A61K 31/685, A61P 25/28.
2. Патент РФ на изобретение №2603470 «СПОСОБ И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ ДЛЯ ЛЕЧЕНИЯ БОЛЕЗНИ АЛЬЦГЕЙМЕРА И РАССТРОЙСТВ, НАРУШЕНИЙ ИЛИ ПОТЕРИ ПАМЯТИ», патентообладатель: "МАССАЧУСЕТС ИНСТИТЬЮТ ОФ ТЕКНОЛОДЖИ" (US), опубликован: 27.11.2016, МПК: A61K 31/685, A61P 25/28.
3. Патент РФ на изобретение №2605339 «СРЕДСТВО ДЛЯ КУПИРОВАНИЯ ГЛУТАМАТ-ИНДУЦИРОВАННОГО АПОПТОЗА И ИНГИБИРОВАНИЯ NMDA-РЕЦЕПТОРОВ, ОБЛАДАЮЩЕЕ ИММУНОМОДУЛИРУЮЩИМ ДЕЙСТВИЕМ, ДЛЯ ЛЕЧЕНИЯ РАССТРОЙСТВ НЕРВНОЙ СИСТЕМЫ, ПОСЛЕДСТВИЙ ЧЕРЕПНО-МОЗГОВОЙ ТРАВМЫ И ИШЕМИЧЕСКОГО И ГЕМОРРАГИЧЕСКОГО ИНСУЛЬТА», патентообладатель: Закрытое акционерное общество "ЭкоФармПлюс" (RU), опубликован: 20.12.2016, МПК: A61K 31/7068, A61K 31/13, A61K 47/48, A61P 9/10, A61P 25/00.
4. Патент РФ на изобретение №2371173 «МЕМАНТИН ДЛЯ ЛЕЧЕНИЯ БОЛЕЗНИ АЛЬЦГЕЙМЕРА ЛЕГКОЙ И ОТ ЛЕГКОЙ ДО УМЕРЕННОЙ СТЕПЕНИ ТЯЖЕСТИ», патентообладатель: "МЕРЦ ФАРМА ГМБХ УНД КО. КГАА" (DE), опубликован: 27.10.2009, МПК: A61K 31/13, A61P 25/28.
5. Патент РФ на изобретение №2326660 «ПЕРОРАЛЬНЫЙ ЛЕКАРСТВЕННЫЙ ПРЕПАРАТ МЕМАНТИН (ВАРИАНТЫ) И СПОСОБ ЕГО ПОЛУЧЕНИЯ (ВАРИАНТЫ)», патентообладатель: Закрытое акционерное общество "Биологические исследования и системы" (RU), опубликован: 20.06.2008, МПК: A61K 31/13, A61K 9/48, A61P 25/28.
6. Патент РФ на изобретение №2404750 «КОМПОЗИЦИЯ, СОДЕРЖАЩАЯ ОСНОВУ ИЛИ ПОКРЫТИЕ ДЛЯ ЗАМЕДЛЕННОГО ВЫСВОБОЖДЕНИЯ И АНТАГОНИСТ NMDA РЕЦЕПТОРА, СПОСОБ ВВЕДЕНИЯ ТАКОГО NMDA АНТАГОНИСТА СУБЪЕКТУ», патентообладатель: "АДАМАС ФАРМАСЬЮТИКАЛС, ИНК." (US), опубликован: 27.11.2010, МПК: A61K 9/20, A61P 25/28.
7. Патент РФ на изобретение №2483715 «ТВЕРДАЯ ЛЕКАРСТВЕННАЯ ФОРМА ПРЕПАРАТОВ МЕМАНТИНА И ЕГО СОЛЕЙ», патентообладатель: Общество с ограниченной ответственностью "АКАДЕМФАРМ" (RU), опубликован: 10.06.2013, МПК: A61K 31/13, A61K 47/38, A61K 9/16, A61K 9/20, A61P 25/16.
8. Патент РФ на изобретение №2390354 «ПРЕПАРАТ МАТРИЧНОГО ТИПА С ЗАМЕДЛЕННЫМ ВЫСВОБОЖДЕНИЕМ, СОДЕРЖАЩИЙ ОСНОВНОЕ ЛЕКАРСТВЕННОЕ СРЕДСТВО ИЛИ ЕГО СОЛЬ, И СПОСОБ ЕГО ПОЛУЧЕНИЯ», патентообладатель: "ЭЙСАЙ Ар энд Ди МЕНЕДЖМЕНТ КО., ЛТД." (JP), опубликован: 27.05.2010, МПК: A61K 47/32, A61K 9/26, A61K 31/445, A61J 3/10.
9. Руководство по проведению доклинических исследований лекарственных средств. Часть первая / под ред. А.Н. Миронова ‒ М.: "Гриф и К", 2012. ‒ 944 c.
10. Morris R. Developments of a water-maze procedure for studying spatial learning in the rat // J Neurosci Methods. ‒ 1984. ‒ Vol. 11, No 1. ‒ P. 47-60.
Группа изобретений относится к области медицины, в частности к неврологии, и раскрывает фармацевтическую композицию, обладающую нейромодулирующим, противопаркинсоническим, нейропротективным и антиспастическим действием, предназначенную для терапии когнитивных нарушений сосудистого происхождения, замедляющую и тормозящую глутаматергическую нейротрансмиссию и прогрессирование нейродегенеративных процессов, включающую мемантина гидрохлорид в интервале значений 5-20 мг и цитиколина мононатриевую соль в интервале значений 450-550 мг, при следующем соотношении количественного и качественного состава ингредиентов фармацевтической композиции, мас.%: цитиколина мононатриевая соль 65,95-69,95; мемантина гидрохлорид 0,67-2,50; целлюлоза микрокристаллическая 0,63-5,13; гидроксипропилметилцеллюлоза (молекулярная масса 1000000) 17,23-17,80; кремния диоксид коллоидный 0,91-1,0; магния стеарат 0,91-1,0; пленочная оболочка I 3,00-7,00; пленочная оболочка II 1,00-2,00 (варианты). Также раскрыты твердые пероральные лекарственные формы (варианты), способы получения твердой пероральной лекарственной формы (варианты), лекарственные препараты в форме таблетки с модифицированным высвобождением (варианты), применение твердой пероральной лекарственной формы и применение способа. Технический результат, обеспечиваемый группой изобретений, заключается в повышении терапевтической активности цитиколина, упрощении терапии когнитивных нарушений сосудистого происхождения, снижении побочных эффектов и устойчивости лекарственных форм при изготовлении и их стабильности при хранении. 13 н. и 22 з.п. ф-лы, 8 табл.
1. Фармацевтическая композиция, обладающая нейромодулирующим, противопаркинсоническим, нейропротективным и антиспастическим действием, предназначенная для терапии когнитивных нарушений сосудистого происхождения, замедляющая и тормозящая глутаматергическую нейротрансмиссию и прогрессирование нейродегенеративных процессов, включающая мемантина гидрохлорид в интервале значений 5-20 мг и цитиколинмононатриевую соль в интервале значений 450-550 мг при следующем соотношении количественного и качественного состава ингредиентов фармацевтической композиции, мас.%:
2. Фармацевтическая композиция по п. 1, отличающаяся тем, что пленочная оболочка I выполнена из смеси гидроксипропилметилцеллюлозы, титана диоксида и макрогола.
3. Фармацевтическая композиция по п. 1, отличающаяся тем, что пленочная оболочка II выполнена из смеси поливинилового спирта, талька, макрогола, оксидов железа и титана диоксида.
4. Фармацевтическая композиция, обладающая нейромодулирующим, противопаркинсоническим, нейропротективным и антиспастическим действием, предназначенная для терапии когнитивных нарушений сосудистого происхождения, замедляющая и тормозящая глутаматергическую нейротрансмиссию и прогрессирование нейродегенеративных процессов, включающая мемантина гидрохлорид в интервале значений 5-20 мг и цитиколина мононатриевую соль в интервале значений 450-550 мг при следующем соотношении количественного и качественного состава ингредиентов фармацевтической композиции, мг:
5. Фармацевтическая композиция по п. 3, отличающаяся тем, что пленочная оболочка I выполнена из смеси гидроксипропилметилцеллюлозы, титана диоксида и макрогола.
6. Фармацевтическая композиция по п. 3, отличающаяся тем, что пленочная оболочка II выполнена из смеси поливинилового спирта, талька, макрогола, оксидов железа и титана диоксида.
7. Твердая пероральная лекарственная форма, обладающая нейромодулирующим, противопаркинсоническим, нейропротективным и антиспастическим действием, предназначенная для терапии когнитивных нарушений сосудистого происхождения, замедляющая и тормозящая глутаматергическую нейротрансмиссию и прогрессирование нейродегенеративных процессов, включающая в качестве действующих веществ мемантин или его фармацевтически приемлемую соль в интервале значений 5,00-20,00 мг и цитиколин или его фармацевтически приемлемую соль в интервале значений 450-550 мг, отличающаяся тем, что указанная лекарственная форма выполнена в форме таблетки модифицированного высвобождения, покрытой пленочной оболочкой.
8. Твердая пероральная лекарственная форма, обладающая нейромодулирующим, противопаркинсоническим, нейропротективным и антиспастическим действием, предназначенная для терапии когнитивных нарушений сосудистого происхождения, замедляющая и тормозящая глутаматергическую нейротрансмиссию и прогрессирование нейродегенеративных процессов, включающая в качестве действующих веществ мемантина гидрохлорид в интервале значений 5,00-20,00 мг и цитиколина мононатриевую соль в интервале значений 450-550 мг, отличающаяся тем, что указанная лекарственная форма выполнена в форме таблетки модифицированного высвобождения, покрытой пленочной оболочкой, при следующем количественном и качественном составе ингредиентов в пересчете на 1 таблетку, мас.%:
9. Твердая пероральная лекарственная форма по п. 8, отличающаяся тем, что пленочная оболочка I выполнена из смеси гидроксипропилметилцеллюлозы, титана диоксида и макрогола.
10. Твердая пероральная лекарственная форма по п. 8, отличающаяся тем, что пленочная оболочка II выполнена из смеси поливинилового спирта, талька, макрогола, оксидов железа и титана диоксида.
11. Твердая пероральная лекарственная форма, обладающая нейромодулирующим, противопаркинсоническим, нейропротективным и антиспастическим действием, предназначенная для терапии когнитивных нарушений сосудистого происхождения, замедляющая и тормозящая глутаматергическую нейротрансмиссию и прогрессирование нейродегенеративных процессов, включающая в качестве действующих веществ мемантина гидрохлорид в интервале значений 5,00-20,00 мг и цитиколина мононатриевую соль в интервале значений 450-550 мг, отличающаяся тем, что указанная лекарственная форма выполнена в форме таблетки модифицированного высвобождения, покрытой пленочной оболочкой, при следующем количественном и качественном составе ингредиентов в пересчете на 1 таблетку, мг:
12. Твердая пероральная лекарственная форма по п. 11, отличающаяся тем, что пленочная оболочка I выполнена из смеси гидроксипропилметилцеллюлозы, титана диоксида и макрогола.
13. Твердая пероральная лекарственная форма по п. 11, отличающаяся тем, что пленочная оболочка II выполнена из смеси поливинилового спирта, талька, макрогола, оксидов железа и титана диоксида.
14. Способ получения твердой пероральной лекарственной формы по любому из пп. 7-13, отличающийся тем, что магния стеарат, цитиколина мононатриевую соль, мемантина гидрохлорид, целлюлозу микрокристаллическую, гидроксипропилметилцеллюлозу, кремния диоксид коллоидный просеивают через сито с диаметром ячейки не более 0,5 мм, затем загружают в миксер-гранулятор или аналогичное перемешивающее устройство цитиколина мононатриевую соль, целлюлозу микрокристаллическую и гидроксипропилметилцеллюлозу, перемешивают до однородного состояния в течение времени, составляющего от 2 до 10 мин, при скорости перемешивания 160-240 об/мин, далее при постоянном перемешивании смеси в течение не более чем 5 мин, при скорости перемешивания 150-400 об/мин, увлажняют смесь водой очищенной с получением гранулята, после чего полученный гранулят подвергают сушке в условиях псевдоожиженного слоя с поддержанием следующих параметров: температура входящего воздуха 45-65°С, остаточная влажность гранулята от 2,5 до 4,5%, далее полученную смесь опудривают кремния диоксидом коллоидным и магний стеаратом, затем полученную смесь подвергают таблетированию на роторном таблеточном прессе с получением ядер таблеток, используя пресс-инструмент диаметром от 10 до 15 мм, при этом процесс таблетирования контролируют по следующим параметрам: твердость - 150-290 Н, истираемость - не более 1,0%, высота - не более 7,0 мм, далее на полученные ядра таблеток наносят пленочную оболочку I, выполненную из смеси гидроксипропилметилцеллюлозы, титана диоксида и макрогола, при этом в процессе растворения пленочной оболочки I добавляют частями фармацевтическую субстанцию мемантина гидрохлорида и перемешивают до образования однородной суспензии, после чего осуществляют нанесение полученной пленочной оболочки I на ядро таблетки при температуре ядра таблетки 35-40°С и периодическом перемешивании, затем готовят раствор пленочной оболочки II, выполненной из смеси поливинилового спирта, талька, макрогола, оксидов железа и титана диоксида, и наносят его на таблетки при тех же условиях, что и пленочную оболочку I.
15. Способ по п. 14, отличающийся тем, что используют целлюлозу микрокристаллическую марки 101.
16. Способ по п. 14, отличающийся тем, что используют кремния диоксид коллоидный марки А 200.
17. Способ по п. 14, отличающийся тем, что нанесение пленочной оболочки I на ядро таблетки осуществляют в барабане коатера.
18. Способ получения лекарственной формы на основе фармацевтической композиции, охарактеризованной по любому из пп. 1-6, отличающийся тем, что магния стеарат, цитиколина мононатриевую соль, мемантина гидрохлорид, целлюлозу микрокристаллическую, гидроксипропилметилцеллюлозу, кремния диоксид коллоидный просеивают через сито с диаметром ячейки не более 0,5 мм, затем загружают в миксер-гранулятор или аналогичное перемешивающее устройство цитиколина мононатриевую соль, целлюлозу микрокристаллическую и гидроксипропилметилцеллюлозу, перемешивают до однородного состояния в течение времени, составляющего от 2 до 10 мин, при скорости перемешивания 160-240 об/мин, и далее при постоянном перемешивании смеси в течение не более чем 5 мин, при скорости перемешивания 150-400 об/мин увлажняют смесь водой очищенной с получением гранулята, после чего полученный гранулят подвергают сушке в условиях псевдоожиженного слоя с поддержанием следующих параметров: температура входящего воздуха 45-65°С, остаточная влажность гранулята от 2,5 до 4,5%, полученный гранулят просеивают через сито с диаметром ячейки не более 1,0 мм, далее полученную смесь опудривают кремния диоксидом коллоидным в течение от 3 до 5 мин, затем к смеси добавляют часть гидроксипропилметилцеллюлозы, перемешивают еще от 8 до 10 мин, затем добавляют магния стеарат и перемешивают еще 2-3 мин, получая таким образом смесь для таблетирования, затем указанную смесь подвергают таблетированию на роторном таблеточном прессе с получением ядер таблеток, используя пресс-инструмент диаметром от 10 до 15 мм, при этом процесс таблетирования контролируют по следующим параметрам: твердость - 150-290 Н, истираемость - не более 1,0%, высота - не более 7,0 мм, далее на полученные таблетки-ядра наносят пленочную оболочку I, в процессе растворения пленочной оболочки I добавляют частями фармацевтическую субстанцию мемантина гидрохлорид и перемешивают до образования однородной суспензии, после чего осуществляют нанесение полученной пленочной оболочки I на ядро таблетки при температуре ядра таблетки 35-40°С и периодическом перемешивании, затем готовят раствор пленочной оболочки II, выполненной из смеси поливинилового спирта, талька, макрогола, оксидов железа и титана диоксида, и наносят его на таблетки при тех же условиях, что и пленочную оболочку I.
19. Способ по п. 18, отличающийся тем, что нанесение пленочной оболочки I на ядро таблетки осуществляют в барабане коатера.
20. Способ по п. 18, отличающийся тем, что в качестве целлюлозы микрокристаллической используют целлюлозу микрокристаллическую марки 101.
21. Способ по п. 18, отличающийся тем, что в качестве кремния диоксида коллоидного используют кремния диоксид коллоидный марки А 200.
22. Лекарственный препарат в форме таблетки с модифицированным высвобождением, обладающий нейромодулирующим, противопаркинсоническим, нейропротективным и антиспастическим действием, предназначенный для терапии когнитивных нарушений сосудистого происхождения, замедляющих и тормозящих глутаматергическую нейротрансмиссию и прогрессирование нейродегенеративных процессов, включающий в качестве действующих веществ цитиколина мононатриевую соль и мемантина гидрохлорид, целлюлозу микрокристаллическую - в качестве наполнителя, гипромеллозу - в качестве матричного агента, кремния диоксид коллоидный - в качестве глиданта, магния стеарат в качестве лубриканта, пленочную оболочку в качестве оболочки и носителя при следующем количественном и качественном составе ингредиентов лекарственной формы в пересчете на 1 таблетку, мас.%:
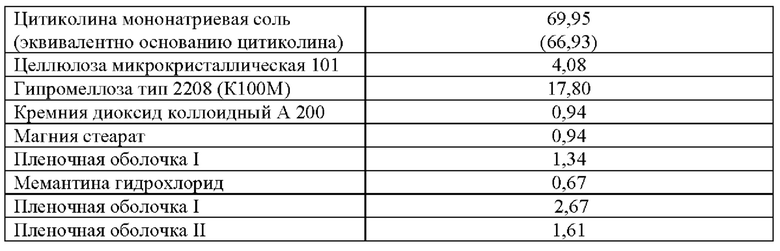
23. Лекарственный препарат по п. 22, отличающийся тем, что пленочная оболочка I выполнена из смеси гидроксипропилметилцеллюлозы, титана диоксида и макрогола.
24. Лекарственный препарат по п. 22, отличающийся тем, что пленочная оболочка II выполнена из смеси поливинилового спирта, талька, макрогола, оксидов железа и титана диоксида.
25. Лекарственный препарат в форме таблетки с модифицированным высвобождением, обладающий нейромодулирующим, противопаркинсоническим, нейропротективным и антиспастическим действием, предназначенный для терапии когнитивных нарушений сосудистого происхождения, замедляющих и тормозящих глутаматергическую нейротрансмиссию и прогрессирование нейродегенеративных процессов, включающий в качестве действующих веществ цитиколин натрия и мемантина гидрохлорид, целлюлозу микрокристаллическую в качестве наполнителя, гипромеллозу в качестве матричного агента, кремния диоксид коллоидный в качестве глиданта, магния стеарат в качестве лубриканта, пленочную оболочку в качестве оболочки и носителя при следующем количественном и качественном составе ингредиентов лекарственной формы в пересчете на 1 таблетку, мг:
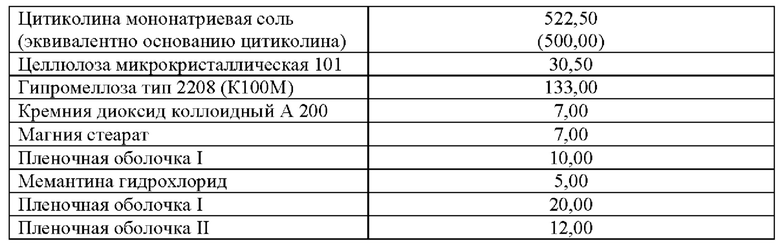
26. Лекарственный препарат по п. 25, отличающийся тем, что пленочная оболочка I выполнена из смеси гидроксипропилметилцеллюлозы, титана диоксида и макрогола.
27. Лекарственный препарат по п. 25, отличающийся тем, что пленочная оболочка II выполнена из смеси поливинилового спирта, талька, макрогола, оксидов железа и титана диоксида.
28. Лекарственный препарат в форме таблетки с модифицированным высвобождением, обладающий нейромодулирующим, противопаркинсоническим, нейропротективным и антиспастическим действием, предназначенный для терапии когнитивных нарушений сосудистого происхождения, замедляющих и тормозящих глутаматергическую нейротрансмиссию и прогрессирование нейродегенеративных процессов, включающий в качестве действующих веществ цитиколин натрия и мемантина гидрохлорид, целлюлозу микрокристаллическую - в качестве наполнителя, гипромеллозу - в качестве матричного агента, кремния диоксид коллоидный в качестве глиданта, магния стеарат в качестве лубриканта, пленочную оболочку в качестве оболочки и носителя при следующем количественном и качественном составе ингредиентов лекарственной формы в пересчете на 1 таблетку, мас.%:
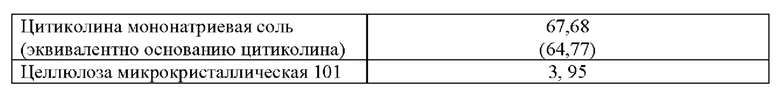
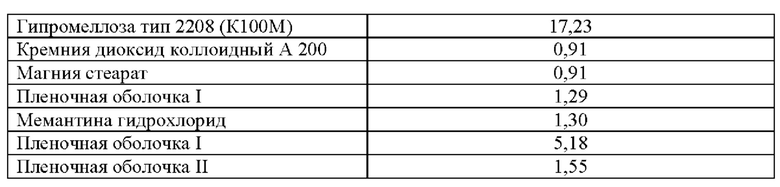
29. Лекарственный препарат по п. 28, отличающийся тем, что пленочная оболочка I выполнена из смеси гидроксипропилметилцеллюлозы, титана диоксида и макрогола.
30. Лекарственный препарат по п. 28, отличающийся тем, что пленочная оболочка II выполнена из смеси поливинилового спирта, талька, макрогола, оксидов железа и титана диоксида.
31. Лекарственный препарат в форме таблетки с модифицированным высвобождением, обладающий нейромодулирующим, противопаркинсоническим, нейропротективным и антиспастическим действием, предназначенный для терапии когнитивных нарушений сосудистого происхождения, замедляющих и тормозящих глутаматергическую нейротрансмиссию и прогрессирование нейродегенеративных процессов, включающий цитиколин натрия и мемантина гидрохлорид в качестве фармацевтической субстанции, целлюлозу микрокристаллическую в качестве наполнителя, гипромеллозу в качестве матричного агента, кремния диоксид коллоидный в качестве глиданта, магния стеарат в качестве лубриканта, пленочную оболочку в качестве оболочки и носителя при следующем количественном и качественном составе ингредиентов лекарственной формы в пересчете на 1 таблетку, мг:
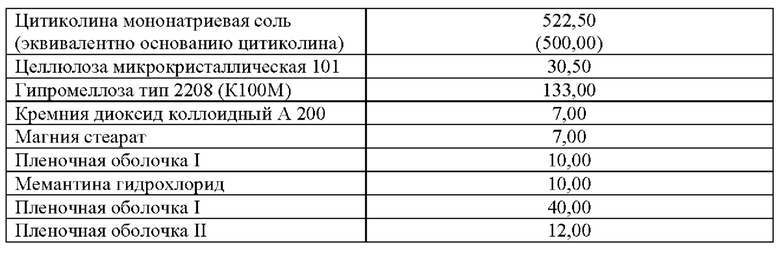
32. Лекарственный препарат по п. 31, отличающийся тем, что пленочная оболочка I выполнена из смеси гидроксипропилметилцеллюлозы, титана диоксида и макрогола.
33. Лекарственный препарат по п. 31, отличающийся тем, что пленочная оболочка II выполнена из смеси поливинилового спирта, талька, макрогола, оксидов железа и титана диоксида.
34. Применение твердой пероральной лекарственной формы по любому из пп. 7-13 для терапии когнитивных нарушений сосудистого происхождения.
35. Применение способа по любому из пп. 14-21 для получения лекарственной формы для терапии когнитивных нарушений сосудистого происхождения.
| AU 2005201251 B2, 27.04.2006 | |||
| ПИЛИПОВИЧ А.А | |||
| Мемантин в терапии когнитивных расстройств, Доктор.Ру | |||
| Неврология | |||
| Психиатрия, 2017, N 8, 137, С | |||
| Устройство для выпрямления многофазного тока | 1923 |
|
SU50A1 |
| US 20140050784 A1, 20.02.2014 | |||
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ ДЛЯ ПРОФИЛАКТИКИ И ЛЕЧЕНИЯ ПСИХИЧЕСКИХ, ПОВЕДЕНЧЕСКИХ, КОГНИТИВНЫХ РАССТРОЙСТВ | 2012 |
|
RU2488388C1 |
| WO 2008066716 A2, 05.06.2008 | |||
| КОМПОЗИЦИЯ, СОДЕРЖАЩАЯ СРЕДСТВО ПРОТИВ ДЕМЕНЦИИ | 2006 |
|
RU2445092C2 |
Авторы
Даты
2023-12-27—Публикация
2020-07-29—Подача