Область техники настоящего изобретения
Настоящее изобретение относится к биотехнологии. Настоящее изобретение относится к способу получения популяции дофаминергических нейронов из черной субстанции мышей, предусматривающему получение ткани черной субстанции у мышей, инкубирование полученной ткани с красителем GBR-BP, диссоциацию окрашенной ткани с получением клеточной суспензии с частично диссоциированной тканью, инкубирование полученной клеточной суспензии с частично диссоциированной тканью совместно с красителями DRAQ5 и GBR-BP, повторную диссоциацию окрашенной клеточной суспензии с частично диссоциированной тканью с получением окрашенной клеточной суспензии и сортировку DRAQ5+/GBR-BP+ клеток полученной окрашенной клеточной суспензии посредством сортировки флуоресцентно-активированных клеток с получением популяции дофаминергических нейронов из черной субстанции. Кроме того, настоящее изобретение относится к применению популяции дофаминергических нейронов, полученной указанным способом, для молекулярно-биологического анализа в норме и при патологии, в частности, для оценки уровня экспрессии генов у мышей в норме и на модели болезни Паркинсона, а также сравнения профилей экспрессии генов в целой ткани и в полученной популяции дофаминергических нейронов.
Включение посредством ссылки
Предпосылки к созданию настоящего изобретения были раскрыты авторами настоящего изобретения ранее в публикации Трошев Д.В., Блохин В.Е., Угрюмов М.В., «Разработка метода получения фракции дофаминергических нейронов для молекулярно-биологических исследований», Материалы Конференции молодых ученых «Актуальные проблемы биологии развития», 12-14 октября 2021 г., Москва, ИБР РАН. -М. Издательство Перо, 2021, 69-70. Указанная публикация включена в настоящий документ посредством ссылки во всей своей полноте и не является обстоятельством, препятствующим признанию патентоспособности настоящего изобретения, так как настоящая заявка на выдачу патента на изобретение подана в федеральный орган исполнительной власти по интеллектуальной собственности до истечения шести месяцев со дня раскрытия информации. Все остальные публикации, патенты и заявки на выдачу патента, упомянутые в настоящем описании, включены в настоящий документ посредством ссылки в той же степени, как если бы каждая отдельная публикация, патент или заявка на выдачу патента была специально и отдельно указана как включенная посредством ссылки.
Предшествующий уровень техники настоящего изобретения
Болезнь Паркинсона (БП) представляет собой возрастзависимое нейродегенеративное заболевание, которое характеризуется избирательной гибелью дофаминергических нейронов компактной части черной субстанции с накоплением в них аномальной формы синаптического белка α-синуклеина, а также патологией нигростриатного дофаминергического пути. Результатом снижения уровня дофамина в полосатом теле при БП является ряд двигательных расстройств, таких как брадикинезия, мышечная ригидность и другие. Широкая распространенность БП, инвалидизация больных, большие финансовые затраты на лечение и реабилитацию делают это заболевание социально значимым.
Важной особенностью этого заболевания является длительный скрытый период, в связи с чем необходима разработка ранней доклинической диагностики.
Учитывая то, что дофаминергические нейроны нигростриатной системы головного мозга являются ключевым звеном центральной регуляции моторной функции, а их гибель приводит к развитию БП, изучение молекулярных механизмов функционирования, дегенерации и «пластичности» этих нейронов в норме и при патологии имеет большое значение. Общепринято, что моторные симптомы (тремор и брадикинезия), по которым диагностируют БП, появляются только через 20-30 лет после начала заболевания при достижении определенного порога деградации нигростриатной дофаминергической системы, состоящего в снижении дофамина в стриатуме на 70% - 80% и потере 50% - 60% дофаминергических нейронов в черной субстанции (ЧС). Неудивительно, что симптоматическое лечение больных с помощью агонистов дофамина на этой клинической стадии заболевания, малоэффективно, а попытки использовать нейропротекторное лечение, предотвращающее гибель нейронов, не дали ощутимого результата.
Таким образом, разработка ранней доклинической диагностики открывает широкие перспективы для разработки нейропротекторного лечения БП, обеспечивающего замедление гибели дофаминергических нейронов, а, следовательно, и продление периода бессимптомного развития заболевания, т.е. периода сохранения нормальной физической и социальной активности больного.
В соответствии с методологией трансляционной медицины разработка инновационных технологий диагностики и терапии должна осуществляться на основе фундаментальных знаний о клеточных и молекулярных механизмах патологии. Учитывая то, что при БП получение биологических образцов (гуморальные среды, биопсия тканей) у больных для проведения фундаментальных исследований крайне ограничено, а на доклинической стадии заболевания невозможно, исследования молекулярных механизмов патогенеза проводят в основном на моделях постадийного развития этого заболевания у животных и клеточных моделях.
При изучении молекулярных механизмов патогенеза БП наиболее важными являются фундаментальные знания о функционировании, гибели и компенсаторных возможностях нигростриатных дофаминергических нейронов. В этом контексте особое значение имеют такие показатели как экспрессия генов и синтез функционально значимых белков. Если экспрессию генов и синтез таких белков, как тирозингидроксилаза (TH) и дофаминовый транспортер (DAT), специфических для дофаминергических нейронов, можно оценивать с помощью метода полимеразной цепной реакции и вестерн-блота в гомогенате ЧС, то экспрессию гораздо более широкого круга генов и уровень синтеза соответствующих белков, участвующих в нейротрансмиссии, нейродегенерации и нейропластичности, оценить избирательно в этих нейронах практически невозможно. Это объясняется тем, что наиболее многочисленные и не менее функционально значимые гены экспрессируются, а кодируемые ими белки синтезируются в ЧС не только в дофаминергических нейронах, но и в других нейронах и в клетках глии. К ним относятся, например, гены, кодирующие белки везикулярного транспорта - экзоцитоза и эндоцитоза - сопряженных процессов, обеспечивающих нейротрансмиссию.
Таким образом, существует потребность в способе получения популяции дофаминергических нейронов из черной субстанции мышей, а именно мышей в норме и при патологии, в целях эффективной оценки уровня экспрессии генов у животных в норме и на модели БП, получения возможности сравнивать профили экспрессии генов в целой ткани и в отдельной популяции дофаминергических нейронов, что приведет к получению новых ценных данных о протекании и сопряженности механизмов нейродегенерации и нейропластичности в ЧС при БП, и, таким образом, в целях эффективного молекулярно-биологического анализа.
На сегодняшний день известны протоколы иммуноокрашивания для идентификации дофаминергических нейронов, в частности, с целью обнаружения тирозингидроксилазы (TH), что активно используется при исследовании БП.
Например, в документе Adolfs, Youri, et al. «Protocol for tissue clearing and 3D analysis of dopamine neurons in the developing mouse midbrain», STAR protocols, 2021, 2(3): 100669, раскрыт протокол иммуноокрашивания дофаминергических нейронов.
В документе Chung, Chee Yeun et al. «Cell type-specific gene expression of midbrain dopaminergic neurons reveals molecules involved in their vulnerability and protection.» Human molecular genetics, 2015, 14(13): 1709-25, также раскрыта методика быстрого иммуноокрашивания тирозингидроксилазы (TH) для идентификации дофаминергических нейронов.
Однако методика иммуноокрашивания не позволяет получить популяцию дофаминергических нейронов.
Также известны способы оценки экспрессии генов. Так, например, согласно патентной заявке EP 1561814 дофаминергические нейроны определяли посредством обнаружения экспрессии специфического гена 65B13.
Кроме того, уже были предприняты попытки использования флуоресцентных красителей для обнаружения дофаминергических нейронов.
В документе Lin, John Y., et al. «Dendritic projections and dye-coupling in dopaminergic neurons of the substantia nigra examined in horizontal brain slices from young rats.» Journal of neurophysiology, 2003, 90(4): 2531-2535, описана методика исследования дофаминергических нейронов черной субстанции с применением смеси красителей: люциферного желтого (LY) и нейробиотина (NB). Использовались срезы головного мозга толщиной 400 мкм. Однако указанное окрашивание не привело к положительным результатам.
В патенте US 8198083 B1 раскрыто использование флуоресцентных красителей, таких как диацетат флуоресцеина (FDA) и йодид пропидия (PI), однако, получение популяции только дофаминергических нейронов не достигнуто.
Таким образом, все еще сохраняется потребность в эффективном способе получения популяции дофаминергических нейронов, а именно нефиксированной фракции дофаминергических нейронов нигростриатной системы головного мозга, в частности, из черной субстанции мышей в норме и при патологии, с целью эффективного проведения молекулярно-биологического анализа, возможности сравнивать профили экспрессии генов в целой ткани и в отдельной популяции дофаминергических нейронов, а также получения ценных данных о протекании и сопряженности механизмов нейродегенерации и нейропластичности в ЧС при БП.
Краткое раскрытие настоящего изобретения
Авторы изобретения предположили, что наиболее эффективным для получения популяции дофаминергических нейронов из черной субстанции мышей было бы применение метода сортировки клеток (FACS). Ранее FACS уже применяли для выделения GFP-меченных дофаминергических нейронов мезенцефалона мышей, однако никогда не использовали для сортировки дофаминергических нейронов ЧС. Для возможности применения этого метода необходимо обнаружение наиболее эффективных флуоресцентных красителей для окрашивания дофаминергических нейронов черной субстанции мышей. Авторами настоящего изобретения неожиданно было обнаружено, что использование комбинации красителей DRAQ5 и GBR-BP, а также использование определенной последовательности окрашивания, предусматривающей сначала окрашивание только GBR-BP, а затем окрашивание DRAQ5 и GBR-BP после предварительной стадии диссоциации, следующей за первой стадией окрашивания, обеспечивает эффективное получение популяции дофаминергических нейронов посредством сортировки флуоресцентно-активированных клеток. Более того, авторы настоящего изобретения разработали наиболее предпочтительные протоколы разработанного способа получения популяции дофаминергических нейронов из черной субстанции мышей, согласно которым содержание дофаминергических нейронов в полученной популяции составляет до 97%.
Согласно одному аспекту настоящее изобретение относится к способу получения популяции дофаминергических нейронов из черной субстанции мышей, предусматривающему:
- получение ткани черной субстанции у мышей,
- инкубирование полученной ткани с красителем GBR-BP,
- диссоциацию окрашенной ткани с получением клеточной суспензии с частично диссоциированной тканью,
- инкубирование полученной клеточной суспензии с частично диссоциированной тканью совместно с красителями DRAQ5 и GBR-BP,
- повторную диссоциацию окрашенной клеточной суспензии с частично диссоциированной тканью с получением окрашенной клеточной суспензии и
- сортировку DRAQ5+/GBR-BP+ клеток полученной окрашенной клеточной суспензии посредством сортировки клеток с получением популяции дофаминергических нейронов из черной субстанции.
Согласно предпочтительному варианту осуществления первого аспекта настоящего изобретения ткань черной субстанции получали из вибратомных срезов черной субстанции.
Согласно наиболее предпочтительному варианту осуществления первого аспекта настоящего изобретения вибратомные срезы черной субстанции имеют толщину 200 мкм.
Согласно другому варианту осуществления первого аспекта настоящего изобретения ткань черной субстанции получали из целой черной субстанции.
Согласно наиболее предпочтительному варианту осуществления первого аспекта настоящего изобретения краситель GBR-BP применяют при концентрации 50 нМ, а краситель DRAQ5 применяют при концентрации 10 мкМ.
Согласно другому варианту осуществления первого аспекта настоящего изобретения краситель GBR-BP применяют при концентрации 20 нМ, а краситель DRAQ5 применяют при концентрации 10 мкМ.
Согласно другому варианту осуществления первого аспекта настоящего изобретения краситель GBR-BP применяют при концентрации от 20 нМ до 50 нМ.
Согласно одному варианту осуществления первого аспекта настоящего изобретения ткань черной субстанции получают у мышей в норме.
Согласно другому варианту осуществления первого аспекта настоящего изобретения ткань черной субстанции получают у мышей при патологии.
Согласно другому варианту осуществления первого аспекта настоящего изобретения указанной патологией является модель болезни Паркинсона.
Согласно второму аспекту настоящее изобретение относится к применению популяции дофаминергических нейронов, полученной способом согласно первому аспекту настоящего изобретения, для молекулярно-биологического анализа в норме и при патологии.
Согласно одному варианту осуществления второго аспекта настоящего изобретения молекулярно-биологический анализ представляет собой оценку уровня экспрессии генов у мышей в норме и на модели болезни Паркинсона.
Согласно другому варианту осуществления второго аспекта настоящего изобретения молекулярно-биологический анализ представляет собой сравнение профилей экспрессии генов в целой ткани и в полученной популяции дофаминергических нейронов.
Краткое описание чертежей
Настоящее изобретение проиллюстрировано на следующих приложенных чертежах.
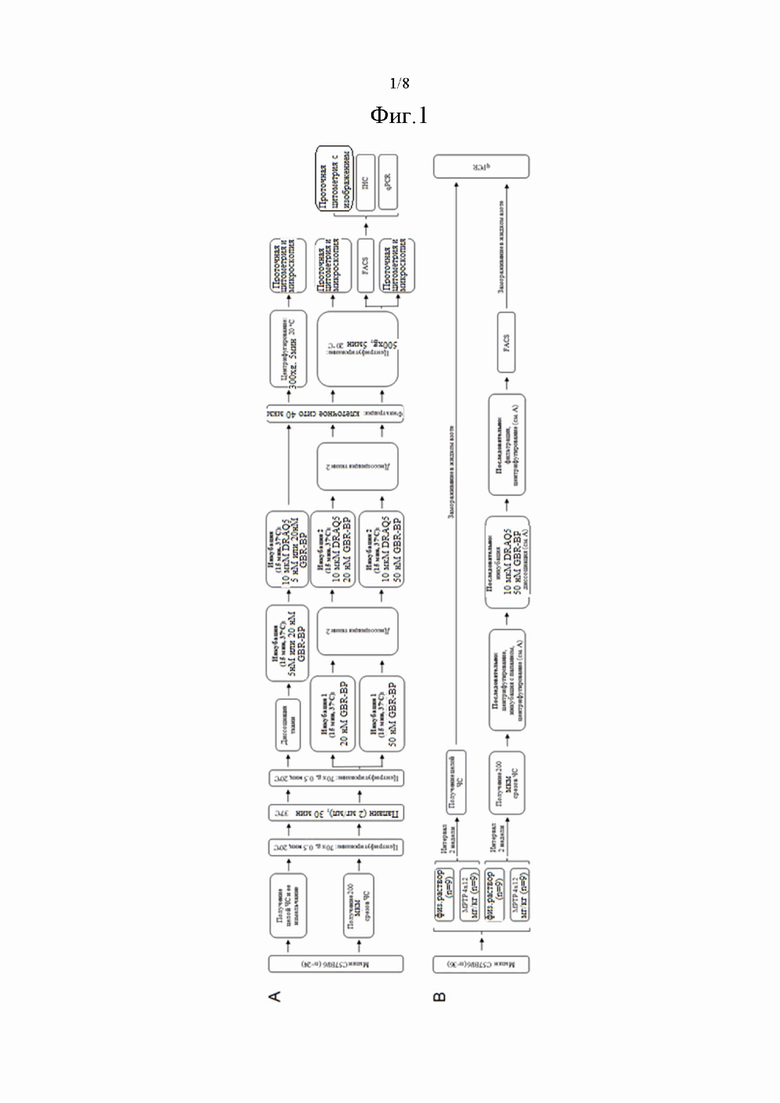
На фиг. 1 показан дизайн экспериментальных процедур, где на фиг. 1(A) проиллюстрирована разработка протокола получения фракции дофаминергических нейронов ЧС мышей, а на фиг.1 (B) показана оценка экспрессии генов белков-маркеров дофаминергических нейронов в целой ЧС и в отсортированных дофаминергических нейронах на модели ранней клинической стадии БП.
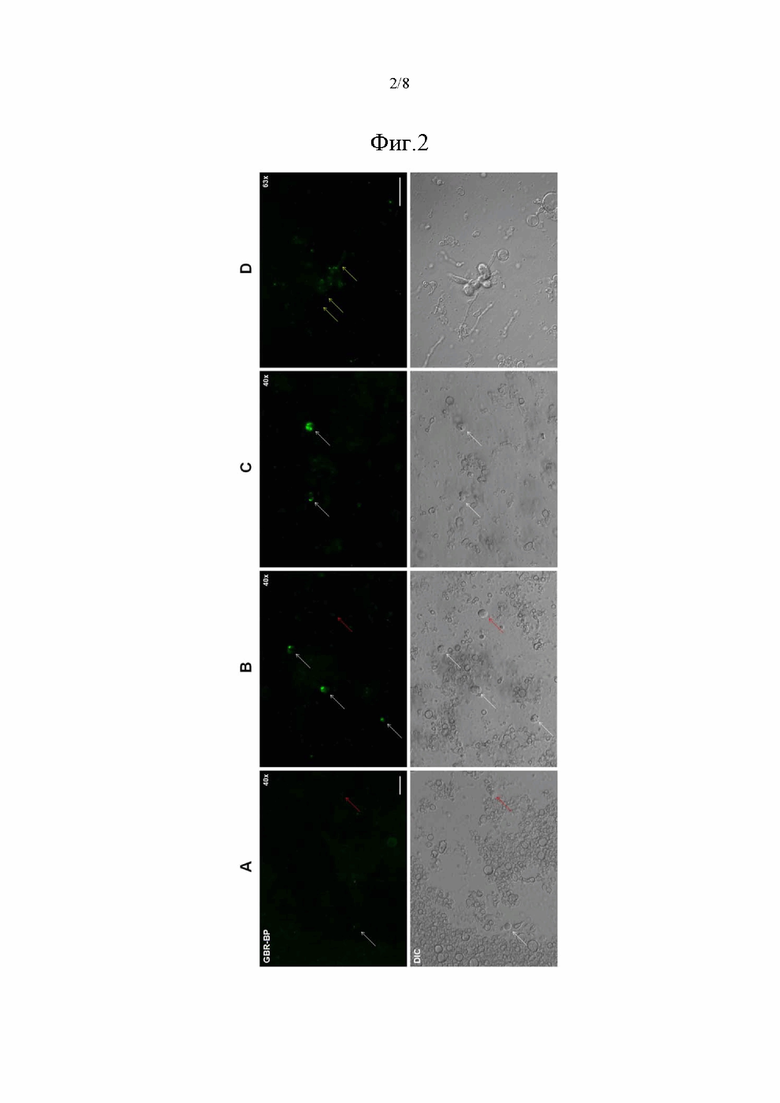
На фиг. 2 приведено сопоставление детектируемого флуоресцентного сигнала GBR-BP в клетках ЧС при разных способах окрашивания, где на фиг. 2(A) показано окрашивание клеточной суспензии 5 нМ GBR-BP, на фиг. 2(B) показано окрашивание срезов ЧС с 20 нМ GBR-BP с последующей диссоциацией ткани, на фиг. 2(C) показано окрашивание срезов ЧС с 50 нМ GBR-BP с последующей диссоциацией ткани, на фиг. 2(D) показано окрашивание клеток после инкубации срезов ЧС с 20 нМ GBR-BP и первой диссоциации ткани. Дополнительно представлены изображения клеток в DIC. Белыми стрелками отмечены GBR-BP-окрашенные клетки. Красными стрелками отмечены GBR-BP-неокрашенные клетки. Желтыми стрелками показана интернализация GBR-BP в нейритах, выявленная после первой стадии диссоциации срезов ЧС. Толщина срезов составляет 200 мкм. Масштабный отрезок составляет 20 мкм.
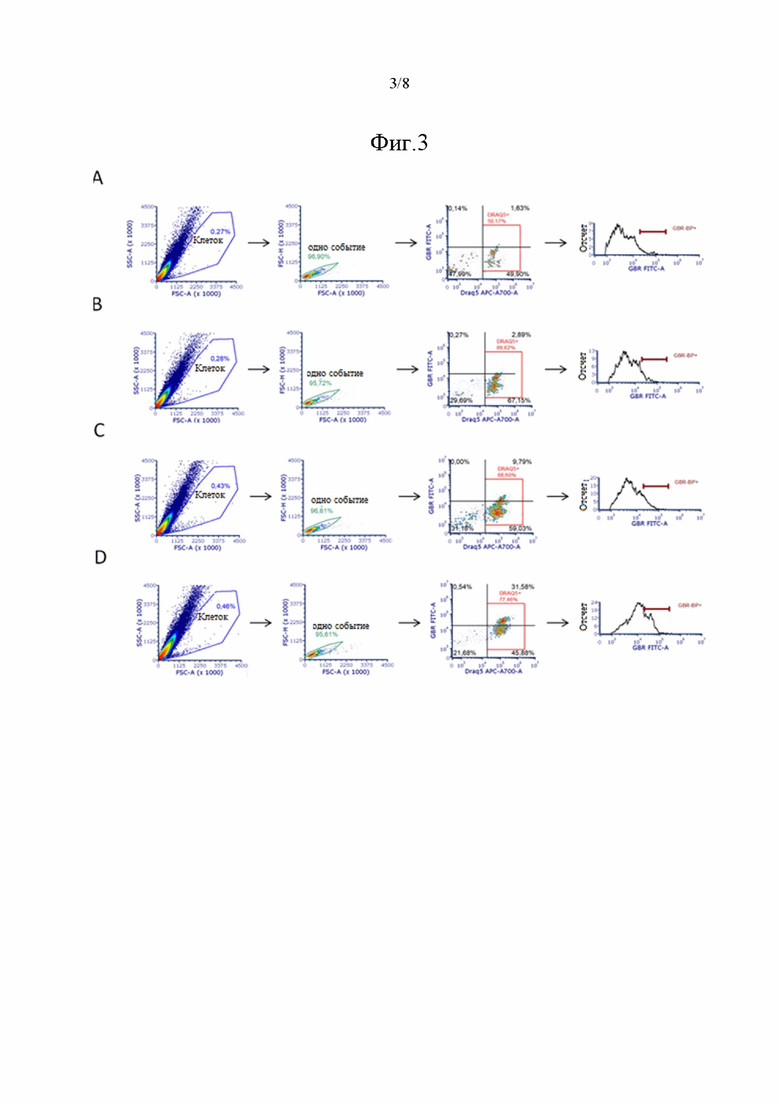
На фиг. 3 показано выделение окрашенных DRAQ5 и GBR-BP клеток ЧС головного мозга мыши при помощи проточной цитометрии. Стратегия выделения популяции окрашенных GBR-BP клеток является следующей: (А) в суспензии, окрашенной 10 мкМ DRAQ5 и 5 нМ GBR-BP, (B) в суспензии, окрашенной 10 мкМ DRAQ5 и 20 нМ GBR-BP, (C) в суспензии, полученной из срезов ЧС, окрашенных 10 мкМ DRAQ5 и 20 нМ GBR-BP, (D) в суспензии, полученной из срезов ЧС, окрашенных 10 мкМ DRAQ5 и 50 нМ GBR-BP. Толщина срезов составляет 200 мкм. Для каждой суспензии представлен анализ 200 000 событий.
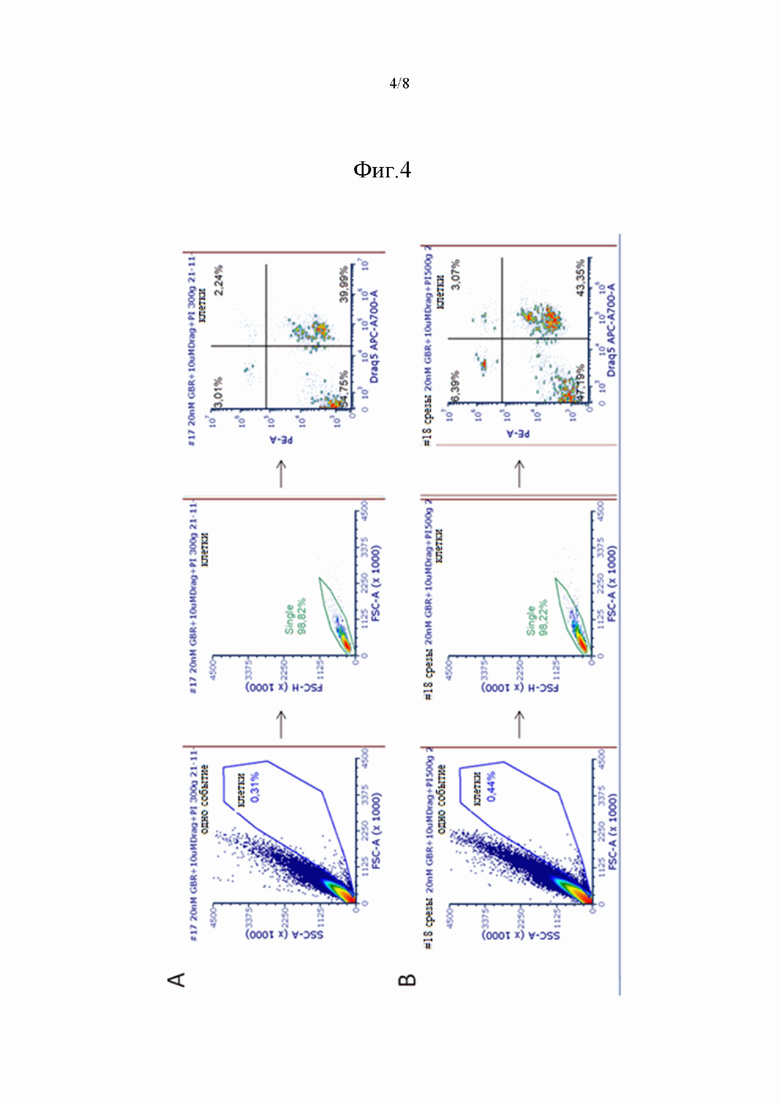
На фиг. 4 показан анализ выживаемости клеток при помощи проточной цитометрии. Стратегия выделения популяции окрашенных PI клеток является следующей: (А) в суспензии, окрашенной 10 мкМ DRAQ5, 20 нМ GBR-BP и 5 мкг/мл PI, (B) в суспензии, полученной из срезов ЧС, окрашенных 10 мкМ DRAQ5, 20 нМ GBR-BP и 5 мкг/мл PI. Толщина срезов составляет 200 мкм. Для каждой суспензии представлен анализ 200 000 событий.
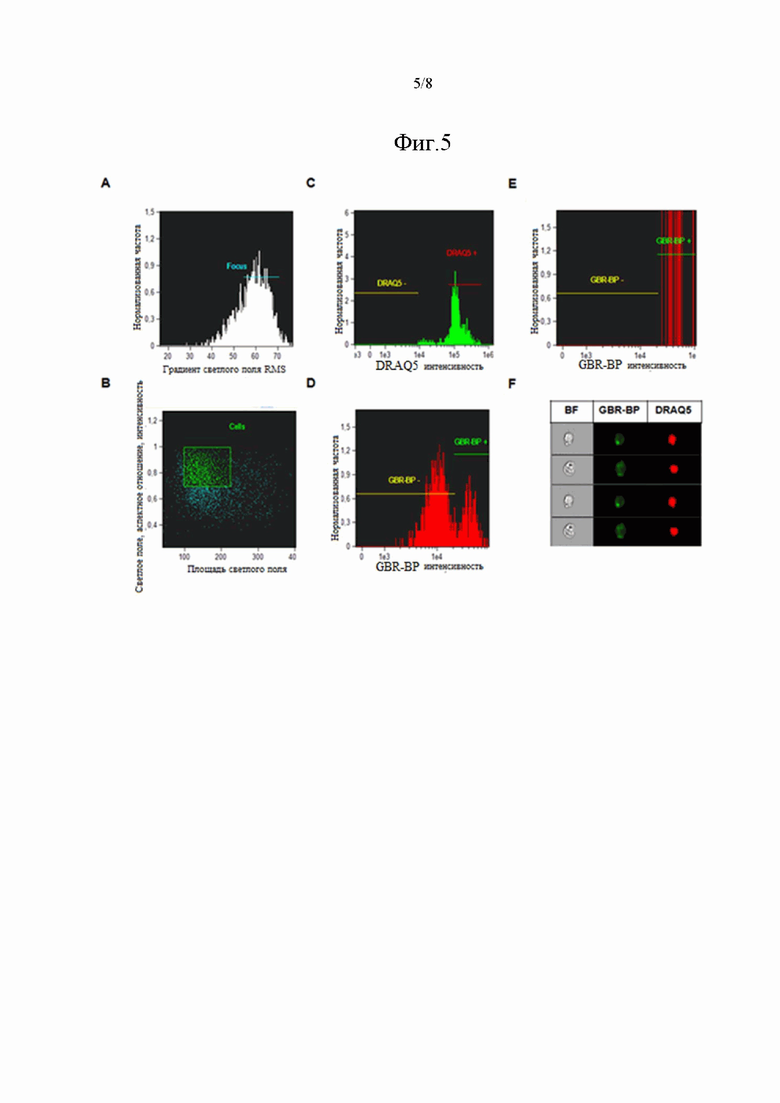
На фиг. 5 показана стратегия выделения границ, использованная для анализа окрашенных клеток в суспензии до сортинга и в отсортированной популяции окрашенных DRAQ5 и GBR-BP клеток, полученных из одной и той же клеточной суспензии, где стратегия является следующей: (A) используя функцию градиент RMS в канале BF, отображающую резкость изображения, были выбраны находящиеся в фокусе изображения, (B) используя функции площади и соотношения сторон в канале светлого поля, были выбраны единичные клетки, (C) выделение популяции клеток с окрашенным DRAQ5 ядром, (D) окрашенные GBR-BP клетки были выявлены на основании высокой сверхпороговой интенсивности флуоресценции GBR-BP в них, (E) выделение окрашенных GBR-BP клеток среди всех клеток с ядром в отсортированной клеточной суспензии и (F) изображения клеток в отсортированной клеточной популяции, окрашенной DRAQ5 и GBR-BP.
На фиг. 6 показано иммуноокрашивание отсортированной клеточной популяции. TH обозначена зеленым цветом, а ядро обозначено синим цветом (DAPI). Правое изображение объединяет изображения TH и DAPI. Масштабный отрезок составляет 20 мкм.
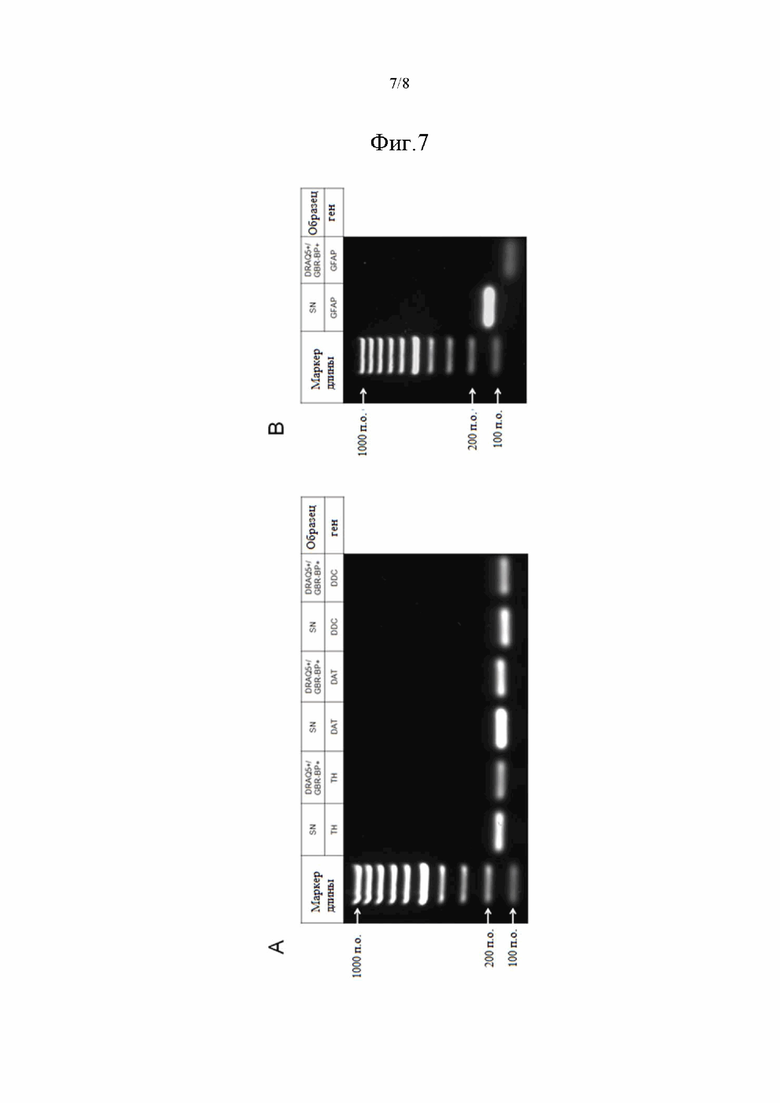
На фиг. 7 показана экспрессия маркеров дофаминергических нейронов (А), но не маркера астроцитов (В), окрашенными DRAQ5 и GBR-BP клетками, отсортированными с помощью FACS. В целой ЧС или в отсортированных клетках с помощью qPCR анализировали экспрессию основных фенотипических маркеров дофаминергических нейронов (TH, DAT, DDC) и маркера астроцитов (GFAP). Крайние левые полосы представляют собой маркеры длины ДНК.
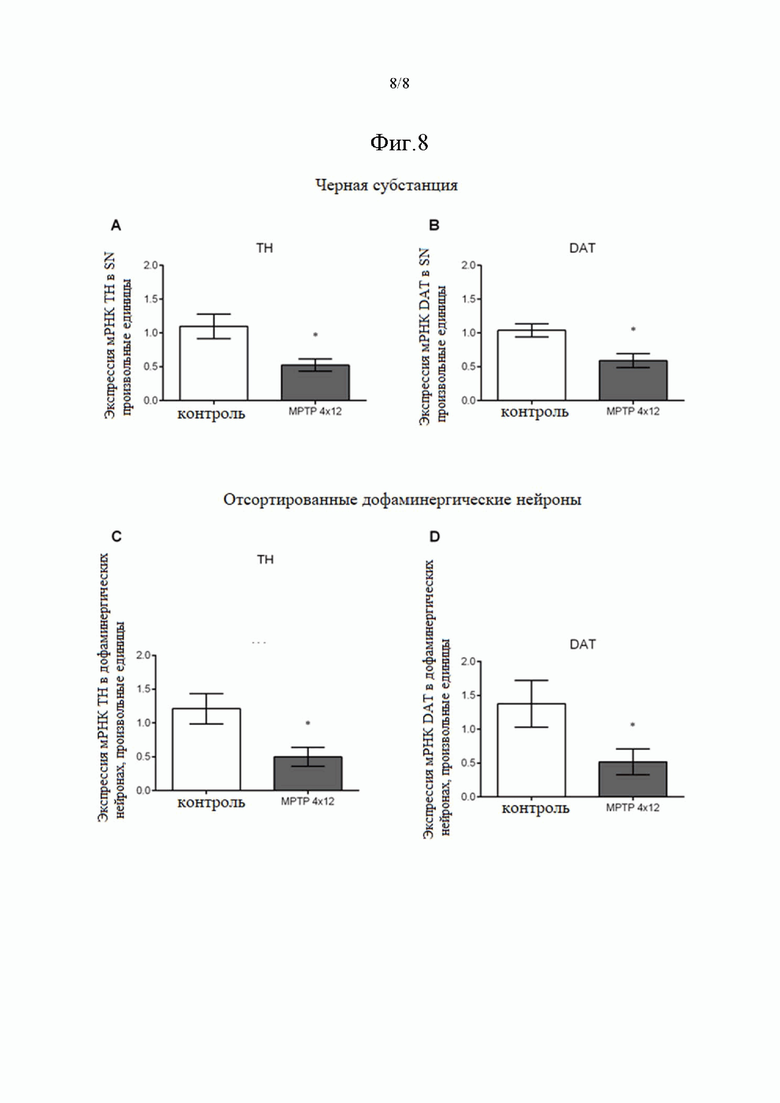
На фиг. 8. Показано изменение экспрессии мРНК TH и DAT в ЧС (А, B) и отсортированных дофаминергических нейронах (C, D) через две недели после введения MPTP или физиологического раствора мышам, где MPTP 4 × 12 означает мышей, получавших 4 инъекции по 12 мг/кг MPTP с 2-часовым интервалом между инъекциями. * p <0,05 по сравнению с контрольной группой. Данные представлены как среднее значение ± SEM. n = 9 для каждой группы.
Подробное раскрытие настоящего изобретения
Авторы настоящего изобретения предположили, что наиболее эффективным для получения популяции дофаминергических нейронов из черной субстанции мышей было бы применение метода сортировки флуоресцентно-активированных клеток. Для возможности применения данного метода необходимо обнаружение наиболее эффективных флуоресцентных красителей для окрашивания дофаминергических нейронов черной субстанции мышей. Авторами настоящего изобретения неожиданно было обнаружено, что использование комбинации красителей DRAQ5 и GBR-BP, а также использование определенной последовательности окрашивания, предусматривающей сначала окрашивание только GBR-BP, а затем окрашивание DRAQ5 и GBR-BP после предварительной стадии диссоциации, следующей за первой стадией окрашивания, обеспечивает эффективное получение популяции дофаминергических нейронов посредством сортировки клеток. Более того, авторы настоящего изобретения разработали наиболее предпочтительные протоколы способа получения популяции дофаминергических нейронов из черной субстанции мышей согласно настоящему изобретению.
Исходя из вышеизложенного, авторами настоящего изобретения были проведены исследования с целью разработки способа получения фракции нефиксированных дофаминергических нейронов нигростриатной системы головного мозга для молекулярно-биологического анализа в норме и при патологии. В ходе проведенных исследований авторами настоящего изобретения также были разработаны предпочтительные варианты осуществления способа согласно настоящему изобретению, а именно разработан оптимальный протокол выделения и диссоциации ЧС и подобраны оптимальные условия для прижизненного окрашивания дофаминергических нейронов в общей клеточной суспензии ЧС.
Как уже указано выше, авторами настоящего изобретения неожиданно было обнаружено, что использование комбинации красителей DRAQ5 и GBR-BP, а также использование определенной последовательности окрашивания, предусматривающей сначала окрашивание только GBR-BP, а затем окрашивание DRAQ5 и GBR-BP после предварительной стадии диссоциации, следующей за первой стадией окрашивания, обеспечивает эффективное получение популяции дофаминергических нейронов посредством сортировки клеток. Более того, авторами настоящего изобретения были получены доказательства, что отсортированные при помощи сортировки флуоресцентно-активированных клеток (FACS) клетки действительно являются дофаминергическими нейронами, а также были получены доказательства возможности использования фракции дофаминергических нейронов для оценки уровня экспрессии генов у животных в норме и при патологии, в частности на модели БП.
Флуоресцентный краситель (GBR-BP) представляет собой флуоресцентную молекулу, состоящую из лиганда (ингибитора) DAT - 1-(2-[бис(4-фторфенил)метокси]этил)-4-(3-фенилпропил)пиперазина (GBR-12909) и флуорофора BODIPY (GBR-BP). Получение GBR-BP описано в документе Лаврова А. В., Грецкая Н. М., Безуглов В. В. «Синтез нового флуоресцентного производного ингибитора обратного захвата дофамина GBR 12909» Евразийский Союз Ученых, 2016, 2-5 (23): 73-76. Авторами настоящего изобретения неожиданно было обнаружено в ходе предшествующих исследований, что GBR-BP эффективен при окрашивании первичной культуры дофаминергических нейронов головного мозга мыши. Также авторами настоящего изобретения неожиданно было обнаружено в ходе предшествующих исследований, что интернализация GBR-BP происходит не только в телах дофаминергических нейронов, но и в их отростках - нейритах.
Флуоресцентный краситель DRAQ5 представляет собой 1,5-бис[[2-(диметиламино)этил]амино]-4,8-дигидроксиантрацен-9,10-дион, это соединение и его получение описаны в публикации международной патентной заявки WO1999065992, где также раскрыто его применение для флуоресцентных анализов. Известно, что DRAQ5 окрашивает ядра живых и фиксированных клеток.
В ходе исследований красителя GBR-BP авторы настоящего изобретения выявили, что он специфически окрашивает дофаминергические нейроны путем связывания с дофаминовым транспортером и последующей интернализации флуоресцентного комплекса в нейроны.
Первый и второй красители имеют неперекрывающиеся спектры эмиссии: DRAQ5 имеет максимум при 681 нм/697 нм, интеркалированный в dsДНК, а GBR-BP имеет максимум при 511 нм.
Авторами настоящего изобретения неожиданно было обнаружено, что использование комбинации указанных красителей и определенной последовательности окрашивания для прижизненного мечения дофаминергических нейронов позволяет эффективно получить популяцию дофаминергических нейронов черной субстанции посредством сортировки флуоресцентно-активированных клеток.
Указанные выше неожиданные находки, сделанные авторами настоящего изобретения, а также сложные исследовательские работы, описанные далее, привели к созданию настоящего изобретения.
Окрашивание целой черной субстанции и срезов черной субстанции
Несмотря на то, что при БП наблюдается гибель именно дофаминергических нейронов ЧС, в настоящее время практически невозможно количественно оценить в дофаминергических нейронах ЧС экспрессию неспецифических для этих нейронов генов и синтез соответствующих белков. Действительно, экспрессия генов, ответственных за синтез белков везикулярного цикла, протеасомной системы, транспортной системы клетки и многих других характерна не только для дофаминергических нейронов. Большинство исследований по профилированию экспрессии генов проводится в целой (объемной) ткани головного мозга, содержащей, наряду с дофаминергическими нейронами, другие клетки, например, глию и клетки эндотелия сосудов. Анализ любых событий в такой гетерогенной популяции не позволяет избирательно оценить экспрессию большинства генов и синтез соответствующих белков и наиболее часто отражает изменения клеточного состава в исследуемой ткани головного мозга при нейродегенерации, что еще раз подтверждает потребность в разработке эффективного способа получения популяции дофаминергических нейронов ЧС мышей.
Изначально целую ткань ЧС, измельченную на мелкие кусочки при помощи бритвенных лезвий, инкубировали в растворе папаина для диссоциации. На первой стадии изготовления клеточной суспензии за основу был взят наиболее распространенный способ, в котором нервную ткань предварительно измельчали при помощи бритвенных лезвий. Ввиду малого объема ткани, инкубацию с папаином проводили в центрифужных пробирках в малом объеме, составляющем 50 мкл. В некоторых известных протоколах, переваривание ткани также проводят в центрифужных пробирках. В ряде имеющихся научных публикаций отмечено, что инкубация в пробирках не позволяет добиться равномерного переваривания всей ткани, так как часть ткани оседает на дне пробирки и труднодоступна для действия протеазы, тогда как верхний слой ткани излишне подвержен действию папаина и советуют перемешивать раствор на стадии ферментативной диссоциации нервной ткани. Учитывая это, авторы настоящего изобретения размещали пробирки в мультиротационном миксере и постоянно перемешивали их содержимое, чтобы не допустить оседания ткани на стенке пробирки и предотвратить агрегацию кусочков ткани между собой. При этом авторы настоящего изобретения не добавляли ДНКазу I, используемую во время инкубации или после инкубации с папаином для ускорения диссоциации и предотвращения агрегации клеток в известных протоколах диссоциации, по причине снижения интенсивности флуоресценции DRAQ5, используемого для последующего прижизненного окрашивания клеточных ядер, после инкубации клеток с оптимальной концентрацией ДНКазы I, составляющей 5 Ед/мл на стадии инкубации измельченных кусочков ЧС с папаином (данные не представлены). После инактивации папаина и диссоциации ткани до состояния клеточной суспензии выявляли дофаминергические нейроны в гетерогенной популяции клеток ЧС. Для этого, помимо DRAQ5, использовали оригинальный краситель GBR-BP, который был неожиданно обнаружен как эффективный при окрашивании первичной культуры дофаминергических нейронов головного мозга мыши в ходе предшествующих исследований, проведенных авторами настоящего изобретения. Окрашивание дофаминергических нейронов в клеточной суспензии изначально проводили при помощи 10 мкМ DRAQ5 и 5 нМ GBR-BP, для поиска клеток в суспензии использовали изображения в дифференционно-интерференционный контрасте (DIC).
Инкубация клеточной суспензии ЧС с 5 нМ GBR-BP (фиг. 1А) позволила выявить клетки, окрашенные GBR-BP, во время прижизненной микроскопии (фиг. 2A). Интенсивность измеренной при микроскопии флуоресценции окрашенных клеток превышала интенсивность флуоресценции неокрашенных клеток в 3,36 раза по показателю скорректированной общей флуоресценции клеток (CTCF). После предварительной инкубации суспензии клеток с GBR-12909 и последующей совместной инкубации с GBR-12909 и 5 нМ GBR-BP окрашенные клетки не были выявлены. Клеточная популяция, выделенная по показателям прямого светорассеяния (FSC) и бокового светорассеяния (SSC) на проточном цитометре, составляла 0,27% от общего числа событий в суспензии и на 96,9% была представлена единичными событиями (фиг. 3A). В то же время, анализ единичных событий в клеточной популяции показал, что на 50,17% она состоит из клеток с окрашенным DRAQ5 ядром, и только лишь 1,63% имеет интенсивность эмиссии GBR-BP выше порога автофлуоресценции (фиг. 3A). Таким образом, при окрашивании клеточной суспензии ЧС 10 мкМ DRAQ5 и 5 нМ GBR-BP достаточно сложно выделить искомую клеточную популяцию (DRAQ5+/GBR-BP+) методом проточной цитометрии. В связи с этим было решено увеличить концентрацию GBR-BP до 20 нМ при неизменной концентрации DRAQ5 и неизменном протоколе окрашивания клеточной суспензии.
Инкубация клеточной суспензии ЧС с 20 нМ GBR-BP (фиг. 1А) также позволила выявить клетки, окрашенные GBR-BP, во время прижизненной микроскопии. Интенсивность измеренной при микроскопии флуоресценции окрашенных клеток превышала интенсивность флуоресценции неокрашенных клеток в 3,72 раза по показателю CTCF. После предварительной инкубации суспензии клеток с GBR-12909 и последующей совместной инкубации с GBR-12909 и 20 нМ GBR-BP не были выявлены окрашенные клетки. Клеточная популяция, выделенная по показателям FSC и SSC на проточном цитометре, составляла 0,28% от общего числа событий в суспензии и на 95,72% была представлена единичными событиями (фиг. 3B), что сопоставимо с описанием суспензии, окрашенной 5 нМ GBR-BP. В то же время, анализ единичных событий в клеточной популяции показал, что на 69,62% она состоит из клеток с окрашенным DRAQ5 ядром, и только лишь 2,89% имеет интенсивность эмиссии GBR-BP выше порога автофлуоресценции (фиг. 3B). Таким образом, при окрашивании клеточной суспензии ЧС 10 мкМ DRAQ5 и 20 нМ GBR-BP так же, как и при окрашивании суспензии 10 мкМ DRAQ5 и 5 нМ GBR-BP, достаточно сложно выделить искомую клеточную популяцию (DRAQ5+/GBR-BP+) методом проточной цитометрии. Авторами настоящего изобретения в ходе предшествующих исследований было обнаружено, что в первичной культуре среднего головного мозга мыши интернализация GBR-BP происходит не только в телах дофаминергических нейронов, но и в их отростках - нейритах. Согласно полученным прижизненным изображениям клеток, клетки в суспензии имеют шарообразную форму и не имеют отростков и других характерных особенностей своей цитоархитектоники, что отражено и в ряде других исследований. Таким образом, использование протокола окрашивания клеточной суспензии при помощи GBR-BP исключает интернализацию GBR-BP в нейритах. В связи с этим было решено окрашивать 10 мкМ DRAQ5 и 20 нМ GBR-BP фронтальные срезы головного мозга толщиной 200 мкм, включающие ЧС, и использовать две стадии диссоциации ткани. Толщину срезов подбирали исходя из результатов пробного эксперимента, где было показано, что использование 200 мкм срезов является оптимальным (данные не представлены). С одной стороны, использование такой толщины позволяет избежать большого разброса в уровне первого и последнего среза, содержащего ЧС, и исключить забор значительного объема регионов головного мозга, прилегающих к ЧС с ростральной и каудальной стороны, что наблюдалось при изготовлении срезов толщиной 300 и 400 мкм. С другой стороны, срезы толщиной 200 мкм позволяют сохранить исходную структуру ткани после ее ферментативной диссоциации в папаине и стадии центрифугирования, в отличие от срезов толщиной 70, 100 и 150 мкм. Ввиду небольшого количества дофаминергических нейронов ЧС, осаждение клеток в суспензии, полученной из срезов ЧС, было решено проводить при 500 × g в соответствии с известным протоколом Eriksen и соавторов.
Инкубация вибратомных срезов ЧС с 20 нМ GBR-BP (фиг. 1А) позволила выявить клетки, окрашенные GBR-BP, во время прижизненной микроскопии клеточной суспензии (фиг. 2B). Интенсивность измеренной при микроскопии флуоресценции окрашенных клеток превышала интенсивность флуоресценции неокрашенных клеток в 4,56 раза по показателю CTCF. После первой стадии диссоциации срезов ЧС, инкубируемых с 20 нМ GBR-BP, было показано, что такой способ инкубации позволяет GBR-BP связывается не только с DAT тел нейронов, но и с DAT, расположенным на нейритах (фиг. 2D), что в свою очередь показывает, что интернализация GBR-BP в нейритах может происходить не только на культуре клеток, как это было обнаружено авторами настоящего изобретения в ходе предшествующих исследований, но и в ткани срезов ЧС. После предварительной инкубации срезов ЧС с GBR-12909 и последующей совместной инкубации с GBR-12909 и 20 нМ GBR-BP окрашенные клетки не были выявлены. Клеточная популяция, выделенная по показателям FSC и SSC на проточном цитометре, составляла 0,43% от общего числа событий в суспензии и на 96,81% была представлена единичными событиями (фиг. 3С). В то же время, анализ единичных событий в клеточной популяции показал, что на 68,6% она состоит из клеток с окрашенным DRAQ5 ядром, и 9,79% клеток имеет интенсивность эмиссии GBR-BP выше порога автофлуоресценции (фиг. 3C). Таким образом, при окрашивании клеточной суспензии, полученной из вибратомных срезов ЧС, 10 мкМ DRAQ5 и 20 нМ GBR-BP возможно выделить искомую клеточную популяцию (DRAQ5+/GBR-BP+) методом проточной цитометрии, однако часть окрашенных клеток находилась ниже порога автофлуоресценции. В связи с этим было решено увеличить концентрацию GBR-BP до 50 нМ при неизменной концентрации DRAQ5 и протоколе получения суспензии из срезов ЧС.
Инкубация вибратомных срезов ЧС с 50 нМ GBR-BP (фиг. 1А) позволила выявить клетки, окрашенные GBR-BP, во время прижизненной микроскопии клеточной суспензии (фиг. 2С). Интенсивность измеренной при микроскопии флуоресценции окрашенных клеток превышала интенсивность флуоресценции неокрашенных клеток в 5,98 раза по показателю CTCF. После предварительной инкубации срезов ЧС с GBR-12909 и последующей совместной инкубации с GBR-12909 и 50 нМ GBR-BP также не были выявлены окрашенные клетки. Клеточная популяция, выделенная по показателям FSC и SSC на проточном цитометре, составляла 0,46% от общего числа событий в суспензии и на 95,61% была представлена единичными событиями (фиг. 3D). В то же время, анализ единичных событий в клеточной популяции показал, что на 77,46% она состоит из клеток с окрашенным DRAQ5 ядром, и 31,58% клеток имеет интенсивность эмиссии GBR-BP выше порога автофлуоресценции (фиг. 3D). Центрифугирование суспензии, полученной из срезов ЧС, при 500 × g в сравнении с центрифугированием при 300 × g, используемым в исходном протоколе, привело к увеличению размера популяции, выделенной по показателям FSC и SSC (0,27-0,28% против 0,43%-0,46%, фиг. 3A-D). Несмотря на то, что использование разных протоколов получения суспензии давало сопоставимое количество DRAQ5+ клеток, общее количество клеток с ядром во всей суспензии увеличилось при центрифугировании суспензии при 500 × g, что не только позволило минимизировать потерю нейронов в процессе центрифугирования, но и упростило отбор супернатанта в сравнении с наиболее часто используемым протоколом осаждения нейронов при 300 × g. Таким образом, окрашивание клеточной суспензии, полученной из вибратомных срезов ЧС, 10 мкМ DRAQ5 и 50 нМ GBR-BP позволило получить наилучшее различие в интенсивности флуоресценции между GBR-BP-окрашенными и GBR-BP-неокрашенными клетками и дало возможность выделить искомую клеточную популяцию (DRAQ5+/GBR-BP+) методом проточной цитометрии.
В дополнение к подбору протокола диссоциации ткани и окрашивания клеток было проведено сравнение выживаемости клеток при использовании двух протоколов диссоциации ткани. Для сопоставления использовали одинаковые концентрации флуоресцентных красителей: 10 мкМ DRAQ5, 20 нМ GBR-BP и 5 мкг/мл йодида пропидия (PI). Клеточная популяция, выделенная по показателям FSC и SSC на проточном цитометре, составляла 0,31% от общего числа событий в суспензии, полученной из целой ЧС, и на 98,82% была представлена единичными событиями. Анализ единичных событий в клеточной популяции показал, что 5,3% окрашенных DRAQ5 клеток - это мертвые клетки, окрашенные также PI (фиг. 4A). Клеточная популяция, выделенная по показателям FSC и SSC на проточном цитометре, составляла 0,44% от общего числа событий в суспензии, полученной из срезов ЧС, и на 98,22% была представлена единичными событиями. Анализ единичных событий в клеточной популяции показал, что 6,61% окрашенных DRAQ5 клеток - это мертвые клетки, окрашенные также PI (фиг. 4B). Таким образом, оба способа диссоциации ткани дают сопоставимое количество мертвых и живых клеток в суспензии.
Сортировка клеток (FACS)
Исходя из сопоставления протоколов диссоциации нервной ткани и ее окрашивания, FACS было решено применять для сортинга суспензии, получаемой из окрашенных 10 мкМ DRAQ5 и 50 нМ GBR-BP срезов ЧС. Количество отсортированных клеток, окрашенных DRAQ5 и GBR-BP, варьировало в диапазоне от 2200 до 4760 клеток при диссоциации срезов ЧС, изготовленных из одного головного мозга.
Анализ клеточной суспензии при помощи проточной цитометрии с визуализацией (IDEAS анализ клеточной суспензии)
Анализ суспензии до сортинга, проведенный при помощи проточной цитометрии с визуализацией на ImageSrteamx mk II system, показал, что единичные сфокусированные изображения объектов в канале светлого поля (BF), выделенных на основании показателя резкости изображения (фиг. 5A) и площади изображения плюс аспектного соотношения (фиг. 5B), преимущественно содержат клетки с окрашенным DRAQ5 ядром (фиг. 5C). Среди окрашенных DRAQ5 клеток были выделены 2 популяции, различающиеся по интенсивности эмиссии в зеленой части спектра: популяция GBR-BP-неокрашенных (GBR-BP-) клеток и популяция GBR-BP-окрашенных (GBR-BP+) клеток (фиг. 5D), что аналогично результатам, полученным при анализе суспензии на проточном цитометре (фиг. 3D). Анализ изображений клеток в суспензии после сортинга, проведенный аналогичным образом, показал, что все клетки с окрашенным DRAQ5 ядром также окрашены и GBR-BP (фиг. 5E, F). Таким образом, авторами настоящего изобретения было показано, что сортируемые клетки не содержат GBR-BP-неокрашенных клеток, имеют только двойное окрашивание и могут быть использованы для оценки того, являются ли они дофаминергическими нейронами.
TH-иммуноокрашивание
Подсчет количества TH-иммунореактивных клеток в отсортированной клеточной популяции, фиксированной в виде мазка на стекле, показал, что в 97% случаев клетки с окрашенным 4′,6-диамидино-2-фенилиндолом (DAPI) ядром иммунореактивны по TH (фиг. 6), тогда как в суспензии до сортинга только 54-56% клеток с окрашенным DAPI ядром являлось TH-иммунореактивными. Это показывает, что отсортированная клеточная популяция преимущественно состоит из дофаминергических нейронов и может быть использована для дальнейшего анализа методами молекулярной биологии.
Способ согласно настоящему изобретению, посредством которого достигается до 97% дофаминергических нейронов в полученной популяции, позволяет использовать в работе животных дикого типа, что не только существенно снижает затраты на эксперименты, но и позволяет сопоставлять полученные таким образом результаты с исследованиями БП на моделях, где наиболее часто используют мышей дикого типа.
Экспрессия маркеров дофаминергических нейронов в отсортированных клетках
Было установлено, что экспрессия маркеров дофаминергических нейронов: TH, DAT, DOPA декарбоксилаза (DDC), в отсортированной клеточной популяции, имеющей двойное окрашивание (DRAQ5+/GBR-BP+), совпадает с таковой, наблюдаемой в целой ЧС. Отсортированные клетки экспрессируют все основные маркеры дофаминергических нейронов (фиг. 7А). При этом авторами настоящего изобретения было показано отсутствие экспрессии маркера астроцитов - глиального фибриллярного кислого белка (GFAP), в отсортированной клеточной популяции в отличие от целой ЧС (фиг. 7В). Таким образом, в рамках данного исследования при помощи селективного лиганда DAT - GBR-BP, были выделены дофаминергические нейроны ЧС головного мозга мыши. В свою очередь, это позволило провести исследование изменения экспрессии генов не только в целой ЧС, но также и в выделенных с помощью метода FACS дофаминергических нейронах в норме и при патологии - на модели БП.
Изменение экспрессии TH и DAT в целой ЧС и в отсортированных дофаминергических нейронах на модели ранней симптоматической стадии БП
Моделирование БП является единственным подходом, позволяющим изучать клеточные и молекулярные механизмы нейродегенерации и нейропластичности на всех стадиях развития заболевания. К наиболее распространенным относятся нейротоксические модели БП, основанные на введении грызунам специфических нейротоксинов дофаминергических нейронов, одним из которых является 1-метил-4-фенил-1,2,3,6-тетрагидропиридин (MPTP) гидрохлорид. При этом модели, основанные на введении MPTP, обладают рядом существенных преимуществ: только они позволяют воспроизвести характерное для больных нарушение моторики при билатеральном снижении дофамина в стриатуме до порогового уровня - 70%, что важно для моделирования доклинической и клинической стадии болезни. Помимо этого, MPTP позволяет моделировать не только центральные, но и периферические проявления БП, характерные для пациентов с этим заболеванием.
Сопоставление экспрессии специфических генов-маркеров дофаминергических нейронов (TH, DAT) в целой ЧС и в отсортированных дофаминергических нейронах проводили на разработанной ранее модели ранней симптоматической стадии БП. В качестве референсного гена использовали цитохром C1 (CYC1), уровень экспрессии которого наименее подвержен изменениям при нейродегенерации. Четыре инъекции 12 мг/кг MPTP с двухчасовым интервалом между инъекциями приводили к 52% снижению экспрессии TH мРНК в целой ЧС по сравнению с контролем (0,525 ± 0,092 у мышей MPTP по сравнению с 1,097 ± 0,183 для контроля, p = 0,004) (фиг. 8А). Экспрессия мРНК DAT в целой ЧС при этом снижалась на 43% по сравнению с контролем (0,589 ± 0,104 у мышей MPTP по сравнению с 1,038 ± 0,098 для контроля, p = 0,0062) (фиг. 8В). В то же время, четыре инъекции 12 мг/кг MPTP с двухчасовым интервалом между инъекциями приводили к 59% снижению экспрессии мРНК TH в отсортированных дофаминергических нейронах по сравнению с контролем (0,498 ± 0,139 у мышей MPTP по сравнению с 1,212 ± 0,224 у контроля, p = 0,0156) (фиг. 8С), тогда как экспрессия мРНК DAT в отсортированных дофаминергических нейронах достоверно снижалась на 62% по сравнению с контролем (0,518 ± 0,191 у мышей MPTP по сравнению с 1,376 ± 0,345 у контроля, p = 0,0448) (фиг. 8D). Показанное снижение экспрессии мРНК TH и DAT в отсортированных дофаминергических нейронах было сопоставимо со снижением экспрессии мРНК TH и DAT в целой ЧС и было аналогично 50% снижению экспрессии мРНК TH и 63% снижению экспрессии мРНК, показанному ранее на модели ранней симптоматической стадии БП. Помимо оценки изменения экспрессии специфических генов-маркеров дофаминергических нейронов, авторами настоящего изобретения также было установлено, что на модели БП количество отсортированных DRAQ5+/GBR-BP+ клеток снижалось на 28,4% по сравнению с контролем (2718 ± 249 у мышей MPTP по сравнению с 3797 ± 366 у контроля, p = 0,0267), тогда как проведенный ранее подсчет TH-иммунореактивных нейронов в ЧС на используемой модели показал снижение количества тел нейронов на 39%.
Примеры
Список сокращений и обозначений
BF - светлое поле
BSA - бычий сывороточный альбумин
CTCF - скорректированная общая флуоресценция клеток
кДНК - комплементарная ДНК
CYC1 - цитохром C1
DA-ergic - дофаминергические
DAPI - 4′,6-диамидино-2-фенилиндол
DAT - активный транспортер дофамина
DDC - DOPA декарбоксилаза
DIC - дифференциальная контрастность в интерференционном изображении
DMEM - среда Игла, модифицированная по Дульбекко
DRAQ5 - 1,5-бис[[2-(диметиламино)этил]амино]-4,8-дигидроксиантрацен-9,10-дион
FACS - сортировка флуоресцентно-активированных клеток
FSC - прямое светорассеяние
GBR-12909 - 1-(2-[бис(4-фторфенил)метокси]этил)-4-(3-фенилпропил)пиперазин
GBR-BP - GBR-BODIPY
GBR-BP- - популяция неокрашенных GBR-BP клеток
GBR-BP+ - популяция окрашенных GBR-BP клеток
DRAQ5+/GBR-BP+ - популяция клеток, окрашенных DRAQ5 и GBR-BP
GFAP - глиальный фибриллярный кислый белок
HBSS - сбалансированный солевой раствор Хенкса
MPTP - 1-метил-4-фенил-1,2,3,6-тетрагидропиридин
PBS - физиологический раствор с фосфатным буфером
БП - болезнь Паркинсона
PI - йодид пропидия
ЧС - черная субстанция, компактный слой
SSC - боковое светорассеяние
TH - тирозингидроксилаза
qPCR - количественная полимеразная цепная реакция
Пример 1. Животные и экспериментальные процедуры
В работе использовали мышей-самцов C57BL/6 в возрасте 8-12 недель весом 20-24 г (питомник «Столбовая», Ступино, Россия) (n=60). Животных содержали при температуре 22 ± 1°C, при 12-часовом цикле день-ночь и свободном доступе к пище и воде. Животные были разделены на три группы (фиг. 1). В первую группу (n=24) были включены интактные мыши, которых использовали для разработки метода получения чистой фракции дофаминергических нейронов (фиг. 1А). ЧС или выделенные дофаминергические нейроны животных второй (n=18, моделирование БП) и третьей (n=18, контроль) группы использовали для оценки изменения в них уровня экспрессии генов методом количественной полимеразной цепной реакции (qPCR) на модели БП (фиг. 1В). Для получения суспензии, сортинга и последующего qPCR использовали свободный от ДНКазы и РНКазы пластик.
Экспериментальные процедуры проводили в соответствии с Руководством Национального института здравоохранения по уходу и использованию лабораторных животных (8-е издание, 2011 г.) и были одобрены Комитетом по уходу и использованию животных Института биологии развития им. Н.К. Кольцова Российской академии наук (протокол №40 от 17.09.2020).
Пример 2. Моделирование болезни Паркинсона
Мышам во второй группе подкожно вводили MPTP гидрохлорид (Sigma, MO, USA), растворенный в физиологическом растворе - четырежды в разовой дозе 12 мг/кг с интервалом в два часа между инъекциями. Мышам в третьей - контрольной группе, по такой же схеме вводили физиологический раствор. Мышей второй и третьей группы содержали две недели в обычных лабораторных условиях перед получением биологических образцов (фиг. 1В).
Пример 3. Выделение черной субстанции
Мышей декапитировали под изофлурановым наркозом (Baxter, IL, USA), получали ЧС и в дальнейшем либо использовали для приготовления клеточной суспензии, либо замораживали в жидком азоте и хранили при -70°C до выделения общей РНК и оценки экспрессии генов с помощью qPCR (фиг. 1A, B). Из головного мозга других животных на вибратоме (Microm HM 650 V, Thermo Scientific, MA, USA) в ледяном буфера раствора Кребса-Рингера (в составе (мМ): NaCl 120, KCl 4,8, CaCl2 2,0, MgSO4 1,2, NaHCO3 25, D-глюкоза 10,1, HEPES 20, и аскорбиновая кислота 0,13, pH 7,4, все реагенты от Sigma, MO, USA) изготавливали по 7 фронтальных срезов толщиной 200 мкм, включающих ЧС (от -2,54 до -3,88 мм из брегмы) в соответствии с атласом головного мозга мыши. Из этих срезов лезвием под контролем бинокулярной лупы (Zeiss, Germany) вырезали ЧС (фиг. 1A, B). Полученные срезы ЧС использовали для приготовления клеточной суспензии.
Пример 4. Получение клеточной суспензии из целой черной субстанции и ее окрашивание
На первой стадии получения суспензии клеток ЧС нервную ткань нарезали лезвиями на мелкие кусочки, переносили в микроцентрифужные пробирки, содержащие по 100 мкл охлажденной среды Игла, модифицированной по Дульбекко, без сыворотки и антибиотиков (DMEM, Gibco, NY, USA). Пробирки с измельченной ЧС центрифугировали 30 секунд при 70 × g и 20°C (MiniSpin, Eppendorf, Germany). Супернатант отбирали, а к осадку добавляли 50 мкл среды DMEM, содержащей 2 мг/мл папаина (Sigma, MO, USA). Папаин предварительно растворяли в DMEM и активировали путем инкубации в течение 30 минут при 37°C. Осадок встряхивали на вортексе и инкубировали в этом растворе 30 минут при 37°C при постоянном перемешивании, что способствовало диссоциации нервной ткани. Ферментативное действие папаина останавливали, добавив в пробирки охлажденную (+4°С) фетальную бычью сыворотку (Gibco, NY, USA) в конечной концентрации 10% (об./об.), раствор перемешивали на вортексе. После этого нервную ткань осаждали центрифугированием в течение 30 секунд при 70 × g и 20°С, а затем промывали дважды в 100 мкл сбалансированного солевого раствора Хенкса (HBSS, Gibco, NY, USA), осаждая ткань в течение 30 секунд при 70 × g и 20°С. Супернатант аккуратно отбирали после каждой стадии центрифугирования. Осажденную нервную ткань ресуспендировали в 50 мкл HBSS, а затем содержимое пробирки прокачивали 30-40 раз через наконечник дозатора объемом 200 мкл с диаметром кончика 0,5 мм до визуального исчезновения кусочков ткани.
Для прижизненного мечения дофаминергических нейронов были использованы два флуоресцентных красителя. Первый краситель - DRAQ5 (Abcam, UK), окрашивает ядра живых и фиксированных клеток. Второй краситель - GBR-BP - специфически окрашивает дофаминергические нейроны путем связывания с дофаминовым транспортером и последующей интернализации флуоресцентного комплекса в нейроны. Клеточную суспензию, полученную из целого кусочка ЧС, инкубировали в темноте при 37°C в течение 15 минут в 50 мкл HBSS, содержащем 5 нМ или 20 нМ GBR-BP при постоянном перемешивании. Через 15 минут после начала инкубации добавляли 10 мкМ DRAQ5 и инкубировали суспензию в течение 15 минут при тех же условиях. Окрашенную клеточную суспензию пропускали через клеточное сито 40 мкм (Corning, NY, USA). Затем клетки осаждали в течение 5 минут при 300 × g, отмывали в 100 мкл HBSS и повторно центрифугировали при тех же условиях. Супернатант отбирали, а осадок ресуспендировали в 50 мкл HBSS. Пробирки с полученными суспензиями хранили в темноте при 4°С до прижизненной флуоресцентной микроскопии и проточной цитометрии (фиг. 1А).
Для оценки специфичности окрашивания полученную суспензию клеток сначала инкубировали с 10 мкМ GBR-12909 - ингибитором дофаминового транспортера, в течение 10 минут при 37°C, а затем с 10 мкМ GBR-12909 и 5 нМ или 20 нМ GBR-BP в течение 30 минут при 37°C.
Для оценки выживаемости клеток неокрашенную суспензию клеток ЧС инкубировали в 50 мкл HBSS c 10 мкМ DRAQ5 и 20 нМ GBR-BP в соответствии с описанным выше протоколом, пропускали через клеточное сито 40 мкм, осаждали, отмывали и центрифугировали. Осадок ресуспендировали в 50 мкл HBSS, содержащем 5 мкг/мл PI (Invitrogen, CA, USA), и инкубировали в течение 15 минут при 37°C при постоянном перемешивании. Пробирку с полученной суспензией хранили в темноте при 4°С до анализа методом проточной цитометрии. Выживаемость клеток оценивали по отношению количества клеток, окрашенных PI, к общему количеству клеток, окрашенных DRAQ5.
Пример 5. Получение клеточной суспензии из вибратомных срезов черной субстанции и ее окрашивание
Выделенную из фронтальных вибратомных срезов головного мозга ЧС переносили в микроцентрифужные пробирки, содержащие 100 мкл охлажденной культуральной среды DMEM. При инкубации срезов, предназначенных для последующих FACS и qPCR, в среду добавляли 100 Ед/мл ингибитора РНКазы RiboLock (Thermo Scientific, МА, USA). Пробирки со срезами ЧС центрифугировали в течение 30 секунд при 70 × g и 20°C. Супернатант удаляли, а к осадку добавляли 50 мкл среды DMEM, содержащей 2 мг/мл папаина. Папаин предварительно растворяли в DMEM и активировали путем инкубации в течение 30 минут при 37°C. Осадок встряхивали на вортексе и инкубировали в этом растворе в течение 30 минут при 37°C и постоянном перемешивании. Ферментативное действие папаина останавливали, добавляя в пробирки охлажденную (+4°С) фетальную бычью сыворотку в конечной концентрации 10% (об./об.), раствор перемешивали на вортексе. После этого нервную ткань последовательно осаждали центрифугированием в течение 30 секунд при 70 × g и 20°С, промывали дважды в 100 мкл HBSS и центрифугировали в течение 30 секунд при 70 × g и 20°С. Супернатант аккуратно отбирали после каждой стадии центрифугирования.
Ткань, полученную из вибратомных срезов ЧС, инкубировали в течение 15 минут в 50 мкл HBSS, содержащем 20 нМ или 50 нМ GBR-BP (фиг. 1А). При инкубации ткани, которую предполагалось использовать для FACS и последующего qPCR, помимо флуоресцентных красителей, в буфер добавляли 100 Ед/мл ингибитора РНКазы RiboLock. После инкубации с флуоресцентными красителями нервную ткань диссоциировали пипетированием в этом же растворе, пропуская 15 раз через наконечник объемом 200 мкл. Полученную клеточную суспензию с частично диссоциированной тканью продолжали инкубировать в растворе, содержащем 10 мкМ DRAQ5 и 20 нМ или 50 нМ GBR-BP при 37°C в течение 15 минут. Затем ткань повторно диссоциировали, пропуская раствор 15-20 раз через наконечник объемом 200 мкл, до визуального исчезновения кусочков ткани. Полученную при этом окрашенную клеточную суспензию пропускали через клеточное сито 40 мкм. Затем клетки осаждали в течение 5 минут при 500 × g и 20°С, отмывали в 100 мкл HBSS, и повторно центрифугировали при тех же условиях. После этого отбирали супернатант, а осадок ресуспендировали в 50 мкл HBSS. Суспензии, которые затем использовались для FACS и последующего анализа методом qPCR, ресуспендировали в 50 мкл HBSS, содержащем 100 Ед/мл ингибитора РНКазы RiboLock. Пробирки с полученными суспензиями хранили в темноте при 4°С до прижизненной флуоресцентной микроскопии и проточной цитометрии / FACS (фиг. 1А).
Для оценки специфичности окрашивания нервную ткань, получаемую из срезов ЧС, после инактивации папаина и отмывания в HBSS сначала инкубировали с 10 мкМ GBR-12909 в течение 10 минут при 37°C, а затем с 10 мкМ GBR-12909 и 20 нМ или 50 нМ GBR-BP в течение 30 минут при 37°C, дважды производя диссоциацию срезов - через 15 минут и 30 минут после начала инкубации в соответствии с описанным выше протоколом.
Для оценки выживаемости клеток неокрашенную нервную ткань, получаемую из срезов ЧС, инкубировали в 50 мкл HBSS c 10 мкМ DRAQ5 и 20 нМ GBR-BP в соответствии с описанным выше протоколом, пропускали полученную суспензию через клеточное сито 40 мкм. Суспензию осаждали, отмывали и центрифугировали. Осадок ресуспендировали в 50 мкл HBSS, содержащем 5 мкг/мл PI, и инкубировали 15 минут при 37°C при постоянном перемешивании. Пробирку с полученной суспензией хранили в темноте при 4°С до проведения проточной цитометрии. Оценивали выживаемость клеток.
Пример 6. Проточная цитометрия и сортировка клеток
Суспензии клеток, полученные при диссоциации целой ЧС или ЧС, вырезанной из вибратомных срезов, анализировали на проточном цитометре (CytoFLEX S, Beckman Coulter, CA, USA) или сортировали на клеточном сортере (SH800S, Sony, Japan) (фиг. 1А) с использованием сопла на 100 мкм при давлении 21-23 фунтов на кв. дюйм. Используя неокрашенную суспензию, по профилям FSC и SSC выделяли область, содержащую клетки, и корректировали ее при анализе суспензии, окрашенной только DRAQ5. Границы автофлуоресценции устанавливали, анализируя неокрашенную суспензию. DRAQ5 возбуждали, используя лазер с длиной волны 638 нм, и детектировали при помощи 712/25 нм (для CytoFLEX S) или 720/60 нм (для SH800S) полосно-пропускающего фильтра. GBR-BP возбуждали, используя лазер с длиной волны 488 нм, и детектировали при помощи 525/40 нм (для CytoFLEX S) или 525/50 нм (для SH800S) полосно-пропускающего фильтра, PI возбуждали, используя лазер с длиной волны 488 нм, и детектировали при помощи 585/42 нм (для CytoFLEX S) полосно-пропускающего фильтра. В суспензиях клеток, окрашенных только DRAQ5, GBR-BP или PI, определяли границы популяции с положительным сигналом по каждому из флуорофоров так, чтобы флуоресценция меченых объектов превышала автофлуоресценцию. FACS применяли только для сортинга суспензии, получаемой из ткани вибратомных срезов, которую окрашивали 10 мкМ DRAQ5 и 50 нМ GBR-BP. Клетки, имеющие двойное окрашивание (DRAQ5+/GBR-BP+), сортировали, используя установленные пороги детекции флуоресценции, и собирали в микроцентрифужные пробирки. В микроцентрифужные пробирки, в которые собирали отсортированные клетки для последующего анализа экспрессии генов методом qPCR, заранее добавляли 50 мкл TRIzol (Sigma, MO, USA), содержащего 100 Ед/мл ингибитора РНКазы RiboLock. К содержимому пробирок после сортинга добавляли 250 мкл TRIzol, перемешивали на вортексе и замораживали в жидком азоте. Пробирки хранили при -70°C до оценки экспрессии генов методом qPCR.
Построение гистограмм и анализ результатов проводили в программах FCS Express 7 (De Novo software, USA) и SH800 Software (Sony, Japan).
Пример 7. Проточная цитометрия с визуализацией
Прижизненные изображения клеток, окрашенных DRAQ5 и GBR-BP в одной и той же клеточной суспензии ЧС от одной и той же мыши, были получены до сортинга и в отсортированном материале на ImageSrteamx mk II system (Luminex Corp., TX, USA), оснащенной 488 нм и 642 нм лазерами, при увеличении объектива 40х. Анализ изображений осуществляли с помощью программного обеспечения IDEAS (Luminex Corp., TX, USA). В первую очередь выделяли изображения, находящиеся в фокусе (гистограмма оценок градиента RMS отражает четкость изображения). Затем выделяли область, содержащую клетки по показателям площади изображения (от 100 до 250 пикселей) и аспектного отношения (от 0,7 до 1). Указанные настройки позволяют анализировать преимущественно одиночные клетки, практически исключая подсчет конгломератов клеток. Дальнейшее определение границ анализируемых популяций клеток проводили по показателям интенсивности флуоресценции DRAQ5 (канал 11) и GBR-BP (канал 2). Пороги детекции DRAQ5 и GBR-BP выставляли по той же схеме, что и при проточной цитометрии/сортинге нейронов.
Пример 8. Иммуноцитохимия
В клетках суспензии, полученной из вибратомных срезов ЧС, до и после сортинга иммуноцитохимически выявляли TH. Для этого суспензию клеток центрифугировали в течение 5 минут при 2000 × g и 4°С (Eppendorf 5424R, Eppendorf, Germany). Супернатант удаляли, осадок ресуспендировали в 200 мкл 4% параформальдегида на 0,2 M фосфатном буфере в составе (мМ): NaH2PO4 38,4, Na2HPO4 161,6, pH 7,2-7,4 (все реагенты от Sigma, MO, USA) и инкубировали в течение 10 минут при 4°С. Затем суспензию центрифугировали в течение 5 минут при 2000 × g, 4°С. Осадок отмывали дважды в 200 мкл 0,02 M физиологического раствора с фосфатным буфером (PBS) в составе (мМ): NaH2PO4 3,84, Na2HPO4 16,16, NaCl 154, pH 7,2-7,4 (все реагенты от Sigma, MO, USA), центрифугировали в течение 5 минут при 2000 × g, 4°С. К осадку добавляли 100 мкл PBS, ресуспендировали. Суспензию в виде мазка наносили на желатинизированное предметное стекло и высушивали в термостате при 37°С. Высушенные мазки инкубировали последовательно: (а) в PBS с 3% бычьего сывороточного альбумина (BSA, Sigma, MO, USA) и 0,1% Triton X100 (Sigma, MO, USA) в течение 30 минут при 20°С; (б) с антителами овцы к TH (1:500) (AB1542, Merck Millipore, MA, USA) в PBS с 1% BSA и 0,02% Triton X100, в течение ночи при 4°C; (в) с антителами осла к гамма-глобулинам овцы, коньюгированными с Alexa Fluor 488 (1:700) (А11015, Invitrogen, CA, USA) в PBS в течение 2 часов при 20°C. После каждой инкубации с антителами препараты промывали трижды по 5 минут в PBS. Окрашенные мазки заключали в среду с DAPI (Abcam, UK).
Пример 9. Микроскопия
Для прижизненной флуоресцентной микроскопии суспензий клеток, окрашенных GBR-BP, и анализа иммуноокрашивания на TH использовали флуоресцентный микроскоп Zeiss Axio Obzerver (Zeiss, Germany), оснащенный Zeiss Colibri LED illumination system (Zeiss, Germany) и камерой Zeiss AxioCam MRc (Zeiss, Germany). Изображения получали при увеличениях объектива 40× и 63× и анализировали их с помощью программы AxioVision 40 V 4.8.2.0 (Zeiss, Germany).
Микроскопию окрашенных иммуногистохимически препаратов проводили на всей площади покровного стекла. Подсчитывали количество TH-иммунореактивных клеток. Общее количество клеток определяли по количеству ядер, окрашенных DAPI. После этого высчитывали процент TH-иммунореактивных клеток по следующей формуле: количество TH-иммунореактивных клеток / количество клеток с окрашенным DAPI ядром.
Программу FiJi использовали для измерения интенсивности флуоресценции клеток как на изображениях суспензии, окрашенной 5 и 20 нМ GBR-BP, так и на изображениях суспензии, полученной из ЧС в вибратомных срезов, окрашенных 20 и 50 нМ GBR-BP. Изображения были конвертированы в 8-битовый формат и показатели «Area», «Integrated Density», и «Mean Gray Value» клеток были измерены. После того, как эти параметры были получены, интенсивность флуоресценции клеток была вычислена по следующей формуле:
CTCF = «Integrated Density» - («Area of selected cell» × «Mean fluorescence of background values»).
Пример 10. Экстракция РНК и qPCR
Выделение общей РНК из отсортированных клеток осуществляли добавлением 700 мкл TRIzol к 300 мкл размороженного TRIzol, содержащего отсортированные клетки. Клетки инкубировали в пробирках при 20°С в течение 5 минут. Затем в каждую пробирку добавляли 100 мкл 1-бром-3-хлорпропана (Sigma, MO, USA) и продолжали инкубацию суспензии при 20°С в течение 15 минут, перемешивая на вортексе каждые 3 минуты. Пробирки центрифугировали (21000 × g) при 4°C в течение 15 минут. Водную фазу, содержащую RNA, переносили в новую микроцентрифужную пробирку. Для лучшего осаждения RNA в эту пробирку добавляли 1 мкл гликогена (Thermo Scientific, МА, USA) и 500 мкл изопропилового спирта (Sigma, MO, USA). Пробы перемешивали на вортексе и инкубировали при 20°С в течение 10 минут, после чего РНК осаждали в течение 10 минут при 21000 × g и 4°C. Супернатант отбирали, а осадок трижды отмывали в 1 мл 80% этанола и центрифугировали (21000 × g) при 4°C в течение 10 минут. После последнего центрифугирования этанол удаляли, а осадок РНК высушивали на воздухе в течение 15 минут. Затем РНК растворяли в 20 мкл воды марки ПЦР (Evrogen, Россия).
Целые замороженные кусочки ЧС, полученные от половины животных (n=9) 2-ой группы (введение MPTP) и половины животных (n=9) 3-ей группы (введение физиологического раствора), размораживали и к ткани добавляли 500 мкл TRIzol. Полученный образец инкубировали в течение 5 минут, гомогенизировали при помощи пипетирования и добавляли 500 мкл TRIzol. Последующие стадии выделения общей РНК выполняли в соответствии с описанным ранее протоколом.
Концентрацию РНК во всех образцах измеряли с помощью спектрофотометра (NanoDrop 8000, Thermo Scientific, МА, USA). Остатки геномной ДНК удаляли при помощи фермента деградации, свободного от ДНКазы I, РНКазы (Thermo Scientific, МА, USA), в соответствии с протоколом производителя. Экспрессию генов ключевых белков дофаминергических нейронов - TH, DAT и DDC, а также маркера астроцитов - GFAP, оценивали в отсортированных клетках и в кусочках целой ЧС методом qPCR в реальном времени. В качестве референcного гена использовался CYC1. Комплементарная ДНК (кДНК) была синтезирована из 150 нг общей РНК при помощи набора Maxima H Minus First Strand cDNA Synthesis Kit (Thermo Scientific, MA, USA) в соответствии с протоколом производителя. Концентрацию кДНК измеряли с помощью спектрофотометра NanoDrop 8000. qPCR проводили с использованием qPCRmix-HS SYBR+LowROX (Evrogen, Россия) на амплификаторе QuantStudio 12k Flex (Applied Biosystems, MA, USA). Для определения экспрессии ключевых маркеров дофаминергических нейронов и GFAP использовали представленные в таблице 1 праймеры (Evrogen, Россия).
Для проведения qPCR использовали 500 нг кДНК и следующий протокол амплификации: стадия удерживания (50°C в течение 2 минут и 95°C в течение 10 минут); стадия ПЦР (95°C в течение 15 секунд и 60°C в течение 1 минуты (50 циклов)); стадия кривой расплава (95°C в течение 15 секунд, 60°C в течение 1 минуты и 95°C в течение 15 секунд). После окончания реакции амплифицированные продукты разделяли при напряжении 100 B в 1,5% агарозном геле (Helicon, Россия), содержащем бромид этидия (Invitrogen, CA, USA). Гели проявляли при помощи ChemiDoc Touch (Bio-Rad Laboratories, CA, USA).
Сравнительный анализ экспрессии TH и DAT в отсортированных дофаминергических нейронах и в целой ЧС у мышей, получавших MPTP или физиологический раствор, проводили методом qPCR так же, как и при оценке экспрессии генов в отсортированных дофаминергических нейронах интактных животных (см. ранее). В этом исследовании использовали праймеры к TH, DAT и CYC1 (таблица 1). Изменение экспрессии TH и DAT рассчитывали с использованием метода 2−ΔΔC(t).
Пример 11. Статистические данные
Статистический анализ проводили с использованием программного обеспечения GraphPad Prism 6 (GraphPad Software, La Jolla, CA, USA). Для попарного сравнения количества отсортированных клеток и экспрессии генов в экспериментальной (MPTP) и контрольной (физиологический раствор) группах использовали критерий Стьюдента или критерий Манна-Уитни. Результаты представлены как среднее значение ± SEM. Различия считались достоверными при p < 0,05.
Результаты
Таким образом, авторами настоящего изобретения неожиданно было обнаружено, что использование комбинации указанных красителей и определенной последовательности окрашивания для прижизненного мечения дофаминергических нейронов позволяет эффективно получить популяцию дофаминергических нейронов черной субстанции посредством сортировки флуоресцентно-активированных клеток. Указанные неожиданные находки, сделанные авторами настоящего изобретения, а также описанные сложные исследовательские работы, позволили разработать способ получения популяции дофаминергических нейронов из черной субстанции мышей. Более того, помимо разработки способа согласно настоящему изобретению, авторами настоящего изобретения были разработаны различные предпочтительные варианты его осуществления. В частности, в соответствии с наиболее предпочтительным вариантом осуществления способа согласно настоящему изобретению ЧС выделяют из 200 мкм вибратомных срезов, а наилучшее различие в интенсивности флуоресценции между GBR-BP-окрашенными и GBR-BP-неокрашенными клетками достигается при окрашивании ткани срезов ЧС 10 мкМ DRAQ5 и 50 нМ GBR-BP с последующими двумя стадиями диссоциации ткани. Использование подобранного протокола прижизненного окрашивания позволило выделить клеточную популяцию DRAQ5+/GBR-BP+ клеток методом проточной цитометрии. В соответствии с наиболее предпочтительным вариантом осуществления способа согласно настоящему изобретению отсортированные при помощи FACS DRAQ5+/GBR-BP+ клетки в 97% являются дофаминергическими нейронами и экспрессируют основные гены-маркеры дофаминергических нейронов.
Кроме того, авторами настоящего изобретения, как раскрыто выше, были получены доказательства возможности использования фракции дофаминергических нейронов для оценки уровня экспрессии генов у животных в норме и на модели БП. В свою очередь, это дает возможность сравнивать профили экспрессии генов в целой ткани и в отдельной популяции дофаминергических нейронов, что в дальнейшем позволит получить новые ценные данные о протекании и сопряженности механизмов нейродегенерации и нейропластичности в ЧС при БП.
Перечень ссылочных источников
1. Agid, Y. Parkinson's disease: pathophysiology. Lancet. 1991, 337, 1321-1324, doi: 10.1016/0140-6736(91)92989-f.
2. Postuma, R.B.; Berg, D. Advances in markers of prodromal Parkinson disease. Nat. Rev. Neurol. 2016, 12.
3. Blesa, J.; Trigo-Damas, I.; Dileone, M.; Lopez-Gonzalez del Rey, N.; Hernandez, L.F.; Obeso, J.A. Compensatory mechanisms in Parkinson's disease: Circuits adaptations and role in disease modification. Exp Neurol. 2017, 298(Pt B), 148-161, doi: 10.1016/j.expneurol.2017.10.002.
4. Ugrumov, M.V. Development of early diagnosis of Parkinson's disease: Illusion or reality? CNS Neurosci Ther. 2020, 26, 997-1009, doi: 10.1111/cns.13429.
5. Simpkins, N.; Jankovic, J. Neuroprotection in Parkinson disease. Arch. Intern. Med. 2003, 163.
6. Biglan, K.M.; Ravina, B. Neuroprotection in Parkinson’s disease: An elusive goal. Semin. Neurol. 2007, 27.
7. Salamon, A.; Zádori, D.; Szpisjak, L.; Klivényi, P.; Vécsei, L. Neuroprotection in Parkinson’s disease: facts and hopes. J. Neural Transm. 2020, 127.
8. Ugrumov, M. V.; Khaindrava, V.G.; Kozina, E.A.; Kucheryanu, V.G.; Bocharov, E. V.; Kryzhanovsky, G.N.; Kudrin, V.S.; Narkevich, V.B.; Klodt, P.M.; Rayevsky, K.S.; et al. Modeling of presymptomatic and symptomatic stages of parkinsonism in mice. Neuroscience 2011, 181, doi:10.1016/j.neuroscience.2011.03.007.
9. Jagmag, S.A.; Tripathi, N.; Shukla, S.D.; Maiti, S.; Khurana, S. Evaluation of models of Parkinson’s disease. Front. Neurosci. 2016, 9.
10. Kozina, E.A.; Khakimova, G.R.; Khaindrava, V.G.; Kucheryanu, V.G.; Vorobyeva, N.E.; Krasnov, A.N.; Georgieva, S.G.; Kerkerian-Le Goff, L.; Ugrumov, M. V. Tyrosine hydroxylase expression and activity in nigrostriatal dopaminergic neurons of MPTP-treated mice at the presymptomatic and symptomatic stages of parkinsonism. J. Neurol. Sci. 2014, 340, doi:10.1016/j.jns.2014.03.028.
11. Mingazov, E.R.; Khakimova, G.R.; Kozina, E.A.; Medvedev, A.E.; Buneeva, O.A.; Bazyan, A.S.; Ugrumov, M. V. MPTP Mouse Model of Preclinical and Clinical Parkinson’s Disease as an Instrument for Translational Medicine. Mol. Neurobiol. 2018, 55, doi:10.1007/s12035-017-0559-6.
12. Zhuang, X.; Mazzoni, P.; Kang, U.J. The role of neuroplasticity in dopaminergic therapy for Parkinson disease. Nat. Rev. Neurol. 2013, 9.
13. Chu, H.Y. Synaptic and cellular plasticity in Parkinson’s disease. Acta Pharmacol. Sin. 2020, 41.
14. Lavrova, A.V.; Gretskaya, N.M.; Akimov, M.G.; Bezuglov, V.V. A novel fluorescent analog of the dopamine reuptake inhibitor GBR12909. Russ. J. Bioorganic Chem. 2019, 45, 416-424, doi: 10.1134/S1068162019040058.
15. Franklin, K.; Paxinos, G. The Mouse Brain in Stereotaxic Coordinates, Compact - 3rd Edition; 2008;
16. Eriksen, J.; Rasmussen, S.G.F.; Rasmussen, T.N.; Vaegter, C.B.; Joo, H.C.; Zou, M.F.; Newman, A.H.; Gether, U. Visualization of dopamine transporter trafficking in live neurons by use of fluorescent cocaine analogs. J. Neurosci. 2009, 29, doi:10.1523/JNEUROSCI.4177-08.2009.
17. Xu, S.Y.; Wu, Y.M.; Ji, Z.; Gao, X.Y.; Pan, S.Y. A modified technique for culturing primary fetal rat cortical neurons. J. Biomed. Biotechnol. 2012, 2012, doi:10.1155/2012/803930.
18. Smith, P.J.; Wiltshire, M.; Errington, R.J. DRAQ5 labeling of nuclear DNA in live and fixed cells. Curr. Protoc. Cytom. 2004, Chapter 7, doi:10.1002/0471142956.cy0725s28.

Изобретение относится к области биотехнологии, а именно к способу получения популяции дофаминергических нейронов из черной субстанции мышей. Указанный способ предусматривает получение ткани черной субстанции у мышей, инкубирование полученной ткани с красителем GBR-BP, диссоциацию окрашенной ткани с получением клеточной суспензии с частично диссоциированной тканью, инкубирование полученной клеточной суспензии с частично диссоциированной тканью совместно с красителями DRAQ5 и GBR-BP, повторную диссоциацию окрашенной клеточной суспензии с частично диссоциированной тканью с получением окрашенной клеточной суспензии и выделение DRAQ5+/GBR-BP+ клеток полученной окрашенной клеточной суспензии. Изобретение применимо для повышения эффективности получения популяции дофаминергических нейронов. 3 з.п. ф-лы, 8 ил., 1 табл., 11 пр.
1. Способ получения популяции дофаминергических нейронов из черной субстанции мышей, предусматривающий:
- получение ткани черной субстанции у мышей из вибратомных срезов черной субстанции толщиной 200 мкм,
- инкубирование полученной ткани с красителем GBR-BP в концентрации 50 нМ в течение 15 минут при 37°C,
- диссоциацию окрашенной ткани с получением клеточной суспензии с частично диссоциированной тканью,
- инкубирование полученной клеточной суспензии с частично диссоциированной тканью совместно с красителями DRAQ5 в концентрации 10 мкМ и GBR-BP в концентрации 50 нМ в течение еще 15 минут при 37°C,
- повторную диссоциацию окрашенной клеточной суспензии с частично диссоциированной тканью с получением окрашенной клеточной суспензии и
- выделение DRAQ5+/GBR-BP+ клеток полученной окрашенной клеточной суспензии посредством сортировки флуоресцентно-активированных клеток с получением популяции дофаминергических нейронов из черной субстанции.
2. Способ по п.1, в котором ткань черной субстанции получают у мышей в норме.
3. Способ по п.1, в котором ткань черной субстанции получают у мышей при патологии.
4. Способ по п.3, в котором указанной патологией является модель болезни Паркинсона.
| ADOLFS Y | |||
| et al., Protocol for tissue clearing and 3D analysis of dopamine neurons in the developing mouse midbrain, STAR protocols, 2021, 2(3), p | |||
| Хирургический инструмент для операции на желудке я кишечнике | 1950 |
|
SU100669A1 |
| FLORENCE GAVEN et al., Primary Culture of Mouse Dopaminergic Neurons, J Vis Exp., 2014, 91, 51751 | |||
| LIN J.Y | |||
| et al., Dendritic projections and dye-coupling in | |||
Авторы
Даты
2024-01-17—Публикация
2022-04-11—Подача