Изобретение относится к области медицинской химии, а именно, к новым органическим соединениям, конкретно к 2-((1-(4R-бензил)-1H-1,2,3-триазол-4-ил)метокси)-3-метил-6-(проп-1-ен-2-ил)циклогекс-3-ен-1-олам, описываемым формулой 1,

где R может быть атомом водорода, метильной или трифторметильной группой, которые могут применяться для лечения болезни Паркинсона.
Болезнь Паркинсона является тяжелым нейродегеративным заболеванием, которое характеризуется прогрессирующей потерей дофаминовых нейронов в головном мозге. Основные симптомами болезни Паркинсона являются моторные (тремор, мышечная ригидность, постулярная неустойчивость) и немоторные (бессонница, боль, психические расстройства и утомляемость) [1]. Большинство случаев диагностируются в 60-65 лет, также выявлены случаи ювенильного паркинсонизма (<21 год) [2].
В настоящее время не существует лекарственных средств, способных вылечить болезнь Паркинсона, и терапия направлена на купирование симптомов. Лекарственные препараты, содержащие 3-гидрокси-L-тирозин (леводопа), непосредственный метаболический предшественник дофамина, являются золотым стандартом лечения. К сожалению, препарат наиболее эффективен только в первые несколько лет после приема [3]. Также длительный прием леводопы связывают с развитием дискинезии и двигательных колебаний. В 16-20% случаев пациенты испытывали дискинезию и двигательные колебания в течение 9 месяцев лечения и от 50 до 60% пациентов через 3-4 лет приема леводопы [4].
Таким образом, актуальной задачей является поиск соединений, обладающих противопаркинсонической активностью.
Ранее было показано, что монотерпеноид (1R,2R,6S)-3-метил-6-(проп-1-ен-2-ил)циклогекс-3-ен-1,2-диол 2 (Проттремин) проявляет высокую противопаркинсоническую активность в дозе 20 мг/кг, устраняя симптомы болезни Паркинсона на модели МФТП (1-метил-4-фенил-1,2,3,6-тетрагидропиридин) на мышах [5], но он пока не вошел в клиническую практику, что делает перспективным поиск новых активных производных.
Поставленная задача решается использованием в качестве противопаркинсонического средства новых производных соединения 2, 2-((1-(4R-бензил)-1H-1,2,3-триазол-4-ил)метокси)-3-метил-6-(проп-1-ен-2-ил)циклогекс-3-ен-1-олов, описываемых формулой 1,

где R может быть атомом водорода, метильной или трифторметильной группой, которые могут применяться для лечения болезни Паркинсона.
Соединения типа 1 могут быть синтезированы из 3-метил-6-(проп-1-ен-2-ил)циклогекс-3-ен-1,2-диола 2 в соответствии с Фиг. 1 через предварительное образование диацетата 3 и эпоксида 4, получаемых в соответствии с работой [6], и, далее, через пропаргиловый эфир 5.
Исходное соединение 2 может быть синтезировано исходя из коммерчески доступного монотерпеноида вербенона (Фиг. 2) [5].
Для изучения противопаркинсонической активности in vivo широко используется модель с нейротоксином МФТП, который вызывает гибель дофаминовых нейронов черной субстанции головного мозга, и, как следствие, развитие паркинсонического синдрома у людей, обезьян и грызунов при парентеральных способах введения [7]. Индукцию паркинсонического синдрома осуществляли четырехкратным внутрибрюшинным введением МФТП в дозе 20 мг/кг самцам мышей линии C57Bl/6. Соединения 1а-в вводили в дозе 20 мг/кг через 24 часа после последней инъекции нейротоксина; тестирование проводили через два часа после введения агентов, оценивая способность соединений устранять симптомы болезни Паркинсона в поведенческом тесте “Открытое поле” в автоматизированной установке TruScan. Введение нейротоксина МФТП приводило к достоверному снижению двигательной и исследовательской активности животных (Таблица). Соединения 1а-в продемонстрировали высокую противопаркинсоническую активность, выраженную в достоверном улучшении двигательной и исследовательской активности мышей.
Изобретение иллюстрируется следующими примерами.
Пример 1. Синтез 3-метил-6-(проп-1-ен-2-ил)-2-(проп-2-ин-1-илокси)циклогекс-3-ен-1-ола 5

К 0.334 г (2.22 ммоль) эпоксида 4 и 160 мг Amberlyst-15 в 10 мл толуола добавили 0.498 г (8.88 ммоль) пропаргилового спирта в 10 мл толуола. Реакционную смесь перемешивали в течение 2 часов при комнатной температуре. Далее Amberlyst-15 отфильтровали, и растворитель отогнали в вакууме ротационного испарителя. Остаток хроматографировали на колонке с силикагелем, элюент – этилацетат/гексан (от 0 до 100%).
Выход: 0.068 г (15%). Бесцветное масло.  =-21.1 (c 1.88, CHCl3). Спектр ЯМР 1H (CDCl3): 1.76-1.79 (3H, м, 3H-7), 1.80 (3H, с, 3H-10), 1.92 -1.99 (1H, м, один из 2H-5), 2.12-2.21 (1H, м, один из 2H-5), 2.37 (1H, дд, J1=11.6 Гц, J2=5.1 Гц, H-6), 2.44 (1H, т, J=2,4 Гц, H-4’), 3,71 (1H, уш. с, H-2), 4.03-4.06 (1H, м, H-1), 4.27 (2H, д., J=2,4 Гц, 2H-2’), 4.82-4.84 (1H, м, один из 2H-9), 4.93-4.96 (1H, с, один из 2H-9), 5.64-5.67 (1H, м, H-4). Спектр ЯМР 13C (CDCl3): 20.70 (CH3, C-7), 22.44 (CH3, C-10), 24.03 (CH2, C-5), 39.76 (CH, C-6), 57.60 (CH2, C-2’), 67.27 (CH, C-1), 74.35 (CH, C-4’), 78.67 (CH, C-2), 80.05 (C, C-3’), 111.14 (CH2, C-9), 125.79 (CH, C-4), 129.89 (C, C-3), 145.76 (C, C-8). HRMS: Найдено: 206.1297. Вычислено: 206.1301 для (C13H18O2)+.
=-21.1 (c 1.88, CHCl3). Спектр ЯМР 1H (CDCl3): 1.76-1.79 (3H, м, 3H-7), 1.80 (3H, с, 3H-10), 1.92 -1.99 (1H, м, один из 2H-5), 2.12-2.21 (1H, м, один из 2H-5), 2.37 (1H, дд, J1=11.6 Гц, J2=5.1 Гц, H-6), 2.44 (1H, т, J=2,4 Гц, H-4’), 3,71 (1H, уш. с, H-2), 4.03-4.06 (1H, м, H-1), 4.27 (2H, д., J=2,4 Гц, 2H-2’), 4.82-4.84 (1H, м, один из 2H-9), 4.93-4.96 (1H, с, один из 2H-9), 5.64-5.67 (1H, м, H-4). Спектр ЯМР 13C (CDCl3): 20.70 (CH3, C-7), 22.44 (CH3, C-10), 24.03 (CH2, C-5), 39.76 (CH, C-6), 57.60 (CH2, C-2’), 67.27 (CH, C-1), 74.35 (CH, C-4’), 78.67 (CH, C-2), 80.05 (C, C-3’), 111.14 (CH2, C-9), 125.79 (CH, C-4), 129.89 (C, C-3), 145.76 (C, C-8). HRMS: Найдено: 206.1297. Вычислено: 206.1301 для (C13H18O2)+.
Пример 2. Синтез 2-((1-бензил-1H-1,2,3-триазол-4-ил)метокси)-3-метил-6-(проп-1-ен-2-ил)циклогекс-3-ен-1-ола 1а
К 0.027 г (0.13 ммоль) пропаргилового эфира 5, растворенного в 10 мл смеси t-BuOH:H2O (2:1), добавили 0.031 г (0.23 ммоль) (азидометил)бензола, 0.009 г (0.03 ммоль) CuSO4*5H2O, 0.008 г (0.04 ммоль) аскорбата натрия. Реакционную смесь кипятили в течение 1 часа. После охлаждения смеси растворитель отгоняли на ротационном испарителе, добавляли насыщенный раствор NaCl и экстрагировали (3*10 мл) этилацетатом. Органический слой сушили над прокаленным Na2SO4. Отфильтрованный от осушителя органический слой упаривали на ротационном испарителе. Полученный продукт очищали колоночной хроматографией. Элюент – этилацетат/н-гексан (от 0 до 100%).
Выход 0.027 г (60%). Желтое масло.  = -9.41 (c 0.85, CHCl3). Спектр ЯМР 1H (CDCl3): 1.65 (3H, с, 3H-7), 1.75 (3H, с, 3H-10), 1.90-1.97 (1H, м, один из 2H-5), 2.12-2.21 (1H, м, один из 2H-5), 2.34 (1H, дд, J1=5.43 Гц, J2=11.51 Гц, H-6), 3.66 (1H, с, H-2), 4.04 (1H, с, H-1), 4.72 (1H, д, J=12.3 Гц, один из 2H-2’), 4.80 (1H, д, J=12.3 Гц, один из 2H-2’), 4.82 (1H, c, один из 2H-9), 4.94 (1H, с, один из 2H-9) 5.49 (1H, с, один из 2H-9), 5.50 (2H, д, J=15 Гц, 2H-5’), 5.60-5.65 (1H, м, H-4), 7.22-7.27 (2H, м, H-11’, H-7’), 7.31-7.37 (3H, м, H-10’, H-8’, H-9’), 7.44 (1H, с, H-4’). Спектр ЯМР13C (CDCl3): 20.73 (CH3, C-7), 22.45 (CH3, C-10), 24.06 (CH2, C-5), 39.88 (CH, C-6), 54.01 (CH2, C-5’), 63.97 (CH2, C-2’), 67.19 (CH, C-1), 79.28 (CH, C-2), 111.12 (CH2, C-9), 122.19 (CH, C-9’), 125.73 (CH, C-4), 127.93 (CH, C-11’), 128.61 (CH, C-7’), 128.94 (CH, C-10’, C-8’), 129.90 (C, C-3), 134.31 (C, C-6’), 145.7 (C, C-8), 145.73 (C, C-3’). HRMS: Найдено: 339.1935. Вычислено: 339.1941 (C20H25O2N3)+.
= -9.41 (c 0.85, CHCl3). Спектр ЯМР 1H (CDCl3): 1.65 (3H, с, 3H-7), 1.75 (3H, с, 3H-10), 1.90-1.97 (1H, м, один из 2H-5), 2.12-2.21 (1H, м, один из 2H-5), 2.34 (1H, дд, J1=5.43 Гц, J2=11.51 Гц, H-6), 3.66 (1H, с, H-2), 4.04 (1H, с, H-1), 4.72 (1H, д, J=12.3 Гц, один из 2H-2’), 4.80 (1H, д, J=12.3 Гц, один из 2H-2’), 4.82 (1H, c, один из 2H-9), 4.94 (1H, с, один из 2H-9) 5.49 (1H, с, один из 2H-9), 5.50 (2H, д, J=15 Гц, 2H-5’), 5.60-5.65 (1H, м, H-4), 7.22-7.27 (2H, м, H-11’, H-7’), 7.31-7.37 (3H, м, H-10’, H-8’, H-9’), 7.44 (1H, с, H-4’). Спектр ЯМР13C (CDCl3): 20.73 (CH3, C-7), 22.45 (CH3, C-10), 24.06 (CH2, C-5), 39.88 (CH, C-6), 54.01 (CH2, C-5’), 63.97 (CH2, C-2’), 67.19 (CH, C-1), 79.28 (CH, C-2), 111.12 (CH2, C-9), 122.19 (CH, C-9’), 125.73 (CH, C-4), 127.93 (CH, C-11’), 128.61 (CH, C-7’), 128.94 (CH, C-10’, C-8’), 129.90 (C, C-3), 134.31 (C, C-6’), 145.7 (C, C-8), 145.73 (C, C-3’). HRMS: Найдено: 339.1935. Вычислено: 339.1941 (C20H25O2N3)+.
Пример 3. Получение 3-метил-6-(проп-1-ен-2-ил)-2-((1-(4-(трифторметил)бензил)-1H-1,2,3-триазол-4-ил)метокси)циклогекс-3-ен-1-ола 1б
К 0.025 г (0.12 ммоль) пропаргилового эфира 5, растворенного в 10 мл смеси t-BuOH:H2O (2:1), добавили 0.043 г (0.22 ммоль) 1-(азидометил)-4-(трифторметил)бензола, 0.008 г (0.03 ммоль) CuSO4*5H2O, 0.007 г (0.04 ммоль) аскорбата натрия. Реакционную смесь кипятили в течение 1 часа. После охлаждения смеси растворитель отгоняли на ротационном испарителе, добавляли насыщенный раствор NaCl и экстрагировали (3*10 мл) этилацетатом. Органический слой сушили над прокаленным Na2SO4. Отфильтрованный от осушителя органический слой упаривали на ротационном испарителе. Полученный продукт очищали колоночной хроматографией. Элюент – этилацетат/н-гексан (от 0 до 100%).
Выход 0.037 г (66%). Бесцветное масло.  = -14.44 (c 0.54, CHCl3). Спектр ЯМР 1H (CDCl3): 1.64-1.66 (3H, м, H-7), 1.75 (3H, с, H-10), 1.94 (1H, дтд, J1=17.8 Гц, J2=5.3 Гц, J3=1.4 Гц, один из H-5), 2.11-2.22 (1H, м, один из H-5), 2.34 (1H, дд, J1=11.78 Гц, J2=5.18 Гц, H-6), 3.67 (1H, уш. с, H-2), 4.04 (1H, уш. с, H-1), 4.71-4.75 (1H, д, J=12.29 Гц, один из H-11), 4.81-4.85 (2H, м, один из H-9, один из H-11), 4.93-4.95 (1H, м, один из H-9), 5.56 (2H, с, H-14), 5.62-5.65 (1H, м, H-4), 7.34 (2H, д, J=8.02 Гц, H-20, H-16), 7.49 (1H, с, H-12), 7.60 (2H, д, J=8.14 Гц, H-19, H-17). Спектр ЯМР 13C (CDCl3): 20.79 (CH3, C-7), 22.48 (CH3,C-10), 39.99 (CH, C-6), 53.36 (CH2, C-14), 63.95 (CH2, C-11), 67.29 (CH, C-1), 79.47 (CH, C-2), 111.23 (CH2, C-9), 122.24 (CH, C-12), 125.95 (CH, C-19, C-17), 128.10 (CH, C-20, C-16), 129.87 (С, С-3), 138.36 (C, C-15), 145.68 (C, C-8), 146.17 (C, C-13). HRMS: Найдено: 407.1809. Вычислено: 407.1815 (C21H24O2N3F3)+.
= -14.44 (c 0.54, CHCl3). Спектр ЯМР 1H (CDCl3): 1.64-1.66 (3H, м, H-7), 1.75 (3H, с, H-10), 1.94 (1H, дтд, J1=17.8 Гц, J2=5.3 Гц, J3=1.4 Гц, один из H-5), 2.11-2.22 (1H, м, один из H-5), 2.34 (1H, дд, J1=11.78 Гц, J2=5.18 Гц, H-6), 3.67 (1H, уш. с, H-2), 4.04 (1H, уш. с, H-1), 4.71-4.75 (1H, д, J=12.29 Гц, один из H-11), 4.81-4.85 (2H, м, один из H-9, один из H-11), 4.93-4.95 (1H, м, один из H-9), 5.56 (2H, с, H-14), 5.62-5.65 (1H, м, H-4), 7.34 (2H, д, J=8.02 Гц, H-20, H-16), 7.49 (1H, с, H-12), 7.60 (2H, д, J=8.14 Гц, H-19, H-17). Спектр ЯМР 13C (CDCl3): 20.79 (CH3, C-7), 22.48 (CH3,C-10), 39.99 (CH, C-6), 53.36 (CH2, C-14), 63.95 (CH2, C-11), 67.29 (CH, C-1), 79.47 (CH, C-2), 111.23 (CH2, C-9), 122.24 (CH, C-12), 125.95 (CH, C-19, C-17), 128.10 (CH, C-20, C-16), 129.87 (С, С-3), 138.36 (C, C-15), 145.68 (C, C-8), 146.17 (C, C-13). HRMS: Найдено: 407.1809. Вычислено: 407.1815 (C21H24O2N3F3)+.
Пример 4. Получение 3-метил-2-((1-(4-метилбензил)-1H-1,2,3-триазол-4-ил)метокси)-6-(проп-1-ен-2-ил)циклогекс-3-ен-1-ола 1в

К 0.025 г (0.12 ммоль) пропаргилового эфира 5, растворенного в 10 мл смеси t-BuOH:H2O (2:1), добавили 0.032 г (0.22 ммоль) 1-(азидометил)-4-метилбензола, 0.008 г (0.03 ммоль) CuSO4*5H2O, 0.007 г (0.04 ммоль) аскорбата натрия. Реакционную смесь кипятили в течение 1 часа. После охлаждения смеси растворитель отгоняли на ротационном испарителе, добавляли насыщенный раствор NaCl и экстрагировали (3*10 мл) этилацетатом. Органический слой сушили над прокаленным Na2SO4. Отфильтрованный от осушителя органический слой упаривали на ротационном испарителе. Полученный продукт очищали колоночной хроматографией. Элюент – этилацетат/н-гексан (от 0 до 100%).
Выход 0.019 г (45%). Бесцветное масло. 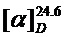 = -19.46 (c 0.74, CHCl3). Спектр ЯМР 1H (CDCl3): 1.61-1.65 (3H, м, H-7), 1.75 (3H, уш. с, С-10), 1.93 (1H, дтд, J1=17.7 Гц, J2=5.3 Гц, J3=1.4 Гц, один из H-5), 2.11-2.22 (1H, м, один из H-5), 2.32 (3H, c, H-21), 2.32-2.37 (1H, м, H-6), 3.65 (1H, уш. с, H-2), 4.03 (1H, уш. с, H-1), 4.70 (1H, д, J=12.29Гц, один из H-11), 4.77-4.82 (2H, м, один из H-9, один из H-11), 4.92-4.95 (1H, м, один из H-9), 5.44 (2H, д, J=1.82 Гц, H-14), 5.60-5.64 (1H, м, H-4), 7.14 (4H, с, H-16, H-17, H-19, H-20), 7.42 (1H, с, H-12). Спектр ЯМР13C (CDCl3): 20.75 (CH3, C-7), 21.0 (CH3, C-21), 22.45 (CH3, C-10), 24.14 (CH2, C-5), 39.93 (CH, C-6), 53.85 (CH2, C-14), 63.95 (CH2, C-11), 67.25 (CH, C-1), 79.34 (CH, C-2), 111.09 (CH2, C-9), 122.16 (CH, C-12), 125.76 (CH, C-4), 128.0 (CH, C-20, C-16), 129.61 (CH, C-19, C-17), 129.96 (C, C-3), 131.31 (C, C-15), 138.58 (C, C-18), 145.67 (C, C-8), 145.79 (C, C-13). HRMS: Найдено: 353.2097. Вычислено: 353.2098 (C21H27O2N3)+.
= -19.46 (c 0.74, CHCl3). Спектр ЯМР 1H (CDCl3): 1.61-1.65 (3H, м, H-7), 1.75 (3H, уш. с, С-10), 1.93 (1H, дтд, J1=17.7 Гц, J2=5.3 Гц, J3=1.4 Гц, один из H-5), 2.11-2.22 (1H, м, один из H-5), 2.32 (3H, c, H-21), 2.32-2.37 (1H, м, H-6), 3.65 (1H, уш. с, H-2), 4.03 (1H, уш. с, H-1), 4.70 (1H, д, J=12.29Гц, один из H-11), 4.77-4.82 (2H, м, один из H-9, один из H-11), 4.92-4.95 (1H, м, один из H-9), 5.44 (2H, д, J=1.82 Гц, H-14), 5.60-5.64 (1H, м, H-4), 7.14 (4H, с, H-16, H-17, H-19, H-20), 7.42 (1H, с, H-12). Спектр ЯМР13C (CDCl3): 20.75 (CH3, C-7), 21.0 (CH3, C-21), 22.45 (CH3, C-10), 24.14 (CH2, C-5), 39.93 (CH, C-6), 53.85 (CH2, C-14), 63.95 (CH2, C-11), 67.25 (CH, C-1), 79.34 (CH, C-2), 111.09 (CH2, C-9), 122.16 (CH, C-12), 125.76 (CH, C-4), 128.0 (CH, C-20, C-16), 129.61 (CH, C-19, C-17), 129.96 (C, C-3), 131.31 (C, C-15), 138.58 (C, C-18), 145.67 (C, C-8), 145.79 (C, C-13). HRMS: Найдено: 353.2097. Вычислено: 353.2098 (C21H27O2N3)+.
Пример 5. Изучение противопаркинсонической активности соединений 1а-в in vivo
Для исследования соединений на противопаркинсоническую активность использовали фармакологическую модель болезни Паркинсона, индуцированную внутрибрюшным введением нейротоксина МФТП, который разрушает дофаминергические нейроны в substantia nigra в головном мозге. Эксперименты проводились на самцах мышей линии C57Bl/6 массой 25-30 г., разделенных на группы по 8 мышей в каждой. Группе интактного контроля вводили физраствор. Паркинсонический синдром индуцировали четырехкратным введением МФТП в дозе 20 мг/кг через каждые два часа. Через 24 часа после последнего введения нейротоксина вводились агенты в дозе 20 мг/кг и далее; через два часа проводилось тестирование двигательной-исследовательской активности и координации животных в автоматизированной установке “TrueScan”.
Олигокинезию оценивали через 2 часа после инъекции МФТП по двигательно-ориентировочной активности в тесте “Открытое поле” в установке TruScan (США) в течение 3 минут. Результаты экспериментов представлены в таблице.
Исходя из результатов экспериментов, МФТП достоверно снижал двигательную и исследовательскую активность животных. Соединения 1а-в, в сравнении с группой МФТП, увеличивали двигательную активность мышей, выраженную в увеличении дистанции движения, время двигательной активности и скорости движения, а также исследовательскую активность, проявляющуюся в количестве исследованных отверстий и времени исследовательских реакций.
Таблица. Исследование противопаркинсонической активности соединений 1а-в
*Р<0.05; **Р<0.01; ***Р<0.001 достоверность по сравнению с контрольной группой
#Р<0.05; ##Р<0.01; ### Р<0.001 достоверность по сравнению с гр. МФТП
А – двигательная активность, сек.; Б – дистанция движения, см; В – скорость движения, см/сек; Г – кол-во исследованных отверстий; Д – время исследовательских реакций.
Источники информации
[1] Kalia, L. V.; Lang, A. E. Lancet 2015, 386, 896–912.
[2] Armstrong, M. J.; Okun, M. S. JAMA, 2020, 323(6), 548–560.
[3] Tambasco, N., Romoli, M., Calabresi, P. Curr. Neuropharmacol, 2018, 16, 1239-1252.
[4] Olanowand, C. W., Stocchi, F. Mov. Disord., 2018, 33(6), 859-866.
[5] Ardashov, O. V.; Pavlova, A. V.; Il’ina, I. V.; Morozova, E. A.; Korchagina, D. V.; Karpova, E. V.; Volcho, K. P.; Tolstikova, T. G.; Salakhutdinov, N. F. J. Med. Chem. 2011, 54(11), 3866–3874.
[6] Kotliarova, A.; Podturkina, A.V.; Pavlova, A.V.; Gorina, D.S.; Lastovka, A.V.; Ardashov, O.V.; Rogachev, A.D.; Izyurov, A.E.; Arefieva, A.B.; Kulikov, A.V.; Tolstikova, T.G.; Volcho, K.P.; Salakhutdinov, N.F.; Sidorova, Y. A Newly Identified Monoterpenoid-Based Small Molecule Able to Support the Survival of Primary Cultured Dopamine Neurons and Alleviate MPTP-Induced Toxicity In Vivo. Molecules 2022, 27, 8286.
[7] Jackson-Lewis, V.; Przeborski, S. Protocol for the MPTP mouse model of Parkinson’s disease. Nat. Protoc., 2007, 2, 141-151.
| название | год | авторы | номер документа |
|---|---|---|---|
| 2-((1H-1,2,4-Триазо-3-ил)тио)-3-метил-6-(проп-1-ен-2-ил)циклогекс-3-ен-1-ол в качестве противопаркинсонического средства | 2022 |
|
RU2796729C1 |
| ЭПОКСИДЫ 3-МЕТИЛ-6-(ПРОП-1-ЕН-2-ИЛ)ЦИКЛОГЕКС-3-ЕН-1,2-ДИОЛА-НОВЫЕ ПРОТИВОПАРКИНСОНИЧЕСКИЕ И ПРОТИВОСУДОРОЖНЫЕ СРЕДСТВА | 2014 |
|
RU2571299C1 |
| ПРОИЗВОДНЫЕ 2-((4-(4-(БЕНЗИЛОКСИ)ПИРИМИДИН-2-ИЛ)ПИПЕРАЗИН-1-ИЛ)МЕТИЛ)-1Н-БЕНЗО[d]ИМИДАЗОЛА В КАЧЕСТВЕ НИЗКОМОЛЕКУЛЯРНЫХ АГОНИСТОВ РЕЦЕПТОРА ГЛЮКАГОНОПОДОБНОГО ПЕПТИДА-1 | 2024 |
|
RU2838323C1 |
| ПРОИЗВОДНЫЕ 1-(4-ИЗОКСАЗОЛ-5-ИЛ)-1Н-ПИРАЗОЛ-1-ИЛ)-2-МЕТИЛПРОПАН-2-ОЛА И РОДСТВЕННЫЕ СОЕДИНЕНИЯ В КАЧЕСТВЕ ИНГИБИРОРОВ ИЛ-17 И ИФН-ГАММА ДЛЯ ЛЕЧЕНИЯ АУТОИММУННЫХ ЗАБОЛЕВАНИЙ И ХРОНИЧЕСКОГО ВОСПАЛЕНИЯ | 2018 |
|
RU2785342C2 |
| СПОСОБЫ ПОЛУЧЕНИЯ НЕКОТОРЫХ 2-(ПИРИДИН-3-ИЛ)ТИАЗОЛОВ | 2013 |
|
RU2647851C2 |
| ИНГИБИТОРЫ ПОЛИ(АДФ-РИБОЗО)ПОЛИМЕРАЗЫ-1 ЧЕЛОВЕКА НА ОСНОВЕ ПРОИЗВОДНЫХ УРАЦИЛА | 2012 |
|
RU2527457C2 |
| СПОСОБ СИНТЕЗА(Z)-3-[2-БУТОКСИ-3'-(3-ГЕПТИЛ-1-МЕТИЛУРЕИДО)БИФЕНИЛ-4-ИЛ]-2-МЕТОКСИАКРИЛОВОЙ КИСЛОТЫ | 2008 |
|
RU2478614C2 |
| 1-АРИЛПИРРОЛО[1,2-A]ПИРАЗИН-3-КАРБОКСАМИДЫ С НЕЙРОПСИХОТРОПНОЙ АКТИВНОСТЬЮ | 2014 |
|
RU2572076C2 |
| СПОСОБЫ ПОЛУЧЕНИЯ ОПРЕДЕЛЕННЫХ 2-(ПИРИДИН-3-ИЛ)ТИАЗОЛОВ | 2013 |
|
RU2647853C2 |
| (6S,9AS)-N-БЕНЗИЛ-6-[(4-ГИДРОКСИФЕНИЛ)МЕТИЛ]-4,7-ДИОКСО-8-({ 6-[3-(ПИПЕРАЗИН-1-ИЛ)АЗЕТИДИН-1-ИЛ]ПИРИДИН-2-ИЛ} МЕТИЛ)-2-(ПРОП-2-ЕН-1-ИЛ)-ОКТАГИДРО-1H-ПИРАЗИНО[2,1-C][1,2,4]ТРИАЗИН-1-КАРБОКСАМИДНОЕ СОЕДИНЕНИЕ | 2014 |
|
RU2669805C2 |

Изобретение относится к области медицинской химии, а именно к производным к 2-((1-(4-бензил)-1H-1,2,3-триазол-4-ил)метокси)-3-метил-6-(проп-1-ен-2-ил)циклогекс-3-ен-1-ола формулы 1, где R может быть атомом водорода, метильной или трифторметильной группой. Технический результат – соединения формулы 1, обладающие противопаркинсонической активностью. 2 ил., 1 табл., 5 пр.

2-((1-(4R-бензил)-1H-1,2,3-триазол-4-ил)метокси)-3-метил-6-(проп-1-ен-2-ил)циклогекс-3-ен-1-олы, описываемые формулой 1
 ,
,
где R может быть атомом водорода, метильной или трифторметильной группой, в качестве противопаркинсонического средства.
| 2-((1H-1,2,4-Триазо-3-ил)тио)-3-метил-6-(проп-1-ен-2-ил)циклогекс-3-ен-1-ол в качестве противопаркинсонического средства | 2022 |
|
RU2796729C1 |
| Волчо К.П | |||
| и др | |||
| Новые противопаркинсонические агенты на основе природных соединений | |||
| Современные проблемы органической химии | |||
| Сборник научных трудов | |||
| Всероссийская научная конференция с международным участием, посвященная 110-летию со дня рождения академика Николая Николаевича Ворожцова | |||
| Издательство: Федеральное | |||
Авторы
Даты
2024-01-22—Публикация
2023-10-30—Подача