Вводная часть
Семейство цитокинов ИЛ-17 связывают с патогенезом аутоиммунных заболеваний и, как правило, соотносят с патогенными симптомами аутоиммунного и хронического воспаления. Сверхэкспрессия ИЛ-17 является признаком аутоиммунных и хронических воспалительных заболеваний, таких как ревматоидный артрит, псориаз и псориатический артрит, анкилозирующий спондилит, воспалительное заболевание кишечника, рассеянный склероз, васкулит и атеросклероз, системная красная волчанка, также как заболевания легких, астма и хроническая обструктивная болезнь легких. (обзор в Miossec and Kolls, Nature Reviews Drug Discovery, 20121).
Семейство цитокинов ИЛ-17 включает шесть членов, из которых лучше всего охарактеризованы ИЛ-17A и ИЛ-17F. ИЛ-17A и ИЛ-17F существуют как в виде гомо-, так и гетеродимеров (ИЛ-17AA, ИЛ-17AF, ИЛ-17FF). ИЛ-17A и ИЛ-17F явно связаны с воспалением, тогда как роль других членов семейства ИЛ-17 менее изучена (изложено в Reynold et al., Cytokine Growth Factor Rev., 20102).
Секреция ИЛ-17 в основном вызывается специфическим подтипом Т-хелперных клеток, называемых Th17-клетками. Дифференциация наивных CD4+ T-клеток в Th17-клетки индуцируется в присутствии цитокинов ИЛ-1β, ТФРβ и ИЛ-6, тогда как ИЛ-23 поддерживает выживаемость TH17-клеток. Важными факторами транскрипции для транскрипции и секреции ИЛ-17 из Th17-клеток являются RORγt и STAT3. Сам ИЛ-17 индуцирует выработку эффекторных молекул в экспрессирующих ИЛ-17R клетках, таких как эндотелиальные клетки, эпителиальные клетки или фибробласты, макрофаги и дендритные клетки, хондроциты и остеобласты. Такими эффекторными молекулами являются провоспалительные цитокины (ИЛ-6, ФНО-α и ИЛ-1b), хемокины (такие как CXCL1, CXCL2, CXCL5, CCL2, CCL7 и CCL20), факторы роста (G-CSF, GM-CSF) и оксид азота, простагландин Е2 и матриксные металлопротеиназы. Происходит инициированная данными эффекторными молекулами инфильтрация нейтрофилов, повреждение тканей и хроническое воспаление (изложено в Miossec и Kolls, Nature Reviews Drug Discovery, 20121).
До признания важности ИЛ-17 в аутоиммунном воспалении ИФН-гамма, происходящий из Th1-клеток, считался важным цитокином, который вызывает аутоиммунные нарушения. Транскрипция и секреция ИФН-гамма из Th1 эффекторных клеток регулируется факторами транскрипции T-bet и STAT4. Как эффекторный цитокин Th1-иммунитета ИФН-гамма является ключевым регулятором активации макрофагов. Параллельно передача сигналов ИФН-гамма генерирует другие цитокины и воспалительные факторы для поддержания воспаления, поддержания Th1-ответов и ингибирования дифференциации регуляторных T-клеток, Th2-клеток и Th17-клеток (изложено в Pollard et al., Discov. Med., 20143 и Green et al., J. Biol. Chem., 20174).
Недавно было описано существование гибридных Th1/Th17-клеток. Данные клетки могут индуцироваться in vitro с помощью ИЛ-23 и ИЛ-6 совместно с ИЛ-1 и секретировать ИЛ-17 и ИФН-гамма. Было продемонстрировано, что данные двойные продуцирующие клетки обладают выраженными провоспалительными свойствами и участвуют в патогенезе ВЗК, ЭАЭ и диабета 1 типа (Buonocore et al., Nature, 20105; Ghoreschi et al., Nature, 20106; Marwaha et al., Clin Immunol, 20147; Ramesh et al., J.Exp. Med. 20148).
Следовательно, соединения, которые нацелены и подавляют как ИЛ-17, так и ИФН-гамма, предназначены для лечения аутоиммунных нарушений.
Эффективность блокирования только передачи сигналов ИЛ-17 в качестве терапевтического лечения аутоиммунных заболеваний уже была доказана в клинических испытаниях, например, с помощью моноклональных антител против ИЛ-17A (секукинумаб, иксекизумаб, ABT-122, CNTO 6785, CJM112, COVA322, ALX-0761, бимекизумаб, SCH-900117) и/или рецептора ИЛ-17 ИЛ-17RA (AMG827, бродалумаб). Другими антителами в клинической разработке, нацеленными на путь ИЛ-17-Th17 путем адресации субъединицы р19 ИЛ-23, являются тилдракизумаб, гуселькумаб, AMG139, BI655066 и LY3074828 (изложено в Bartlett and Million, Nature Reviews Drug Discovery 2015).9 Сообщалось, что были получены положительные результаты для лечения ревматоидного артрита, псориаза, псориатического артрита, увеита, анкилозирующего спондилита и спондилоартрита. Другие исследуемые аутоиммунные заболевания представляют собой болезнь Крона, астму и рассеянный склероз.
С другой стороны, блокирование только передачи сигналов ИФН-гамма при аутоиммунных заболеваниях с помощью ИФН-гамма-специфического моноклонального антитела AMG811 было исследовано в клинических испытаниях на системную и дискоидную красную волчанку без существенного клинического результата до настоящего времени (Werth et al., Arthritis 201710).
1. Miossec, P. & Kolls, J. K. Targeting IL-17 and TH17 cells in chronic inflammation. Nat. Rev. Drug Discov. 11, 763-776 (2012).
2. Reynolds, J. M., Angkasekwinai, P. & Dong, C. IL-17 family member cytokines: regulation, and function in innate immunity. Cytokine Growth Factor Rev. 21, 413-423 (2010).
3. Pollard, K. M., Cauvi, D. M., Toomey, C., Morris, K. V. & Kono, D. H. Interferon-γ and Systemic Autoimmunity. Discov. Med. 16, 123-131 (2013).
4. Green, D. S., Young, H. A. & Valencia, J. C. Current prospects of type II interferon gamma signaling and autoimmunity. J. Biol. Chem. jbc.R116.774745 (2017). doi:10.1074/jbc.R116.774745
5. Buonocore, S. et al. Innate lymphoid cells drive IL-23 dependent innate intestinal pathology. Nature 464, 1371-1375 (2010).
6. Ghoreschi, K. et al. Generation of Pathogenic Th17 Cells in the Absence of TGF-β Signaling. Nature 467, 967-971 (2010).
7. Marwaha, A. K., Tan, S. & Dutz, J. P. Targeting the IL-17/IFN-γ axis as a potential new clinical therapy for type 1 diabetes. Clin. Immunol. Orlando Fla 154, 84-89 (2014).
8. Ramesh, R. et al. Pro-inflammatory human Th17 cells selectively express P-glycoprotein and are refractory to glucocorticoids. J. Exp. Med. 211, 89-104 (2014).
9. Bartlett, H. S. & Million, R. P. Targeting the IL-17-TH17 pathway. Nat. Rev. Drug Discov. 14, 11-12 (2015).
10. Werth, V. P. et al. Brief Report: Pharmacodynamics, Safety, and Clinical Efficacy of AMG 811, a Human Anti-Interferon-γ Antibody, in Patients With Discoid Lupus Erythematosus. Arthritis Rheumatol. Hoboken NJ 69, 1028-1034 (2017).
В WO 2012/101261 A1 и WO 2012/101263 A1 описаны соединения, имеющие структуру ядра соединений настоящего изобретения, но различные схемы замещения, в частности, в отношении R1-группы.
Подробное описание изобретения
В определенных вариантах осуществления настоящее изобретение относится к соединению формулы (I), как описано в следующих пунктах:
1. Соединение формулы (I) или его фармацевтически приемлемая соль или сольват,
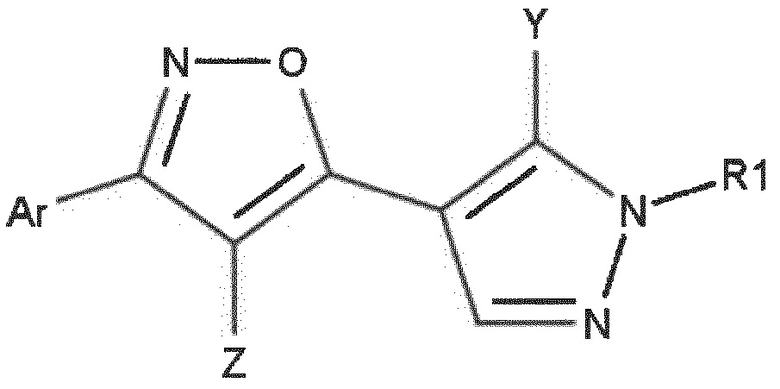 формула (I)
формула (I)
в которой
Ar выбран из группы, состоящей из фенила и гетероарила, каждый из которых необязательно замещен одним или более независимо выбранными заместителями RAr;
RAr выбран из группы, состоящей из галогена, -OH, -CN, алкокси, галогеналкокси, алкила, галогеналкила, моно- или диалкиламино-алкила, моно- или диалкиламино-алкокси, -COOR’, -CONHR’, -CO-R’, -SO2NHR’, -NH-CO-R’, -NO2, -NH-SO2-R’, -SO2-R’, бензилокси, -CO-гетероциклила, -CO-циклоалкила, -CONH-циклоалкила, -CONH-гетероциклила, -O-алкил-гетероциклила, -O-алкил-циклоалкила, (2-окса-6-азаспиро[3.3]гепт-6-ил)-C1-4-алкокси, амино, аралкила, циклоалкила, гетероциклила, фенила и гетероарила, в котором каждая из указанных алкокси, аралкильных, алкильных, циклоалкильных, гетероциклильных, фенильных и гетероарильных групп необязательно замещена одним или более заместителями, независимо выбранными из алкила, галогеналкила, галогена и ОН, и в котором R’ независимо выбран из группы, состоящей из независимо представленных Н, ОН, алкила и галогеналкила;
Z выбран из группы, состоящей из H, галогена, -CO-RZ, -CH2-O-RZ, -CO-CH2-RZ, -CO-CH2-O-RZ, -COORZ, -NHCO-RZ, -CO-NHRZ, -N(RZ)2, -CN, -NHCOORZ, -SO2-RZ, -SO2NHRZ, -алкил-O-RZ, -алкил-O-алкил-O-RZ, амино, алкила, фенила, гетероарила, гетероциклила и циклоалкила, в котором каждая из указанных алкильных, фенильных, гетероарильных, гетероциклильных и циклоалкильных групп необязательно замещена одним или более заместителями, независимо выбранными из группы, состоящей из галогена, алкила, алкокси, галогеналкила, -СОО-алкила, ОН и циклоалкила;
RZ выбран из группы, состоящей из Н, галогена, -ОН, алкила, галогеналкила, циклоалкила, гетероциклила, гетероциклила, фенила и гетероарила,
Y представляет собой Н, галоген, галогеналкил, алкил или алкиловый эфир;
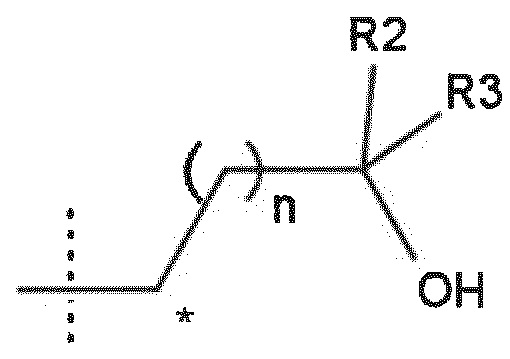
R1 представляет собой группу структуры

в которой
n равно 0 или 1;
R2 представляет собой Н, дейтерий или метил;
R3 представляет собой метил, трифторметил, этил, или, взятый вместе с R2, образует циклопропильную группу, или R3 образует метиленовый мостик с атомом углерода, отмеченным ⃰.
2. Соединение формулы (I) по п.1 или его фармацевтически приемлемая соль или сольват, в котором
Ar выбран из группы, состоящей из фенила, циклоалкила, гетероциклила и гетероарила, каждый из которых необязательно замещен одним или более независимо выбранными заместителями RAr;
RAr выбран из группы, состоящей из галогена, -OH, -CN, алкокси, галогеналкокси, алкила, галогеналкила, моно- или диалкиламино-алкила, моно- или диалкиламино-алкокси, -COOR’, -CONHR’, -CO-R’, -SO2NHR’, -NH-CO-R’, -NO2, -NH-SO2-R’, -SO2-R’, бензилокси, -CO-гетероциклила, -CO-циклоалкила, -CONH-циклоалкила, -CONH-гетероциклила, -O-алкил-гетероциклила, -O-алкил-циклоалкила, (2-окса-6-азаспиро[3.3]гепт-6-ил)-C1-4-алкокси, амино, аралкила, циклоалкила, гетероциклила, фенила и гетероарила, в котором каждая из указанных алкокси, аралкильных, алкильных, циклоалкильных, гетероциклильных, фенильных и гетероарильных групп необязательно замещена одним или более заместителями, независимо выбранными из алкила, галогеналкила, галогена и ОН, и в котором R’ независимо выбран из группы, состоящей из независимо представленных Н, ОН, алкила и галогеналкила;
Z выбран из группы, состоящей из H, галогена, -CO-RZ, -CH2-O-RZ, -CO-CH2-RZ, -CO-CH2-O-RZ, -COORZ, -NHCO-RZ, -CO-NHRZ, -N(RZ)2, -CN, -NHCO2RZ, -SO2-RZ, -SO2NHRZ, -алкил-O-RZ, -алкил-O-алкил-O-RZ, амино, алкила, фенила, гетероарила, гетероциклила и циклоалкила, в котором каждая из указанных алкильных, фенильных, гетероарильных, гетероциклильных и циклоалкильных групп необязательно замещена одним или более заместителями, независимо выбранными из группы, состоящей из галогена, алкила, алкокси, галогеналкила, -СОО-алкила, ОН и циклоалкила;
RZ выбран из группы, состоящей из Н, галогена, -ОН, алкила, галогеналкила, циклоалкила, гетероциклила, гетероциклила, фенила и гетероарила,
Y представляет собой Н, галоген, галогеналкил, алкил или алкиловый эфир;
R1 представляет собой группу структуры
в которой
n равно 0 или 1;
R2 представляет собой Н, дейтерий или метил;
R3 представляет собой метил, трифторметил, этил или, взятый вместе с R2, образует циклопропильную группу;
или
n равно 1, R2 представляет собой Н, дейтерий или метил и R3 образует метиленовый мостик с атомом углерода, отмеченным ⃰.
3. Соединение формулы (I) по п.1 или 2 или его фармацевтически приемлемая соль или сольват, в котором
Ar выбран из группы, состоящей из фенила и 5- или 6-членного гетероарила, каждый из которых необязательно замещен одним или более заместителями RAr;
RAr выбран из группы, состоящей из галогена, OH, CN, C1-4-алкила, C1-4-галогеналкила, -NH2, ацетамидо, -COO-C1-4-алкила, C1-4-алкокси и (моно- или ди-C1-4-алкиламино)-C1-4-алкокси, более определенно, галогена, C1-4-алкокси и (моно- или ди-C1-4-алкиламино)-C1-4-алкокси, бензилокси, -CO-N(RN)2, в котором один RN представляет собой H и другой представляет собой C1-3-алкил, C3-4циклоалкил или оба RN, взятые вместе с N, к которому они присоединены, образуют азетановое, пирролидиновое или морфолиновое кольцо, -CONRN, в котором один RN представляет собой H и другой представляет собой изопропил или циклобутил или оба RN, взятые вместе с N, к которому они присоединены, образуют пирролидиновое, морфолиновое, 1,1-диоксотиоморфолиновое, 4-метилпиперазиновое или 2-окса-6-азаспиро[3.3]гептановое кольцо;
Z выбран из группы, состоящей из H, галогена, -CO-C1-4-алкила, -CO-CH2-C1-4-алкокси, -CO-CH2-O-C3-5-циклоалкила, -CO-гетероциклила, -CH2-OH, -CH2-O-C1-4-алкила, -CH2-O-C3-5-циклоалкила, -NH2, -NH-COO-C1-4алкила, -CN, -COO-C1-4алкила, -CONH-C1-4алкила, -CONH-арилалкила, -CONH-циклоалкила, -CON(C1-4алкил)2, -CON(C1-4алкил)-O-C1-4алкила, -CO-CH2-циклоалкила, COO-гетероциклила, -COO-циклоалкила, циклоалкилметила, алкен-1-она, алкилоксиалкила, -C1-2-алкил-O-C1-2-алкил-O-C1-4-алкила, циклоалкилметил-алкен-1-ола, гетероарила, фенила или гетероциклила, в котором указанный фенил и гетероциклил необязательно замещен одним или более заместителями, независимо выбранными из группы, содержащей галоген, алкил, алкокси, галогеналкил, -COO-алкил, ОН и циклоалкил;
Y выбран из группы, состоящей из Н, алкила, галогеналкила и алкилового эфира;
R1 представляет собой группу структуры

в которой
n равно 0;
R2 представляет собой Н, дейтерий или метил;
R3 представляет собой метил, трифторметил, этил или, взятый вместе с R2, образует циклопропильную группу;
или
n равно 1;
R2 представляет собой Н, дейтерий или метил;
R3 представляет собой метил или трифторметил или образует метиленовый мостик с атомом углерода, отмеченным ⃰.
4. Соединение по любому из пп.1-3 или его фармацевтически приемлемая соль или сольват, в котором
Ar выбран из группы, состоящей из фенила и пиридила, каждый из которых необязательно замещен одним или более заместителями RAr;
RAr выбран из группы, состоящей из галогена, ОН, -O-C1-3-алкила, -O-C1-3-галогеналкила, C1-4-алкила, C1-4-галогеналкила, (моно- или диметиламино)-C1-3-алкила и (моно- или диметиламино)-C1-2-алкокси;
Z выбран из группы, состоящей из H, -COO-C1-3-алкила, -CO-C1-2-алкила, -CO-CH2-C1-3-алкокси, -CO-CH2-O-C3-4-циклоалкила, 5- или 6-членного гетероарила, фенила, -COO-C3-6-циклоалкила, -COO-C3-6-гетероциклила, -CON-C3-6-циклоалкила, -CON-C3-6-гетероциклила, -CO-CH2-C3-6-циклоалкила, -CH2-O-C3-6-циклоалкила, -CO-C1-4-алкила, -C1-2-алкил-O-C1-2-алкила, -CH2-OH, -CH2-O-C1-3-алкила, -CH2-O-циклобутила, -C1-2-алкил-O-C1-2-алкил-O-C1-2-алкила и -C(OH)(C1-4-алкил)(СН2-С3-6-циклоалкила), в котором указанный гетероарил, фенил, гетероциклил, циклоалкил и алкил необязательно замещен одним или более заместителями, независимо выбранными из группы, состоящей из метила, галогена, CF3, ОМе и ОН;
Y выбран из группы, состоящей из CF3 и Me;
R1 выбран из группы, состоящей из 3-гидрокси-3-метилбутила, 2-гидрокси-2-метилпропила, 3-гидрокси-3-метилциклобутила, 2-гидроксипропила, 2-гидроксибутила, 3-гидроксициклобутила, 2-гидрокси-3,3,3-трифторпропила, 2-гидрокси-2-дейтеропропила и 1-гидроксициклопропилметила.
5. Соединение по любому из пп.1-4 или его фармацевтически приемлемая соль или сольват, в котором
Ar выбран из группы, состоящей из фенила, необязательно замещенного одним или более заместителями RAr;
RAr выбран из группы, состоящей из галогена, -O-C1-3-алкила, -O-C1-3-галогеналкила, C1-4-алкила, C1-4-галогеналкила и (диметиламино)-C1-2-алкокси;
Z выбран из группы, состоящей из H, COO-C1-3-алкила, пиримидила, пиразинила, тиазолила, оксазолила, изоксазолила, изотиазолила, имидазолила, оксадиазолила, тиадиазолила, тиофенила, фурана, тетрагидрофурана, циклопропоксиметила, циклогексоксиметила, циклопентоксиметила, -COO-циклопропила, -COO-циклобутила, -COO-циклопентила, -COO-циклогексила, пент-4-ен-1-она, гидроксиметила, метоксиметила, этоксиметила, изопропоксиметила, циклобутоксиметила, метоксиэтила, ацетила, метоксиацетила, -CO-CH2-циклобутила, -CO-CH2-циклопропила, -CO-CH2-циклопентила, -CO-CH2-циклогексила, -COO-оксетана, 1-циклопропилметилпент-4-ен-1-ола, метоксиэтоксиметила, -CONH-циклопропила, -CONH-циклобутила, -CONH-циклопентила и -CONH-циклогексила, в котором указанный пиримидил, пиразинил, тиазолил, оксазолил, изоксазолил, изотиазолил имидазолил, оксадиазолил, тиадиазолил, тиофенил, тетрагидрофуран и фуран необязательно замещен одним или более заместителями, независимо выбранными из группы, состоящей из метила, галогена, CF3, OMe и OH;
Y выбран из группы, состоящей из CF3 и Me;
R1 выбран из группы, состоящей из 3-гидрокси-3-метилбутила, 2-гидрокси-2-метилпропила, 3-гидрокси-3-метилциклобутила, 2-гидроксипропила, 2-гидроксибутила, 3-гидроксициклобутила, 2-гидрокси-3,3,3-трифторпропила, 2-гидрокси-2-дейтеропропила и 1-гидроксициклопропилметила.
6. Соединение по любому из пп.1-5 или его фармацевтически приемлемая соль или сольват, в котором
Ar представляет собой фенил, который необязательно замещен одним или более заместителями RAr;
RAr выбран из группы, состоящей из Cl, -OMe, F и 2-(диметиламино)этокси;
Z выбран из группы, состоящей из H, -ацетила, -COOMe, -COOEt, -CO-CH2-OMe, пиримидин-2-ила, пиразин-2-ила, тиазол-2-ила, циклопропоксиметила, -COO-циклопропила, -COO-циклобутила, пент-4-ен-1-она, пиримидин-4-ила, 2-тетрагидрофурила, метоксиметила, этоксиметила, изопропоксиметила, циклобутоксиметила, 3-оксетанилоксиметила, гидроксиметила, пиразин-2-ила, СО-CH2-циклобутила, -COO-оксетана, 5-метилизоксазол-2-ила, 1-циклопропилметилпент-4-ен-1-ола, 2-метоксиэтоксиметила, -CONH-циклопропила, -CONH-циклобутила и -CONH-циклопентила;
Y выбран из группы, состоящей из CF3 и Me;
R1 выбран из группы, состоящей из 3-гидрокси-3-метилбутила, 3-гидрокси-3-метилциклобутила, 2-гидроксипропила, 2-гидроксибутила, 3-гидроксициклобутила, 2-гидрокси-3,3,3-трифторпропила, 2-гидрокси-2-дейтеропропила и 1-гидроксициклопропилметила.
7. Соединение по любому из пп.1-6, в котором соединение выбрано из группы, состоящей из примеров, перечисленных в настоящем описании в разделе примеров.
8. Соединение по любому из пп.1-7 для применения в качестве лекарственного средства.
9. Соединение по любому из пп.1-7 для применения при лечении заболевания или медицинского состояния, выбранного из группы, состоящей из псориаза, псориатического артрита, аутоиммунного тиреоидита, болезни Грейвса, ревматоидного артрита, витилиго, болезни Крона, язвенного колита, воспалительного заболевания кишечника, анкилозирующего спондилита, сахарного диабета I типа, рассеянного склероза, целиакии, системной красной волчанки, увеита, болезни Бехчета, атопического дерматита, красного плоского лишая, синдрома Шегрена, межпозвонковой грыжи, акне, реакции трансплантат против хозяина, реакции хозяин против трансплантата, АИГ (аутоиммунного гепатита), ПБХ (первичного билиарного холангита), ПСК (первичного склерозирующего холангита), ожирения, волчаночного нефрита, аутоиммунных заболеваний щитовидной железы, включая болезнь Грейвса и болезнь Хашимото, аутоиммунного увеита, колита, IMQ псориаза, ювенильного идиопатического артрита, миастении гравис, системного склероза, сахарного диабета и остеоартрита.
10. Применение соединения формулы (I), как определено по любому из пп.1-7, или его фармацевтически приемлемой соли или сольвата для изготовления лекарственного средства для лечения заболевания или медицинского состояния, при котором ингибирование интерлейкина-17 (ИЛ-17) и/или интерферона-γ (ИФН-γ) является предпочтительным.
11. Применение по п.10, в котором заболевание или медицинское состояние выбрано из группы, состоящей из псориаза, псориатического артрита, аутоиммунного тиреоидита, болезни Грейвса, ревматоидного артрита, витилиго, болезни Крона, язвенного колита, воспалительного заболевания кишечника, анкилозирующего спондилита, сахарного диабета I типа, рассеянного склероза, целиакии, системной красной волчанки, увеита, болезни Бехчета, атопического дерматита, красного плоского лишая, синдрома Шегрена, межпозвонковой грыжи, акне, реакции трансплантат против хозяина, реакции хозяин против трансплантата, АИГ (аутоиммунного гепатита), ПБХ (первичного билиарного холангита), ПСК (первичного склерозирующего холангита), ожирения, волчаночного нефрита, аутоиммунных заболеваний щитовидной железы, включая болезнь Грейвса и болезнь Хашимото, аутоиммунного увеита, колита, IMQ псориаза, ювенильного идиопатического артрита, миастении гравис, системного склероза, сахарного диабета и остеоартрита.
В определенных вариантах осуществления используемая в настоящем описании гетероарильная группа обозначает 5- или 6-членную гетероциклическую группу, содержащую, по меньшей мере, один гетероатом, независимо выбранный из О, N или S. Данная гетероциклическая группа необязательно конденсирована с другим ароматическим или гетероароматическим 5- или 6-членным кольцом, содержащим, по меньшей мере, один гетероатом, независимо выбранный из О, N или S. Например, данная группа может быть выбрана из группы тиадиазола, тиазол-2-ила, тиазол-4-ила, тиазол-5-ила, изотиазол-3-ила, изотиазол-4-ила, изотиазол-5-ила, оксазол-2-ила, оксазол-4-ила, оксазол-5-ила, изооксазол-3-ила, изооксазол-4-ила, изооксазол-5-ила, 1,2,4-оксадиазол-3-ила, 1,2,4-оксадиазол-5-ила, 1,2,5-оксадиазол-3-ила, бензооксазол-2-ила, бензооксазол-4-ила, бензооксазол-5-ила, бензоизооксазол-3-ила, бензоизооксазол-4-ила, бензоизооксазол-5-ила, 1,2,5-оксадиазол-4-ила, 1,3,4-оксадиазол-2-ила, 1,2,4-тиадиазол-3-ила, 1,2,4-тиадиазол-5-ила, 1,3,4-тиадиазол-2-ила, изотиазол-3-ила, изотиазол-4-ила, изотиазол-5-ила, бензоизотиазол-3-ила, бензоизотиазол-4-ила, бензоизотиазол-5-ила, 1,2,5-тиадиазол-3-ила, 1-имидазолила, 2-имидазолила, 1,2,5-тиадиазол-4-ила, 4-имидазолила, бензоимидазол-4-ила, 1-пирролила, 2-пирролила, 3-пирролила, 2-фуранила, 3-фуранила, 2-тиенила, 3-тиенила, 2-пиридила, 3-пиридила, 4-пиридила, 2-пиранила, 3-пиранила, 4-пиранила, 2-пиримидинила, 4-пиримидинила, 5-пиримидинила, пирид-2-ила, пирид-3-ила, пирид-4-ила, пирид-5-ила, пирид-6-ила, 3-пиридазинила, 4-пиридазинила, 2-пиразинила, 1-пиразолила, 3-пиразолила, 4-пиразолила, 1,2,3-триазол-4-ила, 1,2,3-триазол-5-ила, 1,2,4-триазол-3-ила, 1,2,4-триазол-5-ила, 1H-тетразол-2-ила, 1H-тетразол-3-ила, тетразолила, акридила, феназинила, карбазолила, феноксазинила, индолизина, 2-индолила, 3-индолила, 4-индолила, 5-индолила, 6-индолила, 7-индолила, 1-изоиндолила, 3-изоиндолила, 4-изоиндолила, 5-изоиндолила, 6-изоиндолила, 7-изоиндолила, 2-индолинила, 3-индолинила, 4-индолинила, 5-индолинила, 6-индолинила, 7-индолинила, бензо[b]фуранила, бензофуразана, бензотиофуразана, бензотриазол-1-ила, бензотриазол-4-ила, бензотриазол-5-ила, бензотриазол-6-ила, бензотриазол-7-ила, бензотриазина, бензо[b]тиофенила, бензимидазолила, бензотиазолила, хиназолинила, хиноксазолинила, циннолина, хинолинила, тетрагидрохинолинила, изохинолинила или тетрагидроизохинолинила, пурина, фталазина, птеридина, тиатетраазаиндена, тиатриазаиндена, изотиазолопиразина, 6-пиримидинила, 2,4-диметокси-6-пиримидинила, бензимидазол-2-ила, 1Н-бензимидазолила, бензимидазол-4-ила, бензимидазол-5-ила, бензимидазол-6-ила, бензимидазол-7-ила, тетразола, тетрагидротиено[3,4-d]имидазол-2-она, пиразоло[5,1-c][1,2,4]триазина, изотиазолопиримидина, пиразолотриазина, пиразолопиримидина, имидазопиридазина, имидазопиримидина, имидазопиридина, имидазолотриазина, триазолотриазина, триазолопиридина, триазолопиразина, триазолопиримидина или триазолопиридазина. Определенные гетероарильные группы представляют собой пиримидин-4-ил, пиримидин-2-ил, тиазол-2-ил, пиразин-2-ил и изоксазол-2-ил.
В определенных вариантах осуществления используемая в настоящем описании гетероциклильная группа обозначает 3-8-членную, более определенно 3-6-членную гетероциклическую неароматическую группу, содержащую, по меньшей мере, один гетероатом, независимо выбранный из группы, состоящей из O, N и S, в которой гетероциклильная группа необязательно конденсирована с другим неароматическим циклоалкильным или гетероциклильным кольцом; гетероциклильный остаток, в частности, выбран из группы, состоящей из оксетанила, морфолин-4-ила, пиперазинила, изоксазолидин-2-ила, 1-алкилпиперазин-4-ила, пирролидинила, пирролидино, пиперидинила, пиперидино, пиперазинила, пиперазино, морфолинила, морфолино, тиоморфолинила, тиоморфолино, тетрагидрофуранила, тетрагидротиофуранила, тетрагидропиранила и пиранила. Определенные гетероциклильные группы представляют собой тетрагидропиран и оксетан.
Чтобы сохранить определения как можно более короткими, используемые в настоящем описании термины «алкил» и «алк» (как, например, в алкокси) следует понимать как охватывающие линейный и разветвленный алканил, алкенил и алкинил, более определенно алкил и алкенил, еще более определенно алканил. Если не указано иначе, они представляют собой, в частности, варианты осуществления С1-С6-алканила, С2-С6-алкенила или С2-С6-алкинила, более определенно, С1-С5-алканила, С2-С5-алкенила или С2-С5-алкинила, еще более определенно C1-C4-алканила, C2-C4-алкенила или C2-C4-алкинила. Алкильная группа, например, может быть выбрана из группы, состоящей из -CH3, -C2H5, -CH=CH2, -C≡CH, -C3H7, -CH(CH3)2, -CH2-CH=CH2, -C(CH3)=CH2, -CH=CH-CH3, -C≡C-CH3, -CH2-C≡CH, -C4H9, -CH2-CH(CH3)2, -CH(CH3)-C2H5, -C(CH3)3, -C5H11, -C6H13, -C2H4-CH=CH2, -CH=CH-C2H5, -CH=C(CH3)2, -CH2-CH=CH-CH3, -CH=CH-CH=CH2, -C2H4-C≡CH, -C≡C-C2H5, -CH2-C≡C-CH3, -C≡C-CH=CH2, -CH=CH-C≡CH, -C≡C-C≡CH, -C2H4-CH(CH3)2, -CH(CH3)-C3H7, -CH2-CH(CH3)-C2H5, -CH(CH3)-CH(CH3)2, -C(CH3)2-C2H5, -CH2-C(CH3)3, -C3H6-CH=CH2, -CH=CH-C3H7, -C2H4-CH=CH-CH3, -CH2-CH=CH-C2H5, -CH2-CH=CH-CH=CH2, -CH=CH-CH=CH-CH3, -CH=CH-CH2-CH=CH2, -C(CH3)=CH-CH=CH2, -CH=C(CH3)-CH=CH2, -CH=CH-C(CH3)=CH2, -CH2-CH=C(CH3)2, C(CH3)=C(CH3)2, -C3H6-C≡CH,-C≡C-C3H7, -C2H4-C≡C-CH3, -CH2-C≡C-C2H5, -CH2-C≡C-CH=CH2, -CH2-CH=CH-C≡CH, -CH2-C≡C-C≡CH, -C≡C-CH=CH-CH3, -CH=CH-C≡C-CH3, -C≡C-C≡C-CH3, -C≡C-CH2-CH=CH2, -CH=CH-CH2-C≡CH, -C≡C-CH2-C≡CH, -C(CH3)=CH-CH=CH2, -CH=C(CH3)-CH=CH2, -CH=CH-C(CH3)=CH2, -C(CH3)=CH-C≡CH, -CH=C(CH3)-C≡CH, -C≡C-C(CH3)=CH2, -C3H6-CH(CH3)2, -C2H4-CH(CH3)-C2H5, -CH(CH3)-C4H9, -CH2-CH(CH3)-C3H7, -CH(CH3)-CH2-CH(CH3)2, -CH(CH3)-CH(CH3)-C2H5, -CH2-CH(CH3)-CH(CH3)2, -CH2-C(CH3)2-C2H5, -C(CH3)2-C3H7, -C(CH3)2-CH(CH3)2, -C2H4-C(CH3)3, -CH(CH3)-C(CH3)3, -C4H8-CH=CH2, -CH=CH-C4H9, -C3H6-CH=CH-CH3, -CH2-CH=CH-C3H7, -C2H4-CH=CH-C2H5, -CH2-C(CH3)=C(CH3)2, -C2H4-CH=C(CH3)2, -C4H8-C≡CH, -C≡C-C4H9, -C3H6-C≡C-CH3, -CH2-C≡C-C3H7 и -C2H4-C≡C-C2H5. Определенные алкильные группы представляют собой метил, этил, пропил, бутил, пентил, бутенил и пентенил.
В определенных вариантах осуществления используемая в настоящем описании арилалкильная группа обозначает линейный или разветвленный C1-C6-алкил, замещенный, по меньшей мере, одной арильной группой, как определено в настоящем описании. Типичные арилалкильные группы включают бензил, фенилэтил, 4-гидроксибензил, 3-фторбензил, 2-фторфенилэтил и подобные.
В определенных вариантах осуществления используемая в настоящем описании циклоалкильная группа обозначает неароматическую кольцевую систему, содержащую от трех до восьми атомов углерода, в частности от четырех до восьми атомов углерода, более определенно от трех до шести атомов углерода, еще более определенно от трех до пяти атомов углерода.
В определенных вариантах осуществления используемая в настоящем описании алкоксигруппа обозначает O-алкильную группу, причем алкильная группа представляет собой, как определено выше. Более определенно, алкоксигруппа представляет собой метокси, этокси, изопропокси, трет-бутокси или пентоксигруппу, еще более определенно метокси.
В определенных вариантах осуществления используемая в настоящем описании галогеналкильная группа обозначает алкильную группу, в которой один или более, в частности более половины, более определенно все атомы водорода заменены атомами галогена. Галогеналкильная группа представляет собой, например, -C(R10)3, -CR10(R10’)2, -CR10(R10’)R10’’, -C2(R10)5, -CH2-C(R10)3, -C(R10’)2-CH(R10’)2, -CH2-CR10(R10’)2, -CH2-CR10(R10’)R10’’, -C3(R10)7 или -C2H4-C(R10)3, в которой R10, R10’, R10’’ в частности независимо представляют собой F, Cl, Br или I, более определенно F. Более определенно галогеналкил представляет собой CF3.
В определенных вариантах осуществления используемая в настоящем описании галогеналкоксигруппа обозначает -O-галогеналкильную группу.
В определенных вариантах осуществления используемый в настоящем описании галоген или галогеновая группа обозначает фтор, хлор, бром или иод; в частности хлор или фтор.
Если не указано иначе, термины «включенный», «включающий», «включать» и подобные следует понимать как обозначающие включающий, но не ограничивающий.
Компоненты, которые необязательно замещены, как указано в настоящем описании, могут быть замещены, если не указано иначе, в любом химически возможном положении.
В определенных вариантах осуществления настоящего изобретения Ar выбран из группы, состоящей из фенила и 5- или 6-членного гетероарила, более определенно пиридила, который необязательно замещен одним или более заместителями RAr, независимо выбранными из группы, состоящей из галогена, C1-4-алкила, C1-4-галогеналкила, -NH2, ацетамидо, -COO-C1-4-алкила, C1-4-алкокси и (моно- или ди-C1-4-алкиламино)-C1-4-алкокси, более определенно, галогена, C1-4-алкокси, бензилокси, гидроксила, 4-6-членного гетероциклилкарбонила, C1-4-алкиламинокарбонила, С3-4-циклоалкиламинокарбонила, 5-6-членный гетероциклил-С1-4-алкокси, (2-окса-6-азаспиро[3.3]гепт-6-ил)-C1-4-алкокси и (моно- или ди-C1-4-алкиламино)-C1-4-алкокси;
в других определенных вариантах осуществления Ar выбран из группы, состоящей из фенила и пиридила, которые необязательно замещены одним или более заместителями RAr, независимо выбранными из группы, состоящей из галогена, C1-4-алкокси и (моно- или ди-C1-4-алкиламино)-C1-4-алкокси;
в других определенных вариантах осуществления Ar представляет собой фенил, который необязательно замещен одним или более заместителями RAr, независимо выбранными из группы, состоящей из галогена, C1-4-алкокси и (моно- или ди-C1-4-алкиламино)-C1-4-алкокси;
в других определенных вариантах осуществления Ar выбран из группы, состоящей из фенила, 2,6-дифторфенила, 2-хлор-6-фторфенила, 2-хлор-6-метоксифенила, 2-фторфенила, 3-фторфенила, 2-хлорфенила, 4-хлорфенила, 4-метоксифенила, 2,6-дихлорфенила, 3,4-дихлорфенила, 2,4-дихлорфенила, 3-фторпиридин-4-ила, 3,5-дихлорпиридин-4-ила, 3-хлор-5-фторпиридин-4-ила, 2-метоксифенила, 2-метоксипиридин-3-ила, 2-хлор-3-(N-морфолинокарбонил)фенила, 2-хлор-3-(N-азетанилкарбонил)фенила, 2-хлор-3-(N-азетанилкарбонил)фенила, 2-хлор-3-(N-пирролидинилкарбонил)фенила, 2-хлор-3-(этиламино)карбонилфенила, 2-хлор-3-(изопропиламино)карбонилфенила, 2-хлор-3-(циклопропиламино)карбонилфенила, 2-хлор-3-(циклобутиламино)карбонилфенила, 2-метокси-3-(этиламино)карбонилфенила, 2-метокси-3-(изопропиламино)карбонилфенила, 2-метокси-3-(циклопропиламино)карбонилфенила, 2-метокси-3-(N-азетанилкарбонил)фенила, 3-(циклобутиламино)карбонилфенила, 3-(изопропиламино)карбонилфенила, 2-хлор-3-метоксифенила, 2-хлор-3-гидроксифенила, 2-хлор-3-бензилоксифенила, 2-хлор-3-(2-(N-морфолинил)этокси)фенила, 2-хлор-3-(2-(N-1,1-диоксотиоморфолинил)этокси)фенила, 2-хлор-3-(2-(2-окса-6-азаспиро[3.3]гепт-6-ил)этокси)фенила, 2-хлор-3-(2-(N-пирролидинил)этокси)фенила, 2-хлор-3-(2-(N-4-метилпиперазинил)этокси)фенила, 2-хлор-3-(2-(диэтиламино)этокси)фенила и 2-хлор-3-(2-(диметиламино)этокси)фенила;
в других определенных вариантах осуществления Ar выбран из группы, состоящей из 2-хлор-6-фторфенила, 2-хлорфенила, 2-хлор-3-метоксифенила и 2-хлор-3-(2-(диметиламино)этокси)фенила;
в других определенных вариантах осуществления Ar выбран из группы, состоящей из фенила, 2,6-дифторфенила, 2-хлор-6-фторфенила, 2-хлор-6-метоксифенила, 2-фторфенила, 2-хлорфенила, 2,6-дихлорфенила, 2,4-дихлорфенила, 3-фторпиридин-4-ила, 3,5-дихлорпиридин-4-ила, 3-хлор-5-фторпиридин-4-ила и 2-хлор-3-(2-(диметиламино)этокси)фенила;
в других определенных вариантах осуществления Ar выбран из группы, состоящей из фенила, 2,6-дифторфенила, 2-хлор-6-фторфенила, 2-хлор-6-метоксифенила, 2-фторфенила, 2-хлорфенила, 2,6-дихлорфенила, 2,4-дихлорфенила, 3-фторпиридин-4-ила, 3,5-дихлорпиридин-4-ила, 3-хлор-5-фторпиридин-4-ила и 2-хлор-3-метоксифенила;
в других определенных вариантах осуществления Ar выбран из группы, состоящей из фенила, 2-хлор-6-фторфенила, 2-фторфенила, 2-хлорфенила, 2,6-дихлорфенила, 2,4-дихлорфенила, 3-фторпиридин-4-ила, 3,5-дихлорпиридин-4-ила, 3-хлор-5-фторпиридин-4-ила и 2-хлор-3-метоксифенила;
в других определенных вариантах осуществления Ar выбран из группы, состоящей из 2-хлор-6-фторфенила, 2-хлорфенила и 2-хлор-3-метоксифенила.
В определенных вариантах осуществления настоящего изобретения Z выбран из группы, состоящей из H, галогена, -CO-гетероциклила, -CO-алкила, -CO-алкоксиалкила, -NH2, -NH-COO-C1-4-алкила, -CN, -COO-C1-4алкила, -CONH-C1-4алкила, -CONH-арилалкила, -CONH-циклоалкила, -CON(C1-4алкил)2, -CON(C1-4алкил)-O-C1-4алкила, -CO-CH2-циклоалкила, COO-гетероциклила, -COO-циклоалкила, циклоалкилметила, гидроксиметила, -алкил-O-алкоксиалкила, алкен-1-она, алкилоксиалкила, циклоалкилметилалкен-1-ола, гетероарила, фенила или гетероциклила, в котором указанный фенил и гетероциклил необязательно замещен одним или более заместителями, независимо выбранными из группы, содержащей галоген, алкил, алкокси, галогеналкил, -COO-алкил, ОН и циклоалкил;
в других определенных вариантах осуществления настоящего изобретения Z выбран из группы, состоящей из водорода, брома, -COMe, -CO-CH2-OMe, этоксиметила, изопропоксиметила, циклобутоксиметила, 2-метоксиэтоксиметила, гидроксиметила, тетрагидрофурила, -CONH-циклопропила, -CONH-циклобутила, -CO-морфолин-4-ила, -CO-пиперидин-4-ила, -COOH, -CONH2, -CONHNH2, -CONHNH-CO-метила, -CONH-(2,4,6-триметоксифенил)метила, -CONHN=изопропила, -NH-CO-метила, -NH-CO-трифторметила, -NH-COH, -CO-(N-метилпиперазин-4-ила), -CO-(4-[хлорбензил]-пиперазин-1-ила), -СО-пирролидинила, -СО-изоксазолидинила, -NH2, -NH-COO-метила, -CN, -COO-C1-3алкила, -CONH-метила, -CONH-(трифторметилзамещенного бензила), -CONH-циклогексила, -CON(метил)2, -CON(метил)-О-метила, -COOMe, -COOEt, циклопропоксиметила, -COO-циклопропила, -COO-циклобутила, пент-4-ен-1-она, метоксиметила, -CO-CH2-циклобутила, COO-оксетана, 5-метилизоксазол-2-ила, 1-циклопропилметил-пент-4-ен-1-ола, -CONH-циклопентила, фенила, тетразолила, тиазолила, пиримидила, оксадиазолила, оксазолила, тиадиазолила, пиразинила, фуранила и тиофенила, в котором указанный фенил, тетразолил, тиазолил, пиримидил, оксадиазолил, оксазолил, тиадиазолил, пиразинил, фуранил или тиофенил необязательно замещен одним или более заместителями, независимо выбранными из группы, содержащей галоген, метил, ОМе, CF3, -COOMe и -COOEt;
в других определенных вариантах осуществления настоящего изобретения Z выбран из группы, состоящей из H, -COO-C1-3-алкила, -CO-C1-2-алкила, -CO-C1-2-алкокси-C1-2-алкила 5- или 6-членного гетероарила, содержащего один или два гетероатома, независимо выбранных из N, S и O, -CH2-O-V, в котором V выбран из группы, состоящей из H, C1-4-алкила, C3-5-циклоалкила и C1-2-алкокси-C1-2-алкила, -COO-C3-6-циклоалкила, C3-6-алкен-1-она, пиразинила, -CO-CH2-C3-5-циклоалкила, COO-(3-5-членного гетероциклила), метилизоксазолила, 1-циклопропилметил-C3-6-алкен-1-ола, -CONH-C5-6-гетероциклила и -CONH-С3-6-циклоалкила;
в других определенных вариантах осуществления настоящего изобретения Z выбран из группы, состоящей из H, -COOMe, -COOEt, -COMe, -CO-CH2-OMe, пиримидин-2-ила, тиазол-2-ила, циклопропоксиметила, -COO-циклопропила, -COO-циклобутила, пент-4-ен-1-она, пиримидин-4-ила, метоксиметила, этоксиметила, изопропоксиметила, циклобутоксиметила, 2-метоксиэтоксиметила, гидроксиметила, пиразин-2-ила, -CO-CH2-циклобутила, -COO-оксетана, 5-метилизоксазол-2-ила, тетрагидрофурила, 1-циклопропилметил-пент-4-ен-1-ола, -CONH-циклопропила, -CONH-циклобутила и -CONH-циклопентила;
в других определенных вариантах осуществления настоящего изобретения Z выбран из группы, состоящей из -COOMe, -COOEt, пиримидин-2-ила, тиазол-2-ила, пиримидин-4-ила, метоксиметила и 5-метилизоксазол-2-ила.
В определенных вариантах осуществления настоящего изобретения Y выбран из группы, состоящей из Н, алкила, галогеналкила и алкилового эфира;
в других определенных вариантах осуществления Y выбран из группы, состоящей из H, пентафторэтила, трифторметила, метила и метоксикарбонила;
в других определенных вариантах осуществления Y выбран из группы, состоящей из Н, трифторметила, метила и метоксикарбонила;
в других определенных вариантах осуществления Y выбран из группы, состоящей из трифторметила и метила.
В определенных вариантах осуществления настоящего изобретения R’ независимо выбран из группы, состоящей из H, OH, Me, Et, iPr, iBu и CF3, более определенно H, OH, Me, Et и CF3.
В определенных вариантах осуществления настоящего изобретения R1 представляет собой группу структуры

в которой
n равно 0 или 1;
R2 представляет собой Н, дейтерий или метил;
R3 представляет собой метил, трифторметил, этил или, взятый вместе с R2, образует циклопропильную группу;
или
n равно 1, R2 представляет собой Н, дейтерий или метил и R3 образует метиленовый мостик с атомом углерода, отмеченным ⃰;
в других определенных вариантах осуществления настоящего изобретения R1 представляет собой группу структуры

в которой
n равно 0;
R2 представляет собой Н, дейтерий или метил;
R3 представляет собой метил, трифторметил, этил или, взятый вместе с R2, образует циклопропильную группу;
или
n равно 1;
R2 представляет собой Н, дейтерий или метил;
R3 представляет собой метил или трифторметил или образует метиленовый мостик с атомом углерода, отмеченным ⃰;
в других определенных вариантах осуществления настоящего изобретения R1 выбран из группы, состоящей из 3-гидрокси-3-метилбутила, 2-гидрокси-2-метилпропила, 3-гидрокси-3-метилциклобутила, 2-гидроксипропила, 2-гидроксибутила 3-гидроксициклобутила, 2-гидрокси-3,3,3-трифторпропила, 2-гидрокси-2-дейтеропропила и 1-гидроксициклопропилметила;
в других определенных вариантах осуществления настоящего изобретения R1 выбран из группы, состоящей из 3-гидрокси-3-метилбутила, 2-гидрокси-2-метилпропила, 2-гидроксипропила, 3-гидрокси-3-метилциклобутила, 3-гидроксициклобутила и 1-гидроксициклопропилметила;
в других определенных вариантах осуществления настоящего изобретения R1 выбран из группы, состоящей из 3-гидрокси-3-метилбутила, 2-гидрокси-2-метилпропила, 2-гидроксипропила и 1-гидроксициклопропилметила;
в других определенных вариантах осуществления настоящего изобретения R1 выбран из группы, состоящей из 3-гидрокси-3-метилбутила, 2-гидрокси-2-метилпропила и 2-гидроксипропила;
в других определенных вариантах осуществления настоящего изобретения R1 представляет собой 3-гидрокси-3-метилциклобутил или 3-гидроксициклобутил;
в других определенных вариантах осуществления настоящего изобретения R1 выбран из группы, состоящей из 3-гидрокси-3-метилбутила, 2-гидрокси-2-метилпропила и 3-гидрокси-3-метилциклобутила;
в других более определенных вариантах осуществления настоящего изобретения R1 представляет собой 3-гидрокси-3-метилциклобутил.
в других более определенных вариантах осуществления настоящего изобретения R1 представляет собой 3-гидрокси-3-метилбутил.
Определенными соединениями настоящего изобретения являются соединения приведенных ниже примеров настоящего изобретения, более определенно соединения приведенных ниже примеров 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98, 99, 100, 101, 102, 103, 104, 105, 106, 107, 108, 109, 110, 111, 112, 113, 114, 115, 116, 117, 118, 119, 120, 121, 122, 123, 124, 125, 126, 127, 128, 129, 130, 131, 132, 133, 134, 135, 136, 137, 138, 139, 140, 141, 142, 143, 144, 145, 146, 147, 148, 149, 150, 151, 152, 153, 154, 155, 156, 157, 158, 159, 160, 161, 162, 163, 164, 165, 166 и 167, более определенно соединения приведенных ниже примеров 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 18, 19, 20, 22, 23, 24, 25, 27, 29, 30, 31, 32, 33, 35, 36, 37, 44, 46, 47, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 66, 67, 68, 69, 72, 74, 76, 77, 78, 79, 81, 82, 83, 84, 85, 86, 87, 89, 90, 91, 92, 93, 95, 96, 97, 98, 99, 100, 102, 103, 104, 105, 106, 107, 108, 109, 110, 111, 112, 113, 115, 117, 118, 119, 121, 122, 123, 124, 125, 126, 127, 128, 129, 130, 131, 132, 133, 134, 135, 136, 137, 138, 139, 140, 141, 142, 143, 144, 145, 146, 147, 148, 149, 150, 151, 152, 154, 155, 157, 158, 159, 160 и 162, еще более определенно соединения приведенных ниже примеров 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 18, 19, 20, 22, 23, 25, 27, 31, 32, 33, 49, 50, 51, 53, 55, 56, 58, 59, 61, 62, 66, 67, 69, 72, 76, 77, 78, 79, 82, 83, 85, 86, 87, 89, 90, 91, 92, 97, 98, 99, 100, 102, 103, 104, 106, 107, 111, 112, 118, 121, 122, 123, 124, 125, 127, 128, 130, 131, 132, 133, 134, 135, 138, 139, 141, 143, 148, 150 и 160, еще более определенно соединения приведенных ниже примеров 3, 4, 6, 7, 10, 11, 12, 14, 15, 16, 27, 32, 49, 61, 82, 89, 92, 97, 98, 102, 103, 112, 121, 123, 128, 130 и 132.
Очевидно, что соответствующие варианты осуществления, касающиеся остатков Ar, RAr, Z, RZ, Y, R1 и R’, описанных в настоящей заявке, могут быть объединены друг с другом, чтобы получить дополнительные более определенные варианты осуществления. Некоторые примеры таких комбинаций, не ограничивая изобретение определенными комбинациями, описаны в настоящей заявке.
Насколько известно специалисту в данной области техники, соединения изобретения, также как их соли могут содержать, например, при выделении в кристаллической форме различные количества растворителей. Следовательно, в объем изобретения входят все сольваты и в частности все гидраты соединений формулы (I), также как все сольваты и в частности все гидраты солей соединений формулы (I).
Настоящее изобретение дополнительно относится к способам лечения заболеваний или медицинских состояний, которые описаны в настоящей заявке, в частности заболевания или медицинского состояния, при котором ингибирование интерлейкина-17 (ИЛ-17A), интерлейкина-17F (ИЛ-17F), интерлейкина-22 (ИЛ-22) и/или интерферона-γ (ИФН-γ) является предпочтительным, более определенно заболевания или медицинского состояния, выбранного из группы, состоящей из псориаза, псориатического артрита, аутоиммунного тиреоидита, болезни Грейвса, ревматоидного артрита, витилиго, болезни Крона, язвенного колита, воспалительного заболевания кишечника, анкилозирующего спондилита, сахарного диабета I типа, рассеянного склероза, целиакии, системной красной волчанки, увеита, болезни Бехчета, атопического дерматита, красного плоского лишая, синдрома Шегрена, межпозвонковой грыжи, акне, реакции трансплантат против хозяина, реакции хозяин против трансплантата, АИГ (аутоиммунного гепатита), ПБХ (первичного билиарного холангита), ПСК (первичного склерозирующего холангита), ожирения, волчаночного нефрита, сахарного диабета и остеоартрита, причем указанный способ включает введение объекту, нуждающемуся в таком лечении, эффективного количества соединения формулы (I), как описано в настоящей заявке. Аналогично, настоящее изобретение дополнительно относится к способам, аналогичным описанному выше, которые охватывают дополнительные варианты осуществления, описанные в настоящей заявке, в частности медицинские применения и соединения для применения в способах лечения, как описано в настоящей заявке.
Настоящее изобретение дополнительно относится к фармацевтическим композициям, наборам и наборам из частей, включающим соединения в соответствии с настоящим изобретением.
Настоящее изобретение дополнительно относится к применению соединений в соответствии с настоящим изобретением для изготовления фармацевтических композиций, которые используются для лечения и/или профилактики заболеваний, нарушений, болезней и/или состояний, как указано в настоящей заявке.
Настоящее изобретение дополнительно относится к способам и медицинским применениям, описанным в настоящей заявке, включая фармацевтические композиции, как описано в настоящей заявке.
Фармацевтические композиции, как описано в настоящей заявке, содержат одно или более соединений в соответствии с данным изобретением и фармацевтически приемлемый носитель или разбавитель.
Кроме того, изобретение относится к изделию, которое содержит упаковочный материал и фармацевтический агент, содержащийся в указанном упаковочном материале, в котором фармацевтический агент терапевтически эффективен в отношении медицинских состояний, как описано в настоящей заявке, и в котором упаковочный материал содержит этикетку или инструкцию по применению препарата, которая указывает, что фармацевтический агент является пригодным для профилактики или лечения указанных заболеваний, и в котором указанный фармацевтический агент содержит одно или более соединений формулы (I) в соответствии с изобретением. Упаковочный материал, этикетка и инструкция по применению препарата в остальном аналогичны или напоминают то, что обычно считается стандартным упаковочным материалом, этикетками и инструкциями по применению для фармацевтических препаратов, имеющих соответствующую пригодность.
Фармацевтические композиции в соответствии с данным изобретением получают с помощью способов, которые сами по себе известны и знакомы специалисту в данной области техники. В качестве фармацевтических композиций соединения изобретения (=активные соединения) или используются как таковые, или в частности в комбинации с подходящими фармацевтическими вспомогательными веществами и/или эксципиентами, например, в форме таблеток, таблеток с покрытием, капсул, каплетов, суппозиториев, пластырей (например, ТТС), эмульсий, суспензий, гелей или растворов, при этом содержание активного соединения предпочтительно составляет от 0,1 до 95% и в котором при соответствующем выборе вспомогательных веществ и/или эксципиентов может быть достигнута форма для фармацевтического введения (например, форма с отсроченным высвобождением или энтеросолюбильная форма), точно подходящая для активного соединения и/или для желаемого начала действия.
Специалист в данной области техники знаком с вспомогательными веществами, наполнителями, эксципиентами, разбавителями, носителями или адъювантами, которые подходят для желаемых фармацевтических составов, препаратов или композиций, на основании его/ее экспертных знаний. В дополнение к растворителям могут быть использованы гелеобразователи, мазевые основы и другие эксципиенты активного соединения, например, антиоксиданты, диспергирующие вещества, эмульгаторы, консерванты, солюбилизаторы, красители, комплексообразующие агенты или промоторы проникновения.
В зависимости от определенного заболевания, подлежащего лечению или профилактике, дополнительные терапевтически активные агенты, которые обычно вводят для лечения или профилактики данного заболевания, могут необязательно вводиться совместно с соединениями в соответствии с настоящим изобретением. Используемые в настоящем описании дополнительные терапевтические агенты, которые обычно вводят для лечения или профилактики определенного заболевания, известны как подходящие для заболевания, подлежащего лечению.
В дополнительном аспекте настоящего изобретения соединения в соответствии с данным изобретением или соли или сольваты указанных соединений формулы (I) можно комбинировать со стандартными терапевтическими агентами, которые обычно используются для лечения медицинских состояний, как описано в настоящей заявке.
Специалист в данной области техники осведомлен на основании его/ее экспертных знаний об общей суточной дозировке(ах) и форме(ах) введения дополнительного терапевтического агента(ов), вводимого совместно. Указанная общая суточная дозировка(и) может варьироваться в широких пределах. При осуществлении настоящего изобретения и в зависимости от деталей, характеристик или целей их применения, упомянутых выше, соединения в соответствии с настоящим изобретением могут вводиться в комбинированной терапии отдельно, последовательно, одновременно или в хронологическом порядке (например, в виде комбинированных единичных лекарственных форм, в виде отдельных единичных лекарственных форм или смежных дискретных единичных лекарственных форм, в виде фиксированных или нефиксированных комбинаций, в виде набора из частей или в виде смесей) с одним или более стандартными терапевтическими средствами, в частности известными в данной области техники химиотерапевтическими или целевыми специфическими противораковыми агентами, такими как указано выше.
Таким образом, дополнительным аспектом настоящего изобретения является комбинация или фармацевтическая композиция, содержащая первый активный ингредиент, который представляет собой соединение в соответствии с данным изобретением или его фармацевтически приемлемую соль или сольват, второй активный ингредиент, который представляет собой известное в данной области техники стандартное терапевтическое средство для лечения медицинских состояний, как описано в настоящей заявке, и необязательно фармакологически приемлемый носитель, разбавитель и/или эксципиент для последовательного, отдельного, одновременного или в хронологическом порядке применения в терапии в любом порядке, например, для лечения, профилактики или улучшения медицинских состояний пациента, как описано в настоящей заявке.
В данном контексте настоящее изобретение дополнительно относится к комбинации, содержащей первый активный ингредиент, который представляет собой, по меньшей мере, одно соединение в соответствии с данным изобретением, и второй активный ингредиент, который представляет собой, по меньшей мере, одно известное в данной области техники стандартное терапевтическое средство для лечения медицинских состояний, как описано в настоящей заявке, для отдельного, последовательного, одновременного или в хронологическом порядке применения в терапии, такой как, например, в терапии заболеваний, упомянутых в настоящем описании.
Термин «комбинация» в соответствии с данным изобретением может присутствовать в виде фиксированной комбинации, нефиксированной комбинации или набора из частей. «Фиксированная комбинация» определяется как комбинация, в которой указанный первый активный ингредиент и указанный второй активный ингредиент присутствуют вместе в одной стандартной дозе или в одном препарате. Одним примером «фиксированной комбинации» является фармацевтическая композиция, в которой указанный первый активный ингредиент и указанный второй активный ингредиент присутствуют в смеси для одновременного введения, например, в составе. Другим примером «фиксированной комбинации» является фармацевтическая комбинация, в которой указанный первый активный ингредиент и указанный второй активный ингредиент присутствуют в одной единице, не находясь в смеси.
«Набор из частей» определяется как комбинация, в которой указанный первый активный ингредиент и указанный второй активный ингредиент присутствуют в более чем одной единице. Одним примером «набора из частей» является комбинация, в которой указанный первый активный ингредиент и указанный второй активный ингредиент присутствуют отдельно. Компоненты набора из частей можно вводить отдельно, последовательно, одновременно или в хронологическом порядке.
Первый и второй активный ингредиент комбинации или набора из частей в соответствии с данным изобретением может быть предоставлен в виде отдельных составов (т.е. независимо друг от друга), которые в дальнейшем объединяются для одновременного, последовательного, отдельного или в хронологическом порядке применения в комбинированной терапии; или упакованы и представлены вместе как отдельные компоненты комбинированной упаковки для одновременного, последовательного, отдельного или в хронологическом порядке применения в комбинированной терапии.
Тип фармацевтического состава первого и второго активного ингредиента комбинации или набора из частей в соответствии с данным изобретением может быть сходным, то есть оба ингредиента составлены в отдельных таблетках или капсулах, или может быть различным, т.е. подходящим для различных форм введения, таких как, например, один активный ингредиент составлен в виде таблетки или капсулы и другой составлен, например, для внутривенного введения.
Количества первого и второго активных ингредиентов комбинаций, композиций или наборов в соответствии с данным изобретением могут вместе включать терапевтически эффективное количество для лечения, профилактики или улучшения медицинского состояния, как описано в настоящей заявке.
Дополнительный аспект настоящего изобретения представляет собой способ лечения в терапевтических целях медицинских состояний, как описано в настоящей заявке, у пациента, нуждающегося в таком лечении, включающий введение отдельно, последовательно, одновременно, фиксированного или нефиксированного терапевтически эффективного и переносимого количества одного или более соединений в соответствии с настоящим изобретением и терапевтически эффективного и переносимого количества одного или более известных в данной области техники терапевтических агентов для лечения медицинских состояний, как описано в настоящей заявке, указанному пациенту.
Ссылки и формула изобретения для применения соединения формулы (I) или его фармацевтически приемлемой соли или сольвата при изготовлении лекарственного средства для лечения заболевания или медицинского состояния в их общих и специфических формах также относятся к соответствующим способам лечения указанного заболевания или медицинского состояния, причем указанный способ включает введение терапевтически эффективного и переносимого количества соединения формулы (I) или его фармацевтически приемлемой соли или сольвата объекту, нуждающемуся в таком лечении, композиций, содержащих соединение формулы (I) или его фармацевтически приемлемую соль или сольват, для лечения указанного заболевания или медицинского состояния, соединения формулы (I) или его фармацевтически приемлемой соли или сольвата для применения при лечении указанного заболевания или медицинского состояния и наоборот.
Для получения фармацевтических композиций соединения изобретения (= активные соединения) в частности смешивают с подходящими фармацевтическими вспомогательными веществами и дополнительно обрабатывают для получения подходящих фармацевтических составов. Подходящими фармацевтическими составами являются, например, порошки, эмульсии, суспензии, аэрозоли, масла, мази, жирные мази, кремы, пасты, гели или растворы. Фармацевтические композиции в соответствии с изобретением получают с помощью способов, самим собой известных.
Дозировка активных соединений осуществляется в стандартном порядке. Таким образом, формы для местного применения (такие как мази) содержат активные соединения в концентрации, например, 0,1-99%. Стандартная доза в случае системной терапии (п/о) обычно составляет от 0,3 до 30 мг/кг в день (в/в), обычно составляет от 0,3 до 30 мг/кг/ч. Выбор оптимального режима дозировки и продолжительности приема лекарственного средства, в частности оптимальной дозы и способа введения активных соединений, необходимых в каждом случае, может быть определен специалистом в данной области техники на основании его/ее экспертных знаний.
Класс соединений настоящего изобретения является пригодным для разработки лекарственных средств, подходящих для лечения аутоиммунных заболеваний и хронического воспаления или в более общем случае для лечения заболеваний, при которых ингибирование интерлейкина-17 (ИЛ-17) и/или интерферона-γ (ИФН-γ) является предпочтительным.
Соединения настоящего изобретения также являются пригодными для лечения заболеваний, которые связаны или опосредованы воспалительными цитокинами, таких как псориаз, псориатический артрит, аутоиммунный тиреоидит, болезнь Грейвса, ревматоидный артрит, витилиго, болезнь Крона, язвенный колит, воспалительное заболевание кишечника, анкилозирующий спондилит, сахарный диабет I типа, рассеянный склероз, целиакия, системная красная волчанка, увеит, болезнь Бехчета, атопический дерматит, красный плоский лишай, синдром Шегрена, межпозвонковая грыжа, акне, реакция трансплантат против хозяина, реакция хозяин против трансплантата, АИГ (аутоиммунный гепатит), ПБХ (первичный билиарный холангит), ПСК (первичный склерозирующий холангит), ожирение, волчаночный нефрит, сахарный диабет и остеоартрит.
Неожиданно было обнаружено, что соединения, имеющие R1-группы, как подробно описано в настоящей заявке, демонстрируют высокую индукцию цитокинов, в то же время обладая благоприятной растворимостью в воде и/или микросомальной стабильностью. Следующий раздел примеры показывает дополнительные детали.
Примеры
а) Синтез
Используемый в настоящем описании термин «комнатная температура» или «к.т.» обычно относится к приблизительно 25°С; «водн.» относится к водному; «преп.» относится к препаративному; «ТСХ» относится к тонкослойной хроматографии; «колич.» относится к количественному. Соединения со стереоцентрами, в которых стереохимия конкретно не указана, были получены в виде смесей стереоизомеров. Для полноты остатки «R», указанные в следующих схемах синтеза, в каждом случае относятся к общей замещающей группе, включая, в частности, определенные группы, как можно видеть в конкретных примерах, следующих за каждой схемой и ее аналогами, и значение «R» может варьироваться в различных схемах синтеза и положениях в каждой схеме.
Используемые аналитические устройства
Аналитический ЖХ/ESI-МС: автодозатор Waters 2700. Мультисольвентная система доставки Waters 1525. Пробоотборная петля 5 мкл. Колонка Phenomenex Onyx Monolythic C18 50×2 мм с фильтром предочистки из нержавеющей стали 2 мкм. Элюент A, H2O+0,1% HCOOH; элюент B, MeCN. Градиент от 5% B до 100% B в течение 3,80 мин, затем изократический в течение 0,20 мин, затем обратно до 5% B в течение 0,07 мин, затем изократический в течение 0,23 мин; поток 0,6 мл/мин или 1,2 мл/мин.
Одноквадрупольный масс-спектрометр с источником электрораспыления Waters Micromass ZQ 4000. МС-метод, MS4_15minPM-80-800-35V; режим сканирования положительных/отрицательных ионов, m/z 80-800 за 0,5 с; капиллярное напряжение 3,50 кВ; напряжение на конусе 50 В; добавочное напряжение 650 В; температура исходного блока и газа десольватации 120°С и 300°С, соответственно. Детектор абсорбции Waters 2487 Dual λ, настроенный на 254 нм. Программное обеспечение Waters Masslynx V 4.0.
Одноквадрупольный масс-спектрометр с источником электрораспыления Waters Micromass LCZ Platform 4000. МС-метод, MS4_15minPM-80-800-35V; режим сканирования положительных/отрицательных ионов, m/z 80-800 за 1 с; капиллярное напряжение 4,0 кВ; напряжение на конусе 30 В; добавочное напряжение 900 В; температура исходного блока и газа десольватации 120°С и 300°С, соответственно. Фотодиодный матричный детектор Waters 996, установленный от 200 до 400 нм. Программное обеспечение Waters Masslynx V4.0.
Значения для [M+H]+, приведенные в примерах, представляют собой значения m/z, найденные на соответствующей хроматограмме ЖХ/МС для соответствующего соединения. Все эти значения были найдены в допустимых пределах +/- 0,3 единицы по сравнению с вычисленной точной массой при протонировании соединения.
Препаративная тонкослойная хроматография (препаративная ТСХ): пластинки Merck PLC, силикагель 60 F254, 0,5 мм, 1,0 мм или 2,0 мм.
Колоночная хроматография: силикагель Acros 60A, 0,035-0,070 мм.
Препаративная ВЭЖХ-МС: I) Автодозатор 2767, мультисольвентная система доставки Waters 600 с аналитическими насосными насадками (100 мкл); контроллер Waters 600; модуль бинарного градиента с препаративными насосными насадками (500 мкл) Waters 2525. Разбавление в колонке: растворитель1, MeCN:H2O 70:30 (об./об.), растворитель2, MeCN:MeOH:ДМФ 80:15:5 (об./об./об.); скорость потока 5 мл/мин. Автодозатор 2767 с 10 мл шприцем и 10 мл пробоотборной петлей. Колонка с 6-позиционным клапаном Flom 401 с Waters X-Terra RP18, 5 мкм, 19×150 мм с защитным картриджем X-Terra RP18 5 мкм, 19×10 мм, используемая при скорости потока 20 мл/мин; Waters SunFire Prep OBD 5 мкм, 30×50 мм с защитным картриджем SunFire RP18 5 мкм, 19×10 мм, используемая при скорости потока 25 мл/мин; Waters Atlantis Prep T3 OBD 5 мкм, 30×50 мм с защитным картриджем Atlantis, используемая при скорости потока 50 мл/мин; Waters X-Bridge Prep OBD 5 мкм, 19×150 мм с защитным картриджем X-Bridge RP18 5 мкм, 19×10 мм, используемая при скорости потока 20 мл/мин; Waters Atlantis Prep T3 OBD 5 мкм, 19×50 мм с защитным картриджем Atlantis, используемая при скорости потока 25 мл/мин, и YMC-Actus Hydrosphere C18 5 мкм, 20×50 мм с защитным картриджем Actus, используемая при скорости потока 20 мл/мин. Элюент A, H2O, содержащая 0,1% (об./об.) HCO2H или H2O, содержащая 0,1% (об./об.) NEt3; элюент B, MeCN. Различные линейные градиенты, индивидуально адаптированные к образцу. Объем вводимой пробы 9 мл в зависимости от образца. Вспомогательный растворитель MeOH-MeCN-H2O-HCO2H 80:15:4,95:0,05 (об./об./об./об.). Вспомогательный насос Waters Reagent Manager, скорость потока 0,5 мл/мин. Одноквадрупольный масс-спектрометр с источником электрораспыления Waters ZQ. Режим сканирования положительных или отрицательных ионов m/z 105-950 за 1 с; капилляр 3,6 кВ; напряжение на конусе 45 В; добавочное напряжение 700 В; температура зонда и газа десольватации 120°С и 250°С, соответственно. Коллектор водной фракции 2767 с масс или УФ-инициированным сбором фракций. Детектор абсорбции Waters 2487 Dual λ, настроенный на 254 нм. Программное обеспечение Waters Masslynx V 4.0 SP4.
Спектры 1Н ЯМР регистрировали при комнатной температуре на ЯМР Фурье-спектрометре Bruker Supraleitendes (сверхпроводящий ЯМР Фурье-спектрометр), Avance™ 300 МГц. Химические сдвиги δ приведены в м.д. Мультиплетность определенного сигнала (синглет, дублет, триплет, квартет, мультиплет) указывается соответствующим сокращением (с, д, т, к, м соответственно). «Уш.с» обозначает уширенный синглет, «мц» обозначает центрированный мультиплет. Остаточные сигналы растворителя использовали в качестве внутренних стандартов: δ(CDCl3) = 7,26, δ(d6-ДМСО) = 2,50, δ(CD3OD) = 3,31, δ(d6-ацетон) = 2,05.
Общая методика получения алкил-5-метилизоксазол-4-карбоксилатов
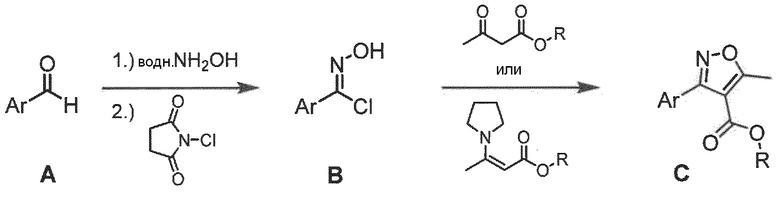
К перемешиваемой смеси альдегида (объем: 60 ммоль) A в этаноле (0,5 мл/ммоль) и воде (0,5 мл/ммоль) добавляли гидроксиламин (1,3 экв., 50 масс.% в воде) при 0°C. Смесь перемешивали при комнатной температуре в течение 24 ч, после чего все летучие вещества удаляли при пониженном давлении. Полученный неочищенный оксим растворяли в ДМФ (1 мл/ммоль) и обрабатывали NCS (1,0 экв.) при комнатной температуре в течение 24 ч.
Если требуется, инициирование реакции можно лучше контролировать, добавляя только 0,15 экв. NCS с последующим добавлением сухого хлорида водорода, барботируя в растворе ДМФ до тех пор, пока температура реакции не поднимется до 35°C; затем NCS (0,85 экв.) можно добавлять порциями.
Реакционную смесь распределяли между ДХМ и водой. Объединенные органические слои высушивали над MgSO4, отфильтровывали и концентрировали при пониженном давлении с получением неочищенного гидроксамоилхлорида B.
Следующие гидроксамоилхлориды B также были синтезированы во время превращений в разделе «Реакция циклоприсоединения», являясь частью синтеза Примеров с 97 по 129 и соответствующих Структурных элементов:
- 2-хлор-6-фтор-N-гидроксибензимидоилхлорид; Результат ЖХ/МС [M+H]+: 208,1;
- 2-хлор-N-гидроксибензимидоилхлорид; Результат ЖХ/МС [M+H]+: 190,1;
- 2,6-дихлор-3-метокси-N-гидроксибензимидоилхлорид: данный тип ароматического замещения был получен из N-[(2-хлор-3-метоксифенил)метилиден]гидроксиламина при обработке 2,0 NCS вместо 1,0 экв., как используется для получения 2-хлор-3-метокси-N-гидроксибензимидоилхлорида); Результат ЖХ/МС [M+H]+: 253,9;
1H ЯМР (CDCl3): δ 3,92 (3Н, с, СН3), 6,97 (1Н, д, СН), 7,32 (1Н, д, СН), 8,39 (1Н, с, ОН).
- 2-хлор-3-метокси-N-гидроксибензимидоилхлорид; Результат ЖХ/МС [M+H]+: 220,0;
- 2-метокси-N-гидроксибензимидоилхлорид;
- 3-(бензилокси)-2-хлор-N-гидроксибензимидоилхлорид; Результат ЖХ/МС [M+H]+: 295,9;
- метил-2-хлор-3-(хлор(гидроксиимино)метил)бензоат
- метил-3-(хлор(гидроксиимино)метил)-2-метоксибензоат
- метил-3-(хлор(гидроксиимино)метил)бензоат
В соответствии с данной методикой следующие структурные элементы C были синтезированы с дополнительной стадией синтеза, как описано ниже:
(Z)-этил-3-(пирролидин-1-ил)бут-2-еноат: К пирролидину (6 ммоль) медленно добавляли этил-3-оксобутаноат (1,0 экв.) (ВНИМАНИЕ: высокоэкзотермическая!) с получением желтой суспензии. Добавляли толуол (5 мл/ммоль) для удаления H2O, получившейся в результате реакции конденсации, с использованием насадки Дина-Старка. Смесь нагревали с обратным холодильником в течение 5 ч, в результате чего получали раствор, который в дальнейшем фракционировали дистилляцией (8 мбар, 150°С) с получением продукта в виде желтого масла (4,2 ммоль, 70%).
1H ЯМР (CDCl3): δ 1,24 (3Н, т, СН3), 1,92 (4Н, м, СН2), 2,45 (3Н, с, СН3), 3,28 (4Н, м, СН2), 4,08 (2Н, к, СН2), 4,46 (1Н, с, СН).

Этил-3-(2-хлор-6-фторфенил)-5-метилизоксазол-4-карбоксилат
К раствору (Z)-2-хлор-6-фтор-N-гидроксибензимидоилхлорида (65 ммоль) в ДМФ (2 мл/ммоль) при 0°C по каплям добавляли раствор (Z)-этил-3-(пирролидин-1-ил)бут-2-еноата (1,05 экв. в EtOH, 0,3 мл/ммоль). После перемешивания при комнатной температуре в течение 1 ч по каплям добавляли триэтиламин (1,1 экв. в EtOH, 0,1 мл/ммоль) более 2 ч. Смесь перемешивали при комнатной температуре в течение 24 ч. Полученную смесь отфильтровывали и фильтрат распределяли между CH2Cl2 и водой. Объединенные органические слои высушивали над MgSO4 и концентрировали при пониженном давлении. Неочищенный продукт дистиллировали при 10 мбар и 160°С. Продукт получали в виде оранжевого масла (80%).
1H ЯМР (CDCl3): δ 1,07 (3Н, т, СН3), 2,79 (3Н, с, СН3), 4,14 (2Н, к, СН2), 7,09 (1Н, тд, СН-аром.), 7,29 (1Н, д, СН-аром.), 7,39 (1Н, м, СН-аром.).

Этил-3-(3-бензилокси-2-хлорфенил)-5-метилизоксазол-4-карбоксилат
К раствору (Z)-3-(бензилокси)-2-хлор-N-гидроксибензимидоилхлорида (60 ммоль) в ДМФ (1 мл/ммоль) при 0°C по каплям добавляли раствор (Z)-этил-3-(пирролидин-1-ил)бут-2-еноата (1,05 экв. в EtOH, 0,3 мл/ммоль). После перемешивания при комнатной температуре в течение 1 ч по каплям добавляли триэтиламин (1,1 экв. в EtOH, 0,1 мл/ммоль) более 2 ч. Смесь перемешивали при комнатной температуре в течение 24 ч. Все летучие вещества удаляли при пониженном давлении. Неочищенный продукт дистиллировали при 2 мбар и 175-185°С. Продукт получали в виде маслянистого желтого твердого вещества (94%).
Результат ЖХ/МС [M+H]+: 372,0;
1H ЯМР (CDCl3): δ 0,98 (3Н, т, СН3), 4,06 (2Н, к, СН2), 4,57 (3Н, с, СН3), 5,07 (2Н, с, СН2), 6,80 (1Н, д, СН-аром.), 7,30 (7Н, м, СН-аром.).

Метил-3-(2-хлор-3-метоксифенил)-5-метилизоксазол-4-карбоксилат
(Z)-2-Хлор-N-гидрокси-3-метоксибензол-1-карбонимидоилхлорид (17 ммоль) растворяли в ДМФ (2 мл/ммоль) и добавляли метилацетоацетат (2,0 экв.) с последующим добавлением триэтиламина (5,0 экв.). Смесь перемешивали при комнатной температуре в течение 24 ч и затем распределяли между CH2Cl2 и водой. Объединенные органические слои высушивали над MgSO4, отфильтровывали и концентрировали при пониженном давлении. Неочищенный продукт очищали с помощью колоночной хроматографии на силикагеле (элюент: петролейный эфир до петролейный эфир/этилацетат 80:20) с получением бледно-коричневатого твердого вещества (75%).
Результат ЖХ/МС [M+H]+: 282,00;
1H ЯМР (CDCl3): δ 2,75 (3Н, с, СН3), 3,69 (3Н, с, ОСН3), 3,94 (3Н, с, ОСН3), 7,01 (1Н, дд, СН-аром.), 7,05 (1Н, дд, CH-аром.), 7,31 (1H, дд, CH-аром.).
Метил-3-(2-хлор-6-фторфенил)-5-метилизоксазол-4-карбоксилат приобретали у Apollo Scientific (PC9397). Метил-3-(2-хлорфенил)-5-метилизоксазол-4-карбоксилат и этил-3-(2-хлорфенил)-5-метилизоксазол-4-карбоксилат приобретали у ABCR (AB158164 и AB334755, соответственно).

Получение 3-(2-хлор-6-фторфенил)-5-метил-4-(тиазол-2-ил)изоксазола

Раствор 28,4 г (100 ммоль) этил-3-(2-хлор-6-фторфенил)-5-метилизоксазол-4-карбоксилата растворяли в 40 мл этанола и добавляли 40 мл водн. NaOH (4,0 М). Смесь нагревали до 60°С в течение 24 ч. Этанол частично испаряли при пониженном давлении и оставшийся раствор подкисляли добавлением водн. HCl (4,0 М). Образовавшийся осадок отфильтровывали, промывали H2O и высушивали под вакуумом с получением 25,2 г (99%) неочищенной 3-(2-хлор-6-фторфенил)-5-метилизоксазол-4-карбоновой кислоты в виде белого с желтоватым или сероватым оттенком твердого вещества.

Результат ЖХ/МС [M+H]+: 255,9;
1H ЯМР (CDCl3): δ 2,79 (3Н, с, СН3), 7,09 (1Н, дт, СН-аром.), 7,30 (1Н, дд, СН-аром.), 7,47-7,34 (1Н, м, СН-аром.).
К светло-бежевой суспензии 25,2 г (99 ммоль) неочищенной 3-(2-хлор-6-фторфенил)-5-метилизоксазол-4-карбоновой кислоты в CH2Cl2 (300 мл) добавляли каталитическое количество ДМФ (прибл. 0,1 мл) с последующим добавлением по каплям оксалилхлорида (5,0 экв.), что приводило к оранжево-красному раствору. Реакционную смесь нагревали с обратным холодильником в течение 1 ч, после чего все летучие вещества удаляли при пониженном давлении. Неочищенный материал 3-(2-хлор-6-фторфенил)-5-метилизоксазол-4-карбонилхлорид непосредственно растворяли в Et2O (250 мл) и охлаждали до 0°C. Добавляли 10% водн. Na2CO3 (250 мл) и полученную двухфазную смесь энергично перемешивали в процессе того, как медленно добавляли водн. раствор аммиака (50 мл; 35 масс.% раствор NH3 в воде). Реакционную смесь перемешивали при 0°С в течение 10 мин и затем при к. т. в течение 3 ч. Две фазы разделяли, органическую фазу промывали H2O и 5% водн. HCl, высушивали над MgSO4 и концентрировали при пониженном давлении с получением неочищенного 3-(2-хлор-6-фторфенил)-5-метилизоксазол-4-карбоксамида в виде бежевого твердого вещества (22,7 г, 90%).

Результат ЖХ/МС [M+H]+: 254,9;
1H ЯМР (CDCl3): δ 2,79 (3Н, с, СН3), 5,40 (2Н, уш., NH2), 7,18 (1Н, т, СН-аром.), 7,38 (1Н, д, СН-аром.), 7,55-7,42 (1Н, м, СН-аром.).
К раствору 12,7 г (50 ммоль) неочищенного 3-(2-хлор-6-фторфенил)-5-метилизоксазол-4-карбоксамида в 150 мл диоксана (Sure/Seal) добавляли 1,0 экв. реагента Лавессона. Смесь перемешивали в течение 4 ч при нагревании с обратным холодильником. После охлаждения до к.т. осадок отфильтровывали и фильтрат концентрировали при пониженном давлении. Масляный остаток очищали с помощью колоночной хроматографии (силикагель; элюент: 100% CH2Cl2) с получением 11,0 г (81%) 3-(2-хлор-6-фторфенил)-5-метилизоксазол-4-карботиоамида в виде желтого твердого вещества.

Результат ЖХ/МС [M+H]+: 270,9;
1H ЯМР (CDCl3): δ 2,84 (3Н, с, СН3), 6,50 (1Н, уш., NH), 7,17 (1Н, тд, СН-аром.), 7,30 (1Н, уш., NH), 7,36 (1Н, дт, CH-аром.), 7,51-7,40 (1H, м, CH-аром.).
К желтой суспензии 10,8 г (40 ммоль) 3-(2-хлор-6-фторфенил)-5-метилизоксазол-4-карботиоамида в этаноле добавляли раствор хлорацетальдегида (10 экв.; 50 масс.% в H2O) и реакционную смесь перемешивали при нагревании с обратным холодильником в течение 24 ч. Все летучие вещества удаляли при пониженном давлении. Остаток растворяли в EtOAc и промывали 3 раза водой. Органическую фазу высушивали над MgSO4, отфильтровывали и концентрировали при пониженном давлении. Остаток очищали с помощью колоночной флэш-хроматографии на силикагеле (элюент: 100% CH2Cl2). Указанное в заголовке соединение 3-(2-хлор-6-фторфенил)-5-метил-4-(тиазол-2-ил)изоксазол получали в виде желтого масла (8,37 г, 71%).

Результат ЖХ/МС [M+H]+: 294,9;
1H ЯМР (CDCl3): δ 2,89 (3Н, с, СН3), 7,15 (1Н, тд, СН-аром.), 7,19 (1Н, д, СН-аром.), 7,35 (1Н, дт, СН-аром.) 7,52-7,42 (1H, м, CH-аром.), 7,80 (1H, д CH-аром.).
Общая методика получения 5-(1-(диметиламино)-4,4,4-трифтор-3-оксобут-1-ен-2-ил)изоксазолов и 5-(1-(диметиламино)-3-оксобут-1-ен-2-ил)изоксазолов

Стадия 1: К раствору 3-арил-5-метилизоксазола (10 ммоль) в сухом толуоле (Sure/Seal; 2 мл/ммоль) добавляли трет-бутокси-бис(диметиламино)метан (реагент Бредерека; 2,5 экв.). Реакционную смесь нагревали с обратным холодильником в течение 5 ч, затем охлаждали до комнатной температуры, концентрировали при пониженном давлении и распределяли между CH2Cl2 и водой. Объединенные органические слои высушивали над MgSO4, летучие вещества удаляли при пониженном давлении с получением неочищенного интермедиата енамина.
Стадия 2а, Y=CF3: Неочищенный интермедиат енамина из стадии 1 (10 ммоль) растворяли в CH2Cl2 (3 мл/ммоль) и охлаждали до 0°С. При данной температуре по каплям добавляли трифторуксусный ангидрид (2,0 экв.) с последующим добавлением триэтиламина (1,0 экв.). Реакционную смесь оставляли нагреваться до комнатной температуры в течение 3 ч и затем распределяли между CH2Cl2 и водой. Объединенные органические слои промывали насыщенным водн. NaHCO3 и высушивали над MgSO4. Неочищенный продукт очищали с помощью флэш-хроматографии на силикагеле (элюент: CH2Cl2 до CH2Cl2/MeOH 95:5).
Стадия 2b, Y=Me: Неочищенный интермедиат енамина из стадии 1 (10 ммоль) растворяли в ТГФ (Sure/Seal; 3 мл/ммоль) и добавляли ацетилхлорид (2,5 экв.) и диизопропилэтиламин (3,0 экв.). Реакционную смесь нагревали с обратным холодильником в течение 18 ч. Превращение контролировали с помощью ТСХ, для доведения превращения до завершения могло потребоваться дополнительное количество ацетилхлорида. После охлаждения до комнатной температуры смесь распределяли между CH2Cl2 и водой. Объединенные органические слои промывали насыщенным водн. NaHCO3 и высушивали над MgSO4. Неочищенный продукт очищали с помощью флэш-хроматографии на силикагеле (элюент: от CH2Cl2 до CH2Cl2/MeOH 95:5).

этил-(Z)-3-(2-хлор-6-фторфенил)-5-(1-(диметиламино)-4,4,4-трифтор-3-оксобут-1-ен-2-ил)изоксазол-4-карбоксилат (стадия 1+2а)
Белый с желтоватым или сероватым оттенком порошок, выход 48% за две стадии.
Результат ЖХ/МС [M+H]+: 434,8;
1H ЯМР (ДМСО): δ 0,84 (3Н, т, СН3), 2,52 (3Н, с, СН3), 3,29 (Н, с, СН3), 3,92 (2Н, к, СН2), 7,32 (1Н, т, СН-аром.), 7,42 (1H, д, CH-аром.), 7,54 (7H, м, CH-аром.), 8,00 (1H, с, CH).

метил-(Z)-3-(2-хлор-6-фторфенил)-5-(1-(диметиламино)-4,4,4-трифтор-3-оксобут-1-ен-2-ил)изоксазол-4-карбоксилат (стадия 1+2а)
Бледно-желтый порошок, выход 53% за две стадии.
Результат ЖХ/МС [M+H]+: 420,8;
1H ЯМР (ДМСО): δ 3,63 (3Н, с, СН3), 3,40 (3Н, с, СН3), 3,57 (3Н, с, СН3), 7,44 (1Н, т, СН-аром.), 7,53 (1Н, д, CH-аром.), 7,65 (7H, м, CH-аром.), 8,12 (1H, с, CH).

этил-(Z)-3-(2-хлорфенил)-5-(1-(диметиламино)-4,4,4-трифтор-3-оксобут-1-ен-2-ил)изоксазол-4-карбоксилат (стадия 1+2a)
Желтое твердое вещество, выход 46% за две стадии.
Результат ЖХ/МС [M+H]+: 416,7;
1H ЯМР (CDCl3): δ 0,38 (3Н, т, СН3), 2,75 (6Н, с, 2х СН3), 4,12 (2Н, к, СН2), 7,45 (5Н, т, СН-аром.).
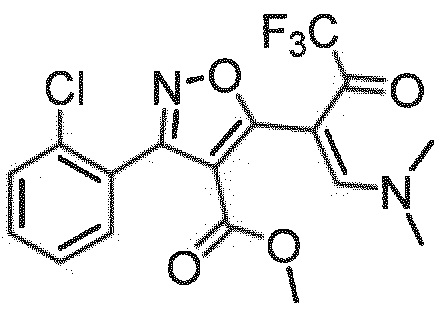
метил-(Z)-3-(2-хлорфенил)-5-(1-(диметиламино)-4,4,4-трифтор-3-оксобут-1-ен-2-ил)изоксазол-4-карбоксилат (стадия 1+2a)
Бледно-желтый порошок, выход 42% за две стадии.
Результат ЖХ/МС [M+H]+: 403,1;
1H ЯМР (CDCl3): δ 3,72 (3Н, с, СН3), 3,34 (3Н, с, СН3), 3,63 (3Н, с, СН3), 7,44 (4Н, м, СН-аром.), 7,95 (1Н, с, СН).
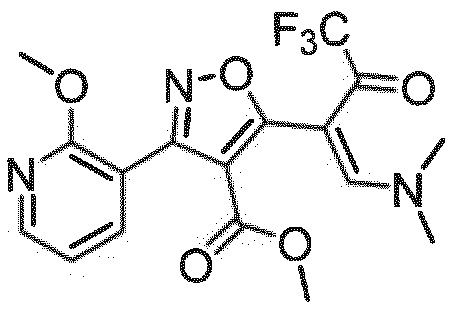
метил-(Z)-5-(1-(диметиламино)-4,4,4-трифтор-3-оксобут-1-ен-2-ил)-3-(2-метоксипиридин-3-ил)изоксазол-4-карбоксилат
Исходя из структурного элемента 2-метоксипиридин-3-карбоксальдегида (30 ммоль), в общих методиках реакции, описанных выше, с последующей стадией 1+2а получали указанное в заголовке соединение в виде бледно-желтого порошка с выходом 16% за 5 стадий.
Результат ЖХ/МС [M+H]+: 399,9;
1H ЯМР (ДМСО): δ 3,64 (3Н, с, СН3), 3,41 (3Н, с, СН3), 3,59 (3Н, с, СН3), 3,82 (3Н, с, СН3), 7,15 (1Н, дд, СН-аром.), 7,92 (1H, дд, CH-аром.), 8,09 (1H, с, CH), 8,34 (1H, дд, CH-аром.).

этил-(Z)-3-(3-(бензилокси)-2-хлорфенил)-5-(1-(диметиламино)-4,4,4-трифтор-3-оксобут-1-ен-2-ил)изоксазол-4-карбоксилат (стадия 1+2а)
Коричневатое масло, выход 38% за две стадии.
Результат ЖХ/МС [M+H]+: 523,1;
1H ЯМР (ДМСО): δ 1,02 (3Н, т, СН3), 2,73 (3Н, д, N-СН3), 3,34 (3Н, д, N-СН3), 4,09 (2Н, к, СН2), 5,21 (2H, с, CH2), 7,12 (2H, м, CH-аром.) 7,39 (6H, м, CH-аром.), 7,97 (1H, с, CH).
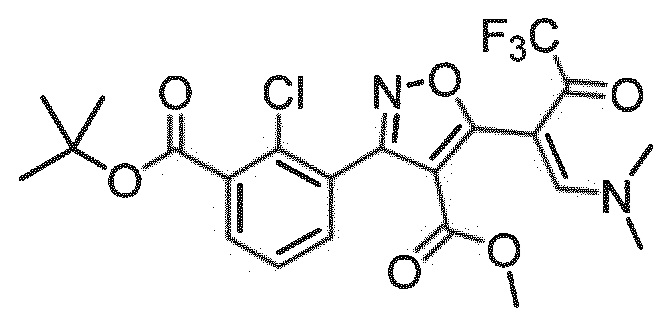
метил-(Z)-3-(3-(трет-бутоксикарбонил)-2-хлорфенил)-5-(1-(диметиламино)-4,4,4-трифтор-3-оксобут-1-ен-2-ил)изоксазол-4-карбоксилат
2-Хлор-3-формилбензойную кислоту (25 ммоль) растворяли в ТГФ (75 мл) и добавляли ди-трет-бутилдикарбонат (2,0 экв.) и N, N-диметиламинопиридин (0,2 экв.). Смесь перемешивали при комнатной температуре в течение 18 ч. Смесь распределяли между этилацетатом и водой. Объединенные органические слои промывали насыщенным водн. NaHCO3 и солевым раствором, высушивали над MgSO4 и концентрировали при пониженном давлении. Флэш-хроматография на силикагеле (элюент: петролейный эфир до петролейный эфир/этилацетат 80:20) предоставляла трет-бутил-2-хлор-3-формилбензоат (87%). Исходя из данного структурного элемента, в общих методиках реакции, описанных выше, с последующей стадией 1+2а получали указанное в заголовке соединение в виде белого с желтоватым или сероватым оттенком порошка с выходом 27% за 5 стадий.
Результат ЖХ/МС [M+H]+: 523,1;
1H ЯМР (CDCl3): δ 1,61 (9Н, с, т-Bu), 3,73 (3Н, с, СН3), 3,35 (3Н, с, СН3), 3,63 (3Н, с, СН3), 7,43 (1Н, т, CH-аром.), 7,59 (1H, дд, CH-аром.), 7,81 (1H, дд, CH-аром.), 7,96 (1H, с, CH).

метил-(Z)-3-(2-хлор-6-фторфенил)-5-(1-(диметиламино)-3-оксобут-1-ен-2-ил)изоксазол-4-карбоксилат (стадия 1+2b)
Оранжевое твердое вещество, выход 52% за две стадии.
Результат ЖХ/МС [M+H]+: 367,1;
1H ЯМР (CDCl3): δ 2,04 (3Н, с, СН3), 2,63 (3Н, д, N-СН3), 3,21 (3Н, д, N-СН3), 3,64 (3Н, с, СН3), 7,13 (1Н, т, СН-аром.), 7,31 (1Н, д, СН-аром.), 7,41 (1Н, м, СН-аром.), 7,87 (1Н, с, СН).
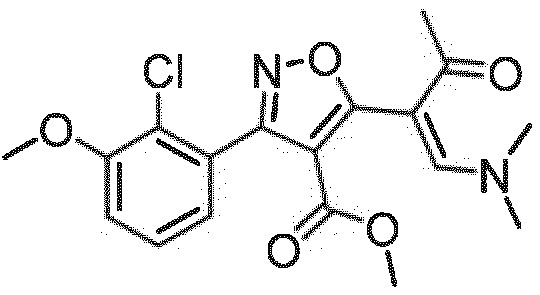
метил-(Z)-3-(2-хлор-3-метоксифенил)-5-(1-(диметиламино)-3-оксобут-1-ен-2-ил)изоксазол-4-карбоксилат (стадия 1+2b)
Коричневатое масло, выход 63% за две стадии.
Результат ЖХ/МС [M+H]+: 379,0;
1H ЯМР (CDCl3): δ 2,45 (3Н, с, СН3), 2,67 (3Н, д, N-СН3), 3,17 (3Н, д, N-СН3), 3,63 (3Н, с, СН3), 3,94 (3Н, с, СН3), 7,09 (2Н, м, СН-аром.), 7,35 (1Н, т, СН-аром.), 7,41 (1Н, м, СН-аром.), 7,85 (1Н, с, СН).

метил-(Z)-3-(2-хлорфенил)-5-(1-(диметиламино)-3-оксобут-1-ен-2-ил)изоксазол-4-карбоксилат (стадия 1+2b)
Бежево-коричневое твердое вещество, выход 40% за две стадии.
Результат ЖХ/МС [M+H]+: 349,3;
1H ЯМР (CDCl3): δ 2,05 (3Н, с, СН3), 2,70 (3Н, д, N-СН3), 3,17 (3Н, д, N-СН3), 3,63 (3Н, с, СН3), 7,44 (4Н, м, CH-аром.), 7,87 (1H, с, CH).

(Z)-3-(3-(2-хлор-6-фторфенил)-4-(5-метил-1,3,4-оксадиазол-2-ил)изоксазол-5-ил)-4-(диметиламино)-1,1,1-трифторбут-3-ен-2-он
Раствор метил-3-(2-хлор-6-фторфенил)-5-метилизоксазол-4-карбоксилата (50 ммоль) растворяли в 20 мл этанола и добавляли 20 мл водн. NaOH (4,0 М). Смесь нагревали до 60°С в течение 24 ч. Этанол частично испаряли при пониженном давлении и оставшийся раствор подкисляли добавлением водн. HCl (4,0 М). Образовавшийся осадок отфильтровывали, промывали H2O и высушивали под вакуумом с получением неочищенной 3-(2-хлор-6-фторфенил)-5-метилизоксазол-4-карбоновой кислоты количественно в виде белого с желтоватым или сероватым оттенком твердого вещества.
Раствор карбоновой кислоты (10 ммоль) в 30 мл SOCl2 нагревали с обратным холодильником в течение 3 ч. Летучие вещества тщательно испаряли под вакуумом. Остаток растворяли в диоксане (Sure/Seal; 100 мл) и по каплям добавляли к перемешиваемой смеси N2H4⃰H2O (20 экв.) в 50 мл диоксана. Смесь перемешивали при комнатной температуре в течение 2 ч и затем распределяли между этилацетатом и водой. Объединенные органические слои промывали водой и солевым раствором, высушивали над MgSO4. Испарение досуха предоставляло неочищенный гидразид, который затем нагревали в образцах прибл. 1,85 ммоль (прибл. 500 мг) в присутствии 10 мл уксусного ангидрида при микроволновом облучении при 140°С в течение 6 ч. Объединенные смеси нескольких микроволновых реакций разбавляли дихлорметаном и промывали водой, высушивали над сульфатом натрия, отфильтровывали и концентрировали при пониженном давлении. Колоночная хроматография на силикагеле (элюент: от CH2Cl2 до CH2Cl2/MeOH 98:2) предоставляла 2-[3-(2-хлор-6-фторфенил)-5-метил-1,2-оксазол-4-ил]-5-метил-1,3,4-оксадиазол в виде желтоватого масла с выходом 38% за три стадии.
Исходя из данного структурного элемента (3 ммоль), в общих методиках реакции 1+2а, описанных выше, получали указанное в заголовке соединение в виде желтого порошка с выходом 44% за 2 стадии.
Результат ЖХ/МС [M+H]+: 349,3;
1H ЯМР (CDCl3): δ 2,39 (3Н, с, СН3), 2,73 (3Н, д, N-СН3), 3,36 (3Н, д, N-СН3), 7,14 (1Н, т, СН-аром.), 7,33 (1Н, д, СН-аром.), 7,45 (1Н, м, СН-аром.), 8,04 (1Н, с, СН).

(Z)-3-(3-(2-хлор-6-фторфенил)-4-(тиазол-2-ил)изоксазол-5-ил)-4-(диметиламино)-1,1,1-трифторбут-3-ен-2-он (стадия 1+2а)
Оранжевый порошок, выход 25% за две стадии.
Результат ЖХ/МС [M+H]+: 445,7;
1H ЯМР (CDCl3): δ 2,65 (3Н, д, N-СН3), 3,25 (3Н, д, N-СН3), 7,06 (1Н, т, СН-аром.), 7,15 (1Н, д, СН-аром.), 7,25 (1Н, д, СН-аром.), 7,38 (1Н, м, СН-аром.), 7,60 (1Н, д, СН-аром.), 8,01 (1Н, с, СН).
Синтез 3-гидразинилциклобутанолов
3-гидразинил-1-метилциклобутан-1-ол
- 2,2-дихлор-3-оксоциклобутилпивалат
К перемешиваемому раствору винилпивалата (40,0 г, 0,321 моль) и порошка Zn (41,2 г, 0,634 моль) в Et2O (300 мл), охлажденному до 15°C, по каплям медленно добавляли (более 2 ч) раствор 2,2,2-трихлорацетилхлорида (73,2 г, 0,407 моль) в Et2O (150 мл). Реакционную смесь перемешивали при комнатной температуре в течение дополнительных 4 ч и затем отфильтровывали через слой целита. Фильтрат промывали водой (400 мл) и солевым раствором (400 мл), высушивали над безводным Na2SO4 и концентрировали при пониженном давлении. Остаток очищали с помощью колоночной хроматографии на силикагеле (элюент: петролейный эфир/этилацетат 30:1) с получением желаемого соединения (59,2 г, выход: 79%) в виде бесцветного твердого вещества.
- 3-оксоциклобутилпивалат
К перемешиваемой суспензии порошка Zn (80,8 г, 1,24 моль) в AcOH (300 мл), охлажденной до 15°C, по каплям медленно (более 0,5 ч) добавляли раствор 2,2-дихлор-3-оксоциклобутилпивалата (59,0 г, 0,248 моль) в AcOH (100 мл). Реакционную смесь перемешивали при комнатной температуре в течение еще 1 ч и затем отфильтровывали через слой целита. Фильтрат разбавляли метил-трет-бутиловым эфиром (1,5 л), промывали солевым раствором (400 мл × 4) и насыщенным водн. NaHCO3 (400 мл × 4) по очереди, пока pH не достигнет приблизительно 8, высушивали над безводным Na2SO4 и концентрировали при пониженном давлении. Остаток очищали с помощью колоночной хроматографии на силикагеле (элюент: петролейный эфир/этилацетат 25:1) с получением желаемого соединения (29,0 г, выход: 59%) в виде масла.
- 3-гидрокси-3-метилциклобутилпивалат
К перемешиваемой суспензии MeMgBr (118 мл, 0,353 моль, 3 М в Et2O) в сухом ТГФ (80 мл), охлажденной до 0°C, по каплям медленно (более 0,5 ч) добавляли раствор 3-оксоциклобутилпивалата (40,0 г, 0,235 моль) в ТГФ (100 мл). Реакционную смесь перемешивали при комнатной температуре в течение дополнительных 1,5 ч. Реакционную смесь выливали в холодный насыщенный водн. NH4Cl (300 мл). Органическую фазу промывали солевым раствором (200 мл), высушивали над безводным Na2SO4 и концентрировали при пониженном давлении. Остаток очищали с помощью колоночной хроматографии на силикагеле (элюент: петролейный эфир/этилацетат 2:1) с получением желаемого соединения (26,0 г, выход: 60%) в виде клейкого масла.
- 1-метилциклобутан-1,3-диол
К перемешиваемому раствору 3-гидрокси-3-метилциклобутилпивалата (3,30 г, 0,0177 моль) в МеОН (30 мл) при комнатной температуре добавляли раствор NaOH (3,18 г, 0,0775 моль) в воде (30 мл). Реакционную смесь перемешивали при комнатной температуре в течение 18 ч и затем концентрировали при пониженном давлении для удаления большей части MeOH. рН остатка доводили до 4 с помощью 1 М водн. HCl и промывали CH2Cl2 (30 мл × 2). Водную фазу концентрировали при пониженном давлении при 55°С. Остаток подвергали азеотропной перегонке с EtOH (20 мл × 2). Добавляли раствор CH2Cl2/EtOH 10:1 (30 мл) и твердый NaHCO3 (2 г). Полученную смесь отфильтровывали через слой целита. Фильтрат концентрировали при пониженном давлении с получением желаемого соединения (1,40 г, выход: 77%) в виде светло-желтого масла.
- 3-гидрокси-3-метилциклобутанон
К перемешиваемому раствору 1-метилциклобутан-1,3-диола (11,6 г, 0,114 моль) в CH2Cl2 (200 мл) и ТГФ (30 мл) при комнатной температуре добавляли периодинан Десса-Мартина (53,0 г, 0,125 моль). Реакционную смесь перемешивали при комнатной температуре в течение 18 ч и затем отфильтровывали через слой целита. Фильтрат концентрировали при пониженном давлении с получением неочищенного желаемого соединения (11,4 г) в виде бледно-желтого масла. Данный неочищенный продукт использовали в следующей стадии без дополнительной очистки.
- трет-бутил-2-(3-гидрокси-3-метилциклобутил)гидразинкарбоксилат
К перемешиваемому раствору 3-гидрокси-3-метилциклобутанона (11,4 г неочищенный, 0,114 моль) в MeOH (200 мл) при комнатной температуре добавляли BocNHNH2 (18,1 г, 0,137 моль) и AcOH (0,5 мл). Реакционную смесь перемешивали при комнатной температуре в течение 3 ч и затем добавляли NaBH3CN (14,4 г, 0,228 моль) при комнатной температуре. Реакционную смесь перемешивали при комнатной температуре в течение 2 ч и затем нагревали до 80°C в течение 18 ч. Реакционную смесь охлаждали до комнатной температуры и концентрировали при пониженном давлении. Остаток разбавляли EtOAc (200 мл), промывали водой (200 мл) и солевым раствором (200 мл) по очереди, высушивали над безводным Na2SO4 и концентрировали при пониженном давлении. Остаток очищали с помощью колоночной хроматографии на силикагеле (элюент: CH2Cl2/MeOH от 100:1 до 40:1) с получением требуемого соединения (12,0 г, выход: 40%) в виде клейкого масла.
- 3-гидразинил-1-метилциклобутанола гидрохлорид
Раствор трет-бутил-2-(3-гидрокси-3-метилциклобутил)гидразинкарбоксилата (350 мг, 1,62 ммоль) в HCl/MeOH (3 М; 4 мл) перемешивали при комнатной температуре в течение 1 ч. Реакционную смесь концентрировали при пониженном давлении с получением желаемого соединения (275 мг, выход: 100%) в виде клейкого масла.
Результат ЖХ/МС [M+H]+: 116,9;
1H ЯМР (CDCl3): δ 1,23 (3Н, д, СН3), 2,09 (4Н, м, СН2), 3,68 (1Н, м, СН), 3,91 (2Н, с, NH2).
3-гидразинеил-1-(метоксиметил)циклобутан-1-ол

Данный гидразинилциклобутанол синтезировали по аналогии с 3-гидразинил-1-метилциклобутан-1-олом, только стадия реакции с использованием MeMgBr была заменена на стадию с использованием метоксиметилмагнийхлорида в ТГФ (30°С, 18 ч).
Общая методика получения 3-арил-5-(1,5-дизамещенных-1Н-пиразол-4-ил)изоксазолов

К раствору 2-ацил-1-(диметиламино)этилена в высушенном этаноле (4 мл/ммоль) добавляли соответствующее производное гидразина (1,3 экв.) и N, N-диизопропилэтиламин (1,3 экв., если гидразин использовали в виде свободного основания, 3,0 экв., если гидразин использовали в виде соли гидрохлорида). Реакционную смесь нагревали при 60°С в течение от 2 до 18 ч, в зависимости от степени превращения, отслеживаемой с помощью ЖХМС. В некоторых случаях нагревание до 78°C было необходимо для перехода к завершению. Смеси распределяли между CH2Cl2 и насыщенным водн. NH4Cl, органический слой высушивали над MgSO4 и концентрировали при пониженном давлении. Продукты выделяли с помощью препаративной ТСХ (пТСХ) на силикагеле.

Пример 1: 1-(4-(3-(2-хлор-6-фторфенил)-4-(тиазол-2-ил)изоксазол-5-ил)-5-(трифторметил)-1Н-пиразол-1-ил)-2-метилпропан-2-ол
Указанное в заголовке соединение синтезировали из (Z)-3-(3-(2-хлор-6-фторфенил)-4-(тиазол-2-ил)изоксазол-5-ил)-4-(диметиламино)-1,1,1-трифторбут-3-ен-2-она (2,2 ммоль) и 1-гидразинил-2-метилпропан-2-ола в виде желтоватого твердого вещества (53%; пТСХ, элюент: петролейный эфир/этилацетат 1:1).
Результат ЖХ/МС [M+H]+: 486,8;
1H ЯМР (CDCl3): δ 1,26 (6Н, с, 2хСН3), 4,26 (1Н, с, ОН), 4,32 (2Н, с, СН2), 7,17 (1Н, тд, СН-аром.), 7,21 (1Н, д, CH-аром.), 7,36 (1H, дт, CH-аром.), 7,54-7,44 (1H, м, CH-аром.), 7,69 (1H, д, CH-аром.), 8,11 (1H, с, CH-аром.).

Пример 2: 1-((4-(3-(2-хлор-6-фторфенил)-4-(тиазол-2-ил)изоксазол-5-ил)-5-(трифторметил)-1Н-пиразол-1-ил)метил)циклопропанол
Указанное в заголовке соединение синтезировали из (Z)-3-(3-(2-хлор-6-фторфенил)-4-(тиазол-2-ил)изоксазол-5-ил)-4-(диметиламино)-1,1,1-трифторбут-3-ен-2-она (0,22 ммоль) и 1-(гидразинилметил)циклопропанола в виде оранжевого масла (27%; пТСХ, элюент: петролейный эфир/этилацетат 1:1).
Результат ЖХ/МС [M+H]+: 484,6;
1H ЯМР (CDCl3): δ 0,81-0,74 (2H, м, CH2), 1,05-0,97 (2H, м, CH2), 4,21-4,00 (1H, м, OH), 4,42 (2H, с, CH2), 7,16 (1H, тд, CH-аром.), 7,22 (1H, д, CH-аром.), 7,35 (1H, дт, CH-аром.), 7,53-7,43 (1H, м, CH-аром.), 7,71 (1H, д CH-аром.), 8,12 (1H, с, CH-аром.).

Пример 3: 4-(4-(3-(2-хлор-6-фторфенил)-4-(тиазол-2-ил)изоксазол-5-ил)-5-(трифторметил)-1Н-пиразол-1-ил)-2-метилбутан-2-ол
Указанное в заголовке соединение синтезировали из (Z)-3-(3-(2-хлор-6-фторфенил)-4-(тиазол-2-ил)изоксазол-5-ил)-4-(диметиламино)-1,1,1-трифторбут-3-ен-2-она (0,57 ммоль) и 4-гидразинил-2-метилбутан-2-ола в виде желтоватого масла (2%; пТСХ, элюент: петролейный эфир/этилацетат 1:1 и пТСХ, элюент: CH2Cl2/MeOH 98:2).
Результат ЖХ/МС [M+H]+: 501,2;
1H ЯМР (CDCl3): δ 1,33 (6H, с, 2xCH3), 2,14 (2H, дт, CH2), 4,54 (2H, дт, CH2), 7,16 (1H, тд, CH-аром.), 7,21 (1H, д, CH-аром.), 7,35 (1H, дт, CH-аром.), 7,52-7,43 (1H, м, CH-аром.), 7,71 (1H, д, CH-аром.), 8,03 (1H, с, CH-аром.).

Пример 4: (2R)-1-(4-(3-(2-хлор-6-фторфенил)-4-(тиазол-2-ил)изоксазол-5-ил)-5-(трифторметил)-1H-пиразол-1-ил)пропан-2-ол
Указанное в заголовке соединение синтезировали из (Z)-3-(3-(2-хлор-6-фторфенил)-4-(тиазол-2-ил)изоксазол-5-ил)-4-(диметиламино)-1,1,1-трифторбут-3-ен-2-она (0,14 ммоль) и (R)-1-гидразинилпропан-2-ола в виде желтоватого масла (23%; пТСХ, элюент: CH2Cl2/MeOH 95:5 и пТСХ, элюент: петролейный эфир/этилацетат 1:1).
Результат ЖХ/МС [M+H]+: 472,8;
1H ЯМР (CDCl3): δ 1,32 (3Н, д, СН3), 3,37 (1Н, д, ОН), 4,25 (1Н, дд, СН), 4,48-4,32 (2Н, м, 2хСН), 7,16 (1Н, тд, CH-аром.), 7,22 (1H, д, CH-аром.), 7,36 (1H, д, CH-аром.), 7,54-7,44 (1H, м, CH-аром.), 7,71 (1H, д, CH-аром.), 8,09 (1H, с, CH-аром.).

Пример 5: (2S)-1-(4-(3-(2-хлор-6-фторфенил)-4-(тиазол-2-ил)изоксазол-5-ил)-5-(трифторметил)-1H-пиразол-1-ил)пропан-2-ол
Указанное в заголовке соединение синтезировали из (Z)-3-(3-(2-хлор-6-фторфенил)-4-(тиазол-2-ил)изоксазол-5-ил)-4-(диметиламино)-1,1,1-трифторбут-3-ен-2-она (0,14 ммоль) и (S)-1-гидразинилпропан-2-ола в виде желтоватого масла (33%; пТСХ, элюент: CH2Cl2/MeOH 95:5 и пТСХ, элюент: петролейный эфир/этилацетат 1:1).
Результат ЖХ/МС [M+H]+: 472,8;
1H ЯМР (CDCl3): δ 1,32 (3Н, д, СН3), 3,37 (1Н, д, ОН), 4,25 (1Н, дд, СН), 4,47-4,32 (2Н, м, 2хСН), 7,17 (1Н, тд, CH-аром.), 7,22 (1H, д, CH-аром.), 7,36 (1H, д, CH-аром.), 7,54-7,44 (1H, м, CH-аром.), 7,71 (1H, д CH-аром.), 8,09 (1H, с, CH-аром.).
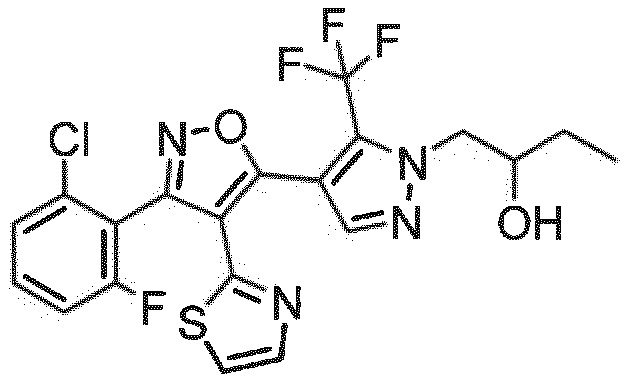
Пример 6: 1-{4-[3-(2-хлор-6-фторфенил)-4-(1,3-тиазол-2-ил)-1,2-оксазол-5-ил]-5-(трифторметил)-1Н-пиразол-1-ил}бутан-2-ол (рацемический)
Указанное в заголовке соединение синтезировали из (Z)-3-(3-(2-хлор-6-фторфенил)-4-(тиазол-2-ил)изоксазол-5-ил)-4-(диметиламино)-1,1,1-трифторбут-3-ен-2-она (0,60 ммоль) и 1-гидразино-2-бутанола в виде желтого твердого вещества (7%; пТСХ, элюент: CH2Cl2/MeOH 95:5 и пТСХ, элюент: петролейный эфир/этилацетат 1:1).
Результат ЖХ/МС [M+H]+: 486,8;
1H ЯМР (CDCl3): δ 1,06 (3Н, т, СН3), 1,69-1,55 (2Н, м, СН2), 3,32 (1Н, уш., ОН), 4,18-4,07 (1Н, м, СН), 4,25 (1Н, дд, CH), 4,41 (1H, дд, CH), 7,16 (1H, тд, CH-аром.), 7,22 (1H, д, CH-аром.), 7,35 (1H, дт, CH-аром.) 7,54-7,42 (1Н, м, СН-аром.), 7,71 (1Н, д, СН-аром.), 8,09 (1Н, с, СН-аром.).

Пример 7: 3-{4-[3-(2-хлор-6-фторфенил)-4-(1,3-тиазол-2-ил)-1,2-оксазол-5-ил]-5-(трифторметил)-1Н-пиразол-1-ил}-1,1,1-трифторпропан-2-ол (рацемический)
Указанное в заголовке соединение синтезировали из (Z)-3-(3-(2-хлор-6-фторфенил)-4-(тиазол-2-ил)изоксазол-5-ил)-4-(диметиламино)-1,1,1-трифторбут-3-ен-2-она (0,50 ммоль) и 1,1,1-трифтор-3-гидразинилпропан-2-ола (рацемический) в виде желтого твердого вещества (38%; пТСХ, элюент: CH2Cl2/MeOH 95:5; смесь структурных изомеров при пиразоле 60:40, ср. Схему выше).
Результат ЖХ/МС [M+H]+: 527,20;
1H ЯМР (CDCl3): δ 4,15 (1Н, уш., ОН), 4,39 (1Н, дд, СН), 4,71-4,49 (2Н, м, СН2), 7,17 (1Н, т, СН-аром.), 7,23 (1Н, д, СН-аром.), 7,36 (1Н, д, СН-аром.), 7,55-7,45 (1Н, м, СН-аром.), 7,71 (1Н, д, СН-аром.), 8,14 (1Н, с, СН-аром.).

Пример 8: этил-3-(2-хлор-6-фторфенил)-5-(1-(2-гидрокси-2-метилпропил)-5-(трифторметил)-1Н-пиразол-4-ил)изоксазол-4-карбоксилат
Указанное в заголовке соединение синтезировали из этил-(Z)-3-(2-хлор-6-фторфенил)-5-(1-(диметиламино)-4,4,4-трифтор-3-оксобут-1-ен-2-ил)изоксазол-4-карбоксилата (1,1 ммоль) и 1-гидразинил-2-метилпропан-2-ола в виде бесцветного порошка (21%; пТСХ, элюент: петролейный эфир/этилацетат 1:1 и пТСХ, элюент: петролейный эфир/CH2Cl2/MeOH 9:4:1).
Результат ЖХ/МС [M+H]+: 475,70;
1H ЯМР (CDCl3): δ 1,00 (3Н, т, СН3), 1,26 (6Н, с, 2х СН3), 4,10 (2Н, к, СН2), 4,31 (2Н, с, СН2), 7,11 (1Н, тд, CH-аром.), 7,33 (1H, д, CH-аром.), 7,43 (1H, м, CH-аром.), 8,04 (1H, с, CH-аром.).
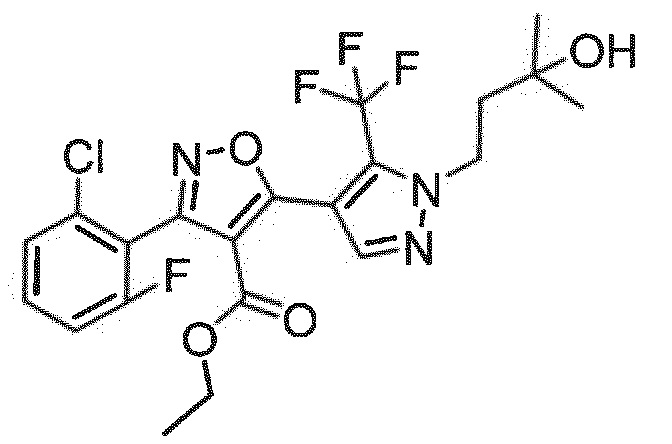
Пример 9: этил-3-(2-хлор-6-фторфенил)-5-[1-(3-гидрокси-3-метилбутил)-5-(трифторметил)-1Н-пиразол-4-ил]-1,2-оксазол-4-карбоксилат
Указанное в заголовке соединение синтезировали из этил-(Z)-3-(2-хлор-6-фторфенил)-5-(1-(диметиламино)-4,4,4-трифтор-3-оксобут-1-ен-2-ил)изоксазол-4-карбоксилата (2,3 ммоль) и 4-гидразинил-2-метилбутан-2-ола в виде желтого масла (45%; пТСХ, элюент: CH2Cl2/MeOH 95:5).
Результат ЖХ/МС [M+H]+: 490,30;
1H ЯМР (CDCl3): δ 0,99 (3Н, т, СН3), 1,33 (3Н, с, СН3), 1,64 (1Н, уш., ОН), 2,15 (2Н, м, СН2), 4,09 (2Н, к, СН2), 4,53 (2Н, м, СН2), 7,13 (1Н, тд, СН-аром.), 7,32 (1Н, д, СН-аром.), 7,41 (1Н, м, СН-аром.), 7,97 (1Н, с, СН-аром.).
 и
и 
Примеры 10 и 11: этил-3-(2-хлор-6-фторфенил)-5-[1-(3-гидрокси-3-метилциклобутил)-5-(трифторметил)-1Н-пиразол-4-ил]-1,2-оксазол-4-карбоксилат, син- и анти-конфигурация)
Указанные в заголовке соединения синтезировали из этил-(Z)-3-(2-хлор-6-фторфенил)-5-(1-(диметиламино)-4,4,4-трифтор-3-оксобут-1-ен-2-ил)изоксазол-4-карбоксилата (0,17 ммоль) и 3-гидразинил-1-метилциклобутан-1-ола (син/анти-смесь) (пТСХ, элюент: CH2Cl2/MeOH 95:5 и пТСХ, элюент: CH2Cl2/MeOH 98:2);
Пример 10: син-диастереомер (3%)
Результат ЖХ/МС [M+H]+: 488,20;
1H ЯМР (CDCl3): δ 0,99 (3Н, т, СН3), 1,49 (3Н, с, СН3), 2,80 (4Н, м, СН2), 4,09 (2Н, к, СН2), 4,72 (1Н, м, СН), 7,13 (1H, тд, CH-аром.), 7,33 (1H, д, CH-аром.), 7,42 (1H, м, CH-аром.), 8,00 (1H, с, CH-аром.).
Пример 11: анти-диастереомер (5%)
Результат ЖХ/МС [M+H]+: 488,20;
1H ЯМР (CDCl3): δ 0,99 (3Н, т, СН3), 1,49 (3Н, с, СН3), 2,65 (2Н, м, СН2), 2,83 (2Н, м, СН2), 4,09 (2Н, к, СН2), 5,26 (1Н, м, СН), 7,13 (1Н, тд, СН-аром.), 7,32 (1Н, д, СН-аром.), 7,42 (1Н, м, СН-аром.), 7,96 (1Н, с, СН-аром.).

Пример 12: этил-3-(2-хлор-6-фторфенил)-5-{1-[(2R)-2-гидроксипропил]-5-(трифторметил)-1H-пиразол-4-ил}-1,2-оксазол-4-карбоксилат
Указанное в заголовке соединение синтезировали из этил-(Z)-3-(2-хлор-6-фторфенил)-5-(1-(диметиламино)-4,4,4-трифтор-3-оксобут-1-ен-2-ил)изоксазол-4-карбоксилата (0,5 ммоль) и (R)-1-гидразинилпропан-2-ола в виде желтого масла (39%; пТСХ, элюент: петролейный эфир/этилацетат 1:1).
Результат ЖХ/МС [M+H]+: 461,70;
1H ЯМР (CDCl3): δ 0,99 (3Н, т, СН3), 1,31 (3Н, д, СН3), 3,33 (1Н, уш., ОН), 4,09 (2Н, к, СН2), 4,24 (1Н, дд, СН), 4,36 (2H, дд, CH2), 7,13 (1H, тд, CH-аром.), 7,32 (1H, д, CH-аром.), 7,42 (1H, м, CH-аром.), 8,01 (1H, с, СН-аром.).

Пример 13: этил-3-(2-хлор-6-фторфенил)-5-(1-((2S)-2-гидроксипропил)-5-(трифторметил)-1Н-пиразол-4-ил)-1,2-оксазол-4-карбоксилат
Указанное в заголовке соединение синтезировали из этил-(Z)-3-(2-хлор-6-фторфенил)-5-(1-(диметиламино)-4,4,4-трифтор-3-оксобут-1-ен-2-ил)изоксазол-4-карбоксилата (0,5 ммоль) и (S)-1-гидразинилпропан-2-ола в виде желтого масла (31%; пТСХ, элюент: петролейный эфир/этилацетат 1:1).
Результат ЖХ/МС [M+H]+: 461,70;
1H ЯМР (CDCl3): δ 1,00 (3Н, т, СН3), 1,32 (3Н, д, СН3), 3,30 (1Н, с, ОН), 4,10 (2Н, к, СН2), 4,25 (1Н, дд, СН), 4,37 (2H, дд, CH2), 7,14 (1H, тд, CH-аром.), 7,33 (1H, д, CH-аром.), 7,43 (1H, м, CH-аром.), 8,02 (1H, с, СН-аром.).

Пример 14: этил-3-(2-хлор-6-фторфенил)-5-[1-(2-гидроксибутил)-5-(трифторметил)-1Н-пиразол-4-ил]-1,2-оксазол-4-карбоксилат (рацемический)
Указанное в заголовке соединение синтезировали из этил-(Z)-3-(2-хлор-6-фторфенил)-5-(1-(диметиламино)-4,4,4-трифтор-3-оксобут-1-ен-2-ил)изоксазол-4-карбоксилата (0,23 ммоль) и 1-гидразино-2-бутанола в виде желтого масла (26%; пТСХ, элюент: CH2Cl2/MeOH 95:5 и снова пТСХ, элюент: CH2Cl2/MeOH 95:5).
Результат ЖХ/МС [M+H]+: 475,8;
1H ЯМР (CDCl3): δ 0,99 (3Н, т, СН3), 1,06 (3Н, т, СН3), 1,61 (2Н, квинт., СН2), 3,15 (1Н, д, ОН), 4,09 (2Н, к, СН2), 4,25 (1Н, дд, СН2), 4,40 (1Н, дд, СН2), 7,13 (1Н, тд, СН-аром.), 7,32 (1Н, д, СН-аром.), 7,42 (1Н, м, CH-аром.), 8,01 (1H, с, CH-аром.).

Пример 15: этил-3-(2-хлор-6-фторфенил)-5-[1-(3,3,3-трифтор-2-гидроксипропил)-5-(трифторметил)-1Н-пиразол-4-ил]-1,2-оксазол-4-карбоксилат (рацемический)
Указанное в заголовке соединение синтезировали из этил-(Z)-3-(2-хлор-6-фторфенил)-5-(1-(диметиламино)-4,4,4-трифтор-3-оксобут-1-ен-2-ил)изоксазол-4-карбоксилата (0,52 ммоль) и 1,1,1-трифтор-3-гидразинилпропан-2-ола (рацемический) в виде бесцветного масла (35%; пТСХ, элюент: CH2Cl2/MeOH 95:5 и пТСХ, элюент петролейный эфир/этилацетат 3:2; смесь структурных изомеров при пиразоле 95:5 (ср. Схему выше).
Результат ЖХ/МС [M+H]+: 515,8;
1H ЯМР (CDCl3): δ 0,99 (3Н, т, СН3), 4,08 (3Н, м, СН2, СН), 4,62 (2Н, м, СН2), 7,13 (1Н, тд, СН-аром.), 7,33 (1Н, д, СН-аром.), 7,43 (1Н, м, СН-аром.), 8,05 (1Н, с, СН-аром.).
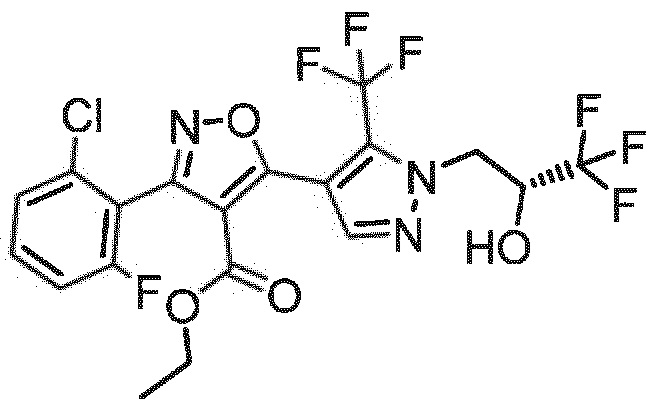
Пример 16: этил-3-(2-хлор-6-фторфенил)-5-{1-[(2R)-3,3,3-трифтор-2-гидроксипропил]-5-(трифторметил)-1H-пиразол-4-ил}-1,2-оксазол-4-карбоксилат
Указанное в заголовке соединение синтезировали из этил-(Z)-3-(2-хлор-6-фторфенил)-5-(1-(диметиламино)-4,4,4-трифтор-3-оксобут-1-ен-2-ил)изоксазол-4-карбоксилата (0,14 ммоль) и (R)-1,1,1-трифтор-3-гидразинилпропан-2-ола в виде бесцветного масла (15%; пТСХ, элюент: CH2Cl2/MeOH 95:5).
Результат ЖХ/МС [M+H]+: 516,2;
1H ЯМР (CDCl3): δ 0,99 (3Н, т, СН3), 3,96 (1Н, д, ОН), 4,09 (2Н, к, СН2), 4,62 (3Н, м, СН2, СН), 7,13 (1Н, тд, CH-аром.), 7,33 (1H, д, CH-аром.), 7,43 (1H, м, CH-аром.), 8,06 (1H, с, CH-аром.).
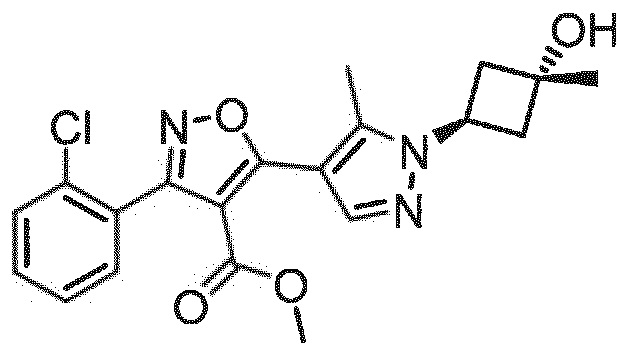 и
и 
Пример 17 и 18: метил-3-(2-хлорфенил)-5-(1-(3-гидрокси-3-метилциклобутил)-5-метил-1Н-пиразол-4-ил)изоксазол-4-карбоксилат (анти- и син-конфигурация)
Указанные в заголовке соединения синтезировали из метил-(Z)-3-(2-хлорфенил)-5-[1-(диметиламино)-3-оксобут-1-ен-2-ил]-1,2-оксазол-4-карбоксилата (0,60 ммоль) и 3-гидразинил-1-метилциклобутан-1-ола (син/анти-смесь) в виде оранжевых масел (пТСХ, элюент: CH2Cl2/MeOH 95:5);
Пример 17: анти-конфигурация в циклобутанольной системе, выход 21%;
Результат ЖХ/МС [M+H]+: 402,30;
1H ЯМР (CDCl3): δ 1,55 (3Н, с, СН3), 2,57 (3Н, с, СН3), 2,59 (2Н, м, СН2), 2,81 (2Н, м, СН2), 3,66 (3Н, с, О-СН3), 5,04 (1Н, м, СН), 7,35 (4Н, м, СН-аром.), 8,31 (1Н, с, СН-аром.).
Пример 18: син-конфигурация в циклобутанольной системе, выход 11%;
Результат ЖХ/МС [M+H]+: 402,3;
1H ЯМР (CDCl3): δ 1,47 (3Н, с, СН3), 2,57 (3Н, с, СН3), 2,82-2,70 (4Н, м, 2хСН2), 2,87 (1Н, уш., ОН), 3,65 (3Н, с, CH3), 4,54 (1H, квинт, CH), 7,53-7,33 (4H, м, 4xCH-аром.), 8,37 (1H, с, CH-аром.).

Пример 19: метил-3-(2-хлорфенил)-5-[1-(3-гидрокси-3-метилбутил)-5-метил-1Н-пиразол-4-ил]-1,2-оксазол-4-карбоксилат
Указанное в заголовке соединение синтезировали из метил-(Z)-3-(2-хлорфенил)-5-[1-(диметиламино)-3-оксобут-1-ен-2-ил]-1,2-оксазол-4-карбоксилата (0,86 ммоль) и 4-гидразинил-2-метилбутан-2-ола в виде желтого масла (31%; пТСХ, элюент: CH2Cl2/MeOH 95:5 и снова пТСХ, элюент: CH2Cl2/MeOH 95:5).
Результат ЖХ/МС [M+H]+: 404,0;
1H ЯМР (CDCl3): δ 1,30 (6Н, с, 2хСН3), 2,05 (2Н, с, СН2), 2,62 (3Н, с, СН3), 3,65 (3Н, с, СН3), 4,32 (2Н, м, СН2), 7,34 (4Н, м, СН-аром.), 8,30 (1Н, с, СН-аром.).

Пример 20: метил-3-(2-хлор-6-фторфенил)-5-[1-(3-гидрокси-3-метилбутил)-5-метил-1Н-пиразол-4-ил]-1,2-оксазол-4-карбоксилат
Указанное в заголовке соединение синтезировали из метил-(Z)-3-(2-хлор-6-фторфенил)-5-(1-(диметиламино)-3-оксобут-1-ен-2-ил)изоксазол-4-карбоксилата (0,79 ммоль) и 4-гидразинил-2-метилбутан-2-ола в виде желтого масла (29%; пТСХ, элюент: CH2Cl2/MeOH 98:2 и пТСХ, элюент: CH2Cl2/MeOH 95:5).
Результат ЖХ/МС [M+H]+: 422,00;
1H ЯМР (CDCl3): δ 1,31 (6Н, с, 2хСН3), 2,05 (2Н, т, СН2), 2,64 (3Н, с, СН3), 3,65 (3Н, с, СН3), 4,32 (2Н, м, СН2), 7,12 (1Н, тд, СН-аром.), 7,32 (1Н, д, СН-аром.), 7,41 (1Н, м, СН-аром.), 8,33 (1Н, с, СН-аром.).

Пример 21: метил-(R)-5-(1-(2-гидроксипропил)-5-(трифторметил)-1H-пиразол-4-ил)-3-(2-метоксипиридин-3-ил)изоксазол-4-карбоксилат
Указанное в заголовке соединение синтезировали из метил-(Z)-5-(1-(диметиламино)-4,4,4-трифтор-3-оксобут-1-ен-2-ил)-3-(2-метоксипиридин-3-ил)изоксазол-4-карбоксилата (0,55 ммоль) и (R)-1-гидразинилпропан-2-ола (30%; пТСХ, элюент: CH2Cl2/MeOH 95:5).
Результат ЖХ/МС [M+H]+: 426,8;
1H ЯМР (CDCl3): δ 1,31 (3Н, д, СН3), 3,66 (3Н, с, СН3), 3,93 (3Н, с, СН3), 4,31 (3Н, м, СН, СН2), 7,01 (1Н, дд, CH-аром.), 7,83 (1H, дд, CH-аром.), 8,01 (1H, с, CH-аром.), 8,30 (1H, дд, CH-аром.).

Пример 22: метил-(S)-3-(2-хлорфенил)-5-(1-(2-гидроксипропил)-5-(трифторметил)-1H-пиразол-4-ил)изоксазол-4-карбоксилат
Указанное в заголовке соединение синтезировали из метил-(Z)-3-(2-хлорфенил)-5-(1-(диметиламино)-4,4,4-трифтор-3-оксобут-1-ен-2-ил)изоксазола-4-карбоксилата (1,0 ммоль) и (S)-1-гидразинилпропан-2-ола (49%; пТСХ, элюент: CH2Cl2/MeOH 95:5).
Результат ЖХ/МС [M+H]+: 429,8;
1H ЯМР (CDCl3): δ 1,32 (3Н, д, СН3), 3,64 (3Н, с, ОСН3), 4,24 (1Н, дд, СН), 4,48-4,31 (2Н, м, СН2), 7,56-7,34 (4Н, м, 4xCH-аром.), 8,00 (1H, с, CH-аром.).
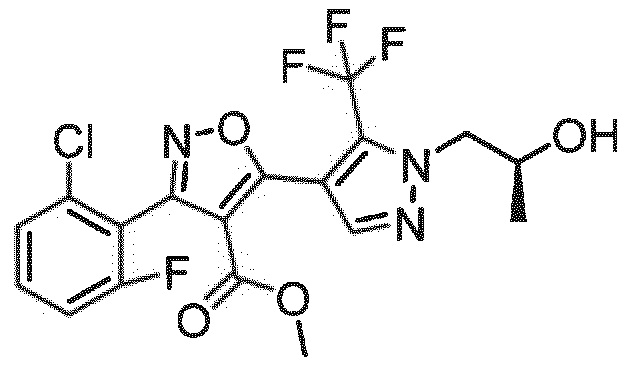
Пример 23: метил-(S)-3-(2-хлор-6-фторфенил)-5-(1-(2-гидроксипропил)-5-(трифторметил)-1H-пиразол-4-ил)изоксазол-4-карбоксилат
Указанное в заголовке соединение синтезировали из метил-(Z)-3-(2-хлор-6-фторфенил)-5-(1-(диметиламино)-4,4,4-трифтор-3-оксобут-1-ен-2-ил)изоксазол-4-карбоксилата (0,83 ммоль) и (S)-1-гидразинилпропан-2-ола (27%; пТСХ, элюент: CH2Cl2/MeOH 95:5 и пТСХ, элюент: петролейный эфир/этилацетат 3:2).
Результат ЖХ/МС [M+H]+: 448,2;
1H ЯМР (CDCl3): δ 1,32 (3Н, д, СН3), 3,64 (3Н, с, ОСН3), 4,25 (1Н, дд, ОСН2), 4,48-4,32 (2Н, м, СН2), 7,14 (1Н, тд, CH-аром.), 7,33 (1H, дт, CH-аром.), 7,48-7,38 (1H, м, CH-аром.), 7,99 (1H, с, CH-аром.).

Пример 24: метил-(S)-3-(2-хлорфенил)-5-(1-(2-гидроксипропил)-5-метил-1Н-пиразол-4-ил)изоксазол-4-карбоксилат
Указанное в заголовке соединение синтезировали из метил-(Z)-3-(2-хлорфенил)-5-[1-(диметиламино)-3-оксобут-1-ен-2-ил]-1,2-оксазол-4-карбоксилата (1,0 ммоль) и (S)-1-гидразинилпропан-2-ола (32%; пТСХ, элюент: CH2Cl2/MeOH 95:5).
Результат ЖХ/МС [M+H]+: 376,3;
1H ЯМР (CDCl3): δ 1,30 (3Н, д, СН3), 2,61 (3Н, с, СН3), 3,65 (3Н, с, ОСН3), 4,58-3,82 (3Н, м, СН и СН2), 7,55-7,33 (4Н, м, 4хСН-аром.), 8,38 (1Н, с, СН-аром.).

Пример 25: метил-3-(2-хлор-3-метоксифенил)-5-[1-(3-гидрокси-3-метилбутил)-5-метил-1Н-пиразол-4-ил]-1,2-оксазол-4-карбоксилат
Указанное в заголовке соединение синтезировали из метил-(Z)-3-(2-хлор-3-метоксифенил)-5-[1-(диметиламино)-3-оксобут-1-ен-2-ил]-1,2-оксазол-4-карбоксилата (1,1 ммоль) и 4-гидразинил-2-метилбутан-2-ола в виде оранжевого масла (33%; пТСХ, элюент: CH2Cl2/MeOH 95:5 и снова пТСХ, элюент: CH2Cl2/MeOH 95:5).
Результат ЖХ/МС [M+H]+: 434,0;
1H ЯМР (CDCl3): δ 1,30 (6Н, с, 2хСН3), 2,04 (2Н, м, СН2), 2,62 (3Н, с, СН3), 3,65 (3Н, с, СН3), 3,95 (4Н, с, ОН, СН3), 4,31 (2Н, м, СН2), 7,07 (2Н, м, СН-аром.), 7,33 (1Н, т, СН-аром.), 8,28 (1Н, с, СН-аром.).
 и
и 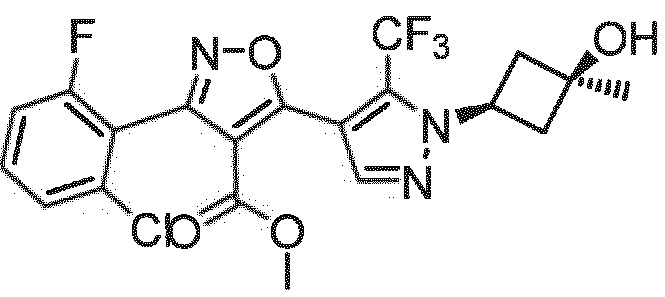
Примеры 26 и 27: метил-3-(2-хлор-6-фторфенил)-5-(1-(3-гидрокси-3-метилциклобутил)-5-(трифторметил)-1Н-пиразол-4-ил)изоксазол-4-карбоксилат (анти- и син-конфигурация)
Указанные в заголовке соединения синтезировали из метил-(Z)-3-(2-хлор-6-фторфенил)-5-[1-(диметиламино)-4,4,4-трифтор-3-оксобут-1-ен-2-ил]-1,2-оксазол-4-карбоксилата (0,24 ммоль) и 3-гидразинил-1-метилциклобутан-1-ола (син/анти-смесь) (пТСХ, элюент: CH2Cl2/MeOH 95:5).
Пример 26: анти-конфигурация в циклобутанольной системе, выход 18%;
Результат ЖХ/МС [M+H]+: 473,80;
1H ЯМР (CDCl3): δ 1,56 (3Н, с, СН3), 2,75-2,49 (2Н, м, СН2), 2,95-2,75 (2Н, м, СН2), 3,63 (3Н, с, ОСН3), 5,26 (1Н, квинт, СН), 7,13 (1Н, тд, СН-аром.), 7,33 (1Н, д, СН-аром.), 7,47-7,37 (1Н, м, СН-аром.), 7,94 (1Н, с, СН-СН аром.).
Пример 27: син-конфигурация в циклобутанольной системе; выход 18%;
Результат ЖХ/МС [M+H]+: 473,8;
1H ЯМР (CDCl3): δ 1,50 (3Н, с, СН3), 2,95-2,71 (4Н, м, 2хСН2), 3,63 (3Н, с, ОСН3), 4,71 (1Н, квинт, СН), 7,14 (1Н, тд, CH-аром.), 7,33 (1H, д, CH-аром.), 7,48-7,38 (1H, м, CH-аром.), 7,99 (1H, с, CH-аром.).

Пример 28: метил-3-(2-хлор-6-фторфенил)-5-(1-(3-гидроксициклобутил)-5-(трифторметил)-1Н-пиразол-4-ил)изоксазол-4-карбоксилат
Указанное в заголовке соединение синтезировали из метил-(Z)-3-(2-хлор-6-фторфенил)-5-[1-(диметиламино)-4,4,4-трифтор-3-оксобут-1-ен-2-ил]-1,2-оксазол-4-карбоксилата (0,24 ммоль) и 3-гидразинилциклобутан-1-ола (син/анти-смесь) (46% в виде смеси син- и анти-конфигурации в циклобутанольной системе; пТСХ, элюент: CH2Cl2/MeOH 95:5).
Результат ЖХ/МС [M+H]+: 459,8;
1H ЯМР (CDCl3): δ 2,86-2,69 (2Н, м, СН2), 3,10-2,93 (2Н, м, СН2), 3,63 (3Н, с, СН3), 4,26 (1Н, квинт, СН), 4,62 (1Н, квинт, СН), 7,13 (1Н, тд, СН-аром.), 7,33 (1Н, д, СН-аром.), 7,47-7,37 (1Н, м, СН-аром.), 7,99 (1Н, с, СН-аром.).

Пример 29: метил-3-(2-хлорфенил)-5-(1-(3-гидрокси-3-(метоксиметил)циклобутил)-5-(трифторметил)-1Н-пиразол-4-ил)изоксазол-4-карбоксилат (син-конфигурация)
Указанное в заголовке соединение синтезировали из метил-(Z)-3-(2-хлорфенил)-5-(1-(диметиламино)-4,4,4-трифтор-3-оксобут-1-ен-2-ил)изоксазола-4-карбоксилата (0,30 ммоль) и 3-гидразинил-1-(метоксиметил)циклобутан-1-ола (син/анти-смесь) с выходом 34%. Син- и анти-конфигурации в полученном продукте не разделялись на данной стадии, поэтому гидроксильную группу силилировали, используя трет-бутилдиметилсилилтрифлат, N, N-диизопропилэтиламин в CH2Cl2 (ср. общие методики силилирования, описанные ниже), после чего разделение изомеров с последующей пТСХ, элюент: петролейный эфир/этилацетат 4:1 и пТСХ, элюент: CH2Cl2/MeOH 95:5. Десилилирование было достигнуто с использованием HCl в MeOH (комнатная температура, 2 ч) с получением указанного в заголовке соединения с син-конфигурацией с выходом 50% из смеси изомеров вместе с 16% анти-изомера (рН доводили до приблизительно 8 путем добавления водн. NaOH (1 М) и смесь экстрагировали EtOAc. Органические слои промывали солевым раствором, высушивали над безводным MgSO4 и концентрировали при пониженном давлении. Остаток очищали с помощью препаративной ТСХ (элюент: петролейный эфир/этилацетат 1:5).
Результат ЖХ/МС [M+H]+: 486,20;
1H ЯМР (CDCl3): δ 2,09 (1Н, уш., ОН), 2,86 (4Н, м, СН2), 3,49 (5Н, с, СН2/СН3), 3,63 (3Н, с, О-СН3), 4,67 (1Н, м, СН), 7,44 (4Н, м, СН-аром.), 8,00 (1Н, с, СН-аром.).

Пример 30: 1-(4-(3-(2-хлор-6-фторфенил)-4-(5-метил-1,3,4-оксадиазол-2-ил)изоксазол-5-ил)-5-(трифторметил)-1H-пиразол-1-ил)-2-метилпропан-2-ол
Указанное в заголовке соединение синтезировали из (Z)-3-(3-(2-хлор-6-фторфенил)-4-(5-метил-1,3,4-оксадиазол-2-ил)изоксазол-5-ил)-4-(диметиламино)-1,1,1-трифторбут-3-ен-2-она (0,18 ммоль) и 1-гидразинил-2-метилпропан-2-ола в виде бледно-желтого масла (4%; пТСХ, элюент: петролейный эфир/этилацетат 4:1 и пТСХ, элюент: CH2Cl2/MeOH 95:5).
Результат ЖХ/МС [M+H]+: 485,70;
1H ЯМР (CDCl3): δ 1,27 (6Н, с, 2х СН3), 2,39 (3Н, с, СН3), 4,34 (2Н, с, СН2), 7,16 (1Н, тд, СН-аром.), 7,35 (1Н, дт, CH-аром.), 7,47 (1H, м, CH-аром.), 8,15 (1H, с, CH-аром.).

этил-3-(3-(бензилокси)-2-хлорфенил)-5-(1-(3-гидрокси-3-метилциклобутил)-5-(трифторметил)-1Н-пиразол-4-ил)изоксазол-4-карбоксилат
Указанное в заголовке соединение синтезировали (син/анти-смесь) из этил-(Z)-3-(3-(бензилокси)-2-хлорфенил)-5-(1-(диметиламино)-4,4,4-трифтор-3-оксобут-1-ен-2-ил)изоксазол-4-карбоксилата (3,3 ммоль) и 3-гидразинил-1-метилциклобутан-1-ола (син/анти-смесь) в виде желтого масла (34%; пТСХ, элюент: петролейный эфир/этилацетат 4:1 и пТСХ, элюент: петролейный эфир/этилацетат 1:1).
Результат ЖХ/МС [M+H]+: 576,3;
1H ЯМР (CDCl3): δ 1,27 (3Н, т, СН3), 2,04 (3Н, с, СН3), 2,77 (4Н, м, 2хСН2), 4,08 (1Н, м, СН), 4,13 (2Н, к, CH2), 5,23 (2H, с, CH2), 7,10 (2H, д, CH-аром.), 7,35 (4H, м, CH-аром.), 7,47 (2H, д, CH-аром.), 7,98 (1Н, с, СН-аром.).

этил-3-(3-(бензилокси)-2-хлорфенил)-5-(1-(3-гидрокси-3-метилбутил)-5-(трифторметил)-1Н-пиразол-4-ил)изоксазол-4-карбоксилат
Указанное в заголовке соединение синтезировали из этил-(Z)-3-(3-(бензилокси)-2-хлорфенил)-5-(1-(диметиламино)-4,4,4-трифтор-3-оксобут-1-ен-2-ил)изоксазол-4-карбоксилата (6,6 ммоль) и 4-гидразинил-2-метилбутан-2-ола в виде желтого масла (84%; колоночная хроматография на силикагеле, элюент: CH2Cl2/MeOH 98:2).
Результат ЖХ/МС [M+H]+: 578,3;
1H ЯМР (CDCl3): δ 0,99 (3Н, т, СН3), 1,33 (6Н, с, 2хСН3), 2,14 (2Н, м, СН2), 3,38 (2Н, с, СН2), 3,56 (1Н, м, СН), 3,65 (1Н, м, СН), 4,07 (2Н, к, СН2), 7,07 (2Н, дд, СН-аром.), 7,40 (6Н, м, СН-аром.), 7,98 (1Н, с, СН-аром.).
Синтез дейтерированных спиртов

Соответствующие производные уксусной кислоты синтезировали в соответствии с общей методикой, описанной выше, для образования пиразола с использованием 2-гидразинилуксусной кислоты. Реакционные смеси распределяли только между CH2Cl2 и насыщенным водн. NH4Cl, органический слой высушивали над MgSO4 и концентрировали при пониженном давлении, и продукты использовали в виде неочищенного материала для следующих стадий.
- 2-(4-(3-(2-хлор-6-фторфенил)-4-(тиазол-2-ил)изоксазол-5-ил)-5-(трифторметил)-1H-пиразол-1-ил)уксусная кислота из (Z)-3-(3-(2-хлор-6-фторфенил)-4-(тиазол-2-ил)изоксазол-5-ил)-4-(диметиламино)-1,1,1-трифторбут-3-ен-2-она;
Результат ЖХ/МС [M+H]+: 472,7;
1H ЯМР (CDCl3): δ 3,15 (1H, с, COOH), 5,15 (2H, с, CH2), 7,16 (1H, т, CH-аром.), 7,24 (1H, д, CH-аром.), 7,35 (1H, д, CH-аром.), 7,48 (1H, м, CH-аром.), 7,75-7,48 (1H, д, CH-аром.), 8,13 (1H, с, CH-аром.).
- 2-{4-[3-(2-хлор-6-фторфенил)-4-(этоксикарбонил)-1,2-оксазол-5-ил]-5-(трифторметил)-1H-пиразол-1-ил}уксусная кислота из этил-(Z)-3-(2-хлор-6-фторфенил)-5-(1-(диметиламино)-4,4,4-трифтор-3-оксобут-1-ен-2-ил)изоксазол-4-карбоксилата;
Результат ЖХ/МС [M+H]+: 461,7;
1H ЯМР (CDCl3): δ 0,98 (3Н, т, СН3), 4,06 (2Н, к, СН2), 4,97 (2Н, с, СН2), 7,09 (1Н, т, СН-аром.), 7,29 (1H, д, CH-аром.), 7,39 (1H, м, CH-аром.), 8,03 (1H, с, CH-аром.).
- 2-{4-[3-(2-хлор-6-фторфенил)-4-(метоксикарбонил)-1,2-оксазол-5-ил]-5-(трифторметил)-1H-пиразол-1-ил}уксусная кислота из метил-(Z)-3-(2-хлор-6-фторфенил)-5-(1-(диметиламино)-4,4,4-трифтор-3-оксобут-1-ен-2-ил)изоксазол-4-карбоксилата;
Неочищенное производное уксусной кислоты (1,0 ммоль), N, O-диметилгидроксиламина гидрохлорид (1,0 экв.), 1-гидроксибензотриазол (1,0 экв.) и 1-(3-диметиламинопропил)-3-этилкарбодиимида гидрохлорид (EDCI; 1,2 экв.) растворяли в сухом ДМФ (Sure/Seal, 4 мл/ммоль). Добавляли N-метилморфолин (10 экв.) и реакционную смесь перемешивали при комнатной температуре в течение 18 ч.
ДМФ удаляли при пониженном давлении и добавляли водн. 5% раствор лимонной кислоты. Смесь экстрагировали CH2Cl2, объединенные органические фазы промывали водой, и высушивали над MgSO4, и концентрировали при пониженном давлении:
- 2-{4-[3-(2-хлор-6-фторфенил)-4-(1,3-тиазол-2-ил)-1,2-оксазол-5-ил]-5-(трифторметил)-1H-пиразол-1-ил}-N-метокси-N-метилацетамид; препаративная ТСХ на силикагеле (элюент: петролейный эфир/этилацетат 7:3), оранжевое масло, выход 14% за две стадии;
Результат ЖХ/МС [M+H]+: 515,8;
1H ЯМР (CDCl3): δ 3,26 (3Н, с, СН3), 3,81 (3Н, с, СН3), 5,34 (2Н, с, СН2), 7,14 (1Н, м, СН-аром.), 7,23 (1Н, дд, СН-аром.), 7,34 (1Н, м, СН-аром.), 7,47 (1Н, м, СН-аром.), 7,73 (1Н, д, СН-аром.), 8,20 (1Н, с, СН-аром.).
- этил-3-(2-хлор-6-фторфенил)-5-(1-{[метокси(метил)карбамоил]метил}-5-(трифторметил)-1Н-пиразол-4-ил)-1,2-оксазол-4-карбоксилат; препаративная ТСХ на силикагеле (элюент: петролейный эфир/этилацетат 7:3), оранжевое масло, выход 38% за две стадии;
Результат ЖХ/МС [M+H]+: 504,7;
1H ЯМР (CDCl3): δ 1,04 (3Н, т, СН3), 3,24 (3Н, с, СН3), 3,79 (3Н, с, СН3), 4,10 (2Н, к, СН2), 5,33 (2Н, с, СН2), 7,12 (1Н, т, СН-аром.), 7,31 (1Н, д, СН-аром.), 7,41 (1Н, м, СН-аром.), 8,13 (1Н, с, СН-аром.).
- метил-3-(2-хлор-6-фторфенил)-5-(1-{[метокси(метил)карбамоил]метил}-5-(трифторметил)-1Н-пиразол-4-ил)-1,2-оксазол-4-карбоксилат; неочищенный материал использовали как таковой для следующей стадии
Соответствующий амид Вайнреба растворяли в ТГФ (Sure/Seal; 4 мл/ммоль) при 0°C. Медленно добавляли метилмагнийбромид (5,0 экв.; 3,2 М в 2-метил-ТГФ) и смесь перемешивали при 0°С в течение 1 ч и затем при комнатной температуре в течение дополнительных 5 ч. Смесь гасили водой и распределяли между CH2Cl2 и водой. Объединенные органические слои высушивали над MgSO4, отфильтровывали и концентрировали при пониженном давлении с получением неочищенного метилкетона:
- 1-{4-[3-(2-хлор-6-фторфенил)-4-(1,3-тиазол-2-ил)-1,2-оксазол-5-ил]-5-(трифторметил)-1H-пиразол-1-ил}пропан-2-он, выход 70% (неочищенный);
Результат ЖХ/МС [M+H]+: 470,8.
- этил-3-(2-хлор-6-фторфенил)-5-[1-(2-оксопропил)-5-(трифторметил)-1Н-пиразол-4-ил]-1,2-оксазол-4-карбоксилат; препаративная ТСХ на силикагеле (элюент: петролейный эфир/этилацетат 3:2 и пТСХ, элюент: CH2Cl2/MeOH 95:5), выход 12%;
Результат ЖХ/МС [M+H]+: 459,70;
1H ЯМР (CDCl3): δ 1,03 (3Н, т, СН3), 3,23 (3Н, с, СН3), 4,12 (2Н, к, СН2), 5,18 (2Н, с, СН2), 7,13 (1Н, т, CH-аром.), 7,33 (1H, д, CH-аром.), 7,43 (1H, м, CH-аром.), 8,12 (1H, с, CH-аром.).
- метил 3-(2-хлор-6-фторфенил)-5-(1-(2-оксопропил)-5-(трифторметил)-1Н-пиразол-4-ил)-1,2-оксазол-4-карбоксилат; препаративная ТСХ на силикагеле (элюент: петролейный эфир/этилацетат 3:2), выход 8% за три стадии;
Результат ЖХ/МС [M+H]+: 445,7;
1H ЯМР (CDCl3): δ 1,23 (3Н, с, СН3), 3,65 (3Н, с, СН3), 5,18 (2Н, с, СН2), 7,14 (1Н, тд, СН-аром.), 7,33 (1Н, д, СН-аром.), 7,43 (1Н, м, СН-аром.), 8,07 (1Н, с, СН-аром.).
Соответствующий метилкетон растворяли в ТГФ (10 мл/ммоль) и охлаждали до 0°С. Добавляли NaBD4 (1,1 экв.) и смесь перемешивали при 0°C в течение 1 ч.
Смесь гасили водой и распределяли между CH2Cl2 и водой. Объединенные органические слои высушивали над MgSO4, отфильтровывали и концентрировали при пониженном давлении. Альфа-дейтерированные спирты очищали с помощью препаративной ТСХ на силикагеле (элюент: CH2Cl2/MeOH 95:5):

Пример 31: 1-{4-[3-(2-хлор-6-фторфенил)-4-(1,3-тиазол-2-ил)-1,2-оксазол-5-ил]-5-(трифторметил)-1Н-пиразол-1-ил}(2-2Н)пропан-2-ол (рацемический) выделяли с выходом 28%.
Результат ЖХ/МС [M+H]+: 473,8;
1H ЯМР (CDCl3): δ 1,31 (3Н, с, СН3), 4,25 (1Н, с, СН), 4,38 (1Н, д, СН), 7,17 (1Н, т, СН-аром.), 7,22 (1Н, д, CH-аром.), 7,36 (1H, д, CH-аром.), 7,54-7,44 (1H, м, CH-аром.), 7,71 (1H, д, CH-аром.), 8,09 (1H, с, CH-аром.).
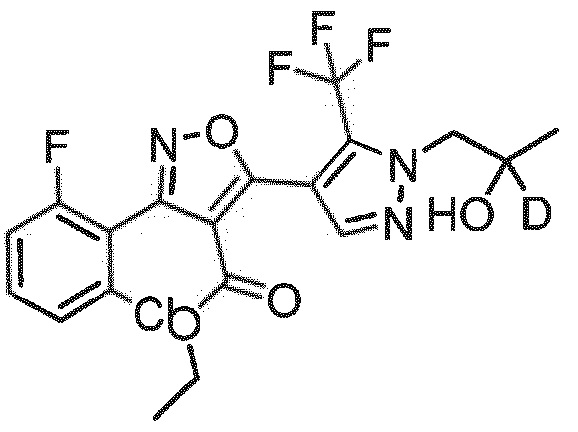
Пример 32: этил-3-(2-хлор-6-фторфенил)-5-{1-[2-гидрокси(2-2Н)пропил]-5-(трифторметил)-1Н-пиразол-4-ил}-1,2-оксазол-4-карбоксилат (рацемический) выделяли в виде бледно-желтого масла с выходом 10%.
Результат ЖХ/МС [M+H]+: 462,7;
1H ЯМР (CDCl3): δ 0,99 (3Н, т, СН3), 1,31 (3Н, с, СН3), 3,25 (1Н, с, ОН), 4,09 (2Н, к, СН2), 4,30 (2Н, дд, СН2), 7,13 (1H, тд, CH-аром.), 7,33 (1H, д, CH-аром.), 7,43 (1H, м, CH-аром.), 8,01 (1H, с, CH-аром.).

Пример 33: метил-3-(2-хлор-6-фторфенил)-5-{1-[2-гидрокси(2-2Н)пропил]-5-(трифторметил)-1Н-пиразол-4-ил}-1,2-оксазол-4-карбоксилат (рацемический) выделяли с выходом 24%
Результат ЖХ/МС [M+H]+: 448,80;
1H ЯМР (CDCl3): δ 1,31 (3Н, с, СН3), 3,64 (3Н, с, ОСН3), 4,31 (2Н, к, СН2), 7,14 (1Н, тд, СН-аром.), 7,33 (1Н, дт, CH-аром.), 7,48-7,38 (1H, м, CH-аром.), 7,99 (1H, с, CH-аром.).
Синтез 4-ацилизоксазолов

Сложные эфиры Примера 8 или Примера 12 (0,25 ммоль) растворяли в 2 мл этанола и добавляли 2 мл водн. NaOH (2,0 М). Смесь нагревали до 60°С в течение 1 ч и затем подкисляли добавлением водн. HCl (1,0 М). Полученную суспензию распределяли между CH2Cl2 и водой, объединенные органические слои высушивали над MgSO4 и растворитель удаляли при пониженном давлении с получением неочищенных карбоновых кислот:
- 3-(2-хлор-6-фторфенил)-5-(1-(2-гидрокси-2-метилпропил)-5-(трифторметил)-1Н-пиразол-4-ил)-1,2-оксазол-4-карбоновая кислота в виде белого с желтоватым или сероватым оттенком твердого вещества, выход 94%;
Результат ЖХ/МС [M+H]+: 447,8;
1H ЯМР (CDCl3): δ 1,22 (6H, с, 2xCH3), 4,30 (2H, с, CH2), 7,12 (1H, тд, CH-аром.), 7,32 (1H, дт, CH-аром.), 7,47-7,37 (1Н, м, СН-аром.), 8,00 (1Н, с, СН-аром.).
- 3-(2-хлор-6-фторфенил)-5-{1-[(2R)-2-гидроксипропил]-5-(трифторметил)-1Н-пиразол-4-ил}-1,2-оксазол-4-карбоновая кислота в виде белого с желтоватым или сероватым оттенком твердого вещества, выход 75%;
Результат ЖХ/МС [M+H]+: 433,9;
1H ЯМР (CDCl3): δ 1,30 (3Н, д, СН3), 4,24 (1Н, дд, СН), 4,47-4,28 (2Н, м, СН2), 7,12 (1Н, тд, СН-аром.), 7,32 (1H, дт, CH-аром.), 7,47-7,36 (1H, м, CH-аром.), 7,98 (1H, с, CH-аром.).
Неочищенное производное уксусной кислоты (1,0 ммоль), N, O-диметилгидроксиламина гидрохлорид (1,2 экв.), 1-гидроксибензотриазол (1,1 экв.) и 1-(3-диметиламинопропил)-3-этилкарбодиимида гидрохлорид (EDCI; 1,2 экв.) растворяли в сухом ДМФ (Sure/Seal, 4 мл/ммоль). Добавляли N-метилморфолин (5 экв.) и реакционную смесь перемешивали при комнатной температуре в течение 18 ч.
Смесь выливали в ледяную воду и экстрагировали CH2Cl2. Объединенные органические фазы промывали водой, и высушивали над MgSO4, и концентрировали при пониженном давлении:
- 3-(2-хлор-6-фторфенил)-5-(1-(2-гидрокси-2-метилпропил)-5-(трифторметил)-1Н-пиразол-4-ил)-N-метокси-N-метил-1,2-оксазол-4-карбоксамид; пТСХ (элюент: CH2Cl2/MeOH 95:5) в виде бледно-желтого твердого вещества, выход 68%;
Результат ЖХ/МС [M+H]+: 491,3;
1H ЯМР (CDCl3): δ 1,23 (6Н, с, 2xCH3), 3,11 (3Н, с, NCH3), 3,38 (3Н, с, ОСН3), 4,13 (1Н, с, ОН), 4,29 (2Н, с, СН2), 7,12 (1H, тд, CH-аром.), 7,32 (1H, дт, CH-аром.), 7,45-7,35 (1H, м, CH-аром.), 7,99 (1H, с, CH-аром.).
- 3-(2-хлор-6-фторфенил)-5-{1-[(2R)-2-гидроксипропил]-5-(трифторметил)-1Н-пиразол-4-ил}-N-метокси-N-метил-1,2-оксазол-4-карбоксамид, неочищенный материал в виде оранжевого масла, выход 95%;
Результат ЖХ/МС [M+H]+: 476,8;
Соответствующий амид Вайнреба растворяли в ТГФ (Sure/Seal; 5 мл/ммоль) при 0°C. Медленно добавляли метилмагнийбромид (5,0 экв.; 3,2 М в 2-метил-ТГФ) и смесь перемешивали при 0°С в течение 1,5 ч. Если ЖХМС показала неполное превращение, смесь перемешивали при комнатной температуре в течение дополнительных 5 ч. Если необходимо, дополнительное количество MeMgBr (3 экв.) снова добавляли при 0°C и смесь выдерживали при комнатной температуре в течение еще 18 ч.
Смесь гасили водой и распределяли между CH2Cl2 и водой. Объединенные органические слои высушивали над MgSO4, отфильтровывали и концентрировали при пониженном давлении.

Пример 34: 1-(3-(2-хлор-6-фторфенил)-5-(1-(2-гидрокси-2-метилпропил)-5-(трифторметил)-1H-пиразол-4-ил)-1,2-оксазол-4-ил)этанон
Указанное в заголовке соединение выделяли с помощью преп. ТСХ на силикагеле (элюент: CH2Cl2/MeOH 95:5) в виде темно-желтого масла с выходом 8%.
Результат ЖХ/МС [M+H]+: 490,7;
1H ЯМР (CDCl3): δ 1,25 (6Н, с, СН3), 2,06 (3Н, с, СН3), 4,12 (1Н, с, ОН), 4,32 (2Н, с, СН2), 7,18 (1Н, тд, СН-аром.), 7,37 (1H, д, CH-аром.), 7,47 (1H, м, CH-аром.), 7,99 (1H, с, CH-аром.).

Пример 35: 1-[3-(2-хлор-6-фторфенил)-5-{1-[(2R)-2-гидроксипропил]-5-(трифторметил)-1H-пиразол-4-ил}-1,2-оксазол-4-ил]этан-1-он
Указанное в заголовке соединение выделяли с помощью преп. ТСХ на силикагеле (элюент: петролейный эфир/этилацетат 1:1) в виде желтого масла с выходом 10%.
Результат ЖХ/МС [M+H]+: 431,8;
1H ЯМР (CDCl3): δ 1,32 (3Н, д, СН3), 2,06 (3Н, с, СН3), 3,22 (1Н, с, СН), 4,26 (1Н, дд, СН2), 4,37 (3Н, дд, ОН, CH2), 7,18 (1H, тд, CH-аром.), 7,37 (1H, д, CH-аром.), 7,47 (1H, м, CH-аром.), 7,98 (1H, с, CH-аром.).
Примеры 36, 37 и 38:
Приготовление реактива Гриньяра. К суспензии магния (1,25 экв.) в Et2O (5 мл) добавляли (бромметил)циклобутан или циклопропилметилбромид (10 ммоль). После завершения реакции Гриньяра раствор отделяли от остального магния и далее использовали как таковой (4 мл соответствующего реагента Гриньяра в Et2O).
3-(2-хлор-6-фторфенил)-5-(1-(2-гидрокси-2-метилпропил)-5-(трифторметил)-1Н-пиразол-4-ил)-N-метокси-N-метилизоксазол-4-карбоксамид (0,25 ммоль) растворяли в ТГФ и реакционную смесь охлаждали до 0°С. Раствор Гриньяра (4 мл, как описано выше) добавляли по каплям при 0°С более 5 ч. После добавления смесь перемешивали в течение 1 ч при 0°C (в случае циклобутан-Гриньяра) или в течение 4 ч при медленном нагревании до комнатной температуры (в случае циклопропилметил-Гриньяра). Реакцию гасили добавлением воды и водного 1 М раствора HCl и экстрагировали CH2Cl2. Органические слои объединяли, высушивали над MgSO4, отфильтровывали и концентрировали при пониженном давлении. Остаток очищали с помощью препаративной ТСХ на силикагеле (элюент: CH2Cl2/MeOH 98:2).

Пример 36: 1-[3-(2-хлор-6-фторфенил)-5-[1-(2-гидрокси-2-метилпропил)-5-(трифторметил)-1H-пиразол-4-ил]-1,2-оксазол-4-ил]-2-циклобутилэтан-1-он
Указанное в заголовке соединение получали в виде бесцветного масла (выход 33%).
Результат ЖХ/МС [M+H]+: 500,3;
1H ЯМР (CDCl3): δ 1,25 (6Н, с, 2хСН3), 1,42 (2Н, м, СН2), 1,80 (2Н, м, СН2), 1,98 (2Н, м, СН2), 2,39 (2Н, д, СН2), 2,58 (1Н, м, СН), 4,13 (1Н, с, ОН), 4,32 (2Н, с, СН2), 7,17 (1Н, тд, СН-аром.), 7,36 (1Н, дт, СН-аром.), 7,47 (1Н, м, СН-аром.), 7,97 (1Н, с, СН-аром.).

Пример 37: 1-[3-(2-хлор-6-фторфенил)-5-[1-(2-гидрокси-2-метилпропил)-5-(трифторметил)-1H-пиразол-4-ил]-1,2-оксазол-4-ил]пент-4-ен-1-он
Наблюдалась перегруппировка циклопропилметильного фрагмента с образованием бутенильного заместителя. Полученный неочищенный продукт дополнительно очищали с помощью препаративной ВЭЖХ/МС с получением указанного в заголовке соединения в виде бесцветного масла (выход 9%).
Результат ЖХ/МС [M-H2O+H]+: 468,3;
1H ЯМР (CDCl3): δ 1,25 (6H, с, 2xCH3), 2,89-2,17 (2H, м, CH2), 2,42-2,33 (2H, м, CH2), 4,11 (1H, с, OH), 4,32 (2H, с, СН2), 4,91-4,77 (2Н, м, СН2), 5,70-5,52 (1Н, м, СН), 7,18 (1Н, тд, СН-аром.), 7,37 (1Н, д, СН-аром.), 7,54-7,42 (1Н, м, СН-аром.), 7,99 (1Н, с, СН-аром.).

Пример 38: 2-[3-(2-хлор-6-фторфенил)-5-[1-(2-гидрокси-2-метилпропил)-5-(трифторметил)-1Н-пиразол-4-ил]-1,2-оксазол-4-ил]-1-циклопропилгекс-5-ен-2-ол (рацемический)
Если добавление циклопропилметил-Гриньяра проводят при комнатной температуре и перемешивание смеси продолжают при данной температуре в течение 3 ч, наблюдали второе добавление реактива Гриньяра к амиду Вайнреба, который не перегруппировался таким же образом, как первая циклопропилметильная группа (ср. Пример 37). Очистку соединения осуществляли с использованием препаративной ВЭЖХ/МС с получением указанного в заголовке соединения в виде светло-желтого масла (выход 14%).
Результат ЖХ/МС [M+H]+: 542,2;
1H ЯМР (CDCl3): δ 1,09-0,91 (1Н, м, СН-диастереотопный), 1,24-1,09 (1Н, м, СН-диастереотопный), 1,26 (6Н, с, 2xCH3), 1,45-1,30 (1Н, м, СН-диастереотопный), 1,71-1,58 (1Н, м, СН-диастереотопный), 1,93-1,80 (2Н, м, СН2), 3,11-2,99 (1Н, м, СН), 4,11 (1Н, с, СН), 4,31 (2H, с, CH2), 4,68 (1H, д, CH), 4,90-4,86 (1H, м, CH), 4,96-4,90 (1H, м, CH), 5,01 (1H, дд, CH), 5,76-5,44 (2H, м, 2xCH), 7,18 (1H, тд, CH-аром.), 7,37 (1H, дт, CH-аром.), 7,54-7,42 (1H, м, CH-аром.), 7,97 (1H, с, СН-аром.).
Примеры 39 и 40:
К раствору или 1-[3-(2-хлор-6-фторфенил)-5-[1-(2-гидрокси-2-метилпропил)-5-(трифторметил)-1Н-пиразол-4-ил]-1,2-оксазол-4-ил]этан-1-она, или 1-[3-(2-хлор-6-фторфенил)-5-{1-[(2R)-2-гидроксипропил]-5-(трифторметил)-1Н-пиразол-4-ил}-1,2-оксазол-4-ил]этан-1-она (0,3 ммоль) в ацетонитриле (1 мл) добавляли NBS (1,02 экв.) и п-толуолсульфоновую кислоту (1,0 экв.) и смесь перемешивали при 50°С в течение 18 ч. Если превращение не было завершено, добавляли дополнительное количество NBS (1,02 экв.) и п-толуолсульфоновой кислоты (1,0 экв.) и перемешивание продолжали при 50°C в течение 5 ч. Растворитель испаряли при пониженном давлении и добавляли насыщенный водн. NaHCO3. Смесь экстрагировали CH2Cl2, объединенные органические слои высушивали над MgSO4, отфильтровывали и концентрировали при пониженном давлении. Неочищенные производные бромацетила получали в виде коричневатого масла с выходом приблизительно 95%.
- 2-бром-1-[3-(2-хлор-6-фторфенил)-5-[1-(2-гидрокси-2-метилпропил)-5-(трифторметил)-1Н-пиразол-4-ил]-1,2-оксазол-4-ил]этан-1-он
Результат ЖХ/МС [M+H]+: 523,6.
- 2-бром-1-[3-(2-хлор-6-фторфенил)-5-{1-[(2R)-2-гидроксипропил]-5-(трифторметил)-1Н-пиразол-4-ил}-1,2-оксазол-4-ил] этан-1-он
Результат ЖХ/МС [M+H]+: 509,6.
Неочищенные бромацетильные производные растворяли в метаноле (2 мл) и добавляли BF3⃰Et2O (1,1 экв.) и Ag2CO3 (1,1 экв.). Смесь перемешивали при 50°C в течение 18 ч, после чего ее распределяли между CH2Cl2 и насыщенным водн. NH4Cl. Объединенные органические слои высушивали над сульфатом натрия, отфильтровывали и концентрировали при пониженном давлении. Остаток очищали с помощью преп. ТСХ (элюент: петролейный эфир/этилацетат 2:1).

Пример 39: 1-[3-(2-хлор-6-фторфенил)-5-[1-(2-гидрокси-2-метилпропил)-5-(трифторметил)-1H-пиразол-4-ил]-1,2-оксазол-4-ил]-2-метоксиэтан-1-он
Указанное в заголовке соединение получали в виде желтоватого масла (10%).
Результат ЖХ/МС [M+H]+: 475,8;
1H ЯМР (CDCl3): δ 1,52 (6Н, с, 2хСН3), 3,15 (3Н, с, СН3), 3,89 (2Н, с, СН2), 4,10 (1Н, с, ОН), 4,32 (2Н, с, СН2), 7,19 (1Н, тд, СН-аром.), 7,38 (1Н, дт, СН-аром.), 7,48 (1Н, м, СН-аром.), 8,02 (1Н, с, СН-аром.).

Пример 40: 1-[3-(2-хлор-6-фторфенил)-5-{1-[(2R)-2-гидроксипропил]-5-(трифторметил)-1H-пиразол-4-ил}-1,2-оксазол-4-ил]-2-метоксиэтан-1-он
Указанное в заголовке соединение получали в виде коричневатого масла (12%).
Результат ЖХ/МС [M+H]+: 461,7;
1H ЯМР (CDCl3): δ 1,32 (3Н, д, СН3), 3,15 (3Н, с, СН3), 1,80 (2Н, м, СН2), 4,25 (1Н, дд, СН2), 4,37 (2Н, дд, ОН, CH2), 7,18 (1H, тд, CH-аром.), 7,37 (1H, дт, CH-аром.), 7,47 (1H, м, CH-аром.), 7,99 (1H, с, CH-аром.).
Синтез изоксазол-4-карбоксамидов

Или 3-(2-хлор-6-фторфенил)-5-(1-(2-гидрокси-2-метилпропил)-5-(трифторметил)-1Н-пиразол-4-ил)изоксазол-4-карбоновую кислоту, или 3-(2-хлор-6-фторфенил)-5-{1-[(2R)-2-гидроксипропил]-5-(трифторметил)-1Н-пиразол-4-ил}-1,2-оксазол-4-карбоновую кислоту (0,15 ммоль), соответствующий амин (1,8 экв.), 1-гидроксибензотриазол (1,5 экв.) и 1-(3-диметиламинопропил)-3-этилкарбодиимида гидрохлорид (EDCI; 1,7 экв.) растворяли в 1 мл сухого ДМФ. Добавляли N-метилморфолин (10 экв.) и смесь перемешивали при комнатной температуре в течение 18 ч. Смесь распределяли между насыщенным водн. раствором NH4Cl и CH2Cl2, объединенные органические слои промывали водой и солевым раствором и высушивали над MgSO4, отфильтровывали и концентрировали при пониженном давлении. Очистка продукта была достигнута с помощью преп. ТСХ на силикагеле.

Пример 41: 3-(2-хлор-6-фторфенил)-N-циклопентил-5-(1-(2-гидрокси-2-метилпропил)-5-(трифторметил)-1H-пиразол-4-ил)изоксазол-4-карбоксамид
Указанное в заголовке соединение синтезировали из 3-(2-хлор-6-фторфенил)-5-(1-(2-гидрокси-2-метилпропил)-5-(трифторметил)-1Н-пиразол-4-ил)изоксазол-4-карбоновой кислоты и циклопентиламина в виде желтоватого твердого вещества с выходом 42% (пТСХ, элюент: петролейный эфир/этилацетат 1:1).
Результат ЖХ/МС [M+H]+: 514,8;
1H ЯМР (CDCl3): δ 1,13 (2Н, м, СН2), 1,25 (6Н, с, 2хСН3), 1,37 (2Н, м, СН2), 1,50 (2Н, м, СН2), 1,82 (2Н, м, СН2), 4,18 (2Н, м, СН2), 4,30 (2Н, с, СН2), 5,24 (1Н, с, ОН), 7,21 (1Н, тд, СН-аром.), 7,40 (1Н, дт, СН-аром.), 7,51 (1Н, м, СН-аром.), 8,11 (1Н, с, СН-аром.).

Пример 42: 3-(2-хлор-6-фторфенил)-N-циклопропил-5-(1-(2-гидрокси-2-метилпропил)-5-(трифторметил)-1H-пиразол-4-ил)изоксазол-4-карбоксамид
Указанное в заголовке соединение синтезировали из 3-(2-хлор-6-фторфенил)-5-(1-(2-гидрокси-2-метилпропил)-5-(трифторметил)-1Н-пиразол-4-ил)изоксазол-4-карбоновой кислоты и циклопропиламина в виде зеленоватого масла с выходом 23% (пТСХ, элюент: петролейный эфир/этилацетат 1:2).
Результат ЖХ/МС [M+H]+: 486,9;
1H ЯМР (CDCl3): δ 0,22 (2Н, м, СН2), 0,69 (2Н, м, СН2), 1,24 (6Н, с, 2хСН3), 2,64 (1Н, м, СН), 4,13 (1Н, с, СН), 4,30 (2Н, с, СН2), 5,42 (1Н, с, ОН), 7,19 (1Н, тд, СН-аром.), 7,38 (1Н, д, СН-аром.), 7,49 (1Н, м, CH-аром.), 8,10 (1H, с, CH-аром.).

Пример 43: 3-(2-хлор-6-фторфенил)-N-циклобутил-5-(1-(2-гидрокси-2-метилпропил)-5-(трифторметил)-1H-пиразол-4-ил)изоксазол-4-карбоксамид
Указанное в заголовке соединение синтезировали из 3-(2-хлор-6-фторфенил)-5-(1-(2-гидрокси-2-метилпропил)-5-(трифторметил)-1Н-пиразол-4-ил)изоксазол-4-карбоновой кислоты и циклобутиламина в виде сероватого твердого вещества с выходом 13% (пТСХ, элюент: петролейный эфир/этилацетат 1:2).
Результат ЖХ/МС [M+H]+: 500,9;
1H ЯМР (CDCl3): δ 1,24 (6H, с, 2xCH3), 1,58 (4H, м, 2xCH2), 2,23 (2H, м, CH2), 4,30 (2H, с, CH2), 4,32 (1H, м, СН), 5,41 (1Н, с, ОН), 7,21 (1Н, тд, СН-аром.), 7,41 (1Н, д, СН-аром.), 7,51 (1Н, м, СН-аром.), 8,08 (1Н, с, СН-аром.).

Пример 44: 3-(2-хлор-6-фторфенил)-N-циклопентил-5-{1-[(2R)-2-гидроксипропил]-5-(трифторметил)-1H-пиразол-4-ил}-1,2-оксазол-4-карбоксамид
Указанное в заголовке соединение синтезировали из 3-(2-хлор-6-фторфенил)-5-{1-[(2R)-2-гидроксипропил]-5-(трифторметил)-1H-пиразол-4-ил}-1,2-оксазол-4-карбоновой кислоты и циклопентиламина в виде оранжевого масла с выходом 12% (пТСХ, элюент: петролейный эфир/этилацетат 1:1).
Результат ЖХ/МС [M+H]+: 500,8;
1H ЯМР (CDCl3): δ 1,20-1,05 (3Н, с, 3х СН-диастереотопный), 1,32 (3Н, д, СН3), 1,42-1,34 (2Н, м, 2х СН-диастереотопный), 1,91-1,74 (3Н, м, 3х СН-диастереотопный), 4,21-4,13 (1Н, м, СН), 4,29-4,22 (1Н, м, СН), 4,44-4,30 (2Н, м, СН2), 5,25 (1Н, уш. ОН), 7,21 (1H, тд, CH-аром.), 7,40 (1H, дт, CH-аром.), 7,56-7,46 (1H, м, CH-аром.), 8,08 (1H, с, CH-аром.).

Пример 45: 3-(2-хлор-6-фторфенил)-N-циклопропил-5-(1-((2R)-2-гидроксипропил)-5-(трифторметил)-1H-пиразол-4-ил)изоксазол-4-карбоксамид
Указанное в заголовке соединение синтезировали из 3-(2-хлор-6-фторфенил)-5-{1-[(2R)-2-гидроксипропил]-5-(трифторметил)-1H-пиразол-4-ил}-1,2-оксазол-4-карбоновой кислоты и циклопропиламина в виде зеленоватого твердого вещества с выходом 27% (пТСХ, элюент: петролейный эфир/этилацетат 1:2).
Результат ЖХ/МС [M+H]+: 472,8;
1H ЯМР (CDCl3): δ 0,24 (2Н, м, СН2), 0,68 (2Н, м, СН2), 1,31 (3Н, д, СН3), 2,63 (1Н, м, СН), 3,34 (1Н, с, СН), 4,23 (1H, дд, CH), 4,35 (2H, м, CH, OH), 5,46 (1H, с, NH), 7,18 (1H, т, CH-аром.), 7,37 (1H, д, CH-аром.), 7,48 (1Н, м, СН-аром.), 8,05 (1Н, с, СН-аром.).

Пример 46: 3-(2-хлор-6-фторфенил)-N-циклобутил-5-(1-((2R)-2-гидроксипропил)-5-(трифторметил)-1H-пиразол-4-ил)изоксазол-4-карбоксамид
Указанное в заголовке соединение синтезировали из 3-(2-хлор-6-фторфенил)-5-{1-[(2R)-2-гидроксипропил]-5-(трифторметил)-1H-пиразол-4-ил}-1,2-оксазол-4-карбоновой кислоты и циклобутиламина в виде желтоватого твердого вещества с выходом 41% (пТСХ, элюент: петролейный эфир/этилацетат 1:2).
Результат ЖХ/МС [M+H]+: 486,9;
1H ЯМР (CDCl3): δ 1,30 (3Н, д, СН3), 1,56 (4Н, м, СН2), 2,22 (2Н, м, СН2), 3,35 (1Н, с, СН), 4,28 (4Н, м, CH2, OH), 5,45 (1H, с, NH), 7,20 (1H, т, CH-аром.), 7,39 (1H, д, CH-аром.), 7,50 (1H, м, CH-аром.), 8,04 (1Н, с, СН-аром.).
Синтез изоксазол-эфиров 4-карбоновых кислот
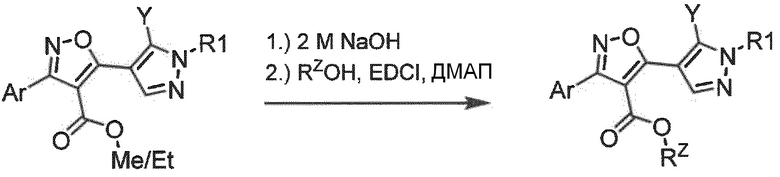
Исходя из соответствующих метиловых или этиловых эфиров (0,3 ммоль), соответствующие карбоновые кислоты получали омылением в соответствии с общей методикой, описанной выше при синтезе 4-ацилизоксазолов (описано исходя из Примера 8 или Примера 12):
- 3-(2-хлор-6-фторфенил)-5-(1-(2-гидрокси-2-метилпропил)-5-(трифторметил)-1Н-пиразол-4-ил)изоксазол-4-карбоновая кислота, ср. выше.
- 3-(2-хлор-6-фторфенил)-5-{1-[(2R)-2-гидроксипропил]-5-(трифторметил)-1Н-пиразол-4-ил}-1,2-оксазол-4-карбоновая кислота, ср. выше.
- 3-(2-хлор-6-фторфенил)-5-{1-[(2S)-2-гидроксипропил]-5-(трифторметил)-1Н-пиразол-4-ил}-1,2-оксазол-4-карбоновая кислота из Примера 13 в виде белого с желтоватым или сероватым оттенком твердого вещества, выход 81%;
Результат ЖХ/МС [M+H]+: 434,2;
1H ЯМР (CDCl3): δ 1,30 (3Н, д, СН3), 4,24 (1Н, дд, СН), 4,46-4,31 (2Н, м, СН2), 7,12 (1Н, тд, СН-аром.), 7,32 (1H, дт, CH-аром.), 7,48-7,36 (1H, м, CH-аром.), 7,97 (1H, с, CH-аром.).
- 3-(2-хлорфенил)-5-{5-метил-1-[3-гидрокси-3-метилциклобутил]-1Н-пиразол-4-ил}-1,2-оксазол-4-карбоновая кислота из Примеров 17/18 (син/анти-смесь, не разделенная на данной стадии) в виде коричневатого масла, выход 52%;
Результат ЖХ/МС [M+H]+: 388,2;
- 3-(2-хлорфенил)-5-{1-[(2S)-2-гидроксипропил]-5-метил-1Н-пиразол-4-ил}-1,2-оксазол-4-карбоновая кислота из Примера 24 в виде коричневатого масла, выход 64%;
- 3-(2-хлор-6-фторфенил)-5-{5-метил-1-[3-гидрокси-3-метилциклобутил]-1Н-пиразол-4-ил}-1,2-оксазол-4-карбоновая кислоты кислота (син/анти-смесь) в виде белого с желтоватым или сероватым оттенком твердого вещества, выход 83%;
Результат ЖХ/МС [M+H]+: 406,2;
Необходимый эфир метил-3-(2-хлор-6-фторфенил)-5-{5-метил-1-[3-гидрокси-3-метилциклобутил]-1Н-пиразол-4-ил}-1,2-оксазол-4-карбоксилата синтезировали, как описано выше, из метил-(Z)-3-(2-хлор-6-фторфенил)-5-(1-(диметиламино)-3-оксобут-1-ен-2-ил)изоксазол-4-карбоксилата (0,80 ммоль) и 3-гидразинил-1-метилциклобутан-1-ола (син/анти-смесь) в виде белого с желтоватым или сероватым оттенком твердого вещества (54% неочищенный) в виде смеси син/анти-конфигураций в циклобутанольном фрагменте.
Результат ЖХ/МС [M+H]+: 420,2;
- 3-(2-хлорфенил)-5-[1-(3-гидрокси-3-метилциклобутил)-5-(трифторметил)-1Н-пиразол-4-ил]-1,2-оксазол-4-карбоновая кислота (син/анти-смесь) в виде желтоватого твердого вещества, выход 96%;
Результат ЖХ/МС [M+H]+: 442,2;
Необходимый эфир этил-3-(2-хлорфенил)-5-[1-(3-гидрокси-3-метилциклобутил)-5-(трифторметил)-1Н-пиразол-4-ил]-1,2-оксазол-4-карбоксилата синтезировали, как описано выше, из этил-(Z)-3-(2-хлорфенил)-5-(1-(диметиламино)-4,4,4-трифтор-3-оксобут-1-ен-2-ил)изоксазол-4-карбоксилата (1,0 ммоль) и 3-гидразинил-1-метилциклобутан-1-ола (син/анти-смесь) в виде желтоватого масла (11%; пТСХ, элюент: CH2Cl2/MeOH 95:5 и пТСХ, элюент: петролейный эфир/этилацетат 1:1) в виде смеси син/анти-конфигураций в циклобутанольном фрагменте.
Результат ЖХ/МС [M+H]+: 470,2;
- 3-(2-хлор-6-фторфенил)-5-[1-(3-гидрокси-3-метилциклобутил)-5-(трифторметил)-1Н-пиразол-4-ил]-1,2-оксазол-4-карбоновая кислота (син/анти-смесь) в виде оранжевого твердого вещества, выход 78%;
Результат ЖХ/МС [M+H]+: 460,1;
Необходимый эфир этил-3-(2-хлор-6-фторфенил)-5-[1-(3-гидрокси-3-метилциклобутил)-3-(трифторметил)-1Н-пиразол-4-ил]-1,2-оксазол-4-карбоксилата синтезировали, как описано выше, из этил-(Z)-3-(2-хлор-6-фторфенил)-5-(1-(диметиламино)-4,4,4-трифтор-3-оксобут-1-ен-2-ил)изоксазол-4-карбоксилата (0,35 ммоль) и 3-гидразинил-1-метилциклобутан-1-ола (син/анти-смесь) в виде коричневатого масла (65% неочищенный) в виде смеси син/анти-конфигураций в циклобутанольном фрагменте.
Результат ЖХ/МС [M+H]+: 488,2;
К смеси соответствующей карбоновой кислоты (0,05 ммоль) и соответствующего спирта (3,0 экв.) в CH2Cl2 (4 мл) добавляли EDCI (1,5 экв.) и ДМАП (0,2 экв.) при комнатной температуре. Реакционную смесь перемешивали при комнатной температуре в течение 18 ч. Все летучие вещества удаляли при пониженном давлении. Остаток очищали с помощью препаративной ТСХ на силикагеле (элюент: ПЭ/EtOAc 1:1).

Пример 47: оксетан-3-ил-3-(2-хлорфенил)-5-{1-[(2S)-2-гидроксипропил]-5-метил-1Н-пиразол-4-ил}-1,2-оксазол-4-карбоксилат
Указанное в заголовке соединение синтезировали из 3-(2-хлорфенил)-5-{1-[(2S)-2-гидроксипропил]-5-метил-1Н-пиразол-4-ил}-1,2-оксазол-4-карбоновой кислоты и оксетан-3-ола в виде белого с желтоватым или сероватым оттенком твердого вещества с выходом 24% (пТСХ, элюент: петролейный эфир/этилацетат 1:1).
Результат ЖХ/МС [M+H]+: 418,2;
1H ЯМР (CDCl3): δ 1,30 (3Н, д, СН3), 2,63 (3Н, с, СН3), 3,37 (1Н, д, СН2), 4,01 (1Н, дд, СН), 4,15 (1Н, дд, СН2) 4,28-4,19 (2H, м, CH2), 4,33 (1H, уш., OH), 4,74 (2H, т, CH2), 5,51-5,40 (м, 1H, CH), 7,56-7,35 (4H, м, 4xCH-аром.), 8,41 (1Н, с, СН-аром.).

Примеры 48 и 49: циклопропил-3-(2-хлорфенил)-5-(1-(3-гидрокси-3-метилциклобутил)-5-(трифторметил)-1Н-пиразол-4-ил)изоксазол-4-карбоксилат (анти- и син-конфигурация)
Указанные в заголовке соединения синтезировали из 3-(2-хлорфенил)-5-[1-(3-гидрокси-3-метилциклобутил)-5-(трифторметил)-1Н-пиразол-4-ил]-1,2-оксазол-4-карбоновой кислоты (син/анти-смесь) и циклопропанола в виде бледно-желтых масел; пТСХ, элюент: CH2Cl2/MeOH 95:5 и пТСХ, элюент: петролейный эфир/этилацетат 7:3.
Пример 48: циклопропил-3-(2-хлорфенил)-5-(1-(3-гидрокси-3-метилциклобутил)-5-(трифторметил)-1Н-пиразол-4-ил)изоксазол-4-карбоксилат (анти-конфигурация), выход 39%;
Результат ЖХ/МС [M+H]+: 482,2;
1H ЯМР (CDCl3): δ 0,34 (2Н, м, СН2), 0,58 (2Н, м, СН2), 1,56 (3Н, с, СН3), 2,64 (2Н, м, СН2), 2,84 (2Н, м, СН2), 4,11 (1Н, м, СН), 5,26 (1Н, квинт., СН), 7,38 (1Н, м, СН-аром.), 7,46 (3Н, м, СН-аром.), 7,97 (1Н, с, CH-аром.).
Пример 49: циклопропил-3-(2-хлорфенил)-5-(1-(3-гидрокси-3-метилциклобутил)-5-(трифторметил)-1Н-пиразол-4-ил)изоксазол-4-карбоксилат (син-конфигурация), выход 25%.
Результат ЖХ/МС [M+H]+: 482,2;
1H ЯМР (CDCl3): δ 0,34 (2Н, м, СН2), 0,58 (2Н, м, СН2), 1,49 (3Н, с, СН3), 2,80 (4Н, м, 2хСН2), 4,12 (1Н, м, СН), 4,72 (1Н, квинт., СН), 5,42 (1Н, с, ОН), 7,99 (1Н, м, СН-аром.), 7,46 (3Н, м, СН-аром.), 8,01 (1Н, с, CH-аром.).

Примеры 50 и 51: циклопропил-3-(2-хлор-6-фторфенил)-5-(1-(3-гидрокси-3-метилциклобутил)-5-(трифторметил)-1Н-пиразол-4-ил)изоксазол-4-карбоксилат (анти- и син-конфигурация)
Указанные в заголовке соединения синтезировали из 3-(2-хлор-6-фторфенил)-5-[1-(3-гидрокси-3-метилциклобутил)-5-(трифторметил)-1Н-пиразол-4-ил]-1,2-оксазол-4-карбоновой кислоты (син/анти-смесь) и циклопропанола в виде желтоватых масел; пТСХ, элюент: петролейный эфир/этилацетат 7:3 и снова пТСХ, элюент: петролейный эфир/этилацетат 7:3.
Пример 50: циклопропил-3-(2-хлор-6-фторфенил)-5-(1-(3-гидрокси-3-метилциклобутил)-5-(трифторметил)-1Н-пиразол-4-ил)изоксазол-4-карбоксилат (анти-конфигурация), выход 1%;
Результат ЖХ/МС [M+H]+: 500,2;
1H ЯМР (CDCl3): δ 0,32 (2Н, м, СН2), 0,58 (2Н, м, СН2), 1,58 (3Н, с, СН3), 2,65 (2Н, м, СН2), 2,83 (2Н, м, СН2), 4,12 (1Н, м, СН), 5,26 (1Н, квинт., СН), 7,12 (1Н, т, СН-аром.), 7,31 (1Н, д, СН-аром.), 7,42 (1Н, м CH-аром.), 7,96 (1H, с, CH-аром.).
Пример 51: циклопропил-3-(2-хлор-6-фторфенил)-5-{1-[3-гидрокси-3-метилциклобутил]-5-(трифторметил)-1Н-пиразол-4-ил}-1,2-оксазол-4-карбоксилат (син-конфигурация), выход 1%.
Результат ЖХ/МС [M+H]+: 500,2;
1H ЯМР (CDCl3): δ 0,32 (2Н, м, СН2), 0,59 (2Н, м, СН2), 1,56 (3Н, с, СН3), 2,82 (4Н, м, 2хСН2), 4,13 (1Н, м, СН), 4,71 (1Н, квинт., СН), 7,13 (1Н, т, СН-аром.), 7,32 (1Н, д, СН-аром.), 7,43 (1Н, м, СН-аром.), 8,00 (1Н, с, СН-аром.).

Пример 52: оксетан-3-ил-3-(2-хлорфенил)-5-(1-(3-гидрокси-3-метилциклобутил)-5-метил-1Н-пиразол-4-ил)изоксазол-4-карбоксилат (син-конфигурация)
Указанное в заголовке соединение синтезировали из 3-(2-хлорфенил)-5-{5-метил-1-[3-гидрокси-3-метилциклобутил]-1Н-пиразол-4-ил}-1,2-оксазол-4-карбоновой кислоты (син-конфигурация, полученная в результате омыления в Примере 18) и оксетан-3-ола в виде бледно-желтого масла с выходом 7% (пТСХ, элюент: петролейный эфир/этилацетат 1:1).
Результат ЖХ/МС [M+H]+: 444,3;
1H ЯМР (CDCl3): δ 1,47 (3Н, с, СН3), 2,59 (3Н, с, СН3), 2,79-2,69 (4Н, м, СН2), 3,64 (1Н, уш., ОН), 4,24 (2Н, т, CH2), 4,55 (1H, квинт., CH), 4,74 (2H, т, CH2), 5,45 (1H, квинт., CH), 7,55-7,36 (4H, м, 4xCH-аром.), 8,42 (1H, с, СН-аром.).

Примеры 53 и 54: циклопропил-3-(2-хлорфенил)-5-{5-метил-1-[3-гидрокси-3-метилциклобутил]-1Н-пиразол-4-ил}-1,2-оксазол-4-карбоксилат (син- и анти-конфигурация)
Указанные в заголовке соединения синтезировали из 3-(2-хлорфенил)-5-{5-метил-1-[3-гидрокси-3-метилциклобутил]-1Н-пиразол-4-ил}-1,2-оксазол-4-карбоновой кислоты (син/анти-смесь) и циклопропанола в виде бесцветных масел; пТСХ, элюент: петролейный эфир/этилацетат 7:3 и снова пТСХ, элюент: петролейный эфир/этилацетат 7:3.
Пример 53: циклопропил-3-(2-хлорфенил)-5-{5-метил-1-[3-гидрокси-3-метилциклобутил]-1Н-пиразол-4-ил}-1,2-оксазол-4-карбоксилат (син-конфигурация), выход 2%;
Результат ЖХ/МС [M+H]+: 428,3;
1H ЯМР (CDCl3): δ 0,33 (2Н, м, СН2), 0,58 (2Н, м, СН2), 1,47 (3Н, с, СН3), 2,58 (3Н, с, СН3), 2,74 (4Н, м, 2хСН2), 4,15 (1Н, м, СН), 4,55 (1Н, квинт., СН), 7,41 (4Н, м, СН-аром.), 8,43 (1Н, с, СН-аром.).
Пример 54: циклопропил-3-(2-хлорфенил)-5-{5-метил-1-[3-гидрокси-3-метилциклобутил]-1Н-пиразол-4-ил}-1,2-оксазол-4-карбоксилат (анти-конфигурация), выход 3%.
Результат ЖХ/МС [M+H]+: 428,3;
1H ЯМР (CDCl3): δ 0,33 (2Н, м, СН2), 0,58 (2Н, м, СН2), 1,55 (3Н, с, СН3), 2,58 (5Н, м, СН3, СН2), 2,80 (2Н, м, CH2), 4,15 (1H, м, CH), 5,04 (1H, квинт., CH), 7,41 (4H, м, CH-аром.), 8,38 (1H, с, CH-аром.).

Пример 55: циклопропил-3-(2-хлор-6-фторфенил)-5-[1-(2-гидрокси-2-метилпропил)-5-(трифторметил)-1Н-пиразол-4-ил]-1,2-оксазол-4-карбоксилат
Указанное в заголовке соединение синтезировали из 3-(2-хлор-6-фторфенил)-5-(1-(2-гидрокси-2-метилпропил)-5-(трифторметил)-1Н-пиразол-4-ил)изоксазол-4-карбоновой кислоты и циклопропанола в виде бледно-желтого твердого вещества с выходом 33% (пТСХ, элюент: петролейный эфир/этилацетат 1:1).
Результат ЖХ/МС [M+H]+: 487,8;
1H ЯМР (CDCl3): δ 0,33 (2Н, м, СН2), 0,60 (2Н, м, СН2), 1,25 (6Н, с, 2хСН3), 4,13 (1Н, м, СН), 4,18 (1Н, с, ОН), 4,31 (2Н, с, СН2), 7,13 (1Н, т, СН-аром.), 7,33 (1Н, д, СН-аром.), 7,47 (1Н, м, СН-аром.), 8,05 (1Н, с, СН-аром.).

Пример 56: циклобутил-3-(2-хлор-6-фторфенил)-5-[1-(2-гидрокси-2-метилпропил)-5-(трифторметил)-1Н-пиразол-4-ил]-1,2-оксазол-4-карбоксилат
Указанное в заголовке соединение синтезировали из 3-(2-хлор-6-фторфенил)-5-(1-(2-гидрокси-2-метилпропил)-5-(трифторметил)-1Н-пиразол-4-ил)изоксазол-4-карбоновой кислоты и циклобутанола в виде бледно-желтого масла с выходом 47% (пТСХ, элюент: петролейный эфир/этилацетат 1:1).
Результат ЖХ/МС [M+H]+: 501,8;
1H ЯМР (CDCl3): δ 1,25 (6H, с, 2xCH3), 1,55 (2H, м, CH2), 1,69 (2H, м, CH2), 2,19 (2H, м, CH2), 4,21 (1H, с, ОН), 4,31 (2Н, с, СН2), 4,97 (1Н, м, СН), 7,15 (1Н, т, СН-аром.), 7,35 (1Н, д, СН-аром.), 7,45 (1Н, м, CH-аром.), 8,06 (1H, с, CH-аром.).

Пример 57: оксетан-3-ил-3-(2-хлор-6-фторфенил)-5-[1-(2-гидрокси-2-метилпропил)-5-(трифторметил)-1H-пиразол-4-ил]-1,2-оксазол-4-карбоксилат
Указанное в заголовке соединение синтезировали из 3-(2-хлор-6-фторфенил)-5-(1-(2-гидрокси-2-метилпропил)-5-(трифторметил)-1Н-пиразол-4-ил)изоксазол-4-карбоновой кислоты и оксетан-3-ола в виде бесцветного твердого вещества с выходом 38% (пТСХ, элюент: петролейный эфир/этилацетат 1:1).
Результат ЖХ/МС [M+H]+: 504,0;
1H ЯМР (CDCl3): δ 1,26 (6H, с, 2xCH3), 4,11 (1H, уш., OH), 4,29-4,21 (2H, м, CH2), 4,31 (2H, с, CH2), 4,80-4,70 (2H, м, СН2), 5,49-5,38 (1Н, м, СН), 7,17 (1Н, тд, СН-аром.), 7,37 (1Н, дт, СН-аром.), 7,52-7,42 (1Н, м, СН-аром.), 8,05 (1Н, с, СН-аром.).

Пример 58: оксетан-3-ил-3-(2-хлор-6-фторфенил)-5-{1-[(2R)-2-гидроксипропил]-5-(трифторметил)-1H-пиразол-4-ил}-1,2-оксазол-4-карбоксилат
Указанное в заголовке соединение синтезировали из 3-(2-хлор-6-фторфенил)-5-{1-[(2R)-2-гидроксипропил]-5-(трифторметил)-1H-пиразол-4-ил}-1,2-оксазол-4-карбоновой кислоты и оксетан-3-ола в виде бесцветного твердого вещества с выходом 21% (пТСХ, элюент: петролейный эфир/этилацетат 1:1).
Результат ЖХ/МС [M+H]+: 490,2;
1H ЯМР (CDCl3): δ 1,32 (3Н, д, СН3), 3,20 (1Н, уш., ОН), 4,32-4,19 (3Н, м, СН и СН2), 4,47-4,32 (2Н, м, СН2), 4,75 (2H, т, CH2), 5,49-5,39 (1H, м, CH), 7,17 (1H, тд, CH-аром.), 7,37 (1H, тд, CH-аром.), 7,52-7,42 (1H, м CH-аром.), 8,03 (1H, с, CH-аром.).

Пример 59: циклопропил-3-(2-хлор-6-фторфенил)-5-{1-[(2S)-2-гидроксипропил]-5-(трифторметил)-1H-пиразол-4-ил}-1,2-оксазол-4-карбоксилат
Указанное в заголовке соединение синтезировали из 3-(2-хлор-6-фторфенил)-5-{1-[(2S)-2-гидроксипропил]-5-(трифторметил)-1H-пиразол-4-ил}-1,2-оксазол-4-карбоновой кислоты и циклопропанола в виде бледно-желтого масла с выходом 30% (пТСХ, элюент: петролейный эфир/этилацетат 1:1).
Результат ЖХ/МС [M+H]+: 474,2;
1H ЯМР (CDCl3): δ 0,32 (2Н, м, СН2), 0,59 (2Н, м, СН2), 1,32 (3Н, д, СН3), 3,26 (1Н, с, ОН), 4,13 (1Н, квинт., СН), 4,25 (1Н, дд, СН), 4,37 (2Н, м, 2хСН), 7,13 (1Н, т, СН-аром.), 7,32 (1Н, д, СН-аром.), 7,44 (1Н, м, CH-аром.), 8,03 (1H, с, CH-аром.).

Пример 60: оксетан-3-ил-3-(2-хлор-6-фторфенил)-5-{1-[(2S)-2-гидроксипропил]-5-(трифторметил)-1H-пиразол-4-ил}-1,2-оксазол-4-карбоксилат
Указанное в заголовке соединение синтезировали из 3-(2-хлор-6-фторфенил)-5-{1-[(2S)-2-гидроксипропил]-5-(трифторметил)-1H-пиразол-4-ил}-1,2-оксазол-4-карбоновой кислоты и оксетан-3-ола в виде бледно-желтого твердого вещества с выходом 29% (пТСХ, элюент: петролейный эфир/этилацетат 1:1).
Результат ЖХ/МС [M+H]+: 490,2;
1H ЯМР (CDCl3): δ 1,32 (3Н, д, СН3), 3,21 (1Н, уш., ОН), 4,31-4,20 (3Н, м, СН и СН2), 4,47-4,31 (2Н, м, СН2), 4,75 (2H, т, CH2), 5,50-5,38 (1H, м, CH), 7,17 (1H, тд, CH-аром.), 7,37 (1H, дт, CH-аром.), 7,52-7,42 (1H, м. CH-аром.), 8,03 (1H, с, CH-аром.).
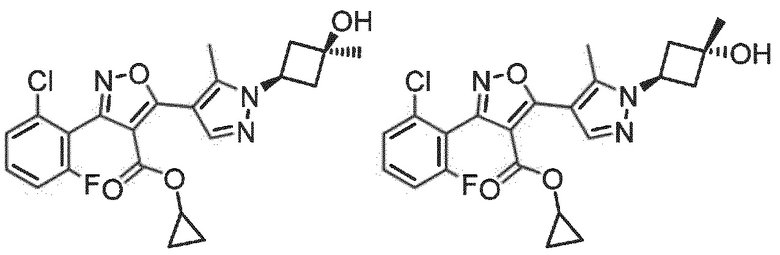
Примеры 61 и 62: циклопропил-3-(2-хлор-6-фторфенил)-5-{5-метил-1-[3-гидрокси-3-метилциклобутил]-1Н-пиразол-4-ил}-1,2-оксазол-4-карбоксилат (син- и анти-конфигурация)
Указанные в заголовке соединения синтезировали из 3-(2-хлор-6-фторфенил)-5-{5-метил-1-[3-гидрокси-3-метилциклобутил]-1Н-пиразол-4-ил}-1,2-оксазол-4-карбоновой кислоты (син/анти-смесь) и циклопропанола в виде желтоватых масел; пТСХ, элюент: петролейный эфир/этилацетат 7:3 и снова пТСХ, элюент: петролейный эфир/этилацетат 7:3.
Пример 61: циклопропил-3-(2-хлор-6-фторфенил)-5-{5-метил-1-[3-гидрокси-3-метилциклобутил]-1Н-пиразол-4-ил}-1,2-оксазол-4-карбоксилат (син-конфигурация), выход 7%;
Результат ЖХ/МС [M+H]+: 446,3;
1H ЯМР (CDCl3): δ 0,29 (2Н, м, СН2), 0,58 (2Н, м, СН2), 1,53 (3Н, с, СН3), 2,58 (4Н, м, СН, СН3), 2,77 (3Н, м, СН, СН2), 4,16 (1Н, м, СН), 5,03 (1Н, квинт., СН), 7,10 (1Н, т, СН-аром.), 7,30 (1Н, д, СН-аром.), 7,40 (1H, м, CH-аром.), 8,41 (1H, с, CH-аром.).
Пример 62: циклопропил-3-(2-хлор-6-фторфенил)-5-{5-метил-1-[3-гидрокси-3-метилциклобутил]-1Н-пиразол-4-ил}-1,2-оксазол-4-карбоксилат (анти-конфигурация), выход 14%.
Результат ЖХ/МС [M+H]+: 446,3;
1H ЯМР (CDCl3): δ 0,30 (2Н, м, СН2), 0,58 (2Н, м, СН2), 1,47 (3Н, с, СН3), 2,59 (3Н, с, СН3), 2,74 (4Н, м, 2хСН2), 3,63 (1Н, с, ОН), 4,16 (1Н, м, СН), 4,55 (1Н, квинт., СН), 7,12 (1Н, т, СН-аром.), 7,31 (1Н, д, СН-аром.), 7,39 (1H, м, CH-аром.), 8,48 (1H, с, CH-аром.).
Синтез 4-алкоксиметилизоксазолов

Стадия восстановления с LiAlH4
Соответствующие метиловые или этиловые эфиры изоксазол-4-карбоновой кислоты растворяли в сухом ТГФ (Sure/Seal; 4 мл/ммоль) и раствор охлаждали до 0°C. Медленно добавляли LiAlH4 (1 М в ТГФ; 1,5 экв.) и смесь перемешивали при 0°С в течение 1,5 ч. Затем смесь гасили солью Рошеля и полученную смесь экстрагировали CH2Cl2. Объединенные органические слои высушивали над MgSO4, отфильтровывали и концентрировали при пониженном давлении с получением неочищенного материала, который непосредственно использовали для следующих стадий.
- (2S)-1-(4-(3-(2-хлор-6-фторфенил)-4-(гидроксиметил)изоксазол-5-ил)-5-(трифторметил)-1H-пиразол-1-ил)пропан-2-ол из Примера 13 (0,4 ммоль) в виде оранжевого твердого вещества (80%).
Результат ЖХ/МС [M+H]+: 419,7;
-4-{4-[3-(2-хлор-6-фторфенил)-4-(гидроксиметил)-1,2-оксазол-5-ил]-5-(трифторметил)-1H-пиразол-1-ил}-2-метилбутан-2-ол из Примера 9 (1,0 ммоль) в виде бледно-желтого масла (87%).
Результат ЖХ/МС [M+H]+: 448,2;
1H ЯМР (CDCl3): δ 1,32 (6H, с, 2xCH3), 2,18-2,08 (2H, м, CH2), 3,79-3,71 (1H, м, OH), 4,08 (1H, дк, OH), 4,40 (2H, с, СН2), 4,58-4,48 (2Н, м, СН2), 7,15 (1Н, тд, СН-аром.), 7,35 (1Н, дт, СН-аром.), 7,48-7,39 (1Н, м, СН-аром.), 7,92 (1Н, с, СН-аром.).
- 3-{4-[3-(2-хлор-6-фторфенил)-4-(гидроксиметил)-1,2-оксазол-5-ил]-5-(трифторметил)-1H-пиразол-1-ил}-1-метилциклобутан-1-ол (син/анти-смесь) из Примеров 10/11 (0,6 ммоль) в виде син/анти-смеси (для данного синтеза син- и анти-изомеры не разделяли на уровне сложного эфира) (колич.).
 Пример 63: 1-(4-(3-(2-хлор-6-фторфенил)-4-(гидроксиметил)изоксазол-5-ил)-5-(трифторметил)-1Н-пиразол-1-ил)-2-метилпропан-2-ол из Примера 8 (0,3 ммоль) в виде желтоватого твердого вещества (пТСХ, элюент: петролейный эфир/этилацетат 1:1; 24%).
Пример 63: 1-(4-(3-(2-хлор-6-фторфенил)-4-(гидроксиметил)изоксазол-5-ил)-5-(трифторметил)-1Н-пиразол-1-ил)-2-метилпропан-2-ол из Примера 8 (0,3 ммоль) в виде желтоватого твердого вещества (пТСХ, элюент: петролейный эфир/этилацетат 1:1; 24%).
Результат ЖХ/МС [M+H]+: 433,8;
1H ЯМР (CDCl3): δ 1,24 (6Н, с, 2хСН3), 1,67 (1Н, с, ОН), 4,16 (1Н, с, ОН), 4,31 (2Н, с, СН2), 4,41 (2Н, д, CH2), 7,16 (1H, тд, CH-аром.), 7,36 (1H, тд, CH-аром.), 7,44 (1H, м, CH-аром.), 8,01 (1H, с, CH-аром.).
- (2R)-1-(4-(3-(2-хлор-6-фторфенил)-4-(гидроксиметил)изоксазол-5-ил)-5-(трифторметил)-1H-пиразол-1-ил)пропан-2-ол из Примера 12 (0,55 ммоль) в виде оранжевого твердого вещества (75%).
Результат ЖХ/МС [M+H]+: 419,7;
- сложный эфир метил-3-(2-хлорфенил)-5-[1-(3-гидрокси-3-метилбутил)-5-(трифторметил)-1Н-пиразол-4-ил]-1,2-оксазол-4-карбоксилата синтезировали, как описано выше, из метил-(Z)-3-(2-хлорфенил)-5-(1-(диметиламино)-4,4,4-трифтор-3-оксобут-1-ен-2-ил)изоксазол-4-карбоксилата (1,2 ммоль) и 4-гидразинил-2-метилбутан-2-ола в виде желтого масла (33%; пТСХ, элюент: CH2Cl2/MeOH 95:5).
Результат ЖХ/МС [M+H]+: 440,3;
1H ЯМР (CDCl3): δ 1,32 (6H, с, 2xCH3), 2,20-2,10 (2H, м, CH2), 3,63 (3H, с, OCH3), 4,58-4,48 (2H, м, CH2), 7,59-7,33 (4Н, м, 4хСН-аром.), 7,95 (1Н, с, СН-аром.).
Из данного сложного эфира (0,4 ммоль) 4-{4-[3-(2-хлорфенил)-4-(гидроксиметил)-1,2-оксазол-5-ил]-5-(трифторметил)-1H-пиразол-1-ил}-2-метилбутан-2-ол синтезировали количественно в соответствии со стандартной методикой.
Результат ЖХ/МС [M+H]+: 430,3;
- (2S)-1-{4-[3-(2-хлорфенил)-4-(гидроксиметил)-1,2-оксазол-5-ил]-5-(трифторметил)-1H-пиразол-1-ил}пропан-2-ол из Примера 22 (1,5 ммоль) (90%).
- 3-{4-[3-(2-хлорфенил)-4-(гидроксиметил)-1,2-оксазол-5-ил]-5-(трифторметил)-1H-пиразол-1-ил}-1-метилциклобутан-1-ол (син/анти-смесь) из этил-3-(2-хлорфенил)-5-[1-(3-гидрокси-3-метилциклобутил)-5-(трифторметил)-1Н-пиразол-4-ил]-1,2-оксазол-4-карбоксилата (0,8 ммоль) (син/анти-смесь; синтез описан выше) (63%).

Пример 64: 3-(4-(3-(2-хлорфенил)-4-(гидроксиметил)-1,2-оксазол-5-ил)-5-(трифторметил)-1Н-пиразол-1-ил)-1-метилциклобутан-1-ол (син-конфигурация)
Из смеси син- и анти-изомеров син-син-изомер отделяли с помощью преп. ТСХ (элюент петролейный эфир/этилацетат 1:1).
Результат ЖХ/МС [M+H]+: 427,9;
1H ЯМР (CDCl3): δ 1,49 (3Н, с, СН3), 2,94-2,68 (4Н, м, 2хСН2), 3,49 (1Н, с, ОН), 4,45 (2Н, с, СН2), 4,73 (1Н, квинт., СН), 7,63-7,34 (4Н, м, 4хСН-аром.), 7,99 (1Н, с, СН-аром.).
-4-{4-[3-(2-хлорфенил)-4-(гидроксиметил)-1,2-оксазол-5-ил]-5-метил-1H-пиразол-1-ил}-2-метилбутан-2-ол из Примера 19 (0,4 ммоль) в виде желтого твердого вещества (84%).
Результат ЖХ/МС [M+H]+: 376,0;
- 3-{4-[3-(2-хлорфенил)-4-(гидроксиметил)-1,2-оксазол-5-ил]-5-метил-1H-пиразол-1-ил}-1-метилциклобутан-1-ол (син/анти-смесь) из Примеров 17/18 (1,1 ммоль) в виде син/анти-смеси (для данного синтеза син- и анти-изомеры не разделяли на уровне сложных эфиров) (колич.).
Результат ЖХ/МС [M+H]+: 374,3;
-4-{4-[3-(2-хлор-6-фторфенил)-4-(гидроксиметил)-1,2-оксазол-5-ил]-5-метил-1H-пиразол-1-ил}-2-метилбутан-2-ол из Примера 20 (2,0 ммоль) в виде желтоватого твердого вещества (94%).
Результат ЖХ/МС [M+H]+: 394,1;
1H ЯМР (CDCl3): δ 1,30 (6Н, с, 2хСН3), 2,08-2,00 (2Н, м, СН2), 2,65 (3Н, с, СН3), 4,36-4,28 (2Н, м, СН2), 4,45 (2Н, д, СН2), 7,16 (1Н, тд, СН-аром.), 7,36 (1Н, дт, СН-аром.), 7,49-7,39 (1Н, м, СН-аром.), 7,97 (1Н, с, СН-аром.).
- 3-{4-[3-(2-хлор-6-фторфенил)-4-(гидроксиметил)-1,2-оксазол-5-ил]-5-метил-1H-пиразол-1-ил}-1-метилциклобутан-1-ол (син/анти-смесь) из метил-3-(2-хлор-6-фторфенил)-5-{5-метил-1-[3-гидрокси-3-метилциклобутил]-1Н-пиразол-4-ил}-1,2-оксазол-4-карбоксилата (1,1 ммоль) (син/анти-смесь; синтез описан выше) в виде желтоватого твердого вещества (89%).
Результат ЖХ/МС [M+H]+: 392,2;
- 3-(4-{3-[3-(бензилокси)-2-хлорфенил]-4-(гидроксиметил)-1,2-оксазол-5-ил}-5-(трифторметил)-1H-пиразол-1-ил)-1-метилциклобутан-1-ол (син/анти-смесь) из этил-3-(3-(бензилокси)-2-хлорфенил)-5-(1-(3-гидрокси-3-метилциклобутил)-5-(трифторметил)-1Н-пиразол-4-ил)изоксазол-4-карбоксилата (0,9 ммоль) (син/анти-смесь) в виде оранжево-коричневого твердого вещества (колич.).
Результат ЖХ/МС [M+H]+: 534,3;
1H ЯМР (CDCl3): δ 1,55 (3Н, с, СН3), 2,94-2,55 (4Н, м, 2хСН2), 3,83-3,68 (1Н, м, СН), 4,44 (2Н, с, ОСН2), 5,22 (2Н, с, OCH2), 7,19-7,09 (2H, м, 2xCH-аром.), 7,54-7,30 (6H, м, 6xCH-аром.), 7,97 (1H, с, CH-аром.).
-4-(4-(3-(3-(бензилокси)-2-хлорфенил)-4-(гидроксиметил)изоксазол-5-ил)-5-(трифторметил)-1H-пиразол-1-ил)-2-метилбутан-2-ол из этил-3-(3-(бензилокси)-2-хлорфенил)-5-(1-(3-гидрокси-3-метилбутил)-5-(трифторметил)-1Н-пиразол-4-ил)изоксазол-4-карбоксилата в виде коричневого масла (91%).
Результат ЖХ/МС [M+H]+: 536,1;
1H ЯМР (CDCl3): δ 1,33 (6H, с, 2xCH3), 1,86 (4H, м, 2x CH2), 3,75 (2H, с, CH2), 5,23 (2H, д, CH2), 7,12 (1H, м, CH-аром.), 7,41 (6H, м, CH-аром.), 7,95 (1H, с, CH-аром.).
Превращение гидроксиметилизоксазола в бромметилизоксазол достигали с помощью двух способов:
А) Соответствующий гидроксиметилизоксазол растворяли в диэтиловом эфире, ТГФ или CH2Cl2 (3 мл/ммоль) при 0°С и медленно добавляли трибромид фосфора (0,5 экв.), растворенный в диэтиловом эфире (3 мл/ммоль). Смесь перемешивали при 0°С в течение 10-30 мин. Смесь обрабатывали NaHCO3 (5%) и дважды экстрагировали CH2Cl2. Объединенные органические слои высушивали над MgSO4 и растворитель удаляли под вакуумом с получением неочищенного материала, который использовали как таковой в дальнейших стадиях.
B) Соответствующий гидроксиметилизоксазол и PPh3 (1,5 экв.) растворяли в сухом ТГФ (Sure/Seal; 4 мл/ммоль) и охлаждали до 0°C. Добавляли CBr4 (1,5 экв.) и смесь перемешивали при 0°C в течение 15 мин и затем при комнатной температуре в течение 2 ч. Смесь гасили водой и полученную смесь дважды экстрагировали CH2Cl2. Объединенные органические слои высушивали над MgSO4 и растворитель удаляли под вакуумом с получением неочищенного материала. Для удаления крупнокускового материала OPPh3 твердый материал обрабатывали Et2O, подвергали воздействию ультразвука, центрифугировали и декантировали; альтернативно, материал очищали с помощью преп. ТСХ на силикагеле (элюент: CH2Cl2/MeOH 95:5).
-4-{4-[4-(бромметил)-3-(2-хлор-6-фторфенил)-1,2-оксазол-5-ил]-5-(трифторметил)-1H-пиразол-1-ил}-2-метилбутан-2-ол из 4-{4-[3-(2-хлор-6-фторфенил)-4-(гидроксиметил)-1,2-оксазол-5-ил]-5-(трифторметил)-1H-пиразол-1-ил}-2-метилбутан-2-ола (0,25 ммоль) в соответствии со способом A (Et2O, 10 мин) в виде желтого твердого вещества (93%).
Результат ЖХ/МС [M+H]+: 510,1;
1H ЯМР (CDCl3): δ 1,32 (6H, с, 2xCH3), 2,12 (2H, м, CH2), 4,15 (2H, с, CH2), 4,53 (2H, м, CH2), 7,17 (1H, т, CH-аром.), 7,37 (1H, д, CH-аром.), 7,44 (1H, м, CH-аром.), 7,92 (1H, с, CH-аром.).
-4-{4-[4-(бромметил)-3-(2-хлорфенил)-1,2-оксазол-5-ил]-5-(трифторметил)-1H-пиразол-1-ил}-2-метилбутан-2-ол из 4-{4-[3-(2-хлорфенил)-4-(гидроксиметил)-1,2-оксазол-5-ил]-5-(трифторметил)-1Н-пиразол-1-ил}-2-метилбутан-2-ола (0,40 ммоль) в соответствии со способом A (CH2Cl2, 30 мин) в виде оранжевого масла (60%; пТСХ, элюент: CH2Cl2/MeOH 95:5).
Результат ЖХ/МС [M+H]+: 492,2;
1H ЯМР (CDCl3): δ 1,32 (6H, с, 2xCH3), 2,13 (2H, м, CH2), 4,23 (2H, с, CH2), 4,55 (2H, м, CH2), 7,45 (1H, м, CH-аром.), 7,54 (2H, м, CH-аром.), 7,65 (1H, м, CH-аром.), 7,92 (1H, с, CH-аром.).
-4-{4-[4-(бромметил)-3-(2-хлорфенил)-1,2-оксазол-5-ил]-5-метил-1H-пиразол-1-ил}-2-метилбутан-2-ол из 4-{4-[3-(2-хлорфенил)-4-(гидроксиметил)-1,2-оксазол-5-ил]-5-метил-1Н-пиразол-1-ил}-2-метилбутан-2-ола (0,25 ммоль) в соответствии со способом A (ТГФ, 20 мин) в виде желтого твердого вещества (84%); наблюдали частичный дополнительный гидрокси-бром обмен в метилбутанольном фрагменте (5-[1-(3-бром-3-метилбутил)-5-метил-1Н-пиразол-4-ил]-4-(бромметил)-3-(2-хлорфенил)-1,2-оксазол).
Результат ЖХ/МС [M-H2O+H]+: 419,9 (указанное в заголовке соединение);
Результат ЖХ/МС [M+H]+: 499,8 (M+ (дополнительный OH-Br-обмен);
-4-{4-[4-(бромметил)-3-(2-хлор-6-фторфенил)-1,2-оксазол-5-ил]-5-метил-1H-пиразол-1-ил}-2-метилбутан-2-ол из 4-{4-[3-(2-хлор-6-фторфенил)-4-(гидроксиметил)-1,2-оксазол-5-ил]-5-метил-1Н-пиразол-1-ил}-2-метилбутан-2-ола (2,0 ммоль) в соответствии со способом В в виде желтоватого масла (95%).
Результат ЖХ/МС [M-H2O+H]+: 437,9;
1H ЯМР (CDCl3): δ 1,32 (6H, с, 2xCH3), 2,05 (2H, м, CH2), 2,63 (3H, с, CH3), 4,29 (2H, с, CH2), 4,33 (2H, м, CH2), 7,17 (1H, т, CH-аром.), 7,36 (1H, д, CH-аром.), 7,45 (1H, м, CH-аром.), 7,95 (1H, с, CH-аром.).
- 3-{4-[4-(бромметил)-3-(2-хлор-6-фторфенил)-1,2-оксазол-5-ил]-5-метил-1H-пиразол-1-ил}-1-метилциклобутан-1-ол (син/анти-смесь) из 3-{4-[3-(2-хлор-6-фторфенил)-4-(гидроксиметил)-1,2-оксазол-5-ил]-5-метил-1Н-пиразол-1-ил}-1-метилциклобутан-1-ола (0,4 ммоль; син/анти-смесь) в соответствии со способом B в виде желтоватого твердого вещества (89%).
Результат ЖХ/МС [M+H]+: 454,1;
- 3-{4-[4-(бромметил)-3-(2-хлорфенил)-1,2-оксазол-5-ил]-5-метил-1H-пиразол-1-ил}-1-метилциклобутан-1-ол (син/анти-смесь) из 3-{4-[3-(2-хлорфенил)-4-(гидроксиметил)-1,2-оксазол-5-ил]-5-метил-1Н-пиразол-1-ил}-1-метилциклобутан-1-ола (0,15 ммоль; син/анти-смесь) в соответствии со способом B (колич.)
Результат ЖХ/МС [M+H]+: 436,2;
- (2R)-1-{4-[4-(бромметил)-3-(2-хлор-6-фторфенил)-1,2-оксазол-5-ил]-5-(трифторметил)-1H-пиразол-1-ил}пропан-2-ол из (2R)-1-(4-(3-(2-хлор-6-фторфенил)-4-(гидроксиметил)изоксазол-5-ил)-5-(трифторметил)-1H-пиразол-1-ил)пропан-2-ола (0,3 ммоль) в соответствии со способом B (87%).
- (2S)-1-{4-[4-(бромметил)-3-(2-хлорфенил)-1,2-оксазол-5-ил]-5-(трифторметил)-1H-пиразол-1-ил}пропан-2-ол из (2S)-1-{4-[3-(2-хлорфенил)-4-(гидроксиметил)-1,2-оксазол-5-ил]-5-(трифторметил)-1H-пиразол-1-ил}пропан-2-ола (0,35 ммоль) в соответствии со способом B (55%).
- 3-{4-[4-(бромметил)-3-(2-хлорфенил)-1,2-оксазол-5-ил]-5-(трифторметил)-1H-пиразол-1-ил}-1-метилциклобутан-1-ол (син/анти-смесь) из 3-{4-[3-(2-хлорфенил)-4-(гидроксиметил)-1,2-оксазол-5-ил]-5-(трифторметил)-1Н-пиразол-1-ил}-1-метилциклобутан-1-ола (0,3 ммоль; син/анти-смесь) в соответствии со способом B (92%).
- 3-{4-[4-(бромметил)-3-(2-хлор-6-фторфенил)-1,2-оксазол-5-ил]-5-(трифторметил)-1H-пиразол-1-ил}-1-метилциклобутан-1-ол (син/анти-смесь) из 3-{4-[3-(2-хлор-6-фторфенил)-4-(гидроксиметил)-1,2-оксазол-5-ил]-5-(трифторметил)-1Н-пиразол-1-ил}-1-метилциклобутан-1-ола (0,35 ммоль; син/анти-смесь) в соответствии со способом B (77%).
- 3-(4-(3-(3-(бензилокси)-2-хлорфенил)-4-(бромметил)изоксазол-5-ил)-5-(трифторметил)-1H-пиразол-1-ил)-1-метилциклобутан-1-ол (син/анти-смесь) из 3-(4-{3-[3-(бензилокси)-2-хлорфенил]-4-(гидроксиметил)-1,2-оксазол-5-ил}-5-(трифторметил)-1H-пиразол-1-ил)-1-метилциклобутан-1-ола (син/анти-смесь) (1,0 ммоль) в соответствии со способом A (Et2O, 10 мин) в виде желтого масла (колич.).
Результат ЖХ/МС [M+H]+: 596,2;
1H ЯМР (CDCl3): δ 1,51 (3Н, с, СН3), 2,78 (4Н, м, 2хСН2), 4,24 (2Н, с, СН2), 4,73 (1Н, м, СН), 5,23 (2Н, с, CH2), 7,15 (2H, д, CH-аром.), 7,39 (6H, д, CH-аром.), 7,97 (1H, с, CH-аром.).
-4-(4-(3-(3-(бензилокси)-2-хлорфенил)-4-(бромметил)изоксазол-5-ил)-5-(трифторметил)-1H-пиразол-1-ил)-2-метилбутан-2-ол из 4-(4-(3-(3-(бензилокси)-2-хлорфенил)-4-(гидроксиметил)изоксазол-5-ил)-5-(трифторметил)-1Н-пиразол-1-ил)-2-метилбутан-2-ола (2,5 ммоль) в соответствии со способом A (CH2Cl2, 15 мин) в виде желтого твердого вещества (94%).
Результат ЖХ/МС [M+H]+-H2О: 580,0;
1H ЯМР (CDCl3): δ 1,34 (6H, с, 2xCH3), 1,94 (4H, м, 2xCH2), 3,45 (2H, с, CH2), 5,23 (2H, с, CH2), 7,15 (2H, м, CH-аром.), 7,39 (6H, м, CH-аром.), 7,99 (1H, с, CH-аром.).
Конечное образование 4-алкоксиметилизоксазолов; альтернативные способы:
А) К перемешиваемому раствору соответствующего 4-гидроксиметилизоксазола в 2-метилтетрагидрофуране (5 мл/ммоль) добавляли гидроксид калия (порошок, 4,0 экв.) и полученную суспензию перемешивали в течение 10 мин при комнатной температуре. Затем добавляли иодметан (4,0 экв.) и смесь перемешивали при комнатной температуре в течение 18 ч. Смесь распределяли между водой и CH2Cl2. Объединенные органические слои высушивали над MgSO4, отфильтровывали и концентрировали при пониженном давлении. Очистку достигали с помощью препаративной ТСХ на силикагеле.
B) Гидрид натрия (1,1 экв.) суспендировали в ТГФ (Sure/Seal; 2 мл/ммоль) и охлаждали до 0°C. Соответствующий 4-гидроксиметилизоксазол растворяли в ТГФ (Sure/Seal; 2 мл/ммоль), охлаждали до 0°C и добавляли к суспензии NaH. Смесь перемешивали в течение 10 мин при 0°C и в течение 0,5 ч при комнатной температуре. Добавляли алкилбромид (2,0 экв.) и продолжали перемешивание при к. т. в течение 18 ч. Реакцию гасили добавлением воды, смесь распределяли между водой и CH2Cl2. Объединенные органические слои высушивали над MgSO4, отфильтровывали и концентрировали при пониженном давлении. Очистку достигали с помощью препаративной ТСХ на силикагеле.
C) При 0°C NaH (1,5 экв.) растворяли в ТГФ (2 мл/ммоль) и добавляли циклопропанол. Смесь перемешивали при 0°C в течение 20 мин. Соответствующий 4-бромметилизоксазол растворяли в ДМФ (2 мл/ммоль) и добавляли к суспензии NaH. Смесь перемешивали при 0°C в течение 1 ч, нагревали до комнатной температуры и перемешивали при данной температуре в течение 18 ч. Добавляли воду и смесь экстрагировали этилацетатом. Объединенные органические слои высушивали над MgSO4 и концентрировали при пониженном давлении. Продукт очищали с помощью препаративной ТСХ на силикагеле (элюент: CH2Cl2/MeOH 95:5).
D) К перемешиваемому раствору соответствующего 4-бромметилизоксазола в ТГФ (4 мл/ммоль) добавляли соответствующий спирт (3,0 экв.), KOtBu (3,0 экв.) и 18-краун-6 эфир (1,0 экв.). Смесь перемешивали при комнатной температуре в течение 18 ч. Смесь распределяли между водой и CH2Cl2. Объединенные органические слои высушивали над MgSO4, отфильтровывали и концентрировали при пониженном давлении. Очистку достигали с помощью препаративной ТСХ на силикагеле.
- 
Пример 65: 1-(4-(3-(2-хлор-6-фторфенил)-4-(метоксиметил)изоксазол-5-ил)-5-(трифторметил)-1Н-пиразол-1-ил)-2-метилпропан-2-ол
способ А, из 1-(4-(3-(2-хлор-6-фторфенил)-4-(гидроксиметил)изоксазол-5-ил)-5-(трифторметил)-1Н-пиразол-1-ил)-2-метилпропан-2-ола (0,1 ммоль) в виде желтоватого масла (30%; пТСХ, элюент: петролейный эфир/этилацетат 1:1 и пТСХ, элюент: петролейный эфир/этилацетат 2:1).
Результат ЖХ/МС [M+H]+: 447,8;
1H ЯМР (CDCl3): δ 1,23 (6Н, с, 2хСН3), 3,14 (3Н, с, СН3), 4,18 (1Н, с, ОН), 4,19 (2Н, с, СН2), 4,31 (2Н, с, CH2), 7,15 (1H, тд, CH-аром.), 7,35 (1H, тд, CH-аром.), 7,43 (1H, м, CH-аром.), 7,94 (1H, с, CH-аром.).
- 
Пример 66: (2R)-1-(4-(3-(2-хлор-6-фторфенил)-4-(метоксиметил)изоксазол-5-ил)-5-(трифторметил)-1H-пиразол-1-ил)пропан-2-ол
способ А, из (2R)-1-(4-(3-(2-хлор-6-фторфенил)-4-(гидроксиметил)изоксазол-5-ил)-5-(трифторметил)-1Н-пиразол-1-ил)пропан-2-ола (0,4 ммоль) в виде желтоватого масла (5%; пТСХ, элюент: петролейный эфир/этилацетат 1:1 и пТСХ, элюент: петролейный эфир/этилацетат 4:1).
Результат ЖХ/МС [M+H]+: 433,8;
1H ЯМР (CDCl3): δ 1,31 (3Н, д, СН3), 3,15 (3Н, с, СН3), 3,27 (1Н, м, СН), 4,19 (2Н, с, СН2), 4,27 (1Н, м, СН), 4,37 (2Н, м, ОН, СН), 7,15 (1Н, тд, СН-аром.), 7,35 (1Н, тд, СН-аром.), 7,43 (1Н, м, СН-аром.), 7,91 (1Н, с, СН-аром.).
- 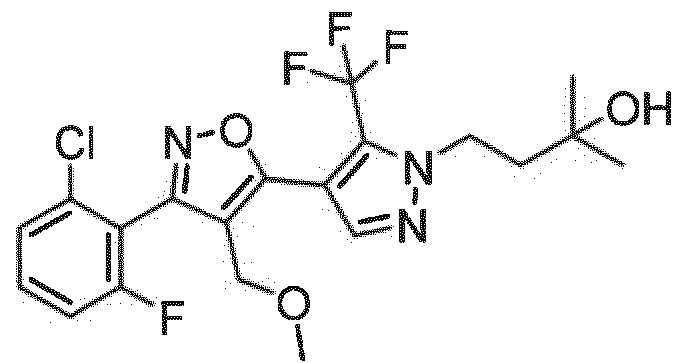
Пример 67: 4-{4-[3-(2-хлор-6-фторфенил)-4-(метоксиметил)-1,2-оксазол-5-ил]-5-(трифторметил)-1H-пиразол-1-ил}-2-метилбутан-2-ол
способ А, из 4-{4-[3-(2-хлор-6-фторфенил)-4-(гидроксиметил)-1,2-оксазол-5-ил]-5-(трифторметил)-1Н-пиразол-1-ил}-2-метилбутан-2-ола (1,5 ммоль) в виде бледно-желтого масла (29%; пТСХ, элюент: петролейный эфир/этилацетат 3:2 и пТСХ, элюент: CH2Cl2/MeOH 95:5).
Результат ЖХ/МС [M+H]+: 462,3;
1H ЯМР (CDCl3): δ 1,33 (6Н, с, 2хСН3), 2,13 (2Н, м, СН2), 3,13 (3Н, с, СН3), 4,19 (2Н, с, СН2), 4,53 (2H, м, CH2), 7,14 (1H, тд, CH-аром.), 7,35 (1H, д, CH-аром.), 7,42 (1H, м, CH-аром.), 7,85 (1H, с, CH-аром.).
- 
Пример 68: (2S)-1-(4-(3-(2-хлор-6-фторфенил)-4-(метоксиметил)изоксазол-5-ил)-5-(трифторметил)-1H-пиразол-1-ил)пропан-2-ол
способ А, из (2S)-1-(4-(3-(2-хлор-6-фторфенил)-4-(гидроксиметил)изоксазол-5-ил)-5-(трифторметил)-1Н-пиразол-1-ил)пропан-2-ола (0,3 ммоль) в виде желтоватого масла (6%; пТСХ, элюент: петролейный эфир/этилацетат 1:1 и пТСХ, элюент: CH2Cl2/MeOH 95:5).
Результат ЖХ/МС [M+H]+: 433,8;
1H ЯМР (CDCl3): δ 1,32 (3Н, д, СН3), 3,15 (3Н, с, СН3), 3,27 (1Н, м, СН), 4,20 (2Н, с, СН2), 4,26 (1Н, м, СН), 4,37 (2Н, м, ОН, СН), 7,15 (1Н, тд, СН-аром.), 7,35 (1Н, тд, СН-аром.), 7,43 (1Н, м, СН-аром.), 7,92 (1Н, с, СН-аром.).
- 
Пример 69: 3-(4-(3-(2-хлор-6-фторфенил)-4-(метоксиметил)изоксазол-5-ил)-5-(трифторметил)-1Н-пиразол-1-ил)-1-метилциклобутан-1-ол (син-конфигурация)
способ А, из 3-{4-[3-(2-хлор-6-фторфенил)-4-(гидроксиметил)-1,2-оксазол-5-ил]-5-(трифторметил)-1Н-пиразол-1-ил}-1-метилциклобутан-1-ола (син/анти-смесь) (0,5 ммоль) (17%; пТСХ, элюент: петролейный эфир/этилацетат 1:1 и пТСХ, элюент: CH2Cl2/MeOH 95:5; выделен только син-диастереомер).
1H ЯМР (CDCl3): δ 1,50 (3Н, с, СН3), 2,95-2,71 (4Н, м, 2хСН2), 3,14 (3Н, с, ОСН3), 4,19 (2Н, с, СН2), 4,72 (1Н, квинт., CH), 7,15 (1H, тд, CH-аром.), 7,35 (1H, д, CH-аром.), 7,49-7,38 (1H, м, CH-аром.), 7,91 (1H, с, CH-аром.).
- Примеры 70 и 71: 3-{4-[3-(2-хлор-6-фторфенил)-4-(метоксиметил)-1,2-оксазол-5-ил]-5-метил-1Н-пиразол-1-ил}-1-метилциклобутан-1-ол (син-конфигурация) и 3-{4-[3-(2-хлор-6-фторфенил)-4-(метоксиметил)-1,2-оксазол-5-ил]-5-метил-1Н-пиразол-1-ил}-1-метилциклобутан-1-ол (анти-конфигурация)
способ А, из 3-{4-[3-(2-хлор-6-фторфенил)-4-(гидроксиметил)-1,2-оксазол-5-ил]-5-метил-1Н-пиразол-1-ил}-1-метилциклобутан-1-ола (син/анти-смесь) (0,3 ммоль) (пТСХ, элюент: CH2Cl2/MeOH 95:5 и снова пТСХ, элюент: CH2Cl2/MeOH 95:5);
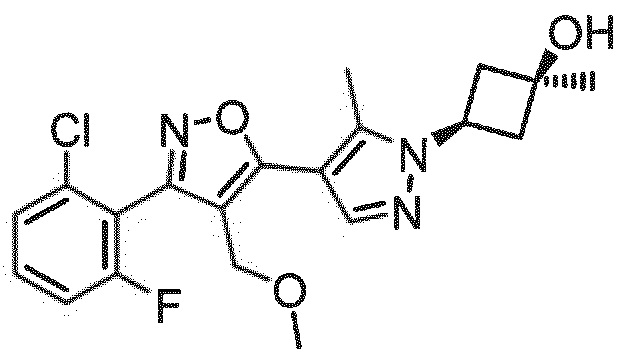
Пример 70: (син-конфигурация), выход 10%;
Результат ЖХ/МС [M+H]+: 406,3;
1H ЯМР (CDCl3): δ 1,52 (3Н, с, СН3), 2,59 (3Н, с, СН3), 2,64 (4Н, м, 2хСН2), 3,17 (3Н, с, СН3), 4,20 (2H, с, CH2), 4,95 (1H, м, CH), 7,14 (1H, тд, CH-аром.), 7,35 (1H, д, CH-аром.), 7,43 (1H, м, CH-аром.) 7,88 (1Н, с, СН-аром.).

Пример 71: (анти-конфигурация), выход 18%;
Результат ЖХ/МС [M+H]+: 406,3;
1H ЯМР (CDCl3): δ 1,54 (3Н, с, СН3), 2,59 (5Н, м, СН2, СН3), 2,76 (2Н, м, СН2), 3,20 (3Н, с, СН3), 4,24 (2H, с, CH2), 5,03 (1H, м, CH), 7,14 (1H, тд, CH-аром.), 7,34 (1H, д, CH-аром.), 7,42 (1H, м, CH-аром.), 7,90 (1Н, с, СН-аром.).
Примеры 72 и 73: 3-{4-[3-(2-хлорфенил)-4-(метоксиметил)-1,2-оксазол-5-ил]-5-метил-1Н-пиразол-1-ил}-1-метилциклобутан-1-ол (син-конфигурация) и 3-{4-[3-(2-хлорфенил)-4-(метоксиметил)-1,2-оксазол-5-ил]-5-метил-1Н-пиразол-1-ил}-1-метилциклобутан-1-ол (анти-конфигурация)
способ А, из 3-{4-[3-(2-хлорфенил)-4-(гидроксиметил)-1,2-оксазол-5-ил]-5-метил-1Н-пиразол-1-ил}-1-метилциклобутан-1-ола (син/анти-смесь) (0,3 ммоль) (пТСХ, элюент: CH2Cl2/MeOH 95:5 и снова пТСХ, элюент: CH2Cl2/MeOH 95:5);
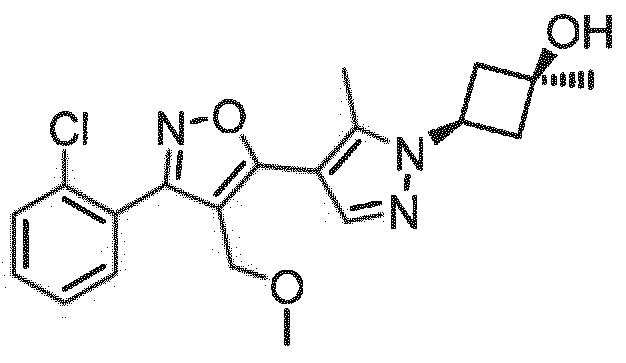
Пример 72: (син-конфигурация), выход 4%;
Результат ЖХ/МС [M+H]+: 388,3;
1H ЯМР (CDCl3): δ 1,48 (3Н, с, СН3), 2,59 (3Н, с, СН3), 2,72 (4Н, м, 2хСН2), 3,25 (3Н, с, СН3), 4,24 (2Н, с, СН2), 4,53 (1Н, квинт., СН), 7,45 (4Н, м, СН-аром.), 7,92 (1Н, с, СН-аром.).

Пример 73: (анти-конфигурация), выход 4%;
Результат ЖХ/МС [M+H]+: 388,3;
1H ЯМР (CDCl3): δ 1,53 (3Н, с, СН3), 2,58 (5Н, м, СН2, СН3), 2,77 (2Н, м, СН2), 3,25 (3Н, с, СН3), 4,24 (2Н, с, CH2), 5,03 (1H, квинт., CH), 7,45 (4H, м, CH-аром.), 7,89 (1H, с, CH-аром.).
 .
.
Пример 74: 3-(4-(3-(2-хлорфенил)-4-(метоксиметил)изоксазол-5-ил)-5-(трифторметил)-1Н-пиразол-1-ил)-1-метилциклобутан-1-ол (син-конфигурация)
способ А, из 3-{4-[3-(2-хлорфенил)-4-(гидроксиметил)-1,2-оксазол-5-ил]-5-(трифторметил)-1Н-пиразол-1-ил}-1-метилциклобутан-1-ола (син/анти-смесь (0,5 ммоль) (14%; пТСХ, элюент: петролейный эфир/этилацетат 1:1 и пТСХ, элюент: CH2Cl2/MeOH 95:5; выделен только син-диастереомер).
Результат ЖХ/МС [M+H]+: 441,9;
1H ЯМР (CDCl3): δ 1,49 (3Н, с, СН3), 2,90-2,72 (4Н, м, 2хСН2), 3,17 (3Н, с, ОСН3), 4,20 (2Н, с, ОСН2), 4,81 (1Н, м, CH), 5,04 (1H, уш., OH), 7,57-7,35 (4H, м, 4xCH-аром.), 7,90 (1H, с, CH-аром.).

Пример 75: (2S)-1-{4-[3-(2-хлорфенил)-4-[(2-метоксиэтокси)метил]-1,2-оксазол-5-ил]-5-(трифторметил)-1H-пиразол-1-ил}пропан-2-ол
способ В, из (2S)-1-{4-[3-(2-хлорфенил)-4-(гидроксиметил)-1,2-оксазол-5-ил]-5-(трифторметил)-1Н-пиразол-1-ил}пропан-2-ола (0,2 ммоль) и 2-бромэтилметилового эфира (57%; пТСХ, элюент: петролейный эфир/этилацетат 1:1 и пТСХ, элюент: CH2Cl2/MeOH 95:5).
Результат ЖХ/МС [M+H]+: 459,8;
1H ЯМР (CDCl3): δ 1,32 (3Н, д, СН3), 3,26 (3Н, с, ОСН3), 3,48-3,32 (5Н, м, 2хСН2 и СН), 4,24 (1Н, дд, СН), 4,47-4,30 (4H, м, 2xCH2), 7,48-7,34 (2H, м, 2xCH-аром.), 7,57-7,49 (2H, м, 2xCH-аром.), 7,98 (1H, с, CH-аром.).

Пример 76: (2R)-1-{4-[3-(2-хлор-6-фторфенил)-4-(этоксиметил)-1,2-оксазол-5-ил]-5-(трифторметил)-1H-пиразол-1-ил}пропан-2-ол
способ В, из (2R)-1-(4-(3-(2-хлор-6-фторфенил)-4-(гидроксиметил)изоксазол-5-ил)-5-(трифторметил)-1Н-пиразол-1-ил)пропан-2-ола (0,5 ммоль) и этилбромида (46%; пТСХ, элюент: петролейный эфир/этилацетат 1:1 и пТСХ, элюент: CH2Cl2/MeOH 95:5).
Результат ЖХ/МС [M+H]+: 447,8;
1H ЯМР (CDCl3): δ 0,99 (3Н, т, СН3), 1,32 (3Н, д, СН3), 3,28 (2Н, к, СН2), 4,31-4,18 (3Н, м, СН и СН2), 4,45-4,31 (2H, м, CH2), 7,14 (1H, тд, CH-аром.), 7,35 (1H, д, CH-аром.), 7,48-7,38 (1H, м, CH-аром.), 7,93 (1H, с, CH-аром.).

Пример 77: 4-{4-[3-(2-хлор-6-фторфенил)-4-(циклопропоксиметил)-1,2-оксазол-5-ил]-5-(трифторметил)-1H-пиразол-1-ил}-2-метилбутан-2-ол
способ C, из 4-{4-[4-(бромметил)-3-(2-хлор-6-фторфенил)-1,2-оксазол-5-ил]-5-(трифторметил)-1H-пиразол-1-ил}-2-метилбутан-2-ола (0,25 ммоль) и циклопропанола в виде бледно-желтого масла (11%).
Результат ЖХ/МС [M+H]+: 488,30;
1H ЯМР (CDCl3): δ 0,28 (3Н, с, СН3), 1,33 (6Н, с, 2хСН3), 2,14 (2Н, м, СН2), 3,12 (1Н, м, СН), 4,27 (2Н, с, СН2), 4,53 (2Н, м, СН2), 7,14 (1Н, тд, СН-аром.), 7,34 (1Н, т, СН-аром.), 7,43 (1Н, м, СН-аром.), 7,85 (1Н, с, СН-аром.).

Пример 78: 4-{4-[3-(2-хлорфенил)-4-(циклопропоксиметил)-1,2-оксазол-5-ил]-5-(трифторметил)-1Н-пиразол-1-ил}-2-метилбутан-2-ол
способ C, из 4-{4-[4-(бромметил)-3-(2-хлорфенил)-1,2-оксазол-5-ил]-5-(трифторметил)-1Н-пиразол-1-ил}-2-метилбутан-2-ола (0,25 ммоль) и циклопропанола в виде бесцветного масла (28%).
Результат ЖХ/МС [M+H]+: 470,30;
1H ЯМР (CDCl3): δ 0,30 (4Н, м, 2хСН2), 1,33 (6Н, с, 2хСН3), 2,13 (2Н, м, СН2), 3,12 (1Н, м, СН), 4,29 (2Н, с, CH2), 4,53 (2H, м, CH2), 7,44 (5H, м, CH-аром.), 7,84 (1H, с, CH-аром.).
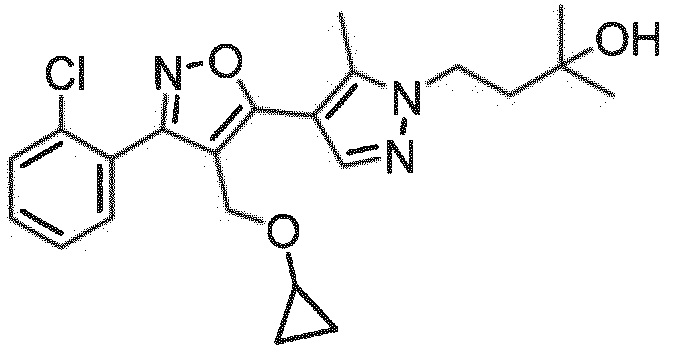
Пример 79: 4-{4-[3-(2-хлорфенил)-4-(циклопропоксиметил)-1,2-оксазол-5-ил]-5-метил-1Н-пиразол-1-ил}-2-метилбутан-2-ол
способ C, из 4-{4-[4-(бромметил)-3-(2-хлорфенил)-1,2-оксазол-5-ил]-5-метил-1Н-пиразол-1-ил}-2-метилбутан-2-ола (0,25 ммоль) и циклопропанола (6%).
Результат ЖХ/МС [M+H]+: 416,0;
1H ЯМР (CDCl3): δ 0,34 (2Н, м, CH2), 0,41 (2Н, м, CH2), 1,27 (6Н, с, 2хСН3), 2,03 (2Н, м, СН2), 2,61 (3Н, с, СН3), 3,18 (1Н, м, СН), 4,32 (2Н, м, СН2), 4,34 (2Н, с, СН2), 7,43 (3Н, м, СН-аром.) 7,53 (1Н, д, СН-аром.), 7,87 (1Н, с, СН-аром.).
- Пример 80 и 81: 3-{4-[3-(2-хлорфенил)-4-(циклопропоксиметил)-1,2-оксазол-5-ил]-5-метил-1Н-пиразол-1-ил}-1-метилциклобутан-1-ол, син- и анти-конфигурация
способ C, из 3-{4-[4-(бромметил)-3-(2-хлорфенил)-1,2-оксазол-5-ил]-5-метил-1Н-пиразол-1-ил}-1-метилциклобутан-1-ола (син/анти-смесь) (0,2 ммоль) и циклопропанола;

Пример 80: (син-конфигурация), выход 2%;
Результат ЖХ/МС [M+H]+: 414,3;
1H ЯМР (CDCl3): δ 0,33 (2Н, м, СН2), 0,40 (2Н, м, СН2), 1,47 (3Н, с, СН3), 2,57 (3Н, с, СН3), 2,63 (2Н, м, СН2), 2,75 (2Н, м, СН2), 3,16 (1Н, м, СН), 3,76 (1Н, м, СН), 4,31 (2Н, с, СН2), 7,44 (4Н, м, СН-аром.), 7,85 (1Н, с, СН-аром.).

Пример 81: (анти-конфигурация), выход 4%.
Результат ЖХ/МС [M+H]+: 414,3;
1H ЯМР (CDCl3): δ 0,34 (2Н, м, СН2), 0,42 (2Н, м, СН2), 1,57 (3Н, с, СН3), 2,58 (5Н, м, СН2, СН3), 2,77 (2Н, м, СН2), 3,18 (1Н, м, СН), 4,33 (2Н, с, СН2), 5,03 (1Н, м, СН), 7,45 (4Н, м, СН-аром.), 7,89 (1Н, с, СН-аром.).
- 
Пример 82: 4-{4-[3-(2-хлор-6-фторфенил)-4-(циклопропоксиметил)-1,2-оксазол-5-ил]-5-метил-1Н-пиразол-1-ил}-2-метилбутан-2-ол
способ C, из 4-{4-[4-(бромметил)-3-(2-хлор-6-фторфенил)-1,2-оксазол-5-ил]-5-метил-1Н-пиразол-1-ил}-2-метилбутан-2-ола (0,3 ммоль) и циклопропанола в виде желтоватого масла (19%).
Результат ЖХ/МС [M+H]+: 434,1;
1H ЯМР (CDCl3): δ 0,41-0,26 (4Н, м, 2хСН2), 1,30 (6Н, с, 2хСН3), 2,04 (2Н, т, СН2), 2,63 (3Н, с, СН3), 3,23-3,14 (1Н, м, СН), 4,35-4,27 (4Н, м, 2хСН2), 7,14 (1Н, тд, СН-аром.), 7,34 (1Н, д, СН-аром.), 7,48-7,38 (1Н, м, СН-аром.), 7,89 (1Н, с, СН-аром.).
- Пример 83 и 84: 3-{4-[3-(2-хлор-6-фторфенил)-4-(циклопропоксиметил)-1,2-оксазол-5-ил]-5-метил-1Н-пиразол-1-ил}-1-метилциклобутан-1-ол, син- и анти-конфигурация
способ C, из 3-{4-[4-(бромметил)-3-(2-хлор-6-фторфенил)-1,2-оксазол-5-ил]-5-метил-1Н-пиразол-1-ил}-1-метилциклобутан-1-ола (син/анти-смесь) (0,4 ммоль) и циклопропанола в виде бесцветного масла (дополнительная пТСХ, элюент: петролейный эфир/этилацетат 1:1);

Пример 83: (син-конфигурация), выход 15%;
Результат ЖХ/МС [M+H]+: 432,3;
1H ЯМР (CDCl3): δ 0,30 (2Н, м, СН2), 0,36 (2Н, м, СН2), 1,47 (3Н, с, СН3), 1,76 (1Н, с, ОН), 2,58 (3Н, с, СН3), 2,72 (2Н, м, СН2), 2,74 (2Н, м, СН2), 3,18 (1Н, м, СН), 4,33 (2Н, с, СН2), 4,53 (1Н, квинт., СН), 7,14 (1H, тд, CH-аром.), 7,34 (1H, д, CH-аром.), 7,42 (1H, м, CH-аром.), 7,95 (1H, с, CH-аром.).

Пример 84: (анти-конфигурация), выход 16%;
Результат ЖХ/МС [M+H]+: 432,3;
1H ЯМР (CDCl3): δ 0,31 (2Н, м, СН2), 0,36 (2Н, м, СН2), 1,53 (3Н, с, СН3), 1,68 (1Н, с, ОН), 2,57 (5Н, м, СН3, СН2), 2,75 (2Н, м, СН2), 3,18 (1Н, м, СН), 4,32 (2Н, с, СН2), 5,03 (1Н, квинт., СН), 7,13 (1Н, тд, СН-аром.), 7,34 (1H, д, CH-аром.), 7,42 (1H, м, CH-аром.), 7,91 (1H, с, CH-аром.).
- 
Пример 85: (2R)-1-(4-(3-(2-хлор-6-фторфенил)-4-(циклопропоксиметил)изоксазол-5-ил)-5-(трифторметил)-1H-пиразол-1-ил)пропан-2-ол
способ C, из (2R)-1-{4-[4-(бромметил)-3-(2-хлор-6-фторфенил)-1,2-оксазол-5-ил]-5-(трифторметил)-1Н-пиразол-1-ил}пропан-2-ола (0,3 ммоль) и циклопропанола (9%).
Результат ЖХ/МС [M+H]+: 459,8;
1H ЯМР (CDCl3): δ 0,94-0,80 (4Н, м, 2хСН2), 1,32 (3Н, д, СН3), 3,19-3,07 (1Н, м, СН), 4,25 (1Н, дд, СН), 4,27 (2Н, с, ОСН2), 4,45-4,32 (2Н, м, СН2), 7,15 (1Н, тд, СН-аром.), 7,35 (1Н, дт, СН-аром.), 7,49-7,39 (1Н, м, СН-аром.), 7,92 (1Н, с, СН-аром.).
- 
Пример 86: 3-(4-(3-(2-хлор-6-фторфенил)-4-(циклопропоксиметил)изоксазол-5-ил)-5-(трифторметил)-1H-пиразол-1-ил)-1-метилциклобутан-1-ол (син-конфигурация)
способ C, из 3-{4-[4-(бромметил)-3-(2-хлор-6-фторфенил)-1,2-оксазол-5-ил]-5-(трифторметил)-1Н-пиразол-1-ил}-1-метилциклобутан-1-ола (син/анти-смесь) (0,2 ммоль) и циклопропанола (52%; выделен только син-диастереомер).
Результат ЖХ/МС [M+H]+: 486,0;
1H ЯМР (CDCl3): δ 0,27 (4Н, д, 2хСН2), 1,50 (3Н, с, СН3), 2,91-2,71 (4Н, м, 2хСН2), 3,16-3,08 (1Н, м, СН), 4,26 (2Н, с, ОСН2), 4,81-4,65 (1Н, м, СН), 7,14 (1Н, тд, СН-аром.), 7,34 (1Н, дт, СН-аром.), 7,48-7,38 (1Н, м, СН-аром.), 7,91 (1Н, с, СН-аром.).
- 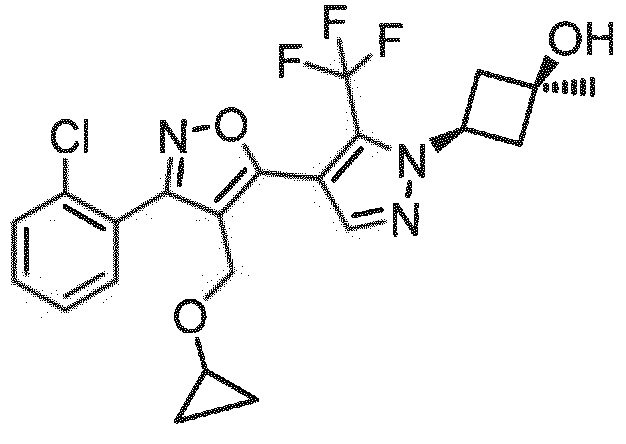
Пример 87: 3-{4-[3-(2-хлорфенил)-4-(циклопропоксиметил)-1,2-оксазол-5-ил]-5-(трифторметил)-1Н-пиразол-1-ил}-1-метилциклобутан-1-ол (син-конфигурация)
способ C, из 3-{4-[4-(бромметил)-3-(2-хлорфенил)-1,2-оксазол-5-ил]-5-(трифторметил)-1Н-пиразол-1-ил}-1-метилциклобутан-1-ола (син/анти-смесь) (0,25 ммоль) и циклопропанола (26%; выделен только син-диастереомер).
Результат ЖХ/МС [M+H]+: 467,9;
1H ЯМР (CDCl3): δ 0,35-0,25 (4Н, м, 2хСН2), 1,50 (3Н, с, СН3), 2,91 (4Н, уш., 2хСН2), 3,17-3,07 (1Н, м, СН), 4,29 (2Н, с, ОСН2), 4,72 (1Н, квинт., СН), 7,56-7,34 (4Н, м, 4хСН-аром.), 7,89 (1Н, с, СН-аром.).
- 
Пример 88: (S)-1-(4-(3-(2-хлорфенил)-4-((оксетан-3-илокси)метил)изоксазол-5-ил)-5-(трифторметил)-1H-пиразол-1-ил)пропан-2-ол
способ C, из (2S)-1-{4-[4-(бромметил)-3-(2-хлорфенил)-1,2-оксазол-5-ил]-5-(трифторметил)-1Н-пиразол-1-ил}пропан-2-ола (0,25 ммоль) и оксетан-3-ола (11%).
Результат ЖХ/МС [M+H]+: 458,3;
1H ЯМР (CDCl3): δ 1,32 (3Н, д, СН3), 4,21 (2Н, с, ОСН2), 4,46-4,23 (6Н, м, 2хСН2 и 2хСН), 4,59-4,51 (2Н, м, СН2), 7,58-7,37 (4H, м, 4xCH-аром.), 7,91 (1H, с, CH-аром.).
- 
Пример 89: (2R)-1-{4-[3-(2-хлор-6-фторфенил)-4-[(пропан-2-илокси)метил]-1,2-оксазол-5-ил]-5-(трифторметил)-1H-пиразол-1-ил}пропан-2-ол
способ D, из (2R)-1-{4-[4-(бромметил)-3-(2-хлор-6-фторфенил)-1,2-оксазол-5-ил]-5-(трифторметил)-1H-пиразол-1-ил}пропан-2-ола (0,25 ммоль) и изопропанола (21%).
Результат ЖХ/МС [M+H]+: 462,1;
1H ЯМР (CDCl3): δ 0,92 (6Н, д, 2хСН3), 1,32 (3Н, д, СН3), 3,28 (1Н, уш., ОН), 3,40 (1Н, септ, СН), 4,29-4,19 (3Н, м, CH и CH2), 4,45-4,31 (2H, м, CH2), 7,14 (1H, тд, CH-аром.), 7,34 (1H, д, CH-аром.), 7,47-7,38 (1H, м, CH-аром.), 7,93 (1Н, с, СН-аром.).
- 
Пример 90: (2R)-1-(4-(3-(2-хлор-6-фторфенил)-4-(циклобутоксиметил)изоксазол-5-ил)-5-(трифторметил)-1H-пиразол-1-ил)пропан-2-ол
способ C, из (2R)-1-{4-[4-(бромметил)-3-(2-хлор-6-фторфенил)-1,2-оксазол-5-ил]-5-(трифторметил)-1Н-пиразол-1-ил}пропан-2-ола (0,25 ммоль) и циклобутанола (17%).
Результат ЖХ/МС [M+H]+: 474,1;
1H ЯМР (CDCl3): δ 1,31 (3Н, д, СН3), 1,74-1,55 (4Н, м, 2хСН2), 2,02-1,88 (2Н, м, СН2), 3,27 (1Н, уш., ОН), 3,75 (1Н, квинт, СН), 4,14 (2Н, с, СН), 4,25 (1Н, д, СН), 4,45-4,31 (2Н, м, СН2), 7,15 (1Н, тд, СН-аром.), 7,35 (1Н, д, СН-аром.), 7,49-7,39 (1Н, м, СН-аром.), 7,94 (1Н, с, СН-аром.).
- 
Пример 91: 4-{4-[3-(2-хлор-3-метоксифенил)-4-(циклопропоксиметил)-1,2-оксазол-5-ил]-5-(трифторметил)-1H-пиразол-1-ил}-2-метилбутан-2-ол
1.) 4-(4-(3-(3-(бензилокси)-2-хлорфенил)-4-(циклопропоксиметил)изоксазол-5-ил)-5-(трифторметил)-1Н-пиразол-1-ил)-2-метилбутан-2-ол
способ C, из 4-(4-(3-(3-(бензилокси)-2-хлорфенил)-4-(бромметил)изоксазол-5-ил)-5-(трифторметил)-1Н-пиразол-1-ил)-2-метилбутан-2-ола (1,0 ммоль) и циклопропанола в виде бесцветного масла (20%).
Результат ЖХ/МС [M+H]+: 576,5;
1H ЯМР (CDCl3): δ 0,38-0,20 (4H, м, 2xCH2), 1,32 (6H, с, 2xCH3), 2,19 (2H, м, CH2), 3,14-3,06 (1H, м, OH), 4,58-4,47 (2H, м, CH2), 5,22 (2H, с, OCH2), 5,23 (2H, с, OCH2), 7,10 (1H, тд, CH-аром.), 7,52-7,28 (6H, м, 6xCH-аром.), 7,84 (1Н, с, СН-аром.).
2.) 2-хлор-3-[4-(циклопропоксиметил)-5-[1-(3-гидрокси-3-метилбутил)-5-(трифторметил)-1Н-пиразол-4-ил]-1,2-оксазол-3-ил]фенол
4-(4-(3-(3-(бензилокси)-2-хлорфенил)-4-(циклопропоксиметил)изоксазол-5-ил)-5-(трифторметил)-1H-пиразол-1-ил)-2-метилбутан-2-ол (0,2 ммоль) растворяли в iPrOH/этилацетат (1:1; 1 мл) и добавляли Pd/C (10%; 0,3 экв.). Атмосферу заменяли водородом и смесь перемешивали при комнатной температуре в течение 18 ч. Смесь отфильтровывали через целит, осадок на фильтре промывали этилацетатом и фильтрат концентрировали при пониженном давлении с получением неочищенного материала (желтое масло; 90%), который использовали как таковой для следующей стадии.
Результат ЖХ/МС [M+H]+: 486,3;
1H ЯМР (CDCl3): δ 0,38-0,24 (4H, м, 2xCH2), 1,32 (6H, с, 2xCH3), 2,18-2,08 (2H, м, CH2), 3,18-3,06 (1H, м, CH), 4,26 (2H, с, OCH2), 4,58-4,45 (2H, м, CH2), 7,20-6,97 (2H, м, 2xCH-аром.), 7,84 (1H, с, CH-аром.).
3.) NaH (1,4 экв.) суспендировали в ТГФ (Sure/Seal; 2 мл/ммоль) и раствор охлаждали до 0°C. Раствор 2-хлор-3-[4-(циклопропоксиметил)-5-[1-(3-гидрокси-3-метилбутил)-5-(трифторметил)-1Н-пиразол-4-ил]-1,2-оксазол-3-ил]фенола (0,6 ммоль) в ТГФ (Sure/Seal: 4 мл/ммоль) добавляли по каплям к смеси. Смесь перемешивали при 0°C в течение 15 мин, затем добавляли MeI (3,3 экв.). Смесь оставляли нагреваться до комнатной температуры и перемешивали при данной температуре в течение 18 ч. Добавляли воду и смесь экстрагировали CH2Cl2 и этилацетатом. Объединенные органические слои высушивали над MgSO4, отфильтровывали и концентрировали при пониженном давлении. Указанное в заголовке соединение получали с помощью препаративной ТСХ на силикагеле (элюент: CH2Cl2/MeOH 98:2 и петролейный эфир/этилацетат 3:2) в виде желтого масла (выход 16%).
Результат ЖХ/МС [M+H]+: 500,40
1H ЯМР (CDCl3): δ 0,30 (4Н, м, 2хСН2), 1,32 (6Н, с, 2хСН3), 2,13 (2Н, м, СН2), 3,11 (1Н, м, СН), 3,96 (3Н, с, CH3), 4,29 (2H, с, CH2), 4,53 (2H, м, CH2), 7,07 (2H, м, CH-аром.), 7,34 (1H, т, CH-аром.), 7,84 (1H, с, CH-аром.).
- 
Пример 92: 3-(4-(3-(2-хлор-3-(2-морфолиноэтокси)фенил)-4-(циклопропоксиметил)изоксазол-5-ил)-5-(трифторметил)-1Н-пиразол-1-ил)-1-метилциклобутан-1-ол (син-конфигурация)
1.) 3-(4-(3-(3-(бензилокси)-2-хлорфенил)-4-(циклопропоксиметил)изоксазол-5-ил)-5-(трифторметил)-1Н-пиразол-1-ил)-1-метилциклобутан-1-ол (син/анти-смесь)
способ C, из 3-(4-(3-(3-(бензилокси)-2-хлорфенил)-4-(бромметил)изоксазол-5-ил)-5-(трифторметил)-1Н-пиразол-1-ил)-1-метилциклобутан-1-ола (син/анти-смесь) (0,30 ммоль) и циклопропанола в виде бесцветного масла (28%).
Результат ЖХ/МС [M+H]+: 574,3;
1H ЯМР (CDCl3): δ 0,58-0,24 (4H, м, 2xCH2), 1,49 (3H, с, CH3), 2,92-2,68 (4H, м, 2xCH2), 3,17-3,05 (1H, м, CH), 4,29 (2H, с, OCH2), 4,80-4,64 (1H, м, CH), 5,24 (2H, с, OCH2), 7,13-7,07 (1H, м, CH-аром.), 7,44-7,28 (5H, м, 5xCH-аром.), 7,52-7,46 (1H, м, CH-аром.), 7,90 (1H, с, CH-аром.).
2.) 2-хлор-3-(4-(циклопропоксиметил)-5-(1-(3-гидрокси-3-метилциклобутил)-5-(трифторметил)-1Н-пиразол-4-ил)изоксазол-3-ил)фенол (син/анти-смесь)
О-дебензилирование достигали в соответствии с методикой, описанной для Примера 91, стадия 2; исходя из 3-(4-(3-(3-(бензилокси)-2-хлорфенил)-4-(циклопропоксиметил)изоксазол-5-ил)-5-(трифторметил)-1Н-пиразол-1-ил)-1-метилциклобутан-1-ола (син/анти-смесь) (0,09 ммоль) (время реакции 1 ч). Неочищенный материал получали в виде бесцветного масла с выходом 52%.
Результат ЖХ/МС [M+H]+: 484,3;
3.) 2-хлор-3-(4-(циклопропоксиметил)-5-(1-(3-гидрокси-3-метилциклобутил)-5-(трифторметил)-1Н-пиразол-4-ил)изоксазол-3-ил)фенол (син/анти-смесь) (0,045 ммоль) и K2CO3 (3,0 экв.) суспендировали в сухом ДМФ (Sure/Seal; 1 мл). Добавляли N-(2-хлорэтил)морфолина гидрохлорид (1,2 экв.) и смесь перемешивали при 50°C в течение 2,5 ч. Смесь распределяли между водой и CH2Cl2, объединенные органические слои высушивали над MgSO4 и концентрировали при пониженном давлении. Указанное в заголовке соединение выделяли из преп. ТСХ на силикагеле (элюент: петролейный эфир/этилацетат 1:1) (выход 14%).
Результат ЖХ/МС [M+H]+: 597,3;
1H ЯМР (CDCl3): δ 0,30 (4Н, м, 2хСН2), 2,64 (4Н, м, 2хСН2), 2,80 (4Н, м, 2хСН2), 2,89 (2Н, т, СН2), 3,10 (1Н, м, СН), 3,73 (4Н, м, 2хСН2), 4,24 (2Н, т, СН2), 4,27 (2Н, с, СН2), 4,72 (1Н, м, СН), 7,08 (2Н, м, СН-аром.), 7,31 (1Н, т, СН-аром.), 7,89 (1Н, с, СН-аром.).
- 
Пример 93: метил-5-[1-(2-гидрокси-2-метилпропил)-5-(трифторметил)-1Н-пиразол-4-ил]-3-(2-гидроксипиридин-3-ил)-1,2-оксазол-4-карбоксилат
Метил-5-(1-(2-гидрокси-2-метилпропил)-5-(трифторметил)-1Н-пиразол-4-ил)-3-(2-метоксипиридин-3-ил)изоксазол-4-карбоксилат (синтезировали аналогично Примеру 21, используя 1-гидразинил-2-метилпропан-2-ол вместо (R)-1-гидразинилпропан-2-ола; 0,025 ммоль) и иодид натрия (3,0 экв.) перемешивали вместе в ацетонитриле (0,150 мл). К данному раствору по каплям добавляли хлортриметилсилан (3,0 экв.). Смесь перемешивали при комнатной температуре в течение 2 ч, затем разбавляли этилацетатом. Органическую фазу промывали водой и насыщенным водн. NaHCO3 и высушивали над MgSO4, отфильтровывали и концентрировали при пониженном давлении с получением указанного в заголовке соединения в виде бледно-желтого масла (82%).
Результат ЖХ/МС [M+H]+: 433,8;
1H ЯМР (CDCl3): δ 1,24 (6Н, с, 2хСН3), 3,67 (3Н, с, СН3), 4,30 (2Н, с, СН2), 6,43 (1Н, тд, СН-аром.), 7,48 (1Н, дд, CH-аром.), 7,85 (1H, дд, CH-аром.), 8,06 (1H, с, CH-аром.).
- 
Пример 94: (2R)-1-(4-(3-(2-хлор-6-фторфенил)изоксазол-5-ил)-5-(трифторметил)-1H-пиразол-1-ил)пропан-2-ол
1. Гидроксильную группу спиртового фрагмента этил-3-(2-хлор-6-фторфенил)-5-{1-[(2R)-2-гидроксипропил]-5-(трифторметил)-1Н-пиразол-4-ил}-1,2-оксазол-4-карбоксилата (Пример 12) защищали TBS в соответствии со способом A, «Общее O-силилирование», описанным ниже;
2. Этилоксазол-4-карбоксилатная группа была омылена в соответствии с методикой, описанной в качестве первой стадии в «Синтезе 4-ацилизоксазолов» выше;
3. Декарбоксилирование полученной оксазол-4-карбоновой кислоты проводили в соответствии с Adv. Synth. Catal. 2013, 355, 790 (Таблица 3, позиция 15), используя каталитический оксид Cu(I) и TMEDA в NMP при 140°C, одновременно удаляя силильную защитную группу с получением указанного в заголовке соединения при очистке с помощью преп. ТСХ (элюент: петролейный эфир/этилацетат 1:1) с выходом 15%.
Результат ЖХ/МС [M+H]+: 389,8;
1H ЯМР (CDCl3): δ 1,31 (3Н, д, СН3), 4,24 (1Н, дд, СН), 4,44-4,31 (2Н, м, СН2), 6,62 (1Н, с, СН-аром.), 7,14 (1H, тд, CH-аром.), 7,46-7,31 (2H, м, 2xCH-аром.), 8,04 (1H, с, CH-аром.).
- 
Пример 95: 1-{4-[3-(2-хлор-6-фторфенил)-4-(метоксиметил)-1,2-оксазол-5-ил]-5-(трифторметил)-1H-пиразол-1-ил}(2-2Н)пропан-2-ол (рацемический)
К перемешиваемому раствору Примера 66 (0,25 ммоль) в CH2Cl2 (1,5 мл) добавляли периодинан Десса-Мартина (3,5 экв.). Реакционную смесь перемешивали при комнатной температуре в течение 18 ч. Реакционную смесь гасили добавлением водн. Na2S2O3 и экстрагировали CH2Cl2. Объединенные органические слои промывали насыщенным водн. NaHCO3 и солевым раствором, высушивали над безводным Na2SO4 и концентрировали при пониженном давлении. Остаток очищали с помощью преп. ТСХ на силикагеле (элюент: петролейный эфир/этилацетат 3:1) с получением 1-{4-[3-(2-хлор-6-фторфенил)-4-(метоксиметил)-1,2-оксазол-5-ил]-5-(трифторметил)-1Н-пиразол-1-ил}пропан-2-она (41%).
Данный пропанон растворяли в ТГФ (10 мл/ммоль) и охлаждали до 0°С. Добавляли NaBD4 (1,1 экв.) и смесь перемешивали при 0°С в течение 1 ч. Смесь гасили водой и распределяли между CH2Cl2 и водой. Объединенные органические слои высушивали над MgSO4, отфильтровывали и концентрировали при пониженном давлении. Указанное в заголовке соединение очищали с помощью препаративной ТСХ на силикагеле (элюент: CH2Cl2/MeOH 95:5) и выделяли с выходом 65%.
Результат ЖХ/МС [M+H]+: 435,1;
1H ЯМР (CDCl3): δ 1,31 (3Н, с, СН3), 3,14 (3Н, с, ОСН3), 3,24 (1Н, с, ОН), 4,19 (2Н, с, СН2), 4,31 (2Н, к, СН2), 7,15 (1Н, тд, СН-аром.), 7,35 (1Н, д, СН-аром.), 7,49-7,38 (1Н, м, СН-аром.), 7,91 (1Н, с, СН-аром.).
- 
Пример 96: (2S)-1-{4-[3-(2-хлорфенил)-4-(оксолан-2-ил)-1,2-оксазол-5-ил]-5-(трифторметил)-1H-пиразол-1-ил}пропан-2-ол (в виде смеси диастереомеров)
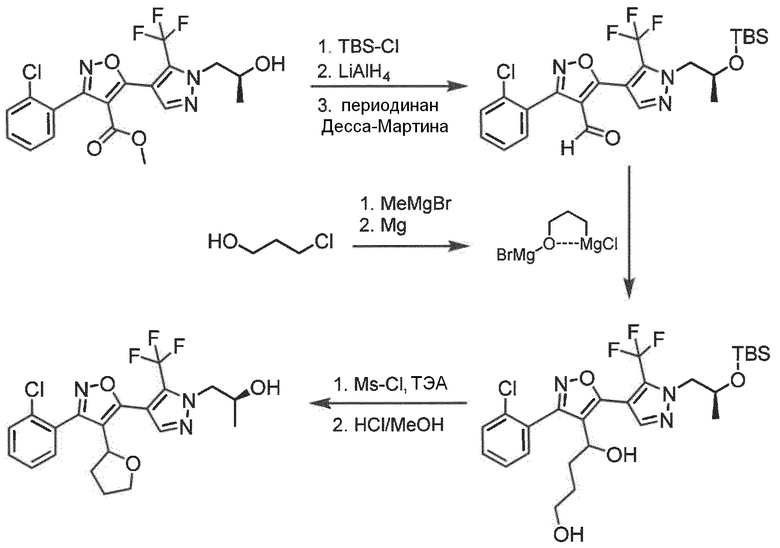
Исходя из метил-(2S)-3-(2-хлорфенил)-5-(1-(2-гидроксипропил)-5-(трифторметил)-1Н-пиразол-4-ил)изоксазол-4-карбоксилата (Пример 22), спиртовая группа была защищена трет-бутилдиметилсилилом (ср. ниже «Общие методики O-силилирования», способ A), метилизоксазол-4-карбоксилат восстанавливали с использованием LiAlH4 (ср. общую методику в качестве первой стадии, описанной выше в «Синтезе 4-алкоксиметилизоксазолов») и окисляли периодинаном Десса-Мартина с получением соответствующего изоксазол-4-альдегида (64%; ср. первую стадию, описанную выше для Примера 95). Реактив Гриньяра готовили из 3-хлорпропан-1-ола и MeMgBr (1,0 экв., 1 М в ТГФ) в ТГФ при 0°С с последующим добавлением Mg (2,0 экв.) и 1,2-дибромэтана (0,1 экв.) и перемешиванием при нагревании с обратным холодильником в течение 20 мин. После охлаждения до комнатной температуры раствор отделяли от остального магния и непосредственно добавляли к (2S)-5-(1-(2-((трет-бутилдиметилсилил)окси)пропил)-5-(трифторметил)-1H-пиразол-4-ил)-3-(2-хлорфенил)изоксазол-4-карбальдегиду в ТГФ с получением 1-(5-(1-((2S)-2-((трет-бутилдиметилсилил)окси)пропил)-5-(трифторметил)-1Н-пиразол-4-ил)-3-(2-хлорфенил)изоксазол-4-ил)бутан-1,4-диола с выходом 60%. Циклизацию бутан-1,4-диольного фрагмента в соответствующее тетрагидрофурановое кольцо достигали с мезилхлоридом в ТГФ и триэтиламином при нагревании с обратным холодильником с выходом 31%. Окончательное снятие О-защиты с помощью HCl/MeOH (3,0 М) (описанное ниже как стадия 2 в «Реакции циклоприсоединения») предоставляло указанное в заголовке соединение в виде смеси диастереомеров с выходом 31%.
Результат ЖХ/МС [M+H]+: 442,3;
1H ЯМР (CDCl3): δ 1,31 (3Н, д, СН3), 1,69-1,39 (4Н, м, 2хСН2), 3,66-3,47 (2Н, м, СН2), 4,22 (1Н, дд, ОСН2), 4,44-4,29 (2H, м, CH2), 4,65 (1H, т, CH), 7,55-7,32 (4H, м, 4xCH-аром.), 7,83 (1H, с, CH-аром.).
Альтернативный путь к пиразолилизоксазолам

Синтез 2-(диметиламино)метилен)-оксобутаноатов
А) этил-2-((диметиламино)метилен)-4,4,4-трифтор-3-оксобутаноат

К раствору этил-4,4,4-трифтор-3-оксобутаноата (18,5 г, 77,3 ммоль) в толуоле (30,0 мл) при 0°C добавляли (диметоксиметил)диметиламин (9,21 г, 77,3 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение прибл. 3 ч до полного расходования этил-4,4,4-трифтор-3-оксобутаноата. Толуол удаляли при пониженном давлении. Остаток очищали с помощью колоночной хроматографии на силикагеле с получением этил-2-((диметиламино)метилен)-4,4,4-трифтор-3-оксобутаноата (15 г, выход: 81%).
Результат ЖХ/МС [M+H]+: 240,0;
1H ЯМР (CDCl3): δ 1,30 (3Н, т, СН3), 2,90 (3Н, уш., NCH3), 3,32 (3Н, уш., NCH3), 4,22 (2Н, к, ОСН2), 7,68 (1Н, с, СН).
B) метил-2-((диметиламино)метилен)-3-оксобутаноат или этил-2-((диметиламино)метилен)-3-оксобутаноат

Метил или этилацетоацетат (20 ммоль) растворяли в N, N-диметилформамиде, диметилацетале (3,0 экв.) и смесь нагревали с помощью микроволнового излучения до 80°C в течение 3 ч. Реакционную смесь концентрировали при пониженном давлении и неочищенный материал (коричневое масло) растворяли в небольшом объеме этилацетата и кристаллизовали, добавляя петролейный эфир, с получением продукта в виде коричневого твердого вещества (53-62%).
Метиловый эфир:
Результат ЖХ/МС [M+H]+: 172,0;
1H ЯМР (CDCl3): δ 2,32 (3Н, с, СН3), 3,04 (6Н, уш., 2хNCH3), 3,75 (3Н, с, СН3), 7,70 (1Н, с, СН).
Этиловый эфир:
Результат ЖХ/МС [M+H]+: 186,0;
1H ЯМР (CDCl3): δ 1,32 (3Н, т, СН3), 2,32 (3Н, с, СН3), 3,03 (6Н, уш., 2хNCH3), 4,23 (2Н, к, ОСН2), 7,66 (1Н, с, СН).
Образование пиразольных структурных элементов из 2-(диметиламино)метилен)оксобутаноатов
К раствору или этил-2-((диметиламино)метилен)-4,4,4-трифтор-3-оксобутаноата, или метил- или этил-2-((диметиламино)метилен)-3-оксобутаноата (10,0 ммоль) в EtOH (5 мл/ммоль) добавляли N, N-диизопропилэтиламин (3,0 экв.) и соответствующий гидразиниловый спирт (обычно в виде гидрохлорида; 1,1 экв.). Реакционную смесь перемешивали при комнатной температуре в течение 18 ч. Смесь распределяли между водой и этилацетатом, объединенные органические слои промывали солевым раствором и высушивали над MgSO4, отфильтровывали и концентрировали при пониженном давлении.
- 
С использованием этил-2-((диметиламино)метилен)-4,4,4-трифтор-3-оксобутаноата и (R)-1-гидразинилпропан-2-ола гидрохлорида: Остаток очищали с помощью колоночной хроматографии на силикагеле (элюент: петролейный эфир эфир/этилацетат 3:1), получая этил-(R)-1-(2-гидроксипропил)-5-(трифторметил)-1Н-пиразол-4-карбоксилат (выход 82%);
Результат ЖХ/МС [M+H]+: 267,0;
1H ЯМР (CDCl3): δ 1,27 (3Н, д, СН3), 1,36 (3Н, т, СН3), 3,00 (1Н, д, ОН), 4,31-4,17 (2Н, м, СН2), 4,34 (2Н, к, CH2), 7,98 (1H, с, CH-аром.).
- 
С использованием этил-2-((диметиламино)метилен)-4,4,4-трифтор-3-оксобутаноата и 4-гидразинил-2-метилбутан-2-ола: неочищенный этил-1-(3-гидрокси-3-метилбутил)-5-(трифторметил)-1Н-пиразол-4-карбоксилат получали в виде оранжевого масла (79%);
Результат ЖХ/МС [M+H]+: 295,3;
1H ЯМР (CDCl3): δ 1,29 (6Н, с, 2хСН3), 1,35 (3Н, т, СН3), 2,09-1,97 (2Н, м, СН2), 4,32 (2Н, к, ОСН2), 4,55-4,46 (2Н, м, СН2), 7,93 (1Н, с, СН-аром.).
- 
С использованием этил-2-((диметиламино)метилен)-4,4,4-трифтор-3-оксобутаноата и 3-гидразинил-1-метилциклобутанола (син/анти-смесь): Остаток очищали с помощью колоночной хроматографии на силикагеле (элюент: петролейный эфир/этилацетат 5:1), получая этил-1-(3-гидрокси-3-метилциклобутил)-5-(трифторметил)-1Н-пиразол-4-карбоксилат (син/анти-смесь) в виде желтого масла (выход 9%);
Результат ЖХ/МС [M+H]+: 293,3;
1H ЯМР (CDCl3, смесь диастереомеров=изомеры 1 и 2): δ 1,34 (6Н, т, СН3 Изомер1+2), 1,46 (3Н, с, СН3 Изомер2), 1,50 (3Н, с, СН3 Изомер1), 2,88-2,55 (8Н, м, СН2 Изомер1+2), 4,31 (2Н, т, СН2 Изомер2), 4,32 (2Н, т, СН2 Изомер1), 4,75-4,65 (1Н, м, СН Изомер2), 5,28-5,17 (1Н, м, СН Изомер1), 7,93 (1Н, с, пиразол-Н Изомер2), 7,97 (1Н, с, пиразол-Н Изомер1).
- 
С использованием этил-2-((диметиламино)метилен)-4,4,4-трифтор-3-оксобутаноата и (S)-1-гидразинилпропан-2-ола: неочищенный этил-(S)-1-(2-гидроксипропил)-5-(трифторметил)-1Н-пиразол-4-карбоксилат получали с выходом 35%;
Результат ЖХ/МС [M+H]+: 267,0;
- 
С использованием метил-2-((диметиламино)метилен)-3-оксобутаноата и 3-гидразинил-1-метилциклобутанола (син/анти-смесь): Остаток очищали с помощью колоночной хроматографии на силикагеле (элюент: петролейный эфир/этилацетат 1:1), получая метил-1-(3-гидрокси-3-метилциклобутил)-5-метил-1Н-пиразол-4-карбоксилат (син-конфигурация) (39%; вторая фракция предоставляла анти-диастереомер в аналогичном количестве).
Результат ЖХ/МС [M+H]+: 225,1;
1H ЯМР (CDCl3): δ 1,52 (3Н, с, СН3), 2,53 (3Н, с, СН3), 2,56 (4Н, м, 2хСН2), 2,82 (3Н, с, СН3), 4,46 (1Н, м, CH), 7,91 (1H, с, CH-аром.).
- 
С использованием этил-2-((диметиламино)метилен)-3-оксобутаноата и 4-гидразинил-2-метилбутан-2-ола: Остаток очищали с помощью колоночной хроматографии на силикагеле (элюент: петролейный эфир/этилацетат 1:1), получая этил-1-(3-гидрокси-3-метилбутил)-5-метил-1Н-пиразол-4-карбоксилат в виде красноватого масла (92%).
Результат ЖХ/МС [M+H]+: 241,1;
1H ЯМР (CDCl3): δ 1,27 (6Н, с, 2хСН3), 3,90 (3Н, т, СН3), 2,02-1,93 (2Н, м, СН2), 2,55 (3Н, с, СН3), 4,34-4,17 (4Н, м, 2xCH2), 7,84 (1H, с, CH-аром.).
Общие методики O -силилирования :
А) К раствору этил-1-(2-гидроксипропил)-5-(трифторметил)-1Н-пиразол-4-карбоксилата 4 (2,67 г, 10,0 ммоль) (R- или S-конфигурация) в CH2Cl2 (20,0 мл) добавляли имидазол (1,02 г, 15,0 ммоль), ДМАП (122 мг, 1,0 ммоль) и затем трет-бутилдиметилсилилхлорид (1,95 г, 13,0 ммоль в CH2Cl2, 5,0 мл) при 0°C. Полученный раствор перемешивали при комнатной температуре в течение 18 ч. Реакцию гасили насыщенным водн. NaHCO3 и экстрагировали CH2Cl2. Объединенные органические фазы промывали 0,1 М водн. HCl и высушивали над MgSO4, отфильтровывали и концентрировали при пониженном давлении. Остаток очищали с помощью колоночной хроматографии на силикагеле.
1. 
Исходя из (R)-спирта, получают этил-(R)-1-(2-((трет-бутилдиметилсилил)окси)пропил)-5-(трифторметил)-1Н-пиразол-4-карбоксилат (84%).
Результат ЖХ/МС [M+H]+: 381,1;
1H ЯМР (CDCl3): δ -0,21 (3Н, с, СН3), -0,03 (3Н, с, СН3), 0,80 (9Н, с, 3хСН3), 1,19 (3Н, д, СН3), 1,35 (3Н, т, СН3), 4,40-4,25 (4Н, м, СН2 и ОСН2), 7,94 (1Н, с, СН-аром.).
2. 
Исходя из (S)-спирта, получают этил-(S)-1-(2-((трет-бутилдиметилсилил)окси)пропил)-5-(трифторметил)-1H-пиразол-4-карбоксилат (55%).
B) К перемешиваемой смеси или этил-1-(3-гидрокси-3-метилциклобутил)-5-(трифторметил)-1H-пиразол-4-карбоксилата (син/анти-смесь), или метил-1-(3-гидрокси-3-метилциклобутил)-5-метил-1Н-пиразол-4-карбоксилата (син-конфигурация) (3,0 ммоль) и N, N-диизопропилэтиламина (3,0 экв.) в CH2Cl2 (5 мл/ммоль) добавляли трет-бутилдиметилсилилтрифлат (1,5 экв.) медленно при 0°C. Реакционную смесь перемешивали при комнатной температуре в течение 3 ч, и затем разбавляли водой, и экстрагировали CH2Cl2. Объединенные органические фазы промывали солевым раствором, высушивали над безводным MgSO4, отфильтровывали и концентрировали.
- 
С использованием этил-1-(3-гидрокси-3-метилциклобутил)-5-(трифторметил)-1Н-пиразол-4-карбоксилата (син-конфигурация): Остаток очищали с помощью колоночной хроматографии на силикагеле (элюент: петролейный эфир/этилацетат от 50:1 до 20:1), получая этил-1-(3-((трет-бутилдиметилсилил)окси)-3-метилциклобутил)-5-(трифторметил)-1Н-пиразол-4-карбоксилат в виде коричневого масла; разделение син- и анти-диастереомеров может быть достигнуто на данном уровне; объединенный выход 84%.
1H ЯМР (CDCl3, диастереомер 1): δ -0,01 (6Н, с, 2xCH3), 0,77 (9H, с, tBu), 1,13 (3H, т, CH3), 1,34 (3Н, с, СН3), 2,53 (4Н, м, СН2), 4,19 (2Н, к, СН2), 5,03 (1Н, м, СН), 7,82 (1Н, с, СН-аром.)
1H ЯМР (CDCl3, диастереомер 2): δ -0,02 (6Н, с, 2xCH3), 0,79 (9H, с, tBu), 1,13 (3H, т, CH3), 1,34 (3Н, с, СН3), 2,53 (4Н, м, СН2), 4,19 (2Н, к, СН2), 5,03 (1Н, м, СН), 7,80 (1Н, с, СН-аром.)
- 
С использованием метил-1-(3-гидрокси-3-метилциклобутил)-5-метил-1Н-пиразол-4-карбоксилата (син-конфигурация): Остаток очищали с помощью колоночной хроматографии на силикагеле (элюент: петролейный эфир/этилацетат 8:1) с получением метил-1-(3-((трет-бутилдиметилсилил)окси)-3-метилциклобутил)-5-метил-1Н-пиразол-4-карбоксилата (син-конфигурация) (38%).
Результат ЖХ/МС [M+H]+: 339,1;
1H ЯМР (CDCl3): δ 0,11 (6Н, 2, 2хСН3), 0,89 (9Н, с, 3хСН3), 1,46 (3Н, с, СН3), 2,50 (3Н, с, СН3), 2,59-2,51 (2Н, м, CH2), 2,90-2,76 (2H, м, CH2), 3,81 (3H, с, OCH3), 4,33-4,17 (1H, м, CH), 7,86 (1H, с, CH-аром.).
С) этил-1-(3-гидрокси-3-метилбутил)-5-(трифторметил)-1Н-пиразол-4-карбоксилат или этил-1-(3-гидрокси-3-метилбутил)-5-метил-1Н-пиразол-4-карбоксилат (4 ммоль) растворяли в бис(триметилсилил)амине (10 мл) и добавляли хлортриметилсилан (1,0 экв.). Смесь перемешивали при комнатной температуре в течение 18 ч. Смесь разбавляли CH2Cl2 и промывали водой и насыщенным водн. NH4Cl. Органическую фазу высушивали над MgSO4, отфильтровывали и концентрировали при пониженном давлении.
- 
С использованием этил-1-(3-гидрокси-3-метилбутил)-5-(трифторметил)-1Н-пиразол-4-карбоксилата: Неочищенный продукт очищали с помощью преп. ТСХ на силикагеле (элюент: CH2Cl2/MeOH 95:5) и снова пТСХ (элюент: петролейный эфир/этилацетат 4:1), получая этил-1-(3-метил-3-((триметилсилил)окси)бутил)-5-(трифторметил)-1Н-пиразол-4-карбоксилат в виде оранжевого масла (75%).
Результат ЖХ/МС [M+H]+: 367,3;
1H ЯМР (CDCl3): δ 0,13 (9H, с, 3xCH3), 1,29 (6H, с, 2xCH3), 1,35 (3H, т, CH3), 2,02-1,92 (2H, м, CH2), 4,32 (2H, к, ОСН2), 4,50-4,40 (2Н, м, СН2), 7,92 (1Н, с, СН-аром.).
- 
С использованием этил-1-(3-гидрокси-3-метилбутил)-5-метил-1Н-пиразол-4-карбоксилата: если реакция не завершается, другой экв. хлортриметилсилан может быть добавлен и перемешивание продолжено при нагревании с обратным холодильником. Неочищенный материал этил-5-метил-1-(3-метил-3-((триметилсилил)окси)бутил)-1Н-пиразол-4-карбоксилат получали в виде красноватого масла (88%) и использовали как таковой в следующей стадии реакции.
Результат ЖХ/МС [M+H]+: 313,1;
- 
С использованием 1-(3-гидрокси-3-метилбутил)-5-(трифторметил)-1Н-пиразол-4-карбоновой кислоты (1,1 ммоль; которую получали из этил-1-(3-гидрокси-3-метилбутил)-5-(трифторметил)-1Н-пиразол-4-карбоксилата путем омыления с использованием 4 N водн. NaOH в ТГФ (комнатная температура, 18 ч), выделяли с выходом 48% в виде коричневого масла при подкислении 6 N водн. HCl и экстракции CH2Cl2) смесь перемешивали при 60°C в герметичной пробирке в течение 18 ч, после чего добавляли еще хлортриметилсилан, перемешивание продолжали в течение еще одного дня до завершения превращения; неочищенный продукт 1-{3-метил-3-[(триметилсилил)окси]бутил}-5-(трифторметил)-1Н-пиразол-4-карбоновой кислоты (84%) использовали как таковой в следующей стадии.
Результат ЖХ/МС [M+H]+: 339,0;
Конденсация алкилпиразол-4-карбоксилатов с гетероарилметильными анионами
К раствору 2-метилпиримидин/2-метилпиразин/4-метилпиримидин (1,2 экв.) в ТГФ (1 мл/ммоль) добавляли LiHMDS (1,0 М в ТГФ; 2,2 экв.) при -10°C в атмосфере N2. Смесь перемешивали при данной температуре в течение 30 мин, и добавляли соответствующий алкилпиразол-4-карбоксилат (1,0 экв. в ТГФ, 1 мл/ммоль), и смесь перемешивали при комнатной температуре в течение 2-18 ч (исходя из контроля хода реакции). Реакцию гасили ледяной водой и полученную смесь экстрагировали EtOAc. Объединенные органические фазы промывали солевым раствором, высушивали над MgSO4, отфильтровывали и концентрировали под вакуумом.
- 
С использованием этил-(R)-1-(2-((трет-бутилдиметилсилил)окси)пропил)-5-(трифторметил)-1Н-пиразол-4-карбоксилата (10 ммоль) и 2-метилпиримидина: Остаток очищали с помощью хроматографии на силикагеле, получая (R)-1-(1-(2-((трет-бутилдиметилсилил)окси)пропил)-5-(трифторметил)-1Н-пиразол-4-ил)-2-(пиримидин-2-ил)этан-1-он (выход: 77%);
Результат ЖХ/МС [M+H]+: 429,0.
- 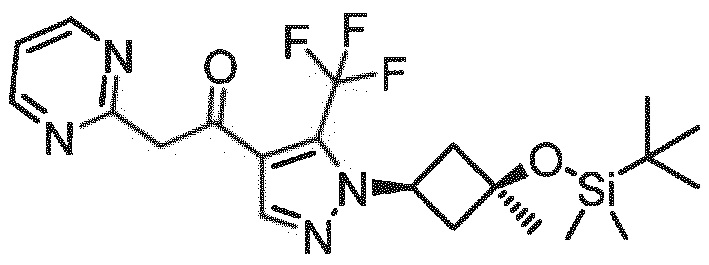
С использованием этил-1-(3-((трет-бутилдиметилсилил)окси)-3-метилциклобутил)-5-(трифторметил)-1Н-пиразол-4-карбоксилата (син-конфигурация) (0,3 ммоль) и 2-метилпиримидина: Остаток очищали с помощью преп. ТСХ на силикагеле (элюент: петролейный эфир/этилацетат 3:1), получая 1-(1-(3-((трет-бутилдиметилсилил)окси)-3-метилциклобутил)-5-(трифторметил)-1Н-пиразол-4-ил)-2-(пиримидин-2-ил)этанон (син-конфигурация) в виде желтого масла (46%).
Результат ЖХ/МС [M+H]+: 455,1;
1H ЯМР (CDCl3): δ -0,01 (6Н, с, 2xCH3), 0,80 (9H, с, tBu), 1,35 (3H, с, CH3), 2,53 (4H, м, СН2), 4,38 (2Н, с, СН2), 5,02 (1Н, м, СН), 6,89 (1Н, т, СН-аром.), 7,65 (1Н, д, СН-аром.), 7,82 (1Н, с, CH-аром.), 8,60 (1H, д, CH-аром.).
- 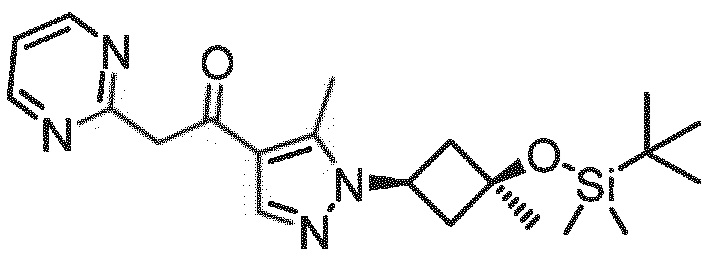
С использованием метил-1-(3-((трет-бутилдиметилсилил)окси)-3-метилциклобутил)-5-метил-1Н-пиразол-4-карбоксилата (син-конфигурация) (1,6 ммоль) и 2-метилпиримидина: Остаток очищали с помощью преп. ТСХ на силикагеле (элюент: петролейный эфир/этилацетат 1:2), получая 1-(1-(3-((трет-бутилдиметилсилил)окси)-3-метилциклобутил)-5-метил-1Н-пиразол-4-ил)-2-(пиримидин-2-ил)этан-1-он (син-конфигурация) в виде бесцветного твердого вещества (17%).
Результат ЖХ/МС [M+H]+: 401,1.
- 
С использованием этил-1-(3-((трет-бутилдиметилсилил)окси)-3-метилциклобутил)-5-(трифторметил)-1Н-пиразол-4-карбоксилата (син-конфигурация) (0,3 ммоль) и 2-метилпиразина: Остаток очищали с помощью преп. ТСХ на силикагеле (элюент: петролейный эфир/этилацетат 3:1), получая 1-(1-{3-[(трет-бутилдиметилсилил)окси]-3-метилциклобутил}-5-(трифторметил)-1Н-пиразол-4-ил)-2-(пиразин-2-ил)этан-1-он (син-конфигурация) (48%).
- 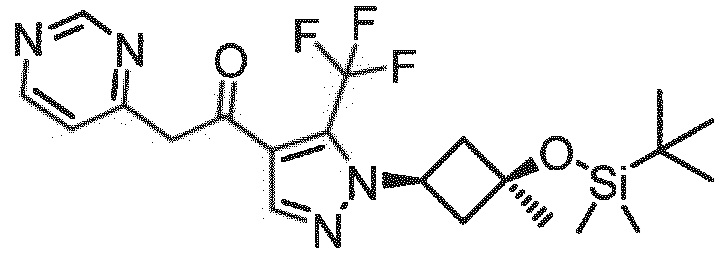
С использованием этил-1-(3-((трет-бутилдиметилсилил)окси)-3-метилциклобутил)-5-(трифторметил)-1Н-пиразол-4-карбоксилата (син-конфигурация) (0,3 ммоль) и 4-метилпиримидина: Остаток очищали с помощью преп. ТСХ на силикагеле (элюент: петролейный эфир/этилацетат 3:1), получая 1-(1-{3-[(трет-бутилдиметилсилил)окси]-3-метилциклобутил}-5-(трифторметил)-1Н-пиразол-4-ил)-2-(пиримидин-4-ил)этан-1-он (син-конфигурация) (63%).

Соответствующий анти-диастереомер получали соответствующим образом, исходя из соответствующего анти-структурного элемента.
- 
С использованием метил-1-(3-((трет-бутилдиметилсилил)окси)-3-метилциклобутил)-5-метил-1Н-пиразол-4-карбоксилата (син-конфигурация) (0,3 ммоль) и 4-метилпиримидина: Остаток очищали с помощью преп. ТСХ на силикагеле (элюент: петролейный эфир/этилацетат 3:1), получая 1-(1-{3-[(трет-бутилдиметилсилил)окси]-3-метилциклобутил}-5-метил-1Н-пиразол-4-ил)-2-(пиримидин-4-ил)этан-1-он (син-конфигурация) (76%).
- 
С использованием метил-1-(3-((трет-бутилдиметилсилил)окси)-3-метилциклобутил)-5-метил-1Н-пиразол-4-карбоксилата (син-конфигурация) (0,3 ммоль) и 2-метилпиразина: остаток очищали с помощью преп. ТСХ на силикагеле (элюент: петролейный эфир/этилацетат 3:1), получая 1-(1-{3-[(трет-бутилдиметилсилил)окси]-3-метилциклобутил}-5-метил-1Н-пиразол-4-ил)-2-(пиразин-2-ил)этан-1-он (син-конфигурация) (79%).
- 
С использованием этил-(R)-1-(2-((трет-бутилдиметилсилил)окси)пропил)-5-(трифторметил)-1Н-пиразол-4-карбоксилата (0,3 ммоль) и 4-метилпиримидина: Остаток очищали с помощью преп. ТСХ на силикагеле (элюент: петролейный эфир/этилацетат 3:1), получая 1-{1-[(2R)-2-[(трет-бутилдиметилсилил)окси]пропил]-5-(трифторметил)-1H-пиразол-4-ил}-2-(пиримидин-4-ил)этан-1-он (74%).
- 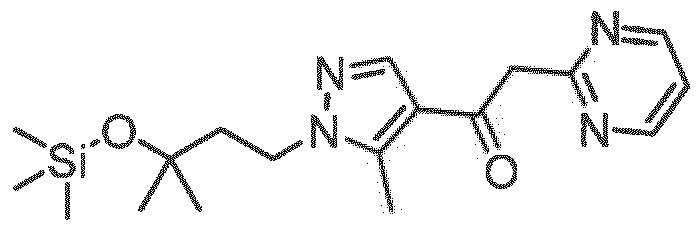
С использованием этил-5-метил-1-{3-метил-3-[(триметилсилил)окси]бутил}-1Н-пиразол-4-карбоксилата (0,9 ммоль) и 2-метилпиримидина: Остаток очищали с помощью преп. ТСХ на силикагеле (элюент: петролейный эфир/этилацетат 1:1), получая 1-(5-метил-1-{3-метил-3-[(триметилсилил)окси]бутил}-1H-пиразол-4-ил)-2-(пиримидин-2-ил)этан-1-он в виде желтоватого масла (31%).
Результат ЖХ/МС [M+H]+: 361,1;
1H ЯМР (CDCl3): δ 0,11 (9H, с, 3xCH3), 1,26 (6H, 2, 2xCH3), 1,95-1,80 (2H, м, CH2), 2,55 (3H, с, CH3), 4,24-4,09 (2H, м, CH2), 4,43 (2H, с, CH2), 7,16 (1H, т, CH-аром.), 7,90 (1H, с, CH-аром.), 8,70 (2H, д, 2xCH-аром.).
- 
С использованием этил-1-{3-метил-3-[(триметилсилил)окси]бутил}-5-(трифторметил)-1Н-пиразол-4-карбоксилата (0,33 ммоль) и 2-метилпиримидина: Остаток очищали с помощью преп. ТСХ на силикагеле (элюент: петролейный эфир/этилацетат 1:1), получая неочищенный 1-(1-{3-метил-3-[(триметилсилил)окси]бутил}-5-(трифторметил)-1H-пиразол-4-ил)-2-(пиримидин-2-ил)этан-1-он в виде оранжевого масла (колич.).
Результат ЖХ/МС [M+H]+: 415,4;
1H ЯМР (CDCl3): δ 0,14 (9H, с, 3xCH3), 1,31 (6H, с, 2xCH3), 2,09-1,93 (2H, м, CH2), 4,47-4,39 (2H, м, CH2), 4,49 (2H, с, CH2), 7,00 (1H, т, CH-аром.), 7,76 (1H, с, CH-аром.), 8,71 (2H, д, 2xCH-аром.).
Синтез 3-(пиразол-4-ил)-3-оксопропаноатов

 и
и 
этил-3-(1-{3-[(трет-бутилдиметилсилил)окси]-3-метилциклобутил}-5-(трифторметил)-1Н-пиразол-4-ил)-3-оксопропаноат, син- и анти-конфигурация, синтезировали из этил-1-(3-((трет-бутилдиметилсилил)окси)-3-метилциклобутил)-5-(трифторметил)-1Н-пиразол-4-карбоксилата (син/анти-смесь)
1.) К раствору этил-1-(3-((трет-бутилдиметилсилил)окси)-3-метилциклобутил)-5-(трифторметил)-1Н-пиразол-4-карбоксилата (син/анти-смесь) (1,84 ммоль) в ТГФ (3 мл) добавляли водн. NaOH (1 М, 4 мл) и смесь перемешивали при комнатной температуре в течение 72 ч. Смесь выливали в 5% водн. лимонную кислоту, которую экстрагировали CH2Cl2. Объединенные органические слои высушивали над MgSO4 и концентрировали досуха. Разделение диастереомеров было невозможно на данной стадии, поэтому неочищенное коричневое масло 1-{3-[(трет-бутилдиметилсилил)окси]-3-метилциклобутил}-5-(трифторметил)-1Н-пиразол-4-карбоновой кислоты (94%) использовали для дальнейших превращений.
Результат ЖХ/МС [M+H]+: 379,1;
2.) Раствор неочищенной 1-{3-[(трет-бутилдиметилсилил)окси]-3-метилциклобутил}-5-(трифторметил)-1Н-пиразол-4-карбоновой кислоты (1,73 ммоль) и 1,1'-карбонилдиимидазола (1,5 экв.; CDI) в ТГФ (Sure/Seal, 7 мл) перемешивали при комнатной температуре в течение 18 ч с образованием активированного производного карбоновой кислоты. Добавляли 1-[(3-этокси-3-оксопропаноил)окси]магнезио-3-этилпропандиоат (1,2 экв., синтез описан ниже) и раствор перемешивали при 55°С в течение 2 ч. Смесь разбавляли этилацетатом и промывали водой. Водный слой экстрагировали этилацетатом и объединенные органические слои высушивали над MgSO4 и концентрировали досуха. Очистку и разделение диастереомеров осуществляли с помощью колоночной хроматографии на силикагеле (элюент: петролейный эфир/CH2Cl2/этилацетат 8:2:1). Син- и анти-изомеры (относительная конфигурация в циклобутанольном фрагменте) этил-3-(1-{3-[(трет-бутилдиметилсилил)окси]-3-метилциклобутил}-5-(трифторметил)-1Н-пиразол-4-ил)-3-оксопропаноата получали в виде желтых масел (каждое 29-36%).
Син-конфигурация:
Результат ЖХ/МС [M+H]+: 449,4;
1H-ЯМР (син-кето-изомер) (CDCl3, J [Гц]): δ = 7,92 (с, 1H пиразол-H), 4,62-4,48 (м, 1H, CH), 4,20 (к, 2H, 3J= 7,1, OCH2CH3), 3,80 (с, 2Н, СН2), 2,92-2,86 (м, 2Н, СН2), 2,61-2,54 (м, 2Н, СН2), 1,45 (с, 3Н, СН3), 1,26 (т, 3Н, 3J= 7,1, OCH2CH3), 0,89 (с, 9H, C(CH3)3), 0,11 (с, 6H, CH3).
Анти-конфигурация:
Результат ЖХ/МС [M+H]+: 449,3;
1H-ЯМР (анти-кето-изомер) (CDCl3, J [Гц]): δ = 7,90 (с, 1H пиразол-H), 5,21-5,08 (м, 1H, CH), 4,20 (к, 2H, 3J= 7,1, OCH2CH3), 3,80 (с, 2H, CH2), 2,75-2,56 (м, 4H, CH2), 1,46 (с, 3H, CH3), 1,26 (т, 3H, 3J= 7,1, OCH2CH3), 0,91 (с, 9Н, С(СН3)3), 0,12 (с, 6Н, СН3).

этил-3-(1-{3-метил-3-[(триметилсилил)окси]бутил}-5-(трифторметил)-1Н-пиразол-4-ил)-3-оксопропаноат
Неочищенную 1-{3-метил-3-[(триметилсилил)окси]бутил}-5-(трифторметил)-1Н-пиразол-4-карбоновую кислоту (0,96 ммоль; синтез описан выше в разделе «Общие методики O-силилирования») обрабатывали CDI и 1-[(3-этокси-3-оксопропаноил)окси]магнезио-3-этилпропандиоатом в соответствии с методикой, описанной выше, с получением указанного в заголовке соединения в виде оранжевого масла (неочищенное, колич.; произошло частичное O-десилилирование).
Результат ЖХ/МС [M+H]+: 409,1.

метил-3-{1-[(2S)-2-[(трет-бутилдиметилсилил)окси]пропил]-5-(трифторметил)-1Н-пиразол-4-ил}-3-оксопропаноат
Этил-(S)-1-(2-((трет-бутилдиметилсилил)окси)пропил)-5-(трифторметил)-1Н-пиразол-4-карбоксилат (0,8 ммоль) сначала омыляли, получая кислоту, которую затем обрабатывали CDI и 1-[(3-метокси-3-оксопропаноил)окси]магнезио-3-метилпропандиоатом в соответствии с методиками, описанными выше, с получением неочищенного указанного в заголовке соединения (колич.).
Синтез 1-[(3-этокси-3-оксопропаноил)окси]магнезио-3-этилпропандиоата в соответствии J. Am. Soc. Chem. 2011, 133, 326: К раствору 2,00 г (11,8 ммоль) калиевой соли этилмалоната в 10 мл воды добавляли 1,19 мг (5,88 ммоль) MgCl2×6H2O и раствор перемешивали при комнатной температуре в течение 30 мин. 60 мл iPrOH добавляли для осаждения хлорида калия. Суспензию перемешивали в течение 1 ч при комнатной температуре, затем фильтровали и промывали iPrOH (2×5 мл). Фильтрат испаряли досуха с получением 1-[(3-этокси-3-оксопропаноил)окси]магнезио-3-этилпропандиоата в виде белого твердого вещества (2,00 г). 1-[(3-метокси-3-оксопропаноил)окси]магнезио-3-метилпропандиоат синтезировали соответственно.
Реакция циклоприсоединения

Стадия 1: К перемешиваемому раствору соответствующего пиразол-4-ил-2-(гетероарил)этан-1-она или алкил-3-(пиразол-4-ил)-3-оксопропаноата (1,0 экв.) и триэтиламина (ТЭА; 4,0 экв.) в ДМФ (Sure/Seal; 5 мл/ммоль) добавляли соответственно замещенный N-гидроксибензимидоилхлорид (3,0 экв.). Смесь перемешивали при указанной температуре в течение 18 ч. Реакционную смесь выливали в воду и экстрагировали EtOAc. Объединенные органические слои промывали солевым раствором, высушивали над безводным Na2SO4 и концентрировали при пониженном давлении. После очистки, как конкретно описано ниже для каждого продукта, проводили O-десилилирование.
Стадия 2: Раствор очищенного силил-защищенного продукта (1,0 экв.) в HCl/MeOH (3,0 М; 15 мл/ммоль) перемешивали при комнатной температуре в течение 3 ч. рН доводили до приблизительно 8 с помощью добавления водн. NaOH (1,0 М) и смесь экстрагировали EtOAc. Объединенные органические слои промывали солевым раствором, высушивали над безводным Na2SO4, концентрировали при пониженном давлении.

Пример 97: (R)-1-(4-(3-(2-хлор-6-фторфенил)-4-(пиримидин-2-ил)изоксазол-5-ил)-5-(трифторметил)-1H-пиразол-1-ил)пропан-2-ол
Стадия 1: (R)-1-(1-(2-((трет-бутилдиметилсилил)окси)пропил)-5-(трифторметил)-1Н-пиразол-4-ил)-2-(пиримидин-2-ил)этан-1-он (4,0 ммоль) и 2-хлор-6-фтор-N-гидроксибензимидоилхлорид; реакцию проводили при комнатной температуре; остаток очищали с помощью колоночной хроматографии на силикагеле (элюент: петролейный эфир/этилацетат 6:1) с получением (R)-5-(1-(2-((трет-бутилдиметилсилил)окси)пропил)-5-(трифторметил)-1Н-пиразол-4-ил)-3-(2-хлор-6-фторфенил)-4-(пиримидин-2-ил)изоксазола в виде желтого масла (24%);
Результат ЖХ/МС [M+H]+: 582,0;
Стадия 2, общая методика циклоприсоединения: Смесь после стадии 2 очищали с помощью колоночной хроматографии на силикагеле (элюент: петролейный эфир/этилацетат 2:1) с получением указанного в заголовке соединения (54%).
Результат ЖХ/МС [M+H]+: 467,7;
1H ЯМР (CDCl3): δ 1,32 (3Н, д, СН3), 4,24 (1Н, дд, СН), 4,52-4,32 (2Н, м, СН2), 7,05 (1Н, т, СН-аром.), 7,10 (1H, тд, CH-аром.), 7,29 (1H, т, CH-аром.), 7,44-7,34 (1H, м, CH-аром.), 8,03 (1H, с, CH-аром.), 8,48 (2H, д, 2xCH-аром.).

Пример 98: 3-(4-(3-(2-хлор-6-фторфенил)-4-(пиримидин-2-ил)изоксазол-5-ил)-5-(трифторметил)-1Н-пиразол-1-ил)-1-метилциклобутанол (син-конфигурация)
Стадия 1: 1-(1-(3-((трет-бутилдиметилсилил)окси)-3-метилциклобутил)-5-(трифторметил)-1Н-пиразол-4-ил)-2-(пиримидин-2-ил)этанон (син-конфигурация) (0,11 ммоль) и 2-хлор-6-фтор-N-гидроксибензимидоилхлорид; реакцию проводили при 50°С; остаток очищали с помощью преп. ТСХ на силикагеле (элюент: петролейный эфир/этилацетат 3:1) с получением 5-(1-(3-((трет-бутилдиметилсилил)окси)-3-метилциклобутил)-5-(трифторметил)-1Н-пиразол-4-ил)-3-(2-хлор-6-фторфенил)-4-(пиримидин-2-ил)изоксазола (син-конфигурация) в виде желтого масла (75%);
Результат ЖХ/МС [M+H]+: 608;
Стадия 2, общая методика циклоприсоединения: Смесь после стадии 2 очищали с помощью преп. ТСХ на силикагеле (элюент: петролейный эфир/этилацетат 1:1) с получением указанного в заголовке соединения в виде бесцветного твердого вещества (12%).
Результат ЖХ/МС [M+H]+: 494,2;
1H ЯМР (CDCl3): δ 1,58 (3Н, с, СН3), 2,94-2,68 (4Н, м, 2хСН2), 4,78-4,65 (1Н, м, СН), 7,04 (1Н, т, СН-аром.), 7,10 (1H, тд, CH-аром.), 7,31-7,28 (1H, м, CH-аром.), 7,44-7,32 (1H, м, CH-аром.), 7,61 (1H, с, CH-аром.), 8,47 (1Н, с, СН-аром.), 8,49 (1Н, с, СН-аром.).

Пример 99: 3-(4-(3-(2-хлорфенил)-4-(пиримидин-2-ил)изоксазол-5-ил)-5-метил-1Н-пиразол-1-ил)-1-метилциклобутан-1-ол (син-конфигурация)
Альтернативная стадия 1:
К раствору 1-(1-(3-((трет-бутилдиметилсилил)окси)-3-метилциклобутил)-5-метил-1Н-пиразол-4-ил)-2-(пиримидин-2-ил)этан-1-она (син-конфигурация) (0,09 ммоль) в ДМФ (3 мл) добавляли NaH (5,0 экв.) при 0°C. Ледяную баню удаляли и смесь перемешивали при комнатной температуре в течение 20 мин. Затем добавляли 2-хлор-N-гидроксибензимидоилхлорид (3,0 экв.) и смесь перемешивали при 60°C в течение 3 ч. Реакцию гасили насыщенным водн. NH4Cl и экстрагировали EtOAc. Органические слои промывали солевым раствором, высушивали над безводным Na2SO4 и концентрировали. Остаток очищали с помощью препаративной ТСХ (элюент: петролейный эфир/этилацетат 2:1) с получением 5-(1-(3-((трет-бутилдиметилсилил)окси)-3-метилциклобутил)-5-метил-1Н-пиразол-4-ил)-3-(2-хлорфенил)-4-(пиримидин-2-ил)изоксазола (син-конфигурация) (41%);
Результат ЖХ/МС [M+H]+: 536,5;
1H ЯМР (CDCl3): δ -0,08 (6Н, с, 2xCH3), 0,88 (9H, с, tBu), 1,45 (3H, с, CH3), 2,52 (2H, м, CH2), 2,56 (3Н, с, СН3), 2,78 (2Н, м, СН2), 4,25 (1Н, м, СН), 7,37 (4Н, м, СН-аром.), 7,86 (1Н, с, СН-аром.), 8,60 (1Н, д, СН-аром.), 8,78 (1Н, д, СН-аром.), 8,82 (1Н, д, СН-аром.).
Стадия 2, общая методика циклоприсоединения: Смесь после стадии 2 очищали с помощью преп. ТСХ на силикагеле (элюент: петролейный эфир/этилацетат 1:5) с получением указанного в заголовке соединения в виде бесцветного твердого вещества (32%).
Результат ЖХ/МС [M+H]+: 422,3;
1H ЯМР (CDCl3): δ 1,47 (3Н, с, СН3), 2,55 (3Н, с, СН3), 2,79-2,66 (4Н, м, 2хСН2), 4,55 (1Н, квинт, СН), 7,11 (1Н, т, CH-аром.), 7,43-7,32 (3H, м, 3xCH-аром.), 7,64-7,57 (1H, м, CH-аром.), 8,18 (1H, с, CH-аром.), 8,62 (2H, д, 2xCH).

Пример 100: 3-{4-[3-(2-хлор-6-фторфенил)-4-(пиразин-2-ил)-1,2-оксазол-5-ил]-5-(трифторметил)-1H-пиразол-1-ил}-1-метилциклобутан-1-ол (син-конфигурация)
Стадия 1: 1-(1-{3-[(трет-бутилдиметилсилил)окси]-3-метилциклобутил}-5-(трифторметил)-1Н-пиразол-4-ил)-2-(пиразин-2-ил)этан-1-он (син-конфигурация) (0,11 ммоль) и 2-хлор-6-фтор-N-гидроксибензимидоилхлорид; реакцию проводили при 50°С; остаток очищали с помощью преп. ТСХ на силикагеле (элюент: петролейный эфир/этилацетат 3:1) с получением 2-[3-(2-хлор-6-фторфенил)-5-{1-[3-[(трет-бутилдиметилсилил)окси]-3-метилциклобутил]-5-(трифторметил)-1Н-пиразол-4-ил}-1,2-оксазол-4-ил]пиразина (син-конфигурация) (75%);
Стадия 2, общая методика циклоприсоединения: Смесь после стадии 2 очищали с помощью преп. ТСХ на силикагеле (элюент: петролейный эфир/этилацетат 1:5) с получением указанного в заголовке соединения (49%).
Результат ЖХ/МС [M+H]+: 494,3;
1H ЯМР (CDCl3): δ 1,48 (3Н, с, СН3), 2,94-2,67 (4Н, м, 2хСН2), 4,68 (1Н, квинт, СН), 7,12 (1Н, тд, СН-аром.), 7,30 (1H, д, CH-аром.), 7,49-7,36 (1H, м, CH-аром.), 7,94 (1H, с, CH-аром.), 8,26 (1H, уш., CH-аром.), 8,49-8,34 (2H, м, 2xCH-аром.).

Пример 101:
3-{4-[3-(2-хлорфенил)-4-(пиразин-2-ил)-1,2-оксазол-5-ил]-5-(трифторметил)-1H-пиразол-1-ил}-1-метилциклобутан-1-ол (син-конфигурация)
Стадия 1: 1-(1-{3-[(трет-бутилдиметилсилил)окси]-3-метилциклобутил}-5-(трифторметил)-1Н-пиразол-4-ил)-2-(пиразин-2-ил)этан-1-он (син-конфигурация) (0,22 ммоль) и 2-хлор-N-гидроксибензимидоилхлорид; реакцию проводили при 50°С; остаток очищали преп. ТСХ на силикагеле (элюент: петролейный эфир/этилацетат 3:1) с получением 2-[3-(2-хлорфенил)-5-{1-[3-[(трет-бутилдиметилсилил)окси]-3-метилциклобутил]-5-(трифторметил)-1Н-пиразол-4-ил}-1,2-оксазол-4-ил]пиразина (син-конфигурация) (20%);
Стадия 2, общая методика циклоприсоединения: Смесь после стадии 2 очищали с помощью преп. ТСХ на силикагеле (элюент: петролейный эфир/этилацетат 1:5) с получением указанного в заголовке соединения (15%).
Результат ЖХ/МС [M+H]+: 476,2;
1H ЯМР (CDCl3): δ 1,44 (3Н, с, СН3), 2,81-2,64 (4Н, м, 2хСН2), 4,63 (1Н, квинт, СН), 7,54-7,45 (1Н, м, СН-аром.), 7,66-7,54 (2H, м, 2xCH-аром.), 7,70 (1H, с, CH-аром.), 7,98 (1H, д, CH-аром.), 8,50 (1H, с, CH-аром.), 9,10 (1H, с, CH-аром.).
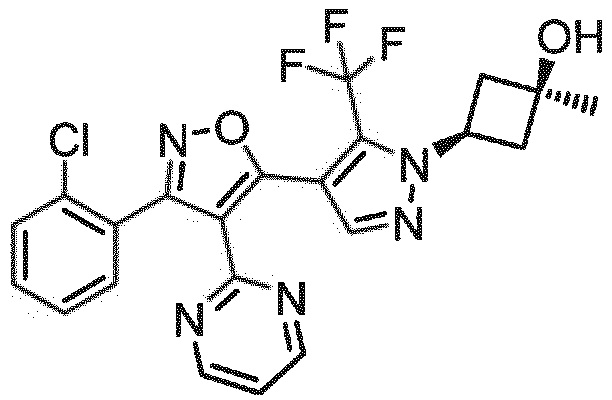
Пример 102:
3-{4-[3-(2-хлорфенил)-4-(пиримидин-2-ил)-1,2-оксазол-5-ил]-5-(трифторметил)-1H-пиразол-1-ил}-1-метилциклобутан-1-ол (син-конфигурация)
Стадия 1: 1-(1-(3-((трет-бутилдиметилсилил)окси)-3-метилциклобутил)-5-(трифторметил)-1Н-пиразол-4-ил)-2-(пиримидин-2-ил)этанон (син-конфигурация) (0,33 ммоль) и 2-хлор-N-гидроксибензимидоилхлорид; реакцию проводили при 50°С; остаток очищали с помощью преп. ТСХ на силикагеле (элюент: петролейный эфир/этилацетат 3:1) с получением 2-[3-(2-хлорфенил)-5-{1-[3-[(трет-бутилдиметилсилил)окси]-3-метилциклобутил]-5-(трифторметил)-1Н-пиразол-4-ил}-1,2-оксазол-4-ил]пиримидина (син-конфигурация) (27%);
Стадия 2, общая методика циклоприсоединения: Смесь после стадии 2 очищали с помощью преп. ТСХ на силикагеле (элюент: петролейный эфир/этилацетат 1:5) с получением указанного в заголовке соединения (8%).
Результат ЖХ/МС [M+H]+: 476,2;
1H ЯМР (CDCl3): δ 1,48 (3Н, с, СН3), 2,92-2,70 (4Н, м, СН2), 4,70 (1Н, квинт, СН), 7,08 (1Н, т, СН-аром.), 7,45-7,34 (3H, м, 3xCH-аром.), 7,67-7,58 (1H, м, CH-аром.), 8,08 (1H, с, CH-аром.), 8,54 (2H, д, 2xCH-аром.).

Пример 103: 3-{4-[3-(2-хлор-3-метоксифенил)-4-(пиримидин-2-ил)-1,2-оксазол-5-ил]-5-(трифторметил)-1Н-пиразол-1-ил}-1-метилциклобутан-1-ол (син-конфигурация)
Стадия 1: 1-(1-(3-((трет-бутилдиметилсилил)окси)-3-метилциклобутил)-5-(трифторметил)-1Н-пиразол-4-ил)-2-(пиримидин-2-ил)этанон (син-конфигурация) (0,38 ммоль) и 2-хлор-3-метокси-N-гидроксибензимидоилхлорид; реакцию проводили при 65°С; остаток очищали с помощью преп. ТСХ на силикагеле (элюент: петролейный эфир/этилацетат 7:3 и снова 4:1) с получением 2-[3-(2-хлор-3-метоксифенил)-5-{1-[3-[(трет-бутилдиметилсилил)окси]-3-метилциклобутил]-5-(трифторметил)-1Н-пиразол-4-ил}-1,2-оксазол-4-ил]пиримидина (син-конфигурация) в виде оранжевого масла (14%);
Результат ЖХ/МС [M+H]+: 620,1;
1H ЯМР (CDCl3): δ 0,13 (6H, с, 2xCH3), 0,91 (9H, с, 3xCH3), 1,27 (3H, с, CH3), 2,69-2,51 (2H, м, CH2), 2,84-2,70 (2H, м, СН2), 3,89 (3Н, с, ОСН3), 7,42-7,01 (4Н, м, 4хСН-аром.), 8,03 (1Н, с, СН-аром.), 8,52 (2Н, д, 2хСН-аром.).
Альтернативная стадия 2: Раствор очищенного силил-защищенного продукта (1,0 экв., 0,06 ммоль) в ТГФ (Sure/Seal, 0,5 мл) обрабатывали тетрабутиламмония фторидом (1 М в ТГФ; 1,1 экв.) при комнатной температуре в течение 2 ч. Растворитель удаляли при пониженном давлении и указанный в заголовке продукт получали из препаративной ТСХ на силикагеле (элюент: петролейный эфир/этилацетат 3:2 и снова 3:2) в виде бледно-желтого масла (16%).
Результат ЖХ/МС [M+H]+: 506,0;
1H ЯМР (CDCl3): δ 1,48 (3Н, с, СН3), 2,91-2,70 (4Н, м, 2хСН2), 3,91 (3Н, с, ОСН3), 4,70 (1Н, квинт, СН), 7,10-7,03 (2Н, м, 2xCH-аром.), 7,26-7,22 (1H, м, CH-аром.), 7,37 (1H, т, CH-аром.), 8,08 (1H, с, CH-аром.), 8,52 (2H, д, 2xCH-аром.).
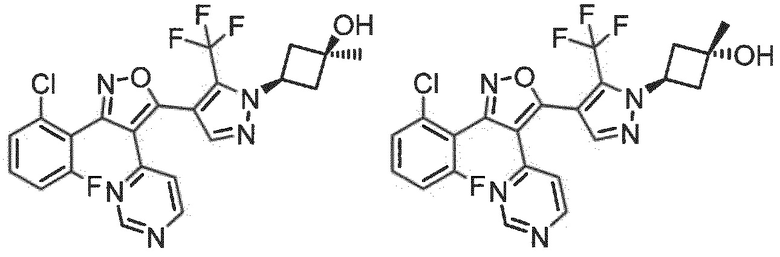
Пример 104 и 105:
3-{4-[3-(2-хлор-6-фторфенил)-4-(пиримидин-4-ил)-1,2-оксазол-5-ил]-5-(трифторметил)-1H-пиразол-1-ил}-1-метилциклобутан-1-ол, син-конфигурация и анти-конфигурация
Стадия 1: 1-(1-{3-[(трет-бутилдиметилсилил)окси]-3-метилциклобутил}-5-(трифторметил)-1Н-пиразол-4-ил)-2-(пиримидин-4-ил)этан-1-он (син- и анти-конфигурация, соответственно) (0,17 ммоль каждая) и 2-хлор-6-фтор-N-гидроксибензимидоилхлорид; реакцию проводили при 60°С; неочищенный 4-[3-(2-хлор-6-фторфенил)-5-{1-[3-[(трет-бутилдиметилсилил)окси]-3-метилциклобутил]-5-(трифторметил)-1Н-пиразол-4-ил}-1,2-оксазол-4-ил]пиримидин (син- и анти-конфигурация, соответственно) (колич.) непосредственно использовали в стадии 2;
Стадия 2, общая методика циклоприсоединения: Смесь после стадии 2 очищали с помощью преп. ТСХ на силикагеле (элюент: петролейный эфир/этилацетат 1:5) с получением указанных в заголовке соединений:
Пример 104, син-конфигурация (9%)
Результат ЖХ/МС [M+H]+: 493,9;
1H ЯМР (CDCl3): δ 1,50 (3Н, с, СН3), 2,97-2,71 (4Н, м, 2хСН2), 4,70 (1Н, квинт, СН), 6,92 (1Н, д, СН-аром.), 7,15 (1H, тд, CH-аром.), 7,34 (1H, д, CH-аром.), 7,52-7,41 (1H, м, CH-аром.), 7,98 (1H, с, CH-аром.), 8,56 (1H, уш., CH-аром.), 9,04 (1H, с, CH-аром.).
Пример 105, анти-конфигурация (11%)
Результат ЖХ/МС [M+H]+: 494,0;
1H ЯМР (CDCl3): δ 1,56 (3Н, с, СН3), 2,74-2,60 (2Н, м, СН2), 2,91-2,80 (2Н, м, СН2), 5,25 (1Н, квинт, СН), 6,98 (1Н, д, СН-аром.), 7,16 (1Н, т, СН-аром.), 7,34 (1Н, д, СН-аром.), 7,53-7,42 (1Н, м, СН-аром.), 7,94 (1Н, с, СН-аром.), 8,56 (1Н, д, СН-аром.), 9,04 (1Н, с, СН-аром.).

Пример 106:
3-{4-[3-(2-хлорфенил)-4-(пиримидин-4-ил)-1,2-оксазол-5-ил]-5-(трифторметил)-1H-пиразол-1-ил}-1-метилциклобутан-1-ол (син-конфигурация)
Стадия 1: 1-(1-{3-[(трет-бутилдиметилсилил)окси]-3-метилциклобутил}-5-(трифторметил)-1Н-пиразол-4-ил)-2-(пиримидин-4-ил)этан-1-он (син-конфигурация) (0,18 ммоль) и 2-хлор-N-гидроксибензимидоилхлорид; реакцию проводили при 50°С; остаток очищали с помощью преп. ТСХ на силикагеле (элюент: петролейный эфир/этилацетат 3:1) с получением 4-[3-(2-хлорфенил)-5-{1-[3-[(трет-бутилдиметилсилил)окси]-3-метилциклобутил]-5-(трифторметил)-1Н-пиразол-4-ил}-1,2-оксазол-4-ил]пиримидина (син-конфигурация) (48%);
Стадия 2, общая методика циклоприсоединения: Смесь после стадии 2 очищали с помощью преп. ТСХ на силикагеле (элюент: петролейный эфир/этилацетат 1:5) с получением указанного в заголовке соединения (20%).
Результат ЖХ/МС [M+H]+: 476,2;
1H ЯМР (CDCl3): δ 1,50 (3Н, с, СН3), 2,97-2,72 (4Н, м, 2хСН2), 4,70 (1Н, квинт, СН), 6,97-6,81 (1Н, м, СН-аром.), 7,56-7,40 (3H, м, 3xCH-аром.), 7,60 (1H, д, CH-аром.), 8,00 (1H, с, CH-аром.), 8,54 (1H, уш., CH-аром.), 9,07 (1Н, с, СН-аром.).

Пример 107:
3-{4-[3-(2-хлорфенил)-4-(пиримидин-4-ил)-1,2-оксазол-5-ил]-5-метил-1H-пиразол-1-ил}-1-метилциклобутан-1-ол (син-конфигурация)
Стадия 1: 1-(1-{3-[(трет-бутилдиметилсилил)окси]-3-метилциклобутил}-5-метил-1Н-пиразол-4-ил)-2-(пиримидин-4-ил)этан-1-он (син-конфигурация) (0,13 ммоль) и 2-хлор-N-гидроксибензимидоилхлорид; реакцию проводили при 50°С; остаток очищали с помощью преп. ТСХ на силикагеле (элюент: петролейный эфир/этилацетат 3:1) с получением 4-[3-(2-хлорфенил)-5-{5-метил-1-[3-[(трет-бутилдиметилсилил)окси]-3-метилциклобутил]-1Н-пиразол-4-ил}-1,2-оксазол-4-ил]пиримидина (син-конфигурация) (60%);
Стадия 2, общая методика циклоприсоединения: Смесь после стадии 2 очищали с помощью преп. ТСХ на силикагеле (элюент: петролейный эфир/этилацетат 1:5) с получением указанного в заголовке соединения (25%).
Результат ЖХ/МС [M+H]+: 422,3;
1H ЯМР (CDCl3): δ 1,47 (3Н, с, СН3), 2,49 (3Н, с, СН3), 2,80-2,65 (4Н, м, СН2), 3,51 (1Н, уш., ОН), 4,51 (1Н, квинт, CH), 6,95 (1H, дд, CH-аром.), 7,49-7,36 (3H, м, 3xCH-аром.), 7,60-7,49 (1H, м, CH-аром.), 7,97 (1H, с, CH-аром.), 8,54 (1H, д, CH-аром.), 9,16 (1H, д, CH-аром.).

Пример 108:
3-{4-[3-(2-хлор-6-фторфенил)-4-(пиримидин-4-ил)-1,2-оксазол-5-ил]-5-метил-1H-пиразол-1-ил}-1-метилциклобутан-1-ол (син-конфигурация)
Стадия 1: 1-(1-{3-[(трет-бутилдиметилсилил)окси]-3-метилциклобутил}-5-метил-1Н-пиразол-4-ил)-2-(пиримидин-4-ил)этан-1-он (син-конфигурация) (0,12 ммоль) и 2-хлор-6-фтор-N-гидроксибензимидоилхлорид; реакцию проводили при 50°С; остаток очищали с помощью преп. ТСХ на силикагеле (элюент: петролейный эфир/этилацетат 3:1) с получением 4-[3-(2-хлор-6-фторфенил)-5-{5-метил-1-[3-[(трет-бутилдиметилсилил)окси]-3-метилциклобутил]-1Н-пиразол-4-ил}-1,2-оксазол-4-ил]пиримидина (син-конфигурация) (72%);
Стадия 2, общая методика циклоприсоединения: Смесь после стадии 2 очищали с помощью преп. ТСХ на силикагеле (элюент: петролейный эфир/этилацетат 1:5) с получением указанного в заголовке соединения (13%).
Результат ЖХ/МС [M+H]+: 440,3;
1H ЯМР (CDCl3): δ 1,47 (3Н, с, СН3), 2,49 (3Н, с, СН3), 2,81-2,66 (4Н, м, СН2), 3,46 (1Н, уш., ОН), 4,52 (1Н, квинт, CH), 7,05 (1H, дд, CH-аром.), 7,11 (1H, тд, CH-аром.), 7,30 (1H, дт, CH-аром.), 7,47-7,37 (1H, м, CH) 7,93 (1Н, с, СН-аром.), 8,57 (1Н, д, СН-аром.), 9,12 (1Н, д, СН-аром.).
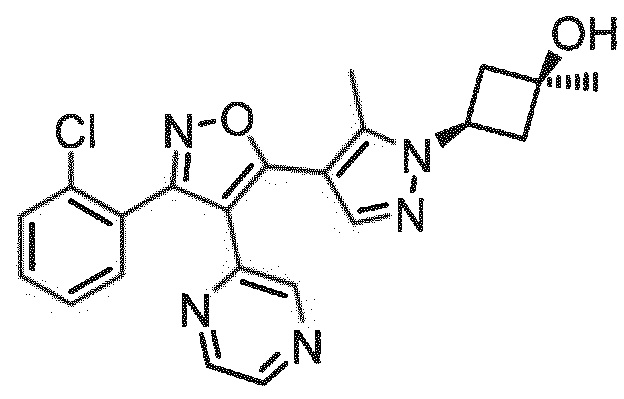
Пример 109:
3-{4-[3-(2-хлорфенил)-4-(пиразин-2-ил)-1,2-оксазол-5-ил]-5-метил-1H-пиразол-1-ил}-1-метилциклобутан-1-ол (син-конфигурация)
Стадия 1: 1-(1-{3-[(трет-бутилдиметилсилил)окси]-3-метилциклобутил}-5-метил-1Н-пиразол-4-ил)-2-(пиразин-2-ил)этан-1-он (син-конфигурация) (0,47 ммоль) и 2-хлор-N-гидроксибензимидоилхлорид; реакцию проводили при 50°С; остаток очищали с помощью преп. ТСХ на силикагеле (элюент: петролейный эфир/этилацетат 3:1) с получением 2-[3-(2-хлорфенил)-5-{5-метил-1-[3-[(трет-бутилдиметилсилил)окси]-3-метилциклобутил]-1Н-пиразол-4-ил}-1,2-оксазол-4-ил]пиразина (син-конфигурация) (25%);
Стадия 2, общая методика циклоприсоединения: Смесь после стадии 2 очищали с помощью преп. ТСХ на силикагеле (элюент: петролейный эфир/этилацетат 1:5) с получением указанного в заголовке соединения (32%).
Результат ЖХ/МС [M+H]+: 422,3;
1H ЯМР (CDCl3): δ 1,46 (3Н, с, СН3), 2,49 (3Н, с, СН3), 2,81-2,61 (4Н, м, СН2), 3,51 (1Н, уш., ОН), 4,50 (1Н, квинт, CH), 7,45-7,33 (3H, м, 3xCH-аром.), 7,62-7,51 (1H, м, CH-аром.), 7,81 (1H, д, CH-аром.), 8,28 (1H, с, CH-аром.), 8,43 (1H, д, CH-аром.), 8,55 (1H, т, CH-аром.).

Пример 110:
3-{4-[3-(2-хлор-6-фторфенил)-4-(пиразин-2-ил)-1,2-оксазол-5-ил]-5-метил-1H-пиразол-1-ил}-1-метилциклобутан-1-ол (син-конфигурация)
Стадия 1: 1-(1-{3-[(трет-бутилдиметилсилил)окси]-3-метилциклобутил}-5-метил-1Н-пиразол-4-ил)-2-(пиразин-2-ил)этан-1-он (син-конфигурация) (0,15 ммоль) и 2-хлор-6-фтор-N-гидроксибензимидоилхлорид; реакцию проводили при 50°С; остаток очищали с помощью преп. ТСХ на силикагеле (элюент: петролейный эфир/этилацетат 3:1) с получением 2-[3-(2-хлор-6-фторфенил)-5-{5-метил-1-[3-[(трет-бутилдиметилсилил)окси]-3-метилциклобутил]-1Н-пиразол-4-ил}-1,2-оксазол-4-ил]пиразина (син-конфигурация) (19%);
Стадия 2, общая методика циклоприсоединения: Смесь после стадии 2 очищали с помощью преп. ТСХ на силикагеле (элюент: петролейный эфир/этилацетат 1:5) с получением указанного в заголовке соединения (13%).
Результат ЖХ/МС [M+H]+: 440,3;
1H ЯМР (CDCl3): δ 1,46 (3Н, с, СН3), 2,51 (3Н, с, СН3), 2,82-2,68 (4Н, м, СН2), 4,52 (1Н, квинт, СН), 7,10 (1Н, тд, CH-аром.), 7,30-7,27 (1H, м, CH-аром.), 7,45-7,34 (1H, м, CH-аром.), 7,88 (1H, с, CH-аром.), 8,36 (1H, с, СН-аром.), 8,44 (1Н, с, СН-аром.), 8,55 (1Н, с, СН-аром.).
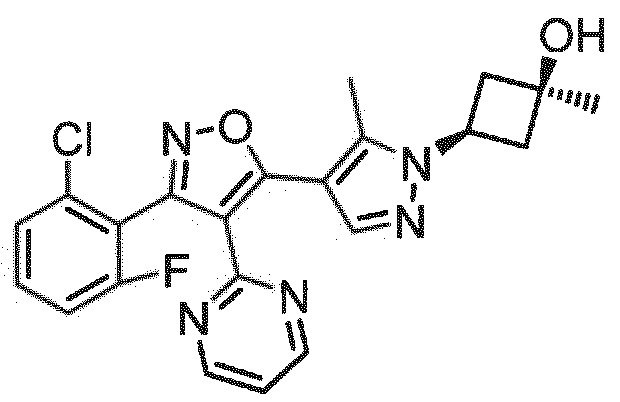
Пример 111:
3-{4-[3-(2-хлор-6-фторфенил)-4-(пиримидин-2-ил)-1,2-оксазол-5-ил]-5-метил-1H-пиразол-1-ил}-1-метилциклобутан-1-ол (син-конфигурация)
Стадия 1: 1-(1-(3-((трет-бутилдиметилсилил)окси)-3-метилциклобутил)-5-метил-1Н-пиразол-4-ил)-2-(пиримидин-2-ил)этан-1-он (син-конфигурация) (0,15 ммоль) и 2-хлор-6-фтор-N-гидроксибензимидоилхлорид; реакцию проводили при 50°С; остаток очищали с помощью преп. ТСХ на силикагеле (элюент: петролейный эфир/этилацетат 3:1) с получением 2-[3-(2-хлор-6-фторфенил)-5-{5-метил-1-[3-[(трет-бутилдиметилсилил)окси]-3-метилциклобутил]-1Н-пиразол-4-ил}-1,2-оксазол-4-ил]пиримидина (син-конфигурация) (36%);
Результат ЖХ/МС [M+H]+: 554,2;
Стадия 2, общая методика циклоприсоединения: Смесь после стадии 2 очищали с помощью преп. ТСХ на силикагеле (элюент: петролейный эфир/этилацетат 1:5) с получением указанного в заголовке соединения (21%).
Результат ЖХ/МС [M+H]+: 440,3;
1H ЯМР (CDCl3): δ 1,47 (3Н, с, СН3), 2,62 (3Н, с, СН3), 3,01-2,70 (4Н, м, СН2), 4,58 (1Н, квинт, СН), 7,16-7,04 (2Н, м, 2xCH-аром.), 7,32-7,20 (1H, м, CH-аром.), 7,43-7,32 (1H, м, CH-аром.), 8,47 (1H, уш., CH-аром.), 8,59 (2H, д, 2xCH-аром.).

Пример 112:
3-{4-[3-(2-хлор-3-метоксифенил)-4-(пиримидин-2-ил)-1,2-оксазол-5-ил]-5-метил-1H-пиразол-1-ил}-1-метилциклобутан-1-ол (син-конфигурация)
Альтернативная стадия 1, как описано для Примера 99 (реакция с NaH): 1-(1-(3-((трет-бутилдиметилсилил)окси)-3-метилциклобутил)-5-метил-1Н-пиразол-4-ил)-2-(пиримидин-2-ил)этан-1-он (син-конфигурация) (0,25 ммоль) и 2-хлор-3-метокси-N-гидроксибензимидоилхлорид; 2-[3-(2-хлор-3-метоксифенил)-5-{5-метил-1-[3-[(трет-бутилдиметилсилил)окси]-3-метилциклобутил]-1Н-пиразол-4-ил}-1,2-оксазол-4-ил]пиримидин (син-конфигурация) (36%) использовали в следующей стадии в виде неочищенного материала без очистки с помощью хроматографии на силикагеле;
Результат ЖХ/МС [M+H]+: 566,5.
Альтернативная стадия 2, как описано для Примера 103 (O-десилилирование с использованием ТБАФ): Остаток очищали с помощью колоночной хроматографии на силикагеле (элюент: CH2Cl2/MeOH/NH3 100:10:1 и снова элюент: петролейный эфир/этилацетат 4:1) с получением указанного в заголовке соединения (17%).
Результат ЖХ/МС [M+H]+: 452,4;
1H ЯМР (CDCl3): δ 1,45 (3Н, с, СН3), 2,52 (3Н, с, СН3), 2,72 (4Н, д, 2хСН2), 3,89 (3Н, с, ОСН3), 4,50 (1Н, квинт, СН), 7,03 (1H, дд, CH-аром.), 7,08 (1H, т, CH-аром.), 7,22 (1H, дд, CH-аром.), 7,34 (1H, т, CH-аром.), 8,11 (1H, с, CH-аром.), 8,59 (2H, д, CH-аром.).

Пример 113:
(2R)-1-{4-[3-(2-метоксифенил)-4-(пиримидин-2-ил)-1,2-оксазол-5-ил]-5-(трифторметил)-1H-пиразол-1-ил}пропан-2-ол
Альтернативная стадия 1, как описано для Примера 99 (реакция с NaH): (R)-1-(1-(2-((трет-бутилдиметилсилил)окси)пропил)-5-(трифторметил)-1H-пиразол-4-ил)-2-(пиримидин-2-ил)этан-1-он (1,0 ммоль) и 2-метокси-N-гидроксибензимидоилхлорид; остаток очищали с помощью преп. ТСХ на силикагеле (элюент: петролейный эфир/этилацетат 3:1) с получением 2-(5-{1-[(2R)-2-[(трет-бутилдиметилсилил)окси]пропил]-5-(трифторметил)-1H-пиразол-4-ил}-3-(2-метоксифенил)-1,2-оксазол-4-ил)пиримидина (34%);
Стадия 2, общая методика циклоприсоединения: Смесь после стадии 2 очищали с помощью преп. ТСХ на силикагеле (элюент: петролейный эфир/этилацетат 1:5) с получением указанного в заголовке соединения (86%).
Результат ЖХ/МС [M+H]+: 445,9;
1H ЯМР (CDCl3): δ 1,30 (3Н, д, СН3), 3,29 (3Н, с, ОСН3), 4,19 (1Н, дд, СН), 4,46-4,26 (2Н, м, СН2), 6,81 (1Н, д, CH-аром.), 7,15-7,05 (2H, м, 2xCH-аром.), 7,43 (1H, тд, CH-аром.), 7,69 (1H, дд, CH-аром.), 8,05 (1H, с, CH-аром.), 8,60 (2H, д, 2xCH-аром.).

Пример 114:
1-{4-[3-(2-метоксифенил)-4-(пиримидин-2-ил)-1,2-оксазол-5-ил]-5-(трифторметил)-1H-пиразол-1-ил}-2-метилпропан-2-ол
К перемешиваемому раствору Примера 113 (0,25 ммоль) в CH2Cl2 (1,5 мл) добавляли периодинан Десса-Мартина (3,5 экв.). Реакционную смесь перемешивали при комнатной температуре в течение 18 ч. Реакционную смесь гасили добавлением водн. Na2S2O3 и экстрагировали CH2Cl2. Объединенные органические слои промывали насыщенным водн. NaHCO3 и солевым раствором, высушивали над безводным Na2SO4 и концентрировали при пониженном давлении. Остаток очищали с помощью колоночной хроматографии на силикагеле (элюент: петролейный эфир/этилацетат 3:1) с получением 1-{4-[3-(2-метоксифенил)-4-(пиримидин-2-ил)-1,2-оксазол-5-ил]-5-(трифторметил)-1Н-пиразол-1-ил}пропан-2-она в виде бесцветного твердого вещества (61%).
Результат ЖХ/МС [M+H]+: 443,8;
1H ЯМР (CDCl3): δ 2,18 (3Н, с, СН3), 3,29 (3Н, с, ОСН3), 5,11 (2Н, с, СН2), 6,81 (1Н, д, СН-аром.), 7,14-7,09 (2H, м, 2xCH-аром.), 7,48-7,39 (1H, м, CH-аром.), 7,69 (1H, дд, CH-аром.), 8,12 (1H, с, CH-аром.), 8,61 (2H, д, 2xCH-аром.).
К раствору данного производного пропанона (0,15 ммоль) в ТГФ (3 мл) по каплям добавляли MeMgBr (1 М в ТГФ; 10 экв.) при 0°С в атмосфере N2. Реакционную смесь перемешивали при комнатной температуре в течение 18 ч. Реакцию гасили добавлением насыщенного водн. NH4Cl и экстрагировали CH2Cl2. Объединенные органические слои промывали солевым раствором, высушивали над безводным Na2SO4 и концентрировали при пониженном давлении. Остаток очищали с помощью колоночной хроматографии на силикагеле (элюент: петролейный эфир/этилацетат 5:1) с получением указанного в заголовке соединения в виде бесцветного твердого вещества. (10%).
Результат ЖХ/МС [M+H]+: 459,8;
1H ЯМР (CDCl3): δ 1,23 (6Н, д, 2хСН3), 3,30 (3Н, с, ОСН3), 4,26 (2Н, с, СН2), 6,82 (1Н, д, СН-аром.), 7,15-7,05 (2H, м, 2xCH-аром.), 7,44 (1H, тд, CH-аром.), 7,68 (1H, дд, CH-аром.), 8,06 (1H, с, CH-аром.), 8,58 (2H, д, 2хСН-аром.).

Пример 115:
(2R)-1-{4-[3-(2-метоксифенил)-4-(пиримидин-4-ил)-1,2-оксазол-5-ил]-5-(трифторметил)-1H-пиразол-1-ил}пропан-2-ол
Альтернативная стадия 1, как описано для Примера 99 (реакция с NaH): (R)-1-(1-(2-((трет-бутилдиметилсилил)окси)пропил)-5-(трифторметил)-1H-пиразол-4-ил)-2-(пиримидин-4-ил)этан-1-он (1,6 ммоль) и 2-метокси-N-гидроксибензимидоилхлорид; остаток очищали с помощью преп. ТСХ на силикагеле (элюент: петролейный эфир/этилацетат 3:1) с получением 4-(5-{1-[(2R)-2-[(трет-бутилдиметилсилил)окси]пропил]-5-(трифторметил)-1H-пиразол-4-ил}-3-(2-метоксифенил)-1,2-оксазол-4-ил)пиримидина (55%);
Стадия 2, общая методика циклоприсоединения: Смесь после стадии 2 очищали с помощью преп. ТСХ на силикагеле (элюент: петролейный эфир/этилацетат 1:5) с получением указанного в заголовке соединения (88%).
Результат ЖХ/МС [M+H]+: 446,0;
1H ЯМР (CDCl3): δ 1,30 (3Н, д, СН3), 3,38 (3Н, с, ОСН3), 4,21 (1Н, дд, СН), 4,45-4,27 (2Н, м, СН2), 6,89 (1Н, д, CH-аром.), 6,95 (1H, д, CH-аром.), 7,13 (1H, тд, CH-аром.), 7,50 (1H, тд, CH-аром.), 7,62 (1H, дд, CH-аром.), 7,99 (1H, с, CH-аром.), 8,53 (1H, уш, CH-аром.), 9,10 (1H, с, CH-аром.).

Пример 116:
1-{4-[3-(2-метоксифенил)-4-(пиримидин-4-ил)-1,2-оксазол-5-ил]-5-(трифторметил)-1H-пиразол-1-ил}-2-метилпропан-2-ол
Производное 2-пропанола Пример 115 (0,25 ммоль) превращали в соответствующий пропанон и затем в соответствующий 2-метил-2-пропанол в соответствии с методиками, описанными для Примера 114. Окисление до 1-{4-[3-(2-метоксифенил)-4-(пиримидин-4-ил)-1,2-оксазол-5-ил]-5-(трифторметил)-1Н-пиразол-1-ил}пропан-2-она достигали с выходом 83%;
Результат ЖХ/МС [M+H]+: 443,8;
1H ЯМР (CDCl3): δ 1,26 (6Н, с, 2⃰СН3), 2,24 (3Н, с, СН3), 2,95 (1Н, с, ОН), 3,42 (3Н, с, СН3), 5,17 (2Н, с, CH2), 6,92 (1H, д, CH-аром.), 7,08 (1H, д, CH-аром.), 7,15 (1H, т, CH-аром.), 7,53 (1H, т, CH-аром.), 7,63 (1Н, д, СН-аром.), 8,03 (1Н, с, СН-аром.), 8,55 (1Н, д, СН-аром.), 9,14 (1Н, с, СН-аром.);
Обработка Гриньяра предоставляла указанное в заголовке соединение с выходом 10%.
Результат ЖХ/МС [M+H]+: 459,9;
1H ЯМР (CDCl3): δ 1,24 (6H, с, 2xCH3), 3,42 (3H, с, OCH3), 4,28 (2H, с, CH2), 6,92 (1H, д, CH-аром.), 7,01 (1H, д, CH-аром.), 7,15 (1H, тд, CH-аром.), 7,53 (1H, тд, CH-аром.), 7,62 (1H, дд, CH-аром.), 8,01 (1H, с, CH-аром.), 8,55 (1H, д, CH-аром.), 9,08 (1H, с, CH-аром.).

Пример 117:
(2R)-1-{4-[3-(2-хлор-3-метоксифенил)-4-(пиримидин-2-ил)-1,2-оксазол-5-ил]-5-(трифторметил)-1H-пиразол-1-ил}пропан-2-ол
Альтернативная стадия 1, как описано для Примера 99 (реакция с NaH): (R)-1-(1-(2-((трет-бутилдиметилсилил)окси)пропил)-5-(трифторметил)-1H-пиразол-4-ил)-2-(пиримидин-2-ил)этан-1-он (3,0 ммоль) и 2-хлор-3-метокси-N-гидроксибензимидоилхлорид; остаток очищали с помощью преп. ТСХ на силикагеле (элюент: петролейный эфир/этилацетат 3:1) с получением 2-(5-{1-[(2R)-2-[(трет-бутилдиметилсилил)окси]пропил]-5-(трифторметил)-1H-пиразол-4-ил}-3-(2-хлор-3-метоксифенил)-1,2-оксазол-4-ил)пиримидина (83%);
Стадия 2, общая методика циклоприсоединения: Смесь после стадии 2 очищали с помощью преп. ТСХ на силикагеле (элюент: петролейный эфир/этилацетат 1:5) с получением указанного в заголовке соединения (77%).
Результат ЖХ/МС [M+H]+: 479,8;
1H ЯМР (CDCl3): δ 1,30 (3Н, д, СН3), 3,85 (3Н, с, ОСН3), 4,21 (1Н, дд, СН), 4,44-4,27 (2Н, м, СН2), 6,97-6,89 (2Н, м, 2xCH-аром.), 7,09 (1Н, т, СН-аром.), 7,57-7,52 (1Н, м, СН-аром.), 8,04 (1Н, с, СН-аром.), 8,55 (1Н, с, СН-аром.).

Пример 118:
1-{4-[3-(2-хлор-6-фторфенил)-4-(пиримидин-2-ил)-1,2-оксазол-5-ил]-5-(трифторметил)-1H-пиразол-1-ил}-2-метилпропан-2-ол
Производное 2-пропанола Пример 97 (1,6 ммоль) превращали в соответствующий пропанон и затем в соответствующий 2-метил-2-пропанол в соответствии с методиками, описанными для Примера 114. Окисление до 1-(4-(3-(2-хлор-6-фторфенил)-4-(пиримидин-2-ил)изоксазол-5-ил)-5-(трифторметил)-1Н-пиразол-1-ил)пропан-2-она достигали с выходом 67%;
Результат ЖХ/МС [M+H]+: 465,7;
1H ЯМР (CDCl3): δ 2,20 (3Н, с, СН3), 5,14 (2Н, с, СН2), 7,15-7,02 (2Н, м, СН-аром.), 7,31-7,27 (1Н, м, СН-аром.), 7,45-7,33 (1H, м, CH-аром.), 8,12 (1H, с, CH-аром.), 8,49 (2H, д, 2xCH-аром.).
Обработка Гриньяра предоставляла указанное в заголовке соединение с выходом 50%.
Результат ЖХ/МС [M+H]+: 481,8;
1H ЯМР (CDCl3): δ 1,25 (6H, с, 2xCH3), 4,30 (2H, с, CH2), 7,09-7,00 (1H, м, CH-аром.), 7,15-7,09 (1H, м, CH-аром.), 7,31-7,24 (1H, м, CH-аром.), 7,44-7,34 (1H, м, CH-аром.), 8,04 (1H, уш., CH-аром.), 8,48-8,42 (2H, м, 2xCH-аром.).

Пример 119:
(2R)-1-{4-[3-(2-хлор-3-метоксифенил)-4-(пиримидин-4-ил)-1,2-оксазол-5-ил]-5-(трифторметил)-1H-пиразол-1-ил}пропан-2-ол
Стадия 1: (R)-1-(1-(2-((трет-бутилдиметилсилил)окси)пропил)-5-(трифторметил)-1Н-пиразол-4-ил)-2-(пиримидин-4-ил)этан-1-он (2,0 ммоль) и 2-хлор-3-метокси-N-гидроксибензимидоилхлорид; ТГФ использовали вместо ДМФ; реакцию проводили при 50°С; неочищенный 4-(5-{1-[(2R)-2-[(трет-бутилдиметилсилил)окси]пропил]-5-(трифторметил)-1H-пиразол-4-ил}-3-(2-хлор-3-метоксифенил)-1,2-оксазол-4-ил)пиримидин (колич.) непосредственно использовали для O-десилилирования;
Стадия 2, общая методика циклоприсоединения: Смесь после стадии 2 очищали с помощью преп. ТСХ на силикагеле (элюент: петролейный эфир/этилацетат 1:5) с получением указанного в заголовке соединения (83%).
Результат ЖХ/МС [M+H]+: 479,8;
1H ЯМР (CDCl3): δ 1,32 (3Н, д, СН3), 3,88 (3Н, с, ОСН3), 4,23 (1Н, дд, СН), 4,49-4,29 (2Н, м, СН2), 6,86 (1Н, д, CH-аром.), 7,04-6,93 (2H, м, CH-аром.), 7,49 (1H, д, CH-аром.), 8,00 (1H, с, CH-аром.), 8,52 (1H, уш., CH-аром.), 9,06 (1H, с, CH-аром.).

Пример 120:
1-{4-[3-(2-хлор-3-метоксифенил)-4-(пиримидин-4-ил)-1,2-оксазол-5-ил]-5-(трифторметил)-1H-пиразол-1-ил}-2-метилпропан-2-ол
Производное 2-пропанола Пример 119 (0,25 ммоль) превращали в соответствующий пропанон и затем в соответствующий 2-метил-2-пропанол в соответствии с методиками, описанными для Примера 114. Окисление до 1-{4-[3-(2-хлор-3-метоксифенил)-4-(пиримидин-4-ил)-1,2-оксазол-5-ил]-5-(трифторметил)-1Н-пиразол-1-ил}пропан-2-она достигали с выходом 76%, обработка Гриньяра предоставляла указанное в заголовке соединение с выходом 16%.
Результат ЖХ/МС [M+H]+: 494,2;
1H ЯМР (CDCl3): δ 1,25 (6H, с, 2xCH3), 3,88 (3H, с, OCH3), 4,29 (2H, с, CH2), 6,85 (1H, д, CH-аром.), 7,03-6,95 (2H, м, 2xCH-аром.), 7,49 (1H, д, CH-аром.), 8,01 (1H, с, CH-аром.), 8,52 (1H, д, CH-аром.), 9,02 (1H, с, CH-аром.).

Пример 121:
4-{4-[3-(2-хлор-3-метоксифенил)-4-(пиримидин-2-ил)-1,2-оксазол-5-ил]-5-(трифторметил)-1H-пиразол-1-ил}-2-метилбутан-2-ол
Альтернативная стадия 1, как описано для Примера 99 (реакция с NaH): 1-(1-{3-метил-3-[(триметилсилил)окси]бутил}-5-(трифторметил)-1H-пиразол-4-ил)-2-(пиримидин-2-ил)этан-1-он (0,6 ммоль) и 2-хлор-3-метокси-N-гидроксибензимидоилхлорид; время реакции: 20 ч, условия реакции привели к одновременному O-десилилированию; остаток очищали с помощью преп. ТСХ на силикагеле (элюент: петролейный эфир/этилацетат 3:1) с получением указанного в заголовке соединения в виде желтого масла (11%).
Результат ЖХ/МС [M+H]+: 508,3;
1H ЯМР (CDCl3): δ 1,31 (6Н, с, 2xCH3), 2,19-2,10 (2Н, м, СН2), 3,91 (3Н, с, ОСН3), 4,56-4,44 (2Н, м, СН2), 7,09-7,02 (2H, м, 2xCH-аром.), 7,37 (1H, т, CH-аром.), 8,02 (1H, с, CH-аром.), 8,52 (2H, д, 2xCH-аром.).

Пример 122:
4-{4-[3-(2-хлорфенил)-4-(пиримидин-2-ил)-1,2-оксазол-5-ил]-5-(трифторметил)-1H-пиразол-1-ил}-2-метилбутан-2-ол
Альтернативная стадия 1, как описано для Примера 99 (реакция с NaH): 1-(1-{3-метил-3-[(триметилсилил)окси]бутил}-5-(трифторметил)-1H-пиразол-4-ил)-2-(пиримидин-2-ил)этан-1-он (0,41 ммоль) и 2-хлор-N-гидроксибензимидоилхлорид; время реакции: 20 ч, условия реакции привели к одновременному O-десилилированию; остаток очищали с помощью преп. ТСХ на силикагеле (элюент: CH2Cl2/MeOH 95:5 и снова элюент: петролейный эфир/этилацетат 1:1) с получением указанного в заголовке соединения в виде бледно-желтого масла (9%).
Результат ЖХ/МС [M+H]+: 478,4;
1H ЯМР (CDCl3): δ 1,32 (6Н, с, 2хСН3), 2,18-2,09 (2Н, м, СН2), 4,55-4,46 (2Н, м, СН2), 7,07 (1Н, т, СН-аром.), 7,43-7,36 (3H, м, 3xCH-аром.), 7,66-7,59 (1H, м, CH-аром.), 8,01 (1H, с, CH-аром.), 8,52 (2H, д, 2xCH-аром.).

Пример 123:
4-{4-[3-(2-хлор-6-фторфенил)-4-(пиримидин-2-ил)-1,2-оксазол-5-ил]-5-(трифторметил)-1H-пиразол-1-ил}-2-метилбутан-2-ол
Альтернативная стадия 1, как описано для Примера 99 (реакция с NaH): 1-(1-{3-метил-3-[(триметилсилил)окси]бутил}-5-(трифторметил)-1H-пиразол-4-ил)-2-(пиримидин-2-ил)этан-1-он (0,41 ммоль) и 2-хлор-6-фтор-N-гидроксибензимидоилхлорид; время реакции: 18 ч, условия реакции привели к одновременному O-десилилированию; остаток очищали с помощью преп. ТСХ на силикагеле (элюент: CH2Cl2/MeOH 95:5 и снова элюент: CH2Cl2/MeOH 95:5) с получением указанного в заголовке соединения в виде бесцветного масла (27%).
Результат ЖХ/МС [M+H]+: 496,0;
1H ЯМР (CDCl3): δ 1,33 (6Н, с, 2хСН3), 2,21-2,11 (2Н, м, СН2), 4,57-4,47 (2Н, м, СН2), 7,04 (1Н, т, СН-аром.), 7,10 (1H, тд, CH-аром.), 7,30-7,26 (1H, м, CH-аром.), 7,44-7,33 (1H, м, CH-аром.), 8,00 (1H, с, CH-аром.), 8,48 (2H, д, 2xCH-аром.).
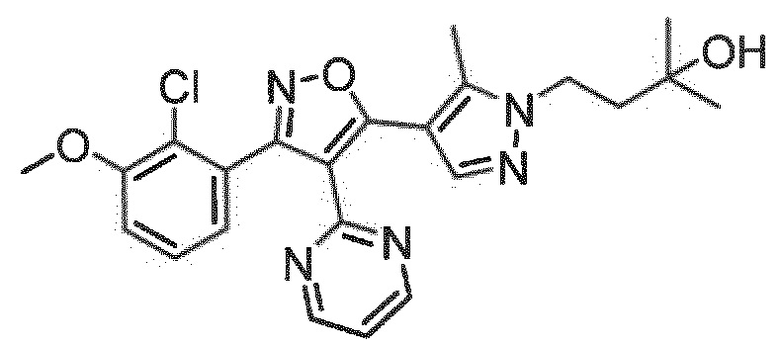
Пример 124:
4-{4-[3-(2-хлор-3-метоксифенил)-4-(пиримидин-2-ил)-1,2-оксазол-5-ил]-5-метил-1H-пиразол-1-ил}-2-метилбутан-2-ол
Альтернативная стадия 1, как описано для Примера 99 (реакция с NaH): 1-(5-метил-1-{3-метил-3-[(триметилсилил)окси]бутил}-1H-пиразол-4-ил)-2-(пиримидин-2-ил)этан-1-он (0,16 ммоль) и 2-хлор-3-метокси-N-гидроксибензимидоилхлорид; время реакции: 3 ч, условия реакции привели к одновременному O-десилилированию; остаток очищали с помощью колоночной флэш-хроматографии на силикагеле (элюент: CH2Cl2/MeOH 95:5) с получением указанного в заголовке соединения в виде желтоватого твердого вещества (24%).
Результат ЖХ/МС [M+H]+: 454,0;
1H ЯМР (CDCl3): δ 1,28 (6H, с, 2xCH3), 2,07-1,98 (2H, м, CH2), 2,56 (3H, с, CH3), 3,89 (3H, с, OCH3), 4,34-4,22 (2H, м, CH2), 7,03 (1H, дд, CH-аром.), 7,08 (1H, т, CH-аром.), 7,22 (1H, дд, CH-аром.), 7,34 (1H, т, CH-аром.), 8,08 (1H, с, CH-аром.), 8,59 (2H, д, 2xCH-аром.).

Пример 125:
4-{4-[3-(2,6-дихлор-3-метоксифенил)-4-(пиримидин-2-ил)-1,2-оксазол-5-ил]-5-метил-1H-пиразол-1-ил}-2-метилбутан-2-ол
Альтернативная стадия 1, как описано для Примера 99 (реакция с NaH): 1-(5-метил-1-{3-метил-3-[(триметилсилил)окси]бутил}-1H-пиразол-4-ил)-2-(пиримидин-2-ил)этан-1-он (0,04 ммоль) и 2,6-дихлор-3-метокси-N-гидроксибензимидоилхлорид; время реакции: 3 ч, условия реакции привели к одновременному O-десилилированию; остаток очищали с помощью колоночной флэш-хроматографии на силикагеле (элюент: CH2Cl2/MeOH 95:5) с получением указанного в заголовке соединения в виде красноватого масла (15%).
Результат ЖХ/МС [M+H]+: 488,0;
1H ЯМР (CDCl3): δ 1,30 (6Н, с, 2хСН3), 2,08-2,00 (2Н, м, СН2), 2,62 (3Н, с, СН3), 3,93 (3Н, с, ОСН3), 4,37-4,24 (2Н, м, CH2), 6,96 (1H, д, CH-аром.), 7,04 (1H, т, CH-аром.), 7,33 (1H, д, CH-аром.), 8,25 (1H, с, CH-аром.), 8,55 (2H, д, 2xCH-аром.).

Пример 126:
4-{4-[3-(2-хлорфенил)-4-(пиримидин-2-ил)-1,2-оксазол-5-ил]-5-метил-1H-пиразол-1-ил}-2-метилбутан-2-ол
Альтернативная стадия 1, как описано для Примера 99 (реакция с NaH): 1-(5-метил-1-{3-метил-3-[(триметилсилил)окси]бутил}-1H-пиразол-4-ил)-2-(пиримидин-2-ил)этан-1-он (0,1 ммоль) и 2-хлор-N-гидроксибензимидоилхлорид; время реакции: 1,5 ч, условия реакции привели к одновременному O-десилилированию; остаток очищали с помощью преп. ТСХ на силикагеле (элюент: CH2Cl2/MeOH 95:5 и снова элюент: CH2Cl2/MeOH 95:5) с получением указанного в заголовке соединения (12%).
Результат ЖХ/МС [M+H]+: 424,0;
1H ЯМР (CDCl3): δ 1,30 (6Н, с, 2хСН3), 2,08-2,00 (2Н, м, СН2), 2,58 (3Н, с, СН3), 4,33-4,26 (2Н, м, СН2), 7,10 (1Н, т, 2xCH-аром.), 7,42-7,31 (3H, м, 3xCH-аром.), 7,65-7,56 (1H, м, CH-аром.), 8,11 (1H, с, CH-аром.), 8,60 (2H, д, 2xCH-аром.).
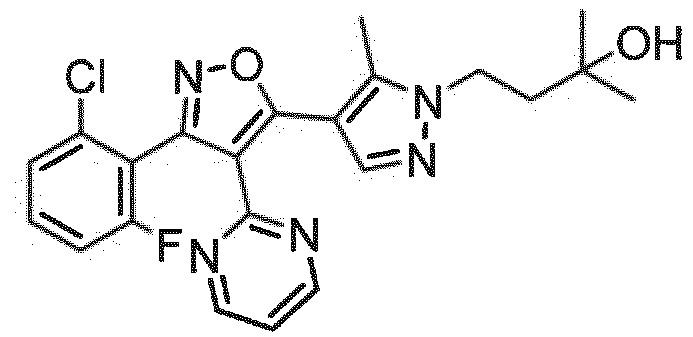
Пример 127:
4-{4-[3-(2-хлор-6-фторфенил)-4-(пиримидин-2-ил)-1,2-оксазол-5-ил]-5-метил-1H-пиразол-1-ил}-2-метилбутан-2-ол
Альтернативная стадия 1, как описано для Примера 99 (реакция с NaH): 1-(5-метил-1-{3-метил-3-[(триметилсилил)окси]бутил}-1H-пиразол-4-ил)-2-(пиримидин-2-ил)этан-1-он (0,1 ммоль) и 2-хлор-6-фтор-N-гидроксибензимидоилхлорид; время реакции: 1,5 ч, условия реакции привели к одновременному O-десилилированию; остаток очищали с помощью колоночной флэш-хроматографии на силикагеле (элюент: CH2Cl2/MeOH 95:5) с получением указанного в заголовке соединения в виде оранжевого масла (30%).
Результат ЖХ/МС [M+H]+: 442,0;
1H ЯМР (CDCl3): δ 1,30 (6Н, с, 2хСН3), 2,04 (2Н, т, СН2), 2,60 (3Н, с, СН3), 4,30 (2Н, т, СН2), 7,14-7,02 (2Н, м, 2xCH-аром.), 7,25-7,19 (1H, м, CH-аром.), 7,41-7,30 (1H, м, CH-аром.), 8,22 (1H, с, CH-аром.), 8,56 (2H, д, 2xCH-аром.).

Пример 128:
4-(4-{3-[3-(бензилокси)-2-хлорфенил]-4-(пиримидин-2-ил)-1,2-оксазол-5-ил}-5-(трифторметил)-1H-пиразол-1-ил)-2-метилбутан-2-ол
Альтернативная стадия 1, как описано для Примера 99 (реакция с NaH): 1-(1-{3-метил-3-[(триметилсилил)окси]бутил}-5-(трифторметил)-1H-пиразол-4-ил)-2-(пиримидин-2-ил)этан-1-он (2,5 ммоль) и 3-(бензилокси)-2-хлор-N-гидроксибензимидоилхлорид; время реакции: 3 ч, условия реакции привели к одновременному O-десилилированию; остаток очищали с помощью колоночной флэш-хроматографии на силикагеле (элюент: CH2Cl2/MeOH 95:5) с получением указанного в заголовке соединения в виде оранжевого масла (12%).
Результат ЖХ/МС [M+H]+: 584,1;
1H ЯМР (CDCl3): δ 1,25 (6H, с, 2xCH3), 2,15-2,02 (2H, м, CH2), 4,51-4,38 (2H, м, CH2), 5,11 (2H, с, OCH2), 7,07-6,97 (2H, м, 2xCH-аром.), 7,42-7,16 (7H, м, 7xCH-аром.), 7,96 (1H, с, CH-аром.), 8,45 (2H, д, 2xCH-аром.).
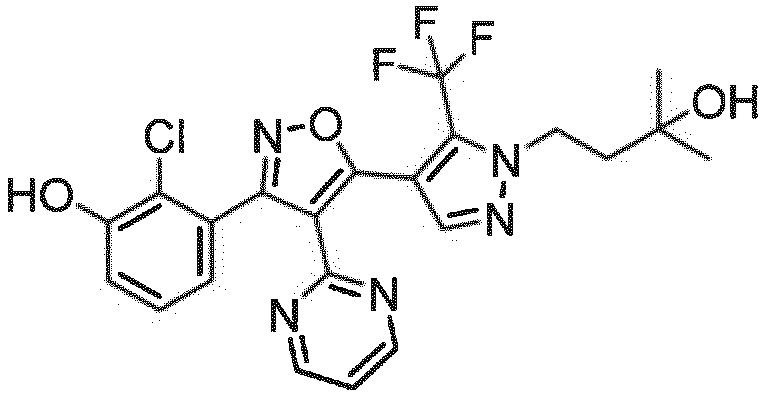
Пример 129:
2-хлор-3-{5-[1-(3-гидрокси-3-метилбутил)-5-(трифторметил)-1Н-пиразол-4-ил]-4-(пиримидин-2-ил)-1,2-оксазол-3-ил}фенол
Бензилоксипроизводное Пример 128 (0,9 ммоль) растворяли в изопропаноле/этилацетате (1:1; 6 мл) и добавляли Pd/C (10%; 0,3 экв.). Атмосферу внутри колбы заменяли водородом и смесь перемешивали при комнатной температуре в течение 18 ч. Pd/C отфильтровывали через целит, фильтрат концентрировали досуха при пониженном давлении и затем под вакуумом с получением указанного в заголовке соединения в виде бледно-коричневатого твердого вещества (83%).
Результат ЖХ/МС [M+H]+: 494,0;
1H ЯМР (CDCl3): δ 1,66 (6Н, с, 2хСН3), 2,54-2,44 (2Н, м, СН2), 4,90-4,81 (2Н, м, СН2), 7,41 (1Н, т, СН-аром.), 7,55-7,45 (2H, м, 2xCH-аром.), 7,64 (1H, к, CH-аром.), 8,40-8,32 (2H, м, CH-аром. и OH), 8,87 (2H, д, 2xCH-аром.).

2-хлор-3-{5-[1-(3-гидрокси-3-метилбутил)-5-метил-1Н-пиразол-4-ил]-4-(пиримидин-2-ил)-1,2-оксазол-3-ил}фенол
Альтернативная стадия 1, как описано для Примера 99 (реакция с NaH): 1-(5-метил-1-{3-метил-3-[(триметилсилил)окси]бутил}-1H-пиразол-4-ил)-2-(пиримидин-2-ил)этан-1-он (0,75 ммоль) и 3-(бензилокси)-2-хлор-N-гидроксибензимидоилхлорид; время реакции: 1,5 ч, условия реакции привели к одновременному O-десилилированию; остаток очищали с помощью колоночной флэш-хроматографии на силикагеле (элюент: CH2Cl2/MeOH 95:5) с получением 4-(4-{3-[3-(бензилокси)-2-хлорфенил]-4-(пиримидин-2-ил)-1,2-оксазол-5-ил}-5-метил-1Н-пиразол-1-ил)-2-метилбутан-2-ола с выходом 22%;
Результат ЖХ/МС [M+H]+: 530,1;
1H ЯМР (CDCl3): δ 1,46 (6Н, с, 2хСН3), 2,21 (2Н, м, СН2), 2,74 (3Н, с, СН3), 4,46 (2Н, м, СН2), 5,33 (2Н, с, СН2), 7,23 (1Н, д, СН-аром.), 7,38-7,62 (8Н, м, СН-аром.), 8,27 (1Н, с, СН-аром.), 8,76 (2Н, д, СН-аром.).
Бензилоксипроизводное было O-дебензилировано в соответствии с протоколом, описанным для Примера 129, с получением указанного в заголовке соединения в виде бледно-желтоватого твердого вещества (неочищенный 96%).
Результат ЖХ/МС [M+H]+: 440,0;
1H ЯМР (CDCl3): δ 1,29 (6Н, с, 2хСН3), 2,35 (2Н, м, СН2), 2,58 (3Н, с, СН3), 4,28 (2Н, м, СН2), 5,33 (2Н, с, СН2), 7,06-7,17 (4Н, м, СН-аром.), 8,09 (1Н, с, СН-аром.), 8,62 (2Н, д, СН-аром.).

метил-(S)-3-(2-хлор-3-гидроксифенил)-5-(1-(2-гидроксипропил)-5-(трифторметил)-1Н-пиразол-4-ил)изоксазол-4-карбоксилат. Альтернативная стадия 1, как описано для Примера 99 (реакция с NaH): метил-3-{1-[(2S)-2-[(трет-бутилдиметилсилил)окси]пропил]-5-(трифторметил)-1H-пиразол-4-ил}-3-оксопропаноат (1,5 ммоль) и 3-(бензилокси)-2-хлор-N-гидроксибензимидоилхлорид; время реакции: 1,5 ч; остаток очищали с помощью колоночной флэш-хроматографии на силикагеле (элюент: CH2Cl2/MeOH 95:5) с получением метил-3-[3-(бензилокси)-2-хлорфенил]-5-{1-[(2S)-2-[(трет-бутилдиметилсилил)окси]пропил]-5-метил-1Н-пиразол-4-ил}-1,2-оксазол-4-карбоксилата с выходом 27%.
Бензилоксипроизводное было O-дебензилировано в соответствии с протоколом, описанным для Примера 129, с получением указанного в заголовке соединения в виде бледно-желтоватого твердого вещества (неочищенный 96%).
Указанное в заголовке соединение синтезировали путем конечного O-десилилирования в соответствии с альтернативной стадией 2, описанной выше в Примере 103 (с использованием ТБАФ) (15%): Остаток очищали с помощью преп. ТСХ на силикагеле (элюент: CH2Cl2/MeOH 95:5).

Пример 130:
3-(4-(3-(2-хлор-3-метоксифенил)-4-(циклопропоксиметил)изоксазол-5-ил)-5-(трифторметил)-1H-пиразол-1-ил)-1-метилциклобутан-1-ол (син-конфигурация)
Стадия 1: этил-3-(1-{3-[(трет-бутилдиметилсилил)окси]-3-метилциклобутил}-5-(трифторметил)-1Н-пиразол-4-ил)-3-оксопропаноат (син-конфигурация) (0,25 ммоль) и 2-хлор-3-метокси-N-гидроксибензимидоилхлорид; реакцию проводили при 65°С; остаток очищали с помощью колоночной флэш-хроматографии на силикагеле (элюент: петролейный эфир/этилацетат 9:1) с получением этил-3-(2-хлор-3-метоксифенил)-5-{1-[3-[(трет-бутилдиметилсилил)окси]-3-метилциклобутил]-5-(трифторметил)-1Н-пиразол-4-ил}-1,2-оксазол-4-карбоксилата (син-конфигурация) (72%);
Результат ЖХ/МС [M+H]+: 614,2;
1H ЯМР (CDCl3): δ 0,13 (6H, с, 2xCH3), 0,91 (9H, с, 3xCH3), 0,99 (3H, т, CH3), 1,26 (3H, с, CH3), 2,68-2,54 (2H, м, СН2), 3,03-2,91 (2Н, м, СН2), 3,95 (3Н, с, ОСН3), 4,08 (2Н, к, ОСН2), 4,56 (1Н, квинт, СН), 7,14-7,05 (2Н, м, 2xCH-аром.), 7,34 (1H, т, CH-аром.), 7,96 (1H, с, CH-аром.).
Стадия 2: Превращение этиловой сложноэфирной группы в циклопропоксиметильный фрагмент достигали в соответствии с общими методиками синтеза 4-алкоксиметилизоксазолов, описанными выше:
- LiAlH4 восстановление этил-3-(2-хлор-3-метоксифенил)-5-{1-[3-[(трет-бутилдиметилсилил)окси]-3-метилциклобутил]-5-(трифторметил)-1H-пиразол-4-ил}-1,2-оксазол-4-карбоксилата (син-конфигурация) (0,18 ммоль) с получением [5-(1-{3-[(трет-бутилдиметилсилил)окси]-3-метилциклобутил}-5-(трифторметил)-1Н-пиразол-4-ил)-3-(2-хлор-3-метоксифенил)-1,2-оксазол-4-ил]метанола (син-конфигурация) в виде бледно-желтого масла (колич.).
Результат ЖХ/МС [M+H]+: 572,1;
1H ЯМР (CDCl3): δ 0,13 (6H, с, 2xCH3), 0,92 (9H, с, tBu), 1,48 (3H, с, CH3), 1,72 (1H, с, ОН), 1,85 (2H, м, СН2), 3,88 (2Н, с, СН2), 3,96 (3Н, с, СН3), 4,42 (2Н, с, СН2), 4,56 (1Н, с, СН), 7,09 (2Н, м, СН-аром.) 7,36 (1Н, т, СН-аром.), 8,94 (1Н, с, СН-аром.).
- Синтез бромметилизоксазола в соответствии со способом A (Et2O, 20 мин) с получением 4-(бромметил)-5-(1-{3-[(трет-бутилдиметилсилил)окси]-3-метилциклобутил}-5-(трифторметил)-1Н-пиразол-4-ил)-3-(2-хлор-3-метоксифенил)-1,2-оксазола (син-конфигурация) в виде желтого масла (колич.)
Результат ЖХ/МС [M+H]+: 634,0;
- Синтез 4-циклопропоксиметилизоксазола в соответствии со способом C (с использованием циклопропанола) с получением 5-(1-{3-[(трет-бутилдиметилсилил)окси]-3-метилциклобутил}-5-(трифторметил)-1H-пиразол-4-ил)-3-(2-хлор-3-метоксифенил)-4-(циклопропоксиметил)-1,2-оксазола (син-конфигурация) в виде бледно-желтого масла (35%).
Результат ЖХ/МС [M+H]+: 612,2;
1H ЯМР (CDCl3): δ 0,13 (6H, с, 2xCH3), 0,35-0,24 (4H, м, 2xCH2), 0,91 (9H, с, 3xCH3), 1,48 (3H, с, CH3), 2,68-2,56 (2H, м, СН2), 3,03-2,88 (2Н, м, СН2), 3,16-3,05 (1Н, м, СН), 3,97 (3Н, с, ОСН3), 4,28 (2Н, с, ОСН2), 4,57 (1Н, квинт, CH), 7,39-6,82 (3H, м, 3xCH-аром.), 7,86 (1H, с, CH-аром.).
Стадия 3: указанное в заголовке соединение синтезировали путем конечного O-десилилирования в соответствии с альтернативной стадией 2, описанной выше в Примере 103 (с использованием ТБАФ): Остаток очищали с помощью преп. ТСХ на силикагеле (элюент: CH2Cl2/MeOH 95:5 и снова элюент: петролейный эфир/этилацетат 4:1) с получением указанного в заголовке соединения в виде оранжевого масла (12%).
Результат ЖХ/МС [M+H]+: 498,0;
1H ЯМР (CDCl3): δ 0,30 (4Н, м, 2хСН2), 1,50 (3Н, с, СН3), 2,80 (4Н, м, 2хСН2), 3,11 (1Н, м, СН), 3,97 (3Н, с, СН3), 4,27 (2Н, с, СН2), 4,72 (1Н, квинт, СН), 7,08 (2Н, д, СН-аром.), 7,34 (1Н, т, СН-аром.), 7,89 (1Н, с, СН-аром.).

Пример 131: этил-3-(2-хлор-3-метоксифенил)-5-{1-[3-гидрокси-3-метилциклобутил]-5-(трифторметил)-1Н-пиразол-4-ил}-1,2-оксазол-4-карбоксилат (син-конфигурация)
Интермедиат после стадии 1, Пример 130, этил-3-(2-хлор-3-метоксифенил)-5-{1-[3-[(трет-бутилдиметилсилил)окси]-3-метилциклобутил]-5-(трифторметил)-1H-пиразол-4-ил}-1,2-оксазол-4-карбоксилат (син-конфигурация) O-десилилировали в соответствии с альтернативной стадией 2, описанной выше в Примере 103 (с использованием ТБАФ): Остаток очищали с помощью преп. ТСХ на силикагеле (элюент: CH2Cl2/MeOH 95:5) с получением указанного в заголовке соединения в виде оранжевого масла (72%).
Результат ЖХ/МС [M+H]+: 500,0;
1H ЯМР (CDCl3): δ 0,99 (3Н, т, СН3), 1,49 (3Н, с, СН3), 2,81 (4Н, м, 2хСН2), 2,95 (3Н, с, СН3), 4,08 (2Н, к, СН2), 4,72 (1Н, м, СН), 7,09 (2Н, м, СН-аром.), 7,35 (1Н, т, СН-аром.), 8,00 (1Н, с, СН-аром.).

Пример 132: этил-3-(2-хлор-3-метоксифенил)-5-[1-(3-гидрокси-3-метилбутил)-5-(трифторметил)-1Н-пиразол-4-ил]-1,2-оксазол-4-карбоксилат
Стадия 1: этил-3-(1-{3-метил-3-[(триметилсилил)окси]бутил}-5-(трифторметил)-1Н-пиразол-4-ил)-3-оксопропаноат (0,80 ммоль) и 2-хлор-3-метокси-N-гидроксибензимидоилхлорид; реакцию проводили при 65°С; условия реакции привели к одновременному O-десилилированию; остаток очищали с помощью преп. ТСХ на силикагеле (элюент: CH2Cl2/MeOH 95:5) с получением указанного в заголовке соединения в виде оранжевого масла (19%);
Результат ЖХ/МС [M+H]+: 502,0;
1H ЯМР (CDCl3): δ 1,00 (3Н, т, СН3), 1,32 (6Н, с, 2хСН3), 2,14 (2Н, м, СН2), 3,95 (3Н, с, СН3), 4,08 (2Н, к, СН2), 4,52 (2Н, м, СН2), 7,09 (2Н, м, СН-аром.), 7,34 (1Н, т, СН-аром.), 7,97 (1Н, с, СН-аром.).
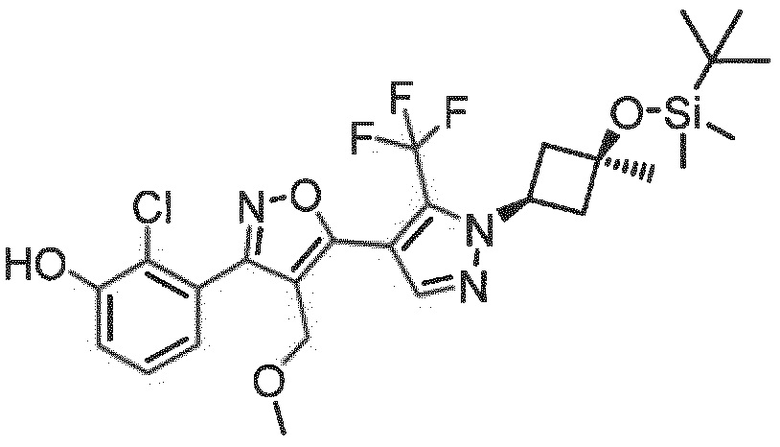
Структурный элемент для синтеза Примеров 150 и 151:
2-хлор-3-[4-(метоксиметил)-5-{1-[3-[(трет-бутилдиметилсилил)окси]-3-метилциклобутил]-5-(трифторметил)-1Н-пиразол-4-ил}-1,2-оксазол-3-ил]фенол (син-конфигурация)
Стадия 1: этил-3-(1-{3-[(трет-бутилдиметилсилил)окси]-3-метилциклобутил}-5-(трифторметил)-1Н-пиразол-4-ил)-3-оксопропаноат (син-конфигурация) (0,18 ммоль) и 3-(бензилокси)-2-хлор-N-гидроксибензимидоилхлорид; реакцию проводили при 65°С; остаток очищали с помощью колоночной флэш-хроматографии на силикагеле (элюент: CH2Cl2/MeOH 100:1) с получением этил-3-[3-(бензилокси)-2-хлорфенил]-5-{1-[3-[(трет-бутилдиметилсилил)окси]-3-метилциклобутил]-5-(трифторметил)-1Н-пиразол-4-ил}-1,2-оксазол-4-карбоксилата (син-конфигурация) в виде бесцветного масла (64%);
Результат ЖХ/МС [M+H]+: 690,4;
1H ЯМР (CDCl3, J [Гц]): δ = 7,97 (с, 1H, пиразол-H), 7,49-7,29 (м, 6H, бензил-H), 7,11 (д, 2H, 3J= 7,9, бензил-H), 5,22 (с, 2H, CH2), 4,62-4,51 (м, 1H, CH), 4,08 (к, 2H, 3J= 7,1, OCH2CH3), 3,01-2,94 (м, 2H, CH2), 2,64-2,58 (м, 2Н, СН2), 1,48 (с, 3Н, СН3), 0,98 (т, 3Н, 3J= 7,1, ОСН2СН3), 0,92 (с, 9Н, С(СН3)3), 0,13 (с, 6Н, СН3).
Стадия 2: Превращение этиловой сложноэфирной группы в метоксиметильный фрагмент достигали в соответствии с общими методиками синтеза 4-алкоксиметилизоксазолов, описанными выше:
- LiAlH4 восстановление этил-3-[3-(бензилокси)-2-хлорфенил]-5-{1-[3-[(трет-бутилдиметилсилил)окси]-3-метилциклобутил]-5-(трифторметил)-1Н-пиразол-4-ил}-1,2-оксазол-4-карбоксилата (син-конфигурация) (0,12 ммоль) с получением {3-[3-(бензилокси)-2-хлорфенил]-5-{1-[3-[(трет-бутилдиметилсилил)окси]-3-метилциклобутил]-5-(трифторметил)-1Н-пиразол-4-ил}-1,2-оксазол-4-ил}метанола (син-конфигурация) в виде бесцветного масла (83%).
Результат ЖХ/МС [M+H]+: 648,4;
- Синтез метоксиметилизоксазола в соответствии со способом A (MeI) с получением 3-[3-(бензилокси)-2-хлорфенил]-4-(метоксиметил)-5-{1-[3-[(трет-бутилдиметилсилил)окси]-3-метилциклобутил]-5-(трифторметил)-1Н-пиразол-4-ил}-1,2-оксазола (син-конфигурация) в виде бесцветного масла (32%)
Результат ЖХ/МС [M+H]+: 662,5;
1H ЯМР (CDCl3, J [Гц]): δ = 7,88 (с, 1H, пиразол-H), 7,50-7,32 (м, 6H, бензил-H), 7,11 (д, 2H, 3J=8,0, бензил-H), 5,22 (с, 2H, CH2), 4,63-4,52 (м, 1H, CH), 4,21 (с, 2H, CH2), 3,15 (с, 3H, OCH3), 3,00-2,93 (м, 2H, CH2), 2,65-2,59 (м, 2Н, СН2), 1,49 (с, 3Н, СН3), 0,92 (с, 9Н, С(СН3)3), 0,14 (с, 6Н, СН3).
Стадия 3: указанное в заголовке соединение синтезировали путем конечного O-дебензилирования в соответствии с протоколом, описанным для Примера 129, с получением указанного в заголовке соединения в виде бесцветного масла после очистки с помощью колоночной флэш-хроматографии на силикагеле (элюент: петролейный эфир/этилацетат 7:3) (51%);
Результат ЖХ/МС [M+H]+: 572,1.
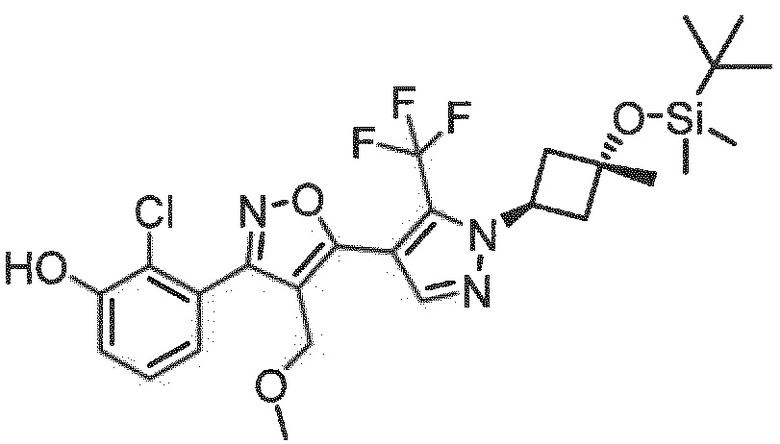
Структурный элемент для синтеза Примеров 152 и 153:
2-хлор-3-[4-(метоксиметил)-5-{1-[3-[(трет-бутилдиметилсилил)окси]-3-метилциклобутил]-5-(трифторметил)-1Н-пиразол-4-ил}-1,2-оксазол-3-ил]фенол (анти-конфигурация)
Стадия 1: этил-3-(1-{3-[(трет-бутилдиметилсилил)окси]-3-метилциклобутил}-5-(трифторметил)-1Н-пиразол-4-ил)-3-оксопропаноат (анти-конфигурация) (0,28 ммоль) и 3-(бензилокси)-2-хлор-N-гидроксибензимидоилхлорид; реакцию проводили при 60°С; остаток очищали с помощью колоночной флэш-хроматографии на силикагеле (элюент: CH2Cl2/MeOH 100:1) с получением этил-3-[3-(бензилокси)-2-хлорфенил]-5-{1-[3-[(трет-бутилдиметилсилил)окси]-3-метилциклобутил]-5-(трифторметил)-1Н-пиразол-4-ил}-1,2-оксазол-4-карбоксилата (анти-конфигурация) в виде бесцветного масла (83%);
Результат ЖХ/МС [M+H]+: 690,4;
1H ЯМР (CDCl3, J [Гц]): δ = 7,96 (с, 1H, пиразол-H), 7,49-7,29 (м, 6H, бензил-H), 7,11 (д, 2H, 3J= 8,2, бензил-H), 5,22-5,17 (м, 3Н, СН, СН2), 4,08 (к, 2Н, 3J= 7,1, ОСН2СН3), 2,81-2,74 (м, 2Н, СН2), 2,68-2,61 (м, 2Н, СН2), 1,52 (с, 3Н, СН3), 0,99 (т, 3Н, 3J= 7,1, ОСН2СН3), 0,93 (с, 9Н, С(СН3)3), 0,14 (с, 6Н, СН3).
Стадия 2: Превращение этиловой сложноэфирной группы в метоксиметильный фрагмент достигали в соответствии с общими методиками синтеза 4-алкоксиметилизоксазолов, описанными выше:
- LiAlH4 восстановление этил-3-[3-(бензилокси)-2-хлорфенил]-5-{1-[3-[(трет-бутилдиметилсилил)окси]-3-метилциклобутил]-5-(трифторметил)-1Н-пиразол-4-ил}-1,2-оксазол-4-карбоксилата (син-конфигурация) (0,23 ммоль) с получением {3-[3-(бензилокси)-2-хлорфенил]-5-{1-[3-[(трет-бутилдиметилсилил)окси]-3-метилциклобутил]-5-(трифторметил)-1Н-пиразол-4-ил}-1,2-оксазол-4-ил}метанола (анти-конфигурация) в виде сероватого масла (73%).
Результат ЖХ/МС [M+H]+: 648,4;
- Синтез метоксиметилизоксазола в соответствии со способом A (MeI) с получением 3-[3-(бензилокси)-2-хлорфенил]-4-(метоксиметил)-5-{1-[3-[(трет-бутилдиметилсилил)окси]-3-метилциклобутил]-5-(трифторметил)-1Н-пиразол-4-ил}-1,2-оксазола (анти-конфигурация) в виде бесцветного масла (37%)
Результат ЖХ/МС [M+H]+: 662,3;
1H ЯМР (CDCl3): δ 0,14 (6H, с, 2xCH3), 0,93 (9H, с, 3xCH3), 1,51 (3H, с, CH3), 2,84-2,53 (4H, м, 2xCH2), 3,15 (3H, с, OCH3), 4,20 (2H, с, OCH2), 5,22 (2H, с, OCH2), 7,18-7,07 (2H, д, 2xCH-аром.), 7,55-7,28 (6H, 6xCH-аром.), 7,87 (1Н, с, СН-аром.).
Стадия 3: указанное в заголовке соединение синтезировали путем конечного O-дебензилирования в соответствии с протоколом, описанным для Примера 129, с получением указанного в заголовке соединения в виде бесцветного масла после очистки с помощью преп. ТСХ на силикагеле (элюент: петролейный эфир/этилацетат 7:3) (56%).
Результат ЖХ/МС [M+H]+: 572,4.

Структурный элемент для синтеза Примеров 154-160:
3-(5-{1-[(2R)-2-[(трет-бутилдиметилсилил)окси]пропил]-5-(трифторметил)-1Н-пиразол-4-ил}-4-(пиримидин-4-ил)-1,2-оксазол-3-ил)-2-хлорбензойная кислота
Стадия 1: 1-{1-[(2R)-2-[(трет-бутилдиметилсилил)окси]пропил]-5-(трифторметил)-1Н-пиразол-4-ил}-2-(пиримидин-4-ил)этан-1-он (1,0 ммоль) и метил-2-хлор-3-(хлор(гидроксиимино)метил)бензоат; реакцию проводили при 60°С; остаток очищали с помощью колоночной флэш-хроматографии на силикагеле (элюент: CH2Cl2/MeOH 100:1) с получением метил-3-(5-{1-[(2R)-2-[(трет-бутилдиметилсилил)окси]пропил]-5-(трифторметил)-1Н-пиразол-4-ил}-4-(пиримидин-4-ил)-1,2-оксазол-3-ил)-2-хлорбензоата (43%);
Стадия 2: сложноэфирную группу омыляли в этаноле (8 мл/ммоль) и водн. NaOH (2,0 М; 8 мл/ммоль), и нагревали до 60°С в течение 1 ч, и затем подкисляли добавлением водн. HCl (1,0 М). Полученную суспензию распределяли между CH2Cl2 и водой, объединенные органические слои высушивали над MgSO4, растворитель удаляли при пониженном давлении с получением неочищенной карбоновой кислоты, которую использовали как таковую для дальнейших превращений.

Структурный элемент для синтеза Примеров 161-165:
3-(5-{1-[(2R)-2-[(трет-бутилдиметилсилил)окси]пропил]-5-(трифторметили)-1Н-пиразол-4-ил}-4-(пиримидин-4-ил)-1,2-оксазол-3-ил)-2-метоксибензойная кислота
Стадия 1: 1-{1-[(2R)-2-[(трет-бутилдиметилсилил)окси]пропил]-5-(трифторметил)-1Н-пиразол-4-ил}-2-(пиримидин-4-ил)этан-1-он (1,0 ммоль) и метил-3-(хлор(гидроксиимино)метил)-2-метоксибензоат; реакцию проводили при 60°С; остаток очищали с помощью колоночной флэш-хроматографии на силикагеле (элюент: CH2Cl2/MeOH 100:1) с получением метил-3-(5-{1-[(2R)-2-[(трет-бутилдиметилсилил)окси]пропил]-5-(трифторметил)-1Н-пиразол-4-ил}-4-(пиримидин-4-ил)-1,2-оксазол-3-ил)-2-метоксибензоата (37%);
Стадия 2: сложноэфирную группу омыляли в этаноле (8 мл/ммоль) и водн. NaOH (2,0 М; 8 мл/ммоль), и нагревали до 60°С в течение 1 ч, и затем подкисляли добавлением водн. HCl (1,0 М). Полученную суспензию распределяли между CH2Cl2 и водой, объединенные органические слои высушивали над MgSO4, растворитель удаляли при пониженном давлении с получением неочищенной карбоновой кислоты, которую использовали как таковую для дальнейших превращений.

Структурный элемент для синтеза Примеров 166 и 167:
3-(5-{1-[(2R)-2-[(трет-бутилдиметилсилил)окси]пропил]-5-(трифторметил)-1Н-пиразол-4-ил}-4-(пиримидин-4-ил)-1,2-оксазол-3-ил)бензойная кислота
Стадия 1: 1-{1-[(2R)-2-[(трет-бутилдиметилсилил)окси]пропил]-5-(трифторметил)-1Н-пиразол-4-ил}-2-(пиримидин-4-ил)этан-1-он (1,0 ммоль) и метил-3-(хлор(гидроксиимино)метил)бензоат; реакцию проводили при 60°С; остаток очищали с помощью колоночной флэш-хроматографии на силикагеле (элюент: CH2Cl2/MeOH 100:1) с получением метил-3-(5-{1-[(2R)-2-[(трет-бутилдиметилсилил)окси]пропил]-5-(трифторметил)-1Н-пиразол-4-ил}-4-(пиримидин-4-ил)-1,2-оксазол-3-ил)бензоата (41%);
Стадия 2: сложноэфирную группу омыляли в этаноле (8 мл/ммоль) и водн. NaOH (2,0 М; 8 мл/ммоль), и нагревали до 60°С в течение 1 ч, и затем подкисляли добавлением водн. HCl (1,0 М). Полученную суспензию распределяли между CH2Cl2 и водой, объединенные органические слои высушивали над MgSO4, растворитель удаляли при пониженном давлении с получением неочищенной карбоновой кислоты, которую использовали как таковую для дальнейших превращений.
Общая методика аминоалкилирования фенольных групп

А) Соответствующее производное фенола (1,0 экв.) растворяли в ДМФ (15 мл/ммоль) и добавляли K2CO3 (3,5 экв.) с последующим добавлением соответствующего аминоалкилгалогенида (2,0 экв.). Смесь перемешивали при указанной температуре в течение 18 ч, и затем разбавляли CH2Cl2, и экстрагировали водой и солевым раствором. Органическую фазу высушивали над MgSO4, отфильтровывали и концентрировали при пониженном давлении. Неочищенный продукт очищали с помощью преп. ТСХ на силикагеле (элюент: CH2Cl2/MeOH 95:5).
B) Реакция Мицунобу: Соответствующее производное фенола (1,0 экв.), PPh3 (1,5 экв.) и соответствующий спирт (1,5 экв.) растворяли в ТГФ (15 мл/ммоль) и смесь охлаждали до 0°C. Добавляли диизопропилазодикарбоксилат (DIAD; 1,5 экв.), и смесь перемешивали при 0°C в течение 30 мин при комнатной температуре в течение указанного времени, и затем разбавляли CH2Cl2, и экстрагировали водой и солевым раствором. Органическую фазу высушивали над MgSO4, отфильтровывали и концентрировали при пониженном давлении. Неочищенный продукт очищали с помощью преп. ТСХ на силикагеле (элюент: CH2Cl2/MeOH 95:5).
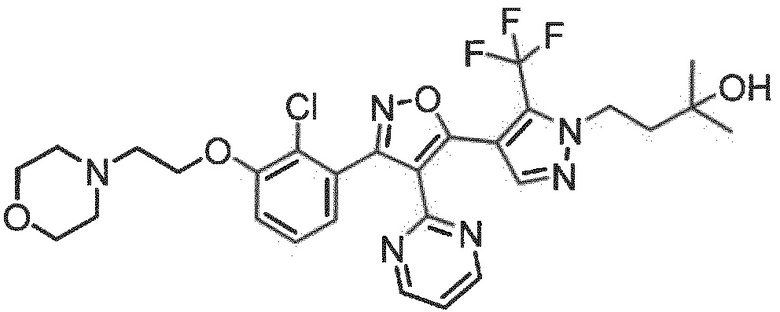
Пример 133: 4-[4-(3-{2-хлор-3-[2-(морфолин-4-ил)этокси]фенил}-4-(пиримидин-2-ил)-1,2-оксазол-5-ил)-5-(трифторметил)-1H-пиразол-1-ил]-2-метилбутан-2-ол
2-хлор-3-{5-[1-(3-гидрокси-3-метилбутил)-5-(трифторметил)-1Н-пиразол-4-ил]-4-(пиримидин-2-ил)-1,2-оксазол-3-ил}фенол (Пример 129) (0,09 ммоль) и N-(2-хлорэтил)морфолина гидрохлорид использовали в способе А, температура реакции 50°С с получением указанного в заголовке соединения в виде оранжевого масла (14%).
Результат ЖХ/МС [M+H]+: 607,5;
1H ЯМР (CDCl3): δ 1,32 (6H, с, 2xCH3), 2,19-2,09 (2H, м, CH2), 2,68-2,57 (4H, м, 2xCH2), 2,90-2,79 (2H, м, CH2), 3,78-3,65 (4H, м, 2xCH2), 4,24-4,16 (2H, м, CH2), 4,56-4,44 (2H, м, CH2), 7,09-7,03 (2H, м, 2xCH-аром.), 7,25-7,21 (1H, м, CH-аром.), 7,34 (1H, т, CH-аром.), 8,01 (1H, с, CH-аром.), 8,52 (2H, д, 2xCH-аром.).

Пример 134: 4-[4-(3-{2-хлор-3-[2-(диметиламино)этокси]фенил}-4-(пиримидин-2-ил)-1,2-оксазол-5-ил)-5-(трифторметил)-1H-пиразол-1-ил]-2-метилбутан-2-ол
2-хлор-3-{5-[1-(3-гидрокси-3-метилбутил)-5-(трифторметил)-1Н-пиразол-4-ил]-4-(пиримидин-2-ил)-1,2-оксазол-3-ил}фенол (Пример 129) (0,09 ммоль) и 2-хлор-N, N-диметилэтиламин использовали в способе А, температура реакции 50°С с получением указанного в заголовке соединения в виде коричневатого масла (8%).
Результат ЖХ/МС [M+H]+: 565,5;
1H ЯМР (CDCl3): δ 1,32 (6H, с, 2xCH3), 2,19-2,09 (2H, м, CH2), 2,37 (6H, с, 2xCH3), 2,82 (2H, т, CH2), 4,18 (2H, т, CH2), 4,56-4,45 (2H, м, CH2), 7,09-7,03 (2H, м, 2xCH-аром.), 7,25-7,21 (1H, м, CH-аром.), 7,34 (1H, т, CH-аром.), 8,01 (1H, с, CH-аром.), 8,52 (2H, д, 2xCH-аром.).

Пример 135: 4-[4-(3-{2-хлор-3-[2-(пирролидин-1-ил)этокси]фенил}-4-(пиримидин-2-ил)-1,2-оксазол-5-ил)-5-(трифторметил)-1H-пиразол-1-ил]-2-метилбутан-2-ол
2-хлор-3-{5-[1-(3-гидрокси-3-метилбутил)-5-(трифторметил)-1Н-пиразол-4-ил]-4-(пиримидин-2-ил)-1,2-оксазол-3-ил}фенол (Пример 129) (0,09 ммоль) и 1-(2-хлорэтил)пирролидин использовали в способе А, температура реакции 50°С с получением указанного в заголовке соединения в виде коричневатого масла (5%).
Результат ЖХ/МС [M+H]+: 591,5;
1H ЯМР (CDCl3): δ 1,32 (6Н, с, 2хСН3), 1,96-1,88 (6Н, м, 3хСН2), 2,18-2,10 (2Н, м, СН2), 3,01-2,89 (2Н, м, СН2), 3,22-3,12 (2H, м, CH2), 4,39-4,29 (2H, м, CH2), 4,54-4,46 (2H, м, CH2), 7,09-7,03 (2H, м, 2xCH-аром.), 7,25-7,21 (1H, м, CH-аром.), 7,35 (1H, т, CH-аром.), 8,00 (1H, с, CH-аром.), 8,52 (2H, д, 2xCH-аром.).
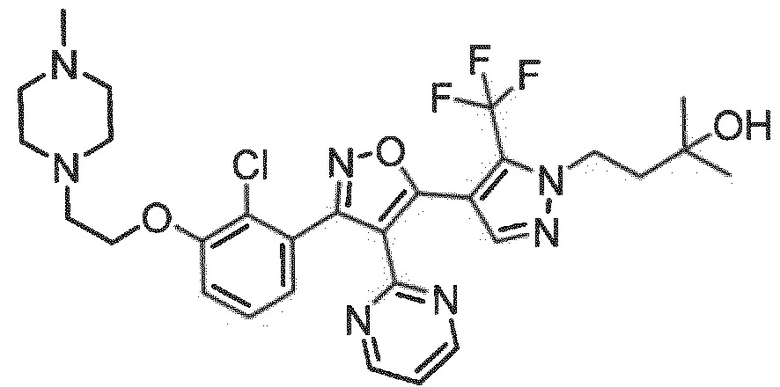
Пример 136: 4-[4-(3-{2-хлор-3-[2-(4-метилпиперазин-1-ил)этокси]фенил}-4-(пиримидин-2-ил)-1,2-оксазол-5-ил)-5-(трифторметил)-1H-пиразол-1-ил]-2-метилбутан-2-ол
2-хлор-3-{5-[1-(3-гидрокси-3-метилбутил)-5-(трифторметил)-1Н-пиразол-4-ил]-4-(пиримидин-2-ил)-1,2-оксазол-3-ил}фенол (Пример 129) (0,09 ммоль) и 1-(2-хлорэтил)-4-метилпиперазин использовали в способе А, температура реакции 100°С с получением указанного в заголовке соединения в виде коричневатого масла (6%).
Результат ЖХ/МС [M+H]+: 620,5;
1H ЯМР (CDCl3): δ 1,31 (6Н, с, 2хСН3), 2,19-2,08 (2Н, м, СН2), 2,31 (3Н, с, СН3), 2,55-2,45 (4Н, м, 2хСН2), 2,70-2,64 (4H, м, 2xCH2), 2,85 (2H, т, CH2), 4,18 (2H, т, CH2), 4,55-4,46 (2H, м, CH2), 7,09-7,03 (2H, м, 2xCH-аром.) 7,25-7,21 (1H, м, CH-аром.), 7,33 (1H, т, CH-аром.), 8,01 (1H, с, CH-аром.), 8,51 (2H, д, 2xCH-аром.).

Пример 137: 4-[4-(3-{2-хлор-3-[2-(диэтиламино)этокси]фенил}-4-(пиримидин-2-ил)-1,2-оксазол-5-ил)-5-(трифторметил)-1H-пиразол-1-ил]-2-метилбутан-2-ол
2-хлор-3-{5-[1-(3-гидрокси-3-метилбутил)-5-(трифторметил)-1Н-пиразол-4-ил]-4-(пиримидин-2-ил)-1,2-оксазол-3-ил}фенол (Пример 129) (0,09 ммоль) и 2-хлор-N, N-диэтилэтиламин использовали в способе А, температура реакции 50°С с получением указанного в заголовке соединения в виде оранжевого масла (13%).
Результат ЖХ/МС [M+H]+: 593,5;
1H ЯМР (CDCl3): δ 1,38-1,29 (12Н, м, 4хСН3), 2,19-2,08 (2Н, м, СН2), 3,20-3,07 (4Н, м, 2хСН2), 3,41-3,33 (2Н, м, СН2), 4,59-4,46 (4H, м, 2xCH2), 7,11-7,04 (2H, м, 2xCH-аром.), 7,26-7,21 (1H, м, CH-аром.), 7,36 (1H, т, CH-аром.), 8,00 (1H, с, CH-аром.), 8,53 (2H, д, 2xCH-аром.).

Пример 138: 4-[2-(2-хлор-3-{5-[1-(3-гидрокси-3-метилбутил)-5-(трифторметил)-1H-пиразол-4-ил]-4-(пиримидин)-2-ил)-1,2-оксазол-3-ил}фенокси)этил]тиоморфолин-1,1-дион
2-хлор-3-{5-[1-(3-гидрокси-3-метилбутил)-5-(трифторметил)-1Н-пиразол-4-ил]-4-(пиримидин-2-ил)-1,2-оксазол-3-ил}фенол (Пример 129) (0,06 ммоль) и 4-(2-гидроксиэтил)тиоморфолин-1,1-дион использовали в способе B (18 ч); дополнительная очистка с помощью второй преп. ТСХ (элюент: петролейный эфир/этилацетат 3:7) предоставляла указанное в заголовке соединение в виде сероватого масла (6%).
Результат ЖХ/МС [M+H]+: 655,4;
1H ЯМР (CDCl3): δ 1,32 (6H, с, 2xCH3), 2,19-2,10 (2H, м, CH2), 3,11-2,99 (6H, м, 3xCH2), 3,27-3,15 (4H, м, 2xCH2), 4,23-4,14 (2H, м, CH2), 4,56-4,45 (2H, м, CH2), 7,11-7,00 (2H, м, 2xCH-аром.), 7,29-7,26 (1H, м, CH-аром.), 7,36 (1H, т, CH-аром.), 8,01 (1H, с, CH-аром.), 8,53 (2H, д, 2xCH-аром.).

Пример 139: 4-(4-{3-[2-хлор-3-(2-{2-окса-6-азаспиро[3.3]гептан-6-ил}этокси)фенил]-4-(пиримидин-2-ил)-1,2-оксазол-5-ил}-5-(трифторметил)-1H-пиразол-1-ил)-2-метилбутан-2-ол
2-хлор-3-{5-[1-(3-гидрокси-3-метилбутил)-5-(трифторметил)-1Н-пиразол-4-ил]-4-(пиримидин-2-ил)-1,2-оксазол-3-ил}фенол (Пример 129) (0,08 ммоль) и 6-(2-хлорэтил)-2-окса-6-азаспиро[3,3]гептан использовали в способе А, температура реакции 70°С с получением указанного в заголовке соединения в виде коричневатого масла (15%).
Результат ЖХ/МС [M+H]+: 619,5;
1H ЯМР (CDCl3): δ 1,32 (6H, с, 2xCH3), 2,18-2,11 (2H, м, CH2), 2,83 (2H, т, CH2), 3,52 (4H, с, 2xCH2), 4,06 (2H, т, CH2), 4,55-4,47 (2H, м, CH2), 4,71 (4H, с, 2xCH2), 7,00 (1H, дд, CH-аром.), 7,07 (1H, т, CH-аром.), 7,23 (1H, дд, CH-аром.), 7,33 (1H, т, CH-аром.), 8,01 (1H, с, CH-аром.), 8,52 (2H, д, 2xCH-аром.).

Пример 140: 4-[4-(3-{2-хлор-3-[3-(диметиламино)пропокси]фенил}-4-(пиримидин-2-ил)-1,2-оксазол-5-ил)-5-(трифторметил)-1H-пиразол-1-ил]-2-метилбутан-2-ол
2-хлор-3-{5-[1-(3-гидрокси-3-метилбутил)-5-(трифторметил)-1Н-пиразол-4-ил]-4-(пиримидин-2-ил)-1,2-оксазол-3-ил}фенол (Пример 129) (0,2 ммоль) и 3-диметиламино-1-пропилхлорид использовали в способе А, температура реакции 60°С с получением указанного в заголовке соединения в виде желтого масла (49%).
Результат ЖХ/МС [M+H]+: 578,9;
1H ЯМР (CDCl3): δ 1,31 (6H, с, 2xCH3), 2,07-1,95 (2H, м, CH2), 2,18-2,08 (2H, м, CH2), 2,27 (6H, с, 2xCH3), 2,51 (2H, т, СН2), 4,11 (2Н, т, СН2), 4,56-4,44 (2Н, м, СН2), 7,10-7,02 (2Н, м, 2хСН-аром.), 7,22 (1Н, дд, СН-аром.), 7,33 (1H, т, CH-аром.), 8,01 (1H, с, CH-аром.), 8,52 (2H, д, 2xCH-аром.).

Пример 141: 4-[3-(2-хлор-3-{5-[1-(3-гидрокси-3-метилбутил)-5-(трифторметил)-1H-пиразол-4-ил]-4-(пиримидин)-2-ил)-1,2-оксазол-3-ил}фенокси)пропил]тиоморфолин-1,1-дион
2-хлор-3-{5-[1-(3-гидрокси-3-метилбутил)-5-(трифторметил)-1Н-пиразол-4-ил]-4-(пиримидин-2-ил)-1,2-оксазол-3-ил}фенол (Пример 129) (0,06 ммоль) и 4-(3-гидроксипропил)тиоморфолин-1,1-дион использовали в способе B (2 ч); указанное в заголовке соединение получали в виде желтого твердого вещества (6%).
Результат ЖХ/МС [M+H]+: 669,2
1H ЯМР (CDCl3): δ 1,32 (6Н, с, 2хСН3), 2,02-1,94 (2Н, м, СН2), 2,18-2,10 (2Н, м, СН2), 2,72 (2Н, т, СН2), 3,05-2,98 (8H, м, 4xCH2), 4,12 (2H, т, CH2), 4,54-4,47 (2H, м, CH2), 7,10-7,02 (2H, м, 2xCH-аром.), 7,26-7,21 (1H, м, CH-аром.), 7,35 (1H, т, CH-аром.), 8,01 (1H, с, CH-аром.), 8,52 (2H, д, 2xCH-аром.).

Пример 142: 4-[4-(3-{2-хлор-3-[3-(пирролидин-1-ил)пропокси]фенил}-4-(пиримидин-2-ил)-1,2-оксазол-5-ил)-5-(трифторметил)-1H-пиразол-1-ил]-2-метилбутан-2-ол
2-хлор-3-{5-[1-(3-гидрокси-3-метилбутил)-5-(трифторметил)-1Н-пиразол-4-ил]-4-(пиримидин-2-ил)-1,2-оксазол-3-ил}фенол (Пример 129) (0,2 ммоль) и 1-(3-хлорпропил)пирролидин использовали в способе А, температура реакции 60°С, вторая преп. ТСХ (элюент: CHCl3/MeOH/водн. NH3 80:9:1) с получением указанного в заголовке соединения в виде желтого масла (9%).
Результат ЖХ/МС [M+H]+: 605,1;
1H ЯМР (CDCl3): δ 1,33 (6H, с, 2xCH3), 2,12-2,05 (4H, м, 2xCH2), 2,21-2,12 (2H, м, CH2), 2,47-2,33 (2H, м, CH2), 3,30-3,09 (6H, м, 3xCH2), 4,30-4,11 (2H, м, CH2), 4,58-4,46 (2H, м, CH2), 7,10-6,96 (3H, м, 3xCH-аром.), 7,34 (1H, д, CH-аром.), 8,00 (1H, с, CH-аром.), 8,47 (2H, д, 2xCH-аром.).

Пример 143: 4-[4-(3-{2-хлор-3-[3-(диэтиламино)пропокси]фенил}-4-(пиримидин-2-ил)-1,2-оксазол-5-ил)-5-(трифторметил)-1H-пиразол-1-ил]-2-метилбутан-2-ол
2-хлор-3-{5-[1-(3-гидрокси-3-метилбутил)-5-(трифторметил)-1Н-пиразол-4-ил]-4-(пиримидин-2-ил)-1,2-оксазол-3-ил}фенол (Пример 129) (0,2 ммоль) и 3-диэтиламино-1-пропанол использовали в способе B (1,5 ч); указанное в заголовке соединение получали в виде желтого твердого вещества (22%).
Результат ЖХ/МС [M+H]+: 607,2;
1H ЯМР (CDCl3): δ 1,09 (6Н, т, 2хСН3), 1,31 (6Н, с, 2хСН3), 2,09-2,00 (2Н, м, СН2), 2,19-2,09 (2Н, м, СН2), 2,72-2,60 (2H, м, CH2), 2,84-2,72 (2H, м, CH2), 4,12 (2H, т, CH2), 4,56-4,45 (2H, м, CH2), 7,09-7,02 (2H, м, 2xCH-аром.), 7,23 (1H, дд, CH-аром.), 7,33 (1H, т, CH-аром.), 8,00 (1H, с, CH-аром.), 8,52 (2H, д, 2xCH-аром.).

Пример 144: 4-[4-(3-{2-хлор-3-[2-(диэтиламино)этокси]фенил}-4-(пиримидин-2-ил)-1,2-оксазол-5-ил)-5-метил-1H-пиразол-1-ил]-2-метилбутан-2-ол
2-хлор-3-{5-[1-(3-гидрокси-3-метилбутил)-5-метил-1Н-пиразол-4-ил]-4-(пиримидин-2-ил)-1,2-оксазол-3-ил}фенол (0,08 ммоль) и 2-хлор-N, N-диэтилэтиламин использовали в способе А, температура реакции 50°С с получением указанного в заголовке соединения с выходом 21%.
Результат ЖХ/МС [M+H]+: 539,1;
1H ЯМР (CDCl3): δ 1,08 (6Н, т, 2хСН3), 1,28 (6Н, с, 2хСН3), 2,08-1,97 (2Н, м, СН2), 2,56 (3Н, с, СН3), 2,70 (4Н, к, 2xCH2), 2,96 (2H, т, CH2), 4,17 (2H, т, CH2), 4,34-4,24 (2H, м, CH2), 7,03 (1H, дд, CH-аром.), 7,08 (1H, т, CH-аром.), 7,20 (1H, дд, CH-аром.), 7,31 (1H, т, CH-аром.), 8,08 (1H, с, CH-аром.), 8,60 (2H, д, 2xCH-аром.).

Пример 145: 4-[4-(3-{2-хлор-3-[2-(диметиламино)этокси]фенил}-4-(пиримидин-2-ил)-1,2-оксазол-5-ил)-5-метил-1H-пиразол-1-ил]-2-метилбутан-2-ол
2-хлор-3-{5-[1-(3-гидрокси-3-метилбутил)-5-метил-1Н-пиразол-4-ил]-4-(пиримидин-2-ил)-1,2-оксазол-3-ил}фенол (0,16 ммоль) и 2-хлор-N, N-диметилэтиламин использовали в способе А, температура реакции 50°С с получением указанного в заголовке соединения в виде бледно-желтого масла (11%).
Результат ЖХ/МС [M+H]+: 511,1;
1H ЯМР (CDCl3): δ 1,29 (6H, с, 2xCH3), 2,08-1,98 (2H, м, CH2), 2,37 (6H, с, 2xCH3), 2,57 (3H, с, CH3), 2,81 (2H, т, CH2), 4,16 (2H, т, CH2), 4,33-4,24 (2H, м, CH2), 7,12-7,00 (2H, м, 2xCH-аром.), 7,22 (1H, дд, CH-аром.), 7,32 (1H, т, CH-аром.), 8,07 (1H, с, CH-аром.), 8,60 (2H, д, 2xCH-аром.).
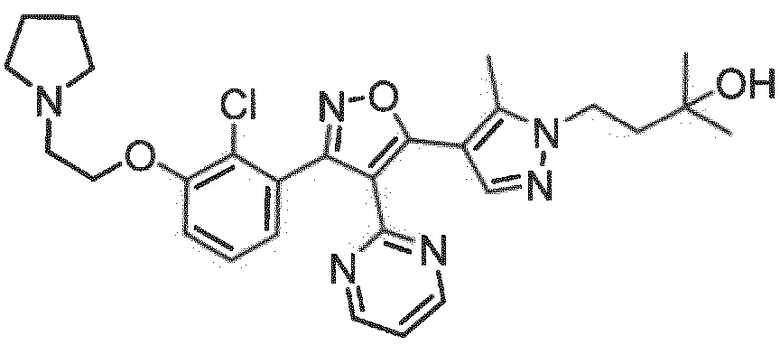
Пример 146:
4-[4-(3-{2-хлор-3-[2-(пирролидин-1-ил)этокси]фенил}-4-(пиримидин-2-ил)-1,2-оксазол-5-ил)-5-метил-1H-пиразол-1-ил]-2-метилбутан-2-ол
2-хлор-3-{5-[1-(3-гидрокси-3-метилбутил)-5-метил-1Н-пиразол-4-ил]-4-(пиримидин-2-ил)-1,2-оксазол-3-ил}фенол (0,16 ммоль) и 1-(2-хлорэтил)пирролидин использовали в способе А, температура реакции 50°С с получением указанного в заголовке соединения после второй преп. ТСХ (элюент: CH2Cl2/MeOH 9:1) в виде бледно-желтого масла (8%).
Результат ЖХ/МС [M+H]+: 537,1;
1H ЯМР (CDCl3): δ 1,29 (6Н, с, 2хСН3), 1,86-1,76 (4Н, м, 2хСН2), 2,07-1,99 (2Н, м, СН2), 2,57 (3Н, с, СН3), 2,75-2,66 (4H, м, 2xCH2), 2,98 (2H, т, CH2), 4,21 (2H, т, CH2), 4,33-4,25 (2H, м, CH2), 7,04 (1H, дд, CH-аром.), 7,08 (1H, т, CH-аром.), 7,21 (1H, дд, CH-аром.), 7,32 (1H, т, CH-аром.), 8,08 (1H, с, CH-аром.), 8,60 (2H, д, 2xCH-аром.).
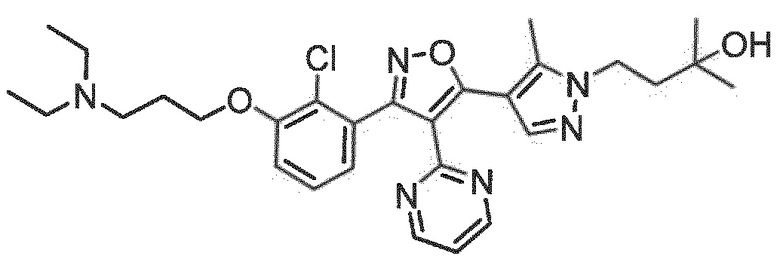
Пример 147: 4-[4-(3-{2-хлор-3-[3-(диэтиламино)пропокси]фенил}-4-(пиримидин-2-ил)-1,2-оксазол-5-ил)-5-метил-1Н-пиразол-1-ил]-2-метилбутан-2-ол
2-хлор-3-{5-[1-(3-гидрокси-3-метилбутил)-5-метил-1Н-пиразол-4-ил]-4-(пиримидин-2-ил)-1,2-оксазол-3-ил}фенол (0,08 ммоль) и 3-диэтиламино-1-пропанол использовали в способе B (1,5 ч); указанное в заголовке соединение получали в виде бледно-желтого масла (22%).
Результат ЖХ/МС [M+H]+: 553,2;
1H ЯМР (CDCl3): δ 1,13 (6Н, т, 2хСН3), 1,29 (6Н, с, 2хСН3), 2,07-1,98 (2Н, м, СН2), 2,16-2,07 (2Н, м, СН2), 2,57 (3Н, с, СН3), 2,73 (4Н, к, 2хСН2), 2,82 (2Н, т, СН2), 4,11 (2Н, т, СН2), 4,32-4,23 (2Н, м, СН2), 7,02 (1Н, дд, 2xCH-аром.), 7,09 (1H, т, CH-аром.), 7,20 (1H, дд, CH-аром.), 7,31 (1H, т, CH-аром.), 8,08 (1H, с, CH-аром.), 8,60 (2H, д, 2xCH-аром.).

Пример 148: метил-3-{2-хлор-3-[2-(морфолин-4-ил)этокси]фенил}-5-{1-[(2S)-2-гидроксипропил]-5-(трифторметил)-1H-пиразол-4-ил}-1,2-оксазол-4-карбоксилат
метил-(S)-3-(2-хлор-3-гидроксифенил)-5-(1-(2-гидроксипропил)-5-(трифторметил)-1H-пиразол-4-ил)изоксазол-4-карбоксилат (0,06 ммоль) и N-(2-хлорэтил)морфолина гидрохлорид использовали в способе А, температура реакции 50°С с получением указанного в заголовке соединения (24%).
Результат ЖХ/МС [M+H]+: 559,3;
1H ЯМР (CDCl3): δ 1,32 (3Н, д, СН3), 2,69 (4Н, уш., 2хСН2), 2,93 (2Н, т, СН2), 3,63 (3Н, с, ОСН3), 3,76 (4Н, т, 2хСН2), 4,30-4,19 (3H, м, CH и CH2), 4,46-4,30 (2H, м, CH2), 7,14-7,06 (2H, м, 2xCH-аром.), 7,33 (1H, т, CH-аром.), 7,99 (1Н, с, СН-аром.).
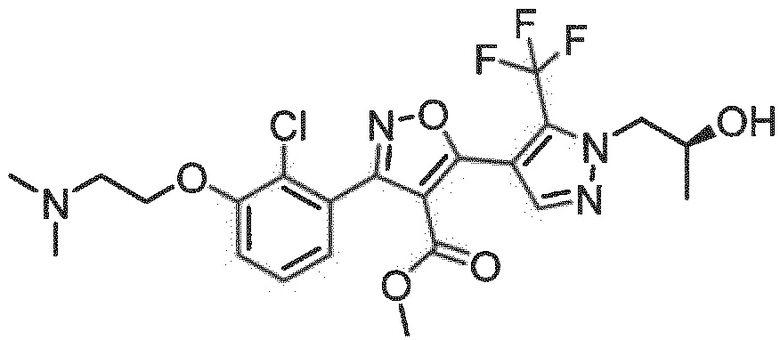
Пример 149: метил-3-{2-хлор-3-[2-(диметиламино)этокси]фенил}-5-{1-[(2S)-2-гидроксипропил]-5-(трифторметил)-1H-пиразол-4-ил}-1,2-оксазол-4-карбоксилат
метил-(S)-3-(2-хлор-3-гидроксифенил)-5-(1-(2-гидроксипропил)-5-(трифторметил)-1H-пиразол-4-ил)изоксазол-4-карбоксилат (0,06 ммоль) и 2-хлор-N, N-диметилэтиламин использовали в способе А, температура реакции 50°С с получением указанного в заголовке соединения (19%).
Результат ЖХ/МС [M+H]+: 517,3;
1H ЯМР (CDCl3): δ 1,32 (3Н, д, СН3), 2,92 (6Н, с, 2хСН3), 3,48 (2Н, т, СН2), 3,63 (3Н, с, ОСН3), 4,24 (1Н, дд, СН), 4,47-4,31 (2H, м, CH2), 4,60 (2H, т, CH2), 7,19-7,11 (2H, м, 2xCH-аром.), 7,38 (1H, т, CH-аром.), 7,99 (1Н, с, СН-аром.).
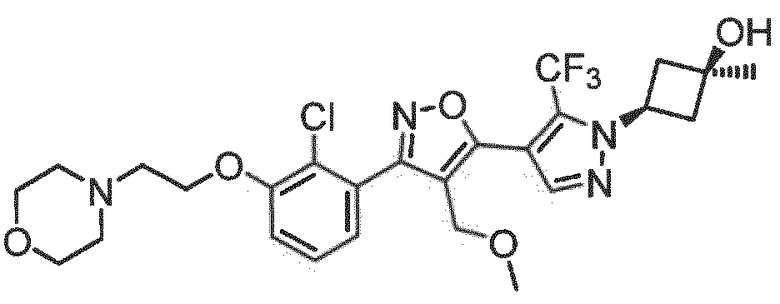
Пример 150: 3-[4-(3-{2-хлор-3-[2-(морфолин-4-ил)этокси]фенил}-4-(метоксиметил)-1,2-оксазол-5-ил)-5-(трифторметил)-1H-пиразол-1-ил]-1-метилциклобутан-1-ол (син-конфигурация)
2-хлор-3-[4-(метоксиметил)-5-{1-[3-[(трет-бутилдиметилсилил)окси]-3-метилциклобутил]-5-(трифторметил)-1Н-пиразол-4-ил}-1,2-оксазол-3-ил]фенол (син-конфигурация) (0,03 ммоль) и N-(2-хлорэтил)морфолина гидрохлорид использовали в способе А, температура реакции 50°С; после стандартной обработки неочищенный материал растворяли в ТГФ (0,5 мл) и обрабатывали ТБАФ (1 М в ТГФ; 1,1 экв.) при комнатной температуре в течение 2 ч. Растворитель удаляли при пониженном давлении и указанное в заголовке соединение выделяли из преп. ТСХ (элюент: CH2Cl2/MeOH/водн. NH3 100:10:1) в виде бледно-желтого масла (56%).
Результат ЖХ/МС [M+H]+: 571,4;
1H ЯМР (CDCl3, J [Гц]): δ = 7,90 (с, 1H, пиразол-H), 7,35-7,29 (м, 1H, бензил-H), 7,11-7,06 (м, 2H, бензил-H), 4,77-4,67 (м, 1H, CH), 4,25-4,19 (м, 4H, CH2, RCH2OCH3), 3,75-3,72 (м, 4H, морфолино-H), 3,15 (с, 3H, RCH2OCH3), 2,91-2,72 (м, 6Н, 3хСН2), 2,66-2,63 (м, 4Н, морфолино-Н), 1,49 (с, 3Н, СН3).
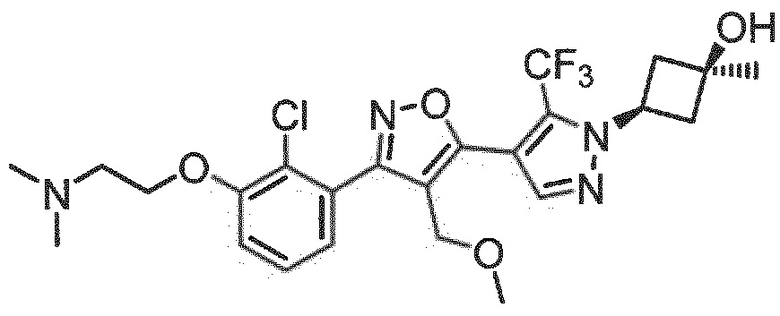
Пример 151:
3-[4-(3-{2-хлор-3-[2-(диметиламино)этокси]фенил}-4-(метоксиметил)-1,2-оксазол-5-ил)-5-(трифторметил)-1H-пиразол-1-ил]-1-метилциклобутан-1-ол (син-конфигурация)
2-хлор-3-[4-(метоксиметил)-5-{1-[3-[(трет-бутилдиметилсилил)окси]-3-метилциклобутил]-5-(трифторметил)-1Н-пиразол-4-ил}-1,2-оксазол-3-ил]фенол (син-конфигурация) (0,03 ммоль) и 2-хлор-N, N-диметилэтиламин использовали в способе А, температура реакции 45°С; после стандартной обработки неочищенный материал растворяли в ТГФ (0,5 мл) и обрабатывали ТБАФ (1 М в ТГФ; 1,1 экв.) при комнатной температуре в течение 3,5 ч. Растворитель удаляли при пониженном давлении и указанное в заголовке соединение выделяли из преп. ТСХ (элюент: CH2Cl2/MeOH/водн. NH3 100:10:1) в виде бесцветного масла (48%).
Результат ЖХ/МС [M+H]+: 529,50;
1H ЯМР (CDCl3, J [Гц]): δ = 7,91 (с, 1H, пиразол-H), 7,35-7,29 (м, 1H, бензил-H), 7,11-7,06 (м, 2H, бензил-H), 4,77-4,67 (м, 1H, CH), 4,22-4,18 (м, 4H, CH2, RCH2OCH3), 3,15 (с, 3H, RCH2OCH3), 2,88-2,72 (м, 6H, 3xCH2), 2,39 (с, 6H, N(CH3)2), 1,49 (с, 3H CH3).

Пример 152: 3-[4-(3-{2-хлор-3-[2-(морфолин-4-ил)этокси]фенил}-4-(метоксиметил)-1,2-оксазол-5-ил)-5-(трифторметил)-1Н-пиразол-1-ил]-1-метилциклобутан-1-ол (анти-конфигурация)
2-хлор-3-[4-(метоксиметил)-5-{1-[3-[(трет-бутилдиметилсилил)окси]-3-метилциклобутил]-5-(трифторметил)-1Н-пиразол-4-ил}-1,2-оксазол-3-ил]фенол (анти-конфигурация) (0,02 ммоль) и N-(2-хлорэтил)морфолина гидрохлорид использовали в способе А, температура реакции 50°С; после стандартной обработки неочищенный материал растворяли в ТГФ (0,5 мл) и обрабатывали ТБАФ (1 М в ТГФ; 1,1 экв.) при комнатной температуре в течение 4,5 ч. Растворитель удаляли при пониженном давлении и указанное в заголовке соединение выделяли из преп. ТСХ (элюент: CH2Cl2/MeOH/водн. NH3 100:10:1) в виде бледно-желтого масла (60%).
Результат ЖХ/МС [M+H]+: 571,3;
1H ЯМР (CDCl3, J [Гц]): δ = 7,87 (с, 1H, пиразол-H), 7,35-7,29 (м, 1H, бензил-H), 7,12-7,06 (м, 2H, бензил-H), 5,32-5,21 (м, 1H, CH), 4,25-4,19 (м, 4H, CH2, RCH2OCH3), 3,75-3,72 (м, 4H, морфолино-H), 3,15 (с, 3H, RCH2OCH3), 2,91-2,80 (м, 4Н, 2хСН2), 2,68-2,61 (м, 6Н, СН2, морфолино-Н), 1,55 (с, 3Н СН3).

Пример 153: 3-[4-(3-{2-хлор-3-[2-(диметиламино)этокси]фенил}-4-(метоксиметил)-1,2-оксазол-5-ил)-5-(трифторметил)-1Н-пиразол-1-ил]-1-метилциклобутан-1-ол (анти-конфигурация)
2-хлор-3-[4-(метоксиметил)-5-{1-[3-[(трет-бутилдиметилсилил)окси]-3-метилциклобутил]-5-(трифторметил)-1Н-пиразол-4-ил}-1,2-оксазол-3-ил]фенол (анти-конфигурация) (0,03 ммоль) и 2-хлор-N, N-диметилэтиламин использовали в способе А, температура реакции 50°С; после стандартной обработки неочищенный материал растворяли в ТГФ (0,5 мл) и обрабатывали ТБАФ (1 М в ТГФ; 1,1 экв.) при комнатной температуре в течение 3,5 ч. Растворитель удаляли при пониженном давлении и указанное в заголовке соединение выделяли из преп. ТСХ (элюент: CH2Cl2/MeOH/водн. NH3 100:10:1) в виде бледно-желтого масла (87%).
Результат ЖХ/МС [M+H]+: 529,30;
1H ЯМР (CDCl3, J [Гц]): δ = 7,87 (с, 1H, пиразол-H), 7,35-7,29 (м, 1H, бензил-H), 7,11-7,06 (м, 2H, бензил-H), 5,31-5,21 (м, 1H, CH), 4,23-4,19 (м, 4H, CH2, RCH2OCH3), 3,15 (с, 3H, RCH2OCH3), 2,87-2,80 (м, 2H, CH2), 2,68-2,60 (м, 2H, CH2), 2,40 (с, 6H, N(CH3)2), 1,55 (с, 3H, CH3).
Общая методика синтеза изоксазол-3-илбензамидов

Или 3-(5-{1-[(2R)-2-[(трет-бутилдиметилсилил)окси]пропил]-5-(трифторметил)-1H-пиразол-4-ил}-4-(пиримидин-4-ил)-1,2-оксазол-3-ил)-2-хлорбензойную кислоту (Примеры 154-160), 3-(5-{1-[(2R)-2-[(трет-бутилдиметилсилил)окси]пропил]-5-(трифторметил)-1Н-пиразол-4-ил}-4-(пиримидин-4-ил)-1,2-оксазол-3-ил)-2-метоксибензойную кислоту (Примеры 161-165), или 3-(5-{1-[(2R)-2-[(трет-бутилдиметилсилил)окси]пропил]-5-(трифторметил)-1Н-пиразол-4-ил}-4-(пиримидин-4-ил)-1,2-оксазол-3-ил)бензойную кислоту (Примеры 166 и 167) (0,15 ммоль), соответствующий амин (1,8 экв.), 1-гидроксибензотриазол (1,5 экв.) и 1-(3-диметиламинопропил)-3-этилкарбодиимида гидрохлорид (EDCI; 1,7 экв.) растворяли в 1 мл сухого ДМФ. Добавляли N-метилморфолин (10 экв.) и смесь перемешивали при комнатной температуре в течение 18 ч. Смесь распределяли между насыщенным водн. раствором NH4Cl и CH2Cl2, объединенные органические слои промывали водой и солевым раствором и высушивали над MgSO4, отфильтровывали и концентрировали при пониженном давлении. Очистку продукта достигали с помощью преп. ТСХ на силикагеле (элюент: петролейный эфир/этилацетат 1:1; при необходимости вторая преп. ТСХ, разбавитель: CH2Cl2/MeOH 98:2).
Конечное O-десилилирование бензамидов достигали в ТГФ (0,5 мл) с ТБАФ (1 М в ТГФ; 1,1 экв.) при комнатной температуре в течение 3,5 ч. Растворитель удаляли при пониженном давлении и указанное в заголовке соединение выделяли из преп. ТСХ (элюент: CH2Cl2/MeOH 95:5).

Пример 154: (R)-(2-хлор-3-(5-(1-(2-гидроксипропил)-5-(трифторметил)-1H-пиразол-4-ил)-4-(пиримидин-4-ил)изоксазол-3-ил)фенил)(морфолино)метанон
Из 3-(5-{1-[(2R)-2-[(трет-бутилдиметилсилил)окси]пропил]-5-(трифторметил)-1Н-пиразол-4-ил}-4-(пиримидин-4-ил)-1,2-оксазол-3-ил)-2-хлорбензойной кислоты и морфолина с выходом 23% за две стадии.
Результат ЖХ/МС [M+H]+: 562,9;
1H ЯМР (CDCl3): δ 1,32 (3Н, д, СН3), 3,19 (2Н, т, СН2), 3,58 (2Н, т, СН2), 3,91-3,66 (4Н, м, 2хСН2), 4,23 (1Н, дд, CH), 4,47-4,30 (2H, м, CH2), 6,90 (1H, уш., CH-аром.), 7,57-7,45 (2H, м, 2xCH-аром.), 7,64 (1H, дд, CH-аром.), 7,97 (1Н, с, СН-аром.), 8,55 (1Н, уш., СН-аром.), 9,06 (1Н, уш., СН-аром.).
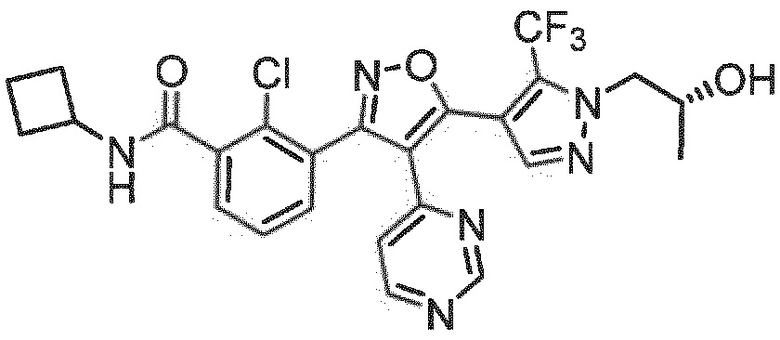
Пример 155: (R)-2-хлор-N-циклобутил-3-(5-(1-(2-гидроксипропил)-5-(трифторметил)-1H-пиразол-4-ил)-4-(пиримидин-4-ил)изоксазол-3-ил)бензамид
Из 3-(5-{1-[(2R)-2-[(трет-бутилдиметилсилил)окси]пропил]-5-(трифторметил)-1Н-пиразол-4-ил}-4-(пиримидин-4-ил)-1,2-оксазол-3-ил)-2-хлорбензойной кислоты и циклобутиламина с выходом 14% за две стадии.
Результат ЖХ/МС [M+H]+: 546,9;
1H ЯМР (CDCl3): δ 1,32 (3Н, д, СН3), 2,60-1,70 (6Н, м, 3хСН2), 4,24 (1Н, дд, СН), 4,50-4,31 (2Н, м, СН2), 4,58 (1Н, квинт, СН), 6,19 (1Н, уш., NH), 6,94 (1Н, с, СН-аром.), 7,50 (1Н, т, СН-аром.), 7,61 (1Н, д, СН-аром.) 7,78 (1Н, д, СН-аром.), 7,98 (1Н, с, СН-аром.), 8,61 (1Н, уш., СН-аром.), 9,07 (1Н, с, СН-аром.).

Пример 156: (R)-2-хлор-N-этил-3-(5-(1-(2-гидроксипропил)-5-(трифторметил)-1H-пиразол-4-ил)-4-(пиримидин-4-ил)изоксазол-3-ил)бензамид
Из 3-(5-{1-[(2R)-2-[(трет-бутилдиметилсилил)окси]пропил]-5-(трифторметил)-1Н-пиразол-4-ил}-4-(пиримидин-4-ил)-1,2-оксазол-3-ил)-2-хлорбензойной кислоты и этиламина (2 М в ТГФ) с выходом 8% за две стадии.
Результат ЖХ/МС [M+H]+: 520,9;
1H ЯМР (CDCl3): δ 1,25 (3Н, к, СН3), 1,32 (3Н, д, СН3), 3,56-3,42 (2Н, м, СН2), 4,24 (1Н, дд, СН), 4,48-4,31 (2Н, м, CH2), 6,00 (1H, уш. N-H), 6,91 (1H, уш., CH-аром.), 7,51 (1H, т, CH-аром.), 7,61 (1H, д, CH-аром.) 7,78 (1Н, д, СН-аром.), 7,98 (1Н, с, СН-аром.), 8,60 (1Н, уш., СН-аром.), 9,06 (1Н, с, СН-аром.).

Пример 157: (R)-2-хлор-3-(5-(1-(2-гидроксипропил)-5-(трифторметил)-1H-пиразол-4-ил)-4-(пиримидин-4-ил)изоксазол-3-ил)-N-изопропилбензамид
Из 3-(5-{1-[(2R)-2-[(трет-бутилдиметилсилил)окси]пропил]-5-(трифторметил)-1Н-пиразол-4-ил}-4-(пиримидин-4-ил)-1,2-оксазол-3-ил)-2-хлорбензойной кислоты и изопропиламина с выходом 12% за две стадии.
Результат ЖХ/МС [M+H]+: 534,9;
1H ЯМР (CDCl3): δ 1,26 (6Н, д, 2хСН3), 1,32 (3Н, д, СН3), 4,48-4,18 (4Н, м, 2хСН и СН2), 5,84 (1Н, д, N-H), 6,96 (1Н, с, СН-аром.), 7,50 (1Н, т, СН-аром.), 7,60 (1Н, д, СН-аром.), 7,76 (1Н, д, СН-аром.), 7,98 (1Н, с, CH-аром.), 8,62 (1H, уш. CH-аром.), 9,07 (1H, с, CH-аром.).

Пример 158: (R)-(азетидин-1-ил)(2-хлор-3-(5-(1-(2-гидроксипропил)-5-(трифторметил)-1H-пиразол-4-ил)-4-(пиримидин-4-ил)изоксазол-3-ил)фенил)метанон
Из 3-(5-{1-[(2R)-2-[(трет-бутилдиметилсилил)окси]пропил]-5-(трифторметил)-1Н-пиразол-4-ил}-4-(пиримидин-4-ил)-1,2-оксазол-3-ил)-2-хлорбензойной кислоты и азетидина с выходом 19% за две стадии.
Результат ЖХ/МС [M+H]+: 532,9;
1H ЯМР (CDCl3): δ 1,32 (3Н, д, СН3), 2,43-2,24 (2Н, м, СН2), 4,00-3,83 (2Н, м, СН2), 4,49-4,14 (5Н, м, СН и 2хСН2) 7,03 (1H, д, CH-аром.), 7,59-7,47 (2H, м, 2xCH-аром.), 7,63 (1H, дд, CH-аром.), 7,97 (1H, с, CH-аром.) 8,63 (1H, уш. CH-аром.), 9,08 (1H, с, CH-аром.).

Пример 159: (R)-2-хлор-N-циклопропил-3-(5-(1-(2-гидроксипропил)-5-(трифторметил)-1H-пиразол-4-ил)-4-(пиримидин-4-ил)изоксазол-3-ил)бензамид
Из 3-(5-{1-[(2R)-2-[(трет-бутилдиметилсилил)окси]пропил]-5-(трифторметил)-1Н-пиразол-4-ил}-4-(пиримидин-4-ил)-1,2-оксазол-3-ил)-2-хлорбензойной кислоты и циклопропиламина с выходом 6% за две стадии.
Результат ЖХ/МС [M+H]+: 532,9;
1H ЯМР (CDCl3): δ 0,68 (2Н, м, СН2), 0,91-0,85 (2Н, м, СН2), 1,32 (3Н, д, СН3), 2,98-2,84 (1Н, м, СН), 4,46-4,18 (3H, м, CH и CH2), 6,17 (1H, уш., NH), 6,91 (1H, уш., CH-аром.), 7,56-7,46 (1H, м, CH-аром.), 7,64-7,57 (1H, м, CH-аром.), 7,77 (1H, дд, CH-аром.), 7,97 (1H, с, CH-аром.), 8,60 (1H, уш., CH-аром.), 9,06 (1H, с, СН-аром.).

Пример 160: (R)-(2-хлор-3-(5-(1-(2-гидроксипропил)-5-(трифторметил)-1H-пиразол-4-ил)-4-(пиримидин-4-ил)изоксазол-3-ил)фенил)(пирролидин-1-ил)метанон
Из 3-(5-{1-[(2R)-2-[(трет-бутилдиметилсилил)окси]пропил]-5-(трифторметил)-1Н-пиразол-4-ил}-4-(пиримидин-4-ил)-1,2-оксазол-3-ил)-2-хлорбензойной кислоты и пирролидина с выходом 23% за две стадии.
Результат ЖХ/МС [M+H]+: 547,0;
1H ЯМР (CDCl3): δ 1,31 (3Н, д, СН3), 2,02-1,81 (4Н, м, 2хСН2), 3,13 (2Н, т, СН2), 3,62 (2Н, т, СН2), 4,23 (1Н, дд, СН), 4,46-4,29 (2Н, м, СН2), 6,90 (1Н, д, СН-аром.), 7,55-7,44 (2H, м, 2xCH-аром.), 7,65-7,55 (1H, м, CH-аром.), 7,96 (1H, с, CH-аром.), 8,56 (1H, уш., СН-аром.), 9,03 (1Н, с, СН-аром.).
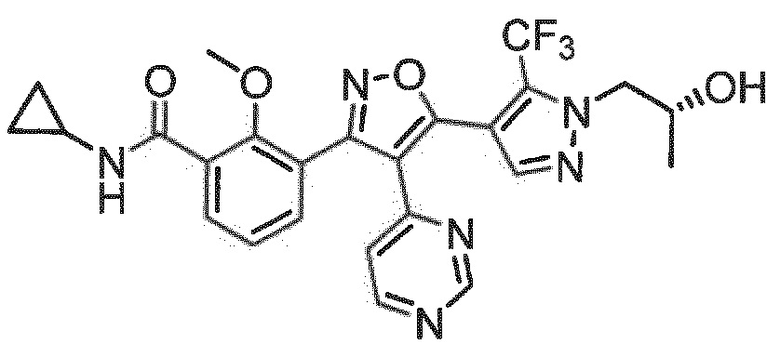
Пример 161: (R)-N-циклопропил-3-(5-(1-(2-гидроксипропил)-5-(трифторметил)-1H-пиразол-4-ил)-4-(пиримидин-4-ил)изоксазол-3-ил)-2-метоксибензамид
Из 3-(5-{1-[(2R)-2-[(трет-бутилдиметилсилил)окси]пропил]-5-(трифторметил)-1Н-пиразол-4-ил}-4-(пиримидин-4-ил)-1,2-оксазол-3-ил)-2-метоксибензойной кислоты и циклопропиламина с выходом 9% за две стадии.
Результат ЖХ/МС [M+H]+: 529,0;
1H ЯМР (CDCl3): δ 0,61-0,49 (2H, м, CH2), 0,94-0,80 (2H, м, CH2), 1,33 (3H, д, CH3), 3,06-2,78 (1H, м, CH), 3,53 (3H, с, OCH3), 4,25 (1H, дд, CH), 4,48-4,32 (2H, м, CH2), 7,08 (1H, д, CH-аром.), 7,50-7,36 (2H, м, 2xCH-аром.), 7,67 (1H, дд, CH-аром.), 7,94 (1H, с, CH-аром.), 8,29 (1H, дд, CH-аром.), 8,66 (1H, д, CH-аром.), 9,14 (1Н, с, СН-аром.).

Пример 162: (R)-3-(5-(1-(2-гидроксипропил)-5-(трифторметил)-1H-пиразол-4-ил)-4-(пиримидин-4-ил)изоксазол-3-ил)-N-изопропил-2-метоксибензамид
Из 3-(5-{1-[(2R)-2-[(трет-бутилдиметилсилил)окси]пропил]-5-(трифторметил)-1Н-пиразол-4-ил}-4-(пиримидин-4-ил)-1,2-оксазол-3-ил)-2-метоксибензойной кислоты и изопропиламина с выходом 18% за две стадии.
Результат ЖХ/МС [M+H]+: 531,0;
1H ЯМР (CDCl3): δ 1,22 (6Н, д, 2хСН3), 1,33 (3Н, д, СН3), 3,57 (3Н, с, ОСН3), 4,48-4,17 (4Н, м, 2хСН и СН2), 7,08 (1Н, уш. NH), 7,21-7,11 (1H, м, CH-аром.), 7,42 (1H, т, CH-аром.), 7,64 (1H, дд, CH-аром.), 7,95 (1H, с, CH-аром.), 8,27 (1H, дд, CH-аром.), 8,64 (1H, с, CH-аром.), 9,14 (1H, с, CH-аром.).
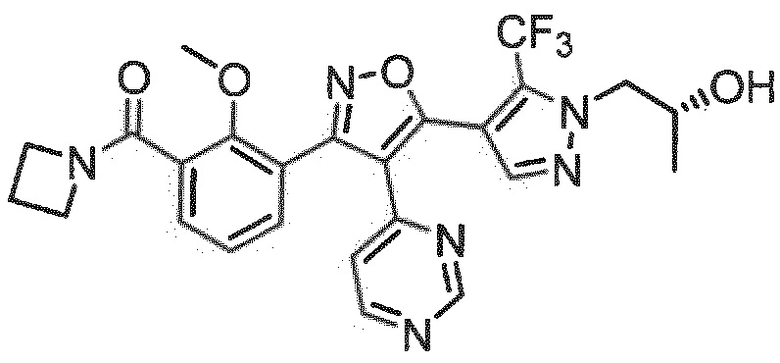
Пример 163: (R)-(азетидин-1-ил)(3-(5-(1-(2-гидроксипропил)-5-(трифторметил)-1Н-пиразол-4-ил)-4-(пиримидин-4-ил)изоксазол-3-ил)-2-метоксифенил)метанон
Из 3-(5-{1-[(2R)-2-[(трет-бутилдиметилсилил)окси]пропил]-5-(трифторметил)-1Н-пиразол-4-ил}-4-(пиримидин-4-ил)-1,2-оксазол-3-ил)-2-метоксибензойной кислоты и азетидина с выходом 15% за две стадии.
Результат ЖХ/МС [M+H]+: 529,0;
1H ЯМР (CDCl3): δ 1,33 (3Н, д, СН3), 2,40-2,19 (2Н, м, СН2), 3,51 (3Н, с, ОСН3), 4,18-3,70 (4Н, м, 2хСН2), 4,48-4,18 (3H, м, CH и CH2), 7,14 (1H, д, CH-аром.), 7,33 (1H, т, CH-аром.), 7,58 (1H, дд, CH-аром.), 7,66 (1H, дд, CH-аром.), 7,95 (1H, с, CH-аром.), 8,63 (1H, уш., CH-аром.), 9,13 (1H, с, CH-аром.).

Пример 164: (R)-N-циклобутил-3-(5-(1-(2-гидроксипропил)-5-(трифторметил)-1H-пиразол-4-ил)-4-(пиримидин-4-ил)изоксазол-3-ил)-2-метоксибензамид
Из 3-(5-{1-[(2R)-2-[(трет-бутилдиметилсилил)окси]пропил]-5-(трифторметил)-1Н-пиразол-4-ил}-4-(пиримидин-4-ил)-1,2-оксазол-3-ил)-2-метоксибензойной кислоты и циклобутиламина с выходом 11% за две стадии.
Результат ЖХ/МС [M+H]+: 543,0;
1H ЯМР (CDCl3): δ 1,32 (3Н, д, СН3), 1,92-1,68 (4Н, м, 2хСН2), 2,47-2,26 (2Н, м, СН2), 3,58 (3Н, с, ОСН3), 4,24 (1Н, дд, СН), 4,46-4,30 (2Н, м, СН2), 4,64-4,49 (1Н, м, СН2), 6,93 (1Н, уш., NH), 7,38 (1Н, т, СН-аром.), 7,51 (1H, д, CH-аром.), 7,62 (1H, дд, CH-аром.), 7,95 (1H, с, CH-аром.), 8,24 (1H, дд, CH-аром.), 8,58 (1H, уш. CH-аром.), 9,10 (1H, с, CH-аром.).

Пример 165: (R)-N-этил-3-(5-(1-(2-гидроксипропил)-5-(трифторметил)-1H-пиразол-4-ил)-4-(пиримидин-4-ил)изоксазол-3-ил)-2-метоксибензамид
Из 3-(5-{1-[(2R)-2-[(трет-бутилдиметилсилил)окси]пропил]-5-(трифторметил)-1Н-пиразол-4-ил}-4-(пиримидин-4-ил)-1,2-оксазол-3-ил)-2-метоксибензойной кислоты и этиламина (2 М в ТГФ) с выходом 4% за две стадии.
Результат ЖХ/МС [M+H]+: 517,0;
1H ЯМР (CDCl3): δ 1,18 (3Н, т, СН3), 1,32 (3Н, д, СН3), 3,52-3,38 (2Н, м, СН2), 3,55 (3Н, с, ОСН3), 4,24 (1Н, дд, CH), 4,47-4,30 (2H, м, CH2), 6,90 (1H, уш., NH), 7,47-7,30 (2H, м, 2xCH-аром.), 7,64 (1H, дд, CH-аром.), 7,94 (1H, с, CH-аром.), 8,26 (1H, дд, CH-аром.), 8,56 (1H, уш., CH-аром.), 9,08 (1H, с, CH-аром.).

Пример 166: (R)-N-циклобутил-3-(5-(1-(2-гидроксипропил)-5-(трифторметил)-1H-пиразол-4-ил)-4-(пиримидин-4-ил)изоксазол-3-ил)бензамид
Из 3-(5-{1-[(2R)-2-[(трет-бутилдиметилсилил)окси]пропил]-5-(трифторметил)-1Н-пиразол-4-ил}-4-(пиримидин-4-ил)-1,2-оксазол-3-ил)бензойной кислоты и циклобутиламина с выходом 16% за две стадии.
Результат ЖХ/МС [M+H]+: 513,0;
1H ЯМР (CDCl3): δ 1,31 (3Н, д, СН3), 1,88-1,71 (2Н, м, СН2), 2,07-1,88 (2Н, м, СН2), 2,54-2,36 (2Н, м, СН2), 3,22 (1Н, д, СН), 4,22 (1Н, дд, СН), 4,47-4,29 (2Н, м, СН2), 4,68-4,49 (1Н, м, СН), 6,23 (1Н, д, N-H), 6,97 (1H, дд, CH-аром.), 7,60-7,43 (2H, м, 2xCH-аром.), 8,02-7,88 (3H, м, 3xCH-аром.), 8,59 (1H, д, CH-аром.), 9,18 (1Н, д, СН-аром.).

Пример 167: (R)-3-(5-(1-(2-гидроксипропил)-5-(трифторметил)-1H-пиразол-4-ил)-4-(пиримидин-4-ил)изоксазол-3-ил)-N-изопропилбензамид
Из 3-(5-{1-[(2R)-2-[(трет-бутилдиметилсилил)окси]пропил]-5-(трифторметил)-1Н-пиразол-4-ил}-4-(пиримидин-4-ил)-1,2-оксазол-3-ил)бензойной кислоты и изопропиламина с выходом 8% за две стадии.
Результат ЖХ/МС [M+H]+: 501,0;
1H ЯМР (CDCl3): δ 1,27 (6Н, д, 2хСН3), 1,31 (3Н, д, СН3), 3,22 (1Н, уш., ОН), 4,58-4,07 (4Н, м, 2хСН и СН2), 5,91 (1Н, д, N-H), 6,97 (1H, дд, CH-аром.), 7,57-7,45 (2H, м, 2xCH-аром.), 7,99-7,88 (3H, м, 3xCH-аром.), 8,59 (1H, д, CH-аром.), 9,18 (1H, д, CH-аром.).
b) Биологические тесты
Анализ цитокинов: Анализ пролиферации и выработки цитокинов человеческими МКПК, стимулированными ФГА
Мононуклеарные клетки периферической крови (МКПК) от здоровых человеческих доноров очищали с использованием Accuspin™ System-Histopaque-1077 (Sigma) в соответствии с протоколом, рекомендованным изготовителем. Затем очищенные МКПК дважды промывали фосфатно-солевым буфером (ФСБ) и ресуспендировали в культуральной среде RPMI1640, дополненной 10% диализированной инактивированной теплом эмбриональной телячьей сывороткой, 1,5 мМ L-глутамина, 100 ед. пенициллина/мл и 100 мг стрептомицина/мл (все из PAN Biotech, Айденбах, Германия). Для стимуляции МКПК высевали при 1×105 клеток/лунка, активировали 2 мкг/мл фитогемагглютинина (ФГА, Sigma) и инкубировали с исследуемыми соединениями в течение 48 часов. Затем в культуральном супернатанте определяли ИЛ-17A, ИЛ-17F и ИФН-γ, используя систему Luminex BioPlex, следуя инструкциям изготовителя (BioRad, Мюнхен, Германия). Для скрининга использовали соединения в концентрации 10, 1, 0,1 и 0,01 мкМ. Для определения IC50 соединения титровали полулогарифмически.
Пролиферацию клеток анализировали с использованием ELISA для пролиферации клеток на основе BrdU от Roche (Мангейм, Германия) в соответствии с инструкциями изготовителя.
Цитокины определяли в вышеупомянутом культуральном супернатанте, используя следующие способы: ИЛ-17A измеряли, используя человеческий гомодимер IL-17A, ELISA Ready Set Go набор от eBioscience (Франкфурт, Германия); ИЛ-17F с использованием человеческого IL-17F ELI-Pair от Hölzel DiagnosticaGmBH (Кельн, Германия); и ИФН-γ с использованием человеческого OptEIA IFN-g ELISA от BD Bioscience (Гейдельберг, Германия), все в соответствии с инструкциями изготовителя.
с) Растворимость в воде
Растворимость в воде исследовали в 50 мМ фосфатном буфере (исследовали pH 4,0, 6,0, 7,4 и 9,0, нижеследующие значения получали при pH 7,4) и определяли с помощью системы ВЭЖХ/ДМД с использованием программы градиента (см. ниже) и системы с обращенной фазой. Для достижения этого образцы (конечный объем 500 мкл, концентрация соединения 200 мкМ) инкубировали в течение 24 часов при 23°C при непрерывном встряхивании при 1400 об/мин (Thermomixer, Eppendorf) в водных фосфатных буферах (pH 4,0, 6,0, 7,4 и 9,0) с конечной концентрацией ДМСО 1%. Чтобы отделить нерастворенное соединение от раствора, образцы центрифугировали (30 мин, 18000g при 23°С). Супернатанты измеряли с помощью ВЭЖХ, снабженной УФ-детектором, и концентрации рассчитывали в соответствии с сигналами стандартной кривой. Стандартную кривую получали путем разбавления исходного раствора каждого соединения (с=0,1 мг/мл; полученного путем добавления 10 мкл 20 мМ соединения в ДМСО до 914 мкл MeCN) в определенном количестве MeCN, чтобы охватить диапазон от 0,1 до 200 мкг/мл. Примеры разбавления приведены в таблице ниже.
Использовали следующее оборудование:
ВЭЖХ/ФДМ: ЖХ-система быстрого разделения Dionex UltiMate 3000
ВЭЖХ-насос: HPG-3400 № 8007268
Автодозатор: WPS-3000SL № 8007769
Колоночный термостат: TCC-3200 № 8006790
Детектор: ФДМ-3000 № 08011269
Колонка: зависит от исследуемого соединения
Программное обеспечение: Chromeleon 6.80 SP3 Build 2345 (128616) no 36452
Excel 2000/2007
Посуда стеклянная: пастеровские пипетки
Виалы: стеклянная виала (2 мл) с уплотнителем (Dionex)
Аналитические весы: Sartorius LE225D-0CE (точность: 0,01 мг)
Прочие условия: наконечники Rainin GPS, пипетки Rainin pipet lite, минишейкер
ВЭЖХ-параметры:
Подвижная фаза A: зависит от исследуемого соединения, например, вода с 0,1% муравьиной кислотой
Подвижная фаза B: зависит от исследуемого соединения, например, ацетонитрил
Объем вводимой пробы: 5 мкл
Температура колонки: зависит от исследуемого соединения, например, 30°С
Температура автодозатора: температура окружающей среды
Пробоотборная петля: 25 мкл
Длина волны детектора ФДМ: зависит от исследуемого соединения, Скорость сбора данных 5 Гц
Время остановки хром.: зависит от исследуемого соединения, например, 3,4 мин
Программа ВЭЖХ: зависит от исследуемого соединения
В качестве примера следующий градиент был использован для измерения определенного соединения:
d) Микросомальная стабильность
Метаболическую стабильность соединений настоящего изобретения определяли путем инкубирования с микросомами печени человека и последующего определения остаточного количества соответствующего соединения («исходного соединения») с помощью ВЭЖХ-МС/МС.
Чтобы достичь этого, в конечном реакционном объеме 1000 мкл каждое соединение инкубировали при конечной концентрации 1 мкМ с 0,5 мг/мл микросом печени человека (HLM Pool 50 Donors, 20 мг/мл, BD Gentest, #452156, LotNr 88114) в 0,1 М калий-фосфатном буфере при pH 7,4, с кофактором в форме регенерирующей системы НАДФH (Promega, #V9510) в соответствии со спецификациями изготовителей. Конечная концентрация ДМСО в каждом образце составляла 0,4%. Инкубирование проводили при 37°С в условиях встряхивания (термомиксер, 1400 об/мин) в течение различных интервалов времени до 60 мин. Чтобы остановить реакцию, для каждой временной точки отбирали 200 мкл реакции и добавляли 200 мкл охлажденного на льду ацетонитрила. Затем образцы центрифугировали (4°С, 14000g в течение 15 мин). Супернатант анализировали на концентрацию остаточного исходного соединения и сканировали на наличие метаболитов с использованием ВЭЖХ-МС/МС. Используя оптимизированные методы МС для каждого соединения, определяют площадь пика под кривой для определенного сигнала соединения. Изменение площадей пиков за время анализа 60 мин напоминает оставшееся исходное соединение в % T0. По этим точкам была установлена линия балансировки. Период полувыведения, а также клиренс могут быть рассчитаны на основе уклона.
Оборудование: Waters XevoTM TQ MS, ВЭЖХ Agilent 1200, автодозатор CTC-PAL (температура 8°C)
Таблица 1 Типичные соединения формулы (I) настоящего изобретения включают следующие:
чЛМ
Значения IC50 для цитокинов определяют с помощью анализа цитокинов, как описано в настоящей заявке:
+++: ˂50 нМ; ++: от 50 нМ до ˂500 нМ; +: от 500 нМ до ˂5 мкМ; 0: ≥5 мкМ.
Значения растворимости в воде определяют с помощью способа, описанного в настоящей заявке:
0: ˂1 мкМ; +: 1-2,99 мкМ, ++: 3-9,99 мкМ, +++: ˃10 мкМ, н.д.: нет данных
Значения t1/2 для микросомальной стабильности определяют с помощью способа, описанного в настоящей заявке:
0: 2-9,99 мин; +: 10-39,99 мин, ++: 40-100 мин, +++: ˃100 мин, н.д.: нет данных.
| название | год | авторы | номер документа |
|---|---|---|---|
| ЗАМЕЩЕННЫЕ ПИРАЗОЛОПИРИМИДИНЫ И ЗАМЕЩЕННЫЕ ПУРИНЫ И ИХ ПРИМЕНЕНИЕ В КАЧЕСТВЕ ИНГИБИТОРОВ УБИКВИТИН-СПЕЦИФИЧЕСКОЙ ПРОЦЕССИРУЮЩЕЙ ПРОТЕАЗЫ 1 (USP1) | 2019 |
|
RU2833222C2 |
| ТИЕНО[2,3-d]ПИРИМИДИНЫ В КАЧЕСТВЕ АНТИМИКРОБНЫХ АГЕНТОВ | 2018 |
|
RU2803136C2 |
| ПИРИДИНАМИНПИРИДОНЫ И ПИРИМИДИНАМИНПИРИДОНЫ | 2018 |
|
RU2804638C2 |
| ИНГИБИТОРЫ КАТЕХОЛ-О-МЕТИЛТРАНСФЕРАЗЫ И ИХ ПРИМЕНЕНИЕ ПРИ ЛЕЧЕНИИ ПСИХОТИЧЕСКИХ РАССТРОЙСТВ | 2011 |
|
RU2586974C2 |
| N-ПИРИДИН-3-ИЛ ИЛИ N-ПИРАЗИН-2-ИЛ КАРБОКСАМИДЫ В КАЧЕСТВЕ АГЕНТОВ, ПОВЫШАЮЩИХ УРОВЕНЬ ХОЛЕСТЕРИНА ЛПВП | 2011 |
|
RU2540069C2 |
| Соединения триазоло-пиримидина и их применение | 2019 |
|
RU2802866C2 |
| ИНГИБИТОРЫ СЕРИН/ТРЕОНИНОВЫХ КИНАЗ | 2013 |
|
RU2650501C2 |
| НОВЫЕ ПРОИЗВОДНЫЕ 5,7-ДИЗАМЕЩЕННОГО [1,3] ТИАЗОЛО[4,5-D]ПИРИМИДИН-2(3H)-ОНА | 2006 |
|
RU2411245C9 |
| ЗАМЕЩЕННЫЕ ПИРИДИНОВЫЕ И ПИРАЗИНОВЫЕ СОЕДИНЕНИЯ В КАЧЕСТВЕ ИНГИБИТОРОВ PDE4 | 2014 |
|
RU2668073C2 |
| БИЦИКЛИЧЕСКИЕ ЛАКТАМЫ И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2016 |
|
RU2827714C1 |
Группа изобретений относится к фармацевтической химии и включает соединение формулы (I) и его применение для изготовления лекарственного средства для лечения заболевания или медицинского состояния, при котором ингибирование интерлейкина-17 (ИЛ-17) и/или интерферона-γ (ИФН-γ) является предпочтительным. В формуле (I) Ar выбран из группы, состоящей из фенила и пиридила, каждый из которых необязательно замещен одним, двумя или тремя независимо выбранными заместителями RAr; RAr выбран из группы, состоящей из галогена, -OH, -CN, C1-6-алкокси, ди-C1-6-алкиламино-C1-6-алкокси, -CONHR’, бензилокси, -CO-азетидинила, -CO-пирролидинила, -CO-морфолинила, -CO-C3-6-циклоалкила, -CONH-C3-6-циклоалкила и -O-C1-6-алкил-гетероциклила, где гетероциклил выбран из группы, состоящей из пирролидинила, пиперазинила, морфолинила, 1,1-диоксотиоморфолинила и (2-окса-6-азаспиро[3.3]гепт-6-ил)-C1-4-алкокси, и где каждая из указанных гетероциклильных групп необязательно замещена C1-6-алкилом, и где R’ представляет собой C1-6-алкил; Z выбран из группы, состоящей из H, -CO-RZ, -CH2-O-RZ, -CO-CH2-RZ, -CO-CH2-O-RZ, -COORZ, -CO-NHRZ, -C1-6-алкил-O-C1-6-алкил-O-RZ, C1-6-алкила, C2-6-алкенила, C2-6-алкинила, 5- или 6-членного гетероарила, включающего один или два гетероатома, независимо выбранных из N, S и O, и тетрагидрофуранила, где каждая из указанных алкильных и гетероарильных групп необязательно замещена C1-6-алкилом, ОН или C3-6-циклоалкилом; RZ выбран из группы, состоящей из Н, C1-6-алкила, C2-6-алкенила, C2-6-алкинила, C3-6-циклоалкила и оксетанила; Y представляет собой C1-4-галогеналкил или C1-6-алкил; R1 является таким, как указано в формуле изобретения. Технический результат - соединение формулы (I), обладающее ингибирующей активностью в отношении интерлейкина-17 (ИЛ-17) и/или интерферона-γ (ИФН-γ). 2 н. и 9 з.п. ф-лы, 1 табл., 167 пр.

1. Соединение формулы (I)
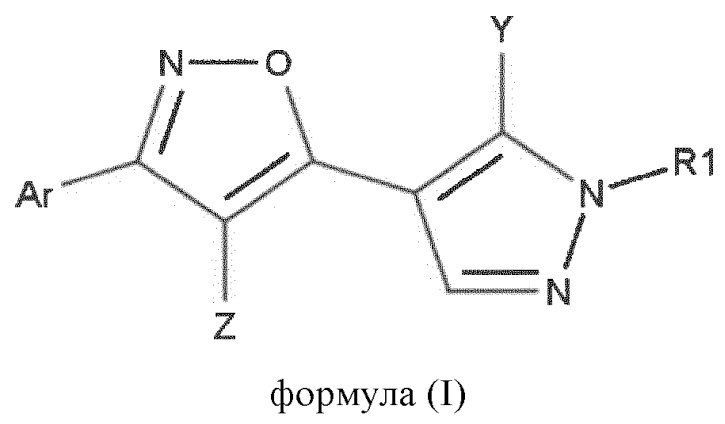
в которой
Ar выбран из группы, состоящей из фенила и пиридила, каждый из которых необязательно замещен одним, двумя или тремя независимо выбранными заместителями RAr;
RAr выбран из группы, состоящей из галогена, -OH, -CN, C1-6-алкокси, ди-C1-6-алкиламино-C1-6-алкокси, -CONHR’, бензилокси, -CO-азетидинила, -CO-пирролидинила, -CO-морфолинила, -CO-C3-6-циклоалкила, -CONH-C3-6-циклоалкила и -O-C1-6-алкил-гетероциклила,
где гетероциклил выбран из группы, состоящей из пирролидинила, пиперазинила, морфолинила, 1,1-диоксотиоморфолинила и (2-окса-6-азаспиро[3.3]гепт-6-ил)-C1-4-алкокси, и где каждая из указанных гетероциклильных групп необязательно замещена C1-6-алкилом, и где R’ представляет собой C1-6-алкил;
Z выбран из группы, состоящей из H, -CO-RZ, -CH2-O-RZ, -CO-CH2-RZ, -CO-CH2-O-RZ, -COORZ, -CO-NHRZ, -C1-6-алкил-O-C1-6-алкил-O-RZ, C1-6-алкила, C2-6-алкенила, C2-6-алкинила, 5- или 6-членного гетероарила, включающего один или два гетероатома, независимо выбранных из N, S и O, и тетрагидрофуранила, где каждая из указанных алкильных и гетероарильных групп необязательно замещена C1-6-алкилом, ОН или C3-6-циклоалкилом;
RZ выбран из группы, состоящей из Н, C1-6-алкила, C2-6-алкенила, C2-6-алкинила, C3-6-циклоалкила и оксетанила;
Y представляет собой C1-4-галогеналкил или C1-6-алкил;
R1 представляет собой группу структуры

в которой
n равно 0 или 1;
R2 представляет собой H, дейтерий или метил;
R3 представляет собой метил, трифторметил, этил, или вместе с R2 образует циклопропильную группу, или R3 образует метиленовый мостик с атомом углерода, отмеченным *.
2. Соединение формулы (I) по п.1, в котором
Ar выбран из группы, состоящей из фенила и пиридила, каждый из которых необязательно замещен одним, двумя или тремя независимо выбранными заместителями RAr;
RAr выбран из группы, состоящей из галогена, -OH, -CN, C1-6-алкокси, ди-C1-6-алкиламино-C1-6-алкокси, -CONHR’, бензилокси, -CO-азетинидила, -CO-пирролидинила, -CO-морфолинила, -CO-C3-6-циклоалкила, -CONH-C3-6-циклоалкила и -O-C1-6-алкил-гетероциклила,
где гетероциклил выбран из группы, состоящей из пирролидинила, пиперазинила, морфолинила, 1,1-диоксотиоморфолинила и (2-окса-6-азаспиро[3.3]гепт-6-ил)-C1-4-алкокси, где каждая из указанных гетероциклильных групп необязательно замещена C1-6-алкилом и где R’ представляет собой C1-6-алкил;
Z выбран из группы, состоящей из H, -CO-RZ, -CH2-O-RZ, -CO-CH2-RZ, -CO-CH2-O-RZ, -COORZ, -CO-NHRZ, C1-6-алкил-O-C1-6-алкил-O-RZ, C1-6-алкила, 5- или 6-членного гетероарила, включающего один или два гетероатома, независимо выбранных из N, S и O, и тетрагидрофуранила, где каждая из указанных алкильных и гетероарильных групп необязательно замещена C1-6-алкилом, ОН или C3-6-циклоалкилом;
RZ выбран из группы, состоящей из Н, C1-6-алкила, C3-6-циклоалкила и оксетанила;
Y представляет собой C1-4-галогеналкил или C1-6-алкил;
R1 представляет собой группу структуры

в которой
n равно 0 или 1;
R2 представляет собой Н, дейтерий или метил;
R3 представляет собой метил, трифторметил, этил или, взятый вместе с R2, образует циклопропильную группу;
или
n равно 1, R2 представляет собой Н, дейтерий или метил и R3 образует метиленовый мостик с атомом углерода, отмеченным *.
3. Соединение формулы (I) по п.1 или 2, в котором
Ar выбран из группы, состоящей из фенила и пиридила, каждый из которых необязательно замещен одним, двумя или тремя заместителями RAr;
RAr выбран из группы, состоящей из галогена, -OH, -CN, C1-4-алкокси, ди-C1-4-алкиламино-C1-4-алкокси, бензилокси, -CO-N(RN)2, в котором один RN представляет собой H и другой представляет собой C1-3-алкил, C3-4циклоалкил или оба RN, взятые вместе с N, к которому они присоединены, образуют азетановое, пирролидиновое или морфолиновое кольцо;
Z выбран из группы, состоящей из H, -CO-C1-4-алкила, -CO-CH2-C1-4-алкокси, -CO-CH2-O-C3-5-циклоалкила, -CH2-OH, -CH2-O-C1-4-алкила, -CH2-O-C3-5-циклоалкила, -COO-C1-4алкила, -CONH-C1-4алкила, -CONH-C3-5-циклоалкила, -CO-CH2-C3-5-циклоалкила, -COO-C3-5-циклоалкила, циклоалкилметила, алкен-1-она, -C1-2-алкил-O-C1-2-алкил-O-C1-4-алкила, 5- или 6-членного гетероарила, включающего один или два гетероатома, независимо выбранных из N, S и O, или тетрагидрофуранила;
Y представляет собой C1-6-алкил или C1-4-галогеналкил;
R1 представляет собой группу структуры

в которой
n равно 0;
R2 представляет собой Н, дейтерий или метил;
R3 представляет собой метил, трифторметил, этил или, взятый вместе с R2, образует циклопропильную группу;
или
n равно 1;
R2 представляет собой Н, дейтерий или метил;
R3 представляет собой метил или трифторметил или образует метиленовый мостик с атомом углерода, отмеченным *.
4. Соединение по любому из пп.1-3, в котором
Ar выбран из группы, состоящей из фенила и пиридила, каждый из которых необязательно замещен одним, двумя или тремя заместителями RAr;
RAr выбран из группы, состоящей из галогена, ОН, -O-C1-3-алкила и диметиламино-C1-2-алкокси;
Z выбран из группы, состоящей из -COO-C1-3-алкила, -CO-CH2-O-C1-2-циклоалкила, 5- или 6-членного гетероарила, включающего один или два гетероатома, независимо выбранных из N, S и O, -COO-C3-5-циклоалкила, -CONH-C3-5-циклоалкила, -CO-CH2-C3-5-циклоалкила, -CH2-O-C3-5-циклоалкила, -CO-C1-4-алкила и -C1-2-алкил-O-C1-2-алкил-O-C1-2-алкила;
Y выбран из группы, состоящей из CF3 и Me;
R1 выбран из группы, состоящей из 3-гидрокси-3-метилбутила, 2-гидрокси-2-метилпропила, 3-гидрокси-3-метилциклобутила, 2-гидроксипропила, 2-гидроксибутила, 3-гидроксициклобутила, 2-гидрокси-3,3,3-трифторпропила, 2-гидрокси-2-дейтеропропила и 1-гидроксициклопропилметила.
5. Соединение по п. 1 или 2, в котором
Ar представляет собой фенил, необязательно замещенный одним, двумя или тремя заместителями RAr;
RAr выбран из группы, состоящей из галогена, -O-C1-3-алкила и (диметиламино)-C1-2-алкокси;
Z выбран из группы, состоящей из H, COO-C1-3-алкила, пиримидила, пиразинила, тиазолила, оксазолила, изоксазолила, изотиазолила, имидазолила, тиофенила, фурана, тетрагидрофурана, циклопропоксиметила, циклогексоксиметила, циклопентоксиметила, -COO-циклопропила, -COO-циклобутила, -COO-циклопентила, -COO-циклогексила, пент-4-ен-1-она, гидроксиметила, метоксиметила, этоксиметила, изопропоксиметила, циклобутоксиметила, ацетила, метоксиацетила, -CO-CH2-циклобутила, -CO-CH2-циклопропила, -CO-CH2-циклопентила, -CO-CH2-циклогексила, -COO-оксетана, метоксиэтоксиметила, -CONH-циклопропила, -CONH-циклобутила, -CONH-циклопентила и -CONH-циклогексила, в котором указанный пиримидил, пиразинил, тиазолил, оксазолил, изоксазолил, изотиазолил имидазолил, тиофенил, тетрагидрофуран и фуран необязательно замещен метилом или OH;
Y выбран из группы, состоящей из CF3 и Me;
R1 выбран из группы, состоящей из 3-гидрокси-3-метилбутила, 2-гидрокси-2-метилпропила, 3-гидрокси-3-метилциклобутила, 2-гидроксипропила, 2-гидроксибутила, 3-гидроксициклобутила, 2-гидрокси-3,3,3-трифторпропила, 2-гидрокси-2-дейтеропропила и 1-гидроксициклопропилметила.
6. Соединение по любому из пп.1-5, в котором
Ar представляет собой фенил, который необязательно замещен одним, двумя или тремя заместителями RAr;
RAr выбран из группы, состоящей из Cl, -OMe, F и 2-(диметиламино)этокси;
Z выбран из группы, состоящей из -COOMe, -COOEt, пиримидин-2-ила, тиазол-2-ила, циклопропоксиметила, -COO-циклопропила, -COO-циклобутила, пент-4-ен-1-она, пиримидин-4-ила, метоксиметила, пиразин-2-ила, СО-CH2-циклобутила, -COO-оксетана, 5-метилизоксазол-2-ила, -CONH-циклопентила;
Y выбран из группы, состоящей из CF3 и Me;
R1 выбран из группы, состоящей из 3-гидрокси-3-метилбутила, 3-гидрокси-3-метилциклобутила, 2-гидроксипропила, 2-гидроксибутила, 3-гидроксициклобутила, 2-гидрокси-3,3,3-трифторпропила, 2-гидрокси-2-дейтеропропила и 1-гидроксициклопропилметила.
7. Соединение по п.1, где соединение выбрано из группы, состоящей из
8. Соединение по любому из пп.1-7 для применения в качестве лекарственного средства для лечения заболевания или медицинского состояния, при котором ингибированием интерлейкина-17 (IL-17) и/или интерферона-γ (ИФН-γ) является предпочтительным.
9. Соединение для применения по п.8, где заболевание или медицинское состояние выбрано из группы, состоящей из псориаза, псориатического артрита, аутоиммунного тиреоидита, ревматоидного артрита, витилиго, болезни Крона, язвенного колита, воспалительного заболевания кишечника, анкилозирующего спондилита, сахарного диабета I типа, рассеянного склероза, целиакии, системной красной волчанки, увеита, болезни Бехчета, атопического дерматита, красного плоского лишая, синдрома Шегрена, межпозвонковой грыжи, акне, реакции трансплантат против хозяина, реакции хозяин против трансплантата, АИГ (аутоиммунного гепатита), ПБХ (первичного билиарного холангита), ПСК (первичного склерозирующего холангита), ожирения, волчаночного нефрита, аутоиммунных заболеваний щитовидной железы, включая болезнь Грейвса и болезнь Хашимото, аутоиммунного увеита, колита, IMQ псориаза, ювенильного идиопатического артрита, миастении гравис, системного склероза, сахарного диабета и остеоартрита.
10. Применение соединения формулы (I), как определено по любому из пп.1-7, для изготовления лекарственного средства для лечения заболевания или медицинского состояния, при котором ингибирование интерлейкина-17 (ИЛ-17) и/или интерферона-γ (ИФН-γ) является предпочтительным.
11. Применение по п.10, в котором заболевание или медицинское состояние выбрано из группы, состоящей из псориаза, псориатического артрита, аутоиммунного тиреоидита, ревматоидного артрита, витилиго, болезни Крона, язвенного колита, воспалительного заболевания кишечника, анкилозирующего спондилита, сахарного диабета I типа, рассеянного склероза, целиакии, системной красной волчанки, увеита, болезни Бехчета, атопического дерматита, красного плоского лишая, синдрома Шегрена, межпозвонковой грыжи, акне, реакции трансплантат против хозяина, реакции хозяин против трансплантата, АИГ (аутоиммунного гепатита), ПБХ (первичного билиарного холангита), ПСК (первичного склерозирующего холангита), ожирения, волчаночного нефрита, аутоиммунных заболеваний щитовидной железы, включая болезнь Грейвса и болезнь Хашимото, аутоиммунного увеита, колита, IMQ псориаза, ювенильного идиопатического артрита, миастении гравис, системного склероза, сахарного диабета и остеоартрита.
| Изложница с суживающимся книзу сечением и с вертикально перемещающимся днищем | 1924 |
|
SU2012A1 |
| Изложница с суживающимся книзу сечением и с вертикально перемещающимся днищем | 1924 |
|
SU2012A1 |
| Гидравлический пресс для изготовления металлических труб | 1926 |
|
SU6769A1 |
Авторы
Даты
2022-12-06—Публикация
2018-09-06—Подача