Область техники, к которой относится изобретение
Настоящее изобретение относится к способам и фармацевтическим композициям для лечения заболеваний, связанных с тубулин карбоксипептидазами (TCP), таких как неврологические нарушения и сердечнососудистые заболевания с ингибитором активности или экспрессии вазогибина или комплекса вазогибин/SVBP (малый вазогибин-связывающий белок).
Уровень техники
Микротрубочки являются цитоскелетными полимерами димеров α/β тубулина, центрально вовлеченных в деление клеток, подвижность и морфогенез. В цикле детирозинирование/тирозинирование тубулина, С-концевой тирозин α-тубулина удаляется неуловимой пептидазой (TCP) и повторно добавляется тубулин-тирозин-лигазой (TTL, для обзора см. ((Вагга и др. (1988), Mol Neurobiol, 2:133)1)). Этот цикл, который является уникальным для тубулина и наиболее консервативным при эволюции от хордовых до млекопитающих, играет жизненно важную роль in vivo ((Erck и др. (2005), Proc Natl Acad Sci USA, 102:7853)2). Де/тирозинирование тубулина для α-тубулина является чрезвычайно важным регуляторным сигналом для митоза (Badin-Larcon и др. (2004), Proc Natl Acad Sci USA, 101:5577; Barisic и Maiato (2016), Trends Cell Biol; Barisic и др. (2015), Science, 348:799) (Barisic и Maiato, 2016; Barisic и др., 2015) (3-5)(Gobrecht и др. (2016), Journal of Neuroscience 36.14: 3890-3902.; Konishi и Setou (2009), Nat Neurosci, 12:559; Marcos и др. (2009), PloS one, 4:e5405; Peris и др. (2006), J Cell Biol, 174:839-849), для физиологии нейронов (6-8) и для мышечной механотрансдукции (Kerr и др. (2015), Nature communications, 6:8526; Robison и др. (2016), Science, 352:aaf0659) (9, 10). Вследствие этого аномальные уровни тирозинирования связаны с трансформацией клеток и агрессивностью опухолей (Lafanechere и др. (1998), J Cell Sci, 111 (Pt 2):171; Whipple и др. (2007), Exp Cell Res, 313:1326)(11, 12), дезорганизацией нейронов (Erck и др. (2005), Proc Natl Acad Sci USA, 102:7853; Peris и др. (2006), J Cell Biol, 174:839; Peris и др. (2009), J Cell Biol, 185:1159)(2), и сердечной недостаточностью и кардиомиопатиями (Robison и др. (2016), Science, 352:aaf0659) (10, 13). Несмотря на то, что реакция детирозинирования впервые была описана еще 40 лет назад (14), идентичность TCP остается неизвестной, и, следовательно, отсутствует полное понимание цикла.
Следовательно, существует потребность идентификации природы TCP ферментов для модуляции их активности в патологическом состоянии.
Сущность изобретения
В настоящей заявке изобретатели успешно идентифицировали комплексы вазогибин/SVBP в качестве TCP ферментов и исследовали влияние их регуляции по типу отрицательной обратной связи на физиологию нейронов.
Таким образом, настоящее изобретение относится к ингибитору активности или экспрессии вазогибина или комплекса вазогибин/SVBP для применения в способе лечения заболеваний, связанных с тубулин карбоксипептидазами (TCP), таких как сердечно-сосудистые и неврологические нарушения у субъекта, который в этом нуждается.
Настоящее изобретение также относится к способу скрининга множества кандидатных соединений, пригодных для лечения заболеваний, связанных с тубулин карбоксипептидазами (TCP), включающий стадии, предусматривающие (а) тестирование каждого из кандидатных соединений для определения его способности ингибировать активность или экспрессию вазогибина или комплекса вазогибин/SVBP и (б) и положительный отбор кандидатных соединений, способных ингибировать указанную активность или экспрессию комплекса вазогибин/SVBP.
Подробное описание изобретения
Обратимое детирозинирование α-тубулина является критически важным для динамики и функционирования микротрубочек, и его дефекты вовлечены в злокачественное новообразование, дезорганизацию головного мозга и кардиомиопатии. Тем не менее не удавалось идентифицировать тубулин тирозин карбоксипептидазу (TCP), отвечающую за детирозинирование. В настоящей заявке, используя химическую протеомику с эффективным уникальным необратимым ингибитором, изобретатели обнаружили, что основная TCP головного мозга представляет собой комплекс вазогибин-1 (VASH1) с малым вазогибин-связывающим белком (SVBP). VASH1 и его гомолог вазогибин-2 (VASH2), при образовании комплекса с SVBP, проявляет эффективную и специфическую активность Tyr/Phe карбоксипептидазы на микротрубочках. Таким образом, изобретатели впервые продемонстрировали ферментативную активность вазогибина и комплекса вазогибин/SVBP. Нокдаун вазогибинов или SVBP в культивируемых нейронах приводит к заметному уменьшению уровней тирозинированного α-тубулина и началу тяжелых дефектов дифференциации. Кроме того, нокдаун вазогибинов разрушает миграцию нейронов в развивающемся неокортексе крыс.Эти результаты привели к установлению комплексов вазогибин/SVBP в качестве TCP ферментов.
Таким образом, настоящее изобретение относится к ингибитору активности или экспрессии комплекса вазогибин/SVBP для применения в способе лечения заболеваний, связанных с тубулин карбоксипептидазами (TCP), у субъекта, который в этом нуждается.
Как используется в настоящей заявке термин "заболевания, связанные с тубулин карбоксипептидазой (TCP)," относится к группе заболеваний, связанных с дезорганизацией цикла детирозинирование/тирозинирование тубулина. Примеры патологий, задействующих тубулин карбоксипептидазы (TCP), включают неврологические нарушения и сердечно-сосудистые заболевания.
Фермент TTL и контролируемое количество тирозинированного тубулина является жизненно важным для организации нейронов (Erck и др. (2005), Proc Natl Acad Sci USA, 102:7853). TTL экспрессия уменьшена в головном мозге людей старшего возраста (Loerch и др. (2008), PloS one, 3:е3329), а также в головном мозге пациентов с болезнью Альцгеймера (данные не опубликованы). Показано, что эти дефекты на животной модели Альцгеймера являются одновременными с нарушениями синаптической пластичности и когнитивных способностей (неопубликованные результаты от Andrieux lab). Таким образом, применение ингибиторов TCP должно восстановить физиологическое количество тирозинированного/детирозинированного тубулина в головном мозге и либо восстанавливать или предотвращать дальнейшее снижение когнитивных способностей, связанных с заболеваниями (когнитивные способности относятся к способностям, необходимых для выполнения любой задачи от наиболее простых до наиболее комплексных: обучение, запоминание, решение проблемы, принятие решения и т.д.).
Кроме того, в недавних исследованиях было показано, что уменьшение детирозинирования микротрубочек способствует регенерации нервов (Gobrecht и др. (2016), The Journal of neuroscience: the official journal of the Society for Neuroscience, 36:3890), и что повышение тирозинированного альфа-тубулина в поврежденных аксонах необходимо для обратной передачи повреждающих сигналов и регенерации аксонов (Song и др., 2015). Нацеленная динамика микротрубочек модифицирует состав ингибирующей окружающей среды, образованной рубцовой тканью, и делает ее более разрешающей для регенерации аксонов. Микротрубочки имеют двойственную функцию при регенерации аксонов. Кроме их роли в поддержании роста аксонов, они обеспечивают транспортные пути для обратной передачи сигналов назад в ядро (Blanquie и Bradke, 2018).
Таким образом, в специфическом варианте осуществления, TCP связанные заболевания включают неврологические нарушения, такие как нейродегенеративные заболевания.
Термин "неврологическое нарушение", как используется в настоящей заявке, определяется как заболевание, нарушение или состояние, которое непосредственно или опосредованно поражает нормальное функционирование или анатомию нервной системы субъекта.
В контексте изобретения, термин "нейродегенеративное нарушение" определяется как заболевание, при котором поражены или потеряны клетки центральной или периферической нервной системы.
Особенно предпочтительным нейродегенеративным нарушением является болезнь Альцгеймера (AD). Хорошо изучено, что микротрубочки являются основными участниками патологии при болезни Альцгеймера (Matsuyama и Jarvik, 1989; Dent, 2016; Brandt и Bakota, 2017). В недавних исследованиях было показано, что экспрессия TTL снижается в головном мозге пациентов с болезнью Альцгеймера (данные не опубликованы), в то время как детирозинированный тубулин повышен (как показано в примерах ниже). Кроме того, нейротоксичность, индуцированная бета-амилоиом, предотвращается в первичных нейронных культурах от трансгенных мышей, делетированных по вазогибин1 или SVBP белку (результаты также представлены ниже). Микротрубочки являются одними из трех компонентов цитоскелета и являются чрезвычайно важными для поддержания целостности аксонов и образования путей для аксонального транспорта (Eira и др., 2016). Дефекты аксонального транспорта являются непосредственной причиной нейродегенеративного заболевания. Обратимое детирозинирование α-тубулина является критически важным для динамики и функционирования микротрубочек, таких как аксональный транспорт, и в дендритных шипиках; постсинаптическом компартменте возбуждающих нейронов в ЦНС (Dent, 2016). Модификации динамики микротрубочек наблюдаются при тяжелых нейродегенеративных заболеваниях, таких как болезнь Альцгеймера, болезнь Паркинсона, боковой амиотрофический склероз, и таупатиями, такими как прогрессирующий надъядерный паралич (Baird и Benneth, 2013; Dubey и др., 2015; Cartelli и Cappelletti, 2017). В недавних исследованиях также предполагается, что МТ динамики принимают участие в головном мозге у взрослых в важных процессах обучения и памяти и могут быть нарушены при дегенеративных заболеваниях (Dent и др., 2016).
Также существует подтверждение нарушения функции синапсов и аксонов и дистрофии нейритов, предшествующих потере нейронов у пациентов с болезнью Хантингтона (Li и Conforti, 2013).
Также было описано, что микротрубочки и/или тубулин были дезорганизованы на моделях ишемии (удар) либо в условиях in vitro или in vivo (Ma и др., 2010; Psilodimitrakopoulos и др., 2013). Было показано, что изменения в аксональном транспорте при рассеянном склерозе (MS) и связанных моделях, таких как экспериментальный аутоиммунный энцефаломиелит, происходят перед развитие нейродегенерации (Van den Berg и др., 2017). Химическая окружающая среда, связанная с нейровоспалением, сама по себе уже способна разрушать связанный с микротрубочками аксональный транспорт (Van den Berg и др., 2017).
Предпочтительно, неврологическое или нейродегенеративное нарушение выбирают из группы, включающей рассеянный склероз, удар, боковой амиотрофический склероз, болезнь Паркинсона, болезнь Хантингтона, болезнь Альцгеймера.
Другими примерами неврологических нарушений также являются травматическое повреждение головного мозга, повреждение спинного мозга, интракраниальные поражения или межпозвоночные поражения включая, но не ограничиваясь только ими, контузию, пенетрацию, сдвиг, компрессию или рваные поражения спинного мозга или синдром «резкого встряхивания младенца».
В предпочтительном варианте осуществления, нейродегенеративное нарушение представляет собой болезнь Альцгеймера.
В другом предпочтительном варианте осуществления, неврологическое нарушение представляет собой удар.
Настоящее изобретение также относится к ингибитору активности или экспрессии комплекса вазогибин/SVBP для применения в качестве нейрозащитного или нейротропного агента.
Контролирование тирозинированного / детирозинированного тубулина в микротрубочках также вовлечено в вязкоэластическую резистентность к укорочению и растяжению саркомера в кардиомиоцитах и, следовательно, в сердечную сократимость (Kerr и др. (2015) Nature Comm., 6:8526; Robison и др. (2016) Science, 352:aaf0659; Chen и др. (2018) Nature Med., 24:1225). Клинические данные показали, что уровни сердечного детирозинированного тубулина отрицательно коррелируют с фракцией выброса левого желудочка у контрольных субъектов и пациентов с гипертрофической кардиомиопатией (Robison и др. (2016) Science, 352:aaf0659). Таким образом, TCP ингибитор также может применяться для лечения гипертрофической кардиомиопатии, пост-ишемической кардиомиопатии, дилятационной кардиомиопатии (Robison и др. (2016) Science, 352:aaf0659; Chen и др. (2018) Nature Med., 24:1225), дистрофинопатии (Belanto и др. (2016)).
В специфическом варианте осуществления TCP ингибитор применяется для лечения сердечной недостаточности, в особенности сердечной недостаточности с уменьшенной фракцией выброса (ишемической, не-ишемической) и сердечной недостаточности с сохраненной фракцией выброса (гипертрофические кардиомиопатии, диабетические кардиомиопатии)
В специфическом варианте осуществления заболевания, связанные с TCP, представляют собой сердечно-сосудистое заболевание, выбранное из группы, включающей инфаркт миокарда, инфаркт миокарда, индуцирующий сердечно-сосудистую дисфункцию, сердечную недостаточность, кардиомиопатию и дистрофинопатию.
В предпочтительном варианте осуществления сердечно-сосудистое заболевание представляет собой сердечную недостаточность с уменьшенной фракцией выброса (ишемическую, неишемическую).
Как используется в настоящей заявке, термины "лечение", "лечить" и подобные, относятся к получению желательного фармакологического и/или физиологического эффекта. Эффект может быть профилактическим в значении полного или частичного предотвращения заболевания или его симптома и/или может быть терапевтическим в значении частичного или полного излечения заболевания и/или побочного эффекта, обусловленного заболеванием. "Лечение", как используется в настоящей заявке, охватывает любое лечение заболевания у субъекта, и включает: (а) увеличение времени выживания; (б) снижения риска смерти вследствие заболевания; (в) предотвращение возникновения заболевания у субъекта, который может быть предрасположен к заболеванию, но еще не было диагностировано его наличие; (г) ингибирование заболевания, то есть, остановку его развития (например, уменьшение скорости прогрессирования заболевания); и (д) облегчение заболевания, то есть, вызывание регрессирования заболевания.
Термины "субъект" и "пациент", используемые взаимозаменяемо в настоящей заявке, относятся к млекопитающему, в особенности человеку, у которого ранее были диагностированы заболевания, связанные с тубулин карбоксипептидазами (TCP), такие как сердечно-сосудистые и неврологические нарушения, или который имеет риск наличия или развития заболеваний, связанных с тубулин карбоксипептидазами (TCP), таких как сердечнососудистые и неврологические нарушения. Типично, диагноз неврологических нарушений, таких как нейродегенеративное заболевание, может быть поставлен после биопсии головного мозга или путем применения нейровизуализационных исследований (IRM, PetScan, и др.) или с помощью биологических маркеров, связанных с заболеванием.
Как используется в настоящей заявке термин 'или "вазогибин" имеет его общепринятое значение в данной области техники и состоит из белков вазогибин-1 или вазогибин-2.
Как используется в настоящей заявке, термин 'или "комплекс вазогибин/SVBP" имеет его общепринятое значение в данной области техники. Комплекс вазогибин/SVBP состоит из вазогибин-1 или вазогибин-2, и SVBP (малый вазогибин-связывающий белок).
Вазогибин 1 селективно индуцируется в эндотелиальных клетках с помощью проангиогенных стимулирующих факторов роста, таких как VEGF; и полагают, что он функционирует в качестве присущего и высоко специфичного ингибитора с обратной связью активированных эндотелиальных клеток, задействованных в процесс ангиогенеза. В то время как мРНК и белок вазогибина 1 индуцируются VEGF зависимым от времени и концентрации образом, секретируемый белок противодействует ангиогенным эффектам VEGF (Watanabe, К. и др. (2004) J. Clin. Invest. 114:898). Вазогибин-2, кодируемый отличающимся геном, продуцирующим тринадцать вариантов сплайсинга, в конечном итоге кодирует девять изоформ (Shibuya, Т. и др. (2006) Arterioscler. Thromb. Vase. Biol. 26:1051, и NCBI RefSeq), является гомологом вазогибин-1. Оба белка, вазогибин и вазогибин-2, являются >95% консервативными между человеком и мышью. (Относительно обзора белков вазогибина и регуляции ангиогенеза см. Sato Y J Biochem. 2013 Jan; 153(1):5-11).
Как предпочтительно было указано, изобретатели настоящего изобретения впервые идентифицировали ферментативную активность вазогибина. Более предпочтительно, они продемонстрировали, что вазогибин-1 и его гомолог вазогибин-2 (VASH2) обладают неканонической каталитической триадой Cys-His-Ser и являются необнаруженными представителями семейства трансглутаминаза-подобных цистеиновых протеаз.
SVBP обозначает малый вазогибин-связывающий белок и представляет собой белок, состоящий из 66 аминокислот.SVBP изначально был выделен командой Tohoku University в 2010 г. и описан как действующий в качестве секреторного шаперона для вазогибин 1 и способствующий анти-ангиогенной активности VASH1 (Suzuki Y, и др., J Cell Sci 2010 123: 3094-3101). В других исследованиях также был описан SVBP в качестве секреторного шаперона белка VASH2 (Xue X. и др., Oncogene. 2013 Mar 28; 32(13): 1724-34).
Таким образом, комплекс вазогибин/SVBP состоит из вазогибин-1 или вазогибин-2, и SVBP (малый вазогибин-связывающий белок). • Ингибитор активности вазогибина
"Ингибитор активности вазогибина" или "ингибитор активности комплекса вазогибин/SVBP" имеет его такое же общепринятое значение в данной области техники, и относится к соединению (природному или нет), которое имеет способность уменьшать или подавлять биологическую активность вазогибина (или его комплекса) или одного из его членов. Типично, указанное соединение ингибирует или уменьшает детирозинирование тубулина посредством вазогибина (или его комплекса). Например, соединение может входить в каталитический сайт вместо субстрата, или блокировать взаимодействие вазогибина (или его комплекса) с белками, ассоциированными с тубулином / микротрубочками / микротрубочкой, такими как +TIP (белки, отслеживающие плюс-конец), или могут связываться с вазогибином (или его комплексом) таким образом, которым вазогибин не способен связываться с белками, ассоциированными с тубулином /микротрубочками/ микротрубочкой, такими как +TIP, или может ингибировать образование комплекса вазогибин/SVBP. Типично, указанный ингибитор представляет собой небольшую органическую молекулу или биологическую молекулу (например, пептиды, липид, антитело, аптамер).
Как используется в настоящей заявке термин 'или "+TIP" обозначает "Белки, отслеживающие плюс-конец". Белки, отслеживающие плюс-конец представляют собой MAP (белок, ассоциированный с микротрубочками) белки, которые связываются с верхушками растущих микротрубочек и играют важную роль в регуляции динамики микротрубочек. Например, наблюдали, что +TIP принимают участие во взаимодействиях микротрубочек с хромосомами во время митоза. Первым MAP, который был идентифицирован в качестве +TIP, был CLIP 170 (цитоплазматический линкерный белок), который, как было показано, принимает участие в событиях избегания деполимеризации микротрубочек. Дополнительные примеры +TIP включают ЕВ1, ЕВ2, ЕВ3, p150Glued, Dynamitin, Lisl, CLIP115, CLASP1, и CLASP2 и др.).
Под "биологической активностью" вазогибина или комплекса вазогибин/SVBP (который является аналогичным) понимают детирозинирование альфа тубулина (мономера, димеров или полимеризованного в микротрубочки), ассоциированного с циклом детирозинирования/ тирозинирования тубулина.
Тесты для определения способности соединения являться ингибитором активности вазогибина (или его комплекса) хорошо известны квалифицированному специалисту в данной области техники. Настоящая заявка дополнительно обеспечивает тест, который предоставляет благоприятную возможность для скрининга и отбора кандидатных ингибиторов вазогибина и/или комплекса вазогибин/SVBP, то есть TCP (см. ниже). В предпочтительном варианте осуществления, ингибитор специфически связывается с вазогибином (или его комплексом) достаточным образом для того, чтобы ингибировать биологическую активность вазогибина. Связывание с вазогибином (или его комплексом) и ингибирование биологической активности вазогибина может быть определено с помощью любых анализов конкуренции, хорошо известных в данной области техники. Например, исследование может включать определение способности агента, тестируемого в качестве ингибитора активности вазогибина, связываться с вазогибином (или его комплексом). Связывающая способность характеризуется с помощью измерения KD. Термин "KD", как используется в настоящей заявке, относится к константе диссоциации, которую получают на основании соотношения Kd к Ka (то есть Kd/Ka) и выражают в виде молярной концентрации (М). KD значения для связывающих биомолекул можно определить с помощью способов, хорошо известных в данной области техники. В специфических вариантах осуществления, ингибитор, который "специфически связывается с вазогибином (или его комплексом)" относится к ингибитору, которых связывается с полипетидом(ами) вазогибина (или его комплекса) человека с KD 1 мкМ или меньше, 100 нМ или меньше, 10 нМ или меньше, или 3 нМ или меньше. После этого, можно осуществлять конкурентный анализ для определения способности агента ингибировать биологическую активность вазогибина. Можно использовать функциональные анализы, такие как оценивание способности индуцировать или ингибировать детирозинирование альфа тубулина в клетках или in vivo (см. пример и Фигуру 1).
Квалифицированный специалист в данной области техники легко может определить, будет ли ингибитор активности вазогибина (или его комплекса) нейтрализовать, блокировать, ингибировать, отменять, уменьшать или препятствовать биологической активности вазогибина. Для проверки того, будет ли ингибитор активности вазогибина связываться с вазогибином (или его комплексом) и/или ингибировать детирозинирование альфа тубулина в клетках таким же образом, что и изначально охарактеризованное алкин-epoY соединение, можно осуществлять с каждым ингибитором. Например, исследование детирозинирования альфа тубулина можно осуществлять с помощью тестов радиоактивности, используя [14С]-тирозинированные стабилизированные таксолом микротрубочки или [14С]-тирозинированный тубулин, как описано в разделе Примеры (и в Агсе и др., (1978) J Neurochemistry (31) 205-210, Argarana и др., (1980) Journal of Neurochemistry, 34(1) 114-118).
В предпочтительном варианте осуществления, ингибитор активности в соответствии с изобретением представляет собой антитело или его части.
В этом варианте осуществления, ингибитор активности вазогибина (или его комплекс) представляет собой антитело (термин включает фрагмент или часть антитела или), которое может связываться с вазогибином (или его комплексом) в клетках и блокировать его биологическую активность.
В предпочтительном варианте осуществления, ингибитор активности вазогибина может состоять из антитела, нацеленного на комплекс вазогибин/SVBP или вазогибин, таким образом, что указанное антитело нарушает вазогибин/ активность ("нейтрализующее антитело").
Следовательно, в контексте настоящего изобретения, нейтрализующее антитело комплекса вазогибин/SVBP или вазогибина, выбирают, как описано выше, относительно его способности (I) связываться с вазогибином (или его комплексом) и/или (II) ингибировать детирозинирование альфа тубулина посредством вазогибина (или его комплекса).
В одном варианте осуществления антител или их частей, описанных в настоящей заявке, антитело представляет собой моноклональное антитело. В одном варианте осуществления антител или их частей, описанных в настоящей заявке, антитело представляет собой поликлональное антитело. В одном варианте осуществления антител или их частей, описанных в настоящей заявке, антитело представляет собой гуманизированное антитело. В одном варианте осуществления антител или их частей, описанных в настоящей заявке, антитело представляет собой химерное антитело. В одном варианте осуществления антител или их частей, описанных в настоящей заявке, часть антитела содержит легкую цепь антитела. В одном варианте осуществления антител или их частей, описанных в настоящей заявке, часть антитела содержит тяжелую цепь антитела. В одном варианте осуществления антител или их частей, описанных в настоящей заявке, часть антитела содержит Fab часть антитела. В одном варианте осуществления антител или их частей, описанных в настоящей заявке, часть антитела содержит F(ab')2 часть антитела. В одном варианте осуществления антител или их частей, описанных в настоящей заявке, часть антитела содержит Fc часть антитела. В одном варианте осуществления антител или их частей, описанных в настоящей заявке, часть антитела содержит Fv часть антитела. В одном варианте осуществления антител или их частей, описанных в настоящей заявке, часть антитела содержит вариабельный домен антитела. В одном варианте осуществления антител или их частей, описанных в настоящей заявке, часть антитела содержит один или несколько CDR доменов антитела.
Как используется в настоящей заявке, "антитело" включает как встречающиеся в природе и так и не встречающиеся в природе антитела. Специфически "антитело" включает поликлональные и моноклональные антитела, и их моновалентные и двухвалентные фрагменты. Кроме того, "антитело" включает химерные антитела, полностью синтетические антитела, одноцепочечные антитела и их фрагменты. Антитело может представлять собой антитело человека или антитело, отличающиеся от антитела человека. Антитело, отличающееся от антитела человека, может быть гуманизировано с помощью рекомбинантных методов для уменьшения его иммуногенности для человека.
Антитела приготавливают в соответствии с общепринятыми способами. Моноклональные антитела могут быть созданы с помощью метода Kohler и Milstein (Nature, (1975) 256:495). Для приготовления моноклональных антител, пригодных в соответствии с изобретением, мышь или другое подходящее животное-хозяин иммунизируют через подходящие интервалы (например, два раза в неделю, еженедельно, два раза в месяц или ежемесячно) с антигенной формой вазогибинов (1 или 2) или SVBP. Животному можно вводить финальный "бустер" антигена в течение одной недели до умерщвления. Часто является желательным применять иммунологический адъювант во время иммунизации. Подходящие иммунологические адъюванты включают полный адъювант Фрейнда, неполный адъювант Фрейнда, квасцы, адъювант Риби, Hunter's Titermax, адъюванты сапонина, такие как QS21 или Quil А, или CpG-содержащие иммуностимулирующие олигонуклеотиды. Другие подходящие адъюванты хорошо известны в данной области техники. Животные могут быть иммунизированы с помощью подкожного, внутрибрюшинного, внутримышечного, внутривенного, интраназального или других путей. Данное животное может быть иммунизировано с помощью множественных форм антигена множественными путями.
Вкратце, может быть обеспечен рекомбинантный комплекс вазогибин/SVBP (или один из его членов) с помощью экспрессии рекомбинантными клеточными линиями (или с помощью других различных систем экспрессии, включая клетки бактерий, дрожжей или насекомых). Может быть обеспечена рекомбинантная форма вазогибина и/или SVBP, используя любой ранее описанный способ. Согласно схеме иммунизации, лимфоциты выделяют из селезенки, лимфоузлов или другого органа животного и сливают с подходящей миеломной клеточной линией, используя агент, такой как полиэтиленгликоль, с образованием гибридомы. После слияния, клетки помещают в среду, которая позволяет расти гибридомам, но не партнерам слияния, используя стандартные способы, как описано (Coding, Monoclonal Antibodies: Principles and Practice: Production and Application of Monoclonal Antibodies in Cell Biology, Biochemistry and Immunology, 3-ье издание, Academic Press, New York, 1996). После культивирования гибридом, анализируют клеточные супернатанты для определения наличия антител с желательной специфичностью, то есть, которые селективно связывают антиген. Подходящие аналитические методики включают ELISA, проточную цитометрию, иммунопреципитацию и вестерн-блоттинг.Другие методики скрининга хорошо известны в данной области техники. Предпочтительными являются те методики, которые подтверждают связывание антител с конформационно интактным, природно свернутым антигеном, такие как неденатурирующий ELISA, проточная цитометрия и иммунопреципитация.
Важным является то, как хорошо известно в данной области техники, что только небольшая часть молекулы антитела, паратоп, вовлечен в связывание антитела с его эпитопом (см., в целом, Clark, W. R. (1986) The Experimental Foundations of Modern Immunology Wiley & Sons, Inc., New York; Roitt, I. (1991) Essential Immunology, 7th Ed., Blackwell Scientific Publications, Oxford). Fc' и Fc участки, например, являются эффекторами каскада комплемента, но не задействованы в связывание антигена. Антитело, от которого был ферментативно отщеплен pFc' участок, или которое было продуцировано без pFc' участка, обозначается как F(ab')2 фрагмент, сохраняя оба антигенсвязывающих сайта интактного антитела. Аналогичным образом, антитело, от которого был ферментативно отщеплен Fc участок, или которое было продуцировано без Fc участка, обозначаемое как Fab фрагмент, сохраняет один из антигенсвязывающих сайтов молекулы интактного антитела. При дальнейшей обработке, Fab фрагменты, состоящие из ковалентно связанной легкой цепи антитело и части тяжелая цепь антитела, обозначаются как Fd. Fd фрагменты представляют собой основную детерминанту специфичности антитела (единичный Fd фрагмент может быть ассоциирован с вплоть до десяти различных легких цепей без изменения специфичности антитела) и Fd фрагменты сохраняют эпитоп-связывающую способность изолированно.
В пределах антигенсвязывающей части антитела, как хорошо известно в данной области техники, существуют участки, определяющие комплементарность (CDR), которые непосредственно взаимодействуют с эпитопом антигена, и каркасные участки (FR), которые поддерживают третичную структуру паратопа (см., в целом, Clark, 1986; Roitt, 1991). В обеих цепях, как в Fd фрагмент тяжелой цепи, так и легкой цепи IgG иммуноглобулинов, существует четыре каркасных участка (от FR1 до FR4), разделенные соответствующе тремя участками, определяющими комплементарность (от CDR1 до CDRS). CDR, и в особенности CDRS участки, и более предпочтительно CDRS тяжелой цепи, в значительной степени отвечают за специфичность антитела.
В настоящее время в данной области техники хорошо известно, что не-CDR участки антитела млекопитающего могут быть заменены на сходные участки конспецифичных или гетероспецифичных антител, в то же время сохраняя эпитопную специфичность исходного антитела. Это наиболее отчетливо проявляется в разработке и применении "гуманизированных" антител, в которых нечеловеческие CDR ковалентно связаны с FR и/или Fc/pFc' участками человека для получения функционального антитела.
Поскольку вазогибин (или его комплекс) представляет собой внутриклеточную мишень, то антитело в соответствии с изобретением, действуя в качестве ингибитор активности, может представлять собой фрагмент антитела без Fc фрагмента.
Следовательно, как является понятным для квалифицированного специалиста в данной области техники, настоящее изобретение также обеспечивает F(ab') 2 Fab, Fv и Fd фрагменты; химерные антитела, в которых Fc и/или FR и/или CDR1 и/или CDR2 и/или CDR3 участки легкой цепи, были заменены на гомологичные человеческие или нечеловеческие последовательности; химерные F(ab')2 фрагменты антител, в которых FR и/или CDR1 и/или CDR2 и/или CDR3 участки легкой цепи были заменены на гомологичные человеческие или нечеловеческие последовательности; химерные Fab фрагменты антител, в которых FR и/или CDR1 и/или CDR2 и/или CDR3 участки легкой цепи были заменены на гомологичные человеческие или нечеловеческие последовательности; и химерные Fd фрагменты антител, в которых FR и/или CDR1 и/или CDR2 участки были заменены на гомологичные человеческие или нечеловеческие последовательности. Настоящее изобретение также включает так называемые одноцепочечные антитела.
Различные молекулы и фрагменты антител могут иметь происхождение из любого из общеизвестных классов иммуноглобулинов, включая, но не ограничиваясь только ими, IgA, секреторные IgA, IgE, IgG и IgM. Подклассы IgG также хорошо известны квалифицированным специалистам в данной области техники и включают, но не ограничиваясь только ими, IgG1, IgG2, IgG3 и IgG4 человека.
В варианте осуществления изобретения, антитело в соответствии с изобретением представляет собой однодоменное антитело. Термин "однодоменное антитело" (sdAb) или "VHH" относится к единичному вариабельному домену тяжелой цепи антител тех типов, которые можно обнаружить у верблюдовых млекопитающих, которые в природе лишены легких цепей. Такие VHH также называются "нанотело®". В соответствии с изобретением, sdAb предпочтительно могут представлять собой sdAb ламы.
Примеры антитела, нейтрализующего вазогибин человека (или его комплекс или один из его членов), описаны или доступны для
• VASH 1 в: Saito М и др. The Journal of Biochemistry, 160(4), Oct. 2016, стр. 227 232); (Watanabe, K., и др. (2004). J. Clin. Invest. 114, 898907) и анти-вазогибин 1 / VASH1 антитело (С-концевое) IHC-plus™ LS-B9515 (Lifespan Bioscience)
• VASH2 в: Koyanagi Т. м др. Cancer Sci. 2017 Mar; 108(3):512-519); US 9701744, и анти-VASH2 терапевтическое антитело (1760) TAB-248CQ (creative biolab), анти-VASH2 (H00079805-H01) Novus bio.
• SVBP в анти-SVBP антителе (HPA008507 SIGMA)
• Ингибитор экспрессии вазогибина (или его комплекса)
"Ингибитор экспрессии вазогибина" или "ингибитор экспрессии комплекса вазогибин/SVBP" относится к природному или синтетическому соединению, которое имеет биологический эффект ингибировать или существенно уменьшать экспрессию по меньшей мере одного гена, кодирующего по меньшей мере один различный представитель вазогибина (или его комплекса).
В предпочтительном варианте осуществления, ингибитор экспрессии вазогибина выбирают из группы, включающей ингибитор экспрессии вазогибин 1 или вазогибин 2.
В предпочтительном варианте осуществления, ингибитор экспрессии комплекса вазогибин/SVBP выбирают из группы, включающей ингибитор экспрессии вазогибин 1, вазогибин 2 или SVBP.

Как показано в разделе Примеров (фигура 3 и 5), применение ингибирования экспрессии вазогибин1, или вазогибина 2 или SVBP в исследованиях в условиях in vitro/in vivo очевидно увеличивает количество нейритов и разветвлений нейронов (фигура 3) и модифицирует задержку дифференциации аксонов (фигура 5).
В предпочтительном варианте осуществления ингибитор экспрессии комплекса вазогибин/SVBP представляет собой ингибитор экспрессии вазогибина 1 и/или вазогибин 2.
Ингибиторы экспрессии для применения в настоящем изобретении могут основываться на антисмысловых олигонуклеотидных конструкциях. Антисмысловые олигонуклеотиды, включая антисмысловые молекулы РНК и антисмысловые молекулы ДНК, будут действовать путем непосредственного блокирования трансляции мРНК комплекса вазогибин/SVBP (или по меньшей мере на одном из его представителей) путем связывания с ней и таким образом предотвращая трансляцию белка или увеличивая распад мРНК, таким образом снижая уровень комплекса вазогибин/SVBP (или по меньшей мере одного из его членов), и, следовательно, активность, в клетке. Например, могут быть синтезированы антисмысловые олигонуклеотиды, состоящие по меньшей мере из приблизительно 15 оснований и комплементарны к уникальным участкам транскрибируемой последовательности мРНК, кодирующей комплекс вазогибин/SVBP (или один из его членов), например, с помощью общепринятых фосфодиэфирных техник, и вводиться, например, путем внутривенной инъекции или инфузии. В данной области техники хорошо известны способы применения антисмыслових техник для специфического ингибирования генной экспрессии генов, последовательности которых известны, (например, см. патенты US №№6,566,135; 6,566,131; 6,365,354; 6,410,323; 6,107,091; 6,046,321; и 5,981,732).
Малые ингибирующие РНК (миРНК) также могут действовать в качестве ингибиторов экспрессии для применения в настоящем изобретении. Экспрессия гена вазогибина (или его комплекса) может быть уменьшена путем контактирования субъекта или клетки с малой двухцепочечной РНК (дцРНК), или вектором или конструкцией, вызывающей продукцию малой двухцепочечной РНК, таким образом, что экспрессия гена комплекса вазогибин/SVBP специфически ингибируется (то есть РНК-интерференция или РНКи). Способы отбора подходящего дцРНК или дцРНК-кодирующего вектора хорошо известны в данной области техники для тех генов, последовательности которых известны (например, см. Tuschl, Т. и др. (1999); Elbashir, S. М. и др. (2001); Harmon, GJ. (2002); McManus, МТ. и др. (2002); Brummelkamp, TR. и др. (2002); патенты US №№6,573,099 и 6,506,559; и публикации Международных заявок на патент №№WO 01/36646, WO 99/32619, и WO 01/68836). Все или часть фосфодиэфирных связей миРНК согласно изобретению благоприятно защищены. Эту защиту обычно осуществляют посредством химического пути, используя способы, которые хорошо известны в данной области техники. Фосфодиэфирные связи могут быть защищены, например, с помощью тиольной или аминной функциональной группы или с помощью фенильной группы. 5'-и/или 3'- концы миРНК согласно изобретению также благоприятно защищены, например, используя техники, описанные выше для защиты фосфодиэфирных связей. Последовательности миРНК благоприятно состоят из по меньшей мере двенадцати непрерывных динуклеотидов или их производных.
Как используется в настоящей заявке, термин "производные миРНК" применительно к данным последовательностям нуклеиновых кислот относится к нуклеиновой кислоте, имеющей процент идентичности по меньшей мере 90% с комплексом вазогибин/SVBP (или по меньшей мере одним из его членов) или его фрагментом, предпочтительно по меньшей мере 95%, в качестве примера по меньшей мере 98%, и более предпочтительно по меньшей мере 98%.
Как используется в настоящей заявке, "процент идентичности" между двумя последовательностями нуклеиновых кислот, обозначает процентное значение идентичных нуклеиновых кислот, между двумя сравниваемыми последовательностями, полученное с наилучшим выравниванием указанных последовательностей, это процентное значение является исключительно статистическим и отличия между этими двумя последовательностями случайно распределяются в последовательностях нуклеиновых кислот. Как используется в настоящей заявке, "наилучшее выравнивание" или "оптимальное выравнивание", обозначает выравнивание, для которого определенный процент идентичности (см. ниже) является наиболее высоким. Сравнение последовательностей между двумя последовательностями нуклеиновых кислот обычно осуществляют путем сравнения этих последовательностей, которые ранее были выровнены в соответствии с наилучшим выравниванием; это сравнение реализуют на сегментах сравнения для идентификации и сравнения сходства локальных участков. Наилучшее выравнивание последовательностей для осуществления сравнения можно реализовать, кроме вручную, путем применения глобального алгоритма гомологии, разработанного SMITH и WATERMAN (Ad. Арр. Math., том 2, стр. : 482, 1981), путем применения глобального алгоритма гомологии, разработанного NEDDLEMAN и WUNSCH (J. Mol. Biol., том 48, ее: 443, 1970), путем применения способа сходства, разработанного PEARSON и LIPMAN (Proc.Natl. Acd. Sci. USA, том 85, ее: 2444, 1988), путем применения компьютерного программного обеспечения, использующего такие алгоритмы (GAP, BESTFIT, BLAST P, BLAST N, FASTA, TFASTA в пакете программного обеспечения Wisconsin Genetics, Genetics Computer Group, 575 Science Dr., Madison, WI USA), путем применения алгоритмов множественного выравнивания MUSCLE (Edgar, Robert С, Nucleic acids Research, том 32, cc.:1792, 2004). Для получения наилучшего локального выравнивания, специалист предпочтительно может использовать программное обеспечение BLAST. Процент идентичности между двумя последовательностями нуклеиновых кислот определяют путем сравнение этих двух последовательностей, оптимально выровненных, последовательности нуклеиновых кислот могут содержать добавления или делеции по сравнению с эталонной последовательностью для получения оптимального выравнивания между этими двумя последовательностями. Процент идентичности рассчитывают путем определения количества идентичных положений между двумя этими последовательностями, и деления этого количества на общее количество сравниваемых положений, и умножения полученного результата на 100 для получения процента идентичности между двумя этими последовательностями.
мшРНК (короткая шпилечная РНК) также могут действовать в качестве ингибиторов экспрессии для применения в настоящем изобретении.
Рибозимы также могут действовать в качестве ингибиторов экспрессии для применения в настоящем изобретении. Рибозимы представляют собой ферментативные молекулы РНК, способные катализировать специфическое расщепление РНК. Механизм действия рибозимов включает гибридизацию специфической последовательности молекулы рибозима с комплементарной целевой РНК, с последующим эндонуклеолитическим расщеплением. Следовательно, являются пригодными в объеме настоящего изобретения сконструированные молекулы рибозимов со шпилечным или молотоголовым мотивом, которые специфически и эффективно катализируют эндонуклеолитическое расщепление последовательностей мРНК комплекса вазогибин/SVBP (или по меньшей мере одного из его членов). Специфические сайты расщепления рибозимами в пределах любой потенциальной РНК мишени изначально идентифицируются путем сканирования целевой молекулы для определения сайтов расщепления рибозимами, которые типично включают следующие последовательности, GUA, GUU, и GUC. После идентификации, короткие РНК последовательности, состоящие из приблизительно 15-20 рибонуклеотидов, соответствующие участку целевого гена, содержащего сайт расщепления, может быть оценены для определения предсказанных характерных особенностей, таких как вторичная структура, что может придавать непригодность олигонуклеотидной последовательности.
Как антисмысловые олигонуклеотиды, так и рибозимы, пригодные в качестве ингибиторов экспрессии, могут быть приготовлены с помощью известных способов. Эти способы включают методики химического синтеза, такие как, например, твердофазный фосфорамидатный химический синтез. Альтернативно, антисмысловые молекулы РНК могут быть созданы путем транскрипции in vitro или in vivo ДНК последовательностей, кодирующую молекулу РНК. Такие последовательности ДНК могут быть инкорпорированы в различные векторы, которые инкорпорируют подходящие промоторы РНК-полимеразы, такие как промоторы полимераз Т7 или SP6. Могут быть интродуцированы различные модификации в олигонуклеотиды согласно изобретению для повышения внутриклеточной стабильности и времени полужизни. Возможные модификации включают, но не ограничиваясь только ими, добавление фланкирующих последовательностей рибонуклеотидов или дезоксирибонуклеотидов к 5' и/или 3' концам молекулы или применение фосфотиоата или 2'-O-метила вместо фосфодиэфирных связей в олигонуклеотидном остове.
Антисмысловые олигонуклеотиды, миРНК, мшРНК и рибозимы согласно изобретению могут доставляться in vivo самостоятельно или в ассоциации с вектор. В его наиболее широком значении, "вектор" представляет собой любой носитель, облегчающий перенос антисмыслового олигонуклеотида, миРНК, мшРНК или нуклеиновой кислоты рибозима в клетки и предпочтительно клетки, экспрессирующие комплекс вазогибин/SVBP. Предпочтительно, вектор транспортирует нуклеиновую кислоту в клетки с уменьшенным разложением относительно степени разложения, который будет иметь место при отсутствии вектора. В целом, векторы, пригодные в соответствии с изобретением, включают, но не ограничиваясь только ими, плазмиды, фагмиды, вирусы, другие носители, имеющие происхождение из вирусных или бактериальных источников, которые модифицируют путем инсерции или инкорпорации антисмыслового олигонуклеотида, миРНК, мшРНК или последовательности нуклеиновых кислот рибозима. Вирусные векторы являются предпочтительном типом вектора и включают, но не ограничиваясь только ими, последовательности нуклеиновых кислот из следующих вирусов: ретровирусы, такие как вирус мышиного лейкоза Молони, вирус саркомы мышей Харви, вирус опухоли молочной железы у мышей, и вирус саркомы Рауса; аденовирус, аденоассоциированный вирус; вирусы SV40-THna; вирусы полиомы; вирусы Эпштейна-Барра; вирусы папилломы; вирус герпеса; вирус осповакцины; полиовирус; и РНК вирус, такой как ретровирус. Квалифицированный специалист легко может применять другие векторы, которые не указаны, но которые известны в данной области техники.
Предпочтительные вирусные векторы основаны на нецитопатических эукариотических вирусах, в которых несущественные гены заменены геном, представляющим интерес. Нецитопатические вирусы включают ретровирусы (например, лентивирус), жизненный цикл которых включает обратную транскрипцию геномной вирусной РНК в ДНК с последующей провирусной интеграцией в ДНК клетки-хозяина. Ретровирусы получили разрешения для исследований генной терапии человека. Наиболее пригодными являются те ретровирусы, которые дефектные по репликации (то есть, способны направлять синтез желательных белков, но неспособны вырабатывать инфицирующую частицу). Такие генетически измененные ретровирусные экспрессионные векторы обычно являются пригодными для высокоэффективной трансдукции генов in vivo. Стандартные протоколы продуцирования дефектных по репликации ретровирусов (включая стадии инкорпорации экзогенного генетического материала в плазмиду, трансфекцию упакованной клеточной линией с вложенной плазмидой, продукцию рекомбинантных ретровирусов упакованной клеточной линией, сбор вирусных частиц из среды для культивирования тканей и инфицирование целевых клеток вирусными частицами) представлены в Kriegler, 1990 и в Murry, 1991).
Предпочтительными вирусами для определенных применений являются аденовирусы и аденоассоциированные (AAV) вирусы, которые представляют собой двухцепочечные ДНК вирусы, которые уже получили разрешение для применения для генной терапии человека. В настоящее время известно 12 различных серотипов AAV (AAV1 - 12), каждый с различными тропизмами к тканям (Wu, Z Mol Ther 2006; 14:316-27). Рекомбинантные AAV имеют происхождение из зависимых парвовирусов AAV2 (Choi, VW J Virol 2005; 79:6801-07). Аденоассоциированный вирус типа 1-12 может быть сконструирован таким образом, чтобы быть дефектным по репликации и способным инфицировать различные типы клеток и виды (Wu, Z Mol Ther 2006; 14:316-27). Он дополнительно имеет такие преимущества, как термостабильность и стабильность к липидным растворителям; высокая частота трансдукции в клетках различных линий, включая гемопоэтические клетки; и отсутствие ингибирования суперинфекции, таким образом предоставляя возможность множественных серий трансдукций. Согласно последним данным, аденоассоциированный вирус можно интегрировать в ДНК клеток человека сайт-специфическим образом, минимизируя таким образом возможность инсерционного мутагенеза и вариабельность экспрессии встроенного гена, характерной для ретровирусной инфекции. Дополнительно, инфицирование аденоассоциированным вирусом дикого типа осуществляют в тканевой культуре после более чем 100 пассажей при отсутствии селективного давления, свидетельствующего о том, что интеграция аденоассоциированного вируса в геном является относительно стабильным событием. Аденоассоциированный вирус также может функционировать экстрахромосомным образом.
Другие векторы включают плазмидные векторы. Плазмидные векторы подробно описаны в данной области техники и хорошо известны квалифицированным специалистам в данной области техники. См., например, Sambrook и др., 1989. За последние несколько лет, плазмидные векторы применяются в качестве ДНК вакцин для доставки генов, кодирующих антиген, в клетки in vivo. Они являются особенно благоприятными для этого, поскольку они не имеют таких же опасений по поводу безопасности по сравнению со многими другими вирусными векторами. Тем не менее, эти плазмиды, имеющие промотор, совместимый с клеткой-хозяином, могут экспрессировать пептид из гена, функционально кодируемого в плазмиде. Некоторые общепринято используемые плазмиды включают pBR322, pUC18, pUC19, pRC/CMV, SV40 и pBlueScript. Другие плазмиды хорошо известны квалифицированным специалистам в данной области техники. Дополнительно плазмиды могут быть сконструированы по заказу, используя рестрикционные ферменты и реакции лигирования для удаления и добавления специфических фрагментов ДНК. Плазмиды могут доставляться различными парентеральными, слизистыми и местными путями. Например, ДНК-плазмиду можно инъецировать с помощью внутримышечного, внутрикожного, подкожного или других путей. Она также может вводиться с помощью интраназальных спреев или капель, ректальных суппозиториев и перорально. Также она может вводиться в эпидермис или слизистую поверхность с использованием генной пушки. Плазмиды можно вводить в водном растворе, высушенные на частицах золота или в ассоциации с другой системой доставки ДНК, включая, но не ограничиваясь только ими, липосомы, дендримеры, улиткообразные и микроинкапсулирование.
В предпочтительном варианте осуществления, антисмысловой олигонуклеотид, миРНК, мшРНК или последовательность нуклеиновой кислоты рибозима помещают под контроль гетерологичного регуляторного участка, например, гетерологичного промотора. Промотор может быть специфическим для моноцита или макрофага.
Пример ингибитора экспрессии (миРНК) комплекса вазогибин/SVBP (или одного из его членов) человека и мыши описан или доступен для:
• вазогибин 1 in Kitajima Т., и др. Anticancer Research October 2014 том 34(10) сс.5321-5329; Miyashita Н, и др. (2012). PLoS ONE 7(10): е46459; Watatani Н и др., Physiol Rep.2014 June; 2(6): е 12054. Vasohibin-1 Gene Silencers siRNA (h), sc-61776, (SantaCruz Biotechnology); SMARTpool: Accell VASH1 siRNA (Darmacon); Invitrogen Stealth mouse siRNA MSS280250, MSS280251, и MSS280252.
• вазогибин 2 в: Tu, M., и др. (2016). (Cancer Letters; 383(2), 28 Dec.; с. 272-281); Koyanagi Т. и др. (Cancer Science 104(12) Dec. 2013 сс.1705-1710); Suenaga K. и др. (PLoS One. 2014; 9(9): е104728); Invitrogen Stealth mouse siRNA MSS213191, MSS280251, и MSS280252.
• SVBP в Suzuki Y, и др. (J Cell Sci 2010 123: 3094-3101).
Примером ингибитора экспрессии (мшРНК) мышиного комплекса вазогибин/SVBP (или одного из его членов), используемого в разделе примеров, являются
• вазогибин-1: CCGAGACATGCGGCTCAAGATTGGCAAGG (SEQ ID N°1)
• вазогибин-2: AGACAAATCGCCTGCTCTGACCGAGAAGA (SEQ ID N°2)
• SVBP: AGAGTGGAGAAGGCTAAGCAGAAATCTGC (SEQ ID N°3)
• Фармацевтическая композиция
Ингибитор активности или экспрессии комплекса вазогибин/SVBP можно комбинировать с фармацевтически приемлемыми наполнителями, и необязательно матрицами с замедленным высвобождением, такими как биоразлагаемые полимеры, с образованием терапевтических композиций.
В фармацевтических композициях согласно настоящему изобретению для перорального, подъязычного, подкожного, внутримышечного, внутривенного, трансдермального, местного или ректального введения, активно вещество, отдельно или в комбинации с другим активным веществом, можно вводить в единичной дозированной форме, в виде смеси с общепринятыми фармацевтическими основами, животным и людям. Подходящие единичные дозированные формы включают формы для перорального пути, такие как таблетки, гелевые капсулы, порошки, гранулы и пероральные суспензии или растворы, формы для подъязычного и буккального введения, аэрозоли, импланты, формы для подкожного, трансдермального, местного, внутрибрюшинного, внутримышечного, внутривенного, субдермального, трансдермального, интратекального и интраназального введения и формы для ректального введения.
Предпочтительно, фармацевтические композиции содержат носители, которые являются фармацевтически приемлемыми для приготовления препарата, способного инъецироваться. Они могут находиться, в частности, в изотонических, стерильных, солевых растворах (мононатрийфосфат или динатрийфосфат, хлорид натрия, калия, кальция или магния и другие или смеси таких солей), или обезвоженных, в особенности лиофилизированных композициях, которые при добавлении, в зависимости от ситуации, стерильной воды или физиологического солевого раствора, обеспечивают восстановление инъецируемых растворов.
Фармацевтические формы, подходящие для инъекционного применения, включают стерильные водные растворы или дисперсии; препараты, включающие кунжутное масло, арахисовое масло или водный пропиленгликоль; и стерильные порошки для экстемпорального приготовления стерильных растворов для инъекций или дисперсии. Во всех случаях, форма должны быть стерильной и должна быть жидкой до такой степени, чтобы легко можно было ввести с помощью шприца. Она должна быть стабильной в условиях изготовления и хранения и должна быть консервирована от загрязняющего действия микроорганизмов, таких как бактерии и грибы.
Растворы, содержащие соединения согласно изобретению в виде свободного основания или фармакологически приемлемые соли могут быть приготовлены в воде, подходяще смешанной с поверхностно-активным веществом, таким как гидроксипропилцеллюлоза. Дисперсии также могут быть приготовлены в глицерине, жидких полиэтиленгликолях, и их смесях и в маслах. В исходных условиях хранения и применения, эти препараты содержат консервант для предотвращения роста микроорганизмов.
Ингибитор активности или экспрессии комплекса вазогибин/SVBP согласно изобретению может быть приготовлен в композиции в нейтральной или солевой форме. Фармацевтически приемлемые соли включают соли присоединения кислоты (образованные со свободными аминогруппами белка) и которые образованы с неорганическими кислотами, такими как, например, соляная или фосфорная кислоты, или органическими кислотами, такими как уксусная, щавелевая, винная, миндальная и другие. Соли, образованные со свободными карбоксильными группами, также могут иметь происхождение из неорганических оснований, таких как, например, гидроксиды натрия, калия, аммония, кальция или трехвалентного железа, и органических оснований, таких как изопропиламин, триметиламин, гистидин, прокаин и другие.
Носитель также может представлять собой растворитель или диспергирующую среду, содержащую, например, воду, этанол, полиол (например, глицерин, пропиленгликоль, и жидкий полиэтиленгликоль, и другие), их подходящие смеси, и растительные масла. Можно поддерживать надлежащую текучесть, например, путем применения покрытия, такого как лецитин, путем поддержания требуемого размера частиц в случае дисперсии и путем применения поверхностно-активных веществ. Предотвращение действия микроорганизмов можно осуществлять с помощью различных антибактериальных и противогрибковых агентов, например, парабенов, хлорбутанола, фенола, сорбиновой кислоты, тимеросала и других. Во многих случаях, может являться предпочтительным включение изотонических агентов, например, Сахаров или хлорида натрия. Пролонгированную абсорбцию композиций для инъекций можно обеспечивать путем применения в композициях агентов, замедляющих абсорбцию, например, моностеарата алюминия и желатина.
Подходящие растворы для инъекций приготавливают путем включения активных полипептидов в требуемом количестве в подходящем растворителе с несколькими другими компонентами, указанными выше, при необходимости, с последующей стерилизацией. Как правило, дисперсии приготавливают путем включения различных стерилизованных активных компонентов в стерильный наполнитель, который содержит основную диспергирующую среду и требуемые другие компоненты из тех, которые описаны выше. В случае стерильных порошков для приготовления стерильных растворов для инъекций, предпочтительными способами приготовления является методики вакуумной сушки и сушки вымораживанием, которые обеспечивают получения порошка активного компонента плюс любого дополнительного желательного компонента из его ранее стерилизованного фильтрованием раствора.
После приготовления, растворы будут вводить с помощью метода, совместимого с дозируемым препаратом и в таком количестве, которое является терапевтически эффективным. Препараты легко вводятся в различных дозированных формах, таких как тип растворов для инъекций, описанных выше, но также можно применять капсулы, высвобождающие лекарственное средство и другие.
Для парентерального введения в водном растворе, например, раствор может быть подходяще забуференным, при необходимости, и жидкий разбавитель сначала придает изотоничность с применением достаточного количества физиологического раствора или глюкозы. Эти предпочтительные водные растворы в особенности пригодны для внутривенного, внутримышечного, подкожного и внутрибрюшинного введения. В этой связи, стерильная водная среда, которую можно применять, будет известна для квалифицированного специалиста в данной области техники с учетом настоящего раскрытия. Например, одна дозировка может быть растворена в 1 мл изотонического раствора NaCl и либо добавлена к 1000 мл гиподермоклизисисной жидкости, или инъецирована в предназначенный сайт инфузии. Некоторые вариации дозировки обязательно будут осуществляться, в зависимости от состояния субъекта, подвергаемого лечению. Лицо, отвечающее за введения, будет в любом случае определять подходящую дозировку для индивидуального субъекта.
Ингибитор активности или экспрессии комплекса вазогибин/SVBP согласно изобретению может быть приготовлена в виде терапевтической смеси, содержащей от приблизительно 0,0001 до 1,0 миллиграмм, или от приблизительно 0,001 до 0,1 миллиграмм, или от приблизительно 0,1 до 1,0 или даже от приблизительно 10 миллиграмм на дозу или т.д. Также можно вводить множественные дозы.
Дополнительно к соединениям согласно изобретению, приготовленных в виде препарата для парентерального введения, такого как внутривенная или внутримышечная инъекция, другие фармацевтически приемлемые формы включают, например, таблетки или другие твердые формы для перорального введения; липосомальные препараты; капсулы с замедленным высвобождением; и любую другую форму, используемую в настоящее время.
• Способ скрининга
Настоящее изобретение дополнительно относится к способу скрининга кандидатных ингибиторов комплекса вазогибин/SVBP (также обозначаемых как "TCP-ингибиторы"). Способ в соответствии с настоящим изобретением включает стадии:
(I) инкубирование кандидатного соединения с вазогибин/SVBP (TCP) и биотинилированным пептидом с последовательностью Биотинил-V-D-S-V-E-G-E-G-E-E-E-D-E-E-Y (SEQ ID NO: 13);
(II) количественное определение, с помощью масс-спектрометрии, биотинилированного пептида Биотинил-V-D-S-V-E-G-E-G-E-E-E-D-E-E-Y (SEQ ID NO: 13) и/или биотинилированный пептид Биотинил-V-D-S-V-E-G-E-G-E-E-E-D-E-E (SEQ ID NO: 12), присутствующего в смеси, полученной после окончания стадии (I); и
(III) определение, является ли кандидатное соединение TCP ингибитором с учетом результатов, полученных на стадии (II).
Пептид согласно SEQ ID NO: 13 представляет собой субстрат TCP и продукт реакции с TTL. Таким образом, если кандидатное соединение представляет собой ингибитор TCP, то количество этого пептида, количественно определенное на стадии (II), является по существу таким же, что и количество пептида, изначально инкубированного на стадии (I).
Пептид согласно SEQ ID NO: 12 представляет собой субстрат TTL и продукт реакции с TCP.
Таким образом, если кандидатное соединение не представляет собой ингибитор TCP, то количество этого пептида повышается во время стадии (I).
Способ согласно настоящему изобретению предоставляет возможность быстрого и точного определения TCP-ингибиторов (см. результаты, представленные в Примере 7 ниже). Заявляемый способ предоставляет возможность определения ингибирующих характеристик тестируемого соединения; типично заявляемый способ предоставляет возможность полумаксимальной ингибирующей концентрации (IC50) ингибитора.
Вышеуказанный способ скрининга может дополнительно включать стадию предварительного инкубирования, на которой TCP и тестируемое соединение предварительно инкубируют перед контактированием с пептидом согласно SEQ ID NO: 13.
Стадию инкубирования осуществляют в условиях, предоставляющих возможность осуществления TCP активности. Типично, стадию инкубирования осуществляют при температуре от 15°С до 25°С. Типично, стадию инкубирования осуществляют при комнатной температуре.
Стадию инкубирования осуществляют в течение периода времени, достаточного для возможности осуществления TCP активности. Типично, указанный период времени составляет от 5 до 60 минут, более предпочтительно от 10 до 30 минут.
Стадию количественного определения осуществляют путем применения масс-спектрометрии (MS). Типично, масс-спектрометр представляет собой RapidFire® масс-спектрометр. В дальнейшем варианте осуществления, масс-спектрометр работает в режиме электрораспыления отрицательно заряженных ионов.
В дальнейшем варианте осуществления, способ скрининга включает, между стадиями (I) и (II), стадию очистки, на которой биотинилированные пептиды согласно SEQ ID NO: 12 или 13 выделяют таким образом, чтобы их количественно определить на стадии (III).
Эту очистку можно осуществить с помощью любого способа, хорошо известного квалифицированному специалисту в данной области техники для выделения биотинилированных пептидов. Стадию очистки предпочтительно можно осуществить с помощью любых средств, предоставляющих возможность специфического связывания биотина. Например, можно использовать любое устройство, содержащее стрептавидин или авидин. Типично, указанную стадию очистки можно осуществлять, используя картридж С-типа с масс-спектрометром, работающим в режиме электрораспыления отрицательно заряженных ионов.
Настоящее изобретение также относится к способу скрининга множества кандидатных соединений, пригодных для лечения заболеваний, связанных с тубулин карбоксипептидазами (TCP), включающий стадии, предусматривающие (а) тестирование каждого из кандидатных соединений для определения его способности ингибировать активность или экспрессию комплекса вазогибин/SVBP или вазогибина и (б) и положительный отбор кандидатных соединений, способных ингибировать указанную активность или экспрессию комплекса вазогибин/SVBP или вазогибина.
Типично, кандидатное соединение выбирают из группы, включающей небольшие органические молекулы, пептиды, полипептиды или олигонуклеотиды. Другие потенциальные кандидатные соединения включают антисмысловые молекулы, миРНК, мшРНК, онРНК или рибозимы.
Тестирование, может ли кандидатное соединение ингибировать активность или экспрессию комплексов вазогибин/SVBP, можно определять с помощью обычных или модифицированных репортерных анализов, известных в данной области техники.
Например, способ может вовлекать контактирование клеток, экспрессирующих вазогибин (или его комплекс) с кандидатным соединением, и измерение опосредованной вазогибином (или его комплексом) транскрипции (например, активации промоторов, содержащий связывающие сайты комплекса вазогибин/SVBP (или по меньшей мере одного из его членов)), и сравнения клеточного ответа со стандартным клеточным ответом. Типично, стандартный клеточный ответ измеряют при отсутствии кандидатного соединения. Снижение клеточного ответа по сравнению со стандартным указывает на то, что кандидатное соединение представляет собой ингибитор экспрессии комплекса вазогибин/SVBP (или по меньшей мере одного из его членов).
В другом варианте осуществления, изобретение обеспечивает способ идентификации лиганда, который специфически связывается с комплексами вазогибин/SVBP (или одним из его членов). Например, может быть приготовлен клеточный компартмент, такой как мембрана или ее препарат, из клетки, которая экспрессирует молекулу, связывающую вазогибин (или его комплекс). Препарат инкубирует с меченным комплексом вазогибин/SVBP или меченным вазогибином и комплексы лиганда, связанного с вазогибином (или его комплексом) выделяют и характеризуют в соответствии с общепринятыми способами, известными в данной области техники. Альтернативно, полипептид, взаимодействующий с вазогибином (или его комплексом), может быть связан с твердой подложкой таким образом, что связывающие молекулы, солюбилизированные из клеток, связываются с колонкой и затем элюируются и характеризуются в соответствии с общепринятыми способами. В другом варианте осуществления, может быть приготовлен клеточный компартмент, такой как мембрана или ее препарат, из клетки, которая экспрессирует молекулу, связывающуюся с вазогибином (или его комплексом), такую как молекула сигнального или регуляторного пути, модулируемого вазогибином (или его комплексом), такого как детирозинирование тубулина. Препарат инкубируют с меченным вазогибином (или его комплексом) при отсутствии или в присутствии кандидатного соединения. Способность кандидатного соединения связываться со связывающей молекулой отображается в снижении связывания меченного лиганда. Молекулы, которые связываются произвольно, то есть без индуцирования эффектов комплекса вазогибин/SVBP или вазогибина на связывание связывающей молекулы комплекса вазогибин/SVBP или вазогибина, наиболее вероятно являются хорошим ингибитором активности комплекса вазогибин/SVBP или вазогибина.
Другой способ включает скрининг для выявления соединений, которые ингибируют активность вазогибина, путем определения, например, количества транскрипции из промоторов, содержащих сайты связывания вазогибина/ (или его комплекса) в клетке, которая экспрессирует вазогибин (или его комплекс.Такой способ может включать трансфектирование эукариотической клетки с применением ДНК, кодирующей вазогибин (или его комплекс) таким образом, что клетка экспрессирует вазогибин (или его комплекс), содержащий клетку с кандидатным соединением, и определение количества транскрипции из промоторов, содержащих сайты связывания вазогибина (или его комплекса). В таком способе можно использовать репортерный ген (например, GFP), связанный с промотором, содержащим сайт связывания вазогибина (или его комплекса), в этом случае, количество транскрипции из репортерного гена может быть определена путем измерения уровня продукта репортерного гена, или уровня активности продукта репортерного гена, в том случае, когда репортерный ген представляет собой фермент. Снижение количества транскрипции из промоторов, содержащих сайты связывания вазогибина (или его комплекса) в клетке, экспрессирующей вазогибин (или его комплекс, по сравнению с клеткой, которая не экспрессирует вазогибин (или его комплекс), будет указывать на то, что кандидатное соединение представляет собой ингибитор активности вазогибина.
Другой способ включает скрининг для выявления соединений, которые ингибируют биологическую активность вазогибина, путем определения уровня детирозинирования альфа тубулина, например, с тестированием радиоактивности, используя микротрубочки, стабилизированные [14С]-тирозинированным таксолом, активность фермента, как описано выше и в разделе примеров (исследование активности TCP).
Таким образом, кандидатные соединения, которые отбирают положительно для теста связывания, могут подвергаться дальнейшим стадиям отбора для дальнейшего исследования их свойств на ингибирование детирозинирования альфа тубулина с исследованием активности TCP.
Кандидатные соединения, которые отбирают положительно, также могут подвергаться дальнейшим стадиям отбора для дальнейшего исследования их свойств на нейронах, выделенных из субъектов, страдающих от нейродегенеративного заболевания, такого как болезнь Альцгеймера, или клеточных линий нейронов, подверженных действию нейротоксинов пептида бета-амилоида. Например, кандидатные соединения, которые отбирают положительно, со способом скрининга, как описано выше, могут дополнительно отбираться для определения из способности ингибировать исчезновение дендритных шипиков из нейронов пациентов с болезнью Альцгеймера или клеточных линий нейронов, подверженных действию нейротоксинов пептида бета-амилоида. Типично, способ скрининга может дополнительно включать стадии I) контактирование нейрона от пациентов с болезнью Альцгеймера или клеточных линий нейронов, подверженных действию нейротоксинов пептида бета-амилоида, с положительно отобранным кандидатным соединением II) определение плотности дендритных шипиков указанных нейронов и III) сравнение плотности, определенной на стадии II), с плотностью, определенной, когда стадию I) осуществляют при отсутствии положительно отобранного кандидатного соединения. Стадию I), как описано выше, можно осуществлять путем добавления количества тестируемого кандидатного соединения в культуральную среду нейрона. Обычно, приготавливают множество образцов культуры, таким образом, что тестируют добавление возрастающих количество кандидатного соединения в различных образцах культуры. Как правило, также приготавливают по меньшей мере один образец культуры без кандидатного соединения в качестве отрицательного контроля для дальнейшего сравнения.
В завершение, кандидатные соединения, которые отбирают положительно, могут подвергаться дальнейшим стадиям отбора для дальнейшего исследования их свойств на животных моделях болезни Альцгеймера (для обзора животной модели болезни Альцгеймера см. Sasaguri Н. и др. (2017) EMBO J.;36(17):2473-2487; или Gotz J и др. (2008) Nature Reviews Neuroscience 9, 532-544; ort Laurijssens В. и др. (2013) Drug Discovery Today: Technologies том 10, издание 3, страницы e319-e327). Типично, положительно отобранное кандидатное соединение может вводиться животному с экспериментальной моделью и определяют прогрессирование болезни Альцгеймера и сравнивают с прогрессированием болезни Альцгеймера на животном с экспериментальной моделью, которому не вводили кандидатное соединение.
Изобретение в дальнейшем иллюстрируется с помощью последующих фигур и примеров. Тем не менее, эти примеры и фигуры не должны интерпретироваться как каким-либо образом ограничивающие объем настоящего изобретения.
Фигуры
Фигура 1. Очистка и идентификация TCP головного мозга мыши (А).
SDS-PAGE (окрашивание серебром) указанных фракций TCP обогащенных (Фракция I - IV) из головного мозга мыши (1 мкг белков). Осуществляли стадию осаждения сульфатом аммония с последующими двумя стадиями на ионообменной колонке, (б) Чувствительность Фракции IV к ингибиторам. TPCK (Тозил фенилаланил хлорметил кетон), TLCK (Тозил-Ь-лизил Хлорметил кетон): коммерчески доступные серин/цистеин ингибиторы, содержащие либо Phe или Lys остаток. Активность фракции IV продемонстрировала в 100-раз более высокую чувствительность к ТРСК по сравнению с TLCK, согласующуюся с высокой аффинностью ароматического остатка. Партенолид представляет собой ингибитор клеточного детирозинирования, содержащий эпоксидный электрофил. Е-64 представляет собой природный продукт ингибитор клана СА цистеиновой протеазы, содержащей эпоксидный электрофил. EpoY, epoEY и epoEEY представляют собой созданные ингибиторы, содержащие эпоксид из Е-64, связанный с Y, EY или EEY аминокислотами соответственно. Алкин-epoY представляет собой «кликабельную» версию epoY. Результаты представлены в виде процентного значения активности фермента (анализ радиоактивности) в контроле с ДМСО (среднее +/- СО, n = 3-6). (С) Структура алкин-epoY. (D) Схематическое представление последних стадий TCP идентификации, используя катализируемое Си циклоприсоединение азид-алкин (клик-реакция). (Е) Мечение предполагаемого TCP из фракции IV с помощью TAMRA зонда, используя алкин-epoY (некликабельный epoY используется в качестве контроля). (F) Схематическое представление вазогибин-1 и вазогибин-2 мышей (69% общая гомология последовательностей; 77% для ядерных доменов (прозрачные синие прямоугольники)). Эти предполагаемые трансглутаминаза-подобные цистеин пептид азы содержат нестандартную триаду каталитических остатков (Cys, His, Ser).
Фигура 2. Вазогибины, ассоциированные с SVBP, являются эффективными тубулин тирозин карбоксипептидазами. (А) Иммуноблот эндогенного тубулина из HEK293T клеток, экспрессирующих каждый VASH (VI, V2) или их инактивированные версии при отсутствии или в присутствии экзогенной SVBP со-экспрессии. Антитела, специфические к тирозинированному и детирозинированному тубулину, использовали для оценки детирозинирование. Антитела к α-тубулину, His и Flag соответственно указывают на количества тубулина, вазогибина и SVBP. Нетрансфектированные клетки (-) проявляют эндогенные уровни модификаций тубулина. ((В) Иммуноблот белковых экстрактов из HEK293T клеток, экспрессирующих mCherry-αlB-тубулин, каждый VASH и SVBP. Использовали нативные или мутированные версии α1B-тубулина, соответственно, оканчивающиеся на EEY или ЕЕА. Уровни де/тирозинированного тубулина измеряли, как в (А). Антитело к mCherry демонстрирует такие же количества экзогенного α-тубулина. (С) Детирозинирующую активность очищенных VASH/SVBP комплексов оценивали, используя радиоактивно меченные микротрубочки (6-8 мкМ), n = 3. Активные и каталитически инактивированные версии вазогибинов совместно экспрессировали с SVBP в HEK293T клетках и очищали на кобальтовой смоле (Фиг. 6А). В качестве контроля использовали очищенную GFP-His конструкцию. Теоретическое максимальное высвобождение тирозина указано в виде 100% линии. (D) Детирозинирующую активность очищенных VASH1/SVBP комплексов (20 или 40 нМ) в микротрубочках головном мозге или димерах тубулина в (5 мкМ) оценивали с помощью иммуноблота. Сходные эксперименты с VASH2/SVBP комплексами (Фиг. 6В). Нами контролировалось, чтобы тубулин находился в димерной или в собранной форме (Фиг. 6С) и чтобы присутствовали идентичные количества ферментативных комплексов (Фиг. 6D). (Е) Детирозинирующая активность очищенных VASH/SVBP комплексов (600 нМ) в микротрубочках головного мозга или рекомбинантного GFP-EB1 (5 мкМ). Карбоксипептидаза A (CPA) использовали в качестве положительного контроля. Антитела к тирозинированному и детирозинированному ЕВ1 были охарактеризованы в (15).
Фигура 3. Регуляция по типу отрицательной обратной связи VASH1 и VASH2 оказывает влияния на дифференциацию нейронов. (A) Vash1, Vash2 и Svbp транскрипты обнаружены в тканях головного мозга и нейронах гиппокампа. Осуществляли реакции ОТ-ПЦР 45 циклов для всех указанных тканей и клеток, используя 50 нг очищенной мРНК, за исключением для GAPDH, для которого осуществляли только 25 циклов. (В) Вестерн-блоттинг эффекта VASH1 и VASH2 (shV1 + shV2) или SVBP (shSVBP) регуляции по типу отрицательной обратной связи на уровни детирозинированного тубулина в нейронах. Нейроны трансфектировали путем электропорации с мшРНК, ассоциированной с turboGFP (tGFP) кДНК, непосредственно перед высеванием и анализировали при 2DIV (результаты из иммуноблотов в трех повторах трех независимых нейронных культур). (С-Е) Влияние регуляции по типу отрицательной обратной связи вазогибинов на рост нейритов и дифференциация аксонов. Нейроны трансфектировали, как указано в В, и анализировали путем иммуноокрашивания при 2DIV и 3DIV. (С) Нейроны на стадии III (несущие аксон) подсчитывали вручную на иммунофлуоресцентных изображениях от 3 до 4 различных культур при 2DIV и 3DIV. (D) Морфометрические анализы для по меньшей мере 85 нейронов (при 2DIV), используя AutoNeuriteJ макро (см. Методы относительно более подробного описания) на иммунофлуоресцентных изображениях создавали, как описано в in С. *, Р<0,05; ***, Р<0,0005, ****, Р<0,0001 (t или критерии Манна-Уитни).
Фигура 4. Регуляция по типу отрицательной обратной связи вазогибинов оказывает влияние на радиальную миграцию новорожденных кортикальных нейронов. (А) Количественный анализ показал распределение GFP положительных нейронов в коре головного мозга, разделенной на шесть равных групп. Данные из 5 головных мозгов на условие, среднее ± СПС. нд, недостоверно, ***р<0,001, ****<0,0001 (критерий Манна-Уитни). (В)
Фигура 5. Регуляция по типу отрицательной обратной связи SVBP изменяет дифференциацию нейронов. (А) Апробация VASH1, VASH2 и SVBP мшРНК. HEK293T клетки совместно трансфектировали плазмидами, предоставляющими возможность экспрессия белка и соответствующей мшРНК или контрольной мшРНК. Неочищенные белковые экстракты анализировали с помощью вестерн-блоттинга с анти-GFP и анти-Flag для тестирования наличия VASH1/2 или SVBP, соответственно, и с анти-turboGFP для оценки присутствия мшРНК; (В-С) Влияние регуляции SVBP по типу отрицательной обратной связи на рост нейритов и дифференциацию аксонов. Нейроны трансфектировали, как представлено на Фиг. 3В, и анализировали путем иммуноокрашивания при 2DIV и 3DIV. (В) Нейроны на стадии III (несущие аксон) подсчитывали вручную на иммунофлуоресцентных изображениях от 3 до 4 различных культур при 2DIV и 3DIV. (С) Морфометрические анализы для по меньшей мере 27 нейронов (при 2DIV), используя AutoNeuriteJ макро (см. Методы относительно более подробного описания) на иммунофлуоресцентных изображениях, созданных, как указано в В. *, Р<0,05; **, Р<0,005; ***, Р<0,0005 (t или критерии Манна-Уитни).
Фигура 6. Очистка и свойства VASH/SVBP комплексов. (А) Вестерн-блоттинг (верхние панели) и SDS-PAGE (нижняя панель) очистки комплексов вазогибин/SVBP. Вазогибины и их каталитически инактивированные версии совместно экспрессировали с SVBP в HEK293T клетках, как представлено на Фиг. 2А и затем очищали на кобальтовой смоле. Конструкцию только GFP (несущую His-tag) использовали в качестве контроля. GFP и вазогибины зондировали с анти-His антителом, и SVBP с анти-Flag антителом. Представлены анализы методом вестерн-блоттинга неочищенных (лизат) и очищенных (элюат) белковых экстрактов и SDS-PAGE очищенного белкового экстракта. Следует отметить, что SVBP совместно очищали со всеми вазогибинами, но не с GFP. (В) Оценивали детирозинирующую активность очищенных VASH2/SVBP комплексов на очищенных микротрубочках из головного мозга или димерах тубулина, как представлено на Фиг. (2D). (С) Контроль с помощью SDS-PAGE несобранных микротрубочек (димеры тубулина, Tub) или собранных микротрубочек (МТ), используемых на Фиг. (2D). МТ и Tub экстракт (500 нг) центрифугировали 15 минут при 25°С и 200 тыс g. СН, супернатант.(D) Контроль с помощью вестерн-блоттинга количеств VASH1, VASH2 и SVBP, используемые на Фиг. 2D.
Фигура 7. Цикл детирозинирование/тирозинирование и вовлеченные ферменты: центральное положение тубулин карбоксипептидазы (TCP), α-тубулин обычно неосинтезируется с С-концевым ароматическим остатком, тирозин для большинства генов или фенилаланин для α8 гена (31). α-тубулин может входить в цикл де/тирозинирование, где димер αβ-тубулин инкорпорируется в микротрубочки и становится субстратом TCP. TCP удаляет последний ароматический остаток, создавая микротрубочку, несущую детирозинированный а тубулин (или αΔ1-тубулин). Детирозинированный а тубулиновый пул также может поступать с помощью прямого неосинтеза из α4 гена, кодирующего α-тубулин без последнего ароматического остатка. Для завершения цикла, микротрубочка деполимеризуется и высвобождает детирозинированные димеры, которые могут повторно тирозинироваться с помощью тубулин тирозин лигазы (TTL). В то время как TTL фермент состоит из единственного белка, TCP ферменты, открытые в настоящем исследовании, содержат каталитическую единицу (вазогибин) и вспомогательный белок (SVBP, малый вазогибин-связывающий белок). Благодаря событию дупликации предкового гена вазогибина, позвоночные несут две TCP каталитические субъединицы, вазогибин-1 (VASH1) и вазогибин-2 (VASH2). Детирозинированный α-тубулин является источником других модификаций. Предпоследний и пред-предпоследний глутаматные остатки могут последовательно обрабатываться ферментами семейства ССР, создавая αΔ2- и αΔ3 тубулин, соответственно (28, 32, 33).
Фигура 8. Сравнение статуса детирозинирования тубулина в головном мозге пациентов с AD и контрольных пациентов. Осуществляли иммуноблот-анализ с белковыми экстрактами из энторинальной, гиппокампа, височной и латеральной ткани головного мозга из здоровых пожилых отобранных пациентов (контроль) и пациентов с AD согласно Braak I - VI, классифицированные с I-II, (рання AD), III-IV (средняя AD) и V-VI (поздняя AD). Количественные определения осуществляли из 3 независимых экспериментов и "контрольный" образец головного мозга использовали в полной серии экспериментов, предоставляющий возможность внутренней стандартизации. Анализируемыми образцами были: контроль n=11, стадия Braak I-II n=5, стадия Braak III-IV n=6 и стадия Braak IV-V n=7. Детирозинированный и Δ2 тубулин стандартизировали к общему тубулину. Все данные представляли в виде среднего значения + СПС. Двухфакторный дисперсионный анализ, используя Mix Models. Источниками вариаций были Braak и участок головного мозга. Влияние участка не является достоверным и влияние Braak является достоверным для Tub детир/Tub общ (* р=0,031) и для Tub A2/tub общ (** р=0,0051).
Фигура 9. Понижающая экспрессия VASH1 оказывает влияние на тирозинирование тубулина в головном мозге. Капиллярный вестерн-блоттинг тирозинированный-тубулин, детирозинированный-тубулин, дельта2-тубулин, α-тубулин и TTL (А). Относительное количественное определение уровней: тирозинированный (б), детирозинированный (С), дельта 2 (D) и общий α-тубулин (Е) и тубулин тирозин лигаза (F) в гиппокампе из VASH1 KO гетерозиготных (+/-), гомозиготных (-/-) и мышей дикого типа (+/+) мышей (среднее ± СПС). Осуществляли статистические сравнения, используя непараметрический критерий Краскела-Уоллиса с последующим критериями множественного сравнения Дьюнна. **р<0,01, ****р<0,0001 по сравнению с мышами дикого типа.
Фигура 10. Понижающая экспрессия SVBP оказывает влияние на тирозинирование тубулина в головном мозге. Капиллярный вестерн-блоттинг тирозинированный-тубулин, детирозинированный-тубулин, дельта2-тубулин, α-тубулин и TTL (А). Относительное количественное определение уровней: тирозинированный (б), детирозинированный (С), дельта 2 (D) и общий α-тубулин (Е) и тубулин тирозин лигаза (F) в гиппокампе из SVBP KO гетерозиготные (+/-), гомозиготные (-/-) и мышей дикого типа (+/+) мышей (среднее ± СПС). Осуществляли статистические сравнения, используя непараметрический критерий Краскела-Уоллиса с последующим критериями множественного сравнения Дьюнна. **р<0,01, ****р<0,0001 по сравнению с мышами дикого типа.
Фигура 11. Понижающая экспрессия VASH2 не оказывает влияния на тирозинирование тубулина в головном мозге. Капиллярный вестерн-блоттинг тирозинированный-тубулин, детирозинированный-тубулин, дельта2-тубулин, α-тубулин и TTL (А). Относительное количественное определение уровней: тирозинированный (б), детирозинированный (С), дельта 2 (D) и общий α-тубулин (Е) и тубулин тирозин лигаза (F) в гиппокампе из VASH2 KO гетерозиготные (+/-), гомозиготные (-/-) и мышей дикого типа (+/+) мышей (среднее ± СПС). Осуществляли статистические сравнения, используя непараметрический критерий Краскела-Уоллиса с последующим критериями множественного сравнения Дьюнна.
Фигура 12. Понижающая экспрессия VASH1 оказывает влияние на тирозинирование тубулина в желудочках сердца. Вестерн-блоттинг α-тубулин, тирозинированный-тубулин, детирозинированный-тубулин, дельта2-тубулин и TTL (А). Относительное количественное определение уровней: тирозинированный (б), детирозинированный (D), дельта 2 (F) и общий (С) α-тубулин и тубулин тирозин лигаза (Е) в желудочках сердца из VASH1 KO гомозиготных (-/-), гетерозиготных (+/-) и мышей дикого типа (+/+) мышей (среднее ± СПС). Осуществляли статистические сравнения, используя непараметрический однофакторный дисперсионный анализ * р<0,05, **р<0,01, ****р<0,0001 по сравнению с мышами дикого типа.
Фигура 13. Понижающая экспрессия SVBP оказывает влияние на тирозинирование тубулина в желудочках сердца. Вестерн-блоттинг α-тубулин, тирозинированный-тубулин, детирозинированный-тубулин, дельта2-тубулин и TTL (А). Относительное количественное определение уровней: тирозинированный (б), детирозинированный (D), дельта 2 (F) и общий (С) α-тубулин и тубулин тирозин лигаза (Е) в желудочках сердца из SVBP KO гомозиготных (-/-), гетерозиготных (+/-) и мышей дикого типа (+/+) мышей (среднее±СПС). Осуществляли статистические сравнения, используя непараметрический однофакторный дисперсионный анализ * р<0,05, **р<0,01, ****р<0,0001 по сравнению с мышами дикого типа.
Фигура 14. Понижающая экспрессия VASH2 не оказывает влияния на тирозинирование тубулина в желудочках сердца. Вестерн-блоттинг α-тубулин, тирозинированный-тубулин, детирозинированный-тубулин, дельта2-тубулин и TTL (А). Относительное количественное определение уровней: тирозинированный (б), детирозинированный (D), дельта 2 (F) и общий (С) α-тубулин и тубулин тирозин лигаза (Е) в желудочках сердца из VASH2 KO гомозиготные (-/-), гетерозиготные (+/-) и мышей дикого типа (+/+) мышей (среднее ± СПС). Осуществляли статистические сравнения, используя непараметрический однофакторный дисперсионный анализ.
Фигура 15. Понижающая регуляция VASH1 или SVBP оказывает влияние на тирозинирование тубулина в зрелых нейронах
Анализ осуществляли на белковых экстрактах из 17DIV кортикальных нейронов. Количественные определения осуществляли из 3 независимых иммуноблотов с экстрактами из 3 различных эмбрионов, (среднее ± СПС, t-критерии). *Р<0,05, **Р<0,01, ***Р<0,001.
Фигура 16. Вазогибин или SVBP делеция защищает культивируемые нейроны мышей от потери дендритных шипиков, индуцированной Ар токсичностью.
(А) Конфокальные изображения репрезентативных примеров дендритных сегментов WT, и SVBP-, VASH1- и VASH2-KO культивируемых нейронов (17DIV), экспрессирующих GFP и леченных или не леченных с применением 100 нМ Ар олигомеры в течение 48 ч. Масштабный отрезок = 5 мкм. (В) Графики плотности общих дендритных шипиков (слева) или зрелой грибовидной формы дендритного шипика (справа) для WT 17 DIV нейронов, леченных или не леченных с применением 100 нМ Ар. Все данные представляли в виде среднего значения + СПС. Критерий Стьюдента. **** р<0,0001. (С) Графики плотности общих дендритных шипиков (слева) или зрелой грибовидной формы дендритного шипика (справа) Ар-леченных нейронов из WT, и SVBP-, VASH1- и VASH2-KO 17DIV культивируемых нейронов. Результаты представлены относительно нелеченных (контроль) нейронов из WT, и SVBP-, VASH1- и VASH2-KO, соответственно, и в виде среднего + СПС. Однофакторный дисперсионный анализ с критериями множественного сравнения Sidak. **** р<0,0001.
Фигура 17. In vitro анализ кондиционированного повторного роста аксонов дикого типа и SVBP KO нейронов спинномозговых ганглиев (DRG) neurons.
(А) Репрезентативные нейроны DRG взрослых диссоциировали и культивировали либо без предварительного кондиционирования (неразрушенные) или через три дня после раздавливания седалищного нерва (разрушенные). (В) Количественное определение длины самого длинного нейрита для каждого нейрона, n = 2 независимых экспериментов; Значения на планках соответствовали количеству определенных нейронов. Планки погрешностей представляют собой с. п.с; Статистический анализ: критерий Краскела-Уоллиса с критерием множественного сравнения Дьюнна; нд, статистически недостоверное отличие; **Р<0,01. По сравнению с диким типом, SVBP KO DRG нейроны растут значительно быстрее после протокола прекондиционирования.
Фигура 18. Чувствительность VASH1/SVBP к ингибиторам.
Осуществляли анализы, используя метод на основе Elisa с пептидом Биотинил-V-15-Y. Тестировали несколько ингибиторов: ТРСК (Тозил фенилаланил хлорметил кетон), коммерчески доступные серин/цистеин ингибиторы, содержащие Phe остаток; понатиниб, коммерчески доступный эффективный ингибитор Ab1 тирозинкиназ; EpoY и epoEEY, созданные ингибиторы, содержащие эпоксидную группу, связанную с Y или EEY аминокислотами соответственно (Aillaud и др., 2017); Алкин-epoY, кликабельная версия epoY. Результаты представлены в виде процентного значения активность фермента в контроле с ДМСО (среднее для по меньшей мере двух повторов).
Фигура 19. Калибровочная кривая: калибровочную кривую получали в диапазоне 2,7 мкМ и 20 мкМ двух пептидов (Биотинил-V-D-S-V-E-G-E-G-E-E-E-D-E-E и Биотинил-V-D-S-V-E-G-E-G-E-E-E-D-E-E-Y) Концентрации рассчитывали на основании 8-ми точечной калибровочной кривой, используя 1/х подбор линейной кривой.
Примеры
Пример 1. Идентификация комплексов вазогибины/SVBP в качестве эффективных тубулин тирозин карбоксипептидаз Материалы и методы:
Животные. Использовали самцов или самок мышей в возрасте 2-4 месяцев. В соответствии с политикой Institut des Neurosciences of Grenoble (GIN) и французским законодательством, эксперименты осуществляли в соответствии с Директивой Совета Европейского сообщества от 24 ноября, 1986 г. (86/609/ЕЕС). Исследование на животных было разрешено Direction Departementale de la protection des populations-Prefecture de l'Isère-France и Комитетом по этическим вопросам под GIN номером 004, аккредитованным французским министерством для исследования.
Приготовление тирозинированного тубулина и микротрубочек, и ЕВ1.
Тубулин из мозга крупного рогатого скота (12 мг/мл, приготовленный, как описано в (34)) тирозинировали путем инкубирования в течение 45 минут при 30°С с очищенной TTL цыплят (1 мг/мл, подарок от Steinmetz группы) и 0,1 мМ L-тирозин или [14С]-L-тирозин (0,125 мкКи/нмоль) в 40 мМ PIPES при рН 6,7, 60 мМ KCl, 2,5 мМ ATP, 1 мМ DTT, 12,5 мМ MgCl2. Полимеризацию микротрубочек разрешали путем разведения одной третьей в 100 мМ PIPES при рН 6,7, 1 мМ EGTA, 1 мМ MgCl2, 30% глицерине, 1 мМ GTP и инкубирования при 32°С в течение 45 минут, с последующим дополнительным инкубированием в течение 45 с 50 мкМ паклитакселом (Calbiochem). Микротрубочки осаждали путем центрифугирования при 100 тыс.g в течение 25 минут и 30°С на 60% глицериновых подушках. Супернатант, содержащий TTL, отбрасывали, и тирозинированные микротрубочки ресуспендировали в 100 мМ PIPES при рН 6,7, 1 мМ EGTA, 1 мМ MgCl2, 10% глицерина, 80 мкМ паклитаксела и хранили при -20°С. Для получения неполимеризированного тирозинированного-тубулина, паклитаксел не добавляли в течение всей процедуры. ЕВ1 приготавливали, как описано в (34).
Исследования активности TCP. В исследованиях радиоактивности, используя [14С]-тирозинированные стабилизированные таксолом микротрубочки, измеряли активность фермента в 100 мМ MES при рН 6,7, 1 мМ EGTA и 1 мМ MgCl2, используя 2 мкМ радиоактивно меченный тубулин, за исключение на Фиг. 2D и S2D (как указано в подписях). Реакции осуществляли в течение 45 минут при 37°С (без или с предварительным инкубированием с ингибиторами, см. подписи) и останавливали на льду путем добавления 20 мкг/мл бычьего сывороточного альбумина и 10% перхлорной кислоты и центрифугирования. Тирозин, отщепленный от микротрубочек, оценивали путем измерения радиоактивности в супернатанте (нулевой момент времени контроля вычитали). Для составления таблицы Фиг. S1A, измеряли детирозинирующую активность из равных объемов различных фракций. В тестах с ингибиторами, детирозинирующую активность тестировали после 20 минут предварительного инкубирования с ингибитором (за исключением на Фиг. S2C и S2D, где использовали различное время инкубирования, как указано в подписях), и результаты с ингибиторами выражали в виде процентов активности по сравнению с контролем с соответствующим растворителем. В тестах с использованием вестерн-блоттингов, активность фермента исследовали с 5 мкМ субстратов (стабилизированные таксолом микротрубочки, тубулин или ЕВ1) в 100 мМ MES при рН 6,7, 1 мМ EGTA и 1 мМ MgCl2 в течение времени, указанного на фигурах. Положительные контроли выполняли с карбоксипептидазой А (2 нг/мл). Реакции останавливали путем добавления буфера Лэммли. Реакцию с карбоксипептидазой A (CPA), которая эффективно отщепляет ароматические и алифатические С-концевые остатки, использовали в качестве положительного контроля. В тестах с использованием VASH/SVBP комплексов, очищенных на кобальтовой смоле из HEK293T клеток, концентрацию ферментов аппроксимировали из окрашивания в геле кумасси синим очищенных VASH1 и VASH2 совместно со стандартами бычьего сывороточного альбумина.
Обогащение фермента. Нами была создана трехэтапная процедура очистки из лизата головного мозга, на основании предыдущих попыток (23, 35). Все этапы осуществляли при 4°С. Головной мозг взрослых мышей гомогенизировали в 50 мМ фосфатном буфере при рН 6,7, 1 мМ EGTA, 1 мМ MgCl2, 1 мкг/мл ДНКазой с коктейлем ингибиторов протеазы (cOmplete EDTA-free, Roche) и центрифугировали 1 час при 100 тыс.g. Собирали супернатант (Фракция I). На стадии 1 (фракционирование в сульфате аммония), Фракция I медленно доводили до 45% сульфата аммония, инкубировали в течение 15 минут и центрифугировали 20 минут при 15 тыс.g. Полученный супернатант подвергали такой же процедуре при 65% сульфате аммония. Осадок после центрифугирования ресуспендировали в одной восьмой исходного объема с 50 мМ MES рН 6,7, 1 мМ EGTA, 1 мМ MgCl2 и обессоливали, используя Bio-Gel Р30 (Bio-Rad), уравновешенный с таким же самым буфером (Фракция II). На стадии 2 (сильная анионная колонка), Фракцию II нагружали на 5 мл Hitrap Q XL колонку (GE Healthcare), соединенную с BioLogic DuoFlow хроматографическими системами (Biorad) и несвязанные белки собирали (Фракция III). На стадии 3 (сильная катионная колонка): Фракцию III доводили до рН 6,2 и 0,12 М NaCl, нагружали на 5 мл Hitrap SP XL колонку (GE Heathcare). Белки элюировали с 0,12 М до 1М NaCl градиента. Белковые фракции уравновешивали в 50 мМ MES при рН 6,7, 1 мМ EGTA, 1 мМ MgCl2 (путем обессоливания с BioGel Р-30). На этих фракциях осуществляли исследование активности TCP и фракции, содержащие активность, объединяли (Фракция IV). Данные очистки типичного эксперимента представлены на Фиг. 1А. Для быстрого обогащения фермента, гомогенат головного мозга непосредственно переводили на этап 3, и затем обессоливали.
Клик-химия (Катализируемое Cu азид-алкин циклоприсоединение, CuCAAC реакция). Фракцию IV уравновешивали в забуференном фосфатом растворе при рН 7,4 и концентрировали до 2 мг/мл. После инкубирования в течение 1 часа при 37°С с 10 мкМ алкин-epoY или 10 мкМ epoY (соответственно кликабельные и контрольные необратимые ингибиторы, см. структуры на Фиг. 1С, S2B), затем добавляли два эквивалентных объема азид-агарозных шариков (Jena Biosciences) и клик-реакцию запускали путем добавления 1 мМ CuSO4, 100 мкМ ТВТА и 1 мМ ТСЕР. Реакцию завершали через 3 часа при комнатной температуре. Для флуоресцентного мечения, использовали 100 мкМ 5/6-TAMRA-PEG3-азид (Jena Bioscience) вместо азид-агарозных шариков.
Приготовление образца для масс-спектрометрии. Удаление неспецифически связанных белков и приготовления пептидных препаратов для анализа осуществляли в соответствии с протоколом Click Chemistry Capture Kit (Jena Bioscience). Вкратце, белки, связанные с агарозой, восстанавливали и алкилировали. Шарики промывали с 1% SDS и 8М мочевиной. Осуществляли трипсиновый протеолиз на шариках (используя Sequencing Grade Modified Trypsin, Promega) и высвобожденные пептиды очищали на С18 картриджах (микроцентрифужные колонки Ultra-Micro, Harvard Apparatus).
Протеомные анализы на основе масс-спектрометрии. Пептиды анализировали с помощью наножидкостной хроматографией, связанной с тандемной масс-спектрометрией (Ultimate 3000, связанный с LTQ-Orbitrap Velos Pro, Thermo Scientific) используя 120-минутный градиент, как описано в (36). Пептиды и белки идентифицировали с помощью сопутствующих поисков относительно Uniprot (версия марта 2017 г., таксономия генома мыши Mus musculus), классических загрязнителей (собственного изготовления) и соответствующих обращенных баз данных, используя Mascot (версия 2.5.1). Для фильтрования результатов использовали программное обеспечение Proline (http://proline.profiproteomics.fr) (консервирование пептидов 1 ранга, идентификация пептидов FDR < 1%, как рассчитано на основании оценки пептидов путем применения стратегии обращенной базы данных, и минимально 1 специфического пептида на идентифицированную белковую группу) перед осуществлением компиляции, группировки и сравнения групп белков из контрольных и положительных образцов. Белки из баз данных загрязнителей и дополнительные кератины выбрасывали из конечного перечня идентифицированных белков. В дальнейшем рассматривали только белки, идентифицированные с минимум 3 специфическими спектральными подсчетами в 3 повторах положительных образцов и отсутствия из контрольных образцов.
Экспрессионные конструкции. кДНК вазогибин-1 (VASH1) и вазогибин-2 (VASH2) мышей (номера доступов NM_177354 и NM_144879, соответственно) ПЦР-амплифицировали и встраивали в изготовленный в собственных условиях вектор, содержащий CAG промотор, который создает белки с Flag меткой на N-конце и с суперукладкой -GFP (sfGFP(37)) и 6 His меткой на С-конце (Flag-вазогибин-sfGFP-His). Соответствующая контрольная плазмида кодирует Flag-sfGFP-His белок. Бицистронные плазмиды, предоставляющие возможность связанной экспрессии обоих структур: вазогибинов и SVBP, получали путем интродуцирования, по ходу транскрипции кДНК Flag-вазогибин-sfGFP-His, кассеты, содержащей IRES последовательность вируса энцефаломиокардита с последующей кДНК, кодирующей мышиный SVBP (номер доступа NM_024462) с С-концевой Мус-меткой (Flag-вазогибин-sfGFP-His/SVBP-Myc). Интродуцировали точечные мутации с помощью ПЦР для созданий ферментативно инактивированных версий вазогибинов: С179А для VASH1 и С158А для VASH2, в соответствии с нумерацией номеров доступа NP_796328 и NP_659128, соответственно. Плазмиду, содержащую мышиный SVBP с С-концевыми Мус и Flag метками (SVBP-Myc-Flag), получали от OriGene. кДНК Eb1 мыши (номер доступа NM_007896) инсертировали в EGFP-меченный вектор для создания EB1-EGFP. Плазмида, кодирующая His-EBl для продукции белка в Е. coli, была описана в (15). кДНК, кодирующие тубулин а1 В человека и тубулин а8 мыши (номера доступов NM_006082 и NM_017379, соответственно) ПЦР-амплифицировали и инсертировали в вектор с N-концевой mCherry меткой. Точечный мутации в кДНК α-тубулина интродуцировали с помощью ПЦР для замены последнего ароматического остатка на аланин: Y451A для α1B-тубулина и F449A для а8-тубулина, в соответствии с нумерацией номеров доступа NP_006073 и NP_059075, соответственно. Плазмиду, экспрессирующую специфические для мыши мшРНК, получали от OriGene: TL511800 В для VASH1, TL506751C для VASH2, TL517601 В для Svbp и TR30021 для контроля. Все конструкции верифицировали с помощью секвенирования ДНК.
Очистка His-меченных вазогибинов из HEK293T клеток. HEK293T клетки, совместно трансфектированные с применением плазмид, предоставляющих возможность экспрессии GFP или активных / неактивных форм вазогибинов и SVBP (Flag-sfGFP-His или Flag-(инактивированный)VASH1/2-sfGFP-His и SVBP-Myc-Flag) лизировали в Трис-буфере при рН 8,0, 0,5% TritonX100, 1 мМ MgCl2, 200 мМ NaCl, 5 мМ имидазол в присутствии коктейля ингибиторов протеазы (cOmplete EDTA-free, Roche). После центрифугирования (10 минут при 16 тыс.g и 4°С), супернатанты собирали и добавляли на 20 мкл кобальтовой смолы (Sigma) и инкубировали в течение 3 часов при 4°С. После 3 промываний с лизирующим буфером, белки элюировали, используя 200 мМ имидазол, Трис буфер при рН 8,0, 1 мМ MgCl2, 200 мМ NaCl. Очищенные белки уравновешивали путем диализа при 4°С в 100 мМ PIPES, 1 мМ EGTA и 1 мМ MgCl2 и использовали непосредственно в анализах радиоактивности.
Культивирование и трансфекция клеток. Нейроны гиппокампа и MEF приготавливали, как было описано ранее (2). HEK293T клетки поддерживали в стандартных условиях. HEK293T трансфектировали с помощью реагента для трансфекции JetPRIME (Polyplus-Transfection). MEF и нейроны трансфектировали, используя наборы Amaxa Nucleofector (Lonza). Соотношение 1:1 обычно использовали для контрансфекций кДНК (для VASH1/2 с SVBP, или для mCherry-тубулина с бицистронными плазмидами, предоставляющими возможность совместной экспрессии VASH1/2 и SVBP.
Вестерн-блоттинг и иммунофлуоресценция. Детирозинирующую активность обнаруживали, используя антитела, специфические для тирозинированного тубулина (YL1/2, Tyr-tub) или нативного ЕВ1 (Tyr ЕВ1), и С-терминально детирозинированного тубулина (deTyr-tub) или ЕВ1 (deTyr-EB1). Контроль общего тубулина или ЕВ1 оценивали с помощью антител, которые распознают оба вида (общий α-tub или α3А1, общий ЕВ1 от BD Transduction lab.). Все эти антитела были описаны и охарактеризованы в (15). Другие первичные антитела, анти-His, анти-Flag, анти-GFP, анти-turboGFP, анти-mCherry, анти-Таи и анти-анкирин было от Qiagen, Molecular Probes, Chromotek, Invitrogen, Sigma, Millipore и Santa-Cruz, соответственно. Для Вестерн-блоттинга, клетки собирали через 24 часа после трансфекции. После промывания средой с забуференным фосфатом физиологическим раствором (PBS) при 37°С, клетки непосредственно лизировали в буфере Лэммли. Белковые экстракты загружали на 10% акриламидные гели (Mini-PROTEAN® TGX Stain-Free™, Invitrogen) и переносили с Trans-Blot® Turbo (BioRad). Мембраны инкубировали с первичными и вторичными антителами, конъюгированными с HRP и в завершение выявляли с помощью камеры Chemidoc (Biorad). Для анализа и графического представления иммуноблотов (Фиг. 4А), определяли белковые полосы из блотов в трех повторах для 3 различных экспериментов, используя программное обеспечение ImageJ (National Institutes of Health, Bethesda, MD). Сигнал детирозинированного α-тубулина нормировали к общему содержанию белка образца, рассчитанному для изображения без окрашивания. Для иммунофлуоресценции, клетки обычно фиксировали при 37°С в 4% парафоральдегиде, 4,2% сахарозе, забуференной фосфатом физиологической среде (PBS) (за исключением для окрашивания анкирином, для которого использовали фиксацию метанолом при 20°С) и пермеализировали, используя 0,1% Triton Х-100, PBS. После этого клетки инкубировали с первичными антителами, затем инкубировали с вторичными антителами (см. ниже), конъюгированными либо с alexa-488, цианин-3 или цианин-5 фторофорами (1:1000). Ядра окрашивали, используя Hoescht 33258 (1 мкг/мл).
ОТ-ПЦР амплификация. Матричную РНК из клеток и тканей приготавливали с набором для очистки Dynabeads (Invitrogen). ОТ-ПЦР осуществляли с помощью Superscript One step RT-PCR System (Invitrogen) с 12,5 мкл с 50 нг РНК. Продукты соответственно 697, 748 и 154 по из мышиных Vash1, Vash2 и Svbp амплифицировали при 58°С с помощью 45 циклов, используя следующие праймеры: 5'-TACAAACCGCCCGCCTTCC (прямой) и 5'-ACAGACCCTGACAGCTACCAACA (обратный) для VASH1 (SEQ ID N°4 и N°5), 5'-GCAGCCTTCCATTGAGCGGT (прямой) и 5'-CAGTCAACCCAGGGCTTTGCC (обратный) для VASH2 (SEQ ID N°6 и N°7), 5'-CCAGCAGGAGCTGAAGCAAAGA (прямой) и 5'-GCACCAGTTCCTCTGCCGGG (обратный) для Svbp (SEQ ID N°8 и N°9). GAPDH амплифицировали при 64°С с помощью 25 циклов с 5'-TCAACGGGAAGCCCATCACCA (прямой) и 5'-GTTTCTCCAGGCGGCACGTC (обратный) праймеры (SEQ ID N°10 и N°11).
Морфометрический анализ нейронов. Мозаичные изображения 2DIV нейронов, зафиксированных и окрашенных с помощью антитела к тубулину, получали с помощью 20Х N.A 0.5 объектива на DMI6000 Leica микроскопе с механизированной стойкой. Изображения сегментировали после усиления с DoG фильтром. Тела клеток единичных нейронов отбирали вручную и использовали для обработки нейронов индивидуально с изготовленным в собственных условиях AutoNeuriteJ macro. Вкратце, изображения нейронов скелетировали и нейритные петли разделяли, используя "Analyze Skeleton 2D/3D ImageJ plugin"(38). Концы нейритов отмечали, используя "BinaryConnectivity" image J plugin (разработанный developed by G. Landini, http://www.mecourse.com/landinig/software/software.html). Получали изображения каждого нейрита с их концов до тела клетки. Для нейритов с перекрытием пути, самый длинный определяли как первичный нейрит. Изображения первичных нейритов вычитали из изображений перекрывающихся нейритов, таким образом определяя вторичные нейритов и количество разветвлений. Измеряли длину нейритов. Нейриты с длиной меньше 12 мкм не рассматривали для избегания артефактов скелетирования. Аксон определяли среди первичных нейритов единичного нейрона, если его длина была по меньшей мере 48 мкм и в 1,3-раза длиннее по сравнению с любым другим первичным нейритов. Используя этот макро, мы отбирали минимум 27 нейронов для каждого условия и сравнивали со средней длиной аксона, среднем количеством первичных нейритов и частотой разветвления.
Внутриутробная электропорация, обработка ткани, иммуногистохимия и анализы. Полное описание доступно в (39). Вкратце, эмбрионы из анестезированных мышей с известным сроком беременности электропорировали при Е14.5 с применением плазмид, предоставляющих возможность экспрессии мшРНК (см. выше). Через четыре дня (Е18.5), головной мозг эмбрионов высекали, фиксировали, изготавливали срезы из замороженных тканей и помещали на предметные стекла для анализов. анти-tGFP первичные антитела (1:300) инкубировали в течение ночи при 4°С. Ядра докрашивали с помощью DAPI (Roche). Изображения получали с помощью 20Х N.A 0.5 объектива на DMI6000 Leica микроскопе с механизированным штативом и анализировали с помощью Image J. Участок коры, где обнаруживали трансфектированные клетки, разделяли на 6 секций равной поверхности, в которых подсчитывали GFP положительные (GFP+) нейроны (5 эмбрионов на условие, 3 срезов на эмбрион). По меньшей мере 260 GFP + нейронов подсчитывали на эмбрион.
Результаты
Для обогащения TCP, была создана трехстадийная процедура очистки, используя стабилизированные таксолом радиоактивно меченные тирозинированные микротрубочки в качестве субстрата для отслеживания активность. При осуществлении типичной процедуры получали конечную очистку приблизительно в 400 раз (Фиг. 1А). В последней фракции (IV) можно было отщепить С-концевой тирозин от тубулина, инкорпорированного в микротрубочки, но не от ЕВ1. ЕВ1 представляет собой белок, который обладает сходной С-концевой последовательностью с α-тубулином (QEEY вместо -GEEY) и обычно не является субстратом для TCP в физиологическом окружении (15).
Для выделения белка(ов), ответственных за активность TCP, из фракции IV, пришли к выводу о том, что можно использовать необратимый ингибитор, как в других протеомных химических исследованиях (16). Сначала тестировали чувствительность TCP головного мозга к различным коммерчески доступным ингибиторам протеазы. Активность ингибировалась несколькими ингибиторами серин/цистеиновых протеаз (AEBSF, TLCK, ТРСК, Е-64, партенолид) и соединением с реакционноспособным тиолом N-Этиламалеимид (Фиг. 1В). Эти результаты, которые согласуются в ранее проведенными исследованиями (17), убедительно свидетельствуют о том, что каталитическая активность предполагаемых TCP зависит от каталитического цистеина.
Несмотря на то, что Е-64 проявляет только умеренную ингибирующую активность (IC50 приблизительно 300 мкМ, Фиг. 1В), этот природный продукт является идеальной исходной точкой для создания ингибитора, поскольку его реакционно-способный эпоксидный электрофил может проявлять пептид или аминокислоту, имитирующую природный белок С-конца. Кроме того, партенолид, соединение, которое широко используется для понижающей регуляции уровней детирозинирования в клетках (4, 6, 9, 10), содержит эпоксидную функциональную группу, которая, как показано, является очень важной для его клеточного влияния (17). Следовательно, были синтезированы три ингибитора, epoY, epoEY и epoEEY, которые содержат эпоксид, связанный с одной, двумя или тремя аминокислотами из С-конца α-тубулина. Было обнаружено, что EpoY является наиболее эффективным ингибитором активности TCP (IC50 приблизительно 500 нМ, Фиг. 1В). Следовательно, синтезировали аналог epoY (алкин-epoY), который может использоваться для очистки меченных мишеней, используя клик-химию. Алкин-epoY сохранял сильную ингибирующую эффективность (Фиг. 1 В) и необратимо ингибировал обогащенную активность фермента. Осуществляли мечение зондом фракции IV с алкин-epoY (или контрольным epoY) с последующей клик-реакцией для присоединения азид TAMRA красного флуоресцентного красителя (Фиг. 1D). Мечение продемонстрировало специфическую модификацию небольшого количества белков приблизительно 50 кДа (Фиг. 1Е). Для идентификации этих мишеней ингибитора, фракцию IV повторно обрабатывали либо с алкин-epoY или epoY в качестве контроля, меченные белки выделяли и белки ковалентно присоединяли к шарикам для анализа путем масс-спектрометрии (Фиг. 1D). В результате этих трех независимых экспериментов был идентифицирован белок вазогибин-1 (VASH1) как наиболее вероятный кандидат TCP (Table 2). Пептиды, охватывающие практически всю последовательность VASH1, были обнаружены только на образцах, обработанных алкин-epoY. Последние данные биоинформатики продемонстрировали, что вазогибин-1 и его гомолог вазогибин-2 (VASH2) обладают неканонической Cys-His-Ser каталитической триадой и представляют собой ранее необнаруженные члены семейства трансглутаминаза-подобных цистеиновых протеаз (18) (Фиг. 1F).

Белки вазогибина (41-42 кДа) в значительной степени были охарактеризованы в качестве регуляторов ангиогенеза, но они все еще плохо понимаются на молекулярном уровне (19). В недавних исследованиях был идентифицирован SVBP (Ccdc23) в качестве высоко аффинного партнера связывания, который имеет шаперон-подобную функцию (20). Таким образом, исследовали способность VASH белков детирозинировать α-тубулин в клетках при отсутствии или в присутствии SVBP. Экспрессия вазогибинов самостоятельно в HEK293T клетках приводила к незначительному увеличению детирозинированного тубулина, в то время как экспрессия любого белка с SVBP приводила к существенному увеличению детирозинированного тубулина, что соответствует практически полной потере эндогенного тирозинированного тубулина. Является важным, что мутация предполагаемого каталитического цистеина на вазогибинах (С179А для VASH1, и С158А для VASH2 (18)) аннулирует их способность продуцировать детирозинированный тубулин. Подобно этому, в мышиных эмбриональных фибробластах (MEF), экспрессия вазогибинов с SVBP приводит к полному детирозинированию эндогенного α-тубулина (Фиг. 2А).
Альфα-тубулины обычно кодируются с С-концевым тирозином, которому предшествуют два глутамата. Тем не менее, в Альфа4-тубулине отсутствует С-концевой тирозин и α8-тубулин содержит С-концевой остаток фенилаланин. Кроме того, фенилаланин может быть инкорпорирован вместо тирозина в тубулин и является возможной причиной нарушения функции нейронов (21). Поэтому тестировали субстратную специфичность вазогибинов путем сверхэкпрессирования α1В- и α8-тубулина совместно с VASH1 или VASH2 и SVBP в HEK293T клетках. Оба изотипа тубулина расщепляются активными вазогибинами при экспрессии с SVBP (Фиг. 2В. 2В). Тем не менее, вазогибины неспособны расщеплять С-концевой остаток, если тирозин мутирован на аланин (Фиг. 2В. 2В), что подтверждает специфичность VASH белков к С-концевому тирозину и фенилаланиновым остаткам.
Для дальнейшего подтверждения каталитической функции вазогибинов и природы их взаимодействий с SVBP, их сверхэкспрессировали в HEK293T клетках при отсутствии или в присутствии SVBP и полученные комплексы очищали, используя кобальтовую смолу. SVBP совместно очищали с обоими вазогибинами, как предполагается на основании ранее проведенных изменений аффинности (KD 30-90 нМ(20)), и образование комплекса не зависит от каталитической активности (Фиг. 6А). Является важным, что два белковых комплекса эффективно катализируют детирозинирование тубулина, в то время как комплексы, содержащие каталитически инактивированные версии вазогибинов, неспособны детирозинировать тубулин (Фиг. 2С). Оба комплекса более быстро расщепляют микротрубочки по сравнению с димерами тубулина (Фиг. 2D, 6В), что согласуется с описанной специфичностью TCP головного мозга (1, 22, 23). Очищенный комплекс VASH1/SVBP не способен отщеплять С-концевой тирозин от ЕВ1, что указывает на его очевидную предпочтительность к тубулину, в то время как, чрезвычайно интересен тот факт, что VASH2/SVBP комплекс способен частично детирозинировать ЕВ1 в аналогичных условиях (Фиг. 2Е). В клетках большинства типов, включая имеющие происхождение из нейронов, показано, что отщепление С концевого тирозина ограничено тубулином (1, 15). Тем не менее, ЕВ1 может быть детирозинирован в специфических эндотелиальных и опухолевых клетках (24) и это может быть связано с их содержанием VASH2 или дефектами регуляторного механизма.
Для подтверждения функциональной важности вазогибинов и их роли в детирозинировании а тубулина, мы оценивали фенотипические эффективны нокдауна экспрессии этих белков в дифференцирующихся нейронах, где цикл де/тирозинирование является чрезвычайно важным для роста бугорковых поисков пути и дифференциации аксонов, то есть для поляризации нейронов (2, 7, 8). Несмотря на то, что невозможно обнаружить вазогибины и SVBP с помощью вестерн-блоттинга в мышиных нейронах, используя коммерчески доступные антитела, их транскрипты амплифицировали из РНК препаратов культивированных нейронов гиппокампа, как тканей головного мозга взрослых мышей, так и эмбрионов мышей (Фиг. 3А). Нейроны гиппокампа трансфектировали плазмидами, экспрессирующими короткие шпилечные РНК (мшРНК), нацеленные либо на вазогибины или SVBP, а также контрольными мшРНК (Фиг. 5А). Вестерн-блоттинг продемонстрировал, что уровни детирозинированного α-тубулина снижены практически на 50% в тех случаях, когда либо два вазогибина или SVPB понижено регулировали, что демонстрирует их важную роль в детирозинировании микротрубочек нейронов (Фиг. 3В). Оставшийся пул детирозинированного α-тубулина в нокдаунах, вероятно, обусловлен наличием α4-тубулина, в котором генетически отсутствует С-концевой тирозин и он остается в детирозинированной форме в головном мозге (25). Конфокальные изображения нейронов, культивированных в течение 2 дней in vitro (2DIV), подтверждали снижение уровней нативного детирозинированного α-тубулина при уменьшении экспрессии вазогибинов. Оставшиеся детирозинированные пулы специфически сконцентрированы в аксоне, в то время как α-тубулин нейритах является высоко тирозинированный. Морфометрический анализ указывает на то, что регуляция вазогибинов по типу отрицательной обратной связи приводит к заметной задержке дифференциации аксонов, как продемонстрировано путем снижения пропорции клеток на III стадии (имеющих аксон) в обеих группах 2DIV и 3DIV (Фиг. 3С). Окрашивание Таи и анкирином нейронов, несущих аксон, подтверждает нормальное распределение, где Таи высоко экспрессируется в аксоновом стержне в 3DIV и анкирин в начальном сегменте аксона в 10DIV. Интересным является тот факт, 2DIV нейроны, в которых «выключены» вазогибины, развивают увеличенное количество нейритов и разветвлений с суммарных уменьшением длина аксонов (Фиг. 3D). Задержка дифференциации аксонов и сходные морфологические аномалии наблюдаются в случае понижающей регуляции SVBP (Фиг. 5 В-С). Таким образом, в отличие от преждевременной дифференциации аксонов, наблюдаемой при отсутствии инвертированного фермента TTL(2), в данном случае наблюдается четкая задержка дифференциации аксонов при понижающей регуляции вазогибинов или SVBP.
В дальнейшем тестировали функциональную значимость в головном мозге мышей in vivo путем сосредоточения на коре головного мозга, где цикл де/тирозинирование является чрезвычайно важным для организации слоя неокортекса (2). В период кортикогенеза миграция нейронов частично основана на поляризации нейронов, которая, как нами было показано, существенно зависит от вазогибинов и SVBP (Фиг. 3С). Е14.5 эмбрионы электропорировали с применением плазмид, экспрессирующих мшРНК, нацеленные на вазогибины, а также контрольными мшРНК, и анализировали радиальную миграцию нейронов через четыре дня. Использовали подтвержденную испытаниями мшРНК, которая подавляет приблизительно 50% пулов детирозинированного α-тубулина в культивируемых нейронах. Для Е18.5, большинство нейронов из головного мозга контрольных животным достигало верхнего слоя (секция 1), в то время как при отсутствии вазогибинов значительная фракция нейронов не может это осуществить (Фиг. 4А-В). Таким образом, эти ферменты имеют решающую роль в миграции нейронов во время развития коры головного мозга.
В совокупности, эти результаты указывают на чрезвычайно важную роль вазогибинов и их ассоциированного партнера SVBP в нейронах и головном мозге, и это дополнительно подтверждает предположение о том, что они являются тубулин карбоксипептидазами.
TCP остаются основным пропущенным элементом цикла де/тирозинирование α-тубулина в течение 40 лет. Вазогибины были идентифицированы в качестве ферментативных белков, которые осуществляют TCP функцию (Фиг. 7) и их взаимодействующий партнер SBVP является важным для их активности. Нами было открыто критическое вовлечение вазогибинов и SVBP в дифференциацию нейронов и развитие коры головного мозга, и описан новый ингибитор, нацеленный на это семейство ферментов, который может использоваться для дальнейших функциональных исследований вазогибинов. Неудачи предыдущих попыток идентификации TCP обусловлены, наиболее вероятно, существенной ассоциацией вазогибинов с SVBP для стабильности и активности, которая, возможно, может быть потеряна по время стандартных анализов очистки. В соответствии с TCP фукнциями, вазогибины широко распределены у эаукариотов, имеют широкую экспрессию в тканях, и вазогибин-1 (который обычно более экспрессируется, чем вазогибин-2), часто встречается в в головном мозге, сердце и почках (18, 26, 27) (см. также GTEx Portal на https://www.gtexportal.org/home/). Идентификация неясной активности TCP в настоящее время обеспечит понимание, на молекулярном уровне, взаимосвязи между детирозинированием α-тубулина и стабильность микротрубочек в клетках (28, 29).
Интересным является тот факт, что, как показано, вазогибины являются чрезвычайно важными для целостности клеток и тканей и дефекты этих белков связаны со злокачественными новообразованиями (30), как будет предполагаться для ферментов, которые регулируют стабильность микротрубочек посредством детирозинирования. В целом, открытие TCP обеспечивает важную информацию для распутывания функции (й) цикла де/тирозинирование, и его влияния на здоровье и заболевания.
Пример 2. Статус детирозинирования в головном мозге здоровых людей и пациентов с АР
1. Обоснование
Анализировали количества тирозинированного, детирозинированного и Δ2-тубулина (другой формы детирозинированного тубулина) путем иммуноблоттинга в головном мозге пациентов с болезнью Альцгеймера и контрольных пациентов. Их анализировали на различных патологических стадиях Braak и сравнивали с соответствующими контрольными образцами здорового головного мозга. Для каждого образца анализировали 4 участка головного мозга (энторинальная кора, гиппокамп, височная и лобная кора).
2. Материалы и методы
Ткани. Образцы тканей человека состояли из 4 участков головного мозга (энторинальная кора, гиппокамп, височная кора, латеральная префронтальная) получали из панели 29 пациентов мужского и женского пола в возрасте от 52 до 93 лет: 11 контролей, 5 стадия Braak I-II, 6 стадия Braak III-IV и 7 стадия Braak IV-V (см. приложение 1 для подробного описания).
Приготовление экстрактов. Образцы головного мозга людей гомогенизировали 2×30 секунд при комнатной температуре в (10 об./мае.) 10 мМ Трис, 0,32М сахарозы, рН=7,4, содержащей полный коктейль ингибиторов (Roche), используя готовый к применению Precellys Lysing Kit (Bertin Technologies) в приборе Minilys. После лизиса, гомогенаты собирали, замораживали в жидком азоте и затем хранили при -80°С до использования (обозначается как маточный гомогенат головного мозга). При необходимости, замороженные аликвоты разводили об./об. с помощью RIPA буфера (50 мМ Трис, 150 мМ NaCl, 1% NP40, 0,5% дезоксихолат, 0,1% SDS, рН=8) перемешивали 30 минут при 4°С и затем центрифугировали 10 минут при 12000 об./мин, 4°С. Супернатанты замораживали в жидком азоте и затем хранили при -80°С до использования.
Антитела. Поликлональные анти-детирозинированные (anti-deTyr) и анти-Δ2 тубулиновые антитела изготавливали собственными усилиями (Bosson и др., 2012; Paturle-Lafanechere и др., 1994).
Иммуноблоты
Анализировали 4 участка от 29 пациентов вплоть до 116 образцов. Каждый образец анализировали в трех повторах. RIPA супернатанты (10 мкл 1/4 разведения замороженных образцов) подвергали электрофорезу на неокрашенных 4%-15% гелях (Bio Rad) и затем быстро переносили на нитроцеллюлозную мембрану, используя Trans-Blot Turbo Transfer System (Bio Rad). Блоты выявляли, используя специфические антитела к детирозинированному и Δ2 тубулину при 1/20000. Использовали поликлональное α3А1 антитело в разведении 1/10000 для обнаружения общего α-тубулина. Подходящие меченные пероксидазой вторичные антитела использовали в разведении 1/20000. Блоты выявляли, используя Pierce ECL субстрат для вестерн-блоттинга (Thermo scientific), и анализировали с помощью системы визуализации ChemiDoc™MP (Bio Rad), используя программное обеспечение Image Lab для количественного определения.
3. Результаты
Результаты представлены на Фигуре 8.
Эти результаты, очевидно, показывают прогрессирующее накопление детирозинированной формы и формы Δ2 тубулина во всех участках головного мозга при болезни Альцгеймера по сравнению с головным мозгом контроля (нет влияния участка головного мозга).
Пример 3. Функционирование VASH1, VASH2 и SVBP в условиях in vivo на детирозинирование микротрубочек
Материалы и методы
Приготовление ткани головного мозга для биохимического анализа:
Гиппокамп гомогенизировали в буфере для лизиса (забуференный фосфатом физиологический раствор (PBS) без CaCl2 и MgCl2, 14190-094 Life Technologies), дополненный протеазой (Р8340, Sigma) и коктейлями ингибиторов протеаз (Р5726 и Р0044, Sigma) при концентрации 150 мг/мл, используя гомогенизатор Precellys (2×20 с, 5000 об./мин). После этого лизаты центрифугировали при 21000 g в течение 20 минут при 4°С. Полученные супернатанты собирали и определяли концентрацию белка, используя метод с бицинхониновой кислотой (Pierce/Thermo Fisher Scientific). Образцы хранили при 80°С до исследования.
Капиллярный вестерн-блоттинг с помощью Wes™ и Peggy Sue™ Simple Western для образцов головного мозга
Оценивали уровни тирозинированного, детирозинированного, дельта 2 тубулинов, общий α-тубулина и тубулин тирозин лигазы, используя автоматизированную систему Simple Western system (Protein Simple) в лизатах гиппокампа из SVBP, VASH1 и VASH2 KO дикого типа, гетерозиготных и гомозиготных мышей. Все процедуры осуществляли с реагентами производителей, за исключением первичных антител, описанных в таблице 1, в соответствии с инструкцией производителя. Образцы загружали при концентрации белка 0,125 мкг/мкл, инкубировали с первичными антителами в течение 60 минут и вторичными антимышиными или антикроличьими IgG в течение 30 минут. Данные анализировали с помощью программного обеспечения Compass (Protein Simple). Уровни белков нормировали к уровню GAPDH.
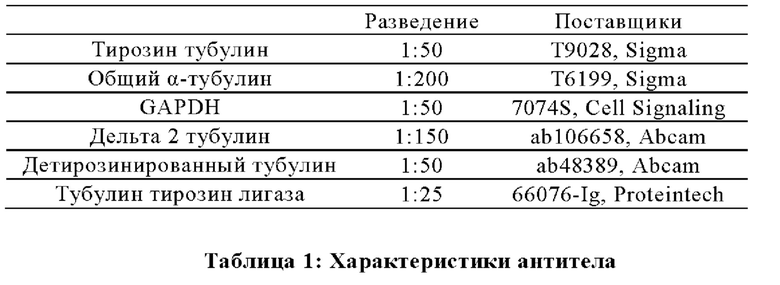
Экстрагирование белков из желудочков сердца и вестерн-блоттинг:
Белки из желудочков сердца (приблизительно 50 мг) гомогенизировали в пробирке Precellys (КТ03961-1-007.2) с помощью гомогенизатора FastPrep для вестерн-блоттинга в буфере для экстрагирования белков (Cellsignaling; 9803S) в присутствии ингибиторов протеазы (Roche; 04906837001) и фосфатазы (Roche; 11836153001). Равные количества белков (30 мкг) разделяли на 12% Bis Tris SDS полиакриламидном гель-электрофорезе (Bio-Rad; 3450119) и переносили на нитроцеллюлозные мембраны с системой TransBlot (Bio-Rad; 170-4159). Белки обнаруживали с первичными антителами к GAPDH (1/10000, Millipore; МАВ374), α-тубулину (1/5000, Sigma; T6199-200uL), тирозинированному-тубулину (1/1000, Abeam; ab6160), детирозинированному-тубулину (1/1000, Abeam; ab48389), дельта2-тубулину (1/1000, Abeam; abl06658), затем с помощью вторичных антител, конъюгированных с инфракрасным красителем (от 1/1000 до 1/10000, Li-Cor). Белок определяли количественно путем денситометрического анализа, используя сканер Odyssey и нормировали к уровням Gapdh.
Мыши: SVBP, VASH1 и VASH 2 нокауты создавали у мышей путем редактирования CRISPR/Cas9 гена (см. Teixera и др. 2018 для VASHI KO генерации). Последовательность в экзоне 2 нацеливали для SVBP, последовательность в экзоне 1 для VASH1 и последовательность в экзоне 2 для VASH2. F0 мозаичные животные, рожденные после повторной имплантации микроинъецированных эмбрионов, генотипировали путем ПЦР/Sanger секвенирования и затем спаривали с C57BL/6 мышами для получения по меньшей мере F4/F5 мышей.
Результаты
Для подтверждения in vivo функций вазогибина1, вазогибин2 и SVBP на детирозинирования микротрубочек, мы измеряли уровни тирозинированного тубулина, детирозинированного тубулина, дельта 2 тубулина, общего α-тубулина и тубулин тирозин лигазы у нокдаун трансгенных мышей (дикий тип, гетерозиготные и гомозиготные) для определения белков либо вазогибин 1, или вазогибин2 или SVBP. Это исследование осуществляли на головном мозге (гиппокамп) и сердце (желудочек)) для мышей, созданных в Grenoble Institute for Neuroscience.
В образцах головного мозга от VASH1 KO гомозиготных мышей, уровни детирозинированного тубулина и дельта 2 тубулина были снижены (Фиг. 9С, D) в то время как уровни тирозинированного тубулина были повышены (Фиг. 9В). Аналогичные, но более заметные эффекты наблюдали у SVBP KO гомозиготных мышей (Фиг. 10B, C, D). В отличие от этого, не наблюдали эффектов у VASH2 KO гомозиготных мышей (Фиг. 11B, C, D).
В образцах желудочков сердца уровни детирозинированного тубулина и дельта 2 тубулина были снижены для VASH1 KO гомозиготных мышей (Фиг. 12C, D) и SVBP KO гомозиготных мышей (Фиг. 13C, D) в то время как уровни тирозинированного тубулина были повышены для VASH1 KO гомозиготных мышей (Фиг. 12В). Как и для образцов головного мозга, не наблюдали эффектов в образцах желудочков сердца от VASH2 KO гомозиготных мышей (Фиг. 14B, C, D).
Как и ожидалось, уровни де-тирозинированного тубулина были снижены у VASH1 и SVBP KO гомозиготных мышей, в то время как уровни тирозинированного тубулина были повышены либо в образцах головного мозга или желудочках сердца. Снижение де-тирозинированного тубулина обусловлено отсутствием VASH1 у VASH1 KO гомозиготных мышей, в то время как у SVBP KO гомозиготных мышей VASH1 больше не активен вследствие отсутствия SVBP, который выполняет роль шаперона для VASH1 и VASH2 и стабилизирует эти два белка. Отсутствуют статистически значимые отличия у VASH2 KO гомозиготных мышей, возможно, вследствие того факта, что уровни экспрессии VASH2 являются боле низкими, чем уровни VASH1 в головном мозге. Не наблюдали статистически значимых отличий для KO гетерозиготных мышей, вне зависимости от белка, возможно, вследствие компенсаторного эффекта, который устанавливается с рождения и/или уровня активности оставшегося белка, достаточного для осуществления детирозинирования.
Снижение уровней де-тирозинированного тубулина подтверждает физиологическую функцию VASH1 и SVBP, но более важным является сопутствующее повышение тирозинированного тубулина, который является чрезвычайно важным для динамики микротрубочек и функциональные показатели говорят в пользу TCP ингибиторов для лечения нейродегенеративных заболеваний, при которых нарушены функции микротрубочек.
Пример 4. Взаимоотношение между уровнем тирозинированного тубулина и плотностью дендритных шипиков (когнитивный маркер) на клеточной модели АР
1. Обоснование
Наша гипотеза состоит в том, что накопление детирозинированных микротрубочек может приводить к потере динамичности микротрубочек, что является вредным для синаптической пластичности и что может способствовать потере дендритных шипиков и потере синапсов, характерных для ранних стадий AD.
Форма шипика (пузатая, тонкая, грибовидная) и количество сильно коррелируют с синаптической эффективностью и когнитивными способностями. Известно, что воздействие Ар олигомеров на нейроны гиппокампа (хроническое воздействие) индуцирует сильное уменьшение плотности дендритных шипиков (Hsieh и др., 2006).
Для тестирования нашей гипотезы, нами было проанализировано плотность и морфологию дендритных шипиков у WT, VASH1, VASH2 и SVBP нокаутных зрелых нейронах гиппокампа в присутствии или отсутствии Ар олигомеров.
Анализировали количество различных форм тубулина (тирозинированный, детирозинированный, А2-тубулин) в зрелых нейронах у мышей дикого типа (WT), VASH1 и SVBP дефектных мышей (гетерозиготные и KO животные).
2. Стратегия эксперимента
Мыши. SVBP, VASH1 и VASH2 нокауты были созданы у мышей путем редактирования гена CRISPR/Cas9 (см. Teixera и др. 2018 для VASH1 KO поколения). Последовательность в экзоне 2 нацеливали для SVBP, последовательность в экзоне 1 для VASH1 и последовательность в экзоне 2 для VASH2. F0 мозаичные животные, рожденные после повторной имплантации микроинъецированных эмбрионов, генотипировали путем ПЦР/Sanger секвенирования и затем спаривали с C57BL/6 мышами для получения по меньшей мере F4/F5 мышей.
Нейроны. Нейроны гиппокампа или кортикальные нейроны иссекали у WT, SVBP-, VASH1- и VASH2-KO Е17 эмбрионов и культивировали, как было описано ранее (Erck и др. 2005).
Анализ дендритных шипиков. Небольшую часть нейронов гиппокампа (1%) инфицировали с помощью GFP лентивируса (MOI 100), смешивали с неинфицированными клетками и высевали на покрытие полилизином чашки при высокой плотности (50000-клеток/см2). После этого нейроны поддерживали в MAC среде, содержащей В27 при 37°С и 5% CO2. Через 15 дней in vitro (15DIV), нейроны инкубировали с 100 нМ Аβ олигомеров (приготовленных, как описано в (Frandemiche и др.) или с ДМСО (контроль). Нейроны фиксировали при 17DIV и окрашивали с анти-GFP антителами. Дендритные шипики идентифицировали в виде GFP-меченных дендритных протрузий. Получали серийные изображения с помощью конфокальной микроскопии с Z интервалом 200 нм и исследовали плотность и морфологический анализ дендритных шипиков, используя NeuronStudio.
Экстракты белков нейронов. Экстракты из кортикальных нейронов собирали в 17DIV. После промывания в забуференной фосфатом физиологической среде (PBS) при 37°С, клетки непосредственно лизировали в буфере Лэммли. Клетки хранили при -20°С до анализа.
Иммуноблоты. Каждый экстракт нейронов анализировали в трех повторах. Экстракты нейронов (n=3 эмбриона) анализировали как образцы человека, за исключением того, что применяли PVDF мембрану и использовали антитела, указанные далее: GAPDH антитело (Sigma, 1/5000), YL1/2 (1/10000), анти-deTyr (1/10000), анти-Δ2 (1/10000), и меченные пероксидазой вторичные антитела (1/10000).
Результаты
Результаты представлены на Фигурах 15 и 16.
Данные убедительно показывают повышение тирозинированного тубулина и снижение детирозинированного и Δ2-тубулина в обеих SVBP и VASH1 нокаутных клетках. Нейроны от гетерозигот существенно не отличались от нейронов дикого типа.
Воздействие токсического Аβ на нейроны дикого типу индуцирует сильное уменьшение (30%) плотности шипиков, в особенности зрелых форм (грибовидных). Если делетированы SVBP, или VASH1 или VASH2, то плотность шипиков и содержание грибовидных в нейронах не чувствительно к воздействию Ар, указывая на то, что уменьшение детирозинирования (увеличение уровня тирозинированного тубулина) защищает от токсичности Ар.
Пример 5. Вовлечение VASH/SVBP комплексов в регенеративный процесс
1. Обоснование
Нейроны с телами клеток, расположенные в ганглиях задних корешков (DRG), являются псевдо-униполярными и имеют единственный аксон, который раздваивается на два аксона, периферический аксон, способный регенерировать при повреждении, и центральный аксон, продолжающийся до центральной нервной системы, который неспособен регенерировать при повреждении. Было показано, что повреждение периферических аксонов приводит к регенеративным процессам (молекулярным, клеточным) в центральной ветке в такой же мере, обозначая, что центральные аксоны этих DRG нейронов способны регенерировать, если периферические аксоны также повреждены (Richardson и Verge, 1987). Этот эффект называется эффектом кондиционирования поражения или предварительного кондиционирования. Кондиционирование поражение индуцирует усиление присущей регенеративной способности в нейронах, что приводит к усилению роста нейритов (Smith и Skene, 1997).
Мы исследовали способность к росту DRG нейронов либо дикого типа или SVBP KO после протокола предварительного кондиционирования.
2. Материалы и методы
Взрослые мыши (2 месяца) WT и SVBP KO хирургически кондиционировали путем пережимания щипцами в течение 30 секунд их левого седалищного нерва (условие предварительного кондиционирования). Через 3 дня, нейроны DRG, соответствующие тем, которые образовывают седалищный нерв, впоследствии культивируют и сравнивают с противоположными нейронами (контрольное условие).
Процедура культивирования состоит из интракардиальной перфузии 4°С PBS мышам каждого генотипа в условиях избыточной дозы Dolethal® для удаления крови. L4-L5-L6 DRG высекали, затем химически (Коллагеназа А и трипсин) и механически диссоциировали, после этого высевали на покрытие поли-Ь-лизином / ламинином покровные стекла с культуральной средой Neurobasal-A (дополненной L-глутамином, В27 и пенициллином/ стрептомицином). Нейроны фиксировали после культивирования в течение 16 часов. Осуществляли иммуномечение общего α-тубулина для визуализации суммарной морфологии нейронов. Количественное определение размеров нейритов осуществляли с помощью ImageJ macro собственного изготовления (Aillaud и др., 2017).
3. Результаты
Результаты представлены на Фигуре 17.
Наши данные указывают на то, что уменьшение детирозинирования (и увеличенный уровень тирозинированного тубулина) путем SVBP делеции способствует регенеративным способностям DRG нейронов.
Пример 6: Анализ TCP ингибиторов, используя метод ELISA с С-концевым пептидом α-тубулина
1. Обоснование
TCP или VASH/SVBP комплексы представляют собой ферменты, которые отщепляют С-концевой тирозин а тубулина на микротрубочках или свободные димеры тубулина (Aillaud и др., 2017). Мы тестировали их способность детирозинировать пептид, соответствующий С-концевой последовательности а тубулина и влияние определенных потенциальных ингибиторов на эту активность. Такой анализ можно адаптировать для скрининга больших наборов лекарственных средств.
2. Материалы и методы
Методика анализа на планшетах была создана для обнаружения и количественного определения детирозинирующей активности VASH/SVBP комплекса. Вкратце, анализы осуществляли на планшетах на 96 лунок Immulon 4НВХ, покрытых нейтравидином при концентрации 50 мкг/мл в забуференной фосфатом физиологической среде (PBS). После промывания с помощью 0,05% Tween в PBS, пептидом Биотинил-V-15-Y (Биотинил-Val-Asp-Ser-Val-Glu-Gly-Glu-Gly-Glu-Glu-Glu-Gly-Glu-Glu-Tyr) покрывали на планшете при концентрации 10-8 М в PBS с последующим промыванием Tween 0,05% в PBS. После этого добавляли VASH1/SVBP фермент (0,2 мкМ), предварительно инкубированный в течение 2 часов при 0°С с ДМСО или ингибитором в различных концентрациях, для реакции в течение 30 минут на пептид. Реакцию останавливали путем 3 промываний с 0,05% Tween в PBS. После этого осуществляли иммунообнаружение, используя анти-тирозинированный тубулин (YL1/2, 1/2000) в качестве первичного антитела, анти-крысиное HRP (1/5000) в качеств вторичного антитела, и с раствором ТМВ в качестве HRP сусбтрата для ELISA (Sigma) на системе PHERAstar (BMG Labtech). Ni-NTA колонки (HiTrap 5 мл)
VASH1 совместно экспрессировали с SVBP, имеющих 6 гистидиновую метку на его С-конце в Е Coli. Комплекс очищали на Ni-NTA колонках с гель-фильтрационной хроматографией.
3. Результаты
Результаты представлены на Фигуре 18.
Данные очевидно показывают, что Биотинил-V-15-Y пептид представляет собой субстрат VASH/SVBP ферментативного комплекса и, следовательно, является походящим для скрининга ингибитора активности.
Пример 7. Бесклеточное исследование для анализа активности TCP ингибиторов
Исследование Тубулин Карбоксипептидазы (TCP) или Тубулин-Тирозин Лигазы (TTL) с помощью RapidFire®/Macc-cneKTpoMeTpHH (MS) предоставляет различные преимущества по сравнению с другими существующими форматами анализов. Во-первых, система экономит стоимость и специфические условиях обработки, которые необходимы при использовании радиоактивных субстратов. Во-вторых, анализы на основе RapidFire®/MS не предусматривают использования вторичных или связанных реакций, которые могут осложнять интерпретацию данных. В-третьих, поскольку виды пептидов измеряют непосредственно с помощью МС, отсутствует необходимость использования флуоресцентных меток, которые могут вызывать артефакты данных.
Два пептида использовали для мониторинга активности ферментов. Первый пептид представлял собой субстрат TTL фермента или продукт реакции TCP: Биотинил-V-D-S-V-E-G-E-G-E-E-E-D-E-E. Второй пептид представлял собой продукт реакции с TTL или субстрат TCP Биотинил-V-D-S-V-E-G-E-G-E-E-E-D-E-E-Y, в котором тирозин (Y) расположен на конце биотинилированного пептида.
Фермент, либо TCP или TTL, предварительно инкубировали с соединением в течение 15 минут при комнатной температуре. После этого, добавляли пептидный субстрат.Пептид инкубировали при комнатной температуре с различными концентрациями (10 100 мкМ) для TCP или TTL при конечной концентрации 55 нМ в реакционном объеме 50 мкл (MES 50 мМ; KCl 100 мМ; MgCl2 25 мМ; DTT 0,001М; АТР 0,0003М и L-Тирозин 0,001М в 5% ДМСО) в течение 30 минут.Через 30 минут, реакцию останавливали путем добавления TFA до конечной концентрации 1%. Конечный объем составлял приблизительно 100 мкл.
Продукты реакции анализировали с помощью RapidFire®/MC, используя условия, описанные выше.
RapidFire® 365 (Agilent Technology) с высокой пропускной способностью (RF) сочетали с G-6460 тройным квадрупольным масс-спектрометром (Agilent), работающей в режиме электрораспыления отрицательно заряженных ионов. Для захвата и элюирования образцов использовали картридж С типа. В методе RapidFire® применяют этап очистки твердофазной экстракцией (SPE) образца, непосредственно связанный с МС обнаружением.
Образцы аспирировали в течение 600 мс, затем загружали 4000 мс и промывали подвижной фазой А 98% ddH2O + 2%ACN + TFA0,01% при скорости потока 1,5 мл/мин. Неподвижную рамку 40 мкл образцов загружали на картридж. После этого образцы элюировали в течение 5000 мс с подвижной фазой В 80% CAN + 20% ddH20 + TFA 0,01% при скорости потока 1,25 мл/мин, с последующим повторным уравновешиванием картриджа с подвижной фазой А при 0,7 мл/мин в течение 500 мс.
Параметры МС: Темп, газа: 200; Сушильный газ: 9; Распылитель: 40; Темп. Защитного газа: 400; Поток защитного газа: 12; VCap: 3500; Напряжение на распылителе: 300; Дельта EMV: 400
MRM переходы для пептидного субстрата тубулина и продуктов реакции составляли m/z 858,3 → 669,5, m/z 939.8 → 719.8, соответственно. Время задержки для каждого перехода составляло 4 мс. Площади пиков интегрировали, и площади под кривыми превращали в количество оставшегося субстрата и образованного продукта, используя калибровочную кривую для субстрата и продукта реакции (см. Фигуру 19).
Ссылки
В настоящей заявке различные ссылки описывают уровень техники, к которому относится настоящая заявка. Раскрытие этих ссылок таким образом включено в настоящую заявку путем ссылки.
1. Н. S. Barra, С.А. Arce, С.Е. Argarana, Molecular neurobiology 2, 133 (Summer, 1988).
2. С. Erck et al., Proceedings of the National Academy of Sciences of the United States of America 102, 7853 (May 31, 2005).
3. A. C. Badin-Larcon et al., Proceedings of the National Academy of Sciences of the United States of America 101, 5577 (Apr 13, 2004).
4. M. Barisic et al., Science (New York, N.Y 348, 799 (May 15, 2015).
5. L. Peris et al., The Journal of cell biology 174, 839 (Sep 11, 2006).
6. P. Gobrecht et al., J Neurosci 36, 3890 (Apr 6, 2016).
7. Y. Konishi, M. Setou, Nat Neurosci 12, 559 (May, 2009).
8. S. Marcos et al., PloS one 4, e5405 (2009).
9. J. P. Kerr et al., Nature communications 6, 8526 (Oct 08, 2015).
10. P. Robison et al., Science (New York, N.Y 352, aaf0659 (Apr 22, 2016).
11. L. Lafanechere et al., Journal of cell science 111 (Pt 2), 171 (Jan, 1998).
12. R. A. Whipple et al., Cancer Res 70, 8127 (Oct 15, 2010).
13. S. Belmadani, C. Pous, R. Ventura-Clapier, R. Fischmeister, P. F. Mery, Molecular and cellular biochemistry 237, 39 (Aug, 2002).
14. M. E. Hallak, J. A. Rodriguez, H. S. Barra, R. Caputto, FEBS Lett 73, 147 (Feb 1, 1977).
15. A. Bosson et al., PloS one 7, e33490 (2012).
16. M. A. Child et al., Nat Chem Biol 9, 651 (Oct, 2013).
17. X. Fonrose et al., Cancer Res 67, 3371 (Apr 1, 2007).
18. L. Sanchez-Pulido, C. P. Ponting, Bioinformatics 32, 1441 (May 15, 2016).
19. Y. Sato, Journal of biochemistry 153, 5 (Jan, 2013).
20. Y. Suzuki et al., Journal of cell science 123, 3094 (Sep 15, 2010).
21. Y. Ditamo, Y. M. Dentesano, S. A. Purro, С.A. Агсе, C. G. Bisig, Scientific reports 6, 38140 (Dec 01, 2016).
22. G. G. Deanin, S. F. Preston, R. K. Hanson, M. W. Gordon, Eur J Biochem 109, 207 (Aug, 1980).
23. N. Kumar, M. Flavin, The Journal of biological chemistry 256, 7678 (Jul 25, 1981).
24. A. Rovini et al., PloS one 8, e65694 (2013).
25. V. Redeker, Methods Cell Biol 95, 77 (2010).
26. S. Nimmagadda et al., Dev Dyn 236, 1358 (May, 2007).
27. T. Shibuya et al., Arteriosclerosis, thrombosis, and vascular biology 26, 1051 (May, 2006).
28. L. Paturle-Lafanechere et al., Journal of cell science 107 (Pt 6), 1529 (Jun, 1994).
29. D. R. Webster, G. G. Gundersen, J. C. Bulinski, G. G. Borisy, Proceedings of the National Academy of Sciences of the United States of America 84, 9040 (Dec, 1987).
30. R. Norita et al., Cancer science 108, 419 (Mar, 2017).
31. V. K. Khodiyar et al., Genomics 90, 285 (Aug, 2007).
32. C. Aillaud et al., Molecular biology of the cell 27, 640 (Feb 15, 2016).
33. K. Rogowski et al., Cell 143, 564 (Nov 12, 2010).
34. S. Ramirez-Rios et al., Molecular biology of the cell 27, 2924 (Oct 01, 2016).
35. С.E. Argarana, H. S. Barra, R. Caputto, Journal of neurochemistry 34, 114 (Jan, 1980).
36. J. Milbradt et al., Mol Cell Proteomics 13, 2132 (Aug, 2014).
37. J. D. Pedelacq, S. Cabantous, T. Tran, Т. C. Terwilliger, G. S. Waldo, Nat Biotechnol 24, 79 (Jan, 2006).
38. I. Arganda-Carreras, R. Fernandez-Gonzalez, A. Munoz-Barrutia, C. Ortiz-De-Solorzano, Microsc Res Tech 73, 1019 (Oct, 2010).
39. M. Barnat, J. Le Friec, C. Benstaali, S. Humbert, Neuron 93, 99 (Jan 04, 2017).
40. J.J. Belanto, J.T. Olthoff, T.L. Mader, CM. Chamberlain, D.M. Nelson, P.M, McCourt, D.M. Talsness, G.G. Gundersen, D.A. Lowe, J.M. Ervasti, Human Molecular Genetics 25, 45951 (2016).
41. C. Yingxian Chen, M.A. Caporizzo, K. Bedi, A. Vite, A.I. Bogush, P. Robison, J.G. Heffler, A.K. Salomon, N.A Kelly, A. Babu, M.P. Morley, K.B. Margulies, B.L. Prosser, Nature Medicine 24, 1225 (2018).
42. P. Robison, M.A. Caporizzo, H. Ahmadzadeh, A. I. Bogush, C. Yingxian Chen, K.B. Margulies, V.B. Shenoy, B.L. Prosser, Science 352, 428 (Apr 22, 2016).
43. R. van den Berg, C.C. Hoogenraad, R.Q. Hintzen, Acta Neuropathology 134, 1 (2017).
44. J.Y. Li, L. Conforti, Experimental Neurology 246, 62 (2013).
45. S. Psilodimitrakopoulos, V. Petegnief, N. de Vera, O. Hernandez, D. Artigas, A.M. Planas, P. Loza-Alvarez, Biophysical Journal 104, 968 (March 2013).
46. X. Ma, W. Yang, X. Jiang, F. Li, X. Li, L. Ye, K. Liu, Neural Regeneration Research 5, 209 (Feb 2010).
47. D. Cartelli, G. Cappelletti, Molecular Neurobiology 54, 6762 (2017).
48. F.J. Baird, C.L. Bennett, Journal of Genetic Syndromes and Gene Therapy 4, 203 (Fev 20, 2014).
49. J. Dubey, N. Ratnakaran, S.P. Koushika, Frontiers in Cellular Neuroscience 9, 343 (Sept 2015).
50. J. Eira, C. Santos Silva, M. Mendes Sousa, M. Almeida Liz, Progress in Neurobiology 141, 61 (2016).
51. R. Brandt, L. Bakota, Journal of Neurochemistry 143, 409 (2017).
52. E.W. Dent, Molecular Biology of the Cell 28, 1 (Jan 2017).
53. S.S. Matsuyama, L.F. Jarkik, Proceedings of the National Academy of Sciences USA 86, 8152 (Oct 1989).
54. O. Blanquie, F. Bradke, Current Opinion in Neurobiology 51, 60 (2018).
55. W. Song, Y. Cho, D. Watt, V. Cavalli, The Journal of Biological Chemistry 290, 14765 (June 2015).
56. J.P. Kerr, P. Robison, G. Shi, A.I. Bogush, A.M. Kempema, J.K. Hexum, N. Becerra, D.A. Harki, S.S. Martin, R. Raiteri, B.L. Prosser, C.W. Ward, Nature Communications 6, 8526 (Oct 2015).
57. Aillaud, C, Bosc, C, Peris, L., Bosson, A., Heemeryck, P., Van Dijk, J., Le Friec, J., Boulan, В., Vossier, F., Sanman, L.E., et al. (2017). Vasohibins/SVBP are tubulin carboxypeptidases (TCPs) that regulate neuron differentiation. Science (New York, NY 358, 1448-1453.
58. Bosson, A., Soleilhac, J.M., Valiron, O., Job, D., Andrieux, A., and Moutin, M.J. (2012). Cap-Gly proteins at microtubule plus ends: is EB1 detyrosination involved? PloS one 7, e33490.
59. Frandemiche, M.L., De Seranno, S., Rush, Т., Borel, E., Elie, A., Arnal, I., Lante, F., and Buisson, A. Activity-dependent tau protein translocation to excitatory synapse is disrupted by exposure to amyloid-beta oligomers. J Neurosci 34, 6084-6097.
60. Hsieh, H., Boehm, J., Sato, C, Iwatsubo, Т., Tomita, Т., Sisodia, S., and Malinow, R. (2006). AMPAR removal underlies Abeta-induced synaptic depression and dendritic spine loss. Neuron 52, 831-843.
61. Paturle-Lafanechere, L., Manier, M., Trigault, N., Pirollet, F., Mazarguil, H., and Job, D. (1994). Accumulation of delta 2-tubulin, a major tubulin variant that cannot be tyrosinated, in neuronal tissues and in stable microtubule assemblies. Journal of cell science 107 (Pt 6), 1529-1543.
62. Wehland, J., and Willingham, M.C. (1983). A rat monoclonal antibody reacting specifically with the tyrosylated form of alpha-tubulin. II. Effects on cell movement, organization of microtubules, and intermediate filaments, and arrangement of Golgi elements. J Cell Biol 97, 1476-1490.
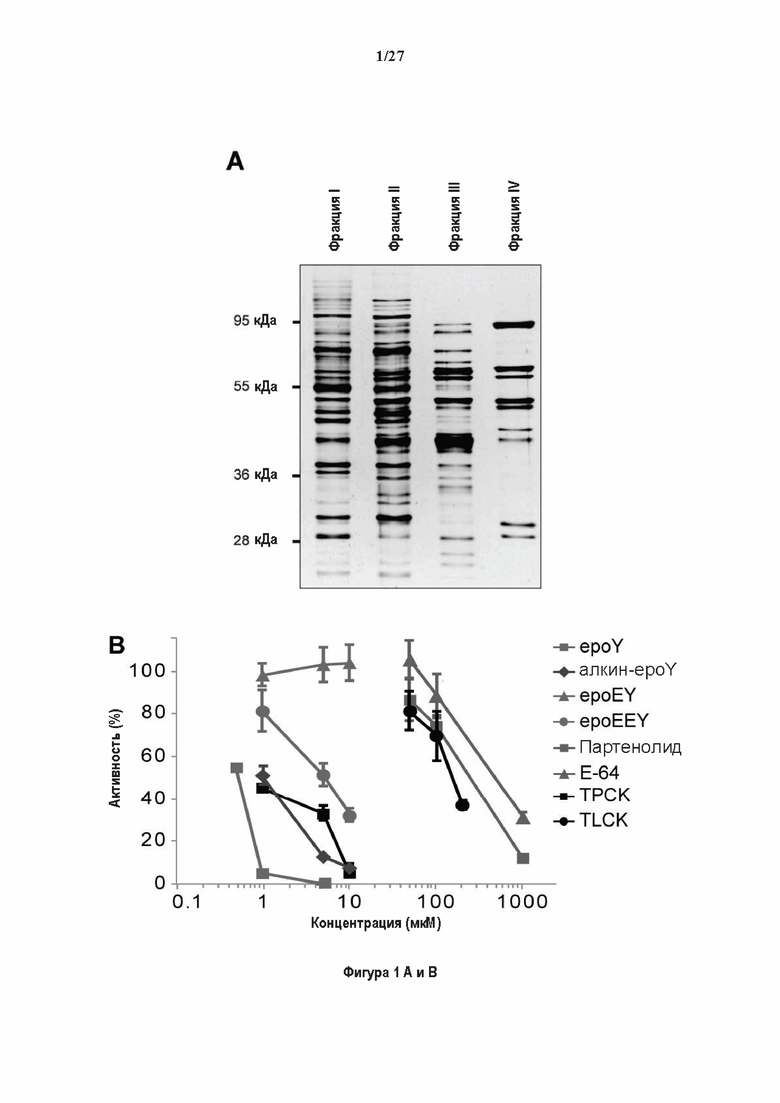
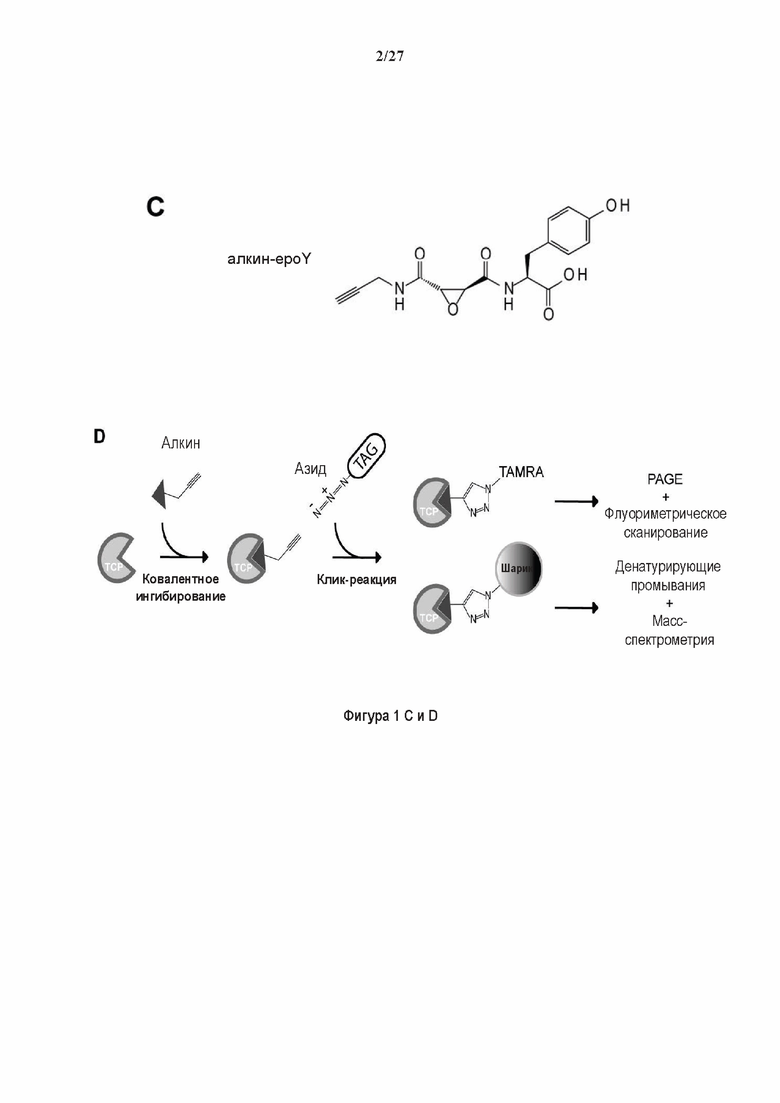
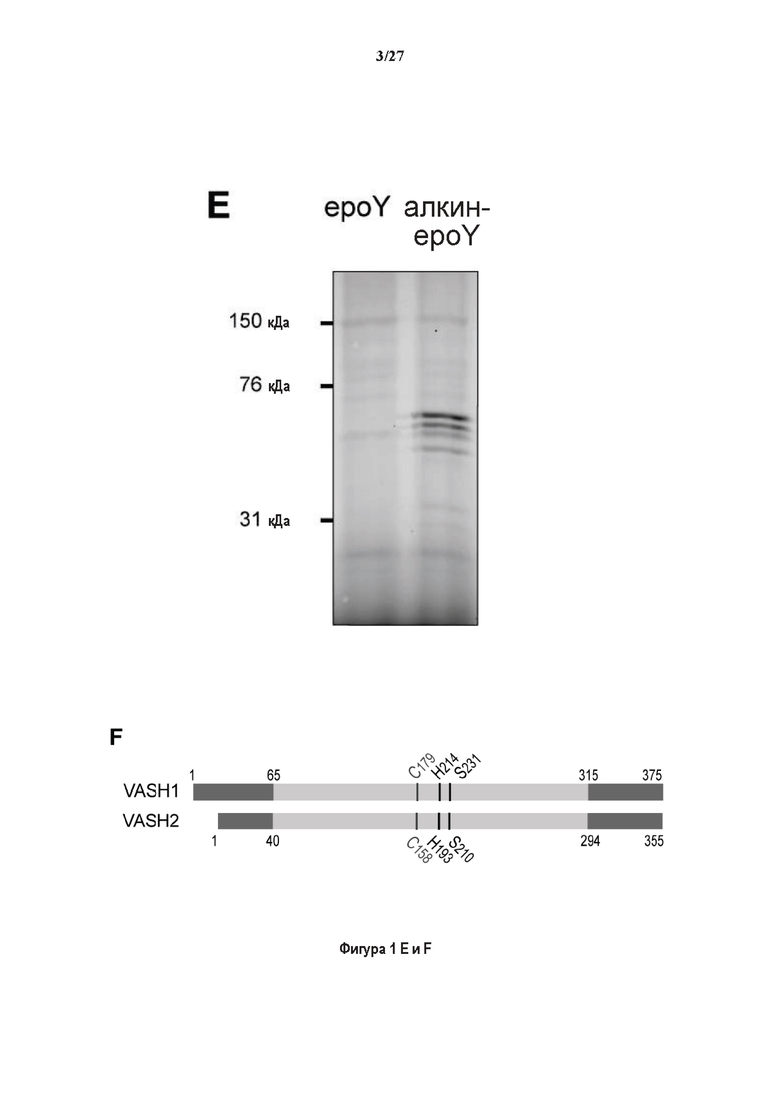
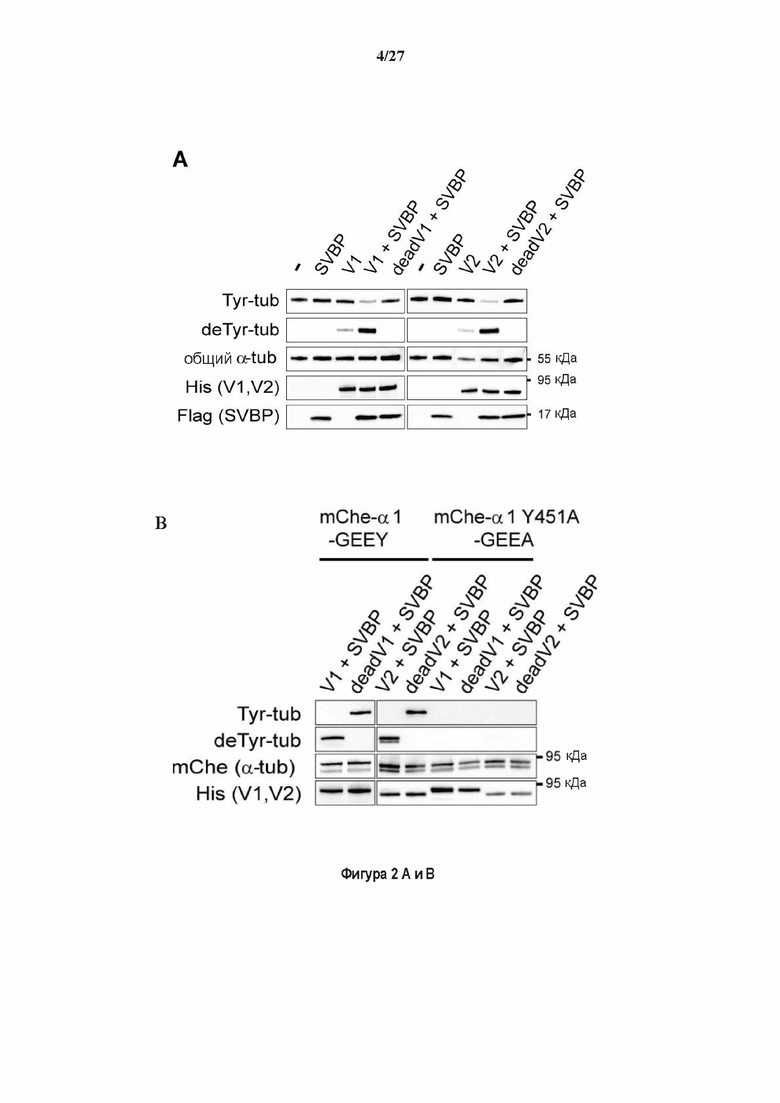
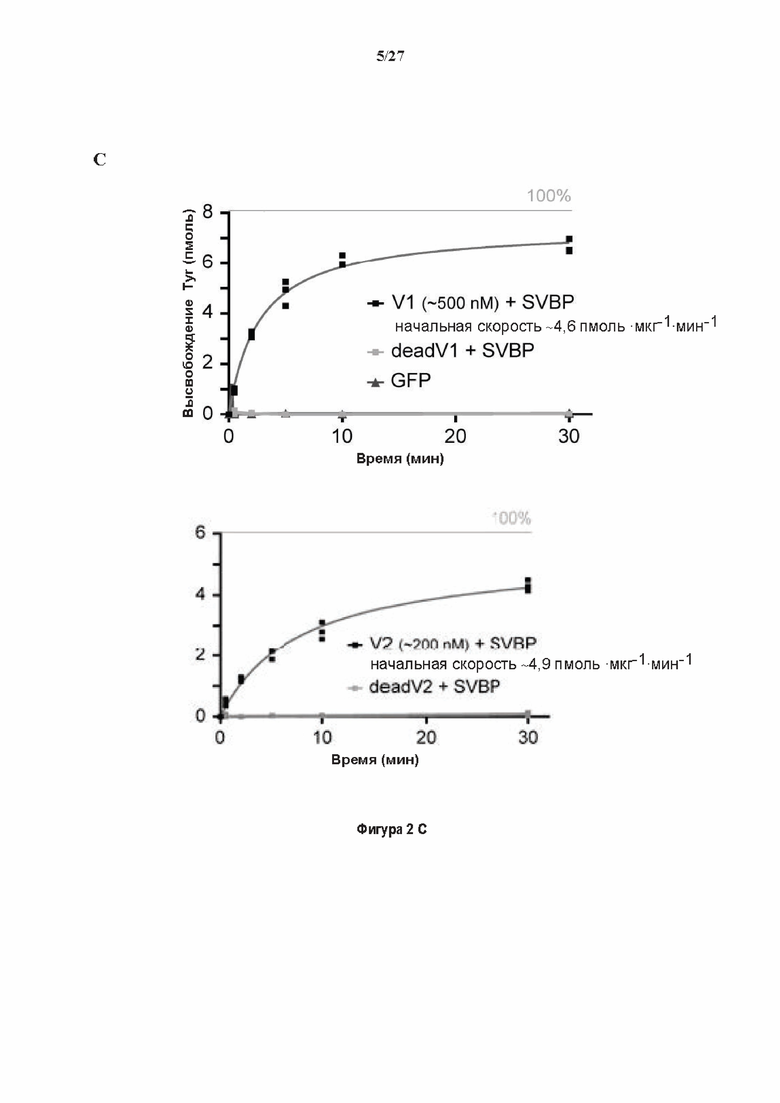

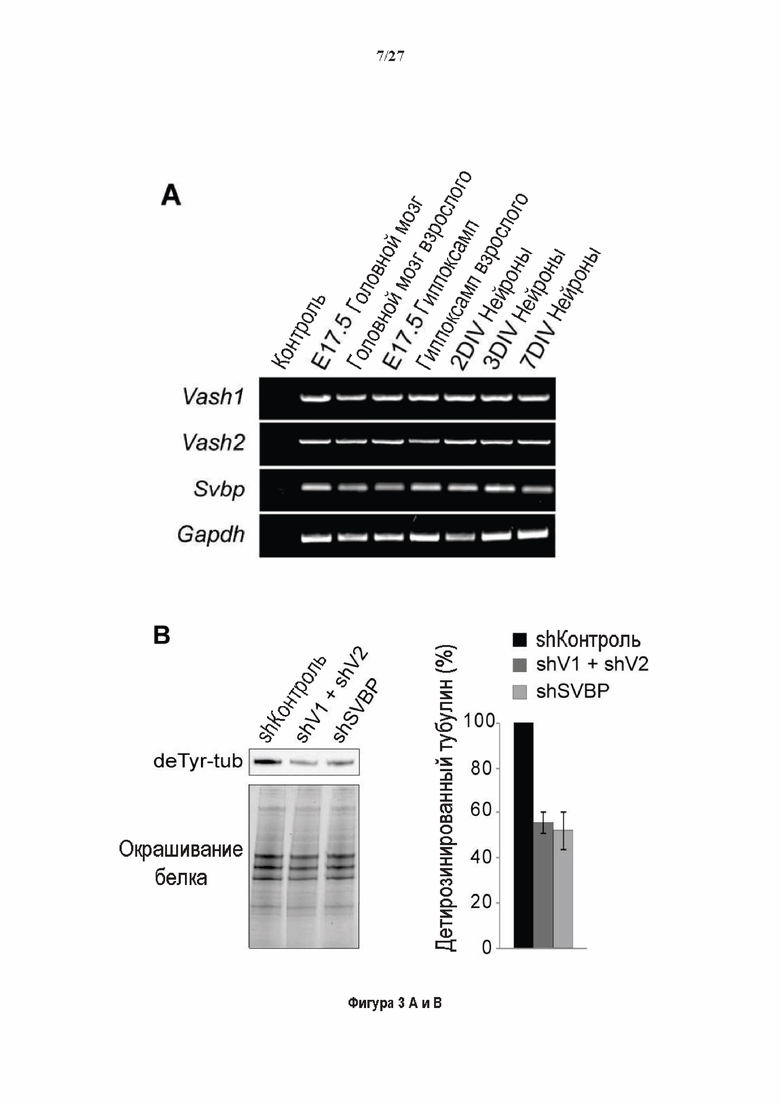
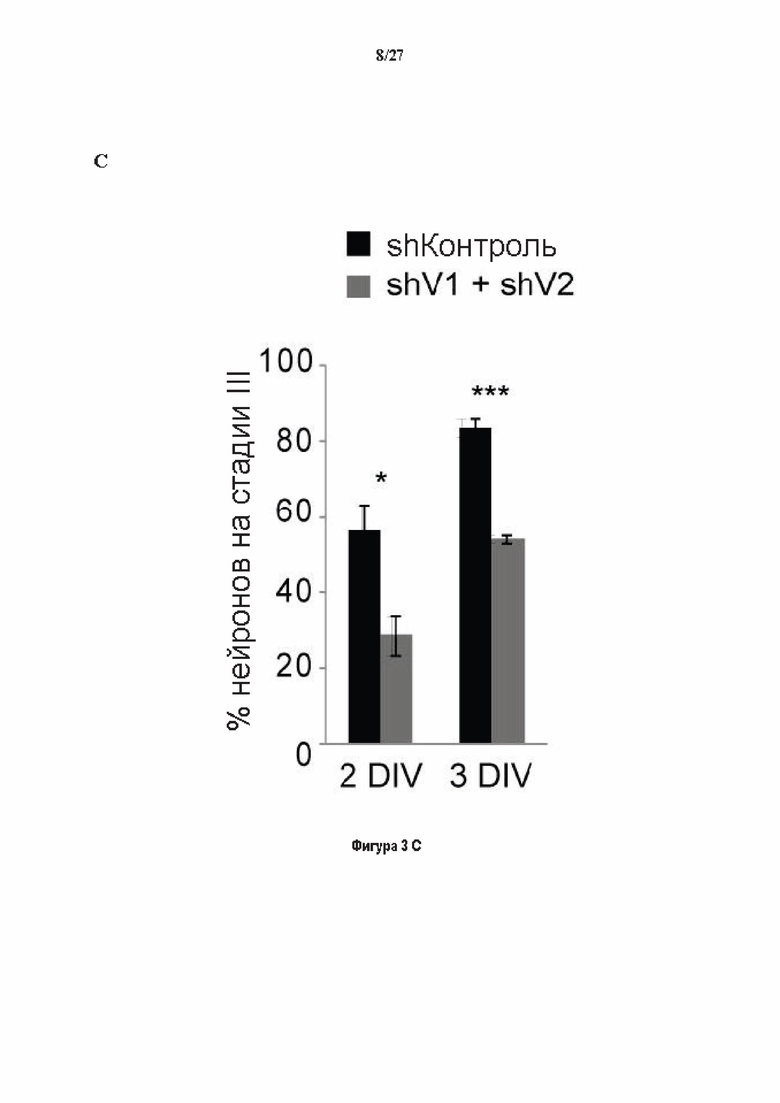

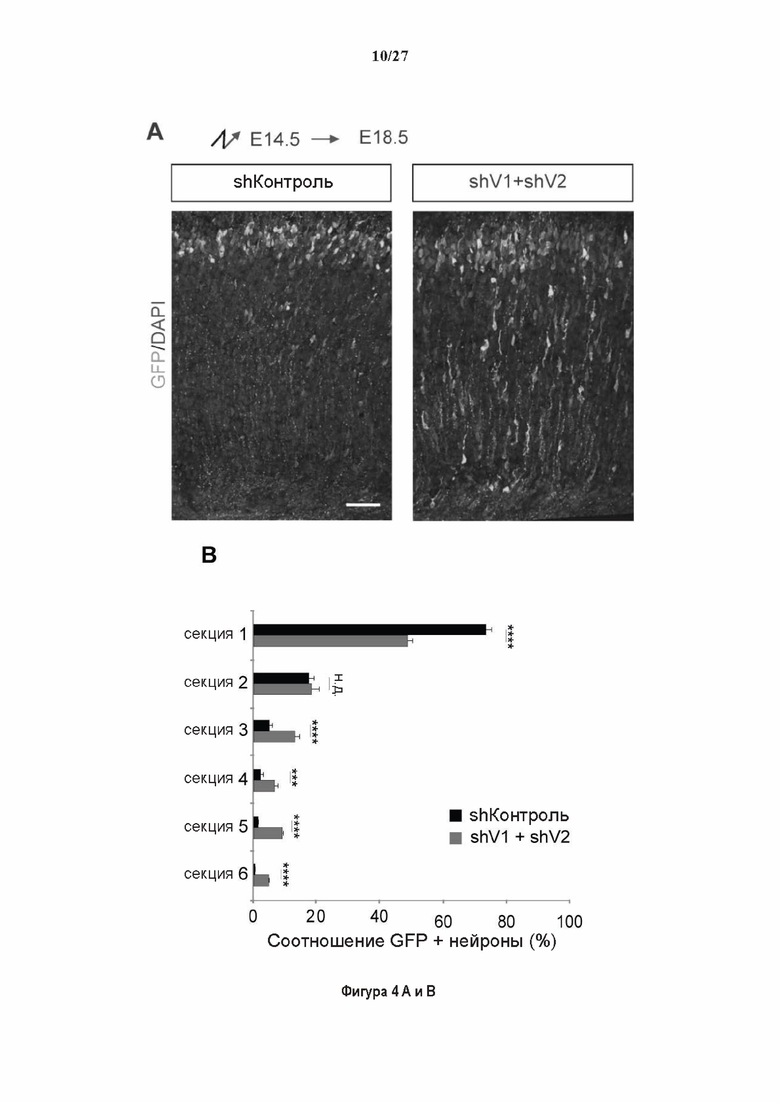

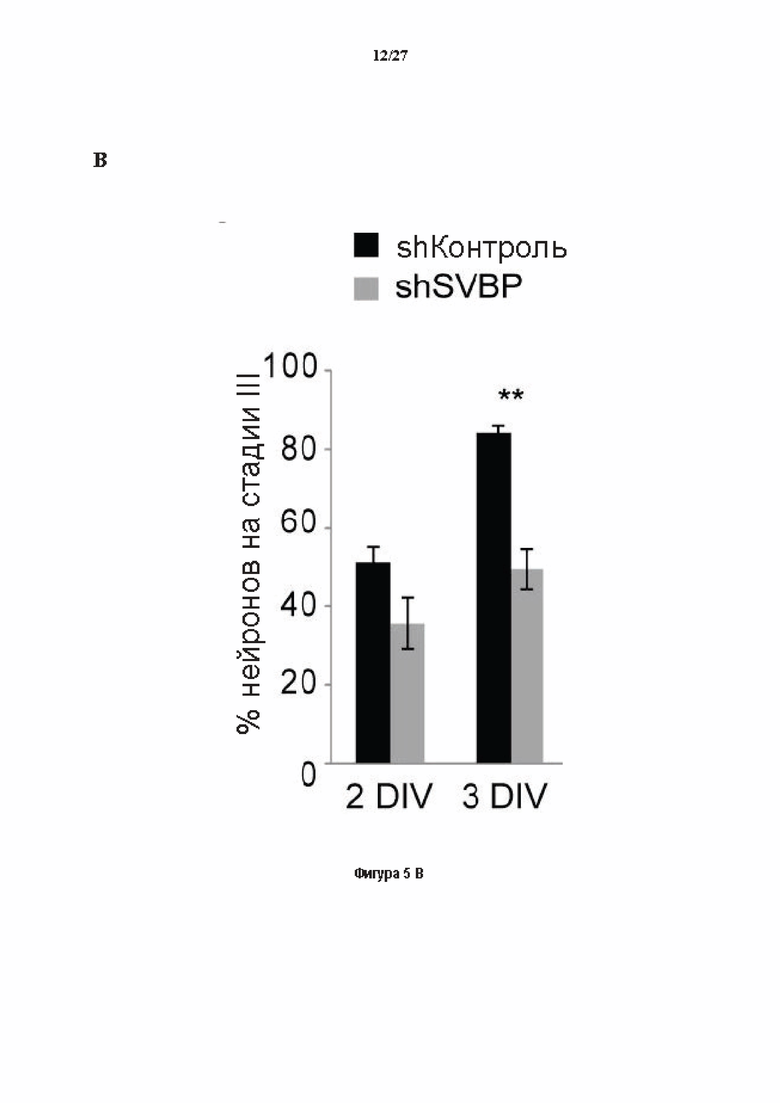
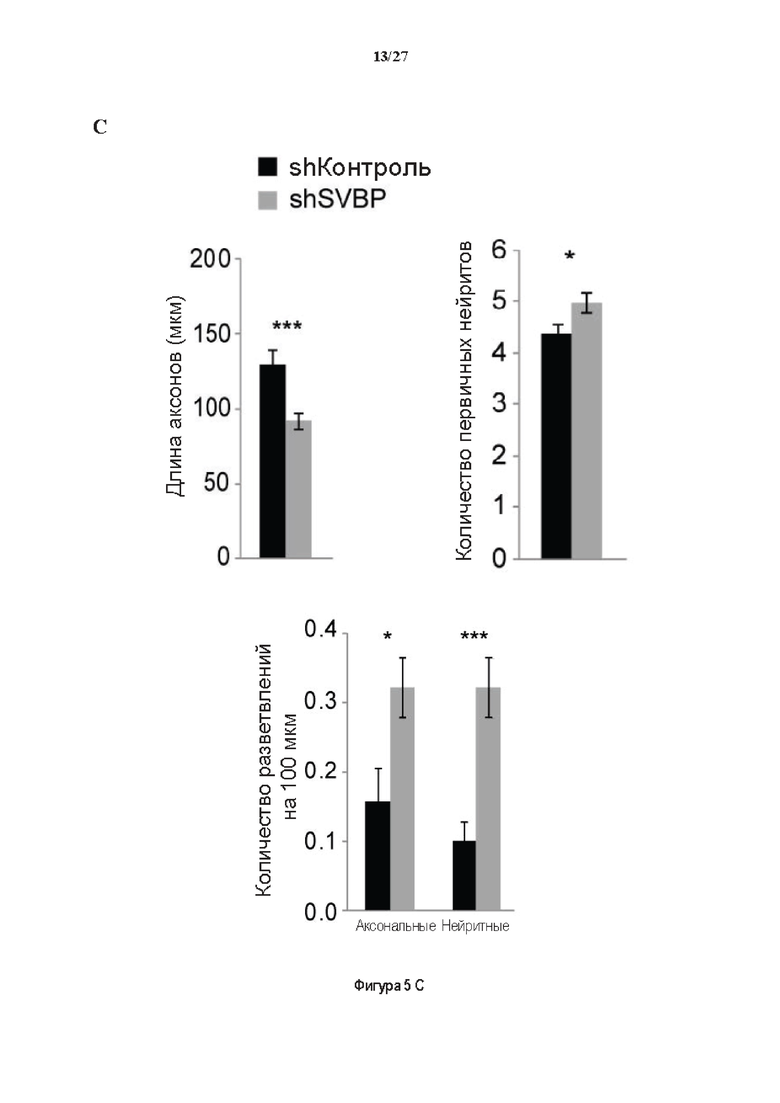
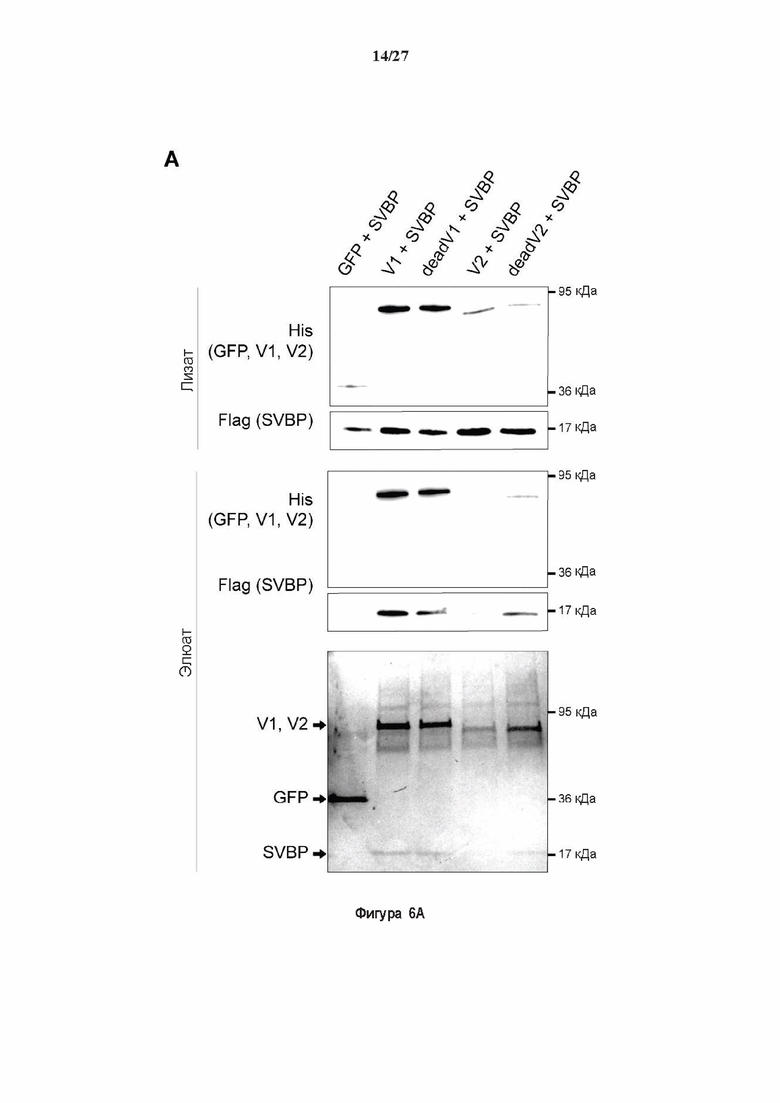

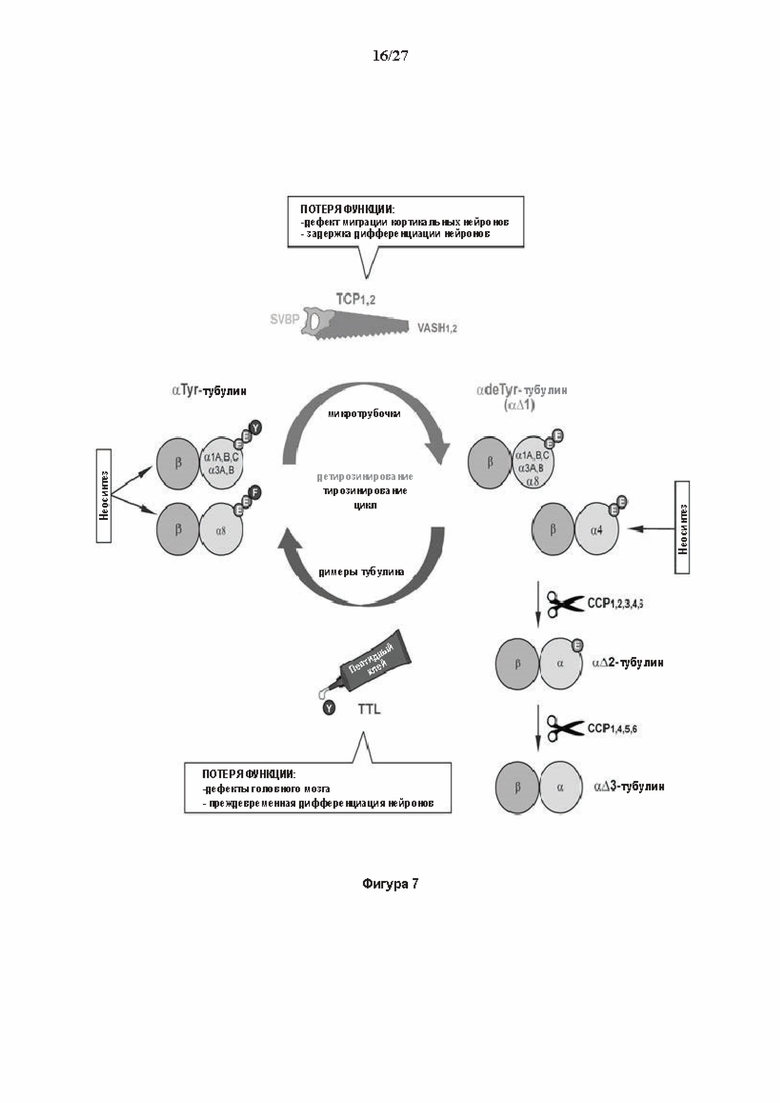
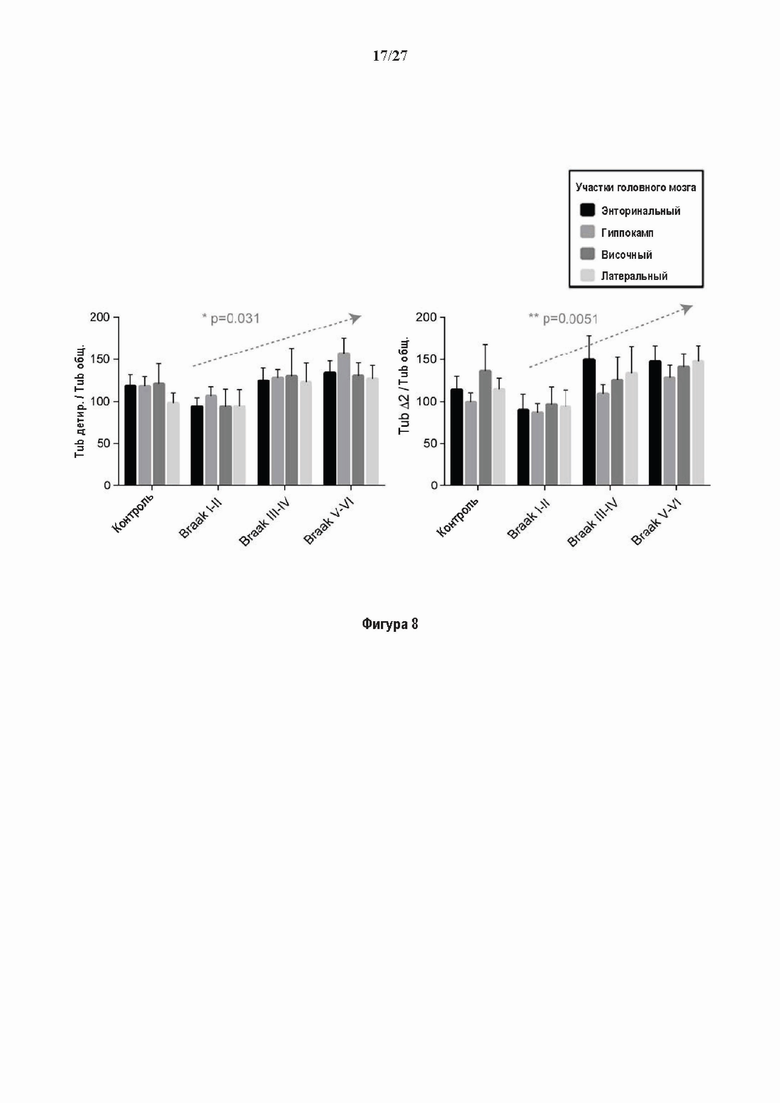
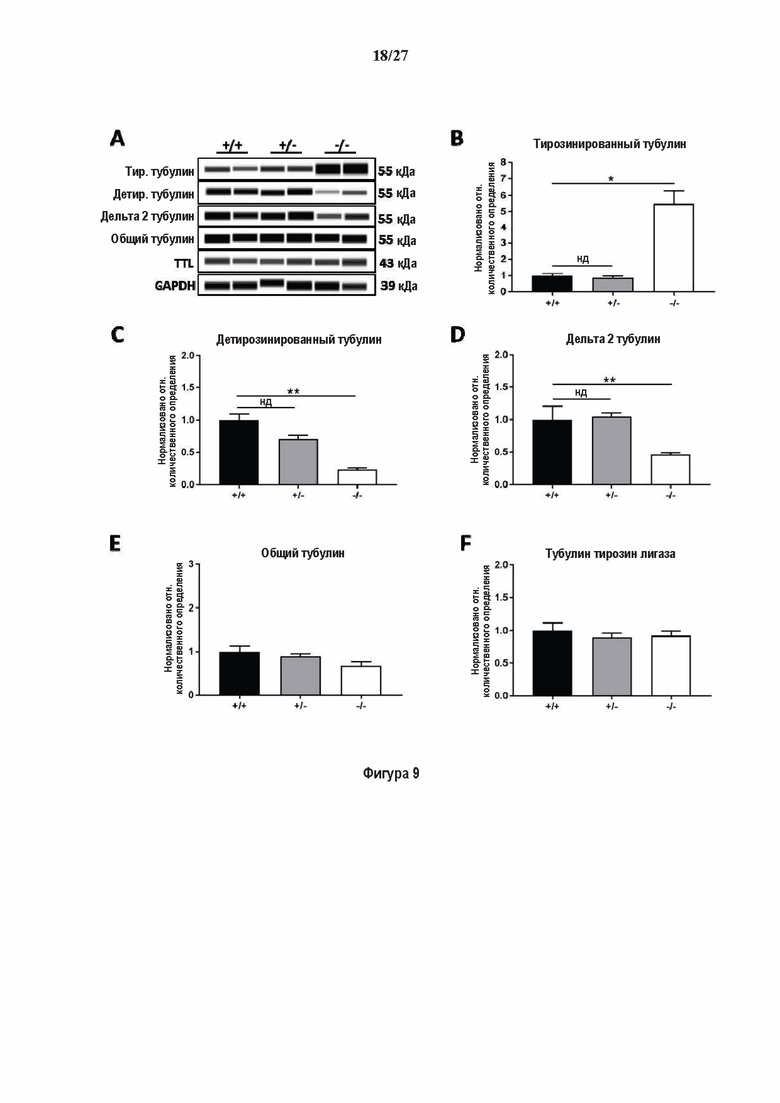
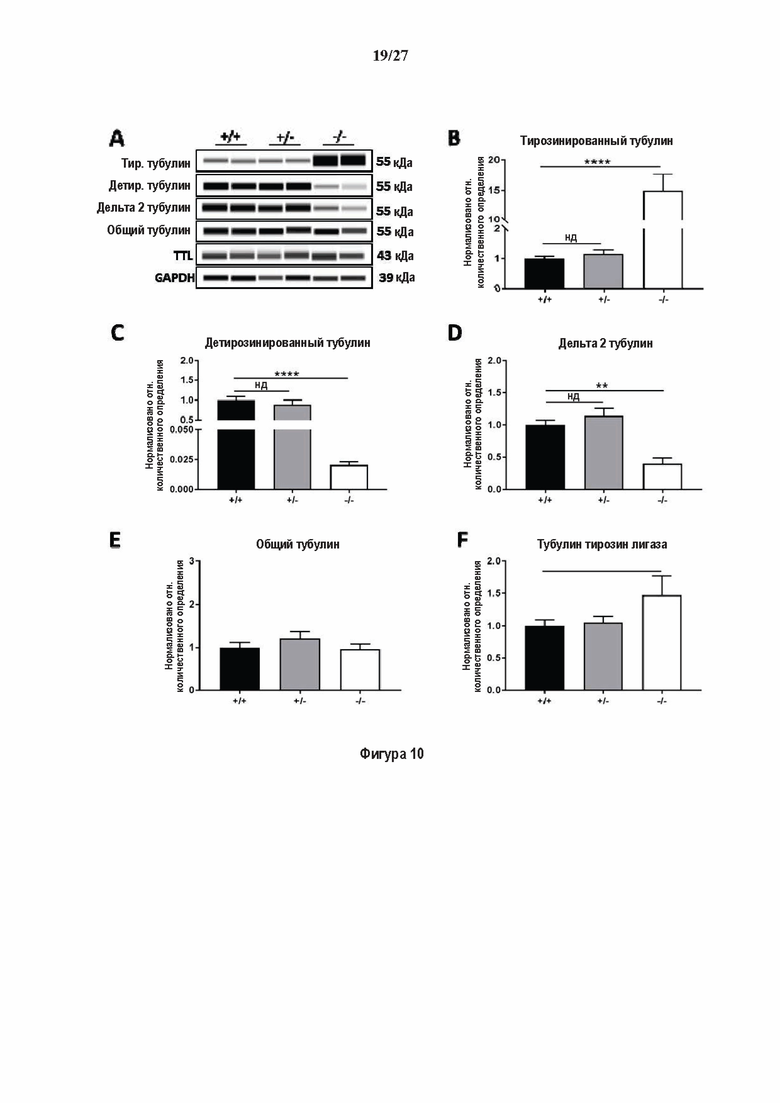
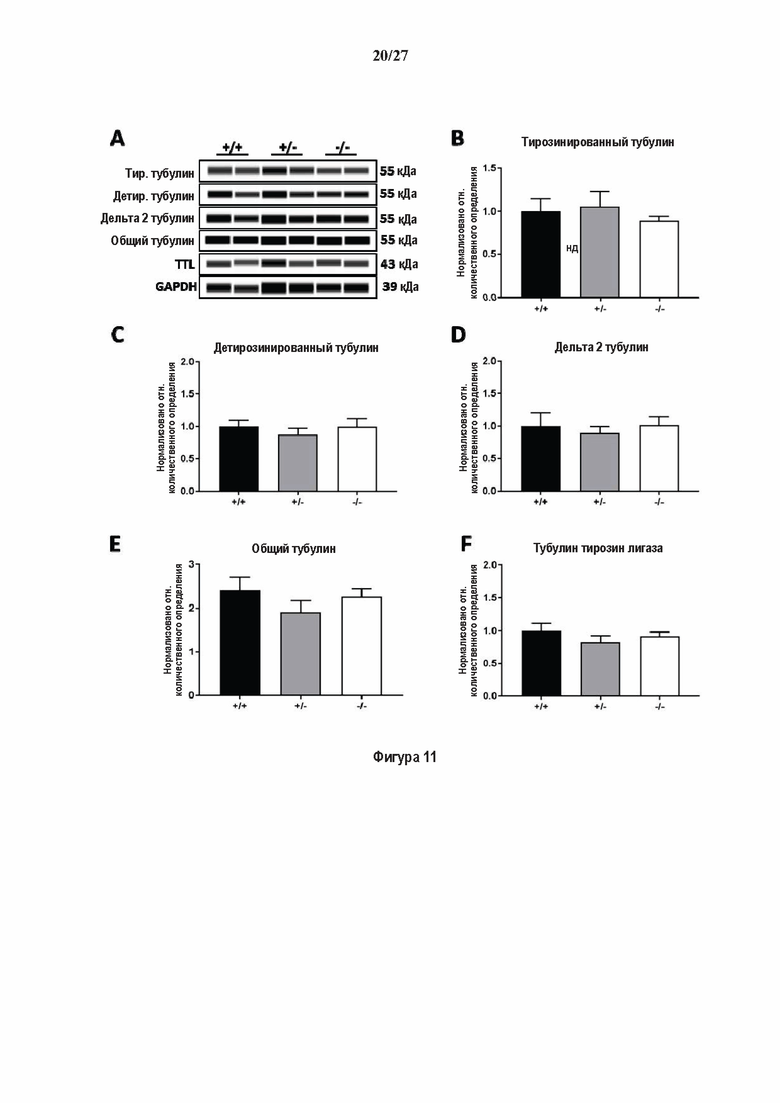
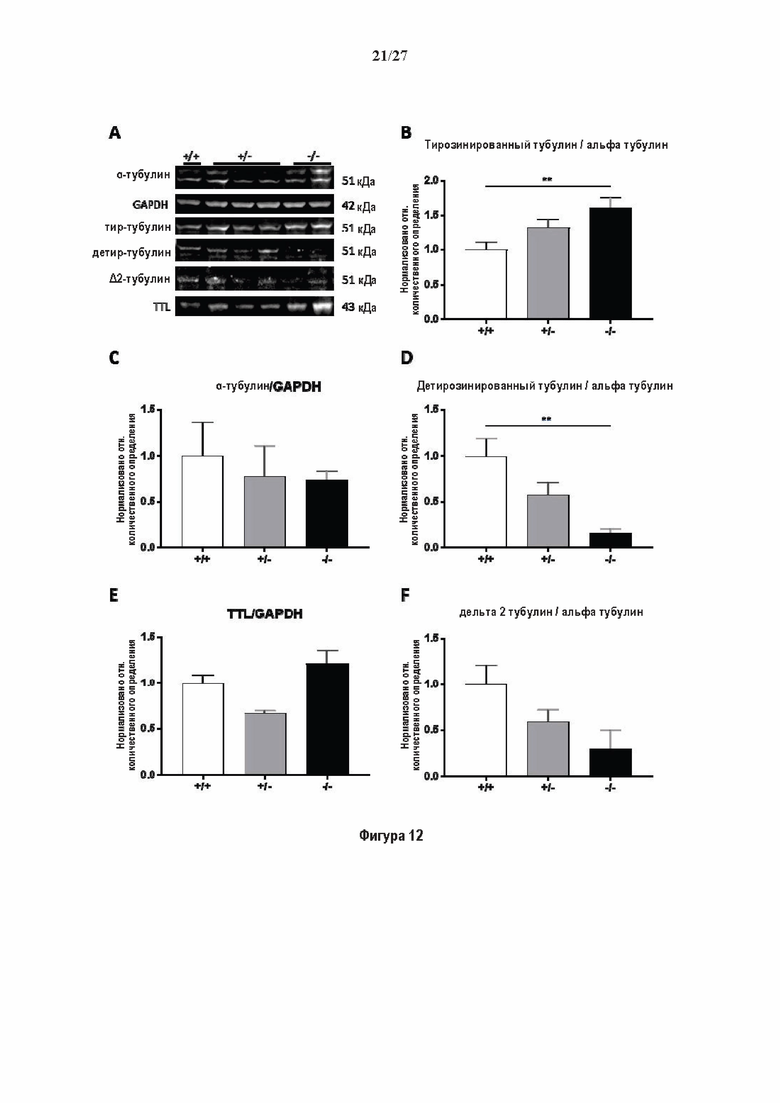
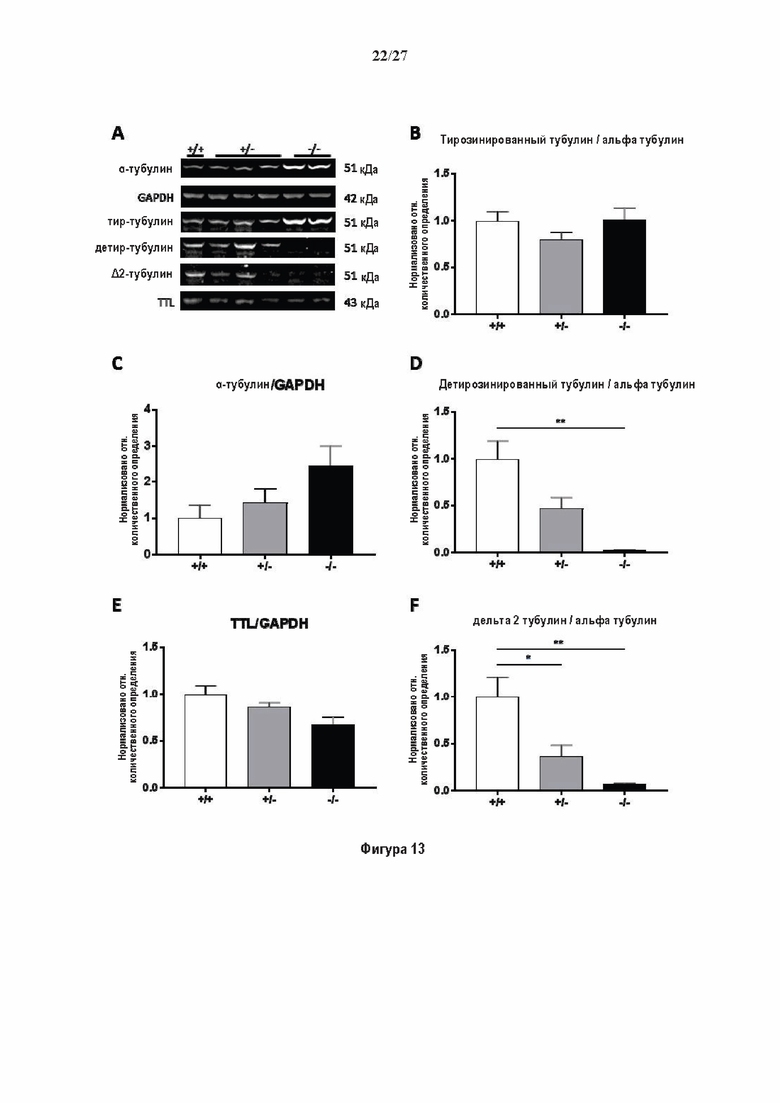
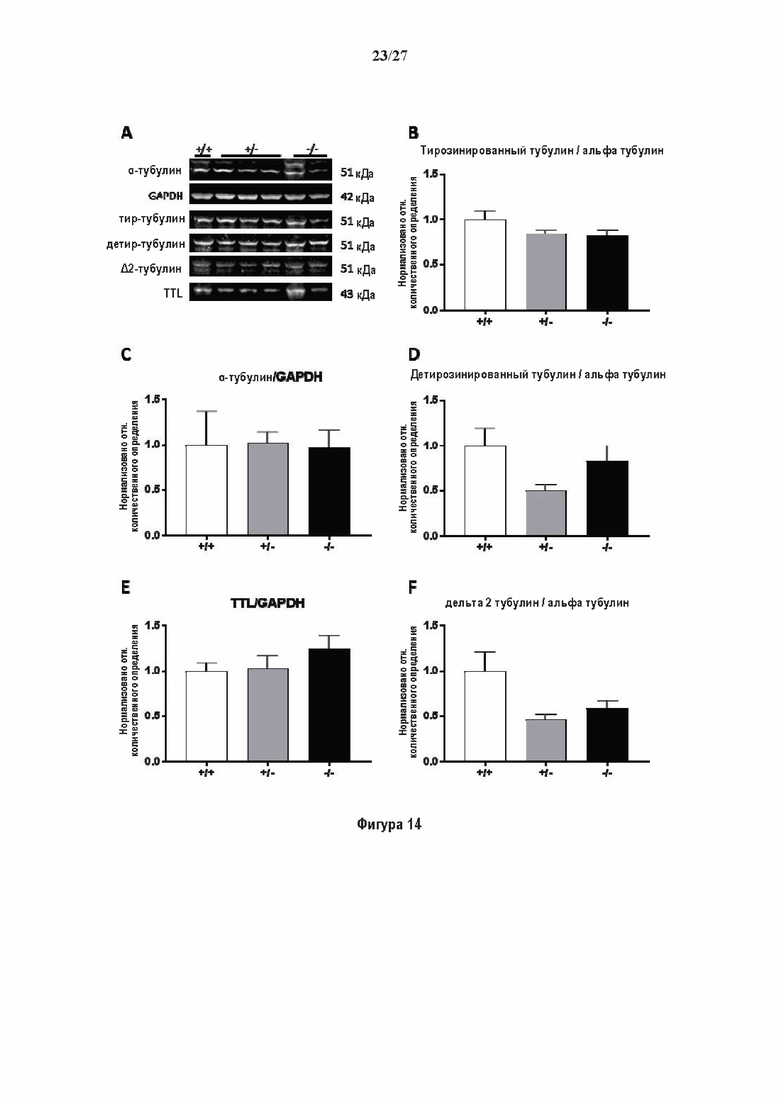
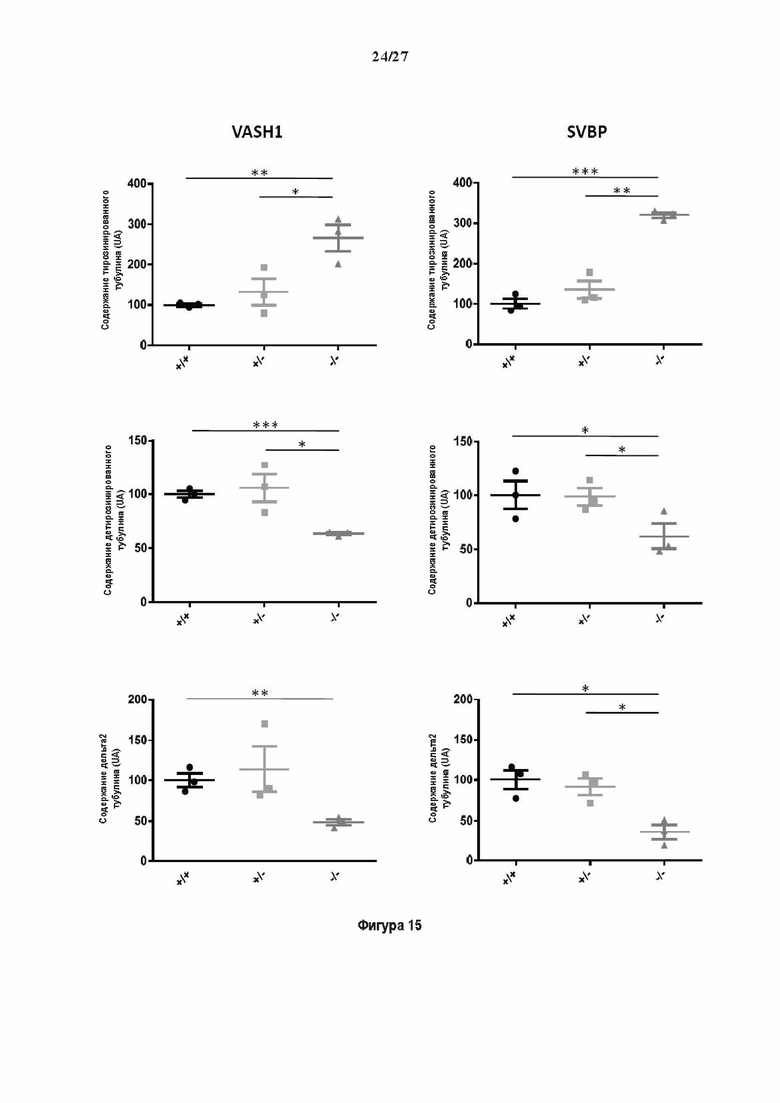
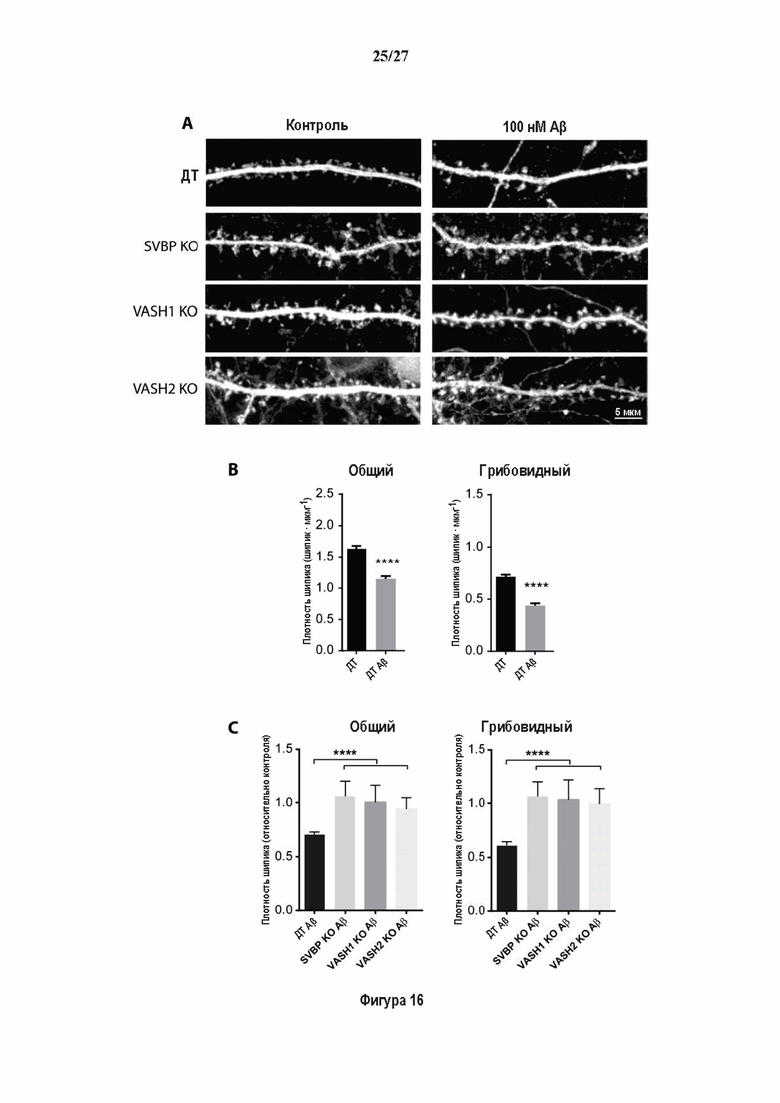
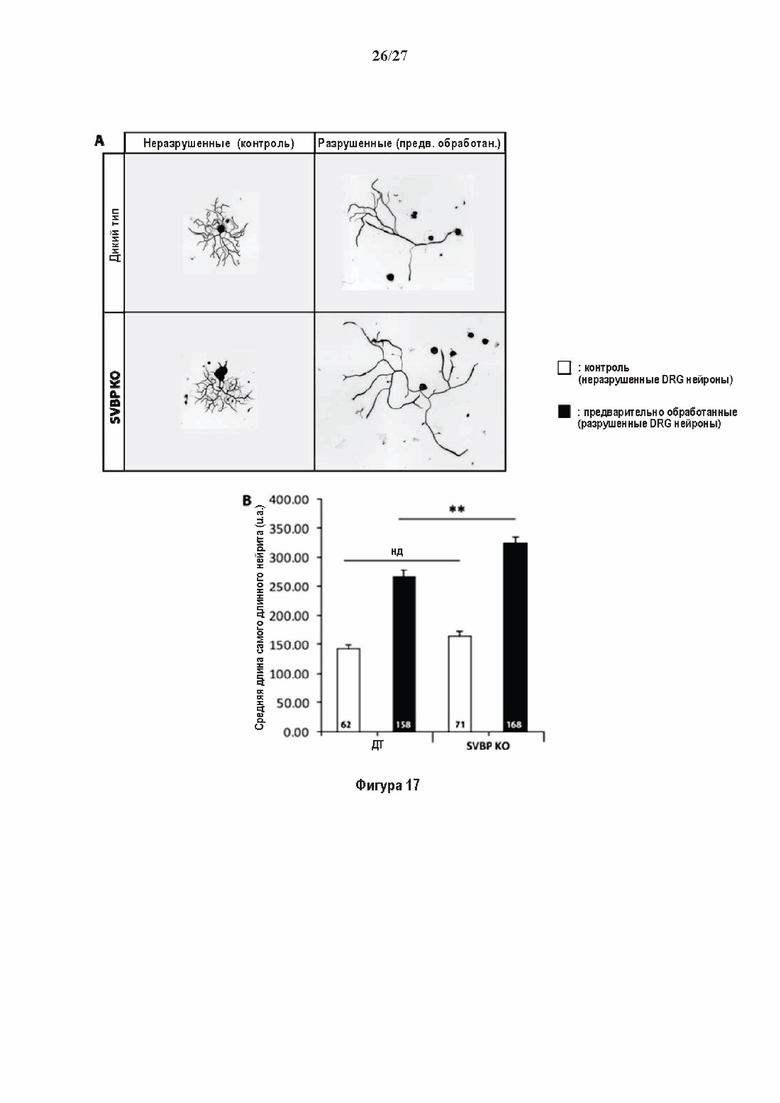
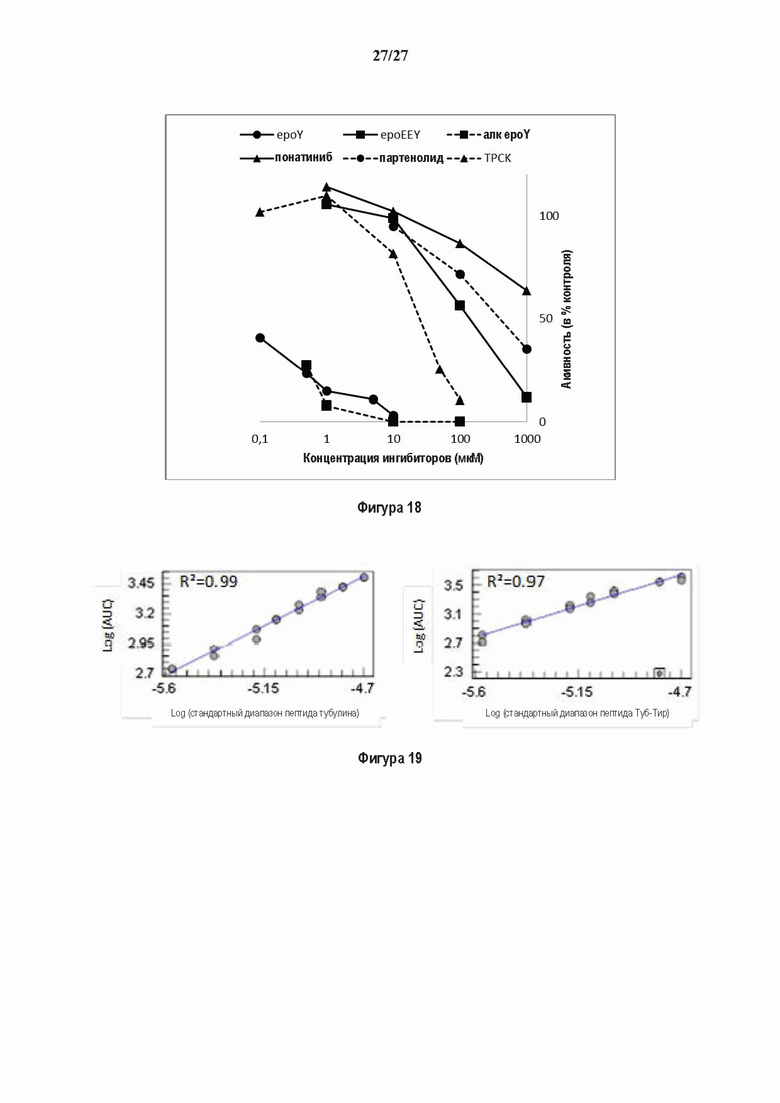
Изобретение относится к способу скрининга кандидатных ингибиторов комплекса вазогибин/SVBP (также обозначаемых как ингибиторы тубулин карбоксипептидазы - "TCP-ингибиторы"). Способ включает стадии: (I) инкубирование кандидатного соединения с вазогибин/SVBP (TCP) и биотинилированным пептидом с последовательностью Биотинил-V-D-S-V-E-G-E-G-E-E-E-D-E-E-Y (SEQ ID NO: 13); (II) количественное определение, с помощью масс-спектрометрии, биотинилированного пептида Биотинил-V-D-S-V-E-G-E-G-E-E-E-D-E-E-Y (SEQ ID NO: 13) и/или биотинилированный пептид Биотинил-V-D-S-V-E-G-E-G-E-E-E-D-E-E (SEQ ID NO: 12), присутствующего в смеси, полученной после окончания стадии (I); и (III) определение, является ли кандидатное соединение TCP ингибитором с учетом результатов, полученных на стадии (II). Поскольку пептид согласно SEQ ID NO: 13 представляет собой субстрат TCP и продукт реакции с тубулин-тирозин-лигазой (TTL)., то в случае, если кандидатное соединение представляет собой ингибитор TCP, количество этого пептида, количественно определенное на стадии (II), является по существу таким же, что и количество пептида, изначально инкубированного на стадии (I). Пептид согласно SEQ ID NO: 12 представляет собой субстрат TTL и продукт реакции с TCP. Таким образом, если кандидатное соединение не представляет собой ингибитор TCP, то количество этого пептида повышается во время стадии (I). Способ согласно настоящему изобретению предоставляет возможность быстрого и точного определения TCP-ингибиторов. 1 з.п. ф-лы, 19 ил., 2 табл., 7 пр.
1. Способ скрининга кандидатных ингибиторов тубулин карбоксипептидазы (TCP), включающий стадии: (I) инкубирование тестируемого кандидатного соединения с TCP и биотинилированным пептидом с последовательностью Биотинил-V-D-S-V-E-G-E-G-E-E-E-D-E-E-Y (SEQ ID NO: 13); количественное определение, с помощью масс-спектрометрии, биотинилированного пептида Биотинил-V-D-S-V-E-G-E-G-E-E-E-D-E-E-Y (SEQ ID NO: 13) и/или биотинилированного пептида Биотинил-V-D-S-V-E-G-E-G-E-E-E-D-E-E, присутствующего в смеси, полученной после окончания стадии (I); и (III) определение, является ли кандидатное соединение TCP ингибитором с учетом результатов, полученных на стадии (II).
2. Способ по п. 1, где указанный способ дополнительно включает между стадиями (I) и (II) стадию очистки, где биотинилированный (е) пептид (ы) Биотинил-V-D-S-V-E-G-E-G-E-E-E-D-E-E (SEQ ID NO: 12) и/или Биотинил-V-D-S-V-E-G-E-G-E-E-E-D-E-E-Y (SEQ ID NO: 13) выделяют таким образом, чтобы количественно определить на стадии (III).
| WO 9905522 A1, 04.02.1999 | |||
| US 2016009790 A1, 14.01.2016 | |||
| NOGALES E | |||
| et al., Structure of the alpha beta tubulin dimer by electron crystallography | |||
| Nature, 1988, V | |||
| Ситценабивная машина | 1922 |
|
SU391A1 |
| ПЕЧНОЙ ЖЕЛЕЗНЫЙ РУКАВ (ТРУБА) | 1920 |
|
SU199A1 |
| Найдено в PubMed, PMID: 9428769, doi:10.1038/34465 | |||
| AILLAUD C | |||
| et al., Evidence for new C-terminally truncated variants of α- | |||
Авторы
Даты
2024-01-25—Публикация
2018-10-26—Подача