УРОВЕНЬ ТЕХНИКИ
[001] Путь CD40/CD40L играет важную роль в управлении видами гуморального иммунного ответа и участвует в патогенезе нескольких аутоиммунных заболеваний. CD40 конститутивно экспрессируется на множестве антигенпрезентирующих клеток, включая дендритные клетки (DC), макрофаги и В-клетки (1), а также может экспрессироваться на клетках, отличных от гематопоэтических.
[002] Экспрессия лиганда CD40, CD40L (также известного как CD154), строго регулируется и в основном обнаруживается на активированных CD4+ Т-клетках (2). Взаимодействия CD40/CD40L между В-клетками и активированными Т-клетками необходимы для формирования эффективных гуморальных ответов на Т-зависимые антигены (3-5). Ось CD40/CD40L управляет размножением, дифференцировкой и переключением изотипов В-клеток in vitro (6-9). In vivo передача сигнала с участием CD40 необходима для образования зародышевого центра (GC), осуществления соматической гипермутации и генерации B-клеток памяти и долгоживущих плазматических клеток (10-13). Дефекты CD40 или CD40L у людей приводят к развитию Х-сцепленного гипериммуноглобулинового синдрома - заболевания, характеризующегося нарушением переключения класса изотипов, которое проявляется в виде высоких уровней IgM в сыворотке крови при низких уровнях или отсутствии выявляемых количеств IgG, IgA или IgE и повышенной восприимчивости к инфекциям (14-16).
[003] Клинические испытания соединений, направленных в отношении CD40L, продемонстрировали потенциальные преимущества целенаправленного воздействия на путь CD40 при аутоиммунном заболевании. В исследовании фазы II гуманизированное антитело к CD40L 5c8, BG9588, обеспечивало значительное снижение уровня протеинурии и титров антител к dsDNA у пациентов с пролиферативным волчаночным нефритом (17). Дополнительные исследования показали, что лечение с помощью молекулы, специфически связывающей CD40L, обеспечивает снижение количества циркулирующих CD38высок. клеток, секретирующих Ig, а также B-клеток периферических GC, присутствующих у пациентов с активным SLE (18, 19). Также было показано, что виды лечения моноклональными антителами (mAb) к CD40L индуцируют формирование выраженного ответа у подгруппы пациентов с иммунной тромбоцитопенией (ITP) (20).
[004] Хотя в клинических испытаниях было показано, что лечение с помощью mAb к CD40L обладает потенциалом, их программы были остановлены из-за возникновения тромбоэмболических нежелательных явлений. Хотя это точно не определено, одним из возможных объяснений возникновения этих непредвиденных угроз безопасности является то, что FcγRIIa (или CD32a) экспрессируется на тромбоцитах человека, но не экспрессируется на тромбоцитах мыши (21). CD40L также в высокой степени экспрессируется на активированных тромбоцитах (22), где одновременное опосредованное антителами связывание как с CD40L, так и с FcγRIIa на соседних клетках может приводить к агрегации тромбоцитов. На мышиных моделях получено подтверждение того, что FcγRIIa играет определенную роль в развитии тромбоцитопении, индуцированной молекулами, специфически связывающими CD40L. У мышей, трансгенных по FcγRIIa человека, mAb к CD40L вызывало шок и тромбоцитопению (23). Этот эффект не наблюдали ни у мышей дикого типа, ни у трансгенных мышей, которым вводили агликозилированную версию антитела, неспособного связывать FcγR.
[005] Для обеспечения нацеливания на CD40L, но без потенциальных осложнений, связанных с mAb, получили CD40L-специфический каркасный белок Tn3 (24, 25). Белки Tn3 происходят из третьего домена фибронектина типа III тенасцина-C человека, и с помощью методов конструирования им можно придать свойства мишень-специфического связывания (26, 27). Слияние двухвалентного CD40L-специфического белка Tn3 с сывороточным альбумином человека (HSA) привело к получению молекулы, т. е. VIB4920, которая была способна связывать CD40L человека и предотвращать его взаимодействие с рецептором CD40. В соответствии с этим нарушением взаимодействия CD40L/CD40, VIB4920 был способен эффективно ингибировать активацию и дифференцировку В-клеток человека in vitro путем блокирования событий передачи сигнала с участием CD40.
[006] В данной области техники существует потребность в новом терапевтическом средстве, которое бы оказывало значительное влияние на виды гуморального иммунного ответа и которое можно было бы использовать для лечения аутоиммунных и/или воспалительных состояний. В данной области техники также существует потребность в обеспечении индуцирования иммунной толерантности в отношении заместительной терапии у пациентов, нуждающихся в этом.
[007] В настоящее время обнаружено, что VIB4920 обеспечивает снижение выраженности клинических симптомов и других маркеров заболевания при введении пациентам, страдающим аутоиммунным/воспалительным заболеванием или нарушением. В частности, введение VIB4920 субъектам с ревматоидным артритом (RA) в определенных дозах приводит к статистически значимому снижению титров аутоантител к ревматоидному фактору (RF), балла по шкале оценки по уровню биомаркера Vectra DA и активности заболевания, измеряемой с помощью DAS28-CRP, по сравнению с плацебо.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
[008] Описание предусматривает способ подавления иммунного ответа, опосредованного B-клетками и T-клетками, у субъекта. Способ включает стадии введения дозы VIB4920, составляющей от 500 мг до 3000 мг, субъекту, нуждающемуся в этом, и обеспечения подавления иммунного ответа, опосредованного B-клетками и T-клетками.
[009] Описание также предусматривает способ лечения аутоиммунного заболевания или нарушения. Способ включает стадии введения дозы VIB4920, составляющей от 500 мг до 3000 мг, субъекту, нуждающемуся в этом, и обеспечения таким образом лечения аутоиммунного заболевания или нарушения.
[0010] Описание дополнительно предусматривает способ снижения показателя активности заболевания, представляющего собой RA, у пациента, проходящего лечение от RA. Способ включает стадии введения VIB4920 пациенту и обеспечения снижения показателя активности заболевания, представляющего собой RA, у пациента. Показатель снижения активности заболевания, представляющего собой RA, может включать один или несколько из следующих показателей: DAS28-CRP, клинический индекс активности заболевания (CDAI), количество болезненных суставов, количество опухших суставов, общую оценку пациентом или общую оценку врачом. VIB4920 можно вводить в дозе, составляющей от примерно 500 мг до 3000 мг.
[0011] Описание также предусматривает способ снижения уровня аутоантител к RF у пациента при лечении от RA. Данный способ включает стадии введения VIB4920 в дозе, составляющей от примерно 500 мг до 3000 мг, пациенту и обеспечения снижения уровня аутоантител к RF у пациента.
[0012] Описание дополнительно предусматривает способ снижения балла по шкале оценки по уровню биомаркера у пациента при лечении от RA. Способ включает стадии введения от примерно 500 мг до 3000 мг VIB4920 пациенту и обеспечения снижения балла по шкале оценки по уровню биомаркера у пациента. В таком способе балл по шкале оценки по уровню биомаркера может представлять собой один или несколько из встречаемости генной сигнатуры плазматической клетки (PC), балла по шкале оценки Vectra-DA или уровня C-реактивного белка (CRP) сыворотки крови.
[0013] Описание также предусматривает способ снижения баллов по шкале оценки по встречаемости генной сигнатуры PC у пациента, нуждающегося в этом. Способ включает стадии введения VIB4920 пациенту, нуждающемуся в этом, и обеспечения снижения балла по шкале оценки по встречаемости генной сигнатуры PC у пациента. Пациент, нуждающийся в этом, может представлять собой пациента, проходящего лечение от системной красной волчанки, ревматоидного артрита, миозита, антифосфолипидного синдрома, аутоиммунного гепатита, болезни Шегрена или других аутоиммунных или воспалительных состояний, а также пациента с трансплантацией и реакцией "трансплантат против хозяина". VIB4920, введенный пациенту, нуждающемуся в этом, может находится в дозе, составляющей от примерно 500 мг до 3000 мг.
[0014] Описание дополнительно предусматривает способ снижения уровня аутоантител у пациента при лечении от аутоиммунного нарушения или аллоантител в случае трансплантата. Способ включает стадии введения VIB4920 пациенту, нуждающемуся в этом, и обеспечения снижения уровня аутоантител или аллоантител у пациента. В таком способе пациент проходит лечение от аутоиммунного заболевания, характеризующегося наличием аутоантител, или пациент проходит лечение для предотвращения отторжения трансплантата. Пациенту вводят VIB4920 в дозе, составляющей от примерно 500 мг до 3000 мг.
[0015] Описание также предусматривает способ снижения выраженности воспаления у пациента. Способ включает стадии введения VIB4920 пациенту, нуждающемуся в этом, и обеспечения снижения выраженности воспаления у пациента. Пациент может представлять собой пациента, проходящего лечение от воспалительного заболевания или нарушения, или может проходить профилактическое лечение от ожидаемого воспаления в ответ на трансплантат, представляющий собой орган или ткань. VIB4920 можно вводить в дозе, составляющей от примерно 500 мг до 3000 мг.
[0016] Описание дополнительно предусматривает способ индуцирования иммунной толерантности в отношении заместительной терапии у пациента. Способ включает стадии введения VIB4920 пациенту, нуждающемуся в заместительной терапии, и обеспечения индуцирования иммунной толерантности в отношении заместительной терапии у пациента. VIB4920 можно вводить в дозе, составляющей от примерно 1000 мг до 3000 мг.
КРАТКОЕ ОПИСАНИЕ ФИГУР
[0017] На фиг. 1A-1G представлена биохимическая характеристика клонов CD40L-специфического Tn3 человека, включая биохимическую характеристику VIB4920 - двухвалентного клона 342, слитого с HSA. На фиг. 1A продемонстрирована способность ряда клонов CD40L-специфического Tn3 человека ингибировать взаимодействия CD40-CD40L, измеренная с помощью Proteon. Процент ингибирования показан для диапазона концентраций Tn3. Показано среднее значение для лунок с параллельными образцами. На фиг. 1B продемонстрирована способность белков Tn3, специфически связывающих CD40L, ингибировать опосредованную CD40L передачу сигнала с помощью NFkB. Клетки HEK293, экспрессирующие CD40R и люциферазу в качестве репортера для NFkB, стимулировали с помощью рекомбинантного CD40L в течение ночи в присутствии белков Tn3, специфически связывающих CD40L. Показан процент ингибирования активности люциферазы. Данные представляют собой среднее значение для лунок с параллельными образцами. На фиг. 1C продемонстрировано ингибирование повышения уровня экспрессии CD86 с помощью конструкций на основе Tn3 в различных концентрациях. PBMC человека стимулировали с помощью рекомбинантного CD40L с последующей предварительной инкубацией с белком Tn3, специфически связывающим CD40L, и оценивали уровень экспрессии CD86 посредством проточной цитометрии. Показано среднее значение для лунок с параллельными образцами. На фиг. 1D показаны результаты испытания указанных молекул Tn3 в отношении их способности к ингибированию взаимодействий CD40-CD40L в ELISA-анализе. Данные представляют собой среднее значение для лунок с параллельными образцами. На фиг. 1E представлены данные, полученные из скрининга клона 342 в отношении связывания с панелью родственных представителей семейства TNF, включая Fas, TNF-альфа, TNF-бета и OX40L. Было обнаружено, что клон 342 селективно связывает CD40L. На фиг. 1F предложена структура VIB4920, полученная на основе данных по кристаллизации Tn3 342 и опубликованной кристаллической структуры HSA (1). На фиг. 1G схематическое изображение структур CD40/CD40L и 342/CD40L совмещено по общей молекуле CD40L. CD40L показан в зеленом цвете, Tn3 - в пурпурном, и рецептор CD40 показан в голубом.
[0018] На фиг. 2A -2D представлена структурная характеристика клона 342 CD40L-специфического Tn3 человека. Фиг. 2A представляет собой схематическое изображение тримерной структуры 342/CD40L. Внеклеточный домен CD40L показан в зеленом цвете; 342 - в пурпурном. На фиг. 2B продемонстрировано поверхность контакта между 342 и CD40L. Фрагменты CD40L и 342 показаны в виде зеленых и пурпурных трубок соответственно. Аминокислоты, участвующие в образовании водородных связей, указаны палочками. Водородные связи показаны черными пунктирными линиями с соответствующими расстояниями (Å). Показаны связи с расстоянием не более 3,5 Å. На фиг. 2C и фиг. 2D проиллюстрировано электростатический потенциал на поверхности взаимодействующих поверхностей (фиг. 2C) CD40L и (фиг. 2D) CD40L-специфического Tn3 342. Молекулы повернуты приблизительно на 90 градусов для того, чтобы показать поверхность контакта, и являются полупрозрачными для обеспечения визуализации аминокислот, участвующих в образовании водородных связей. Красный цвет обозначает отрицательно заряженную поверхность, и синий цвет указывает положительный заряд.
[0019] На фиг. 3A-3G продемонстрировано, как VIB4920 ингибирует передачу сигнала с участием CD40 и активацию B-клеток человека, но не индуцирует агрегацию тромбоцитов в исследованиях ex vivo. На фиг. 3A продемонстрирован процент ингибирования с помощью VIB4920 сигнала люциферазы, отображающего уровень NFkB, в сконструированных клетках HEK29, стимулированных с помощью CD40L в течение ночи. Данные представляет собой среднее значение для лунок с параллельными образцами. Показано одно из двух независимых исследований. На фиг. 3B продемонстрировано, как VIB4920 и mAb к CD40L были способны ингибировать повышение уровня экспрессии CD86 в стимулированных PBMC человека, которые стимулировали. PBMC человека стимулировали с помощью рекомбинантного megaCD40L человека и долю в процентах CD19+/CD86+ клеток измеряли посредством проточной цитометрии через 24 часа. Данные представляют собой среднее значение для лунок с параллельными образцами. На фиг. 3C B-клетки человека стимулировали с помощью IL-21 и megaCD40L в присутствии контроля или молекулы, специфически связывающей CD40L (mAb или Tn3 VIB4920). Уровень размножения B-клеток количественно определяли в день 3. Точечная линия представляет собой уровни ATP в нестимулированных клетках. Показанные данные представляют собой среднее значение и SD по лункам в трех повторностях и являются иллюстрацией двух независимых экспериментов. На фиг. 3D и фиг. 3E продемонстрирован эффект молекулы, специфически связывающей CD40L (mAb или VIB4920 Tn3), в отношении B-клеток человека, если их не стимулировали (nil) или если их стимулировали с помощью IL-21, антитела к IgM и megaCD40L. Число PC количественно определяли в день 7. Конкретно, на фиг. 3D продемонстрирован эффект указанных молекул в день 7 в отношении процента IgD- CD38высок. PC в день 7. На фиг. 3E продемонстрирован эффект указанных молекул в указанных концентрациях в отношении числа PC в день 7. Показанные данные представляют собой среднее значение и SD по лункам в трех повторностях и являются иллюстрацией двух независимых экспериментов. ****=p <0,0001 согласно двустороннему непарному t-тесту Стьюдента. На фиг. 3F и фиг. 3G продемонстрирован эффект молекул, специфически связывающих CD40L (mAb или Tn3 VIB4920), в отношении промытых тромбоцитов человека, подвергнутых инкубированию с ранее образованными иммунными комплексами; агрегацию тромбоцитов или ее отсутствие измеряли в течение 12-14 минут. На фиг. 3F продемонстрирован процент агрегации. Где это указано, тромбоциты предварительно инкубировали с антителом к CD32a в течение 5 минут перед добавлением иммунного комплекса. Аденозиндифосфат (ADP) применяли в качестве положительного контроля агрегации. На фиг. 3G представлен процент агрегации после инкубации тромбоцитов с иммунными комплексами с VIB4920 (Tn3) или mAb к CD40L (5c8) в указанных концентрациях. Данные являются иллюстрацией двух независимых экспериментов.
[0020] Фиг. 4A и 4B. Мышиный заменитель CD40L-специфического Tn3 продемонстрировал сильную нейтрализующую активность in vivo в ответ на иммунизацию. Как на фиг. 4A, так и на фиг. 4B мышей иммунизировали красными клетками крови овцы (SRBC) в день 0 и контроль или Tn3, специфически связывающий CD40L (M31-MSA), вводили ежедневно с дня 9 по день 13. На фиг. 4A представлен процент B-клеток зародышевого центра в селезенке и лимфатическом узле, рассчитанный посредством проточной цитометрии в день 14. Точки представляют собой отдельных животных, и данные являются иллюстрацией двух независимых исследований. ****=p <0,0001 согласно двустороннему непарному t-тесту Стьюдента. На фиг. 4B представлен уровень выработки IgG к красным клеткам крови овцы, согласно количественному определению в сыворотке крови в день 14. Данные представляют собой среднее значение и SEM по четырем животным на группу (n=1 исследование).
[0021] Фиг. 5A и 5B. Схема исследования для клинического исследования фазы 1a для оценки безопасности VIB4920 у здоровых добровольцев. На фиг. 5A продемонстрированы когорты исследования для исследования фазы 1a. На фиг. 5B представлена стратегия введения доз и иммунизации в ходе исследования фазы 1a.
[0022] Фиг. 6A и 6B. В ходе исследования фазы 1a у здоровых добровольцев VIB4920 демонстрировал предпочтительный профиль PK. На фиг. 6A продемонстрированы уровни циркулирующего VIB4920, определенные с помощью ELISA в указанные моменты времени. Точечная линия представляет собой нижний предел чувствительности анализа. Планки погрешностей представляют собой стандартное отклонение от среднего значения, которое не было подсчитано для групп с N=2 субъектов. На фиг. 6B продемонстрированы уровни растворимого CD40L, согласно оценке с помощью ELISA, во всех когортах по введению дозы в указанные моменты времени. Точечная линия представляет собой нижний предел выявления для анализа.
[0023] Фиг. 7. VIB4920 ингибирует варианты антител к лекарственному средству (ADA) при высоких дозах в ходе исследования фазы 1a у здоровых добровольцев. Присутствие ADA определяли с помощью ELISA. Каждый субъект в пределах каждой когорты изображен отдельной линией. Субъекты с высоким содержанием вариантов ADA (медианный титр >480) указаны пурпурной линией; субъекты с низким содержанием вариантов ADA (медианный титр <480) указаны темно-синей линией; субъекты с содержанием вариантов ADA, не поддающимся выявлению, указаны светло-синей линией.
[0024] Фиг. 8A-8C. VIB4920 ингибирует пролиферацию B клеток и TDAR у здоровых людей-добровольцев дозозависимым образом. Здоровых добровольцев иммунизировали KLH за 14 дней до лечения с помощью плацебо или VIB4920 и повторяли введение через 15 дней после введения дозы. На фиг. 8A представлены титры IgG к KLH у здоровых добровольцев в нескольких моментах времени и при разных дозах VIB4920. На фиг. 8B представлены титры IgM к KLH у здоровых добровольцев в нескольких моментах времени и при разных дозах VIB4920. Титры IgG и IgM измеряли с помощью ELISA. Фиг. 8C представляет собой модель ингибирования IgG к KLH в день 43 в виде зависимости доза-ответ.
[0025] Фиг. 9A-9C. VIB4920 ингибирует пролиферацию B-клетки и ответы плазматической клетки, вызывая снижение уровня TDAR у здоровых субъектов-людей. На фиг. 9A представлена выявленная частота встречаемости пролиферирующих B-клеток (Ki67+ CD19+) в кровотоке, согласно количественному определению посредством проточной цитометрии в различные моменты времени у добровольцев, получающих либо плацебо, либо высокую дозу VIB4920 в тестовом исследовании TDAR. На фиг. 9B представлена выявленная частота встречаемости B-клеток памяти с переключенным классом (Ki67+ CD19+ IgD-CD27+) в кровотоке, согласно количественному определению посредством проточной цитометрии в различные моменты времени у добровольцев, получающих либо плацебо, либо высокую дозу VIB4920 в тестовом исследовании TDAR. На фиг. 9C представлен балл по шкале оценки по встречаемости сигнатуры PC в цельной крови, согласно оценке с помощью Taqman PCR. Для групп плацебо и высоких доз VIB4920 значения уровня экспрессии показаны в виде среднего значения и стандартной ошибки. * = P<0,05, ** = P<0,01 при сравнении с плацебо, согласно U-тесту Манна-Уитни.
[0026] Фиг. 10. Схема исследования фазы 1b для оценки VIB4920 у пациентов с RA. Стрелка указывает дозы VIB4920 или плацебо.
[0027] Фиг. 11. Демографическая статистика и клинические характеристики когорт пациентов с RA в клиническом испытании фазы 1b для VIB4920.
[0028] Фиг. 12. VIB4920 демонстрирует приемлемый профиль безопасности у пациентов с RA. Показаны наиболее распространенные TEAE, встречающиеся у по меньшей мере 2 субъектов в исследовании фазы 1b у субъектов с RA.
[0029] Фиг. 13A-13C. VIB4920 демонстрирует линейную PK и дозозависимое снижение содержания вариантов ADA в ходе исследования фазы 1b у пациентов с RA. На фиг. 13A представлены концентрации циркулирующего VIB4920, определенные с помощью ELISA в указанные моменты времени. Точечная линия представляет собой нижний предел чувствительности анализа. Показано среднее значение и стандартная ошибка среднего значения. На фиг. 13B представлен процент субъектов с положительным титром ADA, определенный с помощью ELISA, для каждой вводимой дозировки в любой момент времени исследования. На фиг. 13C представлен титр ADA, определенный с помощью ELISA, в течение времени, у субъектов с содержанием ADA, поддающимся выявлению.
[0030] Фиг. 14A-14F. VIB4920 снижает баллы индекса заболевания и аутоантител у пациентов с RA. На фиг. 14A продемонстрировано изменение DAS28-CRP от исходного уровня (указаны среднее значение и стандартная ошибка) при оценке в указанные моменты времени для указанной дозы VIB4920 или плацебо. На фиг. 14B продемонстрировано изменение CDAI от исходного уровня (указаны среднее значение и стандартная ошибка) при оценке в указанные моменты времени для указанной дозы VIB4920 или плацебо. На фиг. 14C продемонстрировано изменение общей оценки пациентом от исходного уровня (указаны среднее значение и стандартная ошибка) при оценке в указанные моменты времени для указанной дозы VIB4920 или плацебо. На фиг. 14D продемонстрировано изменение общей оценки врачом от исходного уровня (указаны среднее значение и стандартная ошибка) при оценке в указанные моменты времени для указанной дозы VIB4920 или плацебо. На фиг. 14E продемонстрировано изменение балла по шкале оценки Vectra DA от исходного уровня (указаны среднее значение и стандартная ошибка) при оценке в указанные моменты времени для указанной дозы VIB4920 или плацебо. На фиг. 14F продемонстрирован результат измерения процентного значения снижения титров антител к RF, измеряемых с помощью ELISA в указанные моменты времени для каждой указанной дозы VIB4920 или плацебо.
[0031] Фиг. 15A-15B. VIB4920 дозозависимым образом обеспечивает снижение баллов по DAS28-CRP и уровня аутоантител к RF у пациентов с RA. На фиг. 15A продемонстрировано отличие балла по DAS28-CRP в день 85 для плацебо и указанных доз VIB4920. Показана линейная зависимость доза-ответ; ее идентифицировали как наиболее подходящую модель для оценки соотношения между дозой VIB4920 и снижением активности заболевания. На фиг. 15B продемонстрирован процентное значение снижения уровня аутоантител к RF по сравнению с таковым в случае плацебо при указанных дозах VIB4920 в день 85. Показана модель Emax; ее определили как наиболее подходящую для оценки соотношения дозы VIB4920 с титрами RF.
[0032] Фиг. 16. VIB4920 обеспечивает улучшение в отношении категорий DAS28 у пациентов RA, проходивших лечение. Показаны категории DAS28 в день 85. Пятьдесят процентов и семьдесят пять процентов пациентов с RA, проходивших лечение в группах 1000 мг и 1500 мг соответственно, имели низкую активность заболевания или ремиссию в день 85.
[0033] Фиг. 17A-17C. Влияние VIB4920 на количество болезненных/опухших суставов и CRP в ходе исследования фазы 1b у субъектов с RA. На фиг. 17A продемонстрировано изменение количества болезненных суставов у субъектов с RA от исходного уровня при указанных дозах и в указанные моменты времени. На фиг. 17B продемонстрировано изменение количества опухших суставов у субъектов с RA от исходного уровня при указанных дозах и в указанные моменты времени. На фиг. 17C продемонстрировано изменение у субъектов с RA отношения уровней CRP при указанных дозах и в указанные моменты времени к исходному уровню. Показано среднее значение и стандартная ошибка для каждого.
[0034] Фиг. 18. Аминокислотная последовательность молекулы VIB4920.
[0035] Фиг. 19A-19B. Аминокислотные последовательности молекул клона 342 CD40L-специфического Tn3.
[0036] Фиг. 20. Аминокислотная последовательность молекулы клона 342 двухвалентного CD40L-специфического Tn3.
[0037] Фиг. 21A и 21B. Аминокислотные последовательности молекулы клона 309 CD40L-специфического Tn3.
[0038] Фиг. 22A-22F. VIB4920 обеспечивает снижение баллов индекса заболевания и уровня аутоантител у пациентов с RA как во время 12-недельного периода введения доз VIB4920, так и двенадцатинедельного периода наблюдения, следующего за введением последней дозы VIB4920. На фиг. 22A продемонстрировано изменение DAS28-CRP от исходного уровня (указаны среднее значение и стандартная ошибка) при оценке в указанные моменты времени для указанной дозы VIB4920 или плацебо. На фиг. 22B продемонстрировано изменение CDAI от исходного уровня (указаны среднее значение и стандартная ошибка)при оценке в указанные моменты времени для указанной дозы VIB4920 или плацебо. На фиг. 22C продемонстрировано изменение общей оценки пациентом от исходного уровня (указаны среднее значение и стандартная ошибка) при оценке в указанные моменты времени для указанной дозы VIB4920 или плацебо. На фиг. 22D продемонстрировано изменение общей оценки врачом от исходного уровня (указаны среднее значение и стандартная ошибка) при оценке в указанные моменты времени для указанной дозы VIB4920 или плацебо. На фиг. 22E продемонстрировано изменение балла по шкале оценки Vectra DA от исходного уровня (указаны среднее значение и стандартная ошибка) при оценке в указанные моменты времени для указанной дозы VIB4920 или плацебо. На фиг. 22F продемонстрирован результат измерения процентного значения снижения титров антител к RF, измеряемых с помощью ELISA, в указанные моменты времени для каждой указанной дозы VIB4920 или плацебо.
Фиг. 23A-23C. VIB4920 влияет на количество болезненных/опухших суставов и CRP у пациентов с RA. Влияние VIB4920 поддавалось выявлению в ходе клинического испытания фазы 1b у пациентов с RA во время как фазы введения доз, так и 12-недельного периода наблюдения после введения доз. На фиг. 23A продемонстрировано изменение количества болезненных суставов у субъектов с RA от исходного уровня при указанных дозах и в указанные моменты времени. На фиг. 23B продемонстрировано изменение количества опухших суставов у субъектов с RA от исходного уровня при указанных дозах и в указанные моменты времени. На фиг. 23C продемонстрировано изменение у субъектов с RA отношения уровней CRP при указанных дозах и в указанные моменты времени к исходному уровню. Показано среднее значение и стандартная ошибка для каждого.
ПОДРОБНОЕ ОПИСАНИЕ
[0039] В данном документе описан VIB4920 и его применимость в способах подавления иммунного ответа, опосредованного B-клетками, в способах лечения аутоиммунных заболеваний или нарушений, в способах снижения выраженности воспаления, в способах снижения уровня аутоантител у пациента, в способах снижения показателя активности заболевания, представляющего собой RA, у пациента, в способах обеспечения снижения уровня аутоантител к RF у пациента, в способах снижения баллов по шкале оценки по встречаемости генной сигнатуры плазматических клеток у пациента и в способах индуцирования иммунной толерантности в отношении заместительной терапии у пациента.
[0040] Если VIB4920 применяют для лечения аутоиммунного заболевания или нарушения, VIB4920 можно применять для лечения круговой алопеции, анкилозирующего спондилита, антифосфолипидного синдрома, аутоиммунной болезни Аддисона, аутоиммунных заболеваний надпочечной железы, аутоиммунной гемолитической анемии, аутоиммунного гепатита, аутоиммунного оофорита и орхита, синдрома Шегрена, псориаза, атеросклероза, диабетической и других ретинопатий, ретролентальной фиброплазии, возрастной макулярной дегенерации, неоваскулярной глаукомы, гемангиом, гиперплазий щитовидной железы (включая болезнь Грейвса), трансплантации и хронического воспаления роговой оболочки и других тканей, сепсиса, ревматоидного артрита, перитонита, болезни Крона, реперфузионного повреждения, септической лихорадки, эндoтоксинового шока, муковисцидоза, эндокардита, псориаза, артрита (например, псориатического артрита), анафилактического шока, ишемической болезни органов, реперфузионного повреждения, повреждения спинного мозга и отторжения аллотрансплантата, аутоиммунной тромбоцитопении, заболевания Бехчета, буллезного пемфигоида, кардиомиопатии, глютенового энтеропатического дерматита, синдрома хронической усталости и иммунной дисфункции (CFIDS), хронической воспалительной демиелинизирующей полинейропатии, синдрома Чарга-Стросса, буллезного пемфигоида, синдрома CREST, синдрома холодовой агглютинации, болезни Крона, дискоидной волчанки, первичной криоглобулинемии смешанного типа, фибромиалгии-фибромиозита, гломерулонефрита, заболевания Грейвса, синдрома Гийена-Барре, реакции "трансплантат против хозяина", тиреоидита Хашимото, идиопатического фиброза легкого, идиопатической тромбоцитопенической пурпуры (ITP), IgA-нефропатии, ювенильного артрита, красного плоского лишая, эритематозной волчанки, болезни Меньера, смешанное заболевание соединительной ткани, рассеянного склероза опосредованного заболеванием связанным с IgG4, 1 типа или иммуно-опосредованного сахарного диабета, миастении гравис, вульгарной пузырчатки, пернициозной анемии, нодозного полиартериита, воспаления нескольких хрящей, полигландулярных синдромов, ревматической полимиалгии, полимиозита и дерматомиозита, первичной aгаммаглобулинемии, первичного холангиолитического цирроза печени, псориатического артрита, болезни Рейно, синдрома Рейтера, ревматоидного артрита, саркоидоза, склеродермии, синдрома Шегрена, синдрома мышечной скованности, системной эритематозной волчанки, артериита Такаясу, темпорального артериита/гигантоклеточного артериита, язвенного колита, увеита, ANCA-ассоциированного васкулита, других васкулитов, таких как герпетиформный дерматозный васкулит, витилиго, отторжение трансплантата солидного органа, реакция "трансплантат против хозяина", падение чувствительности группы реакционно-способных антител у реципиентов с трансплантатом почки, трансплантация островковых клеток и аллогенная трансплантация гематопоэтических стволовых клеток, фокально-сегментарный гломерулосклероз (FSGS), виды гломерулонефрита.
[0041] VIB4920, более конкретно, можно применять для лечения RA, системной эритематозной волчанки (SLE), миозита, антифосфолипидного синдрома, аутоиммунного гепатита, фокально-сегментарного гломерулосклероза (FSGS), волчаночного нефрита, воспалительных миопатий, идиопатической тромбоцитопенической пурпуры (ITP), системного склероза, васкулита, кожной волчанки, аутоиммунной гемолитической анемии, миастении гравис, заболевания, связанного с IgG4, или синдрома Шегрена. Кроме того, VIB4920 можно применять для лечения реакции "трансплантат против хозяина" и/или для снижения или предотвращения отторжения трансплантата, представляющего собой орган или ткань.
[0042] Лечение аутоиммунного заболевания или нарушения можно осуществлять в форме подавления иммунного ответа, опосредованного B-клетками или T-клетками, которое может представлять собой снижение уровня антител с переключенным классом, снижение уровня подмножеств циркулирующих B-клеток, снижение активности в плазме крови или снижение содержания плазматических клеток и встречаемости генной сигнатуры плазматических клеток. Лечение аутоиммунного заболевания или нарушения может представлять собой обеспечение снижения содержания маркеров воспаления. Маркеры воспаления могут представлять собой один или несколько из уровней аутоантител, содержания плазматических клеток (PC) или встречаемости генной сигнатуры PC (сигнатура характеризуется экспрессией генов IGHA1, IGJ, IGKC, IGKV4-1 и TNFRSF17), содержания подмножеств циркулирующих B-клеток и антител с переключенным классом. Лечение аутоиммунного заболевания или нарушения может представлять собой снижение выраженности клинических признаков и симптомов, таких как клинические признаки и симптомы, измеренные в результате общей оценки пациентом или врачом. Клинические признаки и симптомы могут включать один или несколько из артрита, боли, усталости, лихорадки, плохого самочувствия, высыпания, слабости или признаков дисфункции органов, таких как протеинурия или утрата функции почки.
[0043] Если способ представляет собой способ снижения уровня аутоантител у пациента при лечении от аутоиммунного нарушения, аутоантитела могут представлять собой антинуклеарные антитела, например, у пациента при лечении от SLE, синдрома Шегрена, воспалительной миопатии или системного склероза. Антинуклеарные антитела могут представлять собой одно или несколько из аутоантител к SSA/Ro или SSB-La (SLE или синдром Шегрена), антител к dsDNA (SLE), антител к Smith (SLE), антител к топоизомерaзе (системный склероз) или антител к гистонам (SLE). Если способ представляет собой способ снижения уровня аутоантител у пациента при лечении от аутоиммунного нарушения, аутоантитела могут представлять собой антитела к микросомам печени-почек типа 1, например, у пациента при лечении от аутоиммунного гепатита. Если способ представляет собой способ снижения уровня аутоантител у пациента при лечении от аутоиммунного нарушения, аутоантитела могут представлять собой антитела к никотиновому ацетилхолиновому рецептору или мышечно-специфической киназе, например, у пациента при лечении от миастении гравис. Если способ представляет собой способ снижения уровня антител у пациента при лечении при трансплантации, антитела могут представлять собой аллоантитела.
[0044] Снижение уровня аутоантител у пациента при лечении от аутоиммунного нарушения может представлять собой снижение процента аутоантител до уровня, который является на по меньшей мере 20% меньшим, чем уровень до введения VIB4920. Оно может представлять собой снижение процента аутоантител до уровня, составляющего по меньшей мере 30%, по меньшей мере 40%, по меньшей мере 50%, по меньшей мере 60%, по меньшей мере 70% или по меньшей мере 80% относительно уровней аутоантител до лечения с помощью VIB4920. Снижения уровня аутоантител можно достичь за промежуток времени, составляющий от месяца до трех месяцев от начала введения VIB4920.
[0045] Если аутоиммунное заболевание или нарушение представляет собой RA, лечение ревматоидного артрита может представлять собой обеспечение снижения одного или нескольких из следующего: уровня аутоантител к RF, антител к цитруллинированному пептиду, балла по шкале оценки по уровню биомаркера Vectra DA (балла по шкале оценки по уровню биомаркера Vectra DA, который представляет собой совокупный балл по уровням экспрессии интерлейкина-6, рецептора фактора некроза опухоли типа I, молекулы 1 клеточной адгезии сосудов, эпидермального фактора роста, фактора A роста эндотелия сосудов, YKL-40, матриксной металлопротеиназы 1, MMP-3, CRP, сывороточного амилоида A, лептина и резистина), встречаемости сигнатуры плазматической клетки (PC), уровня C-реактивного белка (CRP) сыворотки крови, DAS28-CRP или клинического индекса активности заболевания (CDAI), или может представлять собой снижение числа болезненных суставов, интенсивности болезненности суставов, числа опухших суставов или интенсивности опухания суставов. Если аутоиммунное заболевание или нарушение представляет собой RA, лечение может представлять собой достижение ACR20, ACR50 или ACR70.
[0046] Лечение аутоиммунного заболевания или нарушения может характеризоваться снижением выраженности клинических симптомов заболевания или нарушения на по меньшей мере 20% или снижением выраженности воспаления, или снижением уровня биомаркеров заболевания или нарушения относительно их уровней до лечения с помощью VIB4920. Снижение выраженности любого из таких симптомов, или воспаления, или уровня биомаркеров может представлять собой снижение выраженности симптомов или воспаления, или уровня биомаркеров, составляющее по меньшей мере 50% относительно их уровней до начала лечения с помощью VIB4920. Снижение может быть таким, что аутоиммунное заболевание или нарушение характеризуется как находящееся в ремиссии.
[0047] Дополнительно, если аутоиммунное заболевание или нарушение представляет собой ревматоидный артрит, тогда лечение аутоиммунного заболевания или нарушения может обеспечивать снижение уровня аутоантител к RF у пациента до уровней, которые составляют примерно по меньшей мере 20%, по меньшей мере 30%, по меньшей мере 40%, по меньшей мере 45%, по меньшей мере 50%, по меньшей мере 60%, по меньшей мере 75% или по меньшей мере 80% относительно уровней аутоантител к RF до лечения с помощью VIB4920. Если аутоиммунное заболевание или нарушение представляет собой ревматоидный артрит, тогда лечение аутоиммунного заболевания или нарушения может представлять собой снижение DAS28-CRP, и снижение DAS28-CRP может являться таким, что имеется скорректированная средняя разность, составляющая по меньшей мере -1,2 или по меньшей мере -1,5, или по меньшей мере -2,0, или по меньшей мере -2,2. Дополнительно, если аутоиммунное заболевание или нарушение представляет собой ревматоидный артрит, тогда лечение аутоиммунного заболевания или нарушения может представлять собой снижение балла по шкале оценки по уровню биомаркера Vectra DA, при этом снижение может представлять собой скорректированную среднюю разность, составляющую по меньшей мере -10,3 или по меньшей мере -10,5, или по меньшей мере -10,8.
[0048] Если VIB4920 применяют в способе снижения выраженности воспаления, воспаление может являться результатом воспалительного заболевания или нарушения или может быть обусловлено повреждением или процессами, направленными на его предупреждение, например может быть обусловлено процедурой трансплантации органа или ткани. Если VIB4920 применяют в способе снижения выраженности воспаления при воспалительном заболевании или нарушении, воспалительное заболевание или нарушение может представлять собой воспалительную миопатию или волчаночный нефрит, кожную волчанку, RA, SLE, ITP, миозит, синдром Шегрена, васкулит, системный склероз, аутоиммунную гемолитическую анемию, миастению гравис или фокально-сегментарный гломерулосклероз. Если VIB4920 применяют в способе снижения выраженности воспаления, воспаление может быть обусловлено повреждением или процессами, направленными на его предупреждение, например может быть обусловлено процедурой трансплантации органа или ткани.
[0049] Если VIB4920 применяют в способе индуцирования иммунной толерантности в отношении заместительной терапии у пациента, VIB4920 может индуцировать развитие иммунной толерантности путем снижения уровня выработки нейтрализующих антител к средству заместительной терапии у пациента. Если пациент не получал лечения с помощью средства заместительной терапией или у него по другой причине не выработались нейтрализующие антитела к средству заместительной терапии, тогда индуцирование иммунной толерантности может предотвратить выработку нейтрализующих антител к средству заместительной терапии у пациента при первой встрече. Однако, если у пациента вырабатываются нейтрализующие антитела к средству заместительной терапии, тогда VIB4920 может индуцировать развитие иммунной толерантности путем снижения уровней нейтрализующих антител к средству заместительной терапии, которые вырабатываются у пациента. Уровни нейтрализующих антител у пациента, вырабатываемые к средству заместительной терапии, могут быть снижены на по меньшей мере 50%, по меньшей мере 55%, по меньшей мере 60%, по меньшей мере 65%, по меньшей мере 70, по меньшей мере 75%, по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 95% или до уровня, который не поддается выявлению. Процентное значение снижения уровней выработки нейтрализующих антител к средству заместительной терапии у пациента может представлять собой сравнение или может быть определено путем сравнения первого уровня нейтрализующих антител, выработанных в ответ на заместительную терапию, до введения первой дозы VIB4920, с вторым уровнем нейтрализующих антител, выработанных в ответ на заместительную терапию, после введения первой или второй, или третьей, или четвертой, или пятой дозы VIB4920. В качестве альтернативы, процентное значение снижения уровней выработки нейтрализующего антитела к средству заместительной терапии у пациента может представлять собой сравнение или может быть определено путем сравнения пиковых уровней нейтрализующих антител, выработанных в ответ на заместительную терапию, до введения первой дозы VIB4920, с пиковыми уровнями нейтрализующих антител, выработанных в ответ на заместительную терапию, после введения первой или второй, или третьей, или четвертой, или пятой дозы VIB4920.
[0050] Индуцирование иммунной толерантности в отношении заместительной терапии у пациента в качестве альтернативы или дополнительно может представлять собой снижение уровня ответа T-клеток на средство заместительной терапии. Если пациент не получал лечения с помощью средства заместительной терапии или получал лечение с помощью средства заместительной терапией, но у него еще отсутствует иммунный ответ T-клеток на средство заместительной терапии, тогда VIB4920 может снижать уровень ответа T-клеток у пациента путем предотвращения образования исходного ответа T-клеток на средство заместительной терапии. Однако, если у пациента имеется существующий ответ T-клеток на средство заместительной терапии, тогда VIB4920 может индуцировать развитие иммунной толерантности путем снижения уровня существующего ответа T-клеток на средство заместительной терапии. Уровень ответа T-клеток на средство заместительной терапии может быть снижен на по меньшей мере 50%, по меньшей мере 55%, по меньшей мере 60%, по меньшей мере 65%, по меньшей мере 70, по меньшей мере 75%, по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 95% или до уровня, который не поддается выявлению. Процентное значение снижения уровня ответа T-клеток на средство заместительной терапии у пациента может представлять собой сравнение или может быть определено путем сравнения первого уровня ответа T-клеток на средство заместительной терапии до введения первой дозы VIB4920 со вторым уровнем ответа T-клеток на средство заместительной терапии после введения первой или второй, или третьей, или четвертой, или пятой дозы VIB4920. В качестве альтернативы, процентное значение снижения уровня ответа T-клеток на средство заместительной терапии у пациента может представлять собой сравнение или может быть определено путем сравнения пикового уровня ответа T-клеток на средство заместительной терапии до введения первой дозы VIB4920 с пиковым уровнем ответа T-клеток на средство заместительной терапии после введения первой или второй, или третьей, или четвертой, или пятой дозы VIB4920. Снижение уровня ответа T-клеток может характеризоваться снижением уровня пролиферации и/или стимуляции CD4+ T-клеток, стимулированных средством заместительной терапии. Снижение уровня ответа T-клеток может также характеризоваться снижением уровня CD4-зависимого ответа CD8+ T-клеток на средство заместительной терапии.
[0051] Заместительная терапия, в отношении которой индуцируют развитие иммунной толерантности, может представлять собой пептидную или белковую заместительную терапию. Если средство заместительной терапии представляет собой средство пептидной или белковой терапии, оно может представлять собой средство терапии на основе фактора VIII или фактора IX, и его можно вводить для лечения пациента, страдающего от гемофилии. Если средство заместительной терапии представляет собой средство пептидной или белковой терапии, оно может представлять собой средство ферментной заместительной терапии (ERT). Если заместительная терапия представляет собой ERT, средство заместительной терапии может представлять собой агалсидазу альфа или агалсидазу бета, оно может замещать альфа-галактозидазу A, и с помощью него можно лечить пациента, страдающего от болезни Фабри. Если заместительная терапия представляет собой ERT, средство заместительной терапии может представлять собой иаронидазу, она может замещать альфа-L-идуронидазу, и с помощью нее можно лечить пациента, страдающего от мукополисахаридоза (MPS) типа 1 (также известного как синдром Гурлер, Гурлер-Шейе или Шейе в зависимости от его тяжести). Если заместительная терапия представляет собой ERT, средство заместительной терапии может представлять собой алглюкозидазу, она может замещать альфа-глюкозидазу, и с помощью нее можно лечить пациента, страдающего от болезни Помпе. Если заместительная терапия представляет собой ERT, средство заместительной терапии может представлять собой идурсульфазу, она может замещать идуронат-2-сульфатазу, и с помощью нее можно лечить пациента, страдающего от MPS типа II. Если заместительная терапия представляет собой ERT, средство заместительной терапии может представлять собой имиглуцеразу или велаглюцеразу альфа, или талиглюцеразу альфа, она может замещать бета-глюкоцереброзидазу, и с помощью нее можно лечить пациента, страдающего от болезни Гоше. Если заместительная терапия представляет собой ERT, средство заместительной терапии может представлять собой арилсульфатазу В Naglazyme, она может замещать N-ацетилгалактозамин-4-сульфатазу, и с помощью нее можно лечить пациента, страдающего от MPS типа VI. Если средство пептидной или белковой заместительной терапии представляет собой пептид или белок, индуцирование иммунной толерантности может снижать уровень выработки нейтрализующих антител к пептиду или белку и/или может снижать уровень ответа T-клеток на пептид или белок у пациента.
[0052] Дополнительно, средство заместительной терапии, в отношении которой индуцируют развитие иммунной толерантности, может представлять собой вирусный вектор, который содержит нуклеиновую кислоту, кодирующую терапевтический пептид или белок. Если средство заместительной терапии представляет собой вирусный вектор, который содержит нуклеиновую кислоту, кодирующую терапевтический пептид или белок, вирусный вектор может представлять собой аденовирусный вектор, вектор на основе аденоассоциированного вируса, ретровирусный вектор, вектор на основе поксвируса, альфавируса, вируса простого герпеса или любой другой вирусный вектор, способный к доставке нуклеиновой кислоты, кодирующей терапевтический пептид или белок, в клетки пациента. Вирусный вектор может быть модифицированным, например, путем псевдотипирования, и/или для удаления его генов дикого типа, и/или для включения нуклеиновых кислот, кодирующих терапевтический пептид или белок.
[0053] Терапевтический пептид или белок, который кодируется нуклеиновой кислотой из вирусного вектора, может представлять собой терапевтический пептид или белок, представляющий собой фактор VIII или фактор IX, или он может представлять собой средство ERT, такое как агалсидаза альфа, агалсидаза бета, идурсульфаза, иаронидаза, алглюкозидаза альфа, имиглуцераза, велаглюцераза альфа, талиглюцераза альфа или арилсульфатаза B Naglazyme.
[0054] Кроме того, если средство заместительной терапии представляет собой вирусный вектор, который содержит нуклеиновую кислоту, кодирующую терапевтический пептид или белок, тогда VIB4920 может индуцировать развитие иммунной толерантности путем снижения уровня иммунного ответа на вирусный вектор или путем снижения уровня иммунного ответа на терапевтический пептид или белок, кодируемые вирусным вектором, или как первое, так и второе. VIB4920 может индуцировать развитие иммунной толерантности в отношении вирусного вектора путем снижения уровня нейтрализующих антител и/или ответа T-клеток на вирусный вектор, либо вектор сам по себе, либо клетки, инфицированные вирусным вектором. VIB4920 может дополнительно или в качестве альтернативы индуцировать развитие иммунной толерантности в отношении средства заместительной терапии, предусматривающего вирусный вектор, путем снижения уровня нейтрализующих антител или ответа T-клеток на терапевтический пептид или белок, кодируемые нуклеиновой кислотой вирусного вектора.
[0055] VIB4920 для применения в различных способах может содержать аминокислотную последовательность, показанную на фиг. 18. VIB4920 может иметь аминокислотную последовательность, показанную на фиг. 18, или может характеризоваться наличием одной или нескольких замен аминокислотных остатков относительно аминокислотной последовательности, показанной на фиг. 18. Если VIB4920 характеризуется наличием изменений аминокислотной последовательности относительно тех, что показаны на фиг. 18, изменения могут представлять собой изменения в одном из линкеров. VIB4920 содержит линкер Gly15, отделяющий два CD40L-специфических мономера, и линкер Gly10, отделяющий CD40L-специфический мономер от последовательности HSA. Оба таких линкера или один из них могут быть изменены и могут быть заменены аминокислотной последовательностью (GmX)n, где X представляет собой серин (S), аланин (A), глицин (G), Leu (L), изолейцин (I) или валин (V); m и n представляют собой целочисленные значения; m равняется 1, 2, 3 или 4; и n равняется 1, 2, 3, 4, 5, 6 или 7. Например, один или оба линкера могут быть изменены так, чтобы они имели аминокислотную последовательность, которая содержит одну из GGGGSGGGGS, GGGGSGGGGSGGGGS, GGGGGGGGGG или GGGGGGGGGGGGGGG. Если VIB4920 имеет аминокислотную последовательность, родственную аминокислотной последовательности, показанной на фиг. 18, это может быть следствием изменений или изменений в аминокислотной последовательности HSA, слитой с двумя CD40L-специфическими мономерами. HSA, слитый с двумя CD40L-специфическими мономерами, может быть изменен на родственный HSA, слитый с двумя CD40L-специфическими мономерами Tn3, кроме по меньшей мере одной аминокислотной замены, пронумерованной относительно положения в полноразмерном зрелом HSA, в положении, выбранном из группы, состоящей из 407, 415, 463, 500, 506, 508, 509, 511, 512, 515, 516, 521, 523, 524, 526, 535, 550, 557, 573, 574 и 580; где по меньшей мере одна аминокислотная замена не предусматривает замену лизина (K) на глутаминовую кислоту (E) в положении 573. Если VIB4920 характеризуется наличием изменений аминокислотной последовательности относительно той, что показана на фиг. 18, изменения могут касаться аминокислотной последовательности одного или обоих CD40L-специфических мономеров Tn3, если только это не приводит к возникновению неблагоприятного эффекта в отношении эффективности VIB4920 in vivo, например, изменение аминокислотной последовательности является таким, что один или оба CD40L-специфических мономера Tn3 имеют аминокислотную последовательность, показанную на фиг. 19A.
[0056] Доза VIB4920, которую вводят в способах, может представлять собой дозу, составляющую от примерно 500 мг до примерно 3000 мг. Доза может составлять от примерно 750 мг до примерно 3000 мг, или от примерно 1000 мг до примерно 3000 мг, или от примерно 1500 мг до примерно 3000 мг, или от примерно 500 мг до примерно 2000 мг, или от примерно 750 мг до примерно 2000 мг, или от примерно 1000 мг до примерно 2000 мг, или от примерно 1000 мг до примерно 2500 мг, или от примерно 1000 мг до примерно 1500 мг. Доза может составлять 500 мг, 750 мг, 900 мг, 1000 мг, 1250 мг, 1500 мг, 1750 мг, 2000 мг, 2250 мг, 2500 мг или 3000 мг.
[0057] Дозу VIB4920 можно вводить приблизительно раз в две недели или можно вводить дважды в месяц. Дозу VIB4920 также можно вводить приблизительно раз в неделю или приблизительно один раз в месяц. Дозу VIB4920 можно вводить раз в 7 дней, раз в 10 дней, раз в 14 дней, раз в 15 дней, раз в 16 дней, раз в 14-10 дней, раз в 14-16 дней или раз в 30 дней. Дозу VIB4920 можно вводить путем внутривенной или подкожной инъекции.
[0058] Если вводимая доза VIB4920 представляет собой дозу, составляющую 1000 мг, 1500 мг или от примерно 1000 мг до примерно 1500 мг, тогда дозу можно вводить раз в две недели или ее можно вводить дважды в месяц. Если доза VIB4920 составляет 3000 мг, тогда дозу VIB4920 можно вводить один раз в месяц. Если доза VIB4920 составляет 500 мг или 750 мг, тогда дозу VIB4920 можно вводить один раз в две недели или в качестве альтернативы вводить дважды в месяц. Любую из таких доз можно вводить внутривенно.
[0059] Доза и схема введения доз VIB4920 могут являться такими, что любой терапевтический эффект, достигаемый в результате введения VIB4920 для лечения какого-либо аутоиммунного/воспалительного заболевания или нарушения, например, снижение уровня аутоантител, снижение балла по шкале оценки Vectra DA, снижение встречаемости сигнатуры плазматической клетки, снижение уровня CRP, снижение DAS28-CRP, снижение количества опухших суставов, снижение количества болезненных суставов, снижения CDAI, улучшение общей оценки пациентом, улучшение общей оценки врачом, достижение ACR20, достижение ACR50 или достижение ACR70, может считаться "продолжительным". "Продолжительный" эффект VIB4920 в лечении аутоиммунного/воспалительного заболевания или нарушения представляет собой эффект, при котором терапевтический эффект, достигнутый с помощью VIB4920, сохраняется (хотя VIB4920 больше не вводят) в течение по меньшей мере 4 недель, по меньшей мере 6 недель, по меньшей мере 8 недель, по меньшей мере 10 недель, по меньшей мере 12 недель, по меньшей мере 16 недель, по меньшей мере 20 недель или по меньшей мере 24 недель после введения последней дозы курса VIB4920. Курс VIB4920 может представлять собой введение дозы VIB4920, составляющей от 500 мг до 3000 мг (например, 500 мг, 750 мг, 1000 мг, 1250 мг, 1500 мг, 1750 мг, 2000 мг, 2250 мг, 2500 мг, 2750 мг или 3000 мг), в течение периода времени, составляющего от примерно 8 до 24 недель (например, 8 недель, или 10 недель, или 12 недель, или 14 недель, или 16 недель, или 18 недель, или 20 недель, или 22 недель, или 24 недель, или 2 месяца, или 4 месяца, или 6 месяцев) с интервалом введения доз один раз в 7-31 день (например, раз в 7 дней, раз в 10 дней, раз в 14 дней, раз в 15 дней, раз в 16 дней, раз в 14-10 дней, раз в 14-16 дней или раз в 30 дней).
[0060] Специалисты в данной области техники определят или смогут установить, используя не более чем обычное экспериментирование, большое количество эквивалентов конкретных вариантов осуществления, описанных в данном документе. Подразумевается, что такие эквиваленты охватываются следующей формулой изобретения.
[0061] Все публикации, патенты и заявки на патенты, упомянутые в данном описании, включены в данный документ посредством ссылки в той же степени, как если бы каждая отдельная публикация, патент или заявка на патент были специально и индивидуально указаны для включения в данный документ посредством ссылки.
ПРИМЕРЫ
Пример 1. Выделение и оптимизация CD40L-специфических белков Tn3
[0062] Tn3 представляет собой небольшой каркасный белок длиной примерно 90 аминокислот, который содержит структуры с вариантами укладки, присущими иммуноглобулину, включая петли, структурно аналогичные участкам антитела, определяющим комплементарность, которые можно рандомизировать для осуществления отбора по конкретным свойствам связывания (24).
[0063] Клоны CD40L-специфического Tn3 человека выделяли, как подробно описан в WO2013/055745 (также см. 24, 27, 50). Вкратце, отбор CD40L-специфических Tn3 человека включал пять раундов пэннинга, при этом чередовали отбор на рекомбинантном белке CD40L человека и на линии клеток СНО, экспрессирующей CD40L человека. Мышиные CD40L-специфические белки Tn3 отбирали с применением только рекомбинантного белка CD40L мыши. Гены Tn3, полученные в результате отбора, совместно клонировали в вектор экспрессии и отдельные меченные с помощью His варианты оценивали в отношении связывания CD40L путем захвата на планшетах Maxisorp, покрытых антителом к His (2 мкг/мл в PBS). Добавляли биотинилированные MegaCD40L (Enzo Biosciences, 0,5 мкг/мл) и инкубировали в течение 1,5 часа. После однократного промывания с помощью PBS/Tween, осуществляли мониторинг взаимодействия между захваченными вариантами Tn3 и CD40L с применением SA-HRP (разбавление 1:1000). Через 20 минут планшеты дважды промывали в PBS/Tween, обеспечивали развитие с помощью субстрата TMB и останавливали с помощью 2,5 M H3PO4. Поглощение измеряли при 450 нм. Созревание аффинности CD40L-специфических белков Tn3 проводили путем отбора улучшенных кандидатов из библиотек на основе фагового дисплея, в которых в CDR-подобных петлях обеспечивали возникновение случайных мутаций (24). Данная стратегия привела к получению клона 342 (фиг. 19) - улучшенного варианта клона 309 CD40L-специфического белка человека (фиг. 21A), и клона M31 - улучшенного варианта клона M13 CD40L-специфического белка мыши. Также получали дополнительные клоны CD40L-Tn3 человека, например клоны 304, 311, 320, 310, 321 и 322. См. WO 2013/055745, включенный в данный документ посредством ссылки.
[0064] Данный ряд клонов CD40L-специфического Tn3 человека характеризовали в отношении их способности к биохимическому ингибированию связывания CD40L с его рецептором (CD40). Все семь элементов из данного ряда ингибировали связывание CD40L с CD40 со значениями IC50 ниже 1 µM (фиг. 1A). Два наиболее сильных ингибитора по результатам биохимического анализа ингибирования CD40L-CD40 дополнительно оценивали в отношении ингибирования опосредованной CD40L передачи сигнала в анализе на основе клеток с применением репортерного гена. Клетки HEK-293, экспрессирующие CD40 человека и люциферазу в качестве репортерного гена для NF-kB, стимулировали с помощью рекомбинантного белка CD40L человека. Клоны 309 и 311 CD40L-специфических белков Tn3 человека дозозависимым образом ингибировали индуцированную с помощью CD40L экспрессию с репортерного гена для NF-kB в микромолярных концентрациях (фиг. 1B), отображая способность таких белков функционально ингибировать передачу сигнала с участием CD40/CD40L.
[0065] Одновременное связывания с несколькими мишенями, происходящее в случае двухвалентных антител, может приводить к заметному увеличению авидности. Для изучения влияния наличия двух валентностей на активность CD40L-специфических белков Tn3, две копии идентичных модулей Tn3 (309-309; например, фиг. 21B) связывали посредством гибкого спейсера, содержащего Gly4Ser, с образованием тандемного двухвалентного слитого белка. Первичные B-клетки человека повышают уровень экспрессии маркера активации CD86 в ответ на стимуляцию посредством CD40. Предварительная инкубация мононуклеарных клеток периферической крови человека (PBMC) с клоном 309 одновалентного CD40L-специфического Tn3 приводила к ингибированию повышения уровня экспрессии CD86 на CD19+ B-клетках человека дозозависимым образом (фиг. 1C). Поразительно, что по сравнению с одновалентным Tn3 наблюдалось почти 1000-кратное улучшение в отношении активности при применении двухвалентной конструкции в данном анализе с применением первичных клеток (фиг. 1C). Кроме того, созревание аффинности (посредством осуществления случайного мутагенеза в вариабельных CDR-подобных петельных участках) клона 309, приводящее к получению клона 342, обеспечивало значительное улучшение аффинности связывания с CD40L (309: 190 нм; 342: 1,4 нм) и демонстрировало примерно 300-кратное улучшение в отношении активности ингибирования взаимодействий CD40-CD40L (фиг. 1D). Клон 342 с созревшей аффинностью также подвергали скринингу в отношении связывания с группой родственных представителей семейства TNF, включая Fas, TNFα, TNFβ и OX40L, и выяснили, что он селективно связывает CD40L. См. фиг. 1E.
[0066] Наконец, как с другими альтернативными каркасными технологиями и по причине их небольшого размера, ожидается, что при систематичном введении полностью очищенные молекулы Tn3 будут демонстрировать очень быстрый клиренс из кровотока. Для улучшения фармакокинетических свойств белков, CD40-специфические белки Tn3 сливали с сывороточным альбумином (28, 29). Мышиный заменитель двухвалентного CD40L-специфического белка Tn3, M13-M13, характеризовался периодом полувыведения у мышей при систематической доставке, составляющим <30 минут. Слияние мышиного сывороточного альбумина (MSA) с белком Tn3 M13-M13 привело к 65-кратному повышению периода полувыведения из сыворотки крови и 345-кратному понижению клиренса (таблица 1).
Таблица 1. Слияние с сывороточным альбумином приводит к сильному улучшению в отношении периода полувыведения молекулы Tn3 M13-M13
CD-1 мыши возрастом 5-7 недель получали одну инъекцию молекулы двухвалентного CD40L-специфического Tn3 с MSA или без него (n=12/группа; 10 мг/кг, i. v.). Образцы крови отбирали из групп по n=3 мыши/группа в различные моменты временив диапазоне от 15 минут до 72 часов и определяли уровни циркулирующего белка Tn3 с помощью ELISA.
[0067] На основе таких наблюдений молекулу двухвалентного CD40L-специфического Tn3 человека, VIB4920, составляли из тандемно расположенных клонов 342 CD40L-специфических белков Tn3 для обеспечения оптимальной активности, слитых с сывороточным альбумином человека (HSA) для обеспечения улучшенного периода полувыведения (фиг. 1F; фиг. 18).
[0068] Чтобы лучше понять молекулярную природу взаимодействия между CD40L и VIB4920, проводили кристаллографические исследования. CD40L-специфический Tn3 (342) и растворимые белки CD40L экспрессировали, очищали, сокристаллизировали и определяли структуру при разрешении 2,8 Å. Молекулярная структура тримерного растворимого CD40L в виде комплекса с Tn3 показана на фиг. 2A. Поверхность контакта с CD40L состоит из аминокислот, большинство из которых принадлежат второй модифицированной петле Tn3, включая восемь из десяти водородных связей, образованных между молекулами (в пределах расстояния, составляющего 3,5 Å, фиг. 2B). Первичное определение характеристик молекулы показало, что клон 342 Tn3 был способен к блокированию взаимодействия между CD40L и CD40. Для визуализации подробностей такого действия структуру комплекса CD40/CD40L совмещали со структурой комплекса клон 342/CD40L (фиг. 1G). При совмещении продемонстрировали, что клон 342 и CD40 имеют общие сайты связывания на CD40L. Следовательно, VIB4920 конкурирует с CD40 и предотвращает его ассоциацию с CD40L.
Пример 2. VIB4920 блокирует активацию и дифференцировку B-клеток человека
[0069] Передача сигнала с участием CD40 была подробно охарактеризована и включает активацию большого количества разных путей и факторов транскрипции, включая NF-kB (30), который может способствовать активации, пролиферации и дифференцировки B-клеток (31). Таким образом, способность VIB4920 ингибировать опосредованную CD40L активацию NF-kB изучали с применением линии клеток, которая экспрессирует CD40 человека и люциферазу в качестве репортерного гена для NF-kB-. Стимулирование данной линии клеток с помощью рекомбинантного CD40L человека или с помощью клеток, экспрессирующих CD40L, индуцирует активацию NF-kB. VIB4920 был способен эффективно блокировать передачу сигнала с участием CD40 при применении данной линии клеток, о чем свидетельствовало дозозависимое ингибирование активации NF-kB (IC50: 0,899 нм; фиг. 3A).
[0070] Покоящиеся B-клетки постоянно экспрессируют костимулирующую молекулу CD86 на низких уровнях, уровень экспрессии которой быстро повышается после активации, включая активацию посредством CD40 (32). Первичные PBMC человека стимулировали с помощью рекомбинантного CD40L человека и экспрессию CD86 оценивали на B-клетках через 16 часов посредством проточной цитометрии. VIB4920 полностью предотвращал опосредованное CD40L повышение уровня экспрессии CD86 первичными B-клетками человека (фиг. 3B).
Пример 3. VIB4920 не индуцирует агрегацию тромбоцитов in vitro
[0071] mAb, направленные на CD40L, не получили одобрения в результате клинических испытаний в связи с проблемами в отношении безопасности, по большей мере из-за тромбоэмболических усложнений, связанных с перекрестным связыванием CD40L на поверхности клеток тромбоцитов. Для подтверждения того, что VIB4920, у которого отсутствует Fc-домен, не индуцирует агрегацию тромбоцитов, авторы настоящего изобретения оценивали его влияние на промытые тромбоциты человека in vitro. Как описано ранее, при предварительном получении в виде комплекса с sCD40L, mAb к CD40L (IgG1 человека) демонстрировали существенно выраженную способность индуцировать агрегацию тромбоцитов (фиг. 3F). Ответ был быстрым, при этом иммунные комплексы mAb-sCD40L индуцировали агрегацию 80% тромбоцитов за 8 минут. Важно, что предварительная инкубация тромбоцитов с антителом, которое блокирует FcγRIIa (mAb IV.3), предотвращала агрегацию, опосредованную mAb-иммунным комплексом, что согласовывалось с существенной ролью Fc-рецепторов в данном ответе (Фиг. 3F). Напротив, при нескольких протестированных концентрациях VIB4920 не демонстрировал склонности индуцировать агрегацию тромбоцитов в данном анализе (фиг. 3G). Такие данные указывают на то, что отсутствие Fc-участка в конструкциях на основе Tn3 может снизить риск агрегации тромбоцитов и возникновения тромбоэмболических явлений, которые наблюдались при использовании терапевтических антител к CD40L в клинической практике. В подтверждение данного результата, по данным (не показаны) длительного (семимесячного) исследования на приматах, отличных от человека, которым вводили дозу VIB4920, составляющую не более 300 мг/кг, не выявили неблагоприятных результатов в отношении функции тромбоцитов, например, не выявили неблагоприятных результатов в тестах на D-димеры (для мониторинга наличия тромбов), PFA100 (для оценки функции тромбоцитов) или комплекс TAT (тромбин-антитромбиновый комплекс).
Пример 4. CD40L-специфические белки Tn3 модулируют виды иммунного ответа in vivo
[0072] Центральная роль CD40L в стимуляции видов T-зависимого иммунного ответа хорошо охарактеризована (9, 35). Следовательно, для оценки способности слитого белка на основе Tn3-MSA блокировать виды гуморального иммунного ответа in vivo применяли T-зависимую модель иммунизации. По причине недостаточной гомологии последовательности между CD40L человека и мыши для таких исследований применяли мышиный заменитель CD40L-специфического Tn3, M31.
[0073] Для тестирования того, являлся ли слитый белок Tn3-MSA способным блокировать виды иммунного ответа in vivo, мышам вводили красные клетки крови овцы (SRBC) и затем обрабатывали ежедневно в дни 9-13 после введения с помощью белка Tn3, специфически связывающего CD40L. Иммунный ответ у обработанных животных оценивали в день 14 путем количественной оценки B-клеток зародышевого центра в селезенке и лимфатических узлах посредством проточной цитометрии. Как ожидалось, иммунизация с помощью SRBC у мышей, обработанных контролем, привела к значительному увеличению частоты встречаемости зародышевых центров (фиг. 4A). Дозозависимое снижение частоты встречаемости B-клеток зародышевого центра наблюдали у мышей, обработанных с помощью слитого белка CD40L-специфического Tn3-MSA (фиг. 4A). При дозе, составляющей 30 мг/кг, слитый белок CD40L-специфического Tn3-MSA индуцировал полное подавление образования зародышевых центров, что было оценено по почти полному отсутствию B-клеток зародышевых центров в селезенке и лимфатических узлах, эквивалентному контрольным неиммунизированным мышам. Другие субпопуляции клеток не были нарушены введением лекарственного средства, включая специфические популяции Т-клеток, гарантируя, что наблюдаемые эффекты не были вторичными по отношению к истощению по Т-клеткам (данные не показаны). Кроме того, уровни IgG к SRBC отражали уровень ответа зародышевых В-клеток. при этом значительное снижение титров SRBC-специфических Ig происходило при более высоких дозах Tn3, специфически связывающего CD40L (фиг. 4B).
Пример 5. VIB4920 хорошо переносится здоровыми добровольцами
[0074] Свойства VIB4920 в отношении безопасности оценивали у людей в ходе исследования фазы 1a (Ph1a), проводимого на здоровых взрослых в возрасте 18-49 лет. Субъекты были включены в семь когорт с увеличением однократной дозы, при этом дозы VIB4920 составляли не более 3000 мг, и были рандомизированы в отношении применения VIB4920 или плацебо (фиг. 5A и 5B). Первичную конечную точку - безопасность и переносимость, - измеряли по частоте возникновения нежелательных явлений, возникающих при лечении (TEAE), и серьезных нежелательных явлений, возникающих при лечении (TESAE). Во всех когортах по введению дозы TEAE в общем характеризовались малой клинической значимостью, при этом наиболее частые явления включали назофарингит (обычная простуда) и головную боль (таблица 2).
Таблица 2. VIB4920 демонстрирует хороший профиль безопасности у людей
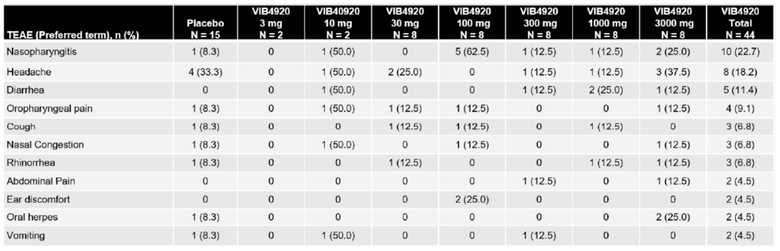
Наиболее распространенные TEAE, встречающиеся у по меньшей мере 2 субъектов в исследовании Ph1a здоровых добровольцев.
[0075] Важно, что общая доля в процентах субъектов с одним или несколькими TEAE, связанными с исследуемым продуктом, являлась сопоставимой для общей группы VIB4920 (40,9%) и группы плацебо (33,3%). Дополнительно, не было реакций, связанных с инфузией, тяжелых инфекций или смертельных исходов, и сообщалось только об одном TESAE, переломе большеберцовой кости, в группе плацебо. Примечательно, что в данном исследовании Ph1a не наблюдали клинически значимого свертывания или аномалий функции тромбоцитов после лечения с помощью VIB4920.
Пример 6. VIB4920 демонстрирует предпочтительный профиль PK/PD у здоровых добровольцев
[0076] В дополнение к оценке профиля безопасности VIB4920, в ходе исследования Ph1a также оценивали фармакокинетические (PK) и фармакодинамические (PD) конечные точки. Профиль PK VIB4920 после введения одной внутривенной дозы, составляющей 3-3000 мг, был линейным, при этом уровень воздействия возрастал пропорционально дозе (фиг. 6A). Среднее значение конечного периода полувыведения молекулы составлял 8 дней, при этом период полувыведения при наиболее высокой дозе составлял не более 10,1+/-1,87 дня.
[0077] CD40L представляет собой трансмембранный белок; однако, он может отщепляться и сбрасываться как активированными T-клетками, так и тромбоцитами. Растворимый CD40L (sCD40L) представляет собой тример с молекулярной массой 18 кДа, который у здоровых доноров выявляют на низких уровнях и на повышенных - в кровотоке пациентов с аутоиммунным заболеванием (36, 37). Измерение уровней sCD40L после введения VIB4920 представляет собой потенциальный показатель уровня связывания мишени, поскольку sCD40L, связанный с VIB4920, может сохраняться и накапливаться в кровотоке. Как ожидалось, после введения VIB4920 в плазме крови наблюдалось дозозависимое повышение уровня общего sCD40L (фиг. 6B), что свидетельствует о связывании мишени. Время для достижения максимального уровня общего sCD40L в плазме крови повышалось с 11,5 до 84 дней при увеличении дозы с 3 мг до 3000 мг, указывая на то, что связывание мишени сохранялось в течение более длительного периода в группе с наиболее высокой дозой.
Пример 7. Сниженные уровни вариантов ADA наблюдали у здоровых субъектов, получающих более высокие дозы VIB4920
[0078] Биологические лекарственные средства по своей природе являются высокоспецифичными/селективными; однако, они представляют собой сложные молекулы, способные вызывать иммунный ответ. Варианты антител к лекарственному средству (ADA) представляют собой показатель иммуногенности терапевтического средства. У здоровых добровольцев варианты ADA выявляли у абсолютного большинства пациентов, получавших низкие дозы VIB4920 (фиг. 7). Более конкретно, у 18 из 20 субъектов, которым вводили дозу в диапазоне 3-100 мг, имелись поддающиеся выявлению уровни вариантов ADA, при этом у 10 из этих индивидуумов были продемонстрированы высокие титры ADA (значение титра, превышающее медианное значение 480). Напротив, частота встречаемости вариантов ADA являлась в значительной степени сниженной при более высоких уровнях VIB4920 (фиг. 7), и только у 1 из 8 субъектов в группе с дозой 3000 мг вырабатывались поддающиеся выявлению титры антител к лекарственному средству. Снижение частоты встречаемости ADA, наблюдаемое при высоких дозах VIB4920, подтверждает иммуномодуляторное свойство молекулы. Дополнительно, низкие доли в процентах и титры вариантов ADA могут означать лучше переносимое, более эффективное терапевтическое средство.
Пример 8. VIB4920 ингибирует зависимый от T-клеток ответ с вовлечением антител у здоровых добровольцев
[0079] VIB4920 дополнительно оценивали в отношении его способности влиять на виды гуморального иммунного ответа у здоровых субъектов. Данную оценку проводили путем определения эффекта VIB4920 в отношении зависимого от T-клеток ответа с вовлечением антител (TDAR), который индуцировали путем иммунизации с помощью гемоцианина из моллюска Megathura crenulata (KLH). Для здоровых субъектов во всех группах лечения осуществляли две процедуры иммунизации путем подкожного введения KLH: (первая) за 14 дней до введения дозы либо VIB4920, либо плацебо, и (вторая) через 15 дней после введения дозы (фиг. 5B). Как для антител IgM, так и для антител IgG, вырабатываемых к KLH, мониторинг осуществляли до дня 113.
[0080] TDAR происходил согласно ожидаемой динамике у субъектов, которых лечили с помощью плацебо, т. е. динамике, включающей резкое повышение титров IgG к KLH в день 22 (одна неделя после повторной иммунизации), пиковые уровни IgG, наблюдаемые в день 29, и затем падение уровня KLH-специфических антител IgG к концу периода мониторинга (фиг. 8A). Кроме того, и в соответствии с предыдущими публикациями, во вторичном ответе на KLH в группе, которую лечили с помощью плацебо, доминировали IgG с в общем намного более умеренным повышением KLH-специфических IgM, выявляемых после повторного введения (фиг. 8B) (38-41).
[0081] Как и ожидалось, здоровые добровольцы, которых лечили с помощью VIB4920 при низких дозах, имели титры антител к KLH, близкие к титрам группы, которую лечили с помощью плацебо. Напротив, здоровые добровольцы, которых лечили с помощью VIB4920 при высоких дозах, демонстрировали в значительной степени сниженный уровень вторичного ответа на KLH, такой, что в день 43 присутствовало статистически значимое снижение уровня IgG к KLH начиная с дозы, составляющей 300 мг (p=0,035), и повышение при дозах 1000 мг (p=0,002) и 3000 мг (p<0,001). Необходимо отметить, что уровень IgG к KLH был сниженным на 78% и 86% по сравнению с таковым в случае плацебо в день 43 в когортах 1000 мг и 3000 мг соответственно (фиг. 8C). В группе с наибольшей дозой 7 из 8 субъектов имели не поддающиеся выявлению титры IgG к KLH в день 43, что позволяет сделать предположение о близком к полному подавлении гуморального иммунного ответа с помощью VIB4920.
Пример 9. Иммуносупрессия с помощью VIB4920 опосредована ингибированием пролиферации B-клеток и видов ответа плазматических клеток
[0082] Механизм, с помощью которого VIB4920 подавляет виды вторичного иммунного ответа, был лучше определен путем сбора периферической крови у субъектов до и после иммунизации и определения характеристик подмножеств циркулирующих лимфоцитов посредством проточной цитометрии. У здоровых субъектов, которых лечили с помощью плацебо, повторная иммунизация индуцировала пролиферацию B-клеток, которую обнаруживали путем выявления повышения частоты встречаемости Ki67+ CD19+ B-клеток в кровотоке при посещении в день 22, т. е. через 7 дней после повторного введения (фиг. 9A).
[0083] У субъектов, которые получали высокую дозу VIB4920, и до повторного введения исходная частота встречаемости пролиферирующих B-клеток была сниженной по сравнению с группой, которую лечили с помощью плацебо. Это соответствует предложенному механизму действия молекулы. Кроме того, в когортах, получающих высокую дозу VIB4920, пролиферативный ответ B-клеток после иммунизации был в значительной степени нарушенным, что демонстрировалось отсутствием повышения уровня Ki67+ B-клеток. См. когорту 3000 мг, одна неделя после введения (фиг. 9A). С помощью дополнительного фенотипирования выявили, что наибольшее влияние VIB4920 на пролиферирующие B-клетки отмечалось в пределах популяции IgD-CD27+ клеток памяти с переключенным изотипом (фиг. 9B). Такие данные соответствуют результатам TDAR, которые демонстрируют, что VIB4920 оказывает влияние в виде подавления на выработку IgG в ответ на вторичное введение.
[0084] Мониторинг изменений в уровне экспрессии генов также осуществляли в периферической крови у субъектов, которых лечили с помощью плацебо или VIB4920, до и после повторной иммунизации с помощью KLH. Конкретно, генную сигнатуру плазматической клетки (PC), представляющую собой точную и надежную сигнатуру, позволяющую выявлять даже слабовыраженные изменения частоты встречаемости циркулирующих PC (42), применяли для подтверждения наличия определенных изменений уровня экспрессии генов. Согласуясь с результатами исследования TDAR, иммунизация индуцировала существенное повышение балла по шкале оценки по встречаемости генной сигнатуры PC в цельной крови у субъектов, которых лечили с помощью плацебо, в первую неделю после повторного введения, который возвращался к исходному уровню за две недели (фиг. 9C). В когорте с наибольшей дозой VIB4920 (3000 мг) балл по шкале оценки по встречаемости генной сигнатуры PC в периферической крови был в значительной степени пониженным по сравнению с субъектами, которых лечили с помощью плацебо, до повторного введения KLH (фиг. 9C). Важно, что у добровольцев, получающих высокую дозу VIB4920, не было повышения балла по шкале оценки по встречаемости генной сигнатуры PC после повторной иммунизации. Эти данные отображают механизм действия VIB4920 и демонстрируют его сильную способность подавлять виды ответа B-клеток и PC.
Пример 10. Введение нескольких доз VIB4920 пациентам с RA является безопасным и хорошо переносимым
[0085] После установления того, что VIB4920 характеризуется приемлемым профилем безопасности и демонстрирует подтверждение механизма действия у здоровых добровольцев, провели клиническое исследование Ph1b для доказательства концепции с введением нескольких возрастающих доз с вовлечением взрослых пациентов с RA с умеренной или сильной активностью. Пациентов с RA лечили с помощью VIB4920 (75 мг, n=8; 500 мг, n=10; 1000 мг, n=12; или 1500 мг, n=12) или плацебо (n=15), которые вводили путем внутривенной (i. v.) инфузии раз в две недели в течение 12 недель (фиг. 10). Пациентов затем наблюдали в течение дополнительных 12 недель после лечения. Ключевые конечные точки, измеренные на неделе 12, включали безопасность, переносимость, параметры PK, варианты ADA и изменение активности заболевания (DAS28-CRP), а также дополнительные биомаркеры, такие как уровень аутоантител к RF, уровень C-реактивного белка (CRP) сыворотки крови и балл по шкале оценки Vectra-DA. Пятьдесят три пациента завершили 12 недель лечения; два пациента (один в группе VIB4920 75 мг и один в группе VIB4920 1500 мг) прервали лечение по причине возникновения нежелательных явлений, один пациент в группе плацебо отозвал информированное согласие, и один пациент в группе VIB4920 75 мг не прошел последующего наблюдения. Основные демографические и клинические характеристики исследуемой популяции на исходном уровне представлены на фиг. 11.
[0086] В целом, VIB4920 являлся в общем безопасным и хорошо переносимым со сбалансированным распределением наблюдаемых TEAE между группой плацебо и четырьмя группами с введением доз активного вещества. Сообщалось, что наиболее распространенными TEAE были диарея, гипергидроз, инфекция верхних дыхательных путей и инфекция мочевыводящих путей, каждое из которых наблюдали у 3 пациентов (7,1%). См. фиг. 12. Не было отмечено никаких тромботических нежелательных явлений или клинически значимых нарушений свертывания крови. Сообщали об одном нежелательном явлении (предпочтительный термин "энцефалит") являющемся серьезным и угрожающим жизни, которое наблюдали в группе с дозой 1500 мг после 6 доз исследуемого лекарственного средства. Не было идентифицировано какого-либо этиологического инфекционного агента, и через несколько месяцев после прекращения приема VIB4920 аналогичные симптомы возобновились, и пациенту впоследствии был поставлен диагноз метастатическая меланома головного мозга.
Пример 11. VIB4920 демонстрировал линейный профиль PK и дозозависимым образом снижал уровни вариантов ADA у пациентов с RA
[0087] У пациентов с RA, получавших низкую дозу VIB4920 наблюдали варианты ADA, аналогичные таковым у здоровых добровольцев из исследования Ph1a, получавших низкую дозу VIB4920. У трех из 8 (37,5%) пациентов с RA, получавших 75 мг VIB4920, и 3 из 10 (30%) пациентов с RA, получавших 500 мг VIB4920, возникли варианты ADA (фиг. 13B). В группе с дозой 75 мг VIB4920 у 2 из 8 субъектов возникли поддающиеся выявлению уровни вариантов ADA во время фазы лечения; у всех 3 субъектов в группе лечения 500 мг VIB4920 возникли поддающиеся выявлению уровни вариантов ADA после лечения (фиг. 13C). В группе с дозой 1000 мг во время периода лечения не выявили вариантов ADA; у одного субъекта имелся поддающийся выявлению уровень ADA после фазы лечения. Не выявляли вариантов ADA в группе с дозой 1500 мг (фиг. 13B), что позволяет сделать предположение о том, что VIB4920 эффективно подавляет ответ в виде ADA при более высоких дозах.
Пример 12. VIB4920 снижает активность заболевания у пациентов с RA
[0088] Баллы по DAS-28/CRP определяли чтобы понять, понижал ли VIB4920 активность заболевания у пациентов с RA во время клинического испытания фазы 1b. Балл по DAS-28/CRP представляет собой совокупный балл по шкале оценки клинической активности заболевания, применяемый при RA, в котором учитывается следующее: число опухших суставов, число болезненных суставов, уровни CRP и общая оценка состояния здоровья пациентом. VIB4920 в значительной степени снижал активность заболевания, количественно определяемую с помощью балла по DAS28-CRP, у пациентов с RA при более высоких дозах (фиг. 14A и фиг. 22A). На неделю 12 после начала лечения скорректированное среднее изменение от исходного уровня DAS28-CRP (SE) составляло: -2,3 (0,3) в группе VIB4920 1500 мг, -2,2 (0,3) в группе VIB4920 1000 мг, -1,2 (0,3) в группе VIB4920 500 мг, 0,1 (0,4) в группе VIB4920 75 мг и -1,0 (0,3) в группе плацебо (фиг. 14A). Неожиданно, данное наблюдаемое снижение балла по DAS28-CRP у пациентов с RA сохранялось в течение по меньшей мере дополнительных 12 недель после введения последней дозы VIB4920. (См. фигуру 22A, в частности дни посещения 113, 141 и 169). Эффект VIB4920 в отношении DAS28-CRP был быстрым, при этом снижение балла становилось заметным ко дню 15, что происходило после только одной дозы лекарственного средства.
[0089] Более того, снижение активности заболевания при двух наивысших дозах VIB4920 при сравнении с плацебо было как клинически, так и статистически значимым; скорректированная средняя разность на неделе 12 (SE) для группы VIB4920 1500 мг составляла -1,4 (0,4) и для группы VIB4920 1000 мг составляла -1,2 (0,4), p-значение составляло 0,002 и 0,006 соответственно. С применением модели линейной зависимости доза-ответ статистически значимая зависимость доза-ответ была продемонстрирована для DAS28CRP (p<0,001). Значимый результат был в основном обеспечен за счет групп лечения 1000 мг и 1500 мг; для 500 мг и 75 мг практически не было показано преимущества относительно плацебо (фиг. 15A). Что касается клинического ответа у отдельного пациента, 75% пациентов в группе 1500 мг и 50% пациентов в группе с дозой 1000 мг достигли балла по DAS28-CRP, составлявшего 3,2 или менее, на неделе 12, указывающего на то, что у них была низкая активность заболевания или клиническая ремиссия при первичной конечной точке. См. фиг. 16.
Пример 13. VIB4920 обеспечивает снижение уровня иммунологических и воспалительных биомаркеров у пациентов с RA
[0090] Эффект VIB4920 в отношении иммунологических и воспалительных биомаркеров определяли с применением теста для анализа крови Vectra DA. Тест Vectra DA является коммерчески доступным и валидированным тестом, с помощью которого измеряют содержание 12 биомаркеров (молекулы адгезии, факторы роста, цитокины, матриксные металлопротеиназы, скелетные белки, гормоны и белки острой фазы) активности заболевания и объединяет их в единый балл для оценки ключевых механизмов и путей, которые обуславливают активность заболевания, представляющего собой RA. При дозах, составляющих 1500 мг и 1000 мг, VIB4920 в значительной степени снижал балл по шкале оценки по уровням ряда биомаркеров Vectra DA как в период продолжительностью 12 недель, в течение которого VIB4920 вводили раз в две недели (фиг. 14E), так и в период наблюдения продолжительностью 12 недель, в течение которого VIB4920 больше не вводили (фиг. 22E). Скорректированная средняя разность для VIB4920 при дозе 1500 мг при сравнении с плацебо (неделя 12) составляла 14,4 (-21,5, -7,2), p=0,001, и скорректированная средняя разность для VIB4920 при дозе 1000 мг при сравнении с плацебо (неделя 12) составляла -10,3 (-17,4, -3,3), p=0,018 (фиг. 14E).
[0091] Результаты определения эффективности хорошо согласовывались с другими конечными точками, которые оценивали в данном испытании (включая клинический индекс активности заболевания - CDAI, количество болезненных и опухших суставов, общую оценку пациентом и врачом и уровень CRP в сыворотке крови), что подтверждает, что 1000 и 1500 мг представляют собой клинически эффективные дозы в данном исследовании (фиг. 14B-14D и фиг. 17A-17C; см. также фиг. 22B-22D и фиг. 23A-23C).
Пример 14. VIB4920 обеспечивает значительное снижение уровня аутоантител к ревматоидному фактору у субъектов с RA
[0092] Аутоантитела к ревматоидному фактору (RF) представляют собой семейство аутоантител, вырабатываемых к Fc-фрагменту IgG. Их уровень является повышенным при RA и они ассоциируются с неблагоприятным прогнозом. Учитывая механизм действия VIB4920, оценивали его влияние на титры аутоантител у субъектов с RA. Примечательно, что VIB4920 в значительной степени снижал титры RF при уровнях доз, составляющих 500, 1000 и 1500 мг (фиг. 14F), в течении периода лечения продолжительностью 12 недель с введением раз в две недели. Кроме того, и что неожиданно, сниженные титры RF при уровнях доз, составляющих 1000 и 1500 мг, сохранялись в течение периода наблюдения продолжительностью 12 недель после введения последней дозы VIB4920 (фиг. 22F). Снижение титров RF в ответ на VIB4920 от исходного уровня было заметным уже в день 29, при этом высокие дозы VIB4920 снижали титры RF примерно на 50% ко дню 85. При применении модели Emax VIB4920 демонстрирует статистически значимую зависимость доза-ответ в отношении снижения титров RF от исходного уровня (p< 0,001) (фиг. 15B).
Пример 15. Способы
[0093] Анализ с применением репортера для NF-kB.
[0094] Клетки HEK293, экспрессирующие люциферазу в качестве репортера для NF-kB-(Panomics), конструировали так, чтобы они стабильно экспрессировали полноразмерный CD40R человека. Клетки высевали при плотности, составляющей 5×104 клеток/лунка, в 96-луночные планшеты, покрытые поли-D-лизином (BD Biosciences), и стимулировали с помощью рекомбинантного белка megaCD40L (1,5 мкг/мл, Enzo Biosciences) или клеток субклона D1.1 Jurkat, сверхэкспрессирущих CD40L (ATCC), в течение 16-24 часов в присутствии или в отсутствие контроля или CD40L-специфических Tn3 в указанных концентрациях. Люминесценцию выявляли с применением системы для анализа с применением люциферазы Bright-Glo (Promega) на считывающем устройстве для планшетов SpectraMax M5 (Molecular Devices).
[0095] Анализ повышения уровня экспрессии CD86
[0096] Кровь человека собирали у здоровых доноров после получения информированного согласия, утвержденного институциональным наблюдательным советом MedImmune. Мононуклеарные клетки периферической крови выделяли из CPT-пробирок (BD Biosciences) после центрифугирования. PBMC (2,5-5,0×105 клеток/лунка) стимулировали в 96-луночном круглодонном планшете с помощью рекомбинантного megaCD40L (100 нг/мл, Enzo Biosciences) в течение 16-18 часов в присутствии CD40L-специфических Tn3 или mAb (клон 5c8), как указано. Для оценки уровня экспрессии CD86 на CD19+ B-клетках применяли проточную цитометрию. Применяли следующие антитела: к CD86 (клон 2331, BD Pharmingen), к CD19 (клон HIB19, BD Pharmingen).
[0097] Анализ B-клеток человека
[0098] Выделяли PBMC. Общие B-клетки подвергали отрицательному отбору с применением технологии разделения клеток MACS (Miltenyi Biotec), которая обычно обеспечивает уровень чистоты более 95%. Очищенные B-клетки периферической крови культивировали при плотности, составляющей от 0,5 до 1,0 × 105 B-клеток на лунку, в 96-луночных круглодонных планшетах в конечном объеме полной среды, составляющем 150 µл. Культуральная среда для экспериментов с B-клетками представляла собой RPMI 1640 (Invitrogen) с добавлением 10% FCS, пенициллина-стрептомицина (100 ед./мл пенициллина, 100 µг/мл стрептомицина), 2-меркаптоэтанола (55 µM), L-глутамина (2 мM) и HEPES (5 мM). На начальном этапе культивирования B-клетки стимулировали с помощью комбинации IL-21 (33 нг/мл, PeproTech Inc.) и megaCD40L (1,5 нм, Enzo Biosciences) с или без F(ab')2 к IgM (5,0 µг/мл, Jackson ImmunoResearch Laboratories). Уровень размножения B-клеток количественно определяли путем измерения уровня ATP в день 3 или день 4 культивирования с применением люминесцентного анализа Cell Titer-Glo (Promega) в соответствии с инструкциями изготовителя. Дифференцировку PC количественно определяли в день 7 посредством проточной цитометрии. Клетки собирали в течение фиксированного периода времени и PC определяли как CD19+ IgD-CD38высок. клетки.
[0099] Мышиная модель иммунизации с помощью SRBC
[00100] Мышей Balb/c (Jackson Laboratories) иммунизировали в день 0 с помощью 0,2 мл SRBC (Colorado Serum Company) путем интраперитонеальной инъекции после извлечения непосредственно из бутылки. Контроль(30 мг/кг) или CD40L-специфические Tn3 (не более 30 мг/кг, как указано) вводили ежедневно в дни 9-13 (внутривенно). Частоту встречаемости B-клеток зародышевого центра в селезенке количественно определяли в день 14 посредством проточной цитометрии. B-клетки GC определяли как CD19+B220+ Fas+PNA+ B-клетки.
[00101] Анализ агрегации тромбоцитов
[00102] Кровь человека собирали у здоровых доноров в пробирки, содержащие ACD-раствор B, содержащий лимонную кислоту, декстрозу и натрий. После центрифугирования, две трети богатой тромбоцитами плазмы крови переносили в полипропиленовую пробирку и инкубировали в течение 10 минут с апиразой (2 Ед./мл) для предотвращения активации тромбоцитов во время обработки. Тромбоциты осаждали и ресуспендировали в модифицированном буфере Тироде (137 мM NaCl, 2,7 мM KCl, 1 мM MgCl2, 5,6 мМ декстрозы, 3,3 мM NaH2PO4, 20 мM HEPES, 0,1% BSA и pH 7,4).
[00103] Получали иммунный комплекс (IC) путем смешивания mAb (h5c8 или отрицательный контроль антитела) или Tn3, специфически связывающего CD40L, с hCD40L (источник - клетка 293) в течение 5 минут при комнатной температуре. В некоторых экспериментах тромбоциты предварительно инкубировали с антителом к CD32a (IV.3) в течение пяти минут перед добавлением IC. Анализ агрегации тромбоцитов проводили в соответствии с инструкциями изготовителя с перемешиванием при 37°C в четырехканальном оптическом агрегометре для тромбоцитов (модель 700, Chrono-Log, Хейвертаун, Пенсильвания). Мониторинг светопроницаемости осуществляли в течение 12-20 минут после смешивания промытых тромбоцитов с агонистами.
[00104] Субъекты и схема исследования для Ph1a
[00105] Рандомизированное, слепое, плацебо-контролируемое исследование фазы I проводили на здоровых взрослых в возрасте 18-49 лет, включая женщин, не способных к деторождению (NCT02151110). Субъектов рандомизировали на семь когорт по введению дозы (3, 10, 30, 100, 300, 1000 или 3000 мг) и вводили дозы последовательно, основываясь на протоколе исследования и рекомендациях от комитета по увеличению дозы (DEC), который проводил рассмотрение данных по безопасности и переносимости, полученные для текущей когорты по введению дозы, а также накопленные данные для предыдущих когорт по введению дозы. У субъектов индуцировали TDAR путем осуществления двух отдельных процедур иммунизации путем введения 1 мг KLH подкожно. Первую процедуру иммунизации путем введения KLH осуществляли в течение периода скрининга, за 14 дней до введения дозы либо VIB4920, либо плацебо, и вторую процедуру иммунизации путем введения KLH осуществляли в день 15 после введения дозы либо VIB4920, либо плацебо. Проводили три промежуточных анализа в соответствии с протоколом, когда все субъекты в когорте 5 (300 мг), когорте 6 (1000 мг) и когорте 7 (3000 мг) завершали день 43 соответственно.
[00106] Анализ PK VIB4920
[00107] VIB4920 в плазме крови человека с K2EDTA измеряли с применением валидированного метода сэндвич-ELISA, в котором после каждой стадии инкубации следовали стадии промывки с помощью 1 х PBS/0,1% Tween 20 (PBST) для удаления несвязанных компонентов. Вкратце, микротитрационные планшеты Nunc покрывали мышиным моноклональным антителом к VIB4920 (MedImmune) при концентрации 1 мкг/мл на ночь при 2-8°C. Стандарты, контроли качества (QC) и образцы, содержащие VIB4920, разводили до минимально необходимого разведения (MRD) метода, составляющего 1:50, в 0,5% бычьем сывороточном альбумине (BSA)/PBST перед добавлением в планшет. После 2-часовой инкубации в планшет добавляли 1 мкг/мл крысиного антитела к VIB4920 (MedImmune), меченного биотином, и инкубировали в течение 1 часа. Связывающийся комплекс визуализировали с помощью последовательных стадий инкубации со связанной со стрептавидином пероксидазой хрена (HRP, GE Healthcare) и субстратом пероксидазы, представляющим собой тетраметилбензидин SureBlue™ (TMB) (KPL, Inc.). Развитие окраски останавливали с помощью 0,2 М серной кислоты перед анализом при 450 нм на считывающем устройстве для микропланшетов. Количественный диапазон составлял от 0,05 до 1,60 мкг/мл; пробы с показателями выше количественного диапазона разбавляли объединенной плазмой крови с K2EDTA, чтобы довести концентрацию до диапазона, измеряемого данным методом.
[00108] Количественное определение sCD40L
[00109] Образцы плазмы крови собирали для измерения концентраций sCD40L в течение периода скрининга и в дни 1, 2, 3, 5, 8, 15, 22, 29, 43, 57, 85 и 113. Общее количество растворимого CD40L (свободного sCD40L и sCD40L, связанного с VIB4920) в плазме крови человека с K2EDTA измеряли с помощью набора для ELISA-анализа sCD40L человека Platinum (eBioscience), который был модифицирован в соответствии с требованиями программы и для которого провели квалификацию, чтобы удостовериться в его правильности и прецизионности. Вкратце, стандарты, QC и образцы, содержащие sCD40L, разбавляли до MRD метода, составляющего 1:50, в разбавителе для анализа, содержащем 0,5% BSA/PBST и VIB4920, чтобы удостовериться в сопоставимости и согласованности результатов. Стадии промывки с помощью PBST следовали за каждой стадией инкубации для удаления несвязанных компонентов. Разбавленные образцы добавляли в планшет, предварительно покрытый антителом к sCD40L, и инкубировали в течение 1,5 часа. Затем добавляли конъюгированные с HRP антитела к sCD40L человека для обеспечения связывания с sCD40L, захваченным антителом покрытия. Связывающийся комплекс визуализировали путем последовательного добавления субстрата пероксидазы, представляющего собой TMB, и стоп-раствора (фосфорной кислоты) перед анализом при 450 и 540 нм на считывающем устройстве для микропланшетов. Количественный диапазон составлял от 6,25 до 400,00 нг/мл; пробы с показателями выше количественного диапазона разбавляли объединенной плазмой крови с K2EDTA, чтобы довести концентрацию до диапазона, измеряемого методом.
[00110] Измерение уровня ADA
[00111] Присутствие вариантов ADA к VIB4920 в плазме крови человека с K2EDTA определяли с применением валидированного метода сэндвич-ELISA, в котором стадии промывки с помощью PBST следовали за каждой стадией инкубации для удаления несвязанных компонентов. Вкратце, QC и образцы разбавляли до MRD метода, составляющего 1:60, в разбавителе для анализа, содержащем 0,5% BSA/PBST, добавляли в промытый планшет, покрытый белком G, Pierce™ (ThermoFisher) и инкубировали 2 часа. Специфическое выявление ADA к VIB4920 осуществляли с помощью инкубации в течение ночи с 1 мкг/мл меченного биотином VIB4920, приготовленного в разбавителе для анализа. Связывающийся комплекс визуализировали с помощью последовательных стадий инкубации со связанной со стрептавидином HRP (GE Healthcare) и субстратом пероксидазы, представляющим собой TMB, SureBlue™ (KPL, Inc.). Развитие окраски останавливали с помощью 0,2 М серной кислоты перед анализом при 450 нм на считывающем устройстве для микропланшетов. Каждый образец подвергали трехуровневому процессу, в котором ответ образца сначала сравнивали с определенным статистическими методами граничным значением OD: если значение для образца находилось на уровне этого значения или выше него, образец считали потенциально положительным, и если ниже - образец определяли как отрицательный в отношении ADA. Потенциально положительные образцы подвергали второй, конкурентной оценке в присутствии избыточного количества VIB4920; образцы с процентом ингибирования на уровне определенной статистическими методами граничной точки подтверждения или выше нее определяли как подтвержденные положительные и использовали для оценки титра. Образцы со значениями, находящимися ниже граничной точки подтверждения, считали отрицательными в отношении ADA к VIB4920. Титрованные образцы серийно разбавляли в объединенной плазме крови человека с K2EDTA до уровня ниже граничного значения скрининга, и результат титра представляли в виде величины, обратной значению наивысшего разведения, при котором в результате измерения образец был определен как положительный, до его определения в результате измерения как отрицательного.
[00112] Оценка антител к KLH
[00113] Антитела IgG к гемоцианину из моллюска Megathura crenulata (KLH) в сыворотке крови человека измеряли с применением валидированного метода сэндвич-ELISA, в котором стадии промывки с помощью PBST следовали за каждой стадией инкубации для удаления несвязанных компонентов; для всех стадий использовали объем 100 мкл/лунка. Вкратце, микротитрационные планшеты nunc покрывали с помощью 3 мкг/мл KLH (Immucothel, biosyn Arzneimittel GmbH), полученного в 1 x PBS, pH 7,2, на ночь при 2-8°C. Стандарты и QC, состоящие из смеси девяти моноклональных антител IgG к KLH различного изотипа и аффинности (AstraZeneca), и образцы, содержащие антитела к KLH, разводили до MRD метода, составляющего 1: 250, в 0,5% BSA/PBST перед добавлением в планшет. После 2-часовой инкубации в планшет добавляли конъюгированные с HRP мышиные антитела к IgG человека (Invitrogen) и инкубировали в течение 1 часа для специфического выявления антител IgG к KLH. Связывающийся комплекс визуализировали путем последовательных стадий добавления субстрата пероксидазы, представляющего собой TMB, и стоп-раствора (0,2 М серная кислота) перед анализом при 450 на считывающем устройстве для микропланшетов. Количественный диапазон составлял от 163,30 до 10000,00 нг/мл; образцы с показателями выше количественного диапазона разбавляли сывороткой крови, чтобы довести концентрацию до диапазона, измеряемого методом.
[00114] Проточная цитометрия в Ph1a
[00115] Кровь собирали в пробирки Cytochex BCT (Streck), отправляли в центральную лабораторную службу Covance (Индианаполис, Индиана) и тестировали посредством проточной цитометрии с применением валидированного метода. Вкратце, клетки окрашивали меченными флуорохромом антителами к CD45 (клон HI30), CD19 (клон HIB19), IgD (клон IA6-2), CD27 (клон M-T271) и CD38 (клон HIT2, все BD) для идентификации популяций В-клеток. Затем клетки обрабатывали с помощью FACSPerm2 (Becton Dickenson) и окрашивали в отношении внутриклеточной экспрессии Ki67 (клон KI67, Biolegend) для измерения количества пролиферирующих клеток.
[00116] Сигнатура PC
[00117] Генную сигнатуру PC определяли, как описано ранее (Streicher 2014). Вкратце, общую РНК выделяли из пробирок для крови PAXgene с применением набора PAXgene Blood RNA (Qiagen). Для TaqMan qPCR cDNA получали с применением набора SuperScript III First-Strand Synthesis SuperMix (Life Technologies) и случайных праймеров. Образцы получали с применением набора TaqMan Pre-Amp Master Mix и анализировали с помощью системы ПЦР в реальном времени BioMark. Авторы настоящего изобретения рассчитали значения ΔΔCt с применением среднего значения по 2 референтным генам (β-актина и GAPDH) и исходного уровня экспрессии у каждого пациента в качестве контроля. Значения кратности изменения определяли путем расчета 2-ΔΔCt.
[00118] Пациенты и схема исследования для Ph1b
[00119] Рандомизированное слепое плацебо-контролируемое исследование фазы 1b проводили с участием пациентов в возрасте 18-70 лет, у которых диагностировали RA в соответствии с критериями EULAR/ACR (Aletaha et al. 2010) в течение по меньшей мере 6 месяцев до включения в исследование. Субъекты характеризовались активностью от умеренной до тяжелой, определяемой по баллу по DAS28-CRP, составляющей по меньшей мере 3,2 во время скрининга, и наличием по меньшей мере 4 опухших и 4 болезненных суставов во время скрининга и рандомизации. Во время скрининга пациенты были положительными либо в отношении ревматоидного фактора (RF-IgM ≥ 14 единиц/мл), либо в отношении антител к цитруллинированному пептиду (ACPA). Пациенты получали метотрексат (МТ) в дозе, составляющей 7,5-25 мг в неделю, или, в случае непереносимости MTX, другое обычное DMARD в течение по меньшей мере 12 недель и в стабильной дозе в течение по меньшей мере 6 недель до скрининга. Предшествующее лечение биологическими средствами (за исключением ритуксимаба или других средств, разрушающих В-клетки), назначаемыми при RA, являлось приемлемым при условии, что перед рандомизацией в настоящем исследовании было проведено надлежащее вымывание. Пациентов лечили с помощью плацебо (n=15) или VIB4920 (75 мг, n=8; 500 мг n=10; 1000 мг n=12; или 1500 мг n=12), вводимых путем i. v. инфузии раз в две недели в течение 12 недель с последующим наблюдением после лечения продолжительностью 12 недель. Измерения балла по шкале оценки VECTRA-DA проводили на базе Crescendo Bioscience (Сан-Франциско, Калифорния), и измерения уровня аутоантитела к RF проводили на базе центральной лабораторной службы Covance (Принстон, Нью-Джерси).
[00120] Статистический анализ
[00121] Для оценки влияния лечения на размножение первичных В-клеток человека, дифференцировку плазматических клеток и ответ B-клеток GC в модели SRBC использовали двусторонний непарный t-тест Стьюдента. Для сравнения балла по шкале оценки по встречаемости генной сигнатуры в нескольких моментах времени в случае VIB4920 и плацебо применяли U-тест Манна-Уитни (фиг. 9C). Статистические тесты и построение графиков выполняли с применением программного обеспечения Graphpad Prism. Зависимость доза-ответ в отношении изменения значения DAS28-CRP и RF от исходного уровня в день 85 анализировали с применением подхода MCP-Mod, с включением соответствующего исходного уровня в качестве ковариаты, с тремя предварительно заданными моделями-кандидатами для зависимости доза-ответ (линейная, Emax и модель Emax Хилла). Тестирование сигнала доза-ответ было скорректировано по множественности с поправкой на величину ошибки от эффекта множественных сравнений, находящейся на уровне 0,10. Окончательную модель выбирали среди тех, которые были обозначены как значимые на основе информационных критериев Акаике. Изменения от исходного уровня значений DAS28-CRP, RF, Vectra DA, CDAI, количества болезненных суставов, количества опухших суставов, общей оценки пациентом и врачом, а также CRP сыворотки крови анализировали с применением смешанной модели для анализа повторных измерений (MMRM) с включением соответствующего результата на исходном уровне в качестве ковариаты.
Ссылки, цитируемые в настоящем раскрытии
1. S. Sugio, A. Kashima, S. Mochizuki, M. Noda, K. Kobayashi, Crystal structure of human serum albumin at 2.5 A resolution. Protein Eng 12, 439-446 (1999)
2. S. Lederman et al., Identification of a novel surface protein on activated CD4+ T cells that induces contact-dependent B cell differentiation (help). The Journal of experimental medicine 175, 1091-1101 (1992).
3. M. Croft, R. M. Siegel, Beyond TNF: TNF superfamily cytokines as targets for the treatment of rheumatic diseases. Nature reviews. Rheumatology 13, 217-233 (2017).
4. T. M. Foy, F. H. Durie, R. J. Noelle, The expansive role of CD40 and its ligand, gp39, in immunity. Seminars in immunology 6, 259-266 (1994).
5. J. B. Splawski, P. E. Lipsky, CD40-mediated regulation of human B-cell responses. Research in immunology 145, 226-234; обсуждение 244-229 (1994).
6. R. J. Armitage et al., Molecular and biological characterization of a murine ligand for CD40. Nature 357, 80-82 (1992).
7. P. Garside et al., Visualization of specific B and T lymphocyte interactions in the lymph node. Science 281, 96-99 (1998).
8. D. Hollenbaugh et al., The human T cell antigen gp39, a member of the TNF gene family, is a ligand for the CD40 receptor: expression of a soluble form of gp39 with B cell co-stimulatory activity. The EMBO journal 11, 4313-4321 (1992).
9. R. J. Noelle et al., A 39-kDa protein on activated helper T cells binds CD40 and transduces the signal for cognate activation of B cells. Proceedings of the National Academy of Sciences of the United States of America 89, 6550-6554 (1992).
10. T. M. Foy et al., gp39-CD40 interactions are essential for germinal center formation and the development of B cell memory. The Journal of experimental medicine 180, 157-163 (1994).
11. T. M. Foy et al., In vivo CD40-gp39 interactions are essential for thymus-dependent humoral immunity. II. Prolonged suppression of the humoral immune response by an antibody to the ligand for CD40, gp39. The Journal of experimental medicine 178, 1567-1575 (1993).
12. S. Han et al., Cellular interaction in germinal centers. Roles of CD40 ligand and B7-2 in established germinal centers. Journal of immunology 155, 556-567 (1995).
13. T. Kawabe et al., The immune responses in CD40-deficient mice: impaired immunoglobulin class switching and germinal center formation. Immunity 1, 167-178 (1994).
14. R. C. Allen et al., CD40 ligand gene defects responsible for X-linked hyper-IgM syndrome. Science 259, 990-993 (1993).
15. A. Aruffo et al., The CD40 ligand, gp39, is defective in activated T cells from patients with X-linked hyper-IgM syndrome. Cell 72, 291-300 (1993).
16. J. P. DiSanto, J. Y. Bonnefoy, J. F. Gauchat, A. Fischer, G. de Saint Basile, CD40 ligand mutations in x-linked immunodeficiency with hyper-IgM. Nature 361, 541-543 (1993).
17. D. T. Boumpas et al., A short course of BG9588 (anti-CD40 ligand antibody) improves serologic activity and decreases hematuria in patients with proliferative lupus glomerulonephritis. Arthritis and rheumatism 48, 719-727 (2003).
18. A. C. Grammer et al., Abnormal germinal center reactions in systemic lupus erythematosus demonstrated by blockade of CD154-CD40 interactions. The Journal of clinical investigation 112, 1506-1520 (2003).
19. W. Huang et al., The effect of anti-CD40 ligand antibody on B cells in human systemic lupus erythematosus. Arthritis and rheumatism 46, 1554-1562 (2002).
20. V. L. Patel, J. Schwartz, J. B. Bussel, The effect of anti-CD40 ligand in immune thrombocytopenic purpura. British journal of haematology 141, 545-548 (2008).
21. S. E. McKenzie et al., The role of the human Fc receptor Fc gamma RIIA in the immune clearance of platelets: a transgenic mouse model. Journal of immunology 162, 4311-4318 (1999).
22. J. E. Freedman, CD40-CD40L and platelet function: beyond hemostasis. Circulation research 92, 944-946 (2003).
23. L. Robles-Carrillo et al., Anti-CD40L immune complexes potently activate platelets in vitro and cause thrombosis in FCGR2A transgenic mice. Journal of immunology 185, 1577-1583 (2010).
24. J. S. Swers et al., Multivalent scaffold proteins as superagonists of TRAIL receptor 2-induced apoptosis. Molecular cancer therapeutics 12, 1235-1244 (2013).
25. R. Vazquez-Lombardi et al., Challenges and opportunities for non-antibody scaffold drugs. Drug discovery today 20, 1271-1283 (2015).
26. R. N. Gilbreth, B. M. Chacko, L. Grinberg, J. S. Swers, M. Baca, Stabilization of the third fibronectin type III domain of human tenascin-C through minimal mutation and rational design. Protein engineering, design & selection : PEDS 27, 411-418 (2014).
27. V. Oganesyan et al., Fibronectin type III domains engineered to bind CD40L: cloning, expression, purification, crystallization and preliminary X-ray diffraction analysis of two complexes. Acta crystallographica. Section F, Structural biology and crystallization communications 69, 1045-1048 (2013).
28. D. Muller et al., Improved pharmacokinetics of recombinant bispecific antibody molecules by fusion to human serum albumin. The Journal of biological chemistry 282, 12650-12660 (2007).
29. B. J. Smith et al., Prolonged in vivo residence times of antibody fragments associated with albumin. Bioconjugate chemistry 12, 750-756 (2001).
30. I. Berberich, G. L. Shu, E. A. Clark, Cross-linking CD40 on B cells rapidly activates nuclear factor-kappa B. Journal of immunology 153, 4357-4366 (1994).
31. M. Kaileh, R. Sen, NF-kappaB function in B lymphocytes. Immunological reviews 246, 254-271 (2012).
32. M. Roy et al., Studies on the interdependence of gp39 and B7 expression and function during antigen-specific immune responses. European journal of immunology 25, 596-603 (1995).
33. R. Ettinger et al., IL-21 induces differentiation of human naive and memory B cells into antibody-secreting plasma cells. Journal of immunology 175, 7867-7879 (2005).
34. J. L. Karnell et al., CD19 and CD32b differentially regulate human B cell responsiveness. Journal of immunology 192, 1480-1490 (2014).
35. B. R. Renshaw et al., Humoral immune responses in CD40 ligand-deficient mice. The Journal of experimental medicine 180, 1889-1900 (1994).
36. K. Kato et al., The soluble CD40 ligand sCD154 in systemic lupus erythematosus. The Journal of clinical investigation 104, 947-955 (1999).
37. R. K. Vakkalanka et al., Elevated levels and functional capacity of soluble CD40 ligand in systemic lupus erythematosus sera. Arthritis and rheumatism 42, 871-881 (1999).
38. P. Bird, J. E. Calvert, P. L. Amlot, Distinctive development of IgG4 subclass antibodies in the primary and secondary responses to keyhole limpet haemocyanin in man. Immunology 69, 355-360 (1990).
39. M. E. Devey, K. M. Bleasdale-Barr, P. Bird, P. L. Amlot, Antibodies of different human IgG subclasses show distinct patterns of affinity maturation after immunization with keyhole limpet haemocyanin. Immunology 70, 168-174 (1990).
40. J. Ferbas et al., A novel assay to measure B cell responses to keyhole limpet haemocyanin vaccination in healthy volunteers and subjects with systemic lupus erythematosus. British journal of clinical pharmacology 76, 188-202 (2013).
41. J. S. Miller et al., Diminished neo-antigen response to keyhole limpet hemocyanin (KLH) vaccines in patients after treatment with chemotherapy or hematopoietic cell transplantation. Clinical immunology 117, 144-151 (2005).
42. K. Streicher et al., The plasma cell signature in autoimmune disease. Arthritis & rheumatology 66, 173-184 (2014).
43. F. J. Dumont, IDEC-131. IDEC/Eisai. Current opinion in investigational drugs 3, 725-734 (2002).
44. W. Schuler et al., Efficacy and safety of ABI793, a novel human anti-human CD154 monoclonal antibody, in cynomolgus monkey renal allotransplantation. Transplantation 77, 717-726 (2004).
45. F. Langer et al., The role of CD40 in CD40L- and antibody-mediated platelet activation. Thrombosis and haemostasis 93, 1137-1146 (2005).
46. C. Heeschen et al., Soluble CD40 ligand in acute coronary syndromes. The New England journal of medicine 348, 1104-1111 (2003).
47. F. Mach, U. Schonbeck, G. K. Sukhova, E. Atkinson, P. Libby, Reduction of atherosclerosis in mice by inhibition of CD40 signalling. Nature 394, 200-203 (1998).
48. T. Oura et al., Long-term hepatic allograft acceptance based on CD40 blockade by ASKP1240 in nonhuman primates. American journal of transplantation : official journal of the American Society of Transplantation and the American Society of Transplant Surgeons 12, 1740-1754 (2012).
49. M. Watanabe et al., ASKP1240, a fully human anti-CD40 monoclonal antibody, prolongs pancreatic islet allograft survival in nonhuman primates. American journal of transplantation : official journal of the American Society of Transplantation and the American Society of Transplant Surgeons 13, 1976-1988 (2013).
50. D. Spencer et al., O-xylosylation in a recombinant protein is directed at a common motif on glycine-serine linkers. J Pharm Sci 102, 3920-3924 (2013).
| название | год | авторы | номер документа |
|---|---|---|---|
| АНТИТЕЛА К CD40 ДЛЯ ПРИМЕНЕНИЯ В ЛЕЧЕНИИ СИНДРОМА ШЕГРЕНА | 2018 |
|
RU2790558C2 |
| ЛЕЧЕНИЕ АУТОИММУННЫХ ЗАБОЛЕВАНИЙ АНТИТЕЛАМИ CD154 | 2015 |
|
RU2695443C2 |
| ПРИМЕНЕНИЕ ОДНОКРАТНОЙ ДОЗЫ CD20-СПЕЦИФИЧЕСКИХ СВЯЗЫВАЮЩИХ МОЛЕКУЛ | 2006 |
|
RU2421242C2 |
| СПОСОБЫ ОПРЕДЕЛЕНИЯ ИЗОТИПА АНТИТЕЛ ПРОТИВ ЛЕКАРСТВЕННЫХ ПРЕПАРАТОВ | 2011 |
|
RU2574976C2 |
| МОНОКЛОНАЛЬНОЕ АНТИТЕЛО-АНТАГОНИСТ ПРОТИВ CD40 ЧЕЛОВЕКА | 2007 |
|
RU2491295C2 |
| СПОСОБЫ И КОМПОЗИЦИИ ДЛЯ СНИЖЕНИЯ ИММУНОГЕННОСТИ С ПОМОЩЬЮ НЕ ПРИВОДЯЩИХ К ДЕПЛЕЦИИ В-КЛЕТОЧНЫХ ИНГИБИТОРОВ | 2020 |
|
RU2821892C2 |
| CD40L-СПЕЦИФИЧНЫЕ КАРКАСНЫЕ СТРУКТУРЫ, ПРОИСХОДЯЩИЕ ИЗ Tn3, И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2012 |
|
RU2704992C2 |
| ПРИМЕНЕНИЕ АНТИ-CD40-АНТИТЕЛ | 2006 |
|
RU2442606C2 |
| СПОСОБ ЛЕЧЕНИЯ ПОВРЕЖДЕНИЯ СУСТАВОВ | 2006 |
|
RU2457860C2 |
| Антитела к CD38 и фармацевтические композиции на их основе для лечения аутоиммунного заболевания, опосредованного аутоантителами | 2020 |
|
RU2809565C2 |
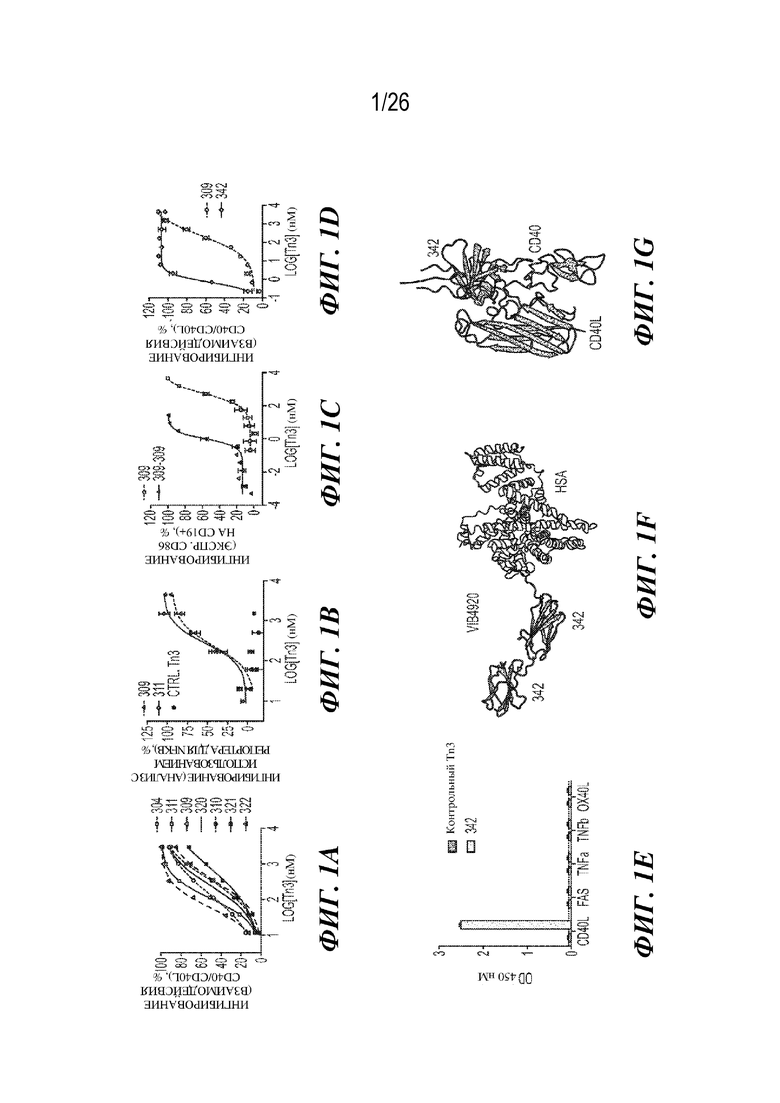
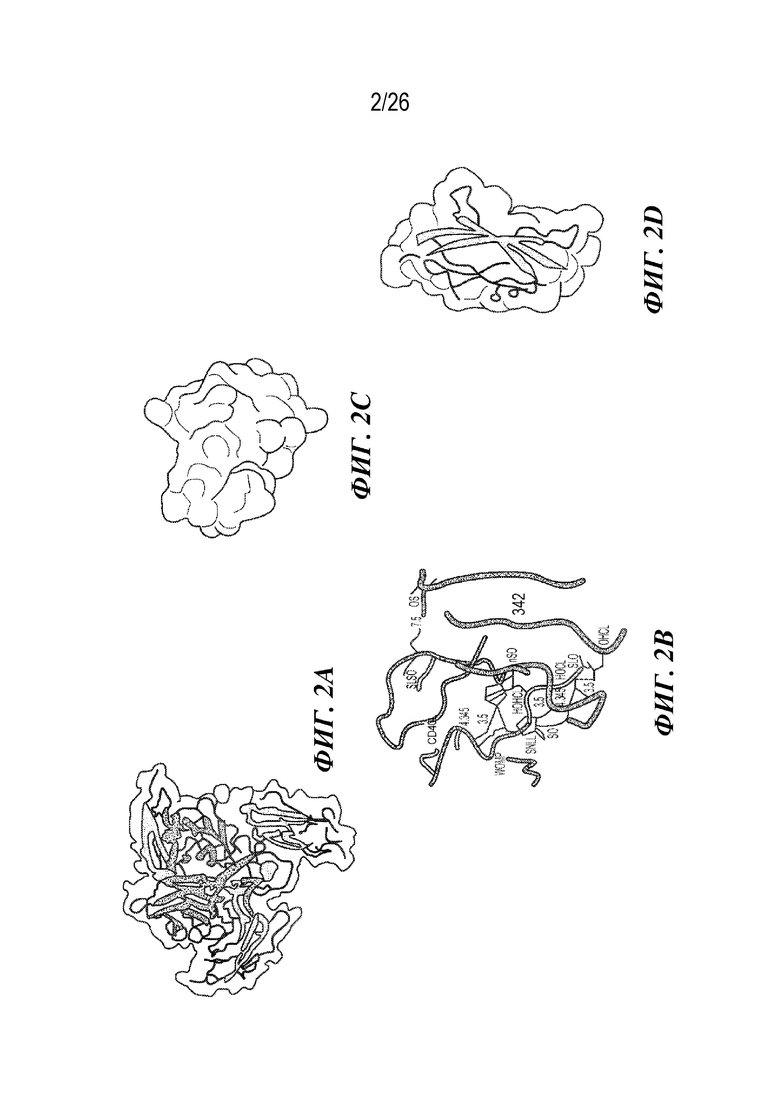
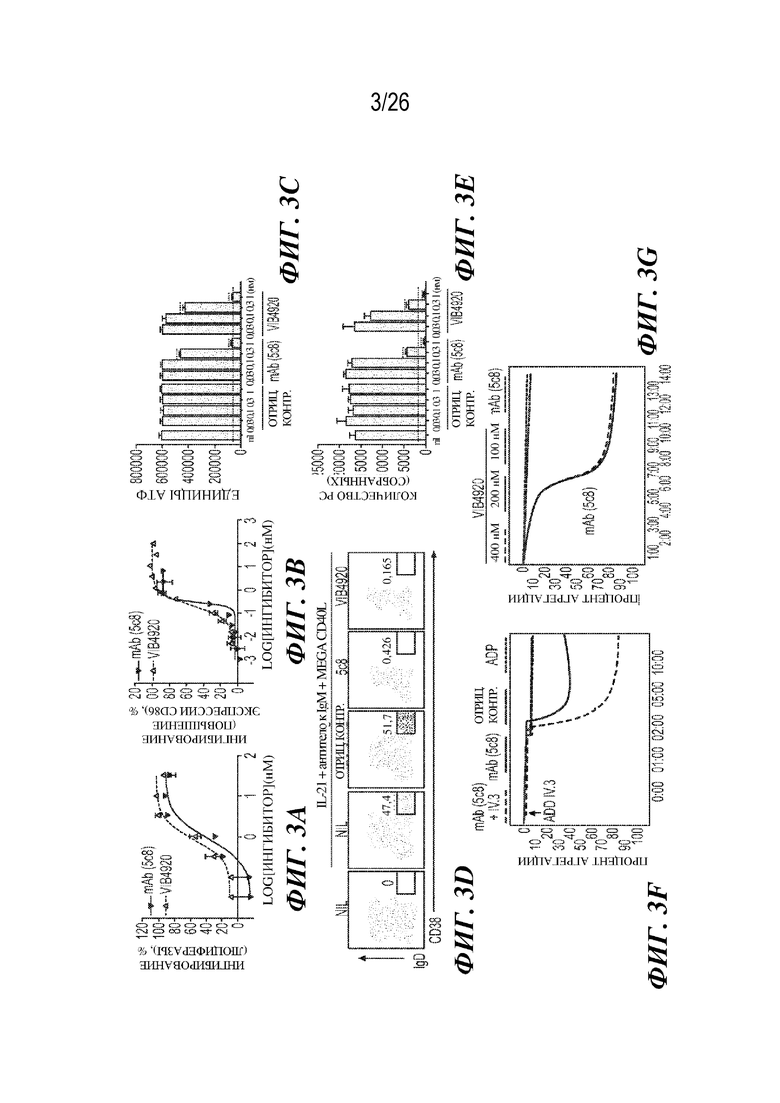
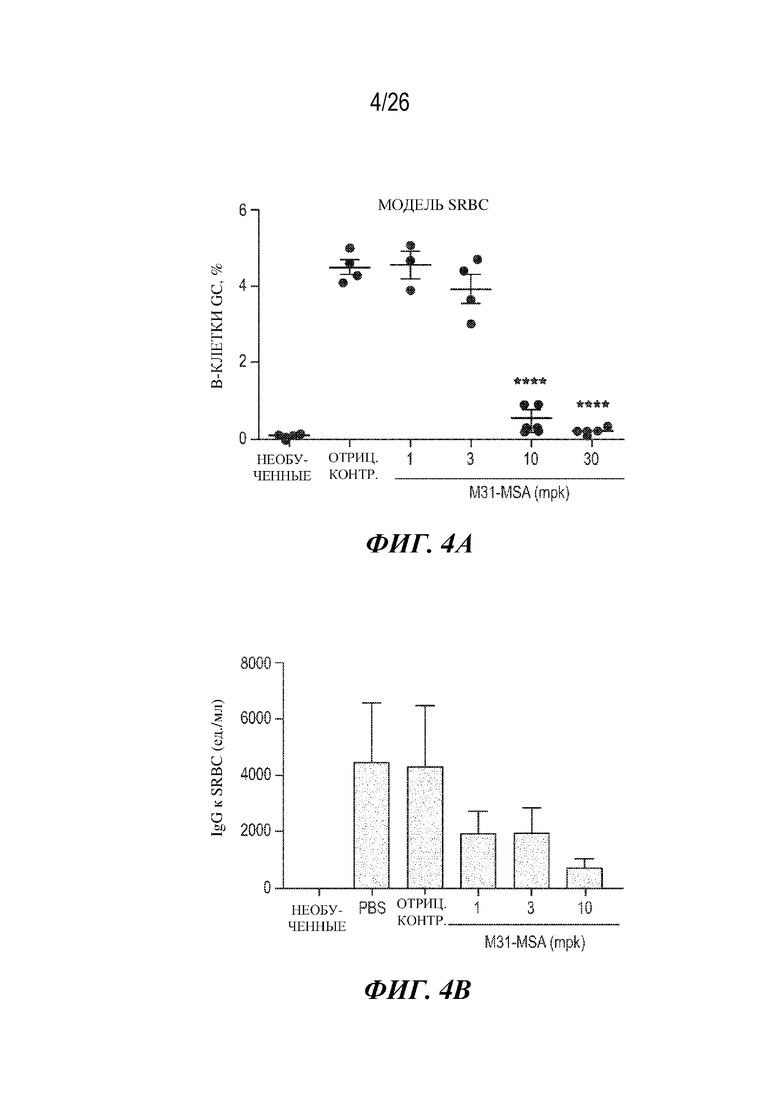
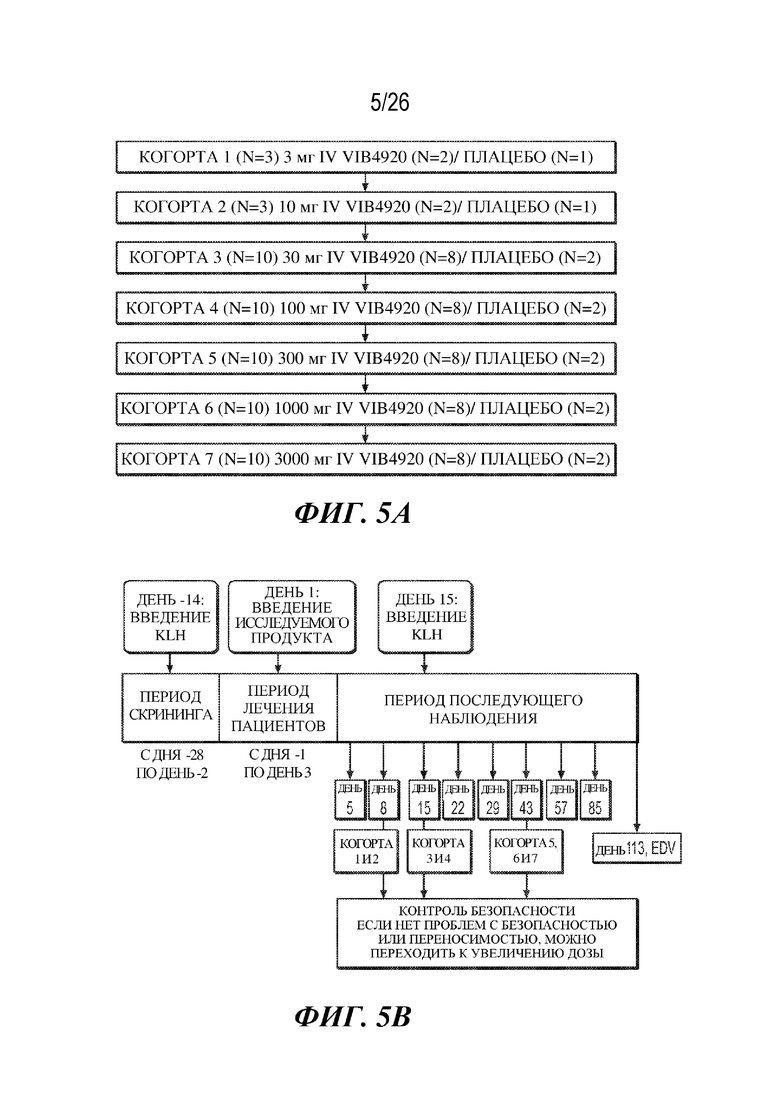
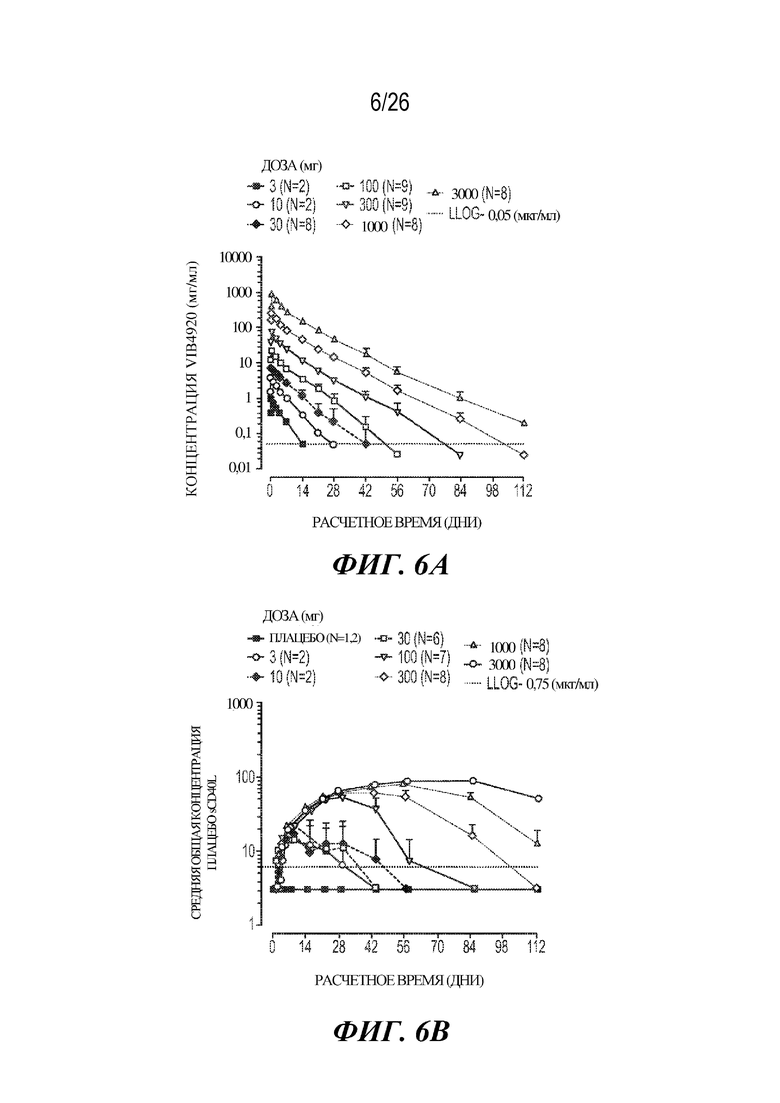
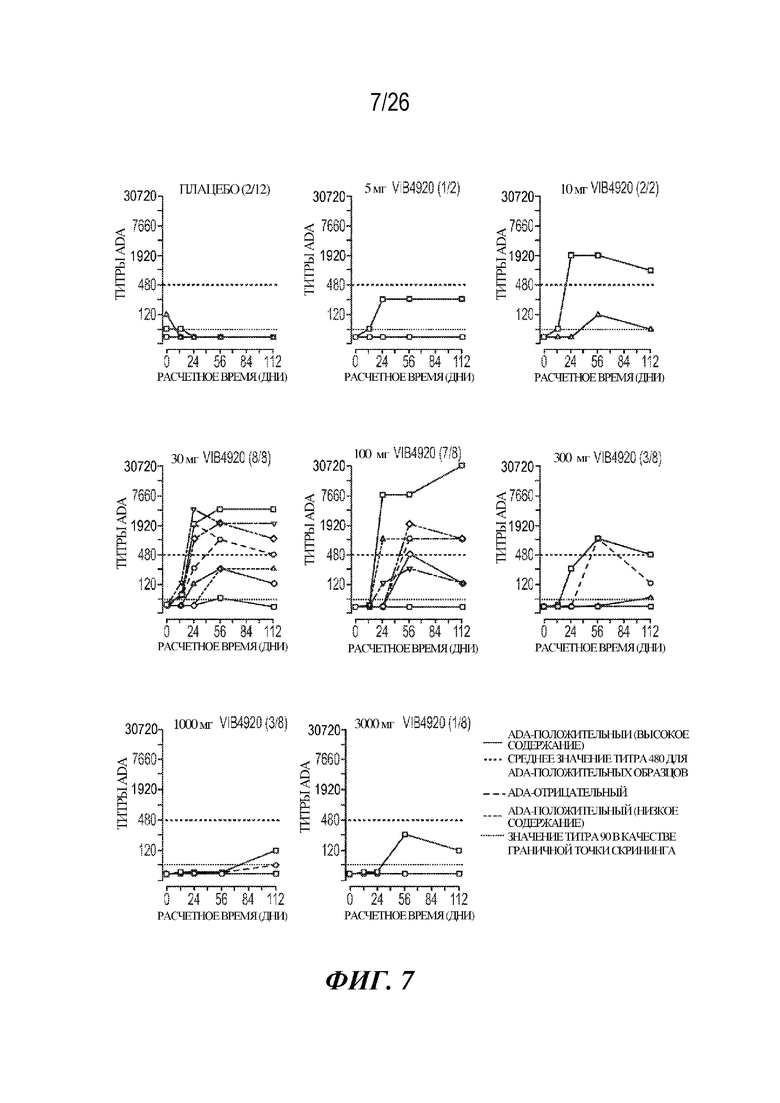
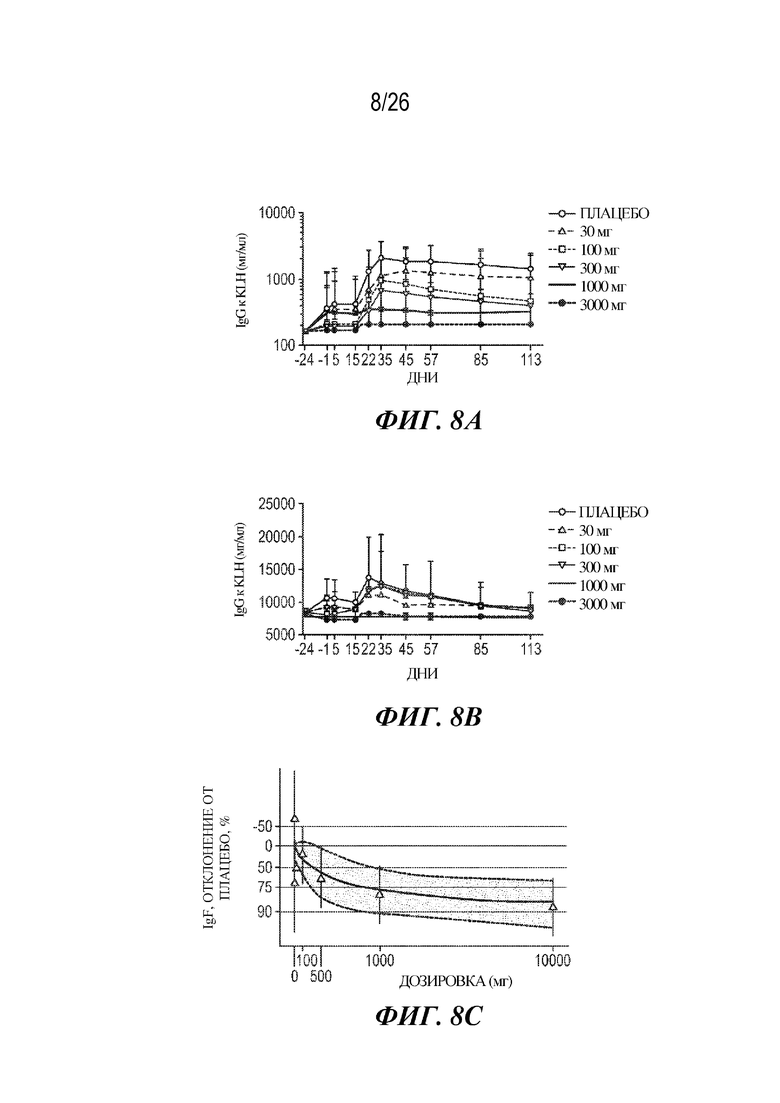
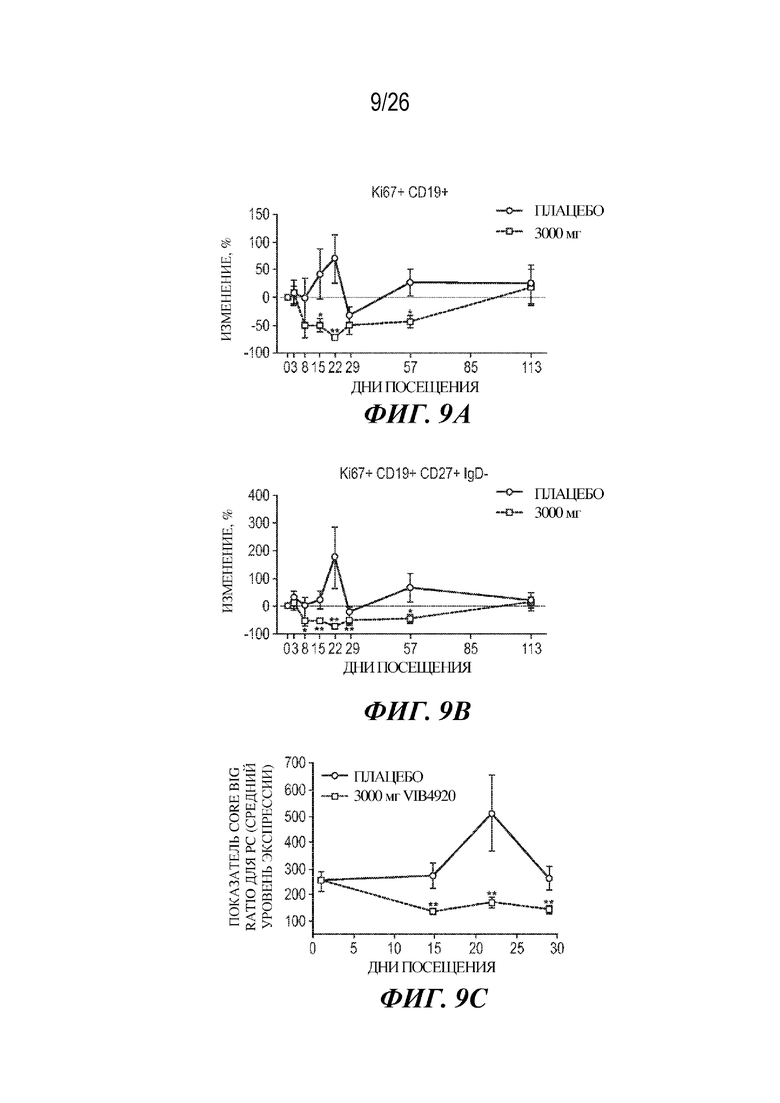
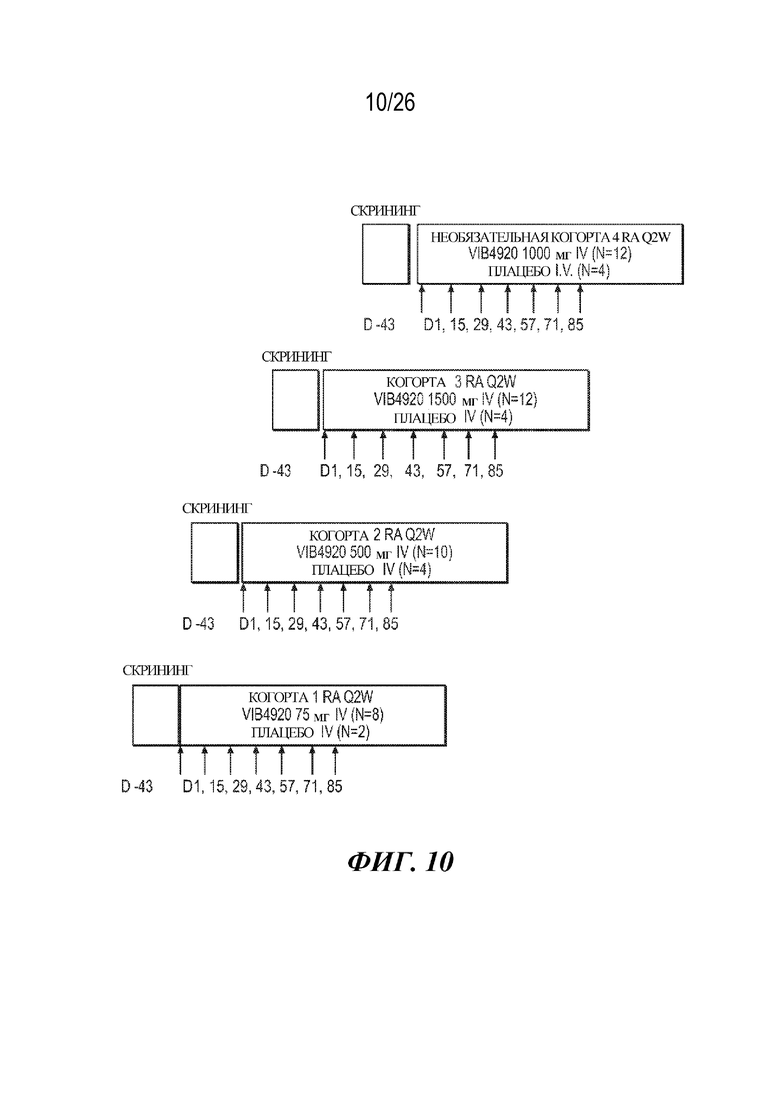
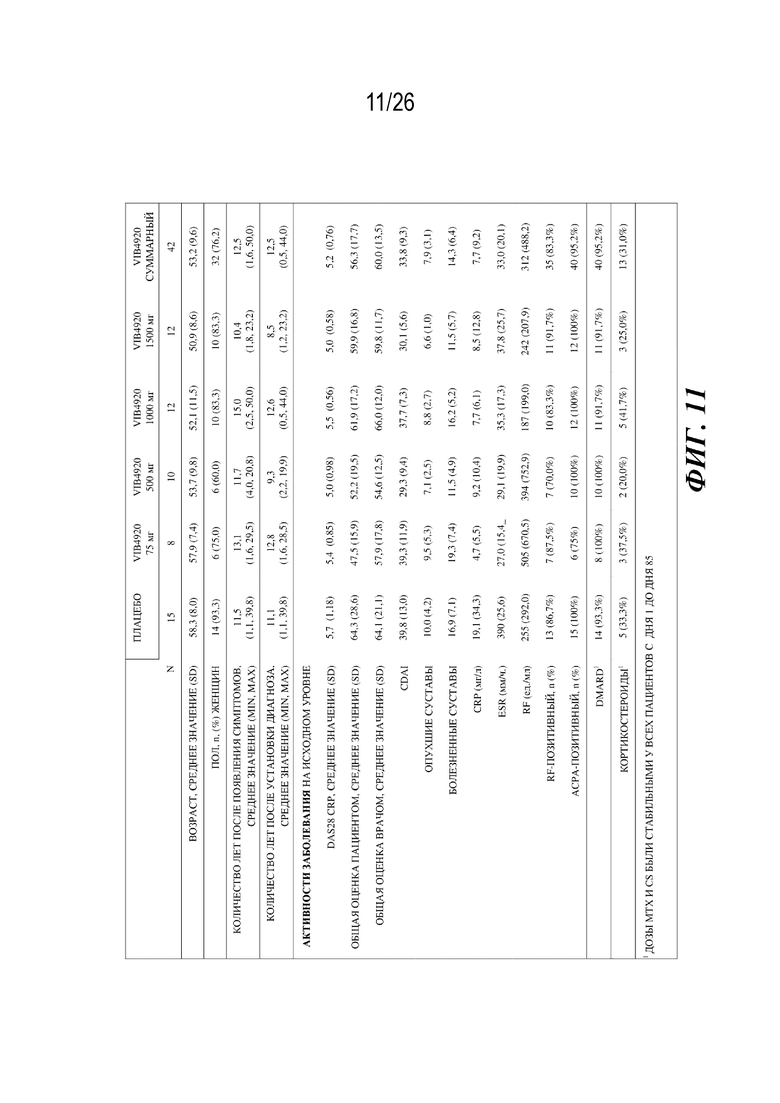
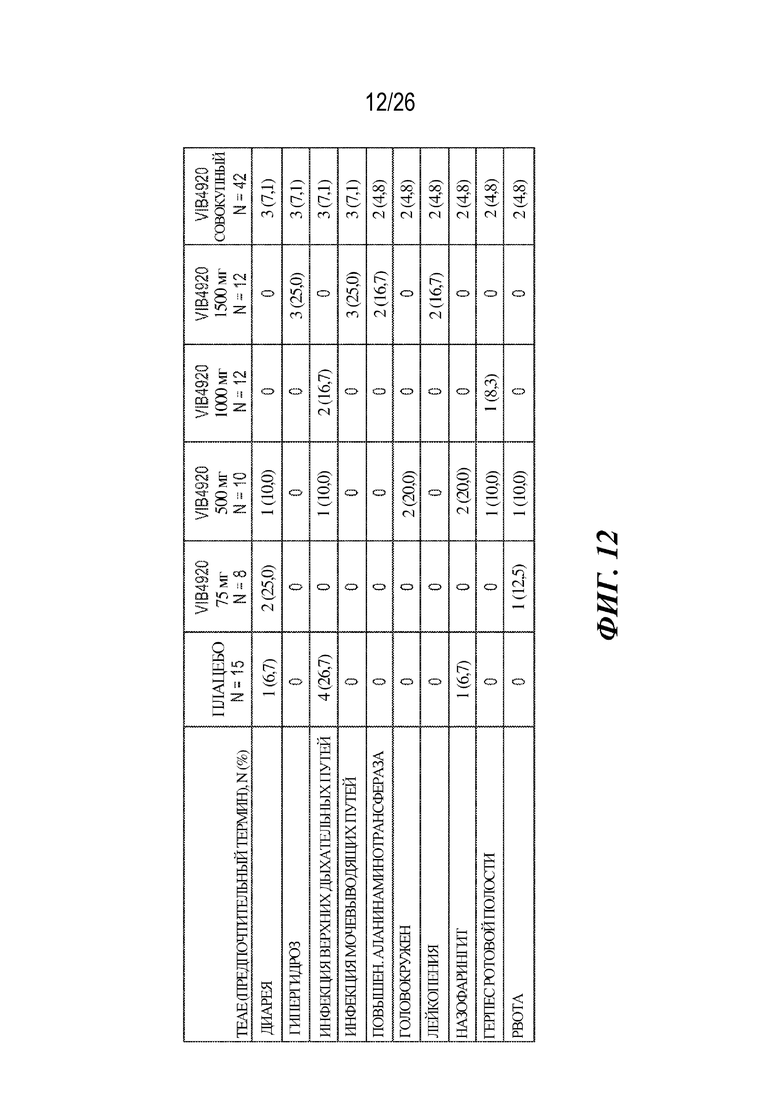
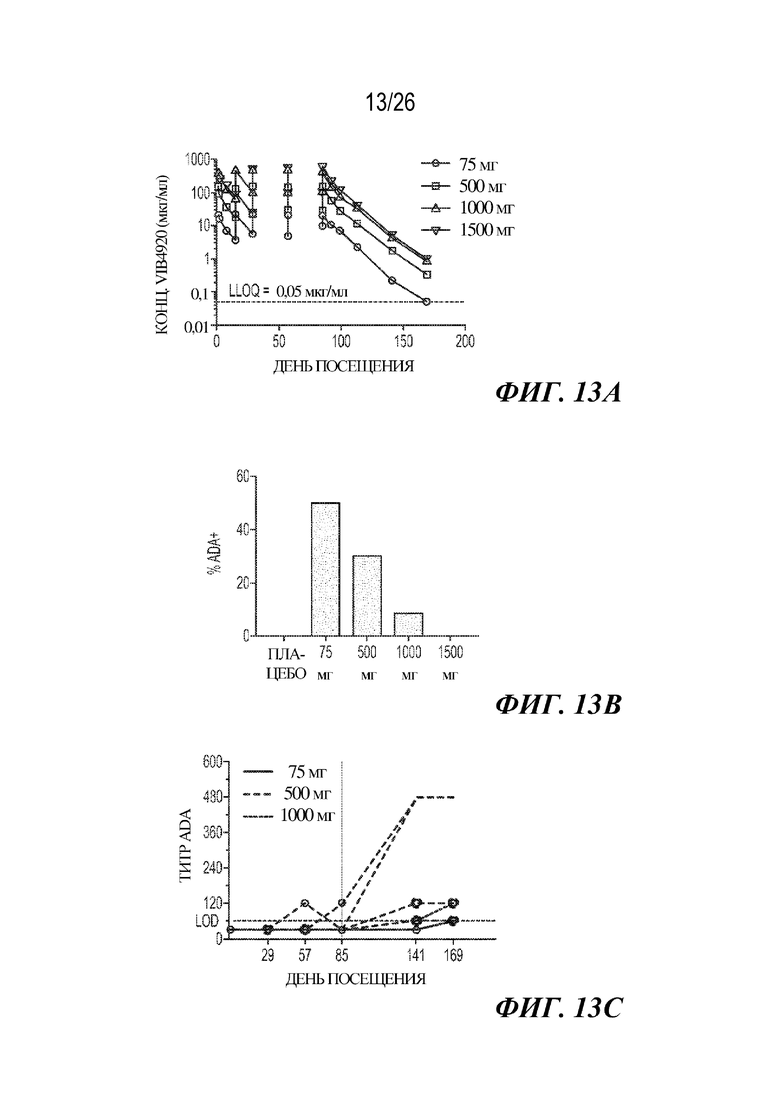
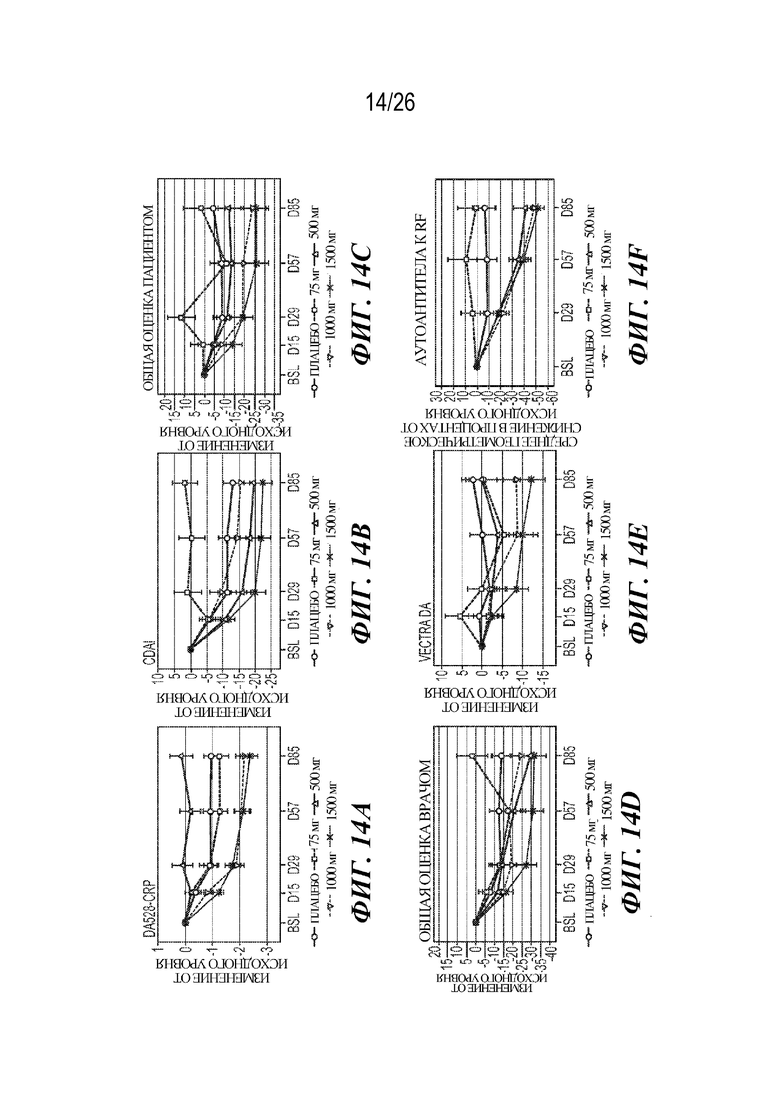
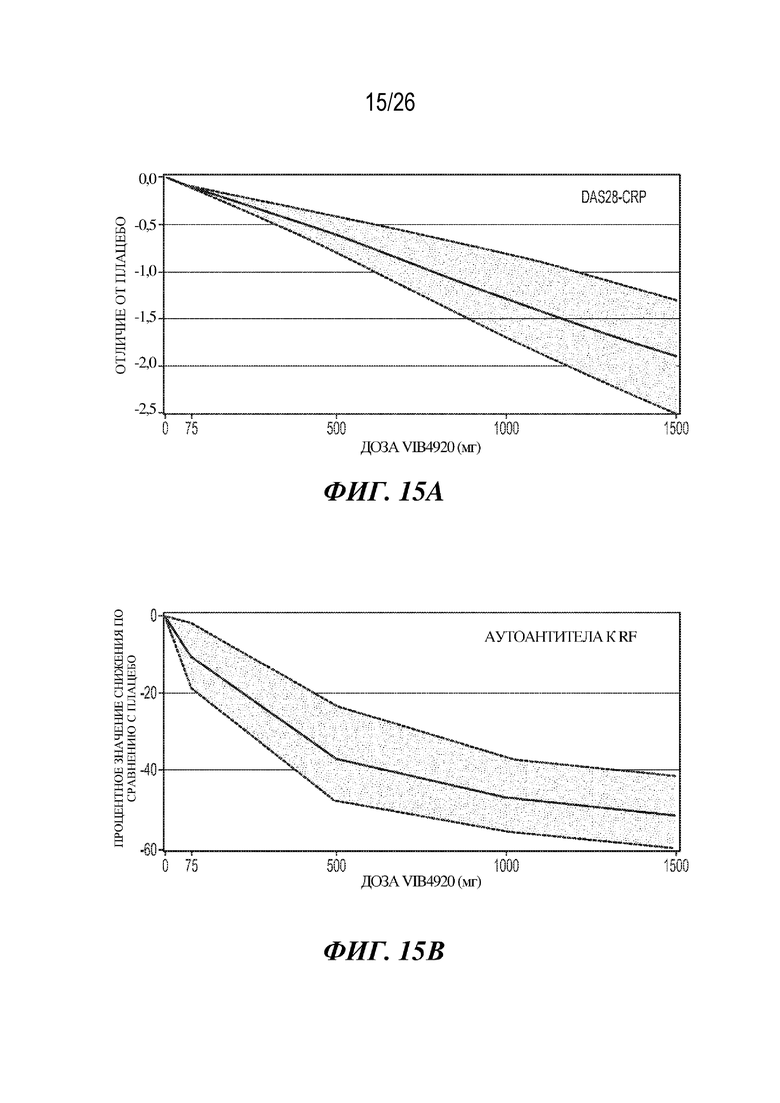
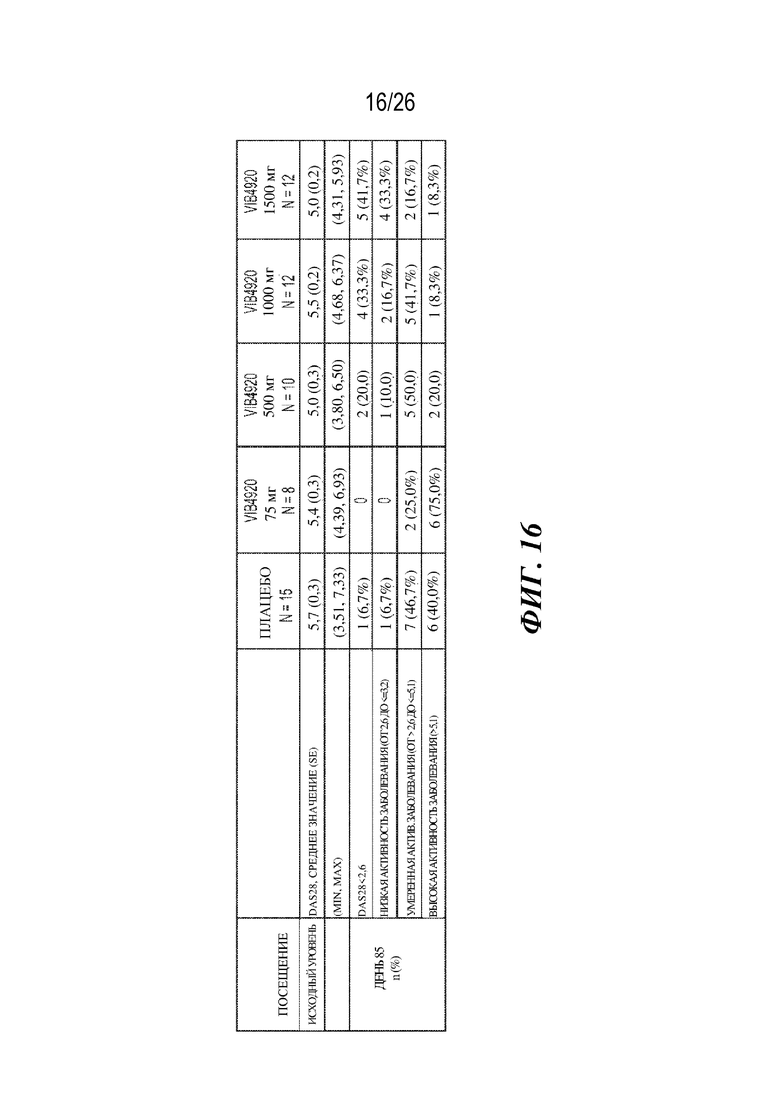
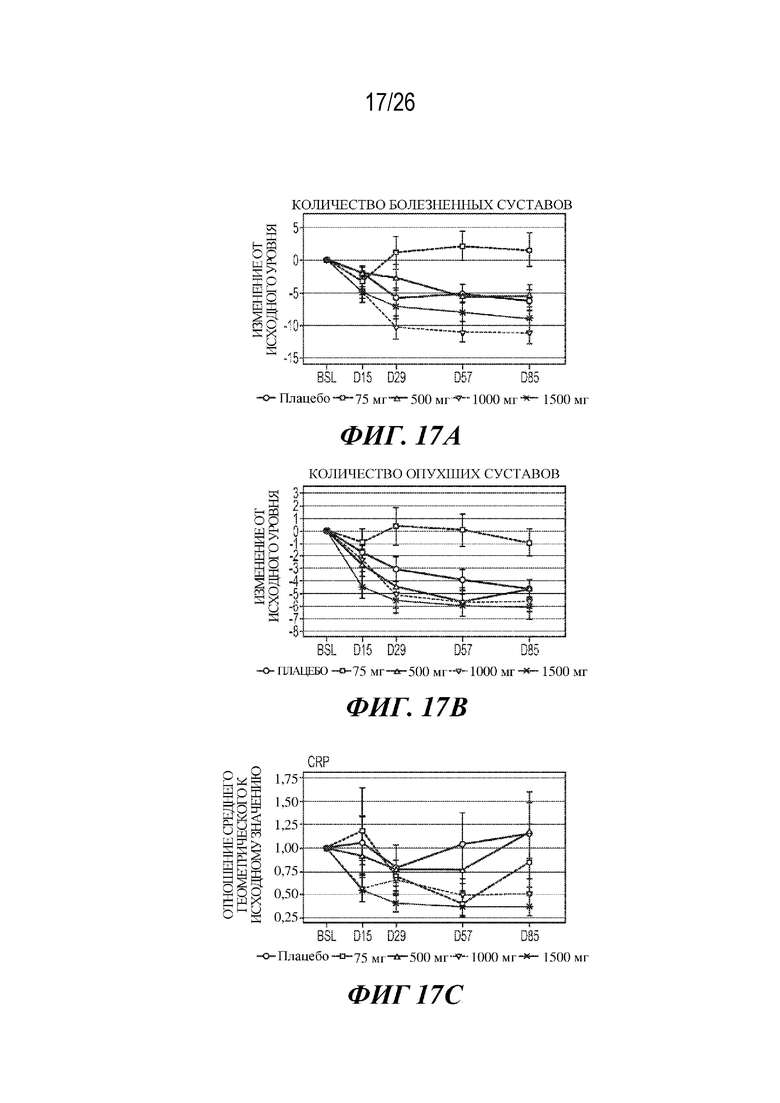




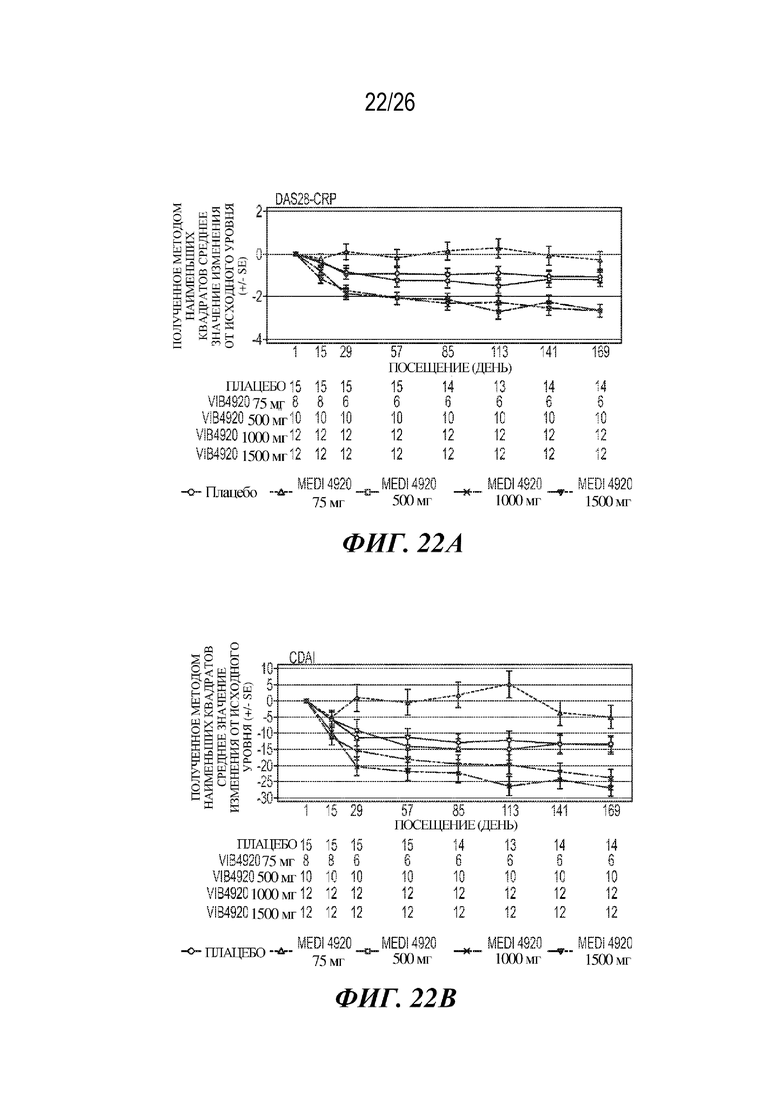
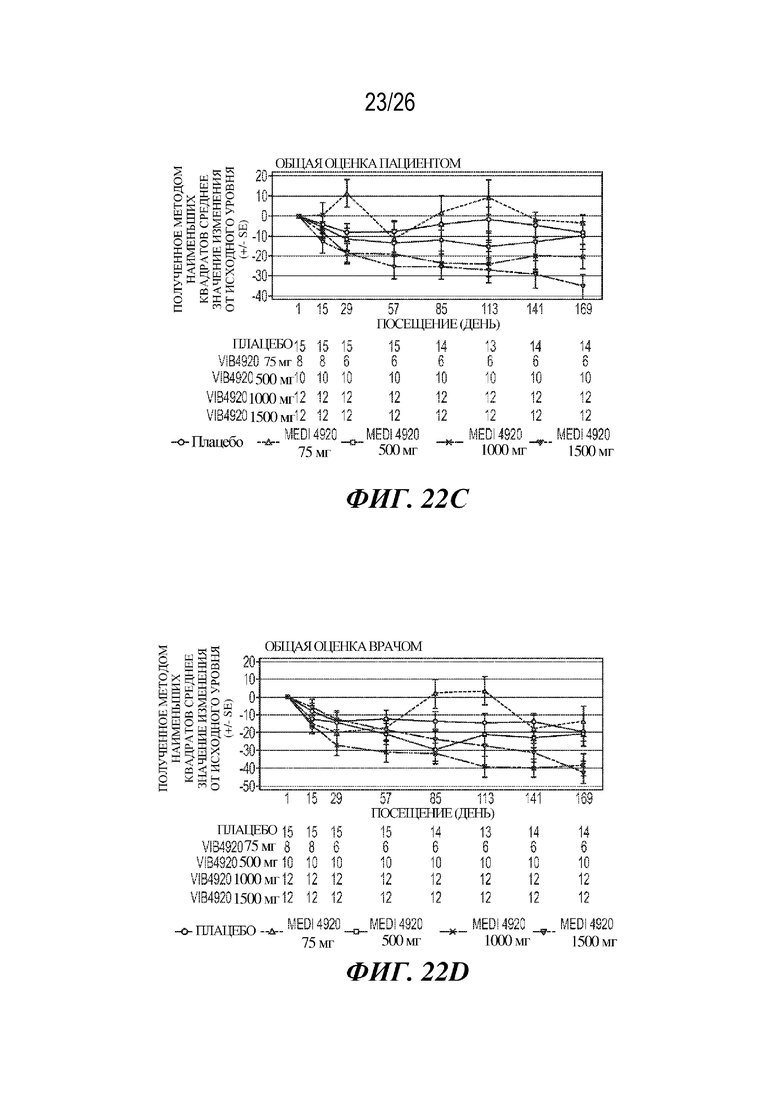
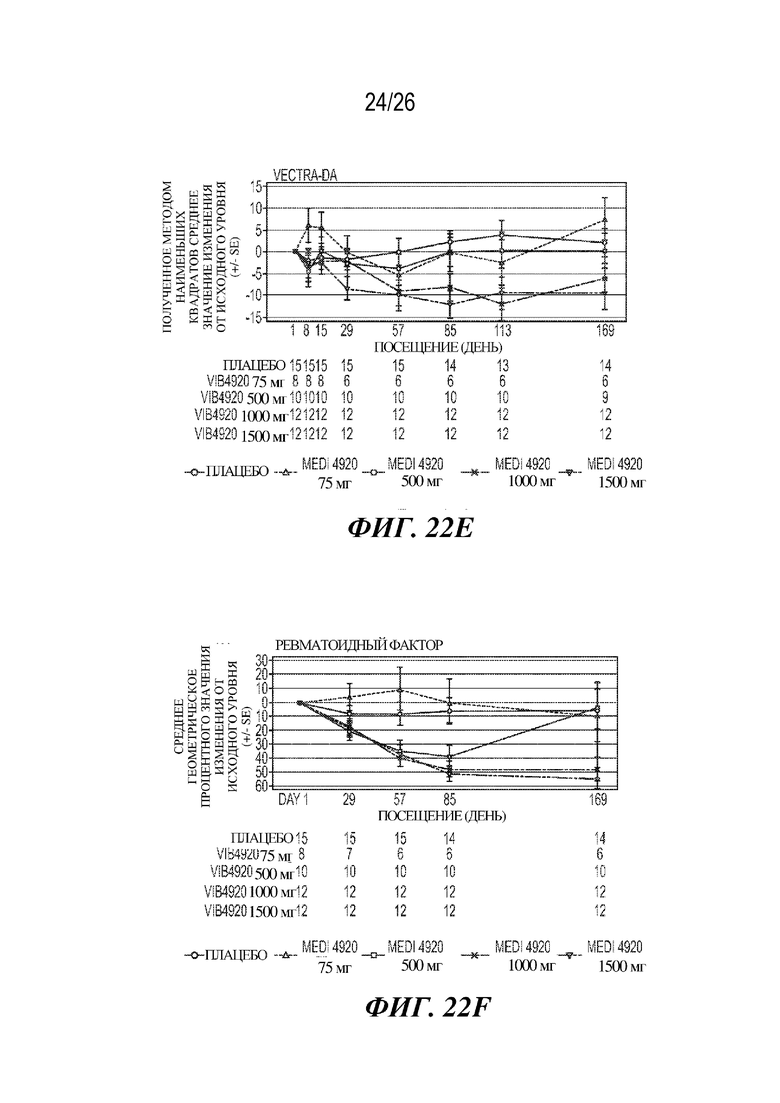
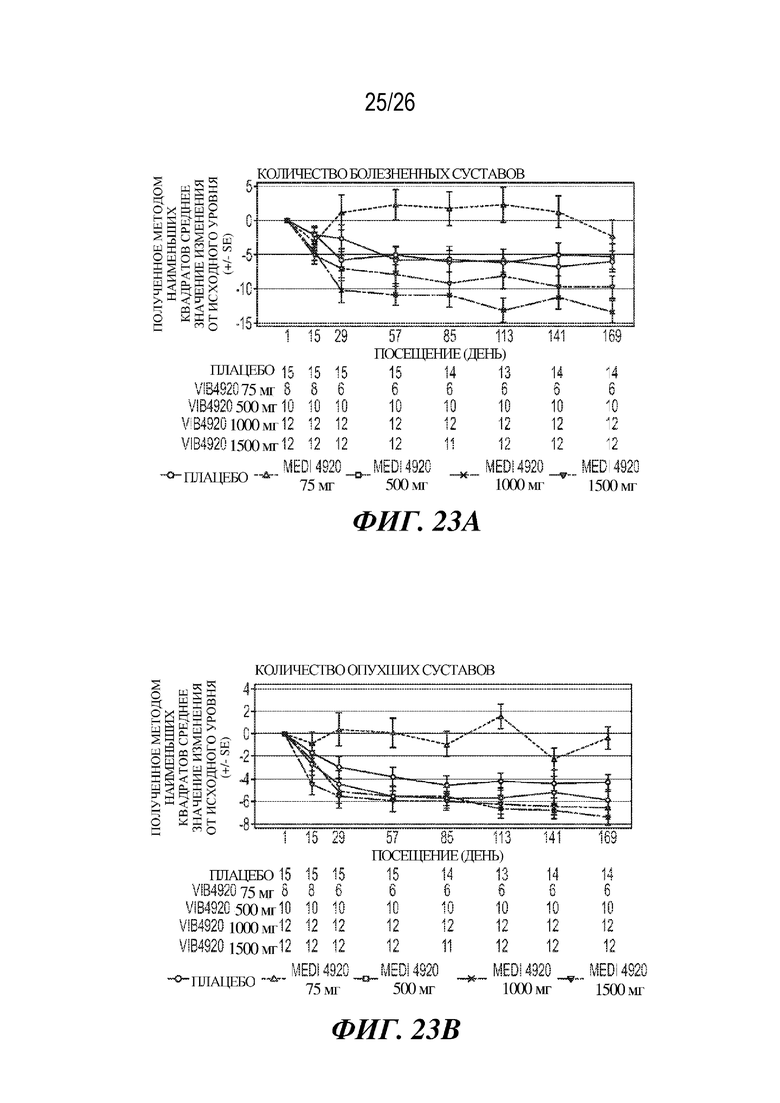
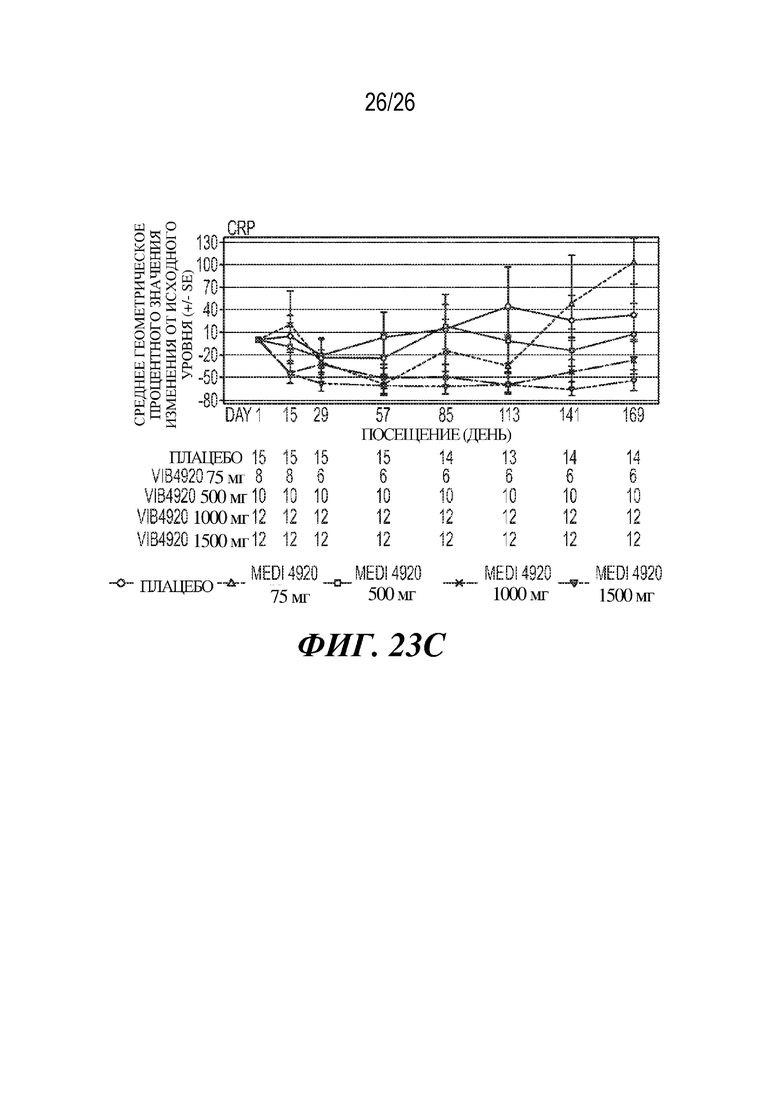
Группа изобретений относится к биотехнологии. Представлены способы лечения или предотвращения аутоиммунного заболевания, включающие введение CD40L-специфического каркасного белка Tn3 в дозе от 500 мг до 3000 мг, субъекту, нуждающемуся в этом. Изобретения используются для лечения или предотвращения таких заболеваний, как фокально-сегментарный гломерулосклероз, системный склероз, миозит, антифосфолипидный синдром, аутоиммунный гепатит, волчаночный нефрит, идиопатическая тромбоцитопеническая пурпура, синдром Шегрена, заболевание, связанное с IgG, эритематозная волчанка. 2 н. и 12 з.п. ф-лы, 26 ил., 2 табл., 15 пр.
1. Способ лечения или предотвращения аутоиммунного заболевания или нарушения, включающий введение CD40L-специфического каркасного белка Tn3 в дозе, составляющей от 500 мг до 3000 мг, субъекту, нуждающемуся в этом, где CD40L-специфический каркасный белок Tn3 содержит:
две мономерные субъединичные последовательности, соединенные первым линкером; и
последовательность сывороточного альбумина человека, где последовательность сывороточного альбумина человека соединена с одной из двух мономерных субъединичных последовательностей вторым линкером, где каждая мономерная субъединичная последовательность содержит полипептидную последовательность SEQ ID NO:3, и где аутоиммунное заболевание или нарушение представляют собой одно из фокально-сегментарного гломерулосклероза, системного склероза, миозита, антифосфолипидного синдрома, аутоиммунного гепатита, волчаночного нефрита, идиопатической тромбоцитопенической пурпуры, васкулита, кожной волчанки, аутоиммунной гемолитической анемии, синдрома Шегрена, заболевания, связанного с IgG4, или системной эритематозной волчанки.
2. Способ лечения или предотвращения аутоиммунного заболевания или нарушения, включающий
введение CD40L-специфического каркасного белка Tn3 в дозе, составляющей от 500 мг до 3000 мг пациенту, нуждающемуся в этом, где CD40L-специфический каркасный белок Tn3 содержит SEQ ID NO: 1, где аутоиммунное заболевание или нарушение представляют собой одно из фокально-сегментарного гломерулосклероза, системного склероза, миозита, антифосфолипидного синдрома, аутоиммунного гепатита, волчаночного нефрита, идиопатической тромбоцитопенической пурпуры, васкулита, кожной волчанки, аутоиммунной гемолитической анемии, синдрома Шегрена, заболевания, связанного с IgG4, или системной эритематозной волчанки.
3. Способ по любому из пп. 1-2, где доза составляет от 1000 мг до 1500 мг.
4. Способ по п. 3, где доза составляет 1000 мг.
5. Способ по любому из пп. 1-2, где доза составляет 1500 мг до 3000 мг.
6. Способ по любому из пп. 1-5, где дозу вводят раз в 14 дней или вводят дважды в месяц.
7. Способ по любому из пп. 1-6, где введение является внутривенным.
8. Способ по любому из пп. 1-7, где введение эффективно в снижении уровня маркера воспаления у субъекта, нуждающегося в этом.
9. Способ по п. 8, где маркер воспаления включает одно или более из уровней аутоантител, встречаемости сигнатуры плазматической клетки (PC), содержания циркулирующих B-клеток и уровня переключения класса антител.
10. Способ по п. 9, где маркер воспаления включает снижение встречаемости сигнатуры PC.
11. Способ по п. 10, где снижение встречаемости сигнатуры PC характеризуется снижением уровня экспрессии гена, выбранного из группы, состоящей из тяжелой константы альфа 1 иммуноглобулина (IGHA1), соединяющей цепи мультимерных IgA и IgM (IGJ), каппа-константного домена иммуноглобулина (IGKC), каппа-вариабельного домена 4-1 иммуноглобулина (IGKV4-1) и члена 17 суперсемейства рецептора TNF (TNFRSF17).
12. Способ по п. 1 или 2, где аутоиммунное заболевание или нарушение представляет собой синдром Шегрена.
13. Способ по п. 1 или 2, где аутоиммунное заболевание или нарушение представляет собой фокально-сегментарный гломерулосклероз.
14. Способ по п. 1 или 2, где воспалительное заболевание или нарушение представляет собой волчаночный нефрит.
| Устройство управления тепловой мощностью твёрдотопливного котла | 2022 |
|
RU2780388C1 |
| WO 2013055745 A2, 18.04.2013 | |||
Авторы
Даты
2024-02-05—Публикация
2019-09-25—Подача