ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННЫЕ ЗАЯВКИ
[1] Согласно настоящей заявке испрашивается приоритет в соответствии с предварительной заявкой на патент США №62/880240, поданной 30 июля 2019 г., и заявке о применимости США №16/943849, поданной 30 июля 2020 г., включенных в данный документ посредством ссылки в полном объеме.
ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
[2] Текстовый файл ASCII, представленный 30 июля 2020 г. посредством EFS-Web, под названием «010802seq.txt», созданный 30 июля 2020 г., имеющий размер 13267 байт, включен в данный документ посредством ссылки в полном объеме.
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ НАСТОЯЩЕЕ ИЗОБРЕТЕНИЕ
[3] Настоящее изобретение в целом относится к композициям и способам снижения иммуногенности биологических терапевтических средств и более конкретно к осуществлению этого с помощью В-клеточных ингибиторов, которые не приводят к деплеции.
УРОВЕНЬ ТЕХНИКИ, К КОТОРОМУ ОТНОСИТСЯ НАСТОЯЩЕЕ ИЗОБРЕТЕНИЕ
[4] Применение биологических препаратов, таких как антитела и полипептиды, в качестве терапевтических средств ассоциировано с риском возникновения нежелательных иммунных реакций у пациентов, обычно определяемых образованием реакций антител к лекарственным средствам (ADA). Такие реакции могут быть обусловлены наличием «чужеродных» эпитопов в молекуле и могут усугубляться внешними факторами, такими как геномный фон и фон заболевания пациента, введение дозы и используемый режим введения, состав и способ введения, а также примеси, среди прочего. Эти иммунные реакции могут иметь различные последствия, от изменения фармакологических свойств до увеличения клиренса или нейтрализации лекарственных средств и потери терапевтической эффективности. В крайних случаях белковая терапия может вызвать развитие тяжелых аллергических и анафилактических реакций со значительным риском для пациента.
[5] Другой хорошо охарактеризованной иммунной реакцией на «чужеродные» средства является так называемое отторжение трансплантата или лоскута (также называемой реакцией «хозяин против трансплантата»), при котором эндогенная иммунная система реагирует против чужеродной ткани, вызывая ее разрушение. Отторжение ткани может быть опосредовано гуморальными и клеточными иммунными ответами. В случае генетически модифицированных клеток, созданных с целью включения отсутствующей копии гена (генная терапия) или для того, чтобы помочь пациенту избавиться от раковых клеток (например, виды терапии на основе CAR-T), существует риск того, что некоторые из «механизмов», используемые для генетической модификации клеток могут быть «презентированы» модифицированными клетками и распознаваться хозяином как «чужеродное» средство. Такое распознавание вызовет реакцию отторжения, которая потенциально может сделать такое лечение неэффективным или, в тяжелых случаях, потенциально вызвать аутоиммунные реакции.
[6] Совсем недавно появление генной терапии столкнулось с существенным препятствием иммуногенности вирусного вектора, используемого для введения трансгена, а также иммуногенности самого трансгенного белка после экспрессии клетками реципиента. Иммуногенность векторов и трансгенов приводит к: 1) сниженной эффективности в качестве вектора и трансгена, поскольку они связываются и выводятся антителами, генерируемыми реципиентом; 2) потребности в повышенных дозах, что увеличивает риски безопасности и затраты; 3) трудностям или невозможности введения повторной дозы, если у субъекта вырабатываются антитела против вектора или трансгена после предыдущей дозы. Иногда реципиенты имеют уже существующие антитела к вектору еще до первого введения, которые уничтожаются вследствие перекрестной реакции с встречающимися в природе вирусами. Другие виды терапии на основе вирусов (например, онколитические вирусы при раке) и виды терапии на основе редактирования генов (например, виды терапии на основе CRISPR-Cas9), также имеют в качестве недостатка иммуногенность.
[7] Таким образом, существует потребность в способах и композициях для снижения иммуногенности, индуцированной различными биологическими терапевтическими средствами, включая без ограничения антитела, клеточную терапию и генную терапию. КРАТКОЕ РАСКРЫТИЕ НАСТОЯЩЕГО ИЗОБРЕТЕНИЯ
[8] В одном из аспектов в данном документе раскрыт способ снижения иммуногенности, включающий введение пациенту, получающему или получавшему биологическое терапевтическое средство, эффективного количества В-клеточного ингибитора, который не приводит к деплеции.
[9] В соответствии с некоторыми вариантами осуществления биологическое терапевтическое средство выбрано из одного или нескольких из следующих вариантов: генная терапия, терапия на основе редактирования генов, терапия на основе матричной РНК (mRNA), онколитические вирусы, ферментозаместительная терапия, терапия антителами, белковая терапия и клеточная терапия. В соответствии с некоторыми вариантами осуществления биологическое терапевтическое средство представляет собой генную терапию.
[10] В соответствии с некоторыми вариантами осуществления В-клеточный ингибитор представляет собой биспецифическое антитело к CD32B × CD79B, способное иммуноспецифически связывать эпитоп CD32B и эпитоп CD79B. В соответствии с некоторыми вариантами осуществления биспецифическое антитело к CD32B × CD79B содержит:
(A) домен VLCD32B, содержащий аминокислотную последовательность под SEQ ID NO: 1;
(B) домен VHCD32B, содержащий аминокислотную последовательность под SEQ ID NO: 2;
(C) домен VLСD79B, содержащий аминокислотную последовательность под SEQ ID NO: 3; и
(D) домен VHCD79B, содержащий аминокислотную последовательность под SEQ ID NO: 4. [11] В соответствии с некоторыми вариантами осуществления биспецифическое антитело к CD32B × CD79B представляет собой диатело Fc, содержащее:
(A) первую полипептидную цепь, содержащую аминокислотную последовательность под SEQ ID NO: 5;
(B) вторую полипептидную цепь, содержащую аминокислотную последовательность под SEQ ID NO: 6; и
(C) третью полипептидную цепь, содержащую аминокислотную последовательность под SEQ ID NO: 7.
[12] В соответствии с некоторыми вариантами осуществления способ может дополнительно включать введение диатела Fc в дозе от приблизительно 5 мг/кг до приблизительно 40 мг/кг и в режиме введения дозы от одной дозы за 2 недели до одной дозы за 6 недель. В соответствии с некоторыми вариантами осуществления способ может включать введение диатела Fc в дозе приблизительно 10 мг/кг и в режиме введения дозы одна доза за 4 недели. В соответствии с некоторыми вариантами осуществления способ может включать введение 3 доз диатела Fc в дозе приблизительно 10 мг/кг с интервалами 2-6 недель.
[13] В соответствии с некоторыми вариантами осуществления способ может включать введение первой дозы за приблизительно 2-6 недель (например, 4 недели) до введения биологического терапевтического средства, второй дозы приблизительно в то же время, что и введение биологического терапевтического средства, и третьей дозы через приблизительно 2-6 недель (например, через 4 недели) после введения биологического терапевтического средства.
[14] В соответствии с некоторыми вариантами осуществления диатело Fc приводит к ингибированию собственной иммуногенности при введении, с более низкой распространенностью и/или титрами антител к лекарственным средствам (ADA) при повышенных дозах. В соответствии с некоторыми вариантами осуществления ADA не нейтрализует диатело Fc.
[15] В соответствии с некоторыми вариантами осуществления диатело Fc дозозависимым образом связывается по меньшей мере с 80% В-клеток при введении и остается связанным по меньшей мере с 50% В-клеток в течение по меньшей мере 4 недель после последнего введения.
[16] В соответствии с некоторыми вариантами осуществления диатело Fc приводит к устойчивому ингибированию продуцирования иммуноглобулина без деплеции циркулирующих В-клеток. В соответствии с некоторыми вариантами осуществления иммуноглобулины включают один или несколько из IgM, IgA, IgG и IgE.
[17] В соответствии с некоторыми вариантами осуществления способ может дополнительно включать наблюдение за пациентом посредством изучения наличия специфических антител к биологическому терапевтическому средству. В соответствии с некоторыми вариантами осуществления способ может дополнительно включать введение одной или нескольких доз В-клеточного ингибитора для дальнейшего модулирования иммуногенности.
[18] В соответствии с некоторыми вариантами осуществления способ может дополнительно включать совместное введение одного или нескольких иммуномодуляторов, таких как сиролимус, рапамицин, абатацепт, теплизумаб и иммуноглобулин G-деградирующий фермент Streptococcus pyogenes.
[19] В данном документе также предусмотрены фармацевтические композиции, содержащие не приводящие к деплеции В-клеточные ингибиторы, описанные в данном документе, поставляемые (например, упакованные) в терапевтически эффективных стандартных дозах. Также могут быть предусмотрены инструкции для режимов введения дозы, раскрытых в данном документе.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
[20] Фиг. 1: Схематический обзор исследования.
[21] Фиг. 2А-2С: Средние (± SD) концентрации PRV-3279 в сыворотке крови (нг/мл) в зависимости от времени дня по линейной шкале (популяция для изучения фармакокинетического анализа) (Фиг. 2А: день 1, Фиг. 2 В: день 15, Фиг. 2С: день 29).
[22] Фиг. 3А-3С: Средние концентрации PRV-3279 в сыворотке крови (нг/мл) в зависимости от времени дня по полулогарифмической шкале (популяция для изучения фармакокинетического анализа) (Фиг. 3А: день 1, Фиг. 3В: день 15, Фиг. 3С: день 29).
[23] Фиг. 4А-4В: Средние (± мSD) концентрации PRV-3279 в сыворотке крови (нг/мл) в зависимости от времени (день) с применением результата ADA в зависимости от дозы (популяция для изучения фармакокинетического анализа) (Фиг. 4А: 3 мг/кг, Фиг. 4В: 10 мг/кг).
[24] Фиг. 5: Блочная диаграмма фармакокинетического параметра сыворотки крови PRV-3279 с применением результата ADA в зависимости от дозы (популяция для изучения фармакокинетического анализа).
[25] Фиг. 6: Среднее арифметическое (± SEM) % максимального связывания антитела к Е/K+ (CD3-/CD19+) в зависимости от времени и лечения (популяция для фармакодинамического анализа).
[26] Фиг. 7: Среднее арифметическое (± SEM) числа клеток В-клеток (CD19+) -(клетки/возвращенные на мкл) (популяция для фармакодинамического анализа).
[27] Фиг. 8: Среднее арифметическое (± SEM) снижения уровней IgM в циркулирующей сыворотке крови (популяция для анализа безопасности).
[28] Фиг. 9: Среднее арифметическое (± SEM) снижения уровней IgE в циркулирующей сыворотке крови (популяция для анализа безопасности).
[29] Фиг. 10: Среднее арифметическое (± SEM) снижения уровней IgG в циркулирующей сыворотке крови (популяция для анализа безопасности).
ПОДРОБНОЕ РАСКРЫТИЕ НАСТОЯЩЕГО ИЗОБРЕТЕНИЯ
[30] В соответствии с одним из аспектов в данном документе раскрыт способ снижения иммуногенности, включающий введение пациенту, получающему или получившему биологическое терапевтическое средство, эффективного количества В-клеточного ингибитора, который не приводит к деплеции. В соответствии с некоторыми вариантами осуществления В-клеточный ингибитор представляет собой биспецифическое антитело к CD32B × CD79B, такое как раскрытое в публикации США №2016/0194396, публикациях WIPO №№WO 2015/021089 и WO 2017/214096, каждая из которых включена посредством ссылки в полном объеме.
Определения
[31] Для удобства в данном документе собраны некоторые термины, используемые в описании, примерах и прилагаемой формуле изобретения. Если не определено иное, все технические и научные термины, употребляемые в данном документе, имеют тоже самое значение, как обычно понимается специалистом в данной области техники, к которой принадлежит настоящее изобретение.
[32] Применение слова в форме единственного числа при использовании совместно с термином «содержащий» в формуле изобретения и/или описании может означать «один», но также соответствует значению «один или несколько», «по меньшей мере один» и «один или более одного».
[33] Во всей настоящей заявке термин «приблизительно» используется для обозначения того, что значение включает в себя неотъемлемую вариацию ошибки для способа/устройства, используемого для определения значения, или вариацию, существующую среди исследуемых субъектов. Обычно этот термин охватывает примерно или менее 1%, 2%, 3%, 4%, 5%, 6%, 7%, 8%, 9%, 10%, 11%, 12%, 13%, 14%, 15%, 16%, 17%, 18%, 19% или 20% вариабельности в зависимости от ситуации.
[34] Термин «по сути» означает более 50%, предпочтительно более 80% и наиболее предпочтительно более 90% или 95%.
[35] Применение термина «или» в формуле изобретения используется для обозначения «и/или», если явно не указано, что он относится только к альтернативам или альтернативы являются взаимоисключающими, хотя настоящее раскрытие поддерживает определение, которое относится только к альтернативам и «и/или».
[36] Используемые в этом описании и пункте (пунктах) формулы изобретения термины «содержащий» (и любая форма включения, такая как «содержать» и «содержит»), «имеющий» (и любая форма наличия, такая как «иметь» и «имеет»), «включая» (и любая форма включения, такая как «включает» и «включать») или «содержащий» (и любая форма включения, такая как «содержит» и «содержат») являются инклюзивными или открытыми и не исключают дополнительных, неуказанных элементов или этапов способов. Предполагается, что любой вариант осуществления, обсуждаемый в данном описании, может быть реализован в отношении любого способа, системы, клеток-хозяев, векторов экспрессии и/или композиции по настоящему изобретению. Кроме того, композиции, системы, клетки-хозяева и/или векторы по настоящему изобретению можно использовать для получения способов и белков по настоящему изобретению.
[37] Используемый в данном документе термин «состоящий по сути из» относится к тем элементам, которые требуются для определенного варианта осуществления. Термин допускает наличие дополнительных элементов, которые существенно не влияют на основную (основные) и новую (новые) или функциональную (функциональные) характеристику (характеристики) этого варианта осуществления настоящего раскрытия.
[38] Термин «состоящий из» относится к композициям, способам и их соответствующим компонентам, как описано в данном документе, которые исключают любой элемент, не упомянутый в этом описании варианта осуществления.
[39] Использование термина «для примера» и соответствующей ему аббревиатуры «например» (независимо от того, выделены они курсивом или нет) означает, что приведенные конкретные термины являются иллюстративными примерами и вариантами осуществления настоящего изобретения, которые не предназначены для ограничения конкретными примерами, на которые имеются ссылки или которые цитируются, если явно не указано иное.
[40] «Нуклеиновая кислота», «молекула нуклеиновой кислоты», «олигонуклеотид» или «полинуклеотид» означает полимерное соединение, содержащее ковалентно связанные нуклеотиды. Термин «нуклеиновая кислота» включает полирибонуклеиновую кислоту (РНК) и полидезоксирибонуклеиновую кислоту (ДНК), обе из которых могут быть одноцепочечными или двухцепочечными. ДНК включает без ограничения комплементарную ДНК (cDNA), геномную ДНК, плазмидную или векторную ДНК и синтетическую ДНК. В соответствии с некоторыми вариантами осуществления настоящее изобретение направлено на полинуклеотид, кодирующий любой из полипептидов, раскрытых в данном документе, например, направлено на полинуклеотид, кодирующий белок Cas или его вариант.В соответствии с некоторыми вариантами осуществления настоящее изобретение направлено на полинуклеотид, кодирующий Cas3, Cas9, Cas10 или их варианты.
[41] Термин «ген» относится к совокупности нуклеотидов, кодирующих полипептид, и включает cDNA и молекулы нуклеиновой кислоты геномной ДНК. Термин «ген» также относится к фрагменту нуклеиновой кислоты, который может выступать в качестве регуляторных последовательностей, предшествующих (5'-некодирующие последовательности) кодирующей последовательности и следующих за ней (3'-некодирующие последовательности).
[42] Термины «пептид», «полипептид» и «белок» используются в данном документе взаимозаменяемо и относятся к полимерной форме аминокислот любой длины, которая может включать кодируемые и некодируемые аминокислоты, химически или биохимически модифицированные или дериватизированные аминокислоты и полипептиды с модифицированными пептидными остовами.
[43] Термины «антитело» или «молекула антитела», как используется в данном документе, относятся к белку, например, иммуноглобулиновой цепи или ее фрагменту, содержащему по меньшей мере одну последовательность вариабельного домена иммуноглобулина. Молекула антитела включает антитела (например, полноразмерные антитела) и фрагменты антител. В соответствии с одним вариантом осуществления молекула антитела содержит антигенсвязывающий или функциональный фрагмент полноразмерного антитела или полноразмерную цепь иммуноглобулина. Например, полноразмерное антитело представляет собой молекулу иммуноглобулина (Ig) (например, IgG), которая встречается в природе или образуется в результате рекомбинаторных процессов нормального фрагмента гена иммуноглобулина. В соответствии с вариантами осуществления молекула антитела относится к иммунологически активной антигенсвязывающей части молекулы иммуноглобулина, такой как фрагмент антитела. Фрагмент антитела, например, функциональный фрагмент, представляет собой часть антитела, например Fab, Fab', F(ab')2, F(ab)2, вариабельный фрагмент (Fv), доменное антитело (dAb) или одноцепочечный вариабельный фрагмент (scFv). Функциональный фрагмент антитела связывается с тем же антигеном, который распознается интактным (например, полноразмерным) антителом. Термины «фрагмент антитела» или «функциональный фрагмент» также включают выделенные фрагменты, состоящие из вариабельных областей, такие как фрагменты «Fv», состоящие из вариабельных областей тяжелой и легкой цепей, или молекулы рекомбинантных одноцепочечных полипептидов, в которых вариабельные области легкой и тяжелой цепи связаны пептидным линкером («белки scFv»). В соответствии с некоторыми вариантами осуществления фрагмент антитела не содержит части антител без антигенсвязывающей активности, такие как фрагменты Fc или отдельные аминокислотные остатки. Иллюстративные молекулы антител включают полноразмерные антитела и фрагменты антител, например, dAb (доменное антитело), одноцепочечные фрагменты Fab, Fab'n F(ab')2 и одноцепочечные вариабельные фрагменты (scFv). Термины «Fab» и «фрагмент Fab» используются взаимозаменяемо и относятся к области, которая содержит один константный и один вариабельный домен от каждой тяжелой и легкой цепи антитела, т.е., VL, CL, VН и CН1.
[44] Во всем описании настоящего изобретения нумерация остатков в константной области тяжелой цепи IgG представлена с помощью EU-индекса, как в Kabat et al., Sequences of Proteins of Immunological Interest, 5th Ed. Public Health Service, NH1, MD (1991) ("Kabat"), явно включенной в данный документ посредством ссылок. Термин «EU-индекс в соответствии с Kabat» относится к EU-нумерации антитела IgG1 человека. Аминокислоты из вариабельных доменов зрелых тяжелых и легких цепей иммуноглобулинов обозначаются положением аминокислоты в цепи. Kabat описал многочисленные аминокислотные последовательности для антител, определил консенсусную аминокислотную последовательность для каждой подгруппы и присвоил номер остатка каждой аминокислоте, a CDR идентифицировали, как определено Kabat (будет понятно, что CDRH1, как определено Chothia, С.& Lesk, AM ((1987) "Canonical structures for the hypervariable regions of immunoglobulins,". J. Mol. Biol. 196:901-917), начинается на пять остатков раньше). Схема нумерации в соответствии с Kabat, распространяется на антитела, не включенные в его компендиум, в результате выравнивания рассматриваемого антитела по отношению к одной из консенсусных последовательностей в нумерации в соответствии с Kabat с помощью отсылки на консервативные аминокислоты. Данный способ присвоения номеров остатков стал стандартом в данной области техники и с его помощью легко идентифицируют аминокислоты в эквивалентных положениях в других антителах, в том числе химерных или гуманизированных вариантах. Например, аминокислота в положении 50 легкой цепи человеческого антитела занимает эквивалентное положение по отношению к положению 50 легкой цепи мышиного антитела.
[45] В соответствии с другими вариантами осуществления молекула антитела является моноспецифической, например, она имеет специфичность связывания по отношению к одному эпитопу. В соответствии с некоторыми вариантами осуществления молекула антитела является мультиспецифической, например, она содержит множество последовательностей вариабельного домена иммуноглобулина, где первая последовательность вариабельного домена иммуноглобулина характеризуется специфичностью связывания по отношению к первому эпитопу, а вторая последовательность вариабельного домена иммуноглобулина характеризуется специфичностью связывания по отношению ко второму эпитопу. В соответствии с некоторыми вариантами осуществления молекула антитела представляет собой молекулу биспецифического антитела.
[46] Термины «молекула биспецифического антитела», «диатело» и «переориентирующееся антитело с двойной аффинностью (DART®)» используются в данном документе взаимозаменяемо и относятся к молекуле антитела, которая характеризуется специфичностью более чем к одному (например, к двум, трем, четырем, или более) эпитопу и/или антигену. В соответствии с некоторыми вариантами осуществления антитело может представлять собой диатела или каркасы, способные связывать антиген, такие как те, которые раскрыты в публикации США №2016/0194396, публикациях WIPO №№ WO 2015/021089 и WO 2017/214096, каждая из которых включена посредством ссылки в полном объеме. В соответствии с некоторыми вариантами осуществления антитело может представлять собой биспецифические диатела к CD32B × CD79B (т.е. «диатела к CD32B × CD79B» и такие диатела, которые дополнительно содержат домен Fc (т.е. «диатела Fc к CD32B × CD79B»). В соответствии с одним вариантом осуществления антитело может представлять собой гуманизированное антитело CD32B × CD79B DART®, продуцируемое в клетках яичника китайского хомячка с молекулярной массой 111,5 кДа.
[47] Термин «антиген» (Ag), как используется в данном документе, относится к макромолекуле, в том числе всем белкам или пептидам. В соответствии с некоторыми вариантами осуществления антиген представляет собой молекулу, которая может вызывать иммунный ответ, например, включающий активацию определенных иммунных клеток и/или образование антител. Антигены участвуют не только в образовании антител. Т-клеточные рецепторы также распознают антигены (хотя антигены этих пептидов или пептидных фрагментов находятся в комплексе с молекулой МНС). Любая макромолекула, в том числе почти все белки или пептиды, может представлять собой антиген. Антигены также могут быть получены из геномной рекомбинантной ДНК. Например, любая ДНК, содержащая нуклеотидную последовательность или частичную нуклеотидную последовательность, которая кодирует белок, способный вызывать иммунный ответ, кодирует «антиген». В соответствии с вариантами осуществления антиген не обязательно должен кодироваться исключительно полноразмерной нуклеотидной последовательностью гена, и антиген совсем не обязательно должен кодироваться геном. В соответствии с вариантами осуществления антиген может быть синтезирован или может быть получен из биологического образца, например, образца ткани, образца опухоли, клетки или жидкости, с другими биологическими компонентами. Используемый в данном документе термин «опухолевый антиген» или взаимозаменяемо «раковый антиген» включает любую молекулу, присутствующую на злокачественной опухоли или ассоциированную с раком, например, раковой клеткой или микроокружением опухоли, которые могут вызывать иммунный ответ. Используемый в данном документе термин «антиген иммунной клетки» включает любую молекулу, присутствующую на иммунной клетке или ассоциированную с ней, которая может вызывать иммунный ответ.
[48] Термин «антигенсвязывающий сайт», или «антигенсвязывающий фрагмент», или «антигенсвязывающая часть» (используемые в данном документе взаимозаменяемо) молекулы антитела относится к части молекулы антитела, например, молекуле иммуноглобулина (Ig), такой как IgG, которая участвует в связывании антигена. В соответствии с некоторыми вариантами осуществления антигенсвязывающий сайт образован аминокислотными остатками вариабельных (V) областей тяжелой (Н) и легкой (L) цепей. Три высокодивергентных участка в вариабельных областях тяжелой и легкой цепей, называемые гипервариабельными участками, расположены между более консервативными фланкирующими участками, называемыми «каркасными областями» (FR). FR представляют собой аминокислотные последовательности, которые естественным образом обнаруживаются между гипервариабельными областями иммуноглобулинов и рядом с ними. В соответствии с вариантами осуществления в молекуле антитела три гипервариабельные области легкой цепи и три гипервариабельные области тяжелой цепи расположены относительно друг друга в трехмерном пространстве с образованием антигенсвязывающей поверхности, которая комплементарна трехмерной поверхности связанного антигена. Три гипервариабельные области каждой тяжелой и легкой цепей называются «определяющими комплементарность областями» или «CDR». Каркасная область и CDR были определены и описаны, например, в Kabat, Е.А., et al. (1991) Sequences of Proteins of hnmunological Interest, Fifth Edition, U.S. Department of Health and Human Services, NIH Publication No. 91-3242, и Chothia, C. et al. (1987) J. Mol. Biol. 196:901-917. Каждая вариабельная цепь (например, вариабельная тяжелая цепь и вариабельная легкая цепь) обычно состоит из трех CDR и четырех FR, расположенных от аминоконца до карбоксиконца в аминокислотном порядке: FR1, CDR1, FR2, CDR2, FR3, CDR3 и FR4. CDR вариабельной области легкой цепи (VL) обычно определяют как включающие остатки в положениях 27-32 (CDR1), 50-56 (CDR2) и 91-97 (CDR3). CDR вариабельной области тяжелой цепи (VH) обычно определяют как включающие остатки в положениях 27-33 (CDR1), 52-56 (CDR2) и 95-102 (CDR3). Специалисту в данной области техники будет понятно, что петли могут иметь разную длину для антител и систем нумерации, таких как нумерация в соответствии с Kabat или Chotia, так что каркасные области характеризуются последовательной нумерацией для антител.
[49] В соответствии с некоторыми вариантами осуществления антигенсвязывающий фрагмент антитела (например, когда он включен как часть слитой молекулы) может не содержать или не иметь полный домен Fc. В соответствии с некоторыми вариантами осуществления антителосвязывающий фрагмент не содержит полный IgG или полный Fc, но может включать одну или несколько константных областей (или их фрагментов) из легкой и/или тяжелой цепей. В соответствии с некоторыми вариантами осуществления антигенсвязывающий фрагмент может вообще не иметь никакого домена Fc. В соответствии с некоторыми вариантами осуществления антигенсвязывающий фрагмент может по сути не содержать полного домена Fc. В соответствии с некоторыми вариантами осуществления антигенсвязывающий фрагмент может содержать часть полного домена Fc (например, домен СН2 или СН3 или его часть). В соответствии с некоторыми вариантами осуществления антигенсвязывающий фрагмент может содержать полный домен Fc. В соответствии с некоторыми вариантами осуществления домен Fc представляет собой домен IgG, например, домен Fc IgG1, IgG2, IgG3 или IgG4. В соответствии с некоторыми вариантами осуществления домен Fc содержит домен СН2 и домен СН3.
[50] Используемый в данном документе термин «введение» и подобные термины означают доставку композиции индивидууму, подлежащему лечению. Предпочтительно композиции по настоящему изобретению вводят, например, парентерально, включая подкожно, внутримышечно или предпочтительно внутривенно.
[51] Используемый в данном документе термин «эффективное количество» означает количество биоактивного средства или диагностического средства, достаточное для обеспечения необходимого местного или системного эффекта при разумном соотношении риск/польза, как при любом медицинском лечении или диагностическом тесте. Это будет варьироваться в зависимости от пациента, заболевания, проводимого лечения и природы средства. Терапевтически эффективное количество будет варьироваться в зависимости от пациента и патологического состояния, подлежащего лечению, массы и возраста пациента, тяжести патологического состояния, способа введения и т.п., что может быть легко определено специалистом в области медицины. Дозы для введения могут варьироваться, например, от приблизительно 1 нг до приблизительно 10000 мг, от приблизительно 5 нг до приблизительно 9500 мг, от приблизительно 10 нг до приблизительно 9000 мг, от приблизительно 20 нг до приблизительно 8500 мг, от приблизительно 30 нг до приблизительно 7500 мг, от приблизительно 40 нг до приблизительно 7000 мг, от приблизительно 50 нг до приблизительно 6500 мг, от приблизительно 100 нг до приблизительно 6000 мг, от приблизительно 200 нг до приблизительно 5500 мг, от приблизительно 300 нг до приблизительно 5000 мг, от приблизительно 400 нг до приблизительно 4500 мг, от приблизительно 500 нг до приблизительно 4000 мг, от приблизительно 1 мкг до приблизительно 3500 мг, от приблизительно 5 мкг до приблизительно 3000 мг, от приблизительно 10 мкг до приблизительно 2600 мг, от приблизительно 20 мкг до приблизительно 2575 мг, от приблизительно 30 мкг до приблизительно 2550 мг, от приблизительно 40 мкг до приблизительно 2500 мг, от приблизительно 50 мкг до приблизительно 2475 мг, от приблизительно 100 мкг до приблизительно 2450 мг, от приблизительно 200 мкг до приблизительно 2425 мг, от приблизительно 300 мкг до приблизительно 2000 мг, от приблизительно 400 мкг до приблизительно 1175 мг, от приблизительно 500 мкг до приблизительно 1150 мг, от приблизительно 0,5 мг до приблизительно 1125 мг, от приблизительно 1 мг до приблизительно 1100 мг, от приблизительно 1,25 мг до приблизительно 1075 мг, от приблизительно 1,5 мг до приблизительно 1050 мг, от приблизительно 2,0 мг до приблизительно 1025 мг, от приблизительно 2,5 мг до приблизительно 1000 мг, от приблизительно 3,0 мг до приблизительно 975 мг, от приблизительно 3,5 мг до приблизительно 950 мг, от приблизительно 4,0 мг до приблизительно 925 мг, от приблизительно 4,5 мг до приблизительно 900 мг, от приблизительно 5 мг до приблизительно 875 мг, от приблизительно 10 мг до приблизительно 850 мг, от приблизительно 20 мг до приблизительно 825 мг, от приблизительно 30 мг до приблизительно 800 мг, от приблизительно 40 мг до приблизительно 775 мг, от приблизительно 50 мг до приблизительно 750 мг, от приблизительно 100 мг до приблизительно 725 мг, от приблизительно 200 мг до приблизительно 700 мг, от приблизительно 300 мг до приблизительно 675 мг, от приблизительно 400 мг до приблизительно 650 мг, от приблизительно 500 мг или от приблизительно 525 мг до приблизительно 625 мг антитела или его антигенсвязывающего участка, как предусмотрено в данном документе. Введение дозы может осуществляться, например, каждую неделю, каждые 2 недели, каждые три недели, каждые 4 недели, каждые 5 недель или каждые 6 недель. Режимы введения дозы могут быть скорректированы для обеспечения оптимального терапевтического ответа. Эффективным количеством также является такое количество, при котором любые токсические или вредные эффекты (побочные эффекты) средства сведены к минимуму и/или перевешиваются полезными эффектами. Введение может быть внутривенным точно или приблизительно 6 мг/кг или 12 мг/кг еженедельно, или 12 мг/кг или 24 мг/кг раз в две недели. Дополнительные режимы введения дозы описаны ниже.
[52] Используемый в данном документе термин «фармацевтически приемлемый» относится к тому, что полезно при приготовлении фармацевтической композиции, которая в целом безопасна, нетоксична и не является нежелательной ни с биологической, ни с другой стороны, и включает то, что приемлемо для ветеринарного применения, а также для фармацевтического применения у человека. Примеры «фармацевтически приемлемых жидких носителей» включают воду и органические растворители. Предпочтительные фармацевтически приемлемые водные жидкости включают PBS, физиологический раствор, растворы декстрозы и т.д.
[53] Термин «иммуногенность» относится к способности конкретного вещества, такого как антиген или эпитоп, вызывать иммунный ответ, который может быть гуморальным и/или клеточно-опосредованным, в организме человека и другого животного. В соответствии с некоторыми вариантами осуществления введение композиции по настоящему изобретению снижает иммуногенность и/или повышает иммунную толерантность к биологическому веществу, такому как терапевтические средства. «Толерантность» или «иммунотолерантность», как используется в данном документе, относится к отсутствию иммунного ответа на конкретный антиген (например, терапевтический биологический препарат) в условиях в целом нормальной иммунной системы.
[54] Используемый в данном документе термин «главный комплекс гистосовместимости» или белок «МНС» относится к набору молекул клеточной поверхности, кодируемых большим семейством генов, которые играют важную роль в иммунной системе позвоночных. Ключевой функцией этих белков является связывание пептидных фрагментов, полученных из эндогенных или экзогенных (чужеродных) белков, и отображение их на клеточной поверхности для распознавания соответствующими Т-клетками организма хозяина. Семейство генов МНС делится на три подгруппы: класс I, класс II и класс III. Гены МНС класса I и класса II человека также называют человеческим лейкоцитарным антигеном (HLA) - HLA класса I и HLA класса II соответственно. Одними из наиболее изученных генов HLA у человека являются девять генов МНС: HLA-A, HLA-В, HLA-C, HLA-DPA1, HLA-DPB1, HLA-DQA1, HLA-DQB1, HLA-DRA, HLA-DRB1 и HLA-DRB345.
[55] Различные аспекты настоящего раскрытия более подробно описаны ниже. Дополнительные определения приведены во всем настоящем описании.
Не приводящие к деплеции В-клеточные ингибиторы и фармацевтические композиции
[56] В соответствии с различными вариантами осуществления В-клеточный ингибитор можно использовать для снижения или модулирования иммуногенности. В соответствии с некоторыми вариантами осуществления такие В-клеточные ингибиторы представляют собой не приводящие к деплециии иммуномодуляторы. Используемый в данном документе термин «не приводящий к деплеции» или «не приводящий к деплетированию» означает, что ингибитор или иммуномодулятор не полностью деплетирует В-клеточные виды активности. С другой стороны, «деплеция» В-клеток означает, что средство действует для элиминации или уничтожения В-клеток, такое как антитела к CD20, например, ритуксимаб. Таким образом, в соответствии с одним вариантом осуществления не приводящие к деплеции В-клеточные ингибиторы или иммуно модуляторы, раскрытые в данном документе, не представляют собой ритуксимаб. В соответствии с некоторыми вариантами осуществления В-клеточные ингибиторы или иммуно модуляторы не представляют собой антитела к CD20 или другие ингибиторы CD20.
[57] Иллюстративные не приводящие к деплеции В-клеточные ингибиторы включают без ограничения биспецифические ингибиторы CD32B × CD79B; модуляторы CD32B; блокаторы В-клеточных рецепторов (BCR), например, молекулы антитела к CD22; ингибиторы выживания и активации В-клеток, например, ингибиторы фактора активации В-клеток (BAFF) или лиганда, индуцирующего пролиферацию A (APRIL), такие как белимуманб; молекулы антитела к CD40 и к CD40L; и ингибиторы тирозинкиназы Брутона (ВТК), такие как ибрутиниб (PCI-32765) и акалабрутиниб.
[58] В соответствии с некоторыми вариантами осуществления В-клеточный ингибитор может представлять собой биспецифическое антитело к CD32B × CD79B, такое как антитело, раскрытое в публикации США №2016/0194396, публикациях WIPO №№ WO 2015/021089 и WO 2017/214096, все из которых включены посредством ссылки в полном объеме, или его антигенсвязывающий фрагмент.
[59] Иллюстративное биспецифическое диатело к CD32B × CD79B может содержать две или более полипептидных цепей и может содержать:
(1) домен VL антитела, который связывает CD32B (VLCD32B), такой как домен VLCD32B, содержащий последовательность (SEQ ID NO: 1):
DIQMTQSPSS LSASVGDRVT ITCRASQEIS GYLSWLQQKP GKAPRRLIYA ASTLDSGVPS RFSGSESGTE FTLTISSLQP EDFATYYCLQ YFSYPLTFGG GTKVEIK
(2) домен VH антитела, который связывает CD32B (VНCD32B), такой как домен VНCD32B, содержащий последовательность (SEQ ID NO: 2):
EVQLVESGGG LVQPGGSLRL SCAASGFTFS DAWMDWVRQA PGKGLEWVAE IRNKAKNHAT YYAESVIGRF TISRDDAKNS LYLQMNSLRA EDTAVYYCGA LGLD Y WGQGT LVTVSS
(3) домен VL антитела, который связывает CD79B (VLCD79B), такой как домен VLCD79B, содержащий последовательность (SEQ ID NO: 3):
DVVMTQSPLS LPVTLGQPAS ISCKSSQSLL DSDGKTYLNW FQQRPGQSPN RLIYLVSKLD SGVPDRFSGS GSGTDFTLKISRVEAEDVGV YYCWQGTHFP LTFGGGTKLE IK
(4) домен VH антитела, который связывает CD79B (VHCD79B), такой как домен VHCD79B, содержащий последовательность (SEQ ID NO: 4):
QVQLVQSGAE VKKPGASVKV SCKASGYTFT SYWMNWVRQA PGQGLEWIGM IDPSDSETHY NQKFKDRVTM TTDTSTSTAY MELRSLRSDD TAVYYCARAM GYWGQGTTVT VSS
[60] В соответствии с одним вариантом осуществления В-клеточный ингибитор может представлять собой PRV-3279, гуманизированный белок на основе переориентирующегося антитела с двойной аффинностью CD32B × CD79B (DART®), продуцируемый в клетках яичника китайского хомячка с молекулярной массой 111,5 кДа. Белки DART® представляют собой биспецифические молекулы на основе антител, которые могут одновременно связывать 2 различных антигена. PRV-3279 предназначен для нацеливания на CD32B (Fc-гамма-рецептор IIb) и CD79B (ассоциированная с иммуноглобулином бета-субъединица комплекса В-клеточного рецептора (BCR)) на В-лимфоцитах. Совместное лигирование CD32B и CD79B в предпочтительном цис-связывающем режиме на В-лимфоцитах запускает передачу сигналов ингибирующего мотива на основе тирозина, связанную с СD32В-иммунорецептором, что приводит к снижению антигенопосредованной активации наивных В-клеток и В-клеток памяти без значительной деплеции. Для продления периода полужизни in vivo PRV-3279 также содержит область Fc человеческого иммуноглобулина G (IgG)1, которая была мутирована для значительного уменьшения или устранения нежелательного связывания с FcγR и комплементом, но сохраняет аффинность к неонатальному связыванию FcR, чтобы использовать преимущества пути спасения IgG, опосредованного этим рецептором.
[61] Молекула CD32B представляет собой трансмембранный ингибирующий рецептор, широко экспрессируемый на В-клетках и других иммунных эффекторных клетках, таких как макрофаги, нейтрофилы и тучные клетки. Компонент антитела к CD32B PRV-3279 основан на гуманизированной версии запатентованного мышиного моноклонального антитела (mAb) 8 В5 компании MacroGenics. CD79B представляет собой важный компонент передачи сигнала BCR, который экспрессируется исключительно на В-клетках. Компонент антитела к CD79B PRV-3279 основан на гуманизированной версии мышиного mAb СВ3.
[62] В соответствии с одним вариантом осуществления PRV-3279 содержит следующую последовательность (CDR подчеркнуты, а спиральные домены выделены жирным шрифтом):
Цепь 1 (Fc CD32BVL CD79bVH спираль Е): (SEQ ID NO.: 5)

Цепь 2 (CD79bVL - CD32BVH - спираль K): (SEQ ID NO.: 6)

Цепь 3 (Fc): (SEQ ID NO.: 7)

[63] В соответствии с другим аспектом предусмотрены фармацевтические композиции, которые можно использовать в способах, раскрываемых в данном документе, т.е. фармацевтические композиции для снижения или подавления иммуногенности у субъекта, нуждающегося в этом, например, во время или после получения биологического средства, который вызывает значительную иммуногенность, или потому что субъект ранее имел иммуногенность к биотерапевтическому средству (например, в случае ранее существовавших антител к AAV вследствие предшествующих аденовирусных инфекций дикого типа или вследствие предшествующего воздействия терапии rAAV). В соответствии с некоторыми вариантами осуществления композиции, раскрываемые в данном документе, можно вводить пациенту перед получением биологического средства, такого как антитело или генная терапия, для предупреждения иммуногенности и/или уменьшения предварительно существующих антител.
[64] В соответствии с некоторыми вариантами осуществления фармацевтическая композиция содержит В-клеточный ингибитор, как описано в данном документе, и фармацевтически приемлемый носитель. В-клеточный ингибитор может быть включен в фармацевтическую композицию вместе с фармацевтически приемлемым носителем. Кроме того, фармацевтическая композиция может включать, например, инструкции по применению композиции для лечения пациентов с целью снижения или подавления иммуногенности у субъекта, нуждающегося в этом, например, во время или после получения биологического средства, который вызывает значительную иммуногенность.
[65] Используемый в данном документе термин «фармацевтически приемлемый носитель» включает любые и все растворители, дисперсионные среды, покрытия, антибактериальные и противогрибковые средства, изотонические средства и средства, замедляющие абсорбцию, буферы и другие вспомогательные вещества, которые являются физиологически совместимыми. Предпочтительно носитель является подходящим для парентерального, перорального или местного введения. В зависимости от пути введения активное соединение, например низкомолекулярное или биологическое средство, может быть покрыто материалом для защиты соединения от действия кислот и других природных условий, которые могут инактивировать соединение.
[66] Фармацевтически приемлемые носители включают стерильные водные растворы или дисперсии и стерильные порошки для немедленного приготовления стерильных растворов или дисперсий для инъекций, а также обычные наполнители для приготовления таблеток, пилюль, капсул и т.п. Применение таких сред и средств для приготовления фармацевтически активных веществ известно из уровня техники. За исключением случаев, когда какие-либо обычные среды или средства несовместимы с активным соединением, предполагается их использование в фармацевтических композициях, предлагаемых в данном документе. В композиции также могут быть включены дополнительные активные соединения.
[67] Фармацевтически приемлемый носитель может включать фармацевтически приемлемый антиоксидант. Примеры фармацевтически приемлемых антиоксидантов включают: (1) водорастворимые антиоксиданты, такие как аскорбиновая кислота, цистеина гидрохлорид, натрия бисульфат, натрия метабисульфат, натрия сульфит и т.п.; (2) жирорастворимые антиоксиданты, такие как аскорбилпальмиат, бутилированный гидроксианизол (ВНА), бутилированный гидрокситолуол (ВНТ), лецитин, пропилгаллат, альфа-токоферол и т.п.; (3) металлохелатирующие средства, такие как лимонная кислота, этиледиаминтетрауксусная кислота (EDTA), сорбитол, винная кислота, ортофосфорная кислота и т.п.
[68] Примеры подходящих водных и неводных носителей, которые могут быть использованы в фармацевтических композициях, предусмотренных в данном документе, включают воду, этанол, полиолы (такие как глицерин, пропиленгликоль, полиэтиленгликоль и т.п.), и их подходящие смеси, и сложные органические эфиры для инъекций, в том числе, этилолеат. При необходимости подходящая текучесть может быть поддержана, например, с помощью применения покрывающих материалов, таких как лецитин, с помощью поддержания необходимого размера частиц в случае дисперсий и с помощью применения поверхностно-активных веществ. Во многих случаях может быть полезным включение в композицию изотонических средств, таких как сахара, полиспирты, такие как маннит, сорбит или хлорид натрия. Длительное всасывание композиций для инъекций может быть достигнуто с помощью включения в композицию средства, которое замедляет всасывание, например, солей моностеарата и желатина.
[69] Эти композиции также могут содержать функциональные наполнители, такие как консерванты, увлажняющие средства, эмульгирующие средства и диспергирующие средства.
[70] Терапевтические композиции в типичном случае должны быть стерильными, непирогенными и стабильными в условиях изготовления и хранения. Композиция может быть разработана в виде раствора, микроэмульсии, липосомы или другой упорядоченной структуры, подходящей для высокой концентрации лекарственного средства.
[71] Стерильные растворы для инъекций могут быть приготовлены с помощью включения активного соединения в требуемом количестве в подходящий растворитель с одним или комбинацией компонентов, перечисленных выше, при необходимости, с последующей стерилизационной, например, путем микрофильтрации. Как правило, дисперсии получают с помощью включения активного соединения в стерильную основу, которая содержит основную дисперсную среду и другие необходимые компоненты из таковых, перечисленных выше. В случае стерильных порошков для приготовления стерильных растворов для инъекций способы приготовления включают вакуумную сушку и сублимационную сушку (лиофилизацию), которые приводят к образованию порошка активного компонента совместно с любым дополнительным необходимыми компонентом из его предварительно стерилизованного фильтрованием раствора. Активное (активные) средство (средства) можно смешивать в стерильных условиях с дополнительным (дополнительными) фармацевтически приемлемым (приемлемыми) носителем (носителями) и с любыми консервантами, буферами или пропеллентами, которые могут потребоваться.
[72] Предупреждение наличия микроорганизмов может быть обеспечено как с помощью стерилизационных процедур, см. выше, так и с помощью включения различных антибактериальных и противогрибковых средств, например, парабена, хлоробутанола, фенолсорбиновой кислоты и т.п. Также может быть желательным включение в композиции изотонических средств, таких как сахара, хлорид натрия и т.п. Помимо этого, длительное всасывание фармацевтической формы для инъекций может быть достигнуто с помощью включения средств, которые задерживают всасывание, таких как алюминия моностеарат и желатин.
[73] Режимы введения дозы корректируют в целях обеспечения оптимального необходимого ответа (например, терапевтического ответа). Например, может быть введен один болюс, в течение определенного времени могут быть введены несколько распределенных доз или доза может быть пропорционально снижена или повышена в зависимости от потребностей терапевтической ситуации.
[74] Иллюстративные диапазоны доз для введения антитела включают: 10-1000 мг (антитела)/кг (масса тела больного), 10-800 мг/кг, 10-600 мг/кг, 10-400 мг/кг, 10-200 мг/кг, 30-1000 мг/кг, 30-800 мг/кг, 30-600 мг/кг, 30-400 мг/кг, 30-200 мг/кг, 50-1000 мг/кг, 50-800 мг/кг, 50-600 мг/кг, 50-400 мг/кг, 50-200 мг/кг, 100-1000 мг/кг, 100-900 мг/кг, 100-800 мг/кг, 100-700 мг/кг, 100-600 мг/кг, 100-500 мг/кг, 100-400 мг/кг, 100-300 мг/кг и 100-200 мг/кг. Иллюстративные схемы введения дозы включают один раз каждые три дня, один раз каждые пять дней, один раз каждые семь дней (т.е. один раз в неделю), один раз каждые 10 дней, один раз каждые 14 дней (т.е. один раз каждые две недели), один раз каждый 21 день (т.е. один раз каждые три недели), один раз каждые 28 дней (т.е. один раз каждые четыре недели), один раз в месяц, один раз каждые 5 недель и один раз каждые 6 недель.
[75] В соответствии с некоторыми вариантами осуществления приблизительно 5-40 мг/кг, приблизительно 5-20 мг/кг или приблизительно 10 мг/кг на дозу PRV-3279 можно вводить один раз каждые 2 недели, один раз каждые 3 недели, один раз каждые 4 недели, один раз в 5 недель или один раз в 6 недель. Можно вводить одну или несколько доз, например, 1 дозу, 2 дозы или 3 дозы. Введение может осуществляться посредством IV инфузии. Любая комбинация вышеперечисленного (например, 3 дозы по 10 мг/кг на дозу, один раз каждые 4 недели) может быть использована для снижения иммуногенности биотерапевтических средств, включая продукты генной терапии. В соответствии с некоторыми вариантами осуществления первая доза может быть введена за 2-6 недель (например, за 4 недели) до генной терапии, вторая доза примерно в то же время, что и генная терапия, и третья доза за 2-6 недель (например, за 4 недели) после генной терапии. После этого за пациентом можно наблюдать, исследуя количество специфических антител к вектору на основе генной терапии (например, rAAV) и/или трансгену. Если антитела не обнаруживаются или обнаруживаются в небольшом количестве, тогда необходимость в дополнительном PRV-3279 отсутствует. Если присутствует значительное количество антител, то можно ввести одну или несколько доз PRV-3279 для дальнейшего модулирования иммуногенности.
[76] Может оказаться выгодным составлять парентеральные композиции в стандартной лекарственной форме для простоты введения и однородности дозировки. Стандартная лекарственная форма, используемая в данном документе, относится к физически дискретным единицам, подходящим в качестве стандартных доз для пациентов, подлежащих лечению; каждая единица содержит предварительно определенное количество активного средства, рассчитанное для получения необходимого терапевтического эффекта в сочетании с любым требуемым фармацевтическим носителем. Описание стандартных лекарственных форм продиктовано и напрямую зависит от (а) уникальных характеристик активного соединения и конкретного терапевтического эффекта, который должен быть достигнут, и (b) ограничений, присущих области приготовления таких активных соединений для лечения чувствительности у индивидуумов.
[77] Фактические уровни дозировки активных ингредиентов в фармацевтических композициях, раскрытых в данном документе, могут варьироваться для получения количества активного ингредиента, эффективного для достижения необходимого терапевтического ответа для конкретного пациента, композиции и способа введения, не являющихся токсичными для пациента. Термин «парентеральный», используемый в данном документе в контексте введения, означает способы введения, отличные от энтерального и местного введения, обычно путем инъекции, и включает без ограничения внутривенные, внутримышечные, внутриартериальные, интратекальные, внутрикапсульные, интраорбитальные, внутрисердечные, внутрикожные, внутрибрюшинные, транстрахеальные, подкожные, субкутикулярные, внутрисуставные, субкапсулярные, субарахноидальные, интраспинальные, эпидуральные и интрастернальные инъекции и инфузии.
[78] Фразы «парентеральное введение» и «вводимый парентерально», используемые в настоящем документе, относятся к способам введения, отличным от энтерального (т.е., через пищеварительный тракт) и местного введения, обычно путем инъекции или инфузии, и включают, без ограничения, внутривенную, внутримышечную, внутриартериальную, интратекальную, внутрикапсульную, внутриглазничную, внутрисердечную, внутрикожную, внутрибрюшинную, транстрахеальную, подкожную, субкутикулярную, внутрисуставную, субкапсулярную, субарахноидальную, интраспинальную, эпидуральную и внутригрудинную инъекцию и инфузию. Внутривенные инъекции и инфузии часто (но не исключительно) используются для введения антител.
[79] Когда средства по настоящему изобретению вводят в виде фармацевтических средств людям или животным, их можно вводить отдельно или в виде фармацевтической композиции, содержащей, например, от 0,001 до 90% (например, от 0,005 до 70%, например, от 0,01 до 30%) активного ингредиента в комбинации с фармацевтически приемлемым носителем.
Терапевтические варианты применения и способы
[80] Композиции, раскрываемые в данном документе, можно использовать для снижения или подавления иммуногенности, вызываемой различными биологическими продуктами, такими как генная терапия, доставляемая различными способами (например, AAV и другие векторы дикого типа и рекомбинантные векторы, стволовые клетки человека, модифицированные лентивирусом), включая кодируемый трансгенный белок; терапия на основе редактирования генов (например, CRISPR7Cas9); терапия на основе матричной РНК (mRNA) (например, mRNA-вакцины); онколитические вирусы (например, VSV, HSV-1); заместительная ферментная терапия (например, замена фактора VIII/IХ); терапевтические средства на основе антител и слитых белков (например, биологические препараты против TNF); клеточная терапия (например, терапия на основе CAR-T).
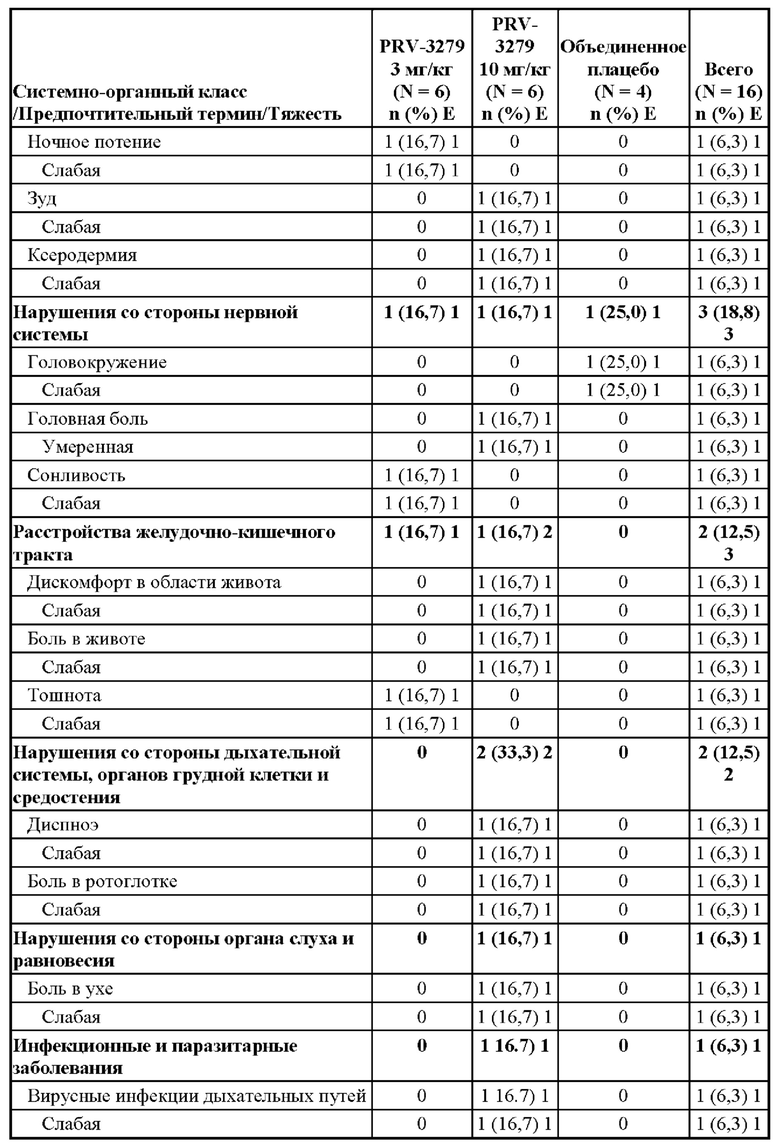
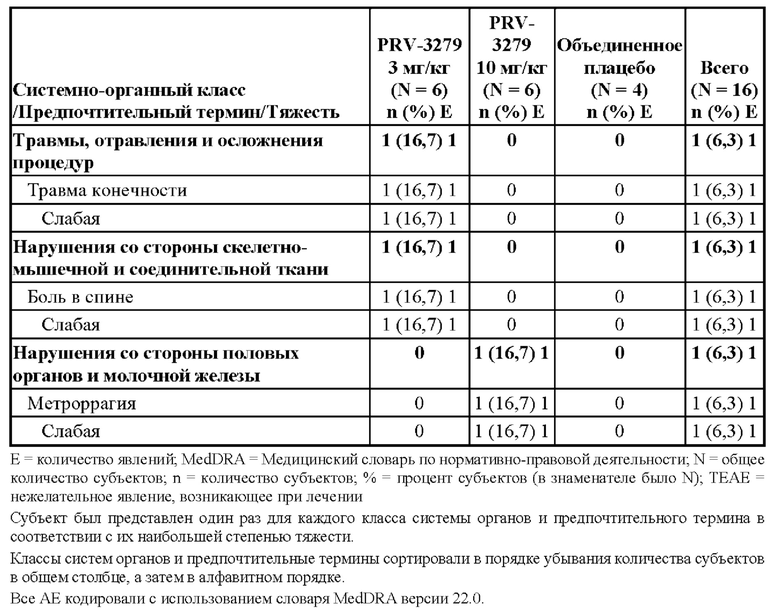
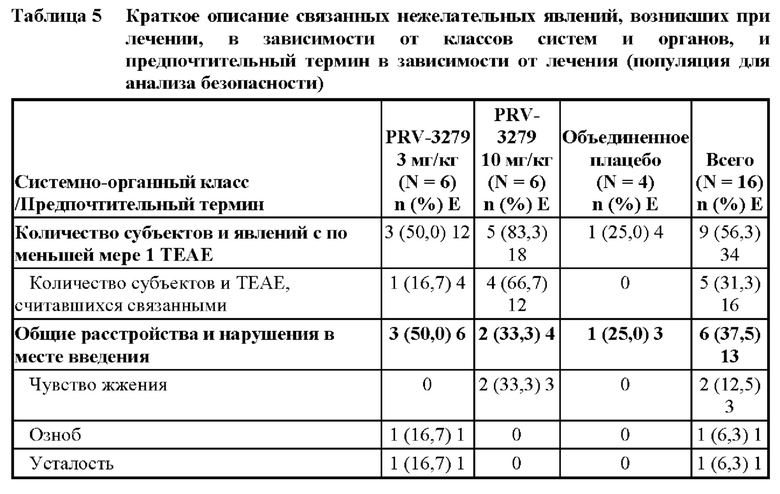
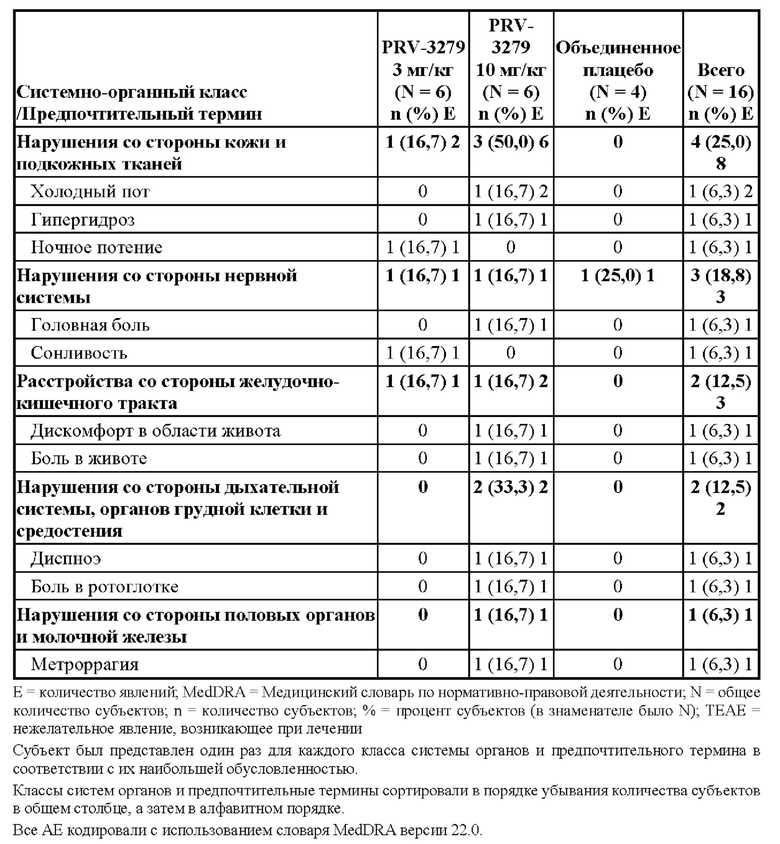
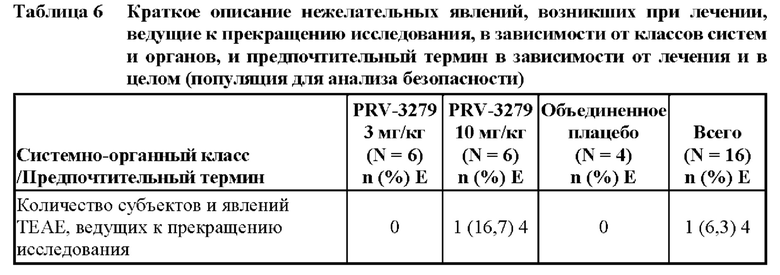
[81] В соответствии с некоторыми вариантами осуществления В-клеточные иммуномодуляторы, раскрываемые в данном документе, можно использовать для улучшения множества существующих или новых платформ генной и клеточной терапии, таких как:
1. виды терапии на основе вектора rAAV (рекомбинантного аденоассоциированного вируса), включая:
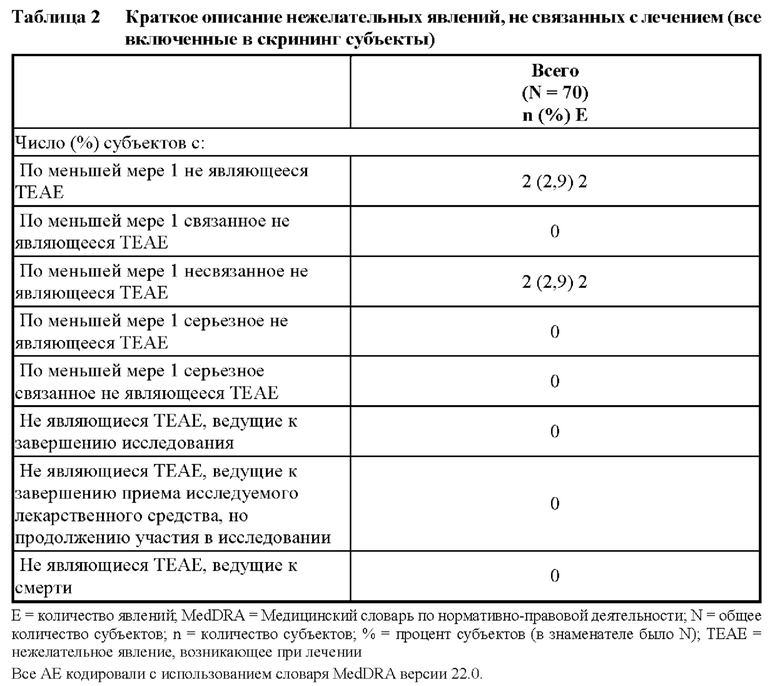
• rAAV для «традиционной» вирусной доставки трансгена, например, при наследственной недостаточности ферментов
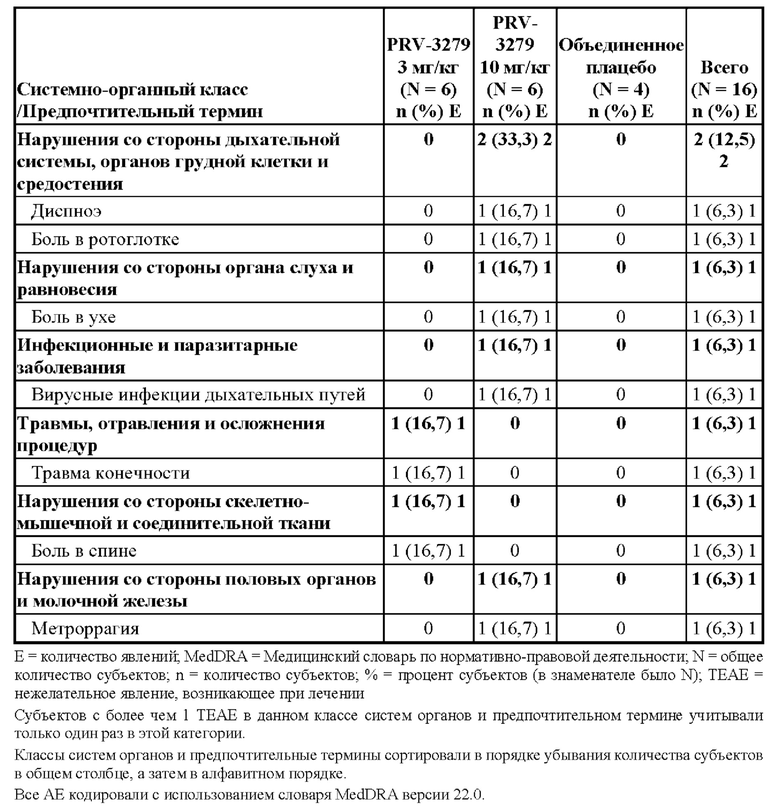
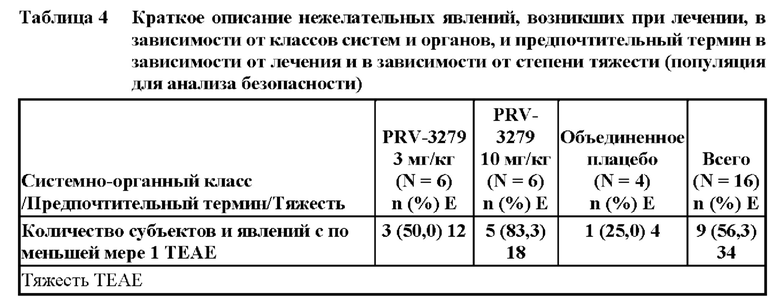
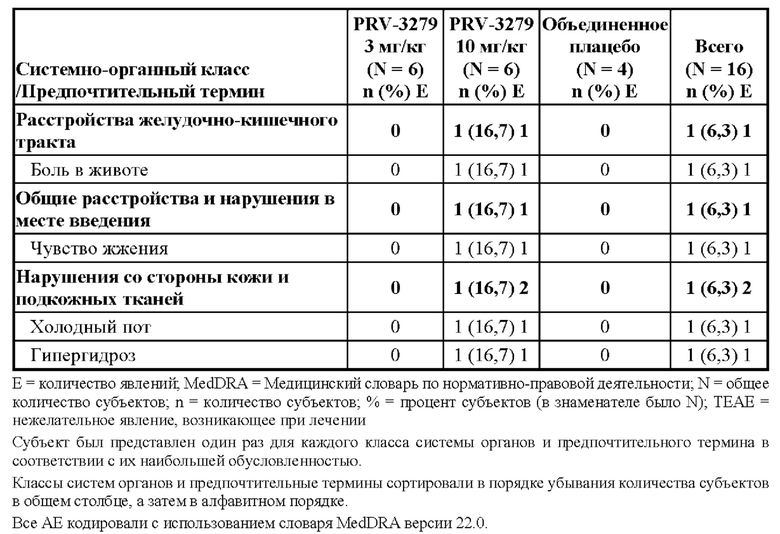
• rAAV для доставки in vivo технологии редактирования генов (например, кластеризованная нуклеаза Cas9, ассоциированная с регулярно расположенными короткими палиндромными повторами (CRISPR) («CRISPR/Cas9»)
• rAAV для доставки вакцинных антител (например, против гриппа)
2. Терапия на основе стволовых клеток человека (HSC) с использованием HSC, модифицированных лентивирусом;
3. Доставка белка Cas9 (Cas9 является бактериальным и иммуногенным); и
4. Онколитический вирус, такой как вирус везикулярного стоматита (VSV) и вирус простого герпеса типа 1 (HSV-1).
[82] В соответствии с некоторыми вариантами осуществления В-клеточные иммуномодуляторы, раскрываемые в данном документе, можно использовать для модулирования ограничивающего иммунного ответа, вызываемого несколькими путями доставки (даже в местах предполагаемой иммунной привилегии), такими как системный, внутримышечный, глазной (требующий высокой локальной дозы, результаты в местном иммунном ответе) и в центральную нервную систему (ЦНС) (где утечка вирусного капсида из ЦНС вызывает системный ответ, который снижает поглощение AAV в ЦНС).
[83] В соответствии с некоторыми вариантами осуществления В-клеточные иммуномодуляторы, раскрываемые в данном документе, можно использовать для модулирования множества ограничивающих иммунологических путей, зависящих от В-клеток, включая:
• Выработку нейтрализующих антител (nАb)
• Антителозависимую клеточно-опосредованную цитотоксичность
• Антителозависимую цитотоксичность, опосредованную комплементом
• Автономную активацию В-клеток, например, через Toll-подобные рецепторы (TLR)
[84] В соответствии с некоторыми вариантами осуществления В-клеточные иммуномодуляторы, раскрываемые в данном документе, можно использовать для улучшения множественных клинических применений AAV посредством модуляции В-клеток, такой как повторное введение дозы и/или увеличение дозы AAV.
[85] В соответствии с некоторыми вариантами осуществления после введения PRV-3279 пиковые концентрации в плазме крови наблюдали в конце инфузии биспецифической молекулы, и при многократном введение дозы наблюдали минимальную кумуляцию. Это показывает, что PRV-3279 характеризуется эффективными фармакокинетическими свойствами.
[86] В соответствии с некоторыми вариантами осуществления введение биспецифического средства PRV-3279 может приводить к ингибированию его собственной иммуногенности, т.е. снижению распространенности и/или титров антител к лекарственным средствам (ADA) при повышенных дозах лекарственного средства. Это отличает их от других иммуномодуляторов. Кроме того, это указывает на то, что повышенная доза PRV-3279, такая как 20 мг/кг, 30 мг/кг или 40 мг/кг, может хорошо переноситься без дополнительной иммуногенности.
[87] В соответствии с некоторыми вариантами осуществления было замечено, что PRV-3279 ADA не влияет на фармакокинетику (РK), фармакодинамику (PD), безопасность или эффективность. Это удивительно, поскольку ADA обычно влияет по меньшей мере на РK и PD. Не ограничиваясь теорией, было высказано предположение, что ADA не нейтрализует PRV-3279.
[88] В соответствии с некоторыми вариантами осуществления биспецифическое средство PRV-3279 дозозависимым образом связывается с большинством (например, >80-90%) В-клеток, включая как наивные, так и фенотипы памяти, при введении, и остается связанным по меньшей мере с 50% В-клеток в течение по меньшей мере 4 недель после последнего введения некоторых более высоких доз лекарственного средства. Это показывает продолжительную устойчивость PD эффекта PRV-3279 и поддерживает введение один раз в месяц (или дольше).
[89] В соответствии с некоторыми вариантами осуществления дозозависимость и устойчивое связывание В-клеток биспецифическим лекарственным средством PRV-3279 приводит к стойкому ингибированию продуцирования иммуноглобулина при отсутствии деплеции какой-либо субпопуляции циркулирующих клеток, включая В-клетки. Иммуноглобулины, уровень которых снижен в периферической крови, включают IgM, IgA, IgG и IgE. Ингибирование можно наблюдать в отсутствие или при наличии (например, при вакцинации) стимуляции антигеном. Это выгодное свойство безопасности PRV-3279 в качестве не приводящего к деплеции средства, так что пациент может сохранять циркулирующие клетки, такие как В-клетки, для функционирования в качестве части иммунной системы. В отличие от этого, пациентам, получающим приводящие к деплеции средства (например, ритуксимаб, окрелизумаб, инебилизумаб), требуется длительное время для выздоровления (например, год).
ПРИМЕРЫ
[90] Следующие примеры, в том числе проведенные эксперименты и достигнутые результаты, предоставлены только для иллюстративных целей и не должны рассматриваться как ограничивающие настоящее раскрытие.
Пример 1: Снижение иммуногенности к рекомбинантному аденоассоциированному вирусу (rAAV)
[91] В некоторых экспериментах можно вводить биспецифическое антитело к CD32B × CD79B в виде монотерапии или в комбинации с другими иммуно модуляторами, например, сиролимусом, рапамицином, абатацептом, теплизумабом и иммуноглобулином G-деградирующим ферментом Streptococcus pyogenes мышам перед введением вектора на основе rAAV, кодирующего потенциально терапевтический трансген, и в последующие моменты после этого для поддержания фармакологического действия. В определенные моменты времени (например, 15-45 дней) мышей можно подвергать эвтаназии и оценивать иммунологические оценки и эффективность переноса гена аденоассоциированного вируса. Иммунологические конечные точки включают: общее количество антител (IgM, IgG) к вектору на основе rAAV и трансгену соответственно, активацию комплемента, функциональные анализы В-клеток и Т-клеток против вектора и трансгенов и фенотипическую характеристику. Эффективность мер переноса гена аденоассоциированного вируса включает число копий генома вектора крови с помощью ПЦР и активность трансгена в тканях, включая без ограничения сердце, скелетные мышцы, печень и селезенку.
[92] Результаты, достигнутые при введении биспецифического антитела к CD32B × CD79B животным-реципиентам rAAV, по сравнению с плацебо-контролем, могут включать снижение специфических ответов антител к rAAV и трансгенов, снижение активации комплемента и снижение специфической активности Т-клеток к rAAV. Число копий генома вектора и активность трансгена могут быть повышены при введении биспецифического антитела к CD32B × CD79B по сравнению с животными, получающими плацебо, что подтверждает гипотезу о том, что введение биспецифического антитела к CD32B × CD79B снижает иммуногенность рекомбинантного AAV.
Пример 2: Снижение иммуногенности к повторным дозам рекомбинантного аденоассоциированного вируса (rAAV)
[93] В некоторых экспериментах можно вводить биспецифическое антитело к CD32B × CD79B в виде монотерапии или в комбинации с другими иммуно модуляторами, например, сиролимусом, мышам перед введением вектора на основе rAAV, кодирующего потенциально терапевтический трансген, и в последующие моменты после этого для поддержания фармакологического действия. В определенные временные точки (например, 45, 90, 135 дней) мышам можно дополнительно вводить (вводят) один и тот же вектор/трансген rAAV. Мыши могут продолжать получать фармакологически релевантные дозы биспецифического антитела к CD32B × CD79B до эвтаназии в определенный временной точке (например, 90, 135,180 дней) и оценки иммунологических конечных точек и эффективности переноса гена аденоассоциированного вируса. Измеряемые иммунологические конечные точки включают: суммарные антитела к вектору на основе rAAV и трансгену соответственно; активация комплемента, функциональные анализы В-клеток и Т-клеток против вектора и трансгенов, а также фенотипическую характеристику. Эффективность мер переноса гена аденоассоциированного вируса включает число копий генома вектора с помощью ПЦР и активность трансгена в различных тканях, включая без ограничения сердце, скелетные мышцы, печень и селезенку.
[94] Результаты, достигнутые при введении биспецифического антитела к CD32B × CD79B животным-реципиентам rAAV, по сравнению с плацебо-контролем, могут включать снижение специфических ответов антител к rAAV и трансгенов, снижение активации комплемента и снижение специфической активности Т-клеток к rAAV. Число копий генома вектора и активность трансгена можно повысить при введении биспецифического антитела к CD32B × CD79B по сравнению с животными, получавшими плацебо. Эти эффекты можно отметить после однократного введения вектора на основе rAAV и после последующего введения (введений) вектора на основе rAAV, что подтверждает гипотезу о том, что введение биспецифического антитела к CD32B × CD79B может позволить повторное введение и повысить эффективность иммуногенного рекомбинантного AAV.
Пример 3: Снижение ранее существовавшего иммунного ответа на AAV или rAAV до введения рекомбинантного аденоассоциированного вируса
[95] В некоторых экспериментах ранее существовавший иммунитет к AAV или rAAV дикого типа может быть выработан у мышей путем введения соответствующего AAV или rAAV того же серотипа AAV, кодирующего потенциально терапевтический трансген. Впоследствии, в определенной временной точке, например, в день 15, биспецифическое антитело к CD32B × CD79B можно вводить в виде монотерапии или в комбинации с другими иммуномодуляторами, например, сиролимусом, тем же мышам в течение определенного периода времени, например, за 14 дней до повторного введения того же вектора на основе rAAV, кодирующего потенциально терапевтический трансген, и в последующие моменты после этого для поддержания фармакологического действия. В определенные временные точки (например, 45, 90, 135 дней) некоторым мышам можно дополнительно вводить (вводят) один и тот же вектор/трансген rAAV. Такие мыши могут продолжать получать фармакологически релевантные дозы биспецифического антитела к CD32B × CD79B до эвтаназии в определенный временной точке (например, 90, 135, 180 дней) и оценки иммунологических конечных точек и эффективности переноса гена аденоассоциированного вируса. Измеряемые иммунологические конечные точки включают: суммарные антитела к вектору на основе AAV дикого типа и/или rAAV и трансгену соответственно; активация комплемента, функциональные анализы В-клеток и Т-клеток против вектора на основе AAV и/или вектора и трансгенов, а также фенотипическую характеристику. Эффективность мер переноса гена аденоассоциированного вируса включает число копий генома вектора с помощью ПЦР и активность трансгена в тканях, включая без ограничения сердце, скелетные мышцы, печень и селезенку.
[96] Результаты, достигнутые при введении биспецифического антитела к CD32B × CD79B преиммунизированным животным AAV и/или rAAV, по сравнению с плацебо-контролем, могут включать снижение специфических ответов антител к предварительно существующему AAV и/или rAAV и трансгенам, снижение активации комплемента и снижение специфической активности Т-клеток к rAAV. После последующего введения rAAV можно отметить снижение антител к rAAV- и трансген-специфических антител, снижение активации комплемента и снижение активности специфических в отношении rAAV Т-клеток. Число копий генома вектора и активность трансгена можно повысить при введении биспецифического антитела к CD32B × CD79B по сравнению с животными, получавшими плацебо. Эти эффекты могут быть отмечены после однократного введения вектора на основе rAAV ранее иммуннизированным животным и после последующего введения (введений) вектора на основе rAAV ранее иммуннизированным животным, что подтверждает гипотезу о том, что введение биспецифического антитела к CD32B × CD79B может позволить вводить дозу иммуногенных рекомбинантных AAV, когда присутствует ранее существовавший иммунный ответ на AAV или rAAV.
Пример 4: Снижение иммуногенности при повторных дозах заместительной ферментной терапии (ERT)
[97] В определенных экспериментах можно вводить биспецифическое антитело к CD32B × CD79B в качестве монотерапии или в комбинации с другими иммуномодуляторами, например сиролимусом, мышам с врожденным дефектом определенного фермента (например, мышам с нокаутом, раскрытым в Front Immunol. 2019 Mar 13; 10:416, включено в данный документ посредством ссылки) до введения заместительной ферментной терапии и в последующие моменты после этого для поддержания фармакологического действия. В определенные моменты времени (например, 7, 14, 21, 28 дней и т.д.) мыши могут получить дополнительное введение (введения) той же ERT. Мыши могут продолжать получать фармакологически релевантные дозы биспецифического антитела к CD32B × CD79B до эвтаназии в определенной временной точке (например, 14, 21, 28, 35 дней и т.д.) и оценки иммунологических конечных точек и эффективности заместительной ферментной терапии. Иммунологические конечные точки включают: 1) общее количество антител (IgM, IgG) к ферменту, функциональные анализы В-клеток и фенотипическую характеристику; и 2) эффективность мер переноса фермента включает устранение физиологических последствий дефекта фермента и биохимический анализ активности фермента и субстрата на протяжении всего эксперимента.
[98] Результаты, достигнутые при введении биспецифического антитела к CD32B × CD79B животным-реципиентам заместительной ферментной терапии, по сравнению с плацебо-контролем, могут включать уменьшение ответов специфических к ферментам антител, улучшение физиологических исходов, зависящих от ферментов, увеличение продолжительности ферментативной активности и снижение накопления субстрата, наблюдаемое при введении биспецифического антитела к CD32B × CD79B, по сравнению с животными, получающими плацебо, что подтверждает гипотезу о том, что введение биспецифического антитела к CD32B × CD79B может снижать иммуногенность заместительной ферментной терапии и делать возможным повторное введение дозы и повышать эффективность заместительной ферментной терапии.
Пример 5: Снижение иммуногенности путем повторного введения дозы терапевтических средств на основе антител и слитых белков
[99] В некоторых экспериментах можно вводить биспецифическое антитело к CD32B × CD79B в виде монотерапии или в комбинации с другими иммуномодуляторами, например, сиролимусом, мышам перед введением антитела или слитого белка, аналогичного человеческому антителу, или терапии на основе слитого белка и в последующие временные точки после этого для поддержания фармакологического действия. В определенные моменты времени (например, 7, 14, 21, 28 дней и т.д.) мышам можно дополнительно вводить (вводят) одно и то же антитело или слитый белок. Мыши могут продолжать получать фармакологически релевантные дозы биспецифического антитела к CD32B × CD79B до эвтаназии в определенной временной точке (например, 14, 21, 28, 35 дней и т.д.) и оценки иммунологических конечных точек и активности антитела или слитого белка. Иммунологические конечные точки включают: 1) общее количество антител (IgM, IgG) к ферменту, функциональные анализы В-клеток и фенотипическую характеристику; и 2) показатели эффективности антитела или слитого белка включают фармакокинетический, иммунологический и/или фармакодинамический анализ активности антитела или слитого белка на протяжении всего эксперимента, например, способность антитела или слитого белка ингибировать целевой белок.
[100] Результаты, достигаемые при введении биспецифического антитела к CD32B × CD79B животным-реципиентам антитела или гибридного белка, по сравнению с плацебо-контролем, могут включать уменьшение гуморального ответа антител или гибридного белка, снижение клиренса и увеличение периода полувыведения (t1/2). Также можно наблюдать улучшенные и пролонгированные фармакодинамические показатели эффективности по сравнению с животными, получающими плацебо, что подтверждает гипотезу о том, что введение биспецифического антитела к CD32B × CD79B может позволить повторное введение и повысить эффективность иммуногенного антитела или слитых белков.
Пример 6: Фаза 1b, двойное слепое, плацебо-контролируемое исследование с множественными возрастающими дозами для оценки безопасности, переносимости, фармакокинетики, фармакодинамики и иммуногенности PRV-3279 у здоровых субъектов
[101] В этом исследовании безопасность, переносимость и иммуногенность многократных доз PRV-3279 оценивали у здоровых добровольцев в дозах, рассчитанных на обеспечение устойчивого высокого уровня охвата рецепторов. Для этого исследования отбирали здоровых субъектов, чтобы избежать фоновых лекарственных средств, которые могли бы исказить развитие ADA, а также признаков и симптомов, которые могли бы исказить оценку переносимости, что позволило провести более тщательное и безопасное исследование иммуногенности и переносимости повторных доз PRV-3279.
[102] Планировали две когорты для последовательного включения в исследование. В когорте А оценивала PRV-3279 в дозе 3 мг/кг каждые 2 недели, в общей сложности 3 дозы. В когорте В оценивали PRV-3279 в дозе 10 мг/кг каждые 2 недели для 3 доз. Каждая группа состояла из 8 субъектов, рандомизированных в группу PRV-3279 или плацебо в соотношении 3:1 (т.е. n = 6 для PRV-3279 и n = 2 для плацебо). 3 дозы исследуемого лекарственного средства (PRV-3279 или плацебо) вводили в виде 2-часовой IV инфузии в день 1, день 15 и день 29 в каждой когорте.
[103] Субъекты прошли скрининговые оценки для определения возможности включения в исследование в течение 28 дней до рандомизации и введения первой дозы в день 1. В день -1 субъектов допускали в отделение клинических исследований (CRU) и они проходили базовые тесты для подтверждения их возможности включения в исследование. В день 1 каждого субъекта случайным образом распределяли для получения 2-часовой IV инфузии либо PRV-3279, либо плацебо двойным слепым методом и контролировали в течение 4 часов после введения дозы. В день 2 субъекты проходили лабораторные тесты безопасности, РК анализ и оценку АЕ и их выписывали из CRU. Субъекты возвращались в CRU для получения второй дозы (день 15) и третьей дозы (день 29) назначенного им лечения. Как и в случае с первой дозой, субъектов госпитализировали в CRU за день до введения дозы и выписывали на следующий день после введения дозы.
[104] Каждая когорта включала 2 сигнальных субъекта: 1 получал PRV-3279 и 1 получал плацебо двойным слепым методом. Сигнальных субъектов оценивали в отношении нежелательных явлений (например, инфузионных реакций, отсроченной гиперчувствительности) с начала первой инфузии по меньшей мере до дня 7 до того, как остальные субъекты в когорте получили свою первую инфузию. Использование контрольных субъектов и поэтапный график введения дозы гарантировали, что любая потенциальная и высокочастотная реакция (например, инфузионные реакции, связанные с ADA) будет распознана до повторного введения дозы всей когорте.
Оценки безопасности включали зарегистрированные АЕ, в том числе реакции гиперчувствительности или инфузионные реакции, измерения основных показателей жизнедеятельности, физические осмотры, ECG и клинические лабораторные тесты. Физикальные осмотры проводили для установления исходного уровня и подтверждения физических признаков, ассоциированных с АЕ. Нежелательные явления собирали при каждом визите и оценивали по степени тяжести и связи с исследуемым лекарственным средством. В день 1, 15 и 29 показатели жизнедеятельности (температуру, пульс, артериальное давление и частоту дыхания) регистрировали сразу же в момент времени 0 (до введения дозы; за 5 минут до инфузии), через 0,5 часа, 1 час (середина инфузии), 2 часа (конец инфузии) и 6 часов после начала инфузии (4 часа после окончания инфузии). Начало IV инфузии обозначали как время «0» часов. Жизненно важные признаки получали в ± 5 минут от запланированных временных точек. Рост регистрировали только во время скринингового визита. Массу получали в день -1, день 14 и день 28.
[105] Образцы сыворотки для РК анализа, иммуногенности и PD анализа получали в выбранные временные точки. Схема дизайна исследования представлена на Фиг. 1.
Краткое описание нежелательных явлений:
[106] Во время исследования AESI, серьезные TEAE, SАЕ или ТЕАЕ, приведших к смерти, отсутствовали. Четыре легких, но повторяющихся ТЕАЕ приводили к отмене у 1 (16,7%) субъекта PRV-3279 в дозе 10 мг/кг. Никакие другие ТЕАЕ не приводили к выбыванию субъекта из исследования.
[107] В целом, 9 (56,3%) субъектов сообщили о 34 ТЕАЕ. Сообщали о восемнадцати ТЕАЕ у 5 (83,3%) субъектов, принимавших PRV-3279 в дозе 10 мг/кг; сообщали о 12 ТЕАЕ у 3 (50,0%) субъектов, принимавших PRV-3279 в дозе 3 мг/кг; и 4 ТЕАЕ были зарегистрированы у 1 (25,0%) субъекта, принимавшего плацебо. Двенадцать ТЕАЕ у 4 (66,7%) субъектов, принимавших PRV-3279 в дозе 10 мг/кг, и 4 ТЕАЕ у 1 (16,7%) субъекта, принимавшего PRV-3279 в дозе 3 мг/кг, рассматривали исследователем связанными с исследуемым лекарственным средством; все другие зарегистрированные ТЕАЕ считали несвязанными.
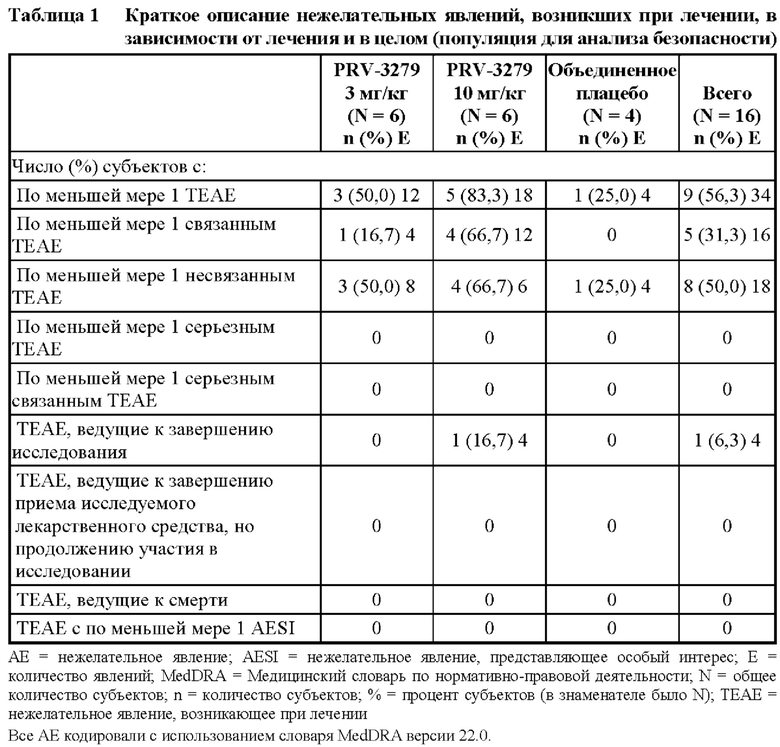
[108] Во время исследования у 2 (9,2%) субъектов сообщали о двух АЕ, которые исследователь считал не относящимися к ТЕАЕ; оба рассматривали не связанными с исследуемым лекарственным средством (Таблица 2).
[109] Краткое описание ТЕАЕ в зависимости от лечения и в целом, в зависимости от SOC и РТ представлено в таблице. Краткое описание ТЕАЕ в зависимости от SOC и РТ в зависимости от лечения по степени тяжести представлено в таблице, и краткое описание связанных ТЕАЕ представлено в таблице. Краткое описание нежелательных явлений, приводящих к прекращению лечения в зависимости от SOC и РТ, в зависимости от лечения и в целом, представлено в таблице.



Фармакокинетические данные о концентрации
[110] PRV-3279 количественно измеряли в сыворотке крови человека с использованием ECL. В этом анализе непокрытый планшет MSD Multi-Array® Standard-Bind покрывали кроличьим антителом к h8B5 в качестве реагента для захвата PRV-3279. Образцы, содержащие PRV-3279, инкубировали на покрытом планшете. Связанный PRV-3279 выявляли с помощью биотинилированного антитела 2А5. Добавляли конъюгат стрептавидин с сульфо-меткой, который связывается с первичным детекторным антителом. В планшет добавляли трипропиламин (ТРА, MSD Gold Read Buffer), и при подаче электрического заряда генерировали электрохемилюминесцентный сигнал, который регистрировали с помощью планшет-ридера MSD SECTOR S 600.
[111] Данные зависимости средней арифметической (± SD) концентрации в сыворотке крови PRV-3279 от времени показаны на Фиг. 2А-2С.BLQ = ниже предела количественного определения; LLOQ; нижний предел количественного определения; SD = стандартное отклонение. Планки погрешностей: SD. Значения, которые представляли собой BLQ перед введением дозы и в фазе абсорбции перед первой поддающейся количественному определению концентрацией, заменяли нулями. После этого значения BLQ между оцениваемыми концентрациями заменяли на LLOQ/2. LLOQ = 1,5 нг/мл
[112] Данные зависимости средней арифметической концентрации в сыворотке крови PRV-3279 от времени показаны на Фиг. 3А-3С. BLQ = ниже предела количественного определения; LLOQ; нижний предел количественного определения; SD = стандартное отклонение. Значения, которые представляли собой BLQ перед введением дозы и в фазе абсорбции перед первой поддающейся количественному определению концентрацией, заменяли нулями. После этого значения BLQ между оцениваемыми концентрациями заменяли на LLOQ/2. LLOQ = 1,5 нг/мл.
[113] После введения 2-часовых инфузий PRV-3279 в дозе 3 мг/кг и 10 мг/кг средние пиковые концентрации наблюдали в конце инфузии (2 часа) в дни 1, 15 и 29. Средние концентрации превышали нижний предел количественного определения (LLOQ; 1,5 нг/мл) в течение 1344 часов после введения в день 29 для обоих уровней доз. Средние концентрации перед введением дозы в дни 15, 29 и 43 составляли 6145 нг/мл, 7590 нг/мл и 12440 нг/мл соответственно для дозы 3 мг/кг и 48383 нг/мл, 60460 нг/мл и 77140 нг/мл соответственно для дозы 10 мг/кг. Поскольку концентрации перед введением дозы в эти дни продолжали увеличиваться и прошло менее 5 периодов полужизни, равновесное состояние не было достигнуто ни в день 15, ни в день 29.
[114] Среднее арифметическое значение концентрации PRV-3279 в зависимости от времени показано в зависимости от лечения, а результаты ADA представлены на Фиг. 4А-4В. Результаты ADA на этом графике определяли на основе результатов образца иммуногенности в каждой конкретной временной точке. ADA = антитело к лекарственному средству; BLQ = ниже предела количественного определения; LLOQ; нижний предел количественного определения; SD = стандартное отклонение. Значения, которые представляли собой BLQ перед введением дозы и в фазе абсорбции перед первой поддающейся количественному определению концентрацией, заменяли нулями. После этого значения BLQ между оцениваемыми концентрациями заменяли на LLOQ/2. LLOQ = 1,5 нг/мл. Для 3 мг/кг, ADA отрицательные/положительные в зависимости от дня: день 1 и 8 = 6/0 (N = 6); день 15, 22 и 29 = 5/1 (N = 6); день 36 = 4/2 (N = 6); день 43 = 3/3 (N = 6); день 57 = 2/4 (N = 6); день 71 = 1/5 (N = 6); день 85 0/6 (N = 6). Для 10 мг/кг, ADA отрицательные/положительные в зависимости от дня: день 1, 8, 15, 22 = 6/0 (N = 6); день 29 = 5/0 (N = 5); день 36 = 5/0 (N = 5); день 43 = 5/0 (N = 5); день 57 = 5/0 (N = 5); день 71 = 3/2 (N = 5); день 85 2/3 (N = 5).
Оценка данных иммуногенности
[115] Антитела к PRV-3279 в сыворотке крови человека обнаруживали и подтверждали в сыворотке крови человека с использованием многоуровневого подхода в анализе MSD-ECL. В этом анализе образцы, положительные контроли (PC) и отрицательный контроль (NC) подвергали минимально необходимому разведению (MRD) 1:10 в 300 мМ уксусной кислоте. Затем подкисленные образцы нейтрализовали и предварительно инкубировали в течение ночи с биотином-PRV-3279, нанесенным на планшет высокой емкости NeutrAvidin. Любые антитела к лекарственным средствам (ADA), присутствующие в сыворотке крови человека, будут связываться с биотином-PRV-3279. После инкубации в течение ночи комплексы биотин-PRV-3279:ADA подвергали второй обработке кислотой для разрушения комплексов. Подкисленные образцы ADA затем наносили на чистый планшет MSD с высоким связыванием. После блокировки образцы ADA обнаруживали с помощью сульфо-меткa-PRV-3279 по хемилюминесцентному сигналу, который генерируется при приложении напряжения. Полученные в результате электрохемилюминесцентный (ECL) сигнал или относительные световые единицы (RLU) прямо пропорциональны количеству ADA, присутствующему в сыворотке крови человека.
[116] В целом, ADA возрастали с течением времени. Антитела к лекарственным средствам у субъектов, получавших дозу 3 мг/кг, обнаруживали ADA раньше (день 15 по сравнению с днем 36), и у всех субъектов ADA обнаруживали к дню 85 по сравнению с субъектами, принимавшими дозу 10 мг/кг, у которых только у 4 из 6 субъектов имели место ADA в день 85. Титры ADA к PRV-3279 от исходного уровня со временем показаны в Табл. 7 и они варьировали в диапазоне от <10 до 270 и от <10 до 2430. Это указывает на то, что PRV-3279 ингибирует свою собственную иммуногенность.

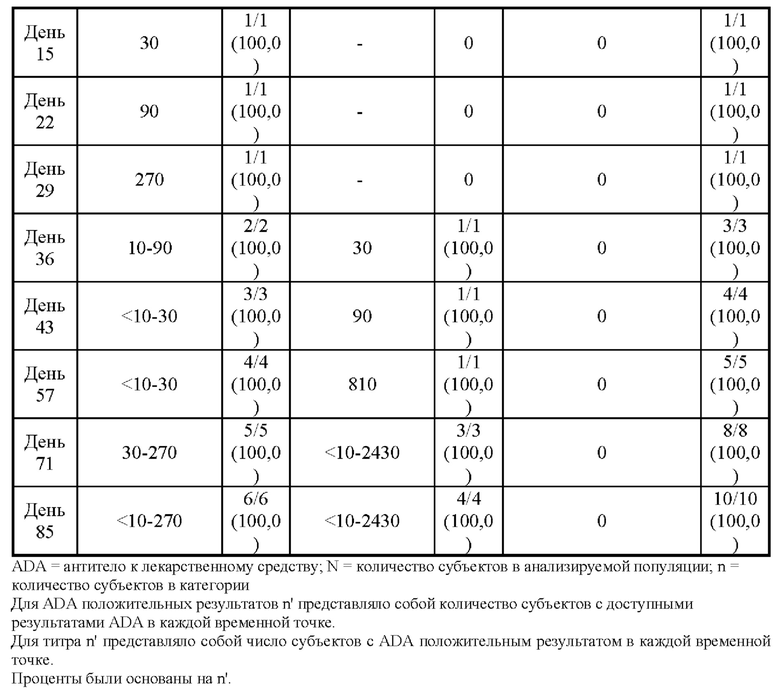
Оценки данных фармакокинетики/иммуногенности
[117] Фармакокинетические параметры (Сmах и AUC0-336) для PRV-3279 описательно обобщены в зависимости от результатов ADA, лечения и дня в Табл. 8. Блочные диаграммы параметров Cmax и AUC0-336 PRV-3279 представлены на Фиг. 5, показывая, что ADA не влияет на РK. ADA = антитело к лекарственному средству; N = количество субъектов в популяции для фармакокинетического анализа в соответствующей категории ADA. Символ внутри блока представляет собой среднее значение. Верхний (нижний) край блока представляет собой 75-й (25-й) процентиль. «Усы» проводят от верхнего (нижнего) края блока до наибольшего (наименьшего) значения в пределах 1,5 × интерквартильных диапазона выше (ниже) края блока. Значения вне «усов» обозначают символами.
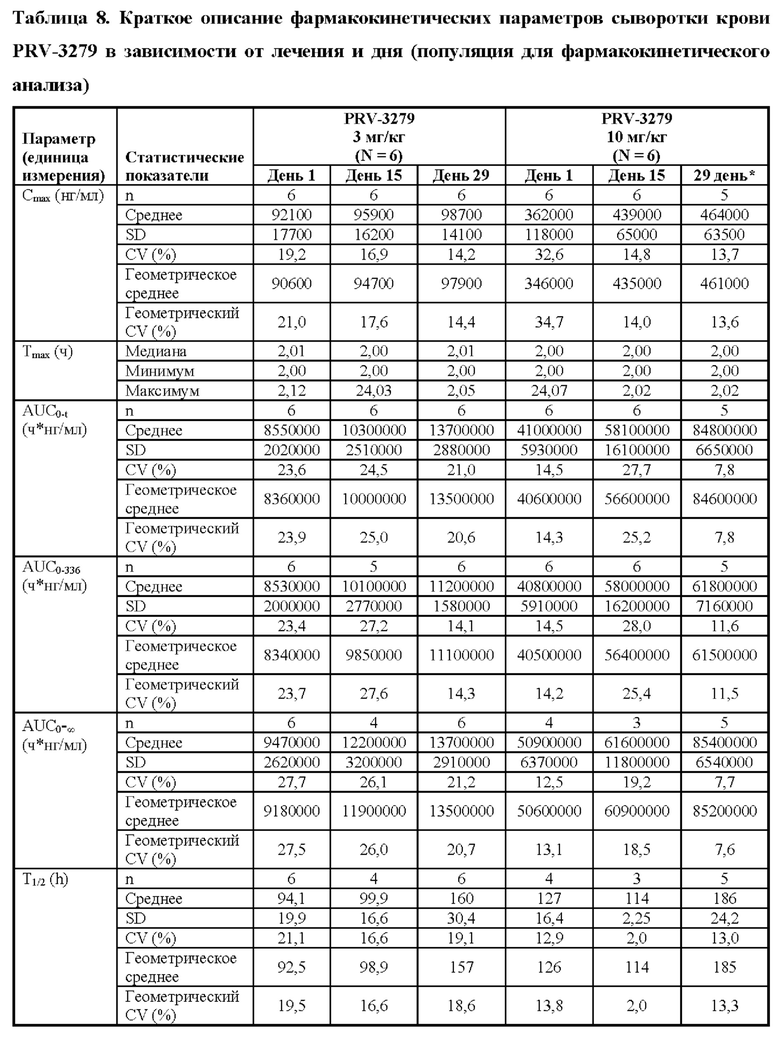
Оценки фармакодинамических данных
[118] Связывание PRV-3279 (процент связанных В-клеток) и абсолютная и процентная занятость рецептора (MESF) путем окрашивания антителом к PRV-3279 (антитело к ЕК) на В-клетках (CD19+), В-клетках памяти (CD19+/CD27+) и наивных В-клетках (CD19+/CD27-) исследовали, включая максимальное связывание, полученное в насыщенном образце PRV-3279. Для расчета % связанных В-клеток и % занятости рецептора максимальное связывание PRV-3279 с В-клетками в каждом отдельном образце рассчитывали путем сравнения % клеток, связанных антителом к PRV-3279 (антитело к ЕК), и абсолютной занятости молекул рецептора эквивалентными значениями растворимых флуорохромов (MESF) в каждой временной точке соответствуют соответствующим значениям насыщенного образца PRV-3279 (всего).
[119] Как показано на Фиг. 6, после введения дозы 3 и 10 мг/кг PRV-3279 > 85% от общего количества доступных В-клеток (CD19+) связывались лекарственным средством через 1 день после введения дозы в обеих группах введения дозы. Связывание немного снизилось до приблизительно 80% перед второй дозой и снова увеличилось до приблизительно 90% после второй дозы в обеих группах доз. В группе, получавшей дозу 10 мг/кг, % связанных В-клеток сохранялся на этом высоком уровне до примерно дня 57, прежде чем он снизился до менее 50% в день 85 (см. Фиг. 6). Для дозы 3 мг/кг % связанных В-клеток был сопоставим с более высокой дозой в течение первых 22 дней и оставался около 70% до дня 43, но связывание обычно больше колебалось при этом уровне дозы между введениями. Процент связанных В-клеток составлял <20% в день 85, что было в том же диапазоне, что и при применении плацебо. Изменчивость данных составляла от низкой до умеренной.
[120] Далее исследовали процентное и абсолютное количество лимфоцитов, моноцитов (CD14+), Т-клеток (CD3+), Т-клеток-хелперов (CD3+/CD4+), цитотоксических Т-клеток (CD3+/CD8+), естественных клеток-киллеров (CD3-/CD16+), натуральных Т-клеток-киллеров (CD3+/CD16+/CD56+) и В-клеток (CD19+). Динамика абсолютного количества В-клеток во времени показана в зависимости от лечения на Фиг. 7. Другие типы клеток демонстрируют аналогичный паттерн (данные не показаны). Количество В-клеток снизилось в среднем на -39% и -47% после введения 3 и 10 мг/кг РКУ-3279 соответственно в течение 1 дня, но вернулось к исходному уровню через 1 неделю. Сопоставимого снижения у субъектов, получавших плацебо, не наблюдали. Падение числа клеток было немного менее выраженным после второй и третьей дозы PRV-3279. После третьей дозы количество клеток оставалось ниже при дозе 10 мг/кг по сравнению с дозой 3 мг/кг, но оба количества были одинаковыми в день 85 и снова сопоставимы с исходным уровнем.
[121] Таким образом, исследование продемонстрировало начальное временное снижение количества периферических В-клеток, которое было менее выраженным после второй и третьей дозы PRV-3279 и быстро восстанавливалось после каждой дозы. В этом исследовании не наблюдали стойкой деплеции В-клеток. Кроме того, ни один из других исследованных типов иммунных клеток не показал клинически значимой деплеции.
[122] Затем с помощью известных способов измеряют циркулирующие уровни иммуноглобулина М (IgM), IgE и IgG. Как показано на Фиг. 8, уровни иммуноглобулина М после введения дозы PRV-3279 3 и 10 мг/кг неуклонно снижались до примерно дня 36 и оставались на этом уровне до дня 85. Снижение не было явно дозозависимым, однако имело тенденцию быть менее выраженным для 3 мг/кг по сравнению с 10 мг/кг в дни 36 и 85. Уровни иммуноглобулина Е после введения дозы PRV-3279 10 мг/кг были аналогичны значениям, наблюдаемым для плацебо в ходе исследования, за исключением последней временной точки в день 85, где среднее изменение % от исходного уровня составило -28,2% для 10 мг/кг по сравнению с -5,0% для плацебо (см. Фиг. 9). Уровни иммуноглобулина G после введения PRV-3279 в дозах 3 и 10 мг/кг сильно варьировали и, как правило, не отличались от плацебо в ходе исследования. % изменений уровней IgG по сравнению с исходным уровнем были в основном в пределах ± 5% для всех видов лечения (см. Фиг. 10).
Выводы
[123] Основная цель этого двойного слепого плацебо-контролируемого исследования MAD фазы 1b заключалась в оценке безопасности и переносимости многократных (3) IV инфузий двух уровней доз PRV-3279 (3 и 10 мг/кг) у здоровых субъектов. Второстепенными целями была характеристика многодозовой РК и иммуногенности PRV-3279. Исследовательская цель состояла в том, чтобы изучить влияние PRV-3279 на потенциальные биомаркеры для взаимодействия с мишенью и В-клеточную кфункцию.
[124] Всего включали в исследование, рандомизировали и вводили дозу 16 субъектам. Двум когортам вводили PRV-3279 или плацебо каждые 2 недели, в общей сложности 3 дозы. 3 дозы исследуемого лекарственного средства (PRV-3279 в дозе 3 мг/кг и 10 мг/кг или плацебо) вводили внутривенно в день 1, 15 и 29 в каждой когорте. Четырнадцать субъектов получили все запланированные процедуры в соответствии с протоколом и завершили исследование. Один субъект, получавший плацебо, отозвал свое согласие после введения плацебо в день 1 и день 15, а 1 субъекта, получавшего PRV-3279 в дозе 10 мг/кг, отозвали вследствие нежелательных явлений после получения 3-минутного введения PRV-3279 в дозе 10 мг/кг в течение 3 минут.
[125] Все 16 (100,0%) субъектов были включены в популяции для оценки безопасности, PD анализа и иммуногенности. Всех 12 (75,5%) субъектов, получавших исследуемое лекарственное средство, включали в популяцию для РК анализа; однако для всех обобщенных графиков фармакокинетики и обобщенной статистики данные, начиная с дня 29, исключали для 1 субъекта, получавшего PRV-3279 в дозе 10 мг/кг, который был исключен из исследования вследствие АЕ.
[126] Это исследование фазы 1b основано на информации о переносимости и PD, полученной в первом исследовании у человека, и посвящено возможности повторного введения дозы PRV-3279. Результаты исследования подтверждают способность PRV-3279 функционально подавлять без деплеции В-клеточную функцию глубоким и стойким образом, на который не влияет ADA.
[127] PRV-3279 хорошо переносилось, не вызывая SAE. РК характеристики поддерживают двухнедельное или, возможно, менее частое введение дозы. Антитела к лекарственным средствам были ниже в группе с более высокой дозой, что согласуется со способностью PRV-3279 ингибировать собственную иммуногенность.
[128] PD эффект занятости рецепторов PRV-3279 сохранялся значительно после прекращения введения дозы, с большей устойчивостью при дозе 10 мг/кг и связыванием >50%, наблюдаемым по меньшей мере через 28 дней после последней дозы, что считается минимальным уровнем связывания, требуемым для оптимальной модуляции В-клеток.
[129] Наблюдалось явное снижение уровня IgM, которое сохранялось в течение всего периода наблюдения, что свидетельствует о продолжительном эффекте PD. Важно, и как и ожидалось, деплеция В-клеток, какие-либо наблюдаемые вредные эффекты на иммунные клетки или цитокины отсутствовали.
[130] В заключение, исходя из превосходного профиля безопасности и превосходных PD эффектов при дозе 10 мг/кг с более низкой иммуногенностью, дозу 10 мг/кг или более высокую можно использовать для снижения иммуногенности биотерапевтических средств, включая продукты генной терапии.
Модификации
[131] Модификации и вариации описанных способов и композиций настоящего раскрытия будут очевидны специалистам в данной области техники без отклонения от объема и сущности настоящего раскрытия. Несмотря на то, что настоящее раскрытие было описано в связи с конкретными вариантами осуществления, следует понимать, что заявляемое раскрытие не должно чрезмерно ограничиваться такими конкретными вариантами осуществления. Действительно, различные модификации описанных способов осуществления настоящего раскрытия предназначены и понятны специалистам в соответствующей области, в которой находится это раскрытие, как находящиеся в рамках объема раскрытия, представленного следующей формулой изобретения.
Включение в описание изобретения сведений посредством ссылки
[132] Все патенты и публикации, упоминаемые в настоящем описании, включены в данный документ посредством ссылки в той же самой степени, как если бы независимый патент и публикация публикация были конкретно и отдельно указаны для включения посредством ссылки.
--->
ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> Провентион Био, Инк.
<120> СПОСОБЫ И КОМПОЗИЦИИ ДЛЯ СНИЖЕНИЯ ИММУНОГЕННОСТИ С ПОМОЩЬЮ
НЕ ПРИВОДЯЩИХ К ДЕПЛЕЦИИ В-КЛЕТОЧНЫХ ИНГИБИТОРОВ
<130> 178833-010802/PCT
<150> 62/880240
<151> 30 июля 2019 г.
<160> 7
<170> PatentIn версия 3.5
<210> 1
<211> 107
<212> Белок
<213> Неизвестно
<220>
<223> Синтетический
<400> 1
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Glu Ile Ser Gly Tyr
20 25 30
Leu Ser Trp Leu Gln Gln Lys Pro Gly Lys Ala Pro Arg Arg Leu Ile
35 40 45
Tyr Ala Ala Ser Thr Leu Asp Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Glu Ser Gly Thr Glu Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Leu Gln Tyr Phe Ser Tyr Pro Leu
85 90 95
Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 2
<211> 116
<212> Белок
<213> Неизвестно
<220>
<223> Синтетический
<400> 2
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Asp Ala
20 25 30
Trp Met Asp Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Glu Ile Arg Asn Lys Ala Lys Asn His Ala Thr Tyr Tyr Ala Glu
50 55 60
Ser Val Ile Gly Arg Phe Thr Ile Ser Arg Asp Asp Ala Lys Asn Ser
65 70 75 80
Leu Tyr Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr
85 90 95
Tyr Cys Gly Ala Leu Gly Leu Asp Tyr Trp Gly Gln Gly Thr Leu Val
100 105 110
Thr Val Ser Ser
115
<210> 3
<211> 112
<212> Белок
<213> Неизвестно
<220>
<223> Синтетический
<400> 3
Asp Val Val Met Thr Gln Ser Pro Leu Ser Leu Pro Val Thr Leu Gly
1 5 10 15
Gln Pro Ala Ser Ile Ser Cys Lys Ser Ser Gln Ser Leu Leu Asp Ser
20 25 30
Asp Gly Lys Thr Tyr Leu Asn Trp Phe Gln Gln Arg Pro Gly Gln Ser
35 40 45
Pro Asn Arg Leu Ile Tyr Leu Val Ser Lys Leu Asp Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Trp Gln Gly
85 90 95
Thr His Phe Pro Leu Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys
100 105 110
<210> 4
<211> 113
<212> Белок
<213> Неизвестно
<220>
<223> Синтетический
<400> 4
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Trp Met Asn Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Met Ile Asp Pro Ser Asp Ser Glu Thr His Tyr Asn Gln Lys Phe
50 55 60
Lys Asp Arg Val Thr Met Thr Thr Asp Thr Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Arg Ser Leu Arg Ser Asp Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Ala Met Gly Tyr Trp Gly Gln Gly Thr Thr Val Thr Val Ser
100 105 110
Ser
<210> 5
<211> 502
<212> Белок
<213> Неизвестно
<220>
<223> Синтетический
<400> 5
Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Ala Ala Gly
1 5 10 15
Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met
20 25 30
Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His
35 40 45
Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val
50 55 60
His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr
65 70 75 80
Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly
85 90 95
Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile
100 105 110
Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val
115 120 125
Tyr Thr Leu Pro Pro Ser Arg Glu Glu Met Thr Lys Asn Gln Val Ser
130 135 140
Leu Trp Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu
145 150 155 160
Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro
165 170 175
Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val
180 185 190
Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met
195 200 205
His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser
210 215 220
Pro Gly Lys Ala Pro Ser Ser Ser Pro Met Glu Asp Ile Gln Met Thr
225 230 235 240
Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly Asp Arg Val Thr Ile
245 250 255
Thr Cys Arg Ala Ser Gln Glu Ile Ser Gly Tyr Leu Ser Trp Leu Gln
260 265 270
Gln Lys Pro Gly Lys Ala Pro Arg Arg Leu Ile Tyr Ala Ala Ser Thr
275 280 285
Leu Asp Ser Gly Val Pro Ser Arg Phe Ser Gly Ser Glu Ser Gly Thr
290 295 300
Glu Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro Glu Asp Phe Ala Thr
305 310 315 320
Tyr Tyr Cys Leu Gln Tyr Phe Ser Tyr Pro Leu Thr Phe Gly Gly Gly
325 330 335
Thr Lys Val Glu Ile Lys Gly Gly Gly Ser Gly Gly Gly Gly Gln Val
340 345 350
Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala Ser Val
355 360 365
Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr Trp Met
370 375 380
Asn Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Ile Gly Met
385 390 395 400
Ile Asp Pro Ser Asp Ser Glu Thr His Tyr Asn Gln Lys Phe Lys Asp
405 410 415
Arg Val Thr Met Thr Thr Asp Thr Ser Thr Ser Thr Ala Tyr Met Glu
420 425 430
Leu Arg Ser Leu Arg Ser Asp Asp Thr Ala Val Tyr Tyr Cys Ala Arg
435 440 445
Ala Met Gly Tyr Trp Gly Gln Gly Thr Thr Val Thr Val Ser Ser Gly
450 455 460
Gly Cys Gly Gly Gly Glu Val Ala Ala Leu Glu Lys Glu Val Ala Ala
465 470 475 480
Leu Glu Lys Glu Val Ala Ala Leu Glu Lys Glu Val Ala Ala Leu Glu
485 490 495
Lys Gly Gly Gly Asn Ser
500
<210> 6
<211> 270
<212> Белок
<213> Неизвестно
<220>
<223> Синтетический
<400> 6
Asp Val Val Met Thr Gln Ser Pro Leu Ser Leu Pro Val Thr Leu Gly
1 5 10 15
Gln Pro Ala Ser Ile Ser Cys Lys Ser Ser Gln Ser Leu Leu Asp Ser
20 25 30
Asp Gly Lys Thr Tyr Leu Asn Trp Phe Gln Gln Arg Pro Gly Gln Ser
35 40 45
Pro Asn Arg Leu Ile Tyr Leu Val Ser Lys Leu Asp Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Trp Gln Gly
85 90 95
Thr His Phe Pro Leu Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys
100 105 110
Gly Gly Gly Ser Gly Gly Gly Gly Glu Val Gln Leu Val Glu Ser Gly
115 120 125
Gly Gly Leu Val Gln Pro Gly Gly Ser Leu Arg Leu Ser Cys Ala Ala
130 135 140
Ser Gly Phe Thr Phe Ser Asp Ala Trp Met Asp Trp Val Arg Gln Ala
145 150 155 160
Pro Gly Lys Gly Leu Glu Trp Val Ala Glu Ile Arg Asn Lys Ala Lys
165 170 175
Asn His Ala Thr Tyr Tyr Ala Glu Ser Val Ile Gly Arg Phe Thr Ile
180 185 190
Ser Arg Asp Asp Ala Lys Asn Ser Leu Tyr Leu Gln Met Asn Ser Leu
195 200 205
Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys Gly Ala Leu Gly Leu Asp
210 215 220
Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser Gly Gly Cys Gly
225 230 235 240
Gly Gly Lys Val Ala Ala Leu Lys Glu Lys Val Ala Ala Leu Lys Glu
245 250 255
Lys Val Ala Ala Leu Lys Glu Lys Val Ala Ala Leu Lys Glu
260 265 270
<210> 7
<211> 227
<212> Белок
<213> Неизвестно
<220>
<223> Синтетический
<400> 7
Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Ala Ala Gly
1 5 10 15
Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met
20 25 30
Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His
35 40 45
Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val
50 55 60
His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr
65 70 75 80
Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly
85 90 95
Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile
100 105 110
Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val
115 120 125
Tyr Thr Leu Pro Pro Ser Arg Glu Glu Met Thr Lys Asn Gln Val Ser
130 135 140
Leu Ser Cys Ala Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu
145 150 155 160
Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro
165 170 175
Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Val Ser Lys Leu Thr Val
180 185 190
Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met
195 200 205
His Glu Ala Leu His Asn Arg Tyr Thr Gln Lys Ser Leu Ser Leu Ser
210 215 220
Pro Gly Lys
225
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБЫ ПРИМЕНЕНИЯ CD32B X CD79B-СВЯЗЫВАЮЩИХ МОЛЕКУЛ ПРИ ЛЕЧЕНИИ ВОСПАЛИТЕЛЬНЫХ ЗАБОЛЕВАНИЙ И РАССТРОЙСТВ | 2017 |
|
RU2772434C2 |
| МОЛЕКУЛЫ СО СПЕЦИФИЧНОСТЬЮ К CD45 И CD79 | 2015 |
|
RU2747980C2 |
| АНТИТЕЛА ПРОТИВ CD79b, КОНЪЮГАТЫ С ЛЕКАРСТВЕННЫМ СРЕДСТВОМ И ИХ ПРИМЕНЕНИЯ | 2019 |
|
RU2805251C2 |
| КОВАЛЕНТНЫЕ ДИАНТИТЕЛА И ИХ ПРИМЕНЕНИЕ | 2009 |
|
RU2744176C2 |
| МОЛЕКУЛЫ СО СПЕЦИФИЧНОСТЬЮ В ОТНОШЕНИИ CD79 И CD22 | 2015 |
|
RU2743590C2 |
| СПОСОБЫ ПРИМЕНЕНИЯ ИММУНОКОНЪЮГАТОВ, СОДЕРЖАЩИХ АНТИТЕЛО К CD79B, ДЛЯ ЛЕЧЕНИЯ ДИФФУЗНОЙ B-КРУПНОКЛЕТОЧНОЙ ЛИМФОМЫ | 2020 |
|
RU2827797C1 |
| АНТИ-CD79b АНТИТЕЛА И ИММУНОКОНЪЮГАТЫ И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2019 |
|
RU2791984C2 |
| ВАРИАНТЫ, НА ОСНОВЕ АДЕНОАССОЦИИРОВАННОГО ВИРУСА, СОСТАВЫ И СПОСОБЫ ДЛЯ ПУЛЬМОНАЛЬНОЙ ДОСТАВКИ | 2021 |
|
RU2829874C1 |
| БИСПЕЦИФИЧЕСКИЕ АНТИГЕНСВЯЗЫВАЮЩИЕ ПОЛИПЕПТИДЫ | 2015 |
|
RU2723940C2 |
| ГЕННАЯ ТЕРАПИЯ ДЛЯ ЛЕЧЕНИЯ ГЕМОФИЛИИ A | 2017 |
|
RU2762257C2 |
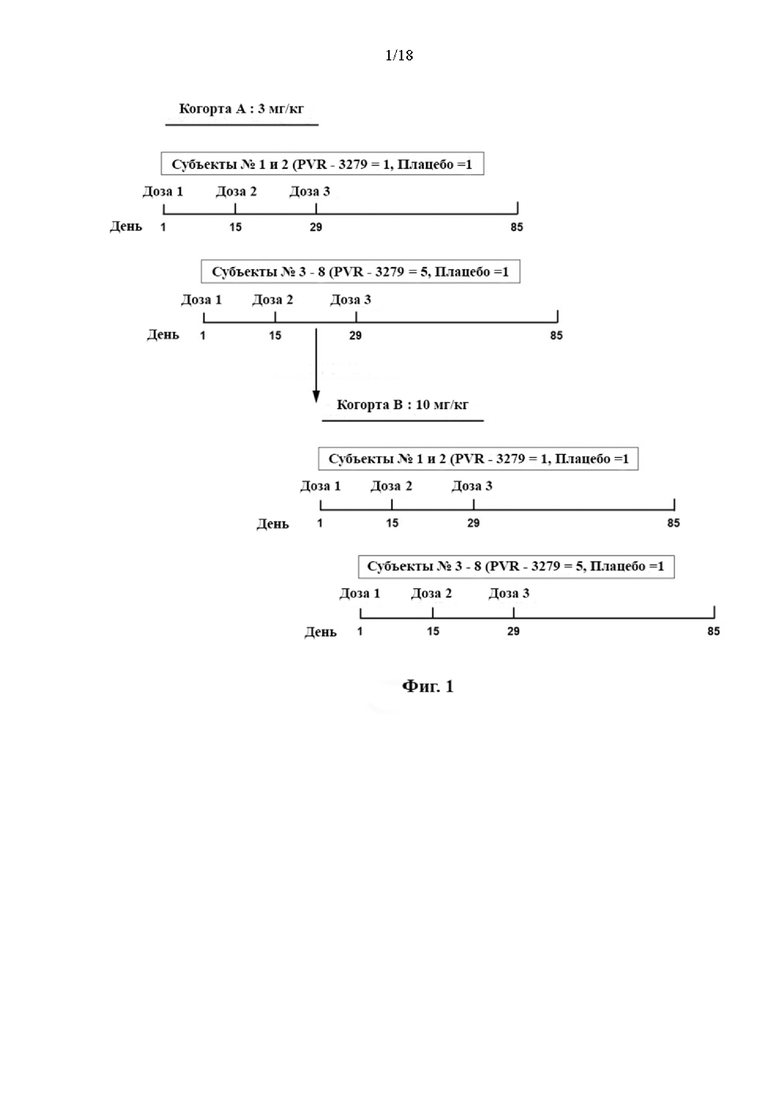
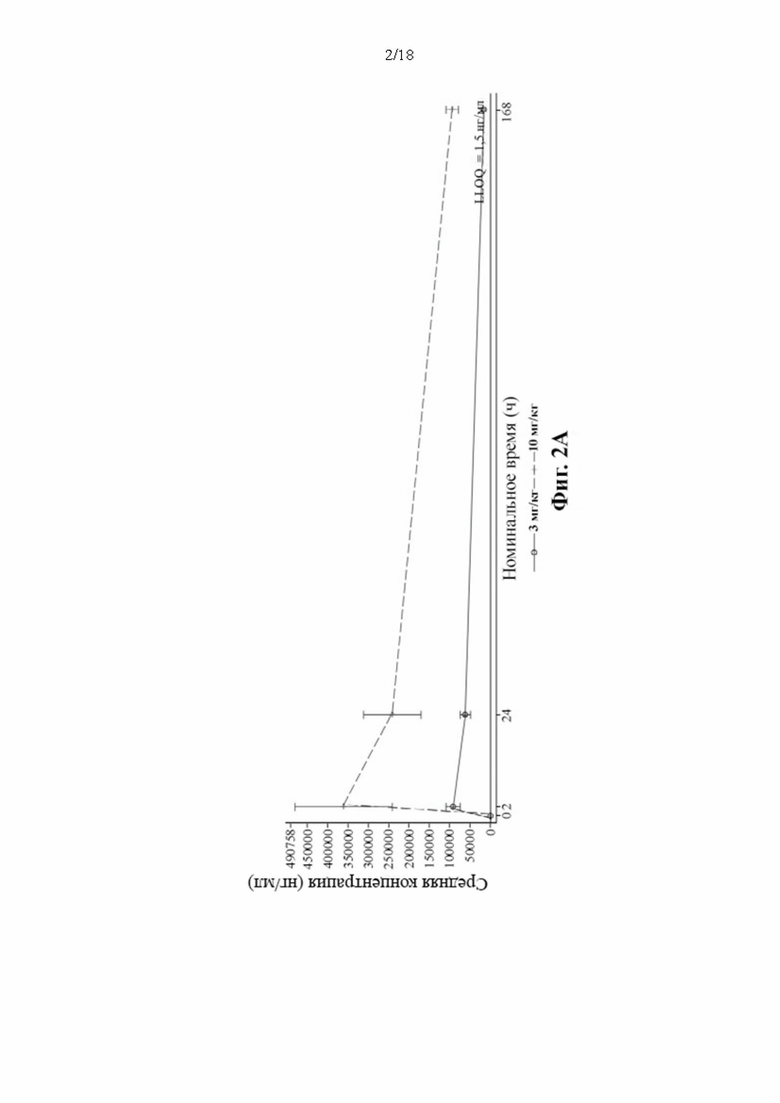
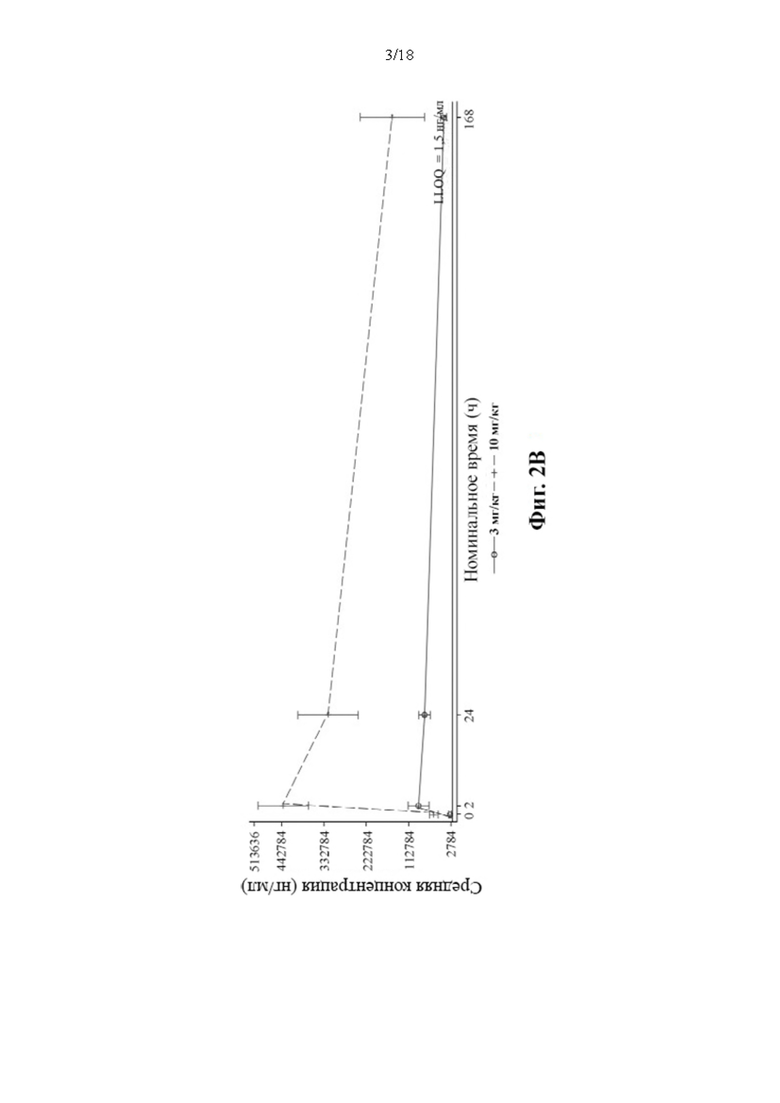
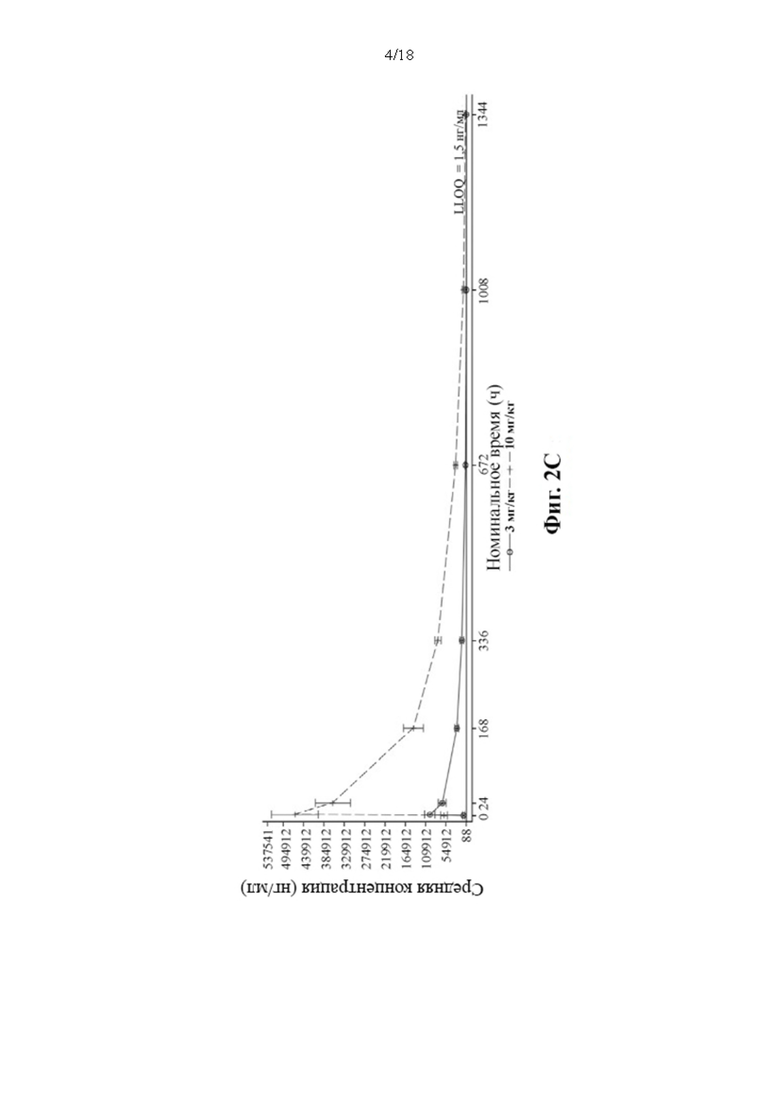
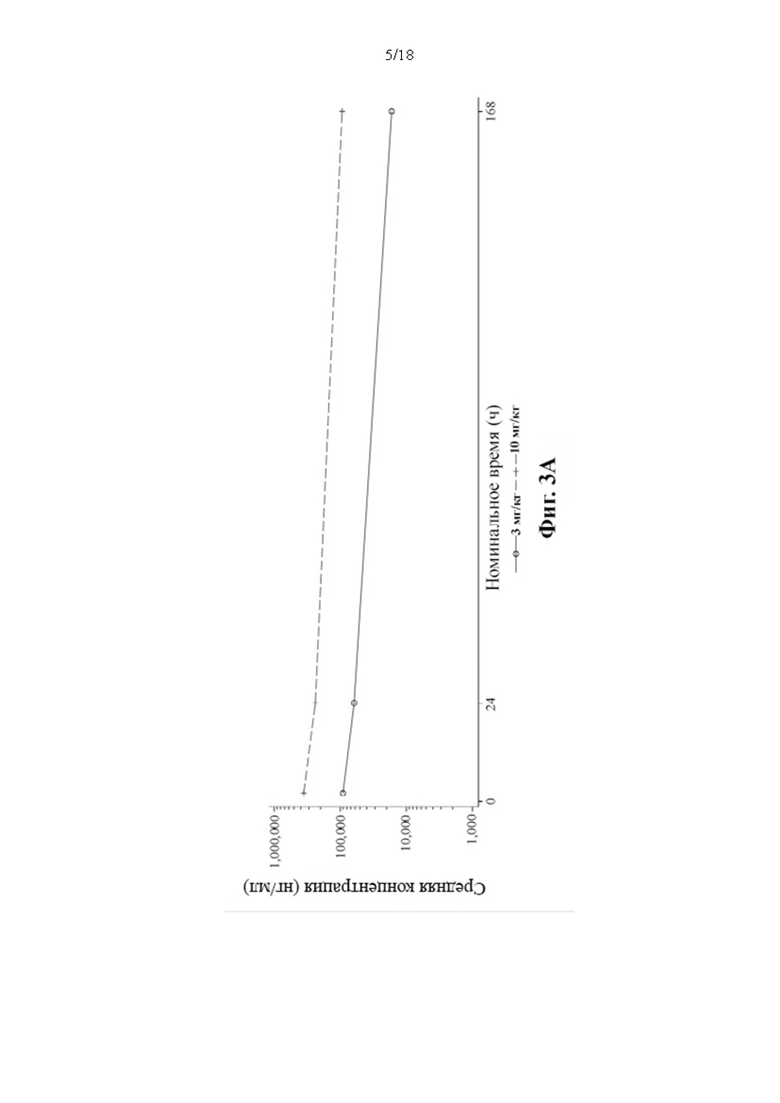
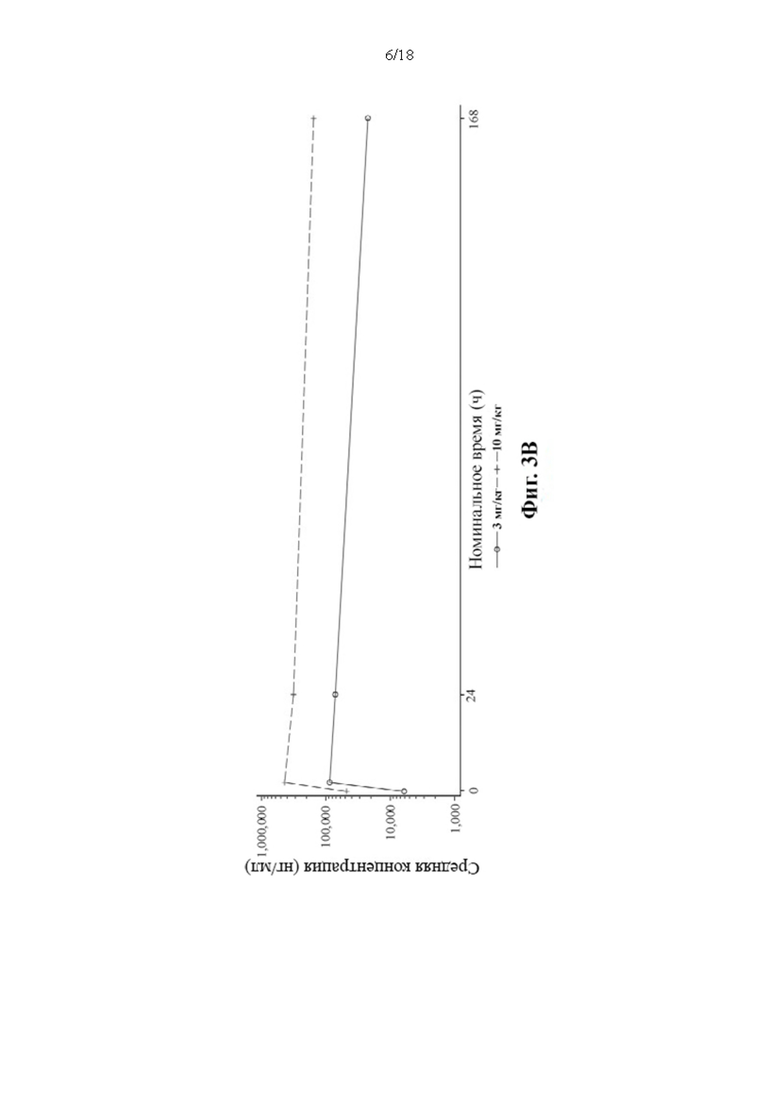
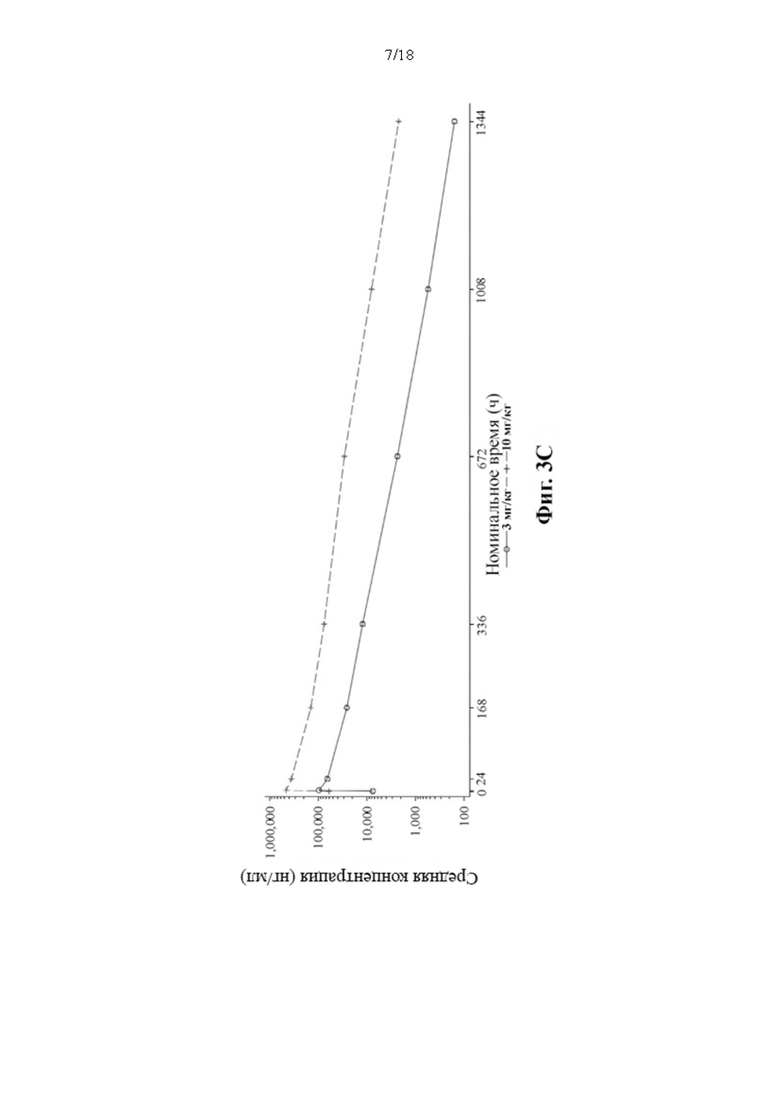
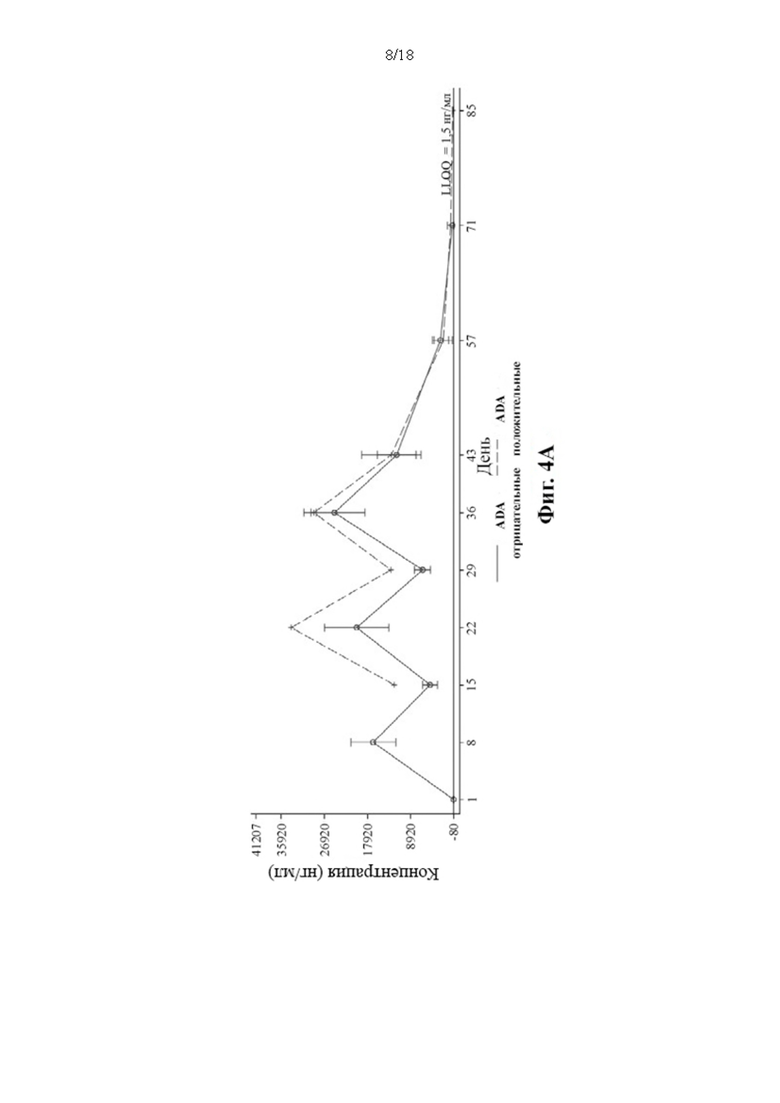





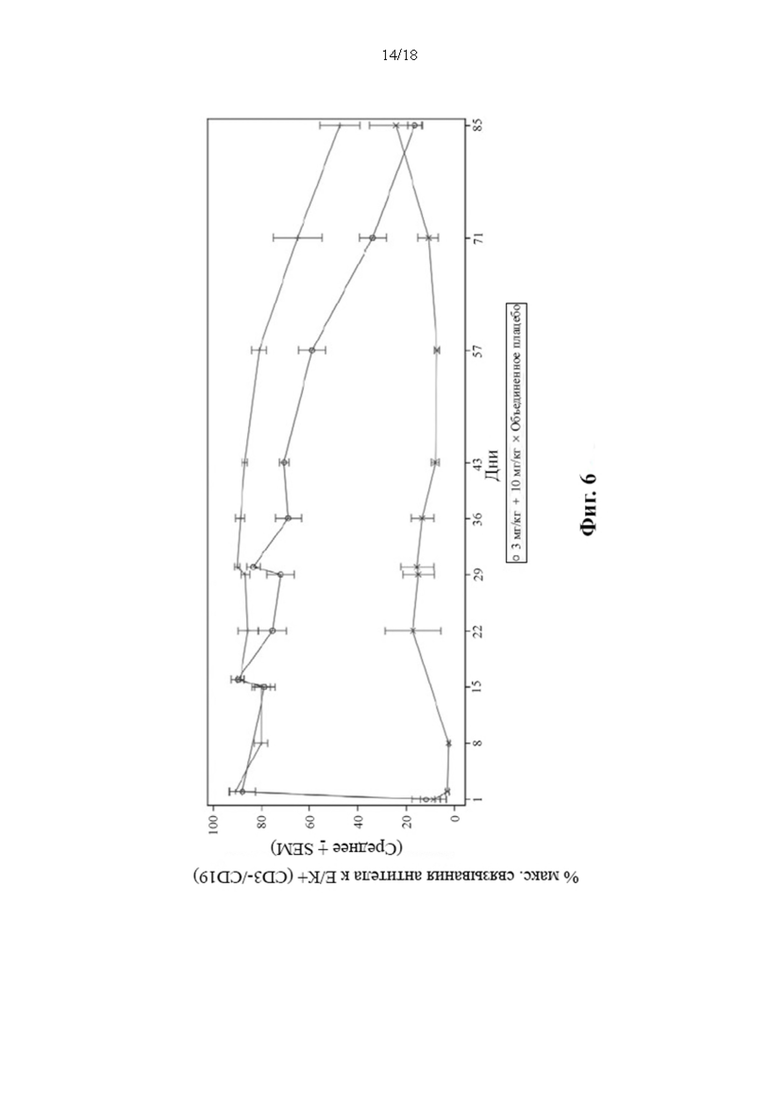
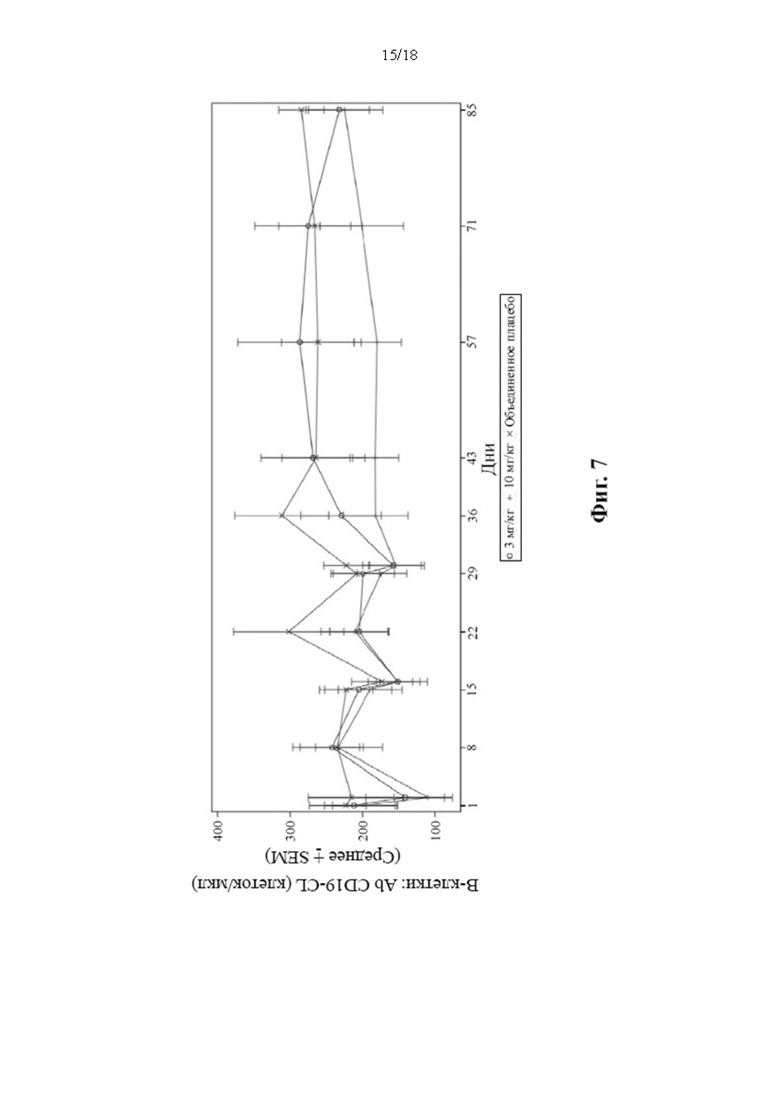
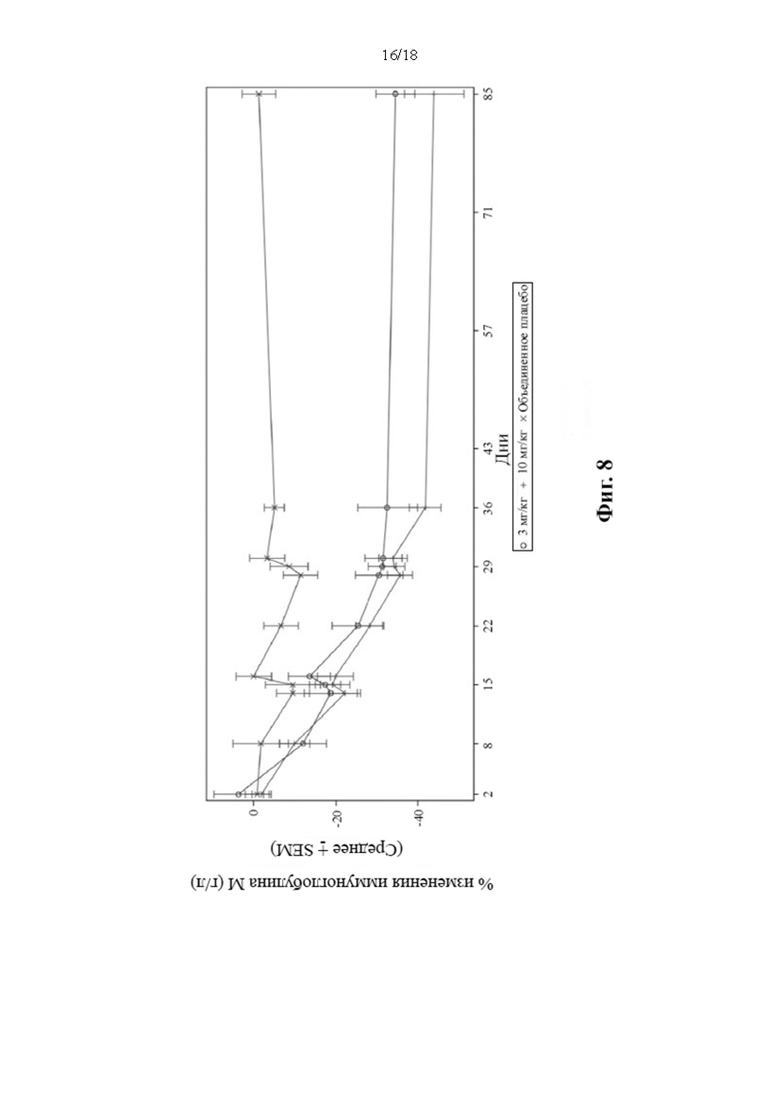
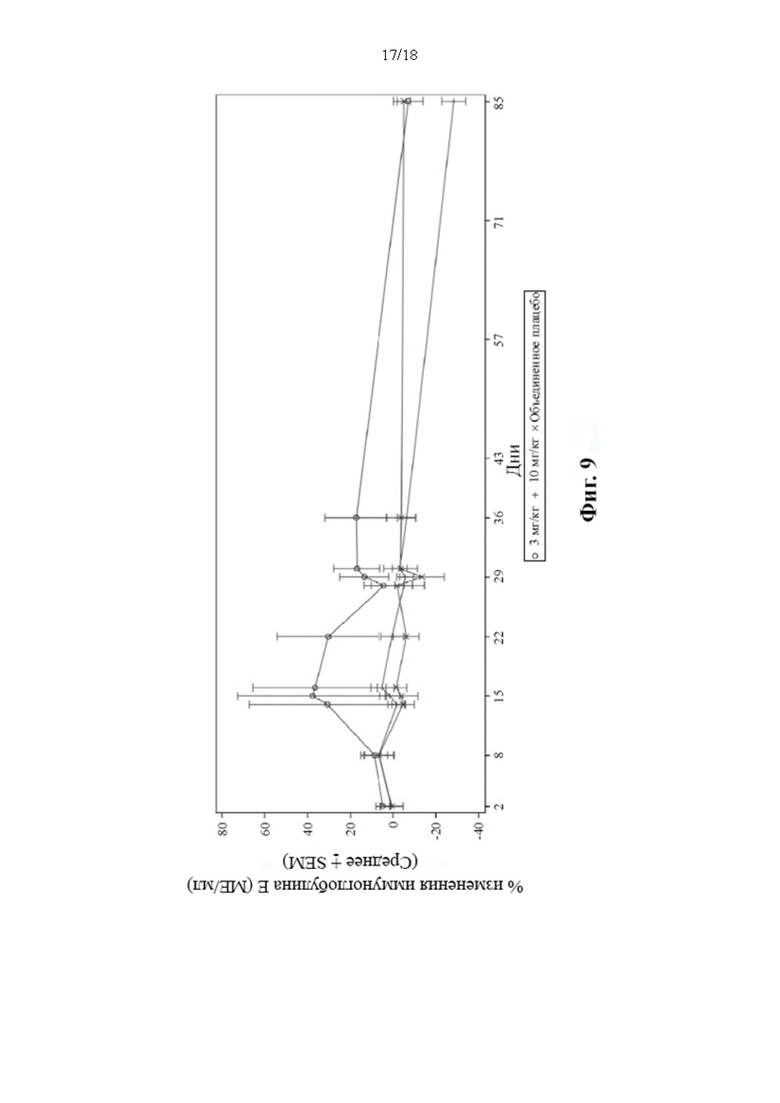
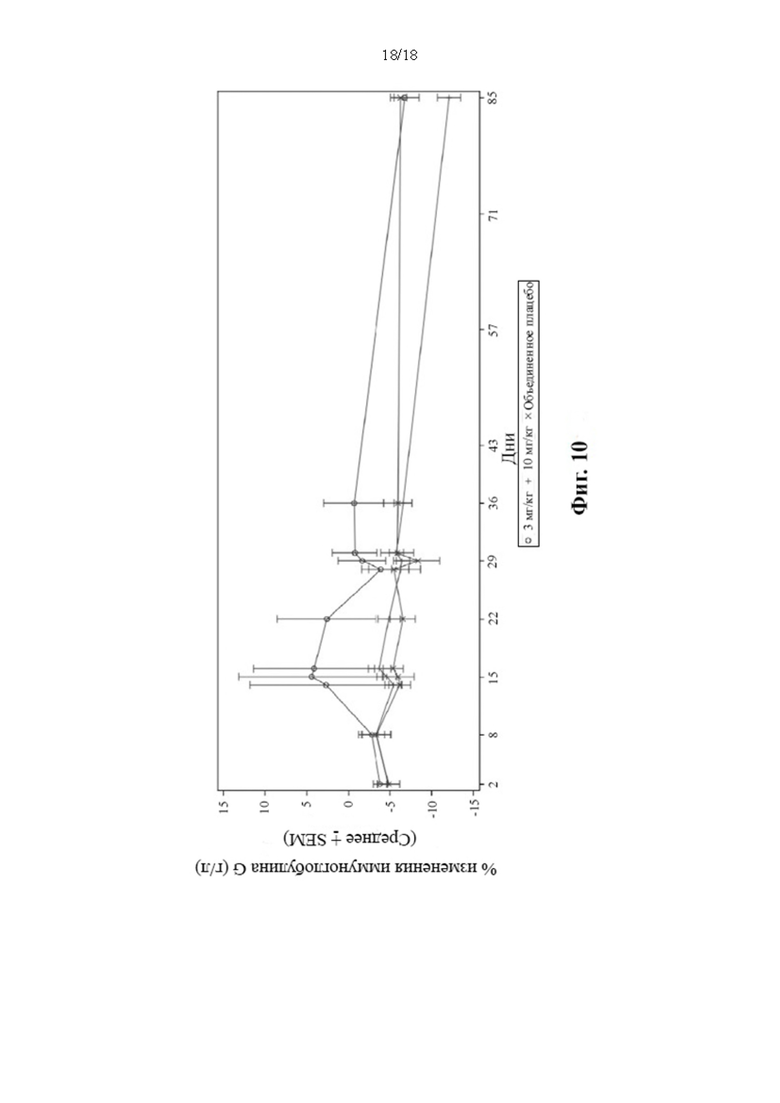
Изобретение относится к области биотехнологии. Предложено применение В-клеточного ингибитора, который не приводит к деплеции, для снижения иммуногенности у субъекта, получающего или получавшего генную терапию. В-клеточный ингибитор представляет собой биспецифическое антитело к CD32B и CD79B. Изобретение может найти дальнейшее применение в терапии. 14 з.п. ф-лы, 10 ил., 8 табл., 6 пр.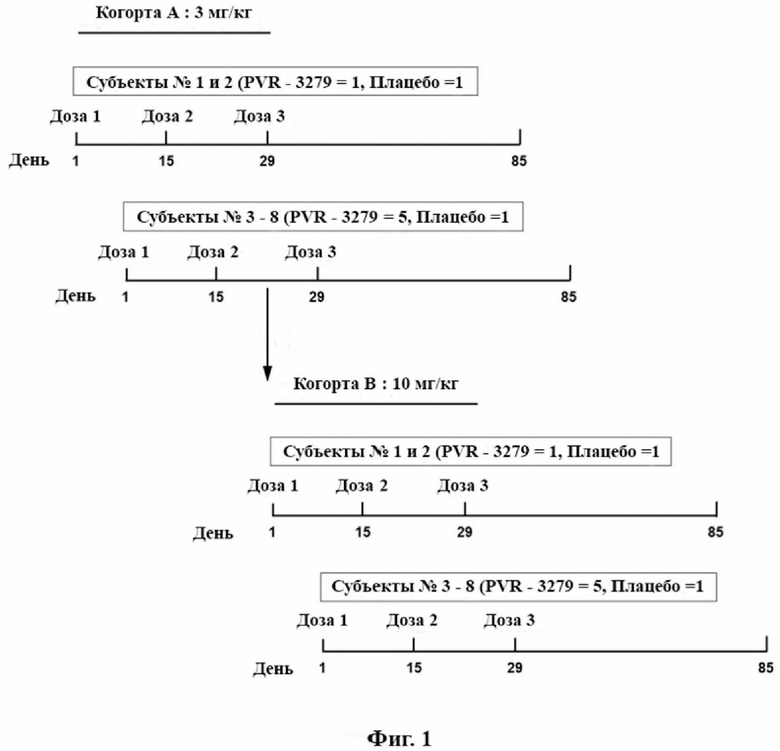
1. Применение В-клеточного ингибитора, который не приводит к деплеции, для снижения иммуногенности у субъекта, получающего или получавшего генную терапию, где В-клеточный ингибитор представляет собой биспецифическое антитело к CD32B × CD79B, способное иммуноспецифически связывать эпитоп CD32B и эпитоп CD79B, где биспецифическое антитело к CD32B × CD79B содержит:
(A) домен VLCD32B, содержащий аминокислотную последовательность под SEQ ID NO: 1;
(В) домен VHCD32B, содержащий аминокислотную последовательность под SEQ ID NO: 2;
(С) домен VLCD79B, содержащий аминокислотную последовательность под SEQ ID NO: 3; и
(D) домен VHCD79B, содержащий аминокислотную последовательность под SEQ ID NO: 4,
где первая доза В-клеточного ингибитора вводится за 3 дня - 6 недель до введения второй дозы и генной терапии, и где третья доза вводится за 3 дня - 6 недель после введения второй дозы и генной терапии.
2. Применение по п. 1, где указанное биспецифическое антитело к CD32B × CD79B представляет собой диатело Fc, содержащее:
(А) первую полипептидную цепь, содержащую аминокислотную последовательность под SEQ ID NO: 5;
(B) вторую полипептидную цепь, содержащую аминокислотную последовательность под SEQ ID NO: 6; и
(C) третью полипептидную цепь, содержащую аминокислотную последовательность под SEQ ID NO: 7.
3. Применение по п. 2, где первая доза диатела Fc составляет от 5 до 40 мг/кг и вводится от 2 до 6 недель до введения второй дозы диатела Fc и генной терапии,
где вторая доза составляет от 5 до 40 мг/кг, и
где третья доза диатела Fc составляет от 5 до 40 мг/кг и вводится через 2-6 недель после введения второй дозы и генной терапии.
4. Применение по п. 2, где первая доза диатела Fc составляет 10 мг/кг и вводится за 4 недели до введения второй дозы диатела Fc и генной терапии,
где вторая доза составляет 10 мг/кг, и
где третья доза диатела Fc составляет 10 мг/кг и вводится через 4 недели после введения второй дозы и генной терапии.
5. Применение по п. 2, где первая доза диатела Fc составляет 10 мг/кг и вводится от 2 до 6 недель до введения второй дозы диатела Fc и генной терапии,
где вторая доза составляет 10 мг/кг, и
где третья доза диатела Fc составляет 10 мг/кг и вводится через 2-6 недель после введения второй дозы и генной терапии.
6. Применение по п. 2, включающее введение первой дозы диатела Fc за 2-6 недель до генной терапии,
где вторая доза диатела Fc вводится в то же время, что и генная терапия, и
где третья доза диатела Fc вводится через 2-6 недель после генной терапии.
7. Применение по п. 2, где диатело Fc приводит к ингибированию собственной иммуногенности при введении, с более низкой распространенностью и/или титрами антител к лекарственным средствам (ADA) при повышенных дозах.
8. Применение по п. 7, где ADA не нейтрализует диатело Fc.
9. Применение по п. 2, где диатело Fc дозозависимым образом связывается по меньшей мере с 80% В-клеток при введении и остается связанным по меньшей мере с 50% В-клеток в течение по меньшей мере 4 недель после последнего введения.
10. Применение по п. 2, где диатело Fc приводит к устойчивому ингибированию продуцирования иммуноглобулина без деплеции циркулирующих В-клеток.
11. Применение по п. 10, где иммуноглобулин включает IgM, IgA, IgG и IgE.
12. Применение по любому из пп. 1-11, дополнительно включающее наблюдение за субъектом посредством изучения наличия специфических антител к генной терапии.
13. Применение по п. 12, дополнительно включающее введение одной или нескольких дополнительных доз В-клеточного ингибитора для дальнейшего модулирования иммуногенности.
14. Применение по любому из пп. 1-11, дополнительно включающее совместное введение одного или нескольких иммуномодуляторов.
15. Применение по п. 14, где один или несколько иммуномодуляторов выбраны из сиролимуса, рапамицина, абатацепта, теплизумаба и иммуноглобулина G-деградирующего фермента Streptococcus pyogenes.
| WO 2017214096 A1, 14.12.2017 | |||
| WO 2015021089 A1, 12.02.2015 | |||
| CHEN W | |||
| et al., SAT0027 Immunomodulatory effects of MGD010, a dart molecule targeting human B-CELL CD32B and CD79B, Annals of the Rheumatic Diseases, Jun 2017, 76 (Suppl 2): 777-778 | |||
| MARK L | |||
| CHIU, GARY L | |||
| GILLILAND, Engineering antibody therapeutics, Current Opinion in Structural |
Авторы
Даты
2024-06-27—Публикация
2020-07-30—Подача