ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННЫЕ ЗАЯВКИ
[1] Настоящая заявка заявляет приоритет предварительной заявки на патент США №61/833898, поданной 11 июня 2013 г., и предварительной заявки на патент США №61/972212, поданной 28 марта 2014 г., полное содержание которых включено в данный документ посредством ссылки.
УРОВЕНЬ ТЕХНИКИ
[2] Существующие на сегодняшний день исследования позволяют получать только аномально функционирующие инсулин-экспрессирующие клетки, которые не секретируют должное количество инсулина в ответ на последовательное изменение уровней глюкозы, или панкреатические клетки-предшественники, которые могут созревать в функционирующие инсулин-экспрессирующие клетки только через 3 месяца после трансплантации в мышь-хозяина, (Cheng et. al., 2012; D'Amour et al., 2005; D'Amour et al., 2006; Kroon et al., 2008; Nostra et al., 2011; Rezania et al., 2012; Schulz et al., 2012; Xie et al., 2013). В отличие от нормальных островковых клеток или диспергированных взрослых β-клеток, которые высвобождают высокие уровни инсулина в ответ на высокие уровни глюкозы при проведении анализа «стимулированной глюкозой секреции инсулина» (GSIS) и могут делать это неоднократно, инсулин-экспрессирующие клетки, полученные пи помощи существующих способов из hPSC, не способны должным образом секретировать инсулин в ответ на добавление разных концентраций глюкозы. Соответственно, существует потребность в способе получения клеток из hPSC, которые демонстрируют фенотип нормальных островковых клеток или взрослых β-клеток.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
[3] В некоторых аспектах в изобретении предложена полученная из стволовой клетки β-клетка (SC-β).
[4] В некоторых вариантах реализации изобретения клетка является зрелой. В некоторых вариантах реализации изобретения клетка демонстрирует in vitro ответ, состоящий в стимулированной глюкозой секреции инсулина (GSIS). В некоторых вариантах реализации изобретения клетка демонстрирует iv vivo ответ GSIS. В некоторых вариантах реализации изобретения клетка демонстрирует in vitro и in vivo ответы, состоящие в стимулированной глюкозой секреции инсулина (GSIS). В некоторых вариантах реализации изобретения клетка демонстрирует ответ GSIS по меньшей мере на одну стимуляцию глюкозой. В некоторых вариантах реализации изобретения клетка демонстрирует ответ GSIS по меньшей мере на две последовательные стимуляции глюкозой. В некоторых вариантах реализации изобретения клетка демонстрирует ответ GSIS по меньшей мере на три последовательные стимуляции глюкозой. В некоторых вариантах реализации изобретения ответ GSIS наблюдают непосредственно сразу после трансплантации клетки человеку или животному. В некоторых вариантах реализации изобретения ответ GSIS наблюдают приблизительно в течение 24 часов после трансплантации клетки в организм человека или животного. В некоторых вариантах реализации изобретения ответ GSIS наблюдают приблизительно в течение двух недель после трансплантации клетки в организм человека или животного. В некоторых вариантах реализации изобретения индекс стимуляции, характеризуемый по соотношению инсулина, секретируемого в ответ на высокие концентрации глюкозы и низкие концентрации глюкозы, сходен с индексом стимуляции эндогенной зрелой панкреатической β-клетки. В некоторых вариантах реализации изобретения индекс стимуляции превышает или равен 1, или превышает или равен 1,1, или превышает или равен 1,3, или превышает или равен 2, или превышает или равен 2,3, или превышает или равен 2,6. В некоторых вариантах реализации изобретения клетка демонстрирует цитокин-индуцированный апоптоз в ответ на цитокин. В некоторых вариантах реализации изобретения цитокин выбран из группы, состоящей из интерлейкина-1β (ИЛ-β), интерферона-γ (ИНФ-γ), фактора некроза опухолей-α (ФНО-α) и их комбинаций. В некоторых вариантах реализации изобретения секреция инсулина из клетки усиливается в ответ на противодиабетический агент. В некоторых вариантах реализации изобретения противодиабетический агент содержит стимулятор секреции, выбранный из группы, состоящей из инкретиномиметика, сульфонилмочевины, меглитинида и их комбинаций. В некоторых вариантах реализации изобретения клетка является моногормональной. В некоторых вариантах реализации изобретения клетка демонстрирует морфологию, которая имеет сходство с морфологией эндогенной зрелой панкреатической β-клетки. В некоторых вариантах реализации изобретения под электронным микроскопом в клетке наблюдаются инкапсулированные кристаллические инсулиновые гранулы, которые имеют сходство с инсулиновыми гранулами эндогенной зрелой панкреатической β-клетки. В некоторых вариантах реализации изобретения клетка демонстрирует низкий коэффициент репликации. В некоторых вариантах реализации изобретения клетка демонстрирует стимулированный глюкозой поток Са2+ (GSCF), который имеет сходство с GSCF эндогенной зрелой панкреатической β-клетки. В некоторых вариантах реализации изобретения клетка демонстрирует ответ GSCF по меньшей мере на одну стимуляцию глюкозой. В некоторых вариантах реализации изобретения клетка демонстрирует ответ GSCF по меньшей мере на две стимуляции глюкозой. В некоторых вариантах реализации изобретения клетка демонстрирует ответ GSCF по меньшей мере на три стимуляции глюкозой. В некоторых вариантах реализации изобретения клетка демонстрирует увеличенный кальциевый поток. В некоторых вариантах реализации изобретения увеличенный кальциевый поток включает увеличенный приток или повышенное соотношение между притоком при низких и высоких концентрациях глюкозы. В некоторых вариантах реализации изобретения клетка экспрессирует по меньшей мере одну маркерную характеристику эндогенной зрелой панкреатической β-клетки, выбранную из группы, состоящей из инсулина, С-пептида, PDX1, MAFA, NKX6-1, РАХ6, NEUROD1, глюкокиназы (GCK), SLC2A1, PCSK1, KCNJ11, АВСС8, SLC30A8, SNAP25, RAB3A, GAD2, PTPRN, NKX2-2, Рах4. В некоторых вариантах реализации изобретения клетка не экспрессирует по меньшей мере один маркер, выбранный из группы, состоящей из а) гормона, выбранного из группы, состоящей из i) глюкагона (GCG) и ii) соматостатина (SST); или b) маркера ацинарных клеток, выбранного из группы, состоящей из i) амилазы и ii) карбоксипептидазы А (СРА1); с) маркера α-клеток, выбранного из группы, состоящей из i) GCG, ii) Arx, iii) Irx1 и Irx2; и d) маркера дуктальных клеток, выбранного из группы, состоящей из i) CFTR и ii) Sox9. В некоторых вариантах реализации изобретения клетка дифференцирована in vitro из инсулин-позитивной эндокринной клетки или ее предшественника, выбранной из группы, состоящей из Nkx6-1-позитивной панкреатической клетки-предшественника, Pdx1-позитивной панкреатической клетки-предшественника и плюрипотентной стволовой клетки. В некоторых вариантах реализации изобретения плюрипотентная стволовая клетка выбрана из группы, состоящей из эмбриональной стволовой клетки и индуцированной плюрипотентной стволовой клетки. В некоторых вариантах реализации изобретения клетка является человеческой. В некоторых вариантах реализации изобретения клетка не является генетически модифицированной. В некоторых вариантах реализации изобретения клетка является генетически модифицированной. В некоторых вариантах реализации изобретения количество инсулина, вырабатываемого на клетку, составляет между 0,5 и 10 мкМЕ на 1000 клеток за 30 минут инкубации при высокой концентрации глюкозы. В некоторых вариантах реализации изобретения количество инсулина, вырабатываемого на клетку, составляет приблизительно 2,5 мкМЕ на 1000 клеток за 30 минут инкубации при высокой концентрации глюкозы. В некоторых вариантах реализации изобретения инкубацию проводят ex vivo.
[5] В некоторых аспектах в изобретении предложена клеточная линия, содержащая клетку SC-β. В некоторых вариантах реализации изобретения клеточная линия стабильно экспрессирует инсулин. В некоторых вариантах реализации изобретения клетки могут быть заморожены, разморожены и амплифицированы со временем удвоения, составляющим между около 24 и 44 часами, без значительных морфологических изменений на протяжении по меньшей мере 30 пассажей.
[6] В некоторых аспектах в изобретении предложен способ генерации клетки SC-β из инсулин-позитивных эндокринных клеток, включающий приведение популяции клеток, содержащей инсулин-позитивные эндокринные клетки, в контакт в условиях, которые стимулируют кластеризацию клеток, по меньшей мере с двумя факторами созревания β-клеток, включающими а) ингибитор сигнального пути трансформирующего фактора роста β (TGF-β) и b) активатор сигнального пути тиреоидного гормона, чтобы индуцировать in vitro созревание по меньшей мере одной инсулин-позитивной эндокринной клетки в популяции в клетку SC-β.
[7] В некоторых вариантах реализации изобретения клетка SC-β демонстрирует ответ по меньшей мере на одну стимуляцию глюкозой. В некоторых вариантах реализации изобретения клетка SC-β демонстрирует ответ по меньшей мере на две последовательные стимуляции глюкозой. В некоторых вариантах реализации изобретения клетка SC-β демонстрирует ответ по меньшей мере на три последовательные стимуляции глюкозой. В некоторых вариантах реализации изобретения морфология клетки SC-β имеет сходство с морфологией эндогенной зрелой β-клетки. В некоторых вариантах реализации изобретения клетка SC-β демонстрирует in vitro и/или in vivo ответы, состоящие в стимулированной глюкозой секреции инсулина (GSIS). В некоторых вариантах реализации изобретения ответ GSIS наблюдают непосредственно сразу после трансплантации клетки SC-β в организм субъекта. В некоторых вариантах реализации изобретения ответ GSIS наблюдают приблизительно в течение 24 часов после трансплантации клетки SC-β в организм субъекта. В некоторых вариантах реализации изобретения ответ GSIS наблюдают приблизительно в течение двух недель после трансплантации клетки SC-β в организм субъекта. В некоторых вариантах реализации изобретения популяцию клеток приводят в контакт с ингибитором сигнального пути TGF-β в концентрации 100 нМ 100 мкМ. В некоторых вариантах реализации изобретения популяцию клеток приводят в контакт с ингибитором сигнального пути TGF-β в концентрации 10 мкМ. В некоторых вариантах реализации изобретения сигнальный путь TGF-β включает киназную сигнализацию рецептора TGF-β типа I. В некоторых вариантах реализации изобретения ингибитор сигнального пути TGF-β включает ингибитор II Alk5. В некоторых вариантах реализации изобретения ингибитор сигнального пути TGF-β включает аналог или производное ингибитора II Alk5. В некоторых вариантах реализации изобретения популяцию клеток приводят в контакт с активатором сигнального пути тиреоидного гормона в концентрации 0,1 мкМ - 10 мкМ. В некоторых вариантах реализации изобретения популяцию клеток приводят в контакт с активатором сигнального пути тиреоидного гормона в концентрации 1 мкМ. В некоторых вариантах реализации изобретения активатор сигнального пути тиреоидного гормона включает трийодотиронин (Т3). В некоторых вариантах реализации изобретения популяцию клеток необязательно приводят в контакт с ингибитором протеинкиназы. В некоторых вариантах реализации изобретения популяцию клеток не приводят в контакт с ингибитором протеинкиназы. В некоторых вариантах реализации изобретения популяцию клеток приводят в контакт с ингибитором протеинкиназы. В некоторых вариантах реализации изобретения популяцию клеток приводят в контакт с ингибитором протеинкиназы в концентрации 10 нМ - 1 мкМ. В некоторых вариантах реализации изобретения популяцию клеток приводят в контакт с ингибитором протеинкиназы в концентрации 100 нМ. В некоторых вариантах реализации изобретения ингибитор протеинкиназы включает стауроспорин. В некоторых вариантах реализации изобретения указанный способ включает приведение популяции клеток в контакт по меньшей мере с одним дополнительным фактором созревания β-клеток. В некоторых вариантах реализации изобретения по меньшей мере один дополнительный фактор созревания β-клеток включает ингибитор муковисцидозного трансмембранного регулятора проводимости (CFTR). В некоторых вариантах реализации изобретения популяцию клеток приводят в контакт с ингибитором CFTR в концентрации 100 нМ - 100 мкМ. В некоторых вариантах реализации изобретения популяцию клеток приводят в контакт с ингибитором CFTR в концентрации 10 нМ - 10 мкМ. В некоторых вариантах реализации изобретения ингибитор CFTR включает Gly-H101. В некоторых вариантах реализации изобретения по меньшей мере один дополнительный фактор созревания β-клеток включает ингибитор O-GlcNAказы. В некоторых вариантах реализации изобретения популяцию клеток приводят в контакт с ингибитором O-GlcNAказы в концентрации 100 нМ - 100 мкМ. В некоторых вариантах реализации изобретения популяцию клеток приводят в контакт с ингибитором O-GlcNAказы в концентрации 10 нМ - 10 мкМ. В некоторых вариантах реализации изобретения ингибитор O-GlcNAказы включает Тиамет-G. В некоторых вариантах реализации изобретения популяцию клеток культивируют в подходящей культуральной среде. В некоторых вариантах реализации изобретения подходящая культуральная среда включает дополненную островковую среду 1066 от Connought Medical Research Laboratories (CMRLS) или компонент CMRLS. В некоторых вариантах реализации изобретения CMRLS дополнена сывороткой. В некоторых вариантах реализации изобретения CMRLS дополнена 10% фетальной бычьей сывороткой. В некоторых вариантах реализации изобретения условия, которые стимулируют кластеризацию клеток, включают суспензионную культуру. В некоторых вариантах реализации изобретения популяцию клеток содержат в суспензионной культуре на протяжении периода времени, достаточного, чтобы индуцировать in vitro созревание по меньшей мере одной из инсулин-позитивных эндокринных клеток в популяции клеток по меньшей мере в одну клетку SC-β. В некоторых вариантах реализации изобретения период времени составляет по меньшей мере 7 дней. В некоторых вариантах реализации изобретения период времени составляет от 7 дней до 21 дня. В некоторых вариантах реализации изобретения период времени составляет от 7 до 14 дней. В некоторых вариантах реализации изобретения период времени составляет от 10 до 14 дней. В некоторых вариантах реализации изобретения период времени составляет 14 дней. В некоторых вариантах реализации изобретения факторы созревания β-клеток пополняют через день. В некоторых вариантах реализации изобретения по меньшей мере 1% инсулин-позитивных эндокринных клеток в популяции клеток индуцируют до созревания в клетки SC-β. В некоторых вариантах реализации изобретения по меньшей мере 99% инсулин-позитивных эндокринных клеток в популяции индуцируют до созревания в клетки SC-β. В некоторых вариантах реализации изобретения по меньшей мере 30% из полученных клеток в популяции включают клетки SC-β. В некоторых вариантах реализации изобретения клетки SC-β экспрессируют С-пептид, инсулин, NKX6-1, Pdx1 и коэкспрессируют NKX6-1 и С-пептид. В некоторых вариантах реализации изобретения инсулин-позитивные эндокринные клетки также экспрессируют Pdx1 и NKX6-1. В некоторых вариантах реализации изобретения инсулин-позитивные эндокринные клетки получают из популяции плюрипотентных стволовых клеток, выбранных из группы, состоящей из эмбриональных стволовых клеток и индуцированных плюрипотентных стволовых клеток. В некоторых вариантах реализации изобретения клетки SC-β включают человеческие клетки. В некоторых вариантах реализации изобретения генерация клеток SC-β in vitro является масштабируемой.
[8] В некоторых аспектах в изобретении предложена выделенная популяция клеток SC-β, полученных в соответствии с описанными в данном документе способами.
[9] В некоторых аспектах в изобретении предложена микрокапсула, содержащая инкапсулированную в ней выделенную популяцию клеток SC-β.
[10] В некоторых аспектах в изобретении предложена композиция, содержащая популяцию клеток SC-β, полученных в соответствии с описанным в данном документе способом.
[11] В некоторых аспектах в изобретении предложен метод анализа, включающий выделенную популяцию клеток SC-β, полученных в соответствии с описанным в данном документе способом.
[12] В некоторых вариантах реализации изобретения метод анализа предназначен для выявления одного или более кандидатных агентов, которые стимулируют или ингибируют судьбу β-клеток, выбранную из группы, состоящей из пролиферации β-клеток, репликации β-клеток, гибели β-клеток, функцию β-клеток, восприимчивость β-клеток к иммунной атаке или восприимчивость β-клеток к дедифференцировке или дифференцировке. В некоторых вариантах реализации изобретения метод анализа предназначен для выявления одного или более кандидатных агентов, которые стимулируют дифференцировку по меньшей мере одной инсулин-позитивной эндокринной клетки или ее предшественника по меньшей мере в одну клетку SC-β.
[13] В некоторых аспектах в изобретении предложен способ лечения нуждающегося в этом субъекта, включающий введение субъекту композиции, содержащей выделенную популяцию клеток SC-β, полученных в соответствии с описанным в данном документе способом. В некоторых вариантах реализации изобретения клетки SC-β инкапсулированы в микрокапсуле. В некоторых вариантах реализации изобретения клетки SC-β получены из популяции плюрипотентных стволовых клеток, полученных от того субъекта, которому вводят клетки SC-β. В некоторых вариантах реализации изобретения клетки SC-β получены из популяции клеток iPS (индуцированных плюрипотентных стволовых клеток), при этом клетки iPS получены из клетки, полученной от того субъекта, которому вводят клетки SC-β. В некоторых вариантах реализации изобретения субъект болен диабетом или подвержен повышенному риску развития диабета. В некоторых вариантах реализации изобретения диабет выбран из группы из диабета I типа, диабета II типа, диабета 1,5 типа и преддиабета. В некоторых вариантах реализации изобретения субъект имеет метаболическое нарушение или подвержен повышенному риску развития метаболического нарушения.
[14] В некоторых аспектах изобретение относится к применению выделенной популяции клеток SC-β, полученных способами по любому из пп. 41-102, для введения нуждающемуся в этом субъекту.
[15] В некоторых вариантах реализации изобретения субъекту вводят выделенную популяцию клеток SC-β, инкапсулированных в микрокапсулах. В некоторых вариантах реализации изобретения субъект болен диабетом или подвержен повышенному риску развития диабета. В некоторых вариантах реализации изобретения диабет выбран из группы из диабета I типа, диабета II типа, диабета 1,5 типа и преддиабета. В некоторых вариантах реализации изобретения субъект имеет метаболическое нарушение или подвержен повышенному риску развития метаболического нарушения.
[16] В некоторых аспектах в изобретении предложена культуральная среда, содержащая а) ингибитор Alk5, b) трийодотиронин (Т3), необязательно, с) стауроспорин и необязательно, d) CMRLS или компонент CMRLS.
[17] В некоторых аспектах изобретение относится к применению культуральной среды, чтобы индуцировать in vitro созревание инсулин-позитивных эндокринных клеток в клетки SC-β, при этом клетки SC-β демонстрируют in vitro и/или in vivo ответ GSIS.
[18] некоторых аспектах в изобретении предложен способ получения NKX6-1-позитивной панкреатической клетки-предшественника из Pdx1-позитивной панкреатической клетки-предшественника, включающий приведение популяции клеток, содержащей Pdx1-позитивные панкреатические клетки-предшественники в контакт в условиях, которые стимулируют кластеризацию клеток, по меньшей мере с двумя факторами созревания β-клеток, включающими а) по меньшей мере один фактор роста из семейства факторов роста фибробластов (FGF), b) ингибитор пути звукового ежа и, необязательно, с) низкую концентрацию активатора сигнального пути ретиноевой кислоты (RA), на протяжении периода, составляющего по меньшей мере пять дней, чтобы индуцировать дифференцировку по меньшей мере одной Pdx1-позитивной панкреатической клетки-предшественника в популяции в NKX6-1-позитивные панкреатические клетки-предшественники, при этом NKX6-1-позитивные панкреатические клетки-предшественники экспрессируют NKX6-1.
[19] В некоторых вариантах реализации изобретения популяцию клеток приводят в контакт по меньшей мере с одним фактором роста из семейства FGF в концентрации 1 нг/мл - 100 нг/мл. В некоторых вариантах реализации изобретения популяцию клеток приводят в контакт по меньшей мере с одним фактором роста из семейства FGF в концентрации 50 нг/мл. В некоторых вариантах реализации изобретения по меньшей мере один фактор роста из семейства FGF включает фактор роста кератиноцитов (KGF). В некоторых вариантах реализации изобретения по меньшей мере один фактор роста из семейства FGF выбран из группы, состоящей из FGF2, FGF8B, FGF10 и FGF21. В некоторых вариантах реализации изобретения популяцию клеток не приводят в контакт с активатором сигнального пути RA. В некоторых вариантах реализации изобретения популяцию клеток приводят в контакт с активатором сигнального пути RA в концентрации 0,01 мкМ - 1,0 мкМ. В некоторых вариантах реализации изобретения популяцию клеток приводят в контакт с активатором сигнального пути RA в концентрации 0,1 мкМ. В некоторых вариантах реализации изобретения активатор сигнального пути RA включает RA. В некоторых вариантах реализации изобретения популяцию клеток приводят в контакт с ингибитором пути SHH в концентрации 0,1 мкМ - 0,5 мкМ. В некоторых вариантах реализации изобретения популяцию клеток приводят в контакт с ингибитором пути SHH в концентрации 0,25 мкМ. В некоторых вариантах реализации изобретения ингибитор пути SHH включает Sant1. В некоторых вариантах реализации изобретения указанный способ включает обработку популяции клеток по меньшей мере одним дополнительным фактором созревания β-клеток. В некоторых вариантах реализации изобретения по меньшей мере один дополнительный фактор созревания β-клеток включает по меньшей мере один фактор роста из семейства EGF. В некоторых вариантах реализации изобретения популяцию клеток обрабатывают по меньшей мере одним фактором роста из семейства EGF в концентрации 2 нг/мл - 200 нг/мл. В некоторых вариантах реализации изобретения популяцию клеток обрабатывают по меньшей мере одним фактором роста из семейства EGF в концентрации 20 нг/мл. В некоторых вариантах реализации изобретения по меньшей мере один фактор роста из семейства EGF выбран из группы, состоящей из бетацеллюлина и EGF. В некоторых вариантах реализации изобретения популяцию клеток культивируют в подходящей культуральной среде. В некоторых вариантах реализации изобретения условия, которые стимулируют кластеризацию клеток, включают суспензионную культуру. В некоторых вариантах реализации изобретения факторы созревания β-клеток пополняют через день. В некоторых вариантах реализации изобретения в суспензионную культуру на протяжении 5 дней не добавляют активатор протеинкиназы С. В некоторых вариантах реализации изобретения активатор протеинкиназы С удаляют из суспензионной культуры перед истечением периода в 5 дней. В некоторых вариантах реализации изобретения активатор протеинкиназы С включает PdbU. В некоторых вариантах реализации изобретения в суспензионную культуру на протяжении 5 дней не добавляют ингибитор сигнального пути BMP (костного морфогенетического белка). В некоторых вариантах реализации изобретения ингибитор сигнального пути BMP удаляют из суспензионной культуры на протяжении времени, составляющего менее 5 дней. В некоторых вариантах реализации изобретения ингибитор сигнального пути BMP включает LDN193189. В некоторых вариантах реализации изобретения по меньшей мере 10% Pdx1-позитивных панкреатических клеток-предшественников в популяции индуцируют до дифференцировки в NKX6-1-позитивные панкреатические клетки-предшественники. В некоторых вариантах реализации изобретения по меньшей мере 95% Pdx1-позитивных панкреатических клеток-предшественников в популяции индуцируют до дифференцировки в NKX6-1-позитивные панкреатические клетки-предшественники. В некоторых вариантах реализации изобретения NKX6-1-позитивные панкреатические клетки-предшественники экспрессируют Pdx1, NKX6-1 и FoxA2. В некоторых вариантах реализации изобретения Pdx1-позитивные панкреатические клетки-предшественники получают из популяции плюрипотентных стволовых клеток, выбранных из группы, состоящей из эмбриональных стволовых клеток и индуцированных плюрипотентных стволовых клеток.
[20] В некоторых аспектах в изобретении предложена выделенная популяция NKX6-1-позитивных панкреатических клеток-предшественников, полученных в соответствии с описанными в данном документе способами.
[21] В некоторых аспектах в изобретении предложена микрокапсула, содержащая инкапсулированную в ней выделенную популяцию NKX6-1-позитивных панкреатических клеток-предшественников.
[22] В некоторых аспектах в изобретении предложена композиция, содержащая популяцию NKX6-1-позитивных панкреатических клеток-предшественников, полученных в соответствии с описанным в данном документе способом.
[23] В некоторых аспектах в изобретении предложен метод анализа, включающий выделенную популяцию NKX6-1-позитивных панкреатических клеток-предшественников, полученных в соответствии с описанным в данном документе способом.
[24] В некоторых вариантах реализации изобретения метод анализа предназначен для выявления одного или более кандидатных агентов, которые стимулируют дифференцировку по меньшей мере одной Pdx1-позитивной панкреатической клетки-предшественника или ее предшественника в NKX6-1-позитивные панкреатические клетки-предшественники.
[25] В некоторых аспектах в изобретении предложен способ лечения нуждающегося в этом субъекта, включающий введение субъекту композиции, содержащей выделенную популяцию NKX6-1-позитивных панкреатических клеток-предшественников, полученных в соответствии с описанным в данном документе способом.
[26] В некоторых вариантах реализации изобретения NKX6-1-позитивные панкреатические клетки-предшественники получены из популяции плюрипотентных стволовых клеток, полученных от того субъекта, которому вводят NKX6-1-позитивные панкреатические клетки-предшественники. В некоторых вариантах реализации изобретения NKX6-1-позитивные панкреатические клетки-предшественники инкапсулированы в микрокапсуле. В некоторых вариантах реализации изобретения субъект болен диабетом или подвержен повышенному риску развития диабета. В некоторых вариантах реализации изобретения диабет выбран из группы из диабета I типа, диабета II типа, диабета 1,5 типа и преддиабета. В некоторых вариантах реализации изобретения субъект имеет метаболическое нарушение или подвержен повышенному риску развития метаболического нарушения.
[27] В некоторых аспектах изобретение относится к применению выделенной популяции NKX6-1-позитивных панкреатических клеток-предшественников, полученных способами по любому из пп. 113-142, для дифференцировки в клетки SC-β.
[28] В некоторых аспектах изобретение относится к применению выделенной популяции NKX6-1-позитивных панкреатических клеток-предшественников, полученных описанным в данном документе способом, для введения нуждающемуся в этом субъекту.
[29] В некоторых вариантах реализации изобретения субъекту вводят выделенную популяцию NKX6-1-позитивных панкреатических клеток-предшественников, инкапсулированных в микрокапсулах. В некоторых вариантах реализации изобретения субъект болен диабетом или подвержен повышенному риску развития диабета. В некоторых вариантах реализации изобретения диабет выбран из группы из диабета I типа, диабета II типа, диабета 1,5 типа и преддиабета. В некоторых вариантах реализации изобретения субъект имеет метаболическое нарушение или подвержен повышенному риску развития метаболического нарушения.
[30] В некоторых аспектах в изобретении предложена культуральная среда, содержащая KGF, b) SANT1) и, необязательно, с) RA, при этом культуральная среда практически не содержит PdbU и LDN 193189. В некоторых вариантах реализации изобретение относится к применению культуральной среды по п. 160, чтобы индуцировать in vitro дифференцировку Pdx1-позитивных панкреатических клеток-предшественников в NKX6-1-позитивные панкреатические клетки-предшественники.
[31] В некоторых аспектах в изобретении предложен способ получения инсулин-позитивной эндокринной клетки из NKX6-1-позитивной панкреатической клетки-предшественника, включающий приведение популяции клеток, содержащей NKX6-1-позитивные панкреатические клетки-предшественники в контакт в условиях, которые стимулируют кластеризацию клеток, по меньшей мере с двумя факторами созревания β-клеток, включающими а) ингибитор сигнального пути TGF-β и b) активатор сигнального пути тиреоидного гормона, чтобы индуцировать дифференцировку по меньшей мере одной NKX6-1-позитивной панкреатической клетки-предшественника в популяции по меньшей мере в одну инсулин-позитивную эндокринную клетку, при этом по меньшей мере одна инсулин-позитивная панкреатическая клетка-предшественник экспрессирует инсулин. В некоторых вариантах реализации изобретения популяцию клеток приводят в контакт c ингибитором сигнального пути TGF-β в концентрации 100 нМ - 100 мкМ. В некоторых вариантах реализации изобретения популяцию клеток приводят в контакте ингибитором сигнального пути TGF-β в концентрации 10 мкМ. В некоторых вариантах реализации изобретения сигнальный путь TGF-β включает киназную сигнализацию рецептора TGF-β типа I. В некоторых вариантах реализации изобретения ингибитор сигнального пути TGF-β включает ингибитор II Alk5. В некоторых вариантах реализации изобретения популяцию клеток приводят в контакте активатором сигнального пути тиреоидного гормона в концентрации 0,1 мкМ - 10 мкМ. В некоторых вариантах реализации изобретения популяцию клеток приводят в контакт с активатором сигнального пути тиреоидного гормона в концентрации 1 мкМ. В некоторых вариантах реализации изобретения активатор сигнального пути тиреоидного гормона включает трийодотиронин (Т3). В некоторых вариантах реализации изобретения указанный способ включает приведение популяции клеток в контакт по меньшей мере с одним дополнительным фактором созревания β-клеток. В некоторых вариантах реализации изобретения по меньшей мере один дополнительный фактор созревания β-клеток включает ингибитор γ-секретазы. В некоторых вариантах реализации изобретения популяцию клеток приводят в контакт с ингибитором γ-секретазы в концентрации 0,1 мкМ - 10 мкМ. В некоторых вариантах реализации изобретения популяцию клеток приводят в контакт с ингибитором γ-секретазы в концентрации 1 мкМ. В некоторых вариантах реализации изобретения ингибитор γ-секретазы включает XXI. В некоторых вариантах реализации изобретения ингибитор γ-секретазы включает DAPT. В некоторых вариантах реализации изобретения по меньшей мере один дополнительный фактор созревания β-клеток включает по меньшей мере один фактор роста из семейства EGF. В некоторых вариантах реализации изобретения популяцию клеток приводят в контакт по меньшей мере с одним фактором роста из семейства EGF в концентрации 2 нг/мл - 200 нг/мл. В некоторых вариантах реализации изобретения популяцию клеток приводят в контакт по меньшей мере с одним фактором роста из семейства EGF в концентрации 20 нг/мл. В некоторых вариантах реализации изобретения по меньшей мере один фактор роста из семейства EGF включает бетацеллюлин. В некоторых вариантах реализации изобретения по меньшей мере один фактор роста из семейства EGF включает EGF. В некоторых вариантах реализации изобретения по меньшей мере один дополнительный фактор созревания β-клеток включает низкую концентрацию активатора сигнального пути ретиноевой кислоты (RA). В некоторых вариантах реализации изобретения популяцию клеток приводят в контакт с активатором сигнального пути RA в концентрации 0,01 мкМ - 1,0 мкМ. В некоторых вариантах реализации изобретения популяцию клеток приводят в контакт с активатором сигнального пути RA в концентрации 0,1 мкМ. В некоторых вариантах реализации изобретения активатор сигнального пути RA включает RA. В некоторых вариантах реализации изобретения по меньшей мере один дополнительный фактор созревания β-клеток включает ингибитор пути «звукового ежа» (SHH). В некоторых вариантах реализации изобретения популяцию клеток приводят в контакт с ингибитором пути SHH в концентрации 0,1 мкМ - 0,5 мкМ. В некоторых вариантах реализации изобретения популяцию клеток приводят в контакт с ингибитором пути SHH в концентрации 0,25 мкМ. В некоторых вариантах реализации изобретения ингибитор пути SHH включает Sant1. В некоторых вариантах реализации изобретения популяцию клеток необязательно приводят в контакт с ингибитором протеинкиназы. В некоторых вариантах реализации изобретения популяцию клеток не приводят в контакт с ингибитором протеинкиназы. В некоторых вариантах реализации изобретения популяцию клеток приводят в контакт с ингибитором протеинкиназы. В некоторых вариантах реализации изобретения популяцию клеток приводят в контакт с ингибитором протеинкиназы в концентрации 10 нМ - 1 мкМ. В некоторых вариантах реализации изобретения популяцию клеток приводят в контакте ингибитором протеинкиназы в концентрации 100 нМ. В некоторых вариантах реализации изобретения ингибитор протеинкиназы включает стауроспорин. В некоторых вариантах реализации изобретения указанный способ включает обработку популяции клеток глюкозой. В некоторых вариантах реализации изобретения популяцию клеток обрабатывают глюкозой в концентрации 1 мМ - 50 мМ. В некоторых вариантах реализации изобретения популяцию клеток обрабатывают глюкозой в концентрации, составляю 25 мМ. В некоторых вариантах реализации изобретения условия, которые стимулируют кластеризацию клеток, включают суспензионную культуру. В некоторых вариантах реализации изобретения популяцию клеток содержат в суспензионной культуре на протяжении периода времени, достаточного, чтобы индуцировать дифференцировку по меньшей мере одной из NKX6-1-позитивных панкреатических клеток-предшественников в популяции в инсулин-позитивную эндокринную клетку. В некоторых вариантах реализации изобретения указанный период времени составляет по меньшей мере 7 дней. В некоторых вариантах реализации изобретения факторы созревания β-клеток пополняют в суспензионной культуре через день. В некоторых вариантах реализации изобретения по меньшей мере 15% из NKX6-1-позитивных панкреатических клеток-предшественников в популяции индуцируют до дифференцировки в инсулин-позитивные эндокринные клетки. В некоторых вариантах реализации изобретения по меньшей мере 99% из NKX6-1-позитивных панкреатических клеток-предшественников в популяции индуцируют до дифференцировки в инсулин-позитивные эндокринные клетки. В некоторых вариантах реализации изобретения инсулин-позитивные эндокринные клетки экспрессируют Pdx1, NKX6-1, NKX2-2, Mafb, glis3, Sur1, Kir6.2, Znt8, SLC2A1, SLC2A3 и/или инсулин. В некоторых вариантах реализации изобретения NKX6-1-позитивные панкреатические клетки-предшественники получают из популяции плюрипотентных стволовых клеток, выбранных из группы, состоящей из эмбриональных стволовых клеток и индуцированных плюрипотентных стволовых клеток.
[32] В некоторых аспектах в изобретении предложена выделенная популяция инсулин-позитивных эндокринных клеток, полученных в соответствии с описанным в данном документе способом.
[33] В некоторых аспектах в изобретении предложена микрокапсула, содержащая инкапсулированную в ней выделенную популяцию инсулин-позитивных эндокринных клеток. В некоторых вариантах реализации в изобретении предложена композиция, содержащая популяцию инсулин-позитивных эндокринных клеток, полученных в соответствии с описанным в данном документе способом.
[34] В некоторых аспектах в изобретении предложен способ лечения нуждающегося в этом субъекта, включающий введение субъекту композиции, содержащей выделенную популяцию инсулин-позитивных эндокринных клеток, полученных в соответствии с описанным в данном документе способом.
[35] некоторых вариантах реализации изобретения инсулин-позитивные эндокринные клетки получены из популяции плюрипотентных стволовых клеток, полученных от того субъекта, которому вводят инсулин-позитивные эндокринные клетки. В некоторых вариантах реализации изобретения инсулин-позитивные эндокринные клетки инкапсулированы в микрокапсуле. В некоторых вариантах реализации изобретения субъект болен диабетом или подвержен повышенному риску развития диабета. В некоторых вариантах реализации изобретения диабет выбран из группы из диабета I типа, диабета II типа, диабета 1,5 типа и преддиабета. В некоторых вариантах реализации изобретения субъект имеет метаболическое нарушение или подвержен повышенному риску развития метаболического нарушения.
[36] В некоторых аспектах изобретение относится к применению выделенной популяции инсулин-позитивных эндокринных клеток, полученных описанным в данном документе способом, для дифференцировки в клетки SC-β.
[37] В некоторых аспектах изобретение относится к применению выделенной популяции инсулин-позитивных эндокринных клеток, полученных описанным в данном документе способом, для введения нуждающемуся в этом субъекту.
[38] В некоторых вариантах реализации изобретения субъекту вводят выделенную популяцию инсулин-позитивных эндокринных клеток, инкапсулированных в микрокапсулах. В некоторых вариантах реализации изобретения субъект болен диабетом или подвержен повышенному риску развития диабета. В некоторых вариантах реализации изобретения диабет выбран из группы из диабета I типа, диабета II типа, диабета 1,5 типа и преддиабета. В некоторых вариантах реализации изобретения субъект имеет метаболическое нарушение или подвержен повышенному риску развития метаболического нарушения.
[39] В некоторых аспектах в изобретении предложена культуральная среда, содержащая а) ингибитор сигнального пути TGF-β, b) активатор пути ТН (тиреоидного гормона) и по меньшей мере один дополнительный фактор созревания β-клеток, выбранный из группы, состоящей из i) XXI, ii) бетацеллюлина, iii) низкой концентрации активатора сигнального пути RA и iv) ингибитора пути SHH.
[40] В некоторых аспектах изобретение относится к применению культуральной среды по п. 221, чтобы индуцировать in vitro дифференцировку NKX6-1-позитивных панкреатических клеток-предшественников в инсулин-позитивные эндокринные клетки.
[41] В некоторых аспектах в изобретении предложен способ получения клеток SC-β, включающий: приведение Pdx1-позитивных, NKX6-1-позитивных, инсулин-позитивных эндокринных клеток в контакт в условиях, которые стимулируют кластеризацию клеток с i) ингибитором сигнального пути трансформирующего фактора роста β (TGF-β), ii) активатором сигнального пути тиреоидного гормона и, необязательно, iii) ингибитором протеинкиназы, чтобы индуцировать in vitro созревание по меньшей мере одной из Pdx1-позитивных, NKX6-1-позитивных, инсулин-позитивных эндокринных клеток в клетки SC-β, при этом клетки SC-β демонстрируют ответ GSIS in vitro и/или in vivo.
[42] В некоторых вариантах реализации изобретения ответ GSIS наблюдают (i) непосредственно сразу после трансплантации клетки SC-β в организм субъекта; (ii) в течение приблизительно 24 часов после трансплантации клетки в организм субъекта; или (iii) в течение приблизительно двух недель после трансплантации клетки в организм субъекта. В некоторых вариантах реализации изобретения клетки SC-β демонстрируют ответ (i) по меньшей мере на одну стимуляцию глюкозой; (ii) по меньшей мере на две последовательные стимуляции глюкозой; или (iii) по меньшей мере на три последовательные стимуляции глюкозой. В некоторых вариантах реализации изобретения морфология клеток SC-β имеет сходство с морфологией эндогенных β-клеток. В некоторых вариантах реализации изобретения Pdx1-позитивные, NKX6-1-позитивные, инсулин-позитивные эндокринные клетки приводят в контакт с ингибитором сигнального пути TGF-β в концентрации 100 нМ - 100 мкМ. В некоторых вариантах реализации изобретения Pdx1-позитивные, NKX6-1-позитивные, инсулин-позитивные эндокринные клетки приводят в контакт с ингибитором сигнального пути TGF-β в концентрации 10 мкМ. В некоторых вариантах реализации изобретения сигнальный путь TGF-β включает киназную сигнализацию рецептора TGF-β типа I. В некоторых вариантах реализации изобретения ингибитор сигнального пути TGF-β включает ингибитор II Alk5. В некоторых вариантах реализации изобретения Pdx1-позитивные, NKX6-1-позитивные, инсулин-позитивные эндокринные клетки приводят в контакт с активатором сигнального пути тиреоидного гормона в концентрации 0,1 мкМ - 10 мкМ. В некоторых вариантах реализации изобретения Pdx1-позитивные, NKX6-1-позитивные, инсулин-позитивные эндокринные клетки приводят в контакт с активатором сигнального пути тиреоидного гормона в концентрации 1 мкМ. В некоторых вариантах реализации изобретения активатор сигнального пути тиреоидного гормона включает трийодотиронин (Т3). В некоторых вариантах реализации изобретения Pdx1-позитивные, NKX6-1-позитивные, инсулин-позитивные эндокринные клетки не приводят в контакт с ингибитором протеинкиназы. В некоторых вариантах реализации изобретения Pdx1-позитивные, NKX6-1-позитивные, инсулин-позитивные эндокринные клетки приводят в контакт с ингибитором протеинкиназы. В некоторых вариантах реализации изобретения Pdx1-позитивные, NKX6-1-позитивные, инсулин-позитивные эндокринные клетки приводят в контакт с ингибитором протеинкиназы в концентрации 10 нМ - 1 мкМ. В некоторых вариантах реализации изобретения Pdx1-позитивные, NKX6-1-позитивные, инсулин-позитивные эндокринные клетки приводят в контакт с ингибитором протеинкиназы в концентрации 100 нМ. В некоторых вариантах реализации изобретения ингибитор протеинкиназы включает стауроспорин. В некоторых вариантах реализации изобретения указанный способ включает приведение Pdx1-позитивных, NKX6-1-позитивных, инсулин-позитивных эндокринных клеток в контакт с ингибитором муковисцидозного трансмембранного регулятора проводимости (CFTR). В некоторых вариантах реализации изобретения Pdx1-позитивные, NKX6-1-позитивные, инсулин-позитивные эндокринные клетки приводят в контакт с ингибитором CFTR в концентрации 100 нМ - 100 мкМ. В некоторых вариантах реализации изобретения Pdx1-позитивные, NKX6-1-позитивные, инсулин-позитивные эндокринные клетки приводят в контакт с ингибитором CFTR в концентрации 10 нМ - 10 мкМ. В некоторых вариантах реализации изобретения ингибитор CFTR включает Gly-Н101. В некоторых вариантах реализации изобретения указанный способ включает приведение Pdx1-позитивных, NKX6-1-позитивных, инсулин-позитивных эндокринных клеток в контакт с ингибитором O-GlcNAказы. В некоторых вариантах реализации изобретения Pdx1-позитивные, NKX6-1-позитивные, инсулин-позитивные эндокринные клетки приводят в контакт с ингибитором O-GlcNAказы в концентрации 100 нМ - 100 мкМ. В некоторых вариантах реализации изобретения Pdx1-позитивные, NKX6-1-позитивные, инсулин-позитивные эндокринные клетки приводят в контакт с ингибитором O-GlcNAказы в концентрации 10 нМ - 10 мкМ. В некоторых вариантах реализации изобретения ингибитор O-GlcNAказы включает Тиамет-G. В некоторых вариантах реализации изобретения Pdx1-позитивные, NKX6-1-позитивные, инсулин-позитивные эндокринные клетки культивируют в подходящей культуральной среде. В некоторых вариантах реализации изобретения подходящая культуральная среда включает дополненную островковую среду 1066 от Connought Medical Research Laboratories (CMRLS) или компонент CMRLS. В некоторых вариантах реализации изобретения CMRLS дополнена сывороткой. В некоторых вариантах реализации изобретения CMRLS дополнена 10% фетальной бычьей сывороткой. В некоторых вариантах реализации изобретения условия, которые стимулируют кластеризацию клеток, включают суспензионную культуру. В некоторых вариантах реализации изобретения Pdx1-позитивные, NKX6-1-позитивные, инсулин-позитивные эндокринные клетки содержат в суспензионной культуре на протяжении периода времени, достаточного, чтобы индуцировать in vitro созревание по меньшей мере некоторых Pdx1-позитивных, NKX6-1-позитивных, инсулин-позитивных эндокринных клеток в клетки SC-β. В некоторых вариантах реализации изобретения период времени составляет по меньшей мере 7 дней. В некоторых вариантах реализации изобретения период времени составляет от 7 дней до 21 дня. В некоторых вариантах реализации изобретения период времени составляет от 7 до 14 дней. В некоторых вариантах реализации изобретения период времени составляет 14 дней. В некоторых вариантах реализации изобретения суспензионную культуру пополняют через день. В некоторых вариантах реализации изобретения по меньшей мере 30% полученных клеток содержат клетки SC-β. В некоторых вариантах реализации изобретения клетки SC-β экспрессируют С-пептид, инсулин, NKX6-1, Pdx1 и коэкспрессируют NKX6-1 и С-пептид. В некоторых вариантах реализации изобретения клетки SC-β включают человеческие клетки. В некоторых вариантах реализации изобретения генерация клеток SC-β in vitro является масштабируемой.
[43] В некоторых вариантах реализации изобретения инсулин-позитивные эндокринные клетки получают путем приведения Pdx1-позитивных, NKX6-1-позитивных панкреатических клеток-предшественников в условиях, которые стимулируют кластеризацию клеток, в контакт с i) ингибитором сигнального пути TGF-β и ii) активатором сигнального пути тиреоидного гормона, чтобы индуцировать дифференцировку по меньшей мере некоторых Pdx1-позитивных, NKX6-1-позитивных панкреатических клеток-предшественников в Pdx1-позитивные, NKX6-1-позитивные, инсулин-позитивные эндокринные клетки, при этом Pdx1-позитивные, NKX6-1-позитивные, инсулин-позитивные эндокринные клетки экспрессируют Pdx1, NKX6-1, NKX2-2, Mafb, glis3, Sur1, Kir6.2, Znt8, SLC2A1, SLC2A3 и/или инсулин.
[44] В некоторых вариантах реализации изобретения Pdx1-позитивные, NKX6-1-позитивные панкреатические клетки-предшественники приводят в контакт с ингибитором сигнального пути TGF-β в концентрации 100 нМ - 100 мкМ. В некоторых вариантах реализации изобретения Pdx1-позитивные, NKX6-1-позитивные панкреатические клетки-предшественники приводят в контакт с ингибитором сигнального пути TGF-β в концентрации 10 мкМ. В некоторых вариантах реализации изобретения сигнальный путь TGF-β включает киназную сигнализацию рецептора TGF-β типа I. В некоторых вариантах реализации изобретения ингибитор сигнального пути TGF-β включает ингибитор II Alk5. В некоторых вариантах реализации изобретения Pdx1-позитивные, NKX6-1-позитивные панкреатические клетки-предшественники приводят в контакт с активатором сигнального пути тиреоидного гормона в концентрации 0,1 мкМ - 10 мкМ. В некоторых вариантах реализации изобретения Pdx1-позитивные, NKX6-1-позитивные панкреатические клетки-предшественники приводят в контакт с активатором сигнального пути тиреоидного гормона в концентрации 1 мкМ. В некоторых вариантах реализации изобретения активатор сигнального пути тиреоидного гормона включает трийодотиронин (Т3). В некоторых вариантах реализации изобретения указанный способ включает приведение в контакт Pdx1-позитивных, NKX6-1-позитивных панкреатических клеток-предшественников по меньшей мере с одним компонентом из i) ингибитора пути SHH, ii) активатора сигнального пути RA, iii) ингибитора γ-секретазы, iv) по меньшей мере одного фактора роста из семейства эпидермальных факторов роста (EGF) и, необязательно, v) ингибитора протеинкиназы. В некоторых вариантах реализации изобретения Pdx1-позитивные, NKX6-1-позитивные панкреатические клетки-предшественники приводят в контакт с ингибитором пути SHH в концентрации 0,1 мкМ - 0,5 мкМ. В некоторых вариантах реализации изобретения Pdx1-позитивные, NKX6-1-позитивные панкреатические клетки-предшественники приводят в контакт с ингибитором пути SHH в концентрации 0,25 мкМ. В некоторых вариантах реализации изобретения ингибитор пути SHH включает Sant1. В некоторых вариантах реализации изобретения Pdx1-позитивные, NKX6-1-позитивные панкреатические клетки-предшественники приводят в контакт с активатором сигнального пути RA в концентрации 0,01 мкМ - 1,0 мкМ. В некоторых вариантах реализации изобретения Pdx1-позитивные, NKX6-1-позитивные панкреатические клетки-предшественники приводят в контакт с активатором сигнального пути RA в концентрации 0,1 мкМ. В некоторых вариантах реализации изобретения активатор сигнального пути RA включает RA. В некоторых вариантах реализации изобретения Pdx1-позитивные, NKX6-1-позитивные панкреатические клетки-предшественники приводят в контакт с ингибитором γ-секретазы в концентрации 0,1 мкМ - 10 мкМ. В некоторых вариантах реализации изобретения Pdx1-позитивные, NKX6-1-позитивные панкреатические клетки-предшественники приводят в контакт с ингибитором γ-секретазы в концентрации 1 мкМ. В некоторых вариантах реализации изобретения ингибитор γ-секретазы включает XXI. В некоторых вариантах реализации изобретения ингибитор γ-секретазы включает DAPT. В некоторых вариантах реализации изобретения Pdx1-позитивные, NKX6-1-позитивные панкреатические клетки-предшественники приводят в контакт по меньшей мере с одним фактором роста из семейства EGF в концентрации 2 нг/мл - 200 нг/мл. В некоторых вариантах реализации изобретения Pdx1-позитивные, NKX6-1-позитивные панкреатические клетки-предшественники приводят в контакт по меньшей мере с одним фактором роста из семейства EGF в концентрации 20 нг/мл. В некоторых вариантах реализации изобретения по меньшей мере один фактор роста из семейства EGF включает бетацеллюлин. В некоторых вариантах реализации изобретения по меньшей мере один фактор роста из семейства EGF включает EGF. В некоторых вариантах реализации изобретения Pdx1-позитивные, NKX6-1-позитивные панкреатические клетки-предшественники не приводят в контакт с ингибитором протеинкиназы. В некоторых вариантах реализации изобретения Pdx1-позитивные, NKX6-1-позитивные панкреатические клетки-предшественники приводят в контакт с ингибитором протеинкиназы. В некоторых вариантах реализации изобретения Pdx1-позитивные, NKX6-1-позитивные панкреатические клетки-предшественники приводят в контакт с ингибитором протеинкиназы в концентрации 10 нМ - 1 мкМ. В некоторых вариантах реализации изобретения Pdx1-позитивные, NKX6-1-позитивные панкреатические клетки-предшественники приводят в контакт с ингибитором протеинкиназы в концентрации 100 нМ. В некоторых вариантах реализации изобретения ингибитор протеинкиназы включает стауроспорин. В некоторых вариантах реализации изобретения указанный способ включает обработку популяции клеток глюкозой. В некоторых вариантах реализации изобретения популяцию клеток обрабатывают глюкозой в концентрации 1 мМ - 50 мМ. В некоторых вариантах реализации изобретения популяцию клеток обрабатывают глюкозой в концентрации, составляю 25 мМ. В некоторых вариантах реализации изобретения условия, которые стимулируют кластеризацию клеток, включают суспензионную культуру. В некоторых вариантах реализации изобретения Pdx1-позитивные, NKX6-1-позитивные панкреатические клетки-предшественники содержат в суспензионной культуре на протяжении периода времени, достаточного, чтобы индуцировать дифференцировку по меньшей мере некоторых из Pdx1-позитивных, NKX6-1-позитивных панкреатических клеток-предшественников в Pdx1-позитивные, NKX6-1-позитивные, инсулин-позитивные эндокринные клетки. В некоторых вариантах реализации изобретения указанный период времени составляет по меньшей мере 7 дней. В некоторых вариантах реализации изобретения суспензионную культуру пополняют через день. В некоторых вариантах реализации изобретения по меньшей мере 15% Pdx1-позитивных, NKX6-1-позитивных панкреатических клеток-предшественников индуцируют до дифференцировки в Pdx1-позитивные, NKX6-1-позитивные, инсулин-позитивные эндокринные клетки. В некоторых вариантах реализации изобретения по меньшей мере 99% Pdx1-позитивных, NKX6-1-позитивных панкреатических клеток-предшественников индуцируют до дифференцировки в Pdx1-позитивные, NKX6-1-позитивные, инсулин-позитивные эндокринные клетки.
[45] В некоторых вариантах реализации изобретения Pdx1-позитивные, NKX6-1-позитивные панкреатические клетки-предшественники получают путем приведения Pdx1-позитивных панкреатических клеток-предшественников в условиях, которые стимулируют кластеризацию клеток, в контакт с i) по меньшей мере одним фактором роста из семейства FGF, ii) по меньшей мере одним ингибитором пути SHH и, необязательно, iii) низкими концентрациями активатора сигнального пути RA, на протяжении периода времени, составляющего пять дней, чтобы индуцировать дифференцировку по меньшей мере некоторых Pdx1-позитивных панкреатических клеток-предшественников в Pdx1-позитивные, NKX6-1-позитивные панкреатические клетки-предшественники, при этом Pdx1-позитивные, NKX6-1-позитивные панкреатические клетки-предшественники экспрессируют Pdx1 и NKX6-1.
[46] В некоторых вариантах реализации изобретения Pdx1-позитивные панкреатические клетки-предшественники приводят в контакт по меньшей мере с одним фактором роста из семейства FGF в концентрации 1 нг/мл - 100 нг/мл. В некоторых вариантах реализации изобретения Pdx1-позитивные панкреатические клетки-предшественники приводят в контакт по меньшей мере с одним фактором роста из семейства FGF в концентрации 50 нг/мл. В некоторых вариантах реализации изобретения по меньшей мере один фактор роста из семейства FGF включает фактор роста кератиноцитов (KGF). В некоторых вариантах реализации изобретения по меньшей мере один фактор роста из семейства FGF выбран из группы, состоящей из FGF2, FGF8B, FGF10 и FGF21. В некоторых вариантах реализации изобретения Pdx1-позитивные панкреатические клетки-предшественники приводят в контакт по меньшей мере с одним ингибитором пути SHH в концентрации 0,1 мкМ 0,5 мкМ. В некоторых вариантах реализации изобретения Pdx1-позитивные панкреатические клетки-предшественники приводят в контакт по меньшей мере с одним ингибитором пути SHH в концентрации 0,25 мкМ. В некоторых вариантах реализации изобретения по меньшей мере один ингибитор пути SHH включает Sant1. В некоторых вариантах реализации изобретения Pdx1-позитивные панкреатические клетки-предшественники приводят в контакте активатором сигнального пути RA в концентрации 0,01 мкМ - 1,0 мкМ. В некоторых вариантах реализации изобретения Pdx1-позитивные панкреатические клетки-предшественники приводят в контакт с активатором сигнального пути RA в концентрации 0,1 мкМ. В некоторых вариантах реализации изобретения активатор сигнального пути RA включает RA. В некоторых вариантах реализации изобретения указанный способ включает приведение в контакт Pdx1-позитивных панкреатических клеток-предшественников по меньшей мере с одним фактором роста из семейства EGF. В некоторых вариантах реализации изобретения Pdx1-позитивные панкреатические клетки-предшественники приводят в контакт по меньшей мере с одним фактором роста из семейства EGF в концентрации 2 нг/мл - 200 нг/мл. В некоторых вариантах реализации изобретения Pdx1-позитивные панкреатические клетки-предшественники приводят в контакт по меньшей мере с одним фактором роста из семейства EGF в концентрации 20 нг/мл. В некоторых вариантах реализации изобретения по меньшей мере один фактор роста из семейства EGF включает бетацеллюлин. В некоторых вариантах реализации изобретения по меньшей мере один фактор роста из семейства EGF включает EGF. В некоторых вариантах реализации изобретения Pdx1-позитивные панкреатические клетки-предшественники культивируют в подходящей культуральной среде. В некоторых вариантах реализации изобретения условия, которые стимулируют кластеризацию клеток, включают суспензионную культуру. В некоторых вариантах реализации изобретения суспензионную культуру пополняют через день. В некоторых вариантах реализации изобретения в суспензионную культуру на протяжении 5 дней не добавляют активатор протеинкиназы С. В некоторых вариантах реализации изобретения активатор протеинкиназы С удаляют из суспензионной культуры перед истечением периода в 5 дней. В некоторых вариантах реализации изобретения активатор протеинкиназы С включает PdbU. В некоторых вариантах реализации изобретения в суспензионную культуру на протяжении 5 дней не добавляют ингибитор сигнального пути BMP. В некоторых вариантах реализации изобретения ингибитор сигнального пути BMP удаляют из суспензионной культуры на протяжении времени, составляющего менее 5 дней. В некоторых вариантах реализации изобретения ингибитор сигнального пути BMP включает LDN193189. В некоторых вариантах реализации изобретения по меньшей мере 10% Pdx1-позитивных панкреатических клеток-предшественников в популяции индуцируют до дифференцировки в Pdx1-позитивные, NKX6-1-позитивные панкреатические клетки-предшественники. В некоторых вариантах реализации изобретения по меньшей мере 95% Pdx1-позитивных панкреатических клеток-предшественников индуцируют до дифференцировки в Pdx1-позитивные, NKX6-1-позитивные панкреатические клетки-предшественники.
[47] В некоторых аспектах в изобретении предложен способ генерации клеток SC-β из плюрипотентных клеток, включающий: а) дифференцировку плюрипотентных стволовых клеток в популяции в Pdx1-позитивные панкреатические клетки-предшественники; b) дифференцировку по меньшей мере некоторых Pdx1-позитивных панкреатических клеток-предшественников в Pdx1-позитивные, NKX6-1-позитивные панкреатические клетки-предшественники путем приведения Pdx1-позитивных панкреатических клеток-предшественников в условиях, которые стимулируют кластеризацию клеток, в контакт с i) по меньшей мере одним фактором роста из семейства FGF, ii) по меньшей мере одним ингибитором пути SHH и, необязательно, iii) активатором сигнального пути RA, через день на протяжении периода, составляющего пять дней, чтобы индуцировать дифференцировку по меньшей мере некоторых Pdx1-позитивных панкреатических клеток-предшественников в популяции в NKX6-1-позитивные панкреатические клетки-предшественники, при этом NKX6-1-позитивные панкреатические клетки-предшественники экспрессируют Pdx1 и NKX6-1; с) дифференцировку по меньшей мере некоторых Pdx1-позитивных, NKX6-1-позитивных панкреатических клеток-предшественников в Pdx1-позитивные, NKX6-1-позитивные, инсулин-позитивные эндокринные клетки путем приведения Pdx1-позитивных, NKX6-1-позитивных панкреатических клеток-предшественников в условиях, которые стимулируют кластеризацию клеток, в контакт с i) ингибитором сигнального пути TGF-β, b) активатором сигнального пути ТН и, необязательно, с) по меньшей мере одним ингибитором пути SHH, ii) активатором сигнального пути RA, iii) ингибитором γ-секретазы и vi) по меньшей мере одним фактором роста из семейства эпидермальных факторов роста (EGF), через день на протяжении периода, составляющего пять-семь дней, чтобы индуцировать дифференцировку по меньшей мере некоторых Pdx1-позитивных, NKX6-1-позитивных панкреатических клеток-предшественников в Pdx1-позитивные, NKX6-1, инсулин-позитивные эндокринные клетки, при этом Pdx1-позитивные, NKX6-1, инсулин-позитивные эндокринные клетки экспрессируют Pdx1, NKX6-1, NKX2-2, Mafb, glis3, Sur1, Kir6.2, Znt8, SLC2A1, SLC2A3 и/или инсулин; и d) дифференцировку по меньшей мере некоторых Pdx1-позитивных, NKX6-1-позитивных, инсулин-позитивных эндокринных клеток в клетки SC-β путем приведения Pdx1-позитивных, NKX6-1-позитивных, инсулин-позитивных эндокринных клеток в условиях, которые стимулируют кластеризацию клеток, в контакт с i) ингибитором сигнального пути трансформирующего фактора роста β (TGF-β), ii) активатором сигнального пути тиреоидного гормона и, необязательно, iii) ингибитором протеинкиназы, через день на протяжении периода, составляющего от семи до 14 дней, чтобы индуцировать in vitro созревание по меньшей мере некоторых Pdx1-позитивных, NKX6-1-позитивных, инсулин-позитивных эндокринных клеток в клетки SC-β, при этом клетки SC-β демонстрируют ответ GSIS in vitro и/или in vivo.
[48] В некоторых вариантах реализации в изобретении предложен способ получения клеток SC-β из плюрипотентных клеток, включающий: а) дифференцировку по меньшей мере некоторых плюрипотентных клеток в популяции в Pdx1-позитивные панкреатические клетки-предшественники; b) дифференцировку по меньшей мере некоторых Pdx1-позитивных панкреатических клеток-предшественников в Pdx1-позитивные, NKX6-1-позитивные панкреатические клетки-предшественники путем приведения Pdx1-позитивных панкреатических клеток-предшественников в условиях, которые стимулируют кластеризацию клеток, в контакт с i) KGF, ii) Sant1 и, необязательно, iii) низкими концентрациями RA, через день на протяжении периода, составляющего пять дней, чтобы индуцировать дифференцировку по меньшей мере некоторых Pdx1-позитивных панкреатических клеток-предшественников в популяции в NKX6-1-позитивные панкреатические клетки-предшественники, при этом NKX6-1-позитивные панкреатические клетки-предшественники экспрессируют Pdx1 и NKX6-1; с) дифференцировку по меньшей мере некоторых Pdx1-позитивных, NKX6-1-позитивных панкреатических клеток-предшественников в Pdx1-позитивные, NKX6-1-позитивные, инсулин-позитивные эндокринные клетки путем приведения Pdx1-позитивных, NKX6-1-позитивных панкреатических клеток-предшественников в контакт c i) ингибитором II Alk5, ii) Т3 и, необязательно, iii) Sant1, iv) RA, v) XXI и vi) бетацеллюлином, через день на протяжении периода, составляющего пять-семь дней, чтобы индуцировать дифференцировку по меньшей мере некоторых Pdx1-позитивных, NKX6-1-позитивных панкреатических клеток-предшественников в Pdx1-позитивные, NKX6-1, инсулин-позитивные эндокринные клетки, при этом Pdx1-позитивные, NKX6-1, инсулин-позитивные эндокринные клетки экспрессируют Pdx1, NKX6-1, NKX2-2, Mafb, glis3, Sur1, Kir6.2, Znt8, SLC2A1, SLC2A3 и/или инсулин; и d) дифференцировку по меньшей мере некоторых Pdx1-позитивных, NKX6-1-позитивных, инсулин-позитивных эндокринных клеток в клетки SC-β путем приведения Pdx1-позитивных, NKX6-1-позитивных, инсулин-позитивных эндокринных клеток в условиях, которые стимулируют кластеризацию клеток, в контакт с i) ингибитором II Alk5, ii) Т3 и, необязательно, iii) стауроспорином, через день на протяжении периода, составляющего от семи до 14 дней, чтобы индуцировать in vitro созревание по меньшей мере некоторых Pdx1-позитивных, NKX6-1-позитивных, инсулин-позитивных эндокринных клеток в клетки SC-β, при этом клетки SC-β демонстрируют ответ GSIS in vitro и/или in vivo.
[49] В некоторых аспектах в изобретении предложен искусственный островок, содержащий клетки SC-β, дифференцированные in vitro из плюрипотентных стволовых клеток.
[50] В некоторых аспектах в изобретении предложена искусственная поджелудочная железа, содержащая клетки SC-β, дифференцированные in vitro из плюрипотентных стволовых клеток.
[51] При практической реализации настоящего изобретения, как правило, применяют, если не указано иное, традиционные методы клеточной биологии, клеточного культивирования, молекулярной биологии, трансгенной биологии, микробиологии, технологии рекомбинантных нуклеиновых кислот (например, ДНК), иммунологии и РНК-интерференции (РНКи), которые соответствуют данной области техники.
Неограничивающие описания конкретных методов можно найти в следующих публикациях: Ausubel, F., et al., (eds.), Current Protocols in Molecular Biology, Current Protocols in Immunology, Current Protocols in Protein Science и Current Protocols in Cell Biology, всеиздательства John Wiley & Sons, N.Y., декабрь, 2008; Sambrook, Russell, and Sambrook, Molecular Cloning: A Laboratory Manual, 3rd ed., Cold Spring Harbor Laboratory Press, Cold Spring Harbor, 2001; Harlow, E. and Lane, D., Antibodies - A Laboratory Manual, Cold Spring Harbor Laboratory Press, Cold Spring Harbor, 1988; Freshney, R.I., "Culture of Animal Cells, A Manual of Basic Technique", 5th ed., John Wiley & Sons, Hoboken, NJ, 2005.
Неограничивающую информацию в отношении терапевтических агентов и человеческих заболеваний можно найти в Goodman and Gilman's The Pharmacological Basis of Therapeutics, 11th Ed., McGraw Hill, 2005, Katzung, B. (ed.) Basic and Clinical Pharmacology, McGraw-Hill/Appleton & Lange; 10th ed. (2006) или 11th edition (July 2009). Неограничивающую информацию в отношении генов и генетических нарушений можно найти в McKusick, V.A.: Mendelian Inheritance in Man. A Catalog of Human Genes and Genetic Disorders. Baltimore: Johns Hopkins University Press, 1998 (12th edition) или более свежих он-лайн базах данных: Online Mendelian Inheritance in Man, OMIM™. McKusick-Nathans Institute of Genetic Medicine, Johns Hopkins University (Baltimore, MD) и National Center for Biotechnology Information, National Library of Medicine (Bethesda, MD), по состоянию на 1 мая 2010 г., World Wide Web URL: http://www.ncbi.nlm.nih.gov/omim/ ив Online Mendelian Inheritance in Animals (OMIA), базе данных по генам, наследственным нарушениям и характеристикам разных видов животных (отличных от людей и мышей), на http://omia.angis.org.au/contact.shtml. Все патенты, патентные публикации и другие публикации (например, научные статьи, книги, веб-страницы и базы данных), упоминаемые в данном документе, в полном объеме включены посредством ссылки. В случае наличия противоречий между описанием изобретения и включенными ссылками, приоритет имеет описание изобретения (включая любые его изменения, которые могут основываться на включенной ссылке). Если не указано иное, в данном документе используются стандартные, принятые в данной области техники значения терминов. В данном документе используются стандартные аббревиатуры для разных терминов.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
[52] Файл патента или заявки содержит по меньшей мере одно графическое изображение, выполненное в цвете. Копии этого патента или патентной заявки с цветными графическими материалами будут предоставлены патентным ведомством по запросу и после уплаты необходимого взноса.
[53] На ФИГ. 1А и 1В показано сравнение ранее опубликованного контрольного способа дифференцировки и нового способа управляемой дифференцировки. На ФИГ. 1А показана схема сравнения типового способа управляемой дифференцировки согласно изобретению для получения INS+ клеток из hPSC и ранее опубликованного контрольного способа дифференцировки. ФИГ. 1В иллюстрирует гистологические срезы недифференцированных HUES8 (вверху), дифференцировавших в DE (середина) и дифференцировавших в РР1 (внизу) и окрашенных ОСТ4, SOX17 и PDX1, соответственно, при применении ранее опубликованного контрольного способа дифференцировки. Масштабная метка = 100 мкм.
[54] ФИГ. 2А, 2В и 2С демонстрируют, что полученные из стволовых клеток β-клетки (SC-β), полученные in vitro, секретируют инсулин в ответ на многоразовую последовательную стимуляцию высокими концентрациями глюкозы, как первичные человеческие β-клетки. ФИГ. 2А, 2В и 2С представляют собой графики, иллюстрирующие полученные метом ELISA измерения человеческого инсулина, секретируемого из SC-β (ФИГ. 2А), первичных β-клеток (ФИГ. 2В) и клеток РН (ФИГ. 2С), которые последовательно стимулировали 2, 20, 2, 20, 2 и 20 мМ глюкозы. После последовательной стимуляции низкими/высокими концентрациями глюкозы клетки деполяризовали при помощи 30 мМ KCl.
[55] ФИГ. 3А, 3В и 3С демонстрируют дополнительные биологические реплики полученных in vitro клеток SC-β, которые секретируют инсулин в ответ на многоразовую последовательную стимуляцию высокими концентрациями глюкозы, как первичные β-клетки. Левые панели такие же, как на ФИГ. 2. Клетки SC-β (SC-β; ФИГ. 3А), первичные β-клетки (1° β; ФИГ. 3В) и клетки РН (ФИГ. 3С) последовательно стимулировали 2, 20, 2, 20, 2 и 20 мМ глюкозы и 30 мМ KCl, а уровень человеческого инсулина измеряли при помощи ELISA.
[56] ФИГ. 4А, 4В, 4С, 4D и 4Е демонстрируют наличие в клетках SC-β цитозольного потока Са2+ в ответ на многоразовую последовательную стимуляцию высокими концентрациями глюкозы, как в случае первичных β-клеток. ФИГ. 4А представляет собой схему, представляющую выявление цитозольного Са2+ на уровне популяции и уровне одиночной клетки при помощи окрашивания Fluo-4 AM. Измерения на уровне популяции проводили на отдельных цельных кластерах (обозначенных на схеме большим красным кругом), а индивидуальные клетки в пределах интактных кластеров (обозначенных маленькими красными кругами) анализировали методом анализа одиночных клеток. ФИГ. 4В представляет собой график, иллюстрирующий популяционные измерения динамической нормированной интенсивности флуоресценции Fluo-4 для клеток SC-β, первичных β-клеток и клеток РН, последовательно стимулируемых 2, 20, 2, 20, 2 и 20 мМ глюкозы и 30 мМ KCl. На ФИГ. 4С показаны флуоресцентные изображения, полученные при окрашивании Fluo-4 AM, применяемом для анализа одиночных клеток. На ФИГ. 4D показаны типовые изображения, на которых указано расположение одиночных клеток, которые демонстрировали ответ на 3 (желтый), 2 (оранжевый), 1 (синий) и 0 (красный) стимуляций глюкозой. На ФИГ. 4Е показан графический количественный анализ частоты появления клеток SC-β (n=156), первичных β-клеток (n=114) и клеток РН (n=138), которые демонстрировали ответ на 20 мМ глюкозы. Масштабная метка = 100 мкм.
[57] ФИГ. 5А, 5В, 5С, 5D, 5Е и 5F демонстрируют, что SC-β экспрессируют маркеры человеческих β-клеток на уровне белковой и генной экспрессии. На ФИГ. 5А показаны иммуногистохимические изображения клеток, окрашенных на С-пептид (зеленый), NKX6-1 (красный) и соматостатин (серый). На ФИГ. 5В показаны иммуногистохимические изображения клеток, окрашенных на С-пептид (зеленый) и PDX1 (красный). На ФИГ. 5С показаны иммуногистохимические изображения клеток, окрашенных на С-пептид (зеленый) и глюкагон (красный) соответствующим красителем DAPI (синий). На ФИГ. 5D показаны типовые точечные графики по данным проточной цитометрии и процентное соотношение клеток в популяции, окрашенных на С-пептид и NKX6-1. На ФИГ. 5Е показан иерархический кластерный анализ на основе всех генов, для которых проводили измерения при помощи микроматричного анализа недифференцированных HUES8, клеток РН, фетальных β-клеток и первичных взрослых β-клеток, отсортированных на основании INS (данные из Hrvatin et al. (Hrvatin et al., 2014)), и клеток SC-β (SC-β), отсортированных на основании INS и NKX6-1. На ФИГ. 5F показана теплокарта 100 генов, обладающих наибольшей изменчивостью среди всех образцов. CP = С-пептид, SST = соматостатин, GCG = глюкагон. Масштабная метка = 100 мкм.
[58] ФИГ. 6 иллюстрирует гистологию кластера клеток SC-β, окрашенных на DAPI (синий), инсулин (зеленый), С-пептид (красный). Масштабная метка = 100 мкм.
[59] ФИГ. 7А, 7В и 7С демонстрируют дополнительное гистологическое окрашивание клеток SC-β. ФИГ. 7А иллюстрирует окрашивание на С-пептида (зеленый) и ISL1 (красный). ФИГ. 7В иллюстрирует окрашивание на С-пептид (зеленый) и MAFA (красный). ФИГ. 7С иллюстрирует окрашивание на С-пептид (зеленый) и MAFB (красный). Масштабная метка = 100 мкм.
[60] На ФИГ. 8А, 8В и 8С показаны типовые точечные графики по данным проточной цитометрии и процентное соотношение клеток SC-β и клеток РН в популяции, окрашенных на С-пептид и SST (ФИГ. 8А), С-пептид и GCG (ФИГ. 8В) и SST и GCG (ФИГ. 8С).
[61] ФИГ. 9А, 9В и 9С демонстрируют, что гранулы SC-β клеток структурно сходны с гранулами первичных человеческих β-клеток. На ФИГ. 9А показаны полученные при помощи электронного микроскопа изображения гранул, на которых выделены типовые кристаллизованные гранулы инсулина (красный), ранние гранулы инсулина (желтый) и смешанные эндокринные гранулы (синий). Масштабная метка = 500 нм. На ФИГ. 9В показаны увеличенные изображения гранул, выделенных на (ФИГ. 9А). Масштабная метка = 500 нм. На ФИГ. 9С показаны полученные при помощи электронного микроскопа изображения клеток, меченых при помощи иммунологического окрашивания золотом, иллюстрирующие гранулы, которые содержат инсулин (менее крупные 5 нм черные точки) и/или глюкагон (более крупные 15 нм черные точки). Типовые частицы золота отмечены красными стрелками (инсулин) и синими стрелками (глюкагон). Масштабная метка = 100 нм.
[62] ФИГ. 10А и 10В демонстрируют, что полученные из стволовых клеток β-клетки (SC-β), полученные из hiPSC in vitro, секретируют инсулин в ответ на многоразовую последовательную стимуляцию высокими концентрациями глюкозы, как первичные человеческие β-клетки. ФИГ. 10А и 10В представляют собой графики, иллюстрирующие полученные метом ELISA измерения человеческого инсулина, секретируемого из SC-β, полученных из не диабетических клеток (ФИГ. 10А) и диабетических клеток 1 типа (ФИГ. 10В), последовательно стимулируемых 2, 20, 2, 20, 2 и 20 мМ глюкозы.
[63] На ФИГ. 11А, 11В, 11С, 11D, 11Е и 11F показаны типовые точечные графики по данным проточной цитометрии и процентное соотношение клеток, окрашенных на С-пептид и NKX6-1, из множественных линий hiPSC. На ФИГ. 11А, 11В и 11С показаны типовые точечные графики по данным проточной цитометрии и процентное соотношение клеток, окрашенных на С-пептид и NKX6-1, из недиабетических линий hiPSC. На ФИГ. 11D, 11Е и 11F показаны типовые точечные графики по данным проточной цитометрии и процентное соотношение клеток, окрашенных на С-пептид и NKX6-1, из диабетических линий hiPSC 1 типа.
[64] ФИГ. 12А, 12В, 12С и 12D демонстрируют, что трансплантированные клетки SC-β быстро начинают функционировать in vivo. ФИГ. 12А представляет собой график, иллюстрирующий полученные метом ELISA измерения человеческого инсулина из сыворотки крови отдельных мышей, которым трансплантировали клетки SC-β (культивируемые на протяжении 1 недели на конечном in vitro этапе), первичные человеческие β-клетки (1° β) или клетки РН. Измерения проводили до (белые столбики) и через 30 минут после (черные столбики) инъекции глюкозы мышам через две недели после трансплантации. На ФИГ. 12В показаны иммуногистохимические изображения трансплантированных клеток с (ФИГ. 12А), окрашенных на С-пептид (зеленый) и PDX1 (красный), для подтверждения наличия трансплантата. ФИГ. 12С представляет собой график, иллюстрирующий полученные метом ELISA измерения человеческого инсулина из сыворотки крови отдельных мышей, которым трансплантировали панкреатические клетки-предшественники. Измерения проводили до (белые столбики) и через 30 минут после (черные столбики) инъекции глюкозы мышам через две недели после трансплантации. ФИГ. 12D представляет собой график, иллюстрирующий полученные метом ELISA измерения человеческого инсулина из сыворотки крови отдельных мышей, которым трансплантировали клетки SC-β, культивируемые на протяжении 2 недель на конечном in vitro этапе. Измерения проводили через 30 минут после (черные столбики) инъекции глюкозы мышам через две недели после трансплантации, н/о = не определено Масштабная метка = 100 мкм.
[65] ФИГ. 13А и 13В иллюстрируют дополнительные гистологические срезы клеток SC-β и клеток РН, трансплантированных мышам за 2 недели. На ФИГ. 13А на небольшом увеличении показаны изображения трансплантатов, окрашенных на DAPI (синий), С-пептид (зеленый) и GCG (красный). Масштабная метка = 200 мкМ. На ФИГ. 13В на большем увеличении показаны изображения трансплантатов, окрашенных на С-пептид (зеленый) и GCG (красный). Масштабная метка = 100 мкМ.
[66] ФИГ. 14А, 14В и 14С демонстрируют применение сред на последнем этапе дифференцировки, чтобы дать возможность клеткам SC-β секретировать больше инсулина in vivo. На ФИГ. 14А показана схема, иллюстрирующая применение различных сред на различных этапах процесса дифференцировки. ФИГ. 14В иллюстрирует, что добавление дополнительных факторов, таких как Sant1, XXI и SSP, в среду CMRL на последнем этапе дифференцировки приводит к лучшему ответу клеток SC-β, состоящему в стимулированной глюкозой секреции инсулина (GSIS), согласно определению индекса стимуляции при стимуляции высокой и низкой концентрациями глюкозы. ФИГ. 14С иллюстрирует, что добавление дополнительных факторов, таких как Sant1, XXI и SSP, в среду CMRL на последнем этапе дифференцировки приводит к лучшему ответу клеток SC-β, состоящему в стимулированной глюкозой секреции инсулина (GSIS), согласно измерению количества высвобождаемого инсулина.
[67] ФИГ. 15А, 15В, 15С, 15D, 15Е, 15F, 15G, 15Н и 15I демонстрируют модификации протокола, которые могут повысить выживаемость и качество получаемых клеток SC-β. ФИГ. 15А представляет собой схематическую иллюстрацию протокола. ФИГ. 15В показывает, насколько больше чистых кластеров эндокринных клеток NKX6.1+ можно получить (ФИГ. 15В), применяя модифицированный протокол. ФИГ. 15С демонстрирует, как применение ингибитора Rock на этапах 3-5 может улучшить выживаемость клеток. ФИГ. 15D демонстрирует, как применение активина А вместе с никотинамидом может привести к понижающей регуляции SOX2 и улучшить выживаемость клеток. ФИГ. 15Е показывает, что SOX2 и NKX6-1 являются взаимоисключающими. ФИГ. 15F демонстрирует, как применение стауроспорина на этапе 6 позволяет генерировать практически чистую популяцию эндокринных клеток, а ФИГ. 15G демонстрирует, как применение стауроспорина на этапе 6 позволяет получить более высокое процентное содержание клеток NKX6-1/С-пептид+. ФИГ. 15I демонстрирует, как применение XXI в комбинации с Alk5i и Т3 на этапах 5-6 увеличивает популяцию NeuroD+ по сравнению с применением только Alk5i и Т3 (ФИГ. 15Н).
[68] ФИГ. 16А, 16В, 16С, 16D, 16Е, 16F, 16G, 16Н и 16I демонстрируют клиническое применение клеток SC-β в качестве терапии диабета или платформы по разработке новых лекарственных препаратов. ФИГ. 16А представляет собой схематическую иллюстрацию применения клеток SC-β для лечения диабета или скрининга лекарственных препаратов для улучшения функции или репликации. ФИГ. 16В представляет собой таблицу, в которой приведены исследуемые лекарства против диабета и их общая терапевтическая категория. ФИГ. 16С представляет собой график, иллюстрирующий полученные метом ELISA измерения человеческого инсулина из высеянных клеток SC-β, обработанных указанными лекарственными препаратами в 2 и 20 мМ глюкозы. Указанные p-величины позволяют сравнить значение уровня инсулина в 20 мМ глюкозы между лекарственным препаратом и контролем. ФИГ. 16D представляет собой иммунофлуоресцентное изображение диспергированных и высеянных клеток SC-β, окрашенных DAPI (синий), С-пептидом (зеленый) и Ki67 (красный), без обработки. ФИГ. 16Е представляет собой иммунофлуоресцентное изображение диспергированных и высеянных клеток SC-β, окрашенных DAPI (синий), С-пептидом (зеленый) и Ki67 (красный), обработанных пролактином на протяжении 48 часов. ФИГ. 16F показан графический количественный анализ доли клеток, которые коэкспрессируют С-пептид и Ki67. *р<0,05. ФИГ. 16G представляет собой график, иллюстрирующий измерения уровня глюкозы в крови натощак для мышей Акиты, которым трансплантировали клетки SC-β (n=6) или клетки РН (n=6). *р<0,05 при сравнении двух групп клеток в один день. ФИГ. 16Н представляет собой график, иллюстрирующий измерения уровня глюкозы в крови у мышей Акиты с прогрессирующим диабетом, которым трансплантировали клетки SC-β или клетки РН. Измерения проводили до (белые столбики) и через 20 минут после (черные столбики) инъекции глюкозы мышам через 2 недели после трансплантации. Насыщение при измерениях уровня глюкозы наблюдали при 550 мг/дл. *р<0,05 при сравнении двух групп клеток в одно и то же время после инъекции глюкозы. ФИГ. 16I представляет собой график, иллюстрирующий полученные метом ELISA измерения человеческого инсулина из сыворотки мышей Акиты через 20 минут после инъекции глюкозы. Мышей стимулировали глюкозой через 2 недели после трансплантации. *р<0,05 при сравнении двух групп клеток. Масштабная метка = 50 мкм.
[69] ФИГ. 17 представляет собой график, иллюстрирующий массу тела мышей Акиты, которым трансплантировали клетки SC-β (n=6) или клетки РН (n=6). *р<0,05 при сравнении двух групп клеток во временную точку, соответствующую 18 и 28 дням.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
[70] Аспекты изобретения относятся к композициям, способам, наборам и агентам для генерации полученных из стволовых клеток β-клеток (SC-β) (например, зрелых панкреатических β-клеток) по меньшей мере из одной инсулин-позитивной эндокринной клетки или ее предшественника (например, клеток iPS, hESC, клеток дефинитивной энтодермы, клеток подзародышевой полости, Pdx1-позитивных панкреатических клеток-предшественников, Pdx1-позитивных, NKX6-1-позитивных панкреатических клеток-предшественников, Ngn3-позитивных эндокринных клеток-предшественников и т.д.), а также к клеткам SC-β, полученным при помощи этих композиций, способов, наборов и агентов, для применения в клеточной терапии, методах анализа (например, скрининге лекарственных препаратов) и разных способах лечения.
[71] Кроме того, аспекты изобретения относятся к способам идентификации клеток SC-β, которые выявляются на основании морфологических критериев без необходимости в применении селектируемого маркера, а также функциональных характеристик, таких как способность экспрессировать инсулин, секретировать инсулин в ответ на одну или более стимуляций глюкозой, демонстрировать зрелый ответ GSIS и образовывать островки в ткани поджелудочной железы in vivo, и, как правило, содержат небольшие веретеноподобные клетки диаметром около 9-15 мкм.
[72] Кроме того, аспекты изобретения относятся к способам выявления факторов созревания β-клеток. Для специалиста в данной области техники очевидно или не трудно при помощи известных в данной области техники методов анализа проверить, является ли конкретный фактор созревания β-клеток функциональным. Например, способность фактора созревания β-клеток преобразовывать по меньшей мере одну инсулин-позитивную эндокринную клетку или ее предшественника в клетку SC-β можно оценить при помощи описанных в данном документе методов анализа. Другие удобные методы анализа включают определение способности активировать транскрипцию репортерной конструкции, содержащей сайт связывания β-клеточного маркера, функционально связанный с нуклеотидной последовательностью, кодирующей выявляемый маркер, такой как люцифераза. Один из методов анализа включает определение того, индуцирует ли кандидатный фактор созревания β-клеток превращение по меньшей мере одной инсулин-позитивоной эндокринной клетки в клетку SC-β, или экспрессию β-клеточных маркеров, или проявление функциональных характеристик зрелой β-клетки, как описано в данном документе. Определение экспрессии β-клеточных маркеров можно проводить при помощи любого подходящего метода, например, иммуноблоттинга. Такие методы анализа можно легко адаптировать, чтобы выявить или подтвердить наличие активности агентов, которые напрямую преобразуют по меньшей мере одну инсулин-позитивную эндокринную клетку или ее предшественника в клетку SC-β.
[73] In vitro-созревшие клетки SC-β (т.е. панкреатические β-клетки), полученные в соответствии с описанными в данном документе способами изобретения, демонстрируют большое количество преимуществ, например, они осуществляют стимулированную глюкозой секрецию инсулина in vitro, сходны по генной экспрессии и ультраструктуре с человеческими островковыми β-клетками, секретируют человеческий инсулин и облегчают гипергликемию при трансплантации мышам, представляют новую платформу для клеточной терапии (например, трансплантации в организм нуждающегося в этом субъекта дополнительных и/или функциональных β-клеток), скрининга лекарственных препаратов (например, для выработки/секреции инсулина, выживаемости, дифференцировки и т.д.), исследований (например, определения разницы между функционированием нормальных и диабетических β-клеток) и тканевой инженерии (например, применения клеток SC-β в качестве первого типа клеток при реконструкции островка).
[74] ОПРЕДЕЛЕНИЯ
[75] Для удобства ниже собраны отдельные термины, употребляемые в данном документе - в описании изобретения, примерах и прилагаемой формуле изобретения. Если не указано иное, все употребляемые в данном документе технические и научные термины имеют значения, которые обычно подразумеваются специалистом в данной области техники, к которой относится данное изобретение.
[76] Термин «дифференцированная клетка», согласно определению этого термина в данном документе, означает любую первичную клетку, которая в своей нативной форме не является плюрипотентной. Согласно другому определению, термин «дифференцированная клетка» относится к клетке более специализированного типа, полученной из клетки менее специализированного типа (например, стволовой клетки, такой как индуцированная плюрипотентная стволовая клетка) в процессе клеточной дифференцировки. Не ограничиваясь теорией, можно сказать, что в ходе нормального онтогенеза плюрипотентная стволовая клетка может дифференцироваться сначала в энтодермальную клетку, которая способна формировать клетки поджелудочной железы и другие типы клеток энтодермы. Дальнейшая дифференцировка энтодермальных клеток приводит к запуску панкреатического пути, при этом ~98% клеток становятся экзокринными, дуктулярными или матричными клетками, а ~2% становятся эндокринными клетками. Ранние эндокринные клетки являются предшественниками островков, которые затем могут дифференцироваться в инсулин-вырабатывающие клетки (например, функциональные эндокринные клетки), которые секретируют инсулин, глюкагон, соматостатин или панкреатический полипептид. Энтодермальные клетки также могут дифференцироваться в другие клетки энтодермального происхождения, например, клетки легких, печение, кишечника, вилочковой железы и т.д.
[77] Употребляемый в данном документе термин «соматическая клетка» относится к любым клеткам, формирующим тело организма, в отличие от клеток зародышевой линии. В случае млекопитающих клетками зародышевой линии (также известным как «гаметы») являются сперматозоиды и яйцеклетки, которые сливаются во время оплодотворения, образуя клетку, называемую зиготой, из которой развивается весь эмбрион млекопитающего. Клетки любого другого типа в организме млекопитающего за исключением сперматозоидов и яйцеклеток, клеток, из которых они образуются (гаметоцитов) и недифференцированных стволовых клеток являются соматическими клетками: внутренние органы, кожа, кости, кровь и соединительная ткань состоят из соматических клеток. В некоторых вариантах реализации изобретения соматическая клетка является «неэмбриональной соматической клеткой», под которой подразумевается соматическая клетка, которая не присутствует в эмбрионе или не получена из эмбриона, и не является результатом пролиферации такой клетки in vitro. В некоторых вариантах реализации изобретения соматическая клетка является «соматической клеткой взрослого организма», под которой подразумевается соматическая клетка, которая присутствует в организме или получена из организма, отличного от эмбриона или зародыша, или является результатом пролиферации такой клетки in vitro. Если не указано иное, способы преобразования по меньшей мере одной инсулин-позитивной эндокринной клетки или ее предшественника в инсулин-вырабатывающую, глюкозочувствительную клетку могут быть осуществлены как in vivo, так и in vitro (при этом in vivo способы практикуют, когда по меньшей мере одна инсулин-позитивная эндокринная клетка или ее предшественник присутствует в организме субъекта, a in vitro способы практикуют, используя по меньшей мере одну выделенную инсулин-позитивную эндокринную клетки или ее предшественника, содержащуюся в культуре).
[78] Употребляемый в данном документе термин «взрослая клетка» относится к клетке, которую можно обнаружить в организме после эмбрионального развития.
[79] Употребляемый в данном документе термин «энтодермальная клетка» относится к клетке из одного из трех первичных слоев зародышевых клеток на очень ранней эмбриональной стадии (другими двумя слоями зародышевых клеток являются мезодерма и эктодерма). Энтодерма является наиболее глубоким слоем из трех. Энтодерма может дифференцироваться сначала в первичную кишечную трубку эмбриона, а затем в выстилку дыхательного и пищеварительного трактов (например, кишечника), печень и поджелудочную железу.
[80] Употребляемый в данном документе термин «клетка энтодермального происхождения» относится к любой клетке, которая развилась или дифференцировалась из энтодермальной клетки. Например, клетка энтодермального происхождения включает клетки печени, легких, поджелудочной железы, вилочковой железы, кишечника, желудка и щитовидной железы. Не ограничиваясь теорией, клетки-предшественники печени и поджелудочной железы (также называемые панкреатическими клетками-предшественниками) развиваются из клеток энтодермы в зародышевой передней кишке. Вскоре после спецификации клетки-предшественники печени и поджелудочной железы быстро приобретают существенно отличающиеся клеточные функции и регенеративные способности. Эти изменения вызваны индуктивными сигналами и генетическими регуляторными факторами, которые среди позвоночных являются высококонсервативными. Заинтересованности в развитии и регенерации органов способствовала острая необходимость в гепатоцитах и панкреатических β-клетках при терапевтическом лечении печеночной недостаточности и диабета I типа. Исследования, проводимые на различных модельных организмах и на людях, позволили обнаружить эволюционно консервативные индуктивные сигналы и системы транскрипционных факторов, которые приводят к дифференцировке клеток печени и поджелудочной железы и служат руководством для стимуляции дифференцировки гепатоцитов и β-клеток из различных типов стволовых клеток и клеток-предшественников.
[81] Употребляемый в данном документе термин «дефинитивная энтодерма» относится к клетке, дифференцировавшейся из энтодермальной клетки, которая может дифференцироваться в клетку SC-β (например, панкреатическую β-клетку). Клетка дефинитивной энтодермы экспрессирует маркер Sox17. Другие маркеры, характерные для клеток дефинитивной энтодермы, включают, но не ограничиваются этим, MIXL2, GATA4, HNF3b, GSC, FGF17, VWF, CALCR, FOXQ1, CXCR4, церберус, ОТХ2, гузекоид, C-Kit, CD99, CMKOR1 и CRIP1. В частности, клетки дефинитивной энтодермы, описанные в данном документе, экспрессируют Sox17 и, в некоторых вариантах реализации изобретения, Sox17 и HNF3B, и не экспрессируют GATA4, SPARC, APF или DAB на значительном уровне. Клетки дефинитивной энтодермы не являются позитивными в отношении маркера Pdx1 (например, они являются Pdx1-негативными). Клетки дефинитивной энтодермы обладают способностью дифференцироваться в клетки, включая клетки печени, легких, поджелудочной железы, вилочковой железы, кишечника, желудка и щитовидной железы. Экспрессию Sox17 и других маркеров дефинитивной энтодермы можно оценить любым известным специалисту в данной области техники способом, таким как иммунохимия, например, при помощи анти-Sox17 антитела, или количественная ОТ-ПЦР.
[82] Термин «панкреатическая энтодерма» относится к клетке энтодермального происхождения, которая способна дифференцироваться во множественные панкреатические линии, включая панкреатические β-клетки, но уже не может дифференцироваться в не панкреатические линии.
[83] Употребляемый в данном документе термин «клетка первичной кишечной трубки» или «клетка кишечной трубки» относится к клетке, дифференцированной из энтодермальной клетки, которая может дифференцироваться в клетку SC-β (например, панкреатическую β-клетку). Клетка первичной кишечной трубки экспрессирует по меньшей мере один из следующих маркеров: HNF1-β, HNF3-β или HNF4-α. Клетки первичной кишечной трубки обладают способностью дифференцироваться в клетки, включая клетки легких, печени, поджелудочной железы, желудка и кишечника. Экспрессию HNF1-β и других маркеров первичной кишечной трубки можно оценить любым известным специалисту в данной области техники способом, таким как иммунохимия, например при помощи анти-HNF1-β антитела.
[84] Термины «панкреатическая клетка-предшественник», «панкреатическая эндокринная клетка-предшественник», «панкреатический предшественник» или «панкреатический эндокринный предшественник» взаимозаменяемо употребляются в данном документе и относятся к стволовой клетке, которая способна стать экспрессирующей панкреатические гормоны клеткой, способной формировать панкреатические эндокринные клетки, панкреатические экзокринные клетки или панкреатические дуктальные клетки. Эти клетки предназначены для дифференцировки по меньшей мере в один тип панкреатических клеток, например, бета-клетки, которые вырабатывают инсулин; альфа-клетки, которые вырабатывают глюкагон; дельта-клетки (или D-клетки), которые вырабатывают соматостатин; и/или F-клетки, которые вырабатывают панкреатический полипептид. Такие клетки экспрессируют по меньшей мере один из следующих маркеров: NGN3, NKX2.2, NeuroD, ISL-1, Рах4, Рах6 или ARX.
[85] Употребляемый в данном документе термин «pdx1-позитивная панкреатическая клетка-предшественник» относится к клетке, которая является клеткой панкреатической энтодермы (ПЭ), которая может дифференцироваться в клетки SC-β, такие как панкреатические β-клетки. Pdx1-позитивная панкреатическая клетка-предшественник экспрессирует маркер Pdx1. Другие маркеры включают, но не ограничиваются этим, Cdcp1 или Ptf1a, или HNF6, или NRx2.2. Экспрессию Pdx1 можно оценить любым известным специалисту в данной области техники способом, таким как иммунохимия с применением анти-Pdx1 антитела или количественная ОТ-ПЦР.
[86] Употребляемый в данном документе термин «pdx1-позитивная, NKX6-1-позитивная панкреатическая клетка-предшественник» относится к клетке, которая является клеткой панкреатической энтодермы (ПЭ), которая может дифференцироваться в инсулин-вырабатывающие клетки, такие как панкреатические β-клетки. pdx1-позитивная, NKX6-1-позитивная панкреатическая клетка-предшественник экспрессирует маркеры Pdx1 NKX6-1. Другие маркеры включают, но не ограничиваются этим, Cdcp1 или Ptf1a, или HNF6, или NRx2.2. Экспрессию NKX6-1 можно оценить любым известным специалисту в данной области техники способом, таким как иммунохимия с применением анти-NKX6-1 антитела или количественная ОТ-ПЦР.
[87] Употребляемый в данном документе термин «Ngn3-позитивная эндокринная клетка-предшественник» относится к предшественникам панкреатических эндокринных клеток, экспрессирующим транскрипционный фактор нейрогенин-3 (Ngn3). Клетки-предшественники являются более дифференцированными, чем мультипотентные стволовые клетки, и могут дифференцироваться только в небольшое количество типов клеток. В частности, Ngn3-позитивные эндокринные клетки-предшественники обладают способностью дифференцироваться в пять типов панкреатических эндокринных клеток (α, β, δ, ε и РР). Экспрессию Ngn3 можно оценить любым известным специалисту в данной области техники способом, таким как иммунохимия с применением анти-Ngn3 антитела или количественная ОТ-ПЦР.
[88] Термины «NeuroD» и «NeuroD1» взаимозаменяемо употребляются в данном документе и обозначают белок, экспрессируемый в панкреатических эндокринных клетках-предшественниках, и кодирующий его ген.
[89] Термины «инсулин-позитивная β-подобная клетка» и «инсулин-позитивная эндокринная клетка» относятся к клетке (например, панкреатической эндокринной клетке), которая демонстрирует по меньшей мере один маркер, характерный для панкреатической β-клетки, а также экспрессирует инсулин но не демонстрирует характерный для эндогенной β-клетки ответ GSIS.
[90] Термин «ее предшественник», употребляемый в отношении инсулин-позитивной эндокринной клетки, относится к любой клетке, которая способна дифференцироваться в инсулин-позитивную эндокринную клетку, включая, например, плюрипотентную стволовую клетку, клетку дефинитивной энтодермы, клетку первичной кишечной трубки, панкреатическую клетку-предшественник или эндокринную клетку-предшественник, при культивировании в условиях, подходящих для дифференцировки клетки-предшественника в инсулин-позитивную эндокринную клетку.
[91] Термины «полученная из стволовой клетки β-клетка», «клетка SC-β», «функциональная β-клетка», «функциональная панкреатическая β-клетка» и «зрелая клетка SC-β» относятся к клетками (например, панкреатическим β-клеткам), которые демонстрируют по меньшей мере один маркер, характерный для панкреатической β-клетки (например, PDX-1 или NKX6-1), экспрессируют инсулин и демонстрируют характерный для эндогенной зрелой β-клетки ответ GSIS. В некоторых вариантах реализации изобретения «клетка SC-β» включает зрелые панкреатические β-клетки. Следует понимать, что клетки SC-β не обязательно должны быть получены (например, напрямую) из стволовых клеток, так как способы согласно изобретению дают возможность получать клетки SC-β из любой инсулин-позитивной эндокринной клетки или ее предшественника, используя в качестве исходного материала любую клетку (например, можно использовать эмбриональные стволовые клетки, индуцированные плюрипотентные стволовые клетки, клетки-предшественники, частично перепрограммированные соматические клетки (например, соматическую клетку, которая была перепрограммирована до промежуточного состояния между индуцированной плюрипотентной стволовой клеткой и соматической клеткой, из которой она была получена), мультипотентные клетки, тотипотентные клетки, трансдифференцированные версии любых из вышеуказанных клеток и т.д., так как изобретение не ограничено в этом смысле). В некоторых вариантах реализации изобретения клетки SC-β демонстрируют ответ на многократную стимуляцию глюкозой (например, по меньшей мере одну, по меньшей мере две или по меньшей мере три или более последовательные стимуляции глюкозой). В некоторых вариантах реализации изобретения ответ имеет сходство с ответом эндогенных островков (например, человеческих островков) на многократную стимуляцию глюкозой. В некоторых вариантах реализации изобретения морфология клетки SC-β имеет сходство с морфологией эндогенной β-клетки. В некоторых вариантах реализации изобретения клетка SC-β демонстрирует in vitro ответ GSIS, который имеет сходство с ответом GSIS эндогенной β-клетки. В некоторых вариантах реализации изобретения клетка SC-β демонстрирует in vivo ответ GSIS, который имеет сходство с ответом GSIS эндогенной β-клетки. В некоторых вариантах реализации изобретения клетка SC-β демонстрирует как in vitro, так и in vivo ответ GSIS, который имеет сходство с ответом GSIS эндогенной β-клетки. Ответ GSIS клетки SC-β можно наблюдать в течение двух недель после трансплантации клетки SC-β в организм хозяина (например, человека или животного). В некоторых вариантах реализации изобретения инсулин в клетках SC-β пакуется в секреторные гранулы. В некоторых вариантах реализации изобретения в клетках SC-β наблюдаются инкапсулированные кристаллические гранулы инсулина. В некоторых вариантах реализации изобретения клетки SC-β имеют индекс стимуляции, превышающий 1. В некоторых вариантах реализации изобретения клетки SC-β имеют индекс стимуляции, превышающий 1,1. В некоторых вариантах реализации изобретения клетки SC-β имеют индекс стимуляции, превышающий 2. В некоторых вариантах реализации изобретения клетки SC-β демонстрируют цитокин-индуцированный апоптоз в ответ на цитокины. В некоторых вариантах реализации изобретения секреция инсулина из клеток SC-β повышается в ответ на известные противодиабетические лекарственные препараты (например, стимуляторы секреции). В некоторых вариантах реализации изобретения клетки SC-β являются моногормональными. В некоторых вариантах реализации изобретения клетки SC-β не характеризуются аномальной коэкспрессией других гормонов, таких как глюкагон, соматостатин или панкреатический полипептид. В некоторых вариантах реализации изобретения клетки SC-β демонстрируют низкий коэффициент репликации. В некоторых вариантах реализации изобретения в клетках SC-β повышается внутриклеточный Са2+ в ответ на глюкозу. Употребляемый в данном документе термин «экзокринная клетка» относится к клетке экзокринной железы, т.е. железы, секреция которой осуществляется через проток. В конкретных вариантах реализации изобретения экзокринные клетки относятся к панкреатической экзокринной клетке, которая является панкреатической клеткой, которая вырабатывает ферменты, которые секретируются в тонкий кишечник. Эти ферменты помогают расщеплять пищу, когда она проходит через желудочно-кишечный тракт. Панкреатические экзокринные клетки также известны как островки Лангерганса, которые секретируют два гормона - инсулин и глюкагон. Панкреатическая экзокринная клетка может относиться к одному из нескольких типов: клетки альфа-2 (которые вырабатывают гормон глюкагон); или β-клетки (которые вырабатывают гормон инсулин); и клетки альфа-1 (которые вырабатывают регуляторный агент соматостатин). В контексте данного документа не вырабатывающие инсулин экзокринные клетки относятся к клетками альфа-2 или клеткам альфа-1. Следует отметить, что термин «панкреатические экзокринные клетки» включает в себя «панкреатические эндокринные клетки», которые относятся к панкреатической клетке, которая вырабатывает гормоны (например, инсулин (вырабатываемый β-клетками), глюкагон (вырабатываемый клетками альфа-2), соматостатин (вырабатываемый дельта-клетками) и панкреатический полипептид (вырабатываемый F-клетками), которые секретируются в кровоток.
[92] В контексте данного документа термин «инсулин-вырабатывающая клетка» относится к клетке, дифференцированной из панкреатической клетки-предшественника, или ее предшественнику, который секретирует инсулин. Инсулин-вырабатывающая клетка, в контексте описанного в данном документе термина, включает панкреатические β-клетки, а также панкреатические β-подобные клетки (например, инсулин-позитивные эндокринные клетки), которые синтезируют (т.е. транскрибируют ген инсулина, транслируют мРНК проинсулина и модифицируют мРНК проинсулина в белок инсулина), экспрессируют (т.е. проявляют фенотипический признак, который несет ген инсулина) или секретируют (высвобождают инсулин во внеклеточное пространство) инсулин постоянным или индуцибельным образом. Популяцию инсулин-вырабатывающих клеток, например, полученных в ходе дифференцировки инсулин-позитивных эндокринных клеток или их предшественников в клетки SC-β в соответствии со способами настоящего изобретения, могут составлять панкреатические β-клетки или β-подобные клетки (например, клетки, которые обладают по меньшей мере одной или по меньшей мере двумя характеристиками эндогенной β-клетки и демонстрируют ответ GSIS, сходный с ответом эндогенной взрослой β-клетки). Новизна представленных композиций и способов не нивелируется наличием в популяции клеток, которые вырабатывают инсулин естественным путем (например, β-клеток). Также предполагается, что популяция инсулин-вырабатывающих клеток, например, полученных раскрытыми в данном документе способами, может содержать зрелые панкреатические β-клетки или клетки SC-β, а также может содержать не вырабатывающие инсулин клетки (т.е. клетки с фенотипом, подобным β-клеткам за исключением того, что они не вырабатывают или не секретируют инсулин).
[93] Употребляемые в данном документе термины «эндогенная β-клетка», «эндогенная зрелая панкреатическая β-клетка» или «эндогенная панкреатическая β-клетка» относятся к инсулин-вырабатывающей клетке поджелудочной железы или клетке, обладающей фенотипом панкреатической β-клетки (β-клетки). Фенотип панкреатической β-клетки хорошо известен специалистам в данной области техники и включает, например, секрецию инсулина в ответ на повышение уровня глюкозы, экспрессию маркеров, таких как с-пептид, полипептид Pdx1 и Glut 2, а также четкие морфологические характеристики, такие как образование островков в поджелудочной железе in vivo, и, как правило, включает небольшие веретеноподобные клетки диаметром около 9-15 мкм.
[94] Употребляемые в данном документе термины «клетка SC-β», «панкреатическая β-подобная клетка» и «зрелая панкреатическая β-подобная клетка» относятся к клеткам, полученным раскрытыми в данном документе способами, которые экспрессируют по меньшей мере 15% количества инсулина, экспрессируемого эндогенной панкреатической β-клеткой, или по меньшей мере около 20%, или по меньшей мере около 30%, или по меньшей мере около 40%, или по меньшей мере около 50%, или по меньшей мере около 60%, или по меньшей мере около 70%, или по меньшей мере около 80%, или по меньшей мере около 90%, или по меньшей мере около 100%, или более 100%, например, по меньшей мере около 1,5-кратное, или по меньшей мере около 2-кратное, или по меньшей мере около 2,5-кратное, или по меньшей мере около 3-кратное, или по меньшей мере около 4-кратное, или по меньшей мере около 5-кратное, или более чем 5-кратное количество инсулина, секретируемого эндогенной панкреатической β-клеткой, или, в альтернативном варианте, демонстрируют по меньшей мере одну или по меньшей мере две характеристики эндогенной панкреатической β-клетки, например, без ограничений, секрецию инсулина в ответ на глюкозу и экспрессию маркеров β-клеток, таких как, например, с-пептид, Pdx1 и glut-2. В одном варианте реализации изобретения клетка SC-β не является иммортализованной клеткой (например, пролиферирует в культуре в течение неопределенного времени). В одном варианте реализации изобретения клетка SC-β не является трансформированной клеткой, например, клеткой, которая демонстрирует трансформационные свойства, такие как рост в мягком агаре или отсутствие контактного торможения.
[95] Термин «маркер β-клеток» относится, без ограничений, к белкам, пептидам, нуклеиновым кислотам, полиморфизму белков и нуклеиновых кислот, сплайс-вариантам, фрагментам белков или нуклеиновых кислот, элементам и другим аналитам, которые специфически экспрессируются или присутствуют в панкреатических β-клетках. Типовые маркеры β-клеток включают, но не ограничиваются этим, полипептид панкреатического и дуоденального гомеобокса 1 (Pdx1), инсулин, с-пептид, амилин, Е-кадгерин, Hnf3β, PCI/3, В2, Nkx2.2, NKX6-1, GLUT2, РС2, ZnT-8, Isll, Рах6, Рах4, NeuroD, Hnflb, Hnf-6, Hnf-3beta θ MafA, 
 β Zhang et al., Diabetes. 50 (10): 2231-6 (2001). В
β Zhang et al., Diabetes. 50 (10): 2231-6 (2001). В 
 β-клеток представляет собой ядерный маркер β-клеток. В некоторых вариантах реализации изобретения маркер β-клеток представляет собой Pdx1 или РН3.
β-клеток представляет собой ядерный маркер β-клеток. В некоторых вариантах реализации изобретения маркер β-клеток представляет собой Pdx1 или РН3.
[96] Термин «панкреатический эндокринный маркер» относится, без ограничений, к белкам, пептидам, нуклеиновым кислотам, полиморфизму белков и нуклеиновых кислот, сплайс-вариантам, фрагментам белков или нуклеиновых кислот, элементам и другим аналитам, которые специфически экспрессируются или присутствуют в панкреатических эндокринных клетках. Типовые маркеры панкреатических эндокринных клеток включают, но не ограничиваются этим, Ngn-3, NeuroD и Islet-1.
[97] Употребляемый в данном документе термин «не вырабатывающая инсулин клетка» означает любую клетку энтодермального происхождения, которая естественным путем не синтезирует, не экспрессирует или не секретирует инсулин постоянно или после индукции. Таким образом, в употребляемый в данном документе термин «не вырабатывающие инсулин клетки» не входят панкреатические β-клетки. Примеры не вырабатывающих инсулин клеток, которые можно использовать в способах согласно настоящему изобретению, включают панкреатические клетки, отличные от β-клеток, такие как вырабатывающие амилазу клетки, ацинарные клетки, клетки из клеточных линий дуктальной аденокарциномы (например, клетки CD18, CD11 и Capan-I (смотрите Busik et al., 1997; Schaffert et al. 1997). Также можно использовать непанкреатические клетки энтодермального происхождения, например, непанкреатические стволовые клетки других эндокринных или экзокринных органов, включая, например, клетки печени, клетки вилочковой железы, клетки щитовидной железы, клетки кишечника, клетки легких и клетки гипофиза. В некоторых вариантах реализации изобретения не вырабатывающие инсулин энтодермальные клетки могут быть клетками млекопитающих или, более конкретно, клетками человека. В данном документе приведены примеры осуществления предложенного способа с применением панкреатических неостровковых клеток млекопитающих, панкреатических вырабатывающих амилазу клеток млекопитающих, панкреатических ацинарных клеток млекопитающих.
[98] Термин «фенотип» относится к одной или некоторому количеству общих биологических характеристик, которые свойственны клетке или организму под воздействием определенных внешних условий и факторов вне зависимости от фактического генотипа.
[99] Употребляемый в данном документе термин «плюрипотентный» относится к клетке, обладающей способностью в разных условиях дифференцироваться в более чем один дифференцированный тип клеток и предпочтительно дифференцироваться в типы клеток, характерные для всех трех зародышевых слоев клеток. Плюрипотентные клетки характеризуются главным образом своей способностью дифференцироваться в более чем один тип клеток, предпочтительно в клетки всех трех зародышевых слоев, например, при применении метода анализа формирования тератомы у бестимусных мышей. О плюрипотентности также свидетельствует экспрессия маркеров эмбриональных стволовых (ES) клеток, хотя предпочтительным признаком плюрипотентности является демонстрация способности дифференцироваться в клетки каждого из трех зародышевых слоев. Следует отметить, что самого по себе культивирования таких клеток недостаточно, чтобы определить их плюрипотентность. Перепрограммированные плюрипотентные клетки (например, в контексте определения этого термина в данном документе, клетки iPS) также обладают характерной способностью к продленному пассированию без утраты способности к росту по сравнению с исходными родительскими клетками, которые в общем случае обладают способностью к ограниченному количеству делений в культуре.
[100] Употребляемые в данном документе термины «клетка iPS» и «индуцированная плюрипотентная стволовая клетка» используются взаимозаменяемо и относятся к плюрипотентной стволовой клетке, искусственно полученной (например, путем индукции или полного обращения) из неплюрипотентной клетки, как правило, соматической клетки взрослого организма, например, путем индукции усиленной экспрессии одного или более генов.
[101] Термины «клетка-предшественник» или «предшественник» употребляются в данном документе взаимозаменяемо и относятся к клеткам, имеющим клеточный фенотип, который является более примитивным (т.е. относится к более раннему этапу развития или прогресса, чем полностью дифференцированная клетка) по сравнению с клетками, которые могут получиться из них в процессе дифференцировки. Часто клетки-предшественники обладают значительным или очень высоким пролиферативным потенциалом. Из клеток-предшественников может развиться большое количество различных типов дифференцированных клеток или один тип дифференцированных клеток в зависимости от пути развития и от окружающей среды, в которой развиваются и дифференцируются клетки.
[102] Употребляемый в данном документе термин «стволовая клетка» относится к недифференцированной клетке, способной пролиферировать и развиваться в новые клетки-предшественники, обладающие способностью генерировать большое количество материнских клеток, которые в свою очередь могут развиваться в дифференцированные или дифференцируемые дочерние клетки. Сами дочерние клетки могут быть индуцированы, чтобы пролиферировать и давать потомство, которое впоследствии дифференцируется в один или более зрелых типов клеток, при этом сохраняется одна или более клеток со способностью к развитию как у родительских клеток. Термин «стволовая клетка» относится к подгруппе клеток-предшественников, которые обладают возможностью или способностью при определенных обстоятельствах дифференцироваться в более специализированный или дифференцированный фенотип и которые при определенных обстоятельствах сохраняют способность пролиферировать без какой-либо значительной дифференцировки. В одном варианте реализации изобретения термин стволовая клетка в общем случае относится к материнской клетке природного происхождения, чьи потомки (потомство) специализируются, часто в разных направлениях, путем дифференцировки, например, приобретая полностью индивидуальные признаки, как это происходит во время прогрессирующей диверсификации эмбриональных клеток и тканей. Клеточная дифференцировка является сложным процессом, как правило, занимающим большое количество этапов деления клеток. Дифференцированная клетка может быть получена из мультипотентной клетки, которая в свою очередь получена из мультипотентной клетки, и т.д. Хотя любые из этих мультипотентных клеток могут считаться стволовыми клетками, диапазон типов клеток, которые могут развиться из каждой из них, может существенно варьироваться. Некоторые дифференцированные клетки также обладают способностью развиваться в клетки с большей способностью к развитию. Такая способность может быть природной или может быть индуцирована искусственно обработкой разными факторами. Во многих биологических системах стволовые клетки являются также «мультипотентными», так как они могут дать потомство, принадлежащее более чем одному типу клеток, хотя это не является необходимым условием для «стволовой клетки». Самообновление представляет другую классическую часть определения стволовых клеток и является важным в контексте данного документа. Согласно теории, самообновление может происходить по любому из двух механизмов. Стволовые клетки могут делиться ассиметрично, при этом одна дочерняя клетка остается стволовой, а другая дочерняя клетка экспрессирует какую-либо отличную специфическую функцию и фенотип. В альтернативном варианте некоторые из стволовых клеток в популяции могут делиться симметрично в два этапа, таким образом, в целом в популяции сохраняется некоторое количество стволовых клеток, при этом другие клетки в популяции дают исключительно дифференцированное потомство. Формально, возможна ситуация, в которой клетки, которые изначально были стволовыми клетками, могут развиться до дифференцированного фенотипа, но потом «реверсировать» и снова экспрессировать фенотип стволовых клеток; это явление специалисты в данной области техники часто называют «дедифференцировкой» или «перепрограммированием», или «ретродифференцировкой». Употребляемый в данном документе термин «плюрипотентная стволовая клетка» включает эмбриональные стволовые клетки, индуцированные плюрипотентные стволовые клетки, плацентарные стволовые клетки и т.д.
[103] В контексте клеточного онтогенеза прилагательное «дифференцированный» или «дифференцирующийся» является относительным понятием, обозначающим «дифференцированную клетку» - клетку, которая осуществила больший прогресс на пути развития, чем клетка, с которой ее сравнивают. Таким образом, стволовые клетки могут дифференцироваться в линейно-специфические клетки-предшественники (такие как мезодермальные стволовые клетки), которые в свою очередь могут в процессе развития дифференцироваться в другие типы клеток-предшественников (такие как предшественники кардиомиоцитов), а затем в конечную дифференцированную клетку, которая играет характерную роль в определенном типе ткани и может сохранять или не сохранять способность к дальнейшей пролиферации.
[104] Термин «эмбриональная стволовая клетка» используют для обозначения плюрипотентных стволовых клеток внутренней клеточной массы эмбриональной бластоцисты (смотрите патенты США №5843780, 6200806). Такие клетки можно получить из внутренней клеточной массы бластоцист, полученных при переносе ядра соматической клетки (смотрите, например, патенты США №5945577, 5994619, 6235970). Отличительные характеристики эмбриональной стволовой клетки определяют фенотип эмбриональной стволовой клетки. Соответственно, клетка имеет фенотип эмбриональной стволовой клетки, если она обладает одной или более уникальными характеристиками эмбриональной стволовой клетки настолько, чтобы клетку можно было отличить от других клеток. Типовые отличительные характеристики эмбриональной стволовой клетки включают, без ограничений, профиль генной экспрессии, способность к пролиферации, способность к дифференцировке, кариотип, восприимчивость к конкретным условиям культивирования и тому подобное.
[105] Термин «взрослая стволовая клетка» или «ASC» («adult stem cell») используют для обозначения любой мультипотентной стволовой клетки, полученной из неэмбриональной ткани, включая фетальную, ювенильную и ткань взрослого организма. Стволовые клетки выделяли из большого количества тканей взрослого организма, включая кровь, костный мозг, головной мозг, обонятельный эпителий, кожу, щитовидную железу, скелетные мышцы и сердечные мышцы. Любые из этих стволовых клеток можно охарактеризовать на основании генной экспрессии, восприимчивости к факторам и морфологии в культуре. Типовые взрослые стволовые клетки включают нейральные стволовые клетки, стволовые клетки нейрального гребня, мезенхимальные стволовые клетки, гематопоэтические стволовые клетки и панкреатические стволовые клетки. Как указано выше, стволовые клетки были обнаружены практически во всех тканях. Соответственно, в настоящем изобретении предполагается, что популяции стволовых клеток могут быть выделены практически из любой животной ткани.
[106] Термин «поджелудочная железа» относится к железистому органу, который секретирует пищеварительные ферменты и гормоны. У людей поджелудочная железа представляет собой желтоватый орган около 7 дюймов (17,8 см) в длину и 1,5 дюймов (3,8 см) в ширину. Она расположена под желудком и соединена с тонким кишечником - мускулистой трубкоподобной частью желудочно-кишечного тракта, простирающейся от нижнего окончания желудка (привратника) до анального отверстия. Большая часть ткани поджелудочной железы состоит из гроздевидных кластеров клеток, которые вырабатывают прозрачную жидкость (поджелудочный сок), который поступает в двенадцатиперстную кишку через общий проток вместе с желчью из печени. Поджелудочный сок содержит три пищеварительных фермента: триптазу, амилазу и липазу, которые вместе с ферментами кишечника завершают расщепление, соответственно, белков, углеводов и жиров. Среди вырабатывающих ферменты клеток поджелудочной железы рассеяны небольшие группы эндокринных клеток, называемые островками Лангерганса, которые секретируют два гормона - инсулин и глюкагон. Панкреатические островки содержат несколько типов клеток: клетки альфа-2, которые вырабатывают гормон глюкагон; β-клетки (также называемые в данном документе "панкреатическими β-клетками»), которые вырабатывают гормон инсулин; и клетки альфа-1, которые вырабатывают регуляторный агент соматостатин. Эти гормоны секретируются непосредственно в кровоток и вместе они регулируют уровень глюкозы в крови. Инсулин снижает уровень сахара в крови и повышает количество гликогена (формы запасания углеводов) в печени; глюкагон оказывает противоположное действие. Неспособность секретирующих инсулин клеток функционировать должным образом приводит к диабету или сахарному диабету.
[107] Употребляемый в данном документе термин «перепрограммирование» относится к процессу, который изменяет или обращает состояние дифференцировки соматической клетки. Перед перепрограммированием клетка может быть частично или полностью дифференцирована. Перепрограммирование включает полное обращение состояния дифференцировки соматической клетки в плюрипотентную клетку. Такое полное обращение дифференцировки приводит к получению индуцированной плюрипотентной (iPS) клетки. В контексте данного документа перепрограммирование также включает частичное обращение состояния дифференцировки клеток, например, в мультипотентное состояние или в соматическую клетку, которая не является ни плюрипотентной, ни мультипотентной, но представляет собой клетку, которая утратила одну или более специфических характеристик дифференцированной клетки, из которой она была получена, например, в случае прямого перепрограммирования дифференцированной клетки в отличный тип соматической клетки. В общем случае перепрограммирование включает изменение, например, обращение, по меньшей мере некоторых наследуемых особенностей нуклеотидной модификации (например, метилирования), конденсации хроматина, эпигенетических изменений, геномного импринтинга и т.д., которые происходят во время клеточной дифференцировки, когда зигота развивается во взрослый организм.
[108] Употребляемый в данном документе термин «агент» обозначает любое соединение или вещество, такое как, без ограничений, небольшая молекула, нуклеиновая кислота, полипептид, пептид, лекарственный препарат, ион и т.д. «Агент» может представлять собой любое химическое вещество, соединение или компонент, включая, без ограничений, синтетические и природные белковые и небелковые соединения. В некоторых вариантах реализации изобретения агент представляет собой нуклеиновую кислоту, аналоги нуклеиновой кислоты, белки, антитела, пептиды, аптамеры, олигомеры нуклеиновых кислот, аминокислоты или углеводы, включая, без ограничений, белки, олигонуклеотиды, рибозимы, ДНК-ферменты, гликопротеины, мшРНК, липопротеины, аптамеры, а также их модификации и комбинации и т.д. В определенных вариантах реализации изобретения агенты представляют собой небольшие молекулы, содержащие химический компонент. Например, химические компоненты включают незамещенные или замещенные алкильные, ароматические или гетероциклические соединения, включая макролиды, лептомицины и близкие к ним природные продукты и аналоги. Может быть известно, что соединения обладают желаемой активностью и/или свойствами, или их можно выбрать из библиотеки различных соединений.
[109] Употребляемый в данном документе термин «приведение в контакт» (т.е. приведение по меньшей мере одной инсулин-позитивной эндокринной клетки или ее предшественника в контакт с фактором созревания β-клеток или комбинацией факторов созревания β-клеток) включает в себя совместную in vitro инкубацию фактора созревания β-клеток и клетки (например, добавление факторов созревания β-клеток к клеткам в культуре). В некоторых вариантах реализации изобретения термин «приведение в контакт» не включает в себя in vivo воздействие на клетки соединений, как описано в данном документе, которое может возникать в организме субъекта естественным путем (т.е. воздействие, которое может возникать в результате естественного физиологического процесса). Этап приведения по меньшей мере одной инсулин-позитивной эндокринной клетки или ее предшественника в контакт с фактором созревания β-клеток, как описано в вариантах реализации изобретения, связанных с получением клеток SC-β, можно проводить любым подходящим способом. Например, можно проводить обработку клеток в адгезивной культуре или в суспензионной культуре. В некоторых вариантах реализации изобретения клетки обрабатывают в условиях, которые стимулируют кластеризацию клеток. В изобретении предусмотрены любые условия, которые стимулируют кластеризацию клеток. Примеры условий, которые стимулируют кластеризацию клеток, включают, без ограничений, суспензионную культуру в планшетах для тканевого культивирования с низкой адгезией, роллерных флаконах, планшетах AggreWell. В некоторых вариантах реализации изобретения авторы изобретения наблюдали, что кластеры оставались стабильными в средах, содержащих 10% сыворотку. В некоторых вариантах реализации изобретения условия, которые стимулируют кластеризацию клеток, включают среду с низким содержанием сыворотки.
[110] Следует понимать, что клетки, которые приводят в контакт с фактором созревания β-клеток, также можно одновременно или последовательно приводить в контакт с другим агентом, таким как фактор роста или другим дифференцировочным агентом или средами для стабилизации клеток или для дополнительной дифференцировки клеток.
[111] Аналогично, по меньшей мере одну инсулин-позитивную эндокринную клетку или ее предшественника можно привести в контакт по меньшей мере с одним фактором созревания β-клеток, а затем привести в контакт по меньшей мере с другим фактором созревания β-клеток. В некоторых вариантах реализации изобретения клетку приводят в контакт по меньшей мере с одним фактором созревания β-клеток, при этом приведение в контакт разделено во времени, а в некоторых вариантах реализации изобретения клетку приводят в контакт по меньшей мере с одним фактором созревания β-клеток практически одновременно. В некоторых вариантах реализации изобретения клетку приводят в контакт по меньшей мере с двумя, по меньшей мере с тремя, по меньшей мере с четырьмя, по меньшей мере с пятью, по меньшей мере с шестью, по меньшей мере с семью, по меньшей мере с восемью, по меньшей мере с девятью или по меньшей мере с 10 факторами созревания β-клеток.
[112] В контексте данного документе термин «клеточная культуральная среда» (также называемая в данном документе «культуральной средой» или «средой») - это среда для культивирования клеток, содержащая питательные вещества, которые поддерживают жизнеспособность клеток и способствуют пролиферации. Клеточная культуральная среда может содержать любые из следующих компонентов в подходящей комбинации: соль(и), буфер(ы), аминокислоты, глюкозу или другой(ие) сахар(а), антибиотики, сыворотку или заменитель сыворотки, а также другие компоненты, такие как факторы роста пептидов и т.д. Клеточные культуральные среды, традиционно применяемые для конкретных типов клеток, известны специалистам в данной области техники.
[113] Термин «клеточная линия» относится к популяции большей частью или практически идентичных клеток, которые, как правило, были получены из одной родительской клетки или из определенной и/или практически идентичной популяции родительских клеток. Клеточная линия могла находиться или ее можно содержать в культуре на протяжении продленного периода времени (например, месяцев, лет или неограниченного периода времени). Она могла подвергаться спонтанному или индуцированному процессу трансформации, следствием которого стала неограниченная продолжительность жизни клеток в культуре. Клеточные линии включают все известные в данной области техники клеточные линии. Следует понимать, что со временем клетки накапливают мутации и возможные эпигенетические изменения, вследствие чего по меньшей мере некоторые свойства отдельных клеток клеточной линии могут отличаться по сравнению друг с другом. В некоторых вариантах реализации изобретения клеточная линия содержит описанную в данном документе клетку SC-β.
[114] Термин «экзогенный» относится к веществу, присутствующему в клетке или организме, отличном от его нативного источника. Например, термины «экзогенная нуклеиновая кислота» или «экзогенный белок» относятся к нуклеиновой кислоте или белку, которые были внесены посредством осуществляемого человеком процесса в биологическую систему, такую как клетка или организм, в которой они обычно не присутствуют или в которой они присутствуют в меньших количествах. Вещество считается экзогенным, если оно внесено в клетку или предшественника клетки, которая наследует это вещество. Термин «эндогенный», напротив, относится к веществу, которое является нативным для биологической системы.
[115] Термин «экспрессия» относится к клеточным процессам, связанным с выработкой РНК и белков и, в зависимости от ситуации, секрецией белков, включая при необходимости, но не ограничиваясь этим, например, транскрипцию, трансляцию, сворачивание, модификацию и процессинг.«Продукты экспрессии» включают РНК, транскрибированную с гена, и полипептиды, полученные посредством трансляции мРНК, транскрибированной с гена.
[116] Употребляемые в данном документе термины «генетически модифицированная» или «сконструированная» клетка относятся к клетке, в которую посредством осуществляемого человеком процесса была внесена экзогенная нуклеиновая кислота (или потомству такой клетки, которое унаследовало по меньшей мере часть этой нуклеиновой кислоты). Нуклеиновая кислота может, например, содержать последовательность, которая является экзогенной для клетки, она может содержать нативные последовательности (т.е. последовательности, которые можно обнаружить в клетках в их естественном состоянии), но в порядке, который не является естественным (например, когда кодирующая область связана с промотором другого гена), или измененные версии нативных последовательностей и т.д. Процесс переноса нуклеиновой кислоты в клетку может быть осуществлен любым подходящим способом. Подходящие способы включают опосредуемую фосфатом кальция или липидами трансфекцию, электропорацию и трансдукцию или инфекцию вирусным вектором. В некоторых вариантах реализации изобретения в геном клетки интегрирован полинуклеотид или его часть. Нуклеиновая кислота может впоследствии быть удалена или исключена из генома, при условии, что такое удаление или исключение приводит к выявляемому изменению в клетке по сравнению с немодифицированной, но в остальном эквивалентной клеткой. Следует понимать, что термин генетически модифицированный включает внесение модифицированной РНК непосредственно в клетку (например, синтетической модифицированной РНК). Такие синтетические модифицированные РНК включают модификации, которые позволяют предотвратить быстрое разрушение эндо- и экзонуклеазами и избежать или снизить клеточный естественный иммунный или интерфероновый ответ на РНК. Модификации включают, но не ограничиваются этим, например, (а) концевые модификации, например, модификации 5' конца (фосфорилирование, дефосфорилирование, конъюгацию, инвертированные связи и т.д.), модификации 3' конца (конъюгацию, ДНК-нуклеотиды, инвертированные связи и т.д.), (b) модификации оснований, например, замещение модифицированными основаниями, стабилизирующими основаниями, дестабилизирующими основаниями или основаниями, которые способны к спариванию с расширенным набором партнеров, или конъюгированными основаниями, (с) модификации Сахаров (например, в позиции 2' или в позиции 4') или замещение сахара, а также (d) модификации межнуклеозидных связей, включая модификацию или замещение фосфодиэфирных связей. В случае, когда такие модификации препятствуют трансляции (т.е. приводят к снижению трансляции на 50% или более чем в случае отсутствия модификации, например, согласно данным анализа in vitro трансляции кроличьих ретикулоцитов), такая модификация не подходит для применения в описанных в данном документе способах и композициях. В некоторых вариантах реализации изобретения клетка SC-β является генетически модифицированной так, чтобы экспрессировать нейрогенин 3. В некоторых вариантах реализации изобретения генетическая модификация клетки SC-β включает внесение синтетической модифицированной мРНК, кодирующей нейрогенин 3. Считается, что генетическая модификация клеток SC-β синтетической модифицированной мРНК, кодирующей нейрогенин 3, повышает выработку инсулина из клеток. Ожидается, что такая генетическая модификация любой вырабатывающей инсулин клетки будет повышать выработку инсулина в этой клетке.
[117] В некоторых аспектах в изобретении предложена клетка SC-β, генетически модифицированная так, чтобы содержать выявляемый маркер в локусе инсулина. В некоторых вариантах реализации изобретения клетка SC-β модифицирована так, чтобы оба аллеля в локусе инсулина были замещены выявляемым маркером. В некоторых вариантах реализации изобретения клетка SC-β генетически модифицирована так, чтобы выявляемый маркер был вставлен в локус инсулина и экспрессировался вместе с инсулином в клетке SC-β в ответ на стимуляцию глюкозой. В некоторых вариантах реализации изобретения клетка SC-β генетически модифицирована так, чтобы выявляемый маркер был вставлен в локус инсулина вместо инсулина и экспрессировался вместо инсулина в клетке SC-β в ответ на стимуляцию глюкозой. Предполагается, что в локус инсулина может быть вставлен любой выявляемый маркер, включая, например, нуклеиновую кислоту, кодирующую флуоресцентный белок (например, ЗФБ). Специалистам в данной области техники понятно, что такие генетически модифицированные клетки SC-β можно применять в различных методах скрининга, например, для выявления агентов, которые стимулируют экспрессию и/или секрецию инсулина из β-клеток, путем анализа выявляемого маркера в ответ на агент. Например, клетку SC-β генетически модифицированную так, чтобы ген инсулина был замещен (например, ЗФБ) в обоих аллелях, можно привести в контакт с исследуемым агентом, и те агенты, которые приводят к флуоресценции клеток SC-β вследствие экспрессии ЗФБ, можно считать кандидатными агентами, которые способны активировать экспрессию гена инсулина в β-клетках. Другими словами, выявляемый маркер можно использовать как суррогатный маркер экспрессии инсулина в таких генетически модифицированных клетках SC-β.
[118] Употребляемый в данном документе термин «идентичность» относится к степени сходства последовательностей из двух или более нуклеиновых кислот или полипептидов. Процент идентичности между представляющей интерес последовательностью и второй последовательностью в окне оценки, например, на протяжении представляющей интерес последовательности, можно оценить путем выравнивания последовательностей, определения количества остатков (нуклеотидов или аминокислот) в пределах окна сравнения, которые находятся напротив идентичного остатка, разрешая при этом внесение гэпов, чтобы максимизировать идентичность, деления на общее количество остатков в представляющей интерес последовательности или во второй последовательности (в зависимости от того, какая из них длиннее), попадающее в окно сравнения, и умножения на 100. При расчете количества идентичных остатков, необходимых для достижения конкретного процента идентичности, дробные числа следует округлять до ближайшего целого числа. Процент идентичности можно рассчитать при помощи большого количества известных в данной области техники компьютерных программ. Например, такие компьютерные программы как BLAST2, BLASTN, BLASTP, Gapped BLAST и т.д., создают выравнивания и подсчитывают процент идентичности между представляющими интерес последовательностями. Алгоритм Karlin and Altschul (Karlin and Altschul, Proc. Natl. Acad. Sci. USA 87:22264-2268, 1990), модифицированный согласно Karlin and Altschul, Proc. Natl. Acad. ScL USA 90:5873-5877, 1993, входит в программы NBLAST и XBLAST, разработанные Altschul et al. (Altschul, et al., J. MoT Biol. 215:403-410, 1990). Чтобы получить выравнивания, содержащие в целях сравнения гэпы, используют Gapped BLAST, описанную Altschul et al. (Altschul, et al. Nucleic Acids Res. 25: 3389-3402, 1997). При использовании программ BLAST и Gapped BLAST можно применять параметры по умолчанию соответствующих программ. Можно использовать матрицу РАМ250 или BLOSUM62. Программное обеспечения для проведения анализа BLAST находится в открытом доступе Национального центра биотехнологической информации (NCBI). Для ознакомления с этими программами, смотрите веб-сайт с URL-адресом: «ncbi.nlm nih.gov». В конкретном варианте реализации изобретения процент идентичности рассчитывают, используя BLAST2 с параметрами по умолчанию, предоставляемыми NCBI.
[119] Употребляемый в данном документе термин «выделенный» или «частично очищенный» в случае нуклеиновой кислоты или полипептида относится к нуклеиновой кислоте или полипептиду, отделенным по меньшей мере от одного из других компонентов (например, нуклеиновой кислоты или полипептида), которые присутствуют вместе с нуклеиновой кислотой или полипептидом в природном источнике и/или которые присутствовали бы вместе с нуклеиновой кислотой или полипептидом в случае экспрессии клеткой или секретировались в случае секретируемых полипептидов. Химически синтезированные нуклеиновая кислота или полипептид или синтезированные посредством in vitro транскрипции/трансляции считаются «выделенными».
[120] Употребляемый в данном документе термин «выделенная клетка» относится к клетке, которая была удалена из организма, в котором она изначально находилась, или к потомству этой клетки. Необязательно, клетку культивировали in vitro, например, в присутствии других клеток. Необязательно, позже клетку вносят во второй организм или повторно вносят в организм, из которого она (или клетка, чьим потомством она является) была выделена.
[121] Термин «выделенная популяция», употребляемый в данном документе в отношении выделенной популяции клеток, относится к популяции клеток, которая была удалена из и отделена от смешанной гетерогенной популяции клеток. В некоторых вариантах реализации изобретения выделенная популяция является в значительной степени очищенной популяцией клеток по сравнению с гетерогенной популяцией, из которой клетки были выделены или обогащены.
[122] Термин «в значительной степени чистый», употребляемый в отношении конкретной клеточной популяции, относится к популяции клеток, которая является по меньшей мере на около 75%, предпочтительно по меньшей мере на около 85%, более предпочтительно по меньшей мере на около 90% и наиболее предпочтительно по меньшей мере на около 95% чистой по сравнению с клетками, составляющими общую популяцию клеток. Тогда термины «в значительной степени чистый» или «преимущественно очищенный», употребляемые в отношении популяции клеток SC-β, относятся к популяции клеток, которая содержит менее чем около 20%, более предпочтительно менее чем около 15%, 10%, 8%, 7%, наиболее предпочтительно менее чем около 5%, 4%, 3%, 2%, 1% или менее 1% клеток, которые не являются клетками SC-β, согласно трактовке этих терминов в данном документе. В некоторых вариантах реализации в настоящее изобретение включены способы расширения популяции клеток SC-β, при этом расширенная популяция клеток SC-β является в значительной степени чистой популяцией клеток SC-β.
[123] Аналогично, термины «в значительной степени чистый» или «преимущественно очищенный», употребляемые в отношении популяции инсулин-позитивных эндокринных клеток, относятся к популяции клеток, которая содержит менее чем около 20%, более предпочтительно менее чем около 15%, 10%, 8%, 7%, наиболее предпочтительно менее чем около 5%, 4%, 3%, 2%, 1% или менее 1% клеток, которые не являются инсулин-позитивными эндокринными клетками, согласно трактовке этих терминов в данном документе. В некоторых вариантах реализации в настоящее изобретение включены способы расширения популяции инсулин-позитивных эндокринных клеток, при этом расширенная популяция инсулин-позитивных эндокринных клеток является в значительной степени чистой популяцией инсулин-позитивных эндокринных клеток.
[124] Аналогично, термины «в значительной степени чистый» или «преимущественно очищенный», употребляемые в отношении популяции Ngn3-позитивных эндокринных клеток-предшественников, относятся к популяции клеток, которая содержит менее чем около 20%, более предпочтительно менее чем около 15%, 10%, 8%, 7%, наиболее предпочтительно менее чем около 5%, 4%, 3%, 2%, 1% или менее 1% клеток, которые не являются Ngn3-позитивными эндокринными клетками-предшественниками или их потомством, согласно трактовке этих терминов в данном документе. В некоторых вариантах реализации в настоящее изобретение включены способы расширения популяции Ngn3-позитивных эндокринных клеток-предшественников, при этом расширенная популяция Ngn3-позитивных эндокринных клеток-предшественников является в значительной степени чистой популяцией Ngn3-позитивных эндокринных клеток-предшественников.
[125] Аналогично, термины «в значительной степени чистый» или «преимущественно очищенный», употребляемые в отношении популяции Pdx1-позитивных, NKX6-1-позитивных панкреатических клеток-предшественников, относятся к популяции клеток, которая содержит менее чем около 20%, более предпочтительно менее чем около 15%, 10%, 8%, 7%, наиболее предпочтительно менее чем около 5%, 4%, 3%, 2%, 1% или менее 1% клеток, которые не являются Pdx1-позитивными, NKX6-1-позитивными панкреатическими клетками-предшественниками или их потомством, согласно трактовке этих терминов в данном документе. В некоторых вариантах реализации в настоящее изобретение включены способы расширения популяции Pdx1-позитивных, NKX6-1-позитивных панкреатических клеток-предшественников, при этом расширенная популяция Pdx1-позитивных, NKX6-1-позитивных панкреатических клеток-предшественников является в значительной степени чистой популяцией Pdx1-позитивных, NKX6-1-позитивных панкреатических клеток-предшественников.
[126] Аналогично, термины «в значительной степени чистый» или «преимущественно очищенный», употребляемые в отношении популяции Pdx1-позитивных панкреатических клеток-предшественников, относятся к популяции клеток, которая содержит менее чем около 20%, более предпочтительно менее чем около 15%, 10%, 8%, 7%, наиболее предпочтительно менее чем около 5%, 4%, 3%, 2%, 1% или менее 1% клеток, которые не являются Pdx1-позитивными панкреатическими клетками-предшественниками или их потомством, согласно трактовке этих терминов в данном документе. В некоторых вариантах реализации в настоящее изобретение включены способы расширения популяции Pdx1-позитивных панкреатических клеток-предшественников, при этом расширенная популяция Pdx1-позитивных панкреатических клеток-предшественников является в значительной степени чистой популяцией Pdx1-позитивных панкреатических клеток-предшественников.
[127] Аналогично, термины «в значительной степени чистый» или «преимущественно очищенный», употребляемые в отношении популяции клеток первичной кишечной трубки, относятся к популяции клеток, которая содержит менее чем около 20%, более предпочтительно менее чем около 15%, 10%, 8%, 7%, наиболее предпочтительно менее чем около 5%, 4%, 3%, 2%, 1% или менее 1% клеток, которые не являются клетками первичной кишечной трубки или их потомством, согласно трактовке этих терминов в данном документе. В некоторых вариантах реализации в настоящее изобретение включены способы расширения популяции клеток первичной кишечной трубки, при этом расширенная популяция клеток первичной кишечной трубки является в значительной степени чистой популяцией клеток первичной кишечной трубки.
[128] Аналогично, термины «в значительной степени чистый» или «преимущественно очищенный», употребляемые в отношении популяции клеток дефинитивной энтодермы, относятся к популяции клеток, которая содержит менее чем около 20%, более предпочтительно менее чем около 15%, 10%, 8%, 7%, наиболее предпочтительно менее чем около 5%, 4%, 3%, 2%, 1% или менее 1% клеток, которые не являются клетками дефинитивной энтодермы или их потомством, согласно трактовке этих терминов в данном документе. В некоторых вариантах реализации в настоящее изобретение включены способы расширения популяции клеток дефинитивной энтодермы, при этом расширенная популяция клеток дефинитивной энтодермы является в значительной степени чистой популяцией клеток дефинитивной энтодермы.
[129] Аналогично, термины «в значительной степени чистый» или «преимущественно очищенный», употребляемые в отношении популяции плюрипотентных клеток, относятся к популяции клеток, которая содержит менее чем около 20%, более предпочтительно менее чем около 15%, 10%, 8%, 7%, наиболее предпочтительно менее чем около 5%, 4%, 3%, 2%, 1% или менее 1% клеток, которые не являются плюрипотентными клетками или их потомством, согласно трактовке этих терминов в данном документе. В некоторых вариантах реализации в настоящее изобретение включены способы расширения популяции плюрипотентных клеток, при этом расширенная популяция плюрипотентных клеток является в значительной степени чистой популяцией плюрипотентных клеток.
[130] Термины «обогащающий» или «обогащенный» взаимозаменяемо употребляются в данном документе и означают, что выход (часть) клеток одного типа увеличивается по меньшей мере на 10% по сравнению с частью клеток этого типа в стартовой культуре или препарате.
[131] Термины «обновление» или «самообновление», или «пролиферация» взаимозаменяемо употребляются в данном документе и относятся к способности стволовых клеток обновляться путем деления на такие же неспециализированные типы клеток на протяжении длительного периода времени и/или от многих месяцев до лет. В некоторых случаях пролиферация относится к увеличению числа клеток путем повторных делений единичных клеток на две идентичные дочерние клетки.
[132] Употребляемый в данном документе термин «линии дифференцировки» описывает клетки общего происхождения или клетки с общим путем развития. Например, в контексте клетки, которая имеет энтодермальное происхождение или принадлежит «энтодермальной линии дифференцировки», это означает, что клетка была получена из клетки энтодермы и может дифференцироваться согласно пути, ограниченному энтодермальной линией дифференцировки, например, согласно одному или более путям развития линии дифференцировки, которые дают начало клеткам дефинитивной энтодермы, которые, в свою очередь, могут дифференцироваться в клетки печени, вилочковой железы, поджелудочной железы, легких и кишечника.
[133] Употребляемый в данном документе термин «ксеногенный» относится к клетками, полученным от разных видов.
[134] Употребляемый в данном документе термин «маркер» используется для описания характеристик и/или фенотипа клетки. Маркеры можно использовать для селекции клеток, обладающих представляющими интерес характеристиками. Маркеры зависят от конкретных клеток. Маркеры являются характеристиками, как морфологическими, функциональными или биохимическими (ферментативными) характеристиками клетки конкретного типа, так и молекул, которые экспрессирует этот тип клеток. Предпочтительно такие маркеры являются белками и более предпочтительно содержат эпитопы для антител или другие связывающие молекулы, известные в данной области техники. При этом маркер может содержать любую молекулу, которую можно обнаружить в клетке, включая, но не ограничиваясь этим, белки (пептиды и полипептиды), липиды, полисахариды, нуклеиновые кислоты и стероиды. Примеры морфологических характеристик или признаков включают, но не ограничиваются этим, форму, размер и соотношение между ядром и цитоплазмой. Примеры функциональных характеристик или признаков включают, но не ограничиваются этим, способность связываться с конкретными субстратами, способность включать в свой состав или исключать конкретные красители, способность к миграции в конкретных условиях и способность дифференцироваться согласно конкретным линиям дифференцировки. Маркеры можно выявлять любыми известными специалисту в данной области техники способами. Также маркерами может являться отсутствие какой-либо морфологической характеристики или отсутствие белков, липидов и т.д. Маркеры могут представлять собой панель уникальных характеристик, соответствующих наличию или отсутствию полипептидов, и других морфологических характеристик.
[135] Термин «модулировать» употребляется в соответствии со своим значением, принятым в данной области техники, т.е. означает вызывать или способствовать качественному или количественному изменению, преобразованию или модификации в представляющем интерес процессе, пути или явлении. Без ограничений, таким изменением может быть повышение, снижение или изменение относительной силы или активности разных компонентов или направлений процесса, пути или явления. «Модулятор» представляет собой агент, который вызывает или способствует качественному или количественному изменению, преобразованию или модификации в представляющем интерес процессе, пути или явлении.
[136] Употребляемый в данном документе термин «ДНК» означает дезоксирибонуклеиновую кислоту.
[137] Термин «полинуклеотид» взаимозаменяемо употребляется в данном документе с термином «нуклеиновая кислота» и обозначает полимер из нуклеозидов. Как правило, полинуклеотид согласно данному изобретению состоит из нуклеозидов, которые можно обнаружить в ДНК или РНК в их естественном состоянии (например, аденозин, тимидин, гуанозин, цитидин, уридин, дезоксиаденозин, дезокситимидин, дезоксигуанозин и дезоксицитидин), соединенных фосфодиэфирными связями. При этом указанный термин также включает молекулы, содержащие нуклеозиды или аналоги нуклеозидов, содержащие химически или биологически модифицированные основания, модифицированные скелеты и т.д., в не зависимости от того, можно ли их обнаружить в нуклеиновых кислотах природного происхождения, и такие молекулы могут быть предпочтительными в определенных применениях. В случае упоминания в данной заявке полинуклеотида, следует понимать, что подразумевается как ДНК, так и РНК, и, в каждом случае, как одно-, так и двухцепочечная форма (а также комплементарные молекулы одноцепочечных молекул). В контексте данного документа «полинуклеотидная последовательность» может относиться к самому полинуклеотидному материалу и/или к информации о последовательности (т.е. порядку букв, применяемых в качестве аббревиатур оснований), которая биохимически характеризует конкретную нуклеиновую кислоту. Представленная в данном документе полинуклеотидная последовательность представлена в направлении от 5' до 3', если не указано иное.
[138] Употребляемый в данном документе термин «полипептид» относится к полимеру из аминокислот. Термины «белок» и «полипептид» взаимозаменяемо употребляются в данном документе. Пептид представляет собой относительно короткий полипептид, как правило, длиной от 2 до 60 аминокислот. Полипептиды в контексте данного документа, как правило, содержат аминокислоты, такие как 20 L-аминокислот, которые наиболее часто входят в состав белков. При этом можно использовать другие известные в данной области техники аминокислоты и/или аналоги аминокислот. Одна или более аминокислот в полипептиде могут быть модифицированы, например, путем добавления химического компонента, такого как углеводная группа, фосфатная группа, группа жирной кислоты или линкер для конъюгации, функционализации и т.д. Полипептид, который содержит ковалентно или нековалентно связанный с ним неполипептидный компонент, считается «полипептидом». Типовые модификации включают гликозилирование и пальмитоилирование. Полипептиды могут быть выделены из природных источников, получены при помощи технологии рекомбинантных ДНК, синтезированы химическим путем, таким как традиционный твердофазный пептидный синтез, и т.д. Употребляемый в данном документе термин «полипептидная последовательность» или «аминокислотная последовательность» может относиться к самому полипептидному материалу и/или к информации о последовательности (т.е. порядку букв или трехбуквенных кодов, применяемых в качестве аббревиатур названий аминокислот), которая биохимически характеризует полипептид. Представленная в данном документе полипептидная последовательность представлена в направлении от N-конца до С-конца, если не указано иное.
[139] Термин «вариант», употребляемый по отношению к полипептиду, может представлять собой, например, полипептид, по меньшей мере на 80%, 85%, 90%, 95%, 98% или 99% идентичен полноразмерному полипептиду. Вариант может быть фрагментом полноразмерного полипептида. Вариант может быть сплайс-вариантом природного происхождения. Вариант может быть полипептидом, по меньшей мере на 80%, 85%, 90%, 95%, 98% или 99% идентичным фрагменту полипептида, при этом длина фрагмента составляет по меньшей мере 50%, 60%, 70%, 80%, 85%, 90%, 95%, 98% или 99% полной длины полипептида дикого типа, или его доменом, обладающим представляющей интерес активностью, такой как способность выявлять присутствие клетки SC-β или инсулин-позитивной эндокринной клетки или ее предшественника, из которой была получена клетка SC-β. В некоторых вариантах реализации изобретения длина домена составляет по меньшей мере 100, 200, 300 или 400 аминокислот, начиная с любой аминокислотной позиции в последовательности и простираясь в направлении С-конца. Предпочтительно избегать известных в данной области техники вариаций, направленных на устранение или значительное снижение активности белка. В некоторых вариантах реализации изобретения в варианте отсутствует N- и/или С-концевая часть полноразмерного полипептида, например, отсутствуют вплоть до 10, 20 или 50 аминокислот с любого конца. В некоторых вариантах реализации изобретения полипептид имеет последовательность зрелого (полноразмерного) полипептида, под которым подразумевается полипептид, в котором была удалена одна или более часть, такая как сигнальный пептид, в ходе нормального внутриклеточного протеолитического процессинга (например, в ходе котрансляционного или посттрансляционного процессинга). В некоторых вариантах реализации изобретения, в которых белок получен путем, отличным от выделения его из клеток, которые экспрессируют его естественным образом, белок представляет собой химерный полипептид, что означает, что он содержит части, полученные от двух или более разных видов. В некоторых вариантах реализации изобретения, в которых белок получен путем, отличным от выделения его из клеток, которые экспрессируют его естественным образом, белок представляет собой производное, что означает, что белок содержит дополнительные последовательности, неродственные этому белку, при условии, что эти последовательности существенно не снижают биологическую активность белка.
[140] Употребляемый в данном документе термин «функциональный фрагмент» означает полипептид, имеющий аминокислотную последовательность, которая меньше по размеру, но в значительной степени гомологична полипептиду, чьим фрагментом он является, и при этом полипептидная последовательность функционального фрагмента обладает по меньшей мере около 50% или 60%, или 70%, или 80%, или 90%, или 100% или более чем 100%, например, 1,5-кратным, 2-кратным, 3-кратным, 4-кратным или более чем 4-кратным эффективным биологическим воздействием по сравнению с полипептидом, чьим фрагментом он является. Функциональные фрагменты полипептидов могут обладать дополнительными функциями, которые могут включать сниженную антигенность, повышенную способность связывать ДНК (как в случае транскрипционных факторов) или измененную способность связывать РНК (как в случае регулировки стабильности или разрушения РНК).
[141] Термин «вектор» относится к молекуле ДНК, несущей, в котором последовательность ДНК, может быть вставлен для введения в клетку-хозяина. Предпочтительными векторами являются те, которые способны к автономной репликации и/или экспрессии нуклеиновых кислот, с которыми они связаны. Векторы, способные управлять экспрессией генов, с которыми они функционально связаны, называются в данном документе «экспрессионными векторами». Таким образом, «экспрессионный вектор» представляет собой специализированный вектор, который содержит необходимые регуляторные области, которые нужны для экспрессии представляющего интерес гена в клетке-хозяине. В некоторых вариантах реализации изобретения представляющий интерес ген функционально связан с другой последовательностью в векторе. Векторы могут быть вирусными векторами и невирусными векторами. В случае применения вирусных векторов предпочтительно, чтобы вирусные векторы были дефективными по репликации, чего можно достичь, например, путем удаления всех нуклеиновых кислот вируса, которые кодируют репликацию. Дефективный по репликации вирусный вектор сохраняет свои инфицирующие свойства и внедряется в клетку так же само, как и реплицирующийся аденовирусный вектор, при этом после попадания в клетку дефективный по репликации вирусный вектор не способен репродуцироваться или размножаться. Также к векторам относятся липосомы и наночастицы, а также другие средства доставки молекулы ДНК в клетку.
[142] Термин «функционально связанный» означает, что регуляторные последовательности, необходимые для экспрессии кодирующей последовательности, размещены в молекуле ДНК в соответствующих позициях относительно кодирующей последовательности так, чтобы оказывать влияние на экспрессию кодирующей последовательности. Это же определение иногда применяют для расположения кодирующих последовательностей и транскрипционных регуляторных элементов (например, промоторов, энхансеров и терминационных элементов) в экспрессионном векторе. Термин «функционально связанный» включает наличие соответствующего стартового сигнала (например, ATG) в начале полинуклеотидной последовательности, предназначенной для экспрессии, и сохранение правильной рамки считывания для того, чтобы сделать возможной экспрессию полинуклеотидной последовательности под управлением регулирующей экспрессию последовательности и выработку желаемого полипептида, кодируемого полинуклеотидной последовательностью.
[143] Термин «вирусные векторы» относится к применению вирусов или вирус-ассоциированных векторов в качестве носителей нуклеотидных конструкций для внесения в клетку. Конструкции могут быть интегрированы и упакованы в нереплицирующиеся дефективные вирусные геномы, такие как аденовирус, аденоассоциированный вирус (AAV) или вирус простого герпеса (HSV) или другие, включая ретровирусные и лентивирусные векторы, для инфекции или трансдукции клеток. Вектор может встраиваться или не встраиваться в клеточный геном. При необходимости конструкции могут содержать вирусные последовательности для трансфекции. В альтернативном варианте конструкция может быть включена в состав векторов, способных к эписомальной репликации, например, векторов EPV и EBV.
[144] Термины «регуляторная последовательность» и «промотор» взаимозаменяемо употребляются в данном документе и относятся к нуклеотидным последовательностям, таким как сигналы инициации, энхансеры и промоторы, которые индуцируют или регулируют транскрипцию кодирующих белок последовательностей, с которыми они функционально связаны. В некоторых примерах транскрипция рекомбинантного гена находится под управлением промоторной последовательности (или другой транскрипционной регуляторной последовательности), которая управляет экспрессией рекомбинантного гена в том типе клеток, в котором должна происходить экспрессия. Также следует понимать, что рекомбинантный ген может находиться под управлением транскрипционных регуляторных последовательностей, которые являются такими же или которые отличаются от тех последовательностей, которые управляют транскрипцией природной формы белка. В некоторых случаях промоторная последовательность распознается клеточным аппаратом синтеза или внесенным аппаратом синтеза, необходимым для инициации транскрипции определенного гена.
[145] Употребляемый в данном документе термин «транскрипционный фактор» относится к белку, который связывается с определенными частями ДНК посредством ДНК-связывающих доменов и является частью системы, которая управляет переносом (или транскрипцией) генетической информации с ДНК в РНК. В контексте данного документа «пролиферирующий» или «пролиферация» относится к увеличению количества клеток в популяции (росту) посредством клеточного деления. Обычно подразумевается, что пролиферация клеток является результатом скоординированной активации множественных путей сигнальной трансдукции в ответ на факторы внешней среды, включая факторы роста и другие митогены. Клеточную пролиферацию также может стимулировать освобождение от воздействия внутри- и внеклеточных сигналов и механизмов, которые блокируют или негативно влияют на пролиферацию клеток.
[146] Термин «селектируемый маркер» относится к гену, РНК или белку, который при экспрессии придает клетке селектируемый фенотип, такой как устойчивость к цитотоксическим или цитостатическим агентам (например, устойчивость к антибиотикам), прототрофность в отношении питательных веществ или экспрессия конкретного белка, который можно использовать как базис для того, чтобы различать клетки, которые экспрессируют белок, и клетки, которые не его экспрессируют. Белки, чью экспрессию можно легко выявить, такие как флуоресцентный или люминесцентный белок или фермент, чье воздействие на субстрат приводит к выработке окрашенного, флуоресцентного или люминесцентного вещества («выявляемых маркеров»), составляют подгруппу селектируемых маркеров. Наличие селектируемого маркера, связанного с элементами, управляющими экспрессией, нативными для гена, который обычно селективно или эксклюзивно экс пресс ируется в плюрипотентных клетках, дает возможность выявлять и отбирать соматические клетки, которые были перепрограммированы в плюрипотентное состояние. Можно использовать большое количество генов селектируемых маркеров, таких как ген устойчивости к неомицину (neo), ген устойчивости к пуромицину (puro), ген гуанинфосфорибозилтрансферазы (gpt), дигидрофолатредуктазы (DHFR), аденозиндеаминазы (ada), пуромицин-N-ацетилтрансферазы (РАС), ген устойчивости к гигромицину (hyg), ген множественной лекарственной устойчивости (mdr), ген тимидинкиназы (TK), гипоксантин-гуанинфосфорибозилтрансферазы (HPRT) и ген hisD. Выявляемые маркеры включают зеленый флуоресцентный белок (ЗФБ), синий, сапфировый, желтый, красный, оранжевый и голубой флуоресцентные белки, а также варианты любого из них. Также можно использовать люминесцентные белки, такие как люцифераза (например, люцифераза светляков или Renilla luciferase). Для специалиста в данной области техники очевидно, что употребляемый в данном документе термин «селектируемый маркер» может относиться к гену или к продукту генной экспрессии, например, к кодируемому белку.
[147] В некоторых вариантах реализации изобретения селектируемый маркер обеспечивает клеткам, которые его экспрессируют, преимущество, связанное с пролиферацией и/или жизнеспособностью, по сравнению с клетками, которые его не экспрессируют или которые экспрессируют его на существенно меньшем уровне. Такое преимущество, связанное с пролиферацией и/или жизнеспособностью, как правило, возникает, когда клетки содержат в определенных условиях, т.е. «селективных условиях». Чтобы убедиться в эффективности селекции, популяцию клеток можно содержать в условиях и на протяжении достаточного периода времени, чтобы клетки, которые не экспрессируют маркер, не пролиферировали и/или не выживали и были исключены из популяции или их количество составляло только очень малую часть популяции. Процесс селекции клеток, которые экспрессируют маркер, который обеспечивает преимущество, связанное с пролиферацией и/или жизнеспособностью, путем содержания популяции клеток в селективных условиях так, чтобы большей частью или полностью исключить клетки, которые не экспрессируют данный маркер, называется в данном документе «позитивной селекцией», а маркер считается «применимым для позитивной селекции». Негативная селекция и маркеры, применимые для негативной селекции, также представляют интерес в контексте некоторых описанных в данном документе способов. Экспрессия таких маркеров обеспечивает клеткам, которые экспрессируют маркер, недостаток, связанный с пролиферацией и/или жизнеспособностью, по сравнению с клетками, которые не экспрессируют маркер или которые экспрессируют его на существенно меньшем уровне (или, другими словами, клетки, которые не экспрессируют маркер, обладают преимуществом, связанным с пролиферацией и/или жизнеспособностью, по сравнению с клетками, которые экспрессируют маркер). Следовательно, клетки, которые экспрессируют маркер, могут быть большей частью или полностью исключены из популяции клеток при содержании в селективных условиях на протяжении достаточного периода времени.
[148] В контексте данного документа термин «репортерный ген» включает в себя любой ген, генетически внесенный в клетку, который дополняет фенотип стволовой клетки. Раскрытые в данном изобретении репортерные гены включают флуоресцентные, люминесцентные, ферментативные и придающие устойчивость гены, а также другие гены, которые специалисты в данной области техники могут без труда выявить. В некоторых вариантах реализации изобретения репортерные гены используют в качестве маркеров для выявления конкретных стволовых клеток, кардиоваскулярных стволовых клеток и их дифференцированного потомства. В общем случае репортерный ген функционально связан с последовательностями, которые управляют его экспрессией способом, который зависит от одного или более условий, которые отслеживают путем определения экспрессии репортерного гена. В некоторых случаях экспрессию репортерного гена можно определить в живых клетках. В случаях, когда используется анализ репортерных генов в живых клетках, экспрессию репортерного гена можно отслеживать для некоторого количества временных точек, например, 2, 3, 4, 5, 6, 8 или 10 или более временных точек. В некоторых случаях, когда используется анализ репортерных генов в живых клетках, экспрессию репортерного гена отслеживают с частотой, составляющей по меньшей мере от около 10 до около 24 часов, например, 20 минут, 1 час, 2 часа, 3 часа, 4 часа, 5 часов, 6 часов, 7 часов, 8 часов, 9 часов, 10 часов, 12 часов, 18 часов, или другой частотой, составляющей любое целочисленное значение от около 10 минут до около 24 часов.
[149] Термины «субъект» и «индивид» взаимозаменяемо употребляются в данном документе и относятся к животному, например, человеку, из организма которого можно получить клетки и/или по отношению к которому применяют лечение, включая профилактическое лечение клетками, как описано в данном документе. В случае лечения тех инфекций, патологических или болезненных состояний, которые являются специфическими для конкретного животного, такого как человек, термин субъект относится к этому конкретному животному. Выражения «не относящиеся к человеку животные» и «не относящиеся к человеку млекопитающие» взаимозаменяемо употребляются в данном документе и включают таких млекопитающих, как крысы, мыши, кролики, овцы, кошки, собаки, коровы, свиньи и обезьяны. Термин «субъект» также включает любых позвоночных, включая, но не ограничиваясь этим, млекопитающих, рептилий, амфибий и рыб. При этом субъект преимущественно является млекопитающим, таким как человек, или относится к другим млекопитающим, таким как домашние млекопитающие, например, собаки, кошки, лошади и тому подобные, или сельскохозяйственным млекопитающим, например, коровам, свиньям и тому подобным.
[150] Термины «диабет» и «сахарный диабет» взаимозаменяемо употребляются в данном документе. Согласно определению Всемирной организации здравоохранения в случае сахарного диабета диагностическое значение уровня глюкозы в плазме натощак составляет 7,0 ммоль/л (126 мг/дл) и выше (в цельной крови - 6,1 ммоль/л или 110 мг/дл) или уровень глюкозы через 2 часа после еды составляет 11,1 ммоль/л или выше (200 мг/дл или выше). Другие показатели, позволяющие предположить или указывающие на высокий риск наличия сахарного диабета, включают повышенное артериальное давление, составляющее 140/90 мм рт.ст. или выше; повышенный уровень плазменных триглицеридов (1,7 ммоль/л; 150 мг/дл) и низкий уровень холестерина липопротеинов высокой плотности (менее 0,9 ммоль/л, 35 мг/дл для мужчин; менее 1,0 ммоль/л, 39 мг/дл для женщин); центральное ожирение (у мужчин: соотношение между объемом талии и бедер превышает 0,90; у женщин: соотношение между объемом талии и бедер превышает 0,85) и/или индекс массы тела, превышающий 30 кг/м2; микроальбуминурию, при которой скорость выделения альбумина с мочой составляет 20 мкг/мин или выше, или соотношение альбумин жреатинин составляет 30 мг/г или выше). Термин диабет включает в себя все формы диабета, например, I типа, II типа и типа 1,5.
[151] Термины «обрабатывать» («лечить»), «обработка» («лечение») и т.д., употребляемые в отношении выделенной клетки, включают воздействие на клетку процесса или условия любого типа или проведение любого типа манипуляции или процедуры с клеткой. При употреблении в отношении субъекта эти термины относятся к осуществлению медицинского или хирургического ухода, наблюдения или лечения индивида. Обычно у индивида наблюдается заболевание или повреждение или имеется повышенный риск возникновения заболевания по сравнению со среднестатическим членом популяции и ему необходимы такие уход, наблюдение или лечение.
[152] Употребляемый в данном документе термин «лечение» относится к введению субъекту эффективного количества композиции так, чтобы наблюдать у субъекта ослабление по меньшей мере одного симптома заболевания или улучшение заболевания, например, благоприятные или желаемые клинические результаты. В контексте данного изобретения благоприятные или желаемые клинические результаты включают, но не ограничиваются этим, облегчение одного или более симптомов, снижение степени заболевания, стабилизацию (т.е. отсутствие ухудшения) состояния заболевания, приостановку или замедление прогрессирования заболевания, улучшение или облегчение состояния заболевания и ремиссию (как частичную, так и полную), как выявляемые, так и не выявляемые. Лечение может относиться к продлению времени жизни по сравнению с ожидаемым временем жизни без лечения. Таким образом, для специалиста в данной области техники очевидно, что лечение может приводить к улучшению болезненного состояния, но при этом не приводить к полному излечению заболевания. Употребляемый в данном документе термин «лечение» включает профилактику. В альтернативном варианте лечение является «эффективным», если прогрессирование заболевание замедляется или останавливается. «Лечение» также может означать продление времени жизни по сравнению с ожидаемым временем жизни без лечения. Нуждающиеся в лечении включают тех, у кого уже было диагностировано сердечное патологическое состояние, а также тех, для кого существует высокая вероятность развития сердечного патологического состояния вследствие генетической чувствительности или других факторов, таких как вес, режим питания и состояние здоровья.
[153] Употребляемые в данном документе термины «введение», «внесение» и «трансплантация» используются взаимозаменяемо в контексте внесения клеток, например, клеток SC-β согласно изобретению, в организм субъекта способом или путем, который приводит по меньшей мере к частичному размещению внесенных клеток в необходимом участке. Клетки, например, клетки SC-β (например, панкреатические β-клетки или панкреатические β-подобные клетки), можно имплантировать непосредственно в поджелудочную железу или, в альтернативном варианте, их можно вводить любым подходящим путем, который приводит к доставке в необходимый участок в организме субъекта, при этом по меньшей мере часть имплантированных клеток или компонентов клеток остается жизнеспособной. Период жизнеспособности клеток после введения в организм субъекта может составлять от нескольких часов, например, двадцать четыре часа, до нескольких дней и вплоть до нескольких лет. В некоторых случаях клетки также можно вводить не в поджелудочную железу, а, например, в печень или подкожно, например, в капсуле (например, микрокапсуле), чтобы сохранить имплантированные клетки в месте имплантации и избежать миграции имплантированных клеток.
[154] Употребляемые в данном документе выражения «парентеральное введение» и «вводимый парентерально» означают режимы введения, отличные от энтерального и местного введения, осуществляемые обычно путем инъекции и включающие, без ограничений, внутривенную, внутримышечную, внутриартериальную, интратекальную, интравентрикулярную, интракапсулярную, внутриглазную, интракардиальную, интрадермальную, внутрибрюшинную, транс трахеальную, подкожную, внутрикожную, внутрисуставную, субкапсулярную, субарахноидальную, интраспинальную, интрацереброспинальную и внутригрудинную инъекцию и инфузию. Употребляемые в данном документе выражения «системное введение», «вводимый системно», «периферическое введение» и «вводимый периферически» означают введение кардиоваскулярных стволовых клеток и/или их потомства, и/или соединения, и/или другого материала отличным от прямого введения в центральную нервную систему путем, так, чтобы он попадал в организм животного и подвергался метаболизму и другим подобным процессам, например, как в случае подкожного введения.
[155] Термин «ткань» относится к группе или слою специализированных клеток, которые вместе выполняют определенные функции. Термин «тканеспецифический» относится к источнику клеток из определенной ткани.
[156] Термины «сниженный», «уменьшенный», «уменьшение», «снижение» или «ингибирование» в общем случае используются для обозначения снижения на статически значимую величину. При этом, во избежание сомнений, «уменьшенный», «уменьшение» или «снижение» или «ингибирование» означает снижение по меньшей мере на 10% по сравнению с контрольным уровнем, например, снижение по меньшей мере на около 20% или по меньшей мере на около 30%, или по меньшей мере на около 40%, или по меньшей мере на около 50%, или по меньшей мере на около 60%, или по меньшей мере на около 70%, или по меньшей мере на около 80%, или по меньшей мере на около 90%, или вплоть до 100% снижения включительно (т.е. отсутствие уровней по сравнению с контрольным образцом), или любое снижение, соответствующее значению в диапазоне 10-100% по сравнению с контрольным уровнем.
[157] Термины «повышенный», «повышать» или «увеличивать», или «активировать» в общем случае используются для обозначения повышения на статически значимую величину; во избежание сомнений, термины «повышенный», «повышать» или «увеличивать», или «активировать» означают повышение по меньшей мере на 10% по сравнению с контрольным уровнем, например, повышение по меньшей мере на около 20% или по меньшей мере на около 30%, или по меньшей мере на около 40%, или по меньшей мере на около 50%, или по меньшей мере на около 60%, или по меньшей мере на около 70%, или по меньшей мере на около 80%, или по меньшей мере на около 90%, или вплоть до 100% повышения включительно, или любое повышение, соответствующее значению в диапазоне 10-100% по сравнению с контрольным уровнем, или по меньшей мере около 2-кратное, или по меньшей мере около 3-кратное, или по меньшей мере около 4-кратное, или по меньшей мере около 5-кратное, или по меньшей мере около 10-кратное повышение, или любое повышение, соответствующее диапазону от 2-кратного до 10-кратного превышения контрольного уровня.
[158] Термин «статистически значимый» или «значительно» относится к статистической значимости и в общем случае означает двойное стандартное отклонение (2СО) концентрации маркера от нормы или ниже. Данный термин относится к статистическому свидетельству наличия разницы. Он определяется как вероятность принятия решения об отбрасывании нулевой гипотезы, когда нулевая гипотеза в действительности является истинной. Это решение часто принимают, используя p-значение.
[159] Употребляемые в данном документе термины «содержащий» или «содержит» используются в отношении композиций, способов и их соответствующего(их) компонента(ов), которые имеют значение для данного изобретения, но также касаются включения произвольных элементов, как существенных, так и нет.
[160] Употребляемый в данном документе термин «состоит преимущественно из» относится к тем элементам, которые необходимы для данного варианта реализации изобретения. Термин допускает наличие дополнительных элементов, которые не оказывают существенного влияния на основную(ые) или функциональную(ые) характеристику(и) этого варианта реализации изобретения.
[161] Термин «состоящий из» относится к описанным в данном документе композициям, способам и их соответствующим компонентам, которые не включают в себя элементы, не приведенные в этом описании варианта реализации изобретения.
[162] В описании изобретения и прилагающейся формуле изобретения употребление формы единственного числа включает отсылку на множественное число, если иное четко не предусмотрено контекстом. Таким образом, например, отсылка на «способ» относится к одному или более способам и/или этапам описываемого в данном документе способа, что становится очевидным для специалистов в данной области техники после прочтения описания изобретения и т.д.
[163] Стволовые клетки
[164] Стволовые клетки - это клетки, которые сохраняют способность к самообновлению посредством митотического клеточного деления и могут дифференцироваться в широкий диапазон специализированных типов клеток. Двумя основными типами стволовых клеток млекопитающих являются: эмбриональные стволовые (ES) клетки, которые находятся в бластоцистах, и взрослые стволовые клетки, которые находятся в тканях взрослого организма. В развивающемся эмбрионе стволовые клетки могут дифференцироваться во все специализированные эмбриональные ткани. Во взрослых организмах стволовые клетки и клетки-предшественники служат системой репарации организма, восполняя популяцию специализированных клеток, а также поддерживают нормальное обновление регенеративных органов, таких как кровь, кожа или ткани кишечника. Плюрипотентные стволовые клетки могут дифференцироваться в клетки, происходящие из любого из трех зародышевых слоев.
[165] Хотя определенные варианты реализации изобретения описаны ниже в связи с применением стволовых клеток для получения клеток SC-β (например, панкреатических β-клеток или β-подобных клеток) или их предшественников, вместо или вместе со стволовыми клетками можно использовать зародышевые клетки для получения по меньшей мере одной клетки SC-β при помощи протоколов, аналогичных описанным в данном документе иллюстративным протоколам. Подходящие зародышевые клетки можно получить, например, из примордиальных клеток, которые присутствуют в человеческом эмбриональном материале, взятом приблизительно через 8-11 недель после последнего менструального цикла. Иллюстративные способы получения зародышевых клеток описаны, например, в Shamblott et al., Proc. Natl. Acad. Sci. USA 95:13726, 1998 и патенте США №6090622.
[166] Клетки ES, например, человеческие эмбриональные стволовые клетки (hESC) или мышиные эмбриональные стволовые клетки (mESC) со способностью к практически бесконечной репликации и возможностью дифференцироваться в большинство типов клеток представляют собой в принципе неограниченный стартовый материал для генерации дифференцированных клеток для клинической терапии (http://stemcells.nih.gov/info/scireport/2006report.htm, 2006). Одним из возможных применений клеток ES является получение новых панкреатических β-клеток для заместительной клеточной терапии диабета I типа путем получения энтодермы, например, дефинитивной энтодермы, из, например, hESC, и дальнейшей дифференцировки дефинитивной энтодермы по меньшей мере в одну инсулин-позитивную эндокринную клетку или ее предшественника, а затем дифференцировки по меньшей мере одной инсулин-позитивной эндокринной клетки или ее предшественника в клетку SC-β.
[167] hESC описаны, например, в Cowan et al. (N Engl. J. Med. 350:1353, 2004) и Thomson et al. (Science 282:1145, 1998); эмбриональные стволовые клетки других приматов, стволовые клетки макака-резуса (Thomson et al., Proc. Natl. Acad. Sci. USA 92:7844, 1995), стволовые клетки мармозетки (Thomson et al., Biol. Reprod. 55:254, 1996) и человеческие эмбриональные зародышевые (hEG) клетки (Shamblott et al., Proc. Natl. Acad. Sci. USA 95:13726, 1998) также можно применять в описанных в данном документе способах. mESC описаны, например, в Tremml et al. (Curr Protoc Stem Cell Biol. Chapter 1: Unit 1C. 4, 2008). Стволовые клетки могут быть, например, унипотентными, тотипотентными, мультипотентными или плюрипотентными. В некоторых примерах в раскрытых в данном документе способах можно применять любые полученные от приматов клетки, которые способны давать потомство, которые являются производными по меньшей мере одного зародышевого слоя или всех трех зародышевых слоев.
[168] В некоторых примерах клетки ES могут быть выделены, например, так, как описано в Cowan et al. (N Engl. J. Med. 350:1353, 2004) и патенте США №5843780, а также в Thomson et al., Proc. Natl. Acad. Sci. USA 92:7844, 1995. Например, hESC можно получить из клеток человеческих бластоцист, используя способы, описанные в Thomson et al. (патент США No. 6,200,806; Science 282:1145, 1998; Curr. Top. Dev. Biol. 38:133 ff., 1998) и Reubinoff et al, Nature Biotech. 18:399, 2000. Эквивалентные hESC типы клеток включают их плюрипотентные производные, такие как клетки, подобные клеткам первичной эктодермы (EPL), как изложено, например, в WO 01/51610 (Bresagen). hESC также можно получить из человеческих предимплантационных эмбрионов. В альтернативном варианте можно использовать in vitro оплодотворенные (IVF) эмбрионы или можно выращивать одноклеточные человеческие эмбрионы до стадии бластоцисты (Bongso et al., Hum Reprod 4: 706, 1989). Эмбрионы культивируют до достижения стадии бластоцисты в среде G1.2 и G2.2 (Gardner et al., Fertil. Steril. 69:84, 1998). Из сформированных бластоцист удаляют блестящую оболочку путем кратковременного воздействия проназой (Sigma). Внутреннюю клеточную массу можно выделить при помощи иммунохирургии, во время которой бластоцисты на протяжении 30 мин подвергают воздействию 1:50 раствора кроличьей античеловеческой антисыворотки к клеткам селезенки, затем трижды на протяжении 5 мин промывают в DMEM и на протяжении 3 мин подвергают воздействию 1:5 раствора комплемента морской свинки (Gibco) (Solter et al., Proc. Natl. Acad. Sci. USA 72:5099, 1975). После двух дополнительных промываний в DMEM лизированные клетки трофэктодермы удаляют из интактной внутренней клеточной массы (ВКМ) путем осторожного пипетирования, а ВКМ высевают на питающие слои mEF. Через 9-15 дней продукт разрастания внутренней клеточной массы можно разделять на группы путем обработки не содержащим кальция и магния фосфатно-солевым буфером (PBS) с 1 мМ ЭДТА, путем обработки диспазой или трипсином или путем механического разделения при помощи микропипетки; а затем пересевать на mEF в свежую среду. Растущие колонии, обладающие недифференцированной морфологией, можно по отдельности собирать при помощи микропипетки, механически разделять на группы и пересевать. ES-подобная морфология имеет характеристики компактных колоний с очевидно высоким соотношением между ядром и цитоплазмой и ярко выраженными ядрышками. Затем полученные в результате hESC можно обычным образом разделять каждые 1-2 недели, например, путем кратковременной обработки трипсином, обработки PBS Дульбекко (содержащим 2 мМ ЭДТА), обработки коллагеназой типа IV (около 200 Е/мл; Gibco) или путем сбора отдельных колоний при помощи микропипетки. В некоторых примерах оптимальные размеры групп составляют около 50-100 клеток. mESC можно получить, используя способы, описанные, например, в Conner et al. (Curr. Prot. in Mol. Biol. Unit 23.4, 2003).
[169] Эмбриональные стволовые клетки могут быть выделены из бластоцист представителей приматов (патент США №5843780; Thomson et al., Proc. Natl. Acad. Sci. USA 92:7844, 1995). Человеческие эмбриональные стволовые (hES) можно получить из клеток человеческих бластоцист, используя способы, описанные в Thomson et al. (патент США №6200806; Science 282:1145, 1998; Curr. Top. Dev. Biol. 38:133 ff., 1998) ив Reubinoff et al, Nature Biotech. 18:399, 2000. Эквивалентные hES клеткам типы клеток включают их плюрипотентные производные, такие как клетки, подобные клеткам первичной эктодермы (EPL), как изложено, например, в WO 01/51610 (Bresagen).
[170] В некоторых альтернативных вариантах реализации изобретения клетки hES можно получить из человеческих предимплантационных эмбрионов. В альтернативном варианте можно использовать in vitro оплодотворенные (TVF) эмбрионы или можно выращивать одноклеточные человеческие эмбрионы до стадии бластоцисты (Bongso et al., Hum Reprod 4: 706, 1989). Эмбрионы культивируют до достижения стадии бластоцисты в среде G1.2 и G2.2 (Gardner et al., Fertil. Steril. 69:84, 1998). Из сформированных бластоцист удаляют блестящую оболочку путем кратковременного воздействия проназой (Sigma). Внутреннюю клеточную массу выделяют при помощи иммунохирургии, во время которой бластоцисты на протяжении 30 мин подвергают воздействию 1:50 раствора кроличьей античеловеческой антисыворотки к клеткам селезенки, затем трижды на протяжении 5 мин промывают в DMEM и на протяжении 3 мин подвергают воздействию 1:5 раствора комплемента морской свинки (Gibco) (Solter et al., Proc. Natl. Acad. Sci. USA 72:5099, 1975). После двух дополнительных промываний в DMEM лизированные клетки трофэктодермы удаляют из интактной внутренней клеточной массы (ВКМ) путем осторожного пипетирования, а ВКМ высевают на питающие слои mEF.
[171] Через 9-15 дней продукт разрастания внутренней клеточной массы разделяют на группы путем обработки не содержащим кальция и магния фосфатно-солевым буфером (PBS) с 1 мМ ЭДТА, путем обработки диспазой или трипсином или путем механического разделения при помощи микропипетки; а затем пересевают на mEF в свежую среду. Растущие колонии, обладающие недифференцированной морфологией, по отдельности собирают при помощи микропипетки, механически разделяют на группы и пересевают.ES-подобная морфология имеет характеристики компактных колоний с очевидно высоким соотношением между ядром и цитоплазмой и ярко выраженными ядрышками. Затем полученные в результате клетки ES обычным образом разделяют каждые 1-2 недели путем кратковременной обработки трипсином, обработки PBS Дульбекко (содержащим 2 мМ ЭДТА), обработки коллагеназой типа IV (~200 Е/мл; Gibco) или путем сбора отдельных колоний при помощи микропипетки. Оптимальные размеры групп составляют около 50-100 клеток.
[172] В некоторых вариантах реализации изобретения человеческие эмбриональные зародышевые клетки (hEG) представляют собой плюрипотентные стволовые клетки, которые можно использовать в описанных в данном документе способах для дифференцировки в клетки первичной энтодермы. hEG клетки можно получить из примордиальных клеток, которые присутствуют в человеческом эмбриональном материале, взятом приблизительно через 8-11 недель после последнего менструального цикла. Подходящие способы получения описаны в Shamblott et al., Proc. Natl. Acad. Sci. USA 95:13726, 1998 и патенте США №6090622, которые в полном объеме включены в данный документ посредством ссылки.
[173] Вкратце, половые тяжи обрабатывают так, чтобы сформировать дезагрегированные клетки. Среда для выращивания EG состоит из DMEM, 4500 мг/л D-глюкозы, 2200 мг/л мМ NaHCO3; 15% подходящей ES фетальной телячьей сыворотки (BRL); 2 мМ глутамина (BRL); 1 мМ пирувата натрия (BRL); 1000-2000 Е/мл человеческого рекомбинантного фактора, ингибирующего лейкемию (LIF, Genzyme); 1-2 нг/мл человеческого рекомбинантного bFGF (Genzyme); и 10 мкМ форсколина (в 10% ДМСО). Девяностошестилуночные планшеты для тканевого культивирования покрывают субконфлюэнтным слоем питающих клеток (например, клеток STO, АТСС № CRL 1503), культивируют на протяжении 3 дней в модифицированной среде для выращивания EG, не содержащей LIF, bFGF или форсколин, в каждую из лунок добавляют ~0,2 мл инактивированной γ-облучением в 5000 рад суспензии первичных зародышевых клеток (ПЗК). Первый пассаж завершают через 7-10 дней в среде для выращивания EG, перенося содержимое каждой лунки в одну из лунок 24-луночного планшета для культивирования, предварительно обработанного облученными мышиными фибробластами STO. Клетки культивируют с ежедневным замещением среды до момента наблюдения клеточной морфологии, соответствующей EG клеткам, как правило, это происходит через 7-60 дней или 1-4 пассажа.
[174] В определенных примерах перед обработкой по меньшей мере одним фактором созревания β-клеток в соответствии с раскрытыми в данном документе способами стволовые клетки могут быть недифференцированными (например, клетка, не относящаяся к конкретной линии дифференцировки), в то время как в других примерах может быть желательно дифференцировать стволовые клетки в один или более промежуточных типов клеток перед обработкой по меньшей мере одним фактором созревания β-клеток, описанным в данном документе. Например, стволовые клетки могут демонстрировать морфологические, биологические или физические характеристики недифференцированных клеток, по которым их можно отличить от дифференцированных клеток эмбриона или зрелого организма. В некоторых примерах недифференцированные клетки могут проявляться в двух измерениях при наблюдении в микроскоп колоний клеток с высоким значением соотношения ядро/цитоплазма и ярко выраженными ядрышками. Стволовые клетки могут быть сами по себе (например, при фактическом отсутствии каких-либо недифференцированных клеток) или их можно использовать в присутствии дифференцированных клеток. В определенных примерах стволовые клетки можно культивировать в присутствии подходящих питательных веществ и, необязательно, других клеток, так, чтобы стволовые клетки могли расти и, необязательно, дифференцироваться. Например, в культуре могут находиться эмбриональные фибробласты или подобные фибробластам клетки, чтобы способствовать росту стволовых клеток. Фибробласты могут присутствовать на одном из этапов роста стволовых клеток, но не обязательно на всех этапах. Например, фибробласты можно добавлять в культуры стволовых клеток на первом этапе культивирования и не добавлять в культуры стволовых клеток на одном или более из последующих этапов культивирования.
[175] Стволовые клетки, применяемые во всех аспектах настоящего изобретения, могут представлять собой любые клетки, полученные из любого типа ткани (например, эмбриональной ткани, такой как фетальная или префетальная ткань, или ткани взрослого организма), при этом стволовые клетки характеризуются способностью в соответствующих условиях давать потомство, принадлежащее разным типам клеток, например, производным по меньшей мере одного из 3 зародышевых слоев (энтодермы, мезодермы и эктодермы). Эти типы клеток могут находиться в форме стабильной клеточной линии или они могут быть напрямую получены из первичной эмбриональной ткани и использованы непосредственно для дифференцировки. Включены клетки, приведенные в реестре человеческих эмбриональных стволовых клеток НИЗ, например, hESBGN-01, hESBGN-02, hESBGN-03, hESBGN-04 (BresaGen, Inc.); HES-1, HES-2, HES-3, HES-4, HES-5, HES-6 (ES Cell International); Miz-hES1 (MizMedi Hospital-Seoul National University); HSF-1, HSF-6 (University of California at San Francisco); и H1, H7, H9, H13, H14 (Wisconsin Alumni Research Foundation (WiCell Research Institute)). В некоторых вариантах реализации изобретения источник человеческих стволовых клеток или плюрипотентных стволовых клеток, используемых для химически индуцированной дифференцировки в зрелые инсулин-позитивные клетки, не связан с разрушением человеческого эмбриона.
[176] В другом варианте реализации изобретения стволовые клетки могут быть выделены из ткани, включая солидную ткань. В некоторых вариантах реализации изобретения ткань представляет собой кожную, жировую ткань (например, жировую клетчатку), мышечную ткань, сердце или сердечную ткань. В других вариантах реализации изобретения ткань представляет собой, без ограничений, например, пуповинную кровь, плаценту, костный мозг или хрящ.
[177] Представляющие интерес стволовые клетки также включают эмбриональные клетки разных типов, примером которых могут служить человеческие эмбриональные стволовые (hES) клетки, описанные в Thomson et al. (1998) Science 282:1145; эмбриональные стволовые клетки других приматов, такие как стволовые клетки макака-резуса (Thomson et al. (1995) Proc. Natl. Acad. Sci. USA 92:7844); стволовые клетки мармозетки (Thomson et al. (1996) Biol. Reprod. 55:254); и человеческие эмбриональные зародышевые (hEG) клетки (Shambloft et al., Proc. Natl. Acad. Sci. USA 95:13726, 1998). Также интерес представляют стволовые клетки, принадлежащие определенной линии дифференцировки, такие как мезодермальные стволовые клетки и другие ранние кардиогенные клетки (смотрите Reyes et al. (2001) Blood 98:2615-2625; Eisenberg & Bader (1996) Circ Res. 78(2):205-16; и т.д.). Эти стволовые клетки могут быть получены от любых видов млекопитающих, например, от человека, лошадей, жвачных, свиней, собак, кошек, грызунов, например, мышей, крыс, хомяков, приматов и т.д. В некоторых вариантах реализации изобретения человеческий эмбрион не подвергают разрушению для получения источника плюрипотентной клетки, используемой в способах и композициях, раскрытых в данном документе.
[178] Клетки ES считаются недифференцированными, если они не принадлежат конкретной линии дифференцировки. Такие клетки демонстрируют морфологические характеристики, которые отличают их от дифференцированных клеток эмбриона или взрослого организма. Специалисты в данной области техники легко определят недифференцированные клетки ES, которые, как правило, проявляются в двух измерениях при наблюдении в микроскоп колоний клеток с высоким значением соотношения ядро/цитоплазма и ярко выраженными ядрышками. Недифференцированные клетки ES экспрессируют гены, которые можно использовать в качестве маркеров для определения наличия недифференцированных клеток, и чьи полипептидные продукты можно использовать в качестве маркеров для негативной селекции. Например, смотрите заявку на патент США №2003/0224411 A1; Bhattacharya (2004) Blood 103(8):2956-64; и Thomson (1998), выше, каждая из которых включена в данный документ посредством ссылки. Линии человеческих клеток ES экспрессируют маркеры клеточной поверхности, которые характерны для недифференцированных клеток ES обезьян и клеток ES человека, включая стадиеспецифический эмбриональный антиген (SSEA)-3, SSEA-4, TRA-1-60, TRA-1-81 и щелочную фосфатазу. Гликолипид глобо-серии GL7, который несет эпитоп SSEA-4, образуется путем добавления сиаловой кислоты к гликолипиду глобо-серии GbS, который несет эпитоп SSEA-3. Таким образом, GL7 вступает в реакцию с антителами как к SSEA-3, так и к SSEA-4. Линии недифференцированных человеческих клеток ES не окрашиваются SSEA-1, но дифференцированные клетки интенсивно окрашиваются SSEA-I. Способы пролиферации hES клеток в недифференцированной форме описаны в WO 99/20741, WO 01/51616 и WO 03/020920.
[179] Смесь клеток из подходящего источника эндотелиальных, мышечных и/или нервных стволовых клеток можно получить от млекопитающего-донора известными в данной области техники способами. Подходящим источником является гематопоэтическое микроокружение. Например, у пациента можно набирать циркулирующую периферическую кровь, предпочтительно мобилизованную (т.е. стимулированную). В альтернативном варианте можно получить костный мозг от млекопитающего, например пациента-человека, проходящего аутотрансплантацию. В некоторых вариантах реализации изобретения стволовые клетки можно получить из жировой ткани субъектов, например, при помощи CELUTION™ SYSTEM от Cytori, как раскрыто в патентах США №7390484 и 7429488, которые в полном объеме включены в данный документ посредством ссылки.
[180] В некоторых вариантах реализации изобретения в раскрытых в данном документе способах применяют человеческие клетки пуповинной крови (HUCBC). Человеческие клетки UBC считаются богатым источником гематопоэтических и мезенхимальных клеток-предшественников (Broxmeyer et al., 1992 Proc. Natl. Acad. Sci. USA 89:4109-4113). Ранее пуповинная и плацентарная кровь считались побочными продуктами, обычно сопровождающими рождение ребенка. Клетки пуповинной крови используют как источник трансплантируемых стволовых клеток и клеток-предшественников и как источник репопулирующих клеток костного мозга для лечения злокачественных заболеваний (т.е. острой лимфоидной лейкемии, острой миелоидной лейкемии, хронической миелоидной лейкемии, миелодиспластического синдрома и нейробластомы) и незлокачественных заболеваний, таких как анемия Фанкони и апластическая анемия (Kohli-Kumar et al., 1993 Br. J. Haematol. 85:419-422; Wagner et al., 1992 Blood 79; 1874-1881; Lu et al., 1996 Crit. Rev. Oncol. Hematol 22:61-78; Lu et al., 1995 Cell Transplantation 4:493-503). Важным преимуществом HUCBC является незрелый иммунитет этих клеток, очень сходный с фетальными клетками, что существенно снижает риск отторжения организмом-хозяином (Taylor & Bryson, 1985 J. Immunol. 134:1493-1497). Человеческая пуповинная кровь содержит мезенхимальные и гематопоэтические клетки-предшественники, а также эндотелиальные клетки-предшественники, которые можно экспансировать в тканевой культуре (Broxmeyer et al., 1992 Proc. Natl. Acad. Sci. USA 89:4109-4113; Kohli-Kumar et al., 1993 Br. J. Haematol. 85:419-422; Wagner et al., 1992 Blood 79; 1874-1881; Lu et al., 1996 Crit. Rev. Oncol. Hematol 22:61-78; Lu et al., 1995 Cell Transplantation 4:493-503; Taylor & Bryson, 1985 J. Immunol. 134:1493-1497 Broxmeyer, 1995 Transfusion 35:694-702; Chenetal., 2001 Stroke 32:2682-2688; Nieda et al., 1997 Br. J. Haematology 98:775-777; Erices et al., 2000 Br. J. Haematology 109:235-242). Общее содержание гематопоэтических клеток-предшественников в пуповинной крови равно или превышает содержание в костном мозге и, кроме того, количество высоко пролиферативных гематопоэтических клеток в восемь раз выше в HUCBC чем в костном мозге и они экспрессируют гематопоэтические маркеры, такие как CD14, CD34 и CD45 (Sanchez-Ramos etal., 2001 Exp. Neur. 171:109-115; Bicknese et al., 2002 Cell Transplantation 11:261-264; Lu et al., 1993 J. Exp Med. 178:2089-2096).
[181] В другом варианте реализации изобретения плюрипотентные клетки представляют собой клетки в гематопоэтическом микроокружении, таком как циркулирующая периферическая кровь, предпочтительно из мононуклеарной фракции периферической крови, пуповинная кровь, костный мозг, фетальная печень или желточный мешок млекопитающих. Стволовые клетки, в особенности нейральные стволовые клетки, также могут быть получены из центральной нервной системы, включая оболочку головного мозга.
[182] В другом варианте реализации изобретения плюрипотентные клетки, присутствующие в эмбриоидных тельцах, получают, собирая клетки ES с кратковременной обработкой протеазами и создавая возможность роста небольших групп недифференцированных человеческих ESC в суспензионной культуре. Дифференцировку индуцируют, убирая кондиционированную среду. Полученные в результате эмбриоидные тельца высевают на полутвердые субстраты. Образование дифференцированных клеток можно наблюдать через время, составляющее от около 7 дней до около 4 недель. Отбор жизнеспособных дифференцирующихся клеток из in vitro культур стволовых клеток проводят путем частичной диссоциации эмбриоидных телец или сходных структур для получения клеточных агрегатов. Отбор агрегатов, содержащих представляющие интерес клетки, проводят на основании фенотипических признаков, используя методы, которые позволяют в значительной степени сохранить контакты между клетками в агрегате.
[183] В альтернативном варианте реализации изобретения стволовые клетки могут представлять собой перепрограммированные стволовые клетки, такие как стволовые клетки, полученные из соматических или дифференцированных клеток. В таком варианте реализации изобретения дедифференцированные стволовые клетки могут, например, представлять собой, без ограничений, неопластические клетки, опухолевые клетки и раковые клетки или альтернативно индуцированные перепрограммированные клетки, такие как индуцированные плюрипотентные стволовые клетки или клетки iPS.
[184] Клонирование и клеточное культивирование
[185] Иллюстративные методы молекулярной генетики и генной инженерии, которые можно применять в описанных в данном документе способах, можно найти, например, в современных изданиях Molecular Cloning: A Laboratory Manual, (Sambrook et al., Cold Spring Harbor); Gene Transfer Vectors for Mammalian Cells (Miller & Calos eds.); и Current Protocols in Molecular Biology (F.M. Ausubel et al. eds., Wiley & Sons). Материалы, касающиеся клеточной биологии, химии белков и методы, связанные с антителами, можно найти, например, в Current Protocols in Protein Science (J.E. Colligan et al. eds., Wiley & Sons); Current Protocols in Cell Biology (J.S. Bonifacino et al., Wiley & Sons) и Current protocols in Immunology (J.E. Colligan et al. eds., Wiley & Sons.). Иллюстративные реагенты, клонирующие векторы и наборы для проведения генетических манипуляций можно приобрести на коммерческом основании, например, от BioRad, Stratagene, Invitrogen, Clon Tech и Sigma-Aldrich Co.
[186] Общее описание подходящих методов клеточного культивирования можно найти, например, в современном издании Culture of Animal Cells: A Manual of Basic Technique (R.I. Freshney ed., Wiley & Sons); General Techniques of Cell Culture (M.A. Harrison & I.F. Rae, Cambridge Univ. Press) и Embryonic Stem Cells: Methods and Protocols (K. Turksen ed., Humana Press). Подходящие питательные вещества и реагенты для тканевого культивирования доступны, например, от Gibco/BRL, Nalgene-Nunc hrternational, Sigma Chemical Co. и ICN Biomedicals.
[187] Специалист в данной области техники может в течение длительного времени выращивать плюрипотентные стволовые клетки в культуре, применяя условия культивирования, которые стимулируют пролиферацию, но не стимулируют дифференцировку. Типовая содержащая сыворотку среда для клеток ES состоит из 80% DMEM (например, Knock-Out DMEM, Gibco), 20% химически определенной фетальной бычьей сыворотки (FB S, Hyclone) заместителя сыворотки (WO 98/30679), 1% заменимых аминокислот, 1 мМ L-глутамина и 0,1 мМ β-меркаптоэтанола. Непосредственно перед применением добавляют человеческий bFGF до 4 нг/мл (WO 99/20741, Geron Corp.). Традиционно клетки ES культивируют на слое питающих клеток, как правило, фибробластов, полученных из эмбриональной или фетальной ткани.
[188] Ученые из Geron обнаружили, что плюрипотентные SC можно сохранять в недифференцированном состоянии даже в отсутствие питающих клеток. Среда для не содержащих питающих компонентов культур включает подходящий культуральный субстрат, а именно - внеклеточную матрицу, такую как Matrigel® или ламинин. Как правило, ферментативное расщепление прекращают до того момента, когда клетки становятся полностью диспергированными (например, это соответствует около 5 мин обработки коллагеназой IV). Группы, содержащие от ~10 до 2000 клеток затем высевают непосредственно на субстрат без дополнительного рассеивания.
[189] Не содержащие питающих компонентов культуры поддерживают при помощи питательной среды, содержащей факторы, которые стимулируют пролиферацию клеток без дифференцировки. Такие факторы можно вносить в среду путем культивирования среды с клетками, секретирующими такие факторы, такими как облученные (~4000 рад) первичные мышиные эмбриональные фибробласты, теломеризованные мышиные фибробласты или подобные фибробластам клетки, полученные из клеток pPS. Среду можно кондиционировать путем высевания питающих компонентов с плотностью ~5-6×104 см-2 в бессывороточную среду, такую как KO DMEM, дополненную 20% заместителя сыворотки и 4 нг/мл bFGF. Среду, кондиционированную на протяжении 1-2 дней, дополняют дополнительным bFGF и применяют для поддержания культуры плюрипотентных SC на протяжении 1-2 дней. Особенности метода не содержащей питающих компонентов культуры дополнительно обсуждаются в международной патентной публикации WO 01/51616; и в Xu et al., Nat. Biotechnol. 19:971, 2001.
[190] При наблюдении в микроскоп клетки ES характеризуются высоким соотношением между ядром и цитоплазмой и ярко выраженными ядрышками, а также образованием компактных колоний со слабо выраженными межклеточными контактами. Клетки ES приматов экспрессируют стадиеспецифические эмбриональные антигены (SSEA) 3 и 4, а также маркеры, выявляемые при помощи антител, называемых Tra-1-60 и Tra-1-81 (Thomson et al., Science 282:1145, 1998). Клетки ES мышей можно использовать в качестве положительного контроля в случае SSEA-1 и в качестве отрицательного контроля в случае SSEA-4, Tra-1-60 и Tra-1-81. SSEA-4 в обязательном порядке присутствует в клетках человеческой эмбриональной карциномы (hEC). Дифференцировка плюрипотентных SC in vitro приводит к прекращению экспрессии SSEA-4, Tra-1-60 и Tra-1-81 и повышению экспрессии SSEA-1, который также можно обнаружить в недифференцированных клетках hEG.
[191] Полученная из стволовых клеток β-клетка (SC-β)
[192] В некоторых аспектах в изобретении предложена полученная из стволовой клетки β-клетка (SC-β). Раскрытые в данном документе клетки SC-β обладают многими отличительными признаками β-клеток, но отличаются от них в некоторых аспектах (например, профилях генной экспрессии). В некоторых вариантах реализации изобретения клетка SC-β не является нативной. В контексте данного документа «не являющаяся нативной» означает, что клетки SC-β существенно отличаются в некоторых аспектах от существующих в природе β-клеток, т.е. нативных β-клеток. При этом следует понимать, что эти существенные различия, как правило, относятся к структурным признакам, которые могут приводить к получению клеток SC-β, демонстрирующих определенные функциональные отличия, например при том, что уровни генной экспрессии клеток SC-β отличаются от нативных β-клеток, клетки SC-β ведут себя сходным с нативными β-клетками образом, но некоторые функции могут быть изменены (например, улучшены) по сравнению с нативными β-клетками. Например, как показано на ФИГ. 2Е, ответ клеток SC-β на 20 мМ глюкозы происходите большей частотой по сравнению с частотой, демонстрируемой нативными β-клетками. Другие различия между клетками SC-β и нативными β-клетками станут очевидны для специалиста в данной области техники на основании раскрытых в данном документе данных.
[193] Клетки SC-β согласно изобретению обладают многими характерными признаками β-клеток, которые важны для нормального функционирования β-клеток. В некоторых вариантах реализации изобретения клетка SC-β демонстрирует ответ, состоящий в стимулированной глюкозой секреции инсулина (GSIS) in vitro. В некоторых вариантах реализации изобретения клетка SC-β демонстрирует ответ GSIS in vivo. В некоторых вариантах реализации изобретения клетка SC-β демонстрирует in vitro и in vivo ответы GSIS. В некоторых вариантах реализации изобретения ответ GSIS имеет сходство с ответом GSIS эндогенной зрелой панкреатической β-клетки. В некоторых вариантах реализации изобретения клетка SC-β демонстрирует ответ GSIS по меньшей мере на одну стимуляцию глюкозой. В некоторых вариантах реализации изобретения клетка SC-β демонстрирует ответ GSIS по меньшей мере на две последовательные стимуляции глюкозой. В некоторых вариантах реализации изобретения клетка SC-β демонстрирует ответ GSIS по меньшей мере на три последовательные стимуляции глюкозой. В некоторых вариантах реализации изобретения ответ GSIS имеет сходство с ответом GSIS эндогенных человеческих островков на многократную стимуляцию глюкозой. В некоторых вариантах реализации изобретения ответ GSIS наблюдают непосредственно сразу после трансплантации клетки в организм человека или животного. В некоторых вариантах реализации изобретения ответ GSIS наблюдают приблизительно в течение 24 часов после трансплантации клетки в организм человека или животного. В некоторых вариантах реализации изобретения ответ GSIS наблюдают приблизительно в течение одной недели после трансплантации клетки в организм человека или животного. В некоторых вариантах реализации изобретения ответ GSIS наблюдают приблизительно в течение двух недель после трансплантации клетки в организм человека или животного. В некоторых вариантах реализации изобретения индекс стимуляции, характеризуемый по соотношению инсулина, секретируемого в ответ на высокие концентрации глюкозы и низкие концентрации глюкозы, сходен с индексом стимуляции эндогенной зрелой панкреатической β-клетки. В некоторых вариантах реализации изобретения клетка SC-β демонстрирует индекс стимуляции, превышающий 1. В некоторых вариантах реализации изобретения клетка SC-β демонстрирует индекс стимуляции, превышающий или равный 1. В некоторых вариантах реализации изобретения клетка SC-β демонстрирует индекс стимуляции, превышающий 1,1. В некоторых вариантах реализации изобретения клетка SC-β демонстрирует индекс стимуляции, превышающий или равный 1,1. В некоторых вариантах реализации изобретения клетка SC-β демонстрирует индекс стимуляции, превышающий 2. В некоторых вариантах реализации изобретения клетка SC-β демонстрирует индекс стимуляции, превышающий или равный 2. В некоторых вариантах реализации изобретения клетка SC-β демонстрирует индекс стимуляции, составляющий по меньшей мере 2,1, 2,2, 2,3, 2,4, 2,5, 2,6, 2,7, 2,8, 2,9, 3,0, 3,1, 3,2, 3,3, 3,4, 3,5, 3,6, 3,7, 3,8, 3,9, 4,0, 4,1, 4,2, 4,3, 4,4, 4,5, 4,6, 4,7, 4,8, 4,9 или 5,0 или более.
[194] В некоторых вариантах реализации изобретения клетка SC-β демонстрирует цитокин-индуцированный апоптоз в ответ на цитокины. В некоторых вариантах реализации изобретения клетка SC-β демонстрирует цитокин-индуцированный апоптоз в ответ на цитокин, выбранный из группы, состоящей из интерлейкина-1β (ИЛ-β), интерферона-γ (ИНФ-γ), фактора некроза опухолей α (ФНО-α) и их комбинаций.
[195] В некоторых вариантах реализации изобретения секреция инсулина из клетки SC-β усиливается в ответ на известные противодиабетические лекарственные препараты (например, противодиабетические лекарственные препараты, которые воздействуют на β-клетки ex vivo или in vitro, и/или противодиабетические лекарственные препараты в общем случае in vivo). В данном изобретении предусмотрен любой противодиабетический лекарственный препарат. В некоторых вариантах реализации изобретения секреция инсулина из клетки SC-β усиливается в ответ на стимулятор секреции. В некоторых вариантах реализации изобретения стимулятор секреции выбран из группы, состоящей из инкретиномиметика, сульфонилмочевины, меглитинида и их комбинаций.
[196] В некоторых вариантах реализации изобретения клетка SC-β является моногормональной. В некоторых вариантах реализации изобретения клетка SC-β демонстрирует морфологию, которая имеет сходство с морфологией эндогенной зрелой панкреатической β-клетки. В некоторых вариантах реализации изобретения в клетке SC-β инкапсулированы кристаллические инсулиновые гранулы. В некоторых вариантах реализации изобретения в клетке SC-β под электронным микроскопом наблюдаются инкапсулированные кристаллические инсулиновые гранулы, которые имеют сходство с инсулиновыми гранулами эндогенной зрелой панкреатической β-клетки. В некоторых вариантах реализации изобретения клетка SC-β демонстрирует низкий коэффициент репликации. В некоторых вариантах реализации изобретения клетка SC-β демонстрирует низкий коэффициент репликации. В некоторых вариантах реализации изобретения клетка SC-β демонстрирует низкую, но повышенную скорость репликации согласно данным по окрашиванию на С-пептид и Ki67 в ответ на обработку пролактином.
[197] В некоторых вариантах реализации изобретения в клетке SC-β повышается внутриклеточный Са2+ в ответ на глюкозу. В некоторых вариантах реализации изобретения клетка SC-β демонстрирует стимулированный глюкозой поток Са2+ (GSCF), который имеет сходство с GSCF эндогенной зрелой панкреатической β-клетки. В некоторых вариантах реализации изобретения клетка SC-β демонстрирует ответ GSCF по меньшей мере на три последовательных стимуляции глюкозой, который имеет сходство с ответом GSCF эндогенной зрелой панкреатической β-клетки на многократную стимуляцию глюкозой.
[198] В некоторых вариантах реализации изобретения клетка SC-β экспрессирует по меньшей мере одну маркерную характеристику эндогенной зрелой панкреатической β-клетки, выбранную из группы, состоящей из инсулина, С-пептида, PDX1, MAFA, NKX6-1, РАХ6, NEUROD1, глюкокиназы (GCK), SLC2A1, PCSK1, KCNJ11, АВСС8, SLC30A8, SNAP25, RAB3A, GAD2 и PTPRN.
[199] В некоторых вариантах реализации изобретения клетка SC-β не экспрессирует по меньшей мере один маркер (например, маркер, не экспрессируемый эндогенными зрелыми панкреатическими β-клетками), выбранный из группы, состоящей из а) гормона, выбранного из группы, состоящей из i) глюкагона (GCG) и ii) соматостатина (SST); b) маркера ацинарных клеток, выбранного из группы, состоящей из i) амилазы и ii) карбоксипептидазы А (СРА1), c) маркера α-клеток, выбранного из группы, состоящей из i) GCG, Arx, Irx1 и Irx2, d) маркера дуктальных клеток, выбранного из группы, состоящей из i) CFTR и ii) Sox9.
[200] Клетки SC-βдифференцированы in vitro из любой стартовой клетки, так как изобретение не ограничено типом стартовой клетки, из которой получены клетки SC-β. Типовые стартовые клетки включают, без ограничений, инсулин-позитивные эндокринные клетки или любых их предшественников, таких как Nkx6-1-позитивная панкреатическая клетка-предшественник, Pdx1-позитивная панкреатическая клетка-предшественник и плюрипотентная стволовая клетка, эмбриональная стволовая клетка и индуцированная плюрипотентная стволовая клетка. В некоторых вариантах реализации изобретения клетки SC-β дифференцированы in vitro из перепрограммированной клетки, частично перепрограммированной клетки (т.е. соматической клетки, например, фибробласта, который был частично перепрограммирован так, чтобы существовать в промежуточном состоянии между индуцированной плюрипотентной клеткой и соматической клеткой, из которой он был получен), трансдифференцированной клетки. В некоторых вариантах реализации изобретения раскрытые в данном документе клетки SC-β могут быть дифференцированы in vitro из инсулин-позитивной эндокринной клетки или ее предшественника. В некоторых вариантах реализации изобретения клетка SC-β дифференцирована in vitro из клетки-предшественника, выбранной из группы, состоящей из Nkx6-1-позитивной панкреатической клетки-предшественника, Pdx1-позитивной панкреатической клетки-предшественника и плюрипотентной стволовой клетки. В некоторых вариантах реализации изобретения плюрипотентная стволовая клетка выбрана из группы, состоящей из эмбриональной стволовой клетки и индуцированной плюрипотентной стволовой клетки. В некоторых вариантах реализации изобретения клетка SC-β или плюрипотентная стволовая клетка, из которой получена клетка SC-β, принадлежат человеку. В некоторых вариантах реализации изобретения клетка SC-β принадлежит человеку.
[201] В некоторых вариантах реализации изобретения клетка SC-β не является генетически модифицированной. В некоторых вариантах реализации изобретения в отсутствие генетической модификации клеток клетка SC-β обладает общими признаками с нативными β-клетками. В некоторых вариантах реализации изобретения клетка SC-в является генетически модифицированной.
[202] В некоторых вариантах реализации изобретения количество инсулина, вырабатываемого на клетку SC-β, составляет по меньшей мере 0,5 мкМЕ на 1000 клеток за 30 минут инкубации (например, ex vivo) при высокой концентрации глюкозы.
[203] В некоторых вариантах реализации изобретения количество инсулина, вырабатываемого на клетку SC-β, составляет по меньшей мере 1, по меньшей мере 2, по меньшей мере 3, по меньшей мере 4, по меньшей мере 5, по меньшей мере 6, по меньшей мере 7, по меньшей мере 8 или по меньшей мере 9 мкМЕ на 1000 клеток за 30 минут инкубации при высокой концентрации глюкозы. В некоторых вариантах реализации изобретения количество инсулина, вырабатываемого на клетку SC-β, составляет 0,5-10 мкМЕ на 1000 клеток за 30 минут инкубации при высокой концентрации глюкозы. В некоторых вариантах реализации изобретения количество инсулина, вырабатываемого на клетку SC-β, составляет приблизительно 2,5 мкМЕ на 1000 клеток за 30 минут инкубации при высокой концентрации глюкозы.
[204] В некоторых аспектах в изобретении предложена клеточная линия, содержащая описанную в данном документе клетку SC-β. В некоторых вариантах реализации изобретения клетки SC-β стабильно экспрессируют инсулин. В некоторых вариантах реализации изобретения клетка SC-β может быть заморожена, разморожена и амплифицирована со временем удвоения, составляющим около 24-44 часов, без значительных морфологических изменений на протяжение по меньшей мере 30 пассажей.
[205] Генерация клеток SC-β
[206] Аспекты изобретения относятся к генерации клеток SC-β (например, панкреатических β-клеток). В общем случае, по меньшей мере одна клетка SC-β или ее предшественник, например, панкреатические клетки-предшественники, полученные в соответствии с раскрытыми в данном документе способами, могут содержать смесь или комбинацию разных клеток, например, смесь клеток, таких как Pdx1-позитивные панкреатические клетки-предшественники, панкреатические клетки-предшественники, коэкспрессирующие Pdx1 и NKX6-1, Ngn3-позитивная эндокринная клетка-предшественник, инсулин-позитивная эндокринная клетка (например, β-подобная клетка) и инсулин-позитивная эндокринная клетка и/или другие плюрипотентные или стволовые клетки.
[207] По меньшей мере одна клетка SC-β или ее предшественник может быть получена в соответствии с любым подходящим протоколом культивирования для дифференцировки стволовой клетки или плюрипотентной клетки до желаемой стадии дифференцировки. В некоторых вариантах реализации изобретения по меньшей мере одна клетка SC-β или ее предшественник получены путем культивирования по меньшей мере одной плюрипотентной клетки на протяжении периода времени и в условиях, подходящих для того, чтобы по меньшей мере одна плюрипотентная клетка дифференцировалась по меньшей мере в одну клетку SC-β или ее предшественника.
[208] В некоторых вариантах реализации изобретения по меньшей мере одна клетка SC-β или ее предшественник принадлежат в значительной степени очищенной популяции клеток SC-β или их предшественников. В некоторых вариантах реализации изобретения популяция клеток SC-β или их предшественников содержит смесь плюрипотентных клеток или дифференцированных клеток. В некоторых вариантах реализации изобретения популяция клеток SC-β или их предшественников практически не содержит, или не содержит эмбриональных стволовых клеток или плюрипотентных клеток или клеток iPS.
[209] В некоторых вариантах реализации изобретения соматическая клетка, например, фибробласт, может быть выделена из организма субъекта, например, в виде биопсии ткани, такой как, например, биопсия кожи, и перепрограммирована в индуцированную плюрипотентную стволовую клетку для дополнительной дифференцировки для получения по меньшей мере одной клетки SC-β или ее предшественника для применения в описанных в данном документе композициях и способах. В некоторых вариантах реализации изобретения соматическую клетку, например, фибробласт, поддерживают в культуре известными специалисту в данной области техники способами, а в некоторых вариантах реализации изобретения размножают перед преобразованием в клетки SC-β раскрытыми в данном документе способами.
[210] В некоторых вариантах реализации изобретения по меньшей мере одну клетку SC-β или ее предшественника поддерживают в культуре известными специалисту в данной области техники способами, а в некоторых вариантах реализации изобретения размножают перед преобразованием в клетки SC-β раскрытыми в данном документе способами.
[211] Кроме того, по меньшей мере одна клетка SC-β или ее предшественник, например, панкреатическая клетка-предшественник, может принадлежать любому виду млекопитающих, а неограничивающие примеры таких клеток включают мышиную, бычью, обезьянью, свиную, лошадиную, овечью или человеческую клетку. Для удобства и упрощения описание способов, приведенное в данном документе, относится по меньшей мере к одной клетке SC-β или ее предшественнику, принадлежащей млекопитающему, но следует понимать, что все описанные в данном документе способы легко можно применить к другим типам клеток, к которым принадлежит по меньшей мере одна клетка SC-β или ее предшественник. В некоторых вариантах реализации изобретения по меньшей мере одна клетка SC-β или ее предшественник получена от человека.
[212] Индукция дифференцировки плюрипотентных стволовых клеток в клетки дефинитивной энтодермы
[213] В аспекты изобретения включены клетки дефинитивной энтодермы. Клетки дефинитивной энтодермы, применяемые в данном документе, можно получить из любого источника или сгенерировать в соответствии с любым подходящим протоколом. В некоторых аспектах плюрипотентные стволовые клетки, например, iPSC или hESC, дифференцированы в клетки энтодермы. В некоторых аспектах клетки энтодермы дополнительно дифференцированы, например, в клетки подзародышевой полости, Pdx1-позитивные панкреатические клетки-предшественники, NKX6-1-позитивные панкреатические клетки-предшественники, Ngn3-позитивные эндокринные клетки-предшественники или инсулин-позитивные эндокринные клетки, с последующей индукцией или созреванием в клетки SC-β.
[214] В некоторых вариантах реализации изобретения стволовые клетки можно высевать на новый субстрат или можно заменять среду, чтобы удалить внеклеточный матрикс или растворимые факторы, которые ингибируют дифференцировку. Иногда это называют «методом прямой дифференцировки», который в общих чертах описан в международной патентной публикации WO 01/51616 и патентной публикации США 2002/0019046, которые в полном объеме включены в данный документ посредством ссылки. В методе прямой дифференцировки обычно предпочтительно начинать с не содержащей питающих компонентов культуры стволовых клеток, чтобы избежать потенциальных осложнений в процессе дифференцировки, причиной которых могут быть остаточные питающие клетки. Другой подход состоит в помещении недифференцированных стволовых клеток в суспензионную культуру, которая будет приводить к постоянному образованию агрегатов из дифференцированных и недифференцированных клеток. Например, стволовые клетки можно собирать при помощи кратковременной обработки коллагеназой, разбивать на кластеры и пассировать в культуральных планшетах, покрытых неадгезивными клетками. Агрегаты можно подкармливать каждые несколько дней, а затем собирать через соответствующий период времени, как правило, составляющий 4-8 дней. В зависимости от условий агрегаты в общем случае начинают формировать гетерогенную популяцию из разных типов клеток, включая достаточно часто встречающиеся клетки энтодермы. Затем агрегаты можно диспергировать и пересевать на субстраты, такие как ламинин или фибронектин, для следующего этапа процесса дифференцировки; или пассировать в суспензионной культуре, используя, например, неадгезивные планшеты и подходящую среду.
[215] Во время прямой дифференцировки или дифференцировки в агрегатах можно отслеживать наличие клеток энтодермы, используя подходящие маркеры, такие как те, которые приведены в патенте США №7326572. В некоторых предпочтительных вариантах реализации изобретения во время дифференцировки можно отслеживать наличие клеток энтодермы, используя такие маркеры, как Sox17. После получения достаточной доли клеток энтодермы, клетки можно пересевать или проводить другие манипуляции, чтобы начать другой этап дифференцировки. В определенных условиях дифференцировку или поддержание клеток можно усилить, если клетки будут находиться в микрокластерах (например, от 50 до 5000 клеток). Дополнительные этапы дифференцировки, предусматриваемые изобретением, приведены на Фиг. 1.
[216] В некоторых вариантах реализации изобретения клетки дефинитивной энтодермы получают путем приведения в контакт (например, культивирования) плюрипотентной стволовой клетки с соединением по формуле (I), как описано в патенте США №8507274 («274-м патенте»), включенном в данный документ посредством ссылки. Соединение, имеющее формулу (I) согласно описанию в 274-м патенте, представляет собой небольшую молекулу, способную проникать в клетку и регулировать клеточные процессы путем модуляции путей сигнальной трансдукции, генной экспрессии или метаболизма, и эффективно применяется в протоколах дифференцировки стволовых клеток. Небольшие молекулы можно синтезировать в большом количестве и с высокой степенью чистоты, а также их удобно доставлять или удалять, что обеспечивает их большой потенциал в терапевтических применениях. Было проведено огромное количество исследований для определения новых небольших молекул, которые могут поддерживать самообновление клеток ES (Chen et al., 2006; Desbordes et al., 2008), мышиных клеток ES с кардиогенной спецификацией (Wu et al., 2004) или нейральных клеток-предшественников (Diamandis et al., 2007), а также индуцировать отдельные типы клеток, в частности, нейрональные и мышечные клетки (обзор авторства Ding and Schultz, 2004). Ожидается, что соединения по формуле (I) из 274-го патента можно применять для дифференцировки плюрипотентной стволовой клетки в клетку дефинитивной энтодермы.
[217] В некоторых вариантах реализации изобретения соединение по формуле (I) из 274-го патента содержит:
[218]
[219] 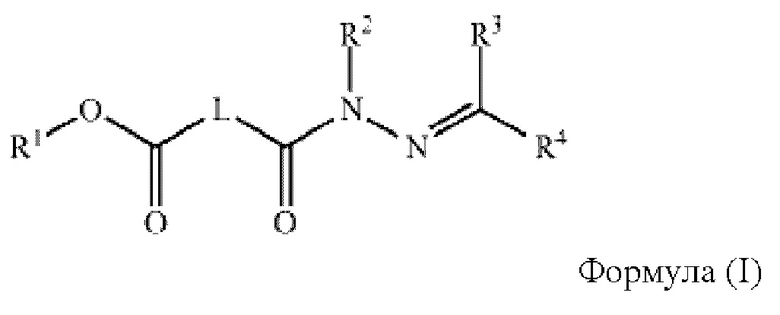
[220] где:
[221] R1 и R2 независимо представляют собой Н, алкил, алкенил, алкинил, арил, гетероарил, циклил или циклил, каждый из которых может быть необязательно замещенным и/или в его скелет может быть вставлен один или более элемент из О, N, S, S(O) и С(О);
[222] R3 и R4 независимо представляют собой Н, галоген, алкил, алкенил, алкинил, алкокси, арил, гетероарил, циклил или циклил, каждый из которых может быть необязательно замещенным, или R3 и R4 вместе с атомом углерода, к которому они присоединены, образуют необязательно замещенный циклил или гетероциклил; и
[223] L представляет собой C1-С10 алкиленил, С2-С10 алкениленил или С2-С10 алкиниленил, каждый из которых может быть необязательно замещенным и/или в его скелет может быть вставлен один или более элемент из О, N, S, S(O) и С(О).
[224] В некоторых вариантах реализации изобретения соединение по формуле (I) из 274-го патента содержит приведенный ниже IDE1:
[225] 
[226] В некоторых вариантах реализации изобретения соединение по формуле (I) из 274-го патента содержит приведенный ниже IDE2:
[227] 
[228] В 274-ом патенте описаны способы подтверждения подлинности полученной таким образом клетки дефинитивной энтодермы, а также способы выделения, хранения, размножения и дополнительной дифференцировки дефинитивной энтодермы, которые, как понятно специалисту в данной области техники, можно применять в описанных в данном документе композициях и способах.
[2 29] В некоторых вариантах реализации изобретения клетки дефинитивной энтодермы можно получать путем дифференцировки по меньшей мере некоторых плюрипотентных клеток в популяции в клетки дефинитивной энтодермы, например, путем приведения популяции плюрипотентных клеток в контакт с i) по меньшей мере одним фактором роста из суперсемейства TGF-β и ii) активатором сигнального пути WNT, чтобы индуцировать дифференцировку по меньшей мере некоторых плюрипотентных клеток в клетки дефинитивной энтодермы, при этом клетки дефинитивной энтодермы экспрессируют по меньшей мере один маркер, характерный для дефинитивной энтодермы.
[230] В изобретении предусматривается применение любого фактора роста из суперсемейства TGF-β, который индуцирует дифференцировку плюрипотентных стволовых клеток в клетки дефинитивной энтодермы (например, одного или в комбинации с активатором сигнального пути WNT). В некоторых вариантах реализации изобретения по меньшей мере один фактор роста из суперсемейства TGF-β включает активин А. В некоторых вариантах реализации изобретения по меньшей мере один фактор роста из суперсемейства TGF-β включает фактор роста и дифференцировки 8 (GDF8).
[231] В изобретении предусматривается применение любого активатора сигнального пути WNT, который индуцирует дифференцировку плюрипотентных стволовых клеток в клетки дефинитивной энтодермы (например, одного или в комбинации с фактором роста из суперсемейства TGF-β). В некоторых вариантах реализации изобретения активатор сигнального пути WNT включает CHIR99021. В некоторых вариантах реализации изобретения активатор сигнального пути WNT включает рекомбинантный белок Wnt3a.
[232] Специалисту в данной области техники понятно, что концентрации применяемых агентов (например, факторов роста) могут варьироваться. В некоторых вариантах реализации изобретения плюрипотентные клетки приводят в контакт по меньшей мере с одним фактором роста из суперсемейства TGF-β в концентрации 10 нг/мл - 1000 нг/мл. В некоторых вариантах реализации изобретения плюрипотентные клетки приводят в контакт по меньшей мере с одним фактором роста из суперсемейства TGF-β в концентрации 100 нг/мл. В некоторых вариантах реализации изобретения плюрипотентные клетки приводят в контакт по меньшей мере с одним фактором роста из суперсемейства TGF-β в концентрации 20 нг/мл, 30 нг/мл, 40 нг/мл, 50 нг/мл, 60 нг/мл, 70 нг/мл, 80 нг/мл или 90 нг/мл. В некоторых вариантах реализации изобретения плюрипотентные клетки приводят в контакт по меньшей мере с одним фактором роста из суперсемейства TGF-β в концентрации 91 нг/мл, 92 нг/мл, 93 нг/мл, 94 нг/мл, 95 нг/мл, 96 нг/мл, 97 нг/мл, 98 нг/мл или 99 нг/мл. В некоторых вариантах реализации изобретения плюрипотентные клетки приводят в контакт по меньшей мере с одним фактором роста из суперсемейства TGF-β в концентрации 110 нг/мл, 120 нг/мл, 130 нг/мл, 140 нг/мл, 150 нг/мл, 160 нг/мл, 170 нг/мл, 180 нг/мл или 190 нг/мл. В некоторых вариантах реализации изобретения плюрипотентные клетки приводят в контакт по меньшей мере с одним фактором роста из суперсемейства TGF-β в концентрации 101 нг/мл, 102 нг/мл, 103 нг/мл, 104 нг/мл, 105 нг/мл, 106 нг/мл, 107 нг/мл, 108 нг/мл или 109 нг/мл.
[233] В некоторых вариантах реализации изобретения плюрипотентные клетки приводят в контакт с активатором сигнального пути WNT в концентрации 1,4 мкг/мл - 140 мкг/мл. В некоторых вариантах реализации изобретения плюрипотентные клетки приводят в контакт с активатором сигнального пути WNT в концентрации 14 мкг/мл. В некоторых вариантах реализации изобретения плюрипотентные клетки приводят в контакт с активатором сигнального пути WNT в концентрации 2 мкг/мл, 3 мкг/мл, 4 мкг/мл, 5 мкг/мл, 6 мкг/мл, 7 мкг/мл, 8 мкг/мл, 9 мкг/мл, 10 мкг/мл, 11 мкг/мл, 12 мкг/мл или 13 мкг/мл. В некоторых вариантах реализации изобретения плюрипотентные клетки приводят в контакт с активатором сигнального пути WNT в концентрации 15 мкг/мл, 16 мкг/мл, 17 мкг/мл, 18 мкг/мл, 19 мкг/мл, 20 мкг/мл, 21 мкг/мл, 22 мкг/мл, 23 мкг/мл, 24 мкг/мл, 25 мкг/мл, 26 мкг/мл, 27 мкг/мл, 28 мкг/мл, 29 мкг/мл или 30 мкг/мл. В некоторых вариантах реализации изобретения плюрипотентные клетки приводят в контакт с активатором сигнального пути WNT в концентрации 13,1 мкг/мл, 13,2 мкг/мл, 13,3 мкг/мл, 13,4 мкг/мл, 13,5 мкг/мл, 13,6 мкг/мл, 13,7 мкг/мл, 13,8 мкг/мл или 13,9 мкг/мл. В некоторых вариантах реализации изобретения плюрипотентные клетки приводят в контакте активатором сигнального пути WNT в концентрации 14,1 мкг/мл, 14,2 мкг/мл, 14,3 мкг/мл, 14,4 мкг/мл, 14,5 мкг/мл, 14,6 мкг/мл, 14,7 мкг/мл, 14,8 мкг/мл или 14,9 мкг/мл.
[234] В общем случае плюрипотентные клетки содержат в подходящей культуральной среде (например, в суспензионной культуре) на протяжении периода времени, достаточного, чтобы индуцировать дифференцировку по меньшей мере некоторых плюрипотентных клеток в клетки дефинитивной энтодермы. Типовая подходящая культуральная среда приведена ниже в Таблице 1.
[235]
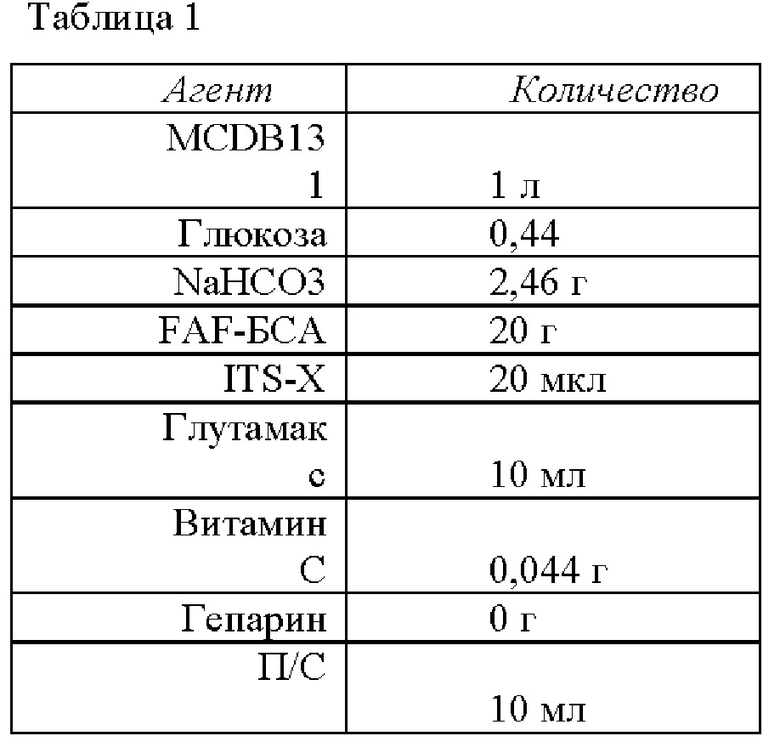
[236] В некоторых вариантах реализации изобретения подходящая культуральная среда для дифференцировки плюрипотентных клеток в клетки дефинитивной энтодермы включает среду S1.
[237] В некоторых вариантах реализации изобретения приведение в контакт плюрипотентных клеток осуществляют в суспензионной культуре. В некоторых вариантах реализации изобретения суспензионную культуру поддерживают в роллерном флаконе. В некоторых вариантах реализации изобретения период времени составляет 3 дня. В некоторых вариантах реализации изобретения в первый день в суспензионную культуру добавляют по меньшей мере один фактор роста из суперсемейства TGF-β и активатор сигнального пути WNT. В некоторых вариантах реализации изобретения на второй день в суспензионной культуре пополняют по меньшей мере один фактор роста из суперсемейства TGF-β. В некоторых вариантах реализации изобретения на второй день в суспензионной культуре не пополняют активатор сигнального пути WNT. В некоторых вариантах реализации изобретения на второй день из суспензионной культуры удаляют активатор сигнального пути WNT. В некоторых вариантах реализации изобретения на второй день в суспензионной культуре пополняют по меньшей мере один фактор роста из суперсемейства TGF-β, а активатор сигнального пути WNT удаляют или не пополняют в суспензионной культуре на второй день. В некоторых вариантах реализации изобретения на третий день в суспензионной культуре не пополняют ни по меньшей мере один фактор роста из суперсемейства TGF-β, ни активатор сигнального пути WNT. В некоторых вариантах реализации изобретения на третий день из суспензионной культуры удаляют как по меньшей мере один фактор роста из суперсемейства TGF-β, так и активатор сигнального пути WNT.
[238] При помощи указанных способов можно индуцировать дифференцировку по меньшей мере одной плюрипотентной клетки в популяции клеток в клетку дефинитивной энтодермы. В общем случае при помощи описанного в данном документе способа можно осуществить дифференцировку любой плюрипотентной клетки в клетку дефинитивной энтодермы. В некоторых вариантах реализации изобретения плюрипотентные клетки включают индуцированные плюрипотентные клетки. В некоторых вариантах реализации изобретения плюрипотентные клетки включают эмбриональные стволовые клетки. В некоторых вариантах реализации изобретения плюрипотентные клетки включают клетки человека.
[239] В некоторых вариантах реализации изобретения дифференцировки по меньшей мере некоторых плюрипотентных клеток в популяции в клетки дефинитивной энтодермы достигают путем приведения популяции плюрипотентных клеток в контакт с i) активином А и ii) CHIR99021, чтобы индуцировать дифференцировку по меньшей мере некоторых плюрипотентных клеток в популяции в клетки дефинитивной энтодермы, при этом клетки дефинитивной энтодермы экспрессируют по меньшей мере один маркер, характерный для дефинитивной энтодермы.
[240] Другие способы получения клеток дефинитивной энтодермы известны в данной области техники, включая, например, способы, которые приведены в патентной заявке Соединенных Штатов US 2006/0003446 авторства G. Keller, et al.; US 2006/0003313 авторства K. D'Amour, et al., US 2005/0158853 авторства K. D'Amour, et al. и US 2005/0260749 авторства Jon Odorico, et al., соответствующие разделы которых включены в данный документ посредством ссылки.
[241] В некоторых вариантах реализации изобретения клетка дефинитивной энтодермы, полученная описанными в данном документе способами, экспрессирует по меньшей мере один маркер, выбранный из группы, состоящей из: Nodal, Tmprss2, Tmem30b, St14, Spink3, Sh3gl2, Ripk4, Rab15, Npnt, Clic6, Cldn8, Cacna1b, Bnipl, Anxa4, Emb, FoxA1, Sox17 и Rbm35a, при этом в клетке дефинитивной энтодермы наблюдается повышенная экспрессия по меньшей мере одного маркера на статистически значимую величину по сравнению с плюрипотентной стволовой клеткой, из которой она была получена. В некоторых вариантах реализации изобретения клетка дефинитивной энтодермы, полученная описанными в данном документе способами, не экспрессирует в статистически значимом количестве по меньшей мере один маркер, выбранный из группы, состоящей из: Gata4, SPARC, AFP и Dab2, по сравнению с плюрипотентной стволовой клеткой, из которой она была получена. В некоторых вариантах реализации изобретения клетка дефинитивной энтодермы, полученная описанными в данном документе способами, не экспрессирует в статистически значимом количестве по меньшей мере один маркер, выбранный из группы, состоящей из: Zicl, Pax6, Flk2 и CD31, по сравнению с плюрипотентной стволовой клеткой, из которой она была получена.
[242] В некоторых вариантах реализации изобретения клетка дефинитивной энтодермы, полученная описанными в данном документе способами, характеризуется более высоким на статистически значимую величину уровнем фосфорилирования Smad2 по сравнению с плюрипотентной стволовой клеткой, из которой она была получена. В некоторых вариантах реализации изобретения клетка дефинитивной энтодермы, полученная описанными в данном документе способами, обладает способностью формировать кишечную трубку in vivo. В некоторых вариантах реализации изобретения клетка дефинитивной энтодермы, полученная описанными в данном документе способами, может дифференцироваться в клетку с морфологией, характерной для клетки кишечника, и при этом клетка с морфологией, характерной для клетки кишечника, экспрессирует FoxA2 и/или Claudin6. В некоторых вариантах реализации изобретения клетка дефинитивной энтодермы, полученная описанными в данном документе способами, может дополнительно дифференцироваться в клетку энтодермального происхождения.
[243] В некоторых вариантах реализации изобретения популяцию плюрипотентных стволовых клеток культивируют в присутствии по меньшей мере одного фактора созревания β-клеток перед какой-либо дифференцировкой или на первой стадии дифференцировки. Можно применять любую плюрипотентную стволовую клетку, такую как человеческая плюрипотентная стволовая клетка или человеческая клетка iPS, или любую обсуждаемую в данном документе плюрипотентную стволовую клетку или другие подходящие плюрипотентные стволовые клетки. В некоторых вариантах реализации изобретения описанный в данном документе фактор созревания β-клеток может присутствовать в культуральной среде популяции плюрипотентных стволовых клеток или его можно добавлять повторно или периодически во время роста (например, репликации или размножения) популяции плюрипотентных стволовых клеток. В определенных примерах популяцию плюрипотентных стволовых клеток можно подвергать воздействию по меньшей мере одного фактора созревания β-клеток перед какой-либо дифференцировкой. В других примерах популяцию плюрипотентных стволовых клеток можно подвергать воздействию по меньшей мере одного фактора созревания β-клеток на первой стадии дифференцировки.
[244] Индукция дифференцировки клеток дефинитивной энтодермы в клетки первичной кишечной трубки
[245] Аспекты изобретения включают клетки первичной кишечной трубки. Применяемые в данном документе клетки первичной кишечной трубки могут быть получены из любого источника или сгенерированы в соответствии с любым подходящим протоколом. В некоторых аспектах клетки дефинитивной энтодермы дифференцируются в клетки первичной кишечной трубки. В некоторых аспектах клетки первичной кишечной трубки дополнительно дифференцируются, например, в Pdx1-позитивные панкреатические клетки-предшественники, NKX6-1-позитивные панкреатические клетки-предшественники, Ngn3-позитивные эндокринные клетки-предшественники, инсулин-позитивные эндокринные клетки с последующей индукцией или созреванием в клетки SC-β.
[246] В некоторых вариантах реализации изобретения клетки первичной кишечной трубки можно получить путем дифференцировки по меньшей мере некоторых клеток дефинитивной энтодермы в популяции в клетки первичной кишечной трубки, например, путем приведения клеток дефинитивной энтодермы в контакт по меньшей мере с одним фактором роста из семейства факторов роста фибробластов (FGF), чтобы индуцировать дифференцировку по меньшей мере некоторых клеток дефинитивной энтодермы в клетки первичной кишечной трубки, при этом клетки первичной кишечной трубки экспрессируют по меньшей мере один маркер, характерный для клеток первичной кишечной трубки.
[247] В изобретении предусмотрено применение любого фактора роста из семейства FGF, который индуцирует дифференцировку клеток дефинитивной энтодермы в клетки первичной кишечной трубки (например, один или в комбинации с другими факторами). В некоторых вариантах реализации изобретения по меньшей мере один фактор роста из семейства FGF включает фактор роста кератиноцитов (KGF). В некоторых вариантах реализации изобретения по меньшей мере один фактор роста из семейства FGF включает FGF2. В некоторых вариантах реализации изобретения по меньшей мере один фактор роста из семейства FGF включает FGF8B. В некоторых вариантах реализации изобретения по меньшей мере один фактор роста из семейства FGF включает FGF10. В некоторых вариантах реализации изобретения по меньшей мере один фактор роста из семейства FGF включает FGF21.
[248] Специалисту в данной области техники понятно, что концентрации применяемых факторов роста могут варьироваться. В некоторых вариантах реализации изобретения клетки дефинитивной энтодермы приводят в контакт по меньшей мере с одним фактором роста из семейства FGF в концентрации 5 нг/мл - 500 нг/мл. В некоторых вариантах реализации изобретения клетки дефинитивной энтодермы приводят в контакт по меньшей мере с одним фактором роста из семейства FGF в концентрации 10 нг/мл, 15 нг/мл, 20 нг/мл, 25 нг/мл, 30 нг/мл, 35 нг/мл или 40 нг/мл. В некоторых вариантах реализации изобретения клетки дефинитивной энтодермы приводят в контакт по меньшей мере с одним фактором роста из семейства FGF в концентрации 60 нг/мл, 65 нг/мл, 70 нг/мл, 75 нг/мл, 80 нг/мл, 85 нг/мл, 90 нг/мл, 95 нг/мл или 100 нг/мл. В некоторых вариантах реализации изобретения клетки дефинитивной энтодермы приводят в контакт по меньшей мере с одним фактором роста из семейства FGF в концентрации 41 нг/мл, 42 нг/мл, 43 нг/мл, 44 нг/мл, 45 нг/мл, 46 нг/мл, 47 нг/мл, 48 нг/мл или 49 нг/мл. В некоторых вариантах реализации изобретения клетки дефинитивной энтодермы приводят в контакт по меньшей мере с одним фактором роста из семейства FGF в концентрации 51 нг/мл, 52 нг/мл, 53 нг/мл, 54 нг/мл, 55 нг/мл, 56 нг/мл, 57 нг/мл, 58 нг/мл или 59 нг/мл. В некоторых вариантах реализации изобретения клетки дефинитивной энтодермы приводят в контакт по меньшей мере с одним фактором роста из семейства FGF в концентрации 50 нг/мл.
[249] В некоторых вариантах реализации изобретения клетки дефинитивной энтодермы культивируют в подходящей культуральной среде.
[250] В общем случае клетки дефинитивной энтодермы содержат в подходящей культуральной среде (например, суспензионной культуре) на протяжении периода времени, достаточного, чтобы индуцировать дифференцировку по меньшей мере некоторых клеток дефинитивной энтодермы в клетки первичной кишечной трубки. Типовая подходящая культуральная среда приведена ниже в Таблице 2.
[251]

[252] В некоторых вариантах реализации изобретения подходящая культуральная среда для дифференцировки клеток дефинитивной энтодермы в клетки первичной кишечной трубки включает среду S2.
[253] В некоторых вариантах реализации изобретения приведение в контакт клеток дефинитивной энтодермы проводят в суспензионной культуре. В некоторых вариантах реализации изобретения суспензионную культуру поддерживают в роллерном флаконе. В некоторых вариантах реализации изобретения период времени составляет от 2 дней до 5 дней. В некоторых вариантах реализации изобретения период времени составляет 3 дня. В некоторых вариантах реализации изобретения суспензионную культуру пополняют через день.
[254] В некоторых вариантах реализации изобретения клетки дефинитивной энтодермы можно получить путем дифференцировки по меньшей мере некоторых клеток дефинитивной энтодермы в популяции в клетки первичной кишечной трубки, например, путем приведения клеток дефинитивной энтодермы в контакт с KGF, чтобы индуцировать дифференцировку по меньшей мере некоторых клеток дефинитивной энтодермы в клетки первичной кишечной трубки, при этом клетки первичной кишечной трубки экспрессируют по меньшей мере один маркер, характерный для дефинитивной энтодермы.
[255] Индукция дифференцировки клеток первичной кишечной трубки в Pdx1-позитивные панкреатические клетки-предшественники
[256] Аспекты изобретения включают Pdx1-позитивные панкреатические клетки-предшественники. Применяемые в данном документе Pdx1-позитивные панкреатические клетки-предшественники могут быть получены из любого источника или сгенерированы в соответствии с любым подходящим протоколом. В некоторых аспектах клетки первичной кишечной трубки дифференцируются в Pdx1-позитивные панкреатические клетки-предшественники. В некоторых аспектах Pdx1-позитивные панкреатические клетки-предшественники дополнительно дифференцируются, например, в NKX6-1-позитивные панкреатические клетки-предшественники, Ngn3-позитивные эндокринные клетки-предшественники, инсулин-позитивные эндокринные клетки с последующей индукцией или созреванием в клетки SC-β.
[257] В некоторых аспектах Pdx1-позитивные панкреатические клетки-предшественники можно получить путем дифференцировки по меньшей мере некоторых клеток первичной кишечной трубки в популяции в Pdx1-позитивные панкреатические клетки-предшественники, например, путем приведения клеток первичной кишечной трубки в контакт с i) по меньшей мере одним ингибитором сигнального пути костного морфогенетического белка (BMP), ii) по меньшей мере одним фактором роста из семейства FGF, iii) по меньшей мере одним ингибитором пути SHH, iv) по меньшей мере одним активатором сигнального пути ретиноевой кислоты (RA); и v) по меньшей мере одним активатором протеинкиназы С, чтобы индуцировать дифференцировку по меньшей мере некоторых клеток первичной кишечной трубки в Pdx1-позитивные панкреатические клетки-предшественники, при этом Pdx1-позитивные панкреатические клетки-предшественники экспрессируют Pdx1.
[258] В изобретении предусмотрено применение любого ингибитора сигнального пути BMP, который индуцирует дифференцировку клеток первичной кишечной трубки в Pdx1-позитивные панкреатические клетки-предшественники (например, один или в комбинации с по меньшей мере одним фактором роста из семейства FGF, по меньшей мере одним ингибитором пути SHH, по меньшей мере одним активатором сигнального пути ретиноевой кислоты и по меньшей мере одним активатором протеинкиназы С). В некоторых вариантах реализации изобретения ингибитор сигнального пути BMP включает LDN193189.
[259] В изобретении предусмотрено применение любого фактора роста из семейства FGF, который индуцирует дифференцировку клеток первичной кишечной трубки в Pdx1-позитивные панкреатические клетки-предшественники (например, один или в комбинации с по меньшей мере одним ингибитором сигнального пути BMP, по меньшей мере одним ингибитором пути SHH, по меньшей мере одним активатором сигнального пути ретиноевой кислоты и по меньшей мере одним активатором протеинкиназы С). В некоторых вариантах реализации изобретения по меньшей мере один фактор роста из семейства FGF включает фактор роста кератиноцитов (KGF). В некоторых вариантах реализации изобретения по меньшей мере один фактор роста из семейства FGF выбран из группы, состоящей из FGF2, FGF8B, FGF10 и FGF21.
[260] В изобретении предусмотрено применение любого ингибитора пути SHH, который индуцирует дифференцировку клеток первичной кишечной трубки в Pdx1-позитивные панкреатические клетки-предшественники (например, один или в комбинации с по меньшей мере одним ингибитором сигнального пути BMP, по меньшей мере одним фактором роста из семейства FGF, по меньшей мере одним активатором сигнального пути ретиноевой кислоты и по меньшей мере одним активатором протеинкиназы С). В некоторых вариантах реализации изобретения ингибитор пути SHH включает Sant1.
[261] В изобретении предусмотрено применение любого активатора сигнального пути RA, который индуцирует дифференцировку клеток первичной кишечной трубки в Pdx1-позитивные панкреатические клетки-предшественники (например, один или в комбинации с по меньшей мере одним ингибитором сигнального пути BMP, по меньшей мере одним фактором роста из семейства FGF, по меньшей мере одним ингибитором пути SHH и по меньшей мере одним активатором протеинкиназы С). В некоторых вариантах реализации изобретения активатор сигнального пути RA включает ретиноевую кислоту.
[262] В изобретении предусмотрено применение любого активатора протеинкиназы С (PKC), который индуцирует дифференцировку клеток первичной кишечной трубки в Pdx1-позитивные панкреатические клетки-предшественники (например, один или в комбинации с по меньшей мере одним ингибитором сигнального пути BMP, по меньшей мере одним фактором роста из семейства FGF, по меньшей мере одним ингибитором пути SHH и по меньшей мере одним активатором сигнального пути ретиноевой кислоты). В некоторых вариантах реализации изобретения активатор PKC включает PdbU. В некоторых вариантах реализации изобретения активатор PKC включает ТРВ.
[263] Специалисту в данной области техники понятно, что концентрации применяемых агентов (например, факторов роста) могут варьироваться. В некоторых вариантах реализации изобретения клетки первичной кишечной трубки приводят в контакт с ингибитором сигнального пути BMP в концентрации 20 нМ - 2000 нМ. В некоторых вариантах реализации изобретения клетки первичной кишечной трубки приводят в контакт с ингибитором сигнального пути BMP в концентрации 30 40 нМ, 50 нМ, 60 нМ, 70 нМ, 80 нМ, 90 нМ, 100 нМ, 110 нМ, 120 нМ, 130 нМ, 140 нМ, 150 нМ, 160 нМ, 170 нМ, 180 нМ или 190 нМ. В некоторых вариантах реализации изобретения клетки первичной кишечной трубки приводят в контакте ингибитором сигнального пути BMP в концентрации 191 нМ, 192 нМ, 193 нМ, 194 нМ, 195 нМ, 196 нМ, 197 нМ, 198 нМ или 199 нМ. В некоторых вариантах реализации изобретения клетки первичной кишечной трубки приводят в контакте ингибитором сигнального пути BMP в концентрации 300 нМ, 400 нМ, 500 нМ, 600 нМ, 700 нМ, 800 нМ, 900 нМ, 1000 нМ, 1100 нМ, 1200 нМ, 1300 нМ, 1400 нМ, 1500 нМ, 1600 нМ, 1700 нМ, 1800 нМ или 1900 нМ. В некоторых вариантах реализации изобретения клетки первичной кишечной трубки приводят в контакте ингибитором сигнального пути BMP в концентрации 210 нМ, 220 нМ, 230 нМ, 240 нМ, 250 нМ, 260 нМ, 270 нМ, 280 нМ или 290 нМ. В некоторых вариантах реализации изобретения клетки первичной кишечной трубки приводят в контакт с ингибитором сигнального пути BMP в концентрации 200 нМ.
[264] В некоторых вариантах реализации изобретения клетки первичной кишечной трубки приводят в контакт по меньшей мере с одним фактором роста из семейства FGF в концентрации 5 нг/мл - 500 нг/мл. В некоторых вариантах реализации изобретения клетки первичной кишечной трубки приводят в контакт по меньшей мере с одним фактором роста из семейства FGF в концентрации 10 нг/мл, 15 нг/мл, 20 нг/мл, 25 нг/мл, 30 нг/мл, 35 нг/мл или 40 нг/мл. В некоторых вариантах реализации изобретения клетки первичной кишечной трубки приводят в контакт по меньшей мере с одним фактором роста из семейства FGF в концентрации 60 нг/мл, 65 нг/мл, 70 нг/мл, 75 нг/мл, 80 нг/мл, 85 нг/мл, 90 нг/мл, 95 нг/мл или 100 нг/мл. В некоторых вариантах реализации изобретения клетки первичной кишечной трубки приводят в контакт по меньшей мере с одним фактором роста из семейства FGF в концентрации 41 нг/мл, 42 нг/мл, 43 нг/мл, 44 нг/мл, 45 нг/мл, 46 нг/мл, 47 нг/мл, 48 нг/мл или 49 нг/мл. В некоторых вариантах реализации изобретения клетки первичной кишечной трубки приводят в контакт по меньшей мере с одним фактором роста из семейства FGF в концентрации 51 нг/мл, 52 нг/мл, 53 нг/мл, 54 нг/мл, 55 нг/мл, 56 нг/мл, 57 нг/мл, 58 нг/мл или 59 нг/мл. В некоторых вариантах реализации изобретения клетки первичной кишечной трубки приводят в контакт по меньшей мере с одним фактором роста из семейства FGF в концентрации 50 нг/мл.
[265] В некоторых вариантах реализации изобретения клетки первичной кишечной трубки приводят в контакт по меньшей мере с одним ингибитором сигнального пути SHH в концентрации 0,1 мкМ - 0,5 мкМ. В некоторых вариантах реализации изобретения клетки первичной кишечной трубки приводят в контакт по меньшей мере с одним ингибитором сигнального пути SHH в концентрации 0,11 мкМ, 0,12 мкМ, 0,13 мкМ, 0,14 мкМ, 0,15 мкМ, 0,16 мкМ, 0,17 мкМ, 0,18 мкМ, 0,19 мкМ, 0,2 мкМ, 0,21 мкМ, 0,22 мкМ, 0,23 мкМ или 0,24 мкМ. В некоторых вариантах реализации изобретения клетки первичной кишечной трубки приводят в контакт по меньшей мере с одним ингибитором сигнального пути SHH в концентрации 0,26 мкМ, 0,27 мкМ, 0,28 мкМ, 0,29 мкМ, 0,30 мкМ, 0,31 мкМ, 0,32 мкМ, 0,33 мкМ, 0,34 мкМ, 0,35 мкМ, 0,36 мкМ, 0,37 мкМ, 0,38 мкМ, 0,39 мкМ, 0,40 мкМ, 0,41 мкМ, 0,42 мкМ, 0,43 мкМ, 0,44 мкМ, 0,45 мкМ, 0,46 мкМ, 0,47 мкМ, 0,48 мкМ, 0,49 мкМ. В некоторых вариантах реализации изобретения клетки первичной кишечной трубки приводят в контакт по меньшей мере с одним ингибитором сигнального пути SHH в концентрации 0,25 мкМ.
[266] В некоторых вариантах реализации изобретения клетки первичной кишечной трубки приводят в контакт с активатором сигнального пути RA в концентрации 0,01 мкМ - 1,0 мкМ. В некоторых вариантах реализации изобретения клетки первичной кишечной трубки приводят в контакт с активатором сигнального пути RA в концентрации 0,02 мкМ, 0,03 мкМ, 0,04 мкМ, 0,05 мкМ, 0,06 мкМ, 0,07 мкМ, 0,08 мкМ или 0,09 мкМ. В некоторых вариантах реализации изобретения клетки первичной кишечной трубки приводят в контакт с активатором сигнального пути RA в концентрации 0,20 мкМ, 0,30 мкМ, 0,40 мкМ, 0,05 мкМ, 0,60 мкМ, 0,70 мкМ, 0,80 мкМ или 0,90 мкМ. В некоторых вариантах реализации изобретения клетки первичной кишечной трубки приводят в контакт с активатором сигнального пути RA в концентрации 0,1 мкМ.
[267] В некоторых вариантах реализации изобретения клетки первичной кишечной трубки приводят в контакт с активатором PKC в концентрации 50 нМ - 5000 нМ. В некоторых вариантах реализации изобретения клетки первичной кишечной трубки приводят в контакт с активатором PKC в концентрации 100 нМ, 150 нМ, 200 нМ, 250 нМ, 300 нМ, 350 нМ, 400 нМ, 450 нМ, 460 нМ, 470 нМ, 480 нМ или 490 нМ. В некоторых вариантах реализации изобретения клетки первичной кишечной трубки приводят в контакт с активатором PKC в концентрации 491 нМ, 492 нМ, 493 нМ, 494 нМ, 495 нМ. 496 нМ, 497 нМ, 498 нМ или 499 нМ. В некоторых вариантах реализации изобретения клетки первичной кишечной трубки приводят в контакт с активатором PKC в концентрации 600 нМ, 700 нМ, 800 нМ, 900 нМ, 1000 нМ, 1100 нМ, 1200 нМ, 1300 нМ, 1400 нМ, 1500 нМ, 1600 нМ, 1700 нМ, 1800 нМ, 1900 нМ или 2000 нМ. В некоторых вариантах реализации изобретения клетки первичной кишечной трубки приводят в контакт с активатором PKC в концентрации 501 нМ, 502 нМ, 503 нМ, 504 нМ, 505 нМ, 506 нМ, 507 нМ, 508 нМ, or 509 нМ, 510 нМ, 520 нМ, 530 нМ, 540 нМ, 550 нМ, 560 нМ, 570 нМ, 580 нМ или 590 нМ. В некоторых вариантах реализации изобретения клетки первичной кишечной трубки приводят в контакт с активатором PKC в концентрации 500 нМ.
[268] В общем случае клетки первичной кишечной трубки содержат в подходящей культуральной среде (например, суспензионной культуре) на протяжении периода времени, достаточного, чтобы индуцировать дифференцировку по меньшей мере некоторых клеток первичной кишечной трубки в Pdx1-позитивные панкреатические клетки-предшественники. Типовая подходящая культуральная среда приведена ниже в Таблице 3.
[269]

[270] В некоторых вариантах реализации изобретения в качестве подходящей культуральной среды для дифференцировки клеток первичной кишечной трубки в панкреатические клетки-предшественники можно использовать среду S3.
[271] В некоторых вариантах реализации изобретения приведение в контакт клеток первичной кишечной трубки проводят в суспензионной культуре. В некоторых вариантах реализации изобретения суспензионную культуру поддерживают в роллерном флаконе. В некоторых вариантах реализации изобретения период времени составляет по меньшей мере 2 дня. В некоторых вариантах реализации изобретения суспензионную культуру пополняют каждый день.
[272] В некоторых вариантах реализации изобретения клетки первичной кишечной трубки можно получить путем дифференцировки по меньшей мере некоторых клеток первичной кишечной трубки в популяции в Pdx1-позитивные панкреатические клетки-предшественники, например, путем приведения клеток первичной кишечной трубки в контакт с i) LDN193189, ii) KGF, iii) Sant1; iv) RA; и iv) PdbU, чтобы индуцировать дифференцировку по меньшей мере некоторых клеток первичной кишечной трубки в Pdx1-позитивные панкреатические клетки-предшественники, при этом Pdx1-позитивные панкреатические клетки-предшественники экспрессируют Pdx1.
[273] Индукция дифференцировки Pdx1-позитивных панкреатических клеток-предшественников в NKX6-1+панкреатические клетки-предшественники
[274] Аспекты изобретения включают NKX6-1-позитивные панкреатические клетки-предшественники. Применяемые в данном документе NKX6-1-позитивные панкреатические клетки-предшественники могут быть получены из любого источника или сгенерированы в соответствии с любым подходящим протоколом. В некоторых аспектах Pdx1-позитивные панкреатические клетки-предшественники дифференцируются в NKX6-1-позитивные панкреатические клетки-предшественники. В некоторых аспектах NKX6-1-позитивные панкреатические клетки-предшественники дополнительно дифференцируются, например, в Ngn3-позитивные эндокринные клетки-предшественники или инсулин-позитивные эндокринные клетки с последующей индукцией или созреванием в клетки SC-β.
[275] В некоторых аспектах способ получения NKX6-1-позитивной панкреатической клетки-предшественника из Pdx1-позитивной панкреатической клетки-предшественника включает приведение популяции клеток (например, в условиях, которые стимулируют кластеризацию клеток), содержащей Pdx1-позитивные панкреатические клетки-предшественники в контакт по меньшей мере с двумя факторами созревания β-клеток, включающими а) по меньшей мере один фактор роста из семейства факторов роста фибробластов (FGF), b) ингибитор пути «звукового ежа» и, необязательно, с) низкую концентрацию активатора сигнального пути ретиноевой кислоты (RA), на протяжении периода времени, составляющего по меньшей мере пять дней, чтобы индуцировать дифференцировку по меньшей мере одной Pdx1-позитивной панкреатической клетки-предшественника в популяции в NKX6-1-позитивную панкреатическую клетку-предшественника, при этом NKX6-1-позитивные панкреатические клетки-предшественники экспрессируют NKX6-1.
[276] В некоторых вариантах реализации изобретения Pdx1-позитивные, NKX6-1-позитивные панкреатические клетки-предшественники получают путем приведения Pdx1-позитивных панкреатических клеток-предшественников в условиях, которые стимулируют кластеризацию клеток, в контакт с i) по меньшей мере одним фактором роста из семейства FGF, ii) по меньшей мере одним ингибитором пути SHH и, необязательно, iii) низкими концентрациями активатора сигнального пути RA, на протяжении периода времени, составляющего пять дней, чтобы индуцировать дифференцировку по меньшей мере некоторых Pdx1-позитивных панкреатических клеток-предшественников в Pdx1-позитивные, NKX6-1-позитивные панкреатические клетки-предшественники, при этом Pdx1-позитивные, NKX6-1-позитивные панкреатические клетки-предшественники экспрессируют Pdx1 и NKX6-1.
[277] В некоторых вариантах реализации изобретения Pdx1-позитивные, NKX6-1-позитивные панкреатические клетки-предшественники получают путем приведения Pdx1-позитивных панкреатических клеток-предшественников в контакт с i) по меньшей мере одним фактором роста из семейства FGF, ii) по меньшей мере одним ингибитором пути SHH и iii) активатором сигнального пути RA, чтобы индуцировать дифференцировку по меньшей мере некоторых Pdx1-позитивных панкреатических клеток-предшественников в Pdx1-позитивные, NKX6-1-позитивные панкреатические клетки-предшественники, при этом Pdx1-позитивные, NKX6-1-позитивные панкреатические клетки-предшественники экспрессируют Pdx1 и NKX6-1.
[278] В некоторых вариантах реализации изобретения Pdx1-позитивные панкреатические клетки-предшественники получают из популяции плюрипотентных клеток. В некоторых вариантах реализации изобретения Pdx1-позитивные панкреатические клетки-предшественники получают из популяции клеток iPS. В некоторых вариантах реализации изобретения Pdx1-позитивные панкреатические клетки-предшественники получают из популяции клеток ESC. В некоторых вариантах реализации изобретения Pdx1-позитивные панкреатические клетки-предшественники получают из популяции клеток дефинитивной энтодермы. В некоторых вариантах реализации изобретения Pdx1-позитивные панкреатические клетки-предшественники получают из популяции клеток первичной кишечной трубки.
[279] В изобретении предусмотрено применение любого фактора роста из семейства FGF, который индуцирует дифференцировку Pdx1-позитивных панкреатических клеток-предшественников в NKX6-1-позитивные панкреатические клетки-предшественники (например, один или в комбинации с по меньшей мере одним ингибитором пути SHH или, необязательно, по меньшей мере одним активатором сигнального пути ретиноевой кислоты). В некоторых вариантах реализации изобретения по меньшей мере один фактор роста из семейства FGF включает фактор роста кератиноцитов (KGF). В некоторых вариантах реализации изобретения по меньшей мере один фактор роста из семейства FGF выбран из группы, состоящей из FGF2, FGF8B, FGF10 и FGF21.
[280] В изобретении предусмотрено применение любого ингибитора пути SHH, который индуцирует дифференцировку Pdx1-позитивных панкреатических клеток-предшественников в NKX6-1-позитивные панкреатические клетки-предшественники (например, один или в комбинации с по меньшей мере одним фактором роста из семейства FGF или по меньшей мере одним активатором сигнального пути ретиноевой кислоты). В некоторых вариантах реализации изобретения ингибитор пути SHH включает Sant1.
[281] В изобретении предусмотрено применение любого активатора сигнального пути RA, который индуцирует дифференцировку Pdx1-позитивных панкреатических клеток-предшественников в NKX6-1-позитивные панкреатические клетки-предшественники (например, один или в комбинации с по меньшей мере одним фактором роста из семейства FGF или по меньшей мере одним ингибитором пути SHH). В некоторых вариантах реализации изобретения активатор сигнального пути RA включает ретиноевую кислоту.
[282] В некоторых вариантах реализации изобретения указанный способ включает приведение популяции клеток (например, Pdx1-позитивных панкреатических клеток-предшественников) в контакт по меньшей мере с одним дополнительным фактором созревания β-клеток. В некоторых вариантах реализации изобретения по меньшей мере один дополнительный фактор созревания β-клеток включает по меньшей мере один фактор роста из семейства EGF. В некоторых вариантах реализации изобретения указанный способ включает приведение Pdx1-позитивных панкреатических клеток-предшественников в контакт по меньшей мере с одним фактором роста из семейства EGF. В изобретении предусмотрено применение любого фактора роста из семейства EGF, который облегчает дифференцировку Pdx1-позитивных панкреатических клеток-предшественников в NKX6-1-позитивные панкреатические клетки-предшественники (например, вместе с любой комбинацией из по меньшей мере одного фактора роста из семейства FGF, по меньшей мере одного ингибитора пути SHH и, необязательно, по меньшей мере одного активатора сигнального пути RA). В некоторых вариантах реализации изобретения по меньшей мере один фактор роста из семейства EGF включает бетацеллюлин. В некоторых вариантах реализации изобретения по меньшей мере один фактор роста из семейства EGF включает EGF.
[283] Специалисту в данной области техники понятно, что концентрации применяемых агентов (например, факторов роста) могут варьироваться. В некоторых вариантах реализации изобретения Pdx1-позитивные панкреатические клетки-предшественники приводят в контакт по меньшей мере с одним фактором роста из семейства FGF в концентрации 1 нг/мл - 100 нг/мл. В некоторых вариантах реализации изобретения Pdx1-позитивные панкреатические клетки-предшественники приводят в контакт по меньшей мере с одним фактором роста из семейства FGF в концентрации 5 нг/мл, 10 нг/мл, 15 нг/мл, 20 нг/мл, 25 нг/мл, 30 нг/мл, 35 нг/мл или 40 нг/мл. В некоторых вариантах реализации изобретения Pdx1-позитивные панкреатические клетки-предшественники приводят в контакт по меньшей мере с одним фактором роста из семейства FGF в концентрации 60 нг/мл, 65 нг/мл, 70 нг/мл, 75 нг/мл, 80 нг/мл, 85 нг/мл, 90 нг/мл, 95 нг/мл или 100 нг/мл. В некоторых вариантах реализации изобретения Pdx1-позитивные панкреатические клетки-предшественники приводят в контакт по меньшей мере с одним фактором роста из семейства FGF в концентрации 41 нг/мл, 42 нг/мл, 43 нг/мл, 44 нг/мл, 45 нг/мл, 46 нг/мл, 47 нг/мл, 48 нг/мл или 49 нг/мл. В некоторых вариантах реализации изобретения Pdx1-позитивные панкреатические клетки-предшественники приводят в контакт по меньшей мере с одним фактором роста из семейства FGF в концентрации 51 нг/мл, 52 нг/мл, 53 нг/мл, 54 нг/мл, 55 нг/мл, 56 нг/мл, 57 нг/мл, 58 нг/мл или 59 нг/мл. В некоторых вариантах реализации изобретения Pdx1-позитивные панкреатические клетки-предшественники приводят в контакт по меньшей мере с одним фактором роста из семейства FGF в концентрации 50 нг/мл.
[284] В некоторых вариантах реализации изобретения Pdx1-позитивные панкреатические клетки-предшественники приводят в контакт по меньшей мере с одним ингибитором пути SHH в концентрации 0,1 мкМ - 0,5 мкМ. В некоторых вариантах реализации изобретения Pdx1-позитивные панкреатические клетки-предшественники приводят в контакт по меньшей мере с одним ингибитором пути SHH в концентрации 0,11 мкМ, 0,12 мкМ, 0,13 мкМ, 0,14 мкМ, 0,15 мкМ, 0,16 мкМ, 0,17 мкМ, 0,18 мкМ, 0,19 мкМ, 0,2 мкМ, 0,21 мкМ, 0,22 мкМ, 0,23 мкМ или 0,24 мкМ. В некоторых вариантах реализации изобретения Pdx1-позитивные панкреатические клетки-предшественники приводят в контакт по меньшей мере с одним ингибитором пути SHH в концентрации 0,26 мкМ, 0,27 мкМ, 0,28 мкМ, 0,29 мкМ, 0,30 мкМ, 0,31 мкМ, 0,32 мкМ, 0,33 мкМ, 0,34 мкМ, 0,35 мкМ, 0,36 мкМ, 0,37 мкМ, 0,38 мкМ, 0,39 мкМ, 0,40 мкМ, 0,41 мкМ, 0,42 мкМ, 0,43 мкМ, 0,44 мкМ, 0,45 мкМ, 0,46 мкМ, 0,47 мкМ, 0,48 мкМ, 0,49 мкМ. В некоторых вариантах реализации изобретения Pdx1-позитивные панкреатические клетки-предшественники приводят в контакт по меньшей мере с одним ингибитором пути SHH в концентрации 0,25 мкМ.
[285] В некоторых вариантах реализации изобретения Pdx1-позитивные панкреатические клетки-предшественники приводят в контакт с активатором сигнального пути RA в концентрации 0,01 мкМ - 1,0 мкМ. В некоторых вариантах реализации изобретения Pdx1-позитивные панкреатические клетки-предшественники приводят в контакт с активатором сигнального пути RA в концентрации 0,02 мкМ, 0,03 мкМ, 0,04 мкМ, 0,05 мкМ, 0,06 мкМ, 0,07 мкМ, 0,08 мкМ или 0,09 мкМ. В некоторых вариантах реализации изобретения Pdx1-позитивные панкреатические клетки-предшественники приводят в контакт с активатором сигнального пути RA в концентрации 0,20 мкМ, 0,30 мкМ, 0,40 мкМ, 0,05 мкМ, 0,60 мкМ, 0,70 мкМ, 0,80 мкМ или 0,90 мкМ. В некоторых вариантах реализации изобретения Pdx1-позитивные панкреатические клетки-предшественники приводят в контакт с активатором сигнального пути RA в концентрации 0,1 мкМ.
[286] В некоторых вариантах реализации изобретения Pdx1-позитивные панкреатические клетки-предшественники приводят в контакт по меньшей мере с одним фактором роста из семейства EGF в концентрации 2 нг/мл - 200 нг/мл. В некоторых вариантах реализации изобретения Pdx1-позитивные панкреатические клетки-предшественники приводят в контакт по меньшей мере с одним фактором роста из семейства EGF в концентрации 3 нг/мл, 4 нг/мл, 5 нг/мл, 6 нг/мл, 7 нг/мл, 8 нг/мл, 9 нг/мл, 10 нг/мл, 11 нг/мл, 12 нг/мл, 13 нг/мл, 14 нг/мл, 16 нг/мл, 17 нг/мл, 18 нг/мл или 19 нг/мл. В некоторых вариантах реализации изобретения Pdx1-позитивные панкреатические клетки-предшественники приводят в контакт по меньшей мере с одним фактором роста из семейства EGF в концентрации 30 нг/мл, 35 нг/мл, 40 нг/мл, 45 нг/мл, 50 нг/мл, 55 нг/мл, 60 нг/мл, 65 нг/мл, 70 нг/мл, 75 нг/мл, 80 нг/мл, 85 нг/мл, 90 нг/мл, 95 нг/мл или 100 нг/мл. В некоторых вариантах реализации изобретения Pdx1-позитивные панкреатические клетки-предшественники приводят в контакт по меньшей мере с одним фактором роста из семейства EGF в концентрации 21 нг/мл, 22 нг/мл, 23 нг/мл, 24 нг/мл, 25 нг/мл, 26 нг/мл, 27 нг/мл, 28 нг/мл или 29 нг/мл. В некоторых вариантах реализации изобретения Pdx1-позитивные панкреатические клетки-предшественники приводят в контакт по меньшей мере с одним фактором роста из семейства EGF в концентрации 20 нг/мл.
[287] В общем случае Pdx1-позитивные панкреатические клетки-предшественники содержат в подходящей культуральной среде на протяжении периода времени, достаточного, чтобы индуцировать дифференцировку по меньшей мере некоторых Pdx1-позитивных панкреатических клеток-предшественников в популяции в Pdx1-позитивные, NKX6-1-позитивные панкреатические клетки-предшественники. Типовая подходящая культуральная среда приведена выше в Таблице 3. В некоторых вариантах реализации изобретения условия, которые стимулируют кластеризацию клеток включают суспензионную культуру. В некоторых вариантах реализации изобретения суспензионную культуру поддерживают в роллерном флаконе. В некоторых вариантах реализации изобретения период времени составляет по меньшей мере 5 дней. В некоторых вариантах реализации изобретения суспензионную культуру пополняют через день. В некоторых вариантах реализации изобретения факторы созревания β-клеток пополняют через день.
[288] В некоторых вариантах реализации изобретения в суспензионную культуру на протяжении 5 дней не добавляют активатор протеинкиназы С. В некоторых вариантах реализации изобретения активатор протеинкиназы С удаляют из суспензионной культуры перед истечением периода в 5 дней. В некоторых вариантах реализации изобретения активатор протеинкиназы С включает PdbU. В некоторых вариантах реализации изобретения в суспензионную культуру на протяжении 5 дней не добавляют ингибитор сигнального пути BMP. В некоторых вариантах реализации изобретения ингибитор сигнального пути BMP удаляют из суспензионной культуры на протяжении времени, составляющего менее 5 дней. В некоторых вариантах реализации изобретения ингибитор сигнального пути BMP включает LDN193189.
[289] В некоторых вариантах реализации изобретения по меньшей мере 10% Pdx1-позитивных панкреатических клеток-предшественников в популяции индуцируют до дифференцировки в Pdx1-позитивные, NKX6-1-позитивные панкреатические клетки-предшественники. В некоторых вариантах реализации изобретения по меньшей мере 95% Pdx1-позитивных панкреатических клеток-предшественников индуцируют до дифференцировки в Pdx1-позитивные, NKX6-1-позитивные панкреатические клетки-предшественники.
[290] В общем случае любая Pdx1-позитивная панкреатическая клетка-предшественник может дифференцироваться в Pdx1-позитивную, NKX6-1-позитивную панкреатическую клетку-предшественника. В некоторых вариантах реализации изобретения NKX6-1-позитивные панкреатические клетки-предшественники экспрессируют Pdx1, NKX6-1 и/или FoxA2.
[291] В некоторых вариантах реализации изобретения Pdx1-позитивные, NKX6-1-позитивные панкреатические клетки-предшественники получают путем приведения Pdx1-позитивных панкреатических клеток-предшественников в условиях, которые стимулируют кластеризацию клеток, в контакт с i) по меньшей мере одним фактором роста из семейства FGF, ii) по меньшей мере одним ингибитором пути SHH и, необязательно, iii) низкими концентрациями активатора сигнального пути RA, на протяжении периода времени, составляющего пять дней, чтобы индуцировать дифференцировку по меньшей мере некоторых Pdx1-позитивных панкреатических клеток-предшественников в Pdx1-позитивные, NKX6-1-позитивные панкреатические клетки-предшественники, при этом Pdx1-позитивные, NKX6-1-позитивные панкреатические клетки-предшественники экспрессируют Pdx1 и NKX6-1.
[292] В некоторых вариантах реализации изобретения NKX6-1-позитивные панкреатические клетки-предшественники можно получить путем дифференцировки по меньшей мере некоторых Pdx1-позитивных панкреатических клеток-предшественников в Pdx1-позитивные, NKX6-1-позитивные панкреатические клетки-предшественники путем приведения Pdx1-позитивных панкреатических клеток-предшественников в условиях, которые стимулируют кластеризацию клеток, в контакт с i) по меньшей мере одним фактором роста из семейства FGF, ii) по меньшей мере одним ингибитором пути SHH и, необязательно, iii) активатором сигнального пути RA через день на протяжении периода времени, составляющего пять дней, чтобы индуцировать дифференцировку по меньшей мере некоторых Pdx1-позитивных панкреатических клеток-предшественников в популяции в NKX6-1-позитивные панкреатические клетки-предшественники, при этом NKX6-1-позитивные панкреатические клетки-предшественники экспрессируются Pdx1 и NKX6-1.
[293] В некоторых вариантах реализации изобретения NKX6-1-позитивные панкреатические клетки-предшественники можно получить путем дифференцировки по меньшей мере некоторых Pdx1-позитивных панкреатических клеток-предшественников в популяции в Pdx1-позитивные, NKX6-1-позитивные панкреатические клетки-предшественники, например, путем приведения Pdx1-позитивных панкреатических клеток-предшественников в контакт с i) по меньшей мере одним фактором роста из семейства FGF, ii) по меньшей мере одним ингибитором пути SHH и, необязательно, iii) активатором сигнального пути RA, чтобы индуцировать дифференцировку по меньшей мере некоторых Pdx1-позитивных панкреатических клеток-предшественников в популяции в NKX6-1-позитивные панкреатические клетки-предшественники, при этом NKX6-1-позитивные панкреатические клетки-предшественники экспрессируют Pdx1 и NKX6-1.
[294] Индукция дифференцировки NKX6-1 + панкреатических клеток-предшественников инсулин + эндокринные клетки
[295] Аспекты изобретения включают инсулин-позитивные эндокринные клетки. Применяемые в данном документе инсулин-позитивные эндокринные клетки могут быть получены из любого источника или сгенерированы в соответствии с любым подходящим протоколом. В некоторых аспектах NKX6-1-позитивные панкреатические клетки-предшественники дифференцируются в инсулин-позитивные эндокринные клетки. В некоторых аспектах инсулин-позитивные эндокринные клетки дополнительно дифференцируются, например, путем индукции или созревания в клетки SC-β.
[296] В некоторых аспектах способ получения инсулин-позитивных эндокринных клеток из NKX6-1-позитивных панкреатических клеток-предшественников включает приведение популяции клеток (например, в условиях, которые стимулируют кластеризацию клеток), содержащей NKX6-1-позитивные панкреатические клетки-предшественники, в контакт по меньшей мере с двумя факторами созревания β-клеток, включающими а) ингибитор сигнального пути TGF-β и b) активатор сигнального пути тиреоидного гормона, чтобы индуцировать дифференцировку по меньшей мере одной NKX6-1-позитивной панкреатической клетки-предшественника в популяции в инсулин-позитивную эндокринную клетку, при этом инсулин-позитивная панкреатическая клетка-предшественник экспрессирует инсулин.
[297] В изобретении предусмотрено применение любого ингибитора сигнального пути TGF-β, который индуцирует дифференцировку NKX6-1-позитивных панкреатических клеток-предшественников в инсулин-позитивные эндокринные клетки (например, один или в комбинации с другими факторами созревания β-клеток, например, активатором сигнального пути тиреоидного гормона). В некоторых вариантах реализации изобретения сигнальный путь TGF-β включает киназную сигнализацию рецептора TGF-β типа I. В некоторых вариантах реализации изобретения ингибитор сигнального пути TGF-β включает ингибитор II Alk5.
[298] В изобретении предусмотрено применение любого активатора сигнального пути тиреоидного гормона, который индуцирует дифференцировку NKX6-1-позитивных панкреатических клеток-предшественников в инсулин-позитивные эндокринные клетки (например, один или в комбинации с другими факторами созревания β-клеток, например, ингибитором сигнального пути TGF-β). В некоторых вариантах реализации изобретения активатор сигнального пути тиреоидного гормона включает трийодотиронин (Т3).
[299] В некоторых вариантах реализации изобретения указанный способ включает приведение популяции клеток (например, NKX6-1-позитивных панкреатических клеток-предшественников) в контакт по меньшей мере с одним дополнительным фактором созревания β-клеток. В некоторых вариантах реализации изобретения указанный способ включает приведение Pdx1-позитивных, NKX6-1-позитивных панкреатических клеток-предшественников в контакт по меньшей мере с одним компонентом из i) ингибитора пути SHH, ii) активатора сигнального пути RA, iii) ингибитора γ-секретазы, iv) по меньшей мере одного фактора роста из семейства эпидермальных факторов роста (EGF) и, необязательно, v) ингибитора протеинкиназы.
[300] В некоторых вариантах реализации изобретения по меньшей мере один дополнительный фактор созревания β-клеток включает ингибитор γ-секретазы. В изобретении предусмотрено применение любого ингибитора γ-секретазы, который способен индуцировать дифференцировку NKX6-1-позитивных панкреатических клеток-предшественников в популяции в инсулин-позитивные эндокринные клетки (например, один или в комбинации с любым компонентом из ингибитора сигнального пути TGF-β и/или активатора сигнального пути тиреоидного гормона). В некоторых вариантах реализации изобретения ингибитор γ-секретазы включает XXI. В некоторых вариантах реализации изобретения ингибитор γ-секретазы включает DAPT.
[301] В некоторых вариантах реализации изобретения по меньшей мере один дополнительный фактор созревания β-клеток включает по меньшей мере один фактор роста из семейства EGF. В изобретении предусмотрено применение любого фактора роста из семейства EGF, который способен индуцировать дифференцировку NKX6-1-позитивных панкреатических клеток-предшественников в популяции в инсулин-позитивные эндокринные клетки (например, один или в комбинации с любым компонентом из ингибитора сигнального пути TGF-β и/или активатора сигнального пути тиреоидного гормона). В некоторых вариантах реализации изобретения по меньшей мере один фактор роста из семейства EGF включает бетацеллюлин. В некоторых вариантах реализации изобретения по меньшей мере один фактор роста из семейства EGF включает EGF.
[302] В некоторых вариантах реализации изобретения по меньшей мере один дополнительный фактор созревания β-клеток включает низкую концентрацию активатора сигнального пути ретиноевой кислоты (RA). В изобретении предусмотрено применение любого активатора сигнального пути RA, который индуцирует дифференцировку NKX6-1-позитивных панкреатических клеток-предшественников в инсулин-позитивные эндокринные клетки (например, один или в комбинации с любым компонентом из ингибитора сигнального пути TGF-β и/или активатора сигнального пути тиреоидного гормона). В некоторых вариантах реализации изобретения активатор сигнального пути RA включает RA.
[303] В некоторых вариантах реализации изобретения по меньшей мере один дополнительный фактор созревания β-клеток включает ингибитор пути «звукового ежа» (SHH). В изобретении предусмотрено применение любого ингибитора пути SHH, который индуцирует дифференцировку NKX6-1-позитивных панкреатических клеток-предшественников в инсулин-позитивные эндокринные клетки (например, один или в комбинации с любым компонентом из ингибитора сигнального пути TGF-β и/или активатора сигнального пути тиреоидного гормона). В некоторых вариантах реализации изобретения ингибитор пути SHH включает Sant1.
[304] В некоторых вариантах реализации изобретения популяцию клеток (например, NKX6-1-позитивных панкреатических клеток-предшественников) обрабатывают глюкозой.
[305] В некоторых вариантах реализации изобретения популяцию клеток необязательно приводят в контакт с ингибитором протеинкиназы. В некоторых вариантах реализации изобретения популяцию клеток не приводят в контакт с ингибитором протеинкиназы. В некоторых вариантах реализации изобретения популяцию клеток приводят в контакт с ингибитором протеинкиназы. В изобретении предусмотрено применение любого ингибитора протеинкиназы, который способен индуцировать дифференцировку NKX6-1-позитивных панкреатических клеток-предшественников в популяции в инсулин-позитивные эндокринные клетки (например, один или в комбинации с любым компонентом из ингибитора сигнального пути TGF-β и/или активатора сигнального пути тиреоидного гормона). В некоторых вариантах реализации изобретения ингибитор протеинкиназы включает стауроспорин.
[306] В некоторых вариантах реализации изобретения инсулин-позитивные эндокринные клетки получают путем приведения Pdx1-позитивных, NKX6-1-позитивных панкреатических клеток-предшественников в контакт с i) по меньшей мере одним ингибитором пути SHH, ii) активатором сигнального пути RA, iii) ингибитором γ-секретазы, iv) ингибитором сигнального пути TGF-β, v) активатором сигнального пути ТН и vi) по меньшей мере одним фактором роста из семейства эпидермальных факторов роста (EGF), чтобы индуцировать дифференцировку по меньшей мере некоторых Pdx1-позитивных, NKX6-1-позитивных панкреатических клеток-предшественников в Pdx1-позитивные, NKX6-1, инсулин-позитивные эндокринные клетки, при этом Pdx1-позитивные, NKX6-1, инсулин-позитивные эндокринные клетки экспрессируют Pdx1, NKX6-1, NKX2-2, Mafb, glis3, Sur1, Kir6.2, Znt8, SLC2A1, SLC2A3 и/или инсулин.
[307] Специалисту в данной области техники понятно, что концентрации применяемых агентов (например, факторов роста) могут варьироваться.
[308] В некоторых вариантах реализации изобретения NKX6-1-позитивные панкреатические клетки-предшественники приводят в контакт по меньшей мере с одним ингибитором сигнального пути TGF-β в концентрации 100 нМ - 100 мкМ. В некоторых вариантах реализации изобретения NKX6-1-позитивные панкреатические клетки-предшественники приводят в контакт по меньшей мере с одним ингибитором сигнального пути TGF-β в концентрации 10 мкМ. В некоторых вариантах реализации изобретения NKX6-1-позитивные панкреатические клетки-предшественники приводят в контакт по меньшей мере с одним ингибитором сигнального пути TGF-β в концентрации 100 нМ, 200 нМ, 300 нМ, 400 нМ, 500 нМ, 600 нМ, 700 нМ, 800 нМ или 900 нМ. В некоторых вариантах реализации изобретения NKX6-1-позитивные панкреатические клетки-предшественники приводят в контакт по меньшей мере с одним ингибитором сигнального пути TGF-β в концентрации 2 мкМ, 3 мкМ, 4 мкМ, 5 мкМ, 6 мкМ, 7 мкМ, 8 мкМ или 9 мкМ. В некоторых вариантах реализации изобретения NKX6-1-позитивные панкреатические клетки-предшественники приводят в контакт по меньшей мере с одним ингибитором сигнального пути TGF-β в концентрации 9,1 мкМ, 9,2 мкМ, 9,3 мкМ, 9,4 мкМ, 9,5 мкМ, 9,6 мкМ, 9,7 мкМ, 9,8 мкМ или 9,9 мкМ. В некоторых вариантах реализации изобретения NKX6-1-позитивные панкреатические клетки-предшественники приводят в контакт по меньшей мере с одним ингибитором сигнального пути TGF-β в концентрации 11 мкМ, 12 мкМ, 13 мкМ, 14 мкМ, 15 мкМ, 16 мкМ, 17 мкМ, 18 мкМ или 19 мкМ. В некоторых вариантах реализации изобретения NKX6-1-позитивные панкреатические клетки-предшественники приводят в контакт по меньшей мере с одним ингибитором сигнального пути TGF-β в концентрации 10,1 мкМ, 10,2 мкМ, 10,3 мкМ, 10,4 мкМ, 10,5 мкМ, 10,6 мкМ, 10,7 мкМ, 10,8 мкМ или 10,9 мкМ.
[309] В некоторых вариантах реализации изобретения NKX6-1-позитивные панкреатические клетки-предшественники приводят в контакт с активатором сигнального пути тиреоидного гормона в концентрации 0,1 мкМ - 10 мкМ. В некоторых вариантах реализации изобретения NKX6-1-позитивные панкреатические клетки-предшественники приводят в контакт с активатором сигнального пути тиреоидного гормона в концентрации 1 мкМ. В некоторых вариантах реализации изобретения NKX6-1-позитивные панкреатические клетки-предшественники приводят в контакт с активатором сигнального пути тиреоидного гормона в концентрации 0,2 мкМ, 0,3 мкМ, 0,4 мкМ, 0,5 мкМ, 0,6 мкМ, 0,7 мкМ, 0,8 мкМ или 0,9 мкМ. В некоторых вариантах реализации изобретения NKX6-1-позитивные панкреатические клетки-предшественники приводят в контакт с активатором сигнального пути тиреоидного гормона в концентрации 1,1 мкМ, 1,2 мкМ, 1,3 мкМ, 1,4 мкМ, 1,5 мкМ, 1,6 мкМ, 1,7 мкМ, 1,8 мкМ или 1,9 мкМ. В некоторых вариантах реализации изобретения NKX6-1-позитивные панкреатические клетки-предшественники приводят в контакт с активатором сигнального пути тиреоидного гормона в концентрации 2 мкМ, 3 мкМ, 4 мкМ, 5 мкМ, 6 мкМ, 7 мкМ, 8 мкМ или 9 мкМ.
[310] В некоторых вариантах реализации изобретения NKX6-1-позитивные панкреатические клетки-предшественники приводят в контакт с ингибитором γ-секретазы в концентрации 0,1 мкМ - 10 мкМ. В некоторых вариантах реализации изобретения NKX6-1-позитивные панкреатические клетки-предшественники приводят в контакт с ингибитором γ-секретазы в концентрации 1 мкМ. В некоторых вариантах реализации изобретения NKX6-1-позитивные панкреатические клетки-предшественники приводят в контакт с ингибитором γ-секретазы в концентрации 0,2 мкМ, 0,3 мкМ, 0,4 мкМ, 0,5 мкМ, 0,6 мкМ, 0,7 мкМ, 0,8 мкМ или 0,9 мкМ. В некоторых вариантах реализации изобретения NKX6-1-позитивные панкреатические клетки-предшественники приводят в контакт с ингибитором γ-секретазы в концентрации 1,1 мкМ, 1,2 мкМ, 1,3 мкМ, 1,4 мкМ, 1,5 мкМ, 1,6 мкМ, 1,7 мкМ, 1,8 мкМ или 1,9 мкМ. В некоторых вариантах реализации изобретения NKX6-1-позитивные панкреатические клетки-предшественники приводят в контакт с ингибитором γ-секретазы в концентрации 2 мкМ, 3 мкМ, 4 мкМ, 5 мкМ, 6 мкМ, 7 мкМ, 8 мкМ или 9 мкМ.
[311] В некоторых вариантах реализации изобретения NKX6-1-позитивные панкреатические клетки-предшественники приводят в контакт по меньшей мере с одним фактором роста из семейства EGF в концентрации 2 нг/мл - 200 нг/мл. В некоторых вариантах реализации изобретения NKX6-1-позитивные панкреатические клетки-предшественники приводят в контакт по меньшей мере с одним фактором роста из семейства EGF в концентрации 3 нг/мл, 4 нг/мл, 5 нг/мл, 6 нг/мл, 7 нг/мл, 8 нг/мл, 9 нг/мл, 10 нг/мл, 11 нг/мл, 12 нг/мл, 13 нг/мл, 14 нг/мл, 16 нг/мл, 17 нг/мл, 18 нг/мл или 19 нг/мл. В некоторых вариантах реализации изобретения NKX6-1-позитивные панкреатические клетки-предшественники приводят в контакт по меньшей мере с одним фактором роста из семейства EGF в концентрации 30 нг/мл, 35 нг/мл, 40 нг/мл, 45 нг/мл, 50 нг/мл, 55 нг/мл, 60 нг/мл, 65 нг/мл, 70 нг/мл, 75 нг/мл, 80 нг/мл, 85 нг/мл, 90 нг/мл, 95 нг/мл или 100 нг/мл. В некоторых вариантах реализации изобретения NKX6-1-позитивные панкреатические клетки-предшественники приводят в контакт по меньшей мере с одним фактором роста из семейства EGF в концентрации 21 нг/мл, 22 нг/мл, 23 нг/мл, 24 нг/мл, 25 нг/мл, 26 нг/мл, 27 нг/мл, 28 нг/мл или 29 нг/мл. В некоторых вариантах реализации изобретения NKX6-1-позитивные панкреатические клетки-предшественники приводят в контакт по меньшей мере с одним фактором роста из семейства EGF в концентрации 20 нг/мл.
[312] В некоторых вариантах реализации изобретения NKX6-1-позитивные панкреатические клетки-предшественники приводят в контакт с активатором сигнального пути RA в концентрации 0,01 мкМ - 1,0 мкМ. В некоторых вариантах реализации изобретения NKX6-1-позитивные панкреатические клетки-предшественники приводят в контакт с активатором сигнального пути RA в концентрации 0,02 мкМ, 0,03 мкМ, 0,04 мкМ, 0,05 мкМ, 0,06 мкМ, 0,07 мкМ, 0,08 мкМ или 0,09 мкМ. В некоторых вариантах реализации изобретения NKX6-1-позитивные панкреатические клетки-предшественники приводят в контакт с активатором сигнального пути RA в концентрации 0,20 мкМ, 0,30 мкМ, 0,40 мкМ, 0,05 мкМ, 0,60 мкМ, 0,70 мкМ, 0,80 мкМ или 0,90 мкМ. В некоторых вариантах реализации изобретения NKX6-1-позитивные панкреатические клетки-предшественники приводят в контакт с активатором сигнального пути RA в концентрации 0,1 мкМ.
[313] В некоторых вариантах реализации изобретения NKX6-1-позитивные панкреатические клетки-предшественники приводят в контакт с низкой концентрацией активатора сигнального пути RA с концентрацией, составляющей 0,01 мкМ - 1,0 мкМ. В некоторых вариантах реализации изобретения NKX6-1-позитивные панкреатические клетки-предшественники приводят в контакт с низкой концентрацией активатора сигнального пути RA с концентрацией, составляющей 0,02 мкМ, 0,03 мкМ, 0,04 мкМ, 0,05 мкМ, 0,06 мкМ, 0,07 мкМ, 0,08 мкМ или 0,09 мкМ. В некоторых вариантах реализации изобретения изобретения NKX6-1-позитивные панкреатические клетки-предшественники приводят в контакт с низкой концентрацией активатора сигнального пути RA с концентрацией, составляющей 0,20 мкМ, 0,30 мкМ, 0,40 мкМ, 0,05 мкМ, 0,60 мкМ, 0,70 мкМ, 0,80 мкМ или 0,90 мкМ. В некоторых вариантах реализации изобретения NKX6-1-позитивные панкреатические клетки-предшественники приводят в контакт с низкой концентрацией активатора сигнального пути RA с концентрацией, составляющей 0,1 мкМ.
[314] В некоторых вариантах реализации изобретения NKX6-1-позитивные панкреатические клетки-предшественники приводят в контакт по меньшей мере с одним ингибитором пути SHH в концентрации 0,1 мкМ - 0,5 мкМ. В некоторых вариантах реализации изобретения NKX6-1-позитивные панкреатические клетки-предшественники приводят в контакт по меньшей мере с одним ингибитором пути SHH в концентрации 0,11 мкМ, 0,12 мкМ, 0,13 мкМ, 0,14 мкМ, 0,15 мкМ, 0,16 мкМ, 0,17 мкМ, 0,18 мкМ, 0,19 мкМ, 0,2 мкМ, 0,21 мкМ, 0,22 мкМ, 0,23 мкМ или 0,24 мкМ. В некоторых вариантах реализации изобретения NKX6-1-позитивные панкреатические клетки-предшественники приводят в контакт по меньшей мере с одним ингибитором пути SHH в концентрации 0,26 мкМ, 0,27 мкМ, 0,28 мкМ, 0,29 мкМ, 0,30 мкМ, 0,31 мкМ, 0,32 мкМ, 0,33 мкМ, 0,34 мкМ, 0,35 мкМ, 0,36 мкМ, 0,37 мкМ, 0,38 мкМ, 0,39 мкМ, 0,40 мкМ, 0,41 мкМ, 0,42 мкМ, 0,43 мкМ, 0,44 мкМ, 0,45 мкМ, 0,46 мкМ, 0,47 мкМ, 0,48 мкМ, 0,49 мкМ. В некоторых вариантах реализации изобретения NKX6-1-позитивные панкреатические клетки-предшественники приводят в контакт по меньшей мере с одним ингибитором пути SHH в концентрации 0,5 мкМ.
[315] В некоторых вариантах реализации изобретения NKX6-1-позитивные панкреатические клетки-предшественники приводят в контакт с ингибитором протеинкиназы в концентрации 10 нМ - 1 мкМ. В некоторых вариантах реализации изобретения NKX6-1-позитивные панкреатические клетки-предшественники приводят в контакт с ингибитором протеинкиназы в концентрации 100 нМ. В некоторых вариантах реализации изобретения NKX6-1-позитивные панкреатические клетки-предшественники приводят в контакт с ингибитором протеинкиназы в концентрации 20 нМ, 30 нМ, 40 нМ, 50 нМ, 60 нМ, 70 нМ, 80 нМ или 90 нМ. В некоторых вариантах реализации изобретения NKX6-1-позитивные панкреатические клетки-предшественники приводят в контакт с ингибитором протеинкиназы в концентрации 110 нМ, 120 нМ, 130 нМ, 140 нМ, 150 нМ, 160 нМ, 170 нМ, 180 нМ или 190 нМ. В некоторых вариантах реализации изобретения NKX6-1-позитивные панкреатические клетки-предшественники приводят в контакт с ингибитором протеинкиназы в концентрации 200 нМ, 300 нМ, 400 нМ, 500 нМ, 600 нМ, 700 нМ, 800 нМ или 900 нМ.
[316] В некоторых вариантах реализации изобретения NKX6-1-позитивные панкреатические клетки-предшественники приводят в контакт с глюкозой в концентрации 1 мМ - 50 мМ. В некоторых вариантах реализации изобретения NKX6-1-позитивные панкреатические клетки-предшественники приводят в контакт с глюкозой в концентрации 25 мМ.
[317] В некоторых вариантах реализации изобретения инсулин-позитивные эндокринные клетки можно получить посредством дифференцировки по меньшей мере некоторых Pdx1-позитивных, NKX6-1-позитивных панкреатических клеток-предшественников в Pdx1-позитивные, NKX6-1-позитивные, инсулин-позитивные эндокринные клетки путем приведения Pdx1-позитивных, NKX6-1-позитивных панкреатических клеток-предшественников в условиях, которые стимулируют кластеризацию клеток, в контакт с i) ингибитором сигнального пути TGF-β, b) активатором сигнального пути ТН и, необязательно, с) по меньшей мере одним ингибитором пути SHH, ii) активатором сигнального пути RA, iii) ингибитором γ-секретазы и vi) по меньшей мере одним фактором роста из семейства эпидермальных факторов роста (EGF), через день на протяжении периода времени, составляющего от пяти до семи дней, чтобы индуцировать дифференцировку по меньшей мере некоторых Pdx1-позитивных, NKX6-1-позитивных панкреатических клеток-предшественников в Pdx1-позитивные, NKX6-1, инсулин-позитивные эндокринные клетки, при этом Pdx1-позитивные, NKX6-1, инсулин-позитивные эндокринные клетки экспрессируют Pdx1, NKX6-1, NKX2-2, Mafb, glis3, Sur1, Kir6.2, Znt8, SLC2A1, SLC2A3 и/или инсулин.
[318] В некоторых вариантах реализации изобретения инсулин-позитивные эндокринные клетки можно получить посредством дифференцировки по меньшей мере некоторых Pdx1-позитивных, NKX6-1-позитивных панкреатических клеток-предшественников в популяции в Pdx1-позитивные, NKX6-1-позитивные, инсулин-позитивные эндокринные клетки, например, путем приведения Pdx1-позитивных, NKX6-1-позитивных панкреатических клеток-предшественников в контакт с i) по меньшей мере одним ингибитором пути SHH, ii) активатором сигнального пути RA, iii) ингибитором γ-секретазы, iv) ингибитором сигнального пути TGF-β, v) активатором сигнального пути ТН и vi) по меньшей мере одним фактором роста из семейства эпидермальных факторов роста (EGF), чтобы индуцировать дифференцировку по меньшей мере некоторых Pdx1-позитивных, NKX6-1-позитивных панкреатических клеток-предшественников в Pdx1-позитивные, NKX6-1, инсулин-позитивные эндокринные клетки, при этом Pdx1-позитивные, NKX6-1, инсулин-позитивные эндокринные клетки экспрессируют Pdx1, NKX6-1, NKX2-2, Mafb, glis3, Sur1, Kir6.2, Znt8, SLC2A1, SLC2A3 и/или инсулин.
[319] В общем случае популяцию клеток содержат в подходящей культуральной среде на протяжении периода времени, достаточного, чтобы индуцировать дифференцировку по меньшей мере одной NKX6-1-позитивной панкреатической клетки-предшественника в популяции в инсулин-позитивную эндокринную клетку. Типовая подходящая культуральная среда приведена в Таблице 4.
[320]

[321] В некоторых вариантах реализации изобретения в качестве подходящей культуральной среды для дифференцировки NKX6-1-позитивных панкреатических клеток-предшественников в инсулин-позитивные эндокринные клетки можно использовать среду ВЕ5. В некоторых вариантах реализации изобретения подходящая культуральная среда приведена в Таблице 5.
[322] В некоторых вариантах реализации изобретения условия, которые стимулируют кластеризацию клеток включают суспензионную культуру. В некоторых вариантах реализации изобретения период времени соответствует периоду времени, достаточному, чтобы максимизировать количество клеток, коэкспрессирующих С-пептид и Nkx6-1. В некоторых вариантах реализации изобретения период времени составляет по меньшей мере 5 дней. В некоторых вариантах реализации изобретения период времени составляет от 5 дней до 7 дней. В некоторых вариантах реализации изобретения указанный период времени составляет по меньшей мере 7 дней. В некоторых вариантах реализации изобретения суспензионную культуру пополняют каждый день (например, факторами созревания (3-клеток). В некоторых вариантах реализации изобретения период времени, составляющий от 5 дней до 7 дней, позволяет максимизировать количество клеток, коэкспрессирующих С-пептид и Nkx6-1.
[323] В некоторых вариантах реализации изобретения по меньшей мере 15% из NKX6-1-позитивных панкреатических клеток-предшественников в популяции индуцируют до дифференцировки в инсулин-позитивные эндокринные клетки.
[324] В некоторых вариантах реализации изобретения по меньшей мере 99% из NKX6-1-позитивных панкреатических клеток-предшественников в популяции индуцируют до дифференцировки в инсулин-позитивные эндокринные клетки.
[325] Индукция созревания инсулин+эндокринных клеток в клетки SC-β
[326] Аспекты изобретения включают клетки SC-β. Применяемые в данном документе клетки SC-β могут быть получены из любого источника или сгенерированы в соответствии с любым подходящим протоколом. В некоторых аспектах инсулин-позитивные эндокринные клетки индуцируют до созревания в клетки SC-β.
[327] В некоторых аспектах в изобретении предложен способ генерации зрелых глюкозозависимых β-клеток из инсулин-позитивных эндокринных клеток, включающий приведение популяции клеток (например, в условиях, которые стимулируют кластеризацию клеток), содержащей инсулин-позитивные эндокринные клетки, в контакт по меньшей мере с двумя факторами созревания β-клеток, включающими а) ингибитор сигнального пути трансформирующего фактора роста β (TGF-β), b) активатор сигнального пути тиреоидного гормона (ТН), чтобы индуцировать in vitro созревание по меньшей мере одной инсулин-позитивной эндокринной клетки в популяции в клетку SC-β.
[328] Аспекты изобретения включают генерацию клеток SC-β, которые по форме и функциональности имеют сходство с эндогенными зрелыми β-клетками, но при этом отличаются от нативных β-клеток. Клетки SC-β могут демонстрировать ответ по меньшей мере на одну стимуляцию глюкозой. В некоторых вариантах реализации изобретения клетки SC-β демонстрируют ответ по меньшей мере на две последовательные стимуляции глюкозой. В некоторых вариантах реализации изобретения клетки SC-β демонстрируют ответ по меньшей мере на три последовательные стимуляции глюкозой. В некоторых вариантах реализации изобретения клетки SC-β демонстрируют ответ на многократную (например, последовательную) стимуляцию глюкозой, который имеет сходство с ответом эндогенных человеческих островков на многократную стимуляцию глюкозой. В некоторых вариантах реализации изобретения клетки SC-β способны высвобождать или секретировать инсулин в ответ на две последовательные стимуляции глюкозой. В некоторых вариантах реализации изобретения клетки SC-β способны высвобождать или секретировать инсулин в ответ на три последовательные стимуляции глюкозой. В некоторых вариантах реализации изобретения клетки SC-β способны высвобождать или секретировать инсулин в ответ на четыре последовательные стимуляции глюкозой. В некоторых вариантах реализации изобретения клетки SC-β способны высвобождать или секретировать инсулин в ответ на пять последовательных стимуляций глюкозой. В некоторых вариантах реализации изобретения клетки SC-β высвобождают или секретируют инсулин в ответ на постоянные последовательные стимуляции глюкозой. В некоторых вариантах реализации изобретения можно проводить анализ клеток, чтобы определить, отвечают ли они на последовательные стимуляции глюкозой, путем определения наличия систематического повышения внутриклеточного Са2+, как описано в приведенных в данном документе примерах.
[329] В некоторых вариантах реализации изобретения морфология клеток SC-β имеет сходство с морфологией эндогенных β-клеток. В некоторых вариантах реализации изобретения клетка SC-β демонстрирует in vitro ответ, состоящий в стимулированной глюкозой секреции инсулина (GSIS). В некоторых вариантах реализации изобретения клетка SC-β демонстрирует ответ GSIS in vivo. В некоторых вариантах реализации изобретения клетка SC-β демонстрирует in vitro и in vivo ответы GSIS. В некоторых вариантах реализации изобретения in vitro и/или in vivo ответ GSIS имеет сходство с ответами GSIS эндогенных зрелых β-клеток. В некоторых вариантах реализации изобретения клетка SC-β демонстрирует in vitro ответ (GSIS), который имеет сходство с ответом GSIS эндогенных β-клеток. В некоторых вариантах реализации изобретения клетка SC-β демонстрирует in vivo ответ GSIS, который имеет сходство с ответом GSIS эндогенных β-клеток. Ответ GSIS можно наблюдать непосредственно сразу после трансплантации в организм субъекта-человека или субъекта-животного. В некоторых вариантах реализации изобретения ответ GSIS наблюдают в течение двух недель после трансплантации клетки SC-β в организм субъекта-человека или субъекта-животного. В некоторых вариантах реализации изобретения ответ GSIS наблюдают в течение двух недель после трансплантации клетки SC-β в организм субъекта-человека или субъекта-животного. В некоторых вариантах реализации изобретения ответ GSIS клетки SC-β наблюдают вплоть до трех недель, четырех недель, пяти недель, шести недель, семи недель, восьми недель, девяти недель, десяти недель, 11 недель, 12 недель, 13 недель, 14 недель, 15 недель, 16 недель, 17 недель, 18 недель, 6 месяцев, 7 месяцев, 8 месяцев, 9 месяцев, 10 месяцев, 11 месяцев или вплоть до 1 года или более после трансплантации клетки SC-β в организм субъекта-человека или субъекта-животного.
[330] В некоторых вариантах реализации изобретения клетки SC-β демонстрируют по меньшей мере один маркер зрелых эндогенных панкреатических β-клеток. Типовые маркеры включают, без ограничений, Pdx1, HNF6, Ptfla, Sox9, FoxA2, Nkx2.2, Ngn3 и NKX6-1. В некоторых вариантах реализации изобретения в клетках SC-β наблюдается повышающая регуляция экспрессии маркера, выбранного из группы, состоящей из HNF6, Ptfla, Sox9, FoxA2, Nkx2.2, Ngn3 и NKX6-1, на статистически значимую величину по сравнению с плюрипотентными стволовыми клетками (например, эмбриональными стволовыми клетками или индуцированными плюрипотентными клетками), из которых были получены клетки SC-β.
[331] В изобретении предусмотрено применение любого ингибитора сигнального пути TGF-β, который индуцирует дифференцировку и/или созревание инсулин-позитивных эндокринных клеток в клетки SC-β (например, один или в любой комбинации по меньшей мере с одним активатором сигнального пути тиреоидного гормона (ТН) или, необязательно, ингибитором протеинкиназы). В некоторых вариантах реализации изобретения сигнальный путь TGF-β включает киназную сигнализацию рецептора TGF-β типа I. В некоторых вариантах реализации изобретения ингибитор сигнального пути TGF-β включает ингибитор II Alk5.
[332] В изобретении предусмотрено применение любого активатора сигнального пути тиреоидного гормона, который индуцирует дифференцировку и/или созревание инсулин-позитивных эндокринных клеток в клетки SC-β (например, один или в любой комбинации по меньшей мере с одним ингибитором сигнального пути TGF-β или, необязательно, ингибитором протеинкиназы). В некоторых вариантах реализации изобретения активатор сигнального пути тиреоидного гормона включает Т3.
[333] В некоторых вариантах реализации изобретения Pdx1-позитивные, NKX6-1-позитивные, инсулин-позитивные клетки необязательно приводят в контакт с ингибитором протеинкиназы. В некоторых вариантах реализации изобретения Pdx1-позитивные, NKX6-1-позитивные, инсулин-позитивные эндокринные клетки не приводят в контакт с ингибитором протеинкиназы. В некоторых вариантах реализации изобретения Pdx1-позитивные, NKX6-1-позитивные, инсулин-позитивные эндокринные клетки приводят в контакт с ингибитором протеинкиназы. В изобретении предусмотрено применение любого ингибитора протеинкиназы, который индуцирует дифференцировку и/или созревание инсулин-позитивных эндокринных клеток в клетки SC-β (например, один или в любой комбинации по меньшей мере с одним ингибитором сигнального пути TGF-β и/или активатором сигнального пути тиреоидного гормона). В некоторых вариантах реализации изобретения ингибитор протеинкиназы включает стауроспорин.
[334] В некоторых вариантах реализации изобретения указанный способ включает приведение популяции клеток (например, инсулин-позитивных эндокринных клеток) в контакт по меньшей мере с одним дополнительным фактором созревания β-клеток.
[335] В некоторых вариантах реализации изобретения по меньшей мере один дополнительный фактор созревания β-клеток включает ингибитор муковисцидозного трансмембранного регулятора проводимости (CFTR). В некоторых вариантах реализации изобретения указанный способ включает приведение Pdx1-позитивных, NKX6-1-позитивных, инсулин-позитивных клеток в контакт с ингибитором CFTR. В изобретении предусмотрено применение любого ингибитора CFTR, который индуцирует дифференцировку и/или созревание инсулин-позитивных эндокринных клеток в клетки SC-β (например, один или в любой комбинации по меньшей мере с одним ингибитором сигнального пути TGF-β и/или активатором сигнального пути тиреоидного гормона, и, необязательно, ингибитором протеинкиназы). В некоторых вариантах реализации изобретения ингибитор CFTR включает Gly-H101.
[336] В некоторых вариантах реализации изобретения по меньшей мере один дополнительный фактор созревания β-клеток включает ингибитор О-GlcNAказы. В некоторых вариантах реализации изобретения указанный способ включает приведение Pdx1-позитивных, NKX6-1-позитивных, инсулин-позитивных клеток в контакт с ингибитором O-GlcNAказы. В изобретении предусмотрено применение любого ингибитора O-GlcNAказы, который индуцирует дифференцировку и/или созревание инсулин-позитивных эндокринных клеток в клетки SC-β (например, один или в любой комбинации по меньшей мере с одним ингибитором сигнального пути TGF-β и/или активатором сигнального пути тиреоидного гормона, и, необязательно, ингибитором протеинкиназы). В некоторых вариантах реализации изобретения ингибитор O-GlcNAказы включает Тиамет-G.
[337] Специалисту в данной области техники понятно, что концентрации применяемых агентов (например, факторов роста) могут варьироваться. В некоторых вариантах реализации изобретения инсулин-позитивные эндокринные клетки приводят в контакт по меньшей мере с одним ингибитором сигнального пути TGF-β в концентрации 100 нМ - 100 мкМ. В некоторых вариантах реализации изобретения инсулин-позитивные эндокринные клетки приводят в контакт по меньшей мере с одним ингибитором сигнального пути TGF-β в концентрации 10 мкМ. В некоторых вариантах реализации изобретения инсулин-позитивные эндокринные клетки приводят в контакт по меньшей мере с одним ингибитором сигнального пути TGF-β в концентрации 200 нМ, 300 нМ, 400 нМ, 500 нМ, 600 нМ, 700 нМ, 800 нМ или 900 нМ. В некоторых вариантах реализации изобретения инсулин-позитивные эндокринные клетки приводят в контакт по меньшей мере с одним ингибитором сигнального пути TGF-β в концентрации 2 мкМ, 3 мкМ, 4 мкМ, 5 мкМ, 6 мкМ, 7 мкМ, 8 мкМ или 9 мкМ. В некоторых вариантах реализации изобретения инсулин-позитивные эндокринные клетки приводят в контакт по меньшей мере с одним ингибитором сигнального пути TGF-β в концентрации 9,1 мкМ, 9,2 мкМ, 9,3 мкМ, 9,4 мкМ, 9,5 мкМ, 9,6 мкМ, 9,7 мкМ, 9,8 мкМ или 9,9 мкМ. В некоторых вариантах реализации изобретения инсулин-позитивные эндокринные клетки приводят в контакт по меньшей мере с одним ингибитором сигнального пути TGF-β в концентрации 11 мкМ, 12 мкМ, 13 мкМ, 14 мкМ, 15 мкМ, 16 мкМ, 17 мкМ, 18 мкМ или 19 мкМ. В некоторых вариантах реализации изобретения инсулин-позитивные эндокринные клетки приводят в контакт по меньшей мере с одним ингибитором сигнального пути TGF-β в концентрации 10,1 мкМ, 10,2 мкМ, 10,3 мкМ, 10,4 мкМ, 10,5 мкМ, 10,6 мкМ, 10,7 мкМ, 10,8 мкМ или 10,9 мкМ.
[338] В некоторых вариантах реализации изобретения инсулин-позитивные эндокринные клетки приводят в контакт с активатором сигнального пути тиреоидного гормона в концентрации 0,1 мкМ - 10 мкМ. В некоторых вариантах реализации изобретения инсулин-позитивные эндокринные клетки приводят в контакт с активатором сигнального пути тиреоидного гормона в концентрации 1 мкМ. В некоторых вариантах реализации изобретения инсулин-позитивные эндокринные клетки приводят в контакт с активатором сигнального пути тиреоидного гормона в концентрации 0,2 мкМ, 0,3 мкМ, 0,4 мкМ, 0,5 мкМ, 0,6 мкМ, 0,7 мкМ, 0,8 мкМ или 0,9 мкМ. В некоторых вариантах реализации изобретения инсулин-позитивные эндокринные клетки приводят в контакт с активатором сигнального пути тиреоидного гормона в концентрации 1,1 мкМ, 1,2 мкМ, 1,3 мкМ, 1,4 мкМ, 1,5 мкМ, 1,6 мкМ, 1,7 мкМ, 1,8 мкМ или 1,9 мкМ. В некоторых вариантах реализации изобретения инсулин-позитивные эндокринные клетки приводят в контакт с активатором сигнального пути тиреоидного гормона в концентрации 2 мкМ, 3 мкМ, 4 мкМ, 5 мкМ, 6 мкМ, 7 мкМ, 8 мкМ или 9 мкМ.
[339] В некоторых вариантах реализации изобретения инсулин-позитивные эндокринные клетки приводят в контакт с ингибитором протеинкиназы в концентрации 10 нМ - 1 мкМ. В некоторых вариантах реализации изобретения инсулин-позитивные эндокринные клетки приводят в контакт с ингибитором протеинкиназы в концентрации 100 нМ. В некоторых вариантах реализации изобретения инсулин-позитивные эндокринные клетки приводят в контакт с ингибитором протеинкиназы в концентрации 20 нМ, 30 нМ, 40 нМ, 50 нМ, 60 нМ, 70 нМ, 80 нМ или 90 нМ. В некоторых вариантах реализации изобретения инсулин-позитивные эндокринные клетки приводят в контакт с ингибитором протеинкиназы в концентрации 110 нМ, 120 нМ, 130 нМ, 140 нМ, 150 нМ, 160 нМ, 170 нМ, 180 нМ или 190 нМ. В некоторых вариантах реализации изобретения инсулин-позитивные эндокринные клетки приводят в контакт с ингибитором протеинкиназы в концентрации 200 нМ, 300 нМ, 400 нМ, 500 нМ, 600 нМ, 700 нМ, 800 нМ или 900 нМ.
[340] В некоторых вариантах реализации изобретения Pdx1-позитивные, NKX6-1-позитивные, инсулин-позитивные эндокринные клетки приводят в контакт с ингибитором CFTR в концентрации 100 нМ - 100 мкМ. В некоторых вариантах реализации изобретения Pdx1-позитивные, NKX6-1-позитивные, инсулин-позитивные эндокринные клетки приводят в контакт с ингибитором CFTR в концентрации 10 нМ - 10 мкМ.
[341] В некоторых вариантах реализации изобретения Pdx1-позитивные, NKX6-1-позитивные, инсулин-позитивные эндокринные клетки приводят в контакт с ингибитором O-GlcNAказы в концентрации 100 нМ - 100 мкМ. В некоторых вариантах реализации изобретения Pdx1-позитивные, NKX6-1-позитивные, инсулин-позитивные эндокринные клетки приводят в контакт с ингибитором О-GlcNAказы в концентрации 10 нМ - 10 мкМ.
[342] В некоторых вариантах реализации изобретения клетку SC-β можно получить посредством дифференцировки по меньшей мере некоторых Pdx1-позитивных, NKX6-1-позитивных, инсулин-позитивных эндокринных клеток в клетки SC-β путем приведения Pdx1-позитивных, NKX6-1-позитивных, инсулин-позитивных эндокринных клеток в условиях, которые стимулируют кластеризацию клеток, в контакт с i) ингибитором сигнального пути трансформирующего фактора роста-β (TGF-β), ii) активатором сигнального пути тиреоидного гормона и, необязательно, iii) ингибитором протеинкиназы, через день на протяжении периода, составляющего от семи до 14 дней, чтобы индуцировать in vitro созревание по меньшей мере некоторых Pdx1-позитивных, NKX6-1-позитивных, инсулин-позитивных эндокринных клеток в клетки SC-β, при этом клетки SC-β демонстрируют ответ GSIS in vitro и/или in vivo. B некоторых вариантах реализации изобретения ответ GSIS имеет сходство с ответом GSIS эндогенной β-клетки.
[343] В некоторых вариантах реализации изобретения клетку SC-β можно получить посредством дифференцировки по меньшей мере некоторых Pdx1-позитивных, NKX6-1-позитивных, инсулин-позитивных эндокринных клеток в популяции в клетки SC-β, например, путем приведения Pdx1-позитивных, NKX6-1-позитивных, инсулин-позитивных эндокринных клеток в контакт с i) ингибитором сигнального пути трансформирующего фактора роста-β (TGF-β), ii) активатором сигнального пути тиреоидного гормона и, необязательно, iii) ингибитором протеинкиназы, чтобы индуцировать in vitro созревание по меньшей мере некоторых Pdx1-позитивных, NKX6-1-позитивных, инсулин-вырабатывающих эндокринных клеток в клетки SC-β, при этом клетки SC-β демонстрируют in vitro и/или in vivo ответ GSIS, который имеет сходство с ответом GSIS эндогенной β-клетки.
[344] В некоторых аспектах в изобретении предложен способ получения клеток SC-β, включающий: приведение Pdx1-позитивных, NKX6-1-позитивных, инсулин-позитивных эндокринных клеток в контакт в условиях, которые стимулируют кластеризацию клеток с i) ингибитором сигнального пути трансформирующего фактора роста β (TGF-β), ii) активатором сигнального пути тиреоидного гормона и, необязательно, iii) ингибитором протеинкиназы, чтобы индуцировать in vitro созревание по меньшей мере одной из Pdx1-позитивных, NKX6-1-позитивных, инсулин-позитивных эндокринных клеток в клетки SC-β, при этом клетки SC-β демонстрируют ответ GSIS in vitro и/или in vivo. В некоторых вариантах реализации изобретения ответ GSIS имеет сходство с ответом GSIS эндогенной β-клетки.
[345] В некоторых аспектах в изобретении предложен способ генерации клеток SC-β из плюрипотентных клеток, включающий: а) дифференцировку плюрипотентных клеток в популяции в Pdx1-позитивные панкреатические клетки-предшественники; b) дифференцировку по меньшей мере некоторых Pdx1-позитивных панкреатических клеток-предшественников в Pdx1-позитивные, NKX6-1-позитивные панкреатические клетки-предшественники путем приведения Pdx1-позитивных панкреатических клеток-предшественников в условиях, которые стимулируют кластеризацию клеток, в контакт с i) по меньшей мере одним фактором роста из семейства FGF, ii) по меньшей мере одним ингибитором пути SHH и, необязательно, iii) активатором сигнального пути RA, через день на протяжении периода времени, составляющего пять дней, чтобы индуцировать дифференцировку по меньшей мере некоторых Pdx1-позитивных панкреатических клеток-предшественников в популяции в NKX6-1-позитивные панкреатические клетки-предшественники, при этом NKX6-1-позитивные панкреатические клетки-предшественники экспрессируют Pdx1 и NKX6-1; с) дифференцировку по меньшей мере некоторых Pdx1-позитивных, NKX6-1-позитивных панкреатических клеток-предшественников в Pdx1-позитивные, NKX6-1-позитивные, инсулин-позитивные эндокринные клетки путем приведения Pdx1-позитивных, NKX6-1-позитивных панкреатических клеток-предшественников в условиях, которые стимулируют кластеризацию клеток, в контакт с i) ингибитором сигнального пути TGF-β, b) активатором сигнального пути ТН и, необязательно с) по меньшей мере одним ингибитором пути SHH, ii) активатором сигнального пути RA, iii) ингибитором γ-секретазы и vi) по меньшей мере одним фактором роста из семейства эпидермальных факторов роста (EGF), через день на протяжении периода времени, составляющего от пяти до семи дней чтобы индуцировать дифференцировку по меньшей мере некоторых Pdx1-позитивных, NKX6-1-позитивных панкреатических клеток-предшественников в Pdx1-позитивные, NKX6-1-позитивные, инсулин-позитивные эндокринные клетки, при этом Pdx1-позитивные, NKX6-1-позитивные, инсулин-позитивные эндокринные клетки экспрессируют Pdx1, NKX6-1, NKX2-2, Mafb, glis3, Sur1, Kir6.2, Znt8, SLC2A1, SLC2A3 и/или инсулин; и d) дифференцировку по меньшей мере некоторых Pdx1-позитивных, NKX6-1-позитивных, инсулин-позитивных эндокринных клеток в клетки SC-β путем приведения Pdx1-позитивных, NKX6-1-позитивных, инсулин-позитивных эндокринных клеток в условиях, которые стимулируют кластеризацию клеток, в контакте i) ингибитором сигнального пути трансформирующего фактора роста-β (TGF-β), ii) активатором сигнального пути тиреоидного гормона и, необязательно, iii) ингибитором протеинкиназы, через день на протяжении периода времени, составляющего от семи до 14 дней, чтобы индуцировать in vitro созревание по меньшей мере некоторых Pdx1-позитивных, NKX6-1-позитивных, инсулин-позитивных эндокринных клеток в клетки SC-β, при этом клетки SC-β демонстрируют ответ GSIS in vitro и/или in vivo. В некоторых вариантах реализации изобретения ответ GSIS имеет сходство с ответом GSIS эндогенных зрелых β-клеток.
[346] В некоторых аспектах в изобретении предложен способ генерации клеток SC-β из плюрипотентных клеток, включающий: а) дифференцировку по меньшей мере некоторых плюрипотентных клеток в популяции в Pdx1-позитивные панкреатические клетки-предшественники; b) дифференцировку по меньшей мере некоторых Pdx1-позитивных панкреатических клеток-предшественников в Pdx1-позитивные, NKX6-1-позитивные панкреатические клетки-предшественники путем приведения Pdx1-позитивных панкреатических клеток-предшественников в условиях, которые стимулируют кластеризацию клеток, в контакт с i) KGF, ii) Sant1 и, необязательно, iii) низкими концентрациями RA, через день на протяжении периода времени, составляющего пять дней, чтобы индуцировать дифференцировку по меньшей мере одной Pdx1-позитивной панкреатической клетки-предшественника в популяции в NKX6-1-позитивные панкреатические клетки-предшественники, при этом NKX6-1-позитивные панкреатические клетки-предшественники экспрессируют Pdx1 и NKX6-1; с) дифференцировку по меньшей мере некоторых Pdx1-позитивных, NKX6-1-позитивных панкреатических клеток-предшественников в Pdx1-позитивные, NKX6-1-позитивные, инсулин-позитивные эндокринные клетки путем приведения Pdx1-позитивных, NKX6-1-позитивных панкреатических клеток-предшественников в условиях, которые стимулируют кластеризацию клеток, в контакт с i) ингибитором II Alk5, ii) Т3 и, необязательно, iii) Sant1, iv) RA, v) XXI и vi) бетацеллюлином, через день на протяжении периода времени, составляющего от пяти до семи дней чтобы индуцировать дифференцировку по меньшей мере некоторых Pdx1-позитивных, NKX6-1-позитивных панкреатических клеток-предшественников в Pdx1-позитивные, NKX6-1-позитивные, инсулин-позитивные эндокринные клетки, при этом Pdx1-позитивные, NKX6-1-позитивные, инсулин-позитивные эндокринные клетки экспрессируют Pdx1, NKX6-1, NKX2-2, Mafb, glis3, Sur1, Kir6.2, Znt8, SLC2A1, SLC2A3 и/или инсулин; и d) дифференцировку по меньшей мере некоторых Pdx1-позитивных, NKX6-1-позитивных, инсулин-позитивных эндокринных клеток в клетки SC-β путем приведения Pdx1-позитивных, NKX6-1-позитивных, инсулин-позитивных эндокринных клеток в условиях, которые стимулируют кластеризацию клеток, в контакт с i) ингибитором II Alk5, ii) T3 и, необязательно, iii) стауроспорином, через день на протяжении периода времени, составляющего от семи до 14 дней, чтобы индуцировать in vitro созревание по меньшей мере некоторых Pdx1-позитивных, NKX6-1-позитивных, инсулин-позитивных эндокринных клеток в клетки SC-β, при этом клетки SC-β демонстрируют in vitro и in vivo ответ GSIS, который имеет сходство с ответом GSIS эндогенной β-клетки.
[347] В общем случае Pdx1-позитивные, NKX6-1-позитивные, инсулин-позитивные эндокринные клетки содержат в подходящей культуральной среде на протяжении периода времени, достаточного, чтобы индуцировать in vitro созревание по меньшей мере некоторых Pdx1-позитивных, NKX6-1-позитивных, инсулин-позитивных эндокринных клеток в клетки SC-β. Типовая подходящая культуральная среда приведена выше в Таблице 4 и ниже в Таблице 5.
[348]

[349] В некоторых вариантах реализации изобретения подходящая культуральная среда включает дополненную островковую среду 1066 от Connought Medical Research Laboratories (CMRLS). В некоторых вариантах реализации изобретения подходящая культуральная среда включает компонент CMRLS (например, вспомогательный цинк). В некоторых вариантах реализации изобретения подходящая культуральная среда приведена в Таблице 3. В некоторых вариантах реализации изобретения CMRLS дополнена сывороткой (например, человеческой). В некоторых вариантах реализации изобретения CMRLS дополнена заместителями сыворотки (например, KOSR). В некоторых вариантах реализации изобретения CMRLS дополнена фетальной бычьей сывороткой. В некоторых вариантах реализации изобретения CMRLS дополнена 10% фетальной бычьей сывороткой. В некоторых вариантах реализации изобретения подходящая культуральная среда для дифференцировки инсулин-позитивных эндокринных клеток в клетки SC-β включает среду S3. В некоторых вариантах реализации изобретения условия, которые стимулируют кластеризацию клеток включают суспензионную культуру. В некоторых вариантах реализации изобретения период времени составляет по меньшей мере 7 дней. В некоторых вариантах реализации изобретения период времени составляет от 7 дней до 21 дня. В некоторых вариантах реализации изобретения период времени составляет от 7 до 14 дней. В некоторых вариантах реализации изобретения период времени составляет от 10 до 14 дней. В некоторых вариантах реализации изобретения период времени составляет 14 дней. В некоторых вариантах реализации изобретения суспензионную культуру пополняют через день (например, факторами созревания β-клеток).
[350] В некоторых вариантах реализации изобретения по меньшей мере 1%, по меньшей мере 2%, по меньшей мере 3%, по меньшей мере 4%, по меньшей мере 5%, по меньшей мере 6%, по меньшей мере 7%, по меньшей мере 8%, по меньшей мере 9%, по меньшей мере 10%, по меньшей мере 20%, по меньшей мере 30%, по меньшей мере 40%, по меньшей мере 50% Pdx1-позитивных, NKX6-1-позитивных, инсулин-позитивных эндокринных клеток индуцируют до созревания в клетки SC-β. В некоторых вариантах реализации изобретения по меньшей мере по меньшей мере 60%, по меньшей мере 70%, по меньшей мере 80%, по меньшей мере 90%, по меньшей мере 99% Pdx1-позитивных, NKX6-1-позитивных, инсулин-позитивных эндокринных клеток индуцируют до созревания в клетки SC-β. В некоторых вариантах реализации изобретения по меньшей мере 30% полученных клеток содержат клетки SC-β. В некоторых вариантах реализации изобретения клетки SC-β экспрессируют С-пептид, инсулин, NKX6-1, Pdx1 и коэкспрессируют NKX6-1 и С-пептид.
[351] В некоторых вариантах реализации изобретения клетки SC-β включают человеческие клетки. В некоторых вариантах реализации изобретения генерация клеток SC-β in vitro является масштабируемой.
[352] Выделенные популяции клеток
[353] Аспекты изобретения относятся к выделенным популяциям клеток, полученных в соответствии с описанными в данном документе способами. В некоторых вариантах реализации изобретения популяцию клеток SC-β получают путем приведения по меньшей мере одной инсулин-позитивной эндокринной клетки или ее предшественника в контакт по меньшей мере с одним описанным в данном документе фактором созревания β-клеток. В некоторых вариантах реализации изобретения популяцию клеток SC-β получают путем приведения по меньшей мере одной инсулин-позитивной эндокринной клетки или ее предшественника в контакт по меньшей мере с двумя описанными в данном документе факторами созревания β-клеток. В некоторых вариантах реализации изобретения популяцию клеток SC-β получают путем приведения по меньшей мере одной инсулин-позитивной эндокринной клетки или ее предшественника в контакт по меньшей мере с тремя описанными в данном документе факторами созревания β-клеток. В некоторых вариантах реализации изобретения популяцию клеток SC-β получают путем приведения по меньшей мере одной инсулин-позитивной эндокринной клетки или ее предшественника в контакт по меньшей мере с четырьмя описанными в данном документе факторами созревания β-клеток. В некоторых вариантах реализации изобретения популяцию клеток SC-β получают путем приведения по меньшей мере одной инсулин-позитивной эндокринной клетки или ее предшественника в контакт по меньшей мере с пятью описанными в данном документе факторами созревания β-клеток. В некоторых вариантах реализации изобретения популяцию клеток SC-β получают путем приведения по меньшей мере одной инсулин-позитивной эндокринной клетки или ее предшественника в контакт по меньшей мере с семью, по меньшей мере с восемью, по меньшей мере с девятью или по меньшей мере с десятью описанными в данном документе факторами созревания β-клеток.
[354] В некоторых аспектах в изобретении предложена выделенная популяция клеток дефинитивной энтодермы. Выделенную популяцию клеток дефинитивной энтодермы можно получить посредством дифференцировки по меньшей мере некоторых плюрипотентных клеток в популяции в клетки дефинитивной энтодермы, например, путем приведения популяции плюрипотентных клеток в контакт с i) по меньшей мере одним фактором роста из суперсемейства TGF-β и ii) активатором сигнального пути Wnt, чтобы индуцировать дифференцировку по меньшей мере некоторых плюрипотентных клеток в популяции в клетки дефинитивной энтодермы, при этом клетки дефинитивной энтодермы экспрессируют по меньшей мере один маркер, характерный для дефинитивной энтодермы.
[355] В некоторых аспектах в изобретении предложена выделенная популяция клеток первичной кишечной трубки. Выделенную популяцию клеток первичной кишечной трубки можно получить посредством дифференцировки по меньшей мере некоторых клеток дефинитивной энтодермы в популяции в клетки первичной кишечной трубки, например, путем приведения клеток дефинитивной энтодермы в контакт по меньшей мере с одним фактором роста из семейства факторов роста фибробластов (FGF), чтобы индуцировать дифференцировку по меньшей мере некоторых клеток дефинитивной энтодермы в клетки первичной кишечной трубки, при этом клетки первичной кишечной трубки экспрессируют по меньшей мере один маркер, характерный для дефинитивной энтодермы.
[356] В некоторых аспектах в изобретении предложена выделенная популяция Pdx1-позитивных панкреатических клеток-предшественников. Выделенную популяцию Pdx1-позитивных панкреатических клеток-предшественников можно получить посредством дифференцировки по меньшей мере некоторых клеток первичной кишечной трубки в популяции в Pdx1-позитивные панкреатические клетки-предшественники, например, путем приведения клеток первичной кишечной трубки в контакт с i) по меньшей мере одним ингибитором сигнального пути костного морфогенетического белка (BMP), ii) по меньшей мере одним фактором роста из семейства FGF, iii) по меньшей мере одним ингибитором пути SHH, iv) по меньшей мере одним активатором сигнального пути ретиноевой кислоты (RA) и v) по меньшей мере одним активатором протеинкиназы С, чтобы индуцировать дифференцировку по меньшей мере некоторых клеток первичной кишечной трубки в Pdx1-позитивные панкреатические клетки-предшественники, при этом Pdx1-позитивные панкреатические клетки-предшественники экспрессируют Pdx1.
[357] В некоторых аспектах в изобретении предложена выделенная популяция NKX6-1-позитивных панкреатических клеток-предшественников. Выделенную популяцию NKX6-1-позитивных панкреатических клеток-предшественников можно получить посредством дифференцировки по меньшей мере некоторых Pdx1-позитивных панкреатических клеток-предшественников в популяции в Pdx1-позитивные, NKX6-1-позитивные панкреатические клетки-предшественники, например, путем приведения Pdx1-позитивных панкреатических клеток-предшественников в контакт с i) по меньшей мере одним фактором роста из семейства FGF, ii) по меньшей мере одним ингибитором пути SHH и, необязательно, iii) активатором сигнального пути RA, чтобы индуцировать дифференцировку по меньшей мере одной Pdx1-позитивной панкреатической клетки-предшественника в популяции в NKX6-1-позитивные панкреатические клетки-предшественники, при этом NKX6-1-позитивные панкреатические клетки-предшественники экспрессируют Pdx1 и NKX6-1.
[358] В некоторых аспектах в изобретении предложена выделенная популяция инсулин-позитивных эндокринных клеток. Выделенную популяцию инсулин-позитивных эндокринных клеток можно получить посредством дифференцировки по меньшей мере некоторых Pdx1-позитивных, NKX6-1-позитивных панкреатических клеток-предшественников в популяции в Pdx1-позитивные, NKX6-1-позитивные, инсулин-позитивные эндокринные клетки, например, путем приведения Pdx1-позитивных, NKX6-1-позитивных панкреатических клеток-предшественников в контакт с i) ингибитором сигнального пути TGF-β, ii) активатором сигнального пути ТН и, необязательно, по меньшей мере одним дополнительным фактором созревания β-клеток, выбранным из группы, состоящей из i) по меньшей мере одного ингибитора пути SHH, ii) активатора сигнального пути RA, iii) ингибитора γ-секретазы, iv) и vi) по меньшей мере одного фактора роста из семейства эпидермальных факторов роста (EGF), чтобы индуцировать дифференцировку по меньшей мере некоторых Pdx1-позитивных, NKX6-1-позитивных панкреатических клеток-предшественников в Pdx1-позитивные, NKX6-1-позитивные, инсулин-позитивные эндокринные клетки, при этом Pdx1-позитивные, NKX6-1-позитивные, инсулин-позитивные эндокринные клетки экспрессируют Pdx1, NKX6-1, NKX2-2, Mafb, glis3, Sur1, Kir6.2, Znt8, SLC2A1, SLC2A3 и/или инсулин.
[359] В некоторых аспектах в изобретении предложена выделенная популяция клеток SC-β. Выделенную популяцию клеток SC-β можно получить посредством дифференцировки по меньшей мере некоторых Pdx1-позитивных, NKX6-1-позитивных, инсулин-позитивных эндокринных клеток в популяции в клетки SC-β, например, путем приведения Pdx1-позитивных, NKX6-1-позитивных, инсулин-позитивных эндокринных клеток в контакт с i) ингибитором сигнального пути трансформирующего фактора роста-β (TGF-β), ii) активатором сигнального пути тиреоидного гормона и, необязательно, iii) ингибитором протеинкиназы, чтобы индуцировать in vitro созревание по меньшей мере некоторых Pdx1-позитивных, NKX6-1-позитивных, инсулин-позитивных эндокринных клеток в клетки SC-β, при этом клетки SC-β демонстрируют ответ GSIS in vitro и/или in vivo. В некоторых вариантах реализации изобретения ответ GSIS имеет сходство с ответом GSIS эндогенной β-клетки.
[360] Аспекты изобретения включают микрокапсулы, содержащие выделенные популяции описанных в данном документе клеток (например, клеток SC-β). Микрокапсулы хорошо известны в данной области техники. Подходящие примеры микрокапсул описаны в литературе (например, Jahansouz et al., "Evolution of β-Cell Replacement Therapy in Diabetes Mellitus: Islet Cell Transplantation" Journal of Transplantation 2011; Volume 2011, Article ID 247959; Orive et al., "Application of cell encapsulation for controlled delivery of biological therapeutics", Advanced Drug Delivery Reviews (2013), http://dx.doi.org/10.1016/j.addr.2013.07.009; Hernandez et al, "Microcapsules and microcarriers for in situ cell delivery", Advanced Drug Delivery Reviews 2010; 62: 711-730; Murua et al., "Cell microencapsulation technology: Towards clinical application", Journal of Controlled Release 2008; 132: 76-83; и Zanin et al., "The development of encapsulated cell technologies as therapies for neurological and sensory diseases", Journal of Controlled Release 2012; 160: 3-13). Микрокапсулы можно приготовить разными способами. Типовые микрокапсулы содержат альгинатное ядро, окруженное поликатионным слоем, покрытым наружной альгинатной мембраной. Поликатионная мембрана образуем полупроницаемую мембрану, которая обеспечивает стабильность и биосовместимость. Примеры поликатионов включают, без ограничений, поли-L-лизин, поли-L-орнитин, хитозан, модифицированный лактозой хитозан и фотополимеризованные биоматериалы. В некоторых вариантах реализации изобретения альгинатное ядро модифицировано, например, так, чтобы получить остов, содержащий альгинатное ядро, содержащее ковалентно конъюгированные олигопептиды с последовательностью RGD (аргинин, глицин, аспарагиновая кислота). В некоторых вариантах реализации изобретения альгинатное ядро модифицировано, например, так, чтобы получить ковалентно усиленную микрокапсулу, содержащую хемоферментативно сконструированный альгинат с повышенной стабильностью. В некоторых вариантах реализации изобретения альгинатное ядро модифицировано, например, так, чтобы получить мембраномиметические пленки, образуемые посредством in-situ полимеризации акрилатных функционализированных фосфолипидов. В некоторых вариантах реализации изобретения микрокапсулы состоят из ферментативно модифицированных при помощи эпимераз альгинатов. В некоторых вариантах реализации изобретения микрокапсулы содержат ковалентные связи между соседними слоями мембраны микрокапсулы. В одном варианте реализации изобретения микрокапсула содержит капсулу размером ниже границы просеивания, содержащую альгинат, сопряженный с фенольными компонентами. В некоторых вариантах реализации изобретения микрокапсула содержит остов, содержащий альгинат-агарозу. В некоторых вариантах реализации изобретения клетку SC-β модифицируют ПЭГ перед инкапсуляцией в альгинате. В некоторых вариантах реализации изобретения выделенные популяции клеток, например, клеток SC-β, инкапсулируют в фотореактивных липосомах и альгинате. Следует понимать, что применяемый в микрокапсулах альгинат можно заменить другими подходящими биоматериалами, включая, без ограничений, ПЭГ, хитозан, полые волокна ПЭС, коллаген, гиалуроновую кислоту, декстран с RGD, EHD и PEGDA, PMBV и PVA, PGSAS, агарозу, агарозу с желатином, PLGA и их многослойные варианты реализации.
[361] В некоторых вариантах реализации изобретения композиции, содержащие популяции клеток, полученные в соответствии с описанными в данном документе способами, также можно использовать в качестве функционального компонента в механическом устройстве, сконструированном для получения одного или более эндокринных полипептидов клеток панкреатических островков. Наипростейшая форма указанного устройства содержит популяцию панкреатических бета-клеток (например, полученную из популяции инсулин-позитивных эндокринных клеток или их предшественников), ограниченную полупроницаемой мембраной, которая препятствует прохождению популяции клеток, удерживая их внутри устройства, но не препятствует прохождению инсулина, глюкагона или соматостатина, секретируемых популяцией клеток. Вышеуказанное включает микроинкапсулированную популяцию бета-клеток, как правило, в форме клеточных кластеров, чтобы сделать возможным взаимодействие, которое ингибирует дифференцировку. Например, в патенте США №4391909 описаны островковые клетки, инкапсулированные в сферической полупроницаемой мембране, состоящей из полисахаридных полимеров с мол. массой >3000, которые перекрестно связаны между собой таким образом, что мембрана является проницаемой для белков размера инсулина, но непроницаемой для молекул с мол. массой более 100000. В патенте США №6023009 описаны островковые клетки, инкапсулированные в полупроницаемой мембране, состоящей из агарозы и агаропектина. Микрокапсулы такого происхождения предназначены для введения в брюшную полость пациента с диабетом и считается, что они обладают определенными преимуществами, связанными с уменьшением проблем гистосовместимости или восприимчивости к бактериям.
[362] Также предусмотрены другие разработанные устройства, содержащие популяцию панкреатических бета-клеток, полученных из инсулин-позитивных эндокринных клеток или их предшественников в соответствии с описанными в данном документе способами, предназначенные как для имплантации пациентам с диабетом, так и для экстракорпоральной терапии. В патенте США №4378016 описана искусственная эндокринная железа, содержащая экстракорпоральный сегмент, подкожный сегмент и сменную капсулу, содержащую вырабатывающие гормоны клетки. В патенте США №5674289 описана биосинтетическая поджелудочная железа, содержащая островковую полость, отделенную полупроницаемой мембраной от одной или более сосудистых полостей с доступом к окружающей ткани. Применяемые устройства, как правило, содержат полость, приспособленную для удержания островковых клеток, и полость, отделенную от островковых клеток полупроницаемой мембраной, которая собирает секретируемые из островковых клеток белки и которая также может пропускать обратный сигнал к островковым клеткам, например, относительно уровня циркулирующей глюкозы.
[363] Аспекты изобретения включают методы анализа, связанные с выделенными популяциями описанных в данном документе клеток (например, клеток SC-β). В некоторых вариантах реализации изобретения указанные методы анализа можно использовать для выявления одного или более кандидатных агентов, которые стимулируют или ингибируют судьбу β-клеток, выбранную из группы, состоящей из пролиферации β-клеток, репликации β-клеток и гибели β-клеток, функцию β-клеток, восприимчивость β-клеток к атакам иммунной системы или восприимчивость β-клеток к дедифференцировке или дифференцировке. В некоторых вариантах реализации изобретения указанные методы анализа можно использовать для выявления одного или более кандидатных агентов, которые стимулируют дифференцировку по меньшей мере одной инсулин-позитивной эндокринной клетки или ее предшественника в клетки SC-β. В некоторых вариантах реализации изобретения указанные методы анализа можно использовать для выявления одного или более кандидатных агентов, которые стимулируют выработку инсулина β-клетками или повышение выработки или секреции инсулина.
[364] В изобретении предусмотрены способы, в которых клетки SC-β получены в соответствии с описанными в данном документе способами из клеток iPS, полученных из клеток, экстрагированных или выделенных из организма индивидов, страдающих от заболевания (например, диабета, ожирения или нарушения, связанного с β-клетками), и эти клетки SC-β сравнивают с нормальными β-клетками из организма здоровых индивидов, у которых отсутствует заболевание, чтобы выявить различия между клетками SC-β и нормальными β-клетками, которые могут служить маркерами заболевания (например, эпигенетическими и/или генетическими). В некоторых вариантах реализации изобретения β-клетки получают от индивида с диабетом и сравнивают с нормальными β-клетками, а затем β-клетки перепрограммируют в клетки iPS и проводят анализ клеток iPS на наличие эпигенетических и/или генетических маркеров, которые присутствуют в β-клетках, полученных от индивида с диабетом, но не присутствуют в нормальных β-клетках, чтобы определить эти маркеры (например, преддиабетические). В некоторых вариантах реализации изобретения клетки iPS и/или SC-β, полученные от пациентов с диабетом, использую для скрининга агентов (например, агентов, которые способны модулировать гены, отвечающие за диабетический фенотип).
[365] Способы дифференцировки инсулин-позитивных эндокринных клеток в клетки SC-β
[366] Генерация клеток SC-β посредством преобразования по меньшей мере одной инсулин-позитивной эндокринной клетки или ее предшественника с применением способов согласно изобретению имеет большое количество преимуществ. Во-первых, способы согласно изобретению дают возможность генерировать аутологические клетки SC-β, которые являются специфическими и генетически соответствующими индивиду. В общем случае аутологические клетки с меньшей вероятностью, чем неаутологические, могут стать предметом иммунологического отторжения. Клетки получают из по меньшей мере одной инсулин-позитивной эндокринной клетки или ее предшественника, например, панкреатической клетки-предшественника, полученной путем перепрограммирования соматической клетки (например, фибробласта) от индивида в индуцированное плюрипотентное состояние и последующего культивирования плюрипотентных клеток для дифференцировки по меньшей мере некоторых плюрипотентных клеток по меньшей мере в одну инсулин-позитивную эндокринную клетку или ее предшественника, с последующей трансплантацией по меньшей мере одной инсулин-позитивной эндокринной клетки или ее предшественника в организм индивида так, чтобы по меньшей мере одна инсулин-позитивная эндокринная клетка или ее предшественник созревала in vivo в клетку SC-β, или индукцией созревания in vitro по меньшей мере одной инсулин-позитивной эндокринной клетки или ее предшественника в клетку SC-β.
[367] В некоторых вариантах реализации изобретения субъект, из организма которого получают по меньшей мере одну инсулин-позитивную эндокринную клетку или ее предшественника, является субъектом-млекопитающим, таким как субъект-человек. В некоторых вариантах реализации изобретения субъект страдает от нарушения, связанного с β-клетками. В некоторых вариантах реализации изобретения субъект страдает от диабета. В некоторых вариантах реализации изобретения субъект страдает от преддиабета. В таких вариантах реализации изобретения по меньшей мере одна инсулин-позитивная эндокринная клетка или ее предшественник может дифференцироваться в клетку SC-β ex vivo при помощи описанных в данном документе способов, а затем ее можно вводить субъекту, из организма которого были собраны клетки, чтобы осуществить лечение субъекта от нарушения, связанного с β-клетками (например, диабета).
[368] В некоторых вариантах реализации изобретения по меньшей мере одна инсулин-позитивная эндокринная клетка или ее предшественник находится в организме субъекта (in vivo) и преобразуется, становясь клеткой SC-β, при помощи описанных в данном документе способов in vivo. В некоторых вариантах реализации изобретения преобразование по меньшей мере одной инсулин-позитивной эндокринной клетки или ее предшественника в клетку SC-β in vivo может быть достигнуто путем введения субъекту композиции, содержащей по меньшей мере один, по меньшей мере два, по меньшей мере три, по меньшей мере четыре, по меньшей мере пять или по меньшей мере шесть факторов созревания β-клеток, как описано в данном документе. В некоторых вариантах реализации изобретения преобразование по меньшей мере одной инсулин-позитивной эндокринной клетки или ее предшественника в клетку SC-β in vivo может быть достигнуто путем введения субъекту композиции, содержащей по меньшей мере один, по меньшей мере два, по меньшей мере три, по меньшей мере четыре, по меньшей мере пять или по меньшей мере шесть факторов созревания β-клеток, как описано в данном документе.
[369] В некоторых вариантах реализации изобретения приведение в контакт можно осуществлять путем содержания по меньшей мере одной инсулин-позитивной эндокринной клетки или ее предшественника в культуральной среде, содержащей один или более факторов созревания β-клеток. В некоторых вариантах реализации изобретения по меньшей мере одна инсулин-позитивная эндокринная клетка или ее предшественник может быть генетически сконструированной. В некоторых вариантах реализации изобретения по меньшей мере одна инсулин-позитивная эндокринная клетка или ее предшественник может быть генетически сконструированной, чтобы экспрессировать один или более факторов созревания β-клеток, как описано в данном документе, например, экспрессировать по меньшей мере один полипептид, выбранный из полипептида панкреатического и дуоденального гомеобокса 1 (PDX-1), инсулина, с-пептида, амилина, Е-кадгерина, Hnf3β, PCI/3, В2, Nkx2.2, NKX6-1, GLUT2, PC2, ZnT-8 или в значительной степени гомологичных им аминокислотных последовательностей, или их функциональных фрагментов или функциональных вариантов.
[370] В случае, если по меньшей мере одну инсулин-позитивную эндокринную клетку или ее предшественника содержат в in vitro условиях, можно применять традиционные условия и способы для тканевого культивирования, известные специалистам в данной области техники. Способы выделения и культивирования разных клеток известны специалистам в данной области техники.
[371] В общем случае, в способах согласно изобретению по меньшей мере одну инсулин-позитивную эндокринную клетку или ее предшественника можно культивировать в стандартных условиях температуры, рН и других внешних условиях, например, в виде адгезивных клеток на планшетах для тканевого культивирования при 37°С и в атмосфере, содержащей 5-10% С02. Клетки и/или культуральную среду соответствующим образом модифицируют, чтобы достичь преобразования клеток SC-β, как описано в данном документе. В определенных вариантах реализации изобретения по меньшей мере одну инсулин-позитивную эндокринную клетку или ее предшественника, например, панкреатическую клетку-предшественника можно культивировать на или в присутствии материала, который имитирует одну или более характеристик внеклеточного матрикса или содержит один или более компонентов внеклеточного матрикса или базальной мембраны. В некоторых вариантах реализации изобретения применяют Matrigel™. Другие материалы включают белки или их смеси, такие как желатин, коллаген, фибронектин и т.д. В определенных вариантах реализации изобретения по меньшей мере одну инсулин-позитивную эндокринную клетку или ее предшественника можно культивировать в присутствии слоя питающих клеток. Такие клетки могут быть, например, мышиного или человеческого происхождения. Также они могут быть облученными, химически инактивированными путем обработки химическим инактиватором, таким как митомицин с, или каким-либо другим способом обработанными, чтобы при необходимости ингибировать их пролиферацию. В других вариантах реализации изобретения по меньшей мере одну инсулин-позитивную эндокринную клетку или ее предшественника культивируют без питающих клеток. В некоторых вариантах реализации изобретения инсулин-позитивные эндокринные клетки или их предшественников культивируют в условиях, которые стимулируют кластеризацию клеток. В контексте данного документа «условия, которые стимулируют кластеризацию клеток» относятся в к любым условиям, которые стимулируют кластеризацию клеток во время дифференцировки в клетки SC-β. В некоторых вариантах реализации изобретения условия, которые стимулируют кластеризацию клеток включают суспензионную культуру. В Boretti and Gooch (Tissue Eng. 2006 Apr; 12(4): 939-48) сообщается, что культивирование в менее адгезивных условиях (среда с низким содержанием сыворотки, субстрат с низкой адгезивноетью) стимулировали кластеризацию клеток при трансдифференцировке панкреатических дуктальных эпителиальных клеток взрослого организма в бета-клетки in vitro. Соответственно, не ограничиваясь теорией, в некоторых вариантах реализации изобретения условия, которые стимулируют кластеризацию клеток, включают минимально адгезивные условия, например, среду с низким содержанием сыворотки, субстрат с низкой адгезивностью.
[372] В некоторых примерах можно применять факторы созревания β-клеток, чтобы индуцировать дифференцировку по меньшей мере одной инсулин-позитивной эндокринной клетки или ее предшественника путем обработки или приведения по меньшей мере одной инсулин-позитивной эндокринной клетки или ее предшественника в контакт с эффективным количеством описанного в данном документе фактора созревания β-клеток, чтобы дифференцировать по меньшей мере одну инсулин-позитивную эндокринную клетку или ее предшественника по меньшей мере в одну клетку SC-β (например, зрелую панкреатическую β-клетку).
[373] Соответственно, в данный документ включены клетки и композиции, полученные описанными в данном документе способами. Точное количество и тип фактора созревания β-клеток могут варьироваться в зависимости от количества инсулин-позитивных эндокринных клеток или их предшественников, необходимой стадии дифференцировки и количества прошедших стадий дифференцировки.
[374] В определенных примерах фактор созревания β-клеток присутствует в эффективном количестве. В контексте данного документа «эффективное количество» относится к количеству соединения, которое должно присутствовать для дифференцировки по меньшей мере 10% или по меньшей мере 20%, или по меньшей мере 30% клеток в популяции инсулин-позитивных эндокринных клеток или их предшественников в клетки SC-β.
[375] В дополнительных примерах факторы созревания β-клеток могут присутствовать в культуральной среде по меньшей мере одной инсулин-позитивной эндокринной клетки или ее предшественника или, в альтернативном варианте, факторы созревания β-клеток можно добавлять к по меньшей мере одной инсулин-позитивной эндокринной клетке или ее предшественнику на некоторых стадиях роста.
[376] Подтверждение наличия и идентификация клеток SC-β
[377] Можно использовать любые известные специалисту в данной области техники средства, чтобы подтвердить наличие клетки SC-β, например, зрелой панкреатической β-клетки, полученной посредством индукции дифференцировки по меньшей мере одной инсулин-позитивной эндокринной клетки или ее предшественника путем ее обработки по меньшей мере одним фактором созревания β-клеток, как описано в данном документе.
[378] В некоторых вариантах реализации изобретения наличие маркеров β-клеток, например, химически индуцированных клеток SC-β, может быть подтверждено путем определения наличия или отсутствия одного или более маркеров, характерных для эндогенной β-клетки. В некоторых вариантах реализации изобретения указанный способ может включать определение положительной экспрессии (например, наличия) маркера зрелых β-клеток. В некоторых вариантах реализации изобретения маркер можно выявить, используя реагент, например, реагент для выявления NKX6-1 и С-пептида. В частности, клетки SC-β согласно данному документу экспрессируют NKX6-1 и С-пептид и не экспрессируют на значительном уровне другие маркеры, которые были бы характерны для незрелых β-клеток (например, MafB). Реагентом для маркера может служить, например, антитело к этому маркеру или праймеры для реакции ОТ-ПЦР или ПЦР, например, полуколичественной или количественной реакции ОТ-ПЦР или ПЦР. Такие маркеры можно использовать для определения получения клетки SC-β. Антитело или другой выявляющий реагент могут быть связаны с меткой, например, радиоактивной, флуоресцентной (например, ЗФБ) или колориметрической меткой для использования при выявлении. Если выявляющим реагентом является праймер, он может быть предоставлен в виде сухого препарата, например, лиофилизированного, или в растворе.
[379] Развитие по меньшей мере одной инсулин-позитивной эндокринной клетки или ее предшественника в клетку SC-β можно отслеживать путем определения экспрессии маркеров, характерных для зрелых β-клеток. В некоторых способах экспрессию определенных маркеров определяют путем выявления наличия или отсутствия маркера. В альтернативном варианте экспрессию определенных маркеров можно определить путем измерения уровня наличия маркера в клетках клеточной культуры или клеточной популяции. В некоторых способах определяют экспрессию маркеров, характерных для клеток SC-β, а также отсутствие значительной экспрессии маркеров, характерных для инсулин-позитивных эндокринных клеток или их предшественников, например, плюрипотентных стволовых клеток или панкреатических клеток-предшественников, из которых они были получены.
[380] Как описано в связи с отслеживанием получения клеток SC-β (например, зрелых панкреатических β-клеток) из инсулин-позитивных эндокринных клеток, для определения экспрессии маркеров можно использовать качественные или полуколичественные методы, такие как методы иммуноблоттинга и иммуноцитохимии, известные специалистам в данной области техники. В альтернативном варианте можно точно количественно оценить экспрессию маркеров, используя такую методику, как количественная ПЦР, широко известными в данной области техники способами. Кроме того, следует понимать, что на полипептидном уровне многие маркеры панкреатических островковых экспрессирующих гормоны клеток являются секретируемыми белками. Следовательно, можно использовать методы для определения внеклеточного содержания маркеров, такие как ELISA.
[381] Клетки SC-β также могут характеризоваться понижающей регуляцией маркеров, характерных для плюрипотентных стволовых клеток, из которых были индуцированы клетки SC-β. Например, клетки SC-β, полученные из плюрипотентных стволовых клеток, могут в зрелом состоянии характеризоваться статистически значимой понижающей регуляцией маркеров плюрипотентных стволовых клеток - щелочной фосфатазы (АР), NANOG, ОСТ-4, SOX-2, SSEA4, TRA-1-60 или TRA-1-81 - по сравнению с плюрипотентными стволовыми клетками, из которых они были получены. Другие маркеры, экспрессируемые плюрипотентными стволовыми клетками, включают, но не ограничиваются этим, щелочную фосфатазу (АР); ABCG2; стадиеспецифический эмбриональный антиген-1 (SSEA-1); SSEA-3; SSEA-4; TRA-1-60; TRA-1-81; Тга-2-49/6Е; ERas/ECATS, Е-кадгерин; βIII-тубулин; α-актин гладких мышц (α-SMA); фактор роста фибробластов 4 (Fgf4), Cripto, Dax1; цинкпальцевый белок 296 (Zfp296); N-ацетилтрансферазу-1 (Nat1); (ассоциированный с клетками ES транскрипт 1 (ECAT1); ESG1/DPPAS/ECAT2; ЕСАТ3; ЕСАТ6; ЕСАТ7; ECAT8; ЕСАТ9; ЕСАТ10; ЕСАТ15-1; ЕСАТ15-2; Fth117; Sa114; транскрипционный фактор недифференцированных эмбриональных клеток (Utf1); Rex1; р53; G3PDH; теломеразу, включая TERT; молчащие гены Х-хромосомы; Dnmt3a; Dnmt3b; TRIM28; F-бокс-содержащий белок 15 (Fbx15); Nanog/ECAT4; Oct3/4; Sox2; Klf4; c-Myc; Esrrb; TDGF1; GABRB3; Zfp42, FoxD3; GDF3; CYP25A1; фактор плюрипотентности 2 (DPPA2); точку разрыва, ассоциированную с Т-клеточной лимфомой 1 (Tcl1); DPPA3/Stella; DPPA4; Dnmt3L; Soxl5; Stat3; Grb2; SV40 большой Т-антиген; HPV16 E6; HPV16 E7, β-катенин и Bmi1 и другие общие маркеры плюрипотентности, при этом, по меньшей мере для одного или более из них в зрелом состоянии наблюдается понижающая регуляция на статистически значимую величину по сравнению с плюрипотентными стволовыми клетками, из которых они были получены.
[382] Понятно, что настоящее изобретение не ограничено маркерами, приведенными в данном документе как маркеры зрелых β-клеток, при этом настоящее изобретение также включает маркеры, такие как маркеры клеточной поверхности, антигены и другие генные продукты, включая EST, РНК (включая микроРНК и антисмысловые РНК), ДНК (включая гены и кДНК), а также их фрагменты.
[383] Обогащение, выделение и очистка клеток SC-β
[384] Другой аспект настоящего изобретения относится к выделению популяции клеток SC-β из гетерогенной популяции клеток, при этом такая смешанная популяция клеток содержит клетки SC-β и инсулин-позитивные эндокринные клетки или их предшественники, из которых были получены клетки SC-β. Популяцию клеток SC-β, полученных любыми вышеописанными способами, можно обогащать, выделять и/или очищать при помощи любого маркера клеточной поверхности, присутствующего на клетках SC-β, который не присутствует на инсулин-позитивных эндокринных клетках или их предшественниках, из которых они были получены. Такие маркеры клеточной поверхности также называются аффинными метками, специфическими для клеток SC-β. Примерами аффинных меток, специфических для клеток SC-β, являются антитела, лиганды или другие связывающие агенты, специфические к молекуле маркера, такой как полипептид, присутствующий на клеточной поверхности клеток SC-β, который практически не присутствует на других типах клеток (например, инсулин-позитивных эндокринных клетках или их предшественниках). В некоторых способах антитело, которое связывается с антигеном клеточной поверхности на клетке SC-β (например, человеческой клетке SC-β), используют в качестве аффинной метки для обогащения, выделения или очистки химически индуцированных (например, путем приведения в контакт по меньшей мере с одним фактором созревания β-клеток, как описано в данном документе) клеток SC-β, полученных описанными в данном документе способами. Такие антитела известны и коммерчески доступны.
[385] Способы применения антител для обогащения, выделения и/или очистки клеток SC-β известны специалисту в данной области техники. Например, в некоторых вариантах реализации изобретения реагент, такой как антитело, инкубируют вместе с популяцией клеток, содержащей клетки SC-β, при этом популяцию клеток обрабатывают, чтобы снизить внутриклеточную и субстратную адгезию. Затем популяцию клеток промывают, центрифугируют и перерастворяют. В некоторых вариантах реализации изобретения, если антитело не помечено меткой, клеточную суспензию затем инкубируют с вторичным антителом, таким как ФИТЦ-конъюгированное антитело, которое способно связываться с первичным антителом. Затем клетки SC-β промывают, центрифугируют и перерастворяют в буфере. Затем суспензию клеток SC-β анализируют и проводят сортировку при помощи клеточного сортера с активацией флуоресценции (FACS). Связанные антителами флуоресцентные перепрограммированные клетки собирают отдельно от несвязанных не флуоресцентных клеток (например, незрелых инсулин-вырабатывающих клеток), отделяя, таким образом, клетки SC-β от других клеток, присутствующих в клеточной суспензии, например, инсулин-позитивных эндокринных клеток или их предшественников или незрелых инсулин-вырабатывающих клеток (например, других дифференцированных типов клеток).
[386] В другом варианте реализации описанных в данном документе способов композицию выделенных клеток, содержащую клетки SC-β, можно дополнительно очищать, используя альтернативный способ на основании аффинности или при помощи дополнительных этапов сортировки с применением таких же или отличных маркеров, специфических для клеток SC-β. Например, в некоторых вариантах реализации изобретения используют сортировку FACS, чтобы сначала отделить клетки SC-β, которые экспрессируют NKX6-1, как один, так и вместе с экспрессией С-пептида или, в альтернативном варианте, с раскрытым в данном документе маркером β-клеток, от клеток, которые не экспрессируют один из этих маркеров (например, негативных клеток) в популяции клеток. Вторая сортировка FAC, например, сортировка позитивных клеток с применением FACS для выделения клеток, являющихся позитивными в отношении маркера, отличного от используемого на первом этапе сортировки, позволяет обогатить популяцию клеток перепрограммированными клетками.
[387] В альтернативном варианте реализации изобретения сортировку FACS применяют для разделения клеток при помощи негативной сортировки в отношении маркера, который присутствует на большинстве инсулин-позитивных эндокринных клеток или их предшественников, но не присутствует на клетках SC-β.
[388] В некоторых вариантах реализации описанных в данном документе способов клетки SC-β флуоресцентно метят без применения антитела, а затем отделяют от немеченых клеток при помощи клеточного сортера с активацией флуоресценции (FACS). В таких вариантах реализации изобретения нуклеиновую кислоту, кодирующую ЗФБ, ЖФБ, или другую нуклеиновую кислоту, кодирующую экспрессируемый флуоресцентный маркерный ген, такой как ген, кодирующий люциферазу, используют, чтобы пометить перепрограммированные клетки, применяя вышеописанные методы. Например, в некоторых вариантах реализации изобретения по меньшей мере одну копию нуклеиновой кислоты, кодирующей ЗФБ или его биологически активный фрагмент, вносят по меньшей мере в одну инсулин-позитивную эндокринную клетку, которую сначала химически индуцируют до клетки SC-β, ниже промотора, экспрессируемого в клетке SC-β, такого как промотор инсулина, так, чтобы экспрессия генного продукта ЗФБ или его биологически активного фрагмента находилась под управлением промотора инсулина.
[389] Кроме вышеописанных процедур, химически индуцированные клетки SC-β также можно выделять при помощи других способов выделения клеток. Кроме того, клетки SC-β также можно обогащать или выделять методами серийного субкультивирования в условиях роста, которые стимулируют селективное выживание или селективную экспансию клеток SC-β. Такие методы известны специалистам в данной области техники и могут включать применение таких агентов, как, например, инсулин, представители семейства TGF-бета, включая активин А, TGF-бета 1, 2 и 3, костные морфогенетические белки (ВМР-2, -3, -4, -5, -6, -7, -11, -12 и -13), факторы роста фибробластов 1 и 2, тромбоцитарный фактор роста АА и ВВ, тромбоцитарно-обогащеннаую плазму, инсулин-подобные факторы роста (IGF-I, II), фактор роста и дифференцировки (GDF-5, -6, -7, -8, -10, -11, -15), фактор роста эндотелия сосудов (VEGF), фактор роста гепатоцитов (HGF), плеотрофин, эндотелин, эпидермальный фактор роста (EGF), бета-целлюлин. Другие фармацевтические соединения могут включать, например, никотинамид, глюкагон-подобный пептид-I (GLP-1) и II, миметитело GLP-1 и 2, эксендин-4, ретиноевую кислоту, паратиреоидный гормон.
[390] Используя описанные в данном документе способы, можно получать in vitro обогащенные, выделенные и/или очищенные популяции клеток SC-β из инсулин-позитивных эндокринных клеток или их предшественников (которые были дифференцированы из плюрипотентных стволовых клеток описанными в данном документе способами). В некоторых вариантах реализации изобретения предпочтительные способы обогащения, выделения и/или очистки относятся к in vitro получению человеческих клеток SC-β из человеческих инсулин-позитивных эндокринных клеток или их предшественников которые были дифференцированы из человеческих плюрипотентных стволовых клеток или из человеческих индуцированных плюрипотентных стволовых клеток (iPS). В варианте реализации изобретения, в котором клетки SC-β дифференцированы из инсулин-позитивных эндокринных клеток, которые были ранее получены из клеток дефинитивной энтодермы, которые были ранее получены из клеток iPS, клетки SC-β могут быть аутологическими для субъекта, из организма которого были получены клетки для генерации клеток iPS.
[391] Используя описанные в данном документе способы, выделенные клеточные популяции клеток SC-β обогащают в отношении содержания клеток SC-β по меньшей мере в от около 2 до около 1000 раз по сравнению с популяцией клеток до химической индукции популяции инсулин-позитивных эндокринных клеток или их предшественников. В некоторых вариантах реализации изобретения клетки SC-β могут быть обогащены по меньшей мере в от около 5 до около 500 раз по сравнению с популяцией до химической индукции популяции инсулин-позитивных эндокринных клеток или их предшественников. В других вариантах реализации изобретения клетки SC-β могут быть обогащены по меньшей мере в от около 10 до около 200 раз по сравнению с популяцией до химической индукции популяции инсулин-позитивных эндокринных клеток или их предшественников. В других вариантах реализации изобретения клетки SC-β могут быть обогащены в от около 20 до около 100 раз по сравнению с популяцией до химической индукции популяции инсулин-позитивных эндокринных клеток или их предшественников. В других вариантах реализации изобретения клетки SC-β могут быть обогащены по меньшей мере в от около 40 до около 80 раз по сравнению с популяцией до химической индукции популяции инсулин-позитивных эндокринных клеток или их предшественников. В определенных вариантах реализации изобретения клетки SC-β могут быть обогащены по меньшей мере в от около 2 до около 20 раз по сравнению с популяцией до химической индукции популяции инсулин-позитивных эндокринных клеток или их предшественников.
[392] Композиции, содержащие клетки SC-β
[393] Некоторые варианты реализации настоящего изобретения относятся к композициям клеток, таким как клеточные культуры или клеточные популяции, содержащим клетки SC-β, при этом клетки SC-β были получены по меньшей мере из одной инсулин-позитивной эндокринной клетки или ее предшественника. В некоторых вариантах реализации изобретения композиции клеток содержат инсулин-позитивные эндокринные клетки. В некоторых вариантах реализации изобретения композиции клеток содержат NKX6-1-панкреатические клетки-предшественники. В некоторых вариантах реализации изобретения композиции клеток содержат Pdx1-панкреатические клетки-предшественники. В некоторых вариантах реализации изобретения композиции клеток содержат клетки первичной кишечной трубки. В некоторых вариантах реализации изобретения композиции клеток содержат клетки дефинитивной энтодермы.
[394] В соответствии с определенными вариантами реализации изобретения, химически индуцированные клетки SC-β представляют собой клетки млекопитающих, а в предпочтительном варианте реализации изобретения такие клетки SC-β являются человеческими клетками SC-β. В некоторых вариантах реализации изобретения инсулин-позитивные эндокринные клетки были получены из клеток дефинитивной энтодермы, например, из человеческих стволовых клеток дефинитивной энтодермы. В соответствии с определенными вариантами реализации изобретения, химически индуцированные Pdx1-позитивные панкреатические клетки-предшественники являются клетками млекопитающих, а в предпочтительном варианте реализации изобретения такие Pdx1-позитивные панкреатические клетки-предшественники являются человеческими Pdx1-позитивными панкреатическими клетками-предшественниками.
[395] Другие варианты реализации настоящего изобретения относятся к композициям, таким как выделенная клеточная популяция или клеточная культура, содержащим клетки SC-β, полученные раскрытыми в данном документе способами. В некоторых вариантах реализации настоящее изобретение относится к композициям, таким как выделенные клеточные популяции или клеточные культуры, содержащим химически индуцированные клетки SC-β, полученные раскрытыми в данном документе способами. В таких вариантах реализации изобретения клетки SC-β составляют менее чем около 90%, менее чем около 85%, менее чем около 80%, менее чем около 75%, менее чем около 70%, менее чем около 65%, менее чем около 60%, менее чем около 55%, менее чем около 50%, менее чем около 45%, менее чем около 40%, менее чем около 35%, менее чем около 30%, менее чем около 25%, менее чем около 20%, менее чем около 15%, менее чем около 12%, менее чем около 10%, менее чем около 8%, менее чем около 6%, менее чем около 5%, менее чем около 4%, менее чем около 3%, менее чем около 2% или менее чем около 1% общего количества клеток в популяции клеток SC-β. В некоторых вариантах реализации изобретения композиция содержит популяцию клеток SC-β, которые составляют более чем около 90% общего количества клеток в клеточной популяции, например, по меньшей мере около 95% или по меньшей мере 96%, или по меньшей мере 97%, или по меньшей мере 98% или по меньшей мере около 99%, или по меньшей мере около 100% общего количества клеток в клеточной популяции являются клетками SC-β.
[396] Определенные другие варианты реализации настоящего изобретения относятся к композициям, таким как выделенные клеточные популяции или клеточные культуры, содержащим комбинацию клеток SC-β и инсулин-позитивных эндокринных клеток или их предшественников, из которых были получены клетки SC-β. В некоторых вариантах реализации изобретения инсулин-позитивные эндокринные клетки, из которых были получены клетки SC-β, составляют менее чем около 25%, менее чем около 20%, менее чем около 15%, менее чем около 10%, менее чем около 5%, менее чем около 4%, менее чем около 3%, менее чем около 2% или менее чем около 1% общего количества клеток в выделенной клеточной популяции или культуре.
[397] Дополнительные варианты реализации настоящего изобретения относятся к композициям, таким как выделенные клеточные популяции или клеточные культуры, полученным описанными в данном документе способами, которые содержат химически индуцированные клетки SC-β как основной тип клеток. В некоторых вариантах реализации изобретения описанные в данном документе способы и процессы дают возможность получать выделенные клеточные культуры и/или клеточные популяции, содержащие по меньшей мере около 99%, по меньшей мере около 98%, по меньшей мере около 97%, по меньшей мере около 96%, по меньшей мере около 95%, по меньшей мере около 94%, по меньшей мере около 93%, по меньшей мере около 92%, по меньшей мере около 91%, по меньшей мере около 90%, по меньшей мере около 89%, по меньшей мере около 88%, по меньшей мере около 87%, по меньшей мере около 86%, по меньшей мере около 85%, по меньшей мере около 84%, по меньшей мере около 83%, по меньшей мере около 82%, по меньшей мере около 81%, по меньшей мере около 80%, по меньшей мере около 79%, по меньшей мере около 78%, по меньшей мере около 77%, по меньшей мере около 76%, по меньшей мере около 75%, по меньшей мере около 74%, по меньшей мере около 73%, по меньшей мере около 72%, по меньшей мере около 71%, по меньшей мере около 70%, по меньшей мере около 69%, по меньшей мере около 68%, по меньшей мере около 67%, по меньшей мере около 66%, по меньшей мере около 65%, по меньшей мере около 64%, по меньшей мере около 63%, по меньшей мере около 62%, по меньшей мере около 61%, по меньшей мере около 60%, по меньшей мере около 59%, по меньшей мере около 58%, по меньшей мере около 57%, по меньшей мере около 56%, по меньшей мере около 55%, по меньшей мере около 54%, по меньшей мере около 53%, по меньшей мере около 52%, по меньшей мере около 51% или по меньшей мере около 50% клеток SC-β.
[398] В другом варианте реализации изобретения выделенные клеточные популяции или композиции клеток (или клеточные культуры) содержат человеческие клетки SC-β. В других вариантах реализации изобретения описанные в данном документе способы и процессы дают возможность получать выделенные клеточные популяции, содержащие по меньшей мере около 50%, по меньшей мере около 45%, по меньшей мере около 40%, по меньшей мере около 35%, по меньшей мере около 30%, по меньшей мере около 25%, по меньшей мере около 24%, по меньшей мере около 23%, по меньшей мере около 22%, по меньшей мере около 21%, по меньшей мере около 20%, по меньшей мере около 19%, по меньшей мере около 18%, по меньшей мере около 17%, по меньшей мере около 16%, по меньшей мере около 15%, по меньшей мере около 14%, по меньшей мере около 13%, по меньшей мере около 12%, по меньшей мере около 11%, по меньшей мере около 10%, по меньшей мере около 9%, по меньшей мере около 8%, по меньшей мере около 7%, по меньшей мере около 6%, по меньшей мере около 5%, по меньшей мере около 4%, по меньшей мере около 3%, по меньшей мере около 2% или по меньшей мере около 1% клеток SC-β. В предпочтительных вариантах реализации изобретения выделенные клеточные популяции могут содержать человеческие клетки SC-β. В некоторых вариантах реализации изобретения процентное содержание клеток SC-β в клеточных культурах или популяциях рассчитывают без учета питающих клеток, оставшихся в культуре.
[399] Другие варианты реализации настоящего изобретения относятся к композициям, таким как выделенные клеточные популяции или клеточные культуры, содержащим смесь клеток SC-β и инсулин-позитивных эндокринных клеток или их предшественников, из которых они были дифференцированы. Например, можно получить клеточные культуры или клеточные популяции, содержащие по меньшей мере около 5 клеток SC-β на каждые 95 инсулин-позитивных эндокринных клеток или их предшественников. В других вариантах реализации изобретения можно получить клеточные культуры или клеточные популяции, содержащие по меньшей мере около 95 клеток SC-β на каждые 5 инсулин-позитивных эндокринных клеток или их предшественников. Кроме того, предусмотрены клеточные культуры или клеточные популяции, содержащие другие соотношения клеток SC-β и инсулин-позитивных эндокринных клеток или их предшественников. Например, можно получить композиции, содержащие по меньшей мере около 1 клетки SC-β на каждые 1000000 или по меньшей мере 100000 клеток, или по меньшей мере 10000 клеток, или по меньшей мере 1000 клеток, или 500, или по меньшей мере 250, или по меньшей мере 100, или по меньшей мере 10 инсулин-позитивных эндокринных клеток или их предшественников.
[400] Дополнительные варианты реализации настоящего изобретения относятся к композициям, таким как клеточные культуры или клеточные популяции, содержащим человеческие клетки, включая человеческую клетку SC-β, которая обладает по меньшей мере одной характеристикой эндогенной β-клетки.
[401] В предпочтительных вариантах реализации настоящего изобретения клеточные культуры и/или клеточные популяции клеток SC-β содержат человеческие клетки SC-β, которые являются нерекомбинантными клетками. В таких вариантах реализации изобретения клеточные культуры и/или клеточные популяции не содержат или практически не содержат рекомбинантных человеческих клеток SC-β.
[402] Факторы созревания β-клеток
[403] Аспекты изобретения включают приведение инсулин-позитивных эндокринных клеток или их предшественников в контакт с факторами созревания β-клеток, например, чтобы индуцировать созревание инсулин-позитивных эндокринных клеток или дифференцировку их предшественников в клетки SC-β (например, зрелые панкреатические β-клетки). Термин «фактор созревания β-клеток» относится к агенту, который стимулирует или способствует преобразованию по меньшей мере одной инсулин-позитивной эндокринной клетки или ее предшественника в клетку SC-β. В некоторых вариантах реализации изобретения фактор созревания β-клеток индуцирует дифференцировку плюрипотентных клеток (например, iPSC или hESC) в клетки дефинитивной энтодермы, например, в соответствии с описанным в данном документе способом. В некоторых вариантах реализации изобретения фактор созревания β-клеток индуцирует дифференцировку клеток дефинитивной энтодермы в клетки первичной кишечной трубки, например, в соответствии с описанным в данном документе способом. В некоторых вариантах реализации изобретения фактор созревания β-клеток индуцирует дифференцировку клеток первичной кишечной трубки в Pdx1-позитивные панкреатические клетки-предшественники, например, в соответствии с описанным в данном документе способом. В некоторых вариантах реализации изобретения фактор созревания β-клеток индуцирует дифференцировку Pdx1-позитивных панкреатических клеток-предшественников в NKX6-1-позитивные панкреатические клетки-предшественники, например, в соответствии с описанным в данном документе способом. В некоторых вариантах реализации изобретения фактор созревания β-клеток индуцирует дифференцировку NKX6-1-позитивных панкреатических клеток-предшественников в инсулин-позитивные эндокринные клетки, например, в соответствии с описанным в данном документе способом. В некоторых вариантах реализации изобретения фактор созревания β-клеток индуцирует созревание инсулин-позитивных эндокринных клеток в клетки SC-β, например, в соответствии с описанным в данном документе способом.
[404] В общем случае можно применять по меньшей мере один описанный в данном документе фактор созревания β-клеток один или в комбинации с другими факторами созревания β-клеток для генерации клеток SC-β в соответствии с раскрытыми в данном документе способами. В некоторых вариантах реализации изобретения по меньшей мере один, по меньшей мере два, по меньшей мере три, по меньшей мере четыре, по меньшей мере пять, по меньшей мере шесть, по меньшей мере семь, по меньшей мере восемь, по меньшей мере девять или по меньшей мере десять описанных в данном документе факторов созревания β-клеток используют в способах генерации клеток SC-β.
[405] Суперсемейство трансформирующих факторов роста β (TGF-β)
[406] Аспекты изобретения относятся к применению факторов роста из суперсемейства трансформирующих факторов роста β (TGF-β) в качестве факторов созревания β-клеток. Суперсемейство «TGF-β» обозначает белки, имеющие структурные и функциональные характеристики известных представителей семейства TGFβ. Характеристики белков семейства TGFβ хорошо известны, как в отношении структурного, так и функционального аспектов. Оно включает группы белков TGFβ ингибины (включая ингибин А и ингибин В), активины (включая активин А, активин В и активин АВ), MIS (ингибирующая субстанция Мюллера), BMP (костные морфогенетические белки), dpp (декапентаплегический), Vg-1, MNSF (моноклональный неспецифический фактор супрессии) и другие. Активность этого семейства белков основана на специфическом связывании с определенными рецепторами на разных типах клеток. Представители этого семейства содержат области, обладающие идентичностью последовательностей, в частности, в С-конце, которые соответствуют их функции. Семейство TGFβ включает более ста различных белков, все из которых содержат по меньшей мере одну область, обладающую идентичностью аминокислотных последовательностей. Представители указанного семейства включают, но не ограничиваются этим, следующие белки, определяемые по их номерам доступа в GenBank: Р07995, Р18331, Р08476, Q04998, Р03970, Р43032, Р55102, Р27092, Р42917, Р09529, Р27093, Р04088, Q04999, Р17491, Р55104, Q9WUK5, Р55103, O88959, O08717, Р58166, O61643, Р35621, Р09534, Р48970, Q9NR23, Р25703, Р30884, Р12643, Р49001, Р21274, O46564, O19006, Р22004, Р20722, Q04906, Q07104, Р30886, Р18075, Р23359, Р22003, Р34821, Р49003, Q90751, Р21275, Q06826, Р30885, Р34820, Q29607, Р12644, Q90752, O46576, Р27539, Р48969, Q26974, Р07713, Р91706, Р91699, Р27091, O42222, Q24735, Р20863, O18828, Р55106, Q9PTQ2, O14793, O08689, O42221, O18830, O18831, O18836, O35312, O42220, Р43026, Р43027, Р43029, O95390, Q9R229, O93449, Q9Z1W4, Q9BDW8, Р43028, Q7Z4P5, Р50414, Р17246, Р54831, Р04202, Р01137, Р09533, Р18341, O19011, Q9Z1Y6, Р07200, Q9Z217, O95393, Р55105, Р30371, Q9MZE2, Q07258, Q96S42, Р97737, ААА97415.1, NP-776788.1, NP-058824.1, EAL24001.1, 1S4Y, NP-001009856.1, NP-032406.1, NP-999193.1, XP-519063.1, AAG17260.1, CAA40806.1, NP-001009458.1, AAQ55808.1, AAK40341.1, AAP33019.1, AAK21265.1, AAC59738.1, CAI46003.1, B40905, AAQ55811.1, AAK40342.1, XP-540364.1, P55102, AAQ55810.1, NP-990727.1, CAA51163.1, AAD50448.1, JC4862, PN0504, BAB17600.1, AAH56742.1, BAB17596.1, CAG06183.1, CAG05339.1, BAB17601.1, CAB43091.1, A36192, AAA49162.1, AAT42200.1, NP-789822.1, AAA59451.1, AAA59169.1, XP-541000.1, NP-990537.1, NP-002184.1, AAC14187.1, AAP83319.1, AAA59170.1, BAB16973.1, AAM66766.1, WFPGBB, 1201278C, AAH30029.1, CAA49326.1, XP-344131.1, ААН48845.1, XP-148966.3, I48235, В41398, ААН77857.1, ААВ26863.1, 1706327А, ВАА83804.1, NP-571143.1, CAG00858.1, ВАВ17599.1, ВАВ17602.1, ААВ61468.1, PN0505, PN0506, САВ43092.1, ВАВ17598.1, ВАА22570.1, ВАВ16972.1, ВАС81672.1, ВАА12694.1, ВАА08494.1, В36192, С36192, ВАВ16971.1, NP-034695.1, AAA49160.1, CAA62347.1, AAA49161.1, AAD30132.1, CAA58290.1, NP-005529.1, XP-522443.1, AAM27448.1, XP-538247.1, AAD30133.1, AAC36741.1, AAH10404.1, NP-032408.1, AAN03682.1, XP-509161.1, AAC32311.1, NP-651942.2, AAL51005.1, AAC39083.1, AAH85547.1, NP-571023.1, CAF94113.1, EAL29247.1, AAW30007.1, AAH90232.1, A29619, NP-001007905.1, AAH73508.1, AAD02201.1, NP-999793.1, NP-990542.1, AAF19841.1, AAC97488.1, AAC60038.1, NP 989197.1, NP-571434.1, EAL41229.1, AAT07302.1, CAI19472.1, NP-031582.1, AAA40548.1, XP-535880.1, NP-037239.1, AAT72007.1, XP-418956.1, CAA41634.1, BAC30864.1, CAA38850.1, CAB81657.2, CAA45018.1, CAA45019.1, BAC28247.1, NP-031581.1, NP-990479.1, NP-999820.1, AAB27335.1, S45355, CAB82007.1, XP-534351.1, NP-058874.1, NP-031579.1, 1REW, AAB96785.1, AAB46367.1, CAA05033.1, BAA89012.1, 1ES7, AAP20870.1, BAC24087.1, AAG09784.1, BAC06352.1, AAQ89234.1, AAM27000.1, AAH30959.1, CAG01491.1, NP-571435.1, 1REU, AAC60286.1, BAA24406.1, A36193, AAH55959.1, AAH54647.1, AAH90689.1, CAG09422.1, BAD16743.1, NP-032134.1, XP-532179.1, AAB24876.1, AAH57702.1, AAA82616.1, CAA40222.1, CAB90273.2, XP-342592.1, XP-534896.1, XP-534462.1, 1LXI, XP-417496.1, AAF34179.1, AAL73188.1, CAF96266.1, AAB34226.1, AAB33846.1, AAT12415.1, AA033819.1, AAT72008.1, AAD38402.1, BAB68396.1, CAA45021.1, AAB27337.1, AAP69917.1, AAT12416.1, NP-571396.1, CAA53513.1, AAO33820.1, AAA48568.1, BAC02605.1, BAC02604.1, BAC02603.1, BAC02602.1, BAC02601.1, BAC02599.1, BAC02598.1, BAC02597.1, BAC02595.1, BAC02593.1, BAC02592.1, BAC02590.1, AAD28039.1, AAP74560.1, AAB94786.1, NP-001483.2, XP-528195.1, NP-571417.1, NP-001001557.1, AAH43222.1, AAM33143.1, CAG10381.1, BAA31132.1, EAL39680.1, EAA12482.2, P34820, AAP88972.1, AAP74559.1, CAI16418.1, AAD30538.1, XP- 345502.1, NP-038554.1, CAG04089.1, CAD60936.2, NP-031584.1, B55452, AAC60285.1, BAA06410.1, AAH52846.1, NP-031580.1, NP-036959.1, CAA45836.1, CAA45020.1, Q29607, AAB27336.1, XP-547817.1, AAT12414.1, AAM54049.1, AAH78901.1, AA025745.1, NP-570912.1, XP-392194.1, AAD20829.1, AAC97113.1, AAC61694.1, AAH60340.1, AAR97906.1, BAA32227.1, BAB68395.1, BAC02895.1, AAW51451.1, AAF82188.1, XP-544189.1, NP-990568.1, ВАС80211.1, AAW82620.1, AAF99597.1, NP-571062.1, CAC44179.1, AAB97467.1, AAT99303.1, AAD28038.1, AAH52168.1, NP-001004122.1, CAA72733.1, NP-032133.2, XP-394252.1, XP-224733.2, JH0801, AAP97721.1, NP-989669.1, S43296, P43029, A55452, AAH32495.1, XP-542974.1, NP-032135.1, AAK30842.1, AAK27794.1, BAC30847.1, EAA12064.2, AAP97720.1, XP-525704.1, AAT07301.1, BAD07014.1, CAF94356.1, AAR27581.1, AAG13400.1, AAC60127.1, CAF92055.1, XP-540103.1, AAO20895.1, CAF97447.1, AAS01764.1, BAD08319.1, CAA10268.1, NP-998140.1, AAR03824.1, AAS48405.1, AAS48403.1, AAK53545.1, AAK84666.1, XP-395420.1, AAK56941.1, AAC47555.1, AAR88255.1, EAL33036.1, AAW47740.1, AAW29442.1, NP-722813.1, AAR08901.1, AAO15420.2, CAC59700.1, AAL26886.1, AAK71708.1, AAK71707.1, CAC51427.2, AAK67984.1, AAK67983.1, AAK28706.1, P07713, P91706, P91699, CAG02450.1, AAC47552.1, NP-005802.1, XP-343149.1, AW34055.1, XP-538221.1, AAR27580.1, XP-125935.3, AAF21633.1, AAF21630.1, AAD05267.1, Q9Z1W4, NP-031585.2, NP-571094.1, CAD43439.1, CAF99217.1, CAB63584.1, NP-722840.1, CAE46407.1, XP-417667.1, BAC53989.1, BAB19659.1, AAM46922.1, AAA81169.1, AAK28707.1, AAL05943.1, AAB17573.1, CAH25443.1, CAG10269.1, BAD16731.1, EAA00276.2, AAT07320.1, AAT07300.1, AAN15037.1, CAH25442.1, AAK08152.2, 2009388A, AAR12161.1, CAG01961.1, CAB63656.1, CAD67714.1, CAF94162.1, NP-477340.1, EAL24792.1, NP-001009428.1, AAB86686.1, AAT40572.1, AAT40571.1, AAT40569.1, NP-033886.1, AAB49985.1, AAG39266.1, Q26974, AAC77461.1, AAC47262.1, BAC05509.1, NP-055297.1, XP-546146.1, XP-525772.1, NP-060525.2, AAH33585.1, AAH69080.1, CAG12751.1, AAH74757.2, NP-034964.1, NP-038639.1, O42221, AAF02773.1, NP-062024.1, AAR18244.1, AAR14343.1, XP-228285.2, AAT40573.1, AAT94456.1, AAL35278.1, AAL35277.1, AAL17640.1, AAC08035.1, AAB86692.1, CAB40844.1, BAC38637.1, BAB16046.1, AAN63522.1, NP-571041.1, AAB04986.2, AAC26791.1, AAB95254.1, BAA11835.1, AAR18246.1, XP-538528.1, BAA31853.1, AAK18000.1, XP-420540.1, AAL35276.1, AAQ98602.1, CAE71944.1, AAW50585.1, AAV63982.1, AAW29941.1, AAN87890.1, AAT40568.1, CAD57730.1, AAB81508.1, AAS00534.1, AAC59736.1, BAB79498.1, AAA97392.1, AAP85526.1, NP-999600.2, NP-878293.1, BAC82629.1, CAC60268.1, CAG04919.1, AAN10123.1, CAA07707.1 AAK20912.1, AAR88254.1, CAC34629.1, AAL35275.1, AAD46997.1, AAN03842.1, NP-571951.2, CAC50881.1, AAL99367.1, AAL49502.1, AAB71839.1, AAB65415.1, NP-624359.1, NP-990153.1, AAF78069.1, AAK49790.1, NP-919367.2, NP-001192.1, XP-544948.1, AAQ18013.1, AAV38739.1, NP-851298.1, CAA67685.1, AAT67171.1, AAT37502.1, AAD27804.1, AAN76665.1, BAC11909.1, XP-421648.1, CAB63704.1, NP-037306.1, A55706, AAF02780.1, CAG09623.1, NP-067589.1, NP-035707.1, AAV30547.1, AAP49817.1, BAC77407.1, AAL87199.1, CAG07172.1, B36193, CAA33024.1, NP-001009400.1, AAP36538.1, XP-512687.1, XP-510080.1, AAH05513.1, 1KTZ, AAH14690.1, AAA31526.1.
[407] Предусматривается, что любой фактор роста из суперсемейства TGF-β, который способен, один или в комбинации с одним или более другими факторами созревания β-клеток, индуцировать дифференцировку по меньшей мере одной инсулин-вырабатывающей эндокринной клетки или ее предшественника в клетку SC-β, можно применять в описанных в данном документе способах, композициях и наборах.
[408] Фактор роста из TGF-β может быть получен природным или рекомбинантным путем. В некоторых вариантах реализации изобретения фактор роста из суперсемейства TGF-β включает активин А. Термин «активин А» включает фрагменты и производные активина А. Последовательность типового активина А раскрыта в виде SEQ ID №: 1 в патентной публикации США №2009/0155218 («публикация 218»). Другие неограничивающие примеры активина А приведены в SEQ ID №: 2-16 публикации 218, а неограничивающие примеры нуклеиновых кислот, кодирующих активин А, приведены в SEQ ID №: 33-34 публикации 218. В некоторых вариантах реализации изобретения фактор роста из суперсемейства TGF-β содержит полипептид, имеющий аминокислотную последовательность, по меньшей мере на 30%, по меньшей мере на 40%, по меньшей мере на 50%, по меньшей мере на 60%, по меньшей мере на 70%, по меньшей мере на 80%, по меньшей мере на 90%, по меньшей мере на 95% или по меньшей мере на 99% или более идентичную SEQ ID №: 1 из публикации 218.
[409] В некоторых вариантах реализации изобретения фактор роста из суперсемейства TGF-β включает фактор роста и дифференцировки 8 (GDF8). Термин «GDF8» включает фрагменты и производные GDF8. Последовательности полипептидов GDF8 доступны специалистам в данной области техники. В некоторых вариантах реализации изобретения фактор роста из суперсемейства TGF-β содержит полипептид, имеющий аминокислотную последовательность, по меньшей мере на 30%, по меньшей мере на 40%, по меньшей мере на 50%, по меньшей мере на 60%, по меньшей мере на 70%, по меньшей мере на 80%, по меньшей мере на 90%, по меньшей мере на 95% или по меньшей мере на 99% или более идентичную человеческой полипептидной последовательности GDF8 (номер доступа в GenBank ЕАХ10880).
[410] В некоторых вариантах реализации изобретения фактор роста из суперсемейства TGF-β включает фактор роста, близкородственный GDF8, например, фактор роста и дифференцировки 11 (GDF11). Полипептидные последовательности GDF11 доступны специалистам в данной области техники. В некоторых вариантах реализации изобретения фактор роста из суперсемейства TGF-β содержит полипептид, имеющий аминокислотную последовательность, по меньшей мере на 30%, по меньшей мере на 40%, по меньшей мере на 50%, по меньшей мере на 60%, по меньшей мере на 70%, по меньшей мере на 80%, по меньшей мере на 90%, по меньшей мере на 95% или по меньшей мере на 99% или более идентичную человеческой полипептидной последовательности GDF11 (номер доступа в GenBank AAF21630).
[411] В определенных вариантах реализации изобретения в раскрытые в данном документе способы, композиции и наборы не входит по меньшей мере один фактор роста из суперсемейства TGF-β.
[412] В некоторых вариантах реализации изобретения по меньшей мере один фактор роста из суперсемейства TGF-β может быть замещен агентом, имитирующим по меньшей мере один фактор роста из суперсемейства TGF-β. Типовые агенты, которые имитируют по меньшей мере один фактор роста из суперсемейства TGF-β, включают, без ограничений, IDE1 и IDE2.
[413] Ингибиторы сигнального пути TGF-β
[414] Аспекты изобретения относятся к применению ингибиторов сигнального пути TGF-β в качестве факторов созревания β-клеток. Предусматривается, что любой ингибитор сигнального пути TGF-β, который способен, один или в комбинации с одним или более другими факторами созревания β-клеток, индуцировать дифференцировку по меньшей мере одной инсулин-вырабатывающей эндокринной клетки или ее предшественника в клетку SC-β, можно применять в описанных в данном документе способах, композициях и наборах. В определенных вариантах реализации изобретения в раскрытые в данном документе способы, композиции и наборы не входит ингибитор сигнального пути TGF-β.
[415] В некоторых вариантах реализации изобретения ингибитор сигнального пути TGF-β включает киназную сигнализацию рецептора TGF-β типа I (TGF-β RI). В некоторых вариантах реализации изобретения ингибитор сигнального пути TGF-β включает ингибитор II ALK5 (CAS 446859-33-2, АТФ-конкурентный ингибитор TGF-B RI киназы, также известный как RepSox, название согласно IUPAC: 2-[5-(6-метилпиридин-2-ил)-1Н-пиразол-4-ил]-1,5-нафтиридин. В некоторых вариантах реализации изобретения ингибитор сигнального пути TGF-β является аналогом или производным ингибитора II ALK5.
[416] В некоторых вариантах реализации изобретения аналог или производное ингибитора II ALK5 представляет собой соединение по формуле I, как описано в патентной публикации США №2012/0021519, в полном объеме включенной в данный документ посредством ссылки.
[417] В некоторых вариантах реализации изобретения ингибитор сигнального пути TGF-β представляет собой ингибитор рецептора TGF-β, описанный в патентной публикации США №2010/0267731. В некоторых вариантах реализации изобретения ингибитор сигнального пути TGF-β включает ингибитор ALK5, описанный в патентных публикациях США №2009/0186076 и 2007/0142376.
[418] В некоторых вариантах реализации изобретения ингибитор сигнального пути TGF-β представляет собой А 83-01. В некоторых вариантах реализации изобретения ингибитор сигнального пути TGF-β не представляет собой А 83-01. В некоторых вариантах реализации изобретения в описанные в данном документе композиции и способы не входит А 83-01.
[419] В некоторых вариантах реализации изобретения ингибитор сигнального пути TGF-β представляет собой SB 431542. В некоторых вариантах реализации изобретения ингибитор сигнального пути TGF-β не представляет собой SB 431542. В некоторых вариантах реализации изобретения в описанные в данном документе композиции и способы не входит SB 431542.
[420] В некоторых вариантах реализации изобретения ингибитор сигнального пути TGF-β представляет собой D 4476. В некоторых вариантах реализации изобретения ингибитор сигнального пути TGF-β не представляет собой D 4476. В некоторых вариантах реализации изобретения в описанные в данном документе композиции и способы не входит D 4476.
[421] В некоторых вариантах реализации изобретения ингибитор сигнального пути TGF-β представляет собой GW 788388. В некоторых вариантах реализации изобретения ингибитор сигнального пути TGF-β не представляет собой GW 788388. В некоторых вариантах реализации изобретения в описанные в данном документе композиции и способы не входит GW 788388.
[422] В некоторых вариантах реализации изобретения ингибитор сигнального пути TGF-β представляет собой LY 364947. В некоторых вариантах реализации изобретения ингибитор сигнального пути TGF-β не представляет собой LY 364947. В некоторых вариантах реализации изобретения в описанные в данном документе композиции и способы не входит LY 364947.
[423] В некоторых вариантах реализации изобретения ингибитор сигнального пути TGF-β представляет собой LY 580276. В некоторых вариантах реализации изобретения ингибитор сигнального пути TGF-β не представляет собой LY 580276. В некоторых вариантах реализации изобретения в описанные в данном документе композиции и способы не входит LY 580276.
[424] В некоторых вариантах реализации изобретения ингибитор сигнального пути TGF-β представляет собой SB 525334. В некоторых вариантах реализации изобретения ингибитор сигнального пути TGF-β не представляет собой SB 525334. В некоторых вариантах реализации изобретения в описанные в данном документе композиции и способы не входит SB 525334.
[425] В некоторых вариантах реализации изобретения ингибитор сигнального пути TGF-β представляет собой SB 505124. В некоторых вариантах реализации изобретения ингибитор сигнального пути TGF-β не представляет собой SB 505124. В некоторых вариантах реализации изобретения в описанные в данном документе композиции и способы не входит SB 505124.
[426] В некоторых вариантах реализации изобретения ингибитор сигнального пути TGF-β представляет собой SD 208. В некоторых вариантах реализации изобретения ингибитор сигнального пути TGF-β не представляет собой SD 208. В некоторых вариантах реализации изобретения в описанные в данном документе композиции и способы не входит SD 208.
[427] В некоторых вариантах реализации изобретения ингибитор сигнального пути TGF-β представляет собой GW 6604. В некоторых вариантах реализации изобретения ингибитор сигнального пути TGF-β не представляет собой GW 6604. В некоторых вариантах реализации изобретения в описанные в данном документе композиции и способы не входит GW 6604.
[428] В некоторых вариантах реализации изобретения ингибитор сигнального пути TGF-β представляет собой GW 788388. В некоторых вариантах реализации изобретения ингибитор сигнального пути TGF-β не представляет собой GW 788388. В некоторых вариантах реализации изобретения в описанные в данном документе композиции и способы не входит GW 788388.
[429] Следующие соединения из набора вышеописанных соединений можно получить из различных источников: LY-364947, SB-525334, SD-208 и SB-505124 доступны от Sigma, P.O. Box 14508, St. Louis, Mo., 63178-9916; 616452 и 616453 доступны от Calbiochem (EMD Chemicals, Inc.), 480 S. Democrat Road, Gibbstown, N.J., 08027; GW788388 и GW6604 доступны от GlaxoSmithKline, 980 Great West Road, Brentford, Middlesex, TW8 9GS, United Kingdom; LY580276 доступно от Lilly Research, Indianapolis, Ind. 46285; и SM16 доступно от Biogen Idec, P.O. Box 14627, 5000 Davis Drive, Research Triangle Park, N.C., 27709-4627.
[430] Сигнальный путь WNT
[431] Аспекты изобретения относятся к применению активаторов сигнального пути WNT в качестве факторов созревания β-клеток. Предусматривается, что любой активатор сигнальногопути WNT, который способен, один или в комбинации с одним или более другими факторами созревания β-клеток, индуцировать дифференцировку по меньшей мере одной инсулин-вырабатывающей эндокринной клетки или ее предшественника в клетку SC-β, можно применять в описанных в данном документе способах, композициях и наборах.
[432] В некоторых вариантах реализации изобретения активатор сигнального пути WNT включает CHIR99021. В некоторых вариантах реализации изобретения активатор сигнального пути WNT включает производное CHTR99021, например, соль CHIR99021, например, трихлоргидрат - хлористоводородную соль CHIR99021. В некоторых вариантах реализации изобретения активатор сигнального пути WNT включает рекомбинантный белок Wnt3a. В некоторых вариантах реализации изобретения активатор сигнального пути WNT включает ингибитор киназы гликогенсинтазы 3 (GSK3). Типовые ингибиторы GSK3 включают, без ограничений, 3F8, А 1070722, AR-A 014418, BIO, BIO-ацетоксим, FRAT-ид, 10Z-гимениальдизин, индирубин-3-оксим, кенпауллон, L803, L803-mts, карбонат лития, NSC 693868, SB 216763, SB 415286, TC-G 24, TCS 2002, TCS 21311, TWS 119, а также аналоги и производные любых из этих соединений. В определенных вариантах реализации изобретения в раскрытые в данном документе способы, композиции и наборы не входит активатор сигнального пути WNT.
[433] Семейство факторов роста фибробластов (FGF)
[434] Аспекты изобретения относятся к применению факторов роста из семейства FGF в качестве факторов созревания β-клеток. Предусматривается, что любой фактор роста из семейства FGF, который способен, один или в комбинации с одним или более другими факторами созревания β-клеток, индуцировать дифференцировку по меньшей мере одной инсулин-вырабатывающей эндокринной клетки или ее предшественника в клетку SC-β, можно применять в описанных в данном документе способах, композициях и наборах. В определенных вариантах реализации изобретения в раскрытые в данном документе способы, композиции и наборы не входит фактор роста из семейства FGF.
[435] В некоторых вариантах реализации изобретения по меньшей мере один фактор роста из семейства FGF включает фактор роста кератиноцитов (KGF). Полипептидные последовательности KGF доступны специалистам в данной области техники. В некоторых вариантах реализации изобретения фактор роста из семейства FGF содержит полипептид, имеющий аминокислотную последовательность, по меньшей мере на 30%, по меньшей мере на 40%, по меньшей мере на 50%, по меньшей мере на 60%, по меньшей мере на 70%, по меньшей мере на 80%, по меньшей мере на 90%, по меньшей мере на 95% или по меньшей мере на 99% или более идентичную человеческой полипептидной последовательности KGF (номер доступа в GenBank ААВ21431).
[436] В некоторых вариантах реализации изобретения по меньшей мере один фактор роста из семейства FGF включает FGF2. Полипептидные последовательности FGF2 доступны специалистам в данной области техники. В некоторых вариантах реализации изобретения фактор роста из семейства FGF содержит полипептид, имеющий аминокислотную последовательность, по меньшей мере на 30%, по меньшей мере на 40%, по меньшей мере на 50%, по меньшей мере на 60%, по меньшей мере на 70%, по меньшей мере на 80%, по меньшей мере на 90%, по меньшей мере на 95% или по меньшей мере на 99% или более идентичную человеческой полипептидной последовательности FGF2 (номер доступа в GenBank NP_001997).
[437] В некоторых вариантах реализации изобретения по меньшей мере один фактор роста из семейства FGF включает FGF8B. Полипептидные последовательности FGF8B доступны специалистам в данной области техники. В некоторых вариантах реализации изобретения фактор роста из семейства FGF содержит полипептид, имеющий аминокислотную последовательность, по меньшей мере на 30%, по меньшей мере на 40%, по меньшей мере на 50%, по меньшей мере на 60%, по меньшей мере на 70%, по меньшей мере на 80%, по меньшей мере на 90%, по меньшей мере на 95% или по меньшей мере на 99% или более идентичную человеческой полипептидной последовательности FGF8B (номер доступа в GenBank ААВ40954).
[438] В некоторых вариантах реализации изобретения по меньшей мере один фактор роста из семейства FGF включает FGF10. Полипептидные последовательности FGF10 доступны специалистам в данной области техники. В некоторых вариантах реализации изобретения фактор роста из семейства FGF содержит полипептид, имеющий аминокислотную последовательность, по меньшей мере на 30%, по меньшей мере на 40%, по меньшей мере на 50%, по меньшей мере на 60%, по меньшей мере на 70%, по меньшей мере на 80%, по меньшей мере на 90%, по меньшей мере на 95% или по меньшей мере на 99% или более идентичную человеческой полипептидной последовательности FGF10 (номер доступа в GenBank CAG46489).
[439] В некоторых вариантах реализации изобретения по меньшей мере один фактор роста из семейства FGF включает FGF21. Полипептидные последовательности FGF21 доступны специалистам в данной области техники. В некоторых вариантах реализации изобретения фактор роста из семейства FGF содержит полипептид, имеющий аминокислотную последовательность, по меньшей мере на 30%, по меньшей мере на 40%, по меньшей мере на 50%, по меньшей мере на 60%, по меньшей мере на 70%, по меньшей мере на 80%, по меньшей мере на 90%, по меньшей мере на 95% или по меньшей мере на 99% или более идентичную человеческой полипептидной последовательности FGF21 (номер доступа в GenBank AAQ89444.1).
[440] Ингибиторы сигнального пути костного морфогенетического белка (BMP)
[441] Аспекты изобретения относятся к применению ингибиторов сигнального пути BMP в качестве факторов созревания β-клеток. Сигнальное семество BMP представляет собой разнотипную подгруппу суперсемейства TGF-β (Sebald et al. Biol. Chem. 385: 697-710, 2004). Более двадцати известных лигандов BMP относятся к трем разным рецепторам типа II (BMPRII, ActRIIa и ActRIIb) и по меньшей мере трем рецепторам типа I (ALK2, ALK3 и ALK6). Димерные лиганды облегчают сборку рецепторных гетеромеров, создавая возможность серин-треонинкиназам конститутивно-активного рецептора типа II фосфорилировать серин-треонинкиназы рецептора типа I. Активированные рецепторы типа I фосфорилируют BMP-чувствительные (BR-) эффекторы SMAD (SMAD 1, 5 и 8), чтобы облегчить ядерную транслокацию в комплексе со SMAD4, ко-SMAD, который также облегчает сигнализацию TGF. Кроме того, BMP-сигналы могут активировать внутриклеточные эффекторы, такие как MAPK р38, SMAD-независимым образом (Nohe et al. Cell Signal 16: 291-299, 2004). Растворимые антагонисты BMP, такие как ноггин, хор дин, гремлин и фоллистатин, ограничивают сигнализацию BMP путем секвестрации лигандов.
[442] Предусматривается, что любой ингибитор сигнального пути BMP, который способен, один или в комбинации с одним или более другими факторами созревания β-клеток, индуцировать дифференцировку по меньшей мере одной инсулин-вырабатывающей эндокринной клетки или ее предшественника в клетку SC-β, можно применять в описанных в данном документе способах, композициях и наборах. В определенных вариантах реализации изобретения в раскрытые в данном документе способы, композиции и наборы не входит ингибитор сигнального пути BMP.
[443] В некоторых вариантах реализации изобретения ингибитор сигнального пути BMP включает LDN 193189 (также известный как LDN193189, 1062368-24-4, LDN-193189, DM 3189, DM-3189, название согласно IUPAC: 4-[6-(4-пиперазин-1-илфенил)пиразоло[1,5-а]пиримидин-3-ил]хинолон).
[444] В некоторых вариантах реализации изобретения ингибитор сигнального пути BMP включает аналог или производное LDN 193189, например, соль, гидрат, сольвент, эфир или пролекарство LDN 193189. В некоторых вариантах реализации изобретения производное (например, соль) LDN 193189 включает гидрохлорид LDN193189.
[445] В некоторых вариантах реализации изобретения ингибитор сигнального пути BMP включает соединение по формуле I из патентной публикации США №2011/0053930.
[446] Сигнальный путь «звукового ежа» (SHH)
[447] Аспекты изобретения относятся к применению ингибиторов сигнального пути SHH в качестве факторов созревания β-клеток. Предусматривается, что любой ингибитор сигнального пути SHH, который способен, один или в комбинации с одним или более другими факторами созревания β-клеток, индуцировать дифференцировку по меньшей мере одной инсулин-вырабатывающей эндокринной клетки или ее предшественника в клетку SC-β, можно применять в описанных в данном документе способах, композициях и наборах.
[448] В некоторых вариантах реализации изобретения ингибитор сигнального пути SHH включает Sant1. В некоторых вариантах реализации изобретения ингибитор сигнального пути SHH включает SANT2. В некоторых вариантах реализации изобретения ингибитор сигнального пути SHH включает SANT3. В некоторых вариантах реализации изобретения ингибитор сигнального пути SHH включает SANT4. В некоторых вариантах реализации изобретения ингибитор сигнального пути SHH включает Cur61414. В некоторых вариантах реализации изобретения ингибитор сигнального пути SHH включает форсколин. В некоторых вариантах реализации изобретения ингибитор сигнального пути SHH включает томатидин. В некоторых вариантах реализации изобретения ингибитор сигнального пути SHH включает AY9944. В некоторых вариантах реализации изобретения ингибитор сигнального пути SHH включает трипаранол. В некоторых вариантах реализации изобретения ингибитор сигнального пути SHH включает соединение А или соединение В (как раскрыто в пат. публ. США №2004/0060568). В некоторых вариантах реализации изобретения ингибитор сигнального пути SHH включает стероидный алкалоид, который антагонизирует сигнализацию «ежа» (например, циклоп амин или его производное), как раскрыто в пат. публ. США №2006/0276391. В определенных вариантах реализации изобретения в раскрытые в данном документе способы, композиции и наборы не входит ингибитор сигнального пути SHH.
[449] Сигнальный путь ретиноевой кислоты
[450] Аспекты изобретения относятся к применению модуляторов сигнализации ретиноевой кислоты в качестве факторов созревания β-клеток. Предусматривается, что любой модулятор сигнализации ретиноевой кислоты, который способен, один или в комбинации с одним или более другими факторами созревания β-клеток, индуцировать дифференцировку по меньшей мере одной инсулин-вырабатывающей эндокринной клетки или ее предшественника в клетку SC-β, можно применять в описанных в данном документе способах, композициях и наборах.
[451] В некоторых вариантах реализации изобретения модулятор сигнализации ретиноевой кислоты включает активатор сигнализации ретиноевой кислоты. В некоторых вариантах реализации изобретения активатор сигнального пути RA включает ретиноевую кислоту. В некоторых вариантах реализации изобретения активатор сигнального пути RA включает агониста рецепторов ретиноевой кислоты. Типовые агонисты рецепторов ретиноевой кислоты включают, без ограничений, CD 1530, AM 580, TTNPB, CD 437, Ch 55, BMS 961, AC 261066, AC 55649, AM 80, BMS 753, тазароген, адапален и CD 2314.
[452] В ннекоторых вариантах реализации изобретения модулятор сигнализации ретиноевой кислоты включает ингибитор сигнализации ретиноевой кислоты. В некоторых вариантах реализации изобретения ингибитор сигнального пути ретиноевой кислоты включает DEAB (название согласно IUPAC: 2-[2-(диэтиламино)этокси]-3-проп-2-енилбензальдегид). В некоторых вариантах реализации изобретения ингибитор сигнального пути ретиноевой кислоты включает аналог или производное DEAB.
[453] В некоторых вариантах реализации изобретения ингибитор сигнального пути ретиноевой кислоты включает антагониста рецепторов ретиноевой кислоты. В некоторых вариантах реализации изобретения антагонист рецепторов ретиноевой кислоты включает (Е)-4-[2-(5,6-дигидро-5,5-диметил-8-фенил-2-нафталенил)этенил]бензойную кислоту, (Е)-4-[[(5,6-дигидро-5,5-диметил-8-фенилэтинил)-2-нафталенил]этенил]бензойную кислоту, (Е)-4-[2-[5,6-дигидро-5,5-диметил-8-(2-нафталенил)-2-нафталенил]этенил]бензойную кислоту и (Е)-4-[2-[5,6-дигидро-5,5-диметил-8-(4-метоксифенил)-2-нафталенил]этенил]бензойную кислоту. В некоторых вариантах реализации изобретения антагонист рецепторов ретиноевой кислоты включает BMS 195614 (CAS №253310-42-8), ER 50891 (CAS №187400-85-7), BMS 493 (CAS №170355-78-9), CD 2665 (CAS №170355-78-9), LE 135 (CAS №155877-83-1), BMS 453 (CAS №166977-43-1) или MM 11253 (CAS №345952-44-5).
[454] В определенных вариантах реализации изобретения в раскрытые в данном документе способы, композиции и наборы не входит модулятор сигнализации ретиноевой кислоты. В определенных вариантах реализации изобретения в раскрытые в данном документе способы, композиции и наборы не входит активатор сигнального пути ретиноевой кислоты. В определенных вариантах реализации изобретения в раскрытые в данном документе способы, композиции и наборы не входит ингибитор сигнального пути ретиноевой кислоты.
[455] Протеинкиназа С
[456] Аспекты изобретения относятся к применению активаторов протеинкиназы С в качестве факторов созревания β-клеток. Протеинкиназы С относятся к одному из наибольших семейств протеинкиназных ферментов и имеют множество изоформ. Традиционные изоформы включают а, βI, βII, γ; новые изоформы включают δ, ε, η, Θ; и атипичные изоформы включают ξ и ι/λ. Ферменты PKC являются преимущественно цитозольными, но при активации транс лоцируются на мембрану. В цитоплазме PKC фосфорилируется другими киназами или автофосфорилируется. Для активации некоторых изоформ PKC (например, PKC-ε) необходима молекула для связывания с сайтом связывания диацилглицерина («DAG») или сайтом связывания фосфатадилсерина («PS»). Другие способны активироваться без привлечения каких-либо вторичных связывающих мессенджеров. Активаторы PKC, которые связываются с сайтом DAG, включают, но не ограничиваются этим, бриостатин, пикологи, форболовые эфиры, аплисиатоксин и гнидимакрин. Активаторы PKC, которые связываются с сайтом PS, включают, но не ограничиваются этим, полиненасыщенные жирные кислоты и их производные. Предусматривается, что любой активатор протеинкиназы С, который способен, один или в комбинации с одним или более другими факторами созревания β-клеток, индуцировать дифференцировку по меньшей мере одной инсулин-вырабатывающей эндокринной клетки или ее предшественника в клетку SC-β, можно применять в описанных в данном документе способах, композициях и наборах.
[457] В некоторых вариантах реализации изобретения активатор PKC включает PdbU. В некоторых вариантах реализации изобретения активатор PKC включает ТРВ. В некоторых вариантах реализации изобретения активатор PKC включает циклопропанированные полиненасыщенные жирные кислоты, циклопропанированные мононенасыщенные жирные кислоты, циклопропанированные полиненасыщенные жирные спирты, циклопропанированные мононенасыщенные жирные спирты, циклопропанированные полиненасыщенные эфиры жирных кислот, циклопропанированные мононенасыщенные эфиры жирных кислот, циклопропанированные полиненасыщенные сульфаты жирных кислот, циклопропанированные мононенасыщенные сульфаты жирных кислот, циклопропанированные полиненасыщенные фосфаты жирных кислот, циклопропанированные мононенасыщенные фосфаты жирных кислот, макроциклические лактоны, производные DAG, изопреноиды, октилиндолактам V, гнидимакрин, ирипаллидал, ингенол, нафталенсульфонамиды, ингибиторы диацилглицеринкиназы, фактор роста фибробластов 18 (FGF-18), фактор роста инсулина, гормоны и активаторы факторов роста, как описано в публикации WIPO № WO/2013/071282. В некоторых вариантах реализации изобретения бриостатин включает бриостатин-1, бриостатин-2, бриостатин-3, бриостатин-4, бриостатин-5, бриостатин-6, бриостатин-7, бриостатин-8, бриостатин-9, бриостатин-10, бриостатин-11, бриостатин-12, бриостатин-13, бриостатин-14, бриостатин-15, бриостатин-16, бриостатин-17 или бриостатин-18. В определенных вариантах реализации изобретения в раскрытые в данном документе способы, композиции и наборы не входит активатор протеинкиназы С.
[458] Ингибиторы γ-секретазы
[459] Аспекты изобретения относятся к применению ингибиторов γ-секретазы в качестве факторов созревания β-клеток. Предусматривается, что любойингибитор γ-секретазы, который способен, один или в комбинации с одним или более другими факторами созревания β-клеток, индуцировать дифференцировку по меньшей мере одной инсулин-вырабатывающей эндокринной клетки или ее предшественника в клетку SC-β, можно применять в описанных в данном документе способах, композициях и наборах. Известно множествоингибиторов γ-секретазы. В некоторых вариантах реализацииизобретения ингибитор γ-секретазы включает XXI. В некоторых вариантах реализацииизобретения ингибитор γ-секретазы включает DAPT. Дополнительные типовые ингибиторы γ-секретазы включают, без ограничений, ингибиторы γ-секретазы, описанные в патентах США №7049296, 8481499, 8501813 и в публикации WIPO № WO/2013/052700. В определенных вариантах реализации изобретения в раскрытые в данном документе способы, композиции и наборы невходит ингибитор γ-секретазы.
[460] Активаторы сигнального пути тиреоидного гормона
[461] Аспекты изобретения относятся к применению активаторов сигнального пути тиреоидного гормона в качестве факторов созревания β-клеток. Предусматривается, что любой активатор сигнального пути тиреоидного гормона, который способен, один или в комбинации с одним или более другими факторами созревания β-клеток, индуцировать дифференцировку по меньшей мере одной инсулин-вырабатывающей эндокринной клетки или ее предшественника в клетку SC-β, можно применять в описанных в данном документе способах, композициях и наборах. В определенных вариантах реализации любого описанного в данном документе аспекта в раскрытые в данном документе способы, композиции и наборы не входит активатор сигнального пути тиреоидного гормона. В определенных вариантах реализации любого описанного в данном документе аспекта в раскрытые в данном документе способы, композиции и наборы не входит Т3 или аналог Т3, описанный в данном документе.
[462] В некоторых вариантах реализации изобретения активатор сигнального пути тиреоидного гормона включает трийодотиронин (Т3). В некоторых вариантах реализации изобретения активатор сигнального пути тиреоидного гормона включает аналог или производное Т3. Типовые аналоги Т3 включают, но не ограничиваются этим, селективные и неселективные тиромиметики, селективный агонист-GC-1 TRβ, GС-24,4-гидрокси-РСВ 106, МВ07811, МВ07344,3,5-дийодотиропропионовую кислоту (DITPA); селективный агонист GC-1 TR-β; 3-йодотиронамин (Т(1)АМ) и 3,3',5-трийодотироуксусную кислоту (Triac) (биоактивные метаболиты гормона тироксина (Т(4)); KB-2115 и KB-141; тиронамины; SKF L-94901; DIBIT; 3'-АС-Т2; тетрайодотироуксусную кислоту (Tetrac) и трийодотироуксусную кислоту (Triac) (путем окислительного дезаминирования и декарбоксилирования аланиновой цепи тироксина [Т4] и трийодотиронина [Т3]), 3,3',5'-трийодотиронин (rT3) (путем дейодирования Т4 и Т3), 3,3'-дийодотиронин (3,3'-Т2) и 3,5-дийодотиронин (Т2) (путем дейодирования Т4, Т3 и rT3) и 3-йодотиронамин (Т1АМ) и тиронамин (Т0АМ) (путем дейодирования и аминокислотного декарбоксилирования Т4 и Т3), а также структурные аналоги TH, такие как 3,5,3'-трийодотиропропионовая кислота (Triprop), 3,5-дибром-3-пиридазинон-1-тиронин (L-940901), N-[3,5-диметил-4-(4'-гидрокси-3'-изопропилфенокси)-фенил]-оксаминовая кислота (CGS 23425), 3,5-диметил-4-[(4'-гидрокси-3'-изопропилбензил)-фенокси]уксусная кислота (GC-1), 3,5-дихлор-4-[(4-гидрокси-3-изопропилфенокси)-фенил]уксусная кислота (KB-141) и 3,5-дийодотиропропионовая кислота (DITPA).
[463] В некоторых вариантах реализации изобретения активатор сигнального пути тиреоидного гормона включает пролекарство или прогормон Т3, такой как тиреоидный гормон Т4 (например, тироксин или L-3,5,3',5'-тетрайодотиронин).
[464] В некоторых вариантах реализации изобретения активатор сигнального пути тиреоидного гормона представляет собой композицию йодотиронина, описанную в патенте США №7163918.
[465] Семейство эпидермалъных факторов роста (EGF)
[466] Аспекты изобретения относятся к применению факторов роста из семейства EGF в качестве факторов созревания β-клеток. Предусматривается, что любой фактор роста из семейства EGF, который способен, один или в комбинации с одним или более другими факторами созревания β-клеток, индуцировать дифференцировку по меньшей мере одной инсулин-вырабатывающей эндокринной клетки или ее предшественника в клетку SC-β, можно применять в описанных в данном документе способах, композициях и наборах. В некоторых вариантах реализации изобретения по меньшей мере один фактор роста из семейства EGF включает бетацеллюлин. В некоторых вариантах реализации изобретения по меньшей мере один фактор роста из семейства EGF включает EGF. Эпидермальный фактор роста (EGF) представляет собой 53-аминокислотный цитокин, который протеолитически отщепляется от предшественника крупного интегрального мембранного белка. В некоторых вариантах реализации изобретения фактор роста из семейства EGF включает вариант полипептида EGF, например, выделенный полипептид эпидермального фактора роста, обладающий по меньшей мере 90% аминокислотной идентичности с человеческой полипептидной последовательностью EGF дикого типа, как раскрыто в патенте США №7084246. В некоторых вариантах реализации изобретения фактор роста из семейства EGF включает сконструированный мутант EGF, который связывается с и агонизирует рецептор EGF, как раскрыто в патенте США №8247531. В некоторых вариантах реализации изобретения по меньшей мере один фактор роста из семейства EGF замещен агентом, который активирует сигнальный путь семейства EGF. В некоторых вариантах реализации изобретения фактор роста из семейства EGF включает соединение, которое имитирует EGF. В определенных вариантах реализации изобретения в раскрытые в данном документе способы, композиции и наборы не входит фактор роста из семейства EGF.
[467] Ингибиторы протеинкиназы
[468] Аспекты изобретения относятся к применению ингибиторовпротеинкиназы в качестве факторов созревания β-клеток. Предусматривается, что любой ингибитор протеинкиназы, который способен, один или в комбинации с другими факторами созревания β-клеток, индуцировать дифференцировку по меньшей мере одной инсулин-вырабатывающей эндокринной клетки или ее предшественника в клетку SC-β, можно применять в описанных в данном документе способах, композициях и наборах.
[469] В некоторых вариантах реализации изобретения ингибитор протеинкиназы включает стауроспорин. В некоторых вариантах реализации изобретения ингибитор протеинкиназы включает аналог стауроспорина. Типовые аналоги стауроспорина включают, без ограничений, Ro-31-8220, соединение бисиндолилмалеимидa (Bis), 10'-{5''-[(метоксикарбонил)амино]-2''-метил}-фениламинокарбонилстауроспорин, старалог (смотрите, например, Lopez et al., "Staurosporine-derived inhibitors broaden the scope of analog-sensitive kinase technology", J. Am. Chem. Soc. Soc. 2013; 135(48):18153-18159) и cgp41251.
[470] В некоторых вариантах реализации изобретения ингибитор протеинкиназы представляет собой ингибитор PKCβ. В некоторых вариантах реализации изобретения ингибитор протеинкиназы представляет собой ингибитор PKCβ с нижеприведенной структурой или производное, аналог или вариант соединения ниже:
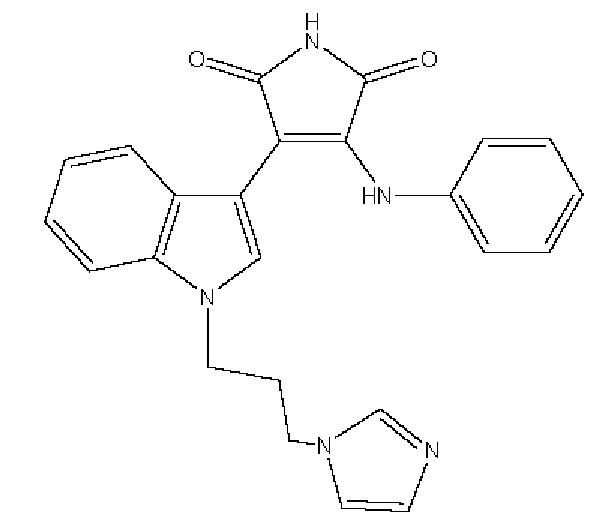
[471] В некоторых вариантах реализации изобретения ингибитор PKCβ представляет собой соединение GSK-2 с нижеприведенной структурой или производное, аналог или вариант соединения ниже:
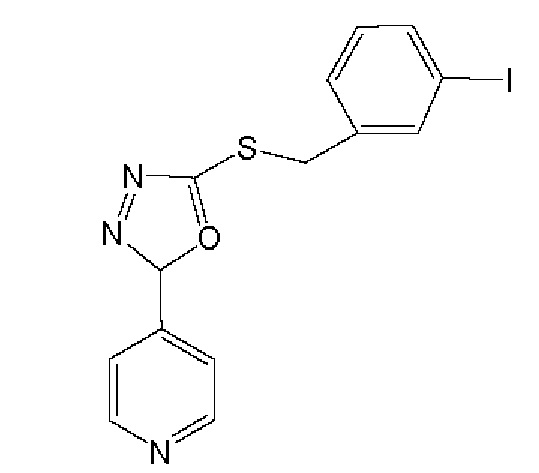
[472] В некоторых вариантах реализации изобретения ингибитор PKC представляет собой бисиндолилмалеимид. Типовые бисиндолилмалеимиды включают, без ограничений, бисиндолилмалеимид I, бисиндолилмалеимид II, бисиндолилмалеимид III, гидрохлорид или производное, аналог или вариант. В некоторых вариантах реализации изобретения производное, аналог или вариант выбраны из производного, аналога или варианта соединения, выбранного из соединений:

[473] В некоторых вариантах реализации изобретения ингибитор PKC представляет собой псевдогиперицин или производное, аналог или вариант соединения ниже:

[474] В некоторых вариантах реализации изобретения ингибитор PKC представляет собой индорублин-3-моноксим, 5-йодо или производное, аналог или вариант соединения ниже:
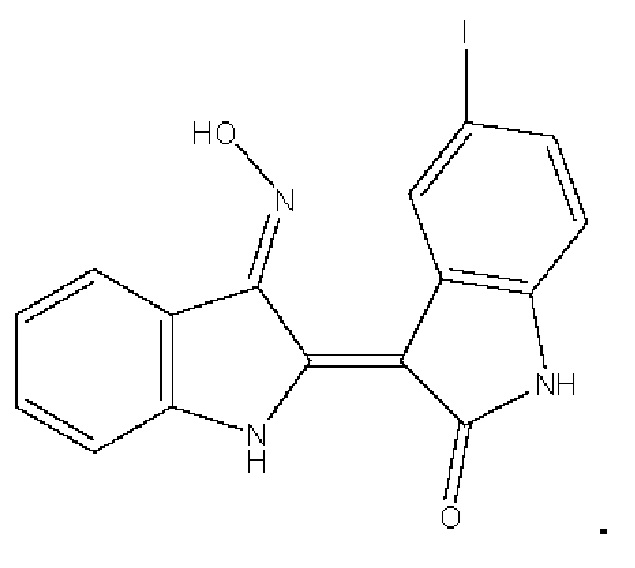
[475] В определенных вариантах реализации изобретения в раскрытые в данном документе способы, композиции и наборы не входит ингибиторы протеинкиназы.
[476] Ингибитор муковисцидозного трансмембранного регулятора проводимости (CFTR)
[477] Аспекты изобретения относятся к применению ингибиторов CFTR в качестве факторов созревания β-клеток. Предусматривается, что любой ингибитор CFTR, который способен, один или в комбинации с одним или более другими факторами созревания β-клеток, индуцировать дифференцировку по меньшей мере одной инсулин-вырабатывающей эндокринной клетки или ее предшественника в клетку SC-β, можно применять в описанных в данном документе способах, композициях и наборах.
[478] Многочисленные применяемые в данном документе ингибиторы CFTR доступны специалистам в данной области техники. Типовые ингибиторы CFTR включают, без ограничений, ингибиторы CFTR агонистов рецепторов LPA2, раскрытые в пат. публ. США №2007/0078111, гидразин-содержащие ингибиторы CFTR, раскрытые в патенте США №7888332, и ингибиторы CFTR, раскрытые в публикации WIPO № WO/2008/121877, соединение ингибитора CFTR, раскрытое в пат. публ. США №2008/0269206. В некоторых вариантах реализации изобретения ингибитор CFTR включает поровый глицин-гидразин-поглощающий ингибитор CFTR. В некоторых вариантах реализации изобретения ингибитор CFTR включает Gly-H101. В некоторых вариантах реализации изобретения ингибитор CFTR включает производное или аналог Gly-H101 (смотрите, например, Muanprasat et al., "Discovery of Glyciine Hydrazide Pore-occluding CFTR Inhibitors", J. Gen. PHysiol 2004; 124(2):125-137). В определенных вариантах реализации изобретения в раскрытые в данном документе способы, композиции и наборы не входит ингибитор CFTR.
[479] Ингибитор O-GlcNAказы
[480] Аспекты изобретения относятся к применению ингибиторов О-GlcNAказы в качестве факторов созревания β-клеток. Предусматривается, что любой ингибитор O-GlcNAказы, который способен, один или в комбинации с одним или более другими факторами созревания β-клеток, индуцировать дифференцировку по меньшей мере одной инсулин-вырабатывающей эндокринной клетки или ее предшественника в клетку SC-β, можно применять в описанных в данном документе способах, композициях и наборах. Многочисленные применяемые в данном документе ингибиторы O-GlcNAказы доступны специалистам в данной области техники. Типовые ингибиторы O-GlcNAказы включают, без ограничений, проницаемые ингибиторы гликозидазы (смотрите, например, публикацию WIPO № WO/2013/169576 и WO/2013/166654), и селективные ингибиторы гликозидазы (смотрите, например, публикацию WIPO № WO/2013/000084 и WO/2013/000085). В некоторых вариантах реализации изобретения ингибитор O-GlcNAказы включает Тиамет-G. В определенных вариантах реализации изобретения в раскрытые в данном документе способы, композиции и наборы не входит ингибитор O-GlcNAказы
[481] Смешанные композиции
[482] Другой аспект настоящего изобретения относится к смешиванию инсулин-позитивных эндокринных клеток или их предшественников и по меньшей мере одного фактора созревания β-клеток, например, чтобы индуцировать дифференцировку по меньшей мере одной инсулин-позитивной эндокринной клетки или ее предшественника в клетки SC-β.
[483] В другом аспекте настоящее изобретение относится к композиции, такой как реакционная смесь, содержащая по меньшей мере одну инсулин-позитивную эндокринную клетку или ее предшественника (например, популяцию инсулин-позитивных эндокринных клеток или их предшественников для дифференцировки в клетки SC-β) и по меньшей мере один фактор созревания β-клеток. В альтернативном варианте настоящее изобретение относится к реакционной смеси, содержащей (i) популяцию клеток SC-β, полученную путем химической индукции дифференцировки популяции инсулин-позитивных эндокринных клеток или их предшественников для дифференцировки в клетку SC-β, и (ii) по меньшей мере один фактор созревания β-клеток.
[484] В некоторых вариантах реализации изобретения концентрация по меньшей мере одного фактора созревания β-клеток, добавляемого в реакционную смесь, является достаточной дозой для индукции дифференцировки по меньшей мере одной инсулин-позитивной эндокринной клетки или ее предшественника в клетку SC-β, как описано в данном документе.
[485] В некоторых вариантах реализации изобретения композиция содержит концентрацию по меньшей мере одного фактора созревания β-клеток, составляющую от около 25 нМ до 10 мкМ или от около 25 нМ до 50 нМ, или от около 50 нМ до 100 нМ, или от около 100 нМ до 200 нМ, или от около 200 нМ до около 500 нМ, или от около 500 нМ до около 1 мкМ, или от около 1 мкМ до 2 мкМ, или от около 2 мкМ до 5 мкМ, или от около 5 мкМ до 10 мкМ.
[486] В некоторых вариантах реализации изобретения композиция или смесь содержит концентрацию по меньшей мере одного фактора созревания β-клеток, составляющую по меньшей мере около 5 нМ, по меньшей мере около 7 нМ, по меньшей мере около 10 нМ, по меньшей мере около 12 нМ, по меньшей мере около 15 нМ, по меньшей мере около 17 нМ, по меньшей мере около 20 нМ, по меньшей мере около 25 нМ, по меньшей мере около 30 нМ, по меньшей мере около 35 нМ, по меньшей мере около 40 нМ, по меньшей мере около 45 нМ, по меньшей мере около 50 нМ, по меньшей мере около 100 нМ или по меньшей мере около 200 нМ, или по меньшей мере около 300 нМ, или по меньшей мере около 400 нМ, или по меньшей мере около 500 нМ, или более чем 500 нМ, или любое целое число в диапазоне 10-500 нМ, или любое целое число в диапазоне 5-50 нМ, или любое целое число в диапазоне 50-100 нМ, или любое целое число в диапазоне 100 нМ - 200 нМ, или любое целое число в диапазоне 200 нМ - 500 нМ. В некоторых вариантах реализации изобретения композиция или смесь содержит концентрацию по меньшей мере одного фактора созревания β-клеток, составляющую по меньшей мере около 0,1 мкМ или по меньшей мере около 0,2 мкМ, или по меньшей мере около 0,3 мкМ, или по меньшей мере около 0,4 мкМ, или по меньшей мере около 0,5 мкМ, или по меньшей мере около 1 мкМ, по меньшей мере около 1,5 мкМ, по меньшей мере около 2 мкМ, по меньшей мере около 2,5 мкМ, по меньшей мере около 3 мкМ, по меньшей мере около 3,5 мкМ, по меньшей мере около 4 мкМ, по меньшей мере около 4,5 мкМ, по меньшей мере около 5 мкМ, по меньшей мере около 6 мкМ, по меньшей мере около 7 мкМ, по меньшей мере около 8 мкМ, по меньшей мере около 9 мкМ, или по меньшей мере около 10 мкМ, или более чем 10 мкМ, или любое целое число в диапазоне 0,1-0,5 мкМ, или любое целое число в диапазоне 0,5-10 мкМ, или любое целое число в диапазоне 0,1-10 мкМ, или любое целое число в диапазоне 0,5-5 мкМ, или любое целое число в диапазоне 5 мкМ - 10 мкМ.
[487] Композиции и наборы
[488] В данном документе описаны композиции, которые содержат описанную в данном документе клетку (например, клетку SC-β или зрелую панкреатическую β-клетку). В некоторых вариантах реализации изобретения композиция также содержит описанный в данном документе фактор созревания β-клеток и/или клеточные культуральные среды. Также в данном документе описаны композиции, содержащие описанные в данном документе соединения (например, клеточные культуральные среды, содержащие одно или более описанных в данном документе соединений). В данном документе описаны наборы.
[489] Другой аспект настоящего изобретения относится к наборам для практической реализации раскрытых в данном документе способов и для получения раскрытых в данном документе клеток SC-β или зрелых панкреатических β-клеток. В одном аспекте набор содержит по меньшей мере одну инсулин-позитивную эндокринную клетку или ее предшественника и по меньшей мере один фактор созревания β-клеток, как описано в данном документе, и, необязательно, набор может дополнительно содержать инструкции для преобразования по меньшей мере одной инсулин-позитивной эндокринной клетки или ее предшественника в популяцию клеток SC-β при помощи описанных в данном документе способов. В некоторых вариантах реализации изобретения набор содержит по меньшей мере два фактора созревания β-клеток. В некоторых вариантах реализации изобретения набор содержит по меньшей мере три фактора созревания β-клеток. В некоторых вариантах реализации изобретения набор содержит по меньшей мере четыре фактора созревания β-клеток. В некоторых вариантах реализации изобретения набор содержит по меньшей мере пять факторов созревания β-клеток. В некоторых вариантах реализации изобретения набор содержит по меньшей мере шесть факторов созревания β-клеток. В некоторых вариантах реализации изобретения набор содержит по меньшей мере семь факторов созревания β-клеток. В некоторых вариантах реализации изобретения набор содержит по меньшей мере восемь факторов созревания β-клеток. В некоторых вариантах реализации изобретения набор содержит по меньшей мере девять факторов созревания β-клеток. В некоторых вариантах реализации изобретения набор содержит по меньшей мере десять факторов созревания β-клеток. В некоторых вариантах реализации изобретения набор содержит факторы созревания β-клеток для дифференцировки плюрипотентных стволовых клеток в клетки дефинитивной энтодермы. В некоторых вариантах реализации изобретения набор содержит факторы созревания β-клеток для дифференцировки клеток дефинитивной энтодермы в клетки первичной кишечной трубки. В некоторых вариантах реализации изобретения набор содержит факторы созревания β-клеток для дифференцировки клеток первичной кишечной трубки в Pdx1-позитивные панкреатические клетки-предшественники. В некоторых вариантах реализации изобретения набор содержит факторы созревания β-клеток для дифференцировки NKX6-1-позитивных панкреатических клеток-предшественников в инсулин-позитивные эндокринные клетки. В некоторых вариантах реализации изобретения набор содержит факторы созревания β-клеток для дифференцировки инсулин-позитивных эндокринных клеток в клетки SC-β.
[490] В некоторых вариантах реализации изобретения набор содержит любую комбинацию факторов созревания β-клеток, например, для дифференцировки плюрипотентных стволовых клеток в клетки дефинитивной энтодермы, дифференцировки клеток дефинитивной энтодермы в клетки первичной кишечной трубки, дифференцировки клеток первичной кишечной трубки Pdx1-позитивные панкреатические клетки-предшественники, дифференцировки NKX6-1-позитивных панкреатических клеток-предшественников в инсулин-позитивные эндокринные клетки и дифференцировки инсулин-позитивных эндокринных клеток в клетки SC-β.
[491] В одном варианте реализации изобретения набор может содержать плюрипотентную стволовую клетку для применения в качестве положительного контроля, например, для оценки или мониторинга эффективности или способности соединения по формуле (I) химически индуцировать дифференцировку плюрипотентной стволовой клетки по меньшей мере в одну инсулин-позитивную эндокринную клетку или ее предшественника и впоследствии в клетку SC-β. Соответственно, набор может содержать достаточное количество по меньшей мере одного фактора созревания β-клеток, чтобы индуцировать дифференцировку контрольной популяции плюрипотентных стволовых клеток (положительный контроль), а также индуцировать дифференцировку представляющей интерес популяции плюрипотентных стволовых клеток (например, предпочитаемой пользователем плюрипотентной стволовой клетки, например, клетки iPS) по меньшей мере в одну инсулин-позитивную эндокринную клетку или ее предшественника или в клетку SC-β.
[492] В некотором варианте реализации изобретения соединение в наборе может предоставляться в водонепроницаемом или газонепроницаемом контейнере, который в некоторых вариантах реализации изобретения практически не содержит других компонентов набора. Соединение может поставляться в более чем одном контейнере, например, оно может поставляться в контейнере, содержащем достаточное количество реагентов для предопределенного количества реакций, например, 1, 2, 3 или большего числа отдельных реакций для индукции плюрипотентных стволовых клеток в клетки дефинитивной энтодермы и впоследствии в инсулин-позитивные эндокринные клетки, и впоследствии в клетки SC-β. Фактор созревания β-клеток может предоставляться в любой форме, например, жидкой, сухой или лиофилизированной форме. Предпочтительно, чтобы описанное в данном документе соединение(я) (например, факторы созревания β-клеток) было в значительной степени очищенным и/или стерильным. Если описанное в данном документе соединение(я) предоставлено в виде жидкого раствора, жидкий раствор предпочтительно представляет собой водный раствор, при этом предпочтительным является стерильный водный раствор. Если описанное в данном документе соединение(я) предоставлено в сухой форме, восстановление в общем случае проводят путем добавления подходящего растворителя. Растворитель, например, стерильная вода или буфер, необязательно может предоставляться в наборе.
[493] В некоторых вариантах реализации изобретения набор необязательно дополнительно содержит информационный материал. Информационный материал может быть описательным, инструктирующим, маркетинговым или другим материалом, который относится к описанным в данном документе способам и/или применению описанного в данном документе соединения(й) в описанных в данном документе способах.
[494] Информационный материал из наборов не ограничен по своему инструктирующему или информативному материалу. В одном варианте реализации изобретения информационный материал может включать информацию о производстве соединения, молекулярной массе соединения, концентрации, сроке годности, информацию о номере партии и месте производства и так далее. В одном варианте реализации изобретения информационный материал относится к способам введения соединения. Кроме того, информационный материал из наборов не ограничен по своей форме. Во многих случаях информационный материал, например, инструкции, предоставлен в напечатанном виде, например, в виде печатного текста, изображения и/или фотографии, например, этикетки или печатного листа. При этом информационный материал также может предоставляться в других форматах, таких как брайлевская печать, машиночитаемый материал, видеозапись или аудиозапись. В другом варианте реализации изобретения информационный материал из наборов содержит контактную информацию, например, физический адрес, адрес электронной почты, веб-сайт или номер телефона, где пользователь набора может получить исчерпывающую информацию об описанном в данном документе соединении и/или его применении в описанных в данном документе способах. Конечно, информационный материал также может предоставляться в любом комбинированном формате.
[495] В одном варианте реализации изобретения информационный материал может содержать инструкции по введению описанного в данном документе соединения(й) (например, фактора созревания β-клеток) подходящим образом для осуществления описанных в данном документе способов, например, в подходящей дозировке, лекарственной форме или подходящим путем введения (например, в дозировке, лекарственной форме или путем введения, описанными в данном документе) (например, в клетку in vitro или клетку in vivo). В другом варианте реализации изобретения информационный материал может содержать инструкции по введению описанного в данном документе соединения(й) подходящему субъекту, например, человеку, например, человеку с риском наличия описанного в данном документе нарушения, или в клетку in vitro.
[496] Кроме описанного в данном документе соединения(й), композиция из набора может содержать другие ингредиенты, такие как растворитель или буфер, стабилизатор, консервант, вкусовая добавка (например, нейтрализатор горечи или подсластитель), ароматизатор или другой косметический ингредиент и/или дополнительный агент, например, для индукции плюрипотентных стволовых клеток (например, in vitro) или для лечения описанного в данном документе патологического состояния или нарушения. В альтернативном варианте в набор могут быть включены другие ингредиенты, но в составе других композиций или в других контейнерах, чем описанное в данном документе соединение. В таких вариантах реализации изобретения набор может содержать инструкции по смешиванию описанного в данном документе соединения(й) и других ингредиентов или по применению описанного в данном документе соединения(й) вместе с другими ингредиентами, например, инструкции по смешиванию двух агентов перед введением.
[497] Описанный в данном документе фактор созревания β-клеток может предоставляться в любой форме, например, жидкой, сухой или лиофилизированной форме. Предпочтительно, чтобы описанное в данном документе соединение(я) было в значительной степени очищенным и/или стерильным. Если описанное в данном документе соединение(я) предоставлено в виде жидкого раствора, жидкий раствор предпочтительно представляет собой водный раствор, при этом предпочтительным является стерильный водный раствор. Если описанное в данном документе соединение(я) предоставлено в сухой форме, восстановление в общем случае проводят путем добавления подходящего растворителя. Растворитель, например, стерильная вода или буфер, необязательно может предоставляться в наборе.
[498] Набор может содержать один или более контейнеров для композиции, содержащей по меньшей мере один описанный в данном документе фактор созревания β-клеток. В некоторых вариантах реализации изобретения набор содержит отдельные контейнеры (например, два отдельных контейнера для двух агентов), перегородки или отделения для композиции(й) и информационного материала. Например, композиция может находиться в бутылочке, флаконе или шприце, а информационный материал может находиться в пластиковом файле или пакете. В других вариантах реализации изобретения отдельные элементы набора находятся в одном неразделенном контейнере. Например, композиция находится в бутылочке, флаконе или шприце с присоединенным информационным материалом в форме этикетки. В некоторых вариантах реализации изобретения набор содержит множество (например, упаковку) отдельных контейнеров, в каждом из которых содержится одна или более единичных дозировочных форм (например, описанная в данном документе дозировочная форма) описанного в данном документе соединения. Например, набор содержит множество шприцов, ампул, пакетов из фольги или блистерных упаковок, в каждой из которых содержится единичная доза описанного в данном документе соединения. Контейнеры из наборов могут быть воздухонепроницаемыми, водостойкими (например, устойчивыми к изменению влажности или испарению) и/или светонепроницаемыми.
[499] Набор необязательно содержит устройство, подходящее для введения композиции, например, шприц, ингалятор, пипетку, щипцы, мерную ложку, капельницу (например, глазную капельницу), тампон (например, хлопковый тампон или тампон из древесного материала) или любое подобное устройство для доставки. В предпочтительном варианте реализации изобретения устройство представляет собой устройство медицинского имплантата, например, упакованного для хирургического проведения.
[500] Также набор также может содержать компонент для выявления маркера клеток SC-β, например, описанного в данном документе маркера, например, реагента для выявления позитивных клеток SC-β. Или в некоторых вариантах реализации изобретения набор также может содержать реагенты для выявления негативных маркеров клеток SC-β для негативной селекции клеток SC-β или для определения клеток, которые не экспрессируют негативные маркеры (например, клеток SC-β). Реагенты могут представлять собой, например, антитело к маркеру или праймеры для реакции ОТ-ПЦР или ПЦР, например, полуколичественной или количественной реакции ОТ-ПЦР или ПЦР. Такие маркеры можно использовать для определения получения клетки iPS. Если выявляющим реагентом является антитело, оно может быть предоставлено в виде сухого препарата, например, лиофилизированного, или в растворе. Антитело или другой выявляющий реагент могут быть связаны с меткой, например, радиоактивной, флуоресцентной (например, ЗФБ) или колориметрической меткой для использования при выявлении. Если выявляющим реагентом является праймер, он может быть предоставлен в виде сухого препарата, например, лиофилизированного, или в растворе.
[501] Может существовать необходимость в проведении анализа кариотипа клеток SC-β. Соответственно, набор может содержать компонент для кариотипирования, например, зонд, краситель, субстрат, фермент, антитело или другие реагенты, применяемые для получения кариотипа клетки.
[502] Набор может содержать клетки SC-β, например, зрелые панкреатические β-клетки, полученные из инсулин-позитивных эндокринных клеток или их предшественников того же типа, например, для применения в качестве положительного контрольного типа клеток.
[503] Также набор может содержать информационные материалы, например, инструкции, для применения двух или более компонентов, включенных в набор.
[504] Информационный материал может быть описательным, инструктирующим, маркетинговым или другим материалом, который относится к описанным в данном документе способам и/или применению описанного в данном документе соединения(й) для дифференцировки плюрипотентной стволовой клетки в соответствии с описанными в данном документе способами. В одном варианте реализации изобретения информационный материал может включать информацию о производстве соединения, молекулярной массе соединения, концентрации, сроке годности, информацию о номере партии и месте производства и так далее. В одном варианте реализации изобретения информационный материал относится к способам культивирования популяции инсулин-позитивных эндокринных клеток в присутствии по меньшей мере одного описанного в данном документе фактора созревания β-клеток.
[505] Способы введения клеток
[506] В одном варианте реализации изобретения описанные в данном документе клетки, например, популяция клеток SC-β, являются трансплантируемыми, например, популяцию клеток SC-β можно вводить субъекту. В некотором варианте реализации изобретения субъект, которому вводят популяцию клеток SC-β, является тем же субъектом, от которого была получена плюрипотентная стволовая клетка для дифференцировки в клетку SC-β (например, для аутологической клеточной терапии). В некоторых вариантах реализации изобретения субъект является другим субъектом. В некоторых вариантах реализации изобретения субъект страдает от диабета, например, диабета I типа, или является нормальным субъектом. Например, клетки для трансплантации (например, композиция, содержащая популяцию клеток SC-β) могут находиться в форме, подходящей для трансплантации, например, трансплантации органов.
[507] Указанный способ может дополнительно включать введение клеток нуждающемуся в этом субъекту, например, субъекту-млекопитающему, например, субъекту-человеку. Источником клеток может являться млекопитающее, предпочтительно человек. Источником или реципиентом клеток также может быть не являющийся человеком субъект, например, животная модель. Термин «млекопитающее» включает организмы, которые включают мышей, крыс, коров, овец, свиней, кроликов, коз, лошадей, обезьян, собак, кошек и, предпочтительно, людей. Аналогично, трансплантируемые клетки могут быть получены из любого из этих организмов, включая нечеловеческий трансгенный организм. В одном варианте реализации изобретения трансплантируемые клетки являются генетически сконструированными, например, клетки содержат экзогенный ген или были генетически сконструированы так, чтобы инактивировать или изменить эндогенный ген.
[508] Композицию, содержащую популяцию клеток SC-β можно вводить субъекту при помощи имплантируемого устройства. Имплантируемые устройства и связанные с ними технологии известны в данной области техники и применимы в качестве систем доставки в том случае, когда необходима продолжительная доставка или доставка с временно-ограниченным высвобождением соединений или композиций, описанных в данном документе. Кроме того, система доставки на основе имплантируемого устройства применима для нацеливания на конкретные точки при доставке соединения или композиции (например, определенные участки, органы). Negrin et al., Biomaterials, 22(6):563 (2001). В данном изобретении также можно применять технологию временно-ограниченного высвобождения, в которой задействованы альтернативные способы доставки. Например, препараты с временно-ограниченным высвобождением на основе полимерных технологий, технологий замедленного высвобождения и технологий инкапсуляции (например, полимерной, липосомной) также можно применять для доставки соединений или композиций, описанных в данном документе.
[509] Фармацевтические композиции, содержащие популяцию инсулин-вырабатывающих глюкозочувствителъных клеток
[510] Для введения субъекту популяцию клеток, полученную раскрытыми в данном документе способами, например, популяцию клеток SC-β (полученную путем приведения по меньшей мере одной инсулин-позитивной эндокринной клетки в контакт по меньшей мере с одним фактором созревания β-клеток (например, одним, двумя, тремя, четырьмя, пятью или более описанными в данном документе факторами созревания β-клеток)), можно вводить субъекту, например, в составе фармацевтически приемлемых композиций. Эти фармацевтически приемлемые композиции содержат терапевтически эффективное количество популяции клеток SC-β, как описано выше, смешанных вместе с одним или более фармацевтически приемлемыми носителями (добавками) и/или разбавителями.
[511] Как более подробно описано ниже, фармацевтические композиции согласно настоящему изобретению можно специальным образом готовить для введения в твердой или жидкой форме, включая те, которые подходят для: (1) перорального введения, например, жидкие лекарственные формы (водные или неводные растворы или суспензии), таблетки для рассасывания, драже, капсулы, пилюли, таблетки (например, предназначенные для буккального, подъязычного или системного всасывания), болюсы, порошки, гранулы, пасты для языка; (2) парентерального введения, например, путем подкожной, внутримышечной, внутривенной или эпидуральной инъекции как, например, стерильный раствор или суспензия или препарат с замедленным высвобождением; (3) местного введения, например, крем, мазь или накожные пластырь или спрей с контролируемым высвобождением; (4) интравагинального или ректального, например, в виде пессария, крема или пена; (5) подъязычного; (6) глазного; (7) трансдермального; (8) трансмукозального; или (9) назального введения. Кроме того, соединения можно имплантировать или инъецировать в организм пациента при помощи системы доставки лекарственных препаратов. Смотрите, например, Urquhart, et al., Ann. Rev. Pharmacol. Toxicol. 24: 199-236 (1984); Lewis, ed. "Controlled Release of Pesticides and Pharmaceuticals" (Plenum Press, New York, 1981); патент США №3773919; и патент США №35 3270960.
[512] Употребляемый в данном документе термин «фармацевтически приемлемый» относится к тем соединениям, материалам, композициям и/или дозировочным формам, которые с медицинской точки зрения подходят для применения в контакте с тканями людей и животных без проявлений излишней токсичности, раздражения, аллергических реакций или других проблем или осложнений и характеризуются рациональным соотношением благоприятный эффект/риск.
[513] Употребляемый в данном документе термин «фармацевтически приемлемый носитель» обозначает фармацевтически приемлемый материал, композицию или среду, такие как жидкий или твердый наполнитель, разбавитель, вспомогательное вещество, вспомогательное вещество в процессе производства (например, лубрикант, тальк, стеарат кальция или цинка или стерическая кислота) или инкапсулирующий растворитель материал, принимающий участие в переносе определенного соединения из одного органа или части тела в другой орган или часть тела. Каждый носитель должен быть «приемлемым» в смысле совместимости с другими ингредиентами препарата и безвредным для пациента. Некоторые примеры материалов, которые могут служить в качестве фармацевтически приемлемых носителей, включают: (1) сахара, такие как глюкоза, лактоза и сахароза; (2) крахмалы, такие как кукурузный крахмал и картофельный крахмал; (3) целлюлозу и ее производные, такие как карбоксиметилцеллюлоза натрия, метилцеллюлоза, этилцеллюлоза, микрокристаллическая целлюлоза и ацетатцеллюлоза; (4) порошкообразный трагакант; (5) солод; (6) желатин; (7) смазывающие агенты, такие как стеарат магния, лаурилсульфат натрия и тальк; (8) вспомогательные вещества, такие как кокосовое масло и воски для суппозиториев; (9) масла, такие как арахисовое масло, хлопковое масло, сафлоровое масло, кунжутное масло, оливковое масло, кукурузное масло и соевое масло; (10) гликоли, такие как пропиленгликоль; (11) полиоли, такие как глицерин, сорбитол, маннитол и полиэтиленгликоль (ПЭГ); (12) эфиры, такие как этилолеат и этиллаурат; (13) агар; (14) буферные агенты, такие как гидроксид магния и гидроксид алюминия; (15) альгиновую кислоту; (16) апирогенную воду; (17) изотонический солевой раствор; (18) раствор Рингера; (19) этиловый спирт; (20) рН забуференные растворы; (21) полиэфиры, поликарбонаты и/или полиангидриды; (22) объемообразующие агенты, такие как полипептиды и аминокислоты (23) сывороточные компоненты, такие как сывороточный альбумин, ЛПВП и ЛПНП; (22) С2-С12 спирты, такие как этанол; и (23) другие нетоксичные совместимые вещества, применяемые в фармацевтических препаратах. Также в препарате могут присутствовать смачивающие агенты, красители, разделительные агенты, покрывающие агенты, подсластители, вкусовые добавки, ароматизаторы, консерванты и антиоксиданты. Такие термины как «вспомогательное вещество», «носитель», «фармацевтически приемлемый носитель» и им подобные взаимозаменяемо употребляются в данном документе.
[514] Выражение «терапевтически эффективное количество», употребляемое в данном документе в отношении популяции клеток, означает, что количество соответствующих клеток в популяции клеток, например, клеток SC-β или зрелых панкреатических β-клеток, или композиции, содержащей клетки SC-β согласно настоящему изобретению, эффективно в смысле оказания желаемого терапевтического действия по меньшей мере в субпопуляции клеток в организме животного при рациональном соотношении благоприятный эффект/риск применимо к любому виду лечения. Например, это такое количество популяции клеток SC-β, вводимое субъекту, которого достаточно, чтобы привести к статистически значимому, выявляемому изменению по меньшей мере одного симптома диабета 1 типа, 1,5 типа или 2 типа, такого как уровень гликозилированного гемоглобина, уровень глюкозы в крови натощак, гипоинсулинемия и т.д. Способы определения терапевтически эффективного количества хорошо известны специалистам в данной области техники. В общем случае терапевтически эффективное количество может варьироваться в зависимости от истории болезни субъекта, возраста, состояния, пола, а также степени тяжести и типа патологического состояния субъекта и введения других фармацевтически активных агентов.
[515] Употребляемый в данном документе термин «вводить» относится к внесению композиции в организм субъекта способом или путем, который приводит по меньшей мере к частичной локализации композиции в необходимом месте организма таким образом, чтобы был произведен необходимый эффект. Описанное в данном документе соединение или композицию можно вводить любым подходящим способом, известным в данной области техники, включая, но не ограничиваясь этим, пероральный или парентеральный пути, включая внутривенное, внутримышечное, подкожное, трансдермальное, дыхательное (аэрозольное), ингаляционное, назальное, ректальное и местное (включая буккальное и подъязычное) введение.
[516] Типовые режимы введения включают, но не ограничиваются этим, инъекцию, инфузию, инсталляцию, ингаляцию или проглатывание. «Инъекция» включает, без ограничений, внутривенную, внутримышечную, внутриартериальную, интратекальную, интравентрикулярную, интракапсулярную, внутриглазную, интракардиальную, интрадермальную, внутрибрюшинную, транс трахеальную, подкожную, внутрикожную, внутрисуставную, субкапсулярную, субарахноидальную, интраспинальную, интрацереброспинальную и внутригрудинную инъекцию и инфузию. В предпочтительных вариантах реализации изобретения композиции вводят путем внутривенной инфузии или инъекции.
[517] Под «лечением», «предотвращением» или «облегчением» заболевания или нарушения подразумевается задержка или предотвращения начала такого заболевания или нарушения, обращение, смягчение, облегчение, подавление, замедление или остановка прогрессирования, усугубления или ухудшения прогрессирования или тяжести патологического состояния, связанных с таким заболеванием или нарушением. В одном варианте реализации изобретения происходит смягчение симптомов заболевания или нарушения по меньшей мере на 5%, по меньшей мере на 10%, по меньшей мере на 20%, по меньшей мере на 30%, по меньшей мере на 40% или по меньшей мере на 50%.
[518] Лечение диабета определяют стандартными медицинскими способами. Целью лечения диабета является снижение уровня сахара до уровня, настолько близкого к нормальному, насколько это возможно в рамках безопасности. Обычно поставленными целями являются 80-120 миллиграммов на децилитр (мг/дл) натощак и 100-140 мг/дл перед сном. Конкретный лечащий врач может ставить перед пациентом разные цели в зависимости от других факторов, например, от того, как часто у пациента наблюдается гипогликемическая реакция. Применяемые медицинские исследования включают исследования крови и мочи пациента для определения уровня сахара в крови, исследования уровня гликозилированного гемоглобина (HbA1c; измерение среднего уровня глюкозы в крови за последние 2-3 месяца, нормальный диапазон которого составляет 4-6%), исследования уровней холестерина и жира, а также исследования уровня белка в моче. Такие исследования являются стандартными исследованиями, известными специалистам в данной области техники (смотрите, например, American Diabetes Association, 1998). Успешную программу лечения также можно определить, уменьшив количество пациентов в программе, имеющих осложнения, связанные с диабетом, например, заболевания глаз, заболевание почек или нервные заболевания.
[519] Задержка начала диабета у субъекта относится к задержке появления по меньшей мере одного симптома диабета, например, гипергликемии, гипоинсулинемии, диабетической ретинопатии, диабетической нефропатии, слепоты, потери памяти, почечной недостаточности, сердечно-сосудистого заболевания (включая ишемическую болезнь сердца, заболевание периферических артерий, цереброваскулярное заболевание, атеросклероз и повышенное кровяное давление), невропатии, вегетативной дисфункции, гипергликемической гиперосмолярной комы или их комбинаций, по меньшей мере на 1 неделю, по меньшей мере на 2 недели, по меньшей мере на 1 месяц, по меньшей мере на 2 месяца, по меньшей мере на 6 месяцев, по меньшей мере на 1 год, по меньшей мере на 2 года, по меньшей мере на 5 лет, по меньшей мере на 10 лет, по меньшей мере на 20 лет, по меньшей мере на 30 лет, по меньшей мере на 40 лет и более, и может включать всю продолжительность жизни субъекта.
[520] В определенных вариантах реализации изобретения субъект является млекопитающим, например, приматом, например, человеком. Термины «пациент» и «субъект» взаимозаменяемо употребляются в данном документе. Предпочтительно субъект является млекопитающим. Млекопитающее может являться человеком, обезьяной, мышью, крысой, собакой, кошкой, лошадью или коровой, но не ограничивается этими примерами. Отличные от людей млекопитающие могут быть преимущественно использованы в качестве субъектов, которые представляют животные модели диабета 1 типа, диабета 2 типа, сахарного диабета или пред диабетических состояний. Кроме того, описанные в данном документе способы можно применять для лечения одомашненных животных и/или домашних животных. Субъектом может быть самец или самка. Субъектом может быть тот, у кого ранее были диагностированы или выявлены диабет (например, 1 типа или 2 типа), одно или более осложнений, связанных с диабетом, или преддиабетическое состояние и, необязательно, кто ранее проходил лечение от диабета, одного или более осложнений, связанных с диабетом, или преддиабетического состояния. Субъектом также может быть тот, кто не страдает от диабета или преддиабетического состояния. Субъектом также может быть тот, у кого были диагностированы или выявлены диабет, одно или более осложнений, связанных с диабетом, или преддиабетическое состояние, но кто демонстрировал улучшение в отношении известных факторов риска диабета в результате получения одного или более видов лечения диабета, одного или более осложнений, связанных с диабетом, или преддиабетического состояния. В альтернативном варианте субъектом также может быть тот, у кого ранее не были диагностированы диабет, одно или более осложнений, связанных с диабетом, или преддиабетическое состояние. Например, субъектом может быть тот, кто демонстрирует наличие одного или более факторов риска диабета, осложнений, связанных с диабетом, или преддиабетического состояния, или субъект, который не демонстрирует факторов риска диабета, или субъект, бессимптомный в отношении диабета, одного или более осложнений, связанных с диабетом, или преддиабетического состояния. Субъектом также может быть тот, кто страдает или подвержен риску возникновения диабета или преддиабетического состояния. Субъектом также может быть тот, у кого были диагностированы или выявлены одно или более осложнений, связанных с диабетом, или преддиабетическое состояние по определению данного документа, или, в альтернативном варианте, субъектом может быть тот, у кого не были ранее диагностированы или выявлены одно или более осложнений, связанных с диабетом, или преддиабетическое состояние.
[521] Употребляемое в данном документе выражение «субъект, нуждающийся в клетках SC-β» относится к субъекту, у которого диагностирован или выявлен, или который подвержен риску развития диабета (например, 1 типа, 1,5 типа или 2 типа), одного или более осложнений, связанных с диабетом, или преддиабетического состояния.
[522] Субъекта, нуждающегося в популяции клеток SC-β, можно определить при помощи любых способов, применяемых для диагностирования диабета. Например, диабет 1 типа можно диагностировать при помощи теста на гликозилированный гемоглобин (А1С), теста на случайный уровень глюкозы в крови и/или теста на уровень глюкозы в крови натощак. Параметры диагностирования диабета известны в данной области техники и без проблем доступны специалистам в данной области техники.
[523] В некоторых вариантах реализации изобретения способы согласно изобретению дополнительно включают отбор субъекта, который нуждается в дополнительных клетках SC-β. Субъекта, нуждающегося в популяции клеток SC-β, можно выбрать на основании представленных симптомов, таких как симптомы диабета 1 типа, 1,5 типа или 2 типа. Типовые симптомы диабета включают, но не ограничиваются этим, повышенную жажду (полидипсию), частое мочеиспускание (полиурию), повышенное чувство голода (полифагию), повышенную утомляемость, потерю массы, гипергликемию, низкие уровни инсулина, высокое содержание сахара в крови (например, уровни сахара, превышающие 250 мг, превышающие 300 мг), наличие кетонов в моче, утомляемость, сухую и/или раздраженную кожу, нечеткость зрения, медленно заживающие порезы и раны, большее, чем обычно, количество инфекционных заболеваний, онемение и покалывание в стопах, диабетическую ретинопатию, диабетическую нефропатию, слепоту, потерю памяти, почечную недостаточность, сердечно-сосудистое заболевание (включая ишемическую болезнь сердца, заболевание периферических артерий, цереброваскулярное заболевание, атеросклероз и повышенное кровяное давление), невропатию, вегетативную дисфункцию, гипергликемическую гиперосмолярную кому или их комбинации.
[524] В некоторых вариантах реализации изобретения композиция, содержащая популяцию клеток SC-β для введения субъекту, может дополнительно содержать фармацевтически активный агент, например, такой как известные в данной области техники агенты для лечения диабета или агенты, обладающие гипогликемической активностью, например, ингибиторы дипептидилпептидазы 4 (DPP-4) (например, алоглиптин, линаглиптин, саксаглиптин, ситаглиптин, вилдаглиптин и берберин), бигуаниды (например, метформин, буформин и фенформин), модуляторы рецептора, активируемого пролифератором пероксисом (PPAR), такие как тиазолидиндионы (TZD) (например, пиоглитазон, ривоглитазон, розиглитазон и троглитазон), двойные агонисты PPAR (например, алеглитазар, мураглитазар и тезаглитазар), сульфонилмочевины (например, ацетогексамид, карбутамид, хлорпропамид, гликлазид, толбутамид, толазамид, глибенкламид (глибурид), глипизид, гликуидон, гликлопирамид и глимепирид), меглитиниды («глиниды») (например, натеглинид, репаглинид и митиглинид), глюкагон-подобный пептид-1 (GLP-1) и его аналоги (например, эксендин-4, эксенатид, лираглутид, альбиглютид), инсулин и аналоги инсулина (например, инсулин лизпро, инсулин аспарт, инсулин глулизин, инсулин гларгин, инсулин детемир, эксубера и НПХ-инсулин), ингибиторы альфа-глюкозидазы (например, акарбоза, миглитол и воглибоза), аналоги амилина (например прамлинтид), ингибиторы натрий-зависимого котранспортера глюкозы Т2 (SGLT Т2) (например, дапаглифлозин, ремоглифлозин и серглифлозин) и другие (например, бенфлуорекс и толрестат).
[525] При диабете 1 типа происходит нежелательное разрушение β-клеток вследствие непрерывного аутоиммунного ответа. Следовательно, этот аутоиммунный ответ можно ослабить, применяя соединения, которые подавляют или блокируют такой аутоиммунный ответ. В некоторых вариантах реализации изобретения композиция, содержащая популяцию клеток SC-P для введения субъекту, может дополнительно содержать фармацевтически активный агент, который является модулятором иммунного ответа. Употребляемый в данном документе термин «модулятор иммунного ответа» относится к соединению (например, небольшой молекуле, антителу, пептиду, нуклеиновой кислоте или реагенту для генной терапии), которое подавляет аутоиммунный ответ у субъекта. Не ограничиваясь теорией, можно сказать, что модулятор иммунного ответа подавляет аутоиммунный ответ путем подавления активности, активации или экспрессии воспалительных цитокинов (например, ИЛ-12, ИЛ-23 или ИЛ-27) или STAT-4. Типовые модуляторы иммунного ответа включают, но не ограничиваются этим, представителей группы, состоящей из лизофиллина (LSF) и аналогов и производных LSF, описанных в патенте США №6774130, содержание которого в полном объеме включено в данный документ посредством ссылки.
[526] Композицию, содержащую клетки SC-β, можно вводить субъекту в одно время или в разное время с введением фармацевтически активного агента или содержащей его композиции. При введении в разное время композиции, содержащие популяцию клеток SC-β и/или фармацевтически активный агент для введения субъекту, можно вводить в течении 5 минут, 10 минут, 20 минут, 60 минут, 2 часов, 3 часов, 4, часов, 8 часов, 12 часов, 24 часов после введения другого. Если композиции, содержащие популяцию клеток SC-β, и композицию, содержащую фармацевтически активный агент, вводят в разных фармацевтических композициях, путь введения может быть разным. В некоторых вариантах реализации изобретения субъекту вводят композицию, содержащую клетки SC-β. В других вариантах реализации изобретения субъекту вводят композицию, содержащую фармацевтически активный агент. В другом варианте реализации изобретения субъекту вводят композиции, содержащие популяцию клеток SC-β, смешанных с фармацевтически активным агентом. В другом варианте реализации изобретения субъекту вводят композицию, содержащую популяцию клеток SC-β, и композицию, содержащую фармацевтически активный агент, при этом введение происходит практически в одно время или последовательно друг за другом.
[527] Токсичность и терапевтическую эффективность введения композиций, содержащих популяцию клеток SC-β, можно определить при помощи стандартных фармацевтических процедур в клеточных культурах или на экспериментальных животных, например, чтобы определить LD50 (дозу, летальную для 50% популяции) и ED50 (дозу, терапевтически эффективную для 50% популяции). Предпочтительными являются композиции, содержащие популяцию клеток SC-β, которые демонстрируют высокие терапевтические индексы.
[528] Количество композиции, содержащей популяцию клеток SC-β, можно протестировать на нескольких общеизвестных животных моделях.
[529] Не страдающая ожирением диабетические (NOD) мышь несет генетический дефект, который приводит к инсулиту, проявляющемуся в возрасте нескольких недель (Yoshida et al., Rev. Immunogenet. 2:140, 2000). У 60-90% самок через 20-30 недель развивается сахарный клинический диабет. Иммунная патология аналогична той, которая наблюдается при I типе диабета у человека. Другими моделями диабета I типа служат мыши, несущие трансгенные мутации и мутации, связанные с генным нокаутом (Wong et al., Immunol. Rev. 169:93, 1999). Недавно в Lenzen et al. (Diabetologia 44:1189, 2001) сообщалось о крысиной модели спонтанного диабета I типа. Также у мышей можно индуцировать гипергликемию (>500 мг глюкозы/дл) путем проведения единичной внутрибрюшинной инъекции стрептозотоцина (Soria et al., Diabetes 49:157, 2000) или путем последовательного применения низких доз стрептозотоцина (Ito et al., Environ. Toxicol. Pharmacol. 9:71, 2001). Чтобы исследовать эффективность имплантированных островковых клеток, у мышей отслеживают возвращение глюкозы до нормальных уровней (<200 мг/дл).
[530] Более крупные животные являются хорошей моделью для исследования осложнений при хронической гипергликемии. Собакам можно привить инсулиновую зависимость путем удаления поджелудочной железы (J. Endocrinol. 158:49, 2001) или кормлением галактозой (Kador et al., Arch. Opthalmol. 113:352, 1995). Также существует наследственная модель диабета I типа у собак кеесхондов (Am. J. Pathol. 105:194, 1981). Одна из первых работ с собачьей моделью (Banting et al., Can. Med. Assoc. J. 22:141, 1922) привела к тому, что в феврале 1925 года два канадца совершили длительное океанское путешествие в Стокгольм.
[531] В качестве иллюстрации, пробное исследование можно провести путем имплантации клеток SC-β в организм следующих животных: а) не диабетических бестимусных (дефицитных в отношении Т-клеток) мышей; b) бестимусных мышей с индуцированным обработкой стрептозотоцином диабетом; и с) бестимусных мышей в процессе регенерации островков после частичной резекции поджелудочной железы. Количество трансплантированных клеток эквивалентно ~1000-2000 нормальных человеческих β-клеток, имплантированных под почечную капсулу, в печень или в поджелудочную железу. В случае не диабетических мышей конечными точками могут быть оценка выживаемости трансплантата (по результатам гистологического исследования) и определение выработки инсулина методами биохимического анализа, RIA, ELISA и иммуногистохимии. Для обработанных стрептозотоцином животных и животных с частичной резекцией поджелудочной железы также можно проводить оценку выживаемости, метаболической регуляции (глюкозы в крови) и увеличения массы.
[532] В некоторых вариантах реализации изобретения данные, полученные после анализа клеточной культуры и в животных исследованиях, можно использовать при подборе диапазона дозировок для применения на людях. Дозировка таких соединений предпочтительно соответствует диапазону циркулирующих концентраций, который включает ED50 с низкой или отсутствующей токсичностью. Дозировка может варьироваться в пределах этого диапазона в зависимости от применяемой дозировочной формы и пути введения.
[533] Терапевтически эффективную дозу композиции, содержащей популяцию клеток SC-β, также можно изначально оценить при помощи анализа клеточных культур. Дозу можно определить на животных моделях in vivo, чтобы достичь секреции инсулина в соответствующей концентрации в ответ на уровень циркулирующей глюкозы в плазме крови. В альтернативном варианте действие любой конкретной дозировки можно отслеживать при помощи подходящего метода биоанализа.
[534] Для принятия решений в отношении длительности и частоты лечения врачи-специалисты, как правило, отслеживают состояние субъектов, чтобы определить, оказывает ли лечение благоприятное терапевтической воздействие, и чтобы определить, нужно ли уменьшить или увеличить дозировку, уменьшить или увеличить частоту введения, прервать лечение, продолжить лечение или внести другие изменения в схему лечения. Режим дозирования может варьироваться от одного раза в неделю до ежедневного в зависимости от количества клинических факторов, таких как чувствительность субъекта к полипептидам. Необходимое количество можно вводить за один раз или делить на дробные дозы, например, 2-4 дробные дозы, и вводить на протяжении определенного периода времени, например, через соответствующие интервалы на протяжении дня или в соответствии с другим режимом. Такие дробные дозы можно вводить в виде единичных дозировочных форм. В некоторых вариантах реализации изобретения введение является постоянным, например, одна или более доз ежедневно на протяжении периода, составляющего недели или месяцы. Примерами режимов дозирования является ежедневное введение, дважды в день, три раза в день или четыре или более раз в день на протяжении периода, составляющего 1 неделю, 2 недели, 3 недели, 4 недели, 1 месяц, 2 месяцы, 3 месяца, 4 месяца, 5 месяцев или 6 месяцев или более.
[535] В другом аспекте изобретения в способах предложено применение популяции клеток SC-β, как раскрыто в данном документе. В одном варианте реализации изобретения раскрытую в данном документе выделенную популяцию клеток SC-β можно применять для производства фармацевтической композиции для проведения трансплантации нуждающимся в лечении субъектам, например, субъекту, который болен или подвержен риску развития диабета, например, без ограничений, субъектам с наследственным или приобретенным диабетом. В одном варианте реализации изобретения выделенная популяция клеток SC-β может быть генетически модифицированной. В другом аспекте субъект может быть болен или подвержен риску возникновения диабета и/или метаболического нарушения. В некоторых вариантах реализации изобретения раскрытая в данном документе выделенная популяция клеток SC-β может быть аутологической и/или аллогенной. В некоторых вариантах реализации изобретения субъект является млекопитающим, а в других вариантах реализации изобретения млекопитающее является человеком.
[536] Применение раскрытой в данном документе выделенной популяции клеток SC-β обладает преимуществами по сравнению с существующими способами, так как популяция клеток SC-β может быть дифференцирована из инсулин-позитивных эндокринных клеток или их предшественников, полученных из стволовых клеток, например, клеток iPS, полученных или собранных у субъекта, которому вводят выделенную популяцию клеток SC-β. Это является огромным преимуществом, так как обеспечивает возобновляемый источник клеток SC-β, который может быть дифференцирован из стволовых клеток в инсулин-позитивные эндокринные клетки известными специалисту в данной области техники способами, а затем дополнительно дифференцирован описанными в данном документе способами в панкреатические β-подобные клетки или клетки, обладающие характеристиками панкреатических β-клеток, для трансплантации в организм субъекта, в частности, в значительной степени чистую популяцию зрелых панкреатических β-подобных клеток, которые не несут риски и ограничения клеток, полученных из других систем.
[537] В другом варианте реализации изобретения выделенную популяцию клеток SC-β (например, зрелых панкреатических β-клеток или β-подобных клеток) можно применять в качестве моделей для изучения свойств дифференцировки в инсулин-вырабатывающие клетки, например, в панкреатические β-клетки или панкреатические β-подобные клетки, или путей развития клеток энтодермального происхождения в панкреатические β-клетки.
[538] В некоторых вариантах реализации изобретения инсулин-позитивные эндокринные клетки или клетки SC-β могут быть генетически сконструированы так, чтобы содержать маркеры, функционально связанные с промоторами, которые экспрессируются в случае экспрессии или секреции маркера, например, маркер может быть функционально связан с инсулиновым промотором и, таким образом, экспрессия маркера происходит, когда инсулин-позитивные эндокринные клетки или их предшественники дифференцируются в клетки SC-β, которые экспрессируют и секретируют инсулин. В некоторых вариантах реализации изобретения популяцию клеток SC-β можно применять в качестве модели для изучения пути дифференцировки клеток, которые дифференцируются в островковые β-клетки или панкреатические β-подобные клетки.
[539] В других вариантах реализации изобретения инсулин-вырабатывающие глюкозочувствительные клетки можно применять в качестве моделей для изучения роли островковых β-клеток в поджелудочной железе и в развитии диабета и метаболических нарушений. В некоторых вариантах реализации изобретения клетки SC-β могут принадлежать нормальному субъекту или субъекту, который несет мутацию и/или полиморфизм (например, в гене Pdx1, который приводит к инсулиннезависимому сахарному диабету с ранним началом (NIDDM), а также сахарному диабету взрослого типа у молодых 4 типа (MODY4), что может быть использовано для выявления небольших молекул и других терапевтических агентов, которые можно применять для лечения субъектов с диабетом, несущих мутацию или полиморфизм в Pdx1. В некоторых вариантах реализации изобретения клетки SC-β могут быть генетически сконструированы так, чтобы исправить полиморфизм в гене Pdx1 перед введением субъекту при проведении терапевтического лечения субъекта с диабетом. В некоторых вариантах реализации изобретения клетки SC-β могут быть генетически сконструированы так, чтобы нести мутацию и/или полиморфизм.
[540] В одном варианте реализации изобретение относится к способу лечения диабета или метаболического нарушения у субъекта, включающему введение эффективного количества композиции, содержащей раскрытую в данном документе популяцию клеток SC-β, субъекту с диабетом и/или метаболическим нарушением. В дополнительном варианте реализации в изобретении предложен способ лечения диабета, включающий введение композиции, содержащей раскрытую в данном документе популяцию клеток SC-β, субъекту, который болен или подвержен повышенному риску развития диабета, в эффективном количестве, достаточном для выработки инсулина в ответ на повышенный уровень глюкозы в крови.
[541] В одном варианте реализации вышеуказанных способов субъект является человеком, а раскрытая в данном документе популяция клеток SC-β представляет собой человеческие клетки. В некоторых вариантах реализации в изобретении предусматривается, что раскрытую в данном документе популяцию клеток SC-β вводят непосредственно в поджелудочную железу субъекта или вводят системным образом. В некоторых вариантах реализации изобретения раскрытую в данном документе популяцию клеток SC-β можно вводить в любом подходящем месте организма субъекта, например, в капсуле в кровеносный сосуд или печень, или в любом подходящем месте, где введенная популяция клеток SC-β может секретировать инсулин в ответ на повышенный уровень глюкозы в крови.
[542] Настоящее изобретение также относится к способу лечения субъекта с диабетом или метаболическим нарушением, которое возникает вследствие генетического дефекта, физической травмы, негативного воздействия окружающей среды или загрязнения воздуха, плохого состояния здоровья, ожирения и других факторов риска диабета, известных специалисту в данной области техники. Эффективность лечения субъекта, которому вводят композицию, содержащую популяцию клеток SC-β, можно отслеживать по клинически принятым критериям и тестам, которые включают, например, (i) тест на гликированный гемоглобин (А1С), который дает информацию по среднему уровню сахара в крови субъекта за последние два-три месяца на основании определения процентного содержания сахара крови, присоединенного к гемоглобину - белку-переносчику кислорода в красных кровяных тельцах. Чем выше уровень сахара в крови, тем больше присоединенного к гемоглобину сахара. Уровень А1С, составляющий 6,5 процентов и выше в двух отдельных пробах, указывает на наличие у субъекта диабета. Величина 6-6,5% дает основание предположить у субъекта наличие преддиабета. (ii) Случайный уровень сахара в крови. Образец крови берут у субъекта в случайно определенное время, а случайный уровень сахара в крови, составляющий 200 миллиграммов на децилитр (мг/дл) - 11,1 миллимолей на литр (ммоль/л) или выше, свидетельствует о наличии у субъекта диабета, (iii) Тест на уровень сахара в крови натощак. Образец крови берут у субъекта после ночного голодания. Уровень сахара в крови натощак, составляющий 70-99 мг/дл (3,9 и 5,5 ммоль/л), является нормальным. Если уровень сахара в крови субъекта натощак составляет 126 мг/дл (7 ммоль/л) или выше в двух отдельных пробах, субъект имеет диабет. Уровень сахара в крови натощак, составляющий от 100 до 125 мг/дл (от 5,6 до 6,9 ммоль/л), указывает на наличие у субъекта преддиабета. (iv) Пероральный тест толерантности к глюкозе. Образец крови берут у субъекта после того, как субъект голодал на протяжении по меньшей мере восьми часов или ночи и выпил после этого сахарный раствор, а уровень сахара в крови определяют через два часа. Уровень сахара в крови, составляющий менее 140 мг/дл (7,8 ммоль/л), является нормальным. Уровень сахара в крови, составляющий от 140 до 199 мг/дл (от 7,8 до 11 ммоль/л), считается преддиабетическим. Иногда это называется нарушением толерантности к глюкозе (IGT). Уровень сахара в крови, составляющий 200 мг/дл (11,1 ммоль/л) или выше, указывает на наличие у субъекта диабета.
[543] В некоторых вариантах реализации изобретения эффект от введения раскрытой в данном документе популяции клеток SC-β нуждающемуся в этом субъекту связан с улучшением переносимости физической нагрузки или других показателей качества жизни, а также снижением смертности. Эффект от клеточной терапии популяцией клеток SC-β может проявляться в течение времени, составляющего от дней до недель после проведения процедуры. При этом благоприятные эффекты могут проявляться уже через несколько часов после проведения процедуры и могут длиться несколько лет. В некоторых вариантах реализации изобретения эффект от клеточной терапии популяцией клеток SC-β проявляется в течение двух недель после проведения процедуры.
[544] В некоторых вариантах реализации изобретения раскрытую в данном документе популяцию клеток SC-β можно применять для восстановления или регенерации тканей пациента-человека или другого субъекта, нуждающегося в таком лечении. В некоторых вариантах реализации изобретения композиции, содержащие популяции клеток SC-β, можно вводить способом, который создает возможность приживления или миграции к необходимому участку ткани и восстановления или регенерации функционально дефицитной области. Доступны специальные устройства, которые приспособлены для введения клеток, способных восстанавливать популяцию β-клеток в поджелудочной железе или в другом необходимом месте. Соответственно, клетки SC-β можно вводить в поджелудочную железу реципиента путем инъекции или вводить путем внутримышечной инъекции.
[545] В некоторых вариантах реализации изобретения композиции, содержащие раскрытую в данном документе популяцию клеток SC-β, имеют множество применений в области клинической терапии, исследований, разработок и в коммерческих целях. Например, в терапевтических целях раскрытую в данном документе популяцию клеток SC-β можно вводить, чтобы повысить выработку инсулина в ответ на повышение уровня глюкозы в крови в случае любой очевидной необходимости, такой как врожденное нарушение метаболической функции, следствие патологического состояния (например, диабета) или результат характерной травмы (т.е. повреждения поджелудочной железы или утраты или повреждения островковых β-клеток). В некоторых вариантах реализации изобретения раскрытую в данном документе популяцию клеток SC-β вводят субъекту не только для того, чтобы помочь восстановить функцию поврежденных или в каком-либо другом смысле нездоровых тканей, но также, чтобы облегчить перестройку поврежденных тканей.
[546] Чтобы определить, подходят ли клеточные композиции для терапевтического введения, популяцию клеток SC-β можно сначала исследовать на подходящей животной модели. На одном уровне клетки оценивают в отношении их способности выживать и сохранять свой фенотип in vivo. Клеточные композиции, содержащие клетки SC-β, можно вводить иммунодефицитным животным (таким как бестимусные мыши, или животные с индуцированным химически или посредством облучения иммунодефицитом). Ткани собирают в период возобновления роста и оценивают наличие вводимых клеток или их потомства.
[547] Это можно осуществить путем введения клеток, которые экспрессируют выявляемую метку (такую как зеленый флуоресцентный белок или β-галактозидаза); которые были предварительно помечены (например, BrdU или [3Н] тимидином), или путем последующего выявления конститутивного клеточного маркера (например, с применением человеко-специфического антитела). Наличие и фенотип вводимой популяции клеток SC-β можно оценить методом иммуногистохимии или ELISA с применением человеко-специфического антитела или методом ОТ-ПЦР анализа с применением праймеров и гибридизационных условий, которые приводят к амплификации, специфической для человеческих полинуклеотидов в соответствии с опубликованными данными по после довательностям.
[548] В данной области техники доступно и известно большое количество животных моделей для исследования диабета, например, как раскрыто в патенте США №6187991, который включен в данный документ посредством ссылки, а также моделей на основе грызунов; NOD (не страдающие ожирением мыши), мыши ВВ_DB, крысы KDP и мыши TCR и другие животные модели диабета, как описано в Rees et al, Diabet Med. 2005 April; 22(4):359-70; Srinivasan K, et al., Indian J Med. Res. 2007 March; 125(3):451-7; Chatzigeorgiou A, et al., In Vivo. 2009 March-April; 23(2):245-58, которые включены в данный документ посредством ссылки.
[549] В некоторых вариантах реализации изобретения раскрытую в данном документе популяцию клеток SC-β можно вводить в любом физиологически приемлемом вспомогательном веществе, при этом клетки SC-β могут найти соответствующий участок для репликации, пролиферации и/или приживления. В некоторых вариантах реализации изобретения раскрытую в данном документе популяцию клеток SC-β можно вносить при помощи инъекции, катетера и тому подобного. В некоторых вариантах реализации изобретения раскрытую в данном документе популяцию клеток SC-β можно замораживать при температуре жидкого азота и хранить на протяжении длительного периода времени с возможностью применения после размораживания. В случае замораживания популяцию клеток SC-β обычно хранят в среде, содержащей 10% ДМСО, 50% ФТС, 40% RPMI 1640. После размораживания клетки можно размножить путем применения факторов роста и/или питающих клеток, имеющих отношение к культивированию клеток SC-β, как описано в данном документе.
[550] В некоторых вариантах реализации изобретения раскрытая в данном документе популяция клеток SC-β может поставляться в форме фармацевтической композиции, содержащей изотоническое вспомогательное вещество, приготовленное в достаточно стерильных условиях для применения на людях. Для ознакомления с общими принципами приготовления медицинских препаратов стоит обратиться к Cell Therapy: Stem Cell Transplantation, Gene Therapy, and Cellular Immunotherapy, by G. Morstyn & W. Sheridan eds, Cambridge University Press, 1996; и Hematopoietic Stem Cell Therapy, E. D. Ball, J. Lister & P. Law, Churchill Livingstone, 2000. Выбор клеточного вспомогательного вещества и любых сопутствующих элементов для композиции, содержащей раскрытую в данном документе популяцию клеток SC-β, адаптируется в соответствии с путем и устройством, применяемым для введения. В некоторых вариантах реализации изобретения композиция, содержащая популяцию клеток SC-β, также может содержать или дополняться одним или более другими ингредиентами, которые облегчают приживление или функциональную мобилизацию клеток SC-β. Подходящие ингредиенты включают белки матрикса, которые способствуют или стимулируют адгезию клеток SC-β или комплементарных типов клеток, в частности, эпителиальных клеток. В другом варианте реализации изобретения композиция может содержать рассасывающиеся или биоразлагаемые матричные скаффолды.
[551] В некоторых вариантах реализации изобретения раскрытую в данном документе популяцию клеток SC-β можно генетически изменять с целью внесения генов, полезных для инсулин-вырабатывающих клеток, таких как панкреатические β-клетки, например, для исправления генетического дефекта у индивида, внесения селектируемого маркера и т.д., или генов, полезных для селекции против клеток, не вырабатывающих инсулин, дифференцировавшихся из по меньшей мере одной инсулин-позитивной эндокринной клетки или ее предшественника, или для селективного самоубийства имплантированных клеток SC-β. В некоторых вариантах реализации изобретения популяцию клеток SC-β также можно генетически модифицировать, чтобы повысить выживаемость, регулировать пролиферацию и тому подобное. В некоторых вариантах реализации изобретения раскрытую в данном документе популяцию клеток SC-β можно генетически изменять при помощи трансфекции или трансдукции подходящим вектором, гомологичной рекомбинации или другим соответствующим способом так, чтобы клетки экспрессировали представляющий интерес ген. В одном варианте реализации изобретения популяцию клеток SC-β трансфицируют генами, кодирующими каталитический компонент теломеразы (TERT), как правило, под управлением гетерологичного промотора, который повышает экспрессию теломеразы по сравнению с той, которая наблюдается с эндогенным промотором (смотрите международную патентную заявку WO 98/14592, которая включена в данный документ посредством ссылки). В других вариантах реализации изобретения вносят селектируемый маркер, чтобы обеспечить большую степень очистки популяции клеток SC-β. В некоторых вариантах реализации изобретения популяцию клеток SC-β можно генетически изменять при помощи содержащих вектор супернатантов на протяжении периода, составляющего 8-16 ч, а затем произвести обмен на среду для роста на 1-2 дня. Селекцию генетически измененных клеток SC-β можно проводить, используя агент для селекции по чувствительности к лекарственному препарату, такому как пуромицин, G418 или бластицидин, а затем повторить культивацию.
[552] Генную терапию можно применять, чтобы модифицировать клетку для замещения генного продукта, чтобы облегчить регенерацию ткани, чтобы лечить заболевание или чтобы улучшить выживаемость клеток после имплантации субъекту (т.е. предотвратить отторжение).
[553] В альтернативном варианте реализации изобретения раскрытую в данном документе популяцию клеток SC-β также можно генетически изменять, чтобы повысить их способность участвовать в регенерации тканей или чтобы доставить терапевтический ген к месту введения. Вектор конструируют, используя известную кодирующую последовательность необходимого гена, функционально связанную с промотором, который является полиспецифическим или специфически активным в дифференцированном типе клеток. В частности, интерес представляют клетки, которые были генетически изменены, чтобы экспрессировать один или более факторов роста разных типов, таких как соматостатин, глюкагон и другие факторы.
[554] Для переноса экзогенных генов в раскрытые в данном документе клетки-мишени SC-β доступно много векторов. Эти векторы могут быть эписомными, например, плазмидами, векторами, полученными из вирусов, таких как цитомегаловирус, аденовирус и т.д., или могут быть интегрированы в геном клетки-мишени путем гомологичной рекомбинации или случайной интеграции, например, векторы, полученные из ретровирусов, таких как MMLV, HIV-1, ALV и т.д. В некоторых вариантах реализации изобретения можно также использовать комбинации ретровирусов и соответствующих пакующих клеточных линий, где капсидные белки остаются функциональными в отношении инфицирования раскрытых в данном документе клеток SC-β. Обычно клетки SC-β и вирус инкубируют на протяжении по меньшей мере 24 часов в культуральной среде. В некоторых вариантах реализации изобретения клеткам SC-β дают возможность расти в культуральной среде на протяжении коротких интервалов, составляющих в некоторых применениях 24-73 часа, или на протяжении по меньшей мере двух недель, и могут давать расти на протяжении пяти недель или более перед проведением анализа. Обычно применяемые ретровирусные векторы являются «дефективными», т.е. неспособными вырабатывать вирусные белки, необходимые для продуктивного инфицирования. Для репликации векторов необходим рост в пакующей клеточной линии.
[555] Специфичность ретровируса к клетке-хозяину определяется оболочечным белком env (р120). Оболочечный белок обеспечивает пакующая клеточная линия. Оболочечные белки делятся по меньшей мере на три типа - экотропные, амфотропные и ксенотропные. Ретровирусы, упакованные экотропным оболочечным белком, например, MMLV, способны инфицировать большинство мышиных и крысиных типов клеток. Экотропные пакующие клеточные линии включают BOSC23 (Pear et al. (1993) P.N.A.S. 90:8392-8396). Ретровирусы, несущие амфотропный оболочечный белок, например, 4070А (Danos et al, supra.), способны инфицировать большинство типов клеток млекопитающих, включая людей, собак и мышей. Амфотропные пакующие клеточные линии включают РАl2 (Miller et al. (1985) Mol. Cell. Biol. 5:431-437); PA317 (Miller et al. (1986) Mol. Cell. Biol. 6:2895-2902); GRIP (Danos et al. (1988) PNAS 85:6460-6464). Ретровирусы, упакованные ксенотропным оболочечным белком, например, AKR env, способны инфицировать большинство типов клеток млекопитающих за исключением клеток мышей. В некоторых вариантах реализации изобретения векторы могут содержать гены, которые впоследствии необходимо удалять, например, при помощи системы рекомбиназы, такой как Cre/Lox, или разрушать клетки, которые их экспрессируют, например, путем включения генов, которые делают возможной селективную токсичность, таких как гены TK вируса герпеса, Bc1-Xs и т.д.
[556] Подходящие индуцибельные промоторы активируются в необходимом типе клеток-мишеней, как в трансфицированных клетках, так и в их потомстве. Под активацией транскрипции подразумевается, что транскрипция в клетках-мишенях повышается по сравнению с базовым уровнем по меньшей мере в около 100 раз, более часто по меньшей мере в около 1000 раз. Известны различные промоторы, которые индуцируются в разных типах клеток.
[557] В одном аспекте настоящего изобретения раскрытая в данном документе популяция клеток SC-β подходит для системного введения или для нацеливания на анатомический участок. Популяцию клеток SC-β можно, например, приживить в или вблизи поджелудочной железы субъекта, или можно вводить системно, например, без ограничений, путем внутриартериального или внутривенного введения. В альтернативных вариантах реализации изобретения популяцию клеток SC-β согласно настоящему изобретению можно вводить различными путями, подходящими для имплантации в панкреатическую или секреторную систему, включая, но не ограничиваясь этим, парентеральный, включая внутривенное и внутриартериальное введение, интратекальное введение, интравентрикулярное введение, интрапаренхиматозное, внутричерепное, интрацистернальное, интрастриарное и интранигральное введение. Необязательно, популяцию клеток SC-β вводят вместе с иммуносупрессивным агентом.
[558] В некоторых вариантах реализации изобретения популяцию клеток SC-β можно вводить и дозировать в соответствии с надлежащей медицинской практикой, принимая во внимание клиническое состояние отдельного пациента, место и способ введения, режим введения, возраст, пол и массу тела пациента, а также другие факторы, известные практикующим медикам. Таким образом, в контексте данного документа фармацевтически «эффективное количество» определяется на основании известных в данной области техники соображений. Количество должно быть эффективным, чтобы достичь улучшения, включая, но не ограничиваясь этим, повышение уровня выживаемости или более быстрое выздоровление, или улучшение или исчезновение симптомов и других индикаторов, которые выбраны в качестве соответствующих показателей специалистами в данной области техники. Популяцию клеток SC-β можно вводить субъекту в следующих местах: клинике, клиническом кабинете, отделении скорой помощи, больничной палате, отделении интенсивной терапии, операционной комнате, отделении для катетеризация и радиологическом отделении.
[559] В других вариантах реализации изобретения популяцию клеток SC-β сохраняют для дальнейшей имплантации/инфузии. Популяцию клеток SC-β можно разделить на более чем одну аликвоту или единицу так, чтобы сохранить часть популяции клеток SC-β для дальнейшего применения, а часть сразу же ввести субъекту. Среднее или долгосрочное хранение всех или части клеток в банке клеток также входит в объем данного изобретения, как раскрыто в патентной заявке США №20030054331 и патентной заявке № WO 03024215, которые в полном объеме включены в данный документ посредством ссылки. В конце обработки концентрированные клетки можно загрузить в устройство для доставки, такое как шприц, для внесения в организм реципиента любыми известными специалисту в данной области техники способами.
[560] В некоторых вариантах реализации изобретения популяцию клеток SC-β можно применять одну или в комбинации с другими клетками, тканями,
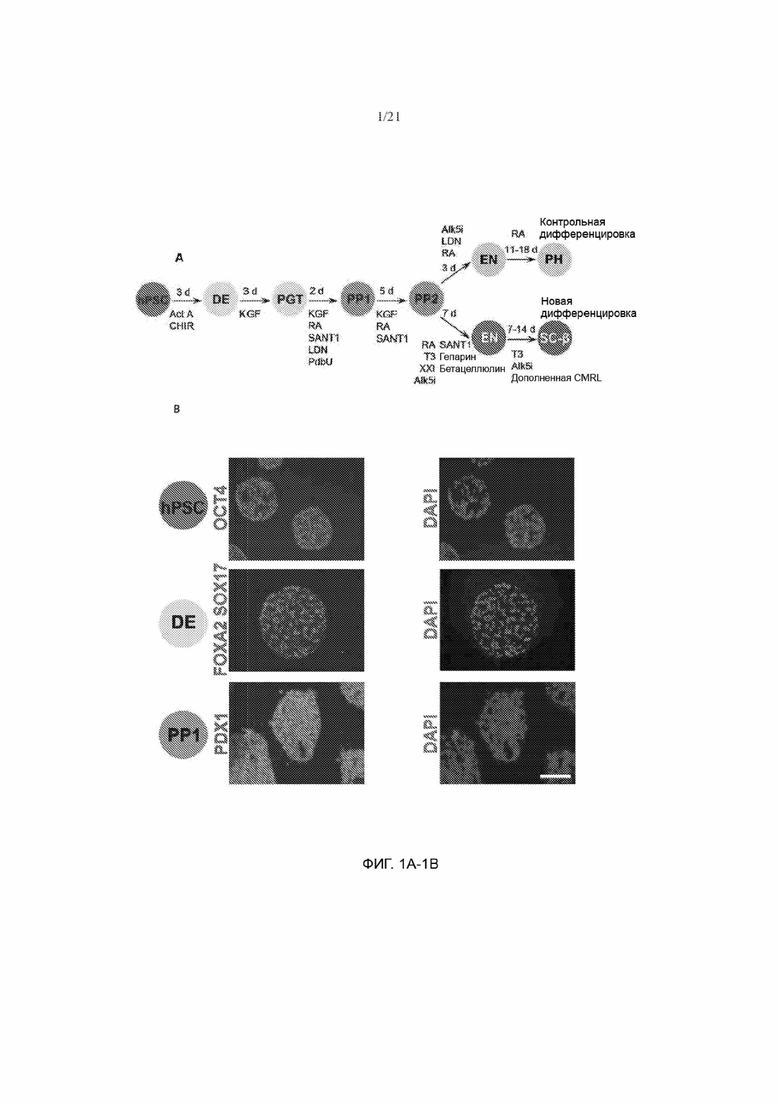


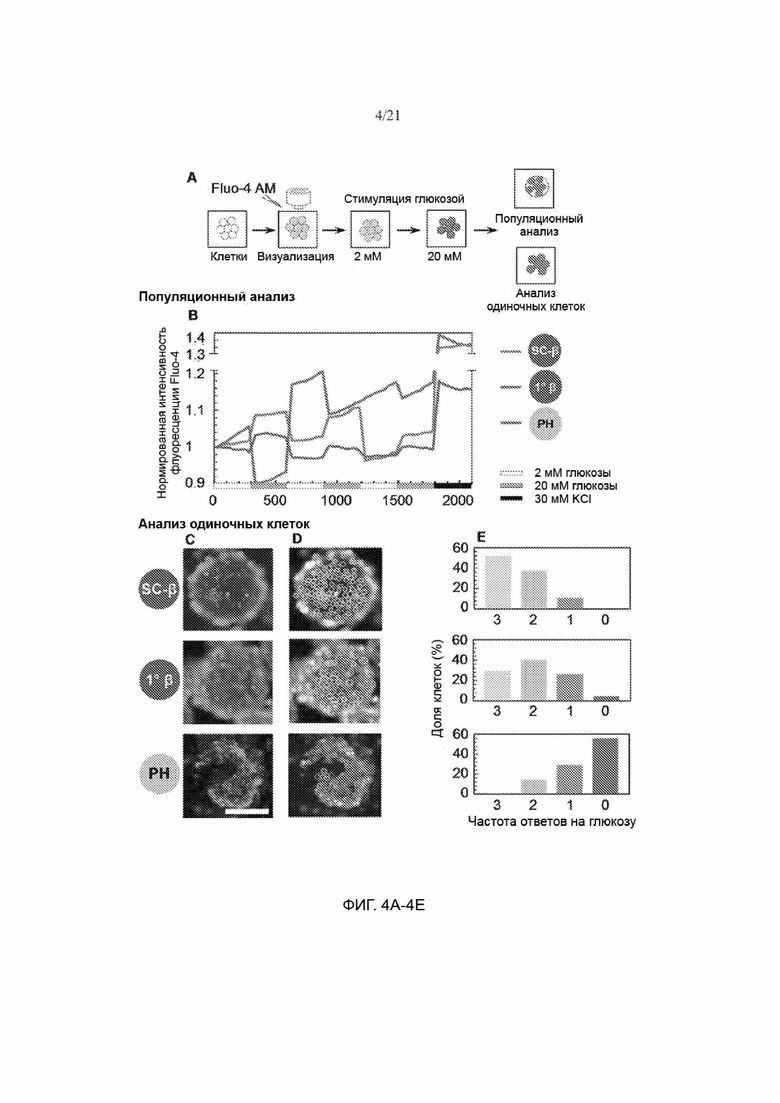
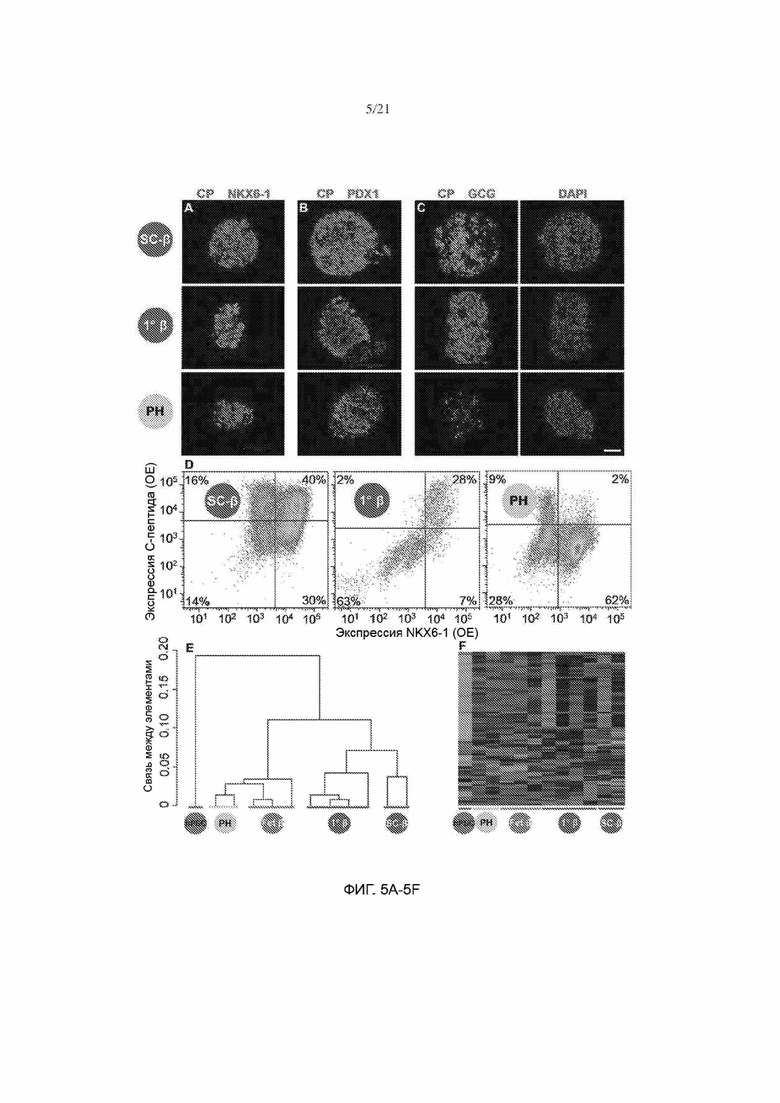
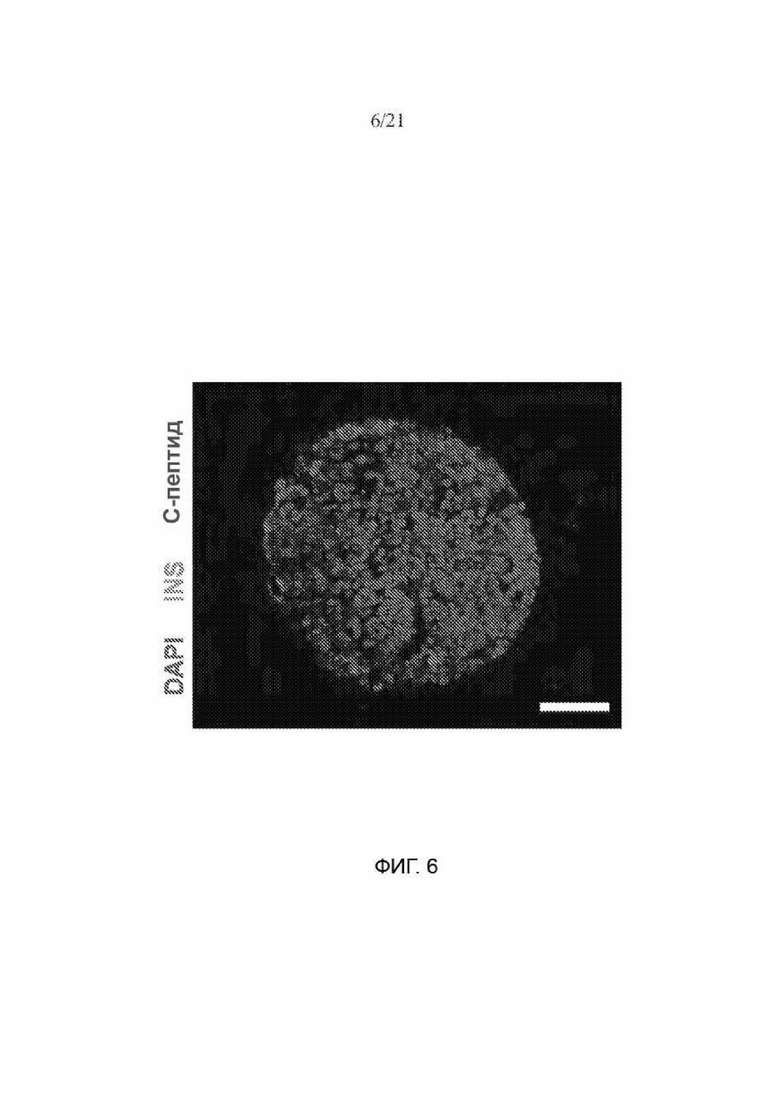
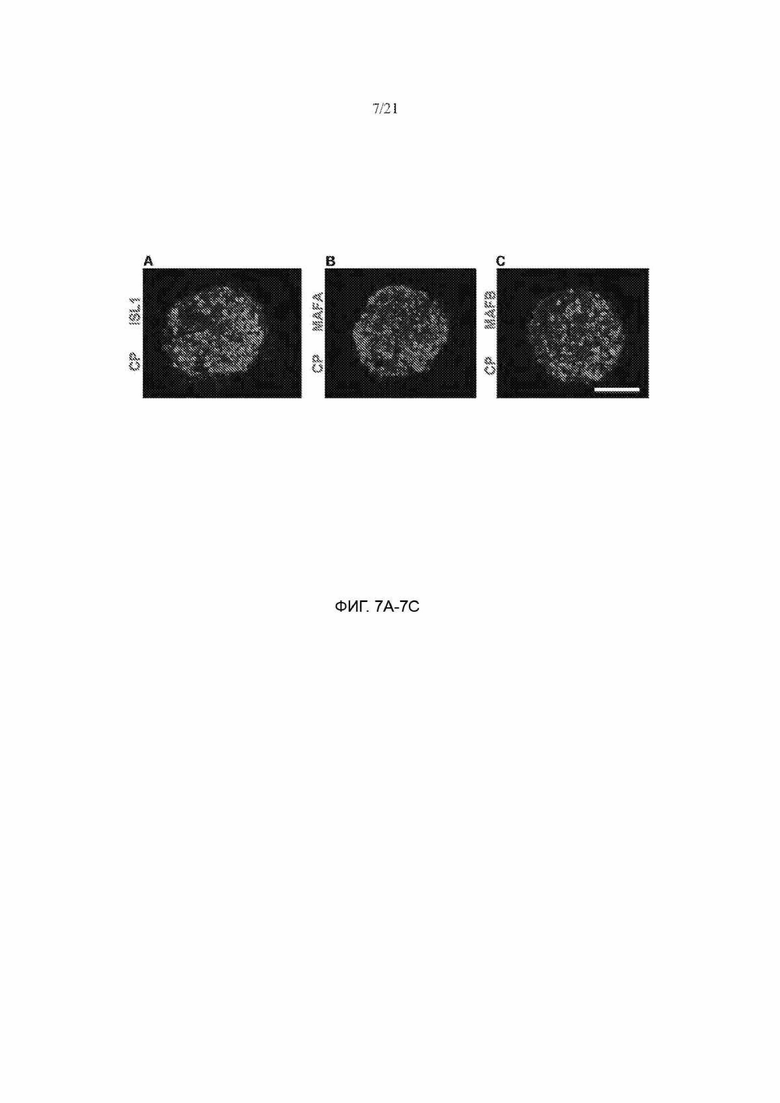
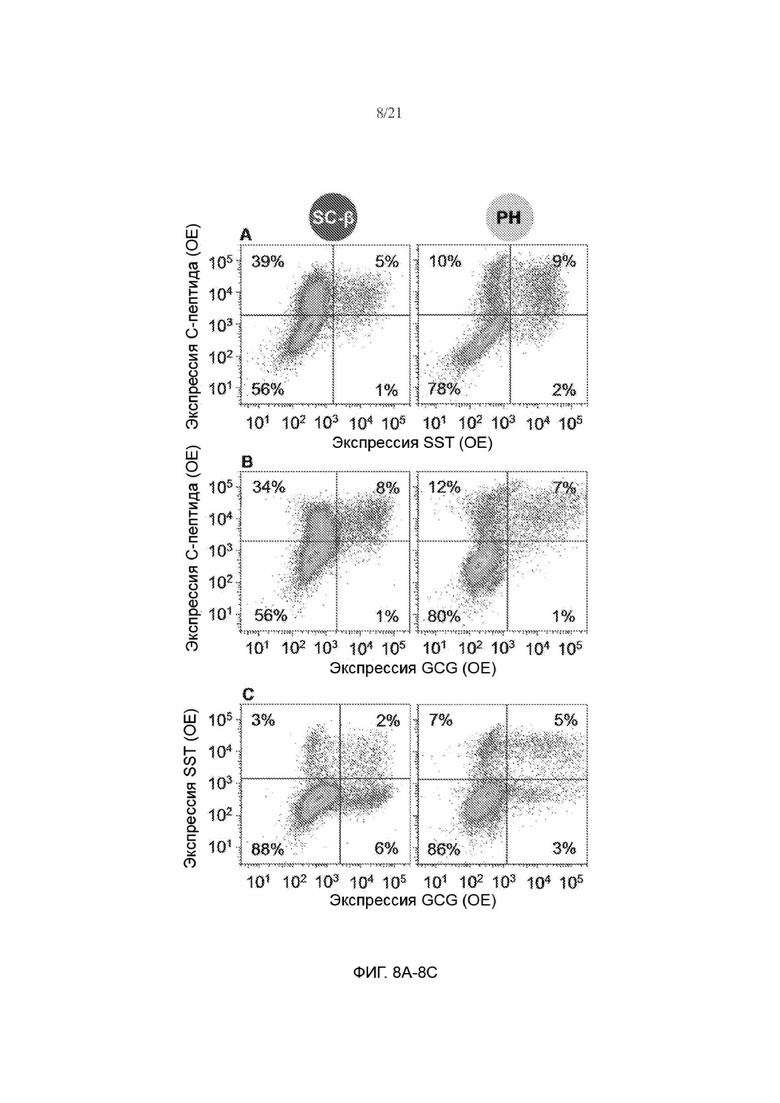

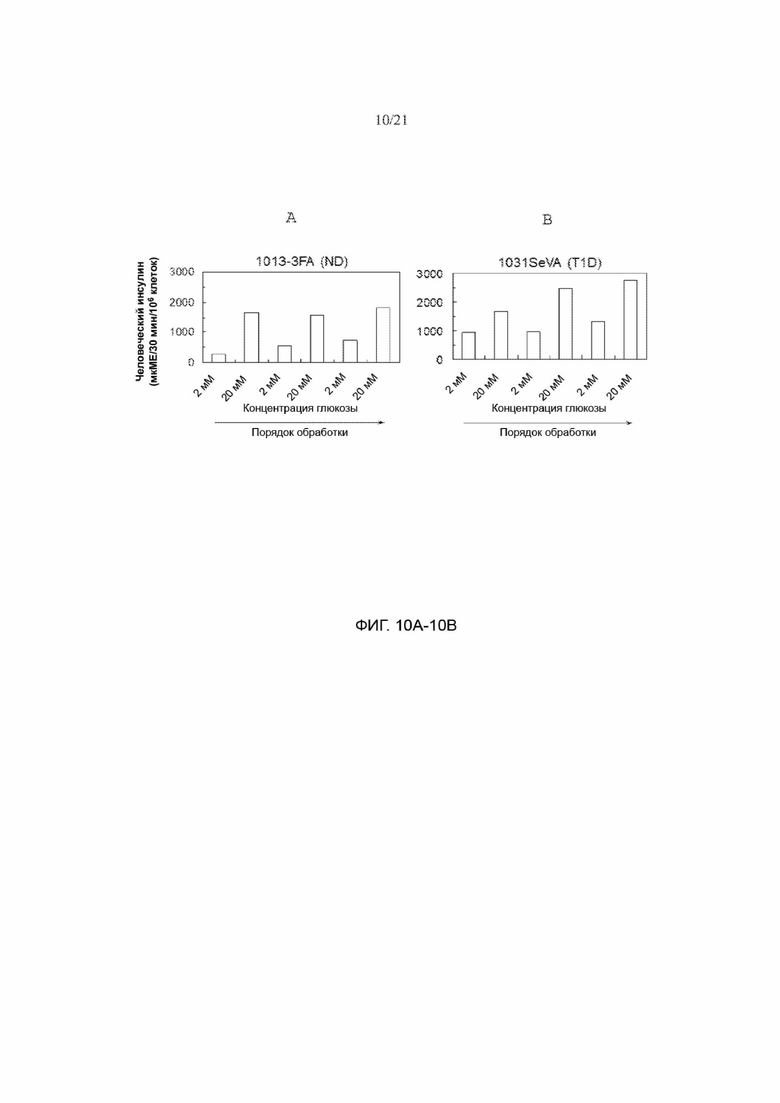

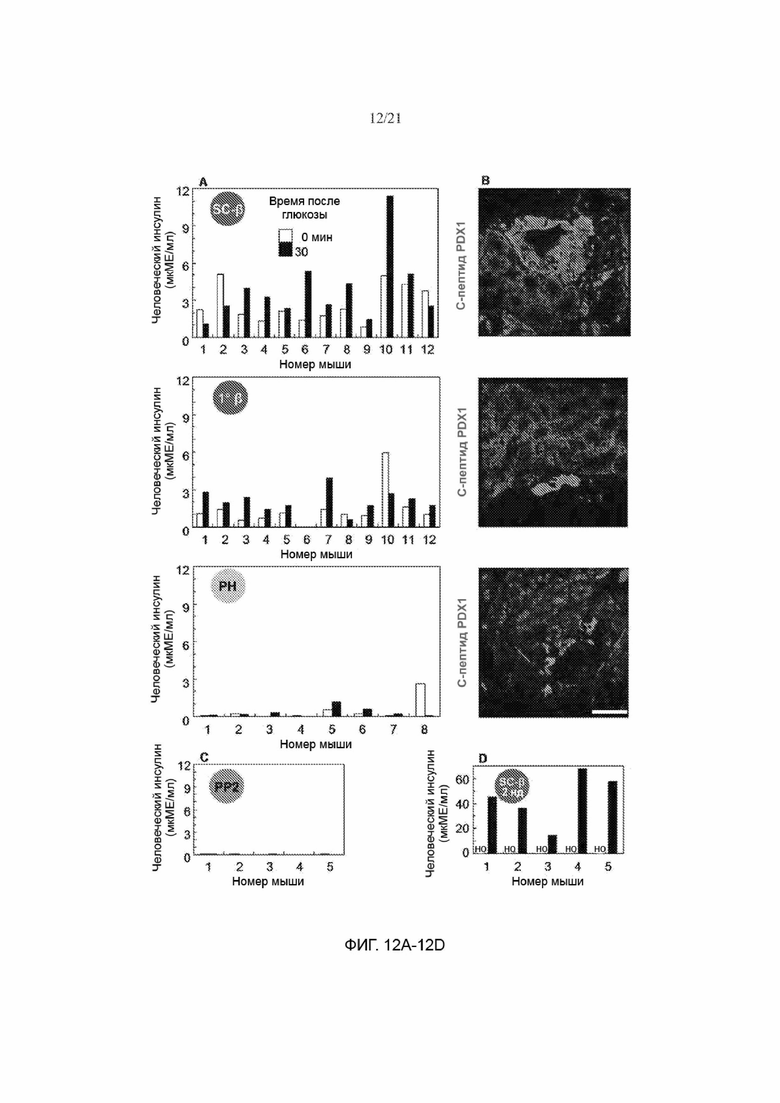
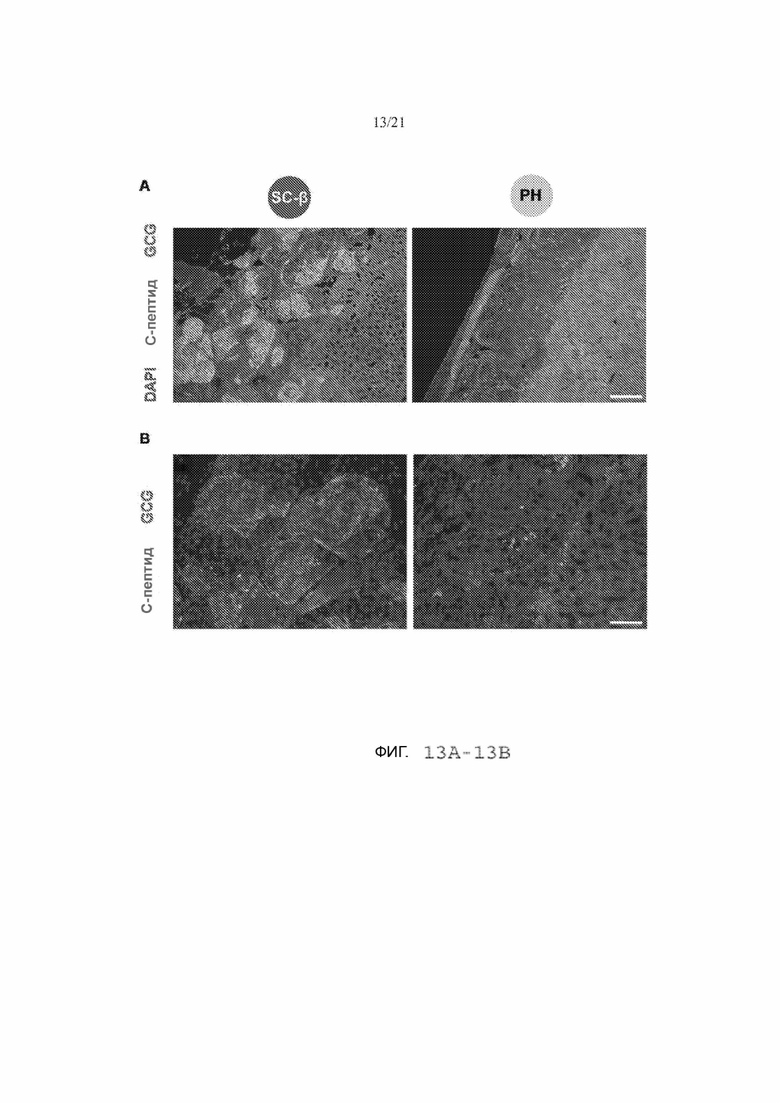




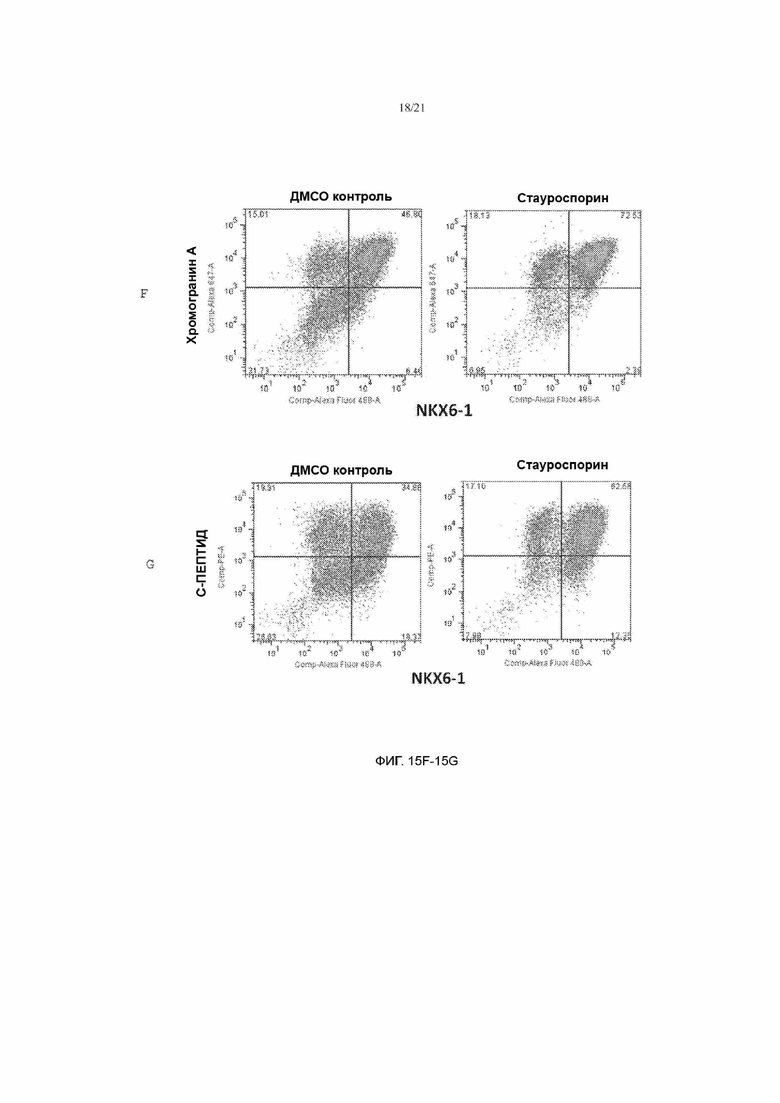


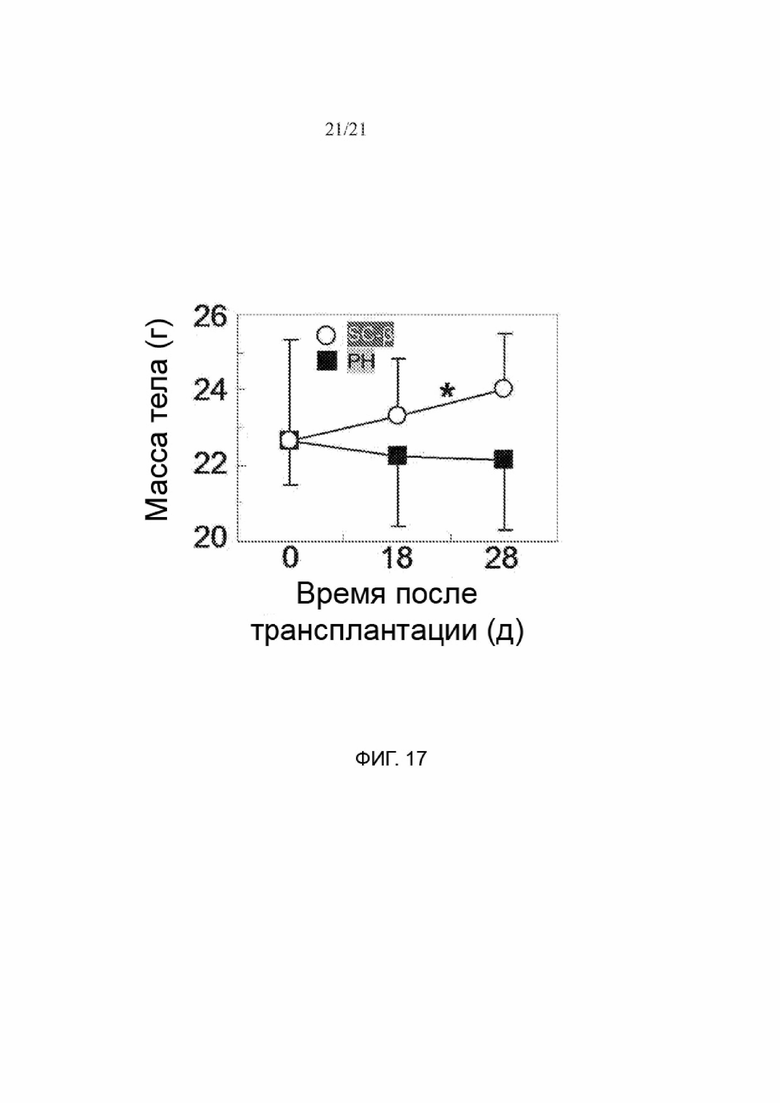
Изобретение относится к биотехнлогии. Раскрыто устройство для секреции инсулина, содержащее популяцию ненативных панкреатических β-клеток, причем ненативные панкреатические β-клетки демонстрируют in vitro ответ, состоящий в стимулированной глюкозой секреции инсулина на стимуляцию глюкозой. Причем устройство содержит полупроницаемую мембрану, которая выполнена с возможностью удерживать ненативные панкреатические β-клетки в устройстве и обеспечивать прохождение инсулина, секретируемого ненативными панкреатическими β-клетками. Изобретение можно эффективно применять в клеточной терапии. 17 з.п. ф-лы, 17 ил., 5 табл.
1. Устройство для секреции инсулина, содержащее популяцию ненативных панкреатических β-клеток, причем ненативные панкреатические β-клетки:
демонстрируют in vitro ответ, состоящий в стимулированной глюкозой секреции инсулина на стимуляцию глюкозой,
экспрессируют INS, PDX1, NKX6.1 и один или более из следующих генов: PC2, MNX1 или ABCC8, и
не экспрессируют один или оба из соматостатина и глюкагона, и
причем устройство содержит полупроницаемую мембрану, причем полупроницаемая мембрана выполнена с возможностью удерживать ненативные панкреатические β-клетки в устройстве и обеспечивать прохождение инсулина, секретируемого ненативными панкреатическими β-клетками, и
причем устройство выполнено с возможностью обеспечения ненативными панкреатическими β-клетками выработки и высвобождения инсулина при имплантации субъекту.
2. Устройство по п. 1, содержащее ненативные панкреатические β-клетки, инкапсулированные биоматериалом, который содержит альгинат, полиэтиленгликоль (PEG), хитозан, полые волокна из сложного полиэфира (PES), коллаген, гиалуроновую кислоту, декстран с аргинином, глицин, аспарагиновую кислоту (RGD), 5-этил-5-(гидроксиметил)- β,β-диметил-1,3-диоксан-2-этанолдиакрилат (EHD), полиэтиленгликоль диакрилат (PEGDA), сополимер 2-метакрилоилоксиэтилфосфорилхолина, н-бутилметакрилата и п-винилфенилбороновой кислоты (PMBV), поливиниловый спирт (PVA), полиглицеринсиалозиды (PGSAS), агарозу, агарозу с желатином, сополимер молочной и гликолевой кислот (PLGA) или любые их комбинации.
3. Устройство по п. 1, отличающееся тем, что по меньшей мере одна из ненативных панкреатических β-клеток модифицирована посредством PEG.
4. Устройство по п. 1, содержащее микроносители или микрокапсулы.
5. Устройство по п. 2, отличающееся тем, что ненативные панкреатические β-клетки отделены полупроницаемой мембраной в островковой камере от одной или нескольких сосудистых камер устройства.
6. Устройство по п. 2, отличающееся тем, что полупроницаемая мембрана выполнена из полисахарида или поликатиона.
7. Устройство по п. 1, дополнительно содержащее иммуномодулятор.
8. Устройство по п. 1, дополнительно содержащее экстракорпоральный сегмент.
9. Устройство по п. 1, дополнительно содержащее каркас из рассасывающейся или биоразлагаемой матрицы.
10. Устройство по п. 1, отличающееся тем, что ненативные панкреатические β-клетки демонстрируют in vitro ответ, состоящий в стимулированной глюкозой секреции инсулина, на первую стимуляцию глюкозой, вторую стимуляцию глюкозой и третью стимуляцию глюкозой, при этом первую стимуляцию глюкозой, вторую стимуляцию глюкозой и третью стимуляцию глюкозой проводят последовательно.
11. Устройство по п. 1, отличающееся тем, что секреция инсулина ненативной панкреатической β-клеткой в ответ на стимуляцию глюкозой пропорциональна концентрации глюкозы при стимуляции глюкозой.
12. Устройство по п. 1, отличающееся тем, что ненативные панкреатические β-клетки содержат одну или более кристаллических инсулиновых гранул.
13. Устройство по п. 1, отличающееся тем, что ненативные панкреатические β-клетки демонстрируют поток Ca2+ в цитозоле в ответ на последовательное проведение первой стимуляции глюкозой и второй стимуляции глюкозой.
14. Устройство по п. 1, отличающееся тем, что ненативные панкреатические β-клетки являются моногормональными.
15. Устройство по п. 1, отличающееся тем, что ненативные панкреатические β-клетки при инкубации в присутствии по меньшей мере 20 мМ глюкозы in vitro секретируют по меньшей мере 0,5 мкМЕ инсулина на 1000 клеток за 30 минут инкубации.
16. Устройство по п. 1, отличающееся тем, что ненативные панкреатические β-клетки характеризуются профилем генной экспрессии, который отличается от профиля генной экспрессии нативной β-клетки.
17. Устройство по п. 1, отличающееся тем, что популяция ненативных панкреатических β-клеток содержит 340-748 миллионов ненативных панкреатических β-клеток.
18. Устройство по п. 1, отличающееся тем, что ненативные панкреатические β-клетки являются генетически модифицированными.
| Устройство для сборки деталей | 1978 |
|
SU831489A1 |
| WO 2013057164 A1, 25.04.2013 | |||
| US 20110281355 A1, 17.11.2011 | |||
| WO 2013057164 A1, 25.04.2013 | |||
| RU 2011121843 A, 10.12.2012. | |||
Авторы
Даты
2024-02-15—Публикация
2014-06-11—Подача