ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННУЮ ЗАЯВКУ
Настоящее изобретение претендует на приоритет по заявке с серийным номером 61/226936 от 20 июля 2009 года.
ОБЛАСТЬ ИЗОБРЕТЕНИЯ
В настоящем изобретении предлагаются способы промотирования дифференцировки полипотентных стволовых клеток в клетки, вырабатывающие инсулин. В частности, в настоящем изобретении предлагается способ получения клеток, способных вырабатывать инсулин, после пересадки животному.
ПРЕДПОСЫЛКИ ИЗОБРЕТЕНИЯ
Успехи заместительной клеточной терапии в лечении сахарного диабета 1 типа и нехватка трансплантатов островков Лангерганса обуславливают интерес к разработке источников клеток, вырабатывающих инсулин, или β-клеток, пригодных для приживления. Одним из подходов является выработка функционирующих β-клеток из полипотентных стволовых клеток, таких как, например, эмбриональные стволовые клетки.
В эмбриональном развитии позвоночных полипотентная стволовая клетка порождает группу клеток, составляющих три зародышевых слоя (эктодерму, мезодерму и энтодерму) в процессе, который называется гаструляцией. Такие ткани, как, например, щитовидная железа, тимус, поджелудочная железа, кишечник и печень, развиваются из энтодермы в ходе промежуточной стадии. Промежуточная стадия этого процесса - образование дефинитивной энтодермы. Клетки дефинитивной энтодермы экспрессируют ряд маркеров, таких как HNF3 бета, GATA4, MIXL1, CXCR4 и SOX17.
Образование поджелудочной железы происходит в результате дифференцировки дефинитивной энтодермы в панкреатическую энтодерму. Клетки панкреатической энтодермы экспрессируют ген панкреатическо-дуоденального гомеобокса PDX1. В отсутствие PDX1 развитие поджелудочной железы не идет дальше образования брюшного и спинного зародышей. Таким образом, экспрессия PDX1 - важнейшая стадия формирования поджелудочной железы. Зрелая поджелудочная железа включает, помимо других типов клеток, экзокринную и эндокринную ткань. Экзокринная и эндокринная ткани образуются в результате дифференцировки панкреатической энтодермы.
Клетки с признаками островковых клеток, по имеющимся сведениям, были получены из эмбриональных клеток мыши. Например, в работе Lumelsky et al. (Science 292:1389, 2001) сообщается о дифференцировке эмбриональных стволовых клеток мыши в структуры, секретирующие инсулин, подобные панкреатическим островкам. В работе Soria et al. (Diabetes 49:157, 2000) сообщается о том, что выделяющие инсулин клетки, выведенные из эмбриональных стволовых клеток мыши, нормализуют гликемию у мышей со стрептозотоцин-индуцированным диабетом.
В одном из примеров - Hori et al. (PNAS 99:16105, 2002) - сообщается о том, что обработка эмбриональных стволовых клеток мыши ингибиторами фосфоинозитид-3-киназы (LY294002) приводила к образованию клеток, напоминающих β-клетки.
В другом примере - Blyszczuk et al. (PNAS 100:998, 2003) - сообщается о генерации выделяющих инсулин клеток из эмбриональных стволовых клеток мыши, конститутивно экспрессирующих Pax4.
Микаллеф с соавторами (Micallef et al.) сообщают о том, что ретиноевая кислота может регулировать склонность эмбриональных стволовых клеток к формированию PDX1-позитивной панкреатической энтодермы. Ретиноевая кислота эффективнее всего индуцирует экспрессию Pdx1 при добавлении в культуры на 4-й день дифференцировки эмбриональных стволовых клеток в период, соответствующий концу гаструляции в эмбрионе (Diabetes 54:301, 2005).
Миязаки с соавторами (Miyazaki et al.) сообщает о повышенной экспрессии Pdx1 линией эмбриональных стволовых клеток мыши. Их результаты показывают, что экзогенная экспрессия Pdx1 явно повышает экспрессию инсулина, соматостатина, глюкокиназы, нейрогенина-3, p48, Pax6 и генов HNF6 в образующихся дифференцированных клетках (Diabetes 53:1030, 2004).
Скауди с соавторами (Skoudy et al.) сообщают о том, что активин A (член суперсемейства TGF-β) повышающе регулирует экспрессию экзокринных панкреатических генов (p48 и амилазы) и эндокринных генов (Pdx1, инсулина и глюкагона) в эмбриональных стволовых клетках мыши. Максимальный эффект наблюдался при применении 1 нМ активина A. Они также наблюдали, что уровень экспрессии инсулина и Pdx1 мРНК не зависел от ретиноевой кислоты; однако применение 3 нМ FGF7 привело к повышению уровня транскрипта для Pdx1 (Biochem. J. 379:749, 2004).
Шираки с соавторами (Shiraki et al.) изучали эффекты факторов роста, которые целенаправленно повышают дифференцировку эмбриональных стволовых клеток в PDX1-положительные клетки. По их наблюдениям, TGF-β2 воспроизводимо увеличивает долю PDX1-положительных клеток (Genes Cells. 2005 Jun; 10(6):503-16).
Гордон с соавторами (Gordon et al.) продемонстрировали индукцию брахиурии [положительных]/HNF3 бета [положительных] клеток энтодермы из эмбриональных стволовых клеток мыши в отсутствие сыворотки и в присутствии активина с ингибитором сигнального пути Wnt (патент США 2006/0003446A1).
Гордон с соавторами (Gordon et al.) (PNAS, Vol 103, page 16806, 2006) утверждают, что «потребовалась одновременная активация Wnt и TGF-бета/центральным/активином для образования передней первичной полоски».
Однако мышиная модель развития эмбриональных стволовых клеток может не отражать в точности программу развития у высших млекопитающих, таких как, например, человек.
Томсон с соавторами (Thomson et al.) изолировали эмбриональные стволовые клетки из бластоцист человека (Science 282:114, 1998). В то же время, Герхарт (Gearhart) с сотрудниками вывели линии эмбриональных половых клеток человека (hEG) из эмбриональной гонадной ткани (Shamblott et al., Proc. Natl. Acad. Sci. USA 95:13726, 1998). В отличие от эмбриональных стволовых клеток мыши, дифференцировку которых можно предотвратить простым культивированием фактора, ингибирующего лейкемию (LIF), эмбриональные стволовые клетки человека необходимо поддерживать в строго определенных условиях (патент США № 6200806; WO 99/20741; WO 01/51616).
Д'Амур с соавторами (D'Amour et al.) описывают получение обогащенных культур дефинитивной энтодермы, выведенной из эмбриональных стволовых клеток человека, в присутствии высокой концентрации активина и низкой концентрации сыворотки (Nature Biotechnology 2005). Трансплантация этих клеток под почечную капсулу мышей приводила к дифференцировке в более зрелые клетки с характеристиками некоторых эндодермальных органов. Клетки дефинитивной энтодермы, выведенные из эмбриональных стволовых клеток человека, можно далее дифференцировать в PDX1-положительные клетки после добавления FGF-10 (патент США № 2005/0266554A1).
Д'Амур с соавторами (D'Amour et al., Nature Biotechnology - 24, 1392-1401 (2006)) утверждают: «Мы разработали процесс дифференцировки, позволяющий превратить эмбриональные стволовые клетки человека (hES) в эндокринные клетки, способные синтезировать панкреатические гормоны инсулин, глюкагон, соматостатин, панкреатический полипептид и грелин. Этот процесс аналогичен формированию поджелудочной железы in vivo, поскольку клетки проходят стадии, напоминающие дефинитивную энтодерму, энтодерму пищеварительной трубки, панкреатическую энтодерму и эндокринный прекурсор как стадии формирования клеток, экспрессирующих эндокринные гормоны».
В другом примере Фиск с соавторами (Fisk et al.) сообщают о системе получения панкреатических островковых клеток из эмбриональных стволовых клеток человека (патент США № 2006/0040387A1). В этом случае путь дифференцировки состоял из трех стадий. Сначала эмбриональные стволовые клетки человека дифференцировались в энтодерму с помощью сочетания бутирата натрия и активина A. Затем полученные клетки культивировались антагонистами TGF-β, такими как Noggin, в сочетании с EGF или бетацеллюлином для образования PDX1-положительных клеток. Терминальную дифференцировку индуцировали никотинамидом.
В одном из примеров Бенвенистри с соавторами (Benvenistry et al.) утверждают: «Мы сделали вывод о том, что повышенная экспрессия PDX1 привела к усилению экспрессии панкреатических обогащенных генов, а для экспрессии инсулина может потребоваться дополнительная активация, присутствующая только in vivo» (Benvenistry et al., Stem Cells 2006; 24:1923-1930).
В другом примере Грейпин-Боттон с соавторами (Grapin-Botton et al.) утверждают: «При ранней активации Ngn3 почти исключительно образовывались глюкагон+клетки при обеднении пула предшественников поджелудочной железы. Как и из E11.5, предшественники PDX1 стали способны дифференцироваться в инсулин [положительные] и PP [положительные] клетки» (Johansson KA et al., Developmental Cell 12, 457-465, March 2007).
Экспрессия NGN3 в клетках, экспрессирующих маркеры, характерные для линии панкреатической энтодермы, может снизить способность клеток далее дифференцироваться в клетки, вырабатывающие инсулин. Предыдущие исследования показали, что клетки, экспрессирующие маркеры, характерные для линии панкреатической энтодермы, которые экспрессируют NGN3, при дальнейшей дифференцировке с большей вероятностью порождают глюкагон-экспрессирующие клетки, чем инсулин-экспрессирующие клетки. Однако экспрессия NGN3 необходима для формирования панкреатических эндокринных клеток или предшественников панкреатических эндокринных клеток (клеток, которые могут формировать, например, глюкагон- или инсулин-экспрессирующие клетки). Поэтому временная регуляция NGN3 важна для того, чтобы предшественники панкреатических эндокринных клеток в итоге дали инсулин-экспрессирующие клетки.
Таким образом, сохраняется существенная потребность в разработке условий создания линий полипотентных стволовых клеток, которые можно было бы распространить на решение актуальных клинических задач, сохраняя при этом возможность дифференцировки в инсулин-экспрессирующие клетки. В настоящем изобретении применен альтернативный подход к повышению эффективности дифференцировки эмбриональных стволовых клеток человека в направлении инсулин-экспрессирующих клеток, создав популяцию клеток, экспрессирующих маркеры, характерные для линии панкреатической энтодермы, которая ко-экспрессирует PDX1, NKX6.1, но не экспрессирует CDX2 и NGN3. Способы, составляющие предмет настоящего изобретения, поддерживают экспрессию NGN3 на минимальном уровне до начала дифференцировки панкреатической энтодермы в предшественники панкреатических эндокринных клеток.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
В одном осуществлении настоящего изобретения образуется популяция клеток, экспрессирующих маркеры, характерные для линии панкреатической энтодермы, ко-экспрессируют PDX1, NKX6.1, но не экспрессируют CDX2 и NGN3. В одном осуществлении популяция клеток способна порождать после пересадки животному C-пептид.
В одном из осуществлений настоящего изобретения предлагается способ дифференцировки популяции полипотентных стволовых клеток в популяцию клеток, экспрессирующих маркеры, характерные для линии панкреатической энтодермы, которая ко-экспрессирует PDX1, NKX6.1, но не экспрессирует CDX2 и NGN3, включающий следующие стадии:
a. культивирование полипотентных стволовых клеток;
b. дифференцировка полипотентных стволовых клеток в клетки, экспрессирующие маркеры, характерные для линии дефинитивной энтодермы;
c. дифференцировка клеток, экспрессирующих маркеры, характерные для линии дефинитивной энтодермы, в клетки, экспрессирующие маркеры, характерные для линии панкреатической энтодермы, которые ко-экспрессируют PDX1, NKX6.1, но не экспрессируют CDX2 и NGN3, посредством обработки клеток, экспрессирующих маркеры, характерные для линии дефинитивной энтодермы, первой средой с добавлением FGF7 с последующим культивированием клеток во второй среде с добавлением FGF7, фактора, способного ингибировать BMP, активина A, антагониста рецептора TGF-β, ретиноевой кислоты и ингибитора сигнального пути белка хеджехог.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
На фиг.1 показано влияние активина A на экспрессию NKX6.1, NGN3, PDX1, PTF1 альфа и ARX на стадии 3, день 4, в клетках, обработанных в соответствии с методами, описанными в примере 1. Для ПЦР-анализа в режиме реального времени отбирались дублирующие пробы. На графике показан кратный рост каждого гена относительно контрольной группы (светло-серые полосы). Темно-серыми полосами показаны клетки, обработанные FGF7, реактивом циклопамин-KAAD, ретиноевой кислотой, 20 нг/мл активина A и реактивом noggin. Черные полосы отображают клетки, обработанные FGF7, реактивом циклопамин-KAAD, ретиноевой кислотой, 50 нг/мл активина A и реактивом noggin.
На фиг.2 показаны иммунофлюоресцентные изображения, показывающие экспрессию NKX6.1 (панели a, c, и e) и NGN3 (панели b, d и f) в клетках, обработанных FGF7+реактивом Noggin+ретиноевой кислотой+реактивом KAAD-циклопамин (панели a и b), а также в клетках, обработанных FGF7+реактивом Noggin+ретиноевой кислотой+реактивом KAAD-циклопамин+20 нг/мл активина A (панели c и d), и в клетках, обработанных FGF7+реактивом Noggin+ретиноевой кислотой+реактивом KAAD-циклопамин+Alk5 ингибитором II.
На фиг.3 показаны иммунофлюоресцентные изображения, показывающие экспрессию PDX1 (панели a и c), CDX2 (панели b и d) в клетках, обработанных DMEM с высоким содержанием глюкозы с 1% B27+FGF7+реактивом Noggin+ретиноевой кислотой+реактивом KAAD-циклопамин+20 нг/мл активина A (панели a и b), и в клетках, обработанных DMEM/F12 с 1% B27+FGF7+реактивом Noggin+ретиноевой кислотой+реактивом KAAD-циклопамина+20 нг/мл активина A (панели c и d).
На фиг.4 показано влияние активина A, активина B, TGFβ2, GDF11 и GDF8 на экспрессию NKX6.1, NGN3 и PDX1 альфа на стадии 3, день 4, в клетках, обработанных в соответствии с методами, описанными в примере 1. Для ПЦР-анализа в режиме реального времени отбирались дублирующие пробы. На графике показан кратный рост каждого гена относительно группы, обработанной FGF7+циклопамином-KAAD+ретиноевой кислотой+реактивом Noggin.
На фиг.5 показано влияние обработки реактивом Noggin и ингибитором II Alk5 на экспрессию NGN3, NEUROD, NKX2.2 и PAX6 (панель a) и NKX6.1, PDX1 и PTF1 альфа (панель b) на стадии 4, день 3, в клетках, обработанных в соответствии с методами, описанными в примере 2. Для ПЦР-анализа в режиме реального времени отбирались дублирующие пробы. На графике показан кратный рост каждого гена относительно группы, обработанной только базальной средой (DMEM с высоким содержанием глюкозы+1% B27) (светло-серые полоски). Темно-серыми полосами показаны клетки, обработанные реактивом Noggin и ингибитором II Alk5.
На фиг.6 показаны иммунофлюоресцентные изображения для клеток, обработанных FGF7+реактивом Noggin+ретиноевой кислотой+KAAD-циклопамином+активином A в течение четырех дней с последующей обработкой реактивом Noggin и ингибитором II Alk5 в течение трех дней, как описано в примере 2. На панели a показана экспрессия NKX6.1, NGN3 и наложение NKX6.1 и NGN3. На панели b показана экспрессия PDX1, NGN3 и наложение PDX1 и NGN3.
На фиг.7 показана экспрессия NGN3, PAX4, PDX1, NKX6.1, NEUROD, инсулина и глюкагона в клетках на стадии 4, день 3 (светло-серые полоски), или на стадии 5, день 3 (темно-серые полоски), или на стадии 5, день 7 (черные полоски) протокола обработки, описанного в примере 3. Для ПЦР-анализа в режиме реального времени отбирались дублирующие пробы. На графике показан кратный рост каждого гена относительно экспрессии, измеренной на стадии 4, день 1.
На фиг.8 показаны иммунофлюоресцентные изображения, демонстрирующие экспрессию инсулина, глюкагона и NKX6.1 в клетках на стадии 5, день 7 протокола обработки, описанного в примере 3. Также показаны наложения экспрессии инсулина и глюкагона, а также экспрессии инсулина и NKX6.1.
На фиг.9 показан циркулирующий C-пептид человека (панель a) и содержание глюкозы в крови не натощак (панель b) у STZ-индуцированных ТКИН-мышей с врожденным отсутствием естественных клеток-киллеров, которым вводили клетки, составляющие предмет настоящего изобретения, в подпочечную капсулу. В указанные моменты времени определялись уровни C-пептида и уровни глюкозы в крови.
ПОДРОБНОЕ ОПИСАНИЕ
Для ясности изложения, но не в порядке ограничения, подробное описание изобретения разделено на следующие подразделы, в которых описываются или иллюстрируются определенные особенности, осуществления или применения настоящего изобретения.
Определения
Стволовые клетки - это недифференцированные клетки, определяющим свойством которых является способность на уровне одной клетки как самообновляться, так и дифференцироваться с образованием дочерних клеток, в том числе самообновляющихся предшественников, не самообновляющихся предшественников и терминально дифференцированных клеток. Стволовые клетки также характеризуются способностью дифференцироваться in vitro в функциональные клетки различных клеточных линий из нескольких зародышевых слоев (энтодерма, мезодерма и эктодерма), а также порождать ткани нескольких зародышевых слоев после пересадки и вносить существенный вклад в большинство тканей (если не во все) после инъекции в бластоцисты.
Стволовые клетки классифицируются по дифференцировочному потенциалу следующим образом: (1) тотипотентные, то есть способные порождать клетки всех эмбриональных и экстраэмбриональных типов; (2) полипотентные, то есть способные порождать клетки всех эмбриональных типов; (3) мультипотентные, то есть способные порождать ряд клеточных линий, но лишь в рамках определенной ткани, органа или физиологической системы (например, гемопоэтические стволовые клетки (HSC) могут образовывать потомство, включающее HSC (самообновление), олигопотентные предшественники с ограничением в пределах клеток крови и все типы и элементы клеток (например, тромбоциты), являющиеся нормальными компонентами крови); (4) олигопотентные, то есть способные порождать более ограниченный набор клеточных линий, чем мультипотентные клетки; и (5) унипотентные, то есть способные порождать одну клеточную линию (например, сперматогенные стволовые клетки).
Дифференцировка - это процесс, в результате которого неспециализированные (некоммитированные) клетки или менее специализированные клетки приобретают свойства специализированной клетки, например, нервной или мышечной. Дифференцированная или образовавшаяся в результате дифференцировки клетка - это такая клетка, которая заняла более специализированное (коммитированное) положение в линии клеток. Термин «коммитированная» применительно к процессу дифференцировки означает клетку, которая дошла по пути дифференцировки до точки, где при нормальных обстоятельствах она будет продолжать дифференцироваться до клетки конкретного типа или подмножества типов клеток и не может, при нормальных обстоятельствах, дифференцироваться в клетку какого-то другого типа или вернуться к менее дифференцированному типу клеток. Дедифференцировкой называют процесс возвращения клетки к менее специализированному (коммитированному) положению в линии клеток. В данном документе линией клеток называется наследственность клетки, то есть от каких клеток она происходит и какие клетки может порождать. Линия клеток помещает клетку в иерархическую схему развития и дифференцировки. Линиеспецифическим маркером называют характеристику, связанную с фенотипом клеток данной линии. Его можно использовать для оценки дифференцировки некоммитированной клетки в данную линию.
«Клетками, экспрессирующими маркеры, характерные для линии дефинитивной энтодермы», или «клетками первой стадии», или «стадией 1» в данном документе называются клетки, экспрессирующие как минимум один из следующих маркеров: SOX17, GATA4, HNF3 бета, GSC, CER1, центральный, FGF8, брахиурия, гомеобокс-белок типа MIX, FGF4 CD48, эомезодермин (EOMES), DKK4, FGF17, GATA6, CXCR4, C-Kit, CD99 или OTX2. Клетки, экспрессирующие маркеры, характерные для линии дефинитивной энтодермы, включают в себя клетки предшественников первичных полосок, клетки первичных полосок, клетки мезоэнтодермы и клетки дефинитивной энтодермы.
«Клетками, экспрессирующими маркеры, характерные для линии панкреатической энтодермы», в данном документе называются клетки, экспрессирующие как минимум один из следующих маркеров: PDX1, HNF1 бета, PTF1 альфа, HNF6, NKX6.1 или HB9. Клетки, экспрессирующие маркеры, характерные для линии панкреатической энтодермы, включают в себя клетки панкреатической энтодермы, первичные клетки кишечного тракта и клетки задней части передней кишки.
«Дефинитивной энтодермой» в данном документе называются клетки, обладающие характеристиками клеток, образующихся из эпибласта во время гаструляции, и образующие желудочно-кишечный тракт, а также их производные. Клетки дефинитивной энтодермы экспрессируют следующие маркеры: HNF3 бета, GATA4, SOX17, Cerberus, OTX2, goosecoid, C-Kit, CD99 и MIXL1.
«Маркерами» в данном документе называются молекулы нуклеиновых кислот или полипептидов, дифференциально экспрессируемые в определенной клетке. В этом контексте под дифференциальной экспрессией подразумевается повышенный уровень для положительного маркера и пониженный уровень для отрицательного маркера. Определяемый уровень маркерной нуклеиновой кислоты или полипептида значительно выше или ниже в определенных клетках по сравнению с другими клетками, и эти клетки можно выявлять и распознавать на фоне других клеток с помощью какого-либо из методов, известных в данной области.
«Панкреатической эндокринной клеткой» или «клеткой, экспрессирующей панкреатические гормоны», в данном документе называется клетка, способная экспрессировать как минимум один из следующих гормонов: инсулин, глюкагон, соматостатин и панкреатический полипептид.
Изоляция, размножение и культивирование полипотентных стволовых клеток
Характеристика полипотентных стволовых клеток
Полипотентные стволовые клетки могут экспрессировать один или несколько относящихся к определенной стадии эмбриональных антигенов (SSEA) 3 и 4, а также маркеры, определяемые с помощью антител, обозначаемых как Tra-1-60 и Tra-1-81 (Thomson et al., Science 282:1145, 1998). Дифференцировка полипотентных клеток in vitro приводит к снижению экспрессии SSEA-4, Tra 1-60 и Tra 1-81 (при ее наличии) и повышению экспрессии SSEA-1. В недифференцированных полипотентных стволовых клетках обычно отмечается активность щелочной фосфатазы, которую можно обнаружить путем фиксации клеток 4% параформальдегидом и дальнейшей обработки реактивом Vector Red в качестве субстрата, как описано изготовителем (Vector Laboratories, Бурлингейм, штат Калифорния). Недифференцированные полипотентные стволовые клетки также обычно экспрессируют OCT4 и TERT, что определяется методом ПЦР в режиме реального времени.
Другой желательный фенотип размножившихся полипотентных стволовых клеток - способность дифференцировки в клетки всех трех зародышевых слоев: ткани энтодермы, мезодермы и эктодермы. Полипотентность полипотентных клеток можно подтвердить, например, инъекцией клеток мышам с тяжелым комбинированным иммунодефицитом (ТКИД), зафиксировав образующиеся тератомы 4% параформальдегидом и проведя их гистологическое исследование на признаки типов клеток из трех зародышевых слоев. В качестве альтернативного варианта можно определить полипотентность созданием эмбриоидных телец и их обследованием на присутствие маркеров, связанных с тремя зародышевыми слоями.
Размножившиеся линии полипотентных стволовых клеток можно кариотипировать с помощью стандартного метода G-бэндинга и сравнивать с опубликованными кариотипами соответствующих видов приматов. Желательно получить клетки, имеющие «нормальный кариотип», то есть клетки должны быть эуплоидными, со всеми хромосомами человека, не имеющими заметных изменений.
Источники полипотентных стволовых клеток
К типам полипотентных стволовых клеток, которые можно использовать, относятся установленные линии полипотентных клеток, выведенные из ткани, образованной после беременности, в том числе преэмбриональной ткани (такой как, например, бластоциста), эмбриональной ткани или ткани плода, взятой в любой момент беременности - как правило, но необязательно, приблизительно до 10-12 недели беременности. К неограничивающим примерам относятся установленные линии эмбриональных стволовых клеток человека и эмбриональные половые клетки человека, такие как, например, линии эмбриональных стволовых клеток человека H1, H7 и H9 (WiCell). Также обсуждается возможность использования составов данной заявки во время первичного установления или стабилизации таких клеток, причем в этом случае источником клеток будут первичные полипотентные клетки, взятые непосредственно из тканей источника. Также подходят клетки, взятые из популяции полипотентных стволовых клеток, уже культивированных в отсутствие питающих клеток. Кроме того, подходят линии мутантных эмбриональных стволовых клеток человека, таких как, например, BG01v (BresaGen, Афины, штат Джорджия).
В одном осуществлении получение эмбриональных стволовых клеток проводят согласно описанию Томсона с соавторами (Thomson et al.) (патент США № 5843780; Science 282:1145, 1998; Curr. Top. Dev. Biol. 38:133 ff., 1998; Proc. Natl. Acad. Sci. U.S.A. 92:7844, 1995).
Культура полипотентных стволовых клеток
В одном осуществлении полипотентные стволовые клетки обычно культивируют на слое питающих клеток, поддерживающих полипотентные стволовые клетки различными способами. В качестве альтернативного варианта, полипотентные стволовые клетки культивируют в культурной системе, которая сама не содержит питающих клеток, но все же поддерживает полипотентные стволовые клетки без существенной дифференцировки. Рост полипотентных стволовых клеток в не содержащей подпитки среде без дифференцировки поддерживается с помощью среды, кондиционированной предварительным культивированием клеток другого типа. В качестве иного варианта, рост полипотентных стволовых клеток в не содержащей подпитки среде без дифференцировки поддерживается с помощью химически определенной среды.
Например, в работах Reubinoff et al. (Nature Biotechnology 18:399-404 (2000)) и Thompson et al. (Science 6 November 1998: Vol. 282. no. 5391, pp. 1145-1147) описано культивирование линий полипотентных стволовых клеток из бластоцист человека с помощью слоя питающих клеток из эмбриональных фибробластов мыши.
В работе Richards et al. (Stem Cells 21:546-556, 2003) оценивается панель из 11 различных взрослых, эмбриональных и неонатальных питающих клеток и определяется их способность поддерживать культуру полипотентных стволовых клеток человека. Ричардс с соавторами (Richards et al.) утверждают, что «линии эмбриональных стволовых клеток человека, культивированные на питающих слоях фибробластов кожи человека, сохраняют морфологию эмбриональных стволовых клеток человека и остаются полипотентными».
В патенте US20020072117 описаны линии клеток, производящие среду, которая поддерживает рост полипотентных стволовых клеток приматов в культуре без питательной среды. Использовавшимися линиями клеток были линии мезенхимных и фибробластоподобных клеток, полученные из эмбриональной ткани или дифференцированные из эмбриональных стволовых клеток. В патенте US20020072117 также описано использование этих линий клеток в качестве первичного слоя питающих клеток.
В другом примере - Wang et al. (Stem Cells 23:1221-1227, 2005) - описаны способы долговременного выращивания полипотентных стволовых клеток человека на слоях питающих клеток, полученных из эмбриональных стволовых клеток человека.
В другом примере - Stojkovic et al. (Stem Cells 2005 23:306-314, 2005) - описана система питающих клеток, полученная в результате спонтанной дифференцировки эмбриональных стволовых клеток человека.
В еще одном примере - Miyamoto et al. (Stem Cells 22:433-440, 2004) - описан источник питающих клеток, полученных из плаценты человека.
В работе Amit et al. (Biol. Reprod 68:2150-2156, 2003) описан слой питающих клеток, полученных из крайней плоти человека.
В другом примере - Inzunza et al. (Stem Cells 23:544-549, 2005) - описан слой питающих клеток, полученных из фибробластов постнатальной крайней плоти.
В патенте US6642048 описана среда, которая поддерживает рост полипотентных стволовых клеток приматов (pPS) в культуре без питающей среды, а также линии клеток, которые используются при получении такой среды. В патенте US6642048 утверждается: «Настоящее исследование включает в себя линии мезенхимных и фибробластоподобных клеток, полученные из эмбриональной ткани или дифференцированные из эмбриональных стволовых клеток. В этом документе описаны и проиллюстрированы способы получения таких линий клеток, обработки среды и выращивания стволовых клеток с помощью кондиционированной среды».
В другом примере - WO2005014799 - описана кондиционированная среда для поддержки, пролиферации и дифференцировки клеток млекопитающих. В документе WO2005014799 утверждается: «Культурная среда, получаемая в соответствии с настоящим изобретением, кондиционируется секреторной деятельностью мышечных клеток; в частности, дифференцированными и иммортализованными трансгенными гепатоцитами, называемыми MMH (Met Murine Hepatocyte)».
В другом примере - Xu et al. (Stem Cells 22:972-980, 2004) - описана кондиционированная среда, полученная из производных эмбриональных стволовых клеток человека, генетически модифицированных таким образом, чтобы иметь повышенную экспрессию обратной транскриптазы теломеразы человека.
В другом примере - US20070010011 - описана химически определенная культурная среда для поддержки полипотентных стволовых клеток.
В альтернативной культурной системе используется не содержащая сыворотки среда с добавлением факторов роста, способных обеспечивать пролиферацию эмбриональных стволовых клеток. Например, в работе Cheon et al. (BioReprod DOI:10.1095/biolreprod.105.046870, October 19, 2005) описана не содержащая питательного слоя и сыворотки культурная система, в которой эмбриональные стволовые клетки поддерживаются в некондиционированной среде, замещающей сыворотку (SR), с добавлением различных факторов роста, способных инициировать самообновление эмбриональных стволовых клеток.
В другом примере - Levenstein et al. (Stem Cells 24:568-574, 2006) - описаны способы долговременного культивирования эмбриональных стволовых клеток человека в отсутствие фибробластов или кондиционированной среды с помощью среды с добавлением bFGF.
В другом примере - US20050148070 - описан способ культивирования эмбриональных стволовых клеток человека в определенной среде без сыворотки и без питающих клеток фибробластов. Способ включает в себя: культивирование стволовых клеток в культурной среде, содержащей альбумин, аминокислоты, витамины, минералы, как минимум один трансферрин или заменитель трансферрина, как минимум один инсулин или заменитель инсулина, при этом культурная среда сама по себе не содержит эмбриональной сыворотки млекопитающих и содержит не менее чем примерно 100 нг/мл фактора роста фибробластов, способного активировать сигнальный рецептор фактора роста фибробластов, где фактор роста поставляется из источника, не являющегося просто питающим слоем фибробластов, а среда поддерживает пролиферацию стволовых клеток в недифференцированном состоянии без питающих клеток или кондиционированной среды.
В другом примере - US20050233446 - описана среда известного состава, используемая в культивировании стволовых клеток, в том числе недифференцированных стволовых примордиальных клеток приматов. В растворе среда в значительной степени является изотонической по сравнению с культивируемыми стволовыми клетками. В заданной культуре конкретная среда состоит из основной среды и некоторого количества следующих веществ: bFGF, инсулина и аскорбиновой кислоты, необходимых для поддержки существенно недифференцированного роста примордиальных стволовых клеток.
В другом примере - US6800480 - указывается: «В одном осуществлении предлагается среда для культивирования клеток для выращивания примордиальных стволовых клеток приматов в существенно недифференцированном состоянии, которая включает в себя основную среду с низким осмотическим давлением и низкой концентрацией эндотоксинов, которая эффективно поддерживает рост примордиальных стволовых клеток приматов. Основная среда смешивается с питательной сывороткой, эффективно поддерживающей рост примордиальных стволовых клеток приматов, и субстратом, выбираемым из группы, в которую входят питающие клетки и компонент внеклеточного матрикса, получаемые из питающих клеток. Кроме того, среда содержит неосновные аминокислоты, антиоксидант и первый фактор роста, выбираемый из группы, в которую входят нуклеозиды и соль пировиноградной кислоты.
В другом примере - US20050244962 - утверждается: «Один аспект изобретения предусматривает способ культивирования эмбриональных стволовых клеток приматов. Стволовые клетки культивируют в культуре, которая сама по себе не содержит эмбриональной сыворотки млекопитающих (также предпочтительно, чтобы она не содержала никакой животной сыворотки), и в присутствии фактора роста фибробластов, получаемого из источника, не являющегося просто питающим слоем фибробластов. В предпочтительной форме питающий слой фибробластов, ранее необходимый для поддержания культуры стволовых клеток, становится ненужным после добавления достаточного фактора роста фибробластов».
В другом примере - WO2005065354 - описана изотоническая культурная среда с известным составом, которая сама по себе не содержит питающего слоя и сыворотки и которая включает в себя: a) базальную среду; b) некоторое количество bFGF, достаточное для поддержки роста существенно недифференцированных стволовых клеток млекопитающих; c) некоторое количество инсулина, достаточное для поддержки роста существенно недифференцированных стволовых клеток млекопитающих; и d) некоторое количество аскорбиновой кислоты, достаточное для поддержки роста существенно недифференцированных стволовых клеток млекопитающих.
В другом примере - WO2005086845 - описан способ поддержки недифференцированной стволовой клетки, заключающийся в воздействии на стволовую клетку одного из членов семейства белков трансформирующего ростового фактора бета (TGF-β), одного из членов семейства белков факторов роста фибробластов (FGF) или никотинамида (NIC) в количестве, достаточном для поддержания клетки в недифференцированном состоянии в течение времени, достаточного для достижения желаемого результата.
Полипотентные клетки можно высевать на подходящий культурный субстрат. В одном осуществлении подходящим культурным субстратом является компонент внеклеточного матрикса, как, например, компоненты, получаемые из базальной мембраны, или компонент, который может участвовать в связях адгезивных молекул между рецептором и лигандом. В одном осуществлении подходящим культурным субстратом является MATRIGEL® (Becton Dickenson). MATRIGEL® - растворимый препарат из клеток опухоли Engelbreth-Holm Swarm, образующих гель при комнатной температуре с образованием восстановленной базальной мембраны.
Могут применяться и другие компоненты внеклеточного матрикса и смеси компонентов. В зависимости от типа пролиферирующих клеток в их число могут входить ламинин, фибронектин, протеогликан, энтактин и сходные компоненты, как сами по себе, так и в различных сочетаниях.
Полипотентные стволовые клетки можно высевать на субстрат в подходящем распределении и в присутствии среды, обеспечивающей выживание клеток, размножение и сохранение желаемых характеристик. Для улучшения всех этих характеристик желательно внимательно отнестись к распределению при высевании, а способы их определения известны специалистам.
Подходящую культурную среду можно создать из таких компонентов, как, например, модифицированная по способу Дульбекко среда Игла (DMEM), Gibco # 11965-092; модифицированная по способу Дульбекко среда Игла нокаутная (KO DMEM), Gibco # 10829-018; базальная среда Ham's F12/50% DMEM; 200 мМ L-глутамин, Gibco # 15039-027; раствор неосновных аминокислот, Gibco 11140-050; β-меркаптоэтанол, Sigma # M7522; человеческий рекомбинантный основной фактор роста фибробластов (bFGF), Gibco # 13256-029.
Образование клеток, экспрессирующих маркеры, характерные для линии панкреатической энтодермы, из полипотентных стволовых клеток
В одном из осуществлений настоящее изобретение предлагает способ получения клеток, экспрессирующих маркеры, характерные для линии панкреатической энтодермы, из полипотентных стволовых клеток, включающий следующие стадии:
a) культивирование полипотентных стволовых клеток;
b) дифференцировка полипотентных стволовых клеток в клетки, экспрессирующие маркеры, характерные для линии дефинитивной энтодермы;
c) дифференцировка клеток, экспрессирующих маркеры, характерные для линии дефинитивной энтодермы, в клетки, экспрессирующие маркеры, характерные для линии панкреатической энтодермы.
В одном аспекте настоящего изобретения клетки, экспрессирующие маркеры, характерные для линии панкреатической энтодермы, ко-экспрессируют PDX1, NKX6.1, но не экспрессируют CDX-2 и NGN3.
Дифференцировка полипотентных стволовых клеток в клетки, экспрессирующие маркеры, характерные для линии дефинитивной энтодермы
Образование клеток, экспрессирующих маркеры, характерные для линии дефинитивной энтодермы, можно определить по тестам на присутствие маркеров до и после соблюдения определенного протокола. Полипотентные стволовые клетки, как правило, не экспрессируют подобные маркеры. Таким образом, дифференцировка полипотентных клеток обнаруживается, когда клетки начинают их экспрессировать.
Возможна дифференцировка полипотентных стволовых клеток в клетки, экспрессирующие маркеры, характерные для линии дефинитивной энтодермы, любым из способов, известных в данной области или предлагаемых в настоящем изобретении.
Например, возможна дифференцировка полипотентных стволовых клеток в клетки, экспрессирующие маркеры, характерные для линии дефинитивной энтодермы, способами, описанными в работе D'Amour et al., Nature Biotechnology 23, 1534-1541 (2005).
Например, возможна дифференцировка полипотентных стволовых клеток в клетки, экспрессирующие маркеры, характерные для линии дефинитивной энтодермы, способами, описанными в работе Shinozaki et al., Development 131, 1651-1662 (2004).
Например, возможна дифференцировка полипотентных стволовых клеток в клетки, экспрессирующие маркеры, характерные для линии дефинитивной энтодермы, способами, описанными в работе McLean et al., Stem Cells 25, 29-38 (2007).
Например, возможна дифференцировка полипотентных стволовых клеток в клетки, экспрессирующие маркеры, характерные для линии дефинитивной энтодермы, способами, описанными в работе D'Amour et al., Nature Biotechnology 24, 1392-1401 (2006).
Например, возможна дифференцировка полипотентных стволовых клеток в клетки, экспрессирующие маркеры, характерные для линии дефинитивной энтодермы, посредством культивирования полипотентных стволовых клеток в среде, содержащей активин A, в отсутствие сыворотки с последующим культивированием клеток активином A и сывороткой и культивированием клеток с активином A и сывороткой в различной концентрации. Пример такого способа описан в работе Nature Biotechnology 23, 1534-1541 (2005).
Например, возможна дифференцировка полипотентных стволовых клеток в клетки, экспрессирующие маркеры, характерные для линии дефинитивной энтодермы, посредством культивирования полипотентных стволовых клеток в среде, содержащей активин A, в отсутствие сыворотки с последующим культивированием клеток с активином A и сывороткой в другой концентрации. Пример такого способа описан в работе D'Amour et al., Nature Biotechnology, 2005.
Например, возможна дифференцировка полипотентных стволовых клеток в клетки, экспрессирующие маркеры, характерные для линии дефинитивной энтодермы, посредством культивирования полипотентных стволовых клеток в среде, содержащей активин A и лиганд Wnt, в отсутствие сыворотки с последующим удалением лиганда Wnt и культивированием клеток с активином A и сывороткой. Пример такого способа описан в работе Nature Biotechnology 24, 1392-1401 (2006).
Например, возможна дифференцировка полипотентных стволовых клеток в клетки, экспрессирующие маркеры, характерные для линии дефинитивной энтодермы, посредством обработки полипотентных стволовых клеток в соответствии с методами, описанными в заявке на патент США с серийным номером 11/736908 компании LifeScan, Inc.
Например, возможна дифференцировка полипотентных стволовых клеток в клетки, экспрессирующие маркеры, характерные для линии дефинитивной энтодермы, посредством обработки полипотентных стволовых клеток в соответствии с методами, описанными в заявке на патент США с серийным номером 11/779311 компании LifeScan, Inc.
Например, возможна дифференцировка полипотентных стволовых клеток в клетки, экспрессирующие маркеры, характерные для линии дефинитивной энтодермы, посредством обработки полипотентных стволовых клеток в соответствии с методами, описанными в заявке на патент США с серийным номером 60/990529.
Например, возможна дифференцировка полипотентных стволовых клеток в клетки, экспрессирующие маркеры, характерные для линии дефинитивной энтодермы, посредством обработки полипотентных стволовых клеток в соответствии с методами, описанными в заявке на патент США с серийным номером 61/076889.
Например, возможна дифференцировка полипотентных стволовых клеток в клетки, экспрессирующие маркеры, характерные для линии дефинитивной энтодермы, посредством обработки полипотентных стволовых клеток в соответствии с методами, описанными в заявке на патент США с серийным номером 61/076900.
Например, возможна дифференцировка полипотентных стволовых клеток в клетки, экспрессирующие маркеры, характерные для линии дефинитивной энтодермы, посредством обработки полипотентных стволовых клеток в соответствии с методами, описанными в заявке на патент США с серийным номером 61/076908.
Например, возможна дифференцировка полипотентных стволовых клеток в клетки, экспрессирующие маркеры, характерные для линии дефинитивной энтодермы, посредством обработки полипотентных стволовых клеток в соответствии с методами, описанными в заявке на патент США с серийным номером 61/076915.
Дифференцировка клеток, экспрессирующих маркеры, характерные для линии дефинитивной энтодермы, в клетки, экспрессирующие маркеры, характерные для линии панкреатической энтодермы
В одном осуществлении клетки, экспрессирующие маркеры, характерные для линии дефинитивной энтодермы, дифференцируются в клетки, экспрессирующие маркеры, характерные для линии панкреатической энтодермы, которые ко-экспрессируют PDX1, NKX6.1, но не экспрессируют CDX2 и NGN3, посредством культивирования клеток, экспрессирующих маркеры, характерные для линии дефинитивной энтодермы, в первой среде с добавлением FGF7 с последующим культивированием клеток во второй среде с добавлением FGF7, фактора, способного ингибировать BMP, активина A, антагониста рецептора TGFβ, ретиноевой кислоты и ингибитора сигнального пути хеджехог.
В одном осуществлении FGF7 может использоваться в концентрации от примерно 50 пг/мл до примерно 50 мкг/мл. В одном осуществлении FGF7 может использоваться в концентрации 50 нг/мл.
В одном осуществлении фактором, способным ингибировать BMP, является реактив noggin. Noggin может использоваться в концентрации от примерно 500 нг/мл до примерно 500 мкг/мл. В одном осуществлении noggin может использоваться в концентрации 100 нг/мл.
В одном осуществлении антагонист рецептора TGFβ выбирается из группы, в которую входят активин A, активин B, TGFβ-I, TGFβ-II, GDF-8 и GDF-11.
Активин A может использоваться в концентрации от примерно 2 нг/мл до 100 нг/мл. В одном осуществлении активин A может использоваться в концентрации 20 нг/мл. В другом осуществлении активин A используется в концентрации 50 нг/мл.
Активин B может использоваться в концентрации от примерно 2 нг/мл до 100 нг/мл. В одном осуществлении активин B может использоваться в концентрации 20 нг/мл. В другом осуществлении активин B используется в концентрации 50 нг/мл.
TGFβ-I может использоваться в концентрации от примерно 2 нг/мл до 100 нг/мл. В одном осуществлении TGFβ-I может использоваться в концентрации 20 нг/мл. В другом осуществлении TGFβ-I используется в концентрации 50 нг/мл.
TGFβ-II может использоваться в концентрации от примерно 2 нг/мл до 100 нг/мл. В одном осуществлении TGFβ-II может использоваться в концентрации 20 нг/мл. В другом осуществлении TGFβ-II используется в концентрации 50 нг/мл.
GDF-8 может использоваться в концентрации от примерно 2 нг/мл до 100 нг/мл. В одном осуществлении GDF-8 может использоваться в концентрации 20 нг/мл. В другом осуществлении GDF-8 используется в концентрации 50 нг/мл.
GDF-11 может использоваться в концентрации от примерно 2 нг/мл до 100 нг/мл. В одном осуществлении GDF-11 может использоваться в концентрации 20 нг/мл. В другом осуществлении GDF-11 используется в концентрации 50 нг/мл.
Ретиноевая кислота может использоваться в концентрации от примерно 1 нМ до примерно 1 мМ. В одном осуществлении ретиноевая кислота может использоваться в концентрации 1 мкМ.
В одном осуществлении ингибитором сигнального пути хеджехог является циклопамин-KAAD. Циклопамин-KAAD может использоваться в концентрации от примерно 0,025 мкМ до примерно 2,5 мкМ. В одном осуществлении циклопамин-KAAD используется в концентрации 0,25 мкМ.
Эффективность дифференцировки можно определять посредством воздействия на обработанную популяцию клеток препарата (например, антитела), позволяющего распознавать именно тот белковый маркер, который экспрессируется клетками, экспрессирующими маркеры, характерные для линии дефинитивной энтодермы.
Методы оценки экспрессии белковых и нуклеиновокислотных маркеров в культивированных и изолированных клетках являются стандартными в данной области. К ним относятся количественная цепная реакция обратной транскриптазы и полимеразы (RT-PCR), нозерн-блоттинг, гибридизация in situ (см., например, Current Protocols in Molecular Biology (Ausubel et al., eds. 2001 supplement)) и иммунологические анализы, такие как иммуногистохимический анализ срезов материала, вестерн-блоттинг, а для маркеров, которые можно выявить в интактных клетках - анализ методом поточной цитометрии (FACS) (см., например, Harlow and Lane, Using Antibodies: A Laboratory Manual, New York: Cold Spring Harbor Laboratory Press (1998)).
Характеристики полипотентных стволовых клеток хорошо известны специалистам; кроме того, продолжается выявление новых характеристик полипотентных стволовых клеток. К маркерам полипотентных стволовых клеток относится, например, экспрессия одного или нескольких из следующих: ABCG2, cripto, FOXD3, CONNEXIN43, CONNEXIN45, OCT4, SOX2, Nanog, hTERT, UTF1, ZFP42, SSEA-3, SSEA-4, Tra 1-60, Tra 1-81.
После обработки полипотентных стволовых клеток по методам, представляющим предмет настоящего изобретения, дифференцированные клетки можно очистить посредством воздействия на обработанную популяцию клеток препарата (например, антитела), позволяющего распознавать именно тот белковый маркер, такой как CXCR4, который экспрессируется клетками, экспрессирующими маркеры, характерные для линии дефинитивной энтодермы.
К числу полипотентных стволовых клеток, которые можно использовать в настоящем изобретении, относятся, например, эмбриональные стволовые клетки человека линии H9 (код Национального института здравоохранения (NIH): WA09), эмбриональные стволовые клетки человека линии H1 (код NIH: WA01), эмбриональные стволовые клетки человека линии H7 (код NIH: WA07), эмбриональные стволовые клетки человека линии SA002 (Cellartis, Швеция). Также в настоящем изобретении можно использовать клетки, которые экспрессируют как минимум один из следующих маркеров, характерных для полипотентных клеток: ABCG2, cripto, CD9, FOXD3, CONNEXIN43, CONNEXIN45, OCT4, SOX2, Nanog, hTERT, UTF1, ZFP42, SSEA-3, SSEA-4, Tra 1-60 и Tra 1-81.
Маркеры, характерные для линии дефинитивной энтодермы, выбираются из группы, в которую входят SOX-17, GATA4, HNF3 бета, GSC, CER1, Nodal, FGF8, брахиурия, гомеобокс-белок типа MIX, FGF4 CD48, эомезодермин (EOMES), DKK4, FGF17, GATA6, CXCR4, C-Kit, CD99 и OTX2. В настоящем изобретении можно использовать клетку, которая экспрессирует как минимум один из маркеров, характерных для линии дефинитивной энтодермы. В одном из аспектов настоящего изобретения клеткой, экспрессирующей маркеры, характерные для линии дефинитивной энтодермы, является клетка предшественника первичной полоски. В другом аспекте настоящего изобретения клеткой, экспрессирующей маркеры, характерные для линии дефинитивной энтодермы, является клетка мезоэнтодермы. В другом аспекте настоящего изобретения клеткой, экспрессирующей маркеры, характерные для линии дефинитивной энтодермы, является клетка дефинитивной энтодермы.
Маркеры, характерные для линии панкреатической энтодермы, выбираются из группы, в которую входят PDX1, HNF1 бета, PTF1 альфа, HNF6, HB9 и PROX1. В настоящем изобретении можно использовать клетку, которая экспрессирует как минимум один из маркеров, характерных для линии панкреатической энтодермы. В одном из аспектов настоящего изобретения клеткой, экспрессирующей маркеры, характерные для линии панкреатической энтодермы, является клетка панкреатической энтодермы.
Образование клеток, экспрессирующих маркеры, характерные для панкреатической эндокринной линии
В одном осуществлении настоящего изобретения клетки, экспрессирующие маркеры, характерные для линии панкреатической энтодермы, которые ко-экспрессируют PDX1, NKX6.1, но не экспрессируют CDX2 и NGN3, получаемые способами, составляющими предмет настоящего изобретения, могут далее дифференцироваться в клетки, экспрессирующие маркеры, характерные для панкреатической эндокринной линии.
Клетки, экспрессирующие маркеры, характерные для линии панкреатической энтодермы, могут дифференцироваться в клетки, экспрессирующие маркеры, характерные для панкреатической эндокринной линии, любым из способов, известных в данной области или предлагаемых в настоящем изобретении.
Например, клетки, экспрессирующие маркеры, характерные для линии панкреатической энтодермы, полученные в соответствии со способами, составляющими предмет настоящего изобретения, далее дифференцируются в клетки, экспрессирующие маркеры, характерные для панкреатической эндокринной линии, посредством культивирования клеток, экспрессирующих маркеры, характерные для линии панкреатической энтодермы, в среде, содержащей эксендин-4, после чего среда с эксендином-4 удаляется, и клетки культивируются в среде, содержащей эксендин-1, IGF-1 и HGF. Пример такого способа описан в работе D'Amour et al., Nature Biotechnology, 2006.
Например, клетки, экспрессирующие маркеры, характерные для линии панкреатической энтодермы, полученные в соответствии со способами, составляющими предмет настоящего изобретения, далее дифференцируются в клетки, экспрессирующие маркеры, характерные для панкреатической эндокринной линии, посредством культивирования клеток, экспрессирующих маркеры, характерные для линии панкреатической энтодермы, в среде, содержащей DAPT (Sigma-Aldrich, MO) и эксендин-4. Пример такого способа описан в работе D'Amour et al., Nature Biotechnology, 2006.
Например, клетки, экспрессирующие маркеры, характерные для линии панкреатической энтодермы, полученные в соответствии со способами, составляющими предмет настоящего изобретения, далее дифференцируются в клетки, экспрессирующие маркеры, характерные для панкреатической эндокринной линии, посредством культивирования клеток, экспрессирующих маркеры, характерные для линии панкреатической энтодермы, в среде, содержащей эксендин-4. Пример такого способа описан в работе D'Amour et al., Nature Biotechnology, 2006.
Например, клетки, экспрессирующие маркеры, характерные для линии панкреатической энтодермы, полученные в соответствии со способами, составляющими предмет настоящего изобретения, далее дифференцируются в клетки, экспрессирующие маркеры, характерные для панкреатической эндокринной линии, посредством обработки клеток, экспрессирующих маркеры, характерные для линии панкреатической энтодермы, фактором, ингибирующим сигнальный путь Notch, в соответствии со способом, описанным в заявке на патент США с серийным номером 11/736908 компании LifeScan, Inc.
Например, клетки, экспрессирующие маркеры, характерные для линии панкреатической энтодермы, полученные в соответствии со способами, составляющими предмет настоящего изобретения, далее дифференцируются в клетки, экспрессирующие маркеры, характерные для панкреатической эндокринной линии, посредством обработки клеток, экспрессирующих маркеры, характерные для линии панкреатической энтодермы, фактором, ингибирующим сигнальный путь Notch, в соответствии со способом, описанным в заявке на патент США с серийным номером 11/779311 компании LifeScan, Inc.
Например, клетки, экспрессирующие маркеры, характерные для линии панкреатической энтодермы, полученные в соответствии со способами, составляющими предмет настоящего изобретения, далее дифференцируются в клетки, экспрессирующие маркеры, характерные для панкреатической эндокринной линии, посредством обработки клеток, экспрессирующих маркеры, характерные для линии панкреатической энтодермы, фактором, ингибирующим сигнальный путь Notch, в соответствии со способом, описанным в заявке на патент США с серийным номером 60/953178 компании LifeScan, Inc.
Например, клетки, экспрессирующие маркеры, характерные для линии панкреатической энтодермы, полученные в соответствии со способами, составляющими предмет настоящего изобретения, далее дифференцируются в клетки, экспрессирующие маркеры, характерные для панкреатической эндокринной линии, посредством обработки клеток, экспрессирующих маркеры, характерные для линии панкреатической энтодермы, фактором, ингибирующим сигнальный путь Notch, в соответствии со способом, описанным в заявке на патент США с серийным номером 60/990529 компании LifeScan, Inc.
Маркеры, характерные для панкреатической эндокринной линии, выбираются из группы, в которую входят NGN3, NEUROD, ISL1, PDX1, NKX6.1, PAX4, NGN3 и PTF-1 альфа. В одном осуществлении панкреатические эндокринные клетки способны экспрессировать не менее одного из следующих гормонов: инсулин, глюкагон, соматостатин и панкреатический полипептид. В настоящем изобретении можно использовать клетку, которая экспрессирует как минимум один из маркеров, характерных для панкреатической эндокринной линии. В одном из аспектов настоящего изобретения клеткой, экспрессирующей маркеры, характерные для панкреатической эндокринной линии, является панкреатическая эндокринная клетка. Панкреатической эндокринной клеткой может быть панкреатическая клетка, экспрессирующая гормоны. В качестве иного варианта панкреатической эндокринной клеткой может быть панкреатическая клетка, секретирующая гормоны.
В одном из аспектов настоящего изобретения панкреатической эндокринной клеткой является клетка, экспрессирующая маркеры, характерные для линии β-клеток. Клетка, экспрессирующая маркеры, характерные для линии β-клеток, экспрессирует PDX1 и не менее одного из следующих факторов транскрипции: NGN3, NKX2.2, NKX6.1, NEUROD, ISL1, HNF3 бета, MAFA, PAX4 и PAX6. В одном из аспектов настоящего изобретения клеткой, экспрессирующей маркеры, характерные для линии β-клеток, является β-клетка.
Способы терапевтического применения
В одном аспекте настоящего изобретения предусматривается способ лечения пациента, у которого диагностирован или может развиться диабет 1 типа. В одном из осуществлений метод предусматривает культивирование полипотентных стволовых клеток, дифференцировку полипотентных стволовых клеток in vitro в линию β-клеток и имплантацию пациенту клеток линии β-клеток. В другом осуществлении способ предусматривает культивирование полипотентных стволовых клеток, дифференцировку полипотентных стволовых клеток in vitro в клетки, экспрессирующие маркеры, характерные для линии панкреатической энтодермы, которая ко-экспрессирует PDX1, NKX6.1, но не экспрессирует CDX2 и NGN3, и имплантацию пациенту клеток линии панкреатической энтодермы, ко-экспрессирующей PDX1, NKX6.1, но не экспрессирующей CDX2 и NGN3.
В еще одном аспекте настоящее изобретение предусматривает способ лечения пациента, у которого диагностирован или может развиться диабет 2 типа. В одном из осуществлений метод предусматривает культивирование полипотентных стволовых клеток, дифференцировку полипотентных стволовых клеток in vitro в линию β-клеток и имплантацию пациенту клеток линии β-клеток. В другом осуществлении способ предусматривает культивирование полипотентных стволовых клеток, дифференцировку полипотентных стволовых клеток in vitro в клетки, экспрессирующие маркеры, характерные для линии панкреатической энтодермы, которая ко-экспрессирует PDX1, NKX6.1, но не экспрессирует CDX2 и NGN3, и имплантацию пациенту клеток линии панкреатической энтодермы, ко-экспрессирующей PDX1, NKX6.1, но не экспрессирующей CDX2 и NGN3.
В отдельных случаях пациент может проходить дополнительное лечение фармацевтическими препаратами или биологически активными веществами, способствующими выживанию и функционированию пересаженных клеток. В числе этих препаратов могут быть, например, инсулин, представители семейства TGF-β, в том числе TGF-β1, 2 и 3, костные морфогенетические белки (BMP-2, -3, -4, -5, -6, -7, -11, -12 и -13), факторы роста фибробластов-1 и -2, фактор роста тромбоцитов-AA и -BB, обогащенная тромбоцитами плазма, фактор роста инсулина (IGF-I, II), фактор роста и дифференцировки (GDF-5, -6, -7, -8, -10, -15), эндотелиальный фактор роста сосудов (VEGF), плейотрофин, эндотелин и другие. Другими фармацевтическими соединениями могут быть, например, никотинамид, глюкагоноподобный пептид-I (GLP-1) и II, GLP-1 и 2 mimetibody, эксендин-4, ретиноевая кислота, паратиреоидный гормон, ингибиторы МАПК, такие как, например, соединения, описанные в опубликованной заявке на патент США 2004/0209901 и в опубликованной заявке на патент США 2004/0132729.
Полипотентные стволовые клетки можно дифференцировать в производящие инсулин клетки перед трансплантацией реципиенту. В отдельном осуществлении полипотентные стволовые клетки полностью дифференцируются в β-клетки перед трансплантацией реципиенту. В качестве иного варианта полипотентные стволовые клетки можно трансплантировать реципиенту в недифференцированном или частично дифференцированном состоянии. Дальнейшая дифференцировка может происходить в организме реципиента.
Клетки дефинитивной энтодермы или, в качестве иного варианта, клетки панкреатической энтодермы или, в качестве иного варианта, β-клетки могут имплантироваться в виде клеток в суспензии или в виде кластеров, которые можно вводить в воротную вену печени. В качестве иного варианта клетки можно дополнять биологически совместимыми и деструктурируемыми полимерными вспомогательными средствами, пористыми недеструктурируемыми средствами или инкапсулировать их для защиты от иммунной реакции организма. Клетки можно имплантировать в подходящий участок тела реципиента. К местам имплантации относятся, например, печень, естественная поджелудочная железа, субкапсулярное пространство почки, сальник, брюшина, субсерозное пространство, кишечник, желудок и подкожный карман.
Для стимулирования дальнейшей дифференцировки, выживаемости или активности имплантированных клеток могут вводиться дополнительные факторы, такие как факторы роста, антиоксиданты и противовоспалительные средства, до или после введения клеток, а также одновременно с ними. В определенных осуществлениях используются факторы роста для дифференцировки введенных клеток in vivo. Эти факторы могут секретироваться эндогенными клетками и взаимодействовать с введенными клетками in situ. Можно индуцировать дифференцировку имплантированных клеток любым сочетанием эндогенных и экзогенно введенных факторов роста, известных в данной области.
Количество клеток, используемых в имплантации, зависит от различных факторов, в том числе от состояния пациента и его реакции на лечение, и может быть определено специалистом.
В одном аспекте настоящего изобретения предусматривается способ лечения пациента, у которого диагностирован или может развиться диабет. Настоящий способ предусматривает культивирование полипотентных стволовых клеток, дифференцировку культивированных клеток in vitro в линию β-клеток и встраивание клеток в трехмерную подложку. Клетки можно сохранять in vitro на этой подложке до имплантации пациенту. В качестве иного варианта подложку с клетками можно непосредственно имплантировать пациенту без дополнительного культивирования in vitro. В подложку можно встраивать по меньшей мере один фармацевтический препарат, способствующий выживанию и функционированию трансплантированных клеток.
К числу материалов подложки, пригодных для использования в целях настоящего изобретения, относятся матрицы тканей, каналы, барьеры и резервуары, используемые для восстановления тканей. В частности, для реализации способов, составляющих предмет настоящего изобретения, подходят синтетические и природные материалы в форме пен, губок, гелей, гидрогелей, тканей и нетканых структур, которые используются in vitro и in vivo для восстановления или регенерации биологической ткани, а также с целью доставки хемотаксических агентов для индуцирования роста ткани. См., например, материалы, описанные в патенте США 5770417, патенте США 6022743, патенте США 5567612, патенте США 5759830, патенте США 6626950, патенте США 6534084, патенте США 6306424, патенте США 6365149, патенте США 6599323, патенте США 6656488, опубликованной заявке на патент США 2004/0062753 A1, патенте США 4557264 и патенте США 6333029.
Для получения подложки со встроенным фармацевтическим препаратом этот фармацевтический препарат можно смешать с раствором полимера перед образованием подложки. В качестве иного варианта фармацевтический препарат можно нанести в виде покрытия на изготовленную подложку, предпочтительно в присутствии фармацевтического носителя. Фармацевтический препарат может присутствовать в виде жидкости, тонко измельченного твердого вещества или в другой подходящей физической форме. В качестве иного варианта можно добавлять в подложку наполнители для изменения скорости высвобождения фармацевтического препарата. В альтернативном осуществлении в подложку встраивается по меньшей мере одно фармацевтическое соединение, представляющее собой противовоспалительный препарат, как, например, соединения, описанные в патенте США 6509369.
В подложку может встраиваться по меньшей мере одно фармацевтическое соединение, представляющее собой антиапоптозный препарат, как, например, соединения, описанные в патенте США 6793945.
В подложку может также встраиваться по меньшей мере одно фармацевтическое соединение, представляющее собой ингибитор фиброза, как, например, соединения, описанные в патенте США 6331298.
В подложку может также встраиваться по меньшей мере одно фармацевтическое соединение, способное стимулировать развитие кровеносных сосудов, как, например, соединения, описанные в опубликованной заявке на патент США 2004/0220393 и в опубликованной заявке на патент США 2004/0209901.
В подложку может также встраиваться по меньшей мере одно фармацевтическое соединение, представляющее собой иммунодепрессант, такой как, например, соединения, описанные в опубликованной заявке на патент США 2004/0171623.
В подложку также может встраиваться по меньшей мере одно из фармацевтических соединений, являющихся факторами роста, таких как, например, представители семейства TGF-β, в том числе TGF-β1, 2 и 3, костные морфогенетические белки (BMP-2, -3, -4, -5, -6, -7, -11, -12 и -13), факторы роста фибробластов-1 и -2, фактор роста тромбоцитов-AA и -BB, обогащенная тромбоцитами плазма, фактор роста инсулина (IGF-I, II), фактор роста и дифференцировки (GDF-5, -6, -8, -10, -15), эндотелиальный фактор роста сосудов (VEGF), плейотрофин, эндотелин и другие. Другими фармацевтическими соединениями могут быть, например, никотинамид, фактор 1-альфа, индуцируемый гипоксией, глюкагоноподобный пептид-I (GLP-1), GLP-1 и GLP-2 mimetibody, и II, эксендин-4, nodal, noggin, NGF, ретиноевая кислота, паратиреоидный гормон, тенасцин-C, тропоэластин, тромбин-производные пептиды, кателицидины, дефензины, ламинин, биологические пептиды с содержанием связывающих клетки и гепарин доменов белков адгезивной внеклеточной матрицы, такие как фибронектин и витронектин, ингибиторы МАПК, такие как, например, соединения, описанные в опубликованной заявке на патент США 2004/0209901 и в опубликованной заявке на патент США 2004/0132729.
Встраивание клеток по данному изобретению в каркас можно выполнять посредством простого размещения клеток на каркасе. Клетки могут проникать в каркас в ходе простой диффузии (J. Pediatr. Surg. 23 (1 Pt 2):3-9 (1988)). Для повышения эффективности высевания клеток было разработано еще несколько подходов. Например, используют вращающиеся колбы для высевания хондроцитов на матрицы полигликолиевой кислоты (Biotechnol. Prog. 14(2):193-202 (1998)). Другой подход к высеванию клеток заключается в использовании центрифугирования, что приводит к минимальной нагрузке на высеваемые клетки и повышает эффективность высевания. Например, Янг с соавторами (Yang et al.) разработали способ высевания клеток (J. Biomed. Mater. Res. 55(3):379-86 (2001)), называемый иммобилизацией клеток на центрифуге (CCI).
Далее настоящее изобретение иллюстрируется, помимо прочего, следующими примерами.
ПРИМЕРЫ
Пример 1
Дифференцировка полипотентных стволовых клеток человека в клетки, экспрессирующие маркеры, характерные для линии панкреатической энтодермы, которые ко-экспрессируют PDX1, NKX6.1, но не экспрессируют CDX2 и NGN3
Этот пример демонстрирует, что активин A можно использовать в сочетании с реактивом Noggin и ретиноевой кислотой для повышения эффективности повышающей регуляции экспрессии NKX6.1. По краткому описанию, клетки линии H1 эмбриональных стволовых клеток человека культивируются на чашках с покрытием MATRIGEL™ (с разбавлением 1:30) и средой RPMI с добавлением 2% БСА, 100 нг/мл активина A, 20 нг/мл WNT-3a, 8 нг/мл bFGF в течение суток с последующей обработкой средой RPMI с добавлением 2% БСА, 100 нг/мл активина A, 8 нг/мл bFGF в течение еще двух дней (стадия 1), затем
a. DMEM/F12+2% БСА+50 нг/мл FGF7 в течение трех дней (стадия 2), затем
b. DMEM с высоким содержанием глюкозы+1% B27+50 нг/мл FGF7+0,25 мкМ циклопамина-KAAD+2 мкМ ретиноевой кислоты (RA)+100 нг/мл реактива Noggin+20 нг/мл активина A или 50 нг/мл активина A в течение четырех дней (стадия 3).
Для контроля отдельные популяции клеток обрабатываются DMEM с высоким содержанием глюкозы с добавлением 1% B27, 50 нг/мл FGF7, 0,25 мкМ циклопамина-KAAD, 2 мкМ ретиноевой кислоты (RA) и 100 нг/мл реактива Noggin.
На стадии 3 дня 4 отбирались двойные пробы культур и проводился анализ экспрессии панкреатических маркеров методом ПЦР в режиме реального времени.
Как показано на фиг.1, наблюдался резкий рост экспрессии NKX6.1 на стадии 3 дня 4 по сравнению с образцами из клеток, не получавших активин A. Рост экспрессии NKX6.1, вызванный активином A, был пропорционален дозе активина A. Кроме того, наблюдалась понижающая регуляция экспрессии NGN3 в клетках на стадии 3, день 4. Для того чтобы определить, был ли задействован путь TGF-бета в активизации образования клеток, экспрессирующих маркеры, характерные для панкреатической эндокринной линии, которая ко-экспрессирует PDX1, NKX6.1, клетки обрабатывались следующим образом:
Клетки линии H1 эмбриональных стволовых клеток человека культивировались на чашках с покрытием из MATRIGEL (с разбавлением 1:30) и дифференцировались в предшественники панкреатических эндокринных клеток по следующему протоколу:
a) среда RPMI (№ по каталогу 22400, Invitrogen, штат Калифорния) с добавлением 2% БСА (№ по каталогу 152401, MP Biomedical, штат Огайо) и 100 нг/мл активина A (R&D Systems, штат Миннесота) плюс 20 нг/мл WNT-3a (№ по каталогу 1324-WN-002, R&D Systems, штат Миннесота) плюс 8 нг/мл bFGF (№ по каталогу 100-18B, PeproTech, штат Нью-Джерси) в течение одного дня с последующей обработкой средой RPMI с добавлением 2% БСА и 100 нг/мл активина A плюс 8 нг/мл bFGF в течение еще двух дней (стадия 1), затем
b) DMEM/F12 (№ по каталогу 11330, Invitrogen, штат Калифорния)+2% БСА+50 нг/мл FGF7 в течение трех дней (стадия 2), затем
c) обработка по варианту 1: DMEM (с высоким содержанием глюкозы)+1% B27 (Invitrogen, штат Калифорния)+50 нг/мл FGF7+0,25 мкМ циклопамина-KAAD+2 мкМ ретиноевой кислоты (RA)+100 нг/мл реактива Noggin в течение четырех дней (стадия 3), или
d) обработка по варианту 2: DMEM (с высоким содержанием глюкозы)+1% B27 (Invitrogen, штат Калифорния)+50 нг/мл FGF7+0,25 мкМ циклопамина-KAAD+2 мкМ ретиноевой кислоты (RA)+100 нг/мл реактива Noggin, 20 нг/мл активина A в течение четырех дней (стадия 3), или
e) обработка по варианту 3: DMEM (с высоким содержанием глюкозы)+1% B27 (Invitrogen, штат Калифорния)+50 нг/мл FGF7+0,25 мкМ циклопамина-KAAD+2 мкМ ретиноевой кислоты (RA)+100 нг/мл реактива Noggin, 1 мкМ ALK5 ингибитора II (Alexis Biochemical) в течение четырех дней (стадия 3).
На стадии 3 дня 4 отбирались двойные пробы культур и проводился анализ экспрессии панкреатических маркеров методом ПЦР в режиме реального времени. Культуры также параллельно фиксировались для иммунофлюоресцентного анализа.
В таблице 1 показаны относительные уровни экспрессии NKX6.1, NGN3 и PDX1 на стадии 3, день 4, после нормализации по минимальному состоянию в данном эксперименте (обработка по варианту 1).
Обработка по варианту 1 (FGF7, ретиноевая кислота и реактив Noggin) привела к экспрессии NKX6.1 и NGN3. См. фиг.2, панели a и b. Однако добавление активина A (обработка по варианту 2) блокировало экспрессию NGN3 и существенно повысило число клеток, экспрессирующих NKX6.1. См. фиг.2, панели c и d. Эти данные позволяют предположить, что активация пути рецептора TGFβ во время образования популяции клеток, экспрессирующих маркеры, характерные для линии панкреатической энтодермы, приводит к образованию популяции клеток, экспрессирующих маркеры, характерные для линии панкреатической энтодермы, которые не экспрессируют NGN3.
Инкубация клеток с ингибитором Alk5 II рецептора TGFβ подтверждает эту гипотезу (см. вариант обработки 3). Обработка клеток DMEM (с высоким содержанием глюкозы) с добавлением 1% B27 (Invitrogen, штат Калифорния), 50 нг/мл FGF7, 0,25 мкМ циклопамина-KAAD, 2 мкМ ретиноевой кислоты (RA), 100 нг/мл реактива Noggin, 1 мкМ ALK5 ингибитора II привела к снижению уровня экспрессии NKX6.1. Наблюдавшийся уровень экспрессии был ниже, чем в клетках, обрабатывавшихся по варианту 1 (см. таблицу 1, а также фиг.2, панель e). С другой стороны, число клеток, экспрессирующих NGN3, значительно возросло. См. таблицу 1, а также фиг.2, панель f. Существенного влияния на экспрессию PDX1 не наблюдалось. Эти результаты позволяют предположить, что сочетание реактива Noggin, ретиноевой кислоты и активина A оказывает синергическое действие, определяя популяцию панкреатических клеток-предшественников, положительную по отношению к экспрессии NKN6.1 и PDX1, но отрицательную по отношению к экспрессии NGN3.
Как показано на фиг.3, панели a и b, большинство клеток, экспрессирующих PDX1, полученных с помощью DMEM (обработка по варианту 2 - DMEM (с высоким содержанием глюкозы) с добавлением 1% B27 (Invitrogen, штат Калифорния), 50 нг/мл FGF7, 0,25 мкМ циклопамина-KAAD, 2 мкМ ретиноевой кислоты (RA), 100 нг/мл реактива Noggin, 20 нг/мл активина А) не экспрессировали CDX2 на стадии 3, день 4. Этим они отличаются от клеток, экспрессирующих PDX1, полученных с помощью DMEM/F12 с добавлением 1% B27 (Invitrogen, штат Калифорния)+50 нг/мл FGF7, 0,25 мкМ циклопамина-KAAD, 2 мкМ ретиноевой кислоты (RA), 100 нг/мл реактива Noggin, 20 нг/мл активина A, где большинство клеток, экспрессировавших PDX1, экспрессировали и CDX2. См. фиг.3, панели c и d.
Тестировался ряд антагонистов рецептора TGFβ. В случае замены в обработке по варианту 2 активина А на GDF-8, GDF-11, активин B или TGFβ2 результаты были аналогичными: обработка GDF-8, GDF-11, активином B или TGFβ2 в течение четырех дней приводила к повышению экспрессии NKX6.1 и понижающей регулировке NGN3. См. фиг.4, панели a и c. Значительного влияния на экспрессию PDX1 не наблюдалось. См. фиг.4, панель b.
Пример 2
Дифференцировка клеток, экспрессирующих маркеры, характерные для линии панкреатической энтодермы, которые ко-экспрессируют PDX1, NKX6.1, но не экспрессируют CDX-2 и NGN3, в предшественники панкреатических эндокринных клеток
Предыдущие исследования показали, что клетки, экспрессирующие маркеры, характерные для линии панкреатической энтодермы, при дальнейшей дифференцировке с большей вероятностью порождают глюкагон-экспрессирующие клетки, чем инсулин-экспрессирующие клетки. Это может быть отчасти обусловлено экспрессией NGN3 в клетках панкреатической энтодермы. Способы, составляющие предмет настоящего изобретения, позволяют получать популяцию клеток панкреатической энтодермы, которые не экспрессируют NGN3, а потому с большей вероятностью будут дифференцироваться в клетки, вырабатывающие инсулин. Однако экспрессия NGN3 необходима для формирования панкреатических эндокринных клеток или предшественников панкреатических эндокринных клеток (клеток, которые могут формировать, например, глюкагон- или инсулин-экспрессирующие клетки). Поэтому временная регуляция NGN3 важна для конечной судьбы предшественников панкреатических эндокринных клеток.
В настоящем изобретении предполагается, что следует поддерживать экспрессию NGN3 на минимальном уровне до начала дифференцировки панкреатической энтодермы в предшественники панкреатических эндокринных клеток.
По краткому описанию, клетки линии H1 эмбриональных стволовых клеток человека культивируются на чашках с покрытием MATRIGEL™ (с разбавлением 1:30) и средой RPMI с добавлением 2% БСА, 100 нг/мл активина A, 20 нг/мл WNT-3a, 8 нг/мл bFGF в течение суток с последующей обработкой средой RPMI с добавлением 2% БСА+100 нг/мл активина A+8 нг/мл bFGF в течение еще двух дней (стадия 1), затем
a) DMEM/F12+2% БСА+50 нг/мл FGF7 в течение трех дней (стадия 2), затем
b) DMEM с высоким содержанием глюкозы+1% B27+50 нг/мл FGF7+0,25 мкМ циклопамина-KAAD+2 мкМ ретиноевой кислоты (RA)+100 нг/мл реактива Noggin+20 нг/мл активина A в течение четырех дней (стадия 3), затем
c) DMEM с высоким содержанием глюкозы+1% B27+100 нг/мл Noggin+1 мкМ ингибитора II ALK5 в течение трех дней (стадия 4), или
d) DMEM с высоким содержанием глюкозы+только 1% B27 в течение трех дней (стадия 4).
Указанный выше протокол дифференцировки был разработан для проверки способности клеток, экспрессирующих маркеры, характерные для линии панкреатической энтодермы, которые ко-экспрессируют PDX1 и NKX6.1, но не экспрессируют CDX2 и NGN3, далее дифференцироваться в предшественники панкреатических эндокринных клеток. Предшественники панкреатических эндокринных клеток экспрессируют NGN3.
Простое культивирование клеток, экспрессирующих маркеры, характерные для линии панкреатической энтодермы, которые ко-экспрессируют PDX1, NKX6.1, но не экспрессируют CDX2 и NGN3, в базальной среде (DMEM с высоким содержанием глюкозы+1% B27) не привело к появлению экспрессии NGN3. См. фиг.5, панель a, светло-серые полоски. Подобным образом, также не наблюдалась экспрессия NEUROD, NKX2.2 и PAX6.
Напротив, в клетках, инкубированных в присутствии ингибитора Alk5 II, наблюдалось значительное увеличение экспрессии NGN3. См. фиг.5, панель a, темно-серые полоски. Также наблюдалась повышающая регуляция экспрессии NEUROD, NKX2.2, PAX4 и PAX6, как и рост экспрессии PTF1 альфа. См. фиг.5, панели a и b. Присутствие ингибитора Alk5 II, судя по всему, не влияло на экспрессию PDX1 и NKX6.1. См. фиг.5, панель b.
Рост экспрессии NGN3, обнаруженный методом ПЦР, в присутствии ингибитора Alk5 II также отразился на росте ряда клеток, положительных к присутствию белка NGN3, как показали иммуноцитохимические измерения. См. фиг.6. Анализ изображений показал, что большая часть клеток, экспрессирующих NGN3, экспрессировала также PDX1, но не NKX6.1. Кроме того, большая часть клеток NKX6.1 экспрессировала PDX1. На этой стадии уровень экспрессии эндокринных клеток, судя по экспрессии инсулина и глюкагона, был минимальным. Наши результаты позволяют предположить, что активация TGF-бета пути должна способствовать образованию популяции клеток, ко-экспрессирующих PDX1 и NKX6.1, а последующее ингибирование TGF-бета пути будет дополнительно приводить к дифференцировке энтодермы в эндокринные клетки-предшественники.
Пример 3
Дифференцировка клеток, экспрессирующих маркеры, характерные для линии панкреатической энтодермы, которые ко-экспрессируют PDX1, NKX6.1, но не экспрессируют CDX-2 и NGN3, в панкреатические эндокринные клетки
Этот пример был разработан для проверки способности клеток, экспрессирующих маркеры, характерные для линии панкреатической энтодермы, которые ко-экспрессируют PDX1 и NKX6.1, но не экспрессирует CDX2 и NGN3, далее дифференцироваться в панкреатические эндокринные клетки из предшественников панкреатических эндокринных клеток.
По краткому описанию, клетки линии H1 эмбриональных стволовых клеток человека культивируются на чашках с покрытием MATRIGEL™ (с разбавлением 1:30) и средой RPMI с добавлением 2% БСА, 100 нг/мл активина A, 20 нг/мл WNT-3a, 8 нг/мл bFGF в течение суток с последующей обработкой средой RPMI с добавлением 2% БСА+100 нг/мл активина A+8 нг/мл bFGF в течение еще двух дней (стадия 1), затем
a) DMEM/F12+2% БСА+50 нг/мл FGF7 в течение трех дней (стадия 2), затем
b) DMEM с высоким содержанием глюкозы+1% B27+50 нг/мл FGF7+0,25 мкМ циклопамина-KAAD+2 мкМ ретиноевой кислоты (RA)+100 нг/мл реактива Noggin+20 нг/мл активина A в течение четырех дней (стадия 3), или
c) DMEM с высоким содержанием глюкозы+1% B27+50 нг/мл FGF7+0,25 мкМ циклопамина-KAAD+2 мкМ ретиноевой кислоты (RA)+100 нг/мл реактива Noggin+20 нг/мл активина A в течение четырех дней (стадия 3), затем
d) DMEM с высоким содержанием глюкозы+1% B27+100 нг/мл Noggin+1 мкМ ингибитора II ALK5 в течение трех дней (стадия 4),
e) DMEM с высоким содержанием глюкозы+1% B27+100 нг/мл реактива Noggin+1 мкМ ингибитора II ALK5+бетацеллюлин 20 нг/мл в течение пяти-семи дней (стадия 5).
Экспрессия NGN3 и PAX4 снизилась от максимального уровня на стадии 4, день 3, и достигла нижнего уровня экспрессии на стадии 5, день 7. В течение этого времени экспрессия эндокринных маркеров (например, инсулина и глюкагона) увеличилась. См. фиг.7. Эти данные указывают на то, что клетки, составляющие предмет настоящего изобретения, были способны к образованию панкреатических эндокринных клеток из эндокринных клеток-предшественников.
Наблюдались клетки, экспрессирующие или только инсулин, или только глюкагон, или инсулин и глюкагон одновременно. См. фиг.8 и таблицу 2. Как показал анализ методом поточной цитометрии (FACS) культур на стадии 5, день 7 (таблица 2), приблизительно 60% дифференцированных предшественников панкреатической энтодермы, ко-экспрессировавших PDX1 и NKX6.1, экспрессировали панэндокринный маркер синаптофизин. Доля клеток, экспрессировавших только инсулин, составляла 10,4%, а клеток, экспрессировавших только глюкагон, - 5,1%. Кроме того, 20% клеток экспрессировало и инсулин, и глюкагон. Среди клеток, экспрессировавших инсулин, но не экспрессировавших больше ни одного панкреатического гормона, 60% экспрессировали также NKX6.1 (маркер взрослых бета-клеток). Эти данные позволяют предположить, что более взрослые инсулин-экспрессирующие клетки образовались по методу, составляющему предмет настоящего изобретения.
Пример 4
Имплантация клеток, составляющих предмет настоящего изобретения, STZ-индуцированным мышам с тяжелым комбинированным иммунодефицитом (ТКИН) с врожденным отсутствием естественных клеток-киллеров (Bg)
Клетки линии H1 эмбриональных стволовых клеток человека культивируются на чашках с покрытием MATRIGEL™ (с разбавлением 1:30) и средой RPMI с добавлением 0,2% ЭБС+100 нг/мл активина A+20 нг/мл WNT-3a в течение суток с последующей обработкой средой RPMI с добавлением 0,5% ЭБС+100 нг/мл активина A в течение еще двух дней (стадия 1), затем
a) DMEM/F12+2% ЭБС+50 нг/мл FGF7 в течение трех дней (стадия 2), затем
b) DMEM с высоким содержанием глюкозы+1% B27+0,25 мкМ циклопамина-KAAD+2 мкМ ретиноевой кислоты (RA)+100 нг/мл реактива Noggin+50 нг/мл FGF7+20 нг/мл активина A в течение четырех дней (стадия 3), затем
c) DMEM с высоким содержанием глюкозы+1% B27+100 нг/мл Noggin+1 мкМ ингибитора II ALK5 в течение четырех дней (стадия 4).
ТКИН/Bg самцы мыши возрастом от пяти до шести недель (C.B-Igh-1b/GbmsTac-Prkdcscid-Lystbg N7) были приобретены в компании Taconic Farms. Мышей держали в клетках микроизолятора со свободным доступом к стерилизованной пище и воде. При подготовке к хирургическому вмешательству мышей метили ярлыком на ухе и измеряли вес тела и уровень сахара в крови ручным глюкометром (One Touch, LifeScan).
За две недели до пересадки мышей взвешивали и вводили им 80 мг/кг стрептозотоцина (Sigma), растворенного в ацетатном буфере с pH 4,5, пять дней подряд, чтобы вызвать диабет. Контролировался уровень глюкозы в крови, и только мыши с уровнем глюкозы >300 мг/дл использовались в качестве реципиентов для трансплантации.
Мышам в качестве обезболивающего вводили смесь изофлурана и кислорода, а место хирургического вмешательства брили небольшими ножницами для животных. Мышам вводили 0,1 мг/кг препарата Buprenex подкожно перед операцией. Место хирургической операции подготавливали, промывая несколько раз 70% изопропиловым спиртом и 10% повидон-йодом.
Клетки конца четвертой стадии кратковременно обрабатывались 1 мг/мл диспазы в течение пяти минут, механически набирались 1-мл стеклянной пипеткой и переносились в неадгезивные планшеты для культивирования в течение ночи. Во время дооперационной подготовки мышей клетки центрифугировали в 1,5 мл микроцентрифуге и большую часть супернатанта убирали, оставляя лишь столько, сколько нужно для того, чтобы собрать гранулу клеток. Клетки собирали в пипетку Rainin Pos-D положительного вытеснения и далее пипетку инвертировали, позволяя клеткам осаждаться под действием силы тяжести. Излишек среды убирали и получали упакованный препарат клеток для пересадки.
Для пересадки использовался катетер 24GЧѕ” I.V., позволяющий проникать в капсулу почки, после чего иглу вынимали. Затем катетер вводили под капсулу почки к дистальному полюсу почки. Наконечник пипетки Pos-D устанавливали жестко в соединитель катетера и вводили 5 миллионов клеток из пипетки через катетер под капсулу почки к дистальному полюсу почки. Капсулу почки герметизировали низкотемпературным прижиганием, и далее почку возвращали в исходное анатомическое положение. Параллельно агрегаты клеток, содержащие 5 миллионов клеток, загружались в 50-мкл устройство с помощью наконечника пипетки Post-D. Устройства объемом 50 мкл приобретались в компании TheraCyte, Inc (Ирвин, штат Калифорния). Устройство герметизировали медицинским силиконовым клеем типа A (Dow Corning, № по каталогу 129109) после загрузки и имплантировали подкожно ТКИН/Bg мышам (животные № 3 и 4). Мышцу зашивали непрерывным швом с использованием викрила 5-0 и далее закрывали кожу при помощи зажимов для ран. После операции мышам вводили 1,0 мг/кг препарата Metacam подкожно. Мышей выводили из анестезии и позволяли им полностью поправиться.
После пересадки мышей взвешивали раз в неделю, а уровень глюкозы в крови измеряли дважды в неделю. Через различные интервалы после пересадки забиралась кровь через ретроорбитальное пространство в пипетки для микроцентрифуги с небольшим содержанием гепарина. Кровь центрифугировали и плазму помещали во вторую пипетку для микроцентрифуги и замораживали на сухом льду, после чего хранили при температуре -80ºC до выполнения анализа С-пептида человека. Уровень С-пептида человека определяли с помощью Mercodia/ALPCO Diagnostics Ultrasensitive C-peptide ELISA (№ по каталогу 80-CPTHU-E01, Alpco Diagnostics, штат Нью-Гемпшир) в соответствии с инструкциями изготовителя.
C-пептид человека обнаруживали в сыворотке животных уже через 4 недели в группе капсулы почки после пересадки, и его уровень рос со временем (фиг.9, панель a). По истечении двух месяцев мы смогли обнаружить значительное количество циркулирующего C-пептида человека, 1,1±0,5 нг/мл (фиг.9, панель a). В период до двух месяцев после пересадки уровень глюкозы в крови не натощак неизменно был выше 400 нг/дл. В этом исследовании введения инсулина не требовалось. Рост концентрации в сыворотке вызванного пересадкой инсулина выше 1 нг/мл, приводит к постепенному уменьшению гипергликемии. Через три месяца мы смогли обнаружить значительное количество циркулирующего C-пептида человека у 90% STZ-индуцированных животных с диабетом. Средний уровень циркулирующего C-пептида человека составлял 2±0,96 нг/мл (n=8) (фиг.9, панель a). Уровень глюкозы у 90% мышей с диабетом, привитых эндокринными предшественниками из клеток hES, был ниже 200 мг/дл и не менялся. После того как мы хирургически удалили пересаженный материал, уровень глюкозы в крови увеличился до гипергликемических значений вскоре после удаления имплантата, что позволяет предположить, что пересаженные клетки человека были единственной причиной поддержания нормогликемии у STZ-обработанных мышей (фиг.9, панель b).
Этот пример демонстрирует, что популяция клеток, ко-экспрессирующих PDX1 и NKX6.1, и популяция эндокринных клеток-предшественников, полученных из популяции клеток, ко-экспрессирующих PDX1 и NKX6.1, обладает способностью далее дифференцироваться в инсулин-секретирующие клетки in vivo.
Публикации, цитируемые в данном документе, включаются в него полностью посредством ссылки. Хотя различные аспекты изобретения проиллюстрированы выше ссылками на примеры и предпочтительные осуществления, следует понимать, что область изобретения определяется не приведенным выше описанием, но указанными ниже пунктами, понимаемыми в соответствии с нормами патентного права.
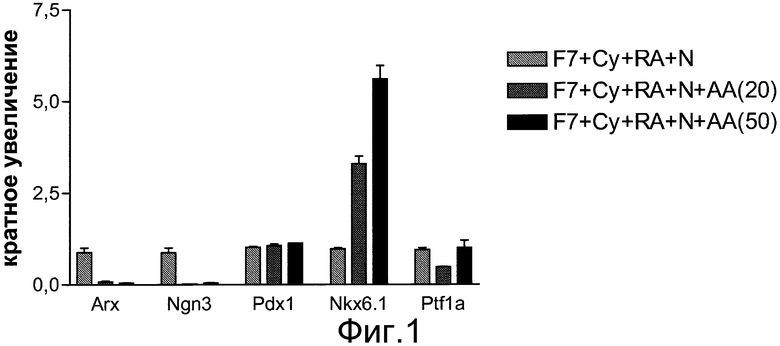
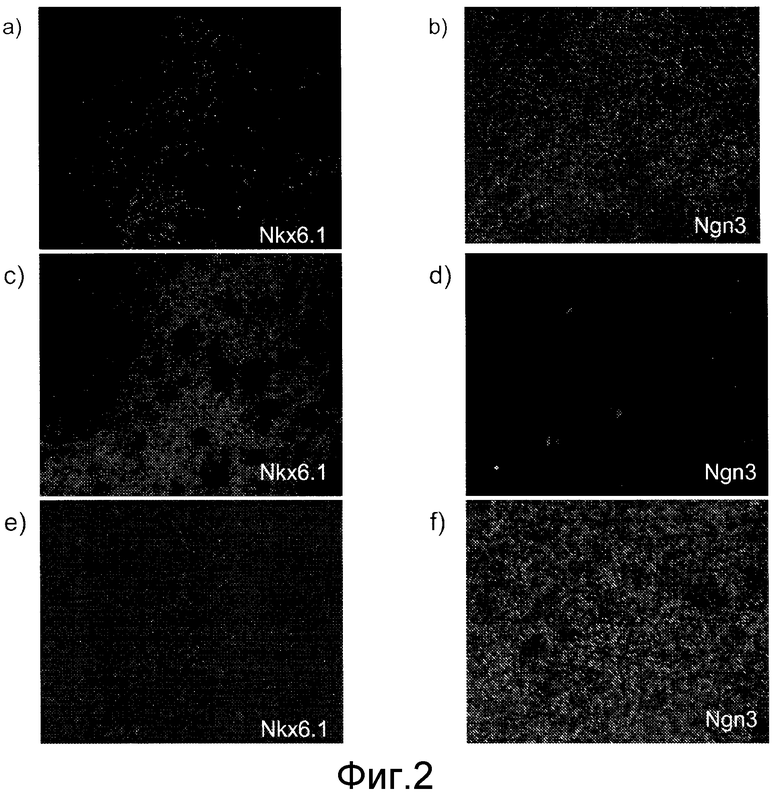

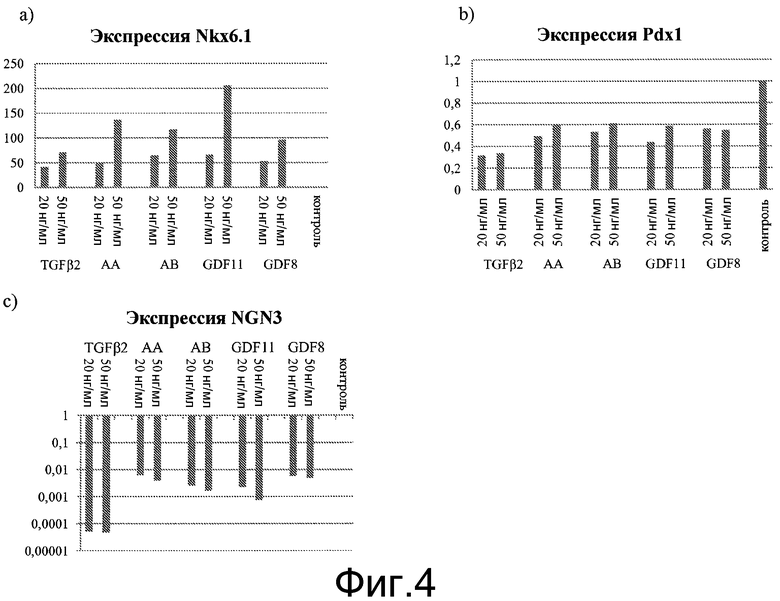
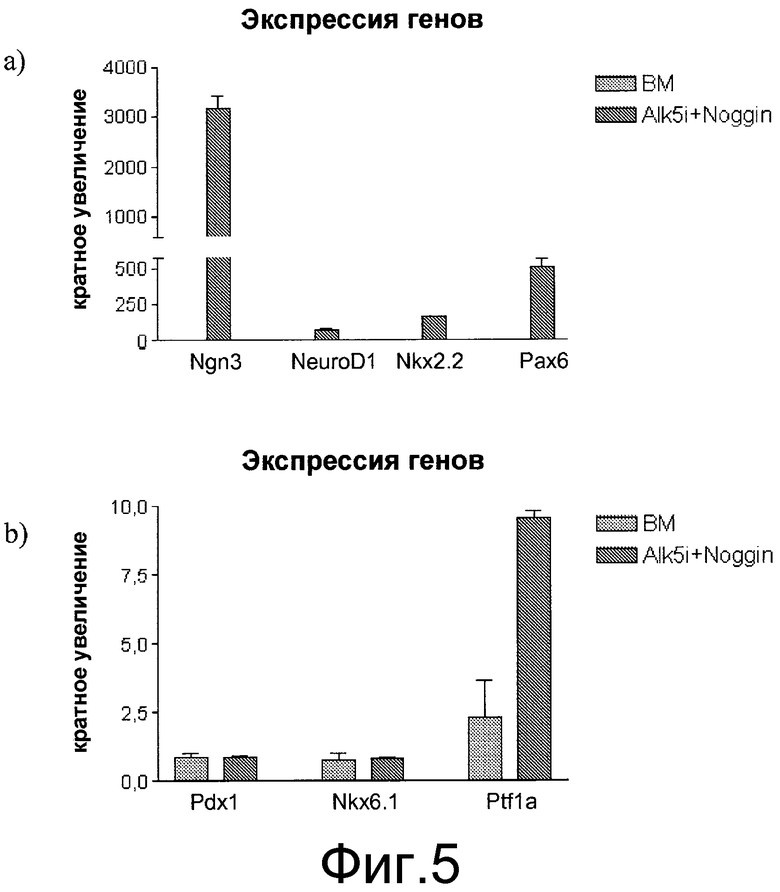

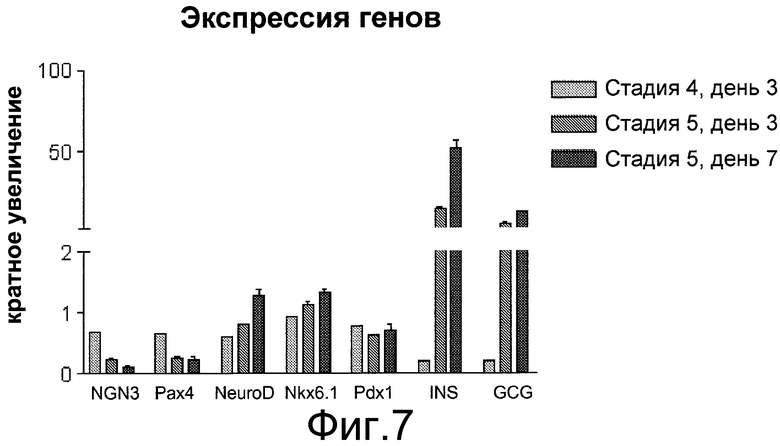
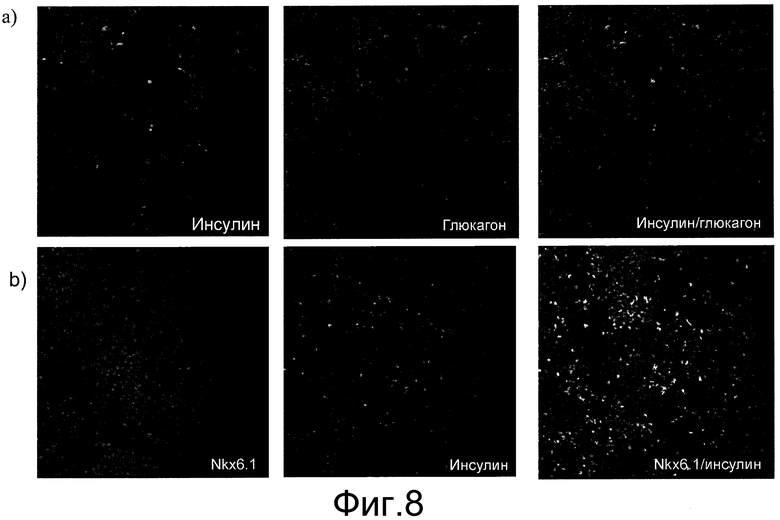
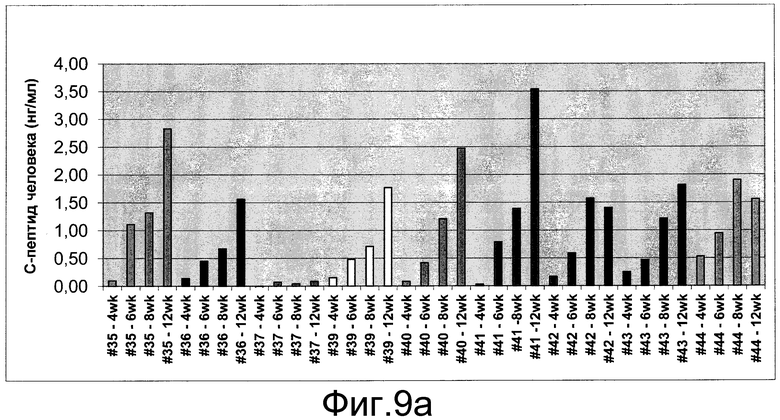
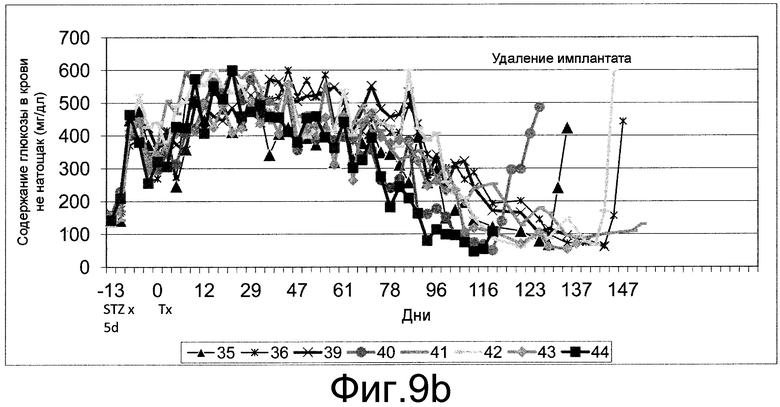
Изобретение относится к области биотехнологии и медицины. Предложен способ дифференцировки популяции полипотентных стволовых клеток, полученных из установленных линий полипотентных стволовых клеток, в популяцию клеток, экспрессирующих маркеры, характерные для линии панкреатической энтодермы, которая ко-экспрессирует PDX1, NKX6.1, но не экспрессирует CDX2 и NGN3. Способ может быть использован для медицинских и биотехнологических целей. 9 ил., 2 табл., 4 пр.
Способ дифференцировки популяции полипотентных стволовых клеток, полученных из установленных линий полипотентных стволовых клеток, в популяцию клеток, экспрессирующих маркеры, характерные для линии панкреатической энтодермы, которая ко-экспрессирует PDX1, NKX6.1, но не экспрессирует CDX2 и NGN3, включающий следующие стадии:
a) культивирование полипотентных стволовых клеток;
b) дифференцировка полипотентных стволовых клеток в клетки, экспрессирующие маркеры, характерные для линии дефинитивной энтодермы;
c) дифференцировка клеток, экспрессирующих маркеры, характерные для линии дефинитивной энтодермы, в клетки, экспрессирующие маркеры, характерные для линии панкреатической энтодермы, которые ко-экспрессируют PDX1, NKX6.1, но не экспрессируют CDX2 и NGN3, посредством обработки клеток, экспрессирующих маркеры, характерные для линии дефинитивной энтодермы, первой средой с добавлением от 50 пг/мл до 50 мкг/мл FGF7 с последующим культивированием клеток во второй среде с добавлением от 50 пг/мл до 50 мкг/мл FGF7, от 500 нг/мл до 500 мкг/мл фактора, способного ингибировать BMP, от 2 нг/мл до 100 нг/мл активина А, от 1 нМ до 1 мМ ретиноевой кислоты, от 0,025 мкМ до 2,5 мкМ ингибитора сигнального пути белка хеджехог и от 2 нг/мл до 100 нг/мл агониста рецептора TGF-β.
| Приспособление для переселения нелетных пчел | 1927 |
|
SU7339A1 |
| Приспособление для соединения концов приводного ремня | 1928 |
|
SU11953A1 |
| РЕКОМБИНАНТНЫЙ ЛЕНТИВИРУСНЫЙ ВЕКТОР, КЛЕТКА-ХОЗЯИН, ТРАНСДУЦИРОВАННАЯ ЛЕНТИВИРУСНЫМ ВЕКТОРОМ, СПОСОБ ЕЕ ТРАНСДУКЦИИ И ПРИМЕНЕНИЕ | 2002 |
|
RU2305708C2 |
| US 20060040387 A1, 23.02.2006 | |||
| ДИФФЕРЕНЦИРОВКА СТРОМАЛЬНЫХ КЛЕТОК, ПОЛУЧЕННЫХ ИЗ ЖИРОВОЙ ТКАНИ, В ЭНДОКРИННЫЕ КЛЕТКИ ПОДЖЕЛУДОЧНОЙ ЖЕЛЕЗЫ И ИХ ИСПОЛЬЗОВАНИЕ | 2002 |
|
RU2351648C2 |
| US 20060281174 A1, 14.12.2006 | |||
| US 20070259421 A1, 08.11.2007 | |||
| US 20030138948 A1, 24.07.2003 | |||
Авторы
Даты
2015-01-27—Публикация
2010-07-19—Подача