Настоящее изобретение относится к новым применениям сульфатных солей N-(3-(4-(3-(диизобутиламино)пропил)пиперазин-1-ил)пропил)-1Н-бензо[d]имидазол-2-амина и их фармацевтически приемлемых сольватов для лечения и/или предупреждения заболеваний двигательных нейронов и нарушений нервно-мышечных соединений.
Предпосылки создания изобретения
Заболевания двигательных нейронов (MND) и нарушения нервно-мышечных соединений (NJD) – те и другие – рассматриваются как нервно-мышечные нарушения, которые ведут к мышечной слабости и усталости, которые со временем становятся более выраженными.
Двигательные нейроны представляют собой нейронные клетки, присутствующие в центральной нервной системе (двигательная кора, ствол головного мозга, спинной мозг ...) и в периферической нервной системе, ответственные за управление такими органами, как мышцы и железы. Двигательные нейроны классифицируются как верхние или нижние двигательные нейроны. Верхние двигательные нейроны (UMN) расположены в коре головного мозга и в стволе головного мозга, они передают сигналы интернейронам и нижним двигательным нейронам (LMN) посредством глутаматергической нейротрансмиссии. LMN расположены в спинном мозге и иннервируют волокна скелетных мышц (нервно-мышечные соединения), где высвобождается ацетилхолин для переноса сигнала через мембрану мышечных клеток, передавая мышце сигнал к сокращению или расслаблению. Как UMN, так и LMN необходимы для произвольных движений, равновесия, регулировки положения тела и управления мышцами в целом.
Прогрессирующая дегенерация двигательных нейронов является отличительной чертой заболеваний двигательных нейронов, она в конечном итоге вызывает апоптоз двигательных нейронов и фасцикуляцию двигательных единиц (единица, определяющая двигательный нейрон - его аксон - нервно-мышечное соединение - отдельные мышечные волокна, которые она иннервирует в целом), препятствуя передаче нервного импульса, управляющего мышцами. Гибель клеточных тел мотонейронов является первичным процессом при МND и происходит в сочетании с отложением агрегированных белков в мотонейронах и олигодендроцитах, а также нейровоспалением. Такие заболевания, которые могут поражать или UMN, или LMN и даже те и другие, вызывают мышечную слабость, гипотонию, замедленность движений, нарушение рефлексов и мышечную атрофию.
Существует множество заболеваний двигательных нейронов, и боковой амиотрофический склероз (ALS) является наиболее распространенным приобретенным заболеванием двигательных нейронов, которое может повлиять на UMN и LMN. Спорадический ALS является наиболее распространенной формой ALS (≥90% случаев), диагностируемой у пациентов, у которых нет известных членов семьи, страдающих таким заболеванием. Семейный ALS имеет генетическое происхождение и протекает в семьях, м несколько генных мутаций идентифицировано и связано с ним. Наиболее распространенная находится в открытой рамке считывания 72 хромосомы 9 (C9ORF72) и может вызывать у пациентов также когнитивные дефекты: ALS-FTD является особой формой ALS, при которой пациенты также страдают от лобно-височной деменции (FTD). Боковой амиотрофический склероз с комплексом паркинсонизма-деменции 1 (ALS-PDC) или болезнь литико-бодига является формой ALS, при которой пациенты испытывают симптомы ALS, деменции и болезни Паркинсона (PD). Другие известные гены, ассоциированные с семейным и спорадическим ALS, включают гены, кодирующие супероксиддисмутазу 1 (SOD1), ДНК-связывающий белок TAR в 43 кДа (TDP-43), РНК-связывающий белок (FUS/TLS: слитый при саркоме/транслоцированный при саркоме) и убиквилин 2 (UBQLN2). Такие мутации могут вызывать токсическое накопление этих белков в двигательных нейронах и астроцитах, что впоследствии ведет к гибели нейронов. Показано, что ДНК-связывающий белок TAR в 43 кДа (TDP-43) накапливается в цитоплазме двигательных нейронов в большинстве случаев ALS. TDP-43 представляет собой ядерный РНК-связывающий белок, участвующий в нескольких аспектах процессинга РНК, который активно перемещается между ядром и цитоплазмой. При ALS TDP-43 исключен из ядра, но такая неправильная цитоплазматическая мислокализация является обычной при повреждении нейронов или стрессе, а TDP-43-позитивные включения могут представлять собой вторичную патологию при заболеваниях двигательных нейронов.
Другие заболевания двигательных нейронов могут поражать или только UMN, такие как первичный боковой склероз (PLS), или только LMN, такие как прогрессирующая мышечная атрофия (PMA). Более того, дегенерация LMN и ALS могут влиять на нервно-мышечное соединение (Dupuis L. et al., Curr. Drug Targets, 2010; 11(10): 1250-1261 - Gromova A. et al., Trends Neurosci., 2020, Sep; 43(9): 709-724 - Hashizume A. et al., J. Neurol. Neurosurg. Psychiatry, 2020, Oct; 91(10): 1085-1091). NJD имеет целью такую критическую область и блокирует нервный импульс, обычно передаваемый к мышце для облегчения движения или ее сокращения. Миастенические синдромы (миастения гравис и синдром Итона-Ламберта) влияют на эффективность синаптической передачи посредством или иммунологических или генетических процессов. При таких патологиях абсолютное число NMJ остается примерно таким же, но их эффективность для запуска потенциала мышечного действия в ответ на стимуляцию двигательных нейронов снижается, что ведет к быстрой утомляемости из-за мышечной слабости (Gilhus NE et al. Curr. Opin. Neurol., 2012, Oct; 25(5): 523-9). Кроме того, признано, что разработка методов лечения для укрепления и стабилизации оставшихся NMJ, общего конечного пути заболеваний с дегенерацией LMN, была бы одинаково полезна для пациентов с ALS, спинальной мышечной атрофией (SMA) и спинально-бульбарной мышечной атрофией (SBMA).
В настоящее время Управление по контролю за продуктами питания и лекарствами США (FDA) и Европейское агентство по лекарственным средствам (EMA) одобрили только один способ лечения для пациентов с ALS. Рилузол представляет собой пероральное лекарственное средство, которое блокирует глутаматергическую нейротрансмиссию в ЦНС. Полагают, что такое действие может происходить частично из-за инактивации вольтаж-зависимых натриевых каналов на глутаматергических нервных окончаниях. Рилузол также блокирует некоторые постсинаптические действия глутаминовой кислоты путем неконкурентной блокады рецепторов N-метил-D-аспартата (NMDA). Кроме того, рилузол не оказывает влияния на двигательные и дыхательные функции и не подходит ни для лечения запущенных форм ALS, ни для лечения других заболеваний двигательных нейронов.
Средство для удаления свободных радикалов эдаварон, вводимое внутривенно, показало эффективность у небольшой подгруппы людей с ALS в 3-й фазе клинического испытания. Исследование показало значительно меньшее снижение пересмотренной оценки по функциональной шкале оценки ALS по сравнению с плацебо. До настоящего времени нет никаких указаний на то, что эдаравон может быть эффективен у более широкой популяции пациентов с ALS, которые не соответствуют критериям (Abe et al., Lancet Neurol., 2017, 16(7), 505-512), и заявка на получение разрешения на маркетинг от EMA для лечения ALS была отозвана.
Не имеется доступного конкретного лечения нарушений нервно-мышечных соединений, кроме кортикостероидов или иммунодепрессантов, которые могут иметь серьезные побочные действия.
Сульфатные соли N-(3-(4-(3-(диизобутиламино)пропил)пиперазин-1-ил)пропил)-1Н-бензо[d]имидазол-2-амина и их сольваты, ранее раскрытые в WO 2014/102339, применимы для лечения и/или предупреждения нейродегенеративных заболеваний, амилоидопатии, тауопатии и заболевания развития. Такие соединения особенно интересны при болезни Альцгеймера, болезни Паркинсона и тауопатиях: в настоящее время проходит фаза 2A клинического испытания с дисульфатной солью N-(3-(4-(3-(диизобутиламино)пропил)пиперазин-1-ил)пропил)-1Н-бензо[d]имидазол-2-амина – лечение пациентов, страдающих прогрессирующим надъядерным параличом (PSP). Такие соли способны модулировать фосфорилирование Taу и повышать уровни нейротрофического фактора програнулина (PGRN), дефицит которого, как известно, ускоряет отложение и фосфорилирование Taу, как показано на мышах, экспрессирующих человеческий tau (J. Neuropathol. Exp. Neurol. 74, 158–165 (2015)). Следовательно, такие соединения особенно применимы для лечения тауопатий, таких как лобно-височная деменция, и поэтому предложены конкретно для лечения ALS-FTD.
Ограниченное количество методов лечения доступно пациентам, страдающим заболеваниями двигательных нейронов или нарушениями нервно-мышечных соединений, и в технике все еще существует потребность в новых химических соединениях, которые можно было бы использовать для лечения или профилактики таких заболеваний, поэтому Заявитель исследовал потенциал применения сульфатных солей N-(3-(4-(3-(диизобутиламино)пропил)пиперазин-1-ил)пропил)-1Н-бензо[d]имидазол-2-амина и их сольватов для такой цели.
Сущность изобретения
Настоящее изобретение основано на неожиданных выводах, что сульфатные соли N-(3-(4-(3-(диизобутиламино)пропил)пиперазин-1-ил)пропил)-1Н-бензо[d]имидазол-2-амина оказывает нейрозащитное действие на двигательные нейроны и нервно-мышечные соединения.
Таким образом, изобретение относится к сульфатным солям N-(3-(4-(3-(диизобутиламино)пропил)пиперазин-1-ил)пропил)-1Н-бензо[d]имидазол-2-амина и их сольватам для применения при лечении и/или предупреждении заболеваний двигательных нейронов и нарушений нервно-мышечных соединений.
Более того, Заявитель показывает, что сульфатные соли N-(3-(4-(3-(диизобутиламино)пропил)пиперазин-1-ил)пропил)-1Н-бензо[d]имидазол-2-амина и их сольваты способны уменьшать аномальную транслокацию TDP43 из ядра к цитоплазме двигательных нейронов – патологическая особенность, наблюдаемая в большинстве случаев ALS.
Подробное описание изобретения
Заявитель показывает, что сульфатные соли N-(3-(4-(3-(диизобутиламино)пропил)пиперазин-1-ил)пропил)-1Н-бензо[d]имидазол-2-амина и их фармацевтически приемлемые сольваты оказывают благотворное воздействие на первичную культуру двигательных нейронов спинного мозга как крыс дикого типа, так и крыс SOD1G93A tg, способствуя их выживанию и целостности сети нейритов после повреждений, вызванных глутаматом. Кроме того, аномальная транслокация TDP-43 из ядра в цитоплазму двигательных нейронов является патологической особенностью, наблюдаемой в большинстве случаев ALS. Результаты, представленные в разделе «Примеры», показывают, что указанные сульфатные соли могут также реверсировать аномальную транслокацию TDP-43 из ядра в цитоплазму при глутаматергическом стрессе.
Более того, сульфатные соли N-(3-(4-(3-(диизобутиламино)пропил)пиперазин-1-ил)пропил)-1Н-бензо[d]имидазол-2-амина и их фармацевтически приемлемые сольваты успешно защищают нервно-мышечные соединения и сеть нейритов от глутаматергического стресса в совместной культуре миобластов и эксплантатов спинного мозга.
Все эти выводы подтверждают, что сульфатные соли N-(3-(4-(3-(диизобутиламино)пропил)пиперазин-1-ил)пропил)-1Н-бензо[d]имидазол-2-аминиа и их фармацевтически приемлемые сольваты могут являться эффективной терапией для улучшения при заболеваниях двигательных нейронов, таких как ALS, SMA и SBMA, а также расстройствах нервно-мышечных соединений, таких как миастения гравис и синдром Итона-Ламберта.
Заболевания двигательных нейронов и нарушения нервно-мышечных соединений включают, но без ограничений, боковой амиотрофический склероз без FTD, первичный боковой склероз (PLS), наследственную спастическую параплегию (HSP), нейролатиризм, Конзо, болезнь Тея-Сакса, болезнь Сандхоффа, прогрессирующую мышечную атрофию (PMA), мономелическую амиотрофию, спинальную мышечную атрофию (SMA), спинально-бульбарную мышечную атрофию (SBMA), прогрессирующий бульбарный паралич (PBP), постполиомиелитический синдром, пострадиационный синдром, синдром скованного человека, нарушения двигательных единиц в результате несчастного случая, миастению гравис и синдром Итона-Ламберта.
Боковой амиотрофический склероз без FTD обозначает формы спорадического или семейного бокового амиотрофического склероза, которые не связаны с лобно-височной деменцией, и включает боковой амиотрофический склероз с комплексом паркинсонизм-деменция 1 (ALS-PDC), семейный боковой амиотрофический склероз, вызванный мутацией одного из генов, кодирующих супероксиддисмутазу 1 (SOD1), ДНК-связывающий белок TAR в 43 кДа (TDP-43), РНК-связывающий белок (FUS/TLS: слитый при саркоме/транслоцированный при саркоме) или убиквилин 2 (UBQLN2). При ALS пациенты с бульбарным началом прогрессируют быстрее, чем пациенты с началом заболевания конечностей или с проявлением LMN. Недавние описания региональных вариантов предполагают, что у некоторых пациентов ALS локализован в одной области позвоночника, включая плечевую амиотрофическую диплегию, амиотрофическую диплегию ног и изолированный бульбарный паралич, которые все в данном случае являются вариантами бокового амиотрофического склероза без FTD. ALS без FTD также включает ALS с респираторным началом, редкий вариант, который составляет примерно 3% всех случаев ALS, при котором начальными симптомами являются затрудненное дыхание при физическом напряжении в состоянии покоя.
Первичный боковой склероз (PLS) представляет собой тип заболевания двигательных нейронов, которое вызывает медленное разрушение нервов в головном мозгу. Это делает нервы неспособными активировать двигательные нейроны в спинном мозгу, которые управляют мышцами.
Наследственная спастическая параплегия (HSP), также известная как семейный спастический парапарез (FSP), вызывается верхними двигательными нейронами, которые медленно дегенерируют, вызывая прогрессирующую спастичность и слабость ног. Это приводит к затруднению ходьбы. По мере продолжения дегенерации симптомы ухудшаются, включая нарушение зрения, атаксию, эпилепсию, когнитивные нарушения, периферическую невропатию и/или глухоту.
Нейролатиризм вызывается токсином, поступающим при потреблении большого количества определенных бобовых рода Lathyrus, содержащих высокие концентрации нейротоксина аналога глутамата β-оксалил-L-α,β-диаминопропионовой кислоты (ODAP). ODAP является ядом митохондрий, приводящим к избыточной гибели клеток, особенно в двигательных нейронах; этот токсин вызывает паралич, характеризующийся отсутствием силы или неспособностью двигать нижними конечностями, и может поражать пирамидные пути, вызывая признаки повреждения верхних двигательных нейронов.
Прогрессирующая мышечная атрофия (РМА), также известная как мышечная атрофия Дюшенна-Арана, клинически характеризуется признаками дисфункции нижних двигательных нейронов и может развиться в ALS. Симптомы РМА включают атрофию, мышечную слабость, отсутствие рефлексов и отсутствие спастичности, симптомы могут быть ограничены руками, ногами или теми и другими.
Мономелическая амиотрофия, также известная как доброкачественная фокальная амиотрофия, ювенильная сегментарная атрофия и болезнь Хираямы, представляет собой редкое доброкачественное заболевание нижних двигательных нейронов, характеризующееся мышечной слабостью и истощением в дистальных отделах верхних конечностей в подростковом возрасте с последующей спонтанной остановкой прогрессирования и стабилизацией симптомов.
Спинальная мышечная атрофия (SМА) является заболеванием, которое лишает людей физической силы, поражая двигательные нервные клетки в спинном мозгу, лишая способности ходить, есть или дышать. SMA вызывается мутацией в гене 1 выживания двигательного нейрона (SMN1). Это является критичным для функционирования нервов, которые управляют мышцами. Без него нервные клетки не могут должным образом функционировать и в конечном итоге погибают, что приводит к изнурительной и иногда фатальной мышечной слабости.
Спинально-бульбарная мышечная атрофия (SBMA), также известная как бульбоспинальная мышечная атрофия и болезнь Кеннеди, представляет собой генетическое заболевание, при котором потеря двигательных нейронов влияет на произвольные движения мышц, в частности лицевых мышц и мышц, участвующих в глотании, а также мышц рук и ног, особенно мышц, ближайших к центру тела.
Прогрессирующий бульбарный паралич (РВР) поражает как верхнюю, так и нижнюю двигательную систему. Такая форма МND часто вызывает трудности с речью или глотанием. Если поражены нижние двигательные нейроны, язык имеет тенденцию к атрофии с видимой фасцикуляцией и сниженной подвижностью. Это приводит скорее к носовому типу речи. Если поражены верхние двигательные нейроны, язык становится спастичным и имеет тенденцию вызывать дизартрию, трудности с механикой речи.
Синдром скованного человека, также известный как расстройство спектра скованности человека, представляет собой неврологическое расстройство, поражающее головной и спинной мозг, вызывающее колебания жесткости туловища и конечностей, болезненные мышечные спазмы, специфическую фобию, преувеличенную реакцию испуга и анкилозирующие деформации, такие как фиксированный поясничный гиперлордоз.
«Расстройства двигательных единиц в результате несчастного случая» при использовании в настоящем описании относятся к расстройствам, при которых двигательные единицы нарушены из-за повреждения нерва после несчастного случая, например, бытового или дорожно-транспортного происшествия.
Миастения гравис представляет собой аутоиммунное расстройство, которое ослабляет передачу ацетилхолина в нервно-мышечном соединении, т.е., антитела, которые атакуют рецепторы ацетилхолина, что приводит к мышечной слабости. Наиболее распространенными симптомами миастении гравис являются слабые, опущенные веки, слабые глазные мышцы, которые вызывают двоение в глазах, и чрезмерная слабость пораженных мышц после их использования.
Синдром Итона-Ламберта представляет собой аутоиммунное заболевание, при котором антитела препятствуют высвобождению рецепторов нейротрансмиттера ацетилхолина в нервно-мышечном соединении. Это вызывает мышечную слабость, которая имеет склонность начинаться в бедре и мышцах бедра, затем обычно распространяется на мышцы плеча, а затем вниз по рукам и ногам к кистям и стопам. Нервы, которые соединяют голову, лицо, глаза, нос, мышцы и уши с мозгом (черепно-мозговые нервы), поражаются последними.
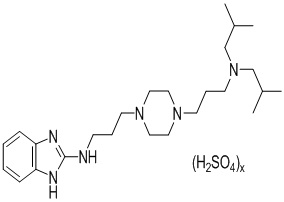
В одном воплощении сульфатные соли N-(3-(4-(3-(диизобутиламино)пропил)пиперазин-1-ил)пропил)-1Н-бензо[d]имидазол-2-амина представляют собой соединения формулы I
 ,
,
где х равен 0,5 – 4, предпочтительно x равен 0,5 – 3,5, предпочтительнее x равен 0– 3.
Другими словами, сульфатная соль N-(3-(4-(3-(диизобутиламино)пропил)пиперазин-1-ил)пропил)-1Н-бензо[d]имидазол-2-амина содержит 0,5 – 4 эквивалента, предпочтительно 0,5 – 3,5 эквивалента, предпочтительнее 0,9 – 3 эквивалента сульфата на одну молекулу N-(3-(4-(3-(диизобутиламино)пропил)пиперазин-1-ил)пропил)-1Н-бензо[d]имидазол-2-амина.
В одном предпочтительном воплощении х равен 1,7 – 2,3, предпочтительно х равен 1,9 – 2,1, предпочтительнее х равен примерно 2 или х равен 2,
В одном особенно предпочтительном воплощении сульфатная соль представляет собой дисульфат N-(3-(4-(3-(диизобутиламино)пропил)пиперазин-1-ил)пропил)-1Н-бензо[d]имидазол-2-амина.
В одном воплощении сульфатная соль формулы I находится в форме фармацевтически приемлемого сольвата, предпочтительно гидрата. Стехиометрия сольвата составляет от 0,5 до 5, предпочтительно от 1 до 4, предпочтительнее от 1,5 до 2,5, еще предпочтительнее от 1 до 2,2, даже предпочтительнее 2 или примерно 2 молекулы сольвата на 1 молекулу соли сульфата формулы I.
Таким образом, сульфатные соли N-(3-(4-(3-(диизобутиламино)пропил)пиперазин-1-ил)пропил)-1Н-бензо[d]имидазол-2-амина и их фармацевтически приемлемые сольваты применимы в качестве лекарственного средства, в частности, для лечения или предупреждения заболеваний двигательных нейронов, нарушений нервно-мышечных соединений и всех заболеваний, при которых наблюдается аномальная транслокация TDP43 из ядра двигательных нейронов в цитоплазму.
Следовательно, изобретение также относится к сульфатной соли N-(3-(4-(3-(диизобутиламино)пропил)пиперазин-1-ил)пропил)-1Н-бензо[d]имидазол-2-амина или ее фармацевтически приемлемым сольватам, определенным в настоящем описании, для применения при лечении и/или предупреждении заболеваний двигательных нейронов и нарушений нервно-мышечных соединений, в частности, выбранных из бокового амиотрофического склероза без FTD, первичного бокового склероза (PLS), наследственной спастической параплегии (HSP), нейролатиризма, Конзо, болезни Тея-Сакса, болезни Сандхоффа, прогрессирующей мышечной атрофии (PMA), мономелической амиотрофии, спинальной мышечной атрофии (SMA), спинально-бульбарной мышечной атрофии (SBMA), прогрессирующего бульбарного паралича (PBP), постполиомиелитического синдрома, пострадиационного синдрома, синдрома скованного человека, нарушений двигательных единиц в результате несчастного случая, миастении гравис, синдрома Итона-Ламберта. Предпочтительно заболевание выбирают из бокового амиотрофического склероза без FTD, первичного бокового склероза (PLS), наследственной спастической параплегии (HSP), прогрессирующей мышечной атрофии (PMA), мономелической амиотрофии, спинальной мышечной атрофии (SMA), спинально-бульбарной мышечной атрофии (SBMA), прогрессирующего бульбарного паралича (PBP), миастении гравис, синдрома Итона-Ламберта, нарушений двигательных единиц в результате несчастного случая. Предпочтительнее заболевание выбирают из бокового амиотрофического склероза без FTD, первичного бокового склероза (PLS), наследственной спастической параплегии (HSP), спинальной мышечной атрофии (SMA), спинально-бульбарной мышечной атрофии (SBMA), прогрессирующего бульбарного паралича (PBP), Даже предпочтительнее заболеванием является боковой амиотрофический склероз без FTD.
Другими словами, изобретение также относится к способу лечения и/или предупреждения заболевания двигательных нейронов или нарушения нервно-мышечных соединений, в частности, перечисленных выше, а также их воплощений, включающему введение пациенту, нуждающемуся в этом, фармацевтически эффективного количества сульфатной соли N-(3-(4-(3-(диизобутиламино)пропил)пиперазин-1-ил)пропил)-1Н-бензо[d]имидазол-2-амина или ее фармацевтически приемлемого сольвата, описанных в настоящем описании. В отдельном воплощении заболевание выбирают из бокового амиотрофического склероза без FTD, первичного бокового склероза (PLS), наследственной спастической параплегии (HSP), спинальной мышечной атрофии (SMA), спинально-бульбарной мышечной атрофии (SBMA), прогрессирующего бульбарного паралича (PBP).
Другими словами, изобретение также относится к применению сульфатной соли N-(3-(4-(3-(диизобутиламино)пропил)пиперазин-1-ил)пропил)-1Н-бензо[d]имидазол-2-амина или ее фармацевтически приемлемого сольвата, описанных в настоящем описании, в производстве лекарственного средства для лечения и/или предупреждения заболевания двигательных нейронов или нарушения нервно-мышечных соединений, в частности, перечисленных выше, а также их воплощений. В отдельном воплощении заболевание выбирают из бокового амиотрофического склероза без FTD, первичного бокового склероза (PLS), наследственной спастической параплегии (HSP), спинальной мышечной атрофии (SMA), спинально-бульбарной мышечной атрофии (SBMA), прогрессирующего бульбарного паралича (PBP).
В отдельном воплощении изобретение также относится к сульфатной соли N-(3-(4-(3-(диизобутиламино)пропил)пиперазин-1-ил)пропил)-1Н-бензо[d]имидазол-2-амина или ее фармацевтически приемлемому сольвату, определенным в настоящем описании, для применения при отсрочке начала у пациента заболеваний двигательных нейронов и нарушений нервно-мышечных соединений, в частности, выбранных из бокового амиотрофического склероза без FTD, первичного бокового склероза (PLS), наследственной спастической параплегии (HSP), нейролатиризма, Конзо, болезни Тея-Сакса, болезни Сандхоффа, прогрессирующей мышечной атрофии (PMA), мономелической амиотрофии, спинальной мышечной атрофии (SMA), спинально-бульбарной мышечной атрофии (SBMA), прогрессирующего бульбарного паралича (PBP), постполиомиелитического синдрома, пострадиационного синдрома, синдрома скованного человека, нарушений двигательных единиц в результате несчастного случая, миастении гравис, синдрома Итона-Ламберта. Предпочтительно заболевание выбирают из бокового амиотрофического склероза без FTD, первичного бокового склероза (PLS), наследственной спастической параплегии (HSP), прогрессирующей мышечной атрофии (PMA), мономелической амиотрофии, спинальной мышечной атрофии (SMA), спинально-бульбарной мышечной атрофии (SBMA), прогрессирующего бульбарного паралича (PBP), миастении гравис, синдрома Итона-Ламберта, нарушений двигательных единиц в результате несчастного случая. Предпочтительнее заболевание выбирают из бокового амиотрофического склероза без FTD, первичного бокового склероза (PLS), наследственной спастической параплегии (HSP), спинальной мышечной атрофии (SMA), спинально-бульбарной мышечной атрофии (SBMA), прогрессирующего бульбарного паралича (PBP), Даже предпочтительнее, заболеванием является боковой амиотрофический склероз без FTD.
Другими словами, изобретение относится к способу отсрочки у пациента начала заболеваний двигательных нейронов или нарушений нервно-мышечных соединений, в частности, перечисленных выше, а также их воплощений, включающему введение пациенту, нуждающемуся в этом, фармацевтически эффективного количества сульфатной соли N-(3-(4-(3-(диизобутиламино)пропил)пиперазин-1-ил)пропил)-1Н-бензо[d]имидазол-2-амина или ее фармацевтически приемлемого сольвата. В отдельном воплощении заболевание выбирают из бокового амиотрофического склероза без FTD, первичного бокового склероза (PLS), наследственной спастической параплегии (HSP), спинальной мышечной атрофии (SMA), спинально-бульбарной мышечной атрофии (SBMA), прогрессирующего бульбарного паралича (PBP).
Другими словами, изобретение также относится к применению сульфатной соли N-(3-(4-(3-(диизобутиламино)пропил)пиперазин-1-ил)пропил)-1Н-бензо[d]имидазол-2-амина или ее фармацевтически приемлемого сольвата, описанных в настоящем описании, при производстве лекарственного средства для отсрочки у пациента начала заболевания двигательных нейронов или нарушения нервно-мышечных соединений, в частности, из перечисленных выше, а также их воплощений. В отдельном воплощении заболевание выбирают из бокового амиотрофического склероза без FTD, первичного бокового склероза (PLS), наследственной спастической параплегии (HSP), спинальной мышечной атрофии (SMA), спинально-бульбарной мышечной атрофии (SBMA), прогрессирующего бульбарного паралича (PBP).
Согласно другому отличительному признаку изобретение относится к способу уменьшения аномальной транслокации TPD43 из ядра двигательных нейронов в цитоплазму у пациента, предпочтительно теплокровного животного и даже предпочтительнее у человека, нуждающегося в таком лечении, который включает введение указанному пациенту фармацевтически эффективного количества сульфатной соли N-(3-(4-(3-(диизобутиламино)пропил)пиперазин-1-ил)пропил)-1Н-бензо[d]имидазол-2-амина или ее фармацевтически приемлемого сольвата.
Согласно одному воплощению, сульфатные соли N-(3-(4-(3-(диизобутиламино)пропил)пиперазин-1-ил)пропил)-1Н-бензо[d]имидазол-2-амина, а также их фармацевтически приемлемые сольваты можно вводить как часть комбинированной терапии. Таким образом, в объем настоящего изобретения включается совместное введение композиций и лекарственных средств, которые содержат в качестве активного соединения, кроме сульфатной соли N-(3-(4-(3-(диизобутиламино)пропил)пиперазин-1-ил)пропил)-1Н-бензо[d]имидазол-2-амина или его фармацевтически приемлемого сольвата, другие терапевтические агенты и/или активные ингредиенты. Такие схемы введения нескольких лекарственных средств, обычно называемые «комбинированной терапией», можно использовать при лечении и/или предупреждении любого заболевания двигательных нейронов и/или нарушения нервно-мышечного соединения. Применение таких комбинаций терапевтических агентов особенно уместно в отношении лечения вышеуказанных заболеваний двигательных нейронов у пациента, нуждающегося в лечении, или человека, рискующего стать таким пациентом.
Кроме требования терапевтической эффективности, что может потребовать применения активных агентов в дополнение к сульфатным солям N-(3-(4-(3-(диизобутиламино)пропил)пиперазин-1-ил)пропил)-1Н-бензо[d]имидазол-2-амина или их фармацевтически приемлемым сольватам, могут быть дополнительные обоснования, которые вынуждают или настоятельно рекомендуют использование комбинаций лекарственных средств, включающих активные ингредиенты, которые представляют собой дополнительную терапию, т.е., которые дополняют функцию, выполняемую сульфатными солями N-(3-(4-(3-(диизобутиламино)пропил)пиперазин-1-ил)пропил)-1Н-бензо[d]имидазол-2-амина или их фармацевтически приемлемыми сольватами. Подходящие дополнительные терапевтические средства, применяемые с целью вспомогательного лечения, включают лекарственные средства, которые вместо непосредственного лечения и/или предупреждения заболевания или состояния, опосредуемого или связанного с дегенерацией двигательных нейронов, дегенерацией нервно-мышечных соединений и/или патологическим накоплением TDP-43 в цитоплазме двигательных нейронов, лечат заболевания или состояния, которые непосредственно вытекают из или косвенно сопровождают указанные дегенерации.
Согласно другому отличительному признаку настоящего изобретения, в комбинированной терапии сукцинатную соль N-(3-(4-(3-(диизобутиламино)пропил)пиперазин-1-ил)пропил)-1Н-бензо[d]имидазол-2-амина, ее фармацевтически приемлемый сольват можно использовать с другими лекарствами, используемыми для лечения заболеваний двигательных нейронов, таких как ALS, SMA, SBMA, и нарушений нервно-мышечных соединений, таких как миастения гравис и синдром Итона-Ламберта. Конкретнее, соединение формулы I, а также его фармацевтически приемлемые сольваты можно использовать в качестве дополнительной терапии в комбинации с рилузолом, эдавароном, пиридостигмином, ингибиторами разложения глюкозилцерамида, такими как амброксол и эпоксид кондуритола В, индукторами высвобождения ацетилхолина, такими как гуанидин, кортикостероидами, такими как преднизолон, противосудорожными лекарствами, такими как карбамазепин и фенитоин, или лекарствами, которые в настоящее время проходят клинические испытания для лечения ALS, как описано в Van Eijk et al., Current opinion in neurology, 2020, 33(5), 655.
Таким образом, в способах лечения и фармацевтических композициях по настоящему изобретению N-(3-(4-(3-(диизобутиламино)пропил)пиперазин-1-ил)пропил)-1Н-бензо[d]имидазол-2-амин или его фармацевтически приемлемый сольват можно использовать в монотерапии заболеваний двигательных нейронов и нарушений нервно-мышечных соединений. Однако указанные способы и композиции также можно использовать для множественной терапии, в которой одно или несколько соединений N-(3-(4-(3-(диизобутиламино)пропил)пиперазин-1-ил)пропил)-1Н-бензо[d]имидазол-2-амина или его фармацевтически приемлемых солей или сольватов вводят в комбинации совместно с одним или несколькими другими терапевтическими агентами.
В вышеописанном воплощении комбинации N-(3-(4-(3-(диизобутиламино)пропил)пиперазин-1-ил)пропил)-1Н-бензо[d]имидазол-2-амина или его фармацевтически приемлемых солей или сольватов с другими терапевтически активными агентами можно вводить, с точки зрения лекарственных форм, или по отдельности или в сочетании друг с другом и, с точки зрения времени их введения, или с периодами или одновременно. Таким образом, введение одного составляющего агента может происходить до, одновременно или последовательно с введением другого(их) составляющего(их) агента(ов).
Как правило, для фармацевтического применения сульфатные соли N-(3-(4-(3-(диизобутиламино)пропил)пиперазин-1-ил)пропил)-1Н-бензо[d]имидазол-2-амина или их фармацевтически приемлемые сольваты можно получить в виде фармацевтической композиции, включающей по меньшей мере по меньшей мере одну сульфатную соль N-(3-(4-(3-(диизобутиламино)пропил)пиперазин-1-ил)пропил)-1Н-бензо[d]имидазол-2-амина или ее фармацевтически приемлемый сольват и по меньшей мере один фармацевтически приемлемый носитель, разбавитель, эксципиент и/или адъювант, и необязательно одно или несколько дополнительных терапевтических агентов и/или активных ингредиентов.
Как неограничивающие примеры, фармацевтическая композиция может находиться в лекарственной форме, подходящей для перорального введения, для парентерального введения (такого как внутривенная, внутримышечная или подкожная инъекция или внутривенная инфузия), для местного применения, для введения путем ингаляции, с помощью кожного пластыря, имплантата, суппозитория и т.д.. Такие подходящие для введения формы – которые могут являться твердыми, полутвердыми или жидкими, в зависимости от способа введения, – а также способы и носители, разбавители и эксципиенты для использования при их получении будут ясны для специалиста; дается ссылка на последнее издание Remington’s Pharmaceutical Sciences. Фармацевтические композиции можно получить в твердой форме и повторно растворить или суспендировать перед применением.
Некоторые предпочтительные, но неограничивающие примеры лекарственных форм включают таблетки, пилюли, порошки, пастилки, саше, кашицы, эликсиры, суспензии, эмульсии, растворы, сиропы, аэрозоли, мази, кремы, лосьоны, мягкие и твердые желатиновые капсулы, суппозитории, капли, стерильные растворы для инъекций и стерильные упакованные порошки (которые обычно восстанавливают перед применением) для введения в виде болюса и/или для непрерывного введения, которые можно получить с использованием носителей, эксципиентов и разбавителей, которые per se подходят для таких препаратов, таких как лактоза, декстроза, сахароза, сорбит, маннит, крахмалы, агар, аравийская камедь, фосфат кальция, альгинаты, трагакант, желатин, силикат кальция, микрокристаллическая целлюлоза, поливинилпирролидон, полиэтиленгликоль, целлюлоза, (стерильная) вода, метилцеллюлоза, метил- и пропилгидроксибензоаты, тальк, стеарат магния, пищевые масла, растительные масла и минеральные масла или их подходящие смеси. Фармацевтические композиции могут необязательно содержать другие вещества, которые обычно используются в фармацевтических препаратах, такие как лубриканты, смачиватели, эмульгаторы и суспендирующие агенты, диспергирующие агенты, разрыхлители, стабилизаторы, агенты для придания изотоничности, агенты для придания объема, наполнители, консерванты, подсластители, корригенты, отдушки, красители, антибактериальные средства и/или противогрибковые средства, такие как парабены, хлорбутанол, фенол, сорбиновая кислота, дозирующие средства, регуляторы расхода, способствующие высвобождению агенты и т.д. Композиции также могут быть составлены таким образом, чтобы обеспечивать быстрое, длительное или отсроченное высвобождение активного соединения(ий), содержащегося(ихся) в них.
Фармацевтические композиции по изобретению предпочтительно находятся в стандартной лекарственной форме и могут быть соответствующим образом упакованы, например, в коробку, блистер, флакон, пузырек, саше, ампулу или в любой другой подходящий контейнер для однократной или многодозовой упаковки (который может быть надлежащим образом маркирован); необязательно с одной или несколькими листовками, содержащими информацию о продукте и/или инструкции по применению. Как правило, такие стандартные дозы будут содержать от 0,05 до 1000 мг и обычно от 1 до 500 мг по меньшей мере одного соединения по изобретению, например, примерно 10, 25, 50, 100, 200, 300 или 400 мг на стандартную дозу.
Обычно, в зависимости от состояния, подлежащего профилактике или лечению, и способа введения, активное соединение по изобретению обычно вводят от 0,01 до 100 мг на килограмм, чаще от 0,1 до 50 мг, например, от 1 до 25 мг, например, примерно 0,5, 1, 2, 5, 10, 15, 20 или 25 мг на килограмм массы тела пациента в день, которые можно вводить в виде однократной суточной дозы, в виде разделенной на одну или более суточных доз, или по существу непрерывно, например, с использованием капельной инфузии.
Все ссылки на соединения формулы I включают ссылки на сольваты, в частности гидраты, их многокомпонентные комплексы и жидкие кристаллы.
Соединения, раскрытые в настоящей заявке, названы с использованием ChemDraw® Ultra, версия 11.0 (CambridgeSoft, Cambridge, MA, USA).
Свободное основание N-(3-(4-(3-(диизобутиламино)пропил)пиперазин-1-ил)пропил)-1Н-бензо[d]имидазол-2-амин можно получить так, как описано в WO 2006/051489, его сульфатные соли и их сольваты получают в соответствии с процедурами, описанными в WO 2014/102339.
Определения
Приведенные ниже определения и пояснения относятся к терминам, используемым во всей заявке, включая как описание и фигуры, так и формулу изобретения.
Термин «введение» или его вариант (например, «вводимое») означает предоставление активного агента или активного ингредиента (например, N-(3-(4-(3-(диизобутиламино)пропил)пиперазин-1-ил)пропил)-1Н-бензо[d]имидазол-2-амина), отдельно или как части фармацевтически приемлемой композиции, пациенту, у которого/которой необходимо лечить или предупреждать состояние, симптом или заболевание.
Термин «человек» относится к субъекту обоих полов и на любой стадии развития (т.е. новорожденному, младенцу, подростку, юноше, взрослому).
Термин «пациент» относится к теплокровному животному, предпочтительнее к человеку, которое/который ожидает получения или получает медицинскую помощь или является/будет объектом медицинской процедуры.
Под «фармацевтически приемлемым» подразумевается, что ингредиенты фармацевтической композиции совместимы друг с другом и не наносят вреда пациенту, которому ее назначают.
Термины «предупреждать», «предупреждающий» и «предупреждение», используемые в настоящей заявке, относятся к способу отсрочки или исключения наступления состояния или заболевания и/или сопутствующих симптомов, недопущения приобретения пациентом состояния или заболевания или снижения риска приобретения пациентом состояния или заболевания.
Выражение «уменьшение», используемое в настоящей заявке, относится к частичному уменьшению или полному уменьшению.
Термин «сольват» используется в настоящем описании для описания соединения в данном изобретении, которое содержит стехиометрические или субстехиометрические количества одной или нескольких молекул фармацевтически приемлемого растворителя, такого как этанол. Термин «гидрат» используется, когда указанным растворителем является вода. Молекулы фармацевтически приемлемого растворителя могут совместно кристаллизоваться с соединением по изобретению и/или присутствовать в его твердых кристаллической и/или аморфной фазах и/или адсорбироваться в них.
Термин «терапевтически эффективное количество» (или проще «эффективное количество»), используемый в настоящей заявке, означает количество активного агента или активного ингредиента (например, N-(3-(4-(3-(диизобутиламино)пропил)пиперазин-1-ил)пропил)-1Н-бензо[d]имидазол-2-амина), которое является достаточным для достижения желательного терапевтического или профилактического эффекта у пациента, которому/кому его вводят.
Термины «лечить», «лечащий» и «лечение», используемые в настоящей заявке, включают облегчение, ослабление или аннулирование состояния или заболевания и/или сопутствующих им симптомов.
Настоящее изобретение будет лучше понято с обращением к следующим далее примерам. Эти примеры предназначены для представления конкретных воплощений изобретения и не предназначены для ограничения объема изобретения.
Краткое описание чертежей
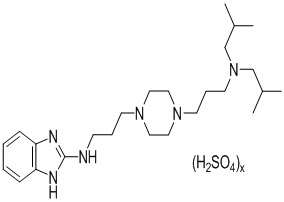
Фиг. 1 показывает влияние инкубации дисульфата N-(3-(4-(3-(диизобутиламино)пропил)пиперазин-1-ил)пропил)-1Н-бензо[d]имидазол-2-амина в течение 48 час после 20 мин повреждения глутаматом в первичной культуре двигательных нейронов спинного мозга крысы на выживаемость (А), сеть нейритов (В) и на внеядерный TDP-43 (eTDP43) (С) MAP-2 положительных МНС. Результаты выражены в процентах от контроля как среднее значение ± SEM (n=5-6/группа). Односторонний ANOVA с последующим тестом PLSD Фишера.
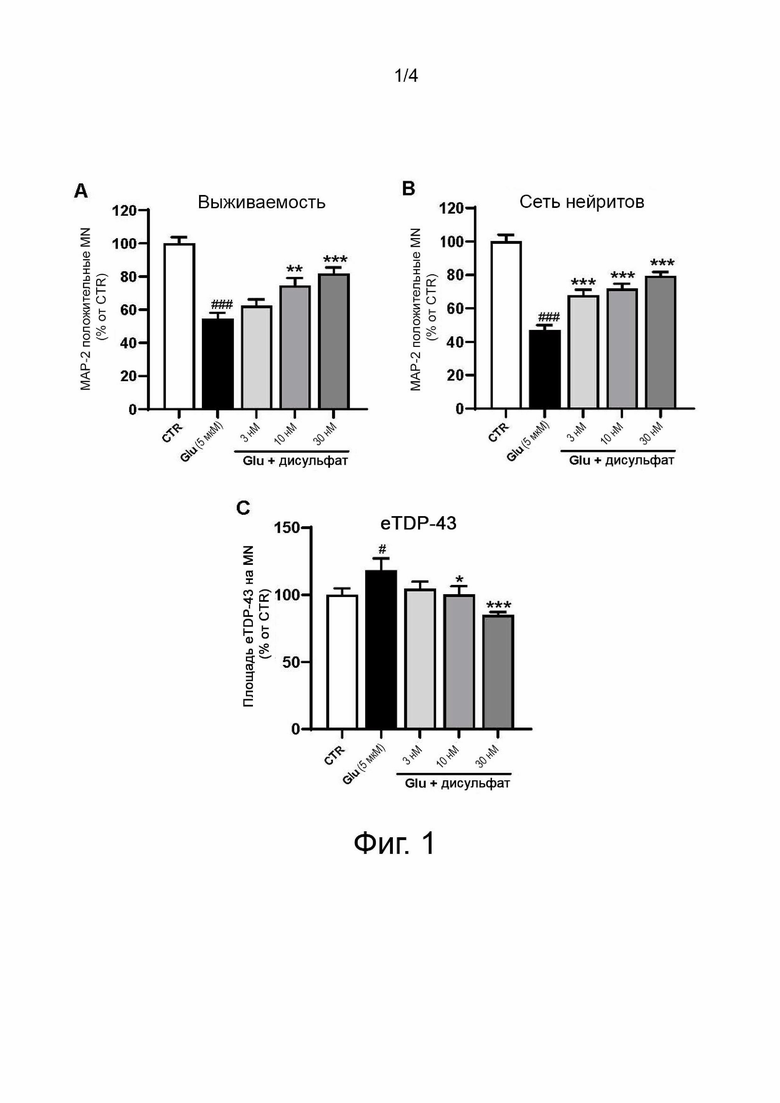
Фиг. 2 показывает влияние 24-часовой предварительной инкубации дисульфата N-(3-(4-(3-(диизобутиламино)пропил)пиперазин-1-ил)пропил)-1Н-бензо[d]имидазол-2-амин) до 20-мин повреждения глутаматом плюс 24-час инкубация после травмы на выживаемость (A), сеть нейритов (B) и на внеядерный TDP-43 (eTDP43) (C) MAP-2 положительных МНС. Результаты выражены в процентах от контроля как среднее значение ± SEM (n=5-6/группа). Односторонний ANOVA с последующим тестом PLSD Фишера.
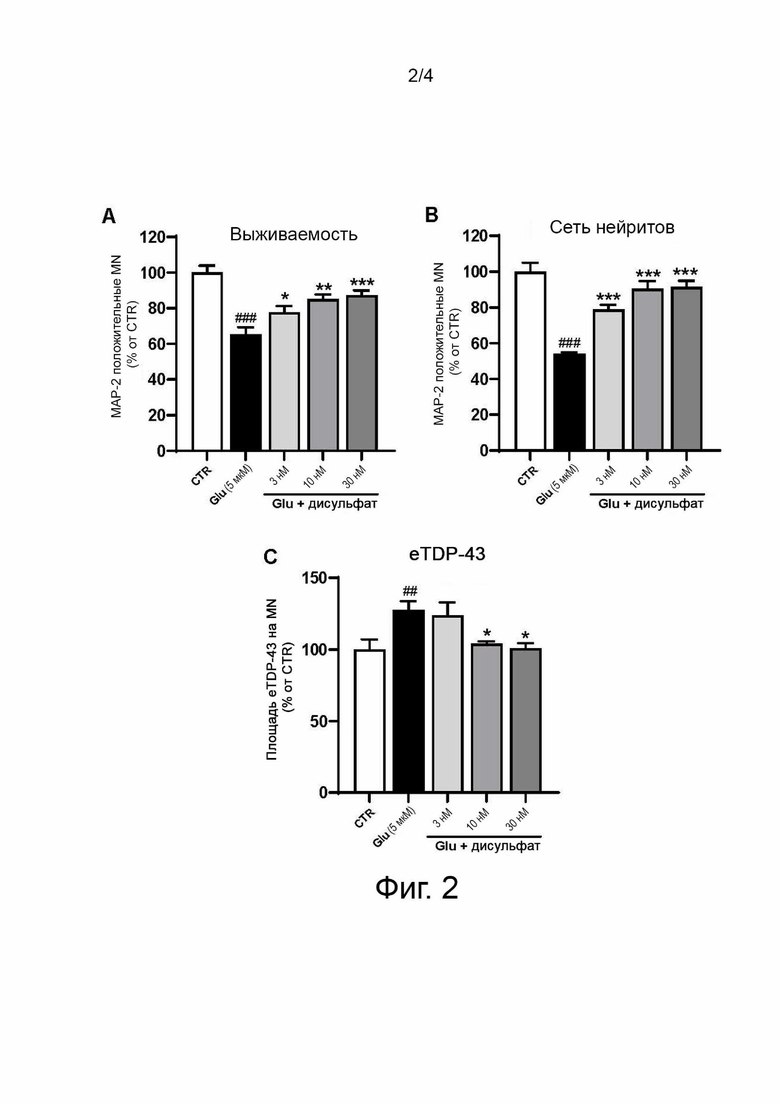
Фиг. 3 показывает влияние дисульфата N-(3-(4-(3-(диизобутиламино)пропил)пиперазин-1-ил)пропил)-1Н-бензо[d]имидазол-2-амина по сравнению с рилузолом (Ril) и эдавароном (Eda) в первичной культуре SOD1G93A Tg двигательных нейронов спинного мозга крысы, поврежденные глутаматом. (A) Число нейронов (A), целостность сети нейритов (B) и транслокация TDP43 (C). Результаты выражены в процентах от контроля как среднее значение +/- SEM (n = 4-6). Односторонний ANOVA с последующим тестом PLSD Фишера.
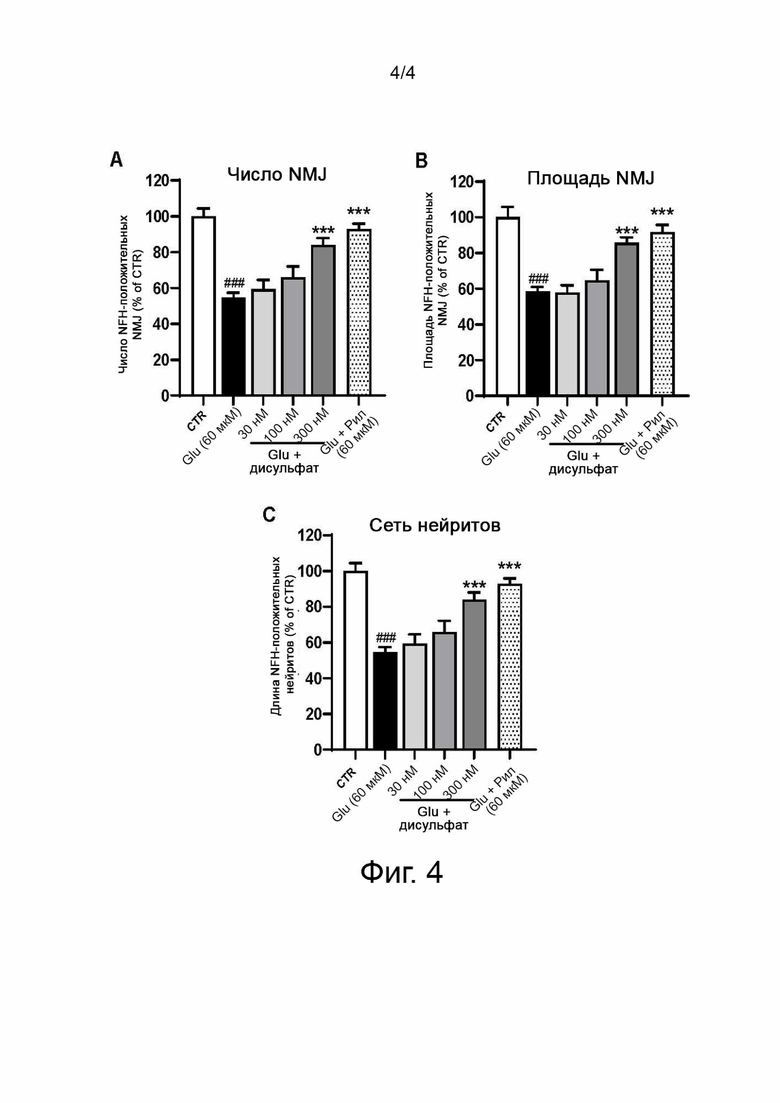
Фиг. 4 показывает влияние дисульфата N-(3-(4-(3-( диизобутиламино)пропил)пиперазин-1-ил)пропил)-1Н-бензо[d]имидазол-2-амина по сравнению с рилузоном (Ril) в совместной культуре эксплантата и миобластов спинного мозга, поврежденных глутаматом: (А) число NMJ, (В) размер NMJ и (С) сеть нейритов NFH (+) MN. Результаты выражены в процентах от контроля как среднее значение +/- SEM (n = 4-6). Односторонний ANOVA с последующим тестом PLSD Фишера.
Биологические примеры
Пример 1. Влияние дисульфата N-(3-(4-(3-(диизобутиламино)пропил)пиперазин-1-ил)пропил)-1Н-бензо[d]имидазол-2-амина на первичные двигательные нейроны крысы, поврежденные глутаматом
Культивирование первичных двигательных нейронов
Двигательные нейроны крыс (MN) культивируют как описано ранее в Martinou et al., Neuron., 1992, Apr; 8(4), 737-44, и Wang et al. Hum. Mol. Genet., 2013 Dec 1; 22(23), 4706-19. Беременных самок крыс с 14-дневным сроком беременности (Rats Wistar; Janvier Labs France) умерщвляют с использованием глубокой анестезии CO2 с последующим смещением шейных позвонков. Затем из матки извлекают плоды и немедленно помещают в охлажденную на льду среду Лейбовица L15 с 2% пенициллина (10000 Е/мл) и раствором стрептомицина (10 мг/мл) (PS) и 1% бычьего сывороточного альбумина (BSA). Спинной мозг обрабатывают в течение 20 мин при 37°C раствором трипсин-этилендиаминтетрауксусная кислота (ЭДТК) в конечной концентрации 0,05% трипсина и 0,02% ЭДТК. Диссоциацию останавливают добавлением модифицированной по способу Дульбекко среды Игла (DMEM) с 4,5 г/л глюкозы, содержащей ДНКазу I II степени (конечная концентрация 0,5 мг/мл) и 10% фетальной телячьей сыворотки (FCS). Клетки механически диссоциируют тремя принудительными проходами через кончик 10-мм пипетки. Затем клетки центрифугируют при 180 × g в течение 10 мин при +4°C на слое BSA (3,5%) в среде L15. Супернатант отбрасывают, и осадок ресуспендируют в определенной питательной среде, состоящей из нейробазальной среды с 2% раствором добавки B27, 2 ммоль/литр L-глутамина, 2% раствора PS и 10 нг/мл нейротрофического фактора головного мозга (BDNF). Жизнеспособные клетки подсчитывают на цитометре Нойбауэра с использованием теста исключения трипанового синего. Клетки высевают при плотности 20000 на лунку в 96-луночные планшеты (иммуноокрашивание), предварительно покрытые поли-L-лизином, и культивируют при 37°C в инкубаторе воздух (95%) - CO2 (5%). Среду меняют каждые 2 дня. Двигательные нейроны после 13 дней культивирования повреждены глутаматом.
Обработка соединениями
На день 13 культивирования добавляют глутамат до конечной концентрации 5 мкМ, разведенный в контрольной среде в присутствии соли сульфата, в течение 20 мин. Через 20 мин глутамат промывают и добавляют свежую питательную среду с солью сульфатом в течение 48 часов.
Оценка конечных точек – 48-час совместная инкубация
После 14 или 15 дней культивирования (48 час после повреждения глутаматом) собирают супернатант клеточной культуры и фиксируют МНС спинного мозга холодным раствором из этанола (95%) и уксусной кислоты (5%) в течение 5 мин при -20°C. После просачивания 0,1% сапонина клетки блокируют в течение 2 час PBS, содержащим 1% фетальной телячьей сыворотки. Затем клетки инкубируют с указанными ниже антителами.
а) Мышиное моноклональное антитело к ассоциированному с антимикротрубочками белку 2 (MAP-2), разведение 1/400 в PBS, содержащем 1% фетальной телячьей сыворотки и 0,1% сапонина. Такое антитело специфически связывает MAP-2, присутствующий в клеточных телах и нейритах всех МN. Это антитело обнаруживают с помощью Alexa Fluor 488 - Goat Anti-Mouse IgG. Ядра нейронов помечают флуоресцентным маркером (раствор Hoechst).
б) Кроличье поликлональное антитело против TDP43 в разведении 1/100 в PBS, содержащем 1% фетальной телячьей сыворотки и 0,1% сапонина. Исследуют цитоплазматическую локализацию TDP43. Это антитело выявляют с помощью Alexa Fluor 568 - Goat Anti-Rabbit IgG.
Для каждого условия автоматически делается по 30 снимков на лунку (представляющих 90% площади лунки) с использованием ImageXpress (Molecular Devices) с увеличением 20х. Все изображения получают в одинаковых условиях (время экспозиции, усиление и интенсивность лазера). Анализ различных конечных точек выполняется автоматически с помощью редактора пользовательских модулей (Molecular Devices). Двигательные нейроны (MAP-2) отличают от интернейронов (окрашивание MAP-2), используя следующие морфологические критерии: диаметр тела клетки >15 мм и наличие минимум трех нейритных отростков (Ferraiuolo et al. Brain, 2011: 134; 2627-2641).
Конечными точками являются
- выживаемость MN (число MN),
- полный нейритный отросток MN (выражается в мкм),
- TDP43 (внеядерный, eTDP43) в MN (выражается как площадь eTDP43-мкм2/число MN).
Статистический анализ
Все величины выражаются как среднее +/- SEM. Статистический анализ проводят с помощью одностороннего ANOVA с последующим тестом PLSD Фишера. Neuro-Sys выполняет графики и статистический анализ различных состояний, используя программное обеспечение GraphPad Prism, версия 7.04. *p<0,05 считается значимым.
Результаты
• Выживаемость двигательных нейронов: как и ожидалось, интоксикация глутаматом значительно снижает выживаемость клеток по сравнению с контрольной группой (средняя выживаемость 55%; фиг. 1А). Низкие дозы дисульфата N-(3-(4-(3-(диизобутиламино)пропил)пиперазин-1-ил)пропил)-1Н-бензо[d]имидазол-2-амина (10 нМ – 30 нМ) показывают положительное и значительное влияние на выживаемость по сравнению с состоянием с глутаматом. Максимальный эффект получают при дозе 30 нМ (средняя выживаемость 82%).
• Целостность сети нейритов: глутамат значительно уменьшает сеть нейритов (фиг. 1B). Все исследованные дозы применяемого дисульфата N-(3-(4-(3-(диизобутиламино)пропил)пиперазин-1-ил)пропил)-1Н-бензо[d]имидазол-2-амина позволяют улучшить сеть нейритов после повреждения глутаматом с максимальным эффектом при 30 нМ (средняя длина 80%).
• Внеядерный TDP-43: применение глутамата значительно усиливает аномальный цитоплазматический сигнал TDP-43 (фиг. 1C). Дисульфатная соль в концентрациях 10 и 30 нМ способна предотвращать накопление TDP-43 в цитоплазме.
Пример 2. Влияние предварительной обработки дисульфатом N-(3-(4-(3-(диизобутиламино)пропил)пиперазин-1-ил)пропил)-1Н-бензо[d]имидазол-2-амина на первичные двигательные нейроны крысы, поврежденные глутаматом, по схеме 24-час предварительная обработка – повреждение – 24-час обработка
Культивирование первичных двигательных нейронов
Культивирование выполняют так, как описано в примере 1.
Обработка соединениями – 24-час предварительная инкубация + 24-час совместная инкубация
В день 12 культивирования первичные двигательные нейроны обрабатывают солью сульфатом в течение 24 часов. В день 13 культивирования добавляют глутамат в конечной концентрации 5 мкМ, разведенный в контрольной среде в присутствии сульфата, в течение 20 мин. Через 20 мин глутамат промывают, и добавляют свежую питательную среду с сульфатной солью еще в течение 24 часов.
Оценка конечной точки
Оценку конечной точки выполняют так, как описано в примере 1.
Статистический анализ
Статистический анализ выполняют так, как описано в примере 1.
Результаты
• Выживаемость двигательных нейронов: как и ожидалось, глутамат значительно снижает выживаемость клеток по сравнению с контрольной группой (средняя выживаемость 65%; фиг. 2А). Низкие дозы сульфатной соли (3 нМ – 30 нМ) показывают положительное и значительное влияние на выживаемость по сравнению с состоянием с глутаматом. Максимальный эффект получают при дозе сульфатной соли 30 нМ (средняя выживаемость 87%).
• Целостность сети нейритов: глутамат сильно нарушает сеть нейритов двигательных нейронов спинного мозга (фиг. 1B). Все исследованные дозы сульфатной соли способны защитить сеть нейритов от повреждения глутаматом с максимальным эффектом при 30 нМ (средняя длина 91%).
• Внеядерный TDP-43: применение глутамата значительно увеличивает цитоплазматический сигнал TDP43 (средний сигнал eTDP-43 128% по сравнению с контролем, фиг. 1C). Сульфатная соль (в дозах 10 нМ – 30 нМ способна полностью предотвращать распределение TDP-43.
Пример 3. Влияние дисульфата N-(3-(4-(3-(диизобутиламино)пропил)пиперазин-1-ил)пропил)-1Н-бензо[d]имидазол-2-амина на созревание SOD1 первичных двигательных нейронов крысы после повреждения глутаматом
Используют генетические модели грызунов для изучения патогенеза ALS, включающие крыс, сверхэкспрессирующих супероксиддисмутазу 1 человека (SOD1) с мутациями, известными как вызывающие семейный ALS человека (например, крыс SOD1G93A). Крысиная модель ALS, экспрессирующая мутированную форму hSOD-1G93A, демонстрирует признаки, которые в точности повторяют клинические и гистопатологические особенности заболевания человека (Nagai et al., The Journal of Neuroscience, December 1, 2001, 21(23): 9246-9254). В исследованиях на людях или грызунах (модели SOD1) потере MN предшествует повышенная возбудимость. Так как повышенная возбудимость нейронов коррелирует со структурными изменениями в дендритных стволах и шипиках, наблюдается атрофия дендритов и выпадение шипика в полосатых нейронах средней колючести (MSNS) и нижних MN поясничного отдела спинного мозга (Ferrucci et al., Neurobiology of Disease, 37 (2010), 370–383; Avossa et al., Neuroscience, 138 (2006), 1179–1194).
Генотипирование эмбрионов по SOD1 двигательных нейронов
В день вскрытия (беременных самок на 14-й день беременности) кусочек головки каждого эмбриона (~3 мм3) с помощью нового скальпеля помещают в 2-мл пробирку без ДНКазы. ДНК экстрагируют с помощью набора для ПЦР тканей SYBR Green Extract-N-Amp (Sigma Aldrich). Коротко, на каждый кусочек головок эмбрионов наносят 120 мкл экстракционного раствора. Затем их инкубируют в течение 10 мин при комнатной температуре. По окончании этого периода инкубации головки инкубируют в течение 5 мин при 95°C. Сразу после этой последней инкубации добавляют 100 мкл нейтрализующего раствора; каждый экстракт ДНК разбавляют 1/40 и хранят при +4°C до использования. Ген SOD1G93A определяют с использованием фрагмента генома с праймерами SOD1 человека (5'-CATCAGCCCTAATCCATCTGA-3'; 5'- CGCGACTAACAATCAAAGTGA-3'). Праймеры SOD1 разводят при 3 мкМ в стерильной сверхчистой воде. Коротко, получают смесь для ПЦР из сверхчистой воды (4 мкл на образец), праймера 3 мкМ (2 мкл на образец) и мастер-микс (10 мкл на образец). В каждую лунку 96-луночного планшета для ПЦР добавляют по 16 мкл смеси для ПЦР. Добавляют по 4 мкл каждой разведенной ДНК в соответствии с программой осаждения.
ОT-ПЦР проводят с использованием системы CFX96 Biorad RT-PCR, используя следующую программу:
- начало: 95°C – 20 с,
- 45 циклов: 95°C – 10 с, 65°C – 10 с, 72°C – 30 с (сбор данных),
- кривая плавления: 95°C – 15 с, 64°C – 1 мин, 90°C – 30 с (непрерывный сбор данных), 60°C 15 с.
Графики амплификации и кривые плавления анализируют с благодарностью с помощью программного обеспечения Biorad.
Результаты для каждого образца сравнивают с отрицательным контролем (сверхчистая вода) и с положительным контролем, чтобы сделать вывод о генотипе каждого эмбриона (WT или Tg).
Культивирование SOD1-двигательных нейронов спинного мозга
Двигательные нейроны спинного мозга (SC) крысы культивируют так, как описано в Martinou et al., Neuron., 1992, Apr; 8(4), 737-44; и в Wang et al., Hum. Mol. Genet., 2013 Dec 1; 22(23), 4706-19. Беременных самок крыс на 14 дни беременности умерщвляют путем смещения шейных позвонков. Плоды собирают и сразу же помещают в охлажденную льдом среду Лейбовица с 2% пенициллина (10000 Е/мл) и раствором стрептомицина (10 мг/мл) (PS) и 1% сывороточного бычьего альбумина (BSA). Каждый плод расправляют в нумерованной чашке Петри (диаметром 35 мм). Хвосты плодов режут, помещают в 1,5-мл пробирку без ДНКазы; экстрагируют ДНК с помощью набора Extract-N-Amp Tissue Kit.
Генотипирование плодов SOD tg выполняют с помощью набора Fast SYBR Green Master Mix. Такое генотипирование проводят во время рассекания спинного мозга, следовательно, рассечение осуществляют по окончании культивирования SOD Tg спинного мозга и WT спинного мозга. Спинной мозг извлекают и помещают в охлажденную льдом среду Лейбовица (L15).
SC греют в течение 20 мин при 37°C с раствором трипсин-ЭДТК при конечной концентрации 0,05% трипсина и 0,02% ЭДТК. Диссоциацию останавливают путем добавления модифицированной по способу Дульбекко среды Игла (DMEM) с 4,5 г/л глюкозы, содержащей ДНКазу I степени II (конечная концентрация 0,5 мг/мл) и 10% фетальной телячьей сыворотки (FCS). Клетки механически диссоциируют тремя принудительными проходами через кончик 10-мл пипетки. Затем клетки центрифугируют при 180 × g в течение 10 мин at +4°C на слое BSA (3,5%) в среде L15. Супернатант отбрасывают, и остаток ресуспендируют в определенной питательной среде, состоящей из нейробазальной среды с 2% раствором добавки of B27, 2 ммоль/л L-глутамина, 2% раствор в PS, и 10 нг/мл нейротрофического фактора головного мозга (BDNF). Жизнеспособные клетки подсчитывают на цитометре Нойбауэра с использованием теста исключения трипанового синего. Клетки высевают при плотности 20000 на лунку в 96-луночные планшеты (иммуноокрашивание), предварительно покрытые поли-L-лизином, и культивируют при 37°C в инкубаторе воздух (95%) - CO2 (5%). Среду меняют каждые 2 дня.
Обработка соединениями – 48-час совместная инкубация
В день 13 среду удаляют, и на культуры воздействуют испытываемыми соединениями дисульфатом N-(3-(4-(3-(диизобутиламино)пропил)пиперазин-1-ил)пропил)-1Н-бензо[d]имидазол-2-амин в сравнении с рилузолом и эдавароном и глутаматом (5 мкМ) в течение 20 мин при 37°C в определенной среде. После воздействия глутамата культуры промывают определенной средой при 37°C, затем помещают в свежую питательную среду, содержащую испытываемое соединение, еще на 48 часов.
Оценка конечных точек
После 15 дней культивирования (48 час после повреждения глутаматом) собирают супернатант клеточной культуры и фиксируют двигательные нейроны спинного мозга холодным раствором из этанола (95%) и уксусной кислоты (5%) в течение 5 мин при -20°C.
После просачивания 0,1% сапонина клетки инкубируют в течение 2 час с указанными ниже антителами.
- Мышиное моноклональное антитело к ассоциированному с антимикротрубочками белку 2 (MAP-2), разведение 1/400 в PBS, содержащем 1% фетальной телячьей сыворотки и 0,1% сапонина (такое антитело окрашивает все двигательные нейроны, зрелые и ранней дифференцировки), такое антитело будет обнаруживаться Alexa Fluor 488 - Goat Anti-Mouse IgG.
- Кроличье поликлональное антитело против TDP43 в разведении 1/100 в PBS, содержащем 1% фетальной телячьей сыворотки и 0,1% сапонина (такое антитело связывается с TDP43, белком, подвергаемым при ALS аномальной транслокации). Рассматривают TDP43 (ядерный или цитоплазматический). Такое антитело обнаруживают с помощью Alexa Fluor 568 - Goat Anti-Rabbit IgG. Ядра нейронов будут помечаться флуоресцентным маркером (раствор Hoechat).
Конечными точками являются
- общая выживаемость MN (число МАР-2 положительных MN),
- вся сеть нейритов (длина выражается в мкм) МАР-2 положительных нейритов,
- цитоплазматический TDP43 (внеядерный, eTDP43) в MN, выражается как площадь (мкм2)/число MN.
Статистический анализ
Статистический анализ выполняют так, как описано в примере 1.
Результаты
Применение глутамата значительно снижает число MN, уменьшает длину сети их нейритов и запускает аномальное распределение TDP43 в сторону цитоплазмы (см. фиг. 3).
Во всех исследованных дозах дисульфат N-(3-(4-(3-(диизобутиламино)пропил)пиперазин-1-ил)пропил)-1Н-бензо[d]имидазол-2-амина является нейрозащитным веществом. Защитное действие на выживаемость нейронов и на распределение TDP-43 зависит от дозы. При дозе 300 нМ защитное действие дисульфата N-(3-(4-(3-(диизобутиламино)пропил)пиперазин-1-ил)пропил)-1Н-бензо[d]имидазол-2-амина выше, чем у рилузола или эдаравона, даже при их более высоких концентрациях 1 мкМ и 5 мкМ соответственно.
Пример 4. Влияние дисульфата N-(3-(4-(3-(диизобутиламино)пропил)пиперазин-1-ил)пропил)-1Н-бензо[d]имидазол-2-амина на нервно-мышечные соединения спинного мозга и мышц, поврежденные глутаматом
Культивирование миобластов человека и эксплантатов спинного мозга крысы
Все эксперименты проводят в соответствии с Руководством Национальных институтов здравоохранения по уходу и использованию лабораторных животных и в соответствии с действующими правилами Европейского Союза (Директива 2010/63/EU).
Создают линию мышечных клеток человека из диссоциированных клеток (22000 клеток на лунки). Их помещают на 48-луночный планшет с покрытием из 0,1% раствора желатина в воде и дают расти в среде для пролиферации, состоящей из смеси 62% среды MEM и 25% среды M199 с добавлением 2 мМ глютамина, 10 мкг/мл человеческого инсулина, 10 нг/мл человеческого рекомбинантного эпидермального фактора роста (EGF), 2 нг/мл основного рекомбинантного фактора роста фибробластов человека (bFGF), 10% фетальной телячьей сыворотки (FCS) и 10000 Е/мл 2% пенициллина и 10000 мкг/мл стрептомицина (PS). Среда будет меняться каждые 2 дня.
Через пять дней после начала культивирования, сразу после слияния клеток-сателлитов, на мышечный монослой помещают целые поперечные срезы спинного мозга с прикрепленными 4 дорсальными корневыми ганглиями (DRG), взятые у 13-дневных эмбрионов крыс Wistar (Janvier Labs, Франция) (один эксплантат на лунку в центральной области). Наличие DRG необходимо для достижения хорошего коэффициента иннервации. Иннервированные культуры поддерживают в смешанной среде, состоящей из MEM и среды 199 (67%/25%) с добавлением 5% FCS, 5 мкг/мл инсулина, 2 мМ глутамина и 2% PS. После 24-час совместного культивирования обычно наблюдают элонгацию нейритов из эксплантатов спинного мозга. Такие нейриты вступают в контакт с миотрубочками и индуцируют образование нервно-мышечных соединений, и первые сокращения наблюдают через ~8 дней совместного культивирования. Вскоре после этого иннервированные мышечные волокна, расположенные в непосредственной близости от эксплантатов спинного мозга, практически непрерывно сокращаются. Иннервированные волокна морфологически и пространственно отличаются от неиннервированных, и их можно легко отличить от них. Планшеты выдерживают при 37°C в увлажненном инкубаторе, в атмосфере воздух (95%) - CO2 (5%).
Обработка соединениями – 48-час совместная инкубация
В день 27 (совместное культивирование) культуры инкубируют с дисульфатом N-(3-(4-(3-(диизобутиламино)пропил)пиперазин-1-ил)пропил)-1Н-бензо[d]имидазол-2-амина и с применением глутамата. Глутамат добавляют в конечной концентрации 60 мкМ, разведенный в контрольной среде, в присутствии дисульфатной соли в течение 20 мин.
После 20-мин интоксикации супернатант удаляют, и добавляют свежую питательную среду с дисульфатом N-(3-(4-(3-(диизобутиламино)пропил)пиперазин-1-ил)пропил)-1Н-бензо[d]имидазол-2-амина еще в течение 48 час.
Оценка конечных точек
Иммуноокрашивание
После 48-час интоксикиции клетки инкубируют с 500 нM α-бунгаротоксина в сочетании с Alexa 488 в течение 15 мин в питательной среде при 37°C для обнаружения окончаний двигательных нервов. После 2 промывок в PBS, клетки фиксируют 4% раствором параформальдегида в PBS, pH = 7,3, в течение 20 мин при комнатной температуре.
Клетки дважды промывают в PBS. Раствор PBS, содержащий 0,1% сапонина и 1% FCS, в течение 15 мин при комнатной температуре для проницаемости клеток и блокирования неспецифических участков.
Затем совместные культуры инкубируют с мышиным моноклональным антителом против нейрофиламента в 200 кД (NFH) при разведении 1/400 в PBS, содержащем 1% FCS, 0,1% сапонина, в течение 2 час при комнатной температуре. Антитело против NFH окрашивает нейриты и аксон двигательного нейрона. Такое антитело обнаруживают с помощью Alexa Fluor 568 - Goat Anti-Mouse IgG в разведении 1/400 в PBS, содержащем 1% FCS, 0,1% сапонина, в течение 1 часа при комнатной температуре. Ядра нейронов помечают ядерным флуоресцентным маркером раствором Hoechst в концентрации 1 мкм/мл в том же растворе.
Анализ
Проводят одно совместное культивирование (6 лунок на условие). Для каждого условия автоматически делается 20 снимков на лунку с помощью ImageXpress (Molecular devices) с увеличением 10×. Все изображения получают в одинаковых условиях.
Автоматически измеряют следующие конечные точки:
(1) число NMJ,
(2) средний размер NMJ (площадь NMJ в мкм2),
(3) общая длина нейритов (мкм) (= сеть иннервации).
Статистический анализ
Статистический анализ выполняют так, как описано в примере 1.
Результаты
Применение глутамата (60 мкМ, 20 мин) приводит к значительному уменьшению числа (А) и общей площади (В) NMJ в культуре. Кроме того, повреждение ведет к значительной потере нейрита (С). Дисульфатная соль (300 нМ) проявляет нейрозащитное действие дозозависимым образом, так как увеличивает число, общую площадь NMJ и общую сеть нейритов, она успешно защищает нервно-мышечные соединения и сеть нейритов от глутаматергического стресса.
| название | год | авторы | номер документа |
|---|---|---|---|
| СОЛИ СУЛЬФАТЫ N-(3-(4-(3-(ДИИЗОБУТИЛАМИНО)ПРОПИЛ)ПИПЕРАЗИН-1ИЛ)ПРОПИЛ)-1Н-БЕНЗО[D]ИМИДАЗОЛ-2-АМИНА, ИХ ПОЛУЧЕНИЕ И ИХ ПРИМЕНЕНИЕ | 2013 |
|
RU2655454C2 |
| НОВЫЕ КОМБИНАЦИИ НЕРАМЕКСАНА ДЛЯ ЛЕЧЕНИЯ НЕЙРОДЕГЕНЕРАТИВНЫХ РАССТРОЙСТВ | 2008 |
|
RU2432161C1 |
| ВАКЦИНА И СПОСОБ ЛЕЧЕНИЯ БОЛЕЗНЕЙ ДВИГАТЕЛЬНЫХ НЕЙРОНОВ | 2002 |
|
RU2303996C2 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ ДЛЯ ИНГИБИРОВАНИЯ АУТОФАГИИ ДВИГАТЕЛЬНЫХ НЕЙРОНОВ И ЕЁ ПРИМЕНЕНИЕ | 2012 |
|
RU2585372C1 |
| ЛЕЧЕНИЕ НЕВРОЛОГИЧЕСКОЙ ДИСФУНКЦИИ С ПРИМЕНЕНИЕМ СУЛЬФАМАТОВ ФРУКТОПИРАНОЗЫ И ЭРИТРОПОЭТИНА | 2002 |
|
RU2317086C2 |
| НОВЫЕ ПРОИЗВОДНЫЕ ОКСИМА ХОЛЕСТ-4-ЕН-3-ОНА, ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ, ИХ СОДЕРЖАЩИЕ, И СПОСОБ ПОЛУЧЕНИЯ | 2009 |
|
RU2496784C2 |
| ЛЕКАРСТВЕННАЯ КОМПОЗИЦИЯ ДЛЯ ЛЕЧЕНИЯ МЫШЕЧНОЙ АТРОФИИ И АСТЕНИЧЕСКОГО БУЛЬБАРНОГО ПАРАЛИЧА И СПОСОБ ЕЕ ПОЛУЧЕНИЯ | 2006 |
|
RU2392955C2 |
| ПРИМЕНЕНИЕ ИНГИБИТОРОВ УРОКИНАЗЫ ДЛЯ ЛЕЧЕНИЯ И/ИЛИ ПРЕДУПРЕЖДЕНИЯ НЕВРОПАТОЛОГИЧЕСКИХ ЗАБОЛЕВАНИЙ | 2006 |
|
RU2410087C2 |
| ПРОИЗВОДНЫЕ ТЕТРАГИДРОИЗОХИНОЛИНА | 2017 |
|
RU2743424C2 |
| ГЕННАЯ ТЕРАПИЯ НЕЙРОДЕГЕНЕРАТИВНЫХ НАРУШЕНИЙ | 2010 |
|
RU2603740C2 |
Настоящее изобретение относится к сульфатным солям N-(3-(4-(3-(диизобутиламино)пропил)пиперазин-1-ил)пропил)-1Н-бензо[d]имидазол-2-амина и их фармацевтически приемлемым сольватам для применения при лечении и/или предупреждении заболеваний двигательных нейронов и нарушений нервно-мышечных соединений. 2 н. и 6 з.п. ф-лы, 4 ил., 2 пр.
1. Применение сульфатной соли N-(3-(4-(3-(диизобутиламино)пропил)пиперазин-1-ил)пропил)-1Н-бензо[d]имидазол-2-амина для лечения и/или предупреждения заболеваний двигательных нейронов и нарушений нервно-мышечных соединений, выбранных из бокового амиотрофического склероза без FTD, первичного бокового склероза (PLS), наследственной спастической параплегии (HSP), нейролатиризма, болезни Тея-Сакса, болезни Сандхоффа, прогрессирующей мышечной атрофии (PMA), мономелической амиотрофии, спинально-бульбарной мышечной атрофии (SBMA), прогрессирующего бульбарного паралича (PBP), пострадиационного синдрома, синдрома скованного человека, нарушений двигательных единиц в результате несчастного случая, миастении гравис, синдрома Итона-Ламберта.
2. Применение сульфатной соли N-(3-(4-(3-(диизобутиламино)пропил)пиперазин-1-ил)пропил)-1Н-бензо[d]имидазол-2-амина для отсрочки начала у пациента заболеваний двигательных нейронов и нарушений нервно-мышечных соединений, выбранных из бокового амиотрофического склероза без FTD, первичного бокового склероза (PLS), наследственной спастической параплегии (HSP), нейролатиризма, болезни Тея-Сакса, болезни Сандхоффа, прогрессирующей мышечной атрофии (PMA), мономелической амиотрофии, спинально-бульбарной мышечной атрофии (SBMA), прогрессирующего бульбарного паралича (PBP), пострадиационного синдрома, синдрома скованного человека, нарушений двигательных единиц в результате несчастного случая, миастении гравис, синдрома Итона-Ламберта.
3. Применение по п. 1 или 2, где сульфатная соль имеет формулу I
Формула I,
где х равен 0,5-4.
4. Применение по п. 3, где x равен около 2.
5. Применение по п. 4, где сульфатная соль представляет собой N-(3-(4-(3-(диизобутиламино)пропил)пиперазин-1-ил)пропил)-1H-бензо[d]имидазол- 2-аминодисульфат.
6. Применение по п. 1 или 2, где заболевания двигательных нейронов и нарушения нервно-мышечных соединений выбирают из бокового амиотрофического склероза без FTD, первичного бокового склероза (PLS), наследственной спастической параплегии (HSP), прогрессирующей мышечной атрофии (PMA), мономелической амиотрофии, спинально-бульбарной мышечной атрофии (SBMA), прогрессирующего бульбарного паралича (PBP), миастении гравис, синдрома Итона-Ламберта, нарушений двигательных единиц в результате несчастного случая.
7. Применение по п. 6, где заболевания двигательных нейронов выбирают из бокового амиотрофического склероза без FTD, первичного бокового склероза (PLS), наследственной спастической параплегии (HSP), спинально-бульбарной мышечной атрофии (SBMA), прогрессирующего бульбарного паралича (PBP).
8. Применение по п. 7, где заболеванием двигательных нейронов является боковой амиотрофический склероз без FTD.
| WO 2014102339 A1, 2014.07.03 | |||
| WO 2006051489 A1, 2006.05.18 | |||
| Zilai Wang, Presynaptic and postsynaptic interaction of the amyloid precursor protein promotes peripheral and central synaptogenesis, J Neurosci | |||
| Колосоуборка | 1923 |
|
SU2009A1 |
| Печь-кухня, могущая работать, как самостоятельно, так и в комбинации с разного рода нагревательными приборами | 1921 |
|
SU10A1 |
| Wolfgang N | |||
| Löscher et al | |||
| Atlas of Neuromuscular Diseases, A | |||
Авторы
Даты
2024-02-28—Публикация
2021-10-07—Подача