Перекрестная ссылка на связанные заявки
По данной заявке испрашивается приоритет на основании 35 USC §119(e)(1) по предварительным заявкам США № 61/174/982, поданной 2 мая 2009 года, и 61/268059, поданной 8 июня 2009 года, которые включены в настоящий документ посредством ссылки в полном объеме.
Область техники
Настоящее изобретение главным образом относится к способам доставки генов. В частности, изобретение относится к композициям и способам для лечения нарушений, влияющих на двигательную функцию, такую как двигательная функция, затронутая заболеванием или повреждением головного и/или спинного мозга.
Описание изобретения
Генная терапия представляет собой перспективный способ лечения нарушений, которые влияют на центральную нервную систему (ЦНС). Генную терапию ЦНС облегчает разработка вирусных векторов, которые способны эффективно инфицировать постмитотические нейроны. Центральная нервная система состоит из спинного мозга и головного мозга. Спинной мозг проводит сенсорную информацию от периферической нервной системы к головному мозгу и проводит двигательную информацию от головного мозга к различным эффекторам. Обзор вирусных векторов для доставки генов в центральную нервную систему можно найти в публикации Davidson et al., Nature Rev. (2003) 4:353-364.
Аденоассоциированные вирусные (AAV) векторы считаются эффективными для генной терапии ЦНС, поскольку они обладают подходящим профилем токсичности и иммуногенности, их можно использовать в трансдукции нервных клеток, и они способны опосредовать длительную экспрессию в ЦНС (Kaplitt et al., Nat. Genet. (1994) 8:148-154; Bartlett et al., Hum. Gene Ther. (1998) 9:1181-1186; и Passini et al., J. Neurosci. (2002) 22:6437-6446).
Одно полезное свойство векторов AAV заключается в способности некоторых векторов AAV подвергаться ретроградному и/или антероградному транспорту в нервных клетках. Нейроны в одной области головного мозга соединены аксонами с дистальными областями головного мозга, тем самым предоставляя транспортную систему для доставки вектора. Например, вектор AAV можно вводить в терминали аксонов нейронов или рядом с ними. Нейроны интернализируют вектор AAV и транспортируют его ретроградным способом по аксону в тело клетки. У аденовируса, HSV, и вируса псевдобешенства показаны схожие свойства в отношении доставки генов в дистальные структуры головного мозга (Soudas et al., FASEB J. (2001) 15:2283-2285; Breakefield et al., New Biol. (1991) 3:203-218; и deFalco et al., Science (2001) 291:2608-2613).
Некоторые исследователи сообщали о том, что трансдукция головного мозга с использованием серотипа AAV 2 (AAV2) ограничена внутричерепным местом инъекции (Kaplitt et al., Nat. Genet. (1994) 8:148-154; Passini et al., J. Neurosci. (2002) 22:6437-6446; и Chamberlin et al., Brain Res. (1998) 793:169-175). Также существует доказательство того, что ретроградный аксональный транспорт нейротропных вирусных векторов, включая векторы AAV и лентивирусные векторы, также может происходить в выбранных цепях головного мозга нормальной крысы (Kaspar et al., Mol. Ther. (2002) 5:50-56; Kasper et al., Science (2003) 301: 839-842 и Azzouz et al., Nature (2004) 429:413-417. Roaul et al., Nat. Med. (2005) 11(4):423-428 и Ralph et al., Nat. Med. (2005) 11(4):429-433 сообщают, что внутримышечная инъекция лентивируса, экспрессирующего интерферирующую РНК для подавления экспрессии Cu/Zn-супероксиддисмутазы (SOD1) человека, задерживала начало заболевания боковым амиотрофическим склерозом (ALS) в терапевтически уместной модели ALS на грызунах.
Клетки, трансдуцированные векторами AAV, могут экспрессировать продукт терапевтического трансгена, такой как фермент или нейротрофический фактор, чтобы опосредовать положительное воздействие внутриклеточно. Эти клетки также могут секретировать продукт терапевтического трансгена, который впоследствии может быть захвачен дистальными клетками, где он может опосредовать свое положительное воздействие. Этот процесс описан как кросс-коррекция (Νeufeld et al., Science (1970) 169:141-146).
Свойство описанных выше рекомбинантных векторов AAV заключается в том, что перед экспрессией кодируемого трансгена нужно конвертировать одноцепочечную ДНК (оцДНК) генома AAV в двухцепочечную ДНК (дцДНК). Эту стадию можно обойти посредством самокомплементарных векторов, в которых упакован геном с инвертированными повторами, который уложен в дцДНК, не требуя синтеза ДНК или спаривания оснований нескольких векторных геномов, тем самым повышая эффективность опосредованного AAV переноса генов. Обзор самокомплементарных векторов AAV см., например, в публикации McCarty, D.M. Molec. Ther. (2008) 16:1648-1656.
Спинальная мышечная атрофия (SMA) представляет собой аутосомное рецессивное нервно-мышечное нарушение, вызванное мутациями в гене выживаемости двигательных нейронов 1 (SMΝ1) и утратой кодируемого SMΝ белка (Lefebvre et al., Cell (1995) 80:155-165). Отсутствие SMΝ ведет к дегенерации двигательных нейронов в брюшном (переднем) роге спинного мозга, что ведет к слабости проксимальных мышц, отвечающих за ползание, ходьбу, движение шеи и глотание, и непроизвольно сокращающихся мышц, которые управляют дыханием и кашлем (Sumner C.J., NeuroRx (2006) 3:235-245). Таким образом, пациенты с SMA предрасположены к пневмониям и другим пульмональным проблемам, таким как рестриктивное легочное заболевание. Начало заболевания и степень тяжести отчасти определяет фенотипический ген-модификатор SMN2, который способен обеспечить образование малого количества SMN (Monani et al., Hum. Mol. Genet. (1999) 8:1177-1183; Lorson et al., Proc. Natl. Acad. Sci. USA (1999) 96:6307-6311). Таким образом, пациенты с высоким числом копий SMN2 (3-4 копии) переносят менее тяжелую форму заболевания (именуемую II или III типом), тогда как 1-2 копии SMN2 обычно ведут к более тяжелому заболеванию I типа (Campbell et al., Am. J. Hum. Genet. (1997) 61:40-50; Lefebvre et al., Nat. Genet. (1997) 16:265-269). В настоящее время не существует эффективного лечения SMA.
Фундаментальная стратегия лечения данного моногенного нарушения состоит в повышении уровней SMN у пациентов с SMA. Один подход для достижения этого состоит в модуляции эндогенного гена SMN2 с использованием низкомолекулярных соединений, которые активируют промотор SMN2 или корректируют паттерн сплайсинга предшественника мРНК SMN2. Изменение сплайсинга SMN2 также можно реализовать с использованием антисмысловых олигонуклеотидов и транс-сплайсинга РНК. Однако несмотря на то, что модуляция SMN2 повышала уровень SMN in vitro и восстанавливала ядерные кристаллические структуры в клеточных линиях с SMA, исследования эффективности с использованием низкомолекулярных лекарственных средств не перешли в поддающиеся измерению улучшения в клинике (Oskoui et al., Neurotherapeutics (2008) 5:499-506).
Сущность изобретения
Настоящее изобретение основано на открытии того, что как стандартные рекомбинантные вирионы AAV (rAAV), так и рекомбинантные самокомплементарные векторы AAV (scAAV) способны доставлять гены в ЦНС при успешной экспрессии в ЦНС и лечении нейродегенеративного заболевания. Этот терапевтический подход для доставки генов, кодирующих терапевтические молекулы, которая ведет по меньшей мере к частичной коррекции неврологических патологий, предоставляет крайне желательный способ лечения различных нейродегенеративных нарушений, включая SMA.
Таким образом, в одном из вариантов осуществления изобретение относится к самокомплементарному аденоассоциированному вирусному (scAAV) вектору, содержащему полинуклеотид, кодирующий белок, который модулирует двигательную функцию у субъекта с нарушением двигательных нейронов. В определенных вариантах осуществления нарушение двигательных нейронов выбирают из спинальной мышечной атрофии (SMA), бокового амиотрофического склероза (ALS), спинобульбарной мышечной атрофии, спиноцеребеллярной атаксии, первичного латерального склероза (PLS) или травматического повреждения спинного мозга.
В дополнительных вариантах осуществления полинуклеотид, присутствующий в векторе scAAV, кодирует белок выживаемости двигательных нейронов (SMN). В определенных вариантах осуществления белок SMN представляет собой SMN-1 человека. В дополнительных вариантах осуществления SMN-1 содержит аминокислотную последовательность, которая обладает по меньшей мере 90% идентичностью последовательности с последовательностью, изображенной на фиг.9B. В дополнительных вариантах осуществления SMN-1 содержит аминокислотную последовательность, как изображено на фиг.9B.
В других вариантах осуществления изобретение относится к рекомбинантному вириону AAV, содержащему вектор scAAV, как описано выше.
В дополнительных вариантах осуществления изобретение относится к композиции, содержащей рекомбинантный вирион AAV, как указано выше, и фармацевтически приемлемый эксципиент.
В дополнительных вариантах осуществления изобретение относится к способу модуляции двигательной функции у субъекта с нарушением двигательных нейронов, включающему введение терапевтически эффективного количества указанной выше композиции в клетки субъекта. В определенных вариантах осуществления композицию вводят в клетки in vitro для того, чтобы трансдуцировать клетки, и трансдуцированные клетки вводят субъекту. В альтернативных вариантах осуществления композиции вводят в клетки in vivo.
В дополнительных вариантах осуществления изобретение относится к способу обеспечения белка SMN у субъекта со спинальной мышечной атрофией (SMA), включающему введение рекомбинантного вириона AAV, содержащего вектор AAV, как описано выше, в клетки субъекта, нуждающегося в этом. В определенных вариантах осуществления композицию вводят в клетки in vitro для того, чтобы трансдуцировать клетки, и трансдуцированные клетки вводят субъекту. В альтернативных вариантах осуществления композиции вводят в клетки in vivo.
В каждом указанном выше способе композицию можно вводить непосредственной инъекцией в спинной мозг. В других вариантах осуществления композицию вводят интрацеребровентрикулярной инъекцией. В дополнительных вариантах осуществления композицию вводят в боковой желудочек головного мозга. В определенных вариантах осуществления композицию вводят в оба боковых желудочка головного мозга. В других вариантах осуществления композицию вводят как интрацеребровентрикулярной инъекцией, так и прямой инъекцией в спинной мозг. В дополнительных вариантах осуществления композицию вводят посредством интратекальной инъекции.
Эти и другие варианты осуществления настоящего изобретения легко решат специалисты в данной области с учетом описания, приведенного в настоящем документе.
Краткое описание рисунков
На фиг.1 показана выживаемость мышей, которых лечили с использованием AAVhSMN1, в сравнении с мышами с SMA, которые не получали лечения. Лечение с использованием AAVhSMN1 повышало выживаемость мышей с SMA. Мыши с SMA, не получавшие лечение (n=34, светлые круги), имели среднее значение продолжительности жизни 15 суток. Мыши с SMA, которых лечили при P0 с использованием AAVhSMN1 (n=24, темные круги), имели среднее значение продолжительности жизни 50 суток (p<0,0001), что составило увеличение срока жизни на 233%.
На фиг.2A-2C показано влияние генной терапии на уровни SMN в спинном мозге. Показаны уровни белка hSMN в инъецированных поясничном (фиг.2A), грудном (фиг.2B) и шейном (фиг.2C) отделах по сравнению с мышами с SMA, не получавшими лечение, и мышами дикого типа. Осуществляли вестерн-блоттинг для поясничного, грудного и шейного отделов спинного мозга через 16, 58-66 и 120-220 суток после инъекции. Посредством вестерн-блоттинга проводили количественное определение для трех отделов, а для контроля уровней белка нормализовали SMN к β-тубулину и наносили на график в виде процентной доли мышей дикого типа с совпадающим возрастом. Легенда (и значения n): SMA, с нокаутом, не получавшие лечение (n=5 на 16 сутки); AAV, мыши с SMA, которых лечили с использованием AAV8-hSMN (n=7 на 16 сутки, n=5 на 58-66 сутки); scAAV, мыши с SMA, которых лечили с использованием scAAV8-hSMN (n=5 в каждый момент времени). Значения представляют среднее значение ±SEM (стандартная ошибка среднего значения).
На фиг.3A-3J показано внутриклеточное распределение белка hSMN и экспрессия в двигательных нейронах спинного мозга у мышей с SMA, получавших и не получавших лечение. Белок hSMN в большом количестве обнаруживали в цитоплазме трансдуцированных клеток (фиг.3A и 3B). Кроме того, белок hSMN обнаруживали в ядре, как проиллюстрировано парой кристаллических структур (стрелка), увеличенных во врезке (фиг.3A). Белок hSMN также обнаруживали в дендритах (фиг.3B и 3C) и аксонах (фиг.3D) нейронов. Белок hSMN не поддавался обнаружению на срезах тканей мышей с SMA, не получавших лечение (фиг.3E). Совместная локализация белка hSMN (фиг.3F) и ChAT мыши (фиг.3G) показывала, что подмножество трансдуцированных клеток представляет собой двигательные нейроны (фиг.3H и 3I). Процентную долю ChAT-клеток, иммуноположительных по белку hSMN, определяли на 16 (белые столбцы) и 58-66 (черные столбцы) сутки (фиг.3J). Значения представляют среднее значение ±SEM.
На фиг.4 показано количество двигательных нейронов в спинном мозге у мышей с SMA, получавших и не получавших лечение. Для каждой группы показано среднее число ChAT иммуноположительных нейронов, которое считали на 10 мкм тканевых срезах. Число отражает количество в каждом десятом срезе с различных уровней шейного, грудного, поясничного и крестцового отделов. Значения представляют среднее значение ±SEM. Легенда: *, p<0,05; **, p<0,01; ***, p<0,001.
На фиг.5A-5C показана площадь поперечного сечения мышечного волокна из мышечных групп у мышей с SMA, получавших и не получавших лечение. Площадь поперечного сечения мышечного волокна из нескольких мышечных групп возрастала при лечении с использованием AAVhSMN1. Составные диаграммы для квадрицепсов, икроножных и межреберных мышц на 16 (фиг.5A) и 58-66 (фиг.5B) сутки показывают, что распределение размеров мышечных волокон схожи у мышей с SMA, получавших лечение, и у мышей дикого типа. Общее среднее значение на 16 сутки показывает, что при лечении площадь поперечного сечения мышечного волокна значительно выше (фиг.5C). Кроме того, на 58-66 сутки средняя площадь статистически сходна у мышей с SMA, получавших лечение, и у мышей дикого типа с совпадающим возрастом в икроножных и межреберных мышцах (фиг.5C). Значения представляют среднее значение ±SEM. Легенда: WT, мыши дикого типа, не получавшие лечение; HET, гетерозиготы, не получавшие лечение; SMA, с нокаутом, не получавшие лечение; AAV, мыши с SMA, получавшие лечение с использованием AAVhSMN1; *, p<0,05; **, p<0,01; ***, p<0,001.
На фиг.6A-6F показана структура нервно-мышечного соединения (NMJ) в мышцах у мышей с SMA, получавших и не получавших лечение. Структуру в квадрицепсе, икроножной и межреберной мышцах улучшали при использовании генной терапии. Показаны нервно-мышечные соединения(NMJ) из квадрицепсов мышей с SMA, не получавших лечение (фиг.6A), мышей с SMA, получавших лечение (фиг.6B), и мышей дикого типа, не получавших лечение (фиг.6C), на 16 сутки, и мышей с SMA, получавших лечение (фиг.6D), и мышей дикого типа, не получавших лечение (фиг.6E), на 58-66 сутки. Пре- и постсинаптическое NMJ метили антителом к нейрофиламенту (зеленый) и окрашивали α-бунгаротоксином (красный), соответственно. Стрелка в основной части указывает на NMJ, которое выделено во врезках ниже. У каждого животного в каждой мышце случайно оценивали по меньшей мере 100 NMJ. Нормальное NMJ определяли как имеющее пресинаптическую терминаль, в которой не наблюдали аномального накопления белка нейрофиламента, показанного на фиг.6A. Значения на фиг.6F представляют среднее значение ±SEM. Легенда: WT, мыши дикого типа, не получавшие лечение; HET, гетерозиготы, не получавшие лечение; SMA, мыши с нокаутом, не получавшие лечение; AAV, мыши с SMA, получавшие лечение с использованием AAVhSMN1; *, p<0,05; **, p<0,01; ***, p<0,001. Масштабная метка: 20 мкм.
На фиг.7A-7F показаны результаты поведенческих тестов у мышей с SMA, получавших и не получавших лечение. В поведенческих тестах мыши с SMA, получавшие лечение, показывали значительные улучшения. Мыши с SMA, получавшие лечение (звездочка), и мыши дикого типа (WT), не получавшие лечение, по существу более приспособлены, чем мыши с SMA, не получавшие лечение (отмечены «x»), на 16 сутки (фиг.7A). Мыши с SMA, получавшие лечение, также значительно тяжелее контрольных мышей с SMA, не получавших лечение, с 11 суток и далее (фиг.7B). Мыши с SMA, получавшие лечение, значительно лучше выполняли тесты на выпрямительный рефлекс (фиг.7C), отрицательный геотаксис (фиг.7D), силу хватания (фиг.7E) и разведение задних конечностей (фиг.7F), чем мыши с SMA, не получавшие лечение. Мыши с SMA, получавшие лечение, статистически идентичны мышам дикого типа и гетерозиготам в тестах на выпрямительный рефлекс и отрицательный геотаксис на 12-16 сутки (фиг.7C и 7D). Значения представляют среднее значение ±SEM. Легенда: мыши WT, не получавшие лечение (светлый круг), гетерозиготы, не получавшие лечение (светлый треугольник); мыши с SMA, не получавшие лечение (светлый квадрат); мыши с SMA, получавшие лечение с использованием AAVhSMN1 (темный квадрат); *, p<0,05; **, p<0,01; ***, p<0,001.
На фиг.8 показана выживаемость мышей, получавших лечение с использованием scAAVhSMN1 и не получавших лечение. Лечение с использованием scAAVhSMN1 повышало выживаемость у мышей с SMA. Мыши с SMA, получавшие лечение при P0 с использованием scAAVhSMN1 (n=17, темные треугольники), имели среднее значение продолжительности жизни 157 суток (p<0,0001) по сравнению с 16 сутками у мышей с SMA, не получавшими лечение (n=47, светлые круги).
На фиг.9A-9B (SEQ ID NO:1 и 2) показана кодирующая последовательность ДНК (фиг.9A) и соответствующая аминокислотная последовательность (фиг.9B) характерного гена выживаемости двигательных нейронов (SMN1) человека.
На фиг.10A-10F показано, что экспрессия scAAV8-hSMN увеличивает количество двигательных нейронов и улучшает NMJ у мышей с SMA. На фиг.10A показана процентная доля mChAT иммуноположительных клеток, которые локализованы совместно с экспрессией hSMN в пояснично-грудном отделе на 16 сутки после инъекции. На фиг.10B-10F показаны средние количества mChAT иммуноположительных клеток в поясничном (фиг.10B), грудном (фиг.10C) и шейном (фиг.10D) отделах и средние процентные доли поврежденных NMJ в квадрицепсе (фиг.10E) и межреберных мышцах (фиг.10F) на 16, 58-66 и 214-269 сутки. Точкой отсчета для фиг.10E и 10F служит 75-90% NMJ в квадрицепсе и межреберных мышцах мышей с SMA, не получавших лечение, которые содержали неправильную поврежденную структуру на 16 сутки (см. фиг.6F). Легенда и значения n: SMA, мыши с нокаутом, не получавшие лечение (светлые столбцы, n=8 на 16 сутки), AAV, AAV8-hSMN (заштрихованные столбцы, n=8 на 16 сутки, n=5 на 58-66 сутки); scAAV, scAAV8-hSMN (темные столбцы, n=5 в каждый момент времени); WT, мыши WT, не получавшие лечение (столбцы в клетку, n=8 на 16 сутки, n=5 на 58-66 и 216-269 сутки). Значения представляют среднее значение ±SEM. Статистические сравнения осуществляли, используя однофакторный дисперсионный анализ (ANOVA) и апостериорный критерий Бонферрони для множественных сравнений на 16 сутки (фиг.10B-10F). С помощью непарного двустороннего критерия Стьюдента сравнивали 1) два вектора друг с другом на 16 сутки (фиг.10A) и 58-66 сутки (фиг.10B-10D); 2) относительное число ChAT-клеток в группах 58-66d и 214-269d при лечении с использованием scAAV8-hSMN (фиг.10B-10D); 3) относительное число аномальных NMJ между мышами WT с совпадающим возрастом, не получавшими лечение, и мышами с SMA, получавшими лечение с использованием scAAV8-hSMN, на 214-269 сутки (E, F); *p<0,05, **p<0,01, ***p<0,001.
Подробное описание изобретения
При практическом осуществлении настоящего изобретения используют, если не указано иначе, стандартные способы химии, биохимии, рекомбинантной ДНК и иммунологии, известные специалистам в данной области. Такие способы полностью описаны в литературе. См., например, Fundamental Virology, 2nd Edition, vol. I & II (B.N. Fields and D.M. Knipe, eds.); Handbook of Experimental Immunology, Vols. I-IV (D.M. Weir and C.C. Blackwell eds., Blackwell Scientific Publications); T.E. Creighton, Proteins: Structures and Molecular Properties (W.H. Freeman and Company, 1993); A.L. Lehninger, Biochemistry (Worth Publishers, Inc., current addition); Sambrook, et al., Molecular Cloning: A Laboratory Manual (2nd Edition, 1989); Methods In Enzymology (S. Colowick and N. Kaplan eds., Academic Press, Inc.).
Все публикации, патенты и патентные заявки, цитируемые в настоящем документе, как выше, так и ниже, настоящим включены посредством ссылки в полном объеме.
1. Определения
В описании настоящего изобретения использованы следующие термины, которые следует использовать в значении, указанном ниже.
Следует отметить, что используемые в данном описании и приложенной формуле изобретения формы единственного числа включают формы множественного числа, если в контексте явно не указано иное. Таким образом, например, упоминание о «рецепторе интерлейкина» включает смесь двух или более таких рецепторов и т.п.
Термины «полипептид» и «белок», используемые взаимозаменяемо в настоящем документе, или кодирующая их нуклеотидная последовательность, относятся к белку или нуклеотидной последовательности, соответственно, которые представляют или нативную последовательность, ее вариант или ее фрагмент. Полноразмерные белки, с сигнальной последовательностью или без нее, и их фрагменты, а также белки с модификациями, такими как делеции, вставки и замены (или консервативные или неконсервативные по природе), в нативной последовательности предназначены для использования в настоящем документе при условии, что белок сохраняет желаемую активность. Эти модификации могут быть преднамеренными, например, введенными посредством сайт-специфического мутагенеза, или могут быть случайными, например, введенными посредством мутаций организма-хозяина, который продуцирует белки, или посредством ошибок ПЦР амплификации. Таким образом, в настоящем документе предполагается использовать активные белки, по существу гомологичные родительской последовательности, например, белки с 70…80…85…90…95…98…99% и т.д. идентичностью, которые сохраняют желаемую активность нативной молекулы.
«Нативный» полипептид, такой как полипептид выживаемости двигательных нейронов (SMN), относится к полипептиду, который имеет такую же аминокислотную последовательность, как и соответствующая молекула, полученная из природы. Такие нативные последовательности можно выделить из природы или можно получить рекомбинантными или синтетическими средствами. Термин «нативная» последовательность, в частности, охватывает природные усеченные или секретируемые формы конкретной молекулы (например, последовательность внеклеточного домена), природные формы вариантов (например, формы, возникшие в результате альтернативного сплайсинга) и природные аллельные варианты полипептида. В различных вариантах осуществления изобретения нативные молекулы, описанные в настоящем документе, представляют собой зрелые или полноразмерные нативные последовательности, содержащие полноразмерные аминокислотные последовательности, представленные на сопроводительных фигурах. Однако несмотря на то, что некоторые молекулы, показанные на сопроводительных фигурах, начинаются с остатков метионина, обозначенных в качестве аминокислотного положения 1 на этой фигуре, другие остатки метионина, расположенные или ближе к 5'-концу, или ближе к 3'-концу относительно аминокислотного положения 1 на этой фигуре, можно использовать в качестве начального аминокислотного остатка для конкретной молекулы. Альтернативно, в зависимости от используемой экспрессирующей системы, у молекул, описанных в настоящем документе, может отсутствовать N-концевой метионин.
Под «вариантом» понимают активный полипептид, как определено в настоящем документе, который обладает по меньшей мере приблизительно 80% идентичностью аминокислотной последовательности с соответствующей полноразмерной нативной последовательностью, полипептид, у которого отсутствует сигнальный пептид, внеклеточный домен полипептида, с сигнальным пептидом или без него, или любой другой фрагмент последовательности полноразмерного полипептида, как описано в настоящем документе. Такие варианты полипептида включают, например, полипептиды, в которых один или несколько аминокислотных остатков добавлены или удалены на N- и/или C-конце полноразмерной нативной аминокислотной последовательности. Как правило, вариант обладает по меньшей мере приблизительно 80% идентичностью аминокислотной последовательности, альтернативно по меньшей мере приблизительно 81% идентичностью аминокислотной последовательности, альтернативно по меньшей мере приблизительно 82% идентичностью аминокислотной последовательности, альтернативно по меньшей мере приблизительно 83% идентичностью аминокислотной последовательности, альтернативно по меньшей мере приблизительно 84% идентичностью аминокислотной последовательности, альтернативно по меньшей мере приблизительно 85% идентичностью аминокислотной последовательности, альтернативно по меньшей мере приблизительно 86% идентичностью аминокислотной последовательности, альтернативно по меньшей мере приблизительно 87% идентичностью аминокислотной последовательности, альтернативно по меньшей мере приблизительно 88% идентичностью аминокислотной последовательности, альтернативно по меньшей мере приблизительно 89% идентичностью аминокислотной последовательности, альтернативно по меньшей мере приблизительно 90% идентичностью аминокислотной последовательности, альтернативно по меньшей мере приблизительно 91% идентичностью аминокислотной последовательности, альтернативно по меньшей мере приблизительно 92% идентичностью аминокислотной последовательности, альтернативно по меньшей мере приблизительно 93% идентичностью аминокислотной последовательности, альтернативно по меньшей мере приблизительно 94% идентичностью аминокислотной последовательности, альтернативно по меньшей мере приблизительно 95% идентичностью аминокислотной последовательности, альтернативно по меньшей мере приблизительно 96% идентичностью аминокислотной последовательности, альтернативно по меньшей мере приблизительно 97% идентичностью аминокислотной последовательности, альтернативно по меньшей мере приблизительно 98% идентичностью аминокислотной последовательности и альтернативно по меньшей мере приблизительно 99% идентичностью аминокислотной последовательности с соответствующей полноразмерной нативной последовательностью. Как правило, полипептиды вариантов составляют по меньшей мере приблизительно 10 аминокислот в длину, например, по меньшей мере приблизительно 20 аминокислот в длину, например, по меньшей мере приблизительно 30 аминокислот в длину, альтернативно по меньшей мере приблизительно 40 аминокислот в длину, альтернативно по меньшей мере приблизительно 50 аминокислот в длину, альтернативно по меньшей мере приблизительно 60 аминокислот в длину, альтернативно по меньшей мере приблизительно 70 аминокислот в длину, альтернативно по меньшей мере приблизительно 80 аминокислот в длину, альтернативно по меньшей мере приблизительно 90 аминокислот в длину, альтернативно по меньшей мере приблизительно 100 аминокислот в длину, альтернативно по меньшей мере приблизительно 150 аминокислот в длину, альтернативно по меньшей мере приблизительно 200 аминокислот в длину, альтернативно по меньшей мере приблизительно 300 аминокислот в длину или более.
Особенно предпочтительные варианты включают замены, которые являются консервативными по природе, т.е. те замены, которые имеют место в семействе аминокислот, которые объединены по их боковым цепям. В частности, аминокислоты обычно делят на четыре семейства: (1) кислые - аспартат и глутамат; (2) основные - лизин, аргинин, гистидин; (3) неполярные - аланин, валин, лейцин, изолейцин, пролин, фенилаланин, метионин, триптофан; и (4) незаряженные полярные - глицин, аспарагин, глутамин, цистеин, серин треонин, тирозин. Фенилаланин, триптофан и тирозин иногда классифицируют как ароматические аминокислоты. Например, достаточно обосновано предсказание о том, что выделенная замена лейцина на изолейцин или валин, аспартата на глутамат, треонина на серин или схожая консервативная замена аминокислоты на структурно родственную аминокислоту не окажет важного влияния на биологическую активность. Например, полипептид, представляющий интерес, может включать вплоть до приблизительно 5-10 консервативных или неконсервативных аминокислотных замен, или даже вплоть до приблизительно 15-25 или 50 консервативных или неконсервативных аминокислотных замен, или любое число от 5 до 50 при условии, что желаемая функция молекулы остается незатронутой.
«Гомология» относится к проценту идентичности двух полинуклеотидных или двух полипептидных фрагментов. Две последовательности ДНК или две полипептидные последовательности являются «по существу гомологичными» друг другу, когда последовательности обладают по меньшей мере приблизительно 50%, предпочтительно по меньшей мере приблизительно 75%, более предпочтительно по меньшей мере приблизительно 80%-85%, предпочтительно по меньшей мере приблизительно 90% и наиболее предпочтительно по меньшей мере приблизительно 95%-98% идентичностью последовательностей на протяжении молекул определенной длины. Как используется в настоящем документе, термин по существу гомологичная также относится к последовательности, которая обладает полной идентичностью с точно определенной последовательностью ДНК или полипептида.
Как правило, «идентичность» относится к точному соответствию нуклеотид-в-нуклеотид или аминокислота-в-аминокислоту двух полинуклеотидных или полипептидных последовательностей, соответственно. Процент идентичности можно определить прямым сравнением информации о последовательности для двух молекул посредством выравнивания последовательностей, подсчета точного числа совпадений между двумя выровненными последовательностями, деления на длину более короткой последовательности и умножения результата на 100. Для облегчения этого анализа можно использовать легко доступные компьютерные программы, такие как ALIGN, Dayhoff, M.O. in Atlas of Protein Sequence and Structure M.O. Dayhoff ed., 5 Suppl. 3:353-358, National Biomedical Research Foundation, Washington, DC, в которой адаптирован алгоритм локальной гомологии Smith and Wateraman Advances in Appl. Math. 2:482-489, 1981 для пептидного анализа. Программы для определения идентичности нуклеотидных последовательностей доступны в Wisconsin Sequence Analysis Package, Version 8 (доступен в Genetics Computer Group, Madison, WI), например, программы BESTFIT, FASTA и GAP, которые также основаны на алгоритме Смита-Ватермана. Эти программы легко использовать с параметрами по умолчанию, которые рекомендованы производителем и описаны в Wisconsin Sequence Analysis Package, который указан выше. Например, процент идентичности конкретной нуклеотидной последовательности относительно эталонной последовательности можно определить с помощью алгоритма гомологии Смита-Ватермана, в котором используют по умолчанию матрицу замен и штраф за пропуск шести положений нуклеотидов.
Другой способ определения процента идентичности в контексте настоящего изобретения заключается в использовании пакета программ MPSRCH, права на который принадлежат University of Edinburgh, разработанного John F. Collins и Shane S. Sturrok и распространяемого компанией IntelliGenetics, Inc. (Mountain View, CA). Из этого набора пакетов можно использовать алгоритм Смита-Ватермана с параметрами по умолчанию для матрицы замен (например, штраф за открытие пропуска 12, штраф за продолжение пропуска один и пропуск шесть). В генерируемых данных значение «Match» отражает «идентичность последовательностей». Другие подходящие программы для вычисления процента идентичности или сходства между последовательностями в целом известны в данной области, например, другой программой выравнивания является BLAST, который используют с параметрами по умолчанию. Например, можно использовать BLASTN и BLASTP со следующими параметрами по умолчанию: генетический код = стандартный; фильтр = нет; нить = обе; порог = 60; ожидаемое = 10; матрица = BLOSUM62; описания = 50 последовательностей; сортировка по = наивысшей оценке; базы данных = не избыточные, GenBank + EMBL + DDBJ + PDB + трансляция GenBank CDS + Swiss protein + Spupdate + PIR. Подробности об этих программах хорошо известны в данной области.
Альтернативно, гомологию можно определить гибридизацией полинуклеотидов в условиях, допускающих образование стабильных дуплексов между гомологичными областями, с последующим расщеплением нуклеазой(ами) со специфичностью к одноцепочечной нуклеиновой кислоте, и определением размеров расщепленных фрагментов. По существу гомологичные последовательности ДНК можно идентифицировать в гибридизации по Саузерну, например, в строгих условиях, как определено для этой конкретной системы. Определение соответствующих условий гибридизации известно специалистам в данной области. См., например, Sambrook et al., выше; DNA Cloning, выше; Nucleic Acids Hybridization, выше.
Под термином «вырожденный вариант» понимают полинуклеотид, содержащий изменения в своей последовательности нуклеиновой кислоты, которая кодирует полипептид, имеющий ту же аминокислотную последовательность, что и полипептид, кодируемый тем полинуклеотидом, из которого вырожденный вариант получен.
«Кодирующая последовательность» или последовательность, которая «кодирует» выбранный полипептид, представляет собой молекулу нуклеиновой кислоты, транскрипция (в случае ДНК) и трансляция (в случае мРНК) которой ведет к образованию полипептида in vivo, когда она находится под управлением соответствующих последовательностей регуляции. Границы кодирующей последовательности определены инициирующим кодоном на 5'-конце (N-конце) и терминирующим трансляцию кодоном на 3'-конце (C-конце). Последовательность терминации транскрипции может быть расположена ближе 3'-концу относительно кодирующей последовательности.
Под «вектором» понимают любой генетический элемент, такой как плазмида, фаг, транспозон, космида, хромосома, вирус, вирион и т.д., который способен к репликации, если он связан с подходящими управляющими элементами, и который может переносить последовательности генов в клетки. Таким образом, термин включает клонирующие и экспрессирующие носители, а также вирусные векторы.
Под «рекомбинантным вектором» понимают вектор, который содержит гетерологичную последовательность нуклеиновой кислоты, которая способна к экспрессии in vivo.
Под «рекомбинантным вирусом» понимают вирус, который генетически изменен, например, вставкой или инсерцией гетерологичной конструкции нуклеиновой кислоты в частицу.
Термин «трансген» относится к полинуклеотиду, который вводят в клетку и который способен к транскрипции в РНК и, необязательно, трансляции и/или экспрессии в соответствующих условиях. В одном из аспектов он придает желаемое свойство той клетке, в которую его ввели, или иным образом ведет к желаемому терапевтическому или диагностическому исходу.
Термины «геномные частицы (гч)» или «эквиваленты генома», как используется в отношении вирусного титра, относятся к числу вирионов, содержащих геномную ДНК рекомбинантного AAV, независимо от инфекционности или функциональности. Число геномных частиц в конкретном препарате вектора можно измерить посредством процедур, таких как описано в настоящем документе в примерах или, например, в публикациях Clark et al., Hum. Gene Ther. (1999) 10:1031-1039; и Veldwijk et al., Mol. Ther. (2002) 6:272-278.
Термины «инфекционная единица» (ие), «инфекционная частица» или «репликационная единица», как используется в отношении вирусного титра, относятся к числу инфекционных частиц рекомбинантного вектора AAV, которое измеряют посредством анализа инфекционных центров, также известного как анализ репликационных центров, описанный, например, в публикации McLaughlin et al., J. Virol. (1988) 62:1963-1973.
Термин «трансдуцирующая единица» (те), как используется в отношении вирусного титра, относится к числу инфекционных частиц рекомбинантного вектора AAV, которые ведут к образованию функционального продукта трансгена, как измеряется в функциональных анализах, таких как описано в примерах в настоящем документе или, например, в публикации Xiao et al., Exp. Neurobiol. (1997) 144:113-124; или в публикации Fisher et al., J. Virol. (1996) 70:520-532 (анализ LFU).
Термин «трансфекция» используют для обозначения захвата чужеродной ДНК клеткой, а клетку «трансфицируют», когда экзогенную ДНК вводят внутрь клеточной мембраны. В данной области в целом известно множество способов трансфекции. См., например, публикации Graham et al. (1973) Virology, 52:456, Sambrook et al. (1989) Molecular Cloning, a laboratory manual, Cold Spring Harbor Laboratories, New York, Davis et al. (1986) Basic Methods in Molecular Biology, Elsevier, и Chu et al. (1981) Gene 13:197. Такие способы можно использовать для введения одного или нескольких фрагментов экзогенной ДНК в подходящие клетки-хозяева.
Термин «гетерологичный», когда он относится к последовательностям нуклеиновых кислот, таким как кодирующие последовательности и последовательности регуляции, обозначает последовательности, которые обычно не соединены вместе и/или обычно не связаны с конкретной клеткой. Таким образом, «гетерологичная» область конструкции нуклеиновой кислоты или вектора представляет собой фрагмент нуклеиновой кислоты, расположенный внутри или присоединенный к другой молекуле нуклеиновой кислоты, которая в природе не найдена совместно с другой молекулой. Например, гетерологичная область конструкции нуклеиновой кислоты может содержать кодирующую последовательность, фланкированную последовательностями, которые в природе не найдены совместно с кодирующей последовательностью. Другой пример гетерологичной кодирующей последовательности представляет собой конструкцию, где сама кодирующая последовательность не найдена в природе (например, синтетические последовательности, которые содержат кодоны, отличные от нативного гена). Аналогичным образом, клетку, трансформированную конструкцией, которая обычно не присутствует в клетке, будут считать гетерологичной для целей данного изобретения. Аллельное разнообразие или природные мутационные события не являются источником гетерологичных ДНК, как используется в настоящем документе.
Последовательность «нуклеиновой кислоты» относится к последовательности ДНК или РНК. Термин охватывает последовательности, которые содержат любые известные аналоги оснований ДНК и РНК, такие как, но без ограничения, 4-ацетилцитозин, 8-гидрокси-N6-метиладенозин, азиридинилцитозин, псевдоизоцитозин, 5-(карбоксигидроксилметил)урацил, 5-фторурацил, 5-бромурацил, 5-карбоксиметиламинометил-2-тиоурацил, 5-карбоксиметил-аминометилурацил, дигидроурацил, инозин, N6-изопентиладенин, 1-метиладенин, 1-метилпсевдоурацил, 1-метилгуанин, 1-метилинозин, 2,2-диметилгуанин, 2-метиладенин, 2-метилгуанин, 3-метилцитозин, 5-метилцитозин, N6-метиладенин, 7-метилгуанин, 5-метиламинометилурацил, 5-метоксиаминометил-2-тиоурацил, бета-D-маннозилквеозин, 5'-метоксикарбонилметилурацил, 5-метоксиурацил, 2-метилтио-N6-изопентениладенин, сложный метиловый эфир урацил-5-оксиуксусной кислоты, урацил-5-оксиуксусная кислота, оксибутоксозин, псевдоурацил, квеозин, 2-тиоцитозин, 5-метил-2-тиоурацил, 2-тиоурацил, 4-тиоурацил, 5-метилурацил, сложный метиловый эфир -урацил-5-оксиуксусной кислоты, урацил-5-оксиуксусная кислота, псевдоурацил, квеозин, 2-тиоцитозин и 2,6-диаминопурин.
Термин «последовательности регуляции» ДНК в совокупности относится к промоторным последовательностям, сигналам полиаденилирования, последовательностям терминации транскрипции, вышележащим регуляторным доменам, участкам начала репликации, внутренним участкам связывания рибосом («IRES»), энхансерам и т.п., которые в совокупности предоставлены для репликации, транскрипции и трансляции кодирующей последовательности в клетке-реципиенте. Не все эти последовательности регуляции должны всегда присутствовать, при условии, что выбранная кодирующая последовательность способна к репликации, транскрипции и трансляции в соответствующей клетке-хозяине.
Термин «промотор» используют в настоящем документе в его обычном смысле для обозначения нуклеотидной области, содержащей регуляторную последовательность ДНК, где регуляторную последовательность получают из гена, который способен к связыванию РНК-полимеразы и инициации транскрипции нижележащей (в направлении 3'-конца) кодирующей последовательности. Транскрипционные промоторы могут включать «индуцибельные промоторы» (где экспрессию полинуклеотидной последовательности, функционально связанной с промотором, индуцируют с использованием анализируемого вещества, кофактора, регуляторного белка и т.д.), «репрессируемые промоторы» (где экспрессию полинуклеотидной последовательности, функционально связанной с промотором, индуцируют с использованием анализируемого вещества, кофактора, регуляторного белка и т.д.) и «конститутивные промоторы».
«Функционально связанный» относится к расположению элементов, где описанные таким образом компоненты выполнены с возможностью осуществления своей обычной функции. Таким образом, последовательности регуляции, функционально связанные с кодирующей последовательностью, способны осуществлять экспрессию кодирующей последовательности. Последовательности регуляции не обязательно прилегают к кодирующей последовательности при условии, что их функция состоит в управлении ее экспрессией. Таким образом, между промоторной последовательностью и кодирующей последовательностью могут присутствовать, например, промежуточные не транслируемые, но транскрибируемые последовательности, и промоторную последовательность все еще можно считать «функционально связанной» с кодирующей последовательностью.
Термин «нервная система» включает как центральную нервную систему, так и периферическую нервную систему. Термин «центральная нервная система» или «ЦНС» включает все клетки и ткани головного мозга и спинного мозга позвоночных. Термин «периферическая нервная система» относится ко всем клеткам и тканям части нервной системы за пределами головного мозга и спинного мозга. Таким образом, термин «нервная система» включает, но не ограничивается ими, нервные клетки, глиальные клетки, астроциты, клетки в спинномозговой жидкости (CSF), клетки в интерстициальном пространстве, клетки в защитных оболочках спинного мозга, эпидуральные клетки (т.е. клетки за пределами твердой мозговой оболочки), клетки не из нервной ткани, прилегающие к или находящиеся в контакте с или иннервируемые нервной тканью, клетки в эпиневрии, периневрии, эндоневрии, канатики, пучки и т.п.
«Активный» или «активность» для целей настоящего изобретения относится к формам терапевтического белка, которые сохраняют биологическую активность соответствующего нативного или природного полипептида. Активность может быть выше, равна или ниже, чем наблюдаемая у соответствующего нативного или природного полипептида.
Под «выделенной», когда говорят о нуклеотидной последовательности, понимают, что указанная молекула присутствует по существу без других биологических макромолекул того же типа. Таким образом, «выделенная молекула нуклеиновой кислоты, которая кодирует конкретный полипептид», относится к молекуле нуклеиновой кислоты, которая по существу свободна от других молекул нуклеиновой кислоты, которые не кодируют рассматриваемый полипептид; однако молекула может содержать некоторые дополнительные основания или фрагменты, которые не оказывают вредного воздействия на основную характеристику композиции.
С целью описания относительного положения нуклеотидных последовательностей в конкретной молекуле нуклеиновой кислоты на всем протяжении настоящей заявки, например, если конкретную нуклеотидную последовательность описывают как расположенную «выше», «ниже», «3-штрих (3')» или «5-штрих (5')» относительно другой последовательности, то следует понимать, что это означает положение последовательностей в «смысловой» или «кодирующей» цепи молекулы ДНК, что является стандартом в данной области.
Под термином «приблизительно», в частности, в отношении заданной величины, понимают, что он включает отклонение в ±5%.
Термины «субъект», «индивидуум» или «пациент» используют взаимозаменяемо в настоящем документе и относят к позвоночному, предпочтительно, к млекопитающему. Млекопитающие включают, но не ограничиваются ими, мышиных, грызунов, обезьян, человека, сельскохозяйственных животных, спортивных и домашних животных.
Термин «модулировать» в настоящем документе обозначает изменение количества или интенсивности эффекта или исхода, например, усиление, увеличение, ослабление, уменьшение или устранение.
В настоящем документе термин «уменьшить интенсивность» является синонимом «облегчать» и обозначает уменьшение или смягчение. Например, можно уменьшить интенсивность симптомов заболевания или нарушения, сделав заболевание или симптомы заболевания менее тяжелыми.
Термины «терапевтическая», «эффективное количество» или «терапевтически эффективное количество» композиции или средства в настоящем документе относятся к достаточному количеству композиции или агента, чтобы обеспечить желаемый ответ, такой как предупреждение, задержку начала или уменьшение интенсивности симптомов у субъекта, или достижение желаемого биологического исхода, такого как коррекция неврологической патологии, например, клеточной патологии, связанной с заболеванием двигательных нейронов, таким как спинальная мышечная атрофия (SMA). Термин «терапевтическая коррекция» относится к той степени коррекции, которая ведет к предупреждению или задержке начала или уменьшению интенсивности симптомов у субъекта. Точное необходимое количество будет варьировать от субъекта к субъекту, в зависимости от вида, возраста и общего состояния субъекта, тяжести состояния, подлежащего лечению, и конкретной макромолекулы, представляющей интерес, способа введения и т.п. Соответствующее «эффективное» количество в каждом отдельном случае может определить специалист в данной области, используя повседневные эксперименты.
«Лечение» конкретного заболевания включает: (1) предупреждение заболевания, т.е. предупреждение развития заболевания или снижение интенсивности заболевания у субъекта, который может быть подвержен или предрасположен к заболеванию, но пока не испытывает или не проявляет симптомов заболевания, (2) подавление заболевания, т.е. купирование развития или обращение состояния заболевания, или (3) облегчение симптомов заболевания, т.е. снижение числа симптомов, испытываемых субъектом, а также изменение клеточной патологии, связанной с заболеванием.
2. Способы осуществления изобретения
Перед подробным описанием настоящего изобретения следует понять, что данное изобретение не ограничено конкретными составами или параметрами процесса, поскольку их, конечно, можно менять. Также следует понимать, что используемая в настоящем документе терминология служит только цели описания конкретных вариантов осуществления изобретения и не предназначена для ограничения.
Несмотря на то, что можно использовать множество способов и веществ, схожих с теми, что описаны в настоящем документе, или эквивалентных им, в настоящем документе описаны вещества и способы, предпочтительные для осуществления настоящего изобретения на практике.
Центральным для настоящего изобретения является открытие того, что доставка вирионов rAAV, содержащих кДНК гена выживаемости двигательных нейронов 1 человека (hSMN1), в ЦНС в агрессивной модели спинальной мышечной атрофии (SMA) на мышах, вызывала экспрессию SMN1 на всем протяжении спинного мозга. Мыши с SMA, получавшие лечение, содержали большее число двигательных нейронов по сравнению с мутантами с совпадающим возрастом, не получавшими лечение. Кроме того, оценка размера мышечных волокон показывала, что размер отдельных мышечных волокон в различных мышечных группах у мышей с SMA, получавших лечение, приближался к наблюдаемому у мышей дикого типа. Кроме того, структура нервно-мышечного соединения (NMJ) у мышей с SMA, получавших лечение, схожа с мышами дикого типа, что отличалось от мышей с SMA, не получавших лечение, которые демонстрировали аномальное накопление белка нейрофиламента в пресинаптических терминалях. Мыши с SMA, получавшие лечение, также проявляли значительные улучшения в комплексе поведенческих тестов, что указывает на функциональность NMJ. Важно, что мыши, которых лечили рекомбинантным AAV, обладали значительно увеличенной продолжительностью жизни по сравнению с их двойниками, не получавшими лечение. Мыши с SMA, которых лечили с использованием самокомплементарного вектора rAAV, также проявляли заметное улучшение среднего значения выживаемости, даже по сравнению с лечением путем использования стандартных не самокомплементарных векторов rAAV.
Эти результаты демонстрируют, что направленное на ЦНС, опосредованное AAV усиление гена SMN1 является высокоэффективным в отношении как нейрональных, так и мышечных патологий SMA и свидетельствуют о полезности вирусной генной терапии в качестве терапевтической стратегии для лечения и предотвращения нейрональных и мышечных патологий, таких как SMA, а также других заболеваний, которые влияют на двигательную функцию. Описанные в настоящем документе способы генной терапии можно использовать отдельно или в сочетании с традиционными лекарственными средствами.
Для того чтобы более глубоко понять изобретение, ниже приведено более подробное обсуждение, касающееся патологий двигательных нейронов и терапевтических молекул, а также различных способов доставки генов для использования с настоящим изобретением.
Патологии двигательных нейронов и терапевтические молекулы
Рассматриваемое изобретение предусматривает композиции и способы для модуляции, коррекции или усиления двигательной функции у субъекта, пораженного нарушением двигательных нейронов или расстройством двигательных нейронов. Только с иллюстративной целью, субъект может страдать одним или несколькими из спинальной мышечной атрофии (SMA), бокового амиотрофического склероза (ALS), спинобульбарной мышечной атрофии, спиноцеребеллярной атаксии, первичного латерального склероза (PLS) или травматического повреждения спинного мозга. Не ограничиваясь конкретной теорией, патология, связанная с повреждением двигательных нейронов, может включать дегенерацию двигательных нейронов, глиоз, аномалии нейрофиламентов, потерю миелинизированных волокон в корково-спинномозговых путях и передних корешках. Например, выявлено два типа начала - бульбарное начало, которое поражает верхние двигательные нейроны (двигательные нейроны коры и ствола головного мозга), поражает мимические мышцы, речь и глотание; и начало в конечностях, поражающее расположенные ниже двигательные нейроны (двигательные нейроны спинного мозга), которое отражено в спазмах, общей слабости, мышечной атрофии, параличе и дыхательной недостаточности. При ALS у субъектов бывает как бульбарное начало, так и начало в конечностях. При PLS у субъектов бывает только бульбарное начало.
Таким образом, в определенных вариантах осуществления субъекту предоставляют конструкции rAAV, которые кодируют биологически активную молекулу, экспрессия которой в ЦНС ведет по меньшей мере к частичной коррекции неврологической патологии и/или к стабилизации развития заболевания, такой как предупреждение, задержка начала или уменьшение интенсивности симптомов у субъекта или достижение желаемого биологического исхода, включая, например, изменение клеточной патологии, связанной с описанным выше заболеванием двигательных нейронов.
В качестве примера, трансген, присутствующий в конструкции rAAV, может представлять собой, но ими не ограничиваясь, белок выживаемости двигательных нейронов (посредством гена SMN1 или гена SMN2), инсулиноподобный фактор роста-1 (IGF-1), кальбиндин D28, парвальбумин, HIF1-α, SIRT-2, VEGF, такой как VEGF165, CNTF (цилиарный нейротрофический фактор), соник хеджхога (shh), эритропоэтин (EPO), лизилоксидазу (LOX), програнулин, пролактин, грелин, нейросерпин, ангиогенин и лактоген плаценты.
Молекулярная основа SMA, аутосомного рецессивного нервно-мышечного нарушения, заключается в гомозиготной потере гена выживаемости двигательных нейронов 1 (SMN1), который также может быть известен как теломерный SMN. Почти идентичная копия гена SMN1, названная SMN2, которая также может быть известна как центромерный SMN, найдена у человека и модулирует тяжесть заболевания. Экспрессия нормального гена SMN1 ведет только к экспрессии белка выживаемости двигательных нейронов (SMN). Экспрессия гена SMN2 ведет к образованию приблизительно 10-20% белка SMN и 80-90% нестабильного/нефункционального белка SMNdelta7. Только 10% транскриптов SMN2 кодируют функциональный полноразмерный белок, идентичный SMN1. Это функциональное различие между генами происходит из трансляционно молчащей мутации, которая, однако, разрушает экзонный энхансер сплайсинга, что обуславливает пропуск экзона 7 в большинстве транскриптов SMN2. Белок SMN играет точно установленную роль в сборке сплайсосомы, а также может опосредовать транспорт мРНК в аксоны и нервные окончания нейронов.
Известны нуклеотидные и аминокислотные последовательности различных молекул SMN1 и белков SMN. См., например, фиг.9A-9B; NCBI номер доступа NM_000344 (человек), NP_000335 (человек), NM_011420 (мышь), EU 791616 (свинья), NM_001131470 (орангутан), NM_131191 (данио), BC062404 (крыса), NM_001009328 (кошка), NM_001003226 (собака), NM_175701 (корова). Также известны различные последовательности SMN2. См., например, NCBI номер доступа NM_022876, NM_022877, NM_017411, NG_008728, BC_000908, BC070242, DQ185039 (все относятся к человеку).
Инсулиноподобный фактор роста 1 (IGF-1) представляет собой терапевтический белок для лечения нейродегенеративных нарушений, включая нарушения двигательных нейронов, благодаря его множественному действию на различных уровнях осевой части центральной нервной системы (см. Dore et al., Trends Neurosci (1997) 20:326-331). Например, полагают, что в головном мозге он снижает апоптоз нейронов и клеток глии, защищает нейроны от токсического действия, вызванного железом, колхицином, кальциевыми дестабилизаторами, пероксидами и цитокинами. По-видимому, он также модулирует высвобождение нейромедиаторов ацетилхолина и глутамата и индуцирует экспрессию нейрофиламента, тубулина и основного белка миелина. Полагают, что в спинном мозге IGF-1 модулирует активность ChAT и снижает потерю холинергического фенотипа, усиливает спрутинг двигательных нейронов, усиливает миелинизацию, ингибирует демиелинизацию, стимулирует пролиферацию и дифференциацию двигательных нейронов из клеток-предшественников и ускоряет деление, созревание и рост Шванновских клеток. В мышце IGF-1, по-видимому, индуцирует образование кластеров рецептора ацетилхолина в нервно-мышечном соединении и повышает нервно-мышечную функцию и мышечную силу.
Ген IGF-1 имеет сложную структуру, которая хорошо известна в данной области. Он имеет по меньшей мере два продукта альтернативного сплайсинга мРНК, образуемых из транскрипта гена. Это пептид из 153 аминокислот, известный под несколькими названиями, включая IGF-IA или IGF-IEa, и пептид из 195 аминокислот, известный под несколькими названиями, включая IGF-IB или IGF-IEb. У человека форма Eb также известна как Ec. Зрелая форма IGF-I представляет собой полипептид из 70 аминокислот. Как IGF-IEa, так и IGF-IEb содержат зрелый пептид из 70 аминокислот, но отличаются последовательностью и длиной их C-концевых удлинений. Белки IGF-1, а также пептидные последовательности IGF-IEa и IGF-IEb известны и описаны, например, в международной публикации № WO 2007/146046, которая включена в настоящий документ посредством ссылки в полном объеме. Геномные и функциональные кДНК IGF-I человека, а также дополнительную информацию относительно гена IGF-I и его продуктов можно получить по номеру доступа Unigene NM_000618.
Кальбиндин D28K (также обозначаемый как кальбиндин D28) и парвальбумин представляют собой кальций-связывающие белки, которые предположительно участвуют в буферизации кальция. Не ограничиваясь конкретной теорией, по-видимому, у субъектов с нарушением двигательных нейронов (например, с ALS) изменяется гомеостаз кальция, и низкие уровни кальбиндина-D28K и/или парвальбумина могут повысить уязвимость двигательных нейронов путем снижения их способности справляться с повышенной кальциевой нагрузкой. Это снижение может вести к повреждению клеток и возможной гибели двигательных нейронов. Дополнительные факты подсказывают, что нейроны с высоким содержанием кальций-связывающих белков, таких как кальбиндин D28K и парвальбумин, устойчивы к дегенерации.
HIF-I представляет собой гетеродимерный белок, состоящий из двух субъединиц: (i) конститутивно экспрессируемой субъединицы β, также известной как ядерный транслокатор арилуглеводородного рецептора (ARNT) (который совместно используют другие родственные факторы транскрипции (например, диоксин/арилуглеводородный рецептор (DR/AhR)); и (ii) субъединицы α (см., например, международную публикацию № WO 96/39426, описание новой аффинной очистки и молекулярного клонирования HIF-Iα. Обе субъединицы являются членами семейства факторов транскрипции с основным мотивом спираль-петля-спираль (bHLH)-PAS. Эти домены регулируют связывание и димеризацию ДНК. Домен трансактивации расположен на C-конце белка. Основная область состоит приблизительно из 15 преимущественно основных аминокислот, отвечающих за непосредственное связывание ДНК. Эта область прилегает к двум амфипатическим α-спиралям, разделенным петлей переменной длины, которая формирует область контакта для первичной димеризации среди членов семейства (Moore, et al., Proc. Natl. Acad. Sci. USA (2000) 97: 10436-10441). Домен PAS включает 200-300 аминокислот, содержащих две области с низкой консервативностью и высокой гидрофобностью приблизительно в 50 аминокислот, обозначенные PAS A и PAS B. Субъединица HIF-Iα не стабильна в условиях нормоксии, сверхэкспрессия этой субъединицы в культивируемых клетках при нормальных уровнях кислорода может индуцировать экспрессию генов, обычно индуцируемых гипоксией. Замена C-концевой области (или области трансактивации) белка индуцируемого гипоксией фактора на сильный домен трансактивации из белка транскрипционного активатора, такого как, например, VP16 вируса простого герпеса (HSV), NFκB или факторы транскрипции дрожжей GAL4 и GCN4, предназначена для того, чтобы стабилизировать белок в условиях нормоксии и обеспечить мощную конститутивную активацию транскрипции. См., например, описание и последовательность белка характерного стабилизированного индуцируемого гипоксией фактора, который представляет собой гибридный/химерный слитый белок, состоящий из ДНК-связывающего домена и домена димеризации из HIF-Iα и домена трансактивации из белка VP16 HSV, в международной публикации № WO 2008/042420, которая включена в настоящий документ посредством ссылки в полном объеме. Также см. описание конститутивно стабильного гибридного HIF-Iα в патентах США №№ 6432927 и 7053062, оба из которых в полном объеме включены в настоящий документ посредством ссылки.
Члены семейства фактора роста эндотелия сосудов (VEGF) входят в число наиболее мощных модуляторов биологических процессов в сосудах. Они регулируют васкулогенез, ангиогенез и обновление сосудов. Описаны четыре различных молекулярных варианта VEGF. Вариант из 165 аминокислот является преобладающей молекулярной формой, найденной в нормальных клетках и тканях. Также известны менее обильная и более короткая форма с делецией 44 аминокислот между положениями 116 и 159 (VEGF121), более длинная форма с инсерцией из 24 основных остатков в положении 116 (VEGF189) и другая более длинная форма с инсерцией из 41 аминокислоты (VEGF206), которая включает инсерцию из 24 аминокислот, найденную в VEGF189. VEGF121 и VEGF165 представляют собой растворимые белки. VEGF189 и VEGF206, по-видимому, преимущественно связаны с клеткой. Все версии VEGF являются биологически активными. См., например, описание последовательности VEGF165 (также см. номер доступа GenBank AB021221), VEGF121 (также см. номер доступа GenBank AF214570) и VEGF189 в публикации Tischer et al., J. Biol. Chem. (1991) 266:11947-11954.; и описание последовательности VEGF206 в публикации Houck et al., Mol. Endocrinol. (1991) 5:1806-1814.
CNTF (цилиарный нейротрофический фактор) представляет собой нейроцитокин, экспрессируемый глиальными клетками в периферических нервах и центральной нервной системе. Общеизвестно, что функция CNTF заключается в поддержании и выживаемости не нейрональных и нейрональных типов клеток. См., например, Vergara, C and Ramirez, B; Brain Res, Brain Res. Rev. (2004) 47: 161-73.
Соник хеджхог (Shh) контролирует важные процессы, связанные с развитием, включая выживаемость нейрональных и глиальных клеток.
Эритропоэтин (EPO) является главным регулятором эритроидных клеток-предшественников. Однако его функционально экспрессирует нервная система, и сообщалось, что он обладает нейропротективными эффектами. См., например, Bartesaghi, S., 2005. Neurotoxicology, 26:923-8. Гены, кодирующие EPO человека и других млекопитающих, клонировали, секвенировали и экспрессировали, и среди различных видов в кодирующей области они обладают высокой степенью гомологии последовательностей. Wen et al., Blood (1993) 82:1507-1516. Последовательность гена, кодирующего нативный EPO человека, а также способы его получения описаны, например, в патентах США №№ 4954437 и 4703008, включенных в настоящий документ посредством ссылки в полном объеме, а также в публикациях Jacobs et al. (1985) Nature 313:806-810; Lin et al. (1985) Proc. Natl. Acad. Sci USA 82:7580; международной публикации № WO 85/02610; и публикации европейского патента № 232034 B1. Кроме того, последовательности генов, кодирующих нативные EPO кошки, собаки и свиньи, известны и легко доступны (№№ доступа GenBank: L10606; L13027 и L10607, соответственно), а также известна и доступна последовательность гена, кодирующая EPO обезьяны (Macaca mulatta) (номер доступа GenBank: L10609).
Лизилоксидаза (LOX) окисляет боковую цепь пептидил-лизина, тем самым превращая определенные остатки лизина в альфа-аминоадипиновый-дельта-полуальдегид. Это представляет собой посттрансляционное изменение, которое, например, делает возможным ковалентное сшивание составных цепей коллагена и эластина. Это стабилизирует фиброзные отложения указанных белков во внеклеточном матриксе. LOX также может окислять лизин в различных катионных белках, указывая на то, что ее функции шире, чем стабилизация или внеклеточный матрикс. LOX синтезируется в виде белка-предшественника; он выходит из клетки в виде proLOX и подвергается протеолитическому процессингу в активный фермент. См., например, Lucero, HA and Kagan, HM, Cell Mol. Life Sci (2006) 63:2304-2316.
Програнулин (PGRN) представляет собой плейотропный белок. Мутации в данном гене вызывают лобно-височную лобарную дегенерацию. Экспрессия PGRN в ЦНС происходит в микроглии и нейронах, и он играет роль в развитии головного мозга. PGRN также участвует в нескольких процессах «моделирования тканей», включая развитие, заживление ран и образование опухолей. Ферменты эластазы превращают PGRN в гранулин (GRN). Тогда как програнулин обладает трофическими свойствами, GRN более близки к медиаторам воспаления. Исследования экспрессии генов на моделях заболеваний ЦНС на животных показывают дифференциальное повышение PRGN в сочетании с активацией микроглии и воспалением. Повышение экспрессии PGRN может быть плотно связано с активацией микроглии и нейровоспалением. Кроме того, повышение экспрессии PGRN происходит в активированной микроглии при многих нейродегенеративных заболеваниях, включая заболевания двигательных нейронов и болезнь Альцгеймера. Исследования выявили мутации в PGRN в качестве причины нейродегенеративного заболевания и указывают на важность функции PGRN для нейрональной выживаемости.
На всем протяжении взрослого периода из клеток-предшественников олигодендроцитов (OPC) продолжается образование олигодендроцитов, миелинизирующих клеток ЦНС, которые необходимы для внутреннего восстановления повреждений миелина во взрослой ЦНС. В значительной степени известны физиологические события, которые модулируют пролиферацию OPC и образование новых миелинизирующих олигодендроцитов во взрослой ЦНС. Недавно поступило сообщение о том, что пациенты с рассеянным склерозом (MS), демиелинизирующим заболеванием, обладают сниженной частотой рецидивирования в третьем триместре беременности, что наводит на мысль о том, что гормоны влияют на образование олигодендроцитов. Ремиссия у пациентов с MS коррелирует со снижением числа и размера активных повреждений белого вещества. Беременность у мышей приводит к увеличению образования новых олигодендроцитов и числа миелинизированных аксонов в ЦНС матери (Gregg et al., J. Neurosci. (2007) 27:1812-1823). Показано, что пролактин, гормон, уровень которого выравнивается на последней стадии беременности, регулирует пролиферацию OPC в течение беременности и способствует заживлению белого вещества у неоплодотворенных самок мышей (Gregg et al., J. Neurosci. (2007) 27:1812-1823).
Лактоген плаценты человека (hPL), гормон, уровень которого также поднимается в течение третьего триместра беременности, может обладать аналогичным влиянием на генерацию олигодендроцита. hPL имеет несколько биологических активностей, которые качественно схожи с гормоном роста человека (hGH) и пролактином, и, по-видимому, является основным регулятором образования IGF-I. Показано, что как hGH, так и IGF-I являются стимуляторами миелинизации во взрослой ЦНС (Carson et al., Neuron (1993) 10:729-740; Peltwon et al., Neurology (1977) 27:282-288). Следовательно, лечение заболеваний ЦНС, в которые вовлечена демиелинизация, таких как MS, ALS, инсульт и повреждение спинного мозга, может выиграть от терапии на основе PRL или hPL, например, посредством внутрижелудочковой инъекции экспрессирующего rhPRL или hPL вирусного вектора.
Грелин представляет собой гормон желудка, который является медиатором высвобождения гормона роста. См. например Wu, et al., Ann. Surg. (2004) 239:464.
Нейросерпин является членом семейства ингибиторов протеазы серпинов. В определенных состояниях ЦНС нейросерпин может играть нейропротективную роль, возможно, посредством блокирования эффектов tPA. См., например, Galliciotti, G and Sonderegger, P, Front Biosci (2006) 11:33; Simonin, et al., (2006) 26:10614; Miranda, E and Lomas, DA, Cell Mol Life Sci (2006) 63:709.
Ангиогенин является членом суперсемейства РНКаз. Он является нормальным компонентом кровообращения, но также в нарушениях двигательных нейронов участвует в качестве фактора риска.
В определенных композициях и способах по изобретению можно доставлять более чем один трансген, кодирующий более чем одну описанную выше терапевтическую молекулу, где каждый трансген функционально связан с промотором для того, чтобы обеспечить возможность экспрессии трансгенов из одного вектора AAV. В дополнительных способах трансгены могут быть функционально связаны с одним промотором. Каждый трансген кодирует биологически активную молекулу, экспрессия которой в ЦНС ведет к по меньшей мере частичной коррекции неврологической патологии. Дополнительно, в тех случаях, когда доставляют более чем один трансген, трансгены можно доставлять посредством более чем одного вектора AAV, где каждый вектор AAV содержит трансген, функционально связанный с промотором.
Нативные молекулы, а также их активные фрагменты и аналоги, которые сохраняют желаемую биологическую активность, как измерено в любом из множества анализов и животных моделей, включая дополнительно описанные в настоящем документе, предназначены для использования с настоящим изобретением.
Полинуклеотиды, кодирующие желаемый белок, для использования с настоящим изобретением можно получить, используя стандартные способы молекулярной биологии. Например, полинуклеотидные последовательности, кодирующие описанные выше молекулы, можно получать, используя рекомбинантные способы, например, посредством скрининга библиотек кДНК и геномных библиотек из клеток, экспрессирующих ген, или посредством доставки гена из вектора, о котором известно, что он индуцирует это. Ген, представляющий интерес, также можно получить синтетическим путем, а не клонированием, на основе известных последовательностей. Молекулы можно конструировать с использованием соответствующих кодонов для конкретной последовательности. Затем полную последовательность собирают из перекрывающихся олигонуклеотидов, полученных стандартными способами, и собирают в полную кодирующую последовательность. См., например, Edge, Nature (1981) 292:756; Nambair et al., Science (1984) 223:1299; и Jay et al., J. Biol. Chem. (1984) 259:6311.
Таким образом, конкретные нуклеотидные последовательности можно получить из векторов, содержащих желаемые последовательности, или синтезировать полностью или частично, используя различные способы синтеза олигонуклеотидов, известные в данной области, такие как способы сайт-специфического мутагенеза и полимеразной цепной реакции (ПЦР), где это применимо. См., например, Sambrook, выше. Один способ получения нуклеотидных последовательностей, кодирующих желаемые последовательности, заключается в ренатурации комплементарных наборов перекрывающихся синтетических олигонуклеотидов, получаемых в стандартном автоматизированном синтезаторе полинуклеотидов, с последующими лигированием с использованием соответствующей ДНК лигазы и амплификацией лигированной нуклеотидной последовательности посредством ПЦР. См., например, Jayaraman et al., Proc. Natl. Acad. Sci. USA (1991) 88:4084-4088. Дополнительно олигонуклеотид-направленный синтез (Jones et al., Nature (1986) 54:75-82), олигонуклеотид-направленный мутагенез предварительно существующих нуклеотидных областей (Riechmann et al., Nature (1988) 332:323-327 и Verhoeyen et al., Science (1988) 239:1534-1536) и ферментативное заполнение пропущенных олигонуклеотидов с использованием ДНК полимеразы T4 (Queen et al., Proc. Natl. Acad. Sci. USA (1989) 86:10029-10033) можно использовать для предоставления молекул для использования в рассматриваемых способах.
После получения конструкции доставляют, используя рекомбинантные вирусные векторы, как описано дополнительно ниже.
Способы доставки генов AAV
Описанные выше конструкции доставляют рассматриваемому субъекту с использованием любого из нескольких способов доставки генов rAAV. В данной области известно несколько AAV-опосредованных способов доставки генов. Как описано дополнительно ниже, гены можно доставлять или непосредственно субъекту или, альтернативно, доставлять ex vivo, в соответствующие клетки, такие как клетки, которые получают у субъекта, и клетки, которые повторно имплантируют субъекту.
Для доставки генов разработаны различные системы векторов AAV. Векторы AAV можно легко сконструировать, используя способы, хорошо известные в данной области. См., например, патенты США №№ 5173414 и 5139941; международные публикации №№ WO 92/01070 (опубликована 23 января 1992 года) и WO 93/03769 (опубликована 4 марта 1993 года); Lebkowski et al., Molec. Cell. Biol. (1988) 8:3988-3996; Vincent et al., Vaccines 90 (1990) (Cold Spring Harbor Laboratory Press); Carter, BJ. Current Opinion in Biotechnology (1992) 3:533-539; Muzyczka, N. Current Topics in Microbiol. and Immunol. (1992) 158:97-129; Kotin, R.M. Human Gene Therapy (1994) 5:793-801; Shelling and Smith, Gene Therapy (1994) 1:165-169; и Zhou et al., J. Exp. Med. (1994) 179:1867-1875. Системы векторов AAV также описаны более подробно ниже.
Геном AAV представляет собой линейную одноцепочечную молекулу ДНК, содержащую приблизительно 4681 нуклеотид. Как правило, геном AAV содержит внутренний, неповторяющийся геном, фланкированный на каждом конце инвертированными концевыми повторами (ITR). ITR имеют длину приблизительно 145 пар нуклеотидов (п.н.). ITR имеют несколько функций, включая предоставление точек начала репликации ДНК, и упаковку сигналов для вирусного генома. Внутренняя неповторяющаяся часть генома содержит две большие открытые рамки считывания, известные как гены репликации (rep) и капсида (cap) AAV. Гены rep и cap кодируют вирусные белки, которые позволяют вирусу осуществлять репликацию и упаковку в вирион. В частности, из области rep AAV экспрессируют семейство по меньшей мере из четырех вирусных белков, Rep 78, Rep 68, Rep 52 и Rep 40, которые названы согласно их кажущейся молекулярной массе. Область cap AAV кодирует по меньшей мере три белка, VP1, VP2 и VP3.
AAV сконструирован для доставки генов, представляющих интерес, путем удаления внутренней неповторяющейся части генома AAV (т.е. генов rep и cap) и вставки гетерологичного гена между ITR. Гетерологичный ген обычно функционально связан с гетерологичным промотором (конститутивным, специфичным для клетки или индуцибельным), способным управлять экспрессией гена в целевых клетках пациента в соответствующих условиях. Примеры промоторов каждого типа хорошо известны в данной области. Также могут быть включены сигналы терминации, такие как сайты полиаденилирования.
AAV представляет собой хелпер-зависимый вирус; иными словами, для образования вирионов AAV необходима совместная инфекция вирусом-хелпером (например, аденовирусом, вирусом герпеса или вирусом осповакцины). В отсутствие совместной инфекции вирусом-хелпером, AAV переходит в латентное состояние, в котором вирусный геном встраивается в хромосому клетки-хозяина, но образования инфекционных вирионов не происходит. Последующая инфекция вирусом-хелпером «спасает» интегрированный геном, предоставляя возможность репликации и упаковки этого генома в инфекционный вирион AAV. Несмотря на то, что AAV может инфицировать клетки различных видов, вирус-хелпер должен относиться к тому же виду, что и клетка-хозяин. Таким образом, например, AAV человека будет осуществлять репликацию в клетках собаки, которые совместно инфицированы аденовирусом собаки.
Рекомбинантные вирионы AAV, содержащие ген, представляющий интерес, можно получать, используя различные принятые в данной области способы, которые более полно описаны ниже. AAV и вирусы-хелперы дикого типа можно использовать для обеспечения необходимых репликативных функций с целью получения вирионов rAAV (см., например, патент США № 5139941, включенный в настоящий документ посредством ссылки в полном объеме). Альтернативно, можно использовать плазмиду, содержащую гены, выполняющие функцию хелпера, в сочетании с инфицированием одним из хорошо известных вирусов-хелперов в качестве источника репликативных функций (см., например, патент США № 5622856 и патент США № 5139941, которые включены в настоящий документ посредством ссылки в полном объеме). Аналогичным образом, плазмиду, содержащую гены со вспомогательными функциями, можно использовать в сочетании с инфекцией AAV дикого типа, чтобы обеспечить необходимые репликативные функции. В случае использования в сочетании с вектором rAAV, существует три подхода, каждого из которых достаточно для получения вирионов rAAV. Специалист в данной области также может использовать другие подходы, хорошо известные в данной области, для получения вирионов rAAV.
В одном из вариантов осуществления настоящего изобретения способ тройной трансфекции (подробно описан в патенте США № 6001650, включенном в настоящий документ посредством ссылки в полном объеме), используют для получения вирионов rAAV, поскольку данный способ не требует использования инфекционного вируса-хелпера, позволяя получать вирионы rAAV без какого-либо поддающегося обнаружению присутствия вируса-хелпера. Это осуществляют, используя три вектора для получения вириона rAAV: вектор AAV с функцией хелпера, вектор со вспомогательной функцией и экспрессирующий вектор rAAV. Однако специалист в данной области примет во внимание, что последовательности нуклеиновой кислоты, кодируемые этими векторами, могут быть представлены в двух или более векторах в различных сочетаниях.
Как объясняется в настоящем документе, вектор AAV с функцией хелпера кодирует последовательности «функции хелпера AAV» (т.е. rep и cap), эта функция in trans для производительной репликации и капсидирования AAV. Предпочтительно, вектор AAV с функцией хелпера поддерживает эффективное образование вектора AAV без образования каких-либо поддающихся определению вирионов AAV WT (т.е. вирионов AAV, содержащих функциональные гены rep и cap). Пример такого вектора, pHLP19, описан в патенте США № 6001650, включенном в настоящий документ посредством ссылки в полном объеме. Гены rep и cap вектора AAV с функцией хелпера можно получить из AAV любого известного серотипа, как объясняется выше. Например, вектор AAV с функцией хелпера может иметь ген rep, полученный из AAV-2, и ген cap, полученный из AAV-6; специалист в данной области примет во внимание, что возможны другие сочетания генов rep и cap, а определяющим признаком является способность поддерживать образование вириона rAAV.
Вектор со вспомогательной функцией кодирует нуклеотидные последовательности для вирусных и/или клеточных функций, которые получены не из AAV, от которых зависит репликация AAV (т.е. «вспомогательные функции»). Вспомогательные функции включают те функции, которые необходимы для репликации AAV, включая, без ограничения, те фрагменты, которые участвуют в активации транскрипции генов AAV, стадиеспецифического сплайсинга мРНК AAV, репликации ДНК AAV, синтезе продуктов экспрессии cap и сборке капсида AAV. Вирусные вспомогательные функции можно получать из любого хорошо известного вируса-хелпера, такого как аденовирус, вирус герпеса и вирус осповакцины. В одном из вариантов осуществления используют плазмиду со вспомогательной функцией pLadeno5 (подробности относительно pLadeno5 описаны в патенте США № 6004797, включенном в настоящий документ посредством ссылки в полном объеме). Эта плазмида обеспечивает полный набор вспомогательных функций аденовируса для получения вектора AAV, но не содержит компоненты, необходимые для формирования репликативно-компетентного аденовируса.
Для более глубокого ознакомления с AAV ниже приведено более подробное обсуждение, которое касается рекомбинантных экспрессирующих векторов AAV и хелперных и вспомогательных функций AAV.
Рекомбинантные экспрессирующие векторы AAV
Рекомбинантные экспрессирующие векторы AAV (rAAV) конструируют с использованием известных способов для того, чтобы предоставить по меньшей мере в виде функционально связанных компонентов в направлении транскрипции управляющие элементы, которые включают область инициации транскрипции, полинуклеотид, представляющий интерес, и область терминации транскрипции. Управляющие элементы выбирают так, чтобы они функционировали в клетке, представляющей интерес, такой как клетка млекопитающего. Полученную конструкцию, которая содержит функционально связанные компоненты, связывают (5' и 3') с функциональными последовательностями ITR AAV.
Нуклеотидные последовательности областей ITR AAV известны. Последовательность AAV-2 см., например, в публикациях Kotin, R.M. (1994) Human Gene Therapy 5:793-801; Berns, K.I. “Parvoviridae and their Replication” в Fundamental Virology, 2nd Edition, (B.N. Fields and D.M. Knipe, eds.). ITR AAV, используемые в векторах по изобретению, не обязаны содержать нуклеотидную последовательность дикого типа и могут быть изменены, например, инсерциями, делециями или заменами нуклеотидов. Дополнительно, ITR AAV можно получить из любого из нескольких серотипов AAV, включая без ограничения AAV-1, AAV-2, AAV-3, AAV-4, AAV-5, AAV-6, AAV-7, AAV-8, AAV-9 и т.д. Кроме того, 5' и 3' ITR, которые фланкируют выбранную нуклеотидную последовательность в экспрессирующем векторе AAV, не обязательно идентичны тому же серотипу или изоляту AAV или получены из него при условии, что их функции отвечают ожиданиям, т.е. позволяют вырезать и спасать последовательность, представляющую интерес, из генома клетки-хозяина или вектора, и позволяет интегрировать молекулу ДНК в геном клетки-реципиента, когда продукты гена Rep AAV присутствуют в клетке.
Размер полинуклеотидных молекул, подходящих для использования в традиционных векторах AAV, составляет менее чем или приблизительно 5 тысяч нуклеотидов (т.п.н.). Выбранная полинуклеотидная последовательность функционально связана с управляющими элементами, которые управляют ее транскрипцией или экспрессией у субъекта in vivo. Такие управляющие элементы могут содержать последовательности регуляции, которые обычно связаны с выбранным геном. Альтернативно, можно использовать гетерологичные последовательности регуляции. Эффективные гетерологичные последовательности регуляции, как правило, включают те, что получены из последовательностей, кодирующих гены млекопитающих или вирусов. Неограничивающие примеры промоторов включают, но не ограничиваются ими, промотор цитомегаловируса (CMV) (Kaplitt et al., Nat. Genet. (1994) 8:148-154), промотор β3-глобина CMV/человека (Mandel et al., J. Neurosci. (1998) 18:4271-4284), промотор GFAP (Xu et al., Gene Ther. (2001) 8:1323-1332), промотор нейронспецифической енолазы длиной 1,8 т.п.н. (NSE) (Klein et al., Exp. Neurol. (1998) 150:183-194), промотор β-актина курицы (CBA) (Miyazaki, Gene (1989) 79:269-277), промотор β-глюкуронидазы (GUSB) (Shipley et al., Genetics (1991) 10:1009-1018) и промоторы убиквитина, например, выделенные из убиквитина A человека, убиквитина B человека и убиквитина C человека, как описано в патенте США № 6667174, включенном в настоящий документ посредством ссылки в полном объеме. Чтобы продлить экспрессию, другие регуляторные элементы дополнительно могут быть функционально связаны с трансгеном, такие как, например, пострегуляторный элемент вируса гепатита лесного сурка (WPRE) (Donello et al., J. Virol. (1998) 72:5085-5092) или сайт полиаденилирования бычьего гормона роста (BGH). Кроме того, последовательности, получаемые из невирусных генов, таких как ген металлотионеина мыши, также найдут применение в настоящем документе. Такие промоторные последовательности коммерчески доступны, например, от Stratagene (San Diego, CA).
Для некоторых применений генной терапии ЦНС может потребоваться контроль активности транскрипции. С этой целью можно обеспечить фармакологическую регуляцию экспрессии гена с использованием вирусных векторов, включающих различные регуляторные элементы и промоторы, чувствительные к лекарственным средствам, как описано, например, в публикациях Habermaet al., Gene Ther. (1998) 5:1604-16011; и Ye et al., Science (1995) 283:88-91.
Экспрессирующий вектор AAV, который содержит полинуклеотидную молекулу, представляющую интерес, фланкированную ITR AAV, можно сконструировать путем непосредственной вставки выбранной последовательности(ей) в геном AAV, из которого вырезали основные открытые рамки считывания (“ORF”) AAV. Другие части генома AAV также можно удалить при условии, что оставляют достаточную часть ITR для того, чтобы сделать возможными функции репликации и упаковки. Такие конструкции можно конструировать, используя способы, хорошо известные в данной области. См., например, патенты США №№ 5173414 и 5139941; международные публикации №№ WO 92/01070 (опубликована 23 января 1992 года) и WO 93/03769 (опубликована 4 марта 1993 года); Lebkowski et al. (1988) Molec. Cell. Biol. 8:3988-3996; Vincent et al. (1990) Vaccines 90 (Cold Spring Harbor Laboratory Press); Carter (1992) Current Opinion in Biotechnology 3:533-539; Muzyczka (1992) Current Topics in Microbiol. and Immunol. 158:97-129; Kotin (1994) Human Gene Therapy 5:793-801; Shelling and Smith (1994) Gene Therapy 1:165-169; и Zhou et al. (1994) J. Exp. Med. 179:1867-1875.
Альтернативно, ITR AAV можно вырезать из вирусного генома или из вектора AAV, содержащего такие же и слитые 5' и 3' выбранной конструкции нуклеиновой кислоты, которая присутствует в другом векторе, с использованием стандартных способов лигирования, таких как те, что описаны в Sambrook et al., выше. Например, лигирование можно осуществлять в 20 мМ Tris-Cl pH 7,5, 10 мМ MgCl2, 10 мМ DTT, 33 мкг/мл BSA, 10 мМ-50 мМ NaCl и или 40 мкМ АТФ, 0,01-0,02 (Weiss) единиц ДНК лигазы T4 при 0°C (для лигирования «липких концов»), или 1 мМ АТФ, 0,3-0,6 (Weiss) единиц ДНК лигазы T4 при 14°C (для лигирования «тупых концов»). Межмолекулярное лигирование «липких концов» обычно осуществляют при общей концентрации ДНК 30-100 мкг/мл (5-100 нМ общая конечная концентрация). Векторы AAV, которые содержат ITR, описаны, например, в патенте США № 5139941. В частности, в настоящем документе описаны несколько векторов AAV, которые доступны из American Type Culture Collection («ATCC») под номерами доступа 53222, 53223, 53224, 53225 и 53226.
В определенных вариантах осуществления экспрессирующие векторы rAAV представлены в виде самокомплементарных конструкций rAAV. Обычно, ДНК rAAV упакована в вирусный капсид в виде одноцепочечной молекулы ДНК (оцДНК) длиной приблизительно 4600 нуклеотидов. После инфицирования клетки вирусом одноцепочечную ДНК конвертируют в форму двухцепочечной ДНК (дцДНК). Только дцДНК могут использовать белки клетки, которые транскрибируют содержащийся ген или гены в РНК. Таким образом, стандартная схема репликации AAV требует синтеза de novo комплементарной цепи ДНК. Эту стадию конвертирования оцДНК генома AAV в дцДНК перед экспрессией можно обойти использованием самокомплементарных (sc) векторов.
Самокомплементарные векторы получают спариванием оснований комплементарных цепей из двух инфицирующих вирусов, что не требует синтеза ДНК (см., например, Nakai et al., J. Virol. (2000) 74:9451-9463). Это спаривание оснований между цепями или ренатурация цепей (SA) возможны, поскольку AAV упаковывает или плюс- или минус-цепь ДНК с равной эффективностью (Berns, K.I., Microbiol. Rev. (1990) 54:316-329).
Таким образом, и без ограничения теорией, необходимость конвертирования дцДНК, или посредством SA или посредством синтеза ДНК, можно полностью обойти посредством упаковки обеих цепей в виде одной молекулы. Этого можно добиться, если использовать склонность AAV к образованию димерных геномов с инвертированными повторами в течение цикла репликации AAV. Если эти димеры достаточно малы, то они могут быть упакованы таким же образом, как и стандартные геномы AAV, и две половины молекулы оцДНК могут сложиться и спарить основания с образованием молекулы дцДНК в половину длины. Конвертирование дцДНК не зависит от синтеза ДНК клетки-хозяина и концентрации вектора (McCarty et al., Gene Ther. (2001) 8:1248-1254).
Конструкции вирусов scAAV содержат приблизительно 4,6 т.п.н. и способны к упаковке в нормальный капсид AAV. Каждый известный серотип AAV способен к упаковке геномов scAAV с аналогичной эффективностью (см., например, Sipo et al., Gene Ther. (2007) 14:1319-1329). Таким образом, в определенных вариантах осуществления настоящего изобретения вектор scAAV содержит белки капсида из серотипов, выбранных из серотипов AAV1, AAV2, AAV3, AAV4, AAV5, AAV6, AAV7, AAV8 или AAV9. Однако вектор scAAV может содержать белки капсида из любых известных серотипов или модифицированные белки капсида, известные в данной области. Эти векторы scAAV также могут представлять собой псевдотипированные векторы, содержащие геном одного серотипа AAV в капсиде второго серотипа AAV. Такие векторы могут содержать, например, вектор AAV, который содержит капсид AAV2 и геном AAV1, или вектор AAV, который содержит капсид AAV5 и геном AAV2 (Auricchio et al., (2001) Hum. Mol. Genet., 10(26):3075-81).
Изначально предполагали, что последовательность трансгена в векторе scAAV может содержать только приблизительно 2,2 т.п.н. Однако, по-видимому, возможна бóльшая свобода в отношении упаковывающей емкости, чем предполагали ранее. Например, авторы Wu et al., Human Gene Ther. (2007) 18:171-182 успешно упаковали конструкции scAAV-2, превышающие 3300 п.н., и продемонстрировали димерные геномы с инвертированными повторами, которые полностью устойчивы к ДНКазе. Эти векторы давали ожидаемое увеличение эффективности трансдукции относительно ssAAV при тестировании на культивируемых клетках.
Векторы scAAV можно получить либо путем создания векторных плазмид, которые составляют приблизительно половину стандартного размера генома, в сочетании с селективной очисткой инфекционной двухцепочечной формы, либо путем использования векторных плазмид размером приблизительно в половину генома с мутацией в одной из концевых последовательностей разрешения вируса AAV, которые обеспечивают синтез двухцепочечного вируса. Оба подхода создают плюс- и минус-цепи вирусных геномов, которые ковалентно связаны в одном концевом повторе.
В частности, образование нормальных мономерных геномов AAV, в свою очередь, основано на эффективном разрешении двух ITR на каждом раунде синтеза ДНК. Эта реакция опосредована оцДНК-эндонуклеазной активностью двух увеличенных изоформ Rep AAV. За одноцепочечным разрывом ITR на концевом сайте разрешения следует элонгация ДНК от одноцепочечного разрыва с помощью ДНК полимеразы организма-хозяина. Образование димерных геномов происходит, когда Rep не может ввести одноцепочечный разрыв в концевой сайт разрешения до того, как его достигает репликационный комплекс, инициированный на другом конце.
Образование димерных геномов при получении scAAV можно резко увеличить посредством ингибирования разрешения на одном концевом повторе. Это легко осуществить путем делеции последовательности концевого сайта разрешения из одного ITR так, чтобы белок Rep не мог создавать обязательный одноцепочечный разрыв оцДНК (см., например, McCarty et al., Gene Ther. (2003) 10:2112-2118 и Wang et al., Gene Ther. (2003) 10:2105-2111). Затем репликационный комплекс, инициированный на другом ITR, осуществляет копирование через шпильку и обратно к инициирующему концу. Репликация продолжается до конца молекулы матрицы, оставляя инвертированный повтор дцДНК с ITR дикого типа на каждом конце и мутировавшим ITR в середине. Затем этот димерный инвертированный повтор может проходить нормальные раунды репликации с двух концов ITR дикого типа. Каждая вытесненная дочерняя цепь содержит инвертированный повтор оцДНК с полным ITR на каждом конце и мутировавшим ITR в середине. Упаковка в капсид AAV начинается с 3'-конца вытесненной цепи. Получение scAAV из конструкций с одним мутировавшим ITR обычно дает более чем 90% димерных геномов.
Получение и очистка вектора scAAV из конструкций с мутировавшими ITR аналогичны случаю со стандартным ssAAV, как описано дополнительно ниже. Однако если используют дот-блоттинг или Саузерн-блоттинг, то вектор ДНК предпочтительно наносят на мембраны для гибридизации в щелочных условиях, чтобы предотвратить повторную ренатурацию комплементарных цепей. Дополнительно, возможно образование ненастоящего сайта одноцепочечного разрыва Rep достаточно близко к мутировавшему ITR, чтобы предоставить возможность терминального разрешения и образования мономерных геномов. Этого можно обычно избежать, поворачивая кассету трансгена относительно мутантных концевых повторов и концевых повторов дикого типа.
Способы получения конструкций scAAV см., например, в публикациях McCarty, D.M., Molec. Ther. (2008) 16:1648-1656; McCarty et al., Gene Ther. (2001) 8:1248-1254; McCarty et al., Gene Ther. (2003) 10:2112-2118; Wang et al., Gene Ther. (2003) 10:2105-2111; Wu et al., Human Gene Ther. (2007) 18:171-182; публикации патентов США №№ 2007/0243168 и 2007/0253936, которые включены в настоящий документ посредством ссылки в полном объеме; а также примеры в настоящем документе.
Для целей изобретения подходящие клетки-хозяева для получения вирионов rAAV из экспрессирующих векторов AAV (или стандартных или sc векторов) включают клетки микроорганизмов, дрожжей, насекомых и млекопитающих, которые можно использовать или которые были использованы в качестве реципиентов гетерологичной молекулы ДНК и которые способны расти, например, в суспензионной культуре, биореакторе или т.п. Термин включает потомство исходной клетки, которая была трансфицирована. Таким образом, «клетка-хозяин», как используется в настоящем описании, как правило, относится к клетке, которая была трансфицирована ДНК с экзогенной последовательностью. Клетки из подходящей клеточной линии человека 293 (легко доступны, например, в American Type Culture Collection под номером доступа ATCC CRL1573) предпочтительно использовать при практическом осуществлении настоящего изобретения. В частности, клеточная линия 293 человека представляет собой линию эмбриональных клеток почки человека, которая была трансформирована фрагментами ДНК аденовируса 5 типа (Graham et al. (1977) J. Gen. Virol. 36:59), и которая экспрессирует аденовирусные гены E1a и E1b (Aiello et al. (1979) Virology 94:460). Клеточная линия 293 легко трансфицируется и обеспечивает особенно удобную платформу для получения вирионов rAAV.
Функции хелпера AAV
Клеткам-хозяевам, содержащим описанные выше экспрессирующие векторы AAV, необходимо придать способность обеспечивать функции хелпера AAV для того, чтобы реплицировать и капсидировать нуклеотидные последовательности, фланкированные ITR AAV, для получения вирионов rAAV. Функции хелпера AAV, как правило, представляют собой полученные из AAV кодирующие последовательности, которые могут быть экспрессированы для обеспечения продуктов генов AAV, которые, в свою очередь, функционируют в trans для продуктивной репликации AAV. Функции хелпера AAV используют в настоящем документе для восполнения необходимых функций AAV, которые отсутствуют у экспрессирующих векторов AAV. Таким образом, функции хелпера AAV включают одну или обе основные ORF AAV, а именно, кодирующие области rep и cap, или их функциональные гомологи.
Под «кодирующей областью rep AAV» понимают принятую в данной сфере область генома AAV, которая кодирует белки репликации Rep 78, Rep 68, Rep 52 и Rep 40. Показано, что эти продукты экспрессии Rep обладают многими функциями, включая распознавание, связывание и внесение одноцепочечного разрыва в точку начала репликации ДНК AAV, активность ДНК-хеликазы и модулирование транскрипции с промоторов AAV (или других гетерологичных промоторов). Продукты экспрессии Rep в совокупности необходимы для репликации генома AAV. Описание кодирующей области rep AAV см., например, в публикациях Muzyczka, N. (1992) Current Topics in Microbiol. and Immunol. 158:97-129; и Kotin, R.M. (1994) Human Gene Therapy 5:793-801. Подходящие гомологи кодирующей области rep AAV включают ген rep вируса герпеса 6 человека (HHV-6), о котором также известно, что он опосредует репликацию ДНК AAV-2 (Thomson et al. (1994) Virology 204:304-311).
Под «кодирующей областью cap AAV» понимают принятую в данной сфере область генома AAV, которая кодирует белки капсида VP1, VP2 и VP3, или их функциональные гомологи. Эти продукты экспрессии Cap обеспечивают функции упаковки, которые в совокупности необходимы для упаковывания вирусного генома. Описание кодирующей области cap AAV см., например, в публикациях Muzyczka, N. и Kotin, R.M. (выше).
Функции хелпера AAV вводят в клетку-хозяина посредством трансфицирования клетки-хозяина хелперной конструкцией AAV или до трансфекции экспрессирующим вектором AAV, или одновременно с ней. Таким образом, хелперные конструкции AAV используют для обеспечения по меньшей мере временной экспрессии генов rep и/или cap AAV для восполнения отсутствующих функций AAV, которые необходимы для продуктивной инфекции AAV. Хелперные конструкции AAV не содержат ITR AAV и не могут осуществлять ни репликацию, ни упаковку самих себя.
Эти конструкции могут быть в форме плазмиды, фага, транспозона, космиды, вируса или вириона. Описано множество хелперных конструкций AAV, таких как общеупотребительные плазмиды pAAV/Ad и pIM29+45, которые кодируют продукты экспрессии Rep и Cap. См., например, Samulski et al. (1989) J. Virol. 63:3822-3828; и McCarty et al. (1991) J. Virol. 65:2936-2945. Описано множество других векторов, которые кодируют продукты экспрессии Rep и/или Cap. См., например, патент США № 5139941.
Вспомогательные функции AAV
Клетке-хозяину (или упаковывающей клетке) также необходимо придать способность обеспечивать полученные не от AAV функции, или «вспомогательные функции», чтобы получать вирионы rAAV. Вспомогательные функции представляют собой полученные не от AAV вирусные и/или клеточные функции, от которых зависит репликация AAV. Таким образом, вспомогательные функции включают по меньшей мере те белки и РНК не от AAV, которые необходимы для репликации AAV, включая те, которые участвуют в активации транскрипции генов AAV, стадиеспецифическом сплайсинге мРНК AAV, репликации ДНК AAV, синтезе продуктов экспрессии Cap и сборке капсида AAV. Вирусные вспомогательные функции можно получить от любого известного вируса-хелпера.
В частности, вспомогательные функции можно вводить в клетки-хозяева, используя способы, известные специалистам в данной области, и затем экспрессировать в них. Обычно, вспомогательные функции обеспечивают посредством инфицирования клеток-хозяев неродственным вирусом-хелпером. Известно множество подходящих вирусов-хелперов, включая аденовирусы; вирусы герпеса, такие как вирус простого герпеса 1 и 2 типа; и вирусы осповакцины. Также в настоящем документе найдут применение невирусные вспомогательные функции, такие как те, которые обеспечены синхронизацией клеток с использованием различных известных средств. См., например, Buller et al. (1981) J. Virol. 40:241-247; McPherson et al. (1985) Virology 147:217-222; Schlehofer et al. (1986) Virology 152:110-117.
Альтернативно, вспомогательные функции можно обеспечить, используя вектор со вспомогательной функцией, как определено выше. См., например, патент США № 6004797 и международную публикацию № WO 01/83797, которые включены в настоящий документ посредством ссылки в полном объеме. Последовательности нуклеиновой кислоты, обеспечивающие вспомогательные функции, можно получить из природных источников, например, из генома аденовирусной частицы, или сконструировать, используя известные в данной области рекомбинантные или синтетические способы. Как объясняется выше, продемонстрировано, что все компоненты генов аденовирусов не являются обязательными для вспомогательных функций хелперов. В частности показано, что мутантные аденовирусы, неспособные к репликации ДНК и синтезу поздних генов, допускают репликацию AAV. Ito et al., (1970) J. Gen. Virol. 9:243; Ishibashi et al, (1971) Virology 45:317. Аналогичным образом показано, что мутации в областях E2B и E3 поддерживают репликацию AAV, что вероятно указывает на неучастие E2B и E3 областей в обеспечении вспомогательных функций. Carter et al., (1983) Virology 126:505. Однако аденовирусы с дефектами в области E1 или с удаленной областью E4 не способны поддерживать репликацию AAV. Таким образом, области E1A и E4 вероятно необходимы для репликации AAV, или напрямую или опосредованно. Laughlin et al., (1982) J. Virol. 41:868; Janik et al., (1981) Proc. Natl. Acad. Sci. USA 78:1925; Carter et al., (1983) Virology 126:505. Другие описанные мутанты Ad включают: E1B (Laughlin et al. (1982), выше; Janik et al. (1981), выше; Ostrove et al., (1980) Virology 104:502); E2A (Handa et al., (1975) J. Gen. Virol. 29:239; Strauss et al., (1976) J. Virol. 17:140; Myers et al., (1980) J. Virol. 35:665; Jay et al., (1981) Proc. Natl. Acad. Sci. USA 78:2927; Myers et al., (1981) J. Biol. Chem. 256:567); E2B (Carter, Adeno-Associated Virus Helper Functions, in I CRC Handbook of Parvoviruses (P. Tijssen ed., 1990)); E3 (Carter et al. (1983), выше); и E4 (Carter et al.(1983), выше; Carter (1995)). Несмотря на то, что исследования вспомогательных функций, обеспечиваемых аденовирусами, содержащими мутации в кодирующей области E1B, дают противоречивые результаты, Samulski et al., (1988) J. Virol. 62:206-210, сообщали, что E1B55k необходим для получения вириона AAV, тогда как E1B19k нет. Кроме того, в международной публикации WO 97/17458 и у Matshushita et al., (1998) Gene Therapy 5:938-945, описаны векторы со вспомогательными функциями, кодирующие различные гены Ad. Особенно предпочтительные векторы со вспомогательными функциями содержат кодирующую область VA РНК аденовируса, кодирующую область ORF6 E4 аденовируса, кодирующую область E2A 72 кДа аденовируса, кодирующую область E1A аденовируса и область E1B аденовируса, не содержащую интактную кодирующую область E1B55k. Такие векторы описаны в международной публикации № WO 01/83797.
Вследствие инфекции клетки-хозяина вирусом-хелпером или трансфекции клетки-хозяина вектором со вспомогательной функцией, экспрессируют вспомогательные функции, которые трансактивируют хелперную конструкцию AAV для получения белков Rep и/или Cap AAV. Продукты экспрессии Rep вырезают рекомбинантную ДНК (включая ДНК, представляющую интерес) из экспрессирующего вектора AAV. Белки Rep также выполняют функцию удвоения генома AAV. Экспрессируемые белки Cap собираются в капсиды, а также происходит упаковка рекомбинантного генома AAV в капсиды. Таким образом, протекает продуктивная репликация AAV и упаковка ДНК в вирионы rAAV. «Рекомбинантный вирион AAV» или «вирион rAAV» определен в настоящем документе как инфекционный вирус с дефектом репликации, содержащий белковую оболочку AAV, которая образует капсид для гетерологичной нуклеотидной последовательности, представляющей интерес, которую с обеих сторон фланкируют ITR AAV.
После репликации рекомбинантного AAV вирионы rAAV можно очистить от клеток-хозяев, используя различные стандартные способы очистки, такие как колоночная хроматография, градиенты CsCl и т.п. Например, можно использовать несколько стадий очистки на колонках, такие как очистка на анионообменной колонке, колонке для аффинной хроматографии и/или катионообменной колонке. См., например, международную публикацию № WO 02/12455. Кроме того, если инфекцию используют для экспрессии вспомогательных функции, то остаточный вирус-хелпер можно инактивировать с помощью известных способов. Например, аденовирус можно инактивировать нагреванием до температуры приблизительно 60°C, например, в течение 20 минут или более. Такое воздействие эффективно инактивирует только вирус-хелпер, поскольку AAV обладает чрезвычайной тепловой стабильностью, тогда как аденовирус-хелпер обладает тепловой лабильностью.
Затем получаемые вирионы rAAV, содержащие нуклеотидную последовательность, представляющую интерес, можно использовать для доставки генов с помощью описанных ниже способов.
Композиции и доставка
A. Композиции
После получения вирионы rAAV, кодирующие ген, представляющий интерес, вводят в композиции, подходящие для доставки. Композиции содержат достаточно генетического вещества для получения терапевтически эффективного количества гена, представляющего интерес, т.е. количества, достаточного для (1) предупреждения развития заболевания или снижения интенсивности заболевания у субъекта, который может быть подвержен или предрасположен к заболеванию, но пока не испытывает или не проявляет симптомов заболевания, (2) подавления заболевания, т.е. купирования развития или обращения состояния заболевания, или (3) облегчения симптомов заболевания, т.е. снижения числа симптомов, испытываемых субъектом, а также изменения клеточной патологии, связанной с заболеванием.
Соответствующие дозы, среди прочих факторов, также зависят от млекопитающего, подлежащего лечению (например, человек или примат, не являющийся человеком, или другое млекопитающее), возраста и общего состояния субъекта, подлежащего лечению, тяжести состояния, подлежащего лечению, способа введения. Специалист в данной области может легко определить соответствующее эффективное количество, а характерные количества предоставлены ниже.
Композиции также содержат фармацевтически приемлемый эксципиент. Такие эксципиенты включают любые фармацевтические средства, которые самостоятельно не индуцируют образование антител, опасных для индивидуума, получающего композицию, и которые можно вводить без неоправданного токсического действия. Фармацевтически приемлемые эксципиенты включают, но не ограничиваются ими, сорбит, любые из множества соединений TWEEN и жидкости, такие как вода, физиологический раствор, глицерин и этанол. В них могут входить фармацевтически приемлемые соли, например, соли неорганических кислот, такие как гидрохлориды, гидробромиды, фосфаты, сульфаты и т.п.; и соли органических кислот, такие как ацетаты, пропионаты, малонаты, бензоаты и т.п. Дополнительно в таких носителях могут присутствовать вспомогательные вещества, такие как увлажняющие или эмульгирующие средства, вещества pH буферов и т.п. Доскональное обсуждение фармацевтически приемлемых эксципиентов доступно в REMINGTON'S PHARMACEUTICAL SCIENCES (Mack Pub. Co., N.J. 1991).
Композиции могут быть жидкими или твердыми, например, лиофилизированными. Композиции также можно вводить в виде аэрозолей.
Одна особенно эффективная композиция содержит вирион rAAV, представляющий интерес, в сочетании с одним или нескольким двухатомными или многоатомными спиртами и, необязательно, с детергентом, таким как сложный эфир сорбитана. См., например, патент США № 6764845, включенный в настоящий документ посредством ссылки в полном объеме.
B. Доставка
Как правило, рекомбинантные вирионы вводят субъекту, используя способы трансдукции in vivo или in vitro. В случае трансдукции in vitro, желаемую клетку-реципиента забирают у субъекта, трансдуцируют рекомбинантным вектором и повторно вводят субъекту. Альтернативно, можно использовать изогенные или ксеногенные клетки, где эти клетки не вызывают у субъекта ненадлежащего иммунного ответа. Подходящие клетки для доставки млекопитающим животным-хозяевам включают типы клеток млекопитающих из органов, опухолей или клеточных линий. Например, можно использовать клетки человека, мыши, козы, овцы, коровы, собаки, кошки и свиньи. Подходящие типы клеток для использования включают, без ограничения, фибробласты, гепатоциты, эндотелиальные клетки, кератиноциты, гематопоэтические клетки, эпителиальные клетки, миоциты, нервные клетки и стволовые клетки. Дополнительно, нервные клетки-предшественники можно трансдуцировать in vitro и затем доставлять в ЦНС.
Клетки можно трансдуцировать in vitro, объединяя рекомбинантные вирионы с желаемой клеткой в соответствующей среде, и можно осуществлять скрининг клеток для обнаружения тех клеток, которые несут ДНК, представляющую интерес, используя общепринятые способы, такие как Саузерн-блоттинг и/или ПЦР, или используя селективные маркеры. Затем трансдуцированные клетки можно вводить в фармацевтические композиции, как описано выше, и вводить композицию субъекту различными способами, как описано ниже, одной или несколькими дозами.
В случае доставки in vivo, рекомбинантные вирионы вводят в фармацевтические композиции, и одну или несколько дозировок можно напрямую вводить указанным образом. Об идентификации структур головного мозга человека см., например, в публикациях The Human Brain: Surface, Three-Dimensional Sectional Anatomy With MRI, and Blood Supply, 2nd ed., eds. Deuteron et al., Springer Vela, 1999; Atlas of the Human Brain, eds. Mai et al., Academic Press; 1997; и Co-Planar Sterotaxic Atlas of the Human Brain: 3-Dimensional Proportional System: An Approach to Cerebral Imaging, eds. Tamarack et al., Thyme Medical Pub., 1988. Об идентификации структур головного мозга мыши см., например, в публикации The Mouse Brain in Sterotaxic Coordinates, 2nd ed., Academic Press, 2000. При желании, можно сопоставлять структуры головного мозга человека и схожие структуры головного мозга другого млекопитающего. Например, большинство млекопитающих, включая человека и грызунов, обладают схожей топографической организацией энториально-гиппокампальных проекций, с проекцией нейронов в латеральной части как латеральной, так и медиальной энторинальной коры, на дорзальную часть или септальное поле гиппокампа, тогда как проекция в вентральный гиппокамп главным образом берет начало из нейронов в медиальных частях энторинальной коры (Principles of Neural Science, 4th ed., eds Kandel et al., McGraw-Hill, 1991; The Rat Nervous System, 2nd ed., ed. Paxinos, Academic Press, 1995). Кроме того, клетки II слоя энторинальной коры проецируются на зубчатую извилину, и они заканчиваются в наружных двух третях молекулярного слоя зубчатой извилины. Аксоны от клеток III слоя проецируются билатерально на области CA1 и CA3 аммонова рога (гиппокампа), терминируются в stratum lacunosum-moleculare.
Чтобы доставить вектор точно в конкретную область центральной нервной системы, в частности, в конкретную область головного мозга, его можно вводить посредством стереотаксической микроинъекции. Например, в день операции пациенту прикрепляют стереотаксическую опорную раму (привинчивают к черепу). Головной мозг со стереотаксической опорной рамой (МРТ-совместимая с опорными маркерами) визуализируют, используя МРТ высокого разрешения. Затем МР-томограммы переносят в компьютер, на котором запущено стереотаксическое программное обеспечение. Последовательность фронтальных, сагиттальных и аксиальных изображений используют для определения целевого места инъекции вектора и траектории. Программное обеспечение непосредственно переводит траекторию в трехмерные координаты, адаптированные для стереотаксической рамы. Трепанационные отверстия сверлят над местом входа и размещают стереотаксическое устройство, локализованное с иглой, введенной на заданную глубину. Затем инъецируют вектор в фармацевтически приемлемом носителе. Затем вектор вводят непосредственной инъекцией в основное целевое место и посредством аксона ретроградный транспорт доставляет его в дистальные целевые места. Можно использовать дополнительные пути введения, например, поверхностное кортикальное применение при непосредственной визуализации или другое нестереотаксическое применение.
Рекомбинантный AAV любого серотипа можно использовать в настоящем изобретении, где рекомбинантный AAV может представлять или самокомплементарный AAV, или несамокомплементарный AAV. Серотип вирусного вектора, используемого в определенных вариантах осуществления, выбирают из группы, состоящей из AAV1, AAV2, AAV3, AAV4, AAV5, AAV6, AAV7, AAV8 и AAV9 (см., например, Gao et al. (2002) PNAS, 99:11854 11859; и Viral Vectors for Gene Therapy: Methods and Protocols, ed. Machida, Humana Press, 2003). Помимо перечисленных в настоящем документе, можно использовать другие серотипы. Кроме того, в способах, описанных в настоящем документе, также можно использовать псевдотипированные векторы AAV. Псевдотипированные векторы AAV представляют собой векторы AAV, которые содержат геном одного серотипа AAV в капсиде второго серотипа AAV; например, вектор AAV, который содержит капсид AAV2 и геном AAV1, или вектор AAV, который содержит капсид AAV5 и геном AAV2 (Auricchio et al., (2001) Hum. Mol. Genet., 10(26):3075-81).
Рекомбинантные вирионы или клетки, трансдуцированные in vitro, можно доставлять непосредственно в нервную ткань, такую как периферические нервы, сетчатка, дорсальные корешковые ганглии, нервно-мышечное соединение, а также ЦНС, посредством инъекции, например, в желудочковую область, например, в один или оба боковых желудочка, а также в полосатое тело (например, в хвостатое ядро или скорлупу полосатого тела), мозжечок, спинной мозг и нервно-мышечные соединения, с использованием иглы, катетера или сходного устройства, используя нейрохирургические способы, известные в данной области, например, посредством стереотаксической инъекции (см., например, Stein et al., J Virol 73:3424-3429, 1999; Davidson et al., PNAS 97:3428-3432, 2000; Davidson et al., Nat.Genet. 3:219-223, 1993; и Alisky and Davidson, Hum. Gene Ther. 11:2315-2329, 2000). В иллюстративном варианте осуществления доставку осуществляют непосредственной инъекцией раствора вектора с высоким титром в спинной мозг субъекта или пациента.
В другом иллюстративном варианте осуществления предоставлен способ доставки трансгена в область спинного мозга и/или ствола головного мозга субъекта посредством введения рекомбинантного вектора AAV, содержащего трансген, по меньшей мере в одну область из областей глубоких ядер мозжечка (DCN) головного мозга субъекта. В глубине мозжечка расположено серое вещество, называемое глубокими ядрами мозжечка, которое обозначают как медиальное ядро (ядро шатра), промежуточное ядро и латеральное (зубчатое) ядро. Используемый в настоящем документе термин «глубокие ядра мозжечка» в совокупности относится к этим трем областям, где одна или несколько из этих трех областей может быть мишенью. Вирусная доставка происходит в условиях, которые способствуют экспрессии трансгена в области спинного мозга и/или ствола головного мозга, по меньшей мере в одном подотделе спинного мозга субъекта. Эти подотделы включают один или несколько шейных, грудных, поясничных или крестцовых сегментов.
Без ограничения теорией, один из вариантов осуществления изобретения заключается в возможности предоставления терапевтической молекулы (например, белка или пептида) в каждый отдел спинного мозга. Это можно осуществить инъекцией вектора AAV, включая вектор scAAV, в DCN. Кроме того, может быть важным нацеливание на отдельную пластинку в каждом отделе спинного мозга. Пластинки представляют собой конкретные подобласти внутри областей головного мозга и спинного мозга. В определенных вариантах осуществления может быть желательным нацеливание на конкретную пластинку в определенном отделе спинного мозга. Поскольку повреждение двигательных нейронов также может происходить в верхних двигательных нейронах, также может быть желательным предоставлять терапевтические молекулы (например, белок или пептид) в отделах ствола головного мозга. В одном из вариантов осуществления может быть желательным предоставлять терапевтическую молекулу как в спинном мозге, включая некоторые или все подотделы, а также в стволе головного мозга, включая некоторые или все подотделы. В настоящем изобретении используют введение вектора AAV в DCN для осуществления описанной выше доставки терапевтической молекулы в область(и) спинного мозга и/или ствол головного мозга.
Другой способ нацеленного воздействия на спинной мозг (например, на глию) состоит в доставке под оболочки, а не в саму ткань спинного мозга. Такая доставка дает множество преимуществ. Высвобождение нацеленного белка происходит в окружающей CSF, и, в отличие от вирусов, высвобождаемые белки могут проникать в паренхиму спинного мозга так же, как это происходит после экстренных интратекальных инъекций. Действительно, интратекальная доставка вирусных векторов может сохранять локальную экспрессию. Дополнительное преимущество интратекальной генной терапии состоит в том, что интратекальный путь имитирует введение поясничной пункцией (т.е. поясничным проколом), которая уже вошла в обычное использование у человека.
Другой способ введения рекомбинантных векторов или трансдуцированных клеток состоит в доставке в нейроны дорсальных корешковых ганглиев (DRG), например, инъекцией в эпидуральное пространство c последующей диффузией в DRG. Например, рекомбинантные векторы или трансдуцированные клетки можно доставлять через интратекальное канюлирование в условиях, где белок диффундирует в DRG. См., например, Chiang et al., Acta Anaesthesiol. Sin. (2000) 38:31-36; Jain, K.K., Expert Opin. Investig. Drugs (2000) 9:2403-2410.
В еще одном другом способе введения в ЦНС используют систему конвекционной доставки (CED), которая представляет собой любую неручную доставку вектора. В одном из вариантов осуществления CED градиент давления создают посредством использования системы неручной доставки. Используя CED, рекомбинантные векторы можно доставлять во многие клетки через большие области ЦНС. Кроме того, доставляемые векторы эффективно экспрессируют трансгены в клетках ЦНС (например, в глиальных клетках). Любое устройство конвекционной доставки может подходить для доставки рекомбинантных векторов. В предпочтительном варианте осуществления устройство может представлять собой осмотический насос или инфузионный насос. Осмотические и инфузионные насосы коммерчески доступны от различных поставщиков, например, Alzet Corporation, Hamilton Corporation, Alza, Inc., Palo Alto, California. Обычно рекомбинантный вектор доставляют через устройства CED следующим образом. Катетер, канюлю или другое инъекционное устройство вводят в ткань ЦНС выбранного субъекта. Стереотаксические карты и позиционирующие устройства доступны, например, от ASI Instruments, Warren, MI. Позиционирование также можно осуществлять, используя анатомические карты, получаемые посредством КТ и/или МРТ визуализации, чтобы помочь направлять инъекционное устройство к выбранной мишени. Кроме того, нужно меньше инфузионных канюль, поскольку описанные в настоящем документе способы можно осуществлять на практике так, что относительно большие области субъекта захватывают рекомбинантные векторы. Поскольку хирургические осложнения часто связаны с множеством проникновений, этот режим доставки способствует уменьшению побочных эффектов, наблюдаемых при использовании стандартных способов доставки. Подробное описание конвекционной доставки см. в патенте США № 6309634, который включен в настоящий документ посредством ссылки в полном объеме.
Интрацеребровентрикулярную, или внутрижелудочковую, доставку рекомбинантного вектора AAV можно осуществлять в любой один или несколько желудочков головного мозга, которые заполнены спинномозговой жидкостью (CSF). CSF представляет собой прозрачную жидкость, которая заполняет желудочки, присутствует в субарахноидальном пространстве и окружает головной мозг и спинной мозг. Образование CSF происходит в хороидных сплетениях посредством выпотевания или пропускания тканевой жидкости головного мозга в желудочки. Хороидное сплетение представляет собой структуру, которая выстилает дно латерального желудочка и свод третьего и четвертого желудочков. Определенные исследования показывают, что эти структуры способны образовывать 400-600 см3 жидкости в сутки, и этого количества достаточно для того, чтобы заполнить пространства центральной нервной системы четыре раза в сутки. Вычислено, что у взрослого человека объем этой жидкости составляет 125-150 мл (4-5 унций). Образование, циркуляция и абсорбция CSF происходит постоянно. Определенные исследования показывают, что каждые сутки происходит образование приблизительно 430-450 мл CSF (приблизительно 2 чашки). Определенные вычисления оценивают скорость образования приблизительно равной 0,35 мл в минуту у взрослых людей и 0,15 мл в минуту у детей. В хороидных сплетениях латеральных желудочков происходит образования наибольшей части CSF. Она течет через отверстие Монро в третий желудочек, где происходит объединение с CSF, образовавшейся в третьем желудочке, и продолжает движение через сильвиев водопровод в четвертый желудочек. Четвертый желудочек образует дополнительную CSF; затем жидкость проходит в субарахноидальное пространство через отверстия Мажанди и Люшки. Затем она циркулирует по всему основанию головного мозга, вниз вокруг спинного мозга и вверх через полушария головного мозга. CSF выходит в кровь через арахноидальные грануляции и внутричерепные сосудистые синусы.
В одном из аспектов описанные способы включают введение в ЦНС пораженного субъекта вириона rAAV, несущего трансген, который кодирует терапевтический продукт и обеспечивает возможность экспрессии трансгена в ЦНС рядом с местом введения на уровне, достаточном для проявления терапевтического эффекта, поскольку CSF транспортирует экспрессируемый белок по всей ЦНС. В некоторых вариантах осуществления способы включают введение композиции вириона с высоким титром, которая несет терапевтический трансген, чтобы экспрессировать продукт трансгена на терапевтическом уровне в первом месте в ЦНС, дистальном относительно основного места действия экспрессируемого продукта.
У экспериментальных мышей общий объем инъецированного раствора AAV составляет, например, от 1 до 20 мкл. Для других млекопитающих, включая человека, объемы и скорости доставки масштабируют соответствующим образом. Лечение может состоять из одной инъекции в каждое целевое место или может повторяться в одном или нескольких местах. Можно использовать несколько мест инъекции. Например, в некоторых вариантах осуществления, в дополнение к первому месту введения, композицию, содержащую вирусный вектор, который несет трансген, вводят в другое место, которое может быть расположено на той же или на противоположной стороне относительно первого места введения. Инъекции могут быть однократными или многократными, односторонними или двусторонними.
Лечение дозами может представлять собой режим однократного дозирования, режим непрерывного или периодического или множественного дозирования. Кроме того, субъекту можно вводить столько доз, сколько целесообразно. Если вводят несколько доз, то первый введенный состав может быть таким же, как последующие составы, или может отличаться от них. Таким образом, например, первое введение может быть в форме вектора AAV, а второе введение в форме аденовирусного вектора, плазмидной ДНК, белковой композиции или тому подобного. Кроме того, последующая доставка может также совпадать со вторым режимом доставки или отличаться от него.
Кроме того, субъект может получать вектор rAAV по настоящему изобретению посредством сочетания способов доставки, раскрытых в настоящем документе. Таким образом, субъект может получать инъекции вектора AAV по меньшей мере в два места инъекции, выбранные из группы, состоящей из интрацеребровентрикулярных инъекций, прямых инъекций в спинной мозг, интратекальных инъекций и инъекций в паренхиму головного мозга (например, в полосатое тело, мозжечок, включая глубокие ядра мозжечка). В одном из вариантов осуществления субъект может получать вектор rAAV через 1) по меньшей мере одну интрацеребровентрикулярную инъекцию и по меньшей мере одну прямую инъекцию в спинной мозг или 2) по меньшей мере одну интрацеребровентрикулярную инъекцию и по меньшей мере одну интратекальную инъекцию, или 3) по меньшей мере одну интрацеребровентрикулярную инъекцию и по меньшей мере одну инъекцию в паренхиму головного мозга, или 4) по меньшей мере одну прямую инъекцию в спинной мозг и по меньшей мере одну интратекальную инъекцию, или 5) по меньшей мере одну прямую инъекцию в спинной мозг и по меньшей мере одну инъекцию в паренхиму головного мозга, или 6) по меньшей мере одну интратекальную инъекцию и по меньшей мере одну инъекцию в паренхиму головного мозга.
Следует понимать, что более чем один трансген можно экспрессировать посредством доставленного рекомбинантного вириона. Альтернативно, отдельные векторы, каждый из которых экспрессирует один или несколько различных трансгенов, также можно доставлять субъекту, как описано в настоящем документе. Таким образом, несколько трансгенов можно доставлять параллельно или последовательно. Кроме того, также предполагается, что векторы, доставляемые способами по настоящему изобретению, можно сочетать с другими подходящими композициями и способами лечения. Дополнительно, можно использовать сочетание лечения белком и нуклеиновой кислотой.
Способы определения наиболее эффективного средства введения и терапевтически эффективных дозировок хорошо известны специалистам в данной области и будут зависеть от вектора, терапевтической композиции, целевых клеток и субъекта, подлежащего лечению. Терапевтически эффективные дозы можно легко определить с использованием, например, одной или нескольких животных моделей рассматриваемого конкретного заболевания. «Терапевтически эффективное количество» попадает в относительно широкий диапазон, который можно определить с помощью клинических исследований. Например, для инъекции вирионов rAAV in vivo доза составит порядка приблизительно от 106 до 1015 геномных частиц рекомбинантного вируса, более предпочтительно от 108 до 1014 геномных частиц рекомбинантного вируса, или любую дозу в этих диапазонах, которая достаточна для обеспечения желаемого эффекта. В определенных вариантах осуществления концентрация или титр вектора в композиции составляет по меньшей мере: (a) 5, 6, 7, 8, 9, 10, 15, 20, 25 или 50 (×1012 гч/мл); (b) 5, 6, 7, 8, 9, 10, 15, 20, 25 или 50 (×109 те/мл); или (c) 5, 6, 7, 8, 9, 10, 15, 20, 25 или 50 (×1010 ие/мл).
Для трансдукции in vitro эффективное количество вирионов rAAV, подлежащее доставке в клетки, составляет порядка от 108 до 1013 рекомбинантных вирусов. В свою очередь, количество трансдуцированных клеток в фармацевтических композициях составляет приблизительно от 104 до 1010 клеток, более предпочтительно от 105 до 108 клеток. Специалист в данной области может легко установить другие эффективные дозировки путем обычных испытаний для определения кривой доза-эффект.
Как правило, доставляют от 1 мкл до 1 мл композиции, например, доставляют от 0,01 до приблизительно 0,05 мл, например, приблизительно от 0,05 до приблизительно 0,3 мл композиции, например, 0,08, 0,09, 0,1, 0,2 и т.д. и любое число в этих диапазонах.
Животные модели
Терапевтическую эффективность и безопасность использования вирионов AAV, содержащих трансгены, как описано выше, можно тестировать на соответствующей животной модели. Например, животные модели, которые кажутся наиболее близкими к заболеванию человека, включают виды животных, у которых происходит спонтанное развитие конкретного заболевания с высокой частотой заболеваемости, или те, у которых оно вызвано.
В частности, известно несколько созданных животных моделей SMA. См., например, Sumner C.J., NeuroRx (2006) 3:235-245; Schmid et al., J. Child Neurol. (2007) 22:1004-1012. Как объясняется выше, молекулярная основа SMA, аутосомного рецессивного нервно-мышечного нарушения, заключается в гомозиготной утрате гена выживаемости двигательных нейронов 1 (SMN1). У человека найдена почти идентичная копия гена SMN1, названная SMN2, которая модулирует тяжесть заболевания. В отличие от человека, у мышей есть один ген (SMN), который соответствует SMN1. Гомозиготная утрата этого гена летальна для эмбрионов и ведет к массовой гибели клеток, указывая на то, что продукт гена SMN необходим для клеточной выживаемости и функции. Введение 2 копий SMN2 мышам, у которых отсутствует SMN, спасает эмбрионы от смерти, в результате чего получают мышей с фенотипом SMA (Monani et al., Hum. Mol. Genet. (2000) 9:333-339. Высокое число копий SMN2 спасает мышей потому, что в двигательных нейронах происходит образование достаточного количества белка SMN. См. также публикацию Hsieh-Li, et al., Nat. Genet. (2000) 24:66-70, где сообщается о получении линий трансгенных мышей, которые экспрессируют SMN2 человека. В частности, трансгенные мыши, несущие SMN2 при генотипе SMN-/-, имеют патологические изменения в спинном мозге и скелетных мышцах, которые схожи с таковыми у пациентов с SMA. Тяжесть патологических изменений у этих мышей коррелирует с количеством белка SMN, которое содержит область, кодируемая экзоном 7. Фенотипы в этой модели на мышах включают потерю двигательных нейронов, атрофию скелетных мышц, неправильные нервно-мышечные соединения (NMJ), дефицит поведения, паралич и укороченную продолжительность жизни, приблизительно равную двум неделям. Le et al., Hum. Mol. Genet. (2005) 14:845-857.
Аналогично, известны животные модели для ALS. ALS представляет собой смертельное нейродегенеративное заболевание, которое отличается избирательной потерей двигательных нейронов в коре, стволе головного мозга и спинном мозге. Развитие заболевания может вести к атрофии мышц конечностей, аксиальных и дыхательных мышц. Гибель двигательных нейронов сопровождает реактивный глиоз, аномалии нейрофиламентов и значительная утрата крупных миелинизированных волокон в корково-спинномозговом пути и передних корешках. Несмотря на то, что этиология ALS изучена мало, накопленные факты указывают на то, что спорадический (SALS) и семейный (FALS) ALS имеют много общих патологических признаков; таким образом, давая надежду на то, что исследование одной из форм приведет к общему лечению. FALS насчитывает приблизительно 10% диагностированных случаев, из которых 20% связаны с доминантно наследуемыми мутациями в Cu/Zn-супероксиддисмутазе (SODI). Трансгенные мыши, которые экспрессируют мутантный белок SODI человека (например, мыши SODIG93A), повторяют многие патологические признаки ALS и представляют собой доступную животную модель для изучения ALS. В качестве первопричины в SALS участвует множество патологических механизмов, включая индуцированную глутаматом эксцитотоксичность, воздействие токсинов, нарушение функции протеосом, повреждение митохондрий, разрушение нейрофиламентов и утрату нейротрофической поддержки.
Экспериментальный аутоиммунный энцефаломиелит (EAE), также называемый экспериментальным аллергическим энцефаломиелитом, предоставляет животную модель MS. EAE очень похож на различные формы и стадии MS. EAE представляет собой острое или хронически рецидивирующее приобретенное, воспалительное и демиелинизирующее аутоиммунное заболевание. Для того чтобы вызвать заболевание, животным вводят белки, которые входят в состав миелина, изолирующей оболочки, которая окружает нейроны. Эти белки индуцируют аутоиммунный ответ у инъецированных животных, у которых развивается патологический процесс, который очень похож на MS у людей. EAE вызывали у животных многих различных видов, включая мышей, крыс, морских свинок, кроликов, макак, макак-резусов и мартышек.
Спинально-бульбарная мышечная атрофия (SBMA) представляет собой заболевание двигательных нейронов с началом во взрослом возрасте, которое вызывает экспансия тринуклеотидных повторов (TNR) в экзоне 1 гена андрогенового рецептора (AR). Это нарушение отличается дегенерацией двигательных и чувствительных нейронов, атрофией проксимальных мышц и эндокринными аномалиями, такими как гинекомастия и пониженная фертильность. Развитие симптомов происходит только у самцов, тогда как самки-носители обычно не имеют симптомов. Молекулярной основой SBMA является экспансия тринуклеотидного повтора CAG, который кодирует полиглутаминовый (polyQ) тракт, в первом экзоне гена андрогенового рецептора (AR). Патологическим признаком являются ядерные включения (NI), содержащие мутантный и усеченный AR с увеличенным polyQ, в оставшихся двигательных нейронах ствола головного мозга и спинного мозга, а также некоторых других висцеральных органов. Для изучения патогенеза SBMA создано несколько моделей на трансгенных мышах. См., например, Katsuno et al., Cytogen. And Genome Res. (2003) 100:243-251. Например, на модели на трансгенных мышах, несущих чистые 239 CAG под управлением промотора AR человека, и на другой модели, несущей усеченный AR с увеличенными CAG, в двигательных нейронах выявлена двигательная недостаточность и ядерные NI. Трансгенные мыши, несущие полноразмерный AAR человека с увеличенным polyQ, демонстрируют прогрессирующую двигательную недостаточность и нейрогенные патологии, а также половые различия фенотипов. Эти модели повторяют экспрессируемый фенотип, который наблюдают при SBMA.
Болезнь Мачадо-Джозефа (MJD), которую также называют спиноцеребеллярной атаксией 3 типа, вызывает мутантный атаксин-3 с полиглутаминовой экспансией. На мышах созданы модели MJD, а также других полиглутаминовых спиноцеребеллярных атаксий. Обзор таких моделей см., например, в публикации Gould, V.F.C. NeuroRX (2005) 2:480-483.
Таким образом, в данной области доступен стандарт для животных моделей с целью скрининга и/или оценки активности и/или эффективности способов и композиций по изобретению для лечения нарушений двигательных нейронов.
Наборы по изобретению
Изобретение также относится к наборам. В определенных вариантах осуществления наборы по изобретению включают один или несколько контейнеров, которые содержат рекомбинантные векторы, кодирующие белок, представляющий интерес. Наборы дополнительно могут содержать соответствующий набор инструкций, как правило, письменных инструкций, которые касаются использования векторов в любом способе, описанном в настоящем документе.
Наборы могут содержать компоненты в любой подходящей удобной упаковке. Например, если рекомбинантные векторы представлены в виде сухого состава (например, лиофилизированного или сухого порошка), то обычно используют сосуд с эластичной пробкой с тем, чтобы векторы можно было легко ресуспендировать посредством инъекции текучего вещества через эластичную пробку. Для жидких составов удобнее всего использовать ампулы с неэластичными съемными закупоривающими устройствами (например, запаянное стекло) или эластичными пробками. Также предполагается упаковка для использования в сочетании с конкретным устройством, таким как шприц или инфузионное устройство, такое как мининасос.
Инструкции, относящиеся к использованию или рекомбинантным векторам, как правило, содержат информацию о дозировке, режиме дозирования и пути введения для предполагаемого способа использования. Контейнеры могут представлять собой стандартные дозы, насыпные упаковки (например, многодозовые упаковки) или субстандартные дозы. Инструкции, поставляемые в наборах по изобретению, обычно представляют собой письменные инструкции на этикетке или вкладыше в упаковку (например, лист бумаги, включенный в набор), однако также приемлемы машиночитаемые инструкции (например, инструкции, расположенные на магнитном или оптическом носителе).
2. Экспериментальная часть
Ниже приведены примеры конкретных вариантов осуществления для выполнения настоящего изобретения. Примеры предложены только в целях иллюстрации и не предназначены для ограничения объема настоящего изобретения каким-либо образом.
Были предприняты усилия для обеспечения точности в отношении используемых чисел (например, количеств, температур и т.д.), но конечно следует предусматривать некоторые экспериментальные ошибки и отклонения.
Вещества и способы
Векторы AAV. Открытую рамку считывания иллюстративного гена SMN1 человека (открытая рамка считывания последовательности показана на фиг.9A; соответствующая аминокислотная последовательность показана на фиг.9B; полная нуклеотидная последовательность найдена под номером доступа Genbank NM_000344)) клонировали в челночную плазмиду, содержащую или инвертированные концевые повторы (ITR) AAV2 и энхансер цитомегаловируса/промотор β-актина (CBA) курицы длиной 1,6 т.п.н., или ITR scAAV2 и промотор β-глюкуронидазы (GUSB) человека длиной 0,4 т.п.н. Ограничение размера рекомбинантного генома в реакции упаковки scAAV требует использования маленького промотора (McCarty, D.M. Molec. Ther. (2008) 16:1648-1656). Таким образом, был выбран промотор GUSB длиной 0,4 т.п.н., поскольку его экспрессия происходит повсеместно на всем протяжении ЦНС, включая двигательные нейроны спинного мозга (Passini et al., J. Virol. (2001) 75:12382-12392). Каждую рекомбинантную плазмиду упаковывали в капсид серотипа AAV-8 посредством совместной трансфекции клеток 293 человека тремя плазмидами (см., например, патент США № 6001650, в полном объеме включенный в настоящий документ посредством ссылки) и очищали вирионы на колонке, как сообщалось ранее (O'Riordan et al., J. Gene Med. (2000) 2:444-454). Титры получаемых векторов AAV2/8-CBA-hSMN1 (AAV-hSMN1) и scAAV2/8-GUSB-hSMN1 (scAAV-hSMN1) составляли 8,3 e12 и 2,8 e12 копий генома на мл, соответственно.
Животные и процедуры. Скрещивали гетерозиготные (SMN+/-, hSMN2+/+, SMNΔ7+/+) племенные пары, и в день рождения (P0) новорожденные детеныши получали всего 3 инъекции по 2 мкл каждая в боковые желудочки обоих полушарий головного мозга и в верхнюю часть поясничного отдела спинного мозга. Общие дозы вирусных векторов составляли 5,0 e10 и 1,7 e10 копий генома для AAV-hSMN1 и scAAV-hSMN1, соответственно. Все инъекции осуществляли с использованием высококачественной вытянутой иглы стеклянной микропипетки, как описано (Passini et al, J. Virol. (2001) 75:12382-12392). После инъекций детенышам отрезали пальцы стопы и определяли их генотипы (Le et al., Hum. Mol. Genet. (2005) 14:845-857), чтобы идентифицировать мышей с SMA (SMN-/-, hSMN2+/+, SMNΔ7+/+), гетерозиготных мышей и мышей дикого типа (SMN+/+, hSMN2+/+, SMNΔ7+/+). Весь помет отбраковывали, оставив 7 детенышей для контроля размера помета по выживаемости. Часть помета не получала инъекции для того, чтобы создать не получавшие лечение контрольные группы.
Вестерн-блоттинг. Для биохимического анализа получавших и не получавших лечение мышей умерщвляли на 16 и 58-66 сутки, проводили реперфузию фосфатно-солевым буфером (PBS), спинной мозг иссекали, разделяли на поясничный, грудной и шейный отделы и быстро замораживали в жидком азоте. Ткани гомогенизировали в концентрации 50 мг/мл, используя буфер для лизиса T-Per и коктейль ингибиторов протеаз (Pierce, Rockford, IL). Гомогенаты осветляли посредством центрифугирования на скорости 10000 RCF в течение 6 минут и измеряли концентрацию белка посредством анализа с BCA (Pierce, Rockford, IL). 10-20 мкг белка гомогената разделяли на 4-12% SDS-PAGE, переносили на нитроцеллюлозную мембрану и исследовали с использованием моноклональных антител мыши против SMN (1:5000 BD Biosciences, San Jose, CA) и поликлональных антител кролика против β-тубулина (1:750, Santa Cruz Biotechnology, Santa Cruz, CA). Мембраны инкубировали с инфракрасными вторичными антителами (1:20000, LI-COR Biosciences, Lincoln NB) и полосы белка визуализировали посредством количественной флуоресценции, используя Odyssey (LI-COR Biosciences). Маркеры молекулярной массы подтверждали размеры полос.
Иммуногистохимия. Для гистологического анализа получавших и не получавших лечение мышей умерщвляли на 16 и 58-66 сутки, проводили реперфузию с использованием 4% параформальдегида (pH 7,4), спинной мозг удаляли и помещали в 30% сахарозу на 48-72 часа, заливали в OCT и резали на 10 мкм замороженные срезы посредством криостата. Срезы спинного мозга блокировали в течение 1 часа при комнатной температуре (КТ) и затем инкубировали или с моноклональными антителами мыши против SMN (разведение 1:200) для идентификации экспрессии hSMN, обусловленной AAV, или с поликлональными антителами козы против холинацетилтрансферазы (ChAT) (Millipore; Burlington, MA; разведение 1:100) для идентификации двигательных нейронов 8 и 9 пластинок (передний рог) спинного мозга, или с поликлональными антителами кролика против глиального фибриллярного кислого белка (GFAP) (Sigma-Aldrich, разведение 1:2500) для обнаружения астроцитов. Первичные антитела инкубировали в течение 1 часа при КТ с последующей инкубацией в течение ночи при 4°C в увлажнительной камере. Затем срезы спинного мозга инкубировали в течение 1 часа при КТ или с ФИТЦ-конъюгированным вторичным антителом против антитела кролика, или с Cy3-конъюгированным вторичным антителом против антитела козы (Jackson ImmunoResearch; West Grove, PA; разведение 1:250). Для усиления иммуноположительного сигнала SMN и ChAT использовали TSA signal amplification kit (Perkin Elmer; Waltham, MA) или протокол восстановления антигена лимонной кислотой (Vector Labs; Burlingame, CA) в соответствии с инструкциями производителя, соответственно. Срезы закрывали покровными стеклами с использованием среды для заливки Vectashield (Vector Labs; Burlingame, CA).
Подсчет двигательных нейронов. Число иммуноположительных по ChAT клеток считали в шейном, грудном и поясничном отделах. Двусторонний подсчет осуществляли при 100× увеличении в передних рогах вдоль рострокаудальной оси трех отделов спинного мозга. Соседние срезы имели расстояние по меньшей мере 100 мкм, чтобы предотвратить двойной подсчет одной клетки. Особое внимание уделяли сравнению анатомически совпадающих срезов между различными животными, и один наблюдатель вслепую определял все количества клеток. Клетки, расположенные в 8 и 9 пластинках спинного мозга, которые давали флуоресцентный ChAT сигнал заметно выше фонового, считали двигательными нейронами.
Размер мышечного волокна. Для гистологического анализа периферии фиксированные квадрицепсы, икроножные и межреберные мышцы с правой стороны каждой мыши обрабатывали в парафине и окрашивали гематоксилин-эозином для определения размера мышечного волокна, как сообщалось (Avila et al., J. Clin. Invest. (2007) 117:659-671). Приблизительно 500 неперекрывающихся мышечных волокон из каждой мышцы каждого животного случайно выбирали и фотографировали при 60× увеличении. Площадь поперечного сечения каждого мышечного волокна измеряли, используя программное обеспечение Metamorph (Molecular Devices, Sunnyvale, CA).
Окрашивание нервно-мышечных соединений (NMJ). Фиксированные мышечные группы с левой стороны каждой мыши хранили в PBS для анализа NMJ. Осуществляли окрашивание расправленных мышечных волокон квадрицепсов, икроножных и межреберных мышц in toto, как сообщалось (Lesbordes et al., Hum. Mol. Genet. (2003) 12:1233-1239). Пресинаптические терминали нервов метили посредством инкубации при 4°C в течение ночи с поликлональными антителами кролика против 150 кДа изоформы нейрофиламента (NF-M, Millipore, Billerica, MA, разведение 1:200), за которым следовало биотинилированное вторичное антитело против антитела кролика (Jackson ImmunoResearch, разведение 1:200). Ацетилхолиновые рецепторы на концевых пластинках мышц метили Alexa 555-конъюгированным α-бунгаротоксином (Molecular Probes, Eugene, OR) в разведении 1:5000 в течение 3 часов при КТ. Окрашенные мышечные волокна помещали на предметные стекла, накрывали покровными стеклами с использованием Vectashield и наблюдали под эпифлуоресцентным микроскопом. Для количественного анализа NMJ минимум 100 NMJ от каждой мышцы каждого животного случайно выбирали и оценивали под микроскопом. Захват конфокальных изображений осуществляли, используя микроскоп Zeiss LSM 510-META.
Поведенческие тесты. В тесте на выпрямительный рефлекс каждую мышь помещали в положение лежа на спине и измеряли время, которое у мыши занимала смена на положение на всех четырех лапах. Процедуру повторяли три раза для каждого животного, и среднее значение трех оценок означало оценку выпрямления. Тест прерывали, если мышь не реагировала в течение 60 секунд. В тесте на отрицательный геотаксис каждую мышь помещали на платформу под углом 45° головой вниз. Тест считали успешным, если мышь поворачивалась на 180° в положение головой вверх. Каждой мыши давали три попытки выполнить задание за 180 секунд или менее. В тесте на силу хватания передние конечности и задние конечности помещали вместе на проволочную решетку и осторожно тянули горизонтально вдоль сетки. Сопротивление регистрировали в граммах посредством преобразователя силы. В тесте на разведение задних конечностей каждую мышь подвешивали за хвост на 5 секунд и получаемое разведение оценивали, основываясь на произвольной системе. Здоровому разведению обеих задних конечностей, схожему с наблюдаемым у мышей дикого типа, давали оценку 4. Острому углу разведения или «слабому разведению» обеих задних конечностей давали оценку 3. Разведению одной ноги давали оценку 2. Мышь, которая не показывала разведение, получала оценку 1. В итоге, оценку 0 получали детеныши, которые вытягивали обе задние конечности вместе, фактически скрещивая их друг с другом.
Статистика. Поведенческие тесты, число двигательных нейронов, площади поперечного сечения мышечных волокон и нервно-мышечные соединения анализировали с использованием однофакторного дисперсионного анализа и апостериорного критерия Бонферрони для множественных сравнений и непарного двустороннего критерия Стьюдента. Кривую выживаемости Каплана-Мейера анализировали с помощью логарифмического рангового критерия, эквивалентного критерию Мантеля-Гензеля. Весь статистический анализ осуществляли в GraphPad Prism v4.0 (GraphPad Software, San Diego, CA). Значимыми считали значения с p<0,05.
Пример 1
Значимое увеличение выживаемости при лечении с использованием AAV-опосредованной доставки SMN1
В постнатальные сутки 0 (P0) мыши с SMA получали интрацеребровентрикулярную инъекцию AAV-hSMN1 в оба боковых желудочка головного мозга и прямую спинномозговую инъекцию в верхнюю часть поясничного отдела спинного мозга с общей дозой 5,0 e10 копий генома на мышь. Мышей с SMA, получавших и не получавших лечение, случайно определяли или в когорту выживаемости, в которой всех мышей оставляли в покое и умерщвляли в гуманной конечной точке, или в когорту с совпадающим возрастом, в которой всех мышей умерщвляли на 16 сутки для сравнения с не получавшими лечение мышами в терминальной стадии SMA с совпадающим возрастом.
В когорте выживаемости мыши с SMA, которых лечили с использованием AAV-hSMN1, демонстрировали значительное увеличение среднего значения продолжительности жизни до 50 суток (p<0,0001) по сравнению с 15 сутками у не получавших лечение контрольных мышей с SMA (фиг.1). Все мыши с SMA, получавшие лечение, оставались живы на 15 сутки и 87,5% мышей с SMA, получавших лечение, оставались на 19 сутки по сравнению с 0% у мышей с SMA, не получавших лечение. Кривая Каплана-Мейера при лечении показывала бимодальное распределение выживаемости, в котором первая группа погибала на 17-27 сутки, а вторая группа на 58-66 сутки (фиг.1). В первой группе большинство мышей с SMA, получавших лечение, демонстрировало способность передвигаться, но мыши имели задержки роста и в итоге их находили мертвыми в клетке. Вторая группа мышей с SMA, получавших лечение, на 58-66 сутки демонстрировала способность передвигаться и увеличение массы, но в итоге происходило развитие тяжелого некроза задних конечностей, который приводил к эвтаназии животного. По существу, параллельно анализировали мышей в возрасте 58-66 суток и когорту с совпадающим возрастом в 16 суток.
Пример 2
AAV-опосредованная экспрессия SMN в спинном мозге и число двигательных нейронов
По всему спинному мозгу происходило повышение уровней белка hSMN после введения AAV-hSMN1 в ЦНС. У всех мышей с SMA, получавших лечение AAV, на 16 сутки имело место приблизительно 34,0- и 3,6-кратное повышение уровней белка hSMN в инъецированном поясничном отделе по сравнению с мышами с SMA, не получавшими лечение, и мышами дикого типа, соответственно (фиг.2A). Повышение экспрессии белка hSMN распространялось в другие отделы, что включало более чем 2,0-кратное повышение относительно уровней дикого типа в грудном и шейном отделах спинного мозга на 16 сутки (фиг.2B и 2C). Во второй группе экспрессию белка hSMN поддерживали у мышей с SMA, получавших лечение AAV, на 58-66 сутки. Инъецированная поясничная и соседние грудная и шейная области превышали контроли WT с совпадающим возрастом приблизительно в 2,5, 2,2 и 1,2 раза, соответственно.
Иммуноокрашивание тканевых срезов показывало белок hSMN в заднем и переднем рогах спинного мозга у мышей с SMA, получавших лечение, на 16 и 58-66 сутки (фиг.3). При более тщательном исследовании трансдуцированных клеток обнаруживали обусловленную вектором экспрессию hSMN в виде пятен по всему цитозолю и кристаллических структур в ядре (фиг.3A). Кроме того, белок hSMN локализован в нейритах в виде четких гранулярных структур, которые можно видеть по всей длине дендритов и аксонов (фиг.3B-3D). Очень низкий уровень эндогенного белка hSMN у мышей с SMA был ниже порога иммунологического определения в клетках (фиг.3E).
Совместная локализация с ChAT и hSMN подтверждала, что подмножество трансдуцированных клеток действительно представляло собой двигательные нейроны (фиг.3F-3I). На 16 сутки приблизительно 18-42% ChAT-положительных клеток в поясничном, грудном и шейном отделах спинного мозга трансдуцировали вектором AAV-hSMN1 (фиг.3J). Эта процентная доля была выше на 58-66 сутки, когда 60-70% двигательных нейронов экспрессировали экзогенный hSMN в трех отделах спинного мозга (фиг.3J). Имело место общее увеличение числа двигательных нейронов у мышей с SMA, получавших лечение, по сравнению с мутантами, не получавшими лечение (фиг.4). Однако у мышей с SMA, получавших лечение, двигательных нейронов было значительно меньше по сравнению с мышами дикого типа на 16 и 58-66 сутки (фиг.4).
Осуществляли иммуноокрашивание hSMN в шейных тканевых срезах гетерозиготных мышей, не получавших лечение, получавших только интрацеребровентрикулярные (ICV) инъекции и получавших только поясничные инъекции. Отдельные ICV инъекции не вносили вклад в поддающиеся оценке паттерны трансдукции AAV в головном мозге, но, тем не менее, создавали существенное нацеливание на шейный отдел спинного мозга, которое не было достижимо при использовании только поясничных инъекций. В частности, только ICV инъекции приводили к экспрессии hSMN в шейном отделе спинного мозга. В этом состояло отличие от интрапаренхимальных инъекций в поясничный отдел, которые показывали очень низкую трансдукцию шейного отдела спинного мозга, предположительно, вследствие дистальной близости места инъекции. Иногда SMN иммуноположительный сигнал с кристаллическим паттерном наблюдали в ядрах получавших лечение гетерозигот и мышей дикого типа. Однако этот паттерн иммуноокрашивания не наблюдали в ядрах мышей с SMA, не получавших лечение.
Таким образом, сочетание ICV и поясничных инъекций у P0 мышей обеспечивало обширную повсеместную трансдукцию спинного мозга. ICV инъекции AAV8-hSMN нацеливали на шейный отдел спинного мозга для трансдукции.
Пример 3
Влияние лечения с использованием AAV на размер мышечных волокон, нервно-мышечные соединения и поведение
Для анализа выбирали квадрицепсы (проксимальные), икроножные (дистальные) и межреберные (дыхательные) мышцы, поскольку они проявляли заметную дегенерацию. На 16 сутки у мышей с SMA, не получавших лечение, мышечные волокна имели малые размеры, и площадь поперечного сечения большинства отдельных клеток составляла <100 мкм2 (фиг.5A). Менее чем у 10% мышечных волокон мышей с SMA, не получавших лечение, площадь поперечного сечения составляла более 200 мкм2. В отличие от этого, распределение размеров мышечных волокон у мышей с SMA, получавших лечение AAV-hSMN1, сходно с мышами дикого типа, и площадь поперечного сечения многих клеток составляла боле 200 и более 400 мкм2 на 16 и 58-66 сутки, соответственно (фиг.5A и 5B). Показано, что общее среднее значение на 16 сутки для мышечных волокон мышей с SMA, получавших лечение, более чем в 2 раза превышало таковое мышей с SMA, не получавших лечение (фиг.5C). Кроме того, средняя площадь поперечного сечения мышечного волокна у мышей с SMA, получавших лечение, на 58-66 сутки составляла 67%, 76% и 82% от таковой квадрицепсов, икроножных и межреберных мышц мышей дикого типа, соответственно (фиг.5C).
Анализ нервно-мышечных соединений (NMJ) мышей с SMA, не получавших лечение, на 16 сутки показал аномальное накопление белка нейрофиламента в пресинаптических терминалях (фиг.6A). Приблизительно в 75-90% пресинаптических терминалей квадрицепсов, икроножных и межреберных мышц мышей с SMA, не получавших лечение (фиг.6F), наблюдали эту характерную патологию. В отличие от этого, большинство пресинаптических терминалей мышей с SMA, получавших лечение AAV-hSMN1, не содержало эти поврежденные структуры (фиг.6B, 6D). Только у 10-25% и 5% пресинаптических терминалей мышей с SMA, получавших лечение, наблюдали эту характерную патологию на 16 и 58-66 сутки, соответственно (фиг.6F). Однако лечение приводило к большему разветвлению пресинаптических терминалей, чем у мышей дикого типа (фиг.6B-6E). Окрашивание постсинаптических NMJ мышей с SMA, получавших лечение, и мышей дикого типа α-бунгаротоксином давало «кренделевидные» структуры, которые указывали на функциональную сеть ацетилхолиновых рецепторов (фиг.6B-6E).
Мышей, получавших и не получавших лечение, периодически подвергали поведенческим тестам, которые одобрены для этой животной модели (Butchbach et al., Neurobiol. Dis. (2007) 27:207-219; El-Khodar et al., Exp. Neurol. (2008) 212:29-43). Мыши с SMA, получавшие лечение, имели хорошие оценки для корпуса и ходильные навыки, тогда как мыши с SMA, не получавшие лечение, были свободны и парализованы (фиг.7A). Мыши с SMA, получавшие лечение, были значительно тяжелее по массе, чем контрольные мыши с SMA, не получавшие лечение, хотя они никогда не достигали размера мышей дикого типа (фиг.7B). Мыши с SMA, получавшие лечение, показывали значимое улучшение задержки выпрямления (фиг.7C). Также мыши с SMA, получавшие лечение, значительно лучше выполняли тест на отрицательный геотаксис, который является мерой пространственного локомоторного поведения (фиг.7D). Кроме того, мыши с SMA, получавшие лечение, показывали значимое улучшение силы хватания и способности разводить свои задние конечности (фиг.7E, 7F).
Пример 4
Влияние использования самокомплементарного AAV на срок жизни
Без ограничения теорией предполагается, что самокомплементарные векторы AAV (scAAV) имеют более высокие кинетические показатели экспрессии благодаря двухцепочечному рекомбинантному геному (обсуждается в McCarty, D.M. Molec. Ther. (2008) 16:1648-1656). Это быстрое повышение экспрессии может быть полезным при очень агрессивных заболеваниях или состояниях, где временной интервал для вмешательства мал. Таким образом, чтобы определить, может ли более ранняя экспрессия повысить эффективность, конструировали и тестировали вектор scAAV (scAAV-hSMN1). Используя то же место инъекции, что и в примере 1, вводили дозу 1,7 e10 копий генома scAAV-hSMN1 мышам с SMA в P0.
Лечение вектором scAAV-hSMN1 приводило к яркому и заметному улучшению среднего значения выживаемости, равной 157 суткам (p<0,0001), что составляло увеличение на 214% и 881% по сравнению с мышами с SMA, получавшими лечение вектором AAV-hSMN1 и не получавшими лечение, соответственно (фиг.8). Приблизительно 42% мышей, получавших лечение scAAV, имели более чем 1000% увеличение (log-кратное увеличение) среднего значения выживаемости. Кроме того, лечение с использованием scAAV2/8-GUSB-hSMN1 у 88% мышей с SMA приводило к выживанию после 66 суток в отличие от 0% при использовании AAV2/8-CBA-hSMN1. Мыши с SMA, получавшие лечение с использованием scAAV, обладали оценками для здорового корпуса, были хорошо ухожены, набирали вес и сохраняли способность передвигаться в течение всей их жизни. Интересно, что у мышей с SMA, получавших лечение с использованием scAAV, развивался только умеренный некроз задних конечностей, который никогда не прогрессировал в тяжелый фенотип. Большинство мышей с SMA, получавших лечение с использованием scAAV, умерщвляли вследствие непредвиденного и внезапного возникновения дыхательной недостаточности, которая включала слышимую щелкающую одышку при дыхании и сниженную частоту дыхания.
Чтобы лучше понять основу наблюдаемого повышения выживаемости при использовании scAAV8-hSMN, дополнительные мыши с SMA получали лечение в P0, и их умерщвляли на 16 или 64 (58-66) сутки после инъекции и проводили анализ кривой выживаемости вместе с долгоживущими мышами, получавшими лечение scAAV8 (фиг.8). На 16 сутки уровни экспрессии SMN в группе scAAV8-hSMN составляли приблизительно 60-90% от наблюдаемых у животных WT. Эти уровни были по существу ниже достигаемых лечением с использованием AAV8-hSMN в этот момент времени. У мышей с SMA, получавших лечение с использованием scAAV8-hSMN, уровни SMN как в поясничном, так и в грудном отделе превышали уровни WT на 58-66 и 120-220 сутки, соответственно, или были равны им (фиг.2A и 2B). В отличие от этого, уровни SMN в шейном отделе спинного мозга оставались относительно низкими во все моменты времени.
Сравнение тропизма вектора AAV в поясничном отделе спинного мозга исследовали с использованием иммуноокрашивания hSMN в замороженных срезах тканей мышей с SMA, не получавших лечение, мышей с SMA, получавших лечение с использованием AAV8-hSMN, и мышей с SMA, получавших лечение с использованием scAAV8-hSMN, на 16 сутки и 157 сутки после инъекции. Диффузный паттерн иммуноокрашивания hSMN, соответствующий морфологии глиальных клеток, наблюдали на 16 сутки при использовании AAV8-hSMN. Двойное иммунное мечение hSMN и mGFAP подтверждало, что подмножество трансдуцированных AAV8-hSMN клеток представляло собой астроциты. В отличие от этого, лечение с использованием scAAV8 приводило к экспрессии hSMN только в отдельных телах клеток с нейрональной морфологией, которая не была локализована совместно с GFAP. Двойное иммунное мечение hSMN и маркера двигательных нейронов mChAT подтверждало, что подмножество клеток, трансдуцированных scAAV8-hSMN и AAV8-hSMN, представляло собой двигательные нейроны. Экспрессию hSMN также наблюдали в слоях вставочных нейронов спинного мозга при использовании обоих вирусных векторов, как показано на примере scAAV8-hSMN на 157 сутки. Таким образом, в отличие от AAV8-hSMN, гистологический анализ мышей с SMA, получавших лечение с использованием scAAV8-hSMN, показал, что экспрессия hSMN в нейронах в значительной степени ограничена.
Кроме того, двойное иммуноокрашивание hSMN и mChAT показало значительное увеличение процентной доли двигательных нейронов, трансдуцированных scAAV8-hSMN, по сравнению с AAV8-hSMN (фиг.10A). Более эффективное нацеливание на двигательные нейроны при использовании scAAV коррелировало со значимым увеличением числа ChAT-положительных клеток (фиг.10B-10D). Анализ нервно-мышечных соединений (NMJ) в квадрицепсах и межреберных мышцах на 16 сутки также показывал значимое уменьшение числа поврежденных структур при использовании scAAV-hSMN по сравнению с AAV8-hSMN (фиг.10E и 10F). Однако имело место увеличение числа неправильных NMJ на 216-269 сутки, которому сопутствовало уменьшение числа двигательных нейронов в группе scAAV-hSMN (фиг.10B-10F).
В целом, инъекция AAV8-hSMN при рождении в ЦНС модели SMA на мышах приводила к повсеместной экспрессии SMN по всему спинному мозгу, которая переходила в устойчивое улучшение физиологии скелетных мышц. Животные с SMA, получавшие лечение, также показывали значимые улучшения в поведенческих тестах, что указывает на выполнение нервно-мышечными соединениями своей функции. Важно, что лечение с использованием AAV8-hSMN увеличивало среднее значение продолжительности жизни мышей с SMA до 50 суток по сравнению с 15 сутками у контрольных животных, не получавших лечение. Кроме того, инъекция самокомплементарного вектора AAV мышам с SMA приводила к повышению эффективности, включая значимое увеличение среднего значения выживаемости до 157 суток. Эти данные доказывают, что направленное на ЦНС, опосредованное AAV повышение SMN является высокоэффективным в отношении как нейрональных, так и мышечных патологий в модели тяжелой SMA на мышах.
Таким образом, описаны композиции и способы для лечения нарушений спинного мозга. Несмотря на то, что предпочтительные варианты осуществления рассматриваемого изобретения описаны с некоторыми подробностями, понятно, что различные изменения можно выполнять, не отступая от сущности и объема изобретения как, определено в настоящем документе.
| название | год | авторы | номер документа |
|---|---|---|---|
| ГЕННАЯ ТЕРАПИЯ НЕЙРОДЕГЕНЕРАТИВНЫХ НАРУШЕНИЙ | 2010 |
|
RU2743398C2 |
| ГЕННАЯ ТЕРАПИЯ НЕЙРОДЕГЕНЕРАТИВНЫХ НАРУШЕНИЙ | 2021 |
|
RU2836835C2 |
| АДЕНОАССОЦИИРОВАННЫЙ ВИРУСНЫЙ ВЕКТОР, СОСТОЯЩИЙ ИЗ БЕЛКОВ КАПСИДА РНР.В, НУКЛЕИНОВОЙ КИСЛОТЫ, КОДИРУЮЩЕЙ БЕЛОК SMN, И ЕГО ПРИМЕНЕНИЕ | 2022 |
|
RU2833225C2 |
| СРЕДСТВА И СПОСОБ ПОЛУЧЕНИЯ ВИРУСНЫХ ВЕКТОРОВ И ВАРИАНТЫ ИХ ПРИМЕНЕНИЯ | 2018 |
|
RU2818529C2 |
| ВИРУСНЫЕ ВЕКТОРЫ НА ОСНОВЕ AAV И ПУТИ ИХ ПРИМЕНЕНИЯ | 2019 |
|
RU2796274C2 |
| ИНТРАТЕКАЛЬНАЯ ДОСТАВКА РЕКОМБИНАНТНОГО АДЕНОАССОЦИИРОВАННОГО ВИРУСА, КОДИРУЮЩЕГО МЕТИЛ-CPG-СВЯЗЫВАЮЩИЙ БЕЛОК 2 | 2017 |
|
RU2788084C2 |
| ВЕКТОР АДЕНОАССОЦИИРОВАННОГО ВИРУСА | 2015 |
|
RU2743382C2 |
| ВЕКТОР НА ОСНОВЕ АДЕНОАССОЦИИРОВАННОГО ВИРУСА ДЛЯ ТЕРАПЕВТИЧЕСКОЙ ДОСТАВКИ В ЦЕНТРАЛЬНУЮ НЕРВНУЮ СИСТЕМУ | 2016 |
|
RU2804953C2 |
| МОДИФИЦИРОВАННЫЕ ГЕНЫ АТАКСИИ ФРИДРЕЙХА И ВЕКТОРЫ ДЛЯ ГЕННОЙ ТЕРАПИИ | 2016 |
|
RU2743792C2 |
| ВЕКТОР НА ОСНОВЕ АДЕНОАССОЦИИРОВАННОГО ВИРУСА ДЛЯ ТЕРАПЕВТИЧЕСКОЙ ДОСТАВКИ В ЦЕНТРАЛЬНУЮ НЕРВНУЮ СИСТЕМУ | 2016 |
|
RU2751952C2 |



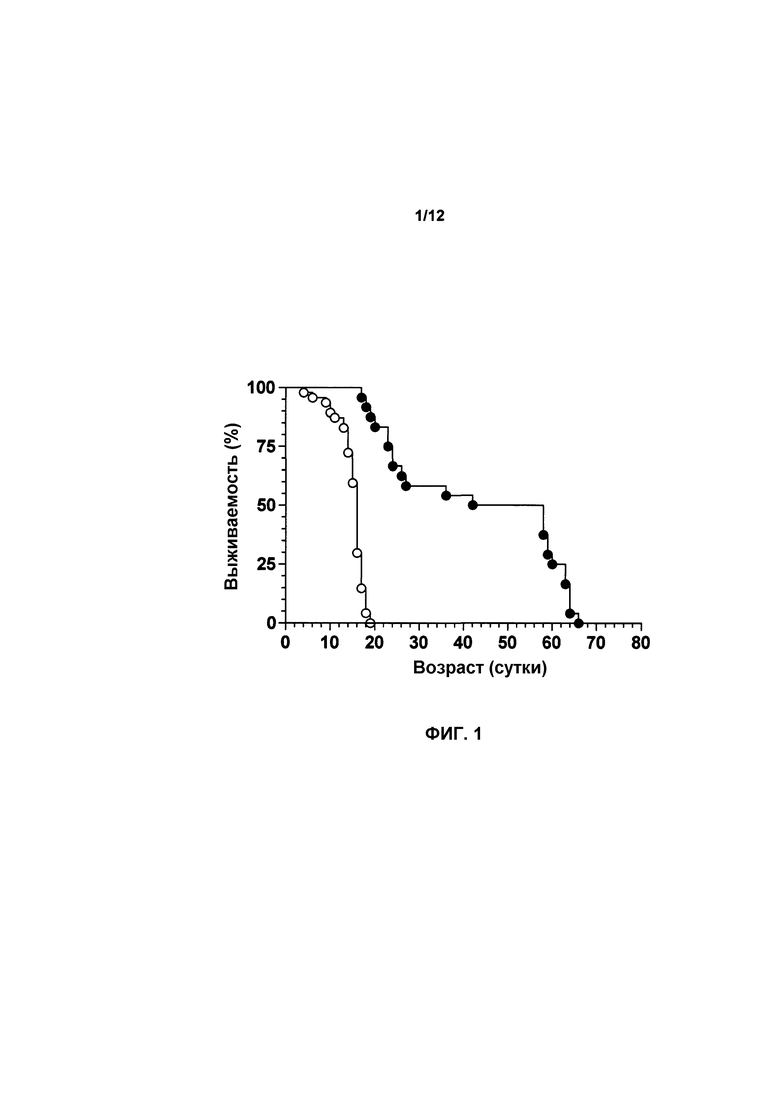
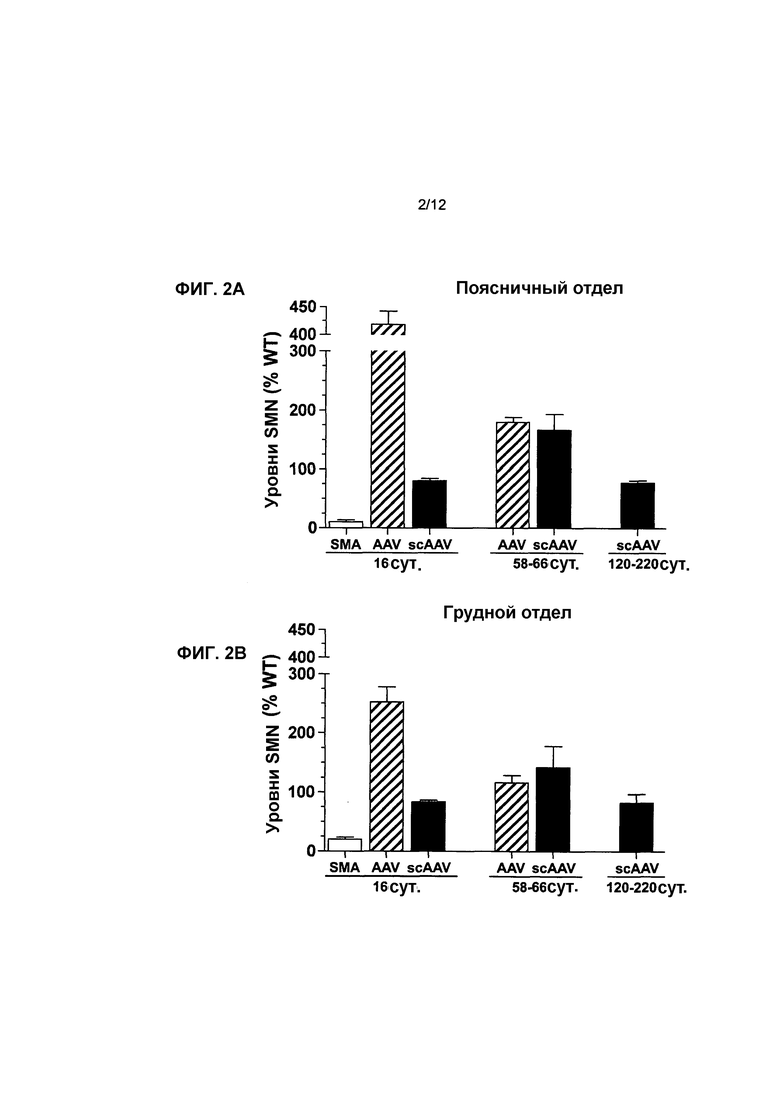
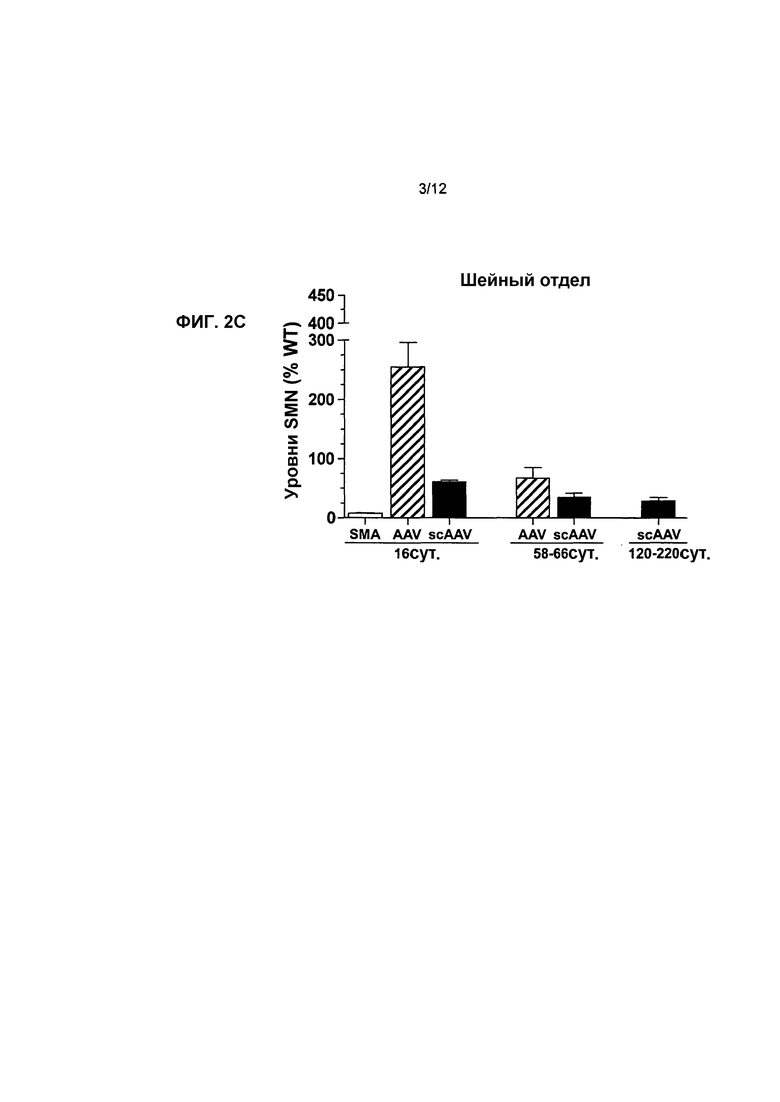
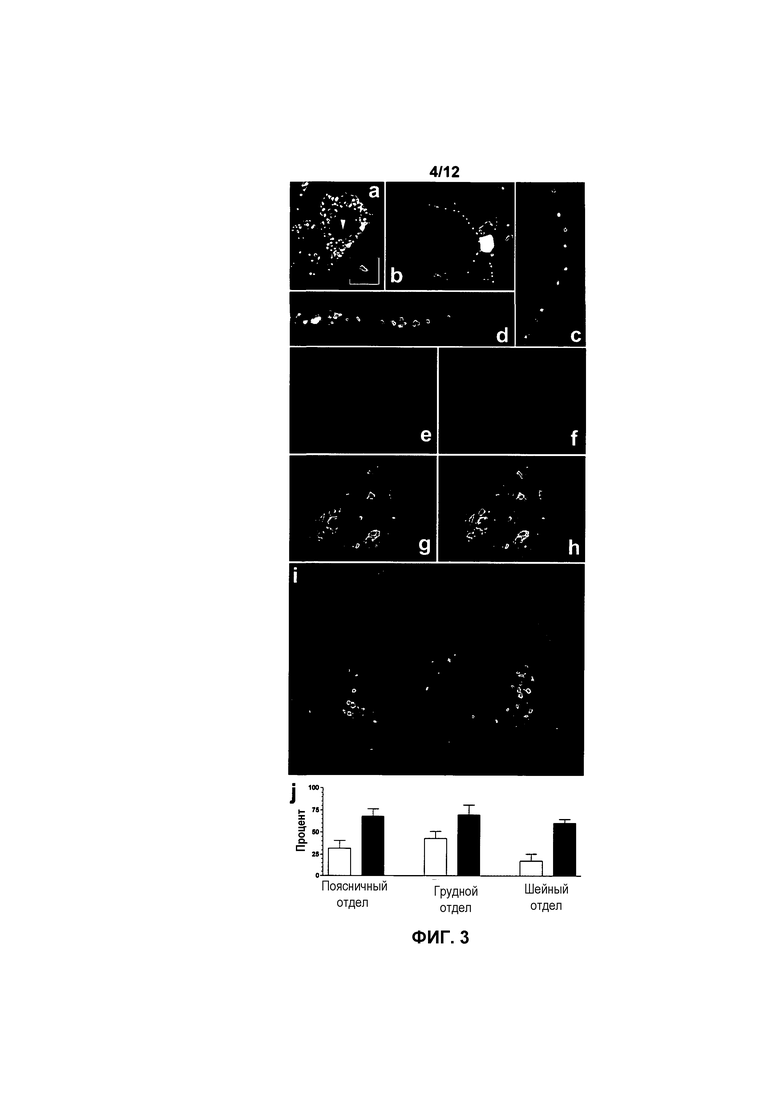
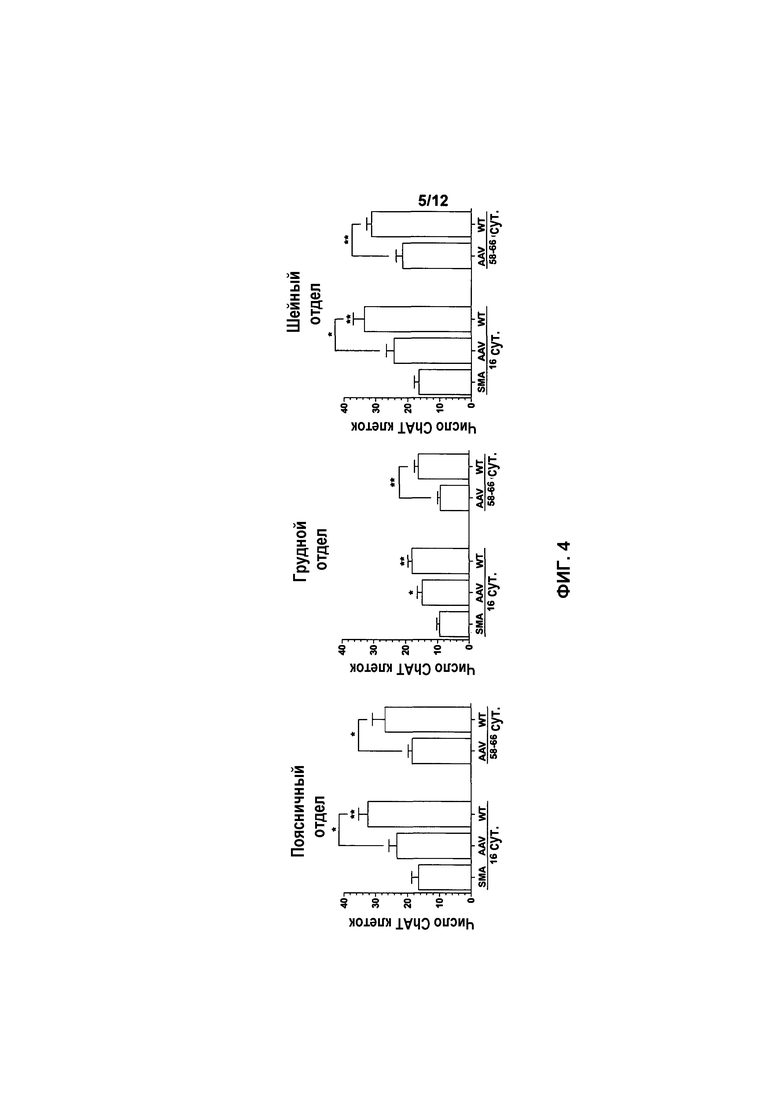
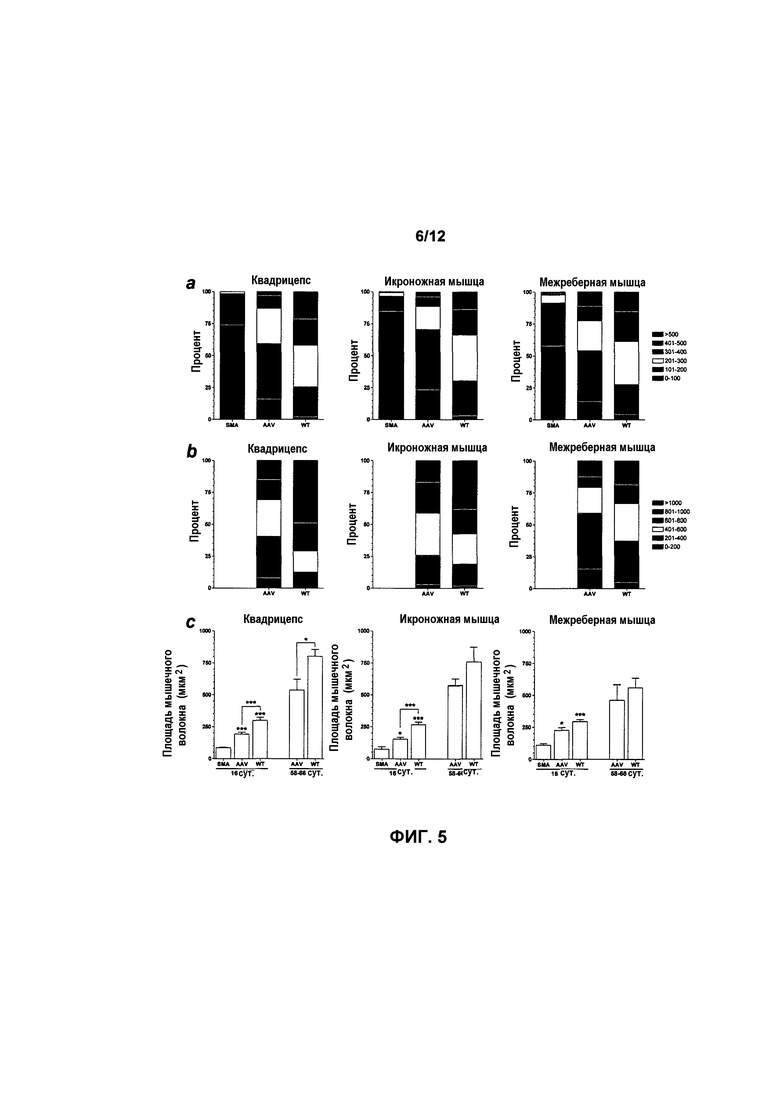
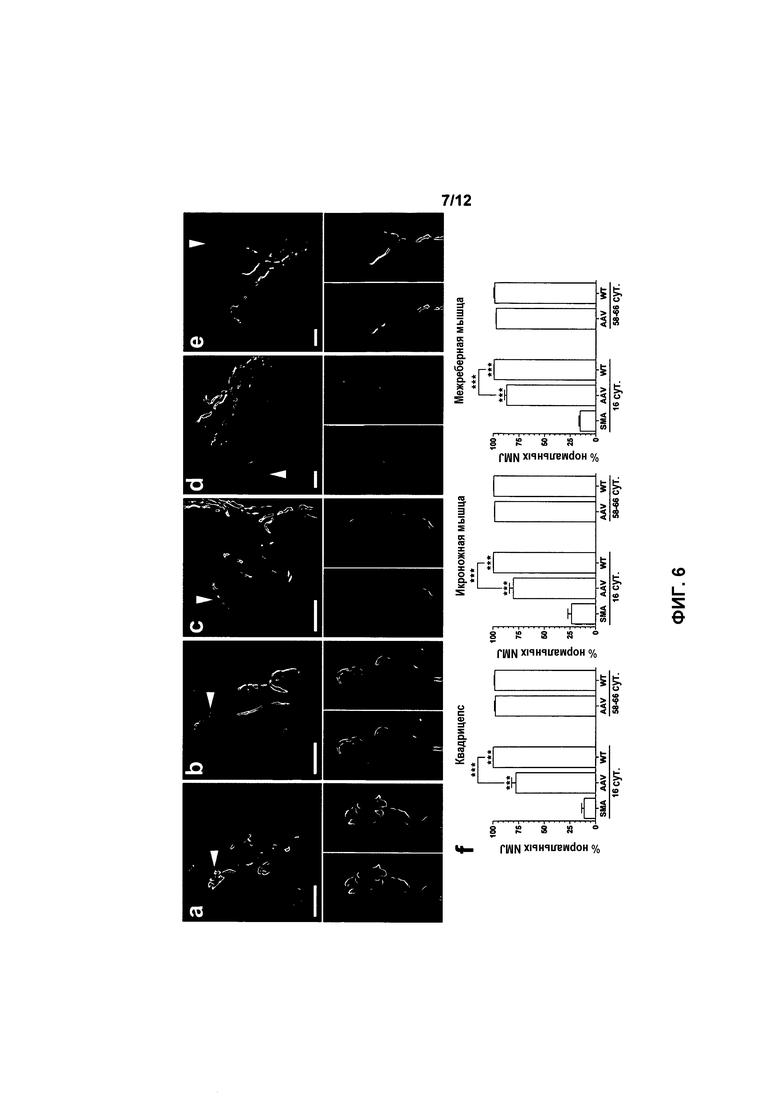
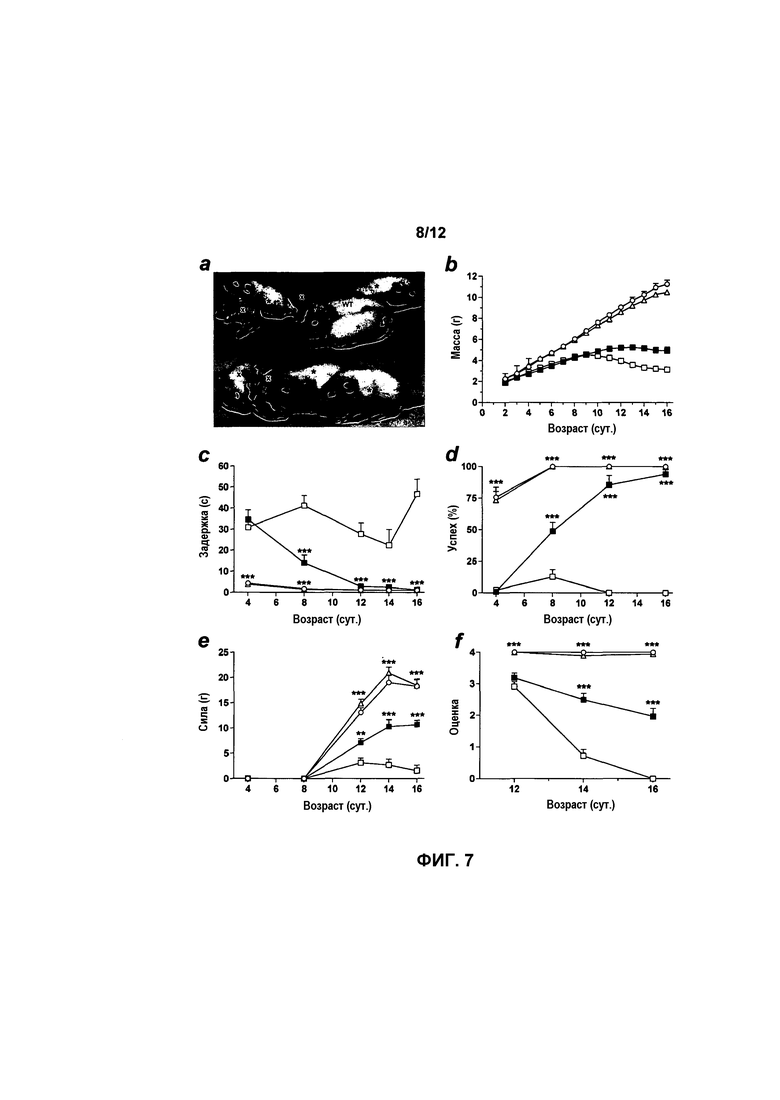
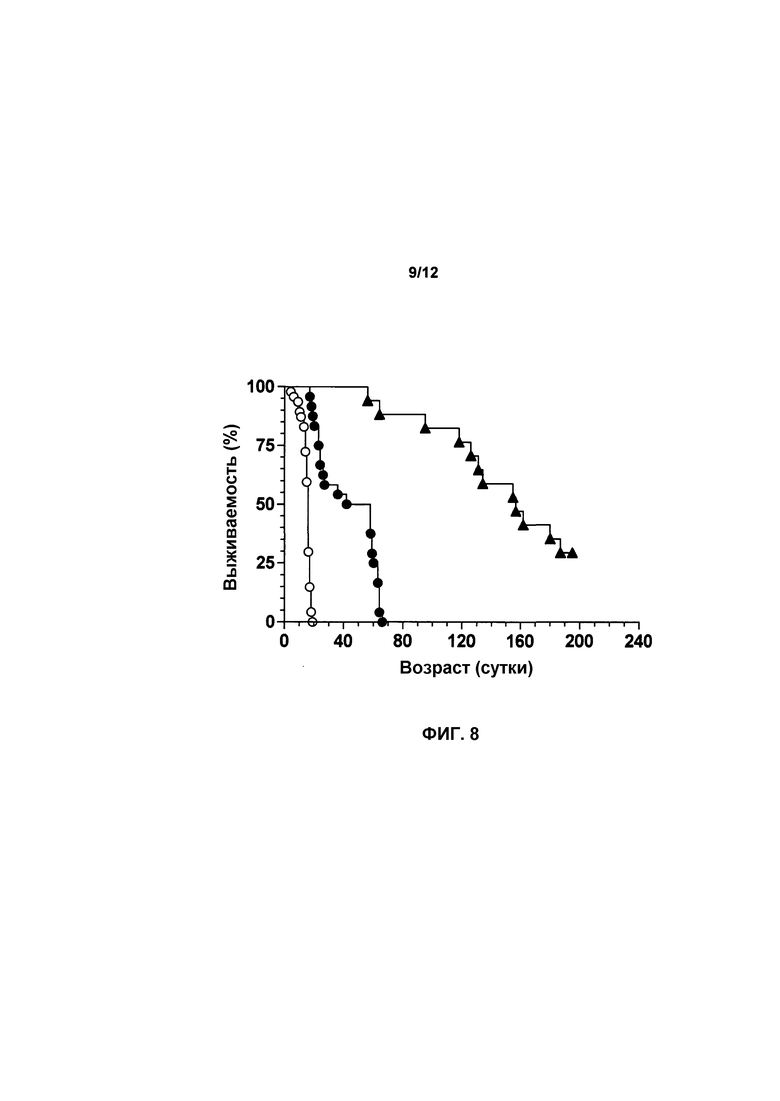

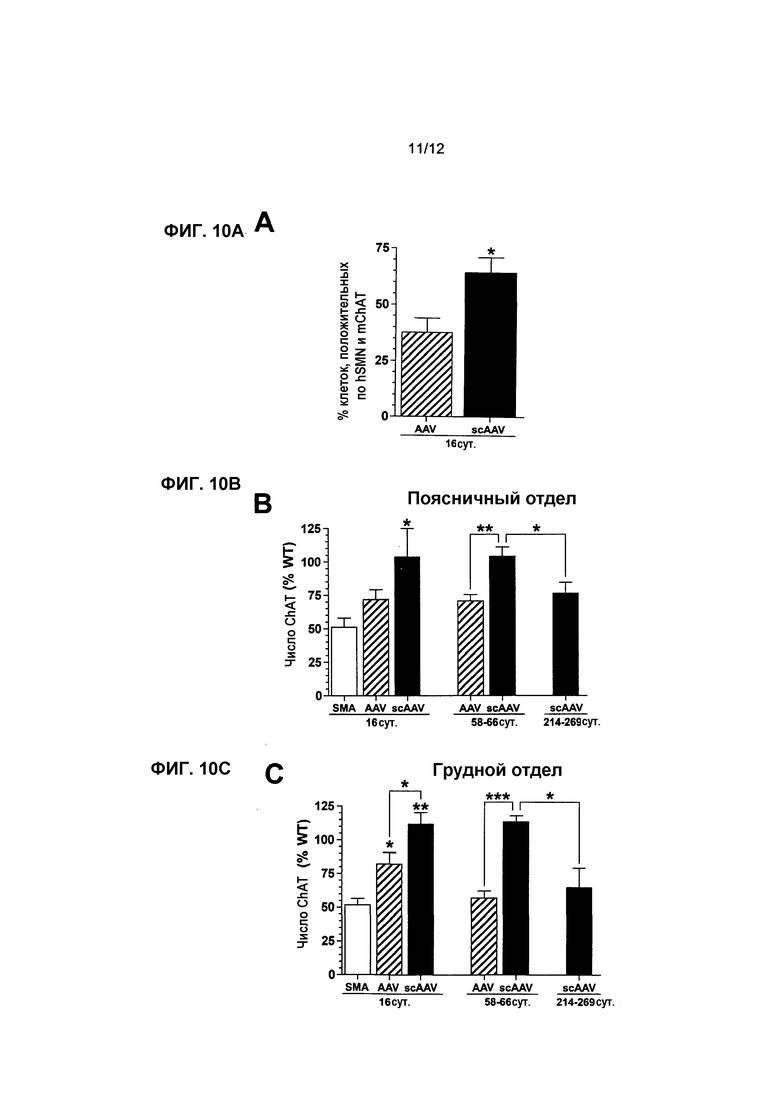

Изобретение относится к области биотехнологии. Описан самокомплементарный аденоассоциированный вирусный вектор для лечения нарушений двигательных нейронов, таких как спинальная мышечная атрофия, боковой амиотрофический склероз, спинобульбарная мышечная атрофия, спиноцеребеллярная атаксия, первичный латеральный склероз и травматическое повреждение спинного мозга. Также описаны композиции и способы для лечения нарушений, влияющих на двигательную функцию, например двигательную функцию, на которую влияет заболевание или повреждение головного мозга и/или спинного мозга. Предложенная группа изобретений может быть использована в медицине. 7 н. и 9 з.п. ф-лы, 17 ил., 4 пр.
1. Самокомплементарный аденоассоциированный вирусный (scAAV) вектор для модуляции двигательной функции у субъекта, который содержит полинуклеотид, кодирующий капсид из серотипа AAV8, и полинуклеотид, кодирующий белок выживаемости двигательных нейронов (SMN).
2. Вектор scAAV по п. 1, где белок SMN кодируется SMN-1 человека.
3. Вектор scAAV по п. 2, где белок SMN содержит аминокислотную последовательность, обладающую по меньшей мере 90% идентичностью последовательности с последовательностью, изображенной на фиг. 9B.
4. Вектор scAAV по п. 3, где белок SMN содержит аминокислотную последовательность, как изображено на фиг. 9B.
5. Рекомбинантный вирион AAV для модуляции двигательной функции у субъекта, содержащий вектор scAAV по любому из пп. 1-4.
6. Композиция для модуляции двигательной функции у субъекта, содержащая рекомбинантный вирион AAV по п. 5 и фармацевтически приемлемый эксципиент.
7. Способ модуляции двигательной функции у субъекта с нарушением двигательных нейронов, включающий введение терапевтически эффективного количества композиции по п. 6 в клетки субъекта.
8. Способ обеспечения белком SMN субъекту со спинальной мышечной атрофией (SMA), включающий введение терапевтически эффективного количества рекомбинантного вириона AAV, содержащего вектор AAV по любому из пп. 1-4, в клетки субъекта, нуждающегося в этом.
9. Способ по любому из пп. 7 или 8, в котором композицию вводят посредством введения в по меньшей мере одну область глубоких ядер мозжечка.
10. Способ по любому из пп. 7 или 8, в котором композицию вводят посредством прямой инъекции в спинной мозг.
11. Способ по любому из пп. 7 или 8, в котором композицию вводят посредством интрацеребровентрикулярной инъекции.
12. Способ по п. 11, в котором композицию вводят в по меньшей мере один боковой желудочек головного мозга.
13. Способ по любому из пп. 7 или 8, в котором композицию вводят посредством как интрацеребровентрикулярной инъекции, так и прямой инъекции в спинной мозг.
14. Способ по любому из пп. 7 или 8, в котором композицию вводят посредством интратекальной инъекции.
15. Применение рекомбинантного вириона AAV по п. 5 в производстве лекарственного средства для модуляции двигательной функции у субъекта с нарушением двигательных нейронов.
16. Применение рекомбинантного вириона AAV, содержащего вектор AAV по любому из пп. 1-4, в производстве лекарственного средства для обеспечения белка SMN в клетках субъекта со спинальной мышечной атрофией (SMA).
| US 2009069261 A1, 12.03.2009 | |||
| HOLLIS E.R | |||
| at al., "Efficient retrograde neuronal transduction utilizing self-complementary AAV1", Mol Ther | |||
| Станок для изготовления деревянных ниточных катушек из цилиндрических, снабженных осевым отверстием, заготовок | 1923 |
|
SU2008A1 |
| US 2008187512 A1, 07.08.2008 | |||
| RU 2146149 C1, 10.03.2000. | |||
Авторы
Даты
2016-11-27—Публикация
2010-04-27—Подача