Область техники
Настоящее изобретение относится к устройству для денудации просвета полости организма, в частности поверхностной вены. Также предусмотрены способы денудации просвета полости организма, в частности поверхностной вены, и способы лечения варикозного расширения вен.
Уровень техники
Варикозное расширение вен представляет собой расширенные извитые вены, которые связаны со структурными изменениями стенок сосудов, несостоятельностью венозных клапанов, рефлюксом и скоплением крови. Они составляют часть спектра хронических заболеваний вен (CVD). Пациенты испытывают симптомы, варьирующиеся от тяжести, ноющей боли и отека до раздражения кожи, изменения цвета и изъязвления в тяжелых случаях. Причина варикозного расширения вен неизвестна, но в их развитии важны генетические факторы, приводящие к слабости компонентов стенок вен и клапанов.
Варикозное расширение вен чаще всего возникает в поверхностной венозной сети нижней конечности, но может также возникать в венах таза и пищевода при определенных патологических состояниях. Поверхностные вены отводят кровь от кожи и подкожных тканей в глубокую венозную сеть и, в конечном итоге, обратно к сердцу. Первичная поверхностная вена представляет собой большую подкожную вену (GSV), которая проходит от голеностопного сустава до паховой области по медиальной стороне нижней конечности. Малая подкожная вена (SSV) проходит от голеностопного сустава до колена по задней поверхности голени. И GSV, и SSV стекают в глубокую бедренную вену в местах соединения в паховой области и кзади от колена, соответственно.
В венах есть клапаны, предотвращающие обратный ток крови за счет увеличения эффективности мышечной помпы в ноге. Клапаны характеризуются двустворчатой структурой, образованной складками эндотелия, поддерживаемыми соединительной тканью и гладкими мышцами. GSV содержит от 10 до 20 клапанов, SSV, как правило, содержит от 6 до 12 клапанов. Некомпетентные клапаны приводят к оттоку крови в направлении, противоположном нормальному потоку, что можно увидеть с помощью ультразвукового доплеровского исследования.
Вены характеризуются более тонкими стенками в отличие от более толстых и эластичных стенок артерий. Вены более податливы (гибкие), что позволяет их просвету варьироваться от сжатой формы при низком давлении до растянутой формы при повышении венозного давления. Толщина стенки подкожной вены, как правило, варьируется от 200 до 700 микрометров (мкм). Как и в артериях, стенка состоит из трех основных слоев: внутренней оболочки, средней и наружной оболочки. Однако, в отличие от артерий, толщина и состав слоев различаются, что приводит к более податливым и менее мышечным сосудам. Внутренний слой состоит из одного слоя плоских клеток, известных как эндотелий, и нескольких тонких эластических волокон, коллагена и гладкомышечных клеток. Важно отметить, что существует бесклеточный слой макромолекул, известный как гликокаликс, который покрывает эндотелиальный слой и защищает его от сдвиговых сил. Гликокаликс, как правило, представляет собой равномерно распределенную структуру толщиной 0,5-3 мкм, что превышает толщину эндотелиальных клеток (0,2 мкм). Средний слой состоит из коллагена, эластичных волокон и трех слоев гладкомышечных клеток. Наружная оболочка или адвентиция представляет собой самый толстый слой и содержит плотный коллаген, сенсорные нервы и эластические волокна.
Свертывание крови или тромбоз могут возникать как в глубоких, так и в поверхностных венозных сетях. Тромб в поверхностных венах, как правило, является одиночным из-за низкой пропускной способности и редко распространяется в глубокую венозную сеть. Это не опасно для пациента и не требует лечения, если нет сопутствующего воспаления, известного как тромбофлебит. Тромбоз глубоких вен голени, известный как тромбоз глубоких вен (DVT), имеет клиническое значение, поскольку он может вызвать обструкцию венозного оттока, повышая венозное давление и приводя к отеку ноги. Тромб также может перемещаться (эмболизировать) в легкие, вызывая потенциально смертельное состояние, известное как легочная эмболия (РЕ).
Варикозное расширение вен представляет собой наиболее частое заболевание периферических сосудов, которое встречается у 40% взрослого населения [1]. Факторы риска включают в себя возраст, семейный анамнез, ожирение, занятия, требующие длительного стояния, и малоподвижный образ жизни.
Варианты лечения варьируются от консервативного компрессионного трикотажа до хирургических процедур. В США ежегодно проводится от 600000 до 700000 процедур для лечения варикозного расширения вен. Здесь лечение варикозного расширения вен перешло от открытой хирургии (предусматривающей удаление всей GSV) к менее инвазивным технологиям на основе термического эндовенозного катетера (с использованием радиочастоты или лазерной энергии). В некоторых странах, включающих в себя Германию и Великобританию, все еще выполняется большая часть процедур по открытой экстракции вен.
Как правило, в настоящее время для лечения рефлюкса поверхностных вен используются минимально инвазивные термические способы лечения с использованием управляемого катетера. Существенным ограничением применения термической энергии является необходимость многократных инъекций препарата больших объемов местного анестетика, смешанного с физиологическим раствором (тумесценция), для изоляции вены и защиты окружающих тканей от термического повреждения. Это требует много времени для врача и болезненно для пациента из-за необходимости многократных инъекций иглы в ногу. Поскольку между кожей и веной требуется пространство для инъекции тумесцентной анестезии, это также ограничивает лечение, когда вены расположены рядом с важными нервами (как в случае лечения вен ниже колена), рядом с кожей или рядом с язвами у пациентов с прогрессирующим сердечно-сосудистым заболеванием (классификация 5 и 6 СЕАР).
Термическое повреждение окружающих нервов и кожи все еще может произойти, несмотря на применение тумесцентной анестезии. Частота повреждения нервов, приводящего к стойкой парестезии, составляет от 0% до 9% в ряде исследований с более высокими показателями для абляций GSV или SSV ниже колена.
Тромбоэмболические события представляют собой наиболее серьезное осложнение лечения поверхностного венозного рефлюкса. Частота DVT и РЕ в реальных исследованиях составила от 3% до 4% и от 0,2 до 0,3% [2], соответственно. Всем используемым в настоящее время способам лечения присущи ограничения, которые могут увеличить риск развития DVT и/или РЕ. Важно, чтобы любой новый способ лечения варикозного расширения вен был направлен на дальнейшее снижение риска тромбоэмболических осложнений.
Неотъемлемой проблемой современных термических способов лечения является риск эндовенозного термоиндуцированного тромбоза (EHIT), который может привести к DVT и РЕ. Считается, что это является результатом прямой передачи термической энергии от наконечника устройства для термической абляции в глубокую венозную систему. Новые волокна наконечника лазера излучают энергию радиально, что снижает риск прямой проводимости. Однако эти технологии не предотвратят распространение пузырьков пара на соседние нецелевые участки, что все еще считается возможным механизмом действия термической абляции в дополнение к поглощению света тканями [3].
За последние 10 лет появились новые нетермические нетумесцентные (NTNT) способы лечения CVD. Менее болезненные способы NTNT больше подходят для клинического кабинета, где сейчас в США проводится приблизительно 90% процедур. Современные способы NTNT предусматривают химическую пенную склеротерапию, механохимическую абляцию (МОСА) и эмболизацию цианоакрилатным клеем (CAG).
Химическая склеротерапия (инъекция химического детергента, который разрушает мембраны эндотелиальных клеток, что приводит к окклюзии вен склерозом) использовалась в течение многих лет, но ее эффективность значительно снижается в крупных венах из-за эффекта разбавления и дезактивации склерозанта компонентами крови. Вспенивание склерозанта газами с образованием эмульсии микропузырьков представляет собой новый способ, который вытесняет кровь и позволяет химическому веществу дольше оставаться в контакте с эндотелием. Несмотря на это усиление, эффективность остается значительно ниже, чем у термических способов, скорее всего, из-за неполного эндотелиального покрытия химическим склерозантом, как было показано в предыдущих гистологических исследованиях [4]. Также существует потенциально повышенный риск DVT, поскольку пена может распространяться в глубокую систему, повреждая эндотелий и формируя DVT. Более высокие концентрации смесей склерозирующей пены могут быть более эффективными, но также характеризуются более высоким риском DVT и системных осложнений. Системные осложнения химического склерозирования включают в себя транзиторные ишемические атаки (TIA) и даже инсульт из-за того, что склерозирующие соединения попадают в артериальное кровообращение через небольшое отверстие в перегородке сердца (открытое овальное отверстие). Тератогенность химических склерозантов также неизвестна, что служит противопоказанием их применение у беременных.
МОСА включает в себя комбинацию химического склерозанта и механического воздействия изнутри просвета вены для улучшения распределения склерозанта и раздражения вены, вызывая веноспазм, который уменьшает диаметр вены. Гистологические исследования показывают ограниченное механическое воздействие на целостность эндотелиальных клеток [5]. Среднесрочные последующие исследования показали клиническую эффективность, но на уровне ниже, чем существующие термические способы. Дистальный конец современных устройств МОСА, вызывающий механическое воздействие, может быть подвержен зацеплению или заеданию за стенку вены или клапаны. Это приводит к дискомфорту пациента, образованию синяков и даже к случайной экстракции вены, как сообщалось ранее [6].
Эмболизация клеем включает в себя инъекцию цианоакрилата или эквивалентного соединения, что приводит к воспалительной реакции, которая вызывает окклюзию вены. Ограничения включают в себя постоянную имплантацию инородного материала в просвет вены, последующий риск аллергических реакций и риск перемещения эмболов в глубокую венозную систему, вызывающего DVT и/или РЕ.
Венозные язвы ног представляют собой основное бремя расходов на здравоохранение в размере 14 миллиардов долларов в год в Соединенных Штатах [7] и в настоящее время в основном лечатся с использованием компрессионных повязок. Новые данные, полученные в результате исследования EVRA [8], объявленного в апреле 2018 г., предоставляют доказательства уровня I в поддержку раннего эндовенозного лечения варикозного расширения вен для увеличения скорости заживления язвы у пациентов с заболеванием класса VI CEAP (С6). Термические способы менее подходят для пациентов с венозной язвой. Необходимость многократных инъекций тумесцентной анестезии удлиняет процедуру для более пожилых пациентов и увеличивает риск инфекции и образования гематомы из-за плохой целостности кожи, прилегающей к язве. Также существует повышенный риск повреждения нерва, приводящего к парестезии, при лечении вен ниже колена, что часто является целью лечения для предотвращения венозного рефлюкса возле ложа язвы [9].
Устройства для лечения кровеносных сосудов, включая в себя варикозное расширение вен, описаны в следующих документах: WO 2017194698, US 2016030719, US 2016030068, US 2016030023, WO 2016102930, US 2011046543, US 2016242790, JP 2016034485, WO 2004112569, US201705609, US 2017056057 и US 2017056057.
В US 6402745 раскрыт пружинный электрод, характеризующийся спиральной конфигурацией, который выполняет функцию электрического разрушения внутреннего просвета сосуда. Электрод находится внутри катетера, и дистальный конец электрода проходит от конца катетера, чтобы контактировать с внутренним просветом сосуда по спирали. Это устройство только частично подвергает денудации внутренний просвет кровеносного сосуда из-за площади контакта между электродом и внутренним просветом сосуда.
В WO 2014140325 описано имплантируемое устройство с щетиной для эмболизации, которое может денудировать кровеносный сосуд при лечении различных показаний, включая в себя варикозное расширение вен и геморрой. Устройство содержит проволочный проводник, имеющий множество щетинок, идущих радиально наружу от проволочного проводника, в котором щетинки выполнены с возможностью соприкосновения с просветом кровеносного сосуда для денудации сосуда за счет очистки щеткой его просвета. Громоздкие имплантируемые устройства могут вызывать у пациента дискомфорт в поверхностных венах, особенно в области паховой области и колен. Использование щетинок для денудации вены приводит к неполной денудации внутреннего просвета вены. Множественные заостренные и/или удлиненные компоненты значительно увеличивают риск заедания и перфорации тонких податливых стенок вены.
Цель настоящего изобретения заключается в преодолении по меньшей мере одной из упомянутых выше проблем.
Сущность изобретения
Настоящее изобретение направлено на потребность в устройстве для лечения поверхностного венозного рефлюкса, которое позволяет избежать проблем, связанных с технологиями с использованием способов лечения с термическими, химическими и клеевыми имплантатами известного уровня техники, обеспечивая при этом лучшую в своем классе эффективность по сравнению с термическими вариантами. Эти цели достигаются за счет создания устройства для денудирования вены, содержащего спираль, выполненную с возможностью транс л номинальной доставки в вену, подлежащую лечению во время процедуры (без имплантации), и развертывания, посредством чего спираль по окружности (в идеале полностью по окружности) входит во внутренний просвет вены. Спираль представляет собой спираль завышенного размера (т.е. в развернутом состоянии она имеет диаметр больше, чем подвергаемая лечению вена) и имеет шероховатую поверхность, контактирующую с просветом, так что при развертывании шероховатая поверхность упирается во внутренний просвет вены и движение в осевом направлении спирали вдоль вены в развернутой конфигурации заставляет абразивную поверхность срезать внутренний просвет вены. Это приводит к механической денудации вены по длине вены, как правило, с последующим разрушением эндотелиального и среднего слоев вены, что в идеале в конечном итоге приводит к окклюзии вены из-за образования тромба, который подвергается фиброзной трансформации в отсутствие эндотелиальной выстилки кровеносного сосуда. В идеале эндотелий полностью разрушается по окружности, поскольку если бы небольшие участки оставались бы нетронутыми, тромб мог бы не образоваться и кровь бы продолжала течь, что приводило бы к неэффективности лечения, реканализации и/или раннему рецидиву. Таким образом, устройство по настоящему изобретению содержит винтовую спираль, размер которой превышает диаметр подвергаемой воздействию вены, чтобы гарантировать круговое соприкосновение между шероховатой поверхностью винтовой спирали и просветом вены. Кроме того, спираль (благодаря своей упруго деформируемой конфигурации) может саморегулироваться, чтобы обеспечить непрерывное круговое соприкосновение при сохранении направленной наружу радиальной силы вдоль участков вены или сосудов с различными диаметрами и извилистыми изгибами (фиг.59).
В соответствии с первым аспектом настоящего изобретения предусмотрено устройство для денудации просвета полости организма, содержащее головку для денудации просвета полости организма, функционально прикрепленную к удлиненному катетерному элементу и выполненную с возможностью транслюминальной доставки и развертывания в просвете полости организма, причем головка для денудации просвета полости организма содержит спираль, которая регулируется из раскрученной конфигурации доставки, подходящей для транслюминальной доставки внутри катетерного элемента, и скрученной развернутой конфигурации, характеризующейся диаметром, равным или большим, чем подлежащий денудации просвет полости организма, и которая соприкасается по окружности с внутренним просветом полости организма, причем спираль содержит абразивную поверхность, выполненную с возможностью денудации просвета полости организма, когда винтовая спираль перемещается в осевом направлении с вращением или без вращения вдоль просвета полости организма в скрученой конфигурации.
В соответствии со вторым аспектом настоящего изобретения предусмотрен способ денудации просвета полости организма, при котором используется устройство, содержащее головку для денудации просвета полости организма, функционально прикрепленную к удлиненному катетерному элементу и выполненную с возможностью транслюминальной доставки и развертывания в просвете полости организма, способ, предусматривающий следующие стадии:
транслюминальная доставка головки для денудации просвета полости организма к подлежащему воздействию просвету полости организма;
развертывание головки для денудации просвета полости организма внутри подлежащего воздействию просвета полости организма, причем головка для денудации просвета полости организма характеризуется абразивной поверхностью в круговом контакте с внутренним просветом полости организма при развертывании;
перемещение головки для денудации просвета полости организма вдоль подлежащего воздействию участка просвета полости организма, причем абразивная поверхность контактирует по окружности с просветом полости организма, в результате чего абразивная поверхность денудирует просвет полости организма;
повторный захват головки для денудации в катетерный элемент; а также извлечение устройства из просвета полости организма.
Согласно одному варианту осуществления спираль представляет собой винтовую спираль.
Согласно одному варианту осуществления спираль характеризуется «завышенным размером» по отношению к диаметру подлежащего воздействию просвета полости организма.
Согласно одному варианту осуществления диаметр спирали (или максимальный диаметр в случае винтовых спиралей, диаметр которых изменяется по длине), как правило, по меньшей мере приблизительно на 5% больше диаметра подвергаемого воздействию просвета полости организма (или в случае просветов полостей организма с различным диаметром по меньшей мере приблизительно на 5% больше диаметра просвета полости организма в его самой широкой точке), например, по меньшей мере на 10%, 15%, 20%, 25% или 30% больше, чем диаметр подлежащего воздействию просвета полости организма, и как правило на 5-30% больше. Важно, чтобы размер спирали был завышен по меньшей мере на одном витке спирали, и, как правило, завышен на 1-2 витках.
Согласно одному варианту осуществления устройство выполнено с возможностью денудировать внутренний просвет вены.
Согласно одному варианту осуществления спираль содержит материал с памятью формы и выполнена с возможностью принятия конфигурации спирали при развертывании.
Винтовая спираль, как правило, достаточно упруго деформируема для саморегулирования, чтобы поддерживать радиальную силу по окружности, действующую на стенку просвета полости организма переменного диаметра, когда она движется вдоль просвета полости организма. Согласно одному варианту осуществления винтовая спираль выполнена с возможностью рефлекторного саморегулирования своего диаметра в ответ на переменные диаметры вены и переменные осевые силы во время осевого движения вдоль зоны воздействия при сохранении направленной наружу радиальной силы на вену.
Винтовая спираль в развернутом состоянии характеризуется завышенными размерами по отношению к самой широкой части просвета полости организма (или той части просвета полости организма, которая подлежит воздействию), тем самым прилагая радиальную силу по всей окружности просвета полости организма по длине подлежащего воздействию просвета полости организма, включая в себя его самую широкую часть.
Винтовая спираль, как правило, достаточно упруго деформируема, чтобы позволить спирали проходить извилистые изгибы в просвете полости организма, сохраняя при этом радиальную силу, действующую на просвет полости организма вдоль изгиба.
Винтовая спираль, как правило, достаточно упруго деформируема, чтобы спираль могла проходить через сужение или препятствие в просвете тела, например, клапан в вене.
Согласно одному варианту осуществления устройство содержит удлиненный рычаг управления для головки для денудации просвета полости организма, расположенный внутри катетерного элемента.
Как правило, рычаг управления подсоединяется к проксимальному концу спирали.
Рычаг управления может представлять собой гипотрубку, например, гипотрубку, изготовленную из нержавеющей стали, полимера или другого материала.
Согласно одному варианту осуществления спираль содержит одиночный элемент спирали.
Согласно одному варианту осуществления одиночный элемент спирали содержит 1-5, 1-4 витка, 1-3 витка и предпочтительно 1-2 витка, а в идеале приблизительно от 1,5 до 1,7 витка в развернутой конфигурации.
Согласно одному варианту осуществления диаметр винтовой спирали варьируется по ее длине.
Согласно одному варианту осуществления диаметр винтовой спирали увеличивается к одному концу (т.е. конический).
Увеличение диаметра может быть от проксимального к дистальному или от дистального к проксимальному.
Используемый в настоящем документе термин «проксимальный» применительно к винтовой спирали относится к концу устройства, который находится ближе всего к точке введения - термин «дистальный» следует толковать, соответственно.
Согласно одному варианту осуществления диаметр винтовой спирали увеличивается к средней точке вдоль спирали, а затем уменьшается.
Согласно одному варианту осуществления дистальный конец спирали заканчивается в точке, расположенной вдоль продольной оси винтовой спирали или рядом с ней.
Согласно одному варианту осуществления винтовая спираль содержит проксимальный участок первого диаметра, промежуточный участок уменьшенного диаметра относительно проксимального участка и дистальный участок увеличенного диаметра относительно промежуточного участка.
Согласно одному варианту осуществления винтовая спираль содержит проксимальный и дистальный участок винтовой спирали и промежуточный соединительный (переходный) участок, который, как правило, не является спиральным и может быть прямым или изогнутым.
Согласно одному варианту осуществления один из проксимальных или дистальных участков винтовой спирали представляет собой правовинтовую спираль, а другой из проксимальных или дистальных участков винтовой спирали представляет собой левовинтовую спираль.
Согласно одному варианту осуществления проксимальный участок винтовой спирали представляет собой правовинтовую спираль, а дистальный участок винтовой спирали представляет собой левовинтовую спираль.
Согласно одному варианту осуществления дистальный участок винтовой спирали представляет собой правовинтовую спираль, а проксимальный участок винтовой спирали представляет собой левовинтовую спираль.
Согласно одному варианту осуществления спираль содержит множество элементов спирали, например, 2, 3, 4, 5 или более. Как правило, каждый элемент спирали характеризуется спиральной формой.
Винтовые спирали могут быть расположены в виде двойной, тройной или четверной спирали.
Как правило, элементы спирали являются коаксиальными.
Как правило, каждый элемент спирали в развернутом состоянии характеризуется одинаковым диаметром.
Как правило, каждый элемент спирали характеризуется одинаковым шагом при развертывании. В развернутой конфигурации множество элементов спирали вместе обеспечивают соприкосновение по окружности внутреннего просвета полости организма. Таким образом, каждый элемент спирали может быть сконфигурирован так, чтобы в развернутой конфигурации он соприкасался только с частью окружности внутреннего просвета, например 90°-270°, 90°-180°, 180°-270° соприкосновения с окружностью просвета полости организма.
Элементы спирали могут быть подсоединены к одному рычагу управления.
Согласно одному варианту осуществления спираль содержит два элемента винтовой спирали, например, двойную спираль.
Как правило, каждый из двух элементов винтовой спирали содержит по меньшей мере 0,5 витка в развернутом состоянии и, как правило, от 0,5 до 1,0 витка или от 0,5 до 0,7 витка.
Согласно одному варианту осуществления спираль содержит три элемента винтовой спирали, например, тройную спираль.
Как правило, каждый из трех элементов винтовой спирали содержит по меньшей мере 0,3 витка в развернутом состоянии и, как правило, от 0,3 до 1,0 витка или приблизительно от 0,3 до 0,5 витка в развернутом состоянии.
Согласно одному варианту осуществления спираль содержит четыре элемента винтовой спирали.
Как правило, каждый из четырех элементов винтовой спирали содержит по меньшей мере 0,25 витка в развернутом состоянии и, как правило, от 0,25 до 0,75 витка в развернутом состоянии.
Согласно одному варианту осуществления множество элементов спирали соединены вместе на их дистальных концах.
Согласно одному варианту осуществления множество элементов спирали не соединены на их дистальных концах.
Согласно одному варианту осуществления спираль или каждый элемент спирали является спиральным и характеризуется конфигурацией с шагом приблизительно от 0,5 до 1,5 диаметра спирали в скрученной конфигурации при развертывании.
Согласно одному варианту осуществления спираль или каждый элемент спирали является спиральным и характеризуется конфигурацией с шагом приблизительно равным диаметру в скрученной конфигурации при развертывании.
Согласно одному варианту осуществления один из элементов винтовой спирали отстоит в осевом направлении от другого элемента спирали. Как правило, согласно этому варианту осуществления рычаг управления (как правило, дистальный конец рычага управления) раздваивается для обеспечения дистальных рычагов управления, каждый из которых соединен с одной из винтовых спиралей. Однако устройство может содержать отдельные рычаги управления для независимого управления двумя винтовыми спиралями.
Согласно варианту осуществления головки для денудации вены, содержащей разнесенные в осевом направлении винтовые спирали, рычаг управления дистальной винтовой спирали, как правило, проходит в осевом направлении через проксимальную винтовую спираль (через одну, несколько или все спирали, составляющие проксимальную винтовую спираль).
Согласно одному варианту осуществления проксимальная винтовая спираль характеризуется максимальным диаметром, который больше максимального диаметра дистальной винтовой спирали (например, в 1,5-4 раза больше).
Согласно другому варианту осуществления проксимальная винтовая спираль характеризуется максимальным диаметром, который меньше максимального диаметра дистальной винтовой спирали (например, в 1,5-4 раза меньше).
Согласно одному варианту осуществления шаг проксимального и дистального элементов спирали разный.
Согласно одному варианту осуществления более узкая спираль характеризуется большим шагом.
Согласно одному варианту осуществления дистальная и/или проксимальная винтовая спираль характеризуется конической формой.
Согласно одному варианту осуществления дистальная и проксимальная винтовые спирали характеризуются конической формой.
Как правило, диаметр винтовой спирали увеличивается в проксимальном направлении (т.е. к точке входа устройства).
Согласно одному варианту осуществления спираль или каждая спираль конфигурируется так, чтобы характеризоваться таким диаметром в скрученной конфигурации, чтобы при развертывании он был по меньшей мере равен или больше диаметра подлежащей воздействию вены.
Согласно одному варианту осуществления винтовая спираль или каждая винтовая спираль характеризуется конической формой (т.е. диаметр спирали увеличивается или уменьшается по мере приближения к точке входа устройства, т.е. проксимально).
Как правило, диаметр винтовой спирали увеличивается в проксимальном направлении.
Согласно одному варианту осуществления спираль характеризуется профилем, выбранным из круглой, овальной, изогнутой, выпуклой, вогнутой, Т-образной, перевернутой Т-образной или любой другой формы.
Согласно одному варианту осуществления спираль характеризуется плоской внутренней поверхностью и внешней поверхностью, которая характеризуется изогнутой, вогнутой, выпуклой или перевернутой Т-образной формой. Винтовые спирали с этими профилями показаны на фиг.34-41.
Согласно одному варианту осуществления шероховатая поверхность спирали или каждого элемента спирали формируется обработкой поверхности спирали, как правило, внешней поверхности спирали, обращенной к просвету полости организма (и/или боковой поверхности спирали), для придания шероховатости поверхности.
Согласно одному варианту осуществления внутренняя поверхность спирали не шероховатая, а идеально гладкая. Это облегчает втягивание спирали в катетерный элемент, где гладкая поверхность спирали входит в контакт с устьем катетера.
Согласно одному варианту осуществления шероховатость поверхности достигается за счет механического, электрического, химического истирания или истирания другими средствами.
Согласно одному варианту осуществления внешняя поверхность спирали содержит углубления, обеспечивающие шероховатую поверхность.
Согласно одному варианту осуществления углубления выполнены с возможностью образования зубцов на поверхности. Согласно одному варианту осуществления углубления представляют собой поперечные углубления.
Согласно одному варианту осуществления поперечные углубления полностью проходят по внешней поверхности спирали.
Согласно одному варианту осуществления поперечные углубления расположены на каждой стороне внешней поверхности (т.е. когда внешняя поверхность спирали вогнута).
Согласно одному варианту осуществления углубления являются продольными и проходят полностью или по меньшей мере частично по длине винтовой спирали. Продольные углубления могут быть прямыми, изогнутыми, волнистыми, зигзагообразными, ромбовидными или любой конфигурации.
Согласно одному варианту осуществления винтовая спираль характеризуется перевернутым Т-образным профилем, в котором зубцы от ножки характеризуются перевернутой Т-образной формой.
Согласно одному варианту осуществления зубцы характеризуются профилем, выбранным из треугольного, многоугольного, ромбовидного или любого другого профиля, выполненного с возможностью соскабливания эндотелиального слоя просвета полости организма.
Согласно одному варианту осуществления спираль содержит боковые зубцы.
Согласно одному варианту осуществления спираль характеризуется плоской внутренней и внешней поверхностью и боковыми зубцами.
Согласно одному варианту осуществления спираль образована из плоской проволоки с ромбовидной текстурой и шероховатой внешней поверхностью и гладкой внутренней поверхностью.
Согласно одному варианту осуществления спираль содержит канавки или поры, которые служат резервуарами для терапевтических средств.
Согласно одному варианту осуществления спираль или каждый элемент спирали содержит проволочный проводник, а абразивная поверхность образована второй проволокой, намотанной по спирали вокруг проволочного проводника, чтобы сформировать вторую спираль.
Согласно одному варианту осуществления вторая проволока характеризуется многоугольным поперечным сечением.
Согласно одному варианту осуществления вторая спираль характеризуется шагом от 1 до 5 мм.
Согласно одному варианту осуществления шаг второй спирали больше на ее проксимальном конце.
Согласно одному варианту осуществления шаг второй спирали меньше на ее проксимальном конце.
Согласно одному варианту осуществления вторая спираль прикреплена к проволочному проводнику, как правило, во множестве мест.
Согласно одному варианту осуществления поверхность второй проволоки обрабатывается для придания поверхности шероховатости.
Согласно одному варианту осуществления винтовая спираль содержит проксимальный участок, который, как правило, коаксиален продольной оси винтовой спирали.
Согласно одному варианту осуществления винтовая спираль содержит дистальный участок, который, как правило, коаксиален продольной оси винтовой спирали.
Согласно одному варианту осуществления рычаг управления для головки для денудации просвета полости организма расположен внутри катетерного элемента. Как правило, рычаг управления подсоединяется к проксимальному концу спирали. Рычаг управления может представлять собой гипотрубку, например, гипотрубку, изготовленную из нержавеющей стали, полимера или другого материала.
Согласно одному варианту осуществления рычаг управления выполнен с возможностью осевого перемещения для развертывания головки для денудации просвета полости организма в заданном месте организма и вывода головки для денудации просвета полости организма в катетерный элемент после воздействия.
Согласно одному варианту осуществления рычаг управления выполнен с возможностью вращательного движения для вращения головки для денудации просвета полости организма в просвете организма.
Согласно одному варианту осуществления устройство содержит дистальный рычаг управления, соединенный сдистальным концом спирали, и проксимальный рычаг управления, соединенный с проксимальным концом спирали, в результате чего относительное осевое перемещение дистального и проксимального рычагов влияет на скручивание и раскручивание спирали.
Согласно одному варианту осуществления дистальный конец спирали содержит атравматическую головку, например, гибкий материал или сферический шарик.
Согласно одному варианту осуществления устройство содержит ручку, функционально соединенную с проксимальным концом катетерного элемента и выполненную с возможностью управления развертыванием и втягиванием спирали. Согласно одному варианту осуществления ручка содержит элемент управления, выполненный с возможностью осевой регулировки рычага или рычагов управления с вращением или без него. Согласно одному варианту осуществления ручка содержит элемент управления, выполненную с возможностью регулировки поворота рычага или рычагов управления.
Согласно одному варианту осуществления устройство выполнено с возможностью регулировки между:
конфигурацией доставки, в которой винтовая спираль уложена внутри катетерного элемента в раскрученной конфигурации,
первой конфигурацией денудации просвета полости организма, в которой при использовании спираль развертывается в подлежащем воздействию просвете полости организма в первом осевом положении и плотно упирается в окружность просвета полости организма;
второй конфигурацией денудации полости организма, в которой при использовании спираль развертывается в подлежащем воздействию просвете полости тела, проксимально к первому осевому положению, и плотно упирается в окружность просвета полости тела; а также
конфигурацией извлечения, в которой спираль уложена внутри катетерного элемента.
Способ по настоящему изобретению можно применять для лечения венозных заболеваний, особенно поверхностного венозного рефлюкса и предпочтительно варикозного расширения вен. Как правило, подвергаются лечению подкожные вены, и как правило, это большая подкожная вена (GSV) или малая подкожная вена (SSV). Согласно одному варианту осуществления способа по настоящему изобретению головка для денудации просвета полости организма перемещается проксимально к месту доступа вдоль подлежащего воздействию участка просвета полости организма.
Согласно одному варианту осуществления способ предусматривает воздействие на участок просвета полости организма, составляющий в длину по меньшей мере 2, 4, 6, 8, 10, 12, 14, 16, 18 или 20 см.
Согласно одному варианту осуществления способ по настоящему изобретению предназначен для полной закупорки просвета полости организма, например, вены или артерии.
Согласно одному варианту осуществления способ по настоящем изобретению предназначен для частичной закупорки просвета полости организма, например, вены или артерии. Таким образом, устройство и способ по настоящему изобретению можно применять для лечения состояний или показаний, характеризующихся дисрегулируемым или нежелательным объемом или скоростью кровотока через участок сосудистой сети, путем применения устройства по настоящему изобретению для частичной закупорки участка сосудистой сети.
В другом случае способ по настоящему изобретению заключается в утолщении стенки вены путем индуцирования значительного утолщения стенки, такой как периферическая гиперплазия внутренней оболочки. Этот эффект «артериализирует» вену, делая ее более устойчивой к воздействию более высокого кровяного давления и сил сдвига. Этот эффект утолщения должен быть самоограничивающимся, когда он возникает в ответ на однократный механический стимул, в отличие от неконтролируемой гиперплазии внутренней оболочки, которая возникает, когда вены подвергаются постоянно более высоким силам сдвига при применении в качестве каналов в артериальной системе. Таким образом, устройство и способ по настоящему изобретению можно применять для подготовки вены перед трансплантацией в артериальную систему кровообращения.
Просвет полости организма может представлять собой сосудистую сеть, например, артерию или вену.
Согласно одному варианту осуществления способ по настоящему изобретению представляет собой способ лечения варикозного расширения вены путем денудации участка верхней ректальной артерии.
Согласно одному варианту осуществления способ согласно настоящему изобретению представляет собой способ лечения геморроя путем денудации участка вены.
Согласно одному варианту осуществления способ по настоящему изобретению представляет собой способ тромбэктомии путем денудации участка вены или артерии, закупоренного тромбом.
Согласно одному варианту осуществления способ по настоящему изобретению представляет собой стадию подготовки для первичного воздействия на целевую область просвета полости организма (т.е. участка сосудистой сети) перед имплантацией медицинского устройства, такого как клапан или стент.
Согласно одному варианту осуществления способ по настоящему изобретению представляет собой стадию подготовки для первичного воздействия на целевую область артерии перед трансплантацией, чтобы снизить риск эндоподтекания 1 типа.
Согласно одному варианту осуществления подлежащий денудации просвет полости организма представляет собой артерию, питающую опухоль, такую как солидная опухоль.
Согласно одному варианту осуществления просвет полости организма представляет собой воротную вену, доставляющую питательные вещества из кишечника в печень. Согласно одному варианту осуществления у подвергаемого лечению субъекта есть заболевание печени, такое как рак, и этот способ, как правило, проводят до резекции печени.
Согласно одному варианту осуществления подвергаемый воздействию просвет полости организма представляет собой кровеносный сосуд, образующий часть артериовенозной мальформации.
Согласно одному варианту осуществления подвергаемый воздействию просвет полости организма представляет собой семенную вену. Таким образом, описаны и способы лечения варикоцеле.
Согласно одному варианту осуществления подвергаемый воздействию просвет полости организма представляет собой кровеносный сосуд (т.е. маточную артерию), снабжающий фибромиому матки.
Согласно одному варианту осуществления подвергаемый воздействию просвет полости организма представляет собой часть желудочно-кишечного тракта, такого как двенадцатиперстная кишка, тощая кишка или подвздошная кишка.
Согласно одному варианту осуществления подвергаемый воздействию просвет полости организма представляет собой артерию простаты.
Согласно одному варианту осуществления подвергаемый воздействию просвет полости организма представляет собой тазовую вену.
Согласно одному варианту осуществления способ по настоящему изобретению применяется для лечения открытого овального отверстия (PFO) путем денудации контактирующей поверхности лоскутов артериальной перегородки, вовлеченных в PFO.
Согласно одному варианту осуществления способ по настоящему изобретению применяется для лечения открытого артериального протока путем разрушения слизистых оболочек илеоцекального клапана и подвздошной кишки.
Согласно одному варианту осуществления способ по настоящему изобретению применяется для лечения чрезмерного развития микрофлоры тонкого кишечника за счет денудации артериального протока.
Согласно одному варианту осуществления способ по настоящему изобретению применяется для лечения пищевода Барретта путем механической абляции или денудации клеток (аномальных клеток) в нижнем отделе пищевода.
Согласно одному варианту осуществления способа по настоящему изобретению способ предусматривает стадию доставки жидкого склерозанта в просвет полости организма дистальнее катетерного элемента.
Согласно одному варианту осуществления способа по настоящему изобретению способ предусматривает стадию доставки термической энергии в просвет полости организма за счет проводимости через поверхность соприкосновения с просветом устройства.
Согласно одному варианту осуществления способа по настоящему изобретению способ предусматривает стадию применения зонда для внутривенного ультразвукового исследования (IVUS), прикрепленного или встроенного в элемент головки для денудации, для определения реакции сосуда на лечение.
Согласно одному варианту осуществления способа по настоящему изобретению терапевтические средства покрывают внешнюю поверхность или погружаются в канавки или поры на устройстве и доставляются к внутренней поверхности просвета полости организма.
Согласно одному варианту осуществления способа согласно настоящему изобретению в способе применяется устройство для денудации просвета полости организма согласно настоящему изобретению.
Согласно другому аспекту в настоящем изобретении предложен способ воздействия на сосуд (или любой просвет полости организма) у субъекта, предусматривающий следующие стадии:
продвижение устройства в дистальном направлении через зону воздействия в сосуде, причем устройство содержит удлиненный катетер, имеющий просвет и дистальный конец, и расширяющийся в радиальном направлении элемент воздействия, расположенный в просвете и выполненный с возможностью осевого перемещения относительно катетера;
развертывание расширяющегося в радиальном направлении элемента воздействия, выступающего за дистальный конец катетера, для радиального расширения и вдавливания по окружности в просвет на дистальном конце зоны воздействия;
извлечение развернутого радиально расширяющегося элемента воздействия проксимально вдоль зоны воздействия, причем элемент воздействия прижимается по окружности к просвету сосуда, чтобы механически и по окружности денудировать зону воздействия сосуда;
повторный захват радиально расширяющегося элемента воздействия в просвет катетера; а также
извлечение устройства из подвергнутого воздействию сосуда.
Согласно одному варианту осуществления сосуд представляет собой варикозную вену, и в котором способ, как правило, представляет собой способ лечения варикозной вены путем денудации стенок просвета вены, чтобы вызвать окклюзию варикозной вены.
Согласно одному варианту осуществления стадия механической и круговой денудации зоны воздействия сосуда предусматривает влияние на круговое воздействие на поверхность субэндотелиального сосуда вдоль зоны воздействия.
Согласно одному варианту осуществления расширяемый в радиальном направлении элемент воздействия является саморегулирующимся из неразвернутой конфигурации доставки, подходящей для транслюминальной доставки внутри катетера, и развернутой радиально расширенной конфигурации, характеризующейся диаметром больше, чем диаметр сосуда в зоне воздействия.
Согласно одному варианту осуществления расширяемый в радиальном направлении элемент воздействия является упруго деформируемым, причем расширяемый в радиальном направлении элемент воздействия рефлекторно саморегулируется в своем диаметре в ответ на переменные диаметры сосудов и переменные осевые силы во время осевого перемещения вдоль зоны воздействия, сохраняя при этом направленную наружу радиальную силу на сосуд.
Согласно одному варианту осуществления внешняя обращенная к просвету сосуда поверхность расширяемого в радиальном направлении элемента воздействия характеризуется шероховатой поверхностью.
Согласно одному варианту осуществления внешняя обращенная к просвету сосуда поверхность расширяемого в радиальном направлении элемента воздействия характеризуется шероховатой поверхностью, причем шероховатая поверхность содержит макро- и микроабразивную поверхность.
Согласно одному варианту осуществления сосуд представляет собой поверхностную вену, такую как большая подкожная вена, малая подкожная вена, перфорантная вена или венозную ветвь.
Согласно одному варианту осуществления поверхностный сосуд представляет собой вену, выбранную из большой подкожной вены и короткой подкожной вены.
Согласно одному варианту осуществления способ представляет собой способ лечения поверхностного венозного рефлюкса у субъекта, причем сосуд представляет собой поверхностную вену.
Согласно одному варианту осуществления способ представляет собой способ лечения варикозного расширения вены у субъекта, причем подвергаемая воздействию вена является варикозной.
Согласно одному варианту осуществления способ приводит к окклюзии подвергаемого воздействию сосуда.
Согласно одному варианту осуществления способ представляет собой способ сужения, но без закупорки сосуда.
Согласно одному варианту осуществления стадия извлечения развернутого радиально расширяющегося элемента воздействия проксимально вдоль зоны воздействия вызывает механическое растяжение стенки сосуда, приводящее к активации гладкой мускулатуры внутри стенки, что приводит к спазму сосудов вдоль зоны воздействия и, возможно, предотвращению секреции оксида азота из эндотелиальных клеток и последующее продление спазма сосудов.
Согласно одному варианту осуществления расширяемый в радиальном направлении элемент воздействия представляет собой спираль.
Согласно одному варианту осуществления расширяемый в радиальном направлении элемент воздействия представляет собой винтовую спираль.
Согласно одному варианту осуществления способ выполняется с использованием способа визуализации, такого как ультразвуковое наведение.
Согласно одному варианту осуществления способ предусматривает стадию повторного захвата элемента воздействия в катетерном элементе, предусматривающий возвращение элемента воздействия в неразвернутое состояние, позволяя изменить положение и повторить развертывание.
Согласно одному варианту осуществления способ предусматривает стадию развертывания временного элемента, закрывающего просвет, во время по меньшей мере одной из стадий, чтобы остановить кровоток в сосудах с высоким потоком.
Согласно другому аспекту в настоящем изобретении предусмотрен способ лечения поверхностного венозного рефлюкса в поверхностной вене у субъекта, предусматривающий стадию механической и круговой денудации зоны воздействия поверхностной вены.
Согласно одному варианту осуществления зона воздействия поверхностной вены, которая подвергается круговой денудации, составляет в длину от 5 до 25 см.
Согласно одному варианту осуществления стадия механической и круговой денудации зоны воздействия поверхностной вены предусматривает осуществление воздействия по окружности на поверхность субэндотелиального сосуда вдоль зоны воздействия.
Согласно одному варианту осуществления стадия механической и круговой денудации зоны воздействия вены предусматривает развертывание устройства для денудации вены в дистальной части целевого участка поверхностной вены для плотного прилегания по окружности к просвету вены и извлечение развернутого устройства для повреждения вены проксимально вдоль зоны воздействия, причем устройство плотно прилегает по окружности к просвету вены.
Согласно одному варианту осуществления стадия механической и круговой денудации зоны воздействия сосуда предусматривает осуществление воздействия по окружности на поверхность субэндотелиального сосуда вдоль зоны воздействия.
Согласно одному варианту осуществления устройство для денудации вены является саморегулирующимся из неразвернутой конфигурации доставки, подходящей для транслюминальной доставки внутри катетера, в развернутую радиально расширенную конфигурацию, характеризующуюся диаметром больше, чем диаметр сосуда в зоне воздействия.
Согласно одному варианту осуществления устройство для денудации вены является упруго деформируемым, причем расширяемый в радиальном направлении элемент воздействия рефлекторно саморегулирует свой диаметр в ответ на переменные диаметры сосуда и переменные осевые силы во время осевого движения вдоль зоны воздействия, сохраняя при этом радиальную направленную наружу силу на сосуд.
Согласно одному варианту осуществления внешняя обращенная к просвету сосуда поверхность устройства для денудации вены характеризуется шероховатой поверхностью.
Согласно одному варианту осуществления внешняя обращенная к просвету сосуда поверхность устройства для повреждения вен характеризуется шероховатой поверхностью, причем шероховатая поверхность содержит макро- и микроабразивную поверхность.
Согласно одному варианту осуществления расширяемый в радиальном направлении элемент воздействия представляет собой спираль и предпочтительно упруго деформируемую спираль.
Согласно одному варианту осуществления расширяемый в радиальном направлении элемент воздействия представляет собой упруго деформируемую винтовую спираль.
Согласно одному варианту осуществления способ выполняется под контролем ультразвука.
Согласно одному варианту осуществления осевое перемещение расширяющегося в радиальном направлении элемента воздействия (или винтовой спирали) осуществляется автоматически или полуавтоматически независимо от оператора.
Согласно одному варианту осуществления устройство выполнено с возможностью сбора данных для обратной связи с операторами или для дальнейшей интерпретации с помощью человеческого, статистического анализа, анализа больших данных или машинного обучения. При этом устройство может включать в себя один или более датчиков, выполненных с возможностью обнаружения данных in vivo, например, температуры, давления, электрического импеданса и т.п., ткани или крови. Устройство может быть выполнено с возможностью передачи данных in vivo по беспроводной связи или по проводам, расположенным в элементе катетера. Устройство может быть выполнено с возможностью передачи данных на удаленный процессор.
Другие аспекты и предпочтительные варианты осуществления настоящего изобретения определены и описаны в других пунктах формулы изобретения, изложенных ниже.
Краткое описание чертежей
На фиг.1 представлена сосудистая сеть человека в осевой плоскости, показывающая состав типичной стенки вены, включая в себя внутреннюю выстилку вены (внутренняя оболочка) с ассоциированным эндотелием и покрытиями гликокаликса, прилегающий промежуточный слой (средняя оболочка) и внешний слой (адвентициальная оболочка). Также включена типичная толщина в микрометрах для стенки вены взрослого человека.
Фиг. 2 представляет собой гистологический аксиальный разрез вены козла через 28 дней после механического эндовенозного воздействия в исследовании авторов настоящего изобретения на животных. Изображение подчеркивает важность периферического покрытия с точки зрения разрушения эндотелиальных клеток. В исследовании авторов настоящего изобретения на животных он взят из подвергнутой частичному воздействию вены. В правом верхнем углу показан сгусток, прикрепленный к стенке вены с миграцией воспалительных клеток в тромб из внешних слоев на ранних фазах фиброзной трансформации. В нижнем левом углу остался неповрежденный эндотелий. Тромб не прижился или реканализировался из-за воздействия интактного эндотелия. Кровь может течь по каналу, что приводит к общей неэффективности воздействия в этом сегменте.
На фиг.3 показан гистологический аксиальный разрез козьей вены через 28 дней после механического эндовенозного воздействия в исследовании авторов настоящего изобретения на животных. Произошло круговое повреждение эндотелия и расслоение из-за сил трения между поверхностным и глубоким слоями. Просвет заполнен прикрепленным тромбом, претерпевающим фиброзные изменения, поскольку в него вторгаются воспалительные клетки, включая фибробласты, образующие коллаген.
На фиг.4 показано устройство для денудации стенок просвета полости организма согласно первому варианту осуществления настоящего изобретения.
Фиг. 5 представляет собой вид сбоку устройства, показанного на фиг.1.
Фиг. 6 представляет собой вид в перспективе устройства, показанного на фиг.1.
Фиг. 7 представляет собой вертикальный вид дистального конца устройства, показанного на фиг.1.
Фиг. 8 представляет собой подробный вид участка винтовой спирали устройства, показанного на фиг.4, показывающий зубчатую поверхность, образованную второй проволокой, спирально намотанной вокруг проволочного проводника.
Фиг. 9 представляет собой подробный вид дальнего конца винтовой спирали устройства, показанного на фиг.4, показывающий больший шаг второй проволоки и сферической концевой втулки.
Фиг. 10 представляет собой подробный вид проксимального конца винтовой спирали устройства, показанного на фиг.4, показывающий винтовую спираль, прикрепленную к стальной гипотрубке, которая установлена внутри катетерного элемента.
Фиг. 11 представляет собой подробный вид проксимального конца винтовой спирали устройства, показанного на фиг.4, показывающий более короткий шаг второй проволоки, когда она приближается к проксимальному концу спирали, чтобы способствовать повторному захвату.
Фиг. 12 представляет собой вид в перспективе винтовой спирали, образующей часть устройства согласно альтернативному варианту осуществления настоящего изобретения, в котором поверхность второй проволоки соприкосновения с просветом включает в себя ряд спиральных углублений.
Фиг. 13 представляет собой вид сбоку устройства, показанного на фиг.4, в разрезе с винтовой спиралью в развернутой конфигурации. На этой фигуре показано, как увеличенная спираль входит в круговое соприкосновение с просветом полости организма, и что радиальная сила, оказываемая увеличенной спиралью, деформирует вену.
Фиг. 14 представляет собой сходную с фиг.13 иллюстрацию и показывает, как спираль меньшего диаметра используется с веной меньшего диаметра.
Фиг. 15 представляет собой вид в перспективе устройства, развернутого вне вены, показывающая, как радиальные силы, действующие со стороны развернутой спирали, деформируют вену.
Фиг. 16 представляет собой подробный вид абразивной поверхности винтовой спирали, соприкасающейся с внутренним просветом вены.
На фиг.17 показана процедура эндовенозной механической денудации вены нижней конечности с целью вызвать окклюзию и предотвратить рефлюкс при лечении заболевания поверхностных вен. Неразвернутое устройство во внешнем катетере показано рядом с сафено-феморальным соединением после навигации под ультразвуковым контролем.
На фиг.18 показана развернутая расширяющаяся в радиальном направлении спираль во время воздействия, вызывающего спазм сосудов подвергаемого воздействию участка.
На фиг.19 показан повторный захват расширяющегося в радиальном направлении элемента до извлечения катетера.
Фиг. 20 представляет собой вид в перспективе устройства для денудации просвета полости организма в соответствии с дополнительным вариантом осуществления настоящего изобретения.
Фиг. 21 представляет собой вид с торца устройства, показанного на фиг.20.
Фиг. 22 представляет собой вид сбоку устройства, показанного на фиг.20, в частично развернутой конфигурации.
Фиг. 23 представляет собой вид сбоку устройства, показанного на фиг.20, в полностью развернутой конфигурации.
Фиг. 24 представляет собой еще один вид сбоку устройства, показанного на фиг.20, в полностью развернутой конфигурации.
На фиг.25 показано устройство для денудации просвета полости организма в соответствии с дополнительным вариантом осуществления настоящего изобретения, в котором спираль состоит из двух коаксиальных элементов винтовой спирали.
Фиг. 26 представляет собой вид с торца устройства, показанного на фиг.25.
Фиг. 27 представляет собой вид сбоку устройства, показанного на фиг.25.
На фиг.28 показано устройство для денудации просвета полости организма в соответствии с дополнительным вариантом осуществления настоящего изобретения, в котором спираль состоит из четырех коаксиальных элементов винтовой спирали.
Фиг. 29 представляет собой вид с торца устройства, показанного на фиг.28.
Фиг. 30 представляет собой вид сбоку устройства, показанного на фиг.28.
На фиг.31 показано устройство для денудации просвета полости организма в соответствии с дополнительным вариантом осуществления настоящего изобретения, в котором спираль состоит из четырех коаксиальных элементов винтовой спирали, которые соединены своими дистальными концами.
Фиг. 32 представляет собой вид с торца устройства, показанного на фиг.31.
Фиг. 33 представляет собой вид сбоку устройства, показанного на фиг.31.
Фиг. 34А и фиг.34В представляют собой виды в перспективе и сбоку участка винтовой спирали в соответствии с настоящим изобретением.
Фиг. 35А и фиг.35В представляют собой виды в перспективе и сбоку участка дополнительной винтовой спирали в соответствии с настоящим изобретением.
Фиг. 36А и фиг.36В представляют собой виды в перспективе и сбоку участка дополнительной винтовой спирали в соответствии с настоящим изобретением.
Фиг. 37А и фиг.37В представляют собой виды в перспективе и сбоку участка дополнительной винтовой спирали в соответствии с настоящим изобретением.
Фиг. 38А и фиг.38В представляют собой виды в перспективе и сбоку участка дополнительной винтовой спирали в соответствии с настоящим изобретением.
Фиг. 39А и фиг.39В представляют собой виды в перспективе и сбоку участка дополнительной винтовой спирали в соответствии с настоящим изобретением.
Фиг. 40А и фиг.40В представляют собой виды в перспективе и сбоку участка дополнительной винтовой спирали в соответствии с настоящим изобретением.
Фиг. 41А и фиг.41В представляют собой виды в перспективе и с торца участка дополнительной винтовой спирали в соответствии с настоящим изобретением.
Фиг. 42А и фиг.42В представляют собой виды сбоку и в перспективе дополнительного варианта осуществления винтовой спирали, образующей часть устройства в соответствии с настоящим изобретением.
Фиг.43А и фиг.43В представляют собой виды сбоку и в перспективе дополнительного варианта осуществления винтовой спирали, образующей часть устройства в соответствии с настоящим изобретением.
Фиг. 44А и фиг.44В представляют собой виды сбоку и в перспективе дополнительного варианта осуществления винтовой спирали, образующей часть устройства в соответствии с настоящим изобретением.
Фиг. 45А и фиг.45В представляют собой виды сбоку и в перспективе дополнительного варианта осуществления винтовой спирали, образующей часть устройства в соответствии с настоящим изобретением.
Фиг. 46А и фиг.46В представляют собой виды в перспективе и сбоку дополнительного варианта осуществления винтовой спирали, образующей часть устройства в соответствии с настоящим изобретением.
Фиг. 47А и фиг.47В представляют собой виды в перспективе и сбоку дополнительного варианта осуществления винтовой спирали, образующей часть устройства в соответствии с настоящим изобретением.
Фиг. 48А-48С представляют собой виды сбоку и в перспективе дополнительного варианта осуществления винтовой спирали, образующей часть устройства в соответствии с настоящим изобретением.
Фиг. 49А и фиг.49В представляют собой виды сбоку и в перспективе головки для денудации вены, образующей часть устройства в соответствии с настоящим изобретением, имеющей две разнесенные в осевом направлении винтовые спирали.
Фиг. 49А и фиг.49В представляют собой виды сбоку и в перспективе головки для денудации вены, образующей часть устройства в соответствии с настоящим изобретением, имеющей две разнесенные в осевом направлении винтовые спирали.
Фиг. 50А и фиг.50В представляют собой виды сбоку и в перспективе головки для денудации вены, образующей часть дополнительного устройства в соответствии с настоящим изобретением, имеющей две разнесенные в осевом направлении винтовые спирали.
Фиг. 51А представляет собой вид в перспективе головки для денудации вены, образующей часть дополнительного устройства в соответствии с настоящим изобретением, имеющей две разнесенные в осевом направлении винтовые спирали.
На фиг.52А показаны небольшие артерии, питающие опухоль, а фиг.52 В представляет собой покомпонентное изображение части одной из артерий, показывающее устройство по настоящему изобретению, используемое для денудации участка просвета артерии и закупоривания артерии благодаря образованию тромба.
На фиг.53А показана сосудистая сеть воротной вены, а фиг.53В представляет собой покомпонентное изображение части одной из вен, показывающее устройство по настоящему изобретению, используемое для денудации участка просвета артерии и закупоривания артерии благодаря образованию тромба.
На фиг.54 показан участок природного артериовенозного шунта сосудистой сети, включающий в себя мальформацию, и устройство в соответствии с настоящим изобретением в применении для денудации стенки участка шунта для перекрытия деформированного шунта путем образования тромба.
На фиг.55 показана левая семенная вена и варикоцеле, окружающее левый семенник, и устройство в соответствии с настоящим изобретением, используемое для денудации участка левой семенной вены для закупоривания вены путем образования тромба.
На фиг.56 показано, как винтовая спираль, образующая часть устройства по настоящему изобретению, может самостоятельно адаптироваться к изменяющемуся диаметру сосуда, а также к сжатиям или суженным участкам в сосудах, когда она протягивается через сосуд: (А) развернутая винтовая спираль в круговом контакте с просветом сосуда, приближаясь к суженному участку сосуда; (В) винтовая спираль, прошедшая через суженный участок и поддерживающая круговой контакт с просветом сосуда непосредственно проксимальнее суженного участка; и (С) винтовая спираль, движущаяся проксимально суженному участку и саморегулирующаяся для поддержания кругового контакта с просветом сосуда.
На фиг.57 показано, как винтовая спираль, образующая часть устройства по настоящему изобретению, может перемещаться через клапаны в венах, когда она протягивается через участок вены: (А) развернутая винтовая спираль в круговом контакте с просветом вены дистальнее клапана; (В) винтовая спираль, проходящая через клапан без заедания; и (С) винтовая спираль, движущаяся проксимально суженному участку и саморегулирующаяся для поддержания кругового контакта с просветом сосуда.
На фиг.58 показано, как винтовая спираль, составляющая часть устройства по настоящему изобретению, может перемещаться через участок сосудистой сети, который постепенно сужается и самостоятельно регулирует диаметр спирали для поддержания кругового контакта с просветом сосуда: (А) развернутая винтовая спираль в круговом контакте с широким участком сосуда; (В) развернутая винтовая спираль в круговом контакте с более узким участком сосуда;
На фиг.59 показано, как винтовая спираль, образующая часть устройства по настоящему изобретению, может самостоятельно адаптироваться к изменяющемуся диаметру сосуда и перемещаться по извилистому сосуду: (А) развернутая винтовая спираль в круговом контакте с просветом сосуда на суженном участке сосуда; (В) винтовая спираль, перемещающаяся через крутой поворот в сосуде, сохраняя при этом круговой контакт с просветом сосуда; и (С) винтовая спираль, перемещающаяся через крутой поворот в сосуде большего диаметра, сохраняя при этом круговой контакт с просветом сосуда.
На фиг.60 показано, как винтовая спираль, образующая часть устройства по настоящему изобретению, может самостоятельно регулировать диаметр спирали для поддержания кругового контакта с просветом сосуда, когда сосуд активно сужается из-за вазоспазма или сужается к меньшей ширине: (А) развернутая винтовая спираль в круговом контакте с участком сосуда длиной 1 и диаметром D до вазоспазма; участок А-А представляет собой осевой вид спиральной проволоки, контактирующей со стенкой сосуда под действием кольцевой силы HF, создаваемой давлением от силы сужения Р; (В) развернутая винтовая спираль в круговом контакте на увеличенной длине L внутри суженного сосуда диаметром d во время вазоспазма.
На фиг.61 показаны переменные статической силы на развернутой спирали, когда она подвергается действию осевой силы FA; (А) перед перемещением в начале извлечения в сосуде диаметра D с контактной силой спирали наружу FC и силой сужения Р сосуда; (В) удлиненный до длины L в суженном сосуде диаметром d; (С) В значительно суженном сосуде диаметром е с удлиненной спиралью до S. Имеется потеря контакта стенки сосуда на проксимальном участке спирали, чтобы уменьшить статическое трение и обеспечить атравматический проход спирали.
На фиг.62 показано, как устройство по настоящему изобретению можно применять для лечения сосудистой сети, имеющей аномально высокий объем крови или высокую скорость кровотока, для частичной закупорки сосуда для нормализации объема или кровотока: (А) показана легочная артерия до воздействия с устройством по настоящему изобретению, развернутым в артерии и вытянутым проксимально; (В) показаны хронические изменения в легочной артерии по фиг.62А после воздействия устройством по настоящему изобретению с гиперплазией интимы, частично перекрывающей (суживающей) артерию для обеспечения уменьшенного объема крови и потока через артерию.
На фиг.63 показан вид под углом варианта осуществления с плоской проволокой, имеющей гладкую внутреннюю поверхность и шероховатую внешнюю поверхность с ромбовидным рисунком в типичном сосуде.
На фиг.64 показан вид под углом устройства в сосуде. На изображениях крупным планом вариантов осуществления внешнего текстурирования показана (А) поверхность с макроабразивными канавками, которая перпендикулярна стенке вены в направлении вывода; (В) макроабразивная поверхность, параллельная стенке вены в направлении вывода; (С) ромбовидная конфигурация макроабразивной поверхности.
На фиг.65 показан наконечник модифицированной внутривенной канюли, модифицированной для хранения миниатюрной винтовой спирали в неразвернутом состоянии.
На фиг.66 показано применение модифицированной канюли, показанной на фиг.65, для доступа к целевой вене и развертывания винтовой спирали после извлечения внешней оболочки.
На фиг.67 показан доступ к ветвям поверхностных вен ног с помощью канюльного устройства, показанного на фиг.65.
На фиг.68 показан способ развертывания миниатюрной спирали в ветвях вен. (А) Достигается внутривенный доступ с помощью проволочного проводника и через проволочный проводник вводится оболочка; (В) Оболочка продвигается по вене, и проволочный проводник удаляется; (С) Оболочка извлекается, чтобы вскрыть хранящийся винтовой абразивный элемент спирали; (D) Оболочка и спираль извлекаются вместе для воздействия на участок вены.
На фиг.69 показана оболочка, использованная на фиг.68, которая удерживает неразвернутую винтовую спираль по своему внутреннему периметру для обеспечения прохода проволочного проводника.
На фиг.70 показан способ применения отрывающейся оболочки проводника для развертывания винтовой спирали в целевой вене.
На фиг.71 показано применение винтовой абляционной спирали для лечения рефлюкса тазовой вены в левой яичниковой вене.
На фиг.72 показано ремоделирование вены при образовании артериальной фистулы (А) Нормальная вена; (В) Гиперплазия интимы с самоограничивающимся утолщением внутреннего слоя. (С) Несостоятельность трансплантата вены из-за чрезмерной гиперплазии интимы, вызывающей закупорку просвета.
На фиг.73 показано применение винтовой спирали с шероховатой внутренней поверхностью и гладкой внешней поверхностью для удаления приставшего тромба в кровеносном сосуде.
На фиг.74 показано применение винтовой спирали с частично текстурированной внешней поверхностью, позволяющей избирательно воздействовать на стенку сосуда с вращательной силой или без нее в дополнение к осевому извлечению.
На фиг.75 показано применение винтовой спирали во время процедуры эндоскопии для восстановления поверхности слизистой оболочки двенадцатиперстной кишки при лечении сахарного диабета.
Подробное описание настоящего изобретения
Все публикации, патенты, заявки на патенты и другие ссылки, упомянутые в настоящем документе, полностью включены в настоящий документ посредством ссылки для всех целей, как если бы каждая отдельная публикация, патент или заявка на патент были специально и индивидуально указаны для включения посредством ссылки, а их содержание цитировалось полностью.
Определения и общие предпочтения
При использовании в настоящем документе и если специально не указано иное, следующие термины характеризуются следующими значениями в дополнение к любым более широким (или более узким) значениям, которыми могут характеризоваться термины в настоящей области техники:
Если иное не требуется по контексту, использование в настоящем документе единственного числа следует читать как включающее в себя множественное число и наоборот. Единственное число, используемое в отношении объекта, следует читать как относящееся к одному или более объектам. По существу, термины «один», «один или более» и «по меньшей мере один» используются в настоящем документе взаимозаменяемо.
Используемый в настоящем документе термин «содержать» или его варианты, такие как «содержит» или «содержащий», следует читать как указывающие на включение любого перечисленного целого числа (например, признака, элемента, характеристики, свойства, стадии способа/процесса или ограничений) или группу целых чисел (например, признаков, элементов, характеристик, свойств, стадий способа/процесса или ограничений), но не исключение любого другого целого числа или группы целых чисел. Таким образом, используемый в настоящем документе термин «содержащий» является включающим или открытым и не исключает дополнительных, не перечисленных целых чисел или стадий способа/процесса.
Используемый в настоящем документе термин «заболевание» используется для определения любого патологического состояния, которое нарушает физиологическую функцию и связано с конкретными симптомами. Этот термин широко используется для обозначения любого нарушения, заболевания, аномалии, патологии, болезни, состояния или синдрома, при которых нарушается физиологическая функция, независимо от природы этиологии (или фактически, установлена ли этиологическая основа заболевания). Таким образом, он охватывает состояния, возникающие в результате инфекции, травмы, повреждения, хирургического вмешательства, радиологической абляции, отравления или недостаточности питания.
Используемый в настоящем документе термин «лечение» относится к вмешательству (например, введению средства субъекту), которое излечивает, облегчает или уменьшает симптомы заболевания или устраняет (или уменьшает влияние) его причину(ы) (например, снижение накопления патологических уровней лизосомальных ферментов). В этом случае термин используется как синоним термина «терапия».
Кроме того, термин «лечение» относится к вмешательству (например, введению средства субъекту), которое предотвращает или задерживает начало или прогрессирование заболевания или снижает (или исключает) его охват в популяции, подвергающейся лечению. В этом случае термин «лечение» используется как синоним термина «профилактика».
Используемое в настоящем документе эффективное количество или терапевтически эффективное количество средства определяет количество, которое может быть введено субъекту без чрезмерной токсичности, раздражения, аллергической реакции или других проблем или осложнений, соизмеримых с разумным соотношением польза/риск, но которое достаточно для обеспечения желаемого эффекта, например, лечение или профилактика, проявляющиеся в постоянном или временном улучшении состояния субъекта. Количество будет варьироваться от субъекта к субъекту, в зависимости от возраста и общего состояния человека, способа введения и других факторов. Таким образом, хотя невозможно указать точное эффективное количество, специалисты в настоящей области техники смогут определить подходящее «эффективное» количество в любом индивидуальном случае, используя рутинные эксперименты и общие знания. Терапевтический результат в этом контексте включает в себя устранение или уменьшение симптомов, уменьшение боли или дискомфорта, увеличение продолжительности жизни, улучшение подвижности и другие маркеры клинического улучшения. Терапевтический результат не обязательно означает полное излечение.
В контексте лечения и эффективных количеств, как определено выше, термин субъект (который следует читать как включающий в себя «индивидуум», «животное», «пациента» или «млекопитающее», если позволяет контекст) означает любого субъекта, в частности субъекта-млекопитающего, которому показано лечение. Субъекты-млекопитающие включают в себя, без ограничения, людей, домашних животных, сельскохозяйственных животных, животных зоопарков, спортивных животных, домашних животных, таких как собаки, кошки, морские свинки, кролики, крысы, мыши, лошади, крупный рогатый скот, козы, коровы; приматы, такие как обезьяны, мартышки, орангутаны и шимпанзе; псовые, такие как собаки и волки; кошачьи, такие как кошки, львы и тигры; непарнокопытные, такие как лошади, ослы и зебры; мясомолочный скот, такой как коровы, свиньи и овцы; копытные, такие как олени и жирафы; и грызуны, такие как мыши, крысы, хомяки и морские свинки. Согласно предпочтительным вариантам осуществления субъект представляет собой человека.
Используемый в настоящем документе термин «денудация» следует понимать как означающий механическое удаление или необратимое функциональное разрушение поверхностного слоя внутренней поверхности просвета полости организма вдоль участка просвета полости организма. Когда просвет полости организма представляет собой сосуд или вену, поверхностный слой внутреннего просвета, как правило, представляет собой один слой плоских клеток, известный как эндотелий сосудов и связанной с ним соединительной ткани, простирающийся до поверхностных клеточных слоев среднего слоя, но не глубже, чем средний слой. Эндотелий необходим для выживания просвета протока организма, поскольку он обеспечивает селективный барьер и антитромботическую поверхность, удаление которой приводит к воздействию протромботических факторов, которые взаимодействуют с нормальными составляющими крови, вызывая свертывание и закупорку просвета полости организма и выпускают в просвет естественные сосудосуживающие средства. Когда просвет полости организма представляет собой вену, этот термин относится к удалению одного или более слоев внутренней оболочки и поверхностного среднего слоя. Устройство и способы по настоящему изобретению денудируют продольный участок просвета полости организма, например 1-60 см, и денудируют просвет полости организма по окружности; это представляет собой полную окружность (или частичную, или почти полную окружность), если просвет полости организма денудирован вдоль подвергаемого воздействию участка.
Используемый в настоящем документе термин «просвет полости организма» означает полость в организме и может представлять собой удлиненную полость, такую как сосуд (т.е. артерия, вена, лимфатический сосуд, уретра, мочеточник, синус, слуховой проход, полость носа, бронх, маточная труба, семенной проток) или кольцевое пространство в сердце, такое как ушко левого предсердия, выносящий тракт левого желудочка, аортальный клапан, митральный клапан, непрерывность митрального клапана, трехстворчатый клапан, легочный клапан или сердечный клапан, или венозный клапан или отверстие клапана. Предпочтительно просвет полости организма представляет собой сосудистую сеть (т.е. вену или артерию, или артериовенозный сосуд). Вена может быть выбрана из подкожной вены (SSV, GSV, AASV), тазовой вены, варикоцеле или воротной вены. Артерия может быть выбрана из аорты, верхней ректальной артерии, участка артерии, предназначенного для стентирования для полной или частичной эмболизации, маточной артерии или артериального протока. Просвет полости организма может представлять собой часть желудочно-кишечного тракта, например, двенадцатиперстную кишку, тонкую кишку. Просвет полости организма может представлять собой пищевод.
Используемый в настоящем документе термин «удлиненный катетерный элемент» следует понимать как означающий удлиненный корпус, имеющий дистальный конец, который функционально соединен с корпусом для денудации просвета полости организма. Согласно одному варианту осуществления катетерный элемент содержит рычаг управления (например, трубчатый элемент), функционально связанный с корпусом для денудации для управления им. Рычаг управления может характеризоваться любой формой, например, стержень, проволока или трубчатый элемент, такой как гипотрубка. Согласно одному варианту осуществления рычаг управления и корпус для денудации регулируются в осевом направлении относительно катетерного элемента. Корпус для денудации, как правило, разматывается и укладывается в дистальный конец катетерного элемента во время доставки и извлечения. Осевое регулирование рычага управления относительно корпуса катетера приводит к развертыванию корпуса для денудации в его скрученной конфигурации.
«Транслюминальная доставка» означает доставку корпуса для денудации просвета полости организма к целевому участку (например, варикозной вене) через просвет полости организма, например, доставку через артерию, вену или желудочно-кишечный тракт.
Используемый в настоящем документе термин «спираль» следует понимать как обозначающий элемент в форме петли, который регулируется из раскрученной конфигурации, подходящей для втягивания в катетерный элемент, и скрученной конфигурации, которая при применении способна соприкасаться по окружности и вдавливаться своей поверхностью в просвет полости организма (т.е. соприкасаться с внутренним просветом вены по меньшей мере на один полный виток спирали). Спираль в ее скрученной конфигурации, как правило, является круглой, но также может быть овальной, квадратной, треугольной или прямоугольной при условии, что она способна соприкасаться по окружности с внутренней стенкой просвета полости организма.
Поскольку большинство вен и артерий характеризуются круглым или почти круглым профилем, круглая спираль является предпочтительной, поскольку радиальная сила, действующая на спираль в ее развернутой конфигурации, равномерно распределяется по стенке просвета полости организма. Спираль, имеющая диаметр, равный или больший диаметра подвергаемого воздействию просвета полости организма, вдоль по меньшей мере одного полного витка спирали, необходима для достижения кругового соприкосновения с внутренним просветом вены и, таким образом, достижения круговой денудации вены (смотрите А на фиг.13). Согласно предпочтительному варианту осуществления спираль представляет собой винтовую спираль, содержащую по меньшей мере один полный круговой виток, а предпочтительно от 1 до 3 витков, например, приблизительно 1,1, 1,2, 1,3, 1,4, 1,5, 1,6, 1,7, 1,8, 1,9, 2,0, 2,1, 2,2, 2,3, 2,4, 2,5, 2,6, 2,7, 2,8 или 2,9 витка. Спирали винтовой спирали предпочтительно являются круглыми, но могут также иметь другой профиль, например овальный, квадратный, треугольный или прямоугольный. Винтовая спираль может быть конической. Диаметр спирали, как правило, составляет 2-20 мм, более предпочтительно 3-12 мм в расслабленном состоянии. Шаг винтовой спирали, как правило, приблизительно такой же, как диаметр, но он может варьироваться от 0,5 до 1,5 диаметра в расслабленном состоянии. Следует понимать, что размеры спирали могут варьироваться в зависимости от просвета полости организма, чтобы гарантировать, что размер спирали «завышен» по сравнению с диаметром просвета полости организма. В этом отношении диаметр спирали (или максимальный диаметр в случае винтовых спиралей, диаметр которых варьируется по длине), как правило, по меньшей мере приблизительно на 5% больше диаметра подвергаемого воздействию просвета полости организма, например, по меньшей мере, на 10%, 15%, 20%, 25% или 30% от диаметра подвергаемого воздействию просвета полости организма и, как правило, на 5-30% больше. Важно, чтобы размер спирали был завышен по меньшей мере на одном витке спирали, и, как правило, на 1-2 витка. Спираль может быть образована из удлиненного элемента, как правило, из одного удлиненного элемента, например, проволоки или нити. Спираль может быть образована из металла (например, нержавеющей стали) или металлического сплава, или она может быть образована из сплава с памятью формы, такого как НИТИНОЛ, или она может быть образована из природного, синтетического или полусинтетического полимера, такого как хитозан, нейлон или искусственный шелк. Головка для денудации просвета полости организма в идеале состоит из одного элемента спирали, хотя согласно некоторым вариантам осуществления спираль может содержать множество элементов спирали, например 2, 3, 4, 5, 6, 7, 8, 9 или 10, а предпочтительно 2-4 элемента спирали.
Ширина элемента спирали составляет по меньшей мере 0,1 мм. Ширина, как правило, составляет от 1 до 3 мм, чтобы обеспечить доставку через катетер подходящего размера и оболочку интродьюсера.
Как правило, винтовая спираль достаточно упруго деформируема, чтобы поддерживать радиальную силу по окружности на стенку просвета полости организма различного диаметра при движении вдоль просвета полости организма (т.е. она выполнена с возможностью «саморегулирования» или «возможности саморегулирования»). Это проиллюстрировано на фиг.59, на которой показано применение устройства по настоящему изобретению для денудации вены с несколькими изгибами и диаметром, который постепенно увеличивается. Согласно этому варианту осуществления винтовая спираль в развернутом состоянии будет иметь завышенный размер по сравнению с самой широкой частью просвета полости организма, тем самым создавая радиальную силу по всей окружности просвета полости организма в его самой широкой точке, показанной на фиг.59С, и достаточно упруго деформируемой, чтобы диаметр спирали мог регулироваться с изменяющимся диаметром вены, сохраняя при этом радиальную силу денудации по окружности просвета полости организма. Винтовая спираль, как правило, достаточно упруго деформируется, чтобы спираль могла проходить через сужения или клапаны в венах, как показано на фиг.56 и 57, соответственно. Эти сужения или изменения диаметра вены на протяжении лечения могут быть статическими (более широкий диаметр проксимального сосуда сужается к более узкому дистальному сосуду) или динамическими (сокращение гладких мышц стенки вены, приводящее к уменьшению диаметра вены в физиологическом процессе, известном как веноспазм). Уменьшение диаметра вены увеличит радиальные силы, действующие на винтовую спираль, это, в свою очередь, увеличит кольцевую силу, создаваемую внутри материала винтовой спирали, которая будет преобразовываться в продольную силу для увеличения длины спирали. Эта концепция проиллюстрирована на фиг.60, где показано устройство развернутым в типичном сосуде длиной 1 и диаметром D. Радиальная сила эквивалентна давлению Р, действующему перпендикулярно стенке вены. Давление, которое сосуд оказывает на спираль завышенного размера или кольцевая сила (HF), действует для сжатия спирали и увеличивается, когда диаметр сосуда уменьшается до d Благодаря открытой конструкции винтовой спирали это увеличенная кольцевая сила будет перемещаться в продольном направлении, чтобы удлинить спираль до длины L. Это позволит уменьшить радиальные силы в точке контакта внешней поверхности устройства со стенкой вены, чтобы предотвратить чрезмерное трение, но поддерживать достаточную силу, чтобы удерживать поверхность в соприкосновении и прижимать ее к вене.
Чрезмерное трение может привести к нежелательному захвату или заеданию сегментов спирали и перфорации стенки и/или травме соединительной ткани, прилегающей к вене.
Используемый в настоящем документе термин «элемент спирали» относится к отдельным и отделенным элементам спирали, которые вместе составляют часть спирали устройства согласно настоящему изобретению. Как правило, каждый элемент спирали является винтовым. Как правило, элементы спирали коаксиальные. Как правило, каждый элемент спирали в развернутом состоянии характеризуется одинаковым диаметром. Как правило, каждый элемент спирали характеризуется одинаковым шагом при развертывании. В развернутой конфигурации множество элементов спирали вместе обеспечивают круговое соприкосновение с внутренним просветом полости организма. Таким образом, каждый элемент спирали может быть сконфигурирован таким образом, что в развернутой конфигурации он соприкасается только с частью окружности внутреннего просвета, например, 90° - 270°, 90° - 180°, 140° - 220° или 180° - 270°, соприкосновения с окружностью просвета полости организма. Согласно одному варианту осуществления спираль содержит два элемента винтовой спирали, например, двойную спираль. Как правило, каждый из двух элементов винтовой спирали в развернутом состоянии содержит по меньшей мере 0,5 витка и, как правило, от 0,5 до 1,0 витка или от 0,5 до 0,7 витка. Согласно одному варианту осуществления спираль содержит три элемента винтовой спирали, например, тройную спираль. Как правило, каждый из трех элементов винтовой спирали содержит по меньшей мере 0,3 витка в развернутом состоянии и, как правило, от 0,3 до 1,0 витка или приблизительно от 0,3 до 0,5 витка в развернутом состоянии. Согласно одному варианту осуществления спираль содержит четыре элемента винтовой спирали. Как правило, каждый из четырех элементов винтовой спирали содержит по меньшей мере 0,25 витка в развернутом состоянии и, как правило, от 0,25 до 0,75 витка в развернутом состоянии. Согласно одному варианту осуществления множество элементов спирали соединены вместе на их дистальных концах (закрытая конфигурация). Согласно одному варианту осуществления множество элементов спирали не соединены на их дистальных концах (открытая конфигурация).
Используемый в настоящем документе термин «неразъемно прикрепленный к катетерному элементу» применительно к головке для денудации просвета полости организма (или сосуда или вены) следует понимать как означающий, что устройство не выполнено с возможностью отсоединения и высвобождения головки от катетерного элемента в организме; другими словами, устройство не предназначено для имплантации головки для денудации просвета полости организма в организм.
Имплантируемые устройства нежелательны для применения при лечении заболеваний поверхностных вен по следующим причинам: поверхностные вены ног расположены относительно близко к поверхности кожи, где их можно легко пальпировать на ощупь. Громоздкие имплантируемые устройства могут вызвать боль, раздражение или местную деформацию кожи; имплантаты могут подавлять способность вены уменьшать диаметр за счет сокращения гладких мышц, известную как веноспазм. Это важно для уменьшения диаметра вены, уменьшения количества тромба внутри вены и предотвращения реканализации; имплантаты могут вызывать воспалительные реакции, опосредованные иммунной системой.
Поверхность соприкосновения с просветом полости организма по меньшей мере части спирали является абразивной для срезания или необратимого повреждения внутреннего слоя просвета полости организма вдали от просвета полости организма. На поверхность можно воздействовать химически, электрически или физически/механически, чтобы сделать ее абразивной. Существует несколько типов механической обработки, которые могут применяться для придания шероховатости поверхности, включая в себя механическое истирание, дробеструйную обработку, пескоструйную обработку, накатку, электроэрозионную обработку и импульсную электрохимическую обработку. Химическое травление также можно использовать для придания шероховатости поверхности детали. Поверхность может быть зубчатой. Поверхность также может включать в себя выступающие части, которые при контакте с просветом сосуда действуют как абразивная поверхность, эти выступающие части могут быть частями, прикрепленными к поверхности абразивной поверхности, или участками, загнутыми вверх от абразивной поверхности, или углублениями с ямками, которые имеют решетчатый эффект. Один из способов создания винтовой спирали с абразивной поверхностью состоит в том, чтобы намотать вторую проволоку или несколько проволок по спирали вокруг проволочного проводника, как описано ниже и показано на фигурах. Вторая проволока может иметь круглое, плоское, многоугольное, треугольное, квадратное, прямоугольное, Х-образное или звездообразное поперечное сечение при условии, что комбинация удлиненного элемента (проволочного проводника) и спирально намотанной второй проволоки создает поверхность контакта с абразивным просветом, способную денудировать просвет при перемещении в осевом направлении вдоль просвета в развернутой конфигурации. Проволоки могут быть не единственным типом материала, обернутого вокруг центрального проволочного проводника или центрального корпуса, например, формованными изделиями на полимерной основе, ребрами, абразивными гранулами или точечной сваркой. Другой способ изготовления зубчатой поверхности состоит в том, чтобы надрезать углубления на поверхности спирали или создать на поверхности выпуклые образования, например, спиральные углубления или образования. Поверхность должна быть достаточно абразивной, чтобы денудировать просвет после одного продольного прохода устройства, чтобы избежать необходимости многократных проходов, которые могут быть ограничены начальным вазоспазмом. Предпочтительная конфигурация включает в себя элементы поверхности для создания как макро, так и микроабразивной поверхности. Макроабразивная поверхность содержит канавки, углубления или зубцы высотой по меньшей мере приблизительно 0,5 мм (например, от 0,5 до 1,0 мм) от вершины до впадины. Микроповерхность содержит бороздки, углубления или зубцы высотой от 5 до 100 микрон от пика до впадины. Эти канавки вызывают истирание и предотвращают засорение абразивной поверхности клеточными остатками на протяжении всего воздействия. Ориентация макро абразивных канавок важна, поскольку они должны быть не параллельны, а перпендикулярны осевому направлению отвода. Это проиллюстрировано на фиг.64, где показано устройство, развернутое в сосуде. Подробный вид поверхности спирали показан на увеличенных изображениях (А), (В) и (С). На (А) показан рисунок канавок, перпендикулярных стенке сосуда при извлечении, который эффективен для механической абляции. На (В) показана ориентация, которая лежит параллельно стенке вены во время вывода и менее эффективна. Из-за вариабельности диаметра сосудов и извилистости венозной анатомии для решения этой проблемы требуется макроабразивный рисунок текстуры. На (С) показан рисунок с ромбовидной накаткой, которая идеально подходит для обеспечения того, чтобы часть макроабразивной поверхности всегда была перпендикулярна стенке вены во время контакта, когда устройство извлекается в осевом направлении. Микроабразивная поверхность может иметь шероховатость поверхности или значение RA, как правило, от 0,8 до 3,2 для достижения разрушения эндотелия и предотвращения чрезмерного статического трения. Величина RA представляет собой среднее арифметическое абсолютных значений отклонений высоты профиля от средней линии, записанных в пределах оценочной длины. Значение RA 0,8 соответствует средней высоте от пика до впадины 4 мкм. Эндотелиальные клетки (ЕС) в большинстве сосудов защищены от прямого воздействия текущей крови бесклеточным слоем, известным как гликокаликс.Эта гелеобразная структура, как правило, имеет толщину 0,5 3 мкм, что превышает толщину самих ЕС (0,2-2,0 мкм).
Используемый в настоящем документе термин «материал с памятью формы» следует понимать как означающий материал, как правило, металлический сплав, который запоминает свою первоначальную форму и который при деформации или принудительном изменении конфигурации возвращается к своей форме до деформации, когда деформирующие силы отпущены. Примером является Нитинол. Согласно одному варианту осуществления спираль или элемент проволочного проводника спирали образован из материала с памятью формы. Способы изготовления спирали из материала с памятью формы, как правило, предусматривают стадии обертывания сплава с памятью формы вокруг штампа или приспособления для термофиксации так, чтобы он формировал желаемую форму после термофиксации, размещение загруженного приспособления в печи на заданную температуру/время и снятие и охлаждение детали. Также возможно сформировать форму из цилиндрической части трубки, которая вырезана лазером до желаемого размера. Также возможно изготовление этой памяти формы другими способами, например, электроактивированными полимерами.
Используемый в настоящем документе термин «зона воздействия» применительно к просвету полости организма, сосуду или поверхностной вене относится к цилиндрическому участку просвета полости организма, который участвует в патогенезе патологического состояния и, как правило, составляет в длину 1 см или больше. В контексте поверхностной вены под термином «зона воздействия» следует понимать цилиндрический участок просвета поверхностной вены, который не обеспечивает эффективную циркуляцию крови и, как правило, составляет в длину 1 см или больше. Согласно одному варианту осуществления зона воздействия составляет 1-50 см, 1-40 см, 1-30 см, 1-25 см, 1-15 см, 1-10 см, 5-50 см, 5-40 см, 5-30 см, 5-25 см, 5-15 см, 5-10 см, 10-50 см, 10-40 см, 10-30 см, 10-25 см или 10-15 см в длину.
Как показано на фиг.1, вены состоят из 3 первичных клеточных слоев: внешнего адвентициального слоя, состоящего из жесткой фиброзной ткани и немиелинизированных нервных волокон, среднего слоя, состоящего из коллагена и гладкомышечных клеток, и внутреннего эндотелиального слоя, состоящего из одного слоя плоских клеток и некоторой соединительной ткани. Кроме того, эндотелиальный слой покрыт бесклеточным гликокаликсом, который обычно представляет собой равномерно распределенную структуру толщиной 0,5-3 мкм.
Вены характеризуются более тонкими стенками, чем артерии, менее жесткими и более податливыми. В отличие от артерий, которые все время сохраняют свою цилиндрическую форму, вены могут опорожняться от крови и спадаться вниз или, альтернативно, значительно растягиваться, чтобы вместить увеличенные объемы крови.
Спазм или сужение вены происходит в ответ на физическое растяжение, активирующее нервы на внешней стороне стенки вены. Сужение также происходит, когда химические вещества, такие как эндотелии-1, высвобождаются эндотелием в ответ на растяжение или нарушение.
Эндотелиальный слой предотвращает свертывание крови в венах. Если эндотелий разрушен или поврежден, экспонируются протромботические факторы, к которым немедленно прилипают тромбоциты, и начинается каскад свертывания крови. Со временем (4-12 недель, как правило, в среднем 8 недель) сгусток в вене становится фиброзным, поскольку в него вторгаются окружающие клетки, которые откладывают фибрин и коллаген в процессе, известном как склероз или фиброзная трансформация. Это предотвращает рефлюкс крови в вену и тем самым успешно лечит варикозное расширение вен.
Цель устройства заключается в том, чтобы разрушить эндотелиальный и средний слои вены, но не внешний адвентициальный слой. Это требует селективного контролируемого механического разрушения на глубину по меньшей мере от 5 мкм до 100 мкм, но не более. Это обеспечивает разрушение эндотелиального и поверхностного среднего слоя без более глубокого разрушения медии/адвентиции, которое может привести к боли и/или перфорации. В более глубоких слоях может происходить дальнейшая гибель клеток из-за высвобождения внутриклеточного содержимого, вызывающего апоптоз в соседних клетках и продолжающегося каскадом с течением времени на глубину до 300 мкм. Возникающий в результате тромбоз или сгусток и фиброзная рубцовая ткань предотвращают попадание крови в вену и, следовательно, появление и симптомы, связанные с варикозным расширением вен. Важно, чтобы эндотелий был полностью разрушен по окружности, поскольку если небольшие участки останутся нетронутыми, сгусток может не образоваться и кровь продолжит течь, что приведет к неудаче лечения и/или раннему рецидиву. Это может произойти, когда жидкие или пенные химические склерозанты используются в крупных венах, и является предполагаемой причиной низкой эффективности, составляющей всего 70% по сравнению с 90-98% при термической обработке.
Поскольку лечение начинается на два или более сантиметра кзади от соединения с глубокими венами, прикрепленный тромб, созданный настоящим изобретением, ограничивается поверхностной веной и, поскольку кровоток отсутствует, он не может быть перенесен в глубокую систему, где может вызвать осложнения.
Точные требования к успешной долгосрочной абляции вен в настоящее время неизвестны. Некоторые специалисты по лечению поверхностного венозного рефлюкса полагают, что полного повреждения эндотелия достаточно. Это приводит к образованию тромба и прекращению кровотока, затем организм превращает тромбированную вену в фиброзный тяж в процессе, известном как склероз или фиброзная трансформация, достигая долговременной абляции. Другие утверждают, что повреждение ткани стенки вены в более глубоком среднем слое, в дополнение к внутреннему слою интимы, необходимо для долгосрочной абляции вены. Другие, такие как сторонники термической абляции, предполагают, что требуется полное трансмуральное повреждение стенки вены от интимы до внешнего адвентициального слоя.
В настоящем изобретении достигается полное периферическое эндотелиальное повреждение за счет его скрученной конфигурации завышенного размера с абразивной поверхностью. Это также вызывает повреждение среднего слоя как минимум тремя отдельными механизмами. Во-первых, абразивная многоугольная поверхность спирали может проникать на глубину более чем 50 мкм, что позволяет повреждению проникать глубже, чем слой интимы. Это также может быть дополнительно увеличено за счет использования более чем одной спирали, позволяющей второй абразивной спирали, расположенной более дистально на устройстве, проникать глубже в участок стенки сосуда, который уже был денудирован более проксимальной спиралью на устройстве. Этого также можно достичь, повторяя процедуру в течение той же продолжительности лечения с использованием того же устройства. Во-вторых, в исследованиях пенной склеротерапии было показано, что гибель клеток происходит на глубине до 300 мкм в стенке вены [10]. Вероятно, это связано с каскадным эффектом гибели клеток, вызванным высвобождением молекул поврежденными клетками, сигнализирующими об апоптозе в соседних клетках. Таким образом, повреждение клеток стенки вены может происходить глубже до поверхностных клеток, затронутых механическим разрушением. В-третьих, силы трения, вызываемые устройством, действующим на поверхностные слои, в сочетании с сопротивлением более глубоких средних слоев, характеризуются эффектом сдвига внутри слоев стенки вены, что приводит к более глубокому повреждению стенки сосуда. Об этом эффекте сообщалось в предыдущих исследованиях, а также в доклинических испытаниях настоящего изобретения.
Риск разрыва вены и/или зацепления устройства пропорционален абразивности или остроте устройства при контакте со стенкой, вызывая соответственно силы трения или резания, и глубине проникновения абразивных элементов в стенку. Зацепление представляет собой часто встречающуюся болевую точку у врачей и пациентов после применения современных механохимических устройств. Есть даже задокументированные случаи, когда вена зацеплялась и случайно удалялась, что приводило к боли и образованию гематом, известных как «непреднамеренное самопроизвольное удаление» [6]. Створки венозного клапана также представляют собой препятствие, при котором механический наконечник может застрять и зацепиться.
Ключевой проблемой в настоящем документе является сложность полного удаления эндотелиального слоя и частичного повреждения среднего слоя, не вызывая чрезмерного сопротивления и/или зацепления.
На фиг.2 подчеркнута важность периферийного покрытия с точки зрения разрушения эндотелиальных клеток. В исследовании авторов настоящего изобретения на животных она взята из частично обработанной вены. В правом верхнем углу показан сгусток, прикрепленный к стенке вены с проникновением тканей, поскольку он начинает становиться фиброзным через 28 дней после процедуры. В нижнем левом углу остался неповрежденный эндотелий. Сгусток не образовался, и кровь может течь по каналу, что приводит к общей неэффективности лечения в этом сегменте. Наоборот, на фиг.3 показаны результаты полного эндотелиального покрытия и повреждения через 28 дней после процедуры с образованием прилипшего тромба, облитерирующего весь просвет сосуда, что препятствует кровотоку, что приводит к успеху лечения. Миграцию воспалительных клеток из адвентиции в тромб можно идентифицировать при микроскопическом исследовании. Это приводит к фиброзной трансформации тромба и длительной окклюзии.
Примеры
Теперь настоящее изобретение будет описано со ссылкой на конкретные примеры. Они являются просто иллюстративными и представлены только для иллюстративных целей: они не предназначены для ограничения каким-либо образом объема заявленной монополии или описанного настоящего изобретения. Эти примеры представляют собой лучший вариант, рассматриваемый в настоящее время для практического применения настоящего изобретения.
На графических материалах и первоначально на фиг.4-7 показано устройство в соответствии с настоящим изобретением для денудации просвета полости организма, обозначенное в целом номером позиции 1. Устройство 1, которое согласно этому варианту осуществления представляет собой устройство для денудации просвета варикозной вены с целью вызвать окклюзию вены и тем самым лечить варикозную вену, содержит элемент 2 полиимидного катетера и головку 3 для денудации, выполненную с возможностью транслюминальной доставки в участок подлежащей лечению варикозной вены, и развертывания в целевом положении в вене. Головка 3 для денудации содержит винтовую спираль 4, имеющую проксимальный конец 5 и дистальный конец 6, которые, как правило, соосны с осью винтовой спирали, и скрученную часть, имеющую приблизительно 1,5 витка, внешний диаметр 13 мм и шаг приблизительно 9 мм.
Винтовая спираль 4 регулируется в осевом направлении относительно катетерного элемента из конфигурации доставки (не показана), в которой спираль разматывается и уложена в дистальном конце катетерного элемента 2, и в развернутой скрученной конфигурации, показанной на фиг.4-7. Винтовая спираль содержит сплав с памятью формы и смещается, чтобы принять скрученную конфигурацию, когда она выходит за пределы дистального конца катетерного элемента. Устройство подходит для применения при варикозном расширении вен, имеющем нормальный диаметр 4-12 мм (т.е. когда размер спирали превышает размер подвергаемой воздействию вены).
Следует отметить, что «завышенный» диаметр винтовой спирали простирается по меньшей мере вдоль одного полного контура спирали (360 градусов). Эта особенность, добавленная к завышенному диаметру спирали относительно вены, гарантирует, что спираль соприкасается и прижимается по окружности к внутреннему просвету вены, оказывая радиальное давление равномерно по всей окружности вены. Завышенный диаметр может проходить менее чем на один полный контур, например, по меньшей мере на 300 градусов, однако это приводит к риску неполной денудации внутреннего просвета вены, что приведет к частичной окклюзии вены и последующей реканализации. Согласно этому варианту осуществления спираль имеет чуть более одного полного витка, чтобы обеспечить полное покрытие, даже когда она растянута, но не слишком длинная, чтобы вызвать повышенное трение о стенку вены и зацепление. Добавление дополнительных витков спирали в более длинную спираль можно использовать для дальнейшего механического повреждения стенки вены. Увеличенная площадь поверхности устройства, контактирующей с веной согласно такому варианту осуществления, также увеличила бы риск зацепления и повреждения стенки вены. Таким образом, спираль с одним полным витком представляет собой наиболее эффективный способ достижения полной денудации внутренней поверхности сосуда.
Скрученная конфигурация и гибкий материал головки для денудации позволяют ей адаптироваться к разным диаметрам вен в диапазоне размеров, которые меньше диаметра спирали, при этом все еще прилагая достаточную радиальную силу, чтобы вызвать денудацию. Эти свойства также позволяют спирали адаптироваться к изменению диаметра вены внутри одной и той же вены на протяжении ее целевой длины воздействия. Эти изменения могут быть вызваны естественным сужением вены или венозными клапанами. Последнее может вызвать значительное зацепление и перфорацию вены, если жесткие конструкции будут пойманы или захвачены створками клапана. Из-за гибкой природы спирали и минимальных выступов абразивных компонентов это маловероятно. В случае ловли устройства створками клапана возникающее в результате небольшое увеличение силы вдоль продольной оси автоматически уменьшит диаметр спирали, одновременно увеличивая ее длину, позволяя спирали высвободиться и избежать зацепления или отсоединения клапана и соответствующих створок, показанных на фиг.60 и 61. Это происходит автоматически во время нормального извлечения устройства из вены и не требует регулировки, дополнительных маневров или дополнительной визуализации, выполняемой оператором.
Ссылаясь на графические материалы и первоначально на фиг.8 и 9, винтовая спираль 4 имеет абразивную поверхность, выполненную с возможностью срезания внутренней выстилки вены (в первую очередь, без ограничения, слой эндотелиальных клеток) от вены, когда винтовая спираль перемещается в осевом направлении вдоль вены в развернутой конфигурации. Согласно этому варианту осуществления винтовая спираль содержит 0,01181-дюймовый проволочный проводник из нитинола 8 и вторую проволоку 9, спирально намотанную вокруг проволочного проводника 8, образуя абразивную зубчатую поверхность на винтовой спирали 4. Ссылаясь на фиг.8 и 9, вторая проволока 9 представляет собой плоскую проволоку, изготовленную из нержавеющей стали или нитинола. Согласно этому варианту осуществления проволока проволочного проводника 8 имеет диаметр приблизительно 1 мм, а вторая проволока 9 имеет ширину приблизительно 0,7 мм и толщину приблизительно 0,02 мм. Шаг второй проволоки составляет приблизительно 1,5 мм. Как показано на фиг.9, шаг второй проволоки 9 на проволочном проводнике 8 уменьшается на дистальном конце 6 винтовой спирали 4, в данном случае приблизительно до 0,3 мм. Назначение меньшего шага/замкнутого шага на дистальном конце состоит в том, чтобы сформировать гибкий дистальный элемент устройства, чтобы помочь направить устройство к целевой анатомии. Как показано на фиг.10, шаг второй проволоки 9 на проволочном проводнике 8 увеличивается на проксимальном конце 5 винтовой спирали 4, в данном случае до максимального значения приблизительно 3 мм. Назначение более высокого шага на проксимальном конце заключается в способствовании плавному повторному захвату дистального кончика после процедуры. Эта проксимальная перегородка также может иметь закрытый участок с меньшим, более узким шагом, чтобы способствовать повторному захвату.
Толщина второй проволоки 9 составляет от 0,1 до 1 мм. Основываясь на тестировании с использованием эквивалентной венозной ткани животных, диаметр более 1 мм несет в себе риск образования выступа на поверхности, который может зацепиться за поверхность стенки вены или прилипнуть к ней.
Как показано на фиг.10 и 11, проксимальный конец 5 спирали 4 прикреплен к гипотрубке 12 из нержавеющей стали, которая проходит через катетерный элемент 2 до его проксимального конца (не показан). При использовании гипотрубка 12 может быть отрегулирована в осевом направлении относительно катетерного элемента 2 для обеспечения развертывания винтовой спирали 4 дистальнее катетерного элемента в скрученную конфигурацию и втягивания винтовой спирали 4 в катетерный элемент во время транслюминальной доставки и извлечения устройства. Согласно этому варианту осуществления катетерный элемент 2 представляет собой катетерную трубку из экструдированного полиимида 4Fr, имеющую сужающуюся внутрь горловину 14 на фиг.11, чтобы способствовать повторному захвату винтовой спирали 4, когда она втягивается в катетерный элемент 2.
Ссылаясь на фиг.9, дистальный конец винтовой спирали 4 заканчивается атравматической головкой, согласно этому варианте осуществления обеспечивается гладкий металлический шарик 15, который служит для предотвращения зацепления винтовой спирали за вену или клапан и снижения риска того, что дистальный наконечник вызовет перфорацию стенки вены при развертывании и извлечении. Кроме того, как показано на фиг.9, шарик 15 имеет такие размеры, чтобы входить в сужающуюся горловину 14 на фиг.11 катетерного элемента 2, когда устройство находится в конфигурации доставки.
Как показано на фиг.9, между концом абразивной спирали и дистальным гладким шариком имеется удлиненный прямой участок длиной приблизительно 5 мм для облегчения навигации и размещения устройства. Шарик на дистальной стороне устройства образует атравматический наконечник, согласно другому варианту осуществления он может быть того же диаметра, что и диаметр абразивного элемента, чтобы образовался не шарик, а прямой атравматический наконечник.
На фиг.12 показана часть устройства согласно альтернативному варианту осуществления настоящего изобретения, в котором частям, идентифицированным со ссылкой на предыдущие варианты осуществления, присвоены одинаковые номера позиций. Согласно этому варианту осуществления на поверхности второй проволоки имеются зазубрины со спиральными углублениями 20, которые служат для создания абразивной зубчатой поверхности на винтовой спирали 4.
На фиг.13-19 показано применение устройства согласно настоящему изобретению. В нижеследующем описании проксимальный относится к месту введения доступа, а дистальный относится к удаленному от места доступа в кровеносном сосуде. Устройство может быть доставлено и удалено через одно место инъекции и не требует имплантации или введения химических средств. Способ лечения вены с рефлюксом с целью вызвать постоянную окклюзию может включать следующие стадии.
На первой стадии устройство приводится в конфигурацию доставки, при этом винтовая спираль 4 втягивается в конец катетерного элемента (не показан). Согласно некоторым вариантам осуществления катетерный элемент представляет собой экструдированный полиимид. Затем устройство доставляется в целевую вену через отдельный катетер-интродьюсер под визуальным контролем, например, ультразвуком.
Затем устройство перемещается дистально под ультразвуковым контролем в требуемое положение. Правильное размещение с дистальным концом катетерного элемента 2, расположенным в начале подлежащей воздействию вены подтверждается ультразвуком, показанным на фиг.17.
Внешний катетер 2 выдвигается в осевом направлении, экспонируя винтовую спираль 4 и гипотрубку 12 в развернутой скрученной конфигурации, показанной на фиг.13. Согласно некоторым вариантам осуществления винтовая спираль развертывается с использованием ручки с элементом, управляемым колесиком. Используя интуитивное движение одной руки, оператор может развернуть спираль, поворачивая дисковый переключатель большим пальцем руки, держащей ручку. Это обеспечивает одновременную визуализацию путем позиционирования ультразвукового зонда с помощью противоположной руки. Это позволяет врачу при необходимости выполнять процедуру без помощника.
Спираль как в неразвернутой, так и в развернутой конфигурации должна легко визуализироваться на ультразвуке, чтобы предотвратить случайное размещение. Это достигается за счет введения эхогенного участка материала на кончик катетера. В развернутом состоянии спираль с ее абразивной поверхностью по своей природе эхогенная.
Поскольку размер спирали превышает размер подвергаемой воздействию вены, она оказывает направленную наружу радиальную силу на просвет вены по меньшей мере по одной полной окружности вены.
В отличие от существующих вариантов лечения, действие устройства на стенку вены, вызывающее длительную окклюзию, происходит только после извлечения устройства из подвергаемого воздействию участка вены. Это может происходить только в проксимальном направлении, которое защищает более дистальную структуру, которая может включать в себя вены в глубокой системе.
Если устройство случайно помещено в неправильное положение целевого сосуда, его можно повторно захватить во внешний катетер и переместить, не вызывая травмы сосуда.
Затем устройство перемещают проксимально вдоль подлежащего воздействию участка вены (как правило, участка вены размером приблизительно от 10 до 70 см), где радиальная сила абразивной поверхности спирали действует на внутренний просвет вены, а осевое движение заставляет винтовую спираль удалять, нарушать или разрушать поверхностные слои внутренней части внутреннего просвета вены. Эти слои состоят из гликокаликса, эндотелия, субэндотелиальной соединительной ткани и поверхностных слоев среднего слоя. Рецепторы растяжения в стенке вены реагируют на внешнюю радиальную силу устройства, что приводит к вазоспазму. Это дополнительно усиливается за счет высвобождения химических средств, хранящихся в эндотелиальных клетках, в основном эндотелина-1, мощного вазоконстриктора. Воздействие субэндотелиального коллагена приводит к адгезии тромбоцитов и запускает каскадную активацию протромботических факторов, приводящую к тромботической окклюзии сосуда. Эта тромботическая окклюзия дополнительно усиливается за счет значительного вазоспазма, как показано на фиг.19, где подвергнутый воздействию участок вены значительно сокращается в острой стадии. Это приводит к полному прекращению кровотока в сосуде. Это было продемонстрировано во время доклинического исследования боковой подкожной вены козы, в которой ручная инъекция контрастного вещества под высоким давлением не попадала в вену через 45 минут после воздействия.
Без ограничения теорией разрушение периферического эндотелиального слоя позволяет внутрипросветному тромбозу прилипать непосредственно к стенке сосуда и вызывать привлечение клеток, участвующих в воспалительной реакции заживления, для миграции из адвентиции через просвет в тромб. Эти клетки включают в себя фибробласты, которые создают коллаген в тромботической окклюзии, со временем превращая сосуд в фиброзный тяж. Это приводит к длительному закрытию сосуда и исчезновению симптомов заболевания вен.
Вопреки предыдущему мнению, что требуется полное повреждение трансмуральных клеток стенки вены, изобретатели продемонстрировали, что одна только поверхностная денудация может вызвать достаточную воспалительную реакцию, чтобы вызвать миграцию фибробластов на внешнем адвентициальном слое внутрь. Это является преимуществом, поскольку обеспечивает механизм действия, который может использовать устройство, которое не вызывает боли у пациента и не требует инъекций препарата в виде укола тумесцентной иглой для предотвращения боли. Это связано с тем, что сенсорные болевые нервные волокна расположены на адвентициальном слое сосуда, на который устройство не влияет напрямую.
Результаты доклинических исследований авторов также доказали важность полного эндотелиального разрушения по окружности для достижения долгосрочной успешной окклюзии. Тромботическая окклюзия без разрушения эндотелия приведет к реканализации, даже если эндотелий частично поврежден, как показано на фиг.2. Это связано с тем, что эндотелий препятствует прилипанию тромба, что вызывает сокращение тромба от стенки сосуда. Это дополнительно усиливается секрецией оксида азота эндотелиальными клетками, способствуя расширению сосудов, таким образом противодействуя эффекту веноспазма. Это может быть основным фактором низкой эффективности способов, основанных на химических склерозантах. Поскольку склерозант дезактивируется кровью и удаляется за счет скорости циркуляции, он может вызывать только неполное эндотелиальное разрушение, особенно в более крупных сосудах, которые имеют больше крови и большую площадь поверхности даже в спавшемся состоянии.
Варианты осуществления на фиг.4-16 имеют головку для денудации просвета полости организма, образованную из единственного элемента спирали, который в развернутой конфигурации содержит один полный спиральный виток и при использовании денудирует по окружности внутренний просвет полости организма. Ссылаясь на фиг.20-24, описан альтернативный вариант осуществления устройства согласно настоящему изобретению, обозначенный в целом номером позиции 30, и в котором части, описанные со ссылкой на предыдущие варианты осуществления, обозначены теми же номерами позиций. Согласно этому варианту осуществления устройство включает в себя удлиненный рычаг управления 31, который проходит через катетерный элемент 2 и функционально соединен с дистальным концом 6 спирали 4, а проксимальный конец 5 спирали прикреплен к гипотрубке 12 из нержавеющей стали. Осевое перемещение рычага управления 31 относительно гипотрубки 12 приводит к развертыванию или раскручиванию спирали. На фиг.22 показано, что спираль имеет частично скрученную конфигурацию, а на фиг.23 показано, что спираль имеет полностью скрученную конфигурацию. Применение этого варианта осуществления практически такое же, как описано ранее, за исключением того, что развертыванием спирали можно управлять, регулируя осевое положение рычага 31 управления и гипотрубки 12.
На фиг. 25-27 описан альтернативный вариант осуществления устройства в соответствии с настоящим изобретением, обозначенный в целом номером позиции 40, и в котором частям, описанным со ссылкой на предыдущие варианты осуществления, присвоены те же номера позиций. Согласно этому варианту осуществления спираль 4 состоит из двух элементов спирали 41а и 41b, которые работают в тандеме, чтобы денудировать по окружности внутренний просвет полости организма, каждый из которых регулируется из раскрученной конфигурации, подходящей для размещения внутри катетерного элемента и транслюминальной доставки через просвет полости организма, и скрученной конфигурации, показанной на фигурах. Каждый элемент спирали 41а, 41b имеет проксимальную часть, которая обычно коаксиальна катетерному элементу, и скрученную часть, которая в развернутой конфигурации содержит менее одного полного витка, так что элементы спирали вместе принимают форму двойной спирали, которая при использовании по окружности соприкасается с подлежащим воздействию просветом полости организма. Как и согласно предыдущим вариантам осуществления, каждый элемент спирали содержит проволочный проводник 8, имеющий вторую проволоку 9, намотанную вокруг проволочного проводника, чтобы обеспечить зазубренную поверхность для денудации просвета полости организма. Использование этого варианта осуществления такое же, как описано со ссылкой на предыдущие варианты осуществления.
На фиг.28-30 описан альтернативный вариант осуществления устройства в соответствии с настоящим изобретением, обозначенный в целом номером позиции 50, и в котором частям, описанным со ссылкой на предыдущие варианты осуществления, присвоены те же номера позиций. Согласно этому варианту осуществления спираль 4 состоит из четырех элементов спирали 51а - 5Id, которые работают в тандеме для денудации по окружности внутреннего просвета полости организма, каждый из которых регулируется из раскрученной конфигурации, подходящей для размещения внутри катетерного элемента и транслюминальной доставки через просвет полости организма, и скрученной конфигурации, показанной на фигурах. Каждый элемент спирали с 51а по 5 Id в своей развернутой конфигурации составляет приблизительно четверть полного витка, и четыре элемента спирали вместе адаптируют форму четверной спирали, так что четыре элемента спирали вместе по окружности соприкасаются с подлежащим воздействию просветом полости организма. Как и согласно предыдущим вариантам осуществления, каждый элемент спирали содержит проволочный проводник 8, имеющий вторую проволоку 9, намотанную вокруг проволочного проводника, чтобы обеспечить зазубренную поверхность для денудации просвета полости организма. Использование этого варианта осуществления такое же, как описано со ссылкой на предыдущие варианты осуществления.
Согласно описанным выше вариантам осуществления, которые содержат более одного элемента спирали, элементы спирали соединены своими проксимальными концами и имеют свободные дистальные концы (т.е. открытые спирали). Однако следует понимать, что спираль может представлять собой замкнутую спираль, в которой элементы спирали соединены вместе на проксимальном и дистальном концах. Такой вариант осуществления описан на фиг.31-33, на которых части, описанные со ссылкой на предыдущие варианты осуществления, обозначены одинаковыми номерами позиций. Согласно этому варианту осуществления устройство 60 содержит спираль, образованную из четырех элементов винтовой спирали 61а - 6 Id, которые соединены вместе на их проксимальном и дистальном концах 5, 6, причем каждая спираль имеет приблизительно половину полного витка. Как и согласно предыдущим вариантам осуществления, каждый элемент спирали содержит проволочный проводник 8, имеющий вторую проволоку 9, намотанную вокруг проволочного проводника, чтобы обеспечить зазубренную поверхность для денудации просвета полости организма. Использование этого варианта осуществления такое же, как описано со ссылкой на предыдущие варианты осуществления.
На фиг.34-41 показаны винтовые спирали, образующие часть устройств по настоящему изобретению, и, в частности, различные типы проволок, образующих спирали, и различные типы углублений/образований на поверхности спирали, образующей шероховатую поверхность. Спирали изготовлены из нитиноловой проволоки, а углубления вырезаются способом накатки.
На фиг.34А и 34В показан участок винтовой спирали 67, имеющий в целом плоский профиль с внешней поверхностью 61 соприкосновения с просветом с поперечными углублениями, образующими зубцы 62, имеющие профиль усеченного треугольника, плоской внутренней поверхностью 63 и срезанными зигзагообразно сторонами, образующими множество боковых зубцов 65.
На фиг.35А и 35В показан участок винтовой спирали 70, имеющий в целом выпуклый профиль с внешней поверхностью 71 соприкосновения с просветом с криволинейными поперечными углублениями, образующими зубцы 72, имеющими треугольный профиль, и гладкой выпуклой внутренней поверхностью 73.
На фиг.36А и 36В показан участок винтовой спирали 80, имеющий в целом плоский профиль с внешней поверхностью 81 соприкосновения с просветом с поперечными углублениями, образованными на каждой стороне 84 поверхности 81, обеспечивающей две серии зубцов 82, имеющих усеченный треугольный профиль, и гладкой выгнутой внутренней поверхностью 83.
На фиг.37А и 37В показан участок винтовой спирали 90, имеющий в целом выпуклый профиль с выпуклой внешней поверхностью 91 соприкосновения с просветом с углублениями, образованными на поверхности 91, обеспечивающими ромбовидные зубцы 92, некоторые с плоскими кончиками, а некоторые с заостренными кончиками, и гладкой плоской внутренней поверхностью 93.
На фиг.38А и 38В показан участок винтовой спирали 100, имеющий в целом серповидный профиль с выпуклой внешней поверхностью 101 соприкосновения с просветом с изогнутыми углублениями, образованными на поверхности 101, обеспечивающими поперечные зубцы 102, имеющие разносторонний треугольный профиль, и гладкой плоской внутренней поверхностью 103.
На фиг.39А и 39В показан участок винтовой спирали 110, имеющий в целом овальный профиль с выпуклой внешней поверхностью 111 соприкосновения с просветом с изогнутыми углублениями V-образного профиля, образованными на поверхности 111, обеспечивающими поперечные зубцы 112, имеющие треугольный профиль, и гладкой плоской внутренней поверхностью 113.
На фигурах 40А и 40В показан участок винтовой спирали 120, имеющий в целом плоский профиль с плоской внешней поверхностью 121 соприкосновения с просветом, плоской внутренней поверхностью 123 и боковыми сторонами, вырезанными зигзагообразно, обеспечивая множество боковых зубцов 125.
На фиг.41А и 41В показан участок винтовой спирали 130, имеющий в целом перевернутый Т-образный профиль с основанием 131, зубцами 132, расположенными на основании, и гладкой плоской внутренней поверхностью 133.
Вышеописанные поверхностные рисунки и формы характеризуются преимуществом, поскольку они позволяют обеспечить правильный угол, глубину и уровень клеточного разрушения во время осевого воздействия на просвет полости организма, причем развернутое устройство автоматически деформируется в ответ на изменения диаметра просвета полости организма. Как описано ранее, макроабразивная поверхность должна идеально контактировать со стенкой сосуда перпендикулярно во время извлечения, чтобы характеризоваться наибольшим эффектом.
На фиг.42-48 показан ряд головок для денудации вен, образующих часть устройств по настоящему изобретению, и, в частности, головок для денудации вен, содержащих одну винтовую спираль, и на которых части, описанные со ссылкой на предыдущие варианты осуществления, обозначены одинаковыми номерами позиций.
На фиг.42А и 42В показана головка для денудации вен, образующая часть устройства по настоящему изобретению, обозначенная в целом номером позиции 140 и содержащая рычаг управления 31 и винтовую спираль 141, имеющую приблизительно три витка, и проксимальный участок 142, где спираль увеличивается по диаметру по направлению к средней точке 143 и к дистальному участку 144, где диаметр спирали уменьшается по диаметру по направлению к дистальному наконечнику 145, который расположен на оси винтовой спирали.
На фиг.43А и 43В показана головка для денудации вен, образующая часть устройства по настоящему изобретению и обозначенная в целом номером позиции 150, и содержащая рычаг управления 31 и винтовую спираль 151, имеющую приблизительно три витка (спирали) 152А, 152 В, 152С, каждый из которых характеризуется немного другим диаметром и немного смещен в осевом направлении относительно предыдущего витка.
На фигурах 44А и 44В показана головка для денудации вен, образующая часть устройства по настоящему изобретению и обозначенная в целом номером позиции 160, и содержащая рычаг управления 31 и винтовую спираль 161, имеющую приблизительно семь витков (спиралей) с переменным диаметром и включающую в себя проксимальный участок 162, где спираль сначала уменьшается, а затем увеличивается в диаметре по направлению к средней точке 163 и дистальному участку 164, где диаметр спирали уменьшается по диаметру по направлению к дистальному концу 165.
На фиг.45А и 45В показана головка для денудации вен, образующая часть устройства по настоящему изобретению и обозначенная в целом номером позиции 170, и содержащая рычаг управления 31 и винтовую спираль 171, имеющую приблизительно четыре витка (спирали) и содержащую проксимальный элемент спирали 172, дистальный элемент спирали 173 и переходный элемент 174, соединяющий элементы спирали, и дистальный наконечник 175.
На фиг.46А и 46В показана головка для денудации вен, образующая часть устройства по настоящему изобретению и обозначенная в целом номером позиции 180, и содержащая винтовую спираль 181, имеющую приблизительно два витка (спирали) и содержащую проксимальный элемент спирали 182, дистальный элемент спирали 183 и переходной элемент 184, содержащий прямой участок, соединяющий элементы спирали, и дистальный наконечник 185.
На фиг.47А и 47 В показана головка для денудации вен, образующая часть устройства по настоящему изобретению и обозначенная в целом номером позиции 190, и содержащая рычаг управления 31 и винтовую спираль 191, имеющую приблизительно три витка (спирали), диаметр которых уменьшается в дистальном направлении по направлению к дистальному концу 195.
На фиг.48А, 48В и 48С показана головка для денудации вен, образующая часть устройства по настоящему изобретению и обозначенная в целом номером позиции 200, и содержащая рычаг управления 31 и винтовую спираль 201, имеющую приблизительно три витка (спирали) и содержащую проксимальный правовинтовой элемент спирали 202 приблизительно с двумя витками, дистальный левовинтовой элемент спирали 203 приблизительно с 1,5 витками, переходной элемент 204 с поворотным участком 206 и дистальный наконечник 205. Поворотный участок 206 допускает переход правовинтовой проксимальной спирали 202 меньшего диаметра в левовинтовую дистальную спираль 203 большего диаметра.
На фиг.49-51 показан ряд головок для денудации вен, образующих часть устройств по настоящему изобретению, и, в частности, головки для денудации вен имеют две несоединенные винтовые спирали, разнесенные в осевом направлении, в которых части, описанные со ссылкой на предыдущие варианты осуществления, обозначены одинаковыми номерами позиций.
На фиг.49А и 49 В показана головка для денудации вен, образующая часть устройства в соответствии с настоящим изобретением, обозначенная в целом номером позиции 210, и содержащая рычаг управления 31, который раздвоен на дистальном конце для обеспечения элементов управления 31А и 31 В, проксимальную винтовую спираль 211, функционально прикрепленную к элементу управления 31 А, и дистальную винтовую спираль 212, разнесенная в осевом направлении от проксимальной винтовой спирали и функционально присоединенную к элементу управления 31 В, который проходит через проксимальную винтовую спираль. Каждая винтовая спираль имеет чуть больше двух витков (спиралей) и, как правило, характеризуется конической формой с увеличивающимся проксимально диаметром.
На фиг.50А и 50 В показана головка для денудации вен, образующая часть устройства в соответствии с настоящим изобретением, обозначенная в целом номером позиции 220, и содержащая рычаг управления 31, который раздвоен на дистальном конце для обеспечения элементов управления 31А и 31 В, проксимальную винтовую спираль 221, функционально прикрепленную к элементу управления 31 А, и дистальную винтовую спираль 222, разнесенную в осевом направлении от проксимальной винтовой спирали и функционально присоединенную к элементу управления 31 В, который проходит через проксимальную винтовую спираль. Каждая винтовая спираль имеет чуть больше двух витков (спиралей) и, как правило, характеризуется конической формой с диаметром, увеличивающимся проксимально. Кроме того, максимальный диаметр проксимальной спирали dl приблизительно в три раза больше максимального диаметра дистальной спирали d2, а шаг дистальной винтовой спирали pi приблизительно в два раза больше, чем у проксимальной винтовой спирали р2.
На фиг.51А показана головка для денудации вен, образующая часть устройства в соответствии с настоящим изобретением, обозначенная в целом номером позиции 230, и содержащая рычаг управления 31, который раздвоен на дистальном конце для обеспечения элементов управления 31А и 31 В, проксимальную винтовую спираль 231, функционально прикрепленную к элементу управления 31 А, и дистальную винтовую спираль 232, разнесенную в осевом направлении от проксимальной винтовой спирали и функциональную присоединенную к элементу управления 31 В, который проходит через часть проксимальной винтовой спирали. Каждая винтовая спираль имеет чуть более двух витков (спиралей) и, как правило, характеризуется конической формой с диаметром, увеличивающимся проксимально. Кроме того, максимальный диаметр проксимальной спирали составляет приблизительно одну треть от максимального диаметра дистальной спирали, а шаг дистальной винтовой спирали приблизительно вдвое меньше, чем у проксимальной винтовой спирали.
Ссылаясь на фиг.61 А, когда спираль развернута и соприкасается с внутренней поверхностью просвета сосуда, между устройством и стенкой сосуда возникает статическое трение. В состоянии покоя в точках контакта спирали (FC) действует радиальная сила, направленная наружу, которая пропорциональна жесткости и диаметру спирали и диаметру сосуда. Это уравновешивается силой сужения сосуда Р. Когда пользователь извлекает устройство, осевая сила FA увеличивается, чтобы преодолеть статическое трение. В системах скольжения между твердыми объектами сила трения пропорциональна контактной силе загрузки (FC) и шероховатости поверхности, описываемой законом трения Амонтона. Также было показано, что площадь контактной поверхности является фактором, увеличивающим трение [11].
В идеале по мере увеличения осевой силы (FA) трение покоя преодолевается до того, как спираль начнет удлиняться. Статическое трение в венах и артериях, как правило, низкое из-за наличия гелеобразного слоя гликокаликса, который, как было показано, снижает статическое трение [12]. Когда сила сужения сосуда увеличивается, как при веноспазме, требуется большая осевая сила, которая приводит к удлинению спирали, при этом сохраняя контакт со стенкой сосуда из-за ее упругой деформируемости, как показано на фиг.61 В. Осевая сила, необходимая для удлинения спирали, пропорциональна жесткости проволоки, а также зависит от профиля проволоки (плоский или круглый).
В некоторых случаях, как показано на фиг.61С, на устройство действует значительная сила сужения из-за чрезмерного веноспазма или естественного препятствия из-за венозных клапанов. В этой ситуации повышенная сила сужения, как правило, сосредоточена на дистальной части спирали. По мере дальнейшего увеличения осевой силы спираль уменьшает свой диаметр настолько, чтобы потерять контакт со стенкой сосуда, как показано на фиг.61С. Это значительно снижает статическое трение и может сузить дистальный конец, чтобы позволить ему преодолеть статическое трение и/или препятствие. Когда это происходит, спираль перепрыгивает или пропускает в проксимальном направлении во время повторного скручивания, принимая свою естественную конфигурацию. Это может привести к тому, что мелкие участки стенки вены будут пропущены абразивной поверхностью. В некоторых случаях, например, при прохождении через очень узкие сужения или венозные клапаны, желательна некоторая деформация спирали, вызывающая потерю контакта, чтобы позволить спирали уменьшить статическое трение до того, как осевая сила станет слишком большой, чтобы вызвать повреждение стенки сосуда или экстракцию вены. Экстракция вены происходит, когда дистальный конец внутрипросветного устройства действует как якорь для передачи осевых сил, которые достаточно велики, чтобы соскоблить или удалить весь сегмент вены из окружающей ткани. Это было документально подтверждено предыдущими устройствами для абляции вен, которые имели недеформируемую, менее эластичную конструкцию и вызывали у пациента значительную боль и синяки, а также усложняли процедуру [6].
Чтобы преодолеть чрезмерное удлинение спирали и результирующий пропуск, переменные, связанные со статическим трением и деформируемостью спирали, могут быть изменены путем изменения толщины, формы, диаметра и/или жесткости элемента устройства. Шероховатость поверхности должна оставаться постоянной для достижения достаточной механической абляции.
Использование других конфигураций спиралей также может ограничить эффект пропуска на эндотелиальном покрытии. Такие варианты осуществления устройства показаны на фиг.42-51. Фиг. 45 и 46 содержат соединительный сегмент (174, 184), который может предотвращать чрезмерное удлинение всей спирали. На фиг.48 показан соединительный сегмент между спиралями с противоположной конфигурацией по часовой стрелке и против часовой стрелки, чтобы противостоять чрезмерному удлинению. На фиг.49-51 показаны отдельные элементы спирали для обеспечения покрытия, если любой из элементов спирали подвергнется чрезмерному статическому трению и потеряет контакт во время удлинения.
Обращаясь к фиг.63, согласно другому варианту осуществления существует вариант с одной плоской проволокой. Эта плоская проволока изготовлена из нитинола. Наружная поверхность этой проволоки текстурирована (имеет шероховатость) с использованием процесса накатки, при котором форма вдавливается в проволоку, аналогичным образом текстура может быть нанесена другими способами, например, штамповкой или микрообработкой. Это создает абразивные частицы в проволоке. На фиг. 37А показан рисунок ромбовидной накатки, вдавленной в нитиноловую проволоку. Наружная поверхность проволоки также может быть подвергнута дробеструйной очистке для создания на проволоке микроабразивной поверхности. Эта плоская проволока впоследствии удерживается в приспособлении для термофиксации и формирует спиральный профиль. Винтовая спираль с ее абразивной внешней поверхностью выполнена с возможностью срезать внутреннюю выстилку вены (в первую очередь, но не ограничиваясь этим слоем эндотелиальных клеток), когда винтовая спираль перемещается в осевом направлении вдоль вены в развернутой конфигурации.
Заболевание вен
Устройство и способ по настоящему изобретению можно применять для лечения или профилактики заболеваний вен. Сочетание недостаточности клапана вены и слабости стенки вены приводит к рефлюксу крови с последующими осложнениями скопления крови в нижних конечностях. Целью лечения поверхностного венозного рефлюкса является удаление или перекрытие рефлюксной вены, позволяя крови отводиться к здоровым венам и эффективно циркулировать обратно к сердцу. Большая подкожная вена (GSV) представляет собой самую длинную вену в организме, которая чаще всего подвергается лечению при венозном рефлюксе. Этот путь проходит от стопы к паховой области, где он соединяется с глубокой бедренной веной. GSV чаще всего является причиной венозного рефлюкса. Другие вены включают в себя малую подкожную вену (SSV), переднюю добавочную подкожную вену (AASV) и многочисленные притоки, которые также могут быть мишенями лечения.
Венозная сеть нижних конечностей делится на три компонента: 1) поверхностные вены, расположенные в поверхностном отделе, поверхностном по отношению к мышечной фасции, дренирующие кожу и подкожную ткань 2) глубокие вены, лежащие глубоко в мышечной фасции и дренирующие мышцы нижней конечности, и 3) перфорантные вены, которые проникают в мышечную фасцию и соединяют поверхностные и глубокие вены.
Понимание фасциальных слоев и отделов ноги, в которых расположены эти вены, важно для понимания рисков, связанных с текущими подходами к лечению. У людей с нормальным телосложением GSV, как правило, проходит близко к коже на глубине от 2 до 5 см. Она ограничена от голени до паха в замкнутом фасциальном пространстве мышечной фасцией под ней и подкожной фасцией вверху. Последняя является частью мембранного слоя подкожной клетчатки. Два фасциальных слоя, включая в себя подкожную фасцию вверху и мышечную фасцию внизу, сливаются на каждом конце, образуя замкнутое пространство, которое называется подкожным отделом. Подкожный отдел содержит подкожную вену и сопутствующие артерии и нервы. Подкожный нерв, как правило, находится далеко от большой подкожной вены (GSV), а не в подкожной фасции выше колена. Однако подкожный нерв находится в непосредственной близости от GSV и находится в подкожной фасции ниже колена. Единственная туловищная вена, расположенная в подкожном отделе, представляет собой GSV или ее дубликат. Все венозные ветви и добавочные вены расположены в подкожном отделе, снаружи от подкожной фасции и подкожного отдела.
Сегментарная гипоплазия GSV встречается у 25% пациентов с заболеванием поверхностных вен [13]. Этот гипопластический сегмент бедра часто перекрывается добавочной веной, которая выходит за пределы подкожной вены ближе к коже. Если эта или любая другая часть GSV проходит в непосредственной близости от кожи, может быть трудно создать плоскость тумесцентной анестезии вокруг вены для защиты кожи при подготовке к термальному лечению венозного заболевания. В некоторых случаях могут быть выполнены только нетермические способы или удаление вены. Венозные ветви бедра выходят за пределы подкожной вены и могут стать варикозными при развитии рефлюкса. Они также менее поддаются термической обработке из-за их более поверхностного расположения. Две основные входные вены бедра - это передняя и задняя огибающие бедренную кость вены. Передняя добавочная подкожная вена бедра проходит в подкожном отделе параллельно GSV, но не является последовательной и присутствует приблизительно у 14% пациентов с варикозным расширением вен. Малая подкожная вена (SSV) начинается на латеральной лодыжке и впадает в глубокую вену в подколенной области за коленом. Она находится рядом с икроножным нервом, который уязвим для термических повреждений [14]. Фасциальные отношения SSV более устойчивы, чем GSV.
Перфорантные вены соединяют поверхностные вены с глубокими венами, проникая в мышечную фасцию. В нижней конечности имеется до 150 перфорантных вен различного размера и распределения. Медиальные перфораторы голени являются наиболее клинически значимыми и могут привести к высокоскоростному кровотоку в поверхностную систему и венозной гипертензии. Их трудно лечить хирургическими, термическими, клеевыми и/или склерозирующими способами из-за их небольшой длины и непосредственной близости к системе глубоких вен. Непреднамеренное распространение тепла, клея или химического склерозанта непосредственно в глубокую венозную систему может привести к DVT и последующей РЕ, потенциально фатальному осложнению. Открытая хирургическая перевязка технически сложна и приводит к значительным осложнениям из-за разреза. Соединение GSV и SSV с глубокими бедренными венами в паховой области и задней части колена, соответственно, также является точками соединения между поверхностной и глубокой системами, и лечение несостоятельной поверхностной вены вблизи этих областей сопряжено с риском тромбоэмболических осложнений.
Ввиду этих анатомических соображений применение термической энергии ограничено из-за неотъемлемого риска повреждения прилегающей кожи и нервов. Кроме того, прямое распространение термической энергии в нецелевые ткани в системе глубоких вен является потенциальной причиной DVT и последующей РЕ. Существующие нетермические способы также ограничены риском повреждения соседних нецелевых тканей. Цианоакрилатный клей может случайно попасть в глубокую венозную систему без возможности его извлечения или повторного захвата. Химические склерозанты по своей природе эффективно циркулируют в глубоких венах по мере их поступления от целевого участка. Пенные склерозирующие препараты могут распространяться в слипшихся эмульсиях склерозанта и воздуха, попадая в глубокую венозную систему, потенциально повреждая эндотелий и приводя к DVT. Химические склерозанты также могут быть случайно введены в подкожную ткань, нервы или артерии, вызывая значительный некроз кожи.
Чтобы противодействовать этим ограничениям, эффективное нетермальное устройство должно иметь возможность аккуратного и точного развертывания с использованием стандартных ультразвуковых способов. Также должна быть возможность извлечь и повторно захватить устройство, если оно было неправильно расположено до воздействия. Ни одно из продаваемых в настоящее время устройств не имеет такой двойной возможности.
Для лечения венозного рефлюкса нижних конечностей предпочтительным является механическое устройство абляции, которое может быть точно развернуто в целевом участке без риска неконтролируемого распространения вперед или повреждения окружающих тканей. Возможность повторного захвата и изменения положения еще больше снижает риск ошибки, связанной с пользователем.
Предлагаемый способ окклюзии вены без применения постоянного имплантата или токсического средства является предпочтительным, поскольку он позволяет избежать риска инфекции, иммунной воспалительной реакции, неврологических побочных эффектов, миграции дебриса, вторичного к механическому износу имплантата, и дискомфорта пациента из-за объемного воздействия.
Способы биорассасывающейся имплантации ранее также не обеспечивали долговременную венозную окклюзию с ре канализацией после абсорбции [15].
Неожиданно авторы обнаружили, что при применении чисто механического не имплантируемо го раствора естественная тромботическая окклюзия действует как «имплантат» и преобразуется естественными механизмами заживления полости организма в постоянную окклюзию в процессе, известном как фиброзная трансформация тромба.
В дополнение к способу окклюзии GSV, SSV, AASV или крупной поверхностной венозной сети предлагается способ лечения некомпетентных венозных ветвей меньшей длины, которая обычно находятся ниже колена. В настоящее время они лечатся процедурой, известной как флебэктомия. Она включает в себя нанесение ножевого разреза на коже под местной анестезией и использование крючка для вены для ручного извлечения короткого сегмента вены. Эта процедура часто выполняется на нескольких сегментах вен на ноге. Это может быть болезненным и неудобным для пациентов из-за необходимости многократных инъекций местного анестетика иглой и трудностей с полной анестезией каждого сегмента вены. Часто из-за неприемлемого дискомфорта пациента или предпочтений врача вместо него используется химический склерозант. Увеличение количества инъекций химического склерозанта может увеличить риск системных токсических побочных эффектов и местных осложнений, включая в себя некроз кожи из-за случайного введения склерозанта в подкожную ткань или артериальную систему.
Согласно одному варианту осуществления способ лечения малых венозных ветвей выполняется с помощью миниатюрной винтовой спирали, как показано на фиг.66 и 67. Механизм действия, обеспечиваемый этим вариантом осуществления, такой же, как ранее описанный для лечения крупных вен, таких как GSV. После введения в целевую вену миниатюрная спираль с абразивной внешней поверхностью развертывается, оказывая радиальную силу на стенку вены. Эта поверхность денудирует внутренний слой при извлечении.
Ссылаясь на фиг.65, согласно одному варианту осуществления винтовая спираль загружена вокруг иглы как часть внутривенной канюли. Изменение текущего расположения внутривенной канюли 14G для уменьшения размера иглы, используемой для ввода в вену при сохранении внешнего диаметра оболочки на уровне 2,1 мм, позволяет разместить винтовую спираль, как показано на фиг.65. Создание более конического наконечника с наружным катетером из полиуретана обеспечивает доступ к коже. Используя современные способы внутривенного доступа, такие как доступ к вене, извлечение иглы и продвижение канюль осуществляется, как показано на фиг.67. Миниатюрный участок спирали может быть развернут путем частичного извлечения наружных полиуретановых канюль (фиг.66). При достижении конца зоны воздействия внешнюю канюлю можно использовать для повторного захвата и атравматического удаления спирали. Этот предложенный способ снижает потребность в местной анестезии, поскольку не требуются разрезы кожи и не требуется никакого вытяжения вены для удаления вены, как при процедурах флебэктомии с крючком. Также не требуется химический склерозант, снижающий связанный с этим риск некроза кожи.
Как показано на фиг.68, согласно другому варианту осуществления доступ к вене осуществляется с помощью иглы малого калибра, и в вену пропускается проволочный направитель. Внешняя оболочка, аналогичная оболочке интродьюсера, проходит по проволочному направителю, как показано на фиг.69. Эта внешняя оболочка изготовлена так, чтобы удерживать спираль, прикрепленную к ее внутренней выстилке, чуть ниже отверстия на наконечнике. Это позволяет проволочному направителю проходить через спираль внутри интродьюсера. Затем спираль развертывается путем частичного извлечения внешней оболочки, фиг.68. Согласно другому варианту осуществления спираль развертывается с помощью отрывающейся оболочки интродьюсера, как показано на фиг.70. Согласно одному варианту осуществления спираль может быть повторно загружена в оболочку и использована по отдельным венам.
Далее следует описание некоторых показаний, связанных с просветом полости организма, которые можно лечить с помощью устройства и способов по настоящему изобретению:
Рефлюкс тазовых вен
Было показано, что аномальный рефлюкс крови в тазовых венах является важной, но часто ранее нераспознанной причиной рецидивирующего варикозного расширения вен на ногах, варикозного расширения вен вульвы/влагалища и состояния, известного как синдром тазового венозного застоя (PCS). Также считается, что это связано с геморроем. Рефлюкс во внутренних подвздошных и яичниковых венах у женщин, как правило, ответственен за развитие этих состояний.
PCS характеризуется видимым застоем в венах малого таза при венографии у женщин с хронической тазовой болью в течение более шести месяцев. Чаще всего причиной рефлюкса и варикозного расширения вен таза является левая яичниковая вена. Заболеваемость, связанная с PCS, может быть серьезной, что приводит к значительному снижению качества жизни и дискомфорту пациента. PCS проявляется различными внутритазовыми симптомами, включая в себя нециклическую боль, частое мочеиспускание и диспареунию. Текущее лечение, как правило, выполняется с использованием катетерного доступа через яремную или бедренную вену, после чего яичниковые вены и/или внутренние подвздошные вены окклюзируются с использованием металлических спиралей для эмболизации, химических склерозантов, таких как 3% тетрадецилсульфат натрия (STS), или их комбинации. Недостатки эмболизации проволочной спиралью включают в себя высокую стоимость лечения, связанного с применением спиральных устройств, и риск осложнений, включая в себя миграцию спирали и разрыв вены. Миграция спирали происходит, когда спирали непреднамеренно перемещаются к нецелевым участкам, таким как почечная вена, или через нижнюю полую вену к легочным венам, вызывая тромбоэмболию легочной артерии. Сообщалось, что миграция спирали происходит в 4% случаев и может привести к значительной заболеваемости [16]. Некоторые пациенты сообщают о постоянном дискомфорте в области таза или гриппоподобных симптомах, причина которых неизвестна, но может быть связана со спиральными имплантатами. Использование эндотермического лазера или радиочастотной абляции вен не было принято для лечения венозной недостаточности малого таза. Это в первую очередь связано с риском термического повреждения важных окружающих структур таза, прилегающих к стенке сосуда. Хотя перфорация трансмурального сосуда и повреждение окружающих тканей при эндотермических способах случаются редко, последствия во время лечения в тазу намного сильнее, чем в нижних конечностях. Кроме того, во время лечения вокруг вен нижних конечностей вводят большие объемы тумесцентной анестезии, чтобы защитить окружающие ткани и предотвратить термическое повреждение и боль. Очевидно, что в тазу это невозможно. Соответственно, для лечения рефлюкса тазовой вены путем окклюзии все еще требуется безопасное и экономичное устройство. Оптимальное решение будет предоставлено не имплантируемым нетермическим способом для снижения этих рисков.
Согласно одному аспекту способ по настоящему изобретению может быть применен для лечения рефлюкса тазовых вен, при котором устройство винтовая спираль используется для механической денудации внутренней подвздошной и/или яичниковой вены, чтобы вызвать постоянную окклюзию. Эта окклюзия предотвратит венозный рефлюкс в вены ног, который вызывает рецидив варикозного расширения вен, венозных территорий, снабжающих влагалище/вульву, и венозных территорий, вовлеченных в PCS. Согласно другому варианту осуществления процедура денудации может быть объединена с временной окклюзией баллонным катетером для уменьшения кровотока и содействия прилипанию тромба к обработанному участку вены. Это может быть особенно применимо для вен таза с более высоким объемом и скоростью рефлюкса. Согласно одному варианту осуществления процедура может быть улучшена за счет комбинированного применения химического склерозанта и/или эмболизирующих частиц. На фиг.71 схематически показана анатомия вен, связанная с рефлюксом вены таза и использованием винтовой спирали для денудации внутренних подвздошных вен и предотвращения обратного потока к вовлеченным венозным территориям, таким образом, излечивая симптомы. Рефлюкс глубоких вен
Рефлюкс глубоких вен, вызванный некомпетентными венозными клапанами, затрагивающими бедренную вену в нижней конечности, нельзя лечить абляцией и окклюзией, поскольку он жизненно важен для циркуляции крови от конечности к сердцу. Некоторые некомпетентные венозные клапаны были облитерированы из-за DVT, но у других сохранились нормальные створки клапана, но из-за слабости стенки они больше не противостоят правильно, чтобы предотвратить рефлюкс. Современные способы лечения предусматривают инвазивные хирургические процедуры для создания новых клапанов. Соответственно, существует необходимость в менее инвазивной процедуре для восстановления функции венозного клапана. Согласно одному аспекту способ по настоящему изобретению может быть применен для лечения рефлюкса глубоких вен, при котором устройство винтовая спираль развертывается и выводится через существующий клапан. Наружная поверхность слегка абразивна, чтобы снизить риск тромботической окклюзии, сохраняя при этом способность разрушать эндотелиальный слой. Это вызывает гипертрофию створок клапана и окружающей ткани с эффектом сближения створок клапана и восстановления функции одностороннего клапана для предотвращения рефлюкса.
Геморрой
Как упоминалось ранее, геморрой можно лечить с помощью эмболизации тазовых вен. Новые способы также нацелены на специфическую окклюзию верхней ректальной артерии, чтобы предотвратить заполнение расширенного венозного сплетения, вызывающее внутренний геморрой [17]. Диаметр этой артерии в большинстве случаев составляет от 3 до 5 мм. Чтобы избежать установки постоянного имплантата и предложить более экономичное решение для этого распространенного состояния, необходимы улучшенные способы лечения. Согласно одному аспекту способ по настоящему изобретению предназначен для лечения геморроя, при котором используется устройство винтовая спираль для механического денудации верхней ректальной артерии, чтобы вызвать постоянную окклюзию и предотвратить наполнение венозного сплетения, таким образом, излечивая состояние.
Варикоцеле
Варикоцеле представляет собой аномальное расширение вен, окружающих яички у мужчин. Клинически значимое варикоцеле встречается почти у 15% взрослых мужчин, что приводит к боли, дискомфорту и снижению фертильности. Лечение рекомендуется молодым мужчинам с атрофией яичек или пониженной фертильностью. Текущее лечение включает в себя окклюзию тестикулярной вены, которая снабжает аномально расширенные вены вокруг яичек. Современные способы окклюзии предусматривают эмболизацию постоянной спиралью, использование клея, химического склерозирующего средства или комбинацию способов. Соответственно, менее инвазивный и более экономичный способ по-прежнему необходим для окклюзии тестикулярной вены, которая снабжает расширенные вены при варикоцеле. Согласно одному аспекту для лечения варикоцеле можно использовать способ по настоящему изобретению, при котором винтовую спираль одноразового использования применяют для механической денудации тестикулярной вены, чтобы вызвать постоянную окклюзию. Фиг. 55 представляет собой схематическое изображение венозной анатомии и связанной с ней процедуры для постоянной окклюзии вены.
Окклюзия воротной вены
Предоперационная эмболизация воротной вены (PVE) представляет собой плановую процедуру для прекращения кровотока в воротной вене в выбранной части печени перед большой резекцией печени. PVE вызывает гипертрофию ткани печени, которая должна остаться после запланированной обширной резекции, и может позволить провести более агрессивную резекцию. Она применяется в качестве дополнительной стадии при лечении первичных и вторичных метастазов в печень колоректального рака. Современные способы предусматривают доступ к портальной венозной системе с использованием прямого чреспеченочного доступа под контролем визуализации с последующей инъекцией эмболизирующих средств, включающих в себя клей, поливиниловый спирт (PVA) и металлические сферы или спирали. Многие из этих способов являются дорогостоящими, и пациент может оказаться неоперабельным во время курса, предшествующего запланированной резекции. Соответственно, требуется более экономичный подход. В связи с прокоагуляционным состоянием большинства пациентов, подвергающихся процедурам на воротной вене в качестве дополнения к резекции опухоли, может оказаться эффективным неимплантационный способ, основанный на тромботической окклюзии выбранных воротных вен. Согласно одному аспекту предложен способ по настоящему изобретению для предоперационной окклюзии воротных вен, при котором используется устройство винтовая спираль для механической денудации воротных вен с целью вызвать окклюзию. Эта окклюзия будет способствовать гипертрофии оставшихся сегментов печени и повысит вероятность выживания пациента после плановой резекции. Фиг. 53А представляет собой схематическое изображение окклюзии воротной вены с использованием неимплантационного способа механической денудации.
Трансплантаты вен
Операция по аортокоронарному шунтированию (CABG) представляет собой стандарт лечения пациентов с заболеванием главной левой коронарной артерии (CAD) и трехсосудистой CAD. Операция по обходному шунтированию периферической артерии (PABG) выполняется пациентам с поздней стадией окклюзионного поражения периферических артерий. Внутренняя артерия молочной железы, как правило, используется для реваскуляризации при коронарном шунтировании, однако вены (почти исключительно большая подкожная вена) остаются наиболее часто используемыми трансплантатами, особенно при операции PABG. Включение венозных трансплантатов в артериальную систему подвергает вену воздействию более высоких сил растяжения и напряжения сдвига, что может привести к чрезмерным воспалительным изменениям в венозной стенке, известным как гиперплазия интимы, что приводит к окклюзии и отказу венозного трансплантата. Проходимость через 10 лет после операции по пересадке вен составляет всего 60% [18]. Непонятно, почему одни трансплантаты вен остаются открытыми, а другие остаются закупоренными в долгосрочной перспективе. Все вены претерпевают некоторое ремоделирование или «артериализацию» при передаче в артериальную систему. Однако чрезмерная и стойкая воспалительная реакция в долгосрочной перспективе вызывает отказ трансплантата. Новое исследование показывает, что состояние вены до пересадки может быть важным предиктором несостоятельности трансплантата. Вены с уже гипертрофированными синтетическими предрасположенными гладкомышечными клетками в медиальном слое имеют худший прогноз. Соответственно, способ увеличения долгосрочных показателей успешности венозных трансплантатов при артериальных заболеваниях является важной клинической потребностью и может быть достигнут путем предварительного кондиционирования или модификации венозного трансплантата перед его применением в качестве канала в артериальной системе. Согласно одному аспекту настоящего изобретения предложен способ предварительной обработки вен, которые будут применяться в качестве трансплантатов в артериальной системе для лечения CAD и PAD. Винтовая спираль с менее абразивной поверхностью или частично абразивной поверхностью обеспечивает утолщение стенки вены без полной тромботической окклюзии и последующего фиброза. Глубина разрушения стенки вены должна быть специфической для развития правильного воспалительного ответа, который не предрасполагает вену к отказу трансплантата. Эта дополнительная процедура в идеале выполняется за 4 12 недель до имплантации трансплантата, чтобы позволить клеточным изменениям, участвующим в ремоделировании вен, произойти и исчезнуть. Это может улучшить способность вены адаптироваться к артериальной среде с большим давлением и более высокими силами сдвига, потому что воспалительные изменения уже произошли и прекратились после однократного механического разрушения в результате воздействия. В этом случае вероятность возникновения неконтролируемых чрезмерных воспалительных и гипертрофических изменений при введении в артериальную систему будет ниже. Это может предотвратить чрезмерную неконтролируемую гипертрофию среднего слоя и гиперплазию интимы и снизить риск образования настенной атеромы, которая является основной причиной недостаточности сердечного трансплантата. На фиг.72 показаны гистологические различия между нормальной веной, артериализированной веной и неудачным венозным трансплантатом. Атериовенозная (AV) фистула
AV фистула представляет собой хирургически созданный анастомоз между артериальным и венозным кровотоком, позволяющий лечить терминальную стадию болезни почек (ESKD) с помощью диализа. Пациенты с работающей AVF имеют более низкие показатели заболеваемости и смертности, а также более низкие затраты на лечение по сравнению с пациентами, которым для диализа используются центральные венозные катетеры. При создании AVF от 20 до 60% наблюдается неприемлемо высокий уровень первичного отказа. Частота неудач увеличилась в последние годы из-за старения населения, зависящего от AVF для диализа и более высоких скоростей насосов, используемых при диализе [19].
Основная причина неудач заключается в стенозе венозного сегмента анастомоза. Основные механизмы, участвующие в создании AVF, плохо изучены, но предполагается, что в этом участвуют недостаточное внешнее ремоделирование и чрезмерная гиперплазия интимы. Соответственно, срочно необходим улучшенный способ формирования AVF для применения у пациентов с ESKD. Согласно одному аспекту настоящего изобретения винтовая спираль с уменьшенной абразивностью или частично абразивная используется перед операцией для создания анастомоза для получения вены со здоровым рисунком ремоделирования. В идеале эту процедуру следует выполнять за 4-12 недель до создания AVF, чтобы позволить клеточным изменениям произойти и исчезнуть. Это предварительное кондиционирование вены может снизить воспалительную реакцию и неконтролируемое ремоделирование, которое приводит к первичной недостаточности AVF, когда нормальная вена подвергается острому воздействию артериального давления и скорости кровотока. Это может увеличить вероятность успеха процедур AVF. Этот способ может также предотвратить синдром обкрадывания AVF, при котором венозная сторона анастомоза становится чрезмерно увеличенной и приводит к ишемии на территориях, снабжаемых артериальной стороной.
Тромбэктомия
Тромботические окклюзии могут возникать в любом месте артериальной или венозной системы и, как правило, состоят из эритроцитов, активированных факторов свертывания крови, тромбоцитов и воспалительных клеток. Со временем от нескольких минут до нескольких дней тромботическая масса становится организованной и прилипает к стенке сосуда, особенно если имеется повреждение стенки сосуда. Ранее описанные варианты осуществления настоящего изобретения были разработаны, чтобы способствовать этому событию, когда требуется окклюзия сосуда, в первую очередь в условиях поверхностного венозного рефлюкса.
Авторы также обнаружили, что расширяющуюся в радиальном направлении винтовую спираль можно также применять для удаления тромба, прилипшего к стенке сосуда, если абразивная поверхность модифицирована так, чтобы она присутствовала только на передней кромке и внутренней поверхности спирали, в то время как внешняя поверхность остается гладкой, чтобы предотвратить травму стенки вены.
Острый тромбоз глубоких вен (DVT) представляет собой потенциально опасное для жизни состояние, если происходит эмболизация легких, известная как легочная эмболия (РЕ). Значительно большие DVT, остающиеся в периферических венах, также могут привести к серьезным осложнениям от хронической венозной гипертензии в нижних конечностях. Антикоагулянты представляют собой краеугольный камень лечения, помогающий растворять сгустки и предотвращать эмболизацию. За последние 10 лет появились новые способы лечения пациентов в острых условиях путем удаления сгустка с помощью механического, химического лизиса или ультразвукового исследования, которые, как было показано, улучшают результаты у определенных групп пациентов. Удаление сгустка, приросшего к стенке вены, технически сложно, и неудача может привести к худшим результатам. Некоторые новые технологии, в которых используются сложные механические системы, аспирация или ультразвук, не возмещаются из-за их высокой стоимости. Катетер-баллон Фогарти представляет собой недорогую альтернативу удалению тромба, но он неэффективен для прилипших тромбов.
В артериальной системе существует аналогичная потребность в удалении организованного тромба, вызывающего острую ишемию конечностей. В нервно-сосудистой системе системы возврата стента используются для извлечения тромба и предотвращения инсульта. В обоих случаях более организованный, прикрепленный тромб представляет собой техническую проблему. Следовательно, существует необходимость в разработке улучшенных решений для удаления прилипшего сгустка или тромба на стенках сосудов. Согласно одному варианту осуществления предложен способ применения винтовой спирали с абразивной внутренней и передней поверхностями для смещения тромба со стенки сосуда, не вызывая травмы эндотелия. На фиг.73 показано, как такое устройство может удалить тромб, оставляя при этом эндотелиальную поверхность нетронутой и с меньшей вероятностью повторного тромбоза. Устройство развертывается дистальнее тромботической окклюзии и извлекается проксимально по направлению к месту доступа. После смещения тромба для удаления тромба из кровообращения можно использовать катетер-баллон Фогарти, захватывающую корзину или аспирационный катетер. Это восстановит кровоток и предотвратит последствия окклюзии сосудов.
Окклюзия внутри стента
Чрескожное стентирование сосудистой сети, как правило, выполняется для восстановления кровотока в частично стенозированной или закупоренной артериальной или венозной циркуляции. Тромбоз внутри стента представляет собой относительно редкое, но потенциально опасное для жизни осложнение, возникающее приблизительно после 1% процедур сердечного стентирования. Стенты, помещенные в пораженные артерии, могут иметь каркасы, покрывающие кальцифицированные или атероматозные бляшки. Поднятые каркасы стента в этих ситуациях могут привести к нарушению покрытия неоинтимой, особенно в стентах с лекарственным покрытием [20]. Как правило, это проявляется в виде тромбоза стента с поздним или очень поздним началом в течение 1 года после имплантации. После таких процедур необходимо снизить частоту тромбоза стента. Согласно одному аспекту настоящего изобретения предусмотрена винтовая спираль с внешней абразивной поверхностью, которая покрывает часть окружности спирали. Это позволяет избирательно воздействовать на участок артериальной поверхности, который, вероятно, останется открытым после установки. На фиг.74 показан способ применения частичной абразивной спирали для выборочного предварительного воздействия на участок артерии перед установкой стента. Это увеличивает вероятность перекрытия каркаса стента неоинтимой и снижает риск позднего рестеноза стента. Технологии визуализации, такие как внутрисосудистое ультразвуковое исследование (IVUS), могут применяться для ориентации устройства и позволяют оператору выборочно нацеливаться на желаемый участок стенки сосуда.
Артериальная окклюзия
Избирательная окклюзия артерий и в целом артериальное кровоснабжение определенных тканей является эффективным способом лечения множества патологических состояний. Эмболизация опухоли представляет собой способ, при котором артерии, поставляющие доброкачественные или злокачественные опухоли, закупориваются с использованием различных способов через чрескожный доступ, включая в себя синтетические или биорассасывающиеся шарики, металлические сферы, клей или металлические спирали. Общие осложнения при применении этих средств включают в себя миграцию в нецелевые сосуды, чрезмерную окклюзию, вызывающую некроз нормальных тканей, боль, инфекцию, связанную с сочетанием инородного тела с некротической тканью [21]. Соответственно, существует потребность в менее инвазивном, не имплантируемом лечении с более низкой частотой осложнений при эмболизации артерий, поставляющих доброкачественные или злокачественные опухоли.
На фиг.52А и 52В показана опухоль 240 и артериальное кровоснабжение опухоли, содержащей небольшие артерии 241. Устройство по настоящему изобретению можно использовать для закупорки одной из мелких артерий и ограничения кровоснабжения опухоли. На фиг.52В показана головка 242 для денудации вены устройства по настоящему изобретению, показанная развернутой в небольшой артерии, где винтовая спираль по окружности входит в просвет артерии. Ссылаясь на фиг.52А, устройство продвигается вдоль артерии, питающей опухоль, и развертывается в точке 243, а затем втягивается проксимально. Втягивание винтовой спирали вдоль артерии в сочетании с контактом по окружности между шероховатой поверхностью винтовой спирали и просветом артерии приводит к денудации участка просвета артерии с удалением эпителиального слоя клеток и последующим образованием тромба в точке 243, приводящим к окклюзии артерии.
Фибромиомы матки
Фибромиомы матки представляют собой доброкачественные образования, которые могут вызвать сильную тазовую боль и дисменорею. Их можно лечить гистерэктомией или минимально инвазивной эмболизацией маточных артерий, кровоснабжающих фибромиому. Наиболее часто используемые эмболические средства для эмболизации маточной артерии (UAE) представляют собой поливиниловый спирт (PVA), микросферы трис-акрил-желатина и микросферы гидрогеля полизен-F. Осложнения включают в себя миграцию эмболического материала в ткани, не являющиеся мишенями, чрезмерный некроз, вызывающий боль и инфекцию. Соответственно, существует потребность в менее инвазивном, не имплантируемом лечении с более низкой частотой осложнений для лечения фибромиомы матки. Согласно одному варианту осуществления предложен способ применения винтовой спирали с абразивной внешней поверхностью для частичной или полной окклюзии маточной артерии или дистальных ветвей, снабжающих фибромиому матки. Уменьшение или устранение кровотока уменьшает размер и облегчает симптомы, вызванные фибромиомой. Вызов достаточного стеноза сосуда с помощью этого способа путем индукции гиперплазии интимы может снизить риск некротических осложнений, сохраняя эффект уменьшения размера фибромиомы. Этот способ также можно применять для лечения следующих состояний, которые включают в себя, без ограничения: артериовенозные мальформации (AVM) в легочном, мозговом или печеночном кровообращении, злокачественные опухоли, доброкачественную гипертрофию предстательной железы (в результате окклюзии предстательной артерии).
Открытое овальное отверстие
Открытое овальное отверстие (PFO) представляет собой частую аномалию сердечной стенки, обнаруживаемую приблизительно у 30% взрослого населения. Хотя, как правило, это доброкачественное обнаружение, в некоторых случаях PFO может открыться, позволяя парадоксальному эмболу перемещаться из венозного кровообращения в артериальное, что может вызвать инсульт и системную эмболизацию. Лечение пациентов с криптогенным инсультом в анамнезе заключается в чрескожном закрытии перегородки с помощью окклюдеров. Эти устройства представляют собой постоянные имплантаты, устанавливаемые поперек дефекта. Анатомия PFO включает в себя перекрытие первичной и вторичной перегородок предсердий, которые образуют лоскутный клапан, который может открываться, когда давление в правом предсердии превышает давление в левом предсердии, например, при кашле или чихании. Эти устройства дороги и могут вызвать осложнения, включая в себя тромбоз и инсульт. Существует потребность в менее инвазивном лечении с меньшим риском осложнений. Согласно одному варианту осуществления предложен способ применения абразивного устройства в форме спирали или обруча для денудации контактирующей поверхности вовлеченных лоскутов межпредсердной перегородки. Это приводит к воспалительной реакции, которая вызывает образование слипания между поверхностями лоскута, что приводит к окончательному закрытию PFO и устранению риска инсульта. Аналогичный способ можно применять в сердце для создания рубцовой ткани и утолщения, чтобы заблокировать нервную проводимость в точках аберрантной проводимости, которые вызывают аритмию.
Открытый артериальный проток
Артериальный проток (DA) представляет собой сосудистое соединение плода между основной легочной артерией и аортой, которое отводит кровь от легочного ложа.
После рождения DA претерпевает активное сужение и, в конечном итоге, облитерацию. Открытый артериальный проток (PDA) возникает, когда DA не может полностью закрыться в постнатальном периоде. Гистологически ткань протока отличается от ткани прилегающей аорты и легочной артерии. Интима протока более толстая, а его средний слой содержит больше гладких мышечных волокон, расположенных характерным спиральным образом. DA может принимать различные формы. Маленькие PDA, как правило, характеризуются диаметром <3 мм. Оптимальный способ лечения младенцев с PDA, требующим закрытия, остается предметом споров и дискуссий. Текущие варианты чрескожного лечения включают в себя спирали и устройства для окклюзии. Ограничения этого лечения включают в себя высокую стоимость и риск миграции спирали, вызывающей эмболические осложнения. Устройства для окклюзии могут привести к серьезным осложнениям, таким как коарктация аорты по мере роста ребенка, если их размер не определен правильно [22]. Соответственно, существует потребность в менее инвазивных эффективных чрескожных способах лечения PDA. Согласно одному варианту осуществления винтовая спираль с внешней абразивной поверхностью используется для денудации DA, вызывая тромбоз и фиброзную окклюзию с течением времени. Это облегчило бы симптомы, связанные с шунтированием, и снизило бы риск эндокардита за счет закрытия DA. Эту технику можно также применять для лечения дефектов межпредсердной перегородки малого диаметра аналогичным образом. Аневризмы аорты
Аневризмы брюшной аорты (AAA) представляют собой аномальные дилатации аорты, которые могут осложняться разрывом, вызывая значительную заболеваемость и смертность. Лечение аневризм больших размеров направлено на снижение риска разрыва. Варианты лечения заключаются в открытой операции с установкой трансплантата или эндоваскулярного восстановления аневризмы с использованием больших покрытых стент-графтов (EVAR). EVAR представляет собой менее инвазивную процедуру со значительно более быстрым временем восстановления и меньшим риском повреждения почек. Однако отдаленные результаты EVAR ограничены эндоподтеканиями у 20% пациентов, требующими радиологического мониторинга, повторной хирургии или дополнительных процедур [23]. Эндоподтекания можно классифицировать от типа I до типа V. Эндоподтекания типа I возникают на проксимальных или дистальных участках прикрепления трансплантата. Кровь попадает через щели между стенкой сосуда и трансплантатом и заполняет мешок, что приводит к риску разрыва. Эндоподтекания типа II возникают, когда в аневризматический мешок происходит ретроградный ток через боковые ответвления от поясничных или брыжеечных сосудов, что также приводит к риску разрыва. На эндоподтекания типа I и II приходится большая часть заболеваемости, связанной с послеоперационным течением EVAR. Современные способы лечения эндоподтеканий I типа включают в себя миниатюрные винты и установку дополнительных стент-графтов. Эндоподтекания типа II можно лечить с помощью эмболизационной спирали в поясничных или брыжеечных сосудах, снабжающих мешок. Все эти способы являются инвазивными, дорогостоящими и несут осложнения в виде разрыва стенки аорты и инфекции. Соответственно, существует потребность в способах снижения риска эндоподтекания типа I и типа II. Согласно одному варианту осуществления предложен способ подготовки участков аорты рядом с местами прикрепления трансплантата для снижения риска эндоподтекания типа I. Это выполняется с помощью винтовой спирали для денудации эндотелиальной выстилки в этих конкретных местах, местоположения которых можно легко определить на основе предоперационного планирования визуализации. Выполняя эту процедуру, артериальная стенка подвергается предварительному воздействию для развития пролиферации неоинтимы в месте прикрепления трансплантата и снижения риска утечки крови и эндоподтекания типа I. Это снизит риск дополнительных процедур, которые могут осложнить послеоперационный период. Аналогичный способ может быть использован для лечения эндоподтеканий типа I по мере их возникновения путем введения расширяемого упругого абразивного устройства в зазор, где происходит эндоподтекание, чтобы вызвать тромботическую окклюзию с фиброзной трансформацией с течением времени. Предложен еще один способ лечения эндоподтеканий типа II с использованием расширяющегося упругого абразивного элемента для денудации питающих поясничных или брыжеечных артерий, вызывая окклюзию и предотвращая риск разрыва мешка. Поскольку кровоток в этих артериях ретроградный от анастомотических соединений, они с большей вероятностью будут вести себя как вены и поддаваться тромботической окклюзии при постоянной имплантации спиралей. Аналогичный способ можно применять для лечения параклапанных подтеканий, связанных с чрескожной заменой сердечного клапана. Параклапанные подтекания после чрескожных процедур замены митрального и аортального клапанов приводят к послеоперационным осложнениям и в некоторых случаях к повторной операции.
Интервенционное лечение сахарного диабета
Шлифовка слизистой оболочки двенадцатиперстной кишки (DMR) представляет собой новый способ, который, как было показано в ранних клинических исследованиях, улучшает контроль уровня глюкозы в крови у пациентов с сахарным диабетом [24]. Двенадцатиперстная кишка является важным каналом для поглощения глюкозы и передачи сигналов эндокринным органам. Считается, что слизистая оболочка двенадцатиперстной кишки становится гиперпластической в ответ на хроническую диету с высоким содержанием сахара, что создает инсулинорезистентный сигнал, ухудшающий контроль глюкозы. Удаляя эту гиперпластическую слизистую оболочку, новая поверхность слизистой оболочки может регенерироваться без вредных сигналов.
Анатомия двенадцатиперстной кишки имеет некоторые важные характеристики с венозной системой. У нее извилистый изогнутый путь, она очень податлива и растяжима, а сокращение мышечной стенки может вызвать сужение. Целью лечения является безопасная абляция только поверхностного слоя слизистой оболочки, не затрагивая более глубокий мышечный слой ниже. Это выполняется на длине двенадцатиперстной кишки приблизительно 10 см.
Современные способы, находящиеся в разработке, предусматривают размещение расширяемого баллона, способного передавать гидротермальную энергию от жидкости внутри баллона к стенке двенадцатиперстной кишки и, таким образом, вызывать абляцию или повреждение клеток слизистой оболочки [22]. Этот способ требует, чтобы опытный эндоскопист создал термический барьер, оторвав слизистую оболочку от подслизистой. В настоящее время это достигается за счет отсасывающих каналов по окружности баллона для удержания поверхностного слоя слизистой оболочки, в то время как игла вводится под слизистую оболочку для введения физиологического раствора. При неправильном выполнении существует риск перфорации стенки двенадцатиперстной кишки и повреждения более глубокого мышечного слоя. Соответственно, существует потребность в менее инвазивном, более простом в исполнении, более дешевом и более быстром лечении, которое может выборочно удалять поверхностные слои двенадцатиперстной кишки на глубину не более чем 0,6 мм. Согласно одному варианту осуществления настоящего изобретения расширяющееся в радиальном направлении упруго деформируемое абразивное устройство доставляется через канал в стандартном эндоскопе, как показано на фиг.75. Абразивный элемент развертывается так, чтобы контактировать со стенкой двенадцатиперстной кишки в дистальном направлении вблизи соединения с тощей кишкой. Абразивный элемент содержит шероховатость поверхности с максимальным расстоянием от пика до впадины 0,6 мм. Аппарат извлекается проксимальнее желудка. Во время вывода он вызывает денудацию или повреждение по окружности слизистой оболочки. Это делает возможной регенерацию и улучшение контроля глюкозы. Аналогичный способ можно применять в других частях желудочно-кишечного тракта для лечения патологий, вызванных абсорбцией липидов, железа, витаминов и минералов, включая в себя марганец.
Избыточный бактериальный рост в тонкой кишке
Избыточный бактериальный рост в тонкой кишке (SIBO) происходит, когда тонкая кишка заселяется чрезмерным количеством микробов, которые обычно присутствуют в толстой кишке. Инвазивные бактериальные штаммы повреждают поверхность кишечника за счет выработки энтеротоксинов и непосредственного прилипания к стенке. Ферментация неабсорбированных углеводов вызывает раздувание, вздутие живота и метеоризм. Воспаление подвздошной кишки также может вызывать диарею и нарушение всасывания питательных веществ. Тонкая кишка (тощая кишка и двенадцатиперстная кишка), как правило, содержит значительно более низкие концентрации бактерий и других микроорганизмов по сравнению с толстой кишкой. Граница между этими отделами желудочно-кишечного тракта контролируется илеоцекальным клапаном. Когда этот клапан становится некомпетентным, он может вызвать рефлюкс содержимого толстой кишки в тонкую кишку. Это способствует чрезмерному росту бактерий, которые питаются богатым питательными веществами содержимым тонкой кишки [25]. В настоящее время в качестве первичного лечения используется лечение антибиотиками, чтобы остановить чрезмерный рост бактерий в тонкой кишке. Однако приблизительно у 40 процентов пациентов с избыточным бактериальным ростом в тонкой кишке (SIBO) после начального лечения антибиотиками наблюдаются стойкие симптомы. Было продемонстрировано, что патологический рефлюкс через илеоцекальный клапан является причинным фактором SIBO [25]. Соответственно, существует потребность в более эффективных способах лечения SIBO. Согласно одному варианту осуществления настоящего изобретения используется расширяющееся в радиальном направлении абразивное устройство для разрушения слизистых оболочек илеоцекального клапана и подвздошной кишки. Это вызывает воспалительную реакцию, за которой следует гиперплазия, которая может уменьшить диаметр илеоцекального клапана, что снижает вероятность рефлюкса жидкости из толстой кишки. Вторичный эффект может заключаться в удалении участков подвздошной кишки, колонизированных прилипшими бактериями, чтобы обеспечить регенерацию нормальной или неколонизированной слизистой оболочки. Этот способ можно применять в сочетании с антибактериальной терапией, чтобы усилить эффект и снизить частоту рецидивов. Аналогичный способ можно применять для сужения желудочно-пищеводного соединения, что может быть причиной желудочного рефлюкса при слабости сфинктера.
Пищевод Барретта
Пищевод Барретта (BE) представляет собой предраковое состояние карциномы пищевода, при котором клеточные изменения в нижнем отделе пищевода происходят из за хронического повреждения и воспаления из-за гастроэзфагеального рефлюксного заболевания (GORD). По оценкам, он присутствует у 10% пациентов с GORD. Раннее вмешательство может предотвратить развитие рака. Современные способы раннего вмешательства включают в себя термическую и радиочастотную абляцию пораженных поверхностных слоев для восстановления нормальной ткани [26]. Радиочастотная абляция представляет собой часто используемый в настоящее время способ, предусматривающий эндоскопическое введение радиочастотного зонда. Главный недостаток способа заключается в высокой стоимости радиочастотного устройства. Соответственно, существует потребность в более простых и эффективных способах лечения этого распространенного состояния. Согласно одному варианту осуществления предложен способ эндоскопического развертывания радиально расширяющегося абразивного элемента для механической абляции аномальных клеток в нижнем пищеводе, что снижает риск развития рака. Учитывая, что гистологическая классификация и окончательный диагноз пищевода Барретта является сложной задачей для патологов, еще одним преимуществом этого способа является то, что он позволяет собирать клетки на оголенной головке, которые могут быть проанализированы после процедуры. В этом отличие от термических способов, которые полностью разрушают клетки. Эта функция сбора клеток может также применяться для диагностики и лечения предраковых или злокачественных поражений в других частях желудочно-кишечного тракта, таких как толстая кишка, легочные бронхи и бронхиолы, матка, шейка матки, мочевыводящие пути и мочевой пузырь.
Лечение перианальных свищей
Перианальные свищи представляют собой аномальные соединения между прямой кишкой и кожей, окружающей анальный канал. Они присутствуют у пациентов с воспалительными заболеваниями кишечника и вызывают значительную заболеваемость из-за инфекции, боли и кровотечения. Их трудно лечить с помощью современных способов, предусматривающих инвазивную хирургическую резекцию или наложение сетонного шва для постепенного удаления канала в течение длительного курса лечения. Эти варианты лечения имеют высокую частоту рецидивов [27]. Соответственно, существует необходимость в разработке менее инвазивного и более эффективного лечения перианального свища. Согласно одному варианту осуществления предусмотрено расширяющееся в радиальном направлении абразивное устройство для развертывания и извлечения в свищевом тракте. Это вызывало денудацию тракта, выстланного эндотелиальными клетками. Последующая воспалительная реакция вызывает рубцевание и блокировку попадания фекального содержимого в тракт и препятствует заживлению.
Последующее закрытие тракта фиброзной воспалительной реакцией предотвращает симптомы. Аналогичный способ можно применять для герметизации или закрытия участков легкого при хронической обструктивной болезни легких. Когда вдыхаемый воздух попадает в эти части патологических легких, кислородный обмен не происходит, что приводит к снижению уровня кислорода в крови. В этих случаях необходимо закупорить или закрыть бронхиолы или альвеолы, чтобы отвести воздух к здоровой ткани легких.
Стерилизация
Женская стерилизация, как правило, выполняется путем перевязки маточных труб, когда пациентке требуется постоянная контрацепция. Современные способы варьируются от открытого хирургического лигирования, сальпингэктомии до минимально инвазивной установки зажима. Осложнения этих процедур включают в себя боль, кровотечение и инфекцию. Требуется менее инвазивный надежный способ, позволяющий избежать хирургической резекции или постоянной имплантации. Согласно одному варианту осуществления в фаллопиеву трубу вставляют, развертывают и извлекают радиально расширяющееся спиральное устройство. Это разрушает эндотелиальный и субэндотелиальный слои, инициируя воспалительную реакцию, вызывающую со временем фиброзную окклюзию маточной трубы. Этот способ также может быть применен к процедурам мужской стерилизации просвета семявыносящего протока.
На фиг.52-55 показано применение устройства по настоящему изобретению для закупорки различных сосудов при лечении заболевания у субъекта.
На фиг.53А и 53В проиллюстрировано применение устройства по настоящему изобретению для перекрытия системы воротной вены. Это воздействие может применяться для лечения рака печени путем окклюзии частей системы воротной вены, которые переносят питательные вещества из кишечника 254 в печень. На фигурах головка 252 для денудации сосуда показана в воротной вене 251 в развернутой конфигурации. Втягивание винтовой спирали вдоль вены в сочетании с контактом по окружности между шероховатой поверхностью винтовой спирали и просветом вены приводит к денудации участка просвета воротной вены с удалением эпителиального слоя клетки и последующее образование тромба, приводящее к окклюзии вены.
На фиг.54 показано применение устройства по настоящему изобретению для лечения артериовенозной мальформации, которая представляет собой аномальный клубок кровеносных сосудов 261, соединяющих венозный 262 и артериальный 263 кровеносные сосуды. Согласно проиллюстрированному варианту осуществления устройство по настоящему изобретению продвигается вдоль артерии к пороку, и винтовая спираль 264 вводится в круговой контакт с сосудом 261 и втягивается для денудации просвета сосуда, вызывая образование тромба и окклюзию сосуда 261, перекрывая тем самым шунт между артериальной и венозной системой крови.
На фиг.55 показано применение устройства по настоящему изобретению для лечения недостаточности семенных вен (или варикоцеле), которое представляет собой состояние, аналогичное варикозному расширению вен, которое возникает в венах мошонки 272 и которое может вызывать бесплодие, боль и дискомфорт для пациента. Согласно проиллюстрированному варианту осуществления устройство по настоящему изобретению продвигается вдоль левой внутренней семенной вены 270, а винтовая спираль 271 вводится в круговой контакт с веной 270 и смещается назад для денудации просвета сосуда, вызывая образование тромба и окклюзию сосуда 270, тем самым закупоривая вену и излечивая состояние.
На фиг.56А-56С показано применение устройства по настоящему изобретению и, в частности, способность устройства самостоятельно регулировать свой диаметр для адаптации к сосудам переменного диаметра. Спираль образована из нитинола и в расслабленном состоянии образует винтовую спираль, имеющую диаметр больше, чем подвергаемый воздействию сосуд. Когда спираль развертывается в сосуде (как правило, развертывается из катетера доставки), катетер расширяется, чтобы соответствовать окружности сосуда, оказывая направленную наружу радиальную силу на окружность сосуда по меньшей мере через один виток спирали. На фиг.56А показана развернутая винтовая спираль 280 в сосуде 281 в круговом контакте с просветом сосуда, приближающемся к суженной части 282 сосуда, при этом диаметр проксимальной части спирали саморегулируется в соответствии с меньшим диаметром сосуда. На фиг.56 В показана винтовая спираль 280, прошедшая через суженный участок 282 и поддерживающая круговой контакт с просветом сосуда непосредственно проксимальнее суженного участка. На фиг.53С показана винтовая спираль, движущаяся проксимально суженному участку и саморегулирующаяся для поддержания кругового контакта с просветом сосуда по мере его расширения.
На фиг.57А-57С показано применение устройства по настоящему изобретению, в частности, как винтовая спираль, образующая часть устройства по настоящему изобретению, может перемещаться через клапаны в венах, когда ее протягивают через участок вены: (А) развернутая винтовая спираль 290, прикрепленная к рычагу управления 31 и находящаяся в круговом контакте с просветом вены 291 дистальнее клапана 292; (В) винтовая спираль 290, которая втягивается проксимально, хотя клапан 292 с диаметром спирали саморегулируется, чтобы предотвратить зацепление спирали за створки клапана; и (С) винтовая спираль, перемещающаяся проксимальнее суженного участка и саморегулирующаяся, чтобы поддерживать круговой контакт с просветом сосуда проксимальнее клапана.
На фиг.58А-58В показано применение устройства по настоящему изобретению, в частности, как винтовая спираль, образующая часть устройства по настоящему изобретению, может саморегулироваться, чтобы перемещаться по участку сосудистой сети 300, который постепенно сужается с увеличением диаметра саморегулирующейся винтовой спирали 301 для поддержания кругового соприкосновения с просветом сосуда: (А) развернутая винтовая спираль 301 в круговом контакте с широким участком 302 сосуда; (В) развернутая винтовая спираль 301, находящаяся в круговом контакте с более узким участком 303 сосуда.
На фиг.59А-59С показано применение устройства по настоящему изобретению, в частности, как винтовая спираль, образующая часть устройства по настоящему изобретению, может самостоятельно адаптироваться к изменяющемуся диаметру сосуда и перемещаться по извилистому сосуду: (А) развернутая винтовая спираль 310 в круговом контакте с просветом сосуда на суженном участке 311 сосуда; (В) винтовая спираль 310 проходит через резкий поворот 312 в сосуде, сохраняя при этом круговой контакт с просветом сосуда; и (С) винтовая спираль 310 проходит через второй резкий поворот 313 в сосуде большего диаметра, сохраняя при этом круговой контакт с просветом сосуда. Из фигур видно, как винтовая спираль адаптируется к изменяющемуся диаметру сосуда и поддерживает круговой контакт с просветом сосуда, даже когда она проходит через извилистые повороты.
На фиг.60А и 60В показано применение устройства по настоящему изобретению, в частности, как винтовая спираль, образующая часть устройства согласно настоящему изобретению, может самостоятельно регулировать диаметр спирали для поддержания кругового соприкосновения с просветом сосуда, когда сосуд сужается из-за вазоспазма: (А) развернутая винтовая спираль в круговом контакте по длине 1 внутри широкого сосуда диаметром D перед вазоспазмом сосуда; участок А-А показывает осевой вид спирали внутри сосуда под давлением сужения Р, которое переводится как кольцевая сила (HF) внутри спирали. Эта HF вызывает удлинение спирали, чему способствует ее конструкция с открытым концом (В): развернутая винтовая спираль в круговом контакте на увеличенной длине L внутри суженного сосуда диаметром d во время вазоспазма сосуда.
На фиг.62А и 62В показано применение устройства по настоящему изобретению для частичного закупоривания просвета полости организма и согласно проиллюстрированному варианту осуществления для специального лечения сосудистой сети, имеющей аномально высокие объемы крови или высокие скорости кровотока, для частичного закупоривания сосуда для нормализации объема или кровотока. (А) показана легочная артерия 330 до воздействия устройством по настоящему изобретению, предусматривающим винтовую спираль 331, рычаг управления 31 и катетерный элемент 2, развернутый в артерии и вытянутый в направлении стрелки, обозначенной X; (В) показана легочная артерия 330 после воздействия устройством по настоящему изобретению с гиперплазией интимы 333, частично перекрывающей артерию для обеспечения уменьшенного объема крови и потока через артерию. Оценка стенки сосуда
Понимание биофизических свойств стенок сосудов в артериальной и венозной системе важно как для прогнозирования прогрессирования заболевания, так и для оценки ответа на лечение.
Аномалии сосудистого эндотелия в настоящее время рассматриваются как ранние предвестники сосудистых заболеваний [28]. Один из таких маркеров представляет собой то, насколько хорошо сосуд может сокращаться или спазмироваться в ответ на механические или химические стимулы. Хроническое высокое кровяное давление и/или хронически неконтролируемый уровень сахара в крови вызывают повреждение эндотелиального слоя и могут быть обнаружены на гораздо более ранней стадии, чем атеросклероз, артериальный стеноз или окклюзия. Ацетилхолиновый ионтофорез представляет собой способ тестирования эндотелиального ответа в сочетании с измерением кровотока в участке сосуда. Эти способы экспериментально показали, что функция эндотелия подавляется употреблением сахаросодержащих напитков и состояниями хронического высокого кровяного давления [29]. Во время хирургических вмешательств на сосудах в настоящее время нет способа оценить функцию эндотелиальных клеток в артерсклеротических поражениях или рядом с ними. Соответственно, существует потребность в сборе дополнительной информации о функции эндотелия, чтобы принимать решения по лечению и прогнозировать. Например, во время внутрисосудистой установки стента в настоящее время врачи не могут узнать, как стенка сосуда отвечает на расширение во время ангиопластики. Это может привести к осложнениям, включающим в себя разрыв сосуда, кровотечение и тромботическую окклюзию [30]. В настоящее время измеряется давление воздуха в надутом баллоне и накачивается до стандартных уровней на основе опыта и ангиографических данных после надувания. Однако из-за различий в характеристиках стенок сосудов и различий между пациентами возникновение осложнений, таких как разрыв стенки сосуда, по-прежнему трудно предсказать. Согласно одному варианту осуществления радиально расширяемый элемент, который контактирует со стенкой сосуда в дискретных удаленных точках, применяется для измерения ответа эндотелия на химические или механические раздражители. Механические стимулы могут быть вызваны радиальной силой самого устройства, которая может быть статической или изменяться с помощью рычага управления. Химические раздражители могут быть вызваны нанесением фармакологических средств на поверхность устройства. Согласно одному варианту осуществления пьезоэлектрические датчики встроены в радиальный расширительный элемент для измерения давления и воздействия потока на спираль во время внутрипросветных процедур. Расширяющийся элемент внутри просвета вены, производящий направленную наружу радиальную силу, вызовет кольцевую силу (HF) внутри стенки сосуда. Эта HF растяжения вызовет противодействующую кольцевую силу сжатия внутри просветного устройства. Таким образом, измерение собственной компрессии внутри устройства будет действовать как суррогатный маркер для характеристики ответа стенки сосуда на растяжение. Эти данные могут быть записаны и сохранены в центральном блоке управления. Эти данные могут применяться для повышения производительности в будущем, включая автоматизацию процедур в сосудистой системе. Эти данные также можно анализировать вручную или с помощью способов машинного обучения для определения прогноза и проверки диагностических маркеров сосудистых заболеваний.
Эквиваленты
Вышеприведенное описание подробно описывает предпочтительные в настоящее время варианты осуществления настоящего изобретения. Ожидается, что после рассмотрения этих описаний специалисты в настоящей области техники осуществят многочисленные модификации и вариации на практике. Подразумевается, что эти модификации и вариации охватываются прилагаемой формулой настоящего изобретения.
Ссылки
1. Evans CJ, et al. Prevalence of varicose veins and chronic venous insufficiency in men and women in the general population: Edinburgh Vein Study. J Epidemiol Community Health 1999.
2. O'Donnell TF, et al. Assessment of thrombotic adverse events and treatment patterns associated with varicose vein treatment J Vase Surg: Venous and Lym Dis 2015.
3. Proebstle T.M, et al. Endovenous treatment of the greater saphenous vein with a 940-nm diode laser. Thrombotic occlusion after endoluminal thermal damage by laser-generated steam bubbles. J Vase Surg 2005.
4. Ikponmwosa A, et al. The Impact of Different Concentrations of Sodium Tetradecyl Sulphate and Initial Balloon Denudation on Endothelial Cell Loss and Tunica Media Injury in a Model of Foam Sclerotherapy Eur J Vase Endovasc Surg 2010.
5. Boersma D, et al. Macroscopic and Histologic Analysis of Vessel Wall Reaction After Mechanochemical Endovenous Ablation Using the ClariVein ОС Device in an Animal Model. Eur J Vase Endovasc Surg 2016.
6. Lane TR, et al. Retrograde inversion stripping as a complication of the ClariVein® mechanochemical venous ablation procedure. Ann R Coll Surg Engl 2015.
7. Rice JB, et al. Burden of venous leg ulcers in the United States. Journal of Medical Economics 2014.
8. Gohel MS, et al. A Randomized Trial of Early Endovenous Ablation in Venous Ulceration. New Eng J Med 2018.
9. Kerver AL, et al. The surgical anatomy of the small saphenous vein and adjacent nerves in relation to endovenous thermal ablation. J Vase Surg 2012.
10. Whiteley M, et al. Media Damage Following Detergent Sclerotherapy Appears to be Secondary to the Induction of Inflammation and Apoptosis: An Immunohistochemical Study Elucidating Previous Histological Observations. Eur J Vase Endovasc Surg 2016.
11. Chen YM, et al. Study on the Sliding Friction of Endothelial Cells Cultured on Hydrogel and the Role of Glycocalyx on Friction Reduction. Advanced Engineering Materials 2010.
12. Dimitrievska S, et al. New functional tools for antithrombogenic activity assessment of live surface glycocalyx. Arterioscler Thromb Vase Biol. 2016.
13. Caggiati A, et al. Segmental hypoplasia of the great saphenous vein and varicose disease. Eur J Vase Endovasc Surg 2004.
14. Sanioglu S, et al. Mid-calf level as a puncture site is not safe enough for thermal ablation of the small saphenous vein. SAGE Open Medicine 2017.
15. Proebstle T.M, et al. A two-cohort feasibility study on polyglycolic acid yarn implantation for abolition of saphenous vein reflux. J Vase Surg: Venous and Lym Dis 2018.
16. Kwon SH, et al. Transcatheter ovarian vein embolization using coils for the treatment of pelvic congestion syndrome. Cardiovasc hitervent Radiol 2007.
17. Zakharchenko A, et al. Safety and efficacy of superior rectal artery embolization with particles and metallic coils for the treatment of hemorrhoids (Emborrhoid technique) Diagnostic and Interventional Imaging 2016.
18. Owens, C. D. Adaptive changes in autogenous vein grafts for arterial reconstruction: clinical implications. J. Vase. Surg. 2010.
19. Beathard GA, et al. Aggressive treatment of early fistula failure. Kidney International 2003.
20. Oyabu J, et al. Angioscopic evaluation of neointima coverage: sirolimus drug-eluting stent versus bare metal stent. Am Heart J. 2006.
21. Leyon JJ, et al. Endovascular Embolization: Review of Currently Available Embolization Agents. Curr Probl Diagn Radiol, January/February 2014.
22. Delaney JW, et al. Patent ductus arteriosus closure using the Amplatzer® vascular plug II for all anatomic variants. Catheter Cardiovasc Interv 2013.
23. Avgerinos ED, Chaer RA, Makaroun MS. Type II endoleaks. J Vase Surg 2014.
24. Haidry RJ, et al. Duodenal mucosal resurfacing: proof-of-concept, procedural development, and initial implementation in the clinical setting. Gastrointestinal Endoscopy 2019.
25. Roland ВС, et al. Low ileocecal valve pressure is significantly associated with small intestinal bacterial overgrowth (SIBO). Dig Dis Sci. 2014.
26. Akiyama J, et al. Managing Barrett's esophagus with radiofrequency ablation. Gastroenterology Report 1 2013.
27. Keogh KM, et al. The proposed use of radiofrequency ablation for the treatment of fistula-in-ano. Med Hypotheses 2016.
28. Boulanger CM,, et al. Highlight on Endothelial Activation and Beyond. Arterioscler Thromb Vase Biol 2018.
29. Loader J, et al. Effects of Sugar-Sweetened Beverage Consumption on Microvascular and Macrovascular Function in a Healthy Population. Arterioscler Thromb Vase Biol 2017.
30. Gruberg L, et al. Incidence, management, and outcome of coronary artery perforation during percutaneous coronary intervention. Am J Cardiol 2000.
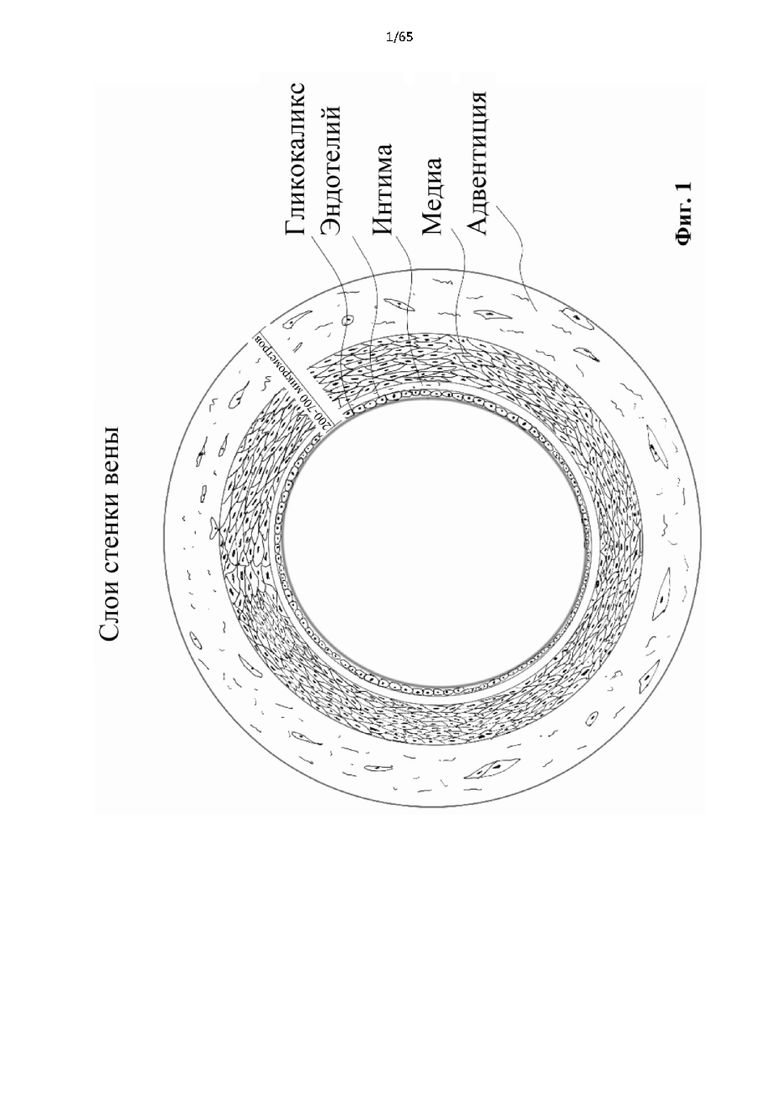
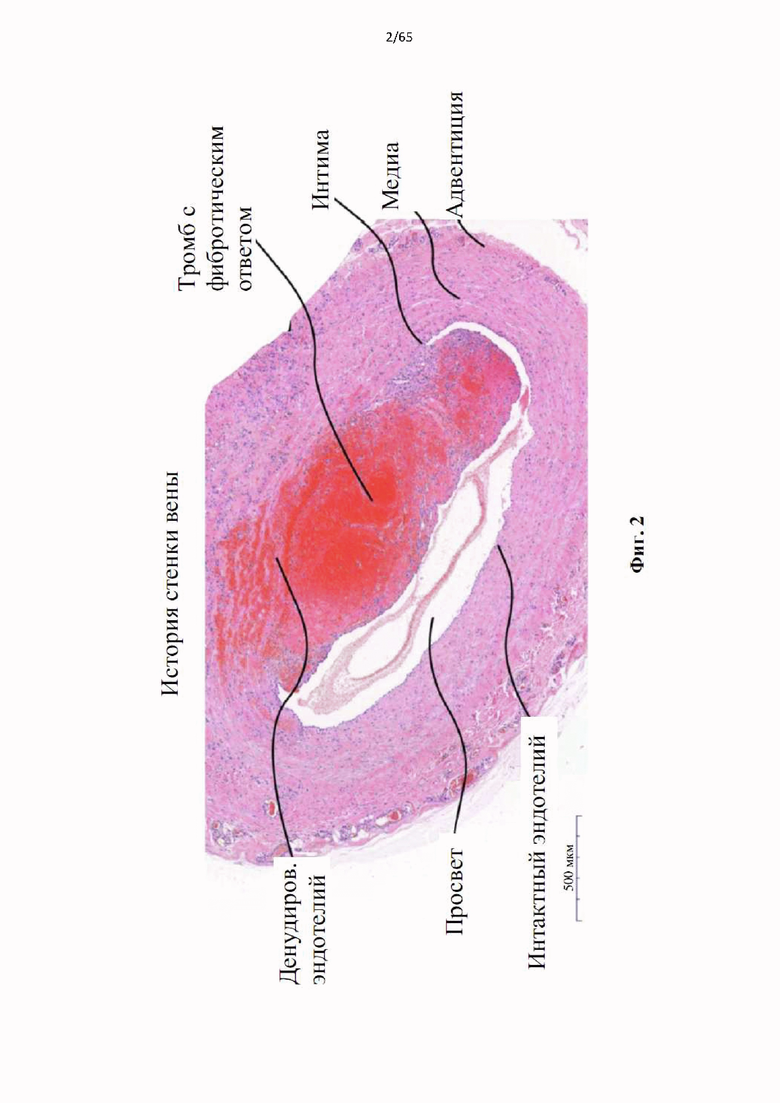
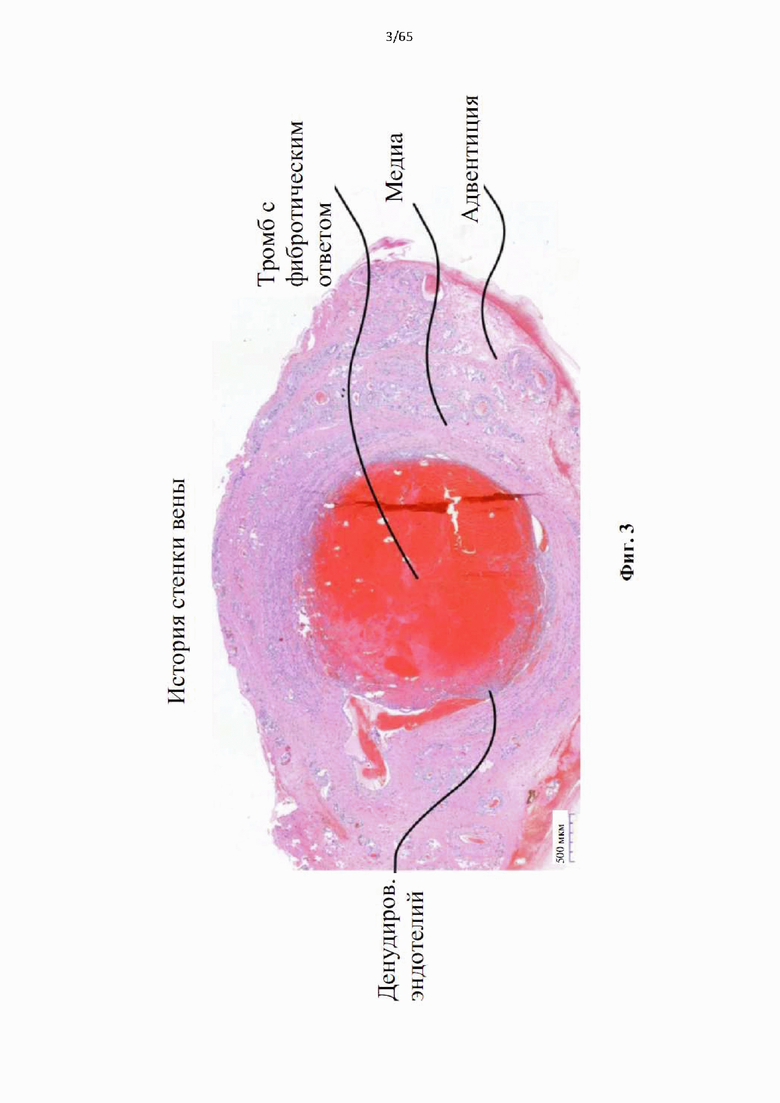
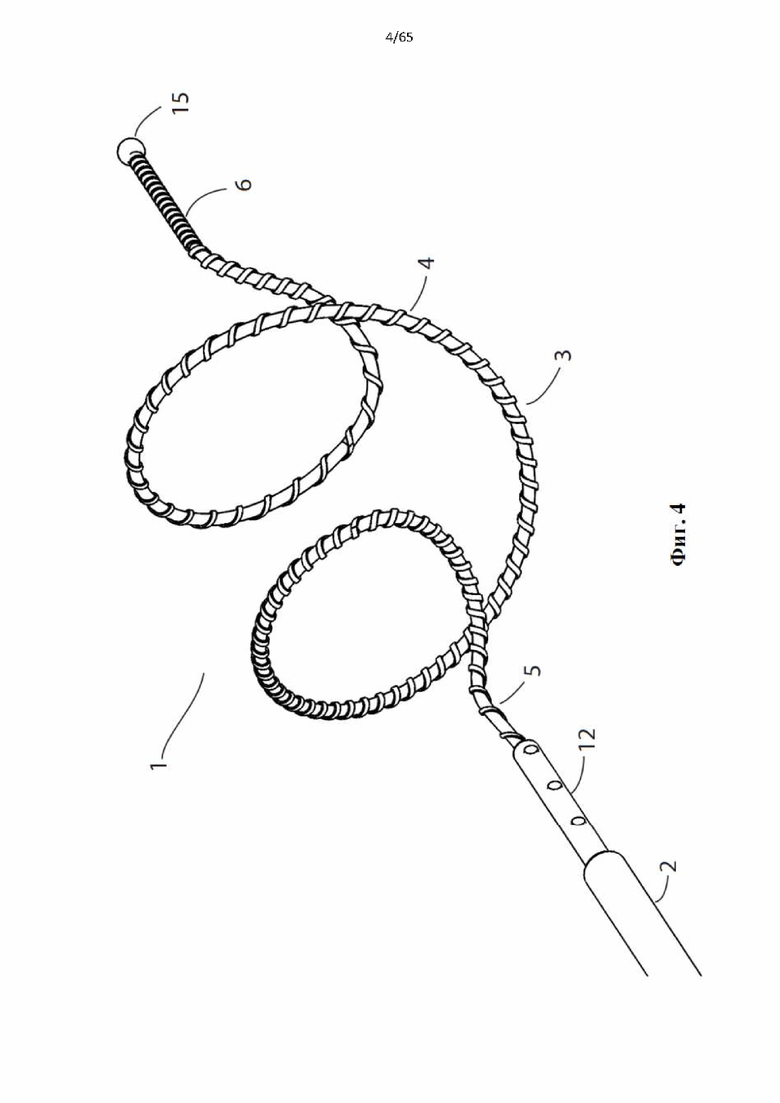
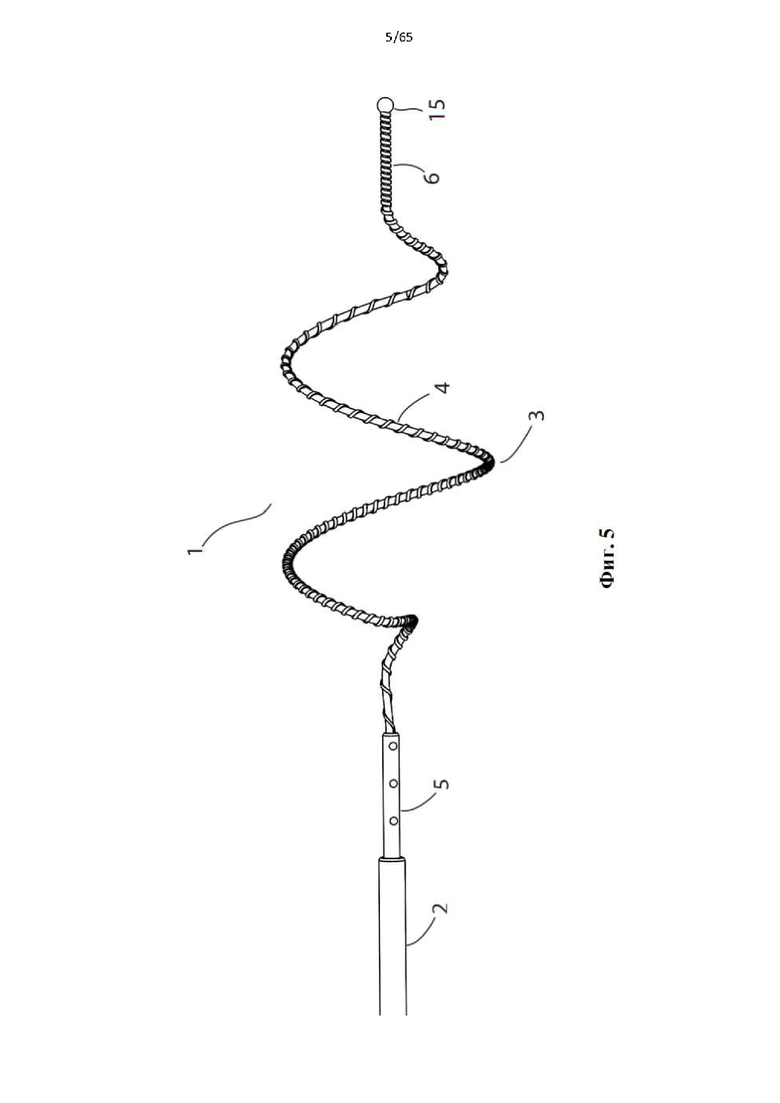
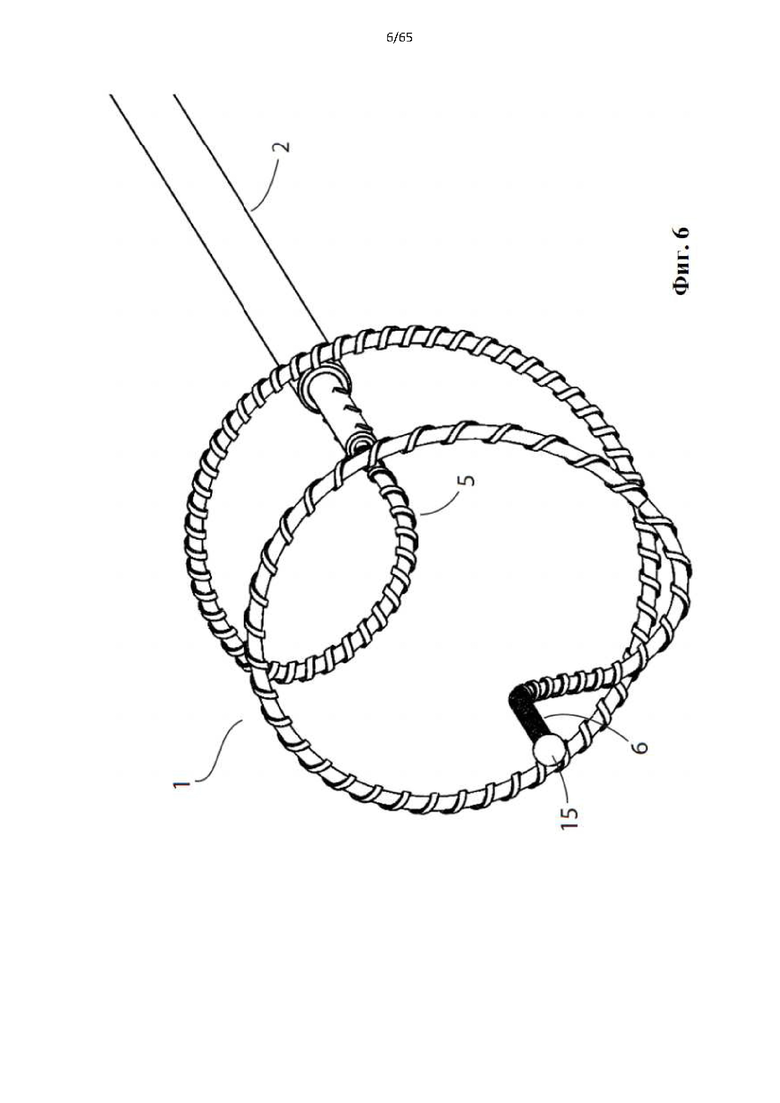
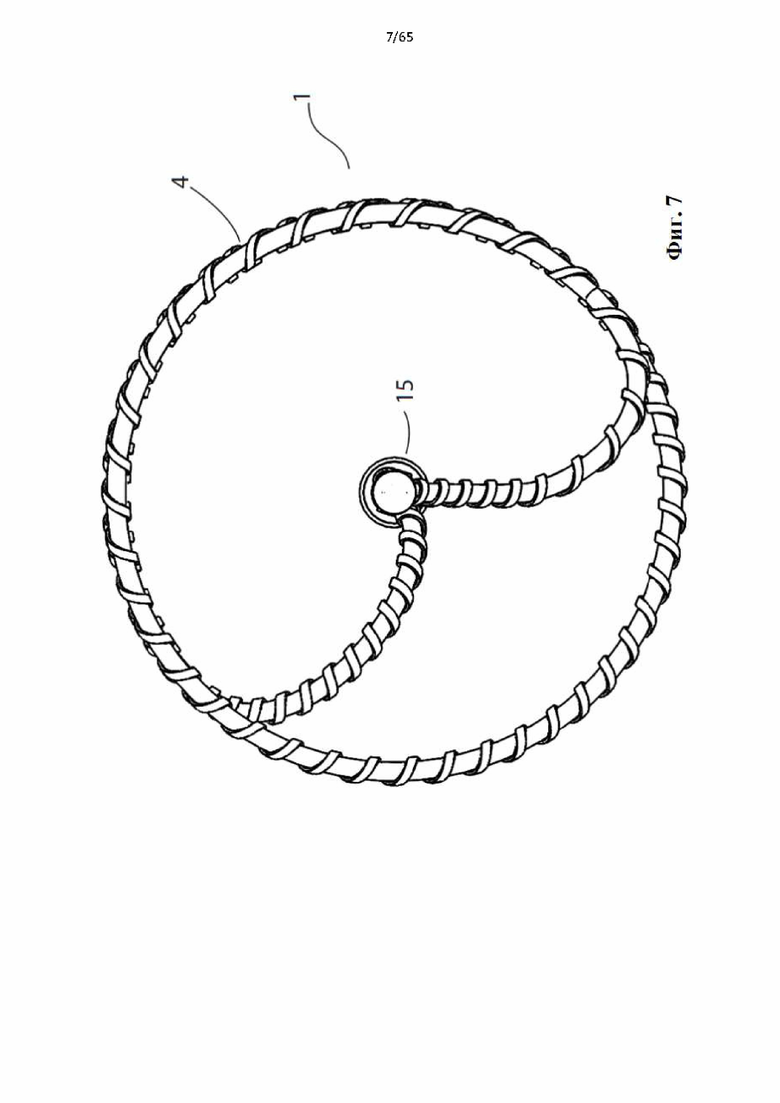
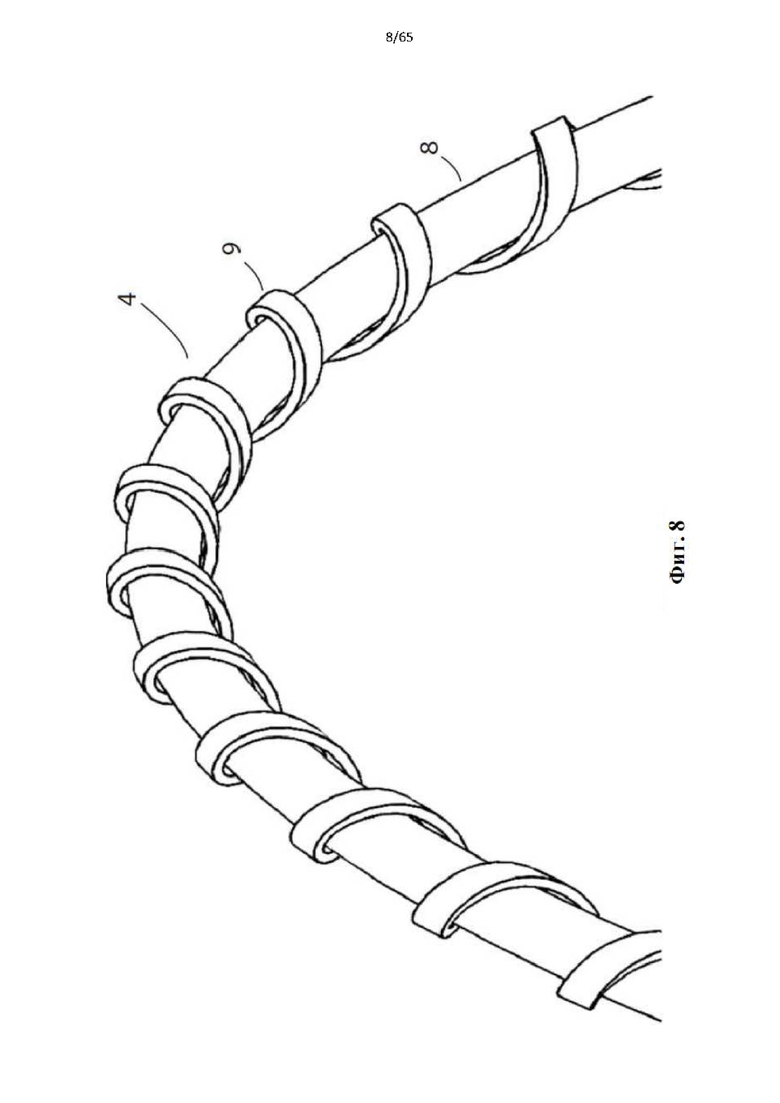
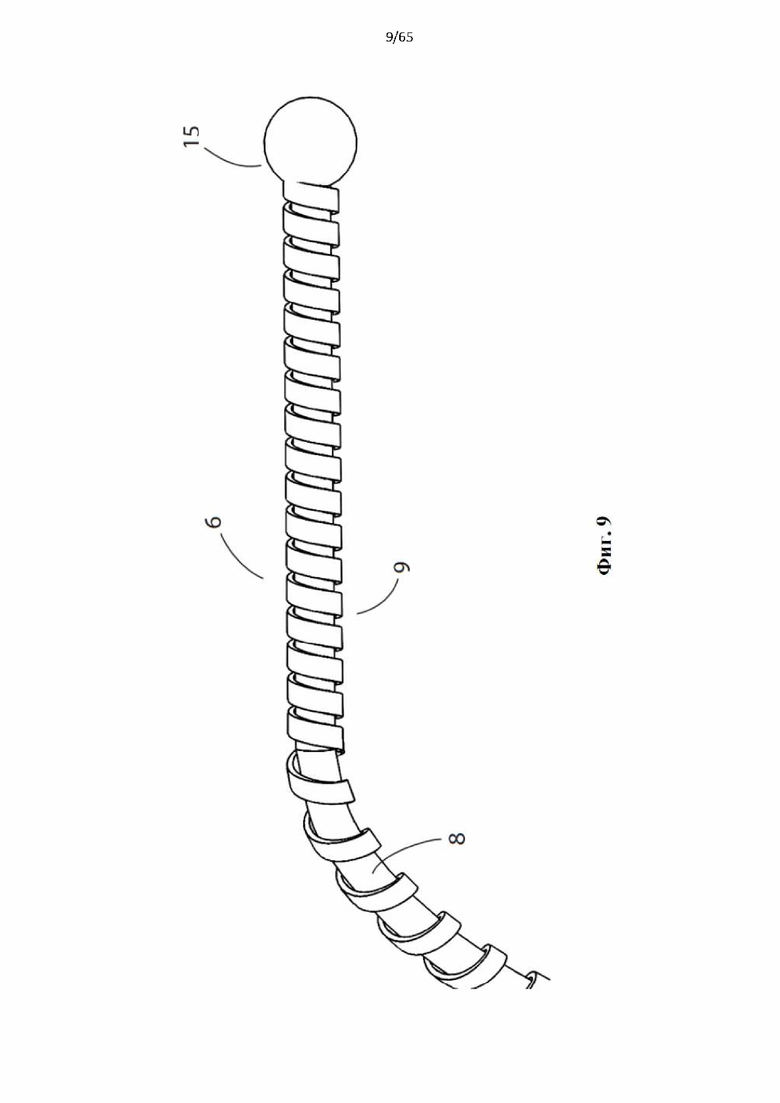
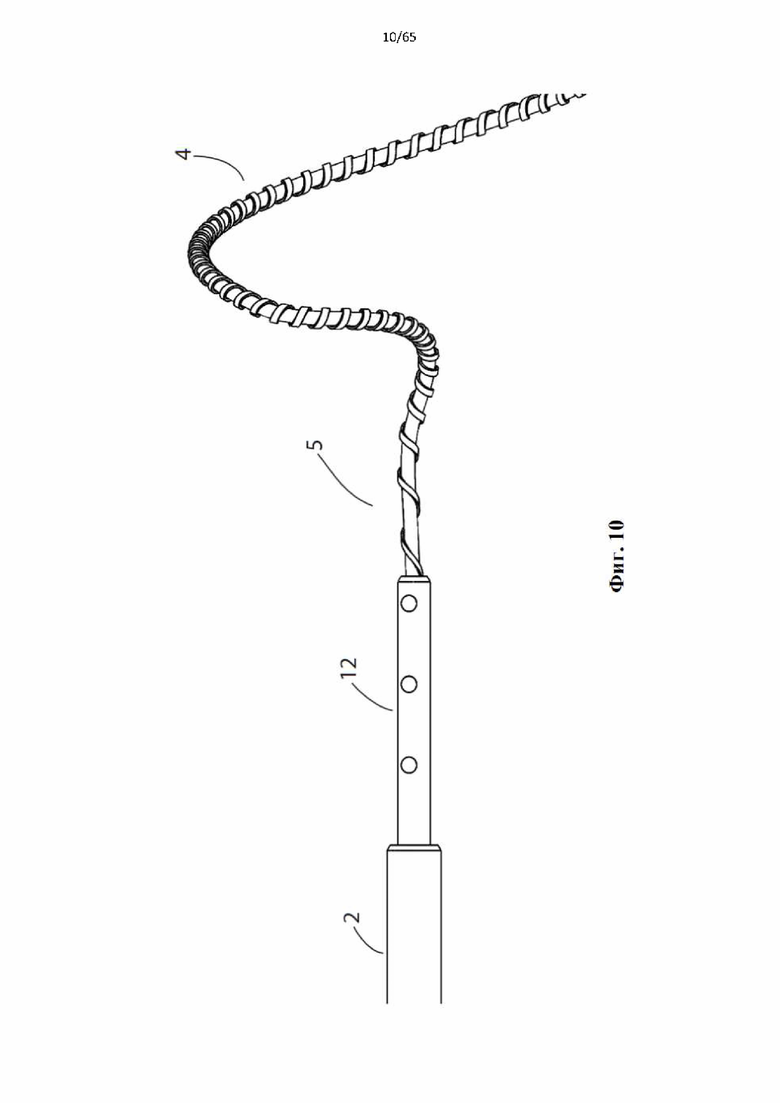
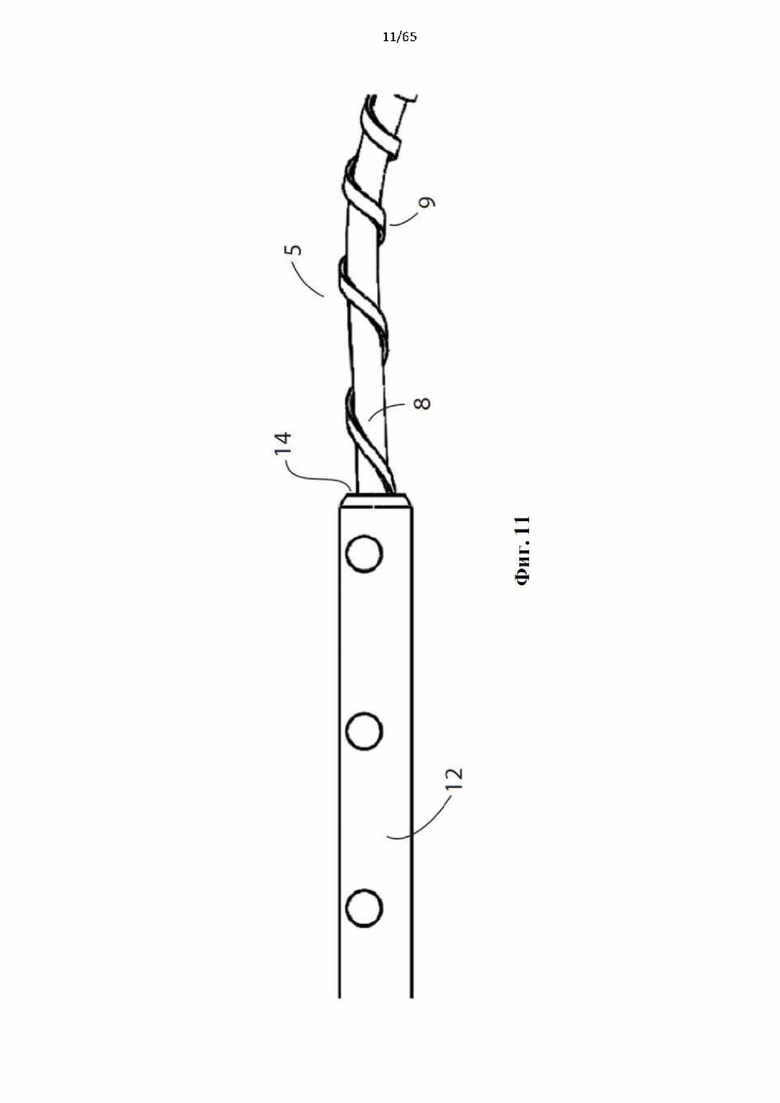
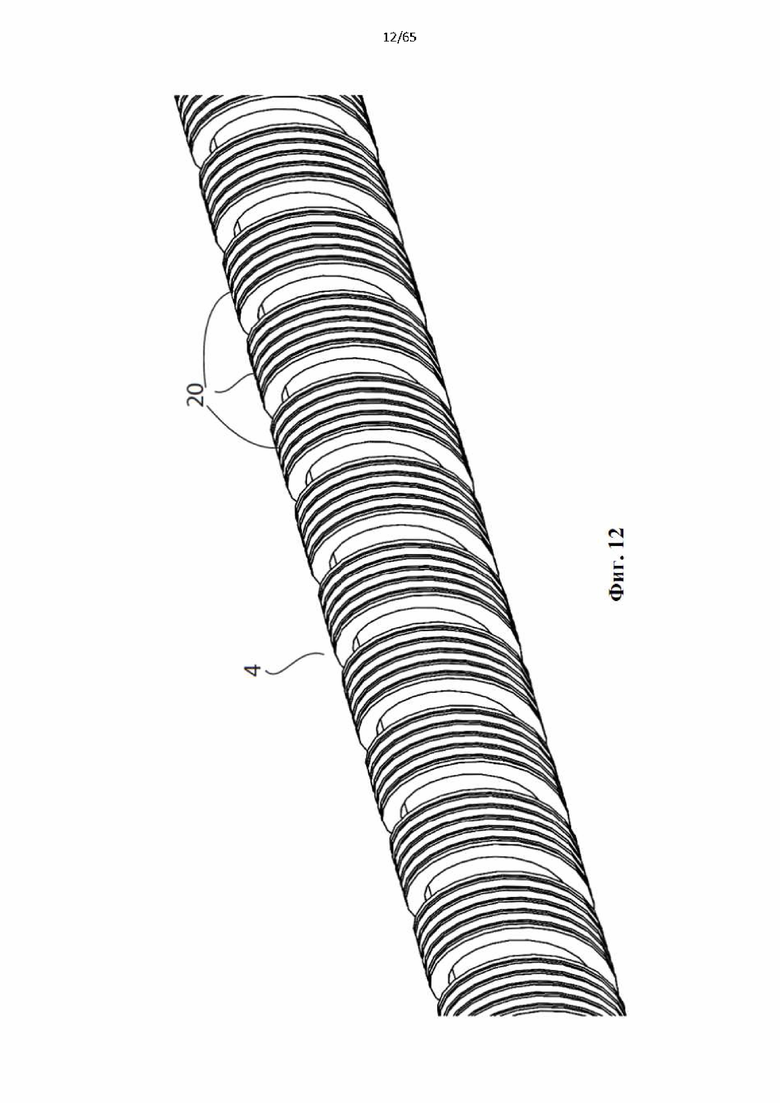
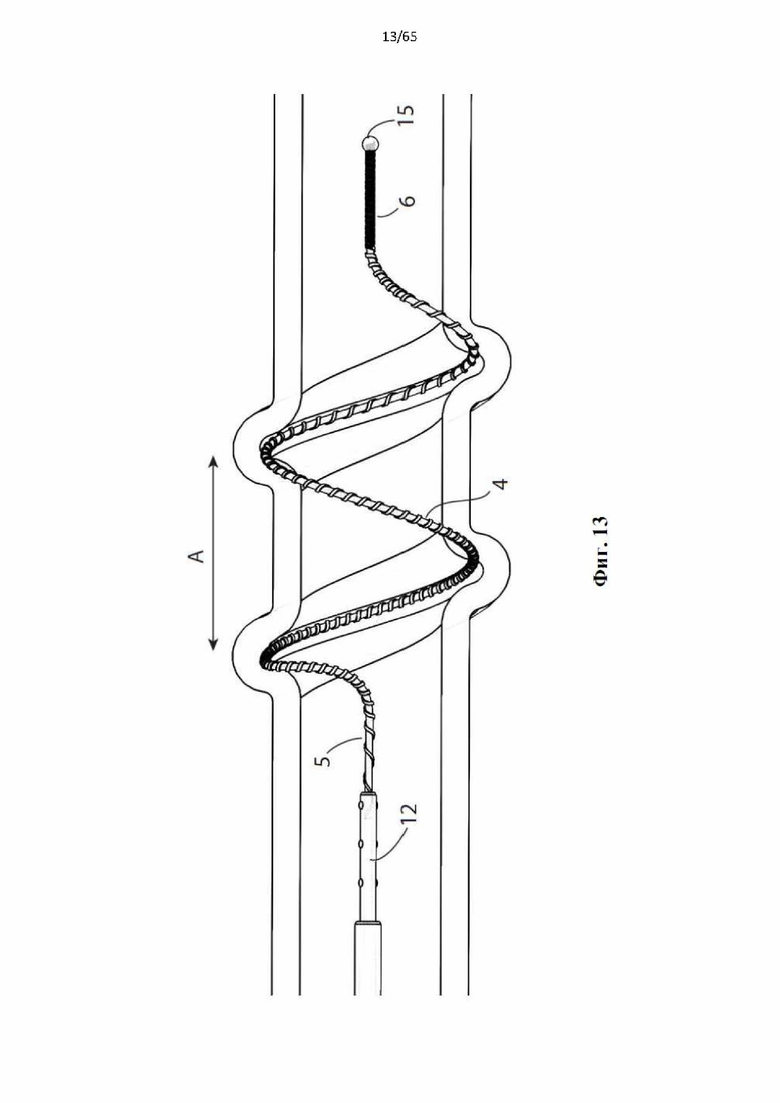
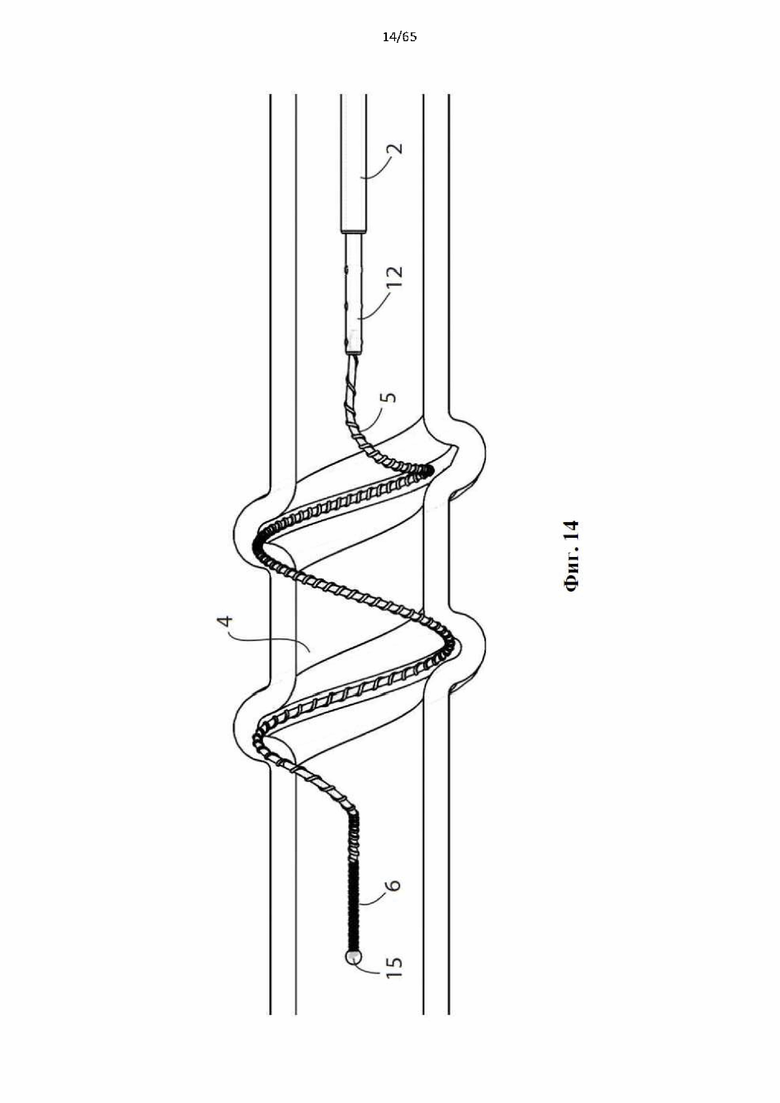
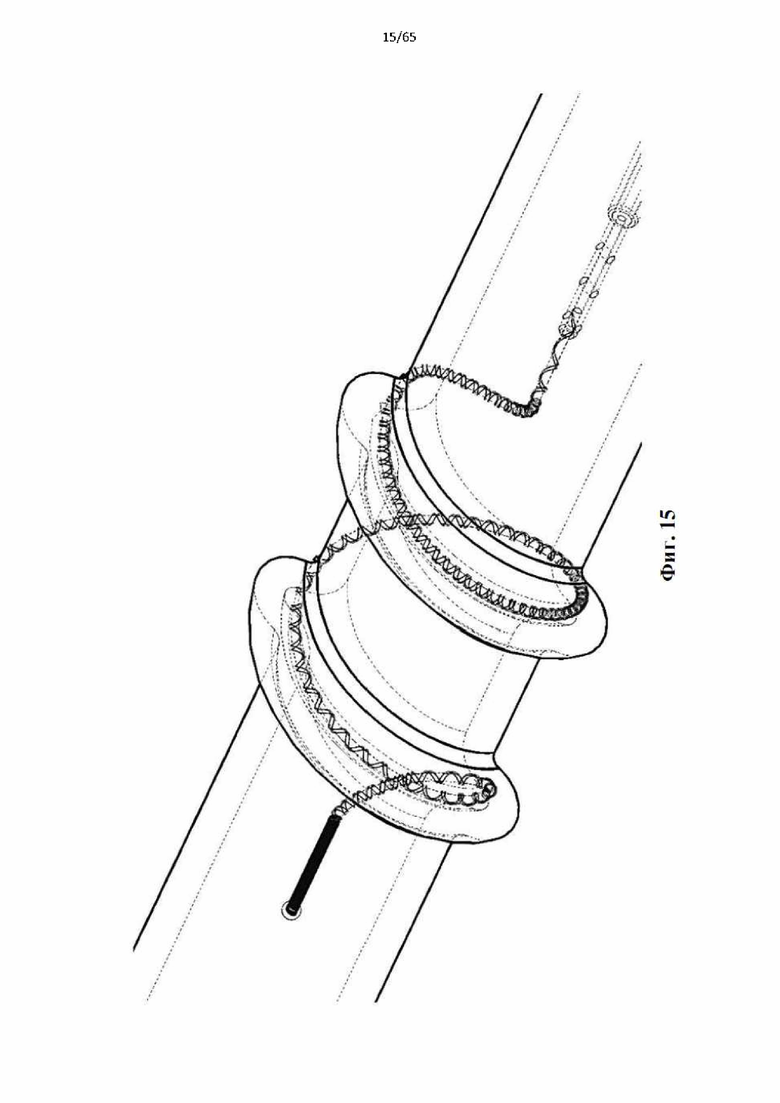
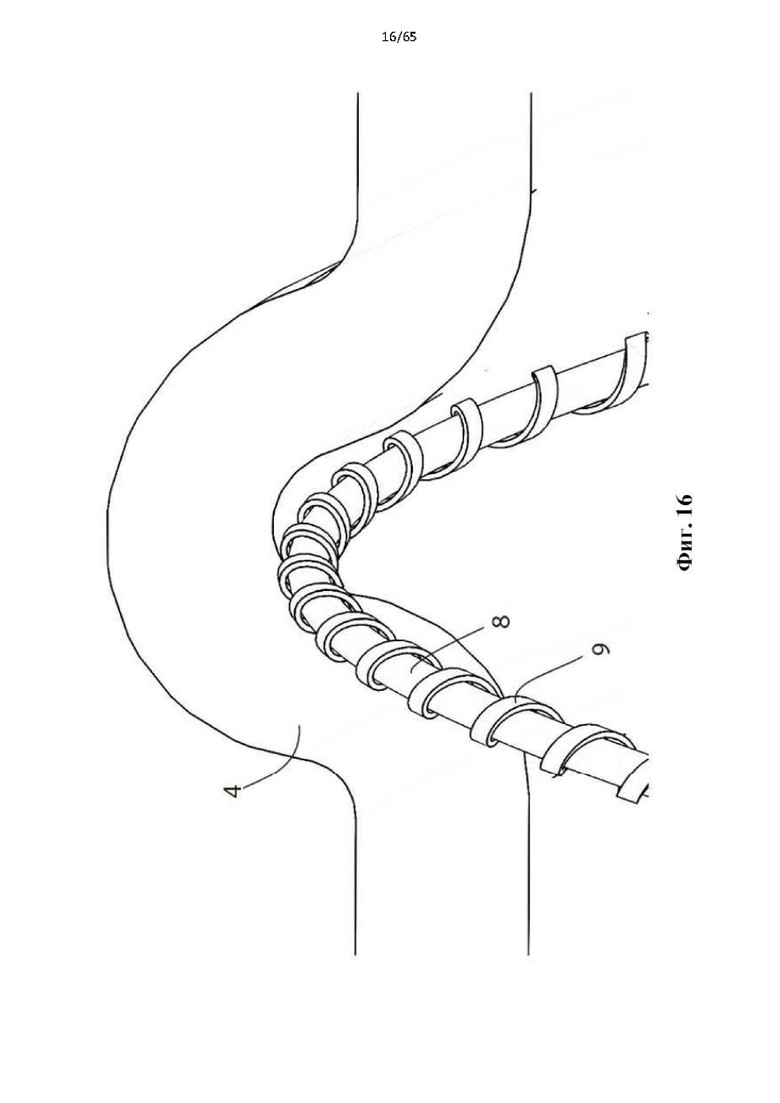
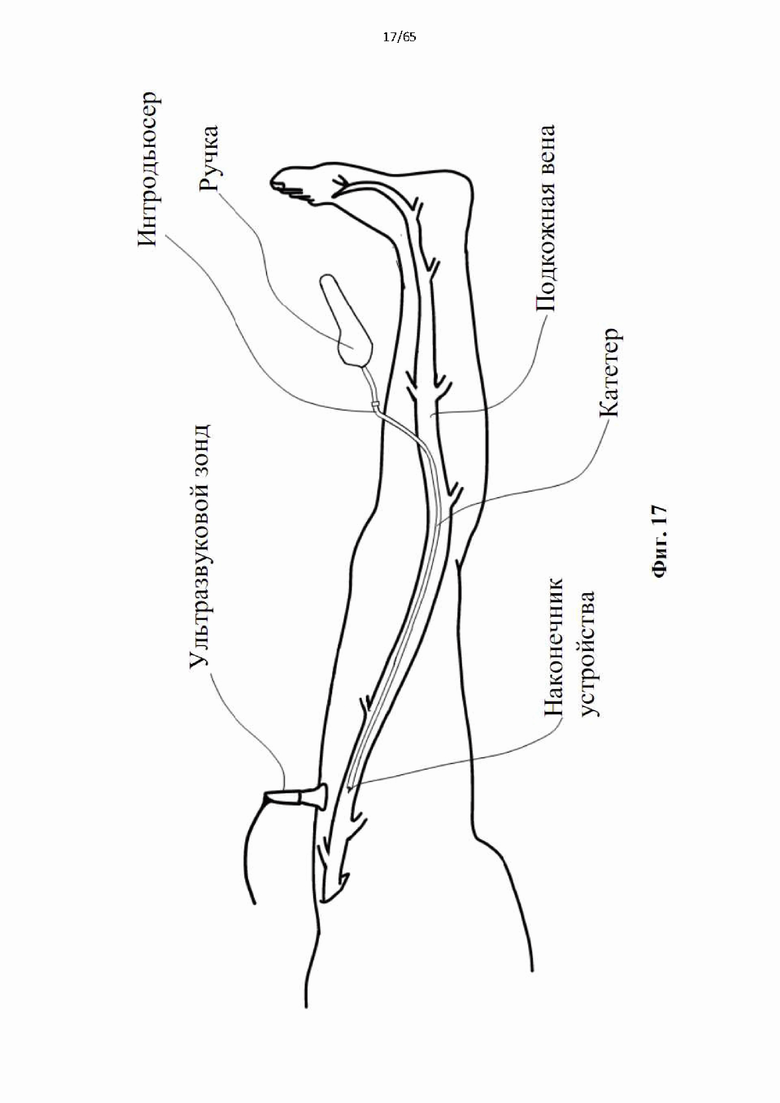
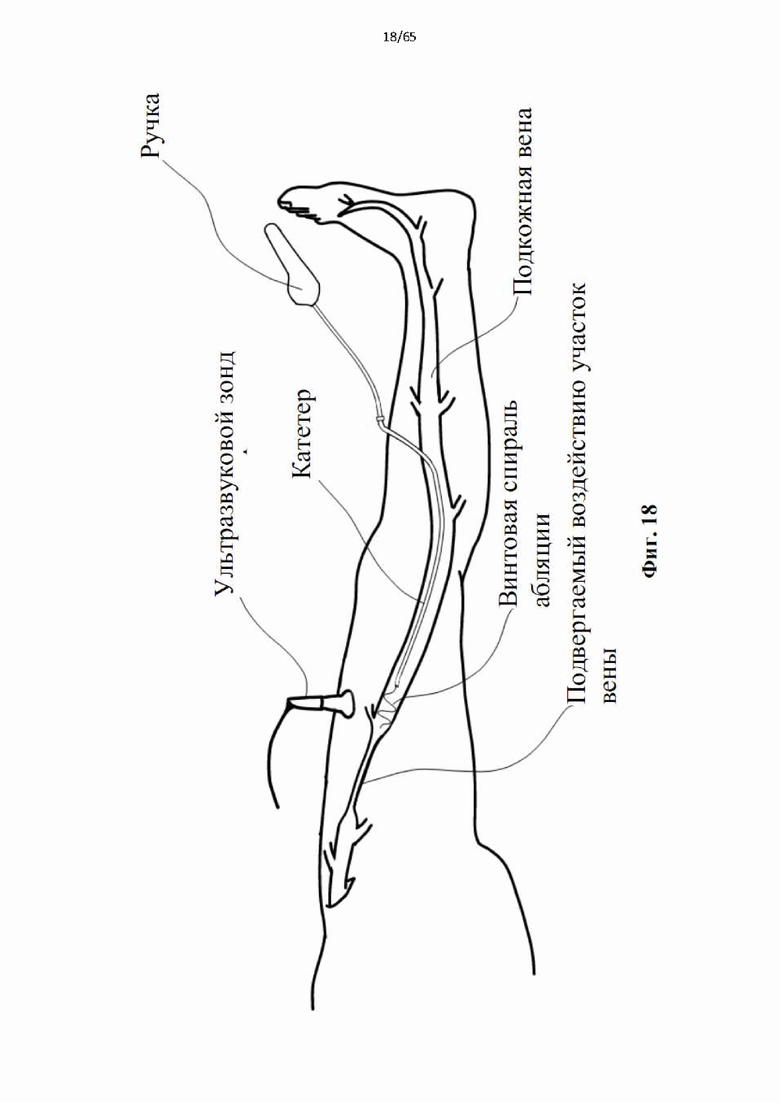
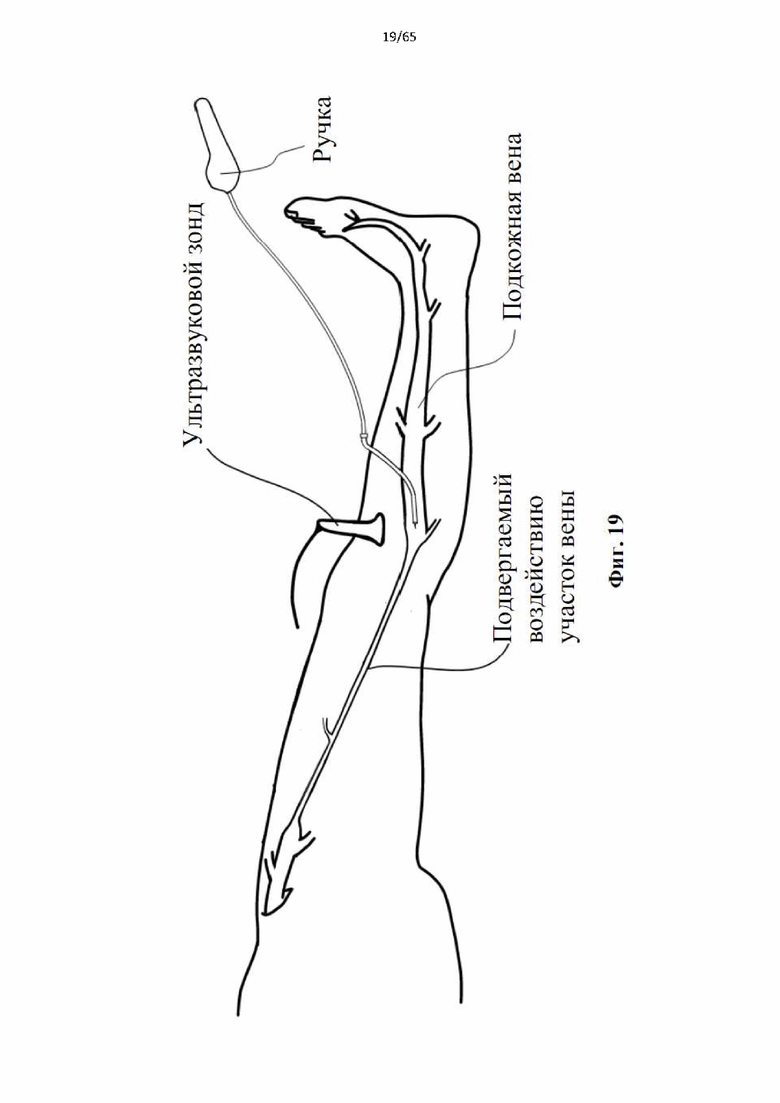
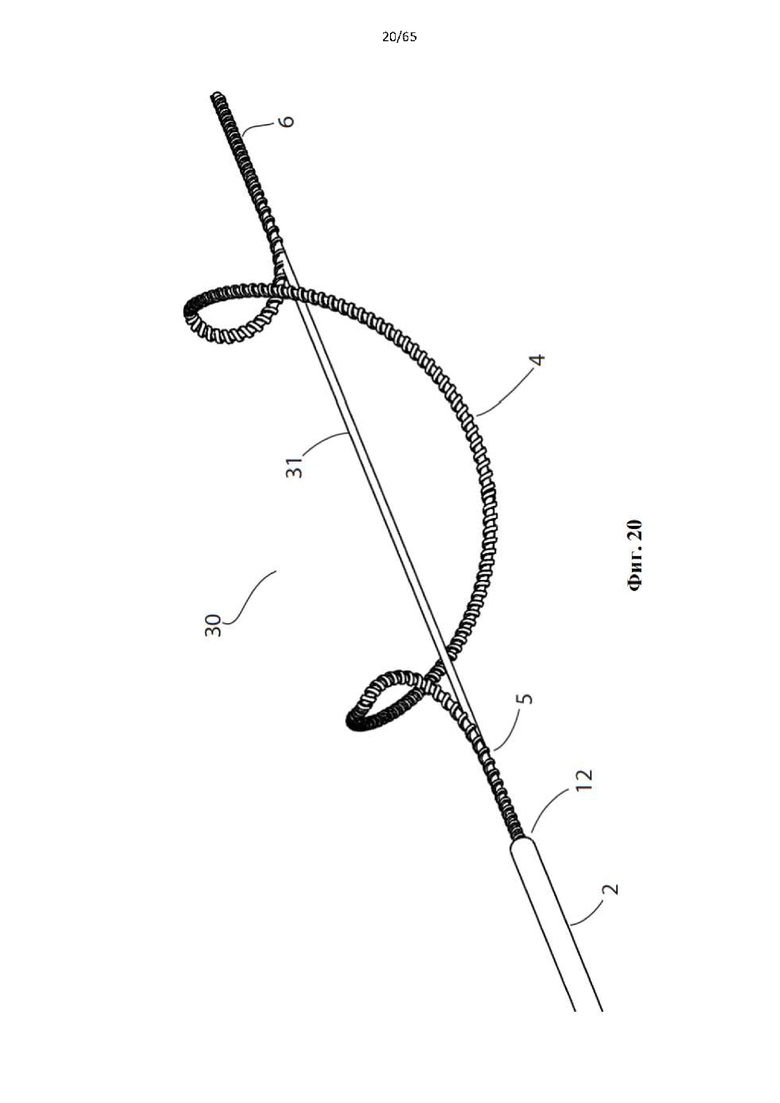
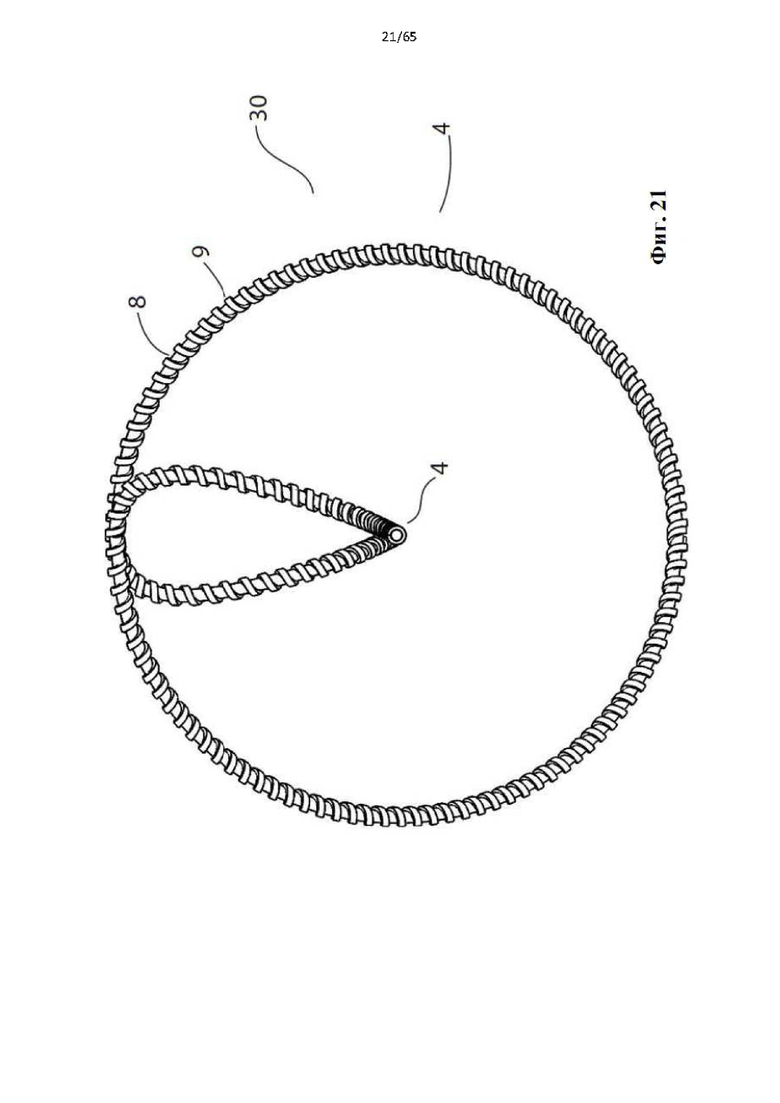
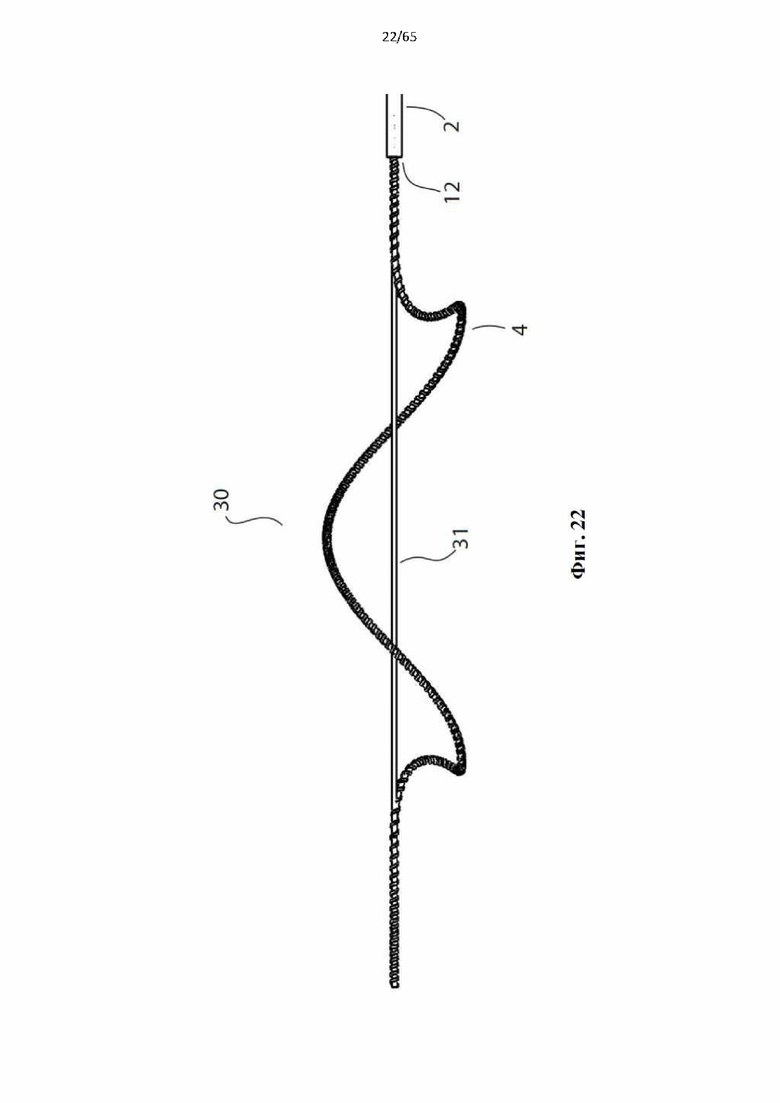
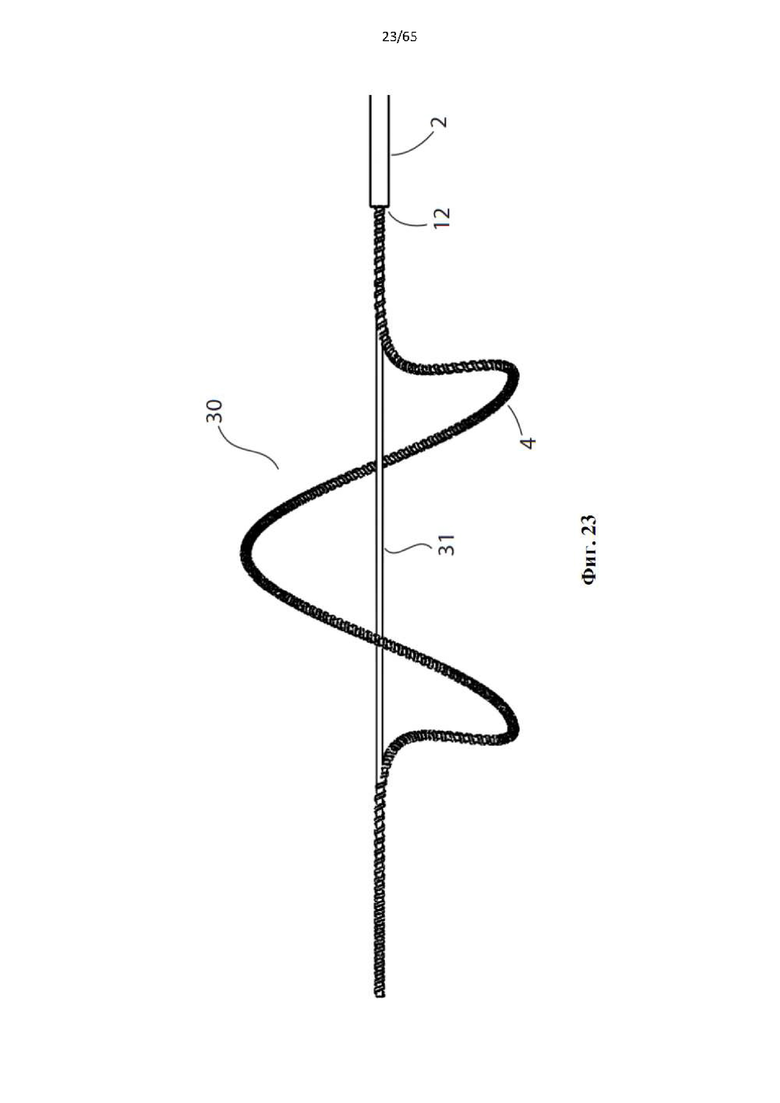
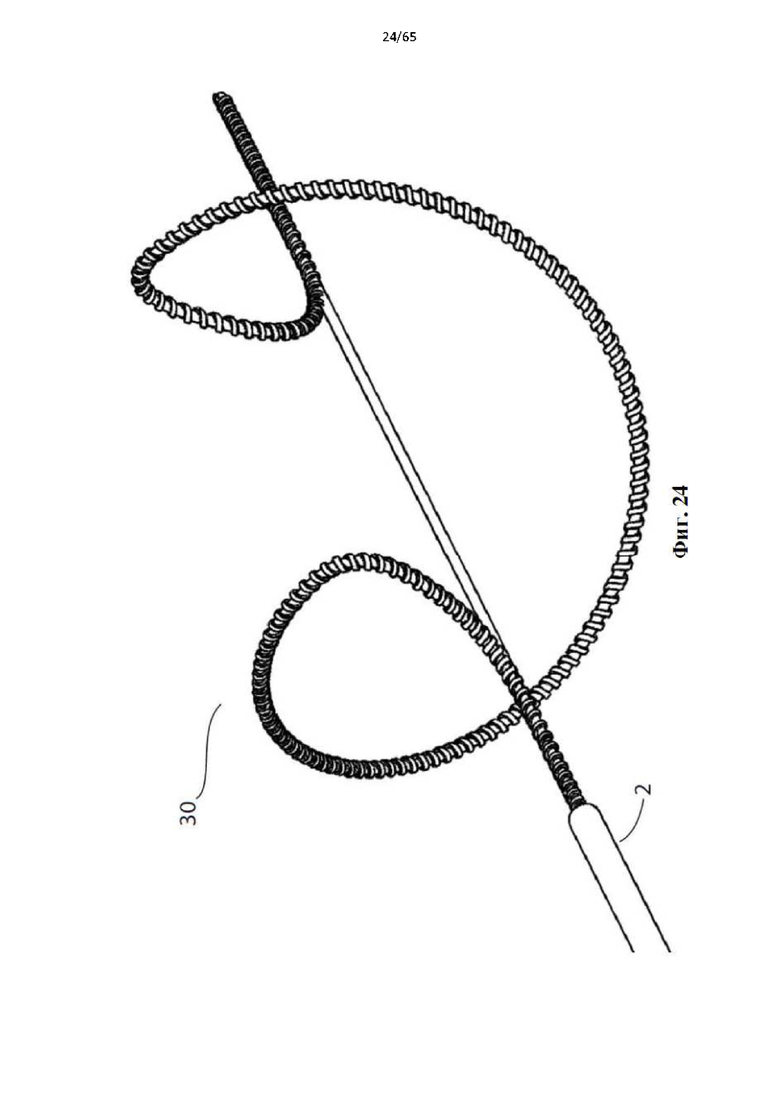
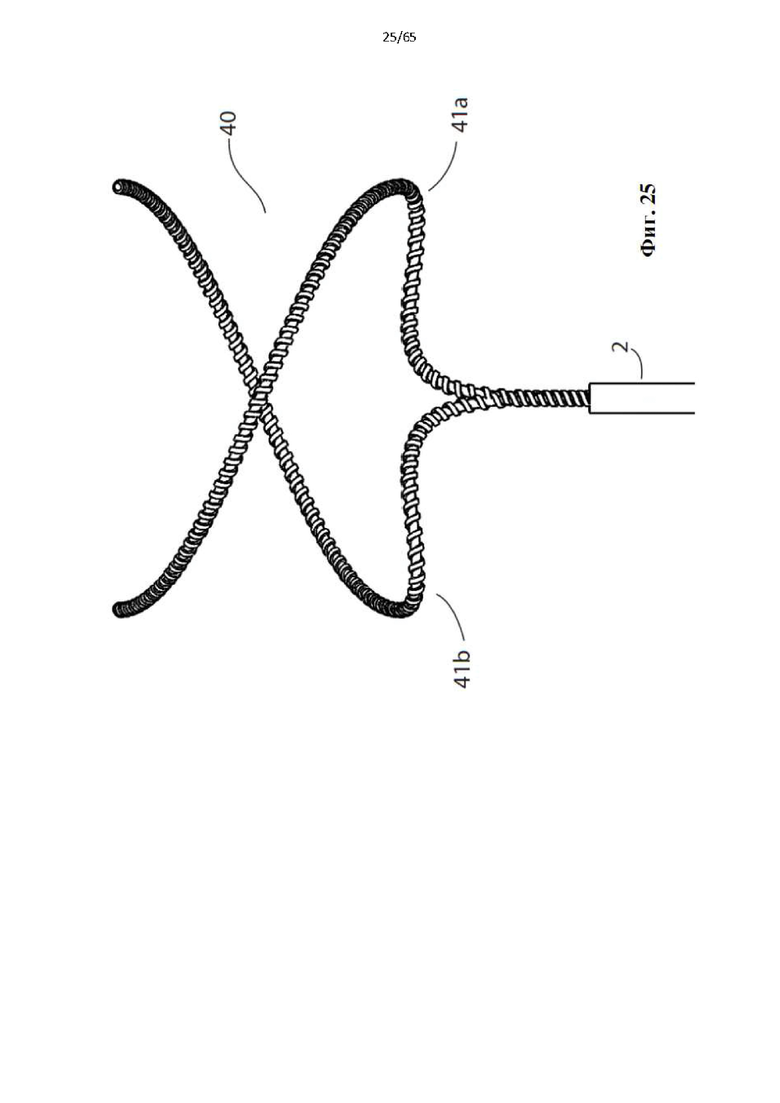
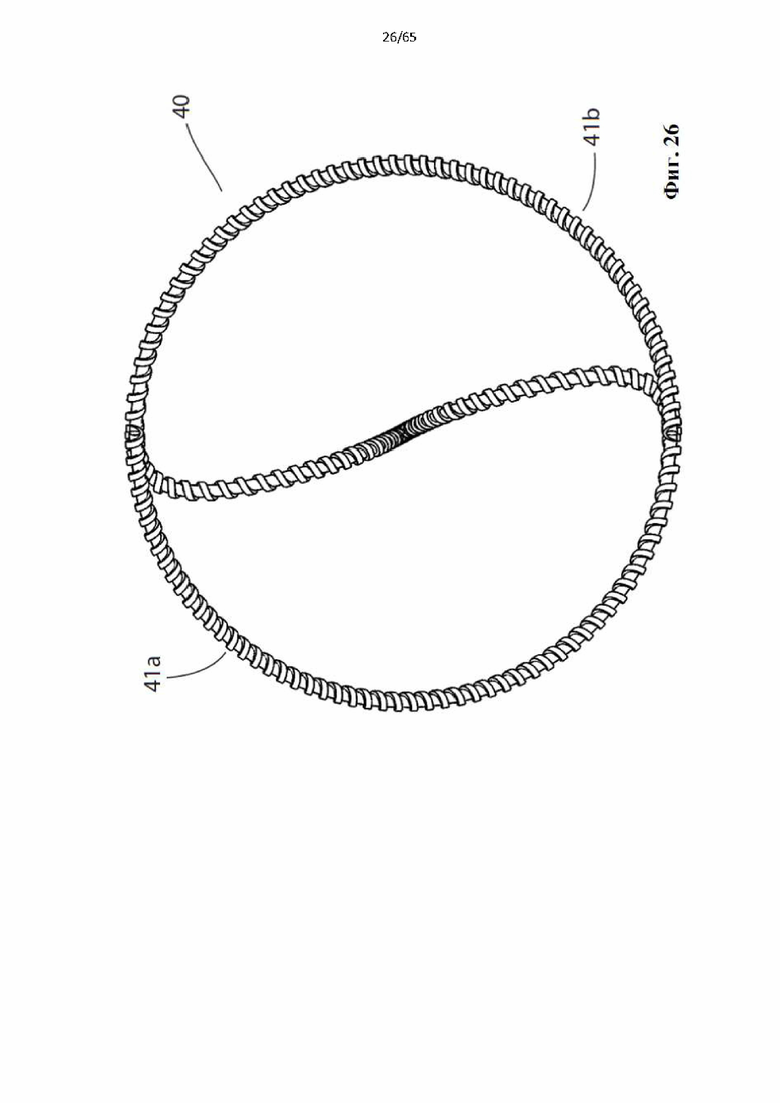
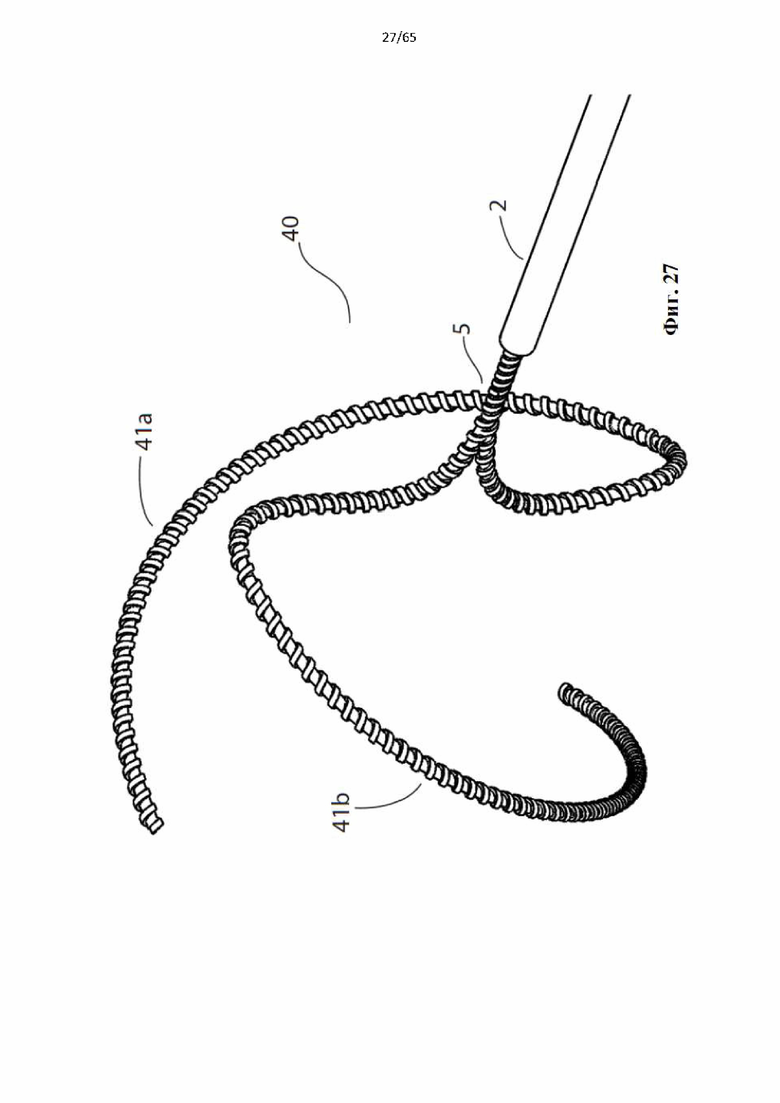
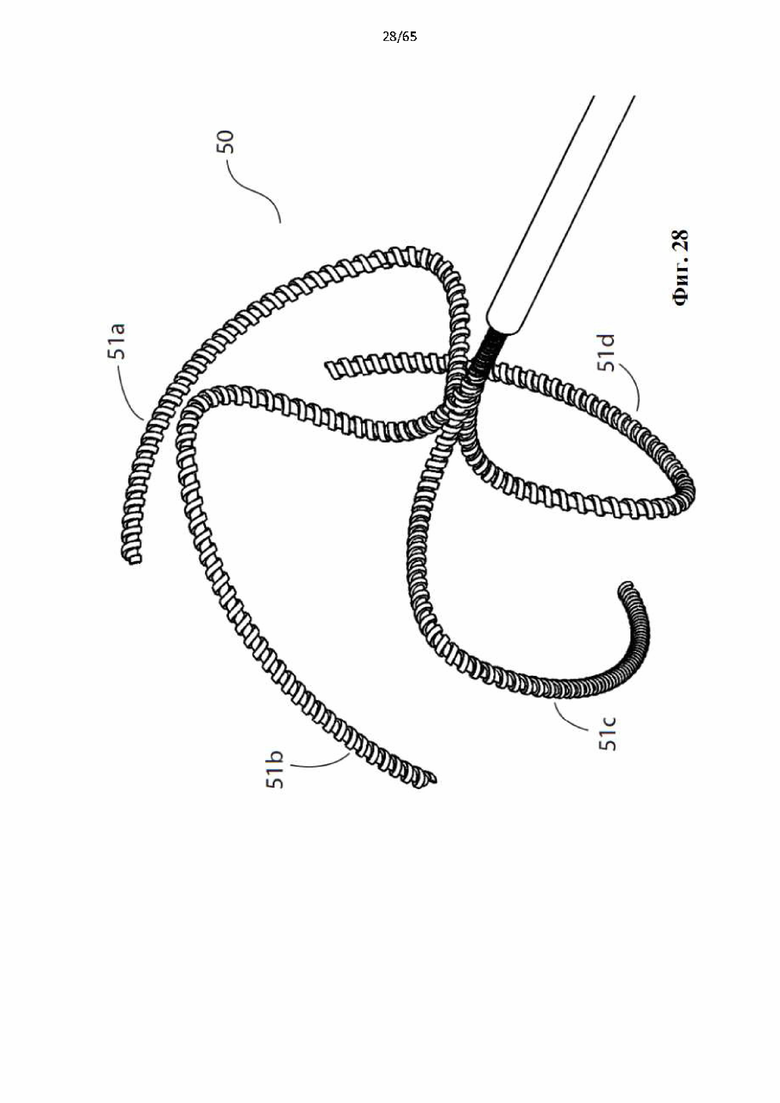
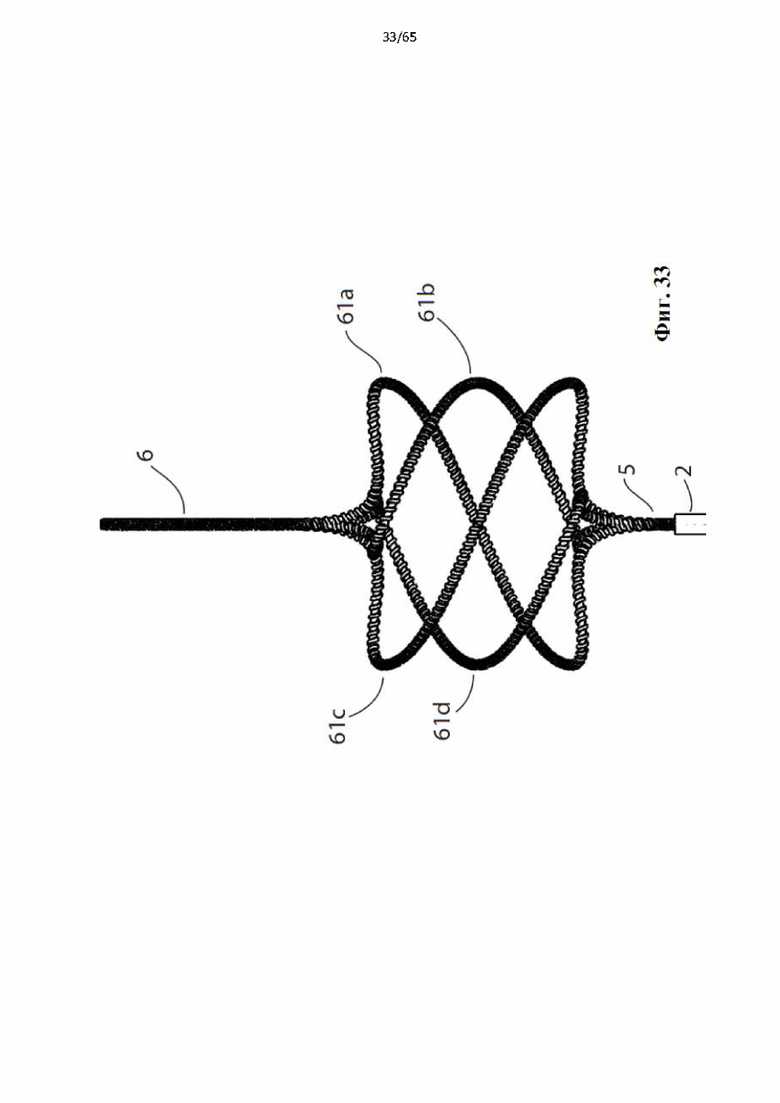
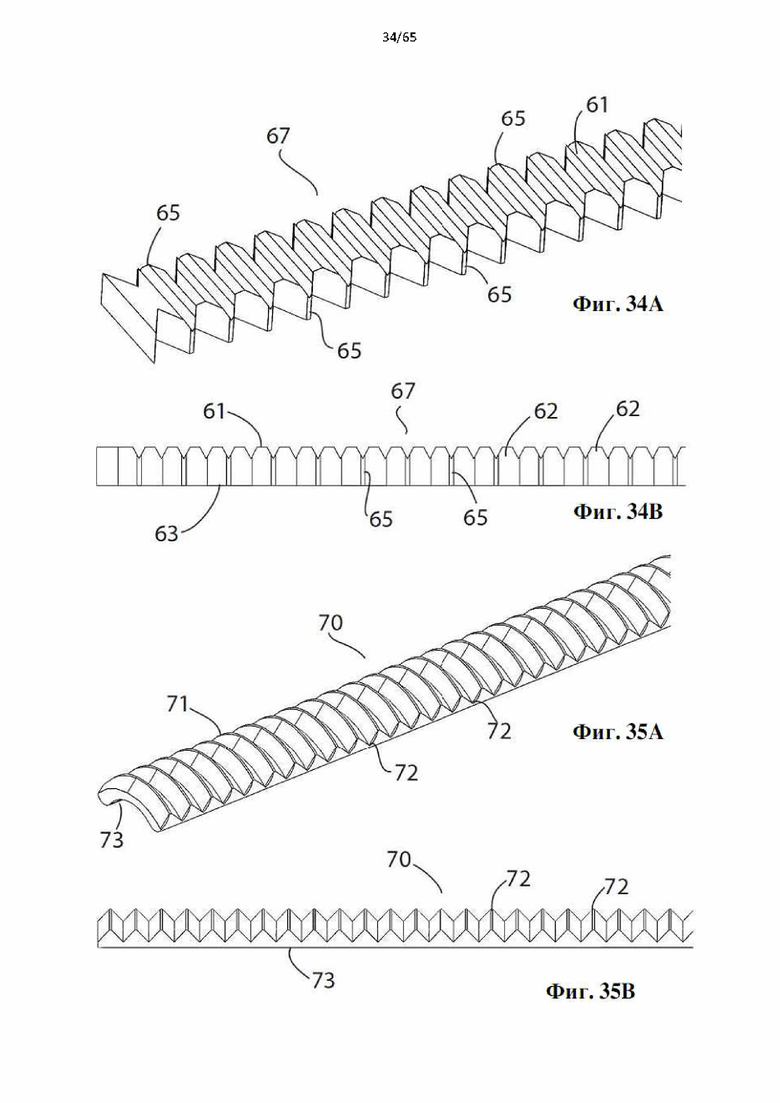
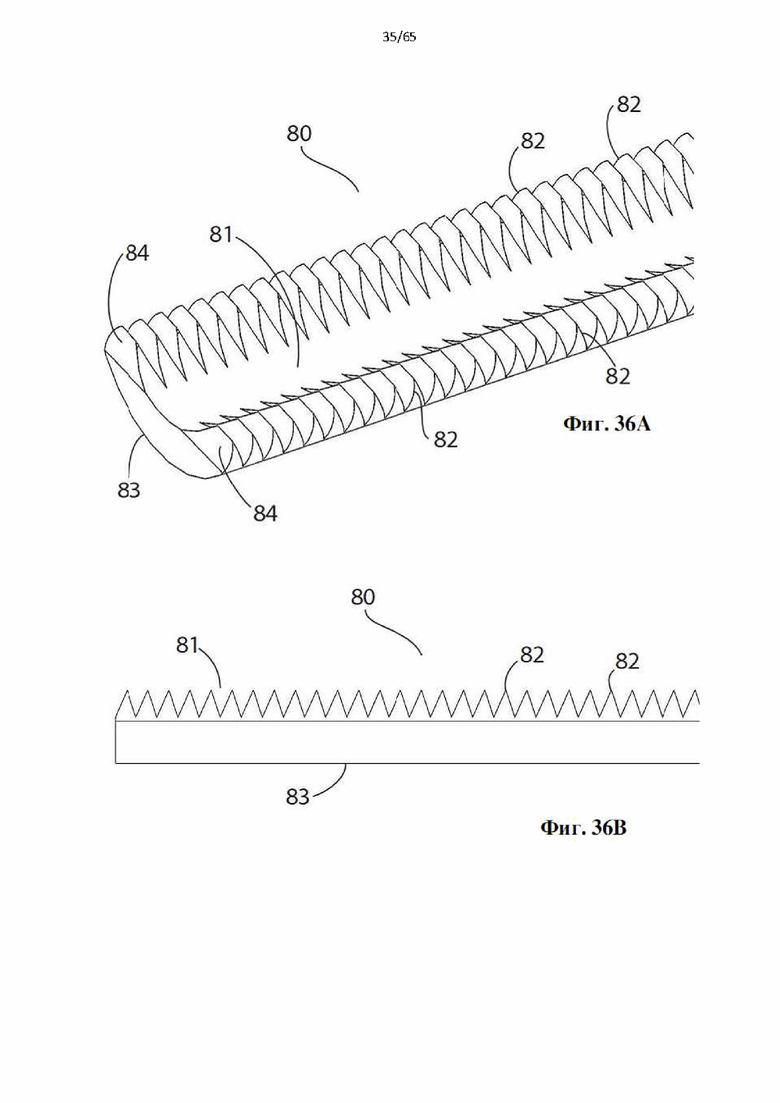
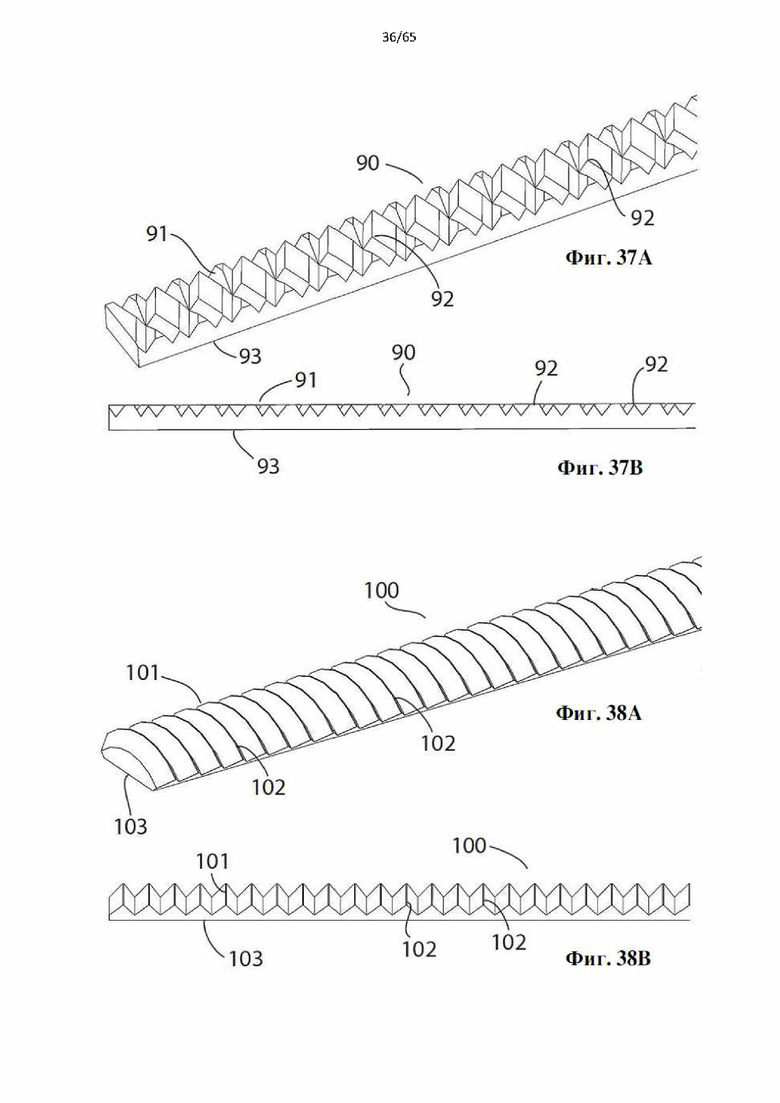
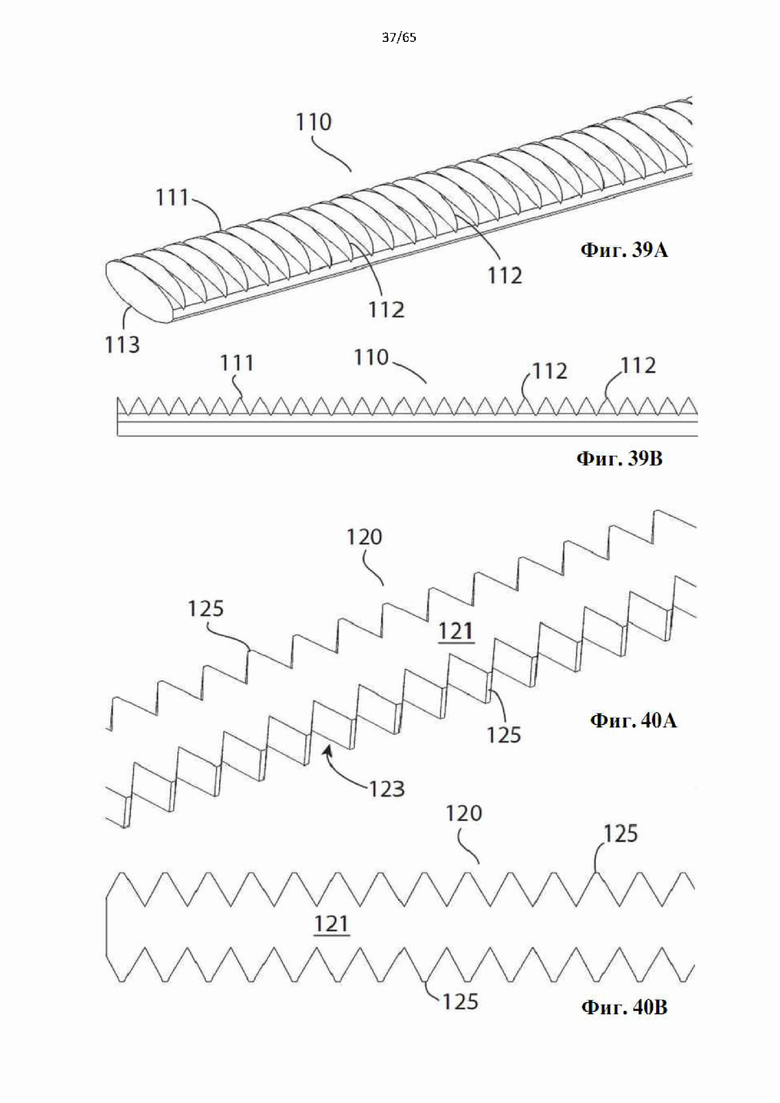
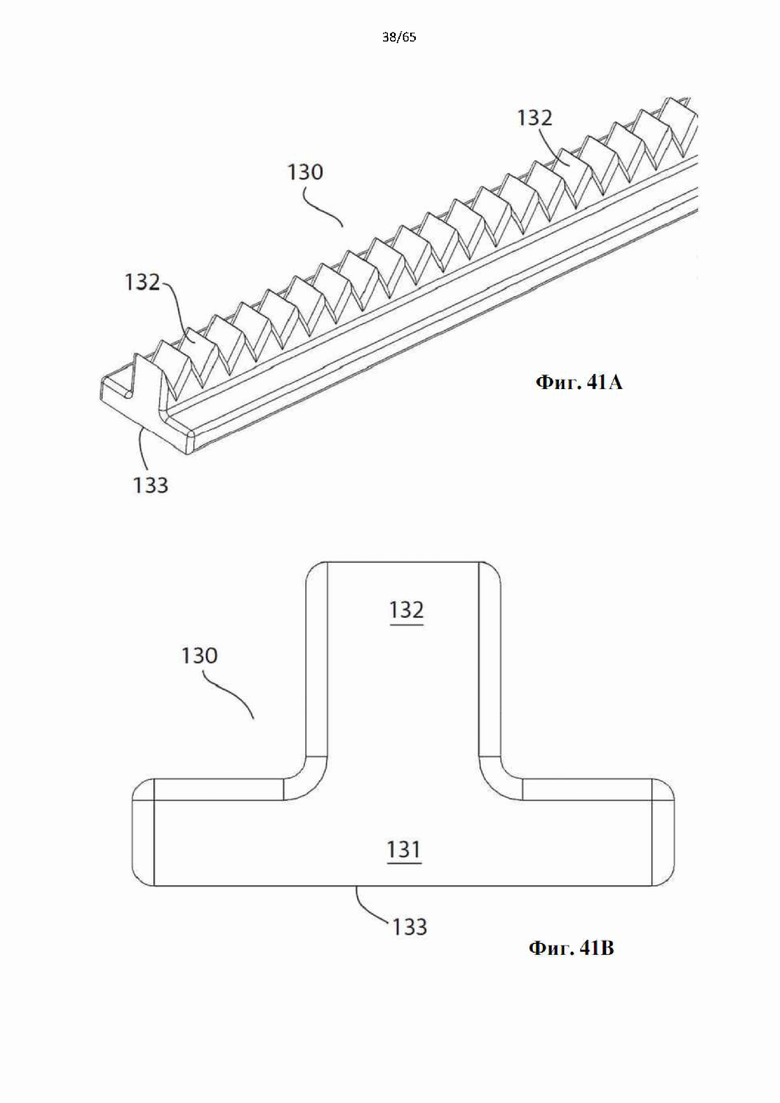
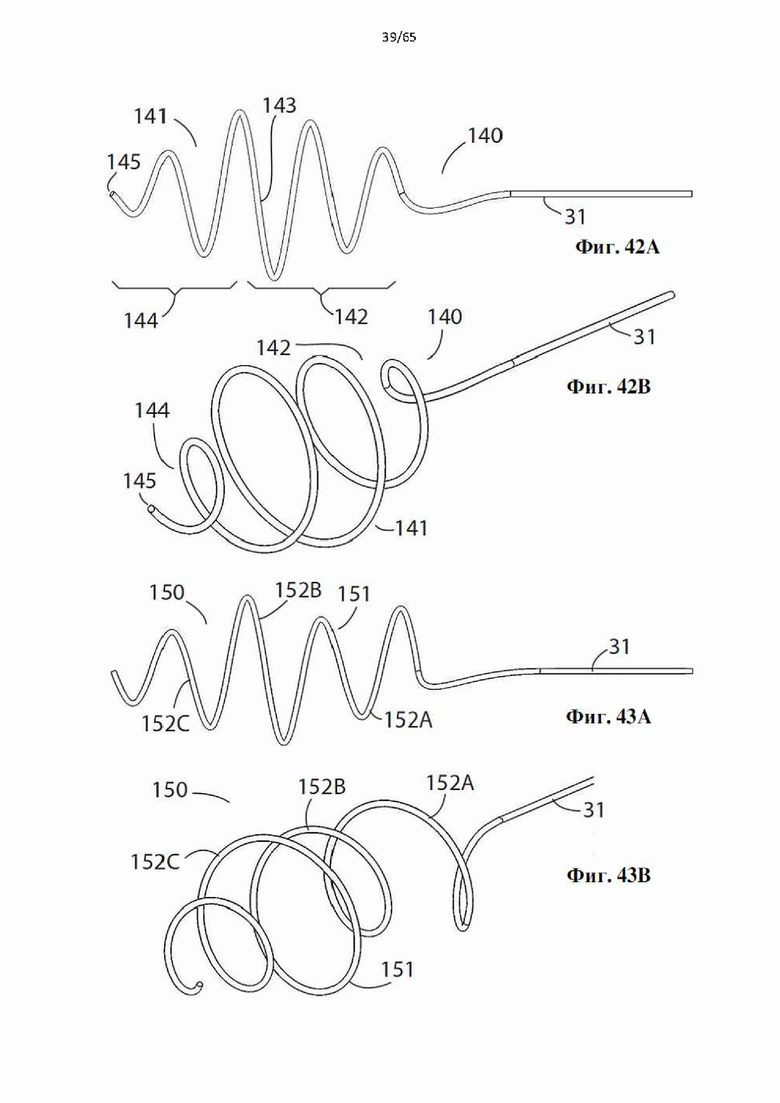
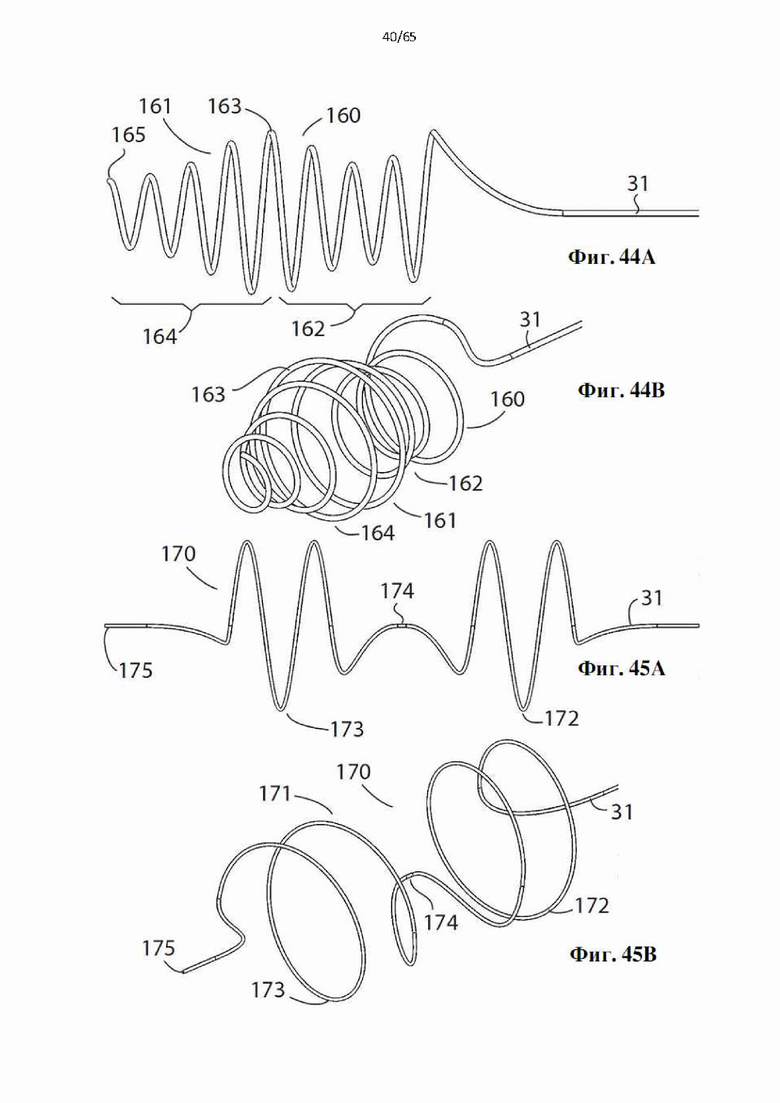
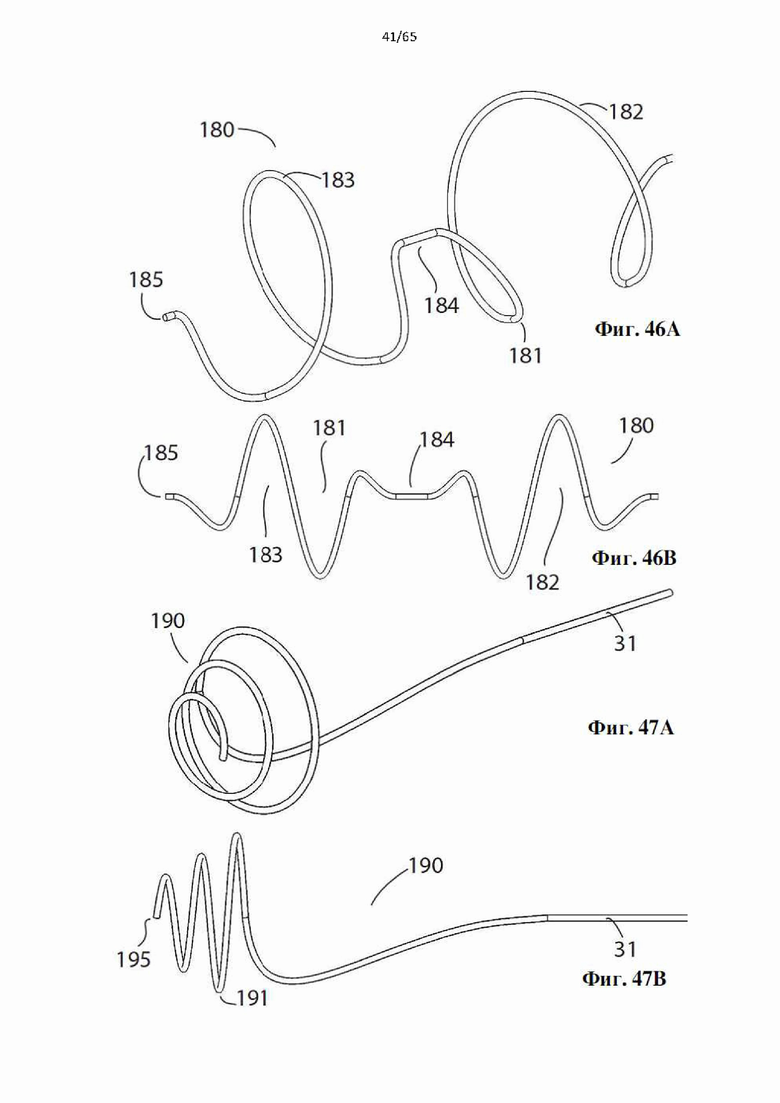
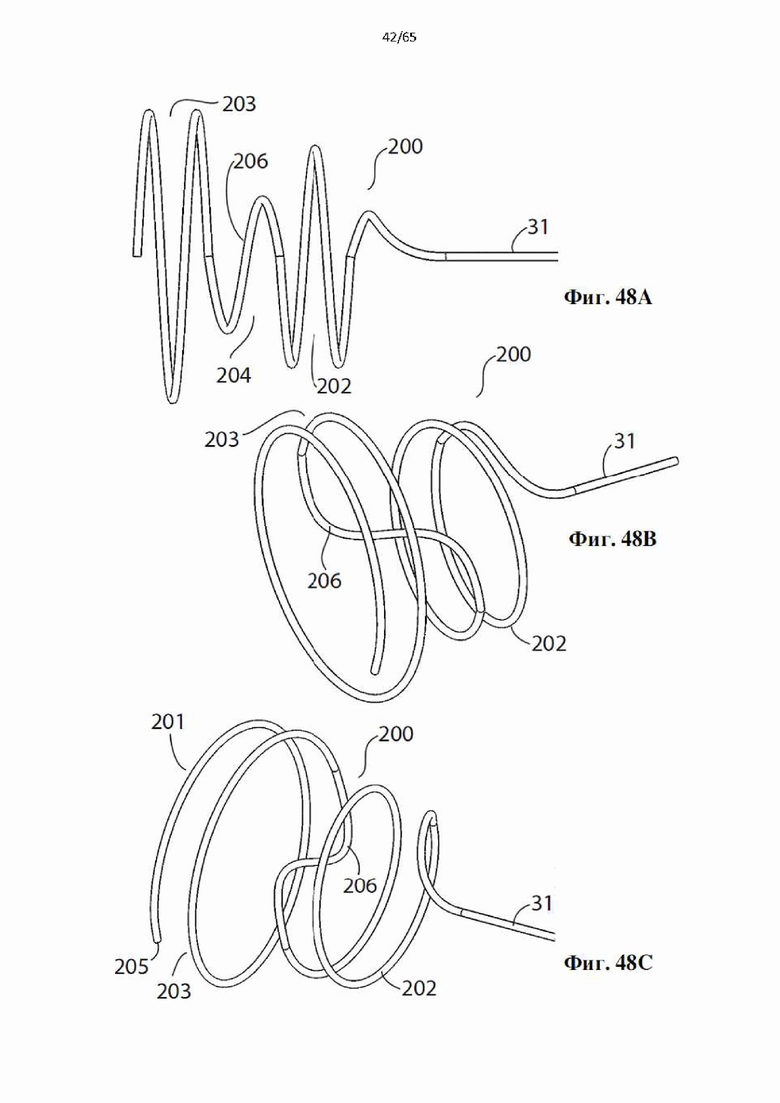
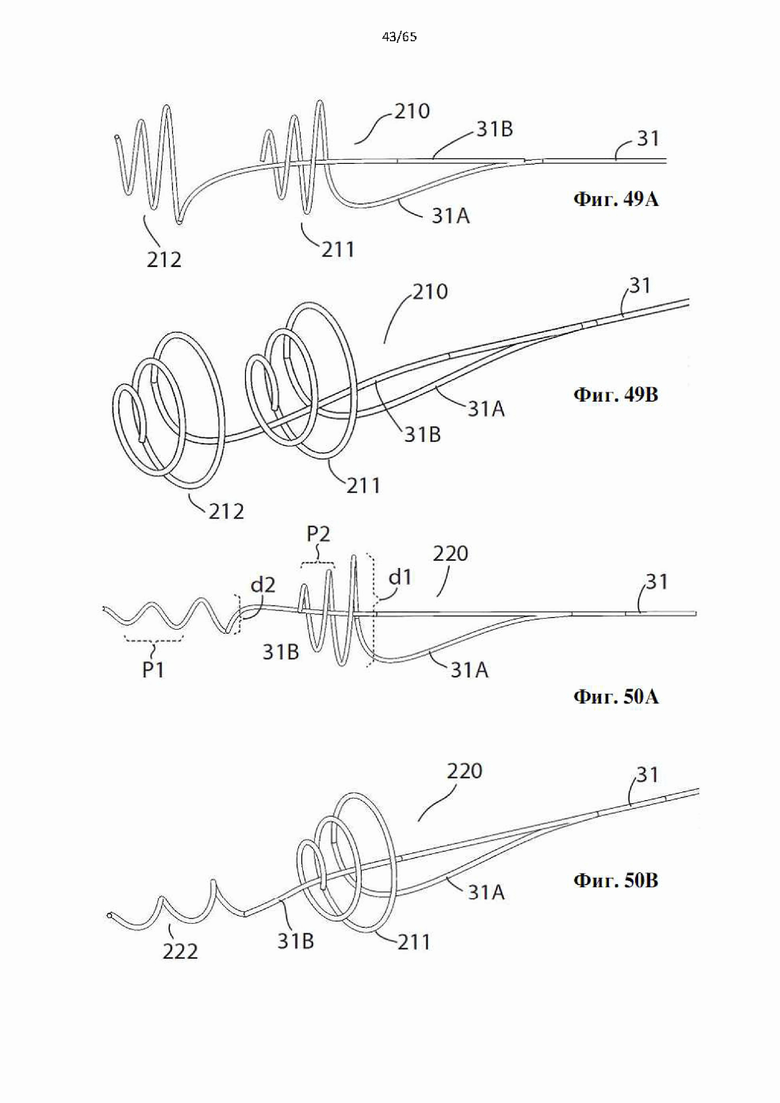
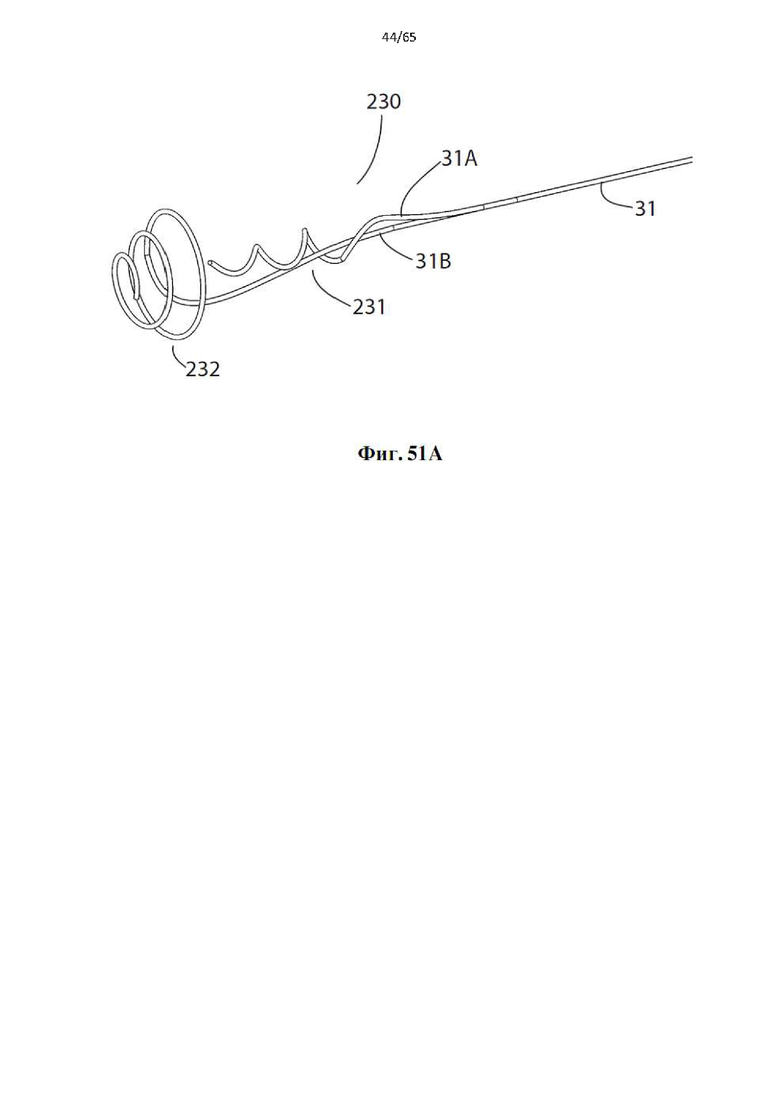
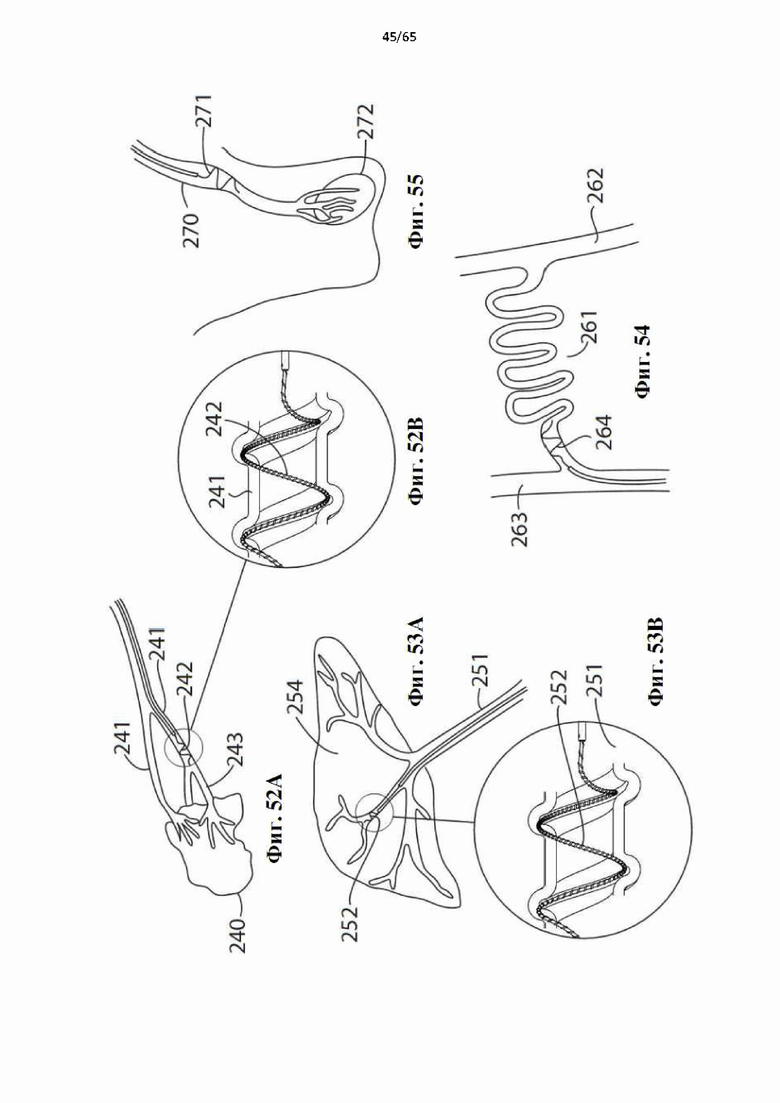
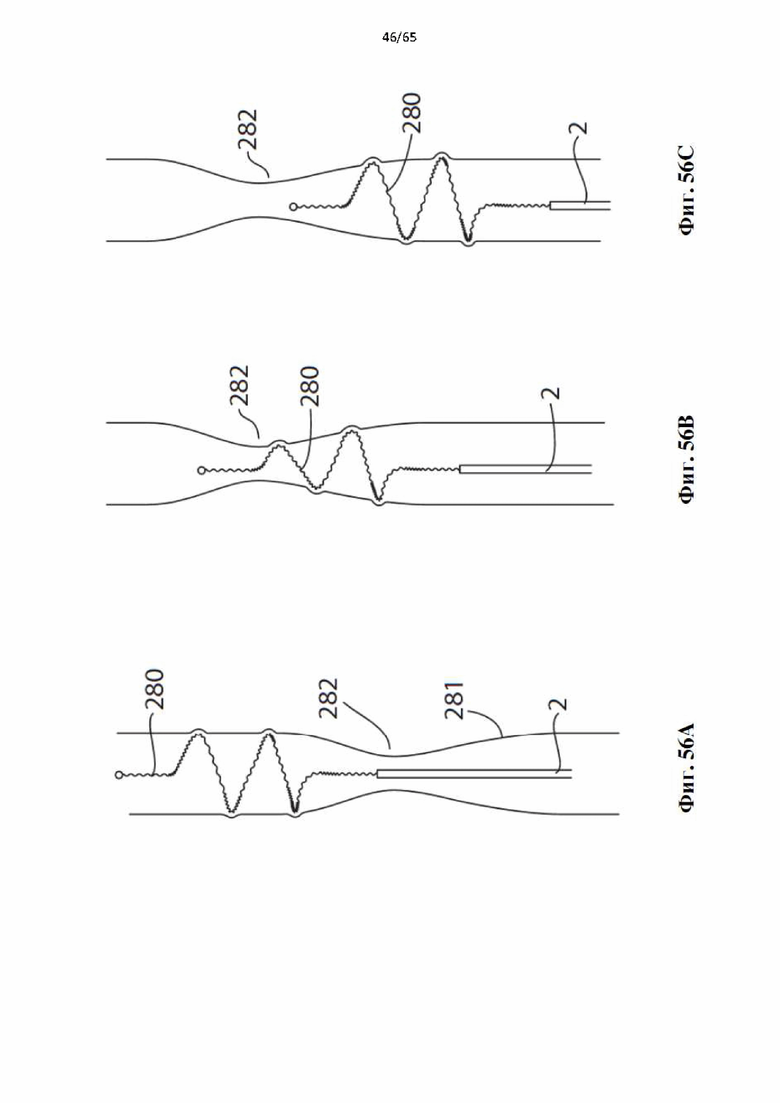
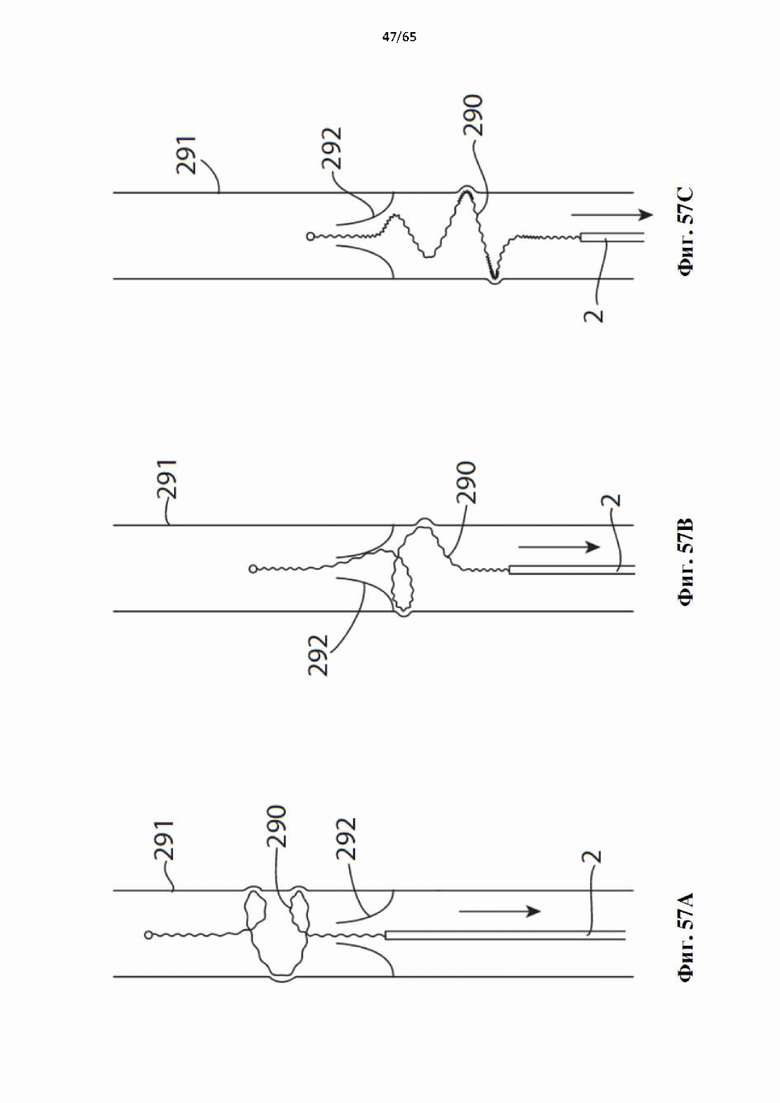
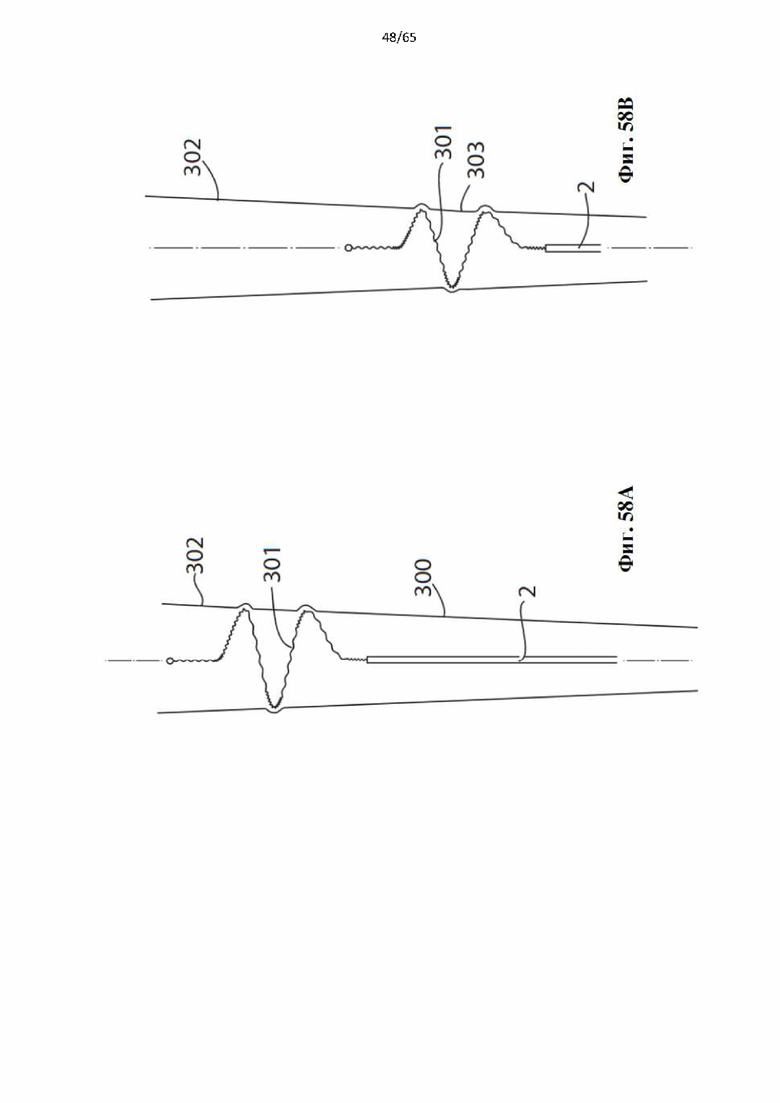
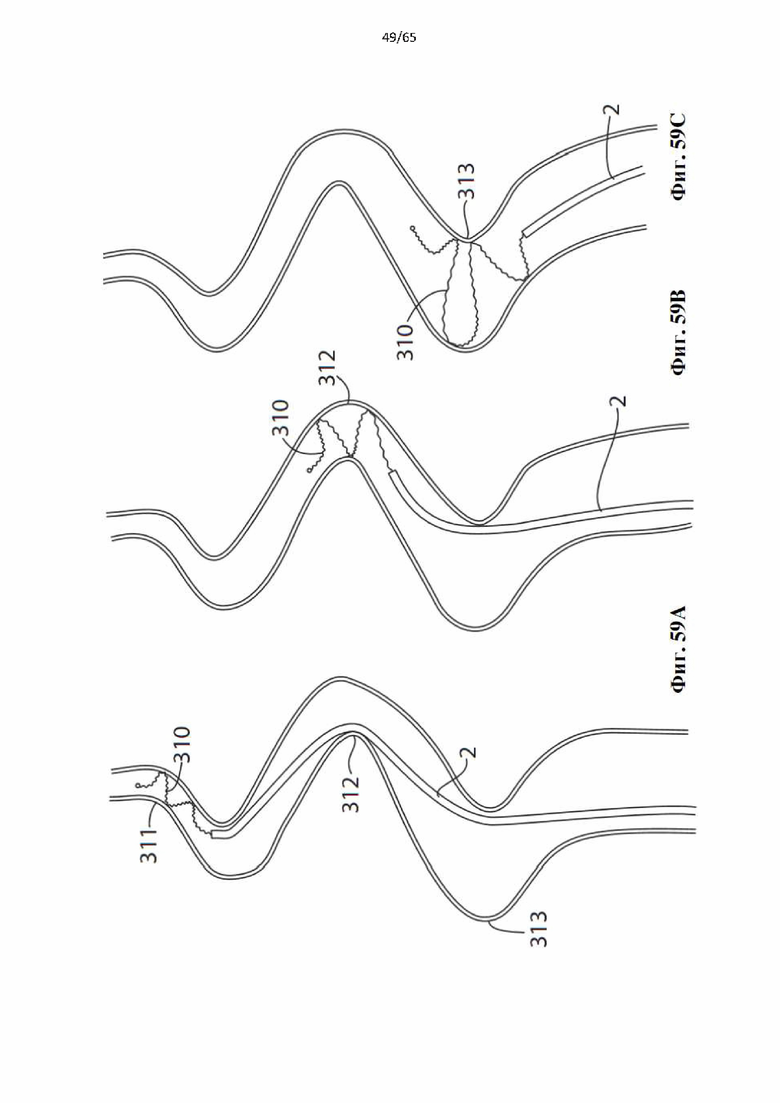
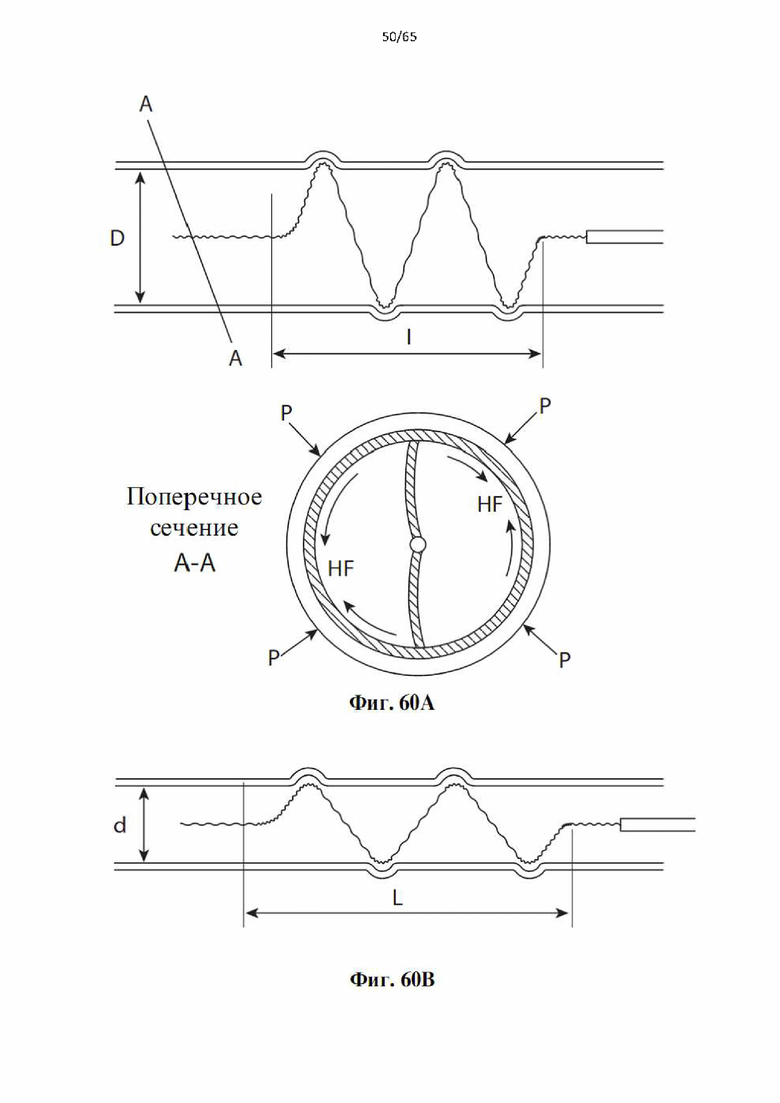
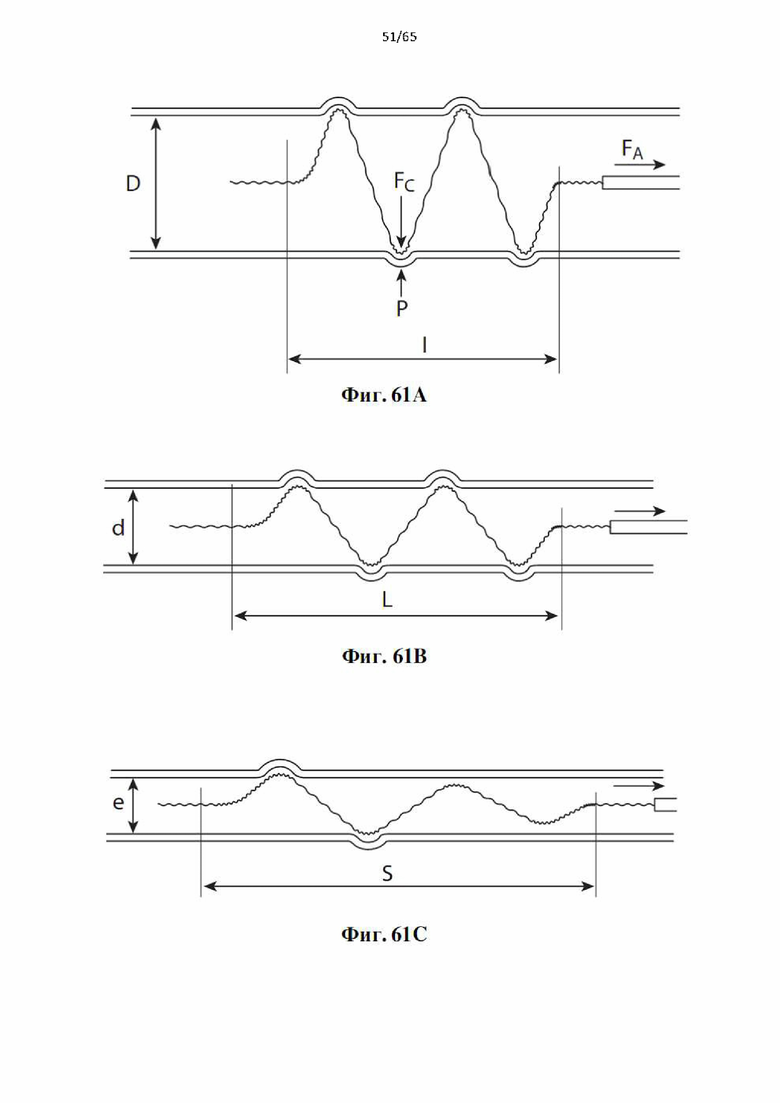
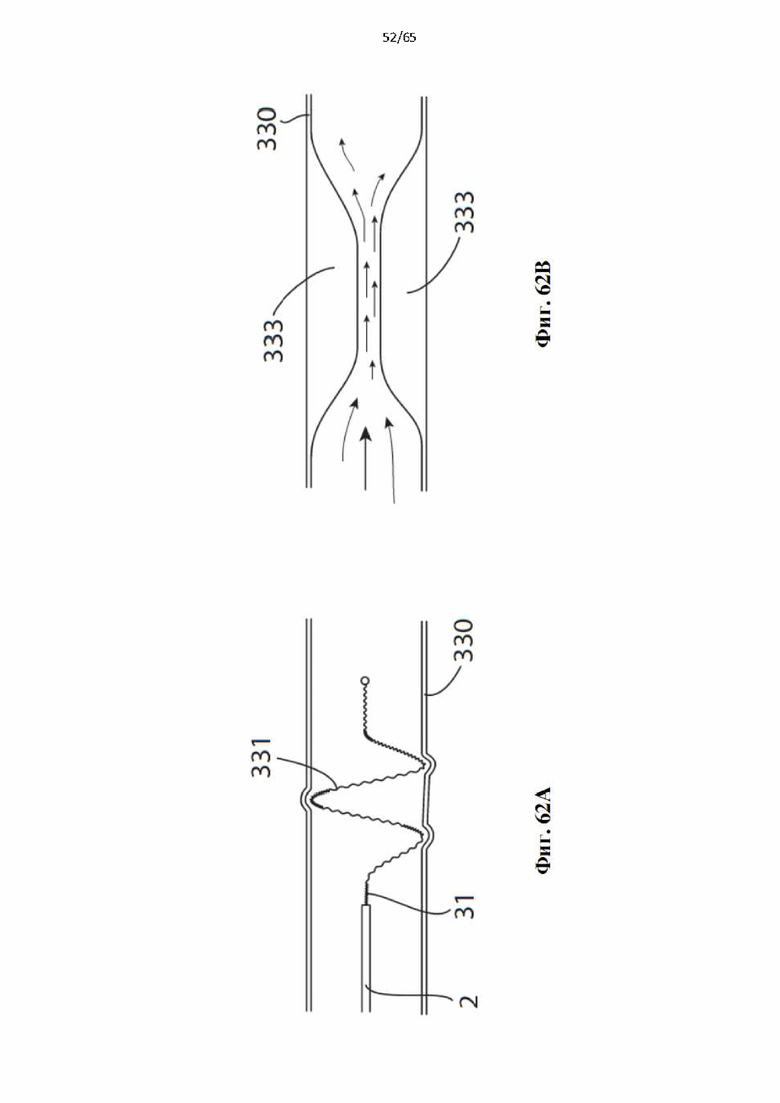
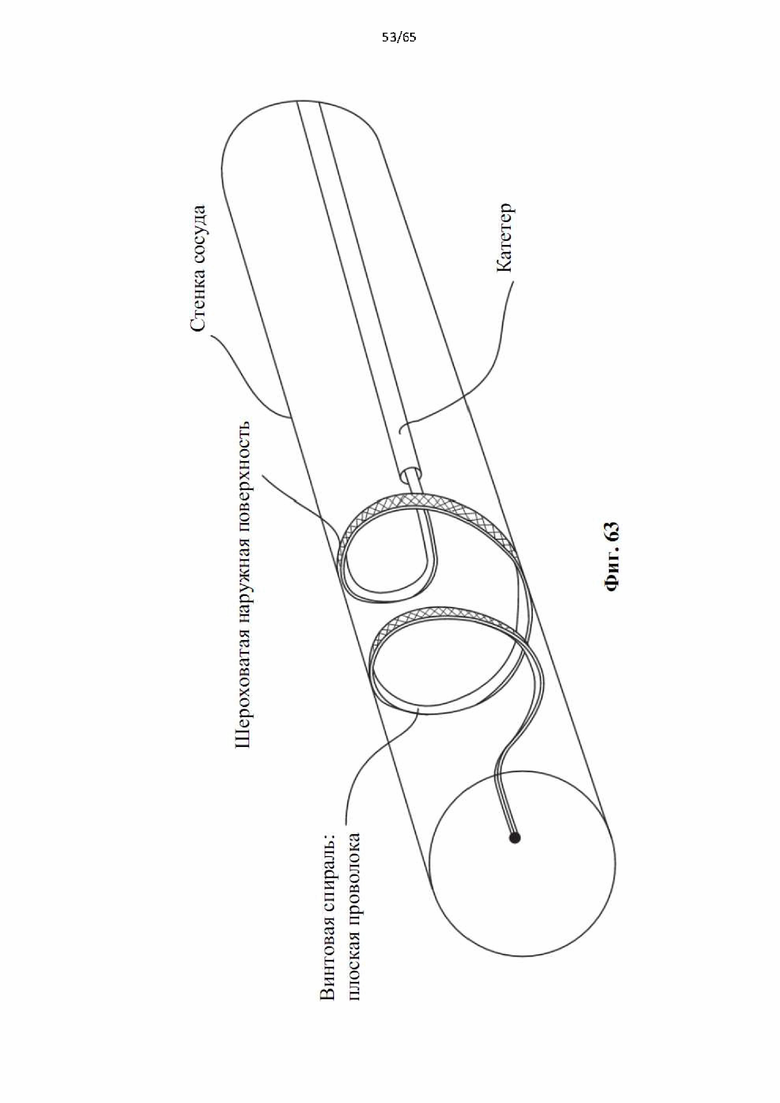
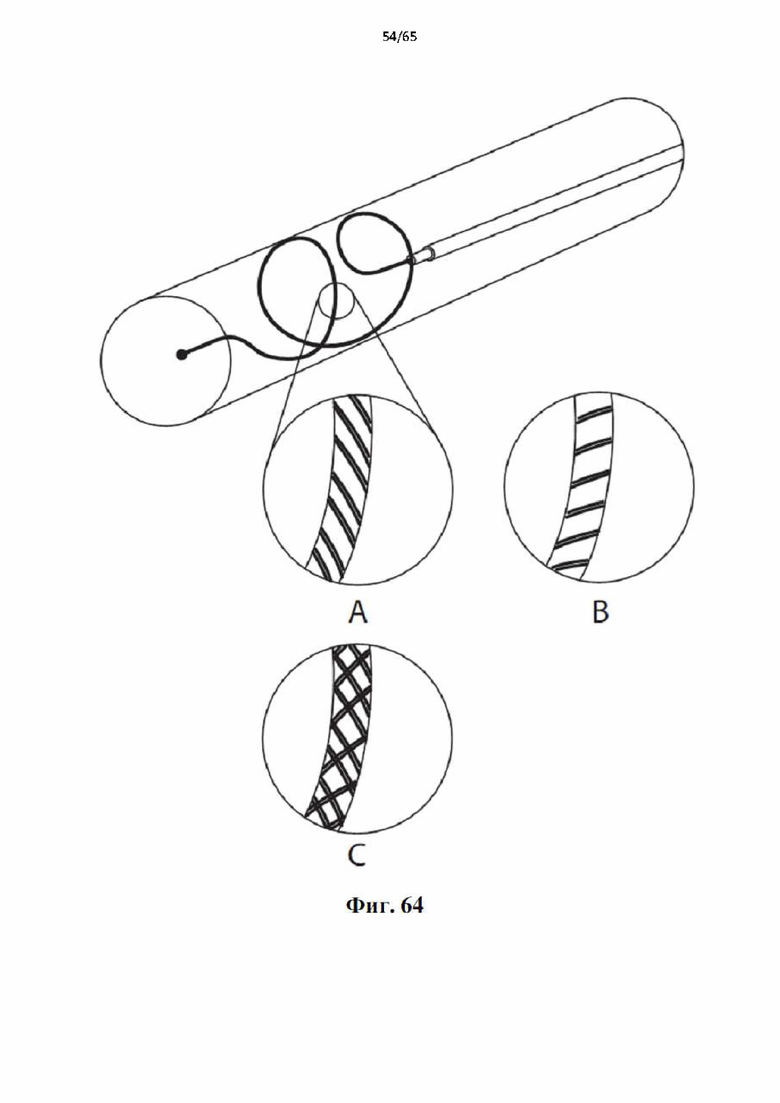
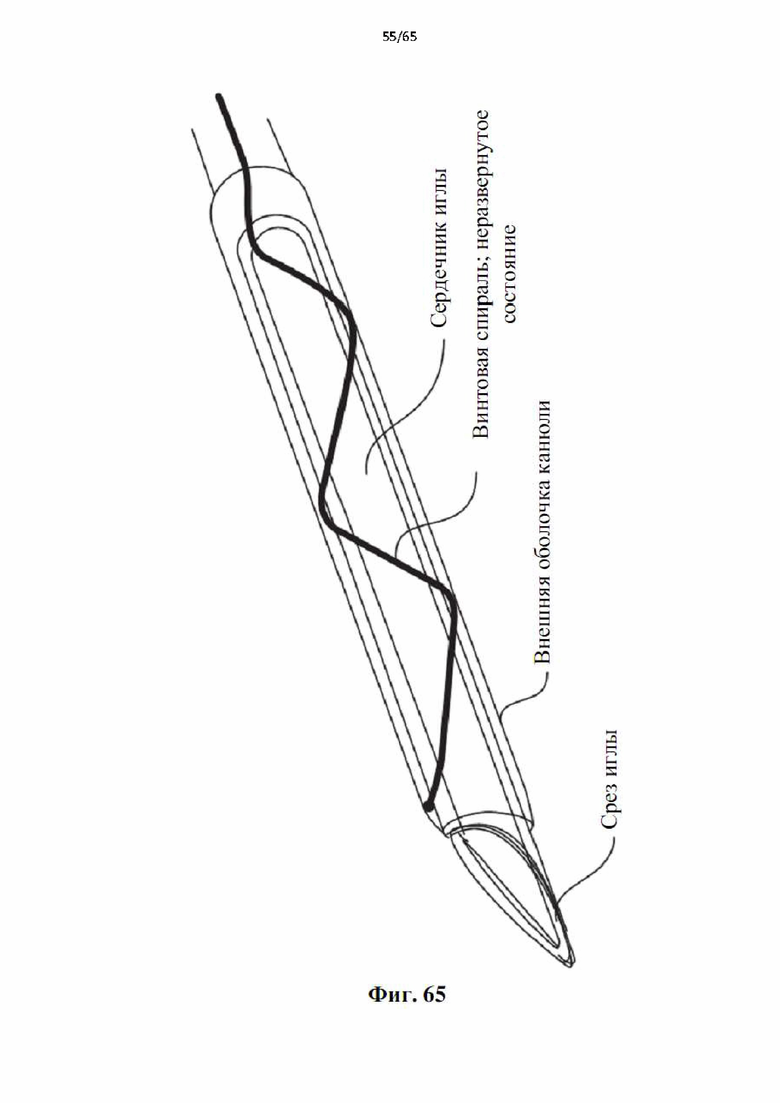
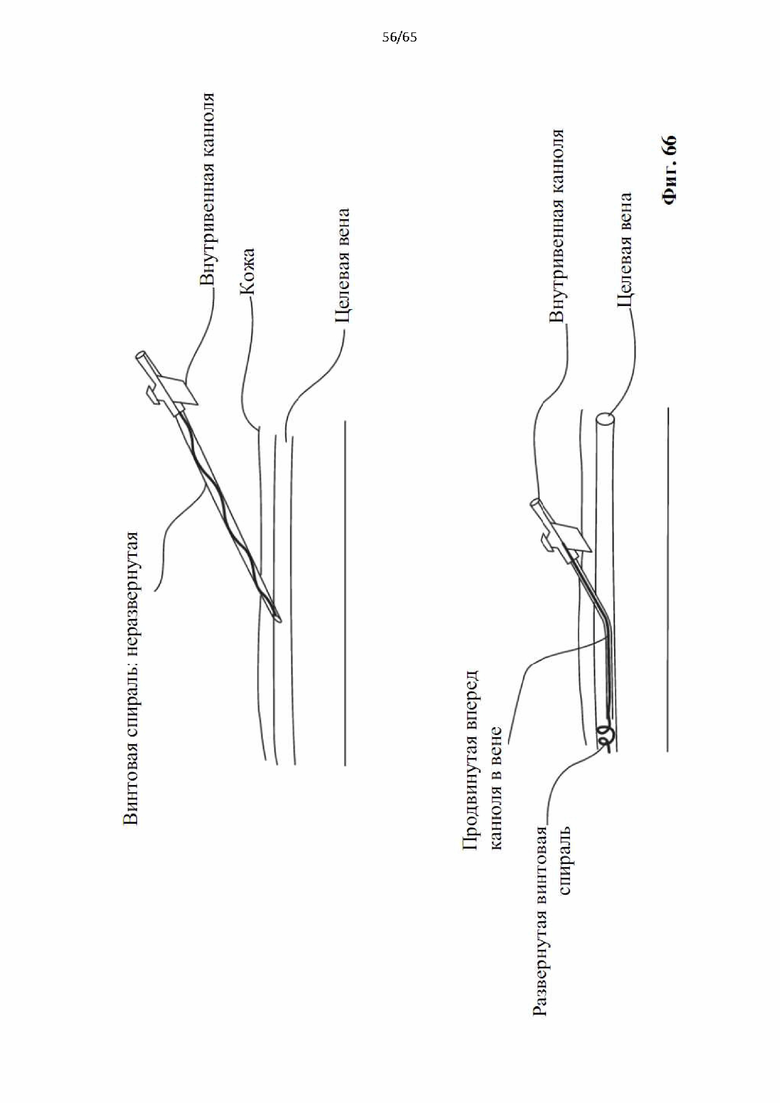
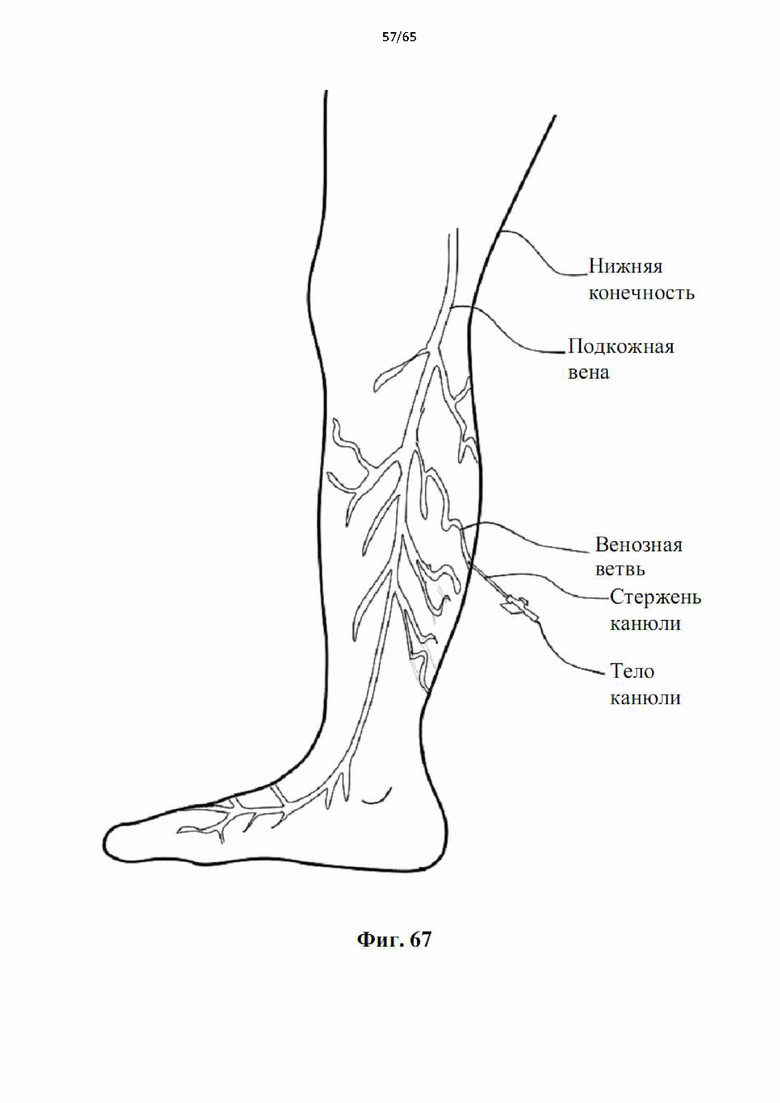

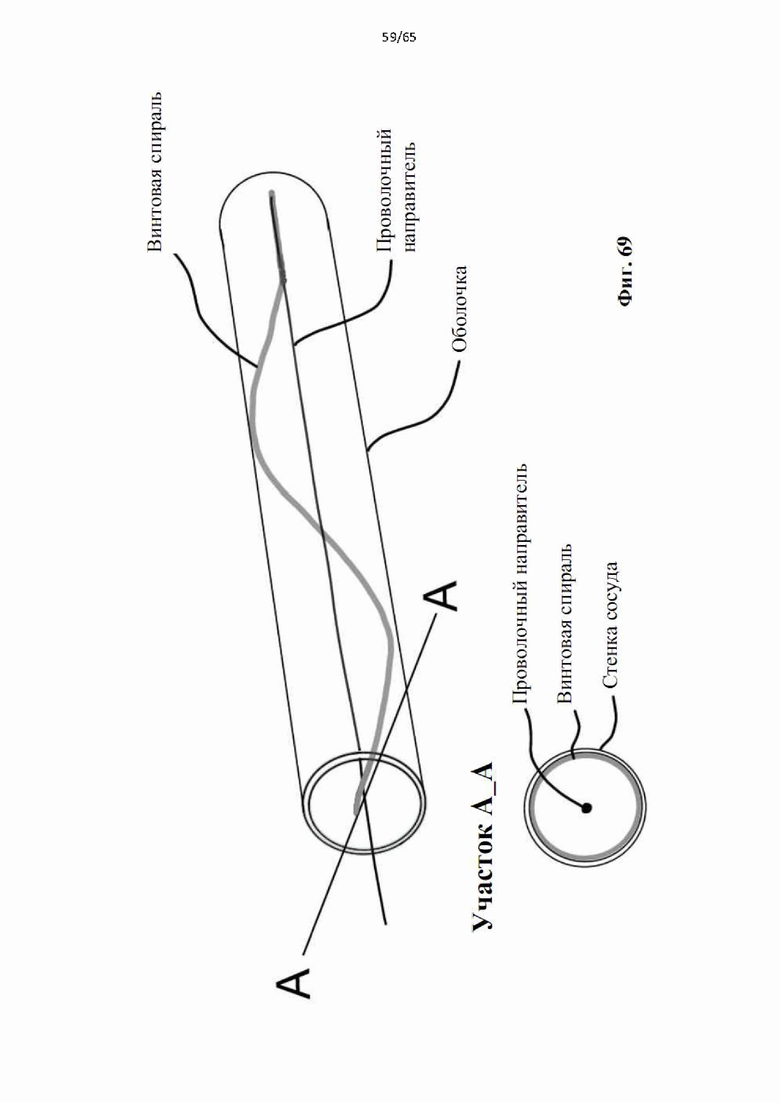
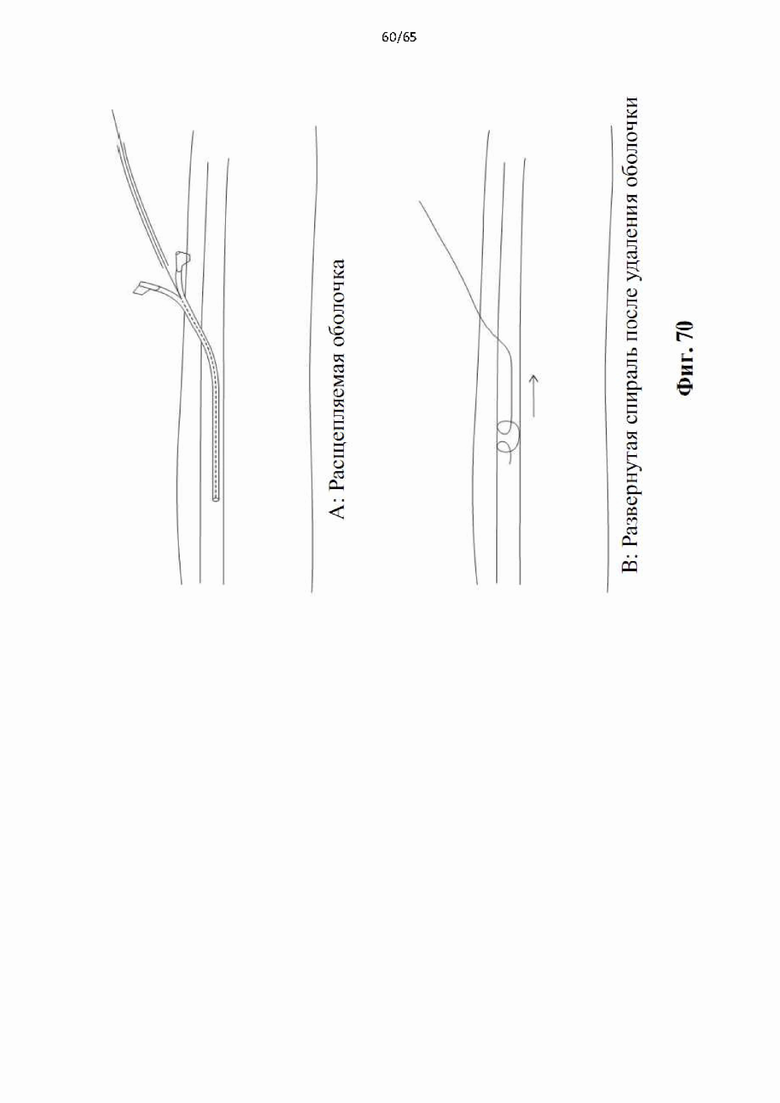
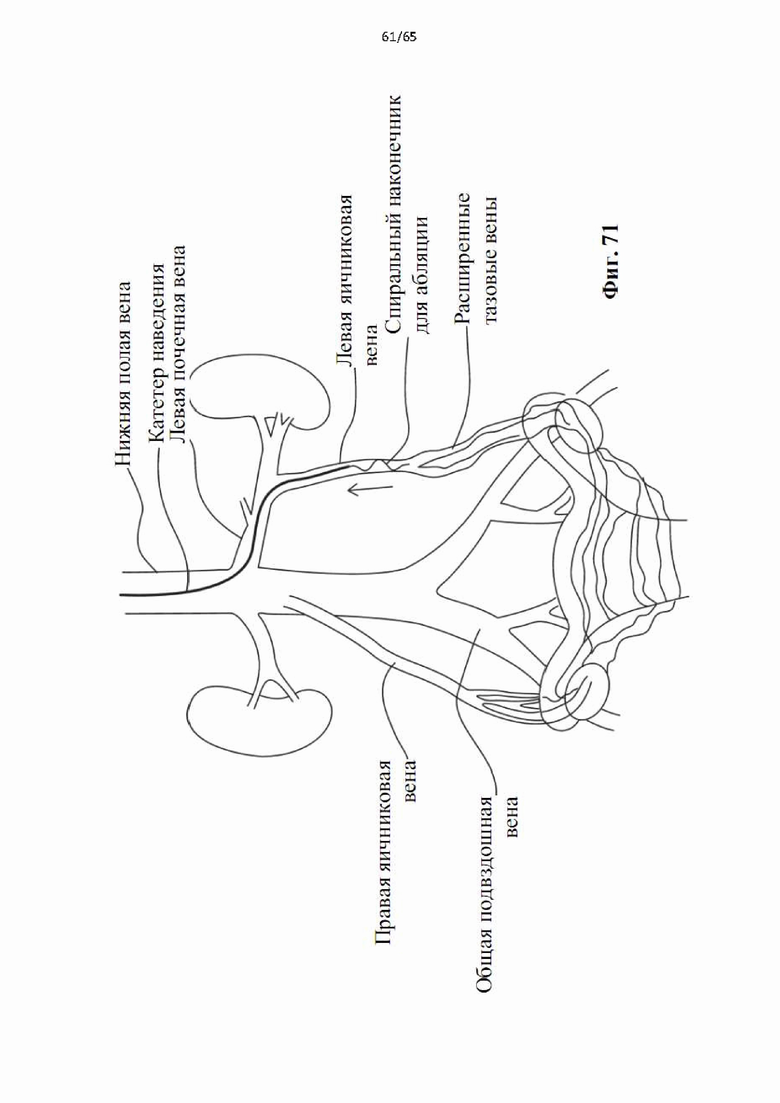
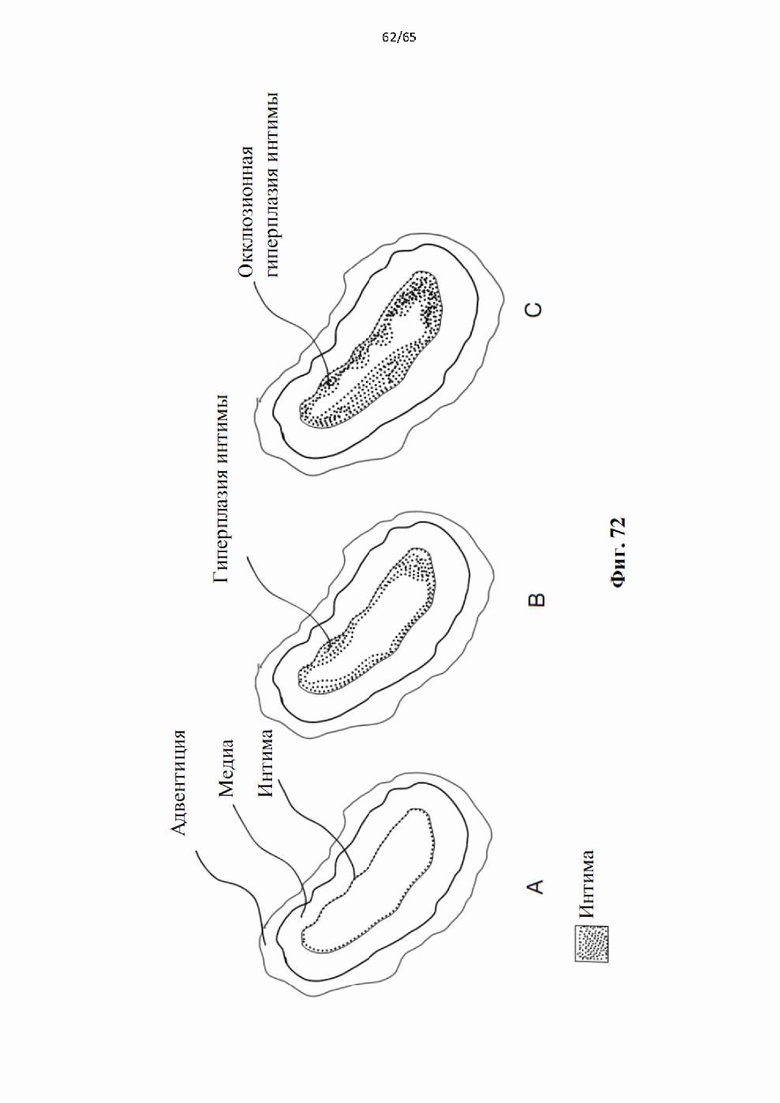
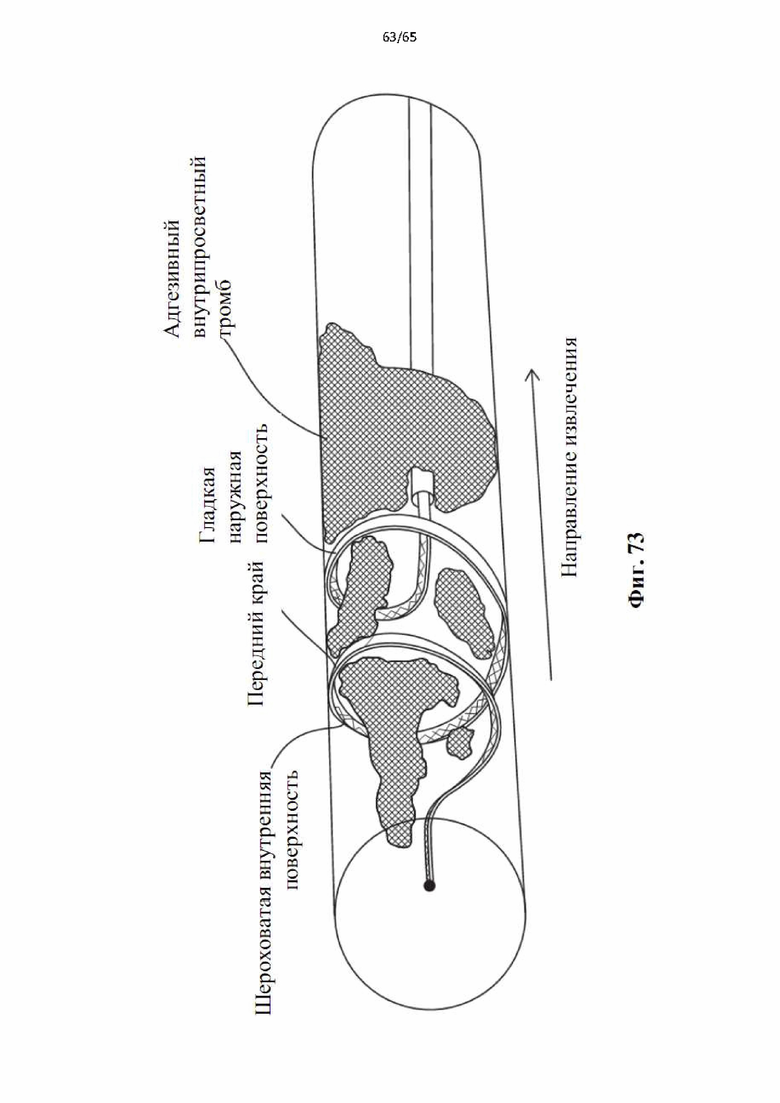
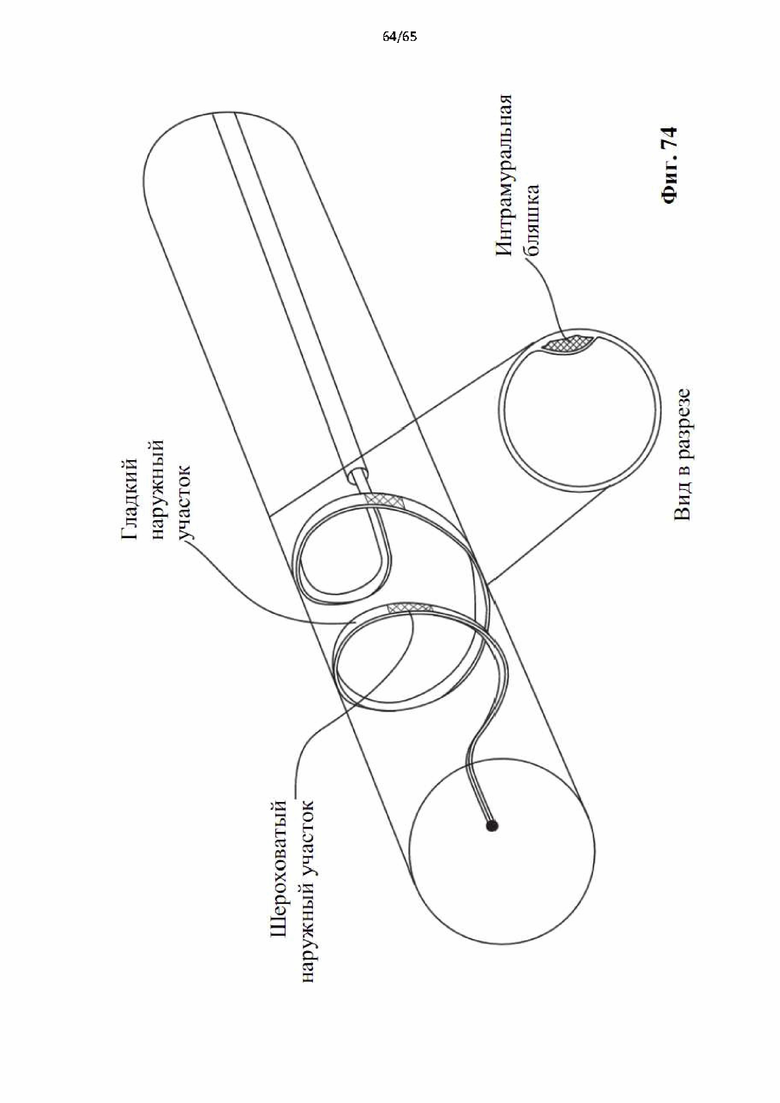
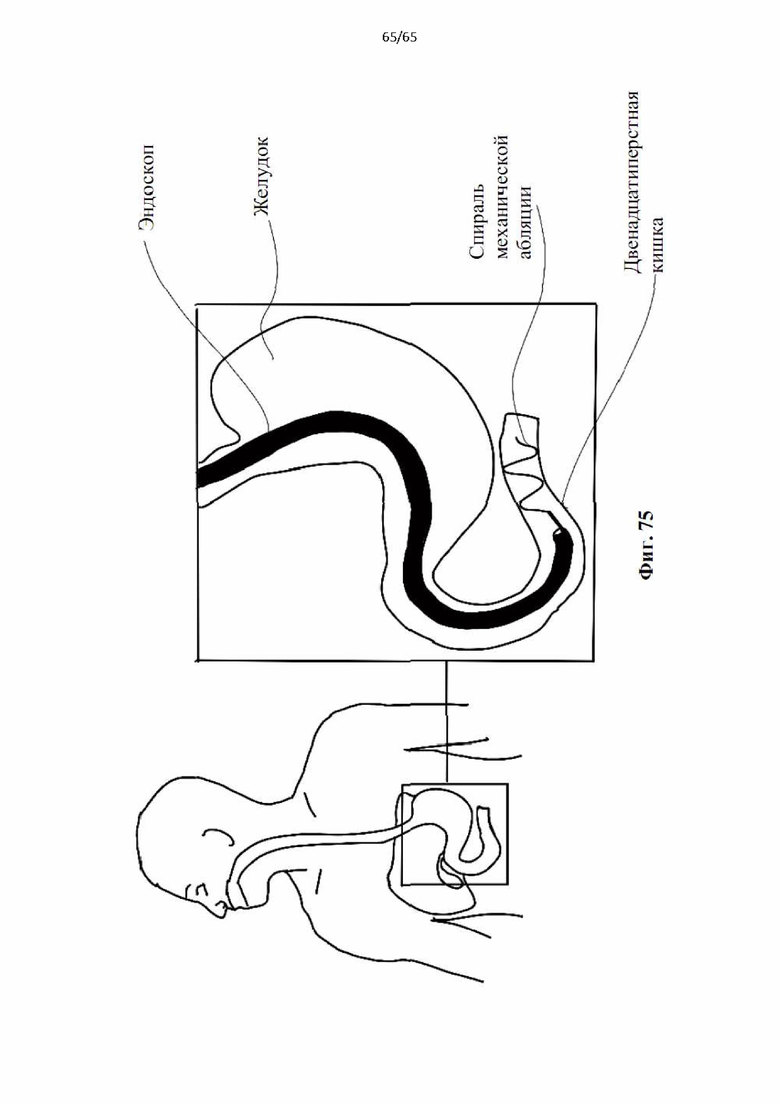
Изобретение относится к медицинской технике, а именно к устройству для денудации просвета полости организма, в частности поверхностной вены. Устройство (1, 30, 40, 50, 60) для денудации вены содержит головку (3) для денудации вены, функционально прикрепленную к удлиненному катетерному элементу (2) и выполненную с возможностью транслюминальной доставки и развертывания в вене. Головка для денудации вены содержит винтовую спираль (4), которая самостоятельно регулируется из раскрученной конфигурации доставки, подходящей для транслюминальной доставки внутри катетерного элемента, и скрученной развернутой конфигурации, которая соприкасается по окружности с внутренним просветом вены в развернутом состоянии. Винтовая спираль имеет внешнюю поверхность соприкосновения с просветом полости организма, которая характеризуется шероховатостью, чтобы срезать или необратимо повреждать внутреннюю выстилку просвета полости организма для круговой денудации внутренней полости, когда спираль перемещается в осевом направлении вдоль просвета полости организма в скрученной развернутой конфигурации. Винтовая спираль в развернутой конфигурации выполнена с возможностью самостоятельной регулировки к изменяющемуся диаметру вены, когда она движется по вене. Внешняя поверхность спирали содержит углубления, обеспечивающие шероховатость поверхности. В соответствии со вторым вариантом устройства винтовая спираль (4) содержит боковые зубцы и в скрученной развернутой конфигурации имеет диаметр больше, чем подлежащая денудации вена. В соответствии с третьим вариантом устройства винтовая спираль (4) характеризуется плоской внутренней и внешней поверхностью и боковыми зубцами. В соответствии с четвертым вариантом устройства винтовая спираль (4) или каждый элемент спирали содержит проволочный проводник, а абразивная поверхность образована второй проволокой, намотанной по спирали вокруг проволочного проводника, чтобы образовать вторую спираль. Изобретение направлено на потребность в устройстве для лечения поверхностного венозного рефлюкса, которое позволяет избежать проблем, связанных с технологиями с использованием способов лечения с термическими, химическими и клеевыми имплантатами известного уровня техники, обеспечивая при этом лучшую в своем классе эффективность по сравнению с термическими вариантами. 4 н. и 50 з.п. ф-лы, 75 ил.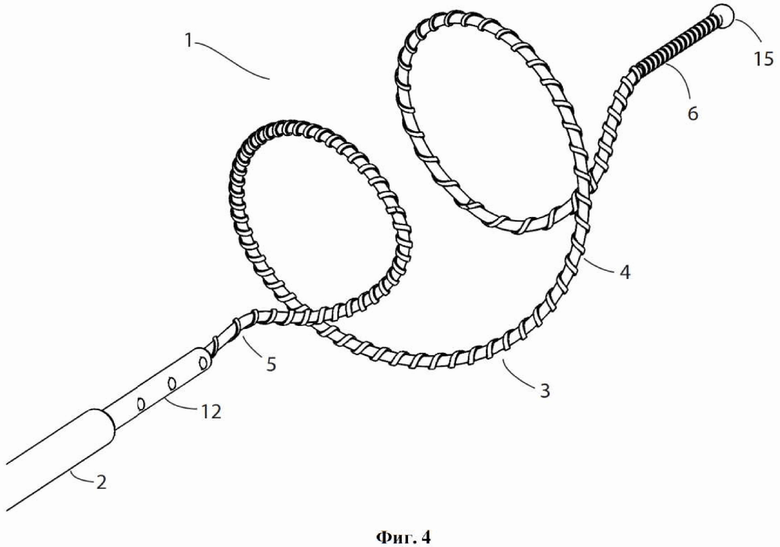
1. Устройство (1, 30, 40, 50, 60) для денудации вены, содержащее головку (3) для денудации вены, функционально прикрепленную к удлиненному катетерному элементу (2) и выполненную с возможностью транслюминальной доставки и развертывания в вене, причем головка для денудации вены содержит винтовую спираль (4), которая самостоятельно регулируется из раскрученной конфигурации доставки, подходящей для транслюминальной доставки внутри катетерного элемента, и скрученной развернутой конфигурации, которая соприкасается по окружности с внутренним просветом вены в развернутом состоянии, причем винтовая спираль имеет внешнюю поверхность соприкосновения с просветом полости организма, которая характеризуется шероховатостью, чтобы срезать или необратимо повреждать внутреннюю выстилку просвета полости организма для круговой денудации внутренней полости, когда спираль перемещается в осевом направлении вдоль просвета полости организма в скрученной развернутой конфигурации, и в которой винтовая спираль в развернутой конфигурации выполнена с возможностью самостоятельной регулировки к изменяющемуся диаметру вены, когда она движется по вене, в котором внешняя поверхность спирали содержит углубления, обеспечивающие шероховатость поверхности.
2. Устройство по п. 1, в котором винтовая спираль характеризуется гладкой внутренней поверхностью.
3. Устройство по п. 1 или 2, в котором головка для денудации вены прикреплена к катетерному элементу без возможности отсоединения.
4. Устройство по п. 1 или 2, в котором винтовая спираль выполнена с возможностью рефлекторной саморегулировки своего диаметра в ответ на переменные диаметры вены и переменные осевые силы во время осевого перемещения вдоль зоны воздействия при сохранении направленной наружу радиальной силы на вену.
5. Устройство по п. 1 или 2, в котором спираль содержит материал с памятью формы и выполнена с возможностью принятия скрученной конфигурации при развертывании.
6. Устройство по п. 1 или 2, в котором устройство содержит удлиненный рычаг управления для головки для денудации вены, расположенной внутри катетерного элемента.
7. Устройство по п. 1 или 2, содержащее одну винтовую спираль.
8. Устройство по п. 1 или 2, в котором винтовая спираль характеризуется наличием 1-3 витков в развернутой конфигурации.
9. Устройство по п. 1 или 2, в котором диаметр винтовой спирали изменяется по ее длине.
10. Устройство по п. 1 или 2, в котором диаметр винтовой спирали увеличивается к одному концу.
11. Устройство по п. 1 или 2, в котором диаметр винтовой спирали увеличивается к проксимальному концу.
12. Устройство по п. 9, в котором диаметр винтовой спирали увеличивается к средней точке вдоль спирали, а затем уменьшается.
13. Устройство по п. 1 или 2, в котором дистальный конец винтовой спирали заканчивается в точке, расположенной вдоль продольной оси винтовой спирали или рядом с ней.
14. Устройство по п. 9, в котором винтовая спираль содержит проксимальный участок первого диаметра, промежуточный участок уменьшенного диаметра относительно проксимального участка и дистальный участок увеличенного диаметра относительно промежуточного участка.
15. Устройство по п. 1 или 2, в котором винтовая спираль содержит проксимальный и дистальный участок винтовой спирали и промежуточный соединительный (переходный) участок, который не является винтовым и может быть прямым или изогнутым.
16. Устройство по п. 1 или 2, в котором один из проксимальных или дистальных участков винтовой спирали представляет собой правовинтовую спираль, а другой из проксимальных или дистальных участков винтовой спирали представляет собой левовинтовую спираль.
17. Устройство по п. 1 или 2, в котором проксимальный участок винтовой спирали представляет собой правовинтовую спираль, а дистальный участок винтовой спирали представляет собой левовинтовую спираль.
18. Устройство по п. 16, в котором дистальный участок винтовой спирали представляет собой правовинтовую спираль, а проксимальный участок винтовой спирали представляет собой левовинтовую спираль.
19. Устройство по п. 1 или 2, в котором винтовая спираль содержит более одного элемента спирали.
20. Устройство по п. 19, в котором элементы винтовой спирали могут быть расположены в виде двойной, тройной или четверной спирали.
21. Устройство по п. 1 или 2, в котором винтовая спираль выполнена с возможностью характеризоваться шагом от 0,5 до 1,5 диаметра винтовой спирали в скрученной конфигурации при развертывании.
22. Устройство по п. 1 или 19, в котором винтовая спираль или элемент винтовой спирали выполнена с возможностью характеризоваться шагом, приблизительно равным диаметру в скрученной конфигурации при развертывании.
23. Устройство по п. 1 или 2, содержащее проксимальную винтовую спираль, разнесенную в осевом направлении от дистальной винтовой спирали, и рычаг управления для винтовых спиралей.
24. Устройство по п. 23, в котором рычаг управления раздвоен на дистальном конце для обеспечения двух дистальных рычагов управления, каждый из которых соединен с одной из винтовых спиралей.
25. Устройство по п. 24, в котором рычаг управления дистальной винтовой спирали проходит в осевом направлении через всю или часть проксимальной винтовой спирали.
26. Устройство по п. 23, в котором проксимальная винтовая спираль характеризуется максимальным диаметром, превышающим максимальный диаметр дистальной винтовой спирали.
27. Устройство по п. 23, в котором проксимальная винтовая спираль характеризуется максимальным диаметром, который меньше максимального диаметра дистальной винтовой спирали.
28. Устройство по п. 23, в котором шаг проксимального и дистального элементов спирали разный.
29. Устройство по п. 28, в котором более узкая винтовая спираль характеризуется большим шагом.
30. Устройство по п. 23, в котором дистальная и/или проксимальная винтовая спираль является конической.
31. Устройство по п. 23, в котором дистальная и проксимальная винтовые спирали являются коническими.
32. Устройство по п. 23, в котором диаметр винтовой спирали увеличивается в проксимальном направлении.
33. Устройство по п. 1 или 2, в котором спираль характеризуется профилем, выбранным из круглого, овального, изогнутого, выпуклого, вогнутого, Т-образного или перевернутого Т-образного.
34. Устройство по п. 1 или 2, в котором спираль характеризуется наличием плоской внутренней поверхности и внешней поверхности, которая не является плоской, изогнутой, вогнутой, выпуклой или перевернутой Т-образной формы.
35. Устройство по п. 1 или 2, в котором шероховатая поверхность винтовой спирали образована обработкой поверхности спирали для придания шероховатости поверхности.
36. Устройство по п. 1 или 2, в котором шероховатость поверхности достигается за счет механического, электрического или химического истирания.
37. Устройство по п. 1 или 2, в котором углубления выполнены с возможностью образования зубцов на поверхности.
38. Устройство по п. 1 или 2, в котором углубления представляют собой поперечные углубления.
39. Устройство по п. 38, в котором поперечные углубления полностью проходят через внешнюю поверхность спирали.
40. Устройство по п. 1 или 2, в котором винтовая спираль характеризуется вогнутым профилем, а поперечные углубления расположены на каждой стороне внешней поверхности.
41. Устройство по п. 37, в котором углубления являются продольными и проходят полностью или по меньшей мере частично по длине винтовой спирали.
42. Устройство по п. 1, в котором винтовая спираль характеризуется перевернутым Т-образным профилем, в котором зубцы образуют ножку перевернутой Т-образной формы.
43. Устройство по п. 37, в котором зубцы характеризуются профилем, выбранным из треугольного, многоугольного, ромбовидного или другого профиля, выполненного с возможностью соскабливания эпителиального слоя просвета полости организма.
44. Устройство по п. 37, в котором зубцы характеризуются формой ромба, образованной чередующимися наклонными углублениями.
45. Устройство по п. 14, в котором дистальный конец винтовой спирали содержит атравматическую головку.
46. Устройство по п. 1 или 2, причем устройство содержит ручку, функционально соединенную с проксимальным концом катетерного элемента и выполненную с возможностью управления развертыванием и втягиванием винтовой спирали посредством осевой регулировки катетерного элемента относительно винтовой спирали.
47. Устройство по п. 1 или 2, в котором шероховатая внешняя поверхность соприкосновения с просветом полости организма винтовой спирали включает в себя макроабразивную поверхность и микроабразивную поверхность.
48. Устройство по п. 1 или 2, в котором шероховатая внешняя поверхность соприкосновения с просветом полости организма винтовой спирали включает в себя участки, которые характеризуются шероховатостью, и промежуточные участки, которые не характеризуются шероховатостью.
49. Устройство по п. 1 или 2, в котором внутренняя поверхность винтовой спирали характеризуется шероховатостью.
50. Устройство (1, 30, 40, 50, 60) для денудации вены, содержащее головку (3) для денудации вены, функционально прикрепленную к удлиненному катетерному элементу (2) и выполненную с возможностью транслюминальной доставки и развертывания в вене, причем головка для денудации вены содержит винтовую спираль (4), которая самостоятельно регулируется из раскрученной конфигурации доставки, подходящей для транслюминальной доставки внутри катетерного элемента, и скрученной развернутой конфигурации, имеющей диаметр больше, чем подлежащая денудации вена, которая соприкасается по окружности с внутренним просветом вены в развернутом состоянии, причем винтовая спираль имеет внешнюю поверхность соприкосновения с просветом полости организма, которая характеризуется шероховатостью, чтобы срезать или необратимо повреждать внутреннюю выстилку просвета полости организма для круговой денудации внутренней полости, когда спираль перемещается в осевом направлении вдоль просвета полости организма в скрученной развернутой конфигурации, и в которой винтовая спираль в развернутой конфигурации выполнена с возможностью самостоятельной регулировки к изменяющемуся диаметру вены, когда она движется по вене, в котором винтовая спираль содержит боковые зубцы.
51. Устройство (1, 30, 40, 50, 60) для денудации вены, содержащее головку (3) для денудации вены, функционально прикрепленную к удлиненному катетерному элементу (2) и выполненную с возможностью транслюминальной доставки и развертывания в вене, причем головка для денудации вены содержит винтовую спираль (4), которая самостоятельно регулируется из раскрученной конфигурации доставки, подходящей для транслюминальной доставки внутри катетерного элемента, и скрученной развернутой конфигурации, которая соприкасается по окружности с внутренним просветом вены в развернутом состоянии, причем винтовая спираль имеет внешнюю поверхность соприкосновения с просветом полости организма, которая характеризуется шероховатостью, чтобы срезать или необратимо повреждать внутреннюю выстилку просвета полости организма для круговой денудации внутренней полости, когда спираль перемещается в осевом направлении вдоль просвета полости организма в скрученной развернутой конфигурации, и в которой винтовая спираль в развернутой конфигурации выполнена с возможностью самостоятельной регулировки к изменяющемуся диаметру вены, когда она движется по вене, в котором спираль характеризуется плоской внутренней и внешней поверхностью и боковыми зубцами.
52. Устройство (1, 30, 40, 50, 60) для денудации вены, содержащее головку (3) для денудации вены, функционально прикрепленную к удлиненному катетерному элементу (2) и выполненную с возможностью транслюминальной доставки и развертывания в вене, причем головка для денудации вены содержит винтовую спираль (4), которая самостоятельно регулируется из раскрученной конфигурации доставки, подходящей для транслюминальной доставки внутри катетерного элемента, и скрученной развернутой конфигурации, которая соприкасается по окружности с внутренним просветом вены в развернутом состоянии, причем винтовая спираль имеет внешнюю поверхность соприкосновения с просветом полости организма, которая характеризуется шероховатостью, чтобы срезать или необратимо повреждать внутреннюю выстилку просвета полости организма для круговой денудации внутренней полости, когда спираль перемещается в осевом направлении вдоль просвета полости организма в скрученной развернутой конфигурации, и в которой винтовая спираль в развернутой конфигурации выполнена с возможностью самостоятельной регулировки к изменяющемуся диаметру вены, когда она движется по вене, в котором спираль или каждый элемент спирали содержит проволочный проводник, а абразивная поверхность образована второй проволокой, намотанной по спирали вокруг проволочного проводника, чтобы образовать вторую спираль.
53. Устройство по п. 52, в котором вторая проволока характеризуется многоугольным поперечным сечением.
54. Устройство по любому из пп. 1 или 50-52, в котором устройство выполнено с возможностью регулировки между:
конфигурацией доставки, в которой винтовая спираль уложена внутри катетерного элемента в раскрученной конфигурации,
конфигурацией для денудации вены, в которой при применении винтовая спираль развернута в подлежащей воздействию вене в первом осевом положении и прилегает к окружности вены; а также
конфигурацией извлечения, в которой спираль уложена внутри катетерного элемента.
| Топчак-трактор для канатной вспашки | 1923 |
|
SU2002A1 |
| УСТРОЙСТВО ДЛЯ УДАЛЕНИЯ МАТЕРИАЛА И СПОСОБ ПРИМЕНЕНИЯ | 2011 |
|
RU2539720C2 |
| Веноэкстрактор | 1990 |
|
SU1738267A1 |
| ИНСТРУМЕНТ И СООТВЕТСТВУЮЩИЙ СПОСОБ ДЛЯ УДАЛЕНИЯ МАТЕРИАЛА ИЗ ТЕЛА | 2009 |
|
RU2514016C2 |
| Способ защиты переносных электрических установок от опасностей, связанных с заземлением одной из фаз | 1924 |
|
SU2014A1 |
| US 6402745 B1, 11.06.2002 | |||
| ПОЛАЯ КИРПИЧНАЯ ИЛИ КАМЕННАЯ СТЕНА С ЗИГЗАГООБРАЗНОЙ ЖЕЛЕЗОБЕТОННОЙ АРМАТУРОЙ | 1925 |
|
SU5075A1 |
Авторы
Даты
2024-03-05—Публикация
2019-05-20—Подача