Область техники, к которой относится изобретение
Настоящее изобретение относится к области молекулярной биологии и может быть использовано для получения диалкил тиосульфинатов с помощью двухкомпонентной системы пиридоксаль-5'-фосфат-зависимый фермент метионин-γ-лиаза из Clostidium novyi и сульфоксид S-алкил-L-цистеина.
Уровень техники
Сульфоксиды S-алк(ен)ил-L-цистеина - небелковые серосодержащие аминокислоты, обнаруженные в растениях подсемейства луковые. При повреждении клеток этих растений сульфоксиды S-алк(ен)ил-L-цистеина превращаются в соответствующие тиосульфинаты под действием фермента аллииназы (ЕС 4.4.1.4) (А. Stoll, Е. Seebeck. Chemical investigations on alliin, the specific principle of garlic. Adv. Enzymol. 1951, 11, 377-400). Впервые сульфоксид S-аллил-L-цистеина (аллиин) был выделен из чеснока в 1947 году (A. Stoll and Е. Seebeck, Experentia, 1947, 3, 114-115). Аллиин является предшественником большинства активных серосодержащих соединений чеснока, образующихся при измельчении чесночных долек. Важнейшим действующим началом чеснока считается диаллил тиосульфинат (аллицин). Антибактериальные свойства аллицина, выделенного из чеснока, впервые были исследованы Cavallito (C.J. Cavallito, J.H. Bailey. Allicin, the antibacterial principle of Allium sativum. I. Isolation, physical properties and antibacterial action. J. Am. Chem. Soc. 1944, 66, 1950-1951). Им же была открыта аллииназа, под действием которой аллиин превращается в аллицин. В клетках чесночной дольки аллииназа содержится в вакуолях, отгороженных от цитоплазмы собственными мембранами, в то время как аллиин равномерно распределен в цитоплазме. Разрушение чесночной клетки ведет к контакту аллииназы и аллиина, в результате чего образуется аллицин. Аллицин - гидрофобная липофильная молекула, обладающая множеством биологических активностей и легко проходящая через клеточные мембраны. Аллицин влияет на множество биологических процессов, в частности в достаточной дозе он оказывает цитотоксическое действие (C.J. Cavallito, J.H. Bailey. Allicin, the antibacterial principle of Allium sativum. I. Isolation, physical properties and antibacterial action. J. Am. Chem. Soc. 1944, 66, 1950-1951). Образование аллицина является защитным механизмом растений (чеснока, лука и других представителей подсемейства) от почвенных бактерий, грибков, червей и т.д. Более высокая эффективность аллицина по отношению к микроорганизмам объясняется наличием у теплокровных больших количеств глутатиона, нейтрализующего аллицин. Позже были выделены еще три сульфоксида из лука: сульфоксид S-метил-L-цистеина (метиин), сульфоксид S-пропил-L-цистеина (пропиин), сульфоксид S-тиранс-1-пропенил-L-цистеина (изоаллиин), сульфоксид S-этил-L-цистеина (этиин) из различных растений подсемейства луковые (R. Kubec, М. Svobodova and J. Velisek. Distribution of S-Alk(en)ylcysteine sulfoxides in some Allium species. Identification Of a new flavor precursor: S-ethylcysteine sulfoxide (Ethiin). J. Agric. Food Chem., 2000, 48, 428-433 doi: 10.1021/jf990938f), сульфоксид S-бензил-L-цистеина из Petiveria alliacea (R. Kubec, R.A. Musah. Cysteine sulfoxide derivatives in Petiveria alliacea. Phytochemistry 2001, 58, 981-985 doi: 10.1016/s0031-9422(01)00304-1).
Аллицин обладает антигрибковой, антибактериальной, антивирусной и антипротейной актиностями (Ankri S, Mirelman D. Antimicrobial properties of allicin from garlic. Microbes Infect. 1999, 1, 125-129 doi: 10.1016/s1286-4579(99)80003-3; Y. Shadkchan, E. Shemesh, D. Mirelman, T. Miron, A. Rabinkov, M. Wilchek, N. Osherov. Efficacy of allicin, the reactive molecule of garlic, in inhibiting Aspergillus spp.in vitro, and in a murine model of disseminated aspergillosis. J. Antimicrob. Chemother. 2004, 53, 832-836 doi: 10.1093/jac/dkh174.). Действие аллицина отличается от других антибиотиков тем, что он быстро проникает через мембрану бактериальной клетки и модифицирует тиоловые группы белков, многие из которых участвуют в важных метаболических процессах (A. Rabinkov, Т. Miron, L. Konstantinovsky, М. Wilchek, D. Mirelman, L. Weiner. The mode of action of allicin: trapping of radicals and interaction with thiol containing proteins. Biochim. Biophys. Acta (1998) 1379, 233-244. doi: 10.1016/s0304-4165(97)00104-9; A. Miiller, J. Eller, F. Albrecht, P. Prochnow, K. Kuhlmann, J.E. Bandow, A.J. Slusarenko, L. Leichert. Allicin Induces Thiol Stress in Bacteria through S-Allylmercapto Modification of Protein Cysteines. J. Biol. Chem. (2016) 291, 11477-11490 doi: 10.1074/jbc.M115.702308). Также известно, что аллицин способен ингибировать различные линии опухолевых клеток in vitro (K. Hirsch, М. Danilenko, J. Giat, Т. Miron, A. Rabinkov, M. Wilchek, D. Mirelman, J. Levy, Y. Sharoni. Effect of purified allicin, the major ingredient of freshly crushed garlic, on cancer cell proliferation. Nutr. Cancer (2000) 38, 245-254 doi: 10.1207/S15327914NC382J4). Однако, аллицин является химически нестабильной молекулой, чувствительной к нагреванию и имеющей непродолжительный срок хранения, так, при -20°С и при рН около 6, он распадается со скоростью 8% в месяц, по этой причине не существует аллицин-содержащих лекарственных препаратов. Было показано, что тиосульфинаты, имеющие в своем составе более длинные насыщенные алкильные группы, более стабильны, чем соединения с более коротким ненасыщенным заместителем (С. Shen, Н. Xiao, K.L. Parkin, In vitro stability and chemical reactivity of thiosulfinates. J. Agric. Food Chem. (2002) 50(9), 2644-51. doi: 10.1021/jf011013e). Аналоги аллицина - диалкил тиосульфинаты (диметил, диэтил и дипропил тиосульфинаты), полученные путем окисления диалкил дисульфидов перекисью водорода, обладают более высокой термостабильностью по сравнению с аллицином и сходными антибактериальной, противогрибковой и противоопухолевой активностями (R. Leontiev, N. Hohaus, С. Jacob, М.С.Н. Gruhlke, A.J. Slusarenko. A Comparison of the Antibacterial and Antifungal Activities of Thiosulfinate Analogues of Allicin. Sci. Rep. 2018, 8, 6763. doi: 10.1038/s41598-018-25154-9; A. Roseblade, A. Ung, M. Bebawy. Synthesis and in vitro biological evaluation of thiosulfinate derivatives for the treatment of human multidrug-resistant breast cancer. Acta Pharmacol. Sin. (2017) 38, 1353-1368 doi: 10.1038/aps.2016.170). Однако, при хранении синтетические диалкил тиосульфинаты распадаются в течение нескольких дней, поэтому представляет практический интерес получение этих соединений in situ с целью использования их как антимикробных и противоопухолевых агентов.
В европейском патенте ЕР 1404853 В1 (David Michael Williams, Chandra Mohen Pant, Process for the production of allicin//2006) описано получение аллицина при помощи выделенной из чеснока аллииназы. В американском патенте US 6689588 В1 (David Mirelman, Ramat Efal, Meir Wilchek, Talia Miron, Kfar Halm, Aharon Rabinkov, Hephzibah Sivaraman, Garlic alliinase covalently bound to carrier for continuous production of allicin//2004) описано получение значительных количеств аллицина из синтетического субстрата аллиина с помощью очищенной иммобилизованной аллииназы. В американском патенте US 20110027341 А1 (David Mirelman, Aharon Rabinkov, Device for in situ production and topical administration of allicin//2008) описано образование аллицина in situ для местного лечения грибковых инфекций с помощью раздельных твердых носителей, содержащих аллиин и аллииназу. Нестабильность аллицина ограничивает его применение. В связи с этим является актуальным получение более стабильных биологически активных аналогов аллицина. Получение и выделение тиосульфинатов с использованием иммобилизованной аллииназы, выделенной из лука, описано в работе (С. Shen, Н. Xiao, K.L. Parkin, In vitro stability and chemical reactivity of thiosulfinates. J. Agric. Food Chem. (2002) 50(9), 2644-51. doi: 10.1021/jfD11013e). Основным недостатком данного метода является тот факт, что аллииназа, получаемая из растительного сырья, ввиду того, что она является гликопротеином, на сегодняшний день не может быть клонирована.
Метионин-γ-лиаза (КФ 4.4.1.11) является пиридоксаль-5'-фосфат-зависимым ферментом, катализирующим реакцию расщепления L-метионина с образованием метилмеркаптана, аммония и α-кетобутирата (Фигура 1). Метионин-γ-лиаза была выделена из нескольких бактериальных источников, таких как Pseudomonas putida, Citrobacter freundii, Clostridium sporogenes, Clostridium tetani, Porphyromonas gingivalis. Фермент также катализирует реакцию β-элиминирования L-цистеина и его S-замещенных производных. Наличие подобной каталитической активности позволяет использовать метионин-γ-лиазу для синтеза тиосульфинатов из сульфоксидов S-замещенных L-аминокислот (Фигура 2). Ранее нами был клонирован фермент из Clostridium novyi с экспрессией 55% и получен гомогенный препарат с высокой удельной активностью (V.V. Kulikova, Е.А. Morozova, S.V. Revtovich, M.I. Kotlov, N.V. Anufrieva, N.P. Bazhulina, S. Raboni, S. Faggiano, E. Gabellieri, P. Cioni, Y.F. Belyi, A. Mozzarelli, T.V. Demidkina. Gene cloning, characterization, and cytotoxic activity of methionine γ-lyase from Clostridium novyi. Iubmb Life (2017) 69, 9, 668-676. doi: 10.1002/iub.1649). Наличие клонированного фермента метионин-γ-лиазы позволяет получать достаточные количества фермента и использовать его для ферментативного синтеза диалкил тиосульфинатов, обладающих антимикробными свойствами, в смесях с сульфоксидами S-алкил-L-цистеина - метиином, этиином и пропиином. Преимущество использования ферментативного способа заключается в том, что он позволяет получать тиосульфинаты in situ.
Раскрытие сущности изобретения
Настоящее изобретение посвящено способу получения диалкил тиосульфинатов (диметил-, диэтил- и дипропил тиосульфината) в результате реакции β-элиминирования сульфоксидов S-алкил-L-цистеина, катализируемой пиридоксаль-5'-фосфат-зависимой метионин-γ-лиазой из Clostridium novyi (Фигура 3).
В своем первом воплощении изобретение заключается в получении фермента - пиридоксаль-5'-фосфат-зависимой метионин-γ-лиазы из Clostridium novyi.
Во втором воплощении изобретение представляет реакцию β-элиминирования сульфоксидов S-алкил-L-цистеина под действием фермента, приводящую к получению целевых диалкил тиосульфинатов.
Краткое описание фигур и таблиц
Фигура 1. Реакция расщепления L-метионина, катализируемая метионин-γ-лиазой.
Фигура 2. Реакция β-элиминирования сульфоксидов, катализируемая метионин-γ-лиазой.
Фигура 3. Синтез диалкил тиосульфинатов с помощью метионин-γ-лиазы.
Фигура 4. 1Н-ЯМР спектры - а) ферментативной реакции метиина с метионин-γ-лиазой; б) метиина.
Фигура 5. 1Н-ЯМР спектры - а) ферментативной реакции этиина с метионин-γ-лиазой; б) этиина.
Фигура 6. а) 1Н-ЯМР спектр ферментативной реакции пропиина с метионин-γ-лиазой; б) область сигналов от метальных групп, по которым оценивают степень протекания ферментативной реакции; в) 1Н-ЯМР спектр пропиина.
Таблица 1. Выход диалкил тиосульфинатов в реакционной смеси сульфоксидов S-алкил-L-цистеина (10 мг/мл) с метионин-γ-лиазой из Clostridium novyi.
Осуществление изобретения
Целью изобретения являлось создание способа получения антибактериальных диалкил тиосульфинатов из сульфоксидов S-алкил-L-цистеина при помощи метионин-γ-лиазы из Clostridium novyi.
Клетки Escherichia coli BL21(DE3), содержащие ген метионин-γ-лиазы из Clostridium novyi в плазмиде рЕТ28а, выращивали на индуцирующей среде при +37°С с перемешиванием (180 об/мин) в течение 24 ч. Клетки собирали центрифугированием (5000 об/мин) в течение 20 мин, затем разрушали при помощи ультразвука. Полученную суспензию откручивали при 10000 об/мин 30 мин, затем проводили осаждение нуклеиновых кислот с помощью протамин сульфата (Serva). Далее очистку фермента проводили, используя ионообменную хроматографию на колонке с DEAE-сефарозой (GE Healthcare, Швеция), уравновешенной рабочим буфером (0,05 М калий-фосфатный буфер, рН 8,0, содержащий 1 мМ дитиотреитол и 0,1 мМ пиридоксаль-5'-фосфат). Колонку промывали рабочим буфером, содержащим 100 мМ KCl. Фермент элюировали рабочим буфером, содержащим 0,5 М KCl, далее концентрировали и диализовали против рабочего буфера. Чистоту препарата проверяли с помощью ПААГ-электрофореза в денатурирующих условиях по методу Лэммли (U.K. Laemmli. Cleavage of structural proteins during the assembly of the head of bacteriophage T4. Nature (1970) 227(5259):680-5. doi: 10.1038/227680a0). Концентрацию очищенных препаратов определяли спектрофотометрически, используя коэффициент А1%278 = 0,8 (Е.А. Морозова, Н.П. Бажулина, Н.В. Ануфриева, Д.В. Мамаева, Я.В. Ткачев, С.А. Стрельцов, В.П. Тимофеев, Н.Г. Фалеев, Т.В. Демидкина. Кинетические и спектральные параметры взаимодействия Citrobacter freundii метионин-γ-лиазы с аминокислотами. Биохимия (2010) Т. 75. С. 1272-1280). Готовые препараты фермента хранили в рабочем буфере при -20°С. Удельную активность фермента в реакции с L-метионином определяли при +37°С, измеряя скорость образования α-кетобутирата в сопряженной реакции с D-2-гидроксиизокапроатдегидрогеназой по снижению поглощения NADH при 340 нм (Δε=6220 М-1см-1). Реакционная смесь содержала 100 мМ L-метионина, 0,2 мМ NADH, 10 ед D-2-гидроксиизокапроатдегидрогеназы в рабочем буфере. За единицу активности принимали количество фермента, которое катализирует образование 1 мкМ/мин α-кетобутирата.
Сульфоксиды S-алкил-L-цистеина (S-метил-L-цистеин, S-этил-L-цистеин, S-пропил-L-цистеин) были синтезированы, как описано ранее (Е. Morozova, V. Kulikova, A. Rodionov, S. Revtovich, N. Anufrieva, Т. Demidkina. Engineered Citrobacter freundii methionine γ-lyase effectively produces antimicrobial thiosulfinates. Biochimie (2016) 128-129, 92-98. doi: 10.1016/j.biochi.2016.07.007; W.H. Briggs, H. Xiao, K.L. Parkin, C. Shen, I.L. Goldman. Differential inhibition of human platelet aggregation by selected Allium thiosulfmates. (2000) J. Agric. Food Chem. 48, 5731-5735. doi: 10.1021/jf0004412).
Сульфоксиды S-метил-L-цистеина, S-этил-L-цистеина и S-пропил-L-цистеина растворяли в 50 мМ калий-фосфатном буфере, рН 7,4, содержащем 0,1 мМ пиридоксаль-5'-фосфата, смешивали с ферментом и инкубировали 1 час при комнатной температуре. В результате реакции получали раствор, содержащий тиосульфинаты. Для количественного определения тиосульфинатов в смеси использовали метод с 2-нитро-5-тиобензоатом (NTB) (Т. Miron, A. Rabinkov, D. Mirelman, L. Weiner, M. Wilchek. A spectrophotometric assay for allicin and alliinase (alliin lyase) activity: reaction of 2-nitro-5-thiobenzoate with thiosulfmates (1998) Anal. Biochem. 265. 317-325. doi: 10.1006/abio. 1998.2924). К реакционной смеси добавляли раствор NTB в 0,05 М калий-фосфатном буфере, рН 7,4 до конечной концентрации 0,2 мг/мл. Инкубировали 30 минут при комнатной температуре и измеряли оптическое поглощение при 412 нм. Концентрацию тиосульфинатов определяли, используя коэффициент молярного поглощения NTB при 412 нм, равный 28300 М-1см-1. Образование тиосульфинатов подтверждали методом 1Н-ЯМР спектроскопии с использованием упомянутого выше буфера, приготовленного на D2O. Спектры 1Н-ЯМР регистрировали на спектрометре АМХ III-400 (Bruker BioSpin, GmbH, Германия) с рабочей частотой 400 МГц. На Фигуре 4а представлен спектр 1Н-ЯМР ферментативной реакции метиина с метионин-γ-лиазой. Степень конверсии метиина (91,7%) оценивали по соотношению сигналов протонов метальной группы метиина при 2,81 м.д. (Фигура 4б) и протонами одной из метальных групп диметил тиосульфината при 3,06 м.д. (на Фигуре 4а).
На Фигуре 5а представлен спектр 1Н-ЯМР ферментативной реакции этиина с метионин-γ-лиазой. Степень конверсии этиина (81,3%) оценивали по соотношению сигналов протонов метальной группы этиина при 1,13 м.д. (Фигура 5б) и протонами одной из метальных групп диэтил тиосульфината при 1,39 м.д. (Фигура 5а).
На Фигуре 6а представлен спектр 1Н-ЯМР ферментативной реакции пропиина с метионин-γ-лиазой. Из-за слабого различия химических сдвигов метальных групп исходного соединения (Фигура 6б) и продукта (Фигура 6а) происходит наложение сигналов (Фигура 6в). Степень конверсии была оценена по фрагментам сигналов и составила 46,1%.
В следующем Примере описано получение трех тиосульфинатов.
ПРИМЕР L
К раствору сульфоксидов (12,5 мг/мл) S-метил-L-цистеина, S-этил-L-цистеина и S-пропил-L-цистеина в 0,8 мл 50 мМ калий-фосфатного буфера, рН 7,4, содержащего 0,1 мМ пиридоксаль-5'-фосфата, добавляют 0,2 мл раствора метионин-γ-лиазы с концентрацией 2 мг/мл и удельной активностью 40 ед/мг в 50 мМ калий-фосфатном буфере, рН 7,4, содержащем 0,1 мМ пиридоксаль-5'-фосфата. Полученную смесь инкубируют 1 час при комнатной температуре, затем определяют концентрацию диметил тиосульфината, диэтил тиосульфината и дипропил тиосульфината в реакционной смеси (Таблица 1) методом с NTB, для этого к реакционной смеси добавляют раствор NTB в 0,05 М калий-фосфатном буфере, рН 7,4 до конечной концентрации 0,2 мг/мл. Инкубируют 30 минут при комнатной температуре и измеряют оптическое поглощение при 412 нм. Концентрацию тиосульфинатов определяют, используя коэффициент молярного поглощения NTB при 412 нм, равный 28300 М-1см-1. Параллельно проводят реакцию в тех же условиях, с использованием буфера, приготовленного на D2O, далее образцы анализируют методом 1Н-ЯМР спектроскопии. Сигналы продуктов в 1Н-ЯМР спектрах соответствуют литературным данным (R. Leontiev, N. Hohaus, С. Jacob, М.С.Н. Gruhlke, A.J. Slusarenko. A Comparison of the Antibacterial and Antifungal Activities of Thiosulfinate Analogues of Allicin. Sci Rep (2018) 8(1), 6763. doi: 10.1038/s41598-018-25154-9).

| название | год | авторы | номер документа |
|---|---|---|---|
| Химерный фермент на основе L-метионин-гамма-лиазы, слитой с VHH антителом М456, и фрагмент ДНК, кодирующий указанный фермент | 2022 |
|
RU2813802C1 |
| Химерный фермент МГЛ-S3 - метионин-гамма-лиаза, слитая с S3 доменом белка VGF из Vaccinia virus, способ получения МГЛ-S3 и противоопухолевый препарат на основе этого фермента | 2022 |
|
RU2816486C2 |
| СПОСОБ ПОЛУЧЕНИЯ АДЖОЕНА | 2010 |
|
RU2542987C2 |
| Способ получения фермента метионин-гамма-лиазы, противоопухолевое лекарственное средство ГЛФ МГЛ на основе этого фермента и применение этого средства для торможения роста опухоли (варианты) | 2018 |
|
RU2733440C2 |
| АНТИМИКРОБНАЯ КОМПОЗИЦИЯ | 2015 |
|
RU2713182C2 |
| СПОСОБ ПОЛУЧЕНИЯ АХОЕНА | 2015 |
|
RU2695788C2 |
| Способ ингибирования бактериальной цистатионин-γ-лиазы | 2023 |
|
RU2841071C1 |
| Способ лечения спиноцеребеллярной атаксии | 2016 |
|
RU2613765C1 |
| СПОСОБ ПОЛУЧЕНИЯ 5-ФТОР-L-ДОФА | 2023 |
|
RU2817082C1 |
| СПОСОБ ФЕРМЕНТАТИВНОГО ПОЛУЧЕНИЯ L-МЕТИОНИНА ИЗ О-ФОСФО-L-ГОМОСЕРИНА И МЕТАНТИОЛА | 2013 |
|
RU2650859C2 |





Изобретение относится к биотехнологии. Предложен способ получения диалкил тиосульфинатов с помощью реакции β-элиминирования сульфоксидов S-алкил-L-цистеина в присутствии метионин-γ-лиазы из Clostridium novyi при комнатной температуре в калий-фосфатном буфере при рН 7,4. Изобретение обеспечивает эффективное получение диалкил тиосульфинатов. 6 ил., 1 табл., 1 пр.
Ферментативный способ получения диалкил тиосульфинатов с помощью реакции β-элиминирования сульфоксидов S-алкил-L-цистеина в присутствии метионин-γ-лиазы из Clostridium novyi при комнатной температуре в калий-фосфатном буфере, рН 7,4:
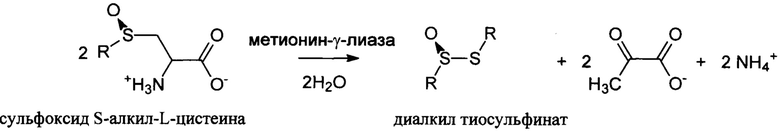
где R представляет собой -СН3, -СН2-СН3, -СН2-СН2-СН3.
| MOROZOVA E.A | |||
| et al | |||
| Engineered Citrobacter freundii methionine γ-lyase effectively produces antimicrobial thiosulfinates | |||
| Biochimie | |||
| Токарный резец | 1924 |
|
SU2016A1 |
| Печь-кухня, могущая работать, как самостоятельно, так и в комбинации с разного рода нагревательными приборами | 1921 |
|
SU10A1 |
| KULIKOVA V.V | |||
| et al | |||
| Gene cloning, characterization, and cytotoxic activity of methionine γ-lyase from Clostridium novyi | |||
| IUBMB Life, 2017, vol | |||
| Способ приготовления пищевого продукта сливкообразной консистенции | 1917 |
|
SU69A1 |
Авторы
Даты
2024-03-11—Публикация
2021-12-29—Подача