ОБЛАСТЬ ИЗОБРЕТЕНИЯ
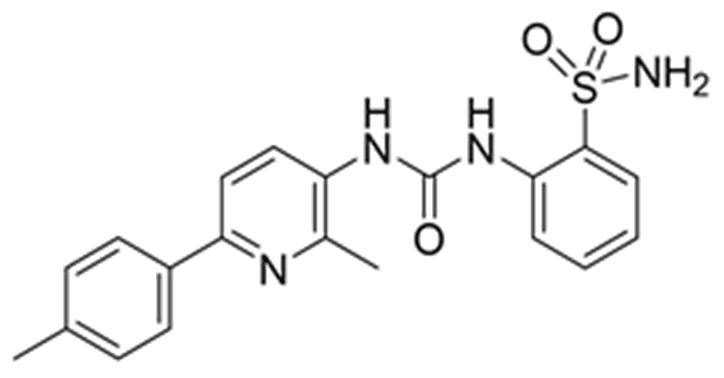
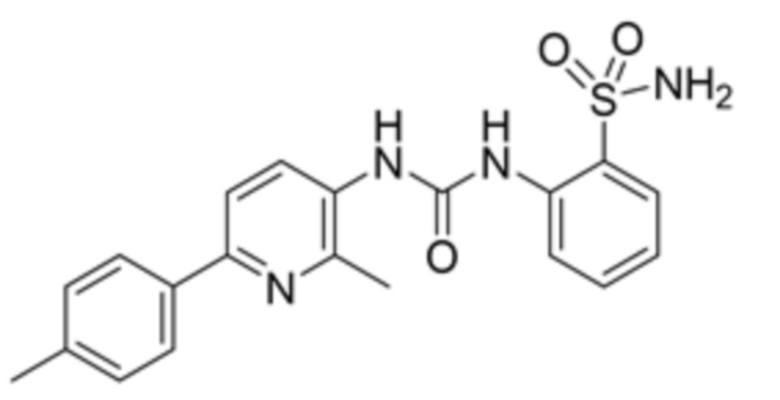
Настоящее изобретение раскрывает и заявляет 2-(3-(2-метил-6-(п-толил)пиридин-3-ил)уреидо)бензолсульфонамид (формула I) в качестве нового низкомолекулярного соединения производного сульфонамида на основе пиридина в качестве ингибитора фермента карбоангидразы IX (CA IX) - белка, сверхэкспрессируемого в раковых тканях. Изобретение также относится к способу синтеза соединения формулы I. Ингибитор карбоангидразы IX человека, описанный в настоящем описании, может использоваться в качестве активного ингредиента в фармацевтических препаратах, используемых в терапии рака. Также описаны и заявляются фармацевтические композиции, содержащие соединение формулы I и способы получения соединения формулы (I).
УРОВЕНЬ ТЕХНИКИ
В настоящей медицинской эре, низкомолекулярные соединения на основе сульфонамида выступают в качестве привлекательного и перспективного класса для разработки новых противораковых средств с эффективной проапоптотической активностью. В качестве средств для терапии злокачественной опухоли одобрены различные производные на основе пиридина, среди них: Регорафениб (Stivarga®), Кризотиниб (Xalkori®) и Сорафениб (Nexavar®) [1-3]. Регорафениб представляет собой пиридин-содержащее биарильное производное мочевины, которое ингибирует несколько ангиогенных киназ, таких как VEGFR-1/3, PDGFRb, FGFR1 и Tie-2 [4]. Регорафениб был одобрен в сентябре 2012 года в качестве средства для терапии метастазирующего рака ободочной и прямой кишки (mCRC) [5]. Описано, что противоопухолевая активность регорафениба опосредуется индукцией апоптоза, помимо его антиангиогенных и антипролиферативных эффектов [6, 7].
Кризотиниб (Xalkori®) представляет собой перорально активный множественный ингибитор рецепторных тирозинкиназ, таких как (ALK), (HGFR, c-Met) и (RON) [8]. FDA одобрило Кризотиниб для лечения взрослых с ранее подвергавшимся лечению положительным по ALK развернутым немелкоклеточным раком легкого [9]. Полагают, что кризотиниб демонстрирует его противораковую активность через апоптоз и другие механизмы [10].
Более того, диарилмочевина является важным фрагментом/фармакофором для разработки низкомолекулярных противораковых средств. Функциональная часть мочевины является основным фармакофорным признаком различных противораковых средств, таких как Линифаниб, Сорафениб и Регорафениб [11].
Карбоангидразы (CA) представляют собой цинковые металлсодержащие ферменты, которые играют важную роль в катализе взаимопревращения диоксида углерода и воды в бикарбонат и протоны [11]. На сегодняшний день известно семь различных семейств CA (α-, β-, γ-, δ-, ζ-, ƞ- и χƟ-CA) [11]. Они существуют в 15 различных изоформах α-CA, выделенных у человека (h), некоторые из которых являются цитозольными (CA I, CA II, CA III, CA VII и CA XIII), другие являются мембраносвязанными (CA IV, CA IX, CA XII, CA XIV и CA XV), две из них являются митохондриальными (CA VA и CA VB), и один изофермент секретируется в слюне (CA VI) [12]. Сверхэкспрессия hCA IX обычно запускается гипоксией в различных типах опухолей, таких как рак молочной железы, глиома и карцинома толстого кишечника [13-15]. Таким образом, ингибирование hCA IX в значительной степени ассоциировано с выраженным подавлением роста первичных опухолей и метастазов, что делает hCA IX валидированной мишенью для лечения разнообразных опухолей [15]. Таким образом, разработка селективных ингибиторов hCA IX является ключевым шагом для разработки эффективного способа лечения злокачественной опухоли, который лишен классических неблагоприятных эффектов, свойственных ингибированию изоформ hCA I и II.
SLC-0111 представляет собой производное сульфонамида на основе диарилмочевины, проходящее клинические испытания фазы I/II для лечения развернутых гипоксических опухолей, осложненных метастазами. SLC-0111 обладает хорошей селективностью в отношении ингибирования трансмембранных связанных с опухолью изоформ hCA IX и XII (относительно цитозольных изоформ hCA I и II) [16-18].
Рак ободочной и прямой кишки является третьим из наиболее смертоносных злокачественных опухолей по всему миру, и он считается четвертой из основных причин смерти. Он составляет более 9% всех случаев злокачественной опухоли [19]. В настоящее время в западных странах смертность от него составляет 10% от связанной со злокачественными опухолями смертности [20], и наиболее высокими частоты встречаемости являются в Австралии, Новой Зеландии, Канаде и США и частях Европы [19]. Кроме того, рак ободочной и прямой кишки в США классифицируется как третий из наиболее распространенных видов рака, диагностируемых как у мужчин, так и у женщин, с приблизительно 101420 новых случаев рака толстого кишечника и 44180 новых случаев рака прямой кишки в США согласно статистике 2019 года The American Cancer, и, согласно ожиданиям, в 2019 году он должен был стать причиной 51020 смертей [21].
Рак ободочной и прямой кишки известен как медленно развивающаяся злокачественная опухоль, которая начинается в качестве опухоли, растущей на внутренней выстилке прямой кишки или толстой кишки, известной как полип, и в конечном итоге дающей начало злокачественной опухоли. Этот полип может образовывать опухоль на стенке прямой кишки или толстой кишки, а затем она может проникать в кровоток или лимфатические сосуды и распространяться в другие анатомические области, вызывая метастазы. Значительное большинство (более 95%) случаев рака ободочной и прямой кишки классифицируют как аденокарциномы. Они начинаются в производящих слизь железах, выстилающих толстую кишку и прямую кишку [22].
В международном патентном документе WO2008071421A1, ингибиторы карбоангидразы, являющиеся нитропроизводными, описаны в качестве потенциальных ингибиторов нескольких изоформ карбоангидразы, включая изоформы IX и XII. Однако ни одно из этих соединений не является производным пиридина или сульфонамида, и ни одно из них не является в высокой степени селективным в отношении CA IX и/или CA XII.
В международном патентном документе WO2012087115A1 был представлен ряд ароматических сульфонамидов в качестве ингибиторов карбоангидразы IX для химиотерапии и лучевой терапии. В международном патентном документе WO2012175654A1 описаны производные тетралинсульфонамида в качестве селективных ингибиторов CA IX и XII относительно CA I и II.
Несмотря на существование различных передовых хирургических и медикаментозных способов терапии первичного и метастазирующего рака ободочной и прямой кишки, таких как лапараскопическая операция в случае первичного заболевания; резекция при метастазирующем заболевании; лучевая терапия при раке прямой кишки и паллиативная химиотерапия, частота излечения и долговременная выживаемость изменились только на небольшой процент более чем за последние десятилетия [20]. Несмотря на то, что было разработано или открыто большое количество различных ингибиторов фермента карбоангидразы, основной проблемой является их неспецифичность и неселективность. В результате неспецифического ингибирования всех форм карбоангидразы, присутствующих в организме человека, ингибиторы, используемые в клинических испытаниях, имеют множество побочных эффектов, включая токсичность. Помимо этого, эти способы терапии вызывают серьезные неблагоприятные эффекты, влияющие на качество жизни пациента. Таким образом, разработка ингибиторов, специфичных к определенной изоформе карбоангидразы человека, все еще остается актуальной и важной задачей. Эти потребности и другие потребности удовлетворяются настоящим изобретением.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Согласно первому аспекту изобретения, предусматривается новый ингибитор карбоангидразы формулы I или его фармацевтически приемлемые соли. Более того, это новое низкомолекулярное соединение (формула I) представляет собой производное сульфонамида на основе пиридина и является специфическим ингибитором ассоциированной с опухолью карбоангидразы, где этот ингибитор является специфичным к изоформе IX.
Другим аспектом настоящего изобретения является предоставление ингибитора карбоангидразы, характеризующегося высокой селективностью в отношении карбоангидразы IX с выраженным подавлением роста первичных опухолей и метастазов и демонстрирующего очень небольшую токсичность, поскольку концентрация лекарственного средства, используемого для индукции пятидесяти процентов злокачественных клеток, не имеет эффекта на здоровые клетки человека.
Другим аспектом настоящего изобретения является предоставление нетоксичного ингибитора карбоангидразы IX формулы I или его фармацевтически приемлемой соли. Эти соединения не имеют никаких вредных и нежелательных эффектов.
Таким образом, широкий вариант осуществления изобретения относится к новому соединению ингибитора карбоангидразы формулы I или его фармацевтически приемлемой соли:
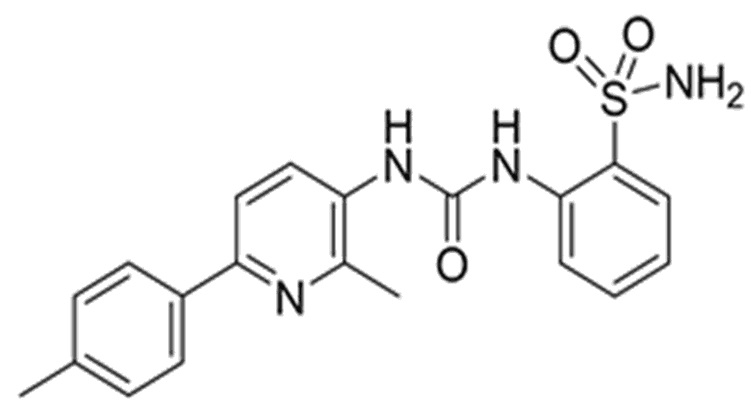
Другим аспектом настоящего изобретения является предоставление специфического ингибитора карбоангидразы для лечения и/или предупреждения пролиферативного нарушения, такого как рак, предпочтительно рак, выбранный из группы, состоящей из злокачественной опухоли молочной железы, шейки матки, яичника, почки, легкого, пищевода, ободочной и прямой кишки, мочевого пузыря, предстательной железы, головного мозга, и более предпочтительно рак ободочной и прямой кишки, где соединение характеризуется нацеливанием на карбоангидразу IX.
Другим аспектом настоящего изобретения является предоставление способа органического синтеза для получения соединения формулы I.
Изобретение может использоваться для получения лекарственного средства, пригодного для лечения и/или предупреждения нарушений вследствие ингибирования сверхэкспрессии карбоангидразы IX.
Другим аспектом настоящего изобретения является предоставление фармацевтической композиции, содержащей фармацевтический носитель и терапевтически эффективное количество соединения формулы I или его фармацевтически приемлемую соль.
Следующий аспект настоящего изобретения относится к нетерапевтическому применению соединения формулы I для диагностики и/или мониторинга пролиферативных нарушений, таких как рак, предпочтительно рак ободочной и прямой кишки.
Эта задача и другие задачи настоящего изобретения станут понятными из прилагаемого обсуждения изобретения, которое следует далее.
Краткое описание чертежей
Настоящее изобретение иллюстрируется прилагаемыми чертежами, где:
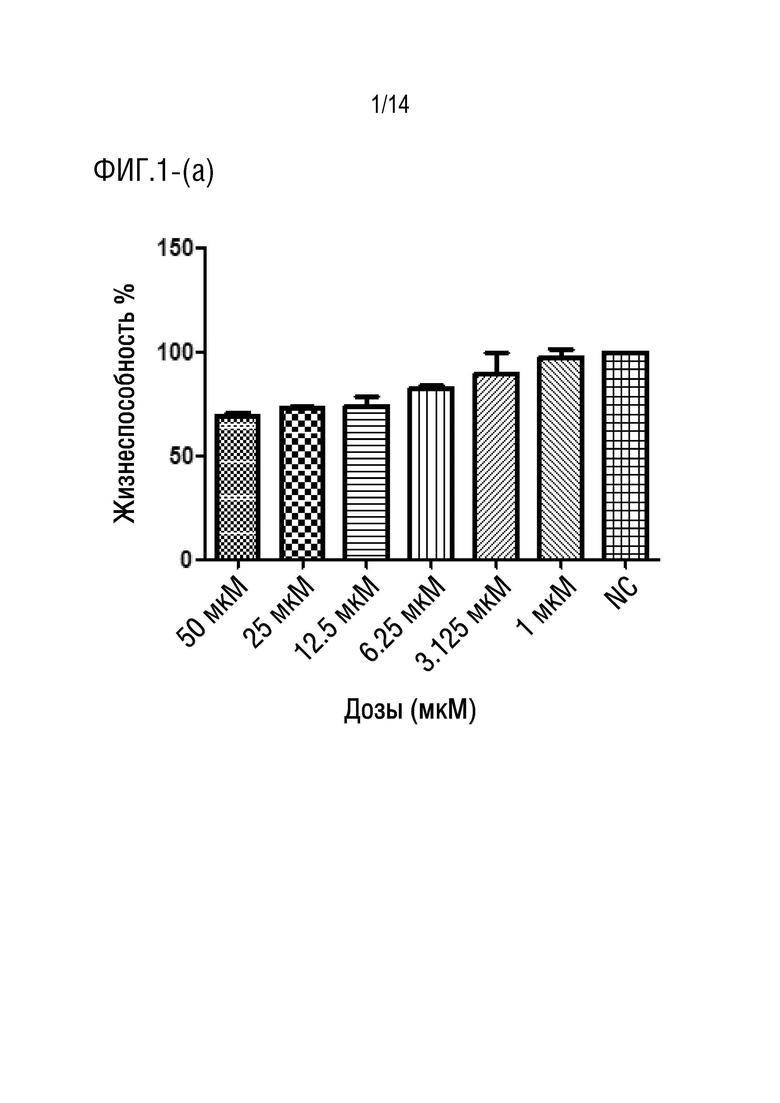
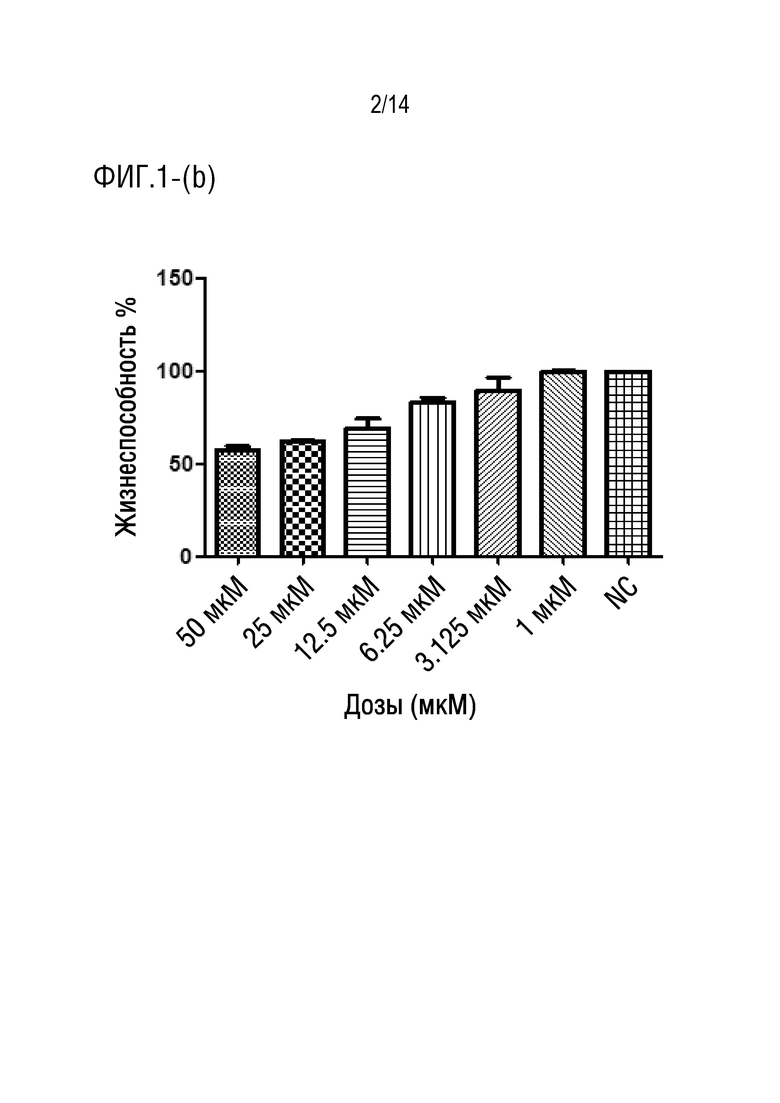
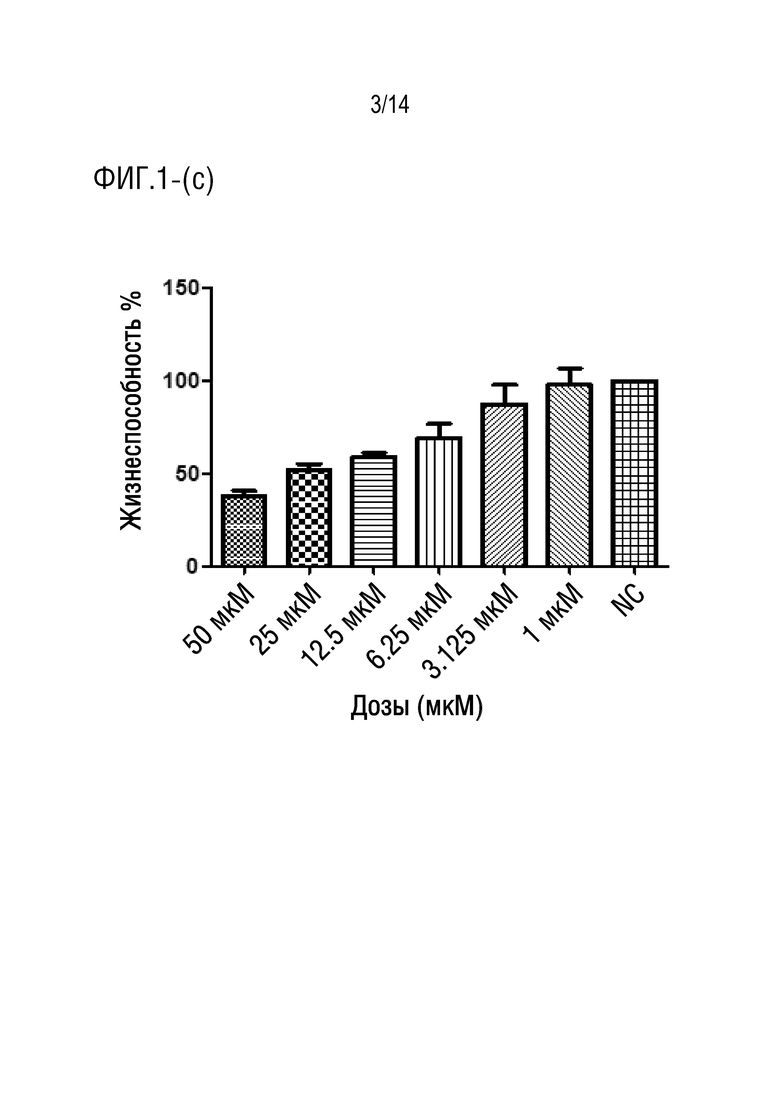
На фиг.1 представлена иллюстрация процента жизнеспособных клеток HCT116, обработанных соединением формулы 1 (a) через 24 ч (P < 0,0001), (b) через 48 ч (P < 0,0001) (c) через 72 ч (P < 0,0001).
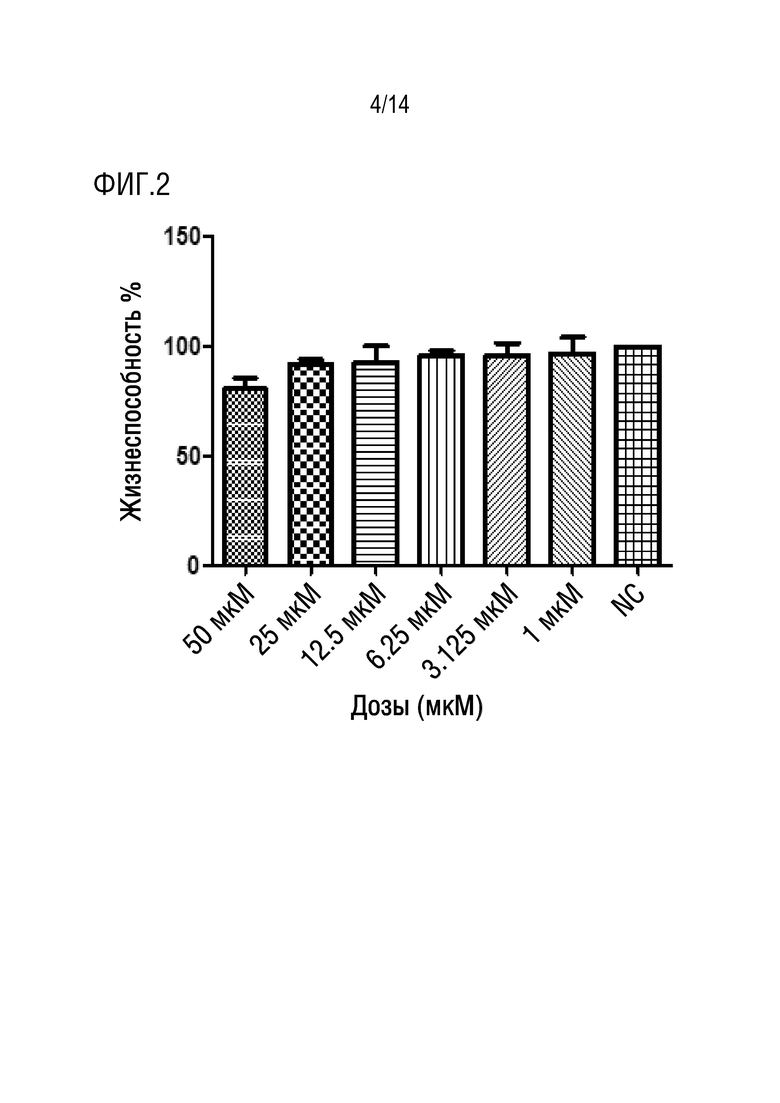
На фиг.2 приводится иллюстрация процентной жизнеспособности клеток HUVEC, обработанных соединением формулы I в течение 72 часов (нет значимых отличий).
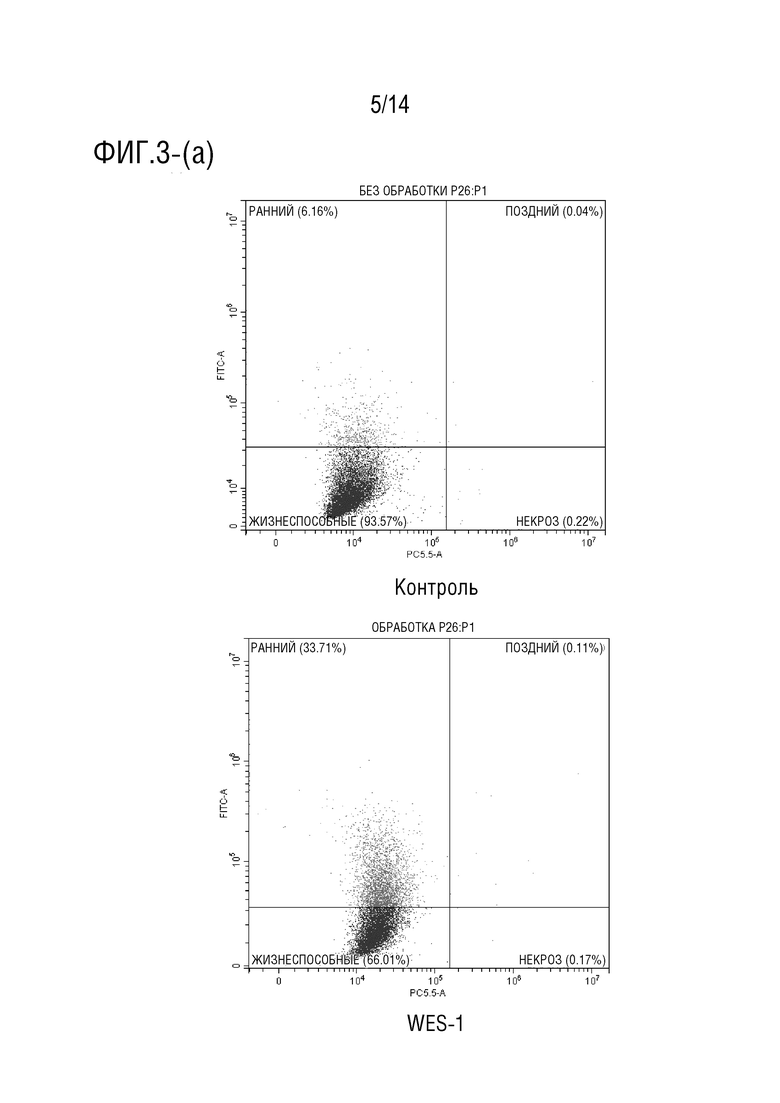
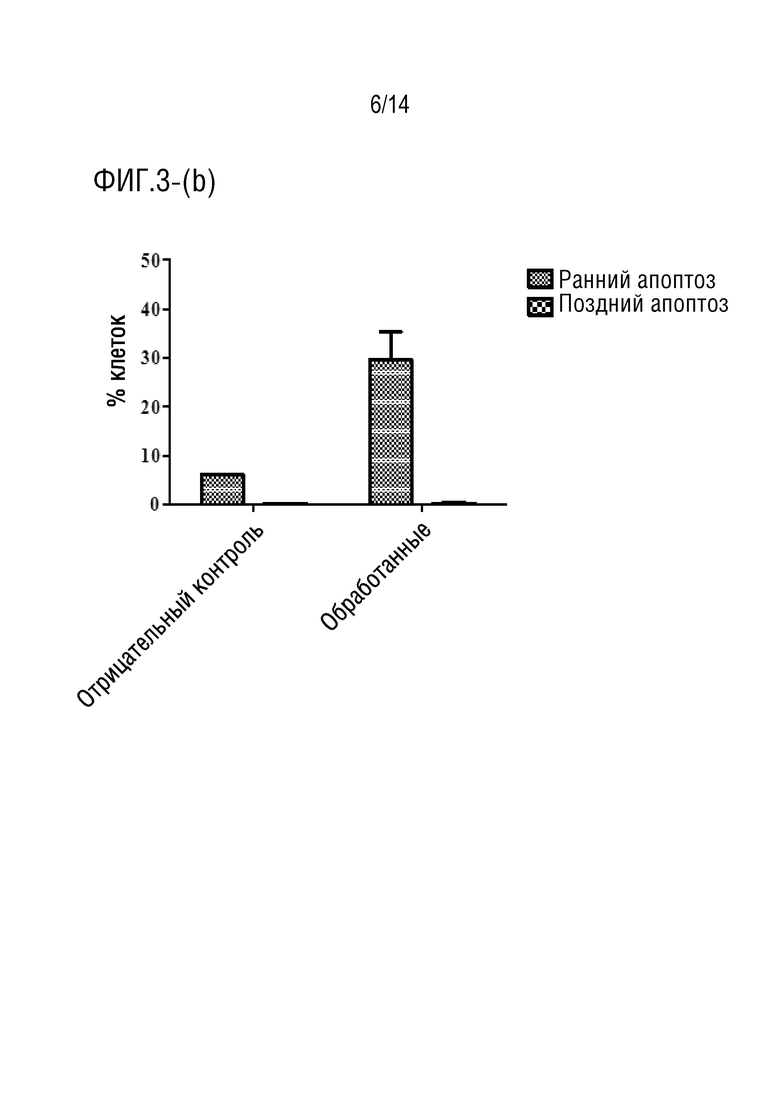
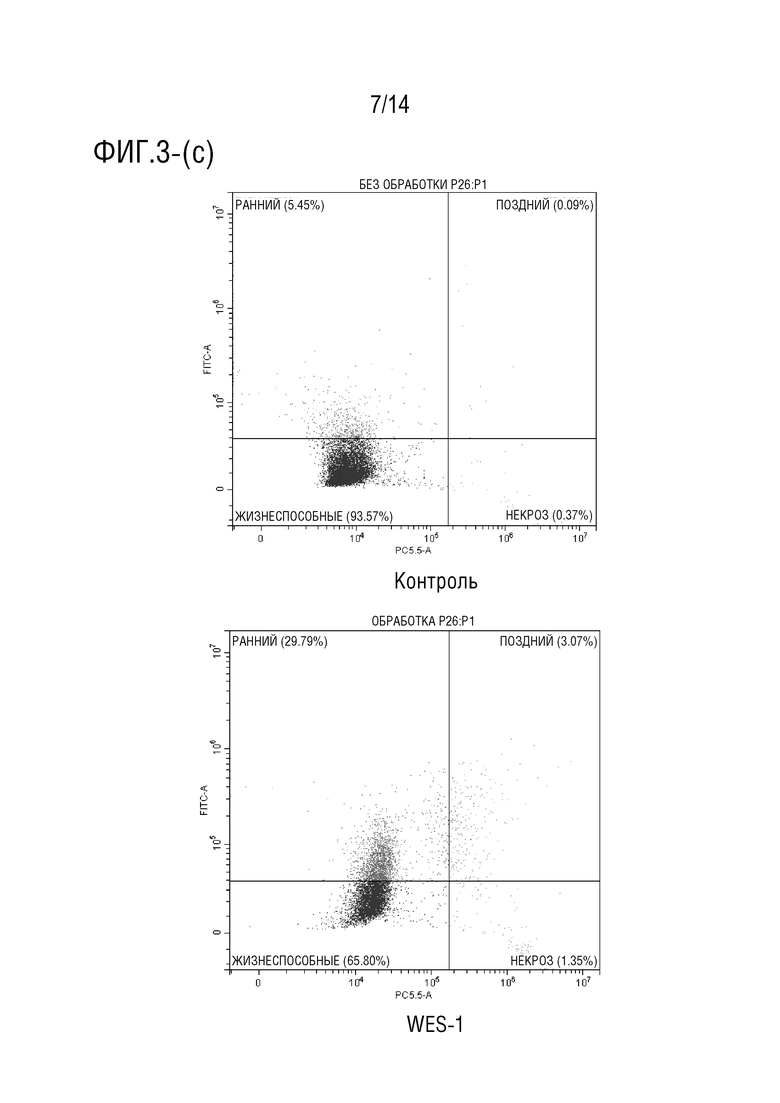
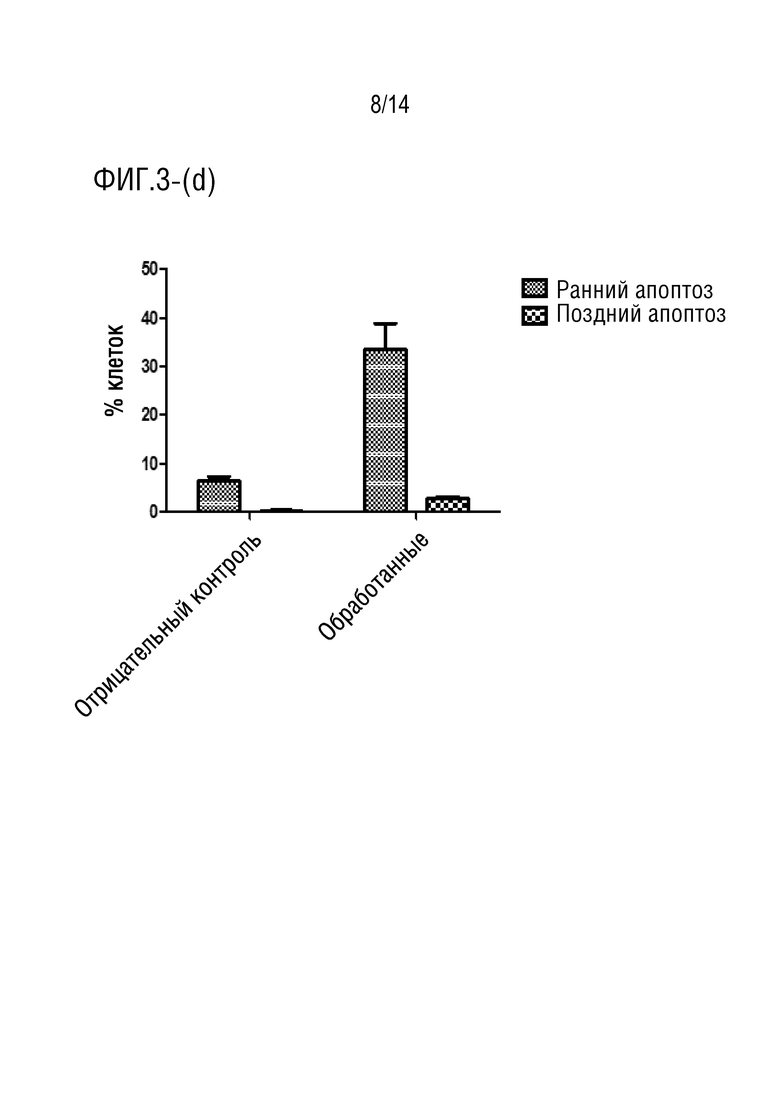
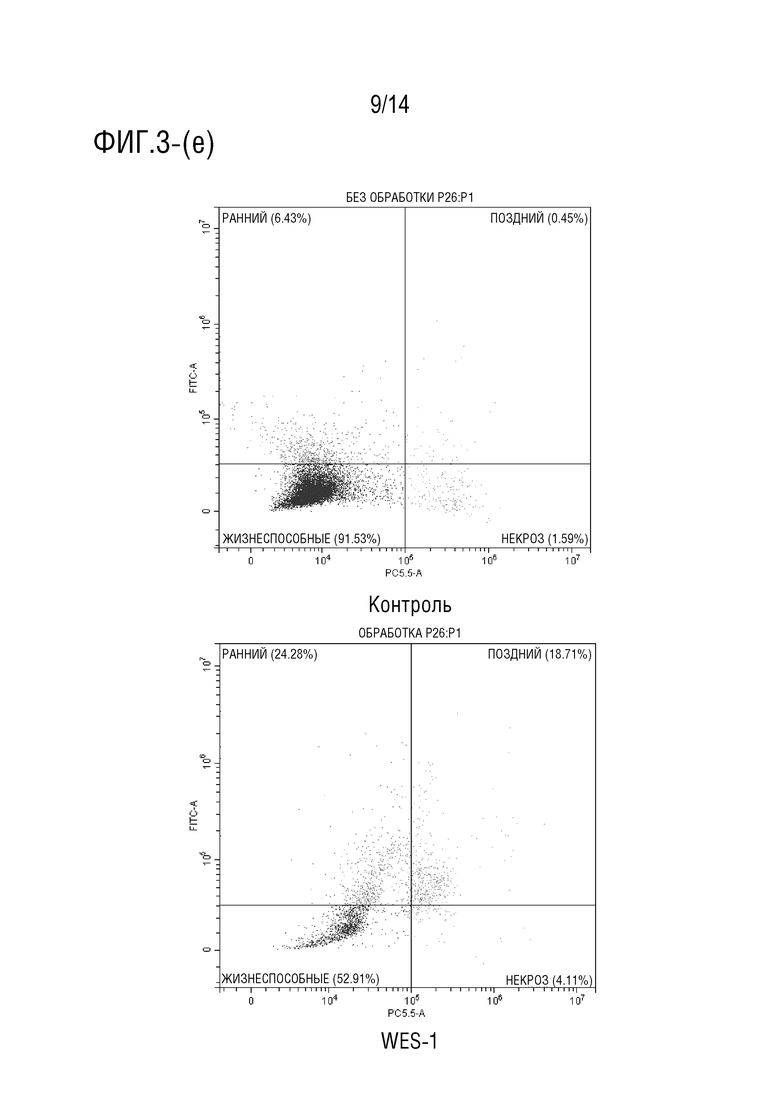
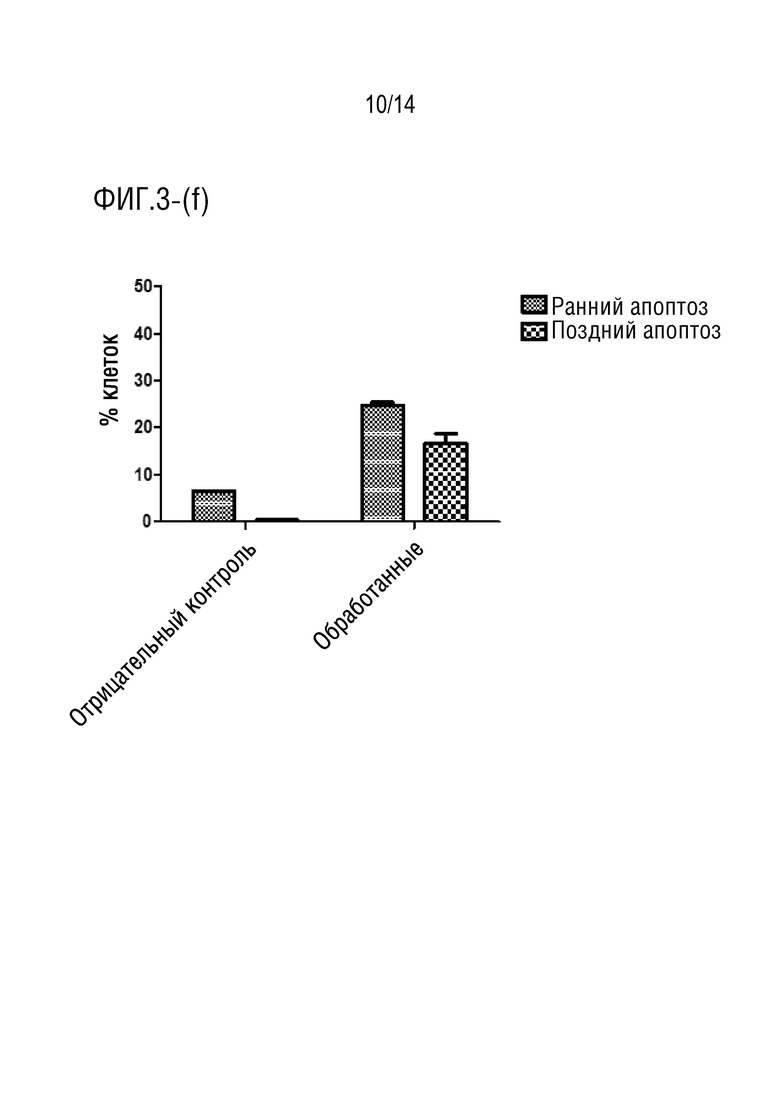
Фиг.3 является иллюстрация анализа апоптоза с аннексином V (a) и (b) клеток HCT116, обработанных соединением формулы I в течение 24 часов (P> 0,001), (c) и (d) клеток HCT116, обработанных соединением формулы I в течение 48 часов (P> 0,0001), (e) и (f) клеток HCT116, обработанных соединением формулы I в течение 72 часов (P> 0,0001).
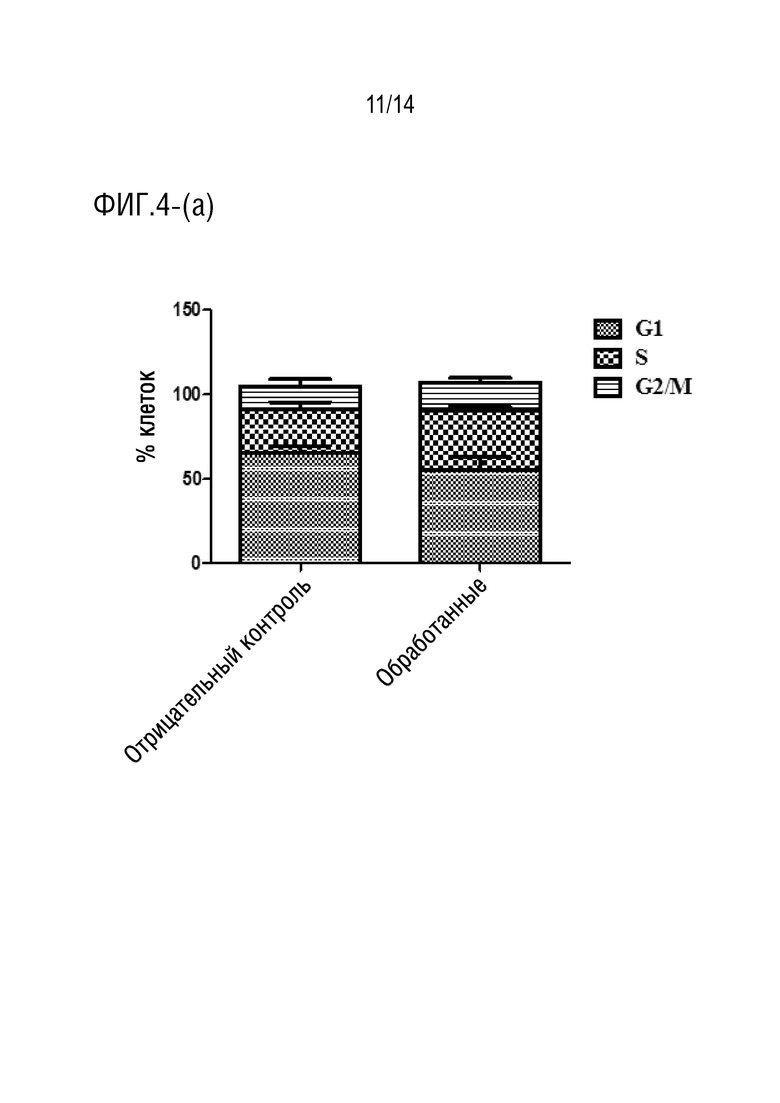
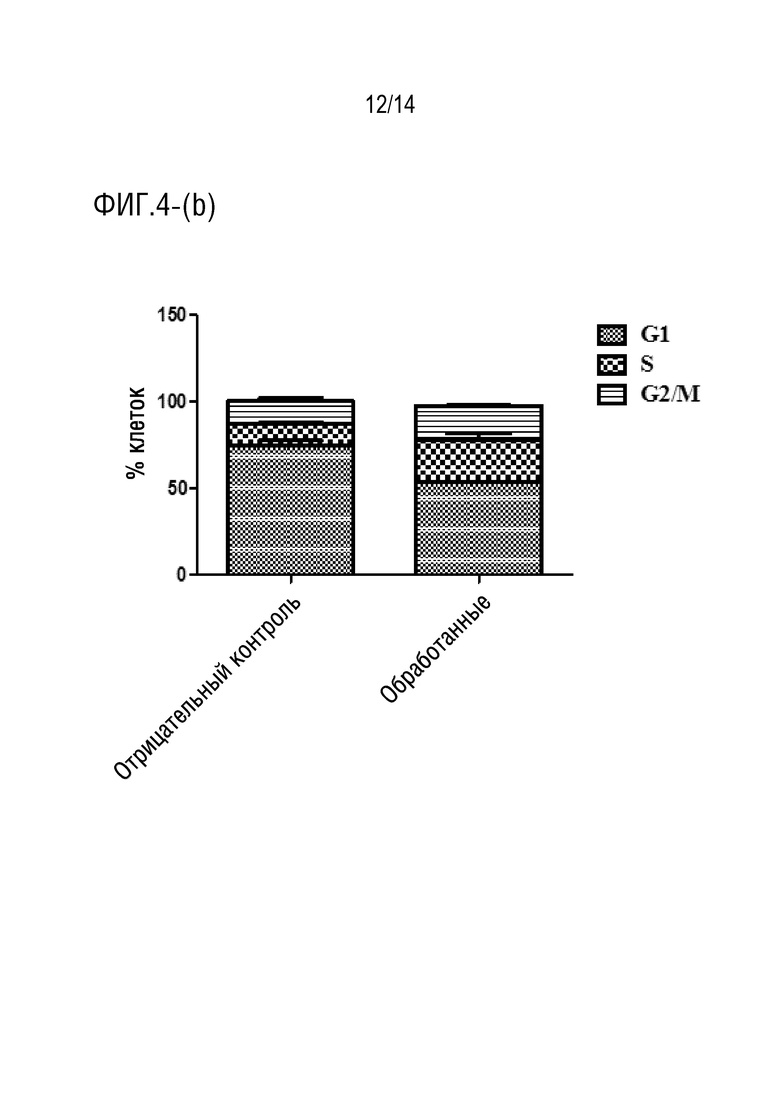
Фиг.4 является иллюстрацией анализа клеточного цикла (a) клеток HCT116, обработанных соединением формулы I в течение 48 часов (P ˂ 0,05), (b) клеток HCT 116, обработанных соединением формулы I в течение 72 часов (P < 0,0001).
Фиг.5 является иллюстрацией демонстрации апоптотических клеток посредством анализа TUNEL. Клетки метили красителем TUNEL и красителем DAPI, апоптотические клетки были зелеными. (a) Необработанные отрицательные контрольные клетки и (b) клетки, обработанные соединением формулы I (масштабная метка соответствует 20 мкм).
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к новому производному сульфонамида на основе пиридина и его специфическому ингибиторному эффекту в отношении карбоангидразы IX - фермента, сверхэкспрессируемого в раковых тканях. Изобретение также относится к способу синтеза.
Настоящее изобретение относится к ингибитору карбоангидразы (формула I).
Если нет иных указаний, термин "формула I", или "соединение", или "низкомолекулярный", или "ингибитор" относится к соединениям формулы I, его пролекарствам, солям соединения и/или пролекарства, гидратам или сольватам соединения, стереоизомерам, таутомерам, изотопно меченым соединениям, полиморфам и производным формулы I.
Задачей настоящего изобретения является предоставление соединения, являющегося специфическим ингибитором карбоангидразы, имеющего химическое наименование 2-(3-(2-метил-6-(п-толил)пиридин-3-ил)уреидо)бензолсульфонамид, в качестве ингибитора активности и/или сверхэкспрессии карбоангидразы IX.
В соответствии с целью(ями) изобретения, как осуществлено и широко описано в настоящем описании, настоящее изобретение относится к соединению, являющемуся специфическим ингибитором карбоангидразы, способному ингибировать активность и/или сверхэкспрессию карбоангидразы IX. Соответственно, изобретение относится к соединению следующей формулы I:
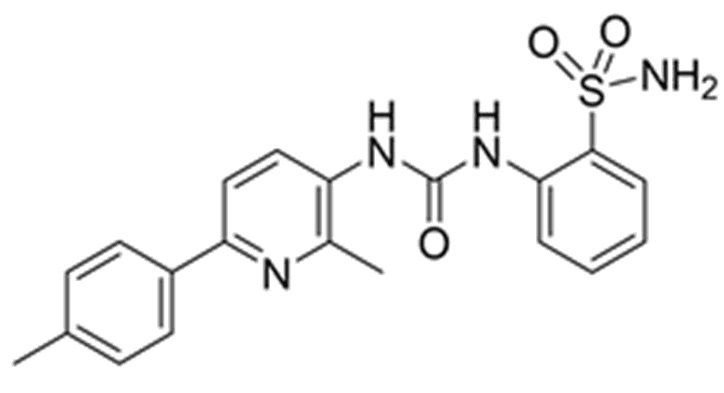
или его фармацевтически приемлемой соли.
Настоящее изобретение, 2-(3-(2-метил-6-(п-толил) пиридин-3-ил)уреидо)бензолсульфонамид (формула I), может быть получено по следующим общим схемам синтеза A-D. На схемах представлена общая методика синтеза соединения формулы I в соответствии с настоящим изобретением.
A) Синтез начинали посредством гидразинолиза сложного эфира 1 посредством реакции гидразина с гидратом в этиловом спирте с получением 2-метил-6-(п-толил)никотиногидразида 2. ((i); этанол, NH2NH2•H2O, кипячение с обратным холодильником в течение 3 ч).
B) Обработка никотинoгидразида 2 нитритом натрия в холодной хлористоводородной кислоте приводила к никотиноилазиду 3. ((ii); NaNO2, HCl, перемешивание в течение 2 ч).
C) Затем никотиноилазид 3 подвергали перегруппировке Курциуса при перемешивании в сухом ксилоле при кипячении с обратным холодильником с получением соответствующего производного изоцианата 4. ((iii); ксилол, кипячение с обратным холодильником 1 ч).
D) Наконец, был получен целевой сульфонамид формулы I посредством реакции изоцианата 4 с 2-аминобензолсульфонамидом 5 в ксилоле при кипячении с обратным холодильником с выходом 83%. ((iv); ксилол, кипячение с обратным холодильником в течение 7 ч).
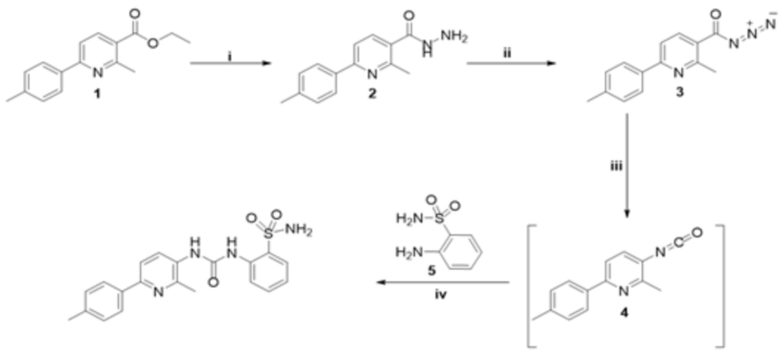
Соли соединений, описанных в настоящем описании, могут быть синтезированы из исходного соединения общепринятыми химическими способами.
Измерение константы ингибирования соединения формулы I в отношении изоформ карбоангидразы (I, II, IV и IX) продемонстрировало, что это соединение является специфичным к указанной ассоциированной с опухолью изоформе фермента, карбоангидразе IX (таблица 1).
Активность соединения формулы I в отношении ингибирования карбоангидразы оценивали для физиологически значимых изоформ hCA: hCA I, II (цитозольные), а также hCA IX и XII (трансмембранные, ассоциированные с опухолью изоформы) с использованием устройства прикладной фотофизики, в котором используется остановленный поток, для анализа активности CA-катализируемой гидратации CO2 [24]. Его ингибиторную активность сравнивали с SLC-0111 и применяемым в клинике стандартным ингибитором карбоангидразы ацетазоламидом (AAZ). Данные ингибирования представлены в таблице 1.
Таблица 1. Данные ингибирования соединением формулы 1 изоформ CA человека: hCA I, II, IV и IX, определенные с использованием анализа гидратазы CO2 с остановленным потоком с использованием SLC-0111 и ацетазоламида (AAZ) в качестве эталонных лекарственных средств.
* Среднее значение для 3 различных анализов с использованием способа остановленного потока (ошибки были в диапазоне 5-10% от сообщенных величин).
Из таблицы можно видеть, что константа ингибирования (KI; нМ) этого специфического ингибитора (формула I) в отношении hCA IX, которая усиливает пролиферацию опухолевых клеток и опухоли [26], составляет 55,9 нМ, что значительно ниже, чем константа ингибирования (KI; нМ) в отношении hCA I, hCA II и/или hCA IV. Помимо этого, константа ингибирования этого специфического ингибитора (формула I) (KI=55,9 нМ) в отношении hCA IX является приблизительно сходной с константой ингибирования эталонных лекарственных средств (SLC-001 и AAZ) (KI=45 нМ и 25,8 нМ, соответственно) в отношении hCA IX. Согласно данным в таблице, специфический ингибитор (формула I) демонстрирует высокую аффинность в отношении hCA IX.
В соответствии с настоящим изобретением, было обнаружено, что соединение формулы I демонстрирует антипролиферативную активность против клеточной линии карциномы ободочной и прямой кишки человека (HCT 116). Эти данные согласуются с анализом жизнеспособности клеток, представленным в примерах.
Было обнаружено, что соединение производного сульфонамида, описанное в настоящем описании, имеет противоопухолевую и противораковую активность и является пригодным для лечения, диагностики и/или прогнозирования пролиферативных нарушений у индивидуумов.
В соответствии с настоящим изобретением было обнаружено, что соединение формулы I имеет антипролиферативный и апоптотический эффект в отношении определенных типов рака, в частности, рака ободочной и прямой кишки человека.
Более того, было обнаружено, что в результате этого ингибирования соединением формулы I регулируется экспрессия карбоангидразы IX, что приводит к подавлению ее функции. Соединение формулы I функционирует в качестве антипролиферативного средства, опосредующего индукцию апоптоза.
В следующем аспекте настоящее изобретение относится к соединению (формулы I), которое ингибирует белок карбоангидразу IX и негативно модулирует его активность.
В одном варианте осуществления изобретения описанное изобретение демонстрирует селективность и высокую аффинность в отношении белка карбоангидразы. Таким образом, ингибирование является сильным.
В соответствии с литературой, ингибирование карбоангидразы IX, которая играет роль в пролиферации опухолевых клеток и прогрессировании опухоли, посредством связывания соединения WES-1 с карбоангидразой IX приводит к подавлению пролиферации и миграции опухолевых клеток.
Как используют в рамках изобретения, термин "ингибировать", "ингибирование" или "ингибирующий" относится к снижению или подавлению данного состояния, симптома, или нарушения, или заболевания, или значительному снижению базовой биологической активности, например, карбоангидразы, или активности ее процессов.
Термин "терапевтически эффективное количество" соединения по настоящему изобретению относится к нетоксичному и достаточному количеству соединения по настоящему изобретению, которое индуцирует биологический или медицинский ответ у индивидуума, например, ингибирование активности белка, или облегчение симптомов, смягчение состояния, замедление или отсрочивание прогрессирования заболевания, или предупреждение заболевания или нарушения, и т.д.
Все из различных вариантов осуществления настоящего изобретения, как описано в настоящем описании, относятся к способам лечения и/или предупреждения различных заболеваний и нарушений, как описано в настоящем описании. Как указано в настоящем описании, соединение, используемое в способе по настоящему изобретению, способно ингибировать активность фермента карбоангидразы IX.
Кроме того, изобретение относится к способам лечения или предупреждения пролиферативных нарушений. В рамках настоящего изобретения термин "пролиферативные нарушения" включает новообразования и злокачественные опухоли, дисплазию, предзлокачественные или предраковые очаги повреждения, аномальный рост клеток, доброкачественные опухоли, злокачественные опухоли или метастазы, и предпочтительно относится к раку.
Более того, изобретение относится к фармацевтической композиции, содержащей такие соединения, к применениям и способам применения таких соединений для лечения и/или предупреждения нарушений, ассоциированных со сверхэкспрессией фермента карбоангидразы IX. В другом варианте осуществления настоящего изобретения фармацевтическая композиция, содержащая соединение, является пригодной для лечения и/или предупреждения пролиферативных нарушений вследствие ингибирования активности карбоангидразы IX.
Настоящее изобретение относится к фармацевтическим композициям, содержащим фармацевтический носитель и терапевтически эффективное количество соединения формулы I или его фармацевтически приемлемой соли.
В одном аспекте изобретение относится к способу производства лекарственного средства для ингибирования активности и/или сверхэкспрессии карбоангидразы IX у млекопитающего, включающему комбинирование терапевтически эффективного количества описанного соединения с фармацевтически приемлемым носителем или разбавителем.
Эти примеры приведены в качестве репрезентативных для конкретных вариантов осуществления изобретения, и они не предназначены для ограничения объема изобретения.
КОНКРЕТНЫЕ ВАРИАНТЫ ОСУЩЕСТВЛЕНИЯ
В этих вариантах осуществления использовали методику органического синтеза для получения низкомолекулярного соединения формулы I, которое специфически ингибирует белок карбоангидразу IX. После получения молекулы-кандидата способом синтеза, проиллюстрированным на схеме A-D, экспериментальные исследования привели к обнаружению соединения (формула I), которое специфически связывается с карбоангидразой IX. Более того, было проведено исследование для охарактеризации ингибиторной активности соединения формулы I in vitro.
Примеры
Пример 1. Синтез соединения согласно изобретению
Химическая часть
Температуру плавления измеряли с использованием устройства для измерения температуры плавления Stuart и не корректировали. Инфракрасные (ИК) спектры регистрировали с использованием дисков KBr на спектрофотометре Schimadzu FT-IR 8400S. Эксперименты 1H-ЯМР и 13C-ЯМР проводили с использованием ЯМР-спектрометра Bruker (400/100 МГц). Химический сдвиг (δH) приводится относительно TMS в качестве внутреннего стандарта. Все величины константы взаимодействия (J) приводятся в Герцах. Химические сдвиги (δC) приводятся следующим образом: с, синглет; д, дублет; м, мультиплет. Все реагенты и растворители сушили и очищали стандартными способами. Соединения 1 и 2 [23] были получены предварительно.
Общие методики получения целевого сульфонамида формулы I
Раствор 2-метил-6-(п-толил)никотинoгидразида 2 (1,2 г, 5 ммоль) и нитрита натрия (0,5 г, 7 ммоль) в хлористоводородной кислоте перемешивали в течение 1 часа на ледяной бане, затем перемешивание продолжали при к.т. в течение дополнительного 1 часа и его переливали на раздробленный лед. Полученное твердое вещество отфильтровывали и сушили воздухом с получением 2-метил-6-(п-толил)никотиноилазида 3, который использовали на следующей стадии без дальнейшей очистки. 2-метил-6-(п-толил)никотиноилазид 3 нагревали в сухом ксилоле при кипячении с обратным холодильником в течение 1 часа, затем к этому раствору добавляли 2-аминобензолсульфонамид 5 (0,86 г, 5 ммоль). Затем реакционную смесь нагревали при температуре кипения с обратным холодильником в течение 7 часов. Полученное твердое вещество после охлаждения до к.т. отфильтровывали, промывали диэтиловым эфиром и перекристаллизовывали из диоксана с получением целевого сульфонамида формулы I.
2-(3-(2-метил-6-(п-толил)пиридин-3-ил)уреидо)бензолсульфонамид (формула I).
Белые кристаллы (выход 83%), m.p. 213-215°C; ИК (KBr, ν см-1): 3207 (NH2), 1713 (C=O) и 1342, 1161 (SO2); 1H-ЯМР (DMSO-d6, 400 МГц) δ м.д.: 2,33 (с, 3H, CH3), 2,53 (с, 3H, CH3), 7,15 (дт, 1H, H-4 в 2-(H2NO2S)-C6H4, J=8,4, 1,2 Гц), 7,24 (д, 2H, H-3 и H-5 в 4-(H3C)-C6H4, J=8,0 Гц), 7,49 (дт, 1H, H-5 в 2-(H2NO2S)-C6H4, J=8,4, 1,2 Гц), 7,71 (д, 1H, H-5 пиридин, J=8,4 Гц), 7,79 (дд, 1H, H-3 в 2-(H2NO2S)-C6H4, J=8,0, 1,2 Гц), 7,92 (д, 2H, H-2 и H-6 в 4-(H3C)-C6H4, J=8,0 Гц), 7,96 (д, 1H, H-6 в 2-(H2NO2S)-C6H4, J=8,4 Гц), 8,03 (д, 1H, H-4 пиридин, J=8,4 Hz), 8,24 (с, 1H, NH, D2O взаимозаменяемые), 8,27 (с, 1H, NH, D2O взаимозаменяемые); 13C-ЯМР (DMSO-d6, 100 МГц) δ м.д.: 21,25 (CH3), 22,03 (CH3), 117,70, 122,88, 124,29, 126,41 (2C), 127,81, 129,68 (2C), 131,13, 132,65, 132,71, 132,90, 136,22, 136,59, 138,18, 149,91, 150,47, 153,26 (C=O).
Пример 2. Специфический ингибиторный эффект соединения формулы I на карбоангидразу IX
Анализ ингибирования CA
Устройство с использованием остановленного потока от Applied Photophysics использовали для анализа активности катализируемой CA гидратации CO2. В качестве индикатора использовали феноловый красный (в концентрации 0,2 мМ), действующий при максимуме поглощения 557 нм, с 20 мМ Hepes (pH 7,5) в качестве буфера и 20 мМ Na2SO4 (для поддержания постоянной ионной силы), отслеживающий первоначальные скорости катализируемой CA реакции гидратации CO2 в течение 10-100 c. Концентрации CO2 находились в диапазоне от 1,7 до 17 мМ для определения кинетических параметров и констант ингибирования. Для каждого ингибитора использовали по меньшей мере шесть отслеживаний первоначальных 5-10% реакции для определения первоначальной скорости. Скорости без катализа определяли аналогичным образом и вычитали из общих наблюдаемых скоростей. Исходные растворы ингибитора (0,1 мМ) получали в дистиллированной-деионизированной воде, и получали разведения вплоть до 0,01 нМ с использованием буфера для анализа. Растворы ингибитора и фермента предварительно инкубировали вместе в течение 15 мин при комнатной температуре перед анализом для обеспечения образования комплекса E-I. Константы ингибирования получали посредством нелинейных способов наименьших квадратов с использованием PRISM 3 и уравнения Ченга-Прусоффа, и они отражают среднее значение для по меньшей мере трех различных определений.
Пример 3. Биологическая оценка
Клеточная культура
HCT 116, клеточную линию карциномы ободочной и прямой кишки человека и эндотелиальные клетки пупочной вены человека (HUVEC) приобретали от ATCC, США, и выращивали на среде с высоким содержанием глюкозы DMEM (Invitrogen), содержавшей 10% инактивированную нагреванием эмбриональную телячью сыворотку с 1% пенициллином/стрептомицином/амфотерицином (Life TechnologiesTM, США).
Анализ жизнеспособности клеток
Процент жизнеспособных клеток рака ободочной и прямой кишки (клетки HCT116) и эндотелиальных клеток пупочной вены человека (HUVEC) после обработки разными концентрациями соединения I (50 мкМ, 25 мкМ, 12,5 мкМ, 6,25 мкМ, 3,125 мкМ, 1 мкМ) в течение 24, 48 и 72 часов, соответственно, и инкубации при температуре 37°C, относительной влажности 80% и 5% CO2, которые являются нормальными условиями культивирования клеток, определяли посредством анализа восстановления 3-(4,5-диметилтиазол-2-ил)-5-(3-карбоксиметоксифенил)-2-(4-сульфофенил)-2H-тетразолия (MTS) (порошок реагентов Cell titer 96® Aqueous MTS, Promega®). Кроме того, определяли IC50 лекарственного средства формулы I - дозу, вызывающую смерть пятидесяти процентов клеток HCT116, с использованием программного обеспечения GraphPad.
После инкубации клеток HUVEC (здоровые клетки) с разными концентрациями лекарственного средства соединения формулы I в течение 24 ч, 48 ч (данные не представлены) и 72 ч (фиг.2), соответственно, авторы изобретения обнаружили, что средняя жизнеспособность при обработке соединением формулы I в концентрации 50 мкМ составляла 80,53%, в то время как при обработке концентрациями (25 мкМ, 12,5 мкМ, 6,25 мкМ, 3,125 мкМ, 1 мкМ) средний диапазон жизнеспособности составлял от 92,07% до 96,89%. С другой стороны, средний диапазон жизнеспособности для клеток HCT116 (клеточная линия карциномы ободочной и прямой кишки человека) при обработке соединением формулы I в концентрациях (50 мкМ, 25 мкМ, 12,5 мкМ, 6,25 мкМ, 3,125 мкМ, 1 мкМ) в течение 24 ч составлял от 69,28% до 97,31% (фиг.1a), в то время как после обработки в течение 48 ч диапазон составлял от 57,60% до 99,96% (фиг.1b), более того, диапазон жизнеспособности после обработки в течение 72 ч составлял от 38,15% до 97,82% (фиг.1c). Из результатов, упомянутых выше для жизнеспособности клеток HCT116, вычисляли IC50 с использованием программного обеспечения GraphPad, и она составила приблизительно 24 мкМ.
Анализ детекции апоптоза с аннексином V-FITC
Клетки HCT116 обрабатывали посредством IC50 соединения формулы I в течение 24, 48 и 72 часов, соответственно, и инкубировали при температуре 37°C, относительной влажности 80% и 5% CO2. Детекцию апоптотических клеток проводили посредством проточной цитометрии (проточный цитометр Beckman flow) с использованием набора ApoDETECTTM Annexin V-FITC Kit (Life TechnologiesTM, США) в соответствии с протоколом производителя.
Обработка клеток HCT116 соединением формулы I в течение 24 ч индуцировала увеличение процента ранних апоптотических клеток приблизительно на 30% (фиг.3a-3b), в то время как при инкубации в течение 48 процент клеток, претерпевших ранний апоптоз, составило приблизительно 33% (фиг.3c-3d). Более того, при обработке клеток HCT116 соединением формулы I в течение 72 ч авторы обнаружили, что процент клеток на ранней стадии апоптоза достиг 25%, в то время как процент клеток на поздней стадии апоптоза составил приблизительно 16,5% (фиг.3e-3f). Эти данные согласуются с анализом жизнеспособности клеток, который показал, что лекарственное средство соединения формулы I демонстрирует антипролиферативную активность против клеточной линии карциномы ободочной и прямой кишки человека (HCT116).
Анализ клеточного цикла посредством проточной цитометрии
Клетки HCT116 обрабатывали посредством IC50 соединения формулы I в течение 48 и 72 часов, соответственно, и инкубировали при температуре 37°C, относительной влажности 80% и 5% CO2. Клеточный цикл анализировали посредством количественного определения содержания ДНК путем окрашивания йодидом пропидия для определения эффекта формулы I на прогрессирование клеточного цикла.
При обработке клеток HCT116 соединением формулы I в течение 48 и 72 ч (фиг.4a-4b), соответственно, было отмечено, что происходило снижение процента клеток в фазе G1, в то время как процент клеток в S-фазе возрастал. Эти данные показали, что происходил арест клеток в S-фазе, и накопление клеток в S-фазе обеспечивали блокаду репликации ДНК, которая приводила к индукции апоптоза [25].
Анализ с TUNEL (фрагментация ДНК)
Апоптоз подтверждали посредством анализа TUNEL, который определяет фрагментацию ДНК, которая является характерной для поздних стадий апоптоза. Клетки HCT116 высевали на покровное стекло, обрабатывали посредством IC50 соединения формулы I и инкубировали в течение 72 часов при температуре 37 градусов C, относительной влажности 80% и 5% CO2. После обработки использовали набор Click-iTTM Plus TUNEL assay (invitrogenTM) с красителем Alexa FluorTM 488 (зеленый) для детекции фрагментированной ДНК, и клетки подвергали контрастному окрашиванию посредством DAPI (). Окрашенные клетки анализировали под конфокальным микроскопом.
Как показано на фиг.5b, клетки HCT116, обработанные соединением формулы I в течение 72 ч, продемонстрировали TUNEL-положительные (зеленая флуоресценция) разрывы цепи ДНК по сравнению с отрицательными контрольными клетками (фиг.5a). Эти данные подтвердили апоптотический эффект формулы I на клетки HCT116.
Визуализация живых клеток in vitro
Клетки HCT116 высевали в 6-ячеечный планшет и обрабатывали посредством IC50 лекарственного средства с соединением формулы I и инкубировали в течение 72 часов при температуре 37°C, относительной влажности 80% и 5% CO2, и проводили мониторинг поведения клеток в течение 72 часов посредством видеозаписи с использованием микроскопа Olympus.
Заключение
Из приведенных выше данных, в соответствии с анализом карбоангидразы авторы изобретения обнаружили, что вновь синтезированное ингибирующее hCA IX соединение формулы I демонстрирует высокую аффинность в отношении фермента hCA IX, который индуцирует пролиферацию опухолевых клеток и прогрессирование опухоли. Кроме того, исходя из результатов апоптотического анализа, авторы изобретением обнаружили, что при обработке злокачественных клеток HCT116 соединением формулы I соединение формулы 1 индуцирует апоптоз клеток, в то время как обработка HUVEC (эндотелиальные клетки пупочной вены здорового человека) демонстрирует более чем 94% жизнеспособность, что указывает на небольшую токсичность. Наконец, можно сделать заключение, что новое и вновь синтезированное соединение (2-(3-(2-метил-6-(п-толил)пиридин-3-ил)уреидо)бензолсульфонамид) (формула I) имеет антипролиферативный и апоптотический эффект против клеточной линии рака ободочной и прямой кишки человека HCT116 с очень небольшой токсичностью в отношении эндотелиальных клеток пупочной вены здорового человека (HUVEC).
Ссылки
1. U.S. FOOD & DRUG ADMINISTRATION. FDA expands approved use of Stivarga to treat liver cancer. 2017, April 27; Available from https://www.fda.gov/news-events/press-announcements/fda-expands-approved-use-stivarga-treat-liver-cancer
2. Cui, J.J. et al. Structure-based drug design of crizotinib (PF-02341066), a potent and selective dual inhibitor of mesenchymal-epithelial transition factor (c-MET) kinase and anaplastic lymphoma kinase (ALK). J Med Chem, 2011. 54(18): p. 6342-63.
3. Wilhelm, S. et al. Discovery and development of sorafenib: a multikinase inhibitor for treating cancer. Nat Rev Drug Discov, 2006. 5(10): p. 835-44.
4. Wilhelm; Scott; (Orange, C.D.J.B., CT) ; Ladouceur; Gaetan; (Guilford, CT) ; Lynch; Mark; (Madison, CT) ; Scott; William J.; (Guilford, CT), Diaryl ureas with kinase inhibiting activity 2007, January 25: U.S.
5. Roed Skarderud, M. et al. Efficacy and safety of regorafenib in the treatment of metastatic colorectal cancer: A systematic review. Cancer Treat Rev, 2018. 62: p. 61-73.
6. Zhang, L. and J. Yu, Role of apoptosis in colon cancer biology, therapy, and prevention. Curr Colorectal Cancer Rep, 2013. 9(4): p. 013-0188.
7. Chen, D. et al. Regorafenib inhibits colorectal tumor growth through PUMA-mediated apoptosis. Clinical cancer research: an official journal of the American Association for Cancer Research, 2014. 20(13): p. 3472-3484.
8. Sahu, A. et al. Crizotinib: A comprehensive review. South Asian J Cancer, 2013. 2(2): p. 91-7.
9. Frampton, J.E., Crizotinib: a review of its use in the treatment of anaplastic lymphoma kinase-positive, advanced non-small cell lung cancer. Drugs, 2013. 73(18): p. 2031-51.
10. Dai, X. et al. (S)-crizotinib induces apoptosis in human non-small cell lung cancer cells by activating ROS independent of MTH1. J Exp Clin Cancer Res, 2017. 36(1): p. 017-0584.
11. Supuran, C.T., Carbonic anhydrases: novel therapeutic applications for inhibitors and activators. Nat Rev Drug Discov, 2008. 7(2): p. 168-81.
12. Ozensoy Guler, O., C. Capasso, and C.T. Supuran, A magnificent enzyme superfamily: carbonic anhydrases, their purification and characterization. J Enzyme Inhib Med Chem, 2016. 31(5): p. 689-94.
13. Supuran, C.T., Carbonic Anhydrase Inhibition and the Management of Hypoxic Tumors. Metabolites, 2017. 7(3).
14. De Simone, G. and C.T. Supuran, Carbonic anhydrase IX: Biochemical and crystallographic characterization of a novel antitumor target. Biochim Biophys Acta, 2010. 2: p. 404-9.
15. Pastorek, J. and S. Pastorekova, Hypoxia-induced carbonic anhydrase IX as a target for cancer therapy: from biology to clinical use. Semin Cancer Biol, 2015. 31: p. 52-64.
16. Lou, Y. et al. Targeting tumor hypoxia: suppression of breast tumor growth and metastasis by novel carbonic anhydrase IX inhibitors. Cancer Res, 2011. 71(9): p. 3364-76.
17. Pacchiano, F. et al. Selective hydrophobic pocket binding observed within the carbonic anhydrase II active site accommodate different 4-substituted-ureido-benzenesulfonamides and correlate to inhibitor potency. Chem Commun, 2010. 46(44): p. 8371-3.
18. Pacchiano, F. et al. Ureido-substituted benzenesulfonamides potently inhibit carbonic anhydrase IX and show antimetastatic activity in a model of breast cancer metastasis. J Med Chem, 2011. 54(6): p. 1896-902.
19. Haggar, F.A. and R.P. Boushey, Colorectal cancer epidemiology: incidence, mortality, survival, and risk factors. Clinics in colon and rectal surgery, 2009. 22(4): p. 191-197.
20. Kuipers, E.J. et al. Colorectal cancer. Nature reviews. Disease primers, 2015. 1: p. 15065-15065.
21. American Cancer Society. Key statistics for colorectal cancer. 2019; Available from https://www.cancer.org/cancer/colon-rectal-cancer/about/key-statistics.html.
22. Marley, A.R. and H. Nan, Epidemiology of colorectal cancer. International journal of molecular epidemiology and genetics, 2016. 7(3): p. 105-114.
23. Eldehna, W.M. et al. Design, synthesis and QSAR study of certain isatin-pyridine hybrids as potential anti-proliferative agents. Eur J Med Chem, 2015. 90: p. 684-94.
24. Khalifah, R.G., The carbon dioxide hydration activity of carbonic anhydrase. I. Stop-flow kinetic studies on the native human isoenzymes B and C. J Biol Chem, 1971. 246(8): p. 2561-73.
25. Xu, X. et al. Inhibition of DNA replication and induction of S phase cell cycle arrest by G-rich oligonucleotides. J Biol Chem, 2001. 276(46): p. 43221-30.
26. Okuno, K. et al. Carbonic anhydrase IX enhances tumor cell proliferation and tumor progression in osteosarcoma. Onco Targets Ther, 2018. 11: p. 6879-6886.
| название | год | авторы | номер документа |
|---|---|---|---|
| ТАРГЕТИРОВАНИЕ РАКОВЫХ ОПУХОЛЕЙ ЗА СЧЕТ ИСПОЛЬЗОВАНИЯ ИНГИБИТОРОВ ИЗОФОРМ КАРБОАНГИДРАЗЫ IX | 2011 |
|
RU2568115C2 |
| ИНГИБИТОРЫ MDM2 И ИХ КОМБИНАЦИИ | 2016 |
|
RU2740091C2 |
| 5-[[4-[[МОРФОЛИН-2-ИЛ]МЕТИЛАМИНО]-5-(ТРИФТОРМЕТИЛ)-2-ПИРИДИЛ]АМИНО]ПИРАЗИН-2-КАРБОНИТРИЛ, ЕГО ТЕРАПЕВТИЧЕСКИЕ ПРИМЕНЕНИЯ | 2013 |
|
RU2659786C2 |
| СОЕДИНЕНИЯ 5-(ПИРИДИН-2-ИЛАМИНО)-ПИРАЗИН-2-КАРБОНИТРИЛА И ИХ ТЕРАПЕВТИЧЕСКОЕ ПРИМЕНЕНИЕ | 2012 |
|
RU2641693C2 |
| ПРИМЕНЕНИЕ АЛЬФАВИРУСА В ПОЛУЧЕНИИ ПРОТИВООПУХОЛЕВЫХ ЛЕКАРСТВЕННЫХ СРЕДСТВ | 2015 |
|
RU2693938C2 |
| СПОСОБЫ ЛЕЧЕНИЯ РАКА, ИМЕЮЩЕГО ГЕМИЗИГОТНУЮ ПОТЕРЮ ТР53 | 2016 |
|
RU2721953C2 |
| СПОСОБ ОПРЕДЕЛЕНИЯ ВЕРОЯТНОСТИ ТЕРАПЕВТИЧЕСКОГО ОТВЕТА НА ПРОТИВОРАКОВУЮ ХИМИОТЕРАПИЮ СЕРДЕЧНЫМ ГЛИКОЗИДОМ | 2008 |
|
RU2508114C2 |
| НАБОР ДЛЯ ОПРЕДЕЛЕНИЯ ВЕРОЯТНОСТИ ТЕРАПЕВТИЧЕСКОГО ОТВЕТА НА ПРОТИВОРАКОВУЮ ХИМИОТЕРАПИЮ СЕРДЕЧНЫМ ГЛИКОЗИДОМ | 2008 |
|
RU2571687C2 |
| СХЕМА ПРИЕМА ДЛЯ СЕЛЕКТИВНОГО ПО АЛЬФА-ИЗОФОРМЕ ИНГИБИТОРА ФОСФАТИДИЛИНОЗИТОЛ-3-КИНАЗЫ | 2014 |
|
RU2680246C1 |
| КОМПОЗИЦИИ, СОДЕРЖАЩИЕ (S)-2-АМИНО-1-(4-ХЛОРФЕНИЛ)-1-[4-(1Н-ПИРАЗОЛ-4-ИЛ)ФЕНИЛ]ЭТАНОЛ, В КАЧЕСТВЕ МОДУЛЯТОРОВ ПРОТЕИНКИНАЗ | 2008 |
|
RU2527151C2 |


Изобретение относится к соединению 2-(3-(2-метил-6-(п-толил)пиридин-3-ил)уреидо)бензолсульфонамид указанной ниже формулы, которое обладает способностью ингибировать активность и/или сверхэкспрессию фермента карбоангидразы IX. Изобретение относится также к применению указанного соединения для получения лекарственного средства для ингибирования активности и/или сверхэкспрессии фермента карбоангидразы IX и для получения лекарственного средства, пригодного для лечения и/или предупреждения заболеваний или нарушений, характеризующихся сверхэкспрессией фермента карбоангидразы IX, и содержащей его фармацевтической композиции. 4 н. и 4 з.п. ф-лы, 5 ил., 1 табл., 3 пр.
1. Соединение 2-(3-(2-метил-6-(п-толил)пиридин-3-ил)уреидо)бензолсульфонамид
 .
.
2. Соединение по п. 1 для применения в качестве ингибитора карбоангидразы IX.
3. Соединение по п. 2 для применения в качестве лекарственного средства.
4. Применение соединения по пп. 1-3 для получения лекарственного средства для ингибирования активности и/или сверхэкспрессии фермента карбоангидразы IX.
5. Применение соединения по пп. 1-4 для получения лекарственного средства, пригодного для лечения и/или предупреждения заболеваний или нарушений, характеризующихся сверхэкспрессией фермента карбоангидразы IX.
6. Применение соединения по п. 5, где заболевание или нарушение представляет собой рак.
7. Применение соединения по п. 6, где заболевание или нарушение представляет собой рак ободочной и прямой кишки.
8. Фармацевтическая композиция для ингибирования активности и/или сверхэкспрессии фермента карбоангидразы IX, содержащая фармацевтический носитель и терапевтически эффективное количество соединения по любому из предшествующих пунктов.
| C | |||
| FABRIZIO | |||
| et al | |||
| Говорящий кинематограф | 1920 |
|
SU111A1 |
| MED | |||
| CHEM., 2017, vol | |||
| Видоизменение пишущей машины для тюркско-арабского шрифта | 1923 |
|
SU25A1 |
| ПРИСПОСОБЛЕНИЕ ДЛЯ ПОСТЕПЕННОГО ОТТОРМАЖИВАНИЯ ОДНОКАМЕРНЫХ ВОЗДУШНЫХ ТОРМАЗОВ | 1925 |
|
SU2569A1 |
| H.I | |||
| GUL | |||
| et al | |||
| New anticancer drug candidates sulfonamides as selective hCA IX or hCA XII inhibitors, BIOORGANIC CHEMISTRY, 2018, vol | |||
| Спускная труба при плотине | 0 |
|
SU77A1 |
| Способ укрепления электродов в катодных лампах | 1923 |
|
SU411A1 |
Авторы
Даты
2024-03-11—Публикация
2020-06-02—Подача