РОДСТВЕННАЯ ЗАЯВКА
Настоящая заявка является родственной заявке на патент США №61/557457, поданной 9 ноября 2011 года, полное содержание которой включено в настоящее описание посредством ссылки.
ОБЛАСТЬ ТЕХНИКИ
Настоящее изобретение относится в целом к области терапевтических соединений. Конкретнее, настоящее изобретение относится к некоторым пиридиламинопиразинкарбонитрильным соединениям, которые, помимо прочего, ингибируют киназную функцию киназы 1 контрольной точки (СНК1). Настоящее изобретение также относится к фармацевтическим композициям, содержащим такие соединения, и применению таких соединений и композиций как in vitro, так и in vivo для ингибирования киназной функции СНК1, а также для лечения опосредованных СНК1 заболеваний и состояний, поддающихся облегчению путем ингибирования киназной функции СНК1, и т.д., включая пролиферативные заболевания, такие как рак и т.д., необязательно в комбинации с другим агентом, например, (a) ингибитором ДНК-топоизомеразы I или II; (b) ДНК-повреждающим агентом; (c) антиметаболитом или ингибитором тимидилатсинтазы (ТС); (d) нацеленным на микротрубочки агентом; и (e) ионизирующим излучением.
УРОВЕНЬ ТЕХНИКИ
В настоящей заявке приведен ряд публикаций с целью более полного описания и раскрытия изобретения и существующего уровня техники в области, к которой относится изобретение. Полное содержание каждой из этих публикаций включено в настоящее описание посредством ссылки в той же степени, как если бы для каждой отдельной публикации конкретно и индивидуально было указано ее включение посредством ссылки.
Во всем тексте настоящего описания, включая последующую формулу изобретения, если иное не следует из контекста, слово "включать" и его вариации, такие как "включает" и "включающий", подразумевают включение заявленного целого или стадии или группы целых или стадий, но не исключение любого другого целого или стадии или группы целых или стадий.
Следует отметить, что в настоящем описании и прилагаемой формуле изобретения неопределенная и определенная формы единственного числа включают определяемые объекты во множественном числе, если контекст явно не предписывает иное. Таким образом, например, ссылка на "фармацевтический носитель" включает смеси двух или более таких носителей и т.п.
В настоящей заявке диапазоны часто выражены как от "примерно" одного конкретного значения и/или до "примерно" другого конкретного значения. Когда выражен такой диапазон, другой вариант реализации включает величины от одного конкретного значения и/или до другого конкретного значения. Аналогично, когда значения выражены в виде приблизительных величин с использованием ранее упомянутого "примерно", следует понимать, что конкретные значения составляют другой вариант реализации.
Настоящее описание содержит информацию, которая может быть полезной для понимания настоящего изобретения. Это не является признанием того, что любая такая информация представляет собой известный уровень техники или относится к описываемому в настоящей заявке изобретению, или что любая специально или неявно упоминаемая публикация представляет собой известный уровень техники.
Киназа 1 контрольной точки (СНК1)
Последовательность событий клеточного цикла представляет собой строго регулируемый процесс и контролируется на некоторых этапах, известных как контрольные точки клеточного цикла (см., например, Weinert and Hartwell, 1989; Bartek and Lukas, 2003). Эти контрольные точки обнаружены во всех четырех фазах клеточного цикла - G1, S (репликации ДНК), G2 и М (митоза), и они обеспечивают корректное завершение ключевых событий, контролирующих точность репликации ДНК и деления клеток. Контрольные точки клеточного цикла активируются рядом стимулов, включая повреждения ДНК и ошибки в последовательности ДНК, вызванные дефектной репликацией. Когда происходит эта активация, клеточный цикл блокируется, что дает время либо для репарации ДНК, либо, если повреждение слишком серьезно, для активации клеточных процессов, ведущих к контролируемой гибели клетки.
Все виды рака в сущности имеют некоторую аномальную форму клеточного цикла. Зачастую раковые клетки характеризуются одной или более дефектными контрольными точками клеточного цикла или имеют дефекты конкретного пути репарации ДНК. Следовательно, эти клетки обычно более зависимы от остальных контрольных точек клеточного цикла и путей репарации по сравнению с нераковыми клетками (у которых все контрольные точки и пути репарации ДНК не повреждены). Ответ раковых клеток на повреждение ДНК зачастую является решающим фактором, определяющим, продолжают ли они пролиферировать или активируют процессы клеточной гибели и умирают. Например, опухолевые клетки, которые содержат мутантную форму (формы) опухолевого супрессора p53, являются дефектными в точке контроля повреждения ДНК фазы G1. Таким образом, ингибиторы контрольных точек фаз G2 или S, как полагают, дополнительно снижают способность опухолевой клетки к репарации поврежденной ДНК.
Многие известные средства для лечения рака вызывают повреждение ДНК посредством либо физической модификации клеточной ДНК, либо нарушения жизненно важных клеточных процессов, которые могут влиять на точность репликации ДНК и деления клеток, таких как метаболизм ДНК, синтез ДНК, транскрипция ДНК и образование веретена деления из микротрубочек. Такие средства лечения включают, например, лучевую терапию, вызывающую разрывы цепей ДНК, и множество химиотерапевтических агентов, включая ингибиторы топоизомеразы, антиметаболиты, алкилирующие ДНК агенты и цитотоксические лекарственные средства, содержащие соединения платины. Существенным ограничением для этих генотоксических способов лечения является лекарственная устойчивость. Один из наиболее важных механизмов, ведущих к этой устойчивости, объясняют активацией контрольных точек клеточного цикла, дающих опухолевой клетке время для репарации поврежденной ДНК. С помощью подавления функции конкретной контрольной точки клеточного цикла или ингибирования конкретного типа репарации ДНК становится, таким образом, возможным преодоление устойчивости опухолевых клеток к генотоксическим агентам и увеличение гибели опухолевых клеток, индуцированной повреждением ДНК, что приводит к повышению терапевтического индекса этих средств для лечения рака.
СНК1 представляет собой серин/треонинкиназу, участвующую в регулировании сигналов контрольных точек клеточного цикла, которые активируются в ответ на повреждение ДНК и возникновение ошибок в последовательности ДНК, вызванное дефектной репликацией (см., например, Bartek and Lukas, 2003). СНК1 передает эти сигналы посредством фосфорилирования субстратов, вовлеченных в ряд клеточных активностей, включая блокирование клеточного цикла и репарацию ДНК. Двумя ключевыми субстратами СНК1 являются фосфатазы Cdc25A и Cdc25C, которые дефосфорилируют циклин-зависимую киназу 1 (CDK1), приводя к активации последней, что является необходимым условием для перехода из фазы G2 в фазу митоза (М-фазу) (см., например, Sanchez et al., 1997). Катализируемое CHK1 фосфорилирование Cdc25C и родственной ей Cdc25A блокирует их способность к активации CDK1, тем самым предотвращая переход клетки из фазы G2 в фазу М. Роль СНК1 в индуцируемой повреждением ДНК контрольной точке фазы G2 клеточного цикла была показана в ряде исследований, в которых функция СНК1 была выключена (см., например, Liu et al., 2000; Zhao et al., 2002; Zachos et al., 2003).
Зависимость индуцируемой повреждением ДНК контрольной точки фазы G2 от СНК1 обеспечивает один пример терапевтической стратегии для лечения рака, включающей направленное ингибирование СНК1. При повреждении ДНК происходят стабилизация и активация белка-супрессора опухолей p53, результатом которых является p53-зависимое блокирование фазы G1, приводящее к апоптозу или репарации ДНК (Balaint and Vousden, 2001). Более чем в половине всех случаев рака обнаружены функциональные дефекты p53, которые могут сделать эти типы рака устойчивыми к генотоксическим средствам лечения, таким как ионизирующее излучение (ИИ) и некоторые виды химиотерапии (см., например, Greenblatt et al., 1994; Carson and Lois, 1995). Эти p53-дефицитные клетки не способны блокировать клеточный цикл в контрольной точке фазы G1 или подвергаться процессам апоптоза или репарации ДНК и, следовательно, могут быть более зависимыми от контрольной точки фазы G2 в отношении жизнеспособности и точности репликации. Соответственно, подавление функции контрольной точки фазы G2 путем ингибирования киназной функции СНК1 может селективно сенсибилизировать p53-дефицитные раковые клетки к генотоксическим средствам лечения рака, что и было продемонстрировано (см., например, Wang et al., 1996; Dixon and Norbury, 2002).
Кроме того, также было показано, что СНК1 участвует в контрольных точках фазы S клеточного цикла и репарации ДНК посредством гомологичной рекомбинации. Таким образом, ингибирование киназы СНК1 в тех случаях рака, которые являются зависимыми от указанных процессов после повреждения ДНК, может обеспечить дополнительные терапевтические стратегии для лечения раковых заболеваний с применением ингибиторов СНК1 (см., например, Sorensen et al., 2005). К тому же, некоторые виды рака могут демонстрировать репликативный стресс вследствие высоких уровней эндогенного повреждения ДНК (см., например, Cavalier et al., 2009; Brooks et al., 2012) или в результате повышенного уровня репликации, стимулируемой онкогенами, например, амплифицированными или избыточно экспрессируемыми генами МУС (см., например, Di Micco et al., 2006; Cole et al., 2011; Murga et al., 2011). Такие виды рака могут обнаруживать усиленную передачу сигнала через киназу СНК1 (см., например, Höglund et al., 2011). Ингибирование киназы CHK1 в тех случаях рака, которые являются зависимыми от указанных процессов, может обеспечить дополнительные терапевтические стратегии для лечения раковых заболеваний с применением ингибиторов СНК1 (см., например, Cole et al., 2011; Davies et al., 2011; Ferrao et al., 2011).
Последние данные о применении СНК1 - специфических миРНК подтверждают целесообразность терапевтического подхода, основанного на селективном ингибировании СНК1, и позволяют предположить, что комбинированное ингибирование с вовлечением некоторых других киназ контрольных точек не обеспечивает дополнительного преимущества и может быть непродуктивным (см., например, Xiao et al., 2006; Guzi et al., 2011). Были описаны низкомолекулярные селективные ингибиторы киназной функции СНК1, относящиеся к различным химическим классам (см., например, Tao et al., 2006).
Известные соединения
Коллинз с соавторами (Collins et al., 2009a) описывают некоторые соединения следующей формулы, ингибирующие киназную функцию киназы 1 контрольной точки (СНК1) и подходящие для лечения, например, рака:
Среди примеров Коллинз с соавторами (Collins et al., 2009a) приводят следующие соединения:
Только в одном из примеров публикации Collins et al., 2009a - RB6 отличен от H, конкретно, представляет собой -OMe, и в то же время -X= представляет собой -N=:
В одном из вариантов реализации из публикации Collins et al., 2009a, -RB6 определен как "независимо представляющий собой -Me, -Et, -nPr, -iPr, -CF3, -ОН, -ОМе, -OEt, -O(nPr), -O(iPr), -OCF3, -CN, -NH2, -NHMe, -NMe2, -O-CH2CH2-OH, -O-CH2CH2-OMe, -O-CH2CH2-NH2, -O-CH2CH2-NHMe, -O-CH2CH2-NMe2, -O-CH2CH2CH2-NH2, -O-CH2CH2CH2-NHMe или -O-CH2CH2CH2-NMe2" (см. стр. 48, строки 37-40 и п. 296 формулы изобретения в указанной публикации).
Коллинз с соавторами (Collins et al., 2009b) описывают некоторые соединения следующей формулы, ингибирующие киназную функцию киназы 1 контрольной точки (СНК1) и подходящие для лечения, например, рака:
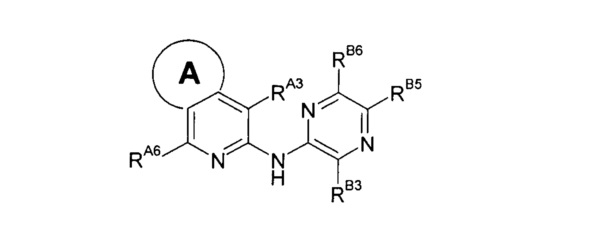
Среди примеров Коллинз с соавторами (Collins et al., 2009b) приводят следующие изохинолиновые соединения:
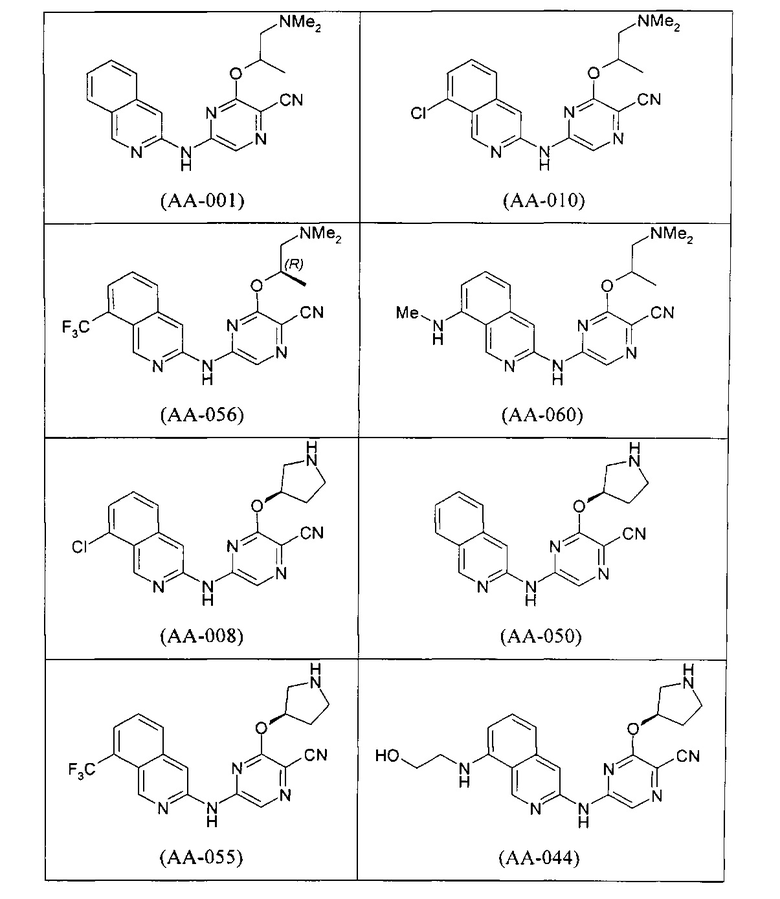
Уолтон с соавторами (Walton et al., 2010) описывают доклинические исследования ингибитора СНК1, названного SAR-020106, который имеет следующую структуру.
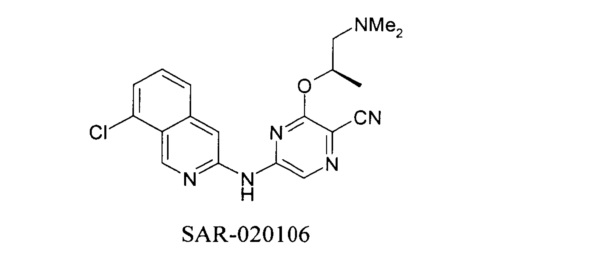
Среди примеров Коллинз с соавторами (Collins et al., 2009b) приводят следующие соединения 1H-имидазо[4,5-b] пиридина:
Альмейда с соавторами (Almeida et al., 2008) описывают некоторые пиразолиламинозамещенные пиразины следующей формулы, предположительно подходящие для лечения рака.
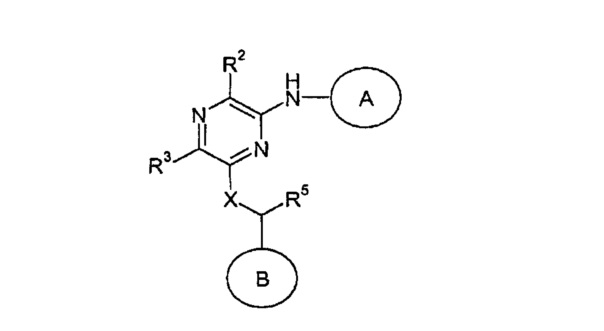
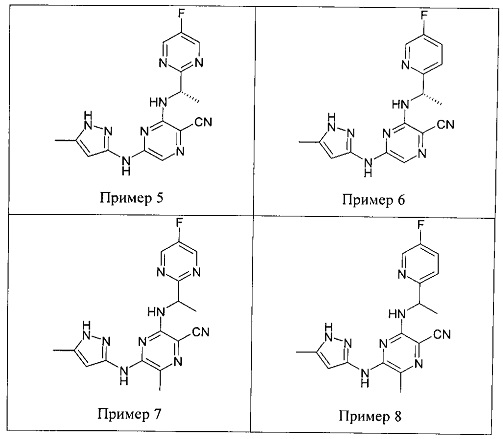
Среди примеров Альмейда с соавторами приводят следующие соединения:
Иоаннидис с соавторами (Ioannidis et al., 2009) описывают некоторые соединения, ингибирующие Янус-киназу (JAK). Следующие соединения показаны на Схеме 5 на стр. 6526 в указанной публикации.
Лин с соавторами (Lin et al., 2005) описывают некоторые макроциклические соединения на основе мочевины, предположительно подходящие в качестве ингибиторов протеинкиназ. См., например, абзац [0004] на стр. 1 в указанной публикации.
Тао с соавторами (Tao et al., 2005) описывают некоторые макроциклические соединения на основе мочевины, предположительно подходящие в качестве ингибиторов протеинкиназ. См., например, стр. 2 в указанной публикации.
Ли с соавторами (Li et al., 2007) описывают получение и исследование некоторых макроциклических ингибиторов СНК1 на основе мочевины. См., например, таблицу 1 на стр. 6502 в указанной публикации.
Тао с соавторами (Тао et al., 2007a) описывают получение и исследование некоторых макроциклических ингибиторов СНК1 на основе мочевины. См., например, таблицу 2 на стр. 6596 в указанной публикации.
Тао с соавторами (Тао et al., 2007b) описывают получение и исследование некоторых макроциклических ингибиторов СНК1 на основе мочевины. См., например, таблицу 3 на стр. 1517 в указанной публикации.
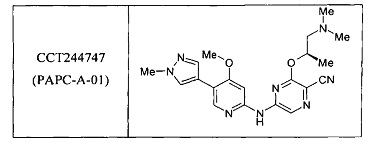
Одним или более из авторов настоящего изобретения был сделан вклад в недавние публикации, в которых описан ряд ингибиторов СНК1, включая следующее соединение, названное ССТ244747. См. Lainchbury et al., 2012 (предварительно опубликована в Интернете 19 октября 2012 года) и Walton et al., 2012 (предварительно опубликована 15 октября 2012 года).
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Один аспект изобретения относится к некоторым пиридиламинопиразинкарбонитрильным соединениям (называемым в настоящей заявке РАРС-соединения), описанным в настоящей заявке.
Другой аспект изобретения относится к композиции (например, фармацевтической композиции), содержащей описанное в настоящей заявке РАРС-соединение и фармацевтически приемлемый носитель или разбавитель.
В одном из вариантов реализации композиция (например, фармацевтическая композиция) подходит для перорального введения субъекту.
Другой аспект изобретения относится к способу получения композиции (например, фармацевтической композиции), включающему стадию смешивания описанного в настоящей заявке РАРС-соединения и фармацевтически приемлемого носителя или разбавителя.
Другой аспект настоящего изобретения относится к способу ингибирования киназной функции СНК1 в клетке, in vitro или in vivo, включающему приведение клетки в контакт с эффективным количеством РАРС-соединения, описанного в настоящей заявке.
В одном из вариантов реализации способ дополнительно включает приведение клетки в контакт с одним или более другими агентами, выбранными из: (а) ингибитора ДНК-топоизомеразы I или II; (b) ДНК-повреждающего агента; (с) антиметаболита или ингибитора тимидилатсинтазы (ТС); (d) нацеленного на микротрубочки агента; и (е) ионизирующего излучения.
Другой аспект настоящего изобретения относится к способу регулирования (например, ингибирования) пролиферации клеток (например, пролиферации клетки), ингибирования прогрессии клеточного цикла, стимулирования апоптоза клеток или осуществления комбинации одного или более из вышеперечисленных, in vitro или in vivo, включающему приведение клетки в контакт с эффективным количеством РАРС-соединения, описанного в настоящей заявке.
В одном из вариантов реализации способ дополнительно включает приведение клетки в контакт с одним или более другими агентами, выбранными из: (а) ингибитора ДНК-топоизомеразы I или II; (b) ДНК-повреждающего агента; (с) антиметаболита или ингибитора тимидилатсинтазы (ТС); (d) нацеленного на микротрубочки агента; и (е) ионизирующего излучения.
Другой аспект настоящего изобретения относится к способу лечения, включающему введение субъекту, нуждающемуся в лечении, терапевтически эффективного количества описанного в настоящей заявке РАРС-соединения, предпочтительно в форме фармацевтической композиции.
В одном из вариантов реализации указанное введение представляет собой пероральное введение.
В одном из вариантов реализации способ дополнительно включает введение субъекту одного или более других агентов, выбранных из: (а) ингибитора ДНК-топоизомеразы I или II; (b) ДНК-повреждающего агента; (с) антиметаболита или ингибитора тимидилатсинтазы (ТС); (d) нацеленного на микротрубочки агента; и (е) ионизирующего излучения.
Другой аспект настоящего изобретения относится к РАРС-соединению, описанному в настоящей заявке, для применения в способе лечения тела человека или животного посредством терапии.
В одном из вариантов реализации соединение предназначено для применения в способе лечения тела человека или животного посредством терапии с помощью перорального введения.
В одном из вариантов реализации способ лечения включает лечение с применением как (i) РАРС-соединения, так и (ii) одного или более других агентов, выбранных из: (а) ингибитора ДНК-топоизомеразы I или II; (b) ДНК-повреждающего агента; (с) антиметаболита или ингибитора тимидилатсинтазы (ТС); (d) нацеленного на микротрубочки агента; и (е) ионизирующего излучения.
Другой аспект настоящего изобретения относится к применению РАРС-соединения, описанного в настоящей заявке, для получения лекарственного средства для применения в способе лечения.
В одном из вариантов реализации лекарственное средство представляет собой лекарственное средство для перорального введения.
В одном из вариантов реализации лечение включает лечение с применением как (i) лекарственного средства, содержащего РАРС-соединение, так и (ii) одного или более других агентов, выбранных из: (а) ингибитора ДНК-топоизомеразы I или II; (b) ДНК-повреждающего агента; (с) антиметаболита или ингибитора тимидилатсинтазы (ТС); (d) нацеленного на микротрубочки агента; и (е) ионизирующего излучения.
В одном из вариантов реализации лечение представляет собой лечение заболевания или состояния, опосредованного СНК1.
В одном из вариантов реализации лечение представляет собой лечение заболевания или состояния, при котором улучшения достигают путем ингибирования киназной функции СНК1.
В одном из вариантов реализации лечение представляет собой лечение пролиферативного заболевания.
В одном из вариантов реализации лечение представляет собой лечение рака.
В одном из вариантов реализации лечение представляет собой лечение p53-дефицитного рака.
В одном из вариантов реализации лечение представляет собой лечение рака головы; рака шеи; рака нервной системы; рака мозга; нейробластомы; рака легкого/средостения; рака молочной железы; рака пищевода; рака желудка; рака печени; рака желчевыводящих путей; рака поджелудочной железы; рака тонкой кишки; рака толстой кишки; рака ободочной и/или прямой кишки; рака женских половых органов; рака мочеполовой системы; рака яичника; рака щитовидной железы; рака надпочечника; рака кожи; меланомы; остеосаркомы; саркомы мягких тканей; злокачественных опухолей детского возраста; болезни Ходжкина; неходжкинской лимфомы; миеломы; лейкоза или метастазов из неизвестного первичного очага.
В одном из вариантов реализации лечение представляет собой лечение: рака легкого, рака молочной железы, рака яичника, рака ободочной и/или прямой кишки, меланомы, глиомы или нейробластомы.
Другой аспект настоящего изобретения относится к набору, содержащему (a) описанное в настоящей заявке РАРС-соединение, предпочтительно обеспеченное в виде фармацевтической композиции и содержащееся в подходящей емкости и/или с подходящей упаковкой; и (b) инструкции по применению, например, письменные указания относительно введения соединения.
В одном из вариантов реализации набор дополнительно содержит один или более других агентов, выбранных из: (а) ингибитора ДНК-топоизомеразы I или II; (b) ДНК-повреждающего агента; (с) антиметаболита или ингибитора тимидилатсинтазы (ТС); и (d) нацеленного на микротрубочки агента.
Другой аспект настоящего изобретения относится к РАРС-соединению, которое может быть получено посредством способа синтеза, описанного в настоящей заявке, или способа, включающего способ синтеза, описанный в настоящей заявке.
Другой аспект настоящего изобретения относится к РАРС-соединению, полученному посредством способа синтеза, описанного в настоящей заявке, или способа, включающего способ синтеза, описанный в настоящей заявке.
Другой аспект настоящего изобретения относится к новым промежуточным соединениям, описанным в настоящей заявке, которые подходят для применения в описанных в настоящей заявке способах синтеза.
Другой аспект настоящего изобретения относится к применению таких новых промежуточных соединений, описанных в настоящей заявке, в описанных в настоящей заявке способах синтеза.
Специалисту в данной области техники будет понятно, что признаки и предпочтительные варианты реализации одного аспекта изобретения также относятся к другому аспекту изобретения.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
Фигура 1 представляет собой МРТ-изображение, полученное в ходе исследования in vivo ("Соединение РАРС-А-01 в трансгенной модели MYCN-опосредованной нейробластомы"), описанного ниже. На изображении показана брюшная полость мыши (k = почка; t = опухоль; s.b. = тонкий кишечник), и оно было получено до начала лечения. Объем опухоли составлял 1960 мм3.
Фигура 2 представляет собой МРТ-изображение, полученное в ходе исследования in vivo ("Соединение РАРС-А-01 в трансгенной модели MYCN-опосредованной нейробластомы"), описанного ниже. На изображении показана брюшная полость мыши (k = почка; t = опухоль; s.b. = тонкий кишечник), и оно было получено после 7 дней лечения с применением соединения РАРС-А-01. Объем опухоли составлял 417 мм3.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Соединения
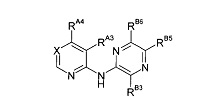
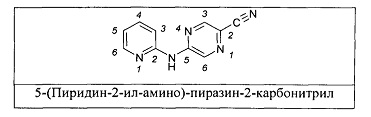
Один из аспектов настоящего изобретения относится к некоторым соединениям, родственным 5-(пиридин-2-ил-амино)-пиразин-2-карбонитрилу:
Все соединения дополнительно характеризуются наличием заместителя, расположенного по соседству с карбонитрильной группой (в положении 3 пиразина), который независимо представляет собой:
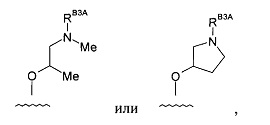
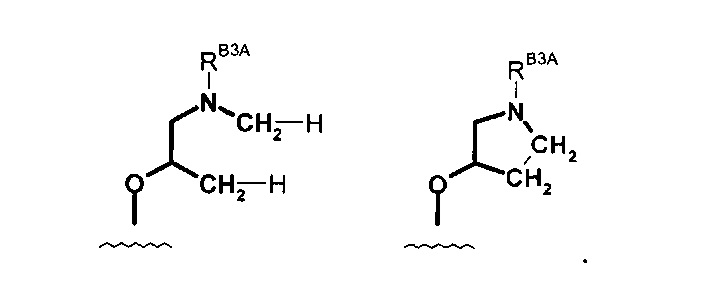
где R имеет значения, определенные в настоящей заявке. Эти две формулы определяют группы, которые в целях удобства могут быть описаны как "ациклический" (слева) и "циклический" (справа) аналоги друг друга и содержат одинаковые атомы/связи, выделенные ниже полужирным шрифтом:
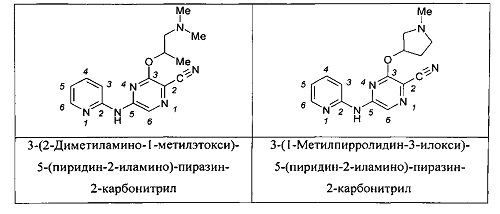
Например, когда RB3A представляет собой метил, указанные соединения являются родственными следующим соединениям:
Соединения согласно настоящему изобретению являются мощными ингибиторами активности СНК1 (например, имеющими IC50 для СНК1 менее 100 нМ). Соединения согласно настоящему изобретению могут дополнительно охарактеризованы следующим: (а) значительной селективностью по сравнению с киназой СНК2 (например, селективностью по отношению к СНК1, по меньшей мере в 100 раз превышающей таковую по отношению к СНК2) и/или (b) значительной биодоступностью при пероральном введении (например, биодоступностью при пероральном введении, составляющей по меньшей мере 100 нМ (концентрация в плазме, 1 час после п.о. введения 10 мг/кг)).
Таким образом, один из аспектов настоящего изобретения относится к соединениям следующей формулы и их фармацевтически приемлемым солям, гидратам и сольватам, в которых -RA4, -RA5 и -RB3 имеют значения, определенные в настоящей заявке (в целях удобства совместно именуемым в настоящем описании "пиридиламинопиразинкарбонитрильные соединения" или "РАРС-соединения"):
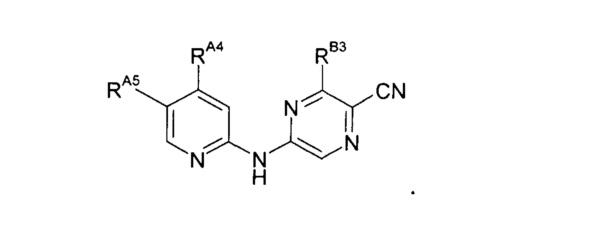
Некоторые варианты реализации изобретения включают следующее:
(1) Соединение следующей формулы или его фармацевтически приемлемую соль, гидрат или сольват:
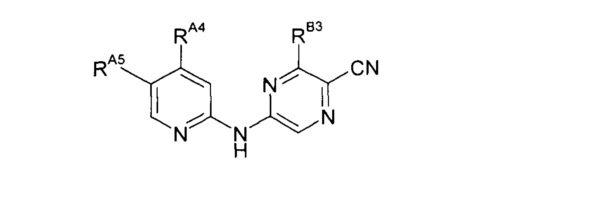
где:
-RB3 независимо представляет собой:
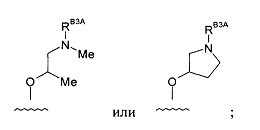
каждый -RB3A независимо представляет собой -Н или насыщенный алифатический C1-3алкил;
-RA4 независимо представляет собой -NHRA4A, -NRA4A2 или -ORA4A;
каждый -RA4A независимо представляет собой насыщенный алифатический С1-3алкил;
-RA5 независимо представляет собой -RA5A, -RA5B, -RA5C, -RA5D, -RA5E или -RA5F;
-RA5A независимо представляет собой:
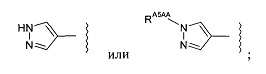
-RA5AA представляет собой насыщенный алифатический С1-3алкил;
-RA5B представляет собой -CF3;
-RA5C независимо представляет собой -F, -Cl, -Br или -I;
-RA5D независимо представляет собой -С≡СН, -C=C-RA5DA или -C≡C-RA5DB-OH;
-RA5DA представляет собой насыщенный алифатический С1-4алкил;
-RA5DB представляет собой насыщенный алифатический С1-4алкилен;
-RA5E независимо представляет собой насыщенный С3-6циклоалкил;
-RA5F представляет собой -C(=O)O-RA5FA; и
-RA5FA представляет собой насыщенный алифатический С1-3алкил.
Во избежание неопределенности следует отметить, что не предполагается совместного образования любыми двумя или более из -RA4, -RA5 и -RB3 кольца, конденсированного с кольцом (кольцами), к которому они присоединены. Например, не предполагается, что RA4 и RA5 совместно образуют кольцо, конденсированное с кольцом, к которому они присоединены. Аналогичным образом, не предполагается, что RA4 и RB3 совместно образуют кольцо, конденсированное с кольцами, к которым они присоединены. Аналогичным образом, не подразумевается, что RA5 и RB3 совместно образуют кольцо, конденсированное с кольцами, к которым они присоединены.
Группа -RB3 содержит один хиральный центр, отмеченный звездочкой в следующих формулах, который независимо может иметь (R)- или (S)-конфигурацию. Если не указано иное, подразумевают включение обеих конфигураций.
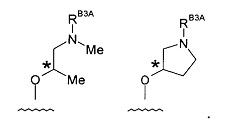
Группа -RB3
(2) Соединение по (1), где -RB3 представляет собой:
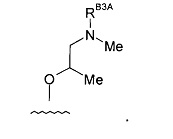
(3) Соединение по (1), где -RB3 представляет собой:
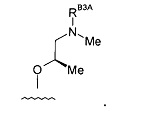
(4) Соединение по (1), где -RB3 представляет собой:
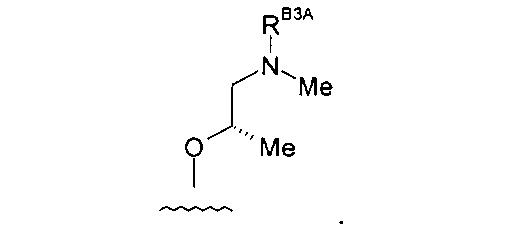
(5) Соединение по (1), где -RB3 представляет собой:
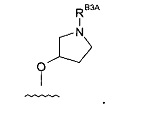
(6) Соединение по (1), где -RB3 представляет собой:
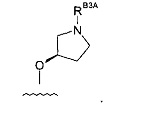
(7) Соединение по (1), где -RB3 представляет собой:
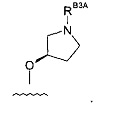
Группа-RB3A
(8) Соединение по любому из (1)-(7), где -RB3A представляет собой насыщенный алифатический С1-3алкил.
(9) Соединение по любому из (1)-(7), где -RB3A представляет собой -Me.
(10) Соединение по любому из (1)-(7), где -RB3A представляет собой -H.
Группа-RA4
(11) Соединение по любому из (1)-(10), где -RA4 независимо представляет собой -NHRA4A или -NRA4A2.
(12) Соединение по любому из (1)-(10), где -RA4 представляет собой -NHRA4A.
(13) Соединение по любому из (1)-(10), где -RA4 представляет собой -NRA4A2.
(14) Соединение по любому из (1)-(10), где -RA4 представляет собой -ORA4A.
Группа -RA4A
(15) Соединение по любому из (1)-(14), где каждый -RA4A независимо представляет собой -Me или -Et.
(16) Соединение по любому из (1)-(14), где каждый -RA4A представляет собой -Me.
Группа -RA5
(17) Соединение по любому из (1)-(16), где -RA5 представляет собой -RA5A.
(18) Соединение по любому из (1)-(16), где -RA5 представляет собой -RA5B.
(19) Соединение по любому из (1)-(16), где -RA5 представляет собой -RA5C.
(20) Соединение по любому из (1)-(16), где -RA5 представляет собой -RA5D.
(21) Соединение по любому из (1)-(16), где -RA5 представляет собой -RA5E.
(22) Соединение по любому из (1)-(16), где -RA5 представляет собой -RA5F.
Группа -RA5A
(23) Соединение по любому из (1)-(22), где -RA5A, если он присутствует, представляет собой:
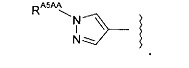
(24) Соединение по любому из (1)-(22), где -RA5A, если он присутствует, представляет собой:
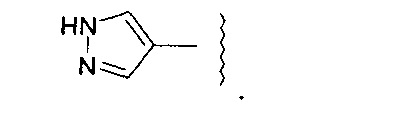
Группа -RA5AA
(25) Соединение по любому из (1)-(24), где каждый -RA5AA, если он присутствует, представляет собой -Me или -Et.
(26) Соединение по любому из (1)-(24), где каждый -RA5AA, если он присутствует, представляет собой -Me.
(27) Соединение по любому из (1)-(24), где каждый -RA5AA, если он присутствует, представляет собой -Et.
Группа -RA5C
(28) Соединение по любому из (1)-(27), где -RA5C, если он присутствует, независимо представляет собой -F, -Cl или -Br.
(29) Соединение по любому из (1)-(27), где -RA5C, если он присутствует, независимо представляет собой -F.
(30) Соединение по любому из (1)-(27), где -RA5C, если он присутствует, независимо представляет собой -О.
(31) Соединение по любому из (1)-(27), где -RA5C, если он присутствует, независимо представляет собой -Br.
(32) Соединение по любому из (1)-(27), где -RA5C, если он присутствует, независимо представляет собой -I.
Группа -RA5D
(33) Соединение по любому из (1)-(32), где -RA5D, если он присутствует, независимо представляет собой -С≡СН или -C≡C-RA5DA.
(34) Соединение по любому из (1)-(32), где -RA5D, если он присутствует, представляет собой -С≡СН.
(35) Соединение по любому из (1)-(32), где -RA5D, если он присутствует, представляет собой -C≡C-RA5DA.
(36) Соединение по любому из (1)-(32), где -RA5D, если он присутствует, представляет собой -C≡C-RA5DB-OH.
Группа -RA5DA
(37) Соединение по любому из (1)-(36), где -RA5DA, если он присутствует, независимо представляет собой -Me, -Et, -СН(Ме)2 или -С(Ме)3.
(38) Соединение по любому из (1)-(36), где -RA5DA, если он присутствует, представляет собой -СН(Ме)2.
(39) Соединение по любому из (1)-(36), где -RA5DA, если он присутствует, представляет собой -С(Ме)3.
Группа-RA5DB-
(40) Соединение по любому из (1)-(39), где -RA5DB-, если он присутствует, представляет собой насыщенный алифатический С1-3алкилен.
(41) Соединение по любому из (1)-(39), где -RA5DB-, если он присутствует, независимо представляет собой -СН2-, -СН(Ме)- или -С(Ме)2-.
(42) Соединение по любому из (1)-(39), где -RA5DB-, если он присутствует, представляет собой -С(Ме)2-.
(43) Соединение по любому из (1)-(39), где -RA5DB-, если он присутствует, представляет собой -СН(Ме)-.
(44) Соединение по любому из (1)-(39), где -RA5DB-, если он присутствует, представляет собой -СН2-.
Группа -RA5E
(45) Соединение по любому из (1)-(44), где -RA5E, если он присутствует, независимо представляет собой циклопропил, циклобутил или циклопентил.
(46) Соединение по любому из (1)-(44), где -RA5E, если он присутствует, независимо представляет собой циклопропил или циклобутил.
(47) Соединение по любому из (1)-(44), где -RA5E, если он присутствует, представляет собой циклопропил.
Группа -RA5FA
(48) Соединение по любому из (1)-(47), где -RA5FA, если он присутствует, представляет собой -Me или -Et.
(49) Соединение по любому из (1)-(47), где -RA5FA, если он присутствует, представляет собой -Me.
(50) Соединение по любому из (1)-(47), где -RA5FA, если он присутствует, представляет собой -Et.
Некоторые предпочтительные комбинации
(51) Соединение по (1), представляющее собой соединение следующей формулы или его фармацевтически приемлемую соль, гидрат или сольват:
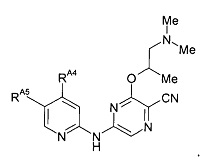
(52) Соединение по (1), представляющее собой соединение следующей формулы или его фармацевтически приемлемую соль, гидрат или сольват:
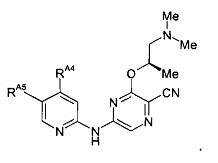
(53) Соединение по (1), представляющее собой соединение следующей формулы или его фармацевтически приемлемую соль, гидрат или сольват:
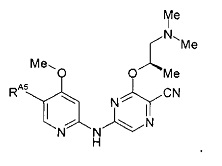
(54) Соединение по (1), представляющее собой соединение одной из следующих формул или его фармацевтически приемлемую соль, гидрат или сольват:
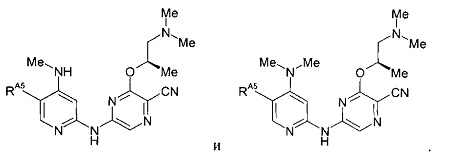
(55) Соединение по (1), представляющее собой соединение следующей формулы или его фармацевтически приемлемую соль, гидрат или сольват:
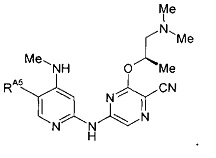
(56) Соединение по (1), представляющее собой соединение следующей формулы или его фармацевтически приемлемую соль, гидрат или сольват:
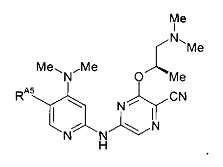
(57) Соединение по (1), представляющее собой соединение следующей формулы или его фармацевтически приемлемую соль, гидрат или сольват:
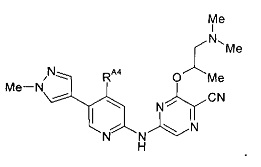
(58) Соединение по (1), представляющее собой соединение следующей формулы или его фармацевтически приемлемую соль, гидрат или сольват:
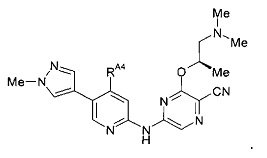
(59) Соединение по (1), представляющее собой соединение одной из следующих формул или его фармацевтически приемлемую соль, гидрат или сольват:
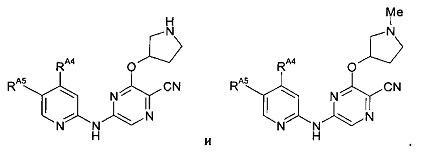
(60) Соединение по (1), представляющее собой соединение одной из следующих формул или его фармацевтически приемлемую соль, гидрат или сольват:
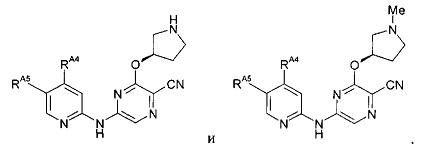
(61) Соединение по (1), представляющее собой соединение одной из следующих формул или его фармацевтически приемлемую соль, гидрат или сольват:
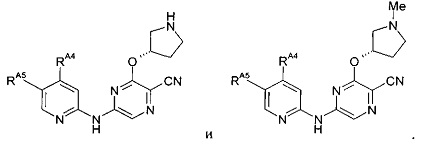
(62) Соединение по (1), представляющее собой соединение одной из следующих формул или его фармацевтически приемлемую соль, гидрат или сольват:
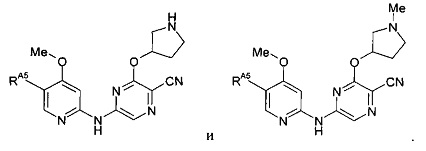
(63) Соединение по (1), представляющее собой соединение одной из следующих формул или его фармацевтически приемлемую соль, гидрат или сольват:
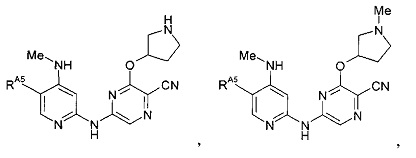
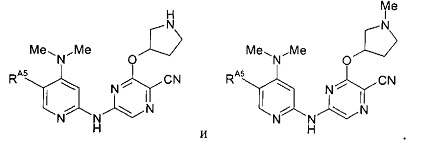
(64) Соединение по (1), представляющее собой соединение одной из следующих формул или его фармацевтически приемлемую соль, гидрат или сольват:
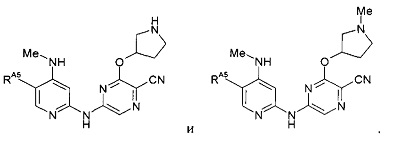
(65) Соединение по (1), представляющее собой соединение одной из следующих формул или его фармацевтически приемлемую соль, гидрат или сольват:
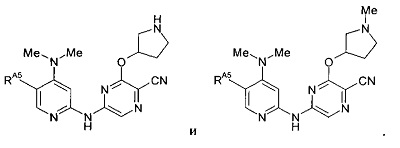
(66) Соединение по (1), представляющее собой соединение одной из следующих формул или его фармацевтически приемлемую соль, гидрат или сольват:
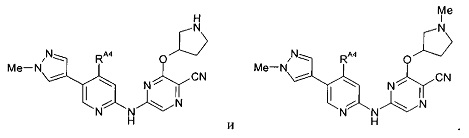
(67) Соединение по (1), представляющее собой соединение одной из следующих формул или его фармацевтически приемлемую соль, гидрат или сольват:
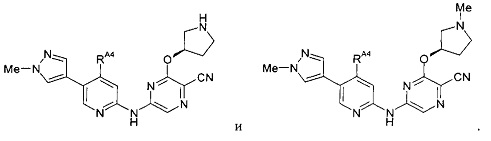
(68) Соединение по (1), представляющее собой соединение одной из следующих формул или его фармацевтически приемлемую соль, гидрат или сольват:
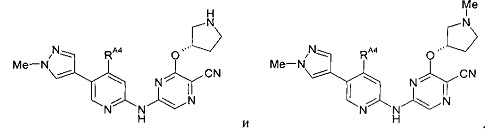
Конкретные соединения
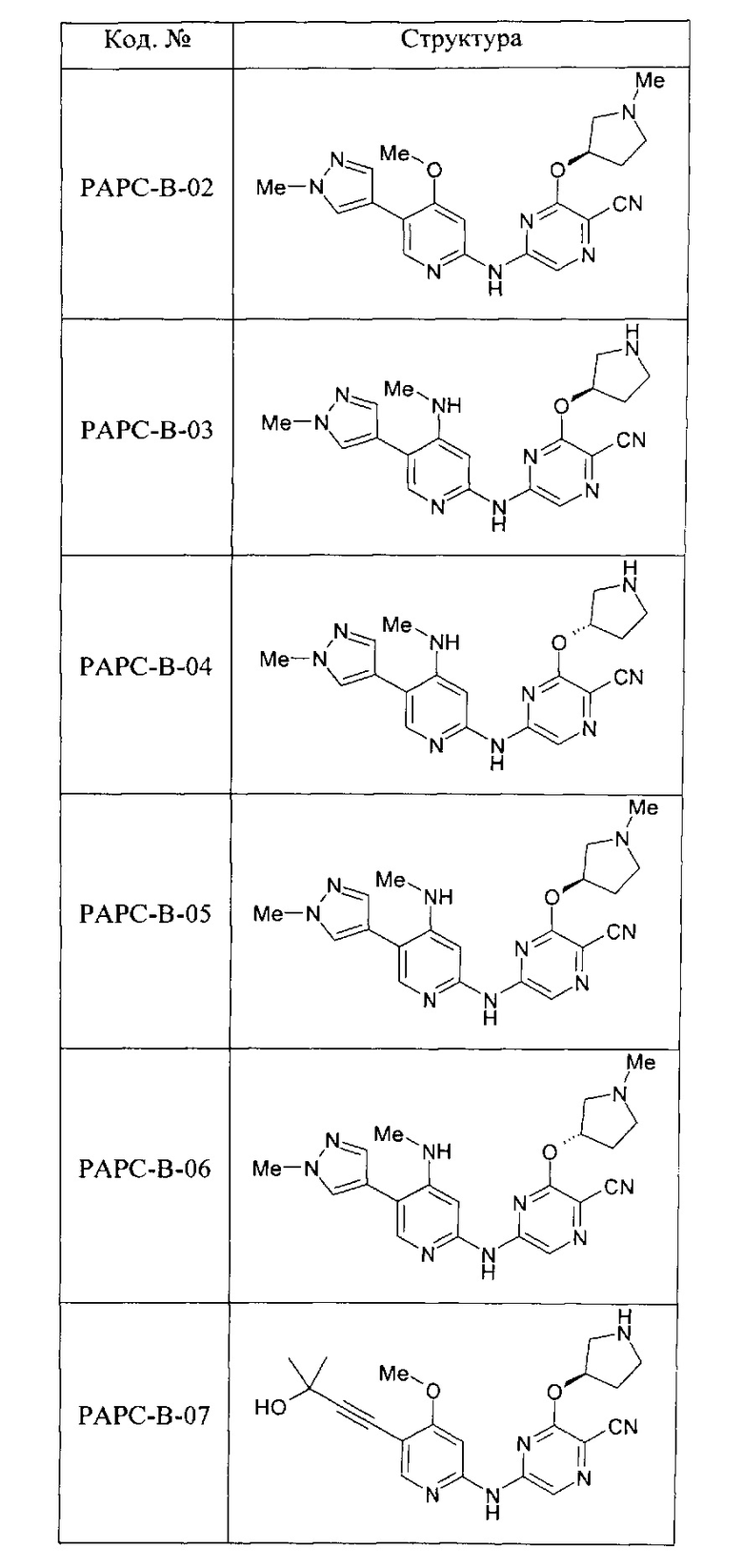
(69) Соединение по (1), представляющее собой соединение одной из следующих формул или его фармацевтически приемлемую соль, гидрат или сольват:
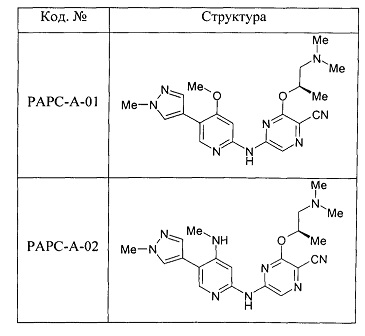
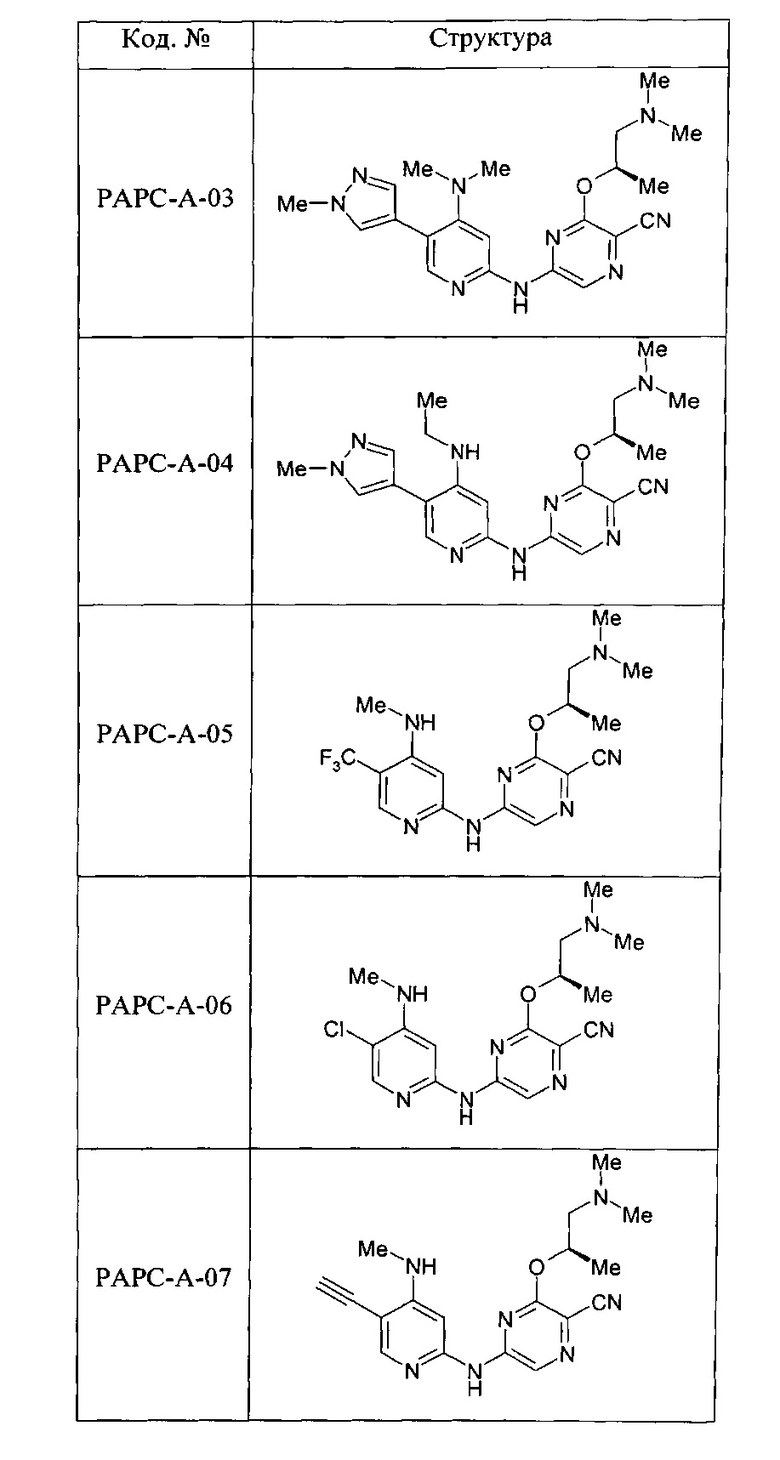
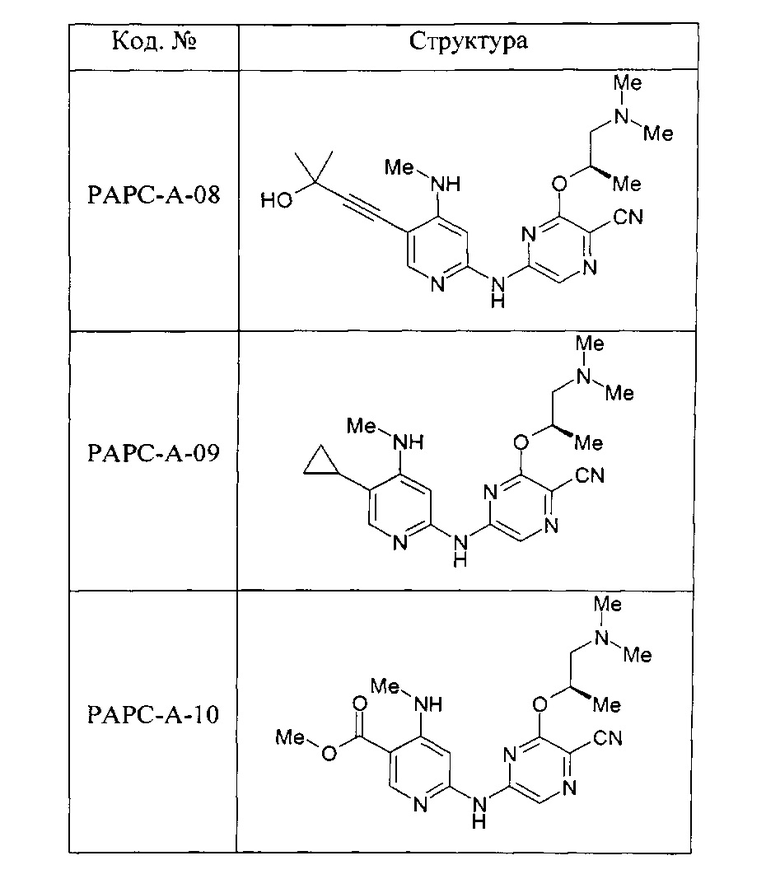
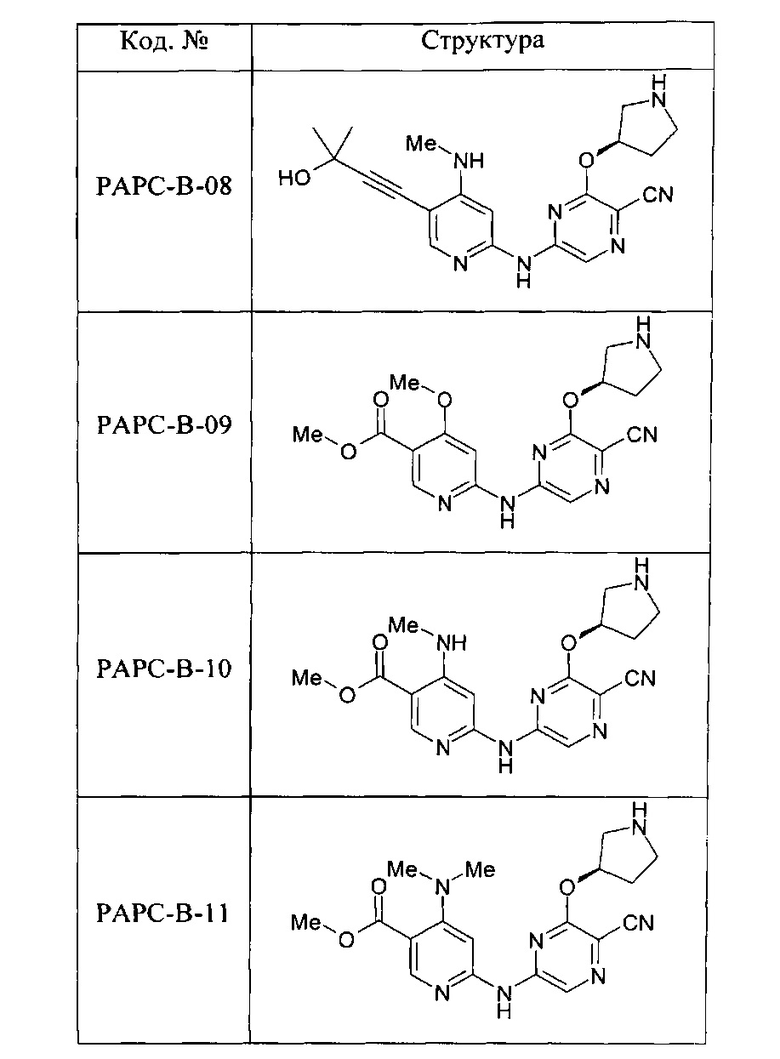
(70) Соединение по (1), представляющее собой соединение одной из следующих формул или его фармацевтически приемлемую соль, гидрат или сольват:
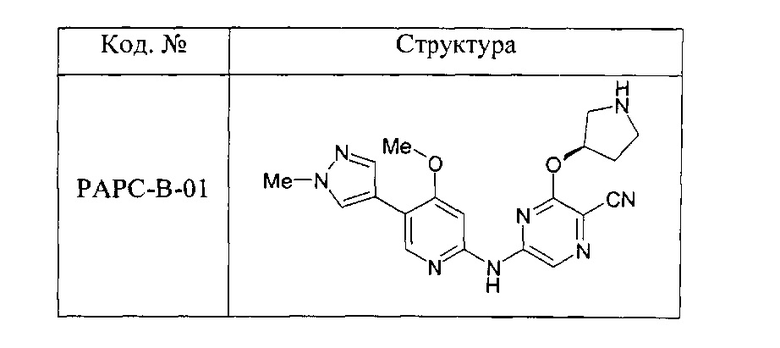
Комбинации
Следует понимать, что некоторые признаки изобретения, которые для ясности описаны в контексте отдельных вариантов реализации, также могут быть предложены совместно в едином варианте реализации. Наоборот, различные признаки изобретения, которые для краткости описаны в контексте единого варианта реализации, также могут быть предложены по отдельности или в любой подходящей субкомбинации. Все комбинации вариантов реализации, относящихся к химическим группам, представленным с помощью переменных (например, -RB3, -RB3A, -RA4, -RA4A, -RA5, -RA5A, -RA5AA, -RA5B, -RA5C, -RA5D, -RA5DA, -RA5DB-, -RA5E, -RA5F, -RA5FA и т.д.), конкретно включены в настоящее изобретение и описаны в настоящей заявке, как если бы каждая без исключения комбинация независимо и в явном виде была описана в той же степени, в какой такие комбинации включают соединения, представляющие собой стабильные соединения (т.е. соединения, которые могут быть выделены, охарактеризованы и исследованы на биологическую активность). Кроме того, все субкомбинации химических групп, перечисленные в описывающих такие переменные вариантах реализации, также конкретно включены в настоящее изобретение и описаны в настоящей заявке, как если бы каждая без исключения такая субкомбинация химических групп независимо и в явном виде была описана в настоящей заявке.
По существу очищенные формы
Один из аспектов настоящего изобретения относится к РАРС-соединениям в очищенной форме.
В одном из вариантов реализации соединение присутствует в по существу очищенной форме и/или в форме, по существу не содержащей загрязняющих примесей.
В одном из вариантов реализации соединение присутствует в по существу очищенной форме с чистотой по меньшей мере 50% по массе, например, по меньшей мере 60% по массе, например, по меньшей мере 70% по массе, например, по меньшей мере 80% по массе, например, по меньшей мере 90% по массе, например, по меньшей мере 95% по массе, например, по меньшей мере 97% по массе, например, по меньшей мере 98% по массе, например, по меньшей мере 99% по массе.
Если не указано конкретно, термин "по существу очищенная форма" относится к соединению в любой стереоизомерной или энантиомерной форме. Например, в одном из вариантов реализации термин "по существу очищенная форма" относится к смеси стереоизомеров, т.е. очищенных от других соединений стереоизомеров. В одном из вариантов реализации термин "по существу очищенная форма" относится к одному стереоизомеру, например, оптически чистому стереоизомеру. В одном из вариантов реализации термин "по существу очищенная форма" относится к смеси энантиомеров. В одном из вариантов реализации термин "по существу очищенная форма" относится к эквимолярной смеси энантиомеров (т.е. рацемической смеси, рацемату). В одном из вариантов реализации термин "по существу очищенная форма" относится к одному энантиомеру, например, оптически чистому энантиомеру.
В одном из вариантов реализации соединение находится в форме, по существу не содержащей загрязняющих примесей, при этом загрязняющие примеси составляют не более 50% по массе, например, не более 40% по массе, например, не более 30% по массе, например, не более 20% по массе, например, не более 10% по массе, например, не более 5% по массе, например, не более 3% по массе, например, не более 2% по массе, например, не более 1% по массе.
Если не указано конкретно, термин "загрязняющие примеси" относится к другим соединениям, отличным от стереоизомеров или энантиомеров. В одном из вариантов реализации термин "загрязняющие примеси" относится к другим соединениям и другим стереоизомерам. В одном из вариантов реализации термин "загрязняющие примеси" относится к другим соединениям и другому энантиомеру.
В одном из вариантов реализации соединение находится в по существу очищенной форме с оптической чистотой, составляющей по меньшей мере 60% (т.е. 60% соединения, из расчета на количество молей, представляет собой целевой стереоизомер или энантиомер, а 40% является нежелательным стереоизомером (стереоизомерами) или энантиомером), например, по меньшей мере 70%, например, по меньшей мере 80%, например, по меньшей мере 90%, например, по меньшей мере 95%, например, по меньшей мере 97%, например, по меньшей мере 98%, например, по меньшей мере, 99%.
Изомеры
Некоторые соединения могут присутствовать в одной или более конкретных геометрических, оптических, энантиомерных, диастереомерных, эпимерных, атроповых, стереоизомерных, таутомерных, конформационных или аномерных формах, включая, но не ограничиваясь перечисленными, цис- и транс-формы; Е- и Z-формы; с-, t- и r-формы; эндо- и экзо-формы; R-, S- и мезо-формы; D- и L-формы; d- и 1-формы; (+) и (-) формы; кето-, енольные и енолятные формы; син- и анти-формы; синклинальные и антиклинальные формы; α- и β-формы; аксиальные и экваториальные формы; формы "ванна", "кресло", "твист", "конверт" и "полукресло" и их комбинации, в дальнейшем совместно именуемые "изомеры" (или "изомерные формы").
Следует отметить, что кроме таутомерных форм, как указано ниже, в контексте настоящей заявки из термина "изомеры", конкретно исключены структурные (или конституционные) изомеры (т.е. изомеры, которые различаются по связям между атомами, а не только по положению атомов в пространстве). Например, ссылку на метоксигруппу, -ОСН3, не следует понимать как ссылку на ее структурный изомер, гидроксиметильную группу, -СН2ОН. Аналогичным образом, ссылку на орто-хлорфенил не следует понимать как ссылку на его структурный изомер, мета-хлорфенил. Однако ссылка на класс структур вполне может включать структурно изомерные формы, попадающие в определение этого класса (например, C1-3алкил включает н-пропил и изо-пропил; бутил включает н-, изо-, втор- и трет-бутил; метоксифенил включает орто-, мета- и пара-метоксифенил).
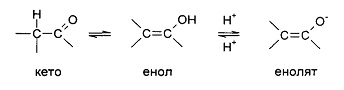
Вышеописанное исключение не относится к таутомерным формам, например, кето-, енольной и енолятной формам, как в, например, следующих таутомерных парах: кето/енол (проиллюстрирована ниже), имин/енамин, амид/иминоспирт, амидин/амидин, нитрозо/оксим, тиокетон/ентиол, N-нитрозо/гидроксиазо и нитро/ацинитро.
Следует отметить, что в термин "изомер" конкретно включены соединения с одной или более изотопными заменами. Например, Н может присутствовать в любой изотопной форме, включая 1Н, 2H(D) и 3Н(Т); С может присутствовать в любой изотопной форме, включая 12С, 13С и 14С; О может присутствовать в любой изотопной форме, включая 16O и 18O и т.п.
Если не указано иное, ссылка на конкретное соединение включает все такие изомерные формы, включая их смеси (например, рацемические смеси). Способы получения (например, асимметрический синтез) и разделения (например, фракционная кристаллизация и хроматографические способы) таких изомерных форм либо известны в данной области техники, либо могут быть легко разработаны путем адаптации предложенных в настоящей заявке способов или известных способов известным образом.
Соли
Удобным или целесообразным может оказаться получение, очистка и/или обработка соответствующей соли соединения, например, фармацевтически приемлемой соли. Берг с соавторами (Berge et al., 1977, "Pharmaceutically Acceptable Salts," J. Pharm. ScL, Vol. 66, pp. 1-19) рассматривают примеры фармацевтически приемлемых солей.
Например, если соединение является анионным или содержит функциональную группу, которая может быть анионной (например, -СООН может быть -СОО-), то может быть образована соль с подходящим катионом. Примеры подходящих неорганических катионов включают, но не ограничиваются перечисленными, ионы щелочных металлов, такие как Na+ и К+, катионы щелочноземельных металлов, такие как Са2+ и Mg2+, и другие катионы, такие как Al3+. Примеры подходящих органических катионов включают, но не ограничиваются перечисленными, ион аммония (т.е. NH4+) и замещенные ионы аммония (например, NH3R+, 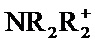

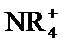
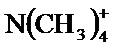
Если соединение является катионным или содержит функциональную группу, которая может быть катионной (например, -NH2 может быть 
Примеры подходящих органических анионов включают, но не ограничиваются перечисленными, ионы, полученные из следующих органических кислот: 2-ацетоксибензойной, уксусной, аскорбиновой, аспарагиновой, бензойной, камфорсульфокислоты, коричной, лимонной, этилендиаминтетрауксусной, этандисульфоновой, этансульфоновой, муравьиной, фумаровой, глюкогептоновой, глюконовой, глутаминовой, гликолевой, гидроксималеиновой, гидроксинафталинкарбоновой, 2-гидроксиэтансульфоновой, молочной, лактобионовой, лауриновой, малеиновой, яблочной, метансульфоновой, слизевой, олеиновой, щавелевой, пальмитиновой, памовой, пантотеновой, фенилуксусной, фенилсульфокислоты, пропионовой, пировиноградной, салициловой, стеариновой, янтарной, сульфаниловой, винной, толуолсульфоновой и валериановой. Примеры подходящих полимерных органических анионов включают, но не ограничиваются перечисленными, ионы, полученные из следующих полимерных кислот: дубильной кислоты, карбоксиметилцеллюлозы.
Если не указано иное, ссылка на конкретное соединение также включает его солевые формы.
Гидраты и сольваты
Удобным или целесообразным может оказаться получение, очистка и/или обработка соответствующего сольвата соединения. В настоящей заявке используемый в общепринятом смысле термин "сольват" относится к комплексу растворенного вещества (например, соединения, соли соединения) и растворителя. Если растворителем является вода, сольват в целях удобства можно называть гидратом, например, полугидратом, моногидратом, сесквигидратом, дигидратом, тригидратом и т.д.
Если не указано иное, ссылка на конкретное соединение также включает его сольватные и гидратные формы.
Химически защищенные формы
Удобным или целесообразным может оказаться получение, очистка и/или обработка соединения в химически защищенной форме. В настоящей заявке используемый в общепринятом смысле термин "химически защищенная форма" относится к соединению, в котором одна или более реакционноспособных функциональных групп защищены от нежелательных химических реакций при заданных условиях (например, pH, температура, облучение, растворитель и т.п.). На практике применяют хорошо известные химические способы для обратимого перевода в инертное состояние функциональной группы, которая в противном случае была бы реакционноспособной при заданных условиях. В химически защищенной форме одна или более реакционноспособных функциональных групп присутствуют в форме защищенной или защитной группы или (также известной как закрытая или закрывающая группа или блокированная или блокирующая группа). Посредством защиты реакционноспособной функциональной группы можно проводить реакции с участием других незащищенных реакционноспособных функциональных групп без воздействия на защищенную группу; защитная группа может быть удалена, обычно на последующей стадии, причем, удаление по существу не влияет на остальную часть молекулы. См., например, Protective Groups in Organic Synthesis (Т. Greene and P. Wuts; 4th Edition; John Wiley and Sons, 2006).
Большое разнообразие таких способов "защиты", "блокирования" или "закрытия" является широко применяемым и хорошо известным в органическом синтезе. Например, соединение, содержащее две неэквивалентные реакционноспособные функциональные группы, обе из которых обладают реакционной способностью при заданных условиях, может быть превращено в производное с переводом одной из функциональных групп в "защищенное" и, следовательно, инертное состояние при заданных условиях; защищенное таким образом соединение может быть использовано в качестве реагента, который фактически содержит только одну реакционноспособную функциональную группу. После завершения целевой реакции (с участием другой функциональной группы) защищенная группа может быть подвергнута "снятию" защиты с возвращением ее первоначальной функциональности.
Например, гидроксигруппа может быть защищена превращением в простой эфир (-OR) или сложный эфир (-OC(=O)R), например, такой как: трет-бутиловый эфир; бензиловый, бензгидриловый (дифенилметиловый) или тритиловый (трифенилметиловый) эфир; триметилсилиловый или трет-бутилдиметилсилиловый эфир или сложный эфир уксусной кислоты (-ОС(=O)СН3, -ОАс).
Например, аминогруппа может быть защищена, например, превращением в амид (-NRCO-R) или уретан (-NRCO-OR), например, такой как: метиламид (-NHCO-CH3); бензилоксиамид (-NHCO-OCH2C6H5, -NH-Cbz); трет-бутоксиамид (-NHCO-OC(CH3)3, -NH-Boc); 2-бифенил-2-пропоксиамид (-NHCO-ОС(СН3)2С6Н4С6Н5, NH-Bpoc), 9-флуоренилметоксиамид (-NH-Fmoc), 6-нитровератрилоксиамид (-NH-NVoc), 2-триметилсилилэтилоксиамид (-NH-Teoc), 2,2,2-трихлорэтилоксиамид (-NH-Troc), аллилоксиамид (NH-Alloc), 2-(фенилсульфонил)этилоксиамид (-NH-Psec) или, в соответствующих случаях (например, циклических аминов), превращением в нитроксидный радикал (>N-O⋅).
Пролекарства
Удобным или целесообразным может оказаться получение, очистка и/или обработка соединения в форме пролекарства. В настоящей заявке термин "пролекарство" относится к соединению, которое при метаболизации (например, in vivo) превращается в целевое активное соединение. Как правило, пролекарство является неактивным или менее активным, чем целевое активное соединение, но может обеспечить свойства, полезные с точки зрения обработки, введения или метаболизации.
Например, некоторые пролекарства представляют собой сложные эфиры активного соединения (например, физиологически приемлемый метаболически лабильный сложный эфир). В процессе метаболизма сложноэфирная группа (-C(=O)OR) расщепляется с образованием активного лекарственного средства. Такие сложные эфиры могут быть получены путем этерификации, например, любой из карбоксильных групп (-С(=O)ОН) исходного соединения с предварительной защитой, в надлежащих случаях, любых других реакционноспособных групп, присутствующих в исходном соединении, с последующим удалением защитных групп при необходимости.
Также, некоторые пролекарства активируются ферментативно с образованием активного соединения или соединения, которое в результате дальнейшей химической реакции дает активное соединение (например, как в способах ADEPT, GDEPT, LIDEPT и т.д.). Например, пролекарство может представлять собой производное сахара или другой гликозидный конъюгат или может представлять собой сложноэфирное производное аминокислоты.
Общие способы химического синтеза
В настоящей заявке описаны некоторые способы химического синтеза РАРС-соединений. Эти и/или другие известные способы могут быть известным образом изменены и/или адаптированы с целью упрощения синтеза дополнительных соединений, описанных в настоящей заявке.
Химический синтез
В настоящей заявке описаны некоторые способы химического синтеза пиридиламинопиразинкарбонитрильных (РАРС) соединений согласно настоящему изобретению. Эти и/или другие известные способы могут быть известным образом изменены и/или адаптированы с целью упрощения синтеза дополнительных соединений в рамках настоящего изобретения.
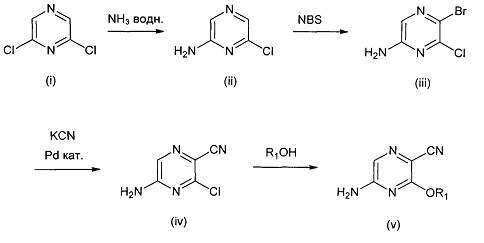
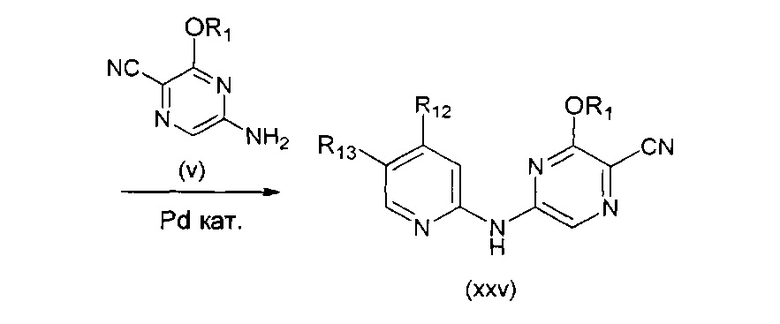
В одном подходе (Общий способ А) соединения типа (v) получают посредством способа, показанного на следующей схеме. Коммерчески доступное соединение (i) подвергают реакции с источником аммиака, как правило, в водном растворе при нагревании, с получением аминопиразина (ii). Последующая реакция с бромирующим агентом, таким как N-бромсукцинимид, при 0°C приводит к получению бромпиразина (iii). Последующее взаимодействие бромпиразина с источником цианида, обычно цианистым калием, в условиях катализируемого палладием сочетания, позволяет получить пиразинкарбонитрил (iv). Последующая реакция со спиртом, как правило, в апротонном растворителе, таком как диоксан, в присутствии основания, такого как гидрид натрия, обычно при нагревании, приводит к получению целевых 6-алкоксизамещенных 2-аминопиразин-5-карбонитрилов (v).
Схема 1
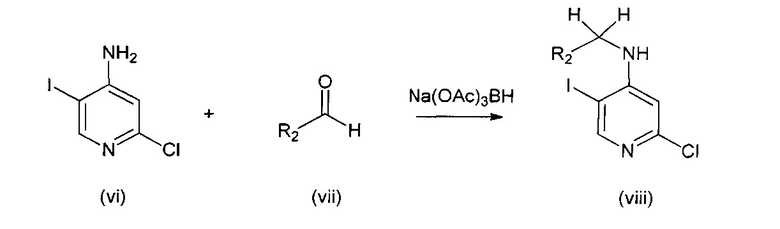
В другом подходе (Общий способ B) соединения типа (viii) получают посредством способа, показанного на следующей схеме. Коммерчески доступное соединение (vi) подвергают реакции с альдегидом (vii), например, параформальдегидом, в условиях восстановительного аминирования с применением восстанавливающего агента, например, триацетоксиборгидрида натрия, обычно при нагревании и в присутствии кислоты, с получением целевых соединений (viii).
Схема 2
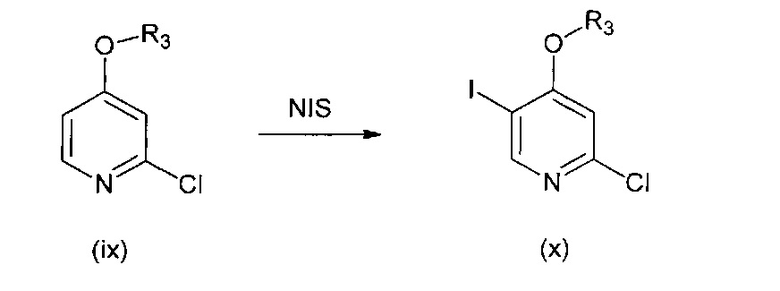
В другом подходе (Общий способ C) соединения типа (х) получают посредством способа, показанного на следующей схеме. Соединения (ix) подвергают реакции с йодирующим агентом, как правило, N-йодсукцинимидом в серной кислоте, с получением целевых соединений (х).
Схема 3
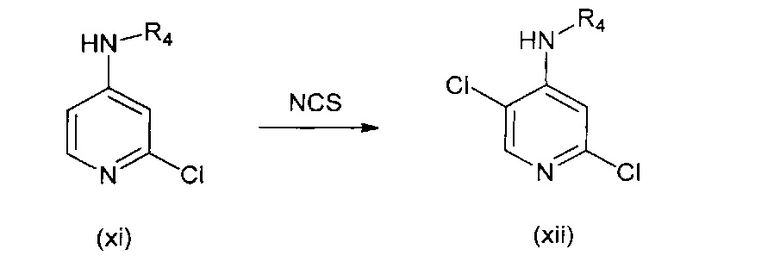
В другом подходе (Общий способ D) соединения типа (xii) получают посредством способа, показанного на следующей схеме. Соединения (xi) подвергают реакции с хлорирующим агентом, как правило, N-хлорсукцинимидом в уксусной кислоте, с получением целевых соединений (xii).
Схема 4
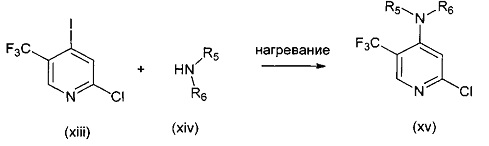
В другом подходе (Общий способ E) соединения типа (xv) получают посредством способа, показанного на следующей схеме. Коммерчески доступное соединение (xiii) подвергают реакции с амином (xiv), например, метиламином, как правило, при нагревании в микроволновом реакторе, с получением целевых соединений (xv).
Схема 5
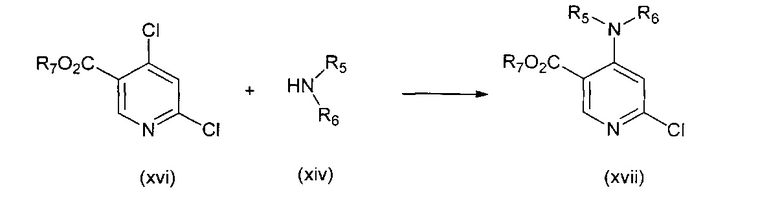
В другом подходе (Общий способ F) соединения типа (xvii) получают посредством способа, показанного на следующей схеме. Соединения (xvi) подвергают реакции с амином (xiv), например, диметиламином, как правило, в ацетонитриле при комнатной температуре или температуре ниже комнатной, с получением целевых соединений (xvii).
Схема 6
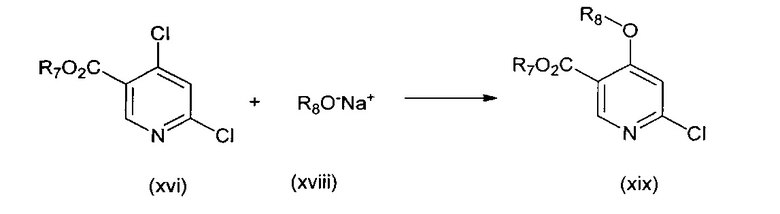
В другом подходе (Общий способ G) соединения типа (xix) получают посредством способа, показанного на следующей схеме. Соединения (xvi) подвергают реакции с алкоксидной солью (xviii), например, метоксидом натрия, в апротонном растворителе, таком как тетрагидрофуран, при комнатной температуре, с получением целевых соединений (xix).
Схема 7
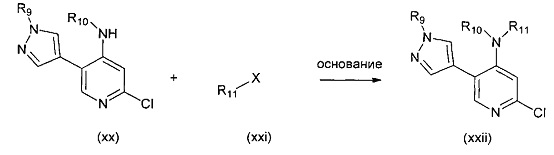
В другом подходе (Общий способ H) соединения типа (xxii) получают посредством способа, показанного на следующей схеме. Соединения (хх) подвергают реакции с галогеналканами (xxi), например, йодметаном, как правило, в апротонном растворителе, таком как ДМФ, и в присутствии основания, такого как гидрид натрия, с получением целевых соединений (xxii).
Схема 8
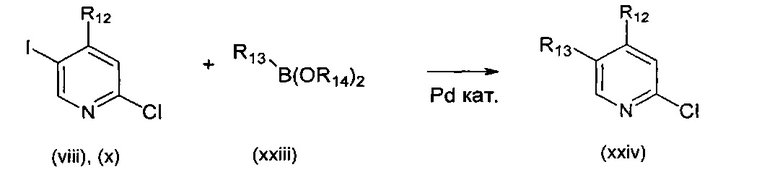
В другом подходе (Общий способ I) соединения типа (xxv) получают посредством способа, показанного на следующей схеме. 5-Иод-2-хлорпиридины (viii) или (х) подвергают сочетанию с бороновыми кислотами или сложными эфирами (xxiii), например, 1-метил-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1Н-пиразолом или 2-циклопропил-4,4,5,5-тетраметил-1,3,2-диоксабороланом, в условиях катализируемого палладием сочетания в растворителе, таком как ацетонитрил, как правило, при нагревании с помощью масляной бани или микроволнового излучения и, как правило, в присутствии карбоната металла в качестве основания, с получением пиридинов (xxiv). Обработка промежуточных соединений (xxiv) пиразиновыми соединениями (v) в условиях катализируемого палладием аминирования, как правило, при нагревании с помощью масляной бани или микроволнового излучения и в присутствии основания, такого как карбонат металла, приводит к получению, после удаления всевозможных защитных групп, целевых РАРС-соединений (xxv).
Схема 9
В другом подходе (Общий способ J) соединения типа (xxvi) получают посредством способа, показанного на следующей схеме. Сложные эфиры 2-хлорпиридин-5-карбоновых кислот (xvii) или (xix) подвергают сочетанию с пиразиновыми соединениями (v) в условиях катализируемого палладием аминирования, как правило, при нагревании с помощью масляной бани или микроволнового излучения и в присутствии основания, такого как карбонат металла, с получением, после удаления всевозможных защитных групп, целевых РАРС-соединений (xxvi).
Схема 10
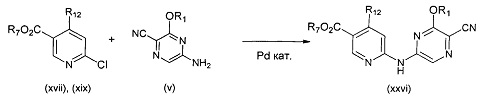
В другом подходе (Общий способ K) соединения типа (xxvii) получают посредством способа, показанного на следующей схеме. 2,5-Дихлорпиридины (xii) подвергают сочетанию с пиразиновыми соединениями (v) в условиях катализируемого палладием аминирования, как правило, при нагревании с помощью масляной бани или микроволнового излучения и в присутствии основания, такого как карбонат металла, с получением, после удаления всевозможных защитных групп, целевых РАРС-соединений (xxii).
Схема 11
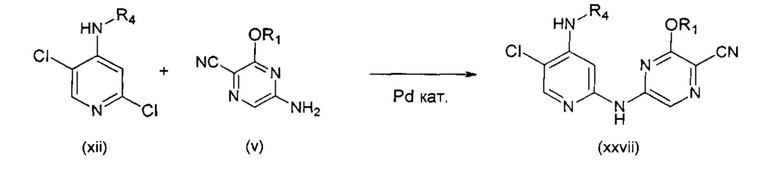
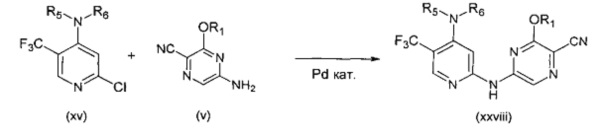
В другом подходе (Общий способ L) соединения типа (xxviii) получают посредством способа, показанного на следующей схеме. 5-Трифторметил-2-хлорпиридины (xv) подвергают сочетанию с пиразиновыми соединениями (v) в условиях катализируемого палладием аминирования, как правило, при нагревании с помощью масляной бани или микроволнового излучения и в присутствии основания, такого как карбонат металла, с получением, после удаления всевозможных защитных групп, целевых РАРС-соединений (xxviii).
Схема 12
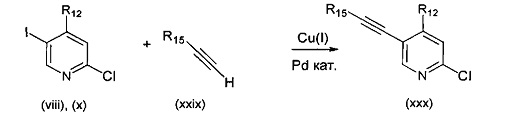
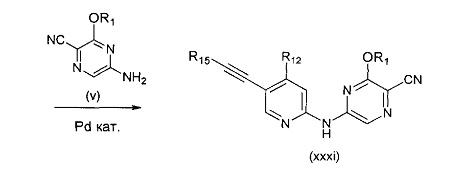
В другом подходе (Общий способ M) соединения типа (xxxi) получают посредством способа, показанного на следующей схеме. 5-Иод-2-хлорпиридины (viii) или (х) подвергают сочетанию с алкинами (xxix), например, этинилтриметилсиланом или триметил(2-метилбут-3-ин-2-илокси)силаном в условиях катализируемого палладием сочетания в присутствии соли меди (I), например, иодида меди (I), в растворителе, таком как ДМФ, как правило, при нагревании с помощью масляной бани или микроволнового излучения и, как правило, в присутствии основания, с получением пиридинов (ххх). Обработка промежуточных соединений (ххх) пиразиновыми соединениями (v) в условиях катализируемого палладием аминирования, как правило, при нагревании с помощью масляной бани или микроволнового излучения и в присутствии основания, такого как карбонат металла, приводит к получению, после удаления всевозможных защитных групп, целевых РАРС-соединений (xxxi).
Схема 13
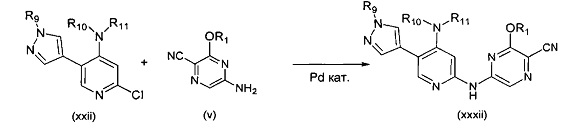
В другом подходе (Общий способ N) соединения типа (xxxii) получают посредством способа, показанного на следующей схеме. 5-(Пиразол-4-ил)-2-хлорпиридины (ххii) подвергают сочетанию с пиразиновыми соединениями (v) в условиях катализируемого палладием аминирования, как правило, при нагревании с помощью масляной бани или микроволнового излучения и в присутствии основания, такого как карбонат металла, с получением, после удаления всевозможных защитных групп, целевых РАРС-соединений (xxxii).
Схема 14
Композиции
Один из аспектов настоящего изобретения относится к композиции (например, фармацевтической композиции), содержащей РАРС-соединение, описанное в настоящей заявке, и фармацевтически приемлемые носитель, разбавитель или вспомогательное вещество.
Другой аспект настоящего изобретения относится к способу получения композиции (например, фармацевтической композиции), включающему смешивание РАРС-соединения, описанного в настоящей заявке, и фармацевтически приемлемого носителя, разбавителя или вспомогательного вещества.
В одном предпочтительном варианте реализации композиция (например, фармацевтическая композиция) подходит для перорального введения субъекту.
Применения
РАРС-соединения, описанные в настоящей заявке, подходят, например, для лечения расстройств (например, заболеваний), при которых улучшения достигают путем ингибирования киназной функции СНК1, описанного в настоящей заявке.
Применение в способах ингибирования СНК1
Один из аспектов настоящего изобретения относится к способу ингибирования киназной функции СНК1, in vitro или in vivo, включающему приведение киназы СНК1 в контакт с эффективным количеством РАРС-соединения, описанного в настоящей заявке.
Один из аспектов настоящего изобретения относится к способу ингибирования киназной функции СНК1 в клетке, in vitro или in vivo, включающему приведение клетки в контакт с эффективным количеством РАРС-соединения, описанного в настоящей заявке.
В одном из вариантов реализации указанный способ дополнительно включает приведение клетки в контакт с одним или более другими агентами, выбранными из:
(a) ингибитора ДНК-топоизомеразы I или II; (b) ДНК-повреждающего агента; (с) антиметаболита или ингибитора тимидилатсинтазы (ТС); (d) нацеленного на микротрубочки агента; и (е) ионизирующего излучения.
Подходящие анализы для определения ингибирования киназной функции СНК1 описаны в настоящей заявке и/или известны в данной области техники.
В одном из вариантов реализации способ осуществляют in vitro.
В одном из вариантов реализации способ осуществляют in vivo.
В одном из вариантов реализации РАРС-соединение обеспечено в форме фармацевтически приемлемой композиции.
Любой тип клеток может быть подвергнут воздействию, включая, но без ограничения, жировые клетки, клетки легких, желудочно-кишечного тракта (включая, например, клетки кишечника, толстой кишки), груди (молочной железы), яичников, предстательной железы, печени (гепатоциты), почек (почечные), мочевого пузыря, поджелудочной железы, головного мозга и кожи.
Специалист в данной области техники способен легко определить, ингибирует ли соединение-кандидат киназную функцию СНК1. Например, подходящие анализы описаны в настоящей заявке.
Применение в способах ингибирования пролиферации клеток и т.д.
Описанные в настоящей заявке РАРС-соединения, например, (а) регулируют (например, ингибируют) пролиферацию клеток; (b) ингибируют прогрессию клеточного цикла; (с) стимулируют апоптоз клеток; или (d) обеспечивают осуществление комбинации одного или более из вышеперечисленных.
Один из аспектов настоящего изобретения относится к способу регулирования (например, ингибирования) пролиферации клеток (например, пролиферации клетки), ингибирования прогрессии клеточного цикла, стимулирования апоптоза клеток или осуществления комбинации одного или более из вышеперечисленных, in vitro или in vivo, включающему приведение клетки в контакт с эффективным количеством РАРС-соединения, описанного в настоящей заявке.
В одном из вариантов реализации указанный способ представляет собой способ регулирования (например, ингибирования) пролиферации клеток (например, пролиферации клетки), in vitro или in vivo, включающий приведение клетки в контакт с эффективным количеством РАРС-соединения, описанного в настоящей заявке.
В одном из вариантов реализации указанный способ дополнительно включает приведение клетки в контакт с одним или более другими агентами, выбранными из: (а) ингибитора ДНК-топоизомеразы I или II; (b) ДНК-повреждающего агента; (с) антиметаболита или ингибитора тимидилатсинтазы (ТС); (d) нацеленного на микротрубочки агента; и (е) ионизирующего излучения.
В одном из вариантов реализации способ осуществляют in vitro.
В одном из вариантов реализации способ осуществляют in vivo.
В одном из вариантов реализации РАРС-соединение обеспечено в форме фармацевтически приемлемой композиции.
Любой тип клеток может быть подвергнут воздействию, включая, но без ограничения, клетки легких, желудочно-кишечного тракта (включая, например, клетки кишечника, толстой кишки), груди (молочной железы), яичников, предстательной железы, печени (гепатоциты), почек (почечные), мочевого пузыря, поджелудочной железы, головного мозга и кожи.
Специалист в данной области техники способен легко определить, регулирует ли (например, ингибирует ли) соединение-кандидат пролиферацию клеток и т.д. Например, анализы, которые с удобством могут быть применены для оценки активности, демонстрируемой конкретным соединением, описаны в настоящей заявке.
Например, образец клеток (например, из опухоли) может быть выращен in vitro, и соединение введено в контакт с указанными клетками, и проведено наблюдение воздействия соединения на эти клетки. В качестве примера "воздействия" может быть определен морфологический статус клеток (например, живые или погибшие и т.д.). В случае, когда обнаруживают влияние соединения на клетки, этот факт может быть использован в качестве прогностического или диагностического маркера эффективности применения соединения в способах лечения пациента-носителя клеток того же клеточного типа.
Применение в способах лечения
Другой аспект настоящего изобретения относится к РАРС-соединению, описанному в настоящей заявке, для применения в способе лечения человека или животного посредством терапии.
Другой аспект настоящего изобретения относится к РАРС-соединению, описанному в настоящей заявке, для применения в способе лечения человека или животного посредством терапии с помощью перорального введения.
В одном из вариантов реализации способ лечения включает лечение с применением как (i) РАРС-соединения, описанного в настоящей заявке, так и (ii) одного или более других агентов, выбранных из: (а) ингибитора ДНК-топоизомеразы I или II; (b) ДНК-повреждающего агента; (с) антиметаболита или ингибитора тимидилатсинтазы (ТС); (d) нацеленного на микротрубочки агента; и (е) ионизирующего излучения.
Другой аспект настоящего изобретения относится к (а) ингибитору ДНК-топоизомеразы I или II, (b) ДНК-повреждающему агенту, (с) антиметаболиту или ингибитору тимидилатсинтазы (ТС) или (d) нацеленному на микротрубочки агенту, описанным в настоящей заявке, для применения в способе лечения человека или животного посредством терапии, при этом способ лечения включает лечение с применением как (i) РАРС-соединения, описанного в настоящей заявке, так и (а) ингибитора ДНК-топоизомеразы I или II, (b) ДНК-повреждающего агента, (c) антиметаболита или ингибитора тимидилатсинтазы (ТС) или (d) нацеленного на микротрубочки агента.
Применение для получения лекарственных средств
Другой аспект настоящего изобретения относится к применению РАРС-соединения, описанного в настоящей заявке, для получения лекарственного средства для применения в способе лечения.
Другой аспект настоящего изобретения относится к применению РАРС-соединения, описанного в настоящей заявке, для получения лекарственного средства для применения в способе лечения с помощью перорального введения.
В одном из вариантов реализации лекарственное средство содержит РАРС-соединение.
В одном из вариантов реализации лечение включает лечение с применением как (i) лекарственного средства, содержащего описанное в настоящей заявке РАРС-соединение, так и (ii) одного или более других агентов, выбранных из: (а) ингибитора ДНК-топоизомеразы I или II; (b) ДНК-повреждающего агента; (с) антиметаболита или ингибитора тимидилатсинтазы (ТС); (d) нацеленного на микротрубочки агента; и (е) ионизирующего излучения.
Другой аспект настоящего изобретения относится к применению (а) ингибитора ДНК-топоизомеразы I или II, (b) ДНК-повреждающего агента, (с) антиметаболита или ингибитора тимидилатсинтазы (ТС) или (d) нацеленного на микротрубочки агента, описанных в настоящей заявке, для получения лекарственного средства для применения в способе лечения, при этом лечение включает лечение с применением как (i) РАРС-соединения, описанного в настоящей заявке, так и (а) ингибитора ДНК-топоизомеразы I или II, (b) ДНК-повреждающего агента, (с) антиметаболита или ингибитора тимидилатсинтазы (ТС) или (d) нацеленного на микротрубочки агента.
Способы лечения
Другой аспект настоящего изобретения относится к способу лечения, включающему введение пациенту, нуждающемуся в лечении, терапевтически эффективного количества РАРС-соединения, описанного в настоящей заявке, предпочтительно в форме фармацевтической композиции.
Другой аспект настоящего изобретения относится к способу лечения, включающему пероральное введение пациенту, нуждающемуся в лечении, терапевтически эффективного количества РАРС-соединения, описанного в настоящей заявке, предпочтительно в форме фармацевтической композиции.
В одном из вариантов реализации способ дополнительно включает введение субъекту одного или более других агентов, выбранных из: (а) ингибитора ДНК-топоизомеразы I или II; (b) ДНК-повреждающего агента; (с) антиметаболита или ингибитора тимидилатсинтазы (ТС); (d) нацеленного на микротрубочки агента; и (е) ионизирующего излучения.
Состояния, подлежащие лечению, - состояния, опосредованные СНК1
В одном из вариантов реализации (например, применения в способах лечения, применения для получения лекарственных средств, способов лечения), лечение представляет собой лечение заболевания или состояния, опосредованного СНК1.
Состояния, подлежащие лечению, - состояния, при которых улучшения достигают путем ингибирования киназной функции СНК1
В одном из вариантов реализации (например, применения в способах лечения, применения для получения лекарственных средств, способов лечения), лечение представляет собой лечение заболевания или состояния, при котором улучшения достигают путем ингибирования киназной функции СНК1.
Расстройства, подлежащие лечению, - пролиферативные заболевания
В одном из вариантов реализации (например, применения в способах лечения, применения для получения лекарственных средств, способов лечения), лечение представляет собой лечение пролиферативного заболевания.
В настоящей заявке термин "пролиферативное заболевание" относится к нежелательной или неконтролируемой клеточной пролиферации избыточных или аномальных клеток, которая является неблагоприятной, такой как неопластический или гиперпластический рост.
В одном из вариантов реализации лечение представляет собой лечение пролиферативного заболевания, характеризующегося доброкачественной, предзлокачественной или злокачественной пролиферацией клеток, включая, например: новообразования, гиперплазии и опухоли (например, гистоцитому, глиому, астроцитому, остеому), различные виды рака (см. ниже), псориаз, заболевания костей, фибропролиферативные расстройства (например, соединительных тканей), фиброз легких, атеросклероз, пролиферацию гладкомышечных клеток в кровеносных сосудах, такую как стеноз или рестеноз после ангиопластики.
Расстройства, подлежащие лечению, - рак
В одном из вариантов реализации (например, применения в способах лечения, применения для получения лекарственных средств, способов лечения), лечение представляет собой лечение рака.
В одном из вариантов реализации лечение представляет собой лечение рака легкого, мелкоклеточного рака легкого, немелкоклеточного рака легкого, рака желудочно-кишечного тракта, рака желудка, рака кишечника, рака толстой кишки, рака прямой кишки, рака ободочной и/или прямой кишки, рака щитовидной железы, рака молочной железы, рака яичника, рака эндометрия, рака предстательной железы, рака яичка, рака печени, рака почки, почечно-клеточной карциномы, рака мочевого пузыря, рака поджелудочной железы, рака мозга, нейробластомы, глиомы, саркомы, остеосаркомы, рака костей, рака носоглотки (например, рака головы, рака шеи), рака кожи, плоскоклеточного рака, саркомы Капоши, меланомы, злокачественной меланомы, лимфомы или лейкоза.
В одном из вариантов реализации лечение представляет собой лечение:
карциномы, например, карциномы мочевого пузыря, молочной железы, толстой кишки (например, колоректальных карцином, таких как аденокарцинома толстой кишки и аденома толстой кишки), почки, эпидермальной карциномы, печени, легкого (например, аденокарциномы, мелкоклеточного рака легкого и немелкоклеточных карцином легкого), пищевода, желчного пузыря, яичника, поджелудочной железы (например, экзокринной карциномы поджелудочной железы), желудка, шейки матки, щитовидной железы, предстательной железы, кожи (например, плоскоклеточной карциномы);
опухоли кроветворной ткани лимфоидного происхождения, например, лейкоза, острого лимфобластного лейкоза, В-клеточной лимфомы, Т-клеточной лимфомы, лимфомы Ходжкина, неходжкинской лимфомы, волосатоклеточной лимфомы или лимфомы Беркетта;
опухоли кроветворной ткани миелоидного происхождения, например, острых и хронических миелоидных лейкозов, миелодиспластического синдрома или промиелоцитарного лейкоза;
мезенхимальной опухоли, например фибросаркомы или рабдомиосаркомы;
опухоли центральной или периферической нервной системы, например, астроцитомы, нейробластомы, глиомы или шванномы;
меланомы; семиномы; тератокарциномы; остеосаркомы; пигментной ксеродермы; кератоакантомы; фолликулярного рака щитовидной железы или саркомы Капоши.
В одном из вариантов реализации лечение представляет собой лечение твердой опухоли.
В одном из вариантов реализации лечение представляет собой лечение рака головы; рака шеи; рака нервной системы; рака мозга; нейробластомы; рака легкого/средостения; рака молочной железы; рака пищевода; рака желудка; рака печени; рака желчевыводящих путей; рака поджелудочной железы; рака тонкой кишки; рака толстой кишки; рака ободочной и/или прямой кишки; рака женских половых органов; рака мочеполовой системы; рака яичника; рака щитовидной железы; рака надпочечника; рака кожи; меланомы; остеосаркомы; саркомы мягких тканей; злокачественных опухолей детского возраста; болезни Ходжкина; неходжкинской лимфомы; миеломы; лейкоза или метастазов из неизвестного первичного очага.
В одном из вариантов реализации рак характеризуется или дополнительно характеризуется наличием дефицита белка p53. В одном из вариантов реализации рак представляет собой p53-дефицитный рак.
В одном из вариантов реализации лечение представляет собой лечение раковых метастазов.
В одном из вариантов реализации рак характеризуется или дополнительно характеризуется наличием раковых стволовых клеток.
Противораковый эффект может быть опосредован одним или несколькими механизмами, включая, но без ограничения, регуляцию клеточной пролиферации, ингибирование прогрессии клеточного цикла, ингибирование ангиогенеза (образования новых кровеносных сосудов), ингибирование образования метастазов (распространения опухоли от ее первичного очага), ингибирование миграции клеток (распространения раковых клеток в другие части организма), ингибирование опухолевой инвазии (распространения опухолевых клеток в соседние нормальные структуры) или стимулирование апоптоза клеток (программируемой клеточной гибели). Соединения согласно настоящему изобретению могут быть применены для лечения описанных в настоящей заявке раковых заболеваний независимо от описанных в настоящей заявке механизмов.
Лечение
Термин "лечение", используемый в настоящей заявке в контексте лечения расстройства, в общем относится к лечению человека или животного (например, в ветеринарии), при котором достигают некоторого желаемого терапевтического эффекта, например, ингибирования развития заболевания, и включает снижение скорости прогрессирования, прекращение прогрессирования, облегчение симптомов расстройства, уменьшение степени тяжести расстройства и излечение расстройства. Термин также включает лечение в качестве профилактической меры (т.е. профилактику). Например, применение в случае пациентов, у которых еще не произошло развития расстройства, но которые входят в группу риска развития расстройства, охватывается термином "лечение".
Например, лечение включает профилактику рака, снижение заболеваемости раком, облегчение симптомов рака и т.д.
Термин "терапевтически эффективное количество" в настоящей заявке относится к такому количеству соединения, или вещества, композиции или лекарственной формы, содержащей соединение, которое эффективно для обеспечения некоторого желаемого терапевтического эффекта, соизмеримого с разумным соотношением польза/риск, при введении в соответствии с требуемой схемой лечения.
Комбинированная терапия
Термин "лечение" включает комбинированное лечение и терапию, при которых сочетают два или более видов лечения или терапии, например, последовательно или одновременно. Например, соединения, описанные в настоящей заявке, также могут быть применены в комбинированной терапии, например, в сочетании с другими агентами. Примеры видов лечения и терапии включают, но не ограничиваются перечисленными, химиотерапию (введение активных агентов, включая, например, лекарственные средства, антитела (например, как в иммунотерапии), пролекарства (например, как в фотодинамической терапии, способах GDEPT, ADEPT, и т.д.)); хирургическое лечение; лучевую терапию; фотодинамическую терапию; генную терапию и контролируемый пищевой рацион.
Один из аспектов настоящего изобретения относится к соединению, описанному в настоящей заявке, в комбинации с одним или более (например, 1, 2, 3, 4 и т.д.) дополнительными терапевтическими агентами, например, агентами или видами терапии, которые регулируют рост, или выживаемость, или дифференцировку клеток посредством различных механизмов и таким образом воздействуют на некоторые характерные особенности развития рака.
Конкретная комбинация будет составлена по усмотрению лечащего врача, который должен выбирать дозировки, используя свои обычные знания в различных областях, и режимы дозирования, известные квалифицированному специалисту-практику.
Агенты (т.е. соединения, описанные в настоящей заявке, а также один или более других агентов) могут быть введены одновременно или последовательно и могут быть введены согласно индивидуальным варьируемым режимам дозирования и посредством различных путей. Например, в случае последовательного введения агенты можно вводить через короткие интервалы времени (например, в течение периода, составляющего 5-10 минут) или более длинные интервалы (например, с промежутком 1, 2, 3, 4 или более часов или даже большим промежутком при необходимости), причем, точный режим дозирования должен быть соизмеримым со свойствами терапевтического агента (агентов).
Агенты (т.е. соединения, описанные в настоящей заявке, а также один или более других агентов) могут быть приготовлены вместе в виде единой лекарственной формы или, альтернативно, индивидуальные агенты могут быть приготовлены раздельно и представлены вместе в форме набора, необязательно с инструкциями по их применению.
Комбинированная терапия, включающая ДНК-повреждающие агенты
Как было указано выше в настоящей заявке, в некоторых вариантах реализации РАРС-соединения применяют в комбинации с (например, в сочетании с) с одним или более другими агентами, выбранными из: (а) ингибитора ДНК-топоизомеразы I или II; (b) ДНК-повреждающего агента; (с) антиметаболита или ингибитора тимидилатсинтазы (ТС); (d) нацеленного на микротрубочки агента; и (е) ионизирующего излучения.
В случае применения как РАРС-соединения, так и одного или более других агентов, они могут быть применены (например, путем введения в контакт, введены и т.д.) в любом порядке. Кроме того, они могут быть применены (например, путем введения в контакт, введены и т.д.) вместе, как часть единого состава, или раздельно, в виде индивидуальных составов.
Например, что касается способов лечения с применением как РАРС-соединения, так и одного или более других агентов, лечение с помощью (например, введение) РАРС-соединения может быть осуществлено перед, одновременно с или вслед за лечением с помощью (например, введением) одного или более других агентов или их комбинации.
В одном из вариантов реализации лечение с помощью (например, введение) РАРС-соединения осуществляют одновременно с или вслед за лечением с помощью (например, введением) одного или более других агентов.
В одном из вариантов реализации один или более других агентов представляет собой ингибитор ДНК-топоизомеразы I или II; например, этопозид, топотекан, камптотецин, иринотекан, SN-38, доксорубицин или даунорубицин.
В одном из вариантов реализации один или более других агентов представляет собой ДНК-повреждающий агент; например, алкилирующие агенты, агенты на основе соединений платины или соединения, генерирующие свободные радикалы, например, темозоламид, цисплатин, карбоплатин, оксалиплатин, митомицин С, циклофосфамид, BCNU, CCNU или блеомицин.
В одном из вариантов реализации один или более других агентов представляет собой антиметаболит или ингибитор тимидилатсинтазы (ТС); например, 5-фторурацил, гидроксимочевину, гемцитабин, арабинозилцитозин, флударабин, Томудекс (Tomudex) или ZD9331.
В одном из вариантов реализации один или более других агентов представляет собой нацеленный на микротрубочки агент; например, паклитаксел, доцетаксел, винкристин или винбластин.
В одном из вариантов реализации один или более других агентов представляет собой ионизирующее излучение (например, как часть лучевой терапии).
Другие применения
РАРС-соединения, описанные в настоящей заявке, также могут быть применены в качестве добавок при культивировании клеток для ингибирования киназной функции СНК1, например, для ингибирования пролиферации клеток и т.д.
РАРС-соединения, описанные в настоящей заявке, также могут быть применены как часть исследования in vitro, например, для определения вероятности того, что лечение организма-кандидата с применением рассматриваемого соединения будет иметь положительный результат.
РАРС-соединения, описанные в настоящей заявке, также могут быть применены в качестве стандартного соединения, например, при проведении анализа, с целью идентификации других соединений, других ингибиторов киназной функции СНК1, других антипролиферативных агентов, другие противораковых агентов и т.д.
Наборы
Один из аспектов изобретения относится к набору, содержащему (a) РАРС-соединение, описанное в настоящей заявке, или композицию, содержащую описанное в настоящей заявке РАРС-соединение, например, предпочтительно обеспеченное в подходящей емкости и/или с подходящей упаковкой; и (b) инструкции по применению, например, письменные указания относительно введения соединения или композиции.
В одном из вариантов реализации набор дополнительно содержит один или более других агентов, выбранных из: (а) ингибитора ДНК-топоизомеразы I или II; (b) ДНК-повреждающего агента; (с) антиметаболита или ингибитора тимидилатсинтазы (ТС); и (d) нацеленного на микротрубочки агента.
Письменные инструкции могут также включать перечень показаний, для которых активный ингредиент представляет собой подходящий вид лечения.
Пути введения
РАРС-соединение или содержащая РАРС-соединение фармацевтическая композиция могут быть введены субъекту посредством любого подходящего пути введения, либо системно/периферически, либо местно (т.е. в место проявления требуемого эффекта).
Пути введения включают, но не ограничиваются перечисленными, пероральный (например, посредством приема внутрь); буккальный; сублингвальный; трансдермальный (включая, например, введение с помощью повязки, пластыря и т.д.); трансмукозальный (включая, например, введение с помощью повязки, пластыря и т.д.); интраназальный (например, с помощью назального аэрозоля); глазной (например, с помощью глазных капель); легочный (например, с помощью ингаляционной или инсуффляционной терапии с применением, например, аэрозоля, например, через полость рта или носа); ректальный (например, с помощью суппозиториев или клизмы); вагинальный (например, с помощью пессария); парентеральный, например, посредством инъекции, включая подкожный, внутрикожный, внутримышечный, внутривенный, внутриартериальный, внутрисердечный, интратекальный, интраспинальный, интракапсулярный, субкапсулярный, интраорбитальный, интраперитонеальный, внутритрахеальный, субкутикулярный, внутрисуставный, субарахноидальный и интрастернальный; имплантацию депо или резервуара, например, подкожно или внутримышечно.
Предпочтительно, путь введения представляет собой пероральный, и РАРС-соединение или содержащую РАРС-соединение фармацевтическую композицию вводят субъекту перорально.
Субъект/Пациент
Субъектом/пациентом могут являться хордовые, позвоночные, млекопитающие, плацентарные млекопитающие, сумчатые (например, кенгуру, вомбат), грызуны (например, морская свинка, хомяк, крыса, мышь), мышевидные (например, мышь), зайцеобразные (например, кролик), пернатые (например, птица), псовые (например, собака), кошачьи (например, кошка), лошадиные (например, лошадь), свиноподобные (например, свинья), овечьи (например, овца), крупный рогатый скот (например, корова), приматы, обезьяноподобные (например, обезьяна или человекообразная обезьяна), обезьяны (например, мартышка, павиан), человекообразные обезьяны (например, горилла, шимпанзе, орангутан, гиббон) или человек.
Кроме того, субъект/пациент может находиться в любой из его форм развития, например, в форме плода.
В одном предпочтительном варианте реализации субъектом/пациентом является человек.
Составы
Наряду с тем, что РАРС-соединение можно вводить отдельно, предпочтительно его предложение в виде фармацевтического состава (например, композиции, препарата, лекарственного средства), содержащего по меньшей мере одно РАРС-соединение, описанное в настоящей заявке, вместе с одним или более другими фармацевтически приемлемыми ингредиентами, хорошо известными специалистам в данной области техники, включая, но не ограничиваются перечисленными, фармацевтически приемлемые носители, разбавители, вспомогательные вещества, адъюванты, наполнители, буферы, консерванты, антиоксиданты, смазывающие вещества, стабилизаторы, солюбилизаторы, поверхностно-активные вещества (например, смачивающие агенты), маскирующие агенты, красители, ароматизаторы и подсластители. Состав может дополнительно содержать другие активные агенты, например, другие терапевтические или профилактические агенты.
Таким образом, согласно настоящему изобретению также предложены фармацевтические композиции, определенные выше, и способы получения фармацевтической композиции, включающие смешивание по меньшей мере одного описанного в настоящей заявке РАРС-соединения вместе с одним или несколькими другими фармацевтически приемлемыми ингредиентами, хорошо известными специалистам в данной области техники, например, носителями, разбавителями, вспомогательными веществами и т.д. При получении композиций в виде отдельных единиц (например, таблеток и т.д.) каждая единица содержит заранее определенное количество (дозу) соединения.
В настоящей заявке термин "фармацевтически приемлемый" относится к соединениям, ингредиентам, веществам, композициям, лекарственным формам и т.д., которые, с медицинской точки зрения, подходят для применения в контакте с тканями рассматриваемого субъекта (например, человека), не демонстрируя повышенной токсичности, раздражения, аллергической реакции или других проблем или осложнений, соизмеримых с разумным соотношением польза/риск. Каждый носитель, разбавитель, вспомогательное вещество и т.д., также должен быть "приемлемым" в смысле совместимости с другими ингредиентами состава.
Сведения о подходящих носителях, разбавителях, вспомогательных веществах и т.д. можно найти в стандартной фармацевтической литературе, например, Remington's Pharmaceutical Sciences, 18th edition, Mack Publishing Company, Easton, Pa., 1990 и Handbook of Pharmaceutical Excipients. 5th edition, 2005.
Составы могут быть получены посредством любых способов, хорошо известных в области фармации. Такие способы включают стадию объединения соединения с носителем, который содержит один или более вспомогательных ингредиентов. Как правило, составы получают посредством равномерного и однородного объединения соединения с носителями (например, жидкими носителями, мелкодисперсным твердым носителем и т.д.) и далее формования продукта при необходимости.
Состав может быть получен с обеспечением быстрого или медленного высвобождения; немедленного, замедленного, приуроченного к определенному времени или пролонгированного высвобождения или их комбинации.
Составы могут быть надлежащим образом получены в форме жидкостей, растворов (например, водных, неводных), суспензий (например, водных, неводных), эмульсий (например, типа "масло в воде", "вода в масле"), эликсиров, сиропов, электуариев, жидкостей для полоскания рта, капель, таблеток (включая, например, таблетки с покрытием), гранул, порошков, леденцов, пастилок, капсул (включая, например, твердые и мягкие желатиновые капсулы), саше, пилюль, ампул, пилюль больших размеров, суппозиториев, пессариев, настоек, гелей, паст, мазей, кремов, лосьонов, масел, пен, спреев, тонкораспыляемых жидкостей или аэрозолей.
Составы могут быть надлежащим образом обеспечены в виде пластыря, лейкопластыря, бандажа, повязки, и т.п., которые пропитывают одним или более соединениями и необязательно одним или более другими фармацевтически приемлемыми ингредиентами, включая, например, усилители проникновения, проницаемости и всасывания. Составы также могут быть надлежащим образом обеспечены в форме депо или резервуара.
Соединение может быть растворено в, суспендировано в или смешано с одним или более другими фармацевтически приемлемыми ингредиентами. Соединение может быть заключено в липосому или другую микрочастицу, предназначенную для направленной доставки соединения, например, к компонентам крови или одному или более органам.
Составы, подходящие для перорального введения (например, посредством приема внутрь), включают жидкости, растворы (например, водные, неводные), суспензии (например, водные, неводные), эмульсии (например, типа "масло в воде", "вода в масле"), эликсиры, сиропы, электуарии, таблетки, гранулы, порошки, капсулы, саше, пилюли, ампулы, пилюли больших размеров.
Составы, подходящие для буккального введения, включают жидкости для полоскания рта, леденцы, пастилки, а также пластыри, лейкопластыри, депо и резервуары. Леденцы, как правило, содержат соединение в ароматизированной основе, обычно сахарозе и камеди или трагаканте. Пастилки, как правило, содержат соединение в инертной матрице, такой как желатин и глицерин или сахароза и камедь. Жидкости для полоскания рта, как правило, содержат соединение в подходящем жидком носителе.
Составы, подходящие для сублингвального введения, включают таблетки, пастилки, леденцы, капсулы и пилюли.
Составы, подходящие для перорального трансмукозального введения, включают жидкости, растворы (например, водные, неводные), суспензии (например, водные, неводные), эмульсии (например, типа "масло в воде", "вода в масле"), жидкости для полоскания рта, леденцы, пастилки, а также пластыри, лейкопластыри, депо и резервуары.
Составы, подходящие для неперорального трансмукозального введения, включают жидкости, растворы (например, водные, неводные), суспензии (например, водные, неводные), эмульсии (например, типа "масло в воде", "вода в масле"), суппозитории, пессарии, гели, пасты, мази, кремы, лосьоны, масла, а также пластыри, лейкопластыри, депо и резервуары.
Составы, подходящие для трансдермального введения, включают гели, пасты, мази, кремы, лосьоны и масла, а также пластыри, лейкопластыри, бандажи, повязки, депо и резервуары.
Таблетки могут быть получены посредством обычных способов, например, прессованием или формованием, необязательно с одним или более вспомогательными ингредиентами. Прессованные таблетки могут быть получены путем прессования в подходящем таблеточном прессе соединения в легкосыпучей форме, такой как порошок или гранулы, необязательно смешанного с одним или более связующими веществами (например, повидоном, желатином, камедью, сорбитом, трагакантом, гидроксипропилметилцеллюлозой); наполнителями или разбавителями (например, лактозой, микрокристаллической целлюлозой, гидрофосфатом кальция); смазывающими веществами (например, стеаратом магния, тальком, диоксидом кремния); разрыхлителями (например, крахмалгликолятом натрия, поперечно-сшитым повидоном, поперечно-сшитой натрий-карбоксиметилцеллюлозой); поверхностно-активными или диспергирующими или смачивающими агентами (например, лаурилсульфатом натрия); консервантами (например, метил-п-гидроксибензоатом, пропил-п-гидроксибензоатом, сорбиновой кислотой); ароматизаторами, усилителями вкуса и подсластителями. Формованные таблетки могут быть получены путем формования в подходящей формовочной машине смеси порошкообразного соединения, увлажненной инертным жидким разбавителем. Таблетки необязательно могут иметь покрытие или насечку и могут быть приготовлены таким образом, чтобы обеспечивать медленное или контролируемое высвобождение содержащегося в них соединения, с применением, например, гидроксипропилметилцеллюлозы в различных соотношениях для обеспечения желаемого профиля высвобождения. Таблетки необязательно могут быть снабжены покрытием, например, с целью изменения профиля высвобождения, например, кишечнорастворимой оболочкой, с обеспечением высвобождения в отделах кишечника, а не в желудке.
Мази, как правило, получают из соединения и парафиновой или водорастворимой мазевой основы.
Кремы, как правило, получают из соединения и кремовой основы типа "масло в воде". При необходимости водная фаза кремовой основы может содержать, например, по меньшей мере около 30% масс/масс, многоатомного спирта, т.е. спирта, содержащего две или более гидроксильные группы, такого как пропиленгликоль, бутан-1,3-диол, маннит, сорбит, глицерин и полиэтиленгликоль и их смеси. Составы для местного введения могут при необходимости содержать соединение, усиливающее всасывание или проникновение соединения через кожу или другие пораженные участки. Примеры таких усилителей проникновения через кожу включают диметилсульфоксид и родственные аналоги.
Эмульсии, как правило, получают из соединения и масляной фазы, которая необязательно может содержать только эмульгатор (иначе известный как эмульгирующий агент), или она может содержать смесь по меньшей мере одного эмульгатора с жиром или маслом или и жиром, и маслом. Предпочтительно, в эмульсию включают гидрофильный эмульгатор вместе с липофильным эмульгатором, который выступает в качестве стабилизатора. Также предпочтительно включение и масла, и жира. Совместно эмульгатор (эмульгаторы) со стабилизатором (стабилизаторами) или без него образуют так называемый эмульгирующий воск, а воск вместе с маслом и/или жиром составляют так называемую эмульгирующую мазевую основу, которая образует масляную дисперсную фазу в составе крема.
Подходящие эмульгаторы и стабилизаторы эмульсии включают Твин 60 (Tween 60), Спан 80 (Span 80), цетостеариловый спирт, миристиловый спирт, глицерилмоностеарат и лаурилсульфат натрия. Выбор подходящих для состава масел или жиров основан на достижении требуемых косметических свойств, поскольку растворимость соединения в большинстве видов масел, применяемых в фармацевтических эмульсионных составах, может быть очень низкой. Таким образом, крем предпочтительно должен представлять собой нежирный, не оставляющий пятен и смываемый продукт с подходящей консистенцией во избежание утечки из тюбика или других емкостей. Могут быть применены одно- или двухосновные алкиловые сложные эфиры с неразветвленной или разветвленной цепью, такие как диизоадипат, изоцетилстеарат, сложный диэфир пропиленгликоля и жирных кислот кокосового масла, изопропилмиристат, децилолеат, изопропилпальмитат, бутилстеарат, 2-этилгексилпальмитат или смесь сложных эфиров с разветвленной цепью, известная как Кродамол CAP (Crodamol САР), причем, три последних сложных эфира являются предпочтительными. Они могут быть применены отдельно или в комбинации в зависимости от требуемых свойств. Альтернативно, могут быть применены липиды с высокой температурой плавления, такие как белый мягкий парафин и/или жидкий парафин или другие минеральные масла.
Составы, подходящие для интраназального введения, в которых носитель представляет собой жидкость, включают, например, назальный спрей, капли для носа или аэрозоль для введения с помощью распылителя и содержат водные или масляные растворы соединения.
Составы, подходящие для интраназального введения, в которых носитель представляет собой твердое вещество, включают, например, составы в виде крупного порошка с размером частиц, например, в диапазоне от примерно 20 до примерно 500 мкм, которые вводят способом, аналогичным употреблению нюхательного табака, т.е. быстрым вдыханием через носовой ход порошка из емкости, подносимой близко к носу.
Составы, подходящие для легочного введения (например, с помощью ингаляционной или инсуффляционной терапии), включают составы в виде спрей-аэрозоля в упаковке под давлением с применением подходящего пропеллента, такого как дихлордифторметан, трихлорфторметан, дихлортетрафторэтан, диоксид углерода или другие подходящие газы.
Составы, подходящие для глазного введения, включают глазные капли, в которых соединение растворено или суспендировано в подходящем носителе, в частности, водном растворителе для соединения.
Составы, подходящие для ректального введения, могут быть представлены в виде суппозиториев с подходящей основой, включая, например, природные или отвержденные масла, воски, жиры, полужидкие или жидкие полиолы, например, масло какао или салицилат или в виде раствора или суспензии для лечения с помощью клизмы.
Составы, подходящие для вагинального введения, могут быть представлены в виде пессариев, тампонов, кремов, гелей, паст, пен или составов для распыления, содержащие, кроме соединения, подходящие носители, известные в данной области техники.
Составы, подходящие для парентерального введения (например, посредством инъекции), включают водные или неводные изотонические апирогенные стерильные жидкости (например, растворы, суспензии), в котором соединение растворено, суспендировано или обеспечено иным образом (например, заключено в липосому или другую микрочастицу). Такие жидкости могут дополнительно содержать другие фармацевтически приемлемые ингредиенты, такие как антиоксиданты, буферы, консерванты, стабилизаторы, бактериостатические агенты, суспендирующие агенты, загустители и растворенные компоненты, превращающие состав в изотонический крови (или другой соответствующей физиологической жидкости) предполагаемого пациента. Примеры вспомогательных веществ включают, например, воду, спирты, полиолы, глицерин, растительные масла и т.п. Примеры подходящих изотонических носителей для применения в таких составах включают физиологический раствор для инъекций, раствор Рингера, или раствор Рингера с лактатом. Как правило, концентрация соединения в жидкости составляет от около 1 нг/мл до примерно 10 мкг/мл, например, от примерно 10 нг/мл до примерно 1 мкг/мл. Составы могут находиться в герметичных однодозовых или многодозовых емкостях, например, ампулах и флаконах, и могут храниться высушенном сублимацией (лиофилизированном) состоянии, требующем лишь добавления стерильного жидкого носителя, например, воды для инъекций, непосредственно перед применением. Инъекционные экстемпоральные растворы и суспензии могут быть получены из стерильных порошков, гранул и таблеток.
Дозирование
Специалисту в данной области техники будет понятно, что подходящие дозировки РАРС-соединений и композиций, содержащих РАРС-соединения, могут варьироваться от пациента к пациенту. Определение оптимальной дозы, в общем случае будет включать соизмерение уровней терапевтического эффекта против любого риска или вредных побочных эффектов. Выбранный уровень дозировки будет зависеть от множества факторов, включая, но без ограничения, активность конкретного РАРС-соединения, путь введения, время введения, скорость экскреции РАРС-соединения, продолжительность лечения, другие лекарственные средства, соединения и/или вещества, применяемые в комбинации, степень тяжести расстройства и вид, пол, возраст, массу тела, состояние, общее состояние здоровья и предшествующий анамнез пациента. Количество РАРС-соединения и путь введения в конечном счете будут оставлены на усмотрение лечащего врача, ветеринара или врача-клинициста, хотя, как правило, доза будет выбрана с учетом достижения локальных концентраций в месте действия, которые обеспечивают желаемый эффект, по существу не вызывая неблагоприятных или вредных побочных эффектов.
Введение может быть осуществлено в одной дозе, непрерывно или периодически (например, раздельными дозами через подходящие промежутки времени) на протяжении всего курса лечения. Способы определения наиболее эффективных путей и доз для введения хорошо известны специалистам в данной области техники и будет зависеть от применяемого для терапии состава, цели терапии, клетки-мишени (клеток-мишеней), подлежащих лечению, и субъекта, подлежащего лечению. Могут быть осуществлены однократные или многократные введения с уровнем дозы и режимом введения, выбранными лечащим врачом, ветеринаром или врачом-клиницистом.
В общем, подходящая доза РАРС-соединения находится в диапазоне от примерно 10 мкг до примерно 250 мг (чаще от примерно 100 мкг до примерно 25 мг) на килограмм массы тела субъекта в сутки. В случае, когда соединение представляет собой соль, сложный эфир, амид, пролекарство и т.п., вводимое количество рассчитывают на основе исходного соединения и, таким образом, фактическая масса, требующаяся для введения, пропорционально увеличивается.
ПРИМЕРЫ
Химический синтез
Следующие примеры предложены исключительно для иллюстрации настоящего изобретения и не ограничивают рамки изобретения, описанного в настоящей заявке.
Общие способы синтеза
Реакции проводили в атмосфере N2. Реакции с применением микроволнового излучения проводили в микроволновых реакторах Biotage Initiator 60 или СЕМ. Флэш-хроматографию на силикагеле выполняли с применением силикагеля 60 от производителя "Merck" (0,025-0,04 мм). Ионообменную хроматографию проводили с применением картриджей со смолами Isolute Flash SCX-II (кислая) или Flash NH2 (основная). Градиентную хроматографию проводили на автоматизированной системе для очистки методом флэш-хроматографии Biotage SP1. Спектры 1Н ЯМР регистрировали на приборе Bruker АМХ500 с рабочей частотой 500 МГц или на приборе Bruker Avance с рабочей частотой 400 МГц с применением сигнала дейтерия в качестве фиксированного внутреннего стандарта. Химические сдвиги (δ) приведены относительно сигнала тетраметилсилана (ТМС) (δ = 0) и/или привязаны к сигналу растворителя, в котором они были измерены. Константы спин-спинового взаимодействия (J) приведены в Гц. Комбинированные анализы ВЭЖХ-МС проводили с применением одного из:
1. (LCT) сепарационного модуля Waters Alliance 2795 и детектора масс Waters/Micromass LCT с ионизацией электрораспылением (режим ионизации с образованием положительных или отрицательных ионов, как указано в тексте), при этом ВЭЖХ проводили на колонках Supelco DISCOVERY С18, 50 мм × 4,6 мм или 30 мм × 4,6 мм внутр. диам., или времяпролетной ВЭЖХ-МС системы Agilent 6210 с колонкой Phenomenex Gemini С18, 3 мкм (3 см × 4,6 мм внутр. диам.). Оба варианта анализа выполняли при температуре 22°С с элюцией градиентом 10%-90% МеОН/0,1% водной муравьиной кислоты при скорости потока 1 мл/мин и времени хроматографирования 3,5 или 4 минуты, как указано в тексте. Детекцию осуществляли по поглощению УФ-излучения на длине волны 254 нм, а способ ионизации представлял собой электрораспыление с образованием положительных или отрицательных ионов. Диапазон сканирования молекулярных масс составлял 50-1000 а.е.м.
2. (ZQ) масс-спектрометра Micromass ZQ/системы для ВЭЖХ Waters Alliance 2795 HT HPLC с колонкой Phenomenex Gemini С18, 5 мкм, 30 мм × 4,6 мм внутр. диам. или Waters X-Bridge С18, 2,5 мкм, 3,0 × 30 мм. Оба варианта анализа выполняли при температуре 35°С с элюцией градиентом 5-95% (0,1% аммиак в ацетонитриле)/(0,1% аммиак, 5% ацетонитрил и 0,063% формиат аммония в воде) при скорости потока 2 мл/мин и времени хроматографирования 4 или 6 минут, как указано в тексте. Детекцию осуществляли по поглощению УФ-излучения на длинах волн 220-400 нм с помощью диодно-матричного УФ-детектора Waters 996, а способ ионизации представлял собой электрораспыление с образованием положительных или отрицательных ионов. Диапазон сканирования молекулярных масс составлял 80-1000 а.е.м.
Общий способ i:
Сочетание 5-иод-2-хлорпиридиновых промежуточных соединений с 1-метил-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1H-пиразолом
Схема 1
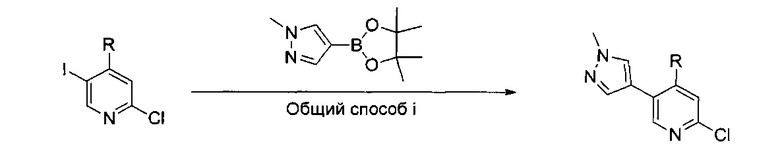
Соответствующий 5-иод-2-хлорпиридиновый промежуточное соединение I-8 или I-9 (1 экв.) растворяли в ацетонитриле (7 мл растворителя на 1 ммоль соединения). Добавляли 1-метил-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1H-пиразол (1 экв.), тетракис-(трифенилфосфин)палладий (0) (5 мол. %) и карбонат натрия (1,5 экв.), и смесь нагревали в микроволновом реакторе при 100°C в течение 30 минут (для промежуточного соединения 1-8) или 15 минут (для промежуточного соединения I-9). Реакционную смесь концентрировали в вакууме с одновременным нанесением на силикагель. Градиентная хроматография (1-5% МеОН:CH2Cl2 в 15 объемах колонки и 5-10% в 8 объемах колонки) приводила к получению целевого 5-замещенного продукта.
Общий способ ii:
Сочетание 5-иод-2-хлорпиридиновых промежуточных соединений с этинилтриметилсиланом или триметил((2-метилбут-3-ин-2-ил)окси)силаном
Схема 2
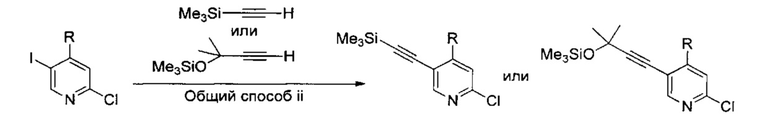
Соответствующий 5-иод-2-хлорпиридин, выбранный из промежуточных соединений I-8 или I-9 (1 экв., 0,365 ммоль) растворяли в ДМФ (0,9 мл на 1 ммоль соединения). По мере необходимости добавляли триметил(2-метилбут-3-ин-2-илокси)силан или этинилтриметилсилан (1,3 экв.). Добавляли дихлорбис(трифенилфосфин)палладий (II) (6 мол. %), иодид меди (I) (6 мол. %) и триэтиламин (18 экв.). Смесь нагревали в микроволновом реакторе при 120°C в течение 10 минут. Смесь охлаждали и выпаривали досуха. Колоночная флэш-хроматография на силикагеле с элюцией смесями этилацетат-гексан приводила к получению целевого 5-замещенного продукта.
Общий способ iii:
Сочетание 2-аминопиразиновых промежуточных соединений I-3, I-4 или I-5 с 2-хлорпиридиновыми промежуточными соединениями
Схема 3
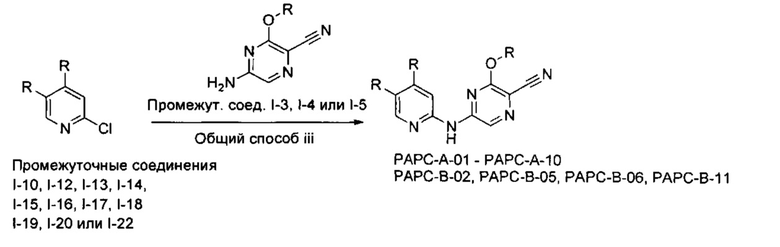
Соответствующий 2-хлорпиридин, выбранный из промежуточных соединений I-10, I-12, I-13, I-14, I-15, I-16, I-17, I-18, I-19, I-20 или I-22 (1 экв.) растворяли в толуоле или диоксан (10 мл растворителя на 1 ммоль соединения). Добавляли соответствующий 2-аминопиразин, выбранный из промежуточных соединений I-3, I-4 или I-5 (1 экв.). Добавляли ксантфос (20 мол. %), карбонат цезия (2 экв.) и трис(дибензилиденацетон)-дипалладий (0) (10 мол. %). Смесь нагревали в микроволновом реакторе при 130°C в течение 60 минут. Реакционную смесь разбавляли МеОН (10 мл) и наносили на колонку SCX-2 с кислой ионообменной смолой массой 2 г.Колонку промывали МеОН (4×20 мл), затем раствором аммиака в МеОН (2M; 4×20 мл). Основный продукт, подлежащий очистке, концентрировали в вакууме с одновременным нанесением на силикагель. Градиентная хроматография (1-10% МеОН:1% NH3 в CH2Cl2 в 15 объемах колонки) приводила к получению целевого продукта сочетания. Если требовалась дополнительная очистка для удаления избытка исходного пиразина, вещество подвергали препаративной тонкослойной хроматографии (ТСХ) со ступенчатым градиентом (2-10% МеОН:1% NH3 в CH2Cl2).
Общий способ iv:
Сочетание 2-аминопиразиновых промежуточных соединений I-6 или I-7 с 2-хлорпиридиновыми промежуточными соединениями с последующим снятием защитной группы N-Boc
Схема 4
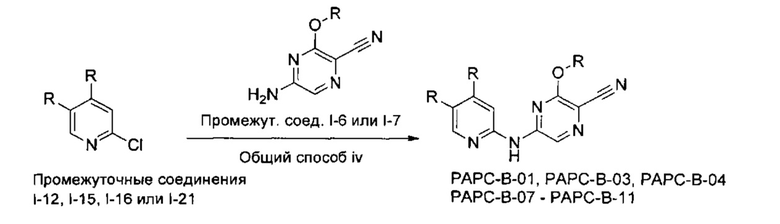
Соответствующий 2-хлорпиридин, выбранный из промежуточных соединений I-12, I-15, I-16 или I-21 (1 экв.) растворяли в толуоле или диоксане (10 мл растворителя на 1 ммоль соединения). Добавляли соответствующий 2-аминопиразин, выбранный из промежуточных соединений I-6 или I-7 (1 экв.). Добавляли ксантфос (20 мол. %), карбонат цезия (2 экв.) и трис(дибензилиденацетон)-дипалладий (0) (10 мол. %). Смесь нагревали в микроволновом реакторе при 130°C в течение 60 минут. Реакционную смесь разбавляли МеОН (10 мл) и наносили на колонку SCX-2 с кислой ионообменной смолой массой 2 г. Колонку промывали МеОН (4×20 мл), затем раствором аммиака в МеОН (2M; 4×20 мл). Основный продукт, подлежащий очистке, концентрировали в вакууме с одновременным нанесением на силикагель и подвергали градиентной хроматографии (1-10% МеОН:1% NH3 в CH2Cl2 в 15 объемах колонки) с получением N-Boc-защищенного продукта сочетания. N-Boc-защищенный продукт сочетания (1 экв.) растворяли в CH2Cl2 (140 мл растворителя на 1 ммоль) соединения. Добавляли одной порцией трифторуксусную кислоту (470 экв.), и раствор перемешивали при комнатной температуре в течение 30 минут. Раствор концентрировали в вакууме с одновременным нанесением на силикагель. Градиентная хроматографии (5% МеОН: 1% NH3 в CH2Cl2 в 5 объемах колонки, далее 5-20% в 15 объемах колонки) приводила к получению целевого продукта, не содержащего N-защитную группу. При необходимости продукт дополнительно очищали посредством препаративной тонкослойной хроматографии со ступенчатым градиентом (2-10% МеОН:1% NH3 в CH2Cl2).
Промежуточное соединение I-1 (R)-1-(диметиламино)-пропан-2-ол
40% раствор диметиламина в воде (11,39 мл, 90 ммоль) медленно добавляли к (R)-пропиленоксиду (5,25 мл, 74,9 ммоль), охлажденному в ледяной бане. Этот раствор перемешивали при комнатной температуре в течение 2 часов, после чего экстрагировали CH2Cl2 (4×5 мл). Объединенные органические слои сушили над Na2SO4, и выделяли чистый (R)-1-(диметиламино)-пропан-2-ол (5,12 г, 49,6 ммоль, выход 40%) в виде прозрачного масла посредством перегонки при пониженном давлении (50 мбар).
1Н ЯМР (CDCl3, 500 МГц) δ 3,82-3,76 (m, 1Н), 3,40 (s ушир., 1Н), 2,27 (s, 6Н), 2,25-2,21 (m, 1Н), 2,16-2,12 (m, 1H), 1,12 (d, J=6,0, 3Н).
Промежуточное соединение I-2 5-Амино-3-хлорпиразин-2-карбонитрил
2,6-Дихлорпиразин (2,89 г, 19,4 ммоль) перемешивали в водном NH3 (28%, 10 мл) и нагревали до 100°C в герметично закрытой пробирке в течение 18 часов. Реакционную смесь охлаждали и полученный осадок отфильтровывали. Растирание с водой и затем эфиром приводило к получению 6-хлорпиразин-2-амина в виде белого твердого вещества (2,28 г, 17,6 ммоль, выход 91%).
1Н ЯМР (d6-ДМСО, 400 МГц) δ 6,9 (s ушир., 2Н), 7,70 (d, J=0,4, 1Н), 7,80 (d, J=0,4, 1H); ЖХ-МС (ZQ, 6 минут) Rt=1,05 минуты; m/z (ИЭР+) 130 (M+H).
6-Хлорпиразин-2-амин (2,50 r, 19,3 ммоль) перемешивали в CH2Cl2 (60 мл) при 0°C. Медленно добавляли N-бромсукцинимид (2,92 г, 16,4 ммоль), и реакционную смесь перемешивали при 0°C в течение 60 минут. Реакционную смесь фильтровали через целитный фильтр и концентрировали с получением коричневого масла. Очистка посредством флэш-хроматографии, элюция 0-25% EtOAc-гексан приводила к получению 5-бром-6-хлорпиразин-2-амина в виде желтого твердого вещества (1,69 г, 8,16 ммоль, выход 42%).
1Н ЯМР (d6-ДМСО, 400 МГц) δ 7,1 (s ушир., 2Н), 7,65 (s, 1Н); ЖХ-МС (ZQ, 4 минуты) Rt=1,46 минуты; m/z (ИЭР-) 205 (М-Н).
Смесь 5-бром-6-хлорпиразин-2-амина (1,00 г, 4,8 ммоль), иодида меди (I) (914 мг, 4,8 ммоль), 18-краун-6 (95 мг, 0,36 ммоль) и тетракис(трифенилфосфин)палладия (0) (83 мг, 0,072 ммоль) суспендировали в сухом ДМФ (20 мл) и пропускали поток азота в течение 5 минут. Добавляли цианид калия (312 мг, 4,8 ммоль), и смесь перемешивали при комнатной температуре в течение 30 минут, затем кипятили с обратным холодильником при 200°C в течение 3 часов. Смесь охлаждали, разбавляли EtOAc и наносили на силикагель (10 г). ДМФ удаляли выпариванием. Продукт очищали посредством флэш-хроматографии с элюцией смесью 1:1 EtOAc-гексан с получением 5-амино-3-хлорпиразин-2-карбонитрила в виде желтого твердого вещества (607 мг, 3,93 ммоль, выход 82%).
1Н ЯМР (d6-ДМСО, 400 МГц) δ 7,87 (s, 1Н), 8,1 (s ушир., 2Н); ЖХ-МС (ZQ, 4 минуты) Rt=1,20 минуты; m/z (ИЭР-) 153 (М-Н).
Промежуточное соединение I-3 (R)-5-Амино-3-((1-(диметиламино)пропан-2-ил)окси)пиразин-2-карбонитрил
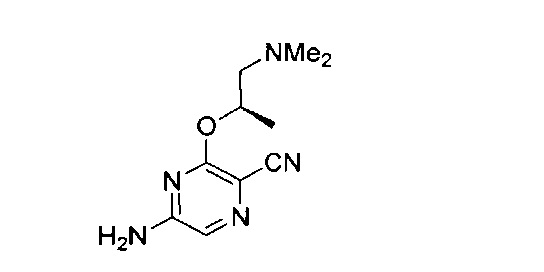
(R)-1-(Диметиламино)пропан-2-ол (0,667 г, 6,47 ммоль) по каплям добавляли к суспензии NaH (60% в масле; 0,388 г, 9,71 ммоль) в диоксане (16,2 мл) и перемешивали в течение 30 минут. Добавляли одной порцией 5-амино-3-хлорпиразин-2-карбонитрил (Промежуточное соединение 1-2) (1,00 г, 6,47 ммоль), и смесь нагревали при 90°C в течение 14 часов. После охлаждения добавляли воду (200 мл), и раствор экстрагировали Et2O (4×100 мл), сушили над MgSO4 и летучие компоненты удаляли в вакууме. Градиентная колоночная хроматография с элюцией МеОН:1% NH3 в CH2Cl2 приводила к получению (R)-5-амино-3-((1-(диметиламино)пропан-2-ил)окси)пиразин-2-карбонитрила (0,558 г, 2,52 ммоль, выход 39%) в виде желтого твердого вещества.
1Н ЯМР (500 МГц, CDCl3) δ 7,54 (s, 1Н), 5,42-5,35 (m, 1Н), 5,31 (s ушир., 2Н), 2,76 (dd, J=7,5, 13,5, 1H), 2,52 (dd, J=4,0, 13,5, 1H), 2,37 (s, 6H), 1,35 (d, J=6,5, 3Н); ЖХ-МС (LCT, 3,5 минуты) Rt=0,80 минуты; m/z (ИЭР) 222 (M+H).
Промежуточное соединение I-4 (R)-5-Амино-3-((1-метилпирролидин-3-ил)окси)пиразин-2-карбонитрил
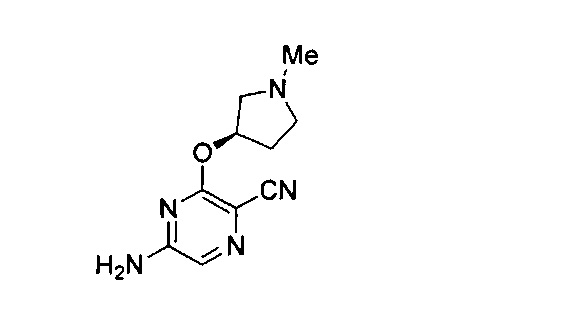
Продукт получали в соответствии с описанием для Промежуточного соединения I-3, при этом (R)-1-(диметиламино)пропан-2-ол заменяли на (R)-1-метилпирролидин-3-ол.
1Н ЯМР (500 МГц, d6-ДМСО) δ 7,60 (s ушир., 2Н), 7,51 (s, 1Н), 5,36-5,28 (m, 1Н), 2,76 (dd, J=10,8, 6,1, 1H), 2,69 (ddd, J=8,2, 8,2, 5,3, 1Н), 2,62 (dd, J=10,8, 2,8, 1H), 2,37-2,21 (m, 2H), 2,26 (s, 3H), 1,85-1,77 (m, 1H); ЖХ-МС (LCT, 3,5 минуты) Rt=0,62 минуты; m/z (ИЭР) 220 (M+H).
Промежуточное соединение I-5
(S)-5-Амино-3-((1-метилпирролидин-3-ил)окси)пиразин-2-карбонитрил
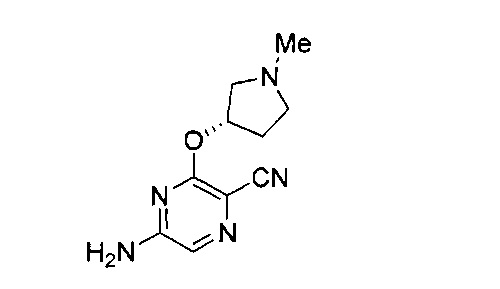
Соединение получали в соответствии с описанием для Промежуточного соединения 1-3, при этом (R)-1-(диметиламино)пропан-2-ол заменяли на (S)-1-метилпирролидин-3-ол.
1Н ЯМР (500 МГц, d6-ДМСО) δ 7,60 (s ушир., 2Н), 7,51 (s, 1Н), 5,36-5,28 (m, 1H), 2,76 (dd, J=10,8, 6,1, 1H), 2,69 (ddd, J=8,2, 8,2, 5,3, 1H), 2,62 (dd, J=10,8, 2,8, 1H), 2,37-2,21 (m, 2H), 2,26 (s, 3H), 1,85-1,77 (m, 1H); ЖХ-МС (LCT, 3,5 минуты) Rt=0,62 минуты; m/z (ИЭР) 220 (M+H).
Промежуточное соединение 1-6
(R)-трет-Бутил-3-((6-амино-3-цианопиранозин-2-ил)окси)пирролидин-1-карбоксилат
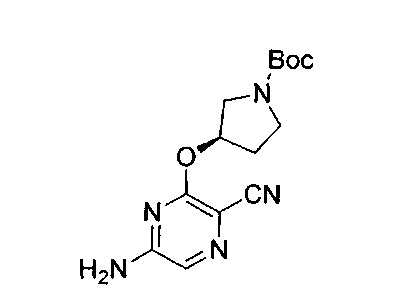
Продукт получали в соответствии с описанием для Промежуточного соединения 1-3, при этом (R)-1-(диметиламино)пропан-2-ол заменяли на (R)-трет-бутил- 3-гидроксипиррол идин-1-карбоксилат.
Был выделен в виде смеси ротамеров. 1Н ЯМР (500 МГц, CDCl3) δ 7,61-7,58 (m, 1Н), 5,49-5,44 (m, 1H), 5,35-5,30 (m, 2Н), 3,69-3,65 (m, 1Н), 3,63-3,50 (m, 3Н), 2,28-2,11 (m, 2Н), 1,46 (s, 9Н); ЖХ-МС (LCT, 3,5 минуты) Rt=2,67 минуты; m/z (ИЭР) 328 (M+Na).
Промежуточное соединение I-7
(S)-трет-Бутил-3-((6-амино-3-цианопиранозин-2-ил)окси)пирролидин-1-карбоксилат
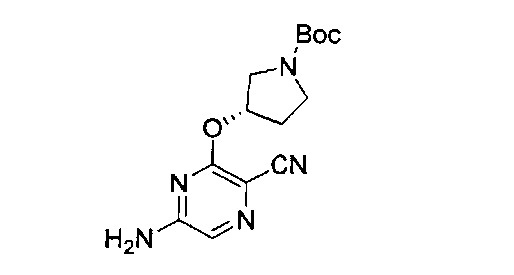
Продукт получали в соответствии с описанием для Промежуточного соединения 1-3, при этом (R)-1-(диметиламино)пропан-2-ол заменяли на (5)-трет-бутил-3-гидроксипирролидин-1-карбоксилат.
Был выделен в виде смеси ротамеров. 1Н ЯМР (500 МГц, CDCl3) δ 7,61-7,58 (m, 1Н), 5,49-5,44 (m, 1Н), 5,35-5,30 (m, 2Н), 3,69-3,65 (m, 1Н), 3,63-3,50 (m, 3Н), 2,28-2,11 (m, 2Н), 1,46 (s, 9Н); ЖХ-МС (LCT, 3,5 минуты) Rt=2,67 минуты; m/z (ИЭР) 328 (M+Na).
Промежуточное соединение I-8
2-Хлор-5-иод-N-метилпиридин-4-амин
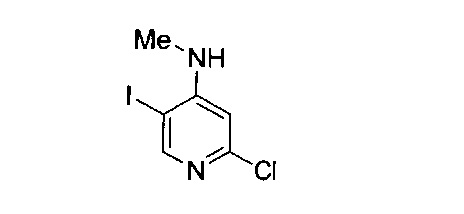
2-Хлор-5-иодпиридин-4-амин (2,0 г, 7,86 ммоль) и параформальдегид (0,472 г, 15,7 ммоль) растворяли в АсОН (56,1 мл) и перемешивали в течение 2,5 часов при 40°C. Добавляли триацетоксиборгидрид натрия (3,66 г, 17,3 ммоль), и смесь перемешивали при 40°C в течение 1,5 часов. Добавляли дополнительную порцию триацетоксиборгидрида натрия (3,66 г, 17,3 ммоль), и смесь перемешивали в течение еще 19 часов. Объем реакционной смеси уменьшали наполовину путем выпаривания в вакууме. В смесь добавляли воду с последующим подщелачиванием NaHCO3. Смесь экстрагировали EtOAc (3×70 мл), и объединенные органические слои сушили над MgSCO4. Добавляли силикагель и концентрировали раствор. Градиентная хроматография с элюцией 5-10% EtOAc в циклогексане в 4 объемах колонки и затем 10% EtOAc в циклогексане в еще 11 объемах колонки приводила к получению 2-хлор-5-иод-N-метилпиридин-4-амина (1,65 г, 6,14 ммоль, выход 78%) в виде белого кристаллического порошка.
1Н ЯМР (500 МГц, CDCl3) δ 8,27 (s, 1H), 6,41 (s, 1Н), 4,85 (s ушир., 1H), 2,93 (d, J=5,0, 3Н); ЖХ-МС (LCT, 3,5 минуты) Rt=1,90 минуты; m/z (ИЭР) 268 (M+H).
Промежуточное соединение I-9
2-Хлор-5-иод-4-метоксипиридин
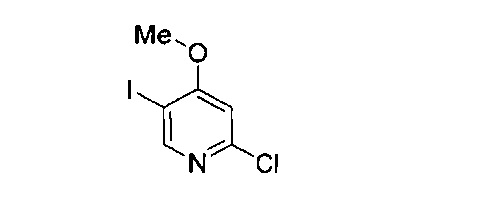
К раствору 2-хлор-4-метоксипиридина (0,5 г, 3,48 ммоль) в серной кислоте (2,5 мл) добавляли порциями N-иодсукцинимид (0,825 г, 3,48 ммоль) при комнатной температуре. Смесь перемешивали при 55°C в течение 2 часов. Реакционную смесь выливали в ледяную воду (10 мл) и медленно добавляли 8M NaOH (20 мл), после чего темно-коричневый раствор становился бледно-желтым. Водный слой экстрагировали CH2Cl2 (2×20 мл). Органические слои промывали солевым раствором (10 мл) и концентрировали в вакууме с одновременным нанесением на силикагель. Флэш-хроматография на сухой колонке с элюцией 25% EtOAc: циклогексан приводила к получению 2-хлор-5-иод-4-метоксипиридина в виде белого кристаллического твердого вещества (0,169 г, 0,760 ммоль, выход 22%).
1Н ЯМР (500 МГц, d6-ДМСО) δ 8,52 (s, 1Н), 7,19 (s, 1H), 3,96 (s, 3Н); ЖХ-МС (LCT, 4 минуты) Rt=2,56 минуты; m/z (ИЭР) 270 (M+H).
Промежуточное соединение I-10
Метил-6-хлор-4-(метиламино)никотинат
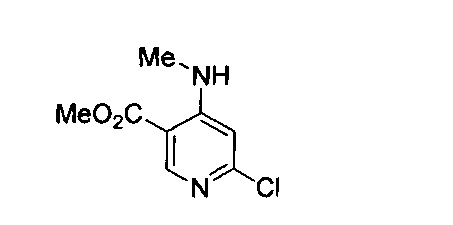
40% метиламин в воде (0,847 мл, 9,78 ммоль) медленно добавляли в течение 5 минут при 0°C к раствору метил-4,6-дихлорникотината (0,40 г, 1,94 ммоль) в MeCN (6 мл). Раствор перемешивали при 0°C в течение 30 мин, а затем при комнатной температуре в течение 2 часов. Реакционную смесь концентрировали в вакууме с одновременным нанесением на силикагель. Градиентная хроматография с элюцией 5% ЕtOАс:циклогексан в 5 объемах колонки и 5-50% в 15 объемах колонки приводила к получению метил-6-хлор-4-(метиламино)никотината (278 мг, 1,386 ммоль, выход 71,4%) в виде белого твердого вещества.
1Н ЯМР (500 МГц, CDCl3) δ 8,65 (s, 1Н), 8,10 (s ушир., 1H), 6,54 (s, 1H), 3,88 (s, 3H), 2,92 (d, J=5,1, 3Н); ЖХ-МС (LCT, 3,5 минуты) Rt=2,35 минуты; m/z (ИЭР) 201 (M+H).
Промежуточное соединение I-11
Метил-6-хлор-4-метоксиникотинат
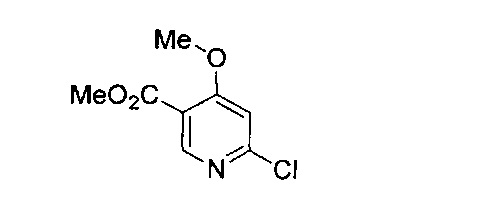
Порошок метоксида натрия (0,136 г, 2,52 ммоль) медленно добавляли к перемешиваемому раствору метил-4,6-дихлорникотината (0,40 г, 1,94 ммоль) в ТГФ (4 мл) при комнатной температуре. Реакционную смесь перемешивали при комнатной температуре в течение 18 часов, затем концентрировали в вакууме с одновременным нанесением на силикагель. Градиентная хроматография с элюцией 5% ЕtOАс:циклогексан в 5 объемах колонки и 5-50% в 15 объемах колонки приводила к получению метил-6-хлор-4-метоксиникотината (218 мг, 1,08 ммоль, выход 56%) в виде белого кристаллического твердого вещества.
1Н ЯМР (500 МГц, CDCl3) δ 8,71 (s, 1Н), 6,92 (s, 1H), 3,97 (s, 3H), 3,90 (s, 3H); ЖХ-МС (LCT, 3,5 минуты) Rt=2,13 минуты; m/z (ИЭР) 202 (M+H).
Промежуточное соединение I-12
Метил-6-хлор-4-(диметиламино)никотинат
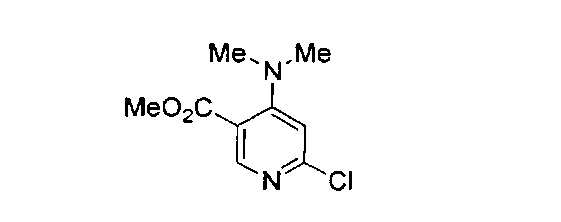
Диметиламин (1,23 мл, 9,71 ммоль) медленно добавляли к перемешиваемому раствору метил-4,6-дихлорникотината (0,40 г, 1,94 ммоль) в MeCN (6 мл) при комнатной температуре. Раствор перемешивали при комнатной температуре в течение 18 часов, затем концентрировали в вакууме с одновременным нанесением на силикагель. Градиентная хроматография с элюцией 5% EtOAc: циклогексан в 5 объемах колонки и 5-50% в 15 объемах колонки приводила к получению метил-6-хлор-4-(диметиламино)никотината (335 мг, 1,56 ммоль, выход 80%) в виде белого твердого вещества.
1Н ЯМР (500 МГц, d6-ДМСО) δ 8,21 (s, 1Н), 6,85 (s, 1H), 3,83 (s, 3Н), 2,90 (s, 6Н); ЖХ-МС (LCT, 3,5 минуты) Rt=2,23 минуты; m/z (ИЭР) 215 (М+Н).
Промежуточное соединение I-13
2-Хлор-N-метил-5-(трифторметил)пиридин-4-амин
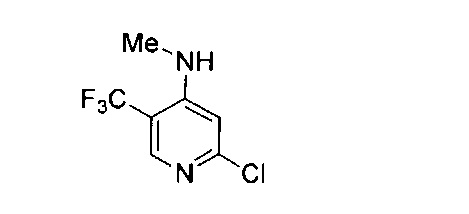
2M метиламина в МеОН (11,6 мл, 23,2 ммоль) добавляли к 2-хлор-4-иод-5-(трифторметил)пиридину (357 мг, 1,16 ммоль), и смесь нагревали в микроволновом реакторе при 130°C в течение 1 часа. Смесь концентрировали в вакууме. Препаративная тонкослойная хроматография с элюцией 20% EtOAc:гексан приводила к получению 2-хлор-N-метил-5-(трифторметил)пиридин-4-амина (77 мг, 0,363 ммоль, выход 31%).
1Н ЯМР (500 МГц, d6-ДМСО) δ 8,17 (s, 1H), 6,90 (s ушир., 1Н), 6,74 (s, 1Н), 2,81 (d, J=5, 3Н); ЖХ-МС (LCT, 3,5 минуты) Rt=1,98 минуты; m/z (ИЭР) 211 (М+Н).
Промежуточное соединение I-14
2,5-Дихлор-N-метилпиридин-4-амин
N-хлорсукцинимид (0,623 г, 4,67 ммоль) добавляли к 2-хлор-N-метилпиридин-4-амину (0,50 г, 3,89 ммоль) и ацетату калия (0,763 г, 7,78 ммоль) в АсОН (25 мл), и смесь перемешивали при 80°C в течение 1,25 часов. Смесь охлаждали и концентрировали в вакууме. Концентрированную смесь разбавляли водой, нейтрализовали водным раствором NaOH и экстрагировали EtOAc (×3). Органические экстракты выпаривали с одновременным нанесением на силикагель. Градиентная хроматографии с элюцией 10-50% EtOAc:циклогексан приводила к получению 2,5-дихлор-N-метилпиридин-4-амина (0,114 г, 0,699 ммоль, выход 18%).
1Н ЯМР (500 МГц, CDCl3) δ 8,02 (s, 1H), 6,52 (s, 1Н), 4,95 (s ушир., 1H), 2,96 (d, J=5, 3Н); ЖХ-МС (LCT, 4 минуты) Rt=2,17 минуты; m/z (ИЭР) 177 (M+H).
Промежуточное соединение I-15
2-Хлор-N-метил-5-(1-метил-H-пиразол-4-ил)пиридин-4-амин
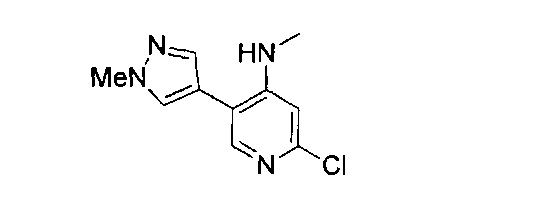
Продукт получали из Промежуточного соединения 1-8 и 1-метил-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1H-пиразола в соответствии с Общим способом i.
1Н ЯМР (500 МГц, CDCl3) δ 7,83 (s, 1Н), 7,56 (s, 1H), 7,45 (s, 1H), 6,48 (s, 1H), 4,68 (s ушир., 1H), 3,96 (s, 3H), 2,84 (d, J=5,1, 3Н); ЖХ-МС (LCT, 3,5 минуты) Rt=1,09 минуты; m/z (ИЭР) 223 (M+H).
Промежуточное соединение I-16
2-Хлор-4-метокси-5-(1-метил-1H-пиразол-4-ил)пиридин
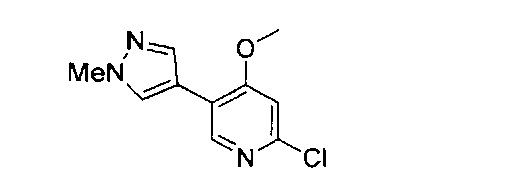
Соединение получали из Промежуточного соединения I-9 и 1-метил-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1H-пиразола в соответствии с Общим способом i.
1Н ЯМР (500 МГц, CDCl3) δ 7,83 (s, 1Н), 7,56 (s, 1Н), 7,45 (s, 1Н), 6,48 (s, 1Н), 4,68 (s ушир., 1Н), 3,96 (s, 3Н), 2,84 (d, J=5,1, 3Н); ЖХ-МС (LCT, 3,5 минуты) Rt=1,09 минуты; m/z (ИЭР) 224 (М+Н).
Промежуточное соединение I-17
2-Хлор-N,N-диметил-5-(1-метил-1H-пиразол-4-ил)пиридин-4-амин
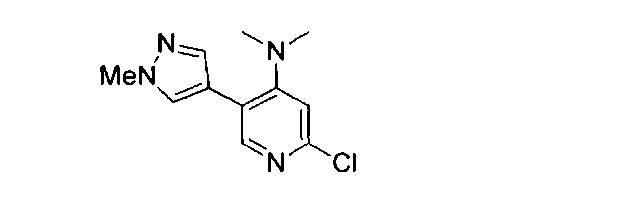
ДМФ (2,99 мл) медленно добавляли к перемешиваемым гидриду натрия (60% в масле; 51 мг, 1,28 ммоль) и 2-хлор-N-метил-5-(1-метил-1H-пиразол-4-ил)пиридин-4-амину (Промежуточному соединению 1-15) (104 мг, 0,467 ммоль) при комнатной температуре. Смесь нагревали до 80°C в течение 10 минут и после добавляли иодметан (0,035 мл, 0,560 ммоль). Смесь перемешивали при 80°C в течение 30 минут, затем охлаждали и разбавляли насыщенным водным раствором NaHCO3 (45 мл) и этилацетатом (70 мл). После перемешивания в течение 10 минут органический слой отделяли, и водный слой экстрагировали этилацетатом (2×70 мл). Объединенные органические слои выпаривали с одновременным нанесением на силикагель. Градиентная хроматография с элюцией 1-10% MeOH:1% NH3 в CH2Cl2 в 10 объемах колонки приводила к получению 2-xnop-N,N-диметил-5-(1-метил-1H-пиразол-4-ил)пиридин-4-амина (102 мг, 0,431 ммоль, выход 92%).
1Н ЯМР (500 МГц, CDCl3) δ 8,03 (s, 1Н), 7,67 (s, 1Н), 7,57 (s, 1Н), 6,77 (s, 1Н), 3,96 (s, 3Н), 2,72 (s, 6Н).
Промежуточное соединение I-18
2-Хлор-N-этил-5-(1-метил-1H-пиразол-4-ил)пиридин-4-амин
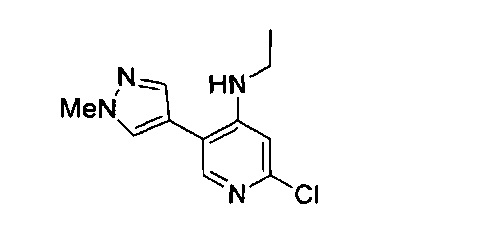
Смесь 2-хлор-5-иодпиридин-4-амина (262 мг, 1,03 ммоль), избытка параформальдегида (618 мг, 21 ммоль) и АсОН (10,3 мл) перемешивали при 40°C в течение 15 минут с последующим добавлением избытка триацетоксиборгидрида натрия (4,8 г, 23 ммоль). После перемешивания в течение 2,5 часов добавляли дополнительные порции параформальдегида (236 мг, 7,86 ммоль) и триацетоксиборгидрида натрия (1,83 г, 8,63 ммоль). Через 18 часов смесь разбавляли водой и подщелачивали NaHCO3. Смесь экстрагировали EtOAc (3×30 мл). Объединенные органические экстракты сушили и выпаривали с одновременным нанесением на силикагель. Градиентная хроматография с элюцией 5-10% EtOH:CH2Cl2 в 17 объемах колонки приводила к получению 2-хлор-N-этил-5-иодпиридин-4-амина (291 мг, 1,03 ммоль, выход 100%). ЖХ-МС (LCT, 3,5 минуты) Rt=2,56 минуты; m/z (ИЭР) 282 (М+Н). Вещество подвергали реакции с 1-метил-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1H-пиразолом в соответствии с Общим способом i с получением 2-хлор-N-этил-5-(1-метил-1H-пиразол-4-ил)пиридин-4-амина.
1Н ЯМР (500 МГц, CDCl3) δ 7,84 (s, 1Н), 7,59 (s, 1H), 7,47 (s, 1H), 6,50 (s, 1H), 4,60 (s ушир., 1H), 3,99 (s, 3H), 3,19 (2H, q, J=7,2), 1,25 (t, J=7,2, 3Н); ЖХ-МС (LCT, 3,5 минуты) Rt=1,35 минуты; m/z (ИЭР) 237 (M+H).
Промежуточное соединение I-19
2-Хлор-N-метил-5-((триметилсилил)этинил)пиридин-4-амин
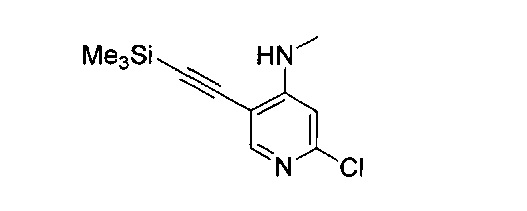
Соединение получали из Промежуточного соединения 1-9 и этинилтриметилсилана в соответствии с Общим способом ii.
1Н ЯМР (500 МГц, CDCl3) δ 8,11 (s, 1Н), 6,47 (s, 1H), 5,15 (s ушир., 1H), 2,97 (d, J=5, 3Н), 0,3 (9H, s); ЖХ-МС (LCT, 4 минуты) Rt=3,13 минуты; m/z (ИЭР) 239 (М+Н).
Промежуточное соединение I-20
2-Хлор-N-метил-5-(3-метил-3-((триметилсилил)окси)бут-1-ин-1-ил)пиридин-4-амин
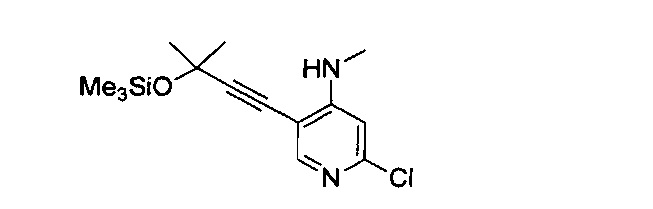
Соединение получали из Промежуточного соединения 1-8 и триметил(2-метилбут-3-ин-2-илокси)силана в соответствии с Общим способом ii.
1Н ЯМР (500 МГц, CDCl3) δ 8,04 (s, 1H), 6,46 (s, 1H), 5,00 (s ушир., 1H), 2,94 (d, J=5, 3H), 1,62 (6H, s), 0,22 (s, 9H); ЖХ-МС (LCT, 3,5 минуты) Rt=2,81 минуты; m/z (ИЭР) 297 (M+H).
Промежуточное соединение I-21
2-Хлор-4-метокси-5-(3-метил-3-((триметилсилил)окси)бут-1-ин-1-ил)пиридин
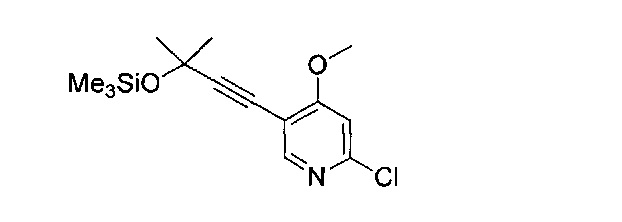
Соединение получали из Промежуточного соединения 1-9 и триметил(2-метилбут-3-ин-2-илокси)силана в соответствии с Общим способом ii.
1Н ЯМР (500 МГц, CDCl3) δ 8,25 (s, 1H), 6,82 (s, 1H), 3,92 (s, 3H), 1,60 (6H, s), 0,23 (s, 9H); ЖХ-МС (LCT, 4 минуты) Rt=3,23 минуты; m/z (ИЭР) 298 (M+H).
Промежуточное соединение I-22
2-Хлор-5-циклопропил-N-метилпиридин-4-амин
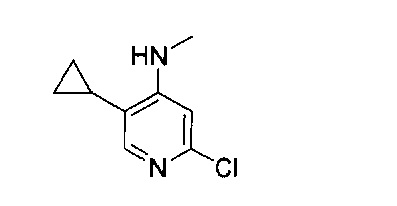
2-Хлор-5-иод-N-метилпиридин-4-амин (Промежуточное соединение I-8) (30 мг, 0,112 ммоль), тетракис(трифенилфосфин)палладий (0) (6,5 мг, 5,59 мкмоль) и 0,5 М водный раствор карбоната натрия раствор (290 мкл, 0,145 ммоль) добавляли к 2-циклопропил-4,4,5,5-тетраметил-1,3,2-диоксаборолану (61 мкл, 0,335 ммоль) в MeCN. Смесь нагревали при 130°C в микроволновом реакторе в течение 1 часа. Смесь концентрировали в вакууме. Препаративная тонкослойная хроматография с элюцией 1% NH3, 6% МеОН в CH2Cl2 приводила к получению 2-хлор-5-циклопропил-N-метилпиридин-4-амина (10 мг, 0,055 ммоль, выход 49%) в виде белого порошка.
1Н ЯМР (500 МГц, CDCl3) δ 7,72 (s, 1Н), 6,34 (s, 1Н), 4,82 (s ушир., 1H), 2,85 (s, 3Н), 1,37-1,34 (m, 1H), 0,85-0,82 (m, 2Н), 0,49-0,46 (m, 2Н); ЖХ-МС (LCT, 4 минуты) Rt=1,23 минуты; m/z (ИЭР) 183 (М+Н).
Соединение РАРС-А-01
(R)-3-((1-(Диметиламино)пропан-2-ил)окси)-5-((4-метокси-5-(1-метил-1H-пиразол-4-ил)пиридин-2-ил)амино)пиразин-2-карбонитрил
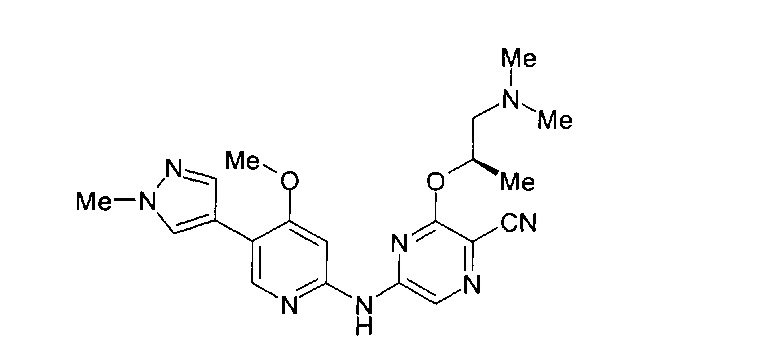
Соединение получали из Промежуточного соединения 1-16 и Промежуточного соединения 1-3 в соответствии с Общим способом ii.
1Н ЯМР (500 МГц, CDCl3/CD3OD) δ 9,14 (s, 1H), 8,35 (s, 1H), 7,83 (s, 1H), 7,76 (s, 1Н), 7,06 (s, 1Н), 5,87-5,75 (m, 1H), 4,00 (s, 3Н), 3,94 (s, 3Н), 3,35 (dd, J=13,7, 6,7, 1Н), 3,21 (d, J=13,7, 1H), 2,87 (s, 6H), 1,53 (d, J=6,4, 3Н); ЖХ-МС (LCT, 3,5 минуты) Rt=2,11 минуты; m/z (ИЭР) 409 (M+H).
Соединение РАРС-А-02
(R)-3-((1-(Диметиламино)пропан-2-ил)окси)-5-((5-(1-метил-1H-пиразол-4-ил)-4-(метиламино)пиридин-2-ил)амино)пиразин-2-карбонитрил
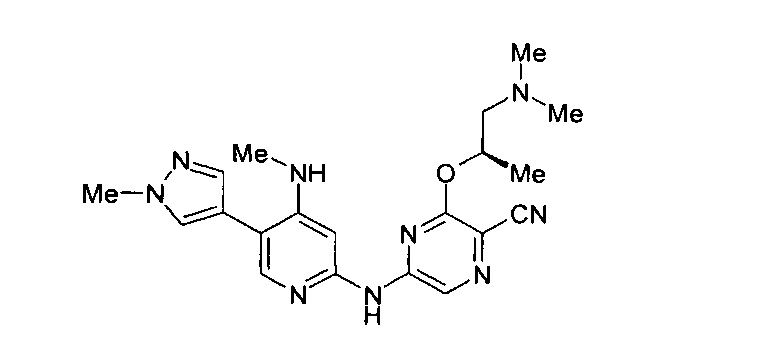
Соединение получали из Промежуточного соединения I-15 и Промежуточного соединения 1-3 в соответствии с Общим способом iii.
1Н ЯМР (500 МГц, CDCl3) δ 8,23 (s ушир., 1Н), 8,23 (s, 1Н), 7,85 (s, 1Н), 7,58 (s, 1H), 7,47 (s, 1Н), 7,03 (s, 1Н), 5,48-5,37 (m, 1H), 4,72 (q, J=5, 1Н), 3,98 (s, 3Н), 2,90 (d, J=5, 3Н), 2,74 (dd, J=13,4, 7,2, 1H), 2,51 (dd, J=13,4, 4,4, 1H), 2,31 (s, 6H), 1,41 (d, J=6,3, 3Н); ЖХ-МС (LCT, 3,5 минуты) Rt=1,09 минуты; m/z (ИЭР) 408 (M+H).
Соединение PAPC-A-03
(R)-5-((4-(Диметиламино)-5-(1-метил-1H-пиразол-4-ил)пиридин-2-ил)амино)-3-((1-(диметиламино)пропан-2-ил)окси)пиразин-2-карбонитрил
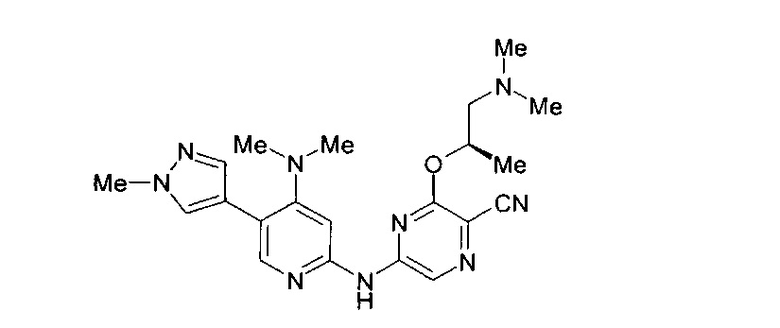
Соединение получали из Промежуточного соединения I-17 и Промежуточного соединения 1-3 в соответствии с Общим способом iii.
1Н ЯМР (500 МГц, CDCl3) δ 8,61 (s ушир., 1Н), 8,23 (s, 1Н), 8,04 (s, 1Н), 7,69 (s, 1H), 7,57 (s, 1Н), 7,29 (s, 1H), 5,50-5,39 (m, 1H), 3,97 (s, 3Н), 2,76 (s, 6Н), 2,73 (dd, J=13,4, 7,3, 1Н), 2,50 (dd, J=13,4, 4,4, 1H), 2,30 (s, 6H), 1,40 (d, J=6,3, 3Н); ЖХ-МС (LCT, 3,5 минуты) Rt=1,59 минуты; m/z (ИЭР) 418 (M+H).
Соединение РАРС-А-04
(R)-3-((1-(Диметиламино)пропан-2-ил)окси)-5-((4-(этиламино)-5-(1-метил-1H-пиразол-4-ил)пиридин-2-ил)амино)пиразин-2-карбонитрил
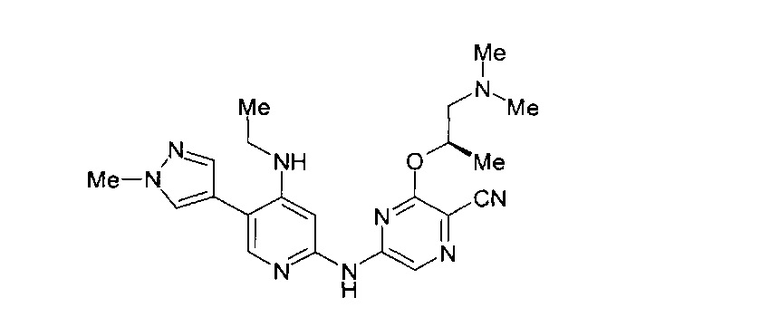
Соединение получали из Промежуточного соединения I-18 и Промежуточного соединения 1-3 в соответствии с Общим способом iii.
1Н ЯМР (500 МГц, CDCl3) δ 8,29 (s, 1H), 7,86 (s, 1H), 7,61 (s, 1H), 7,50 (s, 1H), 7,07 (s, 1H), 5,50-5,47 (m, 1H), 4,63-4,61 (m, 1H), 4,02 (s, 3H), 3,27-3,23 (m, 2H), 2,84-2,80 (m, 1H), 2,62-2,59 (m, 1H), 2,39 (s, 6H), 1,43 (d, J=6,3, 3H), 1,30 (t, J=7,3, 3Н); ЖХ-МС (LCT, 3,5 минуты) Rt=1,22 минуты; m/z (ИЭР) 422 (M+H).
Соединение PAPC-A-05
(R)-3-((1-(Диметиламино)пропан-2-ил)окси)-5-((4-(метиламино)-5-(трифторметил) пиридин-2-ил)амино)пиразин-2-карбонитрил
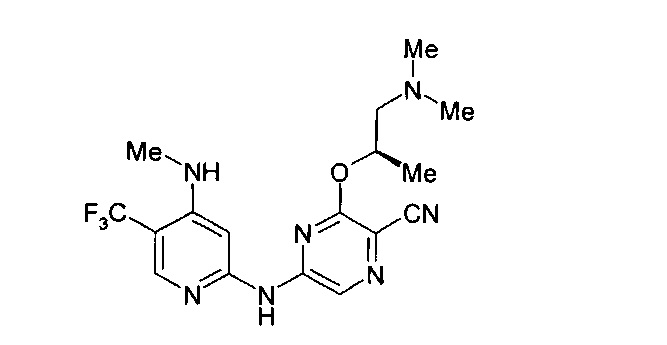
Соединение получали из Промежуточного соединения I-13 и Промежуточного соединения I-3 в соответствии с Общим способом iii.
1Н ЯМР (500 МГц, CD3OD) δ 8,60 (s, 1Н), 8,16 (s, 1Н), 6,98 (s, 1Н), 5,59-5,53 (m, 1Н), 2,94 (s, 3Н), 2,82 (dd, J=13,7, 8, 1Н), 2,51 (dd, J=13,7, 5, 1H), 2,33 (s, 6H), 1,42 (d, J=6, 3Н); ЖХ-МС (LCT, 3,5 минуты) Rt=1,75 минуты; m/z (ИЭР) 396 (M+H).
Соединение РАРС-А-06
(R)-5-((5-Хлор-4-(метиламино)пиридин-2-ил)амино)-3-((1-(диметиламино)пропан-2-ил)окси)пиразин-2-карбонитрил
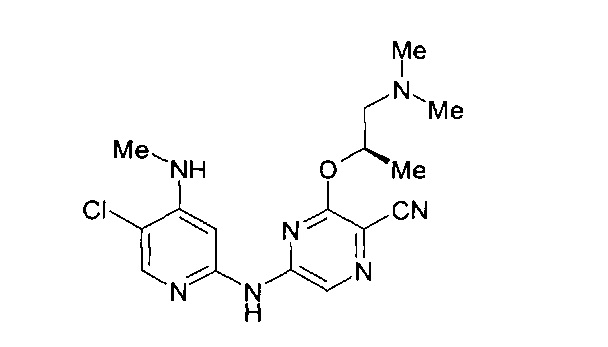
Соединение получали из Промежуточного соединения I-14 и Промежуточного соединения I-3 в соответствии с Общим способом iii.
1Н ЯМР (500 МГц, CDCl3) δ 8,22 (s, 1Н), 8,02 (s ушир., 1H), 7,98 (s, 1H), 7,01 (s, 1H), 5,48-5,36 (m, 1H), 4,97 (q ушир., J=4,2, 1H), 2,98 (d, J=5,1, 3H), 2,74 (dd, J=13,3, 7,3, 1H), 2,51 (dd, J=13,3, 4,3, 1H), 2,31 (s, 6H), 1,41 (d, J=6,3, 3Н); ЖХ-МС (LCT, 3,5 минуты) Rt=1,77 минуты; m/z (ИЭР) 362 (M+H).
Соединение PAPC-A-07
(R)-3-((1-(Диметиламино)пропан-2-ил)окси)-5-((5-этинил-4-(метиламино)пиридин-2-ил)амино)пиразин-2-карбонитрил
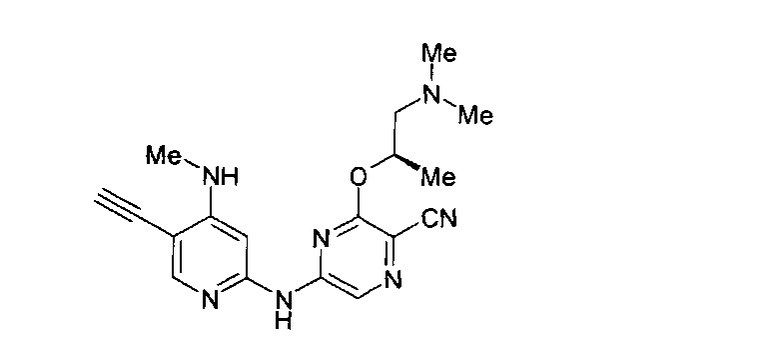
Соединение получали из Промежуточного соединения I-19 и Промежуточного соединения I-3 в соответствии с Общим способом iii.
1Н ЯМР (500 МГц, CDCl3) δ 8,28 (s, 1Н), 8,13 (s, 1H), 7,80 (s ушир., 1H), 6,94 (s, 1H), 5,45-5,40 (m, 1H), 5,21-5,19 (m, 1H), 3,49 (s, 1H), 3,00 (s, 3H), 2,76-2,73 (m, 1H), 2,54-2,52 (m, 1H), 2,34 (s, 6H), 1,43 (d, J=6, ЗН); ЖХ-МС (LCT, 4 минуты) Rt=1,53 минуты; m/z (ИЭР) 352 (M+H).
Соединение РАРС-А-08
(R)-3-((1-(Диметиламино)пропан-2-ил)окси)-5-((5-(3-гидрокси-3-метилбут-1-ин-1-ил)-4-(метиламино)пиридин-2-ил)амино)пиразин-2-карбонитрил
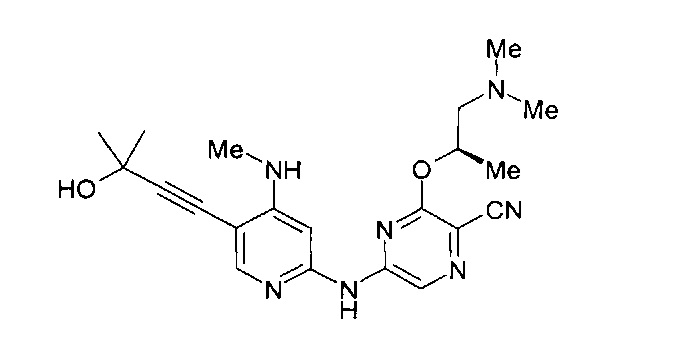
Соединение получали из Промежуточного соединения I-20 и Промежуточного соединения I-3 в соответствии с Общим способом iii.
1Н ЯМР (500 МГц, CD3OD) δ 8,46 (s, 1H), 7,95 (s, 1H), 6,92 (s, 1H), 5,59-5,55 (m, 1H), 2,97 (s, 3H), 2,85 (dd, J=13, 10, 1H), 2,60 (dd, J=13, 5, 1H), 2,35 (s, 6H), 1,61 (s, 6H), 1,43 (d, J=6, 3Н); ЖХ-МС (LCT, 3,5 минуты) Rt=1,43 минуты; m/z (ИЭР) 410 (M+H).
Соединение PAPC-A-09
(R)-5-((5-Циклопропил-4-(метиламино)пиридин-2-ил)амино)-3-((1-(диметиламино)пропан-2-ил)окси)пиразин-2-карбонитрил
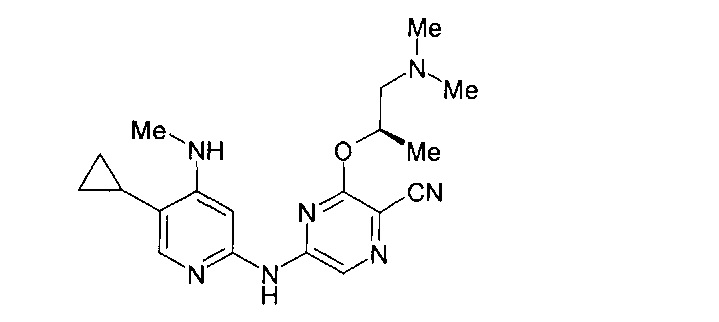
Соединение получали из Промежуточного соединения I-22 и Промежуточного соединения I-3 в соответствии с Общим способом iii.
1Н ЯМР (500 МГц, CDCl3) δ 8,11 (s, 1Н), 7,71 (s, 1H), 6,91 (s, 1H), 5,39-5,37 (m, 1H), 4,92 (s ушир., 1H), 2,93-2,29 (m, 3H), 2,73-2,68 (m, 1H), 2,49 (dd, J=13,3, 3,9, 1H), 2,27 (s, 6H), 1,40-1,38 (m, 1H),1,35 (d, J=6, 3H), 0,86-0,84 (m, 2H), 0,50-0,48 (m, 2H); ЖХ-МС (LCT, 4 минуты) Rt=1,40 минуты; m/z (ИЭР) 368 (M+H).
Соединение PAPC-A-10
(R)-Метил-6-((5-циано-6-((1-(диметиламино)пропан-2-ил)окси)пиразин-2-ил)амино)-4-(метиламино)никотинат
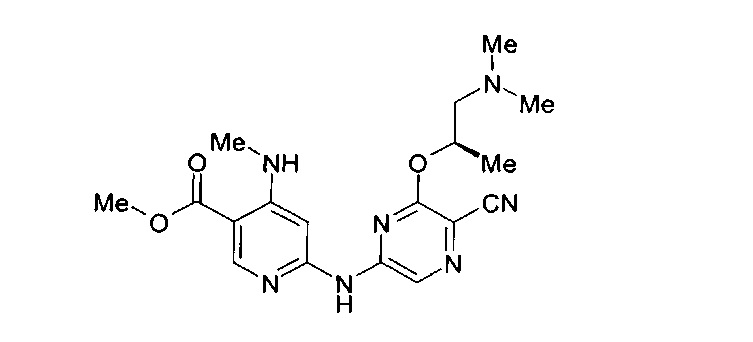
Соединение получали из Промежуточного соединения I-10 и Промежуточного соединения I-3 в соответствии с Общим способом iii.
1Н ЯМР (500 МГц, CDCl3) δ 8,68 (s, 1Н), 8,26 (s, 1H), 8,15 (d, J=5, 1H), 7,03 (s, 1H), 5,50-5,39 (m, 1H), 3,88 (s, 3H), 2,97 (d, J=5, 3H), 2,78 (dd, J=13,4, 7,3, 1H), 2,55 (dd, J=13,4, 4,2, 1H), 2,34 (s, 6H), 1,42 (d, J=6,3, 3Н); ЖХ-МС (LCT, 3,5 минуты) Rt=1,84 минуты; m/z (ИЭР) 386 (M+H).
Соединение PAPC-B-01
(R)-5-((4-Метокси-5-(1-метил-1H-пиразол-4-ил)пиридин-2-ил)амино)-3-(пирролидин-3-илокси)пиразин-2-карбонитрил
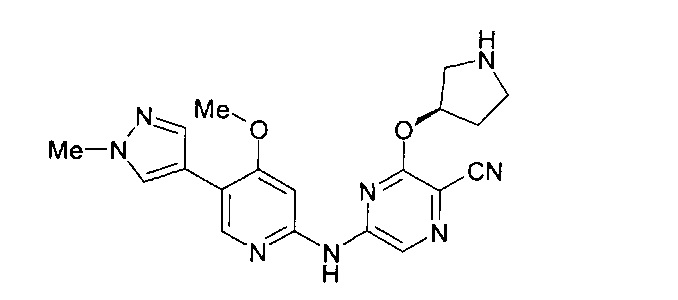
Соединение получали из Промежуточного соединения I-16 и Промежуточного соединения I-6 в соответствии с Общим способом iv.
1Н ЯМР (500 МГц, d6-ДМСО) δ 8,51 (s, 1Н), 8,45 (s, 1H), 8,13 (s, 1Н), 7,93 (d, J=0,6, 1Н), 7,60 (s, 1H), 5,61-5,56 (m, 1H), 3,98 (s, 3H), 3,88 (s, 3H), 3,23 (dd, J=12,7, 5,5, 1H), 3,06-2,97 (m, 2H), 2,94-2,87 (m, 1H), 2,16-2,09 (m, 1H), 1,99-1,92 (m, 1H); ЖХ-МС (LCT, 3,5 минуты) Rt=2,02 минуты; m/z (ИЭР) 393 (M+H).
Соединение РАРС-В-02
(R)-5-((4-Метокси-5-(1-метил-1H-пиразол-4-ил)пиридин-2-ил)амино)-3-((1-метилпирролидин-3-ил)окси)пиразин-2-карбонитрил
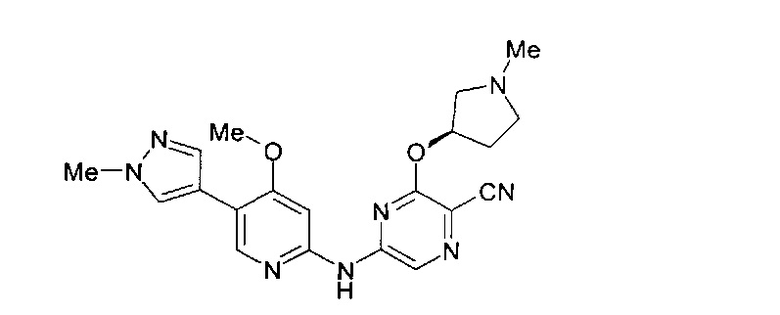
Соединение получали из Промежуточного соединения I-16 и Промежуточного соединения I-4 в соответствии с Общим способом iii.
1Н ЯМР (500 МГц, CDCl3) δ 8,39 (s ушир., 1Н), 8,37 (s, 1Н), 8,32 (s, 1Н), 7,85 (s, 1Н), 7,78 (s, 1H), 7,36 (s, 1Н), 5,51-5,47 (m, 1H), 4,01 (s, 3Н), 3,96 (s, 3Н), 3,15 (dd, J=10,7, 6,3, 1Н), 2,73-2,62 (m, 3Н), 2,39 (s, 3Н), 2,38-2,30 (m, 1Н), 2,12-2,05 (m, 1Н); ЖХ-МС (LCT, 3,5 минуты) Rt=2,01 минуты; m/z (ИЭР) 407 (М+Н).
Соединение РАРС-В-03
(R)-5-((5-(1-Метил-1H-пиразол-4-ил)-4-(метиламино)пиридин-2-ил)амино)-3-(пирролидин-3-илокси)пиразин-2-карбонитрил
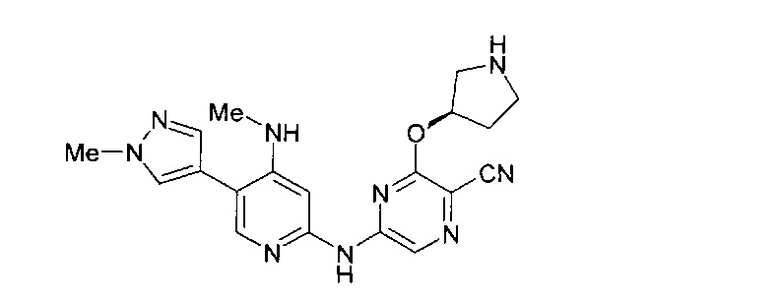
Соединение получали из Промежуточного соединения I-15 и Промежуточного соединения I-6 в соответствии с Общим способом iv.
1Н ЯМР (500 МГц, d6-ДМСО) δ 10,46 (s ушир., 1Н), 8,50 (s, 1Н), 7,89 (s, 1Н), 7,84 (s, 1H), 7,60 (s, 1Н), 7,04 (s, 1H), 5,84 (q, J=4,7, 1Н), 5,61-5,55 (m, 1H), 3,88 (s, 3H), 3,25 (dd, J=12,7, 5,5, 1H), 3,07-3,00 (m, 2H), 2,93 (ddd, J=10,9, 8,1, 4,7, 1H), 2,78 (d, J=4,8, 3Н), 2,17-2,10 (m, 1Н), 2,01-1,93 (m, 1H); ЖХ-МС (LCT, 3,5 минуты) Rt=1,24 минуты; m/z (ИЭР) 392 (M+H).
Соединение PAPC-B-04
(S)-5-((5-(1-Метил-1H-пиразол-4-ил)-4-(метиламино)пиридин-2-ил)амино)-3-(пирролидин-3-илокси)пиразин-2-карбонитрил
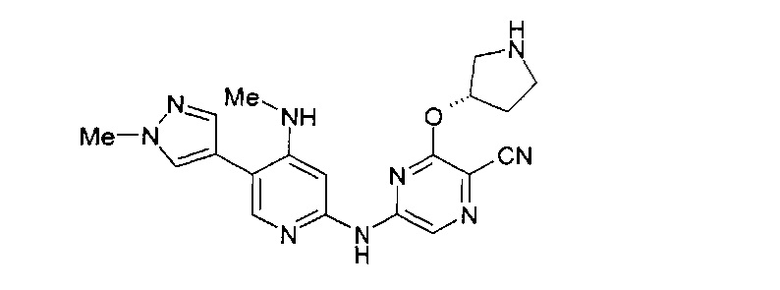
Соединение получали из Промежуточного соединения I-15 и Промежуточного соединения I-7 в соответствии с Общим способом iv.
1Н ЯМР (500 МГц, d6-ДМСО) δ 10,46 (s ушир., 1Н), 8,50 (s, 1H), 7,89 (s, 1Н), 7,84 (s, 1Н), 7,60 (s, 1H), 7,04 (s, 1Н), 5,84 (q, J=4,7, 1H), 5,61-5,55 (m, 1Н), 3,88 (s, 3Н), 3,25 (dd, J=12,7, 5,5, 1H), 3,07-3,00 (m, 2H), 2,93 (ddd, J=10,9, 8,1, 4,7, 1H), 2,78 (d, J=4,8, 3H), 2,17-2,10 (m, 1H), 2,01-1,93 (m, 1H), ЖХ-МС (LCT, 3,5 минуты) Rt=1,24 минуты; m/z (ИЭР) 392 (M+H).
Соединение PAPC-B-05
(R)-5-((5-(1-Метил-1H-пиразол-4-ил)-4-(метиламино)пиридин-2-ил)амино)-3-((1-метилпирролидин-3-ил)окси)пиразин-2-карбонитрил
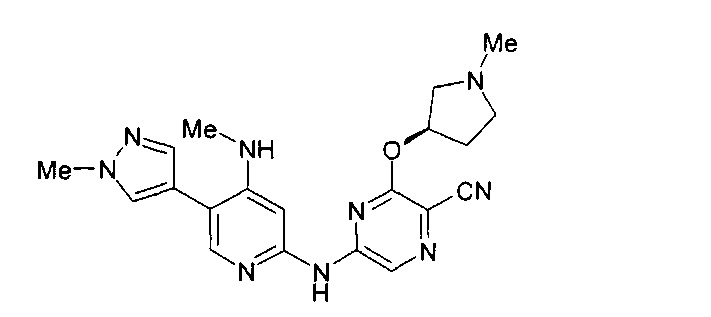
Соединение получали из Промежуточного соединения I-15 и Промежуточного соединения I-4 в соответствии с Общим способом iii.
1Н ЯМР (500 МГц, CD3OD) δ 8,49 (s, 1Н), 7,82 (s, 1Н), 7,78 (s, 1Н), 7,61 (s, 1Н), 6,85 (s, 1H), 5,62-5,60 (m, 1H), 3,97 (s, 3H), 3,05-3,02 (m, 1H), 2,88 (3H, s), 2,87-2,85 (m, 2H), 2,59-2,55 (m, 1H), 2,48-2,43 (m, 1H), 2,42 (s, 3H), 2,10-2,08 (m, 1H); ЖХ-МС (LCT, 4 минуты) Rt=1,20 минуты; m/z (ИЭР) 406 (M+H).
Соединение PAPC-B-06
(S)-5-((5-(1-Метил-1H-пиразол-4-ил)-4-(метиламино)пиридин-2-ил)амино)-3-((1-метилпирролидин-3-ил)окси)пиразин-2-карбонитрил
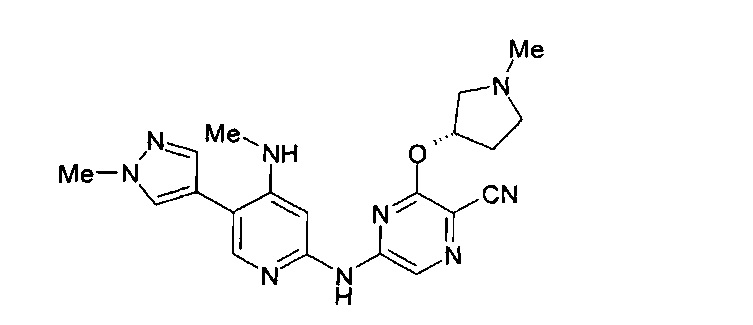
Соединение получали из Промежуточного соединения I-15 и Промежуточного соединения I-5 в соответствии с Общим способом iii.
1Н ЯМР (500 МГц, CDCl3) δ 8,33 (s, 1H), 7,86 (s, 1H), 7,59 (s, 1H), 7,50 (s, 1H), 6,98 (s, 1H), 5,56-5,54 (m, 1H), 4,78-4,77 (m, 1H), 4,00 (s, 3H), 3,29 (dd, J=11, 6,2, 1H), 2,92 (s, 3H), 2,80-2,78 (m, 1H), 2,74 (dd, J=11, 3,5, 1H), 2,47 (s, 3H), 2,41-2,37 (m, 1H), 2,16-2,14 (m, 1H); ЖХ-МС (LCT, 4 минуты) Rt=1,20 минуты; m/z (ИЭР) 406 (M+H).
Соединение PAPC-B-07
(R)-5-((5-(3-Гидрокси-3-метилбут-1-ин-1-ил)-4-метоксипиридин-2-ил)амино)-3-(пирролидин-3-илокси)пиразин-2-карбонитрил
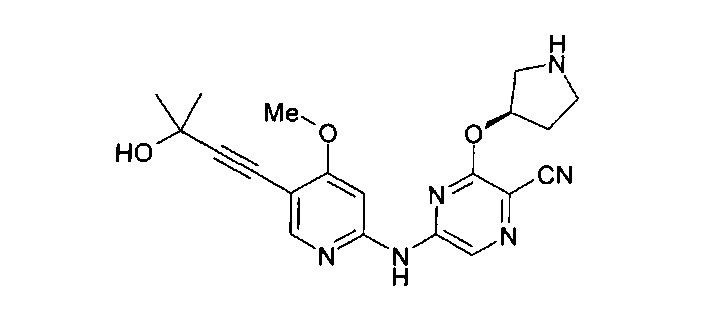
Соединение получали из Промежуточного соединения I-21 и Промежуточного соединения I-6 в соответствии с Общим способом iv.
1Н ЯМР (500 МГц, d6-ДМСО) δ 8,51 (s, 1Н), 8,21 (s, 1H), 7,47 (s, 1H), 5,62 (ddd, J=5,5, 5,5, 2,8, 1Н), 5,41 (s ушир., 1H), 3,92 (s, 3H), 3,38 (dd, J=13, 5,3, 1H), 3,25 (d, J=13, 1H), 3,18-3,09 (m, 2H), 2,25-2,16 (m, 1H), 2,14-2,07 (m, 1H), 1,47 (s, 6H); ЖХ-МС (LCT, 3,5 минуты) Rt=1,84 минуты; m/z (ИЭР) 395 (M+H).
Соединение PAPC-B-08
(R)-5-((5-(3-Гидрокси-3-метилбут-1-ин-1-ил)-4-(метиламино)пиридин-2-ил)амино)-3-(пирролидин-3-илокси)пиразин-2-карбонитрил
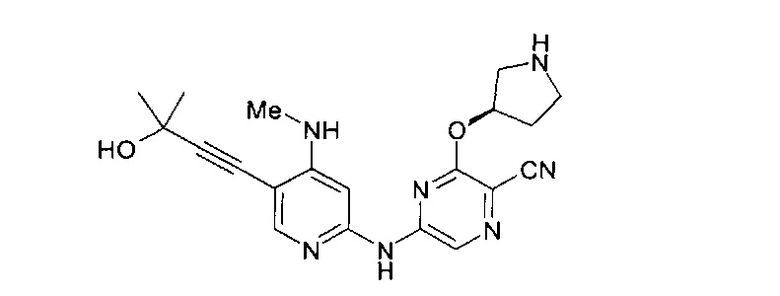
Соединение получали из Промежуточного соединения I-20 и Промежуточного соединения I-6 в соответствии с Общим способом iv.
1Н ЯМР (500 МГц, d6-ДМСО) δ 8,62 (s, 1Н), 7,96 (s, 1Н), 6,71 (s, 1Н), 5,76 (s ушир., 1H), 3,49-3,48 (m, 2Н), 3,45-3,35 (m, 1H), 2,95 (s, 3Н), 2,35-2,32 (т, 2Н), 1,60 (s, 6Н) (2Н закрыты сигналом воды); ЖХ-МС (LCT, 4 минуты) Rt=1,59 минуты; m/z (ИЭР) 394 (М+Н).
Соединение РАРС-В-09
(R)-Метил-6-((5-циано-6-(пирролидин-3-илокси)пиразин-2-ил)амино)-4-(метокси)никотинат
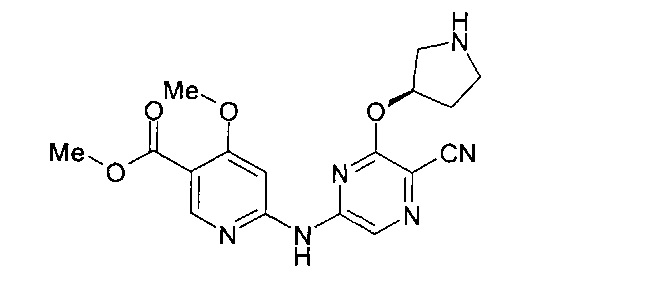
Соединение получали из Промежуточного соединения I-11 и Промежуточного соединения I-6 в соответствии с Общим способом iv.
1Н ЯМР (500 МГц, d6-ДМСО) δ 8,63 (s, 1H), 8,54 (s, 1Н), 7,56 (s, 1Н), 5,62-5,60 (m, 1Н), 3,94 (s, 3Н), 3,79 (s, 3Н), 3,18-2,98 (m, 4H), 2,21-2,12 (m, 1H), 2,07-1,99 (m, 1H); ЖХ-МС (LCT, 3,5 минуты) Rt=2,04 минуты; m/z (ИЭР) 371 (M+H).
Соединение PAPC-B-10
(R)-Метил-6-((5-циано-6-(пирролидин-3-илокси)пиразин-2-ил)амино)-4-(метиламино)никотинат
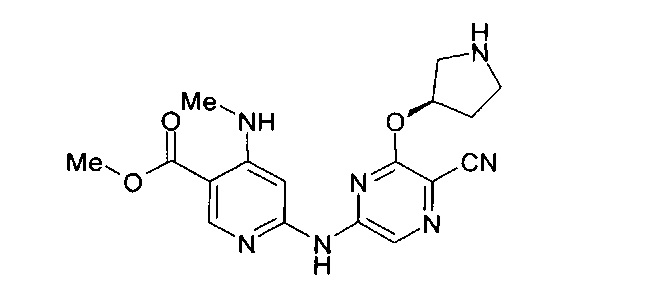
Соединение получали из Промежуточного соединения I-10 и Промежуточного соединения I-6 в соответствии с Общим способом iv.
1Н ЯМР (500 МГц, d6-ДМСО) δ 8,58 (s, 1Н), 8,38 (s, 1Н), 8,01 (q, J=4,7, 1Н), 7,22 (s, 1H), 5,62-5,51 (m, 1H), 3,81 (s, 3H), 3,18 (dd, J=12,6, 5,5, 1H), 3,01-2,92 (m, 2H), 2,90 (d, J=4,9, 3H), 2,85 (ddd, J=10,8, 8,0, 4,8, 1H), 2,14-2,03 (m, 1H), 1,95-1,87 (m, 1H); ЖХ-МС (LCT, 3,5 минуты) Rt=1,64 минуты; m/z (ИЭР) 370 (M+H).
Соединение PAPC-B-11
(R)-Метил-6-((5-циано-6-(пирролидин-3-илокси)пиразин-2-ил) амино)-4-(диметиламино)никотинат
Соединение получали из Промежуточного соединения I-12 и Промежуточного соединения I-6 в соответствии с Общим способом iv.
1Н ЯМР (500 МГц, d6-ДМСО) δ 8,56 (s, 1H), 8,35 (s, 1Н), 7,20 (s, 1Н), 5,68-5,59 (m, 1H), 3,81 (s, 3Н), 3,39 (dd, J=13,1, 5,2, 1Н), 3,31 (s ушир., 1H), 3,27 (d, J=13,1, 1H), 3,19-3,12 (m, 2H), 2,91 (s, 6H), 2,23-2,18 (m, 1H), 2,15-2,08 (m, 1H); ЖХ-МС (LCT, 3,5 минуты) Rt=1,70 минуты; m/z (ИЭР) 384 (M+H).
Биологические методы
Анализ 1A: Определение ингибиторной активности по отношению к СНК1 в формате диссоциативно-усиленного лантанидного флуоресцентного иммуноанализа (DELFIA)
Киназную функцию СНК1 измеряли посредством анализа DELFIA® с целью контроля фосфорилирования пептида CDC25C с применением фосфоспецифичных антител. Ферментативную реакцию проводили в полипропиленовых планшетах (Greiner) с использованием реакционной смеси (25 мкл), содержащей смесь фермента и пептида (СНК1, 1 нМ; биотин-KKKVSRSGLYRSPSMPENLNRPR, 1 мкМ или 15 мкл), АТФ (30 мкМ или 5 мкл) и либо ДМСО (2,5%), либо исследуемое соединение (5 мкл), разведенное с получением диапазона концентраций (конечные концентрации от 0 до 100 мкМ в 2,5% ДМСО) в буфере для анализа (40 мМ Трис, 40 мМ NaCl, 2 мМ MgCl2, 1 мМ DTT и 0,1% Твин 20 (Tween 20)). Реакционную смесь инкубировали в течение 30 минут при комнатной температуре, и затем реакцию останавливали добавлением буфера (125 мкл), содержащего 40 мМ ЭДТА, 0,05% Твин 20, 0,1% БСА в трис-солевом буфере (ТСБ) (10х концентрат, Sigma). Аликвоту (100 мкл) реакционной смеси после остановки реакции переносили в черные планшеты с содержащим нейтравидин покрытием (Perbio) и инкубировали в течение 1 часа на шейкере (Titertek, Flow Laboratories) при комнатной температуре. Планшеты промывали четыре раза промывочным буфером (25 мМ Трис (pH 8), 150 мМ NaCl и 0,1% Твин 20) (WellWash4, Thermo Life Sciences) и инкубировали как указано выше в течение 1 часа со смесью антител (100 мкл), состоящей из антифосфо-СОС25С (1,25 нМ, № по каталогу 9528, Cell Signalling Technology) и содержащих европиевую метку антител против IgG кролика (0,3 мкг/мл, AD0105, Perkin Elmer Life Sciences), разведенных в буфере для анализа DELFIA (Perkin Elmer Life Sciences). Планшеты промывали еще четыре раза промывочным буфером перед добавлением усиливающего сигнал раствора (100 мкл/лунка, Perkin Elmer Life Sciences). Сигнал в лунках планшета считывали с помощью многорежимного счетчика Victor2 1420 (Perkin Elmer Life Sciences), применяя режим с временным разрешением для измерения флуоресценции на длине волны 615 нм. Рассчитывали концентрацию исследуемого соединения, необходимую для ингибирования активности фермента на 50% (IC50).
Анализ 1B: Определение ингибиторной активности по отношению к СНК1 в формате анализа с применением прибора Caliper
Киназную активность СНК1 измеряли посредством анализа с применением микрофлюидного чипа, который позволяет наблюдать отделение фосфорилированного продукта от исходного субстрата. Анализ проводили на приборе EZ Reader II (Caliper Life Sciences Ltd, Runcorn, UK) с применением буфера для разделения (№ по каталогу 760367, Caliper LS), содержащего реагент CR-8 (500 нМ, № по каталогу 760278, Caliper LS). Для построения кривых разведения из 8 точек в двух повторностях применяли акустический дозатор ECHO® 550 (Labcyte Inc™) непосредственно внутри 384-луночных полипропиленовых планшетов для анализа (Greiner Bio-One, Gloucestershire, UK). Для каждого исследуемого соединения использовали стоковый раствор в 100% ДМСО с концентрацией 50 мкМ. Общее количество ДМСО, вносимого в каждую лунку, составляло 250 нл с получением в ходе анализа конечной концентрации ДМСО 2,5% и концентраций исследуемых соединений в диапазоне 0,5-1000 нМ. В лунки этого опытного планшета добавляли 6 мкл СНК1 (конечная концентрация 2 нМ, препарат белка был получен в лаборатории), 2 мкл меченного карбоксифлуоресцеином (FAM) пептида 10 (5-FAM-KKKVSRSGLYRSPSMPENLNRPR-COOH, конечная концентрация 1,5 мкМ, № по каталогу 760354, Caliper LS) и 2 мкл АТФ (конечная концентрация 90 мкМ), разведенных в буфере для определения киназной активности (50 мМ HEPES, 0,02% NaN3, 0,01% БСА, 0,1 мМ ортованадат натрия, 1 мМ DTT, 2 мМ MgCl2, 0,1% Твин 20). Планшет герметично закрывали и центрифугировали (1 минута, 1000 об/мин) перед инкубацией в течение одного часа при комнатной температуре. Реакцию останавливали добавлением буфера для разделения (90 мкл). Сигнал в лунках планшета считывали с помощью прибора EZ Reader II с применением чипа с 12 зондами для отбора образцов из лунок (760137-0372R, Caliper LS) с параметрами настройки: давление -1,5 psi (единиц фунт-силы/квадратный дюйм) и разность потенциалов 1750 В. Процент превращения субстрата в продукт был получен автоматически, а процент ингибирования рассчитывали относительно контрольных лунок (не содержащих фермента и 2,5% ДМСО) и опытных лунок (содержащих все реагенты и 2,5% ДМСО). Величины IC50 рассчитывали с помощью программного обеспечения GraphPad Prism5 с применением нелинейной регрессии для подбора кривой зависимости "логарифм концентрации ингибитора - ответ", описываемой уравнением с переменным угловым коэффициентом.
Анализ 2: Определение селективности ингибиторов для ингибирования СНК1 по сравнению с СНК2
Киназную активность СНК2 in vitro измеряли посредством анализа DELFIA®, позволяющего контролировать фосфорилирование пептида CDC25C с применением фосфоспецифичных антител. Ферментативную реакцию проводили в полипропиленовых 96-луночных планшетах (Greiner). Реакционная смесь (общий объем 25 мкл) содержала смесь фермента и пептида (15 мкл) (содержащую полученный в лаборатории препарат СНК2, 1 нМ; биотин-KKKVSRSGLYRSPSMPENLNRPR, 1 мкМ), АТФ (30 мкМ, 5 мкл) и либо ДМСО (2,5%), либо исследуемое соединение (5 мкл), разведенное с получением диапазона концентраций (конечные концентрации 0-100 мкМ в 2,5% ДМСО) в буфере для анализа (40 мМ HEPES (pH 7,4), 40 мМ KCl, 2 мМ MgCl2, 10 мМ DTT и 0,02% Твин 20). Реакционную смесь инкубировали в течение 30 минут при комнатной температуре, и реакцию останавливали добавлением буфера (125 мкл), содержащего 40 мМ ЭДТА, 0,05% Твин 20, 0,1% БСА в ТСБ (10х концентрат, Sigma). Аликвоту (100 мкл) реакционной смеси переносили в черные 96-луночные планшеты с содержащим нейтравидин покрытием (Perbio) и инкубировали в течение 1 часа на шейкере (Titertek, Flow Laboratories) при комнатной температуре. Планшеты промывали четыре раза промывочным буфером (25 мМ Трис (pH 8), 150 мМ NaCl и 0,1% Твин 20) (WellWash4, Thermo Life Sciences) и инкубировали как указано выше в течение 1 часа со смесью антител (100 мкл), состоящей из антифосфо-СОС25С (разбавленных 1/4000, что эквивалентно 0,35 нМ-1,25 нМ, № по каталогу 9528, Cell Signalling Technology) и меченных европием антител против IgG кролика (0,3 мкг/мл, AD0105, Perkin Elmer Life Sciences), разведенных в буфере для анализа DELFIA® (Perkin Elmer Life Sciences). Планшеты промывали еще четыре раза промывочным буфером перед добавлением усиливающего раствора (100 мкл/лунка, Perkin Elmer Life Sciences). Сигнал в лунках планшета считывали с помощью многорежимного счетчика Victor2 1420 (Perkin Elmer Life Sciences), применяя режим с временным разрешением для измерения флуоресценции на длине волны 615 нм. Рассчитывали концентрацию исследуемого соединения, необходимую для ингибирования активности фермента на 50% (IC50).
Для каждого испытуемого соединения отношение IC50, полученной посредством анализа киназной активности СНК2, к IC50, полученной посредством анализа киназной активности СНК1, (т.е. СНК2 IC50/CHKI IC50) применяли для определения селективности ингибирования СНК1 по сравнению с СНК2.
Анализ 3: Анализ ингибирования митоза (MIA)
Подавление функции контрольной точки путем применения ингибиторов киназной функции СНК1 в сочетании с генотоксическими агентами оценивали посредством основанного на применении европиевой метки ИФА-анализа, разработанного для количественного определения числа клеток, претерпевающих митоз после обработки генотоксическим агентом (для индукции блокирования фазы G2) с последующей обработкой исследуемым соединением в комбинации с нокодазолом с целью прекращения этого блокирования. Клетки линии НТ29 высевали в концентрации 104 клеток/лунка в 96-луночные планшеты в объеме 160 мкл и оставили для прикрепления на 36 часов. Этопозид (10 мМ стоковый раствор в ДМСО) разводили в среде до концентрации 250 мкМ и затем добавляли по 40 мкл в соответствующие лунки с получением конечной концентрации 50 мкМ, и инкубировали в течение 1 часа. Этот вид обработки был ранее оптимизирован до способности индуцировать блокирование фазы G2 в 80% клеток через 16 часов после обработки. После воздействия генотоксических препаратов среду удаляли и заменяли на свежую среду (160 мкл). Клетки были либо необработанными (необработанный контроль или предварительная обработка исключительно этопозидом), либо подвергнутыми воздействию нокодазола вслед за предварительной обработкой этопозидом или исключительно нокодазола (конечная концентрация 100 нг/мл), либо подвергнутыми воздействию возрастающих концентраций исследуемых соединений (конечная концентрация от 200 мкМ до 0,01 нМ) в комбинации с нокодазолом (конечная концентрация 100 нг/мл). Исследуемые соединения добавляли в лунки в аликвотах объемом 40 мкл в четырех повторностях для каждой дозы. После 21-часового периода воздействия среду удаляли и клетки фиксировали с помощью 4% формальдегида в фосфатно-солевом буфере (ФСБ, pH 7,4, предварительно охлажденном до 4°C) в течение 30 минут при 4°C с последующей обработкой 100% метанолом (предварительно охлажденным до -20°C) в течение 10 минут при комнатной температуре. Лунки промывали ФСБ и блокировали 5% сухим молоком (Marvel) в Трис-солевом буфере (ТСБ, pH 7,4) при 37°C в течение 30 минут. Каждую лунку промывали три раза водой, содержащей 0,1% Твин 20. Первые антитела (МРМ-2, №по каталогу 05-368, 1 мкг/мл в 5% растворе молока в ТСБ) добавляли в каждую лунку и инкубировали в течение ночи со встряхиванием при 4°C. Первые антитела удаляли, и лунки промывали водой, содержащей 0,1% Твин 20. Вторые антитела (содержащие европиевую метку антитела против иммуноглобулинов мыши, № по каталогу Perkin Elmer AD0124, 333 нг/мл в буфере для анализа Perkin Elmer, № по каталогу 1244-111) добавляли в каждую лунку и инкубировали при 37°C в течение 1 часа. Каждую лунку промывали водой, содержащей 0,1% Твин 20 и обрабатывали усиливающим сигнал раствором (№ по каталогу Perkin Elmer 1244-105). Интенсивность излучения, опосредованного наличием европиевой метки, подсчитывали с применением счетчика Wallac Victor2 (Perkin Elmer, Bucks, UK). Включали соответствующие контроли, и результаты выражали в виде концентрации исследуемого соединения, необходимой для протекания митоза в 50% клеток (MIA IC50).
Сравнительная оценка биодоступности при пероральном введении по фармакокинетическим параметрам in vivo с применением ограниченной выборки
Мышей-самок линии BALB/c (в возрасте 6 недель) (Charles River UK Ltd, Margate, UK) содержали в контролируемых условиях внешней среды с неограниченным доступом к пище и стерильной воде. На момент эксперимента масса животных составляла 20±2 г. Все процедуры осуществляли в соответствии с этическими принципами местных и национальных организаций относительно проведения экспериментов на животных. Растворы для введения получали путем растворения исследуемых соединений в 10% ДМСО и 5% Твин 20 в 85% солевом растворе. Исследуемые соединения вводили перорально (п.о.) с применением желудочного зонда. Забор крови в содержащие гепарин шприцы осуществляли в выбранных временных точках посредством пункции сердца под анестезией, образцы крови переносили в микроцентрифужные пробирки и центрифугировали при 4500 × g в течение 2 минут с получением плазмы. Количественный анализ проводили посредством высокоэффективной жидкостной хроматографии-тандемной масс-спектрометрии на тройном квадрупольном жидкостном масс-спектрометре (Agilent 6410) с применением мониторинга множественных реакций или выбранных переходов с оломоуцином в качестве внутреннего стандарта. Количественное определение выполняли по стандартной кривой с диапазоном концентраций от 2 нМ до 1000 нМ в стандартном растворе. Были включены контроли качества на уровне 25, 250 и 750 нМ. При необходимости образцы разводили в исследуемом растворе. Концентрации исследуемых соединений в плазме измеряли через 1 час после перорального введения и выражали относительно дозы 10 мг/кг с обеспечением сравнительной оценки степени биодоступности при пероральном введении.
Результаты биологических исследований
Активность по отношению к СНК1
Следующие соединения были исследованы посредством Анализа 1А (Определение ингибиторной активности по отношению к СНК1 в формате анализа DELFIA) или Анализа 1B (Определение ингибиторной активности по отношению к СНК1 в формате анализа с применением прибора Caliper):
РАРС-А-01, РАРС-А-02, РАРС-А-03, РАРС-А-04, РАРС-А-05, РАРС-А-06, РАРС-А-07, РАРС-А-08, РАРС-А-09, РАРС-А-10, РАРС-В-01, РАРС-В-02, РАРС-В-03, РАРС-В-04, РАРС-В-05, РАРС-В-06, РАРС-В-07, РАРС-В-08, РАРС-В-09, РАРС-В-10, РАРС-В-11.
Все соединения характеризовались значениями IC50 для СНК1, составляющими менее чем 0,1 мкМ (100 нМ).
Следующие соединения демонстрировали IC50 для СНК1, составляющие менее чем 0,02 мкМ (20 нМ):
РАРС-А-01, РАРС-А-02, РАРС-А-03, РАРС-А-08, РАРС-А-10, РАРС-В-01, РАРС-В-02, РАРС-В-03, РАРС-В-04, РАРС-В-05, РАРС-В-06, РАРС-В-08, РАРС-В-10, РАРС-В-11.
Селективность ингибирования СНК1 по сравнению с СНК2
Следующие соединения были также исследованы посредством Анализа 2 (Определение селективности ингибиторов для ингибирования СНК1 по сравнению с СНК2):
РАРС-А-01, РАРС-А-02, РАРС-А-03, РАРС-А-07, РАРС-А-08, РАРС-А-09, РАРС-В-02, РАРС-В-03, РАРС-В-04, РАРС-В-06, РАРС-В-10, РАРС-В-11.
Все соединения характеризовались по меньшей мере 100-кратной селективностью по отношению к СНК1 по сравнению с СНК2 (т.е. СНК2 IC50/СНК1 IC50 > 100).
Активность в анализе ингибирования митоза (MIA)
Следующие соединения были исследованы посредством Анализа 3 (Анализ ингибирования митоза (MIA)):
РАРС-А-01, РАРС-А-02, РАРС-А-03, РАРС-А-04, РАРС-А-05, РАРС-А-06, РАРС-А-07, РАРС-А-08, РАРС-А-09, РАРС-А-10, РАРС-В-01, РАРС-В-02, РАРС-В-03, РАРС-В-04, РАРС-В-05, РАРС-В-06, РАРС-В-07, РАРС-В-08, РАРС-В-09, РАРС-В-10, РАРС-В-11.
Следующие соединения демонстрировали MIA IC50, составляющие менее чем 0,5 мкМ:
РАРС-А-01, РАРС-А-02, РАРС-А-03, РАРС-А-04, РАРС-А-05, РАРС-А-06, РАРС-А-07, РАРС-А-08, РАРС-А-09, РАРС-А-10, РАРС-В-01, РАРС-В-02, РАРС-В-03, РАРС-В-04, РАРС-В-05, РАРС-В-06, РАРС-В-08, РАРС-В-10, РАРС-В-11.
Биодоступность при пероральном введении
Следующие соединения оценивали с точки зрения биодоступности при пероральном введении посредством описанного выше способа:
РАРС-А-01, РАРС-А-02, РАРС-А-05, РАРС-А-07, РАРС-А-09, РАРС-В-01, РАРС-В-02, РАРС-В-03, РАРС-В-04, РАРС-В-05, РАРС-В-06, РАРС-В-08, РАРС-В-10.
Все соединения демонстрировали биодоступность при пероральном введении (концентрация в плазме через 1 час после п.о. введения в дозе 10 мг/кг), составляющую по меньшей мере 2 нМ.
Следующие соединения демонстрировали биодоступность при пероральном введении (концентрация в плазме через 1 час после п.о. введения в дозе 10 мг/кг), составляющую по меньшей мере 10 нМ:
РАРС-А-01, РАРС-А-02, РАРС-А-05, РАРС-А-07, РАРС-А-09, РАРС-В-02, РАРС-В-05, РАРС-В-06, РАРС-В-08, РАРС-В-10.
Следующие соединения демонстрировали биодоступность при пероральном введении (концентрация в плазме через 1 час после п.о. введения в дозе 10 мг/кг), составляющую по меньшей мере 100 нМ:
РАРС-А-01, РАРС-А-02, РАРС-А-05, РАРС-А-07, РАРС-В-02, РАРС-В-05.
Следующие соединения демонстрировали биодоступность при пероральном введении (концентрация в плазме через 1 час после п.о. введения в дозе 10 мг/кг), составляющую по меньшей мере 500 нМ:
РАРС-А-01, РАРС-А-02, РАРС-А-05.
Данные для двух особенно предпочтительных соединений кратко представлены ниже:
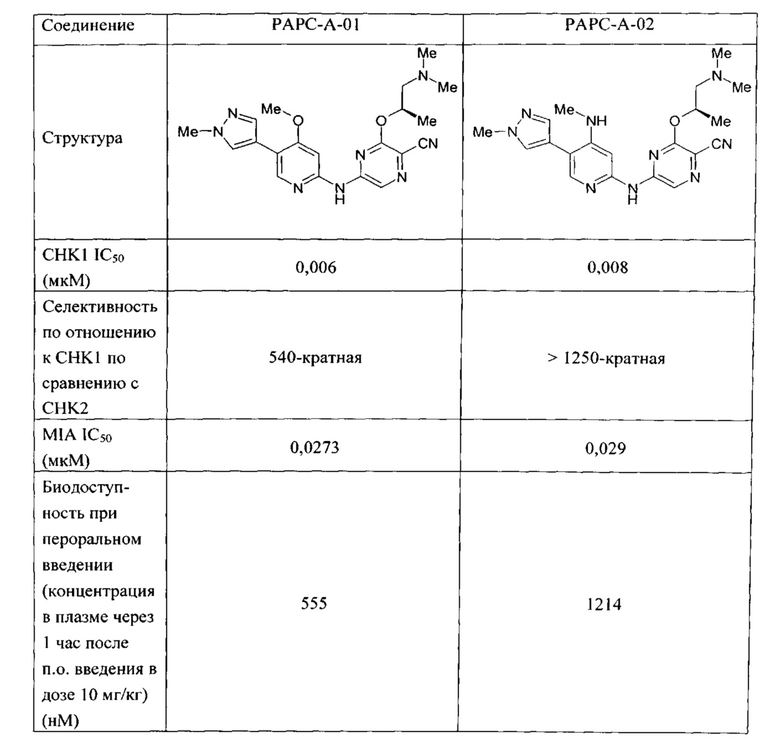
Исследование 1 in vivo: Соединение РАРС-А-01 в трансгенной модели MYCN-опосредованной нейробластомы
Спонтанные нейробластомы, возникающие у гемизиготных трансгенных мышей, несущих ген TH-MYCN (ген MYCN человека под контролем тирозингидроксилазного промотора крысы), обнаруживали посредством пальпации живота. Поочередных животных с хорошо развившимися опухолями (в возрасте 30-70 дней) рандомизировали для получения ими либо исследуемого соединения (РАРС-А-01), либо переносящей среды до тех пор, пока в каждую группу не были набраны 8-9 мышей. Исследуемое соединение (РАРС-А-01) вводили в качестве единственного агента в дозе 100 мг/кг п.о. 1 раз в сутки в течение 7 последовательных дней посредством желудочного зонда (100 мкл/10 г массы тела), а контрольные мыши получали эквивалентный объем переносящей среды (10% ДМСО, 5% Твин 20, 85% солевой раствор). Размер нейробластомы оценивали посредством МРТ и по массе опухоли, иссеченной из брюшной полости в конце терапии.
1Н МРТ проводили с помощью горизонтальной туннельной системы визуализации микрообъектов 7Т Bruker (Bruker Instruments, Ettlingen, Germany) с применением катушки типа "птичья клетка" с зоной охвата 3 см. Анестезию вызывали введением комбинации фентанилцитрата (0,315 мг/мл), флуанизона (10 мг/мл) (Hypnorm, Janssen Pharmaceutical, Oxford, UK), мидазолама (5 мг/мл) (Roche, Welwyn Garden City, UK) и воды (1:1:2). Температура тела животных поддерживали с помощью устройства для подачи теплого воздуха через туннель магнита.
Анатомические T2-взвешенные изображения фронтального и поперечного сечения были получены от двадцати смежных фронтальных срезов толщиной 1 мм брюшной полости мышей с применением последовательности быстрой регистрации с перефокусировкой эха (rapid acquisition with refocused echoes, RARE) с 4 усреднениями из 128 шагов фазового кодирования для поля зрения размером 3×3 см, двух значений времени эха 36 и 132 мс, времени повтора импульсной последовательности (TR) 4,5 с фактора RARE 8. После проведения МРТ мышей оставляли для выхода из состояния анестезии на утепленной подстилке течение 24 часов. Объемы опухолей измеряли посредством сегментации исследуемых областей, взятых на каждом срезе от T2-взвешенных изображений фронтального сечения, содержащих опухоль, с применением разработанного в лаборатории программного обеспечения (ImageView, работающего под языком программирования IDL, ITT, Boulder, Colorado, USA). Результаты МРТ отдельных мышей, до начала лечения и на 7 день лечения, показали регрессию опухоли в течение 7-дневного периода лечения. См. фигуру 1 и фигуру 2.
Средняя масса опухоли в конце исследования составляла 2,1±0,7 г (среднее значение ± станд. откл.) у контрольных мышей и 0,3±0,2 г у мышей из группы, получавшей лечение, с показателем эффективности Т/С, равным 13,4%.
Исследование 2 in vivo: Соединение РАРС-А-01 в комбинации с гемцитабином при НТ29-ксенотрансплантатной карциноме толстой кишки человека
Атимических мышей-самок линии CrTac:NCr-Foxn1nu (в возрасте 6-8 недель) (Charles River UK Ltd., Margate, UK) содержали в контролируемых условиях внешней среды в клетках Maximiser со стерильной подстилкой с неограниченным доступом к пище и воде. Масса животных составляла 20,3±2,0 г в начале исследования. Обработку и все экспериментальные процедуры проводили в стерильных условиях в ламинарных боксах в соответствии с этическими принципами Министерства внутренних дел Великобритании, национальных и местных организаций.
Клетки НТ29 карциномы толстой кишки от Американской коллекции типовых культур (АТСС, LGC Promochem, Middesex, UK) собирали из флаконов для тканевых культур и вводили мышам подкожно в правый бок (3 миллиона клеток на каждый очаг). После развития опухолей (средний диаметр 0,55±0,05 см) мышей рандомизировали в группы лечения (n=6), получающие (а) исследуемое соединение (РАРС-А-01) (75 мг/кг), (b) гемцитабин (100 мг/кг), (с) комбинацию (РАРС-А-01) (75 мг/кг) и гемцитабина (100 мг/кг) или (d) соответствующие переносящие среды.
Гемцитабина гидрохлорид для клинического применения (GEMZAR, Eli Lilly, Newmarket, UK) восстанавливали в стерильном 0,9% растворе хлорида натрия, и аликвоты замораживали при -20°C. Гемцитабин вводили внутривенно один раз в неделю через латеральную хвостовую вену на 0 день (5 день после имплантации опухолевых клеток), 7 и 14 дни. Исследуемое соединение (РАРС-А-01) растворяли в 10% ДМСО и разводили в 85% солевом растворе, содержащем 5% Твин 20. Исследуемое соединение (РАРС-А-01) вводили посредством желудочного зонда в дни 1, 2, 8, 9, 15 и 16. Контрольные животные получали обе переносящие среды с помощью соответствующего пути введения в указанные дни. Соединения вводили в объеме 100 мкл на 10 г массы тела.
Животных обследовали ежедневно, а массы тела и размеры опухолей измеряли три раза в неделю. Два перпендикулярных диаметра опухолей применяли для расчета их объемов по формуле: V=4/3 π [(d1+d2)/4]3.
Значения показателя Т/С значения (объемы опухолей, соответствующих лечению, по сравнению с контролями) рассчитывали по отношению к опухолям у контрольных мышей, получавших переносящие среды, или у мышей, получавших только гемцитабин, и выражали в процентах.
На 24 день после начала терапии были получены следующие результаты:
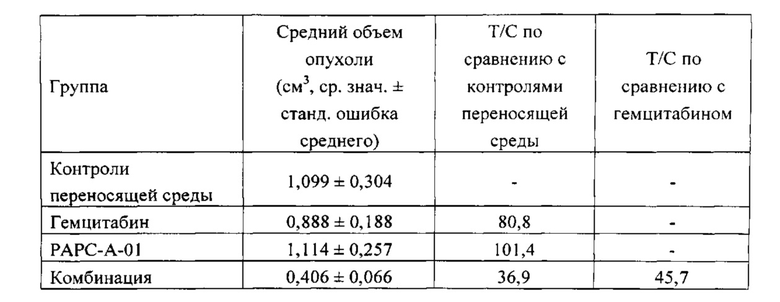
Гемцитабин отдельно, в дозировке, близкой к рекомендованной максимально переносимой дозе, ингибировал рост опухоли приблизительно на 20%. Исследуемое соединение (РАРС-А-01) отдельно не вызывало ингибирования роста. Комбинированная терапия на основе гемцитабина и исследуемого соединения (РАРС-А-01) приводила к ингибированию роста опухоли на 63% по сравнению с контролями и на 54% по сравнению с гемцитабином отдельно.
Выше были описаны принципы, предпочтительные варианты реализации и характер функционирования настоящего изобретения. Однако следует понимать, что изобретение не ограничивается конкретными рассмотренными вариантами реализации. Наоборот, вышеописанные варианты реализации следует считать иллюстративными, а не ограничивающими, и следует понимать, что в этих вариантах реализации специалистами в данной области техники могут быть сделаны изменения без выхода за рамки настоящего изобретения.
Ссылки
В настоящей заявке приведен ряд публикаций с целью более полного описания и раскрытия изобретения и существующего уровня техники, к которому относится изобретение. Ниже представлен полный список ссылок на эти публикации. Полное содержание каждой из этих публикаций включено в настоящее описание посредством ссылки в той же степени, как если бы для каждой отдельной публикации конкретно и индивидуально было указано ее включение посредством ссылки.
Almeida et al., 2008, "Pyrazolyl-amino-substituted pyrazines and their use for the treatment of cancer", международная (PCT) патентная публикация № WO 2008/117050 A1, опубликованная 02 октября 2008 года.
Balaint and Vousden, 2001, "Activation and activities of the p53 tumour suppressor protein," Br. J. Cancer. Vol. 85, pp. 1813-1823.
Bartek and Lukas, 2003, "Chkl and Chk2 kinases in checkpoint control and cancer," Cancer Cell, Vol.3, pp.421-429.
Brooks et al., 2012, "A potent chkl inhibitor is selectively toxic in melanomas with high levels of replicative stress," Oncogene. doi:10.1038/onc.2012.72.
Carson and Lois, 1995, "Cancer progression and p53," Lancet. Vol.346, pp.1009-1011. Cavelier et al., 2009, "Constitutive activation of the DNA damage signaling pathway in acute myeloid leukemia with complex karyotype: Potential importance for checkpoint targeting therapy," Cancer Res.. Vol. 69, pp. 8652-8661.
Cole et al., 2011 "RNAi screen of the protein kinome identifies checkpoint kinase 1 (chkl) as a therapeutic target in neuroblastoma," Proc. Natl. Acad. Sci. U.S.A.. Vol.108, pp.3336-3341.
Collins et al., 2009a, "Pyrazin-2-yl-2-yl-amine and pyrazin-2-yl-pyrimidin-4-yl-amine compounds and their use", международная (PCT) патентная публикация № WO 2009/044162 A1, опубликованная 09 апреля 2009 года.
Collins et al., 2009b, "Bicyclylaryl-aryl-amine compounds and their use", международная (PCT) патентная публикация № WO 2009/103966 A1, опубликованная 27 августа 2009 года.
Davies et al., 2011, "Single-agent inhibition of chkl is antiproliferative in human cancer cell lines in vitro and inhibits tumor xenograft growth in vivo," Oncol. Res.. Vol.19, pp.349-363.
Di Micco et al., 2006, "Oncogene-induced senescence is a DNA damage response triggered by DNA hyper-replication," Nature. Vol.444, pp.638-642.
Dixon and Norbury, 2002, "Therapeutic exploitation of checkpoint defects in cancer cells lacking p53 function," Cell Cycle. Vol.1, pp.362-368.
Ferrao et al., 2011, "Efficacy of chk inhibitors as single agents in myc-driven lymphoma cells," Oncogene. doi:10.1038/onc.2011.358.
Greenblatt et al., 1994, "Mutations in the p53 tumor suppressor gene: clues to cancer etiology and molecular pathogenesis," Cancer Res., Vol.54, pp.4855-4878.
Guzx et al., 2011, "Targeting the replication checkpoint using SCH 900776, a potent and functionally selective CHK1 inhibitor identified via high content screening," Mol. Cancer Ther., Vol.10, pp.591-602.
Höglund et al., 2011, "Therapeutic Implications for the Induced Levels of Chkl in Мус-Expressing Cancer Cells," Clin. Cancer Res.. Vol.17, pp.7067-7079.
Ioannidis et al., 2009, "Discovery of pyrazol-3-ylamino pyrazines as novel JAK2 inhibitors", Bioorg. Med. Chem. Lett.. Vol.19, pp.6524-6528.
Lainchbury et al., 2012, "Discovery of 3-akloxyamino-5-(pyridin-2-ylamino)pyrazine-2-carbonitriles as selective, orally bioavailable CHK1 inhibitors", J. Med. Chem.. предварительно опубликована в Интернете 19 октября 2012 года, dx.doi.org/10.1021/jm3012933.
Li et al., 2007, "Synthesis and in-vitro biological activity of macrocyclic urea CHK1 inhibitors", Bioore. Med. Chem. Lett.. Vol.17, pp.6499-6504.
Lin et al., 2005, "Macrocyclic kinase inhibitors", публикация патента CUIA № US 2005/0215556 A1, опубликованная 29 сентября 2005 года.
Liu et al., 2000, "Chkl is an essential kinase that is regulated by Atr and required for the G(2)/M DNA damage checkpoint," Genes Dev.. Vol.14, pp.1448-1459.
Murga et al., 2011, "Exploiting oncogene-induced replicative stress for the selective killing of Myc-driven tumors," Nat. Struct. Mol. Biol.. Vol.18, pp.1331-1335.
Sanchez et al., 1997, "Conservation of the Chkl checkpoint pathway in mammals: linkage of DNA damage to Cdk regulation through Cdc25," Science. Vol.277, pp.1497-1501.
Sorensen et al, 2005, "Cell-cycle checkpoint kinase Chkl is required for mammalian homologous recombination repair," Nat. Cell Biol.. Vol 7, pp.195-201.
Tao et al., 2005, "Macrocyclic kinase inhibitors", международная (PCT) патентная публикация № WO 2005/047294 A1, опубликованная 26 мая 2005 года.
Tao et al., 2006, "Chkl inhibitors for novel cancer treatment," Anti-Cancer Agents in Medicinal Chemistry. Vol.6, pp.377-388.
Тао et al., 2007а, "Macrocyclic ureas as potent and selective CHK1 inhibitors: an improved synthesis, kinome profiling, structure-activity relationships, and preliminary pharmacokinetics," Bioorg. Med. Chem. Lett.. Vol.17, pp.6593-6601.
Tao et al., 2007b, "Structure-based design, synthesis, and biological evaluation of potent and selective macrocyclic checkpoint kinase 1 inhibitors," J. Med. Chem.. Vol.50, pp.1514-1527.
Walton et al., 2010, "The preclinical pharmacology and therapeutic activity of the novel CHK1 inhibitor SAR-020106," Mol. Cancer Ther.. Vol.9, No. 1, pp.89-100.
Walton et al., 2012, "CCT244747 is a novel potent and selective CHK1 inhibitor with oral efficacy alone and in combination with genotoxic anticancer drugs", Clin. Cancer Research. Vol.18, No. 20, pp.5650-5661.
Wang et al., 1996, "UCN-01: a potent abrogator of G2 checkpoint function in cancer cells with disrupted p53," J. Natl. Cancer Inst.. Vol.8, pp.956-965.
Weinert and Hartwell, 1989, "Control of G2 delay by the rad9 gene of Saccharomyces cerevisiae," J. Cell Sci. Suppl.. Vol.12, pp.145-148.
Xiao et al., 2006, "Differential roles of checkpoint kinase 1, checkpoint kinase 2, and mitogen-activated protein kinase-activated protein kinase 2 in mediating DNA damage-induced cell cycle arrest: implications for cancer therapy," Mol. Cancer Ther.. Vol.5, pp.1935-1943.
Zachos et al., 2003, "Chkl-deficient tumour cells are viable but exhibit multiple checkpoint and survival defects," EMBO J.. Vol.22, pp.713-723.
Zhao et al., 2002, "Disruption of the checkpoint kinase 1/cell division cycle 25A pathway abrogates ionizing radiation-induced S and G2 checkpoints," Proc. Natl. Acad. Sci. USA. Vol.99, pp.14795-14800.
| название | год | авторы | номер документа |
|---|---|---|---|
| 5-[[4-[[МОРФОЛИН-2-ИЛ]МЕТИЛАМИНО]-5-(ТРИФТОРМЕТИЛ)-2-ПИРИДИЛ]АМИНО]ПИРАЗИН-2-КАРБОНИТРИЛ, ЕГО ТЕРАПЕВТИЧЕСКИЕ ПРИМЕНЕНИЯ | 2013 |
|
RU2659786C2 |
| Макрогетероциклические нуклеозидные производные и их аналоги, получение и применение | 2017 |
|
RU2731385C1 |
| ХИНАЗОЛИНОВЫЕ ИНГИБИТОРЫ АКТИВИРУЮЩИХ МУТИРОВАННЫХ ФОРМ РЕЦЕПТОРА ЭПИДЕРМАЛЬНОГО ФАКТОРА РОСТА | 2014 |
|
RU2656597C2 |
| СОЕДИНЕНИЯ-ИНГИБИТОРЫ EGFR | 2017 |
|
RU2751341C2 |
| ЗАМЕЩЕННЫЕ ПИРАЗОЛОПИРИМИДИНЫ И ЗАМЕЩЕННЫЕ ПУРИНЫ И ИХ ПРИМЕНЕНИЕ В КАЧЕСТВЕ ИНГИБИТОРОВ УБИКВИТИН-СПЕЦИФИЧЕСКОЙ ПРОЦЕССИРУЮЩЕЙ ПРОТЕАЗЫ 1 (USP1) | 2019 |
|
RU2833222C2 |
| 2-(Азаиндол-2-ил)бензимидазолы в качестве ингибиторов PAD4 | 2012 |
|
RU2611010C2 |
| ПРОИЗВОДНЫЕ 6-АМИНОХИНАЗОЛИНА ИЛИ 3-ЦИАНОХИНОЛИНА, СПОСОБЫ ИХ ПОЛУЧЕНИЯ И ИХ ПРИМЕНЕНИЕ В КАЧЕСТВЕ ИНГИБИТОРА РЕЦЕПТОРНЫХ ТИРОЗИНКИНАЗ EGFR ИЛИ HER-2 | 2010 |
|
RU2536102C2 |
| ПРОИЗВОДНОЕ ФТАЛАЗИНОНКЕТОНА, СПОСОБ ЕГО ПОЛУЧЕНИЯ И ЕГО ФАРМАЦЕВТИЧЕСКОЕ ПРИМЕНЕНИЕ | 2011 |
|
RU2564527C2 |
| НОВЫЕ СОЕДИНЕНИЯ И КОМПОЗИЦИИ ДЛЯ ИНГИБИРОВАНИЯ FASN | 2014 |
|
RU2686323C2 |
| Селективный ингибитор киназы JAK1 | 2020 |
|
RU2818002C2 |
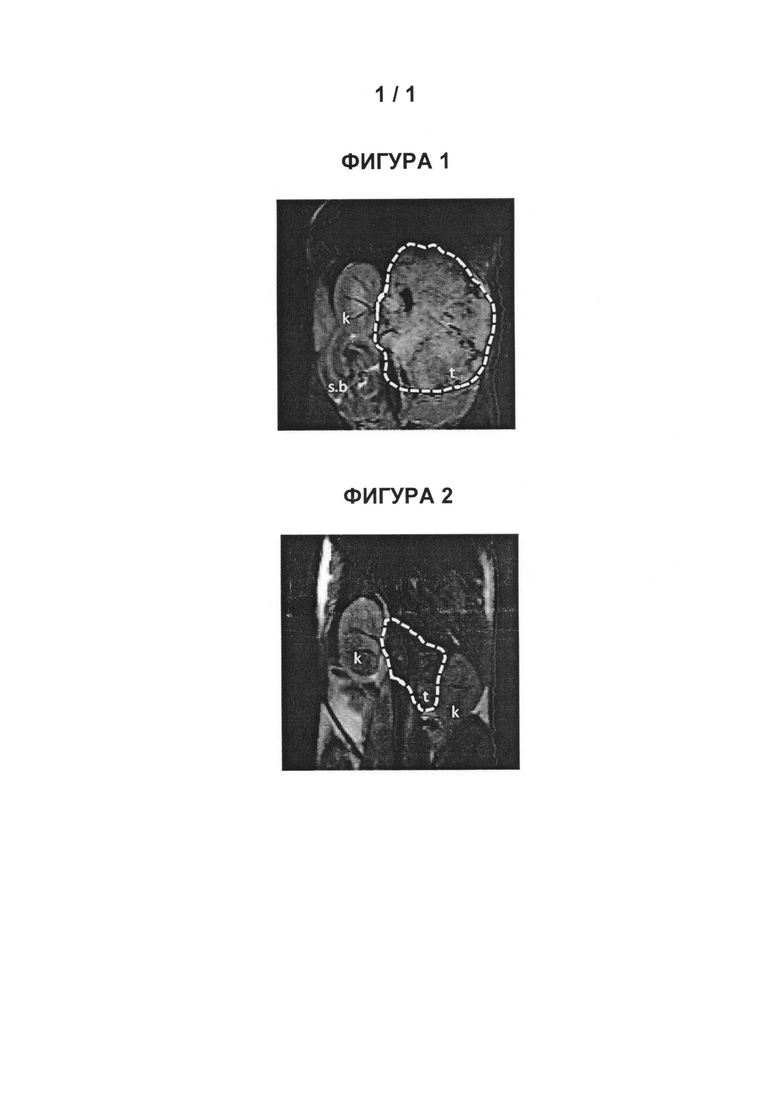
Настоящее изобретение относится к соединениям формулы
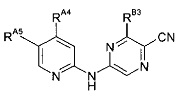 , а также к фармацевтическим композициям на их основе для применения их в лечении заболевания или состояния, опосредованного СНК1. Технический результат: получены новые соединения, которые ингибируют киназную функцию киназы 1 контрольной точки (СНК1). 9 н. и 28 з.п. ф-лы, 2 ил.
, а также к фармацевтическим композициям на их основе для применения их в лечении заболевания или состояния, опосредованного СНК1. Технический результат: получены новые соединения, которые ингибируют киназную функцию киназы 1 контрольной точки (СНК1). 9 н. и 28 з.п. ф-лы, 2 ил.
1. Соединение следующей формулы или его фармацевтически приемлемая соль:
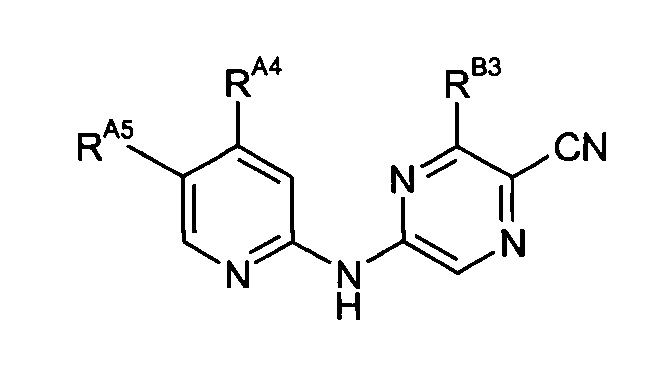
где:
-RB3 независимо представляет собой:
 или
или  ;
;
каждый -RB3A независимо представляет собой -Н или насыщенный алифатический С1-3 алкил;
-RA4 независимо представляет собой -NHRA4A, -NRA4A2 или -ORA4A;
каждый -RA4A независимо представляет собой насыщенный алифатический С1-3 алкил;
-RA5 независимо представляет собой -RA5A, -RA5B, -RA5C, -RA5D, -RA5E или -RA5F;
-RA5A независимо представляет собой:
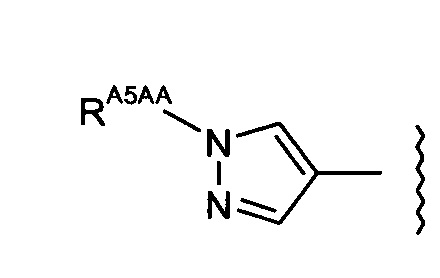 ;
;
-RA5AA представляет собой насыщенный алифатический С1-3 алкил;
-RA5B представляет собой -CF3;
-RA5C независимо представляет собой -Cl;
-RA5D независимо представляет собой 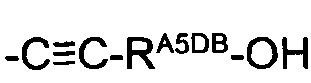 ;
;
-RA5DB представляет собой насыщенный алифатический C1-4 алкилен;
-RA5E независимо представляет собой насыщенный C3-6 циклоалкил;
-RA5F представляет собой -C(=O)O-RA5FA; и
-RA5FA представляет собой насыщенный алифатический C1-3 алкил.
2. Соединение по п. 1, отличающееся тем, что -RB3 представляет собой:
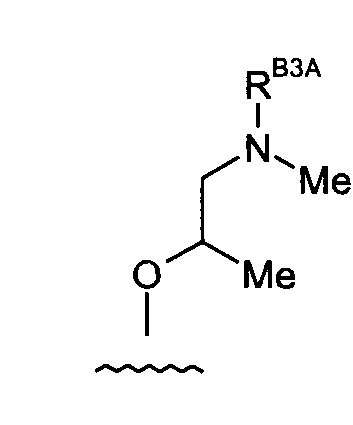 .
.
3. Соединение по п. 1, отличающееся тем, что -RB3 представляет собой:
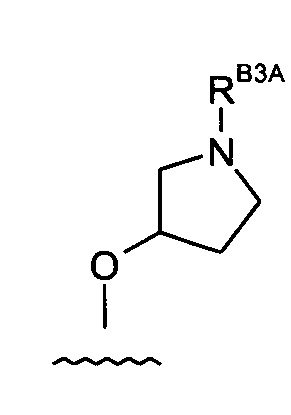 .
.
4. Соединение по п. 1, отличающееся тем, что -RB3A представляет собой -Н или -Me.
5. Соединение по п. 2, отличающееся тем, что -RB3A представляет собой -Me.
6. Соединение по п. 4, отличающееся тем, что -RA4 независимо представляет собой -NHRA4A или -NRA4A2, при этом каждый -RA4A независимо представляет собой -Me или -Et.
7. Соединение по п. 5, отличающееся тем, что -RA4 независимо представляет собой -NHRA4A или -NRA4A2, при этом каждый -RA4A независимо представляет собой -Me или -Et.
8. Соединение по п. 1, отличающееся тем, что -RA5 представляет собой -RA5A.
9. Соединение по п. 2, отличающееся тем, что -RA5 представляет собой -RA5A.
10. Соединение по п. 3, отличающееся тем, что -RA5 представляет собой -RA5A.
11. Соединение по п. 4, отличающееся тем, что -RA5 представляет собой -RA5A.
12. Соединение по п. 5, отличающееся тем, что -RA5 представляет собой -RA5A.
13. Соединение по п. 6, отличающееся тем, что -RA5 представляет собой -RA5A.
14. Соединение по п. 7, отличающееся тем, что -RA5 представляет собой -RA5A.
15. Соединение по п. 1, представляющее собой соединение следующей формулы или его фармацевтически приемлемую соль:
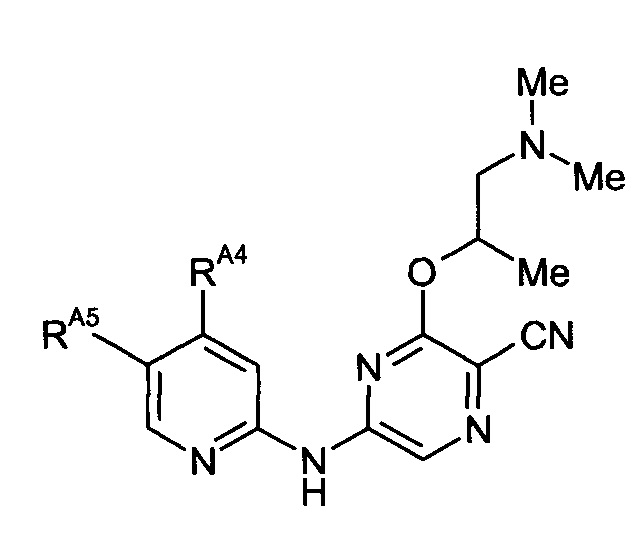 .
.
16. Соединение по п. 1, представляющее собой соединение следующей формулы или его фармацевтически приемлемую соль:
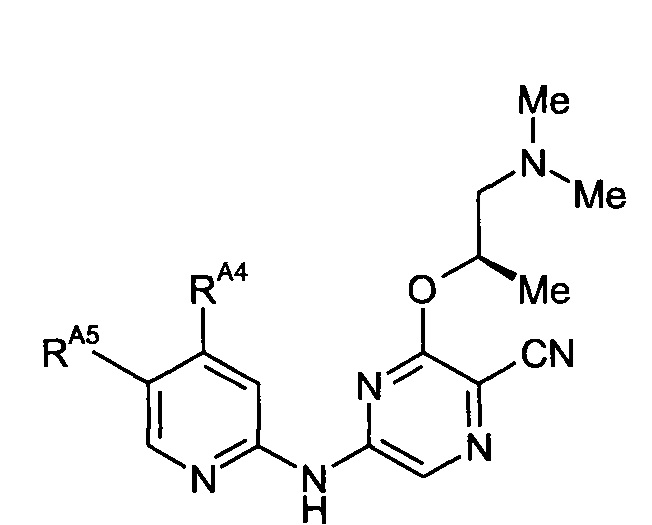 .
.
17. Соединение по п. 1, представляющее собой соединение следующей формулы или его фармацевтически приемлемую соль:
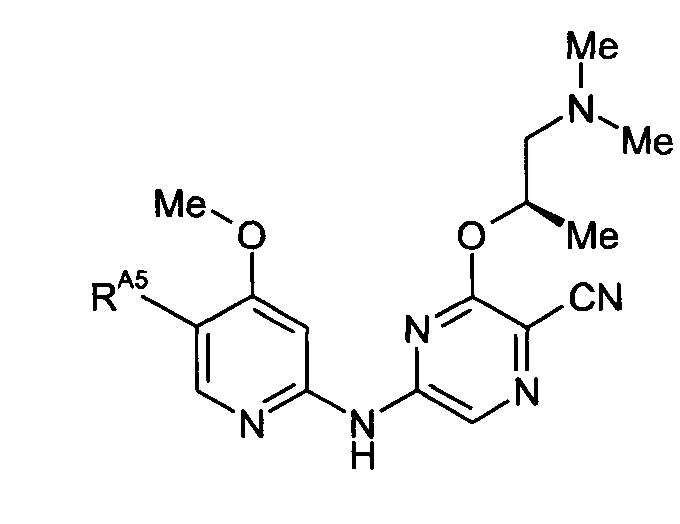 .
.
18. Соединение по п. 1, представляющее собой соединение одной из следующих формул или его фармацевтически приемлемую соль:
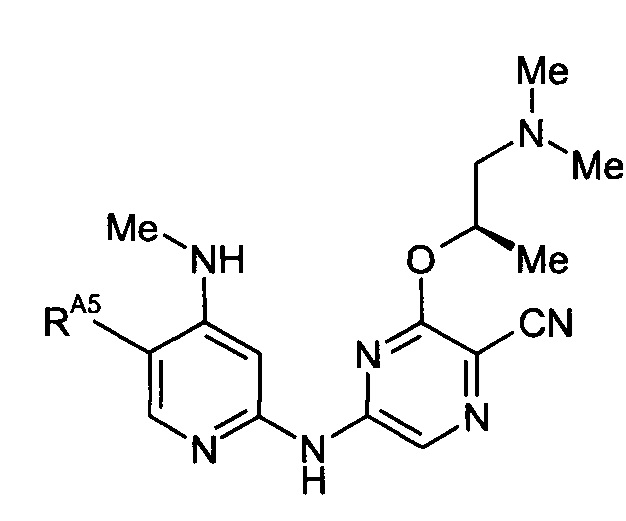 и
и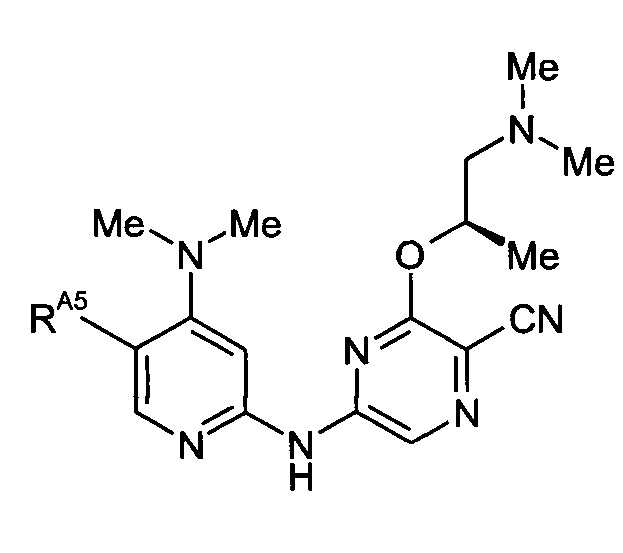 .
.
19. Соединение по п. 1, представляющее собой соединение следующей формулы или его фармацевтически приемлемую соль:
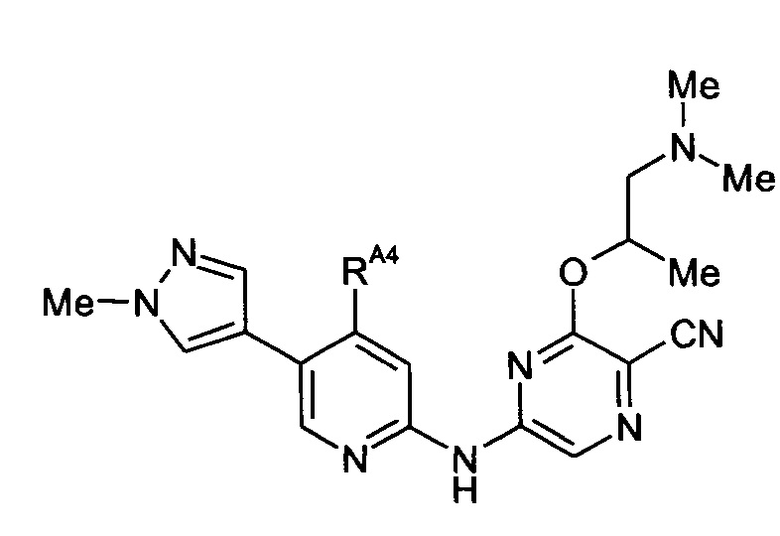 .
.
20. Соединение по п. 1, представляющее собой соединение следующей формулы или его фармацевтически приемлемую соль:
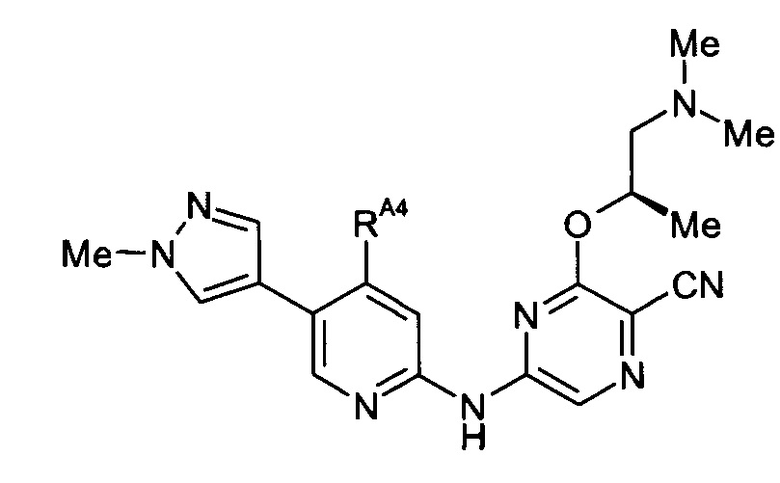 .
.
21. Соединение по п. 1, представляющее собой соединение одной из следующих формул или его фармацевтически приемлемую соль:
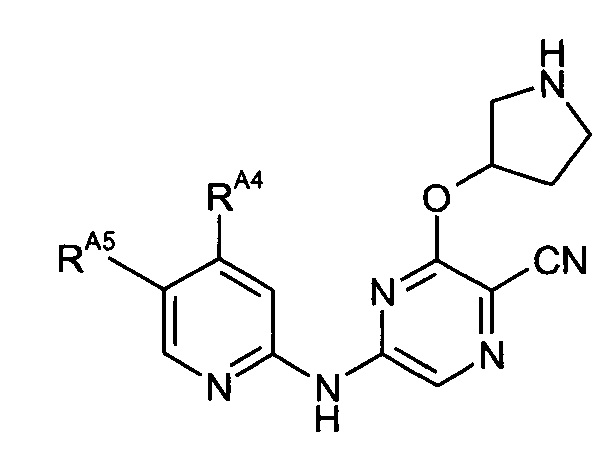 и
и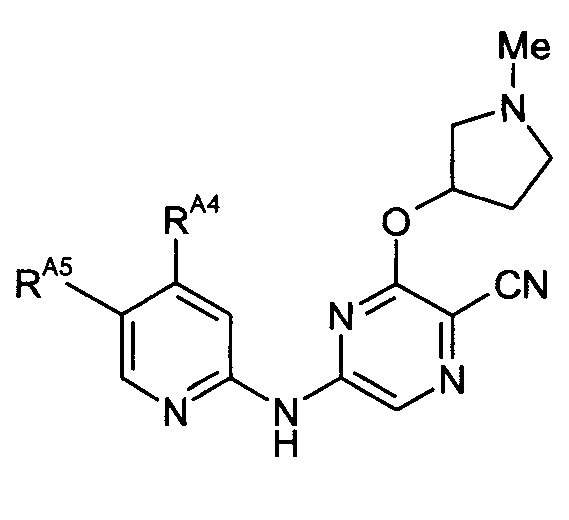 .
.
22. Соединение по п. 1, представляющее собой соединение одной из следующих формул или его фармацевтически приемлемую соль:
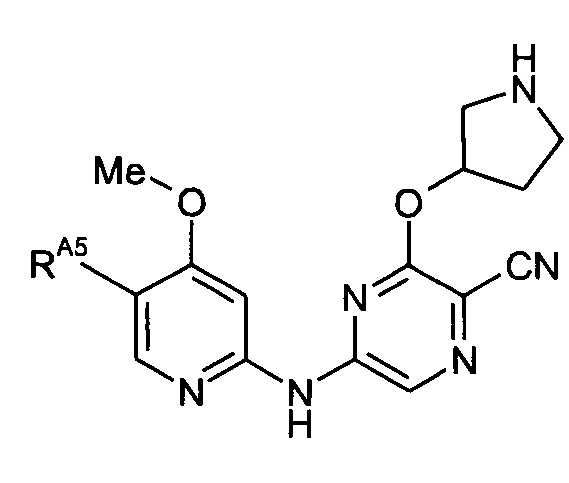 и
и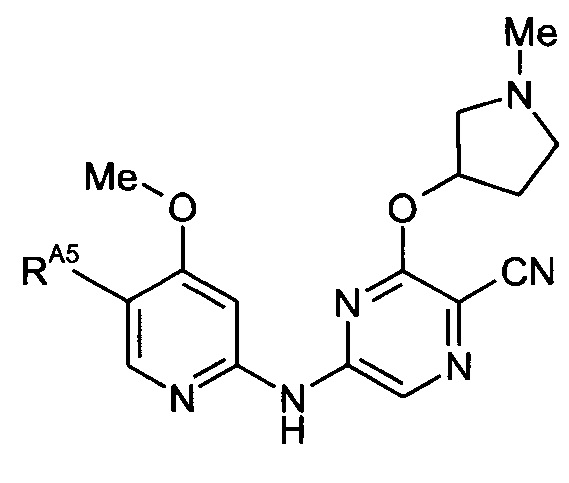 .
.
23. Соединение по п. 1, представляющее собой соединение одной из следующих формул или его фармацевтически приемлемую соль:
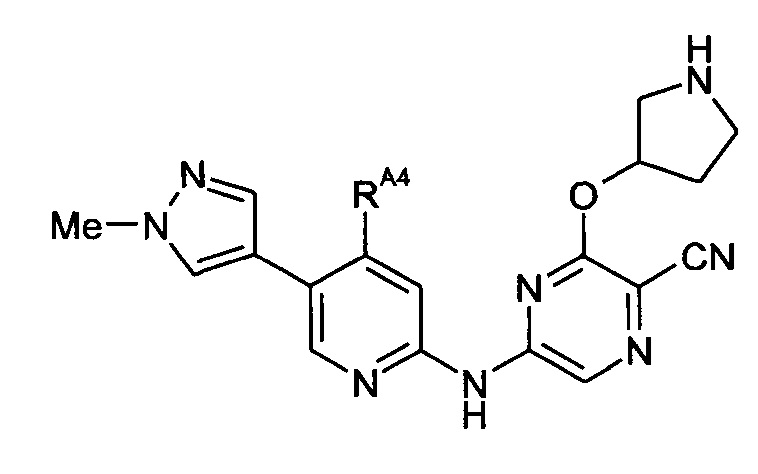 и
и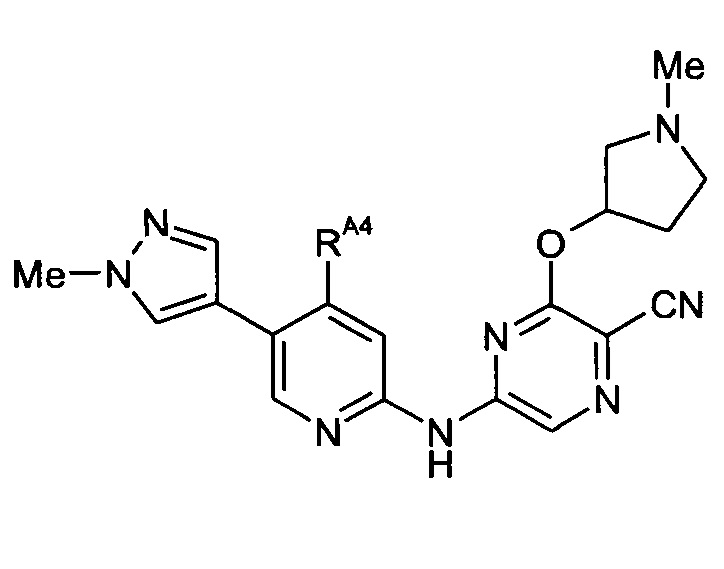 .
.
24. Соединение по п. 1, представляющее собой соединение одной из следующих формул или его фармацевтически приемлемую соль:
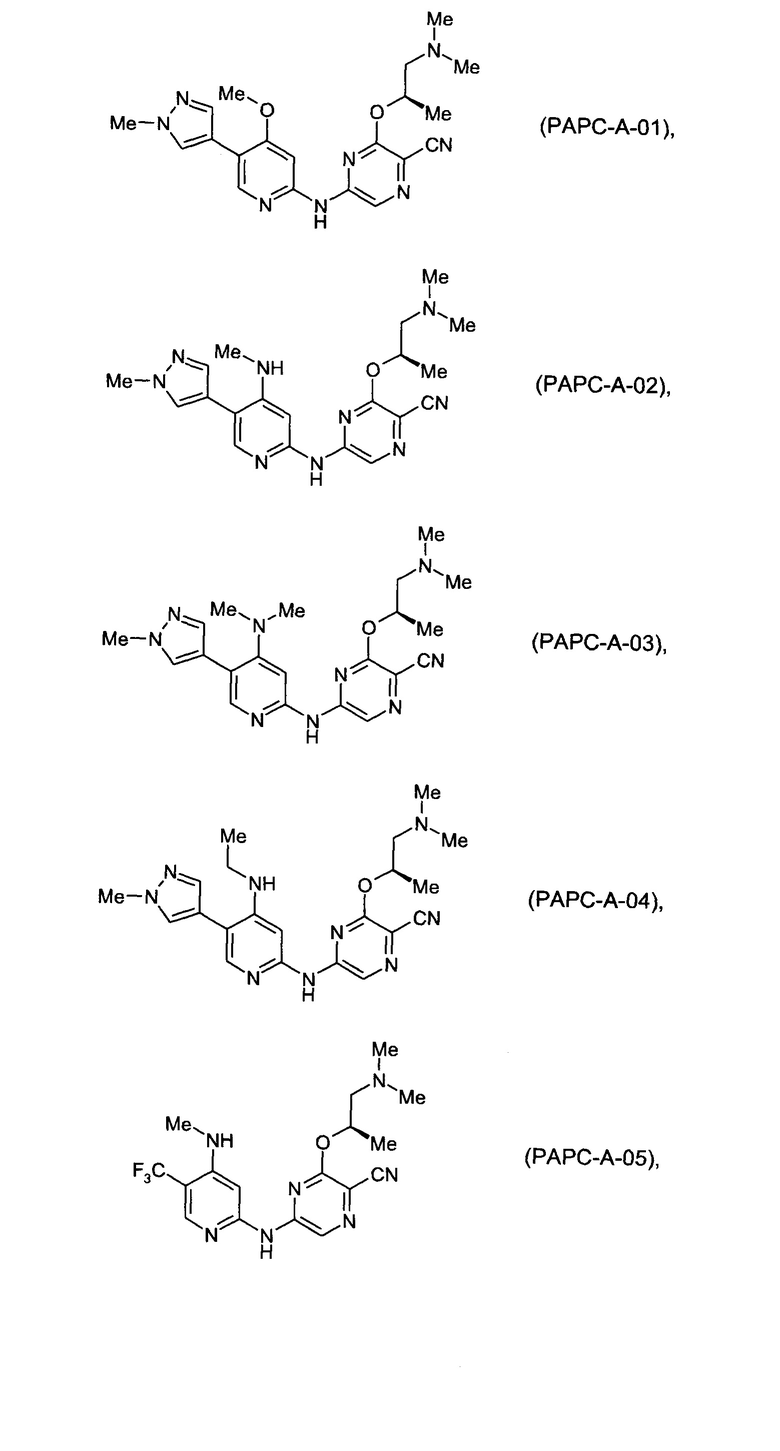
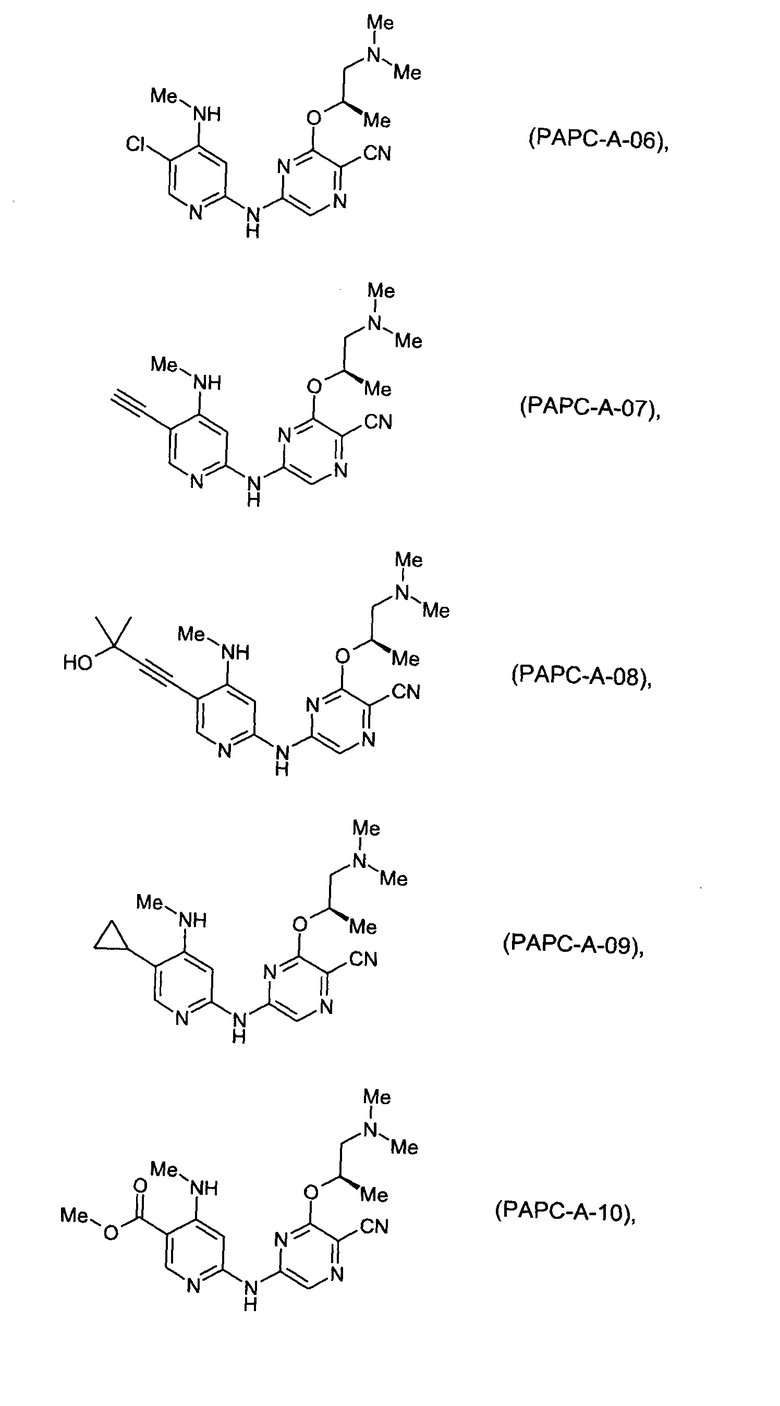
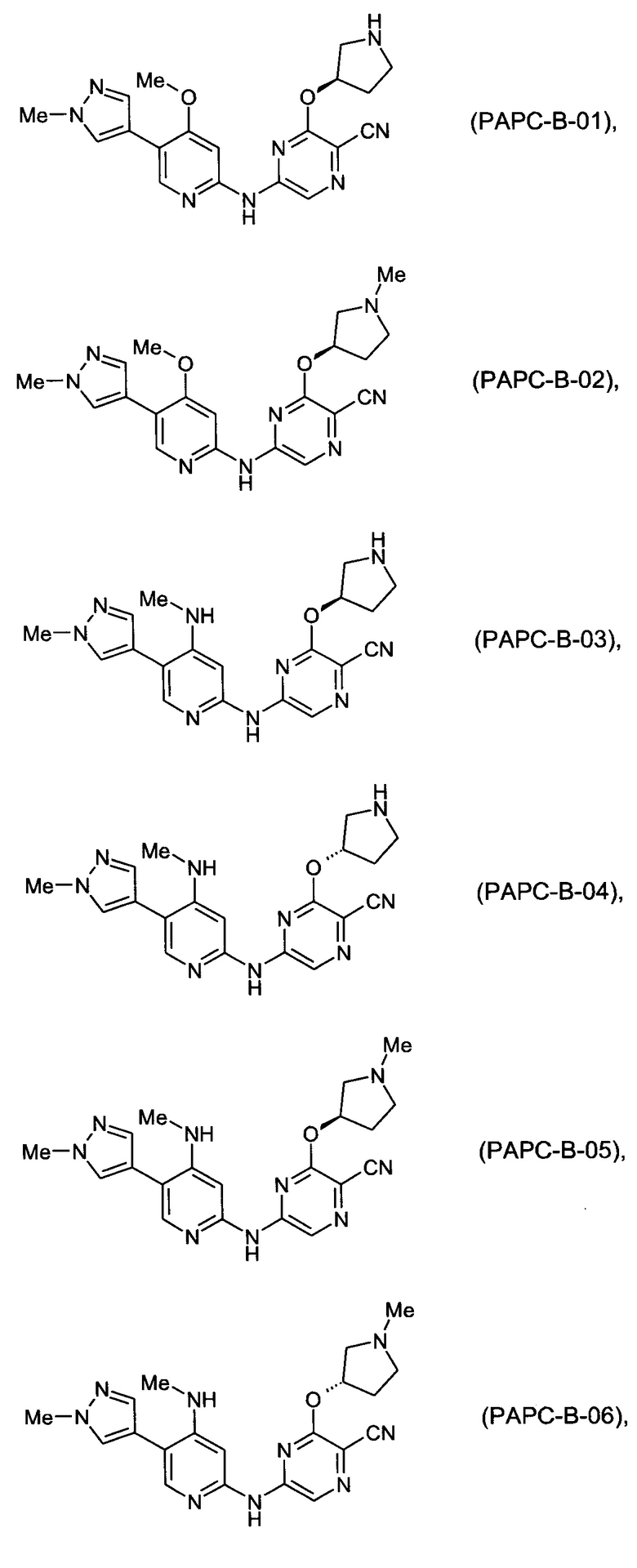
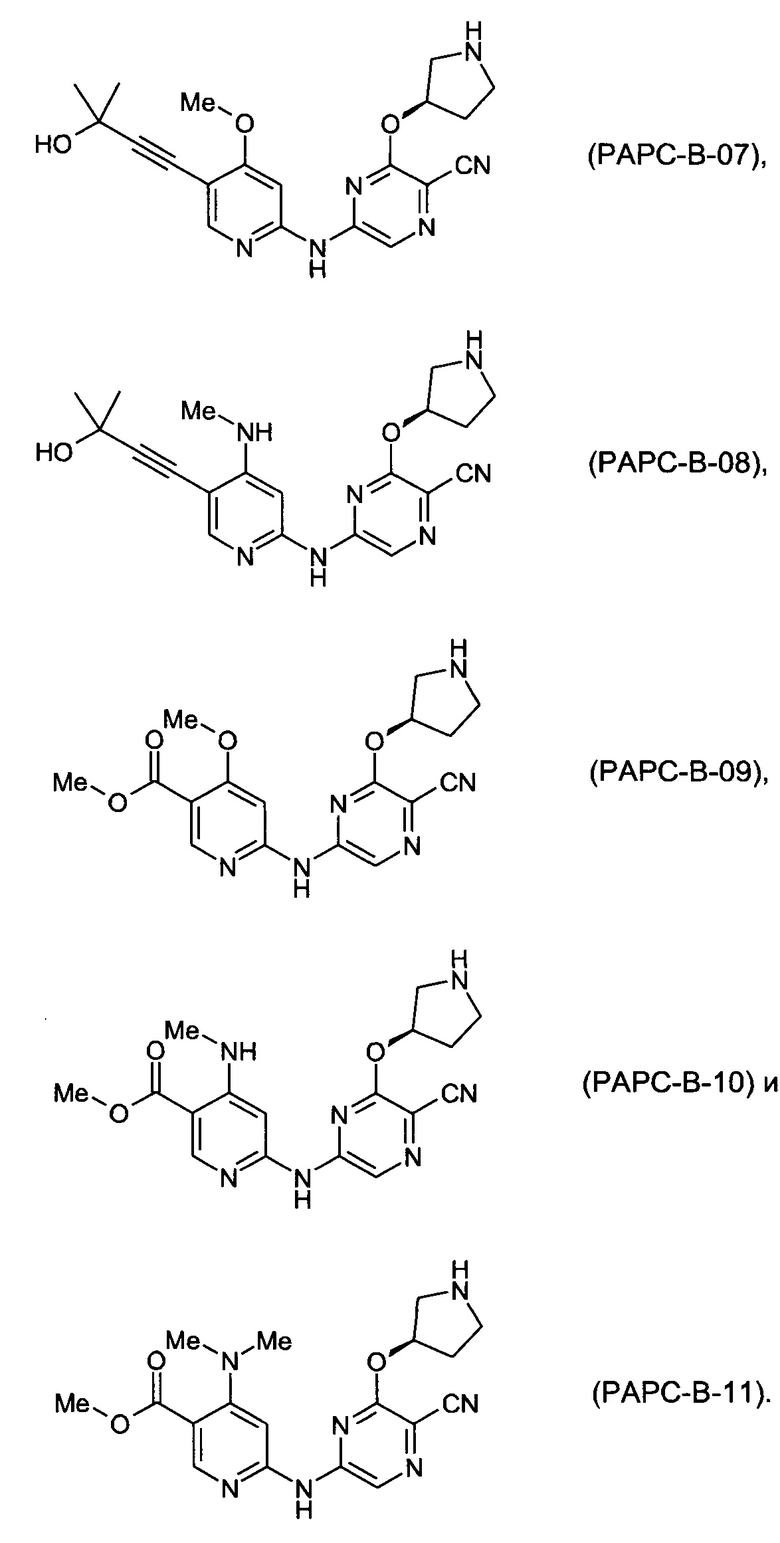
25. Соединение по п. 1, представляющее собой соединение следующей формулы или его фармацевтически приемлемую соль:
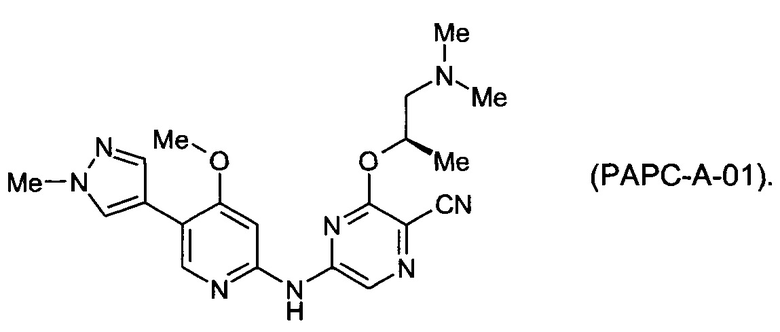
26. Фармацевтическая композиция для лечения заболевания или состояния, опосредованного CHK1, содержащая терапевтически эффективное количество соединения по любому из пп. 1-25 и фармацевтически приемлемый носитель или разбавитель.
27. Способ получения фармацевтической композиции, включающий стадию смешивания соединения по любому из пп. 1-25 и фармацевтически приемлемого носителя или разбавителя.
28. Соединение по любому из пп. 1-25 для лечения заболевания или состояния, поддающегося облегчению путем ингибирования функции киназы СНК1, у человека или животного.
29. Соединение по любому из пп. 1-25 для применения в способе лечения заболевания или состояния, опосредованного CHK1.
30. Соединение по любому из пп. 1-25 для применения в способе лечения рака.
31. Соединение по любому из пп. 1-25 для применения в способе лечения рака ободочной и/или прямой кишки, глиомы или нейробластомы.
32. Применение соединения по любому из пп. 1-25 для получения лекарственного средства для лечения заболевания или состояния, опосредованного CHK1.
33. Применение соединения по любому из пп. 1-25 для получения лекарственного средства для лечения рака.
34. Применение соединения по любому из пп. 1-25 для получения лекарственного средства для лечения рака ободочной и/или прямой кишки, глиомы или нейробластомы.
35. Способ лечения заболевания или состояния, опосредованного CHK1, включающий введение субъекту, нуждающемуся в лечении, терапевтически эффективного количества соединения по любому из пп. 1-25.
36. Способ лечения ракового заболевания, включающий введение субъекту, нуждающемуся в лечении, терапевтически эффективного количества соединения по любому из пп. 1-25.
37. Способ лечения рака ободочной и/или прямой кишки, глиомы или нейробластомы, включающий введение субъекту, нуждающемуся в лечении, терапевтически эффективного количества соединения по любому из пп. 1-25.
| WO 2009044162 A1, 09.04.2009 | |||
| WO 2009103966 A1, 27.08.2009 | |||
| Michael Lainchbury; Ian Collins, Checkpoint kinase inhibitors: a patent review, EXPERT OPINION ON THERAPEUTIC PATENTS, 2011, 21, N 8, стр | |||
| Прибор для вытаскивания дымогарных труб | 1924 |
|
SU1191A1 |
| EA 0200800441 A1, 29.08.2008. | |||
Авторы
Даты
2018-01-22—Публикация
2012-11-09—Подача