Настоящая заявка испрашивает преимущества приоритета на основании предварительной заявки на патент США № 62/656865, поданной 12 апреля 2018 года; предварительной заявки на патент США № 62/679658, поданной 1 июня 2018 года; предварительной заявки на патент США № 62/814824, поданной 6 марта 2019 года; и предварительной заявки на патент США № 62/814828, поданной 6 марта 2019 года, все из которых включены в данный документ посредством ссылки.
В данном документе раскрыты новые органические соединения и фармацевтические композиции, содержащие такие соединения. Данные соединения могут быть применимыми в лечении рака, в частности видов рака, при которых, как известно, применимы средства, которые оказывают целенаправленное воздействие на сплайсосому и мутации в ней. Данные соединения также могут быть применимы в лечении рака при введении в комбинации с по меньшей мере одним дополнительным средством терапии.
В эукариотических организмах свежесинтезированные матричные РНК, как правило, имеют несколько интронов, которые вырезаются с получением зрелой mRNA. Сплайсосома представляет собой комплекс из множества субъединиц, который выполняет данную задачу. Сплайсосома состоит из пяти малых ядерных РНК (snRNA; U1-6) в комбинации с различными белками. Мутации в генах сплайсосомы были обнаружены при различных типах рака.
Например, мутации в субъединице 1 фактора сплайсинга 3B (SF3B1) сплайсосомы встречаются при целом ряде видов рака и служат мишенью для противораковых средств. Такие виды рака включают без ограничения миелодиспластический синдром (MDS), лейкоз, такой как хронический лимфоцитарный лейкоз (CLL), хронический миеломоноцитарный лейкоз (CMML) и острый миелоидный лейкоз (AML), а также солидные опухоли, такие как рак молочной железы и увеальная меланома.
Соединения, выделенные из бактерий Streptomyces platensis (Sakai, Takashi; Sameshima, Tomohiro; Matsufuji, Motoko; Kawamura, Naoto; Dobashi, Kazuyuki; Mizui, Yoshiharu. Pladienolides, New Substances from Culture of Streptomyces platensis Mer-11107. I. Taxonomy, Fermentation, Isolation and Screening. The Journal of Antibiotics. 2004, Vol. 57, No.3.), получившие название пладиенолиды и обнаруженные во время скрининга ингибиторов промотора фактора роста эндотелия сосудов (VEGF), ингибируют экспрессию репортерного гена, контролируемого промотором VEGF человека, при этом данное ингибирование, как известно, является применимым механизмом действия для противораковых средств.
Данные соединения также ингибируют пролиферацию клеток глиомы U251 человека in vitro. Наиболее эффективное из данных соединений, пладиенолид B, ингибирует экспрессию гена, обусловленную промотором VEGF, при IC50, составляющей 1,8 нМ, и ингибирует пролиферацию клеток глиомы при IC50, составляющей 3,5 нМ. Структура пладиенолида B является известной (Sakai, Takashi; Sameshima, Tomohiro; Matsufuji, Motoko; Kawamura, Naoto; Dobashi, Kazuyuki; Mizui, Yoshiharu. Pladienolides, New Substances from Culture of Streptomyces platensis Mer-11107. II. Physico-chemical Properties and Structure Elucidation. The Journal of Antibiotics. Vol. 57, No.3. (2004)), и известно, что пладиенолид B оказывает целенаправленное воздействие на сплайсосому SF3b путем ингибирования сплайсинга и изменения паттерна экспрессии генов (Kotake et al., "Splicing factor SF3b as a target of the antitumor natural product pladienolide", Nature Chemical Biology 2007, 3, 570-575).
Аналогичным образом известны определенные соединения пладиенолида B, а также соединения других пладиенолидов, раскрытые в следующих заявках на патенты: WO 2002/060890; WO 2004/011459; WO 2004/011661; WO 2004/050890; WO 2005/052152; WO 2006/009276; WO 2008/126918 и WO 2015/175594. Например, соединение пладиенолида, (8E,12E,14E)-7-((4-циклогептилпиперазин-1-ил)карбонил)окси-3,6,16,21-тетрагидрокси-6,10,12,16,20-пентаметил-18,19-эпокситрикоза-8,12,14-триен-11-олид, также известный как E7107, представляет собой полусинтетическое производное природного продукта, пладиенолида D, и были опубликованы результаты его исследования фазы I. В качестве другого примера пиридиновое соединение пладиенолида, (2S,3S,6S,7R,10R,E)-7,10-дигидрокси-3,7-диметил-12-оксо-2-((R,2E,4E)-6-(пиридин-2-ил)гепта-2,4-диен-2-ил)оксациклододец-4-ен-6-ил-4-метилпиперазин-1-карбоксилат (также называемый "(2S,3S,4E,6S,7R,10R)-7,10-дигидрокси-3,7-диметил-12-оксо-2-((2E,4E,6R)-6-(пиридин-2-ил)гепта-2,4-диен-2-ил)оксациклододец-4-ен-6-ил-4-метилпиперазин-1-карбоксилат"), также известное как H3B-8800, получило статус орфанного препарата для лечения определенных видов гемобластоза.
Однако необходимы дополнительные средства, применимые в лечении рака, в частности видов рака, при которых, как известно, применимы средства, которые оказывают целенаправленное воздействие на сплайсосому и мутации в ней.
В последнее время было доказано, что блокировка иммунных контрольных точек (ICB) представляет собой смену парадигмы при лечении некоторых различных типов рака. Однако не все пациенты демонстрируют стойкие/длительные ответы на ICB. См., например, Zappasodi, R. et al. Emerging Concepts for Immune Checkpoint Blockade-Based Combination Therapies. Cancer Cell 33, 581-598, doi:10.1016/j.ccell.2018.03.005 (2018); и Wolchok, J. D. et al. Overall Survival with Combined Nivolumab and Ipilimumab in Advanced Melanoma. N Engl J Med 377, 1345-1356, doi:10.1056/NEJMoa1709684 (2017). Следовательно, также существует потребность в разработке дополнительных терапевтических средств для введения их в комбинации с ICB или любым другим средством терапии для усиления и/или увеличения до максимума ответа пациента.
В данном документе раскрыты соединения формулы I:

I,
и их фармацевтически приемлемые соли,
где:
R1 выбран из:

каждый из которых может быть замещен 1-3 группами, независимо выбранными из атомов галогена, гидроксильных групп, C1-C6алкильных групп, C1-C6алкоксигрупп, C3-C8циклоалкильных групп, гидрокси-C1-C6алкильных групп, диметиламиногрупп и метокси-C1-C6алкильных групп;
каждый из R2, R3, R4, R5, R6 и R7 независимо выбран из водорода, гидроксильных групп, групп -O-R10 и C1-C6алкильных групп;
каждый из R8, R9 и R13 независимо выбран из водорода и C1-C6алкильных групп;
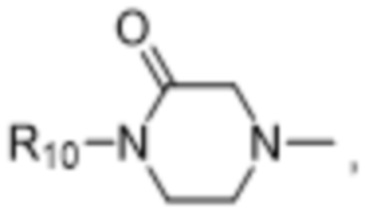
R10 выбран из водорода, C1-C6алкильных групп, C1-C6аминоалкильных групп, C1-C6алкиламиногрупп, групп C1-C6алкилкарбоновой кислоты, C3-C8циклоалкильных групп, бензильных групп, C3-C8гетероциклильных групп, -CH2-C3-C8гетероциклильных групп, -C(O)-C3-C8гетероциклильных групп, ацильных групп, гидрокси-C1-C6алкильных групп, метокси-C1-C6алкильных групп, групп -CD3 и -C(O)-NR11R12;
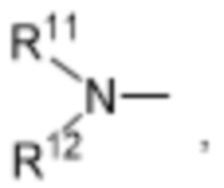
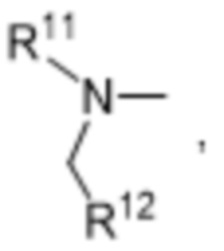
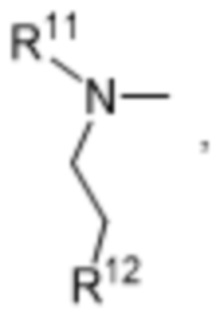
R11 и R12 независимо выбраны из водорода, C1-C6алкильных групп, C1-C6аминоалкильных групп, C1-C6алкиламиногрупп, C3-C8циклоалкильных групп и C3-C8гетероциклильных групп;
V выбран из -CH2- и -N(R9)-;
W выбран из 3-8-членных карбоциклов и 3-8-членных гетероциклов, каждый из которых может быть замещен 1-3 группами, независимо выбранными из атомов галогена, групп -NR8R9, C1-C6алкильных групп, C1-C6алкоксигрупп, метокси-C1-C6алкильных групп, гидрокси-C1-C6алкильных групп и C3-C5циклоалкильных групп;
каждый из X и Y независимо выбран из связи, водорода, 3-8-членных карбоциклов и 3-8-членных гетероциклов, каждый из которых может быть замещен 1-3 группами, независимо выбранными из атомов галогена, гидроксильных групп, C1-C6алкильных групп, гидрокси-C1-C6алкильных групп, C1-C6алкоксигрупп, метокси-C1-C6алкильных групп, -SO2-C1-C6алкильных групп и групп -NR14R15, где каждый из R14 и R15 независимо выбран из водорода и C1-C6алкильных групп;
каждый из L1 и L2 независимо выбран из связи, -O-, -C(O)-, -C(O)O-, -N(R13)-C(O)-, -C(O)-N(R13)-, -N(R13)-S(O2)-, -S(O2)-N(R13)-, -S(O2)- и -N(R13)-; и
каждый n независимо выбран из 0-4.
В данном документе также раскрыты фармацевтические композиции, содержащие по меньшей мере одно соединение, выбранное из соединений формулы I (в том числе формул IIa-e, IIIa, IVa и Va) и их фармацевтически приемлемых солей. В некоторых вариантах осуществления фармацевтические композиции дополнительно содержат по меньшей мере один фармацевтически приемлемый носитель.
В данном документе также раскрыты способы лечения субъекта с раком, включающие введение субъекту терапевтически эффективного количества по меньшей мере одного соединения, выбранного из соединений формулы I (в том числе формул IIa-e, IIIa, IVa и Va) и/или их фармацевтически приемлемых солей. В некоторых вариантах осуществления рак выбран из миелодиспластического синдрома, хронического лимфоцитарного лейкоза, хронического миеломоноцитарного лейкоза, острого миелоидного лейкоза, рака толстой кишки, рака поджелудочной железы, рака эндометрия, рака яичника, рака молочной железы, увеальной меланомы, рака желудка, холангиокарциномы и/или рака легкого. В некоторых вариантах осуществления рак выбран из видов рака, при которых получают положительный результат теста на наличие одной или нескольких мутаций в гене или белке субъединицы 1 фактора сплайсинга 3B (SF3B1). В некоторых вариантах осуществления рак выбран из видов рака, при которых получают положительный результат теста на наличие одной или нескольких мутаций в гене или белке сплайсосомы, таких как перечисленные в таблице 1. В некоторых вариантах осуществления введение по меньшей мере одного соединения, выбранного из соединений формулы I (в том числе формул IIa-e, IIIa, IVa и Va) и/или их фармацевтически приемлемых солей, индуцирует образование по меньшей мере одного неоантигена и/или развитие T-клеточного ответа.
В данном документе также раскрыто применение по меньшей мере одного соединения, выбранного из соединений формулы I (в том числе формул IIa-e, IIIa, IVa и Va) и их фармацевтически приемлемых солей, в способе терапевтического лечения, например, лечения рака. В некоторых вариантах осуществления рак выбран из миелодиспластического синдрома, хронического лимфоцитарного лейкоза, хронического миеломоноцитарного лейкоза, острого миелоидного лейкоза, рака толстой кишки, рака поджелудочной железы, рака эндометрия, рака яичника, рака молочной железы, увеальной меланомы, рака желудка, холангиокарциномы и/или рака легкого. В некоторых вариантах осуществления рак выбран из видов рака, при которых получают положительный результат теста на наличие одной или нескольких мутаций в гене или белке субъединицы 1 фактора сплайсинга 3B (SF3B1). В некоторых вариантах осуществления рак выбран из видов рака, при которых получают положительный результат теста на наличие одной или нескольких мутаций в гене или белке сплайсосомы, таких как перечисленные в таблице 1. В некоторых вариантах осуществления введение по меньшей мере одного соединения, выбранного из соединений формулы I (в том числе формул IIa-e, IIIa, IVa и Va) и/или их фармацевтически приемлемых солей, индуцирует образование по меньшей мере одного неоантигена и/или развитие T-клеточного ответа.
В данном документе также раскрыто по меньшей мере одно соединение, выбранное из соединений формулы I (в том числе формул IIa-e, IIIa, IVa и Va) и их фармацевтически приемлемых солей, для применения в получении лекарственного препарата. В некоторых вариантах осуществления лекарственный препарат применим для лечения рака. В некоторых вариантах осуществления рак выбран из миелодиспластического синдрома, хронического лимфоцитарного лейкоза, хронического миеломоноцитарного лейкоза, острого миелоидного лейкоза, рака толстой кишки, рака поджелудочной железы, рака эндометрия, рака яичника, рака молочной железы, увеальной меланомы, рака желудка, холангиокарциномы и/или рака легкого. В некоторых вариантах осуществления рак выбран из видов рака, при которых получают положительный результат теста на наличие одной или нескольких мутаций в гене или белке субъединицы 1 фактора сплайсинга 3B (SF3B1). В некоторых вариантах осуществления рак выбран из видов рака, при которых получают положительный результат теста на наличие одной или нескольких мутаций в гене или белке сплайсосомы, таких как перечисленные в таблице 1. В некоторых вариантах осуществления введение по меньшей мере одного соединения, выбранного из соединений формулы I (в том числе формул IIa-e, IIIa, IVa и Va) и/или их фармацевтически приемлемых солей, индуцирует образование по меньшей мере одного неоантигена и/или развитие T-клеточного ответа.
В данном документе также раскрыты пути применения по меньшей мере одного соединения, выбранного из соединений формулы I (в том числе формул IIa-e, IIIa, IVa и Va) и/или их фармацевтически приемлемых солей, для оказания целенаправленного воздействия на сплайсосому, например, на субъединицу 1 сплайсосомы SF3B.
В данном документе также раскрыты способы индуцирования образования по меньшей мере одного неоантигена, включающие приведение неопластической клетки в контакт с эффективным количеством по меньшей мере одного соединения, выбранного из соединений формулы I (в том числе формул IIa-e, IIIa, IVa и Va) и/или их фармацевтически приемлемых солей. В некоторых вариантах осуществления такой контакт может индуцировать образование по меньшей мере одного неоантигена.
В данном документе также раскрыты способы индуцирования образования по меньшей мере одного неоантигена и/или развитие T-клеточного ответа у субъекта, у которого имеется неопластическое нарушение или подозрение на его наличие, включающие введение субъекту эффективного количества по меньшей мере одного соединения, выбранного из соединений формулы I (в том числе формул IIa-e, IIIa, IVa и Va) и/или их фармацевтически приемлемых солей.
В данном документе также раскрыты способы лечения субъекта с неопластическим нарушением или подозрением на его наличие. В некоторых вариантах осуществления способ включает введение субъекту эффективного количества по меньшей мере одного соединения, выбранного из соединений формулы I (в том числе формул IIa-e, IIIa, IVa и Va) и/или их фармацевтически приемлемых солей, где введение может привести к индуцированию образования по меньшей мере одного неоантигена и/или развития T-клеточного ответа. В некоторых вариантах осуществления способ также может включать обнаружение одного или нескольких неоантигенов и/или T-клеточного ответа у субъекта после введения по меньшей мере одного соединения, выбранного из соединений формулы I (в том числе формул IIa-e, IIIa, IVa и Va) и/или их фармацевтически приемлемых солей. В некоторых вариантах осуществления способ также может включать непрерывное введение по меньшей мере одного соединения, выбранного из соединений формулы I (в том числе формул IIa-e, IIIa, IVa и Va) и/или их фармацевтически приемлемых солей, если обнаружены один или несколько неоантигенов и/или T-клеточный ответ.
В данном документе также представлены способы лечения субъекта, у которого имеется неопластическое нарушение или подозрение на его наличие, включающие введение субъекту эффективного количества по меньшей мере одного соединения, выбранного из соединений формулы I (в том числе формул IIa-e, IIIa, IVa и Va) и/или их фармацевтически приемлемых солей.
В данном документе также представлены неоантигенные вакцины, содержащие по меньшей мере один неоантигенный пептид. В некоторых вариантах осуществления по меньшей мере один неоантигенный пептид содержит модифицированную или новую неоантигенную последовательность, индуцированную путем приведения неопластической клетки в контакт с эффективным количеством по меньшей мере одного соединения, выбранного из соединений формулы I (в том числе формул IIa-e, IIIa, IVa и Va) и/или их фармацевтически приемлемых солей.
В некоторых вариантах осуществления способы и пути применения, представленные в данном документе, могут дополнительно предусматривать введение по меньшей мере одного дополнительного средства терапии. В некоторых вариантах осуществления способы и пути применения, представленные в данном документе, могут приводить к более низкой системной токсичности и/или улучшенной переносимости.
В данном документе также раскрыт способ лечения рака у субъекта, нуждающегося в этом, включающий введение по меньшей мере одного соединения, выбранного из соединений формулы I (в том числе формул IIa-e, IIIa, IVa и Va) и/или их фармацевтически приемлемых солей, и по меньшей мере одного дополнительного средства терапии.
В данном документе также раскрыт способ лечения субъекта, у которого имеется неопластическое нарушение или подозрение на его наличие, включающий введение по меньшей мере одного соединения, выбранного из соединений формулы I (в том числе формул IIa-e, IIIa, IVa и Va) и/или их фармацевтически приемлемых солей, и по меньшей мере одного дополнительного средства терапии.
Если не указано иное, в данном документе будут применяться следующие определения.
Как описано в данном документе, соединения могут быть замещены одним или несколькими заместителями, такими как проиллюстрированы в целом в данном документе или приведены в качестве примера с помощью конкретных классов, подклассов и молекул по настоящему изобретению. В целом, термин "замещенный" относится к замене водородных радикалов в приведенной структуре на радикал указанного заместителя. Если не указано иное, замещенная группа может иметь заместитель в каждом замещаемом положении группы, и если более одного положения в любой приведенной структуре могут быть замещены более чем одним заместителем, выбранным из указанной группы, то в каждом положении заместитель может быть либо одинаковым, либо разным. Комбинации заместителей, предусмотренные в настоящем изобретении, являются такими, которые приводят к образованию стабильных или химически возможных соединений.
"Стабильный" относится к соединениям, которые по сути не изменяются химически и/или физически при воздействии условий, обеспечивающих их получение, обнаружение и их извлечение, очистку и применение для обеспечения одной или нескольких целей, раскрытых в данном документе. В некоторых вариантах осуществления стабильное соединение или химически возможное соединение представляют собой соединение, которое по сути не изменяется во время хранения при температуре 40°C или меньше в отсутствие влаги или других химически активных условий в течение по меньшей мере недели.
"Изомеры" относятся к соединениям с одинаковым количеством и видом атомов и, следовательно, одинаковой молекулярной массой, но отличающимся по расположению или конфигурации атомов. "Стереоизомеры" относятся к соединениям, которые характеризуются одинаковыми связями атомов, но разным расположением своих атомов в пространстве. "Диастереоизомеры" или "диастереомеры" относятся к стереоизомерам, которые не являются энантиомерами. "Энантиомеры" относятся к стереоизомерам, которые являются несовпадающими при наложении зеркальными отражениями друг друга. "Геометрические изомеры" относятся к цис-транс-изомерам с разными положениями групп по отношению к двойной связи, или кольцу, или центральному атому.
Изложенные в данном документа энантиомеры могут включать "энантиомерно чистые" изомеры, которые содержат по сути один энантиомер, например, ровно 90%, 92%, 95%, 98% или 99% или более или ровно 100% одного энантиомера по конкретному асимметричному центру или центрам. "Асимметричный центр" или "хиральный центр" относятся к тетраэдрическому атому углерода, который содержит четыре различных заместителя.
Применяемый в данном документе термин "стереомерно чистый" означает соединение или композицию на его основе, которые содержат один стереоизомер соединения и по сути не содержат других стереоизомеров данного соединения. Например, стереомерно чистая композиция на основе соединения с одним хиральным центром будет по сути не содержать противоположный энантиомер соединения. В некоторых вариантах осуществления стереомерно чистая композиция на основе соединения с двумя хиральными центрами будет по сути не содержать диастереомеры и по сути не содержать противоположный энантиомер соединения. В некоторых вариантах осуществления стереомерно чистое соединение содержит более приблизительно 80% по весу одного стереоизомера соединения и менее приблизительно 20% по весу других стереоизомеров соединения, например, более приблизительно 90% по весу одного стереоизомера соединения и менее приблизительно 10% по весу других стереоизомеров соединения, кроме того, например, более приблизительно 95% по весу одного стереоизомера соединения и менее приблизительно 5% по весу других стереоизомеров соединения и, кроме того, например, более приблизительно 97% по весу одного стереоизомера соединения и менее приблизительно 3% по весу других стереоизомеров соединения. См., например, патент США № 7189715.
"R" и "S" в качестве терминов, описывающих изомеры, представляют собой идентификаторы стереохимической конфигурации по асимметричному замещенному атому углерода. Обозначение асимметричного замещенного атома углерода как "R" или "S" осуществляют путем применения правил приоритета Кана, Ингольда и Прелога, которые хорошо известны специалистам в данной области техники и описаны в Правилах номенклатуры для органической химии, разработанных Международным союзом теоретической и прикладной химии (IUPAC). Раздел E, Стереохимия.
"Оксид амина", или "N-оксид амина", или "N-оксид" представляет собой химическое соединение, которое содержит функциональную группу R3N+-O−, связь N-O с тремя дополнительными водородами и/или углеводородными боковыми цепями, присоединенными к N. Иногда оно записывается как R3N→O.
"Ar" или "арил" относится к ароматическому карбоциклическому фрагменту, содержащему одно или несколько замкнутых колец. Примеры включают без ограничения фенил, нафтил, антраценил, фенантраценил, бифенил и пиренил. В определенных вариантах осуществления арильные группы содержат 6 атомов углерода ("C6арил").
Применяемые в данном документе "алкил" или "алкильная группа" означают углеводород с неразветвленной, разветвленной или циклической цепью, который является полностью насыщенным. В определенных вариантах осуществления алкильные группы содержат 1-8 атомов углерода ("C1-C8алкил"). В определенных вариантах осуществления алкильные группы содержат 1-6 атомов углерода ("C1-C6алкил"). В определенных вариантах осуществления алкильные группы содержат 1-3 атома углерода. В еще одних вариантах осуществления алкильные группы содержат 2-3 атома углерода, и в других вариантах осуществления алкильные группы содержат 1-2 атома углерода. В определенных вариантах осуществления термин "алкил" или "алкильная группа" относится к циклоалкильной группе. В определенных вариантах осуществления циклоалкильные группы содержат 3-8 атомов углерода ("C3-C8циклоалкил"). В определенных вариантах осуществления циклоалкильные группы содержат 3-6 атомов углерода ("C3-C6циклоалкил"). Неограничивающие примеры иллюстративных алкильных групп включают метил, этил, пропил, изопропил, бутил, циклопропил и циклогексил.
Применяемый в данном документе термин "алкокси" относится к алкильной группе, как определено ранее, присоединенной к основной углеродной цепи через атом кислорода ("алкокси").
Применяемый в данном документе "карбоцикл" включает как ароматическую (например, арильную), так и неароматическую (например, циклоалкильную) группы. В определенных вариантах осуществления карбоциклические группы содержат 3-10 атомов углерода ("3-10-членный карбоцикл"). В определенных вариантах осуществления карбоциклические группы содержат 3-8 атомов углерода ("3-8-членный карбоцикл"). В определенных вариантах осуществления карбоциклические группы содержат 3-6 атомов углерода ("3-6-членный карбоцикл"). В определенных вариантах осуществления карбоциклические группы содержат 3-5 атомов углерода ("3-5-членный карбоцикл").
"Галогеналкил" относится к алкильной группе, замещенной одним или несколькими атомами галогена (F, Cl, Br, I). Например, "фторметил" относится к метильной группе, замещенной одним или несколькими атомами фтора (например, монофторметил, дифторметил или трифторметил).
"Гетероатом" относится к O, S или N.
"Гетероарил" относится к циклическому фрагменту, содержащему одно или несколько замкнутых колец с одним или несколькими гетероатомами (кислорода, азота или серы) в по меньшей мере одном из колец, где по меньшей мере одно из колец является ароматическим, и где кольцо или кольца независимо могут быть конденсированными и/или соединенными мостиковой связью. Примеры включают без ограничения тиофенил, триазолил, пиридинил, пиримидинил, пиридазинил и пиразинил.
Применяемые в данном документе "гетероциклил" или "гетероциклический" означают моноциклический гетероцикл, бициклический гетероцикл или трициклический гетероцикл, содержащий по меньшей мере один гетероатом в кольце. Гетероциклил может быть ароматическим (например, гетероарил) или неароматическим. В определенных вариантах осуществления гетероциклические группы содержат 2-10 атомов углерода, 3-10 атомов углерода, 2-8 атомов углерода, 3-8 атомов углерода, 2-6 атомов углерода, 3-6 атомов углерода, 2-4 атома углерода, 3-4 атома углерода или 3 атома углерода. В определенных вариантах осуществления гетероцикл может представлять собой 3-10-членное кольцо, 3-8-членное кольцо, 3-6-членное кольцо, 3-4-членное кольцо или 3-членное кольцо.
Моноциклический гетероцикл представляет собой 3-, 4-, 5-, 6-, 7- или 8-членное кольцо, содержащее по меньшей мере один гетероатом, независимо выбранный из O, N и S. В некоторых вариантах осуществления гетероцикл представляет собой 3- или 4-членное кольцо, содержащее один гетероатом, выбранный из O, N и S. В некоторых вариантах осуществления гетероцикл представляет собой 5-членное кольцо, не содержащее двойных связей или содержащее одну двойную связь, а также один, два или три гетероатома, выбранные из O, N и S. В некоторых вариантах осуществления гетероцикл представляет собой 6-, 7- или 8-членное кольцо, не содержащее двойных связей, содержащее одну или две двойные связи, а также один, два или три гетероатома, выбранные из O, N и S. Типичные примеры моноциклического гетероцикла включают без ограничения азетидинил, азепанил, азиридинил, диазепанил, 1,3-диоксанил, 1,3-диоксoланил, дигидропиранил (в том числе 3,4-дигидро-2H-пиран-6-ил), 1,3-дитиоланил, 1,3-дитианил, имидазолинил, имидазолидинил, изотиазолинил, изотиазолидинил, изоксaзолинил, изоксазолидинил, морфолинил, оксaдиазолинил, оксaдиазолидинил, оксaзолинил, оксaзолидинил, пиперазинил, пиперидинил, пиранил, пиразолинил, пиразолидинил, пирролинил, пирролидинил, тетрагидрофуранил, тетрагидропиранил (в том числе тетрагидро-2H-пиран-4-ил), тетрагидротиенил, тиадиазолинил, тиадиазолидинил, тиазолинил, тиазолидинил, тиоморфолинил, 1,1-диоксидотиоморфолинил (тиоморфолинсульфон), тиопиранил и тритианил.
Бициклические гетероциклы по настоящему изобретению проиллюстрированы моноциклическим гетероциклом, конденсированным с арильной группой, или моноциклическим гетероциклом, конденсированным с моноциклическим циклоалкилом, или моноциклическим гетероциклом, конденсированным с моноциклическим циклоалкенилом, или моноциклическим гетероциклом, конденсированным с моноциклическим гетероциклом. Типичные примеры бициклических гетероциклов включают без ограничения 3,4-дигидро-2H-пиранил, 1,3-бензoдиоксолил, 1,3-бензoдитиолил, 2,3-дигидро-1,4-бензoдиоксинил, 2,3-дигидро-1-бензофуранил, 2,3-дигидро-1-бензотиенил, 2,3-дигидро-1H-индолил и 1,2,3,4-тетрагидрохинолинил.
В некоторых вариантах осуществления бициклический гетероцикл представляет собой спирогетероцикл. Как известно из уровня техники, "спирогетероцикл" представляет собой бициклический фрагмент с кольцами, соединенными посредством только одного атома. Соединяющий атом также называется спироатомом, и чаще всего он представляет собой четвертичный атом, такой как углерод или азот. Спиросоединения могут быть обозначены с помощью инфикса "спиро", за которым следуют квадратные скобки, в которые заключено число атомов в меньшем кольце и число атомов в большем кольце, за исключением спироатома самого по себе; при этом числа разделены точкой. Примеры таких соединений включают без ограничения 2,6-диазаспиро[3.3]гептан.
Трициклический гетероцикл представляет собой бициклический гетероцикл, конденсированный с арильной группой, или бициклический гетероцикл, конденсированный с моноциклическим циклоалкилом, или бициклический гетероцикл, конденсированный с моноциклическим циклоалкенилом, или бициклический гетероцикл, конденсированный с моноциклическим гетероциклом. Типичные примеры трициклических гетероциклов включают без ограничения 2,3,4,4a,9,9a-гексагидро-1H-карбазолил, 5a,6,7,8,9,9a-гексагидродибензo[b, d]фуранил и 5a,6,7,8,9,9a-гексагидродибензo[b, d]тиенил.
Гетероциклические группы по настоящему изобретению присоединены к исходному молекулярному фрагменту посредством любого замещаемого атома углерода или любого замещаемого атома азота, кислорода или серы, содержащегося в пределах группы, и они могут содержать один или два алкиленовых мостика из 1, 2, 3 или 4 атомов углерода, каждый из которых связывает два несмежных атома углерода в группах. Примеры таких "мостиковых" гетероциклических групп включают без ограничения оксатрицикло[3.3.1.13,7]децил (в том числе 2-оксатрицикло[3.3.1. 13,7]децил), 2,4-диоксабицикло[4.2.1]нонил, оксабицикло[2.2.1]гептил (в том числе 2-оксабицикло[2.2. 1]гептил) и 2,5-диазабицикло[2.2.1]гептан.
В указанных выше гетероариле и гетероциклах атомы азота или серы могут быть необязательно окислены до различных степеней окисления. В конкретном примере группа S(O)0-2 относится к -S-(сульфиду), -S(O)-(сульфоксиду) и -SO2-(сульфону) соответственно. Для удобства подразумевается, что атомы азота, в частности, но не исключительно, атомы, которые определены как атомы азота в составе ароматического кольца, включают соответствующие формы N-оксидов. Таким образом, подразумевается, что в случае соединения по настоящему изобретению, содержащего, например, пиридильное кольцо, соответствующий пиридил-N-оксид включен в качестве другого соединения по настоящему изобретению.
"Лечение", "лечить" или "осуществление лечения" рака относятся к обращению развития (например, преодолению блокировки дифференцировки клеток), облегчению симптомов (например, облегчению одного или нескольких симптомов, таких как утомляемость вследствие анемии, низкие содержание форменных элементов в крови и т. д.) и/или отсрочке прогрессирования (например, отсрочке прогрессирования патологического состояния, например, трансформации в AML) рака, как описано в данном документе.
Применяемый в данном документе "субъект" означает субъекта-животного, например, субъекта-млекопитающего и, в частности, людей.
Термин "антитело" применяется в самом широком смысле для обозначения молекулы иммуноглобулина, которая распознает и специфически связывается с мишенью, такой как белок, полипептид, углевод, полинуклеотид, липид или комбинации вышеуказанного, посредством по меньшей мере одного сайта распознавания антигена в пределах вариабельной области молекулы иммуноглобулина. Тяжелая цепь антитела состоит из вариабельного домена тяжелой цепи (VH) и константной области тяжелой цепи (CH). Легкая цепь состоит из вариабельного домена легкой цепи (VL) и константного домена легкой цепи (CL). Для целей настоящей заявки каждый зрелый вариабельный домен тяжелой цепи и легкой цепи содержит три области, определяющие комплементарность (CDR1, CDR2 и CDR3), в пределах четырех каркасных участков (FR1, FR2, FR3 и FR4), расположенных от N-конца до C-конца: FR1, CDR1, FR2, CDR2, FR3, CDR3 и FR4. "Антитело" может быть встречающимся в природе или созданным человеком, таким как моноклональные антитела, полученные с помощью традиционной гибридомной технологии. Термин "антитело" включает полноразмерные моноклональные антитела и полноразмерные поликлональные антитела, а также фрагменты антител, такие как Fab, Fab', F(ab')2, Fv и одноцепочечные антитела. Антитело может принадлежать к любому из пяти основных классов иммуноглобулинов: IgA, IgD, IgE, IgG и IgM, или к их подклассам (например, изотипы IgG1, IgG2, IgG3, IgG4). Термин дополнительно охватывает человеческие антитела, химерные антитела, гуманизированные антитела и любую модифицированную молекулу иммуноглобулина, содержащую сайт распознавания антигена, при условии, что она демонстрируют требуемую биологическую активность (например, связывает целевой антиген, интернализуется в клетку, экспрессирующую целевой антиген).
Применяемый в данном документе "фармацевтически приемлемый носитель" относится к нетоксичным носителю, вспомогательному веществу или среде-носителю, которые не нарушают фармакологическую активность соединения, с которым они составлены. Фармацевтически приемлемые носители, вспомогательные вещества или среды-носители, которые могут использоваться в композициях по настоящему изобретению, включают без ограничения ионообменники, оксид алюминия, стеарат алюминия, лецитин, сывороточные белки, такие как человечий сывороточный альбумин, буферные вещества, такие как фосфаты, глицин, сорбиновую кислоту, сорбат калия, смеси частичных глицеридов насыщенных растительных жирных кислот, воду, соли или электролиты, такие как сульфат протамина, гидрофосфат динатрия, гидрофосфат калия, хлорид натрия, соли цинка, коллоидный диоксид кремния, трисиликат магния, поливинилпирролидон, вещества на основе целлюлозы, полиэтиленгликоль, циклодекстрины, карбоксиметилцеллюлозу натрия, полиакрилаты, воски, блок-сополимеры полиэтилена и полиоксипропилена, полиэтиленгликоль и ланолин.
"Фармацевтически приемлемая соль" представляет собой соль, которая сохраняет требуемую биологическую активность исходного соединения и не вызывает нежелательных токсикологических эффектов. Примеры таких солей представляют собой: (a) соли присоединения кислоты, образованные с неорганическими кислотами, например, хлористоводородной кислотой, бромистоводородной кислотой, серной кислотой, фосфорной кислотой, азотной кислотой и т. п.; и соли, образованные с органическими кислотами, например, уксусной кислотой, щавелевой кислотой, винной кислотой, янтарной кислотой, малеиновой кислотой, фумаровой кислотой, глюконовой кислотой, лимонной кислотой, яблочной кислотой, аскорбиновой кислотой, бензойной кислотой, дубильной кислотой, пальмитиновой кислотой, альгиновой кислотой, полиглутаминовой кислотой, нафталинсульфоновой кислотой, метансульфоновой кислотой, п-толуолсульфоновой кислотой, нафталиндисульфоновой кислотой, полигалактуроновой кислотой и т. п.; и (b) соли, образованные из элементарных анионов, таких как хлор, бром и йод. См., например, Haynes et al., "Commentary: Occurrence of Pharmaceutically Acceptable Anions and Cations in the Cambridge Structural Database," J. Pharmaceutical Sciences, vol. 94, no. 10 (2005), и Berge et al., "Pharmaceutical Salts", J. Pharmaceutical Sciences, vol. 66, no. 1 (1977), которые включены в данный документ посредством ссылки.
Если не указано иное, применяемая в данном документе номенклатура, используемая для описания химических групп или фрагментов, соответствует традиционным правилам, где название читается слева направо, точка присоединения к остальной части молекулы указана в правой части названия. Например, группа "(C1-3алкокси)C1-3алкил" присоединена к остальной части молекулы по алкильному концу. Дополнительные примеры включают метоксиэтил, где точка присоединения находится на этильном конце, и метиламино, где точка присоединения находится на аминном конце.
Если не указано иное, если химическая группа описана ее химической формулой или структурой, которые имеют фрагмент концевой связи, обозначенный как "-", будет понятно, что "-" представляет собой точку присоединения.
Если не указано иное, соединения, изображенные в данном документе, включают все энантиомерные, диастереомерные и геометрические (или конформационные) формы структуры; например, R- и S-конфигурации для каждого асимметричного центра, (Z)- и (E)-изомеры по двойной связи и конформационные (Z)- и (E)-изомеры. Следовательно, в объем настоящего изобретения включены отдельные стереохимические изомеры, а также энантиомерные, диастереомерные и геометрические (или конформационные) смеси соединений по настоящему изобретению. Если не указано иное, все таутомерные формы соединений по настоящему изобретению включены в объем настоящего изобретения. Дополнительно, если не указано иное, структуры, изображенные в данном документе, включают соединения, которые отличаются только присутствием одного или нескольких обогащенных изотопами атомов. Например, в объем данного изобретения включены соединения с формулой, раскрытой в данном документе, за исключением замещения водорода на дейтерий или тритий или замещения углерода 13C- или 14C-обогащенным углеродом.
В соответствии с некоторыми вариантами осуществления в данном документе представлены соединения формулы I:

I,
и их фармацевтически приемлемые соли,
где:
R1 выбран из:
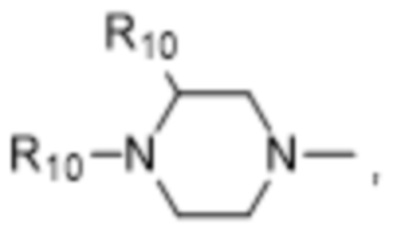
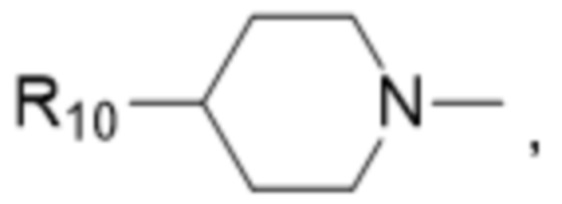
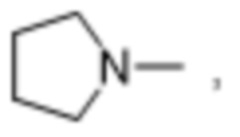
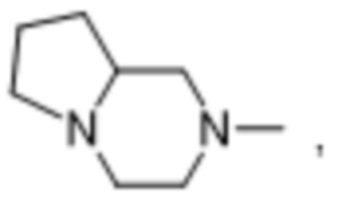


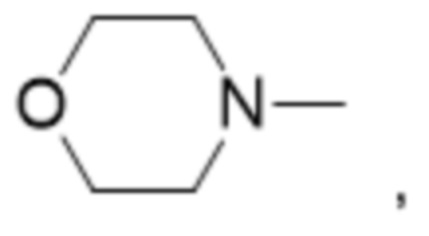
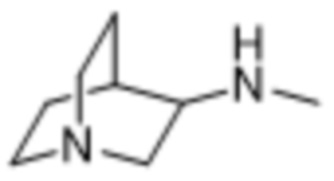 и
и 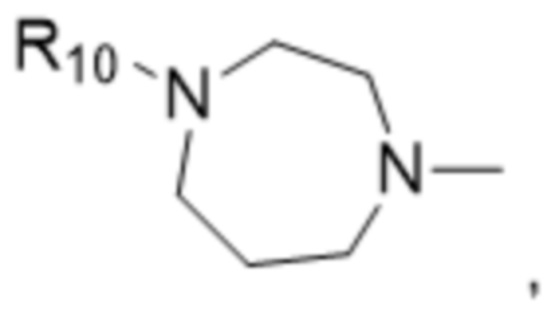
каждый из которых может быть замещен 1-3 группами, независимо выбранными из атомов галогена, гидроксильных групп, C1-C6алкильных групп, C1-C6алкоксигрупп, C3-C8циклоалкильных групп, гидрокси-C1-C6алкильных групп, диметиламиногрупп и метокси-C1-C6алкильных групп;
каждый из R2, R3, R4, R5, R6 и R7 независимо выбран из водорода, гидроксильных групп, групп -O-R10 и C1-C6алкильных групп;
каждый из R8, R9 и R13 независимо выбран из водорода и C1-C6алкильных групп;
R10 выбран из водорода, C1-C6алкильных групп, C1-C6аминоалкильных групп, C1-C6алкиламиногрупп, групп C1-C6алкилкарбоновой кислоты, C3-C8циклоалкильных групп, бензильных групп, C3-C8гетероциклильных групп, -CH2-C3-C8гетероциклильных групп, -C(O)-C3-C8гетероциклильных групп, ацильных групп, гидрокси-C1-C6алкильных групп, метокси-C1-C6алкильных групп, групп -CD3 и -C(O)-NR11R12;
R11 и R12 независимо выбраны из водорода, C1-C6алкильных групп, C1-C6аминоалкильных групп, C1-C6алкиламиногрупп, C3-C8циклоалкильных групп и C3-C8гетероциклильных групп;
V выбран из -CH2- и -N(R9)-;
W выбран из 3-8-членных карбоциклов и 3-8-членных гетероциклов, каждый из которых может быть замещен 1-3 группами, независимо выбранными из атомов галогена, групп -NR8R9, C1-C6алкильных групп, C1-C6алкоксигрупп, метокси-C1-C6алкильных групп, гидрокси-C1-C6алкильных групп и C3-C5циклоалкильных групп;
каждый из X и Y независимо выбран из связи, водорода, 3-8-членных карбоциклов и 3-8-членных гетероциклов, каждый из которых может быть замещен 1-3 группами, независимо выбранными из атомов галогена, гидроксильных групп, C1-C6алкильных групп, гидрокси-C1-C6алкильных групп, C1-C6алкоксигрупп, метокси-C1-C6алкильных групп, -SO2-C1-C6алкильных групп и групп -NR14R15, где каждый из R14 и R15 независимо выбран из водорода и C1-C6алкильных групп;
каждый из L1 и L2 независимо выбран из связи, -O-, -C(O)-, -C(O)O-, -N(R13)-C(O)-, -C(O)-N(R13)-, -N(R13)-S(O2)-, -S(O2)-N(R13)-, -S(O2)- и -N(R13)-; и
каждый n независимо выбран из 0-4.
В некоторых вариантах осуществления R1 в соединениях формулы I выбран из  и
и 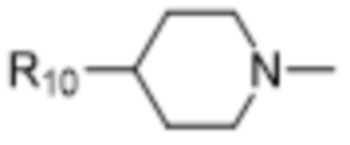 . В некоторых вариантах осуществления R1 в соединениях формулы I замещен одной или тремя группами, выбранными из атомов галогена и C1-C6алкильных групп.
. В некоторых вариантах осуществления R1 в соединениях формулы I замещен одной или тремя группами, выбранными из атомов галогена и C1-C6алкильных групп.
В некоторых вариантах осуществления R1 в соединениях формулы I представляет собой  , замещенный 1-3 группами, выбранными из C1-C6алкильных групп, где R10 представляет собой метил. В некоторых вариантах осуществления R1 в соединениях формулы I является незамещенным.
, замещенный 1-3 группами, выбранными из C1-C6алкильных групп, где R10 представляет собой метил. В некоторых вариантах осуществления R1 в соединениях формулы I является незамещенным.
В некоторых вариантах осуществления R2 и R3 в соединениях формулы I представляют собой метил и водород соответственно.
В некоторых вариантах осуществления R4 и R5 в соединениях формулы I представляют собой водород и гидроксил соответственно.
В некоторых вариантах осуществления R6 и R7 в соединениях формулы I представляют собой водород и метил соответственно
В некоторых вариантах осуществления R8 в соединениях формулы I представляет собой метил.
В некоторых вариантах осуществления V в соединениях формулы I представляет собой -CH2-.
В некоторых вариантах осуществления W в соединениях формулы I выбран из бензольного кольца, пиридинового кольца, бензимидазольного кольца, бензотриазольного кольца, индазольного кольца, 1,2,3,6-тетрагидропиридинового кольца и имидазопиридинового кольца, каждое из которых может быть замещено 1-3 группами, независимо выбранными из атомов галогена, групп -NR8R9, C1-C6алкильных групп, C1-C6алкоксигрупп, метокси-C1-C6алкильных групп, гидрокси-C1-C6алкильных групп и C3-C5циклоалкильных групп.
В некоторых вариантах осуществления W в соединениях формулы I представляет собой бензольное кольцо, которое может быть замещено 1-3 группами, выбранными из атомов галогена и C1-C6алкильных групп.
В некоторых вариантах осуществления каждый из X и Y в соединениях формулы I независимо выбран из связи,
 ,
,
каждый из которых может быть замещен 1-3 группами, независимо выбранными из атомов галогена, гидроксильных групп, C1-C6алкильных групп, гидрокси-C1-C6алкильных групп, C1-C6алкоксигрупп, метокси-C1-C6алкильных групп, -SO2-C1-C6алкильных групп и групп -NR14R15, где каждый из R14 и R15 независимо выбран из водорода и C1-C6алкильных групп.
В некоторых вариантах осуществления Y в соединениях формулы I представляет собой водород, и X в соединениях формулы I выбран из:
 ,
,
каждый из которых может быть замещен 1-3 группами, независимо выбранными из атомов галогена, гидроксильных групп, C1-C6алкильных групп, гидрокси-C1-C6алкильных групп, C1-C6алкоксигрупп, метокси-C1-C6алкильных групп, -S(O2)-C1-C6алкильных групп и групп -NR14R15, где каждый из R14 и R15 независимо выбран из водорода и C1-C6алкильных групп.
В некоторых вариантах осуществления Y в соединениях формулы I представляет собой водород, и X в соединениях формулы I представляет собой связь.
В некоторых вариантах осуществления соединения формулы I выбраны из соединений формулы IIa:
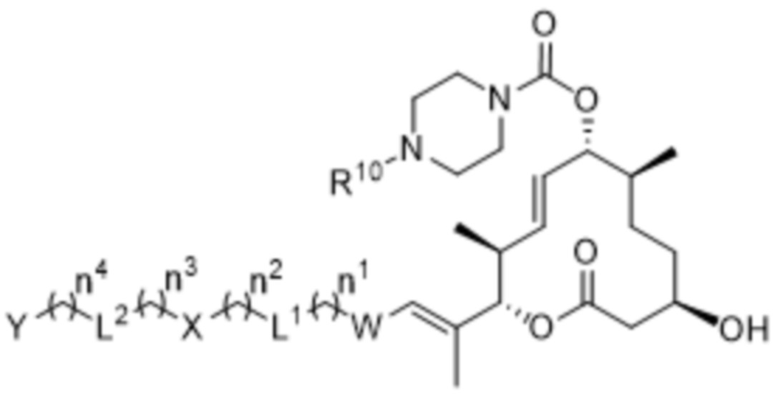
IIa,
и их фармацевтически приемлемых солей,
где:
R10 выбран из водорода и метила;
W выбран из 3-8-членных карбоциклов и 3-8-членных гетероциклов, каждый из которых может быть замещен 1-3 группами, независимо выбранными из атомов галогена, групп -NR8R9, C1-C6алкильных групп, C1-C6алкоксигрупп, метокси-C1-C6алкильных групп, гидрокси-C1-C6алкильных групп и C3-C5циклоалкильных групп;
каждый из X и Y независимо выбран из связи, водорода, 3-8-членных карбоциклов и 3-8-членных гетероциклов, каждый из которых может быть замещен 1-3 группами, независимо выбранными из атомов галогена, гидроксильных групп, C1-C6алкильных групп, гидрокси-C1-C6алкильных групп, C1-C6алкоксигрупп, метокси-C1-C6алкильных групп, -SO2-C1-C6алкильных групп и групп -NR14R15, где каждый из R14 и R15 независимо выбран из водорода и C1-C6алкильных групп;
каждый из L1 и L2 независимо выбран из связи, -O-, -C(O)-, -C(O)O-, -N(R13)-C(O)-, -C(O)-N(R13)-, -N(R13)-S(O2)-, -S(O2)-N(R13)-, -S(O2)- и -N(R13)-, где R13 выбран из водорода и C1-C6алкильных групп; и
каждый n независимо выбран из 0-4.
В некоторых вариантах осуществления W в соединениях формулы IIa выбран из бензольного кольца, пиридинового кольца, бензимидазольного кольца, бензотриазольного кольца, индазольного кольца, 1,2,3,6-тетрагидропиридинового кольца и имидазопиридинового кольца, каждое из которых может быть замещено 1-3 группами, независимо выбранными из атомов галогена, групп -NR8R9, C1-C6алкильных групп, C1-C6алкоксигрупп, метокси-C1-C6алкильных групп, гидрокси-C1-C6алкильных групп и C3-C5циклоалкильных групп.
В некоторых вариантах осуществления W в соединениях формулы IIa представляет собой бензольное кольцо, которое может быть замещено 1-3 группами, выбранными из атомов галогена и C1-C6алкильных групп.
В некоторых вариантах осуществления каждый из X и Y в соединениях формулы IIa независимо выбран из связи,
 ,
,
каждый из которых может быть замещен 1-3 группами, независимо выбранными из атомов галогена, гидроксильных групп, C1-C6алкильных групп, гидрокси-C1-C6алкильных групп, C1-C6алкоксигрупп, метокси-C1-C6алкильных групп, -SO2-C1-C6алкильных групп и групп -NR14R15, где каждый из R14 и R15 независимо выбран из водорода и C1-C6алкильных групп.
В некоторых вариантах осуществления Y в соединениях формулы IIa представляет собой водород, и X в соединениях формулы IIa выбран из:
 ,
,
каждый из которых может быть замещен 1-3 группами, независимо выбранными из атомов галогена, гидроксильных групп, C1-C6алкильных групп, гидрокси-C1-C6алкильных групп, C1-C6алкоксигрупп, метокси-C1-C6алкильных групп, -S(O2)-C1-C6алкильных групп и групп -NR14R15, где каждый из R14 и R15 независимо выбран из водорода и C1-C6алкильных групп.
В некоторых вариантах осуществления Y в соединениях формулы IIa представляет собой водород, и X в соединениях формулы IIa представляет собой связь.
В некоторых вариантах осуществления соединения формулы I выбраны из соединений формулы IIb:
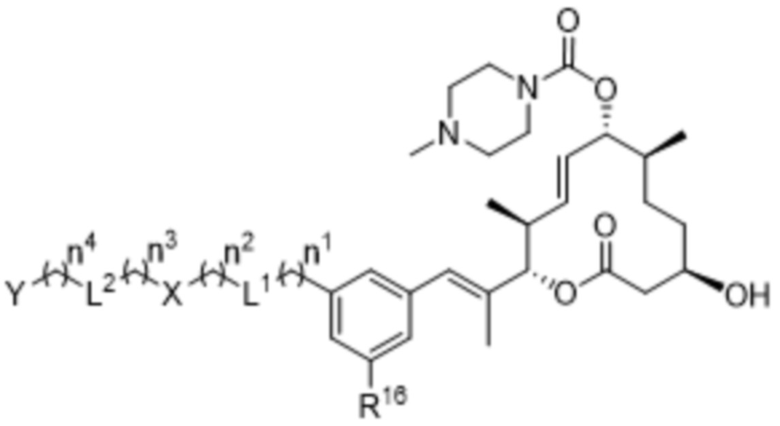
IIb,
и их фармацевтически приемлемых солей,
где:
R16 выбран из водорода и фтора;
каждый из X и Y независимо выбран из связи, водорода, 3-8-членных карбоциклов и 3-8-членных гетероциклов, каждый из которых может быть замещен 1-3 группами, независимо выбранными из атомов галогена, гидроксильных групп, C1-C6алкильных групп, гидрокси-C1-C6алкильных групп, C1-C6алкоксигрупп, метокси-C1-C6алкильных групп, -SO2-C1-C6алкильных групп и групп -NR14R15, где каждый из R14 и R15 независимо выбран из водорода и C1-C6алкильных групп;
каждый из L1 и L2 независимо выбран из связи, -O-, -C(O)-, -C(O)O-, -N(R13)-C(O)-, -C(O)-N(R13)-, -N(R13)-S(O2)-, -S(O2)-N(R13)-, -S(O2)- и -N(R13)-, где R13 выбран из водорода и C1-C6алкильных групп; и
каждый n независимо выбран из 0-4.
В некоторых вариантах осуществления каждый из X и Y в соединениях формулы IIb независимо выбран из связи,
 ,
,
каждый из которых может быть замещен 1-3 группами, независимо выбранными из атомов галогена, гидроксильных групп, C1-C6алкильных групп, гидрокси-C1-C6алкильных групп, C1-C6алкоксигрупп, метокси-C1-C6алкильных групп, -SO2-C1-C6алкильных групп и групп -NR14R15, где каждый из R14 и R15 независимо выбран из водорода и C1-C6алкильных групп.
В некоторых вариантах осуществления Y в соединениях формулы IIb представляет собой водород, и X в соединениях формулы IIb выбран из:
 ,
,
каждый из которых может быть замещен 1-3 группами, независимо выбранными из атомов галогена, гидроксильных групп, C1-C6алкильных групп, гидрокси-C1-C6алкильных групп, C1-C6алкоксигрупп, метокси-C1-C6алкильных групп, -S(O2)-C1-C6алкильных групп и групп -NR14R15, где каждый из R14 и R15 независимо выбран из водорода и C1-C6алкильных групп.
В некоторых вариантах осуществления Y в соединениях формулы IIb представляет собой водород, и X в соединениях формулы IIb представляет собой связь.
В некоторых вариантах осуществления R16 в соединениях формулы IIb представляет собой фтор.
В некоторых вариантах осуществления соединения формулы I выбраны из соединений формулы IIc:
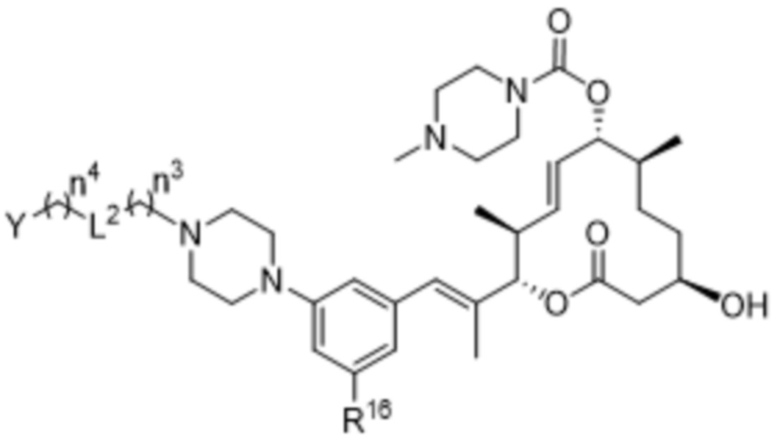
IIc,
и их фармацевтически приемлемых солей,
где:
R16 выбран из водорода и фтора;
Y выбран из водорода, 3-8-членных карбоциклов и 3-8-членных гетероциклов, каждый из которых может быть замещен 1-3 группами, независимо выбранными из атомов галогена, гидроксильных групп, C1-C6алкильных групп, гидрокси-C1-C6алкильных групп, C1-C6алкоксигрупп, метокси-C1-C6алкильных групп, -SO2-C1-C6алкильных групп и групп -NR14R15, где каждый из R14 и R15 независимо выбран из водорода и C1-C6алкильных групп;
L2 выбран из связи, -O-, -C(O)-, -C(O)O-, -N(R13)-C(O)-, -C(O)-N(R13)-, -N(R13)-S(O2)-, -S(O2)-N(R13)-, -S(O2)- и -N(R13)-, где R13 выбран из водорода и C1-C6алкильных групп;
n3 составляет 0; и
n4 выбран из 0-4.
В некоторых вариантах осуществления Y в соединениях формулы IIc выбран из водорода,
 ,
,
каждый из которых может быть замещен 1-3 группами, независимо выбранными из атомов галогена, гидроксильных групп, C1-C6алкильных групп, гидрокси-C1-C6алкильных групп, C1-C6алкоксигрупп, метокси-C1-C6алкильных групп, -SO2-C1-C6алкильных групп и групп -NR14R15, где каждый из R14 и R15 независимо выбран из водорода и C1-C6алкильных групп.
В некоторых вариантах осуществления L2 в соединениях формулы IIc представляет собой связь.
В некоторых вариантах осуществления R16 в соединениях формулы IIc представляет собой фтор.
В некоторых вариантах осуществления соединения формулы I выбраны из соединений формулы IId:
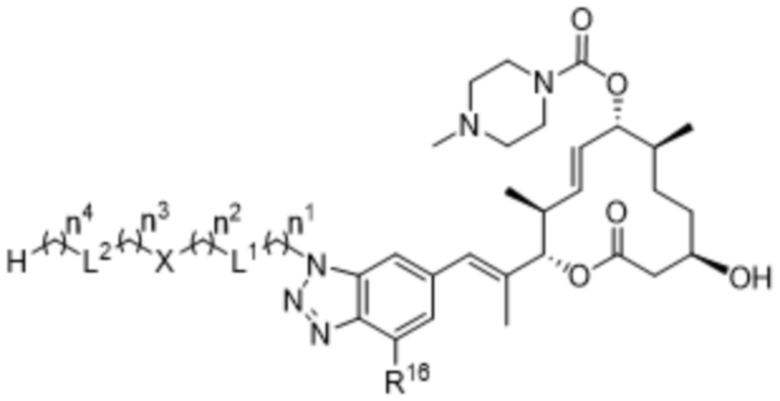
IId,
и их фармацевтически приемлемых солей,
где:
R16 выбран из водорода и фтора;
X выбран из водорода, 3-8-членных карбоциклов и 3-8-членных гетероциклов, каждый из которых может быть замещен 1-3 группами, независимо выбранными из атомов галогена, гидроксильных групп, C1-C6алкильных групп, гидрокси-C1-C6алкильных групп, C1-C6алкоксигрупп, метокси-C1-C6алкильных групп, -SO2-C1-C6алкильных групп и групп -NR14R15, где каждый из R14 и R15 независимо выбран из водорода и C1-C6алкильных групп;
L1 и L2 независимо выбраны из связи, -O-, -C(O)-, -C(O)O-, -N(R13)-C(O)-, -C(O)-N(R13)-, -N(R13)-S(O2)-, -S(O2)-N(R13)-, -S(O2)- и -N(R13)-, где R13 выбран из водорода и C1-C6алкильных групп; и
каждый n независимо выбран из 0-4.
В некоторых вариантах осуществления X в соединениях формулы IId выбран из связи,
 ,
,
каждый из которых может быть замещен 1-3 группами, независимо выбранными из атомов галогена, гидроксильных групп, C1-C6алкильных групп, гидрокси-C1-C6алкильных групп, C1-C6алкоксигрупп, метокси-C1-C6алкильных групп, -SO2-C1-C6алкильных групп и групп -NR14R15, где каждый из R14 и R15 независимо выбран из водорода и C1-C6алкильных групп.
В некоторых вариантах осуществления X в соединениях формулы IId представляет собой связь. В некоторых вариантах осуществления X, L1 и L2 в соединениях формулы IId представляют собой связи.
В некоторых вариантах осуществления R16 в соединении формулы IId представляет собой фтор.
В некоторых вариантах осуществления соединения формулы I выбраны из соединений формулы IIe:
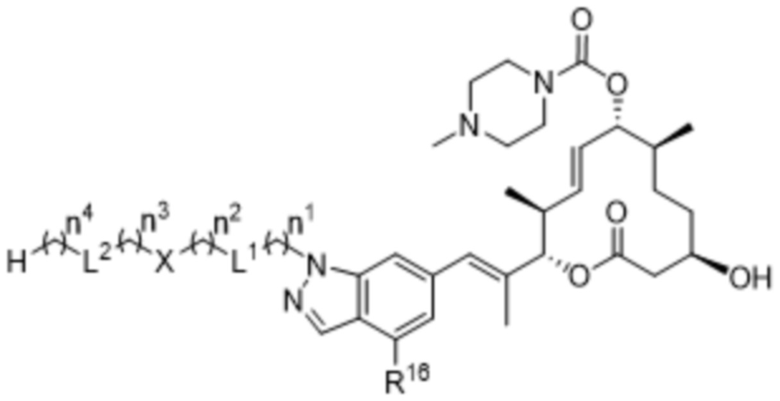
IIe,
и их фармацевтически приемлемых солей,
где:
R16 выбран из водорода и фтора;
X независимо выбран из водорода, 3-8-членных карбоциклов и 3-8-членных гетероциклов, каждый из которых может быть замещен 1-3 группами, независимо выбранными из атомов галогена, гидроксильных групп, C1-C6алкильных групп, гидрокси-C1-C6алкильных групп, C1-C6алкоксигрупп, метокси-C1-C6алкильных групп, -SO2-C1-C6алкильных групп и групп -NR14R15, где каждый из R14 и R15 независимо выбран из водорода и C1-C6алкильных групп;
каждый из L1 и L2 независимо выбран из связи, -O-, -C(O)-, -C(O)O-, -N(R13)-C(O)-, -C(O)-N(R13)-, -N(R13)-S(O2)-, -S(O2)-N(R13)-, -S(O2)- и -N(R13)-, где R13 выбран из водорода и C1-C6алкильных групп; и
каждый n независимо выбран из 0-4.
В некоторых вариантах осуществления X в соединении формулы IIe выбран из связи,
 ,
,
каждый из которых может быть замещен 1-3 группами, независимо выбранными из атомов галогена, гидроксильных групп, C1-C6алкильных групп, гидрокси-C1-C6алкильных групп, C1-C6алкоксигрупп, метокси-C1-C6алкильных групп, -SO2-C1-C6алкильных групп и групп -NR14R15, где каждый из R14 и R15 независимо выбран из водорода и C1-C6алкильных групп.
В некоторых вариантах осуществления X в соединениях формулы IIe представляет собой связь. В некоторых вариантах осуществления X, L1 и L2 в соединениях формулы IIe представляют собой связи.
В некоторых вариантах осуществления R16 в соединении формулы IIe представляет собой фтор.
В некоторых вариантах осуществления соединения формулы I выбраны из соединений формулы IIIa:
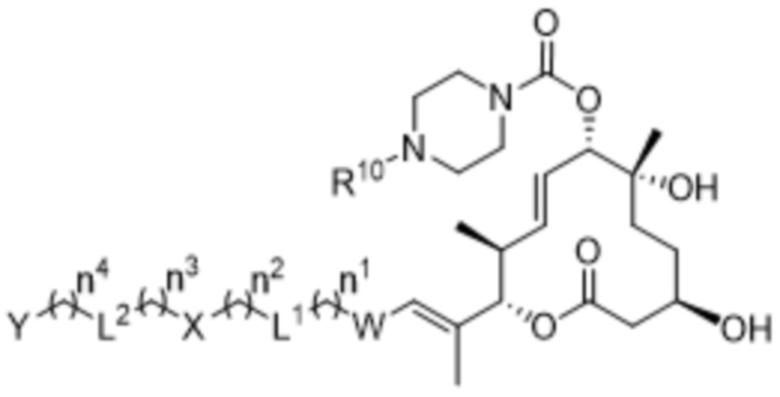
IIIa,
и их фармацевтически приемлемых солей,
где:
R10 выбран из водорода и метила;
W выбран из 3-8-членных карбоциклов и 3-8-членных гетероциклов, каждый из которых может быть замещен 1-3 группами, независимо выбранными из атомов галогена, групп -NR8R9, C1-C6алкильных групп, C1-C6алкоксигрупп, метокси-C1-C6алкильных групп, гидрокси-C1-C6алкильных групп и C3-C5циклоалкильных групп;
каждый из X и Y независимо выбран из связи, водорода, 3-8-членных карбоциклов и 3-8-членных гетероциклов, каждый из которых может быть замещен 1-3 группами, независимо выбранными из атомов галогена, гидроксильных групп, C1-C6алкильных групп, гидрокси-C1-C6алкильных групп, C1-C6алкоксигрупп, метокси-C1-C6алкильных групп, -SO2-C1-C6алкильных групп и групп -NR14R15, где каждый из R14 и R15 независимо выбран из водорода и C1-C6алкильных групп;
каждый из L1 и L2 независимо выбран из связи, -O-, -C(O)-, -C(O)O-, -N(R13)-C(O)-, -C(O)-N(R13)-, -N(R13)-S(O2)-, -S(O2)-N(R13)-, -S(O2)- и -N(R13)-, где R13 выбран из водорода и C1-C6алкильных групп; и
каждый n независимо выбран из 0-4.
В некоторых вариантах осуществления W в соединениях формулы IIIa выбран из бензольного кольца, пиридинового кольца, бензимидазольного кольца, бензотриазольного кольца, индазольного кольца, 1,2,3,6-тетрагидропиридинового кольца и имидазопиридинового кольца, каждое из которых может быть замещено 1-3 группами, независимо выбранными из атомов галогена, групп -NR8R9, C1-C6алкильных групп, C1-C6алкоксигрупп, метокси-C1-C6алкильных групп, гидрокси-C1-C6алкильных групп и C3-C5циклоалкильных групп.
В некоторых вариантах осуществления W в соединениях формулы IIIa представляет собой бензольное кольцо, которое может быть замещено 1-3 группами, выбранными из атомов галогена и C1-C6алкильных групп.
В некоторых вариантах осуществления каждый из X и Y в соединениях формулы IIIa независимо выбран из связи,
 ,
,
каждый из которых может быть замещен 1-3 группами, независимо выбранными из атомов галогена, гидроксильных групп, C1-C6алкильных групп, гидрокси-C1-C6алкильных групп, C1-C6алкоксигрупп, метокси-C1-C6алкильных групп, -SO2-C1-C6алкильных групп и групп -NR14R15, где каждый из R14 и R15 независимо выбран из водорода и C1-C6алкильных групп.
В некоторых вариантах осуществления Y в соединениях формулы IIIa представляет собой водород, и X в соединениях формулы IIIa выбран из:
 ,
,
каждый из которых может быть замещен 1-3 группами, независимо выбранными из атомов галогена, гидроксильных групп, C1-C6алкильных групп, гидрокси-C1-C6алкильных групп, C1-C6алкоксигрупп, метокси-C1-C6алкильных групп, -S(O2)-C1-C6алкильных групп и групп -NR14R15, где каждый из R14 и R15 независимо выбран из водорода и C1-C6алкильных групп.
В некоторых вариантах осуществления Y в соединениях формулы IIIa представляет собой водород, и X в соединениях формулы IIIa представляет собой связь. В некоторых вариантах осуществления соединения формулы I выбраны из соединений формулы IVa:
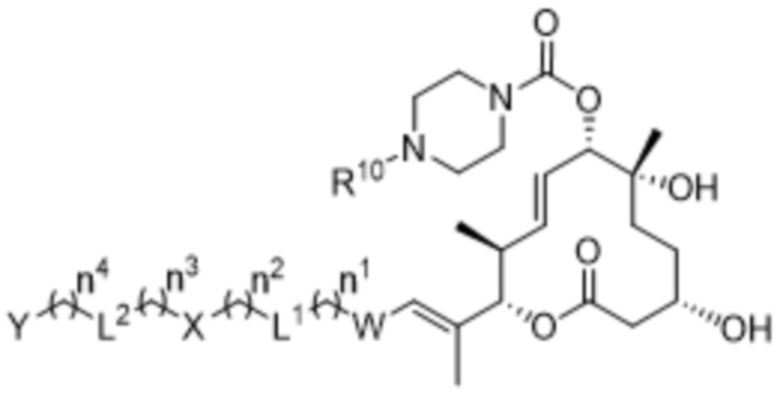
IVa,
или их фармацевтически приемлемой соли,
где:
R10 выбран из водорода и метила;
W выбран из 3-8-членных карбоциклов и 3-8-членных гетероциклов, каждый из которых может быть замещен 1-3 группами, независимо выбранными из атомов галогена, групп -NR8R9, C1-C6алкильных групп, C1-C6алкоксигрупп, метокси-C1-C6алкильных групп, гидрокси-C1-C6алкильных групп и C3-C5циклоалкильных групп;
каждый из X и Y независимо выбран из связи, водорода, 3-8-членных карбоциклов и 3-8-членных гетероциклов, каждый из которых может быть замещен 1-3 группами, независимо выбранными из атомов галогена, гидроксильных групп, C1-C6алкильных групп, гидрокси-C1-C6алкильных групп, C1-C6алкоксигрупп, метокси-C1-C6алкильных групп, -SO2-C1-C6алкильных групп и групп -NR14R15, где каждый из R14 и R15 независимо выбран из водорода и C1-C6алкильных групп;
каждый из L1 и L2 независимо выбран из связи, -O-, -C(O)-, -C(O)O-, -N(R13)-C(O)-, -C(O)-N(R13)-, -N(R13)-S(O2)-, -S(O2)-N(R13)-, -S(O2)- и -N(R13)-, где R13 выбран из водорода и C1-C6алкильных групп; и
каждый n независимо выбран из 0-4.
В некоторых вариантах осуществления W в соединениях формулы IVa выбран из бензольного кольца, пиридинового кольца, бензимидазольного кольца, бензотриазольного кольца, индазольного кольца, 1,2,3,6-тетрагидропиридинового кольца и имидазопиридинового кольца, каждое из которых может быть замещено 1-3 группами, независимо выбранными из атомов галогена, групп -NR8R9, C1-C6алкильных групп, C1-C6алкоксигрупп, метокси-C1-C6алкильных групп, гидрокси-C1-C6алкильных групп и C3-C5циклоалкильных групп.
В некоторых вариантах осуществления W в соединениях формулы IVa представляет собой бензольное кольцо, которое может быть замещено 1-3 группами, выбранными из атомов галогена и C1-C6алкильных групп.
В некоторых вариантах осуществления каждый из X и Y в соединениях формулы IVa независимо выбран из связи,
 ,
,
каждый из которых может быть замещен 1-3 группами, независимо выбранными из атомов галогена, гидроксильных групп, C1-C6алкильных групп, гидрокси-C1-C6алкильных групп, C1-C6алкоксигрупп, метокси-C1-C6алкильных групп, -SO2-C1-C6алкильных групп и групп -NR14R15, где каждый из R14 и R15 независимо выбран из водорода и C1-C6алкильных групп.
В некоторых вариантах осуществления Y в соединениях формулы IVa представляет собой водород, и X в соединениях формулы IVa выбран из:
 ,
,
каждый из которых может быть замещен 1-3 группами, независимо выбранными из атомов галогена, гидроксильных групп, C1-C6алкильных групп, гидрокси-C1-C6алкильных групп, C1-C6алкоксигрупп, метокси-C1-C6алкильных групп, -S(O2)-C1-C6алкильных групп и групп -NR14R15, где каждый из R14 и R15 независимо выбран из водорода и C1-C6алкильных групп.
В некоторых вариантах осуществления Y в соединениях формулы IVa представляет собой водород, и X в соединениях формулы IVa представляет собой связь.
В некоторых вариантах осуществления соединения формулы I выбраны из соединений формулы Va:
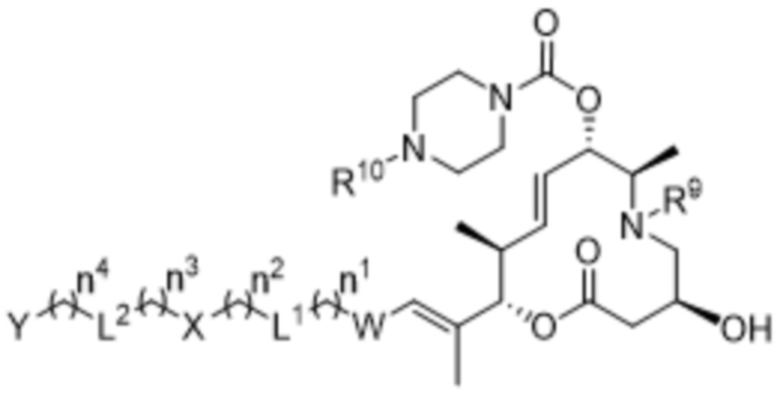
Va,
или их фармацевтически приемлемой соли,
где:
R9 выбран из водорода и C1-C6алкильных групп;
R10 выбран из водорода и метила;
W выбран из 3-8-членных карбоциклов и 3-8-членных гетероциклов, каждый из которых может быть замещен 1-3 группами, независимо выбранными из атомов галогена, групп -NR8R9, C1-C6алкильных групп, C1-C6алкоксигрупп, метокси-C1-C6алкильных групп, гидрокси-C1-C6алкильных групп и C3-C5циклоалкильных групп;
каждый из X и Y независимо выбран из связи, водорода, 3-8-членных карбоциклов и 3-8-членных гетероциклов, каждый из которых может быть замещен 1-3 группами, независимо выбранными из атомов галогена, гидроксильных групп, C1-C6алкильных групп, гидрокси-C1-C6алкильных групп, C1-C6алкоксигрупп, метокси-C1-C6алкильных групп, -SO2-C1-C6алкильных групп и групп -NR14R15, где каждый из R14 и R15 независимо выбран из водорода и C1-C6алкильных групп;
каждый из L1 и L2 независимо выбран из связи, -O-, -C(O)-, -C(O)O-, -N(R13)-C(O)-, -C(O)-N(R13)-, -N(R13)-S(O2)-, -S(O2)-N(R13)-, -S(O2)- и -N(R13)-, где R13 выбран из водорода и C1-C6алкильных групп; и
каждый n независимо выбран из 0-4.
В некоторых вариантах осуществления W в соединениях формулы Va выбран из бензольного кольца, пиридинового кольца, бензимидазольного кольца, бензотриазольного кольца, индазольного кольца, 1,2,3,6-тетрагидропиридинового кольца и имидазопиридинового кольца, каждое из которых может быть замещено 1-3 группами, независимо выбранными из атомов галогена, групп -NR8R9, C1-C6алкильных групп, C1-C6алкоксигрупп, метокси-C1-C6алкильных групп, гидрокси-C1-C6алкильных групп и C3-C5циклоалкильных групп.
В некоторых вариантах осуществления W в соединениях формулы Va представляет собой бензольное кольцо, которое может быть замещено 1-3 группами, выбранными из атомов галогена и C1-C6алкильных групп.
В некоторых вариантах осуществления каждый из X и Y в соединениях формулы Va независимо выбран из связи,
 ,
,
каждый из которых может быть замещен 1-3 группами, независимо выбранными из атомов галогена, гидроксильных групп, C1-C6алкильных групп, гидрокси-C1-C6алкильных групп, C1-C6алкоксигрупп, метокси-C1-C6алкильных групп, -SO2-C1-C6алкильных групп и групп -NR14R15, где каждый из R14 и R15 независимо выбран из водорода и C1-C6алкильных групп.
В некоторых вариантах осуществления Y в соединениях формулы Va представляет собой водород, и X в соединениях формулы Va выбран из:
 ,
,
каждый из которых может быть замещен 1-3 группами, независимо выбранными из атомов галогена, гидроксильных групп, C1-C6алкильных групп, гидрокси-C1-C6алкильных групп, C1-C6алкоксигрупп, метокси-C1-C6алкильных групп, -S(O2)-C1-C6алкильных групп и групп -NR14R15, где каждый из R14 и R15 независимо выбран из водорода и C1-C6алкильных групп.
В некоторых вариантах осуществления Y в соединениях формулы Va представляет собой водород, и X в соединениях формулы Va представляет собой связь.
В некоторых вариантах осуществления R9 в соединениях формулы Va выбран из водорода и метила.
В данном документе также раскрыты соединения, выбранные из:
[(2S,3S,4E,6R,7S,10R)-10-гидрокси-3,7-диметил-12-оксо-2-[(E)-1-(3-пиперазин-1-илфенил)проп-1-ен-2-ил]-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-10-гидрокси-3,7-диметил-2-[(E)-1-[3-(4-метилпиперазин-1-ил)фенил]проп-1-ен-2-ил]-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-(3-фтор-5-морфолин-4-илфенил)проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-10-гидрокси-2-[(E)-1-(1H-индазол-6-ил)проп-1-ен-2-ил]-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-10-гидрокси-2-[(E)-1-(1H-индазол-4-ил)проп-1-ен-2-ил]-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-10-гидрокси-3,7-диметил-2-[(E)-1-(2-морфолин-4-илпиридин-4-ил)проп-1-ен-2-ил]-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-(2-фтор-5-морфолин-4-илфенил)проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-(4-фтор-3-морфолин-4-илфенил)проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-10-гидрокси-3,7-диметил-2-[(E)-1-[3-[(3S)-3-(метиламино)пирролидин-1-ил]фенил]проп-1-ен-2-ил]-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-10-гидрокси-3,7-диметил-2-[(E)-1-[3-[(3S)-3-(метиламино)пирролидин-1-ил]фенил]проп-1-ен-2-ил]-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-(2-фтор-5-морфолин-4-илфенил)проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-пиперидин-1-илпиперидин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-фтор-5-[4-(2-гидроксиэтил)пиперазин-1-ил]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-фтор-5-[4-(2-гидроксиэтил)пиперазин-1-ил]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-пиперидин-1-илпиперидин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-фтор-5-[(3R)-3-фторпирролидин-1-ил]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-фтор-5-[(2R)-2-(гидроксиметил)пирролидин-1-ил]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7R,10S)-2-[(E)-1-[3-[(2R,6S)-2,6-диметилморфолин-4-ил]-5-фторфенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-пиперидин-1-илпиперидин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-[(3S)-3-(диметиламино)пирролидин-1-ил]-5-фторфенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-10-гидрокси-3,7-диметил-2-[(E)-1-(3-метил-5-морфолин-4-илфенил)проп-1-ен-2-ил]-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-10-гидрокси-3,7-диметил-2-[(E)-1-[3-морфолин-4-ил-5-(трифторметил)фенил]проп-1-ен-2-ил]-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-(3-хлор-5-морфолин-4-илфенил)проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-(3-фтор-5-морфолин-4-илфенил)проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-(2-гидроксиэтил)пиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-(3-фтор-5-морфолин-4-илфенил)проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-N-метил-N-(1-метилпиперидин-4-ил)карбамата;
[(2R,3R,4E,6R,7S,10S)-2-[(E)-1-(3-фтор-5-морфолин-4-илфенил)проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-(3S)-3,4-диметилпиперазин-1-карбоксилата;
[(2R,3R,4E,6R,7S,10S)-2-[(E)-1-(3-фтор-5-морфолин-4-илфенил)проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-пропан-2-илпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-(3-фтор-5-морфолин-4-илфенил)проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-трет-бутилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-(3-фтор-5-морфолин-4-илфенил)проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-циклобутилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-(3-фтор-5-морфолин-4-илфенил)проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-циклопентилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-(3,5-дифторфенил)проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-(диметиламино)-5-фторфенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-фтор-5-(4-гидроксипиперидин-1-ил)фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-фтор-5-[метил-(1-метилпиперидин-4-ил)амино]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-фтор-5-[(1R,5S)-8-окса-3-азабицикло[3.2.1]октан-3-ил]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-фтор-5-(2-окса-7-азаспиро[3.4]октан-7-ил)фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-фтор-5-[(3R)-3-гидроксипирролидин-1-ил]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-фтор-5-(3-оксопирролидин-1-ил)фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-(3-фтор-5-морфолин-4-илфенил)проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-(оксан-4-ил)пиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-(3-фтор-5-морфолин-4-илфенил)проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-N-метил-N-(1-метилпиперидин-3-ил)карбамата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-фтор-5-(3-фторазетидин-1-ил)фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-фтор-5-[(3S)-3-(метиламино)пирролидин-1-ил]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-(3-фтор-5-морфолин-4-илфенил)проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-3-(диметиламино)пиперидин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-фтор-5-[(2R)-2-метилпирролидин-1-ил]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-фтор-5-(2-оксопирролидин-1-ил)фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-фтор-5-[(2S)-2-метилпирролидин-1-ил]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-фтор-5-[(2R)-2-(гидроксиметил)пирролидин-1-ил]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-фтор-5-[(3R)-3-(метиламино)пирролидин-1-ил]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-(5-хлорпиридин-3-ил)проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-(3-фтор-5-морфолин-4-илфенил)проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-N-метил-N-(пиридин-4-илметил)карбамата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-(3,5-дихлорфенил)проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-(1,1-диоксо-1,2-тиазолидин-2-ил)фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-(1,3-диметилиндазол-6-ил)проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-(1,1-диоксо-1,4-тиазинан-4-ил)-5-фторфенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-N, N-диметилкарбамата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-(1,1-диоксо-1,4-тиазинан-4-ил)-5-фторфенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-фтор-5-[4-(2-гидроксиэтил)пиперазин-1-ил]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-морфолин-4-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-фтор-5-[4-(2-гидроксиэтил)пиперазин-1-ил]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-N-метил-N-(1-метилпиперидин-4-ил)карбамата;
[(2S,3S,4E,6R,7S,10R)-10-гидрокси-3,7-диметил-2-[(E)-1-(1-метилиндазол-6-ил)проп-1-ен-2-ил]-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-фтор-5-(3-оксоморфолин-4-ил)фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[4-(циклопентилсульфамоил)-2-фторфенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-фтор-5-(4-метилсульфонилпиперазин-1-ил)фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-(4-фтор-1H-индазол-6-ил)проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-(3-фтор-5-имидазол-1-илфенил)проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6S,7R,10S)-2-[(E)-1-(3-фтор-5-морфолин-4-илфенил)проп-1-ен-2-ил]-7,10-дигидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6S,7R,10R)-2-[(E)-1-(3-фтор-5-морфолин-4-илфенил)проп-1-ен-2-ил]-7,10-дигидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-пиперидин-1-илпиперидин-1-карбоксилата;
[(2S,3S,4E,6S,7R,10S)-2-[(E)-1-(3-фтор-5-морфолин-4-илфенил)проп-1-ен-2-ил]-7,10-дигидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-пиперидин-1-илпиперидин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-фтор-5-(2-оксоимидазолидин-1-ил)фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-фтор-5-[3-(2-гидроксиэтил)-2-оксоимидазолидин-1-ил]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-фтор-5-[3-(2-фторэтинил)-2-оксоимидазолидин-1-ил]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-фтор-5-[3-(2-морфолин-4-илэтил)-2-оксоимидазолидин-1-ил]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-[3-(циклопропилметил)-2-оксоимидазолидин-1-ил]-5-фторфенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7R,10S)-2-[(E)-1-[3-фтор-5-[(2S)-2-метилморфолин-4-ил]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7R,10S)-2-[(E)-1-[3-фтор-5-(2-метилморфолин-4-ил)фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7R,10S)-2-[(E)-1-[3-фтор-5-[4-[(2S,3R)-3-гидрокси-2-метилпентил]пиперазин-1-ил]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7R,10S)-2-[(E)-1-[3-фтор-5-[4-[(2R,3R)-3-гидрокси-2-метилпентаноил]пиперазин-1-ил]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-фтор-5-[4-(2-морфолин-4-илэтилсульфонил)пиперазин-1-ил]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-(4-этенилсульфонилпиперазин-1-ил)-5-фторфенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-фтор-5-[(3R)-3-метилморфолин-4-ил]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-фтор-5-[(2R)-2-(гидроксиметил)морфолин-4-ил]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-фтор-5-[(3S)-3-(гидроксиметил)морфолин-4-ил]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7R,10S)-2-[(E)-1-[3-фтор-5-[(2R)-2-(метилкарбамоил)морфолин-4-ил]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-фтор-5-(2-оксо-1,3-диaзинан-1-ил)фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-[3-(циклопропилметил)-2-оксо-1,3-диaзинан-1-ил]-5-фторфенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7R,10S)-2-[(E)-1-[3-фтор-5-[4-[(2R)-2-гидроксипропаноил]пиперазин-1-ил]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-(3-фтор-5-морфолин-4-илфенил)проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-3,4,6,7,8,8a-гексагидро-1H-пирроло[1,2-a]пиразин-2-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-фтор-5-[(3S)-3-метилморфолин-4-ил]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-[4-(2-циклопропил-2-оксоэтил)пиперазин-1-ил]-5-фторфенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-фтор-5-[4-(2-оксо-2-пиразин-2-илэтил)пиперазин-1-ил]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6S,7R,10R)-2-[(E)-1-(3-фтор-5-морфолин-4-илфенил)проп-1-ен-2-ил]-7,10-дигидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[1-(циклопропилметил)-4-фториндазол-6-ил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-10-гидрокси-2-[(E)-1-имидазо[1,2-a]пиридин-6-илпроп-1-ен-2-ил]-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-10-гидрокси-3,7-диметил-2-[(E)-1-(7-метил-1H-индазол-4-ил)проп-1-ен-2-ил]-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[4-(циклопропилсульфамоил)-3-фторфенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[2-фтор-5-(4-гидроксипиперидин-1-ил)сульфонилфенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-(3-фтор-5-морфолин-4-илфенил)проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-(2,2,2-трифторэтил)пиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-10-гидрокси-3,7-диметил-12-оксо-2-[(E)-1-(3-пиперазин-1-илсульфонилфенил)проп-1-ен-2-ил]-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-(4-формилпиперазин-1-ил)сульфонилфенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-10-гидрокси-2-[(E)-1-[3-(4-гидроксипиперидин-1-ил)сульфонилфенил]проп-1-ен-2-ил]-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-10-гидрокси-3,7-диметил-2-[(E)-1-(6-метил-1H-индазол-4-ил)проп-1-ен-2-ил]-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-(1,3-диметилиндазол-4-ил)проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-(3-фтор-5-морфолин-4-илфенил)проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-N-(1-азабицикло[2.2.2]октан-3-ил)-N-метилкарбамата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[2-(циклопропилметил)-4-фториндазол-6-ил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[4-фтор-1-(2-гидроксиэтил)индазол-6-ил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-(4-фтор-1-метилиндазол-6-ил)проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-10-гидрокси-3,7-диметил-12-оксо-2-[(E)-1-[1-(пиридин-4-илметил)пиразол-4-ил]проп-1-ен-2-ил]-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-10-гидрокси-3,7-диметил-2-[(E)-1-(1-метилпиразол-4-ил)проп-1-ен-2-ил]-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-фтор-5-[4-(2-гидроксиэтил)-3-оксопиперазин-1-ил]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7R,10S)-2-[(E)-1-[3-фтор-5-[4-(2-метоксиэтил)-3-оксопиперазин-1-ил]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-10-гидрокси-3,7-диметил-2-[(E)-1-[1-(1-метилпиперидин-4-ил)пиразол-4-ил]проп-1-ен-2-ил]-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-фтор-5-[4-(2,2,2-трифторэтил)пиперазин-1-ил]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7R,10S)-2-[(E)-1-[3-фтор-5-[4-(2-метоксиацетил)пиперазин-1-ил]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-[4-(циклопропанкарбонил)пиперазин-1-ил]-5-фторфенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7R,10S)-2-[(E)-1-[3-фтор-5-[4-(4-метоксифенил)сульфонилпиперазин-1-ил]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-фтор-5-[4-(1-метилпиразол-4-ил)сульфонилпиперазин-1-ил]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-фтор-5-(4-пиридин-3-илсульфонилпиперазин-1-ил)фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-фтор-5-[4-(1-метилимидазол-4-ил)сульфонилпиперазин-1-ил]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-[4-(циклогексанкарбонил)пиперазин-1-ил]-5-фторфенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-фтор-5-[4-(1-метилиндол-6-ил)сульфонилпиперазин-1-ил]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[4-фтор-1-(оксан-4-ил)индазол-6-ил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[4-фтор-2-(оксан-4-ил)индазол-6-ил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-фтор-5-[4-(оксан-4-карбонил)пиперазин-1-ил]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-фтор-5-[4-(2-морфолин-4-илацетил)пиперазин-1-ил]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-фтор-5-[4-(1-метилимидазол-4-карбонил)пиперазин-1-ил]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-[4-(2-циклопропилацетил)пиперазин-1-ил]-5-фторфенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-фтор-5-[4-(2-пиразол-1-илацетил)пиперазин-1-ил]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-фтор-5-[4-(1,3-оксазол-5-карбонил)пиперазин-1-ил]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-фтор-5-[4-(2-гидроксиэтилсульфонил)пиперазин-1-ил]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-фтор-5-[4-(оксетан-3-илсульфонил)пиперазин-1-ил]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[4-фтор-1-(оксетан-3-илсульфонил)индазол-6-ил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-10-гидрокси-2-[(E)-1-(1-гидроксиизохинолин-7-ил)проп-1-ен-2-ил]-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7R,10S)-2-[(E)-1-[4-фтор-1-[2-(метиламино)-2-оксоэтил]индазол-6-ил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[4-фтор-1-(2-оксо-2-пирролидин-1-илэтил)индазол-6-ил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[4-фтор-1-(2-морфолин-4-ил-2-оксоэтил)индазол-6-ил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[1-(цианометил)-4-фториндазол-6-ил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[1-[2-(диметиламино)-2-оксоэтил]-4-фториндазол-6-ил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[1-(циклопропилметил)-3-фториндазол-6-ил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7R,10S)-2-[(E)-1-[3-фтор-5-[4-(3-метоксипропаноил)пиперазин-1-ил]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-фтор-5-[4-(2-гидроксиацетил)пиперазин-1-ил]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-фтор-5-[4-(3-гидроксипропил)пиперазин-1-ил]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-(циклопропилметил)-7-фторбензoтриазол-5-ил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[2-(циклопропилметил)-7-фторбензoтриазол-5-ил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[1-(циклопропилметил)-7-фторбензoтриазол-5-ил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[7-фтор-3-(оксан-4-ил)бензoтриазол-5-ил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[7-фтор-2-(оксан-4-ил)бензoтриазол-5-ил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7R,10S)-2-[(E)-1-[7-фтор-3-(2-метоксиэтил)бензимидазол-5-ил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-фтор-5-[4-(оксолан-3-карбонил)пиперазин-1-ил]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[7-фтор-3-[1-[(2-метилпропан-2-ил)оксикарбонил]пиперидин-4-ил]бензoтриазол-5-ил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-[(4-хлорфенил)метил]-7-фторбензoтриазол-5-ил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-(1-ацетилпиперидин-4-ил)-7-фторбензимидазол-5-ил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[7-фтор-3-(4-гидроксициклогексил)бензoтриазол-5-ил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[7-фтор-3-(оксан-4-илметил)бензoтриазол-5-ил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[7-фтор-3-[(2S)-1-гидроксипропан-2-ил]бензoтриазол-5-ил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[7-фтор-3-[(2R)-1-гидроксипропан-2-ил]бензoтриазол-5-ил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-фтор-5-[4-[(3S)-оксолан-3-карбонил]пиперазин-1-ил]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-фтор-5-[4-[(3R)-оксолан-3-карбонил]пиперазин-1-ил]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-фтор-5-[4-(оксетан-3-карбонил)пиперазин-1-ил]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-фтор-5-[4-(3-метилоксетан-3-карбонил)пиперазин-1-ил]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-фтор-5-[4-(3-гидроксипропаноил)пиперазин-1-ил]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[7-фтор-3-(4-метилоксан-4-ил)бензoтриазол-5-ил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[7-фтор-3-(1-метилсульфонилпиперидин-4-ил)бензoтриазол-5-ил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-(1,1-диоксотиан-4-ил)-7-фторбензoтриазол-5-ил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7R,10S)-2-[(E)-1-[7-фтор-3-(2-метоксиэтил)бензoтриазол-5-ил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-(1-ацетилпиперидин-4-ил)-7-фторбензoтриазол-5-ил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[7-фтор-3-[(3R)-оксан-3-ил]бензoтриазол-5-ил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[7-фтор-3-[(3S)-оксан-3-ил]бензoтриазол-5-ил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[7-фтор-3-[(3R,4S)-3-гидроксиоксан-4-ил]бензoтриазол-5-ил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-(3-циклогексил-7-фторбензoтриазол-5-ил)проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7R,10S)-2-[(E)-1-[7-фтор-3-(4-метоксифенил)бензoтриазол-5-ил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7R,10S)-2-[(E)-1-[7-фтор-3-[(4-метоксифенил)метил]бензoтриазол-5-ил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-(3-хлор-5-фторфенил)проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-фтор-5-[метил(оксан-4-ил)амино]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-фтор-5-[метил(оксетан-3-ил)амино]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-10-гидрокси-3,7-диметил-2-[(E)-1-[3-[метил(оксан-4-ил)амино]фенил]проп-1-ен-2-ил]-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-10-гидрокси-3,7-диметил-2-[(E)-1-[3-[метил(оксетан-3-ил)амино]фенил]проп-1-ен-2-ил]-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-[(1,1-диоксотиан-4-ил)-метиламино]-5-фторфенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-фтор-5-[(1-метилсульфонилпиперидин-4-ил)амино]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-фтор-5-[метил-(1-метилсульфонилпиперидин-4-ил)амино]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7R,10S)-2-[(E)-1-[3-[этил-(1-метилсульфонилпиперидин-4-ил)амино]-5-фторфенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7R,10S)-2-[(E)-1-[3-фтор-5-[(1-метилсульфонилпиперидин-4-ил)-пропан-2-иламино]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-[(1-ацетилпиперидин-4-ил)-метиламино]-5-фторфенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7R,10S)-2-[(E)-1-[3-фтор-5-[метил-(1-пропаноилпиперидин-4-ил)амино]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7R,10S)-2-[(E)-1-[3-фтор-5-[[1-(2-метоксиацетил)пиперидин-4-ил]-метиламино]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-[(1-бензоилпиперидин-4-ил)-метиламино]-5-фторфенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-фтор-5-[метил-[1-(2,2,2-трифторацетил)пиперидин-4-ил]амино]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7R,10S)-2-[(E)-1-[3-фтор-5-[метил-(1-пропилсульфонилпиперидин-4-ил)амино]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-[(1-циклопентилсульфонилпиперидин-4-ил)-метиламино]-5-фторфенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-фтор-5-[метил-[1-(1-метилимидазол-4-ил)сульфонилпиперидин-4-ил]амино]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-[[1-(бензолсульфонил)пиперидин-4-ил]-метиламино]-5-фторфенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-[(1-ацетилпиперидин-4-ил)метил-метиламино]-5-фторфенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-фтор-5-[метил-[(1-метилсульфонилпиперидин-4-ил)метил]амино]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-фтор-5-[метил-[1-(1,3-оксазол-5-карбонил)пиперидин-4-ил]амино]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-фтор-5-[метил-[1-(пиразин-2-карбонил)пиперидин-4-ил]амино]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-фтор-5-[метил-[1-(1-метилимидазол-4-карбонил)пиперидин-4-ил]амино]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7R,10S)-2-[(E)-1-[3-фтор-5-[метил-[1-(пропан-2-илкарбамоил)пиперидин-4-ил]амино]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7R,10S)-2-[(E)-1-[3-фтор-5-[метил-[1-(пропилкарбамоил)пиперидин-4-ил]амино]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-фтор-5-[метил-[1-(фенилкарбамоил)пиперидин-4-ил]амино]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-фтор-5-(1-метилсульфонилпиперидин-4-ил)оксифенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[1-(4,4-дифторциклогексил)-4-фториндазол-6-ил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[4-фтор-1-(1-метилсульфонилпиперидин-4-ил)индазол-6-ил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-(3-фтор-5-пирролидин-1-илсульфонилфенил)проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-(азетидин-1-илсульфонил)фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-10-гидрокси-2-[(E)-1-[3-[(3R)-3-гидроксипирролидин-1-ил]сульфонилфенил]проп-1-ен-2-ил]-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7R,10S)-10-гидрокси-3,7-диметил-2-[(E)-1-[3-[(2S)-2-метилпирролидин-1-ил]сульфонилфенил]проп-1-ен-2-ил]-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-10-гидрокси-2-[(E)-1-[3-[(1-гидрокси-2-метилпропан-2-ил)сульфамоил]фенил]проп-1-ен-2-ил]-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-(4,4-дифторпиперидин-1-ил)сульфонилфенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-10-гидрокси-3,7-диметил-2-[(E)-1-(4-метил-3-пирролидин-1-илсульфонилфенил)проп-1-ен-2-ил]-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-(3,3-дифторпирролидин-1-ил)сульфонилфенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-10-гидрокси-3,7-диметил-12-оксо-2-[(E)-1-(5-пирролидин-1-илсульфонилпиридин-3-ил)проп-1-ен-2-ил]-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-(3,3-дифторазетидин-1-ил)сульфонилфенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-10-гидрокси-3,7-диметил-2-[(E)-1-[4-метил-3-(2-оксопирролидин-1-ил)фенил]проп-1-ен-2-ил]-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-(трет-бутилсульфамоил)фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7R,10S)-10-гидрокси-3,7-диметил-12-оксо-2-[(E)-1-[3-(пропан-2-илсульфамоил)фенил]проп-1-ен-2-ил]-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7R,10S)-2-[(E)-1-[3-(этилсульфамоил)фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-10-гидрокси-3,7-диметил-2-[(E)-1-[3-(4-метилпиперазин-1-ил)сульфонилфенил]проп-1-ен-2-ил]-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7R,10S)-10-гидрокси-3,7-диметил-2-[(E)-1-[3-(метилсульфамоил)фенил]проп-1-ен-2-ил]-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-10-гидрокси-3,7-диметил-12-оксо-2-[(E)-1-(3-пиперидин-1-илсульфонилфенил)проп-1-ен-2-ил]-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-10-гидрокси-3,7-диметил-12-оксо-2-[(E)-1-(3-пирролидин-1-илсульфонилфенил)проп-1-ен-2-ил]-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-(3-циклопропилсульфонилфенил)проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-(циклопропилсульфониламино)фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-фтор-5-[(3S)-3-(метансульфонамидо)пирролидин-1-ил]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7R,10S)-2-[(E)-1-[3-фтор-5-[(3S)-3-[(2-метоксиацетил)амино]пирролидин-1-ил]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-10-гидрокси-3,7-диметил-2-[(E)-1-[1-[(2-метилпропан-2-ил)оксикарбонил]-3,6-дигидро-2H-пиридин-5-ил]проп-1-ен-2-ил]-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2R,3R,4E,6R,7S,10S)-2-[(E)-1-(3-фтор-5-морфолин-4-илфенил)проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-(тридейтериометил)пиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-фтор-5-[4-(2-пиразол-1-илацетил)пиперазин-1-ил]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-N-(пиридин-4-илметил)карбамата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-фтор-5-[4-(2-пиразол-1-илацетил)пиперазин-1-ил]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-N-(пиримидин-4-илметил)карбамата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-фтор-5-[4-(2-пиразол-1-илацетил)пиперазин-1-ил]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-морфолин-4-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-фтор-5-[4-(2-пиразол-1-илацетил)пиперазин-1-ил]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-N-[2-(диметиламино)этил]карбамата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-фтор-5-[4-(2-пиразол-1-илацетил)пиперазин-1-ил]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метил-1,4-диазепан-1-карбоксилата;
[(2R,3R,4E,6R,7S,10S)-2-[(E)-1-[3-фтор-5-[4-(2-пиразол-1-илацетил)пиперазин-1-ил]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-N-[(4-метоксифенил)метил]карбамата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-фтор-5-[4-(2-пиразол-1-илацетил)пиперазин-1-ил]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-(3R)-3-(диметиламино)пирролидин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-фтор-5-[4-(2-пиразол-1-илацетил)пиперазин-1-ил]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-(3S)-3-(диметиламино)пирролидин-1-карбоксилата;
[(2R,3R,4E,6R,7S,10S)-2-[(E)-1-[3-фтор-5-[4-(2-пиразол-1-илацетил)пиперазин-1-ил]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-N-[(2S)-1-гидроксипропан-2-ил]карбамата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-фтор-5-[4-(2-пиразол-1-илацетил)пиперазин-1-ил]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-3-оксопиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-фтор-5-[4-(2-пиразол-1-илацетил)пиперазин-1-ил]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-(3R)-3-фторпирролидин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-фтор-5-[4-(2-пиразол-1-илацетил)пиперазин-1-ил]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-3,3,4-триметилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-фтор-5-[4-(2-пиразол-1-илацетил)пиперазин-1-ил]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-N-метил-N-(1-метилпиперидин-4-ил)карбамата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-фтор-5-[4-(2-пиразол-1-илацетил)пиперазин-1-ил]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-(2-гидроксиэтил)пиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-фтор-5-[4-(2-пиразол-1-илацетил)пиперазин-1-ил]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-пиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-фтор-5-[4-(2-пиразол-1-илацетил)пиперазин-1-ил]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-циклогептилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-фтор-5-[4-(2-пиразол-1-илацетил)пиперазин-1-ил]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-пиридин-4-илпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-фтор-5-[4-(2-пиразол-1-илацетил)пиперазин-1-ил]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-циклогексилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-фтор-5-[4-(2-пиразол-1-илацетил)пиперазин-1-ил]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-N-[2-(4-гидроксифенил)этил]-N-метилкарбамата;
(2S,3S,6R,7S,10R,E)-2-((E)-1-(3-фтор-5-морфолинофенил)проп-1-ен-2-ил)-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил-7-метил-1,7-диазаспиро[3.5]нонан-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-(3-фтор-5-морфолин-4-илфенил)проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-N-(3-морфолин-4-илпропил)карбамата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-(3-фтор-5-морфолин-4-илфенил)проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-N-[2-(диметиламино)этил]карбамата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-(3-фтор-5-морфолин-4-илфенил)проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-(3R)-3-(диметиламино)пирролидин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-(3-фтор-5-морфолин-4-илфенил)проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-(3S)-3-(диметиламино)пирролидин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-(3-фтор-5-морфолин-4-илфенил)проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-N-(2-цианоэтил)-N-метилкарбамата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-(3-фтор-5-морфолин-4-илфенил)проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-3,3,4-триметилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-(3-фтор-5-морфолин-4-илфенил)проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-(3R)-3-фторпирролидин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-(диметилсульфамоиламино)-5-фторфенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7R,10S)-2-[(E)-1-[3-фтор-5-[(2-метоксиацетил)амино]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-[(2-циклопропилацетил)амино]-5-фторфенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-фтор-5-[4-(2-пиразол-1-илацетил)пиперазин-1-ил]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-[(3-гидроксифенил)метил]пиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-фтор-5-[4-(2-пиразол-1-илацетил)пиперазин-1-ил]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-(пиридин-3-илметил)пиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-(1-ацетилпиперидин-4-ил)-7-фторбензoтриазол-5-ил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-пиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-10-гидрокси-2-[(E)-1-[3-[[(3R)-3-гидроксипирролидин-1-карбонил]оксиметил]фенил]проп-1-ен-2-ил]-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[3-[(E)-2-[(2S,3S,4E,6R,7S,10R)-10-гидрокси-3,7-диметил-6-(4-метилпиперазин-1-карбонил)окси-12-оксо-1-оксациклододец-4-ен-2-ил]проп-1-енил]фенил]метил-2-окса-7-азаспиро[3.4]октан-7-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-10-гидрокси-2-[(E)-1-[2-[(2R)-2-(гидроксиметил)пирролидин-1-ил]пиридин-4-ил]проп-1-ен-2-ил]-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[3-[(E)-2-[(2S,3S,4E,6R,7S,10R)-10-гидрокси-3,7-диметил-6-(4-метилпиперазин-1-карбонил)окси-12-оксо-1-оксациклододец-4-ен-2-ил]проп-1-енил]фенил]метилморфолин-4-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-(диметилкарбамоилоксиметил)фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-10-гидрокси-2-[(E)-1-[3-[[(2R)-2-(гидроксиметил)пирролидин-1-карбонил]оксиметил]фенил]проп-1-ен-2-ил]-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-[[(3R)-3-фторпирролидин-1-карбонил]оксиметил]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-10-гидрокси-2-[(E)-1-[3-[(4-гидроксипиперидин-1-карбонил)оксиметил]фенил]проп-1-ен-2-ил]-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-(3-фтор-5-морфолин-4-илфенил)проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-пиперидин-1-илпиперидин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-10-гидрокси-2-[(E)-1-[3-[4-(2-гидроксиэтил)пиперазин-1-ил]фенил]проп-1-ен-2-ил]-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-пиперидин-1-илпиперидин-1-карбоксилата;
2-[4-[3-фтор-5-[(E)-2-[(2S,3S,4E,6R,7S,10R)-10-гидрокси-3,7-диметил-12-оксо-6-(пиперазин-1-карбонилокси)-1-оксациклододец-4-ен-2-ил]проп-1-енил]фенил]пиперазин-1-ил]уксусной кислоты;
(2S,3S,6R,7S,10R,E)-2-((E)-1-(3-(диметиламино)фенил)проп-1-ен-2-ил)-10-гидрокси-3,7-диметил-12-оксооксациклододец-4-ен-6-ил-4-метилпиперазин-1-карбоксилата;
(2S,3S,6R,7S,10R,E)-2-((E)-1-(3-(диметиламино)фенил)проп-1-ен-2-ил)-10-гидрокси-3,7-диметил-12-оксооксациклододец-4-ен-6-илпиперазин-1-карбоксилата;
(2S,3S,6R,7S,10R,E)-2-((E)-1-(5-хлорпиридин-3-ил)проп-1-ен-2-ил)-10-гидрокси-3,7-диметил-12-оксооксациклододец-4-ен-6-илпиперазин-1-карбоксилата;
(2S,3S,6R,7S,10R,E)-10-гидрокси-3,7-диметил-12-оксо-2-((E)-1-(3-(пирролидин-1-илсульфонил)фенил)проп-1-ен-2-ил)оксациклододец-4-ен-6-илпиперазин-1-карбоксилата;
и их фармацевтически приемлемых солей.
В данном документе раскрыты композиции, содержащие по меньшей мере одно соединение по настоящему изобретению (например, соединения формул I, IIa-e, IIIa, IVa и Va и/или их фармацевтически приемлемые соли) и по меньшей мере один фармацевтически приемлемый носитель. По меньшей мере один фармацевтически приемлемый носитель может быть выбран в соответствии с конкретным путем введения, для которого предназначена композиция.
Фармацевтические композиции по настоящему изобретению могут быть составлены для парентерального введения, перорального введения, введения с помощью спрея для ингаляции, местного введения, ректального введения, назального введения, буккального введения, вагинального введения и/или введения с помощью имплантируемой емкости и т. д. Термин "парентеральный", как используется в данном документе, включает методики подкожных, внутривенных, внутримышечных, внутрисуставных, внутрисиновиальных, внутригрудинных, внутриоболочечных, внутрипеченочных, внутриочаговых и внутричерепных инъекций или инфузий. В некоторых вариантах осуществления композиции вводят внутривенно, перорально, подкожно или посредством внутримышечного введения. Стерильные инъекционные формы композиций по настоящему изобретению могут представлять собой водную или маслянистую суспензию. Данные суспензии могут быть составлены в соответствии с методиками, известными из уровня техники, с применением подходящих диспергирующих или смачивающих средств и суспендирующих средств. Стерильный инъекционный препарат может также представлять собой стерильный инъекционный раствор или суспензию в нетоксичном приемлемом для парентерального введения разбавителе или растворителе, например, в виде раствора в 1,3-бутандиоле. К приемлемым средам-носителям и растворителям, которые могут использоваться, относятся вода, раствор Рингера и изотонический раствор хлорида натрия. Кроме того, в качестве растворителя или среды для суспендирования традиционно используются стерильные нелетучие масла.
Можно использовать любое легкое нелетучее масло, в том числе синтетические моно- или диглицериды. В приготовлении инъекционных препаратов применимы жирные кислоты, такие как олеиновая кислота и ее глицеридные производные, также как и натуральные фармацевтически приемлемые масла, такие как оливковое масло или касторовое масло, особенно их полиоксиэтилированные варианты. Данные масляные растворы или суспензии могут также содержать длинноцепочечный спиртовой разбавитель или диспергатор, такой как карбоксиметилцеллюлоза или подобные диспергирующие средства, которые обычно используются при составлении фармацевтически приемлемых лекарственных форм, в том числе эмульсий и суспензий. Другие широко используемые поверхностно-активные вещества, такие как разновидности Tween, Span, и другие эмульгирующие средства или усиливающие биодоступность средства, которые широко используются при изготовлении фармацевтически приемлемых твердых, жидких или других лекарственных форм, также могут применяться для целей получения состава.
В случае перорального введения соединение (например, соединение формул I, IIa-e, IIIa, IVa или Va или его фармацевтически приемлемую соль) может быть представлено в виде лекарственной формы, приемлемой для перорального введения, включая без ограничения капсулы, таблетки, водные суспензии или растворы. В случае таблеток для перорального применения широко используемые носители включают лактозу и кукурузный крахмал. Также можно добавлять смазывающие средства, такие как стеарат магния. В случае перорального введения в форме капсулы применимые разбавители включают лактозу и высушенный кукурузный крахмал. Если водные суспензии предназначены для перорального введения, то активный ингредиент объединяется с эмульгирующим и/или суспендирующим средством. При необходимости также могут быть добавлены определенные подсластители, ароматизаторы или красители.
Соединения и композиции по настоящему изобретению могут применяться для лечения различных типов рака, в том числе тех, которые восприимчивы к средствам, которые оказывают целенаправленное воздействие на SF3B1. Как отмечалось выше, сообщается, что противоопухолевая активность пладиенолида B связана с его целенаправленным воздействием на комплекс SF3b путем ингибирования сплайсинга и изменения паттерна экспрессии генов (Kotake et al., "Splicing factor SF3b as a target of the antitumor natural product pladienolide," Nature Chemical Biology 2007, 3, 570-575). Известно, что мутации в генах сплайсосомы, как, например, в белке субъединицы 1 фактора сплайсинга 3B (SF3B1), наблюдаются при целом ряде видов рака, таких как гематологические злокачественные новообразования и солидные опухоли. Scott et al., "Acquired mutations that affect pre-mRNA splicing in hematologic malignancies and solid tumors," JNCI 105, 20, 1540-1549.
Таким образом, соединения (например, соединения формул I, IIa-e, IIIa, IVa и Va и их фармацевтически приемлемые соли) и композиции по настоящему изобретению могут применяться для лечения гематологических злокачественных новообразований, таких как, например, виды рака крови (лейкозы) и виды рака лимфатических узлов (лимфомы). Лейкозы включают острый лимфобластный лейкоз (ALL), острый миелогенный лейкоз (AML), хронический лимфоцитарный лейкоз (CLL), хронический миелогенный лейкоз (CML), хронический миеломоноцитарный лейкоз (CMML), острый моноцитарный лейкоз (AMoL) и т. д. Лимфомы включают лимфому Ходжкина и неходжкинскую лимфому. Другие гематологические злокачественные новообразования могут включать миелодиспластический синдром (MDS).
Солидные опухоли включают карциномы, такие как аденокарцинома, например, рак молочной железы, рак поджелудочной железы, рак предстательной железы, рак толстой кишки или колоректальный рак, рак легкого, рак желудка, рак шейки матки, рак эндометрия, рак яичника, холангиокарциному, глиому, меланому и т. д.
Соединения и композиции по настоящему изобретению (например, соединение формул I, IIa-e, IIIa, IVa или Va) также могут применяться для лечения видов рака, которые могут быть восприимчивы к средствам, которые оказывают целенаправленное воздействие на ген или белок сплайсосомы, отличный от SF3B1. Далее представлены неограничивающие примеры видов рака, которые могут быть восприимчивы к средствам, которые оказывают целенаправленное воздействие на сплайсосому. Таким образом, соединения по настоящему изобретению могут вводиться субъектам для лечения множества таких видов рака или патологических состояний, как, например, пациентам или субъектам, страдающим от следующего.
a) Миелодиспластический синдром (MDS): см., например, "SF3B1 mutations in myelodysplastic syndromes: clinical associations and prognostic implications", Damm F. et al. Leukemia, 2011, 1-4; "Frequent pathway mutations in splicing machinery in myelodysplasia", Yoshida K. et al, Nature, 2011, 478, 64-69; "Clinical significance of SF3B1 mutations in myelodysplastic syndromes and myelodysplastic/myeloproliferative neoplasms", Malcovati L. et al., Blood, 2011, 118, 24, 6239-6246; "Mutations in the spliceosome machinery, a novel and ubiquitous pathway in leukemogenesis", Makishima et al, Blood, 2012, 119, 3203-3210; "Somatic SF3B1 mutation in myelodysplasia with ring sideroblasts", Pappaemannuil, E. et al, New England J. Med. 2011, DOI 10.1056/NEJMoa1103283.
b) Хронический лимфоцитарный лейкоз (CLL): см., например, "Defects in the spliceosomal machinery: a new pathway of leukaemogenesis", Maciejewski, J.P., Padgett, R.A., Br. J. Haematology, 2012, 1-9; "Mutations in the SF3B1 splicing factor in chronic lymphocytic leukemia: associations with progression and fludarabine-refractoriness", Rossi et al, Blood, 2011, 118, 6904-6908; "Exome sequencing identifies recurrent mutations of the splicing factor SF3B1 gene in chronic lymphocytic leukemia", Quesada et al, Nature Genetics, 2011, 44, 47-52.
c) Хронический миеломоноцитарный лейкоз (CMML): см., например, Yoshida et al, Nature 2011; "Spliceosomal gene mutations are frequent events in the diverse mutational spectrum of chronic myelomonocytic leukemia but largely absent in juvenile myelomonocytic leukemia", Kar S.A. et al, Haematologia, 2012, DOI: 10.3324/haematol.2012.064048; DeBoever et al., "Transcriptome sequencing reveals potential mechanism of cryptic 3' splice site selection in SF3B1-mutated cancers", PLOS Computational Biology, 2013, DOI: 10.1371/journal.pcbi.1004105.
d) Острый миелоидный лейкоз (AML): см., например, Malcovati et al., Blood 2011; Yoshida et al, Nature 2011.
e) Рак молочной железы: см., например, "Whole genome analysis informs breast cancer response to aromatase inhibition", Ellis et al., Nature, 2012, 486, 353-360; DeBoever et al., "Transcriptome sequencing reveals potential mechanism of cryptic 3' splice site selection in SF3B1-mutated cancers", PLOS Computational Biology, 2013, DOI: 10.1371/journal.pcbi.1004105; Maguire et al., "SF3B1 mutations constitute a novel therapeutic target in breast cancer", J Pathol 2015, 235, 571-580.
f) Увеальная меланома: см., например, "SF3B1 mutations are associated with alternative splicing in uveal melanoma", Furney et al., Cancer Disc. 2013, 10, 1122-1129; DeBoever et al., "Transcriptome sequencing reveals potential mechanism of cryptic 3' splice site selection in SF3B1-mutated cancers", PLOS Computational Biology, 2013, DOI: 10.1371/journal.pcbi.1004105.
g) Рак эндометрия: см., например, Tefferi et al., "Myelodysplastic syndromes", N Engl J Med. 2009; 361:1872-85.
h) Рак желудка: см., например, Int J Cancer. 2013 Jul;133(1):260-5, "Mutational analysis of splicing machinery genes SF3B1, U2AF1 and SRSF2 in myelodysplasia and other common tumors", Je et al. i) Рак яичника: см., например, Int J Cancer. 2013 Jul;133(1):260-5, "Mutational analysis of splicing machinery genes SF3B1, U2AF1 and SRSF2 in myelodysplasia and other common tumors", Je et al.
j) Виды рака желчных протоков, такие как холангиокарцинома и рак поджелудочной железы: см., например, Biankin et al., "Pancreatic cancer genomes reveal aberrations in axon guidance pathway genes", Nature 2012, 491, 399-405.
k) Рак легкого: см., например, "Exome sequencing identifies recurrent mutations of the splicing factor SF3B1 gene in chronic lymphocytic leukemia", Quesada et al., Nature Genetics 44, 47-52 (2012); Scott et al., "Acquired mutations that affect pre-mRNA splicing in hematologic malignancies and solid tumors", JNCI 105, 20, 1540-1549.
Кроме того, в Каталоге соматических мутаций при раке (COSMIC) (Wellcome Trust Sanger Institute, Genome Research Limited, England) сообщается, что мутации SF3B1 были обнаружены в образцах различных типов рака.
Соединение по настоящему изобретению (например, соединение формул I, IIa-e, IIIa, IVa или Va) может вводиться субъекту в эффективном для лечения или терапевтически эффективном количестве. Количество соединения по настоящему изобретению, которое может быть объединено с материалом носителя для получения композиции в виде единичной стандартной лекарственной формы, будет варьироваться в зависимости от субъекта, подлежащего лечению, и конкретного пути введения. В некоторых вариантах осуществления вводят дозу, составляющую от 0,01 мг/кг до 100 мг/кг веса тела/сутки по меньшей мере одного соединения, раскрытого в данном документе. В некоторых вариантах осуществления доза составляет от 0,01 мг до 50 мг по меньшей мере одного соединения, раскрытого в данном документе. В некоторых вариантах осуществления вводится от 0,1 мг до 25 мг по меньшей мере одного соединения, раскрытого в данном документе. В некоторых вариантах осуществления вводится от 5 мг до 40 мг по меньшей мере одного соединения, раскрытого в данном документе.
Среднему специалисту будет понятно, что специфическая дозировка и схема лечения для конкретного пациента будут зависеть от множества факторов, в том числе активности специфического используемого соединения, возраста, массы тела, общего состояния здоровья, пола, режима питания, времени введения, скорости выведения, комбинации лекарственных средств, оценки лечащего врача и тяжести конкретного заболевания, подлежащего лечению. Количество по меньшей мере одного соединения, раскрытого в данном документе, будет также зависеть от конкретного соединения/соли, подлежащих применению.
В некоторых вариантах осуществления рак тестируют на наличие одной или нескольких мутаций в гене или белке сплайсосомы и/или для него получен положительный результат теста на их наличие, при этом наличие мутации(-й) ("положительный" результат) может указывать на то, что рак у субъекта является восприимчивым к способу лечения, включающему введение соединения, оказывающего целенаправленное воздействие на данный белок и/или сплайсосому. Примеры таких генов сплайсосомы включают без ограничения гены, представленные в таблице 1.
Сокращения:
MDS=миелодиспластический синдром
AML=острый миелоидный лейкоз
CMML=хронический миеломоноцитарный лейкоз
LUAD=аденокарцинома легкого
UCEC=карцинома эндометрия тела матки
PMF=прогрессивный массивный фиброз
PRAD=аденокарцинома предстательной железы
COAD=аденокарцинома толстой кишки
OV=серозная цистаденокарцинома яичника
SKCM=меланома кожи
LUSC=плоскоклеточная карцинома легкого
STAD=аденокарцинома желудка
GBM=мультиформная глиобластома
LGG=глиома головного мозга низкой степени злокачественности
DLBCL=диффузная B-крупноклеточная лимфома
В некоторых вариантах осуществления рак у субъекта может быть восприимчив к способу лечения, включающему введение соединения, целенаправленно воздействующего на данный белок и/или сплайсосому, даже в отсутствие таких мутаций в гене или белке сплайсосомы.
Скрининг или тестирование на наличие мутаций можно проводить с помощью любых известных способов, например, путем генотипирования, фенотипирования и т. д., посредством амплификации нуклеиновых кислот, электрофореза, микрочипов, блоттинга, функциональных анализов, иммунологических анализов и т. д. Способы скрининга могут включать, например, сбор у указанного субъекта биологического образца, содержащего раковые клетки/раковую ткань.
В некоторых вариантах осуществления субъекта с раком, описанным в данном документе, можно лечить с помощью по меньшей мере одного соединения, выбранного из соединений формулы I (в том числе формул IIa-e, IIIa, IVa и Va) и/или их фармацевтически приемлемых солей, и по меньшей мере одного дополнительного средства терапии.
В некоторых вариантах осуществления по меньшей мере одно дополнительное средство терапии предусматривает средство терапии на основе цитокина или аналога цитокина, например, любое средство терапии на основе цитокина или аналога цитокина, раскрытое в данном документе. Цитокины представляют собой широкую категорию малых белков, которые, как было показано, вовлечены в аутокринную передачу сигнала, паракринную передачу сигнала и/или эндокринную передачу сигнала в качестве иммуномодулирующих средств. Иллюстративные цитокины раскрыты в данном документе и включают хемокины, интерфероны, интерлейкины, лимфокины и факторы некроза опухоли. Применяемый в данном документе термин "цитокин" относится к полипептиду, секретируемому клеткой, который оказывает влияние на функцию других клеток, заключающуюся в опосредовании иммунного ответа, и термин "средство терапии на основе цитокина" относится к введению и/или индуцированию секреции такого пептида. В некоторых вариантах осуществления цитокин представляет собой рекомбинантный цитокин или его аналог. В некоторых вариантах осуществления цитокин представляет собой аналог цитокина. Термины "аналог цитокина" и "средство терапии на основе аналога цитокина" относятся к модифицированному цитокину, где один или несколько аминокислотных остатков нативного цитокина были замещены другими природными или неприродными аминокислотными остатками и/или где один или несколько природных или неприродных аминокислотных остатков были добавлены к нативному цитокину. В некоторых вариантах осуществления средство терапии на основе цитокина или аналога цитокина предусматривает введение по меньшей мере одного цитокина или аналога цитокина пациенту, нуждающемуся в таком лечении.
В некоторых вариантах осуществления по меньшей мере одно дополнительное средство терапии содержит одну или несколько сконструированных T-клеток, целенаправленно воздействующих на опухоль (например, средство терапии на основе CAR-T или других клеток), например, любое средство терапии на основе CAR-T, раскрытое в данном документе. Термины "CAR-T" и "средство терапии на основе CAR-T" используются взаимозаменяемо для обозначения клетки или популяции клеток, модифицированных с помощью CAR (например, T-клетки или популяции T-клеток). В некоторых вариантах осуществления химерный T-клеточный рецептор (CAR) может быть сконструирован с применением антигенраспознающих последовательностей, так что при экспрессии CAR на клетке (например, T-клетке) CAR и/или клетка могут взаимодействовать с антигеном-мишенью. Например, в некоторых вариантах осуществления CAR может быть сконструирован за счет первоначальной идентификации антител, которые распознают домен антигенного белка, экспрессируемый на клеточной поверхности. Затем антигенраспознающие последовательности таких антител могут быть слиты с доменом T-клеточного рецептора для осуществления селективного целенаправленного воздействия и активации. В некоторых вариантах осуществления последовательности CAR клонируют в популяции полученных от пациента T-клеток и обеспечивают размножение клеток с применением доступных в настоящее время протоколов. В некоторых вариантах осуществления затем сконструированные T-клетки переливают обратно в кровоток пациента перед проведением лечения с помощью по меньшей мере одного соединения, выбранного из соединений формулы I (в том числе формул IIa-e, IIIa, IVa и Va) и/или их фармацевтически приемлемых солей, одновременно с ним или после него. В некоторых вариантах осуществления после проведения лечения с помощью по меньшей мере одного соединения и/или фармацевтически приемлемой соли опухолевые клетки могут начать презентировать антиген, например, антиген, на который целенаправленно воздействует популяция сконструированных T-клеток. В некоторых вариантах осуществления популяция сконструированных T-клеток может контактировать с презентирующими антиген опухолевыми клетками и уничтожать их.
В некоторых вариантах осуществления по меньшей мере одно дополнительное средство терапии предусматривает средство терапии на основе ингибитора контрольных точек, например, средство терапии на основе любого ингибитора контрольных точек, раскрытое в данном документе. Контрольные точки иммунного ответа представляют собой ингибиторные пути, которые замедляют или останавливают иммунные реакции и предотвращают избыточное повреждение тканей вследствие неконтролируемой активности иммунных клеток. Применяемые в данном документе термины "ингибитор контрольных точек" и "средство терапии на основе ингибитора контрольных точек" используются взаимозаменяемо для обозначения любого терапевтического средства, в том числе любого низкомолекулярного химического соединения, антитела, молекулы нуклеиновой кислоты или полипептида или любых их фрагментов, которое ингибирует один или несколько ингибиторных путей, за счет чего обеспечивается более функциональная иммунная активность. В некоторых вариантах осуществления средство терапии на основе ингибитора контрольных точек предусматривает введение по меньшей мере одного ингибитора контрольных точек пациенту, нуждающемуся в таком лечении.
В некоторых вариантах осуществления по меньшей мере одно дополнительное средство терапии предусматривает неоантигенную вакцину. В некоторых вариантах осуществления лечение предусматривает введение по меньшей мере одного соединения, выбранного из соединений формулы I (в том числе формул IIa-e, IIIa, IVa и Va) и/или их фармацевтически приемлемых солей, и введение неоантигенной вакцины. В некоторых вариантах осуществления неоантигенная вакцина содержит опухолевый неоантиген и/или неоантиген, индуцированный с помощью по меньшей мере одного соединения, выбранного из соединений формулы I (в том числе формул IIa-e, IIIa, IVa и Va) и/или их фармацевтически приемлемых солей. В некоторых вариантах осуществления лечение дополнительно предусматривает введение средства терапии на основе ингибитора контрольных точек. В некоторых вариантах осуществления средство терапии на основе ингибитора контрольных точек целенаправленно воздействует на PD1/PDL1, CTLA4, OX40, CD40, LAG3, TIM3, GITR и/или KIR. В некоторых вариантах осуществления средство терапии на основе ингибитора контрольных точек целенаправленно воздействует на PD1/PDL1 (например, является антителом к PD1 или антителом к PDL1). В некоторых вариантах осуществления средство терапии на основе ингибитора контрольных точек целенаправленно воздействует на CTLA4 (например, является антителом к CTLA4). В некоторых вариантах осуществления лечение предусматривает введение средства комбинированной терапии, содержащего неоантигенную вакцину, после первоначального (i) введения по меньшей мере одного соединения, выбранного из соединений формулы I (в том числе формул IIa-e, IIIa, IVa и Va) и/или их фармацевтически приемлемых солей, и (ii) обнаружения присутствия неоантигена (например, неоантигена из неоантигенной вакцины). В некоторых вариантах осуществления экспрессиею неоантигена отслеживают на протяжении всего курса лечения. В некоторых вариантах осуществления лечение прекращают, если неоантигены не обнаруживаются.
В некоторых вариантах осуществления в данном документе также раскрыты способы лечения пациента посредством индуцирования образования антигенов в опухолевых клетках, на которые может целенаправленно воздействовать иммунная система пациента, осуществляя клиренс. Не ограничиваясь теорией, в некоторых вариантах осуществления введение по меньшей мере одного соединения, выбранного из соединений формулы I (в том числе формул IIa-e, IIIa, IVa и Va) и/или их фармацевтически приемлемых солей, может обеспечивать продуцирование неоантигенов, которые индуцируют иммунный ответ, индуцируют иммунный ответ на двухнитевую РНК например, в результате повторной экспрессии эндогенных ретровирусов, присутствующих в интроне, и/или продуцирование неоантигенов, которые индуцируют иммуногенную гибель клеток.
Применяемый в данном документе термин "неоантиген" относится к любому антигену, воздействию которого иммунная система ранее не подвергалась, который возникает в результате одной или нескольких опухолеспецифических мутаций и/или в результате воздействия на опухоль по меньшей мере одного соединения, выбранного из соединений формулы I (в том числе формул IIa-e, IIIa, IVa и Va) и/или их фармацевтически приемлемых солей. Опухолеспецифические мутации могут включать миссенс-мутации, сдвиги рамки считывания, транслокации и варианты сплайсинга mRNA, а также мутации, которые влияют на посттрансляционный процессинг, такой как фосфорилирование и гликозилирование. В некоторых вариантах осуществления такие иллюстративные мутации могут быть получены в результате несинонимичных изменений в кодирующей последовательность и/или мутаций, которые изменяют процессинг mRNA (например, сплайсинг). В некоторых вариантах осуществления все из этих иллюстративных мутаций могут приводить к молекулярным изменениям, которые могут распознаваться соответствующим T-клеточным рецептором. В различных вариантах осуществления иллюстративный неоантиген представляет собой неоантиген, образование которого индуцировано доставкой по меньшей мере одного соединения, выбранного из соединений формулы I (в том числе формул IIa-e, IIIa, IVa и Va) и/или их фармацевтически приемлемых солей. В некоторых вариантах осуществления доставка по меньшей мере одного соединения, выбранного из соединений формулы I (в том числе формул IIa-e, IIIa, IVa и Va) и/или их фармацевтически приемлемых солей, может индуцировать новый вариант сплайсинга mRNA, что приводит к трансляции белков, содержащих один или несколько новых пептидных доменов, воздействию которых иммунная система ранее не подвергалась. В некоторых вариантах осуществления опухолеспецифические мутации могут представлять собой варианты сплайсинга mRNA, обусловленные доставкой или введением по меньшей мере одного соединения, выбранного из соединений формулы I (в том числе формул IIa-e, IIIa, IVa и Va) и/или их фармацевтически приемлемых солей.
Не ограничиваясь теорией, в некоторых вариантах осуществления доставка по меньшей мере одного соединения, выбранного из соединений формулы I (в том числе формул IIa-e, IIIa, IVa и Va) и/или их фармацевтически приемлемых солей, может индуцировать новый вариант сплайсинга mRNA (например, пропуск экзона, сохранение интрона), что приводит к изменению открытых рамок считывания и/или кодирующих последовательностей различных генов. В некоторых вариантах осуществления данные измененные гены транслируются в белки, содержащие один или несколько новых пептидных доменов, распознаваемых иммунной системой как чужеродные. В некоторых вариантах осуществления один или несколько новых пептидных доменов не существуют в белках или в любой другой части протеома человека в отсутствие лечения с помощью соединения. В некоторых вариантах осуществления белки, содержащие один или несколько новых пептидных доменов, могут разрушаться под действием протеасомы с образованием новых пептидных фрагментов, которые выступают в качестве субстратов для механизмов иммунопептидной презентации, например, посредством презентации с участием MHC. В некоторых вариантах осуществления новые пептидные фрагменты, представляющие неоантигены, могут быть презентированы в MHC1-связанном пептидоме, например, на опухолевых клетках.
В некоторых вариантах осуществления доставка по меньшей мере одного соединения, выбранного из соединений формулы I (в том числе формул IIa-e, IIIa, IVa и Va) и/или их фармацевтически приемлемых солей, может приводить к одному или нескольким свойственным опухолевым клеткам событиям (например, прекращению роста клеток). В некоторых вариантах осуществления свойственное(-ые) опухолевым клеткам событие(-я) могут приводить к (1) усилению контакта с фагоцитами (Bracci et al. (2014) Cell Death Differ. 21(1):15-25); (2) перемещению новых пептидных фрагментов в дренирующий опухоль лимфатический узел для контакта с антигенпрезентирующими клетками; (3) процессингу в антигенпрезентирующих клетках новых пептидных фрагментов из фагоцитированной опухолевой клетки и презентации фрагментов в качестве неоантигенов популяциям циркулирующих наивных T-клеток; (4) взаимодействию новых пептидных фрагментов с T-клетками, экспрессирующими рецепторы, которые распознают фрагменты в качестве неоантигенов; (5) созреванию и активации эффекторных T-клеток, обуславливающих ответы (например, CD4+ и/или CD8+ T-клеток); и/или (6) контакту T-клеток с дополнительными опухолевыми клетками, подвергнутыми обработке с помощью соединения и презентирующими новые пептидные фрагменты, представляющие собой неоантигены, на своей поверхности в составе комплексов с MHC1. В некоторых вариантах осуществления свойственное(-ые) опухолевым клеткам событие(-я) может(-гут) приводить либо непосредственно, либо опосредованно к привлечению T-клеток с эффекторной функцией и/или уничтожению опухолевых клеток, презентирующих неоантиген.
Также, не ограничиваясь теорией, в некоторых вариантах осуществления доставка по меньшей мере одного соединения, выбранного из соединений формулы I (в том числе формул IIa-e, IIIa, IVa и Va) и/или их фармацевтически приемлемых солей, может вызывать повторную экспрессию эндогенных ретровирусов, присутствующих в интроне, что приводит к иммунному ответу на двухнитевую РНК.
Кроме того, не ограничиваясь теорией, в некоторых вариантах осуществления доставка по меньшей мере одного соединения, выбранного из соединений формулы I (в том числе формул IIa-e, IIIa, IVa и Va) и/или их фармацевтически приемлемых солей, может приводить к иммуногенной гибели клеток, запускаемой индуцированным соединением высвобождением неоантигенов, образованных в результате мутации. В некоторых вариантах осуществления доставка по меньшей мере одного соединения, выбранного из соединений формулы I (в том числе формул IIa-e, IIIa, IVa и Va) и/или их фармацевтически приемлемых солей, может индуцировать иммунный ответ на двухнитевую РНК. В некоторых вариантах осуществления иммунный ответ на двухнитевую РНК может возникать в результате повторной экспрессии эндогенных ретровирусов, присутствующих в интроне. В некоторых вариантах осуществления иммунный ответ на двухнитевую РНК может приводить к гибели опухолевых клеток. В некоторых вариантах осуществления доставка по меньшей мере одного соединения, выбранного из соединений формулы I (в том числе формул IIa-e, IIIa, IVa и Va) и/или их фармацевтически приемлемых солей, может индуцировать иммуногенную гибель клеток. В некоторых вариантах осуществления иммуногенная гибель клеток может быть вызвана высвобождением образованных в результате мутации неоантигенов и/или иммунным ответом хозяина на опухолевые клетки.
Соответственно, в некоторых вариантах осуществления раскрыты способы лечения, включающие индуцирование образования неоантигенов посредством введения одного или нескольких соединений, выбранных из соединений формулы I (в том числе формул IIa-e, IIIa, IVa и Va) и/или их фармацевтически приемлемых солей. В некоторых вариантах осуществления способ включает введение сниженной дозировки по меньшей мере одного соединения, выбранного из соединений формулы I (в том числе формул IIa-e, IIIa, IVa и Va) и/или их фармацевтически приемлемых солей, чем было бы необходимо в случае отсутствия индуцирования образования неоантигенов. В некоторых вариантах осуществления способ включает введение одной или нескольких начальных индуцирующих доз для продуцирования неоантигенов и индуцирования иммунного ответа (например, превращения наивных T-клеток в клетки памяти) с последующим снижением дозировки или частоты введения (т. е. вследствие комбинированного эффекта по меньшей мере одного соединения, выбранного из соединений формулы I (в том числе формул IIa-e, IIIa, IVa и Va) и/или их фармацевтически приемлемых солей, и иммунного целенаправленного воздействия на неоантигены). В некоторых вариантах осуществления лечение может предусматривать введение комбинации из по меньшей мере одного соединения, выбранного из соединений формулы I (в том числе формул IIa-e, IIIa, IVa и Va) и/или их фармацевтически приемлемых солей, для индуцирования иммунного ответа на основе неоантигенов и по меньшей мере одного дополнительного средства терапии (например, второго средства противораковой терапии). Например, в некоторых вариантах осуществления лечение может предусматривать введение комбинации из по меньшей мере одного соединения, выбранного из соединений формулы I (в том числе формул IIa-e, IIIa, IVa и Va) и/или их фармацевтически приемлемых солей, для индуцирования иммунного ответа на основе неоантигенов и одного или нескольких ингибиторов контрольных точек. В некоторых вариантах осуществления лечение может предусматривать введение комбинации из по меньшей мере одного соединения, выбранного из соединений формулы I (в том числе формул IIa-e, IIIa, IVa и Va) и/или их фармацевтически приемлемых солей, для индуцирования иммунного ответа на основе неоантигенов и одного или нескольких цитокинов или аналогов цитокина. В некоторых вариантах осуществления лечение может предусматривать введение комбинации из по меньшей мере одного соединения, выбранного из соединений формулы I (в том числе формул IIa-e, IIIa, IVa и Va) и/или их фармацевтически приемлемых солей, для индуцирования иммунного ответа на основе неоантигенов и одной или нескольких неоантигенных вакцин. В некоторых других вариантах осуществления лечение может предусматривать введение комбинации из по меньшей мере одного соединения, выбранного из соединений формулы I (в том числе формул IIa-e, IIIa, IVa и Va) и/или их фармацевтически приемлемых солей, для индуцирования иммунного ответа на основе неоантигенов и одной или нескольких сконструированных T-клеток, целенаправленно воздействующих на опухоль (например, CAR-T).
В некоторых вариантах осуществления неоантигены могут применяться для отслеживания эффективности лечения с помощью по меньшей мере одного соединения, выбранного из соединений формулы I (в том числе формул IIa-e, IIIa, IVa и Va) и/или их фармацевтически приемлемых солей. Например, после введения по меньшей мере одного соединения, выбранного из соединений формулы I (в том числе формул IIa-e, IIIa, IVa и Va) и/или их фармацевтически приемлемых солей, можно получить образец от пациента (например, биоптат опухоли) и подвергнуть его скринингу в отношении неоантигенов или маркеров иммунного или воспалительного ответа. Если неоантиген и/или иммунный ответ обнаружены, может проводиться дополнительное лечение, например, при сниженной дозировке.
В некоторых вариантах осуществления раскрыты способы лечения, включающие индуцирование иммунного ответа на двухнитевую РНК посредством введения одного или нескольких соединений, выбранных из соединений формулы I (в том числе формул IIa-e, IIIa, IVa и Va) и/или их фармацевтически приемлемых солей.
В некоторых вариантах осуществления раскрыты способы лечения, включающие индуцирование иммуногенной гибели клеток посредством введения одного или нескольких соединений, выбранных из соединений формулы I (в том числе формул IIa-e, IIIa, IVa и Va) и/или их фармацевтически приемлемых солей.
В некоторых вариантах осуществления введение по меньшей мере одного соединения, выбранного из соединений формулы I (в том числе формул IIa-e, IIIa, IVa и Va) и/или их фармацевтически приемлемых солей, можно комбинировать с любым известным средством противораковой терапии. Примеры существующих в настоящее время стратегий активации иммунитета, доступных для лечения онкологических заболеваний, включают без ограничения лечение с помощью молекул, являющихся ингибиторами контрольных точек иммунного ответа (ICI), лечение с помощью цитокинов или аналогов цитокина, вакцинацию с помощью противоопухолевых вакцин и конструирование T-клеток, целенаправленно воздействующих на опухоль (например, размножения инфильтрирующих опухоли лимфоцитов или CAR-T). Эти технологии преимущественно направлены на усиление или индуцирование иммунного ответа на уже существующие опухолевые антигены (либо мутации, либо аберрантную экспрессию белков клеточной поверхности). Одна или несколько из этих стратегий могут предусматривать одну или несколько мутаций, которые способны индуцировать развитие T-клеточного ответа на антиген. Например, ответы пациента на ингибирование контрольных точек могут коррелировать с мутационной нагрузкой с несинонимичными изменениями. Кроме того, могут применяться подходы с использованием противораковой вакцины, которые основаны на предварительно существующих мутациях и антигенности этих мутаций.
Соединения формулы I (в том числе формул IIa-e, IIIa, IVa и Va) и/или их фармацевтически приемлемых соли могут индуцировать широкий спектр изменений в транскриптоме, которые возникают в клетках разного происхождения. Трансляция этих измененных mRNA может обеспечивать стабильные и воспроизводимые измененные белки, которые продуцируют MHC1-связываемые неопептиды, характеризующиеся высокой аффинностью с различными изотипами молекул HLA. Не ограничиваясь теорией, вследствие большого числа изменений в транскриптоме и протеоме лечение с помощью по меньшей мере одного соединения, выбранного из соединений формулы I (в том числе формул IIa-e, IIIa, IVa и Va) и/или их фармацевтически приемлемых солей, может увеличивать число потенциально реакционноспособных неоантигенов для улучшенного вовлечения их в адаптивный иммунный ответ.
В некоторых вариантах осуществления в настоящем изобретении предусмотрен способ индуцирования образования по меньшей мере одного неоантигена путем приведения неопластической клетки в контакт с эффективным количеством по меньшей мере одного соединения, выбранного из соединений формулы I (в том числе формул IIa-e, IIIa, IVa и Va) и/или их фармацевтически приемлемых солей. В некоторых вариантах осуществления в настоящем изобретении предусмотрен способ индуцирования иммунного ответа на двунитевую РНК путем приведения неопластической клетки в контакт с эффективным количеством по меньшей мере одного соединения, выбранного из соединений формулы I (в том числе формул IIa-e, IIIa, IVa и Va) и/или их фармацевтически приемлемых солей. В некоторых вариантах осуществления в настоящем изобретении предусмотрен способ индуцирования иммуногенной гибели клеток путем приведения неопластической клетки в контакт с эффективным количеством по меньшей мере одного соединения, выбранного из соединений формулы I (в том числе формул IIa-e, IIIa, IVa и Va) и/или их фармацевтически приемлемых солей.
В некоторых вариантах осуществления неопластическая клетка находится в культуре клеток in vitro. В некоторых вариантах осуществления неопластическая клетка получена от субъекта. В некоторых вариантах осуществления неопластическая клетка находится в субъекте. В некоторых вариантах осуществления неопластическая клетка получена из гематологического злокачественного новообразования или солидной опухоли. В некоторых вариантах осуществления гематологическое злокачественное новообразование выбрано из B-клеточного злокачественного новообразования, лейкоза, лимфомы и миеломы. В некоторых вариантах осуществления гематологическое злокачественное новообразование выбрано из острого миелоидного лейкоза и множественной миеломы. В некоторых вариантах осуществления солидная опухоль выбрана из рака молочной железы (например, HER2-положительного рака молочной железы), рака желудка (например, аденокарциномы желудка), рака предстательной железы, рака яичника, рака легкого (например, аденокарциномы легкого), рака матки (например, серозной карциномы эндометрия матки), карциномы слюнных протоков, меланомы, рака толстой кишки и рака пищевода. В некоторых вариантах осуществления солидная опухоль выбрана из HER2-положительного рака молочной железы, аденокарциномы желудка и рака предстательной железы.
В некоторых вариантах осуществления в настоящем изобретении дополнительно предусмотрен способ индуцирования образования по меньшей мере одного неоантигена и/или развития T-клеточного ответа у субъекта, у которого имеется неопластическое нарушение или подозрение на его наличие, посредством введения субъекту эффективного количества по меньшей мере одного соединения, выбранного из соединений формулы I (в том числе формул IIa-e, IIIa, IVa и Va) и/или их фармацевтически приемлемых солей. Также в данном документе в некоторых вариантах осуществления предусмотрен способ лечения субъекта, у которого имеется неопластическое нарушение или подозрение на его наличие, посредством введения субъекту эффективного количества по меньшей мере одного соединения, выбранного из соединений формулы I (в том числе формул IIa-e, IIIa, IVa и Va) и/или их фармацевтически приемлемых солей, где введение по меньшей мере одного соединения, выбранного из соединений формулы I (в том числе формул IIa-e, IIIa, IVa и Va) и/или их фармацевтически приемлемых солей, индуцирует образование по меньшей мере одного неоантигена и/или развитие T-клеточного ответа.
В различных других вариантах осуществления в настоящем изобретении предусмотрен способ индуцирования иммунного ответа на двухнитевую РНК у субъекта, у которого имеется неопластическое нарушение или подозрение на его наличие, посредством введения субъекту эффективного количества по меньшей мере одного соединения, выбранного из соединений формулы I (в том числе формул IIa-e, IIIa, IVa и Va) и/или их фармацевтически приемлемых солей. Также в некоторых вариантах осуществления в данном документе предусмотрен способ лечения субъекта, у которого имеется неопластическое нарушение или подозрение на его наличие, посредством введения субъекту эффективного количества по меньшей мере одного соединения, выбранного из соединений формулы I (в том числе формул IIa-e, IIIa, IVa и Va) и/или их фармацевтически приемлемых солей, где введение по меньшей мере одного соединения, выбранного из соединений формулы I (в том числе формул IIa-e, IIIa, IVa и Va) и/или их фармацевтически приемлемых солей, индуцирует иммунный ответ на двухнитевую РНК.
В еще одних вариантах осуществления в настоящем изобретении предусмотрен способ индуцирования иммуногенной гибели клеток у субъекта, у которого имеется неопластическое нарушение или подозрение на его наличие, посредством введения субъекту эффективного количества по меньшей мере одного соединения, выбранного из соединений формулы I (в том числе формул IIa-e, IIIa, IVa и Va) и/или их фармацевтически приемлемых солей. Кроме того, в некоторых вариантах осуществления в данном документе предусмотрен способ лечения субъекта, у которого имеется неопластическое нарушение или подозрение на его наличие, посредством введения субъекту эффективного количества по меньшей мере одного соединения, выбранного из соединений формулы I (в том числе формул IIa-e, IIIa, IVa и Va) и/или их фармацевтически приемлемых солей, предусматривающего по меньшей мере одно соединение, выбранное из соединений формулы I (в том числе формул IIa-e, IIIa, IVa и Va) и/или их фармацевтически приемлемых солей, где введение по меньшей мере одного соединения, выбранного из соединений формулы I (в том числе формул IIa-e, IIIa, IVa и Va) и/или их фармацевтически приемлемых солей, индуцирует иммуногенную гибель клеток.
В некоторых вариантах осуществления в настоящем изобретении дополнительно предусмотрен способ лечения субъекта, у которого имеется неопластическое нарушение или подозрение на его наличие, посредством введения субъекту эффективного количества по меньшей мере одного соединения, выбранного из соединений формулы I (в том числе формул IIa-e, IIIa, IVa и Va) и/или их фармацевтически приемлемых солей, где введение по меньшей мере одного соединения, выбранного из соединений формулы I (в том числе формул IIa-e, IIIa, IVa и Va) и/или их фармацевтически приемлемых солей, индуцирует иммуногенную гибель клеток, в комбинации с одним или несколькими дополнительными средствами терапии, содержащими второе средство.
В некоторых вариантах осуществления терапевтических способов, описанных в данном документе, количество по меньшей мере одного соединения, выбранного из соединений формулы I (в том числе формул IIa-e, IIIa, IVa и Va) и/или их фармацевтически приемлемых солей, или второго вводимого средства снижено вследствие индуцирования образования по меньшей мере одного неоантигена и/или развития T-клеточного ответа по сравнению со стандартной дозировкой по меньшей мере одного соединения, выбранного из соединений формулы I (в том числе формул IIa-e, IIIa, IVa и Va) и/или их фармацевтически приемлемых солей, или второго средства. В некоторых вариантах осуществления вводимое количество по меньшей мере одного соединения, выбранного из соединений формулы I (в том числе формул IIa-e, IIIa, IVa и Va) и/или их фармацевтически приемлемых солей, или второго средства снижено на 10%, 15%, 20%, 25%, 30%, 35%, 40%, 45%, 50%, 75% или 90% по сравнению со стандартной дозировкой по меньшей мере одного соединения, выбранного из соединений формулы I (в том числе формул IIa-e, IIIa, IVa и Va) и/или их фармацевтически приемлемых солей, или второго средства. В некоторых вариантах осуществления частота введения по меньшей мере одного соединения, выбранного из соединений формулы I (в том числе формул IIa-e, IIIa, IVa и Va) и/или их фармацевтически приемлемых солей, или второго средства на по меньшей мере 10%, 15%, 20%, 25%, 30%, 35%, 40%, 45%, 50%, 75% или 90% меньше по сравнению со стандартной схемой введения по меньшей мере одного соединения, выбранного из соединений формулы I (в том числе формул IIa-e, IIIa, IVa и Va) и/или их фармацевтически приемлемых солей, или второго средства. В некоторых вариантах осуществления вводимое количество и/или дозировка по меньшей мере одного соединения, выбранного из соединений формулы I (в том числе формул IIa-e, IIIa, IVa и Va) и/или их фармацевтически приемлемых солей, или второго средства приводят к более низкой системной токсичности и/или улучшенной переносимости.
Применяемый в данном документе термин "стандартная дозировка" или "стандартная схема введения" относится к любой обычной или общепринятой схеме введения терапевтического средства, например, к схеме, предложенной производителем, одобренной регулирующими органами или иным образом протестированной на субъектах-людях для удовлетворения потребностей среднестатистического пациента. В некоторых вариантах осуществления терапевтическое средство представляет собой по меньшей мере одно соединение, выбранное из соединений формулы I (в том числе формул IIa-e, IIIa, IVa и Va) и/или их фармацевтически приемлемых солей, с противораковой активностью.
Например, стандартная схема введения трастузумаба, иллюстративного антитела к HER2, может предусматривать внутривенное введение 8 мг/кг за 90 мин. (неделя 1), а затем внутривенное введение 6 мг/кг за 30-90 мин. через каждые 3 недели (от недели 4 до конца цикла терапии) (Herceptin® (трастузумаб), дополнение к маркировке, соответствующей требованиям FDA, 2017).
В качестве другого примера, стандартная схема введения ипилимумаба, иллюстративного антитела к CTLA4, являющегося ингибитором контрольных точек, может предусматривать внутривенное введение 3 мг/кг за 90 мин. через каждые 3 недели в виде 4 доз (Yervoy® (ипилимумаб), дополнение к маркировке, соответствующей требованиям FDA, 2018). Другая стандартная схема введения ипилимумаба может предусматривать внутривенное введение 10 мг/кг за 90 мин. через каждые 3 недели в виде 4 доз, а затем 10 мг/кг через каждые 12 недель в течение не более 3 лет (Yervoy® (ипилимумаб), дополнение к маркировке, соответствующей требованиям FDA, 2018).
В качестве другого примера, стандартная схема введения ниволумаба, иллюстративного антитела к PD1, являющегося ингибитором контрольных точек, может предусматривать внутривенное введение 3 мг/кг за 60 мин. через каждые 2 недели (Opdivo® (ниволумаб), маркировка, соответствующая требованиям FDA, 2015).
В качестве другого примера, стандартная схема введения атезолизумаба, иллюстративного антитела к PDL1, являющегося ингибитором контрольных точек, может предусматривать внутривенное введение 1200 мг за 60 мин. через каждые 3 недели (Tecentriq® (атезолизумаб), дополнение к маркировке, соответствующей требованиям FDA, 2018).
В качестве еще одного примера, стандартная схема введения T-DM1, иллюстративного конъюгата антитела к HER2 и лекарственного средства, может предусматривать внутривенное введение 3,6 мг/кг за 90 мин. через каждые 3 недели (Kadcyla® (T-DM1), дополнение к маркировке, соответствующей требованиям FDA, 2016).
В некоторых вариантах осуществления способы, описанные в данном документе, могут дополнительно включать введение по меньшей мере одного дополнительного средства терапии (например, ингибитора контрольных точек, неоантигенной вакцины, цитокина или аналога цитокина, CAR-T и т. д.). В некоторых вариантах осуществления количество вводимых по меньшей мере одного соединения, выбранного из соединений формулы I (в том числе формул IIa-e, IIIa, IVa и Va) и/или их фармацевтически приемлемых солей, и/или по меньшей мере одного дополнительного средства терапии снижено вследствие индуцирования образования по меньшей мере одного неоантигена и/или развития T-клеточного ответа по сравнению со стандартной дозировкой по меньшей мере одного соединения, выбранного из соединений формулы I (в том числе формул IIa-e, IIIa, IVa и Va) и/или их фармацевтически приемлемых солей, и/или по меньшей мере одного дополнительного средства терапии. В некоторых вариантах осуществления вводимое количество по меньшей мере одного соединения, выбранного из соединений формулы I (в том числе формул IIa-e, IIIa, IVa и Va) и/или их фармацевтически приемлемых солей, и/или по меньшей мере одного дополнительного средства терапии снижено вследствие индуцирования иммунного ответа на двухнитевую РНК по сравнению со стандартной дозировкой по меньшей мере одного соединения, выбранного из соединений формулы I (в том числе формул IIa-e, IIIa, IVa и Va) и/или их фармацевтически приемлемых солей, и/или по меньшей мере одного дополнительного средства терапии. В некоторых вариантах осуществления вводимое количество по меньшей мере одного соединения, выбранного из соединений формулы I (в том числе формул IIa-e, IIIa, IVa и Va) и/или их фармацевтически приемлемых солей, и/или по меньшей мере одного дополнительного средства терапии снижено вследствие индуцирования иммуногенной гибели клеток по сравнению со стандартной дозировкой по меньшей мере одного соединения, выбранного из соединений формулы I (в том числе формул IIa-e, IIIa, IVa и Va) и/или их фармацевтически приемлемых солей, и/или по меньшей мере одного дополнительного средства терапии. В некоторых вариантах осуществления вводимое количество по меньшей мере одного соединения, выбранного из соединений формулы I (в том числе формул IIa-e, IIIa, IVa и Va) и/или их фармацевтически приемлемых солей, и/или по меньшей мере одного дополнительного средства терапии снижено на 10%, 15%, 20%, 25%, 30%, 35%, 40%, 45%, 50%, 75% или 90% по сравнению со стандартной дозировкой по меньшей мере одного соединения, выбранного из соединений формулы I (в том числе формул IIa-e, IIIa, IVa и Va) и/или их фармацевтически приемлемых солей, и/или по меньшей мере одного дополнительного средства терапии. В некоторых вариантах осуществления частота введения по меньшей мере одного соединения, выбранного из соединений формулы I (в том числе формул IIa-e, IIIa, IVa и Va) и/или их фармацевтически приемлемых солей, и/или по меньшей мере одного дополнительного средства на по меньшей мере 10%, 15%, 20%, 25%, 30%, 35%, 40%, 45%, 50%, 75% или 90% меньше по сравнению со стандартной схемой введения по меньшей мере одного соединения, выбранного из соединений формулы I (в том числе формул IIa-e, IIIa, IVa и Va) и/или их фармацевтически приемлемых солей, и/или по меньшей мере одного дополнительного средства терапии. В некоторых вариантах осуществления вводимое количество и/или дозировка по меньшей мере одного соединения, выбранного из соединений формулы I (в том числе формул IIa-e, IIIa, IVa и Va) и/или их фармацевтически приемлемых солей, и/или по меньшей мере одного дополнительного средства терапии приводят к более низкой системной токсичности и/или улучшенной переносимости.
В некоторых вариантах осуществления введение по меньшей мере одного соединения, выбранного из соединений формулы I (в том числе формул IIa-e, IIIa, IVa и Va) и/или их фармацевтически приемлемых солей, начинают до введения по меньшей мере одного дополнительного средства терапии. В других вариантах осуществления введение по меньшей мере одного соединения, выбранного из соединений формулы I (в том числе формул IIa-e, IIIa, IVa и Va) и/или их фармацевтически приемлемых солей, начинают после введения по меньшей мере одного дополнительного средства терапии. В еще одних вариантах осуществления введение по меньшей мере одного соединения, выбранного из соединений формулы I (в том числе формул IIa-e, IIIa, IVa и Va) и/или их фармацевтически приемлемых солей, начинают одновременно с введением по меньшей мере одного дополнительного средства терапии.
В некоторых вариантах осуществления введение по меньшей мере одного соединения, выбранного из соединений формулы I (в том числе формул IIa-e, IIIa, IVa и Va) и/или их фармацевтически приемлемых солей, повторяют по меньшей мере один раз после начального введения. В некоторых вариантах осуществления количество по меньшей мере одного соединения, выбранного из соединений формулы I (в том числе формул IIa-e, IIIa, IVa и Va) и/или их фармацевтически приемлемых солей, применяемое для повторного введения, снижено по сравнению с количеством, применяемым для начального введения. В некоторых вариантах осуществления количество по меньшей мере одного соединения, выбранного из соединений формулы I (в том числе формул IIa-e, IIIa, IVa и Va) и/или их фармацевтически приемлемых солей, применяемое для повторного введения, снижено по сравнению со стандартной дозировкой по меньшей мере одного соединения, выбранного из соединений формулы I (в том числе формул IIa-e, IIIa, IVa и Va) и/или их фармацевтически приемлемых солей. В некоторых вариантах осуществления количество по меньшей мере одного соединения, выбранного из соединений формулы I (в том числе формул IIa-e, IIIa, IVa и Va) и/или их фармацевтически приемлемых солей, применяемое для повторного введения, снижено на 10%, 15%, 20%, 25%, 30%, 35%, 40%, 45%, 50%, 75% или 90% по сравнению со стандартной дозировкой или начальной дозировкой по меньшей мере одного соединения, выбранного из соединений формулы I (в том числе формул IIa-e, IIIa, IVa и Va) и/или их фармацевтически приемлемых солей.
В некоторых вариантах осуществления введение по меньшей мере одного дополнительного средства терапии повторяют по меньшей мере один раз после начального введения. В некоторых вариантах осуществления количество по меньшей мере одного дополнительного средства терапии, применяемое для повторного введения, снижено по сравнению с количеством, применяемым для начального введения. В некоторых вариантах осуществления количество по меньшей мере одного дополнительного средства терапии, применяемое для повторного введения, снижено по сравнению со стандартной дозировкой по меньшей мере одного дополнительного средства терапии. В некоторых вариантах осуществления количество по меньшей мере одного дополнительного средства терапии, применяемое для повторного введения, снижено на 10%, 15%, 20%, 25%, 30%, 35%, 40%, 45%, 50%, 75% или 90% по сравнению со стандартной дозировкой или начальной дозировкой по меньшей мере одного дополнительного средства терапии.
В некоторых вариантах осуществления повторное введение по меньшей мере одного соединения, выбранного из соединений формулы I (в том числе формул IIa-e, IIIa, IVa и Va) и/или их фармацевтически приемлемых солей, осуществляют одновременно с повторным введением по меньшей мере одного дополнительного средства терапии. В некоторых вариантах введение по меньшей мере одного соединения, выбранного из соединений формулы I (в том числе формул IIa-e, IIIa, IVa и Va) и/или их фармацевтически приемлемых солей, осуществляют последовательно или с разнесением во времени с повторным введением по меньшей мере одного дополнительного средства терапии.
В некоторых вариантах осуществления по меньшей мере одно дополнительное средство терапии предусматривает введение ингибитора контрольных точек, например, любого ингибитора контрольных точек, раскрытого в данном документе. В некоторых вариантах осуществления субъект характеризуется непереносимостью, невосприимчивостью или недостаточной восприимчивостью ингибитора контрольных точек при введении его по отдельности. В некоторых вариантах осуществления ингибитор контрольных точек целенаправленно воздействует на PD1/PDL1, CTLA4, OX40, CD40, LAG3, TIM3, GITR и/или KIR. В некоторых вариантах осуществления ингибитор контрольных точек целенаправленно воздействует на CTLA4, OX40, CD40 и/или GITR. В некоторых вариантах осуществления ингибитор контрольных точек представляет собой антитело, обладающее активностью ингибитора или агониста в отношении своей мишени. В некоторых вариантах осуществления целенаправленное воздействие ингибитора контрольных точек обеспечивается с помощью ингибиторного антитела или другой подобной ингибиторной молекулы. В других вариантах осуществления целенаправленное воздействие ингибитора контрольных точек обеспечивается с помощью антитела-агониста или другой подобной молекулы-агониста.
В некоторых других вариантах осуществления по меньшей мере одно дополнительное средство терапии предусматривает введение неоантигенной вакцины, например, любой неоантигенной вакцины, раскрытой в данном документе. В некоторых вариантах осуществления по меньшей мере одно соединение, выбранное из соединений формулы I (в том числе формул IIa-e, IIIa, IVa и Va) и/или их фармацевтически приемлемых солей, вводят до введения неоантигенной вакцины. В некоторых вариантах осуществления по меньшей мере одно соединение, выбранное из соединений формулы I (в том числе формул IIa-e, IIIa, IVa и Va) и/или их фармацевтически приемлемых солей, вводят после введения неоантигенной вакцины. В некоторых вариантах осуществления по меньшей мере одно соединение, выбранное из соединений формулы I (в том числе формул IIa-e, IIIa, IVa и Va) и/или их фармацевтически приемлемых солей, вводят одновременно с введением неоантигенной вакцины. В некоторых вариантах осуществления введение по меньшей мере одного соединения, выбранного из соединений формулы I (в том числе формул IIa-e, IIIa, IVa и Va) и/или их фармацевтически приемлемых солей, повторяют по меньшей мере один раз после начального введения. В некоторых вариантах осуществления количество по меньшей мере одного соединения, выбранного из соединений формулы I (в том числе формул IIa-e, IIIa, IVa и Va) и/или их фармацевтически приемлемых солей, применяемое для повторного введения, снижено по сравнению с количеством, применяемым для начального введения.
В некоторых вариантах осуществления неоантигенная вакцина содержит по меньшей мере один неоантигенный пептид. В некоторых вариантах осуществления длина по меньшей мере одного неоантигенного пептида находится в диапазоне от приблизительно 10 до приблизительно 50 аминокислот. В некоторых вариантах осуществления длина по меньшей мере одного неоантигенного пептида находится в диапазоне от приблизительно 10 до приблизительно 35 аминокислот. В некоторых вариантах осуществления длина по меньшей мере одного неоантигенного пептида находится в диапазоне от приблизительно 15 до приблизительно 25 аминокислот. В некоторых вариантах осуществления по меньшей мере один неоантигенный пептид содержит одну или более чем одну неоантигенную последовательность.
В некоторых вариантах осуществления длина неоантигенной последовательности и/или антигенной части находится в диапазоне от приблизительно 10 до приблизительно 50 аминокислот. В некоторых вариантах осуществления длина по меньшей мере одного неоантигенного пептида находится в диапазоне от приблизительно 10 до приблизительно 35 аминокислот. В некоторых вариантах осуществления длина неоантигенной последовательности и/или антигенной части находится в диапазоне от приблизительно 15 до приблизительно 25 аминокислот. В некоторых вариантах осуществления длина неоантигенной последовательности и/или антигенной части находится в диапазоне от приблизительно 10 до приблизительно 20 аминокислот. В некоторых вариантах осуществления неоантигенная последовательность и/или антигенная часть непосредственно не перекрываются с канонической пептидной последовательностью (например, любой из иллюстративных канонических пептидных последовательностей, подчеркнутых в таблице 3) или не состоят из нее.
Применяемый в данном документе термин "антигенная часть" или "антигенный фрагмент" неоантигенной последовательности относится к одному или нескольким фрагментам неоантигенной последовательности, которые сохраняют способность индуцировать T-клеточный ответ (например, антиген-специфическое размножение и/или созревание популяции(-ий) эффекторных T-клеток). В некоторых вариантах осуществления антигенная часть может также сохранять способность к интернализации, процессингу и/или презентированию антигенпрезентирующими клетками (например, дендритными клетками). В некоторых вариантах осуществления антигенная часть также сохраняет функцию примирования T-клеток. В некоторых вариантах осуществления длина антигенной части неоантигенной последовательности находится в диапазоне от приблизительно 10 до приблизительно 50 аминокислот. В некоторых вариантах осуществления длина антигенной части неоантигенной последовательности находится в диапазоне от приблизительно 10 до приблизительно 35 аминокислот. В некоторых вариантах осуществления длина антигенной части неоантигенной последовательности находится в диапазоне от приблизительно 15 до приблизительно 25 аминокислот. В некоторых вариантах осуществления длина антигенной части неоантигенной последовательности находится в диапазоне от приблизительно 10 до приблизительно 20 аминокислот. В некоторых вариантах осуществления антигенную часть неоантигенной последовательности (например, антигенная часть под любым из SEQ ID NO: 30-57) или кодирующую ее mRNA составляют в виде неоантигенной вакцины.
Иллюстративный вариант осуществления антигенной части представляет собой участок(участки), фланкирующий(-ие) аминокислоты 45-53 из SEQ ID NO: 30. Другой иллюстративный вариант осуществления антигенной части представляет собой участок(участки), фланкирующий(-ие) аминокислоты 82-90 из SEQ ID NO: 30. В некоторых вариантах осуществления антигенная часть способна связываться с по меньшей мере одним аллелем HLA, экспрессируемым у субъекта (например, HLA-A*02:01). В некоторых других вариантах осуществления антигенная часть способна связываться с по меньшей мере одним аллелем HLA, экспрессируемым у по меньшей мере 10%, по меньшей мере 15%, по меньшей мере 20%, по меньшей мере 25%, по меньшей мере 30%, по меньшей мере 35%, по меньшей мере 40% или по меньшей мере 45% субъектов в популяции субъектов, страдающих неопластическим нарушением. В некоторых вариантах осуществления антигенная часть способна вызывать T-клеточный ответ в отношении опухоли, присутствующей у по меньшей мере 1%, по меньшей мере 5% или по меньшей мере 10% популяции субъектов, страдающих неопластическим нарушением.
В некоторых вариантах осуществления антигенная часть непосредственно не перекрывается с канонической пептидной последовательностью или не состоит из нее. Применяемый в данном документе термин "каноническая пептидная последовательность" относится к любой непрерывной пептидной последовательности, присутствующей в протеоме человека в отсутствие контакта с по меньшей мере одним соединением, выбранным из соединений формулы I (в том числе формул IIa-e, IIIa, IVa и Va) и/или их фармацевтически приемлемых солей (например, в отсутствие контакта с по меньшей мере одним соединением, выбранным из соединений формулы I (в том числе формул IIa-e, IIIa, IVa и Va) и/или их фармацевтически приемлемых солей), и/или воздействию которой иммунная система ранее подвергалась. В некоторых вариантах осуществления каноническая пептидная последовательность происходит из открытой рамки считывания канонического транскрипта и/или кодируется ею. Иллюстративные канонические пептидные последовательности подчеркнуты в таблице 3.
В некоторых вариантах осуществления, если вводят соединение, выбранное из соединений формулы I (в том числе формул IIa-e, IIIa, IVa и Va) и/или их фармацевтически приемлемых солей, каноническая пептидная последовательность может быть получена из 24 нуклеотидов, расположенных непосредственно на 5'-конце рамки до события аберрантного сплайсинга, индуцированного по меньшей мере одним соединением, выбранным из соединений формулы I (в том числе формул IIa-e, IIIa, IVa и Va) и/или их фармацевтически приемлемых солей, и/или может кодироваться ими. Таким образом, в некоторых вариантах осуществления каноническая пептидная последовательность содержит или состоит из 8 аминокислот, расположенных непосредственно в направлении N-конца относительно неоантигенной последовательности, образование которой индуцировано по меньшей мере одним соединением, выбранным из соединений формулы I (в том числе формул IIa-e, IIIa, IVa и Va) и/или их фармацевтически приемлемых солей. В некоторых вариантах осуществления, если последовательность 5'-концевого экзона заканчивается концевым нуклеотидом кодона, каноническая пептидная последовательность заканчивается в конце экзона. В некоторых других вариантах осуществления, если последовательность 5'-концевого экзона заканчивается одним или двумя из трех нуклеотидов кодона, каноническая пептидная последовательность получена из 24 нуклеотидов, предшествующих неполному кодону, и/или кодируется ими. В некоторых вариантах осуществления 3'-концевые последовательности mRNA при событии аберрантного сплайсинга могут транслироваться в той же открытой рамке считывания, полученной 5'-концевого экзона вплоть до достижения стоп-кодона, после чего трансляция может заканчиваться. В некоторых вариантах осуществления, если событие аберрантного сплайсинга (например, пропуск экзона) приводит к сохранению открытой рамки считывания канонического транскрипта, C-концевая последовательность может транслироваться на дополнительные 24 нуклеотида, кодирующих 8 C-концевых аминокислот. В некоторых вариантах осуществления в данном контексте только участок вдоль аберрантного соединения экзонов может кодировать неоантигенную последовательность. В некоторых вариантах осуществления, если открытая рамка считывания сдвинута (например, при сохранении интрона), полная C-концевая последовательность (кодируемая 3'-концевой mRNA) может кодировать неоантигенную последовательность.
В некоторых вариантах осуществления антигенная часть неоантигенной последовательности выбрана посредством сравнения неоантигенной последовательности с канонической пептидной последовательностью и выбора части неоантигенной последовательности, которая непосредственно не перекрывается с канонической пептидной последовательностью, не состоит из нее и/или не выравнивается с ней. В некоторых вариантах осуществления антигенную часть неоантигенной последовательности можно подвергать скринингу в отношении антигенности и/или функции примирования T-клеток таким же образом, как и полноразмерные неоантигенные последовательности (например, неоантигенную последовательность, из которой получена антигенная часть). В некоторых вариантах осуществления антигенную часть неоантигенной последовательности оценивают в отношении антигенности и/или функции примирования T-клеток с применением анализа примирования T-клеток, такого как иллюстративные эксперименты с примированием T-клеток, описанные в данном документе.
В некоторых вариантах осуществления неоантигенная последовательность представляет собой неоантигенную последовательность, специфическую для субъекта. В некоторых вариантах осуществления неоантигенная последовательность представляет собой персонализированную неоантигенную вакцину для субъекта. В некоторых вариантах осуществления неоантигенная последовательность, применяемая для создания персонализированной неоантигенной вакцины для субъекта, способна связываться с по меньшей мере одним аллелем HLA, экспрессируемым у субъекта. В некоторых вариантах осуществления персонализированная неоантигенная вакцина выбрана посредством идентификации неоантигенов, экспрессируемых в опухоли субъекта, например, после введения по меньшей мере одного соединения, выбранного из соединений формулы I (в том числе формул IIa-e, IIIa, IVa и Va) и/или их фармацевтически приемлемых солей, и выбора вакцины, содержащей неоантигенную последовательность, наблюдаемую в опухоли пациента.
Термин "персонализированная", когда его применяют для описания неоантигенной вакцины, относится к вакцине, созданной посредством идентификации одного или нескольких неоантигенов, продуцируемых у пациента, предпочтительно неоантигена, идентифицированного у пациента после воздействия по меньшей мере одного соединения, выбранного из соединений формулы I (в том числе формул IIa-e, IIIa, IVa и Va) и/или их фармацевтически приемлемых солей, и затем применения одного или нескольких из этих неоантигенов в качестве основы вакцины для того же пациента. Соответственно, в некоторых вариантах осуществления пациенту вводят по меньшей мере одно соединение, выбранное из соединений формулы I (в том числе формул IIa-e, IIIa, IVa и Va) и/или их фармацевтически приемлемых солей, и проводят скрининг в отношении неоантигенов, продуцируемых при лечении. В некоторых вариантах осуществления выбранная неоантигенная вакцина содержит неоантигенный пептид или mRNA, раскрытые в данном документе и присутствие которых у пациента подтверждено после воздействия по меньшей мере одного соединения, выбранного из соединений формулы I (в том числе формул IIa-e, IIIa, IVa и Va) и/или их фармацевтически приемлемых солей. В некоторых вариантах осуществления по меньшей мере одно соединение, выбранное из соединений формулы I (в том числе формул IIa-e, IIIa, IVa и Va) и/или их фармацевтически приемлемых солей, и/или пептидную или mRNA-вакцину можно вводить пациенту один раз или повторно. Следовательно, в некоторых вариантах осуществления один или несколько из таких неоантигенов применяют для создания персонализированной вакцины, которую вводят пациенту. В некоторых вариантах осуществления один или несколько неоантигенов, применяемых для создания персонализированной вакцины, обладают аффинностью связывания с одним или несколькими специфическими для пациента аллелями HLA. В некоторых вариантах осуществления у пациента экспрессируется один или несколько аллелей MHC1, которые связываются с одним или несколькими неоантигенами. Прогнозирование того, будет ли неоантиген связываться со специфическим аллелем MHC1, можно осуществлять с применением любого способа вычислительного прогнозирования, известного из уровня техники. Иллюстративные способы вычислительного прогнозирования раскрыты, например, в Meydan et al. (2013) BMC Bioinformatics 14(Suppl. 2):S13, который включен в данный документ посредством ссылки для таких способов.
В некоторых других вариантах осуществления неоантигенная последовательность представляет собой универсальную неоантигенную последовательность. В некоторых вариантах осуществления неоантигенная последовательность представляет собой универсальную неоантигенную вакцину.
Термин "универсальная", когда он применяется для описания неоантигенной вакцины, относится к вакцине, содержащей пептидную последовательность или последовательность mRNA, которые основаны на обычном(-ых) или известном(-ых) неоантигене(-ах), обнаруживаемом(-ых) посредством секвенирования неоантигенов, продуцируемых у многих пациентов и/или в образцах ткани пациентов, предпочтительно после воздействия по меньшей мере одного соединения, выбранного из соединений формулы I (в том числе формул IIa-e, IIIa, IVa и Va) и/или их фармацевтически приемлемых солей. Пептидная последовательность или последовательность mRNA, применяемые в вакцине, необязательно должны присутствовать у каждого пациента, а обнаруживаются у по меньшей мере нескольких пациентов или в образцах ткани пациентов. В некоторых вариантах осуществления по меньшей мере одно соединение, выбранное из соединений формулы I (в том числе формул IIa-e, IIIa, IVa и Va) и/или их фармацевтически приемлемых солей, и/или пептидную или mRNA-вакцину можно вводить пациенту один раз или повторно. Следовательно, в некоторых вариантах осуществления данную пептидную последовательность или последовательность mRNA применяют для вакцинирования дополнительных пациентов. В некоторых вариантах осуществления пациенту вводят по меньшей мере одно соединение, выбранное из соединений формулы I (в том числе формул IIa-e, IIIa, IVa и Va) и/или их фармацевтически приемлемых солей, и затем вводят пептидную или mRNA-вакцину на основе известного неоантигена для усиления иммунного ответа на неоантигены, продуцируемые под действием по меньшей мере одного соединения, выбранного из соединений формулы I (в том числе формул IIa-e, IIIa, IVa и Va) и/или их фармацевтически приемлемых солей. В некоторых вариантах осуществления пациенту вводят универсальную пептидную или mRNA-вакцину и затем вводят по меньшей мере одно соединение, выбранное из соединений формулы I (в том числе формул IIa-e, IIIa, IVa и Va) и/или их фармацевтически приемлемых солей, один раз или повторно. В некоторых вариантах осуществления неоантигенная последовательность (или последовательности), применяемая для создания универсальной неоантигенной вакцины, выбрана на основе общей встречаемости аллеля MHC1 в приведенной популяции пациентов (Maiers et al. (2007) Hum. Immunol. 68(9):779-88).
В некоторых вариантах осуществления неоантигенная последовательность (например, универсальный неоантиген) способна связываться с по меньшей мере одним аллелем HLA, экспрессируемым у по меньшей мере 10%, по меньшей мере 15%, по меньшей мере 20%, по меньшей мере 25%, по меньшей мере 30%, по меньшей мере 35%, по меньшей мере 40% или по меньшей мере 45% субъектов в популяции субъектов, страдающих неопластическим нарушением. В некоторых вариантах осуществления неоантигенная последовательность способна вызывать T-клеточный ответ на опухоль, присутствующую у по меньшей мере 1%, по меньшей мере 5% или по меньшей мере 10% популяции субъектов, страдающих неопластическим нарушением.
В некоторых вариантах осуществления неоантигенная последовательность была идентифицирована посредством секвенирования по меньшей мере одного неоантигенного пептида или кодирующей его mRNA, образование которых индуцировано у субъекта посредством введения эффективного количества по меньшей мере одного соединения, выбранного из соединений формулы I (в том числе формул IIa-e, IIIa, IVa и Va) и/или их фармацевтически приемлемых солей. В некоторых вариантах осуществления по меньшей мере один неоантигеный пептид содержит неоантигенную последовательность, образование которой индуцировано за счет приведения неопластической клетки в контакт с эффективным количеством по меньшей мере одного соединения, выбранного из соединений формулы I (в том числе формул IIa-e, IIIa, IVa и Va) и/или их фармацевтически приемлемых солей. В некоторых вариантах осуществления неопластическая клетка находится в культуре клеток in vitro. В некоторых вариантах осуществления неопластическая клетка получена от субъекта. В некоторых вариантах осуществления неопластическая клетка находится в субъекте.
В некоторых вариантах осуществления неоантигенная вакцина содержит по меньшей мере один неоантигенный пептид и фармацевтически приемлемый носитель (например, любой из иллюстративных носителей, описанных в данном документе). В некоторых вариантах осуществления по меньшей мере один неоантигенный пептид связан с фармацевтически приемлемым носителем. В некоторых вариантах осуществления фармацевтически приемлемый носитель выбран из пептида, сывороточного альбумина, гемоцианина фисуреллы, иммуноглобулина, тиреоглобулина, овальбумина, анатоксина или аттенуированного производного анатоксина, цитокина и хемокина. В некоторых вариантах осуществления неоантигенный пептид и фармацевтически приемлемый носитель ковалентно связаны через линкер. В некоторых вариантах осуществления неоантигенный пептид и фармацевтически приемлемый носитель экспрессируются в виде слитого белка. В некоторых вариантах осуществления неоантигенная вакцина содержит по меньшей мере один неоантигенный пептид и фармацевтически приемлемый разбавитель. В некоторых вариантах осуществления неоантигенная вакцина содержит по меньшей мере один неоантигенный пептид и фармацевтически приемлемый адъювант.
В некоторых вариантах осуществления неоантигенная вакцина содержит по меньшей мере одну неоантигенную mRNA. В некоторых вариантах осуществления по меньшей мере одна неоантигенная mRNA кодирует одну или более одной неоантигенной последовательности.
В некоторых вариантах осуществления неоантигенная последовательность представляет собой неоантигенную последовательность, специфическую для субъекта. В некоторых вариантах осуществления неоантигенная последовательность представляет собой персонализированную неоантигенную вакцину для субъекта. В некоторых вариантах осуществления неоантигенная последовательность способна связываться с по меньшей мере одним аллелем HLA, экспрессируемым у субъекта.
В некоторых других вариантах осуществления неоантигенная последовательность представляет собой универсальную неоантигенную последовательность. В некоторых вариантах осуществления неоантигенная последовательность представляет собой универсальную неоантигенную вакцину. В некоторых вариантах осуществления неоантигенная последовательность способна связываться с по меньшей мере одним аллелем HLA, экспрессируемым у по меньшей мере 10%, по меньшей мере 15%, по меньшей мере 20%, по меньшей мере 25%, по меньшей мере 30%, по меньшей мере 35%, по меньшей мере 40% или по меньшей мере 45% субъектов в популяции субъектов, страдающих неопластическим нарушением. В некоторых вариантах осуществления неоантигенная последовательность способна вызывать T-клеточный ответ на опухоль, присутствующую у по меньшей мере 1%, по меньшей мере 5% или по меньшей мере 10% популяции субъектов, страдающих неопластическим нарушением.
В некоторых вариантах осуществления неоантигенная последовательность была идентифицирована посредством секвенирования белковой последовательности по меньшей мере одного неоантигена. В некоторых вариантах осуществления неоантигенная последовательность была идентифицирована посредством секвенирования по меньшей мере одной mRNA, кодирующей неоантиген, образование которого индуцировано у субъекта посредством введения эффективного количества по меньшей мере одного соединения, выбранного из соединений формулы I (в том числе формул IIa-e, IIIa, IVa и Va) и/или их фармацевтически приемлемых солей. В некоторых вариантах осуществления по меньшей мере одна неоантигенная mRNA кодирует неоантигенную последовательность, образование которой индуцировано посредством приведения неопластической клетки в контакт с эффективным количеством по меньшей мере одного соединения, выбранного из соединений формулы I (в том числе формул IIa-e, IIIa, IVa и Va) и/или их фармацевтически приемлемых солей. В некоторых вариантах осуществления неопластическая клетка находится в культуре клеток in vitro. В некоторых вариантах осуществления неопластическая клетка получена от субъекта. В некоторых вариантах осуществления неопластическая клетка находится в субъекте.
В некоторых вариантах осуществления неоантигенная вакцина содержит по меньшей мере одну неоантигенную mRNA и фармацевтически приемлемый носитель (например, любой из иллюстративных носителей, описанных в данном документе). В некоторых вариантах осуществления по меньшей мере одна неоантигенная mRNA связана с фармацевтически приемлемым носителем. В некоторых вариантах осуществления фармацевтически приемлемый носитель выбран из пептида, сывороточного альбумина, гемоцианина фисуреллы, иммуноглобулина, тиреоглобулина, овальбумина, анатоксина или аттенуированного производного анатоксина, цитокина и хемокина. В некоторых вариантах осуществления неоантигенная вакцина содержит по меньшей мере одну неоантигенную mRNA и фармацевтически приемлемый разбавитель. В некоторых вариантах осуществления неоантигенная вакцина содержит по меньшей мере одну неоантигенную mRNA и фармацевтически приемлемый адъювант. В некоторых вариантах осуществления неоантигенная mRNA инкапсулирована с помощью инкапсулирующего средства. В некоторых вариантах осуществления инкапсулирующее средство представляет собой липосому. В некоторых вариантах осуществления инкапсулирующее средство представляет собой наночастицу.
В некоторых вариантах осуществления по меньшей мере одно дополнительное средство терапии предусматривает введение цитокина или аналога цитокина, например, любого цитокина или аналога цитокина, раскрытых в данном документе. В некоторых вариантах осуществления субъект характеризуется непереносимостью, невосприимчивостью или недостаточной восприимчивостью цитокина или аналога цитокина при введении их по отдельности. В некоторых вариантах осуществления цитокин или аналог цитокина предусматривает средство усиления для T-клеток. В некоторых вариантах осуществления цитокин или аналог цитокина предусматривает IL-2, IL-10, IL-12, IL-15, IFNγ и/или TNFα. В некоторых вариантах осуществления цитокин или аналог цитокина предусматривает IL-2, IL-10, IL-12 и/или IL-15. В некоторых вариантах осуществления введение цитокина или аналога цитокина усиливает примирование T-клеток после введения по меньшей мере одного соединения, выбранного из соединений формулы I (в том числе формул IIa-e, IIIa, IVa и Va) и/или их фармацевтически приемлемых солей, вследствие индуцирования образования и презентации неоантигенов.
В некоторых вариантах осуществления по меньшей мере одно дополнительное средство терапии предусматривает введение сконструированных T-клеток, целенаправленно воздействующих на опухоль (т. е. CAR-T), например, любое средство терапии на основе CAR-T, раскрытое в данном документе.
В некоторых вариантах осуществления способы, описанные в данном документе, могут дополнительно включать обнаружение одного или нескольких неоантигенов и/или T-клеточного ответа у субъекта после введения по меньшей мере одного соединения, выбранного из соединений формулы I (в том числе формул IIa-e, IIIa, IVa и Va) и/или их фармацевтически приемлемых солей, и необязательно продолжение введения по меньшей мере одного соединения, выбранного из соединений формулы I (в том числе формул IIa-e, IIIa, IVa и Va) и/или их фармацевтически приемлемых солей, если обнаружены один или несколько неоантигенов и/или T-клеточный ответ. В некоторых вариантах осуществления обнаружение одного или нескольких неоантигенов и/или T-клеточного ответа у субъекта указывает на эффективность лечения с помощью по меньшей мере одного соединения, выбранного из соединений формулы I (в том числе формул IIa-e, IIIa, IVa и Va) и/или их фармацевтически приемлемых солей. В некоторых вариантах осуществления лечение с помощью дополнительного средства терапии вместе с по меньшей мере одним соединением, выбранным из соединений формулы I (в том числе формул IIa-e, IIIa, IVa и Va) и/или их фармацевтически приемлемых солей, продолжают, если обнаружены один или несколько неоантигенов и/или T-клеточный ответ. В некоторых вариантах осуществления лечение продолжают при сниженной дозировке и/или частоте, если обнаружены один или несколько неоантигенов и/или T-клеточный ответ.
В некоторых вариантах осуществления способы, описанные в данном документе, могут дополнительно включать обнаружение иммунного ответа на двухнитевую РНК у субъекта после введения по меньшей мере одного соединения, выбранного из соединений формулы I (в том числе формул IIa-e, IIIa, IVa и Va) и/или их фармацевтически приемлемых солей, и необязательно продолжение введения по меньшей мере одного соединения, выбранного из соединений формулы I (в том числе формул IIa-e, IIIa, IVa и Va) и/или их фармацевтически приемлемых солей, если обнаружен иммунный ответ на двухнитевую РНК. В некоторых вариантах осуществления обнаружение иммунного ответа на двухнитевую РНК у субъекта указывает на эффективность лечения с помощью по меньшей мере одного соединения, выбранного из соединений формулы I (в том числе формул IIa-e, IIIa, IVa и Va) и/или их фармацевтически приемлемых солей. В некоторых вариантах осуществления лечение с помощью дополнительного средства терапии вместе с по меньшей мере одним соединением, выбранным из соединений формулы I (в том числе формул IIa-e, IIIa, IVa и Va) и/или их фармацевтически приемлемых солей, продолжают, если обнаружен иммунный ответ на двухнитевую РНК. В некоторых вариантах осуществления лечение продолжают при сниженной дозировке и/или частоте, если обнаружен иммунный ответ на двухнитевую РНК.
В некоторых вариантах осуществления способы, описанные в данном документе, могут дополнительно включать обнаружение иммуногенной гибели клеток у субъекта после введения по меньшей мере одного соединения, выбранного из соединений формулы I (в том числе формул IIa-e, IIIa, IVa и Va) и/или их фармацевтически приемлемых солей, и необязательно продолжение введения по меньшей мере одного соединения, выбранного из соединений формулы I (в том числе формул IIa-e, IIIa, IVa и Va) и/или их фармацевтически приемлемых солей, если обнаружена иммуногенная гибель клеток. В некоторых вариантах осуществления обнаружение иммуногенной гибели клеток у субъекта указывает на эффективность лечения с помощью по меньшей мере одного соединения, выбранного из соединений формулы I (в том числе формул IIa-e, IIIa, IVa и Va) и/или их фармацевтически приемлемых солей. В некоторых вариантах осуществления лечение с помощью дополнительного средства терапии вместе с по меньшей мере одним соединением, выбранным из соединений формулы I (в том числе формул IIa-e, IIIa, IVa и Va) и/или их фармацевтически приемлемых солей, продолжают, если обнаружена иммуногенная гибель клеток. В некоторых вариантах осуществления лечение продолжают при сниженной дозировке и/или частоте, если обнаружена иммуногенная гибель клеток.
В некоторых вариантах осуществления субъект характеризуется мутационной нагрузкой с несинонимичными изменениями, составляющей приблизительно 150 мутаций или меньше. В некоторых вариантах осуществления субъект характеризуется мутационной нагрузкой с несинонимичными изменениями, составляющей приблизительно 100 мутаций или меньше. В некоторых вариантах осуществления субъект характеризуется мутационной нагрузкой с несинонимичными изменениями, составляющей приблизительно 50 мутаций или меньше. В некоторых вариантах осуществления субъект имеет неопластическое нарушение, например, гематологическое злокачественное новообразование или солидную опухоль, или имеет подозрение на его наличие. В некоторых вариантах осуществления гематологическое злокачественное новообразование выбрано из B-клеточного злокачественного новообразования, лейкоза, лимфомы и миеломы. В некоторых вариантах осуществления гематологическое злокачественное новообразование выбрано из острого миелоидного лейкоза и множественной миеломы. В некоторых вариантах осуществления солидная опухоль выбрана из рака молочной железы, рака желудка, рака предстательной железы, рака яичника, рака легкого, рака матки, карциномы слюнных протоков, меланомы, рака толстой кишки и рака пищевода. В некоторых вариантах осуществления солидная опухоль выбрана из HER2-положительного рака молочной железы, аденокарциномы желудка и рака предстательной железы.
В некоторых вариантах осуществления в настоящем изобретение дополнительно предусмотрен способ лечения субъекта, у которого имеется неопластическое нарушение или подозрение на его наличие, включающий: (a) введение субъекту эффективного количества по меньшей мере одного соединения, выбранного из соединений формулы I (в том числе формул IIa-e, IIIa, IVa и Va) и/или их фармацевтически приемлемых солей, где введение по меньшей мере одного соединения, выбранного из соединений формулы I (в том числе формул IIa-e, IIIa, IVa и Va) и/или их фармацевтически приемлемых солей, индуцирует образование по меньшей мере одного неоантигена и/или развитие T-клеточного ответа; (b) обнаружение одного или нескольких неоантигенов и/или T-клеточного ответа у субъекта после введения по меньшей мере одного соединения, выбранного из соединений формулы I (в том числе формул IIa-e, IIIa, IVa и Va) и/или их фармацевтически приемлемых солей; и (c) продолжение введения по меньшей мере одного соединения, выбранного из соединений формулы I (в том числе формул IIa-e, IIIa, IVa и Va) и/или их фармацевтически приемлемых солей, если обнаружены один или несколько неоантигенов и/или T-клеточный ответ. В некоторых вариантах осуществления обнаружение одного или нескольких неоантигенов и/или T-клеточного ответа у субъекта указывает на эффективность лечения с помощью по меньшей мере одного соединения, выбранного из соединений формулы I (в том числе формул IIa-e, IIIa, IVa и Va) и/или их фармацевтически приемлемых солей. В некоторых вариантах осуществления один или несколько неоантигенов содержат аминокислотную последовательность под любым из SEQ ID NO: 1-29. В некоторых вариантах осуществления один или несколько неоантигенов содержат аминокислотную последовательность под SEQ ID NO: 1. В некоторых вариантах осуществления один или несколько неоантигенов содержат аминокислотную последовательность под SEQ ID NO: 3. В некоторых вариантах осуществления один или несколько неоантигенов содержат аминокислотную последовательность под любым из SEQ ID NO: 10-13.
В некоторых вариантах осуществления пациента, у которого имеется рак, описанный в данном документе, можно лечить с помощью комбинации по меньшей мере одного соединения, выбранного из соединений формулы I (в том числе формул IIa-e, IIIa, IVa и Va) и/или их фармацевтически приемлемых солей, и средства терапии на основе ингибитора контрольных точек.
Как было показано, лечение пациентов с помощью ингибирования контрольных точек иммунного ответа имеет хорошую эффективность при определенных клинических показаниях. Недавно FDA одобрило применение ингибитора контрольных точек у пациентов с опухолями, проявляющими высокую микросателлитную нестабильность, независимо от происхождения ткани. Данная регистрация частично была основана на наблюдении того, что значения частоты ответа положительно коррелируют с мутационной нагрузкой (Rizvi et al. (2015) Science 348(6230):124-8; Hellmann et al. (2018) Cancer Cell 33(5):853-861). Оценки из литературы варьируют по абсолютным числам и в зависимости от происхождения, но в общем подтверждают, что выше порогового значения ~150-250 мутаций, вероятность ответа повышается. Анализ данных TCGA демонстрирует, что большой процент развивающихся у взрослых опухолей разного происхождения имеет сравнительно небольшую мутационную нагрузку с несинонимичными изменениями (Vogelstein et al. (2013) Science 339:1549-58). Большинство линий происхождения характеризуются средними значениями частоты несинонимичных мутаций ~30-80 на пациента, значительно ниже пороговых значений, требуемых для повышения вероятности ответа на ингибиторы контрольных точек.
Например, как было показано, HER2-положительный рак молочной железы имеет в среднем ~60 несинонимичными мутаций, присутствующих в образце пациента. Однако пороговое значение для эффективности лечения с помощью ингибитора контрольных точек, как упомянуто выше, по оценками находится в диапазоне ~150-250 несинонимичных мутаций, т. е. пациенты со значением выше данного порогового значения более вероятно будут демонстрировать полную ремиссию, частичную ремиссию и/или стабилизацию заболевания, в то время как у пациентов со значением ниже данного порогового значения более вероятно проявляется прогрессирование заболевания. Следовательно, требуются стратегии для увеличения наблюдаемого числа несинонимичных мутаций и/или неоантигенов, присутствующих на опухолевых клетках, и они могут увеличивать общую вероятность ответа, например, на средство терапии на основе ингибитора контрольных точек. Поскольку цитокины (и их аналоги) действуют посредством подобного механизма действия, такие стратегии также могут повышать общую вероятность ответа на средства терапии на основе цитокинов.
В настоящее время значения частоты ответа при HER2-положительном раке молочной железы составляют ~15-25% (CTI NCT02129556). В некоторых вариантах осуществления, раскрытых в данном документе, лечение по меньшей мере одним соединением, выбранным из соединений формулы I (в том числе формул IIa-e, IIIa, IVa и Va) и/или их фармацевтически приемлемых солей, в комбинации с ингибитором контрольных точек и/или средством терапии на основе цитокина может увеличивать такие значения частоты ответа. В некоторых вариантах осуществления лечение с помощью терапевтически эффективного количества по меньшей мере одного соединения, выбранного из соединений формулы I (в том числе формул IIa-e, IIIa, IVa и Va) и/или их фармацевтически приемлемых солей, в комбинации с ингибитором контрольных точек и/или средством терапии на основе цитокина можно применять в отношении любой развивающейся у взрослых опухоли, в частности тех, у которых средняя частота несинонимичных мутаций ниже рассчитанного порогового значения ~150 мутаций. В некоторых вариантах осуществления иллюстративные типы рака, подходящие для лечения с помощью терапевтически эффективного количества по меньшей мере одного соединения, выбранного из соединений формулы I (в том числе формул IIa-e, IIIa, IVa и Va) и/или их фармацевтически приемлемых солей, по отдельности или в комбинации с дополнительным средством терапии (например, средством терапии на основе ингибитора контрольных точек, средством терапии на основе цитокина), включают без ограничения рак пищевода, неходжкинскую лимфому, колоректальный рак, рак головы и шеи, рак желудка, рак эндометрия, аденокарциному поджелудочной железы, рак яичника, рак предстательной железы, печеночноклеточный рак, глиобластому, рак молочной железы (например, HER2-положительный рак молочной железы), рак легкого (например, немелкоклеточный рак легкого), хронический лимфоцитарный лейкоз и острый миелоидный лейкоз. Другие иллюстративные подходящие типы рака определены, например, в Vogelstein et al. (2013) Science 339:1549-58, который включен в данный документ посредством ссылки во всей своей полноте.
Поскольку применение многих средств терапии на основе ингибитора контрольных точек обусловлено постоянной экспрессией опухоль-ассоциированных антигенов, для эффективности и для "повторной стимуляции" популяций реактивных T-клеток необходимо регулярные бустерные введения средств лечения. Индуцибельная природа неоантигенов, описанных в данном документе, которые получены под действием по меньшей мере одного соединения, выбранного из соединений формулы I (в том числе формул IIa-e, IIIa, IVa и Va) и/или их фармацевтически приемлемых солей, обеспечивает терапевтические схемы введения, которые могут быть разработаны для усиления иммунного ответа T-клеток, реактивных в отношении неоантигена, в то же время ограничивающие истощение T-клеток, зачастую вызванное хронической стимуляцией антигеном. Например, в некоторых вариантах осуществления начальную дозу по меньшей мере одного соединения, выбранного из соединений формулы I (в том числе формул IIa-e, IIIa, IVa и Va) и/или их фармацевтически приемлемых солей, вводят субъекту для запуска аберрантного сплайсинга и продуцирования неоантигенных пептидов. В некоторых вариантах осуществления по прошествии периода времени, необходимого для продуцирования белка и презентации антигена, затем субъекту вводят начальную дозу ингибитора контрольных точек для стимуляции и/или усиления примирования и размножения эффекторных Т-клеток. В некоторых вариантах осуществления период ожидания между дозами по меньшей мере одного соединения, выбранного из соединений формулы I (в том числе формул IIa-e, IIIa, IVa и Va) и/или их фармацевтически приемлемых солей, и ингибитора контрольных точек составляет приблизительно 2, приблизительно 3, приблизительно 4, приблизительно 5, приблизительно 6 или приблизительно 7 дней. В некоторых вариантах осуществления период ожидания составляет от приблизительно 3 дней до приблизительно 5 дней.
В некоторых вариантах осуществления ингибитор контрольных точек целенаправленно воздействует на CTLA4, OX40, CD40 и/или GITR. В некоторых вариантах осуществления терапевтический эффект комбинации терапевтически эффективного количества по меньшей мере одного соединения, выбранного из соединений формулы I (в том числе формул IIa-e, IIIa, IVa и Va) и/или их фармацевтически приемлемых солей, и ингибитора контрольных точек может быть аддитивным или супераддитивным.
В некоторых вариантах осуществления введение терапевтически эффективного количества по меньшей мере одного соединения, выбранного из соединений формулы I (в том числе формул IIa-e, IIIa, IVa и Va) и/или их фармацевтически приемлемых солей, начинают до введения ингибитора контрольных точек.
В некоторых вариантах осуществления введение терапевтически эффективного количества по меньшей мере одного соединения, выбранного из соединений формулы I (в том числе формул IIa-e, IIIa, IVa и Va) и/или их фармацевтически приемлемых солей, начинают после введения ингибитора контрольных точек.
В некоторых вариантах осуществления введение терапевтически эффективного количества по меньшей мере одного соединения, выбранного из соединений формулы I (в том числе формул IIa-e, IIIa, IVa и Va) и/или их фармацевтически приемлемых солей, начинают одновременно с введением ингибитора контрольных точек, например, в едином составленном продукте или в отдельных составленных продуктах, вводимых за одну процедуру.
В некоторых вариантах осуществления по прошествии периода времени, необходимого для примирования и размножения Т-клеток, затем субъекту вводят вторую или последующую дозу по меньшей мере одного соединения, выбранного из соединений формулы I (в том числе формул IIa-e, IIIa, IVa и Va) и/или их фармацевтически приемлемых солей, для запуска повторной презентации неоантигенных пептидов. В некоторых вариантах осуществления период ожидания между начальной дозой ингибитора контрольных точек и второй или последующей дозой, содержащей терапевтически эффективное количество по меньшей мере одного соединения, выбранного из соединений формулы I (в том числе формул IIa-e, IIIa, IVa и Va) и/или их фармацевтически приемлемых солей, составляет приблизительно 2, приблизительно 3, приблизительно 4 или приблизительно 5 недель. В некоторых вариантах осуществления период ожидания составляет приблизительно 3 недели. В некоторых вариантах осуществления после второй или последующей дозы по меньшей мере одного соединения, выбранного из соединений формулы I (в том числе формул IIa-e, IIIa, IVa и Va) и/или их фармацевтически приемлемых солей, иммунная система может контактировать с презентирующими неоантиген опухолевыми клетками и/или вызывать уничтожение опухолевых клеток. В некоторых вариантах осуществления затем субъекту вводят вторую или последующую дозу ингибитора контрольных точек для дополнительного размножения популяции эффекторных T-клеток памяти после обеспечения вторичного примирования и размножения Т-клеток.
В некоторых вариантах осуществления период ожидания между начальной дозой, содержащей терапевтически эффективное количество по меньшей мере одного соединения, выбранного из соединений формулы I (в том числе формул IIa-e, IIIa, IVa и Va) и/или их фармацевтически приемлемых солей, и второй или последующей дозой ингибитора контрольных точек составляет приблизительно 2, приблизительно 3, приблизительно 4 или приблизительно 5 недель. В некоторых вариантах осуществления период ожидания составляет приблизительно 3 недели.
В некоторых вариантах осуществления введение доз, содержащих терапевтически эффективное количество по меньшей мере одного соединения, выбранного из соединений формулы I (в том числе формул IIa-e, IIIa, IVa и Va) и/или их фармацевтически приемлемых солей, согласно данной иллюстративной начальной схеме лечения может быть "пульсирующим", т. е. терапевтически эффективное количество по меньшей мере одного соединения, выбранного из соединений формулы I (в том числе формул IIa-e, IIIa, IVa и Va) и/или их фармацевтически приемлемых солей, можно вводить дозами с длительными интервалами (например, приблизительно каждые 4 недели, приблизительно каждые 5 недель, приблизительно каждые 6 недель) для обеспечения презентации антигена, привлечения Т-клеток, и/или уничтожения опухолевых клеток, и/или восстановления популяции Т-клеток памяти. В некоторых вариантах осуществления в более поздние моменты времени лечение с помощью терапевтически эффективного количества по меньшей мере одного соединения, выбранного из соединений формулы I (в том числе формул IIa-e, IIIa, IVa и Va) и/или их фармацевтически приемлемых солей, можно комбинировать с одним или несколькими ингибиторами контрольных точек, целенаправленно воздействующих путем восстановления эффекторной функции истощенных популяций Т-клеток. Например, в некоторых вариантах осуществления в более поздние моменты времени лечение с помощью по меньшей мере одного соединения, выбранного из соединений формул I (в том числе формул IIa-e, IIIa, IVa и Va) и/или их фармацевтически приемлемых солей, можно комбинировать с одним или несколькими ингибиторами контрольных точек, целенаправленно воздействующими на PD1/PDL1, LAG3 и/или TIM3. В некоторых вариантах осуществления пульсирующий характер презентации неоантигена и примирования может обеспечивать введение ингибитора контрольных точек и/или по меньшей мере одного соединения, выбранного из соединений I (в том числе формул IIa-e, IIIa, IVa и Va) и/или их фармацевтически приемлемых солей, менее часто и/или при более низких дозах. В некоторых вариантах осуществления пульсирующий характер презентации неоантигена может обеспечивать один или несколько положительных эффектов лечения для ингибитора контрольных точек (например, антитела к CTLA4, такого как ипилимумаб) в сравнении с ингибитором контрольных точек, вводимым без одновременного введения терапевтически эффективного количества по меньшей мере одного соединения, выбранного из соединений формулы I (в том числе формул IIa-e, IIIa, IVa и Va) и/или их фармацевтически приемлемых солей, например, за счет снижения потенциального риска нежелательных реакций, часто наблюдаемых в случае стандартной схемы введения ингибитора контрольных точек.
В определенных вариантах осуществления ингибитор контрольных точек представляет собой ингибитор пути антигена, ассоциированного с цитотоксическими T-лимфоцитами (CTLA4). CTLA4, также известный как CD152, представляет собой белковый рецептор, который отрицательно регулирует иммунные ответы. CTLA4 конститутивно экспрессируется на регуляторных T-клетках, но его экспрессия повышается в обычных T-клетках только после активации. Подразумевается, что применяемый в данном документе термин "ингибитор CTLA4" относится к любому ингибитору CTLA4 и/или пути CTLA4. Иллюстративные ингибиторы CTLA4 включают без ограничения антитела к CTLA4. Антитела, блокирующие CTLA4, для применения у человека разрабатывали на основе активности в доклинических испытаниях, наблюдаемой на мышиных моделях противоопухолевого иммунитета. Иллюстративные антитела к CTLA4 включают без ограничения ипилимумаб (MDX-010) и тремелимумаб (CP-675,206), оба из которых являются полностью человеческими. Ипилимумаб представляет собой IgG1 со временем полужизни в плазме крови, составляющем примерно 12-14 дней; тремелимумаб представляет собой IgG2 со временем полужизни в плазме крови, составляющем примерно 22 дня. См., например, Phan et al. (2003) Proc Natl Acad Sci USA. 100:8372-7; Ribas et al. (2005) J Clin Oncol. 23:8968-77; Weber et al. (2008) J Clin Oncol. 26:5950-6. В некоторых вариантах осуществления антитело к CTLA4 представляет собой ипилимумаб.
В определенных вариантах осуществления ингибитор контрольных точек представляет собой ингибитор пути белка 1 программируемой клеточной гибели (PD1). Путь белка 1 программируемой клеточной гибели (PD1) представляет главный переключатель иммунного контроля, который может быть задействован опухолевыми клетками для преодоления активного иммунного надзора T-клеток. Лиганды для PD1 (PDL1 и PDL2) конститутивно экспрессируются или могут быть индуцированы в различных опухолях. Было обнаружено, что высокий уровень экспрессии PDL1 (и в меньшей степени PDL2) на опухолевых клетках коррелирует с плохим прогнозом и слабой выживаемостью при различных других типах солидных опухолей. Кроме того, было высказано предположение, что PD1 контролирует размножение опухолеспецифических T-клеток у пациентов со злокачественной меланомой. Эти наблюдения предполагают то, что путь PD1/PDL1 играет важнейшую роль в ускользании опухоли от распознавания иммунной системой и может считаться привлекательной мишенью для терапевтического вмешательства. Подразумевается, что применяемый в данном документе термин "ингибитор PD1" относится к любому ингибитору PD1 и/или пути PD1. Иллюстративные ингибиторы PD1 включают без ограничения антитела к PD1 и к PDL1. В определенных вариантах осуществления ингибитор контрольных точек представляет собой антитело к PD1. Иллюстративные антитела к PD1 включают без ограничения ниволумаб и пемпролизумаб (MK-3475). Ниволумаб, например, представляет собой полностью человеческое антитело к ингибитору контрольных точек иммунного ответа PD1 на основе иммуноглобулина G4 (IgG4), которое нарушает взаимодействие рецептора PD1 с его лигандами PDL1 и PDL2, тем самым обеспечивая ингибирование клеточного иммунного ответа (Guo et al. (2017) J Cancer 8(3):410-6). В некоторых вариантах осуществления антитело к PD1 представляет собой ниволумаб. Пембролизумаб, например, представляет собой эффективное и высокоселективное гуманизированное mAb, относящееся к изотипу IgG4/каппа, разработанное для непосредственного блокирования взаимодействия между PD1 и его лигандами: PDL1 и PDL2. Пембролизумаб значительно увеличивает опосредованные T-лимфоцитами иммунные ответы в культивируемых клетках крови от здоровых доноров-людей, пациентов с раком и приматов. Также сообщалось о том, что пембролизумаб модулирует уровень интерлейкина-2 (IL-2), фактора некроза опухоли альфа (TNFα), интерферона-гамма (IFNγ) и других цитокинов. Иллюстративные антитела к PDL1 включают без ограничения атезолизумаб, авелумаб и дурвалумаб. Атезолизумаб, например, представляет собой гуманизированное mAb на основе IgG1, которое, как сообщалось, блокирует взаимодействие PD1/PDL1 путем целенаправленного воздействия на экспрессированный PDL1 на различных видах злокачественных клеток. Данная блокировка пути PD1/PDL1 может стимулировать иммунные защитные механизмы против опухолей (Abdin et al. (2018) Cancers (Basel) 10(2):32). В некоторых вариантах осуществления антитело к PDL1 представляет собой атезолизумаб.
В определенных вариантах осуществления ингибитор контрольных точек целенаправленно воздействует на PD1/PDL1, CTLA4, OX40, CD40, LAG3, TIM3, GITR и/или KIR. В определенных вариантах осуществления ингибитор контрольных точек целенаправленно воздействует на CTLA4, OX40, CD40 и/или GITR. В определенных вариантах осуществления ингибитор контрольных точек целенаправленно воздействует в качестве ингибиторного антитела или другой подобной ингибиторной молекулы (например, ингибиторного антитела к CTLA4 или к PD1/PDL1). В других определенных вариантах осуществления ингибитор контрольных точек оказывает целенаправленное воздействие в качестве агониста для мишени; примеры из данного класса включают молекулы, стимулирующие мишени OX40, CD40 и/или GITR. В некоторых вариантах осуществления ингибитор контрольных точек, который целенаправленно воздействует на OX40, CD40 и/или GITR, представляет собой антитело-агонист. Антитела-агонисты, направленные против OX40, могут выполнять двойную роль: ингибировать супрессию под действием регуляторных T-клеток, при этом усиливать функции эффекторных T-клеток. Также было показано, что антитела-агонисты к GITR делают эффекторные T-клетки более устойчивыми к ингибированию, индуцированному регуляторными T-клетками (Karaki et al. (2016) Vaccines (Basel) 4(4):37). Подобным образом, антитела-агонисты к CD40 демонстрируют зависимую от T-клеток противоопухолевую активность. Активация CD40 на дендритных клетках увеличивает перекрестную презентацию опухолевых антигенов и, следовательно, число активированных эффекторных T-клеток, направленных на опухоль (Ellmark et al. (2015) Oncoimmunol. 4(7):e1011484).
В определенных вариантах осуществления ингибитор контрольных точек целенаправленно воздействует на CTLA4 (например, является антителом к CTLA4). В определенных вариантах осуществления целенаправленное воздействие на CTLA4 облегчает примирование и активацию наивных T-клеток. В определенных вариантах осуществления ингибитор контрольных точек целенаправленно воздействует на OX40 (например, является антителом к OX40). В определенных вариантах осуществления целенаправленное воздействие на OX40 усиливает размножение эффекторных T-клеток. В определенных вариантах осуществления ингибитор контрольных точек целенаправленно воздействует на CD40 (например, является антителом к CD40). В определенных вариантах осуществления целенаправленное воздействие на CD40 подавляет "толерогенное" примирование T-клеток и/или образование регуляторных T-клеток. В определенных вариантах осуществления ингибитор контрольных точек целенаправленно воздействует на GITR (например, является антителом к GITR). В определенных вариантах осуществления целенаправленное воздействие на GITR подавляет активность регуляторных T-клеток. В определенных вариантах осуществления положительный эффект комбинированной терапии (например, эффект в отношении по меньшей мере одного симптома или риска/скорости прогрессирования заболевания), в составе которой терапевтически эффективное количество по меньшей мере одного соединения, выбранного из соединений формулы I (в том числе формул IIa-e, IIIa, IVa и Va) и/или их фармацевтически приемлемых солей, и средство, целенаправленно воздействующее на CTLA4, OX40, CD40 и/или GITR, является аддитивным. В некоторых вариантах осуществления положительный эффект комбинированной терапии, в составе которой терапевтически эффективное количество по меньшей мере одного соединения, выбранного из соединений формулы I (в том числе формул IIa-e, IIIa, IVa и Va) и/или их фармацевтически приемлемых солей, и средство, целенаправленно воздействующее на CTLA4, OX40, CD40 и/или GITR, является супераддитивным (т. е. синергическим).
Стратегии лечения на основе ингибитора контрольных точек основаны на гипотезе, что лечение облегчает и/или усиливает примирование T-клеток при ответах на опухоли, которые характеризуются слабой или недостаточной антигенностью (например, CTLA4), или что лечение восстанавливает и/или усиливает T-клетки, которые отвечают на опухолевые антигены, но "истощились" вследствие постоянной презентации антигена (например, PD1, PDL1) (Chen and Mellman (2013) Immunity 39(1):1-10). Примеры подходящих средств терапии и средств для ингибирования контрольных точек, например, антитела к PD1, PDL1 или CTLA4, известны из уровня техники. См., например, WO 2001/014424 WO 2013/173223, WO 2016/007235.
Комбинирование этих ответов за счет примированных Т-клеток после терапии ингибитором контрольных точек с лечением для индуцирования образования неоантигенов в опухолевых клетках (например, путем введения терапевтически эффективного количества по меньшей мере одного соединения, выбранного из соединений формулы I (в том числе формул IIa-e, IIIa, IVa и Va) и/или их фармацевтически приемлемых солей), на которые может реагировать примированная иммунная система, может обеспечивать благоприятный синергизм. Поскольку неоантигены, образованные в под действием соединений, выбранных из соединений формулы I (в том числе формул IIa-e, IIIa, IVa и Va) и/или их фармацевтически приемлемых солей, еще не были презентированы для примирования T-клеток, комбинация с ингибитором CTLA4 может быть особенно благоприятной. В некоторых вариантах осуществления лечение включает введение терапевтически эффективного количества по меньшей мере одного соединения, выбранного из соединений формулы I (в том числе формул IIa-e, IIIa, IVa и Va) и/или их фармацевтически приемлемых солей, для индуцирования продуцирования неоантигенов, а также начальное введение ингибитора CTLA4 для стимуляции примирования CD8 Т-клеток, осуществляемое до, одновременно или после этого введения. В некоторых вариантах осуществления пациенту проводят дополнительные введения ингибитора CTLA4, например, для дополнительной стимуляции примирования и/или активации популяций CD8, реактивных в отношении неоантигена. В некоторых вариантах осуществления для увеличения презентации неоантигена в опухоли можно осуществлять дополнительные введения пациенту терапевтически эффективного количества по меньшей мере одного соединения, выбранного из соединений формулы I (в том числе формул IIa-e, IIIa, IVa и Va) и/или их фармацевтически приемлемых солей. Повторные введения терапевтически эффективного количества по меньшей мере одного соединения, выбранного из соединений формулы I (в том числе формул IIa-e, IIIa, IVa и Va) и/или их фармацевтически приемлемых солей, и средства терапии на основе ингибитора контрольных точек могут происходить одновременно или с применением разнесенных во времени интервалах. В некоторых вариантах осуществления лечение дополнительно включает совместное лечение с помощью ингибитора PD1/PDL1, например, для восстановления эффекторной функции истощенных T-клеток, целенаправленно воздействующих на неоантиген, в пределах микроокружения опухоли.
Применяемые в данном документе термины "комбинация" или "комбинированная терапия" относятся к введению терапевтически эффективного количества по меньшей мере одного соединения, выбранного из соединений формулы I (в том числе формул IIa-e, IIIa, IVa и Va) и/или их фармацевтически приемлемых солей, вместе с дополнительным средством или средством терапии (например, ингибитором контрольных точек, цитокином или аналогом цитокина, неоантигенной вакциной, CAR-T), в рамках схемы лечения, предназначенной для обеспечения благоприятного (т. е. аддитивного или синергического) эффекта от совместного действия одного или нескольких вводимых средств. В некоторых вариантах осуществления комбинация также может включать одно или несколько дополнительных средств, в том числе без ограничения химиотерапевтических средств, средств, препятствующих ангиогенезу, и средств, которые снижают иммунную супрессию (например, второй ингибитор контрольных точек). Благоприятный эффект комбинации включает без ограничения фармакокинетическое или фармакодинамическое совместное действие, обеспечиваемое комбинацией терапевтических средств. Введение таких терапевтических средств в комбинации, как правило, осуществляют в течение определенного периода времени (например, минут, часов, дней или недель в зависимости от выбранной комбинации).
Применяемые в данном документе термины вводимый "в комбинации" или "совместное введение" означают, что два или более разных средств лечения доставляются в субъекта на протяжении времени, в течение которого субъект страдает медицинским патологическим состоянием (например, раком или неопластическим нарушением) в любом порядке. Например, в некоторых вариантах осуществления два или более средств лечения доставляются после того, как у субъекта было диагностировано заболевание или нарушение, и перед тем, как заболевание или нарушение были излечены или устранены, или когда субъект был идентифицирован как имеющий риск его развития, но до того как у субъекта развились симптомы заболевания. В некоторых вариантах осуществления все еще осуществляют доставку одного средства лечения, когда начинают доставку второго средства лечения, так что присутствует перекрывание. В некоторых вариантах осуществления доставку первого и второго средства лечения начинают в одно и то же время. Такие типы доставки иногда в данном документе называются "одновременной", "совместной" или "сопутствующей" доставкой. В других вариантах осуществления доставка одного средства лечения заканчивается перед началом доставки второго средства лечения. Данный тип доставки иногда в данном документе называется "поочередной" или "последовательной" доставкой.
В некоторых вариантах осуществления два средства лечения (например, по меньшей мере одно соединение, выбранное из соединений формулы I (в том числе формул IIa-e, IIIa, IVa и Va) и/или их фармацевтически приемлемых солей, и ингибитор контрольных точек) содержатся в одной и той же композиции. Такие композиции можно вводить в любой подходящей форме и с помощью любого подходящего пути. В других вариантах осуществления два средства лечения (например, по меньшей мере одно соединение, выбранное из соединений формулы I (в том числе формул IIa-e, IIIa, IVa и Va) и/или их фармацевтически приемлемых солей, и ингибитор контрольных точек) вводят в отдельных композициях в любой подходящей форме и с помощью любого подходящего пути. Например, в некоторых вариантах осуществления композицию, содержащую терапевтически эффективное количество по меньшей мере одного соединения, выбранного из соединений формулы I (в том числе формул IIa-e, IIIa, IVa и Va) и/или их фармацевтически приемлемых солей, и композицию, содержащую ингибитор контрольных точек, можно вводить одновременно или последовательно в любом порядке в разные моменты времени; в любом случае их следует вводить достаточно близко по времени для обеспечения требуемого терапевтического или профилактического эффекта.
В вариантах осуществления, предусматривающих либо одновременную, либо последовательную доставку, лечение может быть более эффективным вследствие комбинированного введения. В некоторых вариантах осуществления первое средство лечения является более эффективным, например, эквивалентный эффект наблюдают с меньшим количеством первого средства лечения (например, при более низкой дозе), чем наблюдали бы, если первое средство лечения вводили в отсутствие второго средства лечения. В некоторых вариантах осуществления первое средство лечения является более эффективным, так что снижение тяжести симптома или другого параметра, ассоциированного с заболеванием или нарушением, является большим, чем наблюдали бы в случае доставки первого средства лечения в отсутствие второго средства лечения. В других вариантах осуществления аналогичную ситуацию наблюдают для второго средства лечения. В некоторых вариантах осуществления положительный эффект комбинированной терапии (например, эффект в отношении по меньшей мере одного симптома или риска/скорости прогрессирования заболевания) является аддитивным. В некоторых вариантах осуществления положительный эффект комбинированной терапия является супераддитивным.
В некоторых вариантах осуществления в настоящем изобретении предусмотрен способ лечения рака у субъекта, нуждающегося в этом, и/или у субъекта, у которого имеется неопластическое нарушение или подозрение на его наличие, посредством введения субъекту терапевтически эффективного количества по меньшей мере одного соединения, выбранного из соединений формулы I (в том числе формул IIa-e, IIIa, IVa и Va) и/или их фармацевтически приемлемых солей; и по меньшей мере одного дополнительного средства терапии (например, средства терапии на основе ингибитора контрольных точек, цитокина или аналога цитокина, неоантигенной вакцины, CAR-T). В некоторых вариантах осуществления введение по меньшей мере одного соединения, выбранного из соединений формулы I (в том числе формул IIa-e, IIIa, IVa и Va) и/или их фармацевтически приемлемых солей, индуцирует образование по меньшей мере одного неоантигена и/или развитие T-клеточного ответа. В некоторых вариантах осуществления введение терапевтически эффективного количества по меньшей мере одного соединения, выбранного из соединений формулы I (в том числе формул IIa-e, IIIa, IVa и Va) и/или их фармацевтически приемлемых солей, индуцирует иммунный ответ на двухнитевую РНК. В некоторых вариантах осуществления введение терапевтически эффективного количества по меньшей мере одного соединения, выбранного из соединений формулы I (в том числе формул IIa-e, IIIa, IVa и Va) и/или их фармацевтически приемлемых солей, индуцирует иммуногенную гибель клеток. В некоторых вариантах осуществления по меньшей мере одно дополнительное средство терапии может предусматривать по меньшей мере одно, по меньшей мере два, по меньшей мере три, по меньшей мере четыре или по меньшей мере пять дополнительных средств терапии. Например, в некоторых вариантах осуществления терапевтически эффективное количество по меньшей мере одного соединения, выбранного из соединений формулы I (в том числе формул IIa-e, IIIa, IVa и Va) и/или их фармацевтически приемлемых солей, можно вводить в комбинации с двумя видами средств терапии на основе ингибитора контрольных точек, т. е. с применением двух разных ингибиторов контрольных точек. В некоторых других вариантах осуществления по меньшей мере одно соединение, выбранное из соединений формулы I (в том числе формул IIa-e, IIIa, IVa и Va) и/или их фармацевтически приемлемых солей, можно вводить в комбинации со средством терапии на основе ингибитора контрольных точек и неоантигенной вакциной.
В некоторых вариантах осуществления комбинированной терапии вводимое количество по меньшей мере одного соединения, выбранного из соединений формулы I (в том числе формул IIa-e, IIIa, IVa и Va) и/или их фармацевтически приемлемых солей, и/или по меньшей мере одного дополнительного средства терапии снижено на 10%, 15%, 20%, 25%, 30%, 35%, 40%, 45%, 50%, 75% или 90% относительно стандартной дозировки по меньшей мере одного соединения, выбранного из соединений формулы I (в том числе формул IIa-e, IIIa, IVa и Va) и/или их фармацевтически приемлемых солей, и/или по меньшей мере одного дополнительного средства терапии. В некоторых вариантах осуществления частота введения по меньшей мере одного соединения, выбранного из соединений формулы I (в том числе формул IIa-e, IIIa, IVa и Va) и/или их фармацевтически приемлемых солей, и/или по меньшей мере одного дополнительного средства терапии на по меньшей мере 10%, 15%, 20%, 25%, 30%, 35%, 40%, 45%, 50%, 75% или 90% меньше относительно стандартной схемы введения по меньшей мере одного соединения, выбранного из соединений формулы I (в том числе формул IIa-e, IIIa, IVa и Va) и/или их фармацевтически приемлемых солей, и/или по меньшей мере одного дополнительного средства терапии. В некоторых вариантах осуществления вводимое количество и/или дозировка по меньшей мере одного соединения, выбранного из соединений формулы I (в том числе формул IIa-e, IIIa, IVa и Va) и/или их фармацевтически приемлемых солей, и/или по меньшей мере одного дополнительного средства терапии приводят к более низкой системной токсичности и/или улучшенной переносимости.
В некоторых вариантах осуществления введение терапевтически эффективного количества по меньшей мере одного соединения, выбранного из соединений формулы I (в том числе формул IIa-e, IIIa, IVa и Va) и/или их фармацевтически приемлемых солей, начинают до введения по меньшей мере одного дополнительного средства терапии. В некоторых вариантах осуществления введение терапевтически эффективного количества по меньшей мере одного соединения, выбранного из соединений формулы I (в том числе формул IIa-e, IIIa, IVa и Va) и/или их фармацевтически приемлемых солей, начинают после введения по меньшей мере одного дополнительного средства терапии. В некоторых вариантах осуществления введение терапевтически эффективного количества по меньшей мере одного соединения, выбранного из соединений формулы I (в том числе формул IIa-e, IIIa, IVa и Va) и/или их фармацевтически приемлемых солей, начинают одновременно с введением по меньшей мере одного дополнительного средства терапии.
В некоторых вариантах осуществления введение терапевтически эффективного количества по меньшей мере одного соединения, выбранного из соединений формулы I (в том числе формул IIa-e, IIIa, IVa и Va) и/или их фармацевтически приемлемых солей, повторяют по меньшей мере один раз после начального введения. В некоторых вариантах осуществления количество по меньшей мере одного соединения, выбранного из соединений формулы I (в том числе формул IIa-e, IIIa, IVa и Va) и/или их фармацевтически приемлемых солей, применяемое для повторного введения, снижено относительно количества, применяемого для начального введения. В некоторых вариантах осуществления количество по меньшей мере одного соединения, выбранного из соединений формулы I (в том числе формул IIa-e, IIIa, IVa и Va) и/или их фармацевтически приемлемых солей, применяемое для повторного введения, снижено относительно стандартной дозировки по меньшей мере одного соединения, выбранного из соединений формулы I (в том числе формул IIa-e, IIIa, IVa и Va) и/или их фармацевтически приемлемых солей. В некоторых вариантах осуществления количество по меньшей мере одного соединения, выбранного из соединений формулы I (в том числе формул IIa-e, IIIa, IVa и Va) и/или их фармацевтически приемлемых солей, применяемое для повторного введения, снижено на 10%, 15%, 20%, 25%, 30%, 35%, 40%, 45%, 50%, 75% или 90% относительно стандартной дозировки по меньшей мере одного соединения, выбранного из соединений формулы I (в том числе формул IIa-e, IIIa, IVa и Va) и/или их фармацевтически приемлемых солей.
В некоторых вариантах осуществления введение по меньшей мере одного дополнительного средства терапии повторяют по меньшей мере один раз после начального введения. В некоторых вариантах осуществления количество по меньшей мере одного дополнительного средства терапии, применяемое для повторного введения, снижено относительно количества, применяемого для начального введения. В некоторых вариантах осуществления количество по меньшей мере одного дополнительного средства терапии, применяемое для повторного введения, снижено относительно стандартной дозировки по меньшей мере одного дополнительного средства терапии. В некоторых вариантах осуществления количество по меньшей мере одного дополнительного средства терапии, применяемое для повторного введения, снижено на 10%, 15%, 20%, 25%, 30%, 35%, 40%, 45%, 50%, 75% или 90% относительно стандартной дозировки по меньшей мере одного дополнительного средства терапии.
В некоторых вариантах осуществления повторное введение терапевтически эффективного количества по меньшей мере одного соединения, выбранного из соединений формулы I (в том числе формул IIa-e, IIIa, IVa и Va) и/или их фармацевтически приемлемых солей, осуществляют одновременно с повторным введением по меньшей мере одного дополнительного средства терапии. В некоторых вариантах осуществления повторное введение терапевтически эффективного количества по меньшей мере одного соединения, выбранного из соединений формулы I (в том числе формул IIa-e, IIIa, IVa и Va) и/или их фармацевтически приемлемых солей, осуществляют последовательно или с разнесением во времени с повторным введением по меньшей мере одного дополнительного средства терапии.
В некоторых вариантах осуществления в настоящем изобретении предусмотрен способ лечения рака у субъекта, нуждающегося в этом, и/или у субъекта, у которого имеется неопластическое нарушение или подозрение на его наличие, посредством введения субъекту терапевтически эффективного количества по меньшей мере одного соединения, выбранного из соединений формулы I (в том числе формул IIa-e, IIIa, IVa и Va) и/или их фармацевтически приемлемых солей; и средства терапии на основе ингибитора контрольных точек. В некоторых вариантах осуществления средство терапии на основе ингибитора контрольных точек предусматривает введение по меньшей мере одного ингибитора контрольных точек. В некоторых вариантах осуществления субъект характеризуется непереносимостью, невосприимчивостью или недостаточной восприимчивостью по меньшей мере одного ингибитора контрольных точек при введении его по отдельности. В некоторых вариантах осуществления может считаться, что субъект характеризуется невосприимчивостью или недостаточной восприимчивостью по меньшей мере одного ингибитора контрольных точек, как определено с применением, например, иммунозависимых критериев ответа на иммунотерапию (irRC) и/или иммунозависимых критериев оценки ответа на иммунотерапию при солидных опухолях (irRECIST). См., например, Wolchok et al. (2009) Clin Cancer Res. 15(23):7412-20; Bohnsack et al. "Adaptation of the Immune-Related Response Criteria:irRECIST" (Abstract 4958) ESMO 2014. Иллюстративные критерии могут включать критерии, применяемые в уровне техники для определения того, когда состояние опухолей у пациентов с раком улучшается ("ответ"), остается таким же ("стабилизация") или ухудшается ("прогрессирование") во время лечения, в случае если оцениваемое средство лечения представляет собой иммунное противоопухолевое лекарственное средство (например, ингибитор контрольных точек). В некоторых вариантах осуществления может считаться, что субъект характеризуется непереносимостью по меньшей мере одного ингибитора контрольных точек, если у субъекта наблюдается одно или более чем одно нежелательное (степени 2+) явление, идентифицированное для соответствующего ингибитора контрольных точек (например, ипилимумаба). Например, в некоторых вариантах осуществления может считаться, что субъект характеризуется непереносимостью средства лечения на основе ипилимумаба, если у субъекта наблюдается одно или несколько нежелательных явлений, выбранных из энтероколита, гепатита, дерматита (в том числе токсичного эпидермального некролиза), нейропатии и эндокринопатии (Yervoy® (ипилимумаба), приложение к маркировке, соответствующей требованиям FDA, 2018).
В некоторых вариантах осуществления ингибитор контрольных точек целенаправленно воздействует на PD1/PDL1, CTLA4, OX40, CD40, LAG3, TIM3, GITR и/или KIR. В некоторых вариантах осуществления ингибитор контрольных точек целенаправленно воздействует на CTLA4, OX40, CD40 и/или GITR. В некоторых вариантах осуществления целенаправленное воздействие ингибитора контрольных точек обеспечивается с помощью ингибиторного антитела или другой подобной ингибиторной молекулы. В некоторых других вариантах осуществления ингибитор контрольных точек целенаправленно воздействует в качестве антитела-агониста или другой подобной молекулы-агониста. В некоторых вариантах осуществления ингибитор контрольных точек предусматривает ингибитор пути антигена 4, ассоциированного с цитотоксическими T-лимфоцитами (CTLA4). В некоторых вариантах осуществления ингибитор CTLA4 представляет собой антитело к CTLA4. В некоторых вариантах осуществления антитело к CTLA4 представляет собой ипилимумаб. В некоторых вариантах осуществления ингибитор контрольных точек предусматривает ингибитор пути белка 1 программируемой клеточной гибели (PD1). В некоторых вариантах осуществления ингибитор PD1 представляет собой антитело к PD1. В некоторых вариантах осуществления антитело к PD1 представляет собой ниволумаб. В некоторых вариантах осуществления ингибитор PD1 представляет собой антитело к PDL1. В некоторых вариантах осуществления антитело к PDL1 представляет собой атезолизумаб. В некоторых вариантах осуществления ингибитор контрольных точек предусматривает ингибитор CTLA4 и ингибитор PD1. В некоторых вариантах осуществления ингибитор контрольных точек целенаправленно воздействует на OX40. В некоторых вариантах осуществления ингибитор контрольных точек целенаправленно воздействует на CD40. В некоторых вариантах осуществления ингибитор контрольных точек целенаправленно воздействует на GITR. В некоторых вариантах осуществления положительный эффект комбинированной терапии (например, эффект в отношении по меньшей мере одного симптома или риска/скорости прогрессирования заболевания), в составе которой терапевтически эффективное количество по меньшей мере одного соединения, выбранного из соединений формулы I (в том числе формул IIa-e, IIIa, IVa и Va) и/или их фармацевтически приемлемых солей, и ингибитор контрольных точек (например, антитело или молекула, целенаправленно воздействующие на CTLA4, PD1/PDL1, OX40, CD40 и/или GITR), является аддитивным. В некоторых вариантах осуществления положительный эффект комбинированной терапии, в составе которой терапевтически эффективное количество по меньшей мере одного соединения, выбранного из соединений формулы I (в том числе формул IIa-e, IIIa, IVa и Va) и/или их фармацевтически приемлемых солей, и ингибитор контрольных точек (например, антитело или молекула, целенаправленно воздействующие на CTLA4, PD1/PDL1, OX40, CD40 и/или GITR), является супераддитивным (т. е. синергическим).
В некоторых вариантах осуществления в настоящем изобретении предусмотрен способ лечения рака у субъекта, нуждающегося в этом, и/или у субъекта, у которого имеется неопластическое нарушение или подозрение на его наличие, посредством введения субъекту терапевтически эффективного количества по меньшей мере одного соединения, выбранного из соединений формулы I (в том числе формул IIa-e, IIIa, IVa и Va) и/или их фармацевтически приемлемых солей; и средства терапии на основе цитокина или аналога цитокина. В некоторых вариантах осуществления средство терапии на основе цитокина или аналога цитокина предусматривает введение по меньшей мере одного цитокина или аналога цитокина. В некоторых вариантах осуществления субъект характеризуется непереносимостью, невосприимчивостью или недостаточной восприимчивостью по меньшей мере одного цитокина или аналога цитокина при введении их по отдельности.
В некоторых вариантах осуществления цитокин или аналог цитокина предусматривает средство усиления для T-клеток. В некоторых вариантах осуществления цитокин или аналог цитокина предусматривает IL-2, IL-10, IL-12, IL-15, IFNγ и/или TNFα. В некоторых вариантах осуществления цитокин или аналог цитокина предусматривает IL-2, IL-10, IL-12 и/или IL-15. В некоторых вариантах осуществления введение цитокина или аналога цитокина усиливает примирование T-клеток после введения терапевтически эффективного количества по меньшей мере одного соединения, выбранного из соединений формулы I (в том числе формул IIa-e, IIIa, IVa и Va) и/или их фармацевтически приемлемых солей, вследствие индуцирования образования и презентации неоантигенов.
В некоторых вариантах осуществления цитокин или аналог цитокина предусматривает IL-2. В некоторых вариантах осуществления IL-2 усиливает сигналы в эффекторных клетках, содействуя их размножению (Rosenberg (2014) J Immunol. 192(12):5451-8). В некоторых вариантах осуществления цитокин или аналог цитокина предусматривает IL-10. В некоторых вариантах осуществления IL-10 усиливает примирование и активацию CD8+ T-клеток (Mumm et al. (2011) Cancer Cell 20(6):781-96). В некоторых вариантах осуществления цитокин или аналог цитокина предусматривает IL-12. В некоторых вариантах осуществления IL-12 сопрягает врожденный и адаптивный иммунный ответы с усилением антиген-специфического примирования и целенаправленного воздействия (Tugues et al. (2015) Cell Death Differ. 22(2):237-46). В некоторых вариантах осуществления цитокин или аналог цитокина предусматривает IL-15. В некоторых вариантах осуществления IL-15 усиливает примирование и/или активацию эффекторных T-клеток (CD8). В некоторых вариантах осуществления цитокин или аналог цитокина предусматривает IFNγ. В некоторых вариантах осуществления IFNγ дополняет секрецию IFNγ эффекторными T-клетками. В некоторых вариантах осуществления цитокин или аналог цитокина предусматривает TNFα. В некоторых вариантах осуществления TNFα дополняет секрецию TNFα эффекторными T-клетками.
В некоторых вариантах осуществления начальную дозу, содержащую терапевтически эффективное количество по меньшей мере одного соединения, выбранного из соединений формулы I (в том числе формул IIa-e, IIIa, IVa и Va) и/или их фармацевтически приемлемых солей, вводят субъекту для запуска аберрантного сплайсинга и продуцирования неоантигенных пептидов. В некоторых вариантах осуществления по прошествии периода времени, необходимого для продуцирования белка и презентации антигена, затем субъекту вводят начальную дозу цитокина или аналога цитокина для усиления и/или улучшения примирования и размножения эффекторных Т-клеток. В некоторых вариантах осуществления период ожидания между дозами по меньшей мере одного соединения, выбранного из соединений формулы I (в том числе формул IIa-e, IIIa, IVa и Va) и/или их фармацевтически приемлемых солей, и цитокина или аналога цитокина составляет приблизительно 2, приблизительно 3, приблизительно 4, приблизительно 5, приблизительно 6 или приблизительно 7 дней. В некоторых вариантах осуществления период ожидания составляет от приблизительно 3 дней до приблизительно 5 дней. В некоторых вариантах осуществления цитокин или аналог цитокина представляют собой IL-2, IL-10, IL-12, IL-15, IFNγ и/или TNFα. В некоторых вариантах осуществления терапевтический положительный эффект комбинации, в составе которой по меньшей мере одно соединение, выбранное из соединений формулы I (в том числе формул IIa-e, IIIa, IVa и Va) и/или их фармацевтически приемлемых солей, и цитокин или аналог цитокина, может быть аддитивным или супераддитивным.
В некоторых вариантах осуществления по прошествии периода времени, необходимого для примирования и размножения Т-клеток, затем субъекту вводят вторую или последующую дозу, содержащую терапевтически эффективное количество по меньшей мере одного соединения, выбранного из соединений формулы I (в том числе формул IIa-e, IIIa, IVa и Va) и/или их фармацевтически приемлемых солей, для запуска повторной презентации неоантигенных пептидов. В некоторых вариантах осуществления период ожидания между начальной дозой цитокина или аналога цитокина и второй или последующей дозой, содержащей терапевтически эффективное количество по меньшей мере одного соединения, выбранного из соединений формулы I (в том числе формул IIa-e, IIIa, IVa и Va) и/или их фармацевтически приемлемых солей, составляет приблизительно 2, приблизительно 3, приблизительно 4 или приблизительно 5 недель. В некоторых вариантах осуществления период ожидания составляет приблизительно 3 недели. В некоторых вариантах осуществления могут вводиться последующие дозы цитокина или аналога цитокина, например, вперемежку с последующими дозами, содержащими терапевтически эффективное количество по меньшей мере одного соединения, выбранного из соединений формулы I (в том числе формул IIa-e, IIIa, IVa и Va) и/или их фармацевтически приемлемых солей. В некоторых вариантах осуществления после введения второй или последующей дозы, содержащей терапевтически эффективное количество по меньшей мере одного соединения, выбранного из соединений формулы I (в том числе формул IIa-e, IIIa, IVa и Va) и/или их фармацевтически приемлемых солей, иммунная система может контактировать с презентирующими неоантиген опухолевыми клетками и/или вызывать уничтожение опухолевых клеток. В некоторых вариантах осуществления введение доз, содержащих терапевтически эффективное количество по меньшей мере одного соединения, выбранного из соединений формулы I (в том числе формул IIa-e, IIIa, IVa и Va) и/или их фармацевтически приемлемых солей, согласно данной иллюстративной начальной схеме лечения может быть "пульсирующим", т. е. по меньшей мере одно соединение, выбранное из соединений формулы I (в том числе формул IIa-e, IIIa, IVa и Va) и/или их фармацевтически приемлемых солей, можно вводить дозами с длительными интервалами (например, приблизительно каждые 4 недели, приблизительно каждые 5 недель, приблизительно каждые 6 недель) для обеспечения презентации антигена, привлечения Т-клеток, и/или уничтожения опухолевых клеток, и/или восстановления популяции Т-клеток памяти.
В некоторых вариантах осуществления субъект характеризуется мутационной нагрузкой с несинонимичными изменениями, составляющей приблизительно 150 мутаций или меньше. В некоторых вариантах осуществления субъект характеризуется мутационной нагрузкой с несинонимичными изменениями, составляющей приблизительно 100 мутаций или меньше. В некоторых вариантах осуществления субъект характеризуется мутационной нагрузкой с несинонимичными изменениями, составляющей приблизительно 50 мутаций или меньше. В некоторых вариантах осуществления субъект имеет неопластическое нарушение, например, гематологическое злокачественное новообразование или солидную опухоль, или имеет подозрение на его наличие. В некоторых вариантах осуществления гематологическое злокачественное новообразование выбрано из B-клеточного злокачественного новообразования, лейкоза, лимфомы и миеломы. В некоторых вариантах осуществления гематологическое злокачественное новообразование выбрано из острого миелоидного лейкоза и множественной миеломы. В некоторых вариантах осуществления солидная опухоль выбрана из рака молочной железы, рака желудка, рака предстательной железы, рака яичника, рака легкого, рака матки, карциномы слюнных протоков, меланомы, рака толстой кишки и рака пищевода. В некоторых вариантах осуществления солидная опухоль выбрана из HER2-положительного рака молочной железы, аденокарциномы желудка и рака предстательной железы.
В некоторых вариантах осуществления субъект нуждается в способе лечения рака. В некоторых вариантах осуществления рак представляет собой гематологическое злокачественное новообразование или солидную опухоль. В некоторых вариантах осуществления гематологическое злокачественное новообразование выбрано из B-клеточного злокачественного новообразования, лейкоза, лимфомы и миеломы. В некоторых вариантах осуществления гематологическое злокачественное новообразование выбрано из острого миелоидного лейкоза и множественной миеломы. В некоторых вариантах осуществления солидная опухоль выбрана из рака молочной железы, рака желудка, рака предстательной железы, рака яичника, рака легкого, рака матки, карциномы слюнных протоков, меланомы, рака толстой кишки и рака пищевода. В некоторых вариантах осуществления солидная опухоль выбрана из HER2-положительного рака молочной железы, аденокарциномы желудка и рака предстательной железы. В некоторых вариантах осуществления пациента, у которого имеется рак, описанный в данном документе, можно лечить с помощью комбинации из по меньшей мере одного соединения, выбранного из соединений формулы I (в том числе формул IIa-e, IIIa, IVa и Va) и/или их фармацевтически приемлемых солей, и неоантигенной вакцины. Не ограничиваясь теорией, вакцины, применяемые по отдельности или в комбинации с молекулами, представляющими собой ингибитор контрольных точек иммунного ответа (ICI), показали себя перспективными в клинических исследованиях ранних фаз (Ott et al. (2017) Nature 547(7662):217-21; Sahin et al. (2017) Nature 547(7662):222-6), но обычно требуется секвенирование мутаций в опухоли у пациента (Ott et al. (2017) Nature 547(7662):217-21; Aldous and Dong (2018) Bioorg. Med. Chem. 26(10):2842-9). Таким образом, действие вакцин зачастую зависит от достаточных количеств несинонимичных мутаций, которые являются антигенными. В целом, в опухолях с очень низкой мутационной нагрузкой имеется небольшое количество антигенов-кандидатов, и в случае опухолей с быстрым ростом имеется ограниченное время для идентификации и получения специфических для пациента вакцин.
До настоящего времени попытки разработать вакцины, которые характеризовались бы широким охватом иммуногенности для большого процента пациентов, были сосредоточены на белках, которые либо часто мутируют, либо эктопически сверхэкспрессируются или амплифицируются, и/или которые существуют в виде "собственных" белков в организме. Кроме того, эти белки зачастую экспрессируются в тканях, на которые не оказывает воздействие иммунная система (например, нейронные маркеры, экспрессируемые в типах нейроэндокринных опухолей), в то же время другие белки могут в норме экспрессироваться во время эмбриогенеза (например, раковые эмбриональные антигены). Таким образом, применимость вакцин, использующих такие белки в качестве антигенов, зачастую ограничена специфическим линиями происхождения или подгруппами опухоли, в которых присутствуют один или несколько антигенов. Применимость вакцины также будет необходимо подтверждать посредством секвенирования образцов опухоли пациента, что может занимать много времени.
Более того, если такие антигены существуют в виде "собственных" белков, иммунная система вероятно будет примирована для распознавания таких белков как "собственные" и, таким образом, не будет отвечать. Или, в качестве альтернативы, если иммунная система способна обеспечивать эффекторный ответ на такие антигены, он может приводить к побочным эффектам, связанным с воздействием на мишени, в тканях, где может экспрессироваться антиген. В обоих этих случаях одной из ключевых проблем является то, что большинство антигенных пептидов получают из генов-"пассажиров" (т. е. генов, которые мутируют или амплифицируются на протяжении онкогенеза, но не играют важнейшую роль в продолжительном выживании или пролиферации опухоли самой по себе). По этой причине эти гены могут быть подвергнуты сайленсингу без значительных последствий для прогрессирования опухоли и, таким образом, могут позволить опухоль "избежать" иммунного ответа на эти антигены. Не желая ограничиваться теорией, данный механизм может играть роль в эволюции опухоли, при которой случайные мутации, которые характеризуются сильной антигенностью, зачастую подвергаются "отсеивающему отбору" опухолью во время ранних стадий онкогенеза (Dunn et al. (2004) Annu. Rev. Immunol. 22:329-60).
Кроме того, определенные свидетельства также указывают на то, что постоянная презентация антигена и иммунная стимуляция могут приводить к анергии и истощению иммунных клеток (Pardoll (2012) Nat. Rev. Cancer 12(4):252-64). Такие фенотипы лежат в основе терапевтического обоснования используемых в настоящее время средств лечения на основе ICI, поскольку, как было показано, ICI либо сдерживают фенотип истощения иммунных клеток (α-PD1/PD-L1), либо облегчают дополнительные иммунные клеточные ответы (α-CTLA4). Примечательно, что в случае средства терапии на основе α-CTLA4 сообщалось, что определенная подгруппа пациентов демонстрировала серьезные связанные с иммунной системой нежелательные явления, которые могут быть обусловлены содействием активации T-клеток и разрушением механизмов иммунной толерантности, ограничивающей аутореактивные иммунные ответы.
Оба такие подхода (т. е. запуск или усиление de novo иммунных ответов на неоантигены или повторная активация при анергии или истощении существующих иммунных ответов) связаны с постоянной активацией иммунной системы. В связи с этим, эти подходы являются чувствительными к анергии, редактированию и другим опухоль-опосредованным механизмам, направленным на подавление вовлечения иммунной системы.
В противоположность этому, лечение с помощью по меньшей мере одного соединения, выбранного из соединений формулы I (в том числе формул IIa-e, IIIa, IVa и Va) и/или их фармацевтически приемлемых солей, может индуцировать иммунный ответ на новые последовательности, представляющие неоантигены. В некоторых вариантах осуществления презентация неоантигенов предоставляет адаптивной иммунной системе более разнообразные мишени, с которым она контактирует и активируется. В некоторых вариантах осуществления способность по меньшей мере одного соединения, выбранного из соединений формулы I (в том числе формул IIa-e, IIIa, IVa и Va) и/или их фармацевтически приемлемых солей, четко индуцировать альтернативный сплайсинг, и полученные в результате неоантигены могут снижать риск усталости иммунной системы вследствие постоянного воздействия неоантигенов, вызванных мутациями, и/или ограничивать способность опухолевых клеток адаптироваться к уклонению от терапии. В некоторых вариантах осуществления введение по меньшей мере одного соединения, выбранного из соединений формулы I (в том числе формул IIa-e, IIIa, IVa и Va) и/или их фармацевтически приемлемых солей, в комбинации с неоантигенной вакциной усиливает иммунный ответ на неоантигены, продуцируемые под действием по меньшей мере одного соединения, выбранного из соединений формулы I (в том числе формул IIa-e, IIIa, IVa и Va) и/или их фармацевтически приемлемых солей. В некоторых вариантах осуществления по меньшей мере одно соединение, выбранное из соединений формулы I (в том числе формул IIa-e, IIIa, IVa и Va) и/или их фармацевтически приемлемых солей, вводят до, во время или после вакцинации. В некоторых вариантах осуществления по меньшей мере одно соединение, выбранное из соединений формулы I (в том числе формул IIa-e, IIIa, IVa и Va) и/или их фармацевтически приемлемых солей, и/или вакцину можно вводить один раз или более одного раза в течение курса лечения. В некоторых вариантах осуществления вакцину вводят один раз, а по меньшей мере одно соединение, выбранное из соединений формулы I (в том числе формул IIa-e, IIIa, IVa и Va) и/или их фармацевтически приемлемых солей, вводят более одного раза в течение курса лечения. В некоторых вариантах осуществления вакцину вводят один раз, а затем в течение курса лечения вводится одна или несколько бустерных доз.
Применяемый в данном документе термин "неоантигенная вакцина" относится к объединенному образцу из одного или нескольких иммуногенных неоантигенных пептидов или mRNA, например, по меньшей мере двух, по меньшей мере трех, по меньшей мере четырех, по меньшей мере пяти или более неоантигенных пептидов. Термин "вакцина" относится к композиции для развития иммунитета для профилактики и/или лечения заболевания (например, неопластического нарушения, например, гематологического злокачественного новообразования или солидной опухоли). Соответственно, вакцины представляют собой лекарственные препараты, которые содержат иммуногенные средства и предназначены для применения на человеке или животных для развития специфических механизмов иммунной защиты и образования защитных веществ после вакцинации. Неоантигенная вакцина может дополнительно включать фармацевтически приемлемый носитель, разбавитель, вспомогательное вещество и/или адъювант.
Применяемый в данном документе термин "иммуногенный" относится к любому средству или композиции, которые могут вызывать иммунный ответ, например, T-клеточный ответ. Иммунный ответ может быть опосредован антителом, или клеткой, или обоими.
В некоторых вариантах осуществления пациенту вводят по меньшей мере одно соединение, выбранное из соединений формулы I (в том числе формул IIa-e, IIIa, IVa и Va) и/или их фармацевтически приемлемых солей, и затем вводят пептидную или mRNA-вакцину на основе известного неоантигена для усиления иммунного ответа на неоантигены, продуцируемые под действием по меньшей мере одного соединения, выбранного из соединений формулы I (в том числе формул IIa-e, IIIa, IVa и Va) и/или их фармацевтически приемлемых солей. В некоторых других вариантах осуществления пациенту вводят по меньшей мере одно соединение, выбранное из соединений формулы I (в том числе формул IIa-e, IIIa, IVa и Va) и/или их фармацевтически приемлемых солей, и проводят скрининг в отношении неоантигенов, продуцируемых в результате лечения. Следовательно, один или несколько из данных неоантигенов применяют для создания персонализированной вакцины, которую вводят пациенту. В любом из данных вариантов осуществления по меньшей мере одно соединение, выбранное из соединений формулы I (в том числе формул IIa-e, IIIa, IVa и Va) и/или их фармацевтически приемлемых солей, и/или пептидную или mRNA-вакцину можно вводить пациенту один раз или несколько раз.
В некоторых вариантах осуществления подходящий неоантиген для вакцины может быть идентифицирован посредством скрининга панели транскриптов с измененным сплайсингом и устойчивой экспрессией, полученных из одного или нескольких образцов ткани пациента (например, из биоптата опухоли). В некоторых вариантах осуществления последовательности вариантов белка идентифицируют в подвергнутом скринингу образце на основе трансляции вдоль соединения в подвергнутой аберрантному сплайсингу mRNA, при этом сохраняя части белковой последовательности (не более 12 аминокислот), фланкирующие изменения аминокислот, охватывающие соединение. В некоторых вариантах осуществления эти охватывающие соединения пептидные фрагменты исследуют в отношении высокой аффинности связывания с аллелями MHC1, например, с применением такого средства, как NetMHC1 (Nielsen et al. (2003) Protein Sci 12(5):1007-17; Andreatta and Neilsen (2016) Bioinformatics 32(4):511-7). Эти результаты позволяют фильтровать неопептиды до неопептидов, которые, как прогнозируется, характеризуются с высокой аффинностью связывания с составом аллелей HLA, уникальным для пациента, а также собирать пулы неопептидов, которые, как прогнозируется, связываются с широким спектром аллелей HLA, присутствующих с высокой частотой в разных популяциях (Maiers et al. (2007) Hum Immunol 68(9):779-88). В некоторых вариантах осуществления идентифицированные неопептиды затем составляют в виде вакцины, например посредством соединения с подходящим носителем или адъювантом (Ott et al. (2017) Nature 547(7662):217-21), или для доставки в виде mRNA (Sahin et al. (2017) Nature 547(7662):222-6).
В некоторых вариантах осуществления выбранный неоантиген основан на результате скрининга при ответе опухоли индивидуального пациента на по меньшей мере одно соединение, выбранное из соединений формулы I (в том числе формул IIa-e, IIIa, IVa и Va) и/или их фармацевтически приемлемых солей, с идентификацией одного или нескольких неоантигенов, полученных в результате лечения, для применения в последующей вакцинации. В других вариантах осуществления неоантиген выбирают, например, на основе скрининга панели образцов, полученных от разных пациентов, для идентификации общих неоантигенов, продуцируемых под действием по меньшей мере одного соединения, выбранного из соединений формулы I (в том числе формул IIa-e, IIIa, IVa и Va) и/или их фармацевтически приемлемых солей, и затем применяют в качестве универсальной вакцины для будущих пациентов.
Не ограничиваясь теорией, в некоторых вариантах осуществления применение универсальной неоантигенной вакцины позволит избежать необходимости в секвенировании и анализе уникального мутационного статуса опухоли каждого пациента, поскольку выбранные неоантигены не зависят от мутации в опухоли, а скорее имитируют неоантиген, продуцируемый под действием по меньшей мере одного соединения, выбранного из соединений формулы I (в том числе формул IIa-e, IIIa, IVa и Va) и/или их фармацевтически приемлемых солей, и обычно распознаваемый организмом как чужеродный. Кроме того, в некоторых вариантах осуществления применение неоантигенной вакцины может быть особенно эффективным, поскольку опухолевые клетки пациента могут с большей вероятностью мутировать, не продуцируя один или несколько неоантигенов, которые зависят от мутации в опухоли, по сравнению с клетками, которые имитируют неоантиген, продуцируемый под действием по меньшей мере одного соединения, выбранного из соединений формулы I (в том числе формул IIa-e, IIIa, IVa и Va) и/или их фармацевтически приемлемых солей. Это может создавать возможность составления основной вакцины, которая будет характеризоваться широким охватом иммуногенности для большого процента пациентов, ускоряя начало схемы лечения. Пациентов можно вакцинировать согласно схемам, изложенным в данном документе, и перед следующим завершением вакцинации можно дополнительно подвергать лечению с помощью по меньшей мере одного соединения, выбранного из соединений формулы I (в том числе формул IIa-e, IIIa, IVa и Va) и/или их фармацевтически приемлемых солей, например, для индуцирования экспрессии неоантигенных пептидов. В некоторых вариантах осуществления пациентам можно вводить по меньшей мере одно соединение, выбранное из соединений формулы I (в том числе формул IIa-e, IIIa, IVa и Va) и/или их фармацевтически приемлемых солей, до вакцинации, одновременно с нею или после нее. В некоторых вариантах осуществления пациентам вводят по меньшей мере одно соединение, выбранное из соединений формулы I (в том числе формул IIa-e, IIIa, IVa и Va) и/или их фармацевтически приемлемых солей, у которых был проведен скрининг в отношении одного или нескольких неоантигенов, обнаруженных в панели универсальных неоантигенов, и их вакцинируют универсальной неоантигенной вакциной, содержащей по меньшей мере один универсальный неоантиген, идентифицированный у субъекта. В некоторых вариантах осуществления пациентам можно вводить по меньшей мере одно соединение, выбранное из соединений формулы I (в том числе формул IIa-e, IIIa, IVa и Va) и/или их фармацевтически приемлемых солей, один раз или более одного раза после вакцинации. Соединение(-я), выбранное(-ые) из соединений формулы I (в том числе формул IIa-e, IIIa, IVa и Va) и/или их фармацевтически приемлемых солей, и/или вакцину можно вводить один раз или более одного раза в течение курса лечения.
В некоторых вариантах осуществления вакцина может содержать один или более одного неоантигенного пептида или mRNA. В некоторых вариантах осуществления вакцина содержат один или более одного длинного неоантигенного пептида. В некоторых вариантах осуществления такие "длинные" неоантигенные пептиды подвергаются эффективной интернализации, процессингу и перекрестной презентации в специализированных антигенпрезентирующих клетках, таких как дендритные клетки. Подобным образом, в других контекстах было показано, что длинные вакцинные пептиды индуцируют цитотоксические T-клетки у человека (Melief and van der Burg (2008) Nat Rev Cancer 8(5):351-60). В некоторых вариантах осуществления неоантигенный пептид является удлиненным с включением собственно последовательности неоантигенного пептида в дополнение к фланкирующим аминокислотным последовательностям. В некоторых вариантах осуществления удлиненная пептидная последовательность облегчает захват белка антигенпрезентирующими клетками, например, дендритными клетками. В некоторых вариантах осуществления удлиненная пептидная последовательность обеспечивает эффективную презентацию антигена и примирование T-клеток в моделях с разными изотипами HLA. В некоторых вариантах осуществления более длинный неоантигенный пептид и/или удлиненная пептидная последовательность проявляют повышенным захват антигенпрезентирующими клетками (например, дендритными клетками), повышенную презентацию антигена и/или повышенное примирование T-клеток по сравнению с более коротким неоантигенным пептидом и/или более короткой пептидной последовательностью (например, с пептидной последовательность, длина которой составляет менее приблизительно 10 или менее приблизительно 5 аминокислот). В некоторых вариантах осуществления длина длинного неоантигенного пептида находится в диапазоне от приблизительно 5 до приблизительно 50 аминокислот. В некоторых вариантах осуществления длина длинного неоантигенного пептида находится в диапазоне от приблизительно 10 до приблизительно 50 аминокислот. В некоторых вариантах осуществления длина по меньшей мере одного неоантигенного пептида находится в диапазоне от приблизительно 10 до приблизительно 35 аминокислот. В некоторых вариантах осуществления длина длинного неоантигенного пептида находится в диапазоне от приблизительно 15 до приблизительно 25 аминокислот.
В некоторых вариантах осуществления длина неоантигенной последовательности и/или антигенной части находится в диапазоне от приблизительно 10 до приблизительно 35 аминокислот. В некоторых вариантах осуществления длина неоантигенной последовательности и/или антигенной части находится в диапазоне от приблизительно 15 до приблизительно 25 аминокислот. В некоторых вариантах осуществления длина неоантигенной последовательности и/или антигенной части находится в диапазоне от приблизительно 10 до приблизительно 20 аминокислот. В некоторых вариантах осуществления неоантигенная последовательность и/или антигенная часть непосредственно не перекрываются с канонической пептидной последовательностью (например, любой из иллюстративных канонических пептидных последовательностей, подчеркнутых в таблице 3) или не состоят из нее.
Аминокислотные последовательности иллюстративных длинных неоантигенных пептидов представлены в таблице 3.
Эти иллюстративные неоантигенные пептиды образуются после введения ADC, содержащих модуляторы сплайсинга на основе пладиенолида, однако, учитывая аналогичный механизм действия (т. е. аналогичные механизмы модуляции сплайсинга), аналогичные неоантигенные пептиды могут быть получены под действием соединений, выбранных из соединений формулы I (в том числе формул IIa-e, IIIa, IVa и Va) и/или их фармацевтически приемлемых солей.
Белковые последовательности двадцати девяти неопептидов, перечисленных в таблице 2, могут быть удлинены. Удлиненная белковая последовательность включает одновременно собственно неопептидную последовательность в дополнение к фланкирующим аминокислотным последовательностям. Удлиненная белковая последовательность лучше облегчает захват белка дендритными клетками и содействует презентации антигена и примированию T-клеток в моделях с разными изотипами HLA. Аминокислотные последовательности двадцати девяти удлиненных неопептидов представлены в таблице 3.
* Подчеркивание указывает аминокислоты, полученные из открытой рамки считывания канонического транскрипта (т. е. каноническую пептидную последовательность).
Применяемые в данном документе "неоантигенный пептид" или "mRNA-вакцина" охватывают применение фрагмента неоантигенного пептида или кодирующей его mRNA, при условии, что данный фрагмент сохраняет иммуногенный потенциал.
В некоторых вариантах осуществления неоантигенная вакцина содержит по меньшей мере один неоантигенный пептид. В некоторых вариантах осуществления неоантигенная вакцина содержит по меньшей мере 2, по меньшей мере 3, по меньшей мере 4, по меньшей мере 5, по меньшей мере 6, по меньшей мере 7, по меньшей мере 8, по меньшей мере 9, по меньшей мере 10, по меньшей мере 12, по меньшей мере 15 или по меньшей мере 20 неоантигенных пептидов. В некоторых вариантах осуществления длина неоантигенного(-ых) пептида(-ов) находится в диапазоне от приблизительно 5 до приблизительно 50 аминокислот. В некоторых вариантах осуществления длина неоантигенного(-ых) пептида(-ов) находится в диапазоне от приблизительно 10 до приблизительно 50 аминокислот. В некоторых вариантах осуществления длина по меньшей мере одного неоантигенного пептида находится в диапазоне от приблизительно 10 до приблизительно 35 аминокислот. В некоторых вариантах осуществления длина неоантигенного(-ых) пептида(-ов) находится в диапазоне от приблизительно 15 до приблизительно 25 аминокислот.
В некоторых вариантах осуществления в настоящем изобретении предусмотрен способ лечения субъекта, у которого имеется неопластическое нарушение или подозрение на его наличие, посредством введения субъекту эффективного количества по меньшей мере одного соединения, выбранного из соединений формулы I (в том числе формул IIa-e, IIIa, IVa и Va) и/или их фармацевтически приемлемых солей; и неоантигенной вакцины. Неоантигенная вакцина может представлять собой, например, пептидную неоантигенную вакцину или неоантигенную mRNA-вакцину. В некоторых вариантах осуществления по меньшей мере одно соединение, выбранное из соединений формулы I (в том числе формул IIa-e, IIIa, IVa и Va) и/или их фармацевтически приемлемых солей, вводят до введения неоантигенной вакцины. В некоторых вариантах осуществления по меньшей мере одно соединение, выбранное из соединений формулы I (в том числе формул IIa-e, IIIa, IVa и Va) и/или их фармацевтически приемлемых солей, вводят после введения неоантигенной вакцины. В некоторых вариантах осуществления по меньшей мере одно соединение, выбранное из соединений формулы I (в том числе формул IIa-e, IIIa, IVa и Va) и/или их фармацевтически приемлемых солей, вводят одновременно с введением неоантигенной вакцины. В некоторых вариантах осуществления введение по меньшей мере одного соединения, выбранного из соединений формулы I (в том числе формул IIa-e, IIIa, IVa и Va) и/или их фармацевтически приемлемых солей, повторяют по меньшей мере один раз после начального введения. В некоторых вариантах осуществления количество по меньшей мере одного соединения, выбранного из соединений формулы I (в том числе формул IIa-e, IIIa, IVa и Va) и/или их фармацевтически приемлемых солей, применяемое для повторного введения, снижено по сравнению с количеством, применяемым для начального введения.
В некоторых вариантах осуществления в настоящем изобретении дополнительно предусмотрена комбинация, содержащая по меньшей мере одно соединение, выбранное из соединений формулы I (в том числе формул IIa-e, IIIa, IVa и Va) и/или их фармацевтически приемлемых солей; и неоантигенную вакцину (например, универсальную неоантигенную вакцину), для применения в лечении субъекта, у которого имеется неопластическое нарушение или подозрение на его наличие. В некоторых вариантах осуществления неоантигенная вакцина представляет собой пептидную неоантигенную вакцину или неоантигенную mRNA-вакцину. В некоторых вариантах осуществления комбинация дополнительно содержит по меньшей мере одно дополнительное средство терапии. В некоторых вариантах осуществления по меньшей мере одно дополнительное средство терапии предусматривает по меньшей мере одно, по меньшей мере два, по меньшей мере три, по меньшей мере четыре или по меньшей мере пять дополнительных средств терапии.
В некоторых вариантах осуществления в настоящем изобретении дополнительно предусмотрен способ лечения субъекта, у которого имеется неопластическое нарушение или подозрение на его наличие, посредством (a) введения субъекту эффективного количества по меньшей мере одного соединения, выбранного из соединений формулы I (в том числе формул IIa-e, IIIa, IVa и Va) и/или их фармацевтически приемлемых солей; (b) обнаружения одного или нескольких неоантигенов у субъекта после введения по меньшей мере одного соединения, выбранного из соединений формулы I (в том числе формул IIa-e, IIIa, IVa и Va) и/или их фармацевтически приемлемых солей; (c) сравнения одного или нескольких неоантигенов с панелью универсальных неоантигенов и (d) введения субъекту универсальной неоантигенной вакцины, содержащей по меньшей мере один универсальный неоантиген, присутствующий у субъекта. В некоторых вариантах осуществления универсальную неоантигенную вакцину вводят по отдельности или в комбинации с по меньшей мере одним дополнительным средством терапии. В некоторых вариантах осуществления по меньшей мере одно дополнительное средство терапии предусматривает по меньшей мере одно, по меньшей мере два, по меньшей мере три, по меньшей мере четыре или по меньшей мере пять дополнительных средств терапии.
В некоторых вариантах осуществления по меньшей мере одно дополнительное средство терапии предусматривает повторное введение по меньшей мере одного соединения, выбранного из соединений формулы I (в том числе формул IIa-e, IIIa, IVa и Va) и/или их фармацевтически приемлемых солей. В некоторых вариантах осуществления повторное введение по меньшей мере одного соединения, выбранного из соединений формулы I (в том числе формул IIa-e, IIIa, IVa и Va) и/или их фармацевтически приемлемых солей, начинают до введения универсальной неоантигенной вакцины. В некоторых вариантах осуществления повторное по меньшей мере одного соединения, выбранного из соединений формулы I (в том числе формул IIa-e, IIIa, IVa и Va) и/или их фармацевтически приемлемых солей, начинают после введения универсальной неоантигенной вакцины. В некоторых вариантах осуществления повторное введение по меньшей мере одного соединения, выбранного из соединений формулы I (в том числе формул IIa-e, IIIa, IVa и Va) и/или их фармацевтически приемлемых солей, начинают одновременно с введением универсальной неоантигенной вакцины. В некоторых вариантах осуществления количество по меньшей мере одного соединения, выбранного из соединений формулы I (в том числе формул IIa-e, IIIa, IVa и Va) и/или их фармацевтически приемлемых солей, применяемое для повторного введения, снижено по сравнению с количеством, применяемым для начального введения. В некоторых вариантах осуществления количество по меньшей мере одного соединения, выбранного из соединений формулы I (в том числе формул IIa-e, IIIa, IVa и Va) и/или их фармацевтически приемлемых солей, применяемое для начального и/или повторного введения, снижено по сравнению со стандартной дозировкой по меньшей мере одного соединения, выбранного из соединений формулы I (в том числе формул IIa-e, IIIa, IVa и Va) и/или их фармацевтически приемлемых солей, в случае применения в отсутствие лечения с помощью вакцины. В некоторых вариантах осуществления количество по меньшей мере одного соединения, выбранного из соединений формулы I (в том числе формул IIa-e, IIIa, IVa и Va) и/или их фармацевтически приемлемых солей, применяемое для начального и/или повторного введения, снижено на 10%, 15%, 20%, 25%, 30%, 35%, 40%, 45%, 50%, 75% или 90% по сравнению со стандартной дозировкой по меньшей мере одного соединения, выбранного из соединений формулы I (в том числе формул IIa-e, IIIa, IVa и Va) и/или их фармацевтически приемлемых солей.
В некоторых вариантах осуществления по меньшей мере одно дополнительное средство терапии предусматривает введение ингибитора контрольных точек (например, любого из иллюстративных ингибиторов контрольных точек, описанных в данном документе). В некоторых вариантах осуществления введение ингибитора контрольных точек начинают до введения универсальной неоантигенной вакцины и/или повторного введения по меньшей мере одного соединения, выбранного из соединений формулы I (в том числе формул IIa-e, IIIa, IVa и Va) и/или их фармацевтически приемлемых солей. В некоторых вариантах осуществления введение ингибитора контрольных точек начинают после введения универсальной неоантигенной вакцины и/или повторного по меньшей мере одного соединения, выбранного из соединений формулы I (в том числе формул IIa-e, IIIa, IVa и Va) и/или их фармацевтически приемлемых солей. В некоторых вариантах осуществления введение ингибитора контрольных точек начинают одновременно с введением универсальной неоантигенной вакцины и/или повторного введения по меньшей мере одного соединения, выбранного из соединений формулы I (в том числе формул IIa-e, IIIa, IVa и Va) и/или их фармацевтически приемлемых солей. В некоторых вариантах осуществления введение ингибитора контрольных точек повторяют по меньшей мере один раз после начального введения. В некоторых вариантах осуществления количество ингибитора контрольных точек, применяемое для повторного введения, снижено по сравнению с количеством, применяемым для начального введения. В некоторых вариантах осуществления количество ингибитора контрольных точек, применяемое для повторного введения, снижено по сравнению со стандартной дозировкой ингибитора контрольных точек. В некоторых вариантах осуществления количество ингибитора контрольных точек, применяемое для повторного введения, снижено на 10%, 15%, 20%, 25%, 30%, 35%, 40%, 45%, 50%, 75% или 90% по сравнению со стандартной дозировкой ингибитора контрольных точек. В некоторых вариантах осуществления субъект характеризуется непереносимостью, невосприимчивостью или недостаточной восприимчивостью ингибитора контрольных точек при введении его по отдельности.
В некоторых вариантах осуществления в данном документе также предусмотрены неоантигенные вакцины, содержащие по меньшей мере один неоантигенный пептид или по меньшей мере одну неоантигенную mRNA. В некоторых вариантах осуществления неоантигенная вакцина содержит по меньшей мере один неоантигенный пептид. В некоторых других вариантах осуществления неоантигенная вакцина содержит по меньшей мере одну неоантигенную mRNA.
В некоторых вариантах осуществления в данном документе также предусмотрены наборы, содержащие по меньшей мере одно соединение, выбранное из соединений формулы I (в том числе формул IIa-e, IIIa, IVa и Va) и/или их фармацевтически приемлемых солей; и неоантигенную вакцину (например, универсальную неоантигенную вакцин). В некоторых вариантах осуществления неоантигенная вакцина представляет собой пептидную неоантигенную вакцину или неоантигенную mRNA-вакцину. В некоторых вариантах осуществления набор дополнительно содержит один или несколько дополнительных компонентов, в том числе без ограничения: инструкции по применению; другие средства, например, одно или несколько дополнительных терапевтических средств; устройства, контейнеры или другие материалы, предназначенные для получения по меньшей мере одного соединения, выбранного из соединений формулы I (в том числе формул IIa-e, IIIa, IVa и Va) и/или их фармацевтически приемлемых солей, и/или неоантигенной вакцины для терапевтического введения; фармацевтически приемлемые носители и устройства, контейнеры или другие материалы, предназначенные для введения по меньшей мере одного соединения, выбранного из соединений формулы I (в том числе формул IIa-e, IIIa, IVa и Va) и/или их фармацевтически приемлемых солей, и/или неоантигенной вакцины пациенту. Инструкции по применению могут включать руководство для терапевтических применений, в том числе предполагаемые дозировки и/или режимы введения, например, для пациента, у которого имеется неопластическое нарушение или подозрение на его наличие. В некоторых вариантах осуществления набор дополнительно содержит инструкции по терапевтическому применению, например, по применению по меньшей мере одного соединения, выбранного из соединений формулы I (в том числе формул IIa-e, IIIa, IVa и Va) и/или их фармацевтически приемлемых солей, и неоантигенной вакцины для лечения или предупреждения неопластического нарушения у пациента. В некоторых вариантах осуществления набор дополнительно содержит по меньшей мере одно дополнительное терапевтическое средство (например, для введения вместе с по меньшей мере одним соединением, выбранным из соединений формулы I (в том числе формул IIa-e, IIIa, IVa и Va) и/или их фармацевтически приемлемых солей, и неоантигенной вакциной, например, ингибитор контрольных точек). В некоторых вариантах осуществления по меньшей мере одно соединение, выбранное из соединений формулы I (в том числе формул IIa-e, IIIa, IVa и Va) и/или их фармацевтически приемлемых солей, и/или неоантигенная вакцина составлены в виде фармацевтической композиции.
В некоторых вариантах осуществления способов и композиций, раскрытых в данном документе, неоантигенная вакцина содержит по меньшей мере один неоантигенный пептид. В некоторых вариантах осуществления длина по меньшей мере одного неоантигенного пептида находится в диапазоне от приблизительно 10 до приблизительно 50 аминокислот. В некоторых вариантах осуществления длина по меньшей мере одного неоантигенного пептида находится в диапазоне от приблизительно 10 до приблизительно 35 аминокислот. В некоторых вариантах осуществления длина по меньшей мере одного неоантигенного пептида находится в диапазоне от приблизительно 15 до приблизительно 25 аминокислот.
В некоторых вариантах осуществления по меньшей мере один неоантигенный пептид содержит одну или более одной неоантигенной последовательности, раскрытой в данном документе.
В некоторых вариантах осуществления длина неоантигенной последовательности и/или антигенной части находится в диапазоне от приблизительно 10 до приблизительно 35 аминокислот. В некоторых вариантах осуществления длина неоантигенной последовательности и/или антигенной части находится в диапазоне от приблизительно 15 до приблизительно 25 аминокислот. В некоторых вариантах осуществления длина неоантигенной последовательности и/или антигенной части находится в диапазоне от приблизительно 10 до приблизительно 20 аминокислот. В некоторых вариантах осуществления неоантигенная последовательность и/или антигенная часть непосредственно не перекрываются с канонической пептидной последовательностью (например, любой из иллюстративных канонических пептидных последовательностей, подчеркнутых в таблице 3) или не состоят из нее.
В некоторых вариантах осуществления неоантигенная последовательность представляет собой неоантигенную последовательность, специфическую для субъекта. В некоторых вариантах осуществления неоантигенная последовательность представляет собой персонализированную неоантигенную вакцину для субъекта. В некоторых вариантах осуществления неоантигенная последовательность способна связываться с по меньшей мере одним аллелем HLA, экспрессируемым у субъекта.
В некоторых других вариантах осуществления неоантигенная последовательность представляет собой универсальную неоантигенную последовательность. В некоторых вариантах осуществления неоантигенная последовательность представляет собой универсальную неоантигенную вакцину. В некоторых вариантах осуществления неоантигенная последовательность способна связываться с по меньшей мере одним аллелем HLA, экспрессируемым у по меньшей мере 10%, по меньшей мере 15%, по меньшей мере 20%, по меньшей мере 25%, по меньшей мере 30%, по меньшей мере 35%, по меньшей мере 40% или по меньшей мере 45% субъектов в популяции субъектов, страдающих неопластическим нарушением. В некоторых вариантах осуществления неоантигенная последовательность способна вызывать T-клеточный ответ на опухоль, присутствующую у по меньшей мере 1%, по меньшей мере 5% или по меньшей мере 10% популяции субъектов, страдающих неопластическим нарушением.
В некоторых вариантах осуществления неоантигенная последовательность была идентифицирована посредством секвенирования по меньшей мере одного неоантигенного пептида, образование которого индуцировано у субъекта посредством введения эффективного количества по меньшей мере одного соединения, выбранного из соединений формулы I (в том числе формул IIa-e, IIIa, IVa и Va) и/или их фармацевтически приемлемых солей. В некоторых вариантах осуществления по меньшей мере один неоантигеный пептид содержит неоантигенную последовательность, образование которой индуцировано за счет приведения неопластической клетки в контакт с эффективным количеством по меньшей мере одного соединения, выбранного из соединений формулы I (в том числе формул IIa-e, IIIa, IVa и Va) и/или их фармацевтически приемлемых солей. В некоторых вариантах осуществления неопластическая клетка находится в культуре клеток in vitro. В некоторых вариантах осуществления неопластическая клетка получена от субъекта. В некоторых вариантах осуществления неопластическая клетка находится в субъекте.
В некоторых вариантах осуществления неоантигенная вакцина содержит по меньшей мере один неоантигенный пептид или mRNA и фармацевтически приемлемый носитель. В некоторых вариантах осуществления неоантигенный пептид или mRNA могут быть присоединены к подходящему носителю, что помогает развитию иммунного ответа. Иллюстративные носители для связывания с иммуногенными средствами (например, неоантигенным пептидом или mRNA) включают сывороточные альбумины, гемоцианин фисуреллы, молекулы иммуноглобулина, тиреоглобулин, овальбумин, столбнячный анатоксин или анатоксин из других патогенных бактерий, таких как бактерии, вызывающие дифтерию, E. coli, бактерии, вызывающие холеру, или H. pylori, или аттенуированное производное токсина. Другие носители для стимуляции или усиления иммунного ответа включают цитокины, такие как IL-1, α- и β-пептиды IL-1, IL-2, γINF, IL-10, GM-CSF и хемокины, такие как M1P1α и β и RANTES. Иммуногенные средства также можно присоединять к пептидам, которые усиливают транспорт через ткани, как описано, например, в WO 97/17613 и WO 97/17614. В некоторых вариантах осуществления фармацевтически приемлемый носитель выбран из пептида, сывороточного альбумина, гемоцианина фисуреллы, иммуноглобулина, тиреоглобулина, овальбумина, анатоксина или аттенуированного производного анатоксина, цитокина и хемокина.
В некоторых вариантах осуществления неоантигенный пептид или mRNA могут быть присоединены к фармацевтически приемлемому носителю. Иммуногенные средства могут быть присоединены к носителями с помощью химической сшивки. Методики присоединения иммуногенного пептида к носителю включают образование дисульфидных связей с применением N-сукцинимидил-3-(2-пиридилтио)пропионата (SPDP) и сукцинимидил-4-(N-малеимидометил)циклогексан-1-карбоксилата (SMCC) (если в пептиде отсутствует сульфгидрильная группа, это можно осуществлять посредством добавления остатка цистеина). Эти реагенты образуют дисульфидную связь между собой и цистеином в пептиде, расположенном на одном белке, и амидную связь через эпсилон-аминогруппу на лизине или другую свободную аминогруппу в других аминокислотах. Целый ряд таких образующих дисульфидные/амидные связи средств описано в Jansen et al. ((1982) Immun Rev. 62:185). Другие бифункциональные средства для сочетания образуют тиоэфирную связь, вместо дисульфидной связи. Множество этих средств, образующих тиоэфирную связь, коммерчески доступны и включают реакционноспособные сложные эфиры 6-малеимидокапроновой кислоты, 2-бромуксусной кислоты и 2-йодуксусной кислоты, 4-(N-малеимидометил)циклогексан-1-карбоновую кислоту. Карбоксильные группы могут быть активированными посредством объединения их с сукцинимидом или натриевой солью 1-гидроксил-2-нитро-4-сульфоновой кислоты. В некоторых вариантах осуществления неоантигенный пептид и фармацевтически приемлемый носитель ковалентно связаны через линкер.
Неоантиген и другие такие иммуногенные пептиды также могут экспрессироваться в виде слитых белков с носителями. Иммуногенный пептид может быть присоединен по амино-концу, карбокси-концу или в любом участке в пределах пептида (внутреннем) к носителю. В некоторых вариантах осуществления в слитом белке могут присутствовать несколько повторов иммуногенного пептида. В некоторых вариантах осуществления неоантигенный пептид и фармацевтически приемлемый носитель экспрессируются в виде слитого белка.
В некоторых вариантах осуществления неоантигенная вакцина содержит по меньшей мере один неоантигенный пептид или кодирующую его mRNA и фармацевтически приемлемый разбавитель. В некоторых вариантах осуществления неоантигенная вакцина содержит по меньшей мере один неоантигенный пептид или кодирующую его mRNA и фармацевтически приемлемый адъювант (например, адъювант, описанный в данном документе).
В некоторых вариантах осуществления способов и композиций, раскрытых в данном документе, неоантигенная вакцина содержит по меньшей мере одну неоантигенную mRNA. В некоторых вариантах осуществления по меньшей мере одна неоантигенная mRNA кодирует одну или более одной неоантигенной последовательности.
В некоторых вариантах осуществления длина неоантигенной последовательности и/или антигенной части находится в диапазоне от приблизительно 10 до приблизительно 50 аминокислот. В некоторых вариантах осуществления длина по меньшей мере одного неоантигенного пептида находится в диапазоне от приблизительно 10 до приблизительно 35 аминокислот. В некоторых вариантах осуществления длина неоантигенной последовательности и/или антигенной части находится в диапазоне от приблизительно 15 до приблизительно 25 аминокислот. В некоторых вариантах осуществления длина неоантигенной последовательности и/или антигенной части находится в диапазоне от приблизительно 10 до приблизительно 20 аминокислот. В некоторых вариантах осуществления неоантигенная последовательность и/или антигенная часть непосредственно не перекрываются с канонической пептидной последовательностью (например, любой из иллюстративных канонических пептидных последовательностей, подчеркнутых в таблице 3) или не состоят из нее.
В некоторых вариантах осуществления неоантигенная последовательность представляет собой неоантигенную последовательность, специфическую для субъекта. В некоторых вариантах осуществления неоантигенная последовательность представляет собой персонализированную неоантигенную вакцину для субъекта. В некоторых вариантах осуществления неоантигенная последовательность способна связываться с по меньшей мере одним аллелем HLA, экспрессируемым у субъекта.
В некоторых других вариантах осуществления неоантигенная последовательность представляет собой универсальную неоантигенную последовательность. В некоторых вариантах осуществления неоантигенная последовательность представляет собой универсальную неоантигенную вакцину. В некоторых вариантах осуществления неоантигенная последовательность способна связываться с по меньшей мере одним аллелем HLA, экспрессируемым у по меньшей мере 10%, по меньшей мере 15%, по меньшей мере 20%, по меньшей мере 25%, по меньшей мере 30%, по меньшей мере 35%, по меньшей мере 40% или по меньшей мере 45% субъектов в популяции субъектов, страдающих неопластическим нарушением. В некоторых вариантах осуществления неоантигенная последовательность способна вызывать T-клеточный ответ на опухоль, присутствующую у по меньшей мере 1%, по меньшей мере 5% или по меньшей мере 10% популяции субъектов, страдающих неопластическим нарушением.
В некоторых вариантах осуществления неоантигенная последовательность была идентифицирована посредством секвенирования по меньшей мере одной неоантигенной mRNA, образование которого индуцировано у субъекта посредством введения эффективного количества по меньшей мере одного соединения, выбранного из соединений формулы I (в том числе формул IIa-e, IIIa, IVa и Va) и/или их фармацевтически приемлемых солей. В некоторых вариантах осуществления по меньшей мере одна неоантигенная mRNA кодирует неоантигенную последовательность, образование которой индуцировано посредством приведения неопластической клетки в контакт с эффективным количеством по меньшей мере одного соединения, выбранного из соединений формулы I (в том числе формул IIa-e, IIIa, IVa и Va) и/или их фармацевтически приемлемых солей. В некоторых вариантах осуществления неопластическая клетка находится в культуре клеток in vitro. В некоторых вариантах осуществления неопластическая клетка получена от субъекта. В некоторых вариантах осуществления неопластическая клетка находится в субъекте.
В некоторых вариантах осуществления неоантигенная вакцина содержит по меньшей мере одну неоантигенную mRNA и фармацевтически приемлемый носитель. В некоторых вариантах осуществления по меньшей мере одна неоантигенная mRNA связана с фармацевтически приемлемым носителем. В некоторых вариантах осуществления фармацевтически приемлемый носитель выбран из пептида, сывороточного альбумина, гемоцианина фисуреллы, иммуноглобулина, тиреоглобулина, овальбумина, анатоксина или аттенуированного производного анатоксина, цитокина и хемокина.
В некоторых вариантах осуществления неоантигенная вакцина содержит по меньшей мере одну неоантигенную mRNA и фармацевтически приемлемый разбавитель. В некоторых вариантах осуществления неоантигенная вакцина содержит по меньшей мере одну неоантигенную mRNA и фармацевтически приемлемый адъювант (например, адъювант, описанный в данном документе).
В некоторых вариантах осуществления неоантигенная mRNA инкапсулирована с помощью инкапсулирующего средства. В некоторых вариантах осуществления инкапсулирующее средство защищает неоантигенную mRNA от разрушения и улучшает доставку вакцины (McNamara et al. (2015) J Immunol Res. 2015:794528). В некоторых вариантах осуществления инкапсулирующее средство представляет собой липосому. В некоторых вариантах осуществления липосома представляет собой катионную липосому, такую как N-[1-(2,3-диолеолокси)пропил]-N, N,N-триметиламмония хлорид 1 (DOTAP). В некоторых вариантах осуществления инкапсулирующее средство представляет собой наночастицу. В некоторых вариантах осуществления наночастица защищает неоантигенную mRNA от разрушения нуклеазой и/или улучшает захват клеткой и/или эффективность доставки. В некоторых вариантах осуществления наночастица может быть сконструирована таким образом, что она является полностью разлагаемой. В некоторых вариантах осуществления наночастица представляет собой биоразлагаемую наночастицу со структурой ядро-оболочка, содержащую pH-чувствительное ядро из сложного поли(b-аминоэфира) (PBAE), заключенного в фосфолипидную оболочку (Su et al. (2011) Mol Pharm. 8(3):774-87). В некоторых вариантах осуществления такие наночастицы являются особенно эффективными в доставке mRNA in vivo и развитии противоопухолевого иммунного ответа.
В некоторых вариантах осуществления субъект характеризуется мутационной нагрузкой с несинонимичными изменениями, составляющей приблизительно 150 мутаций или меньше. В некоторых вариантах осуществления субъект характеризуется мутационной нагрузкой с несинонимичными изменениями, составляющей приблизительно 100 мутаций или меньше. В некоторых вариантах осуществления субъект характеризуется мутационной нагрузкой с несинонимичными изменениями, составляющей приблизительно 50 мутаций или меньше. В некоторых вариантах осуществления субъект имеет неопластическое нарушение, например, гематологическое злокачественное новообразование или солидную опухоль, или имеет подозрение на его наличие. В некоторых вариантах осуществления гематологическое злокачественное новообразование выбрано из B-клеточного злокачественного новообразования, лейкоза, лимфомы и миеломы. В некоторых вариантах осуществления гематологическое злокачественное новообразование выбрано из острого миелоидного лейкоза и множественной миеломы. В некоторых вариантах осуществления солидная опухоль выбрана из рака молочной железы, рака желудка, рака предстательной железы, рака яичника, рака легкого, рака матки, карциномы слюнных протоков, меланомы, рака толстой кишки и рака пищевода. В некоторых вариантах осуществления солидная опухоль выбрана из HER2-положительного рака молочной железы, аденокарциномы желудка и рака предстательной железы.
Применяемый в данном документе термин "адъювант" относится к веществу, которое способно увеличивать, усиливать или модулировать иммунный ответ на сопутствующее иммуногенное средство, например, неоантигенный пептид или mRNA. В определенных вариантах осуществления неоантиген по настоящему изобретению можно вводить в комбинации с адъювантами, т. е. веществами, которые сами по себе не вызывают адаптивные иммунные ответы, но усиливают или модулируют ответ на сопутствующий неоантиген. Целый ряд адъювантов может применяться в комбинации с раскрытыми неоантигенами, чтобы обеспечивать развитие иммунного ответа. В некоторых вариантах осуществления адъювант(-ы) выбран(-ы) для повышения свойственного ответа на неоантиген, при этом они не вызывают конформационные изменения неоантигена, которые будут влиять на качественную форму ответа. В некоторых вариантах осуществления адъювант(-ы) выбран(-ы) для усиления примирования и/или активации эффекторных T-клеток (например, CD8).
В определенных вариантах осуществления адъювант представляет собой соль алюминия (квасцы), такие как гидроксид алюминия, фосфат алюминия и сульфат алюминия. Такие адъюванты можно применять с другими специфическими иммуностимулирующими средствами, такими как 3-O-деацилированный монофосфориллипид A (MPL) или 3-DMP, полимерные или мономерные аминокислоты, такие как полиглутаминовая кислота или полилизин, или без них. Такие адъюванты могут применяться с другими конкретными иммуностимулирующими средствами, такими как мурамилпептиды (например, N-ацетилмурамил-L-треонил-D-изоглутамин (thr-MDP), N-ацетилнормурамил-L-аланил-D-изоглутамин (nor-MDP), N-ацетилмурамил-L-аланил-D-изоглутаминил-L-аланин-2-(1′-2′-дипальмитоил-sn-глицеро-3-гидроксифосфорилокси)-этиламин (MTP-PE), N-ацетилглюкозаминил-N-ацетилмурамил-L-Al-D-изоглю-L-Ala-дипальмитоксипропиламид (DTP-DPP)), или другими компонентами бактериальной клеточной стенки, или без них. Другие адъюванты представляют собой эмульсии типа "масло в воде" и включают (a) MF59 (WO 90/14837), содержащий 5% сквалена, 0,5% Tween 80 и 0,5% Span 85 (необязательно содержащий различные количества MTP-PE), составленный в субмикронные частицы с применением микрофлюидайзера, такого как микрофлюидайзер модели 110Y (Microfluidics), (b) SAF, содержащий 10% сквалена, 0,4% Tween 80, 5% блок-полимера Pluronic L121 и thr-MDP, либо микрофлюидизированный в субмикронную эмульсию, либо перемешанный на вортексе с образованием эмульсии с частицами большего размера, и (c) адъювантную систему Ribi™ (RAS), (Ribi ImmunoChem), содержащую 2% сквалена, 0,2% Tween 80 и один или несколько компонентов бактериальной клеточной стенки из группы, состоящей из монофосфориллипида A (MPL), димиколата трегалозы (TDM) и каркаса клеточной стенки (CWS), например MPL-FCWS (Detox™). В некоторых вариантах осуществления адъювант представляет собой сапонин, такой как Stimulon™ (QS21), или частицы, образованные из него, такие как ISCOM (иммуностимулирующие комплексы) и ISCOMATRIX. Другие адъюванты включают полный адъювант Фрейнда (CFA) и неполный адъювант Фрейнда(IFA), цитокины, такие как интерлейкины (IL-1, IL-2 и IL-12), колониестимулирующий фактор макрофагов (M-CSF) и фактор некроза опухоли (TNF).
Адъювант можно вводить с иммуногенным средством (например, неоантигенным пептидом или mRNA) в виде одной композиции или его можно вводить до введения иммуногенного средства, одновременно с ним или после него. В некоторых вариантах осуществления иммуногенное средство и адъювант могут быть упакованы и поставлены в одном и том же флаконе или могут быть упакованы в отдельные флаконы и смешиваться перед применением. В некоторых вариантах осуществления иммуногенное средство и адъювант могут быть упакованы с маркировкой, указывающей на предполагаемое терапевтическое применение. В некоторых вариантах осуществления, если иммуногенное средство и адъювант упакованы по отдельности, упаковка может включать инструкции по смешиванию перед применением. Выбор адъюванта и/или носителя зависит от стабильности иммуногенного состава, содержащего адъювант, пути введения, схемы дозирования, эффективности адъюванта для вида животных, подлежащего вакцинации, и для человека, при этом фармацевтически приемлемый адъювант представляет собой адъювант, который был одобрен или может быть одобрен соответствующими регулирующими органами для введения человеку. Например, полный адъювант Фрейнда не подходит для введения человеку. Однако квасцы, MPL или неполный адъювант Фрейнда (Chang et al. (1998) Adv Drug Deliv Rev. 32:173-186) по отдельности или необязательно в комбинации с любыми из квасцов, QS21 и MPL и все их комбинации подходят для введения человеку.
В некоторых вариантах осуществления в настоящем изобретении дополнительно предусмотрены способы скрининга и идентификации по меньшей мере одного неоантигена. Более конкретно в некоторых вариантах осуществления в настоящем изобретении предусмотрен способ идентификации по меньшей мере одного неоантигена посредством (a) приведения неопластической клетки в контакт с эффективным количеством по меньшей мере одного соединения, выбранного из соединений формулы I (в том числе формул IIa-e, IIIa, IVa и Va) и/или их фармацевтически приемлемых солей; (b) обнаружения по меньшей мере одного подвергнутого альтернативному сплайсингу транскрипта mRNA после приведения неопластической клетки в контакт с по меньшей мере одним соединением, выбранным из соединений формулы I (в том числе формул IIa-e, IIIa, IVa и Va) и/или их фармацевтически приемлемых солей; (c) прогнозирования трансляции по меньшей мере одного подвергнутого альтернативному сплайсингу транскрипта mRNA в по меньшей мере один пептид и (d) сравнения по меньшей мере одного пептида с эталонным протеомом, где по меньшей мере один неоантиген идентифицируют, если по меньшей мере один пептид не совпадает с каким-либо пептидам в эталонном протеоме. В некоторых вариантах осуществления способ дополнительно включает приведение в контакт одной или нескольких дополнительных неопластических клеток для идентификации по меньшей мере одного универсального неоантигена. В некоторых вариантах осуществления способ повторяют для одной или нескольких дополнительных неопластических клеток или образцов (например, биоптата ткани) для подтверждения подходящих неоантигенов (например, для применения в неоантигенной вакцине) и/или для идентификации одного или нескольких универсальных неоантигенов.
В различных других вариантах осуществления в настоящем изобретении предусмотрен способ идентификации по меньшей мере одного неоантигена посредством (a) приведения неопластической клетки в контакт с эффективным количеством по меньшей мере одного соединения, выбранного из соединений формулы I (в том числе формул IIa-e, IIIa, IVa и Va) и/или их фармацевтически приемлемых солей; (b) обнаружения по меньшей мере одного пептида, содержащего потенциальную неоантигенную последовательность после приведения неопластической клетки в контакт с по меньшей мере одним соединением, выбранным из соединений формулы I (в том числе формул IIa-e, IIIa, IVa и Va) и/или их фармацевтически приемлемых солей; и (c) сравнения по меньшей мере одного пептида с эталонным протеомом, где по меньшей мере один неоантиген идентифицируют, если по меньшей мере один пептид не совпадает с каким-либо пептидом в эталонном протеоме. В некоторых вариантах осуществления способ дополнительно включает приведение в контакт одной или нескольких дополнительных неопластических клеток для идентификации по меньшей мере одного универсального неоантигена. В некоторых вариантах осуществления способ повторяют для одной или нескольких дополнительных неопластических клеток или образцов (например, биоптата ткани) для подтверждения подходящих неоантигенов (например, для применения в неоантигенной вакцине) и/или для идентификации одного или нескольких универсальных неоантигенов.
В некоторых вариантах осуществления способов идентификации неоантигена, описанных в данном документе, обнаружение по меньшей мере одно подвергнутого альтернативному сплайсингу транскрипта mRNA предусматривает RNAseq. В некоторых вариантах осуществления прогнозирование трансляции по меньшей мере одного подвергнутого альтернативному сплайсингу транскрипта mRNA предусматривает количественное определение изменения в виде значения процента успешного включения при сплайсинге (dPSI) для по меньшей мере одного транскрипта. В некоторых вариантах осуществления прогнозирование трансляции по меньшей мере одного подвергнутого альтернативному сплайсингу транскрипта mRNA предусматривает RiboSeq и/или рибосомный профилинг.
В некоторых вариантах осуществления способов идентификации неоантигена, описанных в данном документе, способы дополнительно включают оценку по меньшей мере одного пептида в отношении прогнозируемого связывания с молекулами главного комплекса гистосовместимости (MHC). В некоторых вариантах осуществления прогнозируемое связывание с молекулами MHC определяют путем измерения исходной аффинности, прогнозирующей силу связывания, для по меньшей мере одного пептида. В некоторых вариантах осуществления исходная аффинность, прогнозирующая прочность связывания, которая составляет приблизительно 500 нМ или более, указывает на связывание с молекулами MHC. В некоторых вариантах осуществления прогнозируемое связывание с молекулами MHC определяют посредством идентификации распределения значений прогнозированной прочности связывания для серии случайных пептидов и сравнения прогнозируемой прочности связывания по меньшей мере одного пептида с данным распределением. В некоторых вариантах осуществления прогнозируемая прочность связывания в верхних 2% распределения указывает на слабое связывание с молекулами MHC. В некоторых вариантах осуществления прогнозируемая прочность связывания в верхних 0,5% распределения указывает на сильное связывание с молекулами MHC.
В некоторых вариантах осуществления способов идентификации неоантигена, описанных в данном документе, неопластическая клетка находится в культуре клеток in vitro. В некоторых вариантах осуществления неопластическая клетка получена от субъекта. В некоторых вариантах осуществления неопластическая клетка находится в субъекте.
В некоторых вариантах осуществления в данном документе также предусмотрены способы получения неоантигенной вакцины посредством (a) идентификации по меньшей мере одного неоантигена (например, по меньшей мере одного неоантигенного пептида или кодирующей его mRNA) с применением любого из иллюстративных способов идентификации, раскрытых в данном документе; и (b) составления по меньшей мере одного неоантигена вместе с фармацевтически приемлемым носителем, разбавителем или адъювантом (например, любым из фармацевтически приемлемых носителей, разбавителей или адъювантов, описанных в данном документе).
В некоторых вариантах осуществления длина по меньшей мере одного неоантигена и/или антигенной части находится в диапазоне от приблизительно 10 до приблизительно 50 аминокислот. В некоторых вариантах осуществления длина по меньшей мере одного неоантигенного пептида находится в диапазоне от приблизительно 10 до приблизительно 35 аминокислот. В некоторых вариантах осуществления длина по меньшей мере одного неоантигена и/или антигенной части находится в диапазоне от приблизительно 15 до приблизительно 25 аминокислот. В некоторых вариантах осуществления длина по меньшей мере одного неоантигена и/или антигенной части находится в диапазоне от приблизительно 10 до приблизительно 20 аминокислот. В некоторых вариантах осуществления по меньшей мере один неоантиген и/или антигенная часть непосредственно не перекрываются с канонической пептидной последовательностью (например, любой из иллюстративных канонических пептидных последовательностей, подчеркнутых в таблице 3) или не состоят из нее.
В некоторых вариантах осуществления по меньшей мере один неоантиген, применяемый в вакцине, присоединен к фармацевтически приемлемому носителю. В некоторых вариантах осуществления фармацевтически приемлемый носитель выбран из пептида, сывороточного альбумина, гемоцианина фисуреллы, иммуноглобулина, тиреоглобулина, овальбумина, анатоксина или аттенуированного производного анатоксина, цитокина и хемокина.
В некоторых вариантах осуществления пациента, у которого имеется рак, описанный в данном документе, можно лечить с помощью комбинации из по меньшей мере одного соединения, выбранного из соединений формулы I (в том числе формул IIa-e, IIIa, IVa и Va) и/или их фармацевтически приемлемых солей, и одной или нескольких сконструированных T-клеток, целенаправленно воздействующих на опухоль (т. е., CAR-T). Таким образом, в некоторых вариантах осуществления в настоящем изобретении предусмотрен способ лечения субъекта, у которого имеется неопластическое нарушение или подозрение на его наличие, посредством введения субъекту эффективного количества по меньшей мере одного соединения, выбранного из соединений формулы I (в том числе формул IIa-e, IIIa, IVa и Va) и/или их фармацевтически приемлемых солей; и сконструированных T-клеток, целенаправленно воздействующих на опухоль (т. е. CAR-T). В некоторых вариантах осуществления химерный T-клеточный рецептор может быть сконструирован с применением антигенраспознающих последовательностей, которые реагируют с идентифицированным неоантигеном.
Например, в некоторых вариантах осуществления с целью целенаправленного воздействия на изменения во внеклеточных доменах белков клеточной поверхности, индуцированных по меньшей мере одним соединением, выбранным из соединений формулы I (в том числе формул IIa-e, IIIa, IVa и Va) и/или их фармацевтически приемлемых солей, может быть сконструирован химерный T-клеточный рецептор (CAR), реактивный в отношении антигена, за счет первоначальной идентификации антител, которые распознают домен неоантигенного белка, экспрессируемый на клеточной поверхности. Затем антигенраспознающие последовательности таких антител могут быть слиты с доменом T-клеточного рецептора для осуществления селективного целенаправленного воздействия и активации.
В различных других вариантах осуществления используется стратегия, объединяющая механизмы презентации антигена опухолевых клеток вместе с неоантигенами, полученными под действием по меньшей мере одного соединения, выбранного из соединений формулы I (в том числе формул IIa-e, IIIa, IVa и Va) и/или их фармацевтически приемлемых солей. В некоторых вариантах осуществления клетки, содержащие известные и часто присутствующие аллели HLA (например, HLA-A*02:01), могут быть обработаны по меньшей мере одним соединением, выбранным из соединений формулы I (в том числе формул IIa-e, IIIa, IVa и Va) и/или их фармацевтически приемлемых солей, и неоантигены, связавшиеся молекулами MHC1, идентифицируют посредством лигандомики. В некоторых вариантах осуществления эти пептиды можно применять для примирования и/или размножения T-клеток от здоровых доноров, экспрессирующих такой же аллель HLA. В некоторых вариантах осуществления такие T-клетки можно выделять и секвенировать α- и β-цепи T-клеточного рецептора (TCR) для идентификации когнатных антигенраспознающих/вариабельных участков. В некоторых вариантах осуществления затем может быть сконструирован когнатный CAR.
В некоторых вариантах осуществления последовательности CAR клонируют в популяции полученных от пациента T-клеток и обеспечивают размножение клеток с применением доступных в настоящее время протоколов. В некоторых вариантах осуществления затем сконструированные T-клетки переливают обратно в кровоток пациента перед проведением лечения с помощью по меньшей мере одного соединения, выбранного из соединений формулы I (в том числе формул IIa-e, IIIa, IVa и Va) и/или их фармацевтически приемлемых солей, одновременно с ним или после него. В некоторых вариантах осуществления после лечения с помощью по меньшей мере одного соединения, выбранного из соединений формулы I (в том числе формул IIa-e, IIIa, IVa и Va) и/или их фармацевтически приемлемых солей, опухолевые клетки могут начать презентировать антиген, например, антиген, на который целенаправленно воздействует популяция сконструированных Т-клеток. В некоторых вариантах осуществления популяция сконструированных T-клеток может контактировать с презентирующими антиген опухолевыми клетками и уничтожать их.
Для возможности более полного понимания настоящего изобретения, описанного в данном документе, далее представлены следующие примеры. Следует понимать, что эти примеры представлены только в иллюстративных целях и их не следует рассматривать как ограничивающие настоящее изобретения любым образом.
ПРИМЕРЫ 1-268
Общие сведения.
Нагревание под воздействием микроволн осуществляли с применением микроволнового реактора Biotage Emrys Liberator или Initiator. Колоночную хроматографию осуществляли с применением Combiflash Rf200d (Teledyne ISCO). Удаление растворителя осуществляли с применением либо роторного испарителя от Büchi, либо центробежного испарителя от Genevac. Препаративную LC/MS осуществляли с применением автоочистителя Waters и 5-микронной колонки XTerra MS C18 19 × 100 мм в условиях кислотной подвижной фазы. Спектры ЯМР записывали с применением спектрометра Varian 400 МГц.
Когда выражение "с созданной инертной атмосферой" используют для описания реактора (например, реакционного сосуда, колбы, стеклянного реактора и т. п.), это означает, что воздух в реакторе был заменен практически не содержащим влаги или сухим инертным газом (таким как азот, аргон и т. п.).
Общие способы и экспериментальные части для получения соединений по настоящему изобретению изложены ниже.
В данном документе используют следующие сокращения:
MeOH: метанол
DMF: диметилформамид
LHMDS: гексаметилдисилазид лития
KHMDS: бис(триметилсилил)амид калия
LCMS: жидкостная хроматография с масс-спектрометрией
MS: Масс-спектрометрия
HPLC: жидкостная хроматография высокого давления
UPLC: сверхпроизводительная жидкостная хроматография
LC: жидкостная хроматография
1H ЯМР: протонный ядерный магнитный резонанс
TBSCl: трет-бутилдиметилсилилхлорид
THF: тетрагидрофуран
TLC: тонкослойная хроматография
HBTU: гексафторфосфат бензотриазолтетраметилурония
TEA: триэтиламин
DCM: дихлорметан
DMSO: диметилсульфоксид
ISCO: автоматизированная хроматография (Combiflash RF200d)
Hex: гексаны
EtOAc: этилацетат
DMAP: диметиламинопиридин
NaOH: гидроксид натрия
MgSO4: сульфат магния
HCl: хлористоводородная кислота
AcOH: уксусная кислота
AIBN: 2,2'-азобис-изобутиронитрил
NBS: N-бромсукцинимид
Boc: N-трет-бутоксикарбонил
TBDMS: трет-бутилдиметилсилил
TBAF: фторид тетрабутиламмония
mCPBA: м-хлорпероксибензойная кислота
Материалы. Следующие соединения являются коммерчески доступными и/или могут быть получены рядом способов, общеизвестных специалисту в области органического синтеза. Более конкретно раскрытые соединения могут быть получены с применением реакций и методик, описанных в данном документе. В описании способов синтеза, описанных ниже, следует понимать, что все предложенные условия реакции, включая выбор растворителя, атмосферы реакционной смеси, температуры реакции, продолжительности эксперимента и процедур обработки, могут быть выбраны как стандартные условия для данной реакции, если не указано иное. Специалисту в области органического синтеза понятно, что функциональные группы, присутствующие в различных частях молекулы, должны быть совместимы с предлагаемыми реагентами и реакциями. Заместители, несовместимые с условиями реакции, являются очевидными для специалиста в данной области техники, и поэтому указаны альтернативные способы. Исходные материалы для примеров либо являются коммерчески доступными, либо их легко получить с помощью стандартных способов из известных материалов.
Информация о LCMS
Подвижные фазы: A (0,1% муравьиной кислоты в H2O) и B (0,1% муравьиной кислоты в ацетонитриле).
Градиент: B 5% - 95% за 1,8 минуты.
Колонка: колонка Acquity BEH C18 (1,7 мкм, 2,1 × 50 мм).
В патентах США №№ 7884128 и 7816401, оба под названием Process for Total Synthesis of Pladienolide B and Pladienolide D (Способ полного синтеза пладиенолида B и пладиенолида D), описаны способы синтеза пладиенолида B и D. Синтез пладиенолида B и D также может быть выполнен с применением способов, известных в уровне техники и описанных в Kanada et al., "Total Synthesis of the Potent Antitumor Macrolides Pladienolide B and D", Angew. Chem. Int. Ed. 46:4350-4355 (2007). Kanada et al. и в публикации поданной согласно PCT заявки WO 2003/099813 под названием Novel Physiologically Active Substances (Новые физиологически активные вещества) описывают способы синтеза E7107 (соединение 45 из WO '813) из пладиенолида D (11107D из WO '813). Соответствующий патент США представляет собой патент № 7550503, выданный Kotake et al.
ИЛЛЮСТРАТИВНЫЙ СИНТЕЗ СОЕДИНЕНИЙ
Иллюстративные соединения получали либо в соответствии с общей схемой A, включающей промежуточные соединения без гидроксильной группы в положении C6, либо в соответствии с общей схемой B, включающей промежуточные соединения с гидроксильной группой в положении C6.
Общая схема A
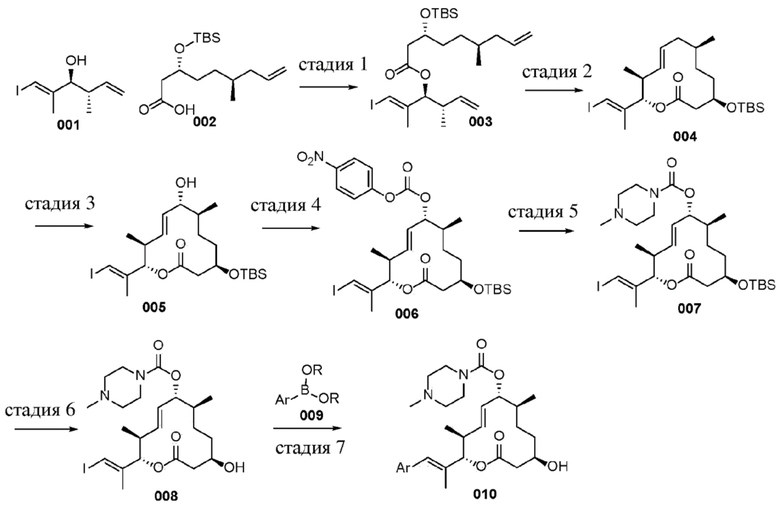
Стадия 1. В раствор (3S,4S, E)-1-йод-2,4-диметилгекса-1,5-диен-3-ола (001, 5,03 г, 19,966 ммоль) и (3R,6S)-3-((трет-бутилдиметилсилил)окси)-6-метилнон-8-еновой кислоты (002, 5,0 г, 16,638 ммоль) в сухом DCM (84 мл, 1297,798 ммоль) добавляли EDC (8,29 г, 43,26 ммоль), DMAP (0,407 г, 3,328 ммоль) с последующим добавлением TEA (6,96 мл, 49,915 ммоль). Реакционный раствор перемешивали при комнатной температуре в течение ночи. С помощью LCMS показывали полное превращение кислоты. Реакционную смесь гасили водой и затем экстрагировали с помощью DCM (3 × 100 мл). Объединенный органический слой высушивали над сульфатом натрия, фильтровали и концентрировали в вакууме. Неочищенный продукт очищали с помощью ISCO с градиентом от 0 до 20% с получением продукта - (3R,6S)-(3S,4S, E)-1-йод-2,4-диметилгекса-1,5-диен-3-ил-3-((трет-бутилдиметилсилил)окси)-6-метилнон-8-еноата (003, 7,5 г, 14,03 ммоль, выход 84%) - в виде бесцветного масла.
Стадия 2. Дегазировали раствор (3R,6S)-(3S,4S, E)-1-йод-2,4-диметилгекса-1,5-диен-3-ил-3-((трет-бутилдиметилсилил)окси)-6-метилнон-8-еноата (002, 6,5 г, 12,159 ммоль) и бензохинона (0,066 г, 0,608 ммоль) в толуоле (1296 мл, 9,38 мМ) в течение 15 минут. Затем добавляли катализатор Ховейды-Граббса II поколения (0,762 г, 1,216 ммоль)) и перемешивали при 50°C в атмосфере азота в течение 6 часов. Реакционную смесь фильтровали через слой целита, промывали с помощью избытка толуола и затем концентрировали. Неочищенную реакционную смесь очищали с помощью ISCO с элюированием от 0 до 20% Hex:EtOAc с получением продукта - (4R,7S,11S,12S, E)-4-((трет-бутилдиметилсилил)окси)-12-((E)-1-йодпроп-1-ен-2-ил)-7,11-диметилоксациклододец-9-ен-2-она (004, 5,71 г, 11,27 ммоль, выход 93%) - в виде грязно-белого масла.
Стадия 3. Растворяли (4R,7S,11S,12S, E)-4-((трет-бутилдиметилсилил)окси)-12-((E)-1-йодпроп-1-ен-2-ил)-7,11-диметилоксациклододец-9-ен-2-он (004, 6,15 г, 11,27 ммоль) в диоксане (520 мл) и дегазировали, добавляли диоксид селена (4,05 г, 36,477 ммоль). Смесь нагревали до 80°C и перемешивали в течение 5 ч. С помощью LCMS демонстрировали завершение реакции. Реакционную смесь разбавляли этилацетатом и промывали насыщенным раствором NaHCO3. Полученное высушивали с помощью Na2SO4, фильтровали и концентрировали in vacuo. Реакционную смесь очищали с помощью ISCO, с градиентом от 0 до 30% Hex:EtOAc, с получением (4R,7S,8R,11S,12S, E)-4-((трет-бутилдиметилсилил)окси)-8-гидрокси-12-((E)-1-йодпроп-1-ен-2-ил)-7,11-диметилоксациклододец-9-ен-2-она (005, 5,5 г, 10,53 ммоль).
Стадия 4. В раствор (4R,7S,8R,11S,12S, E)-4-((трет-бутилдиметилсилил)окси)-8-гидрокси-12-((E)-1-йодпроп-1-ен-2-ил)-7,11-диметилоксациклододец-9-ен-2-она (005, 2,5 г, 4,784 ммоль) в DCM (0,406 г, 4,784 ммоль) добавляли DMAP (0,117 г, 0,957 ммоль), триэтиламин (2,046 мл, 14,353 ммоль) и 4-нитрофенилхлорформиат (1,447 г, 7,177 ммоль). Полученную желтоватую суспензию перемешивали в течение 5 ч. Реакционную смесь концентрировали и очищали с помощью ISCO с градиентом от 0 до 15% Hex:EtOAc с получением продукта - (2S,3S,6R,7S,10R, E)-10-((трет-бутилдиметилсилил)окси)-2-((E)-1-йодпроп-1-ен-2-ил)-3,7-диметил-12-оксооксациклододец-4-ен-6-ил-(4-нитрофенил)карбоната (006, 3,15 г, 4,58 ммоль, выход 96%).
Стадия 5. В раствор (2S,3S,6R,7S,10R, E)-10-((трет-бутилдиметилсилил)окси)-2-((E)-1-йодпроп-1-ен-2-ил)-3,7-диметил-12-оксооксациклододец-4-ен-6-ил-(4-нитрофенил)карбоната (006, 2,1 г, 3,054 ммоль) в DCM (0,259 г, 3,054 ммоль) добавляли DMAP (0,373 г, 3,054 ммоль) и 1-метилпиперазин (0,459 г, 4,581 ммоль). Полученную желтоватую суспензию перемешивали в течение 3 ч. Реакционную смесь концентрировали и подвергали ISCO с элюированием от 0 до 15% DCM:MeOH, с получением продукта - (2S,3S,6R,7S,10R, E)-10-((трет-бутилдиметилсилил)окси)-2-((E)-1-йодпроп-1-ен-2-ил)-3,7-диметил-12-оксооксациклододец-4-ен-6-ил-4-метилпиперазин-1-карбоксилата (007, 1,89 г, 2,91 ммоль, выход 95%).
Стадия 6. В раствор (2S,3S,6R,7S,10R, E)-10-((трет-бутилдиметилсилил)окси)-2-((E)-1-йодпроп-1-ен-2-ил)-3,7-диметил-12-оксооксациклододец-4-ен-6-ил-4-метилпиперазин-1-карбоксилата (007, 1,8 г, 2,775 ммоль) в метаноле (0,089 г, 2,775 ммоль) добавляли гидрат 4-метилбензолсульфоновой кислоты (0,528 г, 2,775 ммоль) при комнатной температуре. Через 2 ч. реакционную смесь гасили с помощью TEA (0,560 г, 5,55 ммоль). Реакционную смесь концентрировали и разбавляли с помощью 300 мл DCM, затем промывали солевым раствором (3 × 50 мл). Органический экстракт концентрировали и подвергали ISCO с элюированием от 0 до 15% DCM:MeOH с получением продукта - (2S,3S,6R,7S,10R, E)-10-гидрокси-2-((E)-1-йодпроп-1-ен-2-ил)-3,7-диметил-12-оксооксациклододец-4-ен-6-ил-4-метилпиперазин-1-карбоксилата (008, 1,4 г, 2,62 ммоль, выход 94%).
Стадия 7. В раствор (2S,3S,6R,7S,10R, E)-10-гидрокси-2-((E)-1-йодпроп-1-ен-2-ил)-3,7-диметил-12-оксооксациклододец-4-ен-6-ил-4-метилпиперазин-1-карбоксилата (009, 15,0 мг, 0,029 ммоль) и арилбороновой кислоты (010, 0,035 ммоль) добавляли оксид серебра (19 мг, 0,086 ммоль) и Pd(0) (3,3 мг, 0,003 ммоль). Смесь нагревали до 60°C в течение 5 ч. С помощью LCMS демонстрировали полное превращение соединения 009. Смесь охлаждали, фильтровали через тонкий слой целита и концентрировали. Неочищенную реакционную смесь подвергали ISCO с элюированием от 0 до 10% DCM:MeOH с получением продуктов (010, 0,019 ммоль, выход 68,4%).
Общая схема B
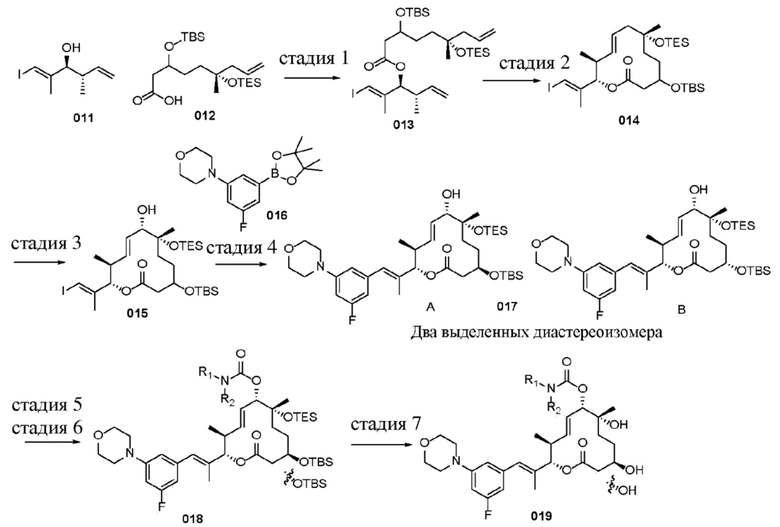
Стадии 1-3 соответствуют стадиям 1-3 из схемы 1 соответственно.
Стадия 4. В перемешиваемый раствор соединений 015 и 016 в смеси 1,4-диоксан/вода (3:1) добавляли 3,0 экв. Ag2O и 0,1 экв. тетракис(трифенилфосфин)палладия(0). Смесь дегазировали и нагревали до 100°C в течение 2 ч. После завершения реакции, которое показывали с помощью UPLC, смесь охлаждали до комнатной температуры и фильтровали с получением соединения 017 в виде смеси двух диастереомеров (изомеров A и B). Изомеры A и B по отдельности выделяли с помощью колоночной хроматографии с градиентом элюирования от 0 до 100% EtOAc/гексаны, затем с градиентом от 0 до 20% MeOH/DCM.
Стадии 5 и 6 соответствуют стадиям 4 и 5 из схемы 1 соответственно.
Стадия 7. В раствор соединения 018 в метаноле добавляли моногидрат п-толуолсульфоновой кислоты при комнатной температуре. Через 2 часа реакционную смесь гасили с помощью избытка Et3N и концентрировали. Раствор экстрагировали с помощью EtOAc, промывали с помощью NaHCO3 и солевым раствором, высушивали с помощью Na2SO4, фильтровали и концентрировали. Неочищенную смесь на основе продукта очищали с помощью колоночной хроматографии на силикагеле с получением соединения 019.
Соединения 1-85 (таблица 4) получали с помощью общих способов из процедур 1-10.
Синтез бромированных арильных промежуточных соединений
Процедура 1
К 1-бром-3,5-дифторбензолу в DMSO добавляли Cs2CO3 или основание Хунига (2,5 экв.) и амин (1,5 экв). Смесь нагревали под действием микроволнового излучения в закрытой пробирке при требуемой температуре в течение 1,5 ч. Реакционную смесь разбавляли с помощью EtOAc, фильтровали и концентрировали in vacuo с получением неочищенного продукта. Неочищенный продукт очищали с помощью колоночной хроматографии на силикагеле.
Процедура 2
В раствор амина в DMF при к. т. добавляли 2-бромэтилэфир (1,2 экв.) и основание Хунига (3,0 экв.). Смесь нагревали под действием микроволнового излучения до 140°C в закрытой пробирке в течение 24 ч. Реакционную смесь охлаждали, гасили с помощью водного раствора NaHCO3, экстрагировали с помощью EtOAc, промывали солевым раствором, высушивали с помощью Na2SO4, фильтровали и концентрировали in vacuo с получением неочищенного продукта. Неочищенный продукт очищали с помощью колоночной хроматографии на силикагеле.
Синтез промежуточных соединений на основе пинаколбороната
Процедура 3
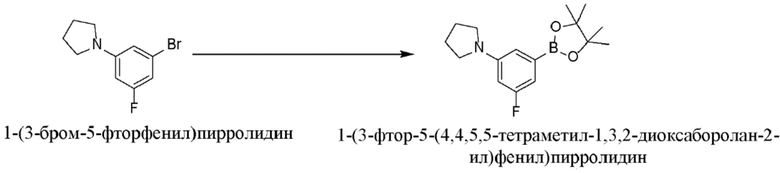
В дегазированный раствор 1-(3-бром-5-фторфенил)пирролидина в 1,4-диоксане (0,1 М) добавляли ацетат калия (2,0 экв.), диборолан (1,2 экв.) и PdCl2(dppf)2 (0,05 экв.). Смесь нагревали с обратным холодильником, при этом реакцию отслеживали с помощью LC. Через 5 ч. в результате водной обработки получали неочищенный продукт. В результате колоночной хроматографии на силикагеле получали 1-(3-фтор-5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил)пирролидин.
Синтез промежуточных продуктов из реакции сочетания Судзуки
Процедура 4
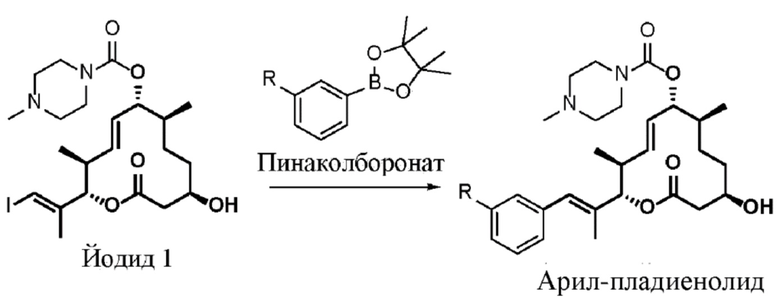
В перемешиваемый раствор йодида 1 и пинаколбороната в п-диоксане добавляли 3,0 экв. оксида серебра (или K2CO3) и 0,1 экв. тетракис(трифенилфосфин)палладия(0). Смесь дегазировали и нагревали до 80°C в течение 90 минут. После завершения реакции, которое показывали с помощью UPLC, реакционную смесь охлаждали до комнатной температуры, фильтровали и концентрировали. В результате очистки с помощью колоночной хроматографии с градиентом элюирования от 0 до 20% MeOH/DCM получали продукт реакции сочетания - арил-пладиенолид.
Процедура 5
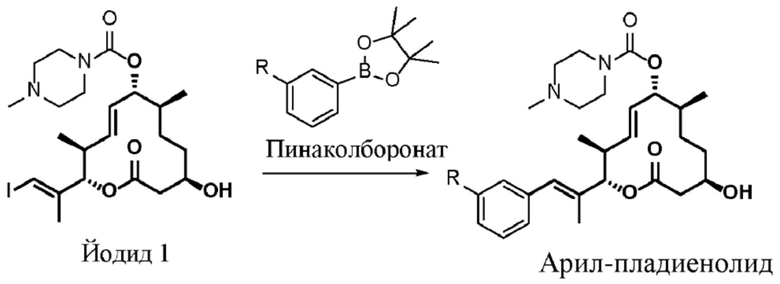
В перемешиваемый раствор йодида 1 и пинаколбороната в смеси п-диоксан/H2O (3:1) добавляли 2,0 экв. K2CO3 и 0,1 экв. Pd(dppf)Cl2. Смесь дегазировали и нагревали до 80°C в течение 1 ч. После завершения реакции, которое показывали с помощью UPLC, реакционную смесь охлаждали до комнатной температуры, фильтровали и концентрировали. В результате очистки с помощью колоночной хроматографии с градиентом элюирования от 0 до 20% MeOH/DCM получали продукт реакции сочетания - арил-пладиенолид.
Процедура 6
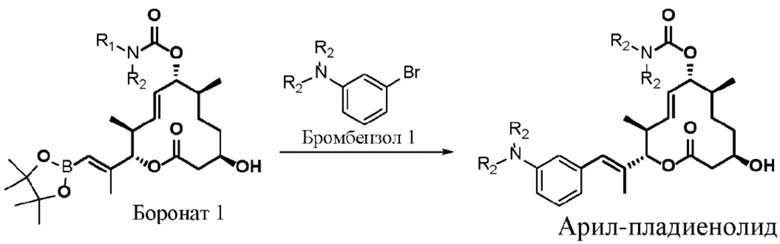
В перемешиваемый раствор бороната (например, бороната 1 выше) и бромбензола 1 в смеси 1,4-диоксан/вода (3:1) добавляли 3,0 экв. карбоната калия (или Ag2O) и 0,1 экв. Pd(PPh3)4 (или PddppfCl2). Смесь дегазировали и нагревали до 100°C в течение 2 ч. После завершения реакции, которое показывали с помощью UPLC, смесь охлаждали до комнатной температуры, фильтровали и очищали с помощью колоночной хроматографии с градиентом элюирования от 0 до 100% EtOAc/гексаны, затем с градиентом от 0 до 20% MeOH/DCM, с получением продукта реакции сочетания - арил-пладиенолида.
Процедура 7
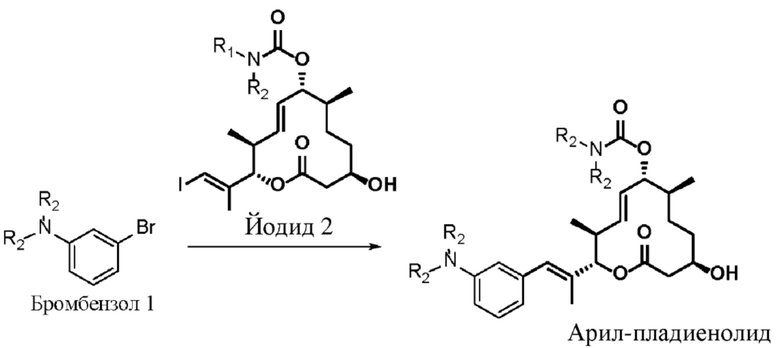
В дегазированный раствор 1,5 экв. бромбензола 1 в 1,4-диоксане добавляли 3,0 экв. ацетата калия, 2,0 экв. диборолана и 0,2 экв. Pd(dppf)Cl2. Смесь нагревали с обратным холодильником, при этом реакцию отслеживали с помощью LC. Через 5 ч. реакционную смесь охлаждали. Добавляли 3,0 экв. Ag2O, 0,2 экв. Pd(PPh3)4 и раствор 1,0 экв. йодида 2. Смесь дегазировали и нагревали до 80°C в течение 2 ч. Смесь охлаждали и проводили прямую колоночную хроматографию на силикагеле с получением продукта реакции сочетания - арил-пладиенолида.
Синтез продуктов амидизации
Процедура 8
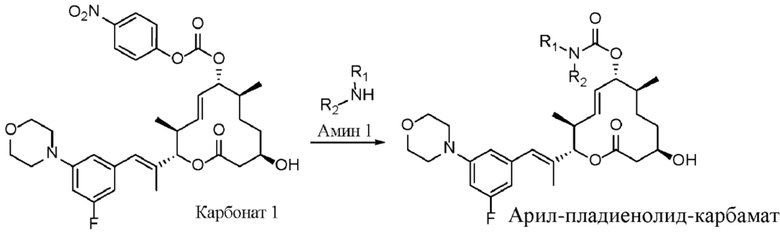
В раствор карбоната 1 в DCM было 3,0 экв. триэтиламина и 2,0 экв. амина 1. Полученную желтоватую суспензию перемешивали в течение 12 часов до исчезновения карбоната 1. Реакционную смесь концентрировали с получением неочищенного продукта, и продукт - арил-пладиенолид-карбамат - выделяли с помощью жидкостной хроматографии.
Процедура 9
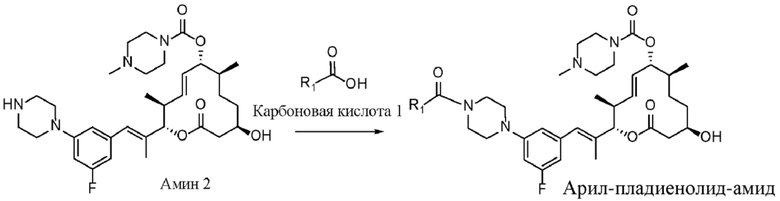
В раствор амина 2 и карбоновой кислоты 1 (1,2 экв.) в DMSO при комнатной температуре добавляли HBTU (1,2 экв.) и триэтиламин (1,5 экв.). Раствор перемешивали в течение 5 часов при комнатной температуре. Для гашения реакции добавляли воду, затем смесь экстрагировали с помощью EtOAc, промывали солевым раствором и концентрировали in vacuo с получением неочищенного продукта. Полученный продукт - арил-пладиенолид-амид - очищали с помощью колоночной хроматографии на силикагеле.
Процедура 10
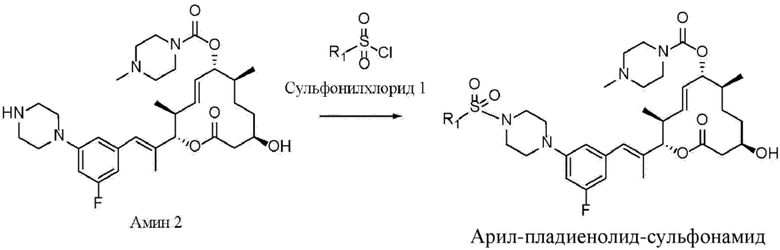
В раствор амина 2 в DCM добавляли 1,2 экв. сульфонилхлорида 1, 3,0 экв. основания Хунига, и 0,1 экв. DMAP. Смесь перемешивали при комнатной температуре до получения амина 2. Реакционную смесь гасили водой, экстрагировали с помощью EtOAc, промывали солевым раствором, высушивали над Na2SO4, фильтровали и концентрировали с получением неочищенного продукта. Продукт - арил-пладиенолид-сульфонамид - очищали с помощью колоночной хроматографии на силикагеле.

[(2S,3S,4E,6R,7S,10R)-10-Гидрокси-3,7-диметил-12-оксо-2-[(E)-1-(3-пиперазин-1-илфенил)проп-1-ен-2-ил]-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилат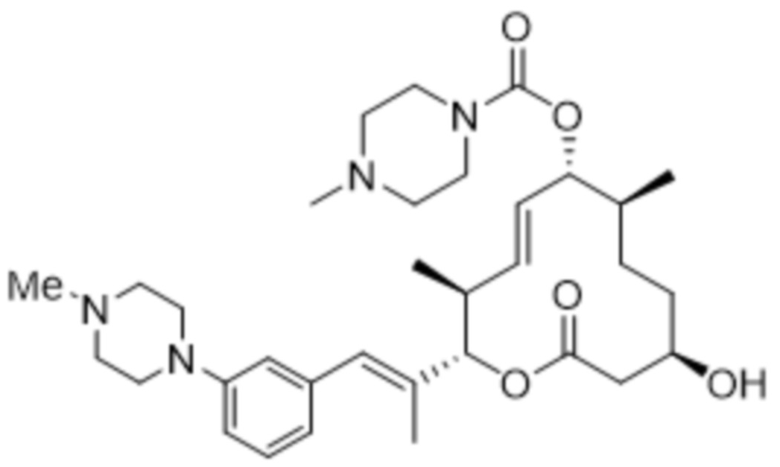
[(2S,3S,4E,6R,7S,10R)-10-Гидрокси-3,7-диметил-2-[(E)-1-[3-(4-метилпиперазин-1-ил)фенил]проп-1-ен-2-ил]-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилат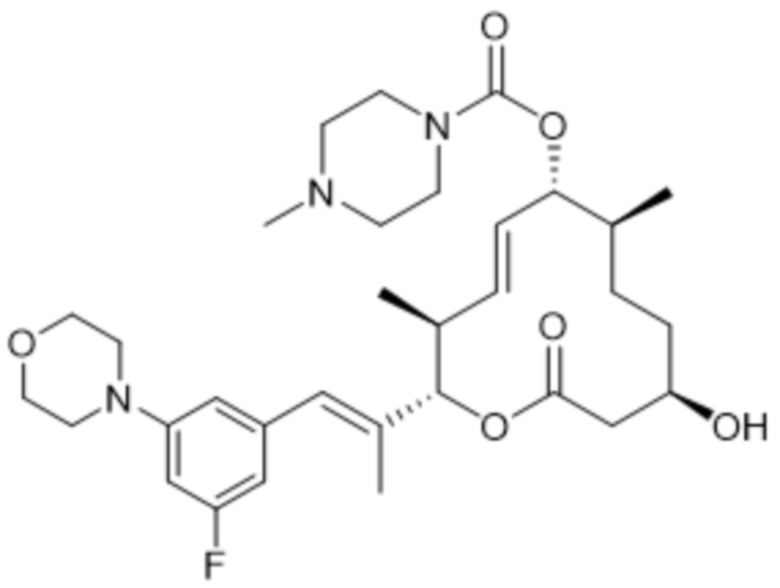
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-(3-Фтор-5-морфолин-4-илфенил)проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилат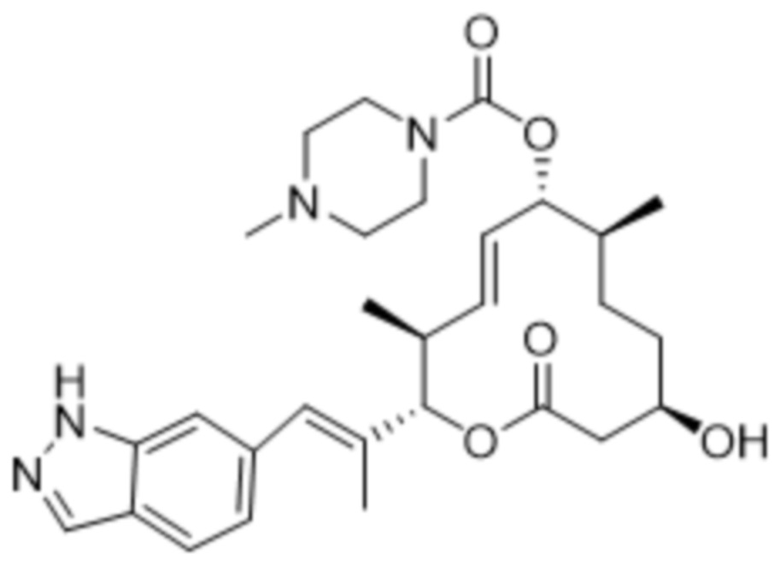
[(2S,3S,4E,6R,7S,10R)-10-Гидрокси-2-[(E)-1-(1H-индазол-6-ил)проп-1-ен-2-ил]-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилат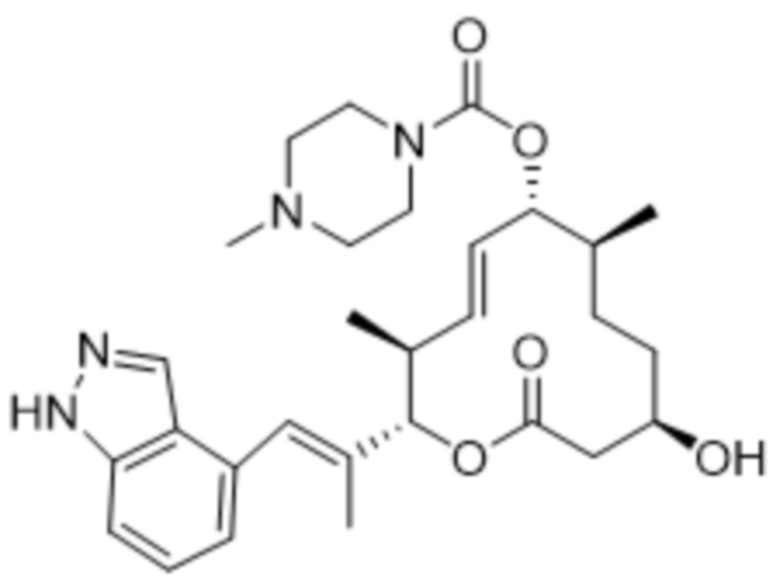
[(2S,3S,4E,6R,7S,10R)-10-Гидрокси-2-[(E)-1-(1H-индазол-4-ил)проп-1-ен-2-ил]-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилат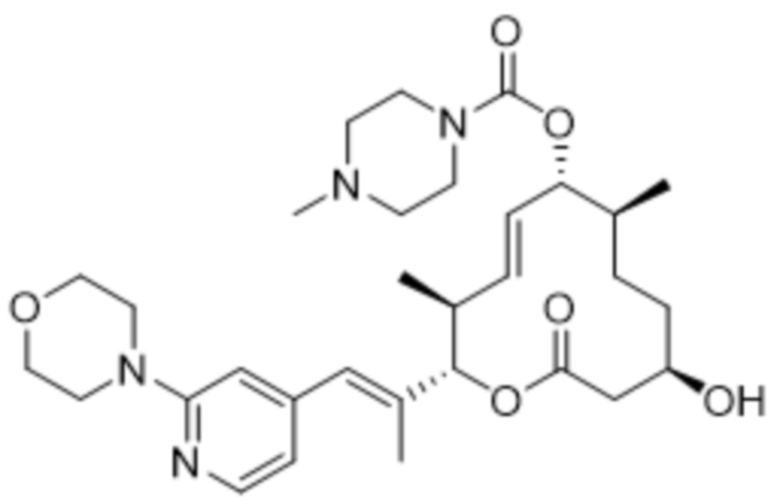
[(2S,3S,4E,6R,7S,10R)-10-Гидрокси-3,7-диметил-2-[(E)-1-(2-морфолин-4-илпиридин-4-ил)проп-1-ен-2-ил]-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилат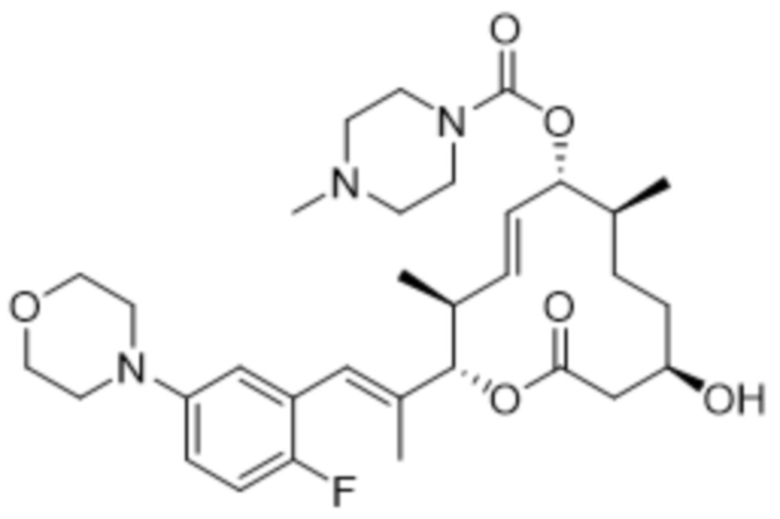
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-(2-Фтор-5-морфолин-4-илфенил)проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилат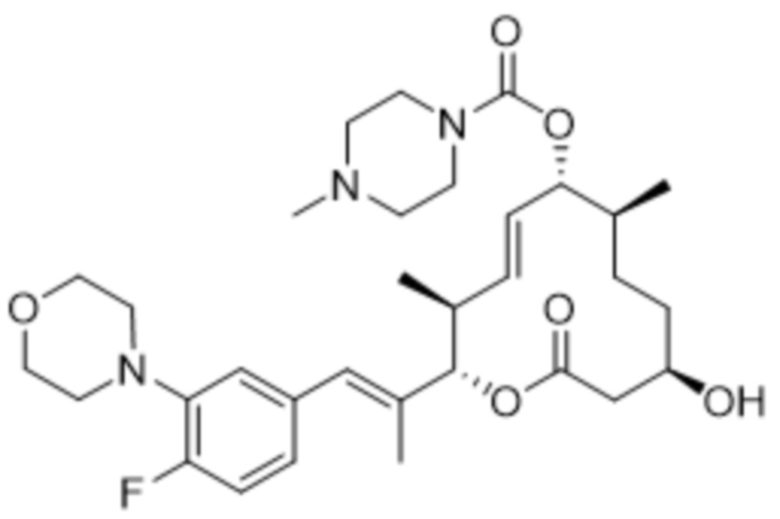
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-(4-Фтор-3-морфолин-4-илфенил)проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилат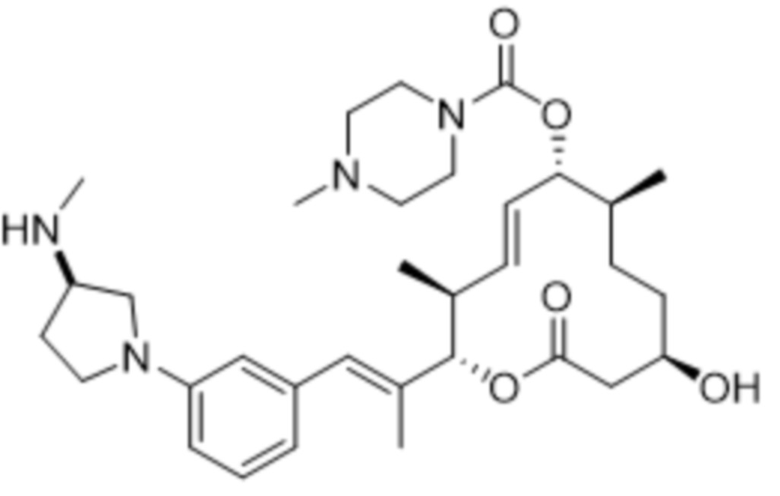
[(2S,3S,4E,6R,7S,10R)-10-Гидрокси-3,7-диметил-2-[(E)-1-[3-[(3S)-3-(метиламино)пирролидин-1-ил]фенил]проп-1-ен-2-ил]-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилат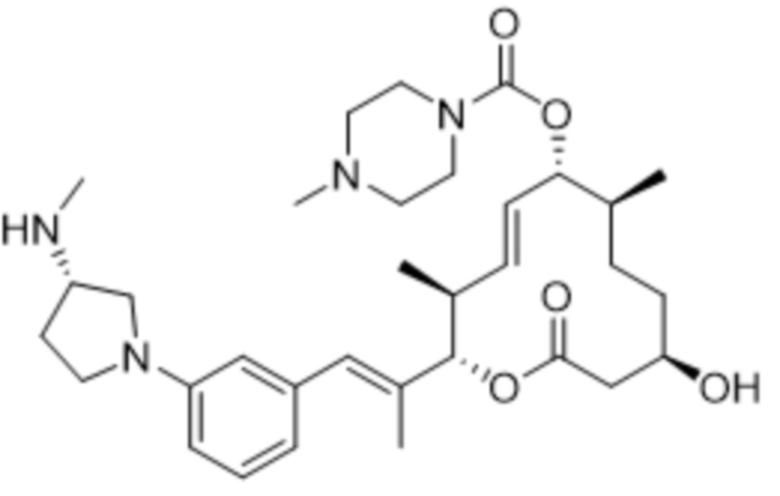
[(2S,3S,4E,6R,7S,10R)-10-Гидрокси-3,7-диметил-2-[(E)-1-[3-[(3S)-3-(метиламино)пирролидин-1-ил]фенил]проп-1-ен-2-ил]-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилат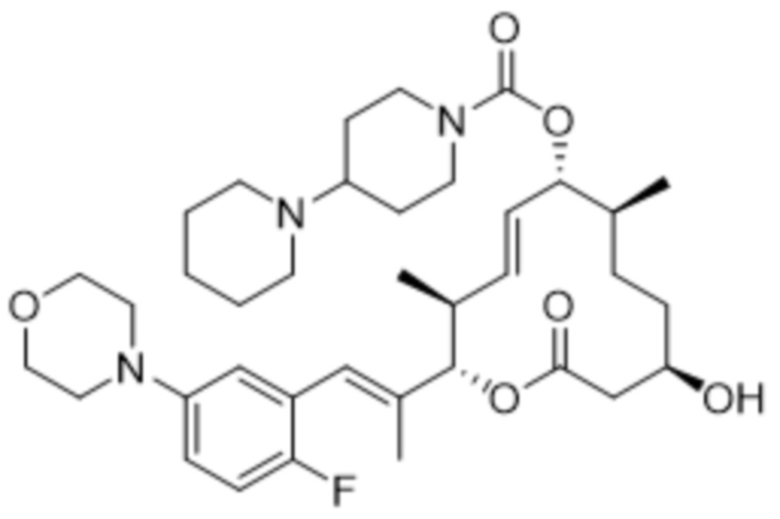
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-(2-Фтор-5-морфолин-4-илфенил)проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-пиперидин-1-илпиперидин-1-карбоксилат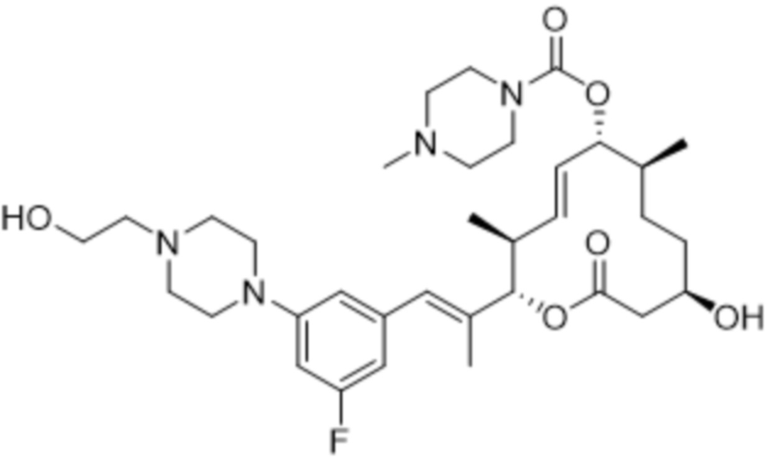
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-Фтор-5-[4-(2-гидроксиэтил)пиперазин-1-ил]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилат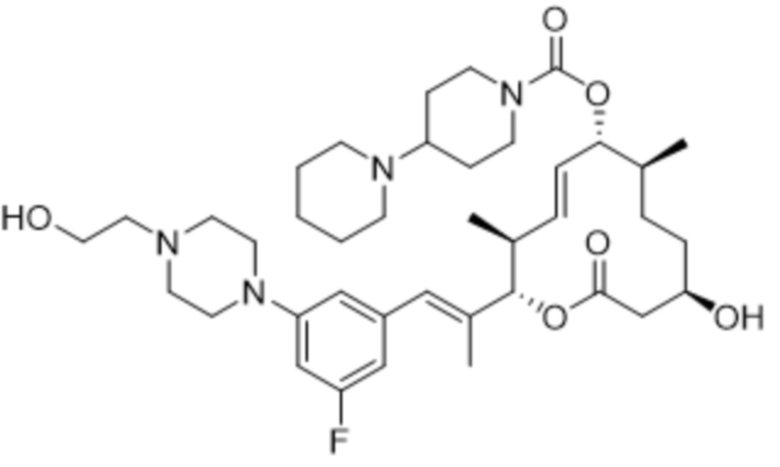
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-Фтор-5-[4-(2-гидроксиэтил)пиперазин-1-ил]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-пиперидин-1-илпиперидин-1-карбоксилат
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-Фтор-5-[(3R)-3-фторпирролидин-1-ил]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилат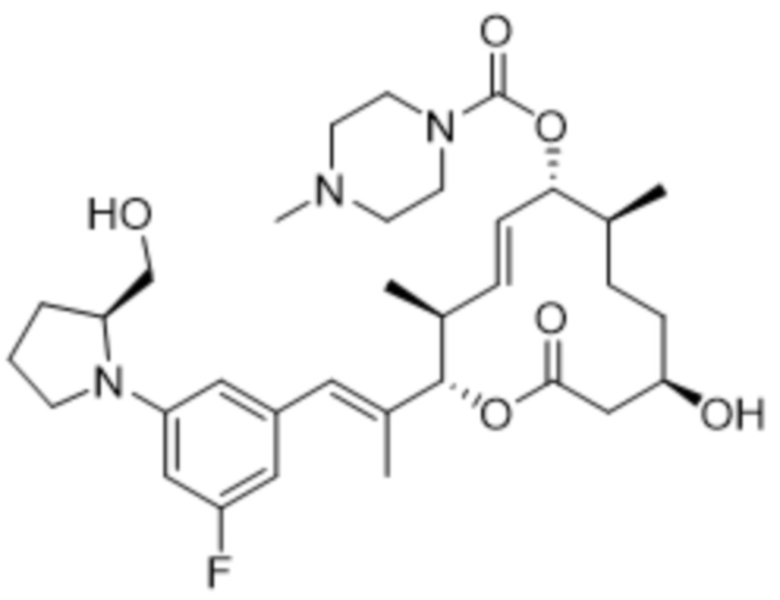
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-Фтор-5-[(2S)-2-(гидроксиметил)пирролидин-1-ил]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилат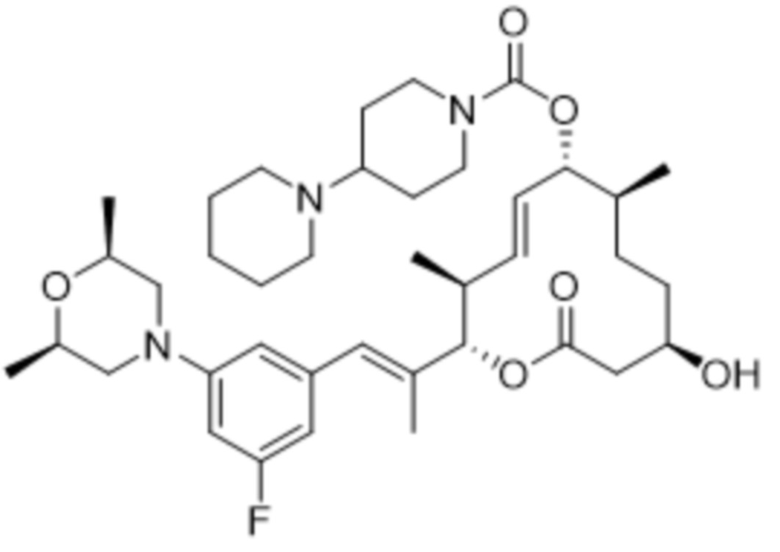
[(2S,3S,4E,6R,7R,10S)-2-[(E)-1-[3-[(2R,6S)-2,6-Диметилморфолин-4-ил]-5-фторфенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-пиперидин-1-илпиперидин-1-карбоксилат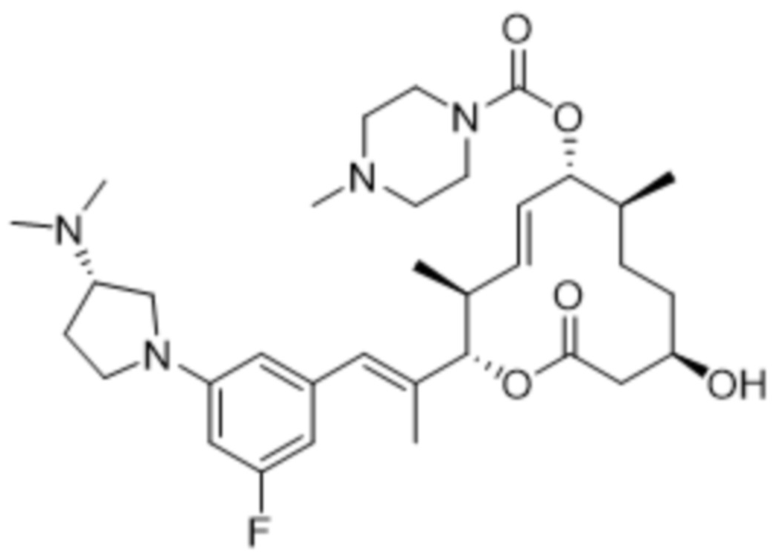
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-[(3S)-3-(Диметиламино)пирролидин-1-ил]-5-фторфенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилат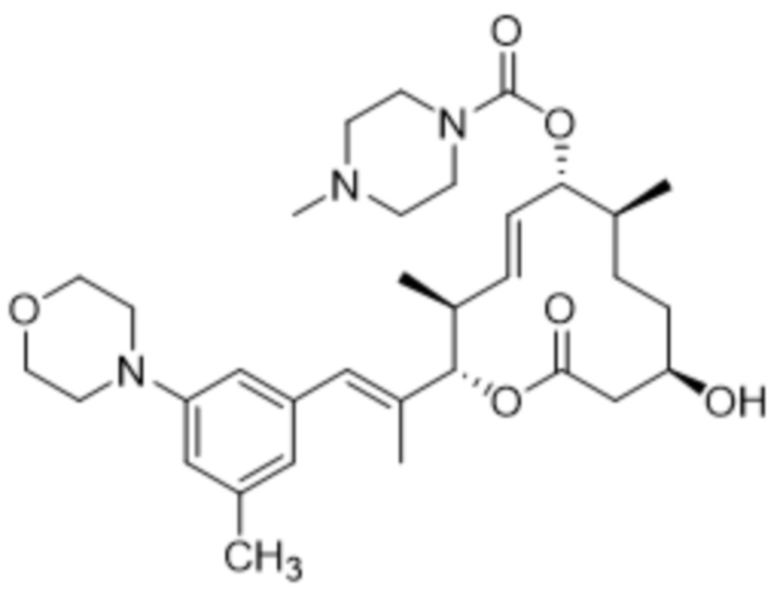
[(2S,3S,4E,6R,7S,10R)-10-Гидрокси-3,7-диметил-2-[(E)-1-(3-метил-5-морфолин-4-илфенил)проп-1-ен-2-ил]-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилат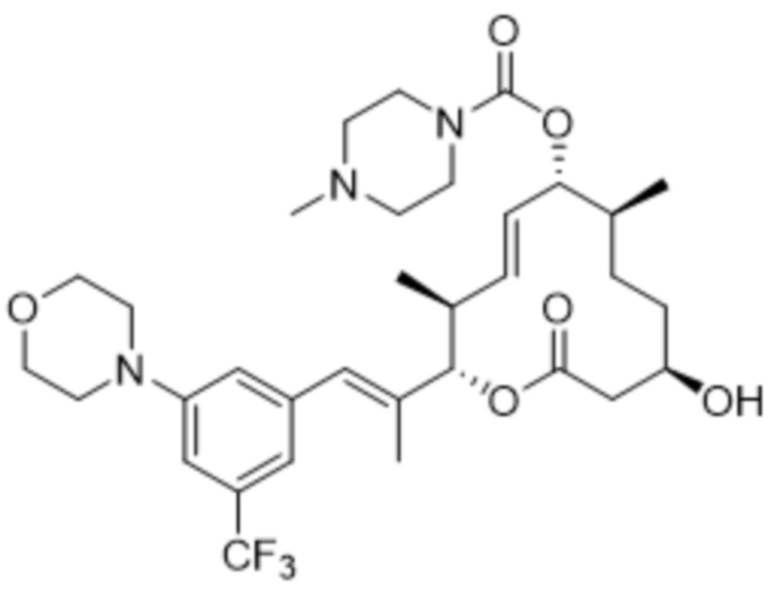
[(2S,3S,4E,6R,7S,10R)-10-Гидрокси-3,7-диметил-2-[(E)-1-[3-морфолин-4-ил-5-(трифторметил)фенил]проп-1-ен-2-ил]-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилат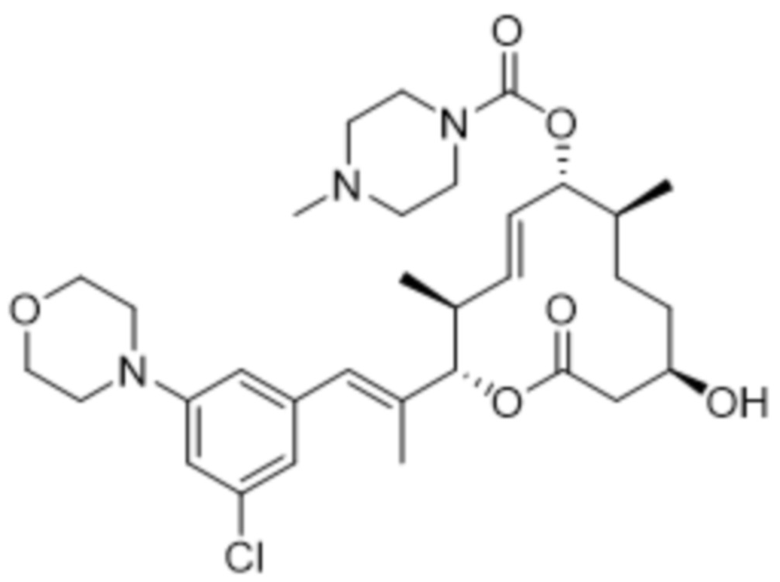
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-(3-Хлор-5-морфолин-4-илфенил)проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилат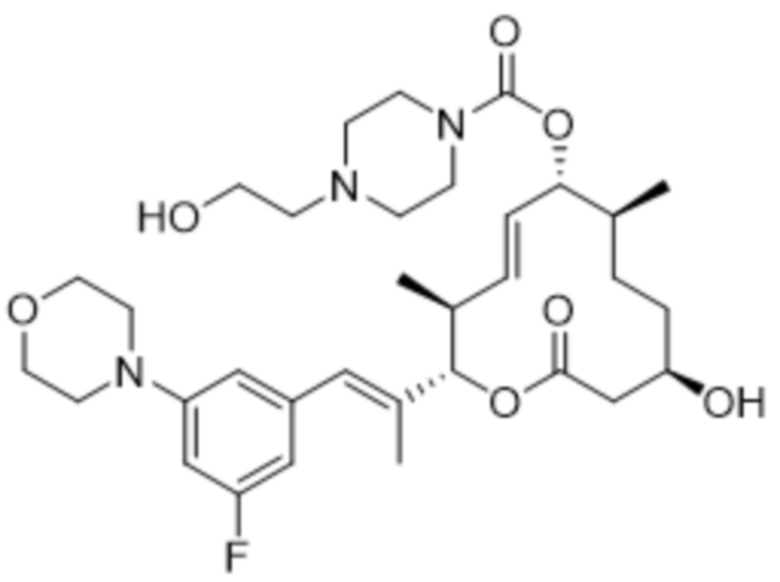
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-(3-Фтор-5-морфолин-4-илфенил)проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-(2-гидроксиэтил)пиперазин-1-карбоксилат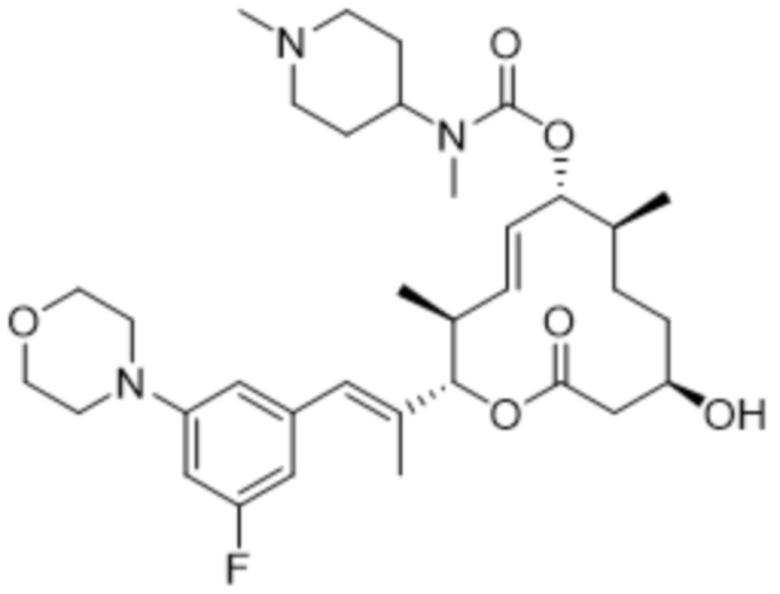
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-(3-Фтор-5-морфолин-4-илфенил)проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-N-метил-N-(1-метилпиперидин-4-ил)карбамат
[(2R,3R,4E,6R,7S,10S)-2-[(E)-1-(3-Фтор-5-морфолин-4-илфенил)проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-(3S)-3,4-диметилпиперазин-1-карбоксилат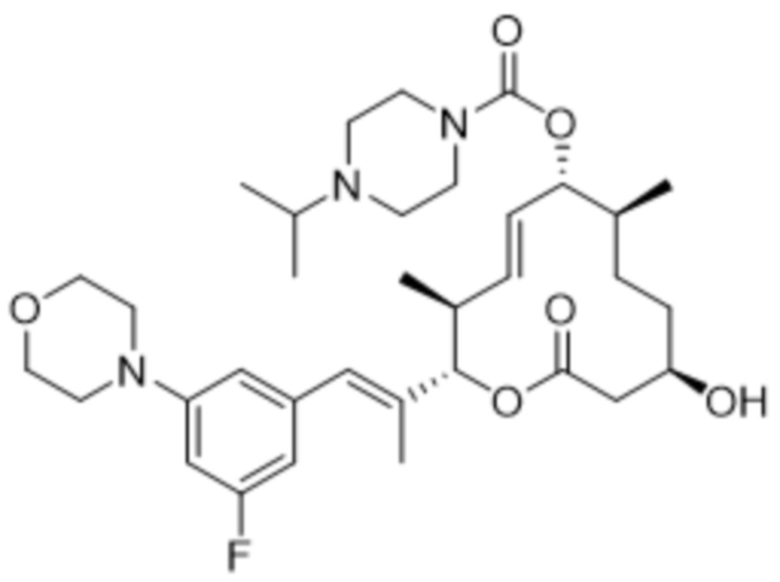
[(2R,3R,4E,6R,7S,10S)-2-[(E)-1-(3-Фтор-5-морфолин-4-илфенил)проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-пропан-2-илпиперазин-1-карбоксилат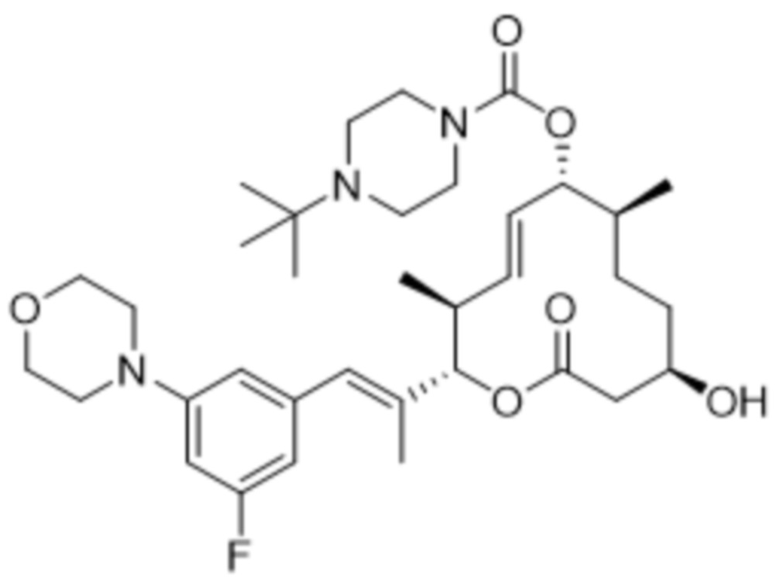
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-(3-Фтор-5-морфолин-4-илфенил)проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-трет-бутилпиперазин-1-карбоксилат
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-(3-Фтор-5-морфолин-4-илфенил)проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-циклобутилпиперазин-1-карбоксилат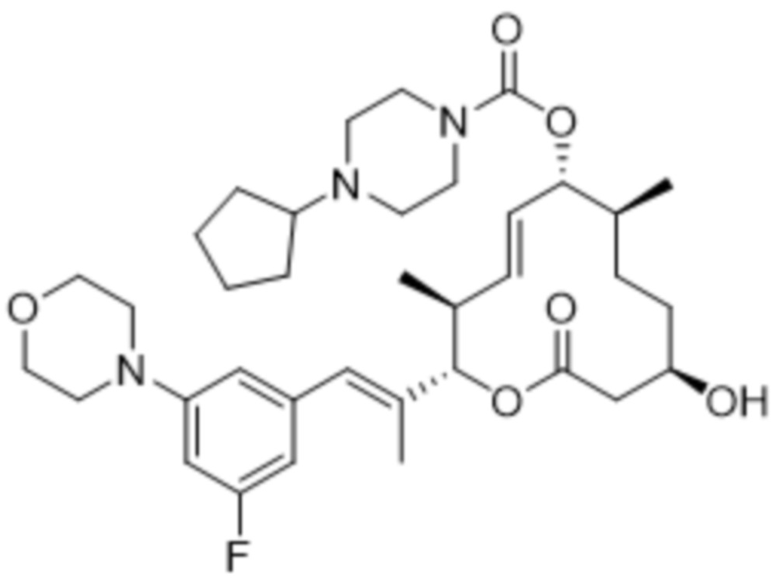
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-(3-Фтор-5-морфолин-4-илфенил)проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-циклопентилпиперазин-1-карбоксилат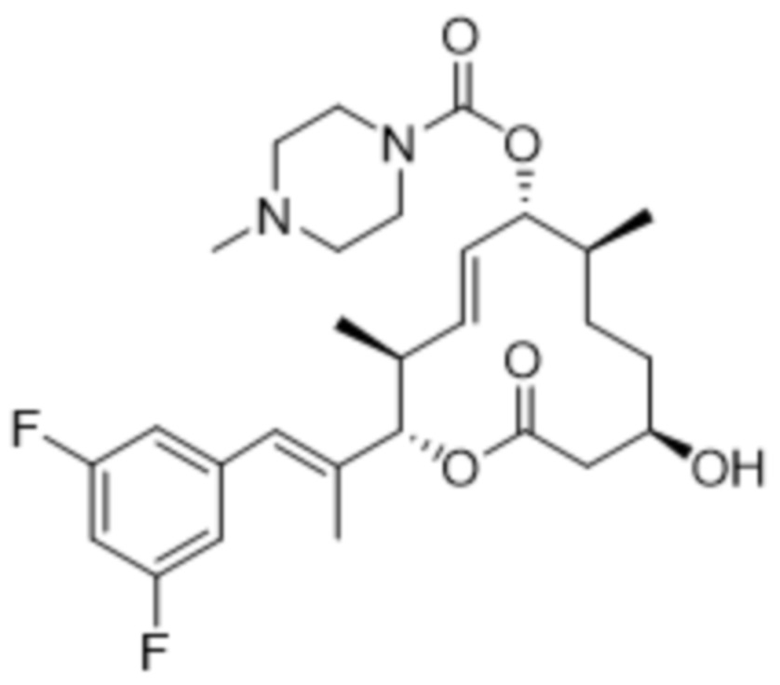
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-(3,5-Дифторфенил)проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилат
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-(Диметиламино)-5-фторфенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилат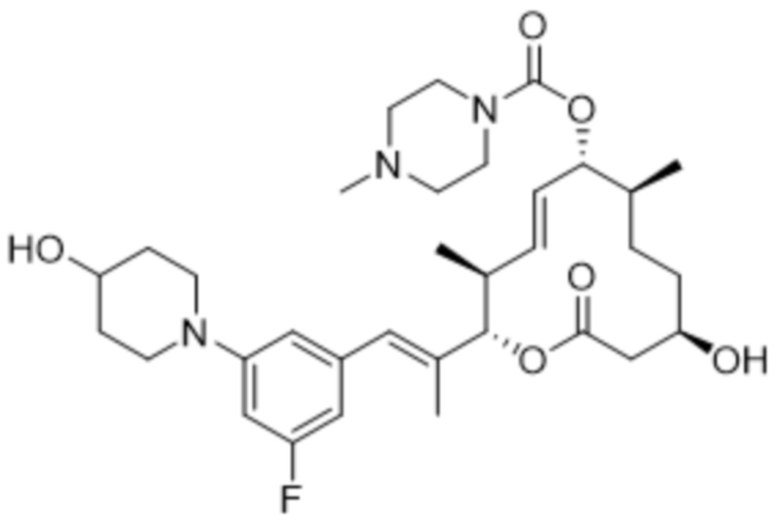
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-Фтор-5-(4-гидроксипиперидин-1-ил)фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилат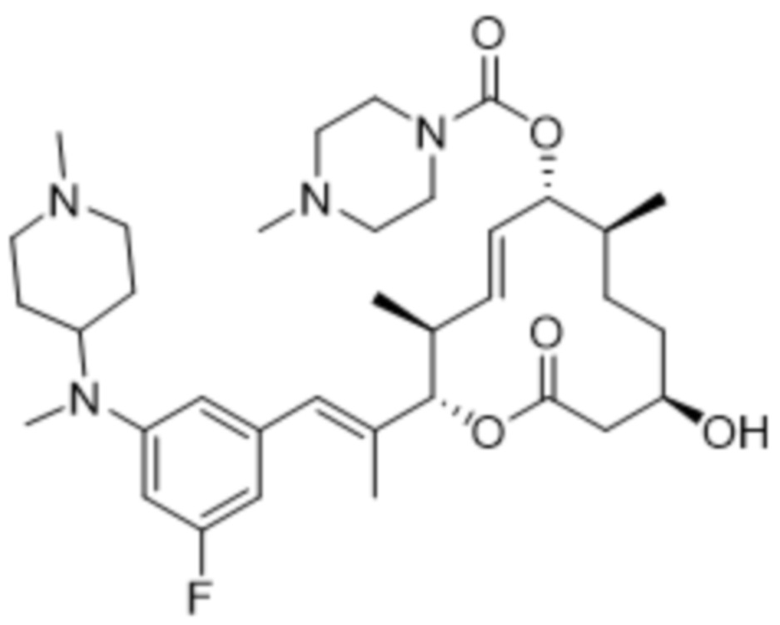
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-Фтор-5-[метил-(1-метилпиперидин-4-ил)амино]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилат
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-Фтор-5-[(1R,5S)-8-окса-3-азабицикло[3.2.1]октан-3-ил]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилат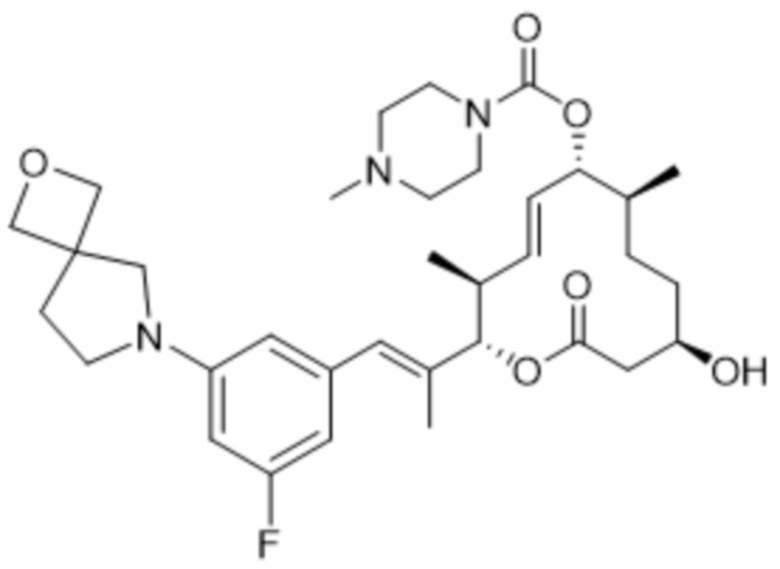
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-Фтор-5-(2-окса-7-азаспиро[3.4]октан-7-ил)фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилат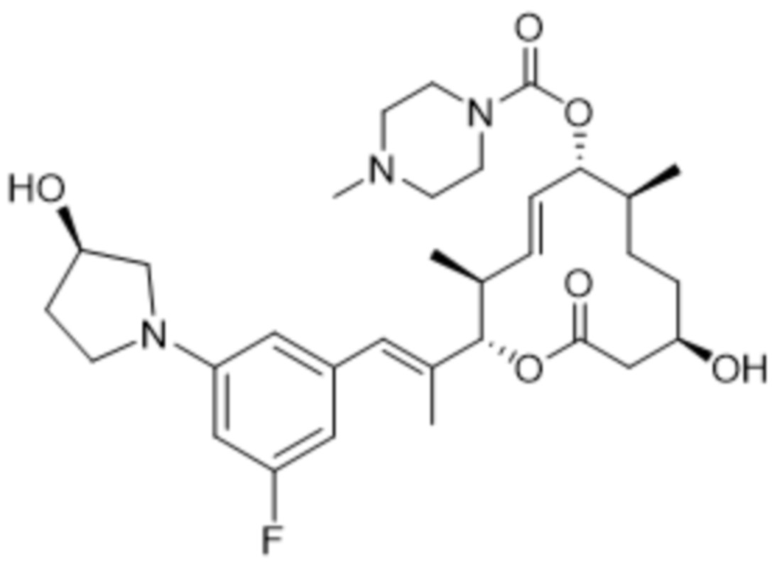
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-Фтор-5-[(3R)-3-гидроксипирролидин-1-ил]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилат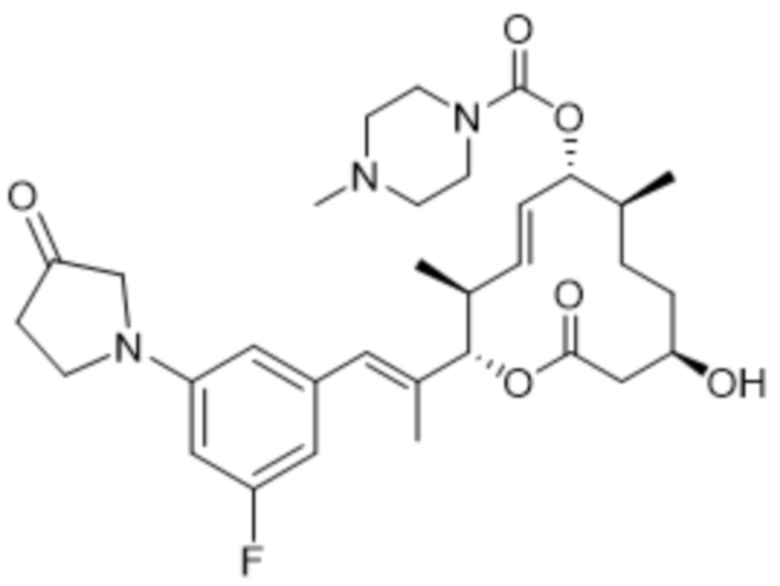
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-Фтор-5-(3-оксопирролидин-1-ил)фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилат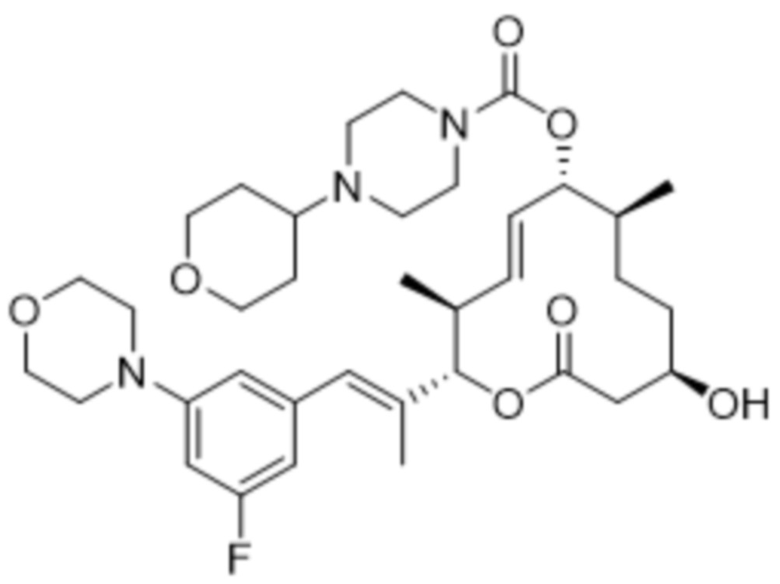
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-(3-Фтор-5-морфолин-4-илфенил)проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-(оксан-4-ил)пиперазин-1-карбоксилат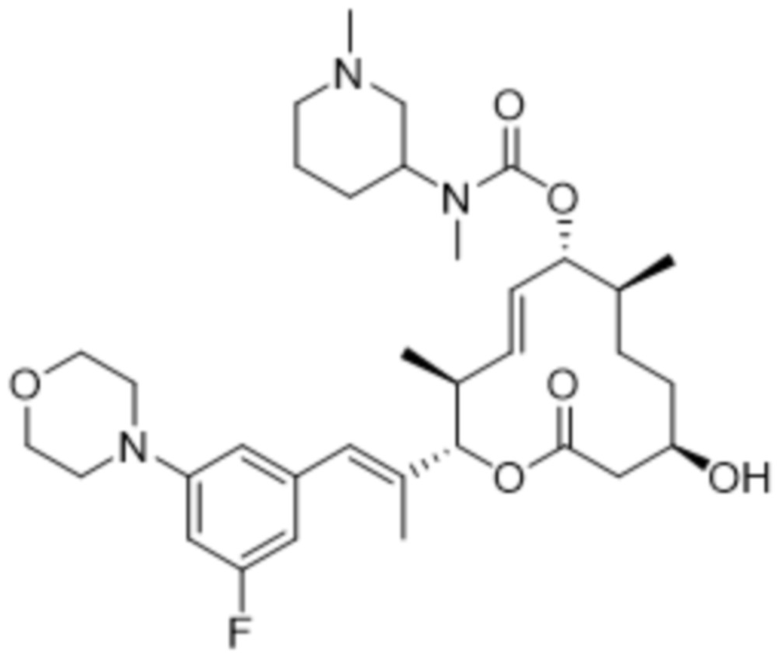
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-(3-Фтор-5-морфолин-4-илфенил)проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-N-метил-N-(1-метилпиперидин-3-ил)карбамат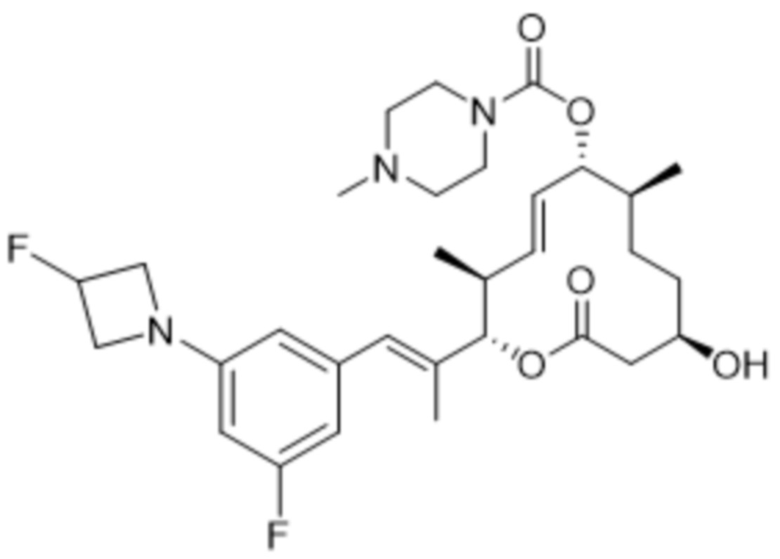
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-Фтор-5-(3-фторазетидин-1-ил)фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилат
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-Фтор-5-[(3S)-3-(метиламино)пирролидин-1-ил]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилат
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-(3-Фтор-5-морфолин-4-илфенил)проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-3-(диметиламино)пиперидин-1-карбоксилат
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-Фтор-5-[(2R)-2-метилпирролидин-1-ил]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилат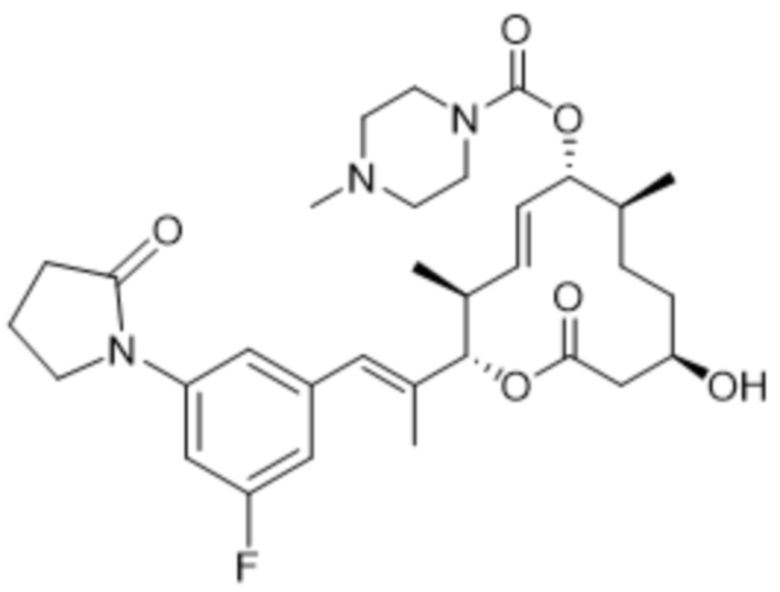
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-Фтор-5-(2-оксопирролидин-1-ил)фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилат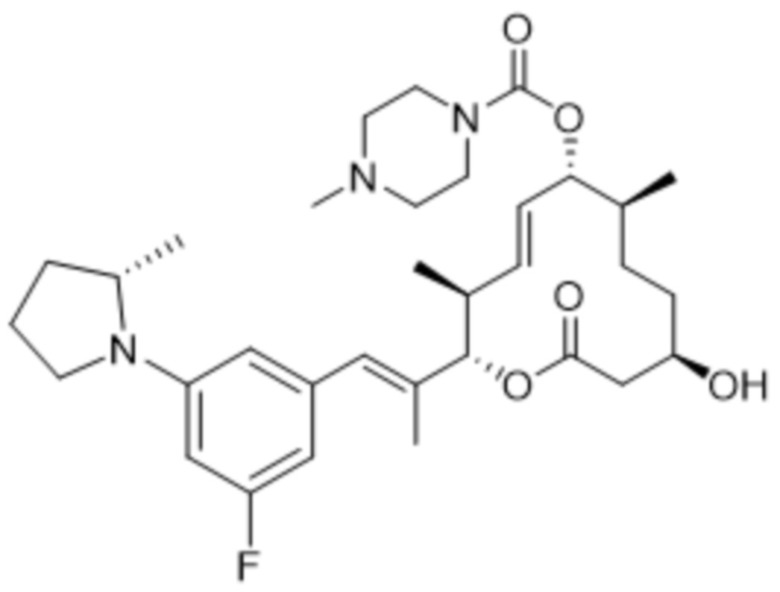
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-Фтор-5-[(2S)-2-метилпирролидин-1-ил]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилат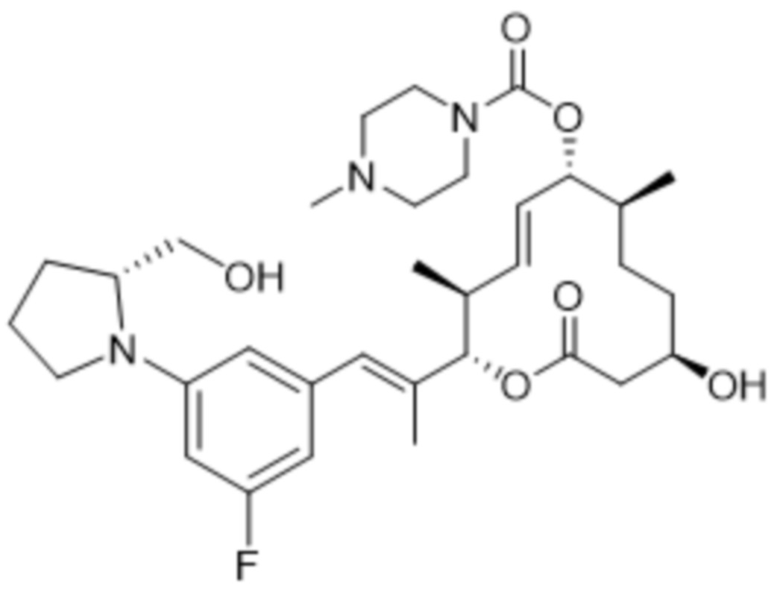
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-Фтор-5-[(2R)-2-(гидроксиметил)пирролидин-1-ил]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилат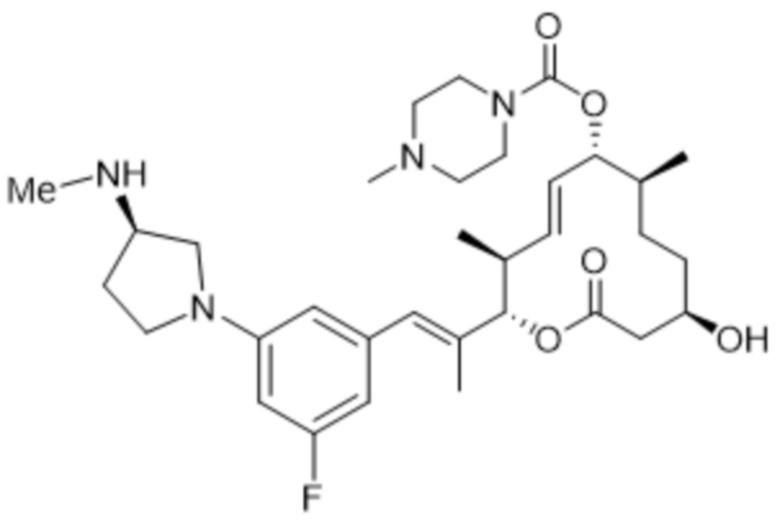
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-Фтор-5-[(3R)-3-(метиламино)пирролидин-1-ил]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилат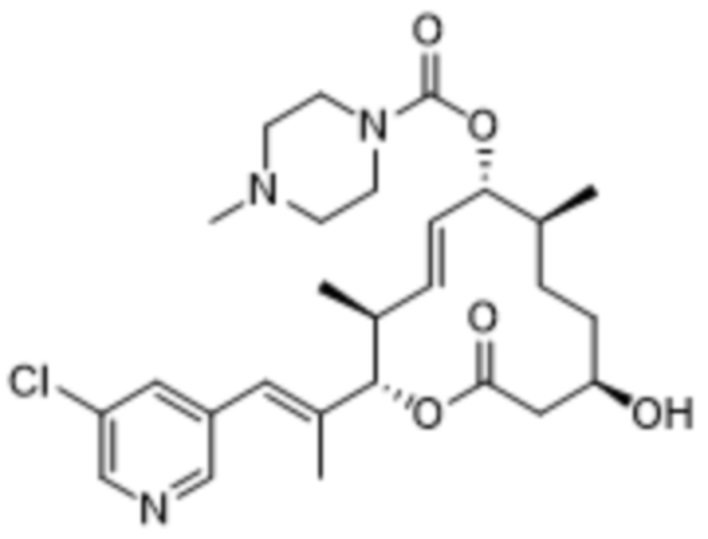
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-(5-Хлорпиридин-3-ил)проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилат
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-(3-Фтор-5-морфолин-4-илфенил)проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-N-метил-N-(пиридин-4-илметил)карбамат
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-(3,5-Дихлорфенил)проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилат
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-(1,1-Диоксо-1,2-тиазолидин-2-ил)фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилат
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-(1,3-Диметил-индазол-6-ил)проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилат
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-(1,1-Диоксо-1,4-тиазинан-4-ил)-5-фторфенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-N, N-диметилкарбамат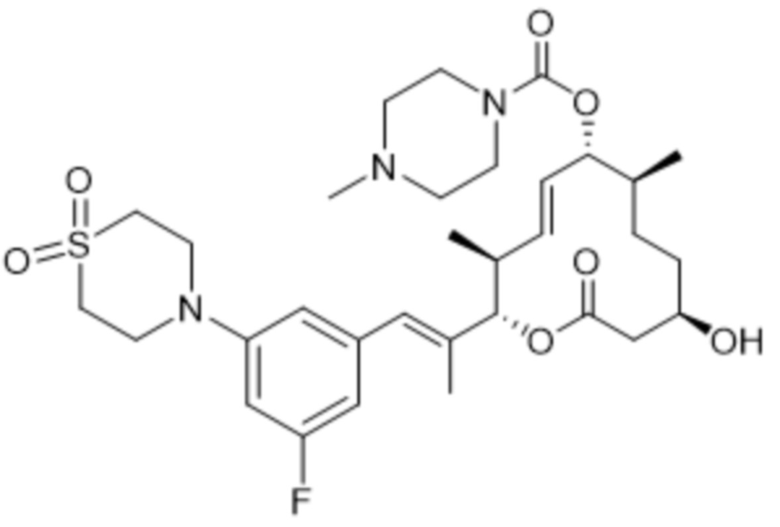
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-(1,1-Диоксо-1,4-тиазинан-4-ил)-5-фторфенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилат
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-Фтор-5-[4-(2-гидроксиэтил)пиперазин-1-ил]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]морфолин-4-карбоксилат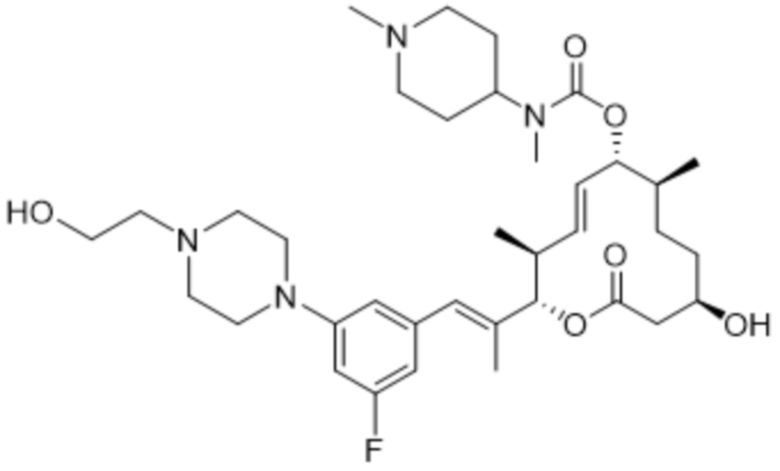
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-Фтор-5-[4-(2-гидроксиэтил)пиперазин-1-ил]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-N-метил-N-(1-метилпиперидин-4-ил)карбамат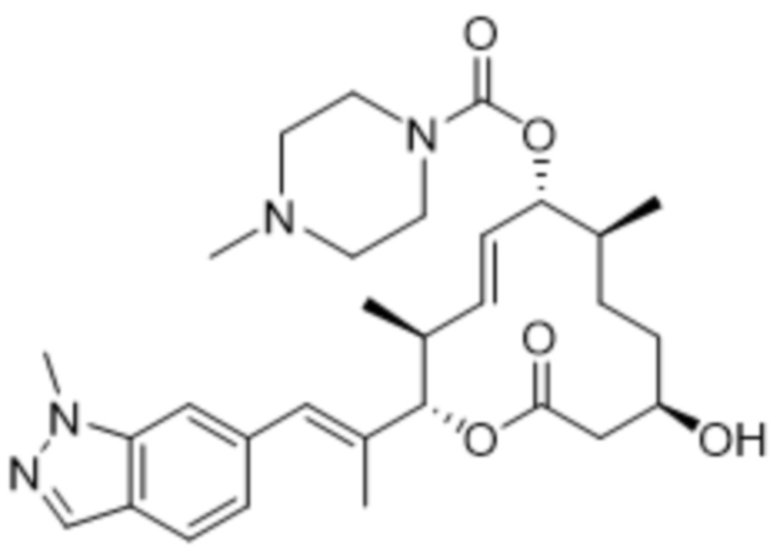
[(2S,3S,4E,6R,7S,10R)-10-Гидрокси-3,7-диметил-2-[(E)-1-(1-метил-индазол-6-ил)проп-1-ен-2-ил]-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилат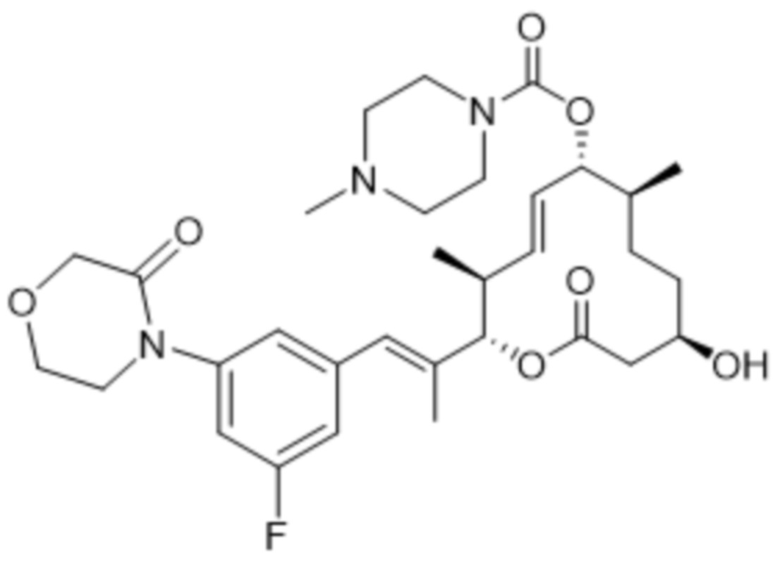
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-Фтор-5-(3-оксоморфолин-4-ил)фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилат
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[4-(Циклопентилсульфамоил)-2-фторфенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилат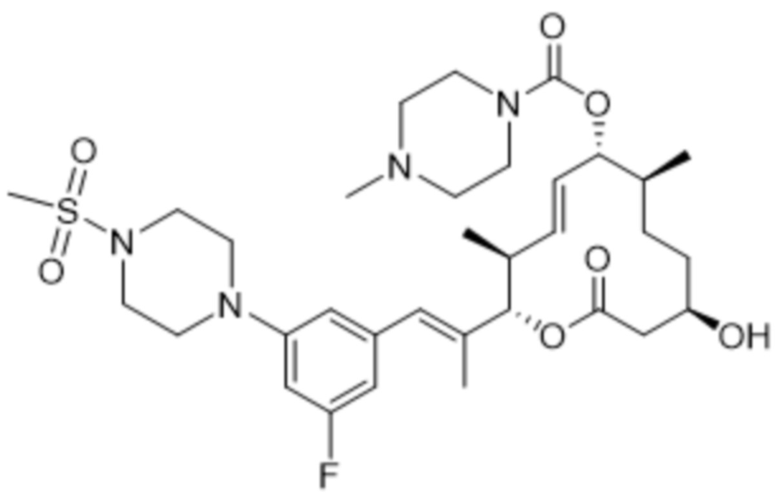
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-Фтор-5-(4-метилсульфонилпиперазин-1-ил)фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилат
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-(4-Фтор-1H-индазол-6-ил)проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилат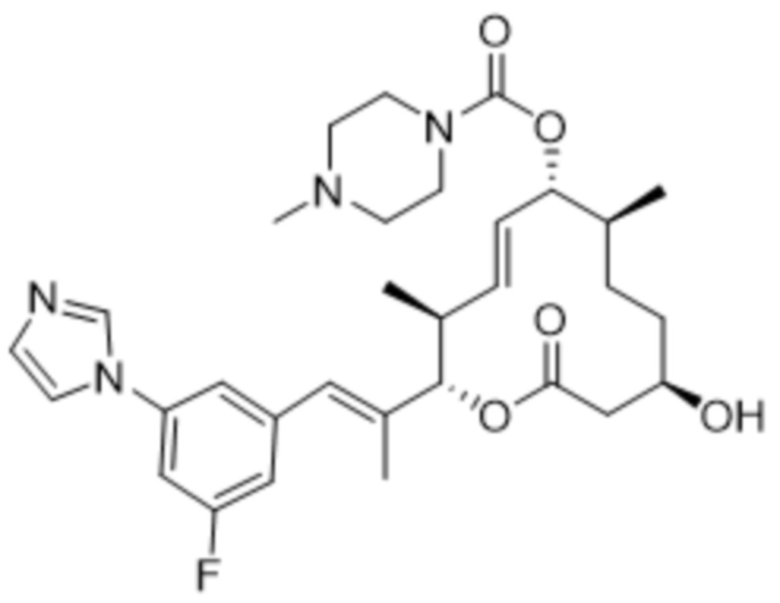
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-(3-Фтор-5-имидазол-1-илфенил)проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилат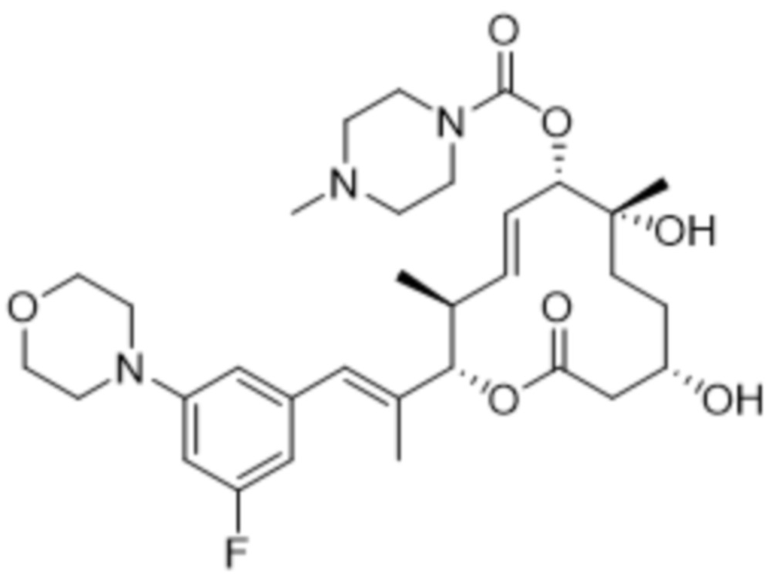
[(2S,3S,4E,6S,7R,10S)-2-[(E)-1-(3-Фтор-5-морфолин-4-илфенил)проп-1-ен-2-ил]-7,10-дигидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилат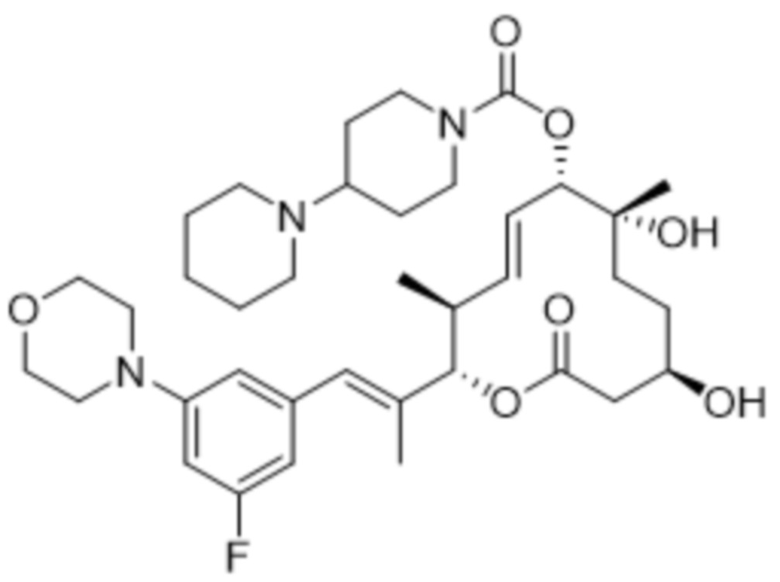
[(2S,3S,4E,6S,7R,10R)-2-[(E)-1-(3-Фтор-5-морфолин-4-илфенил)проп-1-ен-2-ил]-7,10-дигидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-пиперидин-1-илпиперидин-1-карбоксилат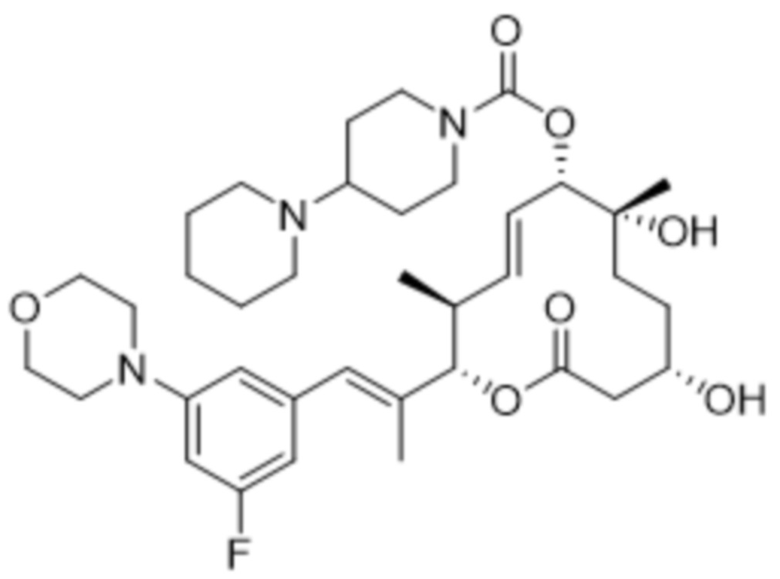
[(2S,3S,4E,6S,7R,10S)-2-[(E)-1-(3-Фтор-5-морфолин-4-илфенил)проп-1-ен-2-ил]-7,10-дигидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-пиперидин-1-илпиперидин-1-карбоксилат
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-Фтор-5-(2-оксоимидазолидин-1-ил)фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилат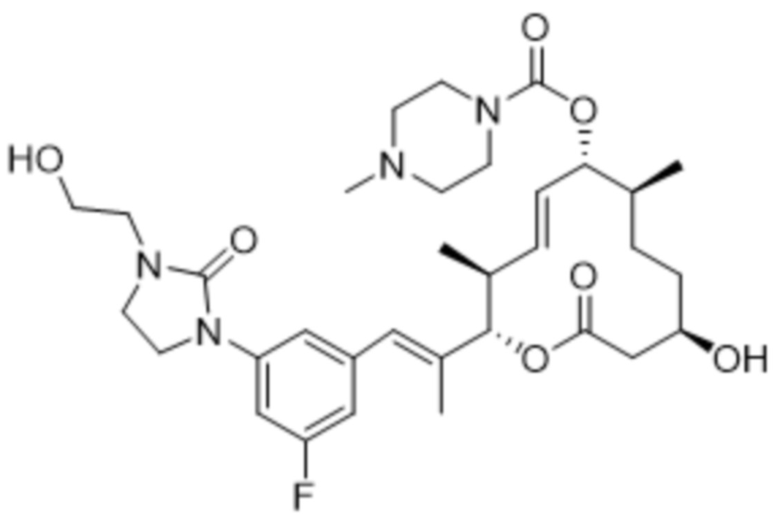
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-Фтор-5-[3-(2-гидроксиэтил)-2-оксоимидазолидин-1-ил]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилат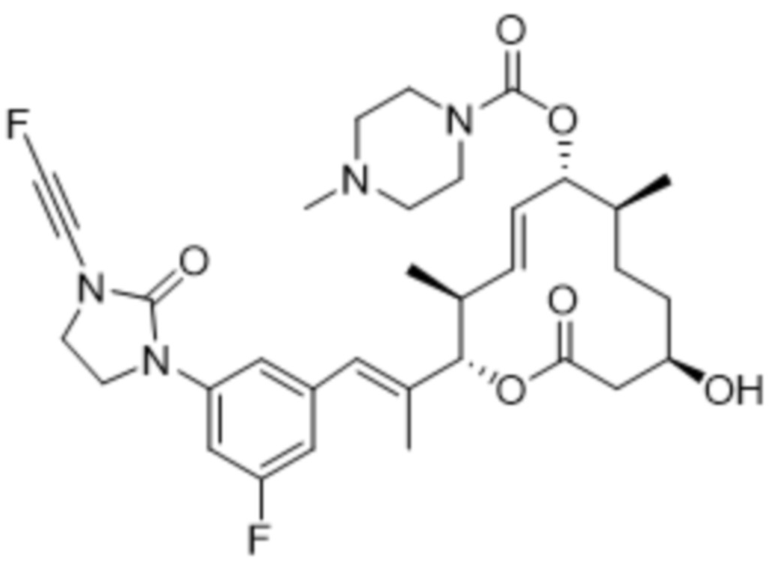
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-Фтор-5-[3-(2-фторэтинил)-2-оксоимидазолидин-1-ил]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилат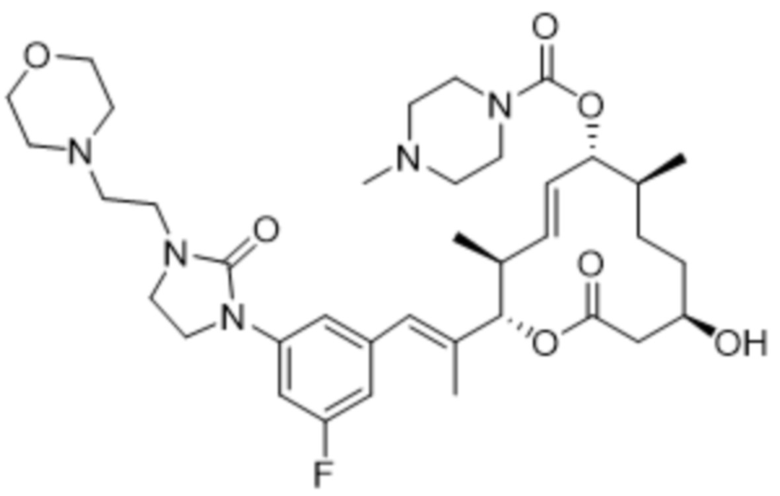
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-Фтор-5-[3-(2-морфолин-4-илэтил)-2-оксоимидазолидин-1-ил]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилат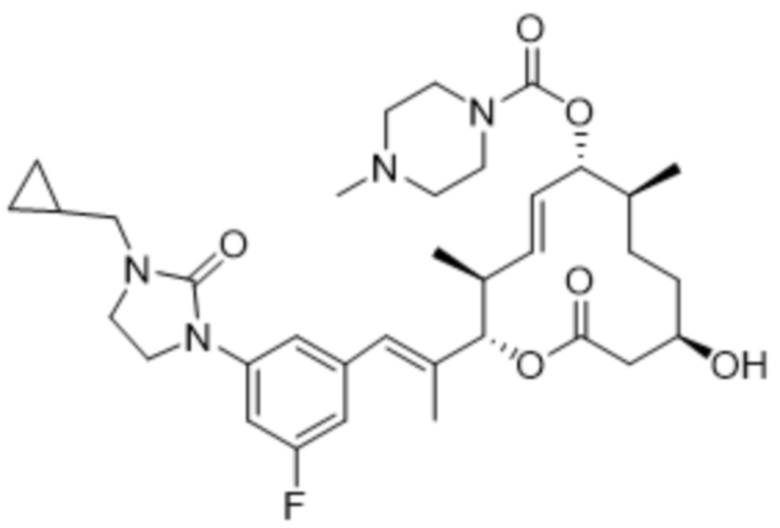
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-[3-(Циклопропилметил)-2-оксоимидазолидин-1-ил]-5-фторфенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилат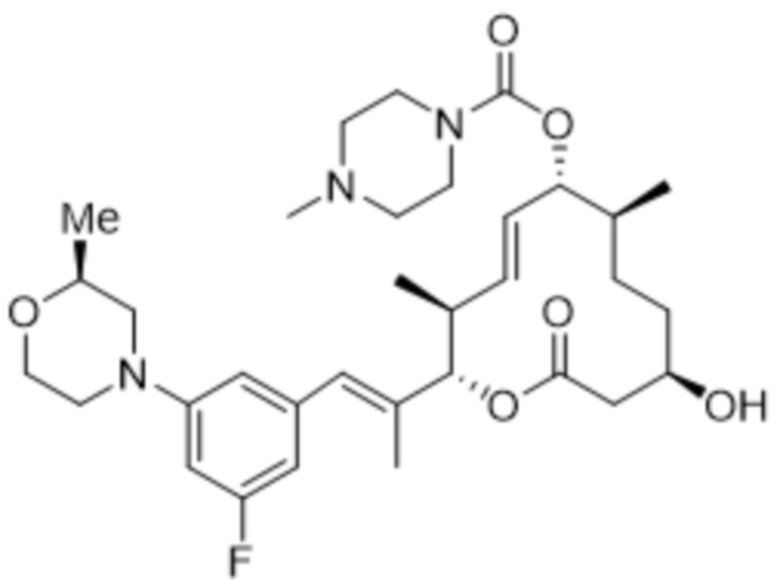
[(2S,3S,4E,6R,7R,10S)-2-[(E)-1-[3-Фтор-5-[(2S)-2-метилморфолин-4-ил]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилат
[(2S,3S,4E,6R,7R,10S)-2-[(E)-1-[3-фтор-5-(2-метилморфолин-4-ил)фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилат
[(2S,3S,4E,6R,7R,10S)-2-[(E)-1-[3-Фтор-5-[4-[(2S,3R)-3-гидрокси-2-метилпентил]пиперазин-1-ил]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилат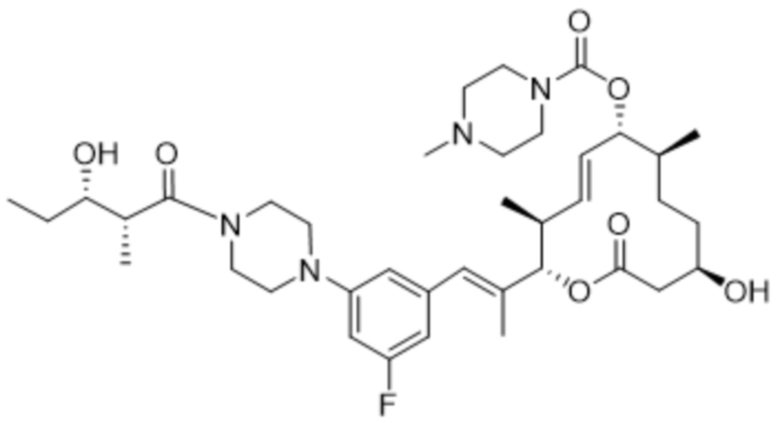
[(2S,3S,4E,6R,7R,10S)-2-[(E)-1-[3-Фтор-5-[4-[(2R,3R)-3-гидрокси-2-метилпентаноил]пиперазин-1-ил]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилат
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-Фтор-5-[4-(2-морфолин-4-илэтилсульфонил)пиперазин-1-ил]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилат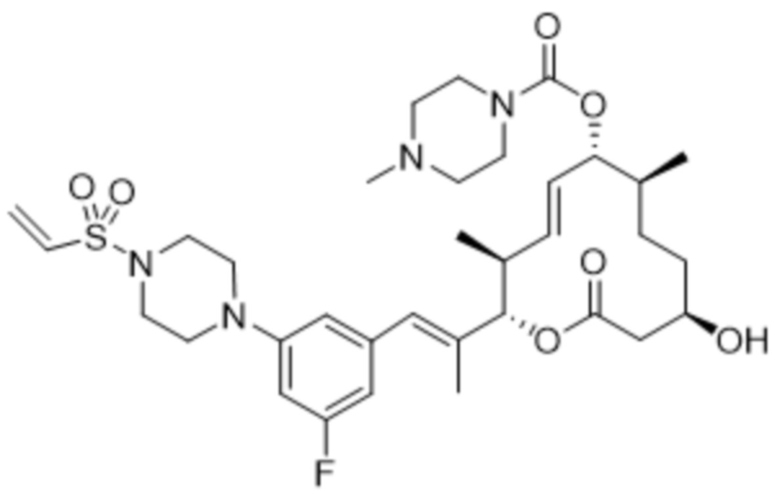
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-(4-этенилсульфонилпиперазин-1-ил)-5-фторфенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилат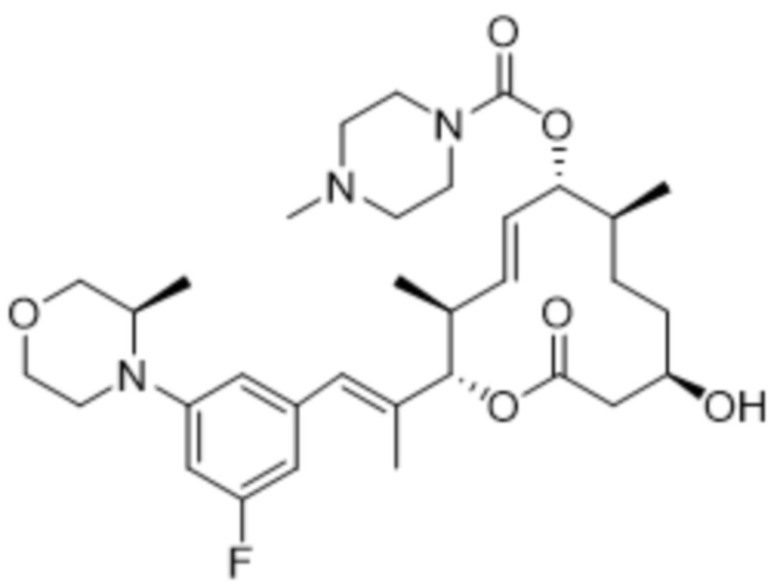
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-Фтор-5-[(3R)-3-метилморфолин-4-ил]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилат
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-Фтор-5-[(2R)-2-(гидроксиметил)морфолин-4-ил]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилат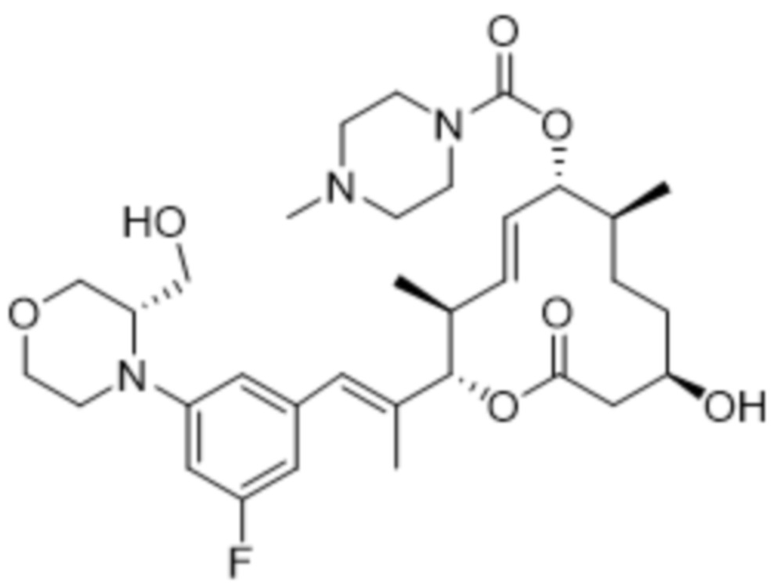
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-Фтор-5-[(3S)-3-(гидроксиметил)морфолин-4-ил]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилат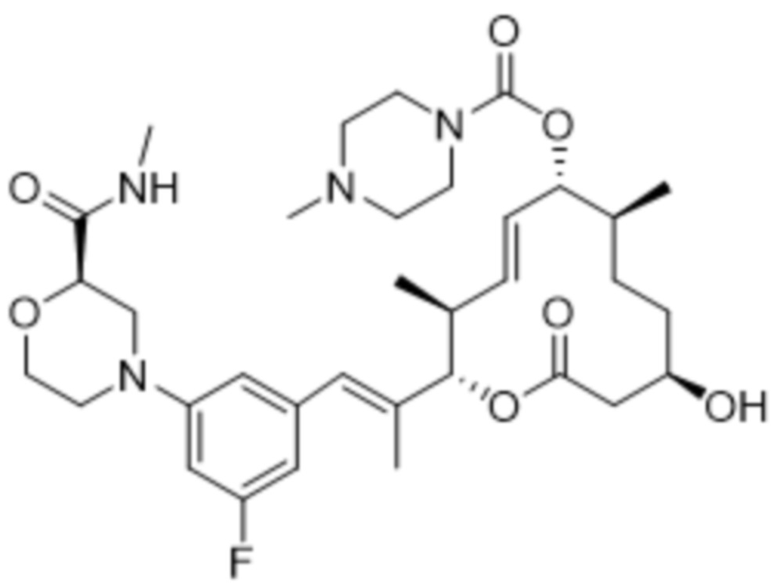
[(2S,3S,4E,6R,7R,10S)-2-[(E)-1-[3-Фтор-5-[(2R)-2-(метилкарбамоил)морфолин-4-ил]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилат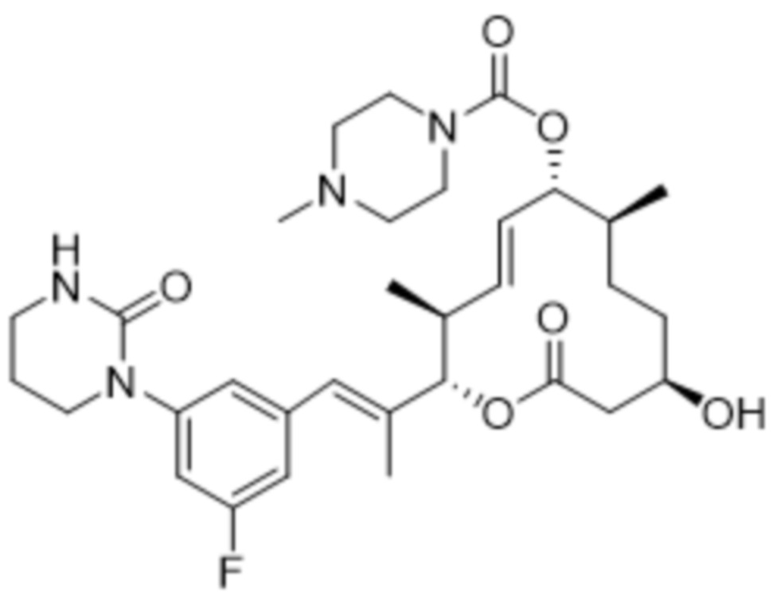
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-Фтор-5-(2-оксо-1,3-диазинан-1-ил)фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилат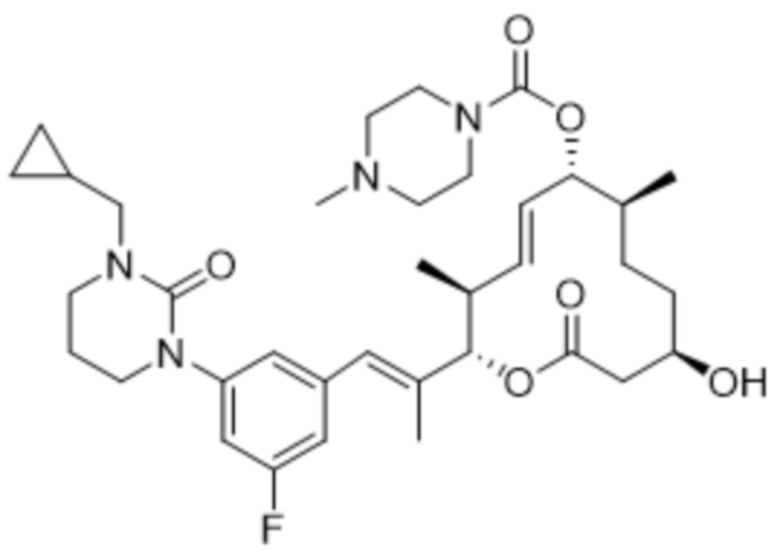
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-[3-(Циклопропилметил)-2-оксо-1,3-диазинан-1-ил]-5-фторфенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилат
[(2S,3S,4E,6R,7R,10S)-2-[(E)-1-[3-Фтор-5-[4-[(2R)-2-гидроксипропаноил]пиперазин-1-ил]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилат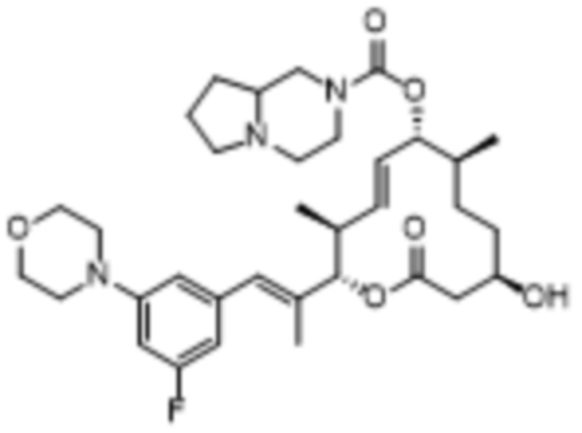
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-(3-Фтор-5-морфолин-4-илфенил)проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-3,4,6,7,8,8a-гексагидро-1H-пирроло[1,2-a]пиразин-2-карбоксилат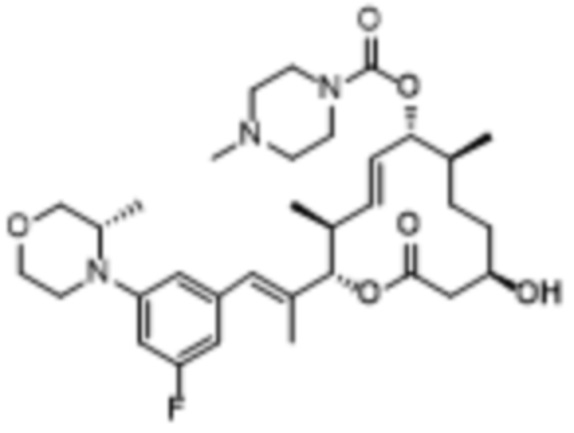
[(2S,3S,4E,6R,7S,10S)-2-[(E)-1-[3-Фтор-5-[(3S)-3-метилморфолин-4-ил]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилат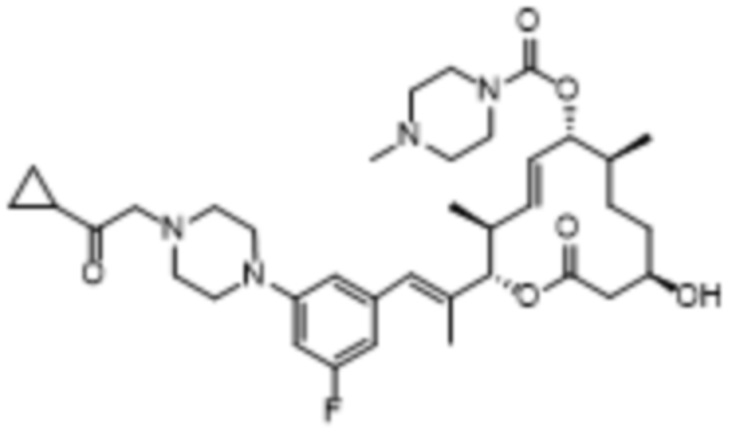
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-[4-(2-Циклопропил-2-оксоэтил)пиперазин-1-ил]-5-фторфенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилат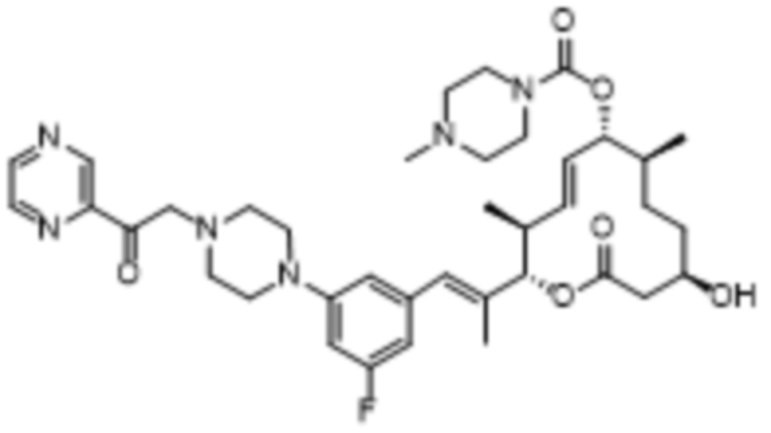
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-Фтор-5-[4-(2-оксо-2-пиразин-2-илэтил)пиперазин-1-ил]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилат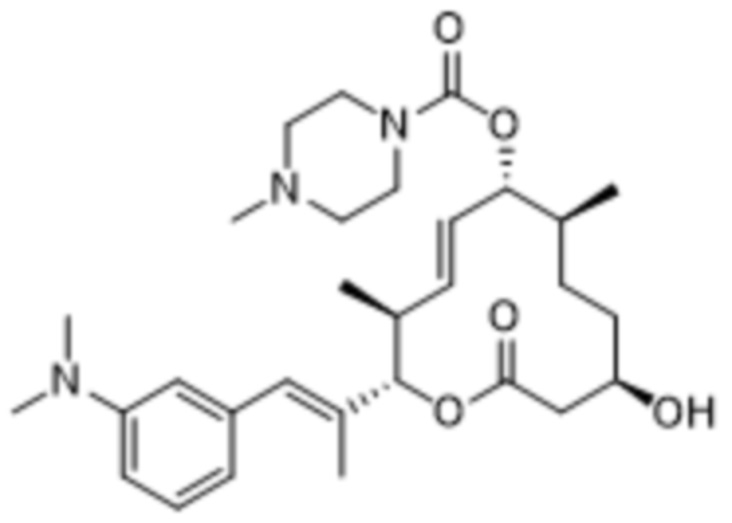
(2S,3S,6R,7S,10R, E)-2-((E)-1-(3-(Диметиламино)фенил)проп-1-ен-2-ил)-10-гидрокси-3,7-диметил-12-оксооксациклододец-4-ен-6-ил-4-метилпиперазин-1-карбоксилат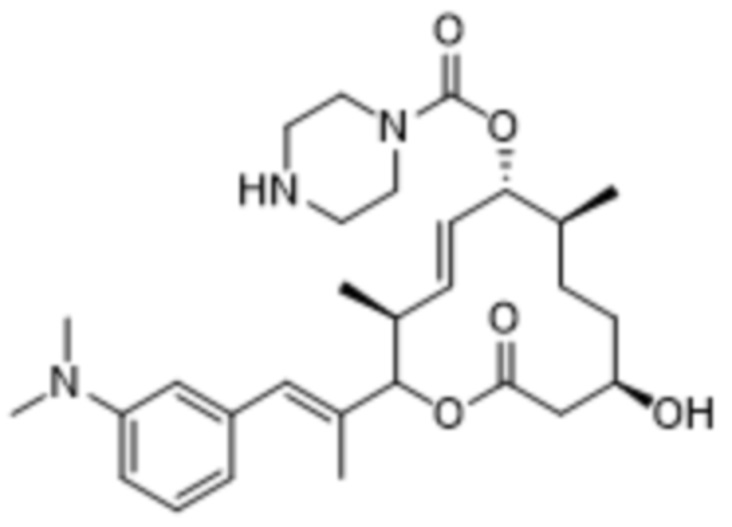
(2S,3S,6R,7S,10R, E)-2-((E)-1-(3-(Диметиламино)фенил)проп-1-ен-2-ил)-10-гидрокси-3,7-диметил-12-оксооксациклододец-4-ен-6-илпиперазин-1-карбоксилат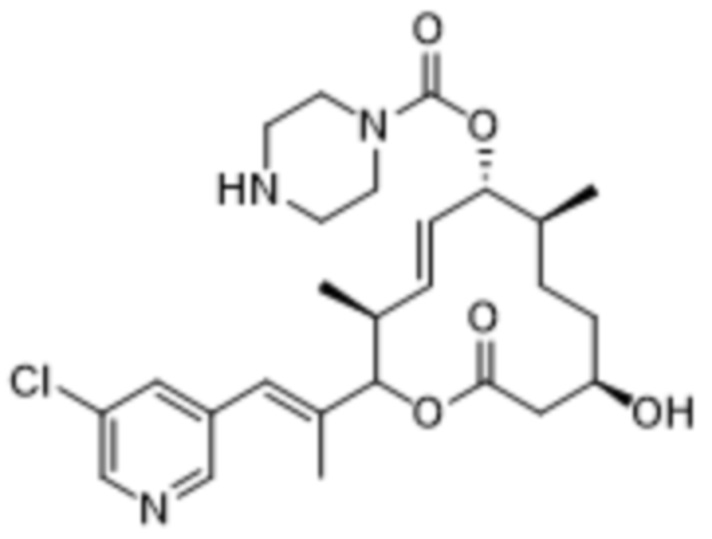
(2S,3S,6R,7S,10R, E)-2-((E)-1-(5-Хлорпиридин-3-ил)проп-1-ен-2-ил)-10-гидрокси-3,7-диметил-12-оксооксациклододец-4-ен-6-илпиперазин-1-карбоксилат
Соединения 86-166 и 264 (таблица 5) получали с помощью следующих процедур 11-19.
Синтез промежуточных соединений на основе индазола
Процедуры 11 и 12 применяли для синтеза промежуточных соединений на основе индазола, характеризующихся следующими общими формулами:
 ,
,  ,
,  и
и  .
.
Процедура 11
В раствор 6-бром-4-фтор-1H-индазола (020, 100 мг, 0,465 ммоль) в THF (3,0 мл, 0,15 М) добавляли карбонат цезия (303 мг, 0,93 ммоль) и (бромметил)циклопропан (021, 126 мг, 0,93 ммоль). При комнатной температуре реакционную смесь перемешивали в течение ночи. Затем реакционную смесь разбавляли с помощью EtOAc (100 мл) и промывали солевым раствором. Объединенный органический слой концентрировали и подвергали ISCO с градиентом от 0 до 30% Hex: EtOAc с получением обоих изомеров, 6-бром-1-(циклопропилметил)-4-фтор-1H-индазола (022, 62 мг, 0,233 ммоль, выход 50%) и 6-бром-2-(циклопропилметил)-4-фтор-1H-индазола (023, 20 мг, 0,078 ммоль, выход 17%), которые собирали.
(022) LCMS (ESI, масса/заряд), 269,0 [M+H]+. 1H ЯМР (400 МГц, CDCl3) δ 0,40-0,50 (m, 2H), 0,57-0,66 (m, 2H), 1,30-1,41 (m, 1H), 1,59 (s, 1H), 4,24 (d, J=6,90 Гц, 2H), 6,96 (dd, J=9,16, 1,25 Гц, 1H), 7,43 (t, J=1,07 Гц, 1H), 8,04 (d, J=0,75 Гц, 1H).
(023) LCMS (ESI, масса/заряд), 269,0 [M+H]+. 1H ЯМР (400 МГц, CDCl3) δ 0,45-0,56 (m, 2H), 0,71-0,80 (m, 2H), 1,38-1,60 (m, 1H), 4,29 (d, J=7,15 Гц, 2H), 6,87 (dd, J=9,54, 1,25 Гц, 1H), 7,70 (t, J=1,13 Гц, 1H), 8,12 (s, 1H).
Процедура 12
Стадия 1. В раствор 6-бром-1H-индазола (024, 900 мг, 3,688 ммоль) в THF (30 мл, 0,12 М) добавляли NaH (66%, 221 мг, 5,532 ммоль). Раствор перемешивали в течение 30 минут, а затем добавляли (бромметил)циклопропан (597 мг, 4,426 ммоль). Полученный раствор перемешивали в атмосфере N2 в течение 12 часов при комнатной температуре. Реакционную смесь разбавляли с помощью EtOAc (200 мл) и промывали солевым раствором. Объединенный органический слой концентрировали и подвергали ISCO с градиентом от 0 до 20% Hex: EtOAc с получением 1-(циклопропилметил)-6-бром-1H-индазола (025, 450 мг, 1,509 ммоль, выход 40,9%).
Стадия 2. В раствор 1-(циклопропилметил)-6-бром-1H-индазола (025, 350 мг, 1,174 ммоль) в ACN (1,5 мл, 0,78 М) при комнатной температуре добавляли уксусную кислоту (200 мкл, 3,5 ммоль) и SELECTFLUOR (832 мг, 2,348 ммоль). Полученный раствор перемешивали в атмосфере N2 в течение 12 часов при 50°C. Затем реакционную смесь разбавляли с помощью EtOAc (100 мл) и промывали солевым раствором. Объединенный органический слой концентрировали и подвергали ISCO с градиентом от 0 до 30% Hex: EtOAc с получением 1-(циклопропилметил)-3-фтор-6-бром-1H-индазола (026, 41 мг, 0,130 ммоль, выход 11,05%).LCMS (ESI, масса/заряд), 269,0 [M+H]+. 1H ЯМР (400 МГц, CDCl3) δ 0,33-0,51 (m, 1H), 0,34-0,39 (m, 2H), 0,45-0,51 (m, 1H), 1,14-1,37 (m, 2H), 1,49 (s, 1H), 4,31 (d, J=7,03 Гц, 2H), 7,16-7,17 (m, 1H), 7,16-7,20 (m, 1H), 7,30 (dd, J=8,41, 4,89 Гц, 1H), 7,89 (d, J=2,26 Гц, 1H).
Процедура 13
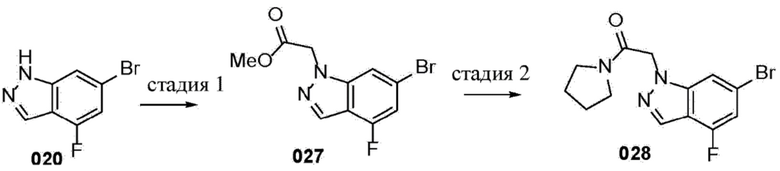
Стадия 1. В раствор 6-бром-4-фтор-1H-индазола (020, 100 мг, 0,465 ммоль) в THF (3,0 мл, 0,15 М) добавляли карбонат цезия (303 мг, 0,93 ммоль) и метил-2-бромацетат (142 мг, 0,93 ммоль). При комнатной температуре реакционную смесь перемешивали в течение ночи. Реакционную смесь разбавляли с помощью EtOAc (100 мл) и промывали солевым раствором. Объединенный органический слой концентрировали и подвергали ISCO с градиентом от 0 до 30% Hex: EtOAc с получением метил-2-(6-бром-4-фтор-1H-индазол-1-ил)ацетата (027, 100 мг, 0,349 ммоль, выход 75%).
Стадия 2. В раствор метил-2-(6-бром-4-фтор-1H-индазол-1-ил)ацетата (027, 13 мг, 0,045 ммоль) в дихлорметане (0,3 мл, 0,15 М) при комнатной температуре добавляли пирролидин (32,2 мг, 0,453 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение ночи. С помощью LCMS показывали полное прохождение реакции. Реакционную смесь разбавляли с помощью EtOAc (100 мл) и промывали солевым раствором. Объединенный органический слой концентрировали и подвергали ISCO с градиентом от 0 до 30% Hex: EtOAc с получением 2-(6-бром-4-фтор-1H-индазол-1-ил)-1-(пирролидин-1-ил)этанона (028, 10 мг, 0,031 ммоль, выход 67,7%).
Синтез промежуточных соединений на основе бензотриазола
Процедуры 14 и 15 применяли для синтеза промежуточных соединений на основе бензотриазола, характеризующихся следующими общими формулами:
 ,
,  ,
,  и
и  .
.
Процедура 14

В раствор 6-бром-4-фтор-1H-бензо[d][1,2,3]триазола (029, 100 мг, 0,463 ммоль) в THF (3,0 мл, 0,15 М) добавляли карбонат цезия (303 мг, 0,93 ммоль) и (бромметил)циклопропан (021, 187 мг, 0,93 ммоль). При комнатной температуре реакционную смесь перемешивали в течение ночи. Реакционную смесь разбавляли с помощью EtOAc (100 мл) и промывали солевым раствором. Объединенный органический слой концентрировали и подвергали ISCO с градиентом от 0 до 30% Hex: EtOAc с получением 5-бром-1-(циклопропилметил)-7-фтор-1H-бензо[d][1,2,3]триазола (030, 40 мг, 0,148 ммоль, выход 32%), 6-бром-2-(циклопропилметил)-4-фтор-2H-бензо[d][1,2,3]триазола (031, 20 мг, 0,074 ммоль, выход 16%) и 6-бром-1-(циклопропилметил)-4-фтор-1H-бензо[d][1,2,3]триазола (032, 16 мг, 0,059 ммоль, выход 12%). (030) LCMS (ESI, масса/заряд), 270,0 [M+H]+. 1H ЯМР (400 МГц, CDCl3) δ 0,38-0,61 (m, 4H), 1,31-1,45 (m, 1H), 4,53 (d, J=7,28 Гц, 2H), 7,18-7,27 (m, 1H), 7,95 (d, J=1,38 Гц, 1H). (031) LCMS (ESI, масса/заряд), 270,0 [M+H]+. 1H ЯМР (400 МГц, CDCl3) δ 0,40-0,51 (m, 2H), 0,55-0,67 (m, 2H), 1,48 (quint, J=7,72, 7,72, 7,72, 7,72, 4,77, 4,77 Гц, 1H), 4,49 (d, J=7,40 Гц, 2H), 7,08 (dd, J=9,54, 1,38 Гц, 1H), 7,77 (d, J=1,38 Гц, 1H). (032) LCMS (ESI, масса/заряд), 270,0 [M+H]+. 1H ЯМР (400 МГц, CDCl3) δ 0,45-0,57 (m, 2H), 0,64-0,76 (m, 2H), 1,35-1,46 (m, 1H), 4,49 (d, J=7,15 Гц, 2H), 7,19 (dd, J=9,22, 1,32 Гц, 1H), 7,58 (d, J=1,38 Гц, 1H).
Процедура 15
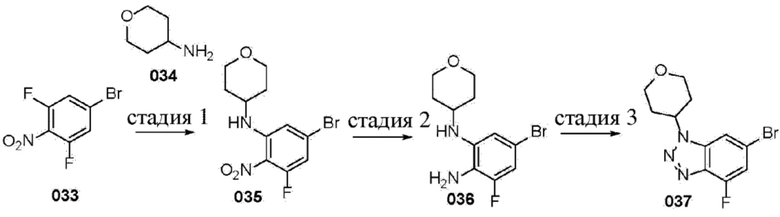
Стадия 1. В раствор 5-бром-1,3-дифтор-2-нитробензола (033, 500 мг, 2,101 ммоль) в THF (10 мл, 0,2 М) при к. т. добавляли тетрагидро-2H-пиран-4-амин (034, 202 мг, 1,996 ммоль) и триэтиламин (0,359 мл, 2,521 ммоль). Реакционную смесь перемешивали при 80°C в течение 4 ч. Реакционную смесь концентрировали и подвергали ISCO с градиентом от 0 до 20% Hex:EtOAc с получением N-(5-бром-3-фтор-2-нитрофенил)тетрагидро-2H-пиран-4-амина (035, 540 мг, 1,692 ммоль, выход 81%).
Стадия 2. В раствор N-(5-бром-3-фтор-2-нитрофенил)тетрагидро-2H-пиран-4-амина (035, 80 мг, 0,251 ммоль) в HCl (1 М) MeOH (2,5 мл) добавляли железо (280 мг, 5,014 ммоль). В атмосфере N2 реакционную смесь перемешивали при комнатной температуре в течение 2 часов. С помощью LCMS показывали полное прохождение реакции. Фильтровали через слой силикагеля, затем выпаривали растворитель. Реакционную смесь повторно растворяли в EtOAc (50 мл) и снова фильтровали через слой силикагеля. Неочищенный продукт 5-бром-3-фтор-N1-(тетрагидро-2H-пиран-4-ил)бензол-1,2-диамин (036, 60 мг, 0,208 ммоль, выход 83%) применяли непосредственно на следующей стадии.
Стадия 3. В раствор 5-бром-3-фтор-N1-(тетрагидро-2H-пиран-4-ил)бензол-1,2-диамина (036, 60 мг, 0,208 ммоль) в уксусной кислоте (1 мл, 0,2 М) при комнатной температуре добавляли нитрит натрия (35,8 мг, 0,519 ммоль). Реакционную смесь перемешивали при 60°C в течение 2 ч. С помощью LC/MS демонстрировали завершение реакции. Реакционную смесь вакуумировали и повторно суспендировали в EtOAc (50 мл), затем промывали солевым раствором. Реакционную смесь концентрировали и подвергали ISCO с градиентом от 0 до 40% Hex: EtOAc с получением 6-бром-4-фтор-1-(тетрагидро-2H-пиран-4-ил)-1H-бензо[d][1,2,3]триазола (037, 42 мг, 0,140 ммоль, выход 67,4%). LCMS (ESI, масса/заряд), 300,3 [M+H]+. 1H ЯМР (400 МГц, CDCl3) δ 2,06-2,13 (m, 2H), 2,42 (qd, J=12,09, 4,39 Гц, 2H), 3,57 (td, J=11,92, 2,01 Гц, 2H), 4,06-4,16 (m, 2H), 4,97 (tt, J=11,50, 4,19 Гц, 1H), 7,19-7,27 (m, 1H), 7,96 (d, J=1,38 Гц, 1H).
Синтез промежуточных соединений на основе бензимидазола
Процедуру 16 применяли для синтеза промежуточных соединений на основе бензотриазола, характеризующихся следующей общей формулой.
Процедура 16
В раствор (1r,4r)-4-((2-амино-5-бром-3-фторфенил)амино)циклогексанола (038, 100 мг, 0,33 ммоль) в муравьиной кислоте (3 мл, 0,11 М) при комнатной температуре добавляли несколько капель концентрированной HCl. Реакционную смесь перемешивали при 60°C в течение 2 ч. С помощью LC/MS демонстрировали завершение реакции. Реакционную смесь вакуумировали и повторно суспендировали в EtOAc (50 мл), затем промывали солевым раствором. Реакционную смесь концентрировали и подвергали ISCO с градиентом от 0 до 10% DCM: MeOH с получением (1r,4r)-4-(6-бром-4-фтор-1H-бензо[d]имидазол-1-ил)циклогексанола (039, 80 мг, 0,256 ммоль, выход 79%). LCMS (ESI, масса/заряд), 313,3 [M+H]+. 1H ЯМР (400 МГц, CDCl3) δ 1,55-1,67 (m, 2H), 1,84-1,99 (m, 2H), 2,20-2,30 (m, 4H), 3,84 (tt, J=10,89, 4,05 Гц, 1H), 4,10-4,22 (m, 1H), 7,15 (dd, J=9,66, 1,51 Гц, 1H), 7,39 (d, J=1,51 Гц, 1H).
Синтез промежуточных соединений на основе фенилпиперазина
Процедуру 17 применяли для синтеза промежуточных соединений на основе фенилпиперазина, характеризующихся следующей общей формулой.
Процедура 17
Стадия 1. В раствор 1-бром-3,5-дифторбензола (040, 218 мг, 1,13 ммоль) в DMSO (5,0 мл, 0,23 М) добавляли K2CO3 (187 мг, 1,356 ммоль) и пиперазин (041, 146 мг, 1,694 ммоль). Реакционную смесь нагревали до 140°C в закрытой пробирке в течение 24 ч. Реакционную смесь охлаждали и разбавляли с помощью EtOAc (200 мл), затем промывали солевым раствором и высушивали с помощью Na2SO4. Органический слой концентрировали и подвергали ISCO с градиентом от 0 до 30% DCM: MeOH с получением 1-(3-бром-5-фторфенил)пиперазина (042, 234 мг, 0,903 ммоль, выход 80%).
Стадия 2. В раствор 1-(3-бром-5-фторфенил)пиперазина (042, 45 мг, 0,174 ммоль) и 2-(1H-пиразол-1-ил)уксусной кислоты (043, 32,9 мг, 0,26 ммоль) в DMSO (1 мл, 0,17 М) при комнатной температуре добавляли HBTU (231 мг, 0,608 ммоль) и TEA (0,087 мл, 0,608 ммоль). Реакционную смесь перемешивали в течение ночи. Реакционную смесь разбавляли с помощью EtOAc (50 мл) и промывали солевым раствором. Объединенный органический слой концентрировали и подвергали ISCO с градиентом от 0 до 10% DCM:MeOH с получением 1-(4-(3-бром-5-фторфенил)пиперазин-1-ил)-2-(1H-пиразол-1-ил)этанона (044, 60 мг, 0,163 ммоль, выход 94%). LCMS (ESI, масса/заряд), 367,0 [M+H]+. 1H ЯМР (400 МГц, CDCl3) δ 2,80 (s, 2H), 3,08-3,21 (m, 4H), 3,64-3,80 (m, 4H), 5,05 (s, 2H), 6,27-6,40 (m, 1H), 6,43-6,540 (m, 1H), 6,69-6,82 (m, 2H), 7,45-7,63 (m, 2H).
Процедура 18

В раствор 1-(3-бром-5-фторфенил)пиперазина (042, 40 мг, 0,154 ммоль) в DCM (1,5 мл, 0,1 ммоль) при комнатной температуре добавляли TEA (31,2 мг, 0,309 ммоль) и и оксетан-3-сульфонилхлорид (045, 25 мг, 0,15 ммоль) и перемешивали в течение 5 мин. Затем добавляли DMAP (0,943 мг, 7,718 мкмоль). Реакционную смесь перемешивали в течение 4 ч. Разбавляли реакционную смесь в DCM (50 мл) и промывали солевым раствором. Объединенный органический слой концентрировали и подвергали ISCO с градиентом от 0 до 100% Hex: EtOAc с получением 1-(3-бром-5-фторфенил)-4-(оксетан-3-илсульфонил)пиперазина (046, 40 мг, 0,11 ммоль, выход 68,3%).
Синтез продуктов боронатного сочетания
Процедура 19

Стадия 1. В раствор (2S,3S,6R,7S,10R, E)-10-гидрокси-2-((E)-1-йодпроп-1-ен-2-ил)-3,7-диметил-12-оксооксациклододец-4-ен-6-ил-4-метилпиперазин-1-карбоксилата (008, 500 мг, 0,936 ммоль) в DMSO (9,0 мл, 0,1 М) добавляли Pd(0) (108 мг, 0,094 ммоль), 4,4,4',4',5,5,5',5'-октаметил-2,2'-би(1,3,2-диоксаборолан) (475 мг, 1,871 ммоль) и ацетат калия (184 мг, 1,871 ммоль). Реакционную смесь продували с помощью N2, после чего нагревали до не более 80°C и перемешивали в течение 30 мин. Реакционную смесь охлаждали до комнатной температуры и добавляли H2O (50 мл). Реакционную смесь экстрагировали с помощью EtOAc (4 × 100 мл). Объединенные органические экстракты высушивали над MgSO4, фильтровали и концентрировали в вакууме. Неочищенную реакционную смесь подвергали ISCO с элюированием от 0 до 10% DCM:MeOH с получением (2S,3S,6R,7S,10R, E)-10-гидрокси-3,7-диметил-12-оксо-2-((E)-1-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)проп-1-ен-2-ил)оксациклододец-4-ен-6-ил-4-метилпиперазин-1-карбоксилата (бороната 1, 360 мг, 0,674 ммоль, выход 72,0%) в виде желтоватого твердого вещества. LCMS (ESI, масса/заряд), 536,4 [M+H]+. 1H ЯМР (400 МГц, CDCl3) δ ppm 0,87-1,08 (m, 6H), 1,19-1,35 (m, 3H), 1,28 (s, 12H), 1,42-1,55 (m, 1H), 1,73-1,85 (m, 1H), 1,88-1,96 (m, 1H), 1,98 (s, 3H), 2,31 (s, 3H), 2,35-2,49 (m, 5H), 2,50-2,65 (m, 2H), 3,39-3,58 (m, 4H), 3,66-3,77 (m, 1H), 4,87 (t, J=10,10 Гц, 1H), 5,14 (d, J=10,54 Гц, 1H), 5,33-5,47 (m, 2H), 5,56 (dd, J=15,00, 9,98 Гц, 1H).
Стадия 2. В раствор (2S,3S,6R,7S,10R, E)-10-гидрокси-3,7-диметил-12-оксо-2-((E)-1-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)проп-1-ен-2-ил)оксациклододец-4-ен-6-ил-4-метилпиперазин-1-карбоксилата (бороната 1, 15 мг, 0,029 ммоль) и арилбромида (047, 0,035 ммоль) добавляли оксид серебра (19 мг, 0,086 ммоль) и Pd(0) (3,3 мг, 0,003 ммоль). Реакционную смесь нагревали до 60°C в течение 5 ч. С помощью LCMS демонстрировали полное превращение бороната. Смесь охлаждали, фильтровали через тонкий слой целита и концентрировали. Неочищенную реакционную смесь подвергали ISCO с элюированием от 0 до 10% DCM:MeOH с получением продукта 010.

[(2S,3S,4E,6S,7R,10R)-2-[(E)-1-(3-Фтор-5-морфолин-4-илфенил)проп-1-ен-2-ил]-7,10-дигидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилат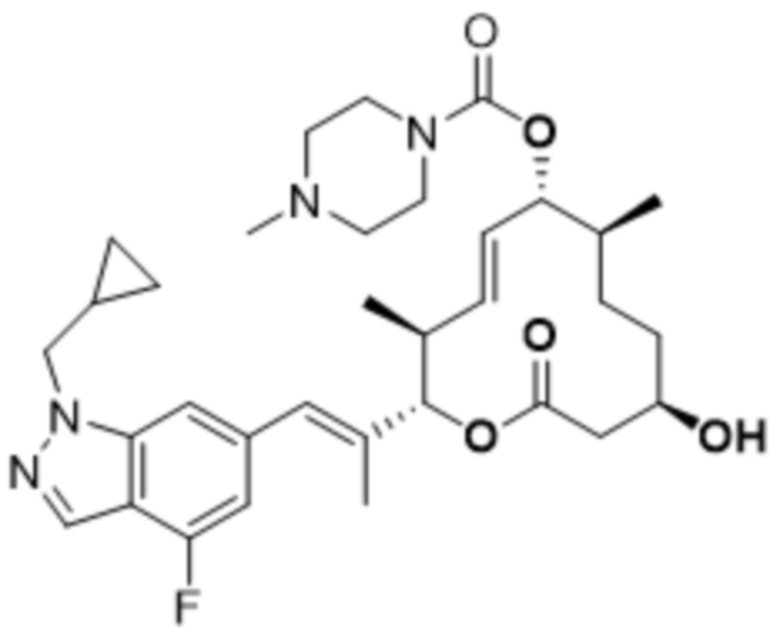
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[1-(Циклопропилметил)-4-фториндазол-6-ил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилат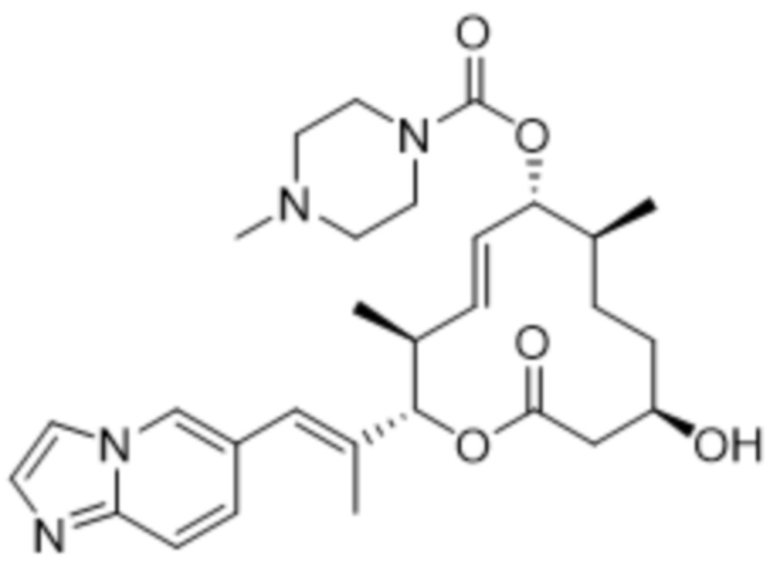
[(2S,3S,4E,6R,7S,10R)-10-Гидрокси-2-[(E)-1-имидазо[1,2-a]пиридин-6-илпроп-1-ен-2-ил]-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилат
[(2S,3S,4E,6R,7S,10R)-10-Гидрокси-3,7-диметил-2-[(E)-1-(7-метил-1H-индазол-4-ил)проп-1-ен-2-ил]-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилат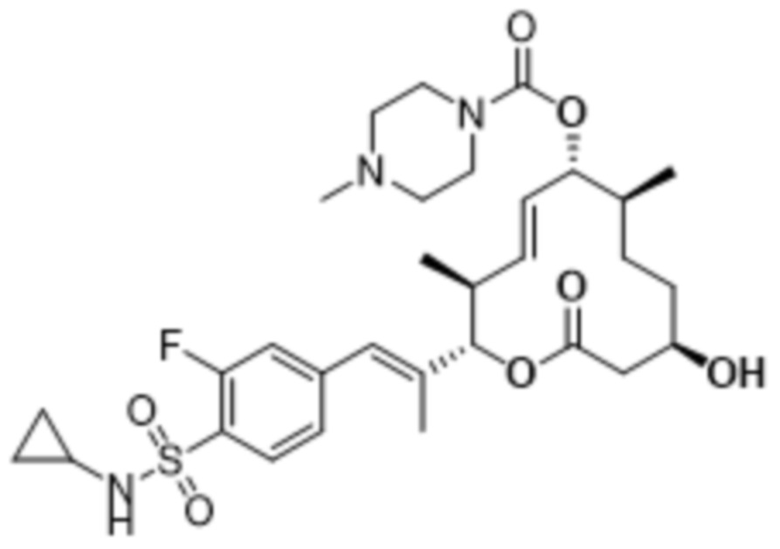
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[4-(Циклопропилсульфамоил)-3-фторфенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилат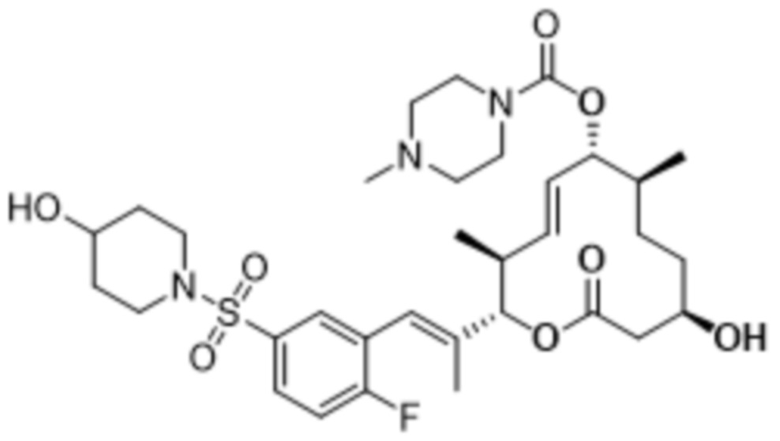
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[2-Фтор-5-(4-гидроксипиперидин-1-ил)сульфонилфенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилат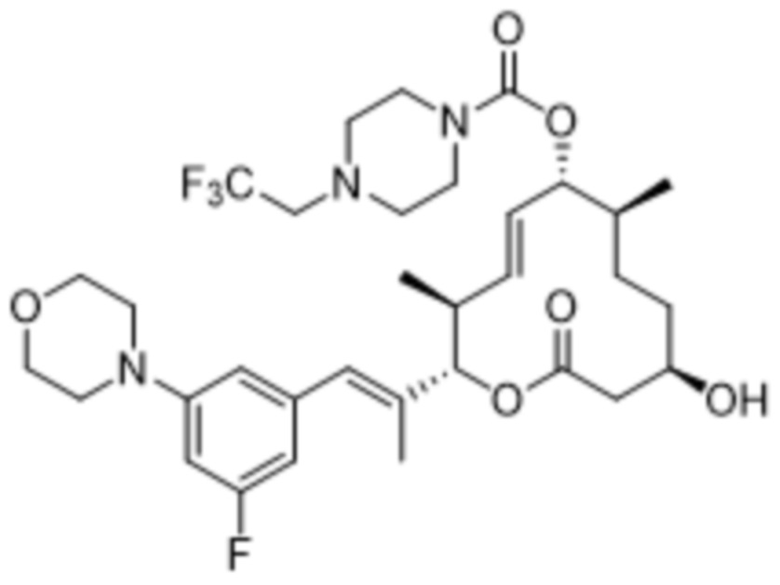
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-(3-Фтор-5-морфолин-4-илфенил)проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-(2,2,2-трифторэтил)пиперазин-1-карбоксилат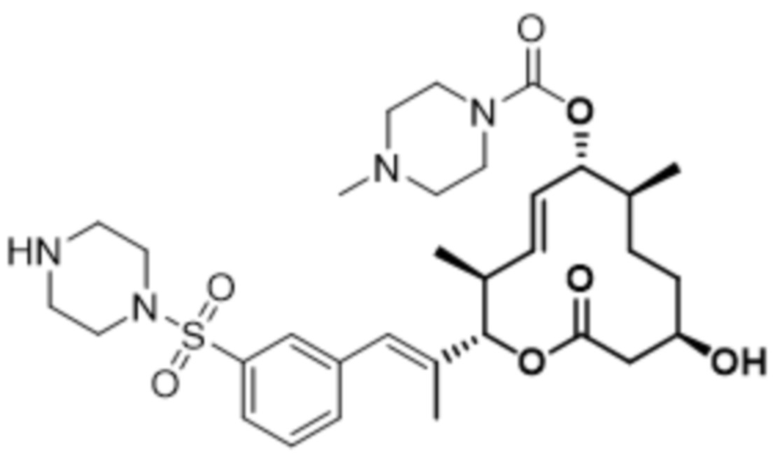
[(2S,3S,4E,6R,7S,10R)-10-Гидрокси-3,7-диметил-12-оксо-2-[(E)-1-(3-пиперазин-1-илсульфонилфенил)проп-1-ен-2-ил]-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилат
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-(4-Формилпиперазин-1-ил)сульфонилфенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилат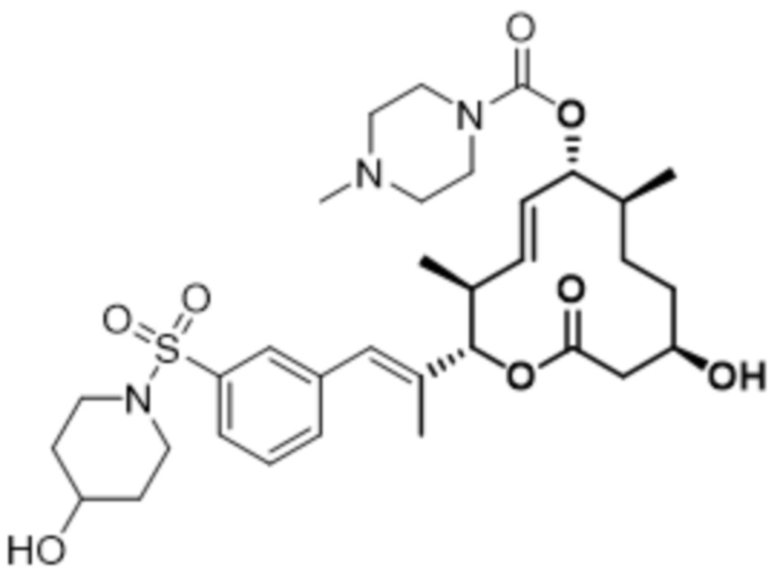
[(2S,3S,4E,6R,7S,10R)-10-Гидрокси-2-[(E)-1-[3-(4-гидроксипиперидин-1-ил)сульфонилфенил]проп-1-ен-2-ил]-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилат
[(2S,3S,4E,6R,7S,10R)-10-Гидрокси-3,7-диметил-2-[(E)-1-(6-метил-1H-индазол-4-ил)проп-1-ен-2-ил]-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилат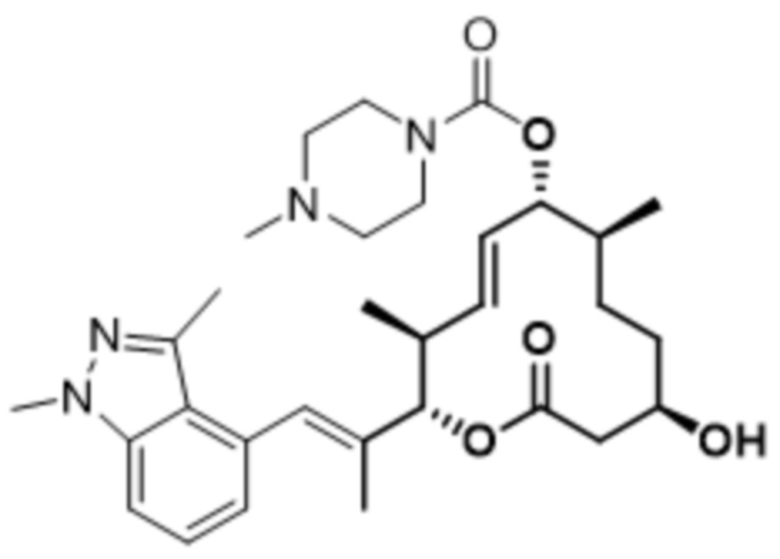
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-(1,3-Диметил-индазол-4-ил)проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилат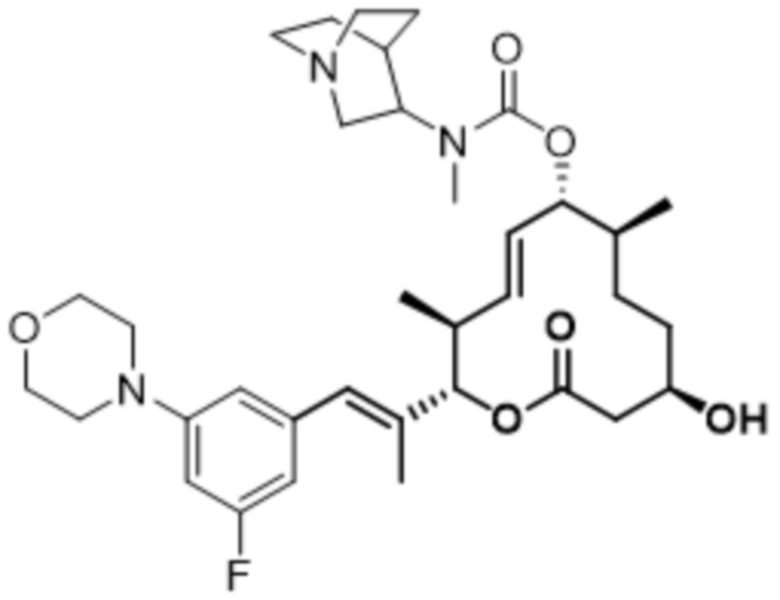
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-(3-Фтор-5-морфолин-4-илфенил)проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-N-(1-азабицикло[2.2.2]октан-3-ил)-N-метилкарбамат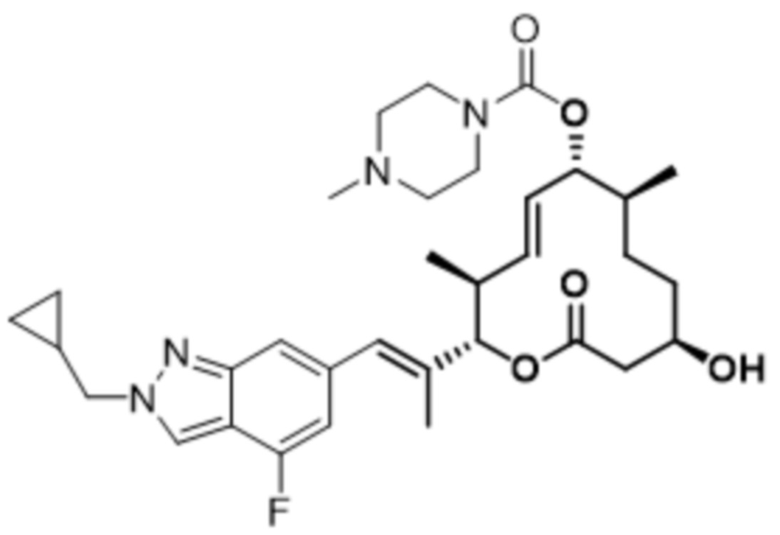
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[2-(Циклопропилметил)-4-фториндазол-6-ил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилат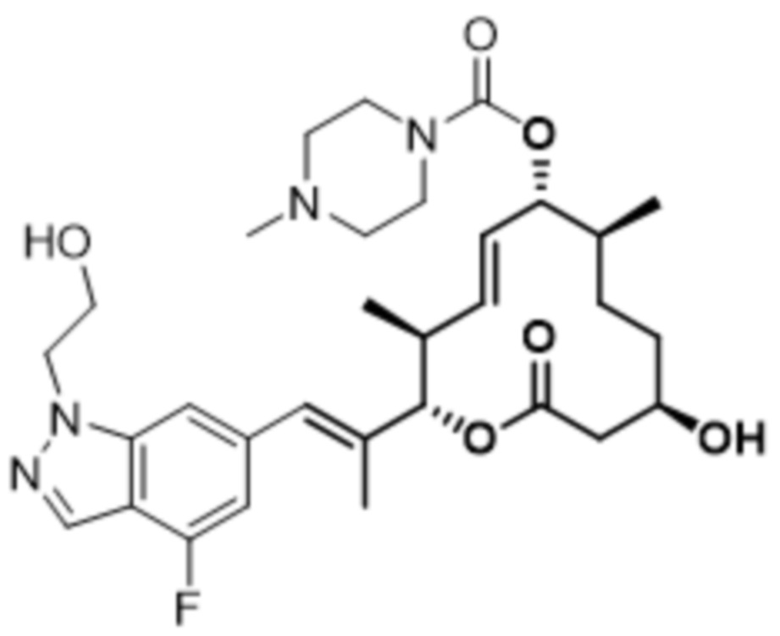
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[4-Фтор-1-(2-гидроксиэтил)индазол-6-ил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилат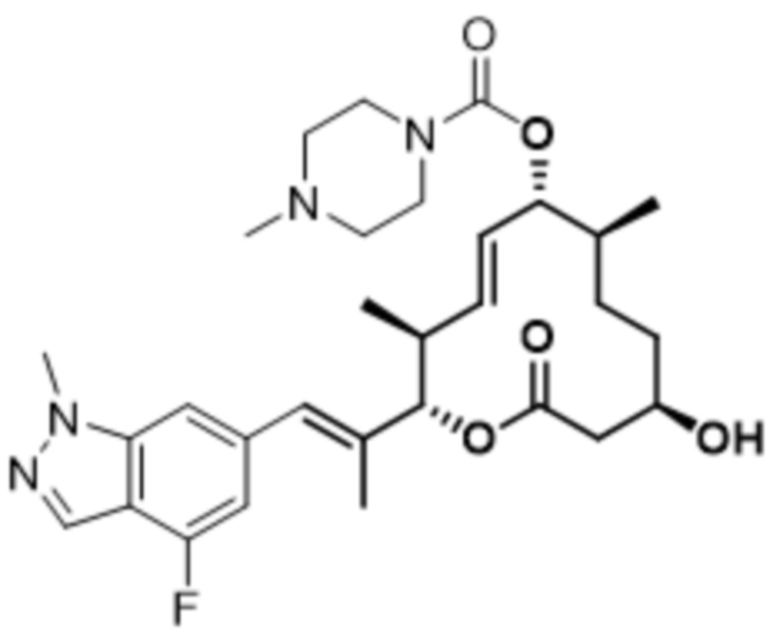
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-(4-Фтор-1-метил-индазол-6-ил)проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилат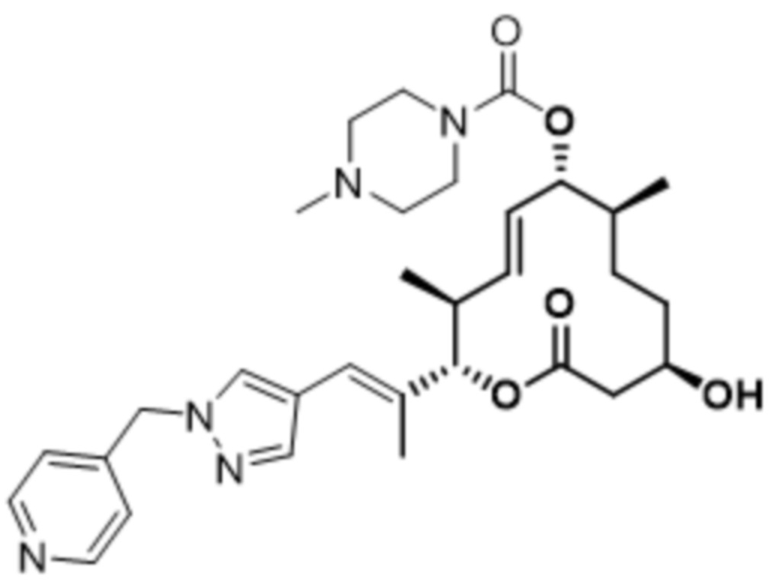
[(2S,3S,4E,6R,7S,10R)-10-Гидрокси-3,7-диметил-12-оксо-2-[(E)-1-[1-(пиридин-4-илметил)пиразол-4-ил]проп-1-ен-2-ил]-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилат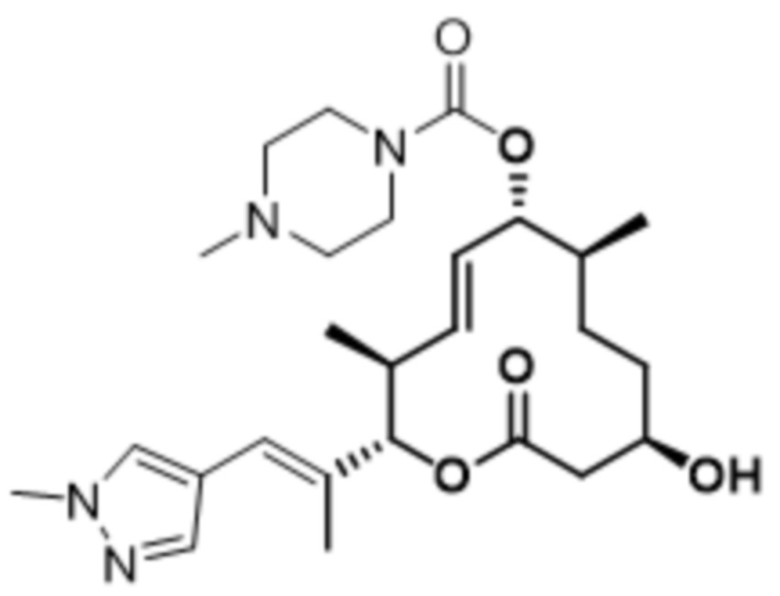
[(2S,3S,4E,6R,7S,10R)-10-Гидрокси-3,7-диметил-2-[(E)-1-(1-метилпиразол-4-ил)проп-1-ен-2-ил]-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилат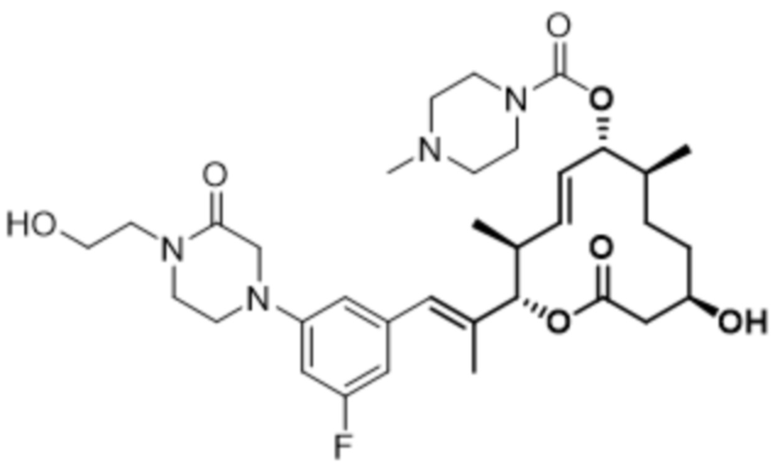
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-Фтор-5-[4-(2-гидроксиэтил)-3-оксопиперазин-1-ил]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилат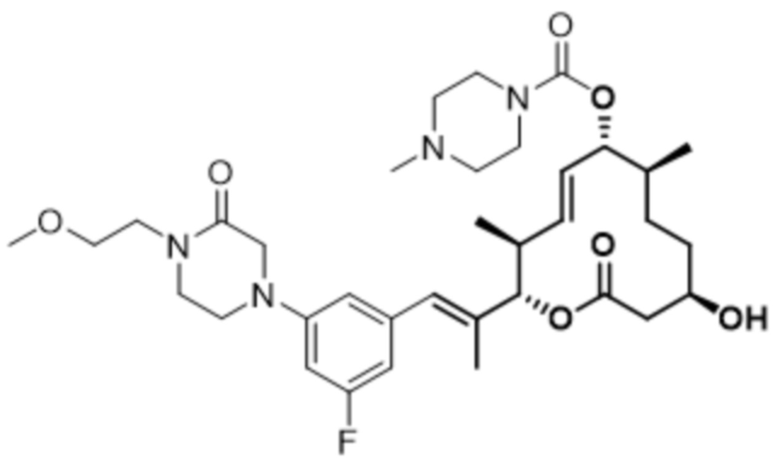
[(2S,3S,4E,6R,7R,10S)-2-[(E)-1-[3-Фтор-5-[4-(2-метоксиэтил)-3-оксопиперазин-1-ил]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилат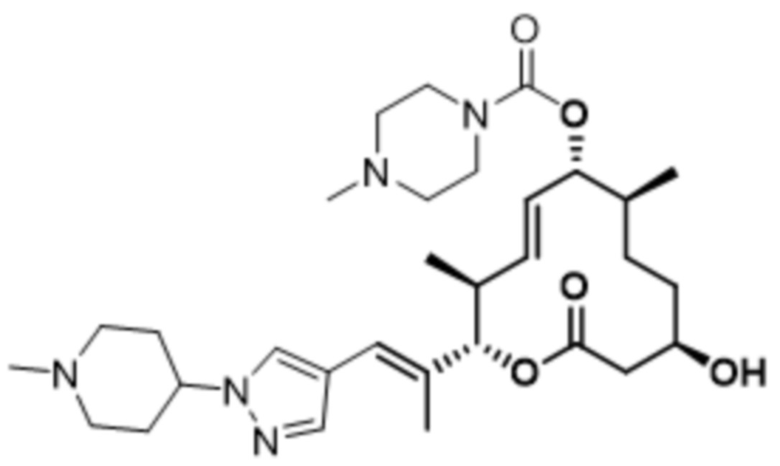
[(2S,3S,4E,6R,7S,10R)-10-Гидрокси-3,7-диметил-2-[(E)-1-[1-(1-метилпиперидин-4-ил)пиразол-4-ил]проп-1-ен-2-ил]-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилат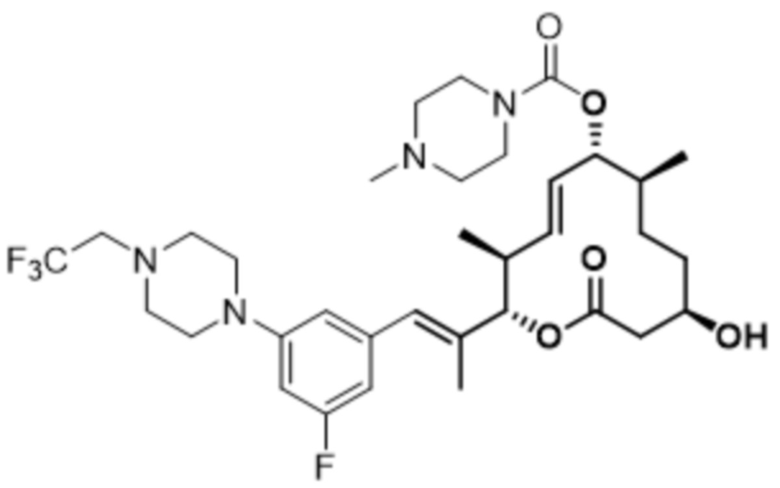
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-Фтор-5-[4-(2,2,2-трифторэтил)пиперазин-1-ил]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилат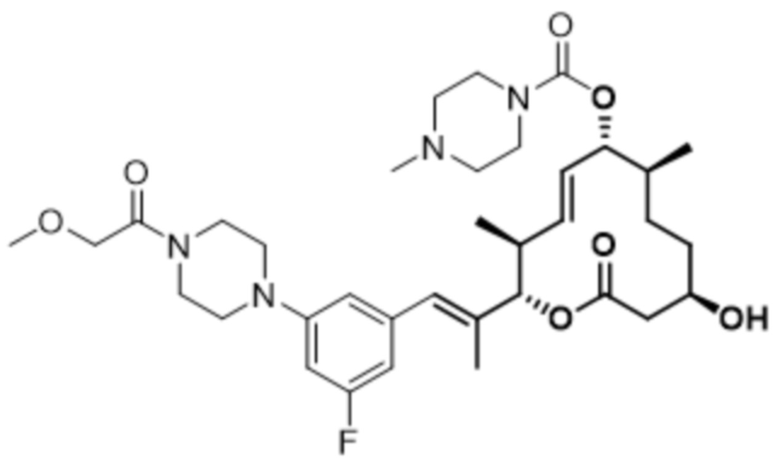
[(2S,3S,4E,6R,7R,10S)-2-[(E)-1-[3-Фтор-5-[4-(2-метоксиацетил)пиперазин-1-ил]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилат
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-[4-(Циклопропанкарбонил)пиперазин-1-ил]-5-фторфенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилат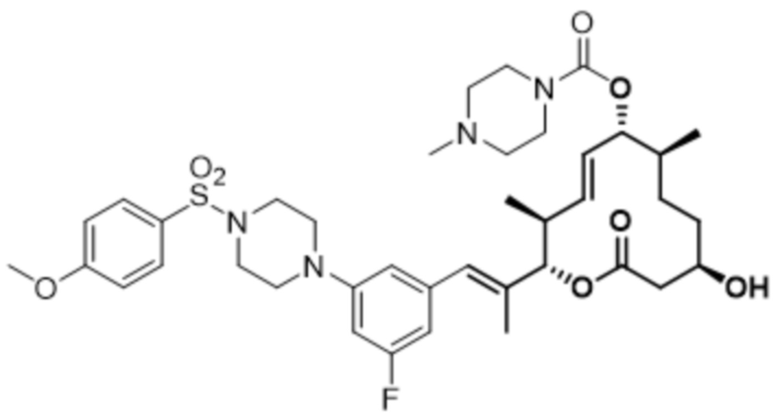
[(2S,3S,4E,6R,7R,10S)-2-[(E)-1-[3-Фтор-5-[4-(4-метоксифенил)сульфонилпиперазин-1-ил]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилат
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-Фтор-5-[4-(1-метилпиразол-4-ил)сульфонилпиперазин-1-ил]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилат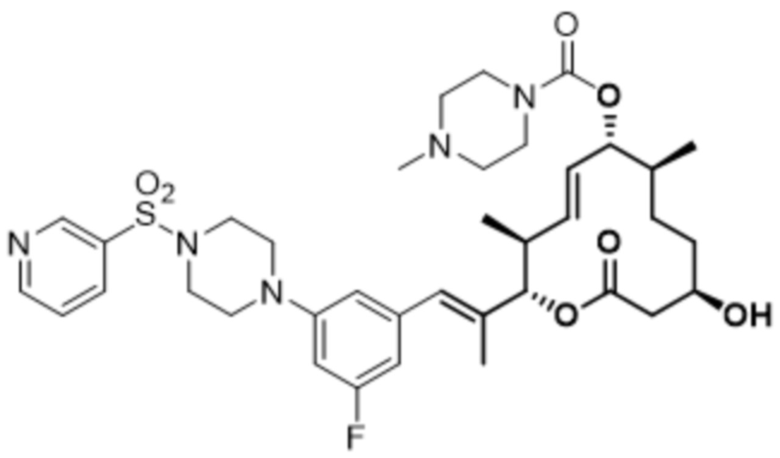
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-Фтор-5-(4-пиридин-3-илсульфонилпиперазин-1-ил)фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилат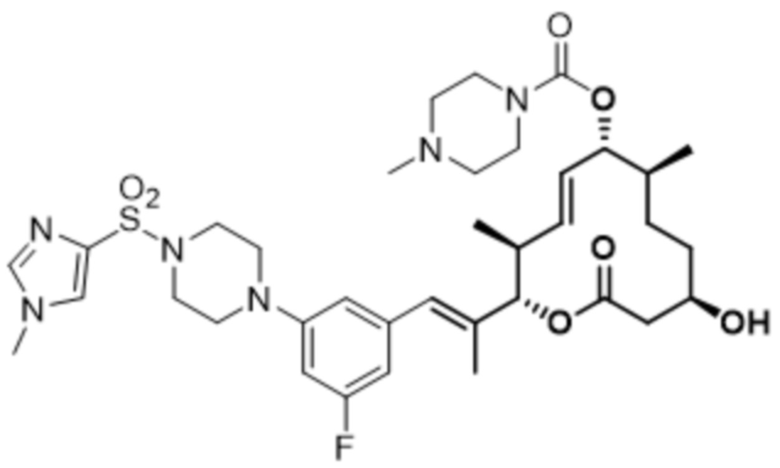
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-Фтор-5-[4-(1-метилимидазол-4-ил)сульфонилпиперазин-1-ил]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилат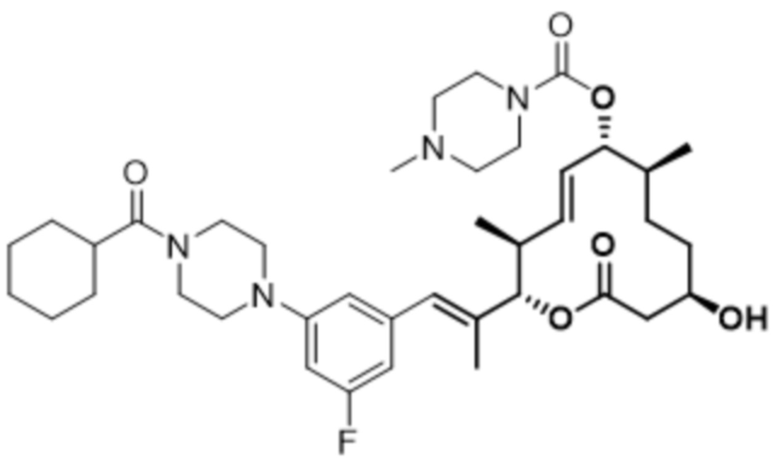
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-[4-(Циклогексанкарбонил)пиперазин-1-ил]-5-фторфенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилат
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-Фтор-5-[4-(1-метилиндол-6-ил)сульфонилпиперазин-1-ил]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилат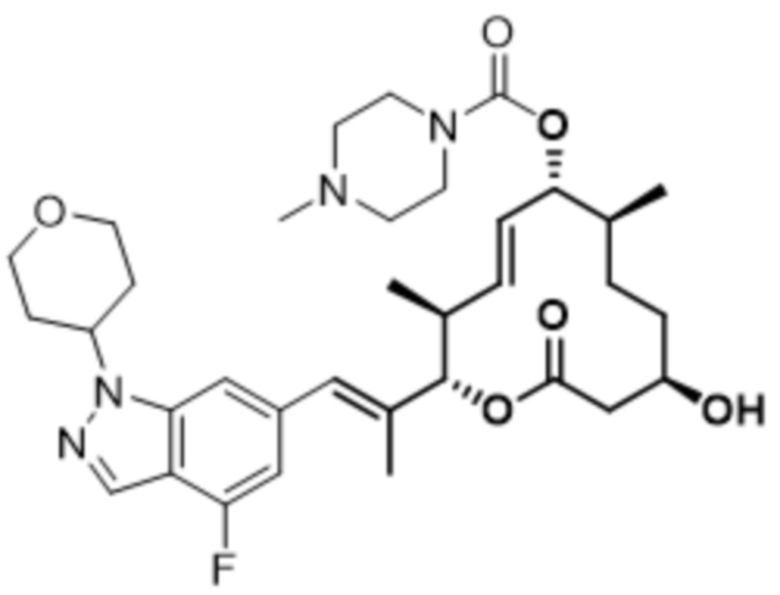
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[4-Фтор-1-(оксан-4-ил)индазол-6-ил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилат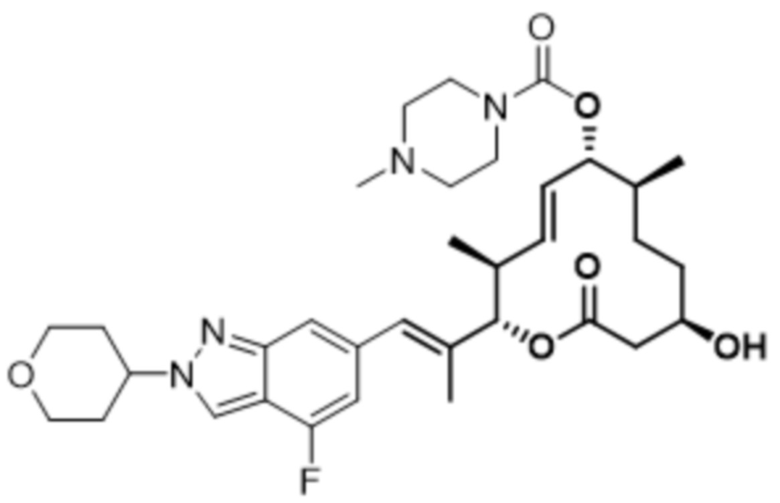
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[4-Фтор-2-(оксан-4-ил)индазол-6-ил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилат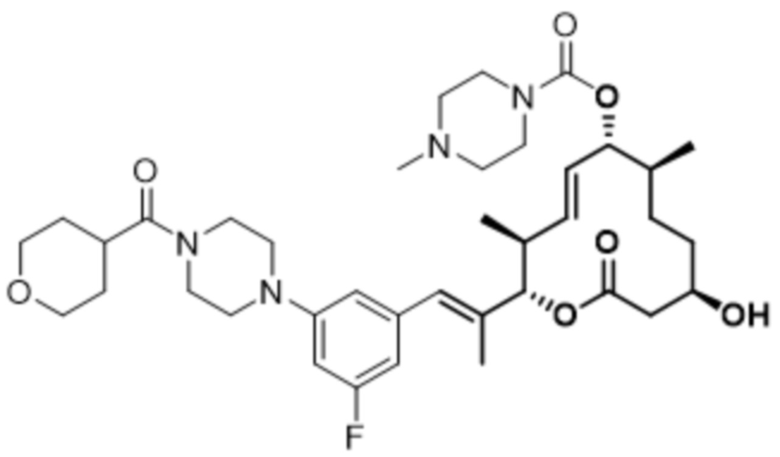
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-Фтор-5-[4-(оксан-4-карбонил)пиперазин-1-ил]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилат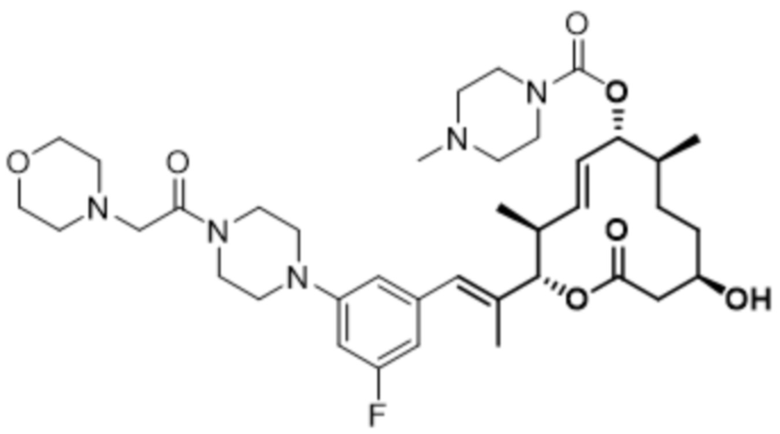
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-Фтор-5-[4-(2-морфолин-4-илацетил)пиперазин-1-ил]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилат
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-Фтор-5-[4-(1-метил-имидазол-4-карбонил)пиперазин-1-ил]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилат
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-[4-(2-Циклопропилацетил)пиперазин-1-ил]-5-фторфенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилат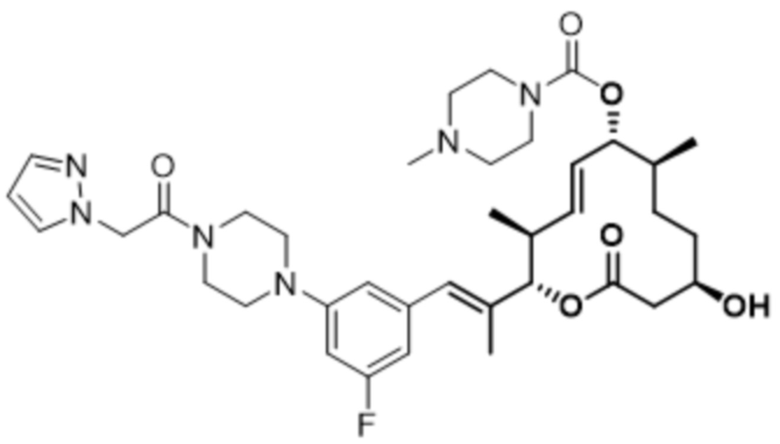
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-Фтор-5-[4-(2-пиразол-1-илацетил)пиперазин-1-ил]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилат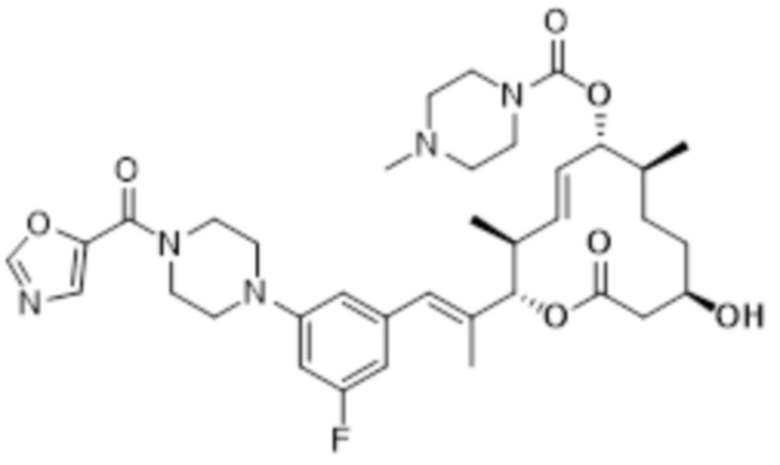
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-Фтор-5-[4-(1,3-оксазол-5-карбонил)пиперазин-1-ил]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилат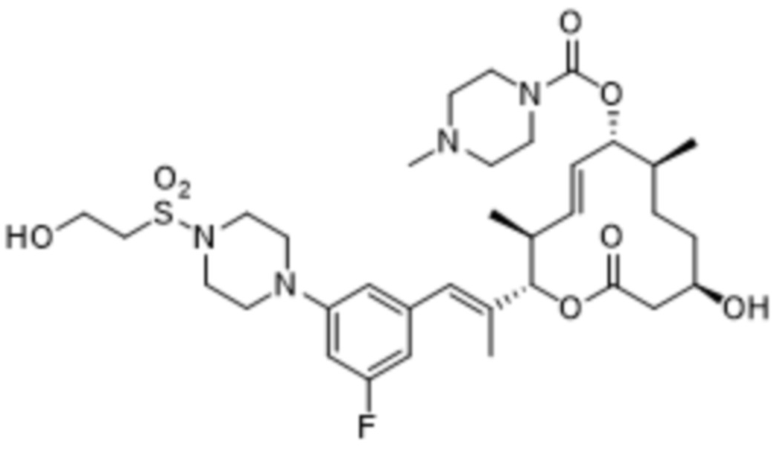
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-Фтор-5-[4-(2-гидроксиэтилсульфонил)пиперазин-1-ил]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилат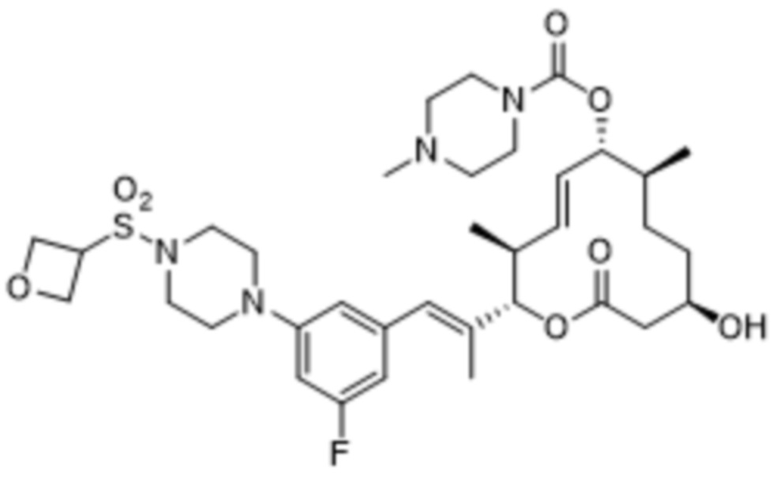
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-Фтор-5-[4-(оксетан-3-илсульфонил)пиперазин-1-ил]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилат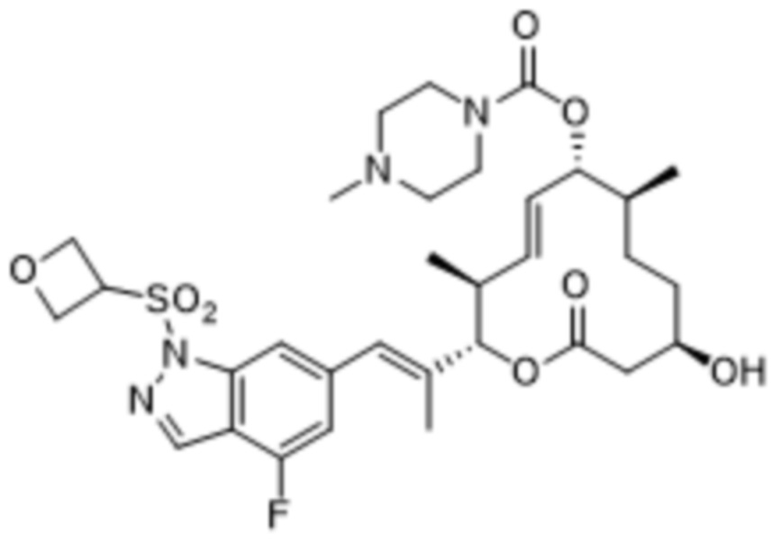
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[4-Фтор-1-(оксетан-3-илсульфонил)индазол-6-ил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилат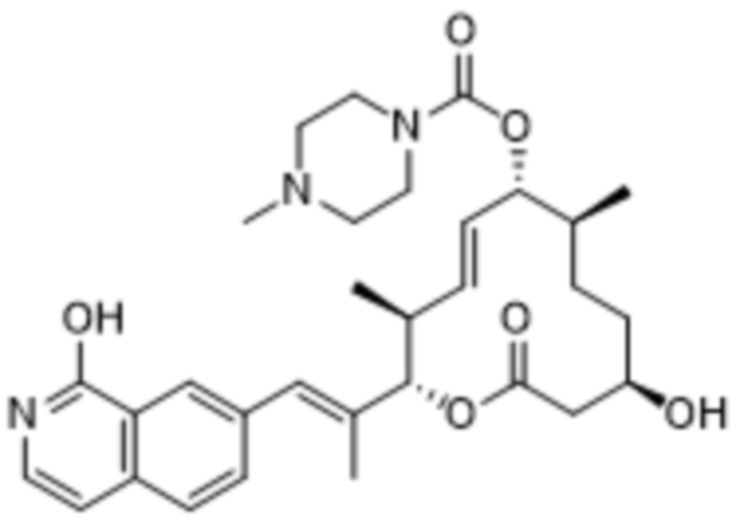
[(2S,3S,4E,6R,7S,10R)-10-Гидрокси-2-[(E)-1-(1-гидроксиизохинолин-7-ил)проп-1-ен-2-ил]-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилат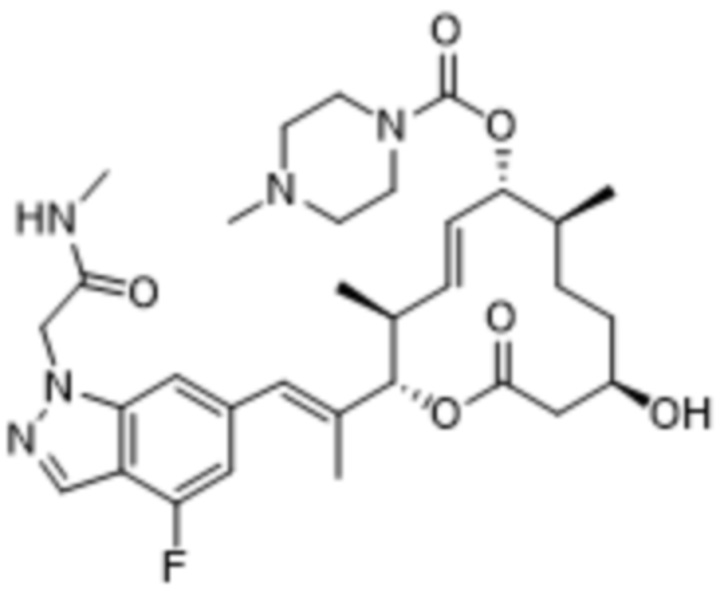
[(2S,3S,4E,6R,7R,10S)-2-[(E)-1-[4-Фтор-1-[2-(метиламино)-2-оксоэтил]индазол-6-ил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилат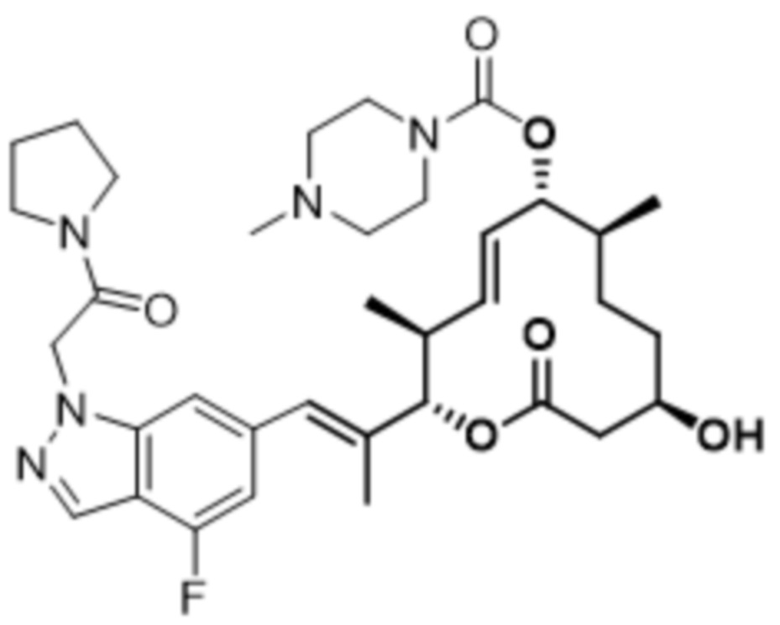
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[4-Фтор-1-(2-оксо-2-пирролидин-1-илэтил)индазол-6-ил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилат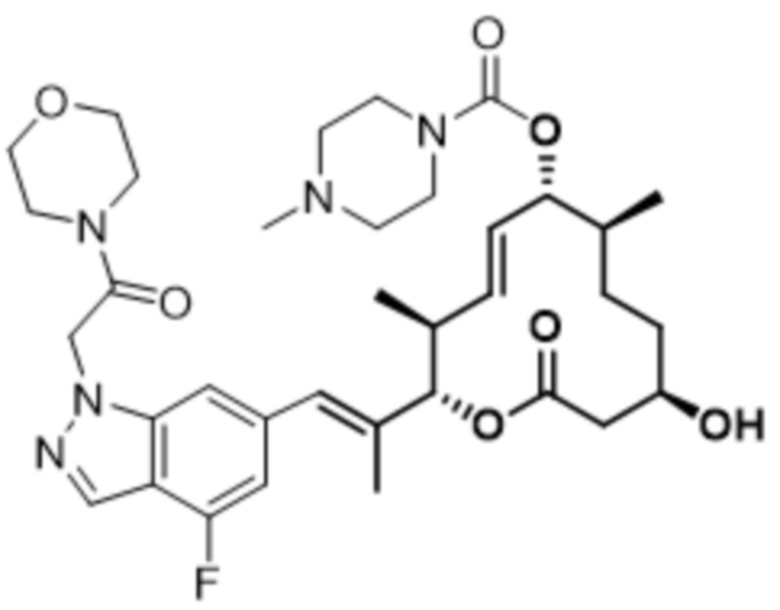
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[4-Фтор-1-(2-морфолин-4-ил-2-оксоэтил)индазол-6-ил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилат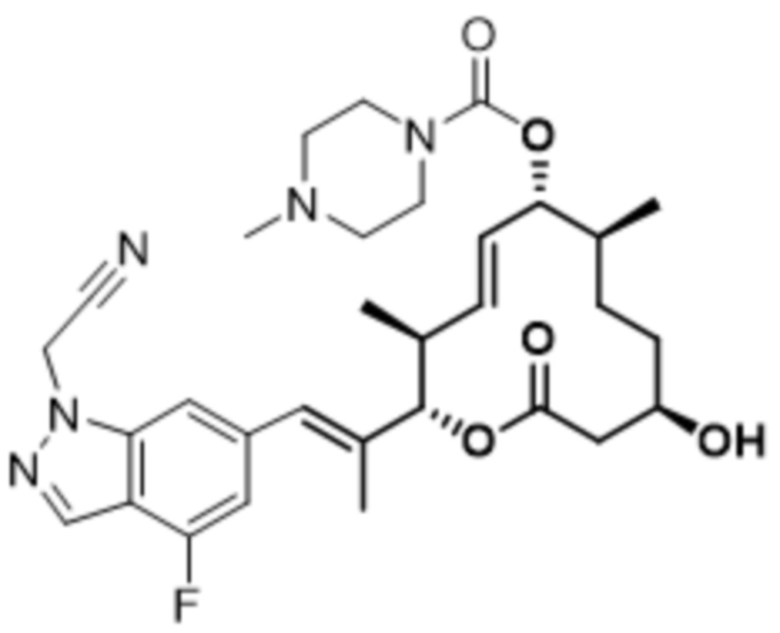
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[1-(Цианометил)-4-фториндазол-6-ил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилат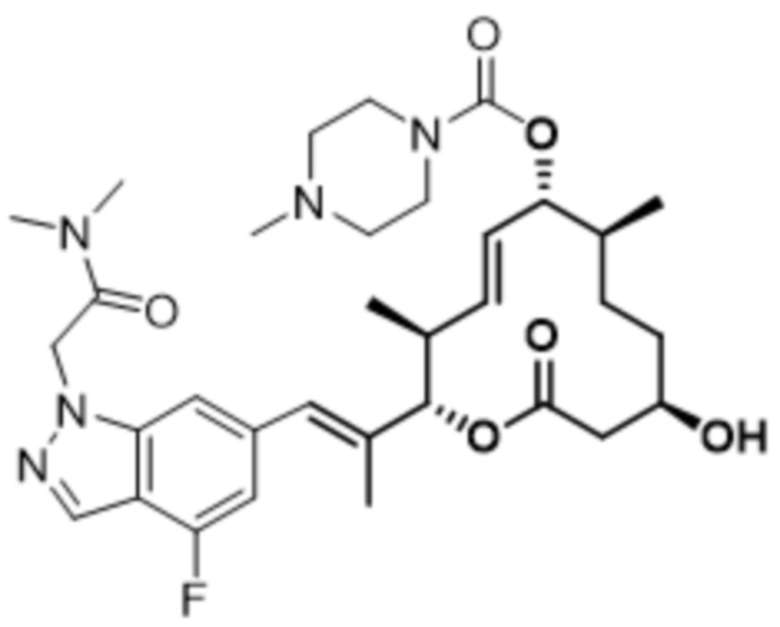
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[1-[2-(Диметиламино)-2-оксоэтил]-4-фториндазол-6-ил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилат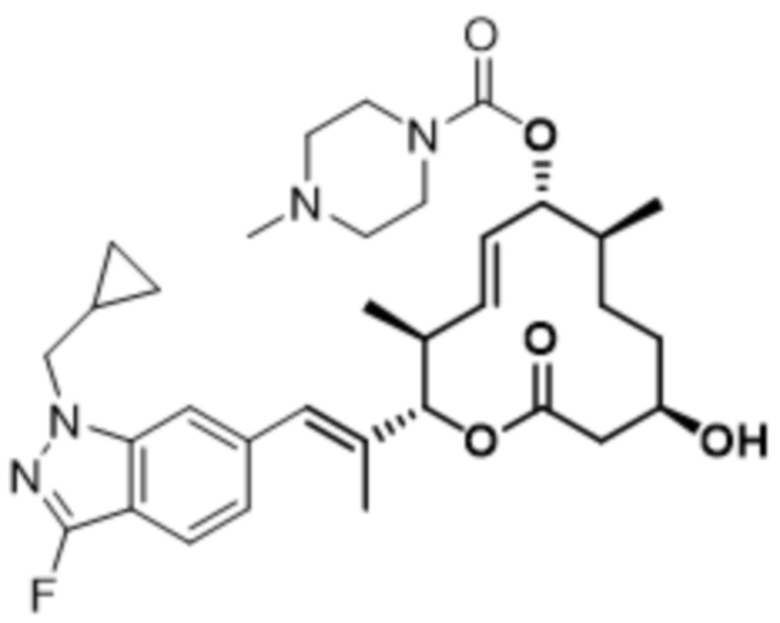
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[1-(Циклопропилметил)-3-фториндазол-6-ил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилат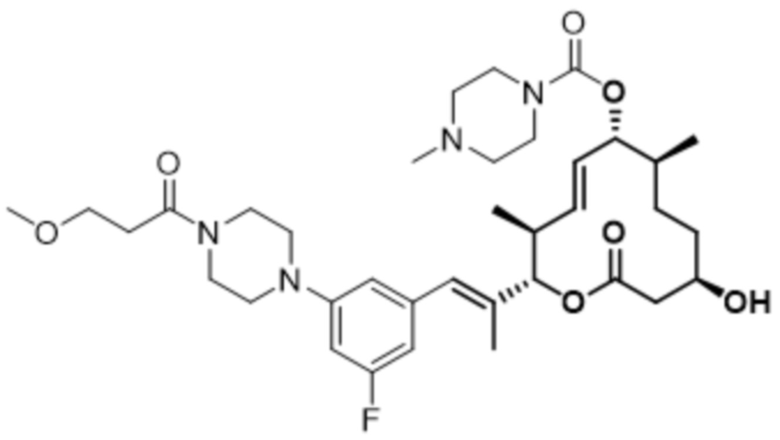
[(2S,3S,4E,6R,7R,10S)-2-[(E)-1-[3-Фтор-5-[4-(3-метоксипропаноил)пиперазин-1-ил]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилат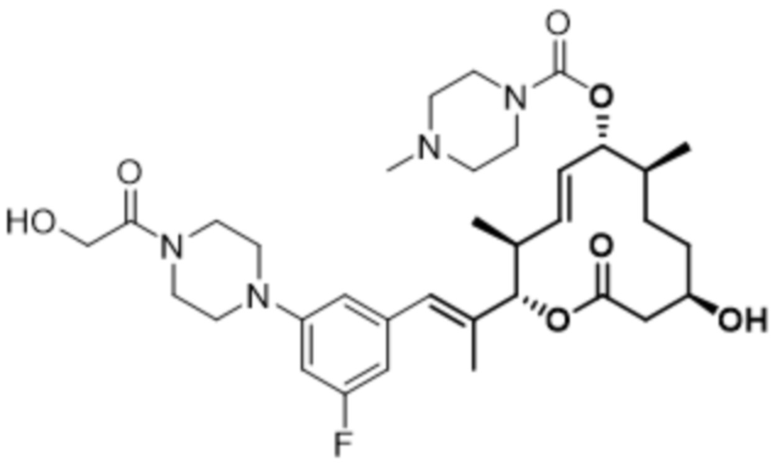
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-Фтор-5-[4-(2-гидроксиацетил)пиперазин-1-ил]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилат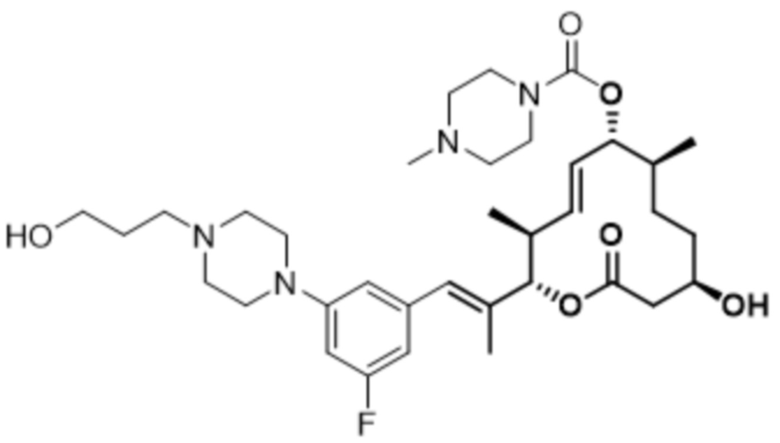
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-Фтор-5-[4-(3-гидроксипропил)пиперазин-1-ил]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилат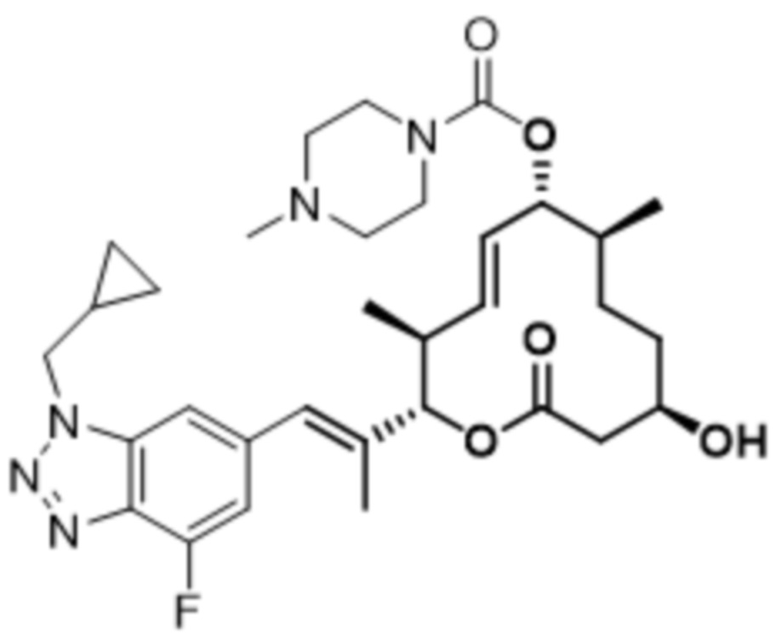
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-(Циклопропилметил)-7-фторбензотриазол-5-ил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилат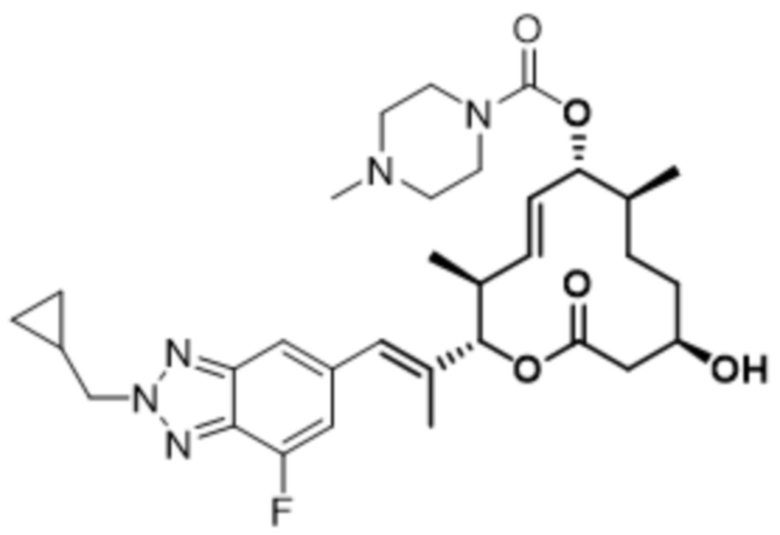
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[2-(Циклопропилметил)-7-фторбензотриазол-5-ил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилат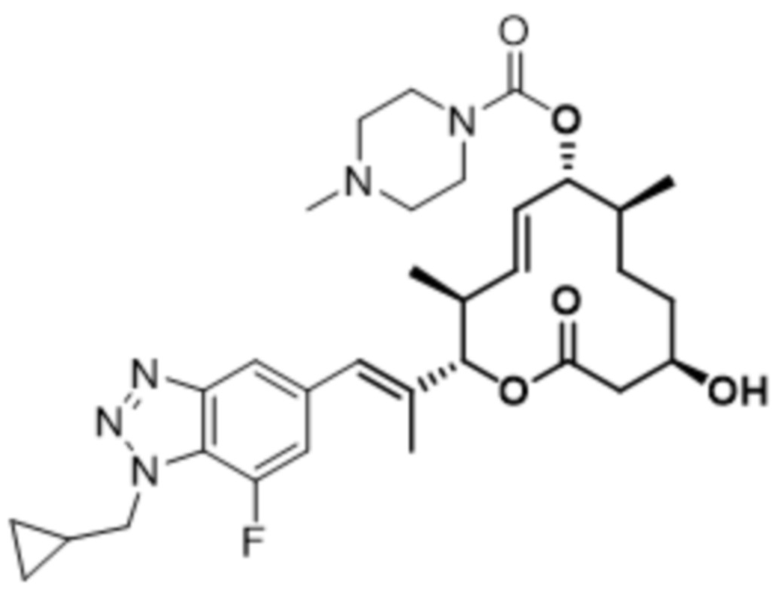
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[1-(Циклопропилметил)-7-фторбензотриазол-5-ил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилат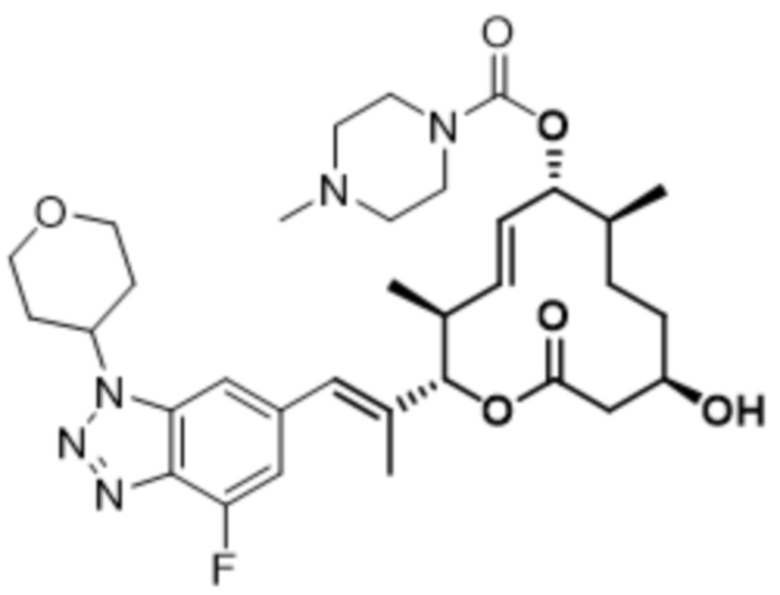
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[7-Фтор-3-(оксан-4-ил)бензотриазол-5-ил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилат
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[7-Фтор-2-(оксан-4-ил)бензотриазол-5-ил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилат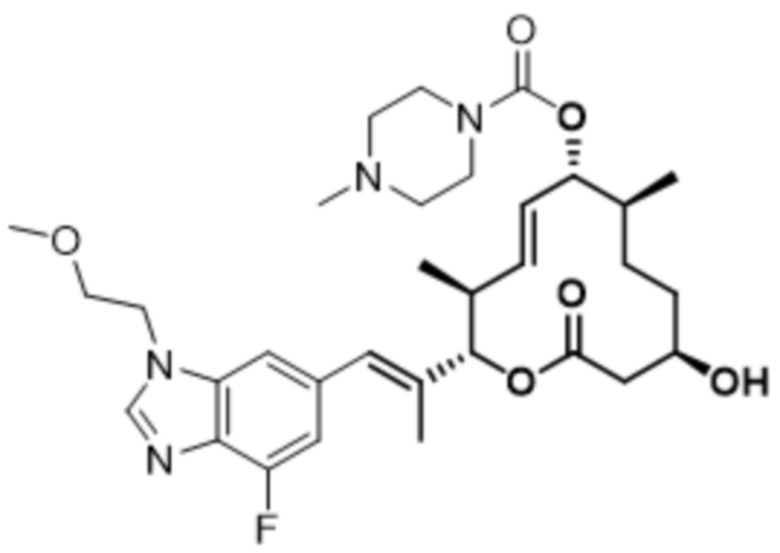
[(2S,3S,4E,6R,7R,10S)-2-[(E)-1-[7-Фтор-3-(2-метоксиэтил)бензимидазол-5-ил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилат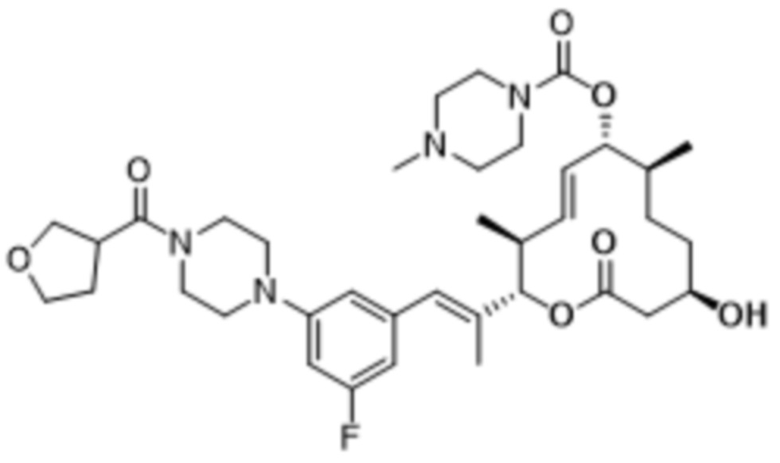
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-Фтор-5-[4-(оксолан-3-карбонил)пиперазин-1-ил]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилат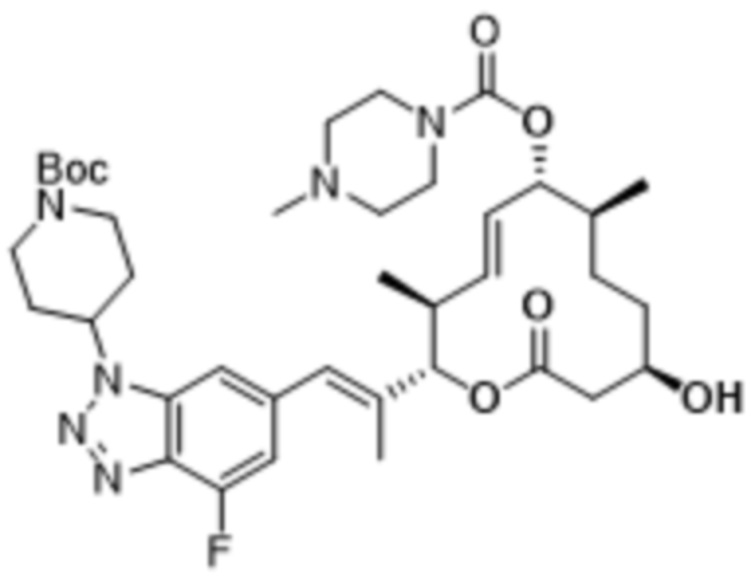
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[7-Фтор-3-[1-[(2-метилпропан-2-ил)оксикарбонил]пиперидин-4-ил]бензотриазол-5-ил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилат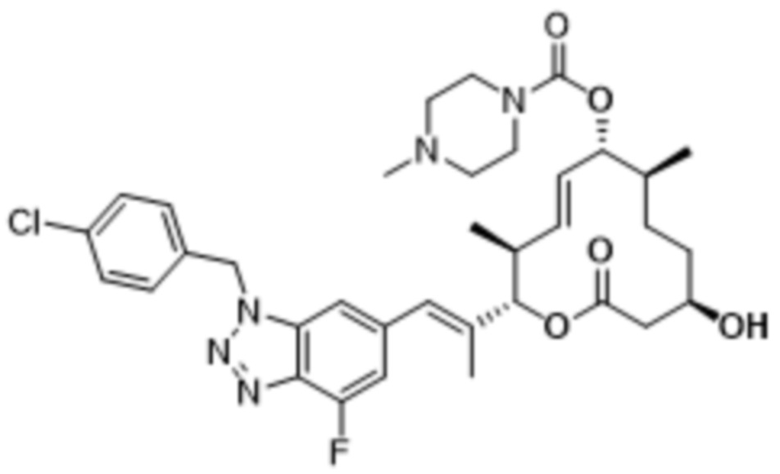
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-[(4-Хлорфенил)метил]-7-фторбензотриазол-5-ил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилат
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-(1-Ацетилпиперидин-4-ил)-7-фторбензимидазол-5-ил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилат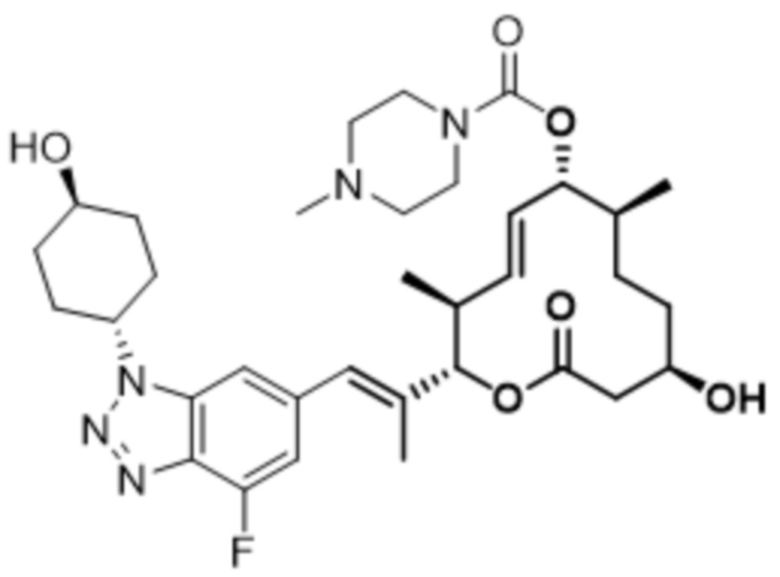
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[7-Фтор-3-(4-гидроксициклогексил)бензотриазол-5-ил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилат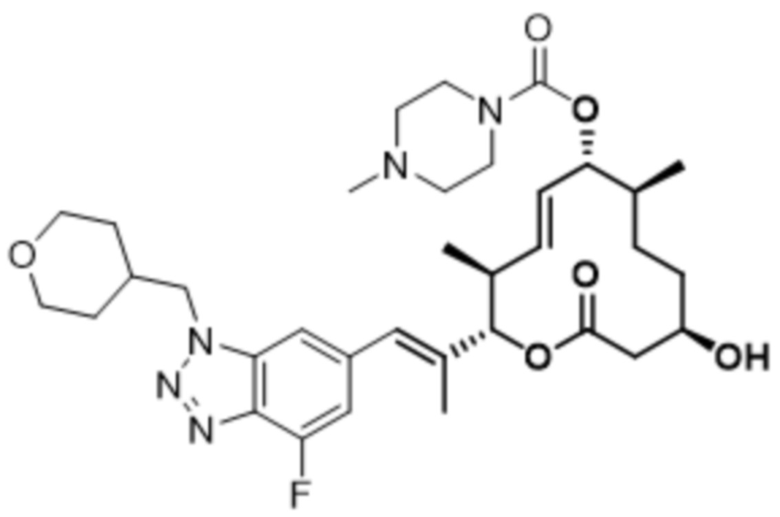
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[7-Фтор-3-(оксан-4-илметил)бензотриазол-5-ил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилат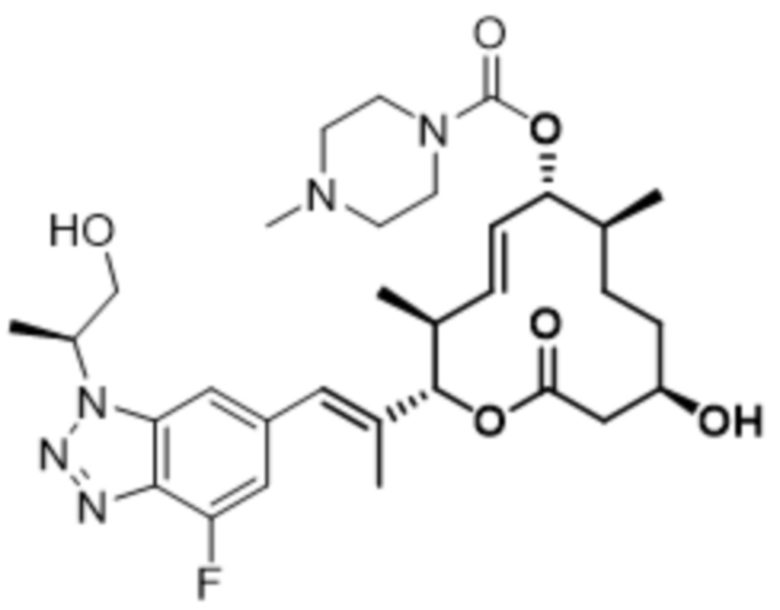
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[7-Фтор-3-[(2S)-1-гидроксипропан-2-ил]бензотриазол-5-ил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилат
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[7-Фтор-3-[(2R)-1-гидроксипропан-2-ил]бензотриазол-5-ил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилат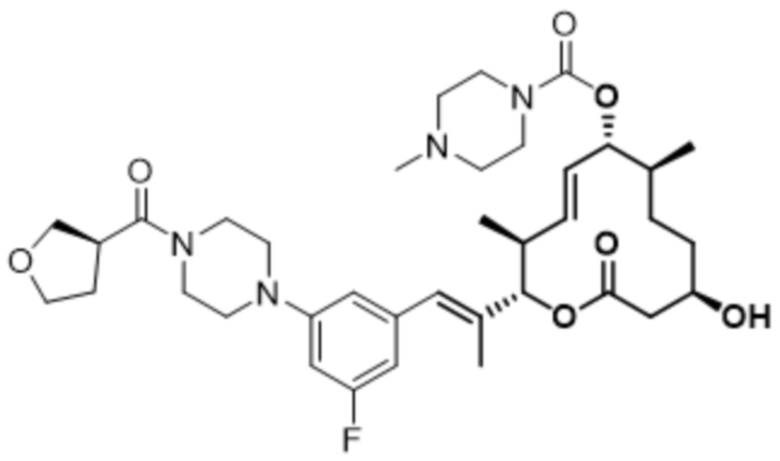
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-Фтор-5-[4-[(3S)-оксолан-3-карбонил]пиперазин-1-ил]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилат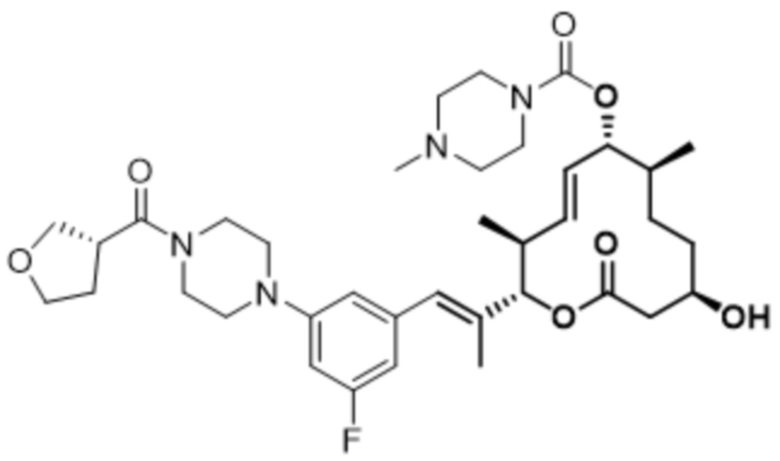
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-Фтор-5-[4-[(3R)-оксолан-3-карбонил]пиперазин-1-ил]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилат
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-Фтор-5-[4-(оксетан-3-карбонил)пиперазин-1-ил]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилат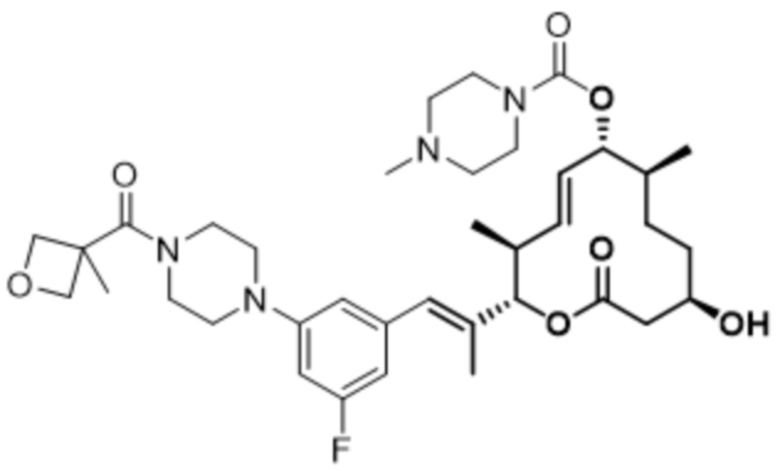
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-Фтор-5-[4-(3-метилоксетан-3-карбонил)пиперазин-1-ил]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилат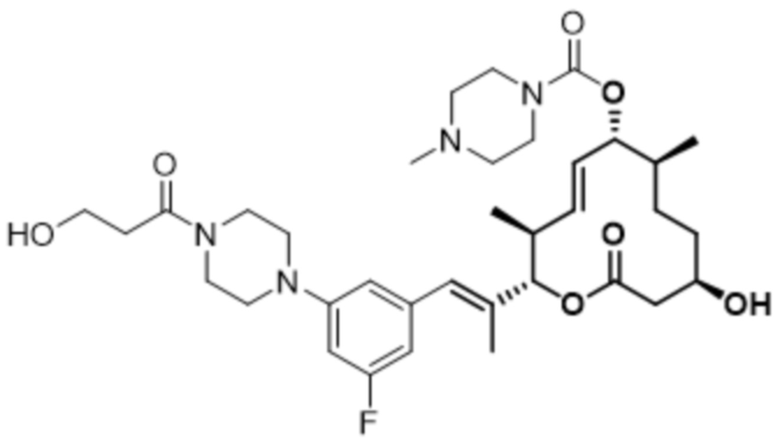
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-Фтор-5-[4-(3-гидроксипропаноил)пиперазин-1-ил]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилат
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[7-Фтор-3-(4-метилоксан-4-ил)бензотриазол-5-ил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилат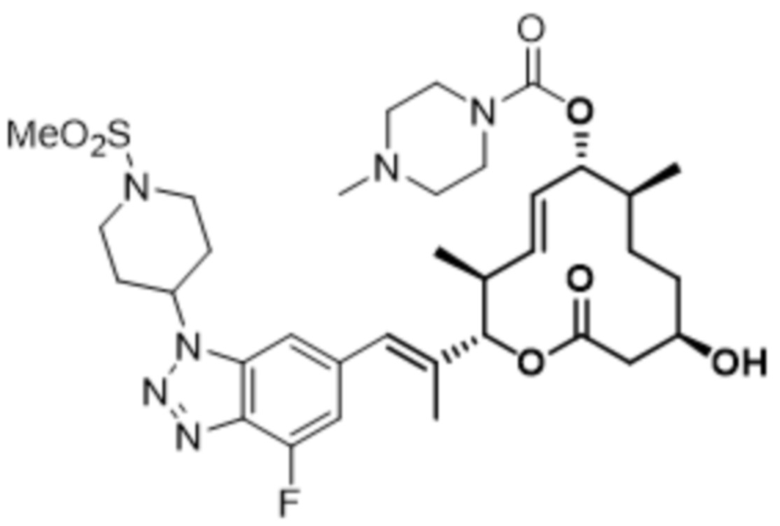
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[7-Фтор-3-(1-метилсульфонилпиперидин-4-ил)бензотриазол-5-ил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилат
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-(1,1-Диоксотиан-4-ил)-7-фторбензотриазол-5-ил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилат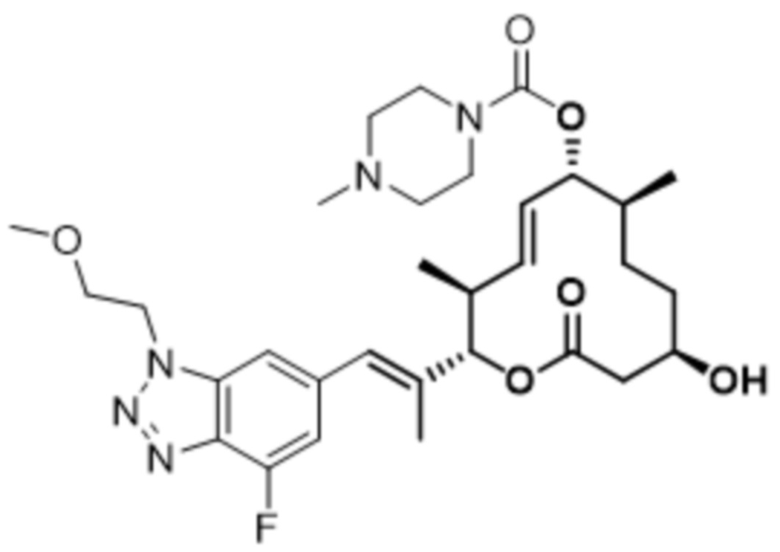
[(2S,3S,4E,6R,7R,10S)-2-[(E)-1-[7-Фтор-3-(2-метоксиэтил)бензотриазол-5-ил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилат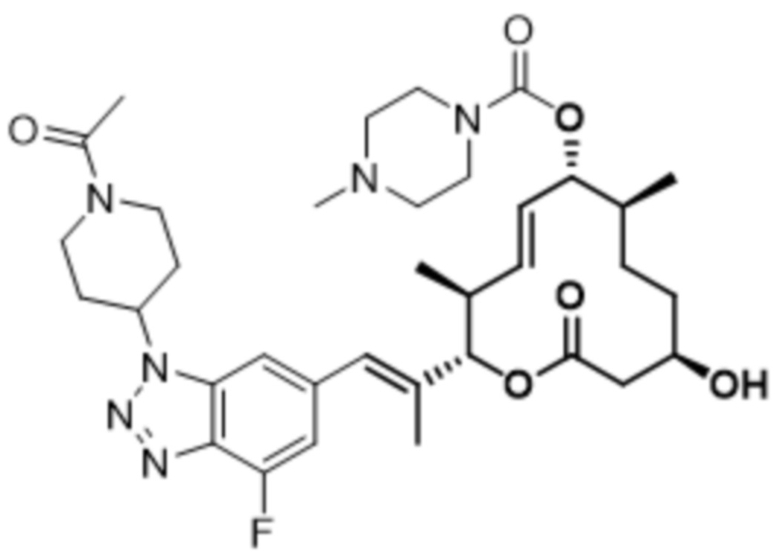
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-(1-Ацетилпиперидин-4-ил)-7-фторбензотриазол-5-ил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилат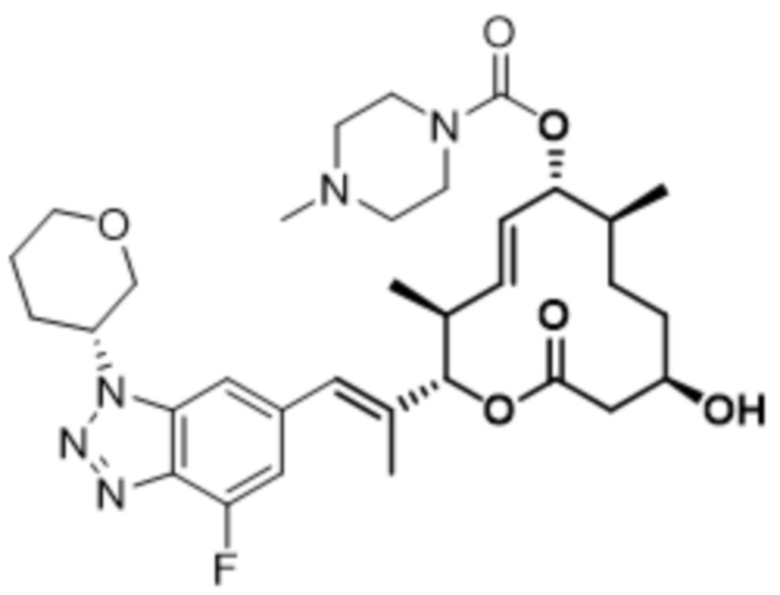
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[7-Фтор-3-[(3R)-оксан-3-ил]бензотриазол-5-ил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилат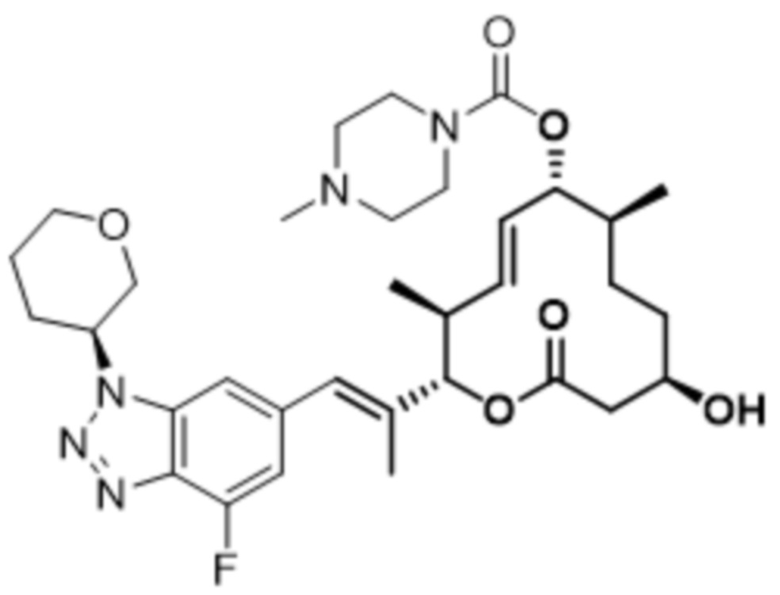
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[7-Фтор-3-[(3S)-оксан-3-ил]бензотриазол-5-ил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилат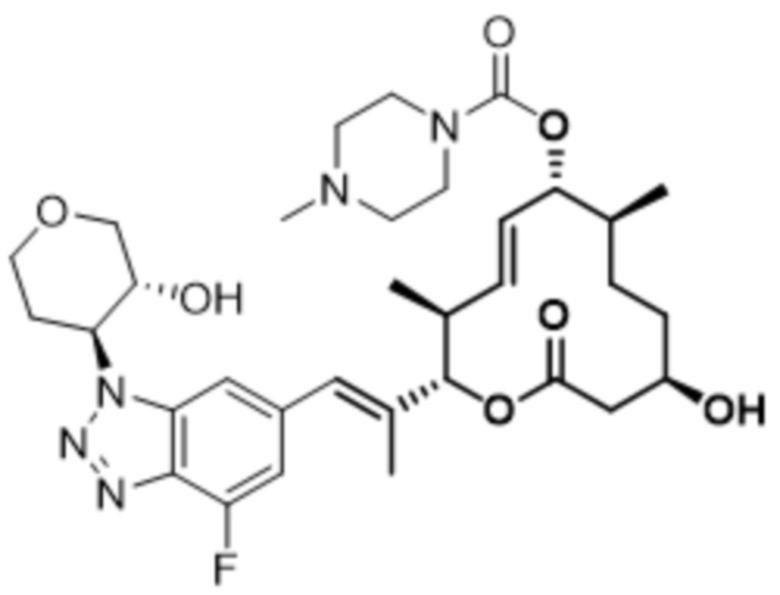
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[7-Фтор-3-[(3R,4S)-3-гидроксиоксан-4-ил]бензотриазол-5-ил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилат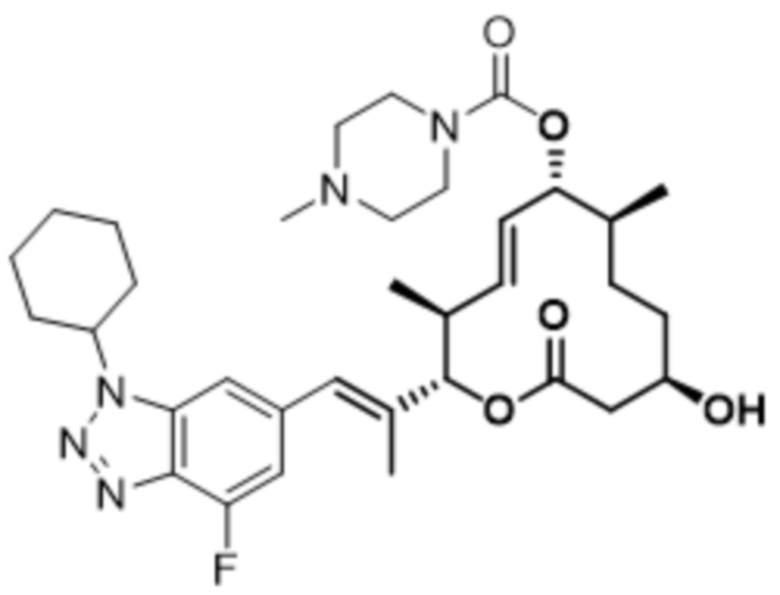
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-(3-Циклогексил-7-фторбензотриазол-5-ил)проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилат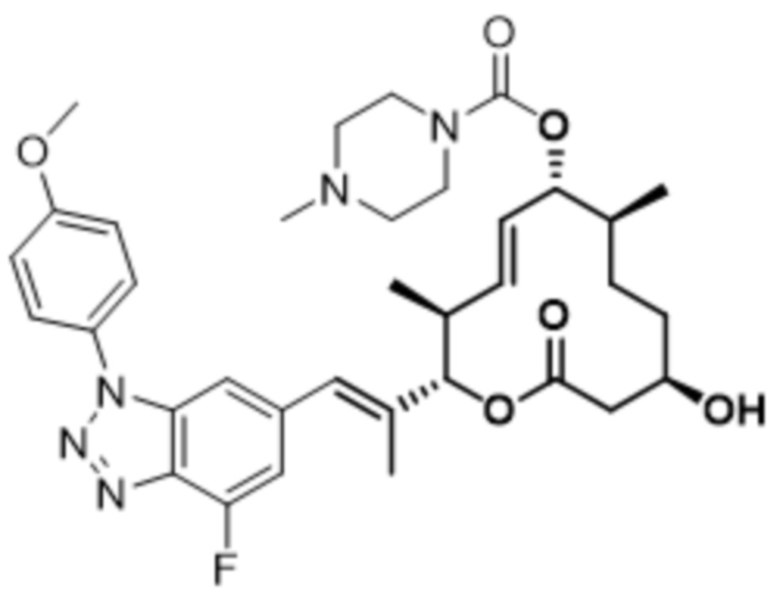
[(2S,3S,4E,6R,7R,10S)-2-[(E)-1-[7-Фтор-3-(4-метоксифенил)бензотриазол-5-ил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилат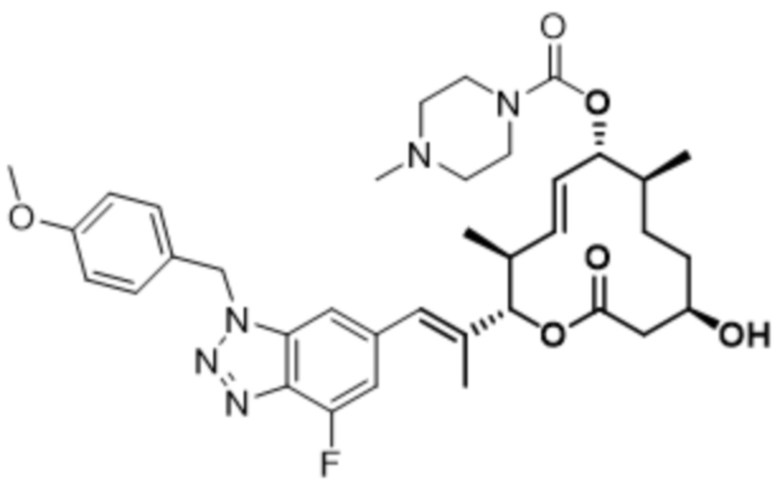
[(2S,3S,4E,6R,7R,10S)-2-[(E)-1-[7-Фтор-3-[(4-метоксифенил)метил]бензотриазол-5-ил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилат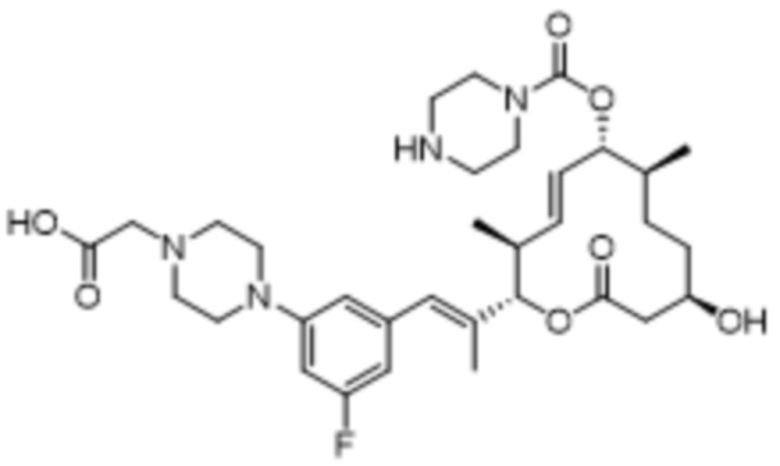
2-[4-[3-Фтор-5-[(E)-2-[(2S,3S,4E,6R,7S,10R)-10-гидрокси-3,7-диметил-12-оксо-6-(пиперазин-1-карбонилокси)-1-оксациклододец-4-ен-2-ил]проп-1-енил]фенил]пиперазин-1-ил]уксусная кислота
Соединения 167-196 (таблицы 5, 6, 8, 10, 12 и 14) и их промежуточные соединения (таблицы 4, 7, 9, 11 и 13) получали с помощью следующих общих способов из процедур 20-29.
Синтез промежуточных соединений на основе бороната
Процедура 20
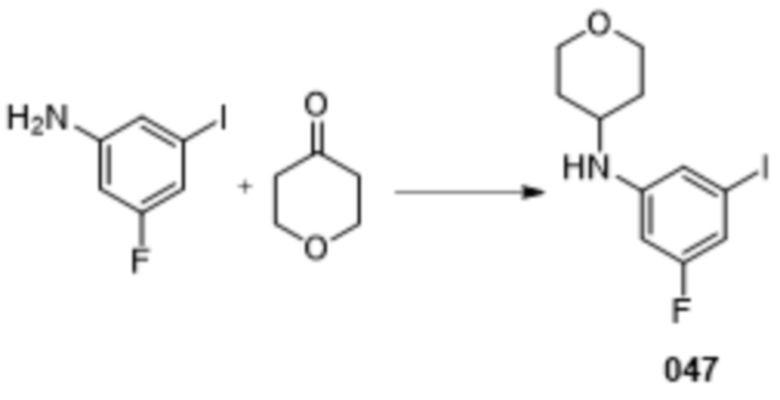
Загружали раствор 3-фтор-5-йоданилина (250 мг, 1,055 ммоль) и дигидро-2H-пиран-4(3H)-она (264 мг, 2,637 ммоль) в метаноле (5 мл) в круглодонную колбу объемом 25 мл с магнитной мешалкой. Добавляли уксусную кислоту (0,121 мл, 2,11 ммоль) и полученный раствор перемешивали в течение 30 минут при комнатной температуре. Добавляли цианоборогидрид натрия (133 мг, 2,11 ммоль), полученный раствор перемешивали в течение ночи при комнатной температуре. Реакцию гасили с помощью 10 мл 1 М водного раствора NaOH, перемешивали в течение 15 минут. Раствор экстрагировали с помощью EtOAc (3 × 15 мл), объединенные органические слои промывали солевым раствором (15 мл), высушивали с помощью MgSO4, фильтровали и выпаривали в вакууме. Неочищенный продукт в сухом виде загружали на 3 г диоксида кремния и очищали с помощью колоночной хроматографии (ISCO с нормальной фазой, колонка Gold на 24 г, градиент EtOAc/гексаны от 0 до 60%) с выделением N-(3-фтор-5-йодфенил)тетрагидро-2H-пиран-4-амина (047) (208 мг, 0,648 ммоль, 61%). 1H ЯМР (400 МГц, CDCl3) δ ppm 1,41-1,55 (m, 2 H) 1,95-2,09 (m, 2 H) 3,38-3,48 (m, 1 H) 3,53 (td, J=11,61, 2,13 Гц, 2 H) 3,65-3,80 (m, 1 H) 4,02 (br d, J=11,54 Гц, 2 H) 6,20-6,30 (m, 1 H) 6,73 (br d, J=1,76 Гц, 2 H). LCMS: 322,6 [M+H]+.
Процедура 21
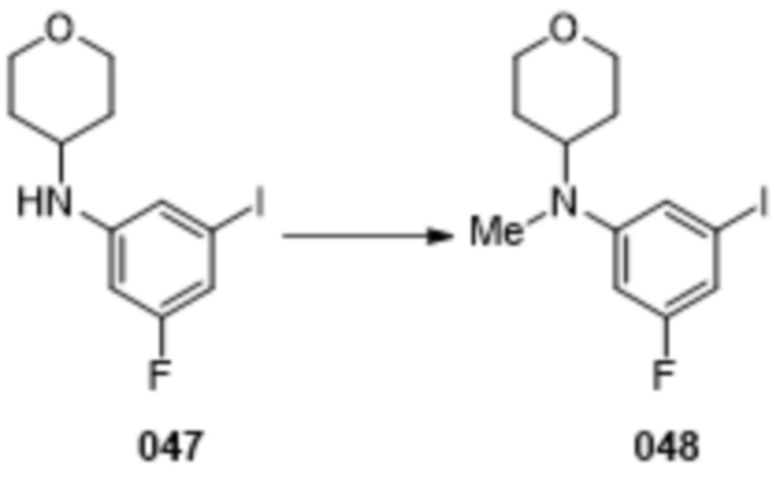
Загружали раствор N-(3-фтор-5-йодфенил)тетрагидро-2H-пиран-4-амина (047) (208 мг, 0,648 ммоль) в ацетонитриле (4 мл) во флакон объемом 10 мл с магнитной мешалкой. Добавляли карбонат цезия (422 мг, 1,295 ммоль) и йодметан (0,203 мл, 3,239 ммоль). Флакон герметизировали и нагревали до 80°C при перемешивании в течение ночи. Реакционную смесь охлаждали до комнатной температуры. Твердые вещества фильтровали, промывали с помощью 20 мл EtOAc и растворители выпаривали в вакууме. Неочищенный материал в сухом виде загружали на 3 г диоксида кремния и очищали с помощью колоночной хроматографии (ISCO с нормальной фазой, колонка Gold на 24 г, градиент EtOAc/гексаны от 0 до 60%) с выделением N-(3-фтор-5-йодфенил)-N-метилтетрагидро-2H-пиран-4-амина (048) (143 мг, 0,427 ммоль, 66%). 1H ЯМР (400 МГц, CDCl3) δ ppm 1,62-1,72 (m, 2 H) 1,80-1,94 (m, 2 H) 2,79 (s, 3 H) 3,46-3,56 (m, 2 H) 3,68-3,78 (m, 1 H) 4,05-4,14 (m, 2 H) 6,38-6,47 (m, 1 H) 6,74-6,81 (m, 1 H) 6,85-6,90 (m, 1 H). LCMS: 336,1 [M+H]+.
Процедура 22
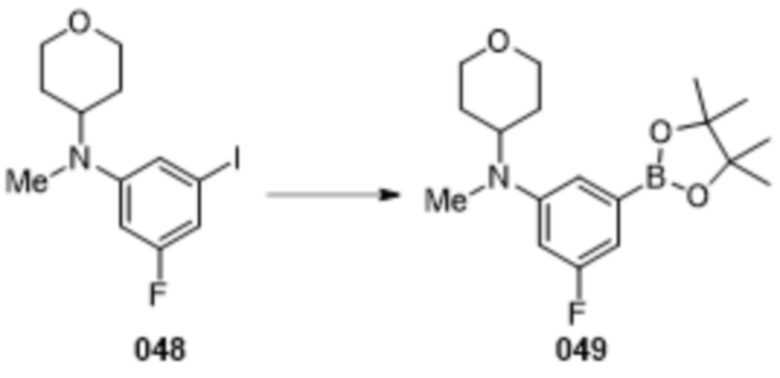
Загружали бис(пинаколато)дибор (130 мг, 0,512 ммоль), ацетат калия (126 мг, 1,28 ммоль) и Pd(dppf)Cl2 (38,8 мг, 0,043 ммоль) во флакон объемом 10 мл с магнитной мешалкой. Добавляли раствор N-(3-фтор-5-йодфенил)-N-метилтетрагидро-2H-пиран-4-амина (048) (143 мг, 0,427 ммоль) в DMF (4 мл). Флакон герметизировали и нагревали до 100°C и перемешивали в течение 20 часов. Флакон охлаждали до комнатной температуры, разбавляли с помощью 5 мл EtOAc, фильтровали через слой целита, промывали с помощью 10 мл EtOAc и выпаривали в вакууме. Неочищенный материал в сухом виде загружали на колонку с 2 г диоксида кремния и очищали с помощью колоночной хроматографии (ISCO с нормальной фазой, колонка Gold на 12 г, градиент EtOAc/гексаны от 0 до 50%) с получением N-(3-фтор-5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил)-N-метилтетрагидро-2H-пиран-4-амина (049) (82 мг, 0,245 ммоль, 57%). 1H ЯМР (400 МГц, CDCl3) δ ppm 1,33-1,40 (m, 12 H) 1,64-1,73 (m, 2 H) 1,80-1,94 (m, 2 H) 2,79-2,85 (m, 3 H) 3,48-3,61 (m, 2 H) 3,79-3,90 (m, 1 H) 4,04-4,13 (m, 2 H) 6,54-6,63 (m, 1 H) 6,82-6,89 (m, 1 H) 6,98-7,04 (m, 1 H). LCMS: 336,3 [M+H]+.
Следующие промежуточные соединения также синтезировали в соответствии с общими способами из процедур 20-22.
N-(3-Фтор-5-йодфенил)оксетан-3-амин
N-(3-Йодфенил)тетрагидро-2H-пиран-4-амин
N-(3-Йодфенил)оксетан-3-амин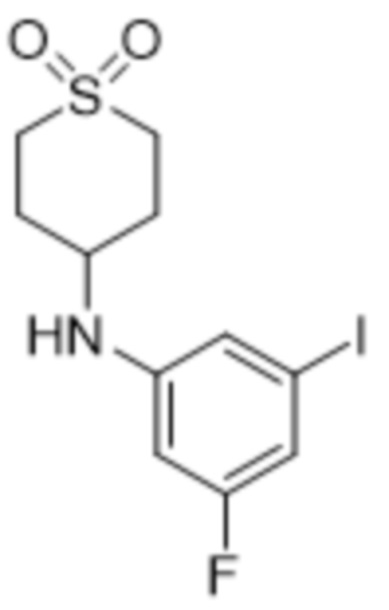
4-((3-Фтор-5-йодфенил)амино)тетрагидро-2H-тиопиран-1,1-диоксид
трет-Бутил-4-((3-фтор-5-йодфенил)амино)пиперидин-1-карбоксилат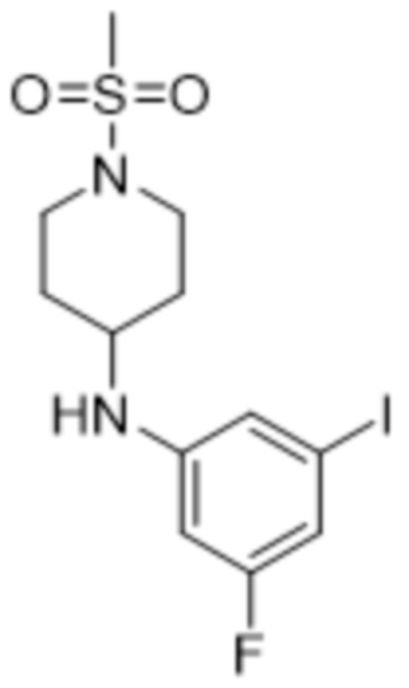
N-(3-Фтор-5-йодфенил)-1-(метилсульфонил)пиперидин-4-амин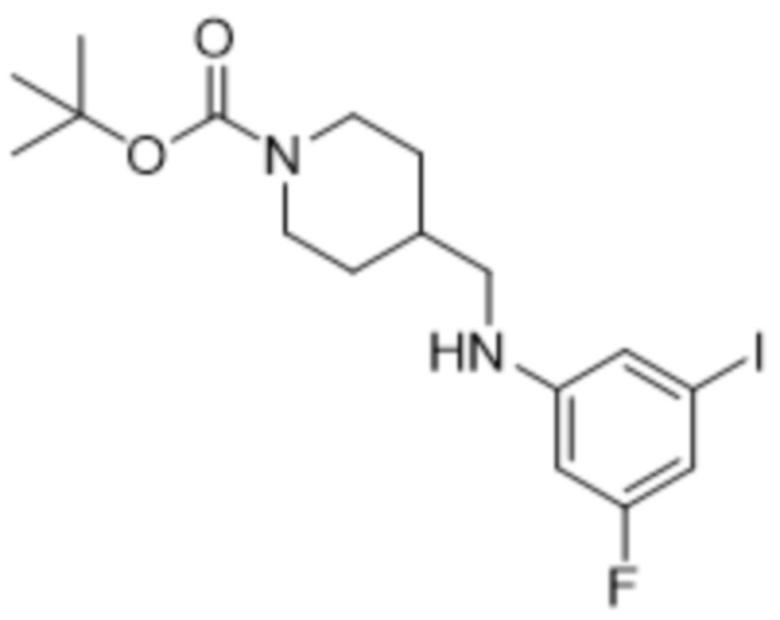
трет-Бутил-4-(((3-фтор-5-йодфенил)амино)метил)пиперидин-1-карбоксилат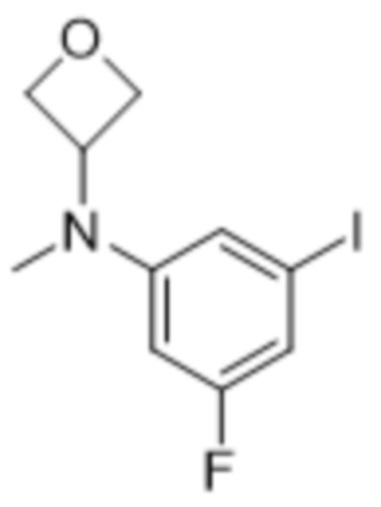
N-(3-Фтор-5-йодфенил)-N-метилоксетан-3-амин
N-(3-Йодфенил)-N-метилтетрагидро-2H-пиран-4-амин
N-(3-Йодфенил)-N-метилоксетан-3-амин
4-((3-Фтор-5-йодфенил)(метил)амино)тетрагидро-2H-тиопиран-1,1-диоксид
трет-Бутил-4-((3-фтор-5-йодфенил)(метил)амино)пиперидин-1-карбоксилат
N-(3-Фтор-5-йодфенил)-N-метил-1-(метилсульфонил)пиперидин-4-амин
N-Этил-N-(3-фтор-5-йодфенил)-1-(метилсульфонил)пиперидин-4-амин
N-(3-Фтор-5-йодфенил)-N-изопропил-1-(метилсульфонил)пиперидин-4-амин
трет-Бутил-4-(((3-фтор-5-йодфенил)(метил)амино)метил)пиперидин-1-карбоксилат
N-(3-Фтор-5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил)-N-метилоксетан-3-амин
N-Метил-N-(3-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил)тетрагидро-2H-пиран-4-амин
N-Метил-N-(3-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил)оксетан-3-амин
Синтез продуктов боронатного сочетания
Процедура 23

Загружали раствор йодида (008) (39 мг, 0,073 ммоль) и (3-хлор-5-фторфенил)бороновой кислоты (15,27 мг, 0,088 ммоль) в 1,4-диоксане (1,0 мл) во флакон объемом 4 мл с магнитной мешалкой. Содержимое флакона дегазировали с помощью аргона в течение 5 минут. Добавляли оксид серебра(I) (50,7 мг, 0,219 ммоль) и тетракис-палладий (8,43 мг, 0,007 ммоль), нагревали до 80°C и перемешивали в течение 1 часа. Раствор охлаждали до комнатной температуры, фильтровали через слой целита, промывали с помощью 15 мл EtOAc и концентрировали в вакууме. Неочищенный материал в сухом виде загружали на 1 г диоксида кремния и очищали с помощью колоночной хроматографии (ISCO с нормальной фазой, колонка Gold на 12 г, градиент MeOH/DCM от 0 до 20%) с получением продукта из примера 167 (15,2 мг, 0,028 ммоль, выход 39%).
Процедура 24
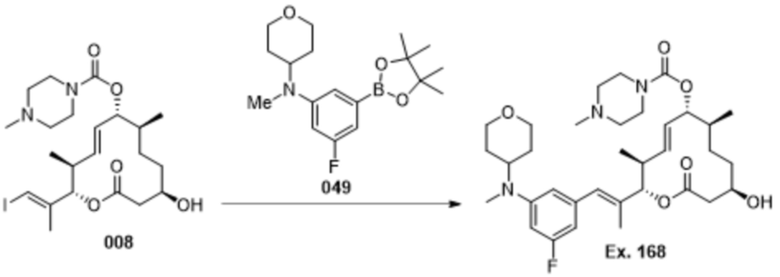
Загружали раствор йодида (008) (30 мг, 0,056 ммоль) и N-(3-фтор-5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил)-N-метилтетрагидро-2H-пиран-4-амина (049) (28,2 мг, 0,084 ммоль) в 1,4-диоксане (1,0 мл) во флакон с объемом 4 мл с магнитной мешалкой. Раствор дегазировали в течение 5 минут. Добавляли оксид серебра(I) (39,0 мг, 0,168 ммоль) и тетракис-палладий (6,49 мг, 0,0056 ммоль). Полученную дисперсию нагревали до 80°C и перемешивали в течение 3 часов. Содержимое флакона охлаждали до комнатной температуры, фильтровали через слой целита, промывали с помощью 15 мл EtOAc и концентрировали в вакууме. Неочищенный продукт очищали с помощью хроматографии с обращенной фазой (MeCN/H2O с 0,1% муравьиной кислоты) и лиофилизировали с получением соединения из примера 168 (2,3 мг, 0,0037 ммоль, 7%).
Соединения 167-171 синтезировали в соответствии с общими способами из процедур 23 и 24.
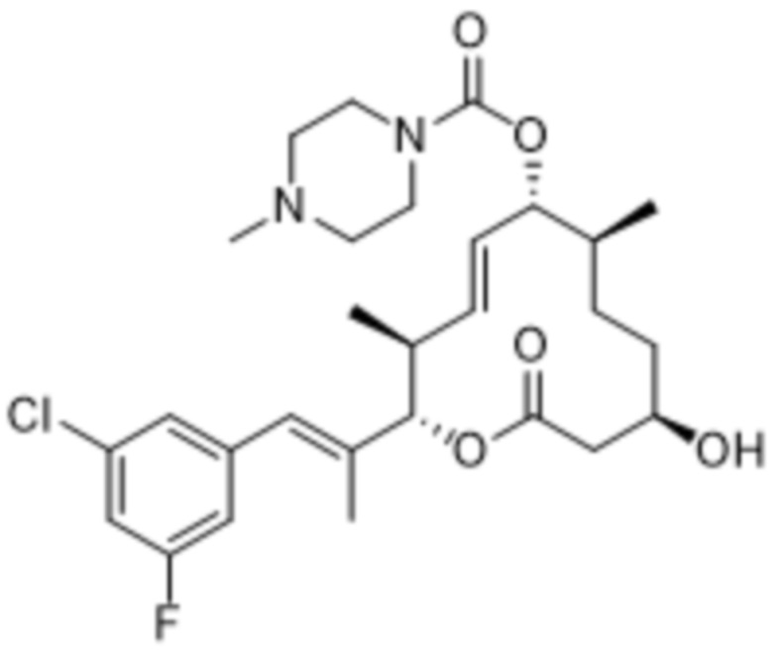
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-(3-Хлор-5-фторфенил)проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилат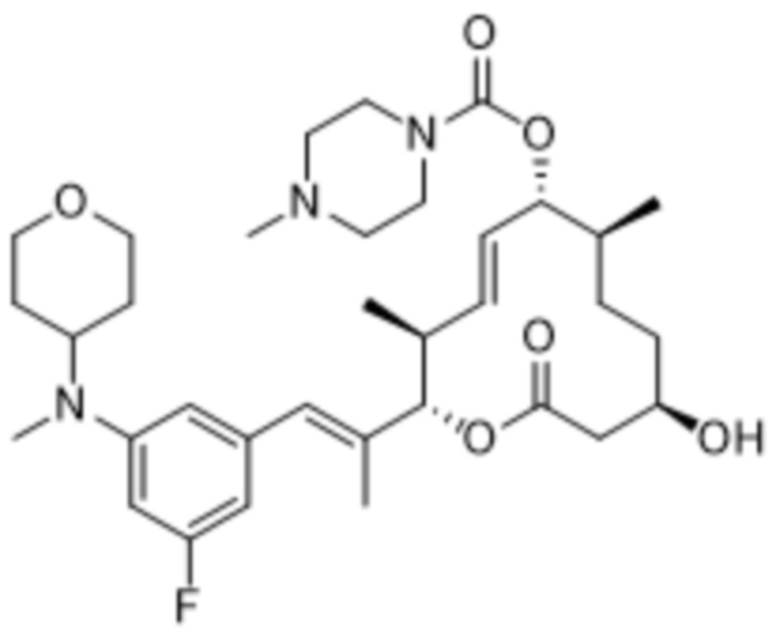
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-Фтор-5-[метил(оксан-4-ил)амино]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилат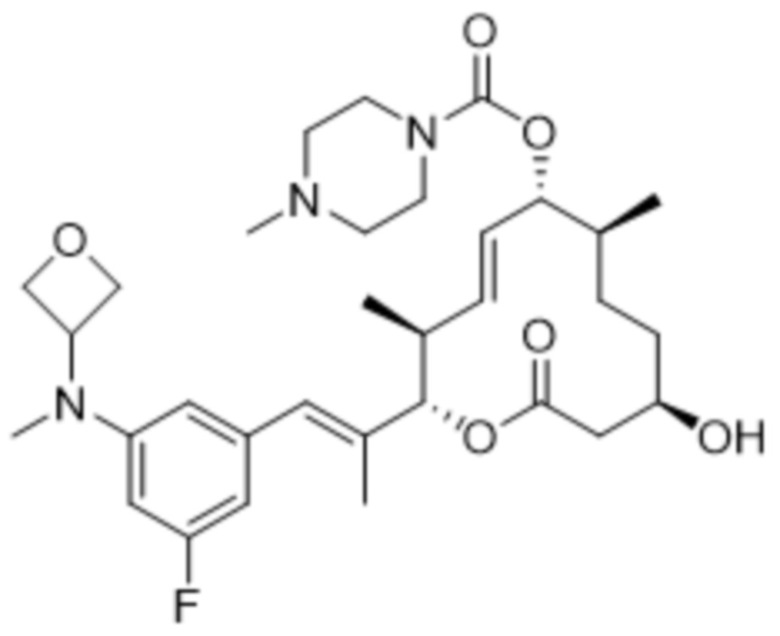
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-Фтор-5-[метил(оксетан-3-ил)амино]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилат
[(2S,3S,4E,6R,7S,10R)-10-Гидрокси-3,7-диметил-2-[(E)-1-[3-[метил(оксан-4-ил)амино]фенил]проп-1-ен-2-ил]-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилат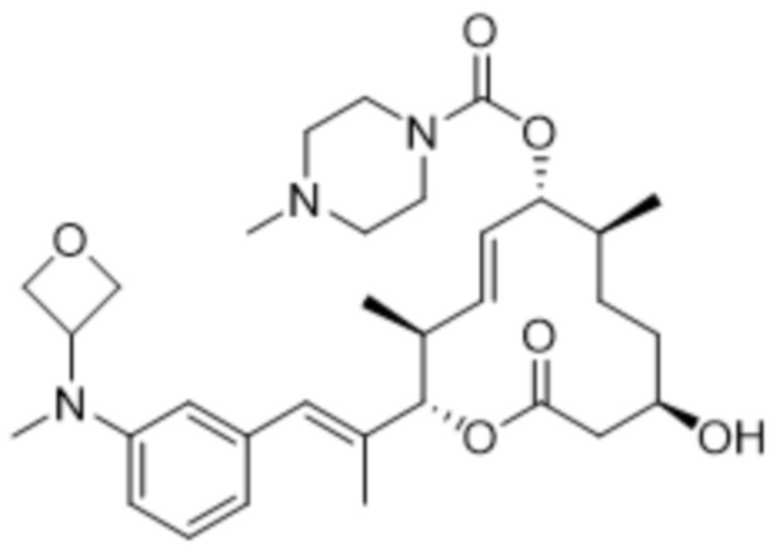
[(2S,3S,4E,6R,7S,10R)-10-Гидрокси-3,7-диметил-2-[(E)-1-[3-[метил(оксетан-3-ил)амино]фенил]проп-1-ен-2-ил]-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилат
Процедура 25

Загружали раствор бороната 1 (11 мг, 0,021 ммоль) и 4-((3-фтор-5-йодфенил)(метил)амино)тетрагидро-2H-тиопиран-1,1-диоксида (11,83 мг, 0,031 ммоль)) в 1,4-диоксане (1,0 мл) во флакон объемом 4 мл с магнитной мешалкой. Раствор дегазировали в течение 5 минут. Добавляли оксид серебра(I) (14,31 мг, 0,062 ммоль) и тетракис-палладий (2,38 мг, 0,0021 ммоль). Полученную дисперсию нагревали до 80°C и перемешивали в течение 3 часов. Содержимое флакона охлаждали до комнатной температуры, фильтровали через слой целита, промывали с помощью 15 мл EtOAc и концентрировали в вакууме. Неочищенный продукт очищали с помощью хроматографии с обращенной фазой (MeCN/H2O с 0,1% муравьиной кислоты) и лиофилизировали с получением соединения из примера 172 (5,1 мг, 0,0077 ммоль, 37%).
Соединения 172-176 синтезировали в соответствии с общими способами из процедуры 25.
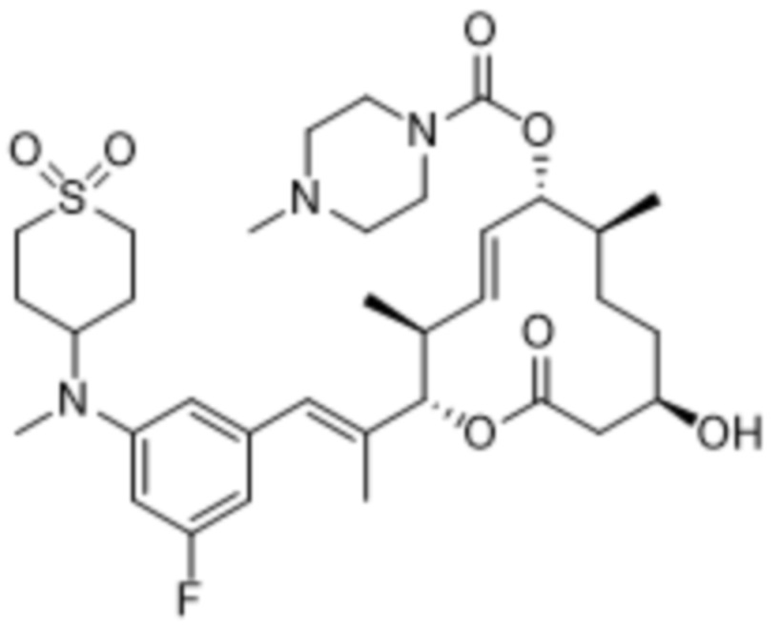
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-[(1,1-Диоксотиан-4-ил)-метиламино]-5-фторфенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилат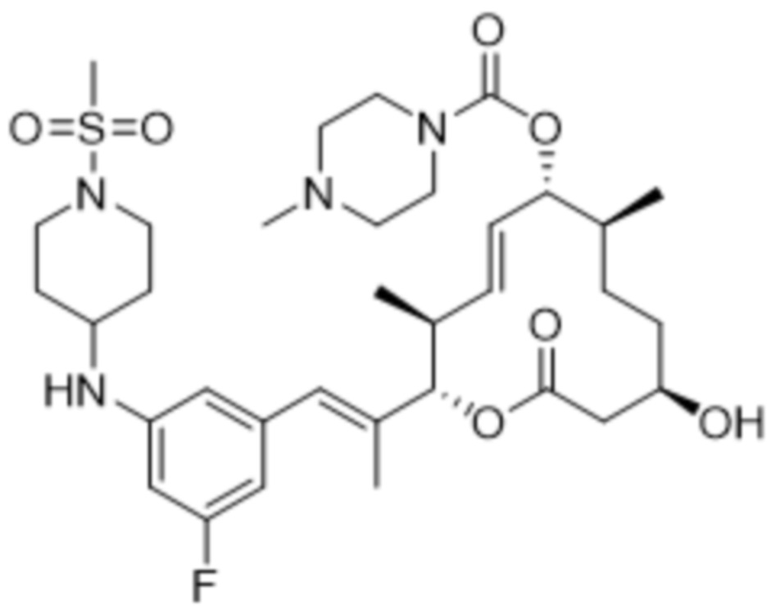
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-Фтор-5-[(1-метилсульфонилпиперидин-4-ил)амино]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилат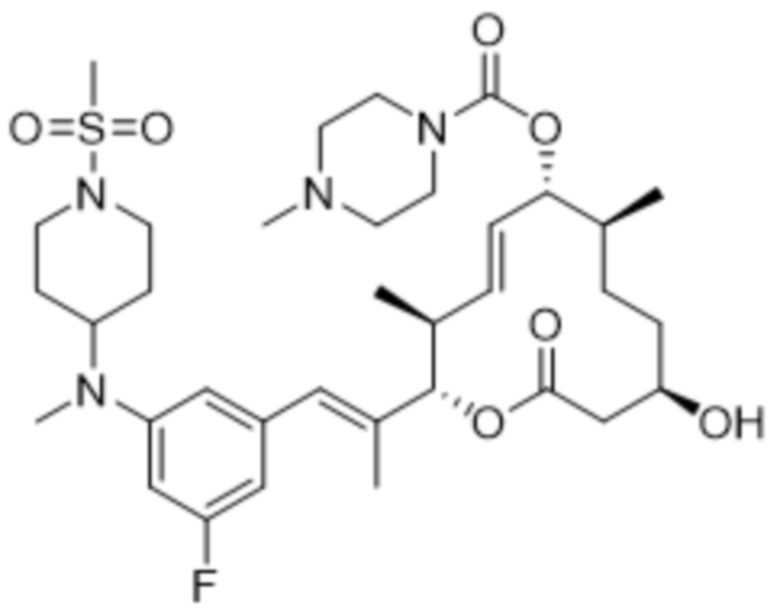
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-Фтор-5-[метил-(1-метилсульфонилпиперидин-4-ил)амино]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилат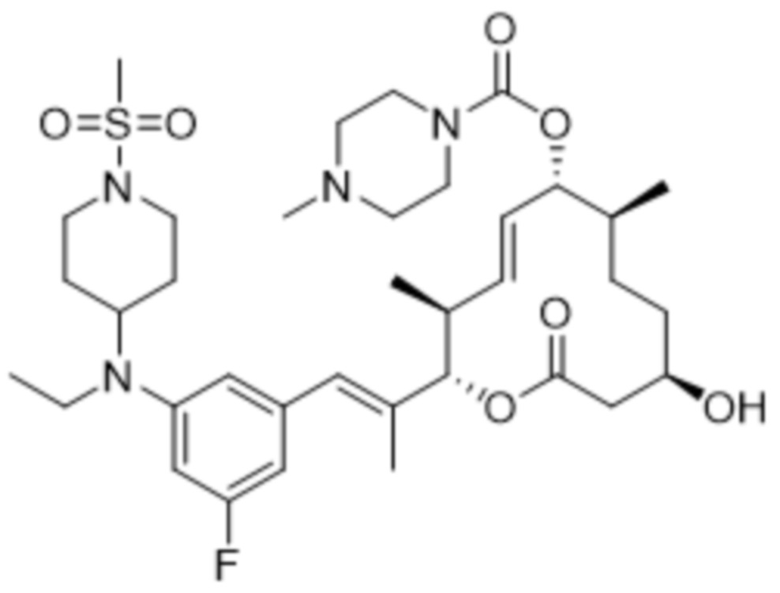
[(2S,3S,4E,6R,7R,10S)-2-[(E)-1-[3-[Этил-(1-метилсульфонилпиперидин-4-ил)амино]-5-фторфенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилат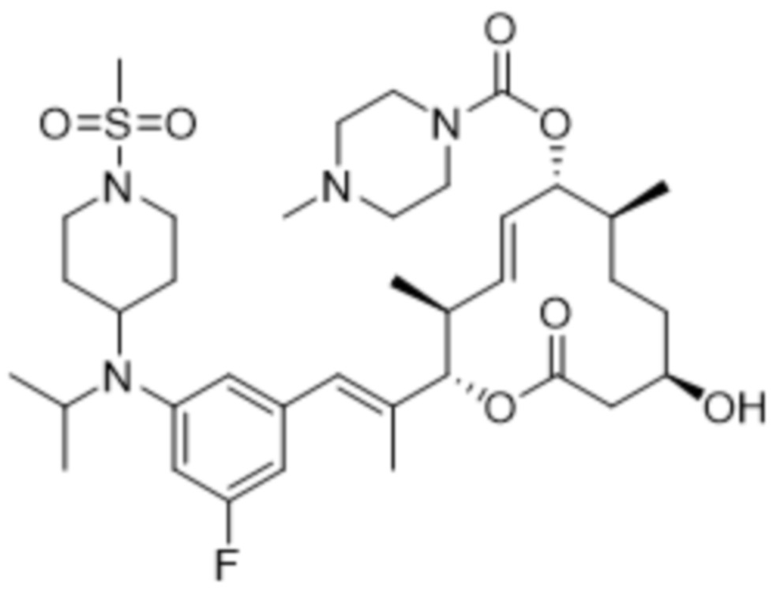
[(2S,3S,4E,6R,7R,10S)-2-[(E)-1-[3-Фтор-5-[(1-метилсульфонилпиперидин-4-ил)-пропан-2-иламино]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилат
Синтез промежуточных соединений на основе пиперидина
Процедура 26
Стадия 1. Загружали раствор трет-бутил-4-((3-фтор-5-йодфенил)(метил)амино)пиперидин-1-карбоксилата (590 мг, 1,359 ммоль) в метаноле (15 мл, 370,765 ммоль) в круглодонную колбу объемом 50 мл с магнитной мешалкой. Добавляли HCl (4,0 М в диоксане, 1,698 мл, 6,793 ммоль), полученный раствор перемешивали в течение ночи при комнатной температуре. Растворители выпаривали в вакууме с получением соли HCl и N-(3-фтор-5-йодфенил)-N-метилпиперидин-4-амина (050) (500 мг, 1,349 ммоль, 99%). LCMS: 335,1 [M+H]+.
Стадия 2. Загружали раствор соли HCl и N-(3-фтор-5-йодфенил)-N-метилпиперидин-4-амина (050) (50 мг, 0,135 ммоль) в дихлорметане (2 мл) во флакон объемом 5 мл с магнитной мешалкой. Добавляли N-этил-N-изопропилпропан-2-амин (0,059 мл, 0,337 ммоль), затем - ацетилхлорид (0,014 мл, 0,202 ммоль). Полученный раствор перемешивали в течение ночи при комнатной температуре. Раствор разделяли между водой (10 мл) и DCM (10 мл), экстрагировали с помощью DCM (3 × 10 мл) и объединенные органические слои промывали водой (10 мл), высушивали с помощью MgSO4, фильтровали и выпаривали в вакууме. Неочищенный продукт в сухом виде загружали на 2 г диоксида кремния и очищали с помощью колоночной хроматографии (ISCO с нормальной фазой, колонка Gold на 24 г, градиент EtOAc/гексаны от 0 до 100%) с получением 1-(4-((3-фтор-5-йодфенил)(метил)амино)пиперидин-1-ил)этан-1-она (051) (24 мг, 0,064 ммоль, 47%). 1H ЯМР (400 МГц, CDCl3) δ ppm 1,61-1,73 (m, 2 H) 1,74-1,90 (m, 2 H) 2,15 (s, 3 H) 2,62 (td, J=12,77, 2,45 Гц, 1 H) 2,75 (s, 3 H) 3,11-3,24 (m, 1 H) 3,63-3,80 (m, 1 H) 3,95 (br dd, J=13,55, 2,38 Гц, 1 H) 4,76-4,87 (m, 1 H) 6,44 (dt, J=12,58, 2,18 Гц, 1 H) 6,82 (dt, J=7,53, 1,69 Гц, 1 H) 6,89 (s, 1 H). LCMS: 377,2 [M+H]+.
Следующие промежуточные соединения также синтезировали в соответствии с общими способами из процедуры 26.
3-Фтор-5-йод-N-метил-N-(пиперидин-4-илметил)анилин
1-(4-((3-Фтор-5-йодфенил)(метил)амино)пиперидин-1-ил)пропан-1-он
1-(4-((3-Фтор-5-йодфенил)(метил)амино)пиперидин-1-ил)-2-метоксиэтан-1-он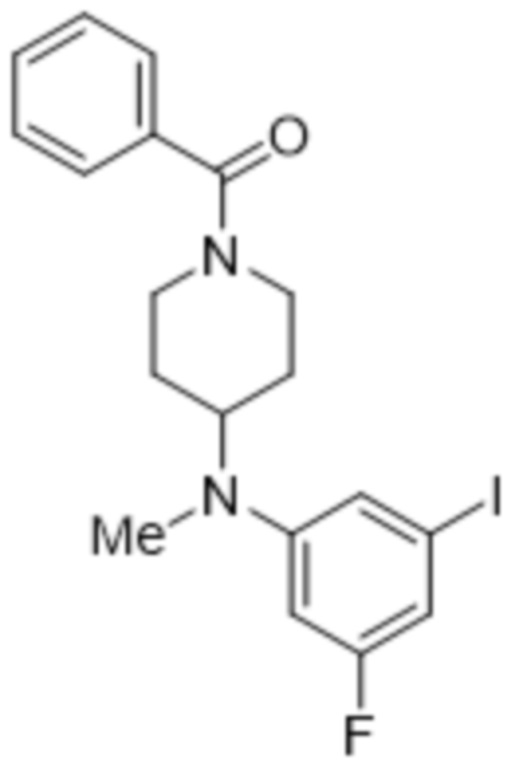
(4-((3-Фтор-5-йодфенил)(метил)амино)пиперидин-1-ил)(фенил)метанон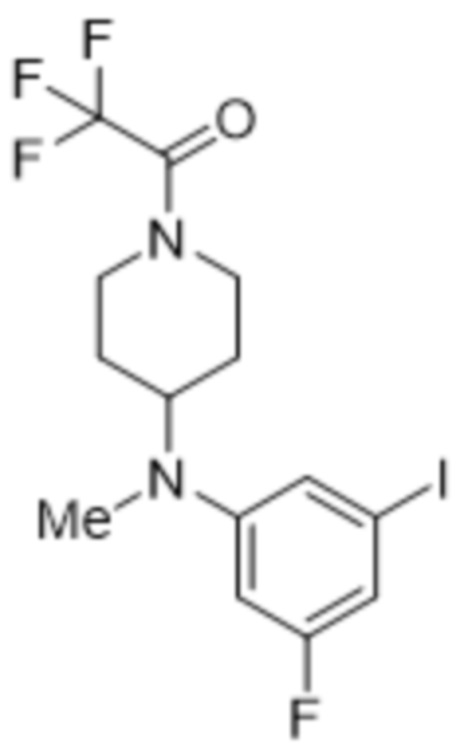
2,2,2-Трифтор-1-(4-((3-фтор-5-йодфенил)(метил)амино)пиперидин-1-ил)этан-1-он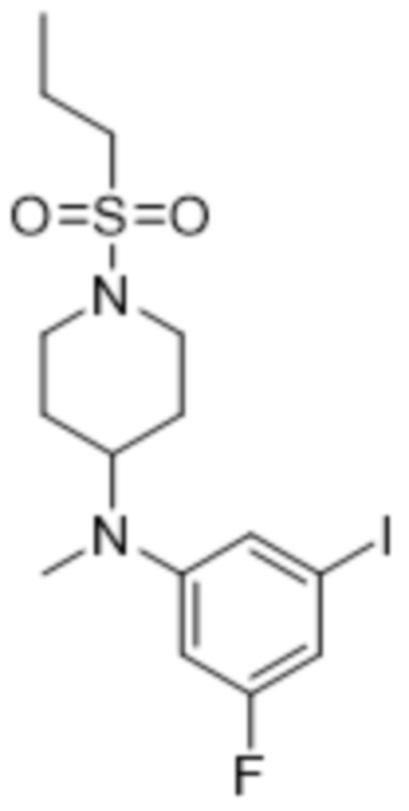
N-(3-Фтор-5-йодфенил)-N-метил-1-(пропилсульфонил)пиперидин-4-амин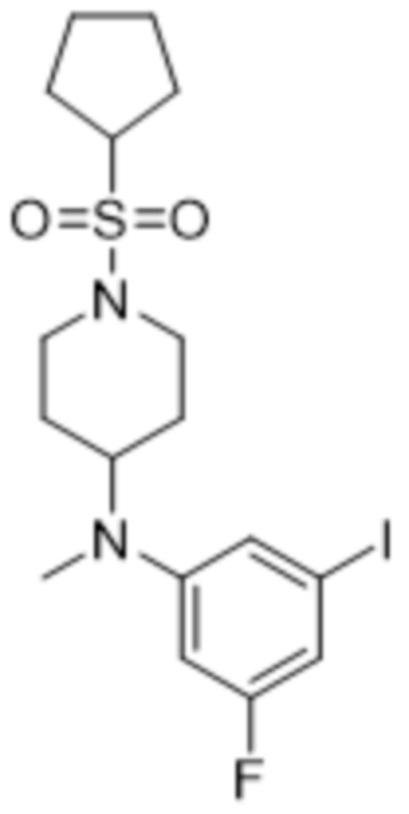
1-(Циклопентилсульфонил)-N-(3-фтор-5-йодфенил)-N-метилпиперидин-4-амин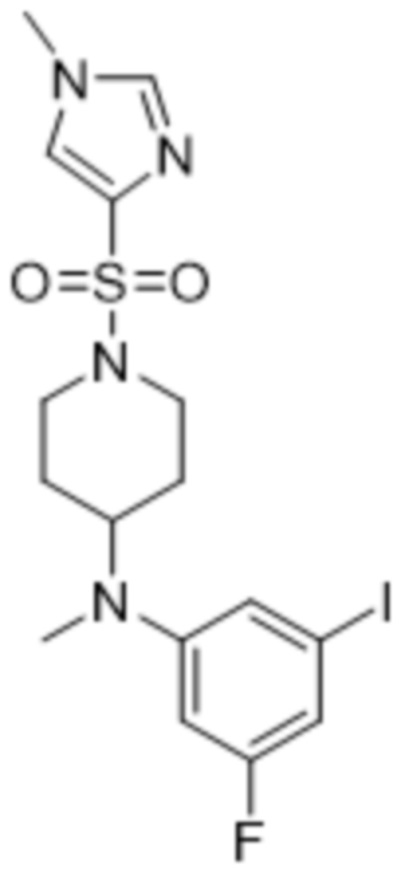
N-(3-Фтор-5-йодфенил)-N-метил-1-((1-метил-1H-имидазол-4-ил)сульфонил)пиперидин-4-амин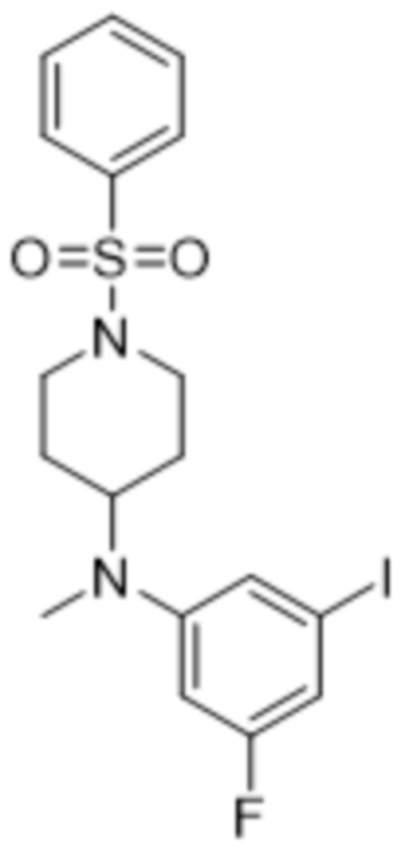
N-(3-Фтор-5-йодфенил)-N-метил-1-(фенилсульфонил)пиперидин-4-амин
1-(4-(((3-Фтор-5-йодфенил)(метил)амино)метил)пиперидин-1-ил)этан-1-он
3-Фтор-5-йод-N-метил-N-((1-(метилсульфонил)пиперидин-4-ил)метил)анилин
Соединения 177-187 получали из указанных выше промежуточных соединений с применением общих способов из процедур 23, 24 и 25.
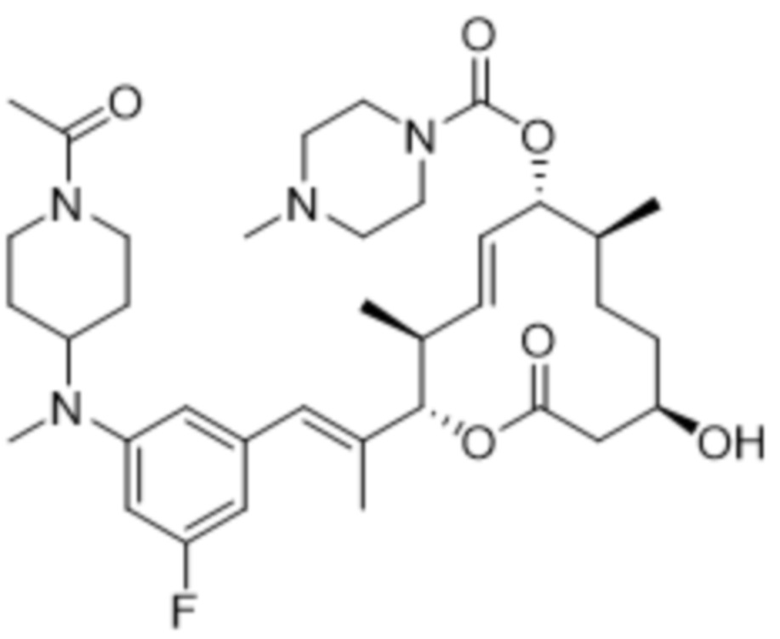
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-[(1-Ацетилпиперидин-4-ил)метиламино]-5-фторфенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилат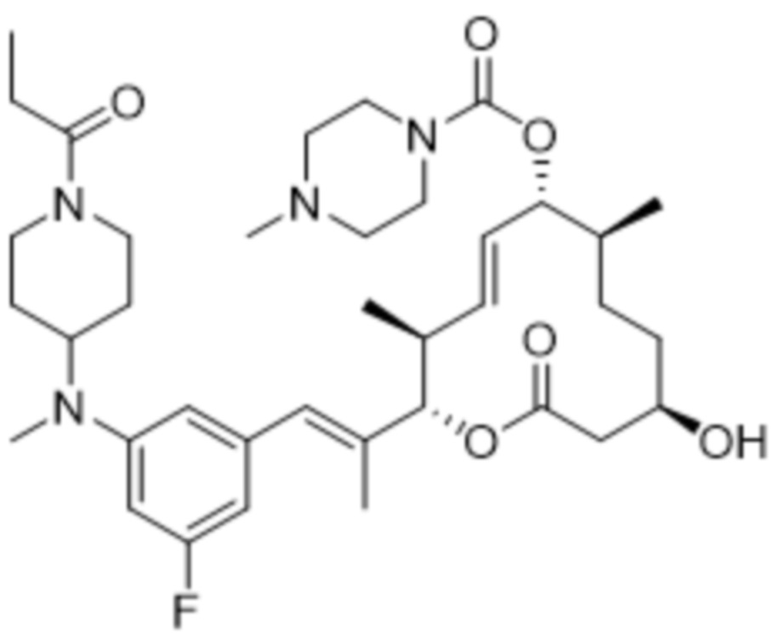
[(2S,3S,4E,6R,7R,10S)-2-[(E)-1-[3-Фтор-5-[метил-(1-пропаноилпиперидин-4-ил)амино]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилат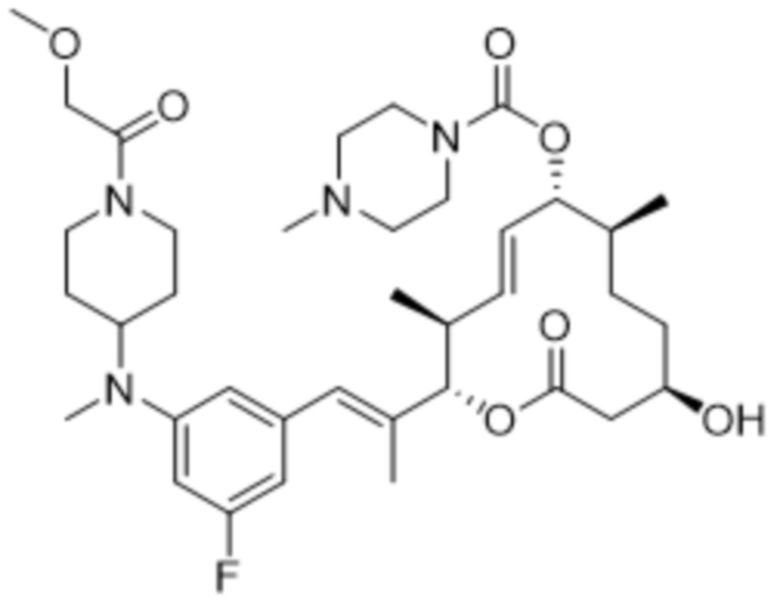
[(2S,3S,4E,6R,7R,10S)-2-[(E)-1-[3-Фтор-5-[[1-(2-метоксиацетил)пиперидин-4-ил]метиламино]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилат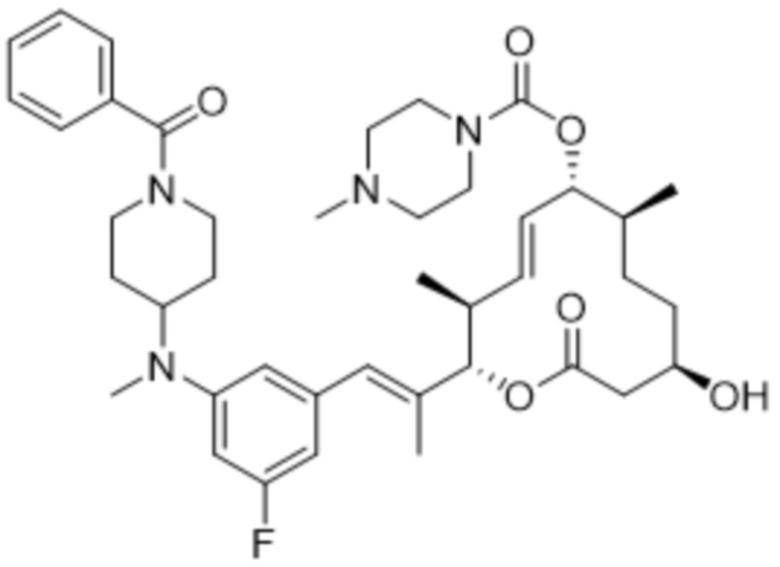
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-[(1-Бензоилпиперидин-4-ил)-метиламино]-5-фторфенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилат
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-Фтор-5-[метил-[1-(2,2,2-трифторацетил)пиперидин-4-ил]амино]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилат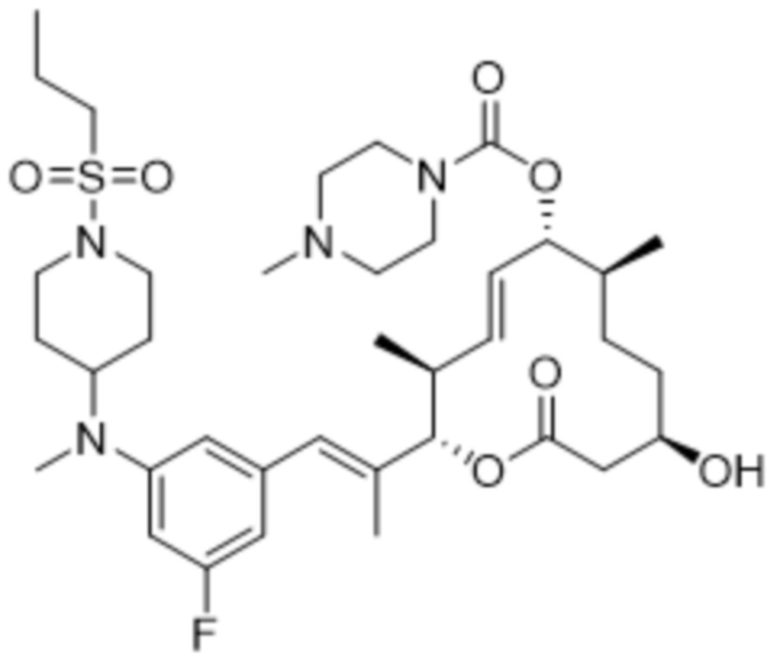
[(2S,3S,4E,6R,7R,10S)-2-[(E)-1-[3-Фтор-5-[метил-(1-пропилсульфонилпиперидин-4-ил)амино]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилат
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-[(1-циклопентилсульфонилпиперидин-4-ил)метиламино]-5-фторфенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилат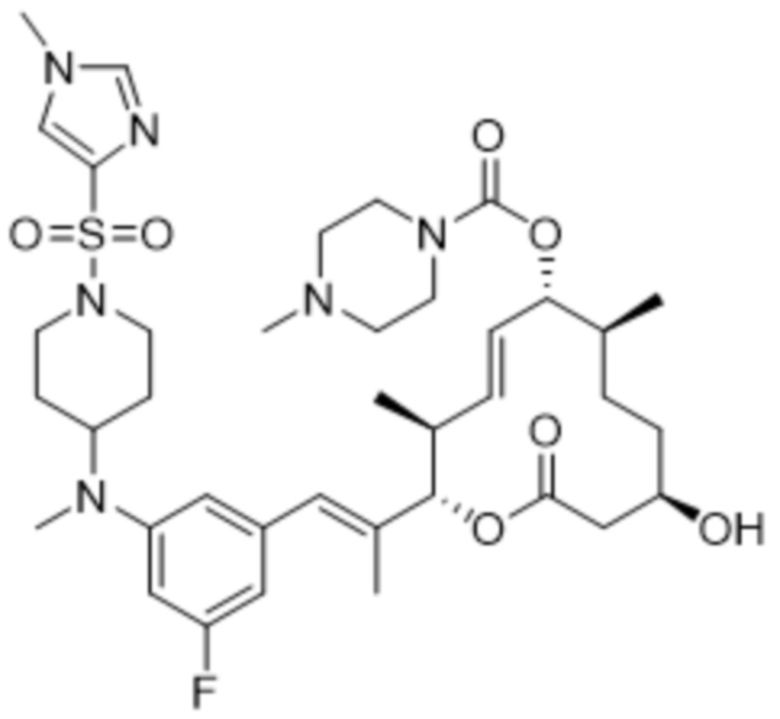
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-Фтор-5-[метил-[1-(1-метилимидазол-4-ил)сульфонилпиперидин-4-ил]амино]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилат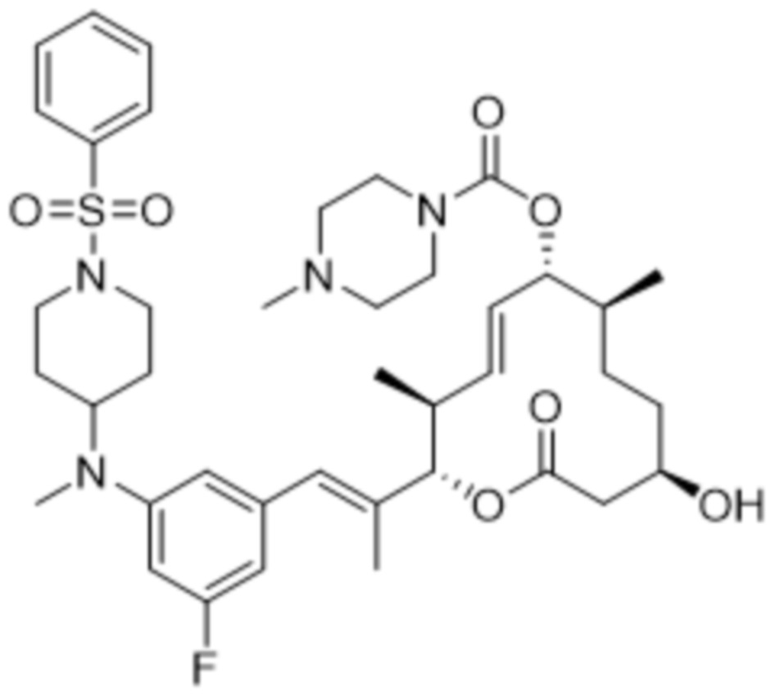
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-[[1-(Бензолсульфонил)пиперидин-4-ил]метиламино]-5-фторфенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилат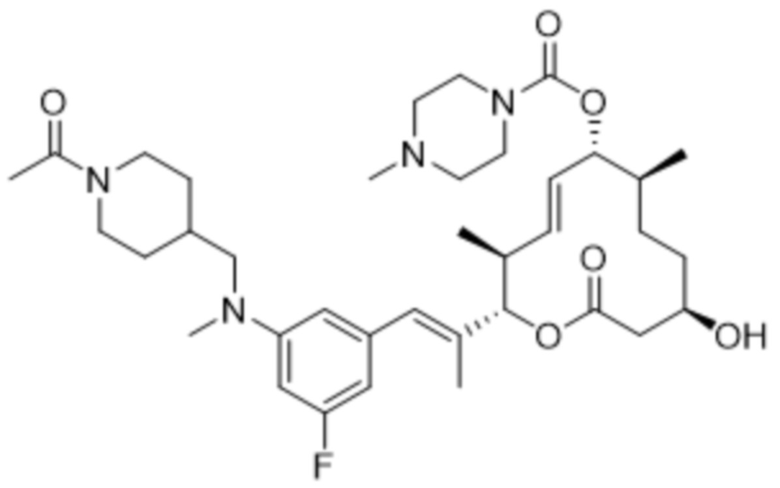
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-[(1-Ацетилпиперидин-4-ил)метилметиламино]-5-фторфенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилат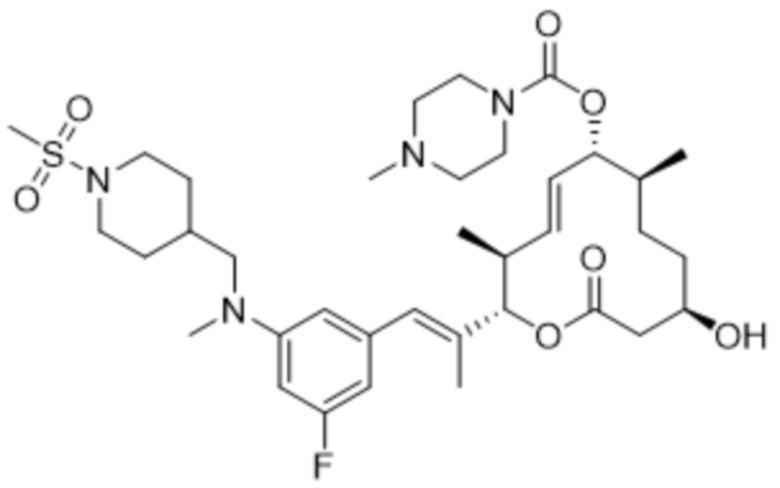
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-Фтор-5-[метил-[(1-метилсульфонилпиперидин-4-ил)метил]амино]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилат
Синтез промежуточных соединений на основе пиперидина
Процедура 27

Загружали раствор пиперидина (050) (50 мг, 0,15 ммоль) и оксазол-5-карбоновой кислоты (25,4 мг, 0,224 ммоль) в DMF (2 мл) во флакон объемом 4 мл с магнитной мешалкой. Добавляли основание Хунига (0,078 мл, 0,449 ммоль), EDC (60,2 мг, 0,314 ммоль) и HOBT (48,1 мг, 0,314 ммоль). Полученный раствор перемешивали в течение ночи при комнатной температуре и разделяли между водой (10 мл) и EtOAc (10 мл). Раствор экстрагировали с помощью EtOAc (3 × 10 мл), промывали водой (10 мл), высушивали с помощью MgSO4, фильтровали и выпаривали в вакууме. Неочищенный материал в сухом виде загружали на 2 г диоксида кремния и очищали с помощью колоночной хроматографии (ISCO с нормальной фазой, колонка Gold на 12 г, градиент MeOH/DCM от 0 до 20%) для выделения (4-((3-фтор-5-йодфенил)(метил)амино)пиперидин-1-ил)(оксазол-5-ил)метанона (052) (24 мг, 0,056 ммоль, 37%). 1H ЯМР (400 МГц, CDCl3) δ ppm 1,68-1,85 (m, 2 H) 1,85-1,96 (m, 2 H) 2,77 (s, 3 H) 2,99-3,51 (m, 2 H) 3,82 (tt, J=11,56, 4,06 Гц, 1 H) 4,37-5,02 (m, 2 H) 6,45 (dt, J=12,55, 2,26 Гц, 1 H) 6,81-6,87 (m, 1 H) 6,91 (s, 1 H) 7,64 (s, 1 H) 7,96-8,00 (m, 1 H). LCMS: 430,3 [M+H]+.
Следующие промежуточные соединения также синтезировали в соответствии с общими способами из процедуры 27.

(4-((3-Фтор-5-йодфенил)(метил)амино)пиперидин-1-ил)(пиразин-2-ил)метанон
(4-((3-Фтор-5-йодфенил)(метил)амино)пиперидин-1-ил)(1-метил-1H-имидазол-4-ил)метанон
Соединения 188-190 получали из указанных выше промежуточных соединений с применением общих способов из процедуры 25.
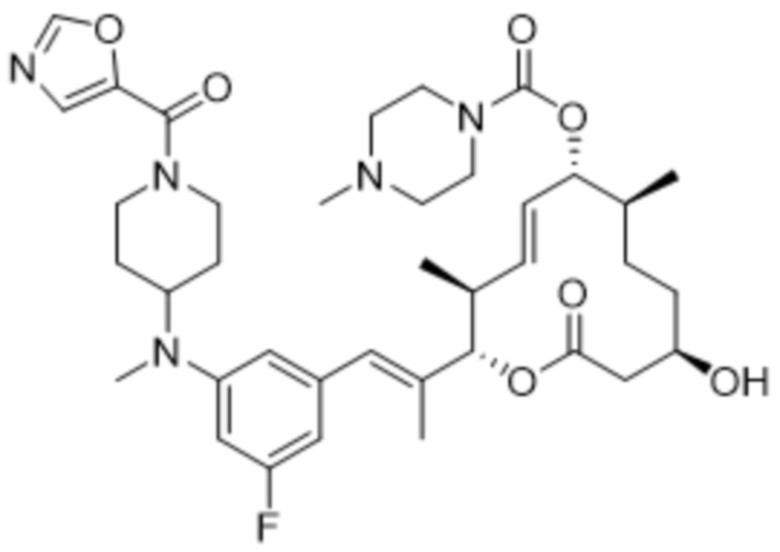
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-Фтор-5-[метил-[1-(1,3-оксазол-5-карбонил)пиперидин-4-ил]амино]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилат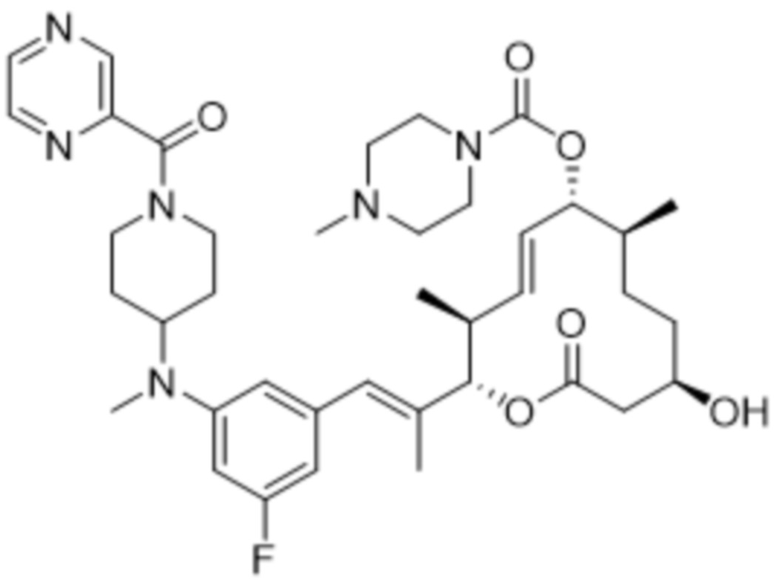
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-Фтор-5-[метил-[1-(пиразин-2-карбонил)пиперидин-4-ил]амино]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилат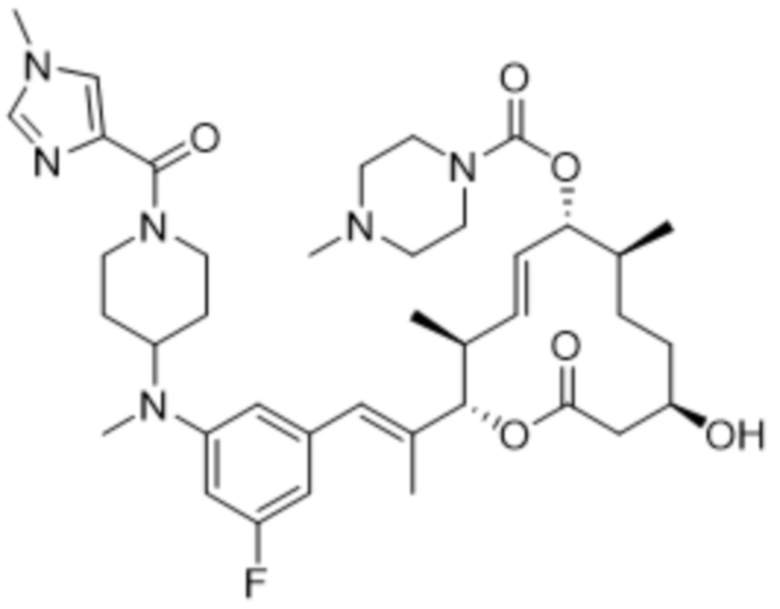
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-Фтор-5-[метил-[1-(1-метилимидазол-4-карбонил)пиперидин-4-ил]амино]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилат
Синтез промежуточных соединений на основе пиперидина
Процедура 28

Загружали раствор соли HCl и N-(3-фтор-5-йодфенил)-N-метилпиперидин-4-амина (050) (50 мг, 0,135 ммоль) в дихлорметане (2 мл) во флакон объемом 5 мл с магнитной мешалкой. Добавляли N-этил-N-изопропилпропан-2-амин (0,035 мл, 0,202 ммоль), затем - 2-изоцианатопропан (17,22 мг, 0,202 ммоль). Полученный раствор перемешивали в течение ночи при комнатной температуре и выпаривали в вакууме. Неочищенный продукт в сухом виде загружали на 2 г диоксида кремния и очищали с помощью колоночной хроматографии (ISCO с нормальной фазой, колонка Gold на 24 г, градиент EtOAc/гексаны от 0 до 100%) с получением 4-((3-фтор-5-йодфенил)(метил)амино)-N-изопропилпиперидин-1-карбоксамида (053) (45 мг, 0,107 ммоль, 80%). 1H ЯМР (400 МГц, CDCl3) δ ppm 1,19 (d, J=6,53 Гц, 6 H) 1,66-1,80 (m, 4 H) 2,75 (s, 3 H) 2,81-2,92 (m, 2 H) 3,57-3,73 (m, 1 H) 4,00 (dd, J=13,49, 6,59 Гц, 1 H) 4,08 (dt, J=13,40, 2,09 Гц, 2 H) 4,27 (br d, J=7,03 Гц, 1 H) 6,41 (dt, J=12,67, 2,26 Гц, 1 H) 6,75-6,82 (m, 1 H) 6,86 (s, 1 H). LCMS: 420,7 [M+H]+.
Следующие промежуточные соединения также синтезировали в соответствии с общими способами из процедуры 28.
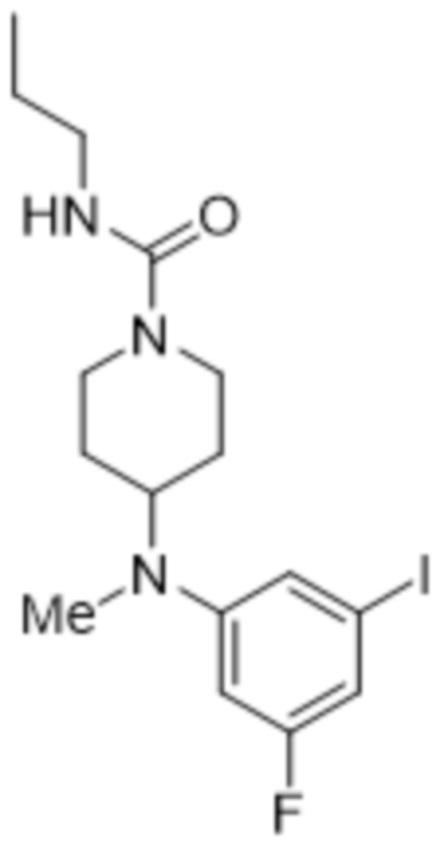
4-((3-Фтор-5-йодфенил)(метил)амино)-N-пропилпиперидин-1-карбоксамид
4-((3-Фтор-5-йодфенил)(метил)амино)-N-фенилпиперидин-1-карбоксамид
Соединения 191-193 получали из указанных выше промежуточных соединений с применением общих способов из процедуры 25.

[(2S,3S,4E,6R,7R,10S)-2-[(E)-1-[3-Фтор-5-[метил-[1-(пропан-2-илкарбамоил)пиперидин-4-ил]амино]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилат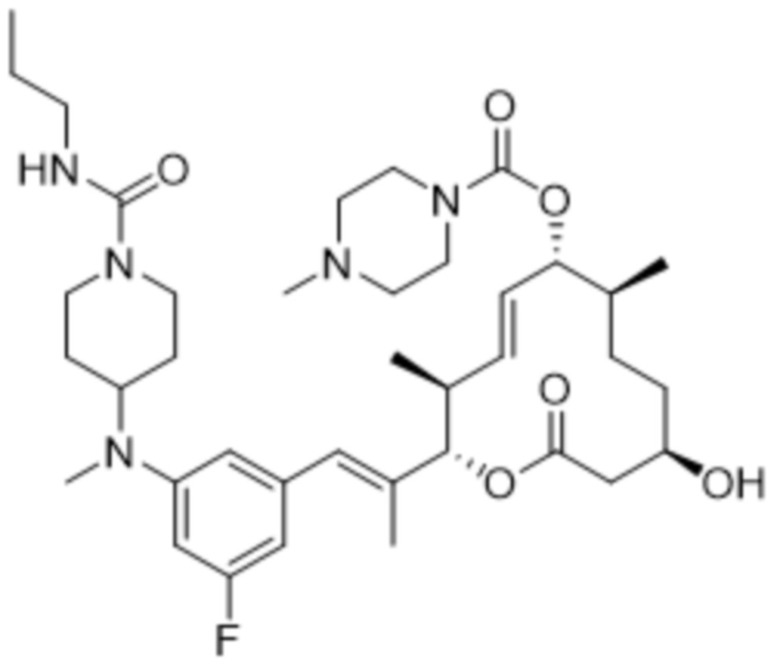
[(2S,3S,4E,6R,7R,10S)-2-[(E)-1-[3-Фтор-5-[метил-[1-(пропилкарбамоил)пиперидин-4-ил]амино]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилат
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-Фтор-5-[метил-[1-(фенилкарбамоил)пиперидин-4-ил]амино]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилат
Синтез промежуточных соединений на основе пиперидина
Процедура 29
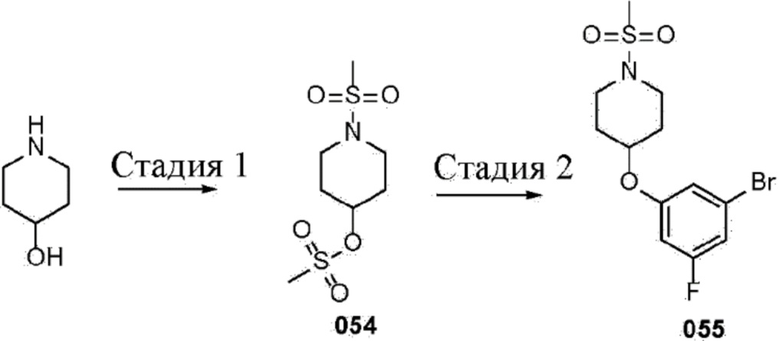
Стадия 1. Загружали раствор пиперидин-4-ола (200 мг, 1,977 ммоль) в DCM (5 мл) в круглодонную колбу объемом 25 мл с магнитной мешалкой. Добавляли основание Хунига (1,036 мл, 5,932 ммоль), затем - метансульфонилхлорид (0,339 мл, 4,35 ммоль). Полученный раствор перемешивали в течение ночи при комнатной температуре и реакцию гасили водой (10 мл). Полученный раствор экстрагировали с помощью DCM (3 × 10 мл), промывали солевым раствором (10 мл), высушивали с помощью MgSO4, фильтровали и выпаривали в вакууме с получением 1-(метилсульфонил)пиперидин-4-илметансульфоната (054) (404 мг, 1,571 ммоль).
Стадия 2. Загружали раствор 3-бром-5-фторфенола (200 мг, 1,047 ммоль) и 1-(метилсульфонил)пиперидин-4-илметансульфоната (054) (404 мг, 1,571 ммоль) в DMF (5 мл) во флакон объемом 10 мл с магнитной мешалкой. Добавляли карбонат цезия (682 мг, 2,094 ммоль). Полученную дисперсию нагревали до 70°C и перемешивали в течение ночи. Реакционную смесь охлаждали до комнатной температуры и разделяли между EtOAc (10 мл) и водой (10 мл). Раствор экстрагировали с помощью EtOAc (3 × 10 мл), промывали солевым раствором (10 мл), высушивали с помощью MgSO4, фильтровали и выпаривали в вакууме. Неочищенный продукт в сухом виде загружали на 2 г диоксида кремния и очищали с помощью колоночной хроматографии (ISCO с нормальной фазой, колонка Gold на 24 г, градиент EtOAc/гексаны от 0 до 60%) с выделением 4-(3-бром-5-фторфенокси)-1-(метилсульфонил)пиперидина (055) (108 мг, 0,307 ммоль, 29%). 1H ЯМР (400 МГц, CDCl3) δ ppm 1,97-2,08 (m, 4 H) 2,84 (s, 3 H) 3,36-3,43 (m, 4 H) 4,48-4,58 (m, 1 H) 6,59 (dt, J=10,45, 2,24 Гц, 1 H) 6,87-6,93 (m, 2 H). LCMS: 353,1 [M+H]+.
Следующее промежуточное соединение также синтезировали в соответствии с общими способами из процедуры 29.
6-Бром-1-(4,4-дифторциклогексил)-4-фтор-1H-индазол
Соединения 194-196 получали из указанных выше промежуточных соединений с применением общих способов из процедуры 25.

[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-Фтор-5-(1-метилсульфонилпиперидин-4-ил)оксифенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилат
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[1-(4,4-Дифторциклогексил)-4-фториндазол-6-ил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилат
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[4-Фтор-1-(1-метилсульфонилпиперидин-4-ил)индазол-6-ил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилат
Соединения 197-207 получали в соответствии с общими способами из процедур 30 и 31.
Синтез промежуточного соединения на основе сульфонилпирролидина
Процедура 30
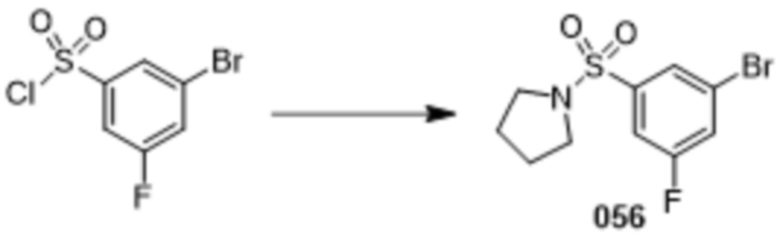
В перемешиваемый раствор 3-бром-5-фторбензол-1-сульфонилхлорида (40 мг, 0,146 ммоль) в дихлорметане (471 мкл) добавляли пирролидин (30,2 мкл, 0,366 ммоль). Реакционный раствор перемешивали при комнатной температуре в течение ночи. Реакционный раствор очищали с помощью колоночной хроматографии с градиентом элюирования EtOAc/гексаны от 0 до 100%. В результате получали 1-((3-бром-5-фторфенил)сульфонил)пирролидин (53,2 мг, 118%) в виде белого твердого вещества. LCMS (ESI, масса/заряд), 308,0, 310,0 [M+H]+. 1H ЯМР (400 МГц, CDCl3) δ 1,81-1,89 (m, 4H), 3,27-3,34 (m, 4H), 7,50 (tdd, J=7,53, 7,53, 2,38, 1,51 Гц, 2H), 7,76-7,83 (m, 1H).
Синтез продуктов боронатного сочетания
Процедура 31
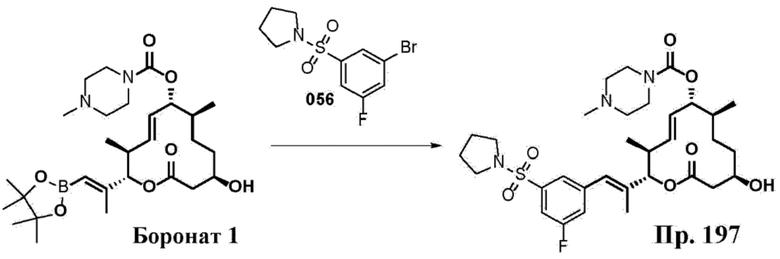
В перемешиваемый раствор бороната 1 (15 мг, 0,028 ммоль) и 1-((3-бром-5-фторфенил)сульфонил)пирролидина (056) (12,11 мг, 0,039 ммоль) в 480 мкл 1,4-диоксана и 10,11 мкл воды добавляли карбонат калия (23,27 мг, 0,168 ммоль) и тетракис-трифенилфосфинпалладий (16,21 мг, 0,014 ммоль). Смесь дегазировали и нагревали до 95°C в течение 2 ч. После завершения реакции, которое показывали с помощью UPLC, смесь охлаждали до комнатной температуры, фильтровали и очищали с помощью колоночной хроматографии с градиентом элюирования от 0 до 100% EtOAc/гексаны, затем с градиентом 0-20% MeOH/DCM. В результате получали соединение из примера 197 (8,1 мг, 45%) в виде бесцветного масла.
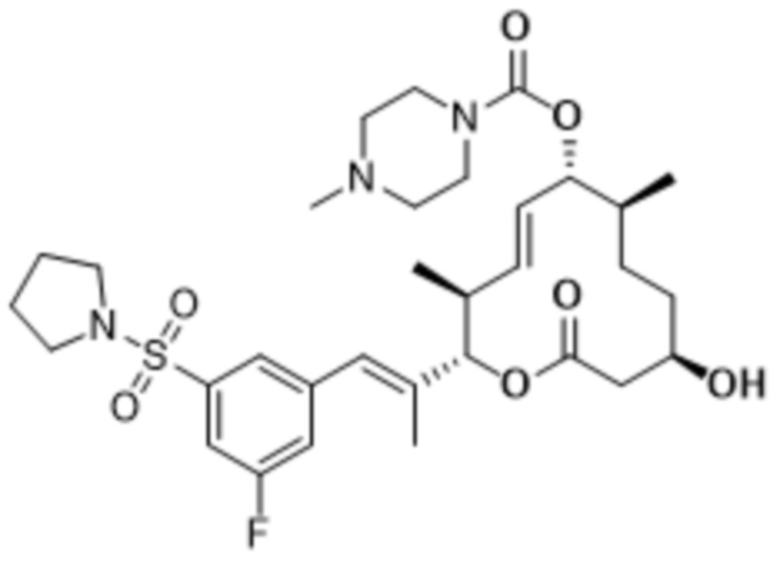
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-(3-Фтор-5-пирролидин-1-илсульфонилфенил)проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилат
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-(Азетидин-1-илсульфонил)фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилат
[(2S,3S,4E,6R,7S,10R)-10-Гидрокси-2-[(E)-1-[3-[(3R)-3-гидроксипирролидин-1-ил]сульфонилфенил]проп-1-ен-2-ил]-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилат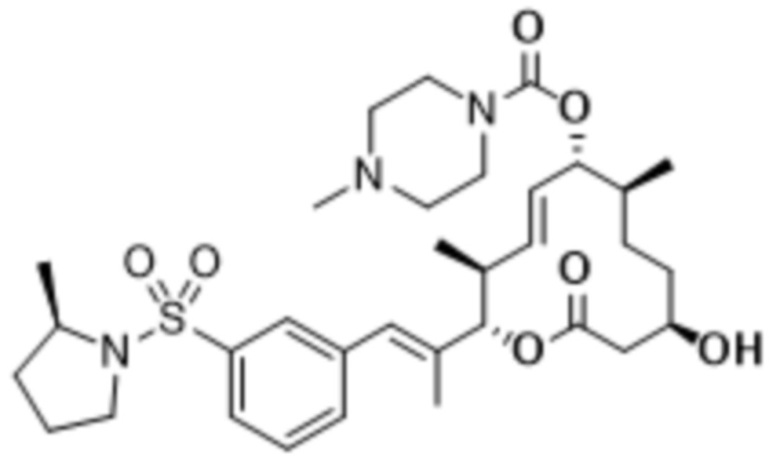
[(2S,3S,4E,6R,7R,10S)-10-Гидрокси-3,7-диметил-2-[(E)-1-[3-[(2S)-2-метилпирролидин-1-ил]сульфонилфенил]проп-1-ен-2-ил]-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилат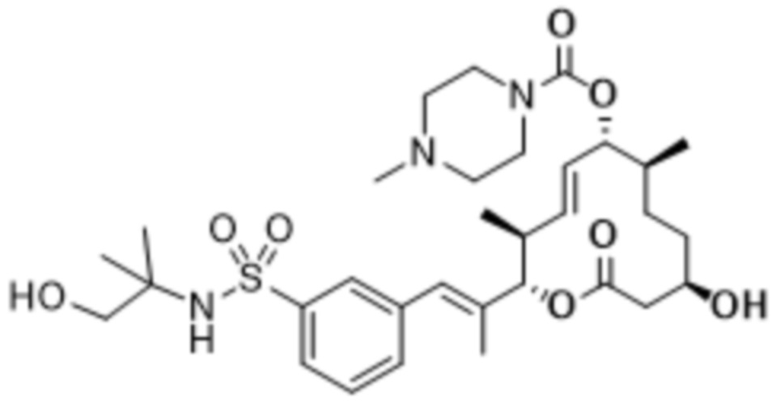
[(2S,3S,4E,6R,7S,10R)-10-Гидрокси-2-[(E)-1-[3-[(1-гидрокси-2-метилпропан-2-ил)сульфамоил]фенил]проп-1-ен-2-ил]-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилат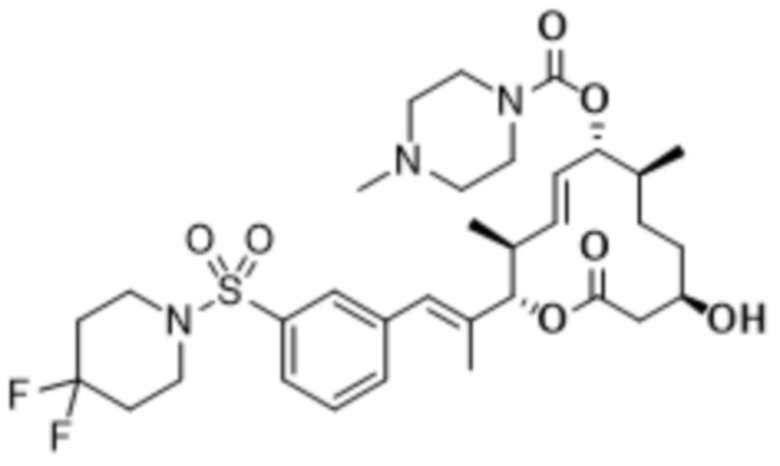
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-(4,4-Дифторпиперидин-1-ил)сульфонилфенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилат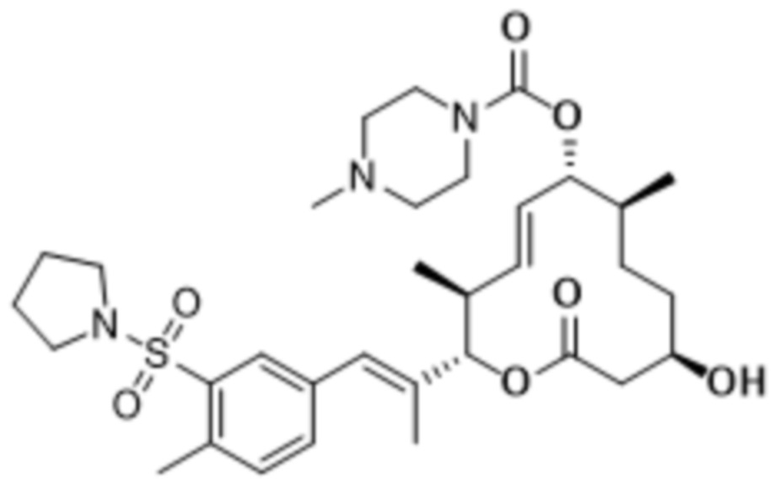
[(2S,3S,4E,6R,7S,10R)-10-Гидрокси-3,7-диметил-2-[(E)-1-(4-метил-3-пирролидин-1-илсульфонилфенил)проп-1-ен-2-ил]-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилат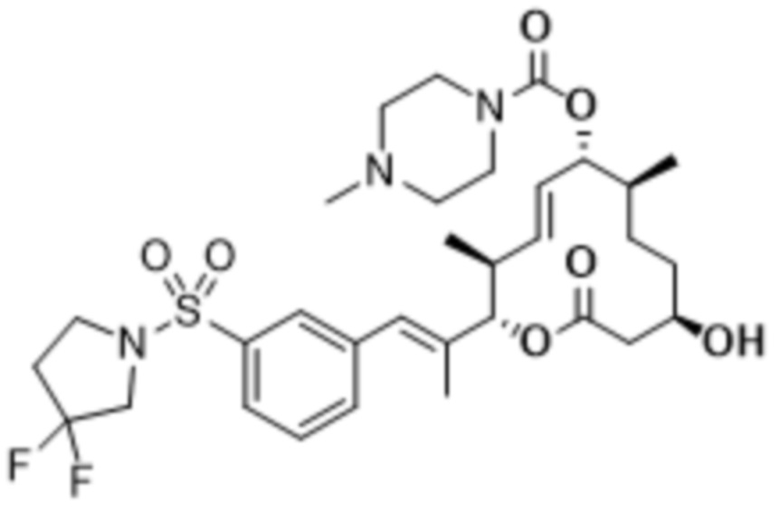
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-(3,3-Дифторпирролидин-1-ил)сульфонилфенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилат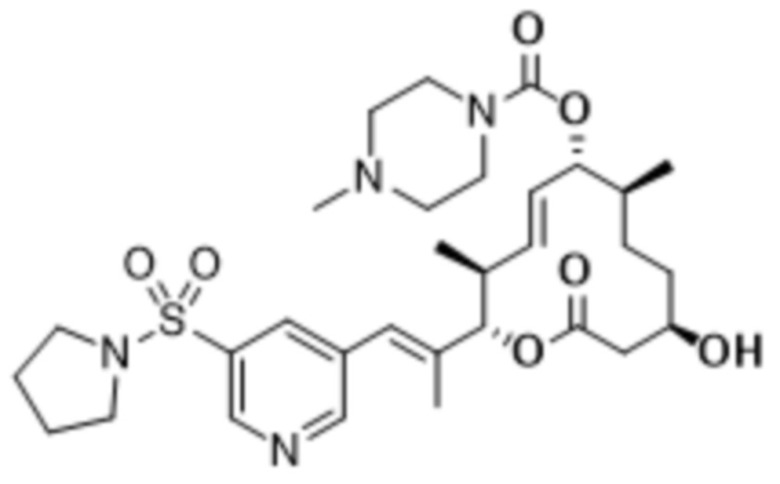
[(2S,3S,4E,6R,7S,10R)-10-Гидрокси-3,7-диметил-12-оксо-2-[(E)-1-(5-пирролидин-1-илсульфонилпиридин-3-ил)проп-1-ен-2-ил]-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилат
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-(3,3-Дифторазетидин-1-ил)сульфонилфенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилат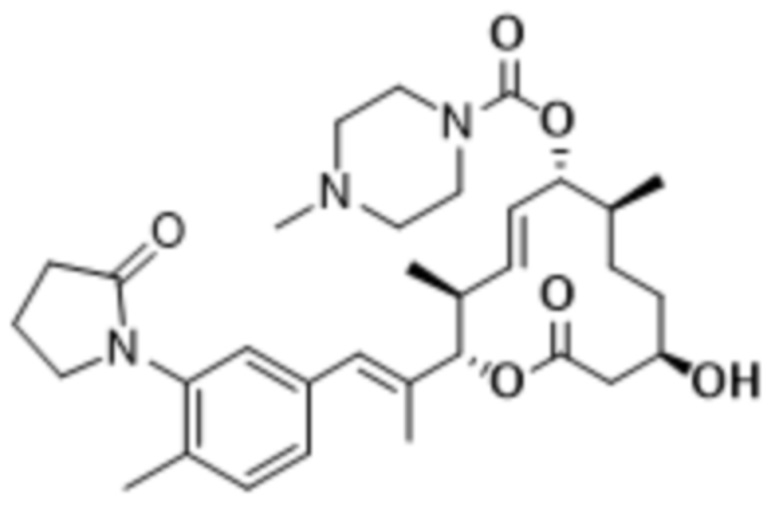
[(2S,3S,4E,6R,7S,10R)-10-Гидрокси-3,7-диметил-2-[(E)-1-[4-метил-3-(2-оксопирролидин-1-ил)фенил]проп-1-ен-2-ил]-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилат
Соединения 208-218 получали в соответствии с общими способами из процедуры 32.
Синтез продуктов боронатного сочетания
Процедура 32
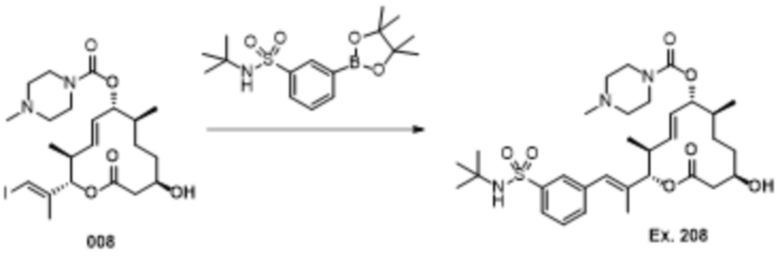
В перемешиваемый раствор йодида (008) (15 мг, 0,028 ммоль) и N-(трет-бутил)-3-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)бензолсульфонамида (11,43 мг, 0,034 ммоль) в 426 мкл п-диоксана добавляли оксид серебра (19,51 мг, 0,084 ммоль) и тетракис(трифенилфосфин)палладий(0) (3,24 мг, 2,807 мкмоль). Смесь дегазировали и нагревали до 80°C в течение 90 минут. После завершения реакции, которое показывали с помощью UPLC, реакционную смесь охлаждали до комнатной температуры, фильтровали и концентрировали. В результате очистки с помощью колоночной хроматографии с градиентом элюирования от 0 до 20% MeOH/DCM получали соединение из примера 208 (23,3 мг, ~100%) в виде бесцветного масла.

[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-(трет-Бутилсульфамоил)фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилат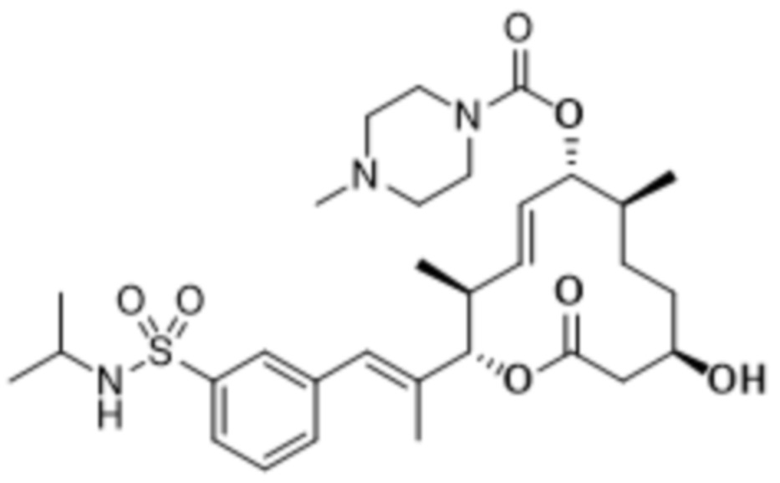
[(2S,3S,4E,6R,7R,10S)-10-Гидрокси-3,7-диметил-12-оксо-2-[(E)-1-[3-(пропан-2-илсульфамоил)фенил]проп-1-ен-2-ил]-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилат
[(2S,3S,4E,6R,7R,10S)-2-[(E)-1-[3-(Этилсульфамоил)фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилат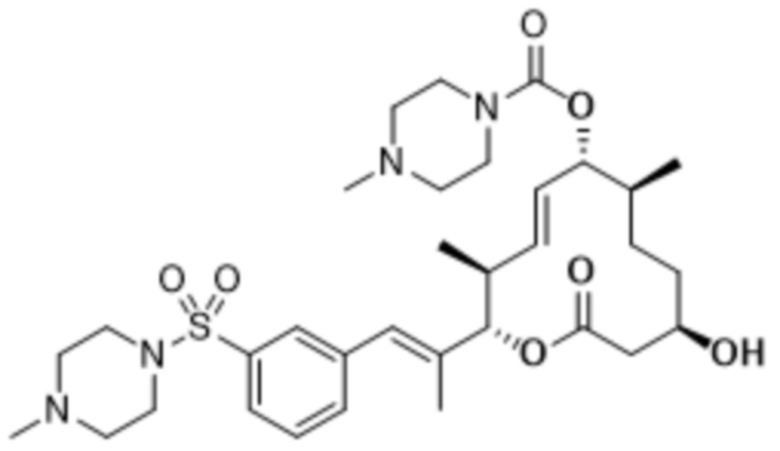
[(2S,3S,4E,6R,7S,10R)-10-Гидрокси-3,7-диметил-2-[(E)-1-[3-(4-метилпиперазин-1-ил)сульфонилфенил]проп-1-ен-2-ил]-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилат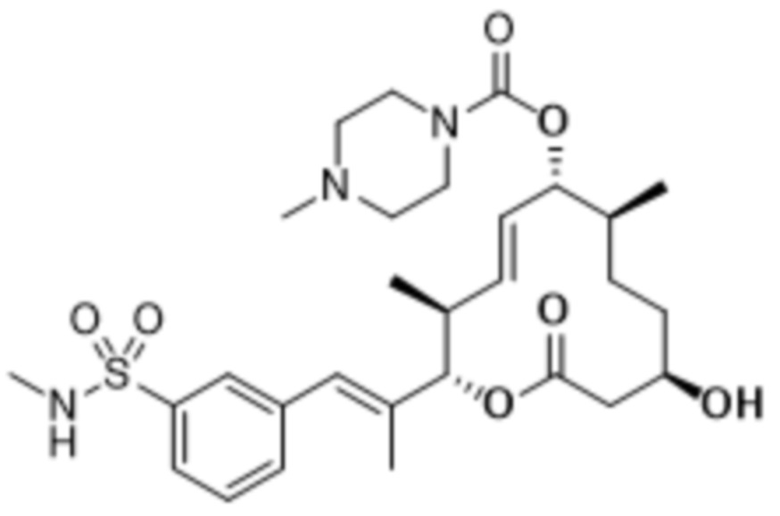
[(2S,3S,4E,6R,7R,10S)-10-гидрокси-3,7-диметил-2-[(E)-1-[3-(метилсульфамоил)фенил]проп-1-ен-2-ил]-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилат
[(2S,3S,4E,6R,7S,10R)-10-Гидрокси-3,7-диметил-12-оксо-2-[(E)-1-(3-пиперидин-1-илсульфонилфенил)проп-1-ен-2-ил]-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилат
[(2S,3S,4E,6R,7S,10R)-10-Гидрокси-3,7-диметил-12-оксо-2-[(E)-1-(3-пирролидин-1-илсульфонилфенил)проп-1-ен-2-ил]-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилат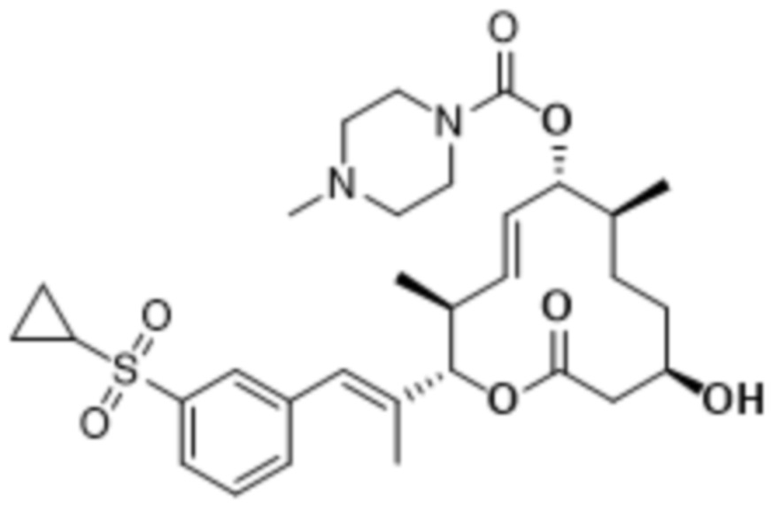
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-(3-Циклопропилсульфонилфенил)проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилат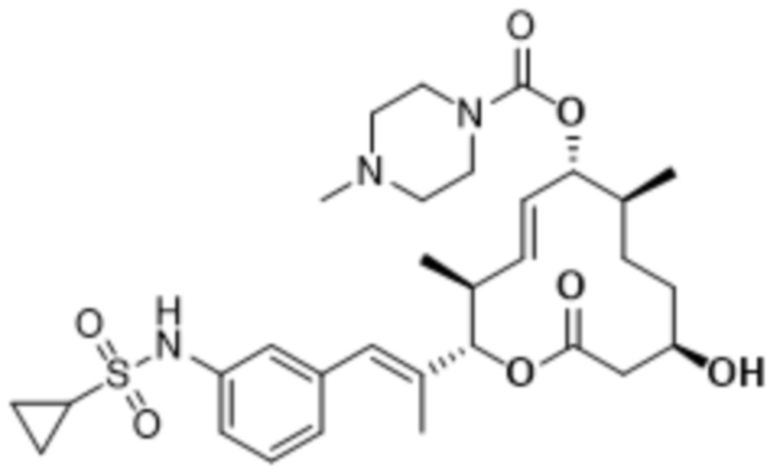
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-(Циклопропилсульфониламино)фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилат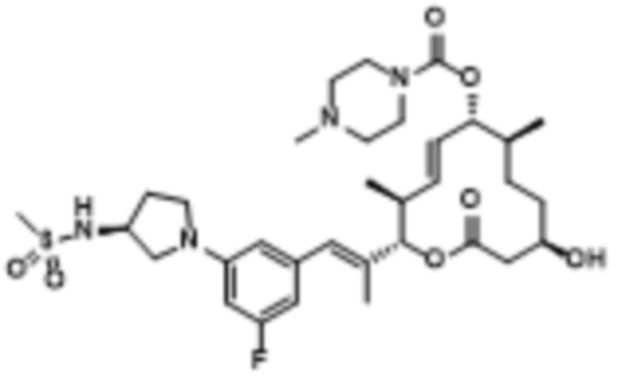
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-Фтор-5-[(3S)-3-(метансульфонамидо)пирролидин-1-ил]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилат
[(2S,3S,4E,6R,7R,10S)-2-[(E)-1-[3-Фтор-5-[(3S)-3-[(2-метоксиацетил)амино]пирролидин-1-ил]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилат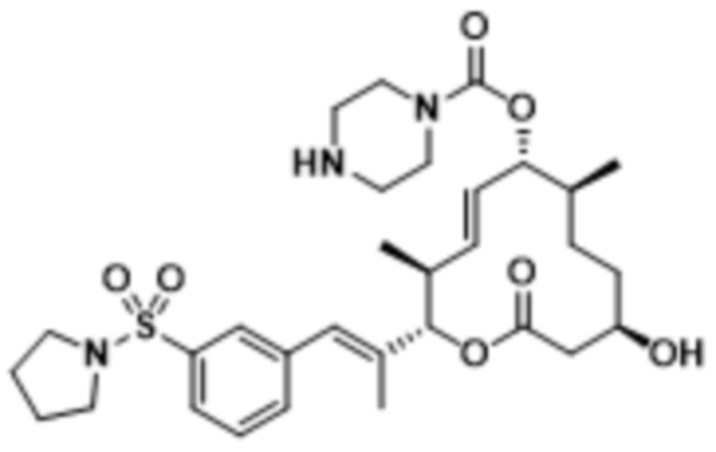
(2S,3S,6R,7S,10R, E)-10-Гидрокси-3,7-диметил-12-оксо-2-((E)-1-(3-(пирролидин-1-илсульфонил)фенил)проп-1-ен-2-ил)оксациклододец-4-ен-6-илпиперазин-1-карбоксилат
Соединения 219 и 220 (таблицы 17 и 18) синтезировали в соответствии с общими способами из процедур 33 и 34.
Процедура 33

Стадия 1. Во флакон загружали DMAP (0,117 г, 0,957 ммоль), DCM (4,78 мл, 0,957 ммоль) (4R,7S,8R,11S,12S, E)-4-((трет-бутилдиметилсилил)окси)-8-гидрокси-12-((E)-1-йодпроп-1-ен-2-ил)-7,11-диметилоксациклододец-9-ен-2-он (005) (0,5 г, 0,957 ммоль), 4-нитрофенилхлорформиат (0,193 г, 0,957 ммоль), их объединяли и перемешивали в течение ночи. Добавляли 1-метилпиперазин (0,191 мл, 1,722 ммоль) и и затем реакционную смесь перемешивали в течение 1 ч. Реакционную смесь непосредственно загружали в колонку с силикагелем и хроматографировали с получением с получением (2S,3S,6R,7S,10R, E)-10-((трет-бутилдиметилсилил)окси)-2-((E)-1-йодпроп-1-ен-2-ил)-3,7-диметил-12-оксооксациклододец-4-ен-6-ил-4-метилпиперазин-1-карбоксилата (007) (0,567 г, 0,874 ммоль, выход 91%). LCMS (ESI, масса/заряд), 649,4 [M+H]+.
Стадия 2. Объединяли оксид серебра (0,098 г, 0,421 ммоль), трет-бутил-3-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-5,6-дигидропиридин-1(2H)-карбоксилат (0,052 г, 0,168 ммоль), (2S,3S,6R,7S,10R, E)-10-гидрокси-2-((E)-1-йодпроп-1-ен-2-ил)-3,7-диметил-12-оксооксациклододец-4-ен-6-ил-4-метилпиперазин-1-карбоксилат (007) (0,045 г, 0,084 ммоль), 1,4-диоксан (0,842 мл, 0,084 ммоль) и барботировали азотом в течение 10 минут, после чего добавляли тетракис(трифенилфосфин)палладий(0) (0,019 г, 0,017 ммоль) и барботировали азотом в течение 10 минут и перемешивали при 90°C в течение 1,5 ч. Реакционную смесь фильтровали, концентрировали и хроматографировали с получением соединения из примера 219 (2S,3S,6R,7S,10R, E)-2-((E)-1-(1-(трет-бутоксикарбонил)-1,2,5,6-тетрагидропиридин-3-ил)проп-1-ен-2-ил)-10-гидрокси-3,7-диметил-12-оксооксациклододец-4-ен-6-ил-4-метилпиперазин-1-карбоксилата (12 мг, 0,020 ммоль, выход 24,16%).
[(2S,3S,4E,6R,7S,10R)-10-Гидрокси-3,7-диметил-2-[(E)-1-[1-[(2-метилпропан-2-ил)оксикарбонил]-3,6-дигидро-2H-пиридин-5-ил]проп-1-ен-2-ил]-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилат
Процедура 34
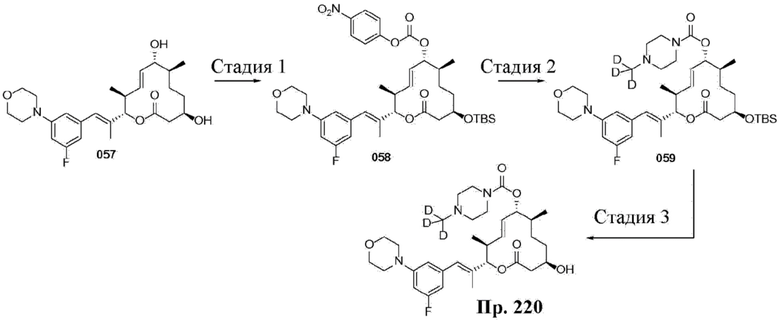
Стадия 1. В раствор спирта (057) (265 мг, 0,423 ммоль, выход 89%) в DCM (2,388 мл, 0,478 ммоль) добавляли DMAP (0,058 г, 0,478 ммоль), основание Хунига (0,417 мл, 2,388 ммоль), 4-нитрофенилхлорформиат (0,173 г, 0,86 ммоль). Полученную желтоватую суспензию перемешивали в течение 12 ч., до исчезновения SM, реакционную смесь концентрировали и хроматографировали с получением карбоната. Затем продукт растворяли в метаноле (4,78 мл, 0,478 ммоль), добавляли тозиловую кислоту (0,182 г, 0,955 ммоль) и перемешивали в течение 1 часа. Добавляли TEA (1 мл) и перемешивали в течение 10 минут. Затем реакционную смесь концентрировали до сухого состояния и добавляли DCM (6 мл) и насыщенный раствор NaHCO3 (2 мл), и перемешивали и экстрагировали. Затем водный слой обратно экстрагировали с помощью DCM (3×). Органические слои объединяли, высушивали над безводным Na2SO4 и концентрировали до сухого состояния с получением (058) (265 мг, 0,423 ммоль, выход 89%). LCMS (ESI, масса/заряд), 627,3 [M+H] 1H ЯМР (400 МГц, CDCl3) δ ppm 0,06-0,12 (m, 6 H) 0,41-0,42 (m, 1 H) 0,85-0,89 (m, 4 H) 0,91 (s, 10 H) 0,97-1,05 (m, 6 H) 1,09-1,14 (m, 3 H) 1,59-1,66 (m, 2 H) 1,68-1,77 (m, 1 H) 1,84-1,89 (m, 3 H) 1,95-2,02 (m, 1 H) 2,04 (s, 2 H) 2,36-2,44 (m, 1 H) 2,51-2,65 (m, 2 H) 3,10-3,18 (m, 4 H) 3,79-3,88 (m, 4 H) 3,88-3,95 (m, 1 H) 4,79-4,88 (m, 1 H) 5,07-5,14 (m, 1 H) 5,45-5,57 (m, 1 H) 5,63-5,74 (m,1 H) 6,42-6,55 (m, 4 H) 7,38 (d, J=9,29 Гц, 2 H) 8,24-8,30 (m, 2 H).
Стадия 2. В раствор карбоната (058) (50 мг, 0,087 ммоль) в DCM (0,434 мл, 0,087 ммоль) добавляли DMAP (10,61 мг, 0,087 ммоль), основание Хунига (0,076 мл, 0,434 ммоль), 4-нитрофенилхлорформиат (0,032 г, 0,156 ммоль). Полученную желтоватую суспензию перемешивали в течение 5 ч. и добавляли d3-N-метилпиперизин (0,027 г, 0,26 ммоль) и перемешивали до завершения реакции (1 ч.). Реакционную смесь концентрировали и хроматографировали с получением (059) (58 мг, 0,082 ммоль, выход 95%). LCMS (ESI, масса/заряд), 705,7 [M+H 1H ЯМР (400 МГц, CDCl3) d ppm 1,01 (s, 6 H) 1,23-1,32 (m, 2 H) 1,55 (s, 11 H) 1,75-1,84 (m, 1 H) 1,88 (d, J=1,25 Гц, 3 H) 1,91-2,02 (m, 1 H) 2,02-2,14 (m, 1 H) 2,20-2,46 (m, 8 H) 2,48-2,70 (m, 3 H) 3,19-3,56 (m, 11 H) 3,57-3,66 (m, 1 H) 3,68-3,80 (m, 1 H) 4,16-4,27 (m, 1 H) 4,39-4,49 (m, 1 H) 4,82-4,94 (m, 1 H) 5,24-5,29 (m, 1 H) 5,36-5,46 (m, 1 H) 5,55-5,66 (m, 1 H) 6,10-6,21 (m, 2 H) 6,34-6,42 (m, 1 H) 6,47-6,55 (m, 1 H).
Стадия 3. Объединяли карбамат (059) (58 мг, 0,082 ммоль), метанол (823 мкл, 0,082 ммоль), тозиловую кислоту (46,9 мг, 0,247 ммоль) и перемешивали в течение ночи. Затем реакционную смесь перемешивали с TEA (1 мл), концентрировали до сухого состояния и экстрагировали насыщенным раствором NaHCO3. Органический слой отделяли, высушивали над Na2SO4 и концентрировали до сухого состояния и хроматографировали (0-10% MeOH в DCM) с получением соединения из примера 220 - (2S,3S,6R,7S,10R, E)-2-((E)-1-(3-фтор-5-морфолинофенил)проп-1-ен-2-ил)-10-гидрокси-3,7-диметил-12-оксооксациклододец-4-ен-6-ил-4-(метил-d3)пиперазин-1-карбоксилата (17 мг, 0,029 ммоль, выход 35,0%).
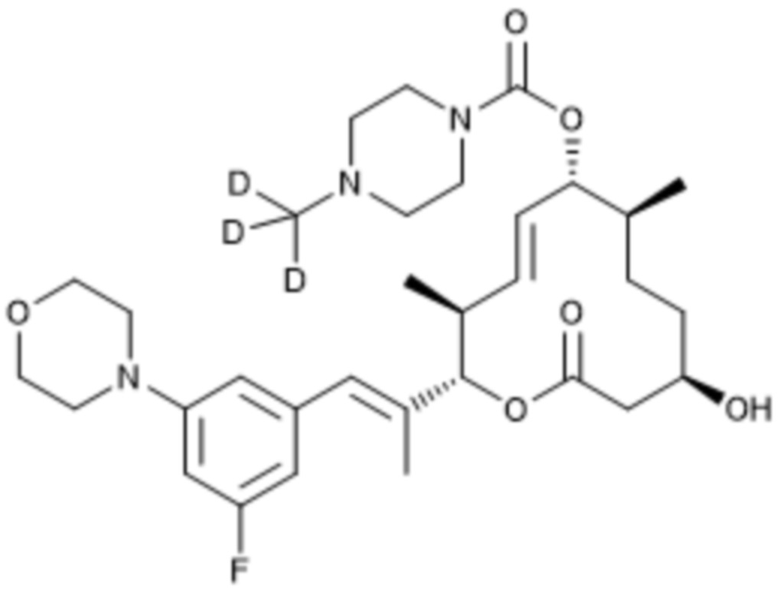
[(2R,3R,4E,6R,7S,10S)-2-[(E)-1-(3-Фтор-5-морфолин-4-илфенил)проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-(тридейтериометил)пиперазин-1-карбоксилат
Соединения 221-253 синтезировали в соответствии с общими способами из процедуры 35.
Процедура 35
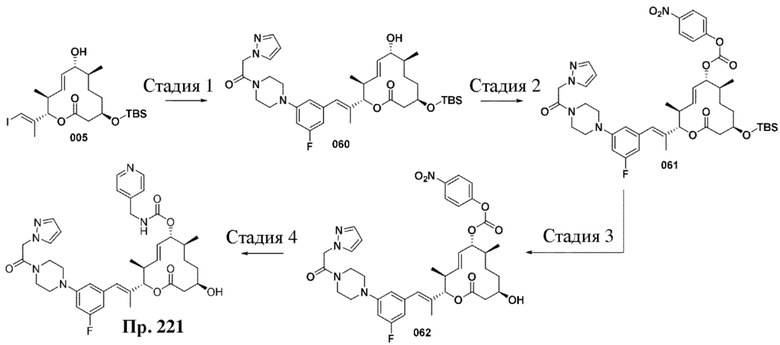
Стадия 1. Объединяли йодид (005) (0,2 г, 0,393 ммоль), 1-(4-(3-фтор-5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил)пиперазин-1-ил)-2-(1H-пиразол-1-ил)этанон (0,179 г, 0,433 ммоль), оксид серебра (0,456 г, 1,967 ммоль), 1,4-диоксан (3,93 мл, 0,393 ммоль) и барботировали азотом в течение ~5 мин. Добавляли Pd(PPh3)4 (0,068 г, 0,059 ммоль) добавляли и реакционную смесь барботировали азотом в течение ~ 5 мин. Затем реакционную смесь помещали на масляную баню при 80 C и перемешивали в течение 3 часов. Реакционную смесь фильтровали и концентрировали, и хроматографировали (от 0 до 100% EtOAc в гексане) с получением соединения (060) (179 мг, 0,268 ммоль, выход 68,0%). LCMS (ESI, масса/заряд), 683,55 [M+H].
Стадия 2. В раствор спирта (060) (0,575 г, 0,842 моль) и DCM (4,21 мл, 0,842 ммоль) добавляли DMAP (0,103 г, 0,842 ммоль), основание Хунига (0,735 мл, 4,21 ммоль), 4-нитрофенилхлорформиат (0,305 г, 1,516 ммоль). Полученную желтоватую суспензию перемешивали в течение 12 ч. до исчезновения исходного материала. Реакционную смесь концентрировали и хроматографировали с получением (061) (0,58 г, 0,684 ммоль, выход 81%). LCMS (ESI, масса/заряд), 848,5 [M+].
Стадия 3. Объединяли карбонат (061) (580 мг, 0,684 ммоль), метанол (6839 мкл, 0,684 ммоль), тозиловую кислоту (390 мг, 2,052 ммоль) и перемешивали в течение 1 часа. Добавляли триэтиламин (1 мл) и реакционную смесь перемешивали в течение 15 минут. Затем реакционную смесь концентрировали до сухого состояния и растворяли в DCM. Неочищенную реакционную смесь перемешивали с насыщенным раствором NaHCO3 в течение 10 минут и экстрагировали. Органические фазы объединяли, высушивали над безводным Na2SO4 и концентрировали до сухого состояния с получением (062) (410 мг, 0,559 ммоль, выход 82%). LCMS (ESI, масса/заряд), 734,4 [M+H].
Стадия 4. Смешивали карбонат (062) (0,015 г, 0,020 ммоль), DCM (0,204 мл, 0,020 ммоль), основание Хунига (7,14 мкл, 0,041 ммоль) и добавляли амин (0,007 г, 0,061 ммоль) и реакционные смеси перемешивали в течение ночи. Затем реакционную смесь концентрировали до сухого состояния и хроматографировали (HPLC с обращенной фазой) с получением продукта из примера 221 - (2S,3S,6R,7S,10R, E)-2-((E)-1-(3-(4-(2-(1H-пиразол-1-ил)ацетил)пиперазин-1-ил)-5-фторфенил)проп-1-ен-2-ил)-10-гидрокси-3,7-диметил-12-оксооксациклододец-4-ен-6-ил(пиридин-4-илметил)карбамата (9,4 мг, 0,013 ммоль, выход 65,4%).

[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-Фтор-5-[4-(2-пиразол-1-илацетил)пиперазин-1-ил]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-N-(пиридин-4-илметил)карбамат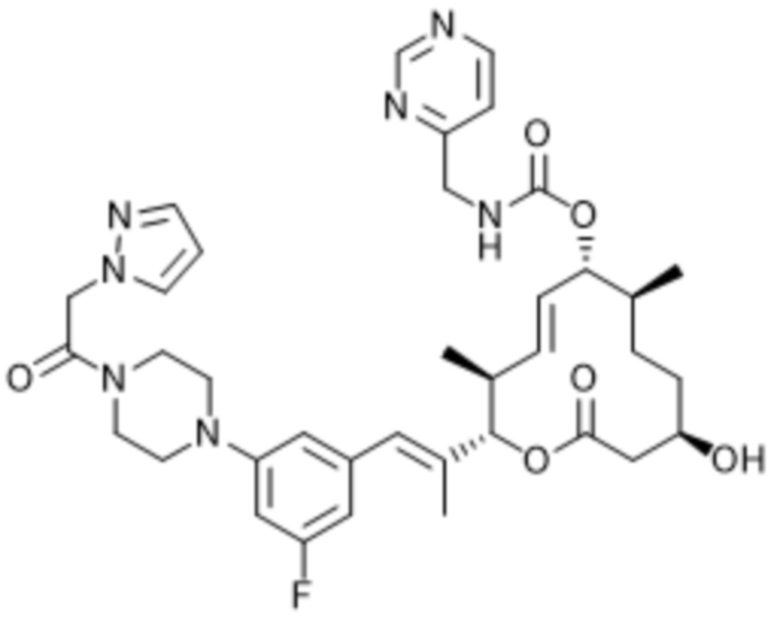
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-Фтор-5-[4-(2-пиразол-1-илацетил)пиперазин-1-ил]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-N-(пиримидин-4-илметил)карбамат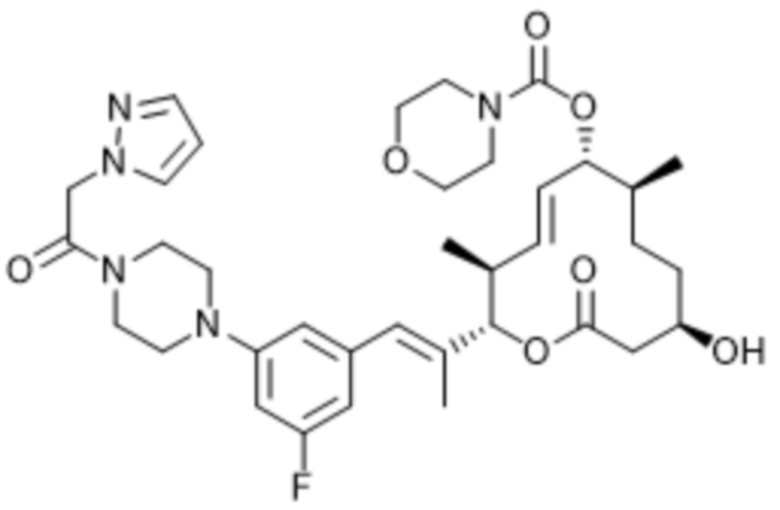
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-Фтор-5-[4-(2-пиразол-1-илацетил)пиперазин-1-ил]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-морфолин-4-карбоксилат
1,91-2,02 (m, 1 H) 2,43-2,52 (m, 1 H) 2,57-2,69 (m, 2 H) 3,18-3,28 (m, 4 H) 3,38-3,50 (m, 4 H) 3,60-3,67 (m, 4 H) 3,71-3,76 (m, 4 H) 3,78-3,84 (m, 1 H) 5,11-5,17 (m, 1 H) 5,18-5,22 (m, 2 H) 5,45-5,60 (m, 3 H) 5,49-5,59 (m, 1 H) 6,29-6,36 (m, 1 H) 6,48-6,58 (m, 2 H) 6,59-6,69 (m, 2 H) 7,51-7,53 (m, 1 H) 7,63-7,66 (m, 1 H)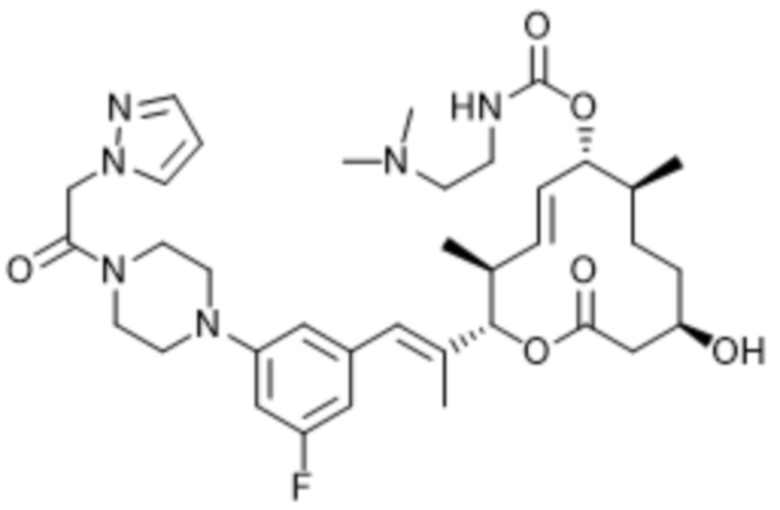
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-Фтор-5-[4-(2-пиразол-1-илацетил)пиперазин-1-ил]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-N-[2-(диметиламино)этил]карбамат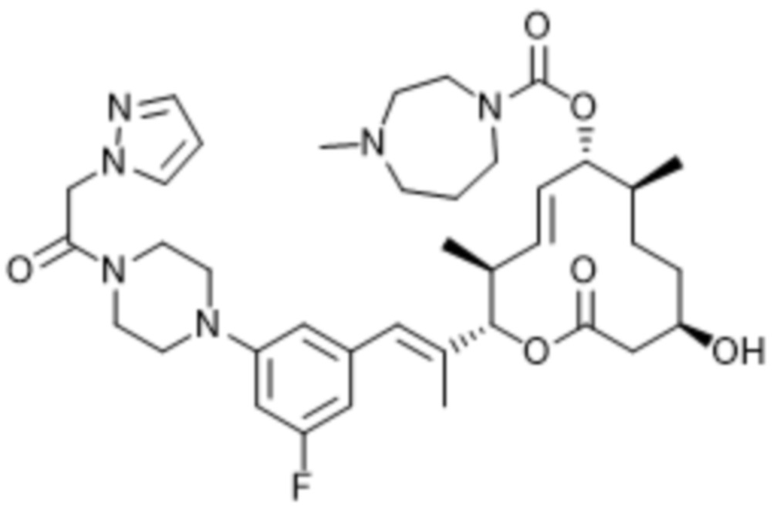
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-Фтор-5-[4-(2-пиразол-1-илацетил)пиперазин-1-ил]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метил-1,4-диазепан-1-карбоксилат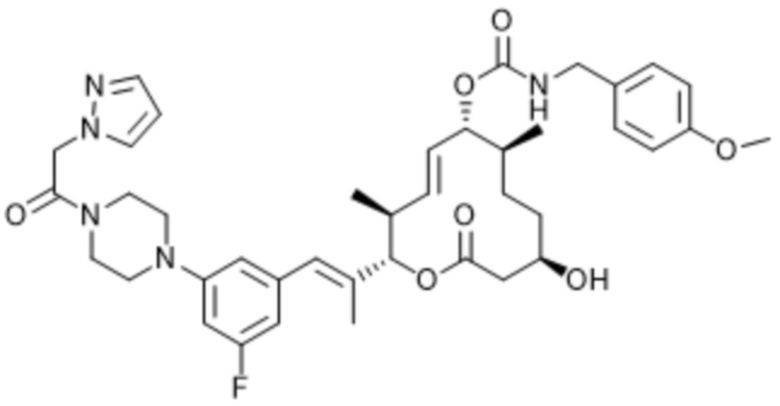
[(2R,3R,4E,6R,7S,10S)-2-[(E)-1-[3-Фтор-5-[4-(2-пиразол-1-илацетил)пиперазин-1-ил]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-N-[(4-метоксифенил)метил]карбамат
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-Фтор-5-[4-(2-пиразол-1-илацетил)пиперазин-1-ил]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-(3R)-3-(диметиламино)пирролидин-1-карбоксилат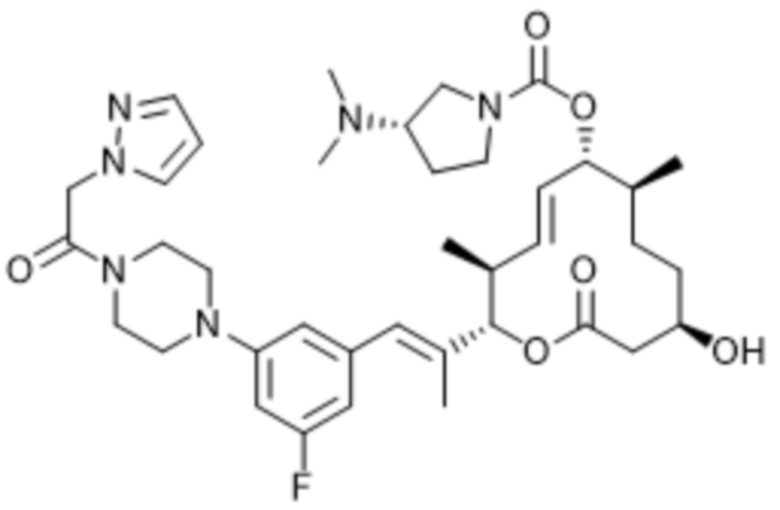
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-Фтор-5-[4-(2-пиразол-1-илацетил)пиперазин-1-ил]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-(3S)-3-(диметиламино)пирролидин-1-карбоксилат
[(2R,3R,4E,6R,7S,10S)-2-[(E)-1-[3-Фтор-5-[4-(2-пиразол-1-илацетил)пиперазин-1-ил]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-N-[(2S)-1-гидроксипропан-2-ил]карбамат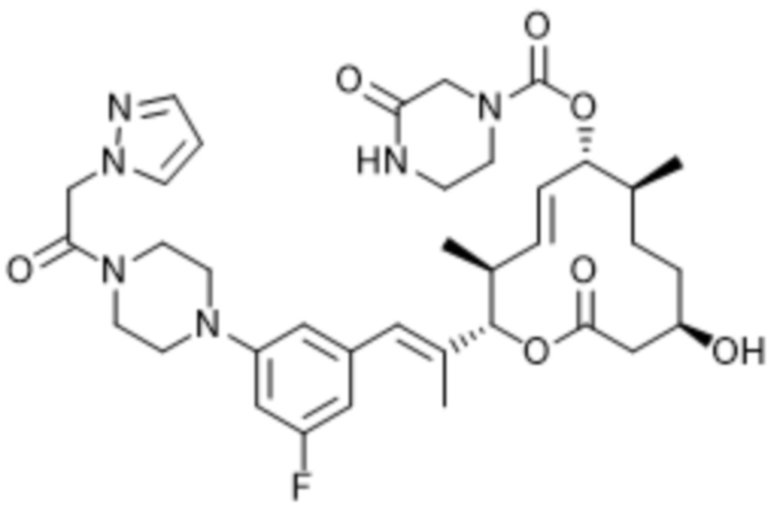
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-Фтор-5-[4-(2-пиразол-1-илацетил)пиперазин-1-ил]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-3-оксопиперазин-1-карбоксилат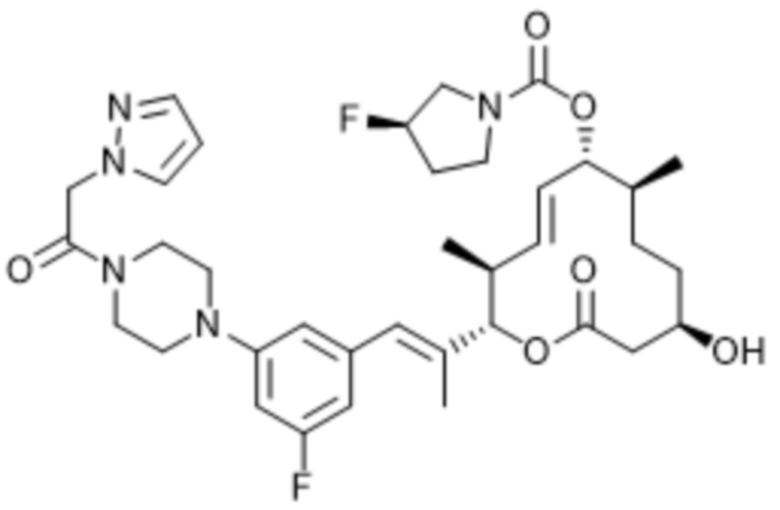
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-Фтор-5-[4-(2-пиразол-1-илацетил)пиперазин-1-ил]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-(3R)-3-фторпирролидин-1-карбоксилат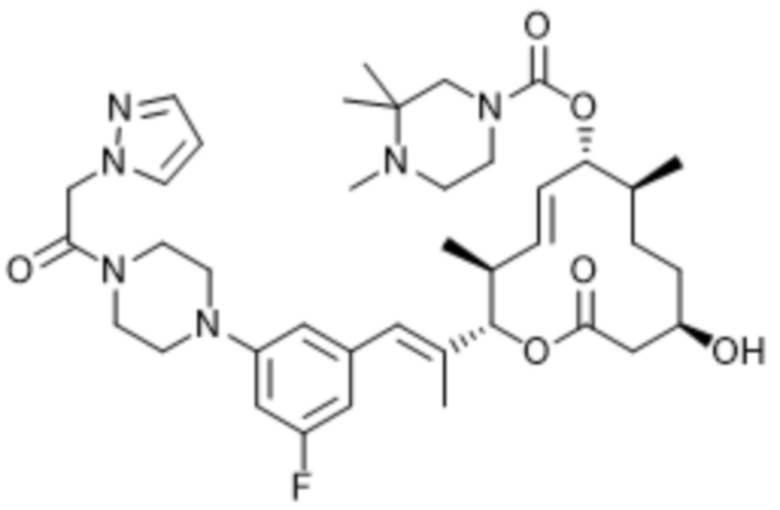
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-Фтор-5-[4-(2-пиразол-1-илацетил)пиперазин-1-ил]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-3,3,4-триметилпиперазин-1-карбоксилат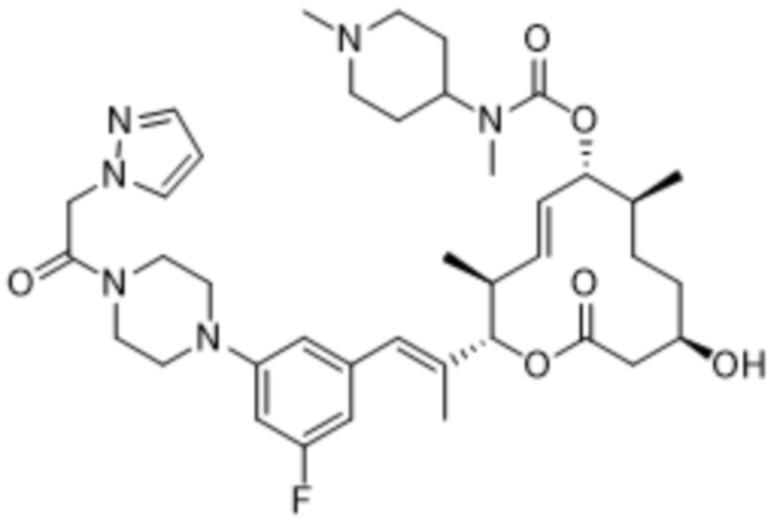
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-Фтор-5-[4-(2-пиразол-1-илацетил)пиперазин-1-ил]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-N-метил-N-(1-метилпиперидин-4-ил)карбамат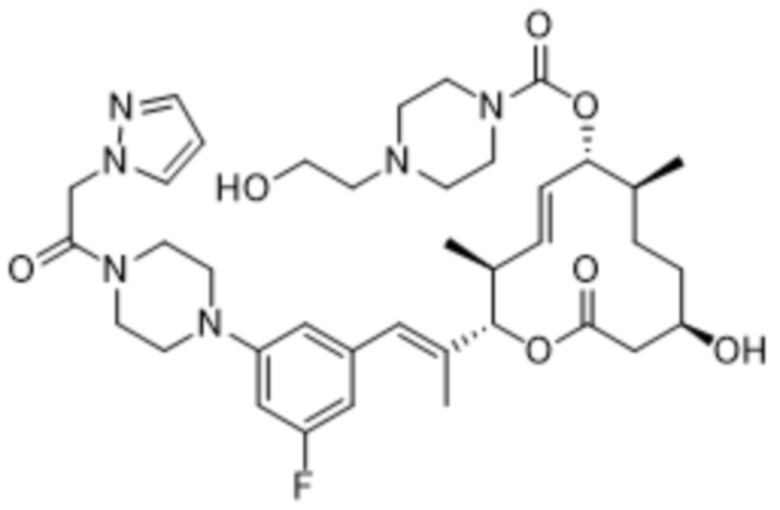
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-Фтор-5-[4-(2-пиразол-1-илацетил)пиперазин-1-ил]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-(2-гидроксиэтил)пиперазин-1-карбоксилат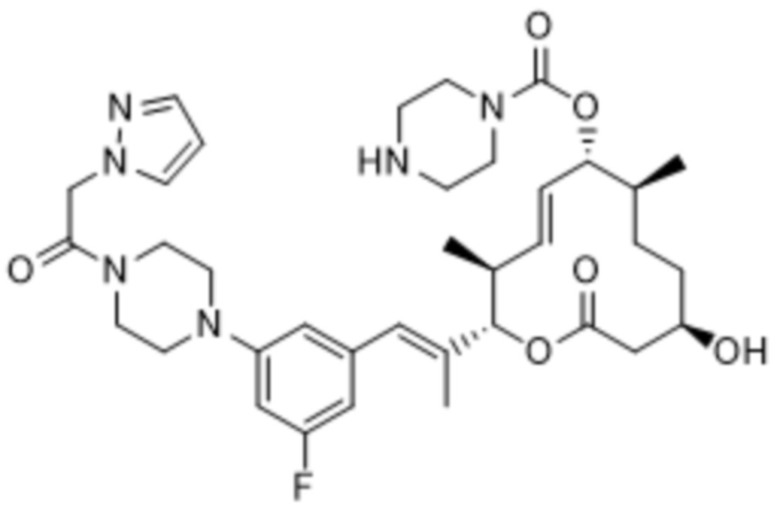
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-Фтор-5-[4-(2-пиразол-1-илацетил)пиперазин-1-ил]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-пиперазин-1-карбоксилат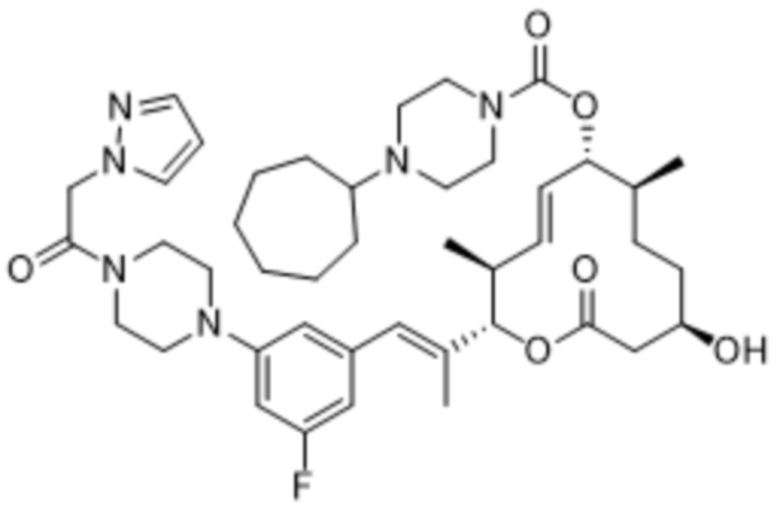
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-Фтор-5-[4-(2-пиразол-1-илацетил)пиперазин-1-ил]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-циклогептилпиперазин-1-карбоксилат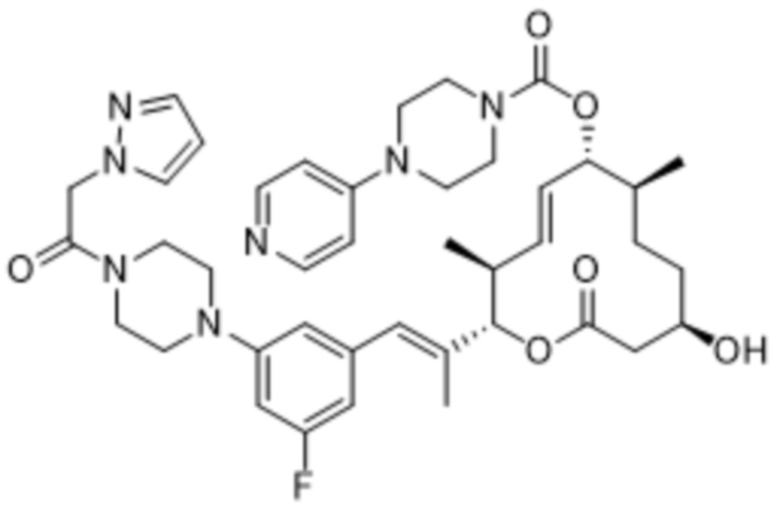
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-Фтор-5-[4-(2-пиразол-1-илацетил)пиперазин-1-ил]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-пиридин-4-илпиперазин-1-карбоксилат
1 H) 2,37 (s, 1 H) 2,43-2,52 (m, 1 H) 2,57-2,71 (m, 2 H) 3,18-3,29 (m, 4 H) 3,53-3,61 (m, 4 H) 3,62-3,69 (m, 4 H) 3,71-3,77 (m, 4 H) 3,77-3,86 (m, 1 H) 4,86-4,91 (m, 1 H) 5,12-5,17 (m, 1 H) 5,20 (s, 2 H) 5,46-5,62 (m, 2 H) 6,32-6,36 (m, 1 H) 6,48-6,57 (m, 2 H) 6,59-6,69 (m, 2H) 7,20-7,25 (m, 1 H) 7,50-7,55 (m, 1 H) 7,63-7,67 (m, 1 H) 7,68-7,74 (m, 1 H)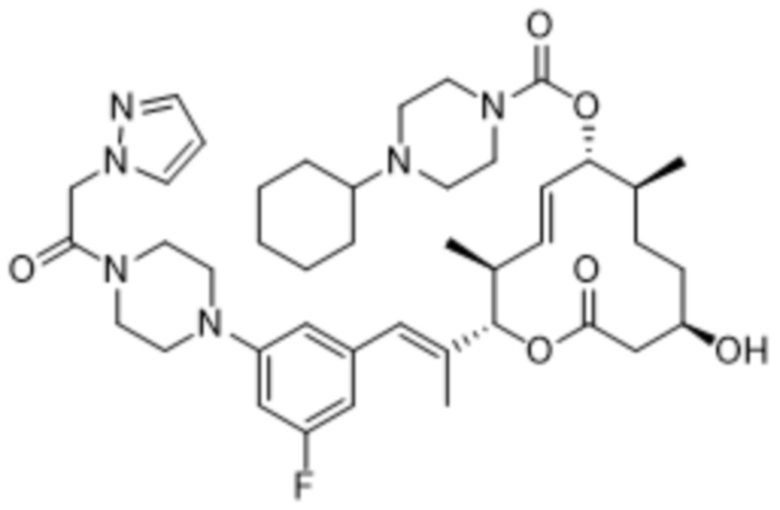
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-Фтор-5-[4-(2-пиразол-1-илацетил)пиперазин-1-ил]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-циклогексилпиперазин-1-карбоксилат
1 H) 2,40-2,52 (m, 1 H) 2,58-2,70 (m, 2 H) 2,84-2,98 (m, 3 H) 3,19-3,29 (m, 4 H) 3,45-3,64 (m, 4 H) 3,70-3,77 (m, 4 H) 3,78-3,86 (m, 1H) 5,11-5,18 (m, 1 H) 5,20 (s, 2 H) 5,44-5,61 (m, 2 H) 6,34 (s, 1 H) 6,49-6,57 (m, 2 H) 6,60-6,68 (m, 2 H) 7,52 (d, J=1,51 Гц, 1 H) 7,64 (d, J=2,01 Гц, 1 H)
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-Фтор-5-[4-(2-пиразол-1-илацетил)пиперазин-1-ил]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-N-[2-(4-гидроксифенил)этил]-N-метилкарбамат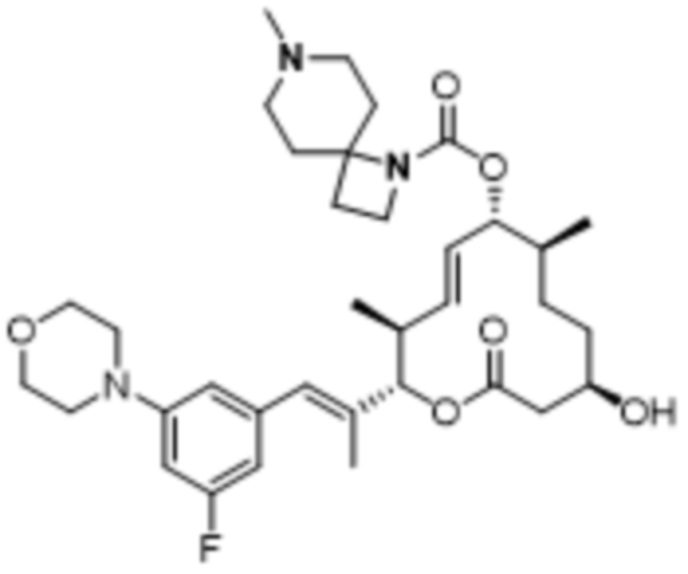
(2S,3S,6R,7S,10R, E)-2-((E)-1-(3-Фтор-5-морфолинофенил)проп-1-ен-2-ил)-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил-7-метил-1,7-диазаспиро[3.5]нонан-1-карбоксилат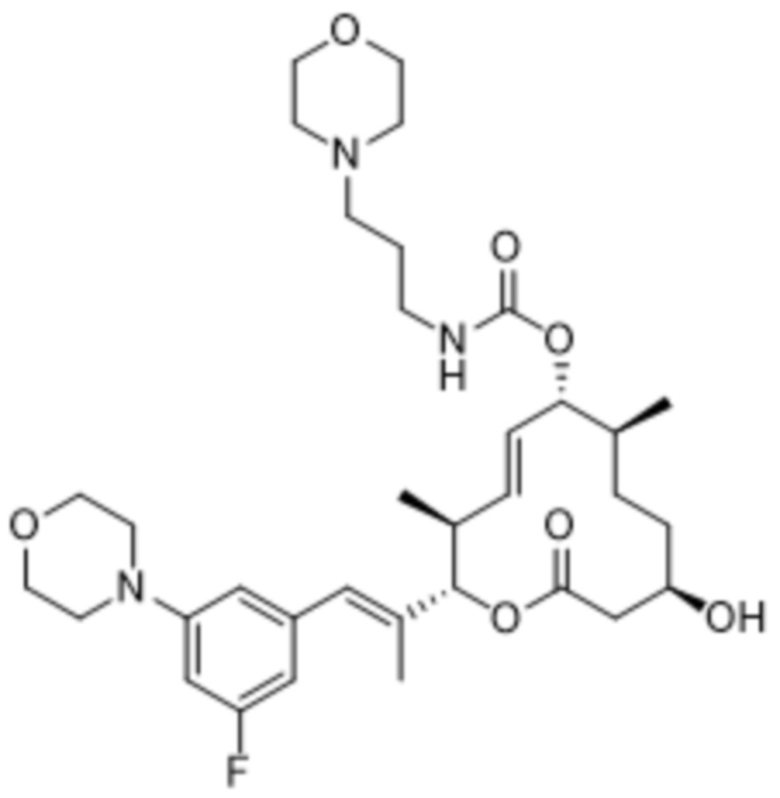
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-(3-Фтор-5-морфолин-4-илфенил)проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-N-(3-морфолин-4-илпропил)карбамат
1,92-2,02 (m, 1 H) 2,42-2,54 (m, 1 H) 2,58-2,67 (m, 2 H) 2,68 (s, 3 H) 3,04-3,14 (m, 2 H) 3,15-3,21 (m, 4 H) 3,76-3,79 (m, 1 H) 3,81 (s, 2H) 3,81-3,94 (m, 7 H) 4,76-4,83 (m, 1 H) 5,09-5,21 (m, 1 H) 5,45-5,62 (m, 2 H) 6,47-6,66 (m, 4 H)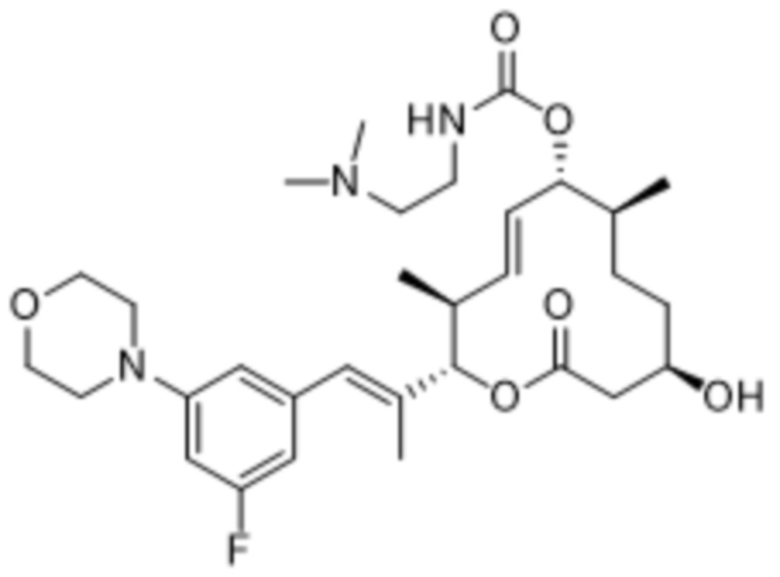
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-(3-Фтор-5-морфолин-4-илфенил)проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-N-[2-(диметиламино)этил]карбамат
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-(3-Фтор-5-морфолин-4-илфенил)проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-(3R)-3-(диметиламино)пирролидин-1-карбоксилат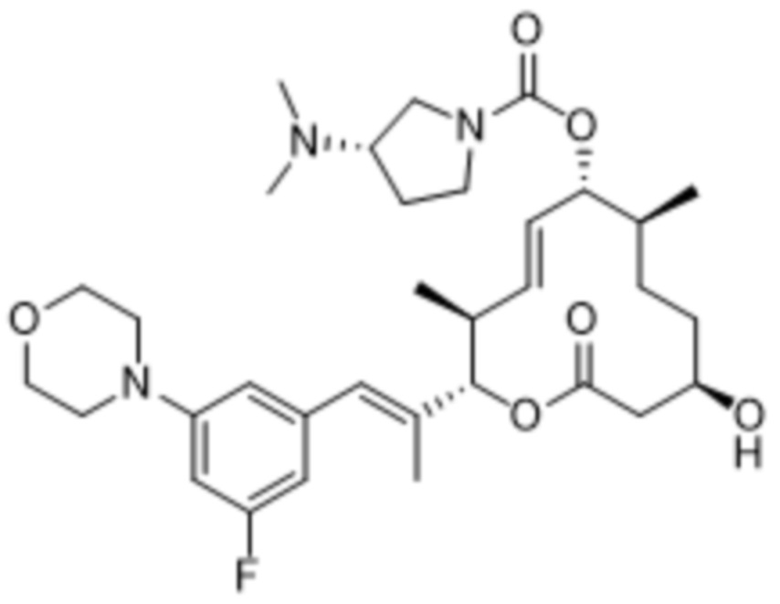
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-(3-Фтор-5-морфолин-4-илфенил)проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-(3S)-3-(диметиламино)пирролидин-1-карбоксилат
(m, 1 H) 1,87 (d, J=1,25 Гц, 3 H) 1,90-2,02 (m, 1 H) 2,10-2,21 (m, 1 H) 2,31 (s, 6 H) 2,40-2,51 (m, 1 H) 2,66 (s, 2 H) 2,76-2,94 (m, 1 H) 3,09-3,19 (m, 5 H) 3,47-3,73 (m, 2 H) 3,75-3,86 (m, 5 H) 5,08-5,18 (m, 1 H) 5,40-5,60 (m, 2 H) 6,43-6,68 (m, 4 H)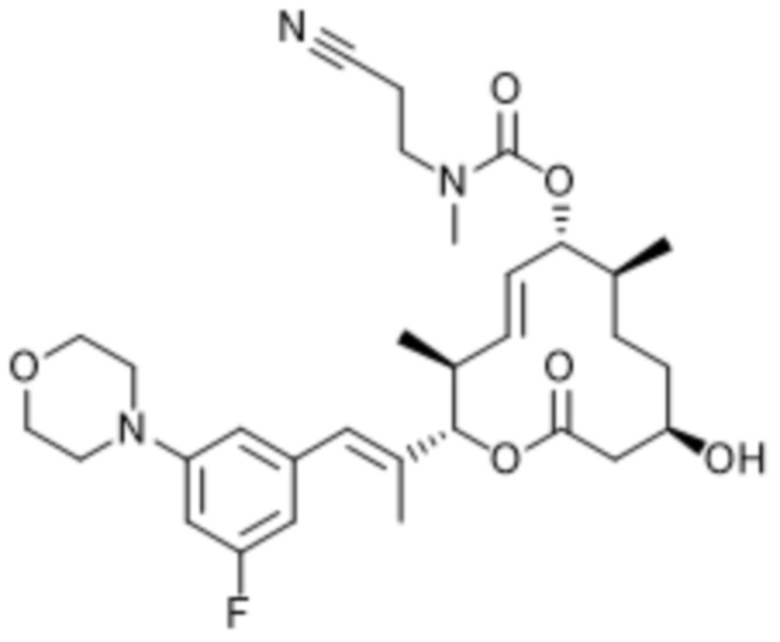
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-(3-Фтор-5-морфолин-4-илфенил)проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-N-(2-цианоэтил)-N-метилкарбамат
(m, 1 H) 2,42-2,52 (m, 1 H) 2,57-2,68 (m, 2 H) 2,68-2,76 (m, 2 H) 2,94-3,03 (m, 3 H) 3,10-3,18 (m, 4 H) 3,47-3,65 (m, 2 H) 3,75-3,86 (m, 5 H) 5,10-5,18 (m, 1 H) 5,45-5,60 (m, 2 H) 6,45-6,66 (m, 4 H)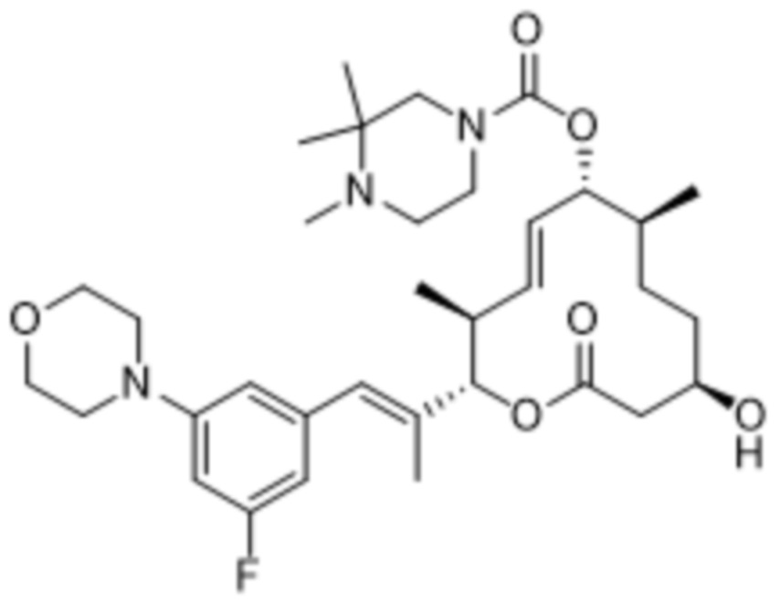
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-(3-Фтор-5-морфолин-4-илфенил)проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-3,3,4-триметилпиперазин-1-карбоксилат
(m, 1 H) 2,27 (s, 3 H) 2,42-2,53 (m, 1 H) 2,66 (s, 4 H) 3,10-3,18 (m, 4 H) 3,20-3,28 (m, 2 H) 3,41-3,63 (m, 2 H) 3,81 (dd, J=10,54, 5,65 Гц, 5 H) 5,09-5,20 (m, 1 H) 5,40-5,62 (m, 2 H) 6,44-6,66 (m, 4 H)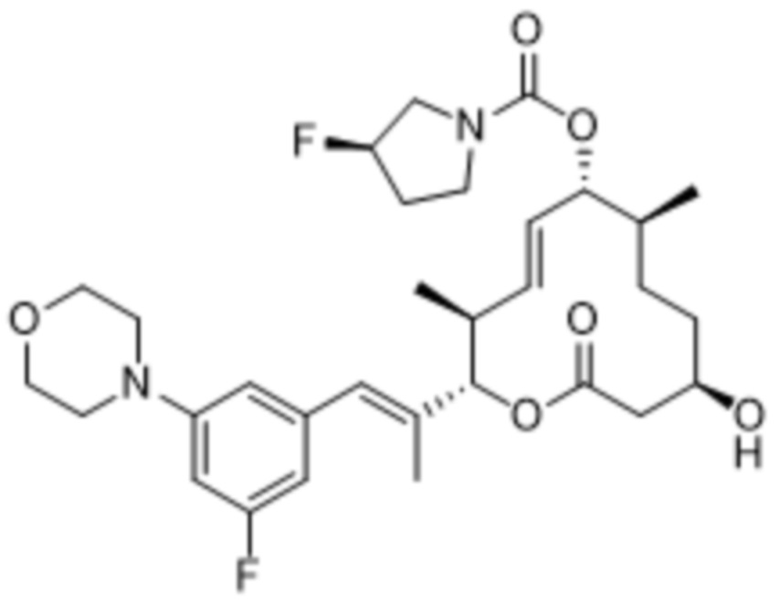
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-(3-Фтор-5-морфолин-4-илфенил)проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-(3R)-3-фторпирролидин-1-карбоксилат
2,40-2,51 (m, 1 H) 2,43-2,51 (m, 1 H) 2,57-2,65 (m, 2 H) 2,66 (s, 4 H) 3,10-3,19 (m, 4 H) 3,37-3,51 (m, 1 H) 3,53-3,73 (m, 2 H) 3,76-3,87 (m, 5 H) 5,09-5,34 (m, 1 H) 5,09-5,16 (m, 1 H) 5,15-5,21 (m, 1 H) 5,28-5,34 (m, 1 H) 5,41-5,62 (m, 2 H) 6,43-6,65 (m, 4 H)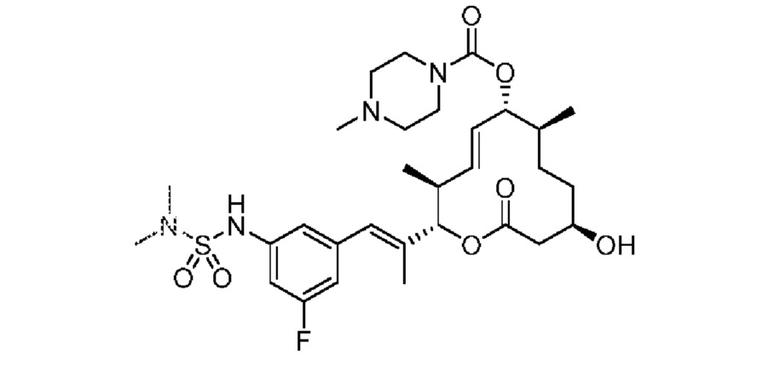
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-(диметилсульфамоиламино)-5-фторфенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилат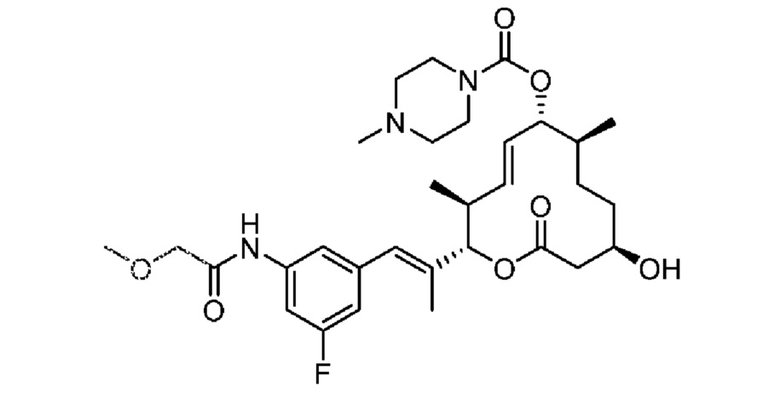
[(2S,3S,4E,6R,7R,10S)-2-[(E)-1-[3-Фтор-5-[(2-метоксиацетил)амино]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилат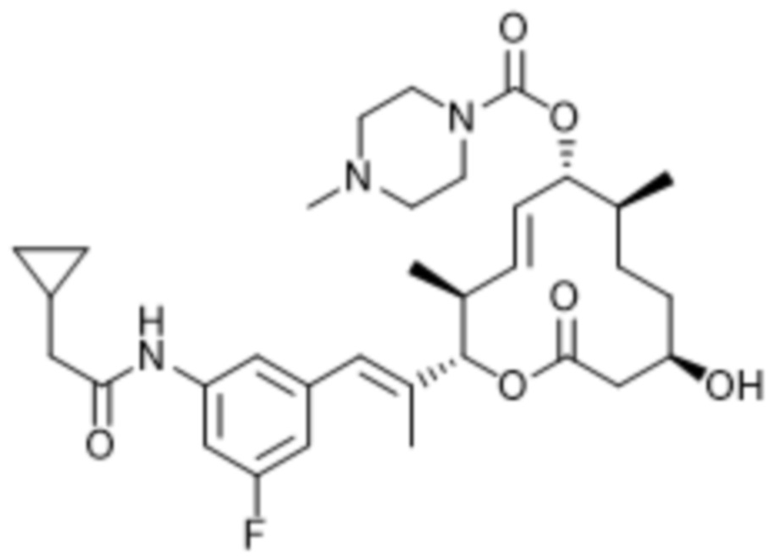
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-[(2-Циклопропилацетил)амино]-5-фторфенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилат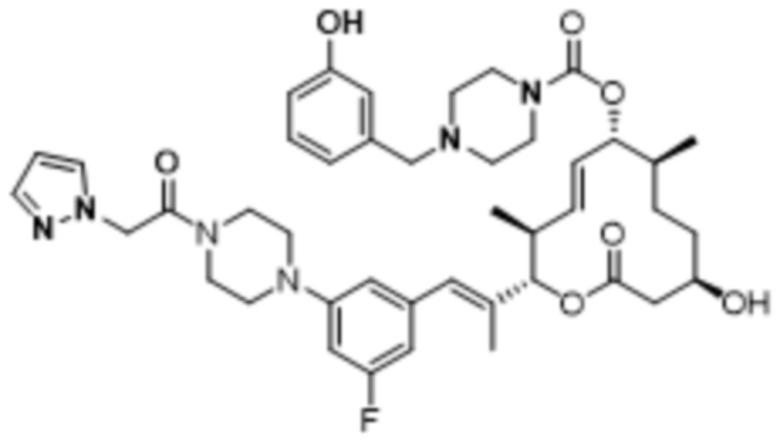
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-Фтор-5-[4-(2-пиразол-1-илацетил)пиперазин-1-ил]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-[(3-гидроксифенил)метил]пиперазин-1-карбоксилат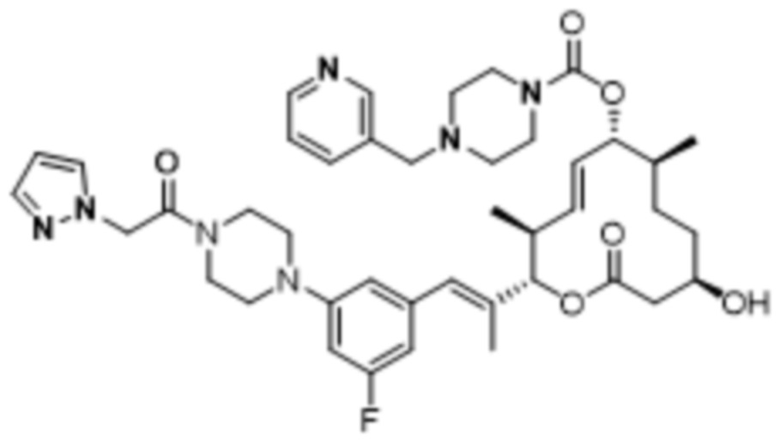
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-Фтор-5-[4-(2-пиразол-1-илацетил)пиперазин-1-ил]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-(пиридин-3-илметил)пиперазин-1-карбоксилат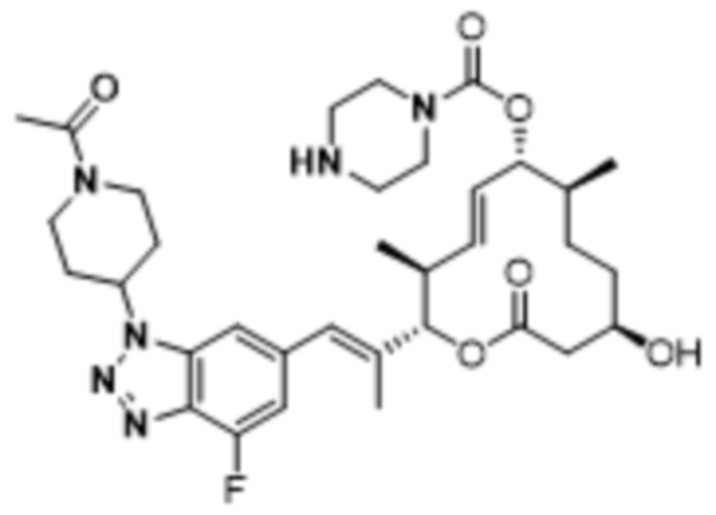
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-(1-Ацетилпиперидин-4-ил)-7-фторбензотриазол-5-ил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]пиперазин-1-карбоксилат
1H ЯМР (400 МГц, CDCl3) d ppm 1,03 (br dd, J=6,78, 4,14 Гц, 12 H) 1,22-1,36 (m, 2 H) 1,45 -1,67 (m, 3 H) 1,74-1,87 (m, 1 H) 1,88-1,94 (m, 3 H) 1,94-2,00 (m, 1 H) 2,20 (s, 3 H) 2,22-2,32 (m, 3 H), 2,35-2,54 (m, 2 H) 2,54-2,72 (m, 3 H) 2,72-2,90 (m, 4 H) 2,91-3,12 (m, 2 H) 3,31-3,48 (m, 5 H) 3,68 -, 3,81 (m, 1 H) 4,04-4,15 (m, 1 H) 4,68-4,80 (m, 1 H) 4,80-4,93 (m, 2 H) 5,26-5,34 (m, 1 H) 5,39-5,49 (m, v1 H) 5,56-5,68 (m, 1 H) 6,65-6,75 (m, 1 H) 6,92-7,04 (m, 1 H) 7,11-7,18 (m, 1 H)
Соединения 254-261 синтезировали в соответствии с общими способами из процедуры 36.
Процедура 36
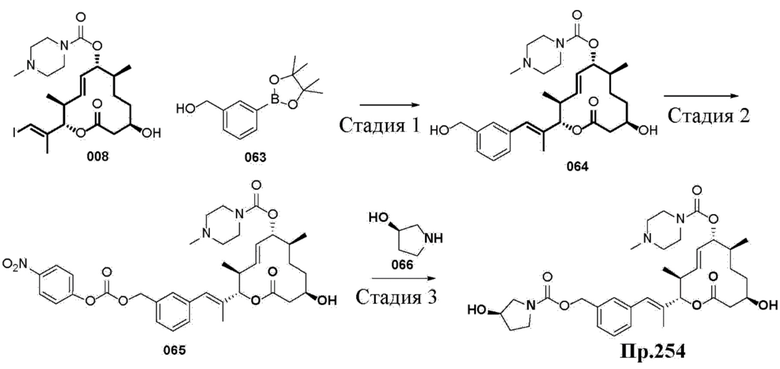
Стадия 1. В перемешиваемый раствор йодида (008) (120 мг, 0,225 ммоль) и бороната (063) (63 мг, 0,269 ммоль) в 3,4 мл п-диоксана добавляли оксид серебра (156 мг, 0,674 ммоль) и тетракис(трифенилфосфин)палладия(0) (25,9 мг, 0,022 ммоль). Смесь дегазировали и нагревали до 80°C в течение 60 минут. После завершения реакции, которое показывали с помощью UPLC, реакционную смесь охлаждали до комнатной температуры, фильтровали и концентрировали. В результате очистки с помощью колоночной хроматографии с градиентом элюирования от 0 до 20% MeOH/DCM получали соединение (064) (59 мг, выход 51%) в виде бесцветного масла. LCMS (ESI, масса/заряд), 515,5 [M+H]+. 1H ЯМР (400 МГц, CDCl3) d ppm 1,00 (m, 6 H) 1,14-1,36 (m, 2 H) 1,50 (m, 1H) 1,64-1,84 (m, 1 H) 1,84-1,94 (m, 4 H) 2,29 (s, 3 H) 2,35 (br s, 4 H) 2,45-2,66 (m, 3 H) 3,48 (br s, 4 H) 3,59-3,76 (m, 1 H) 4,69 (s, 2 H) 4,88 (t, J=10,04 Гц, 1 H) 5,28 (d, J=10,54 Гц, 1 H) 5,40 (dd, J=14,93, 9,66 Гц, 1 H) 5,60 (dd, J=14,93, 9,91 Гц, 1 H) 6,59 (s, 1 H) 7,18-7,35 (m, 4 H).
Стадия 2. В перемешиваемый раствор соединения (064) (59 мг, 0,115 ммоль) в 2 мл 1,2-дихлорэтана при 0°C добавляли 4-нитрофенилкарбонилхлорид (27,7 мг, 0,138 ммоль), триэтиламин (0,083 мл, 0,573 ммоль), затем N, N-диметилпиридин-4-амин (2,8 мг, 0,023 ммоль). Смесь перемешивали при 0°C в течение 21 ч. Завершение определяли с помощью UPLC.
Стадия 3. В смесь из предыдущей стадии, содержащую (065) (примерно 7,8 мг, 0,011 ммоль) в 200 мкл 1,2-дихлорэтана, добавляли (R)-пирролидин-3-ол (066) (4 мг, 0,046 ммоль). Полученную смесь перемешивали при комнатной температуре. После завершения реакции, которое показывали с помощью UPLC, реакционную смесь концентрировали. В результате очистки с помощью HPLC получали указанное в заголовке соединение из примера 254 (3,4 мг, выход 49%).
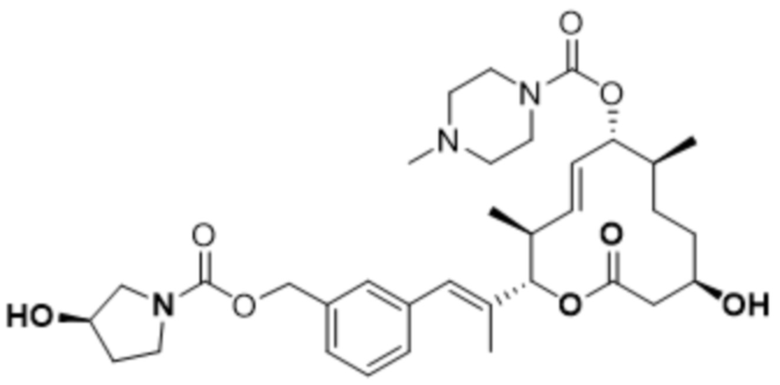
[(2S,3S,4E,6R,7S,10R)-10-Гидрокси-2-[(E)-1-[3-[[(3R)-3-гидроксипирролидин-1-карбонил]оксиметил]фенил]проп-1-ен-2-ил]-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилат
[3-[(E)-2-[(2S,3S,4E,6R,7S,10R)-10-Гидрокси-3,7-диметил-6-(4-метилпиперазин-1-карбонил)окси-12-оксо-1-оксациклододец-4-ен-2-ил]проп-1-енил]фенил]метил-2-окса-7-азаспиро[3.4]октан-7-карбоксилат
[(2S,3S,4E,6R,7S,10R)-10-Гидрокси-2-[(E)-1-[2-[(2R)-2-(гидроксиметил)пирролидин-1-ил]пиридин-4-ил]проп-1-ен-2-ил]-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилат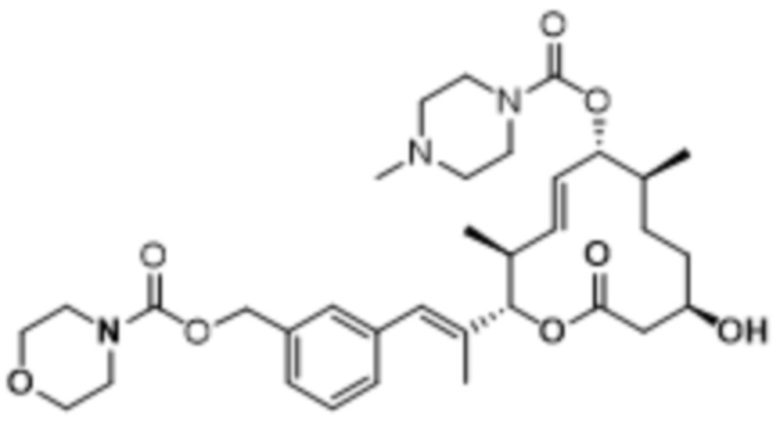
[3-[(E)-2-[(2S,3S,4E,6R,7S,10R)-10-Гидрокси-3,7-диметил-6-(4-метилпиперазин-1-карбонил)окси-12-оксо-1-оксациклододец-4-ен-2-ил]проп-1-енил]фенил]метилморфолин-4-карбоксилат
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-(Диметилкарбамоилоксиметил)фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилат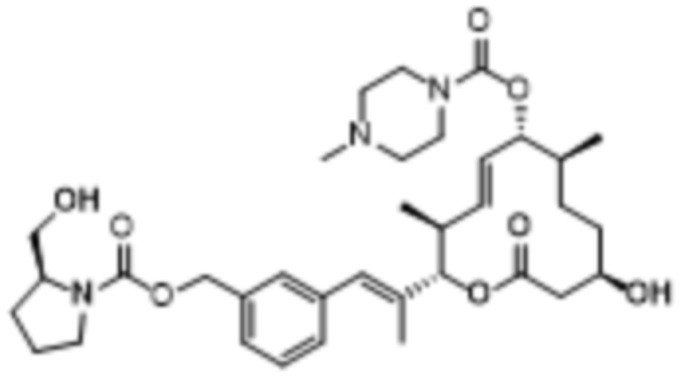
[(2S,3S,4E,6R,7S,10R)-10-Гидрокси-2-[(E)-1-[3-[[(2R)-2-(гидроксиметил)пирролидин-1-карбонил]оксиметил]фенил]проп-1-ен-2-ил]-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилат
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-[[(3R)-3-Фторпирролидин-1-карбонил]оксиметил]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилат
[(2S,3S,4E,6R,7S,10R)-10-Гидрокси-2-[(E)-1-[3-[(4-гидроксипиперидин-1-карбонил)оксиметил]фенил]проп-1-ен-2-ил]-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилат
Соединения 262 и 263 синтезировали в соответствии с общими способами из процедур 37 и 38.
Процедура 37
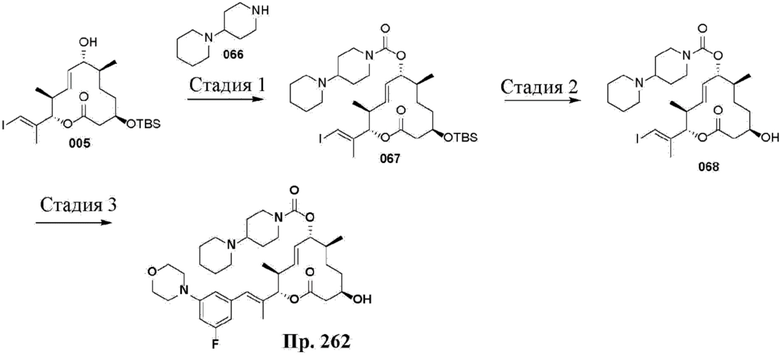
Стадия 1. Раствор DMAP (140 мг, 1,148 ммоль), N1,N1,N8,N8-тетраметилнафталин-1,8-диамина (246 мг, 1,148 ммоль) и триэтиламина (0,667 мл, 4,878 ммоль) в 9 мл диэтилового эфира перемешивали в течение 60 мин. при комнатной температуре. В данную смесь добавляли йодид (005) (500 мг, 0,957 ммоль) в виде раствора в 3 мл диэтилового эфира (по каплям в течение 2 мин.) и перемешивали при комнатной температуре в течение 7 ч. После этого добавляли 1,4'-бипиперидин (066) (725 мг, 4,306 ммоль) и смесь перемешивали в течение 19 ч. Смесь разбавляли смесью гептан/MTBE 10:1 и органические слои несколько раз промывали смесью насыщенный раствор бикарбоната натрия/1 М NaOH 1:1. Затем органические слои промывали солевым раствором и концентрировали. Неочищенный продукт очищали с помощью флэш-хроматографии на силикагеле с градиентом MeOH/EtOAc с выделением соединения (067) (600 мг, 87%). 1H ЯМР (400 МГц, CDCl3) d ppm 0,88 (d, J=3,76 Гц, 6 H) 1,68-1,74 (m, 12 H) 1,78 (d, J=6,78 Гц, 3 H) 2,03 (m, 1H) 2,18-2,42 (m, 12 H) 2,61 (s, 6 H) 3,13-3,35 (m, 8 H) 3,47-3,62 (m, 2 H) 4,64-4,71 (m, 1 H) 5,01 (m, 1 H) 5,60 (t, J=9,72 Гц, 1 H) 5,90 (d, J=10,67 Гц, 1 H) 6,15-6,33 (m, 2 H) 8,08 (s, 1 H).
Стадия 2. В раствор бипиперидина (067) (600 мг, 0,837 ммоль) в 6 мл метанола добавляли гидрат 4-метилбензолсульфоновой кислоты (478 мг, 2,51 ммоль) и перемешивали в течение 2 ч. После этого добавляли избыток триэтиламина и концентрировали. Разбавляли этилацетатом, промывали насыщенным раствором бикарбоната натрия, затем солевым раствором. Органические слои высушивали с помощью сульфата натрия, фильтровали и концентрировали. Неочищенную смесь очищали с помощью флэш-хроматографии на силикагеле с получением соединения (068) (456 мг, 90%). LCMS (ESI, масса/заряд), 603,4 [M+H]+. 1H ЯМР (400 МГц, CDCl3) d ppm 0,90 (d, J=6,65 Гц, 3 H) 0,98 (d, J=6,90 Гц, 3 H) 1,12-1,30 (m, 2 H) 1,34-1,50 (m, 4 H) 1,57 (m, 4 H) 1,74-1,85 (m, 6 H) 1,90 (m, 1 H) 1,99 (s, 1 H) 2,35-2,54 (m, 6 H) 2,57-2,76 (m, 3 H) 3,48 (s, 1 H) 3,71 (br dd, J=6,53, 3,26 Гц, 1 H) 4,16 (br d, J=11,04 Гц, 2 H) 4,83 (t, J=10,04 Гц, 1 H) 5,25-5,40 (m, 2 H) 5,47-5,55 (m, 1 H) 6,47 (d, J=1,00 Гц, 1 H) 7,26 (s, 1 H).
Стадия 3. Соединение из примера 262 синтезировали в соответствии с процедурой, описанной в процедуре 5, путем замены дипиперидина (068) и 4-(3-фтор-5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил)морфолина для получения указанного в заголовке соединения из примера 262. LCMS (ESI, масса/заряд), 656,6 [M+H]+. 1H ЯМР (400 МГц, CDCl3) d ppm 0,99 (m, 6 H) 1,18-1,31 (m, 3 H) 1,36-1,56 (m, 4 H) 1,59 (br s, 4 H) 1,82 (m, 4H) 1,86 (s, 3H) 1,91 (m, 1 H) 2,41 (m, 1 H) 2,47-2,65 (m, 6 H) 2,72 (m, 2H) 3,12-3,17 (m, 4 H) 3,37 (br s, 1 H) 3,72 (br s, 1 H) 3,82-3,87 (m, 4 H) 4,09-4,26 (m, 2 H) 4,86 (t, J=10,04 Гц, 1 H) 5,23-5,26 (m, 1 H) 5,39 (dd, J=15,06, 9,66 Гц, 1 H) 5,58 (dd, J=14,93, 9,91 Гц, 1 H) 6,45-6,53 (m, 4 H).
Процедура 38

Стадия 1. Соединение синтезировали в соответствии с процедурой, описанной в процедуре 5, путем замены дипиперидина (068) и бороната (069) (38,7 мг, 0,10 ммоль) на дипиперидин (070). LCMS (ESI, масса/заряд), 738,5 [M+H]+. 1H ЯМР (400 МГц, CDCl3) d ppm 0,99 (t, J=6,27 Гц, 6 H) 1,15-1,36 (m, 2 H) 1,39-1,56 (m, 13 H) 1,64 (br s, 4 H) 1,74-1,95 (m, 7H) 2,17 (s, 1 H) 2,46-2,66 (m, 8 H) 2,73 (br t, J=12,11 Гц, 2 H) 3,04-3,20 (m, 4 H) 3,53-3,61 (m, 4 H) 3,72 (br s, 1 H) 4,12-4,32 (m, 2 H) 4,87 (t, J=10,04 Гц, 1 H) 5,27 (d, J=10,54 Гц, 1 H) 5,39 (dd, J=14,93, 9,66 Гц, 1 H) 5,59 (dd, J=15,00, 9,98 Гц, 1 H) 6,55 (s, 1 H) 6,78-6,83 (m, 3 H) 7,21-7,27 (m, 2 H).
Стадия 2. В перемешиваемый раствор дипиперидина (070) (19 мг, 0,026 ммоль) (пример 8, стадия b) в 7,7 мл DCM при 0°C добавляли TFA (40 мкл, 0,516 ммоль). Смесь нагревали до комнатной температуры и перемешивали в течение 2 дней. После этого реакционную смесь разбавляли в DCM, промывали насыщенным раствором бикарбоната натрия, высушивали с помощью сульфата натрия, фильтровали и концентрировали. Неочищенный продукт очищали с помощью флэш-хроматографии на колонке C-18 с градиентом ацетонитрил/вода с получением соединения (071) (11 мг, 67%). LCMS (ESI, масса/заряд), 328,9 [(M+Na+H)/2]+.
Стадия 3. В перемешиваемый раствор дипиперидина (071) (11 мг, 0,017 ммоль) в 0,2 мл DCM добавляли 2-бромэтанол (072) (2,45 мкл, 0,035 ммоль) и триэтиламин (9,6 мкл, 0,069 ммоль). Смесь перемешивали до завершения реакции, которое показывали с помощью LC/MS. После этого реакционную смесь разбавляли в DCM, промывали насыщенным раствором бикарбоната натрия, высушивали с помощью сульфата натрия, фильтровали и концентрировали. Неочищенный материал очищали с помощью флэш-хроматографии на силикагеле с получением указанного в заголовке соединения из примера 263 (8,4 мг, 71%).
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-(3-Фтор-5-морфолин-4-илфенил)проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-пиперидин-1-илпиперидин-1-карбоксилат
[(2S,3S,4E,6R,7S,10R)-10-Гидрокси-2-[(E)-1-[3-[4-(2-гидроксиэтил)пиперазин-1-ил]фенил]проп-1-ен-2-ил]-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-пиперидин-1-илпиперидин-1-карбоксилат
БИОЛОГИЧЕСКИЕ МЕТОДЫ И МАТЕРИАЛЫ
Сцинтилляционный анализ сближения (SPA) с зондом на основе [3H]-меченого пладиенолида
Иммобилизацию порции антител к SF3B1 (MBL) на покрытые антителами к Ig мыши сцинтилляционные гранулы из PVT для SPA-анализа (PerkinElmer) проводили следующим образом: для каждых 2,5 мг ядерных экстрактов смешивали 5 мкг антитела к SF3B1 и 1,5 мг гранул в 150 мкл PBS. Смесь антитела-гранулы инкубировали в течение 30 мин. при к. т. и центрифугировали при 18000g в течение 5 мин. Применяли 150 мкл PBS для ресуспендирования каждых 1,5 мг смеси антитела-гранулы. Гранулы суспендировали и добавляли к полученным ядерным экстрактам. Взвесь инкубировали в течение 2 ч. при 4°C с осторожным перемешиванием. Затем гранулы собирали с помощью центрифугирования при 18000g в течение 5 мин. и промывали дважды с помощью PBS+0,1% Triton X-100. После конечной стадии центрифугирования каждые 1,5 мг гранул суспендировали с помощью 150 мкл PBS. Комплексы SF3b тестировали в отношении связывания с зондом на основе [3H]-меченого пладиенолида ([3H]-PB), синтезированного, как описано ранее (Kotake et al., 2007). 100 мкл реакционных смесей для связывания получали с помощью 50 мкл взвеси гранул и путем добавления различных концентраций PB или PB-OH, и после 30 мин. предварительной инкубации добавляли 2,5 нМ [3H]-PB. Смесь инкубировали в течение 30 мин. и сигналы люминесценции считывали с применением планшетного счетчика MicroBeta2 (PerkinElmer). Для аппроксимации данных к кривой нелинейной регрессии применяли Prism 6 (Graphpad).
a.
b. Получение ядерного экстракта клеток HeLa (для анализа модуляции сплайсинга in vitro ниже)
c. Осадки, содержащие клетки HeLa S3, ресуспендировали в гипотоническом буфере (10 мМ HEPES, pH 7,9, 1,5 мМ MgCl2, 10 мМ KCl, 0,2 мМ PMSF и 0,5 мМ DTT) и суспензию доводили до всего 5 объемов осажденных клеток (PCV). После центрифугирования супернатант отбрасывали и клетки доводили до 3 PCV с помощью гипотонического буфера и инкубировали на льду в течение 10 минут. Клетки лизировали с применением гомогенизатора Даунса и затем центрифугировали. Супернатант отбрасывали и осадок ресуспендировали с помощью ½ объема осажденных ядер (PNV) буфера с низким содержанием солей (20 мМ HEPES, pH 7,9, 1,5 мМ MgCl2, 20 мМ KCl, 0,2 мМ EDTA, 25% глицерина, 0,2 мМ PMSF, 0,5 мМ DTT), затем ½ PNV буфера с высоким содержанием солей (такой же, как буфер с низким содержанием солей, за исключением того, что использовали 1,4 M KCl). Ядра осторожно перемешивали в течение 30 минут перед центрифугированием. Затем супернатант (ядерный экстракт) диализировали в буфер для хранения (20 мМ HEPES, pH 7,9, 100 мМ KCl, 0,2 мМ EDTA, 20% глицерина, 0,2 мМ PMSF, 0,5 мМ DTT). Концентрацию белка определяли с применением спектрофотометра NanoDrop 8000 UV-Vis (ThermoFisher Scientific).
d. Анализ сплайсинга in vitro (IVS)
Все последовательности, полученные из Ad2 (Pellizzoni et al., 1998), клонировали в вектор pcDNA3.1(+) (Promega) с применением сайтов рестрикции на 5'-конце для EcoRI и 3'-конце для XbaI. Плазмиды линеаризовали с применением XbaI и применяли в качестве матриц ДНК в реакциях транскрипции in vitro. Плазмиду без интрона FtzΔi (Luo and Reed, 1999) линеаризовали с применением EcoRI. Все РНК транскрибировали in vitro и затем очищали с применением наборов MEGAScript T7 (Invitrogen) и MegaClear (Invitrogen) соответственно. Для реакций сплайсинга с использованием вариантов pre-mRNA Ad2 готовили 1 мкл реакционной смеси с применением 8 мкг ядерных экстрактов, полученных из клеток HeLa S3, 2 нг pre-mRNA, 0,2 нг FTZΔi и различных концентраций иллюстративных полезных нагрузок или DMSO. После 15-минутной предварительной инкубации при 30°C добавляли 1 мкл буфера для активации сплайсинга (0,5 мМ ATP, 20 мМ креатинфосфата, 1,6 мМ MgCl2) и реакционные смеси инкубировали в течение 90 минут при 30°C. Затем реакционные смеси гасили с помощью 13 мкл DMSO, и по 25 нл использовали для RT-qPCR. Реакции RT-qPCR готовили с применением 1-стадийного набора TaqMan RNA-to-CT (Life Technologies), РНК из реакций сплайсинга, наборов праймеры-зонд для mRNA Ad2 (прямой: ACTCTCTTCCGCATCGCTGT; обратный: CCGACGGGTTTCCGATCCAA; зонд: CTGTTGGGCTCGCGGTTG) и Ftz (прямой: TGGCATCAGATTGCAAAGAC; обратный: ACGCCGGGTGATGTATCTAT; зонд: CGAAACGCACCCGTCAGACG). Для аппроксимации данных по образованного сплайсированного продукта к кривой нелинейной регрессии применяли Prism 6 (Graphpad) и нормализовали относительно контрольного образца (DMSO).
Клеточные линии
Клетки Panc 10.05 (CRL-2547), Panc 05.04 (CRL-2557), NCI-H1568 (CRL-5876) и NCI-H1650 (CRL-5883) приобретали в ATCC. Клеточные линии поддерживали в RPMI-1640 (ATCC 30-2001), дополненной 10% фетальной бычьей сыворотки (FBS). В линии клеток Panc дополнительно добавляли инсулин и FBS до общего содержания 15%.
Клетки Panc 10.05 содержат SF3b WT, в то время как клетки Panc 05.04 содержат мутацию K700E в SF3b и характеризуются разной чувствительностью к модуляторам SF3b.
Клетки NCI-H1568 экспрессируют MCL1 на высоком уровне и подвергаются апоптозу при обработке модулятором SF3b, тогда как NCI-H1650 не зависят от MCL1 и, следовательно, нечувствительны к обработке модулятором SF3b, демонстрируя только цитостаз, а не гибель (Aird et al., (2015). Abstract C8: Targeting MCL1-dependent cancers with SF3B splicing modulators. Molecular Cancer Therapeutics. 14. C8-C8. 10.1158/1535-7163.TARG-15-C8.).
Получение соединений и презентация их клеткам
Соединения для анализа получали в виде исходных растворов в 90% диметилсульфоксиде (DMSO), чистоту которого оценивали с помощью LC/MS, и проводили серийное разведение в DMSO с применением жидкостного манипулятора малого объема (VIAFLO ASSIST и электронной 16-канальной пипетки VIAFLO II, 0,5-12,5 мкл) при полулогарифмическом серийном разведении для 11 точек, чтобы создать источник для основного исследования дозозависимого эффекта (MDR), применяемого во всех тестах.
Перенос соединений из планшета с источником для исследования MDR в планшеты, готовые к анализу на клетках, осуществляли непосредственно с помощью низкоэнергетического акустического переноса (ATS100, EDC Biosystems). После переноса соединений в аналитический планшет диапазон концентраций для исследования дозозависимого эффекта, воздействующих на клетки, обычно составлял 10 мкМ-100 пМ (5 log), а конечная концентрация DMSO в анализе постоянно составляла 0,1%. Каждый аналитический планшет имел собственные точки отсчета, поскольку содержал в качестве отрицательных контролей среду-носитель/DMSO, в качестве положительных контролей только среду и цитотоксический контроль для исследования дозозависимого эффекта бортезомиба и стауроспорина. Планшеты, готовые к анализу, запаивали и хранили не более одного месяца при -20°C до применения.
В день проведения анализа клетки собирали, выполняли разведение от 37500 до 25000 клеток на мл, а затем 50 мкл (750-500 клеток) распределяли на планшеты, готовые к анализу, с использованием распределителя реагентов для наливных жидкостей (с применением распределителя реагентов Multidrop™ Combi, Thermo Scientific). Считывали планшет с DMSO, что соответствовало нулевому моменту времени (T0), а затем все другие планшеты инкубировали при 37°C с 5% CO2 и 95% относительной влажности до конца анализа. Анализы пролиферации и жизнеспособности клеток проводили через 72 часа после обработки в зависимости от роста клеток, при этом должно было произойти по меньшей мере одно удвоение числа.
Измерение антипролиферативной активности обработанных клеток
Оценку жизнеспособности и пролиферации проводили путем измерения содержания ATP в клетках с применением реагента для люминесцентного анализа жизнеспособности клеток CellTiter-Glo® (Promega) в соответствии с инструкциями изготовителя (CellTiter-Glo® Luminescent Cell Viability Assay Technical Bulletin Instructions for Use of Product(s) G7570, G7571, G7572, G7573 Literature № TB288, Revised 3/15) с применением ридера для микротитрационных планшетов (Envision, PE).
Пролиферацию клеток оценивали с применением сигнала в нулевой момент времени (T0) в качестве положительного контроля и лунок со средой-носителем в пределах планшета (DMSO) в качестве отрицательного контроля. Данные преобразовывали в процент ингибирования и представляли в диапазоне от -100% до 100% роста, где -100% обозначает цитотоксический эффект, и 100% обозначает не подвергнутый ингибированию или максимальный рост. Рост клеток на уровне 0% или около него считается стационарным ответом.
1. Результаты
среднее геометрическое
IC50 (нМ)
для SF3B1 (WT)
среднее геометрическое
IC50 (нМ)
для Ad2.1
среднее геометрическое
IC50 (нМ)
для Ad2.2
среднее геометрическое
GI50 (нМ),
72 ч.
PANC0504.1
среднее значение
минимального ответа, %
72 ч.
PANC0504.1
среднее геометрическое
GI50 (нМ),
72 ч.
NCIH1568.1
среднее значение
минимального ответа, %
72 ч.
NCIH1568.1
Введение по меньшей мере одного соединения, выбранного из соединений формулы I (в том числе формул IIa-e, IIIa, IVa и Va) и/или их фармацевтически приемлемых солей
Клетки рака толстой кишки CT26 (0,25 × 106; ATCC, № по кат. CRL-2638) имплантировали подкожно в правый бок самок мышей Balb/c (Envigo) возрастом восемь недель в 100 мкл Matrigel без PVS. Допускали рост опухоли CT26 в среднем до ~100 мм3, прежде чем животных включали в исследование эффективности. Каждая группа обработки содержала 12 мышей. Мышей обрабатывали по меньшей мере одним соединением, выбранным из соединений формулы I (в том числе формул IIa-e, IIIa, IVa и Va) и/или их фармацевтически приемлемых солей, антителом к CTLA4 или их комбинацией при различных дозах и посредством различных путей введения. По меньшей мере одно соединение, выбранное из соединений формулы I (в том числе формул IIa-e, IIIa, IVa и Va) и/или их фармацевтически приемлемых солей, находилось в составе композиции, содержащей 5% этанола и 95% раствора метилцеллюлозы (0,5% метилцеллюлозы). Антитело к CTLA4 находилось в составе с PBS при pH 7. Опухоли измеряли 3 раза в неделю в течение периода длительностью до 19 дней. Объемы опухолей рассчитывали по формуле для эллипсоида: объем опухоли = (длина × ширина2)/2.
Другие варианты осуществления
Вариант осуществления 1. Соединение, выбранное из соединений формулы I:

I,
и их фармацевтически приемлемых солей,
где:
R1 выбран из:
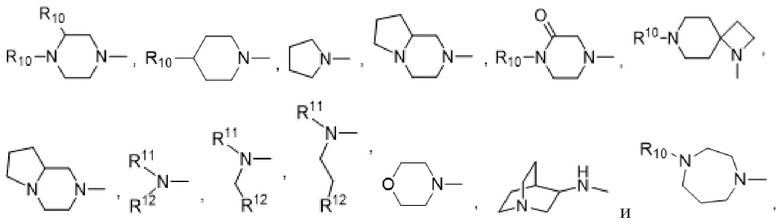
каждый из которых может быть необязательно замещен 1-3 группами, независимо выбранными из атомов галогена, гидроксильных групп, C1-C6алкильных групп, C1-C6алкоксигрупп, C3-C8циклоалкильных групп, гидрокси-C1-C6алкильных групп, диметиламиногрупп и метокси-C1-C6алкильных групп;
каждый из R2, R3, R4, R5, R6 и R7 независимо выбран из водорода, гидроксильных групп, групп -O-R10 и C1-C6алкильных групп;
каждый из R8, R9 и R13 независимо выбран из водорода и C1-C6алкильных групп;
R10 выбран из водорода, C1-C6алкильных групп, C1-C6аминоалкильных групп, C1-C6алкиламиногрупп, групп C1-C6алкилкарбоновой кислоты, C3-C8циклоалкильных групп, бензильных групп, C3-C8гетероциклильных групп, -CH2-C3-C8гетероциклильных групп, -C(O)-C3-C8гетероциклильных групп, ацильных групп, гидрокси-C1-C6алкильных групп, метокси-C1-C6алкильных групп, групп -CD3 и -C(O)-NR11R12;
R11 и R12 независимо выбраны из водорода, C1-C6алкильных групп, C1-C6аминоалкильных групп, C1-C6алкиламиногрупп, C3-C8циклоалкильных групп и C3-C8гетероциклильных групп;
V выбран из -CH2- и -N(R9)-;
W выбран из 3-8-членных карбоциклов и 3-8-членных гетероциклов, каждый из которых может быть необязательно замещен 1-3 группами, независимо выбранными из атомов галогена, групп -NR8R9, C1-C6алкильных групп, C1-C6алкоксигрупп, метокси-C1-C6алкильных групп, гидрокси-C1-C6алкильных групп и C3-C5циклоалкильных групп;
каждый из X и Y независимо выбран из связи, водорода, 3-8-членных карбоциклов и 3-8-членных гетероциклов, каждый из которых может быть необязательно замещен 1-3 группами, независимо выбранными из атомов галогена, гидроксильных групп, C1-C6алкильных групп, гидрокси-C1-C6алкильных групп, C1-C6алкоксигрупп, метокси-C1-C6алкильных групп, -SO2-C1-C6алкильных групп и групп -NR14R15, где каждый из R14 и R15 независимо выбран из водорода и C1-C6алкильных групп;
каждый из L1 и L2 независимо выбран из связи, -O-, -C(O)-, -C(O)O-, -N(R13)-C(O)-, -C(O)-N(R13)-, -N(R13)-S(O2)-, -S(O2)-N(R13)-, -S(O2)- и -N(R13)-; и
каждый n независимо выбран из 0-4.
Вариант осуществления 2. Соединение согласно варианту осуществления 1, где R1 выбран из  и
и  , каждый из которых может быть замещен 1-3 группами, выбранными из атомов галогена и C1-C6алкильных групп.
, каждый из которых может быть замещен 1-3 группами, выбранными из атомов галогена и C1-C6алкильных групп.
Вариант осуществления 3. Соединение согласно варианту осуществления 1 или варианту осуществления 2, где R1 выбран из  , который может быть замещен 1-3 группами, выбранными из C1-C6алкильных групп.
, который может быть замещен 1-3 группами, выбранными из C1-C6алкильных групп.
Вариант осуществления 4. Соединение согласно любому из вариантов осуществления 1-3, где R1 выбран из незамещенного  .
.
Вариант осуществления 5. Соединение согласно любому из вариантов осуществления 1-4, где R2 представляет собой метил, и R3 представляет собой водород.
Вариант осуществления 6. Соединение согласно любому из вариантов осуществления 1-5, где R4 представляет собой водород, и и R5 представляет собой гидроксил.
Вариант осуществления 7. Соединение согласно любому из вариантов осуществления 1-6, где R6 представляет собой водород, и и R7 представляет собой метил.
Вариант осуществления 8. Соединение согласно любому из вариантов осуществления 1-7, где R8 представляет собой метил.
Вариант осуществления 9. Соединение согласно любому из вариантов осуществления 1-8, где V представляет собой -CH2-.
Вариант осуществления 10. Соединение согласно любому из вариантов осуществления 1-9, где W выбран из бензольного кольца, пиридинового кольца, бензимидазольного кольца, бензотриазольного кольца, индазольного кольца, 1,2,3,6-тетрагидропиридинового кольца и имидазопиридинового кольца, каждое из которых может быть необязательно замещено 1-3 группами, независимо выбранными из атомов галогена, групп -NR8R9, C1-C6алкильных групп, C1-C6алкоксигрупп, метокси-C1-C6алкильных групп, гидрокси-C1-C6алкильных групп, и C3-C5циклоалкильных групп.
Вариант осуществления 11. Соединение согласно любому из вариантов осуществления 1-10, где W представляет собой бензольное кольцо, которое может быть необязательно замещено 1-3 группами, выбранными из атомов галогена и C1-C6алкильных групп.
Вариант осуществления 12. Соединение согласно любому из вариантов осуществления 1-11, где каждый из X и Y независимо выбран из связи,

каждый из которых может быть замещен 1-3 группами, независимо выбранными из атомов галогена, гидроксильных групп, C1-C6алкильных групп, гидрокси-C1-C6алкильных групп, C1-C6алкоксигрупп, метокси-C1-C6алкильных групп, -SO2-C1-C6алкильных групп и групп -NR14R15, где каждый из R14 и R15 независимо выбран из водорода и C1-C6алкильных групп.
Вариант осуществления 13. Соединение согласно любому из вариантов осуществления 1-11, где Y представляет собой водород, и X выбран из: 
каждый из которых может быть замещен 1-3 группами, независимо выбранными из атомов галогена, гидроксильных групп, C1-C6алкильных групп, гидрокси-C1-C6алкильных групп, C1-C6алкоксигрупп, метокси-C1-C6алкильных групп, -SO2-C1-C6алкильных групп и групп -NR14R15, где каждый из R14 и R15 независимо выбран из водорода и C1-C6алкильных групп.
Вариант осуществления 14. Соединение, выбранное из соединений формулы IIa:

IIa,
и их фармацевтически приемлемых солей,
где:
R10 выбран из водорода и метила;
W выбран из 3-8-членных карбоциклов и 3-8-членных гетероциклов, каждый из которых может быть замещен 1-3 группами, независимо выбранными из атомов галогена, групп -NR8R9, C1-C6алкильных групп, C1-C6алкоксигрупп, метокси-C1-C6алкильных групп, гидрокси-C1-C6алкильных групп и C3-C5циклоалкильных групп;
каждый из X и Y независимо выбран из связи, водорода, 3-8-членных карбоциклов и 3-8-членных гетероциклов, каждый из которых может быть замещен 1-3 группами, независимо выбранными из атомов галогена, гидроксильных групп, C1-C6алкильных групп, гидрокси-C1-C6алкильных групп, C1-C6алкоксигрупп, метокси-C1-C6алкильных групп, -SO2-C1-C6алкильных групп и групп -NR14R15, где каждый из R14 и R15 независимо выбран из водорода и C1-C6алкильных групп;
каждый из L1 и L2 независимо выбран из связи, -O-, -C(O)-, -C(O)O-, -N(R13)-C(O)-, -C(O)-N(R13)-, -N(R13)-S(O2)-, -S(O2)-N(R13)-, -S(O2)- и -N(R13)-, где R13 выбран из водорода и C1-C6алкильных групп; и
каждый n независимо выбран из 0-4.
Вариант осуществления 15. Соединение согласно варианту осуществления 14, где W выбран из бензольного кольца, пиридинового кольца, бензимидазольного кольца, бензотриазольного кольца, индазольного кольца, 1,2,3,6-тетрагидропиридинового кольца и имидазопиридинового кольца, каждое из которых может быть необязательно замещено 1-3 группами, независимо выбранными из атомов галогена, групп -NR8R9, C1-C6алкильных групп, C1-C6алкоксигрупп, метокси-C1-C6алкильных групп, гидрокси-C1-C6алкильных групп и C3-C5циклоалкильных групп.
Вариант осуществления 16. Соединение согласно варианту осуществления 14 или варианту осуществления 15, где W представляет собой бензольное кольцо, которое может быть необязательно замещено 1-3 группами, выбранными из атомов галогена и C1-C6алкильных групп.
Вариант осуществления 17. Соединение согласно любому из вариантов осуществления 14-16, где каждый из X и Y независимо выбран из связи,

каждый из которых может быть замещен 1-3 группами, независимо выбранными из атомов галогена, гидроксильных групп, C1-C6алкильных групп, гидрокси-C1-C6алкильных групп, C1-C6алкоксигрупп, метокси-C1-C6алкильных групп, -SO2-C1-C6алкильных групп и групп -NR14R15, где каждый из R14 и R15 независимо выбран из водорода и C1-C6алкильных групп.
Вариант осуществления 18. Соединение согласно любому из вариантов осуществления 14-17, где Y представляет собой водород, и X выбран из: 
каждый из которых может быть замещен 1-3 группами, независимо выбранными из атомов галогена, гидроксильных групп, C1-C6алкильных групп, гидрокси-C1-C6алкильных групп, C1-C6алкоксигрупп, метокси-C1-C6алкильных групп, -SO2-C1-C6алкильных групп и групп -NR14R15, где каждый из R14 и R15 независимо выбран из водорода и C1-C6алкильных групп.
Вариант осуществления 19. Соединение согласно любому из вариантов осуществления 14-17, где Y представляет собой водород, и X представляет собой связь.
Вариант осуществления 20. Соединение, выбранное из соединений формулы IIb:

IIb,
и их фармацевтически приемлемых солей,
где:
R16 выбран из водорода и фтора;
каждый из X и Y независимо выбран из связи, водорода, 3-8-членных карбоциклов и 3-8-членных гетероциклов, каждый из которых может быть замещен 1-3 группами, независимо выбранными из атомов галогена, гидроксильных групп, C1-C6алкильных групп, гидрокси-C1-C6алкильных групп, C1-C6алкоксигрупп, метокси-C1-C6алкильных групп, -SO2-C1-C6алкильных групп и групп -NR14R15, где каждый из R14 и R15 независимо выбран из водорода и C1-C6алкильных групп;
каждый из L1 и L2 независимо выбран из связи, -O-, -C(O)-, -C(O)O-, -N(R13)-C(O)-, -C(O)-N(R13)-, -N(R13)-S(O2)-, -S(O2)-N(R13)-, -S(O2)- и -N(R13)-, где R13 выбран из водорода и C1-C6алкильных групп; и
каждый n независимо выбран из 0-4.
Вариант осуществления 21. Соединение согласно варианту осуществления 20, где каждый из X и Y независимо выбран из связи,

каждый из которых может быть замещен 1-3 группами, независимо выбранными из атомов галогена, гидроксильных групп, C1-C6алкильных групп, гидрокси-C1-C6алкильных групп, C1-C6алкоксигрупп, метокси-C1-C6алкильных групп, -SO2-C1-C6алкильных групп и групп -NR14R15, где каждый из R14 и R15 независимо выбран из водорода и C1-C6алкильных групп.
Вариант осуществления 22. Соединение согласно варианту осуществления 20 или варианту осуществления 21, где Y представляет собой водород, и X выбран из: 
каждый из которых может быть замещен 1-3 группами, независимо выбранными из атомов галогена, гидроксильных групп, C1-C6алкильных групп, гидрокси-C1-C6алкильных групп, C1-C6алкоксигрупп, метокси-C1-C6алкильных групп, -SO2-C1-C6алкильных групп и групп -NR14R15, где каждый из R14 и R15 независимо выбран из водорода и C1-C6алкильных групп.
Вариант осуществления 23. Соединение согласно любому из вариантов осуществления 20-22, где Y представляет собой водород, и X представляет собой связь.
Вариант осуществления 24. Соединение согласно любому из вариантов осуществления 20-23, где R16 представляет собой фтор.
Вариант осуществления 25. Соединение, выбранное из соединений формулы IIc:

IIc,
и их фармацевтически приемлемых солей,
где:
R16 выбран из водорода и фтора;
Y выбран из водорода, 3-8-членных карбоциклов и 3-8-членных гетероциклов, каждый из которых может быть замещен 1-3 группами, независимо выбранными из атомов галогена, гидроксильных групп, C1-C6алкильных групп, гидрокси-C1-C6алкильных групп, C1-C6алкоксигрупп, метокси-C1-C6алкильных групп, -SO2-C1-C6алкильных групп и групп -NR14R15, где каждый из R14 и R15 независимо выбран из водорода и C1-C6алкильных групп;
L2 выбран из связи, -O-, -C(O)-, -C(O)O-, -N(R13)-C(O)-, -C(O)-N(R13)-, -N(R13)-S(O2)-, -S(O2)-N(R13)-, -S(O2)- и -N(R13)-, где R13 выбран из водорода и C1-C6алкильных групп;
n3 составляет 0; и
n4 выбран из 0-4.
Вариант осуществления 26. Соединение согласно варианту осуществления 25, где Y выбран из водорода,

каждый из которых может быть замещен 1-3 группами, независимо выбранными из атомов галогена, гидроксильных групп, C1-C6алкильных групп, гидрокси-C1-C6алкильных групп, C1-C6алкоксигрупп, метокси-C1-C6алкильных групп, -SO2-C1-C6алкильных групп и групп -NR14R15, где каждый из R14 и R15 независимо выбран из водорода и C1-C6алкильных групп.
Вариант осуществления 27. Соединение согласно варианту осуществления 25 или варианту осуществления 26, где L2 представляет собой связь.
Вариант осуществления 28. Соединение согласно любому из вариантов осуществления 25-27, где R16 представляет собой фтор.
Вариант осуществления 29. Соединение, выбранное из соединений формулы IId:

IId,
и их фармацевтически приемлемых солей,
где:
R16 выбран из водорода и фтора;
X выбран из водорода, 3-8-членных карбоциклов и 3-8-членных гетероциклов, каждый из которых может быть замещен 1-3 группами, независимо выбранными из атомов галогена, гидроксильных групп, C1-C6алкильных групп, гидрокси-C1-C6алкильных групп, C1-C6алкоксигрупп, метокси-C1-C6алкильных групп, -SO2-C1-C6алкильных групп и групп -NR14R15, где каждый из R14 и R15 независимо выбран из водорода и C1-C6алкильных групп;
L1 и L2 независимо выбраны из связи, -O-, -C(O)-, -C(O)O-, -N(R13)-C(O)-, -C(O)-N(R13)-, -N(R13)-S(O2)-, -S(O2)-N(R13)-, -S(O2)- и -N(R13)-, где R13 выбран из водорода и C1-C6алкильных групп; и
каждый n независимо выбран из 0-4.
Вариант осуществления 30. Соединение согласно варианту осуществления 29, где X выбран из связи,

каждый из которых может быть замещен 1-3 группами, независимо выбранными из атомов галогена, гидроксильных групп, C1-C6алкильных групп, гидрокси-C1-C6алкильных групп, C1-C6алкоксигрупп, метокси-C1-C6алкильных групп, -SO2-C1-C6алкильных групп и групп -NR14R15, где каждый из R14 и R15 независимо выбран из водорода и C1-C6алкильных групп.
Вариант осуществления 31. Соединение согласно варианту осуществления 29 или варианту осуществления 30, где каждый из X, L1 и L2 представляет собой связь.
Вариант осуществления 32. Соединение согласно любому из вариантов осуществления 25-27, где R16 представляет собой фтор.
Вариант осуществления 33. Соединение, выбранное из соединений формулы IIe:

IIe,
и их фармацевтически приемлемых солей,
где:
R16 выбран из водорода и фтора;
X независимо выбран из водорода, 3-8-членных карбоциклов и 3-8-членных гетероциклов, каждый из которых может быть замещен 1-3 группами, независимо выбранными из атомов галогена, гидроксильных групп, C1-C6алкильных групп, гидрокси-C1-C6алкильных групп, C1-C6алкоксигрупп, метокси-C1-C6алкильных групп, -SO2-C1-C6алкильных групп и групп -NR14R15, где каждый из R14 и R15 независимо выбран из водорода и C1-C6алкильных групп;
каждый из L1 и L2 независимо выбран из связи, -O-, -C(O)-, -C(O)O-, -N(R13)-C(O)-, -C(O)-N(R13)-, -N(R13)-S(O2)-, -S(O2)-N(R13)-, -S(O2)- и -N(R13)-, где R13 выбран из водорода и C1-C6алкильных групп; и
каждый n независимо выбран из 0-4.
Вариант осуществления 34. Соединение согласно варианту осуществления 33, где X выбран из связи,

каждый из которых может быть замещен 1-3 группами, независимо выбранными из атомов галогена, гидроксильных групп, C1-C6алкильных групп, гидрокси-C1-C6алкильных групп, C1-C6алкоксигрупп, метокси-C1-C6алкильных групп, -SO2-C1-C6алкильных групп и групп -NR14R15, где каждый из R14 и R15 независимо выбран из водорода и C1-C6алкильных групп.
Вариант осуществления 35. Соединение согласно варианту осуществления 33 или варианту осуществления 34, где каждый из X, L1 и L2 представляет собой связь.
Вариант осуществления 36. Соединение согласно любому из вариантов осуществления 33-35, где R16 представляет собой фтор.
Вариант осуществления 37. Соединение, выбранное из соединений формулы IIIa:

IIIa,
и их фармацевтически приемлемых солей,
где:
R10 выбран из водорода и метила;
W выбран из 3-8-членных карбоциклов и 3-8-членных гетероциклов, каждый из которых может быть замещен 1-3 группами, независимо выбранными из атомов галогена, групп -NR8R9, C1-C6алкильных групп, C1-C6алкоксигрупп, метокси-C1-C6алкильных групп, гидрокси-C1-C6алкильных групп и C3-C5циклоалкильных групп;
каждый из X и Y независимо выбран из связи, водорода, 3-8-членных карбоциклов и 3-8-членных гетероциклов, каждый из которых может быть замещен 1-3 группами, независимо выбранными из атомов галогена, гидроксильных групп, C1-C6алкильных групп, гидрокси-C1-C6алкильных групп, C1-C6алкоксигрупп, метокси-C1-C6алкильных групп, -SO2-C1-C6алкильных групп и групп -NR14R15, где каждый из R14 и R15 независимо выбран из водорода и C1-C6алкильных групп;
каждый из L1 и L2 независимо выбран из связи, -O-, -C(O)-, -C(O)O-, -N(R13)-C(O)-, -C(O)-N(R13)-, -N(R13)-S(O2)-, -S(O2)-N(R13)-, -S(O2)- и -N(R13)-, где R13 выбран из водорода и C1-C6алкильных групп; и
каждый n независимо выбран из 0-4.
Вариант осуществления 38. Соединение, выбранное из соединений формулы IVa:

IVa,
или их фармацевтически приемлемой соли,
где:
R10 выбран из водорода и метила;
W выбран из 3-8-членных карбоциклов и 3-8-членных гетероциклов, каждый из которых может быть замещен 1-3 группами, независимо выбранными из атомов галогена, групп -NR8R9, C1-C6алкильных групп, C1-C6алкоксигрупп, метокси-C1-C6алкильных групп, гидрокси-C1-C6алкильных групп и C3-C5циклоалкильных групп;
каждый из X и Y независимо выбран из связи, водорода, 3-8-членных карбоциклов и 3-8-членных гетероциклов, каждый из которых может быть замещен 1-3 группами, независимо выбранными из атомов галогена, гидроксильных групп, C1-C6алкильных групп, гидрокси-C1-C6алкильных групп, C1-C6алкоксигрупп, метокси-C1-C6алкильных групп, -SO2-C1-C6алкильных групп и групп -NR14R15, где каждый из R14 и R15 независимо выбран из водорода и C1-C6алкильных групп;
каждый из L1 и L2 независимо выбран из связи, -O-, -C(O)-, -C(O)O-, -N(R13)-C(O)-, -C(O)-N(R13)-, -N(R13)-S(O2)-, -S(O2)-N(R13)-, -S(O2)- и -N(R13)-, где R13 выбран из водорода и C1-C6алкильных групп; и
каждый n независимо выбран из 0-4.
Вариант осуществления 39. Соединение согласно варианту осуществления 38, где W выбран из бензольного кольца, пиридинового кольца, бензимидазольного кольца, бензотриазольного кольца, индазольного кольца, 1,2,3,6-тетрагидропиридинового кольца и имидазопиридинового кольца, каждое из которых может быть необязательно замещено 1-3 группами, независимо выбранными из атомов галогена, C1-C6алкильных групп, C1-C6алкоксигрупп, метокси-C1-C6алкильных групп, гидрокси-C1-C6алкильных групп и C3-C5циклоалкильных групп.
Вариант осуществления 40. Соединение согласно варианту осуществления 38 или варианту осуществления 39, где W представляет собой бензольное кольцо, которое может быть необязательно замещено 1-3 группами, выбранными из атомов галогена и C1-C6алкильных групп.
Вариант осуществления 41. Соединение согласно любому из вариантов осуществления 38-40, где каждый из X и Y независимо выбран из связи,

каждый из которых может быть замещен 1-3 группами, независимо выбранными из атомов галогена, гидроксильных групп, C1-C6алкильных групп, гидрокси-C1-C6алкильных групп, C1-C6алкоксигрупп, метокси-C1-C6алкильных групп, -SO2-C1-C6алкильных групп и групп -NR14R15, где каждый из R14 и R15 независимо выбран из водорода и C1-C6алкильных групп.
Вариант осуществления 42. Соединение согласно любому из вариантов осуществления 38-41, где Y представляет собой водород, и X выбран из: 
каждый из которых может быть замещен 1-3 группами, независимо выбранными из атомов галогена, гидроксильных групп, C1-C6алкильных групп, гидрокси-C1-C6алкильных групп, C1-C6алкоксигрупп, метокси-C1-C6алкильных групп, -SO2-C1-C6алкильных групп и групп -NR14R15, где каждый из R14 и R15 независимо выбран из водорода и C1-C6алкильных групп.
Вариант осуществления 43. Соединение согласно любому из вариантов осуществления 38-42, где Y представляет собой водород, и X представляет собой связь.
Вариант осуществления 44. Соединение, выбранное из соединений формулы Va:

Va,
или их фармацевтически приемлемой соли,
где:
R9 выбран из водорода и C1-C6алкильных групп;
R10 выбран из водорода и метила;
W выбран из 3-8-членных карбоциклов и 3-8-членных гетероциклов, каждый из которых может быть замещен 1-3 группами, независимо выбранными из атомов галогена, групп -NR8R9, C1-C6алкильных групп, C1-C6алкоксигрупп, метокси-C1-C6алкильных групп, гидрокси-C1-C6алкильных групп и C3-C5циклоалкильных групп;
каждый из X и Y независимо выбран из связи, водорода, 3-8-членных карбоциклов и 3-8-членных гетероциклов, каждый из которых может быть замещен 1-3 группами, независимо выбранными из атомов галогена, гидроксильных групп, C1-C6алкильных групп, гидрокси-C1-C6алкильных групп, C1-C6алкоксигрупп, метокси-C1-C6алкильных групп, -SO2-C1-C6алкильных групп и групп -NR14R15, где каждый из R14 и R15 независимо выбран из водорода и C1-C6алкильных групп;
каждый из L1 и L2 независимо выбран из связи, -O-, -C(O)-, -C(O)O-, -N(R13)-C(O)-, -C(O)-N(R13)-, -N(R13)-S(O2)-, -S(O2)-N(R13)-, -S(O2)- и -N(R13)-, где R13 выбран из водорода и C1-C6алкильных групп; и
каждый n независимо выбран из 0-4.
Вариант осуществления 45. Соединение согласно варианту осуществления 44, где W выбран из бензольного кольца, пиридинового кольца, бензимидазольного кольца, бензотриазольного кольца, индазольного кольца, 1,2,3,6-тетрагидропиридинового кольца и имидазопиридинового кольца, каждое из которых может быть необязательно замещено 1-3 группами, независимо выбранными из атомов галогена, групп -NR8R9, C1-C6алкильных групп, C1-C6алкоксигрупп, метокси-C1-C6алкильных групп, гидрокси-C1-C6алкильных групп и C3-C5циклоалкильных групп.
Вариант осуществления 46. Соединение согласно варианту осуществления 44 или варианту осуществления 45, где W представляет собой бензольное кольцо, которое может быть замещено 1-3 группами, выбранными из атомов галогена и C1-C6алкильных групп.
Вариант осуществления 47. Соединение согласно любому из вариантов осуществления 44-46, где каждый из X и Y независимо выбран из связи,

каждый из которых может быть замещен 1-3 группами, независимо выбранными из атомов галогена, гидроксильных групп, C1-C6алкильных групп, гидрокси-C1-C6алкильных групп, C1-C6алкоксигрупп, метокси-C1-C6алкильных групп, -SO2-C1-C6алкильных групп и групп -NR14R15, где каждый из R14 и R15 независимо выбран из водорода и C1-C6алкильных групп.
Вариант осуществления 48. Соединение согласно любому из вариантов осуществления 44-47, где Y представляет собой водород, и X выбран из: 
каждый из которых может быть замещен 1-3 группами, независимо выбранными из атомов галогена, гидроксильных групп, C1-C6алкильных групп, гидрокси-C1-C6алкильных групп, C1-C6алкоксигрупп, метокси-C1-C6алкильных групп, -SO2-C1-C6алкильных групп и групп -NR14R15, где каждый из R14 и R15 независимо выбран из водорода и C1-C6алкильных групп.
Вариант осуществления 49. Соединение согласно любому из вариантов осуществления 44-48, где Y представляет собой водород, и X представляет собой связь.
Вариант осуществления 50. Соединение, выбранное из:
[(2S,3S,4E,6R,7S,10R)-10-гидрокси-3,7-диметил-12-оксо-2-[(E)-1-(3-пиперазин-1-илфенил)проп-1-ен-2-ил]-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-10-гидрокси-3,7-диметил-2-[(E)-1-[3-(4-метилпиперазин-1-ил)фенил]проп-1-ен-2-ил]-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-(3-фтор-5-морфолин-4-илфенил)проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-10-гидрокси-2-[(E)-1-(1H-индазол-6-ил)проп-1-ен-2-ил]-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-10-гидрокси-2-[(E)-1-(1H-индазол-4-ил)проп-1-ен-2-ил]-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-10-гидрокси-3,7-диметил-2-[(E)-1-(2-морфолин-4-илпиридин-4-ил)проп-1-ен-2-ил]-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-(2-фтор-5-морфолин-4-илфенил)проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-(4-фтор-3-морфолин-4-илфенил)проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-10-гидрокси-3,7-диметил-2-[(E)-1-[3-[(3S)-3-(метиламино)пирролидин-1-ил]фенил]проп-1-ен-2-ил]-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-10-гидрокси-3,7-диметил-2-[(E)-1-[3-[(3S)-3-(метиламино)пирролидин-1-ил]фенил]проп-1-ен-2-ил]-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-(2-фтор-5-морфолин-4-илфенил)проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-пиперидин-1-илпиперидин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-фтор-5-[4-(2-гидроксиэтил)пиперазин-1-ил]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-фтор-5-[4-(2-гидроксиэтил)пиперазин-1-ил]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-пиперидин-1-илпиперидин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-фтор-5-[(3R)-3-фторпирролидин-1-ил]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-фтор-5-[(2R)-2-(гидроксиметил)пирролидин-1-ил]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7R,10S)-2-[(E)-1-[3-[(2R,6S)-2,6-диметилморфолин-4-ил]-5-фторфенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-пиперидин-1-илпиперидин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-[(3S)-3-(диметиламино)пирролидин-1-ил]-5-фторфенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-10-гидрокси-3,7-диметил-2-[(E)-1-(3-метил-5-морфолин-4-илфенил)проп-1-ен-2-ил]-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-10-гидрокси-3,7-диметил-2-[(E)-1-[3-морфолин-4-ил-5-(трифторметил)фенил]проп-1-ен-2-ил]-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-(3-хлор-5-морфолин-4-илфенил)проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-(3-фтор-5-морфолин-4-илфенил)проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-(2-гидроксиэтил)пиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-(3-фтор-5-морфолин-4-илфенил)проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-N-метил-N-(1-метилпиперидин-4-ил)карбамата;
[(2R,3R,4E,6R,7S,10S)-2-[(E)-1-(3-фтор-5-морфолин-4-илфенил)проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-(3S)-3,4-диметилпиперазин-1-карбоксилата;
[(2R,3R,4E,6R,7S,10S)-2-[(E)-1-(3-фтор-5-морфолин-4-илфенил)проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-пропан-2-илпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-(3-фтор-5-морфолин-4-илфенил)проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-трет-бутилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-(3-фтор-5-морфолин-4-илфенил)проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-циклобутилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-(3-фтор-5-морфолин-4-илфенил)проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-циклопентилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-(3,5-дифторфенил)проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-(диметиламино)-5-фторфенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-фтор-5-(4-гидроксипиперидин-1-ил)фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-фтор-5-[метил-(1-метилпиперидин-4-ил)амино]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-фтор-5-[(1R,5S)-8-окса-3-азабицикло[3.2.1]октан-3-ил]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-фтор-5-(2-окса-7-азаспиро[3.4]октан-7-ил)фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-фтор-5-[(3R)-3-гидроксипирролидин-1-ил]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-фтор-5-(3-оксопирролидин-1-ил)фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-(3-фтор-5-морфолин-4-илфенил)проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-(оксан-4-ил)пиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-(3-фтор-5-морфолин-4-илфенил)проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-N-метил-N-(1-метилпиперидин-3-ил)карбамата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-фтор-5-(3-фторазетидин-1-ил)фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-фтор-5-[(3S)-3-(метиламино)пирролидин-1-ил]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-(3-фтор-5-морфолин-4-илфенил)проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-3-(диметиламино)пиперидин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-фтор-5-[(2R)-2-метилпирролидин-1-ил]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-фтор-5-(2-оксопирролидин-1-ил)фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-фтор-5-[(2S)-2-метилпирролидин-1-ил]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-фтор-5-[(2R)-2-(гидроксиметил)пирролидин-1-ил]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-фтор-5-[(3R)-3-(метиламино)пирролидин-1-ил]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-(5-хлорпиридин-3-ил)проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-(3-фтор-5-морфолин-4-илфенил)проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-N-метил-N-(пиридин-4-илметил)карбамата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-(3,5-дихлорфенил)проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-(1,1-диоксо-1,2-тиазолидин-2-ил)фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-(1,3-диметилиндазол-6-ил)проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-(1,1-диоксо-1,4-тиазинан-4-ил)-5-фторфенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-N, N-диметилкарбамата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-(1,1-диоксо-1,4-тиазинан-4-ил)-5-фторфенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-фтор-5-[4-(2-гидроксиэтил)пиперазин-1-ил]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-морфолин-4-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-фтор-5-[4-(2-гидроксиэтил)пиперазин-1-ил]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-N-метил-N-(1-метилпиперидин-4-ил)карбамата;
[(2S,3S,4E,6R,7S,10R)-10-гидрокси-3,7-диметил-2-[(E)-1-(1-метилиндазол-6-ил)проп-1-ен-2-ил]-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-фтор-5-(3-оксоморфолин-4-ил)фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[4-(циклопентилсульфамоил)-2-фторфенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-фтор-5-(4-метилсульфонилпиперазин-1-ил)фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-(4-фтор-1H-индазол-6-ил)проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-(3-фтор-5-имидазол-1-илфенил)проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6S,7R,10S)-2-[(E)-1-(3-фтор-5-морфолин-4-илфенил)проп-1-ен-2-ил]-7,10-дигидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6S,7R,10R)-2-[(E)-1-(3-фтор-5-морфолин-4-илфенил)проп-1-ен-2-ил]-7,10-дигидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-пиперидин-1-илпиперидин-1-карбоксилата;
[(2S,3S,4E,6S,7R,10S)-2-[(E)-1-(3-фтор-5-морфолин-4-илфенил)проп-1-ен-2-ил]-7,10-дигидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-пиперидин-1-илпиперидин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-фтор-5-(2-оксоимидазолидин-1-ил)фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-фтор-5-[3-(2-гидроксиэтил)-2-оксоимидазолидин-1-ил]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-фтор-5-[3-(2-фторэтинил)-2-оксоимидазолидин-1-ил]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-фтор-5-[3-(2-морфолин-4-илэтил)-2-оксоимидазолидин-1-ил]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-[3-(циклопропилметил)-2-оксоимидазолидин-1-ил]-5-фторфенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7R,10S)-2-[(E)-1-[3-фтор-5-[(2S)-2-метилморфолин-4-ил]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7R,10S)-2-[(E)-1-[3-фтор-5-(2-метилморфолин-4-ил)фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7R,10S)-2-[(E)-1-[3-фтор-5-[4-[(2S,3R)-3-гидрокси-2-метилпентил]пиперазин-1-ил]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7R,10S)-2-[(E)-1-[3-фтор-5-[4-[(2R,3R)-3-гидрокси-2-метилпентаноил]пиперазин-1-ил]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-фтор-5-[4-(2-морфолин-4-илэтилсульфонил)пиперазин-1-ил]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-(4-этенилсульфонилпиперазин-1-ил)-5-фторфенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-фтор-5-[(3R)-3-метилморфолин-4-ил]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-фтор-5-[(2R)-2-(гидроксиметил)морфолин-4-ил]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-фтор-5-[(3S)-3-(гидроксиметил)морфолин-4-ил]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7R,10S)-2-[(E)-1-[3-фтор-5-[(2R)-2-(метилкарбамоил)морфолин-4-ил]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-фтор-5-(2-оксо-1,3-диaзинан-1-ил)фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-[3-(циклопропилметил)-2-оксо-1,3-диaзинан-1-ил]-5-фторфенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7R,10S)-2-[(E)-1-[3-фтор-5-[4-[(2R)-2-гидроксипропаноил]пиперазин-1-ил]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-(3-фтор-5-морфолин-4-илфенил)проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-3,4,6,7,8,8a-гексагидро-1H-пирроло[1,2-a]пиразин-2-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-фтор-5-[(3S)-3-метилморфолин-4-ил]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-[4-(2-циклопропил-2-оксоэтил)пиперазин-1-ил]-5-фторфенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-фтор-5-[4-(2-оксо-2-пиразин-2-илэтил)пиперазин-1-ил]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6S,7R,10R)-2-[(E)-1-(3-фтор-5-морфолин-4-илфенил)проп-1-ен-2-ил]-7,10-дигидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[1-(циклопропилметил)-4-фториндазол-6-ил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-10-гидрокси-2-[(E)-1-имидазо[1,2-a]пиридин-6-илпроп-1-ен-2-ил]-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-10-гидрокси-3,7-диметил-2-[(E)-1-(7-метил-1H-индазол-4-ил)проп-1-ен-2-ил]-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[4-(циклопропилсульфамоил)-3-фторфенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[2-фтор-5-(4-гидроксипиперидин-1-ил)сульфонилфенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-(3-фтор-5-морфолин-4-илфенил)проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-(2,2,2-трифторэтил)пиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-10-гидрокси-3,7-диметил-12-оксо-2-[(E)-1-(3-пиперазин-1-илсульфонилфенил)проп-1-ен-2-ил]-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-(4-формилпиперазин-1-ил)сульфонилфенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-10-гидрокси-2-[(E)-1-[3-(4-гидроксипиперидин-1-ил)сульфонилфенил]проп-1-ен-2-ил]-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-10-гидрокси-3,7-диметил-2-[(E)-1-(6-метил-1H-индазол-4-ил)проп-1-ен-2-ил]-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-(1,3-диметилиндазол-4-ил)проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-(3-фтор-5-морфолин-4-илфенил)проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-N-(1-азабицикло[2.2.2]октан-3-ил)-N-метилкарбамата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[2-(циклопропилметил)-4-фториндазол-6-ил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[4-фтор-1-(2-гидроксиэтил)индазол-6-ил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-(4-фтор-1-метилиндазол-6-ил)проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-10-гидрокси-3,7-диметил-12-оксо-2-[(E)-1-[1-(пиридин-4-илметил)пиразол-4-ил]проп-1-ен-2-ил]-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-10-гидрокси-3,7-диметил-2-[(E)-1-(1-метилпиразол-4-ил)проп-1-ен-2-ил]-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-фтор-5-[4-(2-гидроксиэтил)-3-оксопиперазин-1-ил]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7R,10S)-2-[(E)-1-[3-фтор-5-[4-(2-метоксиэтил)-3-оксопиперазин-1-ил]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-10-гидрокси-3,7-диметил-2-[(E)-1-[1-(1-метилпиперидин-4-ил)пиразол-4-ил]проп-1-ен-2-ил]-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-фтор-5-[4-(2,2,2-трифторэтил)пиперазин-1-ил]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7R,10S)-2-[(E)-1-[3-фтор-5-[4-(2-метоксиацетил)пиперазин-1-ил]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-[4-(циклопропанкарбонил)пиперазин-1-ил]-5-фторфенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7R,10S)-2-[(E)-1-[3-фтор-5-[4-(4-метоксифенил)сульфонилпиперазин-1-ил]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-фтор-5-[4-(1-метилпиразол-4-ил)сульфонилпиперазин-1-ил]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-фтор-5-(4-пиридин-3-илсульфонилпиперазин-1-ил)фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-фтор-5-[4-(1-метилимидазол-4-ил)сульфонилпиперазин-1-ил]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-[4-(циклогексанкарбонил)пиперазин-1-ил]-5-фторфенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-фтор-5-[4-(1-метилиндол-6-ил)сульфонилпиперазин-1-ил]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[4-фтор-1-(оксан-4-ил)индазол-6-ил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[4-фтор-2-(оксан-4-ил)индазол-6-ил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-фтор-5-[4-(оксан-4-карбонил)пиперазин-1-ил]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-фтор-5-[4-(2-морфолин-4-илацетил)пиперазин-1-ил]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-фтор-5-[4-(1-метилимидазол-4-карбонил)пиперазин-1-ил]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-[4-(2-циклопропилацетил)пиперазин-1-ил]-5-фторфенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-фтор-5-[4-(2-пиразол-1-илацетил)пиперазин-1-ил]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-фтор-5-[4-(1,3-оксазол-5-карбонил)пиперазин-1-ил]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-фтор-5-[4-(2-гидроксиэтилсульфонил)пиперазин-1-ил]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-фтор-5-[4-(оксетан-3-илсульфонил)пиперазин-1-ил]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[4-фтор-1-(оксетан-3-илсульфонил)индазол-6-ил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-10-гидрокси-2-[(E)-1-(1-гидроксиизохинолин-7-ил)проп-1-ен-2-ил]-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7R,10S)-2-[(E)-1-[4-фтор-1-[2-(метиламино)-2-оксоэтил]индазол-6-ил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[4-фтор-1-(2-оксо-2-пирролидин-1-илэтил)индазол-6-ил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[4-фтор-1-(2-морфолин-4-ил-2-оксоэтил)индазол-6-ил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[1-(цианометил)-4-фториндазол-6-ил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[1-[2-(диметиламино)-2-оксоэтил]-4-фториндазол-6-ил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[1-(циклопропилметил)-3-фториндазол-6-ил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7R,10S)-2-[(E)-1-[3-фтор-5-[4-(3-метоксипропаноил)пиперазин-1-ил]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-фтор-5-[4-(2-гидроксиацетил)пиперазин-1-ил]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-фтор-5-[4-(3-гидроксипропил)пиперазин-1-ил]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-(циклопропилметил)-7-фторбензoтриазол-5-ил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[2-(циклопропилметил)-7-фторбензoтриазол-5-ил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[1-(циклопропилметил)-7-фторбензoтриазол-5-ил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[7-фтор-3-(оксан-4-ил)бензoтриазол-5-ил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[7-фтор-2-(оксан-4-ил)бензoтриазол-5-ил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7R,10S)-2-[(E)-1-[7-фтор-3-(2-метоксиэтил)бензимидазол-5-ил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-фтор-5-[4-(оксолан-3-карбонил)пиперазин-1-ил]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[7-фтор-3-[1-[(2-метилпропан-2-ил)оксикарбонил]пиперидин-4-ил]бензoтриазол-5-ил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-[(4-хлорфенил)метил]-7-фторбензoтриазол-5-ил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-(1-ацетилпиперидин-4-ил)-7-фторбензимидазол-5-ил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[7-фтор-3-(4-гидроксициклогексил)бензoтриазол-5-ил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[7-фтор-3-(оксан-4-илметил)бензoтриазол-5-ил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[7-фтор-3-[(2S)-1-гидроксипропан-2-ил]бензoтриазол-5-ил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[7-фтор-3-[(2R)-1-гидроксипропан-2-ил]бензoтриазол-5-ил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-фтор-5-[4-[(3S)-оксолан-3-карбонил]пиперазин-1-ил]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-фтор-5-[4-[(3R)-оксолан-3-карбонил]пиперазин-1-ил]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-фтор-5-[4-(оксетан-3-карбонил)пиперазин-1-ил]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-фтор-5-[4-(3-метилоксетан-3-карбонил)пиперазин-1-ил]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-фтор-5-[4-(3-гидроксипропаноил)пиперазин-1-ил]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[7-фтор-3-(4-метилоксан-4-ил)бензoтриазол-5-ил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[7-фтор-3-(1-метилсульфонилпиперидин-4-ил)бензoтриазол-5-ил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-(1,1-диоксотиан-4-ил)-7-фторбензoтриазол-5-ил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7R,10S)-2-[(E)-1-[7-фтор-3-(2-метоксиэтил)бензoтриазол-5-ил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-(1-ацетилпиперидин-4-ил)-7-фторбензoтриазол-5-ил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[7-фтор-3-[(3R)-оксан-3-ил]бензoтриазол-5-ил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[7-фтор-3-[(3S)-оксан-3-ил]бензoтриазол-5-ил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[7-фтор-3-[(3R,4S)-3-гидроксиоксан-4-ил]бензoтриазол-5-ил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-(3-циклогексил-7-фторбензoтриазол-5-ил)проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7R,10S)-2-[(E)-1-[7-фтор-3-(4-метоксифенил)бензoтриазол-5-ил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7R,10S)-2-[(E)-1-[7-фтор-3-[(4-метоксифенил)метил]бензoтриазол-5-ил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-(3-хлор-5-фторфенил)проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-фтор-5-[метил(оксан-4-ил)амино]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-фтор-5-[метил(оксетан-3-ил)амино]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-10-гидрокси-3,7-диметил-2-[(E)-1-[3-[метил(оксан-4-ил)амино]фенил]проп-1-ен-2-ил]-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-10-гидрокси-3,7-диметил-2-[(E)-1-[3-[метил(оксетан-3-ил)амино]фенил]проп-1-ен-2-ил]-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-[(1,1-диоксотиан-4-ил)-метиламино]-5-фторфенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-фтор-5-[(1-метилсульфонилпиперидин-4-ил)амино]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-фтор-5-[метил-(1-метилсульфонилпиперидин-4-ил)амино]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7R,10S)-2-[(E)-1-[3-[этил-(1-метилсульфонилпиперидин-4-ил)амино]-5-фторфенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7R,10S)-2-[(E)-1-[3-фтор-5-[(1-метилсульфонилпиперидин-4-ил)-пропан-2-иламино]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-[(1-ацетилпиперидин-4-ил)-метиламино]-5-фторфенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7R,10S)-2-[(E)-1-[3-фтор-5-[метил-(1-пропаноилпиперидин-4-ил)амино]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7R,10S)-2-[(E)-1-[3-фтор-5-[[1-(2-метоксиацетил)пиперидин-4-ил]-метиламино]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-[(1-бензоилпиперидин-4-ил)-метиламино]-5-фторфенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-фтор-5-[метил-[1-(2,2,2-трифторацетил)пиперидин-4-ил]амино]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7R,10S)-2-[(E)-1-[3-фтор-5-[метил-(1-пропилсульфонилпиперидин-4-ил)амино]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-[(1-циклопентилсульфонилпиперидин-4-ил)-метиламино]-5-фторфенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-фтор-5-[метил-[1-(1-метилимидазол-4-ил)сульфонилпиперидин-4-ил]амино]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-[[1-(бензолсульфонил)пиперидин-4-ил]-метиламино]-5-фторфенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-[(1-ацетилпиперидин-4-ил)метил-метиламино]-5-фторфенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-фтор-5-[метил-[(1-метилсульфонилпиперидин-4-ил)метил]амино]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-фтор-5-[метил-[1-(1,3-оксазол-5-карбонил)пиперидин-4-ил]амино]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-фтор-5-[метил-[1-(пиразин-2-карбонил)пиперидин-4-ил]амино]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-фтор-5-[метил-[1-(1-метилимидазол-4-карбонил)пиперидин-4-ил]амино]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7R,10S)-2-[(E)-1-[3-фтор-5-[метил-[1-(пропан-2-илкарбамоил)пиперидин-4-ил]амино]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7R,10S)-2-[(E)-1-[3-фтор-5-[метил-[1-(пропилкарбамоил)пиперидин-4-ил]амино]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-фтор-5-[метил-[1-(фенилкарбамоил)пиперидин-4-ил]амино]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-фтор-5-(1-метилсульфонилпиперидин-4-ил)оксифенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[1-(4,4-дифторциклогексил)-4-фториндазол-6-ил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[4-фтор-1-(1-метилсульфонилпиперидин-4-ил)индазол-6-ил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-(3-фтор-5-пирролидин-1-илсульфонилфенил)проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-(азетидин-1-илсульфонил)фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-10-гидрокси-2-[(E)-1-[3-[(3R)-3-гидроксипирролидин-1-ил]сульфонилфенил]проп-1-ен-2-ил]-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7R,10S)-10-гидрокси-3,7-диметил-2-[(E)-1-[3-[(2S)-2-метилпирролидин-1-ил]сульфонилфенил]проп-1-ен-2-ил]-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-10-гидрокси-2-[(E)-1-[3-[(1-гидрокси-2-метилпропан-2-ил)сульфамоил]фенил]проп-1-ен-2-ил]-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-(4,4-дифторпиперидин-1-ил)сульфонилфенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-10-гидрокси-3,7-диметил-2-[(E)-1-(4-метил-3-пирролидин-1-илсульфонилфенил)проп-1-ен-2-ил]-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-(3,3-дифторпирролидин-1-ил)сульфонилфенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-10-гидрокси-3,7-диметил-12-оксо-2-[(E)-1-(5-пирролидин-1-илсульфонилпиридин-3-ил)проп-1-ен-2-ил]-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-(3,3-дифторазетидин-1-ил)сульфонилфенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-10-гидрокси-3,7-диметил-2-[(E)-1-[4-метил-3-(2-оксопирролидин-1-ил)фенил]проп-1-ен-2-ил]-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-(трет-бутилсульфамоил)фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7R,10S)-10-гидрокси-3,7-диметил-12-оксо-2-[(E)-1-[3-(пропан-2-илсульфамоил)фенил]проп-1-ен-2-ил]-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7R,10S)-2-[(E)-1-[3-(этилсульфамоил)фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-10-гидрокси-3,7-диметил-2-[(E)-1-[3-(4-метилпиперазин-1-ил)сульфонилфенил]проп-1-ен-2-ил]-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7R,10S)-10-гидрокси-3,7-диметил-2-[(E)-1-[3-(метилсульфамоил)фенил]проп-1-ен-2-ил]-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-10-гидрокси-3,7-диметил-12-оксо-2-[(E)-1-(3-пиперидин-1-илсульфонилфенил)проп-1-ен-2-ил]-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-10-гидрокси-3,7-диметил-12-оксо-2-[(E)-1-(3-пирролидин-1-илсульфонилфенил)проп-1-ен-2-ил]-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-(3-циклопропилсульфонилфенил)проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-(циклопропилсульфониламино)фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-фтор-5-[(3S)-3-(метансульфонамидо)пирролидин-1-ил]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7R,10S)-2-[(E)-1-[3-фтор-5-[(3S)-3-[(2-метоксиацетил)амино]пирролидин-1-ил]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-10-гидрокси-3,7-диметил-2-[(E)-1-[1-[(2-метилпропан-2-ил)оксикарбонил]-3,6-дигидро-2H-пиридин-5-ил]проп-1-ен-2-ил]-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2R,3R,4E,6R,7S,10S)-2-[(E)-1-(3-фтор-5-морфолин-4-илфенил)проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-(тридейтериометил)пиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-фтор-5-[4-(2-пиразол-1-илацетил)пиперазин-1-ил]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-N-(пиридин-4-илметил)карбамата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-фтор-5-[4-(2-пиразол-1-илацетил)пиперазин-1-ил]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-N-(пиримидин-4-илметил)карбамата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-фтор-5-[4-(2-пиразол-1-илацетил)пиперазин-1-ил]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-морфолин-4-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-фтор-5-[4-(2-пиразол-1-илацетил)пиперазин-1-ил]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-N-[2-(диметиламино)этил]карбамата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-фтор-5-[4-(2-пиразол-1-илацетил)пиперазин-1-ил]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метил-1,4-диазепан-1-карбоксилата;
[(2R,3R,4E,6R,7S,10S)-2-[(E)-1-[3-фтор-5-[4-(2-пиразол-1-илацетил)пиперазин-1-ил]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-N-[(4-метоксифенил)метил]карбамата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-фтор-5-[4-(2-пиразол-1-илацетил)пиперазин-1-ил]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-(3R)-3-(диметиламино)пирролидин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-фтор-5-[4-(2-пиразол-1-илацетил)пиперазин-1-ил]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-(3S)-3-(диметиламино)пирролидин-1-карбоксилата;
[(2R,3R,4E,6R,7S,10S)-2-[(E)-1-[3-фтор-5-[4-(2-пиразол-1-илацетил)пиперазин-1-ил]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-N-[(2S)-1-гидроксипропан-2-ил]карбамата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-фтор-5-[4-(2-пиразол-1-илацетил)пиперазин-1-ил]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-3-оксопиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-фтор-5-[4-(2-пиразол-1-илацетил)пиперазин-1-ил]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-(3R)-3-фторпирролидин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-фтор-5-[4-(2-пиразол-1-илацетил)пиперазин-1-ил]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-3,3,4-триметилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-фтор-5-[4-(2-пиразол-1-илацетил)пиперазин-1-ил]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-N-метил-N-(1-метилпиперидин-4-ил)карбамата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-фтор-5-[4-(2-пиразол-1-илацетил)пиперазин-1-ил]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-(2-гидроксиэтил)пиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-фтор-5-[4-(2-пиразол-1-илацетил)пиперазин-1-ил]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-пиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-фтор-5-[4-(2-пиразол-1-илацетил)пиперазин-1-ил]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-циклогептилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-фтор-5-[4-(2-пиразол-1-илацетил)пиперазин-1-ил]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-пиридин-4-илпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-фтор-5-[4-(2-пиразол-1-илацетил)пиперазин-1-ил]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-циклогексилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-фтор-5-[4-(2-пиразол-1-илацетил)пиперазин-1-ил]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-N-[2-(4-гидроксифенил)этил]-N-метилкарбамата;
(2S,3S,6R,7S,10R,E)-2-((E)-1-(3-фтор-5-морфолинофенил)проп-1-ен-2-ил)-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил-7-метил-1,7-диазаспиро[3.5]нонан-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-(3-фтор-5-морфолин-4-илфенил)проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-N-(3-морфолин-4-илпропил)карбамата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-(3-фтор-5-морфолин-4-илфенил)проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-N-[2-(диметиламино)этил]карбамата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-(3-фтор-5-морфолин-4-илфенил)проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-(3R)-3-(диметиламино)пирролидин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-(3-фтор-5-морфолин-4-илфенил)проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-(3S)-3-(диметиламино)пирролидин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-(3-фтор-5-морфолин-4-илфенил)проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-N-(2-цианоэтил)-N-метилкарбамата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-(3-фтор-5-морфолин-4-илфенил)проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-3,3,4-триметилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-(3-фтор-5-морфолин-4-илфенил)проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-(3R)-3-фторпирролидин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-(диметилсульфамоиламино)-5-фторфенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7R,10S)-2-[(E)-1-[3-фтор-5-[(2-метоксиацетил)амино]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-[(2-циклопропилацетил)амино]-5-фторфенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-фтор-5-[4-(2-пиразол-1-илацетил)пиперазин-1-ил]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-[(3-гидроксифенил)метил]пиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-фтор-5-[4-(2-пиразол-1-илацетил)пиперазин-1-ил]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-(пиридин-3-илметил)пиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-(1-ацетилпиперидин-4-ил)-7-фторбензoтриазол-5-ил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-пиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-10-гидрокси-2-[(E)-1-[3-[[(3R)-3-гидроксипирролидин-1-карбонил]оксиметил]фенил]проп-1-ен-2-ил]-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[3-[(E)-2-[(2S,3S,4E,6R,7S,10R)-10-гидрокси-3,7-диметил-6-(4-метилпиперазин-1-карбонил)окси-12-оксо-1-оксациклододец-4-ен-2-ил]проп-1-енил]фенил]метил-2-окса-7-азаспиро[3.4]октан-7-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-10-гидрокси-2-[(E)-1-[2-[(2R)-2-(гидроксиметил)пирролидин-1-ил]пиридин-4-ил]проп-1-ен-2-ил]-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[3-[(E)-2-[(2S,3S,4E,6R,7S,10R)-10-гидрокси-3,7-диметил-6-(4-метилпиперазин-1-карбонил)окси-12-оксо-1-оксациклододец-4-ен-2-ил]проп-1-енил]фенил]метилморфолин-4-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-(диметилкарбамоилоксиметил)фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-10-гидрокси-2-[(E)-1-[3-[[(2R)-2-(гидроксиметил)пирролидин-1-карбонил]оксиметил]фенил]проп-1-ен-2-ил]-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-[[(3R)-3-фторпирролидин-1-карбонил]оксиметил]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-10-гидрокси-2-[(E)-1-[3-[(4-гидроксипиперидин-1-карбонил)оксиметил]фенил]проп-1-ен-2-ил]-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-(3-фтор-5-морфолин-4-илфенил)проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-пиперидин-1-илпиперидин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-10-гидрокси-2-[(E)-1-[3-[4-(2-гидроксиэтил)пиперазин-1-ил]фенил]проп-1-ен-2-ил]-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-пиперидин-1-илпиперидин-1-карбоксилата;
2-[4-[3-фтор-5-[(E)-2-[(2S,3S,4E,6R,7S,10R)-10-гидрокси-3,7-диметил-12-оксо-6-(пиперазин-1-карбонилокси)-1-оксациклододец-4-ен-2-ил]проп-1-енил]фенил]пиперазин-1-ил]уксусной кислоты;
(2S,3S,6R,7S,10R,E)-2-((E)-1-(3-(диметиламино)фенил)проп-1-ен-2-ил)-10-гидрокси-3,7-диметил-12-оксооксациклододец-4-ен-6-ил-4-метилпиперазин-1-карбоксилата;
(2S,3S,6R,7S,10R,E)-2-((E)-1-(3-(диметиламино)фенил)проп-1-ен-2-ил)-10-гидрокси-3,7-диметил-12-оксооксациклододец-4-ен-6-илпиперазин-1-карбоксилата;
(2S,3S,6R,7S,10R,E)-2-((E)-1-(5-хлорпиридин-3-ил)проп-1-ен-2-ил)-10-гидрокси-3,7-диметил-12-оксооксациклододец-4-ен-6-илпиперазин-1-карбоксилата;
(2S,3S,6R,7S,10R,E)-10-гидрокси-3,7-диметил-12-оксо-2-((E)-1-(3-(пирролидин-1-илсульфонил)фенил)проп-1-ен-2-ил)оксациклододец-4-ен-6-илпиперазин-1-карбоксилата;
и их фармацевтически приемлемых солей.
Вариант осуществления 51. Соединение согласно любому из вариантов осуществления 1-50, где указанное соединение содержит более приблизительно 80% по весу одного стереоизомера соединения.
Вариант осуществления 52. Соединение согласно варианту осуществления согласно любому из вариантов осуществления 1-50, где указанное соединение содержит более приблизительно 90% по весу одного стереоизомера соединения.
Вариант осуществления 53. Соединение согласно любому из вариантов осуществления 1-50, где указанное соединение содержит более приблизительно 95% по весу одного стереоизомера соединения.
Вариант осуществления 54. Соединение согласно любому из вариантов осуществления 1-50, где указанное соединение содержит более приблизительно 97% по весу одного стереоизомера соединения.
Вариант осуществления 55. Фармацевтическая композиция, содержащая по меньшей мере одно соединение, выбранное из соединений и/или их фармацевтически приемлемых солей по любому из пп. 1-54.
Вариант осуществления 56. Фармацевтическая композиция согласно варианту осуществления 55, где указанная композиция составлена для внутривенного, перорального, подкожного или внутримышечного введения.
Вариант осуществления 57. Фармацевтическая композиция согласно варианту осуществления 56, где указанная композиция составлена для перорального введения.
Вариант осуществления 58. Способ лечения рака у субъекта, нуждающегося в этом, включающий введение указанному субъекту терапевтически эффективного количества по меньшей мере одного соединения, выбранного из соединений и/или их фармацевтически приемлемых солей согласно любому из вариантов осуществления 1-54, или фармацевтической композиции согласно любому из вариантов осуществления 55-57, где рак выбран из миелодиспластического синдрома, хронического лимфоцитарного лейкоза, острого лимфобластного лейкоза, хронического миеломоноцитарного лейкоза, острого миелоидного лейкоза, рака толстой кишки, рака поджелудочной железы, рака эндометрия, рака яичника, рака молочной железы, увеальной меланомы, рака желудка, холангиокарциномы и рака легкого.
Вариант осуществления 59. Способ согласно варианту осуществления 58, где указанный рак выбран из миелодиспластического синдрома, хронического лимфоцитарного лейкоза, острого лимфобластного лейкоза, хронического миеломоноцитарного лейкоза и острого миелоидного лейкоза.
Вариант осуществления 60. Способ согласно варианту осуществления 58, где указанный рак представляет собой миелодиспластический синдром.
Вариант осуществления 61. Способ согласно варианту осуществления 58, где указанный рак представляет собой хронический миеломоноцитарный лейкоз.
Вариант осуществления 62. Способ согласно варианту осуществления 58, где указанный рак представляет собой острый миелоидный лейкоз.
Вариант осуществления 63. Способ согласно варианту осуществления 58, где указанный рак представляет собой хронический лимфоцитарный лейкоз.
Вариант осуществления 64. Способ согласно варианту осуществления 58, где указанный рак представляет собой острый лимфобластный лейкоз.
Вариант осуществления 65. Способ согласно варианту осуществления 58, где указанный рак представляет собой рак эндометрия.
Вариант осуществления 66. Способ согласно варианту осуществления 58, где указанный рак представляет собой рак яичника.
Вариант осуществления 67. Способ согласно варианту осуществления 58, где указанный рак представляет собой рак молочной железы.
Вариант осуществления 68. Способ согласно варианту осуществления 58, где указанный рак представляет собой увеальную меланому.
Вариант осуществления 69. Способ согласно варианту осуществления 58, где указанный рак представляет собой рак желудка.
Вариант осуществления 70. Способ согласно варианту осуществления 58, где указанный рак представляет собой холангиокарциному.
Вариант осуществления 71. Способ согласно варианту осуществления 58, где указанный рак представляет собой рак легкого.
Вариант осуществления 72. Способ согласно варианту осуществления 58, где указанный рак представляет собой рак толстой кишки.
Вариант осуществления 73. Способ согласно варианту осуществления 58, где указанный рак представляет собой рак поджелудочной железы.
Вариант осуществления 74. Способ согласно любому из вариантов осуществления 58-73, где указанный рак является положительным в отношении одной или нескольких мутаций в гене или белке сплайсосомы.
Вариант осуществления 75. Способ согласно варианту осуществления 74, где указанный ген или белок сплайсосомы выбран из субъединицы 1 фактора сплайсинга 3B (SF3B1), вспомогательного фактора 1 малых ядерных РНК U2 (U2AF1), фактора сплайсинга 2 с высоким содержанием серина/аргинина (SRSF2), белка 2 с "цинковыми пальцами" (тип CCCH), РНК-связывающим мотивом и высоким содержанием серина/аргинина (ZRSR2), фактора сплайсинга 8, участвующего в процессинге pre-mRNA (PRPF8), вспомогательного фактора 2 малых ядерных РНК U2 (U2AF2), фактора сплайсинга 1 (SF1), субъединицы 1 фактора сплайсинга 3a (SF3A1), гомолога B фактора 40 процессинга pre-mRNA PRP40 (PRPF40B), белка 10 с РНК-связывающим мотивом (RBM10), поли(rC)-связывающего белка 1 (PCBP1), фактора 1, участвующего в сплайсинге pre-mRNA, "crooked neck" (CRNKL1), геликазы 9 c DEAH-боксом (Asp-Glu-Ala-His) (DHX9), белка 2, подобного пептидил-пролил-цис-транс-изомеразе (PPIL2), белка 22 с РНК-связывающим мотивом (RBM22), малого ядерного рибонуклеопротеина Sm D3 (SNRPD3), предполагаемой ATP-зависимой РНК-геликазы DDX5 (DDX5), фактора, участвующего в сплайсинге pre-mRNA, с активностью ATP-зависимой РНК-геликазы DHX15 (DHX15) и полиаденилат-связывающего белка 1 (PABPC1).
Вариант осуществления 76. Способ согласно варианту осуществления 75, где ген или белок сплайсосомы представляют собой субъединицу 1 фактора сплайсинга 3B.
Вариант осуществления 77. Способ лечения рака у субъекта, нуждающегося в этом, включающий введение указанному субъекту терапевтически эффективного количества по меньшей мере одного соединения, выбранного из соединений и/или их фармацевтически приемлемых солей согласно любому из вариантов осуществления 1-54, или фармацевтической композиции согласно любому из вариантов осуществления 55-57 и по меньшей мере одного дополнительного средства терапии.
Вариант осуществления 78. Способ согласно варианту осуществления 77, где по меньшей мере одно дополнительное средство терапии предусматривает по меньшей мере одно, по меньшей мере два, по меньшей мере три, по меньшей мере четыре или по меньшей мере пять дополнительных средств терапии.
Вариант осуществления 79. Способ согласно варианту осуществления 77, где терапевтически эффективное количество по меньшей мере одного соединения, выбранного из соединений и/или их фармацевтически приемлемых солей согласно любому из вариантов осуществления 1-54, или фармацевтической композиции согласно любому из вариантов осуществления 55-57, и/или по меньшей мере одного дополнительного средства терапии снижено на 10%, 15%, 20%, 25%, 30%, 35%, 40%, 45%, 50%, 75% или 90% относительно стандартной дозировки соединения формулы I или его фармацевтически приемлемой соли и/или по меньшей мере одного дополнительного средства терапии.
Вариант осуществления 80. Способ согласно любому из вариантов осуществления 77-79, где частота введения по меньшей мере одного соединения, выбранного из соединений и/или их фармацевтически приемлемых солей согласно любому из вариантов осуществления 1-54, или фармацевтической композиции согласно любому из вариантов осуществления 55-57 и/или по меньшей мере одно дополнительного средства терапии на по меньшей мере 10%, 15%, 20%, 25%, 30%, 35%, 40%, 45%, 50%, 75%, или 90% меньше относительно стандартной схемы введения по меньшей мере одного соединения, выбранного из соединений и/или их фармацевтически приемлемых солей согласно любому из вариантов осуществления 1-54, или фармацевтической композиции согласно любому из вариантов осуществления 55-57, и/или по меньшей мере одного дополнительного средства терапии.
Вариант осуществления 81. Способ согласно любому из вариантов осуществления 77-80, где вводимое количество и/или доза по меньшей мере одного соединения, выбранного из соединений и/или их фармацевтически приемлемых солей согласно любому из вариантов осуществления 1-54, или фармацевтической композиции согласно любому из вариантов осуществления 55-57, и/или по меньшей мере одного дополнительного средства терапии приводят к более низкой системной токсичности и/или улучшенной переносимости.
Вариант осуществления 82. Способ согласно варианту осуществления 77, где введение по меньшей мере одного соединения, выбранного из соединений и/или их фармацевтически приемлемых солей согласно любому из вариантов осуществления 1-54, или фармацевтической композиции согласно любому из вариантов осуществления 55-57 начинают до введения по меньшей мере одного дополнительного средства терапии.
Вариант осуществления 83. Способ согласно варианту осуществления 77, где введение по меньшей мере одного соединения, выбранного из соединений и/или их фармацевтически приемлемых солей согласно любому из вариантов осуществления 1-54, или фармацевтической композиции согласно любому из вариантов осуществления 55-57 начинают после введения по меньшей мере одного дополнительного средства терапии.
Вариант осуществления 84. Способ согласно варианту осуществления 77, где введение по меньшей мере одного соединения, выбранного из соединений и/или их фармацевтически приемлемых солей согласно любому из вариантов осуществления 1-54, или фармацевтической композиции согласно любому из вариантов осуществления 55-57 начинают одновременно с введением по меньшей мере одного дополнительного средства терапии.
Вариант осуществления 85. Способ согласно любому из вариантов осуществления 77-84, где введение по меньшей мере одного соединения, выбранного из соединений и/или их фармацевтически приемлемых солей согласно любому из вариантов осуществления 1-54, или фармацевтической композиции согласно любому из вариантов осуществления 55-57 повторяют по меньшей мере один раз после начального введения.
Вариант осуществления 86. Способ согласно варианту осуществления 85, где количество по меньшей мере одного соединения, выбранного из соединений и/или их фармацевтически приемлемых солей согласно любому из вариантов осуществления 1-54, или фармацевтической композиции согласно любому из вариантов осуществления 55-57, применяемое для повторного введения, снижено относительно количества, применяемого для начального введения.
Вариант осуществления 87. Способ согласно варианту осуществления 85, где количество по меньшей мере одного соединения, выбранного из соединений и/или их фармацевтически приемлемых солей согласно любому из вариантов осуществления 1-54, или фармацевтической композиции согласно любому из вариантов осуществления 55-57, применяемое для повторного введения, снижено относительно стандартной дозировки по меньшей мере одного соединения, выбранного из соединений и/или их фармацевтически приемлемых солей согласно любому из вариантов осуществления 1-54, или фармацевтической композиции согласно любому из вариантов осуществления 55-57.
Вариант осуществления 88. Способ согласно варианту осуществления 85, где количество по меньшей мере одного соединения, выбранного из соединений и/или их фармацевтически приемлемых солей согласно любому из вариантов осуществления 1-54, или фармацевтической композиции согласно любому из вариантов осуществления 55-57, применяемое для повторного введения, снижено на 10%, 15%, 20%, 25%, 30%, 35%, 40%, 45%, 50%, 75% или 90% относительно стандартной дозировки по меньшей мере одного соединения, выбранного из соединений и/или их фармацевтически приемлемых солей согласно любому из вариантов осуществления 1-54, или фармацевтической композиции согласно любому из вариантов осуществления 55-57.
Вариант осуществления 89. Способ согласно любому из вариантов осуществления 77-88, где введение по меньшей мере одного дополнительного средства терапии повторяют по меньшей мере один раз после начального введения.
Вариант осуществления 90. Способ согласно варианту осуществления 89, где количество по меньшей мере одного дополнительного средства терапии, применяемое для повторного введения, снижено относительно количества, применяемого для начального введения.
Вариант осуществления 91. Способ согласно варианту осуществления 89, где количество по меньшей мере одного дополнительного средства терапии, применяемое для повторного введения, снижено относительно стандартной дозировки по меньшей мере одного дополнительного средства терапии.
Вариант осуществления 92. Способ согласно варианту осуществления 89, где количество по меньшей мере одного дополнительного средства терапии, применяемое для повторного введения, снижено на 10%, 15%, 20%, 25%, 30%, 35%, 40%, 45%, 50%, 75% или 90% относительно стандартной дозировки по меньшей мере одного дополнительного средства терапии.
Вариант осуществления 93. Способ согласно любому из вариантов осуществления 77-92, где повторное введение по меньшей мере одного соединения, выбранного из соединений и/или их фармацевтически приемлемых солей согласно любому из вариантов осуществления 1-54, или фармацевтической композиции согласно любому из вариантов осуществления 55-57 осуществляют одновременно с повторным введением по меньшей мере одного дополнительного средства терапии.
Вариант осуществления 94. Способ согласно любому из вариантов осуществления 77-92, где повторное введение по меньшей мере одного соединения, выбранного из соединений и/или их фармацевтически приемлемых солей согласно любому из вариантов осуществления 1-54, или фармацевтической композиции согласно любому из вариантов осуществления 55-57 осуществляют последовательно или с разнесением во времени с повторным введением по меньшей мере одного дополнительного средства терапии.
Вариант осуществления 95. Способ согласно любому из вариантов осуществления 77-94, где по меньшей мере одно дополнительное средство терапии предусматривает введение ингибитора контрольных точек.
Вариант осуществления 96. Способ согласно варианту осуществления 95, где субъект характеризуется непереносимостью, невосприимчивостью или недостаточной восприимчивостью ингибитора контрольных точек при введении его по отдельности.
Вариант осуществления 97. Способ согласно варианту осуществления 95, где ингибитор контрольных точек целенаправленно воздействует на CTLA4, PD1, PDL1, OX40, CD40, GITR, LAG3, TIM3 и/или KIR.
Вариант осуществления 98. Способ согласно варианту осуществления 95, где ингибитор контрольных точек целенаправленно воздействует на CTLA4, OX40, CD40 и/или GITR.
Вариант осуществления 99. Способ согласно варианту осуществления 97 или варианту осуществления 98, где ингибитор контрольных точек предусматривает ингибитор пути антигена 4, ассоциированного с цитотоксическими T-лимфоцитами (CTLA4).
Вариант осуществления 100. Способ согласно варианту осуществления 99, где ингибитор CTLA4 представляет собой антитело к CTLA4.
Вариант осуществления 101. Способ согласно варианту осуществления 100, где антитело к CTLA4 представляет собой ипилимумаб.
Вариант осуществления 102. Способ согласно варианту осуществления 97 или варианту осуществления 98, где ингибитор контрольных точек предусматривает ингибитор пути белка 1 программируемой клеточной гибели (PD1).
Вариант осуществления 103. Способ согласно варианту осуществления 102, где ингибитор PD1 представляет собой антитело к PD1.
Вариант осуществления 104. Способ согласно варианту осуществления 103, где антитело к PD1 представляет собой ниволумаб.
Вариант осуществления 105. Способ согласно варианту осуществления 102, где ингибитор PD1 представляет собой антитело к PDL1.
Вариант осуществления 106. Способ согласно варианту осуществления 105, где антитело к PDL1 представляет собой атезолизумаб.
Вариант осуществления 107. Способ согласно варианту осуществления 97 или варианту осуществления 98, где ингибитор контрольных точек предусматривает ингибитор CTLA4 и ингибитор PD1.
Вариант осуществления 108. Способ согласно варианту осуществления 107, где ингибитор CTLA4 представляет собой антитело к CTLA4.
Вариант осуществления 109. Способ согласно варианту осуществления 108, где антитело к CTLA4 представляет собой ипилимумаб.
Вариант осуществления 110. Способ согласно варианту осуществления 107 или варианту осуществления 108, где ингибитор PD1 представляет собой антитело к PD1.
Вариант осуществления 111. Способ согласно варианту осуществления 110, где антитело к PD1 представляет собой ниволумаб.
Вариант осуществления 112. Способ согласно варианту осуществления 107 или варианту осуществления 108, где ингибитор PD1 представляет собой антитело к PDL1.
Вариант осуществления 113. Способ согласно варианту осуществления 112, где антитело к PDL1 представляет собой атезолизумаб.
Вариант осуществления 114. Способ согласно любому из вариантов осуществления 77-94, где по меньшей мере одно дополнительное средство терапии предусматривает введение цитокина или аналога цитокина.
Вариант осуществления 115. Способ согласно варианту осуществления 114, где субъект характеризуется непереносимостью, невосприимчивостью или недостаточной восприимчивостью цитокина или аналога цитокина при введении их по отдельности.
Вариант осуществления 116. Способ согласно варианту осуществления 114, где цитокин или аналог цитокина предусматривает средство усиления для T-клеток.
Вариант осуществления 117. Способ согласно варианту осуществления 114, где цитокин или аналог цитокина предусматривает IL-2, IL-10, IL-12, IL-15, IFNγ и/или TNFα.
Вариант осуществления 118. Способ согласно любому из вариантов осуществления 77-94, где по меньшей мере одно дополнительное средство терапии предусматривает сконструированные T-клетки, целенаправленно воздействующие на опухоль.
Вариант осуществления 119. Способ согласно любому из вариантов осуществления 77-118, где субъект характеризуется мутационной нагрузкой с несинонимичными изменениями, составляющей приблизительно 150 мутаций или меньше.
Вариант осуществления 120. Способ согласно любому из вариантов осуществления 77-119, где субъект характеризуется мутационной нагрузкой с несинонимичными изменениями, составляющей приблизительно 100 мутаций или меньше.
Вариант осуществления 121. Способ согласно любому из вариантов осуществления 77-120, где субъект характеризуется мутационной нагрузкой с несинонимичными изменениями, составляющей 50 мутаций или меньше.
Вариант осуществления 122. Способ согласно любому из вариантов осуществления 77-121, где рак представляет собой гематологическое злокачественное новообразование или солидную опухоль. Способ согласно варианту осуществления 122, где гематологическое злокачественное новообразование выбрано из B-клеточного злокачественного новообразования, лейкоза, лимфомы и миеломы.
Вариант осуществления 123. Способ согласно варианту осуществления 122 или варианту осуществления 123, где гематологическое злокачественное новообразование выбрано из острого миелоидного лейкоза и множественной миеломы.
Вариант осуществления 124. Способ согласно варианту осуществления 122, где солидная опухоль выбрана из рака молочной железы, рака желудка, рака предстательной железы, рака яичника, рака легкого, рака матки, карциномы слюнных протоков, меланомы, рака толстой кишки и рака пищевода.
Вариант осуществления 125. Способ согласно любому из вариантов осуществления 77-121, где рак выбран из миелодиспластического синдрома, хронического лимфоцитарного лейкоза, острого лимфобластного лейкоза, хронического миеломоноцитарного лейкоза, острого миелоидного лейкоза, рака толстой кишки, рака поджелудочной железы, рака эндометрия, рака яичника, рака молочной железы, увеальной меланомы, рака желудка, холангиокарциномы и рака легкого.
Вариант осуществления 126. Способ индуцирования образования по меньшей мере одного неоантигена, включающий приведение неопластической клетки в контакт с терапевтически эффективным количеством по меньшей мере одного соединения, выбранного из соединений и/или их фармацевтически приемлемых солей согласно любому из вариантов осуществления 1-54, или фармацевтической композиции согласно любому из вариантов осуществления 55-57, вследствие чего осуществляется индуцирование продуцирования по меньшей мере одного неоантигена.
Вариант осуществления 127. Способ согласно варианту осуществления 126, где неопластическая клетка находится в культуре клеток in vitro.
Вариант осуществления 128. Способ согласно варианту осуществления 126 или варианту осуществления 127, где неопластическая клетка получена от субъекта.
Вариант осуществления 129. Способ согласно варианту осуществления 126, где неопластическая клетка находится в субъекте.
Вариант осуществления 130. Способ согласно любому из вариантов осуществления 126-129, где неопластическая клетка получена из гематологического злокачественного новообразования или солидной опухоли.
Вариант осуществления 131. Способ согласно варианту осуществления 130, где гематологическое злокачественное новообразование выбрано из B-клеточного злокачественного новообразования, лейкоза, лимфомы и миеломы.
Вариант осуществления 132. Способ согласно варианту осуществления 130 или варианту осуществления 131, где гематологическое злокачественное новообразование выбрано из острого миелоидного лейкоза и множественной миеломы.
Вариант осуществления 133. Способ согласно варианту осуществления 130, где солидная опухоль выбрана из рака молочной железы, рака желудка, рака предстательной железы, рака яичника, рака легкого, рака матки, карциномы слюнных протоков, меланомы, рака толстой кишки и рака пищевода.
Вариант осуществления 134. Способ индуцирования образования по меньшей мере одного неоантигена и/или развития Т-клеточного ответа у субъекта с неопластическим нарушением или подозрением на его наличие, включающий введение субъекту терапевтически эффективного количества по меньшей мере одного соединения, выбранного из соединений и/или их фармацевтически приемлемых солей согласно любому из вариантов осуществления 1-54, или фармацевтической композиции согласно любому из вариантов осуществления 55-57.
Вариант осуществления 135. Способ лечения субъекта с неопластическим нарушением или подозрением на его наличие, включающий введение субъекту терапевтически эффективного количества по меньшей мере одного соединения, выбранного из соединений и/или их фармацевтически приемлемых солей согласно любому из вариантов осуществления 1-54, или фармацевтической композиции согласно любому из вариантов осуществления 55-57, где введение по меньшей мере одного соединения или фармацевтической композиции индуцирует образование по меньшей мере одного неоантигена и/или развитие T-клеточного ответа.
Вариант осуществления 136. Способ согласно варианту осуществления 135, где вводимое количество по меньшей мере одного соединения или фармацевтической композиции снижено вследствие индуцирования образования по меньшей мере одного неоантигена и/или развития Т-клеточного ответа относительно стандартной дозировки по меньшей мере одного соединения или фармацевтической композиции.
Вариант осуществления 137. Способ согласно варианту осуществления 136, где вводимое количество по меньшей мере одного соединения или фармацевтической композиции снижено на 10%, 15%, 20%, 25%, 30%, 35%, 40%, 45%, 50%, 75% или 90% относительно стандартной дозировки по меньшей мере одного соединения или фармацевтической композиции.
Вариант осуществления 138. Способ согласно любому из вариантов осуществления 135-137, где частота введения по меньшей мере одного соединения или фармацевтической композиции на по меньшей мере 10%, 15%, 20%, 25%, 30%, 35%, 40%, 45%, 50%, 75% или 90% меньше относительно стандартной схемы введения по меньшей мере одного соединения или фармацевтической композиции.
Вариант осуществления 139. Способ согласно любому из вариантов осуществления 135-137, где вводимое количество и/или дозировка по меньшей мере одного соединения или фармацевтической композиции приводят к более низкой системной токсичности и/или улучшенной переносимости.
Вариант осуществления 140. Способ согласно любому из вариантов осуществления 134-119, дополнительно включающий введение по меньшей мере одного дополнительного средства терапии.
| название | год | авторы | номер документа |
|---|---|---|---|
| ОПРЕДЕЛЕННЫЕ СОЕДИНЕНИЯ ПЛАДИЕНОЛИДА И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2019 |
|
RU2813597C2 |
| КОНЪЮГАТЫ АНТИТЕЛА И ЛЕКАРСТВЕННОГО СРЕДСТВА В КАЧЕСТВЕ МОДУЛЯТОРА СПЛАЙСИНГА И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2019 |
|
RU2799438C2 |
| СОЕДИНЕНИЯ С КОНДЕНСИРОВАННЫМИ КОЛЬЦАМИ | 2019 |
|
RU2783414C2 |
| ТВЕРДЫЕ ФОРМЫ ПЛАДИЕНОЛИДПИРИДИНОВЫХ СОЕДИНЕНИЙ И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2016 |
|
RU2743349C2 |
| Аналоги сплицеостатина | 2013 |
|
RU2618523C2 |
| ПИРИДИНОВЫЕ СОЕДИНЕНИЯ ПЛАДИЕНОЛИДА И СПОСОБЫ ПРИМЕНЕНИЯ | 2015 |
|
RU2807278C2 |
| ПИРИДИНОВЫЕ СОЕДИНЕНИЯ ПЛАДИЕНОЛИДА И СПОСОБЫ ПРИМЕНЕНИЯ | 2015 |
|
RU2707730C2 |
| ПРОИЗВОДНЫЕ ЦИКЛОГЕКСАНА ИЛИ ТЕТРАГИДРОПИРАНА, ИЛИ ИХ ФАРМАЦЕВТИЧЕСКИ ПРИЕМЛЕМЫЕ СОЛИ, ИЛИ ГИДРАТЫ, ИЛИ СОЛЬВАТЫ ЭТИХ СОЕДИНЕНИЙ, ИЛИ ИХ СОЛЕЙ, ПРОМЕЖУТОЧНЫЕ СОЕДИНЕНИЯ ДЛЯ ИХ ПОЛУЧЕНИЯ И ФУНГИЦИДНОЕ СРЕДСТВО | 1992 |
|
RU2084439C1 |
| РЕАКЦИИ МАКРОЦИКЛИЗАЦИИ И ПРОМЕЖУТОЧНЫЕ СОЕДИНЕНИЯ И ДРУГИЕ ФРАГМЕНТЫ, ПРИГОДНЫЕ В ПОЛУЧЕНИИ АНАЛОГОВ ХАЛИХОНДРИНА B | 2014 |
|
RU2710545C2 |
| ЗАМЕЩЕННЫЕ ПРОИЗВОДНЫЕ КАРБОНУКЛЕОЗИДА, ПРИМЕНЯЕМЫЕ В КАЧЕСТВЕ ПРОТИВОРАКОВЫХ АГЕНТОВ | 2017 |
|
RU2712944C1 |
Изобретение относится к производным пладиенолида или его фармацевтически приемлемым солям, представленным общей формулой I, где R1 выбран из (а-m), и каждый из которых может быть необязательно замещен 1-3 группами, независимо выбранными из атомов галогена, гидроксильных групп, C1-C6алкильных групп, C1-C6алкоксигрупп, C3-C8циклоалкильных групп, и диметиламиногрупп; каждый из R2, R3, R4, R5, R6 и R7 независимо выбран из водорода, гидроксильных групп и C1-C6алкильных групп; каждый из R8, R9 и R13 независимо выбран из водорода и C1-C6алкильных групп; R10, R11 и R12 приведены в формуле изобретения; V представляет собой -CH2-; W выбран из 3-8-членных карбоциклов и 3-10-членных гетероциклов, содержащих 1-3 гетероатома, выбранных из азота и кислорода, каждый из которых может быть необязательно замещен 1-2 группами, независимо выбранными из атомов галогена, групп -NR8R9 и C1-C6алкильных групп; X независимо выбран из связи, 3-8-членных карбоциклов и 3-8-членных гетероциклов, содержащих 1-2 гетероатома, выбранных из азота, серы и кислорода, каждый из которых может быть необязательно замещен 1-2 группами, независимо выбранными из атомов галогена, гидроксильных групп, C1-C6алкильных групп, гидрокси-C1-C6алкильных групп, C1-C6алкоксигрупп, метокси-C1-C6алкильных групп, -SO2-C1-C6алкильных групп и групп -NR14R15, где каждый из R14 и R15 независимо выбран из водорода и C1-C6алкильных групп; Y независимо выбран из водорода, 3-8-членных карбоциклов и 3-8-членных гетероциклов, содержащих 1-2 гетероатома, выбранных из азота, серы и кислорода, каждый из которых может быть необязательно замещен 1-2 группами, независимо выбранными из атомов галогена, гидроксильных групп, C1-C6алкильных групп, гидрокси-C1-C6алкильных групп, C1-C6алкоксигрупп, метокси-C1-C6алкильных групп, -SO2-C1-C6алкильных групп и групп -NR14R15, где каждый из R14 и R15 независимо выбран из водорода и C1-C6алкильных групп; каждый из L1 и L2 независимо выбран из связи, -O-, -C(O)-, -C(O)O-, -N(R13)-C(O)-, -C(O)-N(R13)-, -N(R13)-S(O2)-, -S(O2)-N(R13)-, -S(O2)- и -N(R13)-; и каждый n независимо выбран из 0-4. Также изобретение относится к соединениям, представленным структурными формулами IIa, IIb, IIc, IId, IIe, IIIa, IVa и конкретным соединениям (приведены в формуле изобретения). Технический результат – соединения, применяемые в качестве средств, оказывающих целенаправленное действие на сплайсосому для лечения рака. 9 н. и 34 з.п. ф-лы, 24 табл., 268 пр.
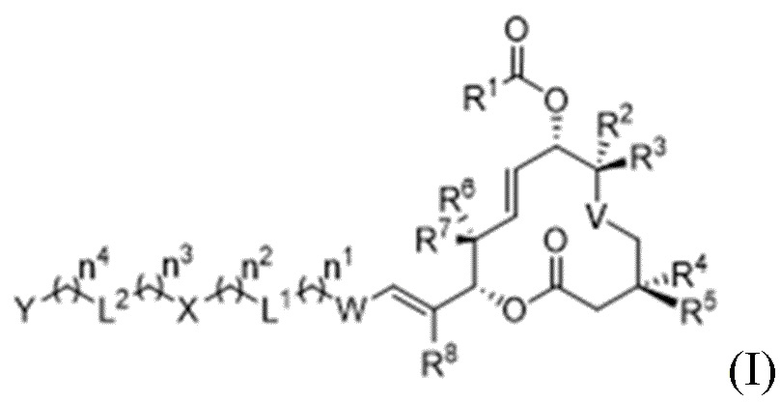
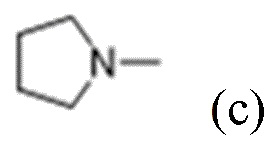
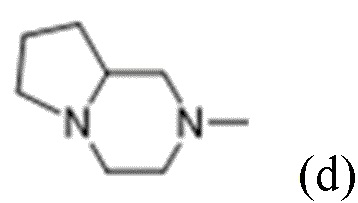
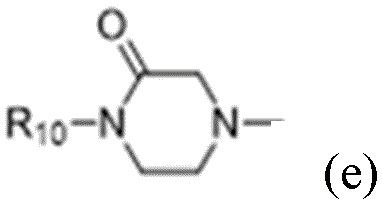
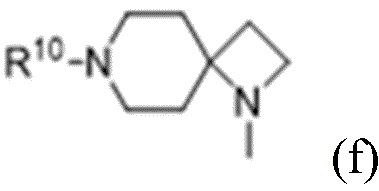

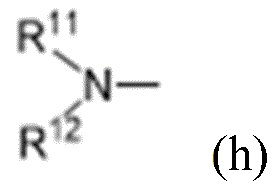
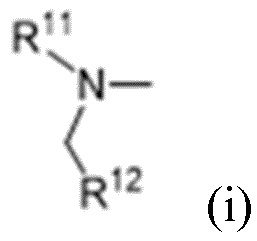

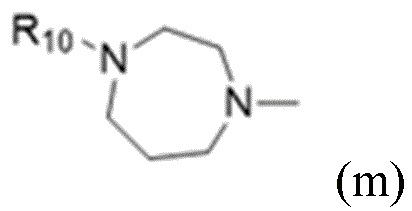
1. Соединение, выбранное из соединений формулы I

I
и их фармацевтически приемлемых солей,
где R1 выбран из:

каждый из которых может быть необязательно замещен 1-3 группами, независимо выбранными из атомов галогена, гидроксильных групп, C1-C6алкильных групп, C1-C6алкоксигрупп, C3-C8циклоалкильных групп и диметиламиногрупп;
каждый из R2, R3, R4, R5, R6 и R7 независимо выбран из водорода, гидроксильных групп и C1-C6алкильных групп;
каждый из R8, R9 и R13 независимо выбран из водорода и C1-C6алкильных групп;
R10 выбран из водорода, C1-C6алкильных групп, C3-C8циклоалкильных групп, бензильных групп, C3-C8гетероциклильных групп, содержащих 1-2 гетероатома, выбранных из азота и кислорода, -CH2-C3-C8гетероциклильных групп, содержащих 1-2 гетероатома, выбранных из азота и кислорода, гидрокси-C1-C6алкильных групп и групп -CD3;
R11 и R12 независимо выбраны из водорода, C1-C6алкильных групп, C1-C6аминоалкильных групп, C1-C6алкиламиногрупп и C3-C8гетероциклильных групп, содержащих 1-2 гетероатома, выбранных из азота и кислорода;
V представляет собой -CH2-;
W выбран из 3-8-членных карбоциклов и 3-10-членных гетероциклов, содержащих 1-3 гетероатома, выбранных из азота и кислорода, каждый из которых может быть необязательно замещен 1-2 группами, независимо выбранными из атомов галогена, групп -NR8R9 и C1-C6алкильных групп;
X независимо выбран из связи, 3-8-членных карбоциклов и 3-8-членных гетероциклов, содержащих 1-2 гетероатома, выбранных из азота, серы и кислорода, каждый из которых может быть необязательно замещен 1-2 группами, независимо выбранными из атомов галогена, гидроксильных групп, C1-C6алкильных групп, гидрокси-C1-C6алкильных групп, C1-C6алкоксигрупп, метокси-C1-C6алкильных групп, -SO2-C1-C6алкильных групп и групп -NR14R15, где каждый из R14 и R15 независимо выбран из водорода и C1-C6алкильных групп;
Y независимо выбран из водорода, 3-8-членных карбоциклов и 3-8-членных гетероциклов, содержащих 1-2 гетероатома, выбранных из азота, серы и кислорода, каждый из которых может быть необязательно замещен 1-2 группами, независимо выбранными из атомов галогена, гидроксильных групп, C1-C6алкильных групп, гидрокси-C1-C6алкильных групп, C1-C6алкоксигрупп, метокси-C1-C6алкильных групп, -SO2-C1-C6алкильных групп и групп -NR14R15, где каждый из R14 и R15 независимо выбран из водорода и C1-C6алкильных групп;
каждый из L1 и L2 независимо выбран из связи, -O-, -C(O)-, -C(O)O-, -N(R13)-C(O)-, -C(O)-N(R13)-, -N(R13)-S(O2)-, -S(O2)-N(R13)-, -S(O2)- и -N(R13)-; и
каждый n независимо выбран из 0-4.
2. Соединение по п. 1, где R1 выбран из 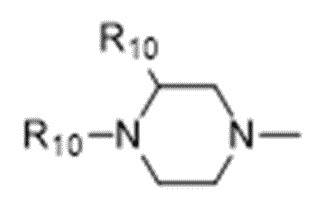 и
и 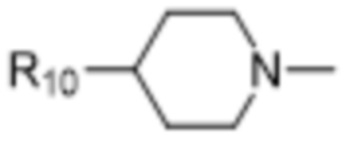 , каждый из которых может быть замещен 1-3 группами, выбранными из атомов галогена и C1-C6алкильных групп.
, каждый из которых может быть замещен 1-3 группами, выбранными из атомов галогена и C1-C6алкильных групп.
3. Соединение по п. 1 или 2, где R1 выбран из 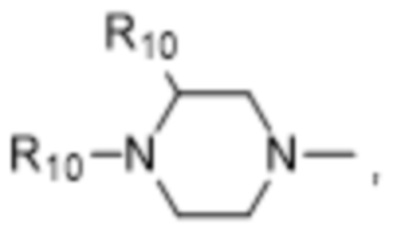 который может быть замещен 1-3 группами, выбранными из C1-C6алкильных групп.
который может быть замещен 1-3 группами, выбранными из C1-C6алкильных групп.
4. Соединение по любому из пп. 1-3, где R1 выбран из незамещенного  .
.
5. Соединение по любому из пп. 1-4, где R2 представляет собой метил и R3 представляет собой водород.
6. Соединение по любому из пп. 1-5, где R4 представляет собой водород и R5 представляет собой гидроксил.
7. Соединение по любому из пп. 1-6, где R6 представляет собой водород и R7 представляет собой метил.
8. Соединение по любому из пп. 1-7, где R8 представляет собой метил.
9. Соединение по любому из пп. 1-8, где W выбран из бензольного кольца, пиридинового кольца, бензимидазольного кольца, бензотриазольного кольца, индазольного кольца, 1,2,3,6-тетрагидропиридинового кольца и имидазопиридинового кольца, каждое из которых может быть необязательно замещено 1-2 группами, независимо выбранными из атомов галогена, групп -NR8R9 и C1-C6алкильных групп.
10. Соединение по любому из пп. 1-9, где W представляет собой бензольное кольцо, которое может быть необязательно замещено 1-2 группами, выбранными из атомов галогена и C1-C6алкильных групп.
11. Соединение по любому из пп. 1-10, где каждый из X и Y независимо выбран из:
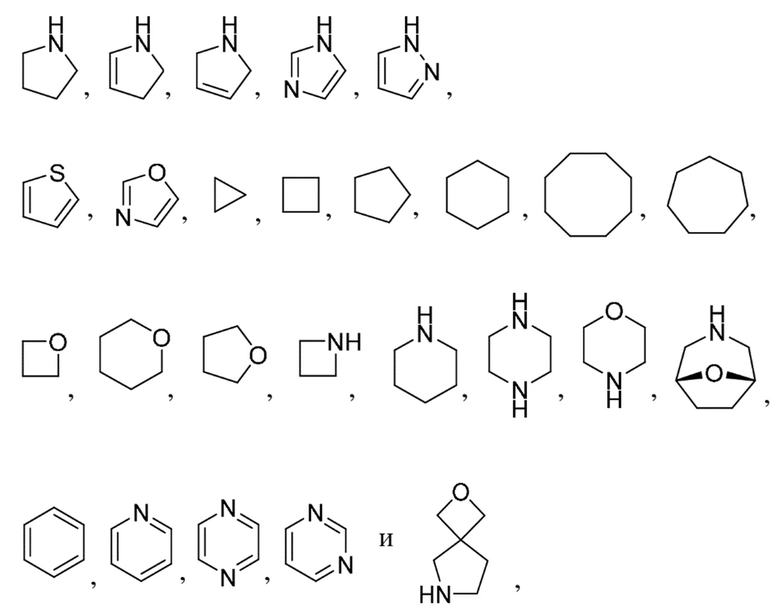
каждый из которых может быть замещен 1-2 группами, независимо выбранными из атомов галогена, гидроксильных групп, C1-C6алкильных групп, гидрокси-C1-C6алкильных групп, C1-C6алкоксигрупп, метокси-C1-C6алкильных групп, -SO2-C1-C6алкильных групп и групп -NR14R15, где каждый из R14 и R15 независимо выбран из водорода и C1-C6алкильных групп.
12. Соединение по любому из пп. 1-10, где Y представляет собой водород и X выбран из:

каждый из которых может быть замещен 1-2 группами, независимо выбранными из атомов галогена, гидроксильных групп, C1-C6алкильных групп, гидрокси-C1-C6алкильных групп, C1-C6алкоксигрупп, метокси-C1-C6алкильных групп, -SO2-C1-C6алкильных групп и групп -NR14R15, где каждый из R14 и R15 независимо выбран из водорода и C1-C6алкильных групп.
13. Соединение, выбранное из соединений формулы IIa
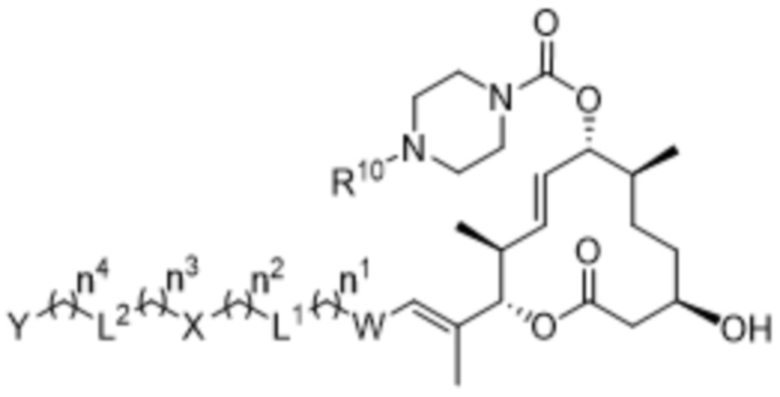
IIa
и их фармацевтически приемлемых солей,
где R10 выбран из водорода и метила;
каждый из R8 и R9 независимо выбран из водорода и C1-C6алкильных групп;
W выбран из 3-8-членных карбоциклов и 3-10-членных гетероциклов, содержащих 1-3 гетероатома, выбранных из азота и кислорода, каждый из которых может быть замещен 1-2 группами, независимо выбранными из атомов галогена, групп -NR8R9 и C1-C6алкильных групп;
X выбран из связи, 3-8-членных карбоциклов и 3-8-членных гетероциклов, содержащих 1-2 гетероатома, выбранных из азота, серы и кислорода, каждый из которых может быть замещен 1-2 группами, независимо выбранными из атомов галогена, гидроксильных групп, C1-C6алкильных групп, гидрокси-C1-C6алкильных групп, C1-C6алкоксигрупп, метокси-C1-C6алкильных групп, -SO2-C1-C6алкильных групп и групп -NR14R15, где каждый из R14 и R15 независимо выбран из водорода и C1-C6алкильных групп;
Y независимо выбран из водорода, 3-8-членных карбоциклов и 3-8-членных гетероциклов, содержащих 1-2 гетероатома, выбранных из азота, серы и кислорода, каждый из которых может быть замещен 1-2 группами, независимо выбранными из атомов галогена, гидроксильных групп, C1-C6алкильных групп, гидрокси-C1-C6алкильных групп, C1-C6алкоксигрупп, метокси-C1-C6алкильных групп, -SO2-C1-C6алкильных групп и групп -NR14R15, где каждый из R14 и R15 независимо выбран из водорода и C1-C6алкильных групп;
каждый из L1 и L2 независимо выбран из связи, -O-, -C(O)-, -C(O)O-, -N(R13)-C(O)-, -C(O)-N(R13)-, -N(R13)-S(O2)-, -S(O2)-N(R13)-, -S(O2)- и -N(R13)-, где R13 выбран из водорода и C1-C6алкильных групп; и
каждый n независимо выбран из 0-4.
14. Соединение по п. 13, где W выбран из бензольного кольца, пиридинового кольца, бензимидазольного кольца, бензотриазольного кольца, индазольного кольца, 1,2,3,6-тетрагидропиридинового кольца и имидазопиридинового кольца, каждое из которых может быть необязательно замещено 1-2 группами, независимо выбранными из атомов галогена, групп -NR8R9 и C1-C6алкильных групп.
15. Соединение по п. 13 или 14, где W представляет собой бензольное кольцо, которое может быть необязательно замещено 1-2 группами, выбранными из атомов галогена и C1-C6алкильных групп.
16. Соединение по любому из пп. 13-15, где каждый из X и Y независимо выбран из:
связи,
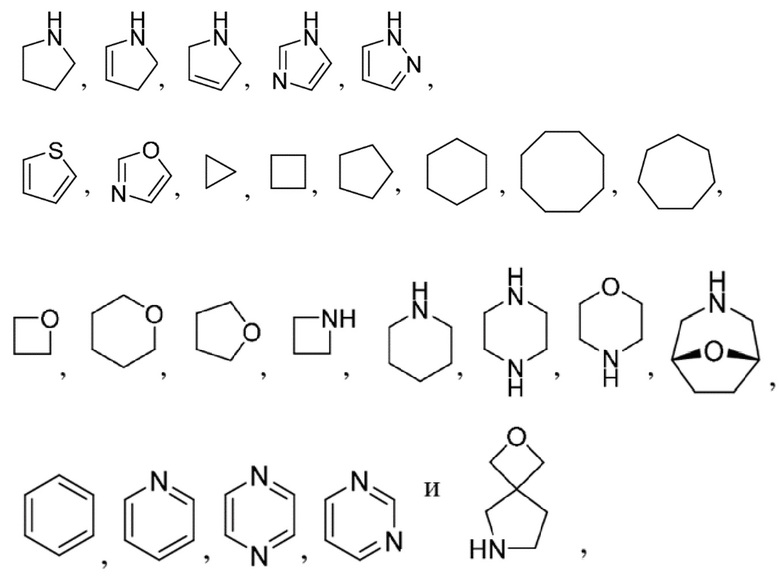
каждый из которых может быть замещен 1-2 группами, независимо выбранными из атомов галогена, гидроксильных групп, C1-C6алкильных групп, гидрокси-C1-C6алкильных групп, C1-C6алкоксигрупп, метокси-C1-C6алкильных групп, -SO2-C1-C6алкильных групп и групп -NR14R15, где каждый из R14 и R15 независимо выбран из водорода и C1-C6алкильных групп.
17. Соединение по любому из пп. 13-15, где Y представляет собой водород и X выбран из:

каждый из которых может быть замещен 1-2 группами, независимо выбранными из атомов галогена, гидроксильных групп, C1-C6алкильных групп, гидрокси-C1-C6алкильных групп, C1-C6алкоксигрупп, метокси-C1-C6алкильных групп, -SO2-C1-C6алкильных групп и групп -NR14R15, где каждый из R14 и R15 независимо выбран из водорода и C1-C6алкильных групп.
18. Соединение по любому из пп. 13-15, где Y представляет собой водород и X представляет собой связь.
19. Соединение, выбранное из соединений формулы IIb

IIb
и их фармацевтически приемлемых солей,
где R16 выбран из водорода и фтора;
X независимо выбран из связи, 3-8-членных карбоциклов и 3-8-членных гетероциклов, содержащих 1-2 гетероатома, выбранных из азота, серы и кислорода, каждый из которых может быть замещен 1-2 группами, независимо выбранными из атомов галогена, гидроксильных групп, C1-C6алкильных групп, гидрокси-C1-C6алкильных групп, C1-C6алкоксигрупп, метокси-C1-C6алкильных групп, -SO2-C1-C6алкильных групп и групп -NR14R15, где каждый из R14 и R15 независимо выбран из водорода и C1-C6алкильных групп;
Y независимо выбран из водорода, 3-8-членных карбоциклов и 3-8-членных гетероциклов, содержащих 1-2 гетероатома, выбранных из азота, серы и кислорода, каждый из которых может быть замещен 1-2 группами, независимо выбранными из атомов галогена, гидроксильных групп, C1-C6алкильных групп, гидрокси-C1-C6алкильных групп, C1-C6алкоксигрупп, метокси-C1-C6алкильных групп, -SO2-C1-C6алкильных групп и групп -NR14R15, где каждый из R14 и R15 независимо выбран из водорода и C1-C6алкильных групп;
каждый из L1 и L2 независимо выбран из связи, -O-, -C(O)-, -C(O)O-, -N(R13)-C(O)-, -C(O)-N(R13)-, -N(R13)-S(O2)-, -S(O2)-N(R13)-, -S(O2)- и -N(R13)-, где R13 выбран из водорода и C1-C6алкильных групп; и
каждый n независимо выбран из 0-4.
20. Соединение по п. 19, где каждый из X и Y независимо выбран из:
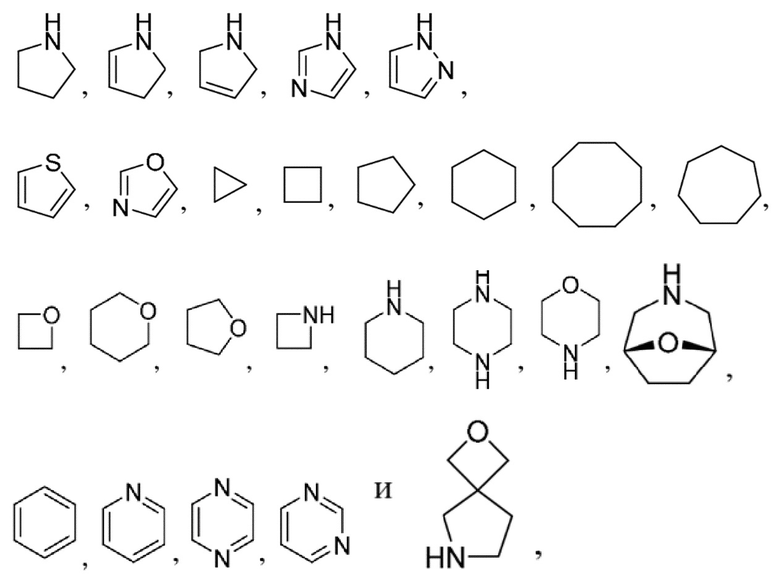
каждый из которых может быть замещен 1-2 группами, независимо выбранными из атомов галогена, гидроксильных групп, C1-C6алкильных групп, гидрокси-C1-C6алкильных групп, C1-C6алкоксигрупп, метокси-C1-C6алкильных групп, -SO2-C1-C6алкильных групп и групп -NR14R15, где каждый из R14 и R15 независимо выбран из водорода и C1-C6алкильных групп.
21. Соединение по п. 19, где Y представляет собой водород и X выбран из:
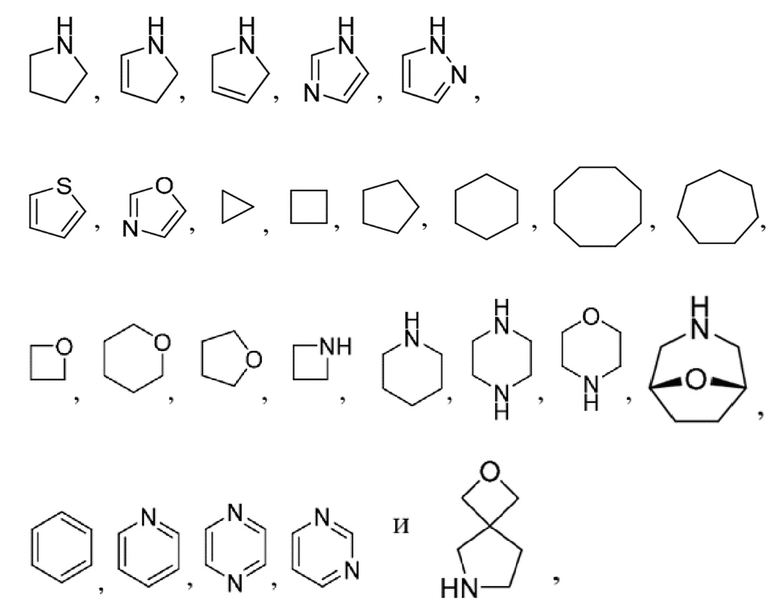
каждый из которых может быть замещен 1-2 группами, независимо выбранными из атомов галогена, гидроксильных групп, C1-C6алкильных групп, гидрокси-C1-C6алкильных групп, C1-C6алкоксигрупп, метокси-C1-C6алкильных групп, -SO2-C1-C6алкильных групп и групп -NR14R15, где каждый из R14 и R15 независимо выбран из водорода и C1-C6алкильных групп.
22. Соединение по п. 19, где Y представляет собой водород и X представляет собой связь.
23. Соединение по любому из пп. 19-22, где R16 представляет собой фтор.
24. Соединение, выбранное из соединений формулы IIc
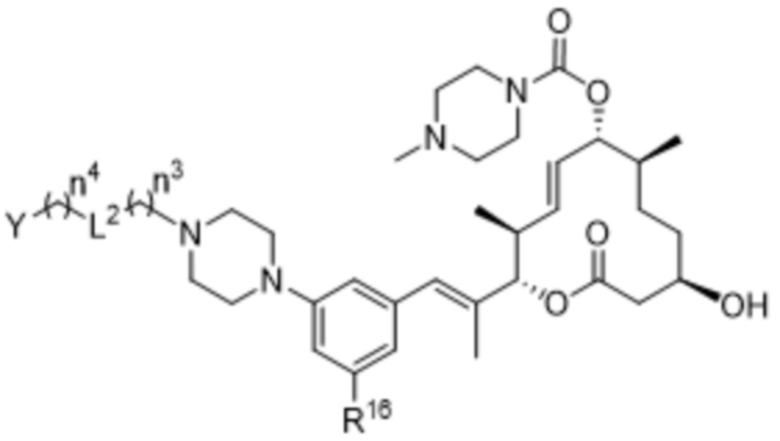
IIc
и их фармацевтически приемлемых солей,
где R16 выбран из водорода и фтора;
Y выбран из водорода, 3-8-членных карбоциклов и 3-8-членных гетероциклов, содержащих 1-2 гетероатома, выбранных из азота, серы и кислорода, каждый из которых может быть замещен 1-2 группами, независимо выбранными из атомов галогена, гидроксильных групп, C1-C6алкильных групп, гидрокси-C1-C6алкильных групп, C1-C6алкоксигрупп, метокси-C1-C6алкильных групп, -SO2-C1-C6алкильных групп и групп -NR14R15, где каждый из R14 и R15 независимо выбран из водорода и C1-C6алкильных групп;
L2 выбран из связи, -O-, -C(O)-, -C(O)O-, -N(R13)-C(O)-, -C(O)-N(R13)-, -N(R13)-S(O2)-, -S(O2)-N(R13)-, -S(O2)- и -N(R13)-, где R13 выбран из водорода и C1-C6алкильных групп;
n3 составляет 0; и
n4 выбран из 0-4.
25. Соединение по п. 24, где Y выбран из:
водорода,

каждый из которых может быть замещен 1-2 группами, независимо выбранными из атомов галогена, гидроксильных групп, C1-C6алкильных групп, гидрокси-C1-C6алкильных групп, C1-C6алкоксигрупп, метокси-C1-C6алкильных групп, -SO2-C1-C6алкильных групп и групп -NR14R15, где каждый из R14 и R15 независимо выбран из водорода и C1-C6алкильных групп.
26. Соединение по п. 24 или 25, где L2 представляет собой связь.
27. Соединение по любому из пп. 24-26, где R16 представляет собой фтор.
28. Соединение, выбранное из соединений формулы IId
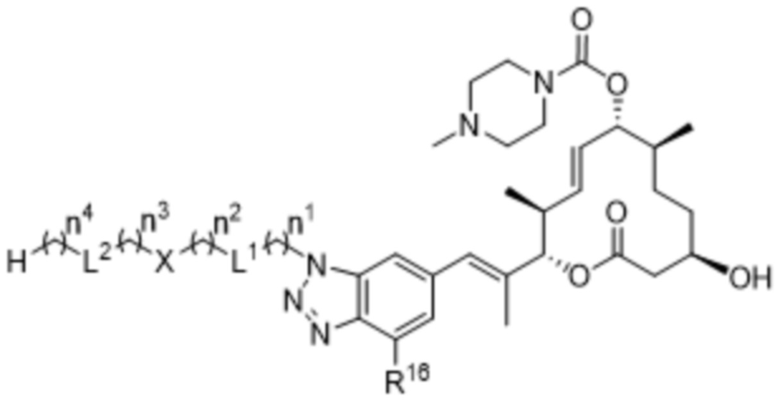
IId
и их фармацевтически приемлемых солей,
где R16 выбран из водорода и фтора;
X выбран из 3-8-членных карбоциклов и 3-8-членных гетероциклов, содержащих 1-2 гетероатома, выбранных из азота, серы и кислорода, каждый из которых может быть замещен 1-2 группами, независимо выбранными из атомов галогена, гидроксильных групп, C1-C6алкильных групп, гидрокси-C1-C6алкильных групп, C1-C6алкоксигрупп, метокси-C1-C6алкильных групп, -SO2-C1-C6алкильных групп и групп -NR14R15, где каждый из R14 и R15 независимо выбран из водорода и C1-C6алкильных групп;
L1 и L2 независимо выбраны из связи, -O-, -C(O)-, -C(O)O-, -N(R13)-C(O)-, -C(O)-N(R13)-, -N(R13)-S(O2)-, -S(O2)-N(R13)-, -S(O2)- и -N(R13)-, где R13 выбран из водорода и C1-C6алкильных групп; и
каждый n независимо выбран из 0-4.
29. Соединение по п. 28, где X выбран из:

каждый из которых может быть замещен 1-2 группами, независимо выбранными из атомов галогена, гидроксильных групп, C1-C6алкильных групп, гидрокси-C1-C6алкильных групп, C1-C6алкоксигрупп, метокси-C1-C6алкильных групп, -SO2-C1-C6алкильных групп и групп -NR14R15, где каждый из R14 и R15 независимо выбран из водорода и C1-C6алкильных групп.
30. Соединение по п. 28 или 29, где каждый из L1 и L2 представляет собой связь.
31. Соединение по любому из пп. 28-30, где R16 представляет собой фтор.
32. Соединение, выбранное из соединений формулы IIe
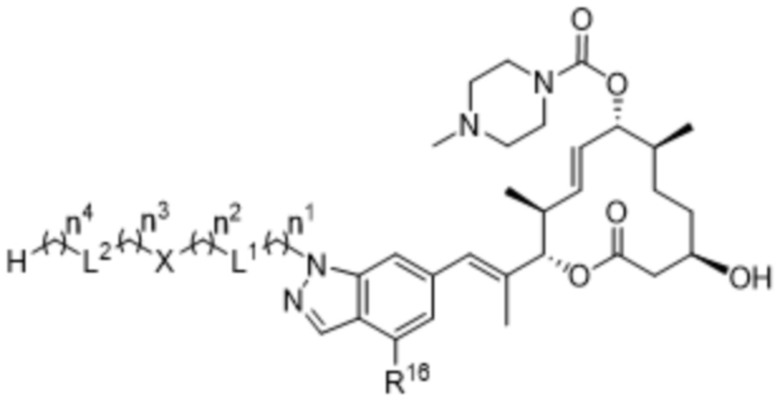
IIe
и их фармацевтически приемлемых солей,
где R16 выбран из водорода и фтора;
X независимо выбран из 3-8-членных карбоциклов и 3-8-членных гетероциклов, содержащих 1-2 гетероатома, выбранных из азота, серы и кислорода, каждый из которых может быть замещен 1-2 группами, независимо выбранными из атомов галогена, гидроксильных групп, C1-C6алкильных групп, гидрокси-C1-C6алкильных групп, C1-C6алкоксигрупп, метокси-C1-C6алкильных групп, -SO2-C1-C6алкильных групп и групп -NR14R15, где каждый из R14 и R15 независимо выбран из водорода и C1-C6алкильных групп;
каждый из L1 и L2 независимо выбран из связи, -O-, -C(O)-, -C(O)O-, -N(R13)-C(O)-, -C(O)-N(R13)-, -N(R13)-S(O2)-, -S(O2)-N(R13)-, -S(O2)- и -N(R13)-, где R13 выбран из водорода и C1-C6алкильных групп; и
каждый n независимо выбран из 0-4.
33. Соединение по п. 32, где X выбран из:

каждый из которых может быть замещен 1-2 группами, независимо выбранными из атомов галогена, гидроксильных групп, C1-C6алкильных групп, гидрокси-C1-C6алкильных групп, C1-C6алкоксигрупп, метокси-C1-C6алкильных групп, -SO2-C1-C6алкильных групп и групп -NR14R15, где каждый из R14 и R15 независимо выбран из водорода и C1-C6алкильных групп.
34. Соединение по п. 32 или 33, где каждый из L1 и L2 представляет собой связь.
35. Соединение по любому из пп. 32-34, где R16 представляет собой фтор.
36. Соединение, выбранное из соединений формулы IIIa
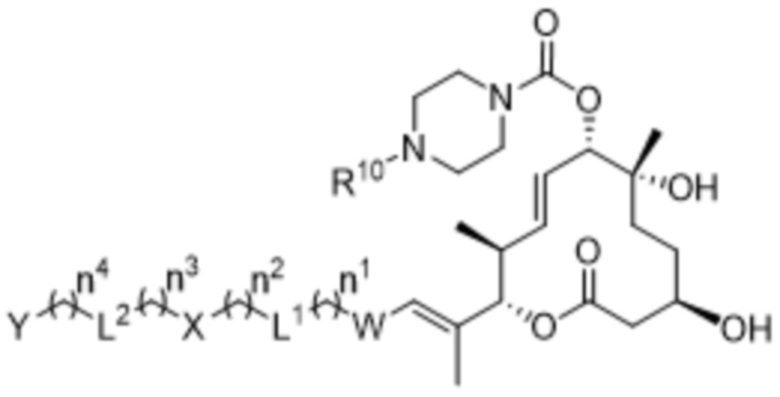
IIIa
и их фармацевтически приемлемых солей,
где R10 выбран из водорода и метила;
каждый из R8 и R9 независимо выбран из водорода и C1-C6алкильных групп;
W выбран из 3-8-членных карбоциклов и 3-10-членных гетероциклов, содержащих 1-3 гетероатома, выбранных из азота и кислорода, каждый из которых может быть замещен 1-2 группами, независимо выбранными из атомов галогена, групп -NR8R9 и C1-C6алкильных групп;
X независимо выбран из связи, 3-8-членных карбоциклов и 3-8-членных гетероциклов, содержащих 1-2 гетероатома, выбранных из азота, серы и кислорода, каждый из которых может быть замещен 1-3 группами, независимо выбранными из атомов галогена, гидроксильных групп, C1-C6алкильных групп, гидрокси-C1-C6алкильных групп, C1-C6алкоксигрупп, метокси-C1-C6алкильных групп, -SO2-C1-C6алкильных групп и групп -NR14R15, где каждый из R14 и R15 независимо выбран из водорода и C1-C6алкильных групп;
Y независимо выбран из водорода, 3-8-членных карбоциклов и 3-8-членных гетероциклов, содержащих 1-2 гетероатома, выбранных из азота, серы и кислорода, каждый из которых может быть замещен 1-3 группами, независимо выбранными из атомов галогена, гидроксильных групп, C1-C6алкильных групп, гидрокси-C1-C6алкильных групп, C1-C6алкоксигрупп, метокси-C1-C6алкильных групп, -SO2-C1-C6алкильных групп и групп -NR14R15, где каждый из R14 и R15 независимо выбран из водорода и C1-C6алкильных групп;
каждый из L1 и L2 независимо выбран из связи, -O-, -C(O)-, -C(O)O-, -N(R13)-C(O)-, -C(O)-N(R13)-, -N(R13)-S(O2)-, -S(O2)-N(R13)-, -S(O2)- и -N(R13)-, где R13 выбран из водорода и C1-C6алкильных групп; и
каждый n независимо выбран из 0-4.
37. Соединение, выбранное из соединений формулы IVa

IVa
или их фармацевтически приемлемых солей,
где R10 выбран из водорода и метила;
каждый из R8 и R9 независимо выбран из водорода и C1-C6алкильных групп; W выбран из 3-8-членных карбоциклов и 3-10-членных гетероциклов, содержащих 1-3 гетероатома, выбранных из азота и кислорода, каждый из которых может быть замещен 1-3 группами, независимо выбранными из атомов галогена, групп -NR8R9 и C1-C6алкильных групп;
X независимо выбран из связи, 3-8-членных карбоциклов и 3-8-членных гетероциклов, содержащих 1-2 гетероатома, выбранных из азота, серы и кислорода, каждый из которых может быть замещен 1-3 группами, независимо выбранными из атомов галогена, гидроксильных групп, C1-C6алкильных групп, гидрокси-C1-C6алкильных групп, C1-C6алкоксигрупп, метокси-C1-C6алкильных групп, -SO2-C1-C6алкильных групп и групп -NR14R15, где каждый из R14 и R15 независимо выбран из водорода и C1-C6алкильных групп;
Y независимо выбран из водорода, 3-8-членных карбоциклов и 3-8-членных гетероциклов, содержащих 1-2 гетероатома, выбранных из азота, серы и кислорода, каждый из которых может быть замещен 1-3 группами, независимо выбранными из атомов галогена, гидроксильных групп, C1-C6алкильных групп, гидрокси-C1-C6алкильных групп, C1-C6алкоксигрупп, метокси-C1-C6алкильных групп, -SO2-C1-C6алкильных групп и групп -NR14R15, где каждый из R14 и R15 независимо выбран из водорода и C1-C6алкильных групп;
каждый из L1 и L2 независимо выбран из связи, -O-, -C(O)-, -C(O)O-, -N(R13)-C(O)-, -C(O)-N(R13)-, -N(R13)-S(O2)-, -S(O2)-N(R13)-, -S(O2)- и -N(R13)-, где R13 выбран из водорода и C1-C6алкильных групп; и
каждый n независимо выбран из 0-4.
38. Соединение по п. 37, где W выбран из бензольного кольца, пиридинового кольца, бензимидазольного кольца, бензотриазольного кольца, индазольного кольца, 1,2,3,6-тетрагидропиридинового кольца и имидазопиридинового кольца, каждое из которых может быть необязательно замещено 1-2 группами, независимо выбранными из атомов галогена и C1-C6алкильных групп.
39. Соединение по п. 37 или 38, где W представляет собой бензольное кольцо, которое может быть необязательно замещено 1-2 группами, выбранными из атомов галогена и C1-C6алкильных групп.
40. Соединение по любому из пп. 37-39, где каждый из X и Y независимо выбран из:

каждый из которых может быть замещен 1-2 группами, независимо выбранными из атомов галогена, гидроксильных групп, C1-C6алкильных групп, гидрокси-C1-C6алкильных групп, C1-C6алкоксигрупп, метокси-C1-C6алкильных групп, -SO2-C1-C6алкильных групп и групп -NR14R15, где каждый из R14 и R15 независимо выбран из водорода и C1-C6алкильных групп.
41. Соединение по любому из пп. 37-39, где Y представляет собой водород и X выбран из:

каждый из которых может быть замещен 1-2 группами, независимо выбранными из атомов галогена, гидроксильных групп, C1-C6алкильных групп, гидрокси-C1-C6алкильных групп, C1-C6алкоксигрупп, метокси-C1-C6алкильных групп, -SO2-C1-C6алкильных групп и групп -NR14R15, где каждый из R14 и R15 независимо выбран из водорода и C1-C6алкильных групп.
42. Соединение по любому из пп. 37-39, где Y представляет собой водород и X представляет собой связь.
43. Соединение, выбранное из:
[(2S,3S,4E,6R,7S,10R)-10-гидрокси-3,7-диметил-12-оксо-2-[(E)-1-(3-пиперазин-1-илфенил)проп-1-ен-2-ил]-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-10-гидрокси-3,7-диметил-2-[(E)-1-[3-(4-метилпиперазин-1-ил)фенил]проп-1-ен-2-ил]-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-(3-фтор-5-морфолин-4-илфенил)проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-10-гидрокси-2-[(E)-1-(1H-индазол-6-ил)проп-1-ен-2-ил]-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-10-гидрокси-2-[(E)-1-(1H-индазол-4-ил)проп-1-ен-2-ил]-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-10-гидрокси-3,7-диметил-2-[(E)-1-(2-морфолин-4-илпиридин-4-ил)проп-1-ен-2-ил]-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-(2-фтор-5-морфолин-4-илфенил)проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-(4-фтор-3-морфолин-4-илфенил)проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-10-гидрокси-3,7-диметил-2-[(E)-1-[3-[(3R)-3-(метиламино)пирролидин-1-ил]фенил]проп-1-ен-2-ил]-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-10-гидрокси-3,7-диметил-2-[(E)-1-[3-[(3S)-3-(метиламино)пирролидин-1-ил]фенил]проп-1-ен-2-ил]-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-(2-фтор-5-морфолин-4-илфенил)проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-пиперидин-1-илпиперидин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-фтор-5-[4-(2-гидроксиэтил)пиперазин-1-ил]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-фтор-5-[4-(2-гидроксиэтил)пиперазин-1-ил]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-пиперидин-1-илпиперидин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-фтор-5-[(3R)-3-фторпирролидин-1-ил]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-фтор-5-[(2S)-2-(гидроксиметил)пирролидин-1-ил]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7R,10S)-2-[(E)-1-[3-[(2R,6S)-2,6-диметилморфолин-4-ил]-5-фторфенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-пиперидин-1-илпиперидин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-[(3S)-3-(диметиламино)пирролидин-1-ил]-5-фторфенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-10-гидрокси-3,7-диметил-2-[(E)-1-(3-метил-5-морфолин-4-илфенил)проп-1-ен-2-ил]-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-10-гидрокси-3,7-диметил-2-[(E)-1-[3-морфолин-4-ил-5-(трифторметил)фенил]проп-1-ен-2-ил]-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-(3-хлор-5-морфолин-4-илфенил)проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-(3-фтор-5-морфолин-4-илфенил)проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-(2-гидроксиэтил)пиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-(3-фтор-5-морфолин-4-илфенил)проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-N-метил-N-(1-метилпиперидин-4-ил)карбамата;
[(2R,3R,4E,6R,7S,10S)-2-[(E)-1-(3-фтор-5-морфолин-4-илфенил)проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-(3S)-3,4-диметилпиперазин-1-карбоксилата;
[(2R,3R,4E,6R,7S,10S)-2-[(E)-1-(3-фтор-5-морфолин-4-илфенил)проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-пропан-2-илпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-(3-фтор-5-морфолин-4-илфенил)проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-трет-бутилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-(3-фтор-5-морфолин-4-илфенил)проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-циклобутилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-(3-фтор-5-морфолин-4-илфенил)проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-циклопентилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-(3,5-дифторфенил)проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-(диметиламино)-5-фторфенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-фтор-5-(4-гидроксипиперидин-1-ил)фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-фтор-5-[метил-(1-метилпиперидин-4-ил)амино]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-фтор-5-[(1R,5S)-8-окса-3-азабицикло[3.2.1]октан-3-ил]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-фтор-5-(2-окса-7-азаспиро[3.4]октан-7-ил)фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-фтор-5-[(3R)-3-гидроксипирролидин-1-ил]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-фтор-5-(3-оксопирролидин-1-ил)фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-(3-фтор-5-морфолин-4-илфенил)проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-(оксан-4-ил)пиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-(3-фтор-5-морфолин-4-илфенил)проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-N-метил-N-(1-метилпиперидин-3-ил)карбамата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-фтор-5-(3-фторазетидин-1-ил)фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7SR,10R)-2-[(E)-1-[3-фтор-5-[(3S)-3-(метиламино)пирролидин-1-ил]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-(3-фтор-5-морфолин-4-илфенил)проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-3-(диметиламино)пиперидин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-фтор-5-[(2R)-2-метилпирролидин-1-ил]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-фтор-5-(2-оксопирролидин-1-ил)фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-фтор-5-[(2S)-2-метилпирролидин-1-ил]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-фтор-5-[(2R)-2-(гидроксиметил)пирролидин-1-ил]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-фтор-5-[(3R)-3-(метиламино)пирролидин-1-ил]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-(5-хлорпиридин-3-ил)проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-(3-фтор-5-морфолин-4-илфенил)проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-N-метил-N-(пиридин-4-илметил)карбамата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-(3,5-дихлорфенил)проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-(1,1-диоксо-1,2-тиазолидин-2-ил)фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-(1,3-диметилиндазол-6-ил)проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-(1,1-диоксо-1,4-тиазинан-4-ил)-5-фторфенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-N,N-диметилкарбамата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-(1,1-диоксо-1,4-тиазинан-4-ил)-5-фторфенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-фтор-5-[4-(2-гидроксиэтил)пиперазин-1-ил]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-морфолин-4-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-фтор-5-[4-(2-гидроксиэтил)пиперазин-1-ил]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-N-метил-N-(1-метилпиперидин-4-ил)карбамата;
[(2S,3S,4E,6R,7S,10R)-10-гидрокси-3,7-диметил-2-[(E)-1-(1-метилиндазол-6-ил)проп-1-ен-2-ил]-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-фтор-5-(3-оксоморфолин-4-ил)фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[4-(циклопентилсульфамоил)-2-фторфенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-фтор-5-(4-метилсульфонилпиперазин-1-ил)фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-(4-фтор-1H-индазол-6-ил)проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-(3-фтор-5-имидазол-1-илфенил)проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6S,7R,10S)-2-[(E)-1-(3-фтор-5-морфолин-4-илфенил)проп-1-ен-2-ил]-7,10-дигидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6S,7R,10R)-2-[(E)-1-(3-фтор-5-морфолин-4-илфенил)проп-1-ен-2-ил]-7,10-дигидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-пиперидин-1-илпиперидин-1-карбоксилата;
[(2S,3S,4E,6S,7R,10S)-2-[(E)-1-(3-фтор-5-морфолин-4-илфенил)проп-1-ен-2-ил]-7,10-дигидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-пиперидин-1-илпиперидин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-фтор-5-(2-оксоимидазолидин-1-ил)фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-фтор-5-[3-(2-гидроксиэтил)-2-оксоимидазолидин-1-ил]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-фтор-5-[3-(2-фторэтинил)-2-оксоимидазолидин-1-ил]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-фтор-5-[3-(2-морфолин-4-илэтил)-2-оксоимидазолидин-1-ил]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-[3-(циклопропилметил)-2-оксоимидазолидин-1-ил]-5-фторфенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7R,10S)-2-[(E)-1-[3-фтор-5-[(2S)-2-метилморфолин-4-ил]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7R,10S)-2-[(E)-1-[3-фтор-5-(2-метилморфолин-4-ил)фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7R,10S)-2-[(E)-1-[3-фтор-5-[4-[(2S,3R)-3-гидрокси-2-метилпентил]пиперазин-1-ил]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7R,10S)-2-[(E)-1-[3-фтор-5-[4-[(2R,3R)-3-гидрокси-2-метилпентаноил]пиперазин-1-ил]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-фтор-5-[4-(2-морфолин-4-илэтилсульфонил)пиперазин-1-ил]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-(4-этенилсульфонилпиперазин-1-ил)-5-фторфенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-фтор-5-[(3R)-3-метилморфолин-4-ил]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-фтор-5-[(2R)-2-(гидроксиметил)морфолин-4-ил]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-фтор-5-[(3S)-3-(гидроксиметил)морфолин-4-ил]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7R,10S)-2-[(E)-1-[3-фтор-5-[(2R)-2-(метилкарбамоил)морфолин-4-ил]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-фтор-5-(2-оксо-1,3-диaзинан-1-ил)фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-[3-(циклопропилметил)-2-оксо-1,3-диaзинан-1-ил]-5-фторфенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7R,10S)-2-[(E)-1-[3-фтор-5-[4-[(2R)-2-гидроксипропаноил]пиперазин-1-ил]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-(3-фтор-5-морфолин-4-илфенил)проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-3,4,6,7,8,8a-гексагидро-1H-пирроло[1,2-a]пиразин-2-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-фтор-5-[(3S)-3-метилморфолин-4-ил]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-[4-(2-циклопропил-2-оксоэтил)пиперазин-1-ил]-5-фторфенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-фтор-5-[4-(2-оксо-2-пиразин-2-илэтил)пиперазин-1-ил]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6S,7R,10R)-2-[(E)-1-(3-фтор-5-морфолин-4-илфенил)проп-1-ен-2-ил]-7,10-дигидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[1-(циклопропилметил)-4-фториндазол-6-ил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-10-гидрокси-2-[(E)-1-имидазо[1,2-a]пиридин-6-илпроп-1-ен-2-ил]-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-10-гидрокси-3,7-диметил-2-[(E)-1-(7-метил-1H-индазол-4-ил)проп-1-ен-2-ил]-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[4-(циклопропилсульфамоил)-3-фторфенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[2-фтор-5-(4-гидроксипиперидин-1-ил)сульфонилфенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-(3-фтор-5-морфолин-4-илфенил)проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-(2,2,2-трифторэтил)пиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-10-гидрокси-3,7-диметил-12-оксо-2-[(E)-1-(3-пиперазин-1-илсульфонилфенил)проп-1-ен-2-ил]-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-(4-формилпиперазин-1-ил)сульфонилфенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-10-гидрокси-2-[(E)-1-[3-(4-гидроксипиперидин-1-ил)сульфонилфенил]проп-1-ен-2-ил]-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-10-гидрокси-3,7-диметил-2-[(E)-1-(6-метил-1H-индазол-4-ил)проп-1-ен-2-ил]-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-(1,3-диметилиндазол-4-ил)проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-(3-фтор-5-морфолин-4-илфенил)проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-N-(1-азабицикло[2.2.2]октан-3-ил)-N-метилкарбамата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[2-(циклопропилметил)-4-фториндазол-6-ил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[4-фтор-1-(2-гидроксиэтил)индазол-6-ил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-(4-фтор-1-метилиндазол-6-ил)проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-10-гидрокси-3,7-диметил-12-оксо-2-[(E)-1-[1-(пиридин-4-илметил)пиразол-4-ил]проп-1-ен-2-ил]-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-10-гидрокси-3,7-диметил-2-[(E)-1-(1-метилпиразол-4-ил)проп-1-ен-2-ил]-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-фтор-5-[4-(2-гидроксиэтил)-3-оксопиперазин-1-ил]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7R,10S)-2-[(E)-1-[3-фтор-5-[4-(2-метоксиэтил)-3-оксопиперазин-1-ил]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-10-гидрокси-3,7-диметил-2-[(E)-1-[1-(1-метилпиперидин-4-ил)пиразол-4-ил]проп-1-ен-2-ил]-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-фтор-5-[4-(2,2,2-трифторэтил)пиперазин-1-ил]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7R,10S)-2-[(E)-1-[3-фтор-5-[4-(2-метоксиацетил)пиперазин-1-ил]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-[4-(циклопропанкарбонил)пиперазин-1-ил]-5-фторфенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7R,10S)-2-[(E)-1-[3-фтор-5-[4-(4-метоксифенил)сульфонилпиперазин-1-ил]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-фтор-5-[4-(1-метилпиразол-4-ил)сульфонилпиперазин-1-ил]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-фтор-5-(4-пиридин-3-илсульфонилпиперазин-1-ил)фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-фтор-5-[4-(1-метилимидазол-4-ил)сульфонилпиперазин-1-ил]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-[4-(циклогексанкарбонил)пиперазин-1-ил]-5-фторфенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-фтор-5-[4-(1-метилиндол-6-ил)сульфонилпиперазин-1-ил]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[4-фтор-1-(оксан-4-ил)индазол-6-ил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[4-фтор-2-(оксан-4-ил)индазол-6-ил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-фтор-5-[4-(оксан-4-карбонил)пиперазин-1-ил]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-фтор-5-[4-(2-морфолин-4-илацетил)пиперазин-1-ил]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-фтор-5-[4-(1-метилимидазол-4-карбонил)пиперазин-1-ил]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-[4-(2-циклопропилацетил)пиперазин-1-ил]-5-фторфенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-фтор-5-[4-(2-пиразол-1-илацетил)пиперазин-1-ил]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-фтор-5-[4-(1,3-оксазол-5-карбонил)пиперазин-1-ил]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-фтор-5-[4-(2-гидроксиэтилсульфонил)пиперазин-1-ил]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-фтор-5-[4-(оксетан-3-илсульфонил)пиперазин-1-ил]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-10-гидрокси-2-[(E)-1-(1-гидроксиизохинолин-7-ил)проп-1-ен-2-ил]-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7R,10S)-2-[(E)-1-[4-фтор-1-[2-(метиламино)-2-оксоэтил]индазол-6-ил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[4-фтор-1-(2-оксо-2-пирролидин-1-илэтил)индазол-6-ил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[4-фтор-1-(2-морфолин-4-ил-2-оксоэтил)индазол-6-ил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[1-(цианометил)-4-фториндазол-6-ил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[1-[2-(диметиламино)-2-оксоэтил]-4-фториндазол-6-ил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[1-(циклопропилметил)-3-фториндазол-6-ил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7R,10S)-2-[(E)-1-[3-фтор-5-[4-(3-метоксипропаноил)пиперазин-1-ил]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-фтор-5-[4-(2-гидроксиацетил)пиперазин-1-ил]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-фтор-5-[4-(3-гидроксипропил)пиперазин-1-ил]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-(циклопропилметил)-7-фторбензoтриазол-5-ил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[2-(циклопропилметил)-7-фторбензoтриазол-5-ил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[1-(циклопропилметил)-7-фторбензoтриазол-5-ил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[7-фтор-3-(оксан-4-ил)бензoтриазол-5-ил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[7-фтор-2-(оксан-4-ил)бензoтриазол-5-ил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7R,10S)-2-[(E)-1-[7-фтор-3-(2-метоксиэтил)бензимидазол-5-ил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-фтор-5-[4-(оксолан-3-карбонил)пиперазин-1-ил]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[7-фтор-3-[1-[(2-метилпропан-2-ил)оксикарбонил]пиперидин-4-ил]бензoтриазол-5-ил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-[(4-хлорфенил)метил]-7-фторбензoтриазол-5-ил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-(1-ацетилпиперидин-4-ил)-7-фторбензимидазол-5-ил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[7-фтор-3-(4-гидроксициклогексил)бензoтриазол-5-ил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[7-фтор-3-(оксан-4-илметил)бензoтриазол-5-ил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[7-фтор-3-[(2S)-1-гидроксипропан-2-ил]бензoтриазол-5-ил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[7-фтор-3-[(2R)-1-гидроксипропан-2-ил]бензoтриазол-5-ил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-фтор-5-[4-[(3S)-оксолан-3-карбонил]пиперазин-1-ил]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-фтор-5-[4-[(3R)-оксолан-3-карбонил]пиперазин-1-ил]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-фтор-5-[4-(оксетан-3-карбонил)пиперазин-1-ил]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-фтор-5-[4-(3-метилоксетан-3-карбонил)пиперазин-1-ил]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-фтор-5-[4-(3-гидроксипропаноил)пиперазин-1-ил]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[7-фтор-3-(4-метилоксан-4-ил)бензoтриазол-5-ил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[7-фтор-3-(1-метилсульфонилпиперидин-4-ил)бензoтриазол-5-ил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-(1,1-диоксотиан-4-ил)-7-фторбензoтриазол-5-ил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7R,10S)-2-[(E)-1-[7-фтор-3-(2-метоксиэтил)бензoтриазол-5-ил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-(1-ацетилпиперидин-4-ил)-7-фторбензoтриазол-5-ил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[7-фтор-3-[(3R)-оксан-3-ил]бензoтриазол-5-ил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[7-фтор-3-[(3S)-оксан-3-ил]бензoтриазол-5-ил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-(3-циклогексил-7-фторбензoтриазол-5-ил)проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7R,10S)-2-[(E)-1-[7-фтор-3-(4-метоксифенил)бензoтриазол-5-ил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7R,10S)-2-[(E)-1-[7-фтор-3-[(4-метоксифенил)метил]бензoтриазол-5-ил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-(3-хлор-5-фторфенил)проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-фтор-5-[метил(оксан-4-ил)амино]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-фтор-5-[метил(оксетан-3-ил)амино]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-10-гидрокси-3,7-диметил-2-[(E)-1-[3-[метил(оксан-4-ил)амино]фенил]проп-1-ен-2-ил]-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-10-гидрокси-3,7-диметил-2-[(E)-1-[3-[метил(оксетан-3-ил)амино]фенил]проп-1-ен-2-ил]-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-[(1,1-диоксотиан-4-ил)-метиламино]-5-фторфенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-фтор-5-[(1-метилсульфонилпиперидин-4-ил)амино]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-фтор-5-[метил-(1-метилсульфонилпиперидин-4-ил)амино]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7R,10S)-2-[(E)-1-[3-[этил-(1-метилсульфонилпиперидин-4-ил)амино]-5-фторфенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7R,10S)-2-[(E)-1-[3-фтор-5-[(1-метилсульфонилпиперидин-4-ил)-пропан-2-иламино]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-[(1-ацетилпиперидин-4-ил)-метиламино]-5-фторфенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7R,10S)-2-[(E)-1-[3-фтор-5-[метил-(1-пропаноилпиперидин-4-ил)амино]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7R,10S)-2-[(E)-1-[3-фтор-5-[[1-(2-метоксиацетил)пиперидин-4-ил]-метиламино]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-[(1-бензоилпиперидин-4-ил)-метиламино]-5-фторфенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-фтор-5-[метил-[1-(2,2,2-трифторацетил)пиперидин-4-ил]амино]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7R,10S)-2-[(E)-1-[3-фтор-5-[метил-(1-пропилсульфонилпиперидин-4-ил)амино]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-[(1-циклопентилсульфонилпиперидин-4-ил)-метиламино]-5-фторфенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-фтор-5-[метил-[1-(1-метилимидазол-4-ил)сульфонилпиперидин-4-ил]амино]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-[[1-(бензолсульфонил)пиперидин-4-ил]-метиламино]-5-фторфенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-[(1-ацетилпиперидин-4-ил)метил-метиламино]-5-фторфенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-фтор-5-[метил-[(1-метилсульфонилпиперидин-4-ил)метил]амино]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-фтор-5-[метил-[1-(1,3-оксазол-5-карбонил)пиперидин-4-ил]амино]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-фтор-5-[метил-[1-(пиразин-2-карбонил)пиперидин-4-ил]амино]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-фтор-5-[метил-[1-(1-метилимидазол-4-карбонил)пиперидин-4-ил]амино]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7R,10S)-2-[(E)-1-[3-фтор-5-[метил-[1-(пропан-2-илкарбамоил)пиперидин-4-ил]амино]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7R,10S)-2-[(E)-1-[3-фтор-5-[метил-[1-(пропилкарбамоил)пиперидин-4-ил]амино]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-фтор-5-[метил-[1-(фенилкарбамоил)пиперидин-4-ил]амино]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-фтор-5-(1-метилсульфонилпиперидин-4-ил)оксифенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[1-(4,4-дифторциклогексил)-4-фториндазол-6-ил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[4-фтор-1-(1-метилсульфонилпиперидин-4-ил)индазол-6-ил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-(3-фтор-5-пирролидин-1-илсульфонилфенил)проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-(азетидин-1-илсульфонил)фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-10-гидрокси-2-[(E)-1-[3-[(3R)-3-гидроксипирролидин-1-ил]сульфонилфенил]проп-1-ен-2-ил]-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7R,10S)-10-гидрокси-3,7-диметил-2-[(E)-1-[3-[(2S)-2-метилпирролидин-1-ил]сульфонилфенил]проп-1-ен-2-ил]-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-10-гидрокси-2-[(E)-1-[3-[(1-гидрокси-2-метилпропан-2-ил)сульфамоил]фенил]проп-1-ен-2-ил]-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-(4,4-дифторпиперидин-1-ил)сульфонилфенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-10-гидрокси-3,7-диметил-2-[(E)-1-(4-метил-3-пирролидин-1-илсульфонилфенил)проп-1-ен-2-ил]-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-(3,3-дифторпирролидин-1-ил)сульфонилфенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-10-гидрокси-3,7-диметил-12-оксо-2-[(E)-1-(5-пирролидин-1-илсульфонилпиридин-3-ил)проп-1-ен-2-ил]-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-(3,3-дифторазетидин-1-ил)сульфонилфенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-10-гидрокси-3,7-диметил-2-[(E)-1-[4-метил-3-(2-оксопирролидин-1-ил)фенил]проп-1-ен-2-ил]-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-(трет-бутилсульфамоил)фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7R,10S)-10-гидрокси-3,7-диметил-12-оксо-2-[(E)-1-[3-(пропан-2-илсульфамоил)фенил]проп-1-ен-2-ил]-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7R,10S)-2-[(E)-1-[3-(этилсульфамоил)фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-10-гидрокси-3,7-диметил-2-[(E)-1-[3-(4-метилпиперазин-1-ил)сульфонилфенил]проп-1-ен-2-ил]-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7R,10S)-10-гидрокси-3,7-диметил-2-[(E)-1-[3-(метилсульфамоил)фенил]проп-1-ен-2-ил]-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-10-гидрокси-3,7-диметил-12-оксо-2-[(E)-1-(3-пиперидин-1-илсульфонилфенил)проп-1-ен-2-ил]-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-10-гидрокси-3,7-диметил-12-оксо-2-[(E)-1-(3-пирролидин-1-илсульфонилфенил)проп-1-ен-2-ил]-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-(3-циклопропилсульфонилфенил)проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-(циклопропилсульфониламино)фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-фтор-5-[(3S)-3-(метансульфонамидо)пирролидин-1-ил]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7R,10S)-2-[(E)-1-[3-фтор-5-[(3S)-3-[(2-метоксиацетил)амино]пирролидин-1-ил]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-10-гидрокси-3,7-диметил-2-[(E)-1-[1-[(2-метилпропан-2-ил)оксикарбонил]-3,6-дигидро-2H-пиридин-5-ил]проп-1-ен-2-ил]-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2R,3R,4E,6R,7S,10S)-2-[(E)-1-(3-фтор-5-морфолин-4-илфенил)проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-(тридейтериометил)пиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-фтор-5-[4-(2-пиразол-1-илацетил)пиперазин-1-ил]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-N-(пиридин-4-илметил)карбамата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-фтор-5-[4-(2-пиразол-1-илацетил)пиперазин-1-ил]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-N-(пиримидин-4-илметил)карбамата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-фтор-5-[4-(2-пиразол-1-илацетил)пиперазин-1-ил]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-морфолин-4-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-фтор-5-[4-(2-пиразол-1-илацетил)пиперазин-1-ил]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-N-[2-(диметиламино)этил]карбамата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-фтор-5-[4-(2-пиразол-1-илацетил)пиперазин-1-ил]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метил-1,4-диазепан-1-карбоксилата;
[(2R,3R,4E,6R,7S,10S)-2-[(E)-1-[3-фтор-5-[4-(2-пиразол-1-илацетил)пиперазин-1-ил]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-N-[(4-метоксифенил)метил]карбамата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-фтор-5-[4-(2-пиразол-1-илацетил)пиперазин-1-ил]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-(3R)-3-(диметиламино)пирролидин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-фтор-5-[4-(2-пиразол-1-илацетил)пиперазин-1-ил]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-(3S)-3-(диметиламино)пирролидин-1-карбоксилата;
[(2R,3R,4E,6R,7S,10S)-2-[(E)-1-[3-фтор-5-[4-(2-пиразол-1-илацетил)пиперазин-1-ил]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-N-[(2S)-1-гидроксипропан-2-ил]карбамата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-фтор-5-[4-(2-пиразол-1-илацетил)пиперазин-1-ил]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-3-оксопиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-фтор-5-[4-(2-пиразол-1-илацетил)пиперазин-1-ил]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-(3R)-3-фторпирролидин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-фтор-5-[4-(2-пиразол-1-илацетил)пиперазин-1-ил]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-3,3,4-триметилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-фтор-5-[4-(2-пиразол-1-илацетил)пиперазин-1-ил]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-N-метил-N-(1-метилпиперидин-4-ил)карбамата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-фтор-5-[4-(2-пиразол-1-илацетил)пиперазин-1-ил]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-(2-гидроксиэтил)пиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-фтор-5-[4-(2-пиразол-1-илацетил)пиперазин-1-ил]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-пиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-фтор-5-[4-(2-пиразол-1-илацетил)пиперазин-1-ил]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-циклогептилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-фтор-5-[4-(2-пиразол-1-илацетил)пиперазин-1-ил]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-пиридин-4-илпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-фтор-5-[4-(2-пиразол-1-илацетил)пиперазин-1-ил]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-циклогексилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-фтор-5-[4-(2-пиразол-1-илацетил)пиперазин-1-ил]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-N-[2-(4-гидроксифенил)этил]-N-метилкарбамата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-(3-фтор-5-морфолин-4-илфенил)проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-N-(3-морфолин-4-илпропил)карбамата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-(3-фтор-5-морфолин-4-илфенил)проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-N-[2-(диметиламино)этил]карбамата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-(3-фтор-5-морфолин-4-илфенил)проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-(3R)-3-(диметиламино)пирролидин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-(3-фтор-5-морфолин-4-илфенил)проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-(3S)-3-(диметиламино)пирролидин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-(3-фтор-5-морфолин-4-илфенил)проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-N-(2-цианоэтил)-N-метилкарбамата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-(3-фтор-5-морфолин-4-илфенил)проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-3,3,4-триметилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-(3-фтор-5-морфолин-4-илфенил)проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-(3R)-3-фторпирролидин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-(диметилсульфамоиламино)-5-фторфенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7R,10S)-2-[(E)-1-[3-фтор-5-[(2-метоксиацетил)амино]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-[(2-циклопропилацетил)амино]-5-фторфенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-фтор-5-[4-(2-пиразол-1-илацетил)пиперазин-1-ил]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-[(3-гидроксифенил)метил]пиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-фтор-5-[4-(2-пиразол-1-илацетил)пиперазин-1-ил]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-(пиридин-3-илметил)пиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-(1-ацетилпиперидин-4-ил)-7-фторбензoтриазол-5-ил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-пиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-10-гидрокси-2-[(E)-1-[3-[[(3R)-3-гидроксипирролидин-1-карбонил]оксиметил]фенил]проп-1-ен-2-ил]-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[3-[(E)-2-[(2S,3S,4E,6R,7S,10R)-10-гидрокси-3,7-диметил-6-(4-метилпиперазин-1-карбонил)окси-12-оксо-1-оксациклододец-4-ен-2-ил]проп-1-енил]фенил]метил-2-окса-7-азаспиро[3.4]октан-7-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-10-гидрокси-2-[(E)-1-[2-[(2R)-2-(гидроксиметил)пирролидин-1-ил]пиридин-4-ил]проп-1-ен-2-ил]-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[3-[(E)-2-[(2S,3S,4E,6R,7S,10R)-10-гидрокси-3,7-диметил-6-(4-метилпиперазин-1-карбонил)окси-12-оксо-1-оксациклододец-4-ен-2-ил]проп-1-енил]фенил]метилморфолин-4-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-(диметилкарбамоилоксиметил)фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-10-гидрокси-2-[(E)-1-[3-[[(2R)-2-(гидроксиметил)пирролидин-1-карбонил]оксиметил]фенил]проп-1-ен-2-ил]-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-[3-[[(3R)-3-фторпирролидин-1-карбонил]оксиметил]фенил]проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-10-гидрокси-2-[(E)-1-[3-[(4-гидроксипиперидин-1-карбонил)оксиметил]фенил]проп-1-ен-2-ил]-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-метилпиперазин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-2-[(E)-1-(3-фтор-5-морфолин-4-илфенил)проп-1-ен-2-ил]-10-гидрокси-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-пиперидин-1-илпиперидин-1-карбоксилата;
[(2S,3S,4E,6R,7S,10R)-10-гидрокси-2-[(E)-1-[3-[4-(2-гидроксиэтил)пиперазин-1-ил]фенил]проп-1-ен-2-ил]-3,7-диметил-12-оксо-1-оксациклододец-4-ен-6-ил]-4-пиперидин-1-илпиперидин-1-карбоксилата;
2-[4-[3-фтор-5-[(E)-2-[(2S,3S,4E,6R,7S,10R)-10-гидрокси-3,7-диметил-12-оксо-6-(пиперазин-1-карбонилокси)-1-оксациклододец-4-ен-2-ил]проп-1-енил]фенил]пиперазин-1-ил]уксусной кислоты;
(2S,3S,6R,7S,10R,E)-2-((E)-1-(3-(диметиламино)фенил)проп-1-ен-2-ил)-10-гидрокси-3,7-диметил-12-оксооксациклододец-4-ен-6-ил-4-метилпиперазин-1-карбоксилата;
и их фармацевтически приемлемых солей.
| WO 2015175594 A1, 19.11.2015 | |||
| EP 1380579 A1, 14.01.2004 | |||
| RU 97105695 A, 27.04.1999 | |||
| ГЕНЕТИЧЕСКИ МОДИФИЦИРОВАННЫЙ МИКРООРГАНИЗМ И СПОСОБ ПОЛУЧЕНИЯ МАКРОЛИДНОГО СОЕДИНЕНИЯ С ГИДРОКСИЛЬНОЙ ГРУППОЙ В 16-ПОЛОЖЕНИИ С ИСПОЛЬЗОВАНИЕМ ТАКИХ МИКРООРГАНИЗМОВ | 2006 |
|
RU2394906C2 |
Авторы
Даты
2024-03-11—Публикация
2019-04-11—Подача