[01] Настоящее изобретение испрашивает преимущество приоритета на основании предварительной заявки на патент США № 62/679672, поданной 1 июня 2018 года; предварительной заявки на патент США № 62/679631, поданной 1 июня 2018 года, и предварительной заявки на патент США № 62/779324, поданной 13 декабря 2018 года. Все из вышеуказанных заявок включены в данный документ посредством ссылки во всей их полноте.
[02] Настоящее изобретение относится к конъюгатам антитела и лекарственного средства (ADC), содержащим модулятор сплайсинга и антитело или его антигенсвязывающий фрагмент, которые связывают опухолевую антигенную мишень человека. Настоящее изобретение дополнительно относится к способам и композициям, применимым в лечении или диагностике видов рака, которые экспрессируют антиген-мишень и/или поддаются лечению путем нарушения сплайсинга РНК, а также к способам получения таких композиций.
[03] Большинство белок-кодирующих генов в геноме человека состоят из нескольких экзонов (кодирующих областей), которые разделены интронами (некодирующими областями). Экспрессия гена приводит к образованию единой матричной РНК-предшественника (pre-mRNA). Интронные последовательности впоследствии удаляются из pre-mRNA за счет процесса, называемого сплайсингом, который приводит к зрелой матричной РНК (mRNA). Путем включения разных комбинаций экзонов альтернативный сплайсинг обусловливает образование мРНК, кодирующих различные изоформы белка.
[04] Сплайсинг РНК катализируется сплайсосомой, динамическим мультибелковым РНК-комплексом, состоящим из пяти малых ядерных РНК (snRNA U1, U2, U4, U5 и U6) и ассоциированных белков. Сплайсосома собирается на pre-mRNA для обеспечения динамического каскада из множественных взаимодействий РНК и белка, что катализирует вырезание интронов и лигирование экзонов (Matera and Wang (2014) Nat Rev Mol Cell Biol. 15(2):108-21). Накапливающие сведения установили связь заболеваний человека с дисрегуляцией сплайсинга РНК, что затрагивает множество генов (Scotti and Swanson (2016) Nat Rev Genet. 17(1):19-32).
[05] Сплайсосома представляет собой важную мишень в онкобиологии. В настоящее время несколько исследований документально подтвердили значительные изменения в профиле сплайсинга у раковых клеток, а также в факторах сплайсинга самих по себе (Agrawal et al. (2018) Curr Opin Genet Dev. 48:67-74). Альтернативный сплайсинг может приводить к дифференциальному включению/исключению экзонов, сохранению интрона или использованию криптических сайтов сплайсинга (Seiler et al. (2018) Cell Rep. 23(1):282-296). В совокупности эти события лежат в основе функциональных изменений, которые могут вносить вклад в онкогенез или устойчивость к терапии (Siegfried and Karni (2018) Curr Opin Genet Dev. 48:16-21).
[06] Определенные природные продукты могут связывать комплекс сплайсосомы SF3b. Эти малые молекулы модулируют сплайсинг путем содействия сохранению интрона и/или пропуску экзона (Teng et al. (2017) Nat Commun. 8:15522). Значительная часть полученных транскриптов содержит преждевременные стоп-кодоны, запускающие нонсенс-опосредованное разложение mRNA (NMD). Кроме того, поскольку канонический сплайсинг нарушен, количество канонических транскриптов значительно снижено, что может отрицательно воздействовать на функцию и жизнеспособность клетки. В связи с этим модуляторы сплайсинга становятся перспективным классом лекарственных средств для лечения рака (Puthenveetil et al (2016) Bioconjugate Chem. 27:1880-8).
[07] Протоонкогенный рецептор-2 эпидермального фактора роста человека (HER2) кодирует трансмембранный тирозинкиназный рецептор, который входит в семейство рецепторов эпидермального фактора роста человека (EGFR) (King et al. (1985) Science 229:974-6). Сверхэкспрессия HER2 обеспечивает конститутивную активацию сигнальных путей фактора роста, таких как путь PI3K-AKT-mTOR, и тем самым выступает в качестве онкогенного фактора при нескольких типах рака, включая примерно 20% инвазивных карцином молочной железы (Slamon et al. (1989) Science 244:707-12; Gajria and Chandarlapaty (2011) Expert Rev Anticancer Ther. 11:263-75). С учетом того, что амплификация HER2 опосредует трансформированный фенотип, и поскольку экспрессия HER2 ограничена по большей части злокачественными клетками, HER2 представляет собой перспективный антиген для целенаправленного воздействия на определенные виды рака и/или доставки новых средств лечения рака (Parakh et al. (2017) Cancer Treat Rev. 59:1-21). Дополнительные антигены для целенаправленной доставки видов противораковой терапии включают без ограничения CD138 (также называемый синдекан-1) и рецептор 2 эфрина типа-A (EPHA2).
[08] CD138 представляет собой гепарансульфатный протеогликан клеточной поверхности, которые является необходимым для поддержания морфологии клетки и ее взаимодействия с близлежащим микроокружением (Akl et al. (2015) Oncotarget 6(30):28693-715; Szatmári et al. (2015) Dis Markers 2015:796052). В целом, утрата экспрессии CD138 в клетках карциномы снижает адгезию клеток к внеклеточному матриксу и увеличивает подвижность клеток и инвазию (Teng et al. (2012) Matrix Biol. 31:3-16). Повышение экспрессии CD138 в строме также изменяет выработку фибронектина и организацию внеклеточного матрикса (Yang et al. (2011) Am J Pathol. 178:325-35). Дополнительно, повышение экспрессии CD138 в фибробластах стромы ассоциировано с ангиогенезом и прогрессированием рака (Maeda et al. (2006) Oncogene 25:1408-12). Экспрессия CD138 повышается во время развития B-клеток и его присутствие является характерным признаком плазматических клеток (Ribatti (2017) Immunol Lett. 188:64-7). Экспрессия CD138 сохраняется при множественной миеломе, злокачественном новообразовании из плазматических клеток. Следовательно, CD138 представляет собой привлекательный антиген для целенаправленного лечения нескольких видов рака и других гематологических злокачественных новообразований (Sherbenou et al. (2015) Blood Rev. 29(2):81-91; Wijdenes et al. (1996) Br J Haematol. 94(2):318-23).
[09] EPHA2 представляет собой трансмембранный гликопротеин, который широко сверхэкспрессируется на нескольких линиях клеток, происходящих из злокачественного рака, и на поздних формах рака (Wykosky and Debinski (2008) Mol Cancer Ref. 6(12):1795-1806). Например, EPHA2 сильно сверхэкспрессирован на примерно 61% опухолях пациентов с GBM (Wykosky et al. (2008) Clin Cancer Res. 14:199-208), 76% раковых опухолях яичника (Thaker et al. (2004) Clin Cancer Res. 10:5145-50) и 85% аденокарциномах предстательной железы (Zeng et al. (2003) Am J Pathol. 163:2271-6). Белок EPHA2 сверхэкспрессируется в высокой степени, если говорить о проценте опухолей пациентов и проценте клеток в пределах опухоли, и он представляет собой рецептор, локализованный в плазматической мембране, который может подвергаться интернализации при связывании с лигандом (Walker-Daniels et al. (2002) Mol Cancer Res. 1:79-87). Более того, экспрессия EPHA2 ассоциирована с неблагоприятным прогнозом, увеличением метастазирования и уменьшением выживания. Таким образом, вследствие его паттерна экспрессии, локализации и функциональной важности при определении исхода у пациентов с раком EPHA2 представляет собой другой привлекательный антиген для целенаправленной доставки новых видов противораковой терапии.
[10] В различных вариантах осуществления настоящего изобретения, помимо прочего, представлены новые соединения с биологической активностью против неопластических клеток. Соединения могут замедлять, подавлять и/или обращать опухолевый рост у млекопитающих и могут быть применимы для лечения пациентов-людей с раком. В различных вариантах осуществления настоящего изобретения представлены новые конъюгаты антитела и лекарственного средства, использующие новые соединения или другие функциональные молекулы ингибиторы сплайсинга.
[11] В различных вариантах осуществления настоящее изобретение, более конкретно, относится соединениям, представляющим собой конъюгат антитела и лекарственного средства (ADC), которые способны к связыванию и уничтожению неопластических клеток. В различных вариантах осуществления соединения ADC, раскрытые в данном документе, содержат линкер, который прикрепляет модулятор сплайсинга к полноразмерному антителу или антигенсвязывающему фрагменту. В различных вариантах осуществления соединения ADC также способны к интернализации в клетку-мишень после связывания.
[12] В различных вариантах осуществления соединения ADC могут быть представлены формулой (I):
Ab-(L-D)p (I),
где Ab представляет собой антитело или его антигенсвязывающий фрагмент, которые целенаправленно воздействуют на неопластическую клетку или другую связанную с опухолью мишень;
D представляет собой модулятор сплайсинга;
L представляет собой линкер, который ковалентно прикрепляет Ab к D; и
p составляет целое число от 1 до 15.
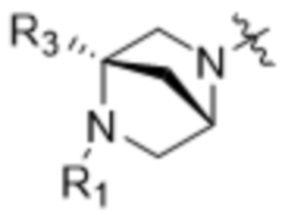
[13] В различных вариантах осуществления соединения ADC могут быть представлены формулой (I):
Ab-(L-D)p (I),
где Ab представляет собой антитело или его антигенсвязывающий фрагмент, которые целенаправленно воздействуют на неопластическую клетку;
D представляет собой модулятор сплайсинга формулы (II):
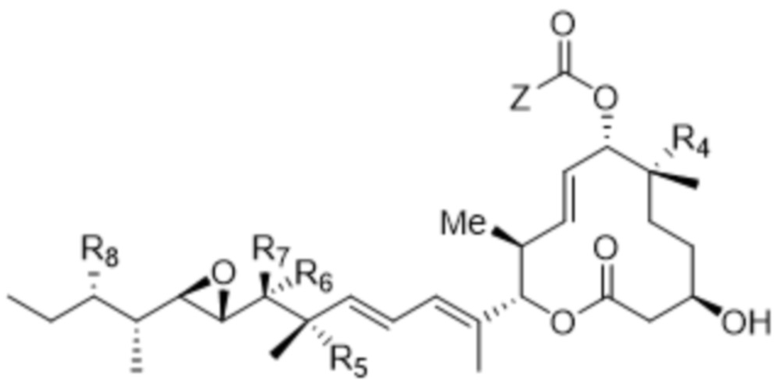 (II),
(II),
или его фармацевтически приемлемую соль, где:
R1 отсутствует или выбран из водорода, C1-C6алкильных групп, C1-C6алкилалкоксигрупп, C1-C6алкиламиногрупп, групп C1-C6алкилкарбоновой кислоты, C1-C6алкилгидроксигрупп, C3-C8циклоалкильных групп, бензильных групп, C3-C8гетероциклильных групп, групп -O-C(=O)-(C1-C6алкил) и -CD3;
R3 выбран из водорода, C1-C6алкильных групп, C1-C6алкилалкоксигрупп, C1-C6алкиламиногрупп, групп C1-C6алкилкарбоновой кислоты, C1-C6алкилгидроксигрупп, C3-C8циклоалкильных групп, бензильных групп, C3-C8гетероциклильных групп и групп -O-C(=O)-(C1-C6алкил); и
каждый из R4, R5 и R8 независимо выбран из водорода, гидроксильных групп, групп -O-(C1-C6алкил), групп -O-C(=O)-(C1-C6алкил) и C1-C6алкильных групп;
каждый из R6 и R7 независимо выбран из водорода, -O-R17, -O-C(=O)-R17, -O-C(=O)-NR15R16, C1-C6алкильных групп и -NR15R16;
каждый из R15 и R16 независимо выбран из водорода, R17, -C(=O)-R17 и -C(=O)-O-R17;
R17 выбран из водорода, C1-C6алкильных групп, C3-C8циклоалкильных групп, бензильных групп и C3-C8гетероциклильных групп; и
Z выбран из 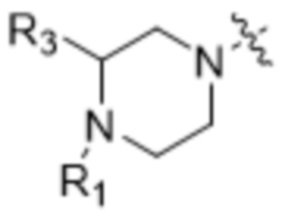 ,
, 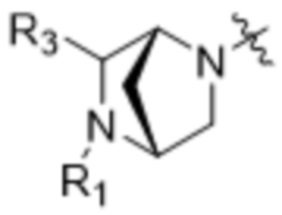 ,
, 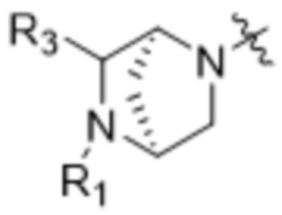 ,
,  и
и 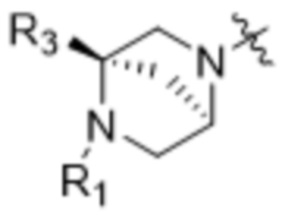 ;
;
где каждый из R1, R3, R4, R5, R6, R7, R8, R15, R16, и R17 независимо замещен 0-3 группами, независимо выбранными из атомов галогена, гидроксильных групп, C1-C6алкильных групп,
групп -O-(C1-C6алкил), -NR15R16, C3-C8циклоалкильных групп, C1-C6алкилгидроксигрупп, C1-C6алкилалкоксигрупп, бензильных групп и C3-C8гетероциклильных групп,
где по меньшей мере один из R6 и R7 представляет собой водород;
и где L представляет собой линкер, который ковалентно прикрепляет Ab к D; и
p составляет целое число от 1 до 15.
[14] В некоторых вариантах осуществления антитело или антигенсвязывающий фрагмент способны к интернализации в клетку-мишень. В некоторых вариантах осуществления линкер ковалентно прикрепляется к модулятору сплайсинга формулы (II) ("L-D"), и L-D имеют структуру формулы (II-A):
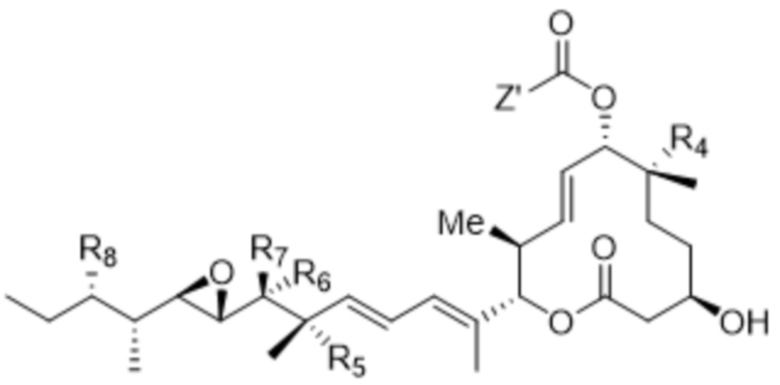 (II-A),
(II-A),
или ее фармацевтически приемлемой соли,
где Z' выбран из 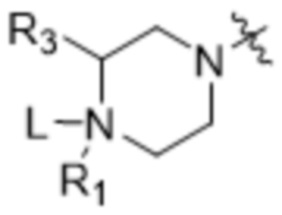 ,
, 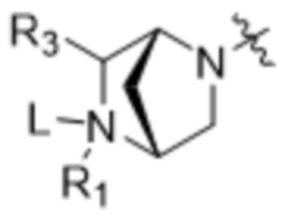 ,
, 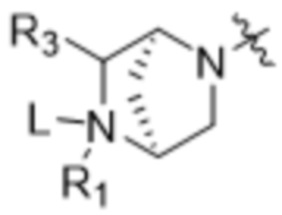 ,
, 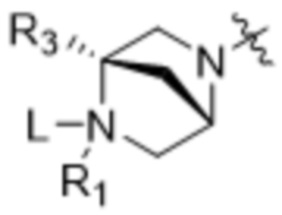 и
и 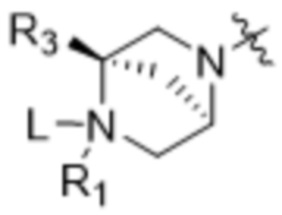 ; и
; и
где все остальные переменные являются такими, как определено для формулы (II).
[15] В различных других вариантах осуществления соединения ADC могут быть представлены формулой (I):
Ab-(L-D)p (I),
где Ab представляет собой антитело или его антигенсвязывающий фрагмент, которые целенаправленно воздействуют на неопластическую клетку;
D представляет собой модулятор сплайсинга формулы (IV):
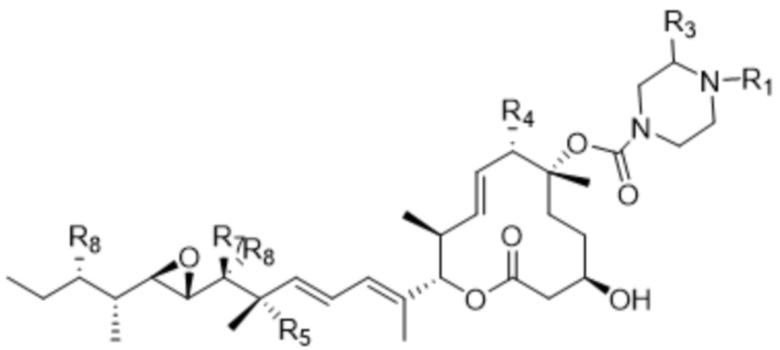 (IV),
(IV),
или его фармацевтически приемлемую соль, где:
R1 выбран из водорода, C1-C6алкильных групп, C1-C6алкилалкоксигрупп, C1-C6алкиламиногрупп, групп C1-C6алкилкарбоновой кислоты, C1-C6алкилгидроксигрупп, C3-C8циклоалкильных групп, бензильных групп, C3-C8гетероциклильных групп, групп -O-C(=O)-(C1-C6алкил) и -CD3;
R3 выбран из водорода, C1-C6алкильных групп, C1-C6алкилалкоксигрупп, C1-C6алкиламиногрупп, групп C1-C6алкилкарбоновой кислоты, C1-C6алкилгидроксигрупп, C3-C8циклоалкильных групп, бензильных групп, C3-C8гетероциклильных групп и групп -O-C(=O)-(C1-C6алкил); и
каждый из R4, R5 и R8 независимо выбран из водорода, гидроксильных групп, групп -O-(C1-C6алкил), групп -O-C(=O)-(C1-C6алкил) и C1-C6алкильных групп;
каждый из R6 и R7 независимо выбран из водорода, -O-R17, -O-C(=O)-R17, -O-C(=O)-NR15R16, C1-C6алкильных групп и -NR15R16;
каждый из R15 и R16 независимо выбран из водорода, R17, -C(=O)-R17 и -C(=O)-O-R17; и
R17 выбран из водорода, C1-C6алкильных групп, C3-C8циклоалкильных групп, бензильных групп и C3-C8гетероциклильных групп;
где каждый из R1, R3, R4, R5, R6, R7, R8, R15, R16, и R17 независимо замещен 0-3 группами, независимо выбранными из атомов галогена, гидроксильных групп, C1-C6алкильных групп,
групп -O-(C1-C6алкил), -NR15R16, C3-C8циклоалкильных групп, C1-C6алкилгидроксигрупп, C1-C6алкилалкоксигрупп, бензильных групп и C3-C8гетероциклильных групп,
где по меньшей мере один из R6 и R7 представляет собой водород;
и где L представляет собой линкер, который ковалентно прикрепляет Ab к D; и
p составляет целое число от 1 до 15.
[16] В некоторых вариантах осуществления антитело или антигенсвязывающий фрагмент способны к интернализации в клетку-мишень. В некоторых вариантах осуществления линкер ковалентно прикрепляется к модулятору сплайсинга ("L-D"), и L-D имеет структуру формулы (IV-A):
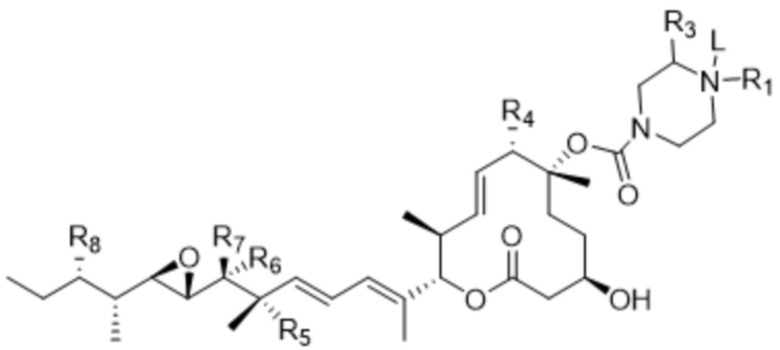 (IV-A),
(IV-A),
или ее фармацевтически приемлемой соли.
[17] В различных других вариантах осуществления соединения ADC могут быть представлены формулой (I):
Ab-(L-D)p (I),
где Ab представляет собой антитело или его антигенсвязывающий фрагмент, которые целенаправленно воздействуют на неопластическую клетку;
D представляет собой модулятор сплайсинга формулы (VI):
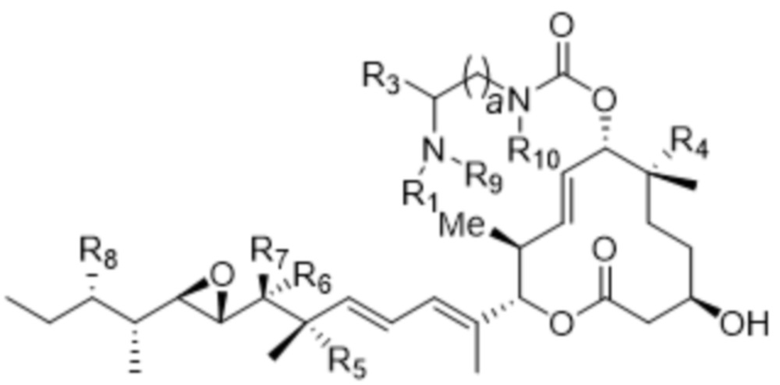 (VI),
(VI),
или его фармацевтически приемлемую соль, где:
каждый из R1 и R9 независимо выбран из водорода, C1-C6алкильных групп, C1-C6алкилалкоксигрупп, C1-C6алкиламиногрупп, групп C1-C6алкилкарбоновой кислоты, C1-C6алкилгидроксигрупп, C3-C8циклоалкильных групп, бензильных групп, C3-C8гетероциклильных групп, групп -O-C(=O)-(C1-C6алкил) и -CD3;
R3 выбран из водорода, C1-C6алкильных групп, C1-C6алкилалкоксигрупп, C1-C6алкиламиногрупп, групп C1-C6алкилкарбоновой кислоты, C1-C6алкилгидроксигрупп, C3-C8циклоалкильных групп, бензильных групп, C3-C8гетероциклильных групп и групп -O-C(=O)-(C1-C6алкил);
каждый из R4, R5 и R8 независимо выбран из водорода, гидроксильных групп, групп -O-(C1-C6алкил), групп -O-C(=O)-(C1-C6алкил) и C1-C6алкильных групп;
каждый из R6 и R7 независимо выбран из водорода, -O-R17, -O-C(=O)-R17, -O-C(=O)-NR15R16, C1-C6алкильных групп, -NR15R16 и линкера;
R10 выбран из водорода, C1-C6алкильных групп, групп -C(=O)-(C1-C6алкил) и -CD3;
каждый из R15 и R16 независимо выбран из водорода, R17, -C(=O)-R17 и
-C(=O)-O-R17;
R17 выбран из водорода, C1-C6алкильных групп, C3-C8циклоалкильных групп, бензильных групп и C3-C8гетероциклильных групп; и
a составляет 1, 2, 3, 4, 5, 6, 7, 8, 9, или 10;
где каждый из R1, R3, R4, R5, R6, R7, R8, R9, R10, R15, R16, и R17 независимо замещен 0-3 группами, независимо выбранными из атомов галогена, гидроксильных групп, C1-C6алкильных групп, групп -O-(C1-C6алкил), -NR15R16, C3-C8циклоалкильных групп, C1-C6алкилгидроксигрупп, C1-C6алкилалкоксигрупп, бензильных групп и C3-C8гетероциклильных групп;
где по меньшей мере один из R6 и R7 представляет собой водород; и
где оба R1 и R9 не могут отсутствовать;
и где L представляет собой линкер, который ковалентно прикрепляет Ab к D; и
p составляет целое число от 1 до 15.
[18] В некоторых вариантах осуществления антитело или антигенсвязывающий фрагмент способны к интернализации в клетку-мишень. В некоторых вариантах осуществления линкер ковалентно прикрепляется к модулятору сплайсинга ("L-D"), и L-D имеют структуру формулы (VI-A):
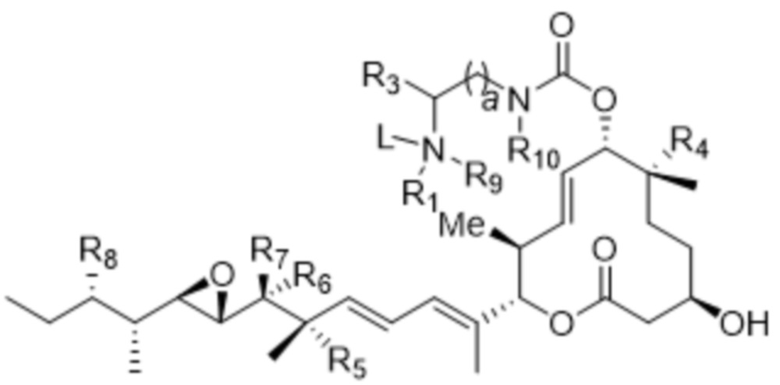 (VI-A),
(VI-A),
или ее фармацевтически приемлемой соли.
[19] В различных других вариантах осуществления соединения ADC могут быть представлены формулой (I):
Ab-(L-D)p (I),
где Ab представляет собой антитело или его антигенсвязывающий фрагмент, которые целенаправленно воздействуют на неопластическую клетку;
D представляет собой модулятор сплайсинга формулы (VIII):
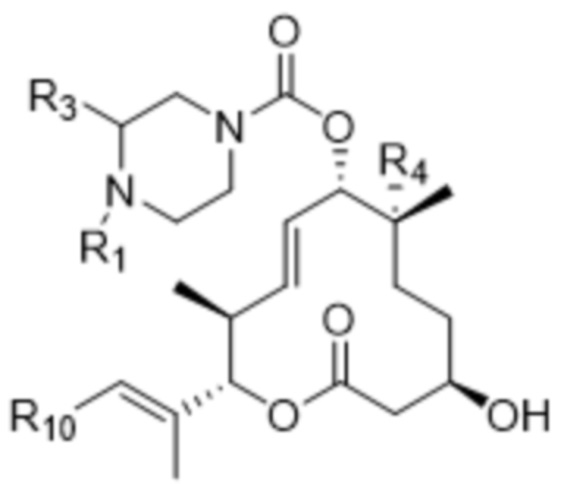 (VIII),
(VIII),
или его фармацевтически приемлемую соль, где:
R1 отсутствует или выбран из водорода, C1-C6алкильных групп, C1-C6алкилалкоксигрупп, C1-C6алкиламиногрупп, групп C1-C6алкилкарбоновой кислоты, C1-C6алкилгидроксигрупп, C3-C8циклоалкильных групп, бензильных групп, C3-C8гетероциклильных групп, групп -O-C(=O)-(C1-C6алкил) и -CD3;
R3 выбран из водорода, C1-C6алкильных групп, C1-C6алкилалкоксигрупп, C1-C6алкиламиногрупп, групп C1-C6алкилкарбоновой кислоты, C1-C6алкилгидроксигрупп, C3-C8циклоалкильных групп, бензильных групп, C3-C8гетероциклильных групп и групп -O-C(=O)-(C1-C6алкил);
R4 выбран из водорода, гидроксильных групп, групп -O-(C1-C6алкил), групп -O-C(=O)-(C1-C6алкил) и C1-C6алкильных групп; и
R10 выбран из 3-10-членных карбоциклов и 3-10-членных гетероциклов, каждый из которых замещен 0-3 Ra, где каждый Ra независимо выбран из атомов галогена, C1-C6алкильных групп, -O-(C1-C6)алкильных групп, C1-C6алкилалкоксигрупп, C1-C6алкилгидроксигрупп, -S(=O)w-(4-7-членные гетероциклы), 4-7-членных карбоциклов и 4-7-членных гетероциклов;
каждый из R15 и R16 независимо выбран из водорода, R17, -C(=O)-R17 и -C(=O)-O-R17; и
R17 выбран из водорода, C1-C6алкильных групп, C3-C8циклоалкильных групп, бензильных групп и C3-C8гетероциклильных групп;
где каждый из R1, R3, R4, R10, R15, R16 и R17 независимо замещен 0-3 группами, независимо выбранными из атомов галогена, гидроксильных групп, C1-C6алкильных групп, групп -O-(C1-C6алкил), -NR15R16, C3-C8циклоалкильных групп, C1-C6алкилгидроксигрупп, C1-C6алкилалкоксигрупп, бензильных групп и C3-C8гетероциклильных групп; и
где каждый Ra независимо замещен 0-3 группами, независимо выбранными из атомов галогена, гидроксильных групп, -NR15R16, C1-C6алкильных групп, групп -(C=O)-(C1-C6алкил),
-(C=O)-(C1-C6алкил)-(C3-C10гетероциклильных групп), групп -S(=O)w-(C3-C8гетероциклил) и групп C1-C6алкилкарбоновой кислоты, каждая из которых замещена 0, 1 или 2 группами, независимо выбранными из атомов галогена, гидроксильных групп, -NR15R16 и C1-C3алкильных групп; и
w составляет 0, 1 или 2;
и где L представляет собой линкер, который ковалентно прикрепляет Ab к D; и
p составляет целое число от 1 до 15.
[20] В некоторых вариантах осуществления антитело или антигенсвязывающий фрагмент способны к интернализации в клетку-мишень. В некоторых вариантах осуществления линкер ковалентно прикрепляется к модулятору сплайсинга ("L-D"), и L-D имеют структуру формулы (VIII-A):
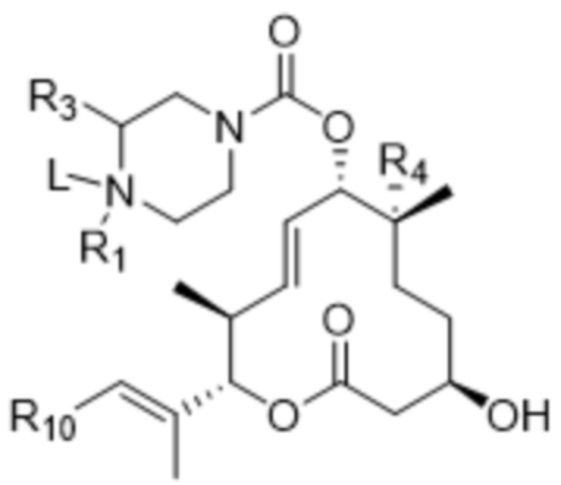 (VIII-A),
(VIII-A),
или ее фармацевтически приемлемой соли.
[21] В некоторых вариантах осуществления модулятор сплайсинга предусматривает модулятор комплекса SF3b.
В некоторых вариантах осуществления модулятор сплайсинга предусматривает пладиенолид или производное пладиенолида. В некоторых вариантах осуществления модулятор сплайсинга предусматривает пладиенолид D или производное пладиенолида D. В некоторых вариантах осуществления пладиенолид D или производное предусматривают D2, D1, D4, D8, D10, D11 (E7107), D20, D21, D22, D12, или D25. В некоторых вариантах осуществления пладиенолид D или производное предусматривают D2. В некоторых вариантах осуществления пладиенолид D или производное предусматривают D1. В некоторых вариантах осуществления пладиенолид D или производное предусматривают D4. В некоторых вариантах осуществления пладиенолид D или производное предусматривают D12.
[22] В некоторых вариантах осуществления пладиенолид D или производное предусматривают цвиттер-ионный пладиенолид D или его производное. В некоторых вариантах осуществления цвиттер-ионный пладиенолид D или производное предусматривают D22 или D25.
[23] В некоторых других вариантах осуществления модулятор сплайсинга предусматривает пладиенолид B или производное пладиенолида B. В некоторых вариантах осуществления пладиенолид B или производное предусматривают D9, D18, D19 или D13.
В некоторых вариантах осуществления модулятор сплайсинга предусматривает арильный пладиенолид. В некоторых вариантах осуществления арильный пладиенолид предусматривает D15, D14, D16, D17, D26 или D33. В некоторых вариантах осуществления арильный пладиенолид предусматривает D15. В некоторых вариантах осуществления арильный пладиенолид представляет собой цвиттер-ионный арильный пладиенолид. В некоторых вариантах осуществления цвиттер-ионный арильный пладиенолид предусматривает D33.
[24] В некоторых вариантах осуществления модулятор сплайсинга предусматривает D1:
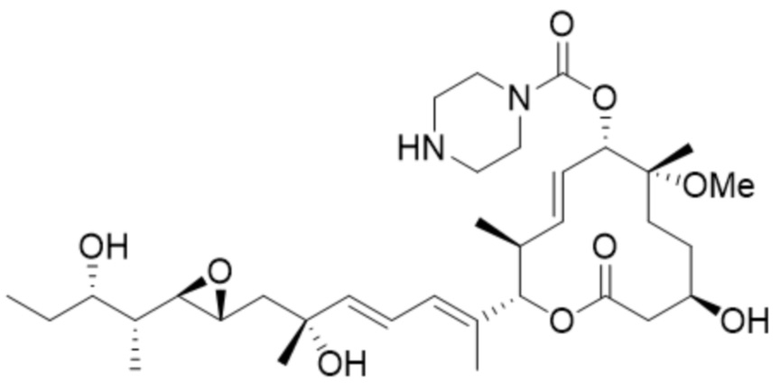 (D1).
(D1).
[25] В некоторых вариантах осуществления модулятор сплайсинга предусматривает D2:
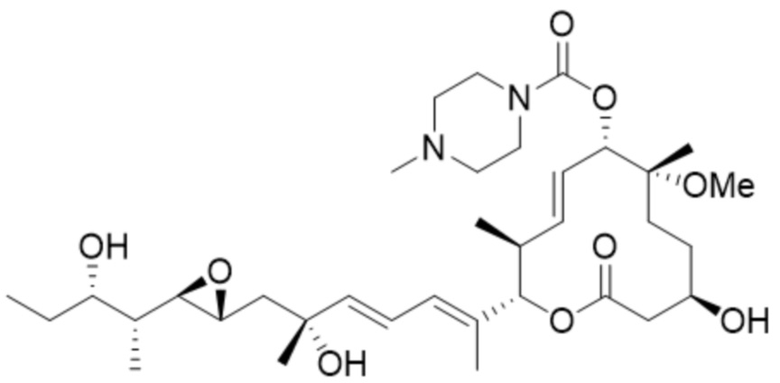 (D2).
(D2).
[26] В некоторых вариантах осуществления модулятор сплайсинга предусматривает D3:
 (D3).
(D3).
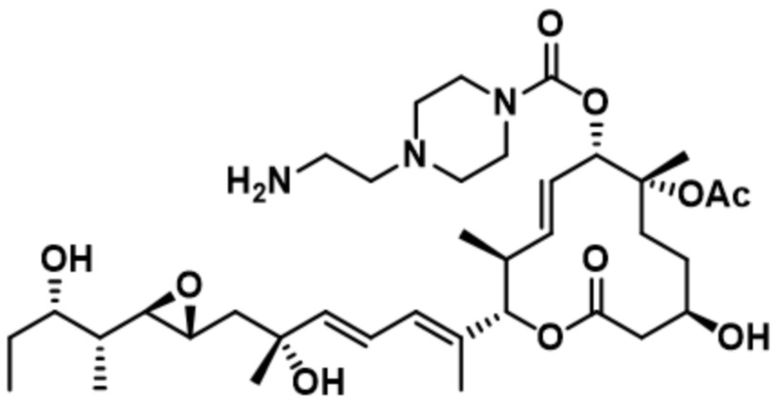
[27] В некоторых вариантах осуществления модулятор сплайсинга предусматривает D4:
 (D4).
(D4).
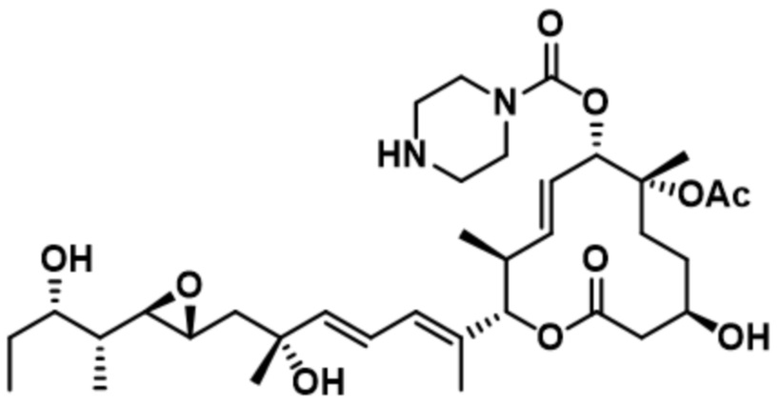
[28] В некоторых вариантах осуществления модулятор сплайсинга предусматривает D4':
 (D4').
(D4').
[29] В некоторых вариантах осуществления модулятор сплайсинга предусматривает D5:
 (D5).
(D5).
[30] В некоторых вариантах осуществления модулятор сплайсинга предусматривает D6:
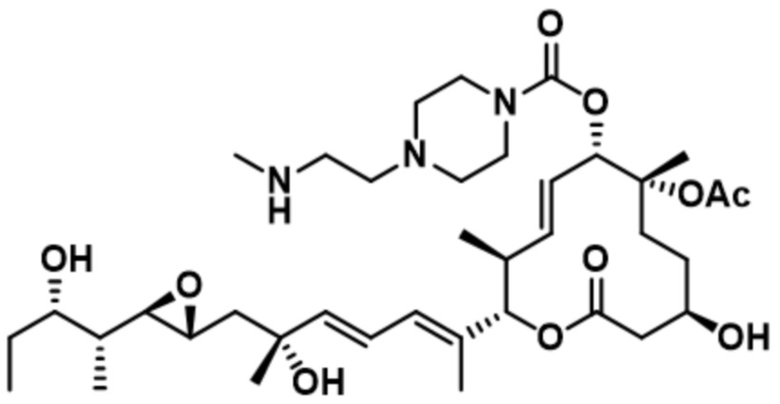 (D6).
(D6).
[31] В некоторых вариантах осуществления модулятор сплайсинга предусматривает D7:
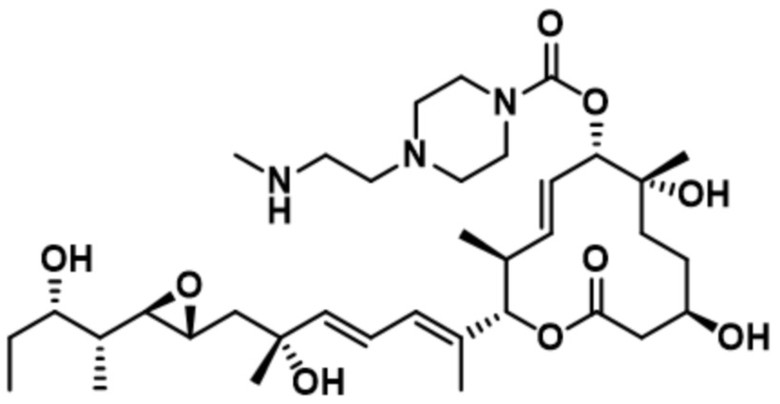 (D7).
(D7).
[32] В некоторых вариантах осуществления модулятор сплайсинга предусматривает D8:
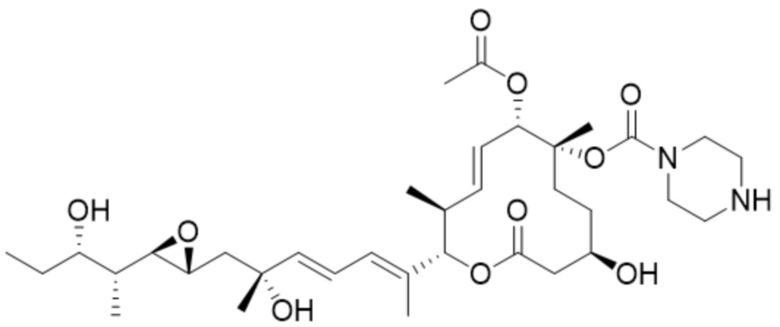 (D8).
(D8).
[33] В некоторых вариантах осуществления модулятор сплайсинга предусматривает D9:
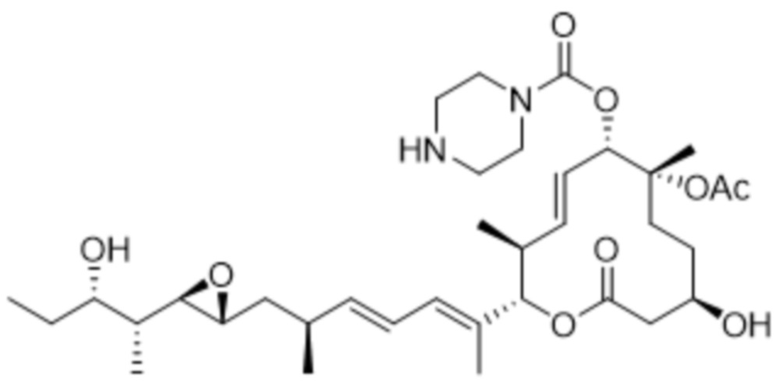 (D9).
(D9).
[34] В некоторых вариантах осуществления модулятор сплайсинга предусматривает D10:
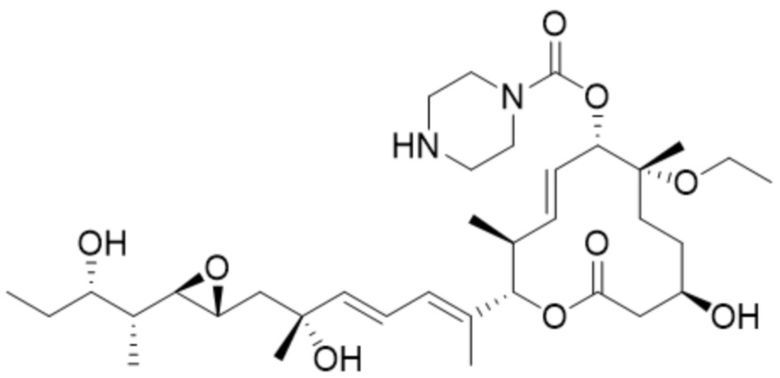 (D10).
(D10).
[35] В некоторых вариантах осуществления модулятор сплайсинга предусматривает D11:
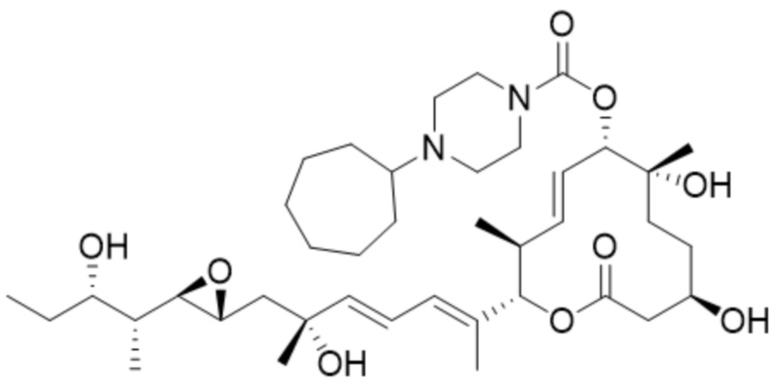 (D11).
(D11).
[36] В некоторых вариантах осуществления модулятор сплайсинга предусматривает D12:
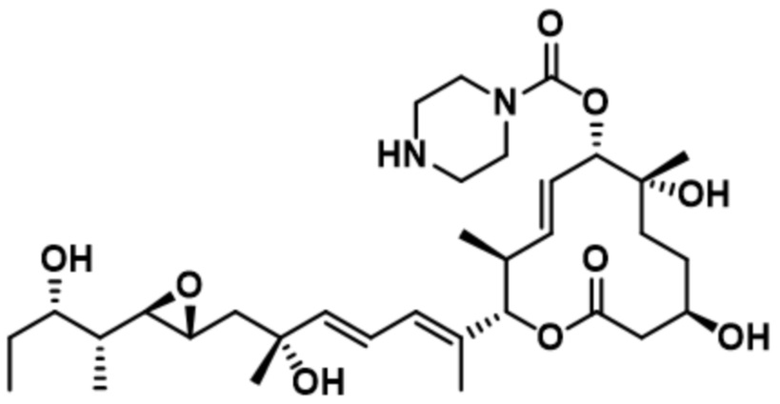 (D12).
(D12).
[37] В некоторых вариантах осуществления модулятор сплайсинга предусматривает D13:
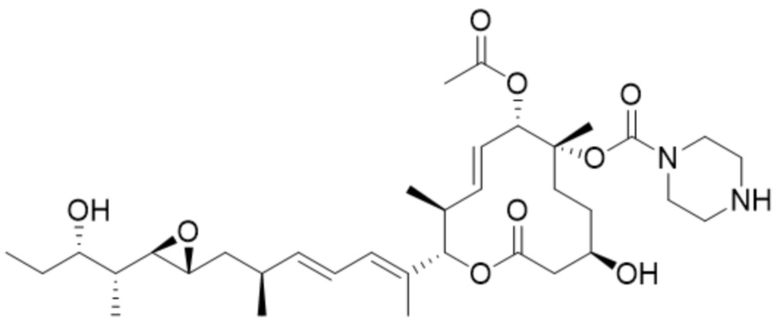 (D13).
(D13).
[38] В некоторых вариантах осуществления модулятор сплайсинга предусматривает D14:
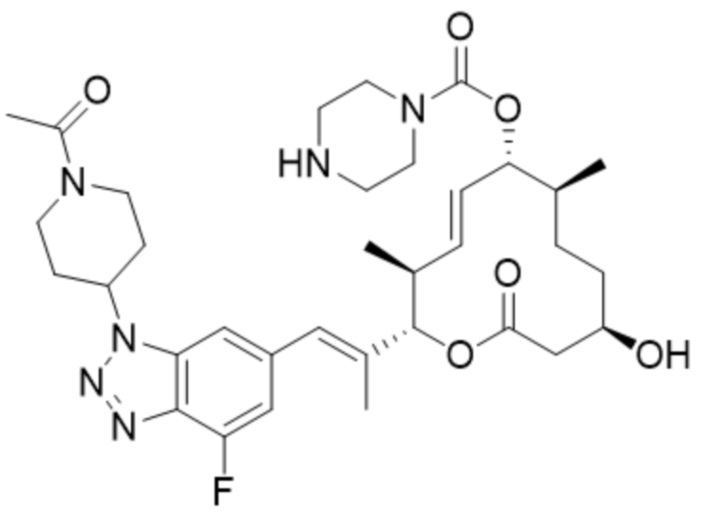 (D14).
(D14).
[39] В некоторых вариантах осуществления модулятор сплайсинга предусматривает D15:
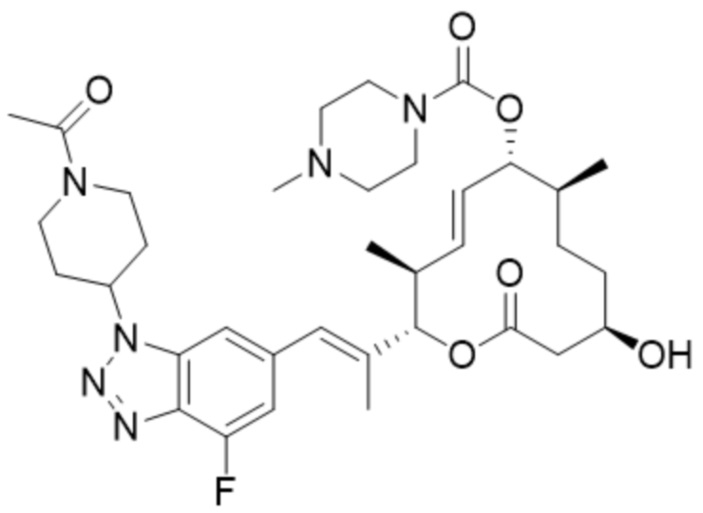 (D15).
(D15).
[40] В некоторых вариантах осуществления модулятор сплайсинга предусматривает D16:
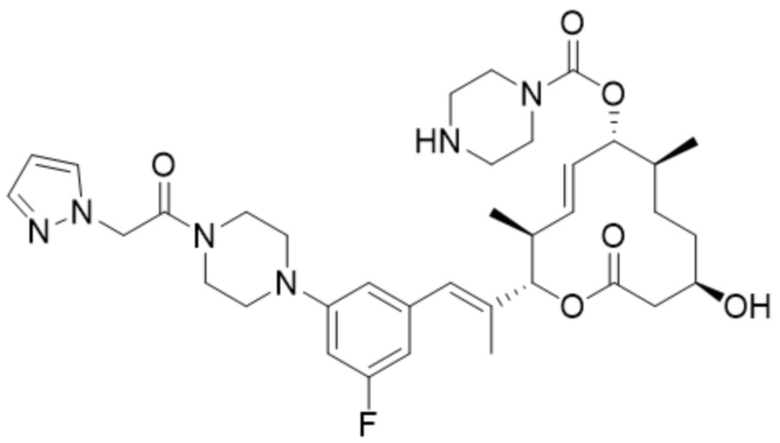 (D16).
(D16).
[41] В некоторых вариантах осуществления модулятор сплайсинга предусматривает D17:
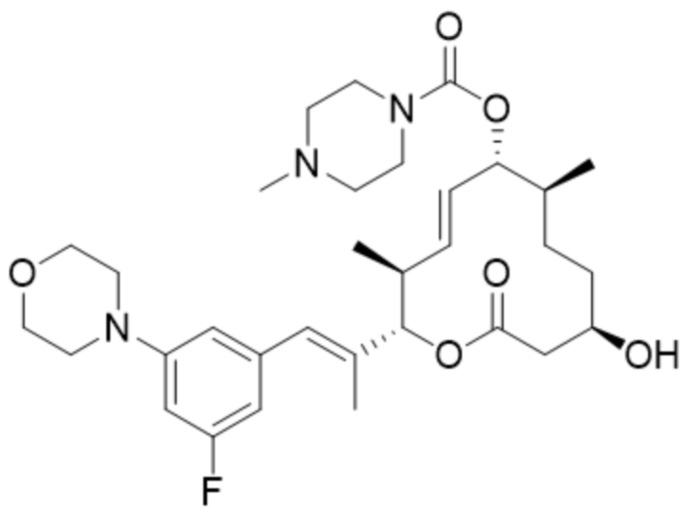 (D17).
(D17).
[42] В некоторых вариантах осуществления модулятор сплайсинга предусматривает D18:
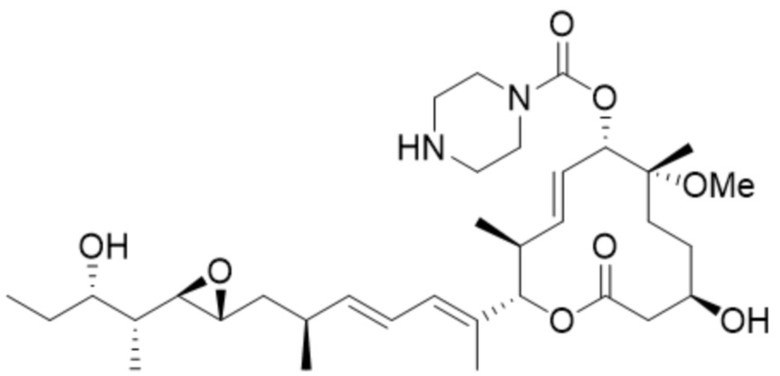 (D18).
(D18).
[43] В некоторых вариантах осуществления модулятор сплайсинга предусматривает D19:
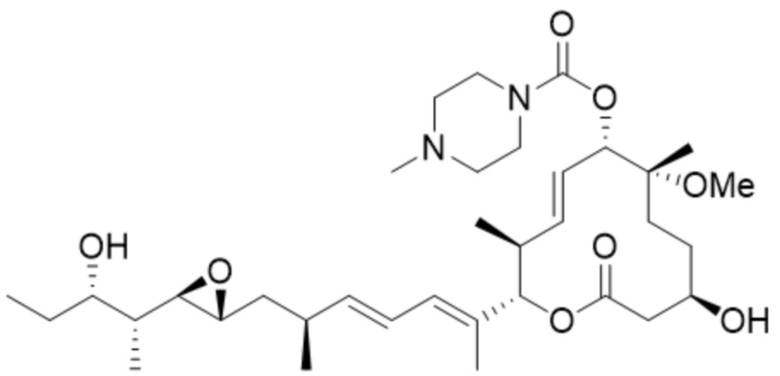 (D19).
(D19).
[44] В некоторых вариантах осуществления модулятор сплайсинга предусматривает D20:
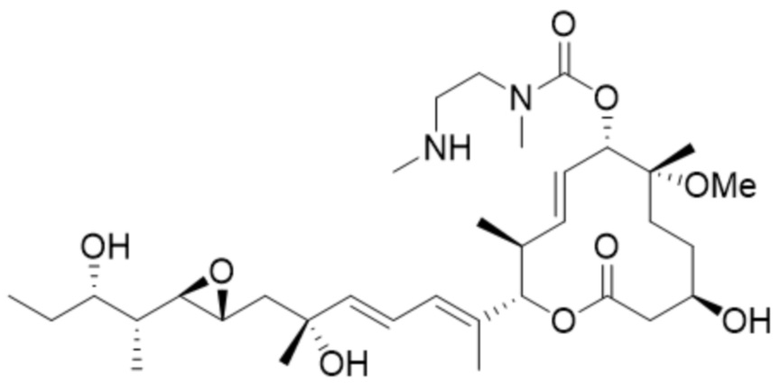 (D20).
(D20).
[45] В некоторых вариантах осуществления модулятор сплайсинга предусматривает D21:
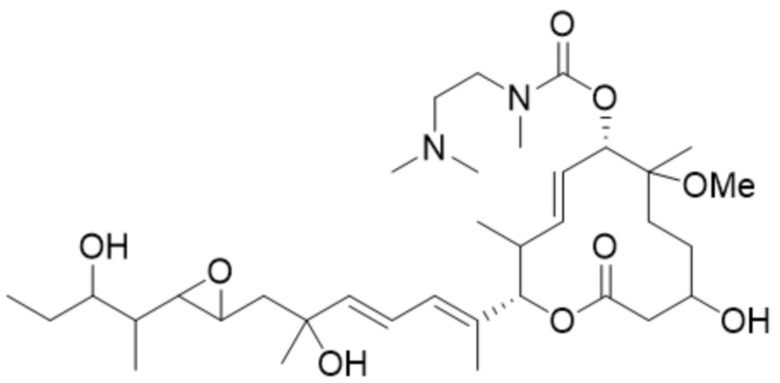 (D21).
(D21).
[46] В некоторых вариантах осуществления модулятор сплайсинга предусматривает D22:
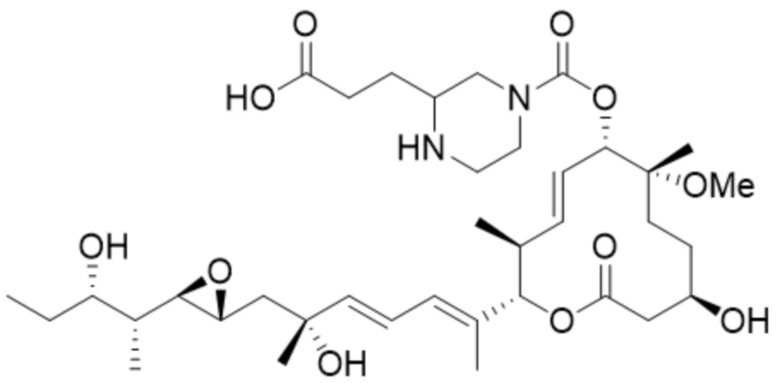 (D22).
(D22).
[47] В некоторых вариантах осуществления модулятор сплайсинга предусматривает D23:
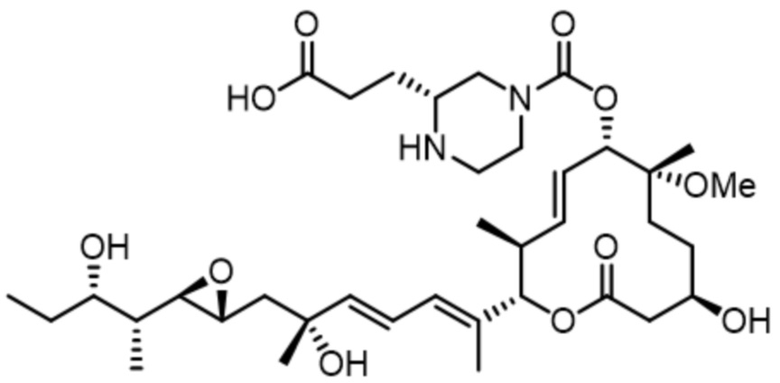 (D23).
(D23).
[48] В некоторых вариантах осуществления модулятор сплайсинга предусматривает D24:
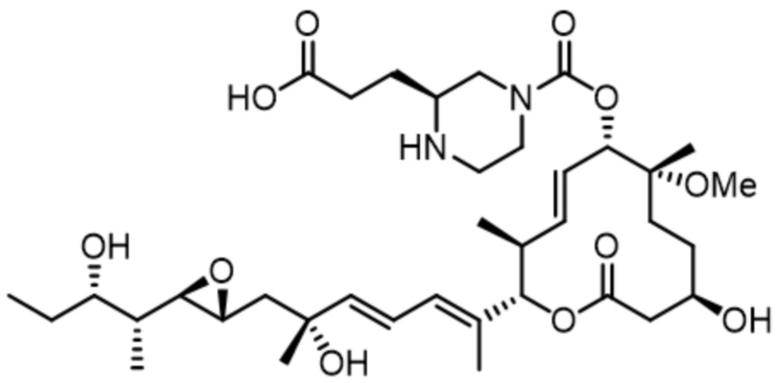 (D24).
(D24).
[49] В некоторых вариантах осуществления модулятор сплайсинга предусматривает D25:
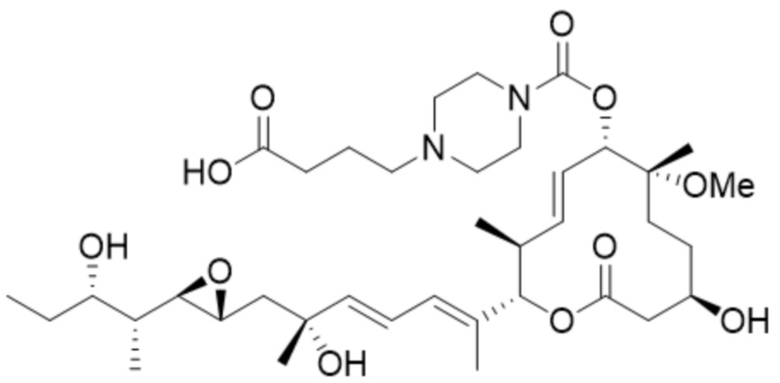 (D25).
(D25).
[50] В некоторых вариантах осуществления модулятор сплайсинга предусматривает D26:
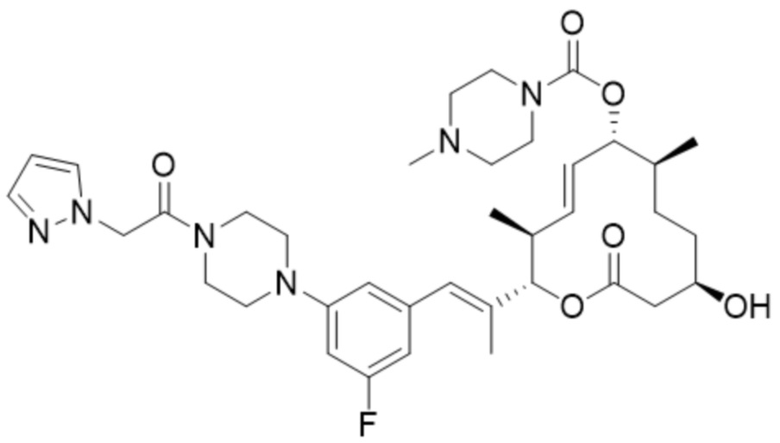 (D26).
(D26).
[51] В некоторых вариантах осуществления модулятор сплайсинга предусматривает D27:
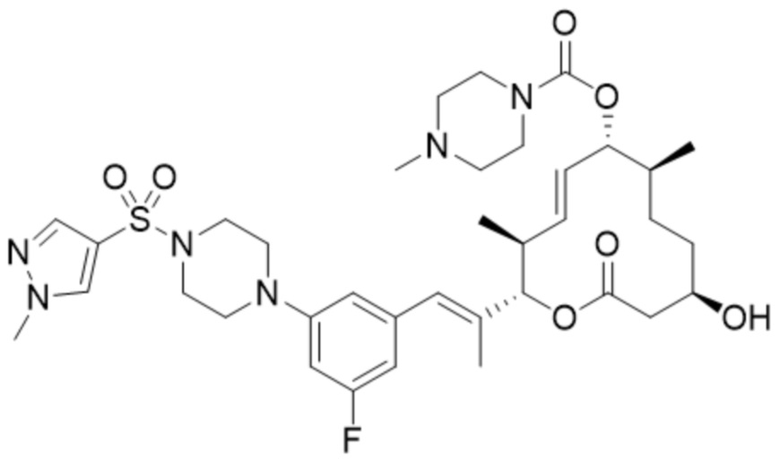 (D27).
(D27).
[52] В некоторых вариантах осуществления модулятор сплайсинга предусматривает D28:
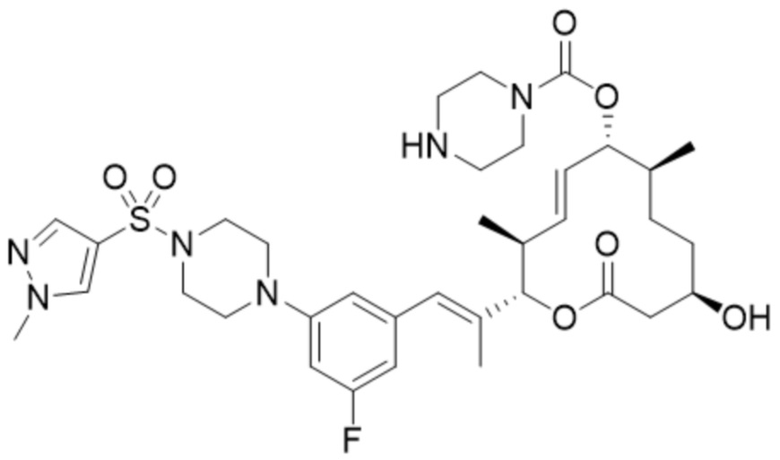 (D28).
(D28).
[53] В некоторых вариантах осуществления модулятор сплайсинга предусматривает D29:
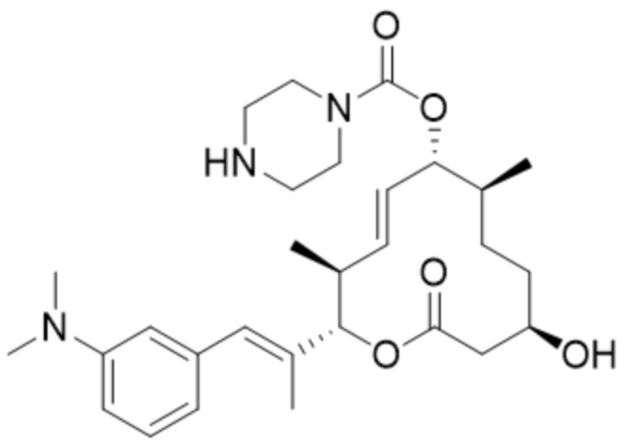 (D29).
(D29).
[54] В некоторых вариантах осуществления модулятор сплайсинга предусматривает D30:
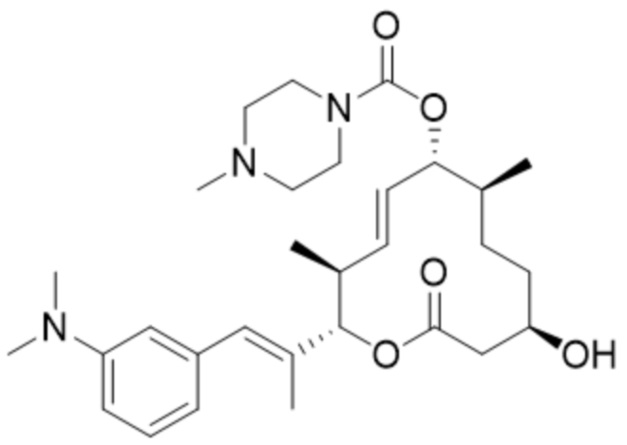 (D30).
(D30).
[55] В некоторых вариантах осуществления модулятор сплайсинга предусматривает D31:
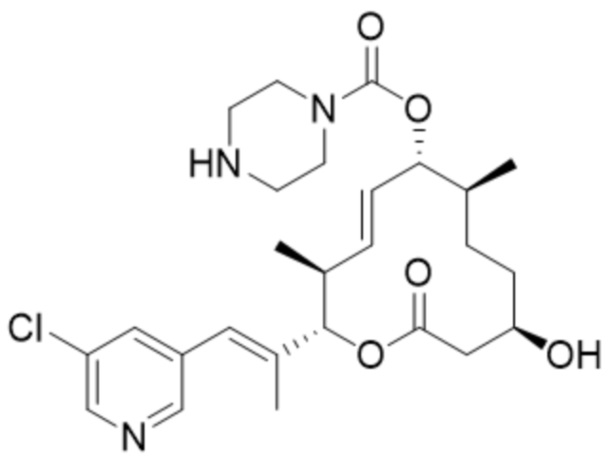 (D31).
(D31).
[56] В некоторых вариантах осуществления модулятор сплайсинга предусматривает D32:
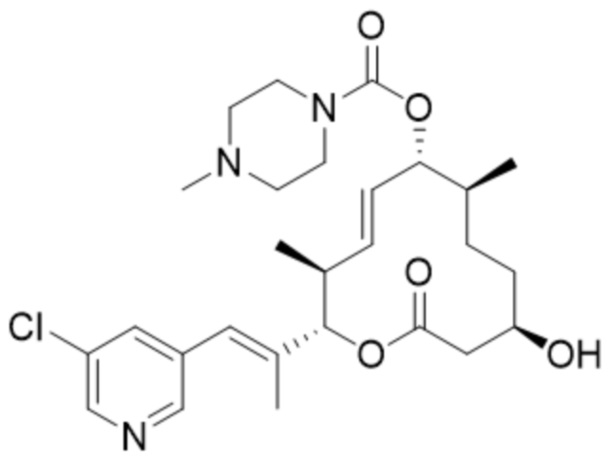 (D32).
(D32).
[57] В некоторых вариантах осуществления модулятор сплайсинга предусматривает D33:
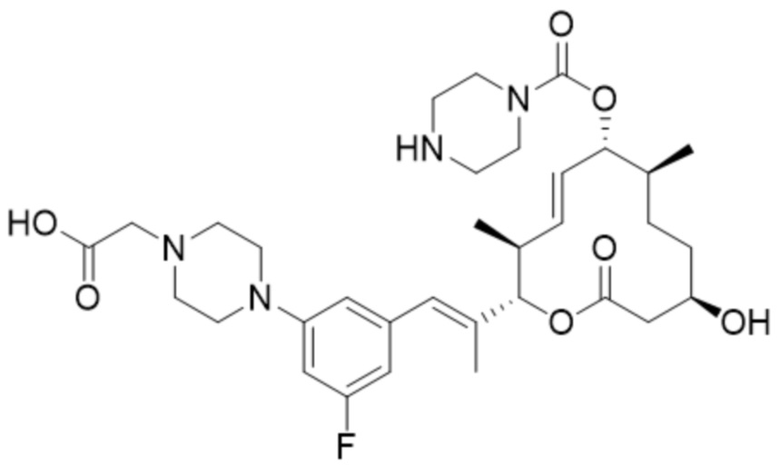 (D33).
(D33).
[58] В некоторых вариантах осуществления модулятор сплайсинга предусматривает D34:
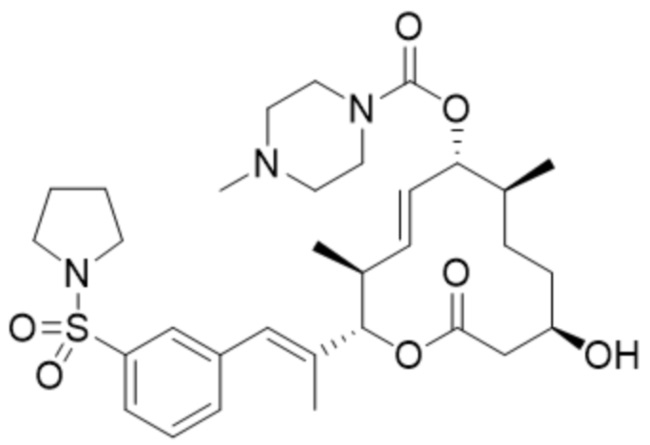 (D34).
(D34).
[59] В некоторых вариантах осуществления модулятор сплайсинга предусматривает D35:
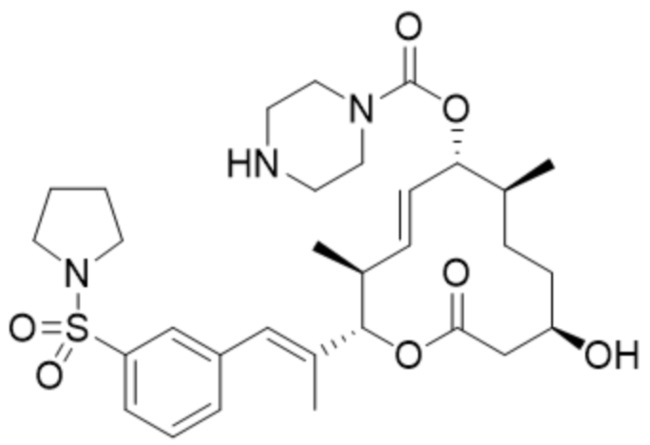 (D35).
(D35).
[60] В некоторых вариантах осуществления модулятор сплайсинга предусматривает один из фрагментов-лекарственных средств, перечисленных в таблице 7. В некоторых вариантах осуществления модулятор сплайсинга предусматривает D1, D2, D3, D4, D4', D5, D6, D7, D8, D9, D10, D11, D12, D13, D14, D15, D16, D17, D18, D19, D20, D21, D22, D23, D24, D25, D26, D27, D28, D29, D30, D31, D32, D33, D34, и/или D35.
[61] В некоторых вариантах осуществления раскрывается модулятор сплайсинга, а также его применение в качестве терапевтического препарата или в качестве части ADC. В некоторых вариантах осуществления модулятор сплайсинга предусматривает D4, D4', D12, D15, D8, D9, D10, D13, D18, D19, D20, D21, D22, D25, или D33.
[62] В некоторых вариантах осуществления модулятор сплайсинга предусматривает D4, и линкер предусматривает MC-Val-Cit-pABC. В некоторых вариантах осуществления модулятор сплайсинга предусматривает D4, и линкер предусматривает MC-β-глюкуронид. В некоторых вариантах осуществления модулятор сплайсинга предусматривает D12, и линкер предусматривает MC-Val-Cit-pABC. В некоторых вариантах осуществления модулятор сплайсинга предусматривает D12, и линкер предусматривает MC-β-глюкуронид. В некоторых вариантах осуществления модулятор сплайсинга предусматривает D15, и линкер предусматривает MC-Val-Ala-pAB.
[63] В различных вариантах осуществления линкер, применяемый в ADC, раскрытом в данном документе, является стабильным за пределами клетки, вследствие чего ADC остается интактным, когда находится во внеклеточных условиях, но способен подвергаться расщеплению после интернализации в клетку, например, опухолевую или раковую клетку. В некоторых вариантах осуществления модулятор сплайсинга отщепляется от антитела или антигенсвязывающего фрагмента, когда ADC проникает в клетку, которая экспрессирует антиген, на который целенаправленно воздействует антитело или антигенсвязывающий фрагмент ADC. В некоторых вариантах осуществления линкер представляет собой расщепляемый линкер.
[64] В некоторых вариантах осуществления линкер предусматривает расщепляемый пептидный фрагмент. В некоторых вариантах осуществления расщепляемый пептидный фрагмент расщепляется под действием фермента. В некоторых вариантах осуществления расщепляемый пептидный фрагмент или линкер предусматривают аминокислотное звено. В некоторых вариантах осуществления аминокислотное звено предусматривает валин-цитруллин ("Val-Cit" или "VC"). В некоторых других вариантах осуществления аминокислотное звено предусматривает валин-аланин ("Val-Ala" или "VA"). В некоторых других вариантах осуществления аминокислотное звено предусматривает глутаминовую кислоту-валин-цитруллин ("Glu-Val-Cit" или "EVC"). В некоторых других вариантах осуществления аминокислотное звено предусматривает аланин-аланин-аспарагин ("Ala-Ala-Asn" или "AAN").
[65] В некоторых вариантах осуществления линкер предусматривает расщепляемый глюкуронидный фрагмент. В некоторых вариантах осуществления расщепляемый глюкуронидный фрагмент расщепляется под действием фермента. В некоторых вариантах осуществления расщепляемый глюкуронидный фрагмент расщепляется под действием глюкуронидазы. В некоторых вариантах осуществления расщепляемый глюкуронидный фрагмент расщепляется под действием β-глюкуронидазы.
[66] В некоторых вариантах осуществления линкер предусматривает по меньшей мере одно спейсерное звено. В некоторых вариантах осуществления спейсерное звено или линкер предусматривают полиэтиленгликольный (PEG) фрагмент. В некоторых вариантах осуществления PEG-фрагмент предусматривает -(PEG)m-, и m составляет целое число от 1 до 10. В некоторых вариантах осуществления m составляет 2. В некоторых других вариантах осуществления спейсерное звено или линкер предусматривают алкильный фрагмент. В некоторых вариантах осуществления алкильный фрагмент предусматривает -(CH2)n-, и n составляет целое число от 1 до 10. В некоторых вариантах осуществления n составляет 2. В некоторых вариантах осуществления n составляет 5. В некоторых вариантах осуществления n составляет 6.
[67] В некоторых вариантах осуществления спейсерное звено прикрепляется к антителу или антигенсвязывающему фрагменту через малеимидный (Mal) фрагмент ("Mal-спейсерное звено"). В некоторых вариантах осуществления Mal-спейсерное звено реагирует с остатком цистеина на антителе или антигенсвязывающем фрагменте. В некоторых вариантах осуществления Mal-спейсерное звено соединяется с антителом или антигенсвязывающим фрагментом через остаток цистеина на антителе или антигенсвязывающем фрагменте.
[68] В некоторых вариантах осуществления линкер предусматривает Mal-спейсерное звено и расщепляемый пептидный фрагмент. В некоторых вариантах осуществления расщепляемый пептидный фрагмент предусматривает аминокислотное звено. В некоторых вариантах осуществления расщепляемый пептидный фрагмент или аминокислотное звено предусматривают Val-Cit. В некоторых вариантах осуществления расщепляемый пептидный фрагмент или аминокислотное звено предусматривают Val-Ala. В некоторых вариантах осуществления расщепляемый пептидный фрагмент или аминокислотное звено предусматривают Glu-Val-Cit. В некоторых вариантах осуществления расщепляемый пептидный фрагмент или аминокислотное звено предусматривают Ala-Ala-Asn. В некоторых вариантах осуществления Mal-спейсерное звено предусматривает алкильный фрагмент. В некоторых вариантах осуществления Mal-спейсерное звено предусматривает PEG-фрагмент. В некоторых вариантах осуществления Mal-спейсерное звено предусматривает малеимидокапроил (MC).
В некоторых вариантах осуществления Mal-спейсерное звено прикрепляет антитело или антигенсвязывающий фрагмент к расщепляемому фрагменту в линкере. В некоторых вариантах осуществления расщепляемый фрагмент в линкере предусматривает расщепляемый пептидный фрагмент. В некоторых вариантах осуществления расщепляемый пептидный фрагмент предусматривает аминокислотное звено. В некоторых вариантах осуществления расщепляемый пептидный фрагмент или аминокислотное звено предусматривают Val-Cit, Val-Ala, Glu-Val-Cit или Ala-Ala-Asn. В некоторых вариантах осуществления линкер предусматривает MC-Val-Cit. В некоторых вариантах осуществления линкер предусматривает MC-Val-Ala. В некоторых вариантах осуществления линкер предусматривает MC-Glu-Val-Cit. В некоторых вариантах осуществления линкер предусматривает MC-Ala-Ala-Asn. В некоторых вариантах осуществления Mal-спейсерное звено предусматривает алкильный фрагмент. В некоторых вариантах осуществления Mal-спейсерное звено предусматривает PEG-фрагмент. В некоторых вариантах осуществления Mal-спейсерное звено предусматривает малеимидокапроил (MC).
[69] В некоторых вариантах осуществления расщепляемый фрагмент в линкере непосредственно соединяется с модулятором сплайсинга, или спейсерное звено прикрепляет расщепляемый фрагмент в линкере к модулятору сплайсинга. В некоторых вариантах осуществления расщепление конъюгата высвобождает модулятор сплайсинга от антитела или антигенсвязывающего фрагмента и линкера. В некоторых вариантах осуществления спейсерное звено, прикрепляющее расщепляемый фрагмент в линкере к модулятору сплайсинга, является саморасщепляющимся.
[70] В некоторых вариантах осуществления спейсерное звено, прикрепляющее расщепляемый фрагмент в линкере к модулятору сплайсинга, предусматривает п-аминобензилоксикарбонил (pABC). В некоторых вариантах осуществления pABC прикрепляет расщепляемый фрагмент в линкере к модулятору сплайсинга. В некоторых вариантах осуществления расщепляемый фрагмент в линкере предусматривает расщепляемый пептидный фрагмент. В некоторых вариантах осуществления расщепляемый пептидный фрагмент предусматривает аминокислотное звено. В некоторых вариантах осуществления расщепляемый пептидный фрагмент или аминокислотное звено предусматривают Val-Cit, Val-Ala, Glu-Val-Cit или Ala-Ala-Asn. В некоторых вариантах осуществления линкер предусматривает Val-Cit-pABC. В некоторых других вариантах осуществления линкер предусматривает Val-Ala-pABC. В некоторых вариантах осуществления линкер предусматривает Glu-Val-Cit-pABC. В некоторых вариантах осуществления линкер предусматривает Ala-Ala-Asn-pABC.
[71] В некоторых вариантах осуществления спейсерное звено, прикрепляющее расщепляемый фрагмент в линкере к модулятору сплайсинга, предусматривает п-аминобензил (pAB). В некоторых вариантах осуществления pAB прикрепляет расщепляемый фрагмент в линкере к модулятору сплайсинга. В некоторых вариантах осуществления расщепляемый фрагмент в линкере предусматривает расщепляемый пептидный фрагмент. В некоторых вариантах осуществления расщепляемый пептидный фрагмент предусматривает аминокислотное звено. В некоторых вариантах осуществления расщепляемый пептидный фрагмент или аминокислотное звено предусматривают Val-Cit, Val-Ala, Glu-Val-Cit или Ala-Ala-Asn. В некоторых вариантах осуществления линкер предусматривает Val-Cit-pAB. В некоторых других вариантах осуществления линкер предусматривает Val-Ala-pAB. В некоторых других вариантах осуществления линкер предусматривает Glu-Val-Cit-pAB. В некоторых других вариантах осуществления линкер предусматривает Ala-Ala-Asn-pAB.
[72] В различных вариантах осуществления линкер представляет собой нерасщепляемый линкер. В некоторых вариантах осуществления модулятор сплайсинга высвобождается из ADC за счет разрушения антитела или антигенсвязывающего фрагмента. В некоторых вариантах осуществления линкер остается ковалентно связанным с по меньшей мере одной аминокислотой антитела и лекарственным средством после интернализации в клетку-мишень и разрушения в ней.
[73] В некоторых вариантах осуществления линкер представляет собой нерасщепляемый линкер, содержащий по меньшей мере одно спейсерное звено. В некоторых вариантах осуществления спейсерное звено или линкер предусматривают полиэтиленгликольный (PEG) фрагмент. В некоторых вариантах осуществления PEG-фрагмент предусматривает -(PEG)m-, и m составляет целое число от 1 до 10. В некоторых вариантах осуществления m составляет 2. В некоторых других вариантах осуществления спейсерное звено или линкер предусматривают алкильный фрагмент. В некоторых вариантах осуществления алкильный фрагмент предусматривает -(CH2)n- или -(CH2)n-O-(CH2)n, и n составляет целое число от 1 до 10. В некоторых вариантах осуществления n составляет 2. В некоторых вариантах осуществления n составляет 5. В некоторых вариантах осуществления n составляет 6.
[74] В некоторых вариантах осуществления спейсерное звено в нерасщепляемом линкере прикрепляется антителу или антигенсвязывающему фрагменту через малеимидный (Mal) фрагмент ("Mal-спейсерное звено"). В некоторых вариантах осуществления Mal-спейсерное звено реагирует с остатком цистеина на антителе или антигенсвязывающем фрагменте. В некоторых вариантах осуществления Mal-спейсерное звено соединяется с антителом или антигенсвязывающим фрагментом через остаток цистеина на антителе или антигенсвязывающем фрагменте. В некоторых вариантах осуществления Mal-спейсерное звено предусматривает алкильный фрагмент. В некоторых вариантах осуществления Mal-спейсерное звено предусматривает PEG-фрагмент. В некоторых вариантах осуществления линкер или Mal-спейсерное звено предусматривают малеимидокапроил (MC). В некоторых вариантах осуществления линкер или Mal-спейсерное звено предусматривают малеимидокапроил (MC) и по меньшей мере одно дополнительное спейсерное звено. В некоторых вариантах осуществления линкер или Mal-спейсерное звено предусматривают MC-(PEG)2. В некоторых вариантах осуществления линкер или Mal-спейсерное звено предусматривают MC-(PEG)2 и по меньшей мере одно дополнительное спейсерное звено. В некоторых вариантах осуществления линкер или Mal-спейсерное звено предусматривают Mal-Hex. В некоторых вариантах осуществления линкер или Mal-спейсерное звено предусматривают Mal-Hex и по меньшей мере одно дополнительное спейсерное звено. В некоторых вариантах осуществления линкер или Mal-спейсерное звено предусматривают Mal-Et. В некоторых вариантах осуществления линкер или Mal-спейсерное звено предусматривают Mal-Et и по меньшей мере одно дополнительное спейсерное звено. В некоторых вариантах осуществления линкер или Mal-спейсерное звено предусматривают Mal-Et-O-Et. В некоторых вариантах осуществления линкер или Mal-спейсерное звено предусматривают Mal-Et-O-Et и по меньшей мере одно дополнительное спейсерное звено. В некоторых вариантах осуществления Mal-спейсерное звено прикрепляет антитело или антигенсвязывающий фрагмент к модулятору сплайсинга.
[75] В различных вариантах осуществления соединения ADC могут быть представлены формулой (I):
Ab-(L-D)p (I),
где Ab представляет собой антитело или его антигенсвязывающий фрагмент, которые целенаправленно воздействуют на неопластическую клетку или другую связанную с опухолью мишень, такую как раковый антиген (например, любую из последовательностей антитела или связывающего домена, раскрытых в данном документе); D представляет собой любую малую молекулу, подходящую для лечения рака (например, модулятор сплайсинга, например, любой из модуляторов сплайсинга, раскрытых в данном документе); L представляет собой линкер, который ковалентно прикрепляет Ab к D (например, любой из линкеров, раскрытых в данном документе); и p составляет целое число от 1 до 15.
[76] В некоторых вариантах осуществления Ab выбран из любой из последовательностей антитела или связывающего домена, раскрытых в данном документе. В некоторых вариантах осуществления Ab представляет собой последовательность антитела или связывающего домена, которая целенаправленно воздействует на HER2 и/или неопластическую клетку, экспрессирующую HER2. В некоторых вариантах осуществления Ab представляет собой последовательность антитела или связывающего домена, которая целенаправленно воздействует на CD138 и/или неопластическую клетку, экспрессирующую CD138. В некоторых вариантах осуществления Ab представляет собой последовательность антитела или связывающего домена, которая целенаправленно воздействует на EPHA2 и/или неопластическую клетку, экспрессирующую EPHA2. В некоторых вариантах осуществления Ab представляет собой последовательность антитела или связывающего домена, которая целенаправленно воздействует на MSLN и/или неопластическую клетку, экспрессирующую MSLN. В некоторых вариантах осуществления Ab представляет собой последовательность антитела или связывающего домена, которая целенаправленно воздействует на FOLH1 и/или неопластическую клетку, экспрессирующую FOLH1. В некоторых вариантах осуществления Ab представляет собой последовательность антитела или связывающего домена, которая целенаправленно воздействует на CDH6 и/или неопластическую клетку, экспрессирующую CDH6. В некоторых вариантах осуществления Ab представляет собой последовательность антитела или связывающего домена, которая целенаправленно воздействует на CEACAM5 и/или неопластическую клетку, экспрессирующую CEACAM5. В некоторых вариантах осуществления Ab представляет собой последовательность антитела или связывающего домена, которая целенаправленно воздействует на CFC1B и/или неопластическую клетку, экспрессирующую CFC1B. В некоторых вариантах осуществления Ab представляет собой последовательность антитела или связывающего домена, которая целенаправленно воздействует на ENPP3 и/или неопластическую клетку, экспрессирующую ENPP3. В некоторых вариантах осуществления Ab представляет собой последовательность антитела или связывающего домена, которая целенаправленно воздействует на FOLR1 и/или неопластическую клетку, экспрессирующую FOLR1. В некоторых вариантах осуществления Ab представляет собой последовательность антитела или связывающего домена, которая целенаправленно воздействует на HAVCR1 и/или неопластическую клетку, экспрессирующую HAVCR1. В некоторых вариантах осуществления Ab представляет собой последовательность антитела или связывающего домена, которая целенаправленно воздействует на KIT и/или неопластическую клетку, экспрессирующую KIT. В некоторых вариантах осуществления Ab представляет собой последовательность антитела или связывающего домена, которая целенаправленно воздействует на MET и/или неопластическую клетку, экспрессирующую MET. В некоторых вариантах осуществления Ab представляет собой последовательность антитела или связывающего домена, которая целенаправленно воздействует на MUC16 и/или неопластическую клетку, экспрессирующую MUC16. В некоторых вариантах осуществления Ab представляет собой последовательность антитела или связывающего домена, которая целенаправленно воздействует на SLC39A6 и/или неопластическую клетку, экспрессирующую SLC39A6. В некоторых вариантах осуществления Ab представляет собой последовательность антитела или связывающего домена, которая целенаправленно воздействует на SLC44A4 и/или неопластическую клетку, экспрессирующую SLC44A4. В некоторых вариантах осуществления Ab представляет собой последовательность антитела или связывающего домена, которая целенаправленно воздействует на STEAP1 и/или неопластическую клетку, экспрессирующую STEAP1. В некоторых вариантах осуществления Ab представляет собой последовательность антитела или связывающего домена, которая целенаправленно воздействует на другой раковый антиген.
[77] В некоторых вариантах осуществления D представляет собой модулятор сплайсинга. В некоторых вариантах осуществления D выбран из любого из модуляторов сплайсинга, раскрытых в данном документе. В некоторых вариантах осуществления D представляет собой модулятор сплайсинга, выбранный из D2, D1, D4, D8, D10, D11 (E7107), D20, D21, D22, D12, D25, D9, D18, D19, D13, D15, D14, D16, D17, D26, и D33 или любого их производного. В некоторых вариантах осуществления D представляет собой модулятор сплайсинга, выбранный из D4, D12, D15, D8, D9, D10, D13, D18, D19, D20, D21, D22, D25, и D33 или любого их производного. В некоторых вариантах осуществления D представляет собой модулятор сплайсинга, предусматривающий D2 или любое его производное. В некоторых вариантах осуществления D представляет собой модулятор сплайсинга, предусматривающий D1 или любое его производное.
[78] В некоторых вариантах осуществления L выбран из любого из линкеров, раскрытых в данном документе, или любой комбинации линкерных компонентов, раскрытых в данном документе. В некоторых вариантах осуществления L представляет собой линкер, предусматривающий MC-Val-Cit-pABC, Mal-(PEG)2-CO, MC-Val-Ala-pAB, MC-Val-Ala-pABC, MC-Val-Cit-pAB, Mal-Hex, Mal-Et или Mal-Et-O-Et. В некоторых вариантах осуществления линкер также может предусматривать одно или несколько дополнительных спейсерных звеньев. В некоторых вариантах осуществления L представляет собой линкер ADL1, ADL2, ADL5, ADL6, ADL7, ADL10, ADL12, ADL13, ADL14, ADL15, ADL21, ADL22, или ADL23. В некоторых вариантах осуществления L представляет собой линкер ADL1, ADL2, ADL5, ADL6, ADL7, ADL12, ADL13, ADL14, ADL21, ADL23, или ADL15. В некоторых вариантах осуществления L представляет собой линкер ADL12, ADL14 или ADL15. В некоторых вариантах осуществления линкер ADL1, ADL2, ADL5, ADL6, ADL7, ADL12, ADL13, ADL14, ADL21, ADL23, или ADL15 также может предусматривать одно или несколько дополнительных спейсерных звеньев. В некоторых вариантах осуществления L представляет собой линкер ADL1 и может необязательно предусматривать одно или несколько дополнительных спейсерных звеньев. В некоторых вариантах осуществления L представляет собой линкер ADL2 и может необязательно предусматривать одно или несколько дополнительных спейсерных звеньев. В некоторых вариантах осуществления L представляет собой линкер ADL5 и может необязательно предусматривать одно или несколько дополнительных спейсерных звеньев. В некоторых вариантах осуществления L представляет собой линкер ADL6 и может необязательно предусматривать одно или несколько дополнительных спейсерных звеньев. В некоторых вариантах осуществления L представляет собой линкер ADL7 и может необязательно предусматривать одно или несколько дополнительных спейсерных звеньев. В некоторых вариантах осуществления L представляет собой линкер ADL12 и может необязательно предусматривать одно или несколько дополнительных спейсерных звеньев. В некоторых вариантах осуществления L представляет собой линкер ADL14 и может необязательно предусматривать одно или несколько дополнительных спейсерных звеньев. В некоторых вариантах осуществления L представляет собой линкер ADL15 и может необязательно предусматривать одно или несколько дополнительных спейсерных звеньев. В различных вариантах осуществления ADC, описанных в данном документе, p составляет от 1 до 10. В различных вариантах осуществления p составляет от 2 до 8. В различных вариантах осуществления p составляет от 4 до 8. В некоторых вариантах осуществления p составляет 4. В некоторых вариантах осуществления p составляет 8.
[79] В некоторых вариантах осуществления L-D из формулы (I) представляют собой ADL1-D1. В некоторых вариантах осуществления L-D из формулы (I) представляют собой ADL6-D1. В некоторых вариантах осуществления L-D из формулы (I) представляют собой ADL5-D2. В некоторых вариантах осуществления L-D из формулы (I) представляют собой ADL1-D18. В некоторых вариантах осуществления L-D из формулы (I) представляют собой ADL5-D19. В некоторых вариантах осуществления L-D из формулы (I) представляют собой ADL14-D1. В некоторых вариантах осуществления L-D из формулы (I) представляют собой ADL12-D1. В некоторых вариантах осуществления L-D из формулы (I) представляют собой ADL15-D1. В некоторых вариантах осуществления L-D из формулы (I) представляют собой ADL12-D20. В некоторых вариантах осуществления L-D из формулы (I) представляют собой ADL10-D1. В некоторых вариантах осуществления L-D из формулы (I) представляют собой ADL12-D2. В некоторых вариантах осуществления L-D из формулы (I) представляют собой ADL15-D2. В некоторых вариантах осуществления L-D из формулы (I) представляют собой ADL12-D21. В некоторых вариантах осуществления L-D из формулы (I) представляют собой ADL6-D9. В некоторых вариантах осуществления L-D из формулы (I) представляют собой ADL1-D4. В некоторых вариантах осуществления L-D из формулы (I) представляют собой ADL1-D3. В некоторых вариантах осуществления L-D из формулы (I) представляют собой ADL1-D12. В некоторых вариантах осуществления L-D из формулы (I) представляют собой ADL1-D7. В некоторых вариантах осуществления L-D из формулы (I) представляют собой ADL1-D6. В некоторых вариантах осуществления L-D из формулы (I) представляют собой ADL1-D5. В некоторых вариантах осуществления L-D из формулы (I) представляют собой ADL22-D4. В некоторых вариантах осуществления L-D из формулы (I) представляют собой ADL5-D10. В некоторых вариантах осуществления L-D из формулы (I) представляют собой ADL5-D11. В некоторых вариантах осуществления L-D из формулы (I) представляют собой ADL1-D13. В некоторых вариантах осуществления L-D из формулы (I) представляют собой ADL1-D8. В некоторых вариантах осуществления L-D из формулы (I) представляют собой ADL1-D22. В некоторых вариантах осуществления L-D из формулы (I) представляют собой ADL5-D25. В некоторых вариантах осуществления L-D из формулы (I) представляют собой ADL12-D22. В некоторых вариантах осуществления L-D из формулы (I) представляют собой ADL5-D15. В некоторых вариантах осуществления L-D из формулы (I) представляют собой ADL1-D14. В некоторых вариантах осуществления L-D из формулы (I) представляют собой ADL5-D26. В некоторых вариантах осуществления L-D из формулы (I) представляют собой ADL1-D16. В некоторых вариантах осуществления L-D из формулы (I) представляют собой ADL5-D17. В некоторых вариантах осуществления L-D из формулы (I) представляют собой ADL1-D33. В некоторых вариантах осуществления L-D из формулы (I) представляют собой ADL1-D28. В некоторых вариантах осуществления L-D из формулы (I) представляют собой ADL1-D31. В некоторых вариантах осуществления L-D из формулы (I) представляют собой ADL1-D29. В некоторых вариантах осуществления L-D из формулы (I) представляют собой ADL1-D35. В некоторых вариантах осуществления L-D из формулы (I) представляют собой ADL5-D32. В некоторых вариантах осуществления L-D из формулы (I) представляют собой ADL5-D27. В некоторых вариантах осуществления L-D из формулы (I) представляют собой ADL12-D35. В некоторых вариантах осуществления L-D из формулы (I) представляют собой ADL12-D28. В некоторых вариантах осуществления L-D из формулы (I) представляют собой ADL1-D23. В некоторых вариантах осуществления L-D из формулы (I) представляют собой ADL1-D24.
[80] В некоторых вариантах осуществления представлен пул ADC, в котором происходит произвольная конъюгация, и среднее значение p в пуле составляет от приблизительно 2 до приблизительно 8. В некоторых вариантах осуществления представлен пул ADC, в котором происходит произвольная конъюгация, и среднее значение p в пуле составляет от приблизительно 4 до приблизительно 8. В некоторых вариантах осуществления представлен пул ADC, в котором происходит произвольная конъюгация, и среднее значение p в пуле составляет приблизительно 4. В некоторых вариантах осуществления представлен пул ADC, в котором происходит произвольная конъюгация, и среднее значение p в пуле составляет приблизительно 8. В данном документе представлены композиции (например, фармацевтические композиции), содержащие множественные копии любого из описанных ADC, где средняя нагрузка лекарственным средством (среднее значение p) ADC в композиции составляет от приблизительно 3,5 до приблизительно 5,5 (например, приблизительно 4) или от приблизительно 7 до приблизительно 9 (например, приблизительно 8).
[81] В некоторых вариантах осуществления антитело или антигенсвязывающий фрагмент (Ab) из ADC целенаправленно воздействуют на неопластическую клетку, полученную из гематологического злокачественного новообразования или солидной опухоли. В некоторых вариантах осуществления антитело или антигенсвязывающий фрагмент целенаправленно воздействуют на неопластическую клетку, полученную из гематологического злокачественного новообразования. В некоторых вариантах осуществления гематологическое злокачественное новообразование выбрано из B-клеточного злокачественного новообразования, лейкоза (например, острого миелоидного лейкоза), лимфомы и миеломы (например, множественной миеломы). В некоторых вариантах осуществления гематологическое злокачественное новообразование выбрано из острого миелоидного лейкоза и множественной миеломы. В некоторых вариантах осуществления антитело или антигенсвязывающий фрагмент целенаправленно воздействуют на неопластическую клетку, полученную из солидной опухоли. В некоторых вариантах осуществления солидная опухоль выбрана из рака молочной железы (например, HER2-положительного рака молочной железы), рака желудка (например, аденокарциномы желудка), рака предстательной железы, рака яичника, рака легкого (например, аденокарциномы легкого), рака матки (например, серозной карциномы эндометрия матки), карциномы слюнных протоков, меланомы, рака толстой кишки, рака шейки матки, рака поджелудочной железы, рака почки, колоректального рака и рака пищевода. В некоторых вариантах осуществления солидная опухоль выбрана из HER2-положительного рака молочной железы, аденокарциномы желудка, рака предстательной железы и остеосаркомы.
[82] В различных вариантах осуществления антитело или антигенсвязывающий фрагмент (Ab) из ADC представляют собой антитело к HER2 или его антигенсвязывающий фрагмент. В некоторых вариантах осуществления антитело или антигенсвязывающий фрагмент связываются с HER2 и целенаправленно воздействуют на неопластические клетки, экспрессирующие HER2 (т. е. ADC целенаправленно воздействует на неопластические клетки, экспрессирующие HER2). В некоторых вариантах осуществления антитело или антигенсвязывающий фрагмент из ADC представляют собой интернализующееся антитело к HER2 или его интернализующийся антигенсвязывающий фрагмент.
[83] В некоторых вариантах осуществления антитело к HER2 или антигенсвязывающий фрагмент содержат три определяющие комплементарность области тяжелой цепи (HCDR1, HCDR2 и HCDR3), содержащие аминокислотные последовательности под SEQ ID NO:1 (HCDR1), SEQ ID NO:2 (HCDR2) и SEQ ID NO:3 (HCDR3); и три определяющие комплементарность области легкой цепи (LCDR1, LCDR2 и LCDR3), содержащие аминокислотные последовательности под SEQ ID NO:4 (LCDR1), SEQ ID NO:5 (LCDR2) и SEQ ID NO:6 (LCDR3). В некоторых вариантах осуществления антитело к HER2 или антигенсвязывающий фрагмент представляют собой интернализующееся антитело или интернализующийся антигенсвязывающий фрагмент. В некоторых вариантах осуществления антитело к HER2 или антигенсвязывающий фрагмент содержат каркасные последовательности человека. В некоторых вариантах осуществления антитело к HER2 или антигенсвязывающий фрагмент содержат вариабельную область тяжелой цепи, содержащую аминокислотную последовательность под SEQ ID NO:19, и вариабельную область легкой цепи, содержащую аминокислотную последовательность под SEQ ID NO:20. В некоторых вариантах осуществления антитело к HER2 или антигенсвязывающий фрагмент содержат константную область тяжелой цепи IgG человека. В некоторых вариантах осуществления антитело к HER2 или антигенсвязывающий фрагмент содержат константную область тяжелой цепи IgG1 человека. В некоторых вариантах осуществления антитело к HER2 или антигенсвязывающий фрагмент содержат константную область легкой каппа- или лямбда-цепи Ig человека. В некоторых вариантах осуществления антитело к HER2 или антигенсвязывающий участок конкурируют за связывание и/или связываются с тем же эпитопом, что и антитело, содержащее вариабельный домен тяжелой цепи под SEQ ID NO:19, и вариабельный домен легкой цепи под SEQ ID NO:20.
[84] В различных вариантах осуществления антитело или антигенсвязывающий фрагмент (Ab) из ADC представляют собой антитело к CD138 или его антигенсвязывающий фрагмент. В некоторых вариантах осуществления антитело или антигенсвязывающий фрагмент связываются с CD138 и целенаправленно воздействуют на неопластические клетки, экспрессирующие CD138 (т. е. ADC целенаправленно воздействует на неопластические клетки, экспрессирующие CD138). В некоторых вариантах осуществления антитело или антигенсвязывающий фрагмент из ADC представляют собой интернализующееся антитело к CD138 или его интернализующийся антигенсвязывающий фрагмент.
[85] В некоторых вариантах осуществления антитело к CD138 или антигенсвязывающий фрагмент содержат три определяющие комплементарность области тяжелой цепи (HCDR1, HCDR2 и HCDR3), содержащие аминокислотные последовательности под SEQ ID NO:7 (HCDR1), SEQ ID NO:8 (HCDR2) и SEQ ID NO:9 (HCDR3); и три определяющие комплементарность области легкой цепи (LCDR1, LCDR2 и LCDR3), содержащие аминокислотные последовательности под SEQ ID NO:10 (LCDR1), SEQ ID NO:11 (LCDR2) и SEQ ID NO:12 (LCDR3). В некоторых вариантах осуществления антитело к CD138 или антигенсвязывающий фрагмент представляют собой интернализующееся антитело или интернализующийся антигенсвязывающий фрагмент. В некоторых вариантах осуществления антитело к CD138 или антигенсвязывающий фрагмент содержат каркасные последовательности человека. В некоторых вариантах осуществления антитело к CD138 или антигенсвязывающий фрагмент содержат вариабельную область тяжелой цепи, содержащую аминокислотную последовательность под SEQ ID NO:21, и вариабельную область легкой цепи, содержащую аминокислотную последовательность под SEQ ID NO:22. В некоторых вариантах осуществления антитело к CD138 или антигенсвязывающий фрагмент содержат константную область тяжелой цепи IgG2a мыши. В некоторых вариантах осуществления антитело к CD138 или антигенсвязывающий фрагмент содержат константную область легкой каппа- цепи Ig мыши. В некоторых вариантах осуществления антитело к CD138 или антигенсвязывающий фрагмент содержат константную область тяжелой цепи IgG человека. В некоторых вариантах осуществления антитело к CD138 или антигенсвязывающий фрагмент содержат константную область тяжелой цепи IgG2a человека. В некоторых вариантах осуществления антитело к CD138 или антигенсвязывающий фрагмент содержат константную область легкой каппа- или лямбда-цепи Ig человека. В некоторых вариантах осуществления антитело к CD138 или антигенсвязывающий участок конкурируют за связывание и/или связываются с тем же эпитопом, что и антитело, содержащее вариабельный домен тяжелой цепи под SEQ ID NO:21, и вариабельный домен легкой цепи под SEQ ID NO:22.
[86] В различных вариантах осуществления антитело или антигенсвязывающий фрагмент (Ab) из ADC представляют собой антитело к EPHA2 или его антигенсвязывающий фрагмент. В некоторых вариантах осуществления антитело или антигенсвязывающий фрагмент связываются с EPHA2 и целенаправленно воздействуют на неопластические клетки, экспрессирующие EPHA2 (т. е. ADC целенаправленно воздействует на неопластические клетки, экспрессирующие EPHA2). В некоторых вариантах осуществления антитело или антигенсвязывающий фрагмент из ADC представляют собой интернализующееся антитело к EPHA2 или его интернализующийся антигенсвязывающий фрагмент.
[87] В некоторых вариантах осуществления антитело к EPHA2 или антигенсвязывающий фрагмент содержат три определяющие комплементарность области тяжелой цепи (HCDR1, HCDR2 и HCDR3), содержащие аминокислотные последовательности под SEQ ID NO:13 (HCDR1), SEQ ID NO:14 (HCDR2) и SEQ ID NO:15 (HCDR3); и три определяющие комплементарность области легкой цепи (LCDR1, LCDR2 и LCDR3), содержащие аминокислотные последовательности под SEQ ID NO:16 (LCDR1), SEQ ID NO:17 (LCDR2) и SEQ ID NO:18 (LCDR3). В некоторых вариантах осуществления антитело к EPHA2 или антигенсвязывающий фрагмент представляют собой интернализующееся антитело или интернализующийся антигенсвязывающий фрагмент. В некоторых вариантах осуществления антитело к EPHA2 или антигенсвязывающий фрагмент содержат каркасные последовательности человека. В некоторых вариантах осуществления антитело к EPHA2 или антигенсвязывающий фрагмент содержат вариабельную область тяжелой цепи, содержащую аминокислотную последовательность под SEQ ID NO:23, и вариабельную область легкой цепи, содержащую аминокислотную последовательность под SEQ ID NO:24. В некоторых вариантах осуществления антитело к EPHA2 или антигенсвязывающий фрагмент содержат константную область тяжелой цепи IgG человека. В некоторых вариантах осуществления антитело к EPHA2 или антигенсвязывающий фрагмент содержат константную область тяжелой цепи IgG1 человека. В некоторых вариантах осуществления антитело к EPHA2 или антигенсвязывающий фрагмент содержат константную область легкой каппа- или лямбда-цепи Ig человека. В некоторых вариантах осуществления антитело к EPHA2 или антигенсвязывающий участок конкурируют за связывание и/или связываются с тем же эпитопом, что и антитело, содержащее вариабельный домен тяжелой цепи под SEQ ID NO:23, и вариабельный домен легкой цепи под SEQ ID NO:24.
[88] В различных вариантах осуществления в данном документе также представлены соединения, содержащие линкер-лекарственное средство, определяемые общей формулой: L-D, где L=линкерный фрагмент, и D=фрагмент-лекарственное средство (например, фрагмент-лекарственное средство, представляющее собой модулятор сплайсинга). В различных вариантах осуществления соединения, представляющие собой линкер-лекарственное средство (L-D), раскрытые в данном документе, могут прикрепляться к антителу или антигенсвязывающему фрагменту и/или являются подходящими для применения в ADC, раскрытых в данном документе, например, в ADC формулы (I).
[89] В различных вариантах осуществления соединения, представляющие собой линкер-лекарственное средство (L-D), раскрытые в данном документе, предусматривают структуру линкер-лекарственное средство в соответствии с формулой (III). В различных вариантах осуществления настоящего изобретения представлено соединение, представляющее собой линкер-лекарственное средство (L-D), формулы (III):
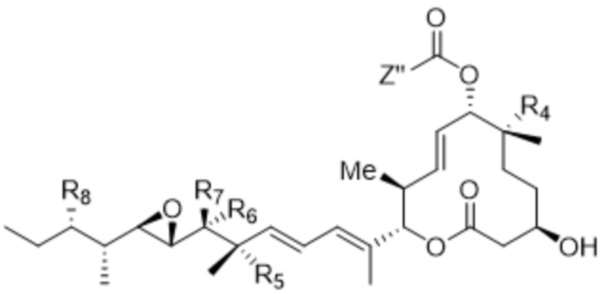 (III),
(III),
или его фармацевтически приемлемая соль, где:
R1 отсутствует или выбран из водорода, C1-C6алкильных групп, C1-C6алкилалкоксигрупп, C1-C6алкиламиногрупп, групп C1-C6алкилкарбоновой кислоты, C1-C6алкилгидроксигрупп, C3-C8циклоалкильных групп, бензильных групп, C3-C8гетероциклильных групп, групп -O-C(=O)-(C1-C6алкил) и -CD3;
R2 отсутствует или представляет собой линкер;
R3 выбран из водорода, C1-C6алкильных групп, C1-C6алкилалкоксигрупп, C1-C6алкиламиногрупп, групп C1-C6алкилкарбоновой кислоты, C1-C6алкилгидроксигрупп, C3-C8циклоалкильных групп, бензильных групп, C3-C8гетероциклильных групп и групп -O-C(=O)-(C1-C6алкил); и
каждый из R4, R5 и R8 независимо выбран из водорода, гидроксильных групп, групп -O-(C1-C6алкил), групп -O-C(=O)-(C1-C6алкил) и C1-C6алкильных групп;
каждый из R6 и R7 независимо выбран из водорода, -O-R17, -O-C(=O)-R17, -O-C(=O)-NR15R16, C1-C6алкильных групп, -NR15R16 и линкера;
каждый из R15 и R16 независимо выбран из водорода, R17, -C(=O)-R17 и
-C(=O)-O-R17;
R17 выбран из водорода, C1-C6алкильных групп, C3-C8циклоалкильных групп, бензильных групп и C3-C8гетероциклильных групп; и
Z'' выбран из 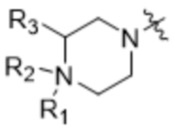 ,
, 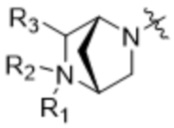 ,
, 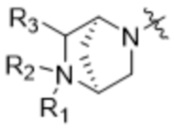 ,
, 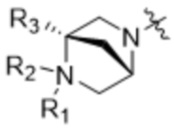 и
и 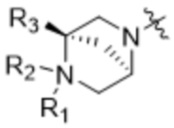 ;
;
где каждый из R1, R2, R3, R4, R5, R6, R7, R8, R15, R16, и R17 независимо замещен 0-3 группами, независимо выбранными из атомов галогена, гидроксильных групп, C1-C6алкильных групп, групп -O-(C1-C6алкил), -NR15R16, C3-C8циклоалкильных групп, C1-C6алкилгидроксигрупп, C1-C6алкилалкоксигрупп, бензильных групп и C3-C8гетероциклильных групп;
где по меньшей мере один из R6 и R7 представляет собой водород; и
где, если R2 представляет собой линкер, то ни R6, ни R7 не представляют собой линкер, и, если R6 или R7 представляют собой линкер, то R2 отсутствует.
[90] В различных других вариантах осуществления соединения, представляющие собой линкер-лекарственное средство (L-D), раскрытые в данном документе, предусматривают структуру линкер-лекарственное средство в соответствии с формулой (V). В различных вариантах осуществления настоящего изобретения представлено соединение, представляющее собой линкер-лекарственное средство (L-D), формулы (V):
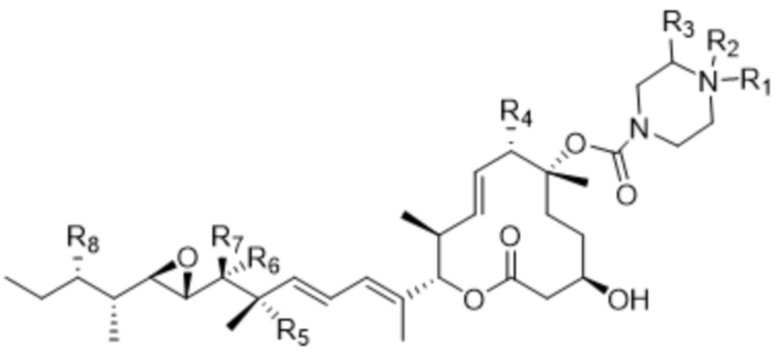 (V),
(V),
или его фармацевтически приемлемая соль, где:
R1 отсутствует или выбран из водорода, C1-C6алкильных групп, C1-C6алкилалкоксигрупп, C1-C6алкиламиногрупп, групп C1-C6алкилкарбоновой кислоты, C1-C6алкилгидроксигрупп, C3-C8циклоалкильных групп, бензильных групп, C3-C8гетероциклильных групп, групп -O-C(=O)-(C1-C6алкил) и -CD3;
R2 отсутствует или представляет собой линкер;
R3 выбран из водорода, C1-C6алкильных групп, C1-C6алкилалкоксигрупп, C1-C6алкиламиногрупп, групп C1-C6алкилкарбоновой кислоты, C1-C6алкилгидроксигрупп, C3-C8циклоалкильных групп, бензильных групп, C3-C8гетероциклильных групп и групп -O-C(=O)-(C1-C6алкил); и
каждый из R4, R5 и R8 независимо выбран из водорода, гидроксильных групп, групп -O-(C1-C6алкил), групп -O-C(=O)-(C1-C6алкил) и C1-C6алкильных групп;
каждый из R6 и R7 независимо выбран из водорода, -O-R17, -O-C(=O)-R17, -O-C(=O)-NR15R16, C1-C6алкильных групп, -NR15R16 и линкера;
каждый из R15 и R16 независимо выбран из водорода, R17, -C(=O)-R17 и -C(=O)-O-R17; и
R17 выбран из водорода, C1-C6алкильных групп, C3-C8циклоалкильных групп, бензильных групп и C3-C8гетероциклильных групп;
где каждый из R1, R2, R3, R4, R5, R6, R7, R8, R15, R16, и R17 независимо замещен 0-3 группами, независимо выбранными из атомов галогена, гидроксильных групп, C1-C6алкильных групп, групп -O-(C1-C6алкил), -NR15R16, C3-C8циклоалкильных групп, C1-C6алкилгидроксигрупп, C1-C6алкилалкоксигрупп, бензильных групп и C3-C8гетероциклильных групп;
где по меньшей мере один из R6 и R7 представляет собой водород; и
где, если R2 представляет собой линкер, то ни R6, ни R7 не представляют собой линкер, и, если R6 или R7 представляют собой линкер, то R2 отсутствует.
[91] В различных других вариантах осуществления соединения, представляющие собой линкер-лекарственное средство (L-D), раскрытые в данном документе, предусматривают структуру линкер-лекарственное средство в соответствии с формулой (VII). В различных вариантах осуществления настоящего изобретения представлено соединение, представляющее собой линкер-лекарственное средство (L-D), формулы (VII):
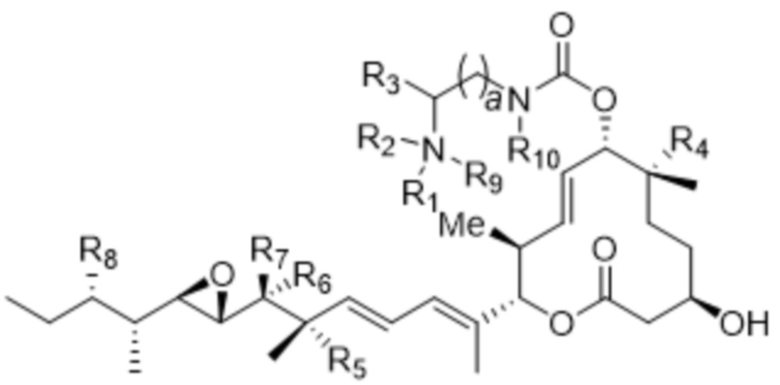 (VII),
(VII),
или его фармацевтически приемлемая соль, где:
каждый из R1 и R9 независимо отсутствует или выбран из водорода, C1-C6алкильных групп, C1-C6алкилалкоксигрупп, C1-C6алкиламиногрупп, групп C1-C6алкилкарбоновой кислоты, C1-C6алкилгидроксигрупп, C3-C8циклоалкильных групп, бензильных групп, C3-C8гетероциклильных групп, групп -O-C(=O)-(C1-C6алкил) и -CD3;
R2 отсутствует или представляет собой линкер;
R3 выбран из водорода, C1-C6алкильных групп, C1-C6алкилалкоксигрупп, C1-C6алкиламиногрупп, групп C1-C6алкилкарбоновой кислоты, C1-C6алкилгидроксигрупп, C3-C8циклоалкильных групп, бензильных групп, C3-C8гетероциклильных групп и групп -O-C(=O)-(C1-C6алкил);
каждый из R4, R5 и R8 независимо выбран из водорода, гидроксильных групп, групп -O-(C1-C6алкил), групп -O-C(=O)-(C1-C6алкил) и C1-C6алкильных групп;
каждый из R6 и R7 независимо выбран из водорода, -O-R17, -O-C(=O)-R17, -O-C(=O)-NR15R16, C1-C6алкильных групп, -NR15R16 и линкера;
R10 выбран из водорода, C1-C6алкильных групп, групп -C(=O)-(C1-C6алкил) и -CD3;
каждый из R15 и R16 независимо выбран из водорода, R17, -C(=O)-R17 и
-C(=O)-O-R17;
R17 выбран из водорода, C1-C6алкильных групп, C3-C8циклоалкильных групп, бензильных групп и C3-C8гетероциклильных групп; и
a составляет 1, 2, 3, 4, 5, 6, 7, 8, 9, или 10;
где каждый из R1, R2, R3, R4, R5, R6, R7, R8, R9, R10, R15, R16, и R17 независимо замещен 0-3 группами, независимо выбранными из атомов галогена, гидроксильных групп, C1-C6алкильных групп, групп -O-(C1-C6алкил), -NR15R16, C3-C8циклоалкильных групп, C1-C6алкилгидроксигрупп, C1-C6алкилалкоксигрупп, бензильных групп и C3-C8гетероциклильных групп;
где по меньшей мере один из R6 и R7 представляет собой водород;
где, если R2 представляет собой линкер, то ни R6, ни R7 не представляют собой линкер, и если R6 или R7 представляют собой линкер, то R2 отсутствует; и
где оба R1 и R9 не могут отсутствовать.
[92] В различных других вариантах осуществления соединения, представляющие собой линкер-лекарственное средство (L-D), раскрытые в данном документе, предусматривают структуру линкер-лекарственное средство в соответствии с формулой (IX). В различных вариантах осуществления настоящего изобретения представлено соединение, представляющее собой линкер-лекарственное средство (L-D), формулы (IX):
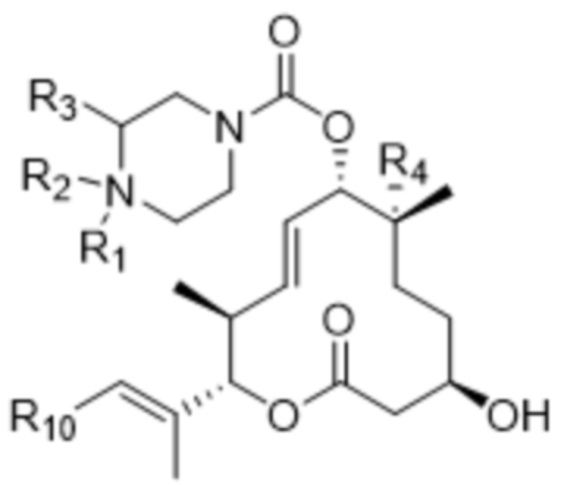 (IX),
(IX),
или его фармацевтически приемлемая соль, где:
R1 отсутствует или выбран из водорода, C1-C6алкильных групп, C1-C6алкилалкоксигрупп, C1-C6алкиламиногрупп, групп C1-C6алкилкарбоновой кислоты, C1-C6алкилгидроксигрупп, C3-C8циклоалкильных групп, бензильных групп, C3-C8гетероциклильных групп, групп -O-C(=O)-(C1-C6алкил) и -CD3;
R2 представляет собой линкер;
R3 выбран из водорода, C1-C6алкильных групп, C1-C6алкилалкоксигрупп, C1-C6алкиламиногрупп, групп C1-C6алкилкарбоновой кислоты, C1-C6алкилгидроксигрупп, C3-C8циклоалкильных групп, бензильных групп, C3-C8гетероциклильных групп и групп -O-C(=O)-(C1-C6алкил);
R4 выбран из водорода, гидроксильных групп, групп -O-(C1-C6алкил), групп -O-C(=O)-(C1-C6алкил) и C1-C6алкильных групп;
R10 выбран из 3-10-членных карбоциклов и 3-10-членных гетероциклов, каждый из которых замещен 0-3 Ra, где каждый Ra независимо выбран из атомов галогена, C1-C6алкильных групп, -O-(C1-C6)алкильных групп, C1-C6алкилалкоксигрупп, C1-C6алкилгидроксигрупп, -S(=O)w-(4-7-членные гетероциклы), 4-7-членных карбоциклов и 4-7-членных гетероциклов;
каждый из R15 и R16 независимо выбран из водорода, R17, -C(=O)-R17 и -C(=O)-O-R17; и
R17 выбран из водорода, C1-C6алкильных групп, C3-C8циклоалкильных групп, бензильных групп и C3-C8гетероциклильных групп;
где каждый из R1, R2, R3, R4, R10, R15, R16 и R17 независимо замещен 0-3 группами, независимо выбранными из атомов галогена, гидроксильных групп, C1-C6алкильных групп, групп -O-(C1-C6алкил), -NR15R16, C3-C8циклоалкильных групп, C1-C6алкилгидроксигрупп, C1-C6алкилалкоксигрупп, бензильных групп и C3-C8гетероциклильных групп; и
где каждый Ra независимо замещен 0-3 группами, независимо выбранными из атомов галогена, гидроксильных групп, -NR15R16, C1-C6алкильных групп, групп -(C=O)-(C1-C6алкил), групп -(C=O)-(C1-C6алкил)-(C3-C10гетероциклил) и групп C1-C6алкилкарбоновой кислоты, каждая из которых замещена 0, 1 или 2 группами, независимо выбранными из атомов галогена, гидроксильных групп, -NR15R16 и C1-C3алкильных групп; и
w составляет 0, 1 или 2.
[93] Также, в различных вариантах осуществления в данном документе представлены пути терапевтического применения описанных соединений ADC и композиций на их основе, например, при лечении неопластического нарушения, например рака. В определенных аспектах настоящего изобретения представлены способы лечения неопластического нарушения, например рака, который экспрессирует антиген, на который целенаправленно воздействует антитело или антигенсвязывающий фрагмент из ADC, такой как HER2, CD138, EPHA2, MSLN, FOLH1, CDH6, CEACAM5, CFC1B, ENPP3, FOLR1, HAVCR1, KIT, MET, MUC16, SLC39A6, SLC44A4, или STEAP1.
[94] В определенных аспектах настоящего изобретения представлены способы лечения субъекта, у которого имеется неопластическое нарушение или подозрение на его наличие, путем введения субъекту терапевтически эффективного количества любого из описанных ADC или композиций на их основе и/или применения соответствующей схемы лечения. В некоторых вариантах осуществления неопластическое нарушение представляет собой гематологическое злокачественное новообразование или солидную опухоль. В некоторых вариантах осуществления неопластическое нарушение представляет собой гематологическое злокачественное новообразование. В некоторых вариантах осуществления гематологическое злокачественное новообразование выбрано из B-клеточного злокачественного новообразования, лейкоза, лимфомы и миеломы. В некоторых вариантах осуществления гематологическое злокачественное новообразование выбрано из острого миелоидного лейкоза и множественной миеломы. В некоторых вариантах осуществления неопластическое нарушение представляет собой солидную опухоль. В некоторых вариантах осуществления солидная опухоль выбрана из рака молочной железы (например, HER2-положительного рака молочной железы), рака желудка (например, аденокарциномы желудка), рака предстательной железы, рака яичника, рака легкого (например, аденокарциномы легкого), рака матки (например, серозной карциномы эндометрия матки), карциномы слюнных протоков, меланомы, рака толстой кишки, рака шейки матки, рака поджелудочной железы, рака почки, колоректального рака и рака пищевода. В некоторых вариантах осуществления солидная опухоль выбрана из HER2-положительного рака молочной железы, аденокарциномы желудка, рака предстательной железы и остеосаркомы.
[95] В некоторых вариантах осуществления лечение с помощью конъюгата антитела и лекарственного средства или композиции индуцирует неспецифическое уничтожение неопластических клеток, которые не экспрессируют антиген-мишень, но являются смежными с неопластическими клетками, которые экспрессируют антиген-мишень. В некоторых вариантах осуществления у субъекта имеется одна или несколько неопластических клеток, которые экспрессируют антиген-мишень.
[96] В некоторых вариантах осуществления антиген-мишень представляет собой HER2. В некоторых вариантах осуществления одна или несколько неопластических клеток получены из рака молочной железы, рака яичника, рака желудка, рака легкого (например, аденокарциномы легкого), рака матки (например, серозной карциномы эндометрия матки), остеосаркомы или карциномы слюнных протоков, экспрессирующих HER2. В некоторых вариантах осуществления субъект характеризуется невосприимчивостью или недостаточной восприимчивостью к лечению с помощью (a) антитела к HER2 при введении его по отдельности и/или (b) модулятора сплайсинга при введении его по отдельности. В некоторых вариантах осуществления субъект характеризуется непереносимостью, невосприимчивостью или недостаточной восприимчивостью к лечению с помощью модулятора сплайсинга при введении его по отдельности.
[97] В некоторых вариантах осуществления антиген-мишень представляет собой CD138. В некоторых вариантах осуществления одна или несколько неопластических клеток получены из множественной миеломы, экспрессирующей CD138. В некоторых вариантах осуществления субъект характеризуется невосприимчивостью или недостаточной восприимчивостью к лечению с помощью (a) антитела к CD138 при введении его по отдельности и/или (b) модулятору сплайсинга при введении его по отдельности. В некоторых вариантах осуществления субъект характеризуется непереносимостью, невосприимчивостью или недостаточной восприимчивостью к лечению с помощью модулятора сплайсинга при введении его по отдельности.
[98] В некоторых вариантах осуществления антиген-мишень представляет собой EPHA2. В некоторых вариантах осуществления одна или несколько неопластических клеток получены из рака молочной железы, рака предстательной железы, рака яичника, рака легкого, меланомы, рака толстой кишки или рака пищевода, экспрессирующих EPHA2. В некоторых вариантах осуществления субъект характеризуется невосприимчивостью или недостаточной восприимчивостью к лечению с помощью (a) антитела к EPHA2 при введении его по отдельности и/или (b) модулятора сплайсинга при введении его по отдельности. В некоторых вариантах осуществления субъект характеризуется непереносимостью, невосприимчивостью или недостаточной восприимчивостью к лечению с помощью модулятора сплайсинга при введении его по отдельности.
[99] В некоторых вариантах осуществления антиген-мишень представляет собой MSLN. В некоторых вариантах осуществления одна или несколько неопластических клеток получены из рака яичника, рака шейки матки, рак поджелудочной железы или рака легкого (например, аденокарциномы легкого), экспрессирующих MSLN. В некоторых вариантах осуществления субъект характеризуется невосприимчивостью или недостаточной восприимчивостью к лечению с помощью (a) антитела к MSLN при введении его по отдельности и/или (b) модулятора сплайсинга при введении его по отдельности. В некоторых вариантах осуществления субъект характеризуется непереносимостью, невосприимчивостью или недостаточной восприимчивостью к лечению с помощью модулятора сплайсинга при введении его по отдельности.
[100] В некоторых вариантах осуществления антиген-мишень представляет собой FOLH1. В некоторых вариантах осуществления одна или несколько неопластических клеток получены из рака предстательной железы, экспрессирующего FOLH1. В некоторых вариантах осуществления субъект характеризуется невосприимчивостью или недостаточной восприимчивостью к лечению с помощью (a) антитела к FOLH1 при введении его по отдельности и/или (b) модулятора сплайсинга при введении его по отдельности. В некоторых вариантах осуществления субъект характеризуется непереносимостью, невосприимчивостью или недостаточной восприимчивостью к лечению с помощью модулятора сплайсинга при введении его по отдельности.
[101] В некоторых вариантах осуществления антиген-мишень представляет собой CDH6. В некоторых вариантах осуществления одна или несколько неопластических клеток получены из рака почки, экспрессирующего CDH6. В некоторых вариантах осуществления субъект характеризуется невосприимчивостью или недостаточной восприимчивостью к лечению с помощью (a) антитела к CDH6 при введении его по отдельности и/или (b) модулятора сплайсинга при введении его по отдельности. В некоторых вариантах осуществления субъект характеризуется непереносимостью, невосприимчивостью или недостаточной восприимчивостью к лечению с помощью модулятора сплайсинга при введении его по отдельности.
[102] В некоторых вариантах осуществления антиген-мишень представляет собой CEACAM5. В некоторых вариантах осуществления одна или несколько неопластических клеток получены из колоректального рака, экспрессирующего CEACAM5. В некоторых вариантах осуществления субъект характеризуется невосприимчивостью или недостаточной восприимчивостью к лечению с помощью (a) антитела к CEACAM5 при введении его по отдельности и/или (b) модулятора сплайсинга при введении его по отдельности. В некоторых вариантах осуществления субъект характеризуется непереносимостью, невосприимчивостью или недостаточной восприимчивостью к лечению с помощью модулятора сплайсинга при введении его по отдельности.
[103] В некоторых вариантах осуществления антиген-мишень представляет собой CFC1B. В некоторых вариантах осуществления одна или несколько неопластических клеток получены из рака поджелудочной железы, экспрессирующего CFC1B. В некоторых вариантах осуществления субъект характеризуется невосприимчивостью или недостаточной восприимчивостью к лечению с помощью (a) антитела к CFC1B при введении его по отдельности и/или (b) модулятора сплайсинга при введении его по отдельности. В некоторых вариантах осуществления субъект характеризуется непереносимостью, невосприимчивостью или недостаточной восприимчивостью к лечению с помощью модулятора сплайсинга при введении его по отдельности.
[104] В некоторых вариантах осуществления антиген-мишень представляет собой ENPP3. В некоторых вариантах осуществления одна или несколько неопластических клеток получены из рака почки, экспрессирующего ENPP3. В некоторых вариантах осуществления субъект характеризуется невосприимчивостью или недостаточной восприимчивостью к лечению с помощью (a) антитела к ENPP3 при введении его по отдельности и/или (b) модулятора сплайсинга при введении его по отдельности. В некоторых вариантах осуществления субъект характеризуется непереносимостью, невосприимчивостью или недостаточной восприимчивостью к лечению с помощью модулятора сплайсинга при введении его по отдельности.
[105] В некоторых вариантах осуществления антиген-мишень представляет собой FOLR1. В некоторых вариантах осуществления одна или несколько неопластических клеток получены из рака яичника, экспрессирующего FOLR1. В некоторых вариантах осуществления субъект характеризуется невосприимчивостью или недостаточной восприимчивостью к лечению с помощью (a) антитела к FOLR1 при введении его по отдельности и/или (b) модулятора сплайсинга при введении его по отдельности. В некоторых вариантах осуществления субъект характеризуется непереносимостью, невосприимчивостью или недостаточной восприимчивостью к лечению с помощью модулятора сплайсинга при введении его по отдельности.
[106] В некоторых вариантах осуществления антиген-мишень представляет собой HAVCR1. В некоторых вариантах осуществления одна или несколько неопластических клеток получены из рака почки или рака пищевода, экспрессирующих HAVCR1. В некоторых вариантах осуществления субъект характеризуется невосприимчивостью или недостаточной восприимчивостью к лечению с помощью (a) антитела к HAVCR1 при введении его по отдельности и/или (b) модулятора сплайсинга при введении его по отдельности. В некоторых вариантах осуществления субъект характеризуется непереносимостью, невосприимчивостью или недостаточной восприимчивостью к лечению с помощью модулятора сплайсинга при введении его по отдельности.
[107] В некоторых вариантах осуществления антиген-мишень представляет собой KIT. В некоторых вариантах осуществления одна или несколько неопластических клеток получены из рака почки, экспрессирующего KIT. В некоторых вариантах осуществления субъект характеризуется невосприимчивостью или недостаточной восприимчивостью к лечению с помощью (a) антитела к KIT при введении его по отдельности и/или (b) модулятора сплайсинга при введении его по отдельности. В некоторых вариантах осуществления субъект характеризуется непереносимостью, невосприимчивостью или недостаточной восприимчивостью к лечению с помощью модулятора сплайсинга при введении его по отдельности.
[108] В некоторых вариантах осуществления антиген-мишень представляет собой MET. В некоторых вариантах осуществления одна или несколько неопластических клеток получены из рака почки или рака пищевода, экспрессирующих MET. В некоторых вариантах осуществления субъект характеризуется невосприимчивостью или недостаточной восприимчивостью к лечению с помощью (a) антитела к MET при введении его по отдельности и/или (b) модулятора сплайсинга при введении его по отдельности. В некоторых вариантах осуществления субъект характеризуется непереносимостью, невосприимчивостью или недостаточной восприимчивостью к лечению с помощью модулятора сплайсинга при введении его по отдельности.
[109] В некоторых вариантах осуществления антиген-мишень представляет собой MUC16. В некоторых вариантах осуществления одна или несколько неопластических клеток получены из рака яичника, рака шейки матки или рака молочной железы, экспрессирующих MUC16. В некоторых вариантах осуществления субъект характеризуется невосприимчивостью или недостаточной восприимчивостью к лечению с помощью (a) антитела к MUC16 при введении его по отдельности и/или (b) модулятора сплайсинга при введении его по отдельности. В некоторых вариантах осуществления субъект характеризуется непереносимостью, невосприимчивостью или недостаточной восприимчивостью к лечению с помощью модулятора сплайсинга при введении его по отдельности.
[110] В некоторых вариантах осуществления антиген-мишень представляет собой SLC39A6. В некоторых вариантах осуществления одна или несколько неопластических клеток получены из рака молочной железы или рака предстательной железы, экспрессирующих SLC39A6. В некоторых вариантах осуществления субъект характеризуется невосприимчивостью или недостаточной восприимчивостью к лечению с помощью (a) антитела к SLC39A6 при введении его по отдельности и/или (b) модулятора сплайсинга при введении его по отдельности. В некоторых вариантах осуществления субъект характеризуется непереносимостью, невосприимчивостью или недостаточной восприимчивостью к лечению с помощью модулятора сплайсинга при введении его по отдельности.
[111] В некоторых вариантах осуществления антиген-мишень представляет собой SLC44A4. В некоторых вариантах осуществления одна или несколько неопластических клеток получены из рака предстательной железы, экспрессирующего SLC44A4. В некоторых вариантах осуществления субъект характеризуется невосприимчивостью или недостаточной восприимчивостью к лечению с помощью (a) антитела к SLC44A4 при введении его по отдельности и/или (b) модулятора сплайсинга при введении его по отдельности. В некоторых вариантах осуществления субъект характеризуется непереносимостью, невосприимчивостью или недостаточной восприимчивостью к лечению с помощью модулятора сплайсинга при введении его по отдельности.
[112] В некоторых вариантах осуществления антиген-мишень представляет собой STEAP1. В некоторых вариантах осуществления одна или несколько неопластических клеток получены из рака предстательной железы, экспрессирующего STEAP1. В некоторых вариантах осуществления субъект характеризуется невосприимчивостью или недостаточной восприимчивостью к лечению с помощью (a) антитела к STEAP1 при введении его по отдельности и/или (b) модулятора сплайсинга при введении его по отдельности. В некоторых вариантах осуществления субъект характеризуется непереносимостью, невосприимчивостью или недостаточной восприимчивостью к лечению с помощью модулятора сплайсинга при введении его по отдельности.
[113] В других определенных аспектах настоящего изобретения представлены способы снижения или подавления роста опухоли у субъекта, у которого имеется неопластическое нарушение или подозрение на его наличие, путем введения субъекту терапевтически эффективного количества любого из описанных ADC или композиций на их основе и/или применения соответствующей схемы лечения.
[114] В некоторых вариантах осуществления лечение с помощью конъюгата антитела и лекарственного средства или композиции индуцирует неспецифическое уничтожение неопластических опухолевых клеток, которые не экспрессируют антиген-мишень, но являются смежными с неопластическими клетками, которые экспрессируют антиген-мишень. В некоторых вариантах осуществления опухоль содержит одну или несколько неопластических клеток, которые экспрессируют антиген-мишень.
[115] В некоторых вариантах осуществления антиген-мишень представляет собой HER2. В некоторых вариантах осуществления одна или несколько неопластических клеток получены из рака молочной железы, рака яичника, рака желудка, рака легкого (например, аденокарциномы легкого), рака матки (например, серозной карциномы эндометрия матки), остеосаркомы или карциномы слюнных протоков, экспрессирующих HER2. В некоторых вариантах осуществления опухоль является резистентной или рефрактерной к лечению с помощью (a) антитела к HER2 при введении его по отдельности и/или (b) модулятора сплайсинга при введении его по отдельности.
[116] В некоторых вариантах осуществления антиген-мишень представляет собой CD138. В некоторых вариантах осуществления одна или несколько неопластических клеток получены из множественной миеломы, экспрессирующей CD138. В некоторых вариантах осуществления опухоль является резистентной или рефрактерной к лечению с помощью (a) антитела к CD138 при введении его по отдельности и/или (b) модулятора сплайсинга при введении его по отдельности.
[117] В некоторых вариантах осуществления антиген-мишень представляет собой EPHA2. В некоторых вариантах осуществления одна или несколько неопластических клеток получены из рака молочной железы, рака предстательной железы, рака яичника, рака легкого, меланомы, рака толстой кишки или рака пищевода, экспрессирующих EPHA2. В некоторых вариантах осуществления опухоль является резистентной или рефрактерной к лечению с помощью (a) антитела к EPHA2 при введении его по отдельности и/или (b) модулятора сплайсинга при введении его по отдельности.
[118] В некоторых вариантах осуществления антиген-мишень представляет собой MSLN. В некоторых вариантах осуществления одна или несколько неопластических клеток получены из рака яичника, рака шейки матки, рак поджелудочной железы или рака легкого (например, аденокарциномы легкого), экспрессирующих MSLN. В некоторых вариантах осуществления опухоль является резистентной или рефрактерной к лечению с помощью (a) антитела к MSLN при введении его по отдельности и/или (b) модулятора сплайсинга при введении его по отдельности.
[119] В некоторых вариантах осуществления антиген-мишень представляет собой FOLH1. В некоторых вариантах осуществления одна или несколько неопластических клеток получены из рака предстательной железы, экспрессирующего FOLH1. В некоторых вариантах осуществления опухоль является резистентной или рефрактерной к лечению с помощью (a) антитела к FOLH1 при введении его по отдельности и/или (b) модулятора сплайсинга при введении его по отдельности.
[120] В некоторых вариантах осуществления антиген-мишень представляет собой CDH6. В некоторых вариантах осуществления одна или несколько неопластических клеток получены из рака почки, экспрессирующего CDH6. В некоторых вариантах осуществления опухоль является резистентной или рефрактерной к лечению с помощью (a) антитела к CDH6 при введении его по отдельности и/или (b) модулятора сплайсинга при введении его по отдельности.
[121] В некоторых вариантах осуществления антиген-мишень представляет собой CEACAM5. В некоторых вариантах осуществления одна или несколько неопластических клеток получены из колоректального рака, экспрессирующего CEACAM5. В некоторых вариантах осуществления опухоль является резистентной или рефрактерной к лечению с помощью (a) антитела к CEACAM5 при введении его по отдельности и/или (b) модулятора сплайсинга при введении его по отдельности.
[122] В некоторых вариантах осуществления антиген-мишень представляет собой CFC1B. В некоторых вариантах осуществления одна или несколько неопластических клеток получены из рака поджелудочной железы, экспрессирующего CFC1B. В некоторых вариантах осуществления опухоль является резистентной или рефрактерной к лечению с помощью (a) антитела к CFC1B при введении его по отдельности и/или (b) модулятора сплайсинга при введении его по отдельности.
[123] В некоторых вариантах осуществления антиген-мишень представляет собой ENPP3. В некоторых вариантах осуществления одна или несколько неопластических клеток получены из рака почки, экспрессирующего ENPP3. В некоторых вариантах осуществления опухоль является резистентной или рефрактерной к лечению с помощью (a) антител а к ENPP3 при введении его по отдельности и/или (b) модулятора сплайсинга при введении его по отдельности.
[124] В некоторых вариантах осуществления антиген-мишень представляет собой FOLR1. В некоторых вариантах осуществления одна или несколько неопластических клеток получены из рака яичника, экспрессирующего FOLR1. В некоторых вариантах осуществления опухоль является резистентной или рефрактерной к лечению с помощью (a) антитела к FOLR1 при введении его по отдельности и/или (b) модулятора сплайсинга при введении его по отдельности.
[125] В некоторых вариантах осуществления антиген-мишень представляет собой HAVCR1. В некоторых вариантах осуществления одна или несколько неопластических клеток получены из рака почки или рака пищевода, экспрессирующих HAVCR1. В некоторых вариантах осуществления опухоль является резистентной или рефрактерной к лечению с помощью (a) антитела к HAVCR1 при введении его по отдельности и/или (b) модулятора сплайсинга при введении его по отдельности.
[126] В некоторых вариантах осуществления антиген-мишень представляет собой KIT. В некоторых вариантах осуществления одна или несколько неопластических клеток получены из рака почки, экспрессирующего KIT. В некоторых вариантах осуществления опухоль является резистентной или рефрактерной к лечению с помощью (a) антитела к KIT при введении его по отдельности и/или (b) модулятора сплайсинга при введении его по отдельности.
[127] В некоторых вариантах осуществления антиген-мишень представляет собой MET. В некоторых вариантах осуществления одна или несколько неопластических клеток получены из рака почки или рака пищевода, экспрессирующих MET. В некоторых вариантах осуществления опухоль является резистентной или рефрактерной к лечению с помощью (a) антитела к MET при введении его по отдельности и/или (b) модулятора сплайсинга при введении его по отдельности.
[128] В некоторых вариантах осуществления антиген-мишень представляет собой MUC16. В некоторых вариантах осуществления одна или несколько неопластических клеток получены из рака яичника, рака шейки матки или рака молочной железы, экспрессирующих MUC16. В некоторых вариантах осуществления опухоль является резистентной или рефрактерной к лечению с помощью (a) антитела к MUC16 при введении его по отдельности и/или (b) модулятора сплайсинга при введении его по отдельности.
[129] В некоторых вариантах осуществления антиген-мишень представляет собой SLC39A6. В некоторых вариантах осуществления одна или несколько неопластических клеток получены из рака молочной железы или рака предстательной железы, экспрессирующих SLC39A6. В некоторых вариантах осуществления опухоль является резистентной или рефрактерной к лечению с помощью (a) антитела к SLC39A6 при введении его по отдельности и/или (b) модулятора сплайсинга при введении его по отдельности.
[130] В некоторых вариантах осуществления антиген-мишень представляет собой SLC44A4. В некоторых вариантах осуществления одна или несколько неопластических клеток получены из рака предстательной железы, экспрессирующего SLC44A4. В некоторых вариантах осуществления опухоль является резистентной или рефрактерной к лечению с помощью (a) антитела к SLC44A4 при введении его по отдельности и/или (b) модулятора сплайсинга при введении его по отдельности.
[131] В некоторых вариантах осуществления антиген-мишень представляет собой STEAP1. В некоторых вариантах осуществления одна или несколько неопластических клеток получены из рака предстательной железы, экспрессирующего STEAP1. В некоторых вариантах осуществления опухоль является резистентной или рефрактерной к лечению с помощью (a) антитела к STEAP1 при введении его по отдельности и/или (b) модулятора сплайсинга при введении его по отдельности.
[132] В еще одних аспектах настоящего изобретения представлены способы определение того, будет ли субъект, у которого имеется неопластическое нарушение или подозрение на его наличие, восприимчивым к лечению с помощью любого из описанных ADC или композиций на их основе, путем получения биологического образца от субъекта и приведения биологического образца в контакт с ADC или композицией. В некоторых вариантах осуществления биологический образец представляет собой образец опухоли. В некоторых вариантах осуществления образец опухоли представляет собой биоптат опухоли или образец крови. В некоторых вариантах осуществления образец крови выбран из крови, фракции крови или клетки, полученной из крови или фракции крови. В некоторых вариантах осуществления у субъекта имеется одна или несколько неопластических клеток, которые экспрессируют антиген-мишень. В некоторых вариантах осуществления антиген-мишень представляет собой HER2. В некоторых вариантах осуществления одна или несколько неопластических клеток получены из рака молочной железы, рака яичника, рака желудка, рака легкого (например, аденокарциномы легкого), рака матки (например, серозной карциномы эндометрия матки), остеосаркомы или карциномы слюнных протоков, экспрессирующих HER2. В некоторых вариантах осуществления антиген-мишень представляет собой CD138. В некоторых вариантах осуществления одна или несколько неопластических клеток получены из множественной миеломы, экспрессирующей CD138. В некоторых вариантах осуществления антиген-мишень представляет собой EPHA2. В некоторых вариантах осуществления одна или несколько неопластических клеток получены из рака молочной железы, рака предстательной железы, рака яичника, рака легкого, меланомы, рака толстой кишки или рака пищевода, экспрессирующих EPHA2. В некоторых вариантах осуществления антиген-мишень представляет собой MSLN. В некоторых вариантах осуществления одна или несколько неопластических клеток получены из рака яичника, рака шейки матки, рак поджелудочной железы или рака легкого (например, аденокарциномы легкого), экспрессирующих MSLN. В некоторых вариантах осуществления антиген-мишень представляет собой FOLH1. В некоторых вариантах осуществления одна или несколько неопластических клеток получены из рака предстательной железы, экспрессирующего FOLH1. В некоторых вариантах осуществления антиген-мишень представляет собой CDH6. В некоторых вариантах осуществления одна или несколько неопластических клеток получены из рака почки, экспрессирующего CDH6. В некоторых вариантах осуществления антиген-мишень представляет собой CEACAM5. В некоторых вариантах осуществления одна или несколько неопластических клеток получены из колоректального рака, экспрессирующего CEACAM5. В некоторых вариантах осуществления антиген-мишень представляет собой CFC1B. В некоторых вариантах осуществления одна или несколько неопластических клеток получены из рака поджелудочной железы, экспрессирующего CFC1B. В некоторых вариантах осуществления антиген-мишень представляет собой ENPP3. В некоторых вариантах осуществления одна или несколько неопластических клеток получены из рака почки, экспрессирующего ENPP3. В некоторых вариантах осуществления антиген-мишень представляет собой FOLR1. В некоторых вариантах осуществления одна или несколько неопластических клеток получены из рака яичника, экспрессирующего FOLR1. В некоторых вариантах осуществления антиген-мишень представляет собой HAVCR1. В некоторых вариантах осуществления одна или несколько неопластических клеток получены из рака почки или рака пищевода, экспрессирующих HAVCR1. В некоторых вариантах осуществления антиген-мишень представляет собой KIT. В некоторых вариантах осуществления одна или несколько неопластических клеток получены из рака почки, экспрессирующего KIT. В некоторых вариантах осуществления антиген-мишень представляет собой MET. В некоторых вариантах осуществления одна или несколько неопластических клеток получены из рака почки или рака пищевода, экспрессирующих MET. В некоторых вариантах осуществления антиген-мишень представляет собой MUC16. В некоторых вариантах осуществления одна или несколько неопластических клеток получены из рака яичника, рака шейки матки или рака молочной железы, экспрессирующих MUC16. В некоторых вариантах осуществления антиген-мишень представляет собой SLC39A6. В некоторых вариантах осуществления одна или несколько неопластических клеток получены из рака молочной железы или рака предстательной железы, экспрессирующих SLC39A6. В некоторых вариантах осуществления антиген-мишень представляет собой SLC44A4. В некоторых вариантах осуществления одна или несколько неопластических клеток получены из рака предстательной железы, экспрессирующего SLC44A4. В некоторых вариантах осуществления антиген-мишень представляет собой STEAP1. В некоторых вариантах осуществления одна или несколько неопластических клеток получены из рака предстательной железы, экспрессирующего STEAP1.
[133] В различных вариантах осуществления в данном документе дополнительно представлены фармацевтические композиции, содержащие ADC и фармацевтически приемлемый разбавитель, носитель и/или вспомогательное вещество. Также раскрыты способы получения описанных соединений ADC и композиций на их основе.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
[134] На фиг. 1 показан дозозависимый эффект иллюстративных соединений, представляющих собой полезные нагрузки, в анализе конкурентного связывания. Ядерные экстракты из клеток 293F, сверхэкспрессирующих SF3B1 дикого типа, меченный flag, подвергали иммунопреципитации с использованием антитела к SF3B1 и коктейля гранул для проведения сцинтилляционного анализа сближения (SPA). Реакционные смеси для связывания содержали смесь антитело-гранулы и возрастающие концентрации соединения, после чего проводили конкурентный анализ с использованием зонда (PB) на основе3H-меченого пладиенолида B. Ось y представляет собой процент изменения (% ответа) специфического связывания по сравнению с контролем DMSO (0%). Данные представлены в виде среднего значения ± стандартное отклонение (SD).
[135] На фиг. 2 показана модуляция сплайсинга иллюстративными соединениями, представляющими собой полезные нагрузки, в in vitro анализе сплайсинга. Ядерные экстракты из клеток HeLa S3 инкубировали с pre-mRNA Ad2.2 и возрастающими концентрациями соединения с последующей количественной оценкой модуляции сплайсинга посредством RT-PCR. Последовательность Ad2.2 получена из аденовирусной Ad2 пре-мРНК в качестве субстрата с модификациями рядом с точкой ветвления последовательности. Ось y представляет собой процент изменения (% ответа) сплайсинга по сравнению с контролем DMSO (0%). Данные представлены в виде среднего значения ± SD.
[136] На фиг. 3 показан дозозависимый эффект иллюстративных соединений, представляющих собой полезные нагрузки, в отношении жизнеспособности клеток на клетках рака молочной железы с амплификацией HER2 (HCC1954). Клетки инкубировали с соединением в течение 144 часов (6 дней) и считывали жизнеспособность с использованием реагента CellTiter-Glo®. Данные представлены в виде среднего значения ± SD.
[137] На фиг. 4 показаны результаты анализа связывания клеток. Связывание иллюстративных HER2-ADC с клетками JIMT1 оценивали посредством проточной цитометрии. Средние значения интенсивности флуоресценции получали для определения связывания конъюгатов с последующим окрашиванием PE-меченым вторичным антителом. Данные представлены в виде среднего значения ± SD.
[138] На фиг. 5А показан дозозависимый эффект иллюстративных HER2-ADC в отношении жизнеспособности клеток на клетках рака молочной железы с амплификацией HER2 (HCC1954). На фиг. 5В показан дозозависимый эффект иллюстративных HER2-ADC в отношении жизнеспособности клеток на клетках рака желудка с амплификацией HER2 (N87). На фиг. 5С показан дозозависимый эффект иллюстративных HER2-ADC в отношении жизнеспособности клеток на клетках рака молочной железы с амплификацией HER2 (SKBR3). Клетки инкубировали с конъюгатами в течение 144 часов (6 дней) и считывали жизнеспособность с использованием реагента CellTiter-Glo®. Данные представлены в виде среднего значения ± SD.
[139] На фиг. 6 показан дозозависимый эффект иллюстративных HER2-ADC в отношении жизнеспособности клеток на клетках рака молочной железы, не экспрессирующих HER2 (MCF7). Клетки инкубировали с конъюгатами в течение 144 часов (6 дней) и считывали жизнеспособность с использованием реагента CellTiter-Glo®. Данные представлены в виде среднего значения ± SD.
[140] На фиг. 7 показаны результаты анализа сплайсинга в гене SLC25A19 на клетках рака молочной железы с амплификацией HER2 (HCC1954). Клетки инкубировали с конъюгатами в течение 24 часов и сплайсинг в транскрипте SLC25A19 измеряли посредством qPCR в режиме реального времени с использованием набора специфических праймеров-зондов Taqman. Ось y представляет собой процент (%) ответа по сравнению с контролем DMSO (0%). Данные представлены в виде среднего значения ± SD.
[141] На фиг. 8 показаны результаты анализа неспецифического уничтожения. Клетки H1568, сверхэкспрессирующие HER2 (положительные по мишени) или клетки H1568, меченные люциферазой (отрицательные по мишени), высеянные отдельно или инкубированные вместе в совместной культуре в течение 144 часов (6 дней), обрабатывали иллюстративными HER2-ADC. Результаты анализа считывали с использованием реагента OneGlo®. Ось y представляет собой процент (%) ответа по сравнению с контролем PBS (100%). Данные представлены в виде среднего значения ± SD.
[142] На фиг. 9 показана кинетика роста опухоли для каждой группы мышей CB17-SCID с имплантированными HCC1954, которых обрабатывали посредством внутривенного введения однократной дозы иллюстративного HER2-ADC или соответствующей полезной нагрузки в той же дозе (6-10 животных на группу). Объемы опухолей измеряли дважды в неделю после обработки. Данные представлены в виде среднего значения ± стандартной погрешности среднего (SEM).
[143] На фиг. 10 показан дозозависимый эффект иллюстративных CD138-ADC в отношении жизнеспособности линии клеток множественной миеломы, экспрессирующих CD138. Клетки MOLP8 инкубировали с конъюгатами в течение 144 часов (6 дней) и считывали жизнеспособность с использованием реагента CellTiter-Glo®. Данные представлены в виде среднего значения ± SD.
[144] На фиг. 11 показан дозозависимый эффект иллюстративных EPH2A-ADC в отношении жизнеспособности линии клеток рака предстательной железы, экспрессирующих EPHA2. Клетки PC3 инкубировали с конъюгатами в течение 144 часов (6 дней) и считывали жизнеспособность с использованием реагента CellTiter-Glo®. Данные представлены в виде среднего значения ± SD.
[145] На фиг. 12A и фиг. 12B показаны результаты in vitro анализа стабильности иллюстративных ADC на основе антитела к HER2, AB185-ADL1-D1. На оси y представлена концентрация общего антитела (фиг. 12A) и конъюгированной (интактной) полезной нагрузки (фиг. 12B); на оси x представлено время инкубации при 37°C в часах.
[146] На фиг. 13 показана концентрации в плазме крови иллюстративных ADC на основе антитела к HER2, AB185-ADL1-D1 после внутривенного введения однократной дозы мышам CD17-SCID с опухолью N87.
[147] На фиг. 14 показана схематическая диаграмма иллюстративного эксперимента по секвенированию РНК и определению белкового лигандoма.
[148] На фиг. 15 показана схематическая диаграмма иллюстративного эксперимента по примированию Т-клеток.
[149] На фиг. 16 показаны результаты FACS-анализа. Моноциты выделяли из мононуклеарных клеток периферической крови (PBMC) и индуцировали их дифференцировку в дендритные клетки (DC) посредством культивирования в коктейле цитокинов. FACS проводили, чтобы удостовериться в дифференцировке DC из моноцитов и их созревании.
[150] На фиг. 17A - D показаны результаты анализа ELISpot. На фиг. 17A показаны планшеты анализа ELISpot, демонстрирующие активацию примирования CD8+ T-клеток посредством неоантигена 1. Стимуляцию CD8+ T-клеток контролировали по секреции IFNγ. На фиг. 17B показано количественное определение пятен IFNγ (число пятен) в планшетах анализа ELISpot с неоантигеном 1 (фиг. 17A). На фиг. 17С показаны планшеты анализа ELISpot, демонстрирующие активацию примирования CD8+ T-клеток посредством неоантигена 3. Стимуляцию CD8+ T-клеток контролировали по секреции IFNγ. На фиг. 17D показано количественное определение пятен IFNγ (кратность изменения) в планшетах анализа ELISpot с неоантигеном 3 (фиг. 17С).
[151] На фиг. 18 показан график сравнения активности иллюстративных ADC на основе антитела к HER2 в отношении сплайсинга (IC50, qPCR) против активности в отношении клеток (GI50, CTG) на клетках рака молочной железы HCC1954. Показанные значения размещены по размеру в зависимости от летальной активности в отношении клеток и заштрихованы по качеству ответа в виде альтернативного сплайсинга.
[152] На фиг. 19 показан график сравнения активности иллюстративных ADC на основе антитела к HER2 в отношении сплайсинга (IC50, qPCR) против активности в отношении клеток (GI50, CTG) на клетках рака желудка N87. Показанные значения размещены по размеру в зависимости от летальной активности в отношении клеток и заштрихованы по качеству ответа в виде альтернативного сплайсинга.
[153] На фиг. 20 показан график сравнения активности и эффективности иллюстративных ADC на основе антитела к HER2 (на клетках рака молочной железы HCC1954) в зависимости от стабильности и проникающей способности соответствующих полезных нагрузок. Показанные значения размещены по размеру в зависимости от стабильность полезной нагрузки и заштрихованы по степени проникающей способности полезной нагрузки.
[154] На фиг. 21 показана кинетика роста опухоли для каждой группы мышей CB17-SCID с имплантированными N87, которых обрабатывали посредством внутривенного введения среды-носителя или 10 мг/кг трастузумаба, TDM1 или иллюстративного соединения HER2-ADC Q7D в течение 2 циклов (N=8 на группу). Данные представлены в виде среднего значения ± стандартной погрешности среднего (SEM) (мм3).
[155] На фиг. 22 показано изменение веса тела для каждой группы мышей CB17-SCID с имплантированными N87, которых обрабатывали посредством внутривенного введения среды-носителя или 10 мг/кг трастузумаба, TDM1 или иллюстративного соединения HER2-ADC Q7D в течение 2 циклов (N=8 на группу). Данные представлены в виде среднего значения ± стандартной погрешности среднего (SEM) (%).
[156] На фиг. 23 показана кинетика роста опухолей (слева) и изменение веса тела (справа) для каждой группы мышей CB17-SCID с имплантированными N87, которых обрабатывали посредством внутривенного введения среды-носителя или 10 мг/кг трастузумаба, TDM1 или иллюстративного соединения HER2-ADC Q7D в течение 2 циклов (N=8 на группу). Данные представлены в виде среднего значения ± SEM (объем опухоли, мм3) или среднего значения ± SEM (вес тела,%).
[157] На фиг. 24A - 24D показана фармакодинамическая модуляция границ сплайсинга mRNA у мышей CB17-SCID с имплантированными N87, которых обрабатывали посредством внутривенного введения среды-носителя или 10 мг/кг трастузумаба, TDM1 или иллюстративного соединения HER2-ADC Q7D в течение 2 циклов. Посредством RT-qPCR отслеживали присутствие FBXW5 (зрелого мРНК-транскрипта) и результаты показаны на фиг. 24А и фиг. 24С. Посредством RT-qPCR отслеживали присутствие TAOK1 (транскрипта с новой границей сплайсинга) и результаты показаны на фиг. 24B и фиг. 24D. Животных (N=4 на группу) отбирали или в момент времени 48 часов (фиг. 24A и фиг. 24B), или в указанные моменты времени (фиг. 24C и фиг. 24D). Опухоли извлекали для выделения РНК и проведения RT-qPCR.
[158] На фиг. 25 показана схематическая диаграмма иллюстративного анализа определения мишени.
[159] На фиг. 26 показана схема иллюстративной биоконъюгации для получения ADC с использованием модуляторов сплайсинга.
ПОДРОБНОЕ ОПИСАНИЕ ИЛЛЮСТРАТИВНЫХ ВАРИАНТОВ ОСУЩЕСТВЛЕНИЯ
[160] Раскрытые композиции и способы можно легче понять со ссылкой на следующее подробное описание, взятое в сочетании с сопутствующими фигурами, которые образуют часть настоящего изобретения.
[161] На всем протяжении данного текста описания относятся к композициям и способам применения композиций. Если в настоящем изобретении описывается или заявляется признак или вариант осуществления, ассоциированные с композицией, такие признак или вариант осуществления равным образом приложимы к способам применения композиции. Аналогичным образом, если в настоящем изобретении описывается или заявляется признак или вариант осуществления, ассоциированные со способом применения композиции, такие признак или вариант осуществления равным образом приложимы к композиции.
[162] Если представлен диапазон значений, он включает варианты осуществления с применением любого конкретного значения в пределах диапазона. Кроме того, ссылка на значения, изложенные в диапазоне, включает все без исключения значения в пределах данного диапазона. Все диапазоны включают свои предельные значения и являются комбинируемыми. Если значения выражены как приблизительные значения с помощью применения предшествующего слова "приблизительно", будет понятно, что конкретное значение образует другой вариант осуществления. Ссылка на конкретное числовое значение включает по меньшей мере данное конкретное значение, если контекст явно не предусматривает иное. Применение "или" будет означать "и/или", если конкретный контекст его применения не предусматривает иное. Все ссылки, процитированные в данном документе, включены посредством ссылки для любой цели. Если ссылка и описание противоречат, описание будет иметь преимущественную силу.
[163] Следует понимать, что определенные признаки раскрытых композиций и способов, которые для ясности описаны в данном документе в контексте отдельных вариантов осуществления, также могут быть представлены в комбинации в одном варианте осуществления. И наоборот, различные признаки раскрытых композиций и способов которые для краткости описаны в контексте одного варианта осуществления, также могут быть представлены по отдельности или в любой подкомбинации.
Определения
[164] На всем протяжении настоящей заявки и формулы изобретения используются различные термины, связанные с аспектами настоящего описания. Если не указано иное, таким терминам присваивается их обычное значение из области техники. Другие специфически определяемые термины следует толковать в том смысле, который соответствует определениям, представленным в данном документе.
[165] Применяемые в данном документе формы единственного числа включают формы множественного числа, если контекст явно не предусматривает иное.
[166] Термины "приблизительно" или "примерно" в контексте числовых значений и диапазонов относятся к значениям или диапазонам, которые приблизительно равны описанным значениям или диапазонам или близки к ним, так что вариант осуществления можно осуществлять, как задумано, как, например, имеется требуемое количество нуклеиновых кислот или полипептидов в реакционной смеси, как очевидно специалисту в данной области техники на основании идей, содержащихся в данном документе. В некоторых вариантах осуществления "приблизительно" означает плюс или минус 10% от числового количества.
[167] Термины "конъюгат антитела и лекарственного средства" "конъюгат на основе антитела", "конъюгат", "иммуноконъюгат" и "ADC" используются взаимозаменяемо и относятся к одному или нескольким терапевтическим соединениям (например, модулятору сплайсинга), которые соединены с одним или несколькими антителами или антигенсвязывающими фрагментами и определяются общей формулой: Ab-(L-D)p (формула I), где Ab=антитело или антигенсвязывающий фрагмент, L=линкерный фрагмент, D=фрагмент-лекарственное средство (например, фрагмент-лекарственное средство, представляющий собой модулятор сплайсинга), и p=число фрагментов-лекарственных средств на антитело или антигенсвязывающий фрагмент. ADC, содержащий фрагмент-лекарственное средство, представляющий собой модулятор сплайсинга, также может обозначаться в данном документе более специфически как "антитело, загруженное модулятором сплайсинга" или "SMLA." В ADC, содержащих фрагмент-лекарственное средство, представляющий собой модулятор сплайсинга, "p" относится к числу соединений, представляющих собой модулятор сплайсинга, связанных с антителом или антигенсвязывающим фрагментом. В некоторых вариантах осуществления линкер L может включать расщепляемый фрагмент между антителом или антигенсвязывающим фрагментом и терапевтическим соединением. В некоторых вариантах осуществления линкер L может включать расщепляемый фрагмент, который может быть присоединен к одному из антитела или антигенсвязывающего фрагмента и терапевтического соединения или к ним обоим с помощью спейсерного(-ых) звена(-ьев). В некоторых вариантах осуществления, если спейсерное звено прикрепляет расщепляемый фрагмент к терапевтическому соединению, оно представляет собой саморасщепляющееся спейсерное звено. В других вариантах осуществления линкер L не включает расщепляемый фрагмент, и он представляет собой нерасщепляемый линкер. В некоторых вариантах осуществления линкер L может включать по меньшей мере одно спейсерное звено, которое может непосредственно прикрепляться к антителу или антигенсвязывающему фрагменту и к терапевтическому соединению. В данном документе описаны иллюстративные расщепляемые и нерасщепляемые линкеры описаны и приведены их примеры.
[168] Термин "антитело" применяется в самом широком смысле для обозначения молекулы иммуноглобулина, которая распознает и специфически связывается с мишенью, такой как белок, полипептид, углевод, полинуклеотид, липид или комбинации вышеуказанного, посредством по меньшей мере одного сайта распознавания антигена в пределах вариабельной области молекулы иммуноглобулина. Тяжелая цепь антитела состоит из вариабельного домена тяжелой цепи (VH) и константной области тяжелой цепи (CH). Легкая цепь состоит из вариабельного домена легкой цепи (VL) и константного домена легкой цепи (CL). Для целей настоящей заявки каждый зрелый вариабельный домен тяжелой цепи и легкой цепи содержит три области, определяющие комплементарность (CDR1, CDR2 и CDR3), в пределах четырех каркасных участков (FR1, FR2, FR3 и FR4), расположенных от N-конца до C-конца: FR1, CDR1, FR2, CDR2, FR3, CDR3 и FR4. "Антитело" может быть встречающимся в природе или созданным человеком, таким как моноклональные антитела, полученные с помощью традиционной гибридомной технологии. Термин "антитело" включает полноразмерные моноклональные антитела и полноразмерные поликлональные антитела, а также фрагменты антител, такие как Fab, Fab', F(ab')2, Fv и одноцепочечные антитела. Антитело может принадлежать к любому из пяти основных классов иммуноглобулинов: IgA, IgD, IgE, IgG и IgM, или к их подклассам (например, изотипам IgG1, IgG2, IgG3, IgG4). Термин дополнительно охватывает человеческие антитела, химерные антитела, гуманизированные антитела и любую модифицированную молекулу иммуноглобулина, содержащую сайт распознавания антигена, при условии, что она демонстрируют требуемую биологическую активность (например, связывает целевой антиген, интернализуется в клетку, экспрессирующую целевой антиген).
[169] Применяемый в данном документе термин "моноклональное антитело" относится к антителу, полученному из популяции практически однородных антител, т. е. отдельные антитела, входящие в состав популяции, являются идентичными, за исключением возможных встречающихся в природе мутаций, которые могут присутствовать в незначительных количествах. Моноклональные антитела являются высокоспецифичными, направлены против одного антигенного эпитопа. В отличие от этого, традиционные препараты (поликлональных) антител, как правило, включают большое разнообразие антител, направленных против (или специфических в отношении) разных эпитопов. Модификатор "моноклональный" указывает на характеристику антитела как полученного из практически однородной популяции антител и не должен рассматриваться как требующий получения антитела с помощью какого-либо конкретного способа. Например, моноклональные антитела, подлежащие применению в соответствии с настоящим изобретением, могут быть получены посредством гибридомного способа, впервые описанного в Kohler et al. (1975) Nature 256:495, или могут быть получены посредством способов рекомбинантной ДНК (см., например, патент США № 4816567). Моноклональные антитела также могут быть выделены из фаговых библиотек антител с применением, например, методик, описанных в Clackson et al. (1991) Nature 352:624-8, и Marks et al. (1991) J Mol Biol. 222:581-97.
[170] Моноклональные антитела, описанные в данном документе, в частности, включают "химерные" антитела, в которых часть тяжелой и/или легкой цепь идентична или гомологична соответствующим последовательностям в антителах, полученных от конкретного вида или принадлежащих к конкретному классу или подклассу антител, в то время как остальная часть цепи(-ей) идентична или гомологична соответствующим последовательностям в антителах, полученных от другого вида или принадлежащих к другому классу или подклассу антител, а также фрагменты таких антител, при условии, что они специфически связывают антиген-мишень и/или проявляют требуемую биологическую активность.
[171] Применяемый в данном документе термин "человеческое антитело" относится к антителу, продуцируемому в человеке, или к антителу, имеющему аминокислотную последовательность антитела, продуцируемого в человеке.
[172] Применяемый в данном документе термин "химерное антитело" относится к антителам, в которых аминокислотная последовательность молекулы иммуноглобулина получена от двух или более видов. В некоторых случаях вариабельные области обеих тяжелой и легкой цепей соответствуют вариабельным областям антител, полученных из одного вида с требуемой специфичностью, аффинностью и активностью, в то время как константные области гомологичны антителам, полученным из другого вида (например, человека), чтобы свести к минимуму иммунный ответ у последнего вида.
[173] Применяемый в данном документе термин "гуманизированное антитело" относится к формам антител, которые содержат последовательности из антител отличного от человека вида (например, мыши), а также человеческих антител. Такие антитела представляют собой химерные антитела, которые содержат минимальную последовательность, полученную из иммуноглобулина, не принадлежащего человеку. В целом, гуманизированное антитело будет содержать практически весь из по меньшей мере одного и, как правило, двух вариабельных доменов, в которых все или практически все из гипервариабельных петель соответствуют петлям иммуноглобулина, на принадлежащего человеку, а все или практически все каркасные (FR) области являются областями из последовательности иммуноглобулина человека. Гуманизированное антитело необязательно также будет содержать по меньшей мере часть константной области (Fc) иммуноглобулина, как правило, константную область иммуноглобулина человека. Гуманизированное антитело может быть дополнительно модифицировано путем замещения остатков или в каркасной области Fv и/или в пределах замещенных остатков, не принадлежащих человеку, для улучшения и оптимизации специфичности, аффинности и/или активности антитела.
[174] Применяемый в данном документе термин "антигенсвязывающий фрагмент" или "антигенсвязывающая часть" антитела относится к одному или нескольким фрагментам антитела или белка, которые сохраняют способность специфически связываться с антигеном (например, HER2, CD138, EPHA2, MSLN, FOLH1, CDH6, CEACAM5, CFC1B, ENPP3, FOLR1, HAVCR1, KITР, MET, MUC16, SLC39A6, SLC44A4, STEAP1). Антигенсвязывающие фрагменты также могут сохранять способность к интернализации в клетку, экспрессирующую антиген. В некоторых вариантах осуществления антигенсвязывающие фрагменты также сохраняют иммунную эффекторную активность. Было показано, что фрагменты полноразмерного антитело могут осуществлять антигенсвязывающую функцию полноразмерного антитела. Примеры связывающих фрагментов, охватываемых термином "антигенсвязывающий фрагмент" или "антигенсвязывающая часть" антитела включают: (i) Fab-фрагмент, одновалентный фрагмент, состоящий доменов VL, VH, CL и CH1; (ii) F(ab')2-фрагмент, двухвалентный фрагмент, содержащий два Fab-фрагмента, связанные дисульфидным мостиком в шарнирной области; (iii) Fd-фрагмент, состоящий из доменов VH и CH1; (iv) Fv-фрагмент, состоящий из доменов VL и VH одного плеча антитела; (v) dAb-фрагмент, который содержит один вариабельный домен, например, домен VH (см., например, Ward et al. (1989) Nature 341:544-6; и публикацию международной заявки № WO 1990/005144); и (vi) выделенную область, определяющую комплементарность (CDR). Кроме того, хотя два домена Fv-фрагмента, VL и VH, кодируются отдельными генами, с применением рекомбинантных способов они могут быть соединены с помощью синтетического линкера, который позволяет получать их как единую белковую цепь, в которой области VL и VH формируют пару с образованием одновалентной молекулы (известной как одноцепочечный Fv (scFv)). См., например, Bird et al. (1988) Science 242:423-6; и Huston et al. (1988) Proc Natl Acad Sci. USA 85:5879-83. Подразумевается, что такие одноцепочечные антитела также охватываются термином "антигенсвязывающий фрагмент" или "антигенсвязывающая часть" антитела, и они известны из уровня техники как иллюстративный тип связывающего фрагмента, который может подвергаться интернализации в клетки после связывания (см., например, Zhu et al. (2010) 9:2131-41; He et al. (2010) J Nucl Med. 51:427-32; и Fitting et al. (2015) MAbs 7:390-402). В определенных вариантах осуществления молекулы scFv могут быть включены в слитый белок. Также охватываются другие формы одноцепочечных антител, такие как диатела. Диатела представляют собой двухвалентные, биспецифические антитела, у которых домены VH и VL экспрессируются в одной полипептидной цепи, но с применением линкера, который слишком короткий, чтобы позволить формирование пары между двумя доменами в одной цепи, тем самым заставляя домены формировать пары с комплементарными доменами другой цепи и создавать два антигенсвязывающий сайта (см., например, Holliger et al. (1993) Proc Natl Acad Sci. USA 90:6444-8; и Poljak et al. (1994) Structure 2:1121-3). Антигенсвязывающие фрагменты получают с применением традиционных методик, известных специалистам в данной области техники, и связывающие фрагменты подвергают скринингу в отношении применимости (например, аффинности связывания, интернализации) так же, как и интактные антитела. Антигенсвязывающие фрагменты можно получать путем расщепления интактного белка, например, с помощью протеазы или химического расщепления.
[175] "Интернализующиеся", как применяется в данном документе при ссылке на антитело или антигенсвязывающий фрагмент, относится к антителу или антигенсвязывающему фрагменту, которые могут захватываться через липидную бислойную мембрану клетки во внутренний компартмент (т. е. "подвергаться интернализации") после связывания с клеткой, предпочтительно в компартмент деградации в клетке. Например, интернализующееся антитело к HER2 представляет собой антитело, которое может захватываться в клетку после связывания с HER2 на клеточной мембране. В некоторых вариантах осуществления антитело или антигенсвязывающий фрагмент, применяемые в ADC, раскрытых в данном документе, целенаправленно воздействуют на антиген клеточной поверхности (например, HER2) и представляют собой интернализующееся антитело или интернализующийся антигенсвязывающий фрагмент (т. е. ADC переносится через клеточную мембрану после связывания антигена). В некоторых вариантах осуществления интернализующееся антитело или антигенсвязывающий фрагмент связывают рецептор на клеточной поверхности. Интернализующееся антитело или интернализующийся антигенсвязывающий фрагмент, которые целенаправленно воздействуют на рецептор на клеточной мембране, могут индуцировать опосредованный рецептором эндоцитоз. В некоторых вариантах осуществления интернализующееся антитело или интернализующийся антигенсвязывающий фрагмент захватываются в клетку посредством опосредованного рецептором эндоцитоза.
[176] "Неинтернализующиеся", как применяется в данном документе при ссылке на антитело или антигенсвязывающий фрагмент, относится к антителу или антигенсвязывающему фрагменту, которые сохраняются на клеточной поверхности после связывания с клеткой. В некоторых вариантах осуществления антитело или антигенсвязывающий фрагмент, применяемые в ADC, раскрытых в данном документе, целенаправленно воздействуют на антиген клеточной поверхности и представляют собой неинтернализующееся антитело или неинтернализующийся антигенсвязывающий фрагмент (т. е. ADC остается на клеточной поверхности и не переносится через клеточную мембрану после связывания антигена). В некоторых вариантах осуществления неинтернализующееся антитело или антигенсвязывающий фрагмент связывают неинтернализующийся рецептор или другой антиген клеточной поверхности. Иллюстративные неинтернализующиеся антигены поверхности клетки включают без ограничения CA125 и CEA, и антитела, которые связываются с неинтернализующимися антигенами-мишенями также известны из уровня техники (см., например, Bast et al. (1981) J Clin Invest. 68(5):1331-7; Scholler and Urban (2007) Biomark Med. 1(4):513-23; и Boudousq et al. (2013) PLoS One 8(7):e69613).
[177] Применяемый в данном документе термин "рецептор 2 эпидермального фактора роста человека", "HER2" или "HER2/NEU" относится к любой нативной форме HER2 человека. Термин охватывает полноразмерную последовательность HER2 (например, эталонную последовательность в UniProt: P04626; SEQ ID NO:31), а также любую форму HER2 человека, которая может происходить в результате процессинга в клетке. Термин также охватывает функциональные варианты или фрагменты HER2 человека, включая без ограничения сплайс-варианты, аллельные варианты и изоформы, которые сохраняют одну или несколько биологических функций HER2 человека (т. е. охватываются варианты и фрагменты, если контекст не указывает на то, что термин применяется для обозначения только белка дикого типа). HER2 может быть выделен из человека или может быть получен рекомбинантным образом или с помощью синтетических способов.
[178] Термин "антитело к HER2" или "антитело, которое связывается с HER2" относится к любой форме антитела или его фрагмента, которые связываются, например специфически связываются, с HER2, и охватывает моноклональные антитела (включая полноразмерные моноклональные антитела), поликлональные антитела и биологически функциональные фрагменты антител, при условии, что они связываются, например специфически связываются, с HER2. В патенте США № 5821337, включенном в данный документ посредством ссылки, представлены иллюстративные HER2-связывающие последовательности, включая иллюстративные последовательности антител к HER2. В некоторых вариантах осуществления антитело к HER2, применяемое в ADC, раскрытых в данном документе, представляет собой интернализующееся антитело или интернализующийся фрагмент антитела. Трастузумаб (патент США № 5821337; Molina et al. (2001) Cancer Res. 61(12):4744-9) представляет собой иллюстративное антитело к HER2 человека.
[179] Применяемый в данном документе термин "синдекан-1", "SDC1" или "CD138" относится к любой нативной форме CD138 человека. Термин охватывает полноразмерную последовательность CD138 (например, эталонную последовательность в UniProt: P18827; SEQ ID NO:32), а также любую форму CD138 человека, которая может происходить в результате процессинга в клетке. Термин также охватывает функциональные варианты или фрагменты CD138 человека, включая без ограничения сплайс-варианты, аллельные варианты и изоформы, которые сохраняют одну или несколько биологических функций CD138 человека (т. е. охватываются варианты и фрагменты, если контекст не указывает на то, что термин применяется для обозначения только белка дикого типа). CD138 может быть выделен из человека или может быть получен рекомбинантным образом или с помощью синтетических способов.
[180] Термин "антитело к CD138 " или "антитело, которое связывается с CD138" относится к любой форме антитела или его фрагмента, которые связываются, например специфически связываются, с CD138, и охватывает моноклональные антитела (включая полноразмерные моноклональные антитела), поликлональные антитела и биологически функциональные фрагменты антител, при условии, что они связываются, например специфически связываются, с CD138. В некоторых вариантах осуществления антитело к CD138, применяемое в ADC, раскрытых в данном документе, представляет собой интернализующееся антитело или интернализующийся фрагмент антитела. B-B4 (Tassone et al. (2004) Blood 104:3688-96) представляет собой иллюстративное антитело к CD138 человека.
[181] Применяемый в данном документе термин "рецептор 2 эфрина типа-A" или "EPHA2" относится к любой нативной форме EPHA2 человека. Термин охватывает полноразмерную последовательность EPHA2 (например, эталонную последовательность в UniProt: P29317; SEQ ID NO:33), а также любую форму EPHA2 человека, которая может происходить в результате процессинга в клетке. Термин также охватывает функциональные варианты или фрагменты EPHA2 человека, включая без ограничения сплайс-варианты, аллельные варианты и изоформы, которые сохраняют одну или несколько биологических функций EPHA2 человека (т. е. охватываются варианты и фрагменты, если контекст не указывает на то, что термин применяется для обозначения только белка дикого типа). EPHA2 может быть выделен из человека или может быть получен рекомбинантным образом или с помощью синтетических способов.
[182] Термин "антитело к EPHA2" или "антитело, которое связывается с EPHA2" относится к любой форме антитела или его фрагмента, которые связываются, например специфически связываются, с EPHA2, и охватывает моноклональные антитела (включая полноразмерные моноклональные антитела), поликлональные антитела и биологически функциональные фрагменты антител, при условии, что они связываются, например специфически связываются, с EPHA2. В WO 2007/030642, включенном в данный документ посредством ссылки, представлены иллюстративные EPHA2-связывающие последовательности, включая иллюстративные последовательности антител к EPHA2. В некоторых вариантах осуществления антитело к EPHA2, применяемое в ADC, раскрытых в данном документе, представляет собой интернализующееся антитело или интернализующийся фрагмент антитела. 1C1 (WO 2007/030642; Jackson et al. (2008) Cancer Res. 68(22): 9367-74) представляет собой иллюстративное антитело к EPHA2 человека.
[183] Применяемый в данном документе термин "мезотелин" или "MSLN" относится к любой нативной форме MSLN человека. Термин охватывает полноразмерную последовательность MSLN (например, эталонную последовательность в UniProt: Q13421; SEQ ID NO:43), а также любую форму MSLN человека, которая может происходить в результате процессинга в клетке. Термин также охватывает функциональные варианты или фрагменты MSLN человека, включая без ограничения сплайс-варианты, аллельные варианты и изоформы, которые сохраняют одну или несколько биологических функций MSLN человека (т. е. охватываются варианты и фрагменты, если контекст не указывает на то, что термин применяется для обозначения только белка дикого типа). MSLN может быть выделен из человека или может быть получен рекомбинантным образом или с помощью синтетических способов.
[184] Термин "антитело к MSLN" или "антитело, которое связывается с MSLN" относится к любой форме антитела или его фрагмента, которые связываются, например специфически связываются, с MSLN, и охватывает моноклональные антитела (включая полноразмерные моноклональные антитела), поликлональные антитела и биологически функциональные фрагменты антител, при условии, что они связываются, например специфически связываются, с MSLN. В WO 2011/074621, включенном в данный документ посредством ссылки, представлены иллюстративные MSLN-связывающие последовательности, включая иллюстративные последовательности антител к MSLN. В некоторых вариантах осуществления антитело к MSLN, применяемое в ADC, раскрытых в данном документе, представляет собой интернализующееся антитело или интернализующийся фрагмент антитела. 11-25, IC14-30, IC7-4, IC17-35 и 2-9 представляют собой иллюстративные антитела к MSLN человека.
[185] Применяемый в данном документе термин "глутаматкарбоксипептидаза 2" или "FOLH1" относится к любой нативной форме FOLH1 человека. Термин охватывает полноразмерную последовательность FOLH1 (например, эталонную последовательность в UniProt: Q04609; SEQ ID NO:44), а также любую форму FOLH1 человека, которая может происходить в результате процессинга в клетке. Термин также охватывает функциональные варианты или фрагменты FOLH1 человека, включая без ограничения сплайс-варианты, аллельные варианты и изоформы, которые сохраняют одну или несколько биологических функций FOLH1 человека (т. е. охватываются варианты и фрагменты, если контекст не указывает на то, что термин применяется для обозначения только белка дикого типа). FOLH1 может быть выделен из человека или может быть получен рекомбинантным образом или с помощью синтетических способов.
[186] Термин "антитело к FOLH1" или "антитело, которое связывается с FOLH1" относится к любой форме антитела или его фрагмента, которые связываются, например специфически связываются, с FOLH1, и охватывает моноклональные антитела (включая полноразмерные моноклональные антитела), поликлональные антитела и биологически функциональные фрагменты антител, при условии, что они связываются, например специфически связываются, с FOLH1. В WO 2019/012260 и WO 2017/212250, включенных в данный документ посредством ссылки, представлены иллюстративные FOLH1-связывающие последовательности, включая иллюстративные последовательности антител к FOLH1. В некоторых вариантах осуществления антитело к FOLH1, применяемое в ADC, раскрытых в данном документе, представляет собой интернализующееся антитело или интернализующийся фрагмент антитела. J591 (деиммунизированное) представляет собой иллюстративное антитело к FOLH1 человек.
[187] Применяемый в данном документе термин "кадгерин-6" или "CDH6" относится к любой нативной форме CDH6 человека. Термин охватывает полноразмерную последовательность CDH6 (например, эталонную последовательность в UniProt: P55285; SEQ ID NO:45), а также любую форму CDH6 человека, которая может происходить в результате процессинга в клетке. Термин также охватывает функциональные варианты или фрагменты CDH6 человека, включая без ограничения сплайс-варианты, аллельные варианты и изоформы, которые сохраняют одну или несколько биологических функций CDH6 человека (т. е. охватываются варианты и фрагменты, если контекст не указывает на то, что термин применяется для обозначения только белка дикого типа). CDH6 может быть выделен из человека или может быть получен рекомбинантным образом или с помощью синтетических способов.
[188] Термин "антитело к CDH6" или "антитело, которое связывается с CDH6" относится к любой форме антитела или его фрагмента, которые связываются, например специфически связываются, с CDH6, и охватывает моноклональные антитела (включая полноразмерные моноклональные антитела), поликлональные антитела и биологически функциональные фрагменты антител, при условии, что они связываются, например специфически связываются, с CDH6. В WO 2018/185618, включенном в данный документ посредством ссылки, представлены иллюстративные CDH6-связывающие последовательности, включая иллюстративные последовательности антител к CDH6. В некоторых вариантах осуществления антитело к CDH6, применяемое в ADC, раскрытых в данном документе, представляет собой интернализующееся антитело или интернализующийся фрагмент антитела.
[189] Применяемый в данном документе термин "молекула 5 клеточной адгезии, родственная карциноэмбриональному антигену" или "CEACAM5" относится к любой нативной форме CEACAM5 человека. Термин охватывает полноразмерную последовательность CEACAM5 (например, эталонную последовательность в UniProt: P06731; SEQ ID NO:46), а также любую форму CEACAM5 человека, которая может происходить в результате процессинга в клетке. Термин также охватывает функциональные варианты или фрагменты CEACAM5 человека, включая без ограничения сплайс-варианты, аллельные варианты и изоформы, которые сохраняют одну или несколько биологических функций CEACAM5 человека (т. е. охватываются варианты и фрагменты, если контекст не указывает на то, что термин применяется для обозначения только белка дикого типа). CEACAM5 может быть выделен из человека или может быть получен рекомбинантным образом или с помощью синтетических способов.
[190] Термин "антитело к CEACAM5" или "антитело, которое связывается с CEACAM5" относится к любой форме антитела или его фрагмента, которые связываются, например специфически связываются, с CEACAM5, и охватывает моноклональные антитела (включая полноразмерные моноклональные антитела), поликлональные антитела и биологически функциональные фрагменты антител, при условии, что они связываются, например специфически связываются, с CEACAM5. В US 2015/0125386, включенном в данный документ посредством ссылки, представлены иллюстративные CEACAM5-связывающие последовательности, включая иллюстративные последовательности антител к CEACAM5. В некоторых вариантах осуществления антитело к CEACAM5, применяемое в ADC, раскрытых в данном документе, представляет собой интернализующееся антитело или интернализующийся фрагмент антитела. hMN14 представляет собой иллюстративное антитело к CEACAM5 человека.
[191] Применяемый в данном документе термин "представитель 1B семейства криптических белков" или "CFC1B" относится к любой нативной форме CFC1B человека. Термин охватывает полноразмерную последовательность CFC1B (например, эталонную последовательность в UniProt: P0CG36; SEQ ID NO:47), а также любую форму CFC1B человека, которая может происходить в результате процессинга в клетке. Термин также охватывает функциональные варианты или фрагменты CFC1B человека, включая без ограничения сплайс-варианты, аллельные варианты и изоформы, которые сохраняют одну или несколько биологических функций CFC1B человека (т. е. охватываются варианты и фрагменты, если контекст не указывает на то, что термин применяется для обозначения только белка дикого типа). CFC1B может быть выделен из человека или может быть получен рекомбинантным образом или с помощью синтетических способов.
[192] Термин "антитело к CFC1B" или "антитело, которое связывается с CFC1B" относится к любой форме антитела или его фрагмента, которые связываются, например специфически связываются, с CFC1B, и охватывает моноклональные антитела (включая полноразмерные моноклональные антитела), поликлональные антитела и биологически функциональные фрагменты антител, при условии, что они связываются, например специфически связываются, с CFC1B. В WO 2002/088170, включенном в данный документ посредством ссылки, представлены иллюстративные CFC1B-связывающие последовательности, включая иллюстративные последовательности антител к CFC1B. В некоторых вариантах осуществления антитело к CFC1B, применяемое в ADC, раскрытых в данном документе, представляет собой интернализующееся антитело или интернализующийся фрагмент антитела.
[193] Применяемый в данном документе термин "член 3 семейства эктонуклеотидпирофосфатаз/фосфодиэстераз" или "ENPP3" относится к любой нативной форме ENPP3 человека. Термин охватывает полноразмерную последовательность ENPP3 (например, эталонную последовательность в UniProt: O14638; SEQ ID NO:48), а также любую форму ENPP3 человека, которая может происходить в результате процессинга в клетке. Термин также охватывает функциональные варианты или фрагменты ENPP3 человека, включая без ограничения сплайс-варианты, аллельные варианты и изоформы, которые сохраняют одну или несколько биологических функций ENPP3 человека (т. е. охватываются варианты и фрагменты, если контекст не указывает на то, что термин применяется для обозначения только белка дикого типа). ENPP3 может быть выделен из человека или может быть получен рекомбинантным образом или с помощью синтетических способов.
[194] Термин "антитело к ENPP3" или "антитело, которое связывается с ENPP3" относится к любой форме антитела или его фрагмента, которые связываются, например специфически связываются, с ENPP3, и охватывает моноклональные антитела (включая полноразмерные моноклональные антитела), поликлональные антитела и биологически функциональные фрагменты антител, при условии, что они связываются, например специфически связываются, с ENPP3. В работе Donate et al. ((2016) Clin Cancer Res. 22(8):1989-99), включенной в данный документ посредством ссылки, представлены иллюстративные ENPP3-связывающие последовательности, включая иллюстративные последовательности антител к ENPP3. В некоторых вариантах осуществления антитело к ENPP3, применяемое в ADC, раскрытых в данном документе, представляет собой интернализующееся антитело или интернализующийся фрагмент антитела.
[195] Применяемый в данном документе термин "фолатный рецептор-альфа" или "FOLR1" относится к любой нативной форме FOLR1 человека. Термин охватывает полноразмерную последовательность FOLR1 (например, эталонную последовательность в UniProt: P15328; SEQ ID NO:49), а также любую форму FOLR1 человека, которая может происходить в результате процессинга в клетке. Термин также охватывает функциональные варианты или фрагменты FOLR1 человека, включая без ограничения сплайс-варианты, аллельные варианты и изоформы, которые сохраняют одну или несколько биологических функций FOLR1 человека (т. е. охватываются варианты и фрагменты, если контекст не указывает на то, что термин применяется для обозначения только белка дикого типа). FOLR1 может быть выделен из человека или может быть получен рекомбинантным образом или с помощью синтетических способов.
[196] Термин "антитело к FOLR1" или "антитело, которое связывается с FOLR1" относится к любой форме антитела или его фрагмента, которые связываются, например специфически связываются, с FOLR1, и охватывает моноклональные антитела (включая полноразмерные моноклональные антитела), поликлональные антитела и биологически функциональные фрагменты антител, при условии, что они связываются, например специфически связываются, с FOLR1. В WO 2005/080431 и Coney et al. ((1991) Cancer Res. 51(22):6125-32), включенных в данный документ посредством ссылки, представлены иллюстративные FOLR1-связывающие последовательности, включая иллюстративные последовательности антител к FOLR1. В некоторых вариантах осуществления антитело к FOLR1, применяемое в ADC, раскрытых в данном документе, представляет собой интернализующееся антитело или интернализующийся фрагмент антитела. Фарлетузумаб и MOv19 представляют собой иллюстративные антитела к FOLR1 человека.
[197] Применяемый в данном документе термин "клеточный рецептор 1 вируса гепатита A" или "HAVCR1" относится к любой нативной форме HAVCR1 человека. Термин охватывает полноразмерную последовательность HAVCR1 (например, эталонную последовательность в UniProt: Q96D42; SEQ ID NO:50), а также любую форму HAVCR1 человека, которая может происходить в результате процессинга в клетке. Термин также охватывает функциональные варианты или фрагменты HAVCR1 человека, включая без ограничения сплайс-варианты, аллельные варианты и изоформы, которые сохраняют одну или несколько биологических функций HAVCR1 человека (т. е. охватываются варианты и фрагменты, если контекст не указывает на то, что термин применяется для обозначения только белка дикого типа). HAVCR1 может быть выделен из человека или может быть получен рекомбинантным образом или с помощью синтетических способов.
[198] Термин "антитело к HAVCR1" или "антитело, которое связывается с HAVCR1" относится к любой форме антитела или его фрагмента, которые связываются, например специфически связываются, с HAVCR1, и охватывает моноклональные антитела (включая полноразмерные моноклональные антитела), поликлональные антитела и биологически функциональные фрагменты антител, при условии, что они связываются, например специфически связываются, с HAVCR1. В работе Thomas et al. ((2016) Mol Cancer Ther. 15(12):2946-54), включенной в данный документ посредством ссылки, представлены иллюстративные HAVCR1-связывающие последовательности, включая иллюстративные последовательности антител к HAVCR1. В некоторых вариантах осуществления антитело к HAVCR1, применяемое в ADC, раскрытых в данном документе, представляет собой интернализующееся антитело или интернализующийся фрагмент антитела.
[199] Применяемый в данном документе термин " рецептор Kit фактора роста тучных/стволовых клеток" или "KIT" относится к любой нативной форме KIT человек. Термин охватывает полноразмерную последовательность KIT (например, эталонную последовательность в UniProt: P10721; SEQ ID NO:51), а также любую форму KIT человека, которая может происходить в результате процессинга в клетке. Термин также охватывает функциональные варианты или фрагменты KIT человека, включая без ограничения сплайс-варианты, аллельные варианты и изоформы, которые сохраняют одну или несколько биологических функций KIT человека (т. е. охватываются варианты и фрагменты, если контекст не указывает на то, что термин применяется для обозначения только белка дикого типа). KIT может быть выделен из человека или может быть получен рекомбинантным образом или с помощью синтетических способов.
[200] Термин "антитело к KIT" или "антитело, которое связывается с KIT" относится к любой форме антитела или его фрагмента, которые связываются, например специфически связываются, с KIT, и охватывает моноклональные антитела (включая полноразмерные моноклональные антитела), поликлональные антитела и биологически функциональные фрагменты антител, при условии, что они связываются, например специфически связываются, с KIT. В работах Shi et al. ((2016) Proc Natl Acad Sci USA 113(33):E4784-93) и Abrams et al. ((2018) Clin Cancer Res. 24(17):4297-308), включенных в данный документ посредством ссылки, представлены иллюстративные KIT-связывающие последовательности, включая иллюстративные последовательности антител к KIT. В некоторых вариантах осуществления антитело к KIT, применяемое в ADC, раскрытых в данном документе, представляет собой интернализующееся антитело или интернализующийся фрагмент антитела.
[201] Применяемый в данном документе термин "рецептор фактора роста гепатоцитов" или "MET" относится к любой нативной форме MET человека. Термин охватывает полноразмерную последовательность MET (например, эталонную последовательность в UniProt: P08581; SEQ ID NO:52), а также любую форму MET человека, которая может происходить в результате процессинга в клетке. Термин также охватывает функциональные варианты или фрагменты MET человека, включая без ограничения сплайс-варианты, аллельные варианты и изоформы, которые сохраняют одну или несколько биологических функций MET человека (т. е. охватываются варианты и фрагменты, если контекст не указывает на то, что термин применяется для обозначения только белка дикого типа). MET может быть выделен из человека или может быть получен рекомбинантным образом или с помощью синтетических способов.
[202] Термин "антитело к MET" или "антитело, которое связывается с MET" относится к любой форме антитела или его фрагмента, которые связываются, например специфически связываются, с MET, и охватывает моноклональные антитела (включая полноразмерные моноклональные антитела), поликлональные антитела и биологически функциональные фрагменты антител, при условии, что они связываются, например специфически связываются, с MET. В работе Yang et al. ((2019) Acta Pharmacol Sin.), включенной в данный документ посредством ссылки, представлены иллюстративные MET-связывающие последовательности, включая иллюстративные последовательности антител к MET. В некоторых вариантах осуществления антитело к MET, применяемое в ADC, раскрытых в данном документе, представляет собой интернализующееся антитело или интернализующийся фрагмент антитела.
[203] Применяемый в данном документе термин "муцин-16" или "MUC16" относится к любой нативной форме MUC16 человека. Термин охватывает полноразмерную последовательность MUC16 (например, эталонную последовательность в UniProt: Q8WXI7; SEQ ID NO:53), а также любую форму MUC16 человека, которая может происходить в результате процессинга в клетке. Термин также охватывает функциональные варианты или фрагменты MUC16 человека, включая без ограничения сплайс-варианты, аллельные варианты и изоформы, которые сохраняют одну или несколько биологических функций MUC16 человека (т. е. охватываются варианты и фрагменты, если контекст не указывает на то, что термин применяется для обозначения только белка дикого типа). MUC16 может быть выделен из человека или может быть получен рекомбинантным образом или с помощью синтетических способов.
[204] Термин "антитело к MUC16" или "антитело, которое связывается с MUC16" относится к любой форме антитела или его фрагмента, которые связываются, например специфически связываются, с MUC16, и охватывает моноклональные антитела (включая полноразмерные моноклональные антитела), поликлональные антитела и биологически функциональные фрагменты антител, при условии, что они связываются, например специфически связываются, с MUC16. В работе Liu et al. ((2016) Ann Oncol. 27(11):2124-30), включенной в данный документ посредством ссылки, представлены иллюстративные MUC16-связывающие последовательности, включая иллюстративные последовательности антител к MUC16. В некоторых вариантах осуществления антитело к MUC16, применяемое в ADC, раскрытых в данном документе, представляет собой интернализующееся антитело или интернализующийся фрагмент антитела.
[205] Применяемый в данном документе термин "транспортер цинка ZIP6" или "SLC39A6" относится к любой нативной форме SLC39A6 человека. Термин охватывает полноразмерную последовательность SLC39A6 (например, эталонную последовательность в UniProt:Q13433; SEQ ID NO:54), а также любую форму SLC39A6 человека, которая может происходить в результате процессинга в клетке. Термин также охватывает функциональные варианты или фрагменты SLC39A6 человека, включая без ограничения сплайс-варианты, аллельные варианты и изоформы, которые сохраняют одну или несколько биологических функций SLC39A6 человека (т. е. охватываются варианты и фрагменты, если контекст не указывает на то, что термин применяется для обозначения только белка дикого типа). SLC39A6 может быть выделен из человека или может быть получен рекомбинантным образом или с помощью синтетических способов.
[206] Термин "антитело к SLC39A6" или "антитело, которое связывается с SLC39A6" относится к любой форме антитела или его фрагмента, которые связываются, например специфически связываются, с SLC39A6, и охватывает моноклональные антитела (включая полноразмерные моноклональные антитела), поликлональные антитела и биологически функциональные фрагменты антител, при условии, что они связываются, например специфически связываются, с SLC39A6. В работе Sussman et al. ((2014) Mol Cancer Ther. 13(12):2991-3000), включенной в данный документ посредством ссылки, представлены иллюстративные SLC39A6-связывающие последовательности, включая иллюстративные последовательности антител к SLC39A6. В некоторых вариантах осуществления антитело к SLC39A6, применяемое в ADC, раскрытых в данном документе, представляет собой интернализующееся антитело или интернализующийся фрагмент антитела.
[207] Применяемый в данном документе термин "белок 4, подобный транспортеру холина" или "SLC44A4" относится к любой нативной форме SLC44A4 человека. Термин охватывает полноразмерную последовательность SLC44A4 (например, эталонную последовательность в UniProt: Q53GD3; SEQ ID NO:55), а также любую форму SLC44A4 человека, которая может происходить в результате процессинга в клетке. Термин также охватывает функциональные варианты или фрагменты SLC44A4 человека, включая без ограничения сплайс-варианты, аллельные варианты и изоформы, которые сохраняют одну или несколько биологических функций SLC44A4 человека (т. е. охватываются варианты и фрагменты, если контекст не указывает на то, что термин применяется для обозначения только белка дикого типа). SLC44A4 может быть выделен из человека или может быть получен рекомбинантным образом или с помощью синтетических способов.
[208] Термин "антитело к SLC44A4" или "антитело, которое связывается с SLC44A4" относится к любой форме антитела или его фрагмента, которые связываются, например специфически связываются, с SLC44A4, и охватывает моноклональные антитела (включая полноразмерные моноклональные антитела), поликлональные антитела и биологически функциональные фрагменты антител, при условии, что они связываются, например специфически связываются, с SLC44A4. В работе Mattie et al. ((2016) Mol Cancer Ther. 15(11):2679-87), включенной в данный документ посредством ссылки, представлены иллюстративные SLC44A4-связывающие последовательности, включая иллюстративные последовательности антител к SLC44A4. В некоторых вариантах осуществления антитело к SLC44A4, применяемое в ADC, раскрытых в данном документе, представляет собой интернализующееся антитело или интернализующийся фрагмент антитела.
[209] Применяемый в данном документе термин "металлоредуктаза STEAP1" или "STEAP1" относится к любой нативной форме STEAP1 человека. Термин охватывает полноразмерную последовательность STEAP1 (например, эталонную последовательность в UniProt: Q9UHE8; SEQ ID NO:56), а также любую форму STEAP1 человека, которая может происходить в результате процессинга в клетке. Термин также охватывает функциональные варианты или фрагменты STEAP1 человека, включая без ограничения сплайс-варианты, аллельные варианты и изоформы, которые сохраняют одну или несколько биологических функций STEAP1 человека (т. е. охватываются варианты и фрагменты, если контекст не указывает на то, что термин применяется для обозначения только белка дикого типа). STEAP1 может быть выделен из человека или может быть получен рекомбинантным образом или с помощью синтетических способов.
[210] Термин "антитело к STEAP1" или "антитело, которое связывается с STEAP1" относится к любой форме антитела или его фрагмента, которые связываются, например специфически связываются, с STEAP1, и охватывает моноклональные антитела (включая полноразмерные моноклональные антитела), поликлональные антитела и биологически функциональные фрагменты антител, при условии, что они связываются, например специфически связываются, с STEAP1. В WO 2008/052187, включенной в данный документ посредством ссылки, представлены иллюстративные STEAP1-связывающие последовательности, включая иллюстративные последовательности антител к STEAP1. В некоторых вариантах осуществления антитело к STEAP1, применяемое в ADC, раскрытых в данном документе, представляет собой интернализующееся антитело или интернализующийся фрагмент антитела.
[211] Применяемый в данном документе термин "специфический" "специфически связывает" или "связывается специфическим образом" относится к реакции связывания между антителом или антигенсвязывающим фрагментом (например, антителом к HER2 ) и антигеном-мишенью (например, HER2) в неоднородной популяции белков и других биологических молекул. Антитела можно тестировать в отношении специфичности связывания путем сравнения связывания с соответствующим антигеном со связыванием с нерелевантным антигеном или смесью антигенов при определенном наборе условий. Если антитело связывается с соответствующим антигеном с аффинностью, прерывающей в по меньшей мере 2, 5, 7 и предпочтительно 10 или более раз, аффинность нерелевантного антигена или смеси антигенов, то считается, что оно является специфическим. "Специфическое антитело" или "мишень-специфическое антитело" представляет собой антитело, которое связывается только с антигеном-мишенью (например, HER2), но не связывается (или проявляет минимальное связывание) с другими антигенами. В определенных вариантах осуществления антитело или антигенсвязывающий фрагмент, которые специфически связывают антиген-мишень (например, HER2), характеризуются KD, составляющей менее 1×10-6 M, менее 1×10-7 M, менее 1×10-8 M, менее 1×10-9 M, менее 1×10-10 M, менее 1×10-11 M, менее 1×10-12 M или менее 1×10-13 M. В некоторых вариантах осуществления KD составляет от 1 пМ до 500 пМ. В некоторых вариантах осуществления KD составляет от 500 пМ до 1 мкМ, от 1 мкМ до 100 нМ или от 100 мМ до 10 нМ.
[212] Термин "эпитоп" относится к части антигена, которую может распознавать антитело или специфически связываться с ней. Если антиген представляет собой полипептид, эпитопы могут быть образованы из смежных аминокислот или несмежных аминокислот, приводимых в соприкосновение за счет третичной укладки полипептида. Эпитоп, связываемый антителом, может быть идентифицирован с применением любой методики картирования эпитопов, известной из уровня техники, включая рентгеноструктурную кристаллографию для идентификации эпитопов путем непосредственной визуализации комплекса антиген-антитело, а также отслеживания связывания антитела с фрагментами или мутированными вариантами антигена или отслеживание доступа растворителя к разным частям антитела и антигена. Иллюстративные стратегии, применяемые для картирования эпитопов антитела, включают без ограничения олигопептидное сканирование на основе массива, ограниченный протеолиз, сайт-направленный мутагенез, высокопроизводительное картирование на основе мутагенеза, водород-дейтериевый обмен и масс-спектрометрию (см., например, Gershoni et al. (2007) 21:145-56; и Hager-Braun and Tomer (2005) Expert Rev Proteomics 2:745-56).
[213] Для определения антител, совместно связывающих идентичные или перекрывающиеся эпитопы, также можно применять конкурентное связывание и эпитоп-специфическую сортировку. Конкурентное связывание может оцениваться с применением анализ перекрестного блокирования, такого как анализ, описанный в "Antibodies, A Laboratory Manual", Cold Spring Harbor Laboratory, Harlow and Lane (1ое изд. 1988, 2ое изд. 2014). В некоторых вариантах осуществления конкурентное связывание идентифицируют, если тестируемое антитело или связывающий белок снижают связывание эталонного антитела или связывающего белка с антигеном-мишенью, таким как HER2 (например, связывающего белка, содержащего CDR и/или вариабельные домены, выбранные из идентифицированных в таблицах 2-4), на по меньшей мере приблизительно 50% в анализе перекрестного блокирования (например, на 50%, 60%, 70%, 80%, 90%, 95%, 99%, 99,5% или больше, или на любой процент между ними) и/или наоборот. В некоторых вариантах осуществления конкурентное связывание может быть обусловлено общими или подобными (например, частично перекрывающимися) эпитопами или обусловлено стерическим несоответствием, при котором антитела или связывающие белки связываются на близкорасположенных эпитопах (см., например, Tzartos, Methods in Molecular Biology (Morris, ed. (1998) vol. 66, pp. 55-66)). В некоторых вариантах осуществления конкурентное связывание можно использовать для сортировки групп связывающих белков, которые имеют аналогичные эпитопы. Например, связывающие белки, которые конкурируют за связывание, могут быть "отсортированы" как группа связывающих белков, которые имеют перекрывающиеся или близкорасположенные эпитопы, в то время как белки, которые не конкурируют, помещают в отдельную группу связывающих белков, которые не имеют перекрывающихся или близкорасположенных эпитопов.
[214] Термин "kon" или "ka" относится к константе скорости ассоциации в случае ассоциации антитела с антигеном с образованием комплекса антитело/антиген. Скорость может быть определена с применением стандартных анализов, таких как поверхностный плазмонный резонанс, биослойная инферометрия или ELISA-анализ.
[215] Термин "koff" или "kd" относится к константе скорости диссоциации в случае диссоциации антитела из комплекса антитело/антиген. Скорость может быть определена с применением стандартных анализов, таких как поверхностный плазмонный резонанс, биослойная инферометрия или ELISA-анализ.
[216] Термин "KD" относится к равновесной константе диссоциации для конкретного взаимодействия антитело-антиген. KD рассчитывают как ka/kd. Скорость может быть определена с применением стандартных анализов, таких как поверхностный плазмонный резонанс, биослойная инферометрия или ELISA-анализ.
[217] Термин "p", или "нагрузка лекарственным средством", или "отношение лекарственное средство:антитело", или "соотношение лекарственного средства и антитела", или "DAR" относится к числу фрагментов-лекарственных средств на антитело или антигенсвязывающий фрагмент, т. е. нагрузке лекарственным средством, или количеству фрагментов -L-D на антитело или антигенсвязывающий фрагмент (Ab) в ADC формулы (I). В ADC, содержащих фрагмент-лекарственное средство, представляющий собой модулятор сплайсинга, "p" относится к числу соединений, представляющих собой модулятор сплайсинга, связанных с антителом или антигенсвязывающим фрагментом. Например, если с антителом или антигенсвязывающим фрагментом связаны два соединения, представляющие собой модулятор сплайсинга (например, два соединения, каждое из которых имеет структуру D1), p=2. В композициях, содержащих множественные копии ADC формулы (I), "среднее значение p" относится к среднему числу фрагментов -L-D на антитело или антигенсвязывающий фрагмент, также называемому "средняя нагрузка лекарственным средством".
[218] "Линкер" или "линкерный фрагмент" применяют в данном документе для обозначения любого химического фрагмента, который способен ковалентно соединить соединение, обычно фрагмент-лекарственное средство, такой как фрагмент-лекарственное средство, представляющий собой модулятор сплайсинга, с другим фрагментом, таким как антитело или антигенсвязывающий фрагмент. Линкеры могут быть восприимчивыми или в значительной степени устойчивыми к индуцированному кислотой расщеплению, индуцированному пептидазой расщеплению, расщеплению на основе света, индуцированному эстеразой расщеплению и/или расщеплению дисульфидной связи в условиях, при которых соединение или антитело остается активным.
[219] Термин "средство" применяют в данном документе для обозначения химического соединения, смеси химических соединений, биологической макромолекулы или экстракта, полученного из биологических материалов. Термин "терапевтическое средство" или "лекарственное средство" относится к средству, которое способно модулировать биологический процесс и/или обладает биологической активностью. Соединения, представляющие собой модулятор сплайсинга, описанные в данном документе, представляю собой иллюстративные терапевтические средства.
[220] Термин "химиотерапевтическое средство" или "противораковое средство" применяют в данном документе для обозначения средств, которые являются эффективными в лечении рака, независимо от механизма действия. Подавление метастазирования или ангиогенеза зачастую является характерной особенностью химиотерапевтического средства. Химиотерапевтические средства включают антитела, биологические молекулы и малые молекулы и охватывают соединения, представляющие собой модулятор сплайсинга, описанные в данном документе. Химиотерапевтическое средство может быть цитотоксическим или цитостатическим средством. Термин "цитостатическое средство" относится к средству, которое ингибирует или подавляет клеточный рост и/или размножение клеток. Термин "цитотоксическое средство" относится к веществу, которое вызывает гибель клеток в первую очередь за счет вмешательства в активность экспрессии и/или функционирование клетки.
[221] Применяемые в данном документе термины "модулятор сплайсинга", "модулятор сплайсосомы" или "сплайс-модулятор" относятся к соединениям, которые характеризуются противораковой активностью за счет взаимодействия с компонентами сплайсосомы. В некоторых вариантах осуществления модулятор сплайсинга изменяет скорость или форму сплайсинга в клетке-мишени. Модуляторы сплайсинга, которые действуют как ингибирующие средства, например, способны к уменьшению неконтролируемой клеточной пролиферации. В некоторых вариантах осуществления модуляторы сплайсинга могут проявлять свое действие путем связывания с комплексом сплайсосомы SF3b. Такие модуляторы могут быть природными соединениями или синтетическими соединениями. Неограничивающие примеры модуляторов сплайсинга и категории таких модуляторов включают пладиенолид (например, пладиенолид D или пладиенолид B), производные пладиенолида (например, производные пладиенолида D или пладиенолида B), гербоксдиен, производные гербоксдиена, сплайсостатин, производные сплайсостатина, судемицин или производные судемицина. Применяемые в данном документе термины "производное" и "аналог" при ссылке на модулятор сплайсинга и т. п. означают любое такой соединение, которое сохраняет по сути такую же, аналогичную или улучшенную биологическую функцию или активность, что и исходное соединение, но имеет измененную химическую или биологическую структуру. В некоторых вариантах осуществления модулятор сплайсинга представляет собой пладиенолид или производное пладиенолида.
[222] Применяемое в данном документе "производное пладиенолида" относится к соединению, которое является структурно связанным с представителем семейства природных продуктов, известных как пладиенолиды, и которое сохраняет одну или несколько биологических функций исходного соединения. Пладиенолиды были впервые идентифицированы у бактерий Streptomyces platensis (Mizui et al. (2004) J Antibiot. 57:188-96) как потенциальные цитотоксические вещества, и они приводят к остановке клеточного цикла на фазе G1 и G2/M клеточного цикла (например, Bonnal et al. (2012) Nat Rev Drug Dis 11:847-59). В природе встречается семь пладиенолидов, пладиенолид A-G (Mizui et al. (2004) J Antibiot. 57:188-96; Sakai et al. (2004) J Antibiotics 57:180-7). В патентах США №№ 7884128 и 7816401 описаны иллюстративные способы синтеза пладиенолида B и D, и каждый из них включен в данный документ посредством ссылки в случае таких способов. Синтез пладиенолида B и D можно также осуществлять с применением иллюстративных способов, описанных в Kanada et al. ((2007) Angew Chem Int Ed. 46:4350-5). В документе Kanada et al. и публикации международной заявки № WO 2003/099813 описаны иллюстративные способы синтеза E7107 (D11) (соединение 45 из WO 2003/099813) из пладиенолида D (11107D из WO 2003/099813). Соответствующий патент США представлен под № 7550503, выданный Kotake et al. Каждая из этих ссылок включена в данный документ для описанных способов синтеза.
[223] Применяемый в данном документе "фрагмент-лекарственное средство, представляющий собой модулятор сплайсинга" относится к компоненту ADC или композиции, который предусматривает структуру соединения, представляющего собой модулятор сплайсинга, например, компонент-модулятор сплайсинга (D) в ADC формулы (I) или в композиции, содержащей -L-D.
[224] Применяемая в данном документе "сплайсосома" относится к рибонуклеопротеиновому комплексу, который удаляет интроны из одного или нескольких сегментов РНК, таких сегменты pre-mRNA.
[225] Термин "гомолог" относится к молекуле, которая проявляет гомологию с другой молекулой, например, имеет последовательности химических остатков, которые являются такими же или аналогичными в соответствующих положениях.
[226] Применяемый в данном документе термин "ингибировать" или "ингибирование" означает снижение измеряемого количества и может включать, но это не обязательное требуется, полное предотвращение или ингибирование.
[227] Термин "отрицательные по мишени", "отрицательные по антигену-мишени" или "отрицательные по антигену" относится к отсутствию экспрессии антигена-мишени в клетке или ткани. Термин "положительные по мишени", "положительные по антигену-мишени" или "положительные по антигену" относится к присутствию экспрессии антигена-мишени. Например, клетка или клеточная линия, которые не экспрессируют антиген-мишень, могут быть описаны как отрицательные по мишени, при этом клетка или клеточная линия, которые экспрессируют антиген-мишень, могут быть описаны как положительные по мишени.
[228] Термин "неспецифическое уничтожение" или "неспецифический эффект" относится к уничтожению отрицательных по мишени клеток в присутствии положительных по мишени клеток, где уничтожение отрицательных по мишени клеток не наблюдается в отсутствие положительных по мишени клеток. Межклеточный контакт или по меньшей мере близость между положительными по мишени и отрицательными по мишени клетками делает возможным неспецифическое уничтожение. Данный тип уничтожения отличим от "нецелевого уничтожения", которое относится к неизбирательному уничтожению отрицательных по мишени клеток. "Нецелевое уничтожение" может наблюдаться в отсутствие положительных по мишени клеток.
[229] Термины "неопластическое нарушение" и "рак" используются в данном документе взаимозаменяемо для обозначения присутствия клеток, обладающих характеристиками, типичными для вызывающих рак клеток, такими как неконтролируемая пролиферация, бессмертие, метастатический потенциал, быстрый рост и скорость пролиферации и/или определенные морфологические признаки. Зачастую раковые клетки могут быть в форме опухоли или массы, но такие клетки могут существовать по отдельности в субъекте или могут циркулировать в кровотоке как независимые клетки, такие как лейкозные или лимфомные клетки. Термины "неопластическое нарушение" и "рак" включают все типы рака и метастазы рака, включая гематологическое злокачественное новообразование, солидные опухоли, саркомы, карциномы и другие виды рака, представляющие собой солидные опухоли и не являющиеся солидными опухолями. Гематологические злокачественные новообразования могут включать B-клеточные злокачественные новообразования, виды рака крови (лейкозы), виды рака плазматических клеток (миеломы, например, множественную миелому) или виды рака лимфатических узлов (лимфомы). Иллюстративные B-клеточные злокачественные новообразования включают хронический лимфоцитарный лейкоз (CLL), фолликулярную лимфому, лимфому из клеток мантийной зоны и диффузную В-крупноклеточную лимфому. Лейкозы могут включать острый лимфобластный лейкоз (ALL), острый миелогенный лейкоз (AML), хронический лимфоцитарный лейкоз (CLL), хронический миелогенный лейкоз (CML), хронический миеломоноцитарный лейкоз (CMML), острый моноцитарный лейкоз (AMoL) и т. д. Лимфомы могут включать лимфому Ходжкина и неходжкинскую лимфому. Другие гематологические злокачественные новообразования могут включать миелодиспластический синдром (MDS). Солидные опухоли могут включать карциномы, такие как аденокарцинома, например, рак молочной железы, рак поджелудочной железы, рак предстательной железы, рак толстой кишки или колоректальный рак, рак легкого, рак желудка, рак шейки матки, рак эндометрия, рак яичника, холангиокарциному, глиому, меланому и т. д.
[230] Термины "опухоль" и "неоплазма" относятся к любой массе ткани, которая образуется в результате избыточного роста или пролиферации клеток, либо доброкачественной, либо злокачественной, включая предраковые поражения.
[231] Термины "опухолевая клетка" и "неопластическая клетка" используются взаимозаменяемо и относятся к отдельным клеткам или к общей популяции клеток, полученной из опухоли или неоплазмы, включая как неканцерогенные клетки, так и раковые стволовые клетки. Применяемый в данном документе термин "опухолевая клетка" будет модифицирован с помощью термина "неканцерогенная", когда он относится исключительно к тем опухолевым клеткам, у которых отсутствует способность обновляться и дифференцироваться, чтобы отличать эти опухолевые клетки от раковых стволовых клеток.
[232] Термины "субъект" и "пациент" используются взаимозаменяемо в данном документе для обозначения любого животного, такого как любое млекопитающее, включая без ограничения человека, отличных от человека приматов, грызунов и т. п. В некоторых вариантах осуществления млекопитающее является мышью. В некоторых вариантах осуществления млекопитающее является человеком. В некоторых вариантах осуществления субъект является мышью. В некоторых вариантах осуществления субъект является человеком.
[233] Термин "совместное введение" или введение "в комбинации с" одним или несколькими терапевтическими средствами включает одновременное введение и последовательное введение в любом порядке.
[234] "Фармацевтическая композиция" относится к препарату, который находится в такой форме, которая допускает введение и впоследствии обеспечивает предусмотренную биологическую активность активного(-ых) ингредиента(-ов) и/или достижение терапевтического эффекта и которая не содержит дополнительных компонентов, которые являются недопустимо токсичными для субъекта, которому состав будет вводиться. Фармацевтическая композиция может быть стерильной.
[235] "Фармацевтическое вспомогательное вещество" предусматривает материал, такой как адъювант, носитель, pH-регулирующие и буферные средства, регулирующие тоничность средства, смачивающие средства, консервант и т. п.
[236] "Фармацевтически приемлемый" означает одобренный или тот, который может быт одобрен, органом регулирования Федерального правительства или правительства штата, или перечисленный в фармакопее США или другой общепризнанной фармакопее для применения у животных и, более конкретно, у человека.
[237] "Фармацевтически приемлемая соль" представляет собой соль, которая сохраняет требуемую биологическую активность исходного соединения и не вызывает нежелательных токсикологических эффектов. Примеры таких солей представляют собой: (a) соли присоединения кислоты, образованные с неорганическими кислотами, например, хлористоводородной кислотой, бромистоводородной кислотой, серной кислотой, фосфорной кислотой, азотной кислотой и т. п.; и соли, образованные с органическими кислотами, например, уксусной кислотой, щавелевой кислотой, винной кислотой, янтарной кислотой, малеиновой кислотой, фумаровой кислотой, глюконовой кислотой, лимонной кислотой, яблочной кислотой, аскорбиновой кислотой, бензойной кислотой, дубильной кислотой, пальмитиновой кислотой, альгиновой кислотой, полиглутаминовой кислотой, нафталинсульфоновой кислотой, метансульфоновой кислотой, п-толуолсульфоновой кислотой, нафталиндисульфоновой кислотой, полигалактуроновой кислотой и т. п.; и (b) соли, образованные из элементарных анионов, таких как хлор, бром и йод. См. например, Haynes et al. "Commentary: Occurrence of Pharmaceutically Acceptable Anions and Cations in the Cambridge Structural Database," J Pharmaceutical Sciences, vol. 94, no. 10 (2005), и Berge et al. "Pharmaceutical Salts," J Pharmaceutical Sciences, vol. 66, no. 1 (1977), которые
включены в данный документ посредством ссылки.
[238] Применяемый в данном документе термин "эффективное количество" относится к количеству соединения, ADC или композиции, описанных в данном документе (например, модулятора сплайсинга или ADC), которое является достаточным для осуществления специально поставленной цели, например, для осуществления терапевтического эффекта после введения, такого как снижение скорости опухолевого роста или объема опухоли, уменьшение симптома рака или некоторые другие признаки эффективности лечения. Эффективное количество можно определять традиционным образом относительно поставленной цели. Термин "терапевтически эффективное количество" относится к количеству соединения, ADC или композиции, описанных в данном документе, которое является эффективным для обнаруживаемого уничтожения, снижения и/или подавления роста или распространения опухолевых клеток, размера или числа опухолей и/или другого показателя уровня, стадии, прогрессирования и/или тяжести рака. Терапевтически эффективное количество может варьироваться в зависимости от предусмотренного применения (in vitro или in vivo) или субъекта и болезненного состояния, подлежащих лечению, например, массы и возраста субъекта, тяжести болезненного состояния, способа введения и т. п., что может легко определить специалист в данной области техники. Термин также применим к дозе, которая будет индуцировать конкретный ответ в клетках-мишенях, например, подавление клеточного роста. Конкретная доза может варьироваться, например, в зависимости от конкретной фармацевтической композиции, субъекта и его возраста и состояния здоровья в настоящее время или рисков, связанных с состоянием здоровья, схемы введения, которой будут следовать, тяжести заболевания, того, вводят ли ее в комбинации с другими средствами, времени введения, ткани, в которую ее вводят, и физической системы доставки, в которой она переносится. В случае рака терапевтически эффективное количество ADC может снижать число раковых клеток, уменьшать размер опухоли, подавлять (например, замедлять или останавливать) метастазирование опухоли, подавлять (например, замедлять или останавливать) опухолевый рост и/или ослаблять один или несколько симптомов.
[239] "Профилактически эффективное количество" относится к количеству, при дозировках и в течение необходимых периодов времени, эффективному в достижении требуемого профилактического результата. Как правило, поскольку профилактическую дозу применяют у субъектов до проявления заболевания или на более ранней стадии заболевания, профилактически эффективное количество будет меньшим, чем терапевтически эффективное количество.
[240] Применяемые в данном документе "лечить" или "терапевтический" и грамматически родственные термины относятся к любому улучшению любого последствия заболевания, такому как продление выживания, меньшие клинические проявления и/или ослабление побочных эффектов, которые являются результатом альтернативного терапевтического способа воздействия. Как легко понять из уровня техники, полное устранение заболевания охватывается лечебным действием, но не требуется для него. Применяемые в данном документе "лечение" или "лечить" относятся к введению описанного ADC или композиции субъекту, например пациенту. Лечение может представлять собой излечение, заживление, смягчение, ослабление, изменение, устранение, облегчение, временное ослабление, улучшение или воздействие на нарушение, симптомы нарушения или предрасположенность к нарушению, например раку. В некоторых вариантах осуществления в дополнение к лечению субъекта, у которого имеется состояние, композицию, раскрытую в данном документе, также можно давать профилактически для предотвращения или снижения вероятности развития данного состояния.
[241] В некоторых вариантах осуществления применяют меченый ADC. Подходящие "метки" включают радионуклиды, ферменты, субстраты, кофакторы, ингибиторы, флуоресцентные фрагменты, хемилюминесцентные фрагменты, магнитные частицы и т. п.
[242] Под применяемым в данном документе "белком" подразумевают по меньшей мере две ковалентно связанные аминокислоты. Термин охватывает полипептиды, олигопептиды и пептиды. В некоторых вариантах осуществления две или более ковалентно связанные аминокислоты связаны посредством пептидной связи. Белок может быть составлен из встречающихся в природе аминокислот и пептидных связей, например, когда белок получают рекомбинантным образом с применением систем экспрессии и клеток-хозяев. В качестве альтернативы белок может включать синтетические аминокислоты (например, гомофенилаланин, цитруллин, орнитин и норлейцин) или пептидомиметические структуры, т. е."пептидные или белковые аналоги," такие как пептоиды. Пептоиды представляют собой иллюстративный класс пептидомиметиков, боковые цепи которых прикреплены к атому азота пептидного остова, а не к α-атомам углерода (как они расположены в аминокислотах), и обладают иным образованием водородных связей и характеристиками конформации по сравнению с пептидами (см., например, Simon et al. (1992) Proc Natl Acad Sci. USA 89:9367). В связи с этим, пептоиды могут быть устойчивыми к протеолизу или другим физиологическим условиям или условиям хранения, и эффективными при проникновении через клеточные мембраны. Такие синтетические аминокислоты можно включать, в частности, когда антитело синтезируется in vitro с помощью общепринятых способов, широко известных из уровня техники. Кроме того, может применяться любая комбинация пептидомиметических, синтетических и встречающихся в природе остатков/структур. "Аминокислота" также включает иминокислотные остатки, такие как пролин и гидроксипролин. "R группа" или "боковая цепь" аминокислоты могут находиться в одной из (L)- или (S)-конфигурации. В специфическом варианте осуществления аминокислоты находятся в (L)- или (S)-конфигурации.
[243] "Рекомбинантный белок" представляет собой белок, полученный с применением рекомбинантных методик с применением любых методик и способов, известных из уровня техники, т. е. благодаря экспрессии рекомбинантной нуклеиновой кислоты. Способы и методики получения рекомбинантных белков широко известны из уровня техники.
[244] "Выделенный" белок не сопровождается по меньшей мере некоторой частью материала, с которым он в норме ассоциирован в природном состоянии, например, составляет по меньшей мере приблизительно 5% или по меньшей мере приблизительно 50% по весу от общего белка в указанном образце. Известно, что выделенный белок может составлять от 5% до 99,9% по весу от общего содержания белка в зависимости от обстоятельств. Например, белок может производиться в значительно более высокой концентрации благодаря применению индуцибельного промотора или высокоэкспрессионного промотора, за счет чего белок производится на повышенных уровнях концентрации. Определение включает продуцирование антитела в самых разнообразных организмах и/или клетках-хозяевах, которые известны из уровня техники.
[245] В случае аминокислотных последовательностей идентичность и/или сходство последовательности могут быть определены с применением стандартных методик, известных из уровня техники, включая без ограничения алгоритм локальной идентичности последовательностей из Smith and Waterman (1981) Adv Appl Math. 2:482, алгоритм выравнивания для определения идентичности последовательностей из Needleman and Wunsch (1970) J Mol Biol. 48:443, способ поиска сходства из Pearson and Lipman (1988) Proc Nat Acad Sci. USA 85:2444, компьютеризированные реализации таких алгоритмов (GAP, BESTFIT, FASTA и TFASTA в пакете программного обеспечения Wisconsin Genetics, Genetics Computer Group, 575 Science Drive, Мэдисон, Висконсин, США), программу анализа последовательностей Best Fit, описанную в работе Devereux et al. (1984) Nucl Acid Res. 12:387-95, предпочтительно с применением установок по умолчанию, или путем визуального просмотра. Предпочтительно, процент идентичность рассчитывают с помощью FastDB на основе следующих параметров: штраф за несовпадение - 1; штраф за гэп - 1; штраф за удлинение гэпа- 0,33 и штраф за соединение - 30 ("Current Methods in Sequence Comparison and Analysis," Macromolecule Sequencing and Synthesis, Selected Methods and Applications, pp. 127-149 (1988), Alan R. Liss, Inc).
[246] Примером применимого алгоритма является PILEUP. PILEUP создает выравнивание множественных последовательностей из группы родственных последовательностей с применением прогрессивных попарных выравниваний. Он также может строить дерево, показывающее кластеризующие взаимосвязи, применяемые для создания выравнивания. PILEUP использует упрощение способа прогрессивного выравнивания из Feng & Doolittle (1987) J Mol Evol. 35:351-60; причем способ подобен способу, описанному в работе Higgins and Sharp (1989) CABIOS 5:151-3. Применимые параметры в PILEUP включают штраф за введение гэпа по умолчанию - 3,00, штраф за удлинение гэпа по умолчанию - 0,10 и оцениваемые концевые гэпы.
[247] Другим примером применимого алгоритма является алгоритм BLAST, описанный в Altschul et al. (1990) J Mol Biol. 215:403-10; Altschul et al. (1997) Nucl Acid Res. 25:3389-402; и Karin et al. (1993) Proc Natl Acad Sci. USA 90:5873-87. Особенно применимой программой BLAST является программа WU-BLAST-2, которую получили из Altschul et al. (1996) Methods in Enzymology 266:460-80. WU-BLAST-2 применяет несколько параметров поиска, большинство из которых установлены как значения по умолчанию. Регулируемые параметры установлены на следующие значения: длина перекрывания=l, доля перекрывания=0,125, пороговая длина слова (T)=II. Параметры HSP S и HSP S2 представляют собой динамические значения и устанавливаются программой самостоятельно в зависимости от состава конкретной последовательности и состава конкретной базы данных, относительно которой производится поиск представляющей интерес последовательности; однако значения можно корректировать для повышения чувствительности.
[248] Дополнительным применимым алгоритмом является BLAST с введением гэпов, сообщаемый в работе Altschul et al. (1997) Nucl Acid Res. 25:3389-402. BLAST с введением гэпов применяет матрицу замен BLOSUM-62; пороговый параметр T, установленный на 9; метод "двух совпадений" для запуска продлений без гэпов, штраф за удлинение гэпов на k составляет 10+k; Xu установлен на 16, и Xg установлен на 40 для стадии поиска в базе данных и на 67 для стадии вывода результатов алгоритмов. Выравнивания с введением гэпов запускаются при показателе, соответствующем приблизительно 22 битам.
[249] Обычно аминокислотная гомология, сходство или идентичность между белками, раскрытыми в данном документе и их вариантами, включая варианты антигенов-мишеней (таких как HER2, CD138, EPHA2, MSLN, FOLH1, CDH6, CEACAM5, CFC1B, ENPP3, FOLR1, HAVCR1, KIT, MET, MUC16, SLC39A6, SLC44A4, или STEAP1) и варианты вариабельных доменов антител (включая отдельные варианты CDR), составляет по меньшей мере 80% с последовательностями, изображенными в данном документе, например, показатели гомологии или идентичности составляют по меньшей мере 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, почти 100% или 100%.
[250] Аналогичным образом "процент (%) идентичности последовательности нуклеиновой кислоты " по отношению к последовательности нуклеиновой кислоты антител и других белков, идентифицированных в данном документе, определяют как процент нуклеотидных остатков в кандидатной последовательности, которые идентичны нуклеотидным остаткам в кодирующей последовательности антигенсвязывающего белка. В специфическом способе используется модуль BLASTN из WU-BLAST-2, установленный на параметры по умолчанию, при этом длина перекрывания и доля перекрывания установлены на 1 и 0,125 соответственно.
[251] Поскольку сайт или область введения вариации аминокислотной последовательности предварительно определены, то мутацию саму по себе не нужно предварительно определять. Например, чтобы оптимизировать свойства мутации в заданном сайте, в кодоне- или области-мишени можно выполнять случайный мутагенез, а экспрессированные варианты CDR антигенсвязывающих белков подвергать скринингу в отношении оптимальной комбинации требуемой активности. Широко известны методики получения мутаций, представляющих собой замены в предварительно определенных сайтах в ДНК с известной последовательностью, например, мутагенез с праймером MI3 и ПЦР-мутагенез.
[252] Применяемые в данном документе "алкил" или "алкильная группа" означают углеводород с неразветвленной, разветвленной или циклической цепью, который является полностью насыщенным. В определенных вариантах осуществления алкильные группы могут содержать 1-8 атомов углерода ("C1-C8алкил"). В определенных вариантах осуществления алкильные группы могут содержать 1-6 атомов углерода ("C1-C6алкил"). В определенных вариантах осуществления алкильные группы содержат 1-3 атома углерода. В еще одних вариантах осуществления алкильные группы содержат 2-3 атома углерода, и в других вариантах осуществления алкильные группы содержат 1-2 атома углерода.
[253] Применяемый в данном документе "алкилалкокси" означает алкильную группу, замещенную алкоксигруппой. Применяемый в данном документе термин "алкокси" относится к алкильной группе, как определено ранее, присоединенной к основной углеродной цепи через атом кислорода ("алкокси").
[254] Применяемый в данном документе "алкиламино" означает алкильную группу, замещенную аминогруппой. Применяемый в данном документе "амино" относится к -NH2, -NH(алкил) или -N(алкил)(алкил).
[255] Применяемый в данном документе "алкилгидрокси" означает алкильную группу, замещенную аминогруппой. Применяемые в данном документе "гидрокси" или "гидроксил" относятся к -OH.
[256] "Алкилен" относится к двухвалентному радикалу алкильной группы. Например, -CH2-, -CH2CH2-, -CH2CH2CH2-, -CH2CH2CH2CH2-, -CH2CH2CH2CH2CH2- и -CH2CH2CH2CH2CH2CH2- относится к метилену, этилену, н-пропилену, н-бутилену, н-пентилену и н-гексилену соответственно.
[257] Применяемый в данном документе "карбоцикл" включает как ароматическую (например, арильную), так и неароматическую (например, циклоалкильную) группы. В определенных вариантах осуществления карбоциклические группы содержат 3-10 атомов углерода ("3-10-членный карбоцикл"). В определенных вариантах осуществления карбоциклические группы содержат 3-8 атомов углерода ("3-8-членный карбоцикл"). В определенных вариантах осуществления карбоциклические группы содержат 3-6 атомов углерода ("3-6-членный карбоцикл"). В определенных вариантах осуществления карбоциклические группы содержат 3-5 атомов углерода ("3-5-членный карбоцикл").
[258] "Галоген" относится к радикалу любого галогена, например, -F, -Cl, -Br или -I.
[259] Применяемые в данном документе термины "гетероцикл", "гетероциклил" и "гетероциклический" означают моноциклический гетероцикл, бициклический гетероцикл или трициклический гетероцикл, содержащий по меньшей мере один гетероатом в кольце.
[260] Моноциклический гетероцикл представляет собой 3-, 4-, 5-, 6-, 7- или 8-членное кольцо, содержащее по меньшей мере один гетероатом, независимо выбранный из O, N и S. В некоторых вариантах осуществления гетероцикл представляет собой 3- или 4-членное кольцо, содержащее один гетероатом, выбранный из O, N и S. В некоторых вариантах осуществления гетероцикл представляет собой 5-членное кольцо, не содержащее двойных связей или содержащее одну двойную связь, и один, два или три гетероатома, выбранные из O, N и S. В некоторых вариантах осуществления гетероцикл представляет собой 6-, 7- или 8-членное кольцо, не содержащее двойных связей, содержащее одну или две двойные связи, и один, два или три гетероатома, выбранные из O, N и S. Иллюстративные примеры моноциклического гетероцикла включают без ограничения азетидинил, азепанил, азиридинил, диазепанил, 1,3-диоксанил, 1,3-диоксоланил, дигидропиранил (включая 3,4-дигидро-2H-пиран-6-ил), 1,3-дитиоланил, 1,3-дитианил, имидазолинил, имидазолидинил, изотиазолинил, изотиазолидинил, изоксазолинил, изоксазолидинил, морфолинил, оксадиазолинил, оксадиазолидинил, оксазолинил, оксазолидинил, пиперазинил, пиперидинил, пиранил, пиразолинил, пиразолидинил, пирролинил, пирролидинил, тетрагидрофуранил, тетрагидропиранил (включая тетрагидро-2H-пиран-4-ил), тетрагидротиенил, тиадиазолинил, тиадиазолидинил, тиазолинил, тиазолидинил, тиоморфолинил, 1,1-диоксидотиоморфолинил (тиоморфолинсульфон), тиопиранил и тритианил.
[261] Бициклические гетероциклы по настоящему изобретению могут включать моноциклический гетероцикл, конденсированный с арильной группой, или моноциклический гетероцикл, конденсированный с моноциклическим циклоалкилом, или моноциклический гетероцикл, конденсированный с моноциклическим циклоалкенилом, или моноциклический гетероцикл, конденсированный с моноциклическим гетероциклом, имеющие в общей сложности 5-12 атомов в кольце. Примеры бициклических гетероциклов включают без ограничения, 3,4-дигидро-2H-пиранил, 1,3-бензoдиоксолил, 1,3-бензoдитиолил, 2,3-дигидро-1,4-бензoдиоксинил, 2,3-дигидро-1-бензофуранил, 2,3-дигидро-1-бензотиенил, 2,3-дигидро-1H-индолил и 1,2,3,4-тетрагидрохинолинил.
[262] Термины "гетероцикл", "гетероциклил" и "гетероциклический" охватывают гетероарилы. "Гетероарил" относится к циклическому фрагменту, содержащему одно или несколько замкнутых колец с одним или несколькими гетероатомами (кислорода, азота или серы) в по меньшей мере одном из колец, где по меньшей мере одно из колец является ароматическим, и где кольцо или кольца независимо могут быть конденсированными и/или соединенными мостиковой связью. Примеры включают без ограничения фенил, тиофенил, триазолил, пиридинил, пиримидинил, пиридазинил и пиразинил.
[263] Как описано в данном документе, соединения по настоящему изобретению могут содержать "необязательно замещенные" фрагменты. В целом, термин "замещенный", независимо от того предшествует ли ему термин "необязательно" или нет, означает, что один или несколько атомов водорода в обозначенном фрагменте заменены подходящим заместителем. Если не указано иное, "необязательно замещенная группа" может иметь подходящий заместитель в каждом замещаемом положении группы, и если более одного положения в любой приведенной структуре могут быть замещены более чем одним заместителем, выбранным из указанной группы, то в каждом положении заместитель может быть либо одинаковым, либо разным. Комбинации заместителей, предусмотренные в настоящем изобретении, предпочтительно являются такими, которые приводят к образованию стабильных или химически возможных соединений.
[264] Специалист в данной области техники будет понимать, что "замещение", или "замещенный", или "отсутствует" включают неявное условие, что такое замещение или его отсутствие находятся в соответствии с допустимой валентностью замещаемого атома и заместителя, что замещение или его отсутствие приводят к стабильному соединению, например, которое не подвергается самопроизвольному преобразованию, как, например, за счет перегруппировки, циклизации, элиминации и т. д. Для целей данного изобретения гетероатомы, такие как азот, могут иметь водородные заместители и/или любые допускаемые заместители органических соединений, описанные в данном документе, которые удовлетворяют валентностям гетероатомов.
[265] "Стабильный" относится к соединениям, которые по сути не изменяются химически и/или физически при воздействии условий, обеспечивающих их получение, обнаружение и, в определенных вариантах осуществления, их извлечение, очистку и применение для обеспечения одной или нескольких целей, раскрытых в данном документе. В некоторых вариантах осуществления стабильное соединение или химически возможное соединение представляют собой соединение, которое по сути не изменяется во время хранения при температуре 40°C или меньше в отсутствие влаги или других химически активных условий в течение по меньшей мере недели. В некоторых вариантах осуществления соединения, раскрытые в данном документе, являются стабильными.
[266] Изложенные в данном документа энантиомеры могут включать "энантиомерно чистые" изомеры, которые содержат по сути один энантиомер, например, ровно 90%, 92%, 95%, 98% или 99% или более или ровно 100% одного энантиомера по конкретному асимметричному центру или центрам. "Асимметричный центр" или "хиральный центр" относятся к тетраэдрическому атому углерода, который содержит четыре различных заместителя.
[267] Соединения, описанные в данном документе, также могут содержать неприродные доли атомных изотопов по одному или нескольким атомам, которые составляют эти соединения. Например, соединения могут иметь радиоактивную метку с помощью радиоактивных изотопов, таких как, например дейтерий (2H), тритий (3H), углерод-13 (13C) или углерод-14 (14C). Подразумевается, что все изотопные варианты соединений, раскрытых в данном документе, независимо от того являются ли они радиоактивными или нет, охвачены в пределах объема настоящего изобретения. Кроме того, подразумевается, что все таутомерные формы соединений, описанных в данном документе, находятся в пределах объема заявляемого изобретения.
Конъюгаты антитела и лекарственного средства
[268] Соединения по настоящему изобретению, представляющие собой конъюгат антитела и лекарственного средства (ADC), включают соединения с противораковой активностью. В частности, соединения ADC включают антитело или антигенсвязывающий фрагмент (включая его антигенсвязывающий фрагмент), конъюгированные (т. е. ковалентно присоединенные с помощью линкера) с фрагментом-лекарственным средством (например, модулятором сплайсинга), где фрагмент-лекарственное средство, когда он не конъюгирован с антителом или антигенсвязывающим фрагментом, характеризуется цитотоксическим или цитостатическим эффектом. В различных вариантах осуществления фрагмент-лекарственное средство, когда он не конъюгирован с антителом или антигенсвязывающим фрагментом, способен связывать и/или взаимодействовать с комплексом сплайсосомы SF3b. В различных вариантах осуществления фрагмент-лекарственное средство, когда он не конъюгирован с антителом или антигенсвязывающим фрагментом, способен модулировать сплайсинг РНК in vitro и/или in vivo. В различных вариантах осуществления за счет целенаправленного воздействия на сплайсинг РНК фрагменты-лекарственные средства и ADC, раскрытые в данном документе, представляют собой активные антипролиферативные средства. В различных вариантах осуществления фрагменты-лекарственные средства и ADC, раскрытые в данном документе, могут целенаправленно воздействовать как на активно делящиеся, так и на покоящиеся клетки.
[269] В различных вариантах осуществления настоящее изобретение по меньшей мере частично основано на обнаружении того, что определенные биологически активные модуляторы сплайсинга могут обеспечивать улучшенные свойств, когда применяются в ADC. Хотя модулятор сплайсинга может демонстрировать желательным образом улучшенные признаки (например, надежное связывание комплекса сплайсосомы SF3b, сильную модуляцию сплайсинга РНК) при применении его самого по себе, в различных вариантах осуществления модулятор сплайсинга может проявлять меньшее количество из тех же желательным образом улучшенных признаков, будучи конъюгированным с антителом или антигенсвязывающим фрагментом. Таким образом, разработка и получение ADC для применения в качестве терапевтического средства для человека, например, в качестве средства для онкотерапии, могут потребовать больше, чем идентификация антитела, способного к связыванию с требуемой мишенью или мишенями, и прикрепления к лекарственному средству, применяемому само по себе для лечения рака. Связывание антитела с лекарственным средство может оказывать значительные эффекты на активность одного или обоих из антитела и лекарственного средства, при этом эффекты будут варьироваться в зависимости от выбранного типа линкера и/или лекарственного средства. Следовательно, в некоторых вариантах осуществления компоненты ADC выбирают так, чтобы (i) сохранить одно или несколько терапевтических свойств, проявляемых антителом и фрагментами-лекарственными средствами отдельно, (ii) поддержать свойства специфического связывания антитела или антигенсвязывающего фрагмента; (iii) оптимизировать нагрузку лекарственным средством и соотношения лекарственного средства и антитела; (iv) обеспечить доставку, например внутриклеточную доставку, фрагмента-лекарственного средства за счет стабильного прикрепления к антителу или антигенсвязывающему фрагменту; (v) сохранить стабильность ADC в качестве интактного конъюгата до момента транспортировки или доставки в сайт-мишень; (vi) свести к минимуму агрегацию ADC до или после введения; (vii) обеспечить терапевтический эффект, например цитотоксический эффект, фрагмента-лекарственного средства после отщепления или другого механизма высвобождения в клеточной среде; (viii) обеспечить проявление эффективности противоракового лечения in vivo, сравнимой или превосходящей эффективность антитела и фрагментов-лекарственных средств отдельно; (ix) свести к минимум нецелевое уничтожение под действием фрагмента-лекарственного средства и/или (x) обеспечить проявление требуемых фармакокинетических и фармакодинамических свойств, возможности получения составов и токсикологического/иммунологического профилей. Каждое из этих свойств может быть необходимо идентифицировать к улучшенного ADC для терапевтического применения (Ab et al. (2015) Mol Cancer Ther. 14:1605-13).
[270] В различных вариантах осуществления ADC, раскрытые в данном документе, проявляют неожиданно благоприятные свойства в некоторых или каждой из категорий, перечисленных выше. Например, в некоторых вариантах осуществления конструкции ADC, раскрытые в данном документе, проявляют неожиданно благоприятные профили нагрузки лекарственных средством, агрегации и/или стабильности и/или сохраняют функцию связывания антитела, активность лекарственного средства и/или улучшенное неспецифическое уничтожение, при этом снижая нецелевое уничтожение, по сравнению с ADC, содержащими альтернативный линкер и/или фрагмент-лекарственное средство (например, альтернативный модулятор сплайсинга). В некоторых вариантах осуществления конструкции ADC, раскрытые в данном документе, демонстрируют превосходную стабильность, активность, эффективность или другой эффект (измеренный in vivo или in vitro) по сравнению с ADC, в которых применяется альтернативный линкер и/или фрагмент-лекарственное средство (например, альтернативный модулятор сплайсинга). В некоторых вариантах осуществления конструкции ADC, раскрытые в данном документе, проявляют эффективность лечения in vivo при введении в виде одиночной дозы. В некоторых вариантах осуществления конструкции ADC, раскрытые в данном документе, являются неожиданно стабильными по сравнению с ADC, в которых применяется альтернативный линкер и/или фрагмент-лекарственное средство (например, альтернативный модулятор сплайсинга).
[271] Соединения ADC по настоящему изобретению могут селективно доставлять эффективную дозу цитотоксического или цитостатического средства к раковым клеткам или к опухолевой ткани. Было обнаружено, что раскрытые ADC характеризуются сильной цитотоксической и/или цитостатической активностью в отношении клеток, экспрессирующих соответствующий антиген-мишень (например, HER2, CD138, EPHA2, MSLN, FOLH1, CDH6, CEACAM5, CFC1B, ENPP3, FOLR1, HAVCR1, KIT, MET, MUC16, SLC39A6, SLC44A4, STEAP1). В некоторых вариантах осуществления цитотоксическая и/или цитостатическая активность ADC зависит от экспрессии антигена-мишени в клетке. В некоторых вариантах осуществления раскрытые ADC особенно эффективны в уничтожении раковых клеток, экспрессирующих антиген-мишень, при это сводится с к минимуму нецелевое уничтожение. В некоторых вариантах осуществления раскрытые ADC не проявляют цитотоксический и/или цитостатический эффект в отношении раковых клеток, которые не экспрессируют антиген-мишень.
[272] Иллюстративные виды рака, экспрессирующие HER2, включают без ограничения рак молочной железы, рак желудка, рак мочевого пузыря, уротелиальную клеточную карциному, рак пищевода, рак легкого (например, аденокарциному легкого), рак матки (например, серозную карциному эндометрия матки), карциному слюнных протоков, рак шейки матки, рак эндометрия и рак яичника (English et al. (2013) Mol Diagn Ther. 17:85-99).
[273] Иллюстративные виды рака, экспрессирующие CD138, включают без ограничения рак внутригрудной локализации (например, рак легкого, мезотелиому), рак кожи (например, базальноклеточную карциному, плоскоклеточную карциному), рак головы и шеи (например, гортани, гипофаринкса, носоглотки), рак молочной железы, урогенитальный рак (например, рак шейки матки, рак яичника, рак эндометрия, рак предстательной железы, рак мочевого пузыря, уротелиальный рак), гематологические злокачественные новообразования (например, миелому, такую как множественная миелома, лимфома Ходжкина) и рак щитовидной железы (Szatmári et al. (2015) Dis Markers 2015:796052).
[274] Иллюстративные виды рака, экспрессирующие EPHA2, включают рак молочной железы, рак головного мозга, рак яичника, рак мочевого пузыря, рак поджелудочной железы, рак пищевода, рак легкого, рак предстательной железы, меланому, рак пищевода и рак желудка (Tandon et al. (2011) Expert Opin Ther Targets 15(1):31-51).
[275] В некоторых вариантах осуществления расщепление ADC высвобождает модулятор сплайсинга от антитела или антигенсвязывающего фрагмента и линкера. В некоторых вариантах осуществления разработан линкер и/или модулятор сплайсинга для облегчения неспецифического уничтожения (уничтожения соседних клеток). В некоторых вариантах осуществления разработан линкер и/или модулятор сплайсинга для облегчения неспецифического уничтожения за счет расщепления после интернализации в клетку и диффузии линкера-фрагмента-лекарственного средства и/или фрагмента-лекарственного средства самого по себе в соседние клетки. В некоторых вариантах осуществления линкер способствует интернализации в клетку. В некоторых вариантах осуществления разработан линкер для сведения к минимуму расщепления во внеклеточной среде и тем самым снижения токсичности для нецелевой ткани (например, нераковой ткани), при этом сохраняющий связывание ADC с тканью-мишенью и неспецифическое уничтожение раковой ткани, которая не экспрессирует антиген, на который целенаправленно воздействует антитело или антигенсвязывающий фрагмент ADC, но которая окружает раковую ткань-мишень, экспрессирующую данный антиген. В некоторых вариантах осуществления разработаны фрагмент-лекарственное средство или катаболит фрагмента-лекарственного средства, получаемый при расщеплении ADC, для облегчения захвата клетками-мишенями или соседними клетками (т. е. способные к проникновению в клетку). Такие фрагменты-лекарственные средства и катаболиты могут обозначаться в данном документе как "неспецифически активные", при этом фрагменты-лекарственные средства или катаболиты со сниженной способностью проникновения в клетку могут называться "неспецифически неактивными".
[276] В некоторых вариантах осуществления раскрытые ADC также демонстрируют активность неспецифического уничтожения, но низкую нецелевую цитотоксичность. Не ограничиваясь теорией, активность неспецифического уничтожения у ADC может быть особенно полезной, если его проникновение в солидную опухоль ограничено, и/или экспрессия антигена-мишени среди опухолевых клеток является неоднородной. В некоторых вариантах осуществления ADC, содержащий расщепляемый линкер, является особенно эффективным в неспецифическом уничтожении и/или демонстрирует увеличенную активность неспецифического уничтожения по сравнению со сравнимым лечением с помощью ADC, содержащего нерасщепляемый линкер. В некоторых вариантах осуществления ADC, раскрытые в данном документе, проявляют увеличенную растворимость и проникновение в клетки-мишени по сравнению с фрагментами-лекарственными средствами самими по себе. В некоторых вариантах осуществления ADC, раскрытые в данном документе, проявляют увеличенную цитотоксичность по сравнению с таковой у фрагмента-лекарственного средства самого по себе. В некоторых вариантах осуществления в ADC, раскрытых в данном документе, применяются фрагменты-лекарственные средства, которые проявляют более низкую цитотоксичность при оценке в качестве отдельного лекарственного средства, в то же время они неожиданно оказываются лучшими, чем ADC, содержащие другие фрагменты-лекарственные средства, которые характеризуются более высокой цитотоксичностью при оценке в качестве отдельного лекарственного средства. В некоторых вариантах осуществления расщепление и высвобождение модулятора сплайсинга улучшает цитотоксичность ADC относительно сравнимого лечения с помощью ADC, содержащего нерасщепляемый линкер. В других вариантах осуществления расщепление и высвобождение модулятора сплайсинга не требуются для того, чтобы ADC обладал требуемой биологической активностью. В некоторых вариантах осуществления ADC, содержащий нерасщепляемый линкер со спейсером увеличенной длины (например, ADL12), обеспечивает такую же или аналогичную цитотоксичность относительно сравнимого лечения с помощью ADC, содержащего расщепляемый линкер (например, ADL1, ADL5), и неожиданно превосходящую цитотоксичность относительно сравнимого лечения с помощью ADC, содержащего более короткий нерасщепляемый линкер. В некоторых вариантах осуществления ADC, содержащий нерасщепляемый линкер со спейсером увеличенной длины без карбонильной группы (например, ADL12), обеспечивает такую же или аналогичную цитотоксичность относительно сравнимого лечения с помощью ADC, содержащего расщепляемый линкер (например, ADL1, ADL5), и неожиданно превосходящую цитотоксичность относительно сравнимого лечения с помощью ADC, содержащего нерасщепляемый линкер со спейсером такой же или аналогичной длины с карбонильной группой (например, ADL10). В некоторых вариантах осуществления удаление карбонильной группы из нерасщепляемого MC-линкера (например, ADL12) может приводить к увеличению цитотоксичности в более 50 раз, более 75 раз, более 100 раз, более 150 раз или более 200 раз относительно сравнительного лечения с помощью ADC, содержащего немодифицированный нерасщепляемый MC-линкер (например, ADL10). В некоторых вариантах осуществления удаление карбонильной группы из нерасщепляемого MC-линкера (например, ADL12) и увеличение длины спейсера (например, добавление по меньшей мере одного спейсерного звена) может приводить к увеличению цитотоксичности в более 50 раз, более 75 раз, более 100 раз, более 150 раз или более 200 раз относительно сравнительного лечения с помощью ADC, содержащего немодифицированный нерасщепляемый MC-линкер (например, ADL10).
[277] В данном документе представлены соединения ADC, содержащие антитело или его антигенсвязывающий фрагмент (Ab), которые целенаправленно воздействуют на опухолевую клетку, фрагмент-лекарственное средство, представляющий собой модулятор сплайсинга (D), и линкерный фрагмент (L), который ковалентно прикрепляет Ab к D. В определенных аспектах антитело или антигенсвязывающий фрагмент способны связываться с опухолеассоциированным антигеном (например, HER2, CD138, EPHA2, MSLN, FOLH1, CDH6, CEACAM5, CFC1B, ENPP3, FOLR1, HAVCR1, KIT, MET, MUC16, SLC39A6, SLC44A4, STEAP1) с высокой специфичностью и высокой аффинностью. В определенных вариантах осуществления антитело или антигенсвязывающий фрагмент подвергаются интернализации в клетку-мишень после связывания, например, в компартмент деградации в клетке. В различных вариантах осуществления для уничтожения раковых клеток могут применяться ADC, которые подвергаются интернализации после связывания с клеткой-мишенью, претерпевают деградацию и высвобождение фрагмента-лекарственного средства, представляющего собой модулятор сплайсинга. Фрагмент-лекарственное средство, представляющий собой модулятор сплайсинга, может высвобождаться от антитела и/или линкерного фрагмента ADC за счет действия ферментов, гидролиза, окисления или любого другого механизма.
[278] Иллюстративный ADC имеет формулу (I):
Ab-(L-D)p (I),
где Ab=антитело или антигенсвязывающий фрагмент, L=линкерный фрагмент, D=фрагмент-лекарственное средство, представляющий собой модулятор сплайсинга, и p=число фрагментов-лекарственных средств, представляющих собой модулятор сплайсинга, на антитело или антигенсвязывающий фрагмент.
[279] В некоторых предпочтительных вариантах осуществления нацеливающий лекарственное средство фрагмент для применения в описанных ADC и композициях представляет собой антитело или антигенсвязывающий фрагмент. Другие иллюстративные нацеливающие лекарственное средство фрагменты для применения в описанных ADC и композициях также представлены и приведены в качестве примера в данном документе. В некоторых вариантах осуществления нацеливающий лекарственное средство фрагмент может быть любым из множества средств, связывающихся с клеткой, и остовов, не являющихся антителом. В некоторых вариантах осуществления нацеливающий лекарственное средство фрагмент представляет собой средство, связывающееся с клеткой. Применяемый в данном документе термин "средство, связывающееся с клеткой" относится к любому средству, которое способно к связыванию с клеткой животного (например, человека) и доставке фрагмента-лекарственного средства (например, фрагмента-лекарственного средства, представляющего собой модулятор сплайсинга, раскрытого в данном документе). Термин охватывает иллюстративные антитела и антигенсвязывающие фрагменты, раскрытые в данном документе (например, моноклональные антитела и их фрагменты, такие как Fab и scFV). Термин дополнительно охватывает иллюстративные средства, связывающиеся с клеткой, такие как DARPin, дуотела, бициклические пептиды, нанотела, центирины, MSH (меланоцит-стимулирующий гормон), слитые молекулы рецептор-Fc, T-клеточные рецепторные структуры, стероидные гормоны, такие как андрогены и эстрогены, факторы роста, колониестимулирующие факторы, такие как EGF, и другие остовы, не являющиеся антителом. В различных вариантах осуществления остовы, не являющиеся антителом, в широком смысле можно разделить на два структурных класса, а именно соединения, имеющие размер домена (примерно 6-20 кДа), и ограниченные пептиды (примерно 2-4 кДа). Иллюстративные остовы, имеющие размер домена, включают без ограничения аффитела, аффилины, антикалины, атримеры, DARPin, FN3-остовы (например, аднектины и центирины), финомеры, домены Кунитца, пронектины, O-тела и слитые белки рецептор-Fc, при этом иллюстративные ограниченные пептиды включают авимеры, бициклические пептиды и Cys-узлы. В некоторых вариантах осуществления нацеливающий лекарственное средство фрагмент, применяемый в описанных ADC и композициях, выбран из аффитела, аффилина, антикалина, атримера, DARPin, FN3-остова, такого как аднектин или центирин, финомера, домена Кунитца, пронектина, O-тела, авимера, бициклического пептида и Cys-узла. В некоторых вариантах осуществления нацеливающий лекарственное средство фрагмент, применяемый в описанных ADC и композициях, представляет собой слитый белок рецептор-Fc, например, химерный слитый белок HER2-Fc. Обзор остовов, не являющихся антителом, приведен, например, в Vazquez-Lombardi et al. (2015) Drug Dis Today 20(10):1271-83.
Антитела
[280] Антитело или антигенсвязывающий фрагмент (Ab) формулы (I) включают в пределах своего объема любое антитело или антигенсвязывающий фрагмент, которые специфически связываются с антигеном-мишенью на раковой клетке. Антитело или антигенсвязывающий фрагмент могут связываться с антигеном-мишенью с константой диссоциации (KD), составляющей ≤1 мМ, ≤100 нМ или ≤10 нМ или любое значение между ними, как измерено, например, с помощью анализа BIAcore®. В определенных вариантах осуществления KD составляет от 1 пМ до 500 пМ. В некоторых вариантах осуществления KD составляет от 500 пМ до 1 мкМ, от 1 мкМ до 100 нМ или от 100 мМ до 10 нМ.
[281] В некоторых вариантах осуществления антитело или антигенсвязывающий фрагмент представляют собой четырехцепочечное антитело (также называемое иммуноглобулин или полноразмерное или интактное антитело), содержащее две тяжелые цепи и две легкие цепи. В некоторых вариантах осуществления антитело или антигенсвязывающий фрагмент представляют собой двухцепочечное полуантитело (одна легкая цепь и одна тяжелая цепь) или антигенсвязывающий фрагмент иммуноглобулина. В некоторых вариантах осуществления антитело или антигенсвязывающий фрагмент представляют собой антигенсвязывающий фрагмент иммуноглобулина, который сохраняет способность связывать раковый антиген-мишень и/или обеспечивать функцию иммуноглобулина.
[282] В некоторых вариантах осуществления антитело или антигенсвязывающий фрагмент представляют собой антитело или его антигенсвязывающий фрагмент. В некоторых вариантах осуществления антитело или антигенсвязывающий фрагмент представляют собой интернализующееся антитело или его интернализующийся антигенсвязывающий фрагмент. В некоторых вариантах осуществления интернализующееся антитело или его интернализующийся антигенсвязывающий фрагмент связываются с раковым антигеном-мишенью, экспрессированным на поверхности клетки, и попадают в клетку после связывания. В некоторых вариантах осуществления фрагмент-лекарственное средство, представляющий собой модулятор сплайсинга, в ADC высвобождается от антитела или антигенсвязывающего фрагмента в ADC после того, как ADC попадет и будет находиться в клетке, экспрессирующей раковый антиген-мишень (т. е. после того, как ADC подвергся интернализации), например, за счет отщепления, за счет разрушения антитела или антигенсвязывающего фрагмента или за счет любого другого подходящего механизма высвобождения.
[283] Аминокислотные последовательности иллюстративных антител по настоящего изобретению представлены в таблицах 2-4.
Таблица 1. Антитела
Таблица 2. Аминокислотные последовательности вариабельных областей mAb
Таблица 3. Аминокислотные последовательности CDR mAb
(AB185)
(AB185)
(AB185)
(AB185)
(AB185)
(AB185)
(AB205)
(AB205)
(AB205)
(AB205)
(AB205)
(AB205)
(AB206)
(AB206)
(AB206)
(AB206)
(AB206)
(AB206)
Таблица 4. Аминокислотные последовательности цепей Ig полноразмерного mAb
(AB185)
(AB185)
(AB205)
(AB205)
(AB206)
(AB206)
Таблица 5. Иллюстративные аминокислотные последовательности антигена-мишени
[284] В различных вариантах осуществления ADC, раскрытый в данном документе, может содержать любой набор из вариабельных доменов тяжелой и легкой цепей, перечисленных в таблицах выше, или набор из последовательностей шести CDR из набора тяжелой и легкой цепей, например, введенный путем прививания шести CDR в выбранный каркас донорного антитела человека. В различных вариантах осуществления ADC, раскрытый в данном документе, может содержать аминокислотные последовательности, которые гомологичны последовательностям, перечисленным в таблицах выше, при условии, что ADC сохраняет способность связываться со своим раковым антигеном-мишенью (например, с KD, составляющей менее 1×10-8 M) и сохраняет одно или несколько функциональных свойств ADC, раскрытых в данном документе (например, способность к интернализации, модулированию сплайсинга РНК, подавлению клеточного роста и т. д.).
[285] В некоторых вариантах осуществления ADC дополнительно содержит константные домены тяжелой и легкой цепей человека или их фрагменты. Например, ADC может содержать константный домен тяжелой цепи IgG человека (такого как IgG1) и константный домен легкой каппа- или лямбда-цепи человека. В различных вариантах осуществления антитело или антигенсвязывающий фрагмент описанных ADC содержат константный домен тяжелой цепи иммуноглобулин G подтипа 1 (IgG1) человека с константным доменом легкой каппа-цепи Ig человека.
[286] В различных других вариантах осуществления раковый антиген-мишень для ADC представляет собой рецептор 2 эпидермального фактора роста человека (HER2).
[287] В различных вариантах осуществления антитело к HER2 или его антигенсвязывающий фрагмент содержат три CDR тяжелой цепи и три CDR легкой цепи, указанные ниже: CDR1 тяжелой цепи (HCDR1), состоящий из SEQ ID NO:1, CDR2 тяжелой цепи (HCDR2), состоящий из SEQ ID NO:2, CDR3 тяжелой цепи (HCDR3), состоящий из SEQ ID NO:3; CDR1 легкой цепи (LCDR1), состоящий из SEQ ID NO:4, CDR2 легкой цепи (LCDR2), состоящий из SEQ ID NO:5, и CDR3 легкой цепи (LCDR3), состоящий из SEQ ID NO:6, как определено по системе нумерации по Kabat.
[288] В различных вариантах осуществления антитело к HER2 или его антигенсвязывающий фрагмент содержат вариабельную область тяжелой цепи, содержащую аминокислотную последовательность под SEQ ID NO:19, и вариабельную область легкой цепи, содержащую аминокислотную последовательность под SEQ ID NO:20. В некоторых вариантах осуществления антитело к HER2 или его антигенсвязывающий фрагмент содержат аминокислотную последовательность вариабельной области тяжелой цепи под SEQ ID NO:19 и аминокислотную последовательность вариабельной области легкой цепи под SEQ ID NO:20 или последовательности, которые на по меньшей мере 95% идентичны раскрытым последовательностям. В некоторых вариантах осуществления антитело к HER2 или его антигенсвязывающий фрагмент имеют аминокислотную последовательность вариабельной области тяжелой цепи, которая на по меньшей мере 96%, по меньшей мере 97%, по меньшей мере 98% или по меньшей мере 99% идентична SEQ ID NO:19, и/или аминокислотную последовательность вариабельной области легкой цепи, которая на по меньшей мере 96%, по меньшей мере 97%, по меньшей мере 98% или по меньшей мере 99% идентична SEQ ID NO:20.
[289] В различных вариантах осуществления антитело к HER2 или его антигенсвязывающий фрагмент представляют собой интернализующееся антитело или интернализующийся антигенсвязывающий фрагмент. В различных вариантах осуществления антитело к HER2 содержит константный домен тяжелой цепи IgG1 человека и константный домен легкой каппа-цепи Ig человека.
[290] В различных вариантах осуществления антитело к HER2 содержит аминокислотную последовательность тяжелой цепи под SEQ ID NO:19 или последовательность, которая на по меньшей мере 95% идентична SEQ ID NO:19, и аминокислотную последовательность легкой цепи под SEQ ID NO:20 или последовательность, которая на по меньшей мере 95% идентична SEQ ID NO:20. В конкретных вариантах осуществления антитело к HER2 содержит аминокислотную последовательность тяжелой цепи под SEQ ID NO:19 и аминокислотную последовательность легкой цепи под SEQ ID NO:20 или последовательности, которые на по меньшей мере 95% идентичны раскрытым последовательностям. В некоторых вариантах осуществления антитело к HER2 имеет аминокислотную последовательность тяжелой цепи, которая на по меньшей мере 96%, по меньшей мере 97%, по меньшей мере 98% или по меньшей мере 99% идентична SEQ ID NO:19, и аминокислотную последовательность легкой цепи, которая на по меньшей мере 96%, по меньшей мере 97%, по меньшей мере 98% или по меньшей мере 99% идентична SEQ ID NO:20. В различных вариантах осуществления антитело к HER2 представляет собой трастузумаб или его антигенсвязывающий фрагмент.
[291] В различных вариантах осуществления антитело к HER2 или его антигенсвязывающий фрагмент содержат три CDR тяжелой цепи и три CDR легкой цепи трастузумаба, или где CDR включают не более одной, двух, трех, четырех, пяти или шести аминокислотных добавлений, делеций или замен в HCDR1 (SEQ ID NO:1), HCDR2 (SEQ ID NO:2), HCDR3 (SEQ ID NO:3); LCDR1 (SEQ ID NO:4), LCDR2 (SEQ ID NO:5) и LCDR3 (SEQ ID NO:6).
[292] В различных других вариантах осуществления раковый антиген-мишень для ADC представляет собой синдекан-1 человека (CD138).
[293] В различных вариантах осуществления антитело к CD138 или его антигенсвязывающий фрагмент содержат три CDR тяжелой цепи и три CDR легкой цепи, указанные ниже: CDR1 тяжелой цепи (HCDR1), состоящий из SEQ ID NO:7, CDR2 тяжелой цепи (HCDR2), состоящий из SEQ ID NO:8, CDR3 тяжелой цепи (HCDR3), состоящий из SEQ ID NO:9; CDR1 легкой цепи (LCDR1), состоящий из SEQ ID NO:10, CDR2 легкой цепи (LCDR2), состоящий из SEQ ID NO:11, и CDR3 легкой цепи (LCDR3), состоящий из SEQ ID NO:12, как определено по системе нумерации по Kabat.
[294] В различных вариантах осуществления антитело к CD138 или его антигенсвязывающий фрагмент содержат вариабельную область тяжелой цепи, содержащую аминокислотную последовательность под SEQ ID NO:21, и вариабельную область легкой цепи, содержащую аминокислотную последовательность под SEQ ID NO:22. В некоторых вариантах осуществления антитело к CD138 или его антигенсвязывающий фрагмент содержат аминокислотную последовательность вариабельной области тяжелой цепи под SEQ ID NO:21 и аминокислотную последовательность вариабельной области легкой цепи под SEQ ID NO:22 или последовательности, которые на по меньшей мере 95% идентичны раскрытым последовательностям. В некоторых вариантах осуществления антитело к CD138 или его антигенсвязывающий фрагмент имеют аминокислотную последовательность вариабельной области тяжелой цепи, которая на по меньшей мере 96%, по меньшей мере 97%, по меньшей мере 98% или по меньшей мере 99% идентична SEQ ID NO:21, и/или аминокислотную последовательность вариабельной области легкой цепи, которая на по меньшей мере 96%, по меньшей мере 97%, по меньшей мере 98% или по меньшей мере 99% идентична SEQ ID NO:22.
[295] В различных вариантах осуществления антитело к CD138 или его антигенсвязывающий фрагмент представляют собой интернализующееся антитело или интернализующийся антигенсвязывающий фрагмент. В различных вариантах осуществления антитело к CD138 содержит константный домен тяжелой цепи IgG2a мыши и константный домен легкой каппа-цепи Ig мыши. В различных вариантах осуществления антитело к CD138 содержит константный домен тяжелой цепи IgG2a человека и константный домен легкой каппа-цепи Ig человека.
[296] В различных вариантах осуществления антитело к CD138 содержит аминокислотную последовательность тяжелой цепи под SEQ ID NO:21 или последовательность, которая на по меньшей мере 95% идентична SEQ ID NO:21, и аминокислотную последовательность легкой цепи под SEQ ID NO:22 или последовательность, которая на по меньшей мере 95% идентична SEQ ID NO:22. В конкретных вариантах осуществления антитело к CD138 содержит аминокислотную последовательность тяжелой цепи под SEQ ID NO:21 и аминокислотную последовательность легкой цепи под SEQ ID NO:22 или последовательности, которые на по меньшей мере 95% идентичны раскрытым последовательностям. В некоторых вариантах осуществления антитело к CD138 имеет аминокислотную последовательность тяжелой цепи, которая на по меньшей мере 96%, по меньшей мере 97%, по меньшей мере 98% или по меньшей мере 99% идентична SEQ ID NO:21, и аминокислотную последовательность легкой цепи, которая на по меньшей мере 96%, по меньшей мере 97%, по меньшей мере 98% или по меньшей мере 99% идентична SEQ ID NO:22. В различных вариантах осуществления антитело к CD138 представляет собой B-B4 или его антигенсвязывающий фрагмент.
[297] В различных вариантах осуществления антитело к CD138 или его антигенсвязывающий фрагмент содержат три CDR тяжелой цепи и три CDR легкой цепи B-B4, или где CDR включают не более одной, двух, трех, четырех, пяти или шести аминокислотных добавлений, делеций или замен в HCDR1 (SEQ ID NO:7), HCDR2 (SEQ ID NO:8), HCDR3 (SEQ ID NO:9); LCDR1 (SEQ ID NO:10), LCDR2 (SEQ ID NO:11) и LCDR3 (SEQ ID NO:12).
[298] В различных других вариантах осуществления раковый антиген-мишень для ADC представляет собой рецептор 2 эфрина типа-A человека (EPHA2).
[299] В различных вариантах осуществления антитело к EPHA2 или его антигенсвязывающий фрагмент содержат три CDR тяжелой цепи и три CDR легкой цепи, указанные ниже: CDR1 тяжелой цепи (HCDR1), состоящий из SEQ ID NO:13, CDR2 тяжелой цепи (HCDR2), состоящий из SEQ ID NO:14, CDR3 тяжелой цепи (HCDR3), состоящий из SEQ ID NO:15; CDR1 легкой цепи (LCDR1), состоящий из SEQ ID NO:16, CDR2 легкой цепи (LCDR2), состоящий из SEQ ID NO:17, и CDR3 легкой цепи (LCDR3), состоящий из SEQ ID NO:18, как определено по системе нумерации по Kabat.
[300] В различных вариантах осуществления антитело к EPHA2 или его антигенсвязывающий фрагмент содержат вариабельную область тяжелой цепи, содержащую аминокислотную последовательность под SEQ ID NO:23, и вариабельную область легкой цепи, содержащую аминокислотную последовательность под SEQ ID NO:24. В некоторых вариантах осуществления антитело к EPHA2 или его антигенсвязывающий фрагмент содержат аминокислотную последовательность вариабельной области тяжелой цепи под SEQ ID NO:23 и аминокислотную последовательность вариабельной области легкой цепи под SEQ ID NO:24 или последовательности, которые на по меньшей мере 95% идентичны раскрытым последовательностям. В некоторых вариантах осуществления антитело к EPHA2 или его антигенсвязывающий фрагмент имеют аминокислотную последовательность вариабельной области тяжелой цепи, которая на по меньшей мере 96%, по меньшей мере 97%, по меньшей мере 98% или по меньшей мере 99% идентична SEQ ID NO:23, и/или аминокислотную последовательность вариабельной области легкой цепи, которая на по меньшей мере 96%, по меньшей мере 97%, по меньшей мере 98% или по меньшей мере 99% идентична SEQ ID NO:24.
[301] В различных вариантах осуществления антитело к EPHA2 или его антигенсвязывающий фрагмент представляют собой интернализующееся антитело или интернализующийся антигенсвязывающий фрагмент. В различных вариантах осуществления антитело к EPHA2 содержит константный домен тяжелой цепи IgG1 человека и константный домен легкой каппа-цепи Ig человека.
[302] В различных вариантах осуществления антитело к EPHA2 содержит аминокислотную последовательность тяжелой цепи под SEQ ID NO:23 или последовательность, которая на по меньшей мере 95% идентична SEQ ID NO:23, и аминокислотную последовательность легкой цепи под SEQ ID NO:24 или последовательность, которая на по меньшей мере 95% идентична SEQ ID NO:24. В конкретных вариантах осуществления антитело к EPHA2 содержит аминокислотную последовательность тяжелой цепи под SEQ ID NO:23 и аминокислотную последовательность легкой цепи под SEQ ID NO:24 или последовательности, которые на по меньшей мере 95% идентичны раскрытым последовательностям. В некоторых вариантах осуществления антитело к EPHA2 имеет аминокислотную последовательность тяжелой цепи, которая на по меньшей мере 96%, по меньшей мере 97%, по меньшей мере 98% или по меньшей мере 99% идентична SEQ ID NO:23, и аминокислотную последовательность легкой цепи, которая на по меньшей мере 96%, по меньшей мере 97%, по меньшей мере 98% или по меньшей мере 99% идентична SEQ ID NO:24. В некоторых вариантах осуществления антитело к EPHA2 содержит тяжелую цепь, кодируемую нуклеотидной последовательностью под SEQ ID NO:23; и легкую цепь, кодируемую нуклеотидной последовательностью под SEQ ID NO:24. В различных вариантах осуществления антитело к EPHA2 представляет собой 1C1 или его антигенсвязывающий фрагмент.
[303] В различных вариантах осуществления антитело к EPHA2 или его антигенсвязывающий фрагмент содержат три CDR тяжелой цепи и три CDR легкой цепи 1C1, или где CDR включают не более одной, двух, трех, четырех, пяти или шести аминокислотных добавлений, делеций или замен в HCDR1 (SEQ ID NO:13), HCDR2 (SEQ ID NO:14), HCDR3 (SEQ ID NO:15); LCDR1 (SEQ ID NO:16), LCDR2 (SEQ ID NO:17) и LCDR3 (SEQ ID NO:18).
[304] В различных вариантах осуществления аминокислотные замены представляю собой замены одиночных остатков. Вставки обычно будут иметь порядок от приблизительно 1 до приблизительно 20 аминокислотных остатков, хотя могут допускаться значительно более длинные вставки при условии, что сохраняется биологическая функция (например, связывание с антигеном-мишенью). Делеции обычно находится в диапазоне от приблизительно 1 до приблизительно 20 аминокислотных остатков, хотя в некоторых случаях делеции могут быть намного более длинными. Замены, делеции, вставки или любые их комбинации могут применяться для достижения конечного производного или варианта. Обычно такие изменения выполняют на небольшом числе аминокислот, чтобы свести к минимуму изменение молекулы, в частности, иммуногенности и специфичности антигенсвязывающего белка. Однако в некоторых обстоятельствах могут допускаться более крупные изменения. Консервативные замены обычно выполняют в соответствии со следующей схемой, изображенной как таблица 6.
Таблица 6
[305] Значительные изменения функции или иммунологической идентичности выполняют путем выбора замен, которые являются менее консервативными, чем показанные в таблице 6. Например, можно выполнять замены, которые в более значительной степени воздействуют на: структуру полипептидного остова в области изменения, например, альфа-спираль или бета-складчатую структуру; заряд или гидрофобность молекулы в сайте-мишени или объем боковой цепи. Замены, которые в общем случае могут приводить к самым большим изменениям свойств полипептида, являются такими, при которых (a) гидрофильный остаток, например серил или треонил, замещен (или заменен) гидрофобным остатком, например лейцилом, изолейцилом, фенилаланилом, валилом или аллилом; (b) цистеин или пролин замещены (или заменены) любым другим остатком; (c) остаток с электроположительной боковой цепью, например лизил, аргинил или гистидил, замещен (или заменен) электроотрицательным остатком, например глутамилом или аспартилом; или (d) остаток с объемной боковой цепью, например фенилаланин, замещен (или заменен) остатком, не имеющим боковой цепи, например глицином.
[306] В различных вариантах осуществления, в которых в ADC применяют вариантные последовательности антител, варианты, как правило, проявляют такую же качественную биологическую активность и будут вызывать такой же иммунный ответ, хотя при необходимости также могут быть выбраны варианты для модификации характеристик антигенсвязывающих белков. В качестве альтернативы вариант может быть разработан таким образом, чтобы биологическая активность антигенсвязывающего белка изменилась. Например, могут быть изменены или удалены сайты гликозилирования.
[307] Различные антитела могут применяться с ADC, применяемыми в данном документе, для целенаправленного воздействия на раковые клетки. Как показано ниже, линкер-полезные нагрузки в ADC, раскрытых в данном документе, являются неожиданно эффективными с антителами, целенаправленно воздействующими на разные опухолевые антигены. Подходящие антигены, экспрессируемые на опухолевых клетках, но не на здоровых клетках, или экспрессируемые на опухолевых клетках на более высоком уровне, чем на здоровых клетках, известны из уровня техники, также как и антитела, направленные против них. Такие антитела можно применять с линкерами и полезными нагрузками в виде модулятора сплайсинга, раскрытыми в данном документе. В некоторых вариантах осуществления антитело или антигенсвязывающий фрагмент целенаправленно воздействуют на HER2, и антитело или антигенсвязывающий фрагмент, целенаправленно воздействующие на HER2, представляют собой трастузумаб. В некоторых вариантах осуществления антитело или антигенсвязывающий фрагмент целенаправленно воздействуют на CD138, и антитело или антигенсвязывающий фрагмент, целенаправленно воздействующие на CD138, представляют собой B-B4. В некоторых вариантах осуществления антитело или антигенсвязывающий фрагмент целенаправленно воздействуют на EPHA2, и антитело или антигенсвязывающий фрагмент, целенаправленно воздействующие на EPHA2, представляют собой 1C1. В некоторых вариантах осуществления помимо того, что раскрытые линкеры и полезные нагрузки в виде модулятора сплайсинга являются неожиданно эффективными с несколькими антителами, целенаправленно воздействующими на разные опухоли, при этом антитела, целенаправленно воздействующие на HER2, такие как трастузумаб, антитела, целенаправленно воздействующие на CD138, такие как B-B4, и антитела, целенаправленно воздействующие на EPHA2, такие как 1C1, обеспечивали особенно улучшенное соотношение лекарственное средство:антитело, уровень агрегации, стабильность (т. е. стабильность in vitro и in vivo), целенаправленное воздействие на опухоль (т. е. цитотоксичность, активность) и/или эффективность лечения. Улучшенная эффективность лечения может быть измерена in vitro или in vivo, и может включать снижение скорости опухолевого роста и/или снижение объема опухоли.
[308] В определенных вариантах осуществления применяют альтернативные антитела для одних мишеней или антитела к разным антигенам-мишеням, и они обеспечивают по меньшей мере некоторые из благоприятных функциональных свойств, описанных выше (например, улучшенную стабильность, улучшенное целенаправленное воздействие на опухоль, улучшенную эффективность лечения и т. д.). В некоторых вариантах осуществления некоторые или все из таких благоприятных функциональных свойств наблюдаются, когда раскрытые линкеры и полезные нагрузки в виде модулятора сплайсинга конъюгированы с альтернативным антителом или антигенсвязывающим фрагментом, целенаправленно воздействующими на HER2-, CD138- или EPHA2. В некоторых вариантах осуществления некоторые или все из таких благоприятных функциональных свойств наблюдаются, когда раскрытые линкеры и полезные нагрузки в виде модулятора сплайсинга конъюгированы с антителом или антигенсвязывающим фрагментом, целенаправленно воздействующими на HER2. В некоторых вариантах осуществления антитело или антигенсвязывающий фрагмент целенаправленно воздействуют на HER2. В некоторых вариантах осуществления антитело или антигенсвязывающий фрагмент, целенаправленно воздействующие на HER2, представляют собой трастузумаб. В некоторых вариантах осуществления некоторые или все из таких благоприятных функциональных свойств наблюдаются, когда раскрытые линкеры и полезные нагрузки в виде модулятора сплайсинга конъюгированы с антителом или антигенсвязывающим фрагментом, целенаправленно воздействующими на CD138. В некоторых вариантах осуществления антитело или антигенсвязывающий фрагмент целенаправленно воздействуют на CD138. В некоторых вариантах осуществления антитело или антигенсвязывающий фрагмент, целенаправленно воздействующие на CD138, представляют собой B-B4. В некоторых вариантах осуществления некоторые или все из таких благоприятных функциональных свойств наблюдаются, когда раскрытые линкеры и полезные нагрузки в виде модулятора сплайсинга конъюгированы с антителом или антигенсвязывающим фрагментом, целенаправленно воздействующими на EPHA2. В некоторых вариантах осуществления антитело или антигенсвязывающий фрагмент целенаправленно воздействуют на EPHA2. В некоторых вариантах осуществления антитело или антигенсвязывающий фрагмент, целенаправленно воздействующие на EPHA2, представляют собой 1C1.
Линкеры
[309] В различных вариантах осуществления линкер в ADC является стабильным вне клетки в достаточной степени, чтобы быть терапевтически эффективным. В некоторых вариантах осуществления линкер является стабильным за пределами клетки, так что ADC остается интактным, когда он находится во внеклеточных условиях (например, до транспорта или доставки в клетку). Термин "интактный", применяемый в контексте ADC, означает, что антитело или антигенсвязывающий фрагмент остаются присоединенными к фрагменту-лекарственному средству (например, модулятору сплайсинга). Применяемый в данном документе "стабильный" в контексте линкера или ADC, содержащего линкер, означает, что не более 20%, не более приблизительно 15%, не более приблизительно 10%, не более приблизительно 5%, не более приблизительно 3% или не более приблизительно 1% линкеров (или любой процент между ними) в образце ADC являются расщепленными (или в случае общего ADC иным образом не являются интактными), когда ADC находится во внеклеточных условиях. В некоторых вариантах осуществления линкеры и/или ADC, раскрытые в данном документе, являются неожиданно стабильными по сравнению с альтернативными линкерами и/или ADC с альтернативными линкерами и/или полезными нагрузками в виде модулятора сплайсинга. В некоторых вариантах осуществления ADC, раскрытые в данном документе, могут оставаться интактными в течение более приблизительно 48 часов, более 60 часов, более приблизительно 72 часов, более приблизительно 84 часов или более приблизительно 96 часов.
[310] Является ли линкер стабильным вне клетки можно определить, например, путем помещения ADC в плазму крови на предварительно заданный период времени (например, 2, 4, 6, 8, 16, 24, 48 или 72 часов) и затем количественного определения количества свободного фрагмента-лекарственного средства, присутствующего в плазме крови. Стабильность может обеспечивать ADC временем для обнаружения опухолевых клеток для целенаправленного воздействия и предотвращать преждевременное высвобождение фрагмента-лекарственного средства, что может снижать терапевтический индекс ADC при неизбирательном повреждении как нормальных, так и опухолевых тканей. В некоторых вариантах осуществления линкер является стабильным за пределами клетки-мишени и высвобождает фрагмент-лекарственное средство из ADC после попадания внутрь клетки, так что лекарственное средство может связываться с его мишенью (например, комплексом сплайсосомы SF3b). Таким образом, эффективный линкер будет: (i) поддерживать свойства специфического связывания антитела или антигенсвязывающего фрагмента; (ii) обеспечивать доставку, например внутриклеточную доставку, фрагмента-лекарственного средства за счет стабильного прикрепления к антителу или антигенсвязывающему фрагменту; (iii) сохранять стабильность и интактность до тех пор, пока ADC не был транспортирован или доставлен к своему сайт-мишени; и (iv) обеспечивать терапевтический эффект, например цитотоксический эффект, фрагмента-лекарственного средства после расщепления или альтернативного механизма высвобождения.
[311] Линкеры могут влиять на физико-химические свойства ADC. Поскольку многие цитотоксические средства являются гидрофобными по природе, связывание их с антителом с дополнительным гидрофобным фрагментом может приводить к агрегации. Агрегаты ADC являются нерастворимыми и зачастую ограничивают достижимую нагрузку лекарственным средством на антителе, что может отрицательно воздействовать на активность ADC. Белковые агрегаты биологических веществ, в целом, также связывались с повышенной иммуногенностью. Как показано ниже, линкеры, раскрытые в данном документе, приводят к ADC с низкими уровнями агрегации и требуемыми уровнями нагрузки лекарственным средством.
[312] Линкер может быть "расщепляемым" или "нерасщепляемым" (Ducry and Stump (2010) Bioconjugate Chem. 21:5-13). Расщепляемые линкеры разработаны для высвобождения фрагмента-лекарственного средства (например, модулятора сплайсинга) при воздействии определенных факторов среды, например, при интернализации в клетку-мишень, при этом нерасщепляемые линкеры обычно зависят от разрушения антитела или антигенсвязывающего фрагмента самих по себе.
[313] В некоторых вариантах осуществления линкер представляет собой нерасщепляемый линкер. В некоторых вариантах осуществления фрагмент-лекарственное средство, представляющий собой модулятор сплайсинга, в ADC высвобождается при разрушении антитела или антигенсвязывающего фрагмента. Нерасщепляемые линкеры в основном остаются ковалентно ассоциированными с по меньшей мере одной аминокислотой антитела и лекарственным средством после интернализации в клетку-мишень и подвергаются разрушению внутри нее. Многочисленные иллюстративные нерасщепляемые линкеры описаны в данном документе, а другие известны из уровня техники. Иллюстративные нерасщепляемые линкеры могут предусматривать тиоэфир, циклогексил, N-сукцинимидил-4-(N-малеимидометил)циклогексан-1 карбоксилат (SMCC) или N-гидроксисукцинимид (NHS), один или несколько полиэтиленгликольных (PEG) фрагментов, например, 1, 2, 3, 4, 5 или 6 PEG-фрагментов, или один или несколько алкильных фрагментов.
[314] В некоторых вариантах осуществления линкер представляет собой расщепляемый линкер. Расщепляемый линкер относится к любому линкеру, который содержит расщепляемый фрагмент. Применяемый в данном документе термин "расщепляемый фрагмент" относится к любой химической связи, которая может расщепляться. Подходящие расщепляемые химические связи широко известны из уровня техники и включают без ограничения кислотолабильные связи, протеаза/пептидаза-лабильные связи, фотолабильные связи, дисульфидные связи и эстераза-лабильные связи. Линкеры, содержащие расщепляемый фрагмент, могут обеспечивать высвобождение фрагмента-лекарственного средства, представляющего собой модулятор сплайсинга, из ADC путем расщепления в конкретном сайте в линкере.
[315] В некоторых вариантах осуществления линкер расщепляется во внутриклеточных условиях, так что расщепление линкера достаточным образом высвобождает фрагмент-лекарственное средство, представляющий собой модулятор сплайсинга, от антитела или антигенсвязывающего фрагмента во внутриклеточной среде, чтобы активировать лекарственное средство и/или сделать лекарственное средство терапевтически эффективным. В некоторых вариантах осуществления фрагмент-лекарственное средство, представляющий собой модулятор сплайсинга, не отщепляется от антитела или антигенсвязывающего фрагмента до тех пор, пока ADC не попадет в клетку, которая экспрессирует антиген, специфический для антитела или антигенсвязывающего фрагмента в ADC, и фрагмент-лекарственное средство, представляющий собой модулятор сплайсинга, отщепляется от антитела или антигенсвязывающего фрагмента после попадания в клетку. В некоторых вариантах осуществления линкер предусматривает расщепляемый фрагмент, который расположен таким образом, что никакая часть линкера или антитела или антигенсвязывающего фрагмента не остается связанной с фрагментом-лекарственным средством, представляющим собой модулятор сплайсинга, после расщепления. Иллюстративные расщепляемые линкеры включают кислотолабильные линкеры, протеаза/пептидаза-чувствительные линкеры, фотолабильные линкеры, диметил-, дисульфид- или сульфонамид-содержащие линкеры.
[316] В некоторых вариантах осуществления линкер представляет собой pH-чувствительный линкер, он является чувствительным к гидролизу при определенных значениях pH. Как правило, pH-чувствительный линкер расщепляется при кислотных условиях. Данная стратегия расщепления обычно использует преимущество более низкого pH в эндосомальном (pH ~5-6) и лизосомальном (pH ~4,8) внутриклеточных компартментах по сравнению с цитозолем (pH ~7,4) для запуска гидролиза кислотолабильной группы в линкере, такой как гидразон (Jain et al. (2015) Pharm Res 32:3526-40). В некоторых вариантах осуществления линкер представляет собой кислотолабильный и/или гидролизируемый линкер. Например, может применяться кислотолабильный линкер, который является гидролизируемым в лизосоме и содержит кислотолабильную группу (например, гидразон, семикарбазон, тиосемикарбазон, амид цис-аконитовой кислоты, сложный ортоэфир, ацеталь, кеталь и т. п.). См., например, патенты США №№ 5122368; 5824805; 5622929; Dubowchik and Walker (1999) Pharm Therapeutics 83:67-123; Neville et al. (1989) Biol Chem. 264:14653-61. Такие линкеры являются относительно стабильными в условиях нейтрального pH, таких как условиях в крови, но являются нестабильными при pH ниже 5,5 или 5,0, приблизительном значении pH в лизосоме. В определенных вариантах осуществления гидролизируемый линкер представляет собой тиоэфирный линкер (такой как, например, тиоэфир, прикрепленный к терапевтическому средству через ацилгидразоновую связь) (см., например, патент США № 5622929).
[317] В некоторых вариантах осуществления линкер расщепляется при восстанавливающих условиях. В некоторых вариантах осуществления линкер расщепляется в присутствии восстановителя, такого как глутатион или дитиотреитол. В некоторых вариантах осуществления линкер представляет собой расщепляемый дисульфидный линкер или расщепляемый сульфонамидный линкер.
[318] В некоторых вариантах осуществления линкер представляет собой расщепляемый дисульфидный линкер. Из уровня техники известно множество дисульфидных линкеров, включая, например, линкеры, которые могут образовываться с применением SATA (N-сукцинимидил-5-ацетилтиоацетат), SPDP (N-сукцинимидил-3-(2-пиридилдитио)пропионат), SPDB (N-сукцинимидил-3-(2-пиридилдитио)бутират) и SMPT (N-сукцинимидилоксикарбонил-альфа-метил-альфа-(2-пиридил-дитио)толуол), SPDB и SMPT. См., например, Thorpe et al. (1987) Cancer Res. 47:5924-31; Wawrzynczak et al., в Immunoconjugates: Antibody Conjugates in Radioimagery and Therapy of Cancer (C. W. Vogel ed., Oxford U. Press, 1987). См. также патент США № 4880935. Дисульфидные линкеры, как правило, применяются для использования обилия внутриклеточных тиолов, которые могут облегчать расщепление их дисульфидных связей. Внутриклеточные концентрации наиболее распространенного внутриклеточного тиола, восстановленного глутатиона, обычно находятся в диапазоне 1-10 нМ, что приблизительно в 1000 раз превышает концентрацию наиболее распространенного низкомолекулярного тиола в крови (т. е. цистеина) на уровне приблизительно 5 мкМ (Goldmacher et al., в Cancer Drug Discovery and Development: Antibody-Drug Conjugates and Immunotoxins (G. L. Phillips ed., Springer, 2013)). Внутриклеточные ферменты семейства протеиндисульфидизомераз также могут вносить вклад во внутриклеточное расщепление дисульфидного линкера. Применяемый в данном документе расщепляемый дисульфидный линкер относится к любому линкеру, который содержит расщепляемый дисульфидный фрагмент. Термин "расщепляемый дисульфидный фрагмент" относится к дисульфидной связи, которая может поддаваться расщеплению и/или восстановлению, например, под действием тиола или фермента.
[319] В некоторых вариантах осуществления линкер представляет собой расщепляемый сульфонамидный линкер. Применяемый в данном документе расщепляемый сульфонамидный линкер относится к любому линкеру, который содержит расщепляемый сульфонамидный фрагмент. Термин "расщепляемый сульфонамидный фрагмент" относится к сульфонамидной группе, т. е. сульфонильной группе, присоединенной к аминогруппе, где связь сера-азот может поддаваться расщеплению.
[320] В некоторых вариантах осуществления линкер может представлять собой линкер дендритного типа для ковалентного прикрепления более одного фрагмента-лекарственного средства к антителу или антигенсвязывающему фрагменту через ветвящийся, мультифункциональный линкерный фрагмент. См., например, Sun et al. (2002) Bioorg Med Chem Lett. 12:2213-5; Sun et al. (2003) Bioorg Med Chem. 11:1761-8. Дендритные линкеры могут повышать молярное соотношение лекарственного средства и антитела, т. е. нагрузке лекарственным средством, что связано с активностью ADC. Таким образом, если антитело или антигенсвязывающий фрагмент имеют только одну реакционно-способную тиольную группу цистеина, например, несколько фрагментов-лекарственных средств, представляющих собой модулятор сплайсинга, можно прикрепить посредством дендритного линкера. В некоторых вариантах осуществления линкерный фрагмент или линкер-фрагмент-лекарственное средство можно прикреплять к антителу или антигенсвязывающему фрагменту с помощью химии восстановления дисульфидных мостиков или технологии ограниченного использования лизина. См., например, публикации международных заявок №№ WO 2013/173391 и WO 2013/173393.
[321] В некоторых вариантах осуществления линкер расщепляется под действием расщепляющего средства, например, фермента, который присутствует во внутриклеточной среде (например, в пределах лизосомы, или эндосомы, или кавеолы). Линкер может представлять собой, например, пептидный линкер, который расщепляется под действием внутриклеточного фермента пептидазы или протеазы, включая без ограничения лизосомальную или эндосомальную протеазу.
[322] В некоторых вариантах осуществления линкер представляет собой расщепляемый пептидный линкер. Применяемый в данном документе расщепляемый пептидный линкер относится к любому линкеру, который содержит расщепляемый пептидный фрагмент. Термин "расщепляемый пептидный фрагмент" относится к любой химической связи, связывающей аминокислоты (природные аминокислоты или синтетические производные аминокислот), которая может расщепляться по действием средства, которое присутствует во внутриклеточной среде. Например, линкер может содержать последовательность валин-аланин (Val-Ala) или последовательность валин-цитруллин (Val-Cit), которые расщепляются под действием пептидазы, такой как катепсин, например катепсин B. В некоторых вариантах осуществления линкер может содержать последовательность глутаминовая кислота-валин-цитруллин (Glu-Val-Cit). В некоторых вариантах осуществления линкер представляет собой расщепляемый ферментом линкер, и расщепляемый пептидный фрагмент в линкере расщепляется под действием фермента. В некоторых вариантах осуществления расщепляемый пептидный фрагмент расщепляется под действием лизосомального фермента, например катепсина. В некоторых вариантах осуществления линкер представляет собой расщепляемый катепсином линкер. В некоторых вариантах осуществления расщепляемый пептидный фрагмент в линкере расщепляется под действием лизосомального цистеин-катепсина, такого как катепсин B, C, F, H, K, L, O, S, V, X или W. В некоторых вариантах осуществления расщепляемый пептидный фрагмент расщепляется под действием катепсина B. Иллюстративный дипептид, который может подвергаться расщеплению под действием катепсина B, представляет собой валин-цитруллин (Val-Cit) (Dubowchik et al. (2002) Bioconjugate Chem. 13:855-69).
[323] В некоторых вариантах осуществления линкер или расщепляемый пептидный фрагмент в линкере предусматривают аминокислотное звено. В некоторых вариантах осуществления аминокислотное звено обеспечивает возможность расщепления линкера под действием протеазы, тем самым облегчая высвобождение фрагмента-лекарственного средства, представляющего собой модулятор сплайсинга, из ADC после воздействия одной или нескольких внутриклеточных протеаз, таких как один или несколько лизосомальных ферментов (Doronina et al. (2003) Nat Biotechnol. 21:778-84; Dubowchik and Walker (1999) Pharm Therapeutics 83:67-123). Иллюстративные аминокислотные звенья включают без ограничения дипептиды, трипептиды, тетрапептиды и пентапептиды. Иллюстративные дипептиды включают без ограничения, валин-аланин (Val-Ala), валин-цитруллин (Val-Cit), аланин-аспарагин (Ala-Asn), аланин-фенилаланин (Ala-Phe), фенилаланин-лизин (Phe-Lys), аланин-лизин (Ala-Lys), аланин-валин (Ala-Val), валин-лизин (Val-Lys), лизин-лизин (Lys-Lys), фенилаланин-цитруллин (Phe-Cit), лейцин-цитруллин (Leu-Cit), изолейцин-цитруллин (Ile-Cit), триптофан-цитруллин (Trp-Cit) и фенилаланин-аланин (Phe-Ala). Иллюстративные трипептиды включают без ограничения аланин-аланин-аспарагин (Ala-Ala-Asn), глицин-валин-цитруллин (Gly-Val-Cit), глицин-глицин-глицин (Gly-Gly-Gly), фенилаланин-фенилаланин-лизин (Phe-Phe-Lys), глутаминовая кислота-валин-цитруллин (Glu-Val-Cit) (см., например, Anami et al. (2018) Nat Comm. 9:2512, который включен в данный документ посредством ссылки в отношении иллюстративных линкеров, предусматривающих Glu-Val-Cit) и глицин-фенилаланин-лизин (Gly-Phe-Lys). Другие иллюстративные аминокислотные звенья включают без ограничения Gly-Phe-Gly-Gly (SEQ ID NO:34), Gly-Phe-Leu-Gly (SEQ ID NO:35), Ala-Leu-Ala-Leu (SEQ ID NO:36), Phe-N9-тозил-Arg и Phe-N9-нитро-Arg, описанные, например, в патенте США № 6214345. В некоторых вариантах осуществления аминокислотное звено в линкере предусматривает Val-Ala. В некоторых вариантах осуществления аминокислотное звено в линкере предусматривает Val-Cit. В некоторых вариантах осуществления аминокислотное звено в линкере предусматривает Glu-Val-Cit. Аминокислотное звено может содержать остатки аминокислот, которые встречаются в природе, и/или минорных аминокислот, и/или не встречающихся в природе аналогов аминокислот, таких как цитруллин. Аминокислотные звенья могут быть разработаны и оптимизированы для ферментативного расщепления под действием конкретного фермента, например, опухолеассоциированной протеазы, лизосомальной протеазы, такой как катепсин B, C, D или S, или плазмин-протеазы.
[324] В некоторых вариантах осуществления линкер представляет собой расщепляемый β-глюкуронидный линкер. Применяемый в данном документе расщепляемый β-глюкуронидный линкер относится к любому линкеру, который содержит расщепляемый β-глюкуронидный фрагмент. Иллюстративный расщепляемый β-глюкуронидный линкер содержит структуру:
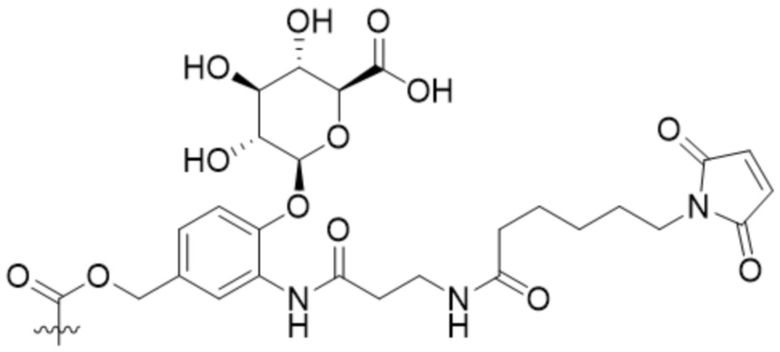
[325] Термин "расщепляемый β-глюкуронидный фрагмент" относится к гликозидной связи, которая может расщепляться под действием средства, характеризующегося β-глюкуронидазной активностью. В некоторых вариантах осуществления линкер содержит гликозидную связь, которая может расщепляться под действием β-глюкуронидазы. β-глюкуронидаза представляет собой UDP-глюкуронозилтрансферазу, которая катализирует гидролиз гликозидной связи глюкуронидов с β-конфигурацией.
[326] В некоторых вариантах осуществления ADC, раскрытый в данном документе, содержит расщепляемый β-глюкуронидный фрагмент в линкере, который расщепляется под действием фермента. В некоторых вариантах осуществления расщепляемый β-глюкуронидный фрагмент в линкере расщепляется под действием лизосомального фермента, например β-глюкуронидазы. В некоторых вариантах осуществления линкер представляет собой расщепляемый β-глюкуронидазой линкер. В некоторых вариантах осуществления расщепляемый β-глюкуронидный фрагмент в линкере обеспечивает возможность расщепления линкера под действием β-глюкуронидазы после интернализации ADC, тем самым облегчая высвобождение фрагмента-лекарственного средства из ADC в клеточной среде.
[327] В некоторых вариантах осуществления линкер в любом из ADC, раскрытых в данном документе, может содержать по меньшей мере одно спейсерное звено, соединяющее антитело или антигенсвязывающий фрагмент с фрагментом-лекарственным средством (например, фрагментом-лекарственным средством, представляющим собой модулятор сплайсинга). В некоторых вариантах осуществления спейсерное звено между антителом или антигенсвязывающим фрагментом и расщепляемым фрагментом, если оно присутствует, соединяет сайт расщепления (например, расщепляемый пептидный фрагмент) в линкере с антителом или антигенсвязывающим фрагментом. В некоторых вариантах осуществления спейсерное звено между фрагментом-лекарственным средством и расщепляемым фрагментом, если оно присутствует, соединяет сайт расщепления (например, расщепляемый пептидный фрагмент) в линкере с фрагментом-лекарственным средством. В некоторых вариантах осуществления не присутствует никакой сайт расщепления, и спейсерное звено применяют для связывания антитела или антигенсвязывающего фрагмента с фрагментом-лекарственным средством.
[328] В некоторых вариантах осуществления линкер и/или спейсерное звено в линкере являются в значительной степени гидрофильными. Гидрофильный линкер может применяться для снижения степени, с которой лекарственное средство может быть выведено из устойчивых раковых клеток через белок множественной лекарственной устойчивости (MDR) или функционально подобные транспортeры. В некоторых вариантах осуществления гидрофильный линкер может включать один или несколько полиэтиленгликольных (PEG) фрагментов, например 1, 2, 3, 4, 5, или 6 PEG-фрагментов. В некоторых вариантах осуществления линкер предусматривает 2 PEG-фрагмента.
[329] В некоторых вариантах осуществления спейсерное звено в линкере предусматривает один или несколько PEG-фрагментов. В некоторых вариантах осуществления спейсерное звено предусматривает один или несколько -(PEG)m-, и m составляет целое число от 1 до 10 (т. е. m может составлять 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10). В некоторых вариантах осуществления m находится в диапазоне от 1 до 10; от 2 до 8; от 2 до 6; от 2 до 5; от 2 до 4 или от 2 до 3. В некоторых вариантах осуществления m составляет 2. В некоторых вариантах осуществления спейсерное звено предусматривает (PEG)2, (PEG)3, (PEG)4, (PEG)5, (PEG)6, (PEG)7, (PEG)8, (PEG)9 или (PEG)10. В некоторых вариантах осуществления спейсерное звено предусматривает (PEG)2.
[330] В некоторых вариантах осуществления спейсерное звено в линкере предусматривает алкильный фрагмент. В некоторых вариантах осуществления спейсерное звено предусматривает один или несколько -(CH2)n-, и n составляет целое число от 1 до 10 (т. е. n может составлять 1, 2, 3, 4, 5, 6, 7, 8, 9, или 10). В некоторых вариантах осуществления n находится в диапазоне от 1 до 10; от 2 до 8; от 2 до 6; от 2 до 5; от 2 до 4 или от 2 до 3. В некоторых вариантах осуществления n составляет 2. В некоторых вариантах осуществления n составляет 5. В некоторых вариантах осуществления n составляет 6. В некоторых вариантах осуществления спейсерное звено предусматривает (CH2)2, (CH2)3, (CH2)4, (CH2)5, (CH2)6, (CH2)7, (CH2)8, (CH2)9 или (CH2)10. В некоторых вариантах осуществления спейсерное звено предусматривает (CH2)2 ("Et"). В некоторых вариантах осуществления спейсерное звено предусматривает (CH2)6 ("Hex"). В некоторых вариантах осуществления спейсерное звено предусматривает (CH2)2-O-(CH2)2 ("Et-O-Et").
[331] Спейсерное звено может применяться, например, для связывания антитела или антигенсвязывающего фрагмента с фрагментом-лекарственным средством, либо непосредственно, либо опосредованно. В некоторых вариантах осуществления спейсерное звено связывает антитело или антигенсвязывающий фрагмент с фрагментом-лекарственным средством, представляющим собой модулятор сплайсинга, непосредственно. В некоторых вариантах осуществления антитело или антигенсвязывающий фрагмент и фрагмент-лекарственное средство, представляющий собой модулятор сплайсинга, присоединены через спейсерное звено, содержащее один или несколько PEG-фрагментов (например, (PEG)2) или один или несколько алкильных фрагментов (например, (CH2)2, (CH2)6 или (CH2)2-O-(CH2)2). В некоторых вариантах осуществления спейсерное звено связывает антитело или антигенсвязывающий фрагмент с фрагментом-лекарственным средством, представляющим собой модулятор сплайсинга, опосредованно. В некоторых вариантах осуществления спейсерное звено связывает антитело или антигенсвязывающий фрагмент с фрагментом-лекарственным средством, представляющим собой модулятор сплайсинга, опосредованно через расщепляемый фрагмент (например, расщепляемый пептид или расщепляемый β-глюкуронид) и/или фрагмент для прикрепления, чтобы соединить спейсерное звено с антителом или антигенсвязывающим фрагментом, например, малеимидным фрагментом.
[332] В различных вариантах осуществления спейсерное звено прикрепляется к антителу или антигенсвязывающему фрагменту (т. е. антителу или антигенсвязывающему фрагменту) через малеимидный (Mal) фрагмент.
[333] Спейсерное звено, которое прикрепляется к антителу или антигенсвязывающему фрагменту через Mal, обозначается в данном документе как "Mal-спейсерное звено". Применяемый в данном документе термин "Mal" или "малеимидный фрагмент" означает соединение, которое содержит малеимидную группа и которое реагирует с сульфгидрильной группой, например, сульфгидрильной группой остатка цистеина на антителе или антигенсвязывающем фрагменте. Другие функциональные группы, которые являются реакционно-способными с сульфгидрильными группами (тиолами), включают без ограничения йодацетамид, бромацетамид, винилпиридин, дисульфид, пиридилдисульфид, изоцианат и изотиоцианат. В некоторых вариантах осуществления Mal-спейсерное звено реагирует с остатком цистеина на антителе или антигенсвязывающем фрагменте. В некоторых вариантах осуществления Mal-спейсерное звено соединяется с антителом или антигенсвязывающим фрагментом через остаток цистеина. В некоторых вариантах осуществления Mal-спейсерное звено предусматривает PEG-фрагмент. В некоторых вариантах осуществления Mal-спейсерное звено предусматривает алкильный фрагмент.
[334] В определенных вариантах осуществления линкер предусматривает Mal-спейсерное звено и расщепляемый пептидный фрагмент. В некоторых вариантах осуществления расщепляемый пептидный фрагмент предусматривает аминокислотное звено. В некоторых вариантах осуществления аминокислотное звено предусматривает Val-Cit. В некоторых вариантах осуществления аминокислотное звено предусматривает Val-Ala. В некоторых вариантах осуществления аминокислотное звено предусматривает Glu-Val-Cit. В некоторых вариантах осуществления линкер предусматривает Mal-спейсерное звено и Val-Cit. В некоторых вариантах осуществления линкер предусматривает Mal-спейсерное звено и Val-Ala. В некоторых вариантах осуществления линкер предусматривает Mal-спейсерное звено и Val-Cit, где Mal-спейсерное звено предусматривает малеимидокапроил (MC). В некоторых вариантах осуществления линкер предусматривает Mal-спейсерное звено и Val-Ala, где Mal-спейсерное звено предусматривает малеимидокапроил (MC). В некоторых вариантах осуществления линкер предусматривает Mal-спейсерное звено и расщепляемый β-глюкуронидный фрагмент.
[335] В некоторых вариантах осуществления линкер предусматривает структуру: Mal-спейсерное звено. В некоторых вариантах осуществления Mal-спейсерное звено предусматривает малеимидокапроил (MC). В некоторых вариантах осуществления линкер предусматривает структуру: MC. В некоторых вариантах осуществления линкер предусматривает структуру: Mal-(CH2)2 ("Mal-Et"). В некоторых вариантах осуществления линкер предусматривает структуру: Mal-(CH2)6 ("Mal-Hex"). В некоторых вариантах осуществления линкер предусматривает структуру: Mal-(CH2)2-O-(CH2)2 ("Mal-Et-O-Et"). В некоторых вариантах осуществления линкер предусматривает структуру: Mal-(PEG)2. В некоторых вариантах осуществления линкер предусматривает структуру: Mal-(PEG)2-CO.
[336] В различных вариантах осуществления Mal-спейсерное звено прикрепляет антитело или антигенсвязывающий фрагмент к расщепляемому пептидному фрагменту. В некоторых вариантах осуществления линкер предусматривает Mal-спейсерное звено-пептид. В некоторых вариантах осуществления линкер предусматривает структуру: Mal-спейсерное звено-Val-Cit. В некоторых вариантах осуществления Mal-спейсерное звено предусматривает малеимидокапроил (MC). В некоторых вариантах осуществления линкер предусматривает структуру: MC-Val-Cit.
[337] В некоторых вариантах осуществления линкер предусматривает структуру: Mal-спейсерное звено-Val-Ala. В некоторых вариантах осуществления Mal-спейсерное звено предусматривает малеимидокапроил (MC). В некоторых вариантах осуществления линкер предусматривает структуру: MC-Val-Ala.
[338] В различных вариантах осуществления Mal-спейсерное звено прикрепляет антитело или антигенсвязывающий фрагмент к расщепляемому β-глюкуронидному фрагменту. В некоторых вариантах осуществления линкер предусматривает Mal-спейсерное звено-β-глюкуронид. В некоторых вариантах осуществления линкер предусматривает MC-β-глюкуронид.
[339] В различных вариантах осуществления расщепляемый фрагмент в линкере присоединяется непосредственно к фрагменту-лекарственному средству, представляющему собой модулятор сплайсинга. В других вариантах осуществления спейсерное звено применяют для прикрепления расщепляемого фрагмента в линкере к фрагменту-лекарственному средству, представляющему собой модулятор сплайсинга. В различных вариантах осуществления модулятор сплайсинга прикреплен к расщепляемому фрагменту в линкере с помощью спейсерного звена.
[340] Спейсерное звено может быть "саморасщепляющимся" или "несаморасщепляющимся." "Несаморасщепляющееся" спейсерное звено представляет собой спейсерное звено, в котором часть или все спейсерное звено остается связанным с фрагментом-лекарственным средством, представляющим собой модулятор сплайсинга, после расщепления линкера. Примеры несаморасщепляющихся спейсерных звеньев включают без ограничения глициновое спейсерное звено и глицин-глициновое спейсерное звено. Несаморасщепляющиеся спейсерные звенья иногда могут разрушаться со временем, но не приводят к легкому высвобождению связанного нативного фрагмента-лекарственного средства целиком в условиях клетки. "Саморасщепляющееся" спейсерное звено обеспечивает возможность высвобождения нативного фрагмента-лекарственного средства во внутриклеточных условиях. "Нативное лекарственное средство" или "нативный фрагмент-лекарственное средство" представляет собой средство, в котором никакая часть спейсерного звена или другая химическая модификация не остается после расщепления/разрушения спейсерного звена.
[341] Саморасщепляющиеся химические структуры, известны из уровня техники и могут быть легко выбраны для раскрытых ADC. В различных вариантах осуществления спейсерное звено, прикрепляющее расщепляемый фрагмент в линкере к фрагменту-лекарственному средству, представляющему собой модулятор сплайсинга, является саморасщепляющимся и подвергается самораспаду одновременно или незадолго перед/вскоре после расщепления расщепляемого фрагмента во внутриклеточных условиях. В некоторых вариантах осуществления модулятор сплайсинга прикреплен к расщепляемому фрагменту в линкере с помощью саморасщепляющегося спейсерного звена. В определенных вариантах осуществления модулятор сплайсинга прикреплен к расщепляемому фрагменту в линкере с помощью саморасщепляющегося спейсерного звена, при этом расщепляемый фрагмент предусматривает Val-Cit, а малеимидокапроил (MC) соединяет расщепляемый фрагмент с антителом или антигенсвязывающим фрагментом. В определенных вариантах осуществления модулятор сплайсинга прикреплен к расщепляемому фрагменту в линкере с помощью саморасщепляющегося спейсерного звена, при этом расщепляемый фрагмент предусматривает Val-Ala, а малеимидокапроил (MC) соединяет расщепляемый фрагмент с антителом или антигенсвязывающим фрагментом. В определенных вариантах осуществления модулятор сплайсинга прикреплен к расщепляемому фрагменту в линкере с помощью саморасщепляющегося спейсерного звена, при этом расщепляемый фрагмент предусматривает Glu-Val-Cit, а малеимидокапроил (MC) соединяет расщепляемый фрагмент с антителом или антигенсвязывающим фрагментом. В определенных вариантах осуществления модулятор сплайсинга соединен с антителом или антигенсвязывающим фрагментом через Mal-спейсерное звено (например, MC) в линкере, соединенном с расщепляемым фрагментом Val-Cit и саморасщепляющимся спейсерным звеном pABC или pAB. В определенных других вариантах осуществления модулятор сплайсинга соединен с антителом или антигенсвязывающим фрагментом через Mal-спейсерное звено (например, MC) в линкере, соединенном с расщепляемым фрагментом Val-Ala и саморасщепляющимся спейсерным звеном pABC или pAB. В определенных других вариантах осуществления модулятор сплайсинга соединен с антителом или антигенсвязывающим фрагментом через Mal-спейсерное звено (например, MC) в линкере, соединенном с расщепляемым фрагментом Glu-Val-Cit и саморасщепляющимся спейсерным звеном pABC или pAB.
[342] В определенных вариантах осуществления саморасщепляющееся спейсерное звено в линкере предусматривает п-аминобензильное звено. В некоторых вариантах осуществления п-аминобензильный спирт (pABOH) присоединен к аминокислотному звену или другому расщепляемому фрагменту в линкере через амидную связь, и между pABOH и фрагментом-лекарственным средством образуется карбамат, метилкарбамат или карбонат (Hamann et al. (2005) Expert Opin Ther Patents 15:1087-103). В некоторых вариантах осуществления саморасщепляющееся спейсерное звено представляет собой или предусматривает п-аминобензилоксикарбонил (pABC). Не ограничиваясь теорией, есть основания полагать, что в самораспад pABC вовлечены самопроизвольные реакции 1,6-элиминирования (Jain et al. (2015) Pharm Res. 32:3526-40).
[343] В различных вариантах осуществления структура п-аминобензилоксикарбонилп (pABC), применяемого в раскрытых ADC, показана ниже:
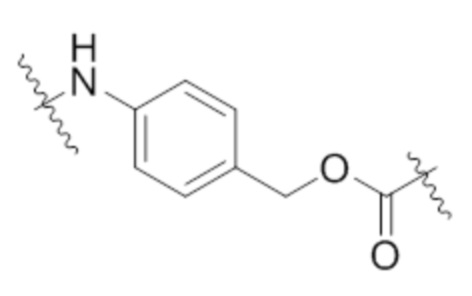
[344] В различных вариантах осуществления саморасщепляющееся спейсерное звено прикрепляет расщепляемый фрагмент в линкере к модулятору сплайсинга. В некоторых вариантах осуществления саморасщепляющееся спейсерное звено представляет собой pABC. В некоторых вариантах осуществления pABC прикрепляет расщепляемый фрагмент в линкере к модулятору сплайсинга. В некоторых вариантах осуществления pABC подвергается самораспаду после расщепления расщепляемого фрагмента, и модулятор сплайсинга высвобождается из ADC в его нативной активной форме.
[345] В некоторых вариантах осуществления антитело к HER2 или антигенсвязывающий фрагмент соединяются с модулятором сплайсинга с помощью линкера, предусматривающего MC-Val-Cit-pABC. В других вариантах осуществления антитело к HER2 или антигенсвязывающий фрагмент соединяются с модулятором сплайсинга с помощью линкера, предусматривающего MC-Val-Ala-pABC.
[346] В некоторых вариантах осуществления антитело к CD138 или антигенсвязывающий фрагмент соединяются с модулятором сплайсинга с помощью линкера, предусматривающего MC-Val-Cit-pABC. В других вариантах осуществления антитело к CD138 или антигенсвязывающий фрагмент соединяются с модулятором сплайсинга с помощью линкера, предусматривающего MC-Val-Ala-pABC.
[347] В некоторых вариантах осуществления антитело к EPHA2 или антигенсвязывающий фрагмент соединяются с модулятором сплайсинга с помощью линкера, предусматривающего MC-Val-Cit-pABC. В других вариантах осуществления антитело к EPHA2 или антигенсвязывающий фрагмент соединяются с модулятором сплайсинга с помощью линкера, предусматривающего MC-Val-Ala-pABC.
[348] В некоторых вариантах осуществления pABC подвергается самораспаду после расщепления расщепляемого пептидного фрагмента в линкере. В некоторых вариантах осуществления расщепляемый пептидный фрагмент предусматривает аминокислотное звено. В некоторых вариантах осуществления линкер предусматривает аминокислотное звено-pABC. В некоторых вариантах осуществления аминокислотное звено представляет собой Val-Cit. В некоторых вариантах осуществления линкер предусматривает Val-Cit-pABC. В некоторых вариантах осуществления аминокислотное звено представляет собой Val-Ala. В некоторых вариантах осуществления линкер предусматривает Val-Ala-pABC. В некоторых вариантах осуществления аминокислотное звено представляет собой Glu-Val-Cit. В некоторых вариантах осуществления линкер предусматривает Glu-Val-Cit-pABC. В некоторых вариантах осуществления аминокислотное звено представляет собой Ala-Ala-Asn. В некоторых вариантах осуществления линкер предусматривает Ala-Ala-Asn-pABC.
[349] В некоторых вариантах осуществления pABC подвергается самораспаду после расщепления расщепляемого β-глюкуронидного фрагмента в линкере. В некоторых вариантах осуществления линкер предусматривает β-глюкуронид-pABC.
[350] В определенных вариантах осуществления саморасщепляющееся спейсерное звено в линкере предусматривает п-аминобензильное звено. В некоторых вариантах осуществления саморасщепляющееся спейсерное звено в линкере предусматривает п-аминобензил (pAB). В некоторых вариантах осуществления в самораспад pAB вовлечены самопроизвольные реакции 1,6-элиминирования.
[351] В различных вариантах осуществления структура п-аминобензила (pAB), применяемого в раскрытых ADC, показана ниже:
[352] В различных вариантах осуществления саморасщепляющееся спейсерное звено прикрепляет расщепляемый фрагмент в линкере к модулятору сплайсинга. В некоторых вариантах осуществления саморасщепляющееся спейсерное звено представляет собой pAB. В некоторых вариантах осуществления pAB прикрепляет расщепляемый фрагмент в линкере к модулятору сплайсинга. В некоторых вариантах осуществления pAB подвергается самораспаду после расщепления расщепляемого фрагмента, и модулятор сплайсинга высвобождается из ADC в его нативной активной форме.
[353] В некоторых вариантах осуществления антитело к HER2 или антигенсвязывающий фрагмент соединяются с модулятором сплайсинга с помощью линкера, предусматривающего MC-Val-Cit-pAB. В других вариантах осуществления антитело к HER2 или антигенсвязывающий фрагмент соединяются с модулятором сплайсинга с помощью линкера, предусматривающего MC-Val-Ala-pAB.
[354] В некоторых вариантах осуществления антитело к CD138 или антигенсвязывающий фрагмент соединяются с модулятором сплайсинга с помощью линкера, предусматривающего MC-Val-Cit-pAB. В других вариантах осуществления антитело к CD138 или антигенсвязывающий фрагмент соединяются с модулятором сплайсинга с помощью линкера, предусматривающего MC-Val-Ala-pAB.
[355] В некоторых вариантах осуществления антитело к EPHA2 или антигенсвязывающий фрагмент соединяются с модулятором сплайсинга с помощью линкера, предусматривающего MC-Val-Cit-pAB. В других вариантах осуществления антитело к EPHA2 или антигенсвязывающий фрагмент соединяются с модулятором сплайсинга с помощью линкера, предусматривающего MC-Val-Ala-pAB.
[356] В некоторых вариантах осуществления pAB подвергается самораспаду после расщепления расщепляемого пептидного фрагмента в линкере. В некоторых вариантах осуществления расщепляемый пептидный фрагмент предусматривает аминокислотное звено. В некоторых вариантах осуществления линкер предусматривает аминокислотное звено-pAB. В некоторых вариантах осуществления аминокислотное звено представляет собой Val-Cit. В некоторых вариантах осуществления линкер предусматривает Val-Cit-pAB. В некоторых вариантах осуществления аминокислотное звено представляет собой Val-Ala. В некоторых вариантах осуществления линкер предусматривает Val-Ala-pAB. В некоторых вариантах осуществления аминокислотное звено представляет собой Glu-Val-Cit. В некоторых вариантах осуществления линкер предусматривает Glu-Val-Cit-pAB. В некоторых вариантах осуществления аминокислотное звено представляет собой Ala-Ala-Asn. В некоторых вариантах осуществления линкер предусматривает Ala-Ala-Asn-pAB.
[357] В некоторых вариантах осуществления pAB подвергается самораспаду после расщепления расщепляемого β-глюкуронидного фрагмента в линкере. В некоторых вариантах осуществления линкер предусматривает β-глюкуронид-pAB.
[358] В некоторых других вариантах осуществления модулятор сплайсинга прикреплен к расщепляемому фрагменту в линкере с помощью несаморасщепляющегося спейсерного звена. В определенных вариантах осуществления модулятор сплайсинга прикреплен к расщепляемому фрагменту в линкере с помощью несаморасщепляющегося спейсерного звена, при этом расщепляемый фрагмент предусматривает Val-Cit, а малеимидокапроил (MC) соединяет расщепляемый фрагмент с антителом или антигенсвязывающим фрагментом. В определенных вариантах осуществления модулятор сплайсинга прикреплен к расщепляемому фрагменту в линкере с помощью несаморасщепляющегося спейсерного звена, при этом расщепляемый фрагмент предусматривает Val-Ala, а малеимидокапроил (MC) соединяет расщепляемый фрагмент с антителом или антигенсвязывающим фрагментом.
[359] В различных аспектах антитело или антигенсвязывающий фрагмент ADC конъюгированы с фрагментом-лекарственным средством, представляющим собой модулятор сплайсинга, через линкер, где линкер предусматривает Mal-спейсерное звено (например, MC), расщепляемое аминокислотное звено и pABC. В некоторых вариантах осуществления спейсерное звено предусматривает алкильный фрагмент. В некоторых вариантах осуществления Mal-спейсерное звено предусматривает малеимидокапроил (MC). В некоторых вариантах осуществления линкер предусматривает Mal-спейсерное звено-аминокислотное звено-pABC. В некоторых вариантах осуществления линкер предусматривает MC-аминокислотное звено-pABC. В некоторых вариантах осуществления линкер предусматривает MC-Val-Cit-pABC. В некоторых вариантах осуществления линкер предусматривает MC-Val-Ala-pABC. В некоторых вариантах осуществления линкер предусматривает MC-Glu-Val-Cit-pABC. В некоторых вариантах осуществления линкер предусматривает MC-Ala-Ala-Asn-pABC.
[360] В различных других аспектах антитело или антигенсвязывающий фрагмент ADC конъюгированы с фрагментом-лекарственным средством, представляющим собой модулятор сплайсинга, через линкер, где линкер предусматривает Mal-спейсерное звено (например, MC), расщепляемое аминокислотное звено и pAB. В некоторых вариантах осуществления спейсерное звено предусматривает алкильный фрагмент. В некоторых вариантах осуществления Mal-спейсерное звено предусматривает малеимидокапроил (MC). В некоторых вариантах осуществления линкер предусматривает Mal-спейсерное звено-аминокислотное звено-pAB. В некоторых вариантах осуществления линкер предусматривает MC-аминокислотное звено-pAB. В некоторых вариантах осуществления линкер предусматривает MC-Val-Cit-pAB. В некоторых вариантах осуществления линкер предусматривает MC-Val-Ala-pAB. В некоторых вариантах осуществления линкер предусматривает MC-Glu-Val-Cit-pAB. В некоторых вариантах осуществления линкер предусматривает MC-Ala-Ala-Asn-pAB.
[361] В различных других аспектах антитело или антигенсвязывающий фрагмент ADC конъюгированы с фрагментом-лекарственным средством, представляющим собой модулятор сплайсинга, через линкер, где линкер предусматривает Mal-спейсерное звено (например, MC), расщепляемый β-глюкуронид и pABC. В некоторых вариантах осуществления линкер предусматривает Mal-спейсерное звено-β-глюкуронид-pABC. В некоторых вариантах осуществления линкер предусматривает MC-β-глюкуронид-pABC.
[362] В еще одних аспектах антитело или антигенсвязывающий фрагмент ADC конъюгированы с фрагментом-лекарственным средством, представляющим собой модулятор сплайсинга, через линкер, где линкер предусматривает Mal-спейсерное звено (например, MC), расщепляемый β-глюкуронид и pAB. В некоторых вариантах осуществления линкер предусматривает Mal-спейсерное звено-β-глюкуронид-pAB. В некоторых вариантах осуществления линкер предусматривает MC-β-глюкуронид-pAB.
[363] В различных вариантах осуществления соединение ADC имеет формулу (I):
Ab-(L-D)p (I),
где Ab представляет собой антитело или антигенсвязывающий фрагмент, которые целенаправленно воздействуют на неопластическую клетку;
D представляет собой модулятор сплайсинга;
L представляет собой линкер, который ковалентно прикрепляет Ab к D; и
p составляет целое число от 1 до 15.
[364] В некоторых вариантах осуществления антитело или антигенсвязывающий фрагмент (Ab) из ADC конъюгированы с фрагментом-лекарственным средством, представляющим собой модулятор сплайсинга, через линкер, где линкер является любым линкером, раскрытым в данном документе или включенным в него посредством ссылки, или содержит один или несколько компонентов любого из линкеров, раскрытых в данном документе или включенных в него посредством ссылки.
[365] В некоторых вариантах осуществления линкер предусматривает расщепляемый фрагмент, который расположен таким образом, что никакая часть линкера или антитела или антигенсвязывающего фрагмента не остается связанной с модулятором сплайсинга после расщепления. В некоторых вариантах осуществления расщепляемый фрагмент представляет собой расщепляемый пептидный фрагмент, например аминокислотное звено, такое как Val-Cit или Val-Ala. В некоторых вариантах осуществления аминокислотное звено или линкер предусматривают Val-Cit. В некоторых вариантах осуществления аминокислотное звено или линкер предусматривают Val-Ala. В некоторых вариантах осуществления аминокислотное звено или линкер предусматривают Glu-Val-Cit.
[366] В некоторых вариантах осуществления линкер предусматривает по меньшей мере одно спейсерное звено, соединяющее антитело или антигенсвязывающий фрагмент с расщепляемым фрагментом. В некоторых вариантах осуществления линкер предусматривает по меньшей мере одно спейсерное звено, соединяющее антитело или антигенсвязывающий фрагмент с фрагментом-лекарственным средством. В некоторых вариантах осуществления спейсерное звено или линкер предусматривают по меньшей мере один алкильный фрагмент.
[367] В некоторых вариантах осуществления спейсерное звено в линкере прикрепляется к антителу или антигенсвязывающему фрагменту через Mal-фрагмент ("Mal-спейсерное звено"). В некоторых вариантах осуществления Mal-спейсерное звено предусматривает по меньшей мере один алкильный фрагмент. В некоторых вариантах осуществления линкер предусматривает малеимидокапроил (MC). В некоторых вариантах осуществления линкер предусматривает Mal-(CH2)2 ("Mal-Et"). В некоторых вариантах осуществления линкер предусматривает Mal-(CH2)6 ("Mal-Hex"). В некоторых вариантах осуществления линкер предусматривает Mal-(CH2)2-O-(CH2)2 ("Mal-Et-O-Et"). В некоторых вариантах осуществления линкер предусматривает Mal-(PEG)2-CO. В некоторых вариантах осуществления Mal-спейсерное звено прикрепляет антитело или антигенсвязывающий фрагмент к фрагменту-лекарственному средству.
[368] В некоторых вариантах осуществления Mal-спейсерное звено или линкер предусматривают Mal-(PEG)2, Mal-(PEG)3, Mal-(PEG)4, Mal-(PEG)5, Mal-(PEG)6, Mal-(PEG)7 или Mal-(PEG)8. В некоторых вариантах осуществления Mal-спейсерное звено или линкер предусматривают Mal-(PEG)2. В некоторых вариантах осуществления Mal-спейсерное звено или линкер предусматривают Mal-(PEG)2-CO, Mal-(PEG)3-CO, Mal-(PEG)4-CO, Mal-(PEG)5-CO, Mal-(PEG)6-CO, Mal-(PEG)7-CO или Mal-(PEG)8-CO. В некоторых вариантах осуществления Mal-спейсерное звено или линкер предусматривают Mal-(PEG)2-CO. В некоторых вариантах осуществления Mal-спейсерное звено или линкер предусматривают Mal-(PEG)2-CO и по меньшей мере одно дополнительное спейсерное звено. В некоторых вариантах осуществления Mal-(PEG)2-CO прикрепляет антитело или антигенсвязывающий фрагмент к фрагменту-лекарственному средству. В некоторых вариантах осуществления линкер предусматривает Mal-(PEG)2-CO или состоит из него. Пример линкера "Mal-(PEG)2-CO" также обозначается в данном документе как "ADL2" или линкер "ADL2".
[369] В некоторых вариантах осуществления Mal-спейсерное звено или линкер предусматривают MC. В некоторых вариантах осуществления Mal-спейсерное звено или линкер предусматривают MC и по меньшей мере одно дополнительное спейсерное звено. В некоторых вариантах осуществления MC прикрепляет антитело или антигенсвязывающий фрагмент к фрагменту-лекарственному средству. В некоторых вариантах осуществления линкер предусматривает MC или состоит из него. Пример линкера "MC" также обозначается в данном документе как "ADL10" или линкер "ADL10".
[370] В некоторых вариантах осуществления Mal-спейсерное звено или линкер предусматривают Mal-(CH2)6 ("Mal-Hex"). В некоторых вариантах осуществления Mal-спейсерное звено или линкер предусматривают Mal-Hex и по меньшей мере одно дополнительное спейсерное звено. В некоторых вариантах осуществления Mal-Hex прикрепляет антитело или антигенсвязывающий фрагмент к фрагменту-лекарственному средству. В некоторых вариантах осуществления линкер предусматривает Mal-Hex. Пример линкера "Mal-Hex" также обозначается в данном документе как "ADL12" или линкер "ADL12".
[371] В некоторых вариантах осуществления Mal-спейсерное звено или линкер предусматривают Mal-(CH2)2 ("Mal-Et"). В некоторых вариантах осуществления Mal-спейсерное звено или линкер предусматривают Mal-Et и по меньшей мере одно дополнительное спейсерное звено. В некоторых вариантах осуществления Mal-Et прикрепляет антитело или антигенсвязывающий фрагмент к фрагменту-лекарственному средству. В некоторых вариантах осуществления линкер предусматривает Mal-Et. Пример линкера "Mal-Et" также обозначается в данном документе как "ADL14" или линкер "ADL14".
[372] В некоторых вариантах осуществления Mal-спейсерное звено или линкер предусматривают Mal-(CH2)2-O-(CH2)2 ("Mal-Et-O-Et"). В некоторых вариантах осуществления Mal-спейсерное звено или линкер предусматривают Mal-Et-O-Et и по меньшей мере одно дополнительное спейсерное звено. В некоторых вариантах осуществления Mal-Et-O-Et прикрепляет антитело или антигенсвязывающий фрагмент к фрагменту-лекарственному средству. В некоторых вариантах осуществления линкер предусматривает Mal-Et-O-Et. Пример линкера "Mal-Et-O-Et" также обозначается в данном документе как "ADL15" или линкер "ADL15".
[373] В некоторых других вариантах осуществления Mal-спейсерное звено прикрепляет антитело или антигенсвязывающий фрагмент к расщепляемому фрагменту в линкере. В некоторых вариантах осуществления расщепляемый фрагмент в линкере представляет собой расщепляемый пептидный фрагмент, например аминокислотное звено. В некоторых вариантах осуществления расщепляемый пептидный фрагмент представляет собой Val-Cit или Val-Ala. В некоторых вариантах осуществления Mal-спейсерное звено или линкер предусматривают MC. В некоторых вариантах осуществления линкер предусматривает MC-Val-Cit. В некоторых вариантах осуществления линкер предусматривает MC-Val-Ala. В некоторых вариантах осуществления линкер предусматривает MC-Glu-Val-Cit. В некоторых вариантах осуществления линкер предусматривает MC-Ala-Ala-Asn.
[374] В некоторых вариантах осуществления спейсерное звено прикрепляет расщепляемый фрагмент в линкере к модулятору сплайсинга. В некоторых вариантах осуществления спейсерное звено, которое прикрепляет расщепляемый фрагмент к модулятору сплайсинга, является саморасщепляющимся.
[375] В некоторых вариантах осуществления спейсерное звено предусматривает pABC. В некоторых вариантах осуществления pABC прикрепляет расщепляемый фрагмент к модулятору сплайсинга. В некоторых вариантах осуществления расщепляемый фрагмент представляет собой расщепляемый пептидный фрагмент, например аминокислотное звено. В некоторых вариантах осуществления линкер предусматривает аминокислотное звено-pABC.
[376] В некоторых вариантах осуществления линкер предусматривает Val-Cit-pABC. В некоторых вариантах осуществления линкер предусматривает Val-Cit-pABC и MC-Mal-спейсерное звено, соединяющее линкер с антителом или антигенсвязывающим фрагментом. В некоторых вариантах осуществления линкер предусматривает MC-Val-Cit-pABC. В некоторых вариантах осуществления линкер предусматривает MC-Val-Cit-pABC и по меньшей мере одно дополнительное спейсерное звено. Пример линкера MC-Val-Cit-pABC также обозначается в данном документе как "ADL1" или линкер "ADL1".
[377] В некоторых вариантах осуществления линкер предусматривает Val-Ala-pABC. В некоторых вариантах осуществления линкер предусматривает Val-Ala-pABC и MC-Mal-спейсерное звено, соединяющее линкер с антителом или антигенсвязывающим фрагментом. В некоторых вариантах осуществления линкер предусматривает MC-Val-Ala-pABC. В некоторых вариантах осуществления линкер предусматривает MC-Val-Ala-pABC и по меньшей мере одно дополнительное спейсерное звено. Пример линкера MC-Val-Ala-pABC также обозначается в данном документе как "ADL6" или линкер "ADL6".
[378] В некоторых вариантах осуществления линкер предусматривает Glu-Val-Cit-pABC. В некоторых вариантах осуществления линкер предусматривает Glu-Val-Cit-pABC и MC Mal-спейсерное звено, соединяющее линкер с антителом или антигенсвязывающим фрагментом. В некоторых вариантах осуществления линкер предусматривает MC-Glu-Val-Cit-pABC. В некоторых вариантах осуществления линкер предусматривает MC-Glu-Val-Cit-pABC и по меньшей мере одно дополнительное спейсерное звено. Пример линкера MC-Glu-Val-Cit-pABC также обозначается в данном документе как "ADL23" или линкер "ADL23".
[379] В некоторых вариантах осуществления линкер предусматривает Ala-Ala-Asn-pABC. В некоторых вариантах осуществления линкер предусматривает Ala-Ala-Asn-pABC и MC-Mal-спейсерное звено, соединяющее линкер с антителом или антигенсвязывающим фрагментом. В некоторых вариантах осуществления линкер предусматривает MC-Ala-Ala-Asn-pABC. В некоторых вариантах осуществления линкер предусматривает MC-Ala-Ala-Asn-pABC и по меньшей мере одно дополнительное спейсерное звено. Пример линкера MC-Ala-Ala-Asn-pABC также обозначается в данном документе как "ADL21" или линкер "ADL21".
[380] В некоторых других вариантах осуществления спейсерное звено предусматривает pAB. В некоторых вариантах осуществления pAB прикрепляет расщепляемый фрагмент к модулятору сплайсинга. В некоторых вариантах осуществления расщепляемый фрагмент представляет собой расщепляемый пептидный фрагмент, например аминокислотное звено. В некоторых вариантах осуществления линкер предусматривает аминокислотное звено-pAB.
[381] В некоторых вариантах осуществления линкер предусматривает Val-Ala-pAB. В некоторых вариантах осуществления линкер предусматривает Val-Ala-pAB и MC-Mal-спейсерное звено, соединяющее линкер с антителом или антигенсвязывающим фрагментом. В некоторых вариантах осуществления линкер предусматривает MC-Val-Ala-pAB. В некоторых вариантах осуществления линкер предусматривает MC-Val-Ala-pAB и по меньшей мере одно дополнительное спейсерное звено. Пример линкера MC-Val-Ala-pAB также обозначается в данном документе как "ADL5" или линкер "ADL5".
[382] В некоторых вариантах осуществления линкер предусматривает Val-Cit-pAB. В некоторых вариантах осуществления линкер предусматривает Val-Cit-pAB и MC-Mal-спейсерное звено, соединяющее линкер с антителом или антигенсвязывающим фрагментом. В некоторых вариантах осуществления линкер предусматривает MC-Val-Cit-pAB. В некоторых вариантах осуществления линкер предусматривает MC-Val-Cit-pAB и по меньшей мере одно дополнительное спейсерное звено. Пример линкера MC-Val-Cit-pAB также обозначается в данном документе как "ADL7" или линкер "ADL7".
[383] В некоторых вариантах осуществления линкер предусматривает β-глюкуронид-pABC. В некоторых вариантах осуществления линкер предусматривает β-глюкуронид-pABC и MC-Mal-спейсерное звено, соединяющее линкер с антителом или антигенсвязывающим фрагментом. В некоторых вариантах осуществления линкер предусматривает MC-β-глюкуронид-pABC. В некоторых вариантах осуществления линкер предусматривает MC-β-глюкуронид-pABC и по меньшей мере одно дополнительное спейсерное звено. Пример MC-β-глюкуронид-pABC также обозначается в данном документе как "ADL13" или линкер "ADL13".
[384] В некоторых вариантах осуществления линкер предусматривает β-глюкуронид-pAB. В некоторых вариантах осуществления линкер предусматривает β-глюкуронид-pAB и MC-Mal-спейсерное звено, соединяющее линкер с антителом или антигенсвязывающим фрагментом. В некоторых вариантах осуществления линкер предусматривает MC-β-глюкуронид-pAB.
[385] В некоторых вариантах осуществления антитело или антигенсвязывающий фрагмент конъюгированы с фрагментом-лекарственным средством, представляющим собой модулятор сплайсинга, через линкер ADL1, ADL2, ADL5, ADL6, ADL7, ADL12, ADL13, ADL14, ADL21, ADL23 или ADL15. В различных вариантах осуществления было обнаружено, что ADC, содержащие линкер ADL1, ADL2, ADL5, ADL6, ADL7, ADL12, ADL13, ADL14, ADL21, ADL23 или ADL15 и раскрытый в данном документе фрагмент-лекарственное средство, представляющий собой модулятор сплайсинга, демонстрируют свойства, требуемые для терапевтического ADC. В различных вариантах осуществления эти свойства включают без ограничения эффективные уровни нагрузки лекарственным средством, низкие уровни агрегации, стабильность при условиях хранения или при нахождении в кровотоке в организме (например, стабильность в сыворотке крови), сохранение аффинности в отношении клеток, экспрессирующих мишень, сравнимую с таковой неконъюгированного антитела, сильную цитотоксичность против клеток, экспрессирующих мишень, низкие уровни нецелевого уничтожения клеток, высокие уровни неспецифического уничтожения и/или эффективную противораковую активность in vivo, все их них по сравнению с ADC, использующими другие линкеры-полезные нагрузки. Например, в различных вариантах осуществления ADC, содержащие линкер ADL1, ADL2, ADL5, ADL6, ADL7, ADL12, ADL13, ADL14, ADL21, ADL23, или ADL15 и раскрытый в данном документе фрагмент-лекарственное средство, представляющий собой модулятор сплайсинга, проявляют повышенную способность подавлять рост и/или пролиферацию у клеток, экспрессирующих мишень по сравнению с ADC, использующими другие линкеры-полезные нагрузки (например, линкер ADL10 и фрагмент-лекарственное средство, представляющий собой модулятор сплайсинга). В различных вариантах осуществления ADC, содержащие линкер ADL1, ADL2, ADL5, ADL6, ADL7, ADL12, ADL13, ADL14, ADL21, ADL23, или ADL15 и раскрытый в данном документе фрагмент-лекарственное средство, представляющий собой модулятор сплайсинга, проявляют неожиданно повышенную стабильность in vivo (например, стабильность в плазме крови) по сравнению с ADC на основе другого модулятора сплайсинга (например, ADC на основе тайланстатина A, например, как сообщается в Puthenveetil et al. Bioconjugate Chem. (2016) 27:1880-8).
[386] В некоторых вариантах осуществления надлежащие или превосходные функциональные свойства, обеспечиваемые конкретной комбинацией линкера ADL1, ADL2, ADL5, ADL6, ADL7, ADL12, ADL13, ADL14, ADL21, ADL23, или ADL15 и раскрытого в данном документе фрагмента-лекарственного средства, представляющего собой модулятор сплайсинга, можно наблюдать в случае линкера-полезной нагрузки, конъюгированных, например, с антителом к HER2, таким как трастузумаб; антителом к CD138, таким как B-B4; или антителом к EPHA2, таким как 1C1.
[387] В некоторых вариантах осуществления ADC содержит ADL1-модулятор сплайсинга и антитело или антигенсвязывающий фрагмент, предусматривающий антитело или его антигенсвязывающий фрагмент, который сохраняет способность целенаправленно воздействовать на неопластическую клетку и подвергаться интернализации в нее. В некоторых вариантах осуществления ADC содержит ADL2-модулятор сплайсинга и антитело или антигенсвязывающий фрагмент, предусматривающий антитело или его антигенсвязывающий фрагмент, который сохраняет способность целенаправленно воздействовать на неопластическую клетку и подвергаться интернализации в нее. В некоторых вариантах осуществления ADC содержит ADL5-модулятор сплайсинга и антитело или антигенсвязывающий фрагмент, предусматривающий антитело или его антигенсвязывающий фрагмент, который сохраняет способность целенаправленно воздействовать на неопластическую клетку и подвергаться интернализации в нее. В некоторых вариантах осуществления ADC содержит ADL6-модулятор сплайсинга и антитело или антигенсвязывающий фрагмент, предусматривающий антитело или его антигенсвязывающий фрагмент, который сохраняет способность целенаправленно воздействовать на неопластическую клетку и подвергаться интернализации в нее. В некоторых вариантах осуществления ADC содержит ADL7-модулятор сплайсинга и антитело или антигенсвязывающий фрагмент, предусматривающий антитело или его антигенсвязывающий фрагмент, который сохраняет способность целенаправленно воздействовать на неопластическую клетку и подвергаться интернализации в нее. В некоторых вариантах осуществления ADC содержит ADL12-модулятор сплайсинга и антитело или антигенсвязывающий фрагмент, предусматривающий антитело или его антигенсвязывающий фрагмент, который сохраняет способность целенаправленно воздействовать на неопластическую клетку и подвергаться интернализации в нее. В некоторых вариантах осуществления ADC содержит ADL13-модулятор сплайсинга и антитело или антигенсвязывающий фрагмент, предусматривающий антитело или его антигенсвязывающий фрагмент, который сохраняет способность целенаправленно воздействовать на неопластическую клетку и подвергаться интернализации в нее. В некоторых вариантах осуществления ADC содержит ADL14-модулятор сплайсинга и антитело или антигенсвязывающий фрагмент, предусматривающий антитело или его антигенсвязывающий фрагмент, который сохраняет способность целенаправленно воздействовать на неопластическую клетку и подвергаться интернализации в нее. В некоторых вариантах осуществления ADC содержит ADL15-модулятор сплайсинга и антитело или антигенсвязывающий фрагмент, предусматривающий антитело или его антигенсвязывающий фрагмент, который сохраняет способность целенаправленно воздействовать на неопластическую клетку и подвергаться интернализации в нее.
[388] В некоторых вариантах осуществления ADC содержит модулятор сплайсинга ADL1 и антитело или его антигенсвязывающий фрагмент, которые целенаправленно воздействуют на неопластическую клетку, экспрессирующую HER2. В некоторых вариантах осуществления ADC содержит модулятор сплайсинга ADL2 и антитело или его антигенсвязывающий фрагмент, которые целенаправленно воздействуют на неопластическую клетку, экспрессирующую HER2. В некоторых вариантах осуществления ADC содержит модулятор сплайсинга ADL5 и антитело или его антигенсвязывающий фрагмент, которые целенаправленно воздействуют на неопластическую клетку, экспрессирующую HER2. В некоторых вариантах осуществления ADC содержит модулятор сплайсинга ADL6 и антитело или его антигенсвязывающий фрагмент, которые целенаправленно воздействуют на неопластическую клетку, экспрессирующую HER2. В некоторых вариантах осуществления ADC содержит модулятор сплайсинга ADL7 и антитело или его антигенсвязывающий фрагмент, которые целенаправленно воздействуют на неопластическую клетку, экспрессирующую HER2. В некоторых вариантах осуществления ADC содержит модулятор сплайсинга ADL12 и антитело или его антигенсвязывающий фрагмент, которые целенаправленно воздействуют на неопластическую клетку, экспрессирующую HER2. В некоторых вариантах осуществления ADC содержит модулятор сплайсинга ADL13 и антитело или его антигенсвязывающий фрагмент, которые целенаправленно воздействуют на неопластическую клетку, экспрессирующую HER2. В некоторых вариантах осуществления ADC содержит модулятор сплайсинга ADL14 и антитело или его антигенсвязывающий фрагмент, которые целенаправленно воздействуют на неопластическую клетку, экспрессирующую HER2. В некоторых вариантах осуществления ADC содержит модулятор сплайсинга ADL15 и антитело или его антигенсвязывающий фрагмент, которые целенаправленно воздействуют на неопластическую клетку, экспрессирующую HER2.
[389] В некоторых вариантах осуществления антитело или его антигенсвязывающий фрагмент, которые целенаправленно воздействуют на неопластическую клетку, экспрессирующую HER2, представляют собой интернализующееся антитело или интернализующийся антигенсвязывающий фрагмент. В некоторых вариантах осуществления антитело или его антигенсвязывающий фрагмент, которые целенаправленно воздействуют на неопластическую клетку, экспрессирующую HER2, содержат три определяющие комплементарность области тяжелой цепи (HCDR), содержащие аминокислотные последовательности под SEQ ID NO:1 (HCDR1), SEQ ID NO:2 (HCDR2) и SEQ ID NO:3 (HCDR3); и три определяющие комплементарность области легкой цепи (LCDR), содержащие аминокислотные последовательности под SEQ ID NO:4 (LCDR1), SEQ ID NO:5 (LCDR2) и SEQ ID NO:6 (LCDR3).
[390] В некоторых вариантах осуществления ADC имеет формулу (I):
Ab-(L-D)p (I),
где:
(i) Ab представляет собой антитело к HER2 или его антигенсвязывающий фрагмент, содержащие определяющие комплементарность области тяжелой цепи (HCDR), содержащие аминокислотные последовательности под SEQ ID NO:1 (HCDR1), SEQ ID NO:2 (HCDR2) и SEQ ID NO:3 (HCDR3); и определяющие комплементарность области легкой цепи (LCDR), содержащие аминокислотные последовательности под SEQ ID NO:4 (LCDR1), SEQ ID NO:5 (LCDR2) и SEQ ID NO:6 (LCDR3);
(ii) D представляет собой модулятор сплайсинга;
(iii) L представляет собой линкер, предусматривающий ADL1, ADL2, ADL5, ADL6, ADL7, ADL12, ADL13, ADL14, ADL21, ADL23, или ADL15; и
(iv) p составляет целое число от 1 до 15.
[391] В некоторых вариантах осуществления антитело или антигенсвязывающий фрагмент, которые целенаправленно воздействуют на неопластическую клетку, экспрессирующую HER2, содержат вариабельную область тяжелой цепи, содержащую аминокислотную последовательность под SEQ ID NO:19, и вариабельную область легкой цепи, содержащую аминокислотную последовательность под SEQ ID NO:20. В некоторых вариантах осуществления антитело или его антигенсвязывающий фрагмент, которые целенаправленно воздействуют на неопластическую клетку, экспрессирующую HER2, содержат константный домен тяжелой цепи IgG1 человека и константный домен легкой каппа-цепи Ig человека. В некоторых вариантах осуществления антитело представляет собой трастузумаб. В некоторых вариантах осуществления p составляет целое число от 1 до 10, от 2 до 8 или от 4 до 8. В некоторых вариантах осуществления p составляет 4. В некоторых вариантах осуществления p составляет 8.
[392] В некоторых вариантах осуществления ADC содержит модулятор сплайсинга ADL1 и антитело или его антигенсвязывающий фрагмент, которые целенаправленно воздействуют на неопластическую клетку, экспрессирующую CD138. В некоторых вариантах осуществления ADC содержит модулятор сплайсинга ADL2 и антитело или его антигенсвязывающий фрагмент, которые целенаправленно воздействуют на неопластическую клетку, экспрессирующую CD138. В некоторых вариантах осуществления ADC содержит модулятор сплайсинга ADL5 и антитело или его антигенсвязывающий фрагмент, которые целенаправленно воздействуют на неопластическую клетку, экспрессирующую CD138. В некоторых вариантах осуществления ADC содержит модулятор сплайсинга ADL6 и антитело или его антигенсвязывающий фрагмент, которые целенаправленно воздействуют на неопластическую клетку, экспрессирующую CD138. В некоторых вариантах осуществления ADC содержит модулятор сплайсинга ADL7 и антитело или его антигенсвязывающий фрагмент, которые целенаправленно воздействуют на неопластическую клетку, экспрессирующую CD138. В некоторых вариантах осуществления ADC содержит модулятор сплайсинга ADL12 и антитело или его антигенсвязывающий фрагмент, которые целенаправленно воздействуют на неопластическую клетку, экспрессирующую CD138. В некоторых вариантах осуществления ADC содержит модулятор сплайсинга ADL13 и антитело или его антигенсвязывающий фрагмент, которые целенаправленно воздействуют на неопластическую клетку, экспрессирующую CD138. В некоторых вариантах осуществления ADC содержит модулятор сплайсинга ADL14 и антитело или его антигенсвязывающий фрагмент, которые целенаправленно воздействуют на неопластическую клетку, экспрессирующую CD138. В некоторых вариантах осуществления ADC содержит модулятор сплайсинга ADL15 и антитело или его антигенсвязывающий фрагмент, которые целенаправленно воздействуют на неопластическую клетку, экспрессирующую CD138.
[393] В некоторых вариантах осуществления антитело или его антигенсвязывающий фрагмент, которые целенаправленно воздействуют на неопластическую клетку, экспрессирующую CD138, представляют собой интернализующееся антитело или интернализующийся антигенсвязывающий фрагмент. В некоторых вариантах осуществления антитело или его антигенсвязывающий фрагмент, которые целенаправленно воздействуют на неопластическую клетку, экспрессирующую CD138, содержат три определяющие комплементарность области тяжелой цепи (HCDR), содержащие аминокислотные последовательности под SEQ ID NO:7 (HCDR1), SEQ ID NO:8 (HCDR2) и SEQ ID NO:9 (HCDR3); и три определяющие комплементарность области легкой цепи (LCDR), содержащие аминокислотные последовательности под SEQ ID NO:10 (LCDR1), SEQ ID NO:11 (LCDR2) и SEQ ID NO:12 (LCDR3).
[394] В некоторых вариантах осуществления ADC имеет формулу (I):
Ab-(L-D)p (I),
где:
(i) Ab представляет собой антитело к CD138 или его антигенсвязывающий фрагмент, содержащие определяющие комплементарность области тяжелой цепи (HCDR), содержащие аминокислотные последовательности под SEQ ID NO:7 (HCDR1), SEQ ID NO:8 (HCDR2) и SEQ ID NO:9 (HCDR3); и определяющие комплементарность области легкой цепи (LCDR), содержащие аминокислотные последовательности под SEQ ID NO:10 (LCDR1), SEQ ID NO:11 (LCDR2) и SEQ ID NO:12 (LCDR3);
(ii) D представляет собой модулятор сплайсинга;
(iii) L представляет собой линкер, предусматривающий ADL1, ADL2, ADL5, ADL6, ADL7, ADL12, ADL13, ADL14, ADL21, ADL23, или ADL15; и
(iv) p составляет целое число от 1 до 15.
[395] В некоторых вариантах осуществления антитело или антигенсвязывающий фрагмент, которые целенаправленно воздействуют на неопластическую клетку, экспрессирующую CD138, содержат вариабельную область тяжелой цепи, содержащую аминокислотную последовательность под SEQ ID NO:21, и вариабельную область легкой цепи, содержащую аминокислотную последовательность под SEQ ID NO:22. В некоторых вариантах осуществления антитело или его антигенсвязывающий фрагмент, которые целенаправленно воздействуют на неопластическую клетку, экспрессирующую CD138, содержат константный домен тяжелой цепи IgG2a мыши и константный домен легкой каппа-цепи Ig мыши. В некоторых вариантах осуществления антитело или его антигенсвязывающий фрагмент, которые целенаправленно воздействуют на неопластическую клетку, экспрессирующую CD138, содержат константный домен тяжелой цепи IgG2a человека и константный домен легкой каппа-цепи Ig человека. В некоторых вариантах осуществления антитело представляет собой B-B4. В некоторых вариантах осуществления p составляет целое число от 1 до 10, от 2 до 8 или от 4 до 8. В некоторых вариантах осуществления p составляет 4. В некоторых вариантах осуществления p составляет 8.
[396] В некоторых вариантах осуществления ADC содержит модулятор сплайсинга ADL1 и антитело или его антигенсвязывающий фрагмент, которые целенаправленно воздействуют на неопластическую клетку, экспрессирующую EPHA2. В некоторых вариантах осуществления ADC содержит модулятор сплайсинга ADL2 и антитело или его антигенсвязывающий фрагмент, которые целенаправленно воздействуют на неопластическую клетку, экспрессирующую EPHA2. В некоторых вариантах осуществления ADC содержит модулятор сплайсинга ADL5 и антитело или его антигенсвязывающий фрагмент, которые целенаправленно воздействуют на неопластическую клетку, экспрессирующую EPHA2. В некоторых вариантах осуществления ADC содержит модулятор сплайсинга ADL6 и антитело или его антигенсвязывающий фрагмент, которые целенаправленно воздействуют на неопластическую клетку, экспрессирующую EPHA2. В некоторых вариантах осуществления ADC содержит модулятор сплайсинга ADL7 и антитело или его антигенсвязывающий фрагмент, которые целенаправленно воздействуют на неопластическую клетку, экспрессирующую EPHA2. В некоторых вариантах осуществления ADC содержит модулятор сплайсинга ADL12 и антитело или его антигенсвязывающий фрагмент, которые целенаправленно воздействуют на неопластическую клетку, экспрессирующую EPHA2. В некоторых вариантах осуществления ADC содержит модулятор сплайсинга ADL13 и антитело или его антигенсвязывающий фрагмент, которые целенаправленно воздействуют на неопластическую клетку, экспрессирующую EPHA2. В некоторых вариантах осуществления ADC содержит модулятор сплайсинга ADL14 и антитело или его антигенсвязывающий фрагмент, которые целенаправленно воздействуют на неопластическую клетку, экспрессирующую EPHA2. В некоторых вариантах осуществления ADC содержит модулятор сплайсинга ADL15 и антитело или его антигенсвязывающий фрагмент, которые целенаправленно воздействуют на неопластическую клетку, экспрессирующую EPHA2.
[397] В некоторых вариантах осуществления антитело или его антигенсвязывающий фрагмент, которые целенаправленно воздействуют на неопластическую клетку, экспрессирующую EPHA2, представляют собой интернализующееся антитело или интернализующийся антигенсвязывающий фрагмент. В некоторых вариантах осуществления антитело или его антигенсвязывающий фрагмент, которые целенаправленно воздействуют на неопластическую клетку, экспрессирующую EPHA2, содержат три определяющие комплементарность области тяжелой цепи (HCDR), содержащие аминокислотные последовательности под SEQ ID NO:13 (HCDR1), SEQ ID NO:14 (HCDR2) и SEQ ID NO:15 (HCDR3); и три определяющие комплементарность области легкой цепи (LCDR), содержащие аминокислотные последовательности под SEQ ID NO:16 (LCDR1), SEQ ID NO:17 (LCDR2) и SEQ ID NO:18 (LCDR3).
[398] В некоторых вариантах осуществления ADC имеет формулу (I):
Ab-(L-D)p (I),
где:
(i) Ab представляет собой антитело к EPHA2 или его антигенсвязывающий фрагмент, содержащие определяющие комплементарность области тяжелой цепи (HCDR), содержащие аминокислотные последовательности под SEQ ID NO:13 (HCDR1), SEQ ID NO:14 (HCDR2) и SEQ ID NO:15 (HCDR3); и определяющие комплементарность области легкой цепи (LCDR), содержащие аминокислотные последовательности под SEQ ID NO:16 (LCDR1), SEQ ID NO:17 (LCDR2) и SEQ ID NO:18 (LCDR3);
(ii) D представляет собой модулятор сплайсинга;
(iii) L представляет собой линкер, предусматривающий ADL1, ADL2, ADL5, ADL6, ADL7, ADL12, ADL13, ADL14, ADL21, ADL23, или ADL15; и
(iv) p составляет целое число от 1 до 15.
[399] В некоторых вариантах осуществления антитело или антигенсвязывающий фрагмент, которые целенаправленно воздействуют на неопластическую клетку, экспрессирующую EPHA2, содержат вариабельную область тяжелой цепи, содержащую аминокислотную последовательность под SEQ ID NO:23, и вариабельную область легкой цепи, содержащую аминокислотную последовательность под SEQ ID NO:24. В некоторых вариантах осуществления антитело или его антигенсвязывающий фрагмент, которые целенаправленно воздействуют на неопластическую клетку, экспрессирующую EPHA2, содержат константный домен тяжелой цепи IgG1 человека и константный домен легкой каппа-цепи Ig человека. В некоторых вариантах осуществления антитело представляет собой 1C1. В некоторых вариантах осуществления p составляет целое число от 1 до 10, от 2 до 8 или от 4 до 8. В некоторых вариантах осуществления p составляет 4. В некоторых вариантах осуществления p составляет 8.
Фрагменты-лекарственные средства
[400] Фрагмент-лекарственное средство (D) из ADC, описанных в данном документе, может представлять собой любое химиотерапевтическое средство. Применимые классы химиотерапевтических средств включают, например, модуляторы сплайсинга РНК. В некоторых предпочтительных вариантах осуществления фрагмент-лекарственное средство представляет собой модулятор сплайсинга. Иллюстративные соединения, представляющие собой модулятор сплайсинга, описаны и приведены в качестве примера в данном документе.
[401] В различных вариантах осуществления фрагмент-лекарственное средство представляет собой соединение, являющееся модулятором сплайсинга, формулы (II):
 (II),
(II),
или его фармацевтически приемлемую соль, где:
R1 отсутствует или выбран из водорода, C1-C6алкильных групп, C1-C6алкилалкоксигрупп, C1-C6алкиламиногрупп, групп C1-C6алкилкарбоновой кислоты, C1-C6алкилгидроксигрупп, C3-C8циклоалкильных групп, бензильных групп, C3-C8гетероциклильных групп, групп -O-C(=O)-(C1-C6алкил) и -CD3;
R3 выбран из водорода, C1-C6алкильных групп, C1-C6алкилалкоксигрупп, C1-C6алкиламиногрупп, групп C1-C6алкилкарбоновой кислоты, C1-C6алкилгидроксигрупп, C3-C8циклоалкильных групп, бензильных групп, C3-C8гетероциклильных групп и групп -O-C(=O)-(C1-C6алкил); и
каждый из R4, R5 и R8 независимо выбран из водорода, гидроксильных групп, групп -O-(C1-C6алкил), групп -O-C(=O)-(C1-C6алкил) и C1-C6алкильных групп;
каждый из R6 и R7 независимо выбран из водорода, -O-R17, -O-C(=O)-R17, -O-C(=O)-NR15R16, C1-C6алкильных групп и -NR15R16;
каждый из R15 и R16 независимо выбран из водорода, R17, -C(=O)-R17 и -C(=O)-O-R17;
R17 выбран из водорода, C1-C6алкильных групп, C3-C8циклоалкильных групп, бензильных групп и C3-C8гетероциклильных групп; и
Z выбран из  ,
,  ,
,  ,
,  и
и  ;
;
где каждый из R1, R3, R4, R5, R6, R7, R8, R15, R16, и R17 независимо замещен 0-3 группами, независимо выбранными из атомов галогена, гидроксильных групп, C1-C6алкильных групп, групп -O-(C1-C6алкил), -NR15R16, C3-C8циклоалкильных групп, C1-C6алкилгидроксигрупп, C1-C6алкилалкоксигрупп, бензильных групп и C3-C8гетероциклильных групп,
где по меньшей мере один из R6 и R7 представляет собой водород.
[402] В некоторых вариантах осуществления R1 выбран из водорода, C1-C4алкильных групп, групп C1-C4алкилкарбоновой кислоты и C3-C8циклоалкильных групп. В некоторых вариантах осуществления R1 представляет собой водород. В некоторых вариантах осуществления R1 представляет собой C1-C4алкильную группу. В некоторых вариантах осуществления R1 представляет собой метил. В некоторых вариантах осуществления R1 представляет собой этил. В некоторых вариантах осуществления R1 представляет собой группу C1-C4алкилкарбоновой кислоты. В некоторых вариантах осуществления R1 представляет собой -CH2CH2CH2CO2H. В некоторых вариантах осуществления R1 представляет собой C3-C8циклоалкильную группу. В некоторых вариантах осуществления R1 представляет собой циклогептил.
[403] В некоторых вариантах осуществления R3 выбран из водорода, C1-C4алкильных групп, C1-C4алкилалкоксигрупп, групп C1-C4алкилкарбоновой кислоты и C1-C4алкилгидроксигрупп. В некоторых вариантах осуществления R3 выбран из водорода и групп C1-C4алкилкарбоновой кислоты. В некоторых вариантах осуществления R3 представляет собой водород. В некоторых вариантах осуществления R3 представляет собой группу C1-C4алкилкарбоновой кислоты. В некоторых вариантах осуществления R3 представляет собой -CH2CH2CO2H.
[404] В некоторых вариантах осуществления R4 выбран из водорода, гидроксильных групп, групп -O-(C1-C4алкил), групп -O-C(=O)-(C1-C4алкил) и C1-C4алкильных групп. В некоторых вариантах осуществления R4 представляет собой водород. В некоторых вариантах осуществления R4 представляет собой гидроксил. В некоторых вариантах осуществления R4 представляет собой группу -O-(C1-C4алкил). В некоторых вариантах осуществления R4 представляет собой -OCH3. В некоторых вариантах осуществления R4 представляет собой -OCH2CH3. В некоторых вариантах осуществления R4 представляет собой группу -O-C(=O)-(C1-C4алкил). В некоторых вариантах осуществления R4 представляет собой -O-C(=O)-CH3. В некоторых вариантах осуществления R4 представляет собой -O-C(=O)-CH2CH3. В некоторых вариантах осуществления R4 представляет собой C1-C4алкильную группу. В некоторых вариантах осуществления R4 представляет собой метил. В некоторых вариантах осуществления R4 представляет собой этил.
[405] В некоторых вариантах осуществления R5 выбран из водорода, гидроксильных групп, групп -O-(C1-C4алкил) и C1-C4алкильных групп. В некоторых вариантах осуществления R5 представляет собой водород. В некоторых вариантах осуществления R5 представляет собой гидроксил. В некоторых вариантах осуществления R5 представляет собой группу -O-(C1-C4алкил). В некоторых вариантах осуществления R5 представляет собой C1-C4алкильную группу.
[406] В некоторых вариантах осуществления R6 представляет собой водород. В некоторых вариантах осуществления R7 представляет собой водород. В некоторых вариантах осуществления R6 представляет собой водород, и R7 представляет собой -O-R17. В некоторых вариантах осуществления R6 представляет собой водород, и R7 представляет собой -OR17, где R17 выбран из водорода и C1-C4алкильных групп. В некоторых вариантах осуществления R6 представляет собой водород, и R7 представляет собой -O-R17, где R17 представляет собой водород. В некоторых вариантах осуществления R6 представляет собой -O-R17, и R7 представляет собой водород. В некоторых вариантах осуществления R6 представляет собой -O-R17, и R7 представляет собой водород, где R17 выбран из водорода и C1-C4алкильных групп. В некоторых вариантах осуществления R6 представляет собой -O-R17, и R7 представляет собой водород, где R17 представляет собой водород. В некоторых вариантах осуществления R6 представляет собой водород, и R7 представляет собой -NR15R16. В некоторых вариантах осуществления R6 представляет собой водород, и R7 представляет собой -NR15R16, где R15 представляет собой H, и R16 выбран из водорода, R17, -C(=O)-R17 и -C(=O)-O-R17. В некоторых вариантах осуществления R6 представляет собой водород, и R7 представляет собой -NR15R16, где R15 представляет собой H, и R16 выбран из водорода, R17, -C(=O)-R17 и -C(=O)-O-R17, и где R17 выбран из водорода, C1-C6алкильных групп, C3-C8циклоалкильных групп и C3-C8гетероциклильных групп. В некоторых вариантах осуществления R6 представляет собой -O-R17. В некоторых вариантах осуществления R6 представляет собой -O-C(=O)-R17. В некоторых вариантах осуществления R6 представляет собой C1-C6алкил. В некоторых вариантах осуществления R6 представляет собой C1-C4алкил. В некоторых вариантах осуществления R6 представляет собой C1алкил. В некоторых вариантах осуществления R6 представляет собой -NR15R16. В некоторых вариантах осуществления R7 представляет собой -O-R17. В некоторых вариантах осуществления R7 представляет собой -O-C(=O)-R17. В некоторых вариантах осуществления R7 представляет собой C1-C6алкил. В некоторых вариантах осуществления R7 представляет собой C1-C4алкил. В некоторых вариантах осуществления R7 представляет собой C1алкил. В некоторых вариантах осуществления R7 представляет собой -NR15R16.
[407] В некоторых вариантах осуществления R8 выбран из водорода, гидроксильных групп, групп -O-(C1-C4алкил) и (C1-C4алкил). В некоторых вариантах осуществления R8 представляет собой водород. В некоторых вариантах осуществления R8 представляет собой гидроксильную группу. В некоторых вариантах осуществления R8 представляет собой группу -O-(C1-C4алкил). В некоторых вариантах осуществления R8 представляет собой группу -O-(C1алкил).
[408] В некоторых вариантах осуществления R15 представляет собой водород. В некоторых вариантах осуществления R15 представляет собой R17. В некоторых вариантах осуществления R15 представляет собой -C(=O)-R17. В некоторых вариантах осуществления R15 представляет собой -C(=O)-O-R17.
[409] В некоторых вариантах осуществления R16 представляет собой водород. В некоторых вариантах осуществления R16 представляет собой R17. В некоторых вариантах осуществления R16 представляет собой -C(=O)-R17. В некоторых вариантах осуществления R16 представляет собой -C(=O)-O-R17.
[410] В некоторых вариантах осуществления R17 выбран из водорода, C1-C4алкильных групп, C3-C6циклоалкильных групп и C3-C8гетероциклильных групп. В некоторых вариантах осуществления R17 представляет собой водород. В некоторых вариантах осуществления R17 представляет собой C1-C4алкильную группу. В некоторых вариантах осуществления R17 представляет собой C1алкильную группу. В некоторых вариантах осуществления R17 представляет собой C3-C6циклоалкильную группу. В некоторых вариантах осуществления R17 представляет собой C3циклоалкильную группу. В некоторых вариантах осуществления R17 представляет собой C4циклоалкильную группу. В некоторых вариантах осуществления R17 представляет собой C5циклоалкильную группу. В некоторых вариантах осуществления R17 представляет собой C6циклоалкильную группу. В некоторых вариантах осуществления R17 представляет собой C3-C8гетероциклильную группу. В некоторых вариантах осуществления R17 представляет собой C3гетероциклильную группу. В некоторых вариантах осуществления R17 представляет собой C4гетероциклильную группу. В некоторых вариантах осуществления R17 представляет собой C5гетероциклильную группу. В некоторых вариантах осуществления R17 представляет собой C6гетероциклильную группу. В некоторых вариантах осуществления R17 представляет собой C7гетероциклильную группу. В некоторых вариантах осуществления R17 представляет собой C8гетероциклильную группу.
[411] В некоторых вариантах осуществления Z представляет собой  . В некоторых вариантах осуществления Z представляет собой
. В некоторых вариантах осуществления Z представляет собой  . В некоторых вариантах осуществления Z представляет собой
. В некоторых вариантах осуществления Z представляет собой  . В некоторых вариантах осуществления Z представляет собой
. В некоторых вариантах осуществления Z представляет собой  . В некоторых вариантах осуществления Z представляет собой
. В некоторых вариантах осуществления Z представляет собой  .
.
[412] В некоторых вариантах осуществления соединение, представляющее собой модулятор сплайсинга, формулы (II) прикрепляется к линкеру L, например, в ADC формулы (I), как показано на формуле (II-A):
 (II-A),
(II-A),
где Z' выбран из  ,
,  ,
,  ,
,  и
и  ; и
; и
где все остальные переменные являются такими, как определено для формулы (II).
[413] В различных других вариантах осуществления фрагмент-лекарственное средство представляет собой соединение, являющееся модулятором сплайсинга, формулы (IV):
 (IV),
(IV),
или его фармацевтически приемлемую соль, где:
R1 выбран из водорода, C1-C6алкильных групп, C1-C6алкилалкоксигрупп, C1-C6алкиламиногрупп, групп C1-C6алкилкарбоновой кислоты, C1-C6алкилгидроксигрупп, C3-C8циклоалкильных групп, бензильных групп, C3-C8гетероциклильных групп, групп -O-C(=O)-(C1-C6алкил) и -CD3;
R3 выбран из водорода, C1-C6алкильных групп, C1-C6алкилалкоксигрупп, C1-C6алкиламиногрупп, групп C1-C6алкилкарбоновой кислоты, C1-C6алкилгидроксигрупп, C3-C8циклоалкильных групп, бензильных групп, C3-C8гетероциклильных групп и групп -O-C(=O)-(C1-C6алкил); и
каждый из R4, R5 и R8 независимо выбран из водорода, гидроксильных групп, групп -O-(C1-C6алкил), групп -O-C(=O)-(C1-C6алкил) и C1-C6алкильных групп;
каждый из R6 и R7 независимо выбран из водорода, -O-R17, -O-C(=O)-R17, -O-C(=O)-NR15R16, C1-C6алкильных групп и -NR15R16;
каждый из R15 и R16 независимо выбран из водорода, R17, -C(=O)-R17 и
-C(=O)-O-R17; и
R17 выбран из водорода, C1-C6алкильных групп, C3-C8циклоалкильных групп, бензильных групп и C3-C8гетероциклильных групп;
где каждый из R1, R3, R4, R5, R6, R7, R8, R15, R16, и R17 независимо замещен 0-3 группами, независимо выбранными из атомов галогена, гидроксильных групп, C1-C6алкильных групп, групп -O-(C1-C6алкил), -NR15R16, C3-C8циклоалкильных групп, C1-C6алкилгидроксигрупп, C1-C6алкилалкоксигрупп, бензильных групп и C3-C8гетероциклильных групп,
где по меньшей мере один из R6 и R7 представляет собой водород.
[414] В некоторых вариантах осуществления R1 выбран из водорода, C1-C4алкильных групп, групп C1-C4алкилкарбоновой кислоты и C3-C8циклоалкильных групп. В некоторых вариантах осуществления R1 представляет собой водород. В некоторых вариантах осуществления R1 представляет собой C1-C4алкильную группу. В некоторых вариантах осуществления R1 представляет собой метил. В некоторых вариантах осуществления R1 представляет собой этил. В некоторых вариантах осуществления R1 представляет собой группу C1-C4алкилкарбоновой кислоты. В некоторых вариантах осуществления R1 представляет собой -CH2CH2CH2CO2H. В некоторых вариантах осуществления R1 представляет собой C3-C8циклоалкильную группу. В некоторых вариантах осуществления R1 представляет собой циклогептил.
[415] В некоторых вариантах осуществления R3 выбран из водорода, C1-C4алкильных групп, C1-C4алкилалкоксигрупп, групп C1-C4алкилкарбоновой кислоты и C1-C4алкилгидроксигрупп. В некоторых вариантах осуществления R3 выбран из водорода и групп C1-C4алкилкарбоновой кислоты. В некоторых вариантах осуществления R3 представляет собой водород. В некоторых вариантах осуществления R3 представляет собой группу C1-C4алкилкарбоновой кислоты. В некоторых вариантах осуществления R3 представляет собой -CH2CH2CO2H.
[416] В некоторых вариантах осуществления R4 выбран из водорода, гидроксильных групп, групп -O-(C1-C4алкил), групп -O-C(=O)-(C1-C4алкил) и C1-C4алкильных групп. В некоторых вариантах осуществления R4 представляет собой водород. В некоторых вариантах осуществления R4 представляет собой гидроксил. В некоторых вариантах осуществления R4 представляет собой группу -O-(C1-C4алкил). В некоторых вариантах осуществления R4 представляет собой -OCH3. В некоторых вариантах осуществления R4 представляет собой -OCH2CH3. В некоторых вариантах осуществления R4 представляет собой группу -O-C(=O)-(C1-C4алкил). В некоторых вариантах осуществления R4 представляет собой -O-C(=O)-CH3. В некоторых вариантах осуществления R4 представляет собой -O-C(=O)-CH2CH3. В некоторых вариантах осуществления R4 представляет собой C1-C4алкильную группу. В некоторых вариантах осуществления R4 представляет собой метил. В некоторых вариантах осуществления R4 представляет собой этил.
[417] В некоторых вариантах осуществления R5 выбран из водорода, гидроксильных групп, групп -O-(C1-C4алкил) и C1-C4алкильных групп. В некоторых вариантах осуществления R5 представляет собой водород. В некоторых вариантах осуществления R5 представляет собой гидроксил. В некоторых вариантах осуществления R5 представляет собой группу -O-(C1-C4алкил). В некоторых вариантах осуществления R5 представляет собой C1-C4алкильную группу.
[418] В некоторых вариантах осуществления R6 представляет собой водород. В некоторых вариантах осуществления R7 представляет собой водород. В некоторых вариантах осуществления R6 представляет собой водород, и R7 представляет собой -O-R17. В некоторых вариантах осуществления R6 представляет собой водород, и R7 представляет собой -OR17, где R17 выбран из водорода и C1-C4алкильных групп. В некоторых вариантах осуществления R6 представляет собой водород, и R7 представляет собой -O-R17, где R17 представляет собой водород. В некоторых вариантах осуществления R6 представляет собой -O-R17, и R7 представляет собой водород. В некоторых вариантах осуществления R6 представляет собой -O-R17, и R7 представляет собой водород, где R17 выбран из водорода и C1-C4алкильных групп. В некоторых вариантах осуществления R6 представляет собой -O-R17, и R7 представляет собой водород, где R17 представляет собой водород. В некоторых вариантах осуществления R6 представляет собой водород, и R7 представляет собой -NR15R16. В некоторых вариантах осуществления R6 представляет собой водород, и R7 представляет собой -NR15R16, где R15 представляет собой H, и R16 выбран из водорода, R17, -C(=O)-R17 и -C(=O)-O-R17. В некоторых вариантах осуществления R6 представляет собой водород, и R7 представляет собой -NR15R16, где R15 представляет собой H, и R16 выбран из водорода, R17, -C(=O)-R17 и -C(=O)-O-R17, и где R17 выбран из водорода, C1-C6алкильных групп, C3-C8циклоалкильных групп и C3-C8гетероциклильных групп. В некоторых вариантах осуществления R6 представляет собой -O-R17. В некоторых вариантах осуществления R6 представляет собой -O-C(=O)-R17. В некоторых вариантах осуществления R6 представляет собой C1-C6алкил. В некоторых вариантах осуществления R6 представляет собой C1-C4алкил. В некоторых вариантах осуществления R6 представляет собой C1алкил. В некоторых вариантах осуществления R6 представляет собой -NR15R16.
[419] В некоторых вариантах осуществления R7 представляет собой -O-R17. В некоторых вариантах осуществления R7 представляет собой -O-C(=O)-R17. В некоторых вариантах осуществления R7 представляет собой C1-C6алкил. В некоторых вариантах осуществления R7 представляет собой C1-C4алкил. В некоторых вариантах осуществления R7 представляет собой C1алкил. В некоторых вариантах осуществления R7 представляет собой -NR15R16.
[420] В некоторых вариантах осуществления R8 выбран из водорода, гидроксильных групп, групп -O-(C1-C4алкил) и (C1-C4алкил). В некоторых вариантах осуществления R8 представляет собой водород. В некоторых вариантах осуществления R8 представляет собой гидроксильную группу. В некоторых вариантах осуществления R8 представляет собой группу -O-(C1-C4алкил). В некоторых вариантах осуществления R8 представляет собой группу -O-(C1алкил).
[421] В некоторых вариантах осуществления R15 представляет собой водород. В некоторых вариантах осуществления R15 представляет собой R17. В некоторых вариантах осуществления R15 представляет собой -C(=O)-R17. В некоторых вариантах осуществления R15 представляет собой -C(=O)-O-R17.
[422] В некоторых вариантах осуществления R16 представляет собой водород. В некоторых вариантах осуществления R16 представляет собой R17. В некоторых вариантах осуществления R16 представляет собой -C(=O)-R17. В некоторых вариантах осуществления R16 представляет собой -C(=O)-O-R17.
[423] В некоторых вариантах осуществления R17 выбран из водорода, C1-C4алкильных групп, C3-C6циклоалкильных групп и C3-C8гетероциклильных групп. В некоторых вариантах осуществления R17 представляет собой водород. В некоторых вариантах осуществления R17 представляет собой C1-C4алкильную группу. В некоторых вариантах осуществления R17 представляет собой C1алкильную группу. В некоторых вариантах осуществления R17 представляет собой C3-C6циклоалкильную группу. В некоторых вариантах осуществления R17 представляет собой C3циклоалкильную группу. В некоторых вариантах осуществления R17 представляет собой C4циклоалкильную группу. В некоторых вариантах осуществления R17 представляет собой C5циклоалкильную группу. В некоторых вариантах осуществления R17 представляет собой C6циклоалкильную группу. В некоторых вариантах осуществления R17 представляет собой C3-C8гетероциклильную группу. В некоторых вариантах осуществления R17 представляет собой C3гетероциклильную группу. В некоторых вариантах осуществления R17 представляет собой C4гетероциклильную группу. В некоторых вариантах осуществления R17 представляет собой C5гетероциклильную группу. В некоторых вариантах осуществления R17 представляет собой C6гетероциклильную группу. В некоторых вариантах осуществления R17 представляет собой C7гетероциклильную группу. В некоторых вариантах осуществления R17 представляет собой C8гетероциклильную группу.
[424] В некоторых вариантах осуществления соединение, представляющее собой модулятор сплайсинга, формулы (IV) прикрепляется к линкеру L, например, в ADC формулы (I), как показано на формуле (IV-A):
 (IV-A).
(IV-A).
[425] В различных других вариантах осуществления фрагмент-лекарственное средство представляет собой соединение, являющееся модулятором сплайсинга, формулы (VI):
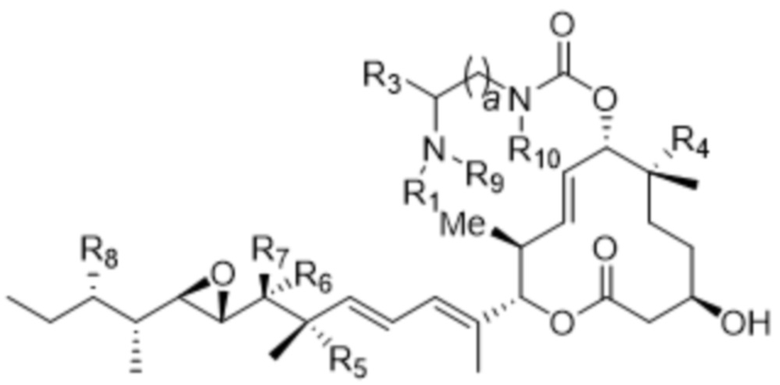 (VI),
(VI),
или его фармацевтически приемлемую соль, где:
каждый из R1 и R9 независимо выбран из водорода, C1-C6алкильных групп, C1-C6алкилалкоксигрупп, C1-C6алкиламиногрупп, групп C1-C6алкилкарбоновой кислоты, C1-C6алкилгидроксигрупп, C3-C8циклоалкильных групп, бензильных групп, C3-C8гетероциклильных групп, групп -O-C(=O)-(C1-C6алкил) и -CD3;
R3 выбран из водорода, C1-C6алкильных групп, C1-C6алкилалкоксигрупп, C1-C6алкиламиногрупп, групп C1-C6алкилкарбоновой кислоты, C1-C6алкилгидроксигрупп, C3-C8циклоалкильных групп, бензильных групп, C3-C8гетероциклильных групп и групп -O-C(=O)-(C1-C6алкил);
каждый из R4, R5 и R8 независимо выбран из водорода, гидроксильных групп, групп -O-(C1-C6алкил), групп -O-C(=O)-(C1-C6алкил) и C1-C6алкильных групп;
каждый из R6 и R7 независимо выбран из водорода, -O-R17, -O-C(=O)-R17, -O-C(=O)-NR15R16, C1-C6алкильных групп, -NR15R16 и линкера;
R10 выбран из водорода, C1-C6алкильных групп, групп -C(=O)-(C1-C6алкил) и -CD3;
каждый из R15 и R16 независимо выбран из водорода, R17, -C(=O)-R17 и -C(=O)-O-R17;
R17 выбран из водорода, C1-C6алкильных групп, C3-C8циклоалкильных групп, бензильных групп и C3-C8гетероциклильных групп; и
a составляет 1, 2, 3, 4, 5, 6, 7, 8, 9, или 10;
где каждый из R1, R3, R4, R5, R6, R7, R8, R9, R10, R15, R16, и R17 независимо замещен 0-3 группами, независимо выбранными из атомов галогена, гидроксильных групп, C1-C6алкильных групп, групп -O-(C1-C6алкил), -NR15R16, C3-C8циклоалкильных групп, C1-C6алкилгидроксигрупп, C1-C6алкилалкоксигрупп, бензильных групп и C3-C8гетероциклильных групп;
где по меньшей мере один из R6 и R7 представляет собой водород; и
где оба R1 и R9 не могут отсутствовать.
[426] В некоторых вариантах осуществления R1 выбран из водорода, C1-C4алкильных групп, групп C1-C4алкилкарбоновой кислоты и C3-C8циклоалкильных групп. В некоторых вариантах осуществления R1 представляет собой водород. В некоторых вариантах осуществления R1 представляет собой C1-C4алкильную группу. В некоторых вариантах осуществления R1 представляет собой метил. В некоторых вариантах осуществления R1 представляет собой этил. В некоторых вариантах осуществления R1 представляет собой группу C1-C4алкилкарбоновой кислоты. В некоторых вариантах осуществления R1 представляет собой -CH2CH2CH2CO2H. В некоторых вариантах осуществления R1 представляет собой C3-C8циклоалкильную группу. В некоторых вариантах осуществления R1 представляет собой циклогептил.
[427] В некоторых вариантах осуществления R3 выбран из водорода, C1-C4алкильных групп, C1-C4алкилалкоксигрупп, групп C1-C4алкилкарбоновой кислоты и C1-C4алкилгидроксигрупп. В некоторых вариантах осуществления R3 выбран из водорода и групп C1-C4алкилкарбоновой кислоты. В некоторых вариантах осуществления R3 представляет собой водород. В некоторых вариантах осуществления R3 представляет собой группу C1-C4алкилкарбоновой кислоты. В некоторых вариантах осуществления R3 представляет собой -CH2CH2CO2H.
[428] В некоторых вариантах осуществления R4 выбран из водорода, гидроксильных групп, групп -O-(C1-C4алкил), групп -O-C(=O)-(C1-C4алкил) и C1-C4алкильных групп. В некоторых вариантах осуществления R4 представляет собой водород. В некоторых вариантах осуществления R4 представляет собой гидроксил. В некоторых вариантах осуществления R4 представляет собой группу -O-(C1-C4алкил). В некоторых вариантах осуществления R4 представляет собой -OCH3. В некоторых вариантах осуществления R4 представляет собой -OCH2CH3. В некоторых вариантах осуществления R4 представляет собой группу -O-C(=O)-(C1-C4алкил). В некоторых вариантах осуществления R4 представляет собой -O-C(=O)-CH3. В некоторых вариантах осуществления R4 представляет собой -O-C(=O)-CH2CH3. В некоторых вариантах осуществления R4 представляет собой C1-C4алкильную группу. В некоторых вариантах осуществления R4 представляет собой метил. В некоторых вариантах осуществления R4 представляет собой этил.
[429] В некоторых вариантах осуществления R5 выбран из водорода, гидроксильных групп, групп -O-(C1-C4алкил) и C1-C4алкильных групп. В некоторых вариантах осуществления R5 представляет собой водород. В некоторых вариантах осуществления R5 представляет собой гидроксил. В некоторых вариантах осуществления R5 представляет собой группу -O-(C1-C4алкил). В некоторых вариантах осуществления R5 представляет собой C1-C4алкильную группу.
[430] В некоторых вариантах осуществления R9 отсутствует или выбран из водорода, C1-C4алкильных групп, групп -(C=O)-(C1-C4алкил) и -CD3. В некоторых вариантах осуществления R9 отсутствует. В некоторых вариантах осуществления R9 представляет собой водород. В некоторых вариантах осуществления R9 представляет собой C1-C4алкильную группу. В некоторых вариантах осуществления C1-C4алкильных группа представляет собой метил. В некоторых вариантах осуществления C1-C4алкильная группа представляет собой этил. В некоторых вариантах осуществления R9 представляет собой группу -(C=O)-(C1-C4алкил). В некоторых вариантах осуществления группа -(C=O)-(C1-C4алкил) представляет собой -(C=O)-метил. В некоторых вариантах осуществления R9 представляет собой -CD3.
[431] В некоторых вариантах осуществления R10 выбран из водорода, C1-C4алкильных групп, групп -(C=O)-(C1-C4алкил) и -CD3. В некоторых вариантах осуществления R10 представляет собой водород. В некоторых вариантах осуществления R10 представляет собой C1-C4алкильную группу. В некоторых вариантах осуществления C1-C4алкильных группа представляет собой метил. В некоторых вариантах осуществления C1-C4алкильная группа представляет собой этил. В некоторых вариантах осуществления R10 представляет собой группу -(C=O)-(C1-C4алкил). В некоторых вариантах осуществления группа -(C=O)-(C1-C4алкил) представляет собой -(C=O)-метил. В некоторых вариантах осуществления R10 представляет собой -CD3.
[432] В некоторых вариантах осуществления R6 представляет собой водород. В некоторых вариантах осуществления R7 представляет собой водород. В некоторых вариантах осуществления R6 представляет собой водород, и R7 представляет собой -O-R17. В некоторых вариантах осуществления R6 представляет собой водород, и R7 представляет собой -OR17, где R17 выбран из водорода и C1-C4алкильных групп. В некоторых вариантах осуществления R6 представляет собой водород, и R7 представляет собой -O-R17, где R17 представляет собой водород. В некоторых вариантах осуществления R6 представляет собой -O-R17, и R7 представляет собой водород. В некоторых вариантах осуществления R6 представляет собой -O-R17, и R7 представляет собой водород, где R17 выбран из водорода и C1-C4алкильных групп. В некоторых вариантах осуществления R6 представляет собой -O-R17, и R7 представляет собой водород, где R17 представляет собой водород. В некоторых вариантах осуществления R6 представляет собой водород, и R7 представляет собой -NR15R16. В некоторых вариантах осуществления R6 представляет собой водород, и R7 представляет собой -NR15R16, где R15 представляет собой H, и R16 выбран из водорода, R17, -C(=O)-R17 и -C(=O)-O-R17. В некоторых вариантах осуществления R6 представляет собой водород, и R7 представляет собой -NR15R16, где R15 представляет собой H, и R16 выбран из водорода, R17, -C(=O)-R17 и -C(=O)-O-R17, и где R17 выбран из водорода, C1-C6алкильных групп, C3-C8циклоалкильных групп и C3-C8гетероциклильных групп. В некоторых вариантах осуществления R6 представляет собой -O-R17. В некоторых вариантах осуществления R6 представляет собой -O-C(=O)-R17. В некоторых вариантах осуществления R6 представляет собой C1-C6алкил. В некоторых вариантах осуществления R6 представляет собой C1-C4алкил. В некоторых вариантах осуществления R6 представляет собой C1алкил. В некоторых вариантах осуществления R6 представляет собой -NR15R16.
[433] В некоторых вариантах осуществления R7 представляет собой -O-R17. В некоторых вариантах осуществления R7 представляет собой -O-C(=O)-R17. В некоторых вариантах осуществления R7 представляет собой C1-C6алкил. В некоторых вариантах осуществления R7 представляет собой C1-C4алкил. В некоторых вариантах осуществления R7 представляет собой C1алкил. В некоторых вариантах осуществления R7 представляет собой -NR15R16.
[434] В некоторых вариантах осуществления R8 выбран из водорода, гидроксильных групп, групп -O-(C1-C4алкил) и (C1-C4алкил). В некоторых вариантах осуществления R8 представляет собой водород. В некоторых вариантах осуществления R8 представляет собой гидроксильную группу. В некоторых вариантах осуществления R8 представляет собой группу -O-(C1-C4алкил). В некоторых вариантах осуществления R8 представляет собой группу -O-(C1алкил).
[435] В некоторых вариантах осуществления R15 представляет собой водород. В некоторых вариантах осуществления R15 представляет собой R17. В некоторых вариантах осуществления R15 представляет собой -C(=O)-R17. В некоторых вариантах осуществления R15 представляет собой -C(=O)-O-R17.
[436] В некоторых вариантах осуществления R16 представляет собой водород. В некоторых вариантах осуществления R16 представляет собой R17. В некоторых вариантах осуществления R16 представляет собой -C(=O)-R17. В некоторых вариантах осуществления R16 представляет собой -C(=O)-O-R17.
[437] В некоторых вариантах осуществления R17 выбран из водорода, C1-C4алкильных групп, C3-C6циклоалкильных групп и C3-C8гетероциклильных групп. В некоторых вариантах осуществления R17 представляет собой водород. В некоторых вариантах осуществления R17 представляет собой C1-C4алкильную группу. В некоторых вариантах осуществления R17 представляет собой C1алкильную группу. В некоторых вариантах осуществления R17 представляет собой C3-C6циклоалкильную группу. В некоторых вариантах осуществления R17 представляет собой C3циклоалкильную группу. В некоторых вариантах осуществления R17 представляет собой C4циклоалкильную группу. В некоторых вариантах осуществления R17 представляет собой C5циклоалкильную группу. В некоторых вариантах осуществления R17 представляет собой C6циклоалкильную группу. В некоторых вариантах осуществления R17 представляет собой C3-C8гетероциклильную группу. В некоторых вариантах осуществления R17 представляет собой C3гетероциклильную группу. В некоторых вариантах осуществления R17 представляет собой C4гетероциклильную группу. В некоторых вариантах осуществления R17 представляет собой C5гетероциклильную группу. В некоторых вариантах осуществления R17 представляет собой C6гетероциклильную группу. В некоторых вариантах осуществления R17 представляет собой C7гетероциклильную группу. В некоторых вариантах осуществления R17 представляет собой C8гетероциклильную группу.
[438] В некоторых вариантах осуществления a составляет 1, 2, 3, 4, 5, 6, 7, 8, 9, или 10. В некоторых вариантах осуществления a составляет 1, 2, 3, 4, 5 или 6. В некоторых вариантах осуществления a составляет 1, 2, 3, 4 или 5. В некоторых вариантах осуществления a составляет 1, 2, 3 или 4. В некоторых вариантах осуществления a составляет 1, 2 или 3. В некоторых вариантах осуществления a составляет 1 или 2. В некоторых вариантах осуществления a составляет 1. В некоторых вариантах осуществления a составляет 2. В некоторых вариантах осуществления a составляет 3. В некоторых вариантах осуществления a составляет 4. В некоторых вариантах осуществления a составляет 5. В некоторых вариантах осуществления a составляет 6. В некоторых вариантах осуществления a составляет 7. В некоторых вариантах осуществления a составляет 8. В некоторых вариантах осуществления a составляет 9. В некоторых вариантах осуществления a составляет 10.
[439] В некоторых вариантах осуществления соединение, представляющее собой модулятор сплайсинга, формулы (VI) прикрепляется к линкеру L, например, в ADC формулы (I), как показано на формуле (VI-A):
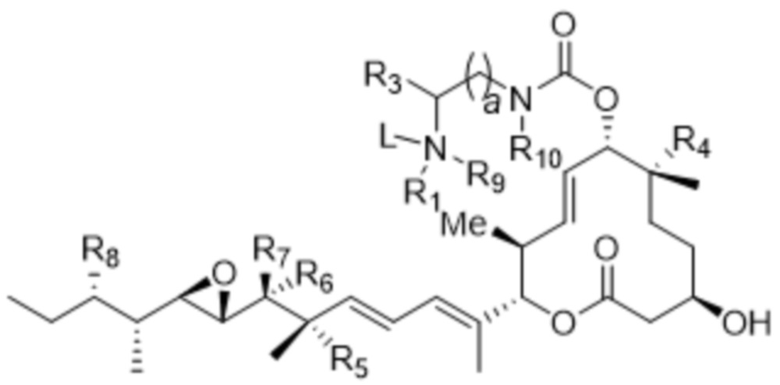 (VI-A).
(VI-A).
[440] В различных других вариантах осуществления фрагмент-лекарственное средство представляет собой соединение, являющееся модулятором сплайсинга, формулы (VIII):
 (VIII),
(VIII),
или его фармацевтически приемлемую соль, где:
R1 отсутствует или выбран из водорода, C1-C6алкильных групп, C1-C6алкилалкоксигрупп, C1-C6алкиламиногрупп, групп C1-C6алкилкарбоновой кислоты, C1-C6алкилгидроксигрупп, C3-C8циклоалкильных групп, бензильных групп, C3-C8гетероциклильных групп, групп -O-C(=O)-(C1-C6алкил) и -CD3;
R3 выбран из водорода, C1-C6алкильных групп, C1-C6алкилалкоксигрупп, C1-C6алкиламиногрупп, групп C1-C6алкилкарбоновой кислоты, C1-C6алкилгидроксигрупп, C3-C8циклоалкильных групп, бензильных групп, C3-C8гетероциклильных групп и групп -O-C(=O)-(C1-C6алкил);
R4 выбран из водорода, гидроксильных групп, групп -O-(C1-C6алкил), групп -O-C(=O)-(C1-C6алкил) и C1-C6алкильных групп; и
R10 выбран из 3-10-членных карбоциклов и 3-10-членных гетероциклов, каждый из которых замещен 0-3 Ra, где каждый Ra независимо выбран из атомов галогена, C1-C6алкильных групп, -O-(C1-C6)алкильных групп, C1-C6алкилалкоксигрупп, C1-C6алкилгидроксигрупп, -S(=O)w-(4-7-членные гетероциклы), 4-7-членных карбоциклов и 4-7-членных гетероциклов;
каждый из R15 и R16 независимо выбран из водорода, R17, -C(=O)-R17 и -C(=O)-O-R17; и
R17 выбран из водорода, C1-C6алкильных групп, C3-C8циклоалкильных групп, бензильных групп и C3-C8гетероциклильных групп;
где каждый из R1, R3, R4, R10, R15, R16 и R17 независимо замещен 0-3 группами, независимо выбранными из атомов галогена, гидроксильных групп, C1-C6алкильных групп, групп -O-(C1-C6алкил), -NR15R16, C3-C8циклоалкильных групп, C1-C6алкилгидроксигрупп, C1-C6алкилалкоксигрупп, бензильных групп и C3-C8гетероциклильных групп; и
где каждый Ra независимо замещен 0-3 группами, независимо выбранными из атомов галогена, гидроксильных групп, -NR15R16, C1-C6алкильных групп, групп -(C=O)-(C1-C6алкил), -(C=O)-(C1-C6алкил)-(C3-C10гетероциклильных групп) и групп C1-C6алкилкарбоновой кислоты, каждая из которых замещена 0, 1 или 2 группами, независимо выбранными из атомов галогена, гидроксильных групп, -NR15R16 и C1-C3алкильных групп; и
w составляет 0, 1 или 2.
[441] В некоторых вариантах осуществления R1 отсутствует или выбран из водорода, C1-C4алкильных групп, групп C1-C4алкилкарбоновой кислоты и C3-C8циклоалкильных групп. В некоторых вариантах осуществления R1 представляет собой водород. В некоторых вариантах осуществления R1 представляет собой C1-C4алкильную группу. В некоторых вариантах осуществления R1 представляет собой метил. В некоторых вариантах осуществления R1 представляет собой этил. В некоторых вариантах осуществления R1 представляет собой группу C1-C4алкилкарбоновой кислоты. В некоторых вариантах осуществления R1 представляет собой
-CH2CH2CH2CO2H. В некоторых вариантах осуществления R1 представляет собой C3-C8циклоалкильную группу. В некоторых вариантах осуществления R1 представляет собой циклогептил.
[442] В некоторых вариантах осуществления R3 выбран из водорода, C1-C4алкильных групп, C1-C4алкилалкоксигрупп, групп C1-C4алкилкарбоновой кислоты и C1-C4алкилгидроксигрупп. В некоторых вариантах осуществления R3 выбран из водорода и групп C1-C4алкилкарбоновой кислоты. В некоторых вариантах осуществления R3 представляет собой водород. В некоторых вариантах осуществления R3 представляет собой группу C1-C4алкилкарбоновой кислоты. В некоторых вариантах осуществления R3 представляет собой -CH2CH2CO2H.
[443] В некоторых вариантах осуществления R4 выбран из водорода, гидроксильных групп, групп -O-(C1-C4алкил), групп -O-C(=O)-(C1-C4алкил) и C1-C4алкильных групп. В некоторых вариантах осуществления R4 представляет собой водород. В некоторых вариантах осуществления R4 представляет собой гидроксил. В некоторых вариантах осуществления R4 представляет собой группу -O-(C1-C4алкил). В некоторых вариантах осуществления R4 представляет собой -OCH3. В некоторых вариантах осуществления R4 представляет собой -OCH2CH3. В некоторых вариантах осуществления R4 представляет собой группу -O-C(=O)-(C1-C4алкил). В некоторых вариантах осуществления R4 представляет собой -O-C(=O)-CH3. В некоторых вариантах осуществления R4 представляет собой -O-C(=O)-CH2CH3. В некоторых вариантах осуществления R4 представляет собой C1-C4алкильную группу. В некоторых вариантах осуществления R4 представляет собой метил. В некоторых вариантах осуществления R4 представляет собой этил.
[444] В некоторых вариантах осуществления R10 выбран из 6-9-членных карбоциклов и 6-9-членных гетероциклов, каждый из которых замещен 0-2 Ra, где каждый Ra независимо замещен 0-3 группами, независимо выбранными из атомов галогена, гидроксильных групп, C1-C6алкильных групп, групп -(C=O)-(C1-C6алкил), групп -(C=O)-(C1-C6алкил)-(3-10-членный гетероцикл) и групп C1-C6алкилкарбоновой кислоты.
[445] В некоторых вариантах осуществления карбоцикл представляет собой фенил, замещенный 0-2 Ra, где каждый Ra независимо замещен 0-3 группами, независимо выбранными из атомов галогена, гидроксильных групп, C1-C6алкильных групп, групп -(C=O)-(C1-C6алкил), групп -(C=O)-(C1-C6алкил)-(3-10-членный гетероцикл) и групп C1-C6алкилкарбоновой кислоты. В некоторых вариантах осуществления фенил замещен 2 Ra, где каждый Ra независимо замещен 0-3 группами, независимо выбранными из атомов галогена, гидроксильных групп, C1-C6алкильных групп, групп -(C=O)-(C1-C6алкил), групп -(C=O)-(C1-C6алкил)-(3-10 членный гетероцикл) и групп C1-C6алкилкарбоновой кислоты. В некоторых вариантах осуществления фенил представляет собой  .
.
[446] В некоторых вариантах осуществления гетероцикл представляет собой 9-членный гетероцикл, замещенный 0-2 Ra, где каждый Ra независимо замещен 0-3 группами, независимо выбранными из атомов галогена, гидроксильных групп, C1-C6алкильных групп, групп -(C=O)-(C1-C6алкил), групп -(C=O)-(C1-C6алкил)-(3-10-членный гетероцикл) и групп C1-C6алкилкарбоновой кислоты. В некоторых вариантах осуществления 9-членный гетероцикл представляет собой  .
.
[447] В некоторых вариантах осуществления Ra выбран из атомов галогена, 3-10-членных карбоциклов и 3-10-членных гетероциклов, где каждый Ra независимо замещен 0-3 группами, независимо выбранными из атомов галогена, гидроксильных групп, C1-C6алкильных групп, групп -(C=O)-(C1-C6алкил), групп -(C=O)-(C1-C6алкил)-(3-10-членный гетероцикл) и групп C1-C6алкилкарбоновой кислоты. В некоторых вариантах осуществления Ra выбран из атомов галогена, 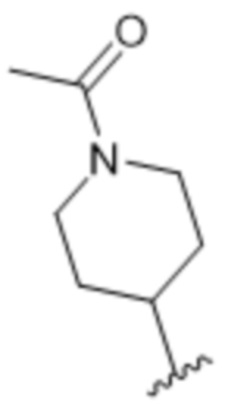 ,
, 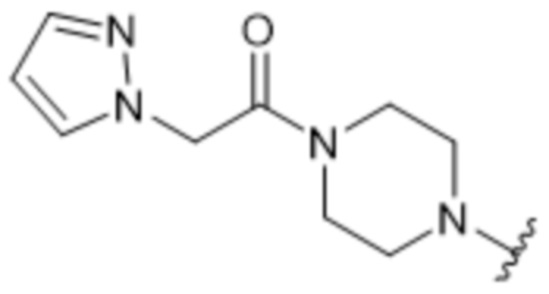 ,
,  и
и  .
.
[448] В некоторых вариантах осуществления R15 представляет собой водород. В некоторых вариантах осуществления R15 представляет собой R17. В некоторых вариантах осуществления R15 представляет собой -C(=O)-R17. В некоторых вариантах осуществления R15 представляет собой -C(=O)-O-R17.
[449] В некоторых вариантах осуществления R16 представляет собой водород. В некоторых вариантах осуществления R16 представляет собой R17. В некоторых вариантах осуществления R16 представляет собой -C(=O)-R17. В некоторых вариантах осуществления R16 представляет собой -C(=O)-O-R17.
[450] В некоторых вариантах осуществления R17 выбран из водорода, C1-C4алкильных групп, C3-C6циклоалкильных групп и C3-C8гетероциклильных групп. В некоторых вариантах осуществления R17 представляет собой водород. В некоторых вариантах осуществления R17 представляет собой C1-C4алкильную группу. В некоторых вариантах осуществления R17 представляет собой C1алкильную группу. В некоторых вариантах осуществления R17 представляет собой C3-C6циклоалкильную группу. В некоторых вариантах осуществления R17 представляет собой C3циклоалкильную группу. В некоторых вариантах осуществления R17 представляет собой C4циклоалкильную группу. В некоторых вариантах осуществления R17 представляет собой C5циклоалкильную группу. В некоторых вариантах осуществления R17 представляет собой C6циклоалкильную группу. В некоторых вариантах осуществления R17 представляет собой C3-C8гетероциклильную группу. В некоторых вариантах осуществления R17 представляет собой C3гетероциклильную группу. В некоторых вариантах осуществления R17 представляет собой C4гетероциклильную группу. В некоторых вариантах осуществления R17 представляет собой C5гетероциклильную группу. В некоторых вариантах осуществления R17 представляет собой C6гетероциклильную группу. В некоторых вариантах осуществления R17 представляет собой C7гетероциклильную группу. В некоторых вариантах осуществления R17 представляет собой C8гетероциклильную группу.
[451] В некоторых вариантах осуществления соединение, представляющее собой модулятор сплайсинга, формулы (VIII) прикрепляется к линкеру L, например, в ADC формулы (I), как показано на формуле (VIII-A):
 (VIII-A).
(VIII-A).
[452] В различных вариантах осуществления фрагмент-лекарственное средство представляет собой модулятор сплайсинга, выбранный из D2 и D1.
[453] В различных вариантах осуществления фрагмент-лекарственное средство представляет собой D2. В различных вариантах осуществления структура фрагмента-лекарственного средства D2, применяемого в раскрытых ADC, показана ниже:

D2.
[454] В различных вариантах осуществления линкер в ADC (например, ADC формулы (I)), описанный в данном документе, ковалентно прикрепляется к фрагменту-лекарственному средству D2 через амин на пиперазиновой группе. В различных вариантах осуществления фрагмент-лекарственное средство представляет собой производное D2. В различных вариантах осуществления производное D2 сохраняет по меньшей мере одну биологическую функцию или активность D2 (например, связывание комплекса SF3b, активность сплайсинга in vitro, цитотоксичность), но имеет измененную химическую структуру.
[455] В различных вариантах осуществления фрагмент-лекарственное средство представляет собой D1 или его фармацевтически приемлемую соль. В различных вариантах осуществления структура фрагмента-лекарственного средства D1, применяемого в раскрытых ADC, показана ниже:

D1.
[456] В различных вариантах осуществления линкер в ADC (например, ADC формулы (I)), описанный в данном документе, ковалентно прикрепляется к фрагменту-лекарственному средству D1 через амин на пиперазиновой группе. В различных вариантах осуществления фрагмент-лекарственное средство представляет собой производное D1. В различных вариантах осуществления производное D1 сохраняет по меньшей мере одну биологическую функцию или активность D1 (например, связывание комплекса SF3b, активность сплайсинга in vitro, цитотоксичность), но имеет измененную химическую структуру.
[457] В некоторых вариантах осуществления модулятор сплайсинга предусматривает D1:
 (D1).
(D1).
[458] В некоторых вариантах осуществления модулятор сплайсинга предусматривает D2:
 (D2).
(D2).
[459] В некоторых вариантах осуществления модулятор сплайсинга предусматривает D3:
 (D3).
(D3).
[460] В некоторых вариантах осуществления модулятор сплайсинга предусматривает D4:
 (D4).
(D4).
[461] В некоторых вариантах осуществления модулятор сплайсинга предусматривает D4':
 (D4').
(D4').
[462] В некоторых вариантах осуществления модулятор сплайсинга предусматривает D5:
 (D5).
(D5).
[463] В некоторых вариантах осуществления модулятор сплайсинга предусматривает D6:
 (D6).
(D6).
[464] В некоторых вариантах осуществления модулятор сплайсинга предусматривает D7:
 (D7).
(D7).
[465] В некоторых вариантах осуществления модулятор сплайсинга предусматривает D8:
 (D8).
(D8).
[466] В некоторых вариантах осуществления модулятор сплайсинга предусматривает D9:
 (D9).
(D9).
[467] В некоторых вариантах осуществления модулятор сплайсинга предусматривает D10:
 (D10).
(D10).
[468] В некоторых вариантах осуществления модулятор сплайсинга предусматривает D11:
 (D11).
(D11).
[469] В некоторых вариантах осуществления модулятор сплайсинга предусматривает D12:
 (D12).
(D12).
[470] В некоторых вариантах осуществления модулятор сплайсинга предусматривает D13:
 (D13).
(D13).
[471] В некоторых вариантах осуществления модулятор сплайсинга предусматривает D14:
 (D14).
(D14).
[472] В некоторых вариантах осуществления модулятор сплайсинга предусматривает D15:
 (D15).
(D15).
[473] В некоторых вариантах осуществления модулятор сплайсинга предусматривает D16:
 (D16).
(D16).
[474] В некоторых вариантах осуществления модулятор сплайсинга предусматривает D17:
 (D17).
(D17).
[475] В некоторых вариантах осуществления модулятор сплайсинга предусматривает D18:
 (D18).
(D18).
[476] В некоторых вариантах осуществления модулятор сплайсинга предусматривает D19:
 (D19).
(D19).
[477] В некоторых вариантах осуществления модулятор сплайсинга предусматривает D20:
 (D20).
(D20).
[478] В некоторых вариантах осуществления модулятор сплайсинга предусматривает D21:
 (D21).
(D21).
[479] В некоторых вариантах осуществления модулятор сплайсинга предусматривает D22:
 (D22).
(D22).
[480] В некоторых вариантах осуществления модулятор сплайсинга предусматривает D23:
 (D23).
(D23).
[481] В некоторых вариантах осуществления модулятор сплайсинга предусматривает D24:
 (D24).
(D24).
[482] В некоторых вариантах осуществления модулятор сплайсинга предусматривает D25:
 (D25).
(D25).
[483] В некоторых вариантах осуществления модулятор сплайсинга предусматривает D26:
 (D26).
(D26).
[484] В некоторых вариантах осуществления модулятор сплайсинга предусматривает D27:
 (D27).
(D27).
[485] В некоторых вариантах осуществления модулятор сплайсинга предусматривает D28:
 (D28).
(D28).
[486] В некоторых вариантах осуществления модулятор сплайсинга предусматривает D29:
 (D29).
(D29).
[487] В некоторых вариантах осуществления модулятор сплайсинга предусматривает D30:
 (D30).
(D30).
[488] В некоторых вариантах осуществления модулятор сплайсинга предусматривает D31:
 (D31).
(D31).
[489] В некоторых вариантах осуществления модулятор сплайсинга предусматривает D32:
 (D32).
(D32).
[490] В некоторых вариантах осуществления модулятор сплайсинга предусматривает D33:
 (D33).
(D33).
[491] В некоторых вариантах осуществления модулятор сплайсинга предусматривает D34:
 (D34).
(D34).
[492] В некоторых вариантах осуществления модулятор сплайсинга предусматривает D35:
 (D35).
(D35).
[493] Иллюстративный ADC имеет формулу (I):
Ab-(L-D)p (I),
где
Ab представляет собой антитело или антигенсвязывающий фрагмент, которые целенаправленно воздействуют на неопластическую клетку;
D представляет собой D2;
L представляет собой линкер, который ковалентно прикрепляет Ab к D; и
p составляет целое число от 1 до 15.
[494] В некоторых вариантах осуществления антитело или антигенсвязывающий фрагмент целенаправленно воздействуют на клетку, экспрессирующую HER2, CD138, EPHA2, MSLN, FOLH1, CDH6, CEACAM5, CFC1B, ENPP3, FOLR1, HAVCR1, KIT, MET, MUC16, SLC39A6, SLC44A4, и/или STEAP1.
[495] В некоторых вариантах осуществления антитело или антигенсвязывающий фрагмент целенаправленно воздействуют на клетку, экспрессирующую HER2. В некоторых вариантах осуществления антитело или антигенсвязывающий фрагмент представляют собой антитело к HER2 или антигенсвязывающий фрагмент. В некоторых вариантах осуществления антитело или антигенсвязывающий фрагмент содержат три определяющие комплементарность области тяжелой цепи (HCDR1, HCDR2 и HCDR3), содержащие аминокислотные последовательности под SEQ ID NO:1 (HCDR1), SEQ ID NO:2 (HCDR2) и SEQ ID NO:3 (HCDR3); и три определяющие комплементарность области легкой цепи (LCDR1, LCDR2 и LCDR3), содержащие аминокислотные последовательности под SEQ ID NO:4 (LCDR1), SEQ ID NO:5 (LCDR2) и SEQ ID NO:6 (LCDR3). В некоторых вариантах осуществления антитело или антигенсвязывающий фрагмент содержат вариабельную область тяжелой цепи, содержащую аминокислотную последовательность под SEQ ID NO:19, и вариабельную область легкой цепи, содержащую аминокислотную последовательность под SEQ ID NO:20. В некоторых вариантах осуществления антитело или антигенсвязывающий фрагмент содержат константную область тяжелой цепи IgG1 человека. В некоторых вариантах осуществления антитело или антигенсвязывающий фрагмент содержат константную область легкой каппа-цепи Ig человека.
[496] В некоторых других вариантах осуществления антитело или антигенсвязывающий фрагмент целенаправленно воздействуют на клетку, экспрессирующую CD138. В некоторых вариантах осуществления антитело или антигенсвязывающий фрагмент представляют собой антитело к CD138 или антигенсвязывающий фрагмент. В некоторых вариантах осуществления антитело или антигенсвязывающий фрагмент содержат три определяющие комплементарность области тяжелой цепи (HCDR1, HCDR2 и HCDR3), содержащие аминокислотные последовательности под SEQ ID NO:7 (HCDR1), SEQ ID NO:8 (HCDR2) и SEQ ID NO:9 (HCDR3); и три определяющие комплементарность области легкой цепи (LCDR1, LCDR2 и LCDR3), содержащие аминокислотные последовательности под SEQ ID NO:10 (LCDR1), SEQ ID NO:11 (LCDR2) и SEQ ID NO:12 (LCDR3). В некоторых вариантах осуществления антитело или антигенсвязывающий фрагмент содержат вариабельную область тяжелой цепи, содержащую аминокислотную последовательность под SEQ ID NO:21, и вариабельную область легкой цепи, содержащую аминокислотную последовательность под SEQ ID NO:22. В некоторых вариантах осуществления антитело или антигенсвязывающий фрагмент содержат константную область тяжелой цепи IgG2a мыши. В некоторых вариантах осуществления антитело или антигенсвязывающий фрагмент содержат константную область легкой каппа-цепи Ig мыши. В некоторых вариантах осуществления антитело или антигенсвязывающий фрагмент содержат константную область тяжелой цепи IgG2a человека. В некоторых вариантах осуществления антитело или антигенсвязывающий фрагмент содержат константную область легкой каппа-цепи Ig человека.
[497] В некоторых других вариантах осуществления антитело или антигенсвязывающий фрагмент целенаправленно воздействуют на клетку, экспрессирующую EPHA2. В некоторых вариантах осуществления антитело или антигенсвязывающий фрагмент представляют собой антитело к EPHA2 или антигенсвязывающий фрагмент. В некоторых вариантах осуществления антитело или антигенсвязывающий фрагмент содержат три определяющие комплементарность области тяжелой цепи (HCDR1, HCDR2 и HCDR3), содержащие аминокислотные последовательности под SEQ ID NO:13 (HCDR1), SEQ ID NO:14 (HCDR2) и SEQ ID NO:15 (HCDR3); и три определяющие комплементарность области легкой цепи (LCDR1, LCDR2 и LCDR3), содержащие аминокислотные последовательности под SEQ ID NO:16 (LCDR1), SEQ ID NO:17 (LCDR2) и SEQ ID NO:18 (LCDR3). В некоторых вариантах осуществления антитело или антигенсвязывающий фрагмент содержат вариабельную область тяжелой цепи, содержащую аминокислотную последовательность под SEQ ID NO:23, и вариабельную область легкой цепи, содержащую аминокислотную последовательность под SEQ ID NO:24. В некоторых вариантах осуществления антитело или антигенсвязывающий фрагмент содержат константную область тяжелой цепи IgG1 человека. В некоторых вариантах осуществления антитело или антигенсвязывающий фрагмент содержат константную область легкой каппа-цепи Ig человека.
[498] В некоторых других вариантах осуществления антитело или антигенсвязывающий фрагмент целенаправленно воздействуют на клетку, экспрессирующую MSLN. В некоторых вариантах осуществления антитело или антигенсвязывающий фрагмент представляют собой антитело к MSLN или антигенсвязывающий фрагмент.
[499] В некоторых других вариантах осуществления антитело или антигенсвязывающий фрагмент целенаправленно воздействуют на клетку, экспрессирующую FOLH1. В некоторых вариантах осуществления антитело или антигенсвязывающий фрагмент представляют собой антитело к FOLH1 или антигенсвязывающий фрагмент.
[500] В некоторых других вариантах осуществления антитело или антигенсвязывающий фрагмент целенаправленно воздействуют на клетку, экспрессирующую CDH6. В некоторых вариантах осуществления антитело или антигенсвязывающий фрагмент представляют собой антитело к CDH6 или антигенсвязывающий фрагмент.
[501] В некоторых других вариантах осуществления антитело или антигенсвязывающий фрагмент целенаправленно воздействуют на клетку, экспрессирующую CEACAM5. В некоторых вариантах осуществления антитело или антигенсвязывающий фрагмент представляют собой антитело к CEACAM5 или антигенсвязывающий фрагмент.
[502] В некоторых других вариантах осуществления антитело или антигенсвязывающий фрагмент целенаправленно воздействуют на клетку, экспрессирующую CFC1B. В некоторых вариантах осуществления антитело или антигенсвязывающий фрагмент представляют собой антитело к CFC1B или антигенсвязывающий фрагмент.
[503] В некоторых других вариантах осуществления антитело или антигенсвязывающий фрагмент целенаправленно воздействуют на клетку, экспрессирующую ENPP3. В некоторых вариантах осуществления антитело или антигенсвязывающий фрагмент представляют собой антитело к ENPP3 или антигенсвязывающий фрагмент.
[504] В некоторых других вариантах осуществления антитело или антигенсвязывающий фрагмент целенаправленно воздействуют на клетку, экспрессирующую FOLR1. В некоторых вариантах осуществления антитело или антигенсвязывающий фрагмент представляют собой антитело к FOLR1 или антигенсвязывающий фрагмент.
[505] В некоторых других вариантах осуществления антитело или антигенсвязывающий фрагмент целенаправленно воздействуют на клетку, экспрессирующую HAVCR1. В некоторых вариантах осуществления антитело или антигенсвязывающий фрагмент представляют собой антитело к HAVCR1 или антигенсвязывающий фрагмент.
[506] В некоторых других вариантах осуществления антитело или антигенсвязывающий фрагмент целенаправленно воздействуют на клетку, экспрессирующую KIT. В некоторых вариантах осуществления антитело или антигенсвязывающий фрагмент представляют собой антитело к KIT или антигенсвязывающий фрагмент.
[507] В некоторых других вариантах осуществления антитело или антигенсвязывающий фрагмент целенаправленно воздействуют на клетку, экспрессирующую MET. В некоторых вариантах осуществления антитело или антигенсвязывающий фрагмент представляют собой антитело к MET или антигенсвязывающий фрагмент.
[508] В некоторых других вариантах осуществления антитело или антигенсвязывающий фрагмент целенаправленно воздействуют на клетку, экспрессирующую MUC16. В некоторых вариантах осуществления антитело или антигенсвязывающий фрагмент представляют собой антитело к MUC16 или антигенсвязывающий фрагмент.
[509] В некоторых других вариантах осуществления антитело или антигенсвязывающий фрагмент целенаправленно воздействуют на клетку, экспрессирующую SLC39A6. В некоторых вариантах осуществления антитело или антигенсвязывающий фрагмент представляют собой антитело к SLC39A6 или антигенсвязывающий фрагмент.
[510] В некоторых других вариантах осуществления антитело или антигенсвязывающий фрагмент целенаправленно воздействуют на клетку, экспрессирующую SLC44A4. В некоторых вариантах осуществления антитело или антигенсвязывающий фрагмент представляют собой антитело к SLC44A4 или антигенсвязывающий фрагмент.
[511] В некоторых других вариантах осуществления антитело или антигенсвязывающий фрагмент целенаправленно воздействуют на клетку, экспрессирующую STEAP1. В некоторых вариантах осуществления антитело или антигенсвязывающий фрагмент представляют собой антитело к STEAP1 или антигенсвязывающий фрагмент.
[512] В некоторых вариантах осуществления L выбран из любого из линкеров, раскрытых в данном документе, или любой комбинации линкерных компонентов, раскрытых в данном документе. В некоторых вариантах осуществления L представляет собой линкер, предусматривающий MC-Val-Cit-pABC, Mal-(PEG)2-CO, MC-Val-Ala-pAB, MC-Val-Ala-pABC, MC-Val-Cit-pAB, Mal-Hex, Mal-Et или Mal-Et-O-Et. В некоторых вариантах осуществления линкер также может предусматривать одно или несколько дополнительных спейсерных звеньев. В некоторых вариантах осуществления L представляет собой линкер ADL1, ADL2, ADL5, ADL6, ADL7, ADL12, ADL13, ADL14, ADL21, ADL23, или ADL15. В некоторых вариантах осуществления L представляет собой линкер ADL12, ADL14 или ADL15. В некоторых вариантах осуществления линкер ADL1, ADL2, ADL5, ADL6, ADL7, ADL12, ADL13, ADL14, ADL21, ADL23, или ADL15 также может предусматривать одно или несколько дополнительных спейсерных звеньев.
[513] Другой иллюстративный ADC имеет формулу (I):
Ab-(L-D)p (I),
где
Ab представляет собой антитело или антигенсвязывающий фрагмент, которые целенаправленно воздействуют на неопластическую клетку;
D представляет собой D1;
L представляет собой линкер, который ковалентно прикрепляет Ab к D; и
p составляет целое число от 1 до 15.
[514] В некоторых вариантах осуществления антитело или антигенсвязывающий фрагмент целенаправленно воздействуют на клетку, экспрессирующую HER2, CD138, EPHA2, MSLN, FOLH1, CDH6, CEACAM5, CFC1B, ENPP3, FOLR1, HAVCR1, KIT, MET, MUC16, SLC39A6, SLC44A4, и/или STEAP1.
[515] В некоторых вариантах осуществления антитело или антигенсвязывающий фрагмент целенаправленно воздействуют на клетку, экспрессирующую HER2. В некоторых вариантах осуществления антитело или антигенсвязывающий фрагмент представляют собой антитело к HER2 или антигенсвязывающий фрагмент. В некоторых вариантах осуществления антитело или антигенсвязывающий фрагмент содержат три определяющие комплементарность области тяжелой цепи (HCDR1, HCDR2 и HCDR3), содержащие аминокислотные последовательности под SEQ ID NO:1 (HCDR1), SEQ ID NO:2 (HCDR2) и SEQ ID NO:3 (HCDR3); и три определяющие комплементарность области легкой цепи (LCDR1, LCDR2 и LCDR3), содержащие аминокислотные последовательности под SEQ ID NO:4 (LCDR1), SEQ ID NO:5 (LCDR2) и SEQ ID NO:6 (LCDR3). В некоторых вариантах осуществления антитело или антигенсвязывающий фрагмент содержат вариабельную область тяжелой цепи, содержащую аминокислотную последовательность под SEQ ID NO:19, и вариабельную область легкой цепи, содержащую аминокислотную последовательность под SEQ ID NO:20. В некоторых вариантах осуществления антитело или антигенсвязывающий фрагмент содержат константную область тяжелой цепи IgG1 человека. В некоторых вариантах осуществления антитело или антигенсвязывающий фрагмент содержат константную область легкой каппа-цепи Ig человека.
[516] В некоторых других вариантах осуществления антитело или антигенсвязывающий фрагмент целенаправленно воздействуют на клетку, экспрессирующую CD138. В некоторых вариантах осуществления антитело или антигенсвязывающий фрагмент представляют собой антитело к CD138 или антигенсвязывающий фрагмент. В некоторых вариантах осуществления антитело или антигенсвязывающий фрагмент содержат три определяющие комплементарность области тяжелой цепи (HCDR1, HCDR2 и HCDR3), содержащие аминокислотные последовательности под SEQ ID NO:7 (HCDR1), SEQ ID NO:8 (HCDR2) и SEQ ID NO:9 (HCDR3); и три определяющие комплементарность области легкой цепи (LCDR1, LCDR2 и LCDR3), содержащие аминокислотные последовательности под SEQ ID NO:10 (LCDR1), SEQ ID NO:11 (LCDR2) и SEQ ID NO:12 (LCDR3). В некоторых вариантах осуществления антитело или антигенсвязывающий фрагмент содержат вариабельную область тяжелой цепи, содержащую аминокислотную последовательность под SEQ ID NO:21, и вариабельную область легкой цепи, содержащую аминокислотную последовательность под SEQ ID NO:22. В некоторых вариантах осуществления антитело или антигенсвязывающий фрагмент содержат константную область тяжелой цепи IgG2a мыши. В некоторых вариантах осуществления антитело или антигенсвязывающий фрагмент содержат константную область легкой каппа-цепи Ig мыши. В некоторых вариантах осуществления антитело или антигенсвязывающий фрагмент содержат константную область тяжелой цепи IgG2a человека. В некоторых вариантах осуществления антитело или антигенсвязывающий фрагмент содержат константную область легкой каппа-цепи Ig человека.
[517] В некоторых других вариантах осуществления антитело или антигенсвязывающий фрагмент целенаправленно воздействуют на клетку, экспрессирующую EPHA2. В некоторых вариантах осуществления антитело или антигенсвязывающий фрагмент представляют собой антитело к EPHA2 или антигенсвязывающий фрагмент. В некоторых вариантах осуществления антитело или антигенсвязывающий фрагмент содержат три определяющие комплементарность области тяжелой цепи (HCDR1, HCDR2 и HCDR3), содержащие аминокислотные последовательности под SEQ ID NO:13 (HCDR1), SEQ ID NO:14 (HCDR2) и SEQ ID NO:15 (HCDR3); и три определяющие комплементарность области легкой цепи (LCDR1, LCDR2 и LCDR3), содержащие аминокислотные последовательности под SEQ ID NO:16 (LCDR1), SEQ ID NO:17 (LCDR2) и SEQ ID NO:18 (LCDR3). В некоторых вариантах осуществления антитело или антигенсвязывающий фрагмент содержат вариабельную область тяжелой цепи, содержащую аминокислотную последовательность под SEQ ID NO:23, и вариабельную область легкой цепи, содержащую аминокислотную последовательность под SEQ ID NO:24. В некоторых вариантах осуществления антитело или антигенсвязывающий фрагмент содержат константную область тяжелой цепи IgG1 человека. В некоторых вариантах осуществления антитело или антигенсвязывающий фрагмент содержат константную область легкой каппа-цепи Ig человека.
[518] В некоторых других вариантах осуществления антитело или антигенсвязывающий фрагмент целенаправленно воздействуют на клетку, экспрессирующую MSLN. В некоторых вариантах осуществления антитело или антигенсвязывающий фрагмент представляют собой антитело к MSLN или антигенсвязывающий фрагмент.
[519] В некоторых других вариантах осуществления антитело или антигенсвязывающий фрагмент целенаправленно воздействуют на клетку, экспрессирующую FOLH1. В некоторых вариантах осуществления антитело или антигенсвязывающий фрагмент представляют собой антитело к FOLH1 или антигенсвязывающий фрагмент.
[520] В некоторых других вариантах осуществления антитело или антигенсвязывающий фрагмент целенаправленно воздействуют на клетку, экспрессирующую CDH6. В некоторых вариантах осуществления антитело или антигенсвязывающий фрагмент представляют собой антитело к CDH6 или антигенсвязывающий фрагмент.
[521] В некоторых других вариантах осуществления антитело или антигенсвязывающий фрагмент целенаправленно воздействуют на клетку, экспрессирующую CEACAM5. В некоторых вариантах осуществления антитело или антигенсвязывающий фрагмент представляют собой антитело к CEACAM5 или антигенсвязывающий фрагмент.
[522] В некоторых других вариантах осуществления антитело или антигенсвязывающий фрагмент целенаправленно воздействуют на клетку, экспрессирующую CFC1B. В некоторых вариантах осуществления антитело или антигенсвязывающий фрагмент представляют собой антитело к CFC1B или антигенсвязывающий фрагмент.
[523] В некоторых других вариантах осуществления антитело или антигенсвязывающий фрагмент целенаправленно воздействуют на клетку, экспрессирующую ENPP3. В некоторых вариантах осуществления антитело или антигенсвязывающий фрагмент представляют собой антитело к ENPP3 или антигенсвязывающий фрагмент.
[524] В некоторых других вариантах осуществления антитело или антигенсвязывающий фрагмент целенаправленно воздействуют на клетку, экспрессирующую FOLR1. В некоторых вариантах осуществления антитело или антигенсвязывающий фрагмент представляют собой антитело к FOLR1 или антигенсвязывающий фрагмент.
[525] В некоторых других вариантах осуществления антитело или антигенсвязывающий фрагмент целенаправленно воздействуют на клетку, экспрессирующую HAVCR1. В некоторых вариантах осуществления антитело или антигенсвязывающий фрагмент представляют собой антитело к HAVCR1 или антигенсвязывающий фрагмент.
[526] В некоторых других вариантах осуществления антитело или антигенсвязывающий фрагмент целенаправленно воздействуют на клетку, экспрессирующую KIT. В некоторых вариантах осуществления антитело или антигенсвязывающий фрагмент представляют собой антитело к KIT или антигенсвязывающий фрагмент.
[527] В некоторых других вариантах осуществления антитело или антигенсвязывающий фрагмент целенаправленно воздействуют на клетку, экспрессирующую MET. В некоторых вариантах осуществления антитело или антигенсвязывающий фрагмент представляют собой антитело к MET или антигенсвязывающий фрагмент.
[528] В некоторых других вариантах осуществления антитело или антигенсвязывающий фрагмент целенаправленно воздействуют на клетку, экспрессирующую MUC16. В некоторых вариантах осуществления антитело или антигенсвязывающий фрагмент представляют собой антитело к MUC16 или антигенсвязывающий фрагмент.
[529] В некоторых других вариантах осуществления антитело или антигенсвязывающий фрагмент целенаправленно воздействуют на клетку, экспрессирующую SLC39A6. В некоторых вариантах осуществления антитело или антигенсвязывающий фрагмент представляют собой антитело к SLC39A6 или антигенсвязывающий фрагмент.
[530] В некоторых других вариантах осуществления антитело или антигенсвязывающий фрагмент целенаправленно воздействуют на клетку, экспрессирующую SLC44A4. В некоторых вариантах осуществления антитело или антигенсвязывающий фрагмент представляют собой антитело к SLC44A4 или антигенсвязывающий фрагмент.
[531] В некоторых других вариантах осуществления антитело или антигенсвязывающий фрагмент целенаправленно воздействуют на клетку, экспрессирующую STEAP1. В некоторых вариантах осуществления антитело или антигенсвязывающий фрагмент представляют собой антитело к STEAP1 или антигенсвязывающий фрагмент.
[532] Другой иллюстративный ADC имеет формулу (I):
Ab-(L-D)p (I),
где
Ab представляет собой антитело или антигенсвязывающий фрагмент, которые целенаправленно воздействуют на неопластическую клетку;
D представляет собой D4;
L представляет собой линкер, который ковалентно прикрепляет Ab к D; и
p составляет целое число от 1 до 15.
[533] В некоторых вариантах осуществления антитело или антигенсвязывающий фрагмент целенаправленно воздействуют на клетку, экспрессирующую HER2, CD138, EPHA2, MSLN, FOLH1, CDH6, CEACAM5, CFC1B, ENPP3, FOLR1, HAVCR1, KIT, MET, MUC16, SLC39A6, SLC44A4, и/или STEAP1.
[534] В некоторых вариантах осуществления антитело или антигенсвязывающий фрагмент целенаправленно воздействуют на клетку, экспрессирующую HER2. В некоторых вариантах осуществления антитело или антигенсвязывающий фрагмент представляют собой антитело к HER2 или антигенсвязывающий фрагмент. В некоторых вариантах осуществления антитело или антигенсвязывающий фрагмент содержат три определяющие комплементарность области тяжелой цепи (HCDR1, HCDR2 и HCDR3), содержащие аминокислотные последовательности под SEQ ID NO:1 (HCDR1), SEQ ID NO:2 (HCDR2) и SEQ ID NO:3 (HCDR3); и три определяющие комплементарность области легкой цепи (LCDR1, LCDR2 и LCDR3), содержащие аминокислотные последовательности под SEQ ID NO:4 (LCDR1), SEQ ID NO:5 (LCDR2) и SEQ ID NO:6 (LCDR3). В некоторых вариантах осуществления антитело или антигенсвязывающий фрагмент содержат вариабельную область тяжелой цепи, содержащую аминокислотную последовательность под SEQ ID NO:19, и вариабельную область легкой цепи, содержащую аминокислотную последовательность под SEQ ID NO:20. В некоторых вариантах осуществления антитело или антигенсвязывающий фрагмент содержат константную область тяжелой цепи IgG1 человека. В некоторых вариантах осуществления антитело или антигенсвязывающий фрагмент содержат константную область легкой каппа-цепи Ig человека.
[535] В некоторых других вариантах осуществления антитело или антигенсвязывающий фрагмент целенаправленно воздействуют на клетку, экспрессирующую CD138. В некоторых вариантах осуществления антитело или антигенсвязывающий фрагмент представляют собой антитело к CD138 или антигенсвязывающий фрагмент. В некоторых вариантах осуществления антитело или антигенсвязывающий фрагмент содержат три определяющие комплементарность области тяжелой цепи (HCDR1, HCDR2 и HCDR3), содержащие аминокислотные последовательности под SEQ ID NO:7 (HCDR1), SEQ ID NO:8 (HCDR2) и SEQ ID NO:9 (HCDR3); и три определяющие комплементарность области легкой цепи (LCDR1, LCDR2 и LCDR3), содержащие аминокислотные последовательности под SEQ ID NO:10 (LCDR1), SEQ ID NO:11 (LCDR2) и SEQ ID NO:12 (LCDR3). В некоторых вариантах осуществления антитело или антигенсвязывающий фрагмент содержат вариабельную область тяжелой цепи, содержащую аминокислотную последовательность под SEQ ID NO:21, и вариабельную область легкой цепи, содержащую аминокислотную последовательность под SEQ ID NO:22. В некоторых вариантах осуществления антитело или антигенсвязывающий фрагмент содержат константную область тяжелой цепи IgG2a мыши. В некоторых вариантах осуществления антитело или антигенсвязывающий фрагмент содержат константную область легкой каппа-цепи Ig мыши. В некоторых вариантах осуществления антитело или антигенсвязывающий фрагмент содержат константную область тяжелой цепи IgG2a человека. В некоторых вариантах осуществления антитело или антигенсвязывающий фрагмент содержат константную область легкой каппа-цепи Ig человека.
[536] В некоторых других вариантах осуществления антитело или антигенсвязывающий фрагмент целенаправленно воздействуют на клетку, экспрессирующую EPHA2. В некоторых вариантах осуществления антитело или антигенсвязывающий фрагмент представляют собой антитело к EPHA2 или антигенсвязывающий фрагмент. В некоторых вариантах осуществления антитело или антигенсвязывающий фрагмент содержат три определяющие комплементарность области тяжелой цепи (HCDR1, HCDR2 и HCDR3), содержащие аминокислотные последовательности под SEQ ID NO:13 (HCDR1), SEQ ID NO:14 (HCDR2) и SEQ ID NO:15 (HCDR3); и три определяющие комплементарность области легкой цепи (LCDR1, LCDR2 и LCDR3), содержащие аминокислотные последовательности под SEQ ID NO:16 (LCDR1), SEQ ID NO:17 (LCDR2) и SEQ ID NO:18 (LCDR3). В некоторых вариантах осуществления антитело или антигенсвязывающий фрагмент содержат вариабельную область тяжелой цепи, содержащую аминокислотную последовательность под SEQ ID NO:23, и вариабельную область легкой цепи, содержащую аминокислотную последовательность под SEQ ID NO:24. В некоторых вариантах осуществления антитело или антигенсвязывающий фрагмент содержат константную область тяжелой цепи IgG1 человека. В некоторых вариантах осуществления антитело или антигенсвязывающий фрагмент содержат константную область легкой каппа-цепи Ig человека.
[537] В некоторых других вариантах осуществления антитело или антигенсвязывающий фрагмент целенаправленно воздействуют на клетку, экспрессирующую MSLN. В некоторых вариантах осуществления антитело или антигенсвязывающий фрагмент представляют собой антитело к MSLN или антигенсвязывающий фрагмент.
[538] В некоторых других вариантах осуществления антитело или антигенсвязывающий фрагмент целенаправленно воздействуют на клетку, экспрессирующую FOLH1. В некоторых вариантах осуществления антитело или антигенсвязывающий фрагмент представляют собой антитело к FOLH1 или антигенсвязывающий фрагмент.
[539] В некоторых других вариантах осуществления антитело или антигенсвязывающий фрагмент целенаправленно воздействуют на клетку, экспрессирующую CDH6. В некоторых вариантах осуществления антитело или антигенсвязывающий фрагмент представляют собой антитело к CDH6 или антигенсвязывающий фрагмент.
[540] В некоторых других вариантах осуществления антитело или антигенсвязывающий фрагмент целенаправленно воздействуют на клетку, экспрессирующую CEACAM5. В некоторых вариантах осуществления антитело или антигенсвязывающий фрагмент представляют собой антитело к CEACAM5 или антигенсвязывающий фрагмент.
[541] В некоторых других вариантах осуществления антитело или антигенсвязывающий фрагмент целенаправленно воздействуют на клетку, экспрессирующую CFC1B. В некоторых вариантах осуществления антитело или антигенсвязывающий фрагмент представляют собой антитело к CFC1B или антигенсвязывающий фрагмент.
[542] В некоторых других вариантах осуществления антитело или антигенсвязывающий фрагмент целенаправленно воздействуют на клетку, экспрессирующую ENPP3. В некоторых вариантах осуществления антитело или антигенсвязывающий фрагмент представляют собой антитело к ENPP3 или антигенсвязывающий фрагмент.
[543] В некоторых других вариантах осуществления антитело или антигенсвязывающий фрагмент целенаправленно воздействуют на клетку, экспрессирующую FOLR1. В некоторых вариантах осуществления антитело или антигенсвязывающий фрагмент представляют собой антитело к FOLR1 или антигенсвязывающий фрагмент.
[544] В некоторых других вариантах осуществления антитело или антигенсвязывающий фрагмент целенаправленно воздействуют на клетку, экспрессирующую HAVCR1. В некоторых вариантах осуществления антитело или антигенсвязывающий фрагмент представляют собой антитело к HAVCR1 или антигенсвязывающий фрагмент.
[545] В некоторых других вариантах осуществления антитело или антигенсвязывающий фрагмент целенаправленно воздействуют на клетку, экспрессирующую KIT. В некоторых вариантах осуществления антитело или антигенсвязывающий фрагмент представляют собой антитело к KIT или антигенсвязывающий фрагмент.
[546] В некоторых других вариантах осуществления антитело или антигенсвязывающий фрагмент целенаправленно воздействуют на клетку, экспрессирующую MET. В некоторых вариантах осуществления антитело или антигенсвязывающий фрагмент представляют собой антитело к MET или антигенсвязывающий фрагмент.
[547] В некоторых других вариантах осуществления антитело или антигенсвязывающий фрагмент целенаправленно воздействуют на клетку, экспрессирующую MUC16. В некоторых вариантах осуществления антитело или антигенсвязывающий фрагмент представляют собой антитело к MUC16 или антигенсвязывающий фрагмент.
[548] В некоторых других вариантах осуществления антитело или антигенсвязывающий фрагмент целенаправленно воздействуют на клетку, экспрессирующую SLC39A6. В некоторых вариантах осуществления антитело или антигенсвязывающий фрагмент представляют собой антитело к SLC39A6 или антигенсвязывающий фрагмент.
[549] В некоторых других вариантах осуществления антитело или антигенсвязывающий фрагмент целенаправленно воздействуют на клетку, экспрессирующую SLC44A4. В некоторых вариантах осуществления антитело или антигенсвязывающий фрагмент представляют собой антитело к SLC44A4 или антигенсвязывающий фрагмент.
[550] В некоторых других вариантах осуществления антитело или антигенсвязывающий фрагмент целенаправленно воздействуют на клетку, экспрессирующую STEAP1. В некоторых вариантах осуществления антитело или антигенсвязывающий фрагмент представляют собой антитело к STEAP1 или антигенсвязывающий фрагмент.
[551] Другой иллюстративный ADC имеет формулу (I):
Ab-(L-D)p (I),
где
Ab представляет собой антитело или антигенсвязывающий фрагмент, которые целенаправленно воздействуют на неопластическую клетку;
D представляет собой D12;
L представляет собой линкер, который ковалентно прикрепляет Ab к D; и
p составляет целое число от 1 до 15.
[552] В некоторых вариантах осуществления антитело или антигенсвязывающий фрагмент целенаправленно воздействуют на клетку, экспрессирующую HER2, CD138, EPHA2, MSLN, FOLH1, CDH6, CEACAM5, CFC1B, ENPP3, FOLR1, HAVCR1, KIT, MET, MUC16, SLC39A6, SLC44A4, и/или STEAP1.
[553] В некоторых вариантах осуществления антитело или антигенсвязывающий фрагмент целенаправленно воздействуют на клетку, экспрессирующую HER2. В некоторых вариантах осуществления антитело или антигенсвязывающий фрагмент представляют собой антитело к HER2 или антигенсвязывающий фрагмент. В некоторых вариантах осуществления антитело или антигенсвязывающий фрагмент содержат три определяющие комплементарность области тяжелой цепи (HCDR1, HCDR2 и HCDR3), содержащие аминокислотные последовательности под SEQ ID NO:1 (HCDR1), SEQ ID NO:2 (HCDR2) и SEQ ID NO:3 (HCDR3); и три определяющие комплементарность области легкой цепи (LCDR1, LCDR2 и LCDR3), содержащие аминокислотные последовательности под SEQ ID NO:4 (LCDR1), SEQ ID NO:5 (LCDR2) и SEQ ID NO:6 (LCDR3). В некоторых вариантах осуществления антитело или антигенсвязывающий фрагмент содержат вариабельную область тяжелой цепи, содержащую аминокислотную последовательность под SEQ ID NO:19, и вариабельную область легкой цепи, содержащую аминокислотную последовательность под SEQ ID NO:20. В некоторых вариантах осуществления антитело или антигенсвязывающий фрагмент содержат константную область тяжелой цепи IgG1 человека. В некоторых вариантах осуществления антитело или антигенсвязывающий фрагмент содержат константную область легкой каппа-цепи Ig человека.
[554] В некоторых других вариантах осуществления антитело или антигенсвязывающий фрагмент целенаправленно воздействуют на клетку, экспрессирующую CD138. В некоторых вариантах осуществления антитело или антигенсвязывающий фрагмент представляют собой антитело к CD138 или антигенсвязывающий фрагмент. В некоторых вариантах осуществления антитело или антигенсвязывающий фрагмент содержат три определяющие комплементарность области тяжелой цепи (HCDR1, HCDR2 и HCDR3), содержащие аминокислотные последовательности под SEQ ID NO:7 (HCDR1), SEQ ID NO:8 (HCDR2) и SEQ ID NO:9 (HCDR3); и три определяющие комплементарность области легкой цепи (LCDR1, LCDR2 и LCDR3), содержащие аминокислотные последовательности под SEQ ID NO:10 (LCDR1), SEQ ID NO:11 (LCDR2) и SEQ ID NO:12 (LCDR3). В некоторых вариантах осуществления антитело или антигенсвязывающий фрагмент содержат вариабельную область тяжелой цепи, содержащую аминокислотную последовательность под SEQ ID NO:21, и вариабельную область легкой цепи, содержащую аминокислотную последовательность под SEQ ID NO:22. В некоторых вариантах осуществления антитело или антигенсвязывающий фрагмент содержат константную область тяжелой цепи IgG2a мыши. В некоторых вариантах осуществления антитело или антигенсвязывающий фрагмент содержат константную область легкой каппа-цепи Ig мыши. В некоторых вариантах осуществления антитело или антигенсвязывающий фрагмент содержат константную область тяжелой цепи IgG2a человека. В некоторых вариантах осуществления антитело или антигенсвязывающий фрагмент содержат константную область легкой каппа-цепи Ig человека.
[555] В некоторых других вариантах осуществления антитело или антигенсвязывающий фрагмент целенаправленно воздействуют на клетку, экспрессирующую EPHA2. В некоторых вариантах осуществления антитело или антигенсвязывающий фрагмент представляют собой антитело к EPHA2 или антигенсвязывающий фрагмент. В некоторых вариантах осуществления антитело или антигенсвязывающий фрагмент содержат три определяющие комплементарность области тяжелой цепи (HCDR1, HCDR2 и HCDR3), содержащие аминокислотные последовательности под SEQ ID NO:13 (HCDR1), SEQ ID NO:14 (HCDR2) и SEQ ID NO:15 (HCDR3); и три определяющие комплементарность области легкой цепи (LCDR1, LCDR2 и LCDR3), содержащие аминокислотные последовательности под SEQ ID NO:16 (LCDR1), SEQ ID NO:17 (LCDR2) и SEQ ID NO:18 (LCDR3). В некоторых вариантах осуществления антитело или антигенсвязывающий фрагмент содержат вариабельную область тяжелой цепи, содержащую аминокислотную последовательность под SEQ ID NO:23, и вариабельную область легкой цепи, содержащую аминокислотную последовательность под SEQ ID NO:24. В некоторых вариантах осуществления антитело или антигенсвязывающий фрагмент содержат константную область тяжелой цепи IgG1 человека. В некоторых вариантах осуществления антитело или антигенсвязывающий фрагмент содержат константную область легкой каппа-цепи Ig человека.
[556] В некоторых других вариантах осуществления антитело или антигенсвязывающий фрагмент целенаправленно воздействуют на клетку, экспрессирующую MSLN. В некоторых вариантах осуществления антитело или антигенсвязывающий фрагмент представляют собой антитело к MSLN или антигенсвязывающий фрагмент.
[557] В некоторых других вариантах осуществления антитело или антигенсвязывающий фрагмент целенаправленно воздействуют на клетку, экспрессирующую FOLH1. В некоторых вариантах осуществления антитело или антигенсвязывающий фрагмент представляют собой антитело к FOLH1 или антигенсвязывающий фрагмент.
[558] В некоторых других вариантах осуществления антитело или антигенсвязывающий фрагмент целенаправленно воздействуют на клетку, экспрессирующую CDH6. В некоторых вариантах осуществления антитело или антигенсвязывающий фрагмент представляют собой антитело к CDH6 или антигенсвязывающий фрагмент.
[559] В некоторых других вариантах осуществления антитело или антигенсвязывающий фрагмент целенаправленно воздействуют на клетку, экспрессирующую CEACAM5. В некоторых вариантах осуществления антитело или антигенсвязывающий фрагмент представляют собой антитело к CEACAM5 или антигенсвязывающий фрагмент.
[560] В некоторых других вариантах осуществления антитело или антигенсвязывающий фрагмент целенаправленно воздействуют на клетку, экспрессирующую CFC1B. В некоторых вариантах осуществления антитело или антигенсвязывающий фрагмент представляют собой антитело к CFC1B или антигенсвязывающий фрагмент.
[561] В некоторых других вариантах осуществления антитело или антигенсвязывающий фрагмент целенаправленно воздействуют на клетку, экспрессирующую ENPP3. В некоторых вариантах осуществления антитело или антигенсвязывающий фрагмент представляют собой антитело к ENPP3 или антигенсвязывающий фрагмент.
[562] В некоторых других вариантах осуществления антитело или антигенсвязывающий фрагмент целенаправленно воздействуют на клетку, экспрессирующую FOLR1. В некоторых вариантах осуществления антитело или антигенсвязывающий фрагмент представляют собой антитело к FOLR1 или антигенсвязывающий фрагмент.
[563] В некоторых других вариантах осуществления антитело или антигенсвязывающий фрагмент целенаправленно воздействуют на клетку, экспрессирующую HAVCR1. В некоторых вариантах осуществления антитело или антигенсвязывающий фрагмент представляют собой антитело к HAVCR1 или антигенсвязывающий фрагмент.
[564] В некоторых других вариантах осуществления антитело или антигенсвязывающий фрагмент целенаправленно воздействуют на клетку, экспрессирующую KIT. В некоторых вариантах осуществления антитело или антигенсвязывающий фрагмент представляют собой антитело к KIT или антигенсвязывающий фрагмент.
[565] В некоторых других вариантах осуществления антитело или антигенсвязывающий фрагмент целенаправленно воздействуют на клетку, экспрессирующую MET. В некоторых вариантах осуществления антитело или антигенсвязывающий фрагмент представляют собой антитело к MET или антигенсвязывающий фрагмент.
[566] В некоторых других вариантах осуществления антитело или антигенсвязывающий фрагмент целенаправленно воздействуют на клетку, экспрессирующую MUC16. В некоторых вариантах осуществления антитело или антигенсвязывающий фрагмент представляют собой антитело к MUC16 или антигенсвязывающий фрагмент.
[567] В некоторых других вариантах осуществления антитело или антигенсвязывающий фрагмент целенаправленно воздействуют на клетку, экспрессирующую SLC39A6. В некоторых вариантах осуществления антитело или антигенсвязывающий фрагмент представляют собой антитело к SLC39A6 или антигенсвязывающий фрагмент.
[568] В некоторых других вариантах осуществления антитело или антигенсвязывающий фрагмент целенаправленно воздействуют на клетку, экспрессирующую SLC44A4. В некоторых вариантах осуществления антитело или антигенсвязывающий фрагмент представляют собой антитело к SLC44A4 или антигенсвязывающий фрагмент.
[569] В некоторых других вариантах осуществления антитело или антигенсвязывающий фрагмент целенаправленно воздействуют на клетку, экспрессирующую STEAP1. В некоторых вариантах осуществления антитело или антигенсвязывающий фрагмент представляют собой антитело к STEAP1 или антигенсвязывающий фрагмент.
[570] Другой иллюстративный ADC имеет формулу (I):
Ab-(L-D)p (I),
где
Ab представляет собой антитело или антигенсвязывающий фрагмент, которые целенаправленно воздействуют на неопластическую клетку;
D представляет собой D15;
L представляет собой линкер, который ковалентно прикрепляет Ab к D; и
p составляет целое число от 1 до 15.
[571] В некоторых вариантах осуществления антитело или антигенсвязывающий фрагмент целенаправленно воздействуют на клетку, экспрессирующую HER2, CD138, EPHA2, MSLN, FOLH1, CDH6, CEACAM5, CFC1B, ENPP3, FOLR1, HAVCR1, KIT, MET, MUC16, SLC39A6, SLC44A4, и/или STEAP1.
[572] В некоторых вариантах осуществления антитело или антигенсвязывающий фрагмент целенаправленно воздействуют на клетку, экспрессирующую HER2. В некоторых вариантах осуществления антитело или антигенсвязывающий фрагмент представляют собой антитело к HER2 или антигенсвязывающий фрагмент. В некоторых вариантах осуществления антитело или антигенсвязывающий фрагмент содержат три определяющие комплементарность области тяжелой цепи (HCDR1, HCDR2 и HCDR3), содержащие аминокислотные последовательности под SEQ ID NO:1 (HCDR1), SEQ ID NO:2 (HCDR2) и SEQ ID NO:3 (HCDR3); и три определяющие комплементарность области легкой цепи (LCDR1, LCDR2 и LCDR3), содержащие аминокислотные последовательности под SEQ ID NO:4 (LCDR1), SEQ ID NO:5 (LCDR2) и SEQ ID NO:6 (LCDR3). В некоторых вариантах осуществления антитело или антигенсвязывающий фрагмент содержат вариабельную область тяжелой цепи, содержащую аминокислотную последовательность под SEQ ID NO:19, и вариабельную область легкой цепи, содержащую аминокислотную последовательность под SEQ ID NO:20. В некоторых вариантах осуществления антитело или антигенсвязывающий фрагмент содержат константную область тяжелой цепи IgG1 человека. В некоторых вариантах осуществления антитело или антигенсвязывающий фрагмент содержат константную область легкой каппа-цепи Ig человека.
[573] В некоторых других вариантах осуществления антитело или антигенсвязывающий фрагмент целенаправленно воздействуют на клетку, экспрессирующую CD138. В некоторых вариантах осуществления антитело или антигенсвязывающий фрагмент представляют собой антитело к CD138 или антигенсвязывающий фрагмент. В некоторых вариантах осуществления антитело или антигенсвязывающий фрагмент содержат три определяющие комплементарность области тяжелой цепи (HCDR1, HCDR2 и HCDR3), содержащие аминокислотные последовательности под SEQ ID NO:7 (HCDR1), SEQ ID NO:8 (HCDR2) и SEQ ID NO:9 (HCDR3); и три определяющие комплементарность области легкой цепи (LCDR1, LCDR2 и LCDR3), содержащие аминокислотные последовательности под SEQ ID NO:10 (LCDR1), SEQ ID NO:11 (LCDR2) и SEQ ID NO:12 (LCDR3). В некоторых вариантах осуществления антитело или антигенсвязывающий фрагмент содержат вариабельную область тяжелой цепи, содержащую аминокислотную последовательность под SEQ ID NO:21, и вариабельную область легкой цепи, содержащую аминокислотную последовательность под SEQ ID NO:22. В некоторых вариантах осуществления антитело или антигенсвязывающий фрагмент содержат константную область тяжелой цепи IgG2a мыши. В некоторых вариантах осуществления антитело или антигенсвязывающий фрагмент содержат константную область легкой каппа-цепи Ig мыши. В некоторых вариантах осуществления антитело или антигенсвязывающий фрагмент содержат константную область тяжелой цепи IgG2a человека. В некоторых вариантах осуществления антитело или антигенсвязывающий фрагмент содержат константную область легкой каппа-цепи Ig человека.
[574] В некоторых других вариантах осуществления антитело или антигенсвязывающий фрагмент целенаправленно воздействуют на клетку, экспрессирующую EPHA2. В некоторых вариантах осуществления антитело или антигенсвязывающий фрагмент представляют собой антитело к EPHA2 или антигенсвязывающий фрагмент. В некоторых вариантах осуществления антитело или антигенсвязывающий фрагмент содержат три определяющие комплементарность области тяжелой цепи (HCDR1, HCDR2 и HCDR3), содержащие аминокислотные последовательности под SEQ ID NO:13 (HCDR1), SEQ ID NO:14 (HCDR2) и SEQ ID NO:15 (HCDR3); и три определяющие комплементарность области легкой цепи (LCDR1, LCDR2 и LCDR3), содержащие аминокислотные последовательности под SEQ ID NO:16 (LCDR1), SEQ ID NO:17 (LCDR2) и SEQ ID NO:18 (LCDR3). В некоторых вариантах осуществления антитело или антигенсвязывающий фрагмент содержат вариабельную область тяжелой цепи, содержащую аминокислотную последовательность под SEQ ID NO:23, и вариабельную область легкой цепи, содержащую аминокислотную последовательность под SEQ ID NO:24. В некоторых вариантах осуществления антитело или антигенсвязывающий фрагмент содержат константную область тяжелой цепи IgG1 человека. В некоторых вариантах осуществления антитело или антигенсвязывающий фрагмент содержат константную область легкой каппа-цепи Ig человека.
[575] В некоторых других вариантах осуществления антитело или антигенсвязывающий фрагмент целенаправленно воздействуют на клетку, экспрессирующую MSLN. В некоторых вариантах осуществления антитело или антигенсвязывающий фрагмент представляют собой антитело к MSLN или антигенсвязывающий фрагмент.
[576] В некоторых других вариантах осуществления антитело или антигенсвязывающий фрагмент целенаправленно воздействуют на клетку, экспрессирующую FOLH1. В некоторых вариантах осуществления антитело или антигенсвязывающий фрагмент представляют собой антитело к FOLH1 или антигенсвязывающий фрагмент.
[577] В некоторых других вариантах осуществления антитело или антигенсвязывающий фрагмент целенаправленно воздействуют на клетку, экспрессирующую CDH6. В некоторых вариантах осуществления антитело или антигенсвязывающий фрагмент представляют собой антитело к CDH6 или антигенсвязывающий фрагмент.
[578] В некоторых других вариантах осуществления антитело или антигенсвязывающий фрагмент целенаправленно воздействуют на клетку, экспрессирующую CEACAM5. В некоторых вариантах осуществления антитело или антигенсвязывающий фрагмент представляют собой антитело к CEACAM5 или антигенсвязывающий фрагмент.
[579] В некоторых других вариантах осуществления антитело или антигенсвязывающий фрагмент целенаправленно воздействуют на клетку, экспрессирующую CFC1B. В некоторых вариантах осуществления антитело или антигенсвязывающий фрагмент представляют собой антитело к CFC1B или антигенсвязывающий фрагмент.
[580] В некоторых других вариантах осуществления антитело или антигенсвязывающий фрагмент целенаправленно воздействуют на клетку, экспрессирующую ENPP3. В некоторых вариантах осуществления антитело или антигенсвязывающий фрагмент представляют собой антитело к ENPP3 или антигенсвязывающий фрагмент.
[581] В некоторых других вариантах осуществления антитело или антигенсвязывающий фрагмент целенаправленно воздействуют на клетку, экспрессирующую FOLR1. В некоторых вариантах осуществления антитело или антигенсвязывающий фрагмент представляют собой антитело к FOLR1 или антигенсвязывающий фрагмент.
[582] В некоторых других вариантах осуществления антитело или антигенсвязывающий фрагмент целенаправленно воздействуют на клетку, экспрессирующую HAVCR1. В некоторых вариантах осуществления антитело или антигенсвязывающий фрагмент представляют собой антитело к HAVCR1 или антигенсвязывающий фрагмент.
[583] В некоторых других вариантах осуществления антитело или антигенсвязывающий фрагмент целенаправленно воздействуют на клетку, экспрессирующую KIT. В некоторых вариантах осуществления антитело или антигенсвязывающий фрагмент представляют собой антитело к KIT или антигенсвязывающий фрагмент.
[584] В некоторых других вариантах осуществления антитело или антигенсвязывающий фрагмент целенаправленно воздействуют на клетку, экспрессирующую MET. В некоторых вариантах осуществления антитело или антигенсвязывающий фрагмент представляют собой антитело к MET или антигенсвязывающий фрагмент.
[585] В некоторых других вариантах осуществления антитело или антигенсвязывающий фрагмент целенаправленно воздействуют на клетку, экспрессирующую MUC16. В некоторых вариантах осуществления антитело или антигенсвязывающий фрагмент представляют собой антитело к MUC16 или антигенсвязывающий фрагмент.
[586] В некоторых других вариантах осуществления антитело или антигенсвязывающий фрагмент целенаправленно воздействуют на клетку, экспрессирующую SLC39A6. В некоторых вариантах осуществления антитело или антигенсвязывающий фрагмент представляют собой антитело к SLC39A6 или антигенсвязывающий фрагмент.
[587] В некоторых других вариантах осуществления антитело или антигенсвязывающий фрагмент целенаправленно воздействуют на клетку, экспрессирующую SLC44A4. В некоторых вариантах осуществления антитело или антигенсвязывающий фрагмент представляют собой антитело к SLC44A4 или антигенсвязывающий фрагмент.
[588] В некоторых других вариантах осуществления антитело или антигенсвязывающий фрагмент целенаправленно воздействуют на клетку, экспрессирующую STEAP1. В некоторых вариантах осуществления антитело или антигенсвязывающий фрагмент представляют собой антитело к STEAP1 или антигенсвязывающий фрагмент.
[589] В некоторых вариантах осуществления L выбран из любого из линкеров, раскрытых в данном документе, или любой комбинации линкерных компонентов, раскрытых в данном документе. В некоторых вариантах осуществления L представляет собой расщепляемый линкер. В некоторых вариантах осуществления L представляет собой нерасщепляемый линкер. В некоторых вариантах осуществления L представляет собой линкер, предусматривающий MC-Val-Cit-pABC, MC-Val-Ala-pABC, MC-Val-Ala-pAB, MC-Glu-Val-Cit-pABC, Ala-Ala-Asn-pABC или β-глюкуронид. В некоторых вариантах осуществления L представляет собой линкер, предусматривающий Mal-Hex, Mal-Et или Mal-Et-O-Et. В некоторых вариантах осуществления L представляет собой линкер, предусматривающий MC-Val-Cit-pABC, Mal-(PEG)2-CO, MC-Val-Ala-pAB, MC-Val-Ala-pABC, MC-Val-Cit-pAB, Mal-Hex, Mal-Et или Mal-Et-O-Et. В некоторых вариантах осуществления линкер также может предусматривать одно или несколько дополнительных спейсерных звеньев. В некоторых вариантах осуществления L представляет собой линкер ADL1, ADL2, ADL5, ADL6, ADL7, ADL12, ADL13, ADL14, ADL21, ADL23, или ADL15. В некоторых вариантах осуществления L представляет собой линкер ADL12, ADL14 или ADL15. В некоторых вариантах осуществления линкер ADL1, ADL2, ADL5, ADL6, ADL7, ADL12, ADL13, ADL14, ADL21, ADL23, или ADL15 также может предусматривать одно или несколько дополнительных спейсерных звеньев.
[590] В некоторых вариантах осуществления p составляет от 1 до 10. В некоторых вариантах осуществления p составляет от 2 до 8. В некоторых вариантах осуществления p составляет от 4 до 8. В некоторых вариантах осуществления p составляет 4. В некоторых вариантах осуществления p составляет 8.
[591] Другой иллюстративный ADC имеет формулу (I):
Ab-(L-D)p (I),
где Ab представляет собой антитело к HER2 или антигенсвязывающий фрагмент, содержащие три определяющие комплементарность области тяжелой цепи (HCDR1, HCDR2 и HCDR3), содержащие аминокислотные последовательности под SEQ ID NO:1 (HCDR1), SEQ ID NO:2 (HCDR2) и SEQ ID NO:3 (HCDR3); и три определяющие комплементарность области легкой цепи (LCDR1, LCDR2 и LCDR3), содержащие аминокислотные последовательности под SEQ ID NO:4 (LCDR1), SEQ ID NO:5 (LCDR2) и SEQ ID NO:6 (LCDR3);
D представляет собой D2, D1, D4, D12 или D15;
L представляет собой линкер, который ковалентно прикрепляет Ab к D; и
p составляет целое число от 1 до 15.
[592] В некоторых вариантах осуществления антитело или антигенсвязывающий фрагмент содержат вариабельную область тяжелой цепи, содержащую аминокислотную последовательность под SEQ ID NO:19, и вариабельную область легкой цепи, содержащую аминокислотную последовательность под SEQ ID NO:20.
[593] В некоторых вариантах осуществления L выбран из любого из линкеров, раскрытых в данном документе, или любой комбинации линкерных компонентов, раскрытых в данном документе. В некоторых вариантах осуществления L представляет собой линкер, предусматривающий MC-Val-Cit-pABC, Mal-(PEG)2-CO, MC-Val-Ala-pAB, MC-Val-Ala-pABC, MC-Val-Cit-pAB, Mal-Hex, Mal-Et или Mal-Et-O-Et. В некоторых вариантах осуществления линкер также может предусматривать одно или несколько дополнительных спейсерных звеньев. В некоторых вариантах осуществления L представляет собой линкер ADL1, ADL2, ADL5, ADL6, ADL7, ADL12, ADL13, ADL14, ADL21, ADL23, или ADL15. В некоторых вариантах осуществления L представляет собой линкер ADL12, ADL14 или ADL15. В некоторых вариантах осуществления линкер ADL1, ADL2, ADL5, ADL6, ADL7, ADL12, ADL13, ADL14, ADL21, ADL23, или ADL15 также может предусматривать одно или несколько дополнительных спейсерных звеньев.
[594] Другой иллюстративный ADC имеет формулу (I):
Ab-(L-D)p (I),
где Ab представляет собой антитело к CD138 или антигенсвязывающий фрагмент, содержащие три определяющие комплементарность области тяжелой цепи (HCDR1, HCDR2 и HCDR3), содержащие аминокислотные последовательности под SEQ ID NO:7 (HCDR1), SEQ ID NO:8 (HCDR2) и SEQ ID NO:9 (HCDR3); и три определяющие комплементарность области легкой цепи (LCDR1, LCDR2 и LCDR3), содержащие аминокислотные последовательности под SEQ ID NO:10 (LCDR1), SEQ ID NO:11 (LCDR2) и SEQ ID NO:12 (LCDR3);
D представляет собой D2, D1, D4, D12 или D15;
L представляет собой линкер, который ковалентно прикрепляет Ab к D; и
p составляет целое число от 1 до 15.
[595] В некоторых вариантах осуществления антитело или антигенсвязывающий фрагмент содержат вариабельную область тяжелой цепи, содержащую аминокислотную последовательность под SEQ ID NO:21, и вариабельную область легкой цепи, содержащую аминокислотную последовательность под SEQ ID NO:22.
[596] В некоторых вариантах осуществления L выбран из любого из линкеров, раскрытых в данном документе, или любой комбинации линкерных компонентов, раскрытых в данном документе. В некоторых вариантах осуществления L представляет собой линкер, предусматривающий MC-Val-Cit-pABC, Mal-(PEG)2-CO, MC-Val-Ala-pAB, MC-Val-Ala-pABC, MC-Val-Cit-pAB, Mal-Hex, Mal-Et или Mal-Et-O-Et. В некоторых вариантах осуществления линкер также может предусматривать одно или несколько дополнительных спейсерных звеньев. В некоторых вариантах осуществления L представляет собой линкер ADL1, ADL2, ADL5, ADL6, ADL7, ADL12, ADL13, ADL14, ADL21, ADL23, или ADL15. В некоторых вариантах осуществления L представляет собой линкер ADL12, ADL14 или ADL15. В некоторых вариантах осуществления линкер ADL1, ADL2, ADL5, ADL6, ADL7, ADL12, ADL13, ADL14, ADL21, ADL23, или ADL15 также может предусматривать одно или несколько дополнительных спейсерных звеньев.
[597] Другой иллюстративный ADC имеет формулу (I):
Ab-(L-D)p (I),
где Ab представляет собой антитело к EPHA2 или антигенсвязывающий фрагмент, содержащие три определяющие комплементарность области тяжелой цепи (HCDR1, HCDR2 и HCDR3), содержащие аминокислотные последовательности под SEQ ID NO:13 (HCDR1), SEQ ID NO:14 (HCDR2) и SEQ ID NO:15 (HCDR3); и три определяющие комплементарность области легкой цепи (LCDR1, LCDR2 и LCDR3), содержащие аминокислотные последовательности под SEQ ID NO:16 (LCDR1), SEQ ID NO:17 (LCDR2) и SEQ ID NO:18 (LCDR3);
D представляет собой D2, D1, D4, D12 или D15;
L представляет собой линкер, который ковалентно прикрепляет Ab к D; и
p составляет целое число от 1 до 15.
[598] В некоторых вариантах осуществления антитело или антигенсвязывающий фрагмент содержат вариабельную область тяжелой цепи, содержащую аминокислотную последовательность под SEQ ID NO:23, и вариабельную область легкой цепи, содержащую аминокислотную последовательность под SEQ ID NO:24.
[599] В некоторых вариантах осуществления L выбран из любого из линкеров, раскрытых в данном документе, или любой комбинации линкерных компонентов, раскрытых в данном документе. В некоторых вариантах осуществления L представляет собой линкер, предусматривающий MC-Val-Cit-pABC, Mal-(PEG)2-CO, MC-Val-Ala-pAB, MC-Val-Ala-pABC, MC-Val-Cit-pAB, Mal-Hex, Mal-Et или Mal-Et-O-Et. В некоторых вариантах осуществления линкер также может предусматривать одно или несколько дополнительных спейсерных звеньев. В некоторых вариантах осуществления L представляет собой линкер ADL1, ADL2, ADL5, ADL6, ADL7, ADL12, ADL13, ADL14, ADL21, ADL23, или ADL15. В некоторых вариантах осуществления L представляет собой линкер ADL12, ADL14 или ADL15. В некоторых вариантах осуществления линкер ADL1, ADL2, ADL5, ADL6, ADL7, ADL12, ADL13, ADL14, ADL21, ADL23, или ADL15 также может предусматривать одно или несколько дополнительных спейсерных звеньев.
[600] В различных вариантах осуществления ADC, содержащие фрагмент-лекарственное средство D2 или D1, могут включать расщепляемый или нерасщепляемый линкер.
[601] В различных вариантах осуществления линкер представляет собой расщепляемый линкер. В различных вариантах осуществления расщепляемый линкер предусматривает MC-Val-Cit-pABC. В различных вариантах осуществления расщепляемый линкер предусматривает MC-Val-Ala-pABC. В различных вариантах осуществления расщепляемый линкер предусматривает MC-Val-Ala-pAB. В различных вариантах осуществления расщепляемый линкер предусматривает MC-Glu-Val-Cit-pABC. В различных вариантах осуществления расщепляемый линкер предусматривает MC-Ala-Ala-Asn-pABC.
[602] В различных других вариантах осуществления линкер представляет собой нерасщепляемый линкер. В различных вариантах осуществления нерасщепляемый линкер предусматривает MC по отдельности или в комбинации с по меньшей мере одним дополнительным спейсерным звеном. В различных вариантах осуществления нерасщепляемый линкер предусматривает Mal-Hex по отдельности или в комбинации с по меньшей мере одним дополнительным спейсерным звеном. В различных вариантах осуществления нерасщепляемый линкер предусматривает Mal-Et по отдельности или в комбинации с по меньшей мере одним дополнительным спейсерным звеном. В различных вариантах осуществления нерасщепляемый линкер предусматривает Mal-Et-O-Et по отдельности или в комбинации с по меньшей мере одним дополнительным спейсерным звеном.
[603] В различных вариантах осуществления в ADC, содержащих фрагмент-лекарственное средство D2 или D1, p составляет от 1 до 10. В различных вариантах осуществления p составляет от 2 до 8. В различных вариантах осуществления p составляет от 4 до 8. В различных вариантах осуществления p составляет 4. В различных вариантах осуществления p составляет 8.
[604] В различных вариантах осуществления раскрытый в данном документе ADC, содержащий фрагмент-лекарственное средство D2 или D1, демонстрирует улучшенное соотношение лекарственное средство:антитело, более низкие уровни агрегации, повышенную стабильность, повышенное целевое уничтожение раковых клеток, сниженное нецелевое уничтожение нераковых клеток и/или повышенную цитотоксичность и/или активность по сравнению с ADC, содержащим альтернативный фрагмент-лекарственное средство (например, альтернативный фрагмент-лекарственное средство, представляющий собой модулятор сплайсинга). В некоторых вариантах осуществления раскрытый в данном документе ADC, содержащий фрагмент-лекарственное средство D2 или D1, обеспечивает надлежащие или превосходные свойства в одной или нескольких категориях, перечисленных выше, или по всему спектру функциональных свойств терапевтического ADC. В некоторых вариантах осуществления ADC, содержащий фрагмент-лекарственное средство D2 или D1, проявляет неожиданно эффективную активность и повышенное ингибирование клеточного роста и/или пролиферации у клеток, которые экспрессируют антиген, на который целенаправленно воздействует ADC, по сравнению с ADC, содержащим альтернативный фрагмент-лекарственное средство (например, альтернативный фрагмент-лекарственное средство, представляющий собой модулятор сплайсинга). В некоторых вариантах осуществления активность можно измерять по величине концентрации соединения, которая обуславливает 50% снижение клеточной пролиферации (GI50). В различных вариантах осуществления ADC, содержащие фрагмент-лекарственное средство D2 или D1, проявляют неожиданно повышенную стабильность in vivo (например, стабильность в плазме крови) по сравнению с ADC с альтернативным фрагментом-лекарственным средством (например, альтернативным фрагментом-лекарственным средством, представляющим собой модулятор сплайсинга, например, тайланстатин A). См., например, ADC, описанный в Puthenveetil et al. (Bioconjugate Chem. (2016) 27:1880-8), в которой показано полное биологическое превращение полезной нагрузки за 72 часа (т. е. ацетат полностью гидролизуется).
[605] В определенных вариантах осуществления промежуточное соединение, которое является предшественником линкерного фрагмента, вводят в реакцию с фрагментом-лекарственным средством (например, модулятором сплайсинга) при подходящих условиях. В определенных вариантах осуществления используются реакционно-способные группы на лекарственном средстве и/или промежуточном соединении или линкере. Продукт реакции между лекарственным средством и промежуточным соединением или дериватизированным лекарственным средством (лекарственное средство плюс линкер) впоследствии вводят в реакцию с антителом или антигенсвязывающим фрагментом при подходящих условиях. В качестве альтернативы промежуточное соединение или линкер можно вначале вводить в реакцию с антителом или антигенсвязывающим фрагментом или дериватизированным антителом или антигенсвязывающим фрагментом, а затем вводить в реакцию с лекарственным средством или дериватизированным лекарственным средством.
[606] Целый ряд разных реакций доступны для ковалентного прикрепления фрагмента-лекарственного средства и/или линкерного фрагмента к антителу или антигенсвязывающему фрагменту. Это зачастую выполняют путем реакции одного или нескольких аминокислотных остатков антитела или антигенсвязывающего фрагмента, включающих аминогруппы лизина, свободные группы карбоновой кислоты глутаминовой кислоты и аспарагиновой кислоты, сульфгидрильные группы цистеины и различные фрагменты ароматических аминокислот. Например, неспецифическое ковалентное прикрепление может быть проведено с применением карбодиимидной реакции для связывания карбокси- (или амино-)группы на фрагменте-лекарственном средстве с амино- (или карбокси-)группой на антителе или антигенсвязывающем фрагменте. В дополнение к этому, для связывания аминогруппы на фрагменте-лекарственном средстве с аминогруппой на антителе или антигенсвязывающем фрагменте можно также применять бифункциональные средства, такие как диальдегиды или сложные имидоэфиры. Для прикрепления лекарственных средств (например, модулятора сплайсинга) к связывающим средствам также подходит реакция с образованием оснований Шиффа. Данный способ предусматривает перйодатное окисление лекарственного средства, которое содержит гликоль или гидроксигруппы, за счет чего образуется альдегид, который затем реагирует со связывающим средством. Прикрепление происходит посредством образования основания Шиффа с аминогруппами связывающего средства. Изотиоцианаты также можно применять в качестве средств для сочетания путем ковалентного прикрепления лекарственных средств к связывающим средствам. Другие методики известны специалисту в данной области техники и находятся в пределах объема настоящего изобретения. Примеры фрагментов-лекарственных средств, которые могут быть получены и связаны с антителом или антигенсвязывающим фрагментом с применением различных химических структур, известных из уровня техники, включают модуляторы сплайсинга, например, модуляторы сплайсинга, описанные и приведенные в качестве примера в данном документе.
Соединения, представляющие собой линкер-лекарственное средство/лекарственное средство
[607] В данном документе дополнительно раскрыты иллюстративные соединения, представляющие собой линкер-лекарственное средство (L-D), а также композиции, содержащие множественные копии таких соединений. В различных вариантах осуществления раскрытые в данном документе соединения, представляющие собой линкер-лекарственное средство, могут определяться общей формулой: L-D, где L=линкерный фрагмент, и D=фрагмент-лекарственное средство (например, фрагмент-лекарственное средство, представляющее собой модулятор сплайсинга). В определенных вариантах осуществления раскрытые L-D соединения подходят для применения в ADC, описанных в данном документе, например, в ADC формулы (I).
[608] В различных вариантах осуществления раскрытые в данном документе соединения, представляющие собой линкер-лекарственное средство (L-D), предусматривают структуру линкера-лекарственного средства в соответствии с формулой (III). В различных вариантах осуществления настоящего изобретения представлено соединение, представляющее собой линкер-лекарственное средство (L-D), формулы (III):
 (III),
(III),
или его фармацевтически приемлемая соль, где:
R1 отсутствует или выбран из водорода, C1-C6алкильных групп, C1-C6алкилалкоксигрупп, C1-C6алкиламиногрупп, групп C1-C6алкилкарбоновой кислоты, C1-C6алкилгидроксигрупп, C3-C8циклоалкильных групп, бензильных групп, C3-C8гетероциклильных групп, групп -O-C(=O)-(C1-C6алкил) и -CD3;
R2 отсутствует или представляет собой линкер;
R3 выбран из водорода, C1-C6алкильных групп, C1-C6алкилалкоксигрупп, C1-C6алкиламиногрупп, групп C1-C6алкилкарбоновой кислоты, C1-C6алкилгидроксигрупп, C3-C8циклоалкильных групп, бензильных групп, C3-C8гетероциклильных групп и групп -O-C(=O)-(C1-C6алкил); и
каждый из R4, R5 и R8 независимо выбран из водорода, гидроксильных групп, групп -O-(C1-C6алкил), групп -O-C(=O)-(C1-C6алкил) и C1-C6алкильных групп;
каждый из R6 и R7 независимо выбран из водорода, -O-R17, -O-C(=O)-R17, -O-C(=O)-NR15R16, C1-C6алкильных групп, -NR15R16 и линкера;
каждый из R15 и R16 независимо выбран из водорода, R17, -C(=O)-R17 и -C(=O)-O-R17;
R17 выбран из водорода, C1-C6алкильных групп, C3-C8циклоалкильных групп, бензильных групп и C3-C8гетероциклильных групп; и
Z'' выбран из  ,
,  ,
,  ,
,  и
и  ;
;
где каждый из R1, R2, R3, R4, R5, R6, R7, R8, R15, R16, и R17 независимо замещен 0-3 группами, независимо выбранными из атомов галогена, гидроксильных групп, C1-C6алкильных групп, групп -O-(C1-C6алкил), -NR15R16, C3-C8циклоалкильных групп, C1-C6алкилгидроксигрупп, C1-C6алкилалкоксигрупп, бензильных групп и C3-C8гетероциклильных групп;
где по меньшей мере один из R6 и R7 представляет собой водород; и
где, если R2 представляет собой линкер, то ни R6, ни R7 не представляют собой линкер, и, если R6 или R7 представляют собой линкер, то R2 отсутствует.
[609] В некоторых вариантах осуществления R1 отсутствует или выбран из водорода, C1-C4алкильных групп, групп C1-C4алкилкарбоновой кислоты и C3-C8циклоалкильных групп. В некоторых вариантах осуществления R1 отсутствует. В некоторых вариантах осуществления R1 представляет собой водород. В некоторых вариантах осуществления R1 представляет собой C1-C4алкильную группу. В некоторых вариантах осуществления R1 представляет собой метил. В некоторых вариантах осуществления R1 представляет собой этил. В некоторых вариантах осуществления R1 представляет собой группу C1-C4алкилкарбоновой кислоты. В некоторых вариантах осуществления R1 представляет собой -CH2CH2CH2CO2H. В некоторых вариантах осуществления R1 представляет собой C3-C8циклоалкильную группу. В некоторых вариантах осуществления R1 представляет собой циклогептил.
[610] В некоторых вариантах осуществления R3 выбран из водорода, C1-C4алкильных групп, C1-C4алкилалкоксигрупп, групп C1-C4алкилкарбоновой кислоты и C1-C4алкилгидроксигрупп. В некоторых вариантах осуществления R3 выбран из водорода и групп C1-C4алкилкарбоновой кислоты. В некоторых вариантах осуществления R3 представляет собой водород. В некоторых вариантах осуществления R3 представляет собой группу C1-C4алкилкарбоновой кислоты. В некоторых вариантах осуществления R3 представляет собой -CH2CH2CO2H.
[611] В некоторых вариантах осуществления R4 выбран из водорода, гидроксильных групп, групп -O-(C1-C4алкил), групп -O-C(=O)-(C1-C4алкил) и C1-C4алкильных групп. В некоторых вариантах осуществления R4 представляет собой водород. В некоторых вариантах осуществления R4 представляет собой гидроксил. В некоторых вариантах осуществления R4 представляет собой группу -O-(C1-C4алкил). В некоторых вариантах осуществления R4 представляет собой -OCH3. В некоторых вариантах осуществления R4 представляет собой -OCH2CH3. В некоторых вариантах осуществления R4 представляет собой группу -O-C(=O)-(C1-C4алкил). В некоторых вариантах осуществления R4 представляет собой -O-C(=O)-CH3. В некоторых вариантах осуществления R4 представляет собой -O-C(=O)-CH2CH3. В некоторых вариантах осуществления R4 представляет собой C1-C4алкильную группу. В некоторых вариантах осуществления R4 представляет собой метил. В некоторых вариантах осуществления R4 представляет собой этил.
[612] В некоторых вариантах осуществления R5 выбран из водорода, гидроксильных групп, групп -O-(C1-C4алкил) и C1-C4алкильных групп. В некоторых вариантах осуществления R5 представляет собой водород. В некоторых вариантах осуществления R5 представляет собой гидроксил. В некоторых вариантах осуществления R5 представляет собой группу -O-(C1-C4алкил). В некоторых вариантах осуществления R5 представляет собой C1-C4алкильную группу.
[613] В некоторых вариантах осуществления R2 отсутствует, и R6 представляет собой линкер. В некоторых вариантах осуществления R2 отсутствует, и R7 представляет собой линкер. В некоторых вариантах осуществления R2 представляет собой линкер. В некоторых вариантах осуществления R6 представляет собой водород. В некоторых вариантах осуществления R7 представляет собой водород.
[614] В некоторых вариантах осуществления R6 представляет собой водород, и R7 представляет собой -O-R17. В некоторых вариантах осуществления R6 представляет собой водород, и R7 представляет собой -OR17, где R17 выбран из водорода и C1-C4алкильных групп. В некоторых вариантах осуществления R6 представляет собой водород, и R7 представляет собой -O-R17, где R17 представляет собой водород. В некоторых вариантах осуществления R6 представляет собой -O-R17, и R7 представляет собой водород. В некоторых вариантах осуществления R6 представляет собой -O-R17, и R7 представляет собой водород, где R17 выбран из водорода и C1-C4алкильных групп. В некоторых вариантах осуществления R6 представляет собой -O-R17, и R7 представляет собой водород, где R17 представляет собой водород. В некоторых вариантах осуществления R6 представляет собой водород, и R7 представляет собой -NR15R16. В некоторых вариантах осуществления R6 представляет собой водород, и R7 представляет собой -NR15R16, где R15 представляет собой H, и R16 выбран из водорода, R17, -C(=O)-R17 и -C(=O)-O-R17. В некоторых вариантах осуществления R6 представляет собой водород, и R7 представляет собой -NR15R16, где R15 представляет собой H, и R16 выбран из водорода, R17, -C(=O)-R17 и -C(=O)-O-R17, и где R17 выбран из водорода, C1-C6алкильных групп, C3-C8циклоалкильных групп и C3-C8гетероциклильных групп. В некоторых вариантах осуществления R6 представляет собой -O-R17. В некоторых вариантах осуществления R6 представляет собой -O-C(=O)-R17. В некоторых вариантах осуществления R6 представляет собой C1-C6алкил. В некоторых вариантах осуществления R6 представляет собой C1-C4алкил. В некоторых вариантах осуществления R6 представляет собой C1алкил. В некоторых вариантах осуществления R6 представляет собой -NR15R16.
[615] В некоторых вариантах осуществления R7 представляет собой -O-R17. В некоторых вариантах осуществления R7 представляет собой -O-C(=O)-R17. В некоторых вариантах осуществления R7 представляет собой C1-C6алкил. В некоторых вариантах осуществления R7 представляет собой C1-C4алкил. В некоторых вариантах осуществления R7 представляет собой C1алкил. В некоторых вариантах осуществления R7 представляет собой -NR15R16.
[616] В некоторых вариантах осуществления R8 выбран из водорода, гидроксильных групп, групп -O-(C1-C4алкил) и (C1-C4алкил). В некоторых вариантах осуществления R8 представляет собой водород. В некоторых вариантах осуществления R8 представляет собой гидроксильную группу. В некоторых вариантах осуществления R8 представляет собой группу -O-(C1-C4алкил). В некоторых вариантах осуществления R8 представляет собой группу -O-(C1алкил).
[617] В некоторых вариантах осуществления R15 представляет собой водород. В некоторых вариантах осуществления R15 представляет собой R17. В некоторых вариантах осуществления R15 представляет собой -C(=O)-R17. В некоторых вариантах осуществления R15 представляет собой -C(=O)-O-R17.
[618] В некоторых вариантах осуществления R16 представляет собой водород. В некоторых вариантах осуществления R16 представляет собой R17. В некоторых вариантах осуществления R16 представляет собой -C(=O)-R17. В некоторых вариантах осуществления R16 представляет собой -C(=O)-O-R17.
[619] В некоторых вариантах осуществления R17 выбран из водорода, C1-C4алкильных групп, C3-C6циклоалкильных групп и C3-C8гетероциклильных групп. В некоторых вариантах осуществления R17 представляет собой водород. В некоторых вариантах осуществления R17 представляет собой C1-C4алкильную группу. В некоторых вариантах осуществления R17 представляет собой C1алкильную группу. В некоторых вариантах осуществления R17 представляет собой C3-C6циклоалкильную группу. В некоторых вариантах осуществления R17 представляет собой C3циклоалкильную группу. В некоторых вариантах осуществления R17 представляет собой C4циклоалкильную группу. В некоторых вариантах осуществления R17 представляет собой C5циклоалкильную группу. В некоторых вариантах осуществления R17 представляет собой C6циклоалкильную группу. В некоторых вариантах осуществления R17 представляет собой C3-C8гетероциклильную группу. В некоторых вариантах осуществления R17 представляет собой C3гетероциклильную группу. В некоторых вариантах осуществления R17 представляет собой C4гетероциклильную группу. В некоторых вариантах осуществления R17 представляет собой C5гетероциклильную группу. В некоторых вариантах осуществления R17 представляет собой C6гетероциклильную группу. В некоторых вариантах осуществления R17 представляет собой C7гетероциклильную группу. В некоторых вариантах осуществления R17 представляет собой C8гетероциклильную группу.
[620] В некоторых вариантах осуществления Z' представляет собой  . В некоторых вариантах осуществления Z' представляет собой
. В некоторых вариантах осуществления Z' представляет собой  . В некоторых вариантах осуществления Z' представляет собой
. В некоторых вариантах осуществления Z' представляет собой  . В некоторых вариантах осуществления Z' представляет собой
. В некоторых вариантах осуществления Z' представляет собой  . В некоторых вариантах осуществления Z' представляет собой
. В некоторых вариантах осуществления Z' представляет собой  .
.
[621] В некоторых вариантах осуществления R2 представляет собой линкер. В некоторых вариантах осуществления линкер предусматривает по меньшей мере один расщепляемый пептидный фрагмент. В некоторых вариантах осуществления по меньшей мере один расщепляемый пептидный фрагмент расщепляется под действием фермента. В некоторых вариантах осуществления линкер или расщепляемый пептидный фрагмент предусматривают по меньшей мере одно аминокислотное звено. В некоторых вариантах осуществления по меньшей мере одно аминокислотное звено выбрано из аргинина, гистидина, лизина, аспарагиновой кислоты, глутаминовой кислоты, серина, треонина, аспарагина, глутамина, цистеина, селеноцистеина, глицина, пролина, аланина, валина, изолейцина, метионина, фенилаланина, тирозина, триптофана и цитруллина. В некоторых вариантах осуществления по меньшей мере одно аминокислотное звено выбрано из аланина, цитруллина и валина. В некоторых вариантах осуществления линкер предусматривает цитруллин и валин. В некоторых вариантах осуществления линкер предусматривает аланин и валин.
[622] В некоторых вариантах осуществления линкер предусматривает a фрагмент, выбранный из сульфонамида, β-глюкуронида, дисульфида и карбонила. В некоторых вариантах осуществления линкер предусматривает сульфонамид. В некоторых вариантах осуществления линкер предусматривает β-глюкуронид. В некоторых вариантах осуществления линкер предусматривает дисульфид. В некоторых вариантах осуществления линкер предусматривает карбонил.
[623] В некоторых вариантах осуществления линкер предусматривает спейсерное звено. В некоторых вариантах осуществления спейсерное звено выбрано из алкильных групп и полиэтиленгликольных (PEG) фрагментов. В некоторых вариантах осуществления алкильных группа представляет собой C1-C12алкильную группу. В некоторых вариантах осуществления алкильных группа представляет собой C1-C6алкильную группу. В некоторых вариантах осуществления алкильная группа представляет собой метилен. В некоторых вариантах осуществления алкильная группа представляет собой этилен. В некоторых вариантах осуществления алкильная группа представляет собой н-пропилен. В некоторых вариантах осуществления алкильная группа представляет собой н-бутилен. В некоторых вариантах осуществления алкильная группа представляет собой н-пентилен. В некоторых вариантах осуществления алкильная группа представляет собой н-гексилен. В некоторых вариантах осуществления PEG-фрагмент предусматривает -(PEG)m-, где m составляет целое число от 1 до 10. В некоторых вариантах осуществления m составляет 1. В некоторых вариантах осуществления m составляет 2. В некоторых вариантах осуществления m составляет 3. В некоторых вариантах осуществления m составляет 4. В некоторых вариантах осуществления m составляет 5. В некоторых вариантах осуществления m составляет 6.
[624] В некоторых вариантах осуществления линкер предусматривает малеимидный (Mal) фрагмент ("Mal-спейсерное звено"). В некоторых вариантах осуществления линкер предусматривает саморасщепляющееся спейсерное звено. В некоторых вариантах осуществления саморасщепляющееся спейсерное звено выбрано из п-аминобензилоксикарбонила (pABC) и п-аминобензила (pAB).
[625] В некоторых вариантах осуществления линкер предусматривает Mal-спейсерное звено, алкильную группу, по меньшей мере одно аминокислотное звено и саморасщепляющийся спейсер. В некоторых вариантах осуществления по меньшей мере одно аминокислотное звено выбрано из аланина, цитруллина и валина. В некоторых вариантах осуществления по меньшей мере одно аминокислотное звено предусматривает аланин и валин. В некоторых вариантах осуществления по меньшей мере одно аминокислотное звено предусматривает цитруллин и валин. В некоторых вариантах осуществления саморасщепляющийся спейсер выбран из pAB и pABC. В некоторых вариантах осуществления саморасщепляющийся спейсер предусматривает pAB. В некоторых вариантах осуществления саморасщепляющийся спейсер предусматривает pABC. В некоторых вариантах осуществления алкильных группа предусматривает C1-C6алкильную группу.
[626] В некоторых вариантах осуществления линкер предусматривает Mal-спейсерное звено, PEG-фрагмент, по меньшей мере одно аминокислотное звено и саморасщепляющийся спейсер. В некоторых вариантах осуществления по меньшей мере одно аминокислотное звено выбрано из аланина, цитруллина и валина. В некоторых вариантах осуществления по меньшей мере одно аминокислотное звено предусматривает аланин и валин. В некоторых вариантах осуществления по меньшей мере одно аминокислотное звено предусматривает цитруллин и валин. В некоторых вариантах осуществления саморасщепляющийся спейсер выбран из pAB и pABC. В некоторых вариантах осуществления саморасщепляющийся спейсер предусматривает pAB. В некоторых вариантах осуществления саморасщепляющийся спейсер предусматривает pABC. В некоторых вариантах осуществления PEG-фрагмент предусматривает -(PEG)m-, где m составляет целое число от 1 до 6.
[627] В различных других вариантах осуществления соединения, представляющие собой линкер-лекарственное средство (L-D), раскрытые в данном документе, предусматривают структуру линкер-лекарственное средство в соответствии с формулой (V). В различных вариантах осуществления настоящего изобретения представлено соединение, представляющее собой линкер-лекарственное средство (L-D), формулы (V):
 (V),
(V),
или его фармацевтически приемлемая соль, где:
R1 отсутствует или выбран из водорода, C1-C6алкильных групп, C1-C6алкилалкоксигрупп, C1-C6алкиламиногрупп, групп C1-C6алкилкарбоновой кислоты, C1-C6алкилгидроксигрупп, C3-C8циклоалкильных групп, бензильных групп, C3-C8гетероциклильных групп, групп -O-C(=O)-(C1-C6алкил) и -CD3;
R2 отсутствует или представляет собой линкер;
R3 выбран из водорода, C1-C6алкильных групп, C1-C6алкилалкоксигрупп, C1-C6алкиламиногрупп, групп C1-C6алкилкарбоновой кислоты, C1-C6алкилгидроксигрупп, C3-C8циклоалкильных групп, бензильных групп, C3-C8гетероциклильных групп и групп -O-C(=O)-(C1-C6алкил); и
каждый из R4, R5 и R8 независимо выбран из водорода, гидроксильных групп, групп -O-(C1-C6алкил), групп -O-C(=O)-(C1-C6алкил) и C1-C6алкильных групп;
каждый из R6 и R7 независимо выбран из водорода, -O-R17, -O-C(=O)-R17, -O-C(=O)-NR15R16, C1-C6алкильных групп, -NR15R16 и линкера;
каждый из R15 и R16 независимо выбран из водорода, R17, -C(=O)-R17 и -C(=O)-O-R17; и
R17 выбран из водорода, C1-C6алкильных групп, C3-C8циклоалкильных групп, бензильных групп и C3-C8гетероциклильных групп;
где каждый из R1, R2, R3, R4, R5, R6, R7, R8, R15, R16 и R17 независимо замещен 0-3 группами, независимо выбранными из атомов галогена, гидроксильных групп, C1-C6алкильных групп, групп -O-(C1-C6алкил), -NR15R16, C3-C8циклоалкильных групп, C1-C6алкилгидроксигрупп, C1-C6алкилалкоксигрупп, бензильных групп и C3-C8гетероциклильных групп;
где по меньшей мере один из R6 и R7 представляет собой водород; и
где, если R2 представляет собой линкер, то ни R6, ни R7 не представляют собой линкер, и, если R6 или R7 представляют собой линкер, то R2 отсутствует.
[628] В некоторых вариантах осуществления R1 отсутствует или выбран из водорода, C1-C4алкильных групп, групп C1-C4алкилкарбоновой кислоты и C3-C8циклоалкильных групп. В некоторых вариантах осуществления R1 отсутствует. В некоторых вариантах осуществления R1 представляет собой водород. В некоторых вариантах осуществления R1 представляет собой C1-C4алкильную группу. В некоторых вариантах осуществления R1 представляет собой метил. В некоторых вариантах осуществления R1 представляет собой этил. В некоторых вариантах осуществления R1 представляет собой группу C1-C4алкилкарбоновой кислоты. В некоторых вариантах осуществления R1 представляет собой -CH2CH2CH2CO2H. В некоторых вариантах осуществления R1 представляет собой C3-C8циклоалкильную группу. В некоторых вариантах осуществления R1 представляет собой циклогептил.
[629] В некоторых вариантах осуществления R3 выбран из водорода, C1-C4алкильных групп, C1-C4алкилалкоксигрупп, групп C1-C4алкилкарбоновой кислоты и C1-C4алкилгидроксигрупп. В некоторых вариантах осуществления R3 выбран из водорода и групп C1-C4алкилкарбоновой кислоты. В некоторых вариантах осуществления R3 представляет собой водород. В некоторых вариантах осуществления R3 представляет собой группу C1-C4алкилкарбоновой кислоты. В некоторых вариантах осуществления R3 представляет собой -CH2CH2CO2H.
[630] В некоторых вариантах осуществления R4 выбран из водорода, гидроксильных групп, групп -O-(C1-C4алкил), групп -O-C(=O)-(C1-C4алкил) и C1-C4алкильных групп. В некоторых вариантах осуществления R4 представляет собой водород. В некоторых вариантах осуществления R4 представляет собой гидроксил. В некоторых вариантах осуществления R4 представляет собой группу -O-(C1-C4алкил). В некоторых вариантах осуществления R4 представляет собой -OCH3. В некоторых вариантах осуществления R4 представляет собой -OCH2CH3. В некоторых вариантах осуществления R4 представляет собой группу -O-C(=O)-(C1-C4алкил). В некоторых вариантах осуществления R4 представляет собой -O-C(=O)-CH3. В некоторых вариантах осуществления R4 представляет собой -O-C(=O)-CH2CH3. В некоторых вариантах осуществления R4 представляет собой C1-C4алкильную группу. В некоторых вариантах осуществления R4 представляет собой метил. В некоторых вариантах осуществления R4 представляет собой этил.
[631] В некоторых вариантах осуществления R5 выбран из водорода, гидроксильных групп, групп -O-(C1-C4алкил) и C1-C4алкильных групп. В некоторых вариантах осуществления R5 представляет собой водород. В некоторых вариантах осуществления R5 представляет собой гидроксил. В некоторых вариантах осуществления R5 представляет собой группу -O-(C1-C4алкил). В некоторых вариантах осуществления R5 представляет собой C1-C4алкильную группу.
[632] В некоторых вариантах осуществления R2 отсутствует, и R6 представляет собой линкер. В некоторых вариантах осуществления R2 отсутствует, и R7 представляет собой линкер. В некоторых вариантах осуществления R2 представляет собой линкер. В некоторых вариантах осуществления R6 представляет собой водород. В некоторых вариантах осуществления R7 представляет собой водород.
[633] В некоторых вариантах осуществления R6 представляет собой водород, и R7 представляет собой -O-R17. В некоторых вариантах осуществления R6 представляет собой водород, и R7 представляет собой -OR17, где R17 выбран из водорода и C1-C4алкильных групп. В некоторых вариантах осуществления R6 представляет собой водород, и R7 представляет собой -O-R17, где R17 представляет собой водород. В некоторых вариантах осуществления R6 представляет собой -O-R17, и R7 представляет собой водород. В некоторых вариантах осуществления R6 представляет собой -O-R17, и R7 представляет собой водород, где R17 выбран из водорода и C1-C4алкильных групп. В некоторых вариантах осуществления R6 представляет собой -O-R17, и R7 представляет собой водород, где R17 представляет собой водород. В некоторых вариантах осуществления R6 представляет собой водород, и R7 представляет собой -NR15R16. В некоторых вариантах осуществления R6 представляет собой водород, и R7 представляет собой -NR15R16, где R15 представляет собой H, и R16 выбран из водорода, R17, -C(=O)-R17 и -C(=O)-O-R17. В некоторых вариантах осуществления R6 представляет собой водород, и R7 представляет собой -NR15R16, где R15 представляет собой H, и R16 выбран из водорода, R17, -C(=O)-R17 и -C(=O)-O-R17, и где R17 выбран из водорода, C1-C6алкильных групп, C3-C8циклоалкильных групп и C3-C8гетероциклильных групп. В некоторых вариантах осуществления R6 представляет собой -O-R17. В некоторых вариантах осуществления R6 представляет собой -O-C(=O)-R17. В некоторых вариантах осуществления R6 представляет собой C1-C6алкил. В некоторых вариантах осуществления R6 представляет собой C1-C4алкил. В некоторых вариантах осуществления R6 представляет собой C1алкил. В некоторых вариантах осуществления R6 представляет собой -NR15R16.
[634] В некоторых вариантах осуществления R7 представляет собой -O-R17. В некоторых вариантах осуществления R7 представляет собой -O-C(=O)-R17. В некоторых вариантах осуществления R7 представляет собой C1-C6алкил. В некоторых вариантах осуществления R7 представляет собой C1-C4алкил. В некоторых вариантах осуществления R7 представляет собой C1алкил. В некоторых вариантах осуществления R7 представляет собой -NR15R16.
[635] В некоторых вариантах осуществления R8 выбран из водорода, гидроксильных групп, групп -O-(C1-C4алкил) и (C1-C4алкил). В некоторых вариантах осуществления R8 представляет собой водород. В некоторых вариантах осуществления R8 представляет собой гидроксильную группу. В некоторых вариантах осуществления R8 представляет собой группу -O-(C1-C4алкил). В некоторых вариантах осуществления R8 представляет собой группу -O-(C1алкил).
[636] В некоторых вариантах осуществления R15 представляет собой водород. В некоторых вариантах осуществления R15 представляет собой R17. В некоторых вариантах осуществления R15 представляет собой -C(=O)-R17. В некоторых вариантах осуществления R15 представляет собой -C(=O)-O-R17.
[637] В некоторых вариантах осуществления R16 представляет собой водород. В некоторых вариантах осуществления R16 представляет собой R17. В некоторых вариантах осуществления R16 представляет собой -C(=O)-R17. В некоторых вариантах осуществления R16 представляет собой -C(=O)-O-R17.
[638] В некоторых вариантах осуществления R17 выбран из водорода, C1-C4алкильных групп, C3-C6циклоалкильных групп и C3-C8гетероциклильных групп. В некоторых вариантах осуществления R17 представляет собой водород. В некоторых вариантах осуществления R17 представляет собой C1-C4алкильную группу. В некоторых вариантах осуществления R17 представляет собой C1алкильную группу. В некоторых вариантах осуществления R17 представляет собой C3-C6циклоалкильную группу. В некоторых вариантах осуществления R17 представляет собой C3циклоалкильную группу. В некоторых вариантах осуществления R17 представляет собой C4циклоалкильную группу. В некоторых вариантах осуществления R17 представляет собой C5циклоалкильную группу. В некоторых вариантах осуществления R17 представляет собой C6циклоалкильную группу. В некоторых вариантах осуществления R17 представляет собой C3-C8гетероциклильную группу. В некоторых вариантах осуществления R17 представляет собой C3гетероциклильную группу. В некоторых вариантах осуществления R17 представляет собой C4гетероциклильную группу. В некоторых вариантах осуществления R17 представляет собой C5гетероциклильную группу. В некоторых вариантах осуществления R17 представляет собой C6гетероциклильную группу. В некоторых вариантах осуществления R17 представляет собой C7гетероциклильную группу. В некоторых вариантах осуществления R17 представляет собой C8гетероциклильную группу.
[639] В некоторых вариантах осуществления R2 представляет собой линкер. В некоторых вариантах осуществления линкер предусматривает по меньшей мере один расщепляемый пептидный фрагмент. В некоторых вариантах осуществления по меньшей мере один расщепляемый пептидный фрагмент расщепляется под действием фермента. В некоторых вариантах осуществления линкер или расщепляемый пептидный фрагмент предусматривают по меньшей мере одно аминокислотное звено. В некоторых вариантах осуществления по меньшей мере одно аминокислотное звено выбрано из аргинина, гистидина, лизина, аспарагиновой кислоты, глутаминовой кислоты, серина, треонина, аспарагина, глутамина, цистеина, селеноцистеина, глицина, пролина, аланина, валина, изолейцина, метионина, фенилаланина, тирозина, триптофана и цитруллина. В некоторых вариантах осуществления по меньшей мере одно аминокислотное звено выбрано из аланина, цитруллина и валина. В некоторых вариантах осуществления линкер предусматривает цитруллин и валин. В некоторых вариантах осуществления линкер предусматривает аланин и валин.
[640] В некоторых вариантах осуществления линкер предусматривает a фрагмент, выбранный из сульфонамида, β-глюкуронида, дисульфида и карбонила. В некоторых вариантах осуществления линкер предусматривает сульфонамид. В некоторых вариантах осуществления линкер предусматривает β-глюкуронид. В некоторых вариантах осуществления линкер предусматривает дисульфид. В некоторых вариантах осуществления линкер предусматривает карбонил.
[641] В некоторых вариантах осуществления линкер предусматривает спейсерное звено. В некоторых вариантах осуществления спейсерное звено выбрано из алкильных групп и полиэтиленгликольных (PEG) фрагментов. В некоторых вариантах осуществления алкильных группа представляет собой C1-C12алкильную группу. В некоторых вариантах осуществления алкильных группа представляет собой C1-C6алкильную группу. В некоторых вариантах осуществления алкильная группа представляет собой метилен. В некоторых вариантах осуществления алкильная группа представляет собой этилен. В некоторых вариантах осуществления алкильная группа представляет собой н-пропилен. В некоторых вариантах осуществления алкильная группа представляет собой н-бутилен. В некоторых вариантах осуществления алкильная группа представляет собой н-пентилен. В некоторых вариантах осуществления алкильная группа представляет собой н-гексилен. В некоторых вариантах осуществления PEG-фрагмент предусматривает -(PEG)m-, где m составляет целое число от 1 до 10. В некоторых вариантах осуществления m составляет 1. В некоторых вариантах осуществления m составляет 2. В некоторых вариантах осуществления m составляет 3. В некоторых вариантах осуществления m составляет 4. В некоторых вариантах осуществления m составляет 5. В некоторых вариантах осуществления m составляет 6.
[642] В некоторых вариантах осуществления линкер предусматривает малеимидный (Mal) фрагмент ("Mal-спейсерное звено"). В некоторых вариантах осуществления линкер предусматривает саморасщепляющееся спейсерное звено. В некоторых вариантах осуществления саморасщепляющееся спейсерное звено выбрано из п-аминобензилоксикарбонила (pABC) и п-аминобензила (pAB).
[643] В некоторых вариантах осуществления линкер предусматривает Mal-спейсерное звено, алкильную группу, по меньшей мере одно аминокислотное звено и саморасщепляющийся спейсер. В некоторых вариантах осуществления по меньшей мере одно аминокислотное звено выбрано из аланина, цитруллина и валина. В некоторых вариантах осуществления по меньшей мере одно аминокислотное звено предусматривает аланин и валин. В некоторых вариантах осуществления по меньшей мере одно аминокислотное звено предусматривает цитруллин и валин. В некоторых вариантах осуществления саморасщепляющийся спейсер выбран из pAB и pABC. В некоторых вариантах осуществления саморасщепляющийся спейсер предусматривает pAB. В некоторых вариантах осуществления саморасщепляющийся спейсер предусматривает pABC. В некоторых вариантах осуществления алкильных группа предусматривает C1-C6алкильную группу.
[644] В некоторых вариантах осуществления линкер предусматривает Mal-спейсерное звено, PEG-фрагмент, по меньшей мере одно аминокислотное звено и саморасщепляющийся спейсер. В некоторых вариантах осуществления по меньшей мере одно аминокислотное звено выбрано из аланина, цитруллина и валина. В некоторых вариантах осуществления по меньшей мере одно аминокислотное звено предусматривает аланин и валин. В некоторых вариантах осуществления по меньшей мере одно аминокислотное звено предусматривает цитруллин и валин. В некоторых вариантах осуществления саморасщепляющийся спейсер выбран из pAB и pABC. В некоторых вариантах осуществления саморасщепляющийся спейсер предусматривает pAB. В некоторых вариантах осуществления саморасщепляющийся спейсер предусматривает pABC. В некоторых вариантах осуществления PEG-фрагмент предусматривает -(PEG)m-, где m составляет целое число от 1 до 6.
[645] В различных других вариантах осуществления соединения, представляющие собой линкер-лекарственное средство (L-D), раскрытые в данном документе, предусматривают структуру линкер-лекарственное средство в соответствии с формулой (VII). В различных вариантах осуществления настоящего изобретения представлено соединение, представляющее собой линкер-лекарственное средство (L-D), формулы (VII):
 (VII),
(VII),
или его фармацевтически приемлемая соль, где:
каждый из R1 и R9 независимо отсутствует или выбран из водорода, C1-C6алкильных групп, C1-C6алкилалкоксигрупп, C1-C6алкиламиногрупп, групп C1-C6алкилкарбоновой кислоты, C1-C6алкилгидроксигрупп, C3-C8циклоалкильных групп, бензильных групп, C3-C8гетероциклильных групп, групп -O-C(=O)-(C1-C6алкил) и -CD3;
R2 отсутствует или представляет собой линкер;
R3 выбран из водорода, C1-C6алкильных групп, C1-C6алкилалкоксигрупп, C1-C6алкиламиногрупп, групп C1-C6алкилкарбоновой кислоты, C1-C6алкилгидроксигрупп, C3-C8циклоалкильных групп, бензильных групп, C3-C8гетероциклильных групп и групп -O-C(=O)-(C1-C6алкил);
каждый из R4, R5 и R8 независимо выбран из водорода, гидроксильных групп, групп -O-(C1-C6алкил), групп -O-C(=O)-(C1-C6алкил) и C1-C6алкильных групп;
каждый из R6 и R7 независимо выбран из водорода, -O-R17, -O-C(=O)-R17, -O-C(=O)-NR15R16, C1-C6алкильных групп, -NR15R16 и линкера;
R10 выбран из водорода, C1-C6алкильных групп, групп -C(=O)-(C1-C6алкил) и -CD3;
каждый из R15 и R16 независимо выбран из водорода, R17, -C(=O)-R17 и -C(=O)-O-R17;
R17 выбран из водорода, C1-C6алкильных групп, C3-C8циклоалкильных групп, бензильных групп и C3-C8гетероциклильных групп; и
a составляет 1, 2, 3, 4, 5, 6, 7, 8, 9, или 10;
где каждый из R1, R2, R3, R4, R5, R6, R7, R8, R9, R10, R15, R16, и R17 независимо замещен 0-3 группами, независимо выбранными из атомов галогена, гидроксильных групп, C1-C6алкильных групп, групп -O-(C1-C6алкил), -NR15R16, C3-C8циклоалкильных групп, C1-C6алкилгидроксигрупп, C1-C6алкилалкоксигрупп, бензильных групп и C3-C8гетероциклильных групп;
где по меньшей мере один из R6 и R7 представляет собой водород;
где, если R2 представляет собой линкер, то ни R6, ни R7 не представляют собой линкер, и если R6 или R7 представляют собой линкер, то R2 отсутствует; и
где оба R1 и R9 не могут отсутствовать.
[646] В некоторых вариантах осуществления R1 отсутствует или выбран из водорода, C1-C4алкильных групп, групп C1-C4алкилкарбоновой кислоты и C3-C8циклоалкильных групп. В некоторых вариантах осуществления R1 отсутствует. В некоторых вариантах осуществления R1 представляет собой водород. В некоторых вариантах осуществления R1 представляет собой C1-C4алкильную группу. В некоторых вариантах осуществления R1 представляет собой метил. В некоторых вариантах осуществления R1 представляет собой этил. В некоторых вариантах осуществления R1 представляет собой группу C1-C4алкилкарбоновой кислоты. В некоторых вариантах осуществления R1 представляет собой -CH2CH2CH2CO2H. В некоторых вариантах осуществления R1 представляет собой C3-C8циклоалкильную группу. В некоторых вариантах осуществления R1 представляет собой циклогептил.
[647] В некоторых вариантах осуществления R3 выбран из водорода, C1-C4алкильных групп, C1-C4алкилалкоксигрупп, групп C1-C4алкилкарбоновой кислоты и C1-C4алкилгидроксигрупп. В некоторых вариантах осуществления R3 выбран из водорода и групп C1-C4алкилкарбоновой кислоты. В некоторых вариантах осуществления R3 представляет собой водород. В некоторых вариантах осуществления R3 представляет собой группу C1-C4алкилкарбоновой кислоты. В некоторых вариантах осуществления R3 представляет собой -CH2CH2CO2H.
[648] В некоторых вариантах осуществления R4 выбран из водорода, гидроксильных групп, групп -O-(C1-C4алкил), групп -O-C(=O)-(C1-C4алкил) и C1-C4алкильных групп. В некоторых вариантах осуществления R4 представляет собой водород. В некоторых вариантах осуществления R4 представляет собой гидроксил. В некоторых вариантах осуществления R4 представляет собой группу -O-(C1-C4алкил). В некоторых вариантах осуществления R4 представляет собой -OCH3. В некоторых вариантах осуществления R4 представляет собой -OCH2CH3. В некоторых вариантах осуществления R4 представляет собой группу -O-C(=O)-(C1-C4алкил). В некоторых вариантах осуществления R4 представляет собой -O-C(=O)-CH3. В некоторых вариантах осуществления R4 представляет собой -O-C(=O)-CH2CH3. В некоторых вариантах осуществления R4 представляет собой C1-C4алкильную группу. В некоторых вариантах осуществления R4 представляет собой метил. В некоторых вариантах осуществления R4 представляет собой этил.
[649] В некоторых вариантах осуществления R5 выбран из водорода, гидроксильных групп, групп -O-(C1-C4алкил) и C1-C4алкильных групп. В некоторых вариантах осуществления R5 представляет собой водород. В некоторых вариантах осуществления R5 представляет собой гидроксил. В некоторых вариантах осуществления R5 представляет собой группу -O-(C1-C4алкил). В некоторых вариантах осуществления R5 представляет собой C1-C4алкильную группу.
[650] В некоторых вариантах осуществления R9 отсутствует или выбран из водорода, C1-C4алкильных групп, групп -(C=O)-(C1-C4алкил) и -CD3. В некоторых вариантах осуществления R9 отсутствует. В некоторых вариантах осуществления R9 представляет собой водород. В некоторых вариантах осуществления R9 представляет собой C1-C4алкильную группу. В некоторых вариантах осуществления C1-C4алкильная группа представляет собой метил. В некоторых вариантах осуществления C1-C4алкильных группа представляет собой этил. В некоторых вариантах осуществления R9 представляет собой группу -(C=O)-(C1-C4алкил). В некоторых вариантах осуществления группа -(C=O)-(C1-C4алкил) представляет собой -(C=O)-метил. В некоторых вариантах осуществления R9 представляет собой -CD3.
[651] В некоторых вариантах осуществления R10 выбран из водорода, C1-C4алкильных групп, групп -(C=O)-(C1-C4алкил) и -CD3. В некоторых вариантах осуществления R10 представляет собой водород. В некоторых вариантах осуществления R10 представляет собой C1-C4алкильную группу. В некоторых вариантах осуществления C1-C4алкильная группа представляет собой метил. В некоторых вариантах осуществления C1-C4алкильных группа представляет собой этил. В некоторых вариантах осуществления R10 представляет собой группу -(C=O)-(C1-C4алкил). В некоторых вариантах осуществления группа -(C=O)-(C1-C4алкил) представляет собой -(C=O)-метил. В некоторых вариантах осуществления R10 представляет собой -CD3.
[652] В некоторых вариантах осуществления R2 отсутствует, и R6 представляет собой линкер. В некоторых вариантах осуществления R2 отсутствует, и R7 представляет собой линкер. В некоторых вариантах осуществления R2 представляет собой линкер. В некоторых вариантах осуществления R6 представляет собой водород. В некоторых вариантах осуществления R7 представляет собой водород. В некоторых вариантах осуществления R6 представляет собой водород, и R7 представляет собой -O-R17. В некоторых вариантах осуществления R6 представляет собой водород, и R7 представляет собой -OR17, где R17 выбран из водорода и C1-C4алкильных групп. В некоторых вариантах осуществления R6 представляет собой водород, и R7 представляет собой -O-R17, где R17 представляет собой водород. В некоторых вариантах осуществления R6 представляет собой -O-R17, и R7 представляет собой водород. В некоторых вариантах осуществления R6 представляет собой -O-R17, и R7 представляет собой водород, где R17 выбран из водорода и C1-C4алкильных групп. В некоторых вариантах осуществления R6 представляет собой -O-R17, и R7 представляет собой водород, где R17 представляет собой водород. В некоторых вариантах осуществления R6 представляет собой водород, и R7 представляет собой -NR15R16. В некоторых вариантах осуществления R6 представляет собой водород, и R7 представляет собой -NR15R16, где R15 представляет собой H, и R16 выбран из водорода, R17, -C(=O)-R17 и -C(=O)-O-R17. В некоторых вариантах осуществления R6 представляет собой водород, и R7 представляет собой -NR15R16, где R15 представляет собой H, и R16 выбран из водорода, R17, -C(=O)-R17 и -C(=O)-O-R17, и где R17 выбран из водорода, C1-C6алкильных групп, C3-C8циклоалкильных групп и C3-C8гетероциклильных групп. В некоторых вариантах осуществления R6 представляет собой -O-R17. В некоторых вариантах осуществления R6 представляет собой -O-C(=O)-R17. В некоторых вариантах осуществления R6 представляет собой C1-C6алкил. В некоторых вариантах осуществления R6 представляет собой C1-C4алкил. В некоторых вариантах осуществления R6 представляет собой C1алкил. В некоторых вариантах осуществления R6 представляет собой -NR15R16.
[653] В некоторых вариантах осуществления R7 представляет собой -O-R17. В некоторых вариантах осуществления R7 представляет собой -O-C(=O)-R17. В некоторых вариантах осуществления R7 представляет собой C1-C6алкил. В некоторых вариантах осуществления R7 представляет собой C1-C4алкил. В некоторых вариантах осуществления R7 представляет собой C1алкил. В некоторых вариантах осуществления R7 представляет собой -NR15R16.
[654] В некоторых вариантах осуществления R8 выбран из водорода, гидроксильных групп, групп -O-(C1-C4алкил) и (C1-C4алкил). В некоторых вариантах осуществления R8 представляет собой водород. В некоторых вариантах осуществления R8 представляет собой гидроксильную группу. В некоторых вариантах осуществления R8 представляет собой группу -O-(C1-C4алкил). В некоторых вариантах осуществления R8 представляет собой группу -O-(C1алкил).
[655] В некоторых вариантах осуществления R15 представляет собой водород. В некоторых вариантах осуществления R15 представляет собой R17. В некоторых вариантах осуществления R15 представляет собой -C(=O)-R17. В некоторых вариантах осуществления R15 представляет собой -C(=O)-O-R17.
[656] В некоторых вариантах осуществления R16 представляет собой водород. В некоторых вариантах осуществления R16 представляет собой R17. В некоторых вариантах осуществления R16 представляет собой -C(=O)-R17. В некоторых вариантах осуществления R16 представляет собой -C(=O)-O-R17.
[657] В некоторых вариантах осуществления R17 выбран из водорода, C1-C4алкильных групп, C3-C6циклоалкильных групп и C3-C8гетероциклильных групп. В некоторых вариантах осуществления R17 представляет собой водород. В некоторых вариантах осуществления R17 представляет собой C1-C4алкильную группу. В некоторых вариантах осуществления R17 представляет собой C1алкильную группу. В некоторых вариантах осуществления R17 представляет собой C3-C6циклоалкильную группу. В некоторых вариантах осуществления R17 представляет собой C3циклоалкильную группу. В некоторых вариантах осуществления R17 представляет собой C4циклоалкильную группу. В некоторых вариантах осуществления R17 представляет собой C5циклоалкильную группу. В некоторых вариантах осуществления R17 представляет собой C6циклоалкильную группу. В некоторых вариантах осуществления R17 представляет собой C3-C8гетероциклильную группу. В некоторых вариантах осуществления R17 представляет собой C3гетероциклильную группу. В некоторых вариантах осуществления R17 представляет собой C4гетероциклильную группу. В некоторых вариантах осуществления R17 представляет собой C5гетероциклильную группу. В некоторых вариантах осуществления R17 представляет собой C6гетероциклильную группу. В некоторых вариантах осуществления R17 представляет собой C7гетероциклильную группу. В некоторых вариантах осуществления R17 представляет собой C8гетероциклильную группу.
[658] В некоторых вариантах осуществления a составляет 1, 2, 3, 4, 5, 6, 7, 8, 9, или 10. В некоторых вариантах осуществления a составляет 1, 2, 3, 4, 5 или 6. В некоторых вариантах осуществления a составляет 1, 2, 3, 4 или 5. В некоторых вариантах осуществления a составляет 1, 2, 3 или 4. В некоторых вариантах осуществления a составляет 1, 2 или 3. В некоторых вариантах осуществления a составляет 1 или 2. В некоторых вариантах осуществления a составляет 1. В некоторых вариантах осуществления a составляет 2. В некоторых вариантах осуществления a составляет 3. В некоторых вариантах осуществления a составляет 4. В некоторых вариантах осуществления a составляет 5. В некоторых вариантах осуществления a составляет 6. В некоторых вариантах осуществления a составляет 7. В некоторых вариантах осуществления a составляет 8. В некоторых вариантах осуществления a составляет 9. В некоторых вариантах осуществления a составляет 10.
[659] В некоторых вариантах осуществления R2 представляет собой линкер. В некоторых вариантах осуществления линкер предусматривает по меньшей мере один расщепляемый пептидный фрагмент. В некоторых вариантах осуществления по меньшей мере один расщепляемый пептидный фрагмент расщепляется под действием фермента. В некоторых вариантах осуществления линкер или расщепляемый пептидный фрагмент предусматривают по меньшей мере одно аминокислотное звено. В некоторых вариантах осуществления по меньшей мере одно аминокислотное звено выбрано из аргинина, гистидина, лизина, аспарагиновой кислоты, глутаминовой кислоты, серина, треонина, аспарагина, глутамина, цистеина, селеноцистеина, глицина, пролина, аланина, валина, изолейцина, метионина, фенилаланина, тирозина, триптофана и цитруллина. В некоторых вариантах осуществления по меньшей мере одно аминокислотное звено выбрано из аланина, цитруллина и валина. В некоторых вариантах осуществления линкер предусматривает цитруллин и валин. В некоторых вариантах осуществления линкер предусматривает аланин и валин.
[660] В некоторых вариантах осуществления линкер предусматривает a фрагмент, выбранный из сульфонамида, β-глюкуронида, дисульфида и карбонила. В некоторых вариантах осуществления линкер предусматривает сульфонамид. В некоторых вариантах осуществления линкер предусматривает β-глюкуронид. В некоторых вариантах осуществления линкер предусматривает дисульфид. В некоторых вариантах осуществления линкер предусматривает карбонил.
[661] В некоторых вариантах осуществления линкер предусматривает спейсерное звено. В некоторых вариантах осуществления спейсерное звено выбрано из алкильных групп и полиэтиленгликольных (PEG) фрагментов. В некоторых вариантах осуществления алкильных группа представляет собой C1-C12алкильную группу. В некоторых вариантах осуществления алкильных группа представляет собой C1-C6алкильную группу. В некоторых вариантах осуществления алкильная группа представляет собой метилен. В некоторых вариантах осуществления алкильная группа представляет собой этилен. В некоторых вариантах осуществления алкильная группа представляет собой н-пропилен. В некоторых вариантах осуществления алкильная группа представляет собой н-бутилен. В некоторых вариантах осуществления алкильная группа представляет собой н-пентилен. В некоторых вариантах осуществления алкильная группа представляет собой н-гексилен. В некоторых вариантах осуществления PEG-фрагмент предусматривает -(PEG)m-, где m составляет целое число от 1 до 10. В некоторых вариантах осуществления m составляет 1. В некоторых вариантах осуществления m составляет 2. В некоторых вариантах осуществления m составляет 3. В некоторых вариантах осуществления m составляет 4. В некоторых вариантах осуществления m составляет 5. В некоторых вариантах осуществления m составляет 6.
[662] В некоторых вариантах осуществления линкер предусматривает малеимидный (Mal) фрагмент ("Mal-спейсерное звено"). В некоторых вариантах осуществления линкер предусматривает саморасщепляющееся спейсерное звено. В некоторых вариантах осуществления саморасщепляющееся спейсерное звено выбрано из п-аминобензилоксикарбонила (pABC) и п-аминобензила (pAB).
[663] В некоторых вариантах осуществления линкер предусматривает Mal-спейсерное звено, алкильную группу, по меньшей мере одно аминокислотное звено и саморасщепляющийся спейсер. В некоторых вариантах осуществления по меньшей мере одно аминокислотное звено выбрано из аланина, цитруллина и валина. В некоторых вариантах осуществления по меньшей мере одно аминокислотное звено предусматривает аланин и валин. В некоторых вариантах осуществления по меньшей мере одно аминокислотное звено предусматривает цитруллин и валин. В некоторых вариантах осуществления саморасщепляющийся спейсер выбран из pAB и pABC. В некоторых вариантах осуществления саморасщепляющийся спейсер предусматривает pAB. В некоторых вариантах осуществления саморасщепляющийся спейсер предусматривает pABC. В некоторых вариантах осуществления алкильных группа предусматривает C1-C6алкильную группу.
[664] В некоторых вариантах осуществления линкер предусматривает Mal-спейсерное звено, PEG-фрагмент, по меньшей мере одно аминокислотное звено и саморасщепляющийся спейсер. В некоторых вариантах осуществления по меньшей мере одно аминокислотное звено выбрано из аланина, цитруллина и валина. В некоторых вариантах осуществления по меньшей мере одно аминокислотное звено предусматривает аланин и валин. В некоторых вариантах осуществления по меньшей мере одно аминокислотное звено предусматривает цитруллин и валин. В некоторых вариантах осуществления саморасщепляющийся спейсер выбран из pAB и pABC. В некоторых вариантах осуществления саморасщепляющийся спейсер предусматривает pAB. В некоторых вариантах осуществления саморасщепляющийся спейсер предусматривает pABC. В некоторых вариантах осуществления PEG-фрагмент предусматривает -(PEG)m-, где m составляет целое число от 1 до 6.
[665] В различных других вариантах осуществления соединения, представляющие собой линкер-лекарственное средство (L-D), раскрытые в данном документе, предусматривают структуру линкер-лекарственное средство в соответствии с формулой (IX). В различных вариантах осуществления настоящего изобретения представлено соединение, представляющее собой линкер-лекарственное средство (L-D), формулы (IX):
 (IX),
(IX),
или его фармацевтически приемлемая соль, где:
R1 отсутствует или выбран из водорода, C1-C6алкильных групп, C1-C6алкилалкоксигрупп, C1-C6алкиламиногрупп, групп C1-C6алкилкарбоновой кислоты, C1-C6алкилгидроксигрупп, C3-C8циклоалкильных групп, бензильных групп, C3-C8гетероциклильных групп, групп -O-C(=O)-(C1-C6алкил) и -CD3;
R2 представляет собой линкер;
R3 выбран из водорода, C1-C6алкильных групп, C1-C6алкилалкоксигрупп, C1-C6алкиламиногрупп, групп C1-C6алкилкарбоновой кислоты, C1-C6алкилгидроксигрупп, C3-C8циклоалкильных групп, бензильных групп, C3-C8гетероциклильных групп и групп -O-C(=O)-(C1-C6алкил);
R4 выбран из водорода, гидроксильных групп, групп -O-(C1-C6алкил), групп -O-C(=O)-(C1-C6алкил) и C1-C6алкильных групп;
R10 выбран из 3-10-членных карбоциклов и 3-10-членных гетероциклов, каждый из которых замещен 0-3 Ra, где каждый Ra независимо выбран из атомов галогена, C1-C6алкильных групп, -O-(C1-C6)алкильных групп, C1-C6алкилалкоксигрупп, C1-C6алкилгидроксигрупп, -S(=O)w-(4-7-членные гетероциклы), 4-7-членных карбоциклов и 4-7-членных гетероциклов;
каждый из R15 и R16 независимо выбран из водорода, R17, -C(=O)-R17 и -C(=O)-O-R17; и
R17 выбран из водорода, C1-C6алкильных групп, C3-C8циклоалкильных групп, бензильных групп и C3-C8гетероциклильных групп;
где каждый из R1, R2, R3, R4, R10, R15, R16 и R17 независимо замещен 0-3 группами, независимо выбранными из атомов галогена, гидроксильных групп, C1-C6алкильных групп, групп -O-(C1-C6алкил), -NR15R16, C3-C8циклоалкильных групп, C1-C6алкилгидроксигрупп, C1-C6алкилалкоксигрупп, бензильных групп и C3-C8гетероциклильных групп; и
где каждый Ra независимо замещен 0-3 группами, независимо выбранными из атомов галогена, гидроксильных групп, -NR15R16, C1-C6алкильных групп, групп -(C=O)-(C1-C6алкил), -(C=O)-(C1-C6алкил)-(C3-C10гетероциклильных групп) и групп C1-C6алкилкарбоновой кислоты, каждая из которых замещена 0, 1 или 2 группами, независимо выбранными из атомов галогена, гидроксильных групп, -NR15R16 и C1-C3алкильных групп; и
w составляет 0, 1 или 2.
[666] В некоторых вариантах осуществления R1 отсутствует или выбран из водорода, C1-C4алкильных групп, групп C1-C4алкилкарбоновой кислоты и C3-C8циклоалкильных групп. В некоторых вариантах осуществления R1 отсутствует. В некоторых вариантах осуществления R1 представляет собой водород. В некоторых вариантах осуществления R1 представляет собой C1-C4алкильную группу. В некоторых вариантах осуществления R1 представляет собой метил. В некоторых вариантах осуществления R1 представляет собой этил. В некоторых вариантах осуществления R1 представляет собой группу C1-C4алкилкарбоновой кислоты. В некоторых вариантах осуществления R1 представляет собой -CH2CH2CH2CO2H. В некоторых вариантах осуществления R1 представляет собой C3-C8циклоалкильную группу. В некоторых вариантах осуществления R1 представляет собой циклогептил.
[667] В некоторых вариантах осуществления R3 выбран из водорода, C1-C4алкильных групп, C1-C4алкилалкоксигрупп, групп C1-C4алкилкарбоновой кислоты и C1-C4алкилгидроксигрупп. В некоторых вариантах осуществления R3 выбран из водорода и групп C1-C4алкилкарбоновой кислоты. В некоторых вариантах осуществления R3 представляет собой водород. В некоторых вариантах осуществления R3 представляет собой группу C1-C4алкилкарбоновой кислоты. В некоторых вариантах осуществления R3 представляет собой -CH2CH2CO2H.
[668] В некоторых вариантах осуществления R4 выбран из водорода, гидроксильных групп, групп -O-(C1-C4алкил), групп -O-C(=O)-(C1-C4алкил) и C1-C4алкильных групп. В некоторых вариантах осуществления R4 представляет собой водород. В некоторых вариантах осуществления R4 представляет собой гидроксил. В некоторых вариантах осуществления R4 представляет собой группу -O-(C1-C4алкил). В некоторых вариантах осуществления R4 представляет собой -OCH3. В некоторых вариантах осуществления R4 представляет собой -OCH2CH3. В некоторых вариантах осуществления R4 представляет собой группу -O-C(=O)-(C1-C4алкил). В некоторых вариантах осуществления R4 представляет собой -O-C(=O)-CH3. В некоторых вариантах осуществления R4 представляет собой -O-C(=O)-CH2CH3. В некоторых вариантах осуществления R4 представляет собой C1-C4алкильную группу. В некоторых вариантах осуществления R4 представляет собой метил. В некоторых вариантах осуществления R4 представляет собой этил.
[669] В некоторых вариантах осуществления R10 выбран из 6-9-членных карбоциклов и 6-9-членных гетероциклов, каждый из которых замещен 0-2 Ra, где каждый Ra независимо замещен 0-3 группами, независимо выбранными из атомов галогена, гидроксильных групп, C1-C6алкильных групп, групп -(C=O)-(C1-C6алкил), групп -(C=O)-(C1-C6алкил)-(3-10-членный гетероцикл) и групп C1-C6алкилкарбоновой кислоты.
[670] В некоторых вариантах осуществления карбоцикл представляет собой фенил, замещенный 0-2 Ra, где каждый Ra независимо замещен 0-3 группами, независимо выбранными из атомов галогена, гидроксильных групп, C1-C6алкильных групп, групп -(C=O)-(C1-C6алкил), групп -(C=O)-(C1-C6алкил)-(3-10-членный гетероцикл) и групп C1-C6алкилкарбоновой кислоты. В некоторых вариантах осуществления фенил замещен 2 Ra, где каждый Ra независимо замещен 0-3 группами, независимо выбранными из атомов галогена, гидроксильных групп, C1-C6алкильных групп, групп -(C=O)-(C1-C6алкил), групп -(C=O)-(C1-C6алкил)-(3-10 членный гетероцикл) и групп C1-C6алкилкарбоновой кислоты. В некоторых вариантах осуществления фенил представляет собой  .
.
[671] В некоторых вариантах осуществления гетероцикл представляет собой 9-членный гетероцикл, замещенный 0-2 Ra, где каждый Ra независимо замещен 0-3 группами, независимо выбранными из атомов галогена, гидроксильных групп, C1-C6алкильных групп, групп -(C=O)-(C1-C6алкил), групп -(C=O)-(C1-C6алкил)-(3-10-членный гетероцикл) и групп C1-C6алкилкарбоновой кислоты. В некоторых вариантах осуществления 9-членный гетероцикл представляет собой  .
.
[672] В некоторых вариантах осуществления Ra выбран из атомов галогена, 3-10-членных карбоциклов и 3-10-членных гетероциклов, где каждый Ra независимо замещен 0-3 группами, независимо выбранными из атомов галогена, гидроксильных групп, C1-C6алкильных групп, групп -(C=O)-(C1-C6алкил), групп -(C=O)-(C1-C6алкил)-(3-10-членный гетероцикл) и групп C1-C6алкилкарбоновой кислоты. В некоторых вариантах осуществления Ra выбран из атомов галогена,  ,
,  ,
,  и
и  .
.
[673] В некоторых вариантах осуществления R15 представляет собой водород. В некоторых вариантах осуществления R15 представляет собой R17. В некоторых вариантах осуществления R15 представляет собой -C(=O)-R17. В некоторых вариантах осуществления R15 представляет собой -C(=O)-O-R17.
[674] В некоторых вариантах осуществления R16 представляет собой водород. В некоторых вариантах осуществления R16 представляет собой R17. В некоторых вариантах осуществления R16 представляет собой -C(=O)-R17. В некоторых вариантах осуществления R16 представляет собой -C(=O)-O-R17.
[675] В некоторых вариантах осуществления R17 выбран из водорода, C1-C4алкильных групп, C3-C6циклоалкильных групп и C3-C8гетероциклильных групп. В некоторых вариантах осуществления R17 представляет собой водород. В некоторых вариантах осуществления R17 представляет собой C1-C4алкильную группу. В некоторых вариантах осуществления R17 представляет собой C1алкильную группу. В некоторых вариантах осуществления R17 представляет собой C3-C6циклоалкильную группу. В некоторых вариантах осуществления R17 представляет собой C3циклоалкильную группу. В некоторых вариантах осуществления R17 представляет собой C4циклоалкильную группу. В некоторых вариантах осуществления R17 представляет собой C5циклоалкильную группу. В некоторых вариантах осуществления R17 представляет собой C6циклоалкильную группу. В некоторых вариантах осуществления R17 представляет собой C3-C8гетероциклильную группу. В некоторых вариантах осуществления R17 представляет собой C3гетероциклильную группу. В некоторых вариантах осуществления R17 представляет собой C4гетероциклильную группу. В некоторых вариантах осуществления R17 представляет собой C5гетероциклильную группу. В некоторых вариантах осуществления R17 представляет собой C6гетероциклильную группу. В некоторых вариантах осуществления R17 представляет собой C7гетероциклильную группу. В некоторых вариантах осуществления R17 представляет собой C8гетероциклильную группу.
[676] В некоторых вариантах осуществления R2 представляет собой линкер. В некоторых вариантах осуществления линкер предусматривает по меньшей мере один расщепляемый пептидный фрагмент. В некоторых вариантах осуществления по меньшей мере один расщепляемый пептидный фрагмент расщепляется под действием фермента. В некоторых вариантах осуществления линкер или расщепляемый пептидный фрагмент предусматривают по меньшей мере одно аминокислотное звено. В некоторых вариантах осуществления по меньшей мере одно аминокислотное звено выбрано из аргинина, гистидина, лизина, аспарагиновой кислоты, глутаминовой кислоты, серина, треонина, аспарагина, глутамина, цистеина, селеноцистеина, глицина, пролина, аланина, валина, изолейцина, метионина, фенилаланина, тирозина, триптофана и цитруллина. В некоторых вариантах осуществления по меньшей мере одно аминокислотное звено выбрано из аланина, цитруллина и валина. В некоторых вариантах осуществления линкер предусматривает цитруллин и валин. В некоторых вариантах осуществления линкер предусматривает аланин и валин.
[677] В некоторых вариантах осуществления линкер предусматривает a фрагмент, выбранный из сульфонамида, β-глюкуронида, дисульфида и карбонила. В некоторых вариантах осуществления линкер предусматривает сульфонамид. В некоторых вариантах осуществления линкер предусматривает β-глюкуронид. В некоторых вариантах осуществления линкер предусматривает дисульфид. В некоторых вариантах осуществления линкер предусматривает карбонил.
[678] В некоторых вариантах осуществления линкер предусматривает спейсерное звено. В некоторых вариантах осуществления спейсерное звено выбрано из алкильных групп и полиэтиленгликольных (PEG) фрагментов. В некоторых вариантах осуществления алкильных группа представляет собой C1-C12алкильную группу. В некоторых вариантах осуществления алкильных группа представляет собой C1-C6алкильную группу. В некоторых вариантах осуществления алкильная группа представляет собой метилен. В некоторых вариантах осуществления алкильная группа представляет собой этилен. В некоторых вариантах осуществления алкильная группа представляет собой н-пропилен. В некоторых вариантах осуществления алкильная группа представляет собой н-бутилен. В некоторых вариантах осуществления алкильная группа представляет собой н-пентилен. В некоторых вариантах осуществления алкильная группа представляет собой н-гексилен. В некоторых вариантах осуществления PEG-фрагмент предусматривает -(PEG)m-, где m составляет целое число от 1 до 10. В некоторых вариантах осуществления m составляет 1. В некоторых вариантах осуществления m составляет 2. В некоторых вариантах осуществления m составляет 3. В некоторых вариантах осуществления m составляет 4. В некоторых вариантах осуществления m составляет 5. В некоторых вариантах осуществления m составляет 6.
[679] В некоторых вариантах осуществления линкер предусматривает малеимидный (Mal) фрагмент ("Mal-спейсерное звено"). В некоторых вариантах осуществления линкер предусматривает саморасщепляющееся спейсерное звено. В некоторых вариантах осуществления саморасщепляющееся спейсерное звено выбрано из п-аминобензилоксикарбонила (pABC) и п-аминобензила (pAB).
[680] В некоторых вариантах осуществления линкер предусматривает Mal-спейсерное звено, алкильную группу, по меньшей мере одно аминокислотное звено и саморасщепляющийся спейсер. В некоторых вариантах осуществления по меньшей мере одно аминокислотное звено выбрано из аланина, цитруллина и валина. В некоторых вариантах осуществления по меньшей мере одно аминокислотное звено предусматривает аланин и валин. В некоторых вариантах осуществления по меньшей мере одно аминокислотное звено предусматривает цитруллин и валин. В некоторых вариантах осуществления саморасщепляющийся спейсер выбран из pAB и pABC. В некоторых вариантах осуществления саморасщепляющийся спейсер предусматривает pAB. В некоторых вариантах осуществления саморасщепляющийся спейсер предусматривает pABC. В некоторых вариантах осуществления алкильных группа предусматривает C1-C6алкильную группу.
[681] В некоторых вариантах осуществления линкер предусматривает Mal-спейсерное звено, PEG-фрагмент, по меньшей мере одно аминокислотное звено и саморасщепляющийся спейсер. В некоторых вариантах осуществления по меньшей мере одно аминокислотное звено выбрано из аланина, цитруллина и валина. В некоторых вариантах осуществления по меньшей мере одно аминокислотное звено предусматривает аланин и валин. В некоторых вариантах осуществления по меньшей мере одно аминокислотное звено предусматривает цитруллин и валин. В некоторых вариантах осуществления саморасщепляющийся спейсер выбран из pAB и pABC. В некоторых вариантах осуществления саморасщепляющийся спейсер предусматривает pAB. В некоторых вариантах осуществления саморасщепляющийся спейсер предусматривает pABC. В некоторых вариантах осуществления PEG-фрагмент предусматривает -(PEG)m-, где m составляет целое число от 1 до 6.
[682] В некоторых вариантах осуществления фрагмент-лекарственное средство представляет собой модулятор сплайсинга выбранный из D1, D2, D3, D4,D4', D5, D6, D7, D8, D9, D10, D11, D12, D13, D14, D15, D16, D17, D18, D19, D20, D21, D22, D23, D24, D25, D26, D27, D28, D29, D30, D31, D32, D33, D34, и D35.
[683] В различных вариантах осуществления фрагмент-лекарственное средство представляет собой модулятор сплайсинга, выбранный из D2 и D1.
[684] В различных вариантах осуществления фрагмент-лекарственное средство представляет собой D2. В различных вариантах осуществления структура фрагмента-лекарственного средства D2, применяемого в раскрытых соединениях, представляющих собой линкер-лекарственное средство (L-D), показана ниже:

D2.
[685] В различных вариантах осуществления линкер в соединениях, представляющих собой линкер-лекарственное средство (L-D), описанных в данном документе, ковалентно прикрепляется к фрагменту-лекарственному средству D2 через амин на пиперазиновой группе. В различных вариантах осуществления фрагмент-лекарственное средство представляет собой производное D2. В различных вариантах осуществления производное D2 сохраняет по меньшей мере одну биологическую функцию или активность D2 (например, связывание комплекса SF3b, активность сплайсинга in vitro, цитотоксичность), но имеет измененную химическую структуру.
[686] В различных вариантах осуществления фрагмент-лекарственное средство представляет собой D1. В различных вариантах осуществления структура фрагмента-лекарственного средства D1, применяемого в раскрытых соединениях, представляющих собой линкер-лекарственное средство (L-D), показана ниже:

D1.
[687] В различных вариантах осуществления линкер в соединениях, представляющих собой линкер-лекарственное средство (L-D), описанных в данном документе, ковалентно прикрепляется к фрагменту-лекарственному средству D1 через амин на пиперазиновой группе. В различных вариантах осуществления фрагмент-лекарственное средство представляет собой производное D1. В различных вариантах осуществления производное D1 сохраняет по меньшей мере одну биологическую функцию или активность D1 (например, связывание комплекса SF3b, активность сплайсинга in vitro, цитотоксичность), но имеет измененную химическую структуру.
[688] Также в данном документе раскрыты иллюстративные соединения на основе лекарственного средства, представляющего собой модулятор сплайсинга, для применения их самих по себе или в качестве фрагментов-лекарственных средств в ADC, раскрытых в данном документе. В различных вариантах осуществления настоящего изобретения дополнительно представлены композиции, содержащие множественные копии таких соединений, например, фармацевтические композиции, содержащие соединение на основе лекарственного средства, представляющего собой модулятор сплайсинга, и фармацевтически приемлемый носитель.
[689] В различных вариантах осуществления настоящего изобретение представлено соединение, выбранное из соединения формулы
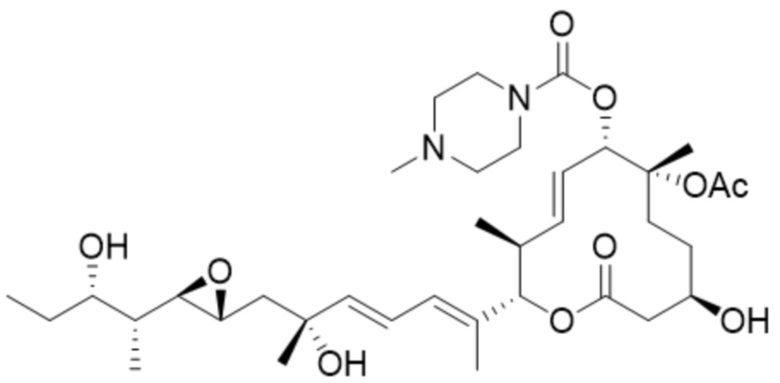 (D4)
(D4)
и его фармацевтически приемлемых солей. В различных вариантах осуществления настоящего изобретения дополнительно представлена фармацевтическая композиция, содержащая соединение или его фармацевтически приемлемую соль и фармацевтически приемлемый носитель.
[690] В различных других вариантах осуществления настоящего изобретение представлено соединение, выбранное из соединения формулы
 (D8)
(D8)
и его фармацевтически приемлемых солей. В различных вариантах осуществления настоящего изобретения дополнительно представлена фармацевтическая композиция, содержащая соединение или его фармацевтически приемлемую соль и фармацевтически приемлемый носитель.
[691] В различных других вариантах осуществления настоящего изобретение представлено соединение, выбранное из соединения формулы
 (D9)
(D9)
и его фармацевтически приемлемых солей. В различных вариантах осуществления настоящего изобретения дополнительно представлена фармацевтическая композиция, содержащая соединение или его фармацевтически приемлемую соль и фармацевтически приемлемый носитель.
[692] В различных других вариантах осуществления настоящего изобретение представлено соединение, выбранное из соединения формулы
 (D10)
(D10)
и его фармацевтически приемлемых солей. В различных вариантах осуществления настоящего изобретения дополнительно представлена фармацевтическая композиция, содержащая соединение или его фармацевтически приемлемую соль и фармацевтически приемлемый носитель.
[693] В различных других вариантах осуществления настоящего изобретение представлено соединение, выбранное из соединения формулы
 (D13)
(D13)
и его фармацевтически приемлемых солей. В различных вариантах осуществления настоящего изобретения дополнительно представлена фармацевтическая композиция, содержащая соединение или его фармацевтически приемлемую соль и фармацевтически приемлемый носитель.
[694] В различных других вариантах осуществления настоящего изобретение представлено соединение, выбранное из соединения формулы
 (D18)
(D18)
и его фармацевтически приемлемых солей. В различных вариантах осуществления настоящего изобретения дополнительно представлена фармацевтическая композиция, содержащая соединение или его фармацевтически приемлемую соль и фармацевтически приемлемый носитель.
[695] В различных других вариантах осуществления настоящего изобретение представлено соединение, выбранное из соединения формулы
 (D19)
(D19)
и его фармацевтически приемлемых солей. В различных вариантах осуществления настоящего изобретения дополнительно представлена фармацевтическая композиция, содержащая соединение или его фармацевтически приемлемую соль и фармацевтически приемлемый носитель.
[696] В различных других вариантах осуществления настоящего изобретение представлено соединение, выбранное из соединения формулы
 (D20)
(D20)
и его фармацевтически приемлемых солей. В различных вариантах осуществления настоящего изобретения дополнительно представлена фармацевтическая композиция, содержащая соединение или его фармацевтически приемлемую соль и фармацевтически приемлемый носитель.
[697] В различных других вариантах осуществления настоящего изобретение представлено соединение, выбранное из соединения формулы
 (D21)
(D21)
и его фармацевтически приемлемых солей. В различных вариантах осуществления настоящего изобретения дополнительно представлена фармацевтическая композиция, содержащая соединение или его фармацевтически приемлемую соль и фармацевтически приемлемый носитель.
[698] В различных других вариантах осуществления настоящего изобретение представлено соединение, выбранное из соединения формулы
 (D22)
(D22)
и его фармацевтически приемлемых солей. В различных вариантах осуществления настоящего изобретения дополнительно представлена фармацевтическая композиция, содержащая соединение или его фармацевтически приемлемую соль и фармацевтически приемлемый носитель.
[699] В различных других вариантах осуществления настоящего изобретение представлено соединение, выбранное из соединения формулы
 (D25)
(D25)
и его фармацевтически приемлемых солей. В различных вариантах осуществления настоящего изобретения дополнительно представлена фармацевтическая композиция, содержащая соединение или его фармацевтически приемлемую соль и фармацевтически приемлемый носитель.
[700] В различных других вариантах осуществления настоящего изобретение представлено соединение, выбранное из соединения формулы
 (D33)
(D33)
и его фармацевтически приемлемых солей. В различных вариантах осуществления настоящего изобретения дополнительно представлена фармацевтическая композиция, содержащая соединение или его фармацевтически приемлемую соль и фармацевтически приемлемый носитель.
Биоконъюгация
[701] В некоторых вариантах осуществления соединение, представляющее собой линкер-лекарственное средство, может быть конъюгировано с антителом или антигенсвязывающим фрагментом в соответствии с иллюстративной схемой, изображенной на фиг. 26. Если вкратце, то в некоторых вариантах осуществления антитело или антигенсвязывающий фрагмент можно обработать реагентом, например восстанавливающим средством, например трис(2-карбоксиэтил)фосфином, для активации антитела или антигенсвязывающего фрагмента за счет восстановления одной или нескольких дисульфидных связей. В некоторых вариантах осуществления активированные антитело или антигенсвязывающий фрагмент затем подвергают обработке с использованием соединения, представляющего собой линкер-лекарственное средство, с предварительно определенной стехиометрией. В дальнейшем в некоторых вариантах осуществления смесь затем подвергают очистке посредством определенной методики, например, с использованием эксклюзионной смолы или ультрафильтрации, с получением требуемого конъюгата антитела и лекарственного средства.
[702] В некоторых вариантах осуществления в данном документе представлен конъюгат антитела и лекарственного средства, имеющий структуру
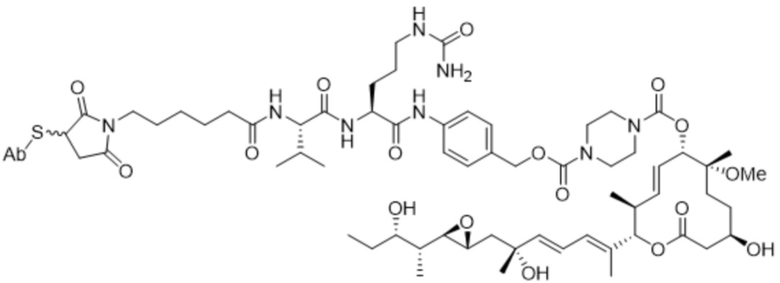 (Ab-ADL1-D1),
(Ab-ADL1-D1),
где Ab представляет собой антитело или антигенсвязывающий фрагмент, ковалентно связанные с малеимидной группой соединения (ADL1-D1), представляющего собой линкер-лекарственное средство, посредством атома серы тиольной группы на антителе или антигенсвязывающем фрагменте.
[703] В некоторых вариантах осуществления в данном документе представлен конъюгат антитела и лекарственного средства, имеющий структуру
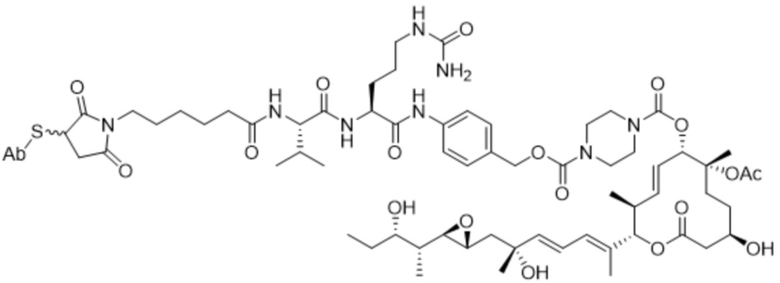 (Ab-ADL1-D4),
(Ab-ADL1-D4),
где Ab представляет собой антитело или антигенсвязывающий фрагмент, ковалентно связанные с малеимидной группой соединения (ADL1-D4), представляющего собой линкер-лекарственное средство, посредством атома серы тиольной группы на антителе или антигенсвязывающем фрагменте.
[704] В некоторых вариантах осуществления в данном документе представлен конъюгат антитела и лекарственного средства, имеющий структуру
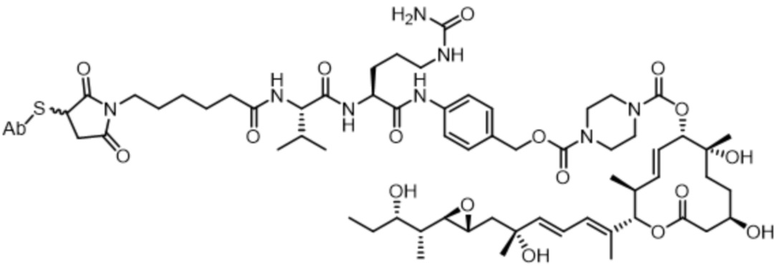 (Ab-ADL1-D12),
(Ab-ADL1-D12),
где Ab представляет собой антитело или антигенсвязывающий фрагмент, ковалентно связанные с малеимидной группой соединения (ADL1-D12), представляющего собой линкер-лекарственное средство, посредством атома серы тиольной группы на антителе или антигенсвязывающем фрагменте.
[705] В некоторых вариантах осуществления в данном документе представлен конъюгат антитела и лекарственного средства, имеющий структуру
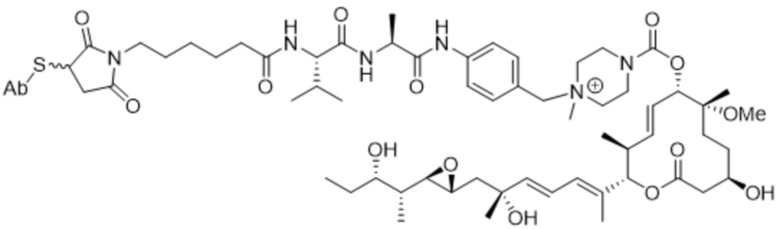 (Ab-ADL5-D2),
(Ab-ADL5-D2),
где Ab представляет собой антитело или антигенсвязывающий фрагмент, ковалентно связанные с малеимидной группой соединения (ADL5-D2), представляющего собой линкер-лекарственное средство, посредством атома серы тиольной группы на антителе или антигенсвязывающем фрагменте.
[706] В некоторых вариантах осуществления в данном документе представлен конъюгат антитела и лекарственного средства, имеющий структуру
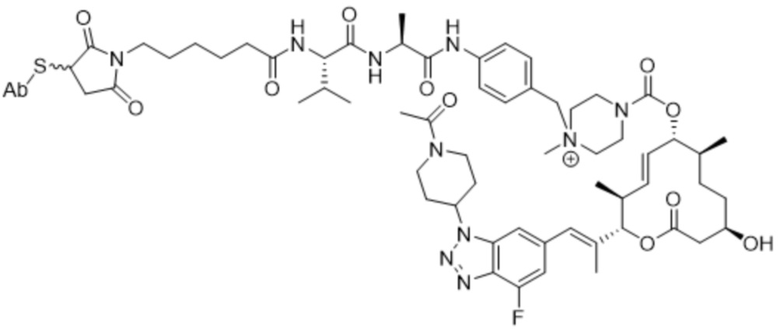 (Ab-ADL5-D15),
(Ab-ADL5-D15),
где Ab представляет собой антитело или антигенсвязывающий фрагмент, ковалентно связанные с малеимидной группой соединения (ADL5-D15), представляющего собой линкер-лекарственное средство, посредством атома серы тиольной группы на антителе или антигенсвязывающем фрагменте.
[707] В некоторых вариантах осуществления в данном документе представлен конъюгат антитела и лекарственного средства, имеющий структуру
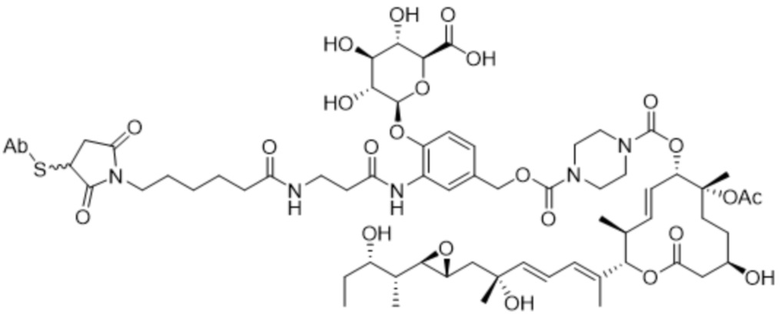 (Ab-ADL13-D4),
(Ab-ADL13-D4),
где Ab представляет собой антитело или антигенсвязывающий фрагмент, ковалентно связанные с малеимидной группой соединения (ADL13-D4), представляющего собой линкер-лекарственное средство, посредством атома серы тиольной группы на антителе или антигенсвязывающем фрагменте.
[708] В некоторых вариантах осуществления Ab представляют собой антитело к HER2 или его антигенсвязывающий фрагмент. В некоторых вариантах осуществления Ab связывается с HER2 и целенаправленно воздействует на неопластические клетки, экспрессирующие HER2 (т. е. ADC целенаправленно воздействует на неопластические клетки, экспрессирующие HER2). В некоторых вариантах осуществления Ab представляет собой интернализующееся антитело к HER2 или его интернализующийся антигенсвязывающий фрагмент.
[709] В некоторых вариантах осуществления антитело к HER2 или антигенсвязывающий фрагмент содержат три определяющие комплементарность области тяжелой цепи (HCDR1, HCDR2 и HCDR3), содержащие аминокислотные последовательности под SEQ ID NO:1 (HCDR1), SEQ ID NO:2 (HCDR2) и SEQ ID NO:3 (HCDR3); и три определяющие комплементарность области легкой цепи (LCDR1, LCDR2 и LCDR3), содержащие аминокислотные последовательности под SEQ ID NO:4 (LCDR1), SEQ ID NO:5 (LCDR2) и SEQ ID NO:6 (LCDR3). В некоторых вариантах осуществления антитело к HER2 или антигенсвязывающий фрагмент представляют собой интернализующееся антитело или интернализующийся антигенсвязывающий фрагмент. В некоторых вариантах осуществления антитело к HER2 или антигенсвязывающий фрагмент содержат каркасные последовательности человека. В некоторых вариантах осуществления антитело к HER2 или антигенсвязывающий фрагмент содержат вариабельную область тяжелой цепи, содержащую аминокислотную последовательность под SEQ ID NO:19, и вариабельную область легкой цепи, содержащую аминокислотную последовательность под SEQ ID NO:20. В некоторых вариантах осуществления антитело к HER2 или антигенсвязывающий фрагмент содержат константную область тяжелой цепи IgG1 человека. В некоторых вариантах осуществления антитело к HER2 или антигенсвязывающий фрагмент содержат константную область легкой каппа-цепи Ig человека.
Нагрузка лекарственным средством
[710] Нагрузка лекарственным средством выражается в виде p, и в данном документе она также упоминается как соотношение лекарственного средства и антитела (DAR). Нагрузка лекарственным средством может находится в диапазоне от 1 до 10 фрагментов лекарственного средства на антитело или антигенсвязывающий фрагмент. В некоторых вариантах осуществления p представляет собой целое число от 1 до 10. В некоторых вариантах осуществления p представляет собой целое число от 1 до 10, от 1 до 9, от 1 до 8, от 1 до 7, от 1 до 6, от 1 до 5, от 1 до 4, от 1 до 3 или от 1 до 2. В некоторых вариантах осуществления p представляет собой целое число от 2 до 10, от 2 до 9, от 2 до 8, от 2 до 7, от 2 до 6, от 2 до 5, от 2 до 4 или от 2 до 3. В некоторых вариантах осуществления p представляет собой целое число от 1 до 8. В некоторых вариантах осуществления p представляет собой целое число от 2 до 4. В других вариантах осуществления p представляет собой целое число от 4 до 8. В других вариантах осуществления p равняется 1, 2, 3, 4, 5, 6, 7 или 8, предпочтительно 4 или 8.
[711] Нагрузка лекарственным средством может быть ограничена числом сайтов прикрепления на антителе или антигенсвязывающем фрагменте. В некоторых вариантах осуществления линкерный фрагмент (L) ADC прикрепляется к антителу или антигенсвязывающему фрагменту посредством химически активной группы на одном или нескольких аминокислотных остатков на антителе или антигенсвязывающем фрагменте. Например, линкер может быть прикреплен к антителу или антигенсвязывающему фрагменту через свободную амино-, имино-, гидроксильную, тиольную или карбоксильную группу (например, к N- или C-концу, эпсилон-аминогруппе одного или нескольких остатков лизина, к свободной карбоксильной группе одного или нескольких остатков глутаминовой кислоты или аспарагиновой кислоты или к сульфгидрильной группе одного или нескольких остатков цистеина). Сайт, к которому прикрепляется линкер, может представлять собой природный остаток в аминокислотной последовательности антитела или антигенсвязывающего фрагмента, или его можно встраивать в антитело или антигенсвязывающий фрагмент, например, посредством технологии рекомбинантных ДНК (например, путем введения остатка цистеина в аминокислотную последовательность) или посредством изменения биохимических свойств белка (например, путем восстановления, изменения показателя pH или гидролиза).
[712] В некоторых вариантах осуществления число фрагментов-лекарственных средств, которое может быть конъюгировано с антителом или антигенсвязывающим фрагментом, ограничено числом остатков цистеина. Например, в том случае, если прикрепление осуществляется за счет тиольной группы цистеинового остатка, антитело может содержать лишь одну или несколько тиольных групп цистеиновых остатков или может содержать одну или несколько в достаточной степени реакционно-способных тиольных групп, посредством которых может быть прикреплен линкер. Обычно антитела не содержат много свободных и реакционно-способных тиольных групп цистеиновых остатков, которые могут быть связаны с фрагментом-лекарственным средством. В действительности, большинство тиольных групп цистеиновых остатков в антителе вовлечены в образование или межцепочечной, или внутрицепочечной дисульфидных связей. Следовательно, в некоторых вариантах осуществления конъюгация с цистеинами может потребовать по меньшей мере частичного восстановления антитела. Избыточное прикрепление линкера-токсина к антителу может дестабилизировать антитело за счет восстановления доступных остатков цистеина с образованием дисульфидных связей. Следовательно, оптимальное соотношение лекарственное средство:антитело должно увеличивать активность ADC (за счет увеличения числа прикрепляемых фрагментов-лекарственных средств на антитело) без дестабилизации антитела или антигенсвязывающего фрагмента. В некоторых вариантах осуществления оптимальное соотношение может составлять 2, 4, 6 или 8.
[713] В некоторых вариантах осуществления антитело или антигенсвязывающий фрагмент подвергают воздействию восстанавливающих условий перед конъюгацией с целью образования одного или нескольких свободных остатков цистеина. В некоторых вариантах осуществления антитело может быть подвергнуто восстановлению посредством восстанавливающего средства, такого как дитиотреитол (DTT) или трис(2-карбоксиэтил)фосфин (TCEP), в условиях частичного или полного восстановления с образованием реакционно-способных тиольных групп цистеина. Неспаренные цистеины могут быть получены посредством частичного восстановления с ограниченными молярными эквивалентами TCEP, который может восстанавливать внутрицепочечные дисульфидные связи, которые соединяют легкую цепь и тяжелую цепь (одна пара на спаривание H-L) и две тяжелые цепи в шарнирной области (две пары на спаривание H-H в случае IgG1 человека), при этом внутрицепочечные дисульфидные связи остаются нетронутыми (Stefano et al. (2013) Methods Mol Biol. 1045:145-71). В одном варианте осуществления дисульфидные связи в антителе восстанавливают электрохимическим способом, например, посредством использования рабочего электрода, который прикладывает восстанавливающее и окисляющее электрическое напряжение. Данный подход может обеспечивать возможность последовательного объединения восстановления дисульфидной связи с аналитическим устройством (например, электрохимическим детектором, ЯМР-спектрометром или масс-спектрометром), или устройством для химического разделения (например, жидкостным хроматографом (например, HPLC), или устройством для электрофореза (см., например, публикацию заявки на патент США № 20140069822)). В некоторых вариантах осуществления антитело подвергают воздействию денатурирующих условий для выявления реакционно-способных нуклеофильных групп на остатках аминокислот, таких как цистеин.
[714] Нагрузку лекарственным средством ADC можно контролировать разными способами, например, посредством: (i) ограничения молярного избытка промежуточного соединения, представляющего собой лекарственное средство-линкер, или реагента, представляющего собой линкер, относительно антитела; (ii) ограничения времени реакции конъюгации или температуры; (iii) частичных или ограничивающих восстановительных условий для модификации тиольных групп цистеина; и/или (iv) конструирования посредством рекомбинантных методик аминокислотной последовательности антитела так, чтобы число и положение остатков цистеина подвергалось модификации для контроля количества и/или положения сайтов прикрепления для линкера-лекарственного средства.
[715] В некоторых вариантах осуществления свободные остатки цистеина вводят в аминокислотную последовательность антитела или антигенсвязывающего фрагмента. Например, могут быть получены антитела, модифицированные цистеином, где одна или несколько аминокислот в родительском антителе заменены аминокислотой цистеином. Любая форма антитела может быть таким образом сконструирована, то есть мутирована. Например, Fab-фрагмент родительского антитела может быть сконструирован с получением Fab, модифицированного цистеином, называемого как "ThioFab." Аналогично родительское моноклональное антитело может быть сконструировано с получением "ThioMab." Мутация в одном сайте дает один модифицированный остаток цистеина в ThioFab, тогда как мутация в одном сайте дает два модифицированных остатка цистеина в ThioMab вследствие димерной природы антитела IgG. ДНК, кодирующая вариант аминокислотной последовательности родительского полипептида, может быть получена посредством множества способов, известных из уровня техники (см., например, способы, описанные в международной публикации № WO 2006/034488). Такие способы включают без ограничения, получение посредством сайт-направленного (или олигонуклеотид-опосредованного) мутагенеза, ПЦР-мутагенеза и кассетного мутагенеза предварительно полученной ДНК, кодирующей полипептид. Варианты рекомбинантных антител также могут быть сконструированы посредством манипуляции с рестриктазами или посредством ПЦР с перекрывающимися праймеры с использованием синтетических олигонуклеотидов. ADC формулы (I) включают без ограничения антитела, которые имеют 1, 2, 3 или 4 модифицированные аминокислоты цистеин (Lyon et al. (2012) Methods Enzymol. 502:123-38). В некоторых вариантах осуществления один или несколько свободных цистеиновых остатков уже присутствуют в антителе или антигенсвязывающем фрагменте без использования генной инженерии, в этом случае существующие цистеиновые остатки могут использоваться для конъюгации антитела или антигенсвязывающего фрагмента с фрагментом-лекарственным средством.
[716] При этом более одной нуклеофильной группы вступают в реакцию с промежуточным соединением, представляющим собой лекарственное средство-линкер, или реагентом, представляющим собой линкерный фрагмент, а затем с реагентом, представляющим собой фрагмент-лекарственное средство, в реакционной смеси, содержащей множество копий антитела или антигенсвязывающего фрагмента и линкерного фрагмента, затем полученный продукт может представлять собой смесь соединений ADC с распределением одного или нескольких фрагментов-лекарственных средств, прикрепленных к каждой копии антитела или антигенсвязывающего фрагмента в смеси. В некоторых вариантах осуществления нагрузка лекарственным средством в смеси ADC, полученная в результате реакции конъюгации, находится в диапазоне от 1 до 10 фрагментов-лекарственных средств, прикрепленных на антитело или антигенсвязывающий фрагмент. Среднее число фрагментов-лекарственных средств на антитело или антигенсвязывающий фрагмент (т. е. средняя нагрузка лекарственным средством или среднее p) можно рассчитать посредством любого общепринятого способа, известного в данной области техники, например, посредством масс-спектрометрии (например, обращенно-фазной LC-MS), и/или высокоэффективной жидкостной хроматографии (например, HIC-HPLC). В некоторых вариантах осуществления среднее число фрагментов-лекарственных средств на антитело или антигенсвязывающий фрагмент определяют посредством хроматографии с гидрофобным взаимодействием-высокоэффективной жидкостной хроматографии (HIC-HPLC). В некоторых вариантах осуществления среднее число фрагментов-лекарственных средств на антитело или антигенсвязывающий фрагмент определяют посредством обращенно-фазной жидкостной хроматографии-масс-спектрометрии (LC-MS). В некоторых вариантах осуществления среднее число фрагментов-лекарственных средств на антитело или антигенсвязывающий фрагмент составляет от приблизительно 1,5 до приблизительно 3,5, от приблизительно 2,5 до приблизительно 4,5, от приблизительно 3,5 до приблизительно 5,5, от приблизительно 4,5 до приблизительно 6,5, от приблизительно 5,5 до приблизительно 7,5, от приблизительно 6,5 до приблизительно 8,5 или от приблизительно 7,5 до приблизительно 9,5. В некоторых вариантах осуществления среднее число фрагментов-лекарственных средств на антитело или антигенсвязывающий фрагмент составляет от приблизительно 2 до приблизительно 4, от приблизительно 3 до приблизительно 5, от приблизительно 4 до приблизительно 6, от приблизительно 5 до приблизительно 7, от приблизительно 6 до приблизительно 8, от приблизительно 7 до приблизительно 9, от приблизительно 2 до приблизительно 8 или от приблизительно 4 до приблизительно 8.
[717] В некоторых вариантах осуществления среднее число фрагментов-лекарственных средств на антитело или антигенсвязывающий фрагмент равняется приблизительно 2. В некоторых вариантах осуществления среднее число фрагментов-лекарственных средств на антитело или антигенсвязывающий фрагмент составляет приблизительно 1,5, приблизительно 1,6, приблизительно 1,7, приблизительно 1,8, приблизительно 1,9, приблизительно 2, приблизительно 2,1, приблизительно 2,2, приблизительно 2,3, приблизительно 2,4 или приблизительно 2,5. В некоторых вариантах осуществления среднее число фрагментов-лекарственных средств на антитело или антигенсвязывающий фрагмент равняется 2.
[718] В некоторых вариантах осуществления среднее число фрагментов-лекарственных средств на антитело или антигенсвязывающий фрагмент равняется приблизительно 4. В некоторых вариантах осуществления среднее число фрагментов-лекарственных средств на антитело или антигенсвязывающий фрагмент составляет приблизительно 3,5, приблизительно 3,6, приблизительно 3,7, приблизительно 3,8, приблизительно 3,9, приблизительно 4, приблизительно 4,1, приблизительно 4,2, приблизительно 4,3, приблизительно 4,4 или приблизительно 4,5. В некоторых вариантах осуществления среднее число фрагментов-лекарственных средств на антитело или антигенсвязывающий фрагмент равняется 4.
[719] В некоторых вариантах осуществления среднее число фрагментов-лекарственных средств на антитело или антигенсвязывающий фрагмент равняется приблизительно 8. В некоторых вариантах осуществления среднее число фрагментов-лекарственных средств на антитело или антигенсвязывающий фрагмент составляет приблизительно 7,5, приблизительно 7,6, приблизительно 7,7, приблизительно 7,8, приблизительно 7,9, приблизительно 8, приблизительно 8,1, приблизительно 8,2, приблизительно 8,3, приблизительно 8,4 или приблизительно 8,5. В некоторых вариантах осуществления среднее число фрагментов-лекарственных средств на антитело или антигенсвязывающий фрагмент равняется 8.
[720] В различных вариантах осуществления выражение "приблизительно," используемое по отношению к среднему числу фрагментов-лекарственных средств на антитело или антигенсвязывающий фрагмент, означает плюс или минус 10%.
[721] Отдельные соединения ADC или "молекулы" могут быть идентифицированы в смеси посредством масс-спектрометрии и разделены посредством UPLC или HPLC, например хроматографии с гидрофобным взаимодействием (HIC-HPLC). В некоторых вариантах осуществления однородный или практически однородный продукт ADC с одним значением нагрузки может быть выделен из конъюгационной смеси, например, посредством электрофореза или хроматографии.
[722] В некоторых вариантах осуществления более высокая нагрузка лекарственным средством (например, p > 8) может приводить к агрегации, нерастворимости, токсичности и потере способности проникать в клетку у определенных конъюгатов антитела и лекарственного средства. Более высокая нагрузка лекарственным средством также может отрицательно влиять на фармакокинетику (например, клиренс) определенных ADC. В некоторых вариантах осуществления более низкая нагрузка лекарственным средством (например, p < 2) может снижать активность определенных ADC в отношении клеток, экспрессирующих мишени, и/или нецелевых клеток. В некоторых вариантах осуществления нагрузка лекарственным средством для ADC по настоящему изобретению находится в диапазоне от приблизительно 2 до приблизительно 8; от приблизительно 2 до приблизительно 6; от приблизительно 2 до приблизительно 5; от приблизительно 3 до приблизительно 5; от приблизительно 2 до приблизительно 4 или от приблизительно 4 до приблизительно 8.
[723] В некоторых вариантах осуществления обеспечивается нагрузка лекарственным средством и/или средняя нагрузка лекарственным средством, составляющая приблизительно 2, например, посредством частичного восстановления внутрицепочечных дисульфидов на антителе или антигенсвязывающем фрагменте, что обеспечивает полезные свойства. В некоторых вариантах осуществления обеспечивается нагрузка лекарственным средством и/или средняя нагрузка лекарственным средством, составляющая приблизительно 4, например, посредством частичного восстановления внутрицепочечных дисульфидов на антителе или антигенсвязывающем фрагменте, что обеспечивает полезные свойства. В некоторых вариантах осуществления обеспечивается нагрузка лекарственным средством и/или средняя нагрузка лекарственным средством, составляющая приблизительно 8, например, посредством частичного восстановления внутрицепочечных дисульфидов на антителе или антигенсвязывающем фрагменте, что обеспечивает полезные свойства. В некоторых вариантах осуществления нагрузка лекарственным средством и/или средняя нагрузка лекарственным средством, составляющая менее приблизительно 2, может давать неприемлемо высокий уровень неконъюгированных фрагментов антител, которые могут конкурировать с ADC за связывание с антигеном-мишенью и/или обусловливать низкую эффективность лечения. В некоторых вариантах осуществления нагрузка лекарственным средством и/или средняя нагрузка лекарственным средством, составляющая более приблизительно 8, может давать неприемлемо высокий уровень неоднородности продукта и/или агрегации ADC. Нагрузка лекарственным средством и/или средняя нагрузка лекарственным средством, составляющая более приблизительно 8, также может оказывать влияние на стабильность ADC вследствие потери одной или нескольких химических связей, требующихся для стабилизации антитела или антигенсвязывающего фрагмента.
[724] В настоящее изобретение включены способы получения описанных ADC. Если вкратце, то ADC содержат антитело или антигенсвязывающий фрагмент в качестве антитела или антигенсвязывающего фрагмента, фрагмент-лекарственное средство (например, модулятор сплайсинга) и линкер, который связывает фрагмент-лекарственное средство и антитело или антигенсвязывающий фрагмент. В некоторых вариантах осуществления ADC могут быть получены с использованием линкера, имеющего реакционно-способные функциональные группы, предназначенные для ковалентного прикрепления к фрагменту-лекарственному средству и к антителу или антигенсвязывающему фрагменту. Например, в некоторых вариантах осуществления тиольная группа цистеина в антителе или антигенсвязывающем фрагменте может образовывать связь с реакционно-способной функциональной группой линкера или промежуточного соединения, представляющего собой лекарственное средство-линкер (например, с малеимидным фрагментом) с получением ADC. Получение ADC можно осуществлять посредством любой методики, известной специалисту в данной области техники.
[725] В некоторых вариантах осуществления ADC получают посредством последовательного приведения в контакт антитела или антигенсвязывающего фрагмента с линкером и фрагментом-лекарственным средством (например, модулятором сплайсинга) с тем, чтобы антитело или антигенсвязывающий фрагмент сперва ковалентно связывались с линкером, а затем предварительно образованное промежуточное соединение, представляющее собой антитело-линкер, вступало в реакцию с фрагментом-лекарственным средством. Промежуточное соединение, представляющее собой антитело-линкер, может быть подвергнуто или может не быть подвергнуто стадии очистки до приведения в контакт с фрагментом-лекарственным средством. В других вариантах осуществления ADC получают посредством приведения в контакт антитела или антигенсвязывающего фрагмента с соединением, представляющим собой линкер-лекарственное средство, предварительно образованным посредством осуществления реакции линкера с фрагментом-лекарственным средством. Предварительное образованное соединение, представляющее собой линкер-лекарственное средство, может быть подвергнуто или может не быть подвергнуто стадии очистки до приведения в контакт с антителом или антигенсвязывающим фрагментом. В других вариантах осуществления антитело или антигенсвязывающий фрагмент приводят в контакт с линкером и фрагментом-лекарственным средством в одной реакционной смеси, что обеспечивает одновременное образование ковалентных связей между антителом или антигенсвязывающим фрагмент и линкером и между линкером и фрагментом-лекарственным средством. Данный способ получения ADC может включать реакцию, в которой антитело или антигенсвязывающий фрагмент приводят в контакт с антителом или антигенсвязывающим фрагментом перед добавлением линкер в реакционную смесь и наоборот. В некоторых вариантах осуществления ADC получают посредством осуществления реакции антитела или антигенсвязывающего фрагмента с линкером, связанным с фрагментом-лекарственным средством, таким как ADL1-модулятор сплайсинга (например, ADL1-D1) или ADL5-модулятор сплайсинга (например, ADL5-D2), при условиях, которые обеспечивают возможность конъюгирования.
[726] ADC полученные в соответствии со способами, описанными выше, могут быть подвергнуты стадии очистки. Стадия очистки может включать любые биохимические способы, известные в данной области техники, предназначенные для проведения очистки белков, или любую комбинацию данных способов. Такие способы включают без ограничения фильтрацию с тангенциальным потоком (TFF), аффинную хроматографию, ионообменную хроматографию, любую хроматографию с переносом заряда или хроматографию на основе изоэлектрического фокусирования, хроматографию со смешанными режимами, например с использованием CHT (керамического гидроксиапатита), хроматографию с гидрофобным взаимодействием, эксклюзионную хроматографию, диализ, фильтрацию, селективное осаждение или любую их комбинацию.
Варианты терапевтического применения и композиции
[727] В данном документе раскрыты способы применения ADC и композиций в лечении у субъекта нарушения, например неопластического нарушения. ADC можно вводить отдельно или в комбинации со вторым терапевтическим средством, и может вводиться в любом фармацевтически приемлемых составе, дозировке и схеме введения. Эффективность лечения с использованием ADC может быть оценена на токсичность, а также показатели эффективность, и, соответственно, скорректирована. Показатели эффективности включают без ограничения цитостатический и/или цитотоксический эффект, наблюдаемые in vitro или in vivo, уменьшение объема опухоли, торможение роста опухоли и/или длительное выживание.
[728] Известны способы определения того, оказывает ли ADC цитостатический и/или цитотоксический эффект на клетку. Например, цитотоксическая или цитостатическая активность ADC может быть измерена путем: воздействия ADC на клетки млекопитающих, экспрессирующих целевой белок, в среде для культивирования клеток; культивирование клеток в течение периода времени от приблизительно 6 часов до приблизительно 6 дней и измерение жизнеспособности клеток. Клеточные анализы in vitro также можно использовать для измерения жизнеспособности (пролиферации), цитотоксичности и индуцирования апоптоза (активации каспаз) посредством ADC.
[729] Для определения того, оказывает ли ADC цитостатический эффект, можно использовать анализ встраивания тимидина. Например, раковые клетки, экспрессирующие целевой антиген при плотности 5000 клеток/лунка в 96-луночном планшете можно культивировать в течение 72-часового периода и подвергать воздействию 0,5 мкКи 3H-тимидина в течение последних 8 часов 72-часового периода. Встраивание 3H-тимидина в клетки культуры измеряют в присутствии и в отсутствие ADC.
[730] Для определения цитотоксичности можно измерить некроз или апоптоз (запрограммированную гибель клеток). Некроз обычно сопровождается повышенной проницаемостью плазматической мембраны; набуханием клетки и разрывом плазматической мембраны. Апоптоз можно определить количественно, например, посредством измерения фрагментации ДНК. Доступны коммерческие фотометрические методы для количественного определения фрагментации ДНК in vitro. Примеры таких анализов, включая TUNEL (который определяет встраивание меченых нуклеотидов во фрагментированную ДНК) и анализы на основе ELISA, описаны в Biochemica (1999) No. 2, pp. 34-37 (Roche Molecular Biochemicals).
[731] Апоптоз также можно определить путем измерения морфологических изменений в клетке. Например, как и в случае некроза, нарушение целостности плазматической мембраны может быть определено путем измерения поглощения определенных красителей (например, флуоресцентного красителя, такого как, например, акридиновый оранжевый или этидия бромид). Способ измерения числа апоптотических клеток был описан Duke and Cohen, Current Protocols in Immunology (Coligan et al., Eds. (1992) pp. 3.17.1-3.17.16). Клетки также могут быть мечены ДНК-красителем (например, акридиновым оранжевым, этидия бромидом или пропидия йодидом), и клетки визуально анализируют на предмет конденсации хроматина и краев вдоль внутренней ядерной мембраны. В некоторых вариантах осуществления апоптоз также можно определить путем скрининга активности каспаз. В некоторых вариантах осуществления можно использовать анализ Caspase-Glo® для измерения активности каспазы-3 и каспазы-7. В некоторых вариантах осуществления анализ предоставляет люминогенный субстрат каспазы-3/7 в реагенте, оптимизированном для активности каспазы, активности люциферазы и лизиса клеток. В некоторых вариантах осуществление добавление реагента Caspase-Glo® 3/7 в формате "добавить-смешать-измерять" может привести к лизису клеток с последующим расщеплением субстрата каспазами и генерацией люминесцентного сигнала «типа свечения», продуцируемого люциферазой. В некоторых вариантах осуществления люминесценция может быть пропорциональна количеству присутствующей каспазной активности и может служить показателем апоптоза. Другие морфологические изменения, которые можно измерить для определения апоптоза, включают, например, конденсацию цитоплазмы, усиление пузырения мембраны и сморщивание клеток. Определение любого из данных эффектов в отношении раковых клеток указывает на то, что ADC применим в лечении рака.
[732] Жизнеспособность клеток может быть измерена, например, путем определения поглощения клетками красителя, такого как нейтральный красный, трипановый синий, кристаллический фиолетовый или синий ALAMAR™ (см., например, Page et al. (1993) Intl J Oncology 3:473-6). В таком анализе клетки инкубируют в средах, содержащих краситель, клетки промывают, а оставшийся краситель, отражающий поглощение красителя клетками, измеряют спектрофотометрически. Жизнеспособность клеток также может быть измерена, например, путем количественного определения АТФ, - показателя метаболически активных клеток. В некоторых вариантах осуществления in vitro активность и/или влияние на жизнеспособность клеток полученных ADC или соединений, представляющих собой модуляторы сплайсинга, можно оценить с помощью люминесцентного анализа жизнеспособности клеток CellTiter-Glo® Luminescent Cell Viability Assay, описанного в примерах, представленных в данном документе. В данном анализе, в определенных вариантах осуществления, один реагент (реагент CellTiter-Glo®) добавляют непосредственно к клеткам, культивируемым в среде с добавлением сыворотки крови. Добавление реагента приводит к лизису клеток и генерированию люминесцентного сигнала, пропорционального количеству присутствующего АТФ. Количество АТФ прямо пропорционально количеству клеток, присутствующих в культуре. Белок-связывающий краситель сульфородамин B (SRB) также можно использовать для измерения цитотоксичности (Skehan et al. (1990) J Natl Cancer Inst. 82:1107-12).
[733] Раскрытые ADC также могут быть оценены на предмет киллинг-активности. Активность уничтожения нецелевых клеток может быть определена, например, с помощью анализа с использованием двух клеточных линий, одной - положительной по антигену-мишени, и другой - отрицательной по антигену-мишени. В определенных вариантах осуществления дизайн анализа позволяет регистрировать только отрицательные по мишени клетки. В определенных вариантах осуществления клетки высевают в трех условиях: (i) только отрицательные по мишени клетки (маркированные или меченные); (ii) только положительные по мишени клетки; и (iii) совместная культура отрицательных по мишени клеток и положительных по мишени клеток. Затем клетки обрабатывают с использованием ADC с последующим контролем цитотоксичности. Если анализ реакции в планшетах проводят посредством считывания с использованием реагента CellTiter-Glo®, то можно контролировать жизнеспособность всех популяций клеток. Когда планшеты считывают с использованием реагента OneGlo®, только маркированные или меченые отрицательные по мишени клетки генерируют сигнал. Уничтожение отрицательных по мишени клеток при смешивании с положительными по мишени клетками указывает на уничтожение нецелевых клеток, тогда как уничтожение отрицательных по мишени клеток в отсутствие положительных по мишени клеток указывает на нецелевое уничтожение.
[734] В определенных аспектах настоящего изобретения представлен способ уничтожения, подавления или модуляции роста или вмешательства в метаболизм раковой клетки или ткани посредством нарушения сплайсинга РНК. Способ можно использовать у любого субъекта, у которого нарушение сплайсинга РНК обеспечивает терапевтический эффект. Субъекты, для которых может быть полезным нарушение сплайсинга РНК, включают без ограничения тех, у кого имеется неопластическое нарушение или кто подвержен риску его развития, такое как гематологическое злокачественное новообразование или солидная опухоль. В определенных вариантах осуществления гематологическое злокачественное новообразование представляет собой B-клеточное злокачественное новообразование, рак крови (лейкоз), рак плазматических клеток (миелому, например, множественную миелому) или рак лимфатических узлов (лимфому). В определенных вариантах осуществления гематологическое злокачественное новообразование выбрано из миелогенного лейкоза или множественной миеломы. В некоторых вариантах осуществления лейкоз представляет собой острый лимфобластный лейкоз (ALL), острый миелогенный лейкоз (AML), хронический лимфоцитарный лейкоз (CLL), хронический миелогенный лейкоз (CML), хронический миеломоноцитарный лейкоз (CMML) или острый моноцитарный лейкоз (AMO). В некоторых вариантах осуществления лимфома представляет собой лимфому Ходжкина или неходжкинскую лимфому. В определенных вариантах осуществления гематологическое злокачественное новообразование представляет собой миелодиспластический синдром (МДС). В определенных вариантах осуществления солидная опухоль представляет собой карциному, такую как рак молочной железы, рак поджелудочной железы, рак предстательной железы, рак толстой кишки или колоректальный рак, рак легкого, рак желудка, рак шейки матки, рак эндометрия, рак яичника, холангиокарциному, глиому или меланому. В определенных вариантах осуществления солидная опухоль выбрана из рака молочной железы, рака желудка, рака предстательной железы, рака яичника, рака легкого (например, аденокарциномы легкого), рака матки (например, серозной карциномы эндометрия матки), карциномы слюнных протоков, меланомы, рака толстой кишки, рака шейки матки, рака поджелудочной железы, рака почки, колоректального рака и рака пищевода. В некоторых вариантах осуществления рак легкого представляет собой аденокарциному. В некоторых вариантах осуществления рак матки представляет собой серозную карциному эндометрия матки.
[735] В различных вариантах осуществления раскрытые ADC можно вводить в любую клетку или ткань, которая экспрессирует HER2, в такую как неопластическая клетка или ткань, экспрессирующая HER2. Иллюстративный вариант осуществления включает способ подавления передачи сигналов в клетке, опосредованной HER2, или способ уничтожения клетки. Способ может быть использован с любой клеткой или тканью, экспрессирующей HER2, такой как раковая клетка или метастатический очаг. Неограничивающие примеры видов рака, экспрессирующих HER2, включают рак молочной железы, рак желудка, рак мочевого пузыря, уротелиальную клеточную карциному, рак пищевода, рак легкого (например, аденокарциному легкого), рак матки (например, серозную карциному эндометрия матки), карциному слюнных протоков, рак шейки матки, рак эндометрия и рак яичника (English et al. (2013) Mol Diagn Ther. 17:85-99). Неограничивающие примеры клеток, экспрессирующих HER2, включают HCC1954 и SKBR3, клетки протоковой карциномы молочной железы человека, N87, клетки карциномы желудка человека и клетки, содержащие рекомбинантную нуклеиновую кислоту, кодирующую HER2 или его часть.
[736] В различных вариантах осуществления раскрытые ADC можно вводить в любую клетку или ткань, которая экспрессирует CD138, в такую как неопластическая клетка или ткань, экспрессирующая CD138. Иллюстративный вариант осуществления включает способ подавления передачи сигналов в клетке, опосредованной CD138, или способ уничтожения клетки. Способ может быть использован с любой клеткой или тканью, экспрессирующей CD138, такой как раковая клетка или метастатический очаг. Неограничивающие примеры видов рака, экспрессирующих CD138, включают рак внутригрудной локализации (например, рак легкого, мезотелиому), рак кожи (например, базальноклеточную карциному, плоскоклеточную карциному), рак головы и шеи (например, гортани, гипофаринкса, носоглотки), рак молочной железы, урогенитальный рак (например, рак шейки матки, рак яичника, рак эндометрия, рак предстательной железы, рак мочевого пузыря, уротелиальный рак), гематологические злокачественные новообразования (например, миелому, такую как множественная миелома, лимфома Ходжкина) и рак щитовидной железы (Szatmári et al. (2015) Dis Markers 2015:796052). Неограничивающие примеры клеток, экспрессирующих CD138, включают MOLP8, клетки множественной миеломы человека, и клетки, содержащие рекомбинантную нуклеиновую кислоту, кодирующую CD138 или его часть.
[737] В различных вариантах осуществления раскрытые ADC можно вводить в любую клетку или ткань, которая экспрессирует EPHA2, в такую как неопластическая клетка или ткань, экспрессирующая EPHA2. Иллюстративный вариант осуществления включает способ подавления передачи сигналов в клетке, опосредованной EPHA2, или способ уничтожения клетки. Способ может быть использован с любой клеткой или тканью, экспрессирующей EPHA2, такой как раковая клетка или метастатический очаг. Неограничивающие примеры видов рака, экспрессирующих EPHA2, включают рак молочной железы, рак головного мозга, рак яичника, рак мочевого пузыря, рак поджелудочной железы, рак пищевода, рак легкого, рак предстательной железы, меланому, рак пищевода и рак желудка (Tandon et al. (2011) Expert Opin Ther Targets 15(1):31-51. Неограничивающие примеры клеток, экспрессирующих EPHA2, включают PC3, клетки рака предстательной железы человека, и клетки, содержащие рекомбинантную нуклеиновую кислоту, кодирующую EPHA2 или его часть.
[738] Иллюстративные способы включают стадии приведения в контакт клетки с ADC, описанным в данном документе, в эффективном количестве, т. е. количестве, достаточном для уничтожения клетки. Способ можно использовать по отношению к клеткам к культуре, например in vitro, in vivo, ex vivo или in situ. Например, клетки, которые экспрессируют HER2 (например, клетки, полученные посредством биопсии опухоли или метастатического очага, клетки из развившейся линии раковых клеток или рекомбинантные клетки), можно культивировать in vitro в культуральной среде, при этом на стадию приведения в контакт может оказывать влияние добавление ADC в питательную среду Данный способ приведет к уничтожению клеток, экспрессирующих HER2, в том числе, в частности, опухолевых клеток, экспрессирующих HER2. Альтернативно ADC можно вводить субъекту посредством любого подходящего способа введения (например, внутривенного, подкожного или непосредственного контакта с опухолевой тканью) для оказания воздействия in vivo. Данный подход можно использовать для антител, нацеливающихся на другие антигены клеточной поверхности (например, CD138, EPHA2).
[739] Эффект in vivo описанной терапевтической композиции на основе ADC можно оценивать на подходящей модели животного. Например, могут быть использованы ксеногенные модели рака, в которых эксплантаты злокачественных опухолей или пассированные ксенотрансплантатные ткани вводят животным с ослабленным иммунитетом, таким как голые мыши или мыши SCID (Klein et al. (1997) Nature Med. 3:402-8). Эффективность можно спрогнозировать, используя анализы, которые измеряют подавление онкогенеза, регрессии опухоли или метастазов и т.п.
[740] Также можно использовать анализы in vivo, которые оценивают стимуляцию смерти опухоли посредством таких механизмов, как апоптоз. В одном варианте осуществления ксенотрансплантаты от мышей, несущих опухоль, обработанных терапевтической композицией, можно оценивать на присутствие апоптотических очагов и сравнивать с необработанными контрольными мышами, несущими ксенотрансплантат. Степень, при которой апоптотические очаги обнаруживают в опухолях обработанных мышей, является показателем терапевтической эффективности композиции.
[741] Кроме того, в данном документе представлены способы лечения неопластического нарушения, например рака. Описанные в данном документе ADC можно вводить млекопитающему, отличному от человека, или человеку с целью терапии. Терапевтические способы предусматривают введение субъекту, страдающему неопластическим нарушением или с подозрением на него, терапевтически эффективного количества ADC или композиции, содержащей модулятор сплайсинга, соединенный с нацеливающим антителом, которое связывается с экспрессируемым антигеном, доступно для связывания или локализовано на поверхности раковых клеток. В некоторых вариантах осуществления лечение с помощью конъюгата антитела и лекарственного средства или композиции индуцирует неспецифическое уничтожение неопластических клеток, которые не экспрессируют антиген-мишень, но являются смежными с неопластическими клетками, которые экспрессируют антиген-мишень.
[742] Иллюстративный вариант осуществления представляет собой способ доставки модулятора сплайсинга в клетку, экспрессирующую HER2, предусматривающий обеспечение конъюгации модулятора сплайсинга с антителом, которое иммуноспецифически связывается с эпитопом HER2 и подвергает клетку воздействию ADC. Иллюстративные опухолевые клетки, которые экспрессируют HER2, для которых приведены ADC по настоящему изобретению, включают клетки карциномы желудка и клетки протоковой карциномы молочной железы.
[743] Другой иллюстративный вариант осуществления представляет собой способ доставки модулятора сплайсинга в клетку, экспрессирующую CD138, предусматривающий обеспечение конъюгации модулятора сплайсинга с антителом, которое иммуноспецифически связывается с эпитопом CD138 и подвергает клетку воздействию ADC. Иллюстративные опухолевые клетки, которые экспрессируют CD138, для которых указаны ADC по настоящему изобретению, включают клетки множественной миеломы.
[744] Другой иллюстративный вариант осуществления представляет собой способ доставки модулятора сплайсинга в клетку, экспрессирующую EPHA2, предусматривающий обеспечение конъюгации модулятора сплайсинга с антителом, которое иммуноспецифически связывается с эпитопом EPHA2 и подвергает клетку воздействию ADC. Иллюстративные опухолевые клетки, которые экспрессируют EPHA2, для которых указаны ADC по настоящему изобретению, включают клетки рака предстательной железы.
[745] Другой иллюстративный вариант осуществления представляет собой способ уменьшения или подавления роста опухоли (например, опухоли, экспрессирующей HER2, опухоли, экспрессирующей CD138, опухоли, экспрессирующей EPHA2), предусматривающий введение терапевтически эффективного количества ADC или композиции, содержащей ADC. В некоторых вариантах осуществления данного лечения достаточно для уменьшения или подавления роста опухоли у пациента, уменьшения количества или размера метастатических очагов, уменьшения опухолевой нагрузки, уменьшения первичной опухолевой нагрузки, уменьшения инвазивности, продления времени выживания и/или поддержания или улучшения качества жизни. В некоторых вариантах осуществления опухоль является устойчивой или рефрактерной к лечению посредством антитела или антигенсвязывающего фрагмента ADC (например, антитела к HER2, антитела к CD138, антитела к EPHA2) при отдельном введении, и/или опухоль устойчива или рефрактерна к лечению посредством фрагмента-лекарственного средства, представляющего собой модулятор сплайсинга, при отдельном введении.
[746] В определенных аспектах настоящего изобретения представлен способ уменьшения или подавления роста опухоли, экспрессирующей HER2. В определенных вариантах осуществления лечение с помощью конъюгата антитела и лекарственного средства или композиции индуцирует неспецифическое уничтожение опухолевых клеток, которые не экспрессируют HER2, но являются смежными с неопластическими опухолевыми клетками, которые экспрессируют HER2. Иллюстративные типы рака, экспрессирующие HER2, включают без ограничения опухоли, полученные из рака молочной железы, рака желудка, рака мочевого пузыря, уротелиальной клеточной карциномы, рака пищевода, рака легкого (например, аденокарциномы легкого), рака матки (например, серозной карциномы эндометрия матки), карциномы слюнных протоков, рака шейки матки, рака эндометрия и рака яичника, экспрессирующих HER2. В некоторых вариантах осуществления опухоль, экспрессирующая HER2, представляет собой опухоль, полученную из рака молочной железы, рака яичника, рака желудка, рака легкого (например, аденокарциномы легкого), рака матки (например, серозной карциномы эндометрия матки), остеосаркомы или карциномы слюнных протоков, экспрессирующих HER2. В некоторых вариантах осуществления опухоль, экспрессирующая HER2, представляет собой аденокарциному легкого или серозную карциному эндометрия матки.
[747] В определенных аспектах настоящего изобретения представлен способ уменьшения или подавления роста опухоли, экспрессирующей CD138. В определенных вариантах осуществления лечение с помощью конъюгата антитела и лекарственного средства или композиции индуцирует неспецифическое уничтожение опухолевых клеток, которые не экспрессируют CD138, но являются смежными с неопластическими опухолевыми клетками, которые экспрессируют CD138. Иллюстративные типы опухолей, экспрессирующих CD138, включают без ограничения опухоли, полученные из рака внутригрудной локализации (например, рака легкого, мезотелиомы), рака кожи (например, базальноклеточной карциномы, плоскоклеточной карциномы), рака головы и шеи (например, гортани, гипофаринкса, носоглотки), рака молочной железы, урогенитального рака (например, рака шейки матки, рака яичника, рака эндометрия, рака предстательной железы, рака мочевого пузыря, уротелиального рака) и рака щитовидной железы, экспрессирующих CD138.
[748] В определенных аспектах настоящего изобретения представлен способ уменьшения или подавления роста опухоли, экспрессирующей EPHA2. В определенных вариантах осуществления лечение с помощью конъюгата антитела и лекарственного средства или композиции индуцирует неспецифическое уничтожение опухолевых клеток, которые не экспрессируют EPHA2, но являются смежными с неопластическими опухолевыми клетками, которые экспрессируют EPHA2. Иллюстративные типы опухолей, экспрессирующие EPHA2, включают без ограничения опухоли, полученные из рака молочной железы, рака головного мозга, рака яичника, рака мочевого пузыря, рака поджелудочной железы, рака пищевода, рака легкого, рака предстательной железы, меланомы, рака пищевода и рака желудка, экспрессирующих EPHA2. В определенных вариантах осуществления опухоль, экспрессирующая EPHA2, представляет собой опухоль, полученная из рака молочной железы, рака предстательной железы, рака яичника, рака легкого, меланомы, рака толстой кишки или рака пищевода, экспрессирующих EPHA2.
[749] Более того, антитела по настоящему изобретению можно вводить млекопитающему, отличному от человека, у которого экспрессируется антиген, с которым ADC способен связываться, для ветеринарных целей или для использования в качестве модели на животном заболевания человека. Что касается последнего, то такие модели на животных могут быть применимы для оценки терапевтической эффективности раскрытых ADC (например, тестирования дозировок и сроков введения).
[750] Дополнительно в данном документе представлены варианты терапевтического применения раскрытых ADC и композиций. В одном иллюстративном варианте осуществления представлено применение ADC в лечении неопластического нарушения (например, рака, экспрессирующего HER2, рака, экспрессирующего CD138, рака, экспрессирующего EPHA2). В другом иллюстративном варианте осуществления представлен ADC для применения в лечении неопластического нарушения (например, рака, экспрессирующего HER2, рака, экспрессирующего CD138, рака, экспрессирующего EPHA2). Способы идентификации субъектов с раком, который экспрессирует антиген-мишень (например, HER2, CD138, EPHA2, MSLN, FOLH1, CDH6, CEACAM5, CFC1B, ENPP3, FOLR1, HAVCR1, KIT, MET, MUC16, SLC39A6, SLC44A4, STEAP1), известны в данной области техники и могут использоваться для идентификации пациентов, подходящих для лечения раскрытым ADC.
[751] В другом иллюстративном варианте осуществления представлено применение ADC в способе изготовления лекарственного препарата для лечения неопластического нарушения (например, рака, экспрессирующего HER2, рака, экспрессирующего CD138, рака, экспрессирующего EPHA2).
[752] Терапевтические композиции, используемые в практической реализации вышеупомянутых способов, могут быть составлены в фармацевтические композиции, содержащие фармацевтически приемлемый носитель, подходящий для требуемого способа доставки. В иллюстративном варианте осуществления представлена фармацевтическая композиция, содержащая ADC по настоящему изобретению и фармацевтически приемлемый носитель. Подходящие носители включают любой материал, который в сочетании с терапевтической композицией сохраняет противоопухолевую функцию терапевтической композиции и, как правило, не взаимодействует с иммунной системой пациента. Фармацевтически приемлемые носители включают любые и все растворители, диспергирующие среды, покрытия, антибактериальные и противогрибковые средства, изотонические средства и средства, замедляющие абсорбцию, и им подобные, которые являются физиологически совместимыми. Примеры фармацевтически приемлемых носителей включают одно или несколько из следующих компонентов: воду, физиологический солевой раствор, фосфатно-буферный физиологический солевой раствор, декстрозу, глицерин, этанол, мезилатную соль и им подобные, а также их комбинации. Во многих случаях в композицию включают изотонические средства, например, сахара, полиспирты, такие как маннит, сорбит, или хлорид натрия. Фармацевтически приемлемые носители могут дополнительно содержать небольшие количества вспомогательных веществ, таких как смачивающие или эмульгирующие средства, консерванты или буферы, которые увеличивают срок хранения или эффективность ADC.
[753] Терапевтические составы можно солюбилизировать и вводить посредством любого пути, обеспечивающего доставку терапевтической композиции к месту опухоли. Потенциально эффективные пути введения включают без ограничения внутривенный, парентеральный, внутрибрюшинный, внутримышечный, внутриопухолевый, внутрикожный, внутрь органа, ортотопический и т. п. Терапевтические препараты на основе белков можно лиофилизировать и хранить в виде стерильных порошков, например, под вакуумом, а затем восстановить в бактериостатической воде (содержащей, например, консервант бензиловый спирт) или в стерильной воде перед инъекцией. Терапевтические составы могут содержать ADC или его фармацевтически приемлемую соль, например мезилатную соль.
[754] В некоторых вариантах осуществления ADC вводят пациенту ежедневно, один раз в два месяца или в любой промежуточный период времени. Дозировки и протоколы введения для лечения рака с использованием вышеупомянутых способов будут варьироваться в зависимости от способа и целевого рака и, как правило, будут зависеть от ряда других факторов, учитываемых в данной области техники.
[755] Известны различные системы доставки, которые можно использовать для введения одного или нескольких ADC по настоящему изобретению. Способы введения ADC включают без ограничения парентеральное введение (например, внутрикожное, внутримышечное, внутрибрюшинное, внутривенное и подкожное), эпидуральное введение, внутриопухолевое введение и чрезслизистое введение (например, интраназальный и пероральный пути). Кроме того, может использоваться легочное введение, например, с использованием ингалятора или небулайзера, а также состава с аэрозольным средством. См. например, композиции и способы для легочного введения, описанные в патентах США №№ 6019968, 5985320, 5985309, 5934272, 5874064, 5855913, 5290540 и 4880078; и публикации международных заявок №№ WO 1992/019244, WO 1997/032572, WO 1997/044013, WO 1998/031346 и WO 1999/066903. ADC можно вводить любым удобным путем, например, путем инфузии или болюсной инъекции, или путем абсорбции через эпителиальные или слизисто-кожные оболочки (например, слизистую оболочку полости рта, слизистую оболочку прямой кишки и слизистую оболочку кишечника и т.д.). Введение может быть системным или местным.
[756] Раскрытые в данном документе терапевтические композиции могут быть стерильными и стабильными в условиях изготовления и хранения В некоторых вариантах осуществления один или несколько ADC или одна или несколько фармацевтических композиций поставляются в виде сухого стерилизованного лиофилизированного порошка или безводного концентрата в герметически закрытом контейнере и они могут быть восстановлены (например, водой или физиологическим солевым раствором) до концентрации, подходящей для введения субъекту. В некоторых вариантах осуществления одно или несколько профилактических или терапевтических средств или одну или несколько фармацевтических композиций поставляют в виде сухого стерильного лиофилизированного порошка в герметично закрытом контейнере в дозированной лекарственной форме, составляющей по меньшей мере 5 мг, по меньшей мере 10 мг, по меньшей мере 15 мг, по меньшей мере 25 мг, по меньшей мере 35 мг, по меньшей мере 45 мг, по меньшей мере 50 мг, по меньшей мере 75 мг или по меньшей мере 100 мг или любое промежуточное количество. В некоторых вариантах осуществления лиофилизированные ADC или фармацевтические композиции хранят при температуре от 2°C до 8°C в оригинальном контейнере. В некоторых вариантах осуществления один или несколько ADC или одна или несколько фармацевтических композиций, описанных в данном документе, поставляют в жидкой форме в герметично закрытом контейнере, например, контейнере с указанием количества и концентрации средства. В некоторых вариантах осуществления жидкую форму вводимой композиции поставляют в герметично закрытом контейнере, содержащем по меньшей мере 0,25 мг/мл, по меньшей мере 0,5 мг/мл, по меньшей мере 1 мг/мл, по меньшей мере 2,5 мг/мл, по меньшей мере 5 мг/мл, по меньшей мере 8 мг/мл, по меньшей мере 10 мг/мл, по меньшей мере 15 мг/мл, по меньшей мере 25 мг/мл, по меньшей мере 50 мг/мл, по меньшей мере 75 мг/мл или по меньшей мере 100 мг/мл ADC. Жидкая форма может храниться при температуре от 2˚C до 8˚C в оригинальном контейнере.
[757] В некоторых вариантах осуществления раскрытые ADC могут быть включены в фармацевтическую композицию, подходящую для парентерального введения. Инъекционный раствор может состоять либо из жидкой, либо из лиофилизированной дозированной лекарственной формы в бесцветных или янтарно-желтых флаконе, ампуле или предварительно заполненном шприце или другом известном устройстве для доставки или хранения.
[758] Описанные в данном документе композиции могут быть в различных формах. К ним относятся, например, жидкие, полутвердые и твердые лекарственные формы, такие как жидкие растворы (например, инъекционные и инфузионные растворы), дисперсии или суспензии, таблетки, пилюли, порошки, липосомы и суппозитории. Предпочтительная форма зависит от предполагаемого способа введения и терапевтического применения.
[759] В различных вариантах осуществления лечение включает однократное болюсное или повторное введение препарата на основе ADC посредством приемлемого пути введения.
[760] Пациенты могут быть оценены в отношении уровней антигена-мишени в данном образце (например, уровней клеток, экспрессирующих целевой антиген) с тем, чтобы способствовать определению наиболее эффективной схемы введения и т. д. Иллюстративный вариант осуществления представляет собой способ определения того, будет ли пациент отвечать на лечение посредством ADC по настоящему изобретению, предусматривающий получение биологического образца от пациента и приведение биологического образца в контакт с ADC. Иллюстративные биологические образцы включают ткань или биологическую жидкость, такую как воспалительный экссудат, кровь, сыворотку крови, жидкость из кишечника, образец кала или биоптат опухоли (например, биоптат опухоли, полученный от пациента, имеющего рак, экспрессирующий антиген-мишень, например, рак, экспрессирующий HER2, рак, экспрессирующий CD138, рак, экспрессирующий EPHA2, или подверженного риску его развития). В некоторых вариантах осуществления образец (например, ткань и/или биологическая жидкость) может быть получена от субъекта, и подходящий иммунологический способ может быть использован для выявления и/или измерения экспрессии белка антигена-мишени (например, HER2, CD138, EPHA2, MSLN, FOLH1, CDH6, CEACAM5, CFC1B, ENPP3, FOLR1, HAVCR1, KIT, MET, MUC16, SLC39A6, SLC44A4, STEAP1). Такие оценки также используются с целью контроля на протяжении всей терапии и полезны для оценки терапевтического успеха в сочетании с оценкой других параметров.
[761] В некоторых вариантах осуществления эффективность ADC может быть оценена путем приведения в контакт образца опухоли от субъекта с ADC и оценки скорости роста или объема опухоли. В некоторых вариантах осуществления, если ADC был определен как эффективный, его можно вводить субъекту.
[762] Вышеупомянутые терапевтические подходы можно комбинировать с любым из множества дополнительных режимов хирургического вмешательства, химиотерапии или лучевой терапии. В некоторых вариантах осуществления ADC или композиции, раскрытые в данном документе, составляют и/или вводят совместно с одним или несколькими дополнительными терапевтическими средствами, например, одним или несколькими химиотерапевтическими средствами. Неограничивающие примеры химиотерапевтических средств включают алкилирующие средства, например, азотистые иприты, соединения этиленимина и алкилсульфонаты; антиметаболиты, например, антагонисты фолиевой кислоты, пурина или пиримидина; антимитотические средства, например ингибиторы тубулина, такие как эрибулин или эрибулина мезилат (Halaven ™), алкалоиды барвинка и ауристатины; цитотоксические антибиотики; соединения, которые повреждают или препятствуют экспрессии или репликации ДНК, например, средства, связывающиеся с малой бороздкой ДНК; и антагонисты рецепторов фактора роста. В некоторых вариантах осуществления химиотерапевтическое средство может быть цитотоксическим или цитостатическим средством. Примеры цитотоксических средств включают без ограничения антимитотические средства, такие как эрибулин или эрибулина мезилат (Halaven™), ауристатины (например, монометилауристатин E (MMAE), монометилауристатин F (MMAF)), майтанзиноиды (например, майтанзин), доластатины, дуостатины, криптофицины, алкалоиды барвинка (например, винкристин, винбластин), таксаны, таксолы и колхицины; антрациклины (например, даунорубицин, доксорубицин, дигидроксиантрациндион); цитотоксические антибиотики (например, митомицины, актиномицины, дуокармицины (например, CC-1065), ауромицины, дуомицины, калихеамицины, эндомицины, феномицины); алкилирующие средства (например, цисплатин); интеркалирующие средства (например, этидия бромид); ингибиторы топоизомераз (например, этопозид, тенопозид); радиоактивные изотопы, такие как At211, I131, I125, Y90, Re186, Re188, Sm153, Bi212 или 213, P32 и радиоактивные изотопы лютеция (например, Lu177); и токсины бактериального, грибного, растительного или животного происхождения (например, рицин (например, А-цепь рицина), дифтерийный токсин, экзотоксин A Pseudomonas (например, PE40), эндотоксин, митогеллин, комбрестатин, рестриктоцин, гелонин, альфа-сарцин, абрин (например, А-цепь абрина), модекцин (например, А-цепь модекцина), курицин, кротин, ингибитор из Sapaonaria officinalis, глюкокортикоид).
[763] В данном документе также раскрыты варианты применения одного или нескольких раскрытых ADC в изготовлении лекарственного препарата для лечения рака, например, в соответствии со способами, описанными выше. В некоторых вариантах осуществления ADC, раскрытые в данном документе, применяют для лечения рака, например, в соответствии с способами, описанными выше.
[764] В различных вариантах осуществления наборы для исследовательских и терапевтических применений, описанных в данном документе, находятся в пределах объема настоящего изобретения. Такие наборы могут содержать носитель, упаковку или контейнер, которые разделены на отсеки, чтобы вмещать один или нескольких контейнеров, таких как флаконы, пробирки и им подобные, при этом каждый из контейнеров содержит один из отдельных элементов для использования в способе, раскрытом в данном документе, вместе с этикеткой или листовкой-вкладышем, содержащими инструкции по применению, например, по применению, описанному в данном документе. Наборы могут содержать контейнер, содержащий фрагмент-лекарственное средство. В настоящем изобретении также представлены один или несколько ADC или фармацевтических композиций на их основе, герметично упакованных в контейнер, такой как ампула или саше, с указанием количества средства.
[765] Наборы могут содержать контейнер, описанный выше, и один или несколько других контейнеров, связанных с ним, которые содержат материалы, необходимые в плане коммерции и с пользовательской точки зрения, включающие буферы, разбавители, фильтры, иглы, шприцы; носитель, упаковку, контейнер, флакон и/или тюбика с указанием на этикетке содержимого и/или инструкции по применению, а также листовки-вкладыши с инструкциями по применению.
[766] Этикетка может присутствовать на контейнере или вместе с ним для указания, что композиция используется для конкретного терапевтического применения или применения, отличного от терапевтического, для такого как прогностическое, профилактическое, диагностическое или лабораторное применение. На этикетке также может быть приведено предписание для применения in vivo или in vitro, как, например, описано в данном документе. Предписания и другая информация также могут быть включены в листовку-вкладыш (листовки-вкладыши) или в этикетку (этикетки), которые включены в состав комплекта или наклеены на него. Этикетка может быть на контейнере или быть связана с ним. Этикетка может быть на самом контейнере, если буквы, числа или другие символы, образующие этикетку, выпрессованы или выгравированы на самом контейнере. Этикетка может быть связана с контейнером, если он присутствует в емкости или носителе, которые также удерживают контейнер, например, в виде листовки-вкладыша. На этикетке может указываться, что композиция применяется для диагностики или лечения состояния, такого как рак, описанного в данном документе.
Неоантигены и способы их применения
[767] В различных вариантах осуществления в данном документе также раскрыты способы лечения пациента посредством индуцирования образования антигенов в опухолевых клетках, на которые может целенаправленно воздействовать иммунная система пациента, осуществляя клиренс. Не ограничиваясь теорией, в различных вариантах осуществления введение модулятора сплайсинга по отдельности и/или как части ADC или композиции может обеспечивать продуцирование неоантигенов, которые индуцируют иммунный ответ, индуцируют иммунный ответ на двухнитевую РНК например, в результате повторной экспрессии эндогенных ретровирусов, присутствующих в интроне, и/или продуцирование неоантигенов, которые индуцируют иммуногенную гибель клеток.
[768] Используемый в данном документе термин "неоантиген" относится к любому антигену, воздействию которого иммунная система ранее не подвергалась, который возникает в результате одной или нескольких опухолеспецифических мутаций и/или в результате воздействия на опухоль лекарственного средства (например, любого одного или нескольких модуляторов сплайсинга, раскрытых в данном документе, по отдельности и/или как части ADC или композиции). Опухолеспецифические мутации могут включать миссенс-мутации, сдвиги рамки считывания, транслокации и варианты сплайсинга mRNA, а также мутации, которые влияют на посттрансляционный процессинг, такой как фосфорилирование и гликозилирование. В различных вариантах осуществления данные иллюстративные мутации могут быть получены в результате несинонимичных изменений в кодирующей последовательность и/или мутаций, которые изменяют процессинг mRNA (например, сплайсинг). В различных вариантах осуществления все из этих иллюстративных мутаций могут приводить к молекулярным изменениям, которые могут распознаваться соответствующим T-клеточным рецептором. В различных предпочтительных вариантах осуществления иллюстративный неоантиген представляет собой неоантиген, образование которого индуцировано доставкой модулятора сплайсинга по отдельности и/или как части ADC или композиции. В различных вариантах осуществления доставка модулятора сплайсинга (например, любого одного или нескольких модуляторов сплайсинга, раскрытых в данном документе) может индуцировать новый сплайс-вариант mRNA, который приводит к трансляции белков, содержащих один или несколько новых пептидных доменов, воздействию которых иммунная система ранее не подвергалась. В различных вариантах осуществления опухолеспецифические мутации могут представлять собой сплайс-варианты mRNA, возникающие в результате доставки или введения модулятора сплайсинга, ADC или композиции, содержащей модулятор сплайсинга или ADC.
[769] Не ограничиваясь теорией, в различных вариантах осуществления доставка модуляторов сплайсинга, отдельно и в качестве части ADC или композиции, может индуцировать новый сплайс-вариант mRNA (например, пропуск экзона, удержание интрона), что приводит к изменению в открытых рамках считывания и/или кодирующих последовательностях различных генов. В различных вариантах осуществления данные измененные гены транслируются в белки, содержащие один или несколько новых пептидных доменов, распознаваемых иммунной системой как чужеродные. В различных вариантах осуществления один или несколько новых пептидных доменов не существуют в белках или в любой другой части протеома человека в отсутствие лечения посредством модулятора сплайсинга. В различных вариантах осуществления белки, содержащие один или несколько новых пептидных доменов, могут разрушаться под действием протеасомы с образованием новых пептидных фрагментов, которые выступают в качестве субстратов для механизмов иммунопептидной презентации, например, посредством презентации с участием MHC. В различных вариантах осуществления новые пептидные фрагменты, представляющие неоантигены, могут быть презентированы в MHC1-связанном пептидоме, например, на опухолевых клетках.
[770] В различных вариантах осуществления доставка модуляторов сплайсинга, по отдельности и в качестве части ADC или композиции, может приводить к одному или нескольким событиям, свойственным опухолевым клеткам (например, остановке роста клеток). В различных вариантах осуществления свойственное(-ые) опухолевым клеткам событие(-я) могут приводить к (1) усилению контакта с фагоцитами (Bracci et al. (2014) Cell Death Differ. 21(1):15-25); (2) перемещению новых пептидных фрагментов в дренирующий опухоль лимфатический узел для контакта с антигенпрезентирующими клетками; (3) процессингу в антигенпрезентирующих клетках новых пептидных фрагментов из фагоцитированной опухолевой клетки и презентации фрагментов в качестве неоантигенов популяциям циркулирующих наивных T-клеток; (4) взаимодействию новых пептидных фрагментов с T-клетками, экспрессирующими рецепторы, которые распознают фрагменты в качестве неоантигенов; (5) созреванию и активации эффекторных T-клеток, обуславливающих ответы (например, CD4+ и/или CD8+ T-клеток); и/или (6) контакту T-клеток с дополнительными опухолевыми клетками, подвергнутыми обработке с помощью модулятора сплайсинга и презентирующими новые пептидные фрагменты, представляющие собой неоантигены, на своей поверхности в составе комплексов с MHC1. В различных вариантах осуществления свойственное(-ые) опухолевым клеткам событие(-я) может(-гут) приводить либо непосредственно, либо опосредованно к привлечению T-клеток с эффекторной функцией и/или уничтожению опухолевых клеток, презентирующих неоантиген.
[771] Кроме того, не ограничиваясь теорией, в различных вариантах осуществления доставка модуляторов сплайсинга по отдельности и как части ADC или композиции может вызывать повторную экспрессию эндогенных ретровирусов, присутствующих в интроне, что приводит к иммунному ответу на двухнитевую РНК.
[772] Кроме того, не ограничиваясь теорией, в различных вариантах осуществления доставка модуляторов сплайсинга по отдельности и как части ADC или композиции может приводить к иммуногенной гибели клеток, вызванной высвобождением, индуцированным модулятором сплайсинга, неоантигенов, образованных в результате мутаций. В различных вариантах осуществления доставка модуляторов сплайсинга по отдельности и как части ADC или композиции может индуцировать иммунный ответ на двухнитевую РНК. В различных вариантах осуществления иммунный ответ на двухнитевую РНК может возникать в результате повторной экспрессии эндогенных ретровирусов, присутствующих в интроне. В различных вариантах осуществления иммунный ответ на двухнитевую РНК может приводить к гибели опухолевых клеток. В различных вариантах осуществления доставка модуляторов сплайсинга по отдельности и как части ADC или композиции может индуцировать иммуногенную гибель клеток. В различных вариантах осуществления иммуногенная гибель клеток может быть вызвана высвобождением образованных в результате мутации неоантигенов и/или иммунным ответом хозяина на опухолевые клетки.
[773] Соответственно, в различных вариантах осуществления раскрыты способы лечения, предусматривающие обеспечение индуцирования неоантигенов посредством введения одного или нескольких модуляторов сплайсинга, и/или ADC, и/или композиций, содержащих модулятор сплайсинга или ADC, например, любого модулятора сплайсинга, ADC или композиции, раскрытых в данном документе. В различных вариантах осуществления способ предусматривает введение модулятора сплайсинга, ADC или композиции в сниженной дозировке, чем потребовалась бы в отсутствии индуцирования неоантигенов. В некоторых вариантах осуществления способ предусматривает введение одной или нескольких начальных индуцирующих доз для продуцирования неоантигенов и индуцирования иммунного ответа (например, превращения наивных T-клеток в клетки памяти) с последующим снижением дозировки или частоты введения (т. е. вследствие комбинированного эффекта модулятора сплайсинга, ADC или композиции и иммунного целенаправленного воздействия на неоантигены). В некоторых вариантах осуществления лечение может предусматривать введение комбинации из модулятора сплайсинга, ADC или композиции для индуцирования иммунного ответа на основе неоантигенов и по меньшей мере одного дополнительного средства терапии (например, второго средств противораковой терапии). Например, в некоторых вариантах осуществления лечение может предусматривать введение комбинации из модулятора сплайсинга, ADC или композиции для индуцирования иммунного ответа на основе неоантигенов и одного или нескольких ингибиторов контрольных точек иммунного ответа. В некоторых вариантах осуществления лечение может предусматривать введение комбинации из модулятора сплайсинга, ADC или композиции для индуцирования иммунного ответа на основе неоантигенов и одного или нескольких цитокинов или аналогов цитокина. В некоторых вариантах осуществления лечение может предусматривать введение комбинации из модулятора сплайсинга, ADC или композиции для индуцирования иммунного ответа на основе неоантигенов и одной или нескольких неоантигенных вакцин. В некоторых других вариантах осуществления лечение может предусматривать введение комбинации из модулятора сплайсинга, ADC или композиции для индуцирования иммунного ответа на основе неоантигенов и одной или нескольких сконструированных Т-клеток, целенаправленно воздействующих на опухоль (например, CAR-T).
[774] В некоторых вариантах осуществления неоантигены можно использовать для контроля эффективности лечения посредством модулятора сплайсинга, ADC или композиции. Например, после введения модулятора сплайсинга, ADC или композиции можно получить образец от пациента (например, биоптат опухоли) и провести скрининг в отношении неоантигенов или маркеров иммунного или воспалительного ответа. Если неоантиген и/или иммунный ответ обнаружены, может проводиться дополнительное лечение, например, при сниженной дозировке.
[775] В различных вариантах осуществления раскрыты способы лечения, предусматривающие обеспечение индуцирования иммунного ответа на двухнитевую РНК посредством введения одного или нескольких модуляторов сплайсинга, и/или ADC, и/или композиций, содержащих модулятор сплайсинга или ADC, например, любого модулятора сплайсинга, ADC или композиции, раскрытых в данном документе.
[776] В различных вариантах осуществления раскрыты способы лечения, предусматривающие обеспечение индуцирования иммуногенной гибели клеток посредством введения одного или нескольких модуляторов сплайсинга, и/или ADC, и/или композиций, содержащих модулятор сплайсинга или ADC, например, любого модулятора сплайсинга, ADC или композиции, раскрытых в данном документе.
[777] В различных вариантах осуществления введение модулятора сплайсинга, ADС или композиции, содержащей модулятор сплайсинга, можно комбинировать с любой известной противораковой терапией. Примеры существующих в настоящее время стратегий активации иммунитета, доступных для лечения онкологических заболеваний, включают без ограничения лечение с помощью молекул, являющихся ингибиторами контрольных точек иммунного ответа (ICI), лечение с помощью цитокинов или аналогов цитокина, вакцинацию с помощью противоопухолевых вакцин и конструирование T-клеток, целенаправленно воздействующих на опухоль (например, размножения инфильтрирующих опухоли лимфоцитов или CAR-T). Эти технологии преимущественно направлены на усиление или индуцирование иммунного ответа на уже существующие опухолевые антигены (либо мутации, либо аберрантную экспрессию белков клеточной поверхности). Одна или несколько из этих стратегий могут предусматривать одну или несколько мутаций, которые способны индуцировать развитие T-клеточного ответа на антиген. Например, ответы пациента на ингибирование контрольных точек могут коррелировать с мутационной нагрузкой с несинонимичными изменениями. Кроме того, могут применяться подходы с использованием противораковой вакцины, которые основаны на предварительно существующих мутациях и антигенности этих мутаций.
[778] Модуляторы сплайсинга и/или ADC, содержащие такие модуляторы, могут вызывать обширные изменения в транскриптоме, которые происходят в нескольких линиях происхождения. Трансляция этих измененных mRNA может обеспечивать стабильные и воспроизводимые измененные белки, которые продуцируют MHC1-связываемые неопептиды, характеризующиеся высокой аффинностью с различными изотипами молекул HLA. Не ограничиваясь теорией, вследствие большого числа изменений в транскриптоме и протеоме лечение с помощью модуляторов сплайсинга и/или ADC, может увеличивать число потенциально реакционноспособных неоантигенов для улучшенного вовлечения их в адаптивный иммунный ответ.
[779] Описываемые в данном документе термины "модулятор сплайсинга", "модулятор сплайсосомы" или "сплайс-модулятор" относятся к соединениям, которые проявляют противораковую активность за счет взаимодействия с компонентами сплайсосомы. В некоторых вариантах осуществления модулятор сплайсинга изменяет скорость или форму сплайсинга в клетке-мишени. Модуляторы сплайсинга, которые действуют как ингибирующие средства, например, способны к уменьшению неконтролируемой клеточной пролиферации. В частности, в некоторых вариантах осуществления модуляторы сплайсинга могут проявлять свое действие посредством угнетения комплекса сплайсосомы SF3b. В некоторых вариантах осуществления модулятор сплайсинга выбран из любого одного или нескольких модуляторов сплайсинга, раскрытых в данном документе. В некоторых вариантах осуществления используемый модулятор сплайсинга доставляют в клетку и/или вводят субъекту как отдельное средство. В некоторых других вариантах осуществления используемый модулятор сплайсинга доставляют в клетку и/или вводят субъекту как часть ADC (например, ADC, выбранного из любого из иллюстративных ADC, раскрытых в данном документе). В некоторых других вариантах осуществления используемый модулятор сплайсинга доставляют в клетку и/или вводят субъекту как часть композиции, содержащей несколько копий модулятора сплайсинга или несколько копий ADC, несущего модулятор сплайсинга. Такие композиций раскрываются в данном документе.
[780] В некоторых вариантах осуществления используемый модулятор сплайсинга, который доставляют в клетку и/или вводят субъекту как часть ADC (например, ADC, выбранного из любого из иллюстративных ADC, описанных в данном документе), обеспечивает дополнительные терапевтические преимущества по сравнению с используемым модулятором сплайсинга, который доставляют в клетку и/или вводят субъекту как отдельное средство. Например, в некоторых вариантах осуществления используемый модулятор сплайсинга, который доставляют в клетку и/или вводят субъекту как часть ADC, обеспечивает целенаправленную доставку модулятора сплайсинга к неопластической клетке, экспрессирующей антиген-мишень (т. е. антиген, подвергается целенаправленному воздействию фрагмента антитела ADC). В некоторых вариантах осуществления такая целенаправленная доставка модулятора сплайсинга уменьшает нецелевое лечение и/или нецелевую цитотоксичность. В некоторых вариантах осуществления такая целенаправленная доставка способствует опухолеселективной презентации неоантигена на неопластических клетках, но не на здоровых клетках, которые не экспрессируют антиген-мишень. В некоторых вариантах осуществления такая целенаправленная доставка приводит, например, к по меньшей мере 75%, 80%, 85%, 90%, 95% или 99% альтернативного сплайсинга и индуцированию новых mRNA и пептидов, ассоциированных с MHC, повторно презентирующих неоантигены в целевых неопластических клетках, но не в нецелевых клетках. Таким образом, не ограничиваясь теорией, в некоторых вариантах осуществления после примирования и/или размножения эффекторных Т-клеток (например, с использованием неоантигенной вакцины) иммунная система может предпочтительно атаковать неопластические клетки, презентирующие неоантиген, но не здоровые клетки из-за предпочтительной экспрессии неоантигенов на опухолевых клетках после обработки с помощью ADC, описанного в данном документе.
Индуцирование иммунного ответа и схема лечения:
[781] В различных вариантах осуществления настоящего изобретения представлен способ индуцирования образования по меньшей мере одного неоантигена посредством приведения в контакт неопластической клетки с эффективным количеством модулятора сплайсинга, модулятора сплайсинга на основе конъюгата антитела и лекарственного средства (ADC) или композиции, содержащей модулятор сплайсинга или ADC. В различных вариантах осуществления настоящего изобретения представлен способ индуцирования иммунного ответа на двухнитевую РНК посредством приведения в контакт неопластической клетки с эффективным количеством модулятора сплайсинга, модулятора сплайсинга на основе конъюгата антитела и лекарственного средства (ADC) или композиции, содержащей модулятор сплайсинга или ADC. В различных вариантах осуществления настоящего изобретения представлен способ индуцирования иммуногенной гибели клетки посредством приведения в контакт неопластической клетки с эффективным количеством модулятора сплайсинга, модулятора сплайсинга на основе конъюгата антитела и лекарственного средства (ADC) или композиции, содержащей модулятор сплайсинга или ADC.
[782] В некоторых вариантах осуществления по меньшей мере один неоантиген содержит аминокислотную последовательность под любым из SEQ ID NO: 37-65. В некоторых вариантах осуществления по меньшей мере один неоантиген содержит аминокислотную последовательность под SEQ ID NO: 37. В некоторых вариантах осуществления по меньшей мере один неоантиген содержит аминокислотную последовательность под SEQ ID NO: 39. В некоторых вариантах осуществления по меньшей мере один неоантиген содержит аминокислотную последовательность под любым из SEQ ID NO: 46-49.
[783] В некоторых вариантах осуществления неопластическая клетка находится в культуре клеток in vitro. В некоторых вариантах осуществления неопластическая клетка получена от субъекта. В некоторых вариантах осуществления неопластическая клетка находится в субъекте. В некоторых вариантах осуществления неопластическая клетка получена из гематологического злокачественного новообразования или солидной опухоли. В некоторых вариантах осуществления гематологическое злокачественное новообразование выбрано из B-клеточного злокачественного новообразования, лейкоза, лимфомы и миеломы. В некоторых вариантах осуществления гематологическое злокачественное новообразование выбрано из острого миелоидного лейкоза и множественной миеломы. В некоторых вариантах осуществления солидная опухоль выбрана из рака молочной железы (например, HER2-положительного рака молочной железы), рака желудка (например, аденокарциномы желудка), рака предстательной железы, рака яичника, рака легкого (например, аденокарциномы легкого), рака матки (например, серозной карциномы эндометрия матки), карциномы слюнных протоков, меланомы, рака толстой кишки, рака шейки матки, рака поджелудочной железы, рака почки, колоректального рака и рака пищевода. В некоторых вариантах осуществления солидная опухоль выбрана из HER2-положительного рака молочной железы, аденокарциномы желудка, рака предстательной железы и остеосаркомы.
[784] В некоторых вариантах осуществления настоящего изобретения дополнительно представлен способ индуцирования образования по меньшей мере одного неоантигена и/или развития T-клеточного ответа у субъекта, у которого имеется неопластическое нарушение или подозрение на его наличие, посредством введения субъекту эффективного количества модулятора сплайсинга, ADC или композиции, содержащей модулятор сплайсинга или ADC. Также в различных вариантах осуществления в данном документе представлен способ лечения субъекта, у которого имеется неопластическое нарушение или подозрение на его наличие, посредством введения субъекту эффективного количества модулятора сплайсинга, ADC или композиции, содержащей модулятор сплайсинга или ADC, где введение модулятора сплайсинга, конъюгата антитела и лекарственного средства или композиции обеспечивает индуцирование образования по меньшей мере одного неоантигена и/или T-клеточного ответа.
[785] В различных вариантах осуществления настоящего изобретения представлен способ индуцирования иммунного ответа на двухнитевую РНК у субъекта, у которого имеется неопластическое нарушение или подозрение на его наличие, посредством введения субъекту эффективного количества модулятора сплайсинга, ADC или композиции, содержащей модулятор сплайсинга или ADC. Также в различных вариантах осуществления в данном документе представлен способ лечения субъекта, у которого имеется неопластическое нарушение или подозрение на его наличие, посредством введения субъекту эффективного количества модулятора сплайсинга, ADC или композиции, содержащей модулятор сплайсинга или ADC, где введение модулятора сплайсинга, конъюгата антитела и лекарственного средства или композиции обеспечивает индуцирование иммунного ответа на двухнитевую РНК.
[786] В еще одних вариантах осуществления настоящего изобретения представлен способ индуцирования иммуногенной гибели клетки у субъекта, у которого имеется неопластическое нарушение или подозрение на его наличие, посредством введения субъекту эффективного количества модулятора сплайсинга, ADC или композиции, содержащей модулятор сплайсинга или ADC. Также в различных вариантах осуществления в данном документе представлен способ лечения субъекта, у которого имеется неопластическое нарушение или подозрение на его наличие, посредством введения субъекту эффективного количества модулятора сплайсинга, ADC или композиции, содержащей модулятор сплайсинга или ADC, где введение модулятора сплайсинга, конъюгата антитела и лекарственного средства или композиции обеспечивает индуцирование иммуногенной гибели клетки.
[787] В некоторых вариантах осуществления терапевтических способов, описанных в данном документе, по меньшей мере один неоантиген содержит аминокислотную последовательность под любым из SEQ ID NO: 37-65. В некоторых вариантах осуществления по меньшей мере один неоантиген содержит аминокислотную последовательность под SEQ ID NO: 37. В некоторых вариантах осуществления по меньшей мере один неоантиген содержит аминокислотную последовательность под SEQ ID NO: 39. В некоторых вариантах осуществления по меньшей мере один неоантиген содержит аминокислотную последовательность под любым из SEQ ID NO: 46-49.
[788] В некоторых вариантах осуществления настоящего изобретения дополнительно представлен способ лечения субъекта, у которого имеется неопластическое нарушение или подозрение на его наличие, посредством введения субъекту эффективного количества модулятора сплайсинга, ADC или композиции, содержащей модулятор сплайсинга или ADC, где введение модулятора сплайсинга, конъюгата антитела и лекарственного средства или композиции в комбинации с одной или несколькими дополнительными видами терапии, предусматривающими второе средство, обеспечивает индуцирование иммуногенной гибели клетки.
[789] В некоторых вариантах осуществления терапевтических способов, описанных в данном документе, вводимое количество модулятора сплайсинга, конъюгата антитела и лекарственного средства, композиции или второго средства уменьшено вследствие индуцирования образования по меньшей мере одного неоантигена и/или T-клеточного ответа по сравнению со стандартной дозировкой модулятора сплайсинга, конъюгата антитела и лекарственного средства, композиции или второго средства. В некоторых вариантах осуществления вводимое количество модулятора сплайсинга, конъюгата антитела и лекарственного средства, композиции или второго средства уменьшено на 10%, 15%, 20%, 25%, 30%, 35%, 40%, 45%, 50%, 75%, или 90% по сравнению со стандартной дозировкой модулятора сплайсинга, конъюгата антитела и лекарственного средства, композиции или второго средства. В некоторых вариантах осуществления модулятор сплайсинга, конъюгат антитела и лекарственного средства, композицию или второе средство вводят на по меньшей мере 10%, 15%, 20%, 25%, 30%, 35%, 40%, 45%, 50%, 75%, или 90% реже по сравнению со стандартной схемой ведения модулятора сплайсинга, конъюгата антитела и лекарственного средства, композиции или второго средства. В некоторых вариантах осуществления вводимое количество и/или назначаемая дозировка модулятора сплайсинга, конъюгата антитела и лекарственного средства, композиции или второго средства обусловливает более низкую системную токсичность и/или улучшенную переносимость.
[790] Применяемый в данном документе термин "стандартная дозировка" или "стандартная схема введения" относится к любой обычной или общепринятой схеме введения терапевтического средства, например, к схеме, предложенной производителем, одобренной регулирующими органами или иным образом протестированной на субъектах-людях для удовлетворения потребностей среднестатистического пациента. В некоторых вариантах осуществления терапевтическое средство представляет собой модулятор сплайсинга, антитело или конъюгат антитела и лекарственного средства с противораковой активностью.
[791] Например, стандартная схема введения трастузумаба, иллюстративного антитела к HER2, раскрытого в данном документе, может предусматривать внутривенное введение 8 мг/кг за 90 мин. (неделя 1), а затем внутривенное введение 6 мг/кг за 30-90 мин. через каждые 3 недели (от недели 4 до конца цикла терапии) (Herceptin® (трастузумаб), дополнение к маркировке, соответствующей требованиям FDA, 2017).
[792] В качестве другого примера, стандартная схема введения ипилимумаба, иллюстративного антитела к CTLA4, являющегося ингибитором контрольных точек, может предусматривать внутривенное введение 3 мг/кг за 90 мин. через каждые 3 недели в виде 4 доз (Yervoy® (ипилимумаб), дополнение к маркировке, соответствующей требованиям FDA, 2018). Другая стандартная схема введения ипилимумаба может предусматривать внутривенное введение 10 мг/кг за 90 мин. через каждые 3 недели в виде 4 доз, а затем 10 мг/кг через каждые 12 недель в течение не более 3 лет (Yervoy® (ипилимумаб), дополнение к маркировке, соответствующей требованиям FDA, 2018).
[793] В качестве другого примера, стандартная схема введения ниволумаба, иллюстративного антитела к PD1, являющегося ингибитором контрольных точек, может предусматривать внутривенное введение 3 мг/кг за 60 мин. через каждые 2 недели (Opdivo® (ниволумаб), маркировка, соответствующая требованиям FDA, 2015).
[794] В качестве другого примера, стандартная схема введения атезолизумаба, иллюстративного антитела к PDL1, являющегося ингибитором контрольных точек, может предусматривать внутривенное введение 1200 мг за 60 мин. через каждые 3 недели (Tecentriq® (атезолизумаб), дополнение к маркировке, соответствующей требованиям FDA, 2018).
[795] В качестве еще одного примера, стандартная схема введения T-DM1, иллюстративного конъюгата антитела к HER2 и лекарственного средства, может предусматривать внутривенное введение 3,6 мг/кг за 90 мин. через каждые 3 недели (Kadcyla® (T-DM1), дополнение к маркировке, соответствующей требованиям FDA, 2016).
[796] В некоторых вариантах осуществления способы, описанные в данном документе, могут дополнительно включать введение по меньшей мере одного дополнительного средства терапии (например, ингибитора контрольных точек, неоантигенной вакцины, цитокина или аналога цитокина, CAR-T и т. д.). В некоторых вариантах осуществления вводимое количество модулятора сплайсинга, конъюгата антитела и лекарственного средства, композиции и/или по меньшей мере одного дополнительного средства терапии уменьшено вследствие индуцирования образования по меньшей мере одного неоантигена и/или T-клеточного ответа по сравнению со стандартной дозировкой модулятора сплайсинга, конъюгата антитела и лекарственного средства, композиции и/или по меньшей мере одного дополнительного средства терапии. В некоторых вариантах осуществления вводимое количество модулятора сплайсинга, конъюгата антитела и лекарственного средства, композиции и/или по меньшей мере одного дополнительного средства терапии уменьшено вследствие индуцирования иммунного ответа на двухнитевую РНК по сравнению со стандартной дозировкой модулятора сплайсинга, конъюгата антитела и лекарственного средства, композиции и/или по меньшей мере одного дополнительного средства терапии. В некоторых вариантах осуществления вводимое количество модулятора сплайсинга, конъюгата антитела и лекарственного средства, композиции и/или по меньшей мере одного дополнительного средства терапии уменьшено вследствие индуцирования иммуногенной гибели клетки по сравнению со стандартной дозировкой модулятора сплайсинга, конъюгата антитела и лекарственного средства, композиции и/или по меньшей мере одного дополнительного средства терапии. В некоторых вариантах осуществления вводимое количество модулятора сплайсинга, конъюгата антитела и лекарственного средства, композиции и/или по меньшей мере одного дополнительного средства терапии уменьшено на 10%, 15%, 20%, 25%, 30%, 35%, 40%, 45%, 50%, 75%, или 90% по сравнению со стандартной дозировкой модулятора сплайсинга, конъюгата антитела и лекарственного средства, композиции и/или по меньшей мере одного дополнительного средства терапии. В некоторых вариантах осуществления частота введения модулятора сплайсинга, конъюгата антитела и лекарственного средства, композиции и/или по меньшей мере одного дополнительного средства терапии уменьшена на 10%, 15%, 20%, 25%, 30%, 35%, 40%, 45%, 50%, 75%, или 90% по сравнению со стандартной схемой введения модулятора сплайсинга, конъюгата антитела и лекарственного средства, композиции и/или по меньшей мере одного дополнительного средства терапии. В некоторых вариантах осуществления вводимое количество и/или назначаемая дозировка модулятора сплайсинга, конъюгата антитела и лекарственного средства, композиции и/или по меньшей мере одного дополнительного средства терапии обусловливает более низкую системную токсичность и/или улучшенную переносимость.
[797] В некоторых вариантах осуществления модулятор сплайсинга, конъюгат антитела и лекарственного средства или композицию начинают вводить до введения по меньшей мере одного дополнительного средства терапии. В других вариантах осуществления модулятор сплайсинга, конъюгат антитела и лекарственного средства или композицию начинают вводить после введения по меньшей мере одного дополнительного средства терапии. В еще одних вариантах осуществления модулятор сплайсинга, конъюгат антитела и лекарственного средства или композицию начинают вводить одновременно с введением по меньшей мере одного дополнительного средства терапии.
[798] В некоторых вариантах осуществления введение модулятора сплайсинга, конъюгата антитела и лекарственного средства или композиции повторяют по меньшей мере один раз после начального введения. В некоторых вариантах осуществления количество модулятора сплайсинга, конъюгата антитела и лекарственного средства или композиции, применяемое для повторного введения, снижено по сравнению с количеством, применяемым для начального введения. В некоторых вариантах осуществления количество модулятора сплайсинга, конъюгата антитела и лекарственного средства или композиции, применяемое для повторного введения, снижено по сравнению со стандартной дозировкой модулятора сплайсинга, конъюгата антитела и лекарственного средства или композиции. В некоторых вариантах осуществления количество модулятора сплайсинга, конъюгата антитела и лекарственного средства или композиции, применяемое для повторного введения, снижено на 10%, 15%, 20%, 25%, 30%, 35%, 40%, 45%, 50%, 75%, или 90% по сравнению со стандартной дозировкой или начальной дозировкой модулятора сплайсинга, конъюгата антитела и лекарственного средства или композиции.
[799] В некоторых вариантах осуществления введение по меньшей мере одного дополнительного средства терапии повторяют по меньшей мере один раз после начального введения. В некоторых вариантах осуществления количество по меньшей мере одного дополнительного средства терапии, применяемое для повторного введения, снижено по сравнению с количеством, применяемым для начального введения. В некоторых вариантах осуществления количество по меньшей мере одного дополнительного средства терапии, применяемое для повторного введения, снижено по сравнению со стандартной дозировкой по меньшей мере одного дополнительного средства терапии. В некоторых вариантах осуществления количество по меньшей мере одного дополнительного средства терапии, применяемое для повторного введения, снижено на 10%, 15%, 20%, 25%, 30%, 35%, 40%, 45%, 50%, 75%, или 90%по сравнению со стандартной дозировкой или начальной дозировкой по меньшей мере одного дополнительного средства терапии.
[800] В некоторых вариантах осуществления повторное введение модулятора сплайсинга, конъюгата антитела и лекарственного средства или композиции осуществляют одновременно с повторным введением по меньшей мере одного дополнительного средства терапии. В некоторых вариантах осуществления введение модулятора сплайсинга, конъюгата антитела и лекарственного средства или композиции осуществляют последовательно или с разнесением во времени с повторным введением по меньшей мере одного дополнительного средства терапии.
[801] В некоторых вариантах осуществления по меньшей мере одно дополнительное средство терапии предусматривает введение ингибитора контрольных точек, например, любого ингибитора контрольных точек, раскрытого в данном документе. В некоторых вариантах осуществления субъект характеризуется непереносимостью, невосприимчивостью или недостаточной восприимчивостью к ингибитору контрольных точек при введении его по отдельности. В некоторых вариантах осуществления ингибитор контрольных точек целенаправленно воздействует на PD1/PDL1, CTLA4, OX40, CD40, LAG3, TIM3, GITR и/или KIR. В некоторых вариантах осуществления ингибитор контрольных точек целенаправленно воздействует на CTLA4, OX40, CD40 и/или GITR. В некоторых вариантах осуществления ингибитор контрольных точек представляет собой антитело, обладающее активностью ингибитора или агониста в отношении своей мишени. В некоторых вариантах осуществления целенаправленное воздействие ингибитора контрольных точек обеспечивается с помощью ингибиторного антитела или другой подобной ингибиторной молекулы. В других вариантах осуществления целенаправленное воздействие ингибитора контрольных точек обеспечивается с помощью антитела-агониста или другой подобной молекулы-агониста.
[802] В некоторых других вариантах осуществления по меньшей мере одно дополнительное средство терапии предусматривает введение неоантигенной вакцины, например, любой неоантигенной вакцины, раскрытой в данном документе. В некоторых вариантах осуществления модулятор сплайсинга, ADC или композицию вводят до введения неоантигенной вакцины. В некоторых вариантах осуществления модулятор сплайсинга, ADC или композицию вводят после введения неоантигенной вакцины. В некоторых вариантах осуществления модулятор сплайсинга, ADC или композицию вводят одновременно с введением неоантигенной вакцины. В некоторых вариантах осуществления введение модулятора сплайсинга, ADC или композиции повторяют по меньшей мере один раз после начального введения. В некоторых вариантах осуществления количество модулятора сплайсинга, ADC или композиции, применяемое для повторного введения, снижено по сравнению с количеством, применяемым для начального введения.
[803] В некоторых вариантах осуществления неоантигенная вакцина содержит по меньшей мере один неоантигенный пептид. В некоторых вариантах осуществления длина по меньшей мере одного неоантигенного пептида находится в диапазоне от приблизительно 10 до приблизительно 50 аминокислот. В некоторых вариантах осуществления длина по меньшей мере одного неоантигенного пептида находится в диапазоне от приблизительно 10 до приблизительно 35 аминокислот. В некоторых вариантах осуществления длина по меньшей мере одного неоантигенного пептида находится в диапазоне от приблизительно 15 до приблизительно 25 аминокислот. В некоторых вариантах осуществления по меньшей мере один неоантигенный пептид содержит одну или более чем одну неоантигенную последовательность.
[804] В некоторых вариантах осуществления неоантигенная последовательность содержит аминокислотную последовательность под любым из SEQ ID NO: 37-65. В некоторых вариантах осуществления неоантигенная последовательность содержит аминокислотную последовательность под SEQ ID NO: 37. В некоторых вариантах осуществления неоантигенная последовательность содержит аминокислотную последовательность под SEQ ID NO: 39. В некоторых вариантах осуществления неоантигенная последовательность содержит аминокислотную последовательность под любым из SEQ ID NO: 46-49.
[805] В некоторых других вариантах осуществления неоантигенная последовательность содержит аминокислотную последовательность под любым из SEQ ID NO: 66-93 или антигенную часть под любым из SEQ ID NO: 66-93. В некоторых вариантах осуществления неоантигенная последовательность содержит аминокислотную последовательность под SEQ ID NO: 66 или антигенную часть под SEQ ID NO: 66. В некоторых вариантах осуществления неоантигенная последовательность содержит аминокислотную последовательность под любым из SEQ ID NO: 74-77 или антигенную часть под любым из SEQ ID NO: 74-77. В некоторых вариантах осуществления длина неоантигенной последовательности и/или антигенной части находится в диапазоне от приблизительно 10 до приблизительно 50 аминокислот. В некоторых вариантах осуществления длина неоантигенной последовательности и/или антигенной части находится в диапазоне от приблизительно 10 до приблизительно 35 аминокислот. В некоторых вариантах осуществления длина неоантигенной последовательности и/или антигенной части находится в диапазоне от приблизительно 15 до приблизительно 25 аминокислот. В некоторых вариантах осуществления длина неоантигенной последовательности и/или антигенной части находится в диапазоне от приблизительно 10 до приблизительно 20 аминокислот. В некоторых вариантах осуществления неоантигенная последовательность и/или антигенная часть непосредственно не перекрываются с канонической пептидной последовательностью (например, любой из иллюстративных канонических пептидных последовательностей, подчеркнутых в таблице 21) или не состоят из нее.
[806] Применяемый в данном документе термин "антигенная часть" или "антигенный фрагмент" неоантигенной последовательности относится к одному или нескольким фрагментам неоантигенной последовательности, которые сохраняют способность индуцировать T-клеточный ответ (например, антиген-специфическое размножение и/или созревание популяции(-ий) эффекторных T-клеток). В некоторых вариантах осуществления антигенная часть может также сохранять способность к интернализации, процессингу и/или презентированию антигенпрезентирующими клетками (например, дендритными клетками). В некоторых вариантах осуществления антигенная часть также сохраняет функцию примирования T-клеток. В некоторых вариантах осуществления длина антигенной части неоантигенной последовательности находится в диапазоне от приблизительно 10 до приблизительно 50 аминокислот. В некоторых вариантах осуществления длина антигенной части неоантигенной последовательности находится в диапазоне от приблизительно 10 до приблизительно 35 аминокислот. В некоторых вариантах осуществления длина антигенной части неоантигенной последовательности находится в диапазоне от приблизительно 15 до приблизительно 25 аминокислот. В некоторых вариантах осуществления длина антигенной части неоантигенной последовательности находится в диапазоне от приблизительно 10 до приблизительно 20 аминокислот. В некоторых вариантах осуществления антигенную часть неоантигенной последовательности (например, антигенная часть под любым из SEQ ID NO: 66-93) или кодирующую ее mRNA составляют в виде неоантигенной вакцины.
[807] Иллюстративный вариант осуществления антигенной части представляет собой участок(участки), фланкирующий(-ие) аминокислоты 45-53 из SEQ ID NO: 66. Другой иллюстративный вариант осуществления антигенной части представляет собой участок(участки), фланкирующий(-ие) аминокислоты 82-90 из SEQ ID NO: 66. В некоторых вариантах осуществления антигенная часть способна связываться с по меньшей мере одним аллелем HLA, экспрессируемым у субъекта (например, HLA-A*02:01). В некоторых других вариантах осуществления антигенная часть способна связываться с по меньшей мере одним аллелем HLA, экспрессируемым у по меньшей мере 10%, по меньшей мере 15%, по меньшей мере 20%, по меньшей мере 25%, по меньшей мере 30%, по меньшей мере 35%, по меньшей мере 40% или по меньшей мере 45% субъектов в популяции субъектов, страдающих неопластическим нарушением. В некоторых вариантах осуществления антигенная часть способна вызывать T-клеточный ответ в отношении опухоли, присутствующей у по меньшей мере 1%, по меньшей мере 5% или по меньшей мере 10% популяции субъектов, страдающих неопластическим нарушением.
[808] В некоторых вариантах осуществления антигенная часть непосредственно не перекрывается с канонической пептидной последовательностью или не состоит из нее. Применяемый в данном документе термин "каноническая пептидная последовательность" относится к любой непрерывной пептидной последовательности, присутствующей в протеоме человека в отсутствие контакта с модулятором сплайсинга (например, в отсутствие контакта с модулятором сплайсинга отдельно и/или как части ADC или композиции), и/или воздействию которой иммунная система ранее подвергалась. В некоторых вариантах осуществления каноническая пептидная последовательность происходит из открытой рамки считывания канонического транскрипта и/или кодируется ею. Иллюстративные канонические пептидные последовательности подчеркнуты в таблице 21.
[809] В некоторых вариантах осуществления, если вводят модулятора сплайсинга (например, отдельно и/или как части ADC или композиции), каноническая пептидная последовательность может быть получена из 24 нуклеотидов, расположенных непосредственно на 5'-конце рамки до события аберрантного сплайсинга, индуцированного модулятором сплайсинга, и/или может кодироваться ими. Таким образом, в некоторых вариантах осуществления каноническая пептидная последовательность содержит 8 аминокислот или состоит из них, располагающихся непосредственно с N-конца неоантигенной последовательности, образование которой индуцировано модулятором сплайсинга. В некоторых вариантах осуществления, если последовательность 5'-концевого экзона заканчивается концевым нуклеотидом кодона, каноническая пептидная последовательность заканчивается в конце экзона. В некоторых других вариантах осуществления, если последовательность 5'-концевого экзона заканчивается одним или двумя из трех нуклеотидов кодона, каноническая пептидная последовательность получена из 24 нуклеотидов, предшествующих неполному кодону, и/или кодируется ими. В некоторых вариантах осуществления 3'-концевые последовательности mRNA при событии аберрантного сплайсинга могут транслироваться в той же открытой рамке считывания, полученной 5'-концевого экзона вплоть до достижения стоп-кодона, после чего трансляция может заканчиваться. В некоторых вариантах осуществления, если событие аберрантного сплайсинга (например, пропуск экзона) приводит к сохранению открытой рамки считывания канонического транскрипта, C-концевая последовательность может транслироваться в дополнительные 24 нуклеотида, кодирующие 8 C-концевых аминокислот. В некоторых вариантах осуществления в данном контексте только участок вдоль аберрантного соединения экзонов может кодировать неоантигенную последовательность. В некоторых вариантах осуществления, если открытая рамка считывания сдвинута (например, при сохранении интрона), полная C-концевая последовательность (кодируемая 3'-концевой mRNA) может кодировать неоантигенную последовательность.
[810] В некоторых вариантах осуществления антигенная часть неоантигенной последовательности выбрана посредством сравнения неоантигенной последовательности с канонической пептидной последовательностью и выбора части неоантигенной последовательности, которая непосредственно не перекрывается с канонической пептидной последовательностью, не состоит из нее и/или не выравнивается с ней. В некоторых вариантах осуществления антигенную часть неоантигенной последовательности можно подвергать скринингу в отношении антигенности и/или функции примирования T-клеток таким же образом, как и полноразмерные неоантигенные последовательности (например, неоантигенную последовательность, из которой получена антигенная часть). В некоторых вариантах осуществления антигенную часть неоантигенной последовательности оценивают в отношении антигенности и/или функции примирования T-клеток с применением анализа примирования T-клеток, такого как иллюстративные эксперименты с примированием T-клеток, описанные в данном документе.
[811] В некоторых вариантах осуществления неоантигенная последовательность представляет собой неоантигенную последовательность, специфическую для субъекта. В некоторых вариантах осуществления неоантигенная последовательность представляет собой персонализированную неоантигенную вакцину для субъекта. В некоторых вариантах осуществления неоантигенная последовательность, применяемая для создания персонализированной неоантигенной вакцины для субъекта, способна связываться с по меньшей мере одним аллелем HLA, экспрессируемым у субъекта. В некоторых вариантах осуществления персонализированная неоантигенная вакцина выбрана посредством идентификации неоантигенов, экспрессируемых в опухоли субъекта, например, после введения модулятора сплайсинга или ADC и выбора вакцины, содержащей неоантигенную последовательность, выявленную в опухоли пациента, например, вакцину, содержащую аминокислотную последовательность под любым из SEQ ID NO: 37-65, которая выявлена в опухоли.
[812] Термин "персонализированная", когда его применяют для описания неоантигенной вакцины, относится к вакцине, созданной посредством идентификации одного или нескольких неоантигенов, продуцируемых у пациента, предпочтительно неоантигена, идентифицированного у пациента после воздействия модулятором сплайсинга, ADC или композиции, и затем применения одного или нескольких из этих неоантигенов в качестве основы для вакцины для того же пациента. Соответственно, в некоторых вариантах осуществления пациенту вводят модулятор сплайсинга, ADC или композицию, а затем проводят скрининг на присутствие неoантигенов, продуцируемых как результат обработки. В некоторых вариантах осуществления выбранная неоантигенная вакцина содержит неоантигенный пептид или mRNA, раскрытые в данном документе, и присутствие которых у пациента подтверждают после воздействия с использованием модулятора сплайсинга, ADC или композиции. В некоторых вариантах осуществления модулятор сплайсинга, ADC или композицию и/или пептид или mRNA-вакцину можно вводить пациенту однократно или повторно. Следовательно, в некоторых вариантах осуществления один или несколько из таких неоантигенов применяют для создания персонализированной вакцины, которую вводят пациенту. В некоторых вариантах осуществления один или несколько неоантигенов, применяемых для создания персонализированной вакцины, обладают аффинностью связывания с одним или несколькими специфическими для пациента аллелями HLA. В некоторых вариантах осуществления у пациента экспрессируется один или несколько аллелей MHC1, которые связываются с одним или несколькими неоантигенами. Прогнозирование того, будет ли неоантиген связываться со специфическим аллелем MHC1, можно осуществлять с применением любого способа вычислительного прогнозирования, известного из уровня техники. Иллюстративные способы вычислительного прогнозирования раскрыты, например, в Meydan et al. (2013) BMC Bioinformatics 14(Suppl. 2):S13, который включен в данный документ посредством ссылки для таких способов.
[813] В некоторых других вариантах осуществления неоантигенная последовательность представляет собой универсальную неоантигенную последовательность. В некоторых вариантах осуществления неоантигенная последовательность представляет собой универсальную неоантигенную вакцину.
[814] Термин "универсальная", когда он применяется для описания неоантигенной вакцины, относится к вакцине, содержащей пептидную последовательность или последовательность mRNA, которые основаны на обычном(-ых) или известном(-ых) неоантигене(-ах), обнаруживаемом(-ых) посредством секвенирования неоантигенов, продуцируемых у многих пациентов и/или в образцах ткани пациентов, предпочтительно после воздействия по меньшей мере с использованием модулятора сплайсинга, ADC или композиции. Пептидная последовательность или последовательность mRNA, применяемые в вакцине, необязательно должны присутствовать у каждого пациента, а обнаруживаются у по меньшей мере нескольких пациентов или в образцах ткани пациентов. В некоторых вариантах осуществления модулятор сплайсинга, ADC или композицию и/или пептид или mRNA-вакцину можно вводить пациенту однократно или повторно. Следовательно, в некоторых вариантах осуществления данную пептидную последовательность или последовательность mRNA применяют для вакцинирования дополнительных пациентов. В некоторых вариантах осуществления пациенту вводят модулятор сплайсинга, ADC или композицию, а затем вводят пептидную или mRNA-вакцину на основе известного неоантигена для усиления иммунного ответа на неоантигены, продуцируемые под действием модулятора сплайсинга, ADC или композиции. В некоторых вариантах осуществления пациенту вводят универсальную пептидную или mRNA-вакцину, а затем однократно или повторно вводят модулятор сплайсинга, ADC или композицию. В некоторых вариантах осуществления неоантигенная последовательность (или последовательности), применяемая для создания универсальной неоантигенной вакцины, выбрана на основе общей встречаемости аллеля MHC1 в приведенной популяции пациентов (Maiers et al. (2007) Hum. Immunol. 68(9):779-88).
[815] В некоторых вариантах осуществления неоантигенная последовательность (например, универсальный неоантиген) способна связываться с по меньшей мере одним аллелем HLA, экспрессируемым у по меньшей мере 10%, по меньшей мере 15%, по меньшей мере 20%, по меньшей мере 25%, по меньшей мере 30%, по меньшей мере 35%, по меньшей мере 40% или по меньшей мере 45% субъектов в популяции субъектов, страдающих неопластическим нарушением. В некоторых вариантах осуществления неоантигенная последовательность способна вызывать T-клеточный ответ на опухоль, присутствующую у по меньшей мере 1%, по меньшей мере 5% или по меньшей мере 10% популяции субъектов, страдающих неопластическим нарушением.
[816] В некоторых вариантах осуществления неоантигенная последовательность была идентифицирована посредством секвенирования по меньшей мере одного неоантигенного пептида или кодирующей его mRNA, образование которых индуцировано у субъекта посредством введения эффективного количества модулятора сплайсинга, конъюгата антитела и лекарственного средства или композиции. В некоторых вариантах осуществления по меньшей мере один неоантигенный пептид содержит неоантигенную последовательность, образование которой индуцировано путем приведения неопластической клетки в контакт с эффективным количеством модулятора сплайсинга, конъюгата антитела и лекарственного средства или композиции. В некоторых вариантах осуществления неопластическая клетка находится в культуре клеток in vitro. В некоторых вариантах осуществления неопластическая клетка получена от субъекта. В некоторых вариантах осуществления неопластическая клетка находится в субъекте.
[817] В некоторых вариантах осуществления неоантигенная вакцина содержит по меньшей мере один неоантигенный пептид и фармацевтически приемлемый носитель (например, любой из иллюстративных носителей, описанных в данном документе). В некоторых вариантах осуществления по меньшей мере один неоантигенный пептид связан с фармацевтически приемлемым носителем. В некоторых вариантах осуществления фармацевтически приемлемый носитель выбран из пептида, сывороточного альбумина, гемоцианина фисуреллы, иммуноглобулина, тиреоглобулина, овальбумина, анатоксина или аттенуированного производного анатоксина, цитокина и хемокина. В некоторых вариантах осуществления неоантигенный пептид и фармацевтически приемлемый носитель ковалентно связаны через линкер. В некоторых вариантах осуществления неоантигенный пептид и фармацевтически приемлемый носитель экспрессируются в виде слитого белка. В некоторых вариантах осуществления неоантигенная вакцина содержит по меньшей мере один неоантигенный пептид и фармацевтически приемлемый разбавитель. В некоторых вариантах осуществления неоантигенная вакцина содержит по меньшей мере один неоантигенный пептид и фармацевтически приемлемый адъювант.
[818] В некоторых вариантах осуществления неоантигенная вакцина содержит по меньшей мере одну неоантигенную mRNA. В некоторых вариантах осуществления по меньшей мере одна неоантигенная mRNA кодирует одну или более одной неоантигенной последовательности. В некоторых вариантах осуществления неоантигенная последовательность содержит аминокислотную последовательность под любым из SEQ ID NO: 37-65. В некоторых вариантах осуществления неоантигенная последовательность содержит аминокислотную последовательность под SEQ ID NO: 37. В некоторых вариантах осуществления неоантигенная последовательность содержит аминокислотную последовательность под SEQ ID NO: 39. В некоторых вариантах осуществления неоантигенная последовательность содержит аминокислотную последовательность под любым из SEQ ID NO: 46-49.
[819] В некоторых других вариантах осуществления неоантигенная последовательность содержит аминокислотную последовательность под любым из SEQ ID NO: 66-93 или антигенную часть под любым из SEQ ID NO: 66-93. В некоторых вариантах осуществления неоантигенная последовательность содержит аминокислотную последовательность под SEQ ID NO: 66 или антигенную часть под SEQ ID NO: 66. В некоторых вариантах осуществления неоантигенная последовательность содержит аминокислотную последовательность под любым из SEQ ID NO: 74-77 или антигенную часть под любым из SEQ ID NO: 74-77. В некоторых вариантах осуществления длина неоантигенной последовательности и/или антигенной части находится в диапазоне от приблизительно 10 до приблизительно 50 аминокислот. В некоторых вариантах осуществления длина неоантигенной последовательности и/или антигенной части находится в диапазоне от приблизительно 10 до приблизительно 35 аминокислот. В некоторых вариантах осуществления длина неоантигенной последовательности и/или антигенной части находится в диапазоне от приблизительно 15 до приблизительно 25 аминокислот. В некоторых вариантах осуществления длина неоантигенной последовательности и/или антигенной части находится в диапазоне от приблизительно 10 до приблизительно 20 аминокислот. В некоторых вариантах осуществления неоантигенная последовательность и/или антигенная часть непосредственно не перекрываются с канонической пептидной последовательностью (например, любой из иллюстративных канонических пептидных последовательностей, подчеркнутых в таблице 21) или не состоят из нее.
[820] В некоторых вариантах осуществления неоантигенная последовательность представляет собой неоантигенную последовательность, специфическую для субъекта. В некоторых вариантах осуществления неоантигенная последовательность представляет собой персонализированную неоантигенную вакцину для субъекта. В некоторых вариантах осуществления неоантигенная последовательность способна связываться с по меньшей мере одним аллелем HLA, экспрессируемым у субъекта.
[821] В некоторых других вариантах осуществления неоантигенная последовательность представляет собой универсальную неоантигенную последовательность. В некоторых вариантах осуществления неоантигенная последовательность представляет собой универсальную неоантигенную вакцину. В некоторых вариантах осуществления неоантигенная последовательность способна связываться с по меньшей мере одним аллелем HLA, экспрессируемым у по меньшей мере 10%, по меньшей мере 15%, по меньшей мере 20%, по меньшей мере 25%, по меньшей мере 30%, по меньшей мере 35%, по меньшей мере 40% или по меньшей мере 45% субъектов в популяции субъектов, страдающих неопластическим нарушением. В некоторых вариантах осуществления неоантигенная последовательность способна вызывать T-клеточный ответ на опухоль, присутствующую у по меньшей мере 1%, по меньшей мере 5% или по меньшей мере 10% популяции субъектов, страдающих неопластическим нарушением.
[822] В некоторых вариантах осуществления неоантигенная последовательность была идентифицирована посредством секвенирования белковой последовательности по меньшей мере одного неоантигена. В некоторых вариантах осуществления неоантигенная последовательность была идентифицирована посредством секвенирования по меньшей мере одной mRNA, кодирующей неоантиген, образование которой индуцировано у субъекта посредством введения эффективного количества модулятора сплайсинга, конъюгата антитела и лекарственного средства или композиции. В некоторых вариантах осуществления по меньшей мере одна неоантигенная mRNA кодирует неоантигенную последовательность, образование которой индуцировано путем приведения неопластической клетки в контакт с эффективным количеством модулятора сплайсинга, конъюгата антитела и лекарственного средства или композиции. В некоторых вариантах осуществления неопластическая клетка находится в культуре клеток in vitro. В некоторых вариантах осуществления неопластическая клетка получена от субъекта. В некоторых вариантах осуществления неопластическая клетка находится в субъекте.
[823] В некоторых вариантах осуществления неоантигенная вакцина содержит по меньшей мере одну неоантигенную mRNA и фармацевтически приемлемый носитель (например, любой из иллюстративных носителей, описанных в данном документе). В некоторых вариантах осуществления по меньшей мере одна неоантигенная mRNA связана с фармацевтически приемлемым носителем. В некоторых вариантах осуществления фармацевтически приемлемый носитель выбран из пептида, сывороточного альбумина, гемоцианина фисуреллы, иммуноглобулина, тиреоглобулина, овальбумина, анатоксина или аттенуированного производного анатоксина, цитокина и хемокина. В некоторых вариантах осуществления неоантигенная вакцина содержит по меньшей мере одну неоантигенную mRNA и фармацевтически приемлемый разбавитель. В некоторых вариантах осуществления неоантигенная вакцина содержит по меньшей мере одну неоантигенную mRNA и фармацевтически приемлемый адъювант. В некоторых вариантах осуществления неоантигенная mRNA инкапсулирована с помощью инкапсулирующего средства. В некоторых вариантах осуществления инкапсулирующее средство представляет собой липосому. В некоторых вариантах осуществления инкапсулирующее средство представляет собой наночастицу.
[824] В некоторых вариантах осуществления по меньшей мере одно дополнительное средство терапии предусматривает введение цитокина или аналога цитокина, например, любого цитокина или аналога цитокина, раскрытых в данном документе. В некоторых вариантах осуществления субъект характеризуется непереносимостью, невосприимчивостью или недостаточной восприимчивостью к цитокину или аналогу цитокина при введении их по отдельности. В некоторых вариантах осуществления цитокин или аналог цитокина предусматривают средство усиления для T-клеток. В некоторых вариантах осуществления цитокин или аналог цитокина предусматривают IL-2, IL-10, IL-12, IL-15, IFNγ и/или TNFα. В некоторых вариантах осуществления цитокин или аналог цитокина предусматривают IL-2, IL-10, IL-12 и/или IL-15. В некоторых вариантах осуществления введение цитокина или аналога цитокин усиливает примирование T-клеток после введения модулятора сплайсинга, конъюгата антитела и лекарственного средства или композиции вследствие индуцирования образования и презентации неоантигенов.
[825] В некоторых вариантах осуществления по меньшей мере одно дополнительное средство терапии предусматривает введение сконструированных T-клеток, целенаправленно воздействующих на опухоль (т. е. CAR-T), например, любое средство терапии на основе CAR-T, раскрытое в данном документе.
[826] В некоторых вариантах осуществления способы, описанные в данном документе, могут дополнительно предусматривать обнаружение одного или нескольких неоантигенов и/или T-клеточного ответа у субъекта после введения модулятора сплайсинга, конъюгата антитела и лекарственного средства или композиции и необязательно продолжение введения модулятора сплайсинга, конъюгата антитела и лекарственного средства или композиции, если обнаружены один или несколько неоантигенов и/или T-клеточный ответ. В некоторых вариантах осуществления обнаружение одного или нескольких неоантигенов и/или T-клеточного ответа у субъекта указывает на эффективность лечения посредством модулятора сплайсинга, конъюгата антитела и лекарственного средства или композиции. В некоторых вариантах осуществления лечение посредством дополнительного средства терапии наряду с модулятором сплайсинга, конъюгатом антитела и лекарственного средства или композицией продолжают в том случае, если обнаружены один или несколько неоантигенов и/или T-клеточный ответ. В некоторых вариантах осуществления лечение продолжают при сниженной дозировке и/или частоте, если обнаружены один или несколько неоантигенов и/или T-клеточный ответ.
[827] В некоторых вариантах осуществления способы, описанные в данном документе, могут дополнительно предусматривать обнаружение иммунитета на двухнитевую РНК у субъекта после введения модулятора сплайсинга, конъюгата антитела и лекарственного средства или композиции и необязательно продолжение введения модулятора сплайсинга, конъюгата антитела и лекарственного средства или композиции, если обнаружен иммунный ответ на двухнитевую РНК. В некоторых вариантах осуществления обнаружение иммунного ответа на двухнитевую РНК у субъекта указывает на эффективность лечения посредством модулятора сплайсинга, конъюгата антитела и лекарственного средства или композиции. В некоторых вариантах осуществления лечение посредством дополнительного средства терапии наряду с модулятором сплайсинга, конъюгатом антитела и лекарственного средства или композицией продолжают в том случае, если обнаружен иммунный ответ на двухнитевую РНК. В некоторых вариантах осуществления лечение продолжают при сниженной дозировке и/или частоте, если обнаружен иммунный ответ на двухнитевую РНК.
[828] В некоторых вариантах осуществления способы, описанные в данном документе, могут дополнительно предусматривать обнаружение иммуногенной гибели клетки у субъекта после введения модулятора сплайсинга, конъюгата антитела и лекарственного средства или композиции и необязательно продолжение введения модулятора сплайсинга, конъюгата антитела и лекарственного средства или композиции, если обнаружена иммуногенная гибель клетки. В некоторых вариантах осуществления обнаружение иммуногенной гибели клетки у субъекта указывает на эффективность лечения посредством модулятора сплайсинга, конъюгата антитела и лекарственного средства или композиции. В некоторых вариантах осуществления лечение посредством дополнительного средства терапии наряду с модулятором сплайсинга, конъюгатом антитела и лекарственного средства или композицией продолжают в том случае, если обнаружена иммуногенная гибель клетки. В некоторых вариантах осуществления лечение продолжают при сниженной дозировке и/или частоте, если обнаружена иммуногенная гибель клеток.
[829] В некоторых вариантах осуществления субъект характеризуется мутационной нагрузкой с несинонимичными изменениями, составляющей приблизительно 150 мутаций или меньше. В некоторых вариантах осуществления субъект характеризуется мутационной нагрузкой с несинонимичными изменениями, составляющей приблизительно 100 мутаций или меньше. В некоторых вариантах осуществления субъект характеризуется мутационной нагрузкой с несинонимичными изменениями, составляющей приблизительно 50 мутаций или меньше. В некоторых вариантах осуществления субъект имеет неопластическое нарушение, например, гематологическое злокачественное новообразование или солидную опухоль, или имеет подозрение на его наличие. В некоторых вариантах осуществления гематологическое злокачественное новообразование выбрано из B-клеточного злокачественного новообразования, лейкоза, лимфомы и миеломы. В некоторых вариантах осуществления гематологическое злокачественное новообразование выбрано из острого миелоидного лейкоза и множественной миеломы. В некоторых вариантах осуществления солидная опухоль выбрана из рака молочной железы, рака желудка, рака предстательной железы, рака яичника, рака легкого, рака матки, карциномы слюнных протоков, меланомы, рака толстой кишки, рака шейки матки, рака поджелудочной железы, рака почки, колоректального рака и рака пищевода. В некоторых вариантах осуществления солидная опухоль выбрана из HER2-положительного рака молочной железы, аденокарциномы желудка, рака предстательной железы и остеосаркомы.
[830] В различных вариантах осуществления в настоящем изобретение дополнительно предусмотрен способ лечения субъекта, у которого имеется неопластическое нарушение или подозрение на его наличие, предусматривающий: (a) введение субъекту эффективного количества модулятора сплайсинга, ADC или композиции, содержащей модулятор сплайсинга или ADC, где введение модулятора сплайсинга, конъюгата антитела и лекарственного средства или композиции обеспечивает индуцирование образования по меньшей мере одного нeoантигена и/или T-клеточного ответа; (b) обнаружение одного или нескольких неоантигенов и/или T-клеточного ответа у субъекта после введения модулятора сплайсинга, конъюгата антитела и лекарственного средства или композиции; и (c) продолжение введения модулятора сплайсинга, конъюгата антитела и лекарственного средства или композиции, если обнаружены один или несколько неоантигенов и/или T-клеточный ответ. В некоторых вариантах осуществления обнаружение одного или нескольких неоантигенов и/или T-клеточного ответа у субъекта указывает на эффективность лечения посредством модулятора сплайсинга, конъюгата антитела и лекарственного средства или композиции. В некоторых вариантах осуществления один или несколько неоантигенов содержат аминокислотную последовательность под любым из SEQ ID NO: 37-65. В некоторых вариантах осуществления один или несколько неоантигенов содержат аминокислотную последовательность под SEQ ID NO: 37. В некоторых вариантах осуществления один или несколько неоантигенов содержат аминокислотную последовательность под SEQ ID NO: 39. В некоторых вариантах осуществления один или несколько неоантигенов содержат аминокислотную последовательность под любым из SEQ ID NO: 46-49.
Комбинация модулятора сплайсинга/ADC и ингибирования контрольных точек иммунного ответа
[831] В различных вариантах осуществления пациент, у которого имеется рак, описанный в данном документе, может быть подвергнут лечению с использованием комбинации модулятора сплайсинга, ADC или композиции и средства терапии на основе ингибитора контрольных точек. Контрольные точки иммунного ответа представляют собой ингибиторные пути, которые замедляют или останавливают иммунные реакции и предотвращают избыточное повреждение тканей вследствие неконтролируемой активности иммунных клеток. Применяемый в данном документе термин "ингибитор контрольных точек" означает любое терапевтическое средство, в том числе любое низкомолекулярное химическое соединение, антитело, молекулу нуклеиновой кислоты или полипептид или любые их фрагменты, которое ингибирует один или несколько ингибиторных путей, за счет чего обеспечивается более функциональная иммунная активность.
[832] Как было показано, лечение пациентов с помощью ингибирования контрольных точек иммунного ответа имеет хорошую эффективность при определенных клинических показаниях. Недавно FDA одобрило применение ингибитора контрольных точек у пациентов с опухолями, проявляющими высокую микросателлитную нестабильность, независимо от происхождения ткани. Данная регистрация частично была основана на наблюдении того, что значения частоты ответа положительно коррелируют с мутационной нагрузкой (Rizvi et al. (2015) Science 348(6230):124-8; Hellmann et al. (2018) Cancer Cell 33(5):853-861). Оценки из литературы варьируют по абсолютным числам и в зависимости от происхождения, но в общем подтверждают, что выше порогового значения ~150-250 мутаций, вероятность ответа повышается. Анализ данных TCGA демонстрирует, что большой процент развивающихся у взрослых опухолей разного происхождения имеет сравнительно небольшую мутационную нагрузку с несинонимичными изменениями (Vogelstein et al. (2013) Science 339:1549-58). Большинство линий происхождения характеризуются средними значениями частоты несинонимичных мутаций ~30-80 на пациента, значительно ниже пороговых значений, требуемых для повышения вероятности ответа на ингибиторы контрольных точек.
[833] Например, как было показано, HER2-положительный рак молочной железы имеет в среднем ~60 несинонимичными мутаций, присутствующих в образце пациента. Однако пороговое значение для эффективности лечения с помощью ингибитора контрольных точек, как упомянуто выше, по оценками находится в диапазоне ~150-250 несинонимичных мутаций, т. е. пациенты со значением выше данного порогового значения более вероятно будут демонстрировать полную ремиссию, частичную ремиссию и/или стабилизацию заболевания, в то время как у пациентов со значением ниже данного порогового значения более вероятно проявляется прогрессирование заболевания. Следовательно, требуются стратегии для увеличения наблюдаемого числа несинонимичных мутаций и/или неоантигенов, присутствующих на опухолевых клетках, и они могут увеличивать общую вероятность ответа, например, на средство терапии на основе ингибитора контрольных точек. Поскольку цитокины (и их аналоги) действуют посредством подобного механизма действия, такие стратегии также могут повышать общую вероятность ответа на средства терапии на основе цитокинов.
[834] В настоящее время значения частоты ответа при HER2-положительном раке молочной железы составляют ~15-25% (CTI NCT02129556). В различных вариантах осуществления, раскрытых в данном документе, лечение с использованием модулятора сплайсинга, ADC или композиции в комбинации со средством терапии на основе ингибитора контрольных точек и/или цитокина может улучшать эту значения частоты ответа. В различных вариантах осуществления лечение с использованием модулятора сплайсинга, ADC или композиции в комбинации терапией ингибитором контрольных точек и/или цитокином может быть применимо по отношению к любой опухоли, возникающей у взрослых, в частности у тех, у кого медианная частота несинонимичных мутаций ниже рассчитанного порогового значения ~150 мутаций. В некоторых вариантах осуществления иллюстративные типы рака, подходящие для лечения с использованием модулятора сплайсинга, ADC или композиции по настоящему изобретению по отдельности или в комбинации с дополнительным средством терапии (например, средством терапии на основе ингибитора контрольных точек, средством терапии на основе цитокина), включают без ограничения рак пищевода, неходжкинскую лимфому, колоректальный рак, рак головы и шеи, рак желудка, рак эндометрия, аденокарциному поджелудочной железы, рак яичника, рак предстательной железы, печеночноклеточный рак, глиобластому, рак молочной железы (например, HER2-положительный рак молочной железы), рак легкого (например, немелкоклеточный рак легкого), хронический лимфоцитарный лейкоз и острый миелоидный лейкоз. Другие иллюстративные подходящие типы рака определены, например, в Vogelstein et al. (2013) Science 339:1549-58, который включен в данный документ посредством ссылки во всей своей полноте.
[835] Поскольку применение многих средств терапии на основе ингибитора контрольных точек обусловлено постоянной экспрессией опухоль-ассоциированных антигенов, для эффективности и для "повторной стимуляции" популяций реактивных T-клеток необходимо регулярные бустерные введения средств лечения. Индуцибельная природа модулятора сплайсинга или неоантигенов, образующихся под действием ADC, обеспечивает терапевтические схемы введения, которые могут быть разработаны для усиления иммунного ответа неоантиген-реактивных T-клеток, в то же время ограничивая истощение T-клеток, зачастую вызванное хронической стимуляцией антигеном. Например, в некоторых вариантах осуществления исходную дозу модулятора сплайсинга, ADC или композиции вводят субъекту для инициации аберрантного сплайсинга и продуцирования неоантигенных пептидов. В некоторых вариантах осуществления по прошествии периода времени, необходимого для продуцирования белка и презентации антигена, затем субъекту вводят начальную дозу ингибитора контрольных точек для стимуляции и/или усиления примирования и размножения эффекторных Т-клеток. В некоторых вариантах осуществления период ожидания между дозами модулятора сплайсинга, ADC или композиции и ингибитора контрольных точек составляет приблизительно 2, приблизительно 3, приблизительно 4, приблизительно 5, приблизительно 6 или приблизительно 7 дней. В некоторых вариантах осуществления период ожидания составляет от приблизительно 3 дней до приблизительно 5 дней. В некоторых вариантах осуществления ингибитор контрольных точек целенаправленно воздействует на CTLA4, OX40, CD40 и/или GITR. В некоторых вариантах осуществления комбинированный терапевтический эффект модулятора сплайсинга, ADC или композиции и ингибитора контрольных точек может быть аддитивным или сверхаддитивным.
[836] В некоторых вариантах осуществления после периода, обеспечивающего возможность примирования и размножения T-клеток, субъекту затем вводят вторую или последующую дозу модулятора сплайсинга, ADC или композиции для инициации повторной презентации неоантигенных пептидов. В некоторых вариантах осуществления период ожидания между исходной дозой ингибитора контрольных точек и второй или последующей дозой модулятора сплайсинга, ADC или композиции составляет приблизительно 2, приблизительно 3, приблизительно 4 или приблизительно 5 недель. В некоторых вариантах осуществления период ожидания составляет приблизительно 3 недели. После второй или последующей дозы модулятора сплайсинга, ADC или композиции в некоторых вариантах осуществления иммунная система может контактировать с презентирующими неоантиген опухолевыми клетками и/или вызывать уничтожение опухолевых клеток. В некоторых вариантах осуществления затем субъекту вводят вторую или последующую дозу ингибитора контрольных точек для дополнительного размножения популяции эффекторных T-клеток памяти после обеспечения вторичного примирования и размножения Т-клеток.
[837] В некоторых вариантах осуществления введение доз модулятора сплайсинга, ADC или композиции после данной иллюстративной исходной схемы лечения может быть пульсирующим, т. е. модулятор сплайсинга, ADC или композицию можно вводить в дозах с длительными интервалами (например, приблизительно каждые 4 недели, приблизительно каждые 5 недель, приблизительно каждые 6 недель) для обеспечения презентации антигена, привлечения Т-клеток, и/или уничтожения опухолевых клеток, и/или восстановления популяции Т-клеток памяти. В более поздние временные точки в некоторых вариантах осуществления лечение с использованием модулятора сплайсинга, ADC или композиции можно объединять с одним или несколькими ингибиторами контрольных точек, направленными на восстановление эффекторной функциональной способности у популяций истощенных T-клеток. Например, в некоторых вариантах осуществления в более поздние временные точки лечение с использованием модулятора сплайсинга, ADC или композиции можно объединять с одним или несколькими ингибиторами контрольных точек, целенаправленно воздействующими на PD1/PDL1, LAG3 и/или TIM3. В некоторых вариантах осуществления пульсирующий характер презентации и примирования неоантигена может обеспечивать возможность менее частого введения и/или в более низких дозах ингибитора контрольных точек и/или модулятора сплайсинга, ADC или композиции, подлежащих введению. В некоторых вариантах осуществления пульсирующий характер презентации неоантигена может обеспечивать один или несколько положительных эффектов лечения ингибитором контрольных точек (например, антителом к CTLA4, таким как ипилимумаб) в сравнении с ингибитором контрольных точек, вводимым без одновременного введения модулятора сплайсинга, ADC или композиции, например, за счет снижения потенциального риска нежелательных реакций, часто наблюдаемых в случае стандартной схемы введения ингибитора контрольных точек.
[838] В определенных вариантах осуществления ингибитор контрольных точек представляет собой ингибитор пути антигена, ассоциированного с цитотоксическими T-лимфоцитами (CTLA4). CTLA4, также известный как CD152, представляет собой белковый рецептор, который отрицательно регулирует иммунные ответы. CTLA4 конститутивно экспрессируется на регуляторных T-клетках, но его экспрессия повышается в обычных T-клетках только после активации. Подразумевается, что применяемый в данном документе термин "ингибитор CTLA4" относится к любому ингибитору CTLA4 и/или пути CTLA4. Иллюстративные ингибиторы CTLA4 включают без ограничения антитела к CTLA4. Антитела, блокирующие CTLA4, для применения у человека разрабатывали на основе активности в доклинических испытаниях, наблюдаемой на мышиных моделях противоопухолевого иммунитета. Иллюстративные антитела к CTLA4 включают без ограничения ипилимумаб (MDX-010) и тремелимумаб (CP-675,206), оба из которых являются полностью человеческими. Ипилимумаб представляет собой IgG1 со временем полужизни в плазме крови, составляющем примерно 12-14 дней; тремелимумаб представляет собой IgG2 со временем полужизни в плазме крови, составляющем примерно 22 дня. См., например, Phan et al. (2003) Proc Natl Acad Sci USA. 100:8372-7; Ribas et al. (2005) J Clin Oncol. 23:8968-77; Weber et al. (2008) J Clin Oncol. 26:5950-6. В некоторых вариантах осуществления антитело к CTLA4 представляет собой ипилимумаб.
[839] В определенных вариантах осуществления ингибитор контрольных точек представляет собой ингибитор пути белка 1 программируемой клеточной гибели (PD1). Путь белка 1 программируемой клеточной гибели (PD1) представляет главный переключатель иммунного контроля, который может быть задействован опухолевыми клетками для преодоления активного иммунного надзора T-клеток. Лиганды для PD1 (PDL1 и PDL2) конститутивно экспрессируются или могут быть индуцированы в различных опухолях. Было обнаружено, что высокий уровень экспрессии PDL1 (и в меньшей степени PDL2) на опухолевых клетках коррелирует с плохим прогнозом и слабой выживаемостью при различных других типах солидных опухолей. Кроме того, было высказано предположение, что PD1 контролирует размножение опухолеспецифических T-клеток у пациентов со злокачественной меланомой. Эти наблюдения предполагают то, что путь PD1/PDL1 играет важнейшую роль в ускользании опухоли от распознавания иммунной системой и может считаться привлекательной мишенью для терапевтического вмешательства. Подразумевается, что применяемый в данном документе термин "ингибитор PD1" относится к любому ингибитору PD1 и/или пути PD1. Иллюстративные ингибиторы PD1 включают без ограничения антитела к PD1 и к PDL1. В определенных вариантах осуществления ингибитор контрольных точек представляет собой антитело к PD1. Иллюстративные антитела к PD1 включают без ограничения ниволумаб и пемпролизумаб (MK-3475). Ниволумаб, например, представляет собой полностью человеческое антитело к ингибитору контрольных точек иммунного ответа PD1 на основе иммуноглобулина G4 (IgG4), которое нарушает взаимодействие рецептора PD1 с его лигандами PDL1 и PDL2, обеспечивая тем самым ингибирование клеточного иммунного ответа (Guo et al. (2017) J Cancer 8(3):410-6). В некоторых вариантах осуществления антитело к PD1 представляет собой ниволумаб. Пембролизумаб, например, представляет собой эффективное и высокоселективное гуманизированное mAb, относящееся к изотипу IgG4/каппа, разработанное для непосредственного блокирования взаимодействия между PD1 и его лигандами: PDL1 и PDL2. Пембролизумаб значительно увеличивает опосредованные T-лимфоцитами иммунные ответы в культивируемых клетках крови от здоровых доноров-людей, пациентов с раком и приматов. Также сообщалось о том, что пембролизумаб модулирует уровень интерлейкина-2 (IL-2), фактора некроза опухоли альфа (TNFα), интерферона-гамма (IFNγ) и других цитокинов. Иллюстративные антитела к PDL1 включают без ограничения атезолизумаб, авелумаб и дурвалумаб. Атезолизумаб, например, представляет собой гуманизированное mAb на основе IgG1, которое, как сообщалось, блокирует взаимодействие PD1/PDL1 путем целенаправленного воздействия на экспрессированный PDL1 на различных видах злокачественных клеток. Данная блокировка пути PD1/PDL1 может стимулировать иммунные защитные механизмы против опухолей (Abdin et al. (2018) Cancers (Basel) 10(2):32). В некоторых вариантах осуществления антитело к PDL1 представляет собой атезолизумаб.
[840] В определенных вариантах осуществления ингибитор контрольных точек целенаправленно воздействует на PD1/PDL1, CTLA4, OX40, CD40, LAG3, TIM3, GITR и/или KIR. В определенных вариантах осуществления ингибитор контрольных точек целенаправленно воздействует на CTLA4, OX40, CD40 и/или GITR. В определенных вариантах осуществления ингибитор контрольных точек целенаправленно воздействует в качестве ингибиторного антитела или другой подобной ингибиторной молекулы (например, ингибиторного антитела к CTLA4 или к PD1/PDL1). В других определенных вариантах осуществления ингибитор контрольных точек оказывает целенаправленное воздействие в качестве агониста для мишени; примеры из данного класса включают молекулы, стимулирующие мишени OX40, CD40 и/или GITR. В некоторых вариантах осуществления ингибитор контрольных точек, который целенаправленно воздействует на OX40, CD40 и/или GITR, представляет собой антитело-агонист. Антитела-агонисты, направленные против OX40, могут выполнять двойную роль: ингибировать супрессию под действием регуляторных T-клеток, при этом усиливать функции эффекторных T-клеток. Также было показано, что антитела-агонисты к GITR делают эффекторные T-клетки более устойчивыми к ингибированию, индуцированному регуляторными T-клетками (Karaki et al. (2016) Vaccines (Basel) 4(4):37). Подобным образом, антитела-агонисты к CD40 демонстрируют зависимую от T-клеток противоопухолевую активность. Активация CD40 на дендритных клетках увеличивает перекрестную презентацию опухолевых антигенов и, следовательно, число активированных эффекторных T-клеток, направленных на опухоль (Ellmark et al. (2015) Oncoimmunol. 4(7):e1011484).
[841] В определенных вариантах осуществления ингибитор контрольных точек целенаправленно воздействует на CTLA4 (например, является антителом к CTLA4). В определенных вариантах осуществления целенаправленное воздействие на CTLA4 облегчает примирование и активацию наивных T-клеток. В определенных вариантах осуществления ингибитор контрольных точек целенаправленно воздействует на OX40 (например, является антителом к OX40). В определенных вариантах осуществления целенаправленное воздействие на OX40 усиливает размножение эффекторных T-клеток. В определенных вариантах осуществления ингибитор контрольных точек целенаправленно воздействует на CD40 (например, является антителом к CD40). В определенных вариантах осуществления целенаправленное воздействие на CD40 подавляет "толерогенное" примирование T-клеток и/или образование регуляторных T-клеток. В определенных вариантах осуществления ингибитор контрольных точек целенаправленно воздействует на GITR (например, является антителом к GITR). В определенных вариантах осуществления целенаправленное воздействие на GITR подавляет активность регуляторных T-клеток. В определенных вариантах осуществления эффективность комбинированной терапии (например, влияние на по меньшей мере один симптом или риск/скорость прогрессирования заболевания) с модулятором сплайсинга, ADC или композицией и средством, целенаправленно воздействующим на CTLA4, OX40, CD40 и/или GITR, является аддитивной. В некоторых вариантах осуществления эффективность комбинированной терапии с модулятором сплайсинга, ADC или композицией и средством, целенаправленно воздействующим на CTLA4, OX40, CD40 и/или GITR, является сверхаддитивной (т. е. синергетической).
[842] Стратегии лечения на основе использования ингибитора контрольных точек основаны на гипотезе, что лечение облегчает и/или усиливает примирование T-клеток при ответах на опухоли, которые характеризуются слабой или недостаточной антигенностью (например, CTLA4), или что лечение восстанавливает и/или усиливает T-клетки, которые отвечают на опухолевые антигены, но "истощились" вследствие постоянной презентации антигена (например, PD1, PDL1) (Chen and Mellman (2013) Immunity 39(1):1-10). Примеры подходящих средств терапии и средств для ингибирования контрольных точек, например, антитела к PD1, PDL1 или CTLA4, известны из уровня техники. См., например, WO 2001/014424, WO 2013/173223, WO 2016/007235.
[843] Комбинирование данных ответов за счет примированных T-клеток после терапии ингибитором контрольных точек с лечением для индуцирования неоантигенов в опухолевых клетках, на которые примированная иммунная система может реагировать, может обеспечивать благоприятный синергизм. Поскольку неоантигены, образующиеся под действием модулятора сплайсинга или ADC, еще не презентированы для примирования T-клеток, комбинация с ингибитором CTLA4 может быть, в частности, предпочтительной. В некоторых вариантах осуществления лечение предусматривает введение одного или нескольких модуляторов сплайсинга, ADC или композиции для индуцирования продуцирования неоантигенов а также начальное введение ингибитора CTLA4 для стимуляции примирования CD8 Т-клеток, осуществляемое до, одновременно или после этого введения. В некоторых вариантах осуществления пациенту проводят дополнительные введения ингибитора CTLA4, например, для дополнительной стимуляции примирования и/или активации популяций CD8, реактивных в отношении неоантигена. В некоторых вариантах осуществления дополнительные введения модулятора сплайсинга, ADC или композиции можно назначать пациенту для повышения презентирования неоантигена опухолью. Повторные введения модулятора сплайсинга, ADC или композиции и терапии ингибитором контрольных точек можно осуществлять одновременно или с разнесенными во времени интервалами. В некоторых вариантах осуществления лечение дополнительно включает совместное лечение с помощью ингибитора PD1/PDL1, например, для восстановления эффекторной функции истощенных T-клеток, целенаправленно воздействующих на неоантиген в пределах микроокружения опухоли.
[844] Применяемые в данном документе термины "комбинация" или "комбинированная терапия" относятся к введению одного или нескольких модулятора сплайсинга, ADC или композиции вместе с дополнительным средством или средством терапии (например, ингибитором контрольных точек, цитокином или аналогом цитокина, неоантигенной вакциной, CAR-T) в рамках схемы лечения, предназначенной для обеспечения благоприятного (т. е. аддитивного или синергического) эффекта от совместного действия одного или нескольких вводимых средств. В некоторых вариантах осуществления комбинация также может включать одно или несколько дополнительных средств, в том числе без ограничения химиотерапевтических средств, средств, препятствующих ангиогенезу, и средств, которые снижают иммунную супрессию (например, второй ингибитор контрольных точек). Благоприятный эффект комбинации включает без ограничения фармакокинетическое или фармакодинамическое совместное действие, обеспечиваемое комбинацией терапевтических средств. Введение таких терапевтических средств в комбинации, как правило, осуществляют в течение определенного периода времени (например, минут, часов, дней или недель в зависимости от выбранной комбинации).
[845] Применяемые в данном документе термины вводимый "в комбинации" или "совместное введение" означают, что два или более разных средств лечения доставляются в субъекта на протяжении времени, в течение которого субъект страдает медицинским патологическим состоянием (например, неопластическим нарушением). Например, в некоторых вариантах осуществления два или более средств лечения доставляются после того, как у субъекта было диагностировано заболевание или нарушение, и перед тем, как заболевание или нарушение были излечены или устранены, или когда субъект был идентифицирован как имеющий риск его развития, но до того как у субъекта развились симптомы заболевания. В некоторых вариантах осуществления все еще осуществляют доставку одного средства лечения, когда начинают доставку второго средства лечения, так что присутствует перекрывание. В некоторых вариантах осуществления доставку первого и второго средства лечения начинают в одно и то же время. Такие типы доставки иногда в данном документе называются "одновременной", "совместной" или "сопутствующей" доставкой. В других вариантах осуществления доставка одного средства лечения заканчивается перед началом доставки второго средства лечения. Данный тип доставки иногда в данном документе называется "поочередной" или "последовательной" доставкой.
[846] В некоторых вариантах осуществления два средства лечения (например, модулятор сплайсинга, ADC или композиция и ингибитор контрольных точек) содержатся в одной и той же композиции. Такие композиции можно вводить в любой подходящей форме и с помощью любого подходящего пути. В других вариантах осуществления два средства лечения (например, модулятор сплайсинга, ADC или композиция и ингибитор контрольных точек) вводятся в отдельных композициях, в любой подходящей форме и посредством любого подходящего пути. Например, в некоторых вариантах осуществления композицию, содержащую модулятор сплайсинга или ADC, и композицию, содержащую ингибитор контрольных точек, можно вводить одновременно или последовательно в любом порядке в разные моменты времени; в любом случае их следует вводить достаточно близко по времени для обеспечения требуемого терапевтического или профилактического эффекта.
[847] В вариантах осуществления, предусматривающих либо одновременную, либо последовательную доставку, лечение может быть более эффективным вследствие комбинированного введения. В некоторых вариантах осуществления первое средство лечения является более эффективным, например, эквивалентный эффект наблюдают с меньшим количеством первого средства лечения (например, при более низкой дозе), чем наблюдали бы, если первое средство лечения вводили в отсутствие второго средства лечения. В некоторых вариантах осуществления первое средство лечения является более эффективным, так что снижение тяжести симптома или другого параметра, ассоциированного с заболеванием или нарушением, является большим, чем наблюдали бы в случае доставки первого средства лечения в отсутствие второго средства лечения. В других вариантах осуществления аналогичную ситуацию наблюдают для второго средства лечения. В некоторых вариантах осуществления положительный эффект комбинированной терапии (например, эффект в отношении по меньшей мере одного симптома или риска/скорости прогрессирования заболевания) является аддитивным. В некоторых вариантах осуществления положительный эффект комбинированной терапия является супераддитивным.
[848] В различных вариантах осуществления по настоящему изобретению представлен способ лечения субъекта, у которого имеется неопластическое нарушение или подозрение на его наличие, посредством введения субъекту эффективного количества модулятора сплайсинга, ADC или композиции, содержащей модулятор сплайсинга или ADC; и по меньшей мере одного дополнительного средства терапии (т. е. средства терапии на основе ингибитора контрольных точек, цитокина или аналога цитокина, неоантигенной вакцины, CAR-T). В некоторых вариантах осуществления введение модулятора сплайсинга, ADC или композиции обеспечивает индуцирование образования по меньшей мере одного неоантигена и/или T-клеточного ответа. В некоторых вариантах осуществления введение модулятора сплайсинга, ADC или композиции обеспечивает индуцирование иммунного ответа на двухнитевую РНК. В некоторых вариантах осуществления введение модулятора сплайсинга, ADC или композиции обеспечивает индуцирование иммуногенной клеточной смерти. В некоторых вариантах осуществления по меньшей мере одно дополнительное средство терапии может предусматривать по меньшей мере одно, по меньшей мере два, по меньшей мере три, по меньшей мере четыре или по меньшей мере пять дополнительных средств терапии. Например, в некоторых вариантах осуществления модулятор сплайсинга, ADC или композицию можно вводить в комбинации средствами терапии на основе ингибиторов контрольных точек, т. е. с применением двух разных ингибиторов контрольных точек. В некоторых других вариантах осуществления модулятор сплайсинга, ADC или композицию можно вводить в комбинации со средством терапии на основе ингибитора контрольных точек и неоантигенной вакцины.
[849] В некоторых вариантах осуществления комбинированной терапии вводимое количество модулятора сплайсинга, конъюгата антитела и лекарственного средства или композиции и/или по меньшей мере одного дополнительного средства терапии уменьшено на 10%, 15%, 20%, 25%, 30%, 35%, 40%, 45%, 50%, 75%, или 90% по сравнению со стандартной дозировкой модулятора сплайсинга, конъюгата антитела и лекарственного средства или композиции и/или по меньшей мере одного дополнительного средства терапии. В некоторых вариантах осуществления частота введения модулятора сплайсинга, конъюгата антитела и лекарственного средства или композиции и/или по меньшей мере одного дополнительного средства терапии уменьшена на 10%, 15%, 20%, 25%, 30%, 35%, 40%, 45%, 50%, 75%, или 90% по сравнению со стандартной схемой введения модулятора сплайсинга, конъюгата антитела и лекарственного средства или композиции и/или по меньшей мере одного дополнительного средства терапии. В некоторых вариантах осуществления вводимое количество и/или назначаемая дозировка модулятора сплайсинга, конъюгата антитела и лекарственного средства или композиции и/или по меньшей мере одного дополнительного средства терапии обусловливает более низкую системную токсичность и/или улучшенную переносимость.
[850] В некоторых вариантах осуществления модулятор сплайсинга, конъюгат антитела и лекарственного средства или композицию начинают вводить до введения по меньшей мере одного дополнительного средства терапии. В некоторых вариантах осуществления модулятор сплайсинга, конъюгат антитела и лекарственного средства или композицию начинают вводить после введения по меньшей мере одного дополнительного средства терапии. В некоторых вариантах осуществления модулятор сплайсинга, конъюгат антитела и лекарственного средства или композицию начинают вводить одновременно с введением по меньшей мере одного дополнительного средства терапии.
[851] В некоторых вариантах осуществления введение модулятора сплайсинга, конъюгата антитела и лекарственного средства или композиции повторяют по меньшей мере один раз после начального введения. В некоторых вариантах осуществления количество модулятора сплайсинга, конъюгата антитела и лекарственного средства или композиции, применяемое для повторного введения, снижено по сравнению с количеством, применяемым для начального введения. В некоторых вариантах осуществления количество модулятора сплайсинга, конъюгата антитела и лекарственного средства или композиции, применяемое для повторного введения, снижено по сравнению со стандартной дозировкой модулятора сплайсинга, конъюгата антитела и лекарственного средства или композиции. В некоторых вариантах осуществления количество модулятора сплайсинга, конъюгата антитела и лекарственного средства или композиции, применяемое для повторного введения, снижено на 10%, 15%, 20%, 25%, 30%, 35%, 40%, 45%, 50%, 75%, или 90% по сравнению со стандартной дозировкой модулятора сплайсинга, конъюгата антитела и лекарственного средства или композиции.
[852] В некоторых вариантах осуществления введение по меньшей мере одного дополнительного средства терапии повторяют по меньшей мере один раз после начального введения. В некоторых вариантах осуществления количество по меньшей мере одного дополнительного средства терапии, применяемое для повторного введения, снижено по сравнению с количеством, применяемым для начального введения. В некоторых вариантах осуществления количество по меньшей мере одного дополнительного средства терапии, применяемое для повторного введения, снижено по сравнению со стандартной дозировкой по меньшей мере одного дополнительного средства терапии. В некоторых вариантах осуществления количество по меньшей мере одного дополнительного средства терапии, применяемое для повторного введения, снижено на 10%, 15%, 20%, 25%, 30%, 35%, 40%, 45%, 50%, 75%, или 90% по сравнению со стандартной дозировкой по меньшей мере одного дополнительного средства терапии.
[853] В некоторых вариантах осуществления повторное введение модулятора сплайсинга, конъюгата антитела и лекарственного средства или композиции осуществляют одновременно с повторным введением по меньшей мере одного дополнительного средства терапии. В некоторых вариантах осуществления повторное введение модулятора сплайсинга, конъюгата антитела и лекарственного средства или композиции осуществляют последовательно или с разнесением во времени с повторным введением по меньшей мере одного дополнительного средства терапии.
[854] В различных вариантах осуществления по настоящему изобретению представлен способ лечения субъекта, у которого имеется неопластическое нарушение или подозрение на его наличие, посредством введения субъекту эффективного количества модулятора сплайсинга, ADC или композиции, содержащей модулятор сплайсинга или ADC; и средства терапии на основе ингибитора контрольных точек. В некоторых вариантах осуществления средство терапии на основе ингибитора контрольных точек предусматривает введение по меньшей мере одного ингибитора контрольных точек. В некоторых вариантах осуществления субъект характеризуется непереносимостью, невосприимчивостью или недостаточной восприимчивостью по меньшей мере одного ингибитора контрольных точек при введении его по отдельности. В некоторых вариантах осуществления может считаться, что субъект характеризуется невосприимчивостью или недостаточной восприимчивостью по меньшей мере одного ингибитора контрольных точек, как определено с применением, например, иммунозависимых критериев ответа на иммунотерапию (irRC) и/или иммунозависимых критериев оценки ответа на иммунотерапию при солидных опухолях (irRECIST). См., например, Wolchok et al. (2009) Clin Cancer Res. 15(23):7412-20; Bohnsack et al. "Adaptation of the Immune-Related Response Criteria:irRECIST" (Abstract 4958) ESMO 2014. Иллюстративные критерии могут включать критерии, применяемые в уровне техники для определения того, когда состояние опухолей у пациентов с раком улучшается ("ответ"), остается таким же ("стабилизация") или ухудшается ("прогрессирование") во время лечения, в случае если оцениваемое средство лечения представляет собой иммунное противоопухолевое лекарственное средство (например, ингибитор контрольных точек). В некоторых вариантах осуществления может считаться, что субъект характеризуется непереносимостью по меньшей мере одного ингибитора контрольных точек, если у субъекта наблюдается одно или более чем одно нежелательное (степени 2+) явление, идентифицированное для соответствующего ингибитора контрольных точек (например, ипилимумаба). Например, в некоторых вариантах осуществления может считаться, что субъект характеризуется непереносимостью средства лечения на основе ипилимумаба, если у субъекта наблюдается одно или несколько нежелательных явлений, выбранных из энтероколита, гепатита, дерматита (в том числе токсичного эпидермального некролиза), нейропатии и эндокринопатии (Yervoy® (ипилимумаба), приложение к маркировке, соответствующей требованиям FDA, 2018).
[855] В некоторых вариантах осуществления ингибитор контрольных точек целенаправленно воздействует на PD1/PDL1, CTLA4, OX40, CD40, LAG3, TIM3, GITR и/или KIR. В некоторых вариантах осуществления ингибитор контрольных точек целенаправленно воздействует на CTLA4, OX40, CD40 и/или GITR. В некоторых вариантах осуществления целенаправленное воздействие ингибитора контрольных точек обеспечивается с помощью ингибиторного антитела или другой подобной ингибиторной молекулы. В некоторых других вариантах осуществления ингибитор контрольных точек целенаправленно воздействует в качестве антитела-агониста или другой подобной молекулы-агониста. В некоторых вариантах осуществления ингибитор контрольных точек предусматривает ингибитор пути антигена 4, ассоциированного с цитотоксическими T-лимфоцитами (CTLA4). В некоторых вариантах осуществления ингибитор CTLA4 представляет собой антитело к CTLA4. В некоторых вариантах осуществления антитело к CTLA4 представляет собой ипилимумаб. В некоторых вариантах осуществления ингибитор контрольных точек предусматривает ингибитор пути белка 1 программируемой клеточной гибели (PD1). В некоторых вариантах осуществления ингибитор PD1 представляет собой антитело к PD1. В некоторых вариантах осуществления антитело к PD1 представляет собой ниволумаб. В некоторых вариантах осуществления ингибитор PD1 представляет собой антитело к PDL1. В некоторых вариантах осуществления антитело к PDL1 представляет собой атезолизумаб. В некоторых вариантах осуществления ингибитор контрольных точек предусматривает ингибитор CTLA4 и ингибитор PD1. В некоторых вариантах осуществления ингибитор контрольных точек целенаправленно воздействует на OX40. В некоторых вариантах осуществления ингибитор контрольных точек целенаправленно воздействует на CD40. В некоторых вариантах осуществления ингибитор контрольных точек целенаправленно воздействует на GITR. В некоторых вариантах осуществления эффективность комбинированной терапии (например, влияние на по меньшей мере один симптом или риск/скорость прогрессирования заболевания) с модулятором сплайсинга, ADC или композицией и ингибитором контрольных точек (например, антителом или молекулой, целенаправленно воздействующими на CTLA4, PD1/PDL1, OX40, CD40 и/или GITR) является аддитивной. В некоторых вариантах осуществления эффективность комбинированной терапии с модулятором сплайсинга, ADC или композицией и средством на основе ингибитора контрольных точек (например, антителом или молекулой, целенаправленно воздействующими на CTLA4, PD1/PDL1, OX40, CD40 и/или GITR) является сверхаддитивной (т. е. синергетической).
[856] В различных вариантах осуществления по настоящему изобретению представлен способ лечения субъекта, у которого имеется неопластическое нарушение или подозрение на его наличие, посредством введения субъекту эффективного количества модулятора сплайсинга, ADC или композиции, содержащей модулятор сплайсинга или ADC; и средства терапии на основе цитокина или аналога цитокина. В некоторых вариантах осуществления средство терапии на основе цитокина или аналога цитокина предусматривает введение по меньшей мере одного цитокина или аналога цитокина. В некоторых вариантах осуществления субъект характеризуется непереносимостью, невосприимчивостью или недостаточной восприимчивостью по меньшей мере одного цитокина или аналога цитокина при введении их по отдельности.
[857] В некоторых вариантах осуществления цитокин или аналог цитокина предусматривают средство усиления для T-клеток. В некоторых вариантах осуществления цитокин или аналог цитокина предусматривают IL-2, IL-10, IL-12, IL-15, IFNγ и/или TNFα. В некоторых вариантах осуществления цитокин или аналог цитокина предусматривают IL-2, IL-10, IL-12 и/или IL-15. В некоторых вариантах осуществления введение цитокина или аналога цитокин усиливает примирование T-клеток после введения модулятора сплайсинга, конъюгата антитела и лекарственного средства или композиции вследствие индуцирования образования и презентации неоантигенов.
[858] В некоторых вариантах осуществления цитокин или аналог цитокина предусматривают IL-2. В некоторых вариантах осуществления IL-2 усиливает сигналы в эффекторных клетках, содействуя их размножению (Rosenberg (2014) J Immunol. 192(12):5451-8). В некоторых вариантах осуществления цитокин или аналог цитокина предусматривают IL-10. В некоторых вариантах осуществления IL-10 усиливает примирование и активацию CD8+ T-клеток (Mumm et al. (2011) Cancer Cell 20(6):781-96). В некоторых вариантах осуществления цитокин или аналог цитокина предусматривают IL-12. В некоторых вариантах осуществления IL-12 сопрягает врожденный и адаптивный иммунный ответы с усилением антиген-специфического примирования и целенаправленного воздействия (Tugues et al. (2015) Cell Death Differ. 22(2):237-46). В некоторых вариантах осуществления цитокин или аналог цитокина предусматривают IL-15. В некоторых вариантах осуществления IL-15 усиливает примирование и/или активацию эффекторных T-клеток (CD8). В некоторых вариантах осуществления цитокин или аналог цитокина предусматривают IFNγ. В некоторых вариантах осуществления IFNγ дополняет секрецию IFNγ эффекторными T-клетками. В некоторых вариантах осуществления цитокин или аналог цитокина предусматривают TNFα. В некоторых вариантах осуществления TNFα дополняет секрецию TNFα эффекторными T-клетками.
[859] В некоторых вариантах осуществления исходную дозу модулятора сплайсинга, ADC или композиции вводят субъекту для инициации аберрантного сплайсинга и продуцирования неоантигенных пептидов. В некоторых вариантах осуществления по прошествии периода времени, необходимого для продуцирования белка и презентации антигена, субъекту затем вводят начальную дозу цитокина или аналога цитокина для стимуляции и/или усиления примирования и размножения эффекторных Т-клеток. В некоторых вариантах осуществления период ожидания между дозами модулятора сплайсинга, ADC или композиции и цитокина или аналога цитокина составляет приблизительно 2, приблизительно 3, приблизительно 4, приблизительно 5, приблизительно 6 или приблизительно 7 дней. В некоторых вариантах осуществления период ожидания составляет от приблизительно 3 дней до приблизительно 5 дней. В некоторых вариантах осуществления цитокин или аналог цитокина представляют собой IL-2, IL-10, IL-12, IL-15, IFNγ и/или TNFα. В некоторых вариантах осуществления комбинированный терапевтический эффект модулятора сплайсинга, ADC или композиции и цитокина или аналога цитокина может быть аддитивным или сверхаддитивным.
[860] В некоторых других вариантах осуществления исходную дозу цитокина или аналог цитокина вводят субъекту для стимуляции и/или усиления примирования и размножения эффекторных T-клеток. После периода ожидания в некоторых вариантах осуществления субъекту затем вводят исходную дозу модулятора сплайсинга, ADC или композиции для инициации аберрантного сплайсинга и продуцирования неоантигенных пептидов. В некоторых вариантах осуществления период ожидания между дозами цитокина и аналога цитокина и модулятора сплайсинга, ADC или композиции составляет приблизительно 2, приблизительно 3, приблизительно 4, приблизительно 5, приблизительно 6 или приблизительно 7 дней. В некоторых вариантах осуществления период ожидания составляет от приблизительно 3 дней до приблизительно 5 дней. В некоторых вариантах осуществления цитокин или аналог цитокина представляют собой IL-2, IL-10, IL-12, IL-15, IFNγ и/или TNFα. В некоторых вариантах осуществления комбинированный терапевтический эффект цитокина или аналога цитокина и модулятора сплайсинга, ADC или композиции может быть аддитивным или сверхаддитивным.
[861] В некоторых вариантах осуществления после периода, обеспечивающего возможность примирования и размножения T-клеток, субъекту затем вводят вторую или последующую дозу модулятора сплайсинга, ADC или композиции для инициации повторной презентации неоантигенных пептидов. В некоторых вариантах осуществления период ожидания между исходной дозой цитокина или аналога цитокина и второй или последующей дозой модулятора сплайсинга, ADC или композиции составляет приблизительно 2, приблизительно 3, приблизительно 4 или приблизительно 5 недель. В некоторых вариантах осуществления период ожидания составляет приблизительно 3 недели. В некоторых вариантах осуществления последующие дозы цитокина или аналога цитокина можно вводить, например, вперемежку с последующими дозами модулятора сплайсинга, ADC или композиции. После второй или последующей дозы модулятора сплайсинга, ADC или композиции в некоторых вариантах осуществления иммунная система может контактировать с презентирующими неоантиген опухолевыми клетками и/или вызывать уничтожение опухолевых клеток. В некоторых вариантах осуществления введение доз модулятора сплайсинга, ADC или композиции после данной иллюстративной исходной схемы лечения может быть пульсирующим, т. е. модулятор сплайсинга, ADC или композицию можно вводить в дозах с длительными интервалами (например, приблизительно каждые 4 недели, приблизительно каждые 5 недель, приблизительно каждые 6 недель) для обеспечения презентации антигена, привлечения Т-клеток, и/или уничтожения опухолевых клеток, и/или восстановления популяции Т-клеток памяти.
[862] В некоторых вариантах осуществления субъект характеризуется мутационной нагрузкой с несинонимичными изменениями, составляющей приблизительно 150 мутаций или меньше. В некоторых вариантах осуществления субъект характеризуется мутационной нагрузкой с несинонимичными изменениями, составляющей приблизительно 100 мутаций или меньше. В некоторых вариантах осуществления субъект характеризуется мутационной нагрузкой с несинонимичными изменениями, составляющей приблизительно 50 мутаций или меньше. В некоторых вариантах осуществления субъект имеет неопластическое нарушение, например, гематологическое злокачественное новообразование или солидную опухоль, или имеет подозрение на его наличие. В некоторых вариантах осуществления гематологическое злокачественное новообразование выбрано из B-клеточного злокачественного новообразования, лейкоза, лимфомы и миеломы. В некоторых вариантах осуществления гематологическое злокачественное новообразование выбрано из острого миелоидного лейкоза и множественной миеломы. В некоторых вариантах осуществления солидная опухоль выбрана из рака молочной железы, рака желудка, рака предстательной железы, рака яичника, рака легкого, рака матки, карциномы слюнных протоков, меланомы, рака толстой кишки, рака шейки матки, рака поджелудочной железы, рака почки, колоректального рака и рака пищевода. В некоторых вариантах осуществления солидная опухоль выбрана из HER2-положительного рака молочной железы, аденокарциномы желудка, рака предстательной железы и остеосаркомы.
Комбинация модулятора сплайсинга/ADC и неоантигенной вакцины
[863] В различных вариантах осуществления пациент, у которого имеется описанный в данном документе рак, может быть подвергнут лечению с использованием комбинации модулятора сплайсинга, ADC или композиции и неоантигенной вакцины. Не ограничиваясь теорией, вакцины, применяемые по отдельности или в комбинации с молекулами, представляющими собой ингибитор контрольных точек иммунного ответа (ICI), показали себя перспективными в клинических исследованиях ранних фаз (Ott et al. (2017) Nature 547(7662):217-21; Sahin et al. (2017) Nature 547(7662):222-6), но обычно требуется секвенирование мутаций в опухоли у пациента (Ott et al. (2017) Nature 547(7662):217-21; Aldous and Dong (2018) Bioorg. Med. Chem. 26(10):2842-9). Таким образом, действие вакцин зачастую зависит от достаточных количеств несинонимичных мутаций, которые являются антигенными. В целом, в опухолях с очень низкой мутационной нагрузкой имеется небольшое количество антигенов-кандидатов, и в случае опухолей с быстрым ростом имеется ограниченное время для идентификации и получения специфических для пациента вакцин.
[864] До настоящего времени попытки разработать вакцины, которые характеризовались бы широким охватом иммуногенности для большого процента пациентов, были сосредоточены на белках, которые либо часто мутируют, либо эктопически сверхэкспрессируются или амплифицируются, и/или которые существуют в виде "собственных" белков в организме. Кроме того, эти белки зачастую экспрессируются в тканях, на которые не оказывает воздействие иммунная система (например, нейронные маркеры, экспрессируемые в типах нейроэндокринных опухолей), в то же время другие белки могут в норме экспрессироваться во время эмбриогенеза (например, раковые эмбриональные антигены). Таким образом, применимость вакцин, использующих такие белки в качестве антигенов, зачастую ограничена специфическим линиями происхождения или подгруппами опухоли, в которых присутствуют один или несколько антигенов. Применимость вакцины также будет необходимо подтверждать посредством секвенирования образцов опухоли пациента, что может занимать много времени.
[865] Более того, если такие антигены существуют в виде "собственных" белков, иммунная система вероятно будет примирована для распознавания таких белков как "собственные" и, таким образом, не будет отвечать. Или, в качестве альтернативы, если иммунная система способна обеспечивать эффекторный ответ на такие антигены, он может приводить к побочным эффектам, связанным с воздействием на мишени, в тканях, где может экспрессироваться антиген. В обоих этих случаях одной из ключевых проблем является то, что большинство антигенных пептидов получают из генов-"пассажиров" (т. е. генов, которые мутируют или амплифицируются на протяжении онкогенеза, но не играют важнейшую роль в продолжительном выживании или пролиферации опухоли самой по себе). По этой причине эти гены могут быть подвергнуты сайленсингу без значительных последствий для прогрессирования опухоли и, таким образом, могут позволить опухоль "избежать" иммунного ответа на эти антигены. Не желая ограничиваться теорией, данный механизм может играть роль в эволюции опухоли, при которой случайные мутации, которые характеризуются сильной антигенностью, зачастую подвергаются "отсеивающему отбору" опухолью во время ранних стадий онкогенеза (Dunn et al. (2004) Annu. Rev. Immunol. 22:329-60).
[866] Кроме того, определенные свидетельства также указывают на то, что постоянная презентация антигена и иммунная стимуляция могут приводить к анергии и истощению иммунных клеток (Pardoll (2012) Nat. Rev. Cancer 12(4):252-64). Такие фенотипы лежат в основе терапевтического обоснования используемых в настоящее время средств лечения на основе ICI, поскольку, как было показано, ICI либо сдерживают фенотип истощения иммунных клеток (α-PD1/PD-L1), либо облегчают дополнительные иммунные клеточные ответы (α-CTLA4). Примечательно, что в случае средства терапии на основе α-CTLA4 сообщалось, что определенная подгруппа пациентов демонстрировала серьезные связанные с иммунной системой нежелательные явления, которые могут быть обусловлены содействием активации T-клеток и разрушением механизмов иммунной толерантности, ограничивающей аутореактивные иммунные ответы.
[867] Оба такие подхода (т. е. запуск или усиление de novo иммунных ответов на неоантигены или повторная активация при анергии или истощении существующих иммунных ответов) связаны с постоянной активацией иммунной системы. В связи с этим, эти подходы являются чувствительными к анергии, редактированию и другим опухоль-опосредованным механизмам, направленным на подавление вовлечения иммунной системы.
[868] В противоположность этому, лечение с использованием модулятора сплайсинга, ADC или композиции, раскрытых в данном документе, может индуцировать иммунный ответ на новые последовательности, представляющие собой неоантигены. В некоторых вариантах осуществления презентация неоантигенов предоставляет адаптивной иммунной системе более разнообразные мишени, с которым она контактирует и активируется. В некоторых вариантах осуществления способность модулятора сплайсинга, ADC или композиции быстро индуцировать альтернативный сплайсинг и образование неоантигенов может снижать риск истощения иммунной системы вследствие постоянного воздействия неоантигенов, вызванных мутациями, и/или ограничивать способность опухолевых клеток адаптироваться к уклонению от терапии. В некоторых вариантах осуществления введение модулятора сплайсинга, ADC или композиции в комбинации с неоантигенной вакциной усиливает иммунный ответ на неоантигены, продуцируемые под действием модулятора сплайсинга, ADC или композиции. В некоторых вариантах осуществления модулятор сплайсинга, ADC или композицию вводят до, в ходе или после вакцинации. В некоторых вариантах осуществления модулятор сплайсинга, ADC или композицию и/или вакцину можно вводить один раз или больше одного раза на протяжении курса лечения. В некоторых вариантах осуществления вакцину вводят однократно, а модулятор сплайсинга, ADC или композицию затем в течение курса лечения вводят несколько раз. В некоторых вариантах осуществления вакцину вводят один раз, а затем в течение курса лечения вводится одна или несколько бустерных доз.
[869] Применяемый в данном документе термин "неоантигенная вакцина" относится к объединенному образцу из одного или нескольких иммуногенных неоантигенных пептидов или mRNA, например, по меньшей мере двух, по меньшей мере трех, по меньшей мере четырех, по меньшей мере пяти или более неоантигенных пептидов. Термин "вакцина" относится к композиции для развития иммунитета для профилактики и/или лечения заболевания (например, неопластического нарушения, например, гематологического злокачественного новообразования или солидной опухоли). Соответственно, вакцины представляют собой лекарственные препараты, которые содержат иммуногенные средства и предназначены для применения на человеке или животных для развития специфических механизмов иммунной защиты и образования защитных веществ после вакцинации. Неоантигенная вакцина может дополнительно включать фармацевтически приемлемый носитель, разбавитель, вспомогательное вещество и/или адъювант.
[870] Применяемый в данном документе термин "иммуногенный" относится к любому средству или композиции, которые могут вызывать иммунный ответ, например, T-клеточный ответ. Иммунный ответ может быть опосредован антителом, или клеткой, или обоими.
[871] В некоторых вариантах осуществления пациенту вводят модулятор сплайсинга, ADC или композицию, а затем вводят пептидную или mRNA-вакцину на основе известного неоантигена для усиления иммунного ответа на неоантигены, продуцируемые под действием модулятора сплайсинга, ADC или композиции. В некоторых вариантах осуществления пациенту вводят модулятор сплайсинга, ADC или композицию, а затем проводят скрининг на присутствие неoантигенов, продуцируемых как результат обработки. Следовательно, один или несколько из данных неоантигенов применяют для создания персонализированной вакцины, которую вводят пациенту. В одном из данных вариантов осуществления модулятор сплайсинга, ADC или композицию и/или пептид или mRNA-вакцину можно вводить пациенту однократно или повторно.
[872] В различных вариантах осуществления подходящий неоантиген для вакцины может быть идентифицирован посредством скрининга панели транскриптов с измененным сплайсингом и устойчивой экспрессией, полученных из одного или нескольких образцов ткани пациента (например, из биоптата опухоли). В некоторых вариантах осуществления последовательности вариантов белка идентифицируют в подвергнутом скринингу образце на основе трансляции вдоль соединения в подвергнутой аберрантному сплайсингу mRNA, при этом сохраняя части белковой последовательности (не более 12 аминокислот), фланкирующие изменения аминокислот, охватывающие соединение. В некоторых вариантах осуществления эти пептидные фрагменты, охватывающие границы сплайсинга, исследуют в отношении высокой аффинности связывания с аллелями MHC1, например, с применением такого средства, как NetMHC1 (Nielsen et al. (2003) Protein Sci 12(5):1007-17; Andreatta and Neilsen (2016) Bioinformatics 32(4):511-7). Эти результаты позволяют фильтровать неопептиды до неопептидов, которые, как прогнозируется, характеризуются с высокой аффинностью связывания с составом аллелей HLA, уникальным для пациента, а также собирать пулы неопептидов, которые, как прогнозируется, связываются с широким спектром аллелей HLA, присутствующих с высокой частотой в разных популяциях (Maiers et al. (2007) Hum Immunol 68(9):779-88). В различных вариантах осуществления идентифицированные неопептиды затем составляют в виде вакцины, например посредством конъюгации с подходящим носителем или адъювантом (Ott et al. (2017) Nature 547(7662):217-21), или для доставки в виде мРНК (Sahin et al. (2017) Nature 547(7662):222-6).
[873] В некоторых вариантах осуществления выбор неоантигена основан на скрининге ответа опухоли у отдельного пациента на воздействие модулятора сплайсинга, ADC или композиции с идентификацией одного или нескольких неоантигенов, образовавшихся под действием обработки, для применения в последующей вакцинации. В других вариантах осуществления неоантиген выбирают, например, на основе скрининга панели образцов, полученных от разных пациентов, для идентификации общих неоантигенов, продуцируемых под действием модулятора сплайсинга, ADC или композиции, а затем их применяют в качестве универсальной вакцины для будущих пациентов.
[874] Не ограничиваясь теорией, в некоторых вариантах осуществления применение универсальной неоантигенной вакцины позволит избежать необходимости в секвенировании и анализе уникального мутационного статуса опухоли каждого пациента, поскольку выбранные неоантигены не зависят от мутации в опухоли, а скорее имитируют неоантиген, продуцируемый под действием модулятора сплайсинга, ADC или композиции, и обычно распознаваемый организмом как чужеродный. Кроме того, в некоторых вариантах осуществления применение неоантигенной вакцины может быть особенно эффективным, поскольку опухолевые клетки пациента могут с большей вероятностью мутировать, не продуцируя один или несколько неоантигенов, которые зависят от мутации в опухоли, по сравнению с клетками, которые имитируют неоантиген, продуцируемый под действием модулятора сплайсинга, ADC или композиции. Это может создавать возможность составления основной вакцины, которая будет характеризоваться широким охватом иммуногенности для большого процента пациентов, ускоряя начало схемы лечения. Пациентов можно вакцинировать согласно схемам, изложенным в данном документе, и перед следующим завершением вакцинации можно дополнительно подвергать лечению с использованием модулятора сплайсинга, ADC или композиции, например, для индуцирования экспрессии неоантигенных пептидов. В некоторых вариантах осуществления пациентам можно вводить модулятор сплайсинга, ADC или композицию до вакцинации или одновременно с ней. В некоторых вариантах осуществления пациентам вводят модулятор сплайсинга, ADC или композицию, у которых был проведен скрининг в отношении одного или нескольких неоантигенов, обнаруженных в панели универсальных неоантигенов, и их вакцинируют универсальной неоантигенной вакциной, содержащей по меньшей мере один универсальный неоантиген, идентифицированный у субъекта. В некоторых вариантах осуществления пациентам можно вводить модулятор сплайсинга, ADC или композицию один или несколько раз после вакцинации. Модулятор сплайсинга, или ADC, или композицию и/или вакцину можно вводить один раз или больше одного раза на протяжении курса лечения.
[875] В некоторых вариантах осуществления вакцина может содержать один или более одного неоантигенного пептида или мРНК. В различных вариантах осуществления вакцина может содержать один или более одного длинного неоантигенного пептида. В различных вариантах осуществления такие "длинные" неоантигенные пептиды подвергаются эффективной интернализации, процессингу и перекрестной презентации в специализированных антигенпрезентирующих клетках, таких как дендритные клетки. Подобным образом, в других контекстах было показано, что длинные вакцинные пептиды индуцируют цитотоксические T-клетки у человека (Melief and van der Burg (2008) Nat Rev Cancer 8(5):351-60). В различных вариантах осуществления неоантигенный пептид является удлиненным с включением собственно последовательности неоантигенного пептида в дополнение к фланкирующим аминокислотным последовательностям. В различных вариантах осуществления удлиненная пептидная последовательность облегчает захват белка антигенпрезентирующими клетками, например, дендритными клетками. В различных вариантах осуществления удлиненная пептидная последовательность обеспечивает эффективную презентацию антигена и примирование T-клеток в моделях с разными изотипами HLA. В различных вариантах осуществления более длинный неоантигенный пептид и/или удлиненная пептидная последовательность проявляют повышенным захват антигенпрезентирующими клетками (например, дендритными клетками), повышенную презентацию антигена и/или повышенное примирование T-клеток по сравнению с более коротким неоантигенным пептидом и/или более короткой пептидной последовательностью (например, с пептидной последовательностью, длина которой составляет менее приблизительно 10 или менее приблизительно 5 аминокислот). В некоторых вариантах осуществления длина длинного неоантигенного пептида находится в диапазоне от приблизительно 5 до приблизительно 50 аминокислот. В некоторых вариантах осуществления длина длинного неоантигенного пептида находится в диапазоне от приблизительно 10 до приблизительно 50 аминокислот. В некоторых вариантах осуществления длина длинного неоантигенного пептида находится в диапазоне от приблизительно 10 до приблизительно 35 аминокислот. В некоторых вариантах осуществления длина длинного неоантигенного пептида находится в диапазоне от приблизительно 15 до приблизительно 25 аминокислот. Аминокислотные последовательности иллюстративных длинных неоантигенных пептидов представлены в таблице 21.
[876] Применяемые в данном документе "неоантигенный пептид" или "mRNA-вакцина" охватывают применение фрагмента неоантигенного пептида или кодирующей его mRNA, при условии, что данный фрагмент сохраняет иммуногенный потенциал.
[877] В некоторых вариантах осуществления неоантигенная вакцина содержит по меньшей мере один неоантигенный пептид. В некоторых вариантах осуществления неоантигенная вакцина содержит по меньшей мере 2, по меньшей мере 3, по меньшей мере 4, по меньшей мере 5, по меньшей мере 6, по меньшей мере 7, по меньшей мере 8, по меньшей мере 9, по меньшей мере 10, по меньшей мере 12, по меньшей мере 15 или по меньшей мере 20 неоантигенных пептидов. В некоторых вариантах осуществления длина неоантигенного(-ых) пептида(-ов) находится в диапазоне от приблизительно 5 до приблизительно 50 аминокислот. В некоторых вариантах осуществления длина неоантигенного(-ых) пептида(-ов) находится в диапазоне от приблизительно 10 до приблизительно 50 аминокислот. В некоторых вариантах осуществления длина неоантигенного(-ых) пептида(-ов) находится в диапазоне от приблизительно 10 до приблизительно 35 аминокислот. В некоторых вариантах осуществления длина неоантигенного(-ых) пептида(-ов) находится в диапазоне от приблизительно 15 до приблизительно 25 аминокислот.
[878] В различных вариантах осуществления по настоящему изобретению представлен способ лечения субъекта, у которого имеется неопластическое нарушение или подозрение на его наличие, посредством введения субъекту эффективного количества модулятора сплайсинга, ADC или композиции, содержащей модулятор сплайсинга или ADC; и неоантигенной вакцины. Неоантигенная вакцина может представлять собой, например, пептидную неоантигенную вакцину или неоантигенную mRNA-вакцину. В некоторых вариантах осуществления модулятор сплайсинга, ADC или композицию вводят до введения неоантигенной вакцины. В некоторых вариантах осуществления модулятор сплайсинга, ADC или композицию вводят после введения неоантигенной вакцины. В некоторых вариантах осуществления модулятор сплайсинга, ADC или композицию вводят одновременно с введением неоантигенной вакцины. В некоторых вариантах осуществления введение модулятора сплайсинга, ADC или композиции повторяют по меньшей мере один раз после начального введения. В некоторых вариантах осуществления количество модулятора сплайсинга, ADC или композиции, применяемое для повторного введения, снижено по сравнению с количеством, применяемым для начального введения.
[879] В различных вариантах осуществления настоящего изобретения дополнительно представлена комбинация, содержащая модулятор сплайсинга, ADC или композицию, содержащую модулятор сплайсинга или ADC; и неоантигенную вакцину (например, универсальную неоантигенную вакцину), предназначенная для применения в лечении субъекта, у которого имеется неопластическое нарушение или с подозрением на его наличие. В некоторых вариантах осуществления неоантигенная вакцина представляет собой пептидную неоантигенную вакцину или неоантигенную mRNA-вакцину. В некоторых вариантах осуществления комбинация дополнительно содержит по меньшей мере одно дополнительное средство терапии. В некоторых вариантах осуществления по меньшей мере одно дополнительное средство терапии предусматривает по меньшей мере одно, по меньшей мере два, по меньшей мере три, по меньшей мере четыре или по меньшей мере пять дополнительных средств терапии.
[880] В различных вариантах осуществления настоящего изобретения дополнительно представлен способ лечения субъекта, у которого имеется неопластическое нарушение или с подозрением на его наличие, посредством (a) введения субъекту эффективного количества модулятора сплайсинга, ADC или композиции, содержащей модулятор сплайсинга или ADC; (b) выявления одного или нескольких неоантигенов у субъекта после введения модулятора сплайсинга, ADC или композиции; (c) сравнения одного или нескольких неоантигенов с панелью универсальных неоантигенов и (d) введения субъекту универсальной неоантигенной вакцины, содержащей по меньшей мере один универсальный неоантиген, присутствующий у субъекта. В некоторых вариантах осуществления универсальную неоантигенную вакцину вводят по отдельности или в комбинации с по меньшей мере одним дополнительным средством терапии. В некоторых вариантах осуществления по меньшей мере одно дополнительное средство терапии предусматривает по меньшей мере одно, по меньшей мере два, по меньшей мере три, по меньшей мере четыре или по меньшей мере пять дополнительных средств терапии.
[881] В некоторых вариантах осуществления по меньшей мере одна дополнительная терапия предусматривает введение модулятора сплайсинга, ADC или композиции. В некоторых вариантах осуществления повторное введение модулятора сплайсинга, ADC или композиции начинают после введения универсальной неоантигенной вакцины. В некоторых вариантах осуществления повторное модулятора сплайсинга, ADC или композиции начинают после введения универсальной неоантигенной вакцины. В некоторых вариантах осуществления повторное введение модулятора сплайсинга, ADC или композиции начинают одновременно с введением универсальной неоантигенной вакцины. В некоторых вариантах осуществления количество модулятора сплайсинга, ADC или композиции, применяемое для повторного введения, снижено по сравнению с количеством, применяемым для начального введения. В некоторых вариантах осуществления количество модулятора сплайсинга, ADC или композиции, применяемое для начального и/или повторного введения, снижено по сравнению со стандартной дозировкой модулятора сплайсинга, ADC или композиции в случае применения в отсутствие лечения с помощью вакцины. В некоторых вариантах осуществления количество модулятора сплайсинга, ADC или композиции, применяемое для начального и/или повторного введения, снижено на 10%, 15%, 20%, 25%, 30%, 35%, 40%, 45%, 50%, 75%, или 90% по сравнению со стандартной дозировкой модулятора сплайсинга, ADC или композиции.
[882] В некоторых вариантах осуществления по меньшей мере одно дополнительное средство терапии предусматривает введение ингибитора контрольных точек (например, любого из иллюстративных ингибиторов контрольных точек, описанных в данном документе). В некоторых вариантах осуществления введение ингибитора контрольных точек начинают до введения универсальной неоантигенной вакцины и/или повторного введения модулятора сплайсинга, ADC или композиции. В некоторых вариантах осуществления введение ингибитора контрольных точек начинают после введения универсальной неоантигенной вакцины и/или повторного модулятора сплайсинга, ADC или композиции. В некоторых вариантах осуществления введение ингибитора контрольных точек начинают одновременно с введением универсальной неоантигенной вакцины и/или повторным введением модулятора сплайсинга, ADC или композиции. В некоторых вариантах осуществления введение ингибитора контрольных точек повторяют по меньшей мере один раз после начального введения. В некоторых вариантах осуществления количество ингибитора контрольных точек, применяемое для повторного введения, снижено по сравнению с количеством, применяемым для начального введения. В некоторых вариантах осуществления количество ингибитора контрольных точек, применяемое для повторного введения, снижено по сравнению со стандартной дозировкой ингибитора контрольных точек. В некоторых вариантах осуществления количество ингибитора контрольных точек, применяемое для повторного введения, снижено на 10%, 15%, 20%, 25%, 30%, 35%, 40%, 45%, 50%, 75%, или 90% по сравнению со стандартной дозировкой ингибитора контрольных точек. В некоторых вариантах осуществления субъект характеризуется непереносимостью, невосприимчивостью или недостаточной восприимчивостью к ингибитору контрольных точек при введении его по отдельности.
[883] В различных вариантах осуществления в данном документе также представлены неоантигенные вакцины, содержащие по меньшей мере один неоантигенный пептид или по меньшей мере одну неоантигенную mRNA. В некоторых вариантах осуществления неоантигенная вакцина содержит по меньшей мере один неоантигенный пептид. В некоторых других вариантах осуществления неоантигенная вакцина содержит по меньшей мере одну неоантигенную mRNA.
[884] Также в данном документе в различных вариантах осуществления представлены наборы, содержащие модулятор сплайсинга, ADC или композицию, содержащую модулятор сплайсинга или ADC; и неоантигенную вакцину (например, универсальную неоантигенную вакцину). В некоторых вариантах осуществления неоантигенная вакцина представляет собой пептидную неоантигенную вакцину или неоантигенную mRNA-вакцину. В некоторых вариантах осуществления набор дополнительно содержит один или несколько дополнительных компонентов, включающих без ограничения: инструкции для применения; другие средства, например, одно или несколько дополнительных терапевтических средств; устройства, контейнеры или другие материалы, предназначенные для получение модулятора сплайсинга, ADC, композиции и/или неоантигенной вакцины для терапевтического введения; фармацевтически приемлемые носители и устройства, контейнеры или другие материалы для введения модулятора сплайсинга, ADC, композиции и/или неоантигенной вакцины пациенту. Инструкции по применению могут включать руководство для терапевтических применений, в том числе предполагаемые дозировки и/или режимы введения, например, для пациента, у которого имеется неопластическое нарушение или подозрение на его наличие. В различных вариантах осуществления набор дополнительно содержит инструкции для терапевтического применения, например, применения модулятора сплайсинга, ADC или композиции и неоантигенной вакцины для лечения или предупреждения неопластического нарушения у пациента. В различных вариантах осуществления набор дополнительно содержит по меньшей мере одно дополнительное терапевтическое средство (например, предназначенное для введения вместе с модулятором сплайсинга, ADC или композицией и неоантигенной вакциной, например, ингибитором контрольных точек). В различных вариантах осуществления модулятор сплайсинга, ADC, композиция и/или неоантигенная вакцина составлены в фармацевтическую композицию.
[885] В некоторых вариантах осуществления способов и композиций, раскрытых в данном документе, неоантигенная вакцина содержит по меньшей мере один неоантигенный пептид. В некоторых вариантах осуществления длина по меньшей мере одного неоантигенного пептида находится в диапазоне от приблизительно 10 до приблизительно 50 аминокислот. В некоторых вариантах осуществления длина по меньшей мере одного неоантигенного пептида находится в диапазоне от приблизительно 10 до приблизительно 35 аминокислот. В некоторых вариантах осуществления длина по меньшей мере одного неоантигенного пептида находится в диапазоне от приблизительно 15 до приблизительно 25 аминокислот.
[886] В некоторых вариантах осуществления по меньшей мере один неоантигенный пептид содержит одну или более чем одну неоантигенную последовательность. В некоторых вариантах осуществления неоантигенная последовательность содержит аминокислотную последовательность под любым из SEQ ID NO: 37-65. В некоторых вариантах осуществления неоантигенная последовательность содержит аминокислотную последовательность под SEQ ID NO: 37. В некоторых вариантах осуществления неоантигенная последовательность содержит аминокислотную последовательность под SEQ ID NO: 39. В некоторых вариантах осуществления неоантигенная последовательность содержит аминокислотную последовательность под любым из SEQ ID NO: 46-49.
[887] В некоторых других вариантах осуществления неоантигенная последовательность содержит аминокислотную последовательность под любым из SEQ ID NO: 66-93 или антигенную часть под любым из SEQ ID NO: 66-93. В некоторых вариантах осуществления неоантигенная последовательность содержит аминокислотную последовательность под SEQ ID NO: 66 или антигенную часть под SEQ ID NO: 66. В некоторых вариантах осуществления неоантигенная последовательность содержит аминокислотную последовательность под любым из SEQ ID NO: 74-77 или антигенную часть под любым из SEQ ID NO: 74-77. В некоторых вариантах осуществления длина неоантигенной последовательности и/или антигенной части находится в диапазоне от приблизительно 10 до приблизительно 50 аминокислот. В некоторых вариантах осуществления длина неоантигенной последовательности и/или антигенной части находится в диапазоне от приблизительно 10 до приблизительно 35 аминокислот. В некоторых вариантах осуществления длина неоантигенной последовательности и/или антигенной части находится в диапазоне от приблизительно 15 до приблизительно 25 аминокислот. В некоторых вариантах осуществления длина неоантигенной последовательности и/или антигенной части находится в диапазоне от приблизительно 10 до приблизительно 20 аминокислот. В некоторых вариантах осуществления неоантигенная последовательность и/или антигенная часть непосредственно не перекрываются с канонической пептидной последовательностью (например, любой из иллюстративных канонических пептидных последовательностей, подчеркнутых в таблице 21) или не состоят из нее.
[888] В некоторых вариантах осуществления неоантигенная последовательность представляет собой неоантигенную последовательность, специфическую для субъекта. В некоторых вариантах осуществления неоантигенная последовательность представляет собой персонализированную неоантигенную вакцину для субъекта. В некоторых вариантах осуществления неоантигенная последовательность способна связываться с по меньшей мере одним аллелем HLA, экспрессируемым у субъекта.
[889] В некоторых других вариантах осуществления неоантигенная последовательность представляет собой универсальную неоантигенную последовательность. В некоторых вариантах осуществления неоантигенная последовательность представляет собой универсальную неоантигенную вакцину. В некоторых вариантах осуществления неоантигенная последовательность способна связываться с по меньшей мере одним аллелем HLA, экспрессируемым у по меньшей мере 10%, по меньшей мере 15%, по меньшей мере 20%, по меньшей мере 25%, по меньшей мере 30%, по меньшей мере 35%, по меньшей мере 40% или по меньшей мере 45% субъектов в популяции субъектов, страдающих неопластическим нарушением. В некоторых вариантах осуществления неоантигенная последовательность способна вызывать T-клеточный ответ на опухоль, присутствующую у по меньшей мере 1%, по меньшей мере 5% или по меньшей мере 10% популяции субъектов, страдающих неопластическим нарушением.
[890] В некоторых вариантах осуществления неоантигенная последовательность была идентифицирована посредством секвенирования по меньшей мере одного неоантигенного пептида, образование которого индуцировано у субъекта посредством введения эффективного количества модулятора сплайсинга, конъюгата антитела и лекарственного средства или композиции. В некоторых вариантах осуществления по меньшей мере один неоантигенный пептид содержит неоантигенную последовательность, образование которой индуцировано путем приведения неопластической клетки в контакт с эффективным количеством модулятора сплайсинга, конъюгата антитела и лекарственного средства или композиции. В некоторых вариантах осуществления неопластическая клетка находится в культуре клеток in vitro. В некоторых вариантах осуществления неопластическая клетка получена от субъекта. В некоторых вариантах осуществления неопластическая клетка находится в субъекте.
[891] В некоторых вариантах осуществления неоантигенная вакцина содержит по меньшей мере один неоантигенный пептид или mRNA и фармацевтически приемлемый носитель. В некоторых вариантах осуществления неоантигенный пептид или mRNA могут быть присоединены к подходящему носителю, что способствует развитию иммунного ответа. Иллюстративные носители для связывания с иммуногенными средствами (например, неоантигенным пептидом или mRNA) включают сывороточные альбумины, гемоцианин фисуреллы, молекулы иммуноглобулина, тиреоглобулин, овальбумин, столбнячный анатоксин или анатоксин из других патогенных бактерий, таких как бактерии, вызывающие дифтерию, E. coli, бактерии, вызывающие холеру, или H. pylori, или аттенуированное производное токсина. Другие носители для стимуляции или усиления иммунного ответа включают цитокины, такие как IL-1, α- и β-пептиды IL-1, IL-2, γINF, IL-10, GM-CSF и хемокины, такие как M1P1α и β и RANTES. Иммуногенные средства также можно присоединять к пептидам, которые усиливают транспорт через ткани, как описано, например, в WO 97/17613 и WO 97/17614. В некоторых вариантах осуществления фармацевтически приемлемый носитель выбран из пептида, сывороточного альбумина, гемоцианина фисуреллы, иммуноглобулина, тиреоглобулина, овальбумина, анатоксина или аттенуированного производного анатоксина, цитокина и хемокина.
[892] В некоторых вариантах осуществления неоантигенный пептид или mRNA могут быть присоединены к фармацевтически приемлемому носителю. Иммуногенные средства могут быть присоединены к носителями с помощью химической сшивки. Методики присоединения иммуногенного пептида к носителю включают образование дисульфидных связей с применением N-сукцинимидил-3-(2-пиридилтио)пропионата (SPDP) и сукцинимидил-4-(N-малеимидометил)циклогексан-1-карбоксилата (SMCC) (если в пептиде отсутствует сульфгидрильная группа, это можно осуществлять посредством добавления остатка цистеина). Эти реагенты образуют дисульфидную связь между собой и остатками цистеина в пептиде на одном белке и амидную связь через эпсилон-аминогруппу на лизине или другую свободную аминогруппу в других аминокислотах. Целый ряд таких образующих дисульфидные/амидные связи средств описано в Jansen et al. ((1982) Immun Rev. 62:185). Другие бифункциональные средства для сочетания образуют тиоэфирную связь, вместо дисульфидной связи. Множество этих средств, образующих тиоэфирную связь, коммерчески доступны и включают реакционноспособные сложные эфиры 6-малеимидокапроновой кислоты, 2-бромуксусной кислоты и 2-йодуксусной кислоты, 4-(N-малеимидометил)циклогексан-1-карбоновую кислоту. Карбоксильные группы могут быть активированными посредством объединения их с сукцинимидом или натриевой солью 1-гидроксил-2-нитро-4-сульфоновой кислоты. В некоторых вариантах осуществления неоантигенный пептид и фармацевтически приемлемый носитель ковалентно связаны через линкер.
[893] Неоантиген и другие такие иммуногенные пептиды также могут экспрессироваться в виде слитых белков с носителями. Иммуногенный пептид может быть присоединен по амино-концу, карбокси-концу или в любом участке в пределах пептида (внутреннем) к носителю. В некоторых вариантах осуществления в слитом белке могут присутствовать несколько повторов иммуногенного пептида. В некоторых вариантах осуществления неоантигенный пептид и фармацевтически приемлемый носитель экспрессируются в виде слитого белка.
[894] В некоторых вариантах осуществления неоантигенная вакцина содержит по меньшей мере один неоантигенный пептид или кодирующую его mRNA и фармацевтически приемлемый разбавитель. В некоторых вариантах осуществления неоантигенная вакцина содержит по меньшей мере один неоантигенный пептид или кодирующую его mRNA и фармацевтически приемлемый адъювант (например, адъювант, описанный в данном документе).
[895] В некоторых вариантах осуществления способов и композиций, раскрытых в данном документе, неоантигенная вакцина содержит по меньшей мере одну неоантигенную mRNA. В некоторых вариантах осуществления по меньшей мере одна неоантигенная mRNA кодирует одну или более одной неоантигенной последовательности. В некоторых вариантах осуществления неоантигенная последовательность содержит аминокислотную последовательность под любым из SEQ ID NO: 37-65. В некоторых вариантах осуществления неоантигенная последовательность содержит аминокислотную последовательность под SEQ ID NO: 37. В некоторых вариантах осуществления неоантигенная последовательность содержит аминокислотную последовательность под SEQ ID NO: 39. В некоторых вариантах осуществления неоантигенная последовательность содержит аминокислотную последовательность под любым из SEQ ID NO: 46-49.
[896] В некоторых других вариантах осуществления неоантигенная последовательность содержит аминокислотную последовательность под любым из SEQ ID NO: 66-93 или антигенную часть под любым из SEQ ID NO: 66-93. В некоторых вариантах осуществления неоантигенная последовательность содержит аминокислотную последовательность под SEQ ID NO: 66 или антигенную часть под SEQ ID NO: 66. В некоторых вариантах осуществления неоантигенная последовательность содержит аминокислотную последовательность под любым из SEQ ID NO: 74-77 или антигенную часть под любым из SEQ ID NO: 74-77. В некоторых вариантах осуществления длина неоантигенной последовательности и/или антигенной части находится в диапазоне от приблизительно 10 до приблизительно 50 аминокислот. В некоторых вариантах осуществления длина неоантигенной последовательности и/или антигенной части находится в диапазоне от приблизительно 10 до приблизительно 35 аминокислот. В некоторых вариантах осуществления длина неоантигенной последовательности и/или антигенной части находится в диапазоне от приблизительно 15 до приблизительно 25 аминокислот. В некоторых вариантах осуществления длина неоантигенной последовательности и/или антигенной части находится в диапазоне от приблизительно 10 до приблизительно 20 аминокислот. В некоторых вариантах осуществления неоантигенная последовательность и/или антигенная часть непосредственно не перекрываются с канонической пептидной последовательностью (например, любой из иллюстративных канонических пептидных последовательностей, подчеркнутых в таблице 21) или не состоят из нее.
[897] В некоторых вариантах осуществления неоантигенная последовательность представляет собой неоантигенную последовательность, специфическую для субъекта. В некоторых вариантах осуществления неоантигенная последовательность представляет собой персонализированную неоантигенную вакцину для субъекта. В некоторых вариантах осуществления неоантигенная последовательность способна связываться с по меньшей мере одним аллелем HLA, экспрессируемым у субъекта.
[898] В некоторых других вариантах осуществления неоантигенная последовательность представляет собой универсальную неоантигенную последовательность. В некоторых вариантах осуществления неоантигенная последовательность представляет собой универсальную неоантигенную вакцину. В некоторых вариантах осуществления неоантигенная последовательность способна связываться с по меньшей мере одним аллелем HLA, экспрессируемым у по меньшей мере 10%, по меньшей мере 15%, по меньшей мере 20%, по меньшей мере 25%, по меньшей мере 30%, по меньшей мере 35%, по меньшей мере 40% или по меньшей мере 45% субъектов в популяции субъектов, страдающих неопластическим нарушением. В некоторых вариантах осуществления неоантигенная последовательность способна вызывать T-клеточный ответ на опухоль, присутствующую у по меньшей мере 1%, по меньшей мере 5% или по меньшей мере 10% популяции субъектов, страдающих неопластическим нарушением.
[899] В некоторых вариантах осуществления неоантигенная последовательность была идентифицирована посредством секвенирования по меньшей мере одной mRNA, образование которой индуцировано у субъекта посредством введения эффективного количества модулятора сплайсинга, конъюгата антитела и лекарственного средства или композиции. В некоторых вариантах осуществления по меньшей мере одна неоантигенная mRNA кодирует неоантигенную последовательность, образование которой индуцировано путем приведения неопластической клетки в контакт с эффективным количеством модулятора сплайсинга, конъюгата антитела и лекарственного средства или композиции. В некоторых вариантах осуществления неопластическая клетка находится в культуре клеток in vitro. В некоторых вариантах осуществления неопластическая клетка получена от субъекта. В некоторых вариантах осуществления неопластическая клетка находится в субъекте.
[900] В некоторых вариантах осуществления неоантигенная вакцина содержит по меньшей мере одну неоантигенную mRNA и фармацевтически приемлемый носитель. В некоторых вариантах осуществления по меньшей мере одна неоантигенная mRNA связана с фармацевтически приемлемым носителем. В некоторых вариантах осуществления фармацевтически приемлемый носитель выбран из пептида, сывороточного альбумина, гемоцианина фисуреллы, иммуноглобулина, тиреоглобулина, овальбумина, анатоксина или аттенуированного производного анатоксина, цитокина и хемокина.
[901] В некоторых вариантах осуществления неоантигенная вакцина содержит по меньшей мере одну неоантигенную mRNA и фармацевтически приемлемый разбавитель. В некоторых вариантах осуществления неоантигенная вакцина содержит по меньшей мере одну неоантигенную mRNA и фармацевтически приемлемый адъювант (например, адъювант, описанный в данном документе).
[902] В некоторых вариантах осуществления неоантигенная mRNA инкапсулирована с помощью инкапсулирующего средства. В некоторых вариантах осуществления инкапсулирующее средство защищает неоантигенную mRNA от разрушения и улучшает доставку вакцины (McNamara et al. (2015) J Immunol Res. 2015:794528). В некоторых вариантах осуществления инкапсулирующее средство представляет собой липосому. В некоторых вариантах осуществления липосома представляет собой катионную липосому, такую как N-[1-(2,3-диолеолокси)пропил]-N,N,N-триметиламмония хлорид 1 (DOTAP). В некоторых вариантах осуществления инкапсулирующее средство представляет собой наночастицу. В некоторых вариантах осуществления наночастица защищает неоантигенную mRNA от разрушения нуклеазой и/или улучшает захват клеткой и/или эффективность доставки. В некоторых вариантах осуществления наночастица может быть сконструирована таким образом, что она является полностью разлагаемой. В некоторых вариантах осуществления наночастица представляет собой биоразлагаемую наночастицу со структурой ядро-оболочка, содержащую pH-чувствительное ядро из сложного поли(b-аминоэфира) (PBAE), заключенного в фосфолипидную оболочку (Su et al. (2011) Mol Pharm. 8(3):774-87). В некоторых вариантах осуществления такие наночастицы являются особенно эффективными в доставке mRNA in vivo и развитии противоопухолевого иммунного ответа.
[903] В некоторых вариантах осуществления субъект характеризуется мутационной нагрузкой с несинонимичными изменениями, составляющей приблизительно 150 мутаций или меньше. В некоторых вариантах осуществления субъект характеризуется мутационной нагрузкой с несинонимичными изменениями, составляющей приблизительно 100 мутаций или меньше. В некоторых вариантах осуществления субъект характеризуется мутационной нагрузкой с несинонимичными изменениями, составляющей приблизительно 50 мутаций или меньше. В некоторых вариантах осуществления субъект имеет неопластическое нарушение, например, гематологическое злокачественное новообразование или солидную опухоль, или имеет подозрение на его наличие. В некоторых вариантах осуществления гематологическое злокачественное новообразование выбрано из B-клеточного злокачественного новообразования, лейкоза, лимфомы и миеломы. В некоторых вариантах осуществления гематологическое злокачественное новообразование выбрано из острого миелоидного лейкоза и множественной миеломы. В некоторых вариантах осуществления солидная опухоль выбрана из рака молочной железы, рака желудка, рака предстательной железы, рака яичника, рака легкого, рака матки, карциномы слюнных протоков, меланомы, рака толстой кишки, рака шейки матки, рака поджелудочной железы, рака почки, колоректального рака и рака пищевода. В некоторых вариантах осуществления солидная опухоль выбрана из HER2-положительного рака молочной железы, аденокарциномы желудка, рака предстательной железы и остеосаркомы.
[904] Применяемый в данном документе термин "адъювант" относится к веществу, которое способно увеличивать, усиливать или модулировать иммунный ответ на сопутствующее иммуногенное средство, например, неоантигенный пептид или mRNA. В определенных вариантах осуществления неоантиген по настоящему изобретению можно вводить в комбинации с адъювантами, т. е. веществами, которые сами по себе не вызывают адаптивные иммунные ответы, но усиливают или модулируют ответ на сопутствующий неоантиген. Целый ряд адъювантов может применяться в комбинации с раскрытыми неоантигенами, чтобы обеспечивать развитие иммунного ответа. В некоторых вариантах осуществления адъювант(-ы) выбран(-ы) для повышения свойственного ответа на неоантиген, при этом они не вызывают конформационные изменения неоантигена, которые будут влиять на качественную форму ответа. В некоторых вариантах осуществления адъювант(-ы) выбран(-ы) для усиления примирования и/или активации эффекторных T-клеток (например, CD8).
[905] В определенных вариантах осуществления адъювант представляет собой соль алюминия (квасцы), такие как гидроксид алюминия, фосфат алюминия и сульфат алюминия. Такие адъюванты можно применять с другими специфическими иммуностимулирующими средствами, такими как 3-O-деацилированный монофосфориллипид A (MPL) или 3-DMP, полимерные или мономерные аминокислоты, такие как полиглутаминовая кислота или полилизин, или без них. Такие адъюванты могут применяться с другими конкретными иммуностимулирующими средствами, такими как мурамилпептиды (например, N-ацетилмурамил-L-треонил-D-изоглутамин (thr-MDP), N-ацетилнормурамил-L-аланил-D-изоглутамин (nor-MDP), N-ацетилмурамил-L-аланил-D-изоглутаминил-L-аланин-2-(1′-2′-дипальмитоил-sn-глицеро-3-гидроксифосфорилокси)-этиламин (MTP-PE), N-ацетилглюкозаминил-N-ацетилмурамил-L-Al-D-изоглю-L-Ala-дипальмитоксипропиламид (DTP-DPP)), или другими компонентами бактериальной клеточной стенки, или без них. Другие адъюванты представляют собой эмульсии типа "масло в воде" и включают (a) MF59 (WO 90/14837), содержащий 5% сквалена, 0,5% Tween 80 и 0,5% Span 85 (необязательно содержащий различные количества MTP-PE), составленный в субмикронные частицы с применением микрофлюидайзера, такого как микрофлюидайзер модели 110Y (Microfluidics), (b) SAF, содержащий 10% сквалена, 0,4% Tween 80, 5% блок-полимера Pluronic L121 и thr-MDP, либо микрофлюидизированный в субмикронную эмульсию, либо перемешанный на вортексе с образованием эмульсии с частицами большего размера, и (c) адъювантную систему Ribi™ (RAS), (Ribi ImmunoChem), содержащую 2% сквалена, 0,2% Tween 80 и один или несколько компонентов бактериальной клеточной стенки из группы, состоящей из монофосфориллипида A (MPL), димиколата трегалозы (TDM) и каркаса клеточной стенки (CWS), например MPL-FCWS (Detox™). В некоторых вариантах осуществления адъювант представляет собой сапонин, такой как Stimulon™ (QS21), или частицы, образованные из него, такие как ISCOM (иммуностимулирующие комплексы) и ISCOMATRIX. Другие адъюванты включают полный адъювант Фрейнда (CFA) и неполный адъювант Фрейнда(IFA), цитокины, такие как интерлейкины (IL-1, IL-2 и IL-12), колониестимулирующий фактор макрофагов (M-CSF) и фактор некроза опухоли (TNF).
[906] Адъювант можно вводить с иммуногенным средством (например, неоантигенным пептидом или mRNA) в виде одной композиции или его можно вводить до введения иммуногенного средства, одновременно с ним или после него. В некоторых вариантах осуществления иммуногенное средство и адъювант могут быть упакованы и поставлены в одном и том же флаконе или могут быть упакованы в отдельные флаконы и смешиваться перед применением. В некоторых вариантах осуществления иммуногенное средство и адъювант могут быть упакованы с маркировкой, указывающей на предполагаемое терапевтическое применение. В некоторых вариантах осуществления, если иммуногенное средство и адъювант упакованы по отдельности, упаковка может включать инструкции по смешиванию перед применением. Выбор адъюванта и/или носителя зависит от стабильности иммуногенного состава, содержащего адъювант, пути введения, схемы дозирования, эффективности адъюванта для вида животных, подлежащего вакцинации, и для человека, при этом фармацевтически приемлемый адъювант представляет собой адъювант, который был одобрен или может быть одобрен соответствующими регулирующими органами для введения человеку. Например, полный адъювант Фрейнда не подходит для введения человеку. Однако квасцы, MPL или неполный адъювант Фрейнда (Chang et al. (1998) Adv Drug Deliv Rev. 32:173-186) по отдельности или необязательно в комбинации с любыми из квасцов, QS21 и MPL и все их комбинации подходят для введения человеку.
[907] В различных вариантах осуществления в настоящем изобретении дополнительно представлены способы скрининга и идентификации по меньшей мере одного неоантигена. Более конкретно в различных вариантах осуществления настоящего изобретения представлен способ идентификации по меньшей мере одного неоантигена посредством (a) приведения в контакт неопластической клетки с эффективным количеством модулятора сплайсинга, ADC или композиции, содержащей модулятор сплайсинга или ADC; (b) выявления по меньшей мере одного подвергнутого альтернативному сплайсингу транскрипта mRNA после приведения в контакт неопластической клетки с модулятором сплайсинга, ADC или композицией; (c) прогнозирования трансляции по меньшей мере одного подвергнутого альтернативному сплайсингу транскрипта mRNA в по меньшей мере один пептид; и (d) сравнения по меньшей мере одного пептида с эталонным протеомом, где по меньшей мере один неоантиген идентифицируют, если по меньшей мере один пептид не совпадает с какими-либо пептидами в эталонном протеоме. В различных вариантах осуществления способ дополнительно предусматривает приведение в контакт одной или нескольких дополнительных неопластических клеток для идентификации по меньшей мере одного универсального неоантигена. В различных вариантах осуществления способ повторяют для одной или нескольких дополнительных неопластических клеток или одного или нескольких образцов (например, биоптата ткани) для подтверждения подходящих неоантигенов (например, для применения в неоантигенной вакцине) и/или для идентификации одного или нескольких универсальных неоантигенов.
[908] В различных вариантах осуществления настоящего изобретения представлен способ идентификации по меньшей мере одного неоантигена посредством (a) приведения в контакт неопластической клетки с эффективным количеством модулятора сплайсинга, ADC или композиции, содержащей модулятор сплайсинга или ADC; (b) выявления по меньшей мере одного пептида, содержащего потенциальную неоантигенную последовательность, после приведения в контакт неопластической клетки с модулятором сплайсинга, ADC или композицией; и (c) сравнения по меньшей мере одного пептида с эталонным протеомом, где по меньшей мере один неоантиген идентифицируют, если по меньшей мере один пептид не совпадает с какими-либо пептидами в эталонном протеоме. В различных вариантах осуществления способ дополнительно предусматривает приведение в контакт одной или нескольких дополнительных неопластических клеток для идентификации по меньшей мере одного универсального неоантигена. В различных вариантах осуществления способ повторяют для одной или нескольких дополнительных неопластических клеток или одного или нескольких образцов (например, биоптата ткани) для подтверждения подходящих неоантигенов (например, для применения в неоантигенной вакцине) и/или для идентификации одного или нескольких универсальных неоантигенов.
[909] В некоторых вариантах осуществления способов идентификации неоантигена, описанных в данном документе, обнаружение по меньшей мере одно подвергнутого альтернативному сплайсингу транскрипта mRNA предусматривает RNAseq. В некоторых вариантах осуществления прогнозирование трансляции по меньшей мере одного подвергнутого альтернативному сплайсингу транскрипта mRNA предусматривает количественное определение изменения в виде значения процента успешного включения при сплайсинге (dPSI) для по меньшей мере одного транскрипта. В некоторых вариантах осуществления прогнозирование трансляции по меньшей мере одного подвергнутого альтернативному сплайсингу транскрипта mRNA предусматривает RiboSeq и/или рибосомный профилинг.
[910] В некоторых вариантах осуществления способов идентификации неоантигена, описанных в данном документе, способы дополнительно включают оценку по меньшей мере одного пептида в отношении прогнозируемого связывания с молекулами главного комплекса гистосовместимости (MHC). В некоторых вариантах осуществления прогнозируемое связывание с молекулами MHC определяют путем измерения прогнозируемой прочности связывания на основе исходной аффинности для по меньшей мере одного пептида. В некоторых вариантах осуществления прогнозируемая прочность связывания на основе исходной аффинности, которая составляет приблизительно 500 нМ или больше, указывает на связывание с молекулами MHC. В некоторых вариантах осуществления прогнозируемое связывание с молекулами MHC определяют посредством идентификации распределения значений прогнозируемой прочности связывания для серии случайных пептидов и сравнения прогнозируемой прочности связывания по меньшей мере одного пептида с данным распределением. В некоторых вариантах осуществления прогнозируемая прочность связывания в верхних 2,0% распределения указывает на слабое связывание с молекулами MHC. В некоторых вариантах осуществления прогнозируемая прочность связывания в верхних 0,5% распределения указывает на сильное связывание с молекулами MHC.
[911] В некоторых вариантах осуществления способов идентификации неоантигена, описанных в данном документе, неопластическая клетка находится в культуре клеток in vitro. В некоторых вариантах осуществления неопластическая клетка получена от субъекта. В некоторых вариантах осуществления неопластическая клетка находится в субъекте.
[912] В различных вариантах осуществления в данном документе также представлены способы получения неоантигенной вакцины посредством (a) идентификации по меньшей мере одного неоантигена (например, по меньшей мере одного неоантигенного пептида или кодирующей его mRNA) с применением любого из иллюстративных способов идентификации, раскрытых в данном документе и (b) составления по меньшей мере одного неоантигена вместе с фармацевтически приемлемыми носителем, разбавителем или адъювантом (например, любым из фармацевтически приемлемых носителей, разбавителей или адъювантов, описанных в данном документе). В некоторых вариантах осуществления по меньшей мере один неоантиген, применяемый в вакцине, содержит аминокислотную последовательность под любым из SEQ ID NO: 37-65. В некоторых вариантах осуществления по меньшей мере один неоантиген, применяемый в вакцине, содержит аминокислотную последовательность под SEQ ID NO: 37. В некоторых вариантах осуществления по меньшей мере один неоантиген, применяемый в вакцине, содержит аминокислотную последовательность под SEQ ID NO: 39. В некоторых вариантах осуществления по меньшей мере один неоантиген, применяемый в вакцине, содержит аминокислотную последовательность под любым из SEQ ID NO: 46-49.
[913] В некоторых других вариантах осуществления по меньшей мере один неоантиген, применяемый в вакцине, содержит аминокислотную последовательность под любым из SEQ ID NO: 66-93 или антигенную часть под любым из SEQ ID NO: 66-93. В некоторых вариантах осуществления по меньшей мере один неоантиген, применяемый в вакцине, содержит аминокислотную последовательность под SEQ ID NO: 66 или антигенную часть под SEQ ID NO: 66. В некоторых вариантах осуществления по меньшей мере один неоантиген, применяемый в вакцине, содержит аминокислотную последовательность под любым из SEQ ID NO: 74-77 или антигенную часть под любым из SEQ ID NO: 74-77. В некоторых вариантах осуществления длина по меньшей мере одного неоантигена и/или антигенной части находится в диапазоне от приблизительно 10 до приблизительно 50 аминокислот. В некоторых вариантах осуществления длина по меньшей мере одного неоантигена и/или антигенной части находится в диапазоне от приблизительно 10 до приблизительно 35 аминокислот. В некоторых вариантах осуществления длина по меньшей мере одного неоантигена и/или антигенной части находится в диапазоне от приблизительно 15 до приблизительно 25 аминокислот. В некоторых вариантах осуществления длина по меньшей мере одного неоантигена и/или антигенной части находится в диапазоне от приблизительно 10 до приблизительно 20 аминокислот. В некоторых вариантах осуществления по меньшей мере один неоантиген и/или антигенная часть непосредственно не перекрываются с канонической пептидной последовательностью (например, любой из иллюстративных канонических пептидных последовательностей, подчеркнутых в таблице 21) или не состоят из нее.
[914] В некоторых вариантах осуществления по меньшей мере один неоантиген, применяемый в вакцине, присоединен к фармацевтически приемлемому носителю. В некоторых вариантах осуществления фармацевтически приемлемый носитель выбран из пептида, сывороточного альбумина, гемоцианина фисуреллы, иммуноглобулина, тиреоглобулина, овальбумина, анатоксина или аттенуированного производного анатоксина, цитокина и хемокина.
Комбинация модулятора сплайсинга/ADC и сконструированных T-клеток (CAR-T):
[915] в различных вариантах осуществления пациент, у которого имеется рак, описанный в данном документе, может быть подвергнут лечению с использованием комбинации модулятора сплайсинга, ADC или композиции и одной или нескольких сконструированных Т-клеток, целенаправленно воздействующих на опухоль (т. е. CAR-T). Таким образом, в некоторых вариантах осуществления по настоящему изобретению представлен способ лечения субъекта, у которого имеется неопластическое нарушение или подозрение на его наличие, посредством введения субъекту эффективного количества модулятора сплайсинга, ADC или композиции, содержащей модулятор сплайсинга или ADC; и сконструированных Т-клеток, целенаправленно воздействующих на опухоль (т. е. CAR-T). В различных вариантах осуществления химерный T-клеточный рецептор может быть сконструирован с применением антигенраспознающих последовательностей, которые реагируют с идентифицированным неоантигеном.
[916] Например, в различных вариантах осуществления с целью целенаправленного воздействия на изменения, индуцированные модулятором сплайсинга или ADC, во внеклеточных доменах белков клеточной поверхности химерный антиген-реактивный T-клеточный рецептор (CAR) может быть сконструирован посредством первоначальной идентификации антител, которые распознают домен неоантигенного белка, экспрессируемый на клеточной поверхности. Затем антигенраспознающие последовательности таких антител могут быть слиты с доменом T-клеточного рецептора для осуществления селективного целенаправленного воздействия и активации.
[917] В различных других вариантах осуществления используется стратегия встраивания антиген-презентирующего механизма опухолевых клеток вместе с неоантигеном, образованный под действием модулятора сплайсинга или ADC. В некоторых вариантах осуществления клетки, содержащие известные и часто представленные аллели HLA (например, HLA-A*02:01) могут быть подвергнуты обработке посредством модулятора сплайсинга, ADC или композиции а MHC1-связанные неоантигены идентифицируют посредством лигандoмики. В некоторых вариантах осуществления эти пептиды можно применять для примирования и/или размножения T-клеток от здоровых доноров, экспрессирующих такой же аллель HLA. В некоторых вариантах осуществления такие T-клетки можно выделять и секвенировать α- и β-цепи T-клеточного рецептора (TCR) для идентификации когнатных антигенраспознающих/вариабельных участков. В некоторых вариантах осуществления затем может быть сконструирован когнатный CAR.
[918] В некоторых вариантах осуществления последовательности CAR клонируют в популяции полученных от пациента T-клеток и обеспечивают размножение клеток с применением доступных в настоящее время протоколов. В некоторых вариантах осуществления затем осуществляют трансфузию сконструированных T-клеток в кровоток пациенту с последующей обработкой модулятором сплайсинга, ADC или композицией. После обработки c использованием модулятора сплайсинга, ADC или композиции в некоторых вариантах осуществления может начаться презентирование антигена опухолевыми клетками. В некоторых вариантах осуществления популяция сконструированных T-клеток может контактировать с презентирующими антиген опухолевыми клетками и уничтожать их.
[919] Для специалистов в данной области техники будет очевидно, что другие подходящие модификации и адаптации описанных в данном документе способов по настоящему изобретению очевидны и могут быть выполнены с использованием подходящих эквивалентов, не выходя за рамки объема настоящего изобретения или раскрытых в данном документе вариантов осуществления. После подробного описания настоящего изобретения то же самое будет более понятно со ссылкой на следующие примеры, которые включены только в целях иллюстрации и не предназначены для ограничения.
ПРИМЕРЫ
ПРИМЕР 1
[920] Описаны способы синтеза полезных нагрузок, линкеров и соединений на основе конъюгируемой конструкции линкер-полезная нагрузка (линкер-лекарственное средство, L-D), характеризующихся структурой, показанной в таблицах 7-9. Конъюгируемую конструкцию линкер-полезные нагрузки применяли при получении конъюгатов антитела и лекарственного средства (ADC). Иллюстративные ADC описаны в примерах 3-5.
1.1 Реагенты и материалы
[921] Исходные материалы, применяемые в следующих способах синтеза, либо коммерчески доступны, либо их можно легко получить с помощью стандартных способов из известных материалов. Раскрытая конъюгируемая конструкция линкер-полезные нагрузки может быть получена с применением реакций и методик, описанных в данном документе. В описании способов синтеза, описанных ниже, следует понимать, что все предложенные условия реакции, в том числе выбор растворителя, атмосфера реакционной смеси, температура реакции, продолжительность эксперимента и процедура обработки, могут быть выбраны как стандартные условия для данной реакции, если не указано иное. Специалисту в области органического синтеза понятно, что функциональные группы, присутствующие в различных частях молекулы, должны быть совместимы с предлагаемыми реагентами и реакциями. Заместители, несовместимые с условиями реакции, являются очевидными для специалиста в данной области техники, и поэтому в данном документе указаны альтернативные способы.
[922] Проводили препаративную жидкостную хроматографию-масс-спектрометрию (LC/MS) с применением Waters AutoPurification System и колонки XTerra MS C18 (5 мкм, 19 мм x 100 мм) в условиях кислотной подвижной фазы. Спектры ядерного магнитного резонанса (ЯМР) записывали при 400 MГц с применением прибора от Varian (Agilent Technologies). Нагревание под воздействием микроволн осуществляли с применением микроволнового реактора Biotage Emrys Liberator или Initiator. Колоночную хроматографию проводили с применением Teledyne Isco Combiflash Rf200d. Удаление растворителя осуществляли с применением либо роторного испарителя от Büchi, либо центробежного испарителя от Genevac.
[923] Термины/аббревиатуры. Применяемый в данном документе термин "с созданной инертной атмосферой" относится к замещению воздуха в реакторе (например, реакционном сосуде, колбе, стеклянном реакторе) инертным газом, практически не содержащим влаги, таким как азот или аргон. В данном документе используют следующие сокращения: DCM=дихлорметан, DMF=диметилформамид, HPLC=высокоэффективная жидкостная хроматография, KHMDS=бис(триметилсилил)амид калия, LC/MS=жидкостная хроматография-масс-спектрометрия, MeOH=метанол, к. т. = комнатная температура, TBSCl=трет-бутилдиметилсилилхлорид, THF=тетрагидрофуран, TLC=тонкослойная хроматография. Мультиплетность указана с применением следующих аббревиатур: s=синглет, d=дублет, t=триплет, q=квартет, quint=квинтет, sxt=секстет, m=мультиплет, dd=дублет дублетов, ddd=дублет дублетов дублетов, dt=дублет триплетов, br s=широкий синглет.
[924] LC/MS. Подвижные фазы=A (0,1% муравьиная кислота в H2O) и B (0,1% муравьиная кислота в ацетонитриле). Градиент=B от 5% до 95% за 1,8 мин. Колонка=колонка Waters Acquity BEH C18 (1,7 мкм, 2,1×50 мм).
[925] Ссылки. В патентах США №№ 7884128 и 7816401 описаны иллюстративные способы синтеза пладиенолида B и D, и каждый из них включен в данный документ посредством ссылки в случае таких способов. Синтез пладиенолида B и D можно также осуществлять с применением иллюстративных способов, описанных в Kanada et al. ((2007) Angew Chem Int Ed. 46:4350-5). В документе Kanada et al. и публикации международной заявки № WO 2003/099813 описаны иллюстративные способы синтеза E7107 (D11) (соединение 45 из WO 2003/099813) из пладиенолида D (11107D из WO 2003/099813). Соответствующий патент США представлен под № 7550503, выданный Kotake et al. Каждая из этих ссылок включена в данный документ для описанных способов синтеза.
Таблица 7. Структура иллюстративных фрагментов-лекарственных средств (полезных нагрузок)
(Группа полезной нагрузки)

D1
(Пладиенолид D)
D2
(Пладиенолид D)
D3
(Пладиенолид D)
D4
(Пладиенолид D)
D5
(Пладиенолид D)
D6
(Пладиенолид D)
D7
(Пладиенолид D)
D4'
(Пладиенолид D)
D8
(Пладиенолид D)
D9
(Пладиенолид B)
D10
(Пладиенолид D)
D11 (E7107)
(Пладиенолид D)
D12
(Пладиенолид D)
D13
(Пладиенолид B)
D14
(Арилпладиенолид)
D15
(Арилпладиенолид)
D16
(Арилпладиенолид)
D17
(Арилпладиенолид)
D18
(Пладиенолид B)
D19
(Пладиенолид B)
D20
(Пладиенолид D)
D21
(Пладиенолид D)
D22
(Цвиттер-ионный пладиенолид D)
D23
(Цвиттер-ионный пладиенолид D)
D24
(Цвиттер-ионный пладиенолид D)
D25
(Цвиттер-ионный пладиенолид D)
D26
(Арилпладиенолид)
D27
(Арилпладиенолид)
D28
(Арилпладиенолид)
D29
(Арилпладиенолид)
D30
(Арилпладиенолид)
D31
(Арилпладиенолид)
D32
(Арилпладиенолид)
D33
(Цвиттер-ионный арилпладиенолид)
D34
(Цвиттер-ионный арилпладиенолид)
D35
(Цвиттер-ионный арилпладиенолид)
Таблица 8. Структура иллюстративных линкеров
(название по IUPAC)
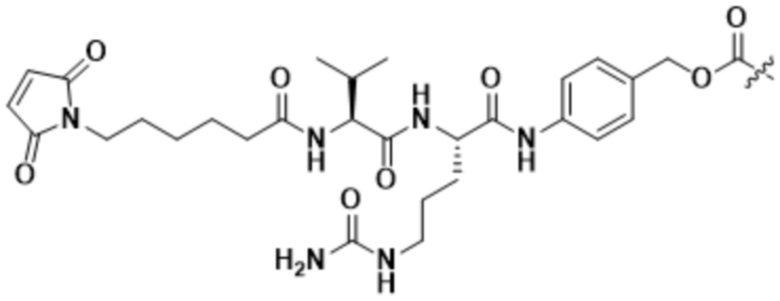
ADL1 - "MC-Val-Cit-pABC"
({4-[(2S)-5-(карбамоиламино)-2-[(2S)-2-[6-(2,5-диоксо-2,5-дигидро-1H-пиррол-1-ил)гексанамидо]-3-метилбутанамидо]пентанамидо]фенил}метилформиат)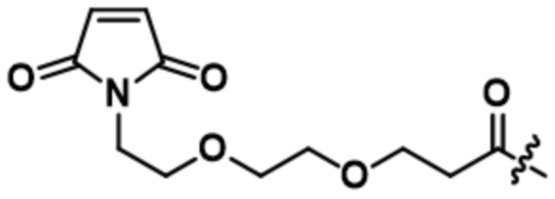
ADL2 - "MC-(PEG)2-CO"
(3-{2-[2-(2,5-диоксо-2,5-дигидро-1H-пиррол-1-ил)этокси]этокси}пропаналь)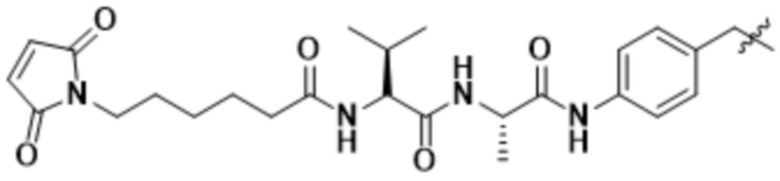
ADL5 - "MC-Val-Ala-pAB"
(6-(2,5-диоксо-2,5-дигидро-1H-пиррол-1-ил)-N-[(1S)-2-метил-1-{[(1S)-1-[(4-метилфенил)карбамоил]этил]карбамоил}пропил]гексанамид)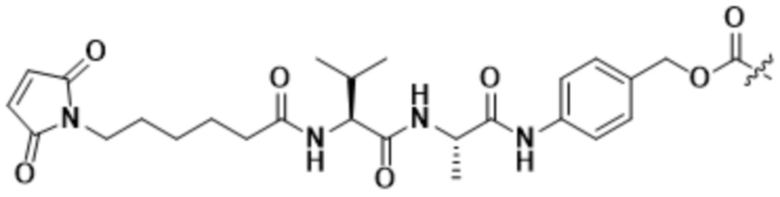
ADL6 - "MC-Val-Ala-pABC"
({4-[(2S)-2-[(2S)-2-[6-(2,5-диоксо-2,5-дигидро-1H-пиррол-1-ил)гексанамидо]-3-метилбутанамидо]пропанамидо]фенил}метилформиат)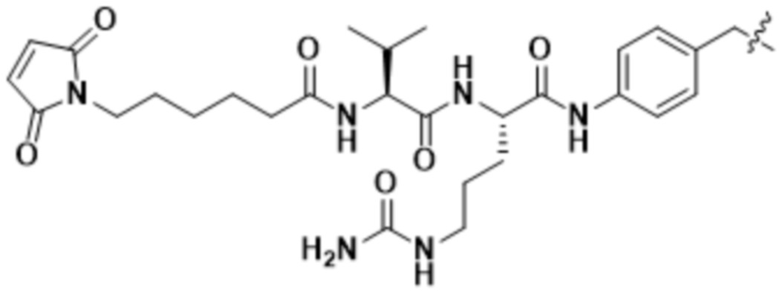
ADL7 - "MC-Val-Cit-pAB"
(N-[(1S)-1-{[(1S)-4-(карбамоиламино)-1-[(4-метилфенил)карбамоил]бутил]карбамоил}-2-метилпропил]-6-(2,5-диоксо-2,5-дигидро-1H-пиррол-1-ил)гексанамид)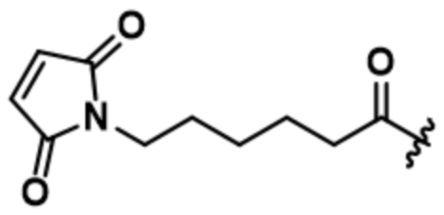
ADL10 - "MC"
(6-(2,5-диоксо-2,5-дигидро-1H-пиррол-1-ил)гексаналь)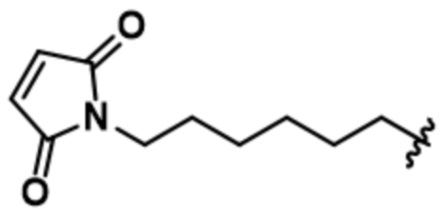
ADL12 - "Mal-Hex"
(1-гексил-2,5-дигидро-1H-пиррол-2,5-дион)
ADL13 - "MC-β-глюкуронид"
((2S,3S,4S,5R,6S)-6-(2-{3-[6-(2,5-диоксо-2,5-дигидро-1H-пиррол-1-ил)гексанамидо]пропанамидо}-4-[(формилокси)метил]фенокси)-3,4,5-тригидроксиоксан-2-карбоновая кислота)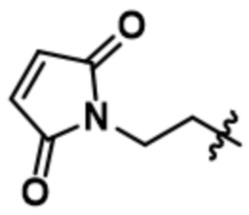
ADL14 - "Mal-Et"
(1-этил-2,5-дигидро-1H-пиррол-2,5-дион)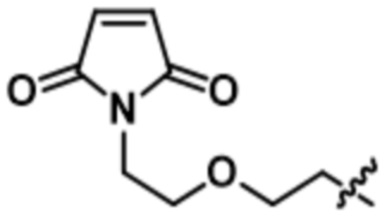
ADL15 - "Mal-Et-O-Et"
(1-(2-этоксиэтил)-2,5-дигидро-1H-пиррол-2,5-дион)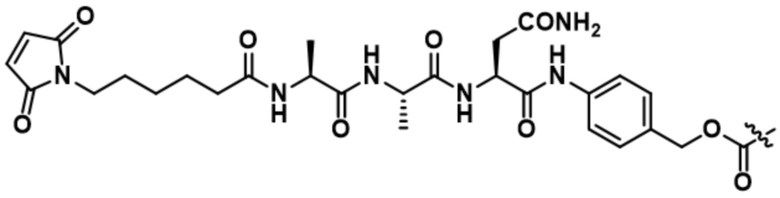
ADL21 - "MC-Ala-Ala-Asp-pABC"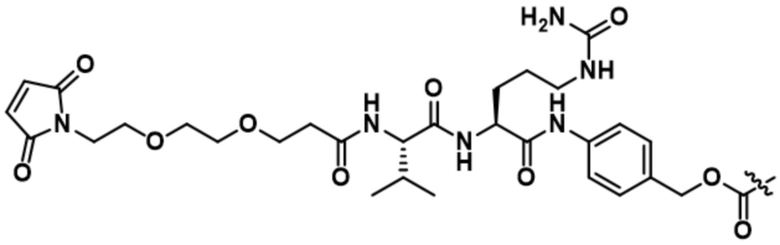
ADL22 - "Mc-PEG2-Val-Cit-pABC"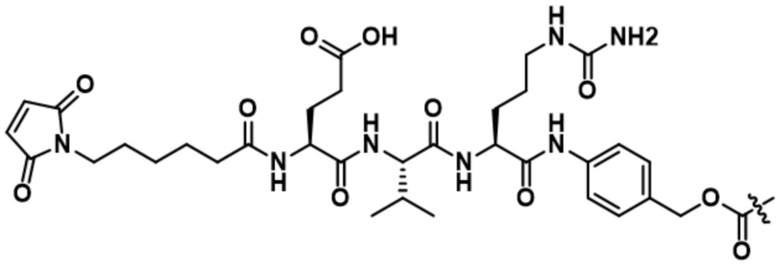
ADL23 - "MC-Glu-Val-Cit-pABC"
Таблица 9. Структуры иллюстративных соединений на основе конъюгируемых конструкций линкер-полезная нагрузка (L-D)
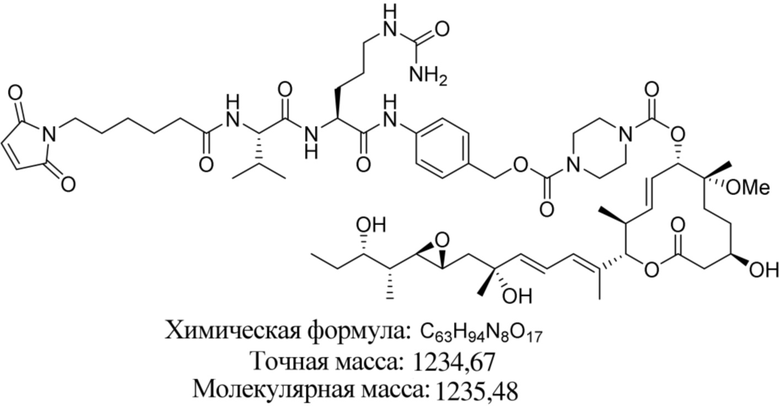
ADL1-D1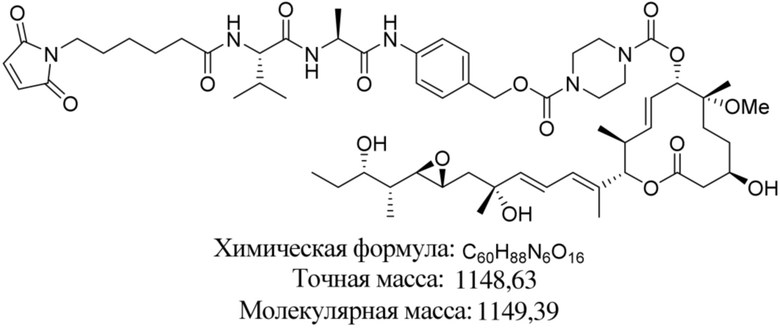
ADL6-D1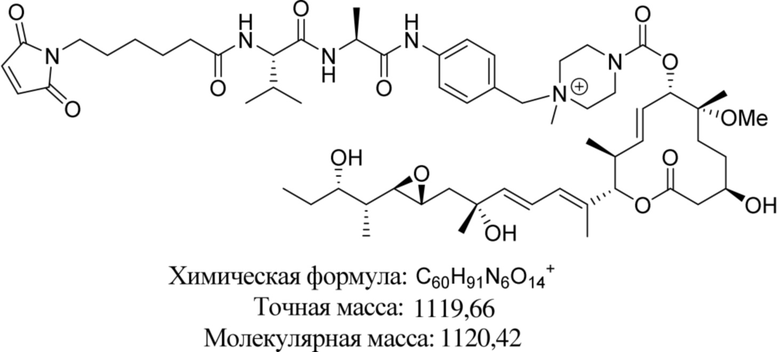
ADL5-D2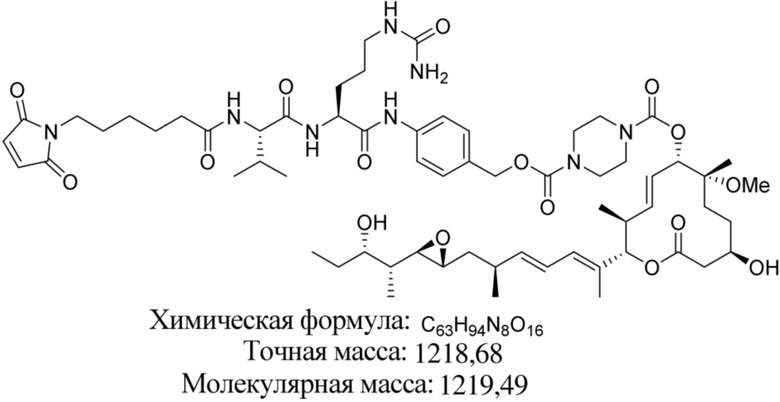
ADL1-D18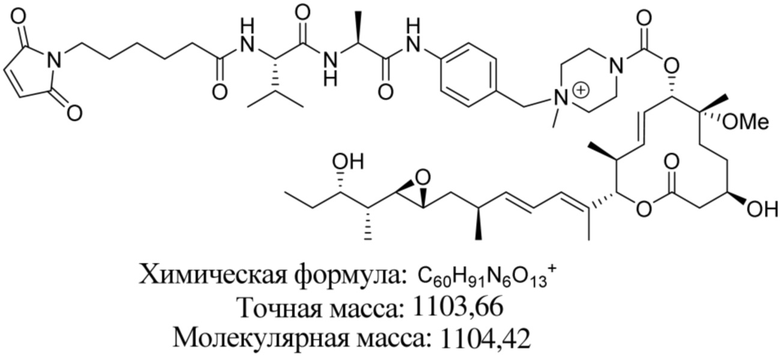
ADL5-D19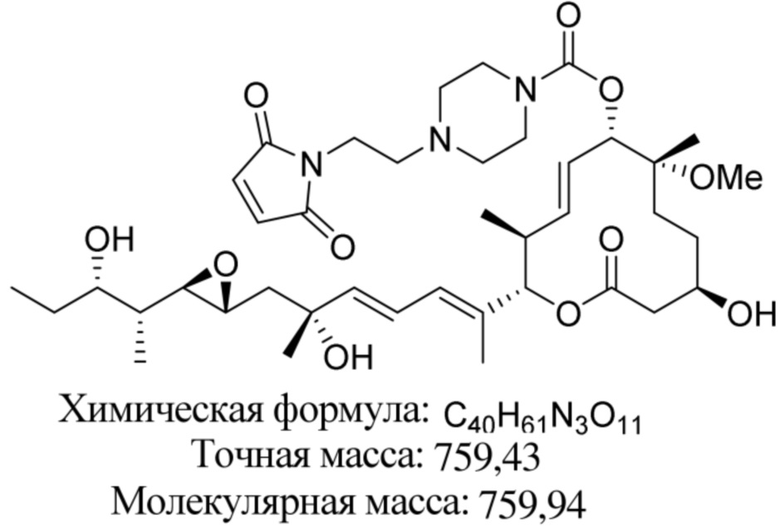
ADL14-D1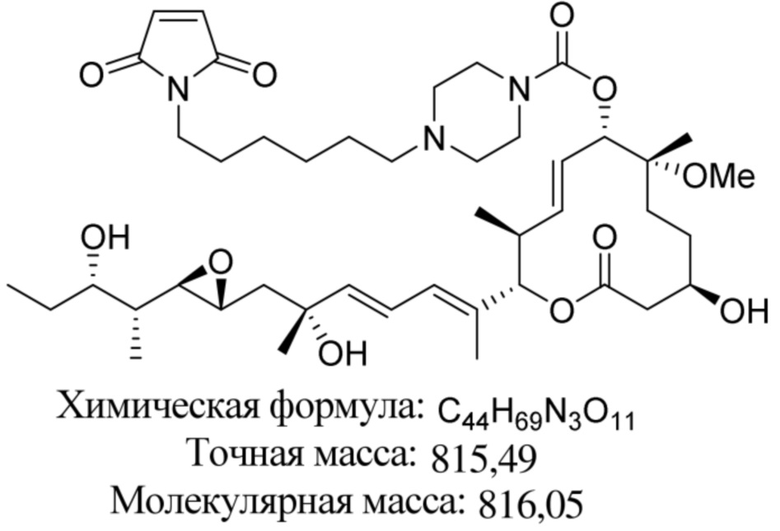
ADL12-D1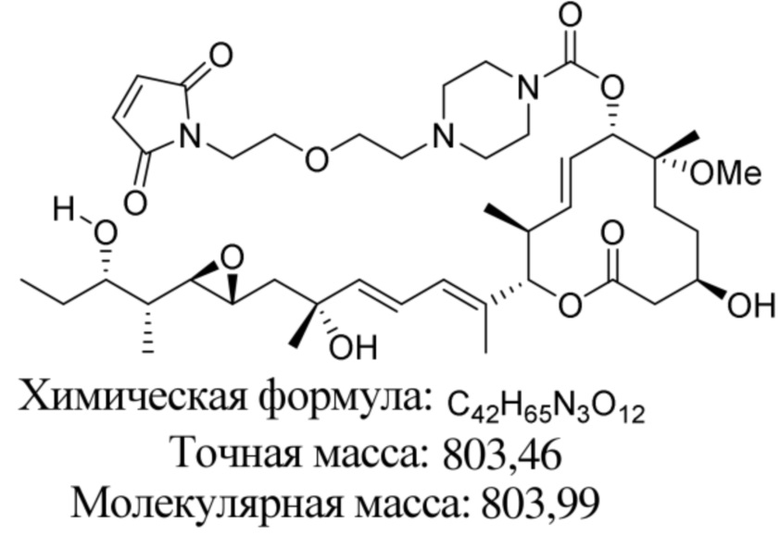
ADL15-D1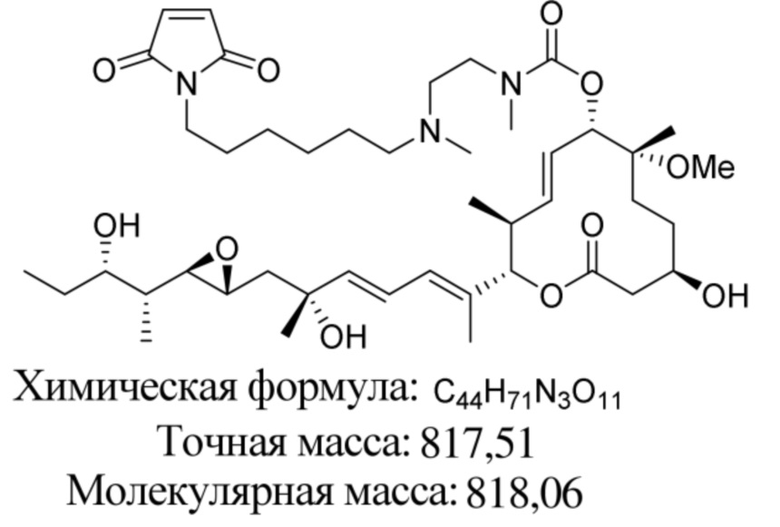
ADL12-D20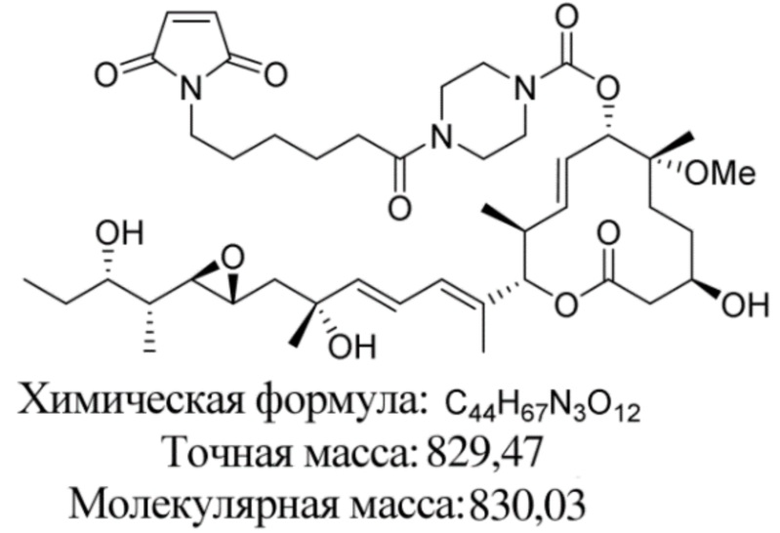
ADL10-D1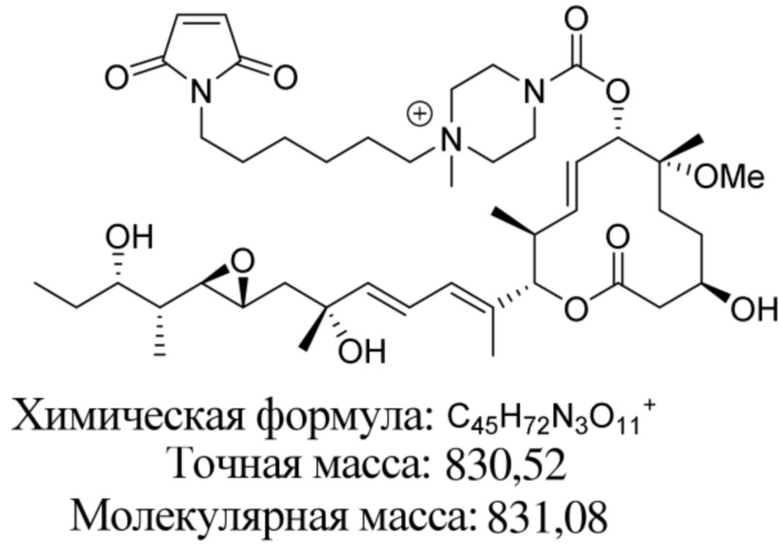
ADL12-D2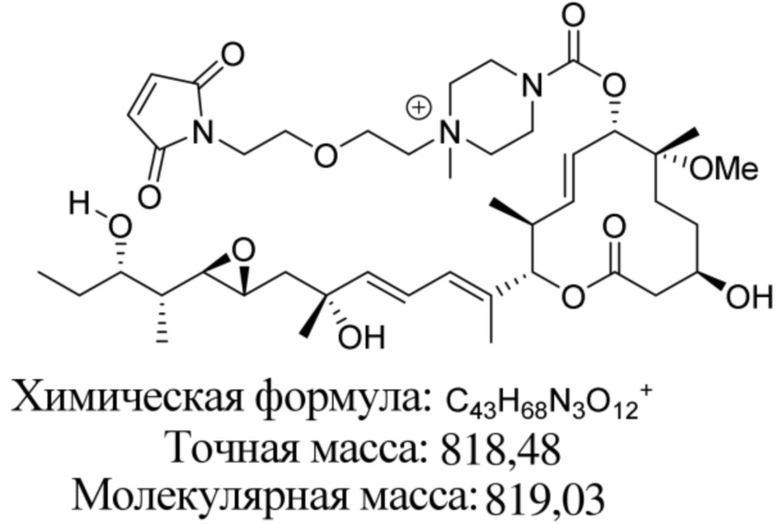
ADL15-D2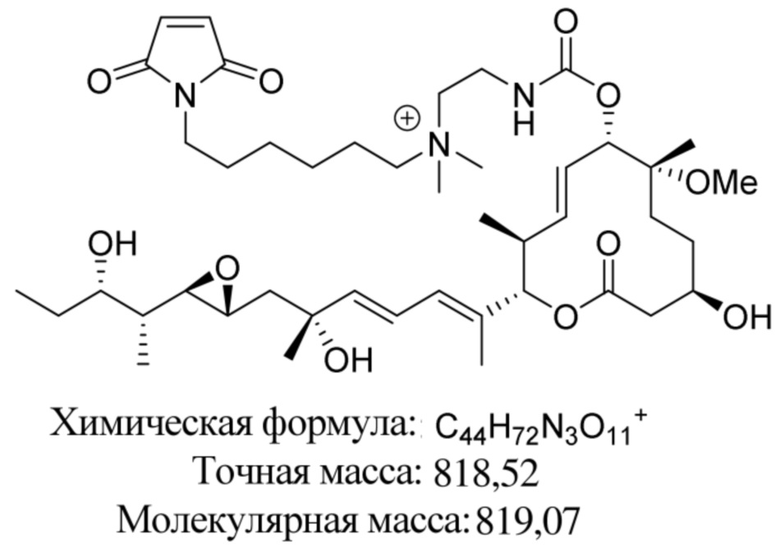
ADL12-D21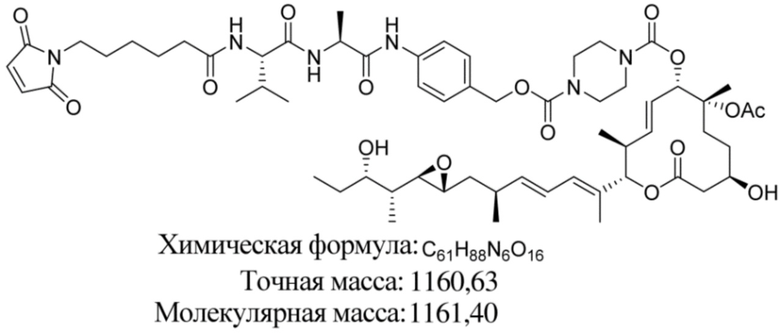
ADL6-D9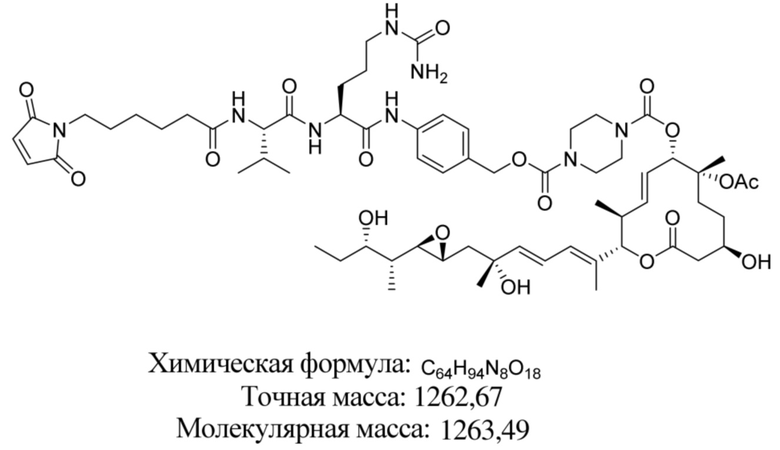
ADL1-D4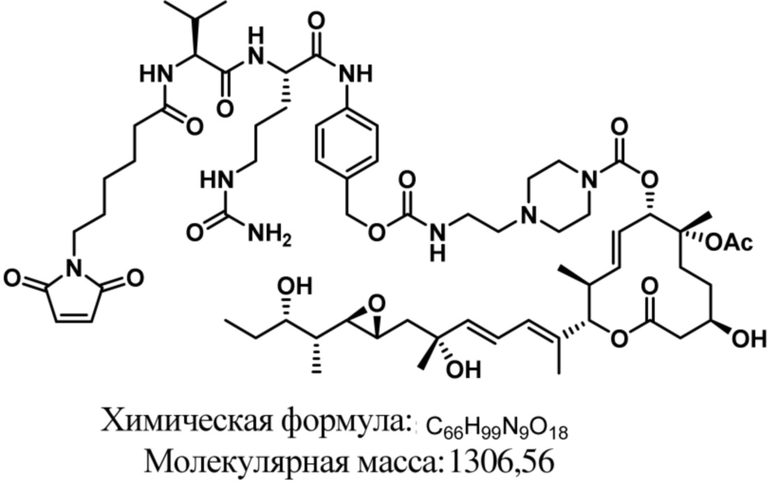
ADL1-D3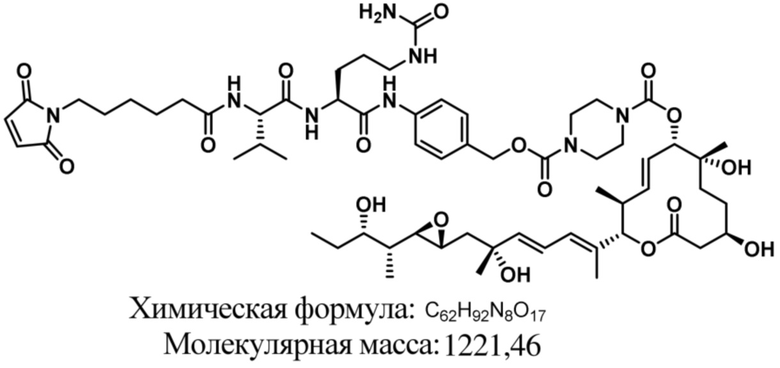
ADL1-D12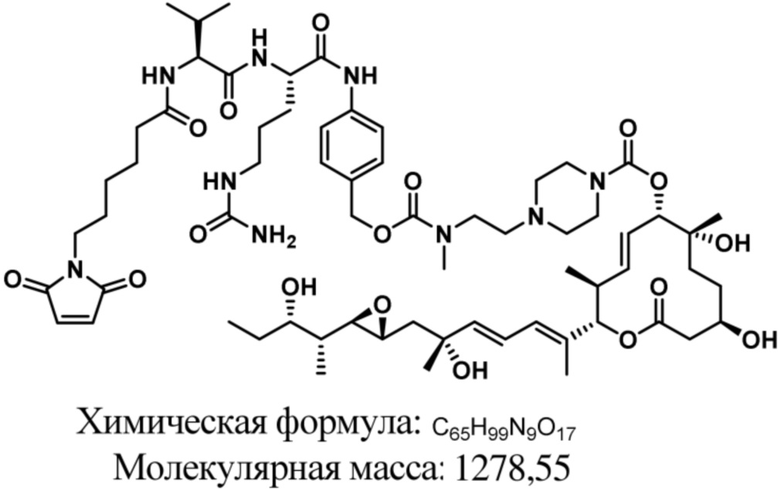
ADL1-D7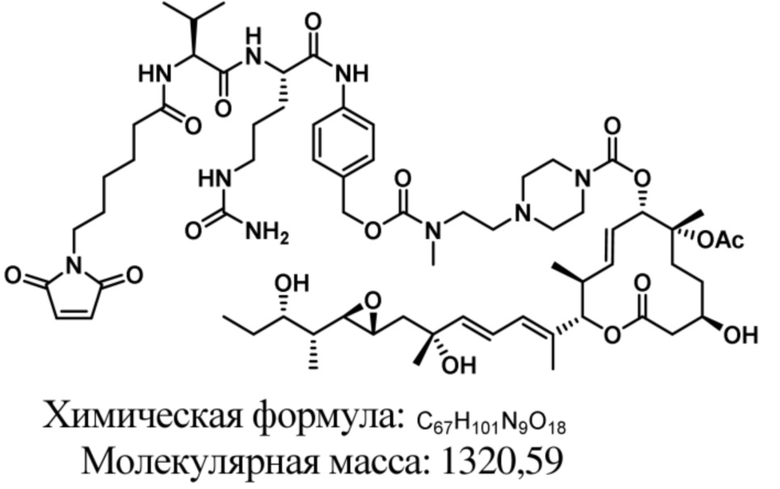
ADL1-D6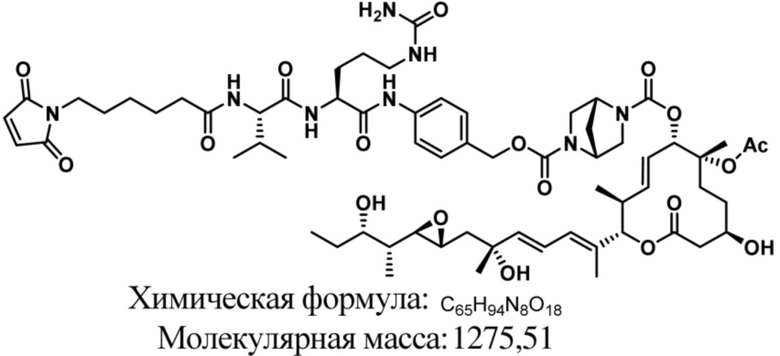
ADL1-D5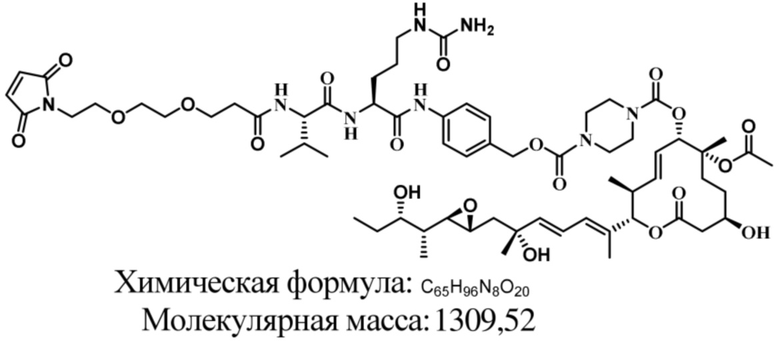
ADL22-D4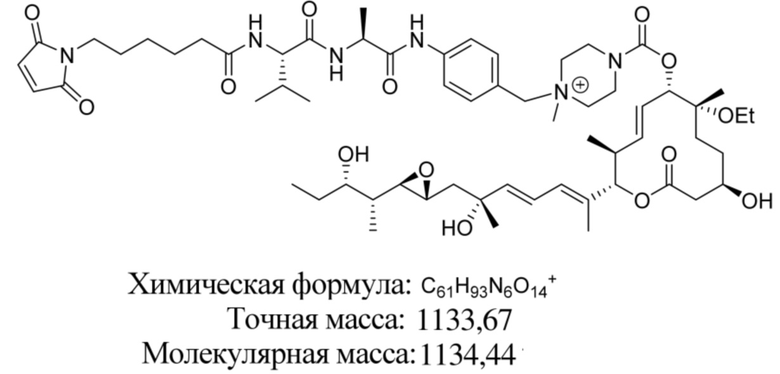
ADL5-D10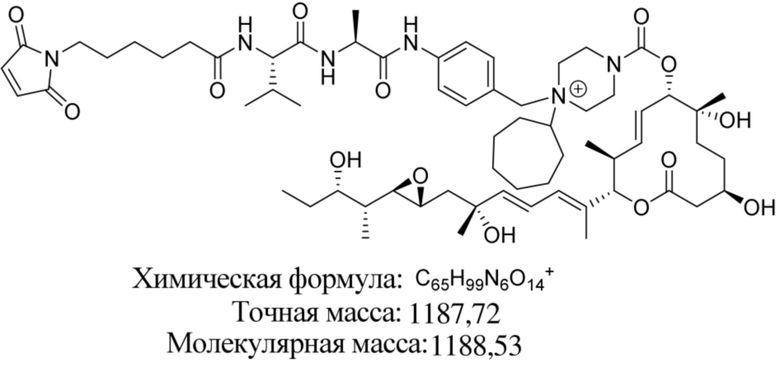
ADL5-D11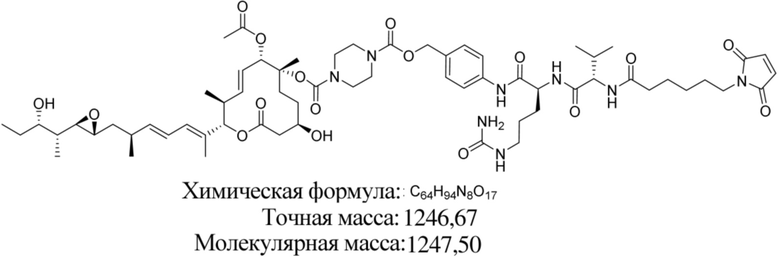
ADL1-D13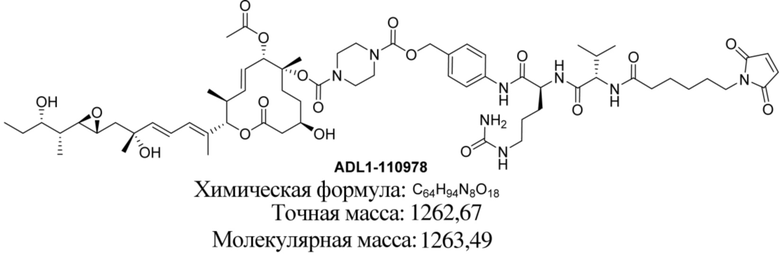
ADL1-D8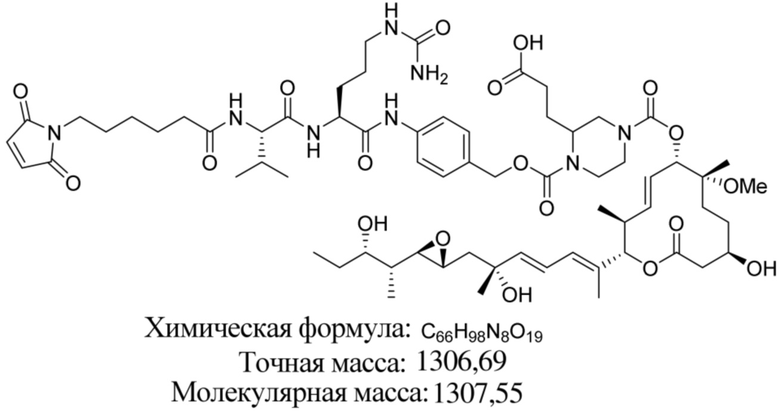
ADL1-D22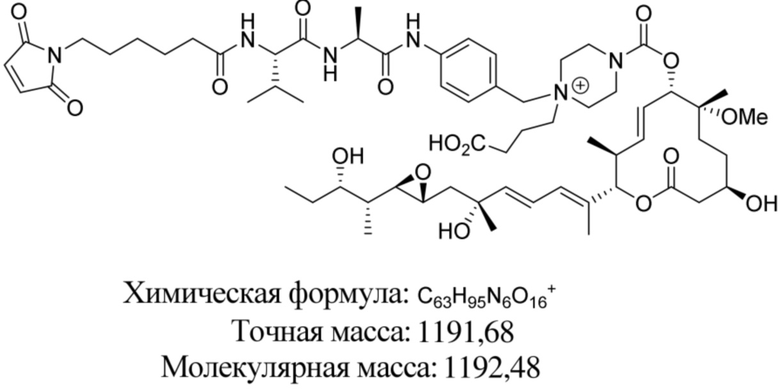
ADL5-D25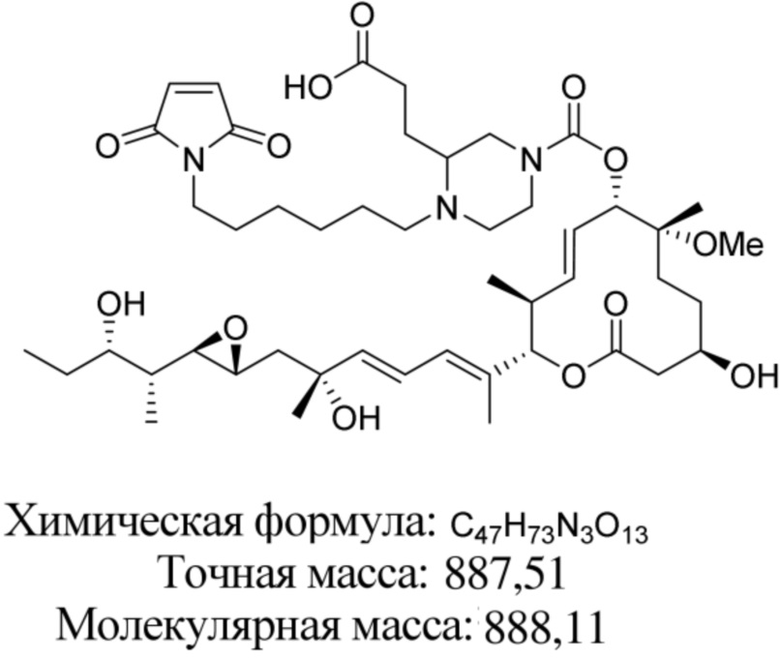
ADL12-D22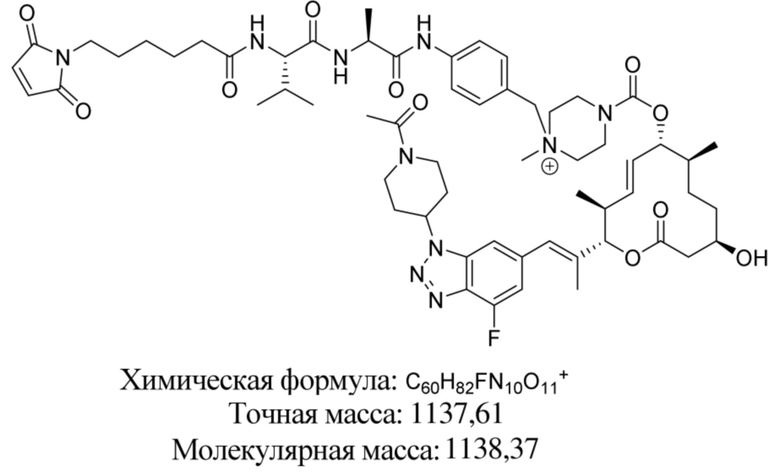
ADL5-D15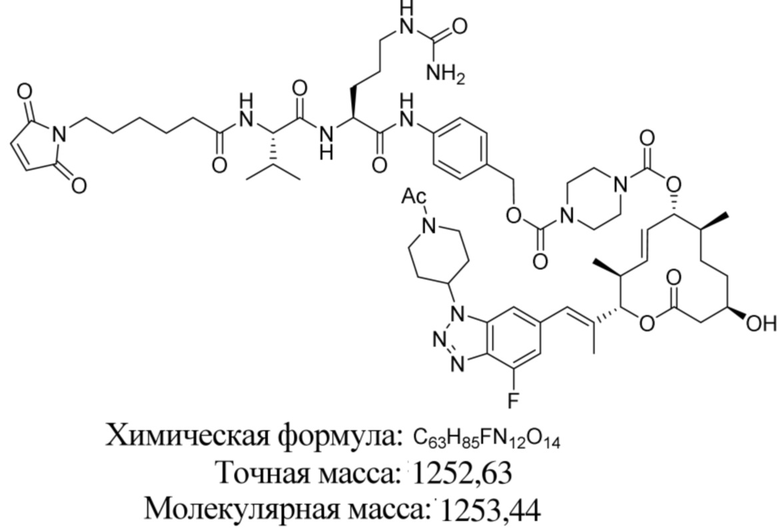
ADL1-D14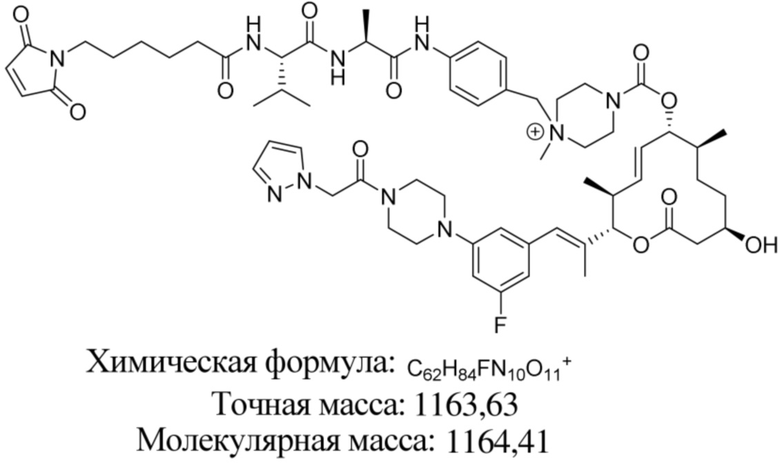
ADL5-D26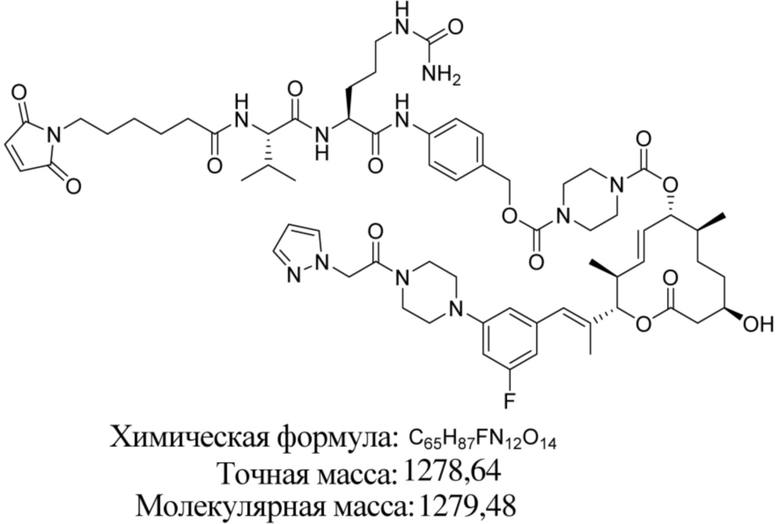
ADL1-D16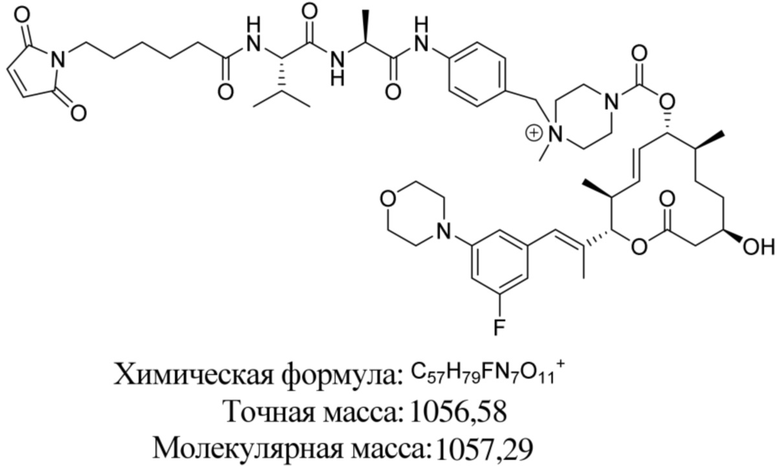
ADL5-D17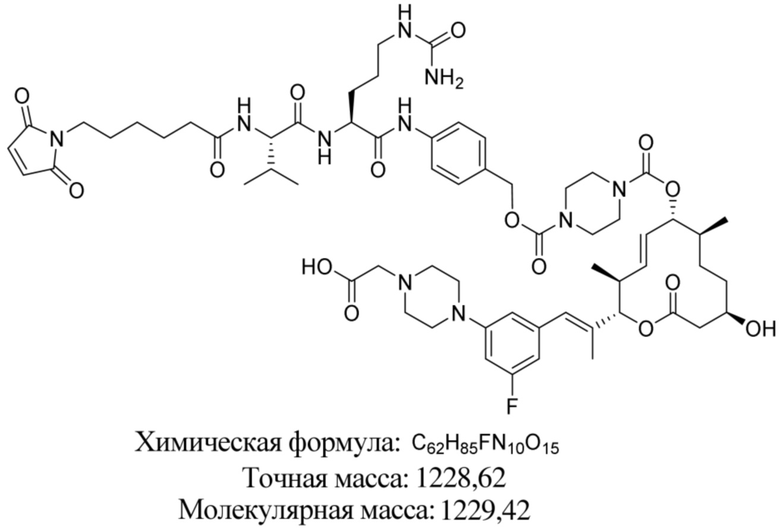
ADL1-D33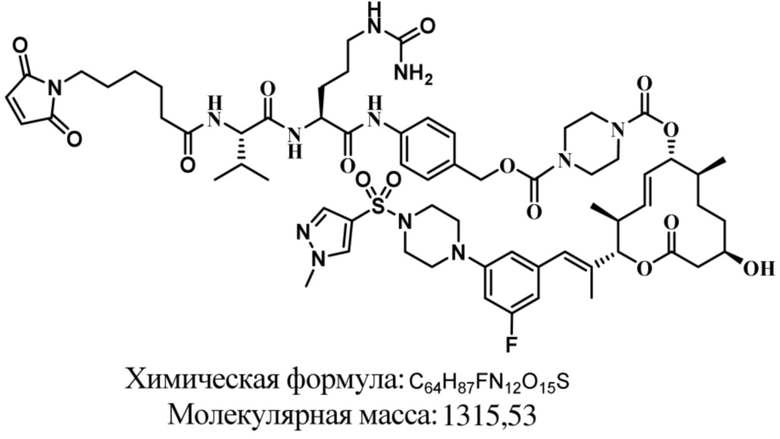
ADL1-D28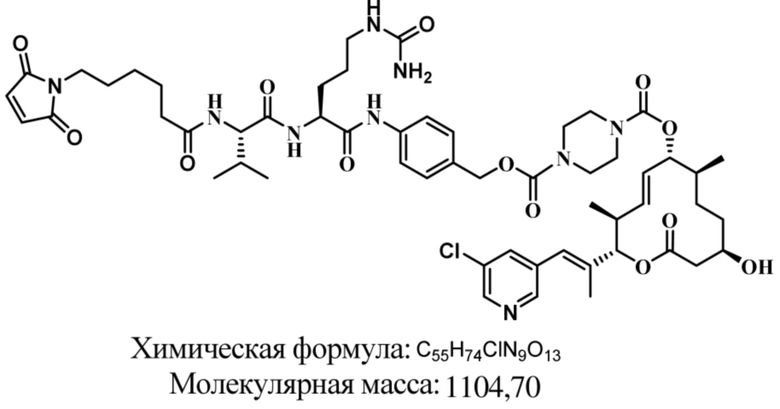
ADL1-D31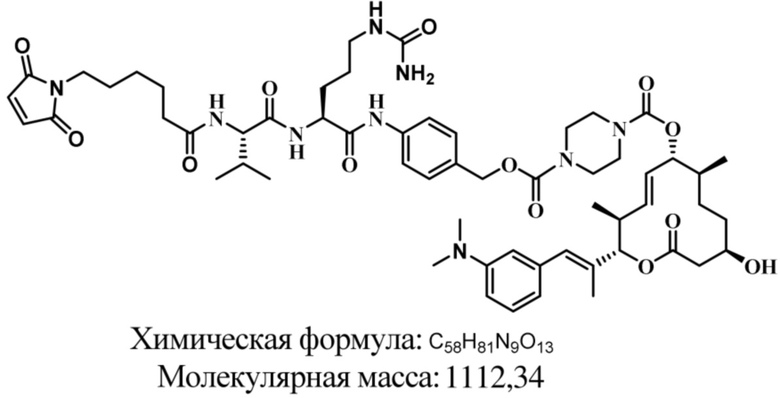
ADL1-D29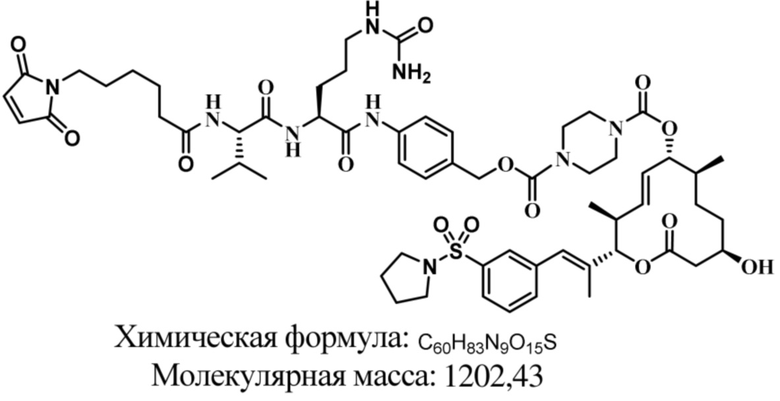
ADL1-D35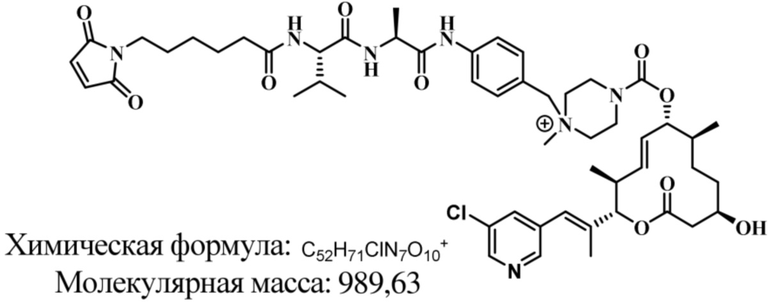
ADL5-D32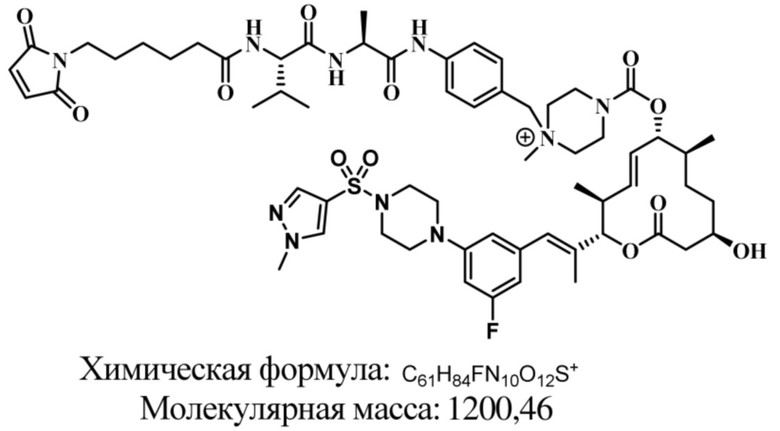
ADL5-D27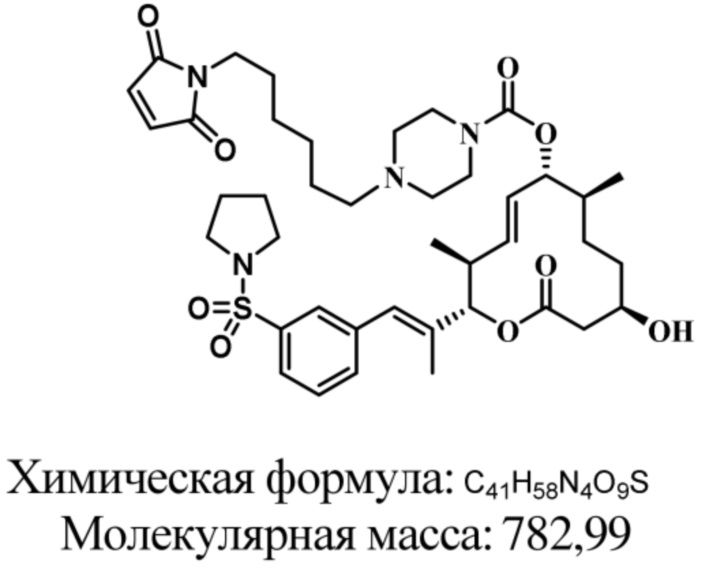
ADL12-D35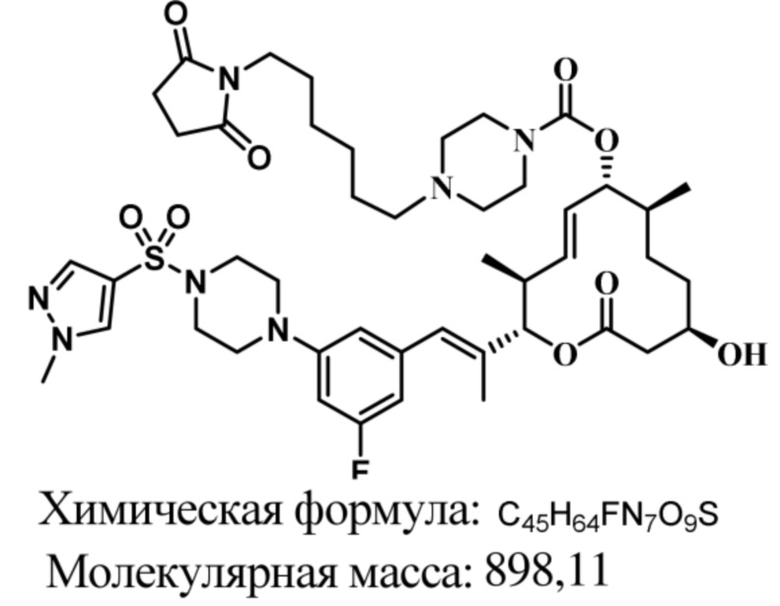
ADL12-D28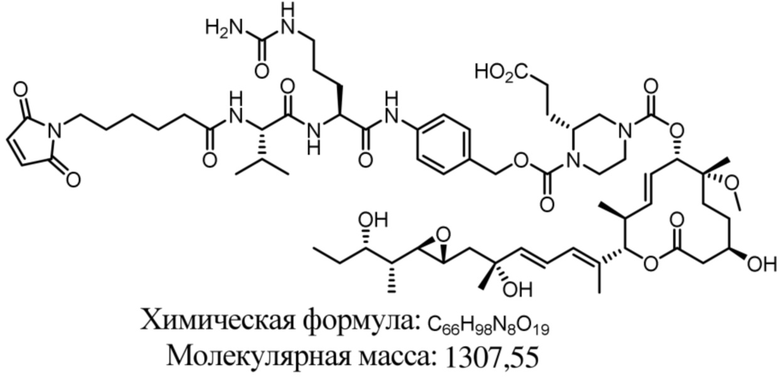
ADL1-D23
ADL1-D24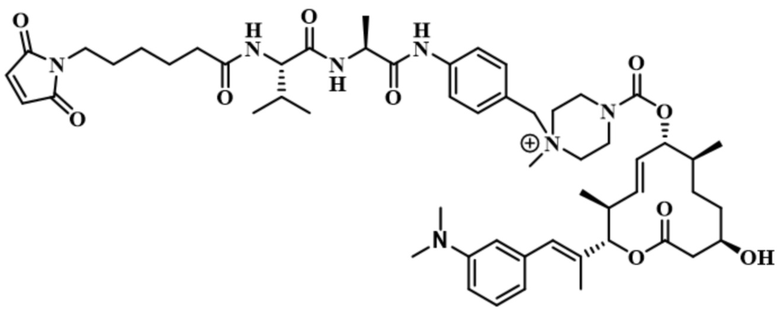
ADL5-D30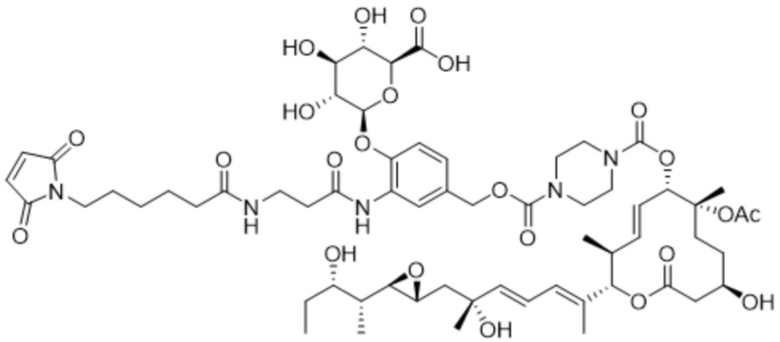
ADL13-D4
1.2 Получение полезных нагрузок на основе пладиенолида
1.2.1 Краткое описание. Общая процедура 1
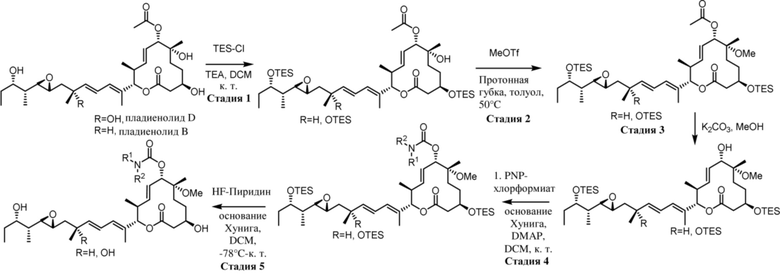
Схема 1
[926] Стадия 1. (2S,3S,6S,7R,10R, E)-7,10-Дигидрокси-2-((R,2E,4E)-6-гидрокси-7-((2S,3S)-3-((2R,3S)-3-гидроксипентан-2-ил)оксиран-2-ил)-6-метилгепта-2,4-диен-2-ил)-3,7-диметил-12-оксооксациклододец-4-ен-6-ил-ацетат (1,7 г, 3,154 ммоль), триэтиламин (4,40 мл, 31,536 ммоль), 1,2-дихлорэтан (31,5 мл, 3,154 ммоль) объединяли и перемешивали при к. т. Добавляли хлортриэтилсилан (2,1 мл, 12,615 ммоль) и перемешивали в течение ночи. Солевой раствор выливали в реакционную смесь и перемешивали в течение 30 мин. и органический слой отделяли. Затем водный слой обратно экстрагировали с помощью DCM (3X). Органические слои объединяли, высушивали (безводн. Na2SO4), концентрировали до сухого состояния и хроматографировали с получением (2S,3S,6S,7R,10R, E)-7-гидрокси-3,7-диметил-2-((R,2E,4E)-6-метил-6-((триэтилсилил)окси)-7-((2S,3S)-3-((2S,3S)-3-((триэтилсилил)окси)пентан-2-ил)оксиран-2-ил)гепта-2,4-диен-2-ил)-12-оксо-10-((триэтилсилил)окси)оксациклододец-4-ен-6-ил-ацетата (1,274 г, 1,423 ммоль, выход 45,1%).
[927] 1H-ЯМР (400 МГц, DMSO-d6): δ ppm 0,51-0,64 (m, 18 H) 0,74-0,84 (m, 9 H) 0,90-0,97 (m, 26 H) 1,04 (s, 3 H) 1,18 (s, 4 H) 1,37 (s, 3 H) 1,41-1,57 (m, 4 H) 1,69 (s, 3 H) 1,84-1,93 (m, 1 H) 2,00-2,05 (m, 3 H) 2,24-2,35 (m, 1 H) 2,38-2,45 (m, 1 H) 2,72-2,80 (m, 1 H) 3,28-3,30 (m, 1 H) 3,62-3,70 (m, 1 H) 3,80-3,90 (m, 1 H) 4,56 (s, 1 H) 4,81-4,93 (m, 2 H) 5,41-5,52 (m, 1 H) 5,63-5,73 (m, 1 H) 5,77-5,87 (m, 1 H) 6,01-6,12 (m, 1 H) 6,42 (dd, J=15,12, 11,11 Гц, 1 H).
[928] Стадия 2. К раствору (2S,3S,6S,7R,10R, E)-7-гидрокси-3,7-диметил-2-((R,2E,4E)-6-метил-6-((триэтилсилил)окси)-7-((2S,3S)-3-((2S,3S)-3-((триэтилсилил)окси)пентан-2-ил)оксиран-2-ил)гепта-2,4-диен-2-ил)-12-оксо-10-((триэтилсилил)окси)оксациклододец-4-ен-6-ил-ацетата (0,7 г, 0,782 ммоль) в толуоле (4,16 мл, 39,085 ммоль) добавляли 1,8-нафталиндиамин, N, N,N',N'-тетраметил- (1,173 г, 5,472 ммоль) с последующим добавлением метилтрифторметансульфоната (0,354 мл, 3,127 ммоль) при 0°C. Затем обеспечивали нагревание реакционной смеси до 50°C и нагревали ее в течение 3 часов. Растворитель выпаривали. С помощью очистки посредством колоночной хроматографии получали (2S,3S,6S,7R,10R, E)-7-метокси-3,7-диметил-2-((R,2E,4E)-6-метил-6-((триэтилсилил)окси)-7-((2S,3S)-3-((2S,3S)-3-((триэтилсилил)окси)пентан-2-ил)оксиран-2-ил)гепта-2,4-диен-2-ил)-12-оксо-10-((триэтилсилил)окси)оксациклододец-4-ен-6-ил-ацетат (467 мг, 0,513 ммоль, выход 65,7%) в виде бесцветного масла.
[929] 1H-ЯМР (400 МГц, MeOH-d4): δ ppm 0,62-0,70 (m, 18 H) 0,83-0,95 (m, 13 H) 0,99-1,07 (m, 27 H) 1,22 (s, 3 H) 1,24-1,36 (m, 2 H), 1,28-1,28 (m, 1 H) 1,45 (s, 3 H) 1,47-1,65 (m, 8 H) 1,78 (d, J=0,88 Гц, 3 H) 1,91-2,00 (m, 1 H) 2,07 (s, 3 H) 2,37-2,45 (m, 1 H) 2,51-2,68, (m, 3 H) 2,88-2,92 (m, 1 H) 3,20-3,24 (m, 1 H) 3,35 (s, 3 H) 3,74-3,82 (m, 1 H) 3,93-4,02 (m, 1 H) 4,94-4,99 (m, 1 H) 5,08-5,14 (m, 1 H), 5,53-5,64 (m, 1 H) 5,70-5,79 (m, 1 H) 5,81-5,88 (m, 1 H) 6,12-6,18 (m, 1 H) 6,47-6,58 (m, 1 H).
[930] Стадия 3. (2S,3S,6S,7R,10R, E)-7-Гидрокси-3,7-диметил-2-((R,2E,4E)-6-метил-6-((триэтилсилил)окси)-7-((2R,3R)-3-((2S,3S)-3-((триэтилсилил)окси)пентан-2-ил)оксиран-2-ил)гепта-2,4-диен-2-ил)-12-оксо-10-((триэтилсилил)окси)оксациклододец-4-ен-6-ил-ацетат (500 мг, 0,558 ммоль) растворяли в MeOH (6009 мкл, 148,524 ммоль) и добавляли карбонат калия (232 мг, 1,675 ммоль). Реакционную смесь перемешивали при к. т. в течение 1 часа и определяли завершение реакции. Реакционную смесь разбавляли водой и экстрагировали с помощью EtOAc (3X). Объединенные органические вещества промывали солевым раствором, высушивали над сульфатом натрия, фильтровали и концентрировали. С помощью очистки посредством колоночной хроматографии получали (4R,7R,8S,11S,12S, E)-7,8-дигидрокси-7,11-диметил-12-((R,2E,4E)-6-метил-6-((триэтилсилил)окси)-7-((2R,3R)-3-((2S,3S)-3-((триэтилсилил)окси)пентан-2-ил)оксиран-2-ил)гепта-2,4-диен-2-ил)-4-((триэтилсилил)окси)оксациклододец-9-ен-2-он (305 мг, 0,357 ммоль, выход 64,0%).
[931] 1H-ЯМР (400 МГц, MeOH-d4): δ ppm 0,61-0,72 (m, 18 H) 0,82-0,92 (m, 7 H) 0,92-1,06 (m, 30 H) 1,19-1,40 (m, 7 H) 1,42-1,66 (m, 8 H) 1,51-1,52 (m, 1 H) 1,75-1,81 (m, 3 H) 1,91-2,01 (m, 1 H) 2,34-2,45 (m, 1 H) 2,51-2,61 (m, 2 H) 2,61-2,69 (m, 1 H) 2,86-2,94 (m, 1 H) 3,67-3,73 (m, 1 H) 3,73-3,80 (m, 1 H) 3,89-3,96 (m, 1 H) 4,08-4,17 (m, 1 H) 4,93-4,99 (m, 1 H) 5,36-5,47 (m, 1 H) 5,67-5,78 (m, 1 H) 5,80-5,88 (m, 1 H) 6,10-6,19 (m, 1 H) 6,47-6,58 (m, 1 H).
[932] Стадия 4. Объединяли (4R,7R,8S,11S,12S, E)-8-гидрокси-7-метокси-7,11-диметил-12-((R,2E,4E)-6-метил-6-((триэтилсилил)окси)-7-((2S,3S)-3-((2S,3S)-3-((триэтилсилил)окси)пентан-2-ил)оксиран-2-ил)гепта-2,4-диен-2-ил)-4-((триэтилсилил)окси)оксациклододец-9-ен-2-он (0,386 г, 0,445 ммоль), DCM (0,1 M), DMAP (1,0 экв.), основание Хунига (5,0 экв.), 4-нитрофенилхлорформиат (1,8 экв.) и перемешивали в течение ночи. Затем реакционную смесь экстрагировали с помощью 1 н. NaOH. Органический слой высушивали (безводн. Na2SO4) и концентрировали до сухого состояния. Остаток смешивали с DCM (0,1 M), основанием Хунига (5,0 экв.), амином (2,0 экв.), которые объединяли и перемешивали в течение 1 часа. Реакционную смесь концентрировали и хроматографировали с получением три-TES-пладиенолида карбамата.
[933] Стадия 5. Объединяли три-TES-пладиенолида карбамат (1 экв.), DCM (0,04 M) и DIPEA (191 экв.) и охлаждали до -78°C. Добавляли гидрофторид-пиридин (6,2 экв.) и обеспечивали нагревание реакционной смеси до к. т. и перемешивали ее в течение ночи. Реакционную смесь охлаждали на ледяной бане, затем добавляли насыщ. NaHCO3, перемешивали и экстрагировали с помощью DCM. Органические слои объединяли, высушивали над безводным Na2SO4, концентрировали и хроматографировали с получением пладиенолида карбамата.
1.2.1.1 D1
[934] Общую процедуру 1 (указанную в разделе 1.2.1) использовали для синтеза D1.
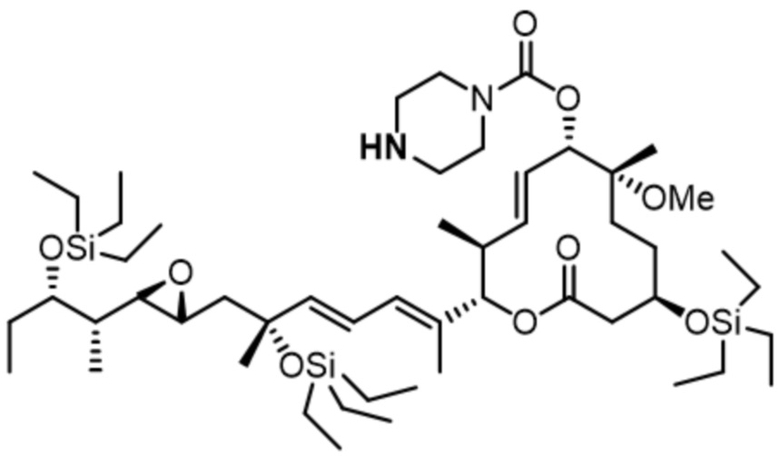
[935] (2S,3S,6S,7R,10R, E)-7-Метокси-3,7-диметил-2-((R,2E,4E)-6-метил-6-((триэтилсилил)окси)-7-((2S,3S)-3-((2S,3S)-3-((триэтилсилил)окси)пентан-2-ил)оксиран-2-ил)гепта-2,4-диен-2-ил)-12-оксо-10-((триэтилсилил)окси)оксациклододец-4-ен-6-илпиперазин-1-карбоксилат (240 мг, 0,245 ммоль, выход 55,1%). LC/MS (ESI, масса/заряд), 980,4 [M+H]+.
[936] 1H-ЯМР (400 МГц, CDCl3-d): δ ppm 0,56-0,66 (m, 18 H) 0,78-0,91 (m, 9 H) 0,96 (t, J=7,91 Гц, 27 H) 1,18-1,22 (m, 3 H) 1,23-1,28 (m, 1 H) 1,37-1,41 (m, 3 H) 1,41-1,63 (m, 7 H) 1,69-1,74 (m, 3 H) 1,89 (dd, J=13,87, 4,96 Гц, 1 H) 2,33-2,62 (m, 4 H) 2,78-2,89 (m, 5 H), 3,35 (s, 3 H) 3,43-3,52 (m, 4 H) 3,73 (td, J=6,40, 3,51 Гц, 1 H) 3,86 (br dd, J=7,84, 3,95 Гц, 1 H) 4,94-5,13 (m, 2 H) 5,58-5,76 (m, 3 H) 6,12, (br d, J=0,75 Гц, 1 H) 6,41 (dd, J=15,06, 11,04 Гц, 1 H).
D1

[937] (2S,3S,6S,7R,10R, E)-10-Гидрокси-2-((R,2E,4E)-6-гидрокси-7-((2R,3R)-3-((2R,3S)-3-гидроксипентан-2-ил)оксиран-2-ил)-6-метилгепта-2,4-диен-2-ил)-7-метокси-3,7-диметил-12-оксооксациклододец-4-ен-6-илпиперазин-1-карбоксилат.
[938] 1H-ЯМР (400 МГц, MeOH-d4): δ ppm 0,83-1,01 (m, 10 H) 1,23 (s, 3 H) 1,25-1,32 (m, 1 H) 1,35 (s, 3 H) 1,40-1,61 (m, 6 H) 1,61-1,71 (m, 2 H) 1,79 (d, J=0,75 Гц, 3 H) 1,84-1,93 (m, 1 H) 2,45-2,63 (m, 3 H) 2,63-2,72 (m, 1 H) 2,77-2,85 (m, 4 H) 2,86-2,94 (m, 1 H) 3,33-3,37 (m, 3 H) 3,40-3,57 (m, 5 H) 3,77-3,89 (m, 1 H) 4,38-4,42 (m, 1 H) 5,01-5,12 (m, 2 H) 5,52-5,65 (m, 1 H) 5,69-5,80 (m, 1 H) 5,84-5,92 (m, 1 H) 6,09-6,18 (m, 1 H) 6,49-6,60 (m, 1 H).
1.2.1.2 D2
[939] Общую процедуру 1 (указанную в разделе 1.2.1) использовали для синтеза D2.
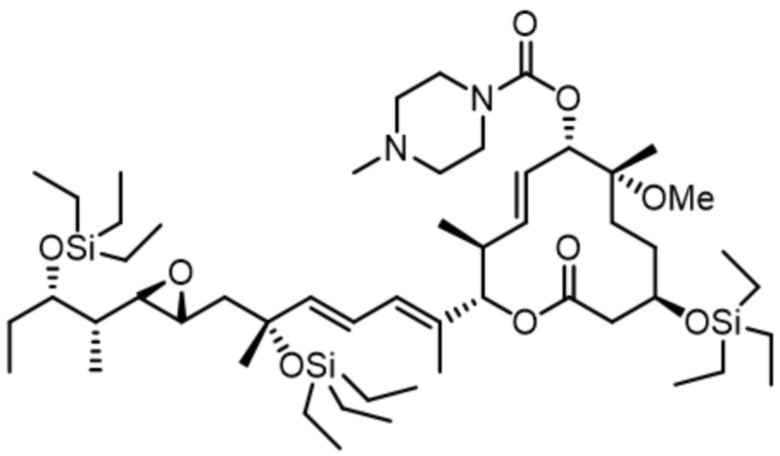
[940] (2S,3S,6S,7R,10R, E)-7-Метокси-3,7-диметил-2-((R,2E,4E)-6-метил-6-((триэтилсилил)окси)-7-((2R,3R)-3-((2S,3S)-3-((триэтилсилил)окси)пентан-2-ил)оксиран-2-ил)гепта-2,4-диен-2-ил)-12-оксо-10-((триэтилсилил)окси)оксациклододец-4-ен-6-ил-4-метилпиперазин-1-карбоксилат (413 мг, 0,416 ммоль, выход 90%). LC/MS (ESI, масса/заряд), 994 [M+H]+.
[941] 1H-ЯМР (400 МГц, MeOH-d4): δ ppm 0,61-0,71 (m, 18 H) 0,83-0,94 (m, 9 H) 0,98-1,07 (m, 28 H) 1,23 (s, 3 H) 1,41-1,48 (m, 3 H) 1,48-1,65 (m, 7 H) 1,72-1,81 (m, 3 H) 1,93-1,99 (m, 1 H) 2,03 (s, 3 H) 2,32 (s, 3 H) 2,38-2,48 (m, 5 H) 2,52-2,67 (m, 3 H) 2,87-2,93 (m, 1 H) 3,47-3,61 (m, 4 H) 3,72-3,81 (m, 1 H) 3,96-4,04 (m, 1 H) 4,53-4,62 (m, 1 H) 4,93-5,07 (m, 2 H) 5,51-5,64 (m, 1 H) 5,69-5,79 (m, 1 H) 5,81-5,92 (m, 1 H) 6,09-6,21 (m, 1 H) 6,46-6,60 (m, 1 H).
D2

[942] (2S,3S,6S,7R,10R, E)-10-Гидрокси-2-((R,2E,4E)-6-гидрокси-7-((2R,3R)-3-((2R,3S)-3-гидроксипентан-2-ил)оксиран-2-ил)-6-метилгепта-2,4-диен-2-ил)-7-метокси-3,7-диметил-12-оксооксациклододец-4-ен-6-ил-4-метилпиперазин-1-карбоксилат (37,8 мг, 0,058 ммоль, выход 24,05%). LC/MS (ESI, масса/заряд), 651,69 [M+H]+.
[943] 1H-ЯМР (400 МГц, DMSO-d6): δ ppm 0,76-0,89 (m, 9 H) 1,10 (s, 3 H) 1,20-1,26 (m, 3 H) 1,30-1,42 (m, 4 H) 1,42-1,55 (m, 2 H) 1,66-1,75 (m, 3 H) 1,75-1,82 (m, 1 H) 2,13-2,21 (m, 3 H) 2,25 (br s, 4 H) 2,31-2,41 (m, 2 H) 2,54-2,60 (m, 2 H) 2,72-2,82 (m, 1 H) 3,22 (s, 3 H) 3,36-3,40 (m, 3 H) 3,66-3,76 (m, 1 H) 4,36-4,46 (m, 1 H) 4,53-4,60 (m, 1 H) 4,78-4,85 (m, 1 H) 4,86-4,96 (m, 2 H) 5,36-5,50 (m, 1 H) 5,60-5,74 (m, 1 H) 5,80-5,92 (m, 1 H) 6,02-6,11 (m, 1 H) 6,34-6,46 (m, 1 H).
1.3 Получение конструкции линкер MC-Val-Cit-pABC-полезные нагрузки
1.3.1 Краткое описание. Общая процедура 1
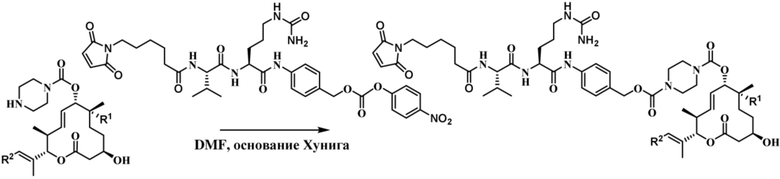
Схема 2
[944] Полезную нагрузку (1,0 экв.), основание Хунига (3,0 экв.), DMF (0,1 M) и 4-((S)-2-((S)-2-(6-(2,5-диоксо-2,5-дигидро-1H-пиррол-1-ил)гексанамидо)-3-метилбутанамидо)-5-уреидопентанамидо)бензил(4-нитрофенил)карбонат (1,2 экв.) объединяли и перемешивали при к. т. в течение ночи. Затем реакционную смесь концентрировали и очищали посредством колоночной хроматографии (MeOH в DCM) или HPLC с обращенной фазой с получением продукта.
1.3.1.1 ADL1-D1
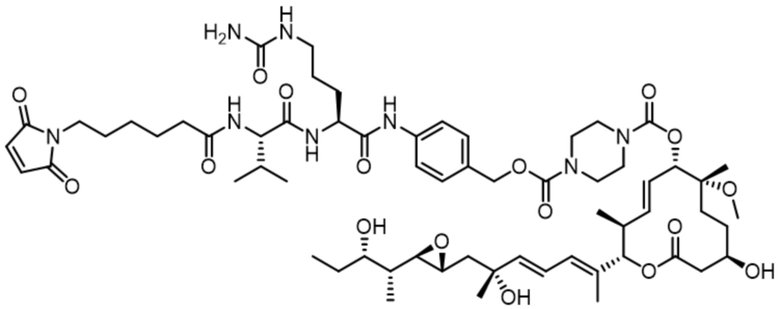
[945] Линкер-полезная нагрузка (ADL1-D1). Общую процедуру 1 (указанную в разделе 1.3.1) использовали для синтеза 1-(4-((S)-2-((S)-2-(6-(2,5-диоксо-2,5-дигидро-1H-пиррол-1-ил)гексанамидо)-3-метилбутанамидо)-5-уреидопентанамидо)бензил)-4-((2S,3S,6S,7R,10R, E)-10-гидрокси-2-((R,2E,4E)-6-гидрокси-7-((2R,3R)-3-((2R,3S)-3-гидроксипентан-2-ил)оксиран-2-ил)-6-метилгепта-2,4-диен-2-ил)-7-метокси-3,7-диметил-12-оксооксациклододец-4-ен-6-ил)пиперазин-1,4-дикарбоксилата (50 мг, 0,040 ммоль, выход 42%). LC/MS (ESI, масса/заряд), 1258,5 [M+Na]+.
[946] 1H-ЯМР (400 МГц, MeOH-d4): δ ppm 0,85-1,04 (m, 16 H) 1,18-1,26 (m, 3 H) 1,26-1,38 (m, 6 H) 1,40-1,71 (m, 14 H) 1,80 (s, 3 H) 1,85-1,98 (m, 2 H) 2,02-2,15 (m, 1 H) 2,24-2,34 (m, 2 H) 2,44-2,64 (m, 3 H) 2,65-2,72 (m, 1 H) 2,87-2,96 (m, 1 H) 3,06 -3,27 (m, 2 H) 3,37 (s, 6 H) 3,43-3,61 (m, 12 H) 3,79-3,90 (m, 1 H) 4,12-4,21 (m, 1 H) 4,48-4,55 (m, 1 H) 5,02-5,14 (m, 4 H) 5,55-5,65 (m, 1 H), 5,69-5,81 (m, 1 H) 5,85-5,93 (m, 1 H) 6,12-6,19 (m, 1 H) 6,49-6,60 (m, 1 H) 6,81 (s, 2 H) 7,29-7,38 (m, 2 H) 7,57-7,65 (m, 2 H).
1.3.1.2 ADL1-D18
[947] Полезную нагрузку D18 получали с применением процедур, указанных в разделе 1.2.1, с использованием пладиенолида B в качестве исходного материала (SM) (R=H; схема 1).
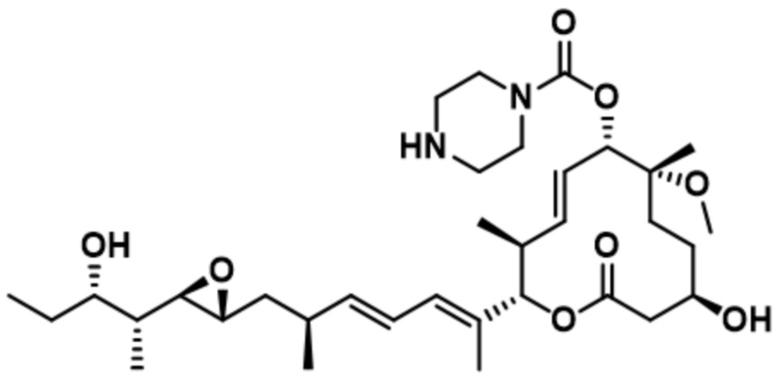
[948] (2S,3S,6S,7R,10R, E)-10-Гидрокси-2-((S,2E,4E)-7-((2R,3R)-3-((2R,3S)-3-гидроксипентан-2-ил)оксиран-2-ил)-6-метилгепта-2,4-диен-2-ил)-7-метокси-3,7-диметил-12-оксооксациклододец-4-ен-6-илпиперазин-1-карбоксилат (205 мг, 0,330 ммоль, выход 77%). LC/MS (ESI, масса/заряд), 621,6 [M+H]+.
[949] 1H-ЯМР (400 МГц, MeOH-d4): δ ppm 0,88-0,99 (m, 9 H) 1,10 (d, J=6,78 Гц, 3 H) 1,24 (s, 4 H) 1,42-1,69 (m, 8 H) 1,77 (d, J=0,88 Гц, 3 H) 2,43-2,63 (m, 4 H) 2,64-2,70 (m, 1 H) 2,71-2,82 (m, 5 H) 3,34 (br s, 3 H) 3,37 (s, 2 H) 3,42-3,57 (m, 5 H) 3,79-3,89 (m, 1 H) 5,06 (s, 2 H), 5,54-5,63 (m, 1 H) 5,64-5,80 (m, 2 H) 6,07-6,16 (m, 1 H) 6,29-6,40 (m, 1 H).
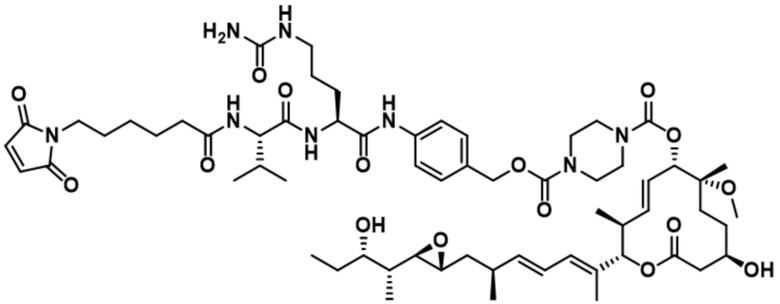
[950] Линкер-полезная нагрузка (ADL1-D18). Общую процедуру 1 (указанную в разделе 1.3.1) использовали для синтеза 1-(4-((S)-2-((S)-2-(6-(2,5-диоксо-2,5-дигидро-1H-пиррол-1-ил)гексанамидо)-3-метилбутанамидо)-5-уреидопентанамидо)бензил)-4-((2S,3S,6S,7R,10R, E)-10-гидрокси-2-((S,2E,4E)-7-((2R,3R)-3-((2R,3S)-3-гидроксипентан-2-ил)оксиран-2-ил)-6-метилгепта-2,4-диен-2-ил)-7-метокси-3,7-диметил-12-оксооксациклододец-4-ен-6-ил)пиперазин-1,4-дикарбоксилата (72 мг, 0,059 ммоль, выход 54,7%). LC/MS (ESI, масса/заряд), 1220,08 [M+H]+.
[951] 1H-ЯМР (400 МГц, MeOH-d4): δ ppm 0,87-1,02 (m, 15 H) 1,10 (d, J=6,78 Гц, 3 H) 1,23 (s, 4 H) 1,29-1,38 (m, 2 H) 1,44-1,68 (m, 13 H), 1,54-1,55 (m, 1 H) 1,77 (d, J=0,75 Гц, 4 H) 1,87-1,95 (m, 1 H) 2,05-2,15 (m, 1 H) 2,24-2,32 (m, 2 H) 2,45-2,62 (m, 4 H) 2,65-2,70 (m, 1 H), 2,71-2,78 (m, 1 H) 3,13-3,18 (m, 2 H) 3,46-3,58 (m, 11 H) 3,79-3,90 (m, 1 H) 4,13-4,21 (m, 1 H) 4,47-4,56 (m, 1 H) 5,11 (s, 4 H) 5,53-5,81 (m, 3 H) 6,06-6,16 (m, 1 H) 6,29-6,40 (m, 1 H) 6,81 (s, 2 H) 7,34 (d, J=8,53 Гц, 2 H) 7,60 (d, J=8,53 Гц, 2 H).
1.3.1.3 ADL1-D8 и ADL6-D8
[952] Полезную нагрузку D8 синтезировали в соответствии с процедурой, указанной ниже.
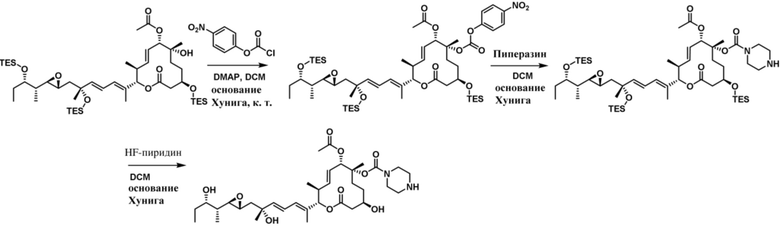
Схема 3
[953] Стадия 1. В раствор три-TES-пладиенолида D (200 мг, 0,223 ммоль) в дихлорметане (2 мл) при 0°C добавляли DMAP (409 мг, 3,35 ммоль) и 4-нитрофенилхлорформиат (338 мг, 1,675 ммоль). Реакционную смесь перемешивали при к. т. в течение 7 дней, разбавляли с помощью EtOAc и воды, затем слои разделяли. Водный слой экстрагировали с помощью EtOAc (2X) и объединенные органические экстракты промывали солевым раствором. Объединенные органические слои высушивали над Na2SO4, фильтровали и концентрировали in vacuo. С помощью флэш-хроматографии получали (2S,3S,6S,7R,10R, E)-3,7-диметил-2-((R,2E,4E)-6-метил-6-((триэтилсилил)окси)-7-((2R,3R)-3-((2S,3S)-3-((триэтилсилил)окси)пентан-2-ил)оксиран-2-ил)гепта-2,4-диен-2-ил)-7-(((4-нитрофенокси)карбонил)окси)-12-оксо-10-((триэтилсилил)окси)оксациклододец-4-ен-6-ил-ацетат (170 мг, выход 72%).
[954] 1H-ЯМР (400 МГц, CHCl3-d): δ ppm 0,54-0,67 (m, 18 H) 0,78-1,03 (m, 36 H) 1,19-1,32 (m, 1 H) 1,39 (s, 3 H) 1,43-1,52 (m, 3 H) 1,55-1,63 (m, 3 H) 1,64 (s, 3 H) 1,74 (s, 3 H) 1,88 (dd, J=13,80, 5,02 Гц, 1 H) 2,13 (s, 3 H) 2,23-2,37 (m, 1 H) 2,39-2,48 (m, 2 H) 2,51-2,63 (m, 2 H) 2,84 (s, 1 H) 3,69-3,77 (m, 1 H) 3,82-4,00 (m, 1 H) 5,04 (d, J=10,79 Гц, 1 H) 5,24 (d, J=9,03 Гц, 1 H) 5,67-5,84 (m, 3 H) 6,12 (d, J=10,16 Гц, 1 H) 6,42 (dd, J=15,06, 11,04 Гц, 1 H) 7,42 (d, J=9,29 Гц, 2 H) 8,29 (d, J=9,16 Гц, 2 H).
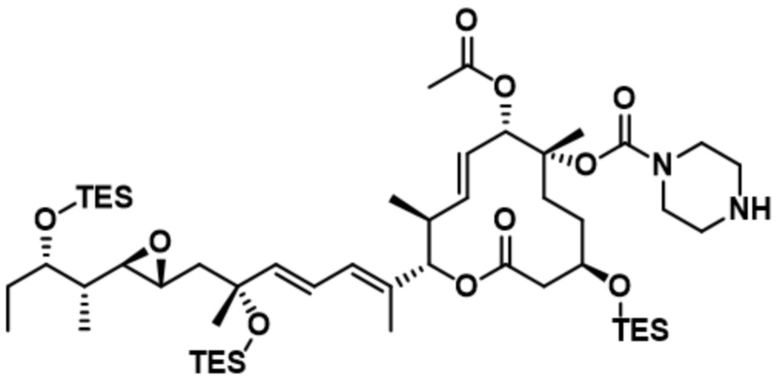
[955] Стадия 2. В раствор (2S,3S,6S,7R,10R, E)-3,7-диметил-2-((R,2E,4E)-6-метил-6-((триэтилсилил)окси)-7-((2R,3R)-3-((2S,3S)-3-((триэтилсилил)окси)пентан-2-ил)оксиран-2-ил)гепта-2,4-диен-2-ил)-7-(((4-нитрофенокси)карбонил)окси)-12-оксо-10-((триэтилсилил)окси)оксациклододец-4-ен-6-ил-ацетата (100 мг, 0,094 ммоль) в DCM добавляли пиперазин и DMAP. Полученную желтоватую суспензию перемешивали в течение 6 часов. Реакционную смесь концентрировали с получением неочищенного продукта. С помощью флэш-хроматографии получали (2S,3S,6S,7R,10R, E)-6-ацетокси-3,7-диметил-2-((R,2E,4E)-6-метил-6-((триэтилсилил)окси)-7-((2R,3R)-3-((2S,3S)-3-((триэтилсилил)окси)пентан-2-ил)оксиран-2-ил)гепта-2,4-диен-2-ил)-12-оксо-10-((триэтилсилил)окси)оксациклододец-4-ен-7-илпиперазин-1-карбоксилат (95 мг, 100%). LC/MS (ESI, масса/заряд), 1008,8 [M+H]+.
[956] 1H-ЯМР (400 МГц, CHCl3-d): δ ppm 0,42-0,70 (m, 22 H) 0,79-0,84 (m, 7 H) 0,86-0,91 (m, 4 H) 0,92-1,03 (m, 30 H) 1,15-1,30 (m, 2 H) 1,37-1,42 (m, 3 H) 1,44-1,52 (m, 3 H) 1,56-1,62 (m, 2 H) 1,62-1,68 (m, 1 H) 1,71-1,76 (m, 3 H) 1,83-1,93 (m, 1 H) 2,03-2,11 (m, 4 H) 2,36-2,45 (m, 2 H) 2,45-2,53 (m, 2 H) 2,54-2,64 (m, 1 H) 2,78-2,86 (m, 1 H) 2,86-3,07 (m, 4 H) 3,32-3,45 (m, 1 H) 3,45-3,64 (m, 3 H) 3,69-3,78 (m, 1 H) 3,79-3,94 (m, 1 H) 5,00 (d, J=10,54 Гц, 1 H) 5,18 (s, 1 H) 5,54-5,79 (m, 3 H) 5,98-6,21 (m, 1 H) 6,33-6,57 (m, 1 H) 6,84-6,96 (m, 3 H) 8,02-8,35 (m, 2 H) 8,06-8,08 (m, 1 H).
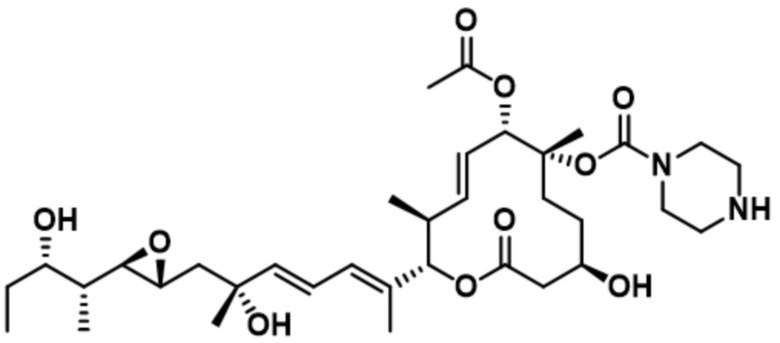
[957] Стадия 3. В раствор (2S,3S,6S,7R,10R, E)-6-ацетокси-3,7-диметил-2-((R,2E,4E)-6-метил-6-((триэтилсилил)окси)-7-((2R,3R)-3-((2S,3S)-3-((триэтилсилил)окси)пентан-2-ил)оксиран-2-ил)гепта-2,4-диен-2-ил)-12-оксо-10-((триэтилсилил)окси)оксациклододец-4-ен-7-илпиперазин-1-карбоксилата (95 мг, 0,094 ммоль) в THF (3 мл) добавляли TBAF (0,424 мл, 1 M, 0,424 ммоль) и перемешивали при к. т. в течение 10 часов. Смесь концентрировали и разбавляли с помощью EtOAc, промывали водой и солевым раствором. Органический слой разделяли и высушивали над Na2SO4, фильтровали и концентрировали in vacuo. С помощью очистки посредством HPLC получали (2S,3S,6S,7R,10R, E)-6-ацетокси-10-гидрокси-2-((R,2E,4E)-6-гидрокси-7-((2R,3R)-3-((2R,3S)-3-гидроксипентан-2-ил)оксиран-2-ил)-6-метилгепта-2,4-диен-2-ил)-3,7-диметил-12-оксооксациклододец-4-ен-7-илпиперазин-1-карбоксилат (16 мг, 26%). LC/MS (ESI, масса/заряд), 665,6 [M+H]+.
[958] 1H-ЯМР (400 МГц, CHCl3-d): δ ppm 0,90 (dd, J=6,84, 2,20 Гц, 6 H) 0,94 (t, J=7,40 Гц, 3 H) 1,20-1,30 (m, 1 H) 1,34 (s, 3 H) 1,39-1,54 (m, 3 H) 1,55 (s, 3 H) 1,59-1,73 (m, 3 H) 1,78 (d, J=0,88 Гц, 3 H) 1,86 (dd, J=13,99, 5,46 Гц, 1 H) 2,05 (s, 3 H) 2,39-2,53 (m, 3 H) 2,55-2,65 (m, 1 H) 2,67 (dd, J=8,03, 2,26 Гц, 1 H) 2,89 (s, 1 H) 3,22 (br s, 4 H) 3,50-3,57 (m, 1 H) 3,58-3,90 (m, 5 H) 5,08 (d, J=10,67 Гц, 1 H) 5,18 (d, J=9,03 Гц, 1 H) 5,58-5,78 (m, 2 H) 5,88 (d, J=15,31 Гц, 1 H) 6,10-6,23 (m, 1 H) 6,53 (dd, J=15,25, 10,98 Гц, 1 H).
[959] Стадия 4.
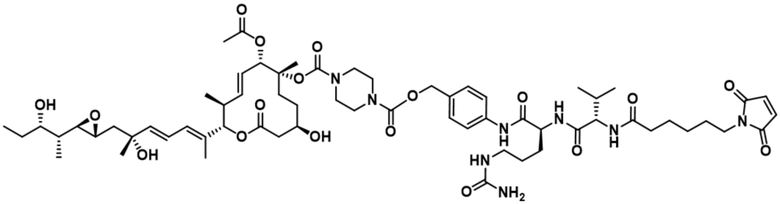
[960] Линкер-полезная нагрузка (ADL1-D8). К 4-((S)-2-((S)-2-(6-(2,5-диоксо-2,5-дигидро-1H-пиррол-1-ил)гексанамидо)-3-метилбутанамидо)-5-уреидопентанамидо)бензил-(4-нитрофенил)карбонату (7,5 мг, 10,166 мкмоль) в DMF (315 мкл, 4,066 ммоль) добавляли основание Хунига (5,33 мкл, 0,03 ммоль). Реакционную смесь охлаждали до 0°C и добавляли (2S,3S,6S,7R,10R, E)-6-ацетокси-10-гидрокси-2-((R,2E,4E)-6-гидрокси-7-((2R,3R)-3-((2R,3S)-3-гидроксипентан-2-ил)оксиран-2-ил)-6-метилгепта-2,4-диен-2-ил)-3,7-диметил-12-оксооксациклододец-4-ен-7-ил-пиперазин-1-карбоксилат (7,50 мг, 0,011 ммоль). Реакционную смесь перемешивали при к. т. до израсходования исходного материала. Реакционную смесь концентрировали in vacuo. С помощью флэш-хроматографии получали ADL1-D8 (7,2 мг, 5,70 мкмоль, выход 56,1%). LC/MS (ESI, масса/заряд), 1263,8 [M+H]+. Общую процедуру 1 (1.3.1) можно также использовать для получения ADL1-110987.
[961] 1H-ЯМР (400 МГц, ХЛОРОФОРМ-d): δ ppm 0,80-1,02 (m, 16 H) 1,20-1,35 (m, 6 H) 1,38-1,48 (m, 2 H) 1,57-1,69 (m, 7 H) 1,74-1,81 (m, 4 H) 1,86-1,96 (m, 2 H) 2,00-2,11 (m, 4 H) 2,31 (br d, J=6,02 Гц, 2 H) 2,45-2,55 (m, 2 H) 2,59-2,74 (m, 2 H) 2,85-2,96 (m, 1 H) 3,05-3,25 (m, 5 H) 3,40-3,59 (m, 9 H) 3,62-3,88 (m, 1 H) 4,15 (d, J=7,53 Гц, 1 H) 5,05-5,22 (m, 5 H) 5,56-5,77 (m, 2 H) 5,84-5,98 (m, 1 H) 6,11-6,22 (m, 1 H) 6,47-6,61 (m, 1 H) 7,31-7,40 (m, 2 H) 7,56-7,65 (m, 2 H).
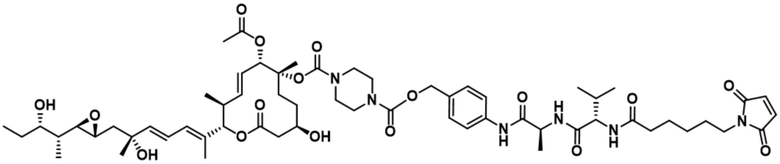
[962] Линкер-полезная нагрузка (ADL6-D8). К 4-((S)-2-((S)-2-(6-(2,5-диоксо-2,5-дигидро-1H-пиррол-1-ил)гексанамидо)-3-метилбутанамидо)пропанамидо)бензил(4-нитрофенил)карбонату (5 мг, 7,673 мкмоль) в DMF (238 мкл, 3,069 ммоль) добавляли основание Хунига (4,02 мкл, ,023 ммоль). Реакционную смесь охлаждали до 0°C и добавляли (2S,3S,6S,7R,10R, E)-6-ацетокси-10-гидрокси-2-((R,2E,4E)-6-гидрокси-7-((2R,3R)-3-((2R,3S)-3-гидроксипентан-2-ил)оксиран-2-ил)-6-метилгепта-2,4-диен-2-ил)-3,7-диметил-12-оксооксациклододец-4-ен-7-ил-пиперазин-1-карбоксилат. Реакционную смесь перемешивали при к. т. до израсходования исходного материала. Реакционную смесь концентрировали in vacuo. С помощью очистки посредством HPLC получали ADL6-D8 (1,2 мг, 1,019 мкмоль, выход 13,28%). LC/MS (ESI, масса/заряд), 1199,9 [M+Na]+.
[963] 1H ЯМР (400 МГц, CHCl3-d): δ ppm 0,78-1,04 (m, 18 H) 1,15-1,52 (m, 58 H) 1,64-1,72 (m, 3 H) 1,78 (d, J=6,53 Гц, 4 H) 2,04-2,19 (m, 3 H) 2,21-2,30 (m, 1 H) 2,44-2,67 (m, 4 H) 2,76 (dd, J=6,09, 2,95 Гц, 1 H) 2,90-3,02 (m, 1 H) 3,42-3,57 (m, 8 H) 3,61-3,70 (m, 1 H) 3,77 (br s, 1 H) 4,10-4,27 (m, 1 H) 4,58 (br d, J=6,65 Гц, 1 H) 5,01-5,26 (m, 4 H) 5,52-5,70 (m, 2 H) 5,88 (s, 1 H) 5,93-6,02 (m, 1 H) 6,08-6,18 (m, 1 H) 6,47-6,58 (m, 1 H) 7,29-7,35 (m, 2 H) 7,55 (d, J=8,66 Гц, 1 H).
1.3.1.4 ADL1-D4
[964] Синтезировали ADL1-D4 с применением процедур, указанных ниже.
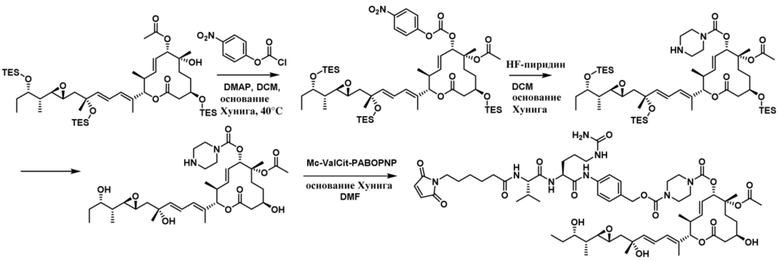
Схема 4
[965] Стадия 1. (2S,3S,6S,7R,10R, E)-3,7-Диметил-2-((R,2E,4E)-6-метил-6-((триэтилсилил)окси)-7-((2R,3R)-3-((2S,3S)-3-((триэтилсилил)окси)пентан-2-ил)оксиран-2-ил)гепта-2,4-диен-2-ил)-6-(((4-нитрофенокси)карбонил)окси)-12-оксо-10-((триэтилсилил)окси)оксациклододец-4-ен-7-ил-ацетат.
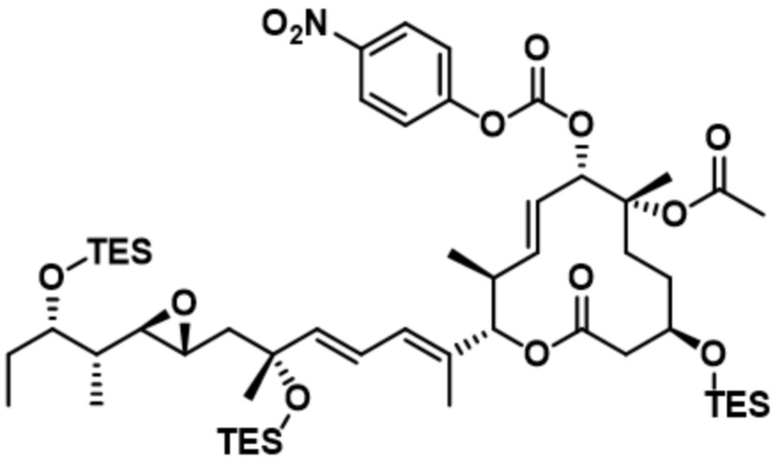
[966] В раствор три-TES-пладиенолида D (160 мг, 0,179 ммоль) в 1,2-дихлорэтане (5 мл) при 20°C добавляли DMAP (32,7 мг, 0,268 ммоль), триэтиламин (0,75 мл, 5,36 ммоль) и 4-нитрофенилхлорформиат (360 мг, 1,787 ммоль). Реакционную смесь перемешивали при 40°C в течение 4 дней и при 60°C в течение 2 часов. Реакционную смесь разбавляли с помощью EtOAc и промывали водой, затем слои разделяли. Водный слой экстрагировали с помощью EtOAc (2X). Объединенные органические экстракты последовательно промывали водой и солевым раствором, высушивали над MgSO4, фильтровали и концентрировали in vacuo. С помощью флэш-хроматографии получали (2S,3S,6S,7R,10R, E)-7-ацетокси-3,7-диметил-2-((R,2E,4E)-6-метил-6-((триэтилсилил)окси)-7-((2R,3R)-3-((2S,3S)-3-((триэтилсилил)окси)пентан-2-ил)оксиран-2-ил)гепта-2,4-диен-2-ил)-12-оксо-10-((триэтилсилил)окси)оксациклододец-4-ен-6-илпиперазин-1-карбоксилат (150 мг, выход 79%).
[967] 1H-ЯМР (400 МГц, CHCl3-d): δ ppm 0,48-0,71 (m, 24 H) 0,78-0,85 (m, 7 H) 0,86-0,93 (m, 5 H) 0,94-1,03 (m, 34 H) 1,18-1,22 (m, 2 H) 1,22-1,26 (m, 2 H) 1,35-1,43 (m, 4 H) 1,43-1,52 (m, 4 H) 1,54 (s, 4 H) 1,56-1,65 (m, 3 H) 1,68-1,72 (m, 3 H) 1,75 (br d, J=0,75 Гц, 2 H) 1,84-1,95 (m, 1 H) 2,01-2,06 (m, 2 H) 2,09 (s, 2 H) 2,11 (s, 2 H) 2,33-2,52 (m, 4 H) 2,57 (dd, J=8,09, 2,07 Гц, 2 H) 2,80-2,90 (m, 1 H) 3,66-3,80 (m, 1 H) 3,82-3,93 (m, 2 H) 4,92-5,13 (m, 2 H) 5,63-5,68 (m, 1 H) 5,69-5,74 (m, 1 H) 5,75-5,83 (m, 2 H) 6,12 (br d, J=10,67 Гц, 1 H) 6,41 (ddd, J=15,15, 11,01, 5,08 Гц, 1 H) 7,50 (d, J=9,41 Гц, 2 H) 8,35 (d, J=9,29 Гц, 2 H).
[968] Стадия 2. (2S,3S,6S,7R,10R, E)-7-Ацетокси-3,7-диметил-2-((R,2E,4E)-6-метил-6-((триэтилсилил)окси)-7-((2R,3R)-3-((2S,3S)-3-((триэтилсилил)окси)пентан-2-ил)оксиран-2-ил)гепта-2,4-диен-2-ил)-12-оксо-10-((триэтилсилил)окси)оксациклододец-4-ен-6-илпиперазин-1-карбоксилат.
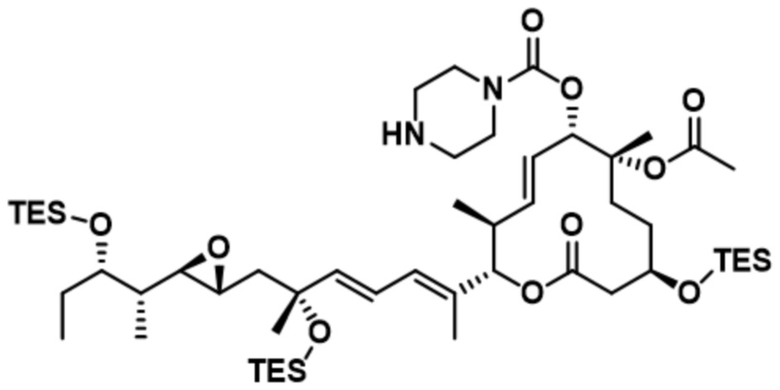
[969] В раствор (2S,3S,6S,7R,10R, E)-3,7-диметил-2-((R,2E,4E)-6-метил-6-((триэтилсилил)окси)-7-((2R,3R)-3-((2S,3S)-3-((триэтилсилил)окси)пентан-2-ил)оксиран-2-ил)гепта-2,4-диен-2-ил)-6-(((4-нитрофенокси)карбонил)окси)-12-оксо-10-((триэтилсилил)окси)оксациклододец-4-ен-7-ил-ацетата в DCM (1 мл) добавляли пиперазин (0,447 г, 5,195 ммоль) и основание Хунига (0,9 мл, 5,195 ммоль). Полученную желтоватую суспензию перемешивали в течение 6 часов. Реакционную смесь концентрировали и хроматографировали на силикагеле с получением (2S,3S,6S,7R,10R, E)-7-ацетокси-3,7-диметил-2-((R,2E,4E)-6-метил-6-((триэтилсилил)окси)-7-((2R,3R)-3-((2S,3S)-3-((триэтилсилил)окси)пентан-2-ил)оксиран-2-ил)гепта-2,4-диен-2-ил)-12-оксо-10-((триэтилсилил)окси)оксациклододец-4-ен-6-илпиперазин-1-карбоксилата (1,0 г, 0,844 ммоль, выход 81%). LC/MS (ESI, масса/заряд), 1008,1 [M+H]+.
D4
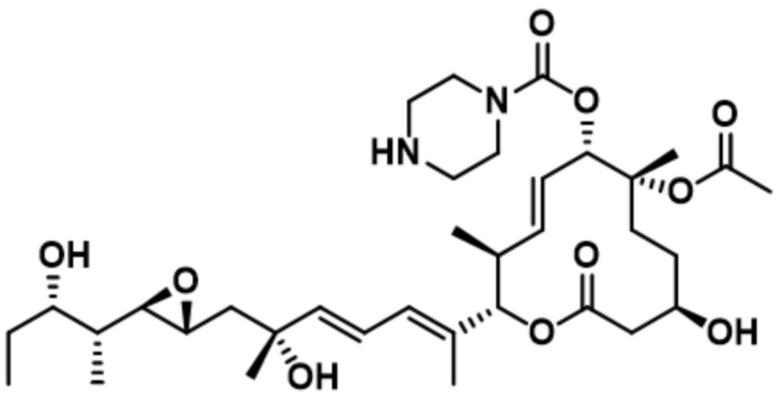
[970] Стадия 3. (2S,3S,6S,7R,10R, E)-7-Ацетокси-3,7-диметил-2-((R,2E,4E)-6-метил-6-((триэтилсилил)окси)-7-((2S,3S)-3-((2S,3S)-3-((триэтилсилил)окси)пентан-2-ил)оксиран-2-ил)гепта-2,4-диен-2-ил)-12-оксо-10-((триэтилсилил)окси)оксациклододец-4-ен-6-илпиперазин-1-карбоксилат (1,09 г, 0,92 ммоль), DCM (20,71 мл, 321,826 ммоль) и DIPEA (19,91 мл, 114,018 ммоль) объединяли и охлаждали до -78°C. Добавляли гидрофторид-пиридин (0,518 г, 5,232 ммоль) и обеспечивали нагревание реакционной смеси до к. т. и перемешивали ее в течение ночи. Согласно LC/MS предполагали десилилирование. Реакционную смесь охлаждали на ледяной бане. Добавляли насыщенный раствор NaHCO3 и перемешивали и экстрагировали с помощью DCM. Органические слои объединяли, высушивали над безводным Na2SO4 и концентрировали и хроматографировали с получением (2S,3S,6S,7R,10R, E)-7-ацетокси-10-гидрокси-2-((R,2E,4E)-6-гидрокси-7-((2R,3R)-3-((2R,3S)-3-гидроксипентан-2-ил)оксиран-2-ил)-6-метилгепта-2,4-диен-2-ил)-3,7-диметил-12-оксооксациклододец-4-ен-6-илпиперазин-1-карбоксилата (225 мг, 36,8%). LC/MS (ESI, масса/заряд), 665,6 [M+H]+.
[971] 1H-ЯМР (400 МГц, CHCl3-d): δ ppm 0,87-0,92 (m, 6 H) 0,94 (t, J=7,40 Гц, 3 H) 1,16-1,31 (m, 1 H) 1,35 (s, 3 H) 1,40-1,56 (m, 4 H) 1,59 (s, 3 H) 1,66 (br dd, J=14,68, 7,03 Гц, 3 H) 1,76-1,80 (m, 3 H) 1,87 (dd, J=14,12, 5,46 Гц, 1 H) 2,05 (s, 3 H) 2,30-2,41 (m, 1 H) 2,50 (d, J=3,76 Гц, 2 H) 2,56-2,72 (m, 2 H) 2,90 (br d, J=2,01 Гц, 1 H) 3,19 (br t, J=5,14 Гц, 4 H) 3,50-3,59 (m, 1 H) 3,71 (br s, 4 H) 3,77-3,89 (m, 1 H) 5,01-5,13 (m, 2 H) 5,58-5,71 (m, 1 H) 5,71-5,81 (m, 1 H) 5,88 (d, J=15,31 Гц, 1 H) 6,15 (br d, J=10,79 Гц, 1 H) 6,53 (dd, J=15,18, 10,92 Гц, 1 H).
AD1-D4
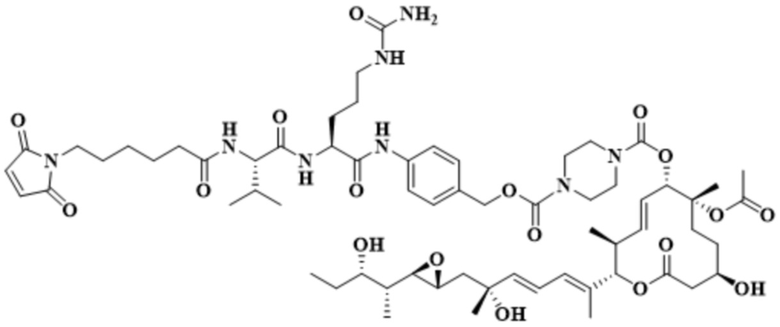
[972] К 4-((S)-2-((S)-2-(6-(2,5-диоксо-2,5-дигидро-1H-пиррол-1-ил)гексанамидо)-3-метилбутанамидо)-5-уреидопентанамидо)бензил(4-нитрофенил)карбонату (23 мг, 0,031 ммоль) в DMF (966 мкл) в круглодонной колбе добавляли основание Хунига (16,33 мкл, 0,094 ммоль). Реакционную смесь охлаждали до 0°C и добавляли D4 (22,80 мг, 0,034 ммоль) и перемешивали при к. т. Реакционную смесь концентрировали in vacuo. С помощью флэш-хроматографии получали ADL1-D4 (30,5 мг, 0,024 ммоль, выход 77%). LC/MS (ESI, масса/заряд), 1263,8 [M+H]+.
[973] 1H-ЯМР (400 МГц, MeOH-d4): δ ppm 0,87-0,93 (m, 7 H) 0,93-1,01 (m, 8 H) 1,19-1,34 (m, 4 H) 1,50 (s, 3 H) 1,57 (s, 5 H) 1,58-1,70 (m, 6 H) 1,70-1,77 (m, 1 H) 1,78 (s, 3 H) 1,83-1,95 (m, 2 H) 2,04 (s, 3 H) 2,05-2,13 (m, 1 H) 2,27 (t, J=7,40 Гц, 2 H) 2,32-2,42 (m, 1 H) 2,50 (d, J=3,64 Гц, 2 H) 2,55-2,74 (m, 2 H) 2,90 (td, J=5,83, 2,26 Гц, 1 H) 3,03-3,26 (m, 2 H) 3,35 (s, 13 H) 3,42-3,61 (m, 11 H) 3,80 (br dd, J=9,85, 3,58 Гц, 1 H) 4,16 (d, J=7,40 Гц, 1 H) 4,50 (dd, J=8,91, 5,14 Гц, 1 H) 4,56 (s, 1 H) 5,05 (dd, J=14,37, 10,10 Гц, 2 H) 5,09 (s, 2 H) 5,49 (s, 1 H) 5,59-5,69 (m, 1 H) 5,72-5,80 (m, 1 H) 5,87 (d, J=15,18 Гц, 1 H) 6,09-6,22 (m, 1 H) 6,44-6,60 (m, 1 H) 7,32 (d, J=8,66 Гц, 2 H) 7,58 (d, J=8,53 Гц, 2 H).
1.3.1.5 ADL1-D9, ADL6-D9 и ADL1-D13
D9 и D13
[974] D9 и D13 синтезировали в виде смеси изомеров 3:1 с использованием процедур, указанных в синтезе D4 (схема 4), с применением три-TES-пладиенолида B.
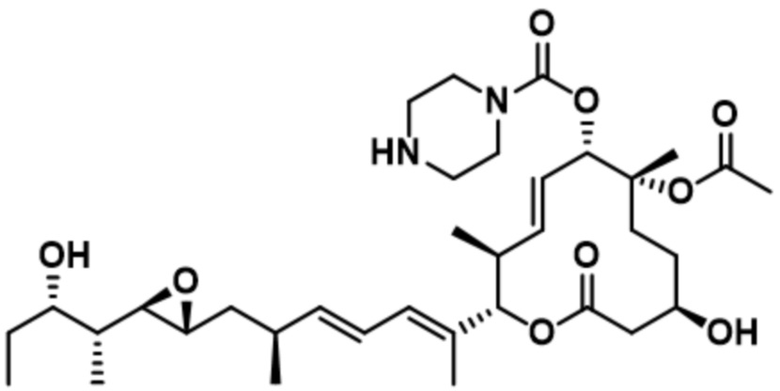
[975] Полезная нагрузка (D9): LC/MS (ESI, масса/заряд), 649,7 [M+H]+.
[976] 1H-ЯМР (400 МГц, CHCl3-d): δ ppm 0,87-1,01 (m, 10 H) 1,08 (d, J=6,78 Гц, 3 H) 1,27-1,63 (m, 12 H) 1,66-1,74 (m, 1 H) 1,76 (s, 3 H) 1,97-2,10 (m, 3 H) 2,35-2,57 (m, 5 H) 2,58-2,65 (m, 1 H) 2,65-2,71 (m, 1 H) 2,77 (td, J=5,93, 2,32 Гц, 1 H) 2,89-3,05 (m, 4 H) 3,07-3,34 (m, 8 H) 3,50-3,68 (m, 5 H) 3,72-3,88 (m, 1 H) 4,88-5,09 (m, 1 H) 5,18 (d, J=10,67 Гц, 1 H) 5,50-5,84 (m, 3 H) 6,01-6,13 (m, 1 H) 6,19-6,36 (m, 1 H).
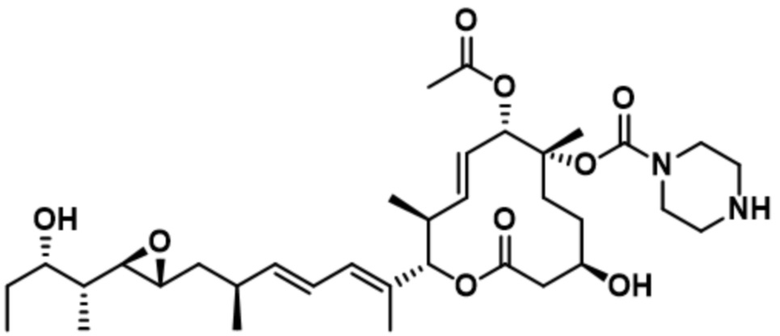
[977] Полезная нагрузка (D13): LC/MS (ESI, масса/заряд), 649,6 [M+H]+.
[978] 1H ЯМР (400 МГц, CHCl3-d) δ ppm 0,84-1,01 (m, 11 H) 1,08 (d, J=6,78 Гц, 3 H) 1,29-1,64 (m, 10 H) 1,63-1,73 (m, 1 H) 1,76 (s, 3 H) 1,94-2,12 (m, 4 H) 2,37-2,58 (m, 4 H) 2,59-2,65 (m, 1 H) 2,68 (dd, J=7,40, 2,26 Гц, 1 H) 2,77 (td, J=5,93, 2,32 Гц, 1 H) 3,01-3,30 (m, 4 H) 3,49 (s, 1 H) 3,54-3,67 (m, 2 H) 3,69-3,92 (m, 5 H) 4,13-4,78 (m, 11 H) 5,13-5,24 (m, 2 H) 5,48-5,61 (m, 1 H) 5,62-5,74 (m, 2 H) 6,04-6,13 (m, 1 H) 6,18-6,32 (m, 1 H).
ADL1-D9.
[979] Общую процедуру 1 (указанную в разделе 1.3.1) использовали для синтеза ADL1-D9.
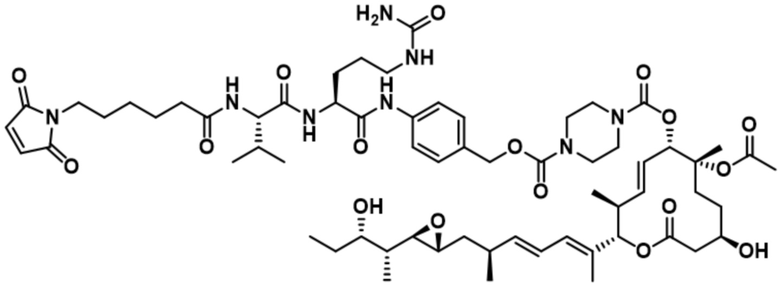
[980] Линкер-полезная нагрузка (ADL1-D9): (30,5 мг, 0,024 ммоль, выход 77%). LC/MS (ESI, масса/заряд), 1263,8 [M+H]+.
[981] 1H-ЯМР (400 МГц, MeOH-d4): δ ppm 0,87-0,93 (m, 7 H) 0,93-1,01 (m, 8 H) 1,19-1,34 (m, 4 H) 1,50 (s, 3 H) 1,57 (s, 5 H) 1,58-1,70 (m, 6 H) 1,70-1,77 (m, 1 H) 1,78 (s, 3 H) 1,83-1,95 (m, 2 H) 2,04 (s, 3 H) 2,05-2,13 (m, 1 H) 2,27 (t, J=7,40 Гц, 2 H) 2,32-2,42 (m, 1 H) 2,50 (d, J=3,64 Гц, 2 H) 2,55-2,74 (m, 2 H) 2,90 (td, J=5,83, 2,26 Гц, 1 H) 3,03-3,26 (m, 2 H) 3,35 (s, 13 H) 3,42-3,61 (m, 11 H) 3,80 (br dd, J=9,85, 3,58 Гц, 1 H) 4,16 (d, J=7,40 Гц, 1 H) 4,50 (dd, J=8,91, 5,14 Гц, 1 H) 4,56 (s, 1 H) 5,05 (dd, J=14,37, 10,10 Гц, 2 H) 5,09 (s, 2 H) 5,49 (s, 1 H) 5,59-5,69 (m, 1 H) 5,72-5,80 (m, 1 H) 5,87 (d, J=15,18 Гц, 1 H) 6,09-6,22 (m, 1 H) 6,44-6,60 (m, 1 H) 7,32 (d, J=8,66 Гц, 2 H) 7,58 (d, J=8,53 Гц, 2 H).
ADL6-D9
[982] Общую процедуру 1 (указанную в разделе 1.3.1) использовали для синтеза ADL6-D9.
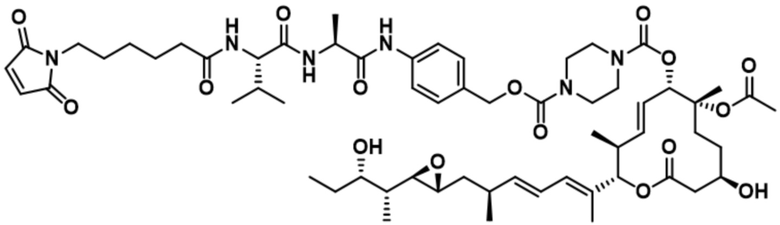
[983] Линкер-полезная нагрузка (ADL6-D9). К разбавленному 4-((S)-2-((S)-2-(6-(2,5-диоксо-2,5-дигидро-1H-пиррол-1-ил)гексанамидо)-3-метилбутанамидо)пропанамидо)бензил(4-нитрофенил)карбонату (16,5 мг, 0,025 ммоль) в DMF (784 мкл) добавляли основание Хунига (13,27 мкл, 0,076 ммоль). Реакционную смесь охлаждали до 0°C и добавляли D9. Реакционную смесь перемешивали при к. т. до определения завершения реакции посредством LC/MS. Реакционную смесь концентрировали in vacuo. С помощью флэш-хроматографии остатка на силикагеле с DCM/MeOH получали указанное в заголовке соединение (16,7 мг, выход 57%). LC/MS (ESI, масса/заряд), 1184,6 [M+Na]+.
[984] 1H-ЯМР (400 МГц, MeOH-d4): δ ppm 0,80-1,02 (m, 16 H) 1,05-1,12 (m, 4 H) 1,13-1,34 (m, 5 H) 1,38-1,51 (m, 7 H) 1,53-1,68 (m, 11 H) 1,71-1,80 (m, 4 H) 1,97-2,16 (m, 4 H) 2,24-2,32 (m, 2 H) 2,32-2,42 (m, 1 H) 2,43-2,55 (m, 3 H) 2,56-2,69 (m, 3 H) 2,73 (br d, J=2,13 Гц, 1 H) 3,07-3,18 (m, 1 H) 3,42-3,61 (m, 17 H) 3,75-3,91 (m, 1 H) 4,11-4,24 (m, 1 H) 4,43 (s, 2 H) 5,59-5,88 (m, 4 H) 6,06-6,17 (m, 1 H) 6,29-6,39 (m, 1 H) 7,24-7,39 (m, 2 H) 7,52-7,64 (m, 2 H).
ADL1-D13.
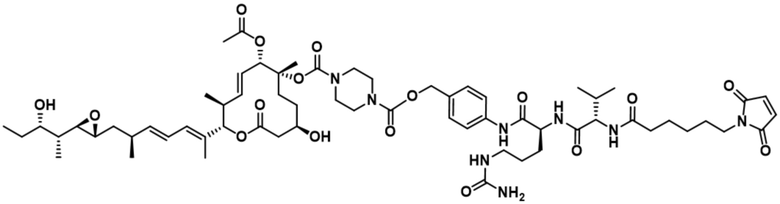
[985] Линкер-полезная нагрузка (AD1-D13). К 4-((S)-2-((S)-2-(6-(2,5-диоксо-2,5-дигидро-1H-пиррол-1-ил)гексанамидо)-3-метилбутанамидо)-5-уреидопентанамидо)бензил(4-нитрофенил)карбонату (4,2 мг, 5,693 мкмоль) в DMF (176 мкл, 2,277 ммоль) добавляли основание Хунига (2,98 мкл, 0,017 ммоль). Реакционную смесь охлаждали до 0°C и добавляли D13 (4,06 мг, 6,262 мкмоль). Реакционную смесь перемешивали при к. т. до определения завершения реакции посредством LC/MS. Реакционную смесь концентрировали in vacuo. С помощью флэш-хроматографии остатка на силикагеле с DCM/MeOH получали указанное в заголовке соединение (4,8 мг, выход 68%). LC/MS (ESI, масса/заряд), 1248,0 [M+H]+.
[986] 1H-ЯМР (400 МГц, CHCl3-d): δ ppm 0,58-0,98 (m, 10 H) 0,99-1,06 (m, 2 H) 1,11-1,31 (m, 6 H) 1,57-1,75 (m, 3 H) 2,11-2,26 (m, 1 H) 2,30-2,73 (m, 2 H) 3,28-3,80 (m, 7 H) 4,14-4,33 (m, 1 H) 4,44-4,55 (m, 1 H) 4,63-4,81 (m, 1 H) 4,92-5,06 (m, 1 H) 5,09 (s, 1 H) 5,49-5,74 (m, 1 H) 5,88-6,09 (m, 1 H) 6,14-6,36 (m, 1 H) 6,99-7,08 (m, 1 H) 7,21-7,38 (m, 2 H) 7,53-7,67 (m, 1 H) 7,95 (s, 1 H).
1.3.1.6 ADL1-D14
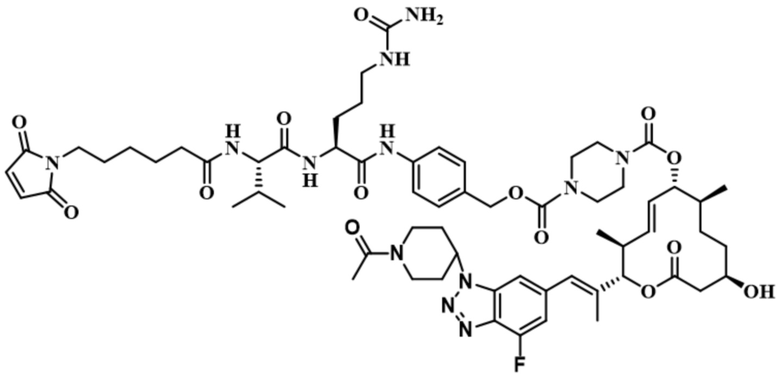
[987] Общую процедуру 1 (указанную в разделе 1.3.1) использовали для синтеза 1-((2S,3S,6R,7S,10R, E)-2-((E)-1-(1-(1-ацетилпиперидин-4-ил)-4-фтор-1H-бензо[d][1,2,3]триазол-6-ил)проп-1-ен-2-ил)-10-гидрокси-3,7-диметил-12-оксооксациклододец-4-ен-6-ил)-4-(4-((S)-2-((S)-2-(6-(2,5-диоксо-2,5-дигидро-1H-пиррол-1-ил)гексанамидо)-3-метилбутанамидо)-5-уреидопентанамидо)бензил)пиперазин-1,4-дикарбоксилата (30 мг, 0,024 ммоль, выход 39,2%). LC/MS (ESI, масса/заряд), 1254,5 [M+H]+.
[988] 1H-ЯМР (400 МГц, DMSO-d6): δ ppm 0,75-1,00 (m, 12 H), 1,06-1,26 (m, 4 H), 1,26-1,77 (m, 13 H), 1,75-2,02 (m, 7 H), 2,08 (s, 8 H), 2,23-2,35 (m, 2 H), 2,54-2,70 (m, 2 H), 2,78-3,10 (m, 4 H), 3,36 (br s, 13 H), 3,66-3,79 (m, 1 H), 3,95-4,08 (m, 1 H), 4,11-4,25 (m, 1 H), 4,28-4,46 (m, 1 H), 4,46-4,58 (m, 1 H), 4,58-4,66 (m, 1 H), 4,66-4,77 (m, 1 H), 5,01 (s, 3 H), 5,14-5,27 (m, 1 H), 5,39 (s, 4 H), 5,71-5,79 (m, 1 H), 5,87-6,00 (m, 1 H), 6,63-6,75 (m, 1 H), 6,99 (s, 2 H), 7,13-7,24 (m, 1 H), 7,24-7,34 (m, 2 H), 7,52-7,62 (m, 2 H), 7,65-7,74 (m, 1 H), 7,75-7,82 (m, 1 H), 7,98-8,13 (m, 1 H).
1.3.1.7 ADL1-D33
D33
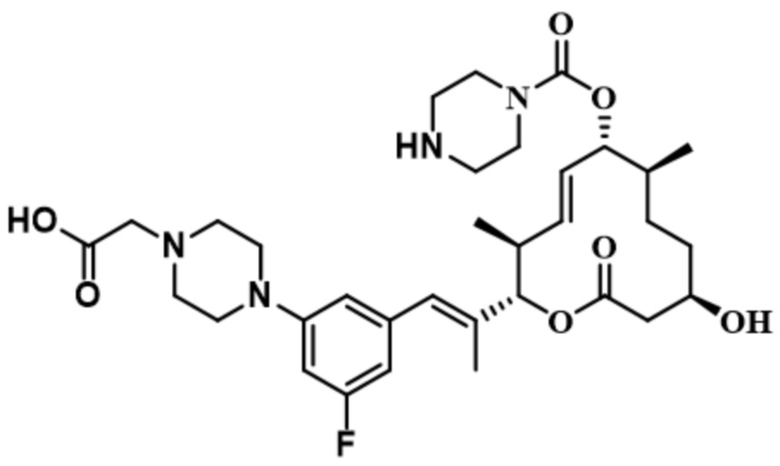
[989] К перемешиваемому раствору (2S,3S,6R,7S,10R, E)-2-((E)-1-(3-фтор-5-(4-(2-метокси-2-оксоэтил)пиперазин-1-ил)фенил)проп-1-ен-2-ил)-10-гидрокси-3,7-диметил-12-оксооксациклододец-4-ен-6-илпиперазин-1-карбоксилата (27 мг, 0,042 ммоль) в THF/H2O (3 мл/1 мл) при 0°C добавляли LiOH и обеспечивали медленное нагревание реакционной смеси до 25°C. Синтезировали (2S,3S,6R,7S,10R, E)-2-((E)-1-(3-фтор-5-(4-(2-метокси-2-оксоэтил)пиперазин-1-ил)фенил)проп-1-ен-2-ил)-10-гидрокси-3,7-диметил-12-оксооксациклододец-4-ен-6-илпиперазин-1-карбоксилат с применением процедур, указанных в международной заявке на патент № PCT/US2019/026992 (см., например, процедуры 17 и 19), которая включена в данный документ посредством ссылки. Через 6 часов реакционную смесь нейтрализовали с помощью фосфатного буфера (NaH2PO4, 1,0 M, 3 мл) и фазы разделяли. Водный слой экстрагировали этилацетатом (3×2 мл) и объединенные органические слои высушивали с помощью безводного сульфата натрия и концентрировали in vacuo. С помощью колоночной хроматографии с обращенной фазой получали указанное в заголовке соединение (19,4 мг, 0,031 ммоль, выход 73,4%). LC/MS (ESI, масса/заряд), 631,4 [M+H]+.
[990] 1H-ЯМР (400 МГц, CHCl3-d): δ ppm 0,85-1,16 (m, 2 H) 1,23-1,52 (m, 1 H) 1,57-1,77 (m, 1 H) 1,87 (s, 1 H) 1,92-2,13 (m, 1 H) 2,35-2,55 (m, 1 H) 2,50-2,74 (m, 1 H) 3,11 (br s, 1 H) 3,36-3,54 (m, 2 H) 3,64 (br d, J=10,42 Гц, 2 H) 3,77-3,90 (m, 1 H) 4,76 (br s, 4 H) 5,07-5,19 (m, 1 H) 5,38-5,68 (m, 1 H) 6,40-6,76 (m, 1 H) 8,02-8,66 (m, 1 H).
ADL1-D33.
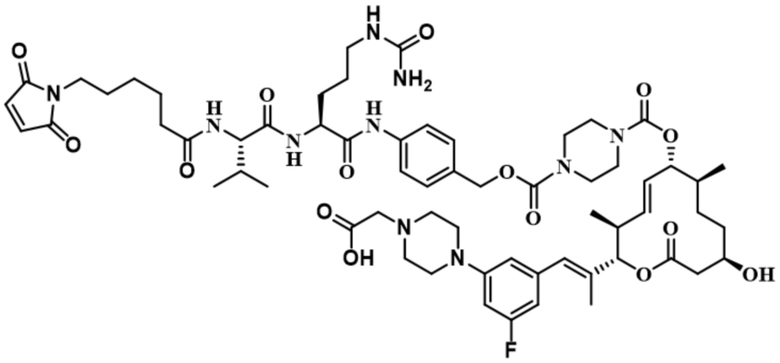
[991] Линкер-полезная нагрузка (ADL1-D33). К 4-((S)-2-((S)-2-(6-(2,5-диоксо-2,5-дигидро-1H-пиррол-1-ил)гексанамидо)-3-метилбутанамидо)-5-уреидопентанамидо)бензил(4-нитрофенил)карбонату (17 мг, ,023 ммоль) в DMF (714 мкл, 9,217 ммоль) добавляли основание Хунига (12,07 мкл, 0,069 ммоль). Реакционную смесь охлаждали до 0°C и добавляли 2-(4-(3-фтор-5-((E)-2-((2S,3S,6R,7S,10R, E)-10-гидрокси-3,7-диметил-12-оксо-6-((пиперазин-1-карбонил)окси)оксациклододец-4-ен-2-ил)проп-1-ен-1-ил)фенил)пиперазин-1-ил)уксусную кислоту (16,71 мг, 0,026 ммоль). Реакционную смесь перемешивали при к. т. до определения завершения реакции посредством LC/MS. Реакционную смесь концентрировали in vacuo. С помощью флэш-хроматографии на силикагеле и дополнительной очистки с помощью HPLC получали указанное в заголовке соединение (13,5 мг, 10,98 мкмоль, выход 47,7%). LC/MS (ESI, масса/заряд), 1229,5 [M+H]+.
[992] 1H-ЯМР (400 МГц, MeOH-d4): δ ppm 0,92-0,99 (m, 10 H) 1,01 (d, J=6,78 Гц, 3 H) 1,24-1,46 (m, 9 H) 1,52-1,70 (m, 10 H) 1,70-1,82 (m, 1 H) 1,87 (d, J=1,00 Гц, 4 H) 1,89-2,00 (m, 2 H) 2,01-2,23 (m, 2 H) 2,27 (t, J=7,40 Гц, 2 H) 2,46 (dd, J=14,31, 5,27 Гц, 1 H) 2,57-2,71 (m, 2 H) 2,86 (d, J=0,63 Гц, 1 H) 3,00 (s, 1 H) 3,06-3,27 (m, 4 H) 3,35 (s, 5 H) 3,41-3,53 (m, 19 H) 3,66 (s, 2 H) 3,76-3,90 (m, 1 H) 4,07-4,21 (m, 1 H) 4,39-4,69 (m, 37 H) 5,09 (s, 3 H) 5,13 (d, J=10,54 Гц, 1 H) 5,52 (dd, J=14,56, 9,03 Гц, 2 H) 6,55 (br s, 2 H) 6,69 (d, J=1,38 Гц, 2 H) 7,33 (d, J=8,66 Гц, 2 H) 7,59 (d, J=8,53 Гц, 2 H) 7,88-8,04 (m, 1 H) 8,16-8,33 (m, 1 H).
1.3.2 ADL1-D4, ADL1-D5, ADL21-D4, ADL22-D4, ADL23-D4, ADL13-D4
1.3.2.1 Общая процедура для приготовления D4 и D5
[993] 4-Стадийную процедуру, указанную ниже, использовали для синтеза указанных в заголовке соединений.
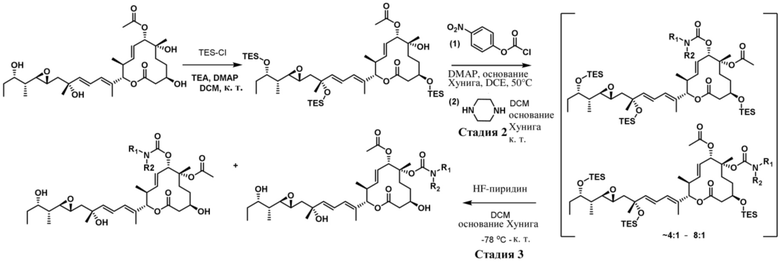
Стадия 2
[994] К раствору три-TES-пладиенолида D (1,0 экв.) в 1,2-дихлорэтане (0,2 M) при 20°C добавляли DMAP (1,5 экв.), триэтиламин (30 экв.) и 4-нитрофенилхлорформиат (10 экв.). Смесь перемешивали при 40°C в течение 4 дней и затем в течение 2 ч. при 60°C. Реакционную смесь разбавляли с помощью EtOAc и промывали водой, затем слои разделяли и водный слой экстрагировали с помощью EtOAc (2x). Объединенные органические экстракты последовательно промывали водой и солевым раствором, высушивали над сульфатом магния, фильтровали и концентрировали in vacuo. Полученный осадок очищали посредством хроматографии на силикагеле (EtOAc в гексане) с получением промежуточного соединения в виде карбоната. Карбонат (1,0 экв.), DCM (0,2 М), триэтиламин (3,0 экв.) и амин (2,0 экв.) объединяли и перемешивали при к. т. в течение 1 часа. Полученную смесь концентрировали in vacuo и хроматографировали (DCM/MeOH) с получением карбаматного промежуточного соединения в виде смеси региoизомеров.
Стадия 3
[995] Смесь региоизомерных карбаматов, полученных на стадии 2 (1,0 экв.), растворяли в DCM (0,04 М). Добавляли основание Хунига (124 экв.) и полученную смесь охлаждали до -78°C. Добавляли по каплям HF-пиридин (30 экв.) и смесь нагревали до к. т. и перемешивали в течение ночи при к. т. Затем смесь охлаждали до -78°C и в реакционную смесь добавляли по каплям насыщенный бикарбонат натрия и смесь нагревали до к. т. Органические слои разделяли и водный слой экстрагировали с помощью DCM (3X). Объединенные органические слои высушивали над безводным сульфатом натрия, фильтровали и концентрировали in vacuo. Полученный осадок подвергали очистке с помощью HPLC с обращенной фазой с получением каждого из требуемых региоизомерных продуктов.
D5
[996] Указанное в заголовке соединение получали с применением 2,5-диазабицикло[2.2.1]гептана на стадии 2 посредством стадий 2 и 3 общей процедуры 1.3.2.1.
Стадия 2
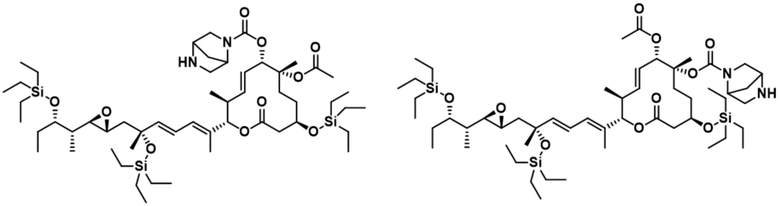
[997] Получали смесь (2S,3S,6S,7R,10R, E)-7-ацетокси-3,7-диметил-2-((R,2E,4E)-6-метил-6-((триэтилсилил)окси)-7-((2R,3R)-3-((2S,3S)-3-((триэтилсилил)окси)пентан-2-ил)оксиран-2-ил)гепта-2,4-диен-2-ил)-12-оксо-10-((триэтилсилил)окси)оксациклододец-4-ен-6-ил-2,5-диазабицикло[2.2.1]гептан-2-карбоксилата и (2S,3S,6S,7R,10R, E)-6-ацетокси-3,7-диметил-2-((R,2E,4E)-6-метил-6-((триэтилсилил)окси)-7-((2R,3R)-3-((2S,3S)-3-((триэтилсилил)окси)пентан-2-ил)оксиран-2-ил)гепта-2,4-диен-2-ил)-12-оксо-10-((триэтилсилил)окси)оксациклододец-4-ен-7-ил-2,5-диазабицикло[2.2.1]гептан-2-карбоксилата (21,7 мг, 45,1%) в виде бесцветного масла. LCMS (ESI, масса/заряд), [M+H]+ 1020,6
[998] 1H ЯМР (400 МГц, МЕТАНОЛ-d ) δ ppm 0,61-0,70 (m, 19 H) 0,82-0,95 (m, 10 H) 0,95-1,04 (m, 29 H) 1,23 (br dd, J=7,15, 4,64 Гц, 1 H)1,30 (s, 1 H) 1,42-1,64 (m, 12 H) 1,78 (s, 4 H) 1,88-2,01 (m, 2 H) 2,06 (br d, J=10,92 Гц, 3 H) 2,14 (br s, 1 H) 2,43 (br d, J=4,64 Гц, 2 H) 2,49 (br s, 1 H) 2,63 (dd, J=8,16, 2,13 Гц, 2 H) 2,86-2,91 (m, 1 H) 3,47-3,66 (m, 2 H) 3,76 (td, J=6,37, 3,33 Гц, 1 H) 3,95 (br d, J=4,27 Гц, 1 H) 4,34 (br s, 1H) 6,15 (br d, J=10,92 Гц, 1 H) 6,52 (dd, J=15,12, 10,98 Гц, 1H)
Стадия 3
D5
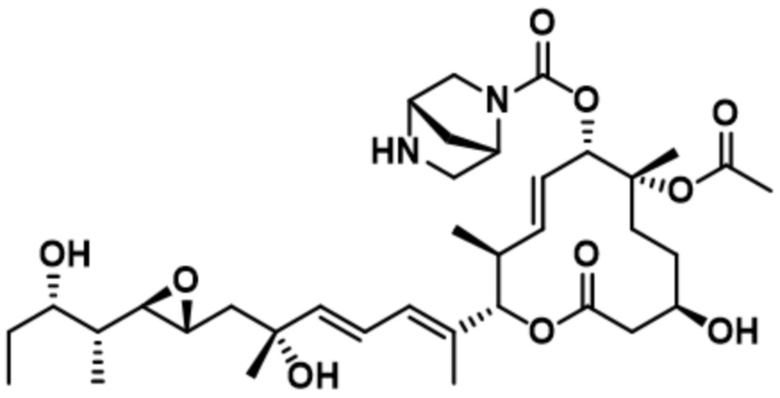
[999] С помощью очистки посредством HPLC получали (2S,3S,6S,7R,10R, E)-7-ацетокси-10-гидрокси-2-((R,2E,4E)-6-гидрокси-7-((2R,3R)-3-((2R,3S)-3-гидроксипентан-2-ил)оксиран-2-ил)-6-метилгепта-2,4-диен-2-ил)-3,7-диметил-12-оксооксациклододец-4-ен-6-ил-(1S,4S)-2,5-диазабицикло[2.2.1]гептан-2-карбоксилат (5 мг, 34,7%) в виде белого твердого вещества. LCMS (ESI, масса/заряд), [M+H]+ 677,6
[1000] 1H ЯМР (400 МГц, МЕТАНОЛ-d4) δ ppm 0,85-0,98 (m, 9 H) 1,25 (td, J=7,40, 4,14 Гц, 1 H) 1,34 (s, 3 H) 1,42-1,69 (m, 9 H) 1,79 (s, 4 H) 1,82-1,96 (m, 2 H) 2,04 (d, J=9,29 Гц, 3 H) 2,33 (br d, J=10,04 Гц, 1 H) 2,47-2,54 (m, 2 H) 2,57-2,72 (m, 2 H) 2,87-2,92 (m, 1 H) 3,03 (br s,2 H) 3,33-3,43 (m, 2 H) 3,43-3,57 (m, 2 H) 3,77-3,84 (m, 1 H) 3,86-3,94 (m, 1 H) 4,50 (br s, 1 H) 4,97-5,11 (m, 2 H) 5,60-5,68 (m, 1 H) 5,73-5,82 (m, 1 H) 5,88 (d, J=15,31 Гц, 1 H) 6,15 (br d, J=11,04 Гц, 1 H) 6,53 (dd, J=15,25, 10,98 Гц, 1 H) 8,54 (s, 1 H)
D4
[1001] Указанное в заголовке соединение получали с применением пиперазина на стадии 2 посредством стадий 2 и 3 общей процедуры 1.3.2.1.
Стадия 2.

[1002] С помощью стадии 2 общей процедуры 1.3.2.1 с применением пиперазина получали (2S,3S,6S,7R,10R, E)-7-ацетокси-3,7-диметил-2-((R,2E,4E)-6-метил-6-((триэтилсилил)окси)-7-((2R,3R)-3-((2S,3S)-3-((триэтилсилил)окси)пентан-2-ил)оксиран-2-ил)гепта-2,4-диен-2-ил)-12-оксо-10-((триэтилсилил)окси)оксациклододец-4-ен-6-илпиперазин-1-карбоксилат (1,0 г, 0,844 ммоль, выход 81%). LC/MS (ESI, масса/заряд), 1008,1 [M+H]+.
Стадия 3. D4

[1003] С помощью очистки посредством HPLC получали (2S,3S,6S,7R,10R, E)-7-ацетокси-10-гидрокси-2-((R,2E,4E)-6-гидрокси-7-((2R,3R)-3-((2R,3S)-3-гидроксипентан-2-ил)оксиран-2-ил)-6-метилгепта-2,4-диен-2-ил)-3,7-диметил-12-оксооксациклододец-4-ен-6-илпиперазин-1-карбоксилат (225 мг, 36,8%). LC/MS (ESI, масса/заряд), 665,6 [M+H]+.
[1004] 1H-ЯМР (400 МГц, CHCl3-d): δ ppm 0,87-0,92 (m, 6 H) 0,94 (t, J=7,40 Гц, 3 H) 1,16-1,31 (m, 1 H) 1,35 (s, 3 H) 1,40-1,56 (m, 4 H) 1,59 (s, 3 H) 1,66 (br dd, J=14,68, 7,03 Гц, 3 H) 1,76-1,80 (m, 3 H) 1,87 (dd, J=14,12, 5,46 Гц, 1 H) 2,05 (s, 3 H) 2,30-2,41 (m, 1 H) 2,50 (d, J=3,76 Гц, 2 H) 2,56-2,72 (m, 2 H) 2,90 (br d, J=2,01 Гц, 1 H) 3,19 (br t, J=5,14 Гц, 4 H) 3,50-3,59 (m, 1 H) 3,71 (br s, 4 H) 3,77-3,89 (m, 1 H) 5,01-5,13 (m, 2 H) 5,58-5,71 (m, 1 H) 5,71-5,81 (m, 1 H) 5,88 (d, J=15,31 Гц, 1 H) 6,15 (br d, J=10,79 Гц, 1 H) 6,53 (dd, J=15,18, 10,92 Гц, 1 H).
ADL1-D4.

[1005] Общую процедуру 1 (1.3.1) использовали для получения ADL1-D4. С помощью флэш-хроматографии получали ADL1-D4 (30,5 мг, 0,024 ммоль, выход 77%).
[1006] LC/MS (ESI, масса/заряд), 1263,8 [M+H]+.
[1007] 1H-ЯМР (400 МГц, MeOH-d4): δ ppm 0,87-0,93 (m, 7 H) 0,93-1,01 (m, 8 H) 1,19-1,34 (m, 4 H) 1,50 (s, 3 H) 1,57 (s, 5 H) 1,58-1,70 (m, 6 H) 1,70-1,77 (m, 1 H) 1,78 (s, 3 H) 1,83-1,95 (m, 2 H) 2,04 (s, 3 H) 2,05-2,13 (m, 1 H) 2,27 (t, J=7,40 Гц, 2 H) 2,32-2,42 (m, 1 H) 2,50 (d, J=3,64 Гц, 2 H) 2,55-2,74 (m, 2 H) 2,90 (td, J=5,83, 2,26 Гц, 1 H) 3,03-3,26 (m, 2 H) 3,35 (s, 13 H) 3,42-3,61 (m, 11 H) 3,80 (br dd, J=9,85, 3,58 Гц, 1 H) 4,16 (d, J=7,40 Гц, 1 H) 4,50 (dd, J=8,91, 5,14 Гц, 1 H) 4,56 (s, 1 H) 5,05 (dd, J=14,37, 10,10 Гц, 2 H) 5,09 (s, 2 H) 5,49 (s, 1 H) 5,59-5,69 (m, 1 H) 5,72-5,80 (m, 1 H) 5,87 (d, J=15,18 Гц, 1 H) 6,09-6,22 (m, 1 H) 6,44-6,60 (m, 1 H) 7,32 (d, J=8,66 Гц, 2 H) 7,58 (d, J=8,53 Гц, 2 H).
ADL1-D5
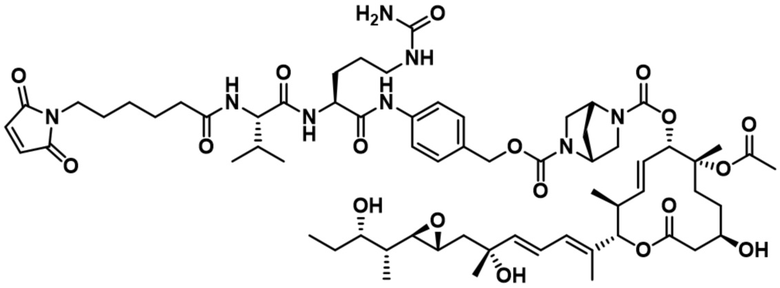
[1008] Общую процедуру 1 (1.3.1) использовали для получения ADL1-D5 с применением D5. С помощью флэш-хроматографии получали (14 мг, выход 51,6%). LCMS (ESI, масса/заряд), 1276,43 [M+H]+
[1009] 1H ЯМР (400 МГц, МЕТАНОЛ-d4) δ ppm 0,86-1,00 (m, 16 H) 1,23-1,40 (m, 7 H) 1,42-1,69 (m, 16 H) 1,73-1,80 (m, 4 H) 1,84-1,96 (m, 4H) 1,98-2,10 (m, 4 H) 2,27 (t, J=7,40 Гц, 2 H) 2,31-2,41 (m, 1 H) 2,50 (br d, J=3,39 Гц, 2 H) 2,56-2,64 (m, 1 H) 2,64-2,72 (m, 1 H) 2,80-2,93 (m, 1 H) 3,12 (br d, J=6,90 Гц, 1 H) 3,16-3,26 (m, 1 H) 3,35-3,56 (m, 7 H) 3,76-3,86 (m, 1 H) 4,16 (d, J=7,40 Гц, 1 H) 4,48-4,58 (m, 3H) 4,93-5,16 (m, 4 H) 5,65 (br d, J=9,91 Гц, 1 H) 5,70-5,82 (m, 1 H) 5,88 (d, J=15,18 Гц, 1 H) 6,14 (br d, J=11,04 Гц, 1 H) 6,50-6,58 (m, 1 H), 6,79 (s, 2 H) 7,26-7,36 (m, 2 H) 7,56-7,63 (m, 2 H)
1.3.3 Синтез ADL22-D4
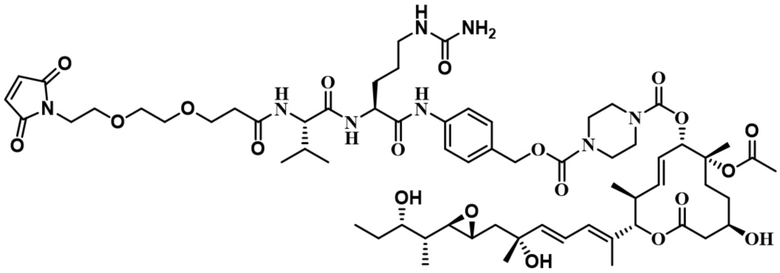
[1010] К раствору (2S,3S,6S,7R,10R, E)-7-ацетокси-10-гидрокси-2-((R,2E,4E)-6-гидрокси-7-((2R,3R)-3-((2R,3S)-3-гидроксипентан-2-ил)оксиран-2-ил)-6-метилгепта-2,4-диен-2-ил)-3,7-диметил-12-оксооксациклододец-4-ен-6-илпиперазин-1-карбоксилата (12 мг, 0,018 ммоль) в DMF (2 мл) добавляли 4-((2S,5S)-15-(2,5-диоксо-2,5-дигидро-1H-пиррол-1-ил)-5-изопропил-4,7-диоксо-2-(3-уреидопропил)-10,13-диокса-3,6-диазапентадеканамидо)бензил(4-нитрофенил)карбонат (16,98 мг, ,022 ммоль) и основание Хунига (7,00 мг, ,054 ммоль). Смесь перемешивали в течение 1 ч. при 20˚C. Смесь концентрировали in vacuo непосредственно на силикагеле и очищали с помощью колоночной хроматографии (MeOH/DCM 0-20%) с получением 1-((2S,3S,6S,7R,10R, E)-7-ацетокси-10-гидрокси-2-((R,2E,4E)-6-гидрокси-7-((2R,3R)-3-((2R,3S)-3-гидроксипентан-2-ил)оксиран-2-ил)-6-метилгепта-2,4-диен-2-ил)-3,7-диметил-12-оксооксациклододец-4-ен-6-ил)-4-(4-((2S,5S)-15-(2,5-диоксо-2,5-дигидро-1H-пиррол-1-ил)-5-изопропил-4,7-диоксо-2-(3-уреидопропил)-10,13-диокса-3,6-диазапентадеканамидо)бензил)пиперазин-1,4-дикарбоксилата (12 мг, 9,16 мкмоль, выход 50,8%) в виде белого твердого вещества. LCMS (ESI, масса/заряд), 1310,2 [M+H]+
[1011] Химическая формула: C65H96N8O20. Молекулярная масса: 1309,52.
[1012] 1H ЯМР (400 МГц, DMSO-d6) δ ppm 0,73-0,89 (m, 17 H) 1,03-1,13 (m, 1 H) 1,21-1,25 (m, 4 H) 1,25-1,40 (m, 5 H) 1,42-1,47 (m, 4 H) 1,48, (br s, 3 H) 1,69 (s, 4 H) 1,73-1,83 (m, 1 H) 1,99 (s, 2 H) 2,10-2,25 (m, 1 H) 2,36 (br s, 3 H) 2,40-2,48 (m, 2 H) 2,54-2,66 (m, 2 H) 2,72-2,80, (m, 1 H) 2,88-3,08 (m, 2 H) 3,34-3,44 (m, 9 H) 3,44-3,48 (m, 3 H) 3,48-3,52 (m, 2 H) 3,52-3,59 (m, 3 H) 3,64-3,75 (m, 1 H) 4,24 (s, 1 H), 4,40 (br d, J=5,65 Гц, 2 H) 4,62 (d, J=5,02 Гц, 1 H) 4,80-4,85 (m, 1 H) 4,90 (br d, J=9,03 Гц, 2 H) 5,01 (s, 2 H) 5,40 (s, 2 H) 5,48-5,57 (m, 1 H), 5,66-5,76 (m, 1 H) 5,81-5,91 (m, 1 H) 5,94-6,01 (m, 1 H) 6,02-6,11 (m, 1 H) 6,36-6,45 (m, 1 H) 7,02 (s, 2 H) 7,27-7,33 (m, 2 H) 7,58 (s, 2H) 7,81-7,89 (m, 1 H) 8,11 (br d, J=7,40 Гц, 1 H) 9,96-10,02 (m, 1 H)
1.3.4 Общая процедура синтеза ADL21-D12, ADL21-D1, ADL21-D4
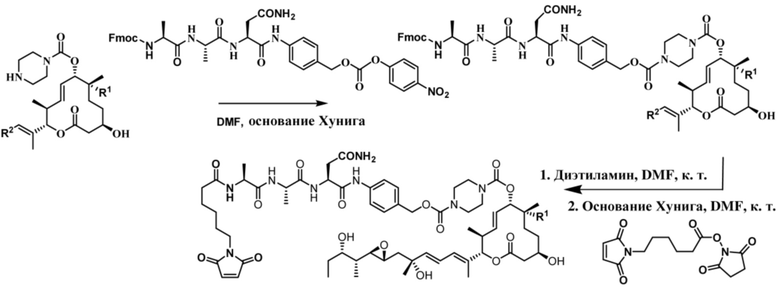
Стадия 1
[1013] Полезную нагрузку (1,0 экв.) и (9H-флуорен-9-ил)метил((S)-1-(((S)-1-(((S)-4-амино-1-((4-((((4-нитрофенокси)карбонил)окси)метил)фенил)амино)-1,4-диоксобутан-2-ил)амино)-1-оксопропан-2-ил)амино)-1-оксопропан-2-ил)карбамат (1,0 экв.) растворяли в DMF (0,1 М) и добавляли основание Хунига (3,0 экв.). Реакционную смесь перемешивали при к. т. в течение 30 минут, после чего реакционную смесь концентрировали in vacuo и полученный осадок хроматографировали (MeOH/DCM) с получением требуемого продукта.
Стадия 2 и 3
[1014] Растворяли конструкцию fmoc-Ala-Ala-аспарагин-PABC-полезная нагрузка (1,0 экв.) в N, N-диметилформамиде (0,05 М), затем добавляли диэтиламин (6,0 экв.). Реакционную смесь перемешивали при к. т. в течение 1 часа и смесь выпаривали до сухого состояния. Неочищенный продукт разбавляли N, N-диметилформамидом (0,05 М). Добавляли 2,5-диоксопирролидин-1-ил-6-(2,5-диоксо-2,5-дигидро-1H-пиррол-1-ил)гексанoат (1,2 экв.) и основание Хунига (2,5 экв.) в смесь и перемешивали при к. т. в течение 1 ч. Затем смесь концентрировали in vacuo и полученный осадок очищали посредством HPLC с обращенной фазой с получением требуемой конструкции линкер малеимидокапроил-Ala-Ala-аспарагин-PABC-полезная нагрузка.
1.3.4.1 ADL21-D1
Стадия 1.
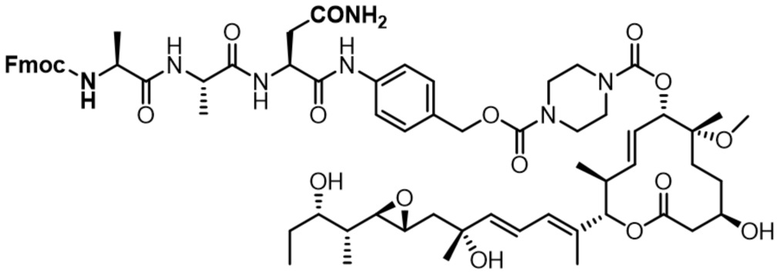
[1015] 1-(4-((5S,8S,11S)-11-(2-Амино-2-оксоэтил)-1-(9H-флуорен-9-ил)-5,8-диметил-3,6,9-триоксо-2-окса-4,7,10-триазадодекан-12-амидо)бензил)-4-((2S,3S,6S,7R,10R, E)-10-гидрокси-2-((R,2E,4E)-6-гидрокси-7-((2R,3R)-3-((2R,3S)-3-гидроксипентан-2-ил)оксиран-2-ил)-6-метилгепта-2,4-диен-2-ил)-7-метокси-3,7-диметил-12-оксооксациклододец-4-ен-6-ил)пиперазин-1,4-дикарбоксилат (140,2 мг, 71,9%) LCMS (ESI, масса/заряд) 1265,6 [M+H]+
Химическая формула: C67H89N7O17.
Молекулярная масса: 1264,48.
Стадии 2 и 3
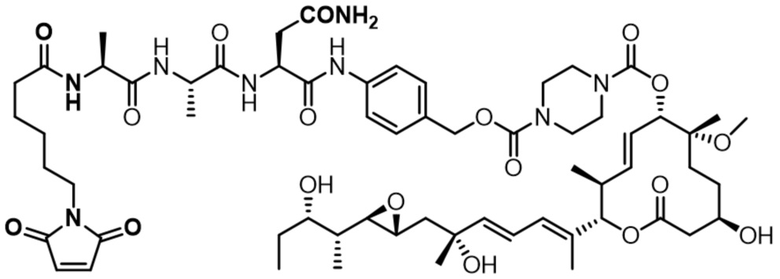
[1016] 1-(4-((S)-4-Амино-2-((S)-2-((S)-2-(6-(2,5-диоксо-2,5-дигидро-1H-пиррол-1-ил)гексанамидо)пропанамидо)пропанамидо)-4-оксобутанамидо)бензил)-4-((2S,3S,6S,7R,10R, E)-10-гидрокси-2-((R,2E,4E)-6-гидрокси-7-((2R,3R)-3-((2R,3S)-3-гидроксипентан-2-ил)оксиран-2-ил)-6-метилгепта-2,4-диен-2-ил)-7-метокси-3,7-диметил-12-оксооксациклододец-4-ен-6-ил)пиперазин-1,4-дикарбоксилат (49,1 мг, 35,8%). LCMS (ESI, масса/заряд) 1258,19 [M+Na]+
[1017] 1H ЯМР (400 МГц, МЕТАНОЛ-d4) δ ppm 0,85-0,98 (m, 10 H) 1,22 (s, 4 H) 1,26-1,45 (m, 14 H) 1,45-1,69 (m, 12 H) 1,79 (s, 3 H) 1,90 (s, 2H) 2,20-2,27 (m, 2 H) 2,52 (br dd, J=10,10, 3,70 Гц, 3 H) 2,67 (br d, J=2,13 Гц, 1 H) 2,85 (t, J=6,15 Гц, 3 H) 3,14 (t, J=1,57 Гц, 1 H) 3,41-3,57, (m, 14 H) 3,78-3,88 (m, 1 H) 4,27 (dd, J=12,36, 7,09 Гц, 2 H) 4,77 (s, 1 H) 4,97-5,13 (m, 6 H) 5,51-5,64 (m, 1 H) 5,72 (br d, J=9,66 Гц, 1 H), 5,88 (d, J=15,43 Гц, 1 H) 6,12-6,17 (m, 1 H) 6,47-6,61 (m, 1 H) 6,79 (s, 2 H) 7,33 (m, J=8,66 Гц, 2 H), 7,68 (m, J=8,66 Гц, 2 H)
1.3.4.2 ADL21-D4
Стадия 1
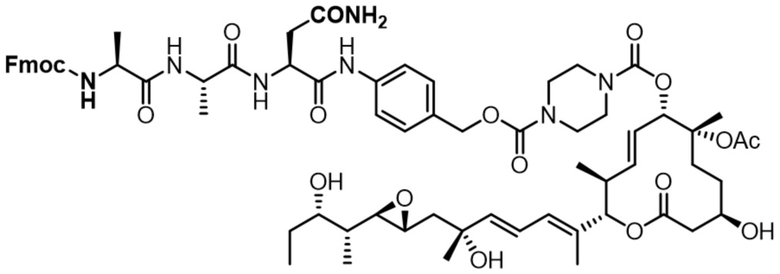
[1018] 1-((2S,3S,6S,7R,10R, E)-7-Ацетокси-10-гидрокси-2-((R,2E,4E)-6-гидрокси-7-((2R,3R)-3-((2R,3S)-3-гидроксипентан-2-ил)оксиран-2-ил)-6-метилгепта-2,4-диен-2-ил)-3,7-диметил-12-оксооксациклододец-4-ен-6-ил)-4-(4-((5S,8S,11S)-11-(2-амино-2-оксоэтил)-1-(9H-флуорен-9-ил)-5,8-диметил-3,6,9-триоксо-2-окса-4,7,10-триазадодекан-12-амидо)бензил)пиперазин-1,4-дикарбоксилат (125 мг, 85,6%). LCMS (ESI, масса/заряд) 1293,4 [M+H]+
Стадии 2 и 3
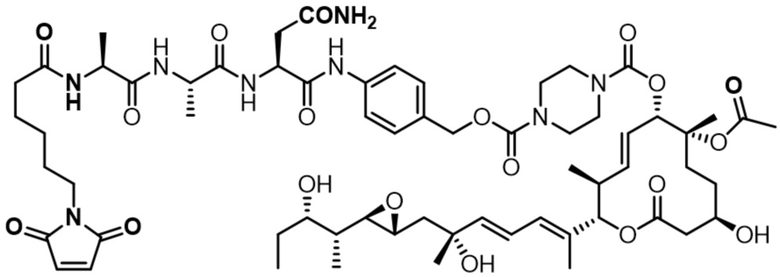
[1019] 1-((2S,3S,6S,7R,10R, E)-7-Ацетокси-10-гидрокси-2-((R,2E,4E)-6-гидрокси-7-((2R,3R)-3-((2R,3S)-3-гидроксипентан-2-ил)оксиран-2-ил)-6-метилгепта-2,4-диен-2-ил)-3,7-диметил-12-оксооксациклододец-4-ен-6-ил)-4-(4-((S)-4-амино-2-((S)-2-((S)-2-(6-(2,5-диоксо-2,5-дигидро-1H-пиррол-1-ил)гексанамидо)пропанамидо)пропанамидо)-4-оксобутанамидо)бензил)пиперазин-1,4-дикарбоксилат (35 мг, 80%). LCMS (ESI, масса/заряд) 1285,0 [M+Na]+
[1020] 1H ЯМР (400 МГц, DMSO-d6) δ ppm 0,71-0,87 (m, 9 H) 1,04-1,12 (m, 1 H) 1,14-1,26 (m, 13 H) 1,27-1,40 (m, 3 H) 1,40-1,52 (m, 9 H) 1,52-1,62 (m, 1 H) 1,69 (s, 3 H) 1,74-1,83 (m, 1 H) 1,99 (d, J=4,27 Гц, 4 H) 2,03-2,14 (m, 2 H) 2,15-2,26 (m, 1 H) 2,31-2,41 (m, 2 H) 2,54-2,65 (m, 4 H) 2,72-2,80 (m, 1 H) 3,17 (d, J=5,27 Гц, 3 H) 3,36 (br s, 9 H) 3,63-3,74 (m, 1 H) 3,99-4,12 (m, 2 H) 4,14-4,22 (m, 1 H) 4,23-4,30 (m, 1 H) 4,40 (d, J=5,65 Гц, 1 H) 4,55-4,65 (m, 2 H) 4,82 (s, 1 H) 4,87-4,93 (m, 2 H) 5,01 (s, 2 H) 5,47-5,57 (m, 1 H) 5,66-5,77 (m, 1 H) 6,01-6,09 (m, 1 H) 6,35-6,45 (m, 1 H) 6,89-6,96 (m, 1 H) 6,99 (s, 2 H) 7,30 (d, J=8,66 Гц, 2 H) 7,36-7,42 (m, 1 H) 7,62 (s, 2 H) 7,97-8,21 (m, 3 H), 9,62-9,72 (m, 1 H).
1.3.5 ADL21-D12
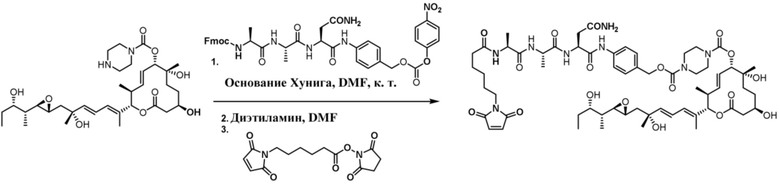
[1021] К раствору (2S,3S,6S,7R,10R, E)-7,10-дигидрокси-2-((R,2E,4E)-6-гидрокси-7-((2R,3R)-3-((2R,3S)-3-гидроксипентан-2-ил)оксиран-2-ил)-6-метилгепта-2,4-диен-2-ил)-3,7-диметил-12-оксооксациклододец-4-ен-6-илпиперазин-1-карбоксилата (50 мг, 0,08 ммоль) в DMF (1 мл) добавляли (9H-флуорен-9-ил)метил((S)-1-(((S)-1-(((S)-4-амино-1-((4-((((4-нитрофенокси)карбонил)окси)метил)фенил)амино)-1,4-диоксобутан-2-ил)амино)-1-оксопропан-2-ил)амино)-1-оксопропан-2-ил)карбамат (73,9 мг, 0,096 ммоль) с последующим добавлением N-этил-N-изопропилпропан-2-амина (104 мг, 0,803 ммоль). Реакционную смесь перемешивали в течение 1 ч. Реакционную смесь концентрировали до сухого состояния и очищали с помощью колоночной хроматографии на силикагеле. Фракции, содержащие требуемое соединение, концентрировали с получением чистого масла, которое использовали непосредственно на следующей стадии с предположительным выходом 100%. Затем полученное масло растворяли в DMF (2 мл) и загружали диэтиламин (58,7 мг, 0,803 ммоль). Полученную смесь перемешивали в течение 1 ч. при 20˚C и концентрировали in vacuo. Остаток повторно растворяли в DMF (1 мл) и затем добавляли 2,5-диоксопирролидин-1-ил-6-(2,5-диоксо-2,5-дигидро-1H-пиррол-1-ил)гексанoат (32,2 мг, 0,104 ммоль) и N-этил-N-изопропилпропан-2-амин (104 мг, 0,803 ммоль). Полученную смесь перемешивали в течение 1 ч. Реакционную смесь концентрировали до сухого состояния и очищали с помощью HPLC с обращенной фазой с получением 1-(4-((S)-4-амино-2-((S)-2-((S)-2-(6-(2,5-диоксо-2,5-дигидро-1H-пиррол-1-ил)гексанамидо)пропанамидо)пропанамидо)-4-оксобутанамидо)бензил)-4-((2S,3S,6S,7R,10R, E)-7,10-дигидрокси-2-((R,2E,4E)-6-гидрокси-7-((2R,3R)-3-((2R,3S)-3-гидроксипентан-2-ил)оксиран-2-ил)-6-метилгепта-2,4-диен-2-ил)-3,7-диметил-12-оксооксациклододец-4-ен-6-ил)пиперазин-1,4-дикарбоксилата (7,5 мг, 6,14 мкмоль, выход 7,65%) в виде белого твердого вещества. LCMS (ESI, масса/заряд) 1222,28 [M+H]+
1.3.6 ADL21-D8
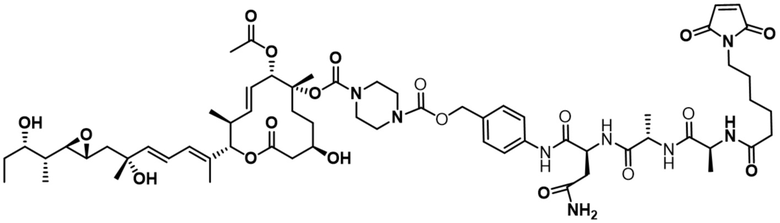
[1022] К раствору (2S,3S,6S,7R,10R, E)-6-ацетокси-10-гидрокси-2-((R,2E,4E)-6-гидрокси-7-((2R,3R)-3-((2R,3S)-3-гидроксипентан-2-ил)оксиран-2-ил)-6-метилгепта-2,4-диен-2-ил)-3,7-диметил-12-оксооксациклододец-4-ен-7-илпиперазин-1-карбоксилата (27,0 мг, ,041 ммоль) в DMF добавляли (9H-флуорен-9-ил)метил((S)-1-(((S)-1-(((S)-4-амино-1-((4((((4-нитрофенокси)карбонил)окси)метил)фенил)амино)-1,4-диоксобутан-2-ил)амино)-1-оксопропан-2-ил)амино)-1-оксопропан-2-ил)карбамат (40,5 мг, ,053 ммоль) с последующим добавлением основания Хунига (36,2 мкл, 0,203 ммоль). После перемешивания в течение 20 минут при к. т. смесь затем концентрировали in vacuo и полученный осадок очищали с помощью колоночной хроматографии (0-20% MeOH/DCM) с получением требуемого промежуточного соединения. Остаток затем объединяли с DMF (2 мл) и диэтиламином (29,7 мг, 0,406 ммоль) и перемешивали в течение 20 минут при к. т. Далее смесь концентрировали in vacuo и полученный осадок повторно растворяли в DMF (2 мл) и обрабатывали с помощью 2,5-диоксопирролидин-1-ил-6-(2,5-диоксо-2,5-дигидро-1H-пиррол-1-ил)гексанoата (16,28 мг, ,053 ммоль) и основания Хунига (36,2 мкл, 0,203 ммоль). Полученную смесь перемешивали в течение 20 минут перед концентрированием до сухого состояния и проведением очистки полученного осадка посредством колоночной хроматографии с помощью элюирования промежуточного соединения в градиенте 0-20% MeOH/DCM. Полученный остаток затем подвергали очистке с помощью HPLC с обращенной фазой с получением 1-((2S,3S,6S,7R,10R, E)-6-ацетокси-10-гидрокси-2-((R,2E,4E)-6-гидрокси-7-((2R,3R)-3-((2R,3S)-3-гидроксипентан-2-ил)оксиран-2-ил)-6-метилгепта-2,4-диен-2-ил)-3,7-диметил-12-оксооксациклододец-4-ен-7-ил)-4-(4-((S)-4-амино-2-((S)-2-((S)-2-(6-(2,5-диоксо-2,5-дигидро-1H-пиррол-1-ил)гексанамидо)пропанамидо)пропанамидо)-4-оксобутанамидо)бензил)пиперазин-1,4-дикарбоксилата (3,5 мг, 2,77 мкмоль, выход 6,82%), выделенного в виде белого твердого вещества. 1-((2S,3S,6S,7R,10R, E)-6-Ацетокси-10-гидрокси-2-((R,2E,4E)-6-гидрокси-7-((2R,3R)-3-((2R,3S)-3-гидроксипентан-2-ил)оксиран-2-ил)-6-метилгепта-2,4-диен-2-ил)-3,7-диметил-12-оксооксациклододец-4-ен-7-ил)-4-(4-((S)-4-амино-2-((S)-2-((S)-2-(6-(2,5-диоксо-2,5-дигидро-1H-пиррол-1-ил)гексанамидо)пропанамидо)пропанамидо)-4-оксобутанамидо)бензил)пиперазин-1,4-дикарбоксилат (3,5 мг, 6,8%). LCMS (ESI, масса/заряд) 1285,60 [M+Na]+
[1023] 1H ЯМР: 0,68-0,90 (m, 11 H) 1,03-1,13 (m, 2 H) 1,15-1,26 (m, 14 H) 1,24-1,38 (m, 4 H) 1,40-1,63 (m, 12 H), 1,69 (s, 3 H) 1,74-1,83 (m, 1 H) 2,03 (s, 3 H) 2,06-2,12 (m, 2 H) 2,24-2,41 (m, 3 H) 2,53-2,63 (m, 4 H), 3,79-3,80 (m, 1H) 4,13-4,30 (m, 2 H) 4,32-4,33 (m, 1 H) 4,33-4,47 (m, 1 H) 4,44-4,48 (m, 1 H) 4,52-4,73 (m, 2 H) 4,74-4,97 (m, 2 H) 5,03 (s, 3 H) 5,47-5,61 (m, 1 H) 5,65-5,77 (m, 1 H) 5,79-5,92 (m, 1 H) 5,98-6,12 (m, 1 H) 6,30-6,46 (m, 1 H) 6,75-6,85 (m, 1 H) 6,90-6,95 (m, 1 H) 6,99 (s, 1H) 7,26-7,36 (m, 2 H) 7,37-7,46 (m, 1 H) 7,56-7,73 (m, 2 H) 7,90-8,09 (m, 1 H) 8,07-8,22 (m, 2 H) 8,46 (s, 1 H) 9,59-9,78 (m, 1 H)
1.3.7 Получение конструкции линкер DBCO-Val-Cit-pABC-полезная нагрузка, ADL25-D4
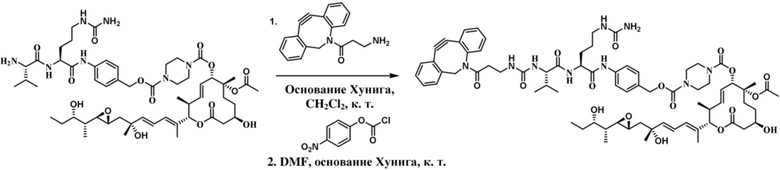
[1024] К раствору 3-амино-1-(11,12-дигидродибензo[b, f]азоцин-5(6H)-ил)пропан-1-она (19,36 мг, 0,07 ммоль) в DCM (5 мл) при 0˚C добавляли основание Хунига (10,26 мг, 0,079 ммоль) с последующим добавлением 4-нитрофенилкарбонилхлорида (14,12 мг, 0,07 ммоль). Реакцию нагревали до 20˚C и перемешивали в течение 2 ч. Затем смесь концентрировали до сухого состояния и разбавляли с помощью DMF. В полученную смесь добавляли основание Хунига (10,26 мг, ,079 ммоль) и 1-((2S,3S,6S,7R,10R, E)-7-ацетокси-10-гидрокси-2-((R,2E,4E)-6-гидрокси-7-((2R,3R)-3-((2R,3S)-3-гидроксипентан-2-ил)оксиран-2-ил)-6-метилгепта-2,4-диен-2-ил)-3,7-диметил-12-оксооксациклододец-4-ен-6-ил)-4-(4-((S)-2-((S)-2-амино-3-метилбутанамидо)-5-уреидопентанамидо)бензил)пиперазин-1,4-дикарбоксилат (50 мг, ,047 ммоль) и перемешивали в течение 1 ч. Затем смесь концентрировали до сухого состояния и очищали с помощью колоночной хроматографии с последующей очисткой с обращенной фазой с получением 1-((2S,3S,6S,7R,10R, E)-7-ацетокси-10-гидрокси-2-((R,2E,4E)-6-гидрокси-7-((2R,3R)-3-((2R,3S)-3-гидроксипентан-2-ил)оксиран-2-ил)-6-метилгепта-2,4-диен-2-ил)-3,7-диметил-12-оксооксациклододец-4-ен-6-ил)-4-(4-((9S,12S)-9-изопропил-3,7,10-триоксо-12-(3-уреидопропил)-2,6,8,11-тетраазатридекан-13-дибензолциклооктинамидо)бензил)пиперазин-1,4-дикарбоксилата (5,3 мг, 8,27%). LCMS (ESI, масса/заряд) 1372,7 [M]+
1.3.8. Получение конструкции линкер малеимидо-Glu-Val-Cit-pABC-полезная нагрузка
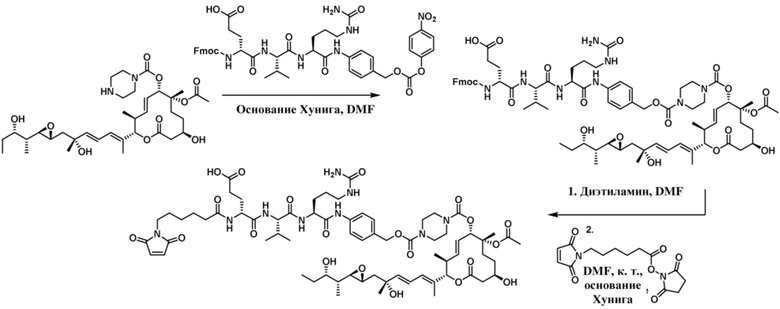
[1025] К раствору (2S,3S,6S,7R,10R, E)-7-ацетокси-10-гидрокси-2-((R,2E,4E)-6-гидрокси-7-((2R,3R)-3-((2R,3S)-3-гидроксипентан-2-ил)оксиран-2-ил)-6-метилгепта-2,4-диен-2-ил)-3,7-диметил-12-оксооксациклододец-4-ен-6-илпиперазин-1-карбоксилата (20 мг, 0,03 ммоль) в DMF (1 мл) добавляли (S)-4-((((9H-флуорен-9-ил)метокси)карбонил)амино)-5-(((S)-3-метил-1-(((S)-1-((4-((((4-нитрофенокси)карбонил)окси)метил)фенил)амино)-1-оксо-5-уреидопентан-2-ил)амино)-1-оксобутан-2-ил)амино)-5-оксопентановую кислоту (32,3 мг, 0,036 ммоль) и основание Хунига (11,66 мг, 0,09 ммоль) и перемешивали в течение 1 ч. при 20˚C. Затем добавляли диэтиламин (110 мг, 1,504 ммоль) и смесь перемешивали в течение дополнительных 30 мин. при 20˚C. Затем смесь разбавляли этилацетатом и концентрировали in vacuo. Полученный осадок разбавляли с помощью DMF (1 мл), 2,5-диоксопирролидин-1-ил-6-(2,5-диоксо-2,5-дигидро-1H-пиррол-1-ил)гексанoата (13,91 мг, 0,045 ммоль) и основания Хунига (11,66 мг, 0,09 ммоль) и реакционную смесь перемешивали в течение 50 минут. Затем реакционную смесь разбавляли этилацетатом, концентрировали до сухого состояния и очищали с применением HPLC с обращенной фазой с получением (S)-5-(((S)-1-(((S)-1-((4-(((4-((((2S,3S,6S,7R,10R, E)-7-ацетокси-10-гидрокси-2-((R,2E,4E)-6-гидрокси-7-((2R,3R)-3-((2R,3S)-3-гидроксипентан-2-ил)оксиран-2-ил)-6-метилгепта-2,4-диен-2-ил)-3,7-диметил-12-оксооксациклододец-4-ен-6-ил)окси)карбонил)пиперазин-1-карбонил)окси)метил)фенил)амино)-1-оксо-5-уреидопентан-2-ил)амино)-3-метил-1-оксобутан-2-ил)амино)-4-(6-(2,5-диоксо-2,5-дигидро-1H-пиррол-1-ил)гексанамидо)-5-оксопентановой кислоты (9,3 мг, 6,68 мкмоль, выход 22,20%) в виде белого твердого вещества; LCMS (ESI, масса/заряд) 1393,4 [M+H]+
[1026] 1H ЯМР (400 МГц, DMSO-d6) δ ppm 0,74-0,89 (m, 16 H) 1,03-1,66 (m, 25 H) 1,69 (s, 4 H) 1,74-1,94 (m, 2 H) 2,00 (s, 4 H) 2,09 (br d, J=4,39 Гц, 2 H) 2,21 (br d, J=7,53 Гц, 3 H) 2,31-2,42 (m, 2 H) 2,53-2,84 (m, 3 H) 2,89-3,09 (m, 2 H) 3,34-3,48 (m, 10 H) 3,65-3,74 (m, 1 H) 4,19, (dd, J=8,47, 6,59 Гц, 1 H) 4,26-4,45 (m, 3 H) 4,57-4,64 (m, 1 H) 4,79-4,85 (m, 1 H) 4,90 (br d, J=9,03 Гц, 2 H) 5,01 (s, 2 H) 5,43 (br s, 2 H), 5,47-5,59 (m, 1 H) 5,67-5,80 (m, 1 H) 5,81-5,93 (m, 1 H) 5,94-6,14 (m, 2 H) 6,35-6,47 (m, 1 H) 6,99 (s, 2 H) 7,30 (d, J=8,66 Гц, 2 H) 7,58, (d, J=8,53 Гц, 2 H) 7,63-7,71 (m, 1 H) 7,98-8,06 (m, 1 H) 8,15-8,27 (m, 1 H) 9,99-10,09 (m, 1 H)
1.3.10. ADL1-D3, ADL10-D3
[1027] Полезную нагрузку D3 получали с помощью процедуры, приведенной ниже.
D3
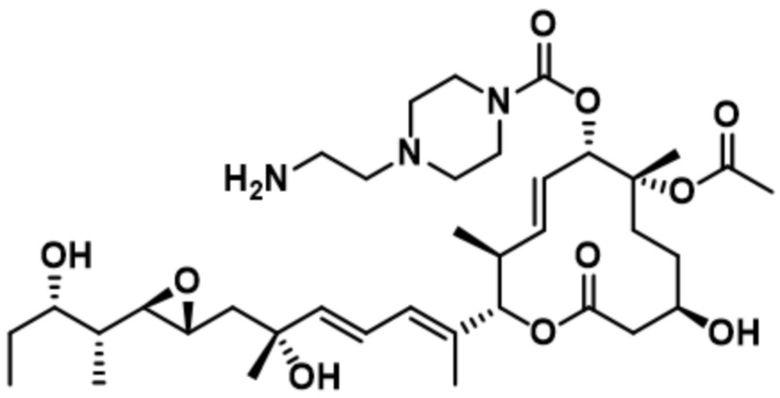
[1028] К смеси (2S,3S,6S,7R,10R, E)-7-ацетокси-10-гидрокси-2-((R,2E,4E)-6-гидрокси-7-((2R,3R)-3-((2R,3S)-3-гидроксипентан-2-ил)оксиран-2-ил)-6-метилгепта-2,4-диен-2-ил)-3,7-диметил-12-оксооксациклододец-4-ен-6-илпиперазин-1-карбоксилата (55 мг, 0,083 ммоль) в DCM (3 мл) добавляли (9H-флуорен-9-ил)метил-(2-оксоэтил)карбамат (46,5 мг, 0,165 ммоль) и триацетоксиборогидрид натрия (52,6 мг, 0,248 ммоль). Реакционную смесь перемешивали в течение 20 минут при к. т. Затем реакционную смесь концентрировали до сухого состояния и очищали с помощью колоночной хроматографии на силикагеле (0-10% MeOH/DCM). Очищенный материал растворяли в DMF (3 мл). В смесь затем загружали диэтиламин (121 мг, 1,655 ммоль) и перемешивали при к. т. Затем смесь концентрировали in vacuo и очищали посредством очистки с помощью HPLC с обращенной фазой с получением (2S,3S,6S,7R,10R, E)-7-ацетокси-10-гидрокси-2-((R,2E,4E)-6-гидрокси-7-((2R,3R)-3-((2R,3S)-3-гидроксипентан-2-ил)оксиран-2-ил)-6-метилгепта-2,4-диен-2-ил)-3,7-диметил-12-оксооксациклододец-4-ен-6-ил-4-(2-аминоэтил)пиперазин-1-карбоксилата (6 мг, 8,48 мкмоль, выход 10,25%) в виде белого твердого вещества.
[1029] LCMS (ESI, масса/заряд), 708,2 [M+H]+
[1030] 1H ЯМР (400 МГц, DMSO-d6) δ ppm 0,74-0,86 (m, 9 H) 1,04-1,15 (m, 1 H) 1,23 (s, 3 H) 1,26-1,40 (m, 3 H) 1,45 (s, 4 H) 1,47-1,51 (m, 1 H), 1,52-1,63 (m, 1 H) 1,69 (s, 3 H) 1,73-1,82 (m, 1 H) 1,99 (s, 3 H) 2,13-2,42 (m, 9 H) 2,53-2,65 (m, 4 H) 2,72-2,80 (m, 1 H), 3,35-3,41 (m, 3 H) 3,65-3,76 (m, 1 H) 4,36-4,46 (m, 1 H) 4,57-4,66 (m, 1 H) 4,79-4,85 (m, 1 H) 4,87-4,95 (m, 2 H) 5,43-5,56 (m, 1 H) 5,64-5,77 (m, 1 H) 5,80-5,91 (m, 1 H) 6,01-6,12 (m, 1 H) 6,33-6,49 (m, 1 H).
1.3.10.1 ADL10-D3
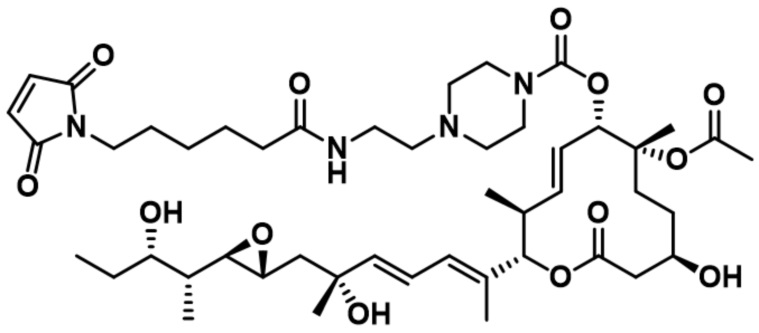
[1031] К раствору (2S,3S,6S,7R,10R, E)-7-ацетокси-10-гидрокси-2-((R,2E,4E)-6-гидрокси-7-((2R,3R)-3-((2R,3S)-3-гидроксипентан-2-ил)оксиран-2-ил)-6-метилгепта-2,4-диен-2-ил)-3,7-диметил-12-оксооксациклододец-4-ен-6-ил-4-(2-аминоэтил)пиперазин-1-карбоксилата (40 мг, 0,057 ммоль) в DMF (2 мл) добавляли 2,5-диоксопирролидин-1-ил-6-(2,5-диоксо-2,5-дигидро-1H-пиррол-1-ил)гексанoат (27,9 мг, 0,09 ммоль) с последующим добавлением основания Хунига (36,5 мг, 0,283 ммоль) и перемешивали в течение 20 минут. Затем полученную смесь концентрировали на силикагеле и очищали с помощью колоночной хроматографии (0-20% MeOH/DCM) с получением (2S,3S,6S,7R,10R, E)-7-ацетокси-10-гидрокси-2-((R,2E,4E)-6-гидрокси-7-((2R,3R)-3-((2R,3S)-3-гидроксипентан-2-ил)оксиран-2-ил)-6-метилгепта-2,4-диен-2-ил)-3,7-диметил-12-оксооксациклододец-4-ен-6-ил-4-(2-(6-(2,5-диоксо-2,5-дигидро-1H-пиррол-1-ил)гексанамидо)этил)пиперазин-1-карбоксилата (22 мг, выход 43,2%) в виде желтоватого твердого вещества. LCMS (ESI, масса/заряд) 902,1 [M+H]+
[1032] 1H ЯМР (400 МГц, DMSO-d6) δ ppm 0,73-0,89 (m, 10 H) 0,99-1,29 (m, 10 H) 1,30-1,38 (m, 2 H) 1,40-1,49 (m, 9 H) 1,52-1,64 (m, 1 H), 1,69 (s, 3 H) 1,74-1,83 (m, 1 H) 1,93-2,07 (m, 5 H) 2,34 (br d, J=16,94 Гц, 9 H) 2,59 (s, 3 H) 3,07-3,21 (m, 2 H) 3,36 (br d, J=14,05 Гц, 3 H) 3,66-3,78 (m, 1 H) 4,37-4,45 (m, 1 H) 4,57-4,66 (m, 1 H) 4,79-4,86 (m, 1 H) 4,87-4,97 (m, 2 H) 5,46-5,57 (m, 1 H) 5,66-5,75 (m, 1 H) 5,81-5,91 (m, 1 H) 5,99-6,13 (m, 1 H) 6,31-6,47 (m, 1 H) 7,00 (s, 2 H) 7,62-7,71 (m, 1 H)
1.3.10.2 ADL1-D3
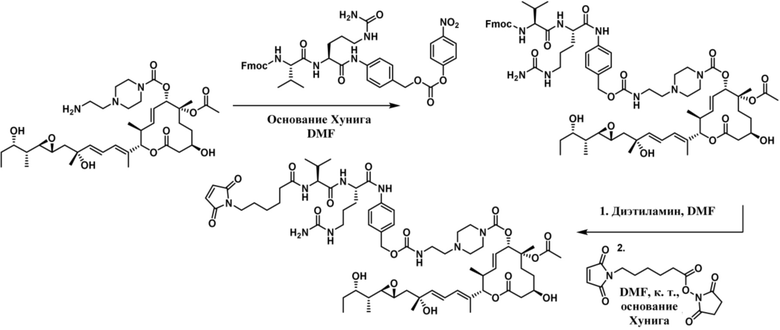
[1033] К раствору (2S,3S,6S,7R,10R, E)-7-ацетокси-10-гидрокси-2-((R,2E,4E)-6-гидрокси-7-((2R,3R)-3-((2R,3S)-3-гидроксипентан-2-ил)оксиран-2-ил)-6-метилгепта-2,4-диен-2-ил)-3,7-диметил-12-оксооксациклододец-4-ен-6-ил-4-(2-аминоэтил)пиперазин-1-карбоксилата (30 мг, 0,042 ммоль) в DMF (2 мл) добавляли (9H-флуорен-9-ил)метил((S)-3-метил-1-(((S)-1-((4-((((4-нитрофенокси)карбонил)окси)метил)фенил)амино)-1-оксо-5-уреидопентан-2-ил)амино)-1-оксобутан-2-ил)карбамат (35,7 мг, 0,047 ммоль) с последующим добавлением основания Хунига (16,43 мг, 0,127 ммоль) и обеспечивали перемешивание смеси в течение 1 ч. Полученную смесь концентрировали непосредственно на силикагеле и очищали с помощью колоночной хроматографии на силикагеле с получением (2S,3S,6S,7R,10R, E)-7-ацетокси-10-гидрокси-2-((R,2E,4E)-6-гидрокси-7-((2R,3R)-3-((2R,3S)-3-гидроксипентан-2-ил)оксиран-2-ил)-6-метилгепта-2,4-диен-2-ил)-3,7-диметил-12-оксооксациклододец-4-ен-6-ил-4-(2-((((4-((S)-2-((S)-2-((((9H-флуорен-9-ил)метокси)карбонил)амино)-3-метилбутанамидо)-5-уреидопентанамидо)бензил)окси)карбонил)амино)этил)пиперазин-1-карбоксилата, который применяли непосредственно на следующей стадии. К раствору (2S,3S,6S,7R,10R, E)-7-ацетокси-10-гидрокси-2-((R,2E,4E)-6-гидрокси-7-((2R,3R)-3-((2R,3S)-3-гидроксипентан-2-ил)оксиран-2-ил)-6-метилгепта-2,4-диен-2-ил)-3,7-диметил-12-оксооксациклододец-4-ен-6-ил-4-(2-((((4-((S)-2-((S)-2-((((9H-флуорен-9-ил)метокси)карбонил)амино)-3-метилбутанамидо)-5-уреидопентанамидо)бензил)окси)карбонил)амино)этил)пиперазин-1-карбоксилата (30 мг, 0,022 ммоль) в DMF (2 мл) добавляли диэтиламин (82 мг, 1,123 ммоль) и обеспечивали перемешивание смеси в течение 1 ч. при 20°C. Полученную смесь разбавляли с помощью этилацетата и концентрировали in vacuo. Полученный осадок затем повторно растворяли в DMF и загружали 2,5-диоксопирролидин-1-ил-6-(2,5-диоксо-2,5-дигидро-1H-пиррол-1-ил)гексанoат (8,31 мг, 0,027 ммоль) и основание Хунига (8,71 мг, 0,067 ммоль). Полученную смесь перемешивали 1 ч. при 20˚C. Затем раствор концентрировали на силикагеле и очищали с помощью колоночной хроматографии (0-20% MeOH/DCM) с получением (2S,3S,6S,7R,10R, E)-7-ацетокси-10-гидрокси-2-((R,2E,4E)-6-гидрокси-7-((2R,3R)-3-((2R,3S)-3-гидроксипентан-2-ил)оксиран-2-ил)-6-метилгепта-2,4-диен-2-ил)-3,7-диметил-12-оксооксациклододец-4-ен-6-ил-4-(2-((((4-((S)-2-((S)-2-(6-(2,5-диоксо-2,5-дигидро-1H-пиррол-1-ил)гексанамидо)-3-метилбутанамидо)-5-уреидопентанамидо)бензил)окси)карбонил)амино)этил)пиперазин-1-карбоксилата (25 мг, 0,019 ммоль, выход 85%) в виде белого твердого вещества; LC/MS (ESI, масса/заряд), 1306,2 [M]+.
[1034] 1H ЯМР (400 МГц, DMSO-d6) δ ppm 0,75-0,89 (m, 18 H) 1,05-1,12 (m, 1 H) 1,15-1,20 (m, 1 H) 1,21-1,26 (m, 4 H) 1,26-1,39 (m, 5 H) 1,40-1,40 (m,1 H) 1,42-1,47 (m, 5 H) 1,57 (br s, 3 H) 1,69 (s, 4 H) 1,73-1,81 (m, 1 H) 1,92-1,98 (m, 1 H) 1,99 (d, J=4,39 Гц, 4 H) 2,14-2,26 (m, 1 H) 2,29-2,42 (m, 4H) 2,42-2,47 (m, 1 H) 2,53-2,64 (m, 2 H) 2,73-2,78 (m, 1 H) 2,88-3,08 (m, 2 H) 3,35-3,60 (m, 19 H) 3,65-3,75 (m, 1 H) 4,22 (dd, J=8,47, 6,71 Гц, 1H) 4,32-4,45 (m, 2 H) 4,60-4,65 (m, 1 H) 4,79-4,85 (m, 1 H) 4,90 (br d, J=9,03 Гц, 2 H) 5,01 (s, 2 H) 5,40 (s, 2 H) 5,47-5,58 (m, 1 H) 5,66-5,77 (m, 1H) 5,87 (s, 1 H) 5,97 (s, 1 H) 6,03-6,13 (m, 1 H) 6,35-6,45 (m, 1 H) 7,02 (s, 2 H) 7,30 (d, J=8,53 Гц, 2 H) 7,59 (d, J=8,53 Гц, 2 H) 7,81-7,88 (m, 1 H), 8,09-8,15 (m, 1 H) 9,90-10,09 (m, 1 H)
1.3.11 ADL1-D6 и ADL1-D7 получали с помощью общей процедуры, описанной ниже
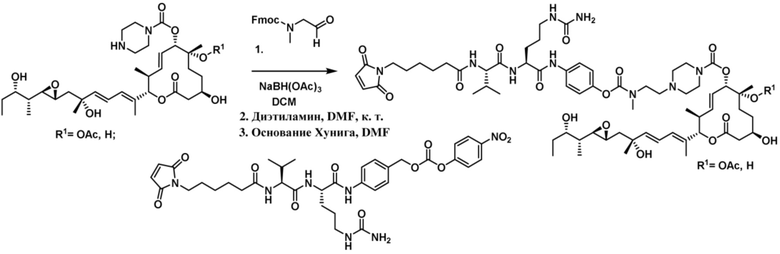
[1035] К раствору (2S,3S,6S,7R,10R, E)-7-ацетокси-10-гидрокси-2-((R,2E,4E)-6-гидрокси-7-((2R,3R)-3-((2R,3S)-3-гидроксипентан-2-ил)оксиран-2-ил)-6-метилгепта-2,4-диен-2-ил)-3,7-диметил-12-оксооксациклододец-4-ен-6-илпиперазин-1-карбоксилата (30 мг, 0,045 ммоль) в DCM (0,1 М) добавляли (9H-флуорен-9-ил)метил(2-оксоэтил)карбамат (5 экв.) и триацетоксиборогидрид натрия (10 экв.) и перемешивали в течение 30 минут. Затем смесь разбавляли этилацетатом и промывали водой и солевым раствором. Органический слой высушивали над безводным Na2SO4, концентрировали и очищали с помощью колоночной хроматографии (градиент 0-10% MeOH/DCM) для выделения требуемого продукта. Полученный материал затем разбавляли с помощью DMF (0,1 М), загружали диэтиламин (20 экв.) и перемешивали в течение 20 минут. Затем смесь концентрировали до сухого состояния и снова разбавляли в DMF и загружали 4-((S)-2-((S)-2-(6-(2,5-диоксо-2,5-дигидро-1H-пиррол-1-ил)гексанамидо)-3-метилбутанамидо)-5-уреидопентанамидо)бензил(4-нитрофенил)карбонат (1,2 экв.), затем основание Хунига (3,0 экв.). Смесь перемешивали в течение 30 минут, концентрировали in vacuo и очищали посредством очистки с помощью препаративной HPLC с получением целевого продукта.
1.3.11.2 ADL1-D7
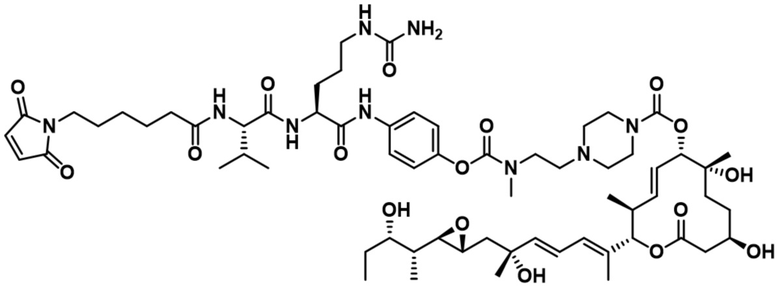
[1036] С помощью общей процедуры 1 (1.3.11) получали (2S,3S,6S,7R,10R, E)-7,10-дигидрокси-2-((R,2E,4E)-6-гидрокси-7-((2R,3R)-3-((2R,3S)-3-гидроксипентан-2-ил)оксиран-2-ил)-6-метилгепта-2,4-диен-2-ил)-3,7-диметил-12-оксооксациклододец-4-ен-6-ил-4-(2-(((4-((S)-2-((S)-2-(6-(2,5-диоксо-2,5-дигидро-1H-пиррол-1-ил)гексанамидо)-3-метилбутанамидо)-5-уреидопентанамидо)фенокси)карбонил)(метил)амино)этил)пиперазин-1-карбоксилат (3,1 мг, выход 5,03%). LC/MS (ESI, масса/заряд), 1278,4 [M+H]+.
1.3.11.2 ADL1-D6
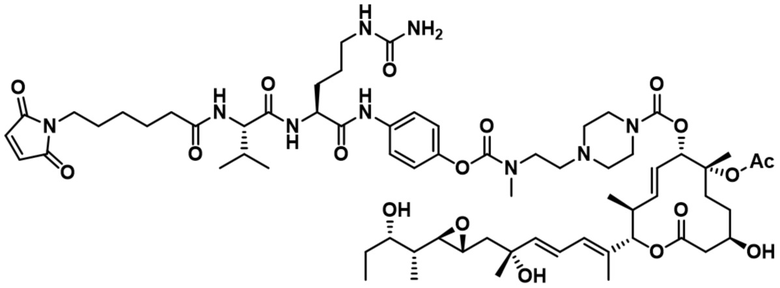
[1037] С помощью общей процедуры 1 (1.3.11) получали (2S,3S,6S,7R,10R, E)-7-ацетокси-10-гидрокси-2-((R,2E,4E)-6-гидрокси-7-((2R,3R)-3-((2R,3S)-3-гидроксипентан-2-ил)оксиран-2-ил)-6-метилгепта-2,4-диен-2-ил)-3,7-диметил-12-оксооксациклододец-4-ен-6-ил-4-(2-(((4-((S)-2-((S)-2-(6-(2,5-диоксо-2,5-дигидро-1H-пиррол-1-ил)гексанамидо)-3-метилбутанамидо)-5-уреидопентанамидо)фенокси)карбонил)(метил)амино)этил)пиперазин-1-карбоксилат (2 мг, выход 3,36%) LC/MS (ESI, масса/заряд), 1321,37 [M+H]+.
1.3.1.5 ADL1-D9, ADL6-D9 и ADL1-D13
D9 и D13
[1038] D9 и D13 синтезировали в виде смеси изомеров 3:1 с использованием процедур, указанных в синтезе D4 (схема 4), с применением три-TES-пладиенолида B.

[1039] Полезная нагрузка (D9): LC/MS (ESI, масса/заряд), 649,7 [M+H]+.
[1040] 1H-ЯМР (400 МГц, CHCl3-d): δ ppm 0,87-1,01 (m, 10 H) 1,08 (d, J=6,78 Гц, 3 H) 1,27-1,63 (m, 12 H) 1,66-1,74 (m, 1 H) 1,76 (s, 3 H) 1,97-2,10 (m, 3 H) 2,35-2,57 (m, 5 H) 2,58-2,65 (m, 1 H) 2,65-2,71 (m, 1 H) 2,77 (td, J=5,93, 2,32 Гц, 1 H) 2,89-3,05 (m, 4 H) 3,07-3,34 (m, 8 H) 3,50-3,68 (m, 5 H) 3,72-3,88 (m, 1 H) 4,88-5,09 (m, 1 H) 5,18 (d, J=10,67 Гц, 1 H) 5,50-5,84 (m, 3 H) 6,01-6,13 (m, 1 H) 6,19-6,36 (m, 1 H).

[1041] Полезная нагрузка (D13): LC/MS (ESI, масса/заряд), 649,6 [M+H]+.
[1042] 1H ЯМР (400 МГц, CHCl3-d) δ ppm 0,84-1,01 (m, 11 H) 1,08 (d, J=6,78 Гц, 3 H) 1,29-1,64 (m, 10 H) 1,63-1,73 (m, 1 H) 1,76 (s, 3 H) 1,94-2,12 (m, 4 H) 2,37-2,58 (m, 4 H) 2,59-2,65 (m, 1 H) 2,68 (dd, J=7,40, 2,26 Гц, 1 H) 2,77 (td, J=5,93, 2,32 Гц, 1 H) 3,01-3,30 (m, 4 H) 3,49 (s, 1 H) 3,54-3,67 (m, 2 H) 3,69-3,92 (m, 5 H) 4,13-4,78 (m, 11 H) 5,13-5,24 (m, 2 H) 5,48-5,61 (m, 1 H) 5,62-5,74 (m, 2 H) 6,04-6,13 (m, 1 H) 6,18-6,32 (m, 1 H).
ADL1-D9
[1043] Общую процедуру 1 (указанную в разделе 1.3.1) использовали для синтеза ADL1-D9.

[1044] Линкер-полезная нагрузка (ADL1-D9): (30,5 мг, 0,024 ммоль, выход 77%). LC/MS (ESI, масса/заряд), 1263,8 [M+H]+.
[1045] 1H-ЯМР (400 МГц, MeOH-d4): δ ppm 0,87-0,93 (m, 7 H) 0,93-1,01 (m, 8 H) 1,19-1,34 (m, 4 H) 1,50 (s, 3 H) 1,57 (s, 5 H) 1,58-1,70 (m, 6 H) 1,70-1,77 (m, 1 H) 1,78 (s, 3 H) 1,83-1,95 (m, 2 H) 2,04 (s, 3 H) 2,05-2,13 (m, 1 H) 2,27 (t, J=7,40 Гц, 2 H) 2,32-2,42 (m, 1 H) 2,50 (d, J=3,64 Гц, 2 H) 2,55-2,74 (m, 2 H) 2,90 (td, J=5,83, 2,26 Гц, 1 H) 3,03-3,26 (m, 2 H) 3,35 (s, 13 H) 3,42-3,61 (m, 11 H) 3,80 (br dd, J=9,85, 3,58 Гц, 1 H) 4,16 (d, J=7,40 Гц, 1 H) 4,50 (dd, J=8,91, 5,14 Гц, 1 H) 4,56 (s, 1 H) 5,05 (dd, J=14,37, 10,10 Гц, 2 H) 5,09 (s, 2 H) 5,49 (s, 1 H) 5,59-5,69 (m, 1 H) 5,72-5,80 (m, 1 H) 5,87 (d, J=15,18 Гц, 1 H) 6,09-6,22 (m, 1 H) 6,44-6,60 (m, 1 H) 7,32 (d, J=8,66 Гц, 2 H) 7,58 (d, J=8,53 Гц, 2 H).
ADL6-D9
[1046] Общую процедуру 1 (указанную в разделе 1.3.1) использовали для синтеза ADL6-D9.

[1047] Линкер-полезная нагрузка (ADL6-D9). К разбавленному 4-((S)-2-((S)-2-(6-(2,5-диоксо-2,5-дигидро-1H-пиррол-1-ил)гексанамидо)-3-метилбутанамидо)пропанамидо)бензил(4-нитрофенил)карбонату (16,5 мг, 0,025 ммоль) в DMF (784 мкл) добавляли основание Хунига (13,27 мкл, 0,076 ммоль). Реакционную смесь охлаждали до 0°C и добавляли D9. Реакционную смесь перемешивали при к. т. до определения завершения реакции посредством LC/MS. Реакционную смесь концентрировали in vacuo. С помощью флэш-хроматографии остатка на силикагеле с DCM/MeOH получали указанное в заголовке соединение (16,7 мг, выход 57%). LC/MS (ESI, масса/заряд), 1184,6 [M+Na]+.
[1048] 1H-ЯМР (400 МГц, MeOH-d4): δ ppm 0,80-1,02 (m, 16 H) 1,05-1,12 (m, 4 H) 1,13-1,34 (m, 5 H) 1,38-1,51 (m, 7 H) 1,53-1,68 (m, 11 H) 1,71-1,80 (m, 4 H) 1,97-2,16 (m, 4 H) 2,24-2,32 (m, 2 H) 2,32-2,42 (m, 1 H) 2,43-2,55 (m, 3 H) 2,56-2,69 (m, 3 H) 2,73 (br d, J=2,13 Гц, 1 H) 3,07-3,18 (m, 1 H) 3,42-3,61 (m, 17 H) 3,75-3,91 (m, 1 H) 4,11-4,24 (m, 1 H) 4,43 (s, 2 H) 5,59-5,88 (m, 4 H) 6,06-6,17 (m, 1 H) 6,29-6,39 (m, 1 H) 7,24-7,39 (m, 2 H) 7,52-7,64 (m, 2 H).
ADL1-D13.

[1049] Линкер-полезная нагрузка (AD1-D13). К 4-((S)-2-((S)-2-(6-(2,5-диоксо-2,5-дигидро-1H-пиррол-1-ил)гексанамидо)-3-метилбутанамидо)-5-уреидопентанамидо)бензил(4-нитрофенил)карбонату (4,2 мг, 5,693 мкмоль) в DMF (176 мкл, 2,277 ммоль) добавляли основание Хунига (2,98 мкл, 0,017 ммоль). Реакционную смесь охлаждали до 0°C и добавляли D13 (4,06 мг, 6,262 мкмоль). Реакционную смесь перемешивали при к. т. до определения завершения реакции посредством LC/MS. Реакционную смесь концентрировали in vacuo. С помощью флэш-хроматографии остатка на силикагеле с DCM/MeOH получали указанное в заголовке соединение (4,8 мг, выход 68%). LC/MS (ESI, масса/заряд), 1248,0 [M+H]+.
[1050] 1H-ЯМР (400 МГц, CHCl3-d): δ ppm 0,58-0,98 (m, 10 H) 0,99-1,06 (m, 2 H) 1,11-1,31 (m, 6 H) 1,57-1,75 (m, 3 H) 2,11-2,26 (m, 1 H) 2,30-2,73 (m, 2 H) 3,28-3,80 (m, 7 H) 4,14-4,33 (m, 1 H) 4,44-4,55 (m, 1 H) 4,63-4,81 (m, 1 H) 4,92-5,06 (m, 1 H) 5,09 (s, 1 H) 5,49-5,74 (m, 1 H) 5,88-6,09 (m, 1 H) 6,14-6,36 (m, 1 H) 6,99-7,08 (m, 1 H) 7,21-7,38 (m, 2 H) 7,53-7,67 (m, 1 H) 7,95 (s, 1 H).
1.3.1.6 ADL1-D14

[1051] Общую процедуру 1 (указанную в разделе 1.3.1) использовали для синтеза 1-((2S,3S,6R,7S,10R, E)-2-((E)-1-(1-(1-ацетилпиперидин-4-ил)-4-фтор-1H-бензо[d][1,2,3]триазол-6-ил)проп-1-ен-2-ил)-10-гидрокси-3,7-диметил-12-оксооксациклододец-4-ен-6-ил)-4-(4-((S)-2-((S)-2-(6-(2,5-диоксо-2,5-дигидро-1H-пиррол-1-ил)гексанамидо)-3-метилбутанамидо)-5-уреидопентанамидо)бензил)пиперазин-1,4-дикарбоксилата (30 мг, 0,024 ммоль, выход 39,2%). LC/MS (ESI, масса/заряд), 1254,5 [M+H]+.
[1052] 1H-ЯМР (400 МГц, DMSO-d6): δ ppm 0,75-1,00 (m, 12 H), 1,06-1,26 (m, 4 H), 1,26-1,77 (m, 13 H), 1,75-2,02 (m, 7 H), 2,08 (s, 8 H), 2,23-2,35 (m, 2 H), 2,54-2,70 (m, 2 H), 2,78-3,10 (m, 4 H), 3,36 (br s, 13 H), 3,66-3,79 (m, 1 H), 3,95-4,08 (m, 1 H), 4,11-4,25 (m, 1 H), 4,28-4,46 (m, 1 H), 4,46-4,58 (m, 1 H), 4,58-4,66 (m, 1 H), 4,66-4,77 (m, 1 H), 5,01 (s, 3 H), 5,14-5,27 (m, 1 H), 5,39 (s, 4 H), 5,71-5,79 (m, 1 H), 5,87-6,00 (m, 1 H), 6,63-6,75 (m, 1 H), 6,99 (s, 2 H), 7,13-7,24 (m, 1 H), 7,24-7,34 (m, 2 H), 7,52-7,62 (m, 2 H), 7,65-7,74 (m, 1 H), 7,75-7,82 (m, 1 H), 7,98-8,13 (m, 1 H).
1.3.1.7 ADL1-D33
D33

[1053] К перемешиваемому раствору (2S,3S,6R,7S,10R, E)-2-((E)-1-(3-фтор-5-(4-(2-метокси-2-оксоэтил)пиперазин-1-ил)фенил)проп-1-ен-2-ил)-10-гидрокси-3,7-диметил-12-оксооксациклододец-4-ен-6-илпиперазин-1-карбоксилата (27 мг, 0,042 ммоль) в THF/H2O (3 мл/1 мл) при 0°C добавляли LiOH и обеспечивали медленное нагревание реакционной смеси до 25°C. Синтезировали (2S,3S,6R,7S,10R, E)-2-((E)-1-(3-фтор-5-(4-(2-метокси-2-оксоэтил)пиперазин-1-ил)фенил)проп-1-ен-2-ил)-10-гидрокси-3,7-диметил-12-оксооксациклододец-4-ен-6-илпиперазин-1-карбоксилат с применением процедур, указанных в международной заявке на патент № PCT/US2019/026992 (см., например, процедуры 17 и 19), которая включена в данный документ посредством ссылки. Через 6 часов реакционную смесь нейтрализовали с помощью фосфатного буфера (NaH2PO4, 1,0 M, 3 мл) и фазы разделяли. Водный слой экстрагировали этилацетатом (3×2 мл) и объединенные органические слои высушивали с помощью безводного сульфата натрия и концентрировали in vacuo. С помощью колоночной хроматографии с обращенной фазой получали указанное в заголовке соединение (19,4 мг, 0,031 ммоль, выход 73,4%). LC/MS (ESI, масса/заряд), 631,4 [M+H]+.
[1054] 1H-ЯМР (400 МГц, CHCl3-d): δ ppm 0,85-1,16 (m, 2 H) 1,23-1,52 (m, 1 H) 1,57-1,77 (m, 1 H) 1,87 (s, 1 H) 1,92-2,13 (m, 1 H) 2,35-2,55 (m, 1 H) 2,50-2,74 (m, 1 H) 3,11 (br s, 1 H) 3,36-3,54 (m, 2 H) 3,64 (br d, J=10,42 Гц, 2 H) 3,77-3,90 (m, 1 H) 4,76 (br s, 4 H) 5,07-5,19 (m, 1 H) 5,38-5,68 (m, 1 H) 6,40-6,76 (m, 1 H) 8,02-8,66 (m, 1 H).
ADL1-D33.

[1055] Линкер-полезная нагрузка (ADL1-D33). К 4-((S)-2-((S)-2-(6-(2,5-диоксо-2,5-дигидро-1H-пиррол-1-ил)гексанамидо)-3-метилбутанамидо)-5-уреидопентанамидо)бензил(4-нитрофенил)карбонату (17 мг, ,023 ммоль) в DMF (714 мкл, 9,217 ммоль) добавляли основание Хунига (12,07 мкл, 0,069 ммоль). Реакционную смесь охлаждали до 0°C и добавляли 2-(4-(3-фтор-5-((E)-2-((2S,3S,6R,7S,10R, E)-10-гидрокси-3,7-диметил-12-оксо-6-((пиперазин-1-карбонил)окси)оксациклододец-4-ен-2-ил)проп-1-ен-1-ил)фенил)пиперазин-1-ил)уксусную кислоту (16,71 мг, 0,026 ммоль). Реакционную смесь перемешивали при к. т. до определения завершения реакции посредством LC/MS. Затем реакционную смесь концентрировали in vacuo. С помощью флэш-хроматографии на силикагеле и дополнительной очистки с помощью HPLC получали указанное в заголовке соединение (13,5 мг, 10,98 мкмоль, выход 47,7%). LC/MS (ESI, масса/заряд), 1229,5 [M+H]+.
[1056] 1H-ЯМР (400 МГц, MeOH-d4): δ ppm 0,92-0,99 (m, 10 H) 1,01 (d, J=6,78 Гц, 3 H) 1,24-1,46 (m, 9 H) 1,52-1,70 (m, 10 H) 1,70-1,82 (m, 1 H) 1,87 (d, J=1,00 Гц, 4 H) 1,89-2,00 (m, 2 H) 2,01-2,23 (m, 2 H) 2,27 (t, J=7,40 Гц, 2 H) 2,46 (dd, J=14,31, 5,27 Гц, 1 H) 2,57-2,71 (m, 2 H) 2,86 (d, J=0,63 Гц, 1 H) 3,00 (s, 1 H) 3,06-3,27 (m, 4 H) 3,35 (s, 5 H) 3,41-3,53 (m, 19 H) 3,66 (s, 2 H) 3,76-3,90 (m, 1 H) 4,07-4,21 (m, 1 H) 4,39-4,69 (m, 37 H) 5,09 (s, 3 H) 5,13 (d, J=10,54 Гц, 1 H) 5,52 (dd, J=14,56, 9,03 Гц, 2 H) 6,55 (br s, 2 H) 6,69 (d, J=1,38 Гц, 2 H) 7,33 (d, J=8,66 Гц, 2 H) 7,59 (d, J=8,53 Гц, 2 H) 7,88-8,04 (m, 1 H) 8,16-8,33 (m, 1 H).
ADL1-D28.
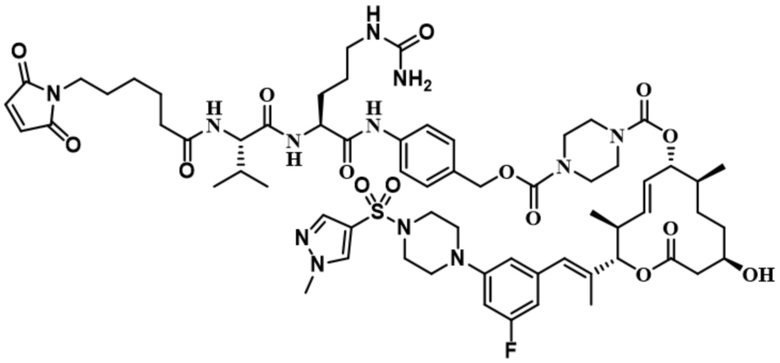
[1057] 4-((S)-2-((S)-2-(6-(2,5-Диоксо-2,5-дигидро-1H-пиррол-1-ил)гексанамидо)-3-метилбутанамидо)-5-уреидопентанамидо)бензил(4-нитрофенил)карбонат (6,17 мг, 8,37 мкмоль) и (2S,3S,6R,7S,10R, E)-2-((E)-1-(3-фтор-5-(4-((1-метил-1H-имидазол-4-ил)сульфонил)пиперазин-1-ил)фенил)проп-1-ен-2-ил)-10-гидрокси-3,7-диметил-12-оксооксациклододец-4-ен-6-илпиперазин-1-карбоксилат (6 мг, 8,37 мкмоль) растворяли в DMF (0,3 мл) и добавляли основание Хунига (4,39 мкл, 0,025 ммоль). Реакционную смесь перемешивали при к. т в течение ночи. Растворитель выпаривали и подвергали очистке с помощью HPLC с обращенной фазой с получением 1-(4-((S)-2-((S)-2-(6-(2,5-диоксо-2,5-дигидро-1H-пиррол-1-ил)гексанамидо)-3-метилбутанамидо)-5-уреидопентанамидо)бензил)-4-((2S,3S,6R,7S,10R, E)-2-((E)-1-(3-фтор-5-(4-((1-метил-1H-пиразол-4-ил)сульфонил)пиперазин-1-ил)фенил)проп-1-ен-2-ил)-10-гидрокси-3,7-диметил-12-оксооксациклододец-4-ен-6-ил)пиперазин-1,4-дикарбоксилата (1,5 мг, 13,6%). LC/MS (ESI, масса/заряд), 1315,66 [M+H]+.
[1058] 1H ЯМР (400 МГц, МЕТАНОЛ-d4) d ppm 0,85-0,93 (m, 12 H) 1,16-1,31 (m, 6 H) 1,43-1,57 (m, 9 H) 1,62-1,70 (m, 1 H) 1,75 (s, 3 H) 1,77-1,90 (m, 2 H) 1,96-2,03 (m, 1 H) 2,13-2,20 (m, 2 H) 2,31-2,40 (m, 1 H) 2,46-2,55 (m, 2 H) 2,97-3,06 (m, 2 H) 3,08-3,10 (m, 1 H) 3,15 (br d, J=6,27 Гц, 9 H) 3,33-3,43 (m, 10 H) 3,71 (s, 4 H) 4,03-4,09 (m, 1 H) 4,37-4,44 (m, 1 H) 4,44-4,53 (m, 1 H) 4,96-5,06 (m, 3 H) 5,33- 5,51 (m, 2 H) 6,36-6,44 (m, 2 H) 6,45-6,53 (m, 2 H) 6,69 (s, 2 H) 7,19-7,25 (m, 2 H) 7,47-7,52 (m, 2 H) 7,63-7,70 (m, 2 H)
ADL1-D31.
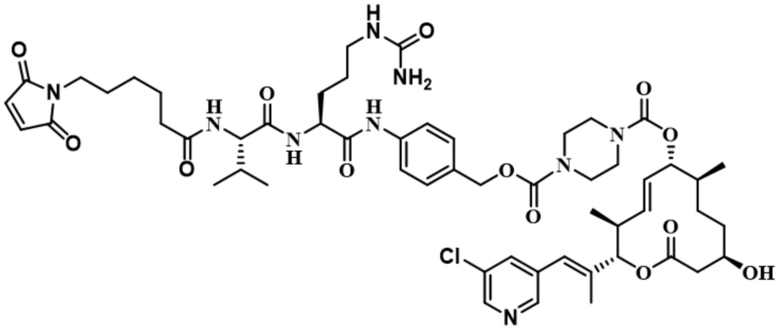
[1059] 4-((S)-2-((S)-2-(6-(2,5-Диоксо-2,5-дигидро-1H-пиррол-1-ил)гексанамидо)-3-метилбутанамидо)-5-уреидопентанамидо)бензил(4-нитрофенил)карбонат (13,12 мг, 0,018 ммоль) и (2S,3S,6R,7S,10R, E)-2-((E)-1-(5-хлорпиридин-3-ил)проп-1-ен-2-ил)-10-гидрокси-3,7-диметил-12-оксооксациклододец-4-ен-6-илпиперазин-1-карбоксилат (9 мг, 0,018 ммоль) растворяли в DMF (179 мкл, 2,312 ммоль) и добавляли основание Хунига (9,32 мкл, 0,053 ммоль). Реакционную смесь перемешивали при к. т в течение ночи. Растворитель выпаривали и очищали посредством HPLC с обращенной фазой с получением 1-((2S,3S,6R,7S,10R, E)-2-((E)-1-(5-хлорпиридин-3-ил)проп-1-ен-2-ил)-10-гидрокси-3,7-диметил-12-оксооксациклододец-4-ен-6-ил)-4-(4-((S)-2-((S)-2-(6-(2,5-диоксо-2,5-дигидро-1H-пиррол-1-ил)гексанамидо)-3-метилбутанамидо)-5-уреидопентанамидо)бензил)пиперазин-1,4-дикарбоксилата (6,9 мг, 34,09%). LC/MS (ESI, масса/заряд), 1105,59 [M+H]+.
[1060] 1H ЯМР (400 МГц, МЕТАНОЛ-d4) d ppm 0,88 (s, 12 H) 1,17-1,31 (m, 4 H) 1,43-1,57 (m, 8 H) 1,61-1,70 (m, 1 H) 1,80 (d, J=1,25 Гц, 5 H), 1,92-2,01 (m, 1 H) 2,14-2,20 (m, 2 H) 2,32-2,42 (m, 1 H) 2,48-2,59 (m, 2 H) 2,96-3,14 (m, 3 H) 3,38 (s, 10 H) 3,36-3,36 (m, 1 H) 3,38-3,40 (m, 3 H) 3,67-3,75 (m, 1 H) 4,03-4,07 (m, 1 H) 4,37-4,42 (m, 1 H) 4,97-5,01 (m, 2 H) 5,04-5,11 (m, 1 H) 5,35-5,51 (m, 2 H) 6,46-6,52, (m, 1 H) 6,69 (s, 2 H) 7,18-7,26 (m, 2 H) 7,45-7,54 (m, 2 H) 7,68-7,74 (m, 1 H) 8,29-8,34 (m, 2 H).
ADL1-D29.
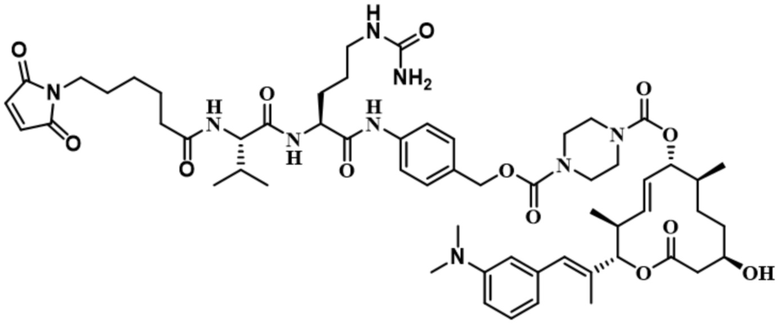
[1061] 4-((S)-2-((S)-2-(6-(2,5-Диоксо-2,5-дигидро-1H-пиррол-1-ил)гексанамидо)-3-метилбутанамидо)-5-уреидопентанамидо)бензил(4-нитрофенил)карбонат (8,62 мг, 0,012 ммоль) и (2S,3S,6R,7S,10R, E)-2-((E)-1-(3-(диметиламино)фенил)проп-1-ен-2-ил)-10-гидрокси-3,7-диметил-12-оксооксациклододец-4-ен-6-илпиперазин-1-карбоксилат (6 мг, 0,012 ммоль) растворяли в DMF (118 мкл, 1,518 ммоль) и основании Хунига (6,12 мкл, 0,035 ммоль). Реакционную смесь перемешивали при к. т в течение ночи. Растворитель выпаривали и очищали посредством HPLC с обращенной фазой с получением 1-((2S,3S,6R,7S,10R, E)-2-((E)-1-(3-(диметиламино)фенил)проп-1-ен-2-ил)-10-гидрокси-3,7-диметил-12-оксооксациклододец-4-ен-6-ил)-4-(4-((S)-2-((S)-2-(6-(2,5-диоксо-2,5-дигидро-1H-пиррол-1-ил)гексанамидо)-3-метилбутанамидо)-5-уреидопентанамидо)бензил)пиперазин-1,4-дикарбоксилата (4,0 мг, 30,79%). LC/MS (ESI, масса/заряд), 1112,59 [M+H]+.
[1062] 1H ЯМР (400 МГц, МЕТАНОЛ-d4) δ ppm 0,87 (s, 12 H) 1,17-1,23 (m, 3 H) 1,26-1,32 (m, 1 H) 1,44-1,57 (m, 8 H) 1,63-1,69 (m, 1 H) 1,74-1,81 (m, 4 H) 1,83-1,88 (m, 1 H) 1,93-2,03 (m, 1 H) 2,13-2,20 (m, 2 H) 2,34-2,42 (m, 1 H) 2,48-2,57 (m, 2 H) 2,81 (s, 5 H) 2,98-3,05 (m, 2H) 3,08-3,14 (m, 1 H) 3,38 (br s, 9 H) 3,65-3,75 (m, 1 H) 4,03-4,07 (m, 1 H) 4,35-4,43 (m, 1 H) 4,44-4,52 (m, 1 H) 4,96-5,01 (m, 2 H) 5,02-5,08 (m, 1 H) 5,34-5,51 (m, 2 H) 6,43-6,48 (m, 1 H) 6,51-6,61 (m, 3 H) 6,69 (s, 2 H) 7,03-7,10 (m, 1 H) 7,20-7,26 (m, 2 H) 7,46-7,51 (m, 2H).
ADL1-D35.
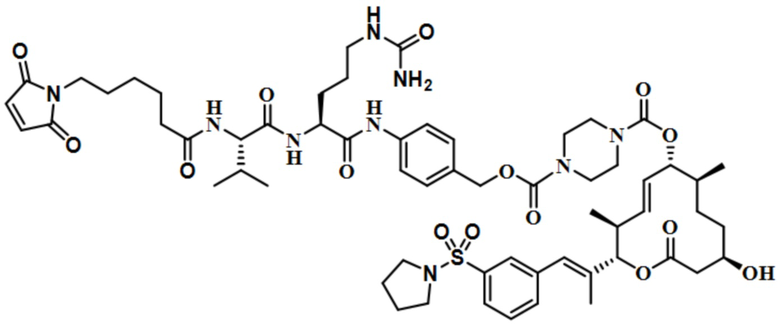
[1063] 4-((S)-2-((S)-2-(6-(2,5-Диоксо-2,5-дигидро-1H-пиррол-1-ил)гексанамидо)-3-метилбутанамидо)-5-уреидопентанамидо)бензил-(4-нитрофенил)карбонат (9,78 мг, 0,013 ммоль) и (2S,3S,6R,7S,10R, E)-10-гидрокси-3,7-диметил-12-оксо-2-((E)-1-(3-(пирролидин-1-илсульфонил)фенил)проп-1-ен-2-ил)оксациклододец-4-ен-6-илпиперазин-1-карбоксилат (8 мг, 0,013 ммоль) растворяли в DMF (133 мкл, 1,722 ммоль) и добавляли основание Хунига (6,94 мкл, 0,04 ммоль) [две капли]. Полученную смесь перемешивали при к. т в течение ночи, концентрировали in vacuo и очищали посредством HPLC с обращенной фазой с получением продукта, 1-(4-((S)-2-((S)-2-(6-(2,5-диоксо-2,5-дигидро-1H-пиррол-1-ил)гексанамидо)-3-метилбутанамидо)-5-уреидопентанамидо)бензил)-4-((2S,3S,6R,7S,10R, E)-10-гидрокси-3,7-диметил-12-оксо-2-((E)-1-(3-(пирролидин-1-илсульфонил)фенил)проп-1-ен-2-ил)оксациклододец-4-ен-6-ил)пиперазин-1,4-дикарбоксилата (8,2 мг, 51,47%). LC/MS (ESI, масса/заряд), 1203,53 [M+H]+.
[1064] 1H ЯМР (400 МГц, МЕТАНОЛ-d4) d ppm 0,85-0,93 (m, 12 H) 1,17-1,34 (m, 4 H) 1,42-1,57 (m, 8 H) 1,61-1,69 (m, 5 H) 1,79 (s, 4 H) 1,83-1,90 (m, 1 H) 1,94-2,03 (m, 1 H) 2,12-2,20 (m, 2 H) 2,33-2,43 (m, 1 H) 2,48-2,59 (m, 2 H) 2,96-3,05 (m, 2 H) 3,06-3,17 (m, 6 H) 3,31 -3,41 (m, 10 H) 3,67-3,77 (m, 1 H) 4,02-4,10 (m, 1 H) 4,36-4,43 (m, 1 H) 4,96-5,02 (m, 2 H) 5,04-5,11 (m, 1 H) 5,35-5,51 (m, 2 H) 6,59 (s, 1H) 6,69 (s, 2 H) 7,20-7,27 (m, 2 H) 7,45-7,52 (m, 4 H) 7,58-7,65 (m, 2 H).
1.4 Получение конструкции линкер MC-Val-Ala-pABC-полезные нагрузки
1.4.1 Обзор
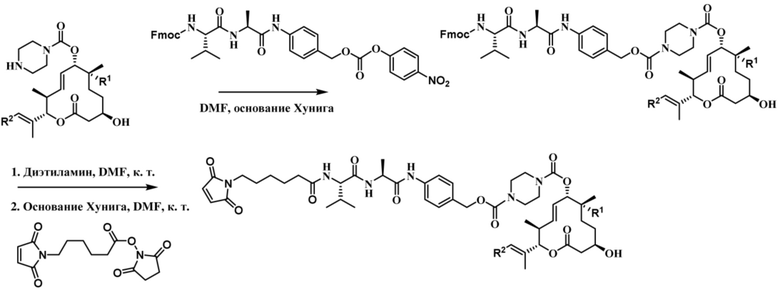
Схема 5
[1065] Стадия 1. Полезную нагрузку в виде макроцикла (1,0 экв.), DMF (0,1 M), (9H-флуорен-9-ил)метил-((S)-3-метил-1-(((S)-1-((4-((((4-нитрофенокси)карбонил)окси)метил)фенил)амино)-1-оксопропан-2-ил)амино)-1-оксобутан-2-ил)карбамат (1,5 экв.; полученный с применением процедуры, описанной в WO 2012/153193) и основание Хунига (3,0 экв.) объединяли и перемешивали в течение ночи. Реакционную смесь концентрировали до сухого состояния и хроматографировали с получением конструкции fmoc-Val-Ala-pABC-полезная нагрузка.
[1066] Стадия 2. Конструкцию аммоний-fmoc-Val-Ala-pABC-полезная нагрузка (1,0 экв.), растворенную в DMF (0,1 M), и диэтиламин (10 экв.) объединяли и перемешивали в течение 30 мин. Реакционную смесь концентрировали до сухого состояния под высоким вакуумом. Неочищенный продукт растворяли в DMF (0,1 M) и добавляли основание Хунига (2 экв.), после чего добавляли 2,5-диоксопирролидин-1-ил-6-(2,5-диоксо-2,5-дигидро-1H-пиррол-1-ил)гексанoат (3 экв.) и перемешивали в течение ночи. Затем реакционную смесь концентрировали до сухого состояния и хроматографировали (0-30% MeOH в DCM) с получением требуемой конструкции MC-Val-Ala-pABC-полезная нагрузка.
1.4.1.1 ADL6-D1
[1067] Схема 5, стадия 1. Согласно общей процедуре, указанной выше (раздел 1.4.1), получали 1-(4-((S)-2-((S)-2-((((9H-флуорен-9-ил)метокси)карбонил)амино)-3-метилбутанамидо)пропанамидо)бензил)-4-((2S,3S,6S,7R,10R, E)-10-гидрокси-2-((R,2E,4E)-6-гидрокси-7-((2S,3S)-3-((2R,3S)-3-гидроксипентан-2-ил)оксиран-2-ил)-6-метилгепта-2,4-диен-2-ил)-7-метокси-3,7-диметил-12-оксооксациклододец-4-ен-6-ил)пиперазин-1,4-дикарбоксилат (32 мг, 0,027 ммоль, выход 27,9%). LC/MS (ESI, масса/заряд), [M+Na]+ 1200,5.
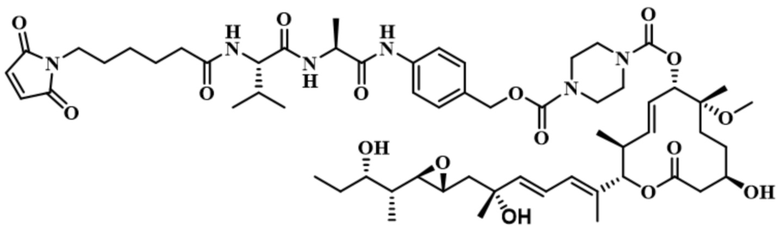
[1068] Схема 5, стадия 2. Согласно общей процедуре, указанной выше (раздел 1.4.1), получали 1-(4-((S)-2-((S)-2-(6-(2,5-диоксо-2,5-дигидро-1H-пиррол-1-ил)гексанамидо)-3-метилбутанамидо)пропанамидо)бензил)-4-((2S,3S,6S,7R,10R, E)-10-гидрокси-2-((R,2E,4E)-6-гидрокси-7-((2R,3R)-3-((2R,3S)-3-гидроксипентан-2-ил)оксиран-2-ил)-6-метилгепта-2,4-диен-2-ил)-7-метокси-3,7-диметил-12-оксооксациклододец-4-ен-6-ил)пиперазин-1,4-дикарбоксилат (24 мг, 0,021 ммоль, выход 77%). LC/MS (ESI, масса/заряд), 1149,2 [M+H]+.
[1069] 1H-ЯМР (400 МГц, MeOH-d4): δ ppm 0,85-1,02 (m, 16 H), 1,20-1,23 (m, 3 H) 1,23-1,32 (m, 3 H) 1,34 (s, 3 H) 1,41-1,46 (m, 4 H) 1,46-1,72 (m, 11 H) 1,78 (s, 3 H) 1,87 (dd, J=14,05, 5,40 Гц, 1 H) 2,08 (dq, J=13,77, 6,83 Гц, 1 H) 2,27 (t, J=7,40 Гц, 2 H) 2,43-2,63 (m, 3 H) 2,64-2,70 (m, 1 H) 2,90 (td, J=5,83, 2,26 Гц, 1 H) 3,32-3,33 (m, 4 H) 3,42-3,57 (m, 11 H) 3,82 (br dd, J=8,66, 3,89 Гц, 1 H) 4,15 (d, J=7,15 Гц, 1 H), 4,47 (q, J=7,15 Гц, 1 H) 4,99-5,12 (m, 4 H) 5,57 (dd, J=15,18, 9,79 Гц, 1 H) 5,69-5,78 (m, 1 H) 5,87 (d, J=15,18 Гц, 1 H) 6,13 (d, J=10,92 Гц, 1 H), 6,53 (dd, J=15,31, 10,92 Гц, 1 H) 6,78 (s, 2 H) 7,32 (d, J=8,53 Гц, 2 H) 7,58 (d, J=8,53 Гц, 2 H).
1.4.1.2 ADL6-D16
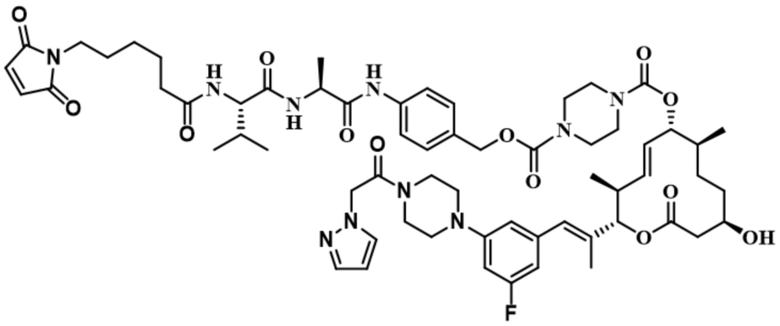
[1070] Схема 5, стадия 1. Согласно общей процедуре, указанной выше (раздел 1.4.1), получали 1-((2S,3S,6R,7S,10R, E)-2-((E)-1-(3-(4-(2-(1H-пиразол-1-ил)ацетил)пиперазин-1-ил)-5-фторфенил)проп-1-ен-2-ил)-10-гидрокси-3,7-диметил-12-оксооксациклододец-4-ен-6-ил)-4-(4-((S)-2-((S)-2-((((9H-флуорен-9-ил)метокси)карбонил)амино)-3-метилбутанамидо)пропанамидо)бензил)пиперазин-1,4-дикарбоксилат (0,060 г, 0,049 ммоль, выход 60,8%). LC/MS (ESI, масса/заряд), 1223,68 [M+H].
[1071] Схема 5, стадия 2. Согласно процедуре, указанной выше (раздел 1.4.1), получали 1-((2S,3S,6R,7S,10R, E)-2-((E)-1-(3-(4-(2-(1H-пиразол-1-ил)ацетил)пиперазин-1-ил)-5-фторфенил)проп-1-ен-2-ил)-10-гидрокси-3,7-диметил-12-оксооксациклододец-4-ен-6-ил)-4-(4-((S)-2-((S)-2-(6-(2,5-диоксо-2,5-дигидро-1H-пиррол-1-ил)гексанамидо)-3-метилбутанамидо)пропанамидо)бензил)пиперазин-1,4-дикарбоксилат (11,50 мг, 9,64 мкмоль, выход 12,05%). LC/MS (ESI, масса/заряд),1194,82 [M+H]+.
[1072] 1H-ЯМР (400 МГц, CHCl3-d): δ ppm 0,97 (br d, J=1,25 Гц, 12 H), 1,24-1,41 (m, 5 H), 1,41-1,47(m, 3 H), 1,52-1,69 (m, 6 H), 1,84-1,90 (m, 3 H), 1,92-2,01 (m, 1 H), 2,02-2,16 (m, 1 H), 2,23-2,30 (m, 2 H), 2,42-2,51 (m, 1 H), 2,57-2,65 (m, 2 H), 3,19-3,28 (m, 4 H), 3,35 (s, 4 H), 3,40-3,54 (m, 11 H), 3,69-3,77 (m, 4 H), 3,78-3,85 (m, 1 H), 4,12-4,18 (m, 1 H), 4,43-4,51 (m, 1 H), 5,07-5,16 (m, 3 H), 5,20 (s, 2 H), 5,42 -5,62 (m, 2 H), 6,29-6,38 (m, 1 H), 6,46-6,58 (m, 2 H), 6,59-6,68 (m, 2 H), 7,28-7,37 (m, 2 H), 7,50-7,67 (m, 4 H).
1.5 Получение конструкции линкер MC-Val-Ala-pAB-полезные нагрузки
1.5.1 Обзор
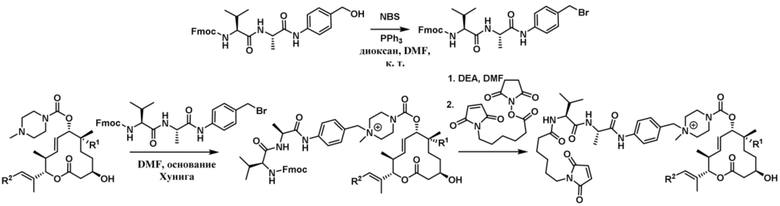
Схема 6
[1073] Стадия 1. (9H-Флуорен-9-ил)метил((S)-1-(((S)-1-((4-(гидроксиметил)фенил)амино)-1-оксопропан-2-ил)амино)-3-метил-1-оксобутан-2-ил)карбамат (0,5 г, 0,97 ммоль), 1,4-диоксан (9,70 мл, 0,97 ммоль), трифенилфосфин (0,509 г, 1,939 ммоль), N-бромсукцинимид (0,345 г, 1,939 ммоль) и DMF (2,424 мл, 0,97 ммоль) объединяли и перемешивали в течение 3 часов при к. т. Реакционную смесь концентрировали и хроматографировали с получением (9H-флуорен-9-ил)метил((S)-1-(((S)-1-((4-(бромметил)фенил)амино)-1-оксопропан-2-ил)амино)-3-метил-1-оксобутан-2-ил)карбамата (116 мг, 0,201 ммоль, выход 20,68%). LC/MS (ESI, масса/заряд), 580,14 [M+H].
[1074] Стадия 2. Полезную нагрузку (1,0 экв.), (9H-флуорен-9-ил)метил((S)-1-(((S)-1-((4-(бромметил)фенил)амино)-1-оксопропан-2-ил)амино)-3-метил-1-оксобутан-2-ил)карбамат (0,069 г, 0,12 ммоль), N, N-диметилформамид (0,1 M) и основание Хунига (1,5 экв.) объединяли и перемешивали в течение ночи. Реакционную смесь концентрировали до сухого состояния и хроматографировали (0-10% MeOH в DCM) с получением конструкции четвертичный аммоний-fmoc-Val-Ala-pAB-полезная нагрузка.
[1075] Стадия 3. Конструкцию четвертичный аммоний-fmoc-Val-Ala-pAB-полезная нагрузка (1,0 экв.), растворенную в DMF (0,1 M), и диэтиламин (10 экв.) объединяли и перемешивали в течение 30 мин. Реакционную смесь концентрировали до сухого состояния под высоким вакуумом. Неочищенный продукт растворяли в DMF (0,1 M) и добавляли основание Хунига (2 экв.), после чего добавляли 2,5-диоксопирролидин-1-ил-6-(2,5-диоксо-2,5-дигидро-1H-пиррол-1-ил)гексанoат (3 экв.) и перемешивали в течение ночи. Затем реакционную смесь концентрировали до сухого состояния и хроматографировали (0-30% MeOH в DCM) с получением требуемой конструкции линкер четвертичный аммоний-полезная нагрузка.
1.5.1.1 ADL5-D2
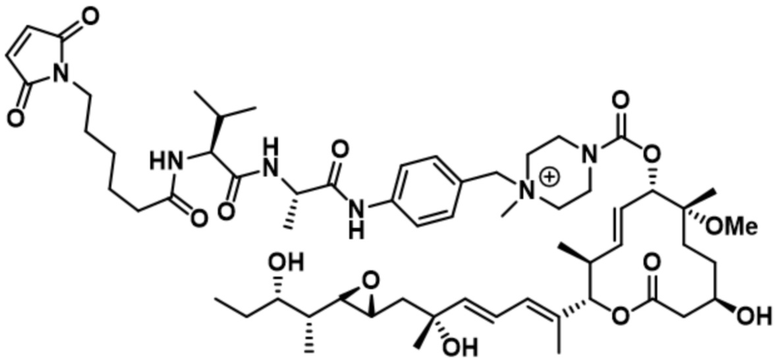
[1076] Схема 6, стадия 2. 1-(4-((S)-2-((S)-2-((((9H-Флуорен-9-ил)метокси)карбонил)амино)-3-метилбутанамидо)пропанамидо)бензил)-4-((((2S,3S,6S,7R,10R, E)-10-гидрокси-2-((R,2E,4E)-6-гидрокси-7-((2S,3S)-3-((2R,3S)-3-гидроксипентан-2-ил)оксиран-2-ил)-6-метилгепта-2,4-диен-2-ил)-7-метокси-3,7-диметил-12-оксооксациклододец-4-ен-6-ил)окси)карбонил)-1-метилпиперазин-1-ийбромид (30 мг, 0,024 ммоль, выход 26,5%). LC/MS (ESI, масса/заряд), 1149,77 [M+H]+.
[1077] Схема 6, стадия 3. Моно(1-(4-((S)-2-((S)-2-(6-(2,5-диоксо-2,5-дигидро-1H-пиррол-1-ил)гексанамидо)-3-метилбутанамидо)пропанамидо)бензил)-4-((((2S,3S,6S,7R,10R, E)-10-гидрокси-2-((R,2E,4E)-6-гидрокси-7-((2S,3S)-3-((2R,3S)-3-гидроксипентан-2-ил)оксиран-2-ил)-6-метилгепта-2,4-диен-2-ил)-7-метокси-3,7-диметил-12-оксооксациклододец-4-ен-6-ил)окси)карбонил)-1-метилпиперазин-1-ий-2-илий)монобромид (4,8 мг, выход 15,33%). LC/MS (ESI, масса/заряд), 1120,99 [M+H]+.
[1078] 1H-ЯМР (400 МГц, MeOH-d4): δ ppm 0,88 (s, 15 H), 1,09-1,26 (m, 9 H), 1,31-1,58 (m, 14 H), 1,42-1,44 (m, 1 H), 1,68 (s, 3 H), 1,73-1,81 (m, 1 H), 1,91-2,03 (m, 1 H), 2,14-2,22 (m, 2 H), 2,35-2,52 (m, 3 H), 2,53-2,60 (m, 1 H), 2,74-2,83 (m, 1 H), 2,97 (s, 3 H), 3,25 (s, 1 H), 3,28-3,46 (m, 8 H), 3,52-3,66 (m, 2 H), 3,70-3,78 (m, 1 H), 3,97-4,11 (m, 3 H), 4,32-4,41 (m, 1 H), 4,45-4,54 (m, 2 H), 4,91-5,01 (m, 2 H), 5,44-5,55 (m, 1 H), 5,57-5,70 (m, 1 H), 5,72-5,82 (m, 1 H), 6,00-6,08 (m, 1 H), 6,43 (dd, J=15,25, 10,98 Гц, 1 H), 6,69 (s, 2 H), 7,36-7,47 (m, 2 H), 7,67 -7,75 (m, 2 H).
1.5.1.2 ADL5-D19
[1079] Общую процедуру, указанную выше (раздел 1.5.1), использовали для синтеза ADL5-D19. Полезную нагрузку D19 синтезировали с применением процедур, указанных в разделе 1.2.1.
D19
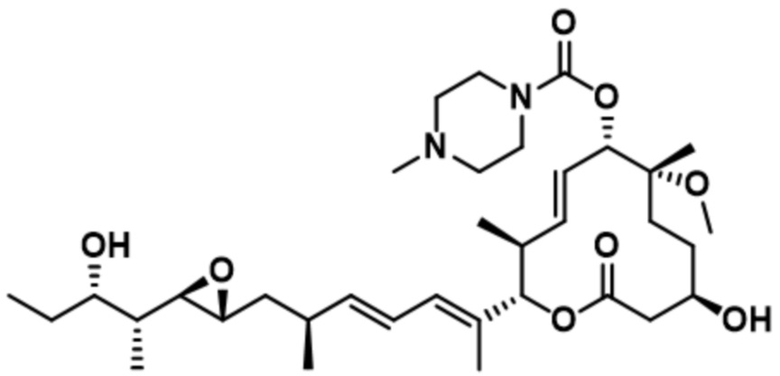
[1080] (2S,3S,6S,7R,10R, E)-10-Гидрокси-2-((S,2E,4E)-7-((2R,3R)-3-((2R,3S)-3-гидроксипентан-2-ил)оксиран-2-ил)-6-метилгепта-2,4-диен-2-ил)-7-метокси-3,7-диметил-12-оксооксациклододец-4-ен-6-ил-4-метилпиперазин-1-карбоксилат (114,2 мг, 0,180 ммоль, выход 82%). LC/MS (ESI, масса/заряд), 635,8 [M+H].
[1081] 1H-ЯМР (400 МГц, MeOH-d4): δ ppm 0,88-1,00 (m, 9 H) 1,10 (d, J=6,65 Гц, 3 H) 1,16-1,27 (m, 4 H) 1,40-1,70 (m, 8 H) 1,77 (d, J=0,88 Гц, 3 H) 2,28-2,36 (m, 3 H) 2,42 (br t, J=5,08 Гц, 3 H) 2,47-2,61 (m, 4 H) 2,68 (dd, J=8,22, 2,20 Гц, 1 H) 2,74 (td, J=5,99, 2,20 Гц, 1 H) 3,13 -3,17 (m, 1 H) 3,34-3,38 (m, 3 H) 3,47-3,58 (m, 5 H) 3,81-3,87 (m, 1 H) 5,01-5,10 (m, 2 H) 5,54-5,81 (m, 3 H) 6,06-6,15 (m, 1 H) 6,34 (dd, J=15,00, 10,98 Гц, 1 H).
[1082] 1-(4-((S)-2-((S)-2-((((9H-Флуорен-9-ил)метокси)карбонил)амино)-3-метилбутанамидо)пропанамидо)бензил)-4-((((2S,3S,6S,7R,10R, E)-10-гидрокси-2-((S,2E,4E)-7-((2R,3R)-3-((2R,3S)-3-гидроксипентан-2-ил)оксиран-2-ил)-6-метилгепта-2,4-диен-2-ил)-7-метокси-3,7-диметил-12-оксооксациклододец-4-ен-6-ил)окси)карбонил)-1-метилпиперазин-1-ий (25 мг, 45,6%). LC/MS (ESI, масса/заряд), 1133,1 [M+]+.
[1083] 1H-ЯМР (400 МГц, MeOH-d4): δ ppm 0,94 (br dd, J=18,45, 7,15 Гц, 18 H) 1,10 (d, J=6,78 Гц, 3 H) 1,25 (s, 4 H) 1,28-1,35 (m, 1 H) 1,46 (br d, J=7,03 Гц, 9 H) 1,59-1,70 (m, 2 H) 1,77 (s, 3 H) 2,05-2,12 (m, 1 H) 2,44-2,60 (m, 4 H) 2,63-2,72 (m, 1 H) 2,70-2,77 (m, 1 H) 3,06 (s, 3 H) 3,40-3,44 (m, 1 H) 3,50 (br d, J=1,63 Гц, 4 H) 3,64-3,75 (m, 1 H) 3,80-3,88 (m, 1 H) 3,91-3,99 (m, 1 H) 4,04-4,20 (m, 1 H) 4,21-4,28 (m, 1 H) 4,37-4,43 (m, 1 H) 4,59 (br s, 2 H) 4,93-4,95 (m, 2 H) 5,06-5,08 (m, 2 H) 5,57-5,80 (m, 4 H) 6,05-6,16 (m, 1 H) 6,27-6,41 (m, 1 H) 7,28-7,37 (m, 2 H) 7,38-7,45 (m, 2 H) 7,47-7,53 (m, 2 H) 7,65-7,72 (m, 2 H) 7,74-7,86 (m, 4 H).
ADL5-D19.
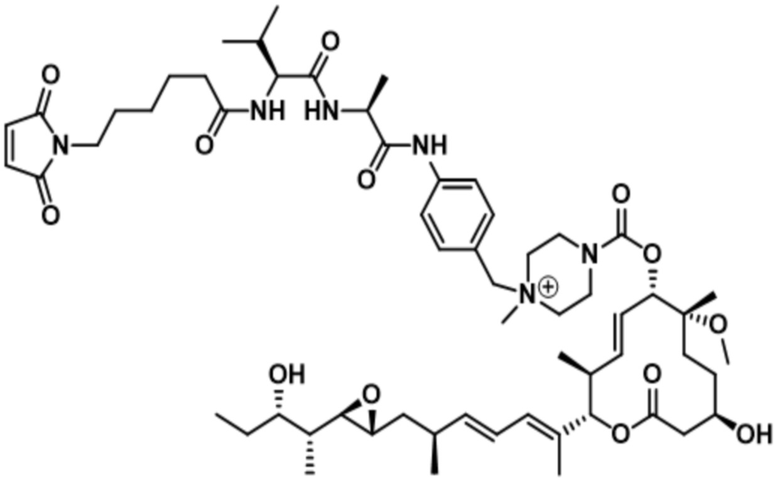
[1084] Линкер-полезная нагрузка (ADL5-D19). 1-(4-((S)-2-((S)-2-(6-(2,5-Диоксо-2,5-дигидро-1H-пиррол-1-ил)гексанамидо)-3-метилбутанамидо)пропанамидо)бензил)-4-((((2S,3S,6S,7R,10R, E)-10-гидрокси-2-((S,2E,4E)-7-((2R,3R)-3-((2R,3S)-3-гидроксипентан-2-ил)оксиран-2-ил)-6-метилгепта-2,4-диен-2-ил)-7-метокси-3,7-диметил-12-оксооксациклододец-4-ен-6-ил)окси)карбонил)-1-метилпиперазин-1-ий (19,4 мг, 0,018 ммоль, выход 80%). LC/MS (ESI, масса/заряд), 1105,9 [M+H].
[1085] 1H ЯМР (400 МГц, MeOH-d4): δ ppm 0,85-1,03 (m, 16 H) 1,10 (d, J=6,78 Гц, 3 H) 1,17-1,27 (m, 4 H) 1,29-1,37 (m, 3 H) 1,44-1,70, (m, 15 H) 1,74-1,80 (m, 3 H) 2,04-2,14 (m, 1 H) 2,30 (t, J=7,47 Гц, 2 H) 2,44-2,61 (m, 4 H) 2,64-2,69 (m, 1 H) 2,72-2,78 (m, 1 H) 3,09 (s, 3 H) 3,40-3,59 (m, 9 H) 3,62-3,77 (m, 2 H) 3,82-3,89 (m, 1 H) 4,12-4,21 (m, 3 H) 4,40-4,55 (m, 1 H) 4,56-4,66 (m, 3 H) 5,03-5,12 (m, 2 H) 5,55-5,81 (m, 3 H) 6,06-6,16 (m, 1 H) 6,26-6,41 (m, 1 H) 6,81 (s, 2 H) 7,48-7,57 (m, 2 H) 7,78-7,86 (m, 2 H).
1.5.1.3 ADL5-D17
[1086] Общую процедуру, указанную выше (раздел 1.5.1), использовали для синтеза ADL5-D17. Полезную нагрузку D17 синтезировали с применением процедур, указанных в международной заявке на патент № PCT/US2019/026992 (см., например, процедуру 2, процедуру 3 и процедуру 4 или 5), которая включена в данный документ посредством ссылки.
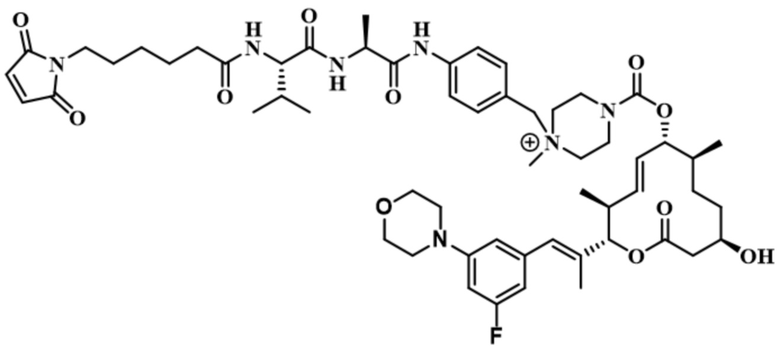
[1087] Стадия 1. 1-(4-((S)-2-((S)-2-((((9H-Флуорен-9-ил)метокси)карбонил)амино)-3-метилбутанамидо)пропанамидо)бензил)-4-((((2S,3S,6R,7S,10R, E)-2-((E)-1-(3-фтор-5-морфолинoфенил)проп-1-ен-2-ил)-10-гидрокси-3,7-диметил-12-оксооксациклододец-4-ен-6-ил)окси)карбонил)-1-метилпиперазин-1-ий (12,9 мг, 69,8%). LC/MS (ESI, масса/заряд), 1086,43 [M+H].
[1088] 1H-ЯМР (400 МГц, MeOH-d4): δ ppm 0,96-1,07 (m, 12 H), 1,27-1,42 (m, 3 H), 1,46 (d, J=7,15 Гц, 3 H), 1,62-1,72 (m, 2 H), 1,88 (d, J=1,13 Гц, 3 H), 1,97-2,06 (m, 1 H), 2,04-2,14 (m, 1 H), 2,44-2,53 (m, 1 H), 2,58-2,69 (m, 2 H), 3,08 (s, 3 H), 3,13-3,19 (m, 4 H), 3,38-3,56 (m, 4 H), 3,61-3,75 (m, 2 H), 3,79-3,88 (m, 5 H), 3,90-3,98 (m, 1 H), 4,07-4,18 (m, 2 H), 4,20-4,29 (m, 1 H), 4,35-4,45 (m, 2 H), 4,45-4,54 (m, 1 H), 4,61 (s, 2 H), 4,86-4,92 (m, 2 H), 5,15 (d, J=10,67 Гц, 1 H), 5,46-5,65 (m, 2 H), 6,46-6,67 (m, 4 H), 7,28-7,37 (m, 2 H), 7,37-7,45 (m, 2 H), 7,47-7,53 (m, 2 H), 7,66-7,71 (m, 2 H), 7,74-7,84 (m, 4 H).
[1089] Стадия 2. 1-(4-((R)-2-((R)-2-(6-(2,5-Диоксо-2,5-дигидро-1H-пиррол-1-ил)гексанамидо)-3-метилбутанамидо)пропанамидо)бензил)-4-((((2S,3S,6R,7S,10R, E)-2-((E)-1-(3-фтор-5-морфолинoфенил)проп-1-ен-2-ил)-10-гидрокси-3,7-диметил-12-оксооксациклододец-4-ен-6-ил)окси)карбонил)-1-метилпиперазин-1-ия бромид (7,6 мг, выход 60,5%). LC/MS (ESI, масса/заряд), 1057,62 [M+H].
[1090] 1H-ЯМР (400 МГц, MeOH-d4): δ ppm 0,95-1,08 (m, 12 H), 1,24-1,42 (m, 5 H), 1,47 (d, J=7,15 Гц, 3 H), 1,52-1,71 (m, 6 H), 1,89 (d, J=1,13 Гц, 3 H), 1,95-2,05 (m, 1 H), 2,05-2,15 (m, 1 H), 2,26-2,34 (m, 2 H), 2,46-2,53 (m, 1 H), 2,58-2,69 (m, 2 H), 3,07-3,12 (m, 3 H), 3,14 -3,19 (m, 4 H), 3,39-3,58 (m, 6 H), 3,61-3,76 (m, 2 H), 3,80-3,86 (m, 5 H), 4,09-4,18 (m, 3 H), 4,43-4,51 (m, 1 H), 4,62 (s, 2 H), 4,87-4,93 (m, 2 H), 5,12-5,19 (m, 1 H), 5,46-5,65 (m, 2 H), 6,47-6,66 (m, 4 H), 6,80 (s, 2 H), 7,53 (d, J=8,66 Гц, 2 H), 7,82 (d, J=8,66 Гц, 2 H).
1.5.1.4 ADL5-D10
[1091] Общую процедуру, указанную выше (раздел 1.5.1), использовали для синтеза ADL5-D10. Полезную нагрузку D10 синтезировали с применением процедур, указанных в разделе 1.2.1.
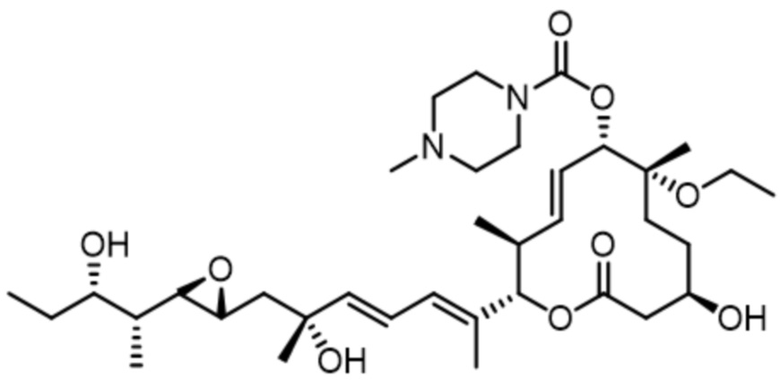
[1092] (2S,3S,6S,7R,10R, E)-7-Этокси-10-гидрокси-2-((R,2E,4E)-6-гидрокси-7-((2R,3R)-3-((2R,3S)-3-гидроксипентан-2-ил)оксиран-2-ил)-6-метилгепта-2,4-диен-2-ил)-3,7-диметил-12-оксооксациклододец-4-ен-6-ил-4-метилпиперазин-1-карбоксилат (16,6 мг, 0,025 ммоль, выход 38,7%). LC/MS (ESI, масса/заряд), 665,7 [M+H]+.
[1093] 1H-ЯМР (400 МГц, МЕТАНОЛ-d): δ ppm 0,76-0,87 (m, 9 H), 1,03-1,09 (m, 3 H), 1,10-1,13 (m, 3 H) 1,13-1,19 (m, 1 H) 1,20-1,27 (m, 3 H), 1,29-1,48 (m, 6 H) 1,51-1,59 (m, 1 H) 1,65-1,71 (m, 3 H) 1,73-1,81 (m, 1 H) 2,20 (s, 3 H) , 2,27-2,34 (m, 4 H) 2,34-2,44 (m, 2 H) 2,44-2,53 (m, 1 H) 2,53-2,59 (m, 1 H) 2,76-2,83 (m, 1 H) 3,23-3,26 (m, 1 H) 3,34-3,52 (m, 7 H) 3,67-3,75 (m, 1 H) 4,86-4,92 (m, 1 H) 4,92-4,99 (m,1 H), 5,41-5,51 (m, 1 H), 5,60-5,71 (m, 1 H), 5,72-5,82 (m, 1 H), 6,00-6,07 (m, 1 H), 6,37-6,48 (m, 1 H)
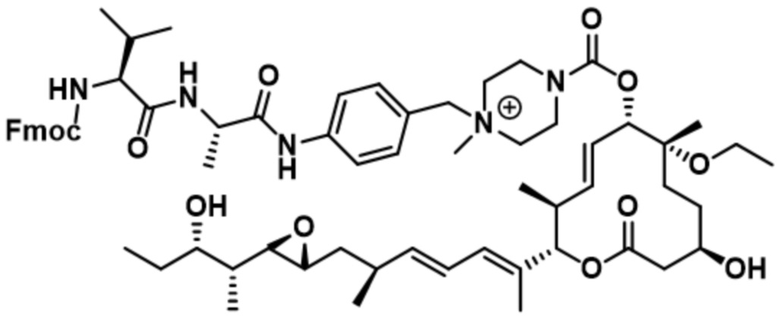
[1094] Стадия 1. 1-(4-((S)-2-((S)-2-((((9H-Флуорен-9-ил)метокси)карбонил)амино)-3-метилбутанамидо)пропанамидо)бензил)-4-((((2S,3S,6S,7R,10R, E)-7-этокси-10-гидрокси-2-((R,2E,4E)-6-гидрокси-7-((2R,3R)-3-((2R,3S)-3-гидроксипентан-2-ил)оксиран-2-ил)-6-метилгепта-2,4-диен-2-ил)-3,7-диметил-12-оксооксациклододец-4-ен-6-ил)окси)карбонил)-1-метилпиперазин-1-ий (18,6 мг, 0,016 ммоль, выход 87%) в виде бесцветной пленки. LC/MS (ESI, масса/заряд), 1163,01 [M]+.
[1095] 1H-ЯМР (400 МГц, MeOH-d4): δ ppm 0,86-1,03 (m, 16 H), 1,20 (s, 3 H), 1,25 (s, 4 H), 1,36 (s, 3 H), 1,43-1,72 (m, 10 H), 1,81 (s, 3 H), 1,84 -1,92 (m, 1 H), 2,06-2,14 (m, 1 H), 2,46-2,63 (m, 3 H), 2,67-2,72 (m, 1 H), 2,88-2,94 (m, 1 H), 3,03-3,09 (m, 3 H), 3,38-3,45 (m, 3 H), 3,54 (s, 6 H), 3,63-3,79 (m, 2 H), 3,81-3,88 (m, 1 H), 3,92-3,98 (m, 1 H), 4,07-4,18 (m, 2 H), 4,21-4,28 (m, 1 H), 4,36-4,44 (m, 2 H), 4,47-4,53 (m, 1 H), 4,55-4,63 (m, 3 H), 5,02-5,11 (m, 3 H), 5,56-5,66 (m, 1 H), 5,75-5,84 (m, 1 H), 5,86-5,92 (m, 1 H), 6,12-6,19 (m, 1 H), 6,49-6,61 (m, 1 H), 7,29-7,36 (m, 2 H), 7,38-7,44 (m, 2 H), 7,47-7,53 (m, 2 H), 7,64-7,71 (m, 2 H), 7,80 (dd, J=15,06, 7,91 Гц, 4 H).
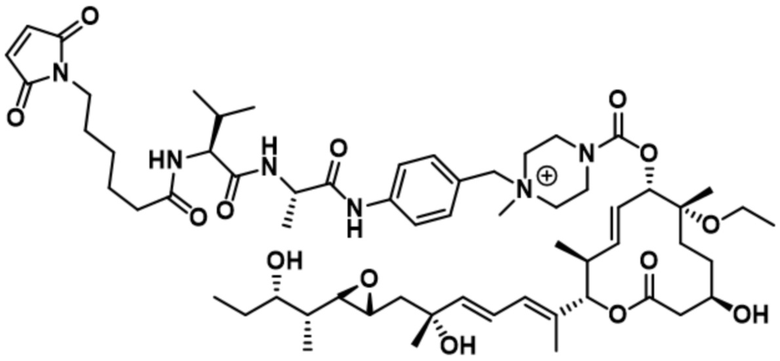
[1096] Стадия 2. 1-(4-((S)-2-((S)-2-(6-(2,5-Диоксо-2,5-дигидро-1H-пиррол-1-ил)гексанамидо)-3-метилбутанамидо)пропанамидо)бензил)-4-((((2S,3S,6S,7R,10R, E)-7-этокси-10-гидрокси-2-((R,2E,4E)-6-гидрокси-7-((2R,3R)-3-((2R,3S)-3-гидроксипентан-2-ил)оксиран-2-ил)-6-метилгепта-2,4-диен-2-ил)-3,7-диметил-12-оксооксациклододец-4-ен-6-ил)окси)карбонил)-1-метилпиперазин-1-ий (14,09 мг, выход 82%). LC/MS (ESI, масса/заряд), 1057,62 [M+H]+.
[1097] 1H-ЯМР (400 МГц, MeOH-d4): δ ppm 0,87-1,03 (m, 15 H), 1,20 (s, 3 H), 1,22-1,29 (m, 4 H), 1,37 (s, 6 H), 1,45-1,72 (m, 14 H), 1,81 (s, 3 H), 1,84-1,95 (m, 1 H), 2,05-2,16 (m, 1 H), 2,26-2,36 (m, 2 H), 2,47-2,62 (m, 3 H), 2,66-2,74 (m, 1 H), 2,86-2,95 (m, 1 H), 3,11 (s, 3 H), 3,42-3,51 (m, 4 H), 3,51-3,62 (m, 5 H), 3,64-3,78 (m, 2 H), 3,81-3,89 (m, 1 H), 4,09-4,20 (m, 3 H), 4,43-4,52 (m, 1 H), 4,54-4,59 (m, 1 H), 4,55-4,67 (m, 2 H), 4,60-4,68 (m, 2 H), 5,01-5,12 (m, 2 H), 5,54-5,65 (m, 1 H), 5,75-5,86 (m, 1 H), 5,86-5,94 (m, 1 H), 6,10-6,21 (m, 1 H), 6,47-6,62 (m, 1 H), 6,81 (s, 2 H), 7,49-7,60 (m, 2 H) 7,76-7,89 (m, 2 H).
1.5.1.5 ADL5-D15
[1098] Общую процедуру, указанную выше (раздел 1.5.1), использовали для синтеза ADL5-D15. Полезную нагрузку D15 синтезировали с применением процедур, указанных в международной заявке на патент № PCT/US2019/026992, которая включена в данный документ посредством ссылки.
[1099] Стадия 1. 1-(4-((S)-2-((S)-2-((((9H-Флуорен-9-ил)метокси)карбонил)амино)-3-метилбутанамидо)пропанамидо)бензил)-4-((((2S,3S,6R,7S,10R, E)-2-((E)-1-(1-(1-ацетилпиперидин-4-ил)-4-фтор-1H-бензо[d][1,2,3]триазол-6-ил)проп-1-ен-2-ил)-10-гидрокси-3,7-диметил-12-оксооксациклододец-4-ен-6-ил)окси)карбонил)-1-метилпиперазин-1-ий (100 мг, 0,086 ммоль, выход 57,3%). LC/MS (ESI, масса/заряд), 1167,76 [M+H].
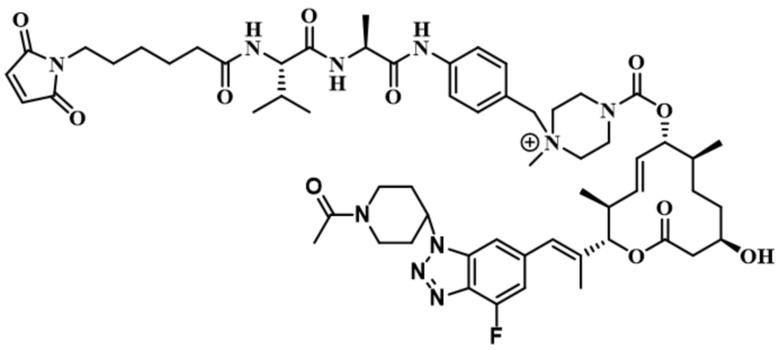
[1100] Стадия 2. 4-((((2S,3S,6R,7S,10R, E)-2-((E)-1-(1-(1-Ацетилпиперидин-4-ил)-4-фтор-1H-бензо[d][1,2,3]триазол-6-ил)проп-1-ен-2-ил)-10-гидрокси-3,7-диметил-12-оксооксациклододец-4-ен-6-ил)окси)карбонил)-1-(4-((S)-2-((S)-2-(6-(2,5-диоксо-2,5-дигидро-1H-пиррол-1-ил)гексанамидо)-3-метилбутанамидо)пропанамидо)бензил)-1-метилпиперазин-1-ий (32 мг, 0,028 ммоль, выход 32,8%). LC/MS (ESI, масса/заряд), 1138,64 [M+H].
[1101] 1H-ЯМР (400 МГц, MeOH-d4): δ ppm 0,99 (s, 10 H), 1,26-1,40 (m, 5 H), 1,42-1,49 (m, 3 H), 1,67 (br s, 6 H), 1,96 (d, J=1,00 Гц, 3 H), 2,00-2,13 (m, 2 H), 2,16-2,42 (m, 7 H), 2,44-2,55 (m, 1 H), 2,59-2,76 (m, 2 H), 2,98-3,26 (m, 4 H), 3,38-3,59 (m, 7 H), 3,60-3,76 (m, 2 H), 3,78-3,90 (m, 1 H), 4,13 (br d, J=7,15 Гц, 3 H), 4,41-4,52 (m, 1 H), 4,53-4,71 (m, 3 H), 4,89-4,97 (m, 1 H), 5,10-5,27 (m, 2 H), 5,48-5,67 (m, 2 H), 6,79 (s, 2 H) 7,07-7,17 (m, 1 H), 7,48-7,61 (m, 3 H), 7,78-7,84 (m, 2 H).
1.5.1.5 ADL5-D32
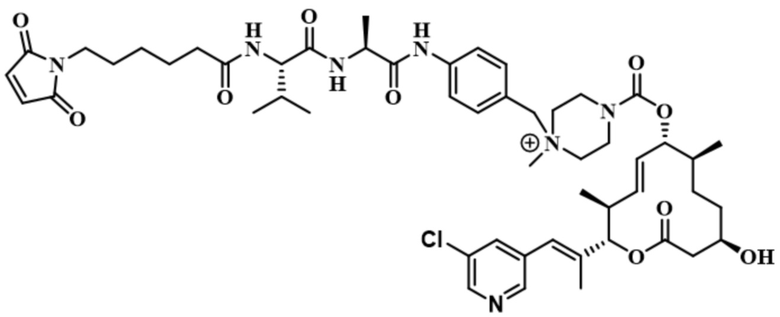
[1102] Общую процедуру, указанную выше (раздел 1.5.1), использовали для синтеза ADL5-D32. Полезную нагрузку D15 синтезировали с применением процедур, указанных в международной заявке на патент № PCT/US2019/026992, которая включена в данный документ посредством ссылки.
[1103] Стадия 1. 1-(4-((S)-2-((S)-2-((((9H-Флуорен-9-ил)метокси)карбонил)амино)-3-метилбутанамидо)пропанамидо)бензил)-4-((((2S,3S,6R,7S,10R, E)-2-((E)-1-(5-хлорпиридин-3-ил)проп-1-ен-2-ил)-10-гидрокси-3,7-диметил-12-оксооксациклододец-4-ен-6-ил)окси)карбонил)-1-метилпиперазин-1-ий (15 мг, 0,015 ммоль, выход 69,6%)LC/MS (ESI, масса/заряд), 1018,4 [M]+
[1104] 1H ЯМР (400 МГц, МЕТАНОЛ-d4) d ppm 0,99 (s, 14 H) 1,29-1,41 (m, 3 H) 1,44-1,49 (m, 3 H) 1,61-1,71 (m, 2 H) 1,92 (d, J=1,25 Гц, 3 H), 1,95-2,13 (m, 2 H) 2,45-2,53 (m, 1 H) 2,60-2,70 (m, 2 H) 3,04-3,09 (m, 3 H) 3,37 (s, 3 H) 3,39-3,47 (m, 1 H) 3,47-3,54 (m, 2 H) 3,61-3,75, (m, 2 H) 3,78-3,87 (m, 1 H) 3,93-3,99 (m, 1 H) 4,08-4,18 (m, 2 H) 4,22-4,29 (m, 1 H) 4,39-4,45 (m, 2 H) 4,45-4,53 (m, 1 H) 4,56-4,63 (m,3 H) 5,17-5,23 (m, 1 H) 5,48-5,64 (m, 2 H) 6,57-6,64 (m, 1 H) 7,28-7,36 (m,2 H) 7,37-7,45 (m, 2 H) 7,47-7,54 (m, 2 H) 7,64-7,70 (m, 2H) 7,75-7,84 (m, 5 H) 8,41-8,48 (m, 2 H)
[1105] Стадия 2. 4-((((2S,3S,6R,7S,10R, E)-2-((E)-1-(5-Хлорпиридин-3-ил)проп-1-ен-2-ил)-10-гидрокси-3,7-диметил-12-оксооксациклододец-4-ен-6-ил)окси)карбонил)-1-(4-((S)-2-((S)-2-(6-(2,5-диоксо-2,5-дигидро-1H-пиррол-1-ил)гексанамидо)-3-метилбутанамидо)пропанамидо)бензил)-1-метилпиперазин-1-ий (6,2 мг, выход 42,5%). LC/MS (ESI, масса/заряд), 990,34 [M+H].
[1106] 1H ЯМР (400 МГц, МЕТАНОЛ-d4) d ppm 0,97-1,09 (m, 12 H) 1,24-1,41 (m, 5 H) 1,47 (d, J=7,15 Гц, 3 H) 1,55-1,71 (m, 6 H) 1,92 (d, J=1,13 Гц, 3 H) 1,98-2,15 (m, 2 H) 2,27-2,36 (m, 2 H) 2,46-2,53 (m, 1 H) 2,60-2,71 (m, 2 H) 3,06-3,13 (m, 3 H) 3,35-3,38 (m, 1 H) 3,41-3,58 (m, 6 H) 3,62-3,76 (m, 2 H) 3,80-3,88 (m, 1 H) 4,08-4,19 (m, 3 H) 4,43-4,52 (m, 1 H) 4,57-4,66 (m, 2 H) 5,16-5,24 (m, 1 H) 5,49-5,68, (m, 2 H) 6,62 (s, 1 H) 6,81 (s, 2 H) 7,49-7,57 (m, 2 H) 7,76-7,87 (m, 3 H) 8,39-8,49 (m, 2 H)
1.5.1.5 ADL5-D30

[1107] Общую процедуру, указанную выше (раздел 1.5.1), использовали для синтеза ADL5-D30. Полезную нагрузку D30 синтезировали с применением процедур, указанных в международной заявке на патент № PCT/US2019/026992, которая включена в данный документ посредством ссылки.
[1108] Стадия 1. 1-(4-((S)-2-((S)-2-((((9H-Флуорен-9-ил)метокси)карбонил)амино)-3-метилбутанамидо)пропанамидо)бензил)-4-((((2S,3S,6R,7S,10R, E)-2-((E)-1-(3-(диметиламино)фенил)проп-1-ен-2-ил)-10-гидрокси-3,7-диметил-12-оксооксациклододец-4-ен-6-ил)окси)карбонил)-1-метилпиперазин-1-ий (16 мг, 0,016 ммоль, выход 51,4%). LC/MS (ESI, масса/заряд), 1027,50 [M+H]+
[1109] 1H ЯМР (400 МГц, МЕТАНОЛ-d4) d ppm 0,95-1,07 (m, 13 H) 1,31-1,42 (m, 2 H) 1,44-1,50 (m, 3 H) 1,63-1,71 (m, 2 H) 1,84-1,92 (m, 3H) 1,98-2,14 (m, 2 H) 2,47-2,56 (m, 1 H) 2,60-2,67 (m, 2 H) 2,93 (s, 6 H) 3,03-3,09 (m, 3 H) 3,37 (s, 4 H) 3,47-3,56 (m, 2 H) 3,63-3,75 (m, 2 H) 3,79-3,88 (m, 1 H) 3,92-3,98 (m, 1 H) 4,08-4,19 (m, 2 H) 4,21-4,27 (m, 1 H) 4,37-4,44 (m, 2 H) 4,45-4,54 (m, 1 H) 4,57-4,62 (m, 2H) 4,91-4,94 (m, 2 H) 5,15-5,20 (m, 1 H) 5,47-5,55 (m, 1 H) 5,56-5,65 (m, 1 H) 6,58 (s, 1 H) 6,67 (d, J=1,51 Гц, 3 H) 7,15-7,24 (m, 1 H), 7,28-7,36 (m, 2 H) 7,38-7,45 (m, 2 H) 7,47-7,54 (m, 2 H) 7,64-7,73 (m, 2 H) 7,75-7,85 (m, 4 H)
[1110] Стадия 2. 4-((((2S,3S,6R,7S,10R, E)-2-((E)-1-(5-Хлорпиридин-3-ил)проп-1-ен-2-ил)-10-гидрокси-3,7-диметил-12-оксооксациклододец-4-ен-6-ил)окси)карбонил)-1-(4-((S)-2-((S)-2-(6-(2,5-диоксо-2,5-дигидро-1H-пиррол-1-ил)гексанамидо)-3-метилбутанамидо)пропанамидо)бензил)-1-метилпиперазин-1-ий (6,2 мг, выход 42,5%). LC/MS (ESI, масса/заряд), 990,34 [M+H].
[1111] 1H ЯМР (400 МГц, МЕТАНОЛ-d4) d ppm 0,88 (d, J=6,65 Гц, 12 H) 1,16-1,30 (m, 4 H) 1,32-1,38 (m, 3 H) 1,43-1,58 (m, 6 H) 1,75-1,80, (m, 3 H) 1,84-1,92 (m, 1 H) 1,93-2,02 (m, 1 H) 2,14-2,21 (m, 2 H) 2,35-2,42 (m, 1 H) 2,48-2,57 (m, 2 H) 2,82 (s, 6 H) 2,94-3,02 (m, 3 H), 3,27-3,32 (m, 1 H) 3,35-3,45 (m, 4 H) 3,50-3,64 (m, 2 H) 3,68-3,76 (m, 1 H) 3,97-4,07 (m, 3 H) 4,31-4,40 (m, 1 H) 4,47-4,53 (m, 2 H) 5,03- 5,09 (m, 1 H) 5,35-5,44 (m, 1 H) 5,45-5,55 (m, 1 H) 6,42-6,50 (m, 1 H) 6,51-6,62 (m, 3 H) 6,69 (s, 2 H) 7,03-7,12 (m, 1 H) 7,38-7,44 (m, 2H) 7,66-7,75 (m, 2 H) 8,42-8,47 (m, 1 H).
1.5.1.5 ADL5-D27
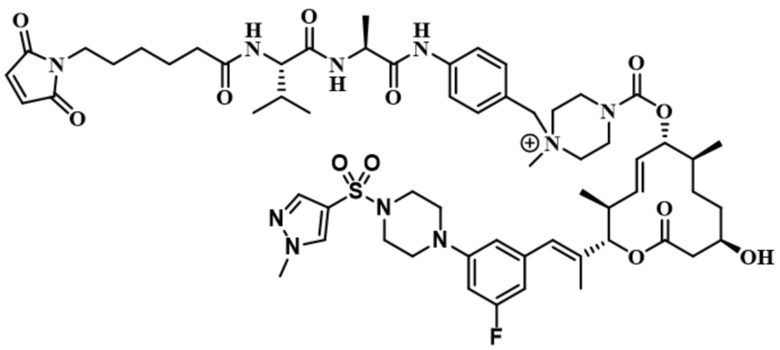
[1112] Общую процедуру, указанную выше (раздел 1.5.1), использовали для синтеза ADL5-D27. Полезную нагрузку D27 синтезировали с применением процедур, указанных в международной заявке на патент № PCT/US2019/026992, которая включена в данный документ посредством ссылки.
[1113] Стадия 1. 1-(4-((S)-2-((S)-2-((((9H-Флуорен-9-ил)метокси)карбонил)амино)-3-метилбутанамидо)пропанамидо)бензил)-4-((((2S,3S,6R,7S,10R, E)-2-((E)-1-(3-фтор-5-(4-((1-метил-1H-пиразол-4-ил)сульфонил)пиперазин-1-ил)фенил)проп-1-ен-2-ил)-10-гидрокси-3,7-диметил-12-оксооксациклододец-4-ен-6-ил)окси)карбонил)-1-метилпиперазин-1-ий (25,2 мг, 0,020 ммоль, выход 83%). LC/MS (ESI, масса/заряд), 1230,54 [M+H]+
Стадия 2. 1-(4-((S)-2-((S)-2-(6-(2,5-Диоксо-2,5-дигидро-1H-пиррол-1-ил)гексанамидо)-3-метилбутанамидо)пропанамидо)бензил)-4-((((2S,3S,6R,7S,10R, E)-2-((E)-1-(3-фтор-5-(4-((1-метил-1H-пиразол-4-ил)сульфонил)пиперазин-1-ил)фенил)проп-1-ен-2-ил)-10-гидрокси-3,7-диметил-12-оксооксациклододец-4-ен-6-ил)окси)карбонил)-1-метилпиперазин-1-ий (5,2 мг, 4,33 мкмоль, выход 21,13%). LC/MS (ESI, масса/заряд), 1201,68 [M+H]+
[1114] 1H ЯМР (400 МГц, МЕТАНОЛ-d4) d ppm 0,87 (d, J=6,78 Гц, 12 H) 1,13-1,29 (m, 4 H) 1,31-1,38 (m, 3 H) 1,43-1,59 (m, 6 H) 1,71-1,79, (m, 3 H) 1,83-2,02 (m, 2 H) 2,14-2,21 (m, 2 H) 2,34-2,41 (m, 1 H) 2,56 (s, 8 H) 2,94-3,01 (m, 3 H) 3,12-3,18 (m, 8 H) 3,28-3,45 (m, 5 H), 3,48-3,63 (m, 2 H) 3,70 (s, 4 H) 3,97-4,07 (m, 3 H) 4,29-4,41 (m, 1 H) 4,49 (s, 2 H) 4,98-5,06 (m, 1 H) 5,34-5,54 (m, 2 H) 6,37-6,45 (m, 2H) 6,51 (s, 2 H) 6,69 (s, 2 H) 7,37-7,43 (m, 2 H) 7,63-7,73 (m, 4 H)
1.5.1.6 ADL10-D1
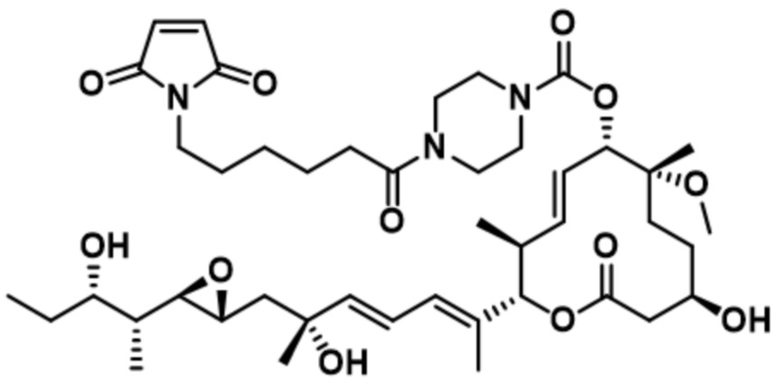
[1115] (2S,3S,6S,7R,10R, E)-10-Гидрокси-2-((R,2E,4E)-6-гидрокси-7-((2S,3S)-3-((2R,3S)-3-гидроксипентан-2-ил)оксиран-2-ил)-6-метилгепта-2,4-диен-2-ил)-7-метокси-3,7-диметил-12-оксооксациклододец-4-ен-6-илпиперазин-1-карбоксилат (0,012 г, 0,019 ммоль), 2,5-диоксопирролидин-1-ил-6-(2,5-диоксо-2,5-дигидро-1H-пиррол-1-ил)гексанoат (0,012 г, 0,038 ммоль) и DCM (0,188 мл, 0,019 ммоль) объединяли и перемешивали в течение ночи. Смесь непосредственно загружали на колонку с силикагелем и хроматографировали с получением (2S,3S,6S,7R,10R, E)-10-гидрокси-2-((R,2E,4E)-6-гидрокси-7-((2R,3R)-3-((2R,3S)-3-гидроксипентан-2-ил)оксиран-2-ил)-6-метилгепта-2,4-диен-2-ил)-7-метокси-3,7-диметил-12-оксооксациклододец-4-ен-6-ил-4-(6-(2,5-диоксо-2,5-дигидро-1H-пиррол-1-ил)гексаноил)пиперазин-1-карбоксилата (8,4 мг, 10,12 мкмоль, выход 53,7%). LC/MS [M+Na] 853,5.
[1116] 1H-ЯМР (400 МГц, MeOH-d4): δ ppm 0,89 (s, 9 H) 1,21-1,39 (m, 9 H) 1,41-1,56 (m, 5 H) 1,57-1,71 (m, 6 H) 1,69-1,71 (m, 1 H) 1,79, (d, J=0,88 Гц, 3 H) 1,82-1,90 (m, 1 H) 2,34-2,43 (m, 1 H) 2,41-2,41 (m, 1 H) 2,46-2,63 (m, 3 H) 2,65-2,68 (m, 2 H) 2,68 (s, 3 H) 2,86-2,92 (m, 1 H) 3,33 (s, 3 H) 3,51 (br d, J=7,03 Гц, 6 H) 3,54-3,60 (m, 5 H) 3,77-3,88 (m, 1 H) 5,06 (s, 2 H) 5,53-5,63 (m, 1 H) 5,70-5,80 (m, 1 H), 5,83-5,94 (m, 1 H) 6,08-6,19 (m, 1 H) 6,47-6,59 (m, 1 H) 6,80 (s, 2 H).
1.6 Получение ADL12-D1, ADL14-D1 и ADL15-D1
1.6.1 Краткое описание. Общая процедура 1
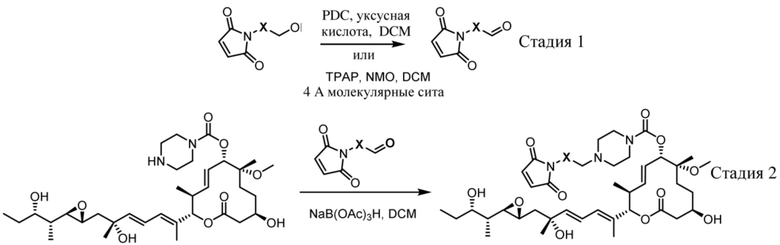
Схема 7
[1117] Стадия 1 для ADL12-D1. К перемешиваемому раствору 1-(6-гидроксигексил)-1H-пиррол-2,5-диона (0,200 г, 1,014 ммоль) в DCM (20,28 мл, 1,014 ммоль) добавляли PDC (3,81 г, 10,14 ммоль) и уксусную кислоту (0,1 мл). Реакционную смесь перемешивали в течение 3 часов при к. т. Затем реакционную смесь фильтровали через подушку из силикагеля и концентрировали до сухого состояния с получением 6-(2,5-диоксо-2,5-дигидро-1H-пиррол-1-ил)гексанaля (40 мг, 0,205 ммоль, выход 20,21%).
[1118] Стадия 1 для ADL14-D1 и ADL15-D1. К перемешиваемому раствору малеимидного спирта (1,0 экв.) в DCM (0,05 M) добавляли предварительно активированный порошкообразный MS-4A, 2,6 мг на 1 мг спирта, N-метилморфолин-N-оксид (1,2 экв.) и TPAP (0,1 экв.) в данном порядке. Реакционную смесь перемешивали в течение 60 мин. при к. т. Затем реакционную смесь фильтровали через подушку из силикагеля и концентрировали до сухого состояния. Неочищенный продукт затем переносили на следующую стадию (стадия 2).
[1119] Стадия 2. Смешивали (2S,3S,6S,7R,10R, E)-10-гидрокси-2-((R,2E,4E)-6-гидрокси-7-((2S,3S)-3-((2R,3S)-3-гидроксипентан-2-ил)оксиран-2-ил)-6-метилгепта-2,4-диен-2-ил)-7-метокси-3,7-диметил-12-оксооксациклододец-4-ен-6-илпиперазин-1-карбоксилат (1,0 экв.), 2-(2,5-диоксо-2,5-дигидро-1H-пиррол-1-ил)ацетальдегид (2,0-3,0 экв.), DCM (0,1 M), триацетоксиборогидрид натрия (3,0 экв.) и перемешивали в течение 10 мин. Затем реакционную смесь непосредственно загружали на колонку с силикагелем и хроматографировали с получением требуемой конструкции линкер-полезная нагрузка.
1.6.1.1 ADL12-D1
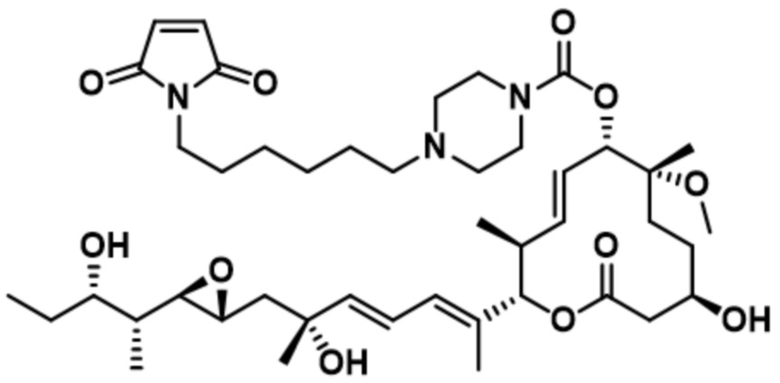
[1120] Линкер-полезная нагрузка (ADL12-D1). Общую процедуру, указанную в разделе 1.6.1, использовали для синтеза (2S,3S,6S,7R,10R, E)-10-гидрокси-2-((R,2E,4E)-6-гидрокси-7-((2R,3R)-3-((2R,3S)-3-гидроксипентан-2-ил)оксиран-2-ил)-6-метилгепта-2,4-диен-2-ил)-7-метокси-3,7-диметил-12-оксооксациклододец-4-ен-6-ил-4-(6-(2,5-диоксо-2,5-дигидро-1H-пиррол-1-ил)гексил)пиперазин-1-карбоксилата (41 мг, 0,050 ммоль, выход 80%). LC/MS [M+]+ 816,75.
[1121] 1H-ЯМР (400 МГц, MeOH-d4): δ ppm 0,86-0,98 (m, 9 H) 1,20-1,23 (m, 3 H) 1,23-1,40 (m, 8 H) 1,41-1,70 (m, 12 H) 1,79 (d, J=0,63 Гц, 3 H) 1,83-1,91 (m, 1 H) 2,33-2,40 (m, 2 H) 2,43 (br t, J=4,77 Гц, 4 H) 2,48-2,64 (m, 3 H) 2,65-2,69 (m, 1 H) 2,87-2,92 (m, 1 H) 3,32 (s, 3 H) 3,41-3,60 (m, 7 H) 3,79-3,87 (m, 1 H) 5,04 (dd, J=19,39, 10,23 Гц, 2 H) 5,57 (dd, J=15,18, 9,79 Гц, 1 H) 5,69-5,79 (m, 1 H) 5,87 (d, J=15,31 Гц, 1 H) 6,11-6,17 (m, 1 H) 6,49-6,58 (m, 1 H) 6,80 (s, 2 H).
1.6.1.X ADL12-D28
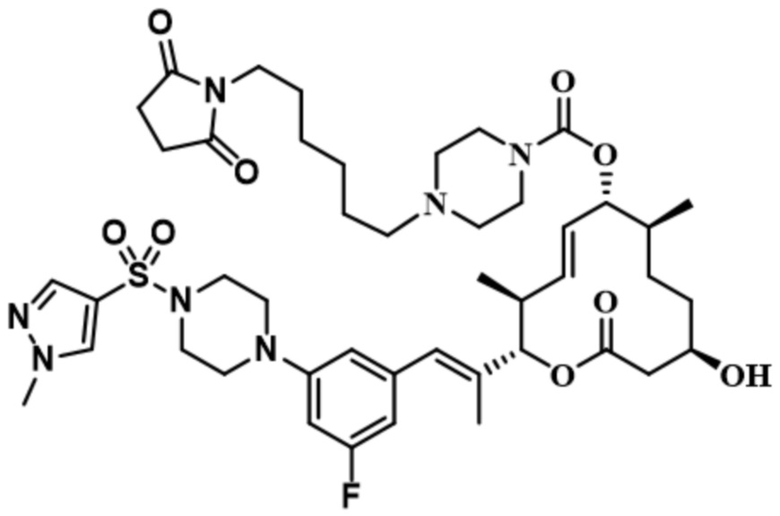
[1122] Линкер-полезная нагрузка (ADL12-D28). Общую процедуру, указанную в разделе 1.6.1, использовали для синтеза (2S,3S,6R,7S,10R, E)-2-((E)-1-(3-фтор-5-(4-((1-метил-1H-пиразол-4-ил)сульфонил)пиперазин-1-ил)фенил)проп-1-ен-2-ил)-10-гидрокси-3,7-диметил-12-оксооксациклододец-4-ен-6-ил-4-(6-(2,5-диоксо-2,5-дигидро-1H-пиррол-1-ил)гексил)пиперазин-1-карбоксилата (2,3 мг, 30,7%). LC/MS [M+]+ 897,32.
[1123] 1H ЯМР (400 МГц, МЕТАНОЛ-d4) δ ppm 0,85-0,93 (m, 6 H) 1,16-1,34 (m, 6 H) 1,37-1,58 (m, 6 H) 1,72-1,77 (m, 3 H) 1,80-1,88 (m, 1 H), 2,23-2,41 (m, 7 H) 2,47-2,57 (m, 2 H) 3,08-3,19 (m, 9 H) 3,33-3,42 (m, 5 H) 3,70 (s, 4 H) 4,67-4,72 (m, 1 H) 4,98-5,07 (m, 1 H) 5,33-5,50 (m, 2 H) 6,36-6,43 (m, 2 H) 6,44-6,53 (m, 2 H) 6,70 (s, 2 H) 7,62-7,69 (m, 2 H)
1.6.1.X ADL12-D35
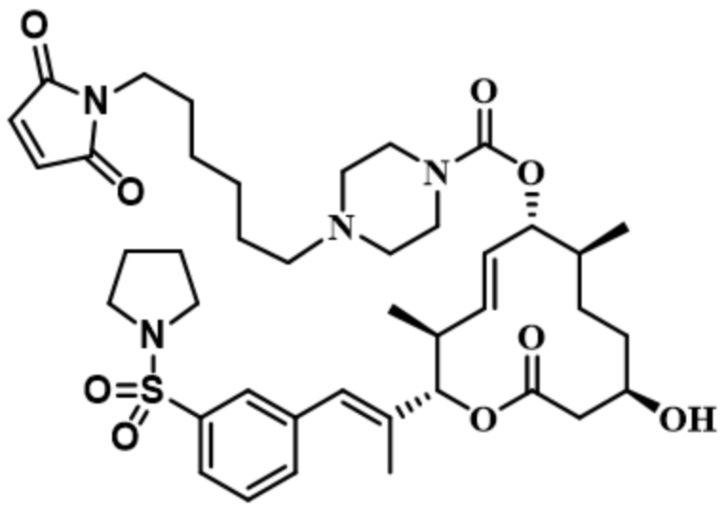
[1124] Линкер-полезная нагрузка (ADL12-D35). Общую процедуру, указанную в разделе 1.6.1, использовали для синтеза (2S,3S,6R,7S,10R, E)-10-гидрокси-3,7-диметил-12-оксо-2-((E)-1-(3-(пирролидин-1-илсульфонил)фенил)проп-1-ен-2-ил)оксациклододец-4-ен-6-ил-4-(6-(2,5-диоксо-2,5-дигидро-1H-пиррол-1-ил)гексил)пиперазин-1-карбоксилата (4,0 мг, 5,11 мкмоль, выход 28,8%). LC/MS [M+H]+ 783,5.
[1125] 1H ЯМР (400 МГц, МЕТАНОЛ-d4) d ppm 0,91 (dd, J=6,78, 2,51 Гц, 6 H) 1,17-1,33 (m, 6 H) 1,38-1,59 (m, 6 H) 1,65 (s, 4 H) 1,80 (s, 3 H), 1,82-1,91 (m, 1 H) 2,23-2,41 (m, 7 H) 2,49-2,61 (m, 2 H) 3,14 (s, 4 H) 3,38 (br d, J=7,15 Гц, 6 H) 3,67-3,76 (m, 1 H) 4,68-4,73 (m, 1 H) 5,03-5,11 (m, 1 H) 5,34-5,52 (m, 2 H) 6,55-6,62 (m, 1 H) 6,70 (s, 2 H) 7,46-7,54 (m, 2 H) 7,58-7,65 (m, 2 H)
1.6.1.X ADL12-D22 (R)
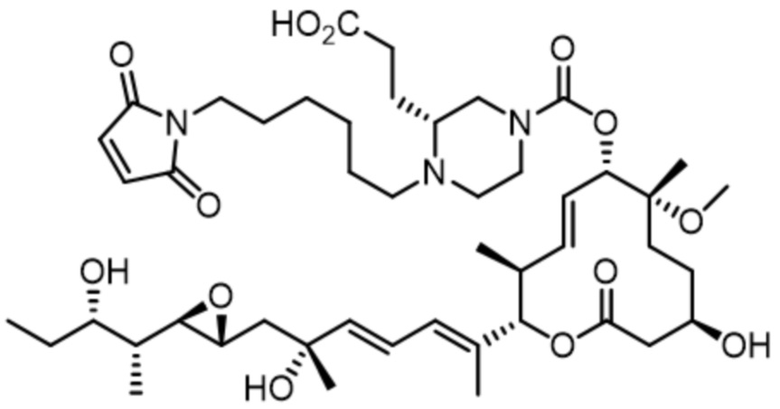
[1126] Линкер-полезная нагрузка (ADL12-D28). Общую процедуру, указанную в разделе 1.6.1, использовали для синтеза 3-((R)-1-(6-(2,5-диоксо-2,5-дигидро-1H-пиррол-1-ил)гексил)-4-((((2S,3S,6S,7R,10R, E)-10-гидрокси-2-((R,2E,4E)-6-гидрокси-7-((2R,3R)-3-((2R,3S)-3-гидроксипентан-2-ил)оксиран-2-ил)-6-метилгепта-2,4-диен-2-ил)-7-метокси-3,7-диметил-12-оксооксациклододец-4-ен-6-ил)окси)карбонил)пиперазин-2-ил)пропановой кислоты (3,2 мг, 3,60 мкмоль, выход 15,39%). LC/MS [M+]+ 888,5.
1.6.1.X ADL12-D22 (S)
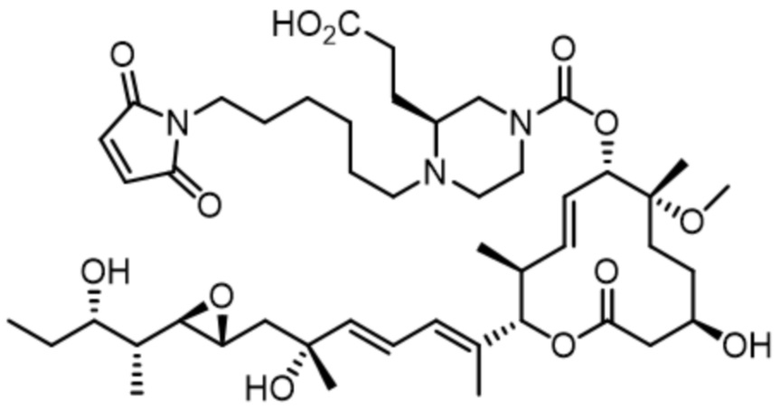
[1127] Линкер-полезная нагрузка (ADL12-D28). Общую процедуру, указанную в разделе 1.6.1, использовали для синтеза 3-((S)-1-(6-(2,5-диоксо-2,5-дигидро-1H-пиррол-1-ил)гексил)-4-((((2S,3S,6S,7R,10R, E)-10-гидрокси-2-((R,2E,4E)-6-гидрокси-7-((2R,3R)-3-((2R,3S)-3-гидроксипентан-2-ил)оксиран-2-ил)-6-метилгепта-2,4-диен-2-ил)-7-метокси-3,7-диметил-12-оксооксациклододец-4-ен-6-ил)окси)карбонил)пиперазин-2-ил)пропановой кислоты (3,6 мг, 3,60 мкмоль, выход 28,7%). LC/MS [M+]+ 888,56.
1.6.1.2 ADL14-D1
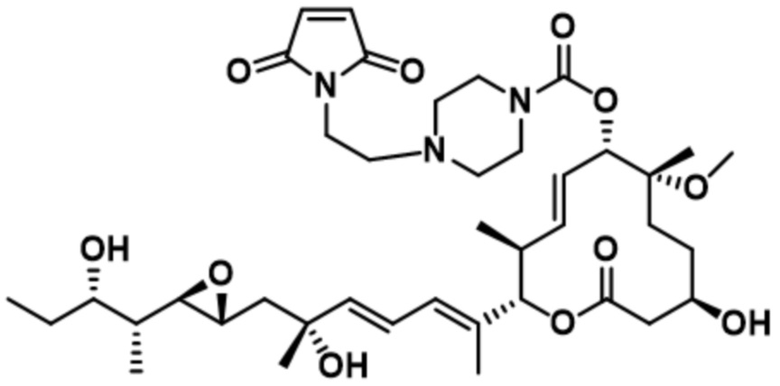
[1128] Линкер-полезная нагрузка (ADL14-D1). Общую процедуру, указанную в разделе 1.6.1, использовали для синтеза (2S,3S,6S,7R,10R, E)-10-гидрокси-2-((R,2E,4E)-6-гидрокси-7-((2R,3R)-3-((2R,3S)-3-гидроксипентан-2-ил)оксиран-2-ил)-6-метилгепта-2,4-диен-2-ил)-7-метокси-3,7-диметил-12-оксооксациклододец-4-ен-6-ил-4-(2-(2,5-диоксо-2,5-дигидро-1H-пиррол-1-ил)этил)пиперазин-1-карбоксилата (8 мг, 10,53 ммоль, выход 33,5%). LC/MS [M+H] 760,3.
[1129] 1H-ЯМР (400 МГц, MeOH-d4): δ ppm 0,85-1,01 (m, 9 H), 1,17-1,33 (m, 5 H), 1,36 (s, 3 H), 1,41-1,71 (m, 7 H), 1,80 (s, 3 H), 1,83-1,95 (m, 1 H), 2,48 (br s, 10 H), 2,89-2,98 (m, 1 H), 3,40-3,57 (m, 5 H), 3,61-3,72 (m, 2 H), 3,78-3,91 (m, 1 H), 4,98-5,14 (m, 2 H), 5,50-5,52 (m, 1 H), 5,52-5,65 (m, 1 H), 5,69-5,82 (m, 1 H), 5,86-5,96 (m, 1 H), 6,09-6,21 (m, 1 H), 6,47-6,60 (m, 1 H), 6,79-6,90 (m, 2 H).
1.6.1.3 ADL15-D1
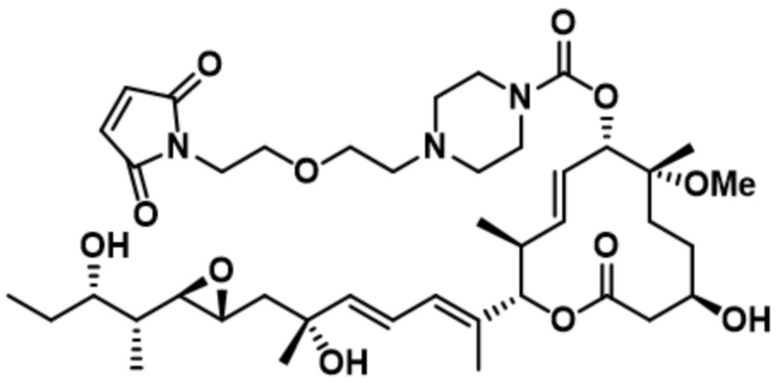
[1130] Линкер-полезная нагрузка (ADL15-D1). Общую процедуру, указанную в разделе 1.6.1, использовали для синтеза (2S,3S,6S,7R,10R, E)-10-гидрокси-2-((R,2E,4E)-6-гидрокси-7-((2R,3R)-3-((2R,3S)-3-гидроксипентан-2-ил)оксиран-2-ил)-6-метилгепта-2,4-диен-2-ил)-7-метокси-3,7-диметил-12-оксооксациклододец-4-ен-6-ил-4-(2-(2-(2,5-диоксо-2,5-дигидро-1H-пиррол-1-ил)этокси)этил)пиперазин-1-карбоксилата (7 мг, 8,71 мкмоль, выход 23,10%). LC/MS [M=+H] 804,1.
[1131] 1H-ЯМР (400 МГц, MeOH-d4): δ ppm 0,85-1,02 (m, 9 H), 1,18-1,32 (m, 4 H), 1,36 (s, 3 H), 1,40-1,72 (m, 7 H), 1,78-1,83 (m, 3 H), 1,85-1,93 (m, 1 H), 2,42-2,65 (m, 9 H), 2,67-2,73 (m, 1 H), 2,89-2,96 (m, 1 H), 3,37 (s, 5 H), 3,41-3,58 (m, 5 H), 3,59-3,67 (m, 4 H), 3,68-3,75 (m, 2 H), 3,81-3,89 (m, 1 H), 4,94-5,15 (m, 2 H), 5,61 (br d, J=10,04 Гц, 1 H), 5,69-5,82 (m, 1 H), 5,89 (br d, J=15,18 Гц, 1 H), 6,16 (br d, J=10,92 Гц, 1 H), 6,56 (br s, 1 H), 6,77-6,91 (m, 2 H).
1.7 ADL12-D2
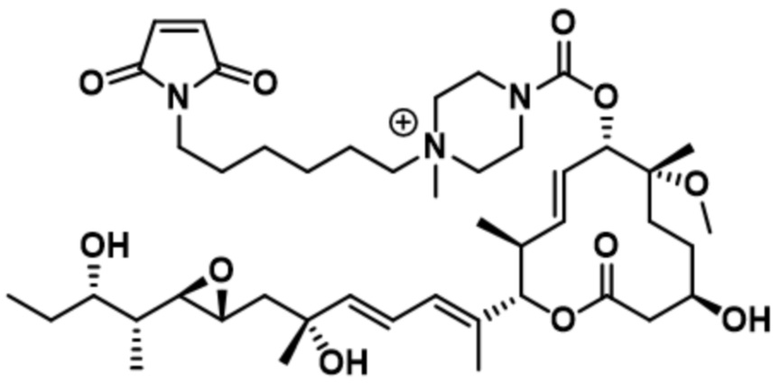
[1132] (2S,3S,6S,7R,10R, E)-10-Гидрокси-2-((R,2E,4E)-6-гидрокси-7-((2S,3S)-3-((2R,3S)-3-гидроксипентан-2-ил)оксиран-2-ил)-6-метилгепта-2,4-диен-2-ил)-7-метокси-3,7-диметил-12-оксооксациклододец-4-ен-6-ил-4-(6-(2,5-диоксо-2,5-дигидро-1H-пиррол-1-ил)гексил)пиперазин-1-карбоксилат (26 мг, 0,032 ммоль), ацетонитрил (319 мкл, 0,032 ммоль), йодметан (19,92 мкл, 0,319 ммоль) объединяли и перемешивали в течение ночи. Реакционную смесь концентрировали до сухого состояния и хроматографировали (0-30% MeOH в DCM) с получением 1-(6-(2,5-диоксо-2,5-дигидро-1H-пиррол-1-ил)гексил)-4-((((2S,3S,6S,7R,10R, E)-10-гидрокси-2-((R,2E,4E)-6-гидрокси-7-((2R,3R)-3-((2R,3S)-3-гидроксипентан-2-ил)оксиран-2-ил)-6-метилгепта-2,4-диен-2-ил)-7-метокси-3,7-диметил-12-оксооксациклододец-4-ен-6-ил)окси)карбонил)-1-метилпиперазин-1-ия (14 мг, 0,017 ммоль, выход 52,9%). LC/MS [M+] 831,6.
[1133] 1H-ЯМР (400 МГц, MeOH-d4): δ ppm 0,86-0,98 (m, 9 H) 1,26 (s, 4 H) 1,36 (s, 3 H) 1,40-1,58 (m, 9 H) 1,60-1,71 (m, 4 H) 1,80 (d, J=0,88 Гц, 4 H) 1,85-1,91 (m, 1 H) 1,87-1,88 (m, 1 H) 2,48-2,63 (m, 3 H) 2,65-2,72 (m, 1 H) 2,88-2,94 (m, 1 H) 3,18 (s, 3 H) 3,34-3,41 (m, 3 H) 3,53 (s, 10 H) 3,73-3,90 (m, 3 H) 3,90-4,06 (m, 2 H) 5,02-5,11 (m, 2 H) 5,56-5,66 (m, 1 H) 5,70-5,81 (m, 1 H) 5,84-5,94 (m, 1 H) 6,11-6,20 (m, 1 H) 6,50-6,60 (m, 1 H) 6,83 (s, 2 H).
1.8 ADL15-D2
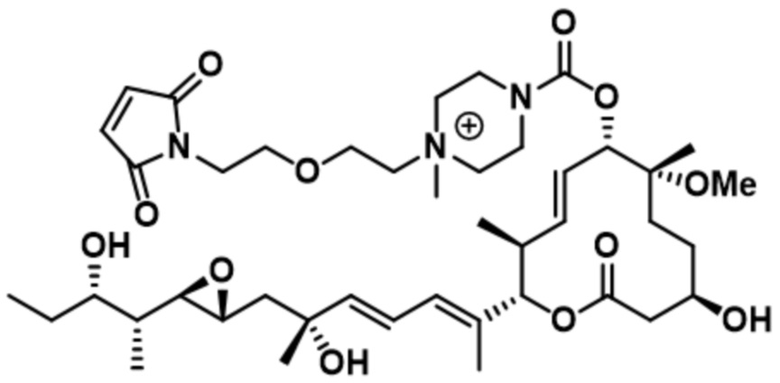
[1134] (2S,3S,6S,7R,10R, E)-10-Гидрокси-2-((R,2E,4E)-6-гидрокси-7-((2S,3S)-3-((2R,3S)-3-гидроксипентан-2-ил)оксиран-2-ил)-6-метилгепта-2,4-диен-2-ил)-7-метокси-3,7-диметил-12-оксооксациклододец-4-ен-6-ил-4-(2-(2-(2,5-диоксо-2,5-дигидро-1H-пиррол-1-ил)этокси)этил)пиперазин-1-карбоксилат (6 мг, 7,463 мкмоль), йодметан (0,467 мкл, 7,463 мкмоль) и ацетонитрил (0,390 мкл, 7,463 мкмоль) объединяли и перемешивали при к. т. Реакционную смесь концентрировали до сухого состояния с получением (2S,3S,6S,7R,10R, E)-10-гидрокси-2-((R,2E,4E)-6-гидрокси-7-((2R,3R)-3-((2R,3S)-3-гидроксипентан-2-ил)оксиран-2-ил)-6-метилгепта-2,4-диен-2-ил)-7-метокси-3,7-диметил-12-оксооксациклододец-4-ен-6-ил-4-(2-(2-(2,5-диоксо-2,5-дигидро-1H-пиррол-1-ил)этокси)этил)-4-метил-4l4-пиперазин-1-карбоксилата (6 мг, 7,33 мкмоль, выход 98%). LC/MS [M+]+ 819,28.
[1135] 1H-ЯМР (400 МГц, MeOH-d4): δ ppm 0,74-0,88 (m, 9 H) 1,18 (br d, J=4,27 Гц, 5 H) 1,23-1,27 (m, 3 H) 1,28-1,49 (m, 5 H) 1,51-1,61 (m, 2 H) 1,66-1,71 (m, 3 H) 1,73-1,80 (m, 1 H) 2,36-2,53 (m, 3 H) 2,55-2,60 (m, 1 H) 2,78-2,83 (m, 1 H) 3,10-3,14 (m, 3 H) 3,23-3,25 (m, 3 H) 3,32-3,51 (m, 5 H) 3,52-3,67 (m, 6 H) 3,67-3,87 (m, 7 H) 4,93-5,01 (m, 2 H) 5,44-5,55 (m, 1 H) 5,61-5,70 (m, 1 H) 6,00-6,07 (m, 1 H) 6,38-6,48 (m, 1 H) 6,75 (s, 2 H).
1.9 ADL5-D25
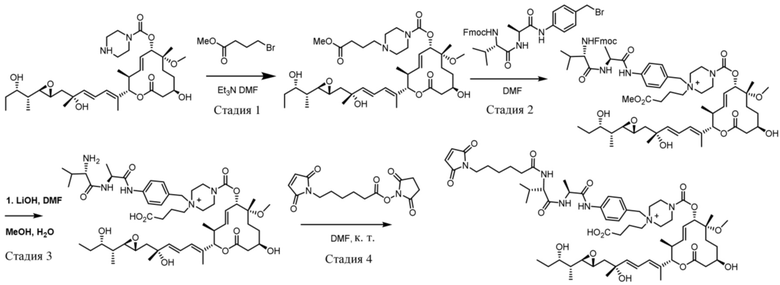
Схема 8
Стадия 1. D1 (40 мг, 0,063 ммоль) растворяли в N, N-диметилформамиде (730 мкл, 9,422 ммоль) и добавляли метилбромбутарат (23,69 мкл, 0,188 ммоль) с последующим добавлением
триэтиламина (35,0 мкл, 0,251 ммоль). Раствор перемешивали при к. т. в течение 2 дней. Растворитель выпаривали. С помощью очистки посредством колоночной хроматографии получали (2S,3S,6S,7R,10R, E)-10-гидрокси-2-((R,2E,4E)-6-гидрокси-7-((2R,3R)-3-((2R,3S)-3-гидроксипентан-2-ил)оксиран-2-ил)-6-метилгепта-2,4-диен-2-ил)-7-метокси-3,7-диметил-12-оксооксациклододец-4-ен-6-ил-4-(4-метокси-4-оксобутил)пиперазин-1-карбоксилат (51 мг, 0,069 ммоль, выход ~100%) в виде бесцветного масла. LC/MS (ESI, масса/заряд), 737,4 [M+H]+.
[1136] 1H-ЯМР (400 МГц, MeOH-d4): δ ppm 0,76-0,86 (m, 9 H), 1,12 (s, 3 H), 1,14-1,19 (m, 1 H), 1,24 (s, 3 H), 1,34-1,50 (m, 5 H), 1,52-1,60 (m, 1 H), 1,69 (s, 6 H), 2,27 (s, 8 H), 2,37-2,49 (m, 3 H), 2,54-2,61 (m, 1 H), 2,77-2,83 (m, 1 H), 3,35-3,47 (m, 5 H), 3,56 (s, 3 H), 3,67-3,76 (m, 1 H), 4,46 (s, 3 H), 4,89-5,00 (m, 3 H), 5,42-5,52 (m, 1 H), 5,57-5,70 (m, 1 H), 5,73-5,81 (m, 1 H), 5,98-6,08 (m, 1 H), 6,43 (dd, J=15,25, 10,98 Гц, 1 H).
[1137] Стадия 2. Суспендировали Fmoc-Val-Ala-PAB-бромид (88 мг, 0,152 ммоль) и (2S,3S,6S,7R,10R, E)-10-гидрокси-2-((R,2E,4E)-6-гидрокси-7-((2R,3R)-3-((2R,3S)-3-гидроксипентан-2-ил)оксиран-2-ил)-6-метилгепта-2,4-диен-2-ил)-7-метокси-3,7-диметил-12-оксооксациклододец-4-ен-6-ил-4-(4-метокси-4-оксобутил)пиперазин-1-карбоксилат (51 мг, 0,069 ммоль) в N, N-диметилформамиде (670 мкл, 8,651 ммоль). Реакционную смесь перемешивали при к. т в течение ночи. Растворитель выпаривали. С помощью очистки посредством колоночной хроматографии получали 1-(4-((S)-2-((S)-2-((((9H-флуорен-9-ил)метокси)карбонил)амино)-3-метилбутанамидо)пропанамидо)бензил)-4-((((2S,3S,6S,7R,10R, E)-10-гидрокси-2-((R,2E,4E)-6-гидрокси-7-((2R,3R)-3-((2R,3S)-3-гидроксипентан-2-ил)оксиран-2-ил)-6-метилгепта-2,4-диен-2-ил)-7-метокси-3,7-диметил-12-оксооксациклододец-4-ен-6-ил)окси)карбонил)-1-(4-метокси-4-оксобутил)пиперазин-1-ий (42 мг, 0,034 ммоль, выход 49,1%) в виде воскообразного твердого вещества. LC/MS (ESI, масса/заряд), 1235,4 [M]+.
[1138] Стадия 3. 1-(4-((S)-2-((S)-2-((((9H-Флуорен-9-ил)метокси)карбонил)амино)-3-метилбутанамидо)пропанамидо)бензил)-4-((((2S,3S,6S,7R,10R, E)-10-гидрокси-2-((R,2E,4E)-6-гидрокси-7-((2R,3R)-3-((2R,3S)-3-гидроксипентан-2-ил)оксиран-2-ил)-6-метилгепта-2,4-диен-2-ил)-7-метокси-3,7-диметил-12-оксооксациклододец-4-ен-6-ил)окси)карбонил)-1-(4-метокси-4-оксобутил)пиперазин-1-ий (42 мг, 0,034 ммоль) растворяли в соотношении 5:2:1 в THF (600 мкл, 7,322 ммоль), MeOH (250 мкл, 6,179 ммоль), воде (125 мкл, 6,939 ммоль) и добавляли гидроксид лития (1,221 мг, 0,051 ммоль). Смесь перемешивали при к. т. в течение 1 часа. Смесь гасили уксусной кислотой (5,84 мкл, 0,102 ммоль) и растворитель выпаривали и очищали с помощью RP HPLC с получением 1-(4-((S)-2-((S)-2-амино-3-метилбутанамидо)пропанамидо)бензил)-1-(3-карбоксипропил)-4-((((2S,3S,6S,7R,10R, E)-10-гидрокси-2-((R,2E,4E)-6-гидрокси-7-((2R,3R)-3-((2R,3S)-3-гидроксипентан-2-ил)оксиран-2-ил)-6-метилгепта-2,4-диен-2-ил)-7-метокси-3,7-диметил-12-оксооксациклододец-4-ен-6-ил)окси)карбонил)пиперазин-1-ия в виде воскообразного твердого вещества (18,4 мг, 0,018 ммоль, выход 54,2%). LC/MS (ESI, масса/заряд), 998,5 [M]+.
[1139] Стадия 4. 1-(4-((S)-2-((S)-2-Амино-3-метилбутанамидо)пропанамидо)бензил)-1-(3-карбоксипропил)-4-((((2S,3S,6S,7R,10R, E)-10-гидрокси-2-((R,2E,4E)-6-гидрокси-7-((2R,3R)-3-((2R,3S)-3-гидроксипентан-2-ил)оксиран-2-ил)-6-метилгепта-2,4-диен-2-ил)-7-метокси-3,7-диметил-12-оксооксациклододец-4-ен-6-ил)окси)карбонил)пиперазин-1-ий (18,4 мг, 0,018 ммоль) растворяли в N, N-диметилформамиде (356 мкл, 4,603 ммоль) и добавляли 2,5-диоксопирролидин-1-ил-6-(2,5-диоксо-2,5-дигидро-1H-пиррол-1-ил)гексанoат (6,81 мг, 0,022 ммоль) с последующим добавлением основания Хунига (8,04 мкл, 0,046 ммоль). Реакционный раствор перемешивали при к. т. в течение 30 мин. Растворитель выпаривали и неочищенный остаток очищали посредством RP HPLC с получением (1-(3-карбоксипропил)-1-(4-((S)-2-((R)-2-(6-(2,5-диоксо-2,5-дигидро-1H-пиррол-1-ил)гексанамидо)-3-метилбутанамидо)пропанамидо)бензил)-4-((((2S,3S,6S,7R,10R, E)-10-гидрокси-2-((R,2E,4E)-6-гидрокси-7-((2R,3R)-3-((2R,3S)-3-гидроксипентан-2-ил)оксиран-2-ил)-6-метилгепта-2,4-диен-2-ил)-7-метокси-3,7-диметил-12-оксооксациклододец-4-ен-6-ил)окси)карбонил)пиперазин-1-ия (8,8 мг, 7,38 мкмоль, выход 40,1%) в виде белого лиофилизированного твердого вещества. LC/MS (ESI, масса/заряд), 1191,5 [M]+.
[1140] 1H-ЯМР (400 МГц, DMSO-d6): δ ppm 0,68-0,81 (m, 18 H), 0,98-1,07 (m, 4 H), 1,07-1,14 (m, 3 H), 1,16 (br d, J=3,89 Гц, 5 H), 1,22-1,33 (m, 8 H), 1,36-1,47 (m, 7 H), 1,62 (s, 3 H) 1,66-1,73 (m, 1 H), 1,83-1,92 (m, 5 H), 1,98-2,13 (m, 2 H), 2,26 (dt, J=3,54, 1,80 Гц, 1 H), 2,27-2,33 (m, 1 H), 2,47-2,51 (m, 2 H), 2,58-2,62 (m, 1 H), 2,66-2,72 (m, 1 H), 3,15 (s, 3 H) 3,45-3,58 (m, 3 H), 3,60-3,68 (m, 2 H) 3,77-3,86 (m, 2 H), 4,06-4,13 (m, 1 H), 4,27-4,37 (m, 2 H), 4,46-4,54 (m, 3 H), 4,72-4,78 (m, 1 H), 4,80-4,87 (m, 2 H), 5,32-5,48 (m, 1 H), 5,53-5,67 (m, 1 H), 5,73-5,86 (m, 1 H), 5,93-6,05 (m, 1 H), 6,16-6,26 (m, 1 H), 6,20 (s, 1 H), 6,23-6,41 (m, 1 H), 6,27-6,38 (m, 1 H), 6,93 (s, 2 H), 6,98-7,06 (m, 2 H), 7,43-7,50 (m, 2 H), 7,62-7,69 (m, 2 H), 7,74-7,80 (m, 1 H), 8,22-8,27 (m, 1 H), 8,44-8,49 (m, 4 H), 10,15-10,22 (m, 1 H).
1.10 ADL12-D20 и ADL12-D21
[1141] Общую процедуру 1, указанную в разделе 1.2.1, использовали для синтеза D20.
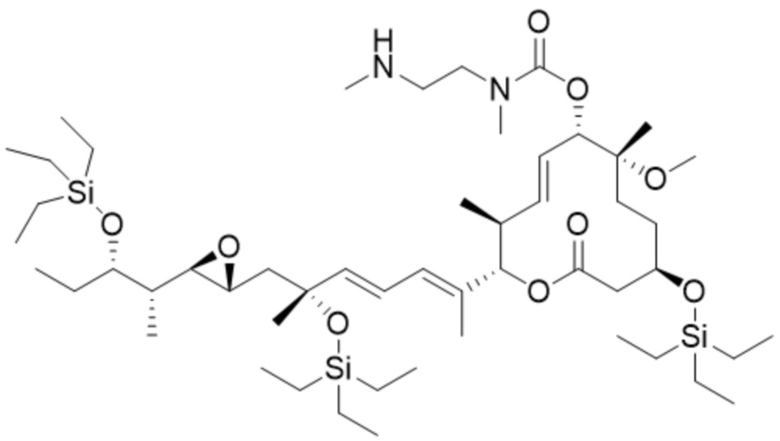
[1142] (2S,3S,6S,7R,10R, E)-7-Метокси-3,7-диметил-2-((R,2E,4E)-6-метил-6-((триэтилсилил)окси)-7-((2R,3R)-3-((2S,3S)-3-((триэтилсилил)окси)пентан-2-ил)оксиран-2-ил)гепта-2,4-диен-2-ил)-12-оксо-10-((триэтилсилил)окси)оксациклододец-4-ен-6-илметил(2-(метиламино)этил)карбамат (43 мг, 0,044 ммоль, выход 90%) в виде бесцветного масла. LC/MS (ESI, масса/заряд), 981,4 [M+H]+.
[1143] 1H-ЯМР (400 МГц, MeOH-d4): δ ppm 0,62-0,73 (m, 18 H), 0,82-0,93 (m, 9 H), 0,95-1,06 (m, 27 H), 1,24 (br s, 4 H), 1,45 (br s, 10 H), 1,78 (br s, 3 H), 1,92-2,00 (m, 1 H), 2,46 (br s, 4 H), 2,51-2,67 (m, 3 H), 2,76-2,84 (m, 2 H), 2,86-2,93 (m, 1 H), 2,93-3,02 (m, 3 H), 3,34-3,38 (m, 3 H), 3,43-3,49 (m, 2 H), 3,72-3,82 (m, 1 H), 3,93-4,04 (m, 1 H), 4,94-5,07 (m, 2 H), 5,53-5,64 (m, 1 H), 5,72-5,89 (m, 2 H), 6,07-6,21 (m, 1 H), 6,44-6,61 (m, 1 H).
D20
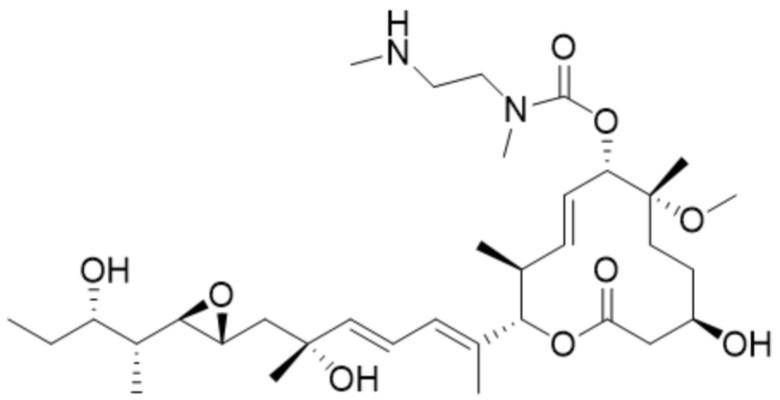
[1144] (2S,3S,6S,7R,10R, E)-10-Гидрокси-2-((R,2E,4E)-6-гидрокси-7-((2R,3R)-3-((2R,3S)-3-гидроксипентан-2-ил)оксиран-2-ил)-6-метилгепта-2,4-диен-2-ил)-7-метокси-3,7-диметил-12-оксооксациклододец-4-ен-6-илметил(2-(метиламино)этил)карбамат (16,4 мг, 0,026 ммоль, выход 58,6%) в виде бесцветного масла. LC/MS (ESI, масса/заряд), 639,7 [M+H]+.
[1145] 1H-ЯМР (400 МГц, MeOH-d4): δ ppm 0,92 (br d, J=6,53 Гц, 9 H), 1,25 (br s, 4 H), 1,36 (s, 3 H), 1,41-1,74 (m, 6 H), 1,45-1,59 (m, 1 H), 1,64-1,72 (m, 1 H), 1,80 (s, 3 H), 1,85-1,94 (m, 1 H), 2,42 (s, 3 H), 2,50-2,63 (m, 3 H), 2,65-2,73 (m, 1 H), 2,73-2,80 (m, 2 H), 2,88-3,01 (m, 4 H), 3,35-3,38 (m, 3 H), 3,35-3,40 (m, 3 H), 3,41-3,48 (m, 2 H), 3,52-3,57 (m, 1 H), 3,78-3,89 (m, 1 H), 5,00-5,13 (m, 2 H), 5,53-5,64 (m, 1 H), 5,71-5,82 (m, 1 H), 5,84-5,94 (m, 1 H), 6,12-6,19 (m, 1 H), 6,49-6,61 (m, 1 H).
ADL12-D20.
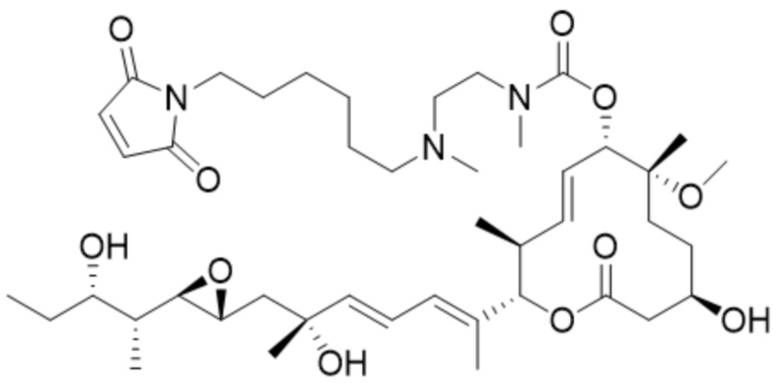
[1146] Общую процедуру, указанную в разделе 1.6.1, использовали для синтеза ALD12-D20 и получали (13,0 мг, 0,016 ммоль, 67,7%) в виде бесцветного масла. LC/MS (ESI, масса/заряд), 818,3 [M+H]+.
[1147] 1H-ЯМР (400 МГц, MeOH-d4): δ ppm 0,91 (br s, 9 H), 1,21-1,31 (m, 4 H), 1,36 (br s, 7 H), 1,46-1,73 (m, 11 H), 1,80 (s, 3 H), 1,84-1,93 (m, 1 H), 2,50-2,72 (m, 7 H), 2,75-2,85 (m, 1 H), 2,87-3,09 (m, 7 H), 3,48-3,68 (m, 6 H) 3,80-3,89 (m, 1 H), 5,02-5,13 (m, 2 H), 5,55-5,66 (m, 1 H), 5,71-5,82 (m, 1 H), 5,85-5,94 (m, 1 H), 6,11-6,22 (m, 1 H), 6,49-6,61 (m, 1 H), 6,83 (br d, J=1,13 Гц, 2 H).
ADL12-D21.
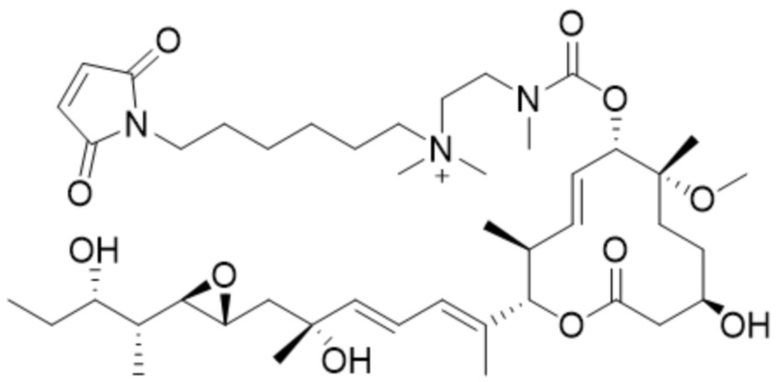
[1148] ((2S,3S,6S,7R,10R, E)-10-Гидрокси-2-((R,2E,4E)-6-гидрокси-7-((2R,3R)-3-((2R,3S)-3-гидроксипентан-2-ил)оксиран-2-ил)-6-метилгепта-2,4-диен-2-ил)-7-метокси-3,7-диметил-12-оксооксациклододец-4-ен-6-ил-(2-((6-(2,5-диоксо-2,5-дигидро-1H-пиррол-1-ил)гексил)(метил)амино)этил)(метил)карбамат (7 мг, 8,557 мкмоль) растворяли в N, N-диметилформамиде (99 мкл, 1,284 ммоль) и добавляли метилиодид (2,68 мкл, 0,043 ммоль). Раствор перемешивали при к. т. в течение ночи. Растворитель выпаривали. С помощью очистки посредством колоночной хроматографии получали 6-(2,5-диоксо-2,5-дигидро-1H-пиррол-1-ил)-N-(2-(((((2S,3S,6S,7R,10R, E)-10-гидрокси-2-((R,2E,4E)-6-гидрокси-7-((2R,3R)-3-((2R,3S)-3-гидроксипентан-2-ил)оксиран-2-ил)-6-метилгепта-2,4-диен-2-ил)-7-метокси-3,7-диметил-12-оксооксациклододец-4-ен-6-ил)окси)карбонил)(метил)амино)этил)-N, N-диметилгексан-1-аминий (7 мг, 8,40 мкмоль, выход 98%). LC/MS (ESI, масса/заряд), 832,7 [M+H]+.
[1149] 1H-ЯМР (400 МГц, MeOH-d4): δ ppm 0,75-0,87 (m, 9 H), 1,14 (s, 4 H), 1,25 (s, 3 H), 1,27-1,45 (m, 9 H), 1,48-1,61 (m, 4 H), 1,69 (s, 4 H), 1,72-1,79 (m, 2 H), 2,35-2,53 (m, 3 H), 2,53-2,60 (m, 1 H), 2,75-2,83 (m, 1 H), 2,85-2,95 (m, 3 H), 3,06 (br d, J=10,42 Гц, 6 H), 3,15-3,20 (m, 2 H), 3,25 (br d, J=2,38 Гц, 3 H), 3,42 (br d, J=6,90 Гц, 5 H), 3,53-3,69 (m, 2 H), 3,69-3,78 (m, 1 H), 4,88-5,01 (m, 2 H), 5,44-5,56 (m, 1 H), 5,59-5,72 (m, 1 H), 5,73-5,83 (m, 1 H), 5,99-6,10 (m, 1 H), 6,40 (s, 1 H), 6,72 (s, 2 H).
1.11 ADL12-D22
[1150] Общую процедуру 1, указанную в разделе 1.2.1, использовали для синтеза D22.
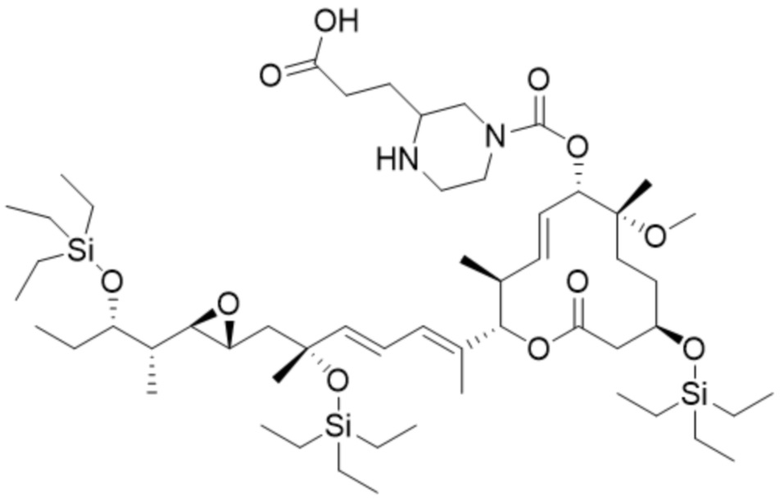
[1151] 3-(4-((((2S,3S,6S,7R,10R, E)-7-Метокси-3,7-диметил-2-((R,2E,4E)-6-метил-6-((триэтилсилил)окси)-7-((2R,3R)-3-((2S,3S)-3-((триэтилсилил)окси)пентан-2-ил)оксиран-2-ил)гепта-2,4-диен-2-ил)-12-оксо-10-((триэтилсилил)окси)оксациклододец-4-ен-6-ил)окси)карбонил)пиперазин-2-ил)пропановая кислота (48 мг, 0,046 ммоль, выход 34,4%) в виде бесцветного масла. LC/MS (ESI, масса/заряд), 1051,4 [M+H]+.
[1152] 1H-ЯМР (400 МГц, MeOH-d4): δ ppm 0,62-0,70 (m, 18 H), 0,82-0,94 (m, 9 H), 1,01 (tt, J=7,92, 3,18 Гц, 27 H), 1,22-1,28 (m, 4 H), 1,45 (s, 3 H), 1,47-1,66 (m, 7 H), 1,76-1,87 (m, 5 H), 1,92-1,99 (m, 1 H), 2,36-2,47 (m, 3 H), 2,50-2,68 (m, 3 H), 2,86-2,93 (m, 1 H), 2,98-3,08 (m, 2 H), 3,10-3,18 (m, 1 H), 3,18-3,26 (m, 2 H), 3,27-3,31 (m, 1 H), 3,34-3,36 (m, 3 H), 3,36-3,37 (m, 1 H) 3,72-3,81 (m, 1 H), 3,95-4,19 (m, 3 H), 4,93-5,00 (m, 1 H), 5,01-5,07 (m, 1 H), 5,54-5,66 (m, 1 H) 5,72-5,81 (m, 1 H) 5,81-5,90 (m, 1 H), 6,12-6,19 (m, 1 H), 6,47-6,58 (m, 1 H).
D22
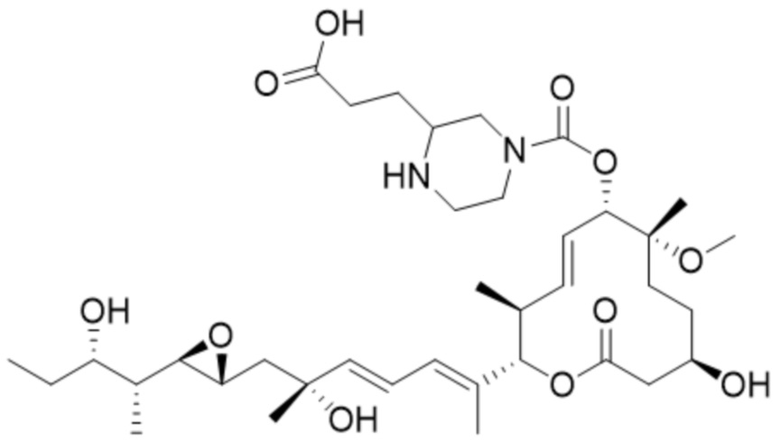
[1153] N-Этил-N-изопропилпропан-3-(4-((((2S,3S,6S,7R,10R, E)-10-гидрокси-2-((R,2E,4E)-6-гидрокси-7-((2R,3R)-3-((2R,3S)-3-гидроксипентан-2-ил)оксиран-2-ил)-6-метилгепта-2,4-диен-2-ил)-7-метокси-3,7-диметил-12-оксооксациклододец-4-ен-6-ил)окси)карбонил)пиперазин-2-ил)пропановая кислота (23,5 мг, 0,031 ммоль, выход 68,2%). LC/MS (ESI, масса/заряд), 709,5 [M+H]+.
[1154] 1H-ЯМР (400 МГц, DMSO-d6): δ ppm 0,71-0,77 (m, 9 H), 1,03 (s, 5 H), 1,14-1,20 (m, 6 H), 1,23-1,33 (m, 5 H), 1,36-1,48 (m, 5 H), 1,63 (s, 3 H), 1,67-1,75 (m, 1 H), 2,13-2,24 (m, 4 H), 2,58-2,64 (m, 1 H), 2,68-2,81 (m, 2 H), 3,20-3,20 (m, 3 H), 3,61-3,77 (m, 4 H), 4,28-4,39 (m, 1 H), 4,44-4,53 (m, 1 H), 4,79-4,88 (m, 2 H), 5,28-5,43 (m, 1 H), 5,52-5,66 (m, 1 H), 5,73-5,85 (m, 1 H), 5,94-6,04 (m, 1 H), 6,27-6,41 (m, 1 H), 6,43-6,53 (m, 2 H), 8,19-8,29 (m, 1 H).
ADL12-D22.
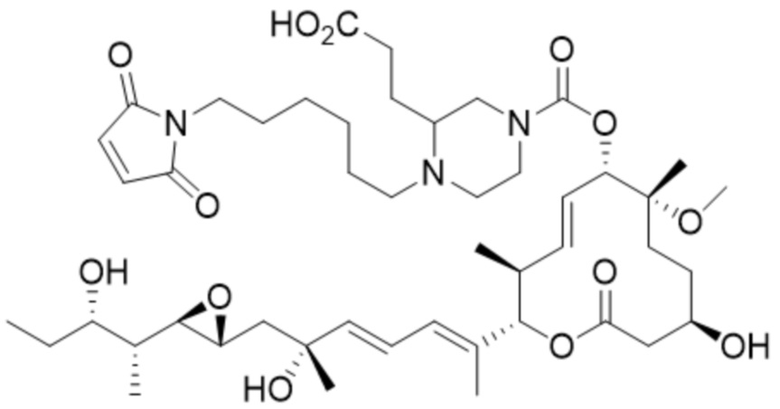
[1155] Общую процедуру, указанную в разделе 1.6.1, использовали для синтеза ADL12-D22 (3,6 мг, 4,05 мкмоль, выход 34,4%). LC/MS (ESI, масса/заряд), 888,7 [M+H]+.
[1156] 1H-ЯМР (400 МГц, MeOH-d4): δ ppm 0,77-0,89 (m, 9 H), 1,08-1,31 (m, 13 H), 1,35-1,60 (m, 12 H), 1,69 (s, 3 H), 1,73-1,83 (m, 1 H), 1,85-1,97 (m, 1 H), 2,15-2,27 (m, 1 H), 2,27-2,83 (m, 11 H), 2,84-2,98 (m, 1 H), 3,39 (s, 7 H), 3,67-3,77 (m, 1 H), 4,89-5,01 (m, 2 H), 5,40-5,53 (m, 1 H), 5,59-5,69 (m, 1 H), 5,72-5,83 (m, 1 H), 5,99-6,11 (m, 1 H), 6,37-6,49 (m, 1 H), 6,69 (s, 2 H).
ADL1-D22.
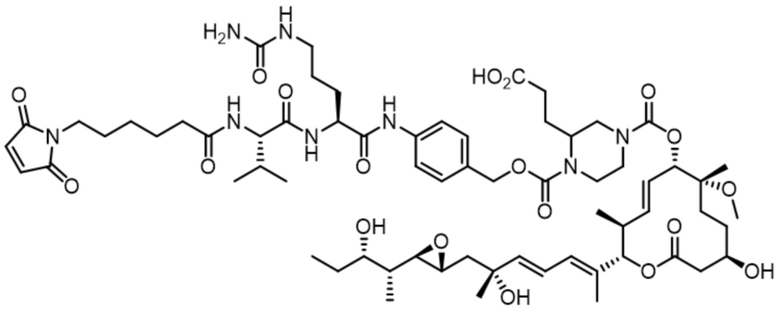
[1157] Общую процедуру 1, указанную в разделе 1.2.1, использовали для синтеза ADL1-D22 (4,7 мг, 3,59 мкмоль, выход 38,6%) в виде белого лиофилизированного твердого вещества. LC/MS (ESI, масса/заряд), 1307,6 [M+H]+.
[1158] 1H ЯМР (400 МГц, DMSO-d6): δ ppm 0,68-0,79 (m, 16 H), 1,03 (s, 3 H), 1,16 (s, 5 H), 1,23-1,44 (m, 13 H), 1,48-1,55 (m, 1 H), 1,62 (s, 4 H), 1,68-1,74 (m, 1 H), 1,86-1,93 (m, 1 H), 2,02 (s, 4 H), 2,24-2,37 (m, 3 H), 2,46-2,51 (m, 2 H), 2,66-2,73 (m, 1 H), 2,79-2,99 (m, 4 H), 3,15 (s, 3 H), 3,21-3,22 (m, 2 H), 3,30 (s, 4 H), 3,61-3,67 (m, 1 H), 3,73-3,88 (m, 3 H), 4,01-4,08 (m, 1 H), 4,09-4,16 (m, 1 H), 4,29-4,38 (m, 2 H), 4,43-4,51 (m, 1 H), 4,73-4,78 (m, 1 H), 4,79-4,88 (m, 2 H), 4,91-4,98 (m, 2 H), 5,29-5,43 (m, 3 H), 5,54-5,67 (m, 1 H), 5,74-5,83 (m, 1 H), 5,95-6,07 (m, 1 H), 6,28-6,40 (m, 1 H), 6,54-6,62 (m, 1 H), 6,93 (s, 2 H), 7,17-7,26 (m, 2 H), 7,44-7,57 (m, 2 H), 7,66-7,76 (m, 1 H), 7,95-8,03 (m, 1 H), 8,42-8,49 (m, 1 H), 9,89-9,96 (m, 1 H).
ADL1-D23.
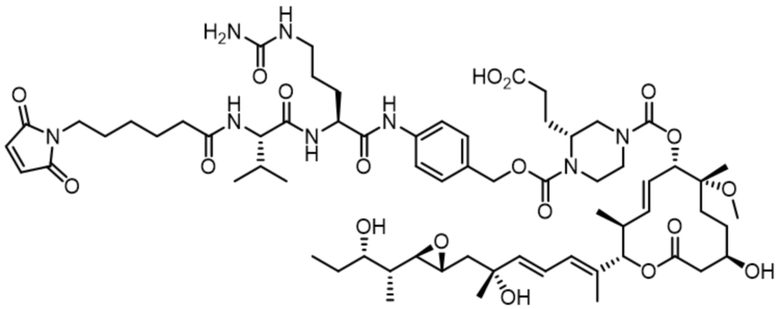
[1159] 4-((S)-2-((S)-2-(6-(2,5-Диоксо-2,5-дигидро-1H-пиррол-1-ил)гексанамидо)-3-метилбутанамидо)-5-уреидопентанамидо)бензил(4-нитрофенил)карбонат (16,76 мг, ,023 ммоль) и 3-((R)-4-((((2S,3S,6S,7R,10R, E)-10-гидрокси-2-((R,2E,4E)-6-гидрокси-7-((2R,3R)-3-((2R,3S)-3-гидроксипентан-2-ил)оксиран-2-ил)-6-метилгепта-2,4-диен-2-ил)-7-метокси-3,7-диметил-12-оксооксациклододец-4-ен-6-ил)окси)карбонил)пиперазин-2-ил)пропановую кислоту (16,1 мг, 0,023 ммоль) растворяли в DMF (229 мкл, 2,953 ммоль) и добавляли основание Хунига (11,90 мкл, 0,068 ммоль). Реакционную смесь перемешивали в течение ночи при к. т. Затем растворитель выпаривали и подвергали очистке с помощью HPLC с обращенной фазой с получением 3-((R)-1-(((4-((S)-2-((S)-2-(6-(2,5-диоксо-2,5-дигидро-1H-пиррол-1-ил)гексанамидо)-3-метилбутанамидо)-5-уреидопентанамидо)бензил)окси)карбонил)-4-((((2S,3S,6S,7R,10R, E)-10-гидрокси-2-((R,2E,4E)-6-гидрокси-7-((2R,3R)-3-((2R,3S)-3-гидроксипентан-2-ил)оксиран-2-ил)-6-метилгепта-2,4-диен-2-ил)-7-метокси-3,7-диметил-12-оксооксациклододец-4-ен-6-ил)окси)карбонил)пиперазин-2-ил)пропановой кислоты (3,9 мг, 2,98 мкмоль, выход 13,13%). LC/MS (ESI, масса/заряд), 1308,6 [M+H]+.
ADL1-D24 (S)
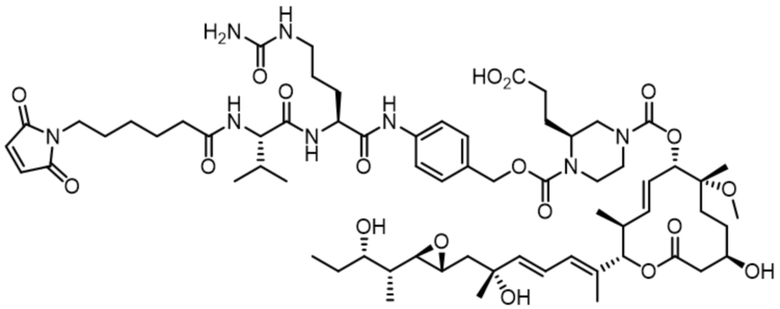
[1160] 3-((S)-4-((((2S,3S,6S,7R,10R, E)-10-Гидрокси-2-((R,2E,4E)-6-гидрокси-7-((2R,3R)-3-((2R,3S)-3-гидроксипентан-2-ил)оксиран-2-ил)-6-метилгепта-2,4-диен-2-ил)-7-метокси-3,7-диметил-12-оксооксациклододец-4-ен-6-ил)окси)карбонил)пиперазин-2-ил)пропановую кислоту (10 мг, 0,014 ммоль), N, N-диметилформамид (141 мкл, 0,014 ммоль), основание Хунига (5 мкл, 0,028 ммоль), 4-((S)-2-((S)-2-(6-(2,5-диоксо-2,5-дигидро-1H-пиррол-1-ил)гексанамидо)-3-метилбутанамидо)-5-уреидопентанамидо)бензил(4-нитрофенил)карбонат (20,8 мг, 0,028 ммоль) объединяли и перемешивали в течение 2 часов. Хроматографировали (MeOH/CH2Cl2) с получением 3-((S)-1-(((4-((S)-2-((S)-2-(6-(2,5-диоксо-2,5-дигидро-1H-пиррол-1-ил)гексанамидо)-3-метилбутанамидо)-5-уреидопентанамидо)бензил)окси)карбонил)-4-((((2S,3S,6S,7R,10R, E)-10-гидрокси-2-((R,2E,4E)-6-гидрокси-7-((2R,3R)-3-((2R,3S)-3-гидроксипентан-2-ил)оксиран-2-ил)-6-метилгепта-2,4-диен-2-ил)-7-метокси-3,7-диметил-12-оксооксациклододец-4-ен-6-ил)окси)карбонил)пиперазин-2-ил)пропановой кислоты (5 мг, 3,82 мкмоль, выход 27,1%). LC/MS (ESI, масса/заряд), 1308,4 [M+H]+.
ПРИМЕР 2
[1162] Проводили профилирование иллюстративных полезных нагрузок модуляторов сплайсосомы, применяемых в получении ADC. Полезные нагрузки оценивали в отношении связывания с комплексом SF3b, in vitro активности в отношении сплайсинга и способности ингибировать рост клетки.
2.1 Связывание с SF3B1/сцинтилляционный анализ сближения (SPA)
[1163] Сцинтилляционный анализ сближения проводили для измерения аффинности связывания соединений ("полезных нагрузок") с комплексом SF3b. Иммобилизацию порции антитела к SF3B1 (MBL) на покрытые антителами к Ig мыши сцинтилляционные гранулы из PVT для SPA-анализа (PerkinElmer) проводили следующим образом: для каждых 2,5 мг ядерных экстрактов смешивали 5 мкг антитела к SF3B1 и 1,5 мг гранул в 150 мкл PBS. Смесь антитела-гранулы инкубировали в течение 30 мин. при к. т. и центрифугировали при 18000g в течение 5 мин. Использовали 150 мкл PBS для ресуспендирования каждых 1,5 мг смеси антитела-гранулы. Гранулы суспендировали и добавляли к полученным ядерным экстрактам. Взвесь инкубировали в течение 2 часов при 4°C с осторожным перемешиванием. Затем гранулы собирали посредством центрифугирования при 18000g в течение 5 мин. и промывали дважды с использованием PBS+0,1% Triton X-100. После конечной стадии центрифугирования каждые 1,5 мг гранул суспендировали с использованием 150 мкл PBS. Комплексы SF3b тестировали в отношении связывания с зондом на основе [3H]-меченого пладиенолида ([3H]-PB), синтезированного так, как это описано ранее (Kotake et al. (2007) Nat Chem Biol. 3(9):570-5). 100 мкл реакционных смесей для связывания получали с использованием 50 мкл взвеси гранул и путем добавления различных концентраций PB или PB-OH, и после 30 мин. предварительной инкубации добавляли 2,5 нМ [3H]-PB. Смесь инкубировали в течение 30 мин. и сигналы люминесценции считывали с применением планшетного счетчика MicroBeta2 (PerkinElmer). Для аппроксимации данных к кривой нелинейной регрессии применяли Prism 7 (Graphpad).
[1164] Аналогичные профили связывания выявляли в случае всех тестируемых полезных нагрузок (фиг. 1). В целом специфическое связывание находилось в нижнем наномолярном диапазоне, указывая на то, что все тестируемые полезные нагрузки являются средствами с высокой активностью связывания с комплексом SF3b и перспективными соединениями-кандидатами для использования в составе ADC.
2.2 In vitro сплайсинг (IVS)
[1165] Для оценки активности нагрузки в безклеточной системе проводили анализ in vitro сплайсинга. Полезные нагрузки инкубировали c ядерными экстрактами и конструкцией на основе pre-mRNA в качестве субстрата и минигенов.
[1166] Получение ядерного экстракта из HeLa: осадки, содержащие клетки HeLa S3, ресуспендировали в гипотоническом буфере (10 мМ HEPES, pH 7,9, 1,5 мМ MgCl2, 10 мМ KCl, 0,2 мМ PMSF и 0,5 мМ DTT) и суспензию доводили до всего 5 объемов осажденных клеток (PCV). После центрифугирования супернатант отбрасывали и клетки доводили до 3 PCV с помощью гипотонического буфера и инкубировали на льду в течение 10 минут. Клетки лизировали с использованием гомогенизатора Даунса, а затем центрифугировали. Супернатант отбрасывали и осадок ресуспендировали с помощью ½ объема осажденных ядер (PNV) буфера с низким содержанием солей (20 мМ HEPES, pH 7,9, 1,5 мМ MgCl2, 20 мМ KCl, 0,2 мМ EDTA, 25% глицерина, 0,2 мМ PMSF, 0,5 мМ DTT), затем ½ PNV буфера с высоким содержанием солей (такой же, как буфер с низким содержанием солей, за исключением того, что использовали 1,4 M KCl). Ядра осторожно перемешивали в течение 30 мин. перед центрифугированием. Затем супернатант (ядерный экстракт) диализировали в буфер для хранения (20 мМ HEPES, pH 7,9, 100 мМ KCl, 0,2 мМ EDTA, 20% глицерина, 0,2 мМ PMSF, 0,5 мМ DTT). Концентрацию белка определяли с применением спектрофотометра NanoDrop 8000 UV-Vis (ThermoFisher Scientific).
[1167] IVS: все последовательности, полученные из Ad2 (Pellizzoni et al. (1998) Cell 95(5):615-24), клонировали в вектор pcDNA3.1(+) (Promega) с использованием сайтов рестрикции на 5'-конце для EcoRI и 3'-конце для XbaI. Плазмиды линеаризовали с использованием XbaI и применяли в качестве ДНК-матриц в реакциях транскрипции in vitro. Плазмиду без интрона Ftz∆i (Luo and Reed (1999) 96(26):14937-42) линеаризовали с использованием EcoRI. Все РНК транскрибировали in vitro и затем очищали с применением наборов MEGAScript T7 (Invitrogen) и MegaClear (Invitrogen) соответственно. Для реакций сплайсинга с использованием вариантов pre-mRNA Ad2 готовили 1 мкл реакционной смеси с использованием 8 мкг ядерных экстрактов, полученных из клеток HeLa S3, 2 нг pre-mRNA, 0,2 нг FTZ∆i и варьируемых концентраций иллюстративных соединений или DMSO. После 15-мин. предварительной инкубации при 30°C добавляли 1 мкл буфера для активации сплайсинга (0,5 мМ ATP, 20 мМ креатинфосфата, 1,6 мМ MgCl2) и реакционные смеси инкубировали в течение 90 мин. при 30°C. Затем реакционные смеси гасили с использованием 13 мкл DMSO, и по 25 нл использовали для RT-qPCR. Реакции RT-qPCR готовили с применением 1-стадийного набора TaqMan RNA-to-CT (Life Technologies), РНК из реакций сплайсинга, наборов праймеры-зонд для mRNA Ad2 (прямой: ACTCTCTTCCGCATCGCTGT; обратный: CCGACGGGTTTCCGATCCAA; зонд: CTGTTGGGCTCGCGGTTG) и Ftz (прямой: TGGCATCAGATTGCAAAGAC; обратный: ACGCCGGGTGATGTATCTAT; зонд: CGAAACGCACCCGTCAGACG). Для аппроксимации данных по образованного сплайсированного продукта к кривой нелинейной регрессии применяли Prism 7 (Graphpad) и нормализовали относительно контрольного образца (DMSO). С учетом того, что все тестируемые полезные нагрузки специфически связываются с комплексом SF3b и демонстрируют аналогичные профили связывания (фиг. 1), выдвинули гипотезу о том что все также должны модулировать сплайсинг в сопоставимой степени. Все нагрузки в значительной степени модулировали сплайсинг pre-mRNA Ad2.2 (фиг. 2). В присутствии нагрузки наблюдали уменьшение количества сплайсированного продукта.
2.3 Жизнеспособность клеток
[1168] Линию HCC1954 (Американская коллекция типовых культур (ATCC)) из клеток протоковой карциномы молочной железы высевали при 2000 клеток/лунка в плоскодонные 96-луночные планшеты для культур тканей (Corning) при общем объеме 90 мкл среды для культур тканей с 10% фетальной бычьей сыворотки (ThermoFisher Scientific). Клетки обрабатывали с использованием 3-кратного последовательного разведения соединения от 200 нМ до 0,03 нМ. Каждую концентрацию тестировали в трех повторностях. В момент времени обработки планшет с необработанными клетками оценивали с применением анализа жизнеспособности клеток CellTiter-Glo®2.0 Luminescent Cell Viability Assay в соответствии с рекомендациями изготовителя (Promega; № G9241). Реагент CellTiter-Glo® 2.0 добавляли в среду, инкубировали и проводили анализ на ридере EnVision Multilabel Reader (PerkinElmer). Значения представлены с нулевым моментом времени (T0). Число жизнеспособных клеток через 144 часа (T144) обработки соединением также определяли с применением анализа CellTiter-Glo®2.0 Luminescent Cell Viability Assay. значение люминесценции в нулевой момент времени (T0), контроль роста (C) в DMSO и рост в присутствии тестируемого соединения (T144) использовали для расчета процентной доли роста для каждой концентрации соединения. Процент ингибирования роста рассчитывали как: [(T144-T0)/(C-T0)] x 100 - для концентраций, для которых T144>/=T0, или [(T144-T0)/T0] x 100 для концентраций, для которых T144<T0. Кривые зависимости доза-ответ строили на графике с применением Prism 7 (Graphpad) и аппроксимировали с использованием нелинейного регрессионного анализа и логарифма (ингибитор) в зависимости от ответа - переменного углового коэффициента (четыре параметра).
[1169] Дозозависимый эффект в отношении жизнеспособности клеток определяли для всех полезных нагрузок в клетках рака молочной железы HCC1954 с амплификацией HER2. Большая часть тестируемых полезных нагрузок демонстрировала значения GI50 (т. е. концентрацию соединения, которая вызывает 50% уменьшение пролиферации клеток) в одноразрядном наномолярном диапазоне за исключением плохо проникающих полезных нагрузок, таких как D25 (фиг. 3). Иллюстративные данные по проникающей способности показаны в таблице 14.
ПРИМЕР 3
[1170] Иллюстративные нагрузки, которые оценивали в примере 2, конъюгировали с иллюстративным антителом к HER2 (трастузумабом) посредством остатков цистеина на антителе. Получение и оценка иллюстративных ADC на основе HER2 описаны ниже.
3.1 Антитело
[1171] Антитело трастузумаб ("AB185") (Molina et al. (2001) Cancer Res. 61(12):4744-9) использовали для получения ADC на основе антитела к HER2 (также называемого в данном документе как SMLA).
3.2 Биоконъюгация
[1172] Антитело (трастузумаб) при 10 мг/мл в буфере PBS (pH 7,0) смешивали с 5 мM TCEP (2-4 молярные эквиваленты) (ThermoFisher Scientific; № 77720) для расщепления межцепочечных дисульфидных связей. Реакционную смесь осторожно перемешивали при 22oC в течение 3 часов. Затем добавляли пропиленгликоль (15% объем/объем) с последующим добавлением 8 молярных эквивалентов линкера-полезной нагрузки (6 мМ стоковый раствор в DMSO) и раствор тщательно перемешивали. Реакционную помещали на вращающуюся подставку в термостате при 22oC. После 2-часовой конъюгации реакционную смесь очищали для удаления неконъюгированной полезной нагрузки с использованием AKTA GE M150 (колонки для обессоливания HiTrapTM 26/10; скорость потока: 3 мл/мин.) (GE Healthcare Bio-Sciences) в DPBS (pH 7,5). Полученный конъюгат концентрировали посредством ультрафильтрации через Amicon (30 кДа, Ultra-4) (EMD Millipore) и подвергали стерильной фильтрации через 0,22-мкм PVDF одноразовый фильтр (EMD Millipore). Проводили оценку полученного прозрачного раствора посредством UV-VIS для определения концентрации антитела ([mAb]; моль/л) и концентрации конъюгированной полезной нагрузки ([LD]; моль/л) в соответствии с законом Бэра-Ламберта (A=E*c*l) и согласно следующим уравнениям:
A280 нм=EmAb280 нм * [mAb] * l+ELD280 нм * [LD] * l
A252 нм=EmAb252 нм * [mAb] * l+ELD252 нм * [LD] * l
EmAb280 нм: трастузумаб=213,380 см-1M-1
EmAb252 нм: трастузумаб=79,112 см-1M-1
ELD280 нм=800 см-1M-1
ELD252 нм=31,000 см-1M-1
Аббревиатуры: c - молярная концентрация; l - оптическая длина (Nanodrop: 0,1 см); E - молярный коэффициент светопоглощения; A - абсорбция.
3.3 Определение биофизических характеристик
[1173] Соотношение лекарственного средства и антитела (DAR), процент агрегации и процент неконъюгированной полезной нагрузки определяли для иллюстративных ADC на основе антитела к HER2 посредством жидкостной хроматографии-масс-спектрометрии (LC/MS), эксклюзионной хроматографии (SEC), обращенно-фазовой высокоэффективной жидкостной хроматографии (HPLC) соответственно. В целом, конъюгаты содержат менее 2% лекарственного средства в свободной форме и содержат менее 10% агрегатов.
3.3.1 Анализ LC/MS - DAR
[1174] Анализ LC/MS проводили с использованием системы Agilent 1290 UPLC, соединенной с времяпролетным масс-спектрометром Agilent G6224A Accurate Mass TOF. Конъюгат подвергали дегликозилированию с использованием PNGase F (New England Biolabs; № P0705L) в течение 4 часов при 37oC, денатурировали с использованием 8 M Gdn-HCl (Sigma; № G9284), а в завершении разделяли на домены легкой и тяжелой цепей с применением DTT (конечная концентрация 5 мМ) (Promega; № V3151). Полученный образец загружали в колонку Agilent PLRP-S (2,1×150 мм, 8 мкм) и элюировали в градиенте от 25% B до 50% B в течение 28 мин. при комнатной температуре (RT). Подвижная фаза A представляла собой воду с 0,05% TFA, подвижная фаза B представляла собой ацетонитрил с 0,04% TFA, при этом скорость потока составляла 1 мл/мин. DAR рассчитывали по масс-спектру после деконволюции с помощью взвешенных средних значений интенсивности пиков неконъюгированного и конъюгированного лекарственного средства для легкой цепи (L0 или L1) и тяжелой цепи (H0, H1, H2 и H3). Общее DAR для интактного конъюгата рассчитывали с применением уравнения: (DARLC* 2) + (DARHC*2) = общее DAR. Значения DAR для иллюстративных ADC на основе антитела к HER2 приведены в таблицах 10-14.
3.3.2 Анализ SEC - агрегация
[1175] Эксклюзионную хроматографию проводили с использованием колонки TOSON-G3000SWXL (№ 008541) в 0,2 M калия фосфате (pH 7) с 0,25 мМ калия хлоридом и 15% (объем/объем) IPA при скорости потока 0,75 мл/мин. Площадь пиков поглощения при 280 нм определяли для высокомолекулярных и мономерных компонентов конъюгата по интеграции площади под кривой. Процент мономеров для иллюстративных ADC на основе антитела к HER2 приведен в таблице 10.
3.3.3 Анализ HPLC - лекарственное средство в свободной форме
[1176] Конъюгат осаждали с использованием 10 объемов ацетонитрила на льду в течение 2 часов и осаждали центрифугированием. Затем супернатанты, содержащие остаточную неконъюгированную полезную нагрузку, загружали в колонку Agilent Poroshell 120 SB-C18 120A (4,6×100 мм, 2,7 мкм) и элюировали в градиенте от 45% B до 70% B в течение 10 мин. При RT. Подвижная фаза A представляла собой 100% воды, подвижная фаза B представляла собой 100% ацетонитрила, и при этом скорость потока составляла 0,6 мл/мин. с обнаружением при 252 нм. Количество остаточного свободного лекарственного средства определяли количественно посредством УФ-детекции, сравнивая с внешней стандартной кривой для неконъюгированного линкера-полезной нагрузки. Процент свободного лекарственного средства для иллюстративных ADC на основе антитела к HER2 приведен в таблице 10.
3.4 Характеристики связывания
3.4.1 Определение посредством FACS характеристик связывания с положительными по мишени клетками
[1177] Связывание неконъюгированного антитела к HER2 и ADC на основе антитела к HER2 с положительными по мишени клетками оценивали посредством проточной цитометрии с применением непрямой иммунофлуоресценции. Клетки рака молочной железы JIMT1 (DSMZ), которые эндогенно экспрессируют HER2, высевали (5×104 клеток/лунка) в 96-луночный планшет с v-образным дном (Greiner Bio-One) и инкубировали в течение 2 часов при 4°C с тестируемыми соединениями, разбавленными до различных концентраций в среде для анализа (RPMI-1640, дополненной 10% (вес/объем) эмбрионального бычьего сывороточного альбумина (Thermo Fisher Scientific)). Затем клетки промывали с использованием PBS+2% FBS (буфер для FACS) и окрашивали фикоэритрин-меченным (PE) козьим антителом к иммуноглобулину G (IgG) (Invitrogen) в течение 40 мин. при 4°C в темноте. Клетки промывали холодным буфером для FACS и фиксировали с использованием буфера FluroFix (Biolegend) в течение 30 мин. при комнатной температуре. Фиксированные клетки отмывали с использованием буфера для FACS. Фиксированные клетки анализировали по среднему геометрическому интенсивности флуоресценции PE с применением проточного цитометра LSRFortessa (BD Bioscience). Трастузумаб и T-DM1 (DM1, конъюгированное с трастузумабом) включали в качестве контролей.
[1178] Все ADC на основе антитела к HER2 демонстрировали устойчивое связывание с HER2 на клетках JIMT1. Связывание ADC было сопоставимым со связыванием трастузумаба и T-DM1 (фиг. 4). Это свидетельствует о том, что конъюгация с полезной нагрузкой не оказывает влияния на антиген-связывающую аффинность антитела.
3.5 In vitro анализ
3.5.1 Жизнеспособность клеток
[1179] ADC на основе антитела к HER2 тестировали на нескольких клеточных линиях с амплификацией HER2 в отношении их способности ингибировать рост клеток. Использовали клеточные линии HCC1954 (ATCC), 2000 клеток/лунка), N87 (ATCC, 4000 клеток/лунка), SKBR3 (ATCC, 3000 клеток/лунка) и MCF7 (ATCC, 1500 клеток/лунка). Анализ жизнеспособности клеток проводили так, как это описано в разделе 2.3.
[1180] Неожиданно, но не все ADC были активными на клетках HCC1954, несмотря на то, что они имеют сходные профили связывания (фиг. 1) и полезные нагрузки со сходными биохимическими свойствами. ADC c определенными линкерами (например, ADL10) и/или некоторыми полезными нагрузками (например, D14) были менее способны к ингибированию роста клеток, при этом ADC с чередующимися линкерами (ADL1, ADL5, ADL12) и/или полезными нагрузками (например, D1, D25, D2, D4) были более активными на клетках HCC1954 (фиг. 5A и таблицы 10, 11 и 14). Такие тенденции обычно наблюдались среди клеточных линий (HCC1954, N87 и SKBR3) и признаков (HCC1954 и SKBR3 представляют собой клеточные линии рака молочной железы с высокой экспрессией HER2; N87 представляет собой клеточную линию рака желудка с высокой экспрессией HER2) (фиг. 5B-C и таблицы 11 и 12). Более того, обычно традиционные нерасщепляемые линкеры, такие как ADL10, эффективно не доставляют полезные нагрузки модулятора сплайсинга. Однако небольшие модификации длины тех же самых линкеров делают ADC более активными, например, при сравнении AB185-ADL10-D1 и AB185-ADL12-D1 по дозозависимому эффекту в отношении жизнеспособности клеток (фиг. 5A-C).
[1181] Чтобы гарантировать, что активность ADC на основе антитела к HER2 является антиген-зависимой, проводили обработку HER2-отрицательных клеток MCF7. Ни один из тестируемых ADC не был активен в тех же концентрациях, что и подвергнутые устойчивому целенаправленному воздействию HER2-положительные клетки (фиг. 6 и таблица 13). Это свидетельствует о том, что активность ADC на основе антитела к HER2 является антиген-зависимой.
Таблица 10. Характеристики иллюстративных ADC на основе антитела к HER2
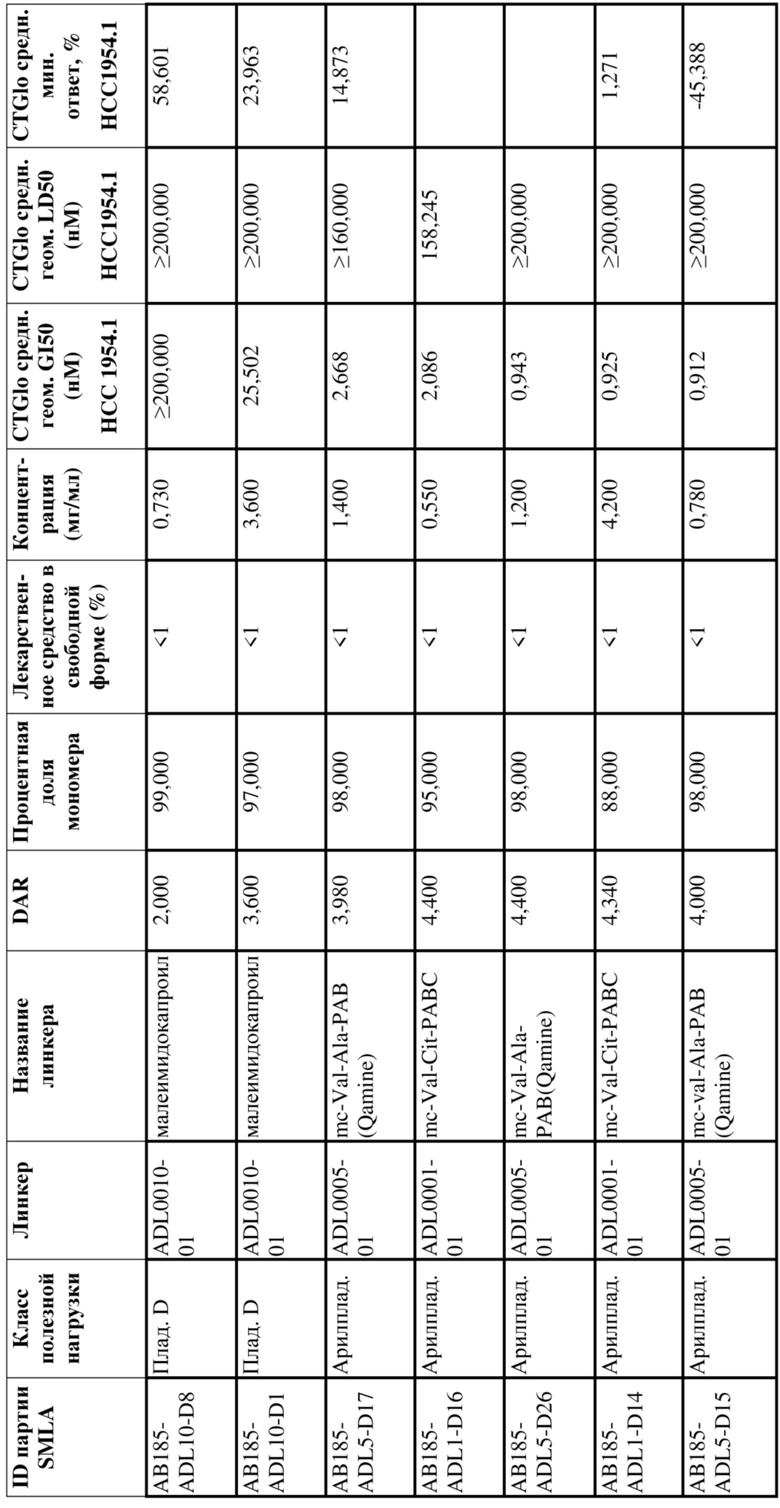 Таблица 10 (продолжение). Характеристики иллюстративных ADC на основе антитела к HER2
Таблица 10 (продолжение). Характеристики иллюстративных ADC на основе антитела к HER2
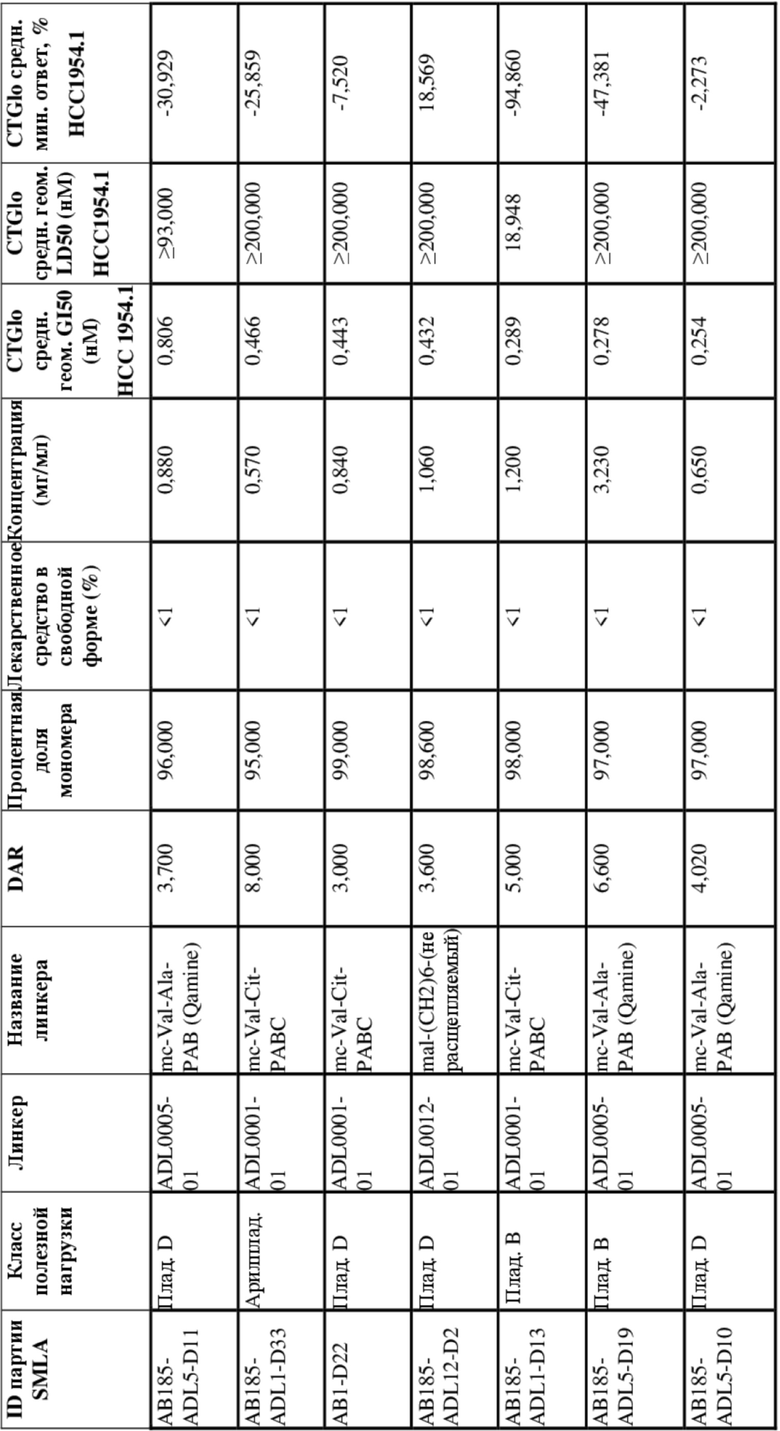
Таблица 10 (продолжение). Характеристики иллюстративных ADC на основе антитела к HER2
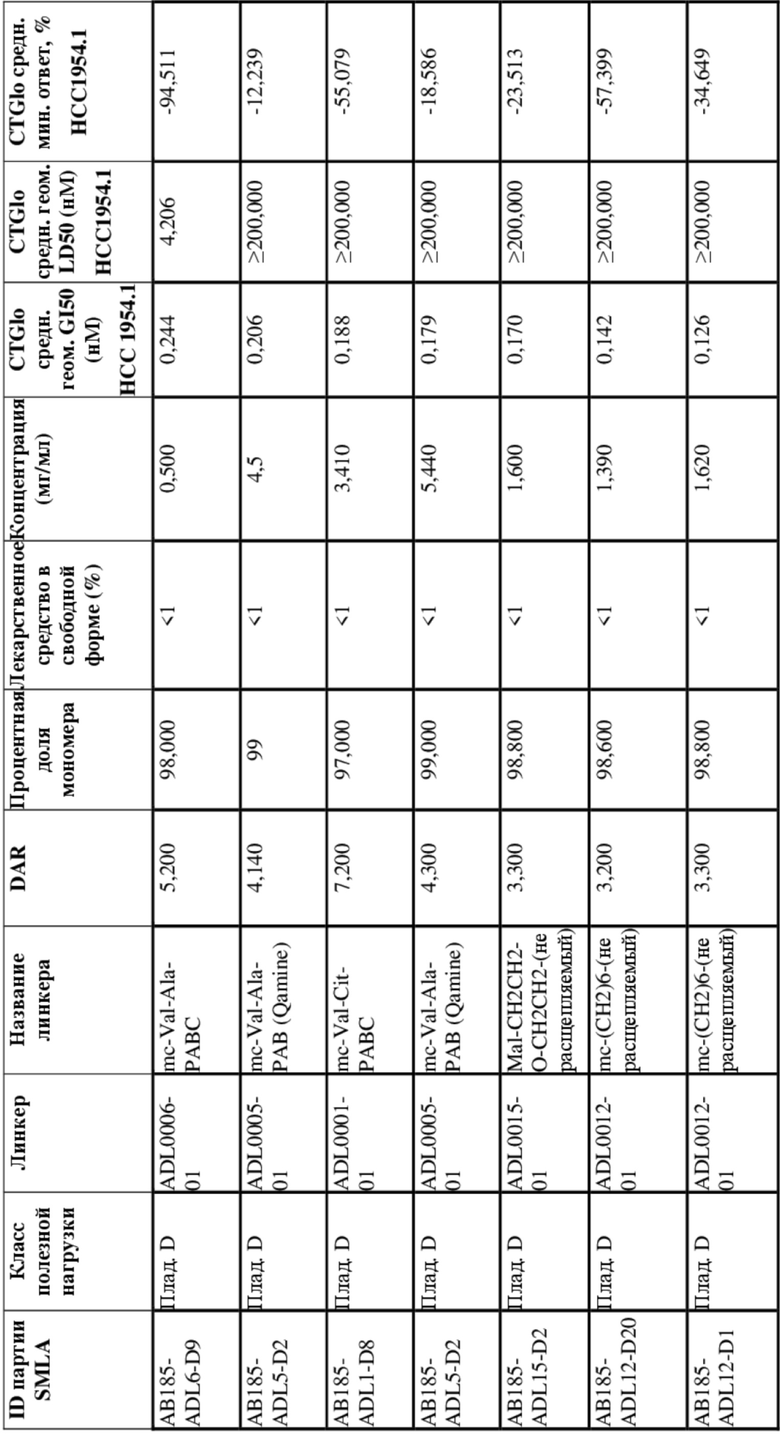
Таблица 10 (продолжение). Характеристики иллюстративных ADC на основе антитела к HER2 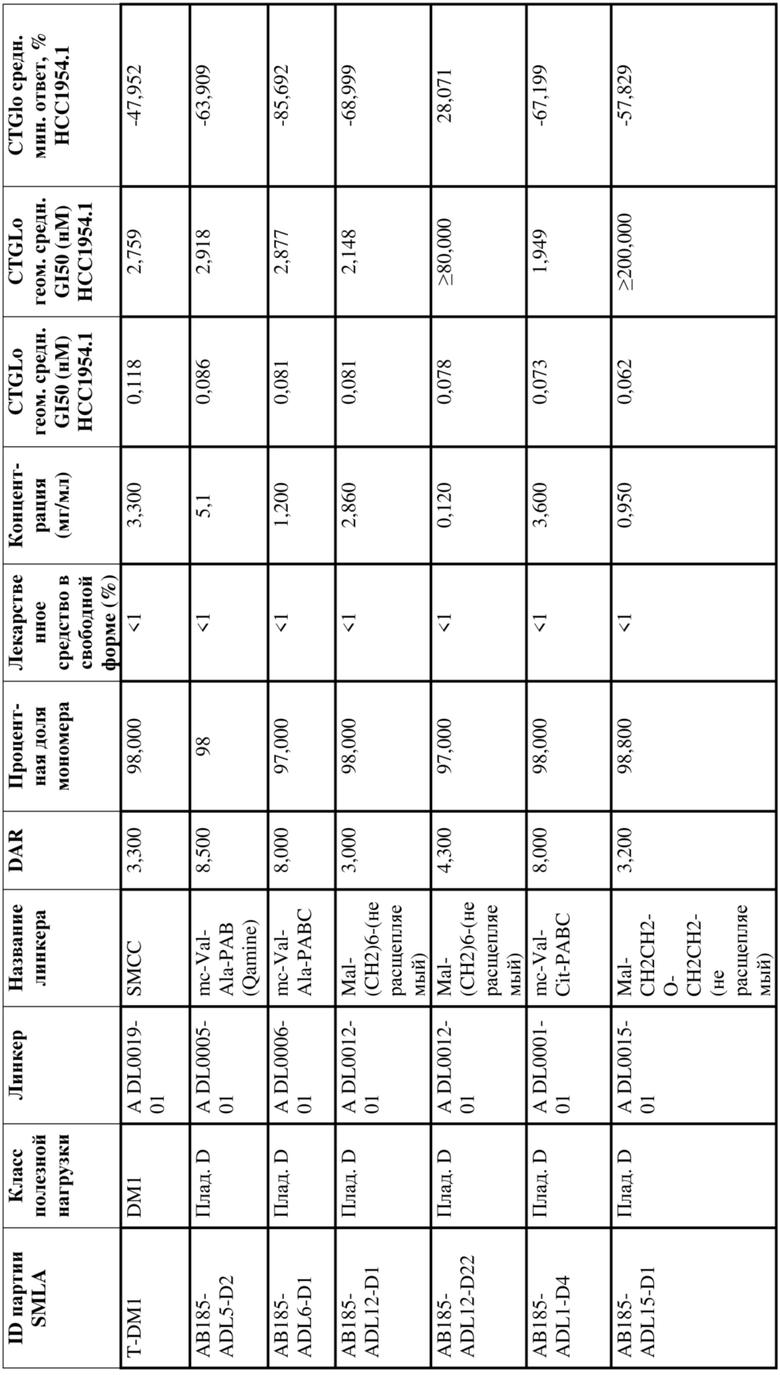
Таблица 10 (продолжение). Характеристики иллюстративных ADC на основе антитела к HER2
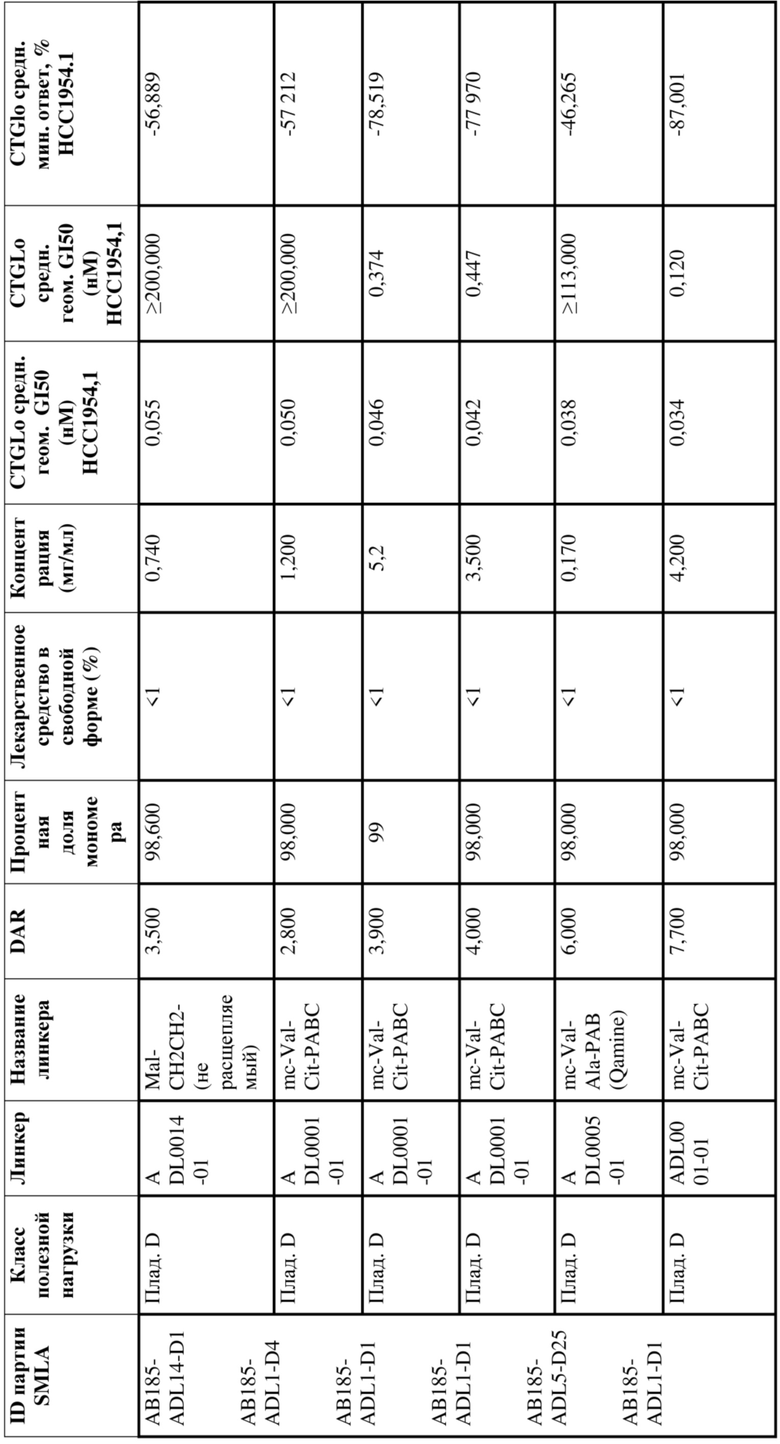
Таблица 11. Иллюстративные ADC на основе антитела к HER2 - клетки HCC1954
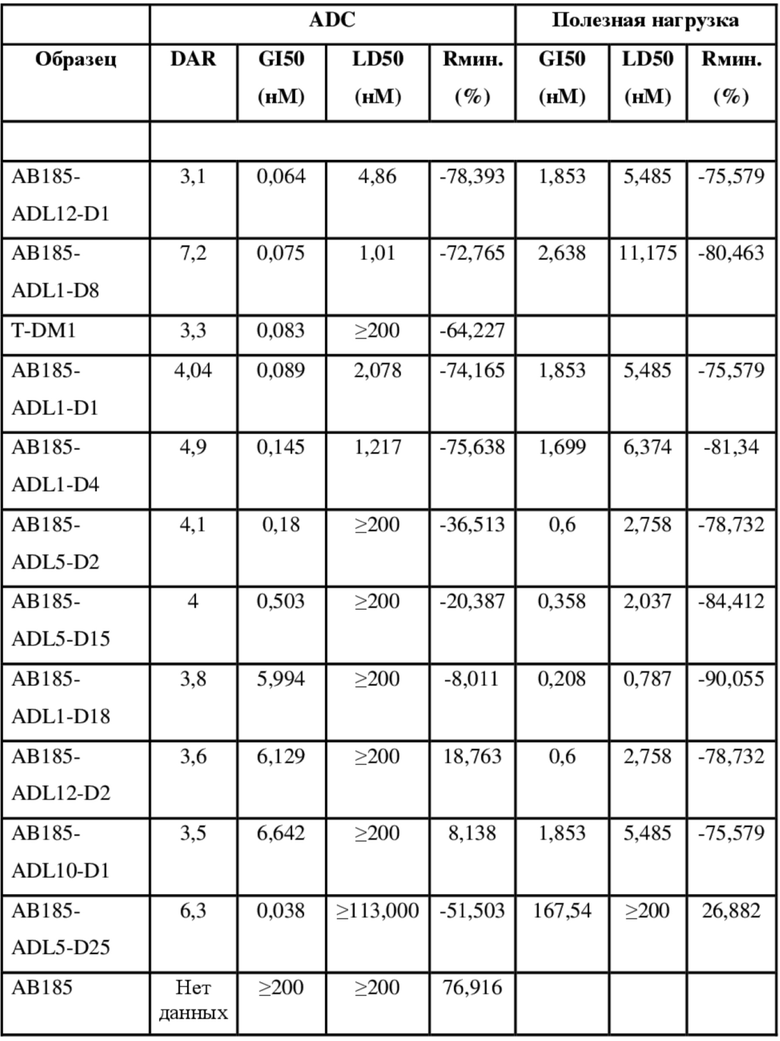
Таблица 12. Иллюстративные ADC на основе антитела к HER2 - клетки N87
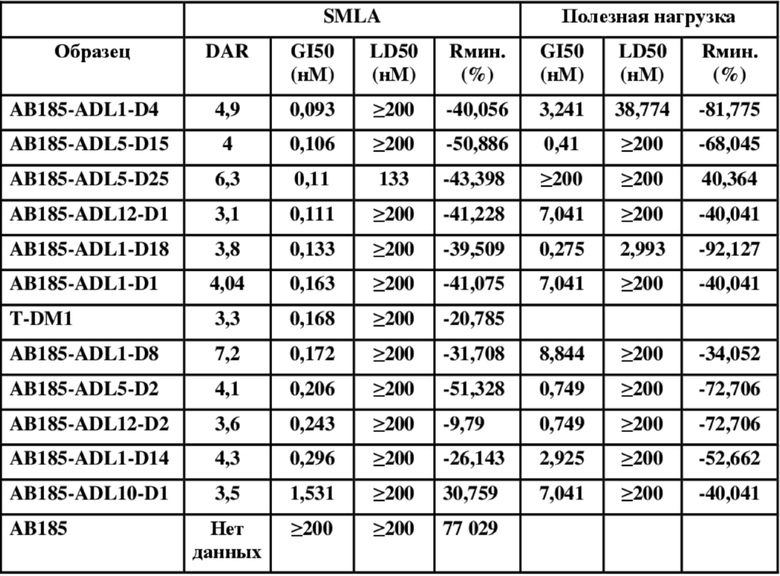
Таблица 13. Иллюстративные ADC на основе антитела к HER2 - клетки MCF7
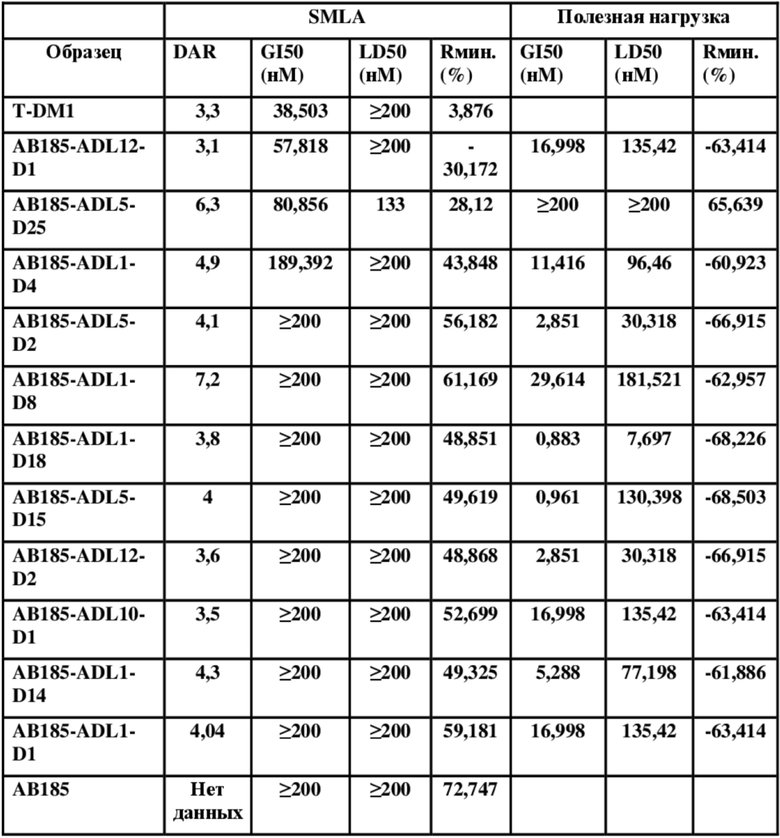
3.5.2 Проникающая способность ADC с полезной нагрузкой в отношении клеток Caco-2
[1182] Клетки Caco-2 культивировали в течение 21 дня в 24-луночных планшетах со вставками Transwell при 37°C, 95% влажности, 5% CO2. Целостность клеточного монослоя подтверждали по TEER (трансэпителиальному электрическому сопротивлению) и с помощью красителя люцифер желтый. Полезные нагрузки вносили в двух повторностях при 10 мкм по отдельности с каждой стороны клеточного монослоя. Показатели проникающей способности от апикального к базолатеральному (A-B) направлению и от базолатерального к апикальному (B-A) направлению определяли посредством отбора аликвот из обеих камер сразу после обработки (t=0) и после инкубации в течение 2 часов. Образцы представляли собой белок, осажденный с органическим растворителем, содержащим внутренний стандарт, и их анализировали посредством LC-MS/MS (SCIEX; API 5500). Соотношение значений площади пика полезной нагрузки/внутреннего стандарта в зависимости от времени в обоих направлениях использовали для получения значений проникающей способности (см/сек.). Коэффициент эффлюкса рассчитывали путем деления B-A/A-B. Контрольные соединения для низких и высоких значений проникающей способности и эффлюкса проявляли свою функцию так, как и ожидалось. Значения проникающей способности приведены в таблице 14.
3.5.3 Химическая стабильность ADC с полезной нагрузкой
[1183] Полезные нагрузки инкубировали в буфере McIlvaine (цитратно-фосфатном), pH 5,5 (Boston Bioproducts; № BB-2466) с конечной концентрацией 20 мкM (менее 0,5% DMSO из исходного раствора). Раствор полезной нагрузки и внутренний стандарт с помощью пипетки вносили в 96-луночные планшеты, проводили цикл UPLC (Waters Aquity H-класс) и анализировали по исходному хроматографическому сигналу (t=0). Колонка представляла собой колонку UPLC HSS T3 1.8 мкм, 2,1×50 мм (№ 186003538). Градиент подвижной фазы A от 95% до 10% использовали в течение 1 мин., где A представляла собой 0,1% муравьиную кислоту в воде, а подвижная фаза B представляла собой 0,1% муравьиную кислоту в ацетонитриле (скорость потока 0,9 мл/мин.). Остальную часть раствора полезной инкубировали во встряхивателе для планшетов при 37°C (Eppendorf ThermoMixer). Анализы образцов посредством UPLC повторяли в моменты времени 24, 72 и 96 часов после инкубации при 37°C. Соотношение значений площади пика для полезной нагрузки и внутреннего стандарта определяли для трех моментов времени: для момента времени 0, дня 1 и либо дня 3, либо дня 4. Момент времени 0 определяли как 100. Соотношение значений площади пика для более поздних моментов времени сравнивали с моментом времени 0. Процент оставшихся рассчитывали следующим образом: (соотношение значений площади пика в день X/соотношение значений площади пика в момент времени 0) * 100 = % оставшихся. Кривую линию строили посредством расчетов в Excel, сравнивания логарифм % оставшихся и момент времени. Значения времени полужизни рассчитывали в Excel с помощью натурального логарифма(2)/кривой, и они приведены в таблице 14.
Таблица 14. Характеристики иллюстративных ADC на основе антитела к HER2 и соответствующих полезных нагрузок
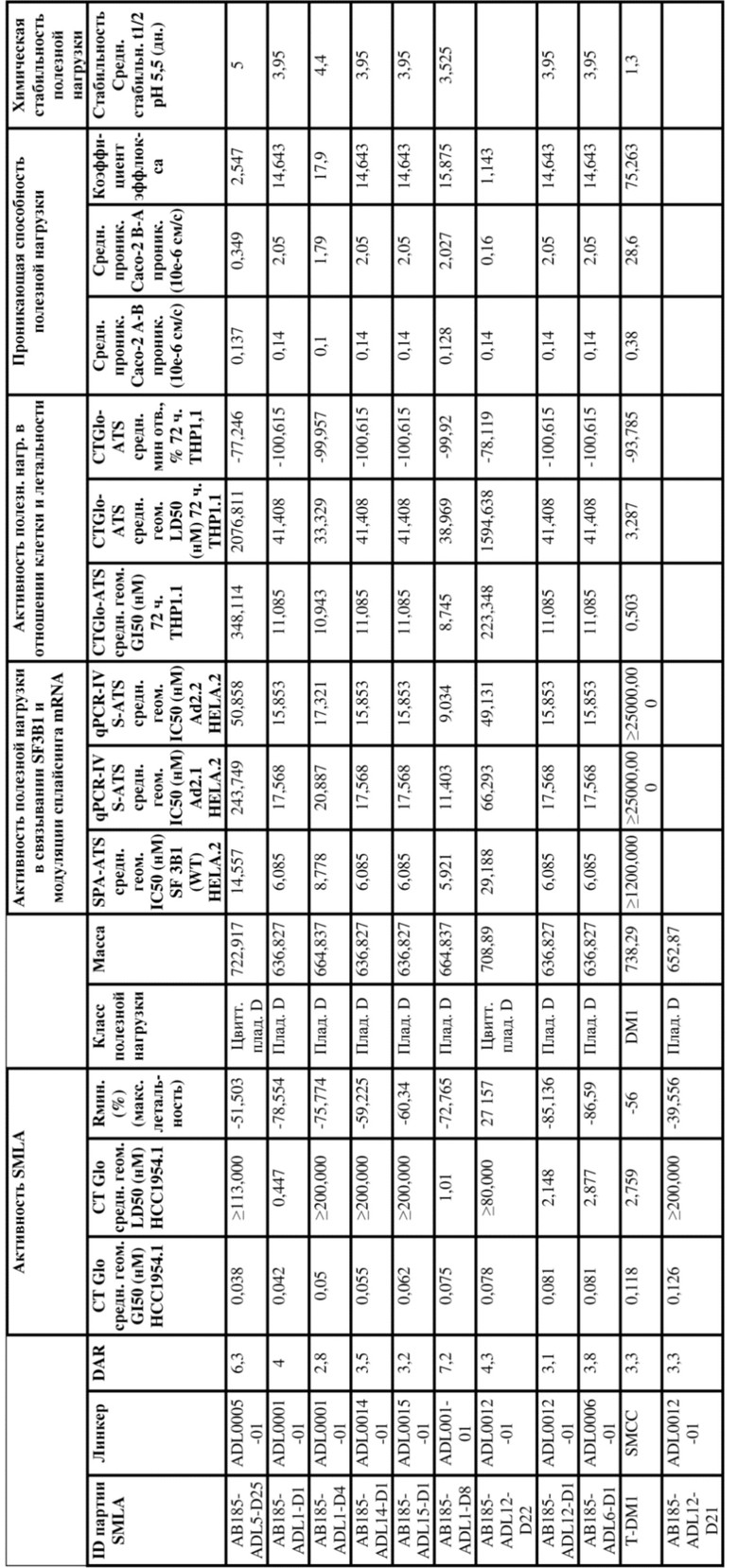
Таблица 14 (продолжение). Характеристики иллюстративных ADC на основе антитела к HER2 и соответствующих полезных нагрузок
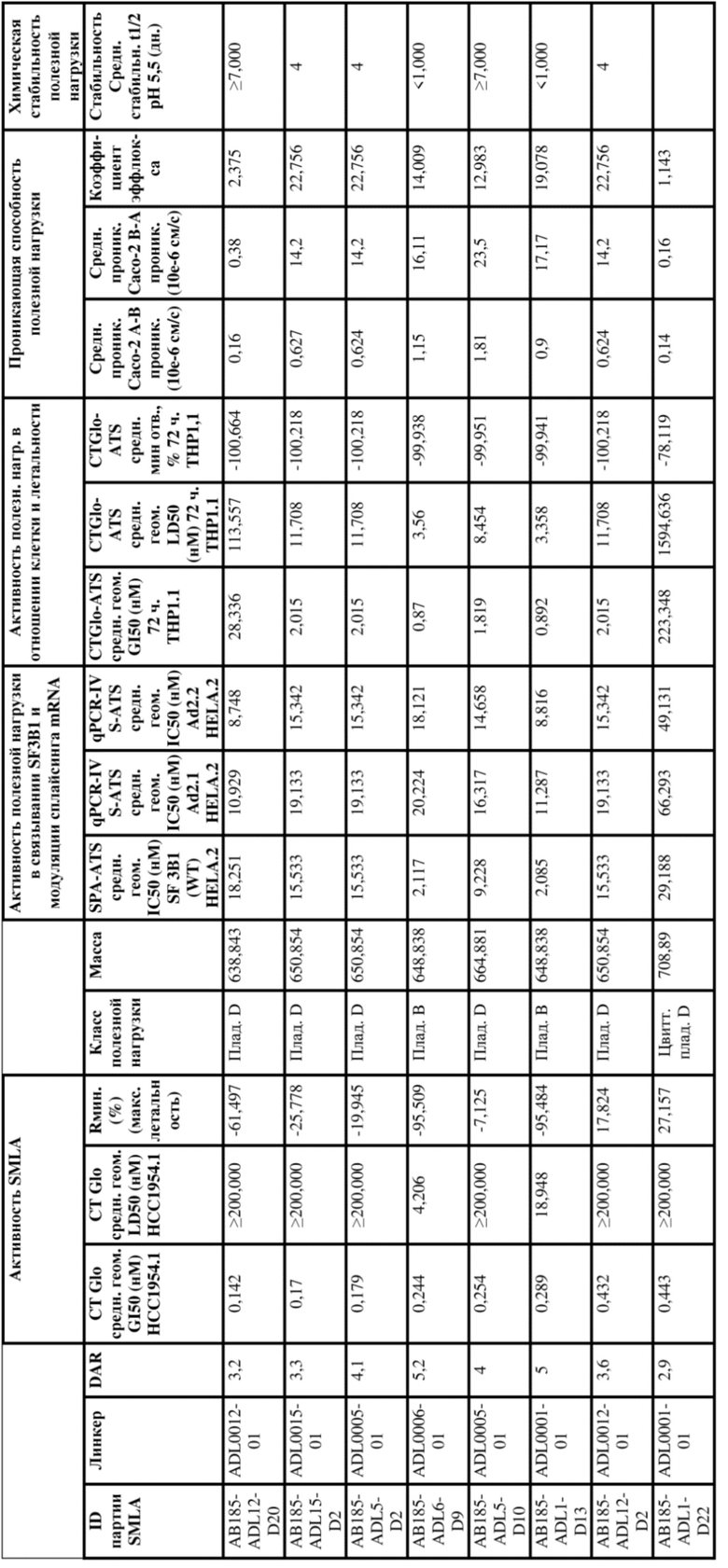
Таблица 14 (продолжение). Характеристики иллюстративных ADC на основе антитела к HER2 и соответствующих полезных нагрузок
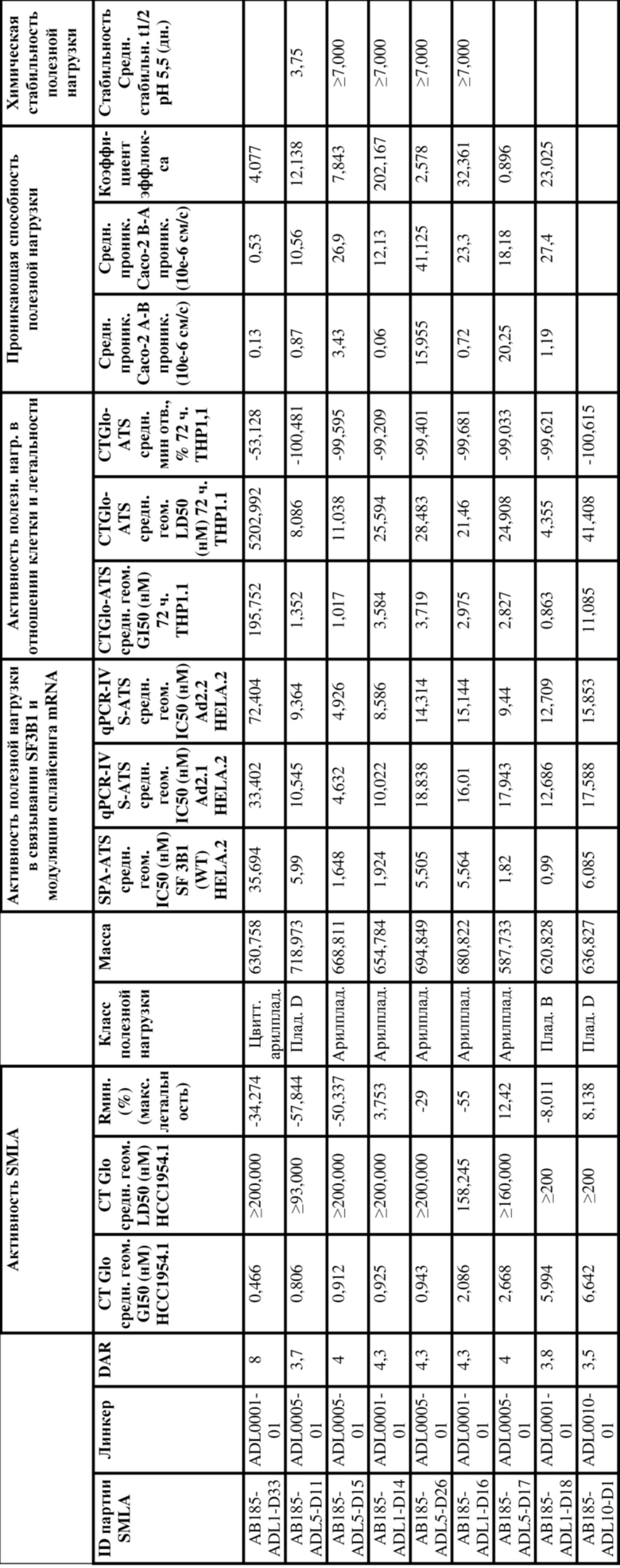
3.5.4 PD-анализ сплайсинга в клетке
[1184] Для подробного исследования механизма действия иллюстративных ADC на основе HER2 сплайсинг зрелого транскрипта SLC25A19 исследовали в клетках HCC1954, обработанных ADC в возрастающих концентрациях.
[1185] Клетки HCC1954 (ATCC) высевали в среде RPMI+10%FBS без фенола красного (ATCC) при 1×105 клеток на лунку в количестве 90 мкл на лунку. Клетки обрабатывали конъюгатами дозозависимым образом в 3-кратном разведении. Через 24 часа или 6 часов, соответственно, клетки лизировали с использованием 50 мкл буфера CL (IgePal CA-630, 5M NaCl, 1M трис-HCl 1M pH 7,4 в воде), содержащем 25 мкл/мл RNasin® (Promega) и инкубировали в течение 45 мин. при RT на качающейся мешалке. Полученную смесь (0,5 мкл) использовали для оценки модуляции сплайсинга в ПЦР-реакции с обратной транскрипцией, используя Taqman Fast Virus 1-Step MasterMix (Applied Biosystems) и следующие праймеры Taqman в соответствии с рекомендациями изготовителя: SLC25A19 (Invitrogen, Hs00222265_m1); RPLPO (Invitrogen, Hs99999902_m1); 18S (Invitrogen, Hs99999901_s1).
[1186] Контроль T-DM1 (трастузумаб со средством, разрушающим микротрубочки, в качестве полезной нагрузки) не оказывал какого-либо влияния на сплайсинг SLC25A19 (фиг. 7). В противоположность этому, ADC на основе антитела к HER2, которые демонстрируют сильную рост-ингибирующую активность в разных клеточных линиях (фиг. 5), также демонстрируют сильную модуляцию сплайсинга, что указывает на целевой механизм действия (фиг. 7). Аналогичным образом, ADC на основе антитела к HER2, которые проявляют низкую активность в анализе жизнеспособности клеток были менее активны в том, что касается модуляции сплайсинга.
3.5.5 Анализ неспецифического уничтожения клеток
[1187] Способность иллюстративных конъюгатов на основе антитела к HER2 уничтожать как положительные по мишени клетки, так и соседние отрицательные по мишени клетки измеряли в анализе неспецифического уничтожения клеток. NCI-H1568, клетки немелкоклеточного рака легкого (ATCC), конструировали так, чтобы они экспрессировали люциферазу. КДНК синтезировали с помощью GeneArt (ThermoFisher Scientific) и клонировали в вектор доставки pLVX-EF1a (ThermoFisher Scientific). Отдельно конструировали NCI-H1568 для экспрессии человеческого HER2 (клонировали в pLenti6.3/V5-DEST, ThermoFisher Scientific) с использованием системы вирусной трансфекции TransIT® в соответствии с инструкциями производителя (Mirus Bio LLC; № MIR6003). Для оценки неспецифической активности конъюгатов 2000 положительных по мишени (HER2-трансдуцированных) клеток NCI-H1568 и 2000 отрицательных по мишени (меченных люциферазой) клеток NCI-H1568 высевали вместе в прозрачные круглодонные 96-луночные планшеты (Corning) и инкубировали с конъюгатами, добавляемых в 3-кратных последовательных разведениях в трех повторностях, 30-0,005 нМ. В ходе обработки планшет с необработанными клетками анализировали с применением системы для анализа люциферазной активности OneGlo® Luciferase Assay System (Promega) и системы для оценки жизнеспособности клеток CellTiter-Glo®2.0 Luminescent Cell Viability Assay System (Promega) в соответствии с рекомендациями производителя для определения момента времени ноль (T0). После 6 дней в культуре оставшуюся популяцию клеток анализировали посредством OneGlo® Luciferase Assay System (Promega) для измерения фракции выживших отрицательных по мишени клеток. Общую жизнеспособность измеряли посредством CellTiter-Glo®2.0 Luminescent Cell Viability Assay System (T144). Кривые зависимости доза-ответ строили так, как это описано в разделе 2.3.
[1188] Дизайн анализа неспецифического уничтожения позволяет определять только отрицательные по мишени клетки, устранение которых обусловлено поглощением катаболита, высвобождаемого соседними положительными по мишени клетками. Как уже обсуждалось выше, клетки высевали в трех условиях: (1) только отрицательные по мишени клетки (меченные люциферазой); (2) только положительные по мишени клетки; и (3) совместная культура отрицательных по мишени и положительных по мишени клеток. Если анализ реакции в планшетах проводят посредством считывания с использованием реагента CellTiter-Glo®, то можно определять жизнеспособность всех популяций клеток для подтверждения антиген-зависимой активности ADC. В противоположность этому, если используют реагент OneGlo®, то лишь в отрицательных по мишени (меченные люциферазой) клетках будет возникать сигнал.
[1189] Отрицательные по мишени (меченные люциферазой) клетки были не чувствительны к обработке с использованием ADC на основе антитела к HER2, если их культивировали отдельно (фиг. 8). Однако в том случае, если отрицательные по мишени клетки культивировали с положительными по мишени клетками, обработка с использованием ADC на основе антитела к HER2 приводила к повышенному уровню уничтожения отрицательных по мишени клеткам. Эти данные свидетельствуют о том, что отрицательные по мишени клетки более эффективно уничтожались ADC на основе антитела к HER2 в случае их совместного культивирования с положительными по мишени клетками, что в данном назвали как неспецифическое уничтожение. Неспецифическое уничтожение отличается от нецелевого уничтожения, которое определено как уничтожение собственно целевых (антиген)-отрицательных клеток в отсутствие и независимо от совместного культивирования с положительными по мишени клетками.
[1190] В данном эксперименте AB185-ADL5-D2 демонстрирует повышенную способность к уничтожению популяций раковых клеток, разнородных по антигенам, по сравнению с AB185-ADL1-D1. Не вдаваясь в теорию, полагают, что данное отличие в активности может быть обусловлено добавлением одной метильной группы в D2, которая обеспечивает трехкратное повышение активности полезной нагрузки в отношении клетки и проникающую способность по сравнению с D1 (см. таблицу 14). Обработка с использованием ADC D2 популяции раковых клеток, разнородных по антигенам, является столь же эффективной, как и обработка контрольным ADC на основе AB185-MC-Val-Cit-MMAE.
3.6 In vivo анализ
[1191] In vivo оценивали иллюстративные ADC на основе антитела к HER2, которые демонстрировали выраженные модуляцию сплайсинга и ингибирование роста клеток.
3.6.1 Исследование эффективности с использованием ксенотрансплантата на основе HCC1954
[1192] Для исследования эффективности иллюстративных ADC на основе антитела к HER2 на мышиной ксенотрансплантатной модели клетки HCC1954 (ATCC), клетки протоковой карциномы молочной железы (10×106 клеток/100 мкл/1:1 RPMI:Matrigel по объему) подкожно имплантировали в правый бок самкам мышей CB17-SCID. Мышей обрабатывали посредством однократного в/в болюсного введения дозы конъюгатов (составленных в DPBS, pH 7,4) или носителя-контроля. Количества, которые вводили животным, приведены на фиг. 9. Дважды в неделю животных осматривали в отношении роста опухоли и изменения веса тела до достижения ими одной из следующих конечных точек: (1) чрезмерный объем опухоли (рассчитывали по формуле для эллипсоида): (длина x ширина2)/2) или (2) возникновение любых нарушений здоровья, таких как чрезмерная потеря веса тела. Все исследования на животных проводили в соответствии с Биомедицинским руководством по уходу и использованию лабораторных животных H3.
[1193] Обработка с использованием ADC на основе антитела к HER2 (AB185-ADL5-D2 или AB185-ADL1-D1) в однократной дозе, составляющей по меньшей мере 2 мг/кг, приводила к значительной регрессии опухоли (фиг. 9). Также наблюдали дозозависимый эффект конъюгированной полезной нагрузки, при котором ADC на основе антитела к HER2 с более высокими значениями DAR (DAR ~ 4) демонстрировали повышенную эффективность и в большей степени замедляли рост опухоли по сравнению с контрольным антителом T-DM1 в той же дозе. Кроме того, полезная нагрузка, целенаправленно воздействующая на опухоль через ADC, была более эффективной по сравнению с соответствующей неконъюгированной полезной нагрузкой.
ПРИМЕР 4
[1194] Чтобы определить, можно ли экстраполировать свойства иллюстративных ADC на основе антитела к HER2, описанных в примере 3, на другие ADC, целенаправленно воздействующие на альтернативные антигены и/или состояния, определенные полезные нагрузки конъюгировали с иллюстративным антителом к CD138 (B-B4) и иллюстративным антителом к EPH2A (1C1). CD138 экспрессируется на злокачественных плазматических клетках, например, при множественной миеломе, тогда как EPH2A чаще экспрессируется при множестве злокачественных новообразованиях. Получение и оценка иллюстративных ADC на основе антител к CD138 и EPH2A описаны ниже.
4.1 Антитела
[1195] Антитело B-B4 ("AB205") (Tassone et al. (2004) Blood 104:3688-96) и антитело 1C1 ("AB206") (Jackson et al. (2008) Cancer Res. 68(22):9367-74) использовали для получения ADC на основе антитела к CD138 и ADC на основе антитела к EPH2A соответственно.
4.2 Биоконъюгация
[1196] Антитело (B-B4 или 1C1) при 10 мг/мл в буфере PBS (pH 7,0) смешивали с 5 мM TCEP (2-4 молярные эквиваленты) (ThermoFisher Scientific; № 77720) для расщепления межцепочечных дисульфидных связей. Реакционную смесь осторожно перемешивали при 22oC в течение 3 часов. Затем добавляли пропиленгликоль (15% объем/объем) с последующим добавлением 8 молярных эквивалентов линкера-полезной нагрузки (6 мМ стоковый раствор в DMSO) и раствор тщательно перемешивали. Реакционную помещали на вращающуюся подставку в термостате при 22oC. После 2-часовой конъюгации реакционную смесь очищали для удаления неконъюгированной полезной нагрузки с использованием AKTA GE M150 (колонки для обессоливания HiTrapTM 26/10; скорость потока: 3 мл/мин.) (GE Healthcare Bio-Sciences) в DPBS (pH 7,5). Полученный конъюгат концентрировали посредством ультрафильтрации через Amicon (30 кДа, Ultra-4) (EMD Millipore) и подвергали стерильной фильтрации через 0,22-мкм PVDF одноразовый фильтр (EMD Millipore). Проводили оценку полученного прозрачного раствора посредством UV-VIS для определения концентрации антитела ([mAb]; моль/л) и концентрации конъюгированной полезной нагрузки ([LD]; моль/л) в соответствии с законом Бэра-Ламберта (A=E*c*l) и согласно следующим уравнениям:
A280 нм=EmAb280 нм * [mAb] * l+ELD280 нм * [LD] * l
A252 нм=EmAb252 нм * [mAb] * l+ELD252 нм * [LD] * l
EmAb280 нм: B-B4=224,320 см-1M-1
1C1=215,380 см-1M-1
EmAb252 нм: B-B4=83,670 см-1M-1
1C1=80,337 см-1M-1;
ELD280 нм=800 см-1M-1
ELD252 нм=31,000 см-1M-1
Аббревиатуры: c - молярная концентрация; l - оптическая длина (Nanodrop: 0,1 см); E - молярный коэффициент светопоглощения; A - абсорбция.
4.3 Определение биофизических характеристик
[1197] DAR, процент агрегации и процент неконъюгированной полезной нагрузки определяли для иллюстративных ADC на основе антитела к CD138 и на основе антитела к EPHA2 посредством жидкостной хроматографии-масс-спектрометрии (LC/MS), эксклюзионной хроматографии (SEC), обращенно-фазовой высокоэффективной жидкостной хроматографии (HPLC) соответственно. Все конъюгаты, описанные в данном документе, содержат менее 2% лекарственного средства в свободной форме и содержат менее 10% агрегатов.
4.3.1 Анализ LC/MS - DAR
[1198] Анализ LC/MS проводили так, как это описано в разделе 3.3.1. Значения DAR для иллюстративных ADC на основе антитела к CD138 и антитела к EPHA2 приведены в таблицах 15-18.
4.3.2 Анализ SEC - агрегация
[1199] Анализ SEC проводили так, как это описано в разделе 3.3.2. Процент мономеров для иллюстративных ADC на основе антитела к CD138 и антитела к EPHA2 приведен в таблицах 15-17.
4.3.3 Анализ HPLC - лекарственное средство в свободной форме
[1200] Анализ HPLC проводили так, как это описано в разделе 3.3.3. Процент лекарственного средства в свободной форме для иллюстративных ADC на основе антитела к CD138 и антитела к EPHA2 приведен в таблицах 15-17.
4.4 In vitro анализ
4.4.1 Жизнеспособность клеток
[1201] ADC на основе антитела к CD138 тестировали на линии клеток множественной миеломы MOLP8, экспрессирующей CD138. Аналогичным образом, ADC на основе антитела к EPHA2 тестировали на линии клеток рака предстательной железы PC3, экспрессирующей EPHA2. Анализ жизнеспособности клеток проводили так, как это описано в разделе 2.3.
[1202] Конъюгация полезной нагрузки с антителом к CD138 (фиг. 10 и таблица 16) и антителом к EPHA2 (фиг. 11 и таблица 18) привела к закономерностям, аналогичным тем, которые обсуждали в разделе 3.5.1 для ADC на основе антитела к HER2. В частности, ADC с определенными линкерами (например, ADL12) и/или полезными нагрузками (например, D1, D25, D4) продемонстрировали самую высокую активность в отношении антиген-экспрессирующих клеток. Соответственно, альтернативные полезные нагрузки (например, D14) были в меньшей степени способны ингибировать рост клеток посредством доставки, опосредованной антителами, несмотря на то, что они являются высокоактивными низкомолекулярными соединениями.
Таблица 15. Характеристики иллюстративных ADC на основе антитела к CD138
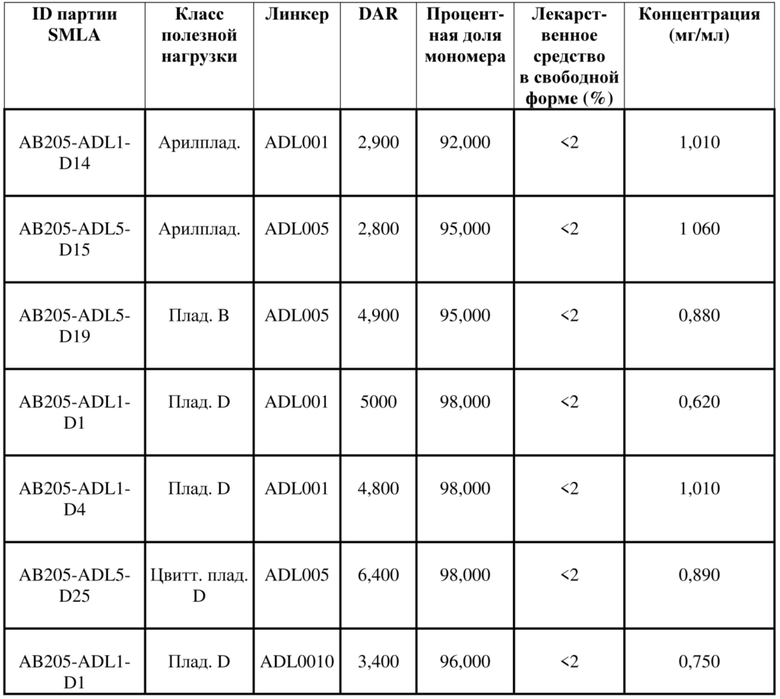
Таблица 15 (продолжение). Характеристики иллюстративных ADC на основе антитела к CD138
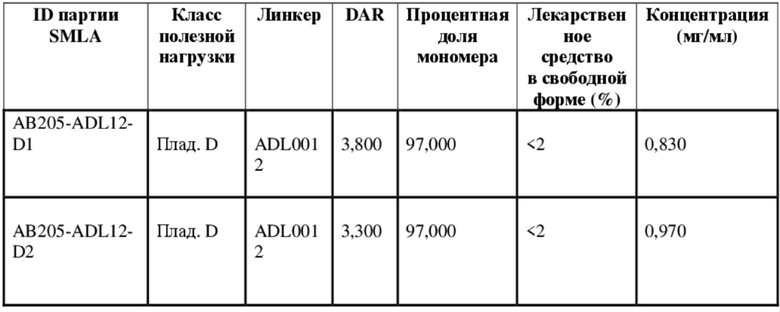
[1203]
Таблица 16. Иллюстративные ADC на основе антитела к CD138 - клетки MOLP8
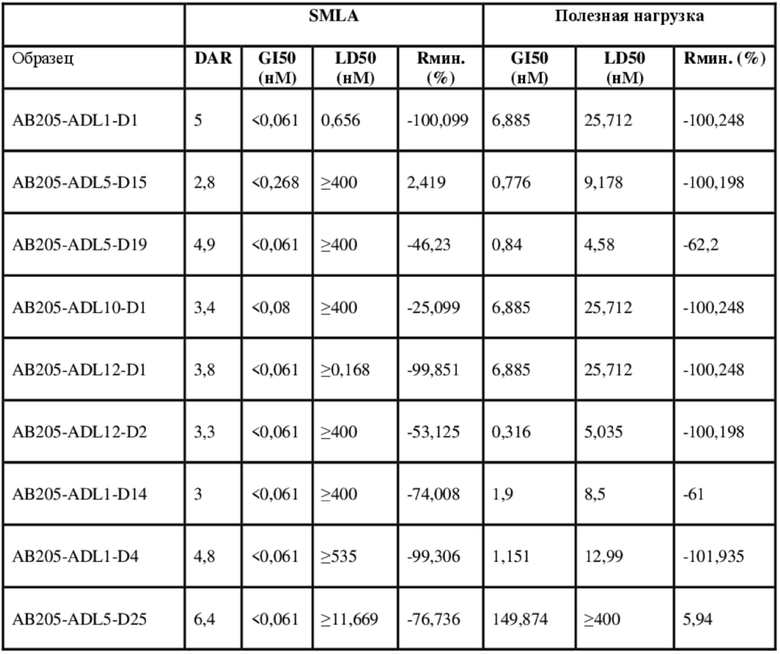 Таблица 17. Характеристики иллюстративных ADC на основе антитела к EPHA2
Таблица 17. Характеристики иллюстративных ADC на основе антитела к EPHA2
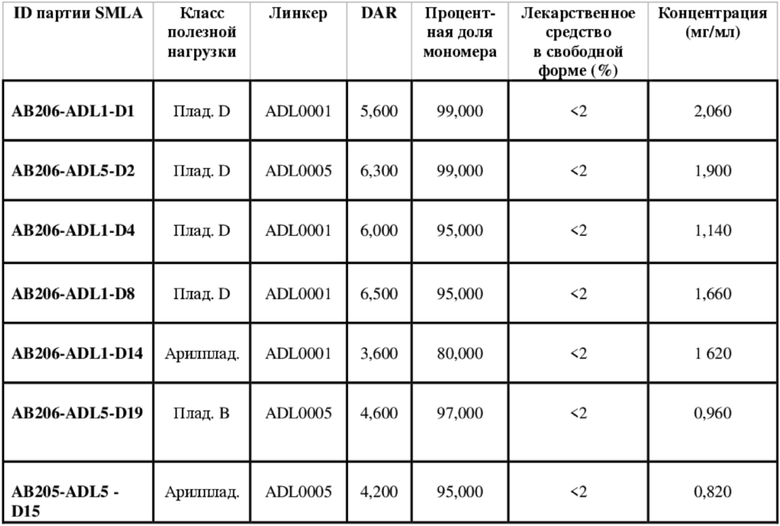
Таблица 17 (продолжение). Характеристики иллюстративных ADC на основе антитела к EPHA2
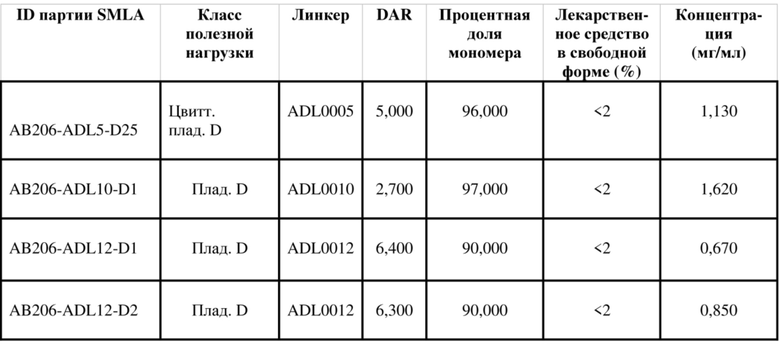
Таблица 18. Иллюстративные ADC на основе антитела к EPHA2 - клетки PC3
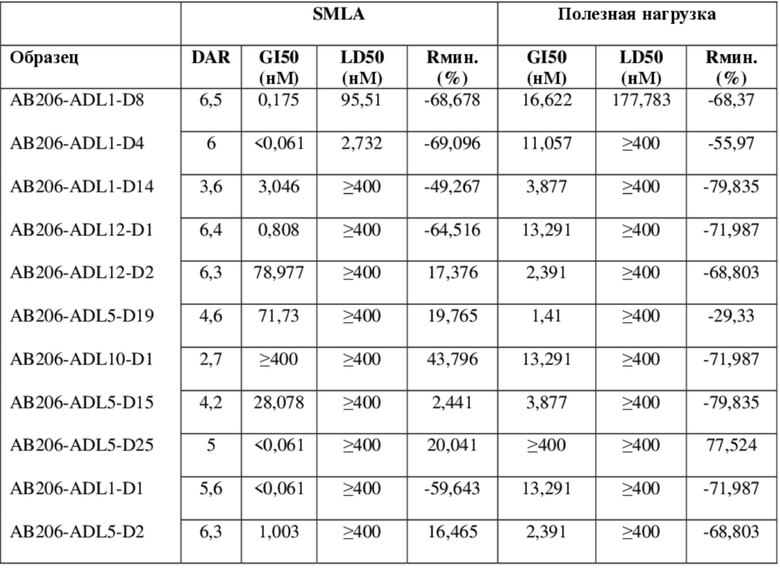
ПРИМЕР 5
[1203] In vitro и/или in vivo стабильность иллюстративных ADC на основе антитела к HER2 оценивали так, как это описано ниже.
5.1 Общее антитело и конъюгированная полезная нагрузка из AB185-ADL1-D1 в плазме крови
[1204] После обработки in vitro (раздел 5.1.1) или обработки in vivo (раздел 5.1.2) с использованием AB185-ADL1-D1 уровни общего антитела (TAb) и конъюгированной полезной нагрузки (CP) количественно определяли в плазме крови посредством методики иммунопреципитации с последующими LC/MS/MS. Подбор количеств был линейным с весовым коэффициентом 1/x2 от 0,5 до 100 мкг/мл и от 0,5 до 500 нг/мл в плазме крови мышей для TAb и CP соответственно. Образцы плазмы крови смешивали с внутренним стандартом, представляющим собой универсальное моноклональное человеческое антитело, меченное стабильным изотопом (SIuTMMAB, Sigma, Сент-Луис, Миссури), и 10 мМ PBS, pH 7,4 и инкубировали при комнатной температуре в течение одного часа. К смеси добавляли магнитные гранулы DynabeadsR MyOneTM Streptavidin T1 (ThermoFisher Scientific) и инкубировали дополнительные 30 мин. при комнатной температуре. Магнитную подставку использовали для связывания гранул, которые последовательно промывали буфером CHAPS, а затем буфером PBS. Представляющие интерес аналиты элюировали из гранул с использованием 30 мМ HCl. Отдельные аликвоты элюента использовали для количественного определения TAb или CP. В случае TAb добавляли трис-HCl, pH 8,3, затем трипсин и оставляли инкубироваться в течение ночи при 37°C. В случае CP добавляли 1M ацетат аммония, затем внутренний стандарт, представляющий собой дейтерированную полезную нагрузку, и катепсин B, и оставляли инкубироваться в течение ночи при 25°C. Образцы анализировали с помощью LC/MS/MS и количественно анализировали с использованием соотношения площадей пика аналита и внутреннего стандарту и сравнивали с соответствующей калибровочной кривой. Для расчета концентрации CP в значение концентрации TAb вносили поправку на молекулярные массы полезной нагрузки, молекулярную массу AB185-ADL1-D1 и DAR (соотношение лекарственного средства и антитела).
5.1.1 In vitro стабильность AB185-ADL1-D1 в плазме крови мыши, крысы и обезьяны
[1205] В объединенную плазму крови (Bioreclamation) мыши, крысы и обезьяны и PBS вносили AB185-ADL1-D1 (4,81 мг/мл) с достижением конечной концентрации 50 мкг/мл. Образцы инкубировали при 37°C, влажности 95%, 5% CO2 в течение 4 дней таким образом, чтобы стабилизировать показатель pH и свести к минимуму неспецифическое связывание и испарение. Через 4, 24, 48, 72 и 96 часов аликвоты доставали из термостата и помещали на хранение при -70°C до обработки. Образцы размораживали и подвергали обработке для биологического анализа с использованием способов, описанных выше (раздел 5.1) для общего антитела и конъюгированной полезной нагрузки. Момент времени 0 определяли как 100% для каждой матрицы. Соотношение значений площади пика для более поздних моментов времени сравнивали с моментом времени 0 отдельно для каждой матрицы. Процент оставшихся рассчитывали следующим образом: (соотношение значений площади пика в день X/соотношение значений площади пика в момент времени 0) * 100 = % оставшихся. Кривую линию строили посредством расчетов в Excel, сравнивания логарифм % оставшихся и момент времени. Время полужизни рассчитывали в Excel с помощью натурального логарифма(2)/кривой.
[1206] Было обнаружено, что общее антитело из AB185-ADL1-D1 стабильно в буфере и во всех видах плазмы крови, демонстрируя лишь умеренное осаждение в течение 4 дней (фиг. 12A). Уровни конъюгированной (интактной) полезной нагрузки D1 сохранялись в течение 4 дней (фиг. 12B).
5.1.2 Фармакокинетические (PK) исследования на основе алгоритма Snapshot плазмы крови мышей после введения однократной в/в дозы AB185-ADL1-D1
[1207] Мышей (CB17-SCID) обрабатывали посредством введения однократной в/в дозы AB185-ADL1-D1, составляющей 10 мг/кг или 20 мг/кг, с последующими отборами крови в момент умерщвления (пункция сердца) в пробирки с литием-гепарином (n=3 на момент времени на группу введения дозы) через 24, 48 и 72 часа после введения дозы. Кровь центрифугировали в течение 5 мин. при 5000 об./мин. при 4°C для удаления эритроцитов, а плазму крови помещали на хранение при -80°C до дальнейшего использования. Образцы размораживали и подвергали обработке для биологического анализа с использованием способов, описанных выше (раздел 5.1) для общего антитела и конъюгированной полезной нагрузки.
[1208] После однократной в/в дозы AB185-ADL1-D1 более 400 нг/мл интактной полезной нагрузки D1 оставалось конъюгированной с антителом AB185 в момент времени 72 часа после введения дозы (фиг. 13). ADC AB185-ADL1-D1 продемонстрировал улучшенную стабильность по сравнению с альтернативным ADC, несущим полезную нагрузку с аналогичным механизмом действия. ADC на основе тайланстатина А, описанный в Puthenveetil et al. (Bioconjugate Chem. (2016) 27:1880-8) является сравнительно менее стабильным и демонстрирует полное биологическое превращение полезной нагрузки к 72 часам (т. е. ацетат полностью гидролизуется).
5.2 Ускоренное исследование стабильности AB185-ADL14-D1 и AB185-ADL5-D25
[1209] Свежеприготовленные SMLA (~ 1 мг каждого в пробирках эппендорф, 4~5 мг/мл) центрифугировали и измеряли посредством УФ-поглощения (NanoDrop) при 280 нм для определения концентрации белка. Затем образцы инкубировали на водяной бане при 37°C и отбирали образцы в четырех временных точках: 0 (свежеприготовленный), день 1, день 2 и день 4. Образцы, взятые в разные моменты времени, хранили при -80°C до завершения последнего отбора образцов. После оттаивания при 22°C образцы анализировали с помощью SEC, хроматографии с гидрофобным взаимодействие (HIC) и обращенно-фазовой MS(RP-HPLC) для количественной оценки агрегации/фрагментов антител и DAR. Процент агрегации, концентрация и значения DAR (HIC и RP-HPLC) для AB185-ADL14-D1 и AB185-ADL5-D25 в четырех моментах времени показаны в таблице 19.
Таблица 19. Ускоренное исследование стабильности выбранных ADC на основе антитела к HER2
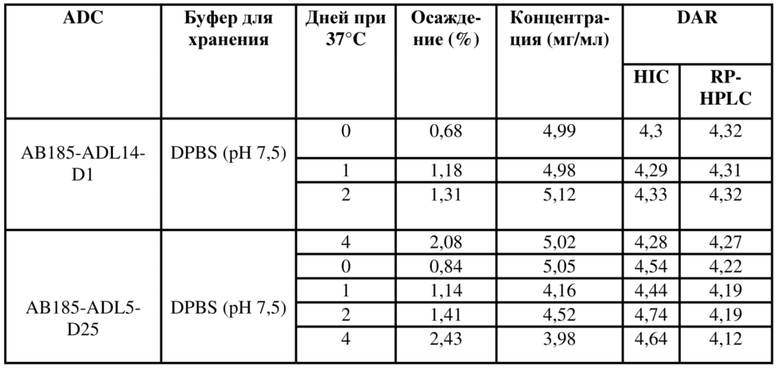
ПРИМЕР 6
[1210] Чтобы определить, могут ли клетки, обработанные ADC на основе модулятора сплайсинга (т. е иллюстративными ADC, описанными в данном документе), продуцировать неоантигены, подходящие для примирования наивных Т-клеток для перехода в эффекторные клетки (т. е эффекторные клетки, способные воздействовать на такие неоантигены), провели следующие эксперименты.
6.1 Эксперимент по секвенированию РНК и определению белкового лигандома
6.1.1 Обзор
[1211] Изменения в транскриптоме исследовали после обработки с использованием ADC. Две линии клеток со сверхэкспрессией HER2, одну сконструированную линию клеток немелкоклеточного рака легкого (NCI-H1568) и другую линию клеток рака молочной железы с амплификацией HER2 (HCC1954), обрабатывали с использованием ADC (AB185-ADL1-D1) в концентрациях, предназначенных для инициации устойчивого аберрантного сплайсинга мРНК (4 нМ и 1,3 нМ соответственно). Эксперименты по секвенированию РНК проводили в момент времени 24 часа после обработки. Данные эксперименты продемонстрировали, что множество мРНК-транскриптов демонстрируют измененные паттерны сплайсинга.
[1212] Затем, чтобы выяснить, могут ли идентифицированные транскрипты транслироваться и презентироваться в качестве неоантигенов на комплексах MHC1 и опухолевых клеток, выбрали момент времени, который позволит осуществить трансляцию мРНК-транскриптов, но который будет предшествовать обширным цитотоксическим эффектам (поскольку они могут ухудшить отбор клеточного материала для анализа). Затем линии клеток NCI-H1568 и HCC1954 обрабатывали с использованием ADC при 3 нМ в течение 48 часов, и пептидом, связанный с MHC1, анализировали посредством LC-MS/MS. Данные о пептидоме отфильтровывали по начальному размеру пептида до 8-14 аминокислотных фрагментов (определяемого как критерий предельного размера для связывания с MHC1), а затем отфильтровывали против известных белков человека. Идентифицированные пептиды были охарактеризованы как аутоантигены независимо от того, в каких условиях и в какой клеточной линии их обнаружили. Все остальные пептидные последовательности картировали на данные секвенирования РНК по 3 рамкам трансляции. С использованием строгих критериев для оценки пептидных последовательностей (включая исключение: любого пептида, идентифицированного в любом необработанном образце, любого пептида, который не был закодирован в канонической открытой рамке считывания, и любого пептида, который не кодировался частью, охватывающей участок соединения экзонов, мРНК, где участки соединения экзонов были изменены посредством обработки с использованием AB185-ADL1-D1) идентифицировали четыре неопептида, связанные с MHC1. Схематическое изображение иллюстративного эксперимента по секвенированию РНК и определению белкового лигандома см. на фиг. 14.
6.1.2 Подробное описание способов
6.1.2.1 Секвенирование РНК клеток, обработанных с использованием ADC
[1213] Клетки NCI-H1568 (ATCC), сверхэкспрессирующие HCC1954 и HER2, высевали из расчета 1×105 клеток на отдельную лунку 6-луночного планшета для культуры ткани (Corning). Клетки обрабатывали фосфатно-буферным солевым раствором или AB185-ADL1-D1 в концентрации 1,3 нМ и 4 нМ соответственно в течение 24 часов. Общую РНК экстрагировали из клеток с использованием набора RNAeasy Mini (Qiagen) и оценивали качественно и количественно (набор RNA 6000 Nano LabChip на 2100 Bioanalyzer, оба от Agilent). Отобранные посредством полиаденилирования библиотеки для секвенирования РНК создавали в соответствии со стандартными протоколами Illumina. Библиотеки кДНК качественно и количественно проверяли посредством набора DNA-1000 на 2100 Bioanalyzer (оба от Agilent). Библиотеки объединяли и секвенировали на HiSeq 2000 (Illumina) с получением ридов со спаренными концами размером 101 основание.
[1214] Необработанные риды, полученные посредством секвенирования, выравнивали с человеческой референтной последовательностью hg19 посредством STAR 2.4.2a с применением выравнивания 35 в два прохода, а количественное определение изоформ проводили с применением Kallisto 0.42.4 (Bray et al. (2016) Nat Biotechnol. 34(5):525-7) против аннотации версии 25 в GENCODE, картированной на GRCh37. Оценку количества оставшихся интронов осуществляли путем определения 6 нуклеотидов (-3 нуклеотида от сайта сплайсинга и +3 после сайта сплайсинга) граничных участков экзон-интронного сочленения и подсчета выравниваний, которые полностью перекрывали данные участки. Все необработанные данные о числе границ сплайсинга, в том числе об экзон-интронных сочленениях, объединяли во всех технических повторах для каждой когорты. Частоту используемости различных границ сплайсинга оценивали с применением биномиального z-критерия для выявления отличий в пропорции между обработанными и необработанными пулами образцов. Пропорции рассчитывали на основе всех границ сплайсинга (и экзон-интронных сочленений), которые имеют общий сайт сплайсинга, аналогично проценту сплайсированных в (PSI) измерении. С целью сохранения допущения о нормальности в анализе учитывались только те общие сайты сплайсинга с общим количеством границ сплайсинга (сумма необработанного количества по всем границам сплайсинга, имеющим этот сайт сплайсинга), превышающим 10 ридов или равным ему в обработанных и необработанных когортах. Z-показатели, соответствующие q-значению ≤0,05 с поправкой на уровень ложноположительных результатов (FDR) для обработанных ("аберрантных") границ сплайсинга и ≤0,20 для необработанных ("канонических") границ сплайсинга, считали значимыми.
[1215] Две или более границы сплайсинга, которые имеют общий сайт сплайсинга и имеют по меньшей мере одну границу сплайсинга, которая в значительной степени положительно экспрессируется в обработанных образцах, или по крайней мере одну границу сплайсинга, которая в значительной степени экспрессируется в необработанных образцах, соответственно считались аберрантными или каноническими границами сплайсинга. Как аберрантные, так и канонические границы сплайсинга должны были присутствовать в событии, чтобы его можно было считать отличительным сплайсингом. В случае событий сохранения интрона оба экзон-интронные сочленения (5'- и 3'-сайты сплайсинга), а также соединяющая их граница сплайсинга должны были быть значимыми.
6.1.2.2 MHC1-связанный пептидом клеток, обработанных с использованием ADC
[1216] Клетки NCI-H1568 (ATCC), сверхэкспрессирующие HCC1954 и HER2, высевали из расчета 1×108 клеток на 15 см2 планшетов для культур тканей (Corning). Клетки обрабатывали фосфатно-буферным солевым раствором или AB185-ADL1-D1 в концентрации 3 нМ в течение 48 часов. Клетки механически собирали из планшетов и обрабатывали согласно Bassani-Sternberg et al. ((2015) Mol Cell Proteomics 14(3):658-73). Если вкратце, то процедура включала солюбилизацию белковых комплексов MHC-1 из клеточных мембран, обогащение белка MHC-1 вместе с его связанными пептидами посредством иммунопреципитации, селективное элюирование и очистку связанных пептидов, а также идентификацию и количественное определение пептидов посредством LC/MS/MS-анализа. Для иммунопреципитации использовали моноклональное антитело W6/32, выделенное из линии клеток гибридомы HB-95TM. Масс-спектрометрические анализы проводили с использованием устройства Q Exactive HF. Файлы необработанных данных, полученные в этом исследовании, обрабатывали с использованием программного пакета MaxQuant (версии 1.5.7.13) для идентификации и количественной оценки пептидов и белков с применением базы данных последовательностей человеческих белков (версии 22017). В дополнение к этой базе данных были включены спрогнозированные варианты транскриптов на основе экспериментов RNAseq с клетками HCC1954 и NCI-H1568, обработанными AB185-ADL1-D1. MaxQuant выполняет сравнение 6-рамочной трансляции и интегрирует полученные пептидные последовательности для сопоставления со спектрами MS². Данные дополнительно отфильтровывали вручную по пептидным последовательностям, которые были характерны для образцов, обработанных AB185-ADL1-D1, а также по пептидам, кодируемым mRNA с границами сплайсинга, модулированными посредством обработки AB185-ADL1-D1 (фиг. 14). Четыре неопептида идентифицировали с помощью строгой фильтрации данных RNAseq по лигандому, связанному с MHC-1. Эти неопептиды кодировались четырьмя генами. Белковые последовательности четырех неопептидов, обозначаемых в данном документе как неоантиген 1, неоантиген 2, неоантиген 3 и неоантиген 4, были удлинены для последующих экспериментов по инициации примирования иммунных клеток. Удлиненная белковая последовательность включает одновременно собственно неопептидную последовательность в дополнение к фланкирующим аминокислотным последовательностям. Удлиненная белковая последовательность лучше облегчает захват белка дендритными клетками и содействует презентации антигена и примированию T-клеток в моделях с разными изотипами HLA.
6.2 Эксперимент по примированию Т-клеток
6.2.1 Обзор
[1217] Данный эксперимент представлял собой восстановление in vitro взаимодействий, которые происходят в нормальных вторичных лимфатических органах человека (например, в лимфатических узлах, дренирующих опухоль). В данном эксперименте моноциты выделяли из мононуклеарных клеток периферической крови (PBMC) и индуцировали их дифференцировку в дендритные клетки (DC) посредством культивирования в коктейле цитокинов. После дифференцировки до зрелых DC зрелые DC культивировали с удлиненными неопептидными последовательностями. В ходе культивирования зрелые DC захватывают пептиды, процессируют их во фрагменты и презентируют их на MHC1 для примирования CD8 Т-клеток. Затем DC смешивали с дополнительными PBMC от того же донора и инкубировали в течение примерно 2 недель в коктейле цитокинов для стимуляции активации CD8 T-клеток. После инкубации клетки переносили в планшет для ELISpot, который повторно покрывали пептидами, используемыми для примирования, и повторную стимуляцию CD8 Т-клеток контролировали по секреции IFNγ. Затем планшет для ELISpot обрабатывали и получали изображение, и пятна IFNγ подсчитывали для оценки числа активных CD8 Т-клеток. Схематическое изображение иллюстративного эксперимента по примированию Т-клеток см. на фиг. 15.
6.2.2 Подробное описание способов
6.2.2.1 Анализ ELISpot опосредованного неоантигенами примирования и активации Т-клеток
[1218] Клеточный материал в виде мононуклеарных клеток периферической крови (PBMC) приобретали у нескольких поставщиков (StemExpress, HemaCare, Precision Medicine) и использовали для получения антиген-реактивных CD8+ Т-клеток согласно Wölfl and Greenberg ((2014) Nat Prot. 9(4):950-66; фиг. 15). Если вкратце, то замороженные РВМС (5×107 клеток) размораживали и на 2-3 часа высевали в пластиковых флаконах для культур тканей Т-75 (Corning) в RPMI1640, дополненной 5% сыворотки крови АВ человека и 1% пенициллина/стрептомицина. Не прикрепившиеся клетки удаляли и отбрасывали, а прикрепившиеся клетки культивировали в течение 5 дней в RPMI1640/5% сыворотки крови человека, дополненной 20 нг/мл GM-CSF и 20 нг/мл IL-4. На 6 день в среду дополнительно добавляли TNF-α при 20 нг/мл. На 7 день зрелые DC собирали, подсчитывали и загружали неопептидами, которые были идентифицированы в экспериментах с MHC1-пептидомом (фиг. 16). Клетки разделяли и нагружали каждым пептидом в конечной концентрации 10 мкг/106 клеток/мл и инкубировали 1 день. На 8 день DC обрабатывали митомицином C в концентрации 20 мкг/мл в течение 30 мин. и тщательно промывали. Одновременно с обработкой DC 108 соответствующих PBMC оттаивали и промывали RPMI1640. Затем РВМС во флаконах T25 смешивали с DC при соотношении 10:1 в 10 мл RPMI1640/5% сыворотки крови AB человека, дополненной IL-21 в концентрации 30 нг/мл. После 3 дней совместного культивирования (день 11) добавляли еще 10 мл свежей среды, дополненной IL-7 и IL-15 в конечной концентрации 5 нг/мл. После дополнительных 3 дней совместного культивирования (день 14) добавляли еще 10 мл свежей среды, дополненной IL-7 и IL-15 в конечной концентрации 5 нг/мл, и совместную культуру переносили во флакон T-75. На 17 день добавляли еще 20 мл среды, дополненной IL-7 и IL-15 в конечной концентрации 10 нг/мл, и клетки переносили во флакон T-175. На 20 день клетки собирали, проводили анализ ELISpot в соответствии с инструкциями производителя (R&D Systems). В лунки предварительно вносили пептиды в конечной концентрации 10 мкг/мл на лунку, вносили клетки при плотности клеток 2×105 клеток на лунку, высеянные клетки дублировали и инкубировали в течение ночи. Пятна IFNγ проявляли и считывали на ридере AID ELISpot в соответствии с инструкциями производителя (фиг. 17A - D).
[1219] Иллюстративные данные экспериментов по примированию антигеном показаны на фиг. 17A - D. Партии клеток PBMC, полученных от доноров, подвергали дифференцировке в DC и примированию с использованием неопептидов, как показано на фиг. 15. Анализ данных ELISpot показывает, что в PBMC от здоровых доноров примирование наивных Т-клеток посредством DC-презентирования неопептидов может приводить к антиген-специфическому росту и созреванию популяций эффекторных (CD8) Т-клеток. Эти популяции Т-клеток проявляют антиген-специфическую повторную активацию, о чем свидетельствует секреция IFNγ только в присутствии антигенного пептида, но не в присутствии пептидов, которые не инициируют примирование.
RT-qPCR
[1220] РНК выделяли из клеточных линий с использованием RNeasy Mini с обработкой с помощью DNaseI (Qiagen), и 1-2 мкг РНК подвергали обратной транскрипции с использованием обратной транскриптазы Superscript VILO (ThermoFisher Scientific) в 20 мкл в соответствии с инструкциями производителя. Лизаты РНК выделяли и подвергали обратной транскрипции с использованием набора TaqMan Gene Expression Cells-to-CT (ThermoFisher Scientific) в соответствии с инструкциями производителя. Количественную ПЦР выполняли с использованием реагента TaqMan Gene Expression Master Mix (ThermoFisher Scientific) с зондами для транскрипта, нацеливающимися на границы сплайсинга в неоантигене, в формате дуплекса с РНК GAPDH VIC-PL (ThermoFisher Scientific), и количественный анализ проводили с использованием методики ΔΔCt.
ПРИМЕР 7
7.1 Эксперимент по секвенированию РНК и определению белкового лигандома
7.1.1 Способы
[1221] Эксперимент по секвенированию РНК и определению белкового лигандома проводили так, как это описано в примере 6 (разделе 6.1). Схематическое изображение иллюстративного эксперимента по секвенированию РНК и определению лигандома MHC1 см. на фиг. 14.
7.1.2 Результаты
[1222] Двадцать девять неопептидов идентифицировали с помощью строгой фильтрации данных RNAseq по лигандому, связанному с MHC1 (таблица 20). Отобрали четыре неопептида, которые удлиняли для следующих экспериментов по инициации примирования иммунных клеток. Четыре выбранных неопептида выделены жирным шрифтом в таблице 20.
Таблица 20. Неопептиды
[1223] Белковые последовательности двадцати девяти неопептидов могут быть удлинены. Удлиненная белковая последовательность включает одновременно собственно неопептидную последовательность в дополнение к фланкирующим аминокислотным последовательностям. Удлиненная белковая последовательность лучше облегчает захват белка дендритными клетками и содействует презентации антигена и примированию T-клеток в моделях с разными изотипами HLA. Аминокислотные последовательности двадцати девяти удлиненных неопептидов представлены в таблице 21.
Таблица 21. Аминокислотные последовательности удлиненных неопептидов
* Подчеркивание указывает на аминокислоты, полученные из открытой рамки считывания канонического транскрипта (т. е. канонической пептидной последовательности).
7.2 Эксперимент по примированию Т-клеток
7.2.1 Обзор
[1224] Схематическое изображение иллюстративного эксперимента по примированию Т-клеток см. на фиг. 15.
7.2.2 Материалы
[1225] Материалы, используемые для примирования T-клеток:
среда RPMI 1640 (Thermo Fisher Scientific, № кат. A10491-01)
Пенициллин/стрептомицин (100x, Thermo Fisher Scientific, № кат. 15140122)
Человеческая сыворотка крови типа AB (Sigma, № H3667-100ML)
Рекомбинантный человеческий IL-4 (Peprotech, № кат. 200-04)
Рекомбинантный человеческий GM-CSF (Peprotech, № кат. 300-03)
Рекомбинантный человеческий TNF-α (Peprotech, № кат. 300-01A)
Человеческий IL-7 (Peprotech, № кат. 200-07)
Человеческий IL-15 (Peprotech, № кат. 200-15)
Человеческий IL-21 (Peprotech, № кат. 200-21)
Пептиды (New England Peptide - 95% чистота, растворены в DMSO, 1000X стоковый раствор при концентрации 10 мкг/мкл)
Набор ELISpot для человеческого IFN-y(R&D Systems, № кат. EL285)
7.2.3 Способы
7.2.3.1 Получение и созревание дендритных клеток из человеческих моноцитов и загрузка неoпептидами
[1226] Замороженные или свежие PBMC размораживали и однократно промывали предварительно нагретой средой RPMI, а аликвоту не прикрепившихся клеток оставляли для секвенирования TCR на исходном уровне. PBMC ресуспендировали в 10 мл среды для дендритных клеток (DC) (RPMI 1640, дополненная 5% сыворотки крови AB человека и 1% пенициллина/стрептомицина) в количестве 5×106 клеток на мл, всего 50 миллионов клеток. Клетки переносили в пластиковый флакон для культур тканей Т-75 и инкубировали при 37°C, при 5% CO2 в течение 2-3 часов. После осторожного встряхивания не прикрепившиеся клетки удаляли и выбрасывали, а прикрепившиеся (обогащенные моноцитами) клетки трижды промывали предварительно нагретой средой DC. 10 мл среды для DC, дополненной GM-CSF в конечной концентрации 20 нг/мл и IL-4 в конечной концентрации 20 нг/мл, добавляли к прикрепившимся клеткам. Прикрепившиеся клетки инкубировали при 37°C, 5% CO2, при 100% влажности в течение 5 дней. На 6 день добавляли рекомбинантный TNF-α до конечной концентрации 20 нг/мл и культивировали еще в течение 48 часов. На 7 день собирали и подсчитывали DC, затем нагружали неопептидами (каждый при 10 мкг/1×106 клеток/мл) или контролем без неопептида. На 8 день клетки собирали в виде зрелых DC. Зрелые DC обрабатывали митомицином C при конечной концентрации 20 мкг/мл в течение 30 мин. при 37°C с последующей интенсивной промывкой перед совместной инкубацией с Т-клетками для примирования.
7.2.3.2 Начало совместного культивирования с аутологичными T-клетками
[1227] В день 0 замороженные или свежие размораживали и однократно промывали в предварительно нагретой среде. Затем РВМС ресуспендировали и в флаконах T25 смешивали с DC при соотношении 10:1 (10×106:1×106 клеток) в 10 мл RPMI1640/5% сыворотки крови AB человека, дополненной IL-21 в концентрации 30 нг/мл. После 3 дней совместного культивирования (день 3) добавляли еще 10 мл свежей среды, дополненной IL-7 и IL-15 в конечной концентрации 5 нг/мл. После дополнительных 3 дней совместного культивирования (день 6) добавляли еще 10 мл свежей среды, дополненной IL-7 и IL-15 в конечной концентрации 5 нг/мл, и совместную культуру переносили во флакон T-75. На 9 день добавляли еще 20 мл среды, дополненной IL-7 и IL-15 в конечной концентрации 10 нг/мл, и клетки переносили во флакон T-175. На 11-12 дни клетки собирали, проводили анализ ELISpot в соответствии с инструкциями производителя (R&D Systems) и проводили секвенирование TCR (1×106 клеток). В лунки предварительно вносили пептиды в конечной концентрации 10 мкг/мл на лунку, вносили клетки при плотности клеток 2×105 клеток на лунку, высеянные клетки дублировали и инкубировали в течение ночи. Пятна IFNγ проявляли и считывали на ридере AID ELISpot в соответствии с инструкциями производителя.
7.2.4 Результаты
[1228] Иллюстративные данные экспериментов по примированию антигеном приведены в таблице 22.
Таблица 22. Данные по примированию T-клеток
(прогнозированное связывание)
[1229] Партии клеток PBMC, полученных от доноров, подвергали дифференцировке в DC и примированию с использованием неопептидов, как показано на фиг. 15. Анализ данных ELISpot показывает, что в PBMC от здоровых доноров примирование наивных Т-клеток посредством DC-презентирования неопептидов может приводить к антиген-специфическому росту и созреванию популяций эффекторных (CD8) Т-клеток. Эти популяции Т-клеток проявляют антиген-специфическую повторную активацию, о чем свидетельствует секреция IFNγ только в присутствии антигенного пептида, но не в присутствии пептидов, которые не инициируют примирование. Данные также свидетельствуют о том, что ответ на неопептиды необязательно может быть предсказан на основе HLA.
ПРИМЕР 8
8.1 Идентификация неoпептидов
8.1.1 Обзор
[1230] Для идентификации неопептидов, образовавшихся в результате модуляции сплайсинга, пептиды длиной 8-11 аминокислот, которые, как предполагают, связываются с MHC класса I из канонического протеома и протеома с модулированным сплайсингом сравнивали по отдельности по тандемным масс-спектрам с использованием стандартного подхода "мишень-ловушка". Сначала мРНК-транскрипты с альтернативным сплайсингом подвергали трансляции и сравнивали с референтным протеомом. Затем по спектрам, которые не соответствовали референтному протеому, проводили поиск соответствующих новых пептидов. Схематическую диаграмму иллюстративного процесса идентификации новых пептидов, образовавшихся в результате модуляции сплайсинга, смотри на фиг. 14.
8.1.2 Способы
8.1.2.1 Создание базы данных потенциальных неопептидов
[1231] Для создания базы данных потенциальных неопептидов проводили идентификацию пептидов, охватывающих границы экзонов или содержащих интроны, не обнаруженные в референтном протеоме (см. Li et al. (2011) Mol. Cell Proteomics 10 (5): M110.006536). Пептиды, полученные из референтного протеома, отбирали из проанализированных вручную последовательностей белков и загружали. Кроме того, белки отфильтровывали по границам сплайсинга, выявленным в нормальных тканях. В качестве альтернативного подхода полноразмерные белки можно транслировать в после событий сплайсинга, выполнять поиск пептидов, охватывающих границы сплайсинга экзонов или содержащих интроны, а затем сравнивать с помощью BLAST с референтным протеомом.
[1232] Чтобы избежать ненужных статистических тестов, использовали только пептиды, вероятность связывания которых с MHC была cпрогнозирована. Последовательности белков (как из референтного протеома, так и полученные в результате трансляции транскриптов с пропуском экзона или сохраненным интроном) оценивали на предмет связывания с высокой аффинностью с аллелями MHC1 с использованием программного обеспечения NetMHCPan и/или MHCnuggets. В случае и первого, и второго программных пакетов хиты с сильным или слабым связыванием были выбраны (i) по необработанным данным прогнозирования прочности аффинного связывания (пороговое значение 500 нМ для слабого связывания) или (ii) путем отбора большого числа случайных существующих пептидов и определения распределения значений прогнозируемой силы связывания для пептидов. Затем предполагаемое значение силы связывания для любых новых пептидов сравнивали с данным распределением. Пороговые значения сильного и слабого связывания, измеренные с помощью последней методики (методики (ii)), представляли собой спрогнозированные значения силы связывания для с 0,5% с наивысшим показателем или 2,0% наивысшим показателем случайным образом отобранных существующих пептидов соответственно (смотри Nielsen and Andreatta (2016) Genome Med. 8(1):33). В настоящее время прогнозирование для MHC ограничено пептидными последовательностями длиной 8-11 аминокислот и содержится в базе данных по иммунным эпитопам (IEDB).
8.1.2.2 Идентификация транскриптов, образованных в результате модуляции сплайсинга, с использованием секвенирования РНК (RNAseq) и профилирования рибосом (RiboSeq)
[1233] Ряд неопептидов получены из более крупных пептидных доменов (например, TUBA1C), тогда как пептидные фрагменты из остальной части транслируемого участка могут остаться не выявленными. Это может быть следствием усиленной деградации не выявленных участков, аффинности связывания с MHC1 или технических проблем, связанных с выявлением посредством масс-спектрометрии (МС). Как правило, при анализе RNAseq число прогнозируемых неопептидов будет завышено (поскольку не все транскрипты, подвергнутые альтернативному сплайсингу, будут транслироваться), тогда как в MHC1-лигандоме будет занижено число прогнозируемых неопептидов.
[1234] Для составления списка неопептидов в качестве маркера трансляции в белки идентифицировали доступные варианты границ сплайсинга, образованные в результате модуляции сплайсинга, со связанными рибосомами (Andreev et al. (2017) Nucleic Acids Res. 45 (2): 513-26). RiboSeq или рибосомальное профилирование позволило выявить последовательности mRNA (и вариантные домены), которые подверглись активной трансляции, о чем свидетельствует присутствие рибосом, связанных с транскриптом, а также специфических доменов соединения экзонов.
ПРИМЕР 9
9.1 In vitro анализ иллюстративных ADC на основе антитела к HER2
9.1.1 Способы
[1235] Клетки HCC1954, NCI-N87 или MCF7 (ATCC) высевали в среде RPMI без фенолового красного+10% FBS (ATCC) или EMEM+10% FBS+инсулин (0,01 мг/мл) (для MCF7) в количестве 2,5 х 103 клеток на лунку при 90 мкл на лунку. Клетки (n=3 лунки на условие) обрабатывали конъюгатами дозозависимым образом в 3-кратном разведении. Через 24 часа клетки лизировали с использованием 50 мкл буфера CL (IgePal CA-630, 5M NaCl, 1M трис-HCl 1M pH 7,4 в воде), содержащем 25 мкл/мл RNasin® (Promega) и инкубировали в течение 45 мин. при RT на качающейся мешалке. Полученную смесь (1 мкл) использовали для оценки модуляции сплайсинга в ПЦР-реакции с обратной транскрипцией, используя Taqman Fast Virus 1-Step MasterMix (Applied Biosystems) и следующие праймеры Taqman в соответствии с рекомендациями изготовителя: SLC25A19 (Invitrogen, Hs00222265_m1); FBXW5 (IDT, прямой праймер: CACACCAGATCGGCATCAA (SEQ ID NO:37), обратный праймер: CGATGATGTGTCCGTGTATGT (SEQ ID NO:38), зонд: ATCCTGCCACACCAGATGACCAC (SEQ ID NO:39), краситель: FAM, гаситель: ZEN/Iowa Black FQ); TAOK1 (IDT, прямой праймер: CTGCTTCGGATTTACTAGAAGAGATA (SEQ ID NO:40), обратный праймер: GCGTTCCCACAAAGGAATTG (SEQ ID NO:41), зонд: TGCTGACTTTGGCTCTGCTTCCAT (SEQ ID NO:42), краситель: FAM, гаситель: ZEN/Iowa Black FQ); RPLP0 (Invitrogen, Hs99999902_m1).
9.2 In vivo эффективность и фармакодинамика (PD) иллюстративных ADC на основе антитела к HER2
9.2.1 Способы - in vivo эффективность в ксенотрансплантатной модели на основе клеток NCI-N87
[1236] Мышей CB17-SCID (Charles River Laboratories) содержали в соответствии с федеральными, государственными, городскими регуляторными правилами и правилами аккредитации AAALAC в отношении исследований на животных города Кембридж, штата Массачусетс. Линию клеток карциномы желудка человека NCI-N87 получали из Американской коллекции типовых культур (АТСС № CRL-5822). Клетки пассажа 14 использовали для экспериментов с опухолями. В последний раз клетки проверяли в отношении присутствия мышиных патогенов в сентябре 2016 года, а на микоплазмы в декабре 2018 года.
[1237] Суспензию отдельных клеток из 5 миллионов клеток на 0,1 мл (50% ATCC-модифицированная среда RPMI-1640, № кат. A10491-01 (Thermo-Fisher Scientific) и 50% Corning Matrigel, № кат. 356254 (VWR Scientific)) подкожно вводили в наружный участок правого бока с использованием шприца с иглой 25Ga. Мышей рандомизировали в день 0 при среднем объеме опухоли 180-183 мм3, n=8 на группу для анализа эффективности и n=4 на группу для фармакодинамики (PD). В день 1 исследуемые препараты вводили (10 мг/кг) в объеме 5 мл/кг внутривенно каждые 7 дней в течение 2 циклов для анализа эффективности; один курс обработки использовали для PD-оценки. Животных в когортах PD умерщвляли через 24, 48, 72 и/или 96 часов после введения однократной дозы в зависимости от исследуемого препарата. Объем опухоли и вес тела измеряли один или два раза в неделю до завершения (61 день) исследования. Объем опухоли рассчитывали по формуле длина x ширина2/2. В ходе исследования исключали мышей, достигших конечной точки (размер опухоли ≥ 20 мм3 в любом направлении или объем опухоли ≥ исходного веса тела x 100) или имевших изъязвление опухоли или глазную инфекцию.
[1238] Соединения составляли в ламинарном боксе биологической защиты. Средой носителем для исследуемого препарата был фосфатно-буферный солевой раствор с pH 7,4 (№ кат. A10010-049 (Thermo-Fisher Scientific)). Группы представлены в таблице 23.
[1239] Противоопухолевую активность рассчитывали следующим образом:
% T/C формула=обработанные/контроль*100
%TGI формула = (среда-носитель среднеедень X - обработанные среднеедень X)/носитель среднеедень X * 100, где день X представлял собой день 22.
9.2.2 Способы - in vivo PD (RT-qPCR)
[1240] РНК выделяли из образцов опухолей с использованием набора MagMAX-96 для микрочипов и устройства MagMAX Express-96 Deep Well Magnetic Particle Processor (ThermoFisher Scientific). Образцы опухолей (весом 50-100 мг) собирали в буфере RNAlater и помещали на хранение при -80°C до выделения РНК. Гомогенизацию тканей выполняли путем добавления 2-3 керамических гранул и 1 мл реагента Tri-reagent в пробирку с опухолями с последующим разрушением на приборе Omni Bead Ruptor 24 (Omni International). Выделение РНК осуществляли в соответствии с инструкциями производителя.
[1241] Лизаты РНК выделяли и подвергали обратной транскрипции с использованием реагента TaqMan Fast Virus 1-Step Master Mixt (ThermoFisher Scientific) в соответствии с инструкциями производителя.
[1242] Количественную ПЦР с кДНК выполняли с использованием реагента TaqMan Gene Expression Master Mix (ThermoFisher Scientific) с зондами для транскрипта, нацеливающимися на границы сплайсинга в FBXW5 или TAOK1, в формате дуплекса с РНК RPLP0 VIC-PL (ThermoFisher Scientific), и количественный анализ проводили с использованием методики ΔΔCt.
Таблица 23. Группы
9.3 Результаты
In vitro анализ:
[1243] иллюстративные ADC на основе антитела к HER2 оценивали в отношении антипролиферативной активности на двух HER2-положительных линиях клеток разного происхождения (на клетках рака молочной железы HCC1954 и клетках рака желудка N87) и HER2-отрицательной линии клеток (MCF7). Измеряли эффективность ингибирования роста (GI50-активность), а также качество ответа (Rмин по сравнению с контролем). Альтернативный сплайсинг в репрезентативном гене домашнего хозяйства SLC25A19 измеряли с помощью qPCR после обработки указанных линий клеток с использованием ADC. Измеряли GI50 и качество ответа сплайсинга. Результаты in vitro анализа приведены в таблице 25.
[1244] В целом, тестируемые ADC на основе антитела к HER2 показали благоприятную эффективность в отношении антиген-положительных линий клеток и минимальный ответ в отношении жизнеспособности и сплайсинга в отношении антиген-отрицательной линии клеток. ADC различались по качеству ответа в уничтожении клеток и завершенности альтернативного сплайсинга в SLC25A19. ADC относили к одной из четырех категорий в отношении влияния на каждую из антиген-положительных линий клеток: 1) высокое качество ответа/высокая летальность и выраженный ответ в виде сплайсинга; 2) высокое качество ответа/высокая летальность и слабый ответ в виде сплайсинга; 3) низкое качество ответа/низкая летальность и выраженный ответ в виде сплайсинга; или 4) низкая клеточная летальность и слабый ответ в виде сплайсинга. Несколько ADC продемонстрировали благоприятные свойства категории 3 в отношении линии клеток рака желудка N87. Соединение AB185-ADL13-D4 проявляло неизменно летальное действие и продемонстрировало высокое качество ответа в виде сплайсинга как на клетках HCC1954, так и на клетках N87. Такая постоянная антиген-специфическая летальная активность является обычно желательной для ADC, при этом водорастворимый линкер может обеспечить еще более высокую нагрузку лекарственного средства с благоприятными характеристиками конъюгата. Смена линкера на ADL23 (трипептид EVC) неожиданно изменила профиль в обеих клеточных линиях. Соединение AB185-ADL1-D12 также было уникальным в том плане, что оно является высоколетальным для клеток HCC1954, но активность полезной нагрузки в отношении клеток является неизменно низкой для ряда линий клеток солидных и гематологических опухолей. D12 также является единственной полезной нагрузкой в этих группах с низким коэффициентом эффлюкса. Таким образом, ADC, высвобождающие данную полезную нагрузку, могут быть активными против видов рака с множественной лекарственной устойчивостью, которые экспрессируют антиген-мишень.
[1245] При сравнении активности в отношении сплайсинга (IC50 в qPCR) с активностью в отношении клеток (GI50 в CTG) на клетках рака молочной железы HCC1954 глюкуронидный линкер и полезная нагрузка D12 продемонстрировали благоприятные свойства. Полезная нагрузка с карбаматным переключением C6/C7 (D8) и двухосновная полезная нагрузка (D5) продемонстрировали активность в отношении клеток, но не продемонстрировали наиболее эффективного альтернативного сплайсинга. Смена дипептида на трипептидный линкер с полезной нагрузкой D4 или D1 снижает эффективность альтернативного сплайсинга, но активность в отношении клеток остается высокой. Смотри фиг. 18 (размещено по размеру в зависимости от летальной активности в отношении клеток, заштриховано по качеству ответа в виде альтернативного сплайсинга).
[1246] При сравнении активности в отношении сплайсинга (IC50 в qPCR) с активностью в отношении клеток (GI50 в CTG) на клетках рака желудка N87 глюкуронидный линкер (с D4) и полезная нагрузка D12 продемонстрировали благоприятные свойства, как и на клетках HCC1954. В целом, все ADC показали минимальную активность в отношении сплайсинга и активность в отношении HER2-отрицательной линии клеток MCF7. Несмотря на относительно низкую активность полезной нагрузки D12 в отношении клеток, активность ADC на основе антитела к HER2 с данной полезной нагрузкой была высокой, а полезная нагрузка показала низкий коэффициент эффлюкса. Эти свойства потенциально могут повысить эффективность лечения рака с множественной лекарственной устойчивостью. Смотри фиг. 19 (размещено по размеру в зависимости от летальной активности в отношении клеток, заштриховано по качеству ответа в виде альтернативного сплайсинга).
[1247] In vitro анализ проводили с дополнительными ADC на основании антитела к HER2. Сравнение ADC на основе антитела к HER2 и соответствующих полезных нагрузок показано в таблице 26. При сравнении активности и летальности ADC на основе антитела к HER2 со стабильностью и проникающей способностью соответствующих полезных нагрузок (фиг. 20) соединение AB185-ADL5-D15 продемонстрировало благоприятное сочетание эффективности, летальной активности, химической стабильности и проникающей способности катаболита (например, для предполагаемого нецелевого уничтожения). Как описано ниже, AB185-ADL5-D15 также было активно in vivo и продемонстрировало высокую противоопухолевую активность на ксенотрансплантатной модели NCI-N87.
In vivo эффективность:
[1248] Линию клеток рака желудка NCI-N87, экспрессирующую человеческий HER2, и ксенотрансплантатную модель на ее основе получали путем инокуляции клеток NCI-N87 мышам SCID для оценки противоопухолевой активности иллюстративных ADC на основе антитела к HER2. Трастузумаб и TDM1 использовали в качестве препаратов сравнения.
[1249] Противоопухолевые эффекты при внутривенном введении трастузумаба, TDM1 и четырех ADC на основе антитела к HER2 в ксенотрансплантатной модели на основе клеток карциномы желудка NCI-N87 показаны на фиг. 21 и фиг. 23. Влияние на вес тела показано на фиг. 22 и фиг. 23. Тестируемый препарат или среду-носитель вводили внутривенно (в/в) Q7D в течение 2 циклов. Данные представляют собой среднее значение ± SEM (объем опухоли, мм3) или ± SEM (вес тела,%) (N=8). * p <0,0001 по сравнению с группой среды-носителя в день 22 с использованием однофакторного дисперсионного анализа.
[1250] Табличные данные по in vitro и in vivo эффективности на NCI-N87 представлены в таблице 24. Табличные данные представляют собой процент (%) ингибирования роста опухоли (TGI объема опухоли) или % T/C (объем опухоли) (N=8). Соединение AB185-ADL5-D2 оказалось неожиданно активным in vivo, несмотря на невысокую летальность in vitro, и продемонстрировало улучшенную эффективность in vivo по сравнению, например, с AB185-ADL14-D1.
Таблица 24. Эффективность иллюстративный ADC на основе антитела к HER2 в отношении клеток линии NCI-N87
[1251] Трастузумаб, человеческое антитело к HER2, являющееся стандартом лечения HER2-положительного рака молочной железы, не продемонстрировал противоопухолевой активности в данной модели. Однако TDM1, препарат второй линии, содержащий трастузумаб с ковалентно связанным DM1 (цитотоксическим средством), показал значительно лучшую противоопухолевую активность (TGI 71%), чем один отдельно трастузумаб (TGI 4%). Среди четырех протестированных ADC ABL185-ADL5-D2, AB185-ADL5-D15 и AB185-ADL1-D4 показали высокую противоопухолевую активность с ингибированием роста опухоли (TGI), составляющим 73%, 67% и 68% соответственно. Опухоли во всех группах респондеров со временем возобновляли рост. Полного ответа не наблюдали ни в одной группе, при одно из восьми животных в каждой из следующих групп проявило частичный ответ: TDM1, ABL185-ADL5-D2 и AB185-ADL5-D15. Все реагенты и тестируемые препараты хорошо переносились мышами, причем потеря веса тела была минимальной. В целом, 3 из 4 протестированных ADC на основе антитела к HER2 продемонстрировали высокую противоопухолевую активность по сравнению с TDM1 в опухолевой модели NCI-N87 без значительной потери веса тела.
In vivo PD:
[1252] PD-модуляция границ сплайсинга в мРНК посредством внутривенного введения трастузумаба, TDM1 и четырех ADC на основе антитела к HER2 в ксенотрансплантатной модели на основе клеток карциномы желудка NCI-N87 показана на фиг. 24A - 24D. С помощью RT-qPCR отслеживали присутствие FBXW5 (зрелого мРНК-транскрипта) и TAOK1 (транскрипта с новым участком сплайсинга). Испытуемый препарат или среду-носитель вводили внутривенно (в/в) в дозе 10 мг/кг. Животных (N=4 на группу) отбирали либо через 48 часов (фиг. 24A и фиг. 24B), либо в указанные моменты времени (фиг. 24C и фиг. 24D). Опухоли извлекали для выделения РНК и проведения RT-qPCR. * p <0,05 по сравнению со средой-носителем с использованием однофакторного дисперсионного анализа (фиг. 24A и фиг. 24B) или двухфакторного дисперсионного анализа (фиг. 24C и фиг. 24D).
[1253] Ни трастузумаб, ни TDM1 не продемонстрировали значимых изменений при наблюдении в отношении сплайсинга FBXW5 или TAOK1. Все конъюгаты AB185 и ADL5-D2/ADL1-D4/ADL5-D15 показали значительное истощение FBXW5, а конъюгаты AB185 и ADL5-D2/ADL1-D4 продемонстрировали значительное увеличение TAOK1. ADL5-D15 показал увеличение TAOK1, но статистическая значимость не была достигнута. ADL14-D1 не проявил статистически значимых изменений в копийности какого-либо из транскриптов мРНК.
Таблица 25. Характеристики иллюстративных ADC на основе антитела к HER2 и соответствующих полезных нагрузок
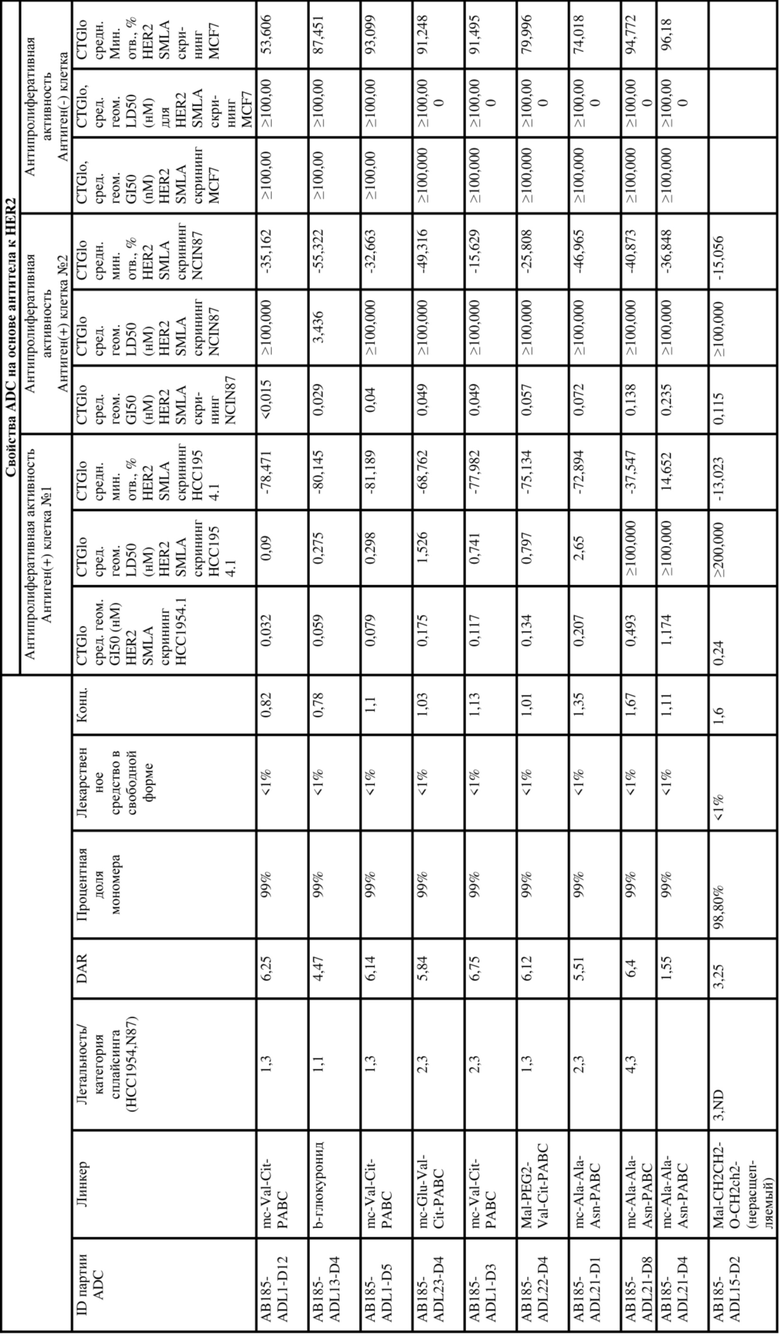
Таблица 25 (продолжение). Характеристики иллюстративных ADC на основе антитела к HER2 и соответствующих полезных нагрузок
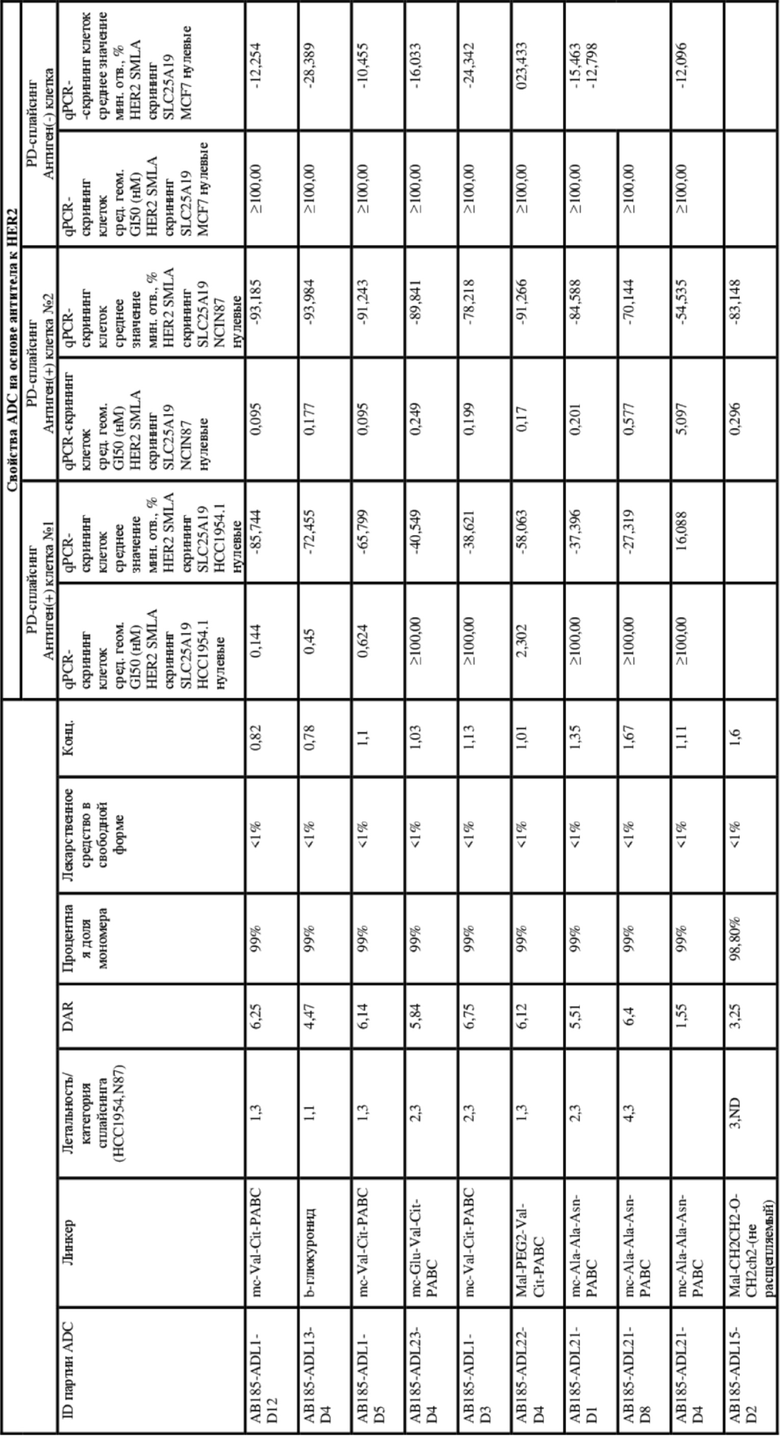
Таблица 25 (продолжение). Характеристики иллюстративных ADC на основе антитела к HER2 и соответствующих полезных нагрузок
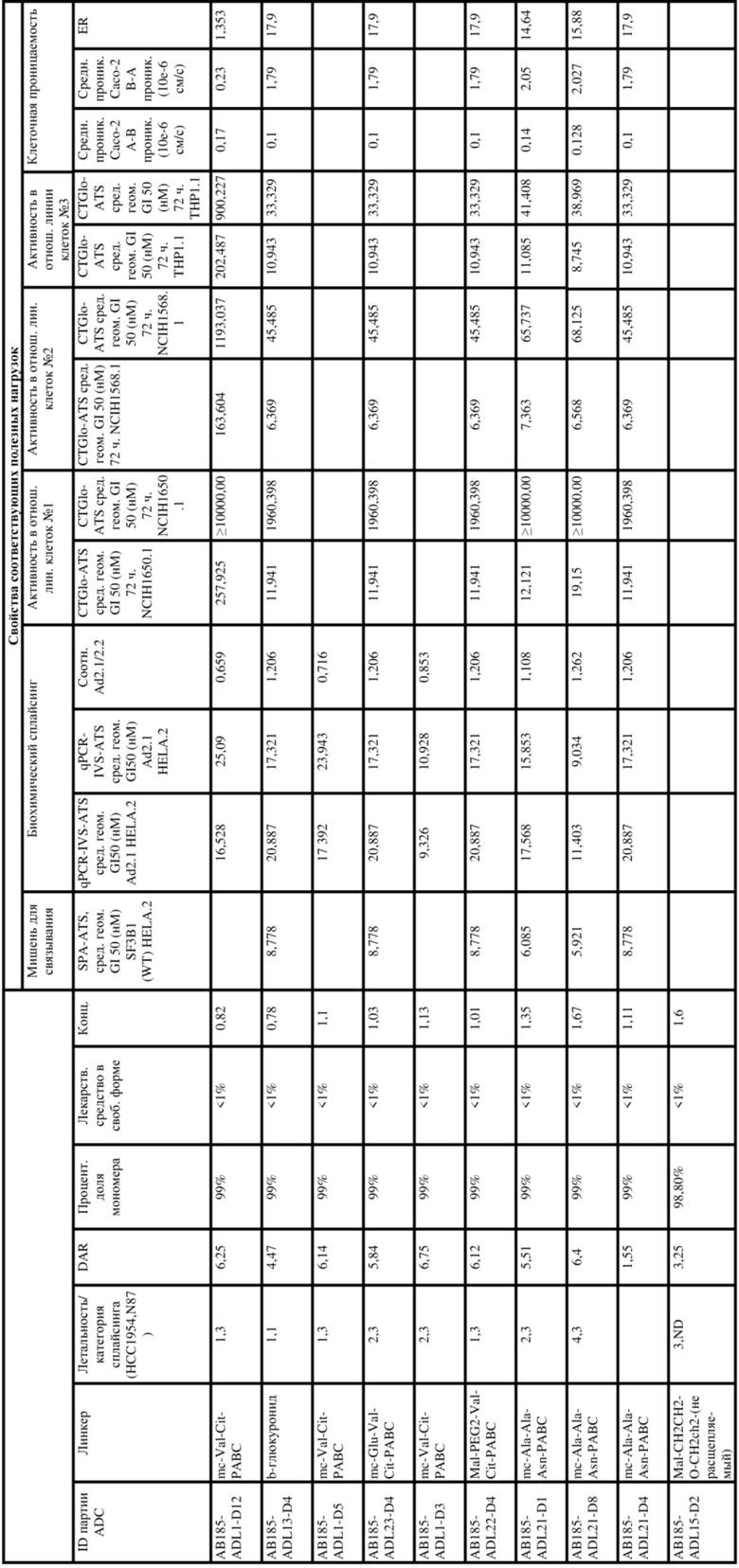
Таблица 26. Иллюстративные ADC на основе антитела к HER2 - клетки HCC1954
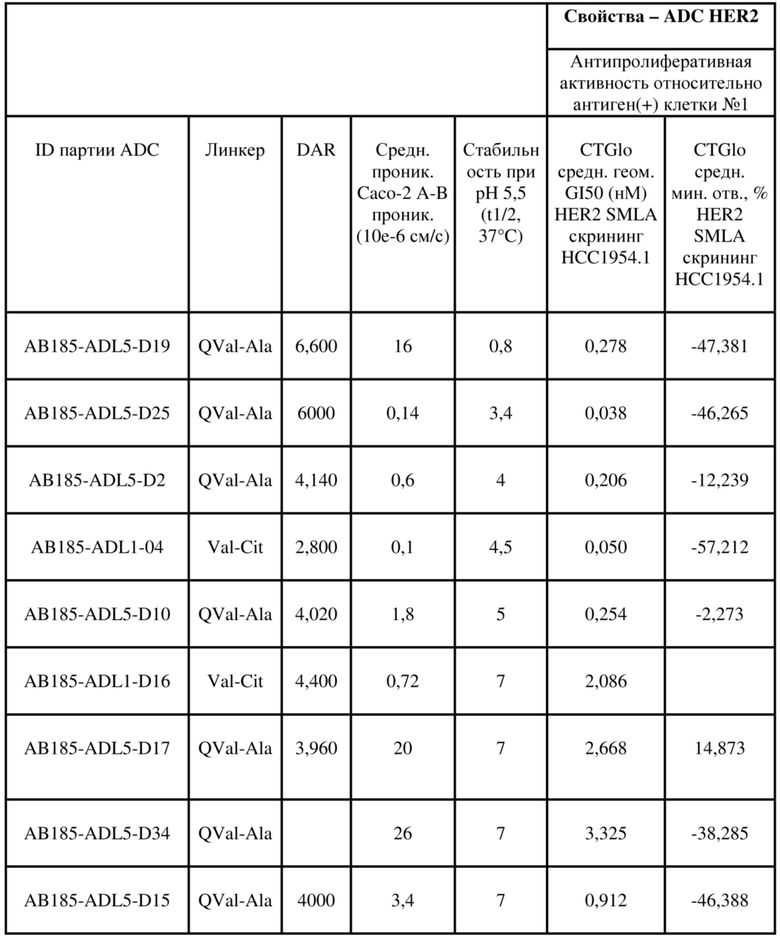
ПРИМЕР 10
10.1 Выбор типа опухоли/мишени на основе на биоинформационного анализа
[1254] Чтобы идентифицировать антигены-мишени, которые высоко экспрессируются в опухолях с низкой мутационной нагрузкой (TMB) по сравнению с нормальной тканью, проводили биоинформационный прогностический анализ. В данном примере поясняется: 1) как задавали каждый фильтр и 2) как использовали таблицу антиген/тип опухоли для идентификации подходящих пар мишень/опухоль. Схематическую диаграмму иллюстративного анализа определения мишени см. на фиг. 25.
10.1.1 Обзор
[1255] Антигены-мишени и типы опухолей идентифицировали с применением биоинформационного прогностического анализа. Данные из TCGA обрабатывали для определения мутационной нагрузки опухоли (TMB), экспрессии антигенов-мишеней для доставки ADC, и инфильтрации опухоли иммунными клетками. Анализы с использованием опубликованных граничных значений TMB и инфильтрации для стратификации прогнозируемых респондеров и не являющихся респондерами на ингибиторы контрольных точек иммунного ответа (ICI) проводили для выявления типов опухолей и соответствующих им антигенов. Экспрессию поверхностного антигена дополнительно подвергали фильтрации для оценки популяции с вероятностной экспрессией антигена, которая в по меньшей мере в 2 раза выше, чем в любой нормальной ткани (согласно оценке из базы данных тканеспецифической экспрессии GTEx). Типы опухолей (или субпопуляции опухолевых клеток из TCGA) с подходящий процентной долей пациентов, у которых имеются один или несколько антигенов-мишеней, дополнительно анализировали в отношении мутации и показателей иммунитета. Оценивали процентную долю антиген-положительных пациентов, у которых мутационная нагрузка опухоли ниже совокупного показателя 10 мутаций/миллион оснований, а балл T-клеточной инфильтрации превышает 0,5. Типы опухолей для ~50% пациентов, отвечающих этим критериям, перечислены в таблице 27. Пациенты в данных когортах (но не ограничиваясь этими когортами) могут отвечать на лечение посредством ADC на основе модулятора сплайсинга (например, описанным в данном документе ADC на основе модулятора сплайсинга).
10.1.2 Способы
[1256] Пояснение к таблице прогнозирования антигенов и типов опухолей из Вестника онкологии:
Антиген: название гена, кодирующего антиген; лишь 59 генов, которые могут быть подходящими мишенями для ADC, из литературного обзора в Вестнике онкологии (см. Moek et al. (2017) Annals of Oncology, 28: 3083-3091) включили в таблицу (исходный полный анализ включал полный набор генов белков клеточной поверхности (сурфасом), выявленный анализом in silico).
Когорта: название когорты согласно TCGA
ПОДТИП: информация о подтипе опухоли согласно TCGA
Всего_случаев: общее число случаев
Случаи.по.подтипу: число случаев по подтипу
LTPM_медиана: медианное значение экспрессии по log2(TPM+1)
LTPM_медиана_низкаяTMB: медианное значение экспрессии по log2(TPM+1) для случаев с низкой TMB (< 350)
LTMB_медиана: медианное значение log10(TMB)
LTMB_MAD: устойчивое измерение стандартного отклонения по величине MAD (абсолютному отклонению среднего) log10(TMB)
Инфильтрат_медиана: медианное значение балла инфильтрации в соответствии с молекулярными сигнатурами T-клеток из PLoS One
Инфильтрат_MAD: устойчивое измерение стандартного отклонения по величине MAD (абсолютному отклонению среднего) балла инфильтрации в соответствии с молекулярными сигнатурами T-клеток из PLoS One
Корреляция с чистотой: корреляция экспрессии с чистотой опухоли
GTEX_ткань: название ткани из базы GTEx с наивысшим медианным значением экспрессии
GTEX_LTPM_медиана: медианное значение экспрессии антигена в ткани из GTEx с наивысшим медианным значением экспрессии
Сурфасом.фильтр*: популяция пациентов после использования фильтра по сурфасому: экспрессия в > 2 раза превышает экспрессию в нормальной ткани из GTEx с наивысшим медианным значением
НизкаяTMB.Фильтр: популяции пациентов после использования фильтра низкой мутационной нагрузки опухоли (TMB): < 350 на экзом-секвенир. (10 на 2 миллиона оснований)
НизкаяTMB.Сурфасом.Фильтр: популяции пациентов после использования как фильтра по сурфасому, так и фильтра по мутационной нагрузке опухоли (tmb)
Выс.инфильтр.НизкаяTMB.Сурфасом.Фильтр: популяция пациентов после использования трех фильтров: фильтра экспрессии сурфасома, фильтра низкой мутационной нагрузки опухоли (tmb) и фильтра высокой инфильтрации
Сурфасом.Фильтр.Проц. доля: процентная доля популяции после использования фильтра по сурфасому: экспрессия в > 2 раза превышает экспрессию в нормальной ткани из GTEx с наивысшим медианным значением
НизкаяTMB.Фильтр.Проц. доля: процентная доля популяции после использования фильтра низкой мутационной нагрузки опухоли (TMB) < 350
НизкаяTMB.Сурфасом.Фильтр.Проц. доля: процентная доля популяции после использования как фильтра по сурфасому, так и фильтра по мутационной нагрузке опухоли (tmb)
Выс. инфильт.НизкаяTMB.Сурфасом.Фильтр.Проц.: процентная доля популяции после использования трех фильтров: фильтра экспрессии сурфасома, фильтра низкой мутационной нагрузки опухоли (tmb) и фильтра высокой инфильтрации
[1257] Вероятностная оценка популяции пациентов:
Собранные источники:
1. публикация об иммунном фоне при многих видах рака (Ready et al. (2019) Journal of Clinical Oncology, 37:992-1000)
2. Набор данных секвенирования РНК/секвенирования экзома из TCGA, полученный посредством Omicsoft
3. Публикациях о сигнатурах экспрессии генов при определении характеристик иммунного микроокружения (Thorsson et al. (2018) Иммунитет, 48, 812-830)
4. Данные из GTEx версии 7
Мутационную нагрузку опухоли рассчитывали с использованием программного обеспечения Omicsoft на основе вызова данных по мутациям из TCGA, полученных посредством секвенирования экзома. Сигнатуры T-клеток (CD3D, CD3E, CD2) из PLoS One использовали для количественного определения инфильтрации иммунными клетками. Z-показатель рассчитывали с использованием log2(TPM+1) значения данных секвенирования РНК из TCGA.
Сурфасом.Фильтр: вероятность того, что у отдельного пациента имеется >2-кратное превышение экспрессии (log2(TPM+1)) по сравнению с нормальной тканью из GTEx с наивысшим медианным значением, рассчитывали следующим образом:
1. идентифицировали нормальную ткань из GTEx, которая характеризуется наивысшим медианным значением по данному гену среди всех нормальных тканей из GTEx, принимая этот показатель за Th.
2. Получали данные из GTEx по этому гену при 1000 пациентов по каждой ткани, используя метод увеличения числа примеров миноритарного класса (SMOTE (Siemers et al. (2017) PLoS One, 12 (7): e0179726), сохраняя при этом распределение данных по тканям.
3. Подсчитывали, сколько раз (n раз) у этого пациента будет >2 превышение данных для ткани Th, полученных из GTEx, причем вероятность того, что у этого пациента будет >2-кратное превышение нормального значения из GTEx равна n/1000
4. Рассчитывали данную вероятность для каждого пациента
5. Сумма отдельных вероятностей представляет собой вероятностную оценку популяционной когорты с более чем >2 превышением по сравнению с нормальной тканью из GTEx.
6. При одновременном использовании других фильтров сумма отдельных вероятностей будет применима только для пациентов, данные по которым провели через другие фильтры.
10.1.3 Примеры
[1258] Антигены-мишени и типы опухолей, определенные с использованием описанного выше иллюстративного биоинформационного прогностического анализа, представлены в таблице 27.
Таблица 27. Иллюстративные антигены-мишени и типы опухолей
Рак шейки матки
Рак поджелудочной железы
Аденокарцинома легкого
Рак пищевода
Рак пищевода
Рак шейки матки
Рак молочной железы
Рак предстательной железы
| название | год | авторы | номер документа |
|---|---|---|---|
| КОНЪЮГАТЫ АНТИТЕЛА И ЛЕКАРСТВЕННОГО СРЕДСТВА, СОДЕРЖАЩИЕ МОДУЛЯТОР СПЛАЙСИНГА НА ОСНОВЕ ГЕРБОКСИДИЕНА, И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2019 |
|
RU2820607C2 |
| АНТИТЕЛА ПРОТИВ SEZ6 И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2013 |
|
RU2691698C2 |
| КОМПОЗИЦИИ И СПОСОБЫ, ОТНОСЯЩИЕСЯ К КОНЪЮГАТАМ ЛЕКАРСТВЕННЫХ СРЕДСТВ С АНТИТЕЛАМИ ПРОТИВ CD19 | 2019 |
|
RU2806333C2 |
| ЛЕКАРСТВЕННЫЙ КОНЪЮГАТ ПРОИЗВОДНОГО ЭРИБУЛИНА, СПОСОБ ЕГО ПОЛУЧЕНИЯ И ЕГО ПРИМЕНЕНИЕ В МЕДИЦИНЕ | 2021 |
|
RU2830242C1 |
| МУЛЬТИСПЕЦИФИЧЕСКИЕ АНТИТЕЛА, АНАЛОГИ АНТИТЕЛ, КОМПОЗИЦИИ И СПОСОБЫ | 2010 |
|
RU2580038C2 |
| КОНЪЮГАТЫ АНТИТЕЛ С ЛЕКАРСТВЕННЫМИ СРЕДСТВАМИ, ХАРАКТЕРИЗУЮЩИЕСЯ ВЫСОКОЙ IN VIVO ПЕРЕНОСИМОСТЬЮ | 2018 |
|
RU2764031C2 |
| БЕЛКИ, СВЯЗЫВАЮЩИЕ РЕЦЕПТОР ПРОЛАКТИНА, И ИХ ПРИМЕНЕНИЕ | 2013 |
|
RU2664463C2 |
| КОНЪЮГАТ АНТИТЕЛО-ЛЕКАРСТВЕННОЕ СРЕДСТВО, ПРОМЕЖУТОЧНОЕ СОЕДИНЕНИЕ ДЛЯ ЕГО ПОЛУЧЕНИЯ, СПОСОБ ЕГО ПОЛУЧЕНИЯ И ЕГО ПРИМЕНЕНИЕ | 2020 |
|
RU2800137C1 |
| КОНЪЮГАТЫ АНТИТЕЛО-ЛЕКАРСТВЕННОЕ СРЕДСТВО НА ОСНОВЕ ЭРИБУЛИНА И СПОСОБЫ ПРИМЕНЕНИЯ | 2017 |
|
RU2754369C2 |
| АНТИ-ТАТ226 АНТИТЕЛА И ИММУНОКОНЪЮГАТЫ | 2007 |
|
RU2448980C2 |
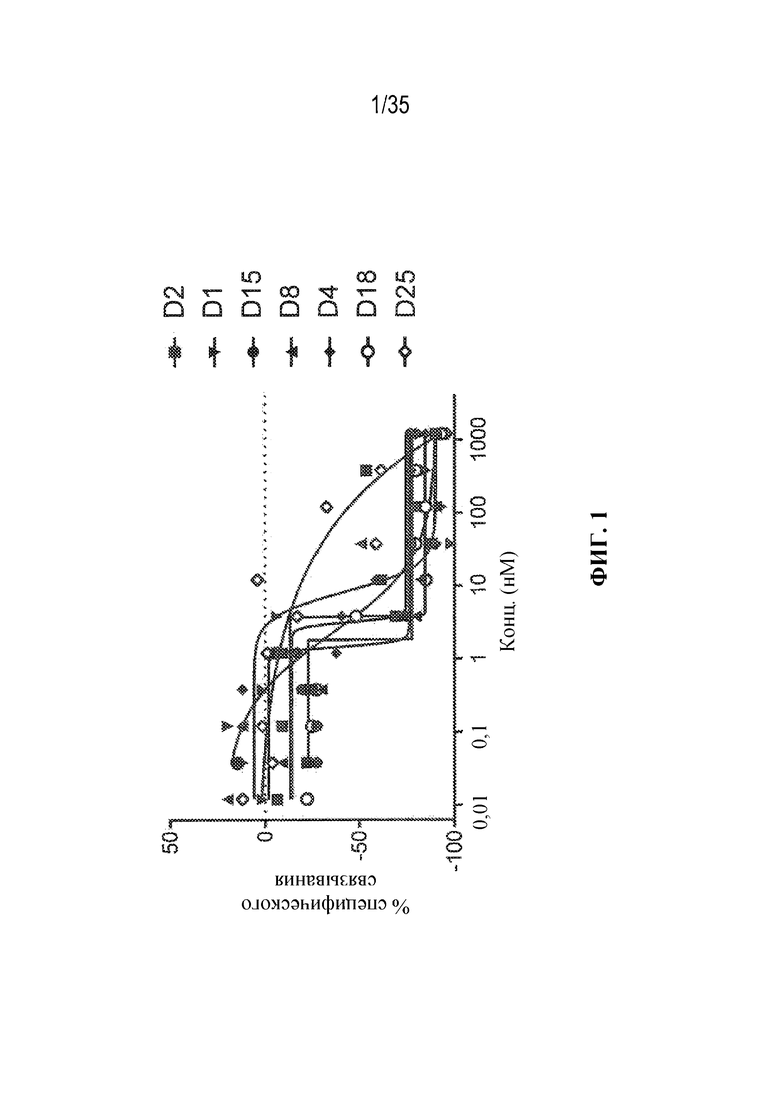
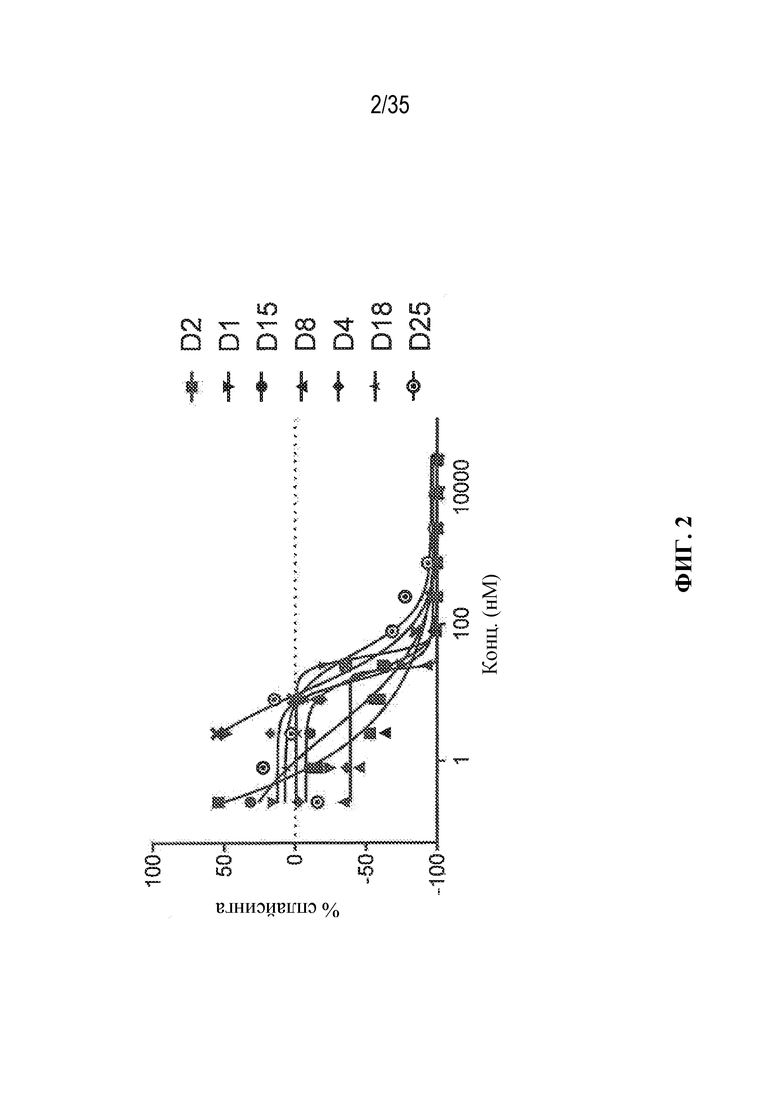
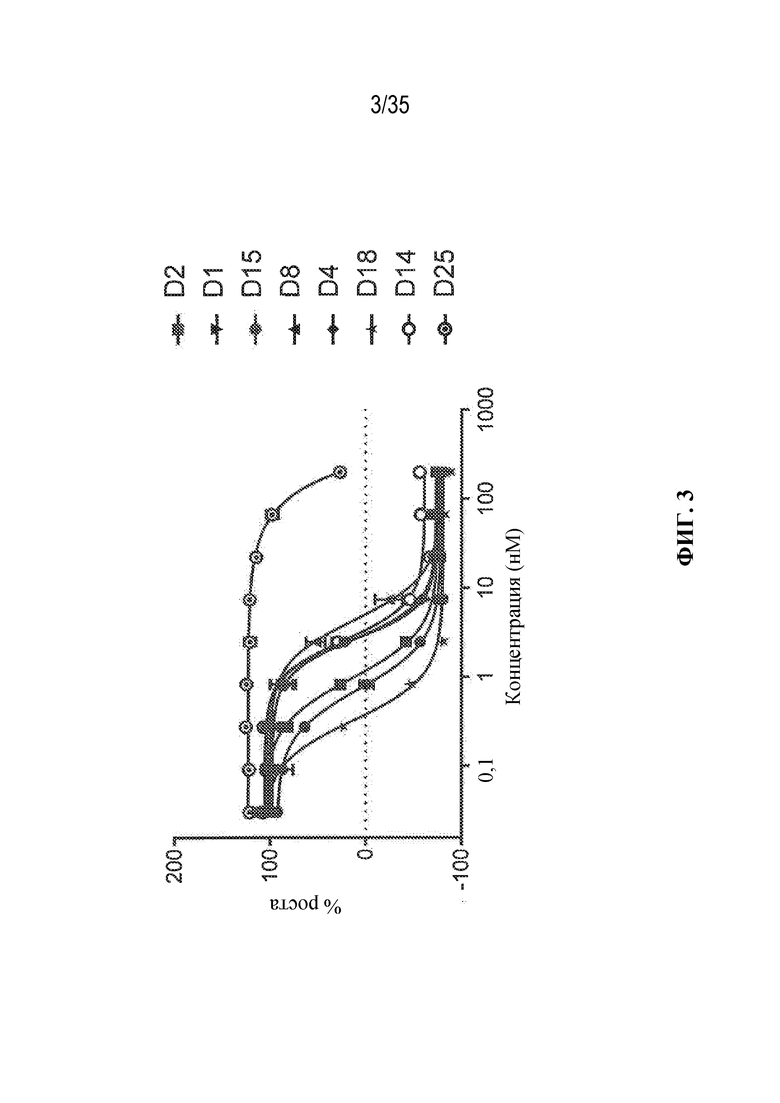
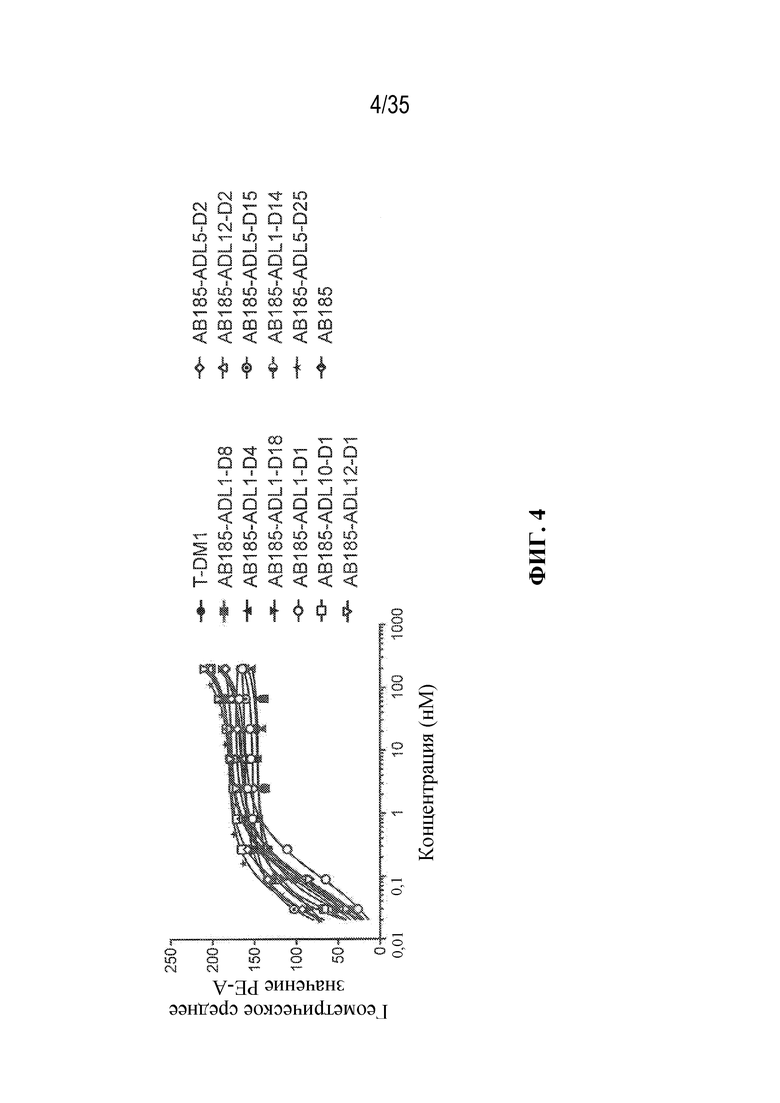
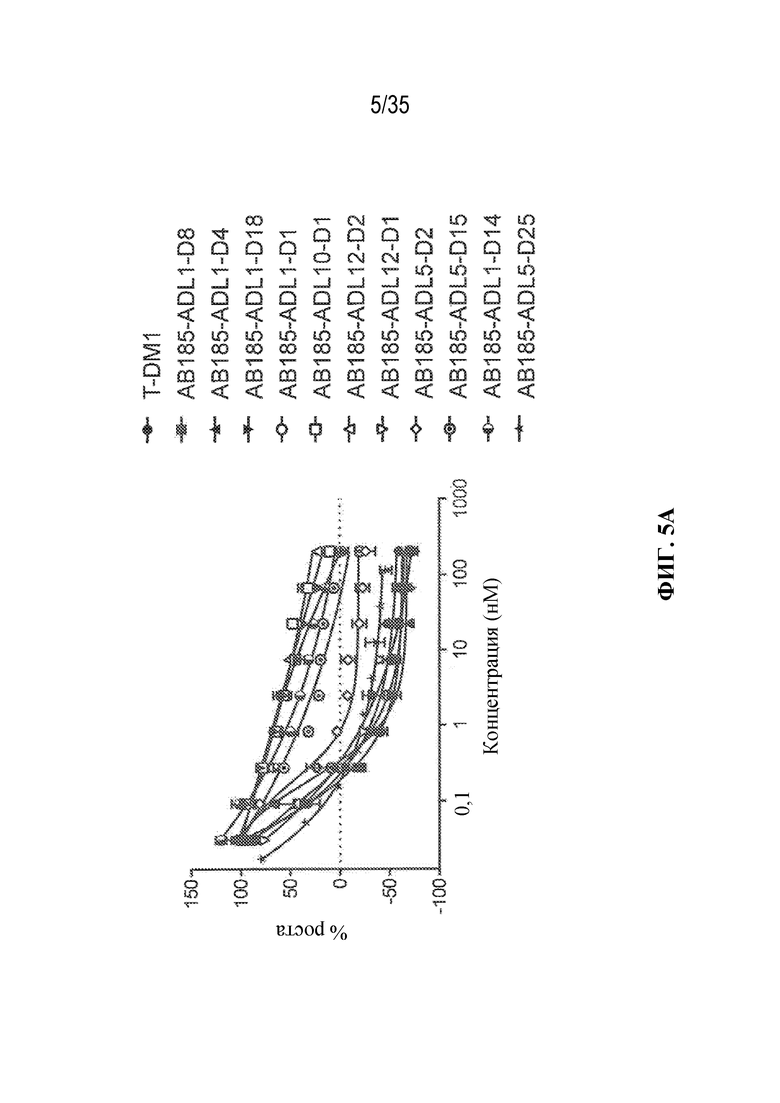
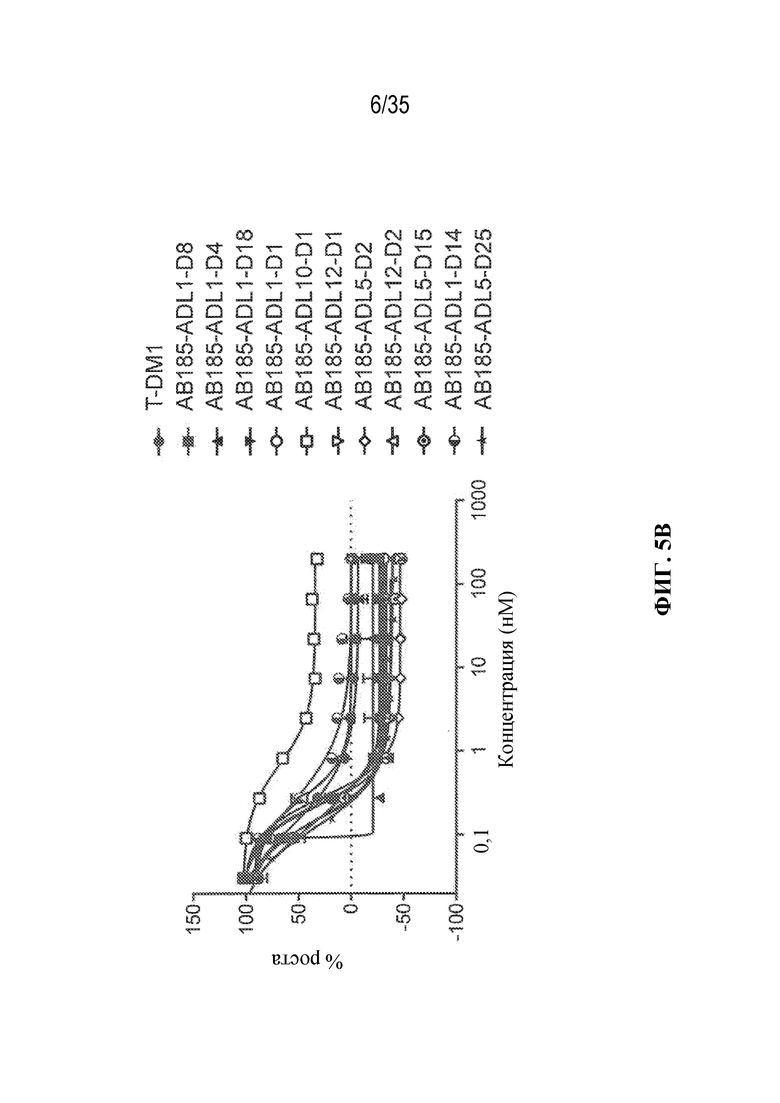
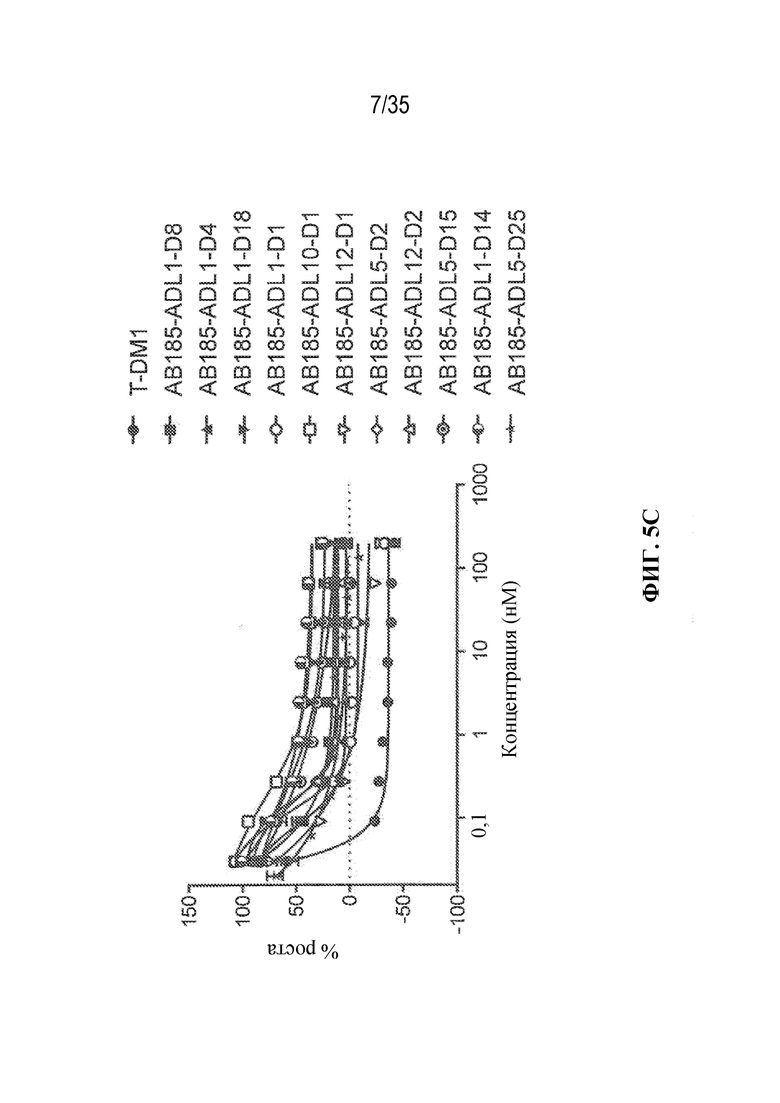
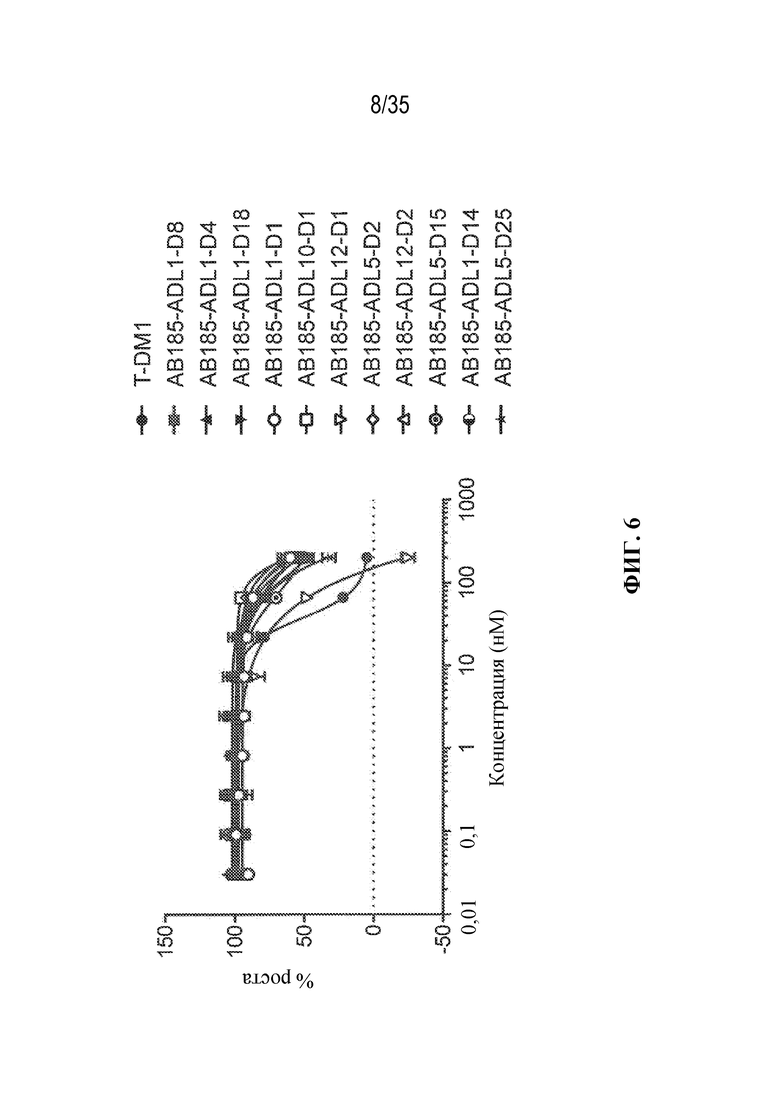
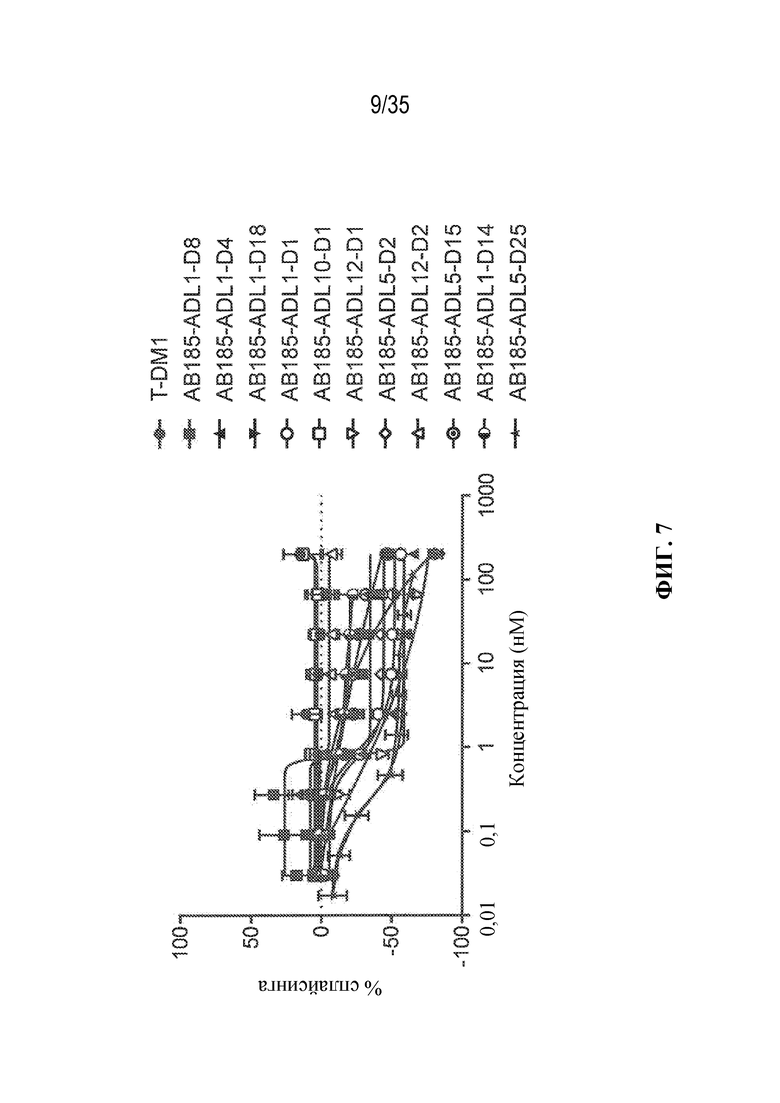
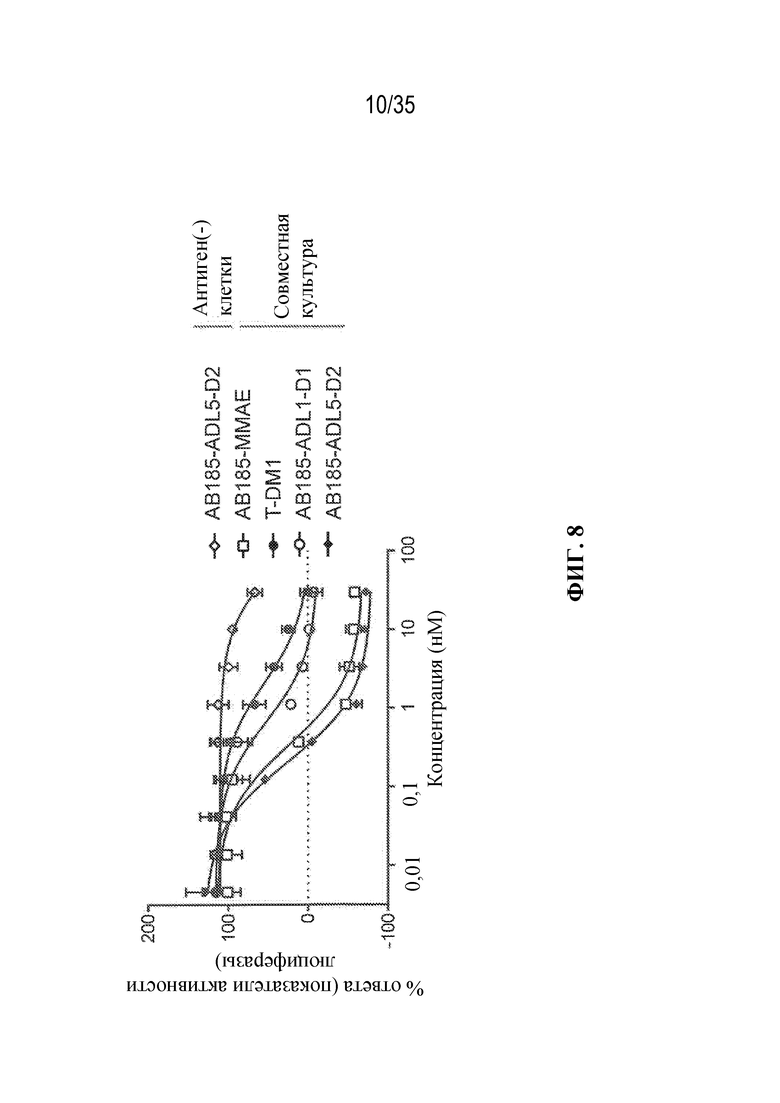
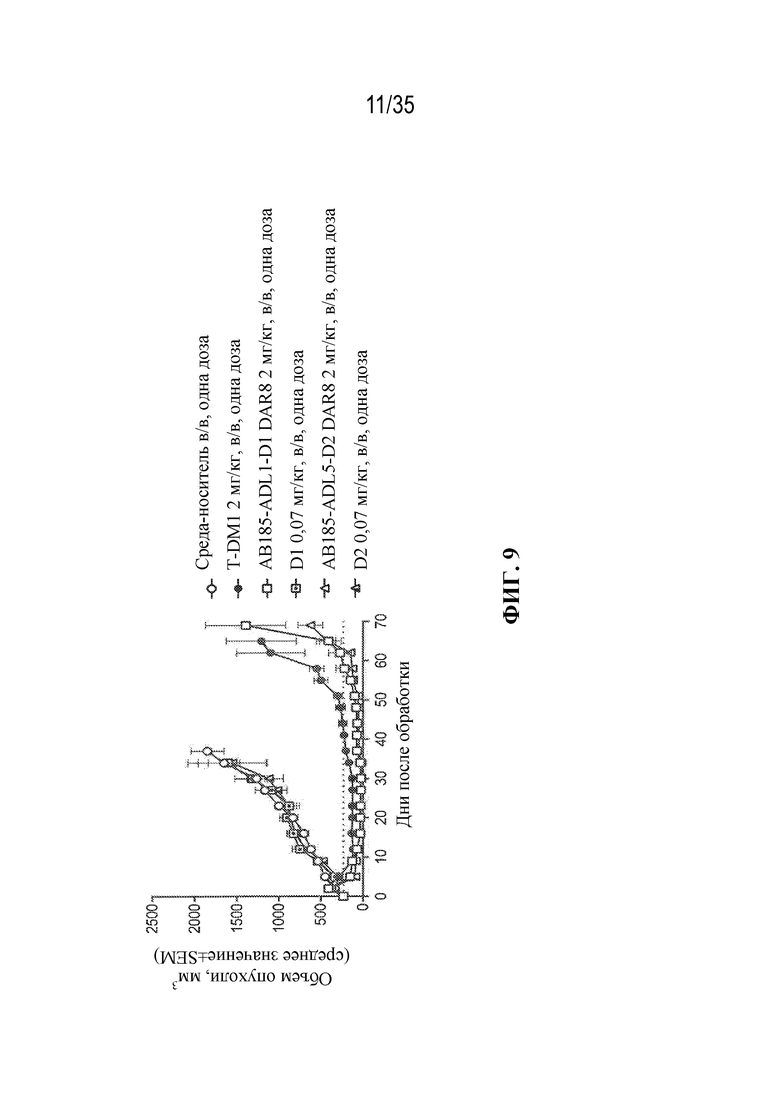
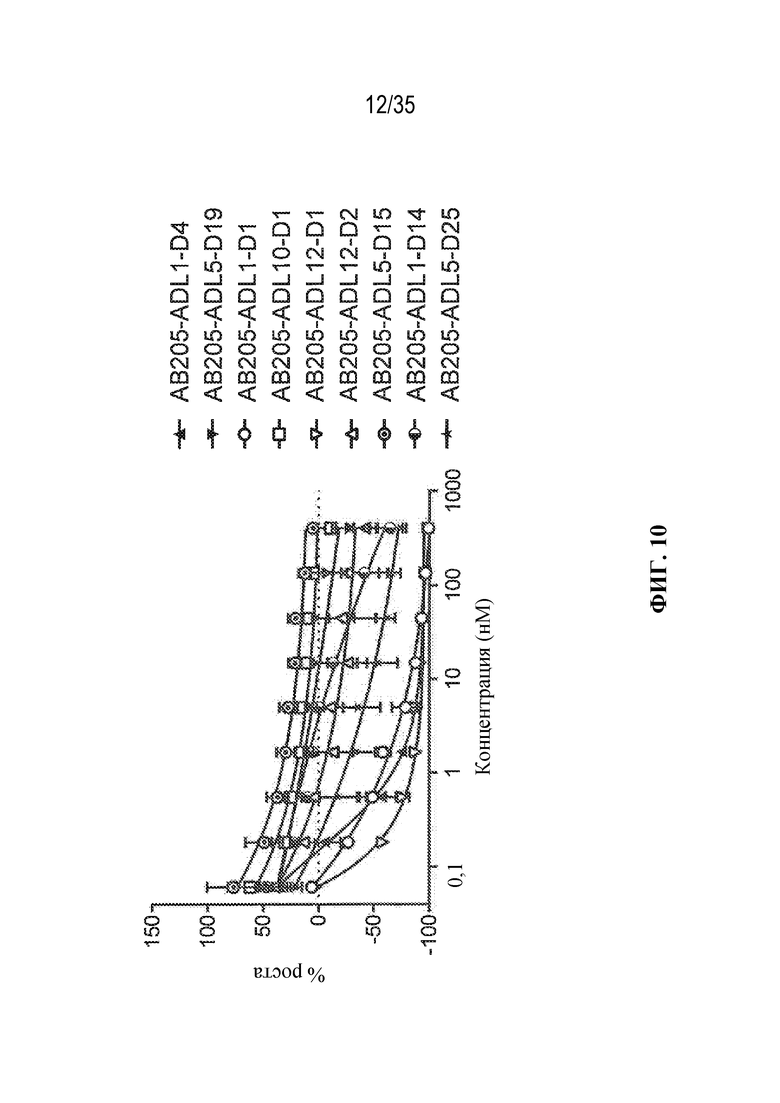
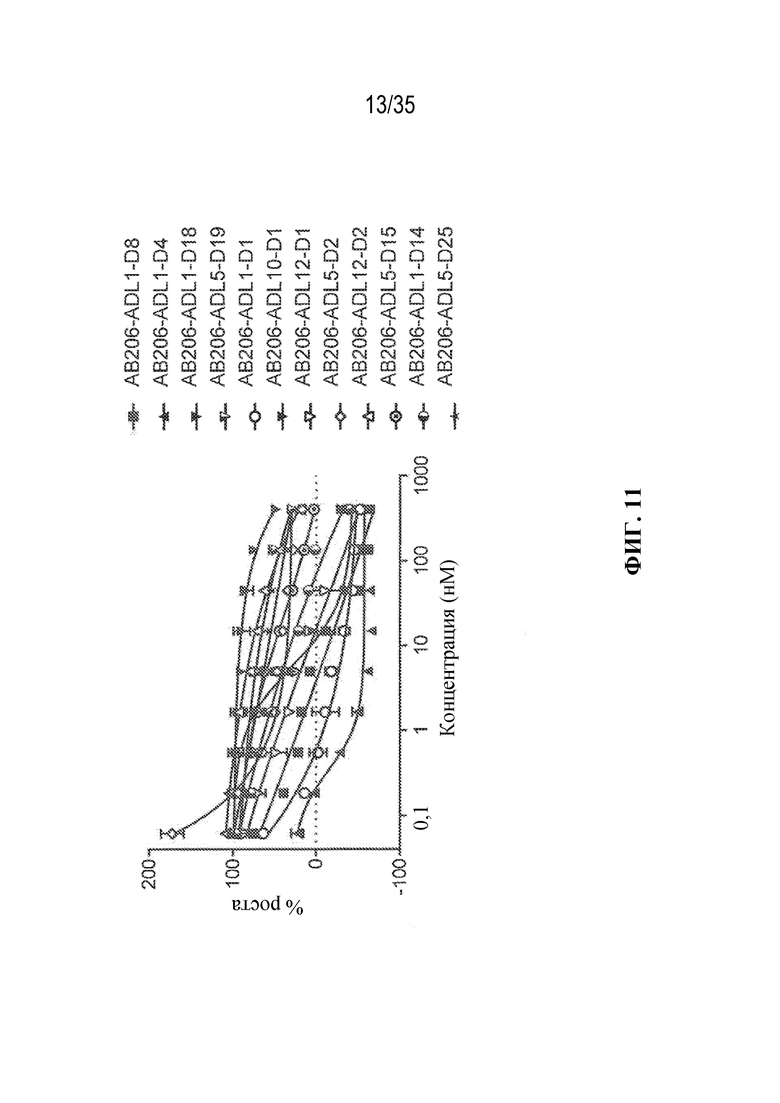
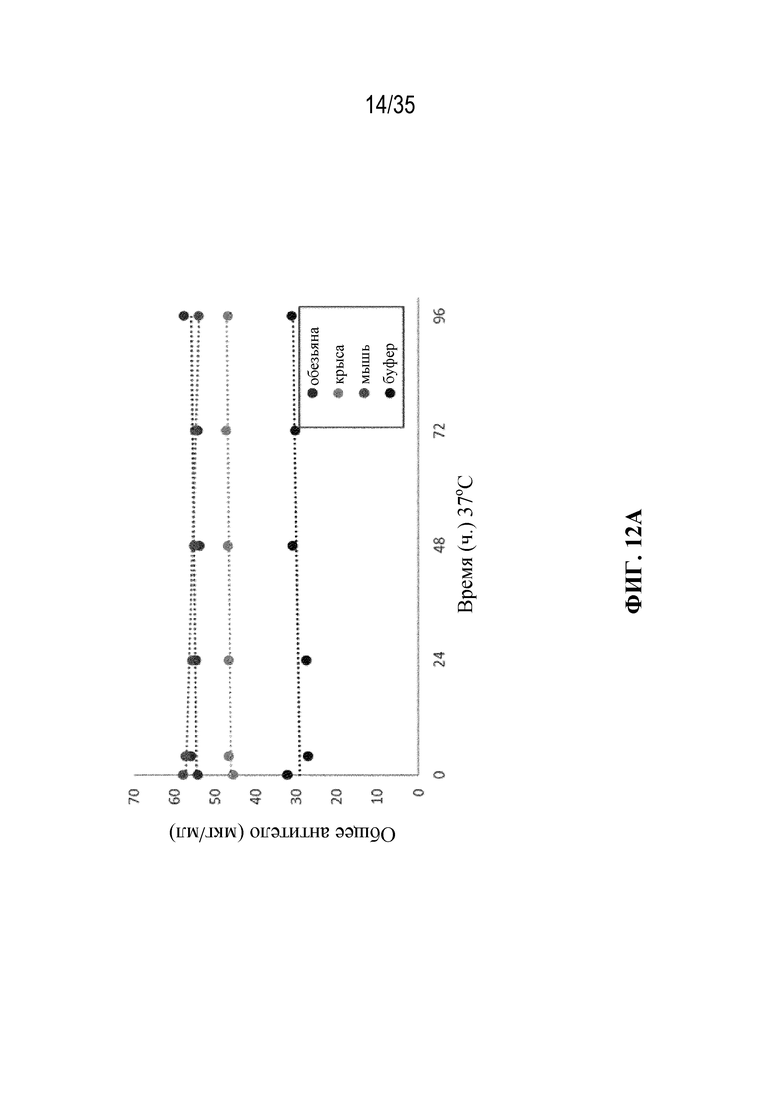
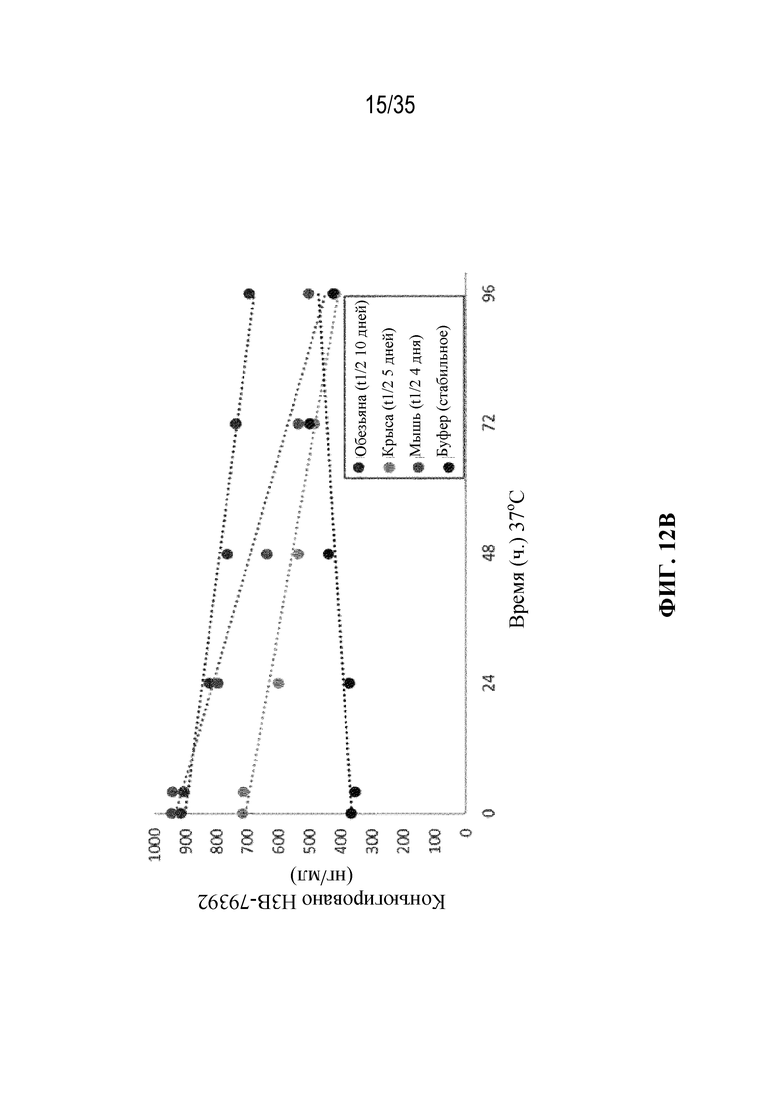
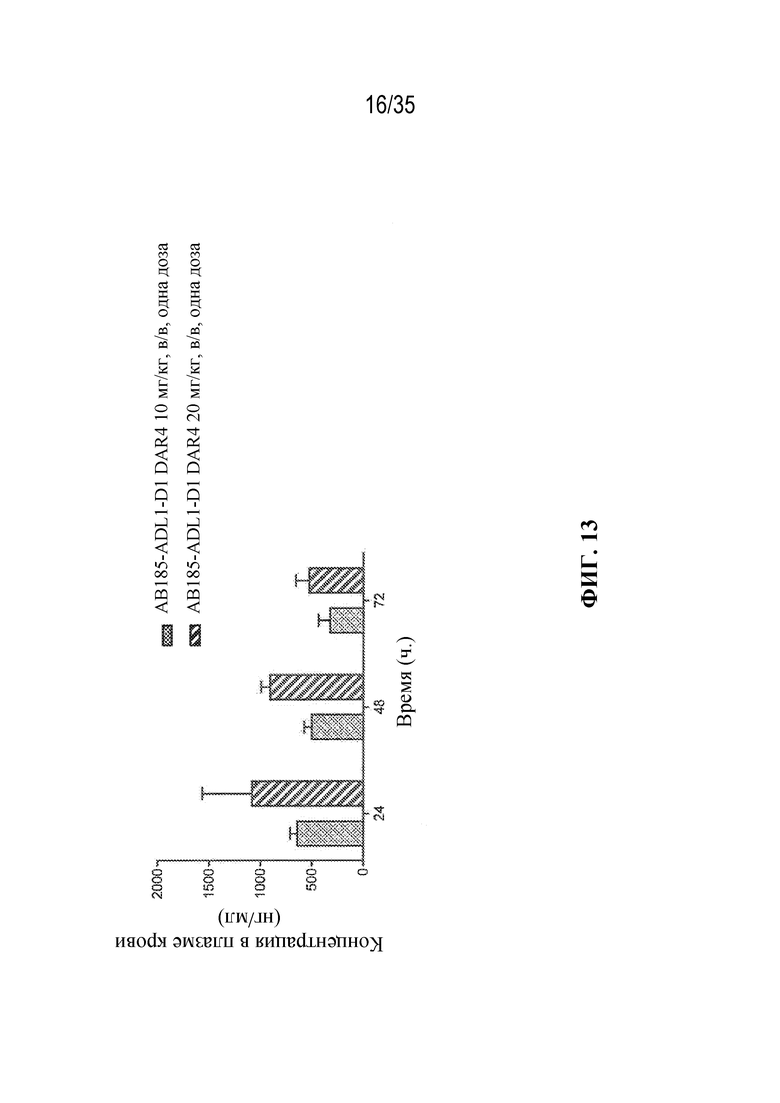
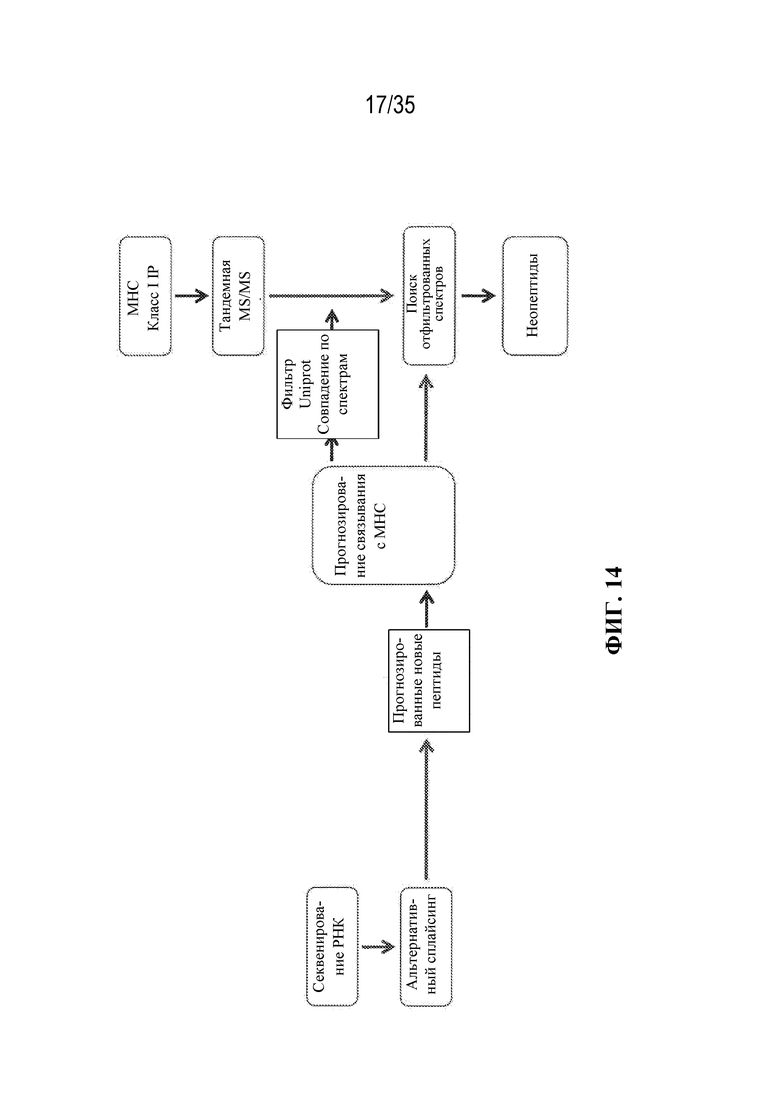
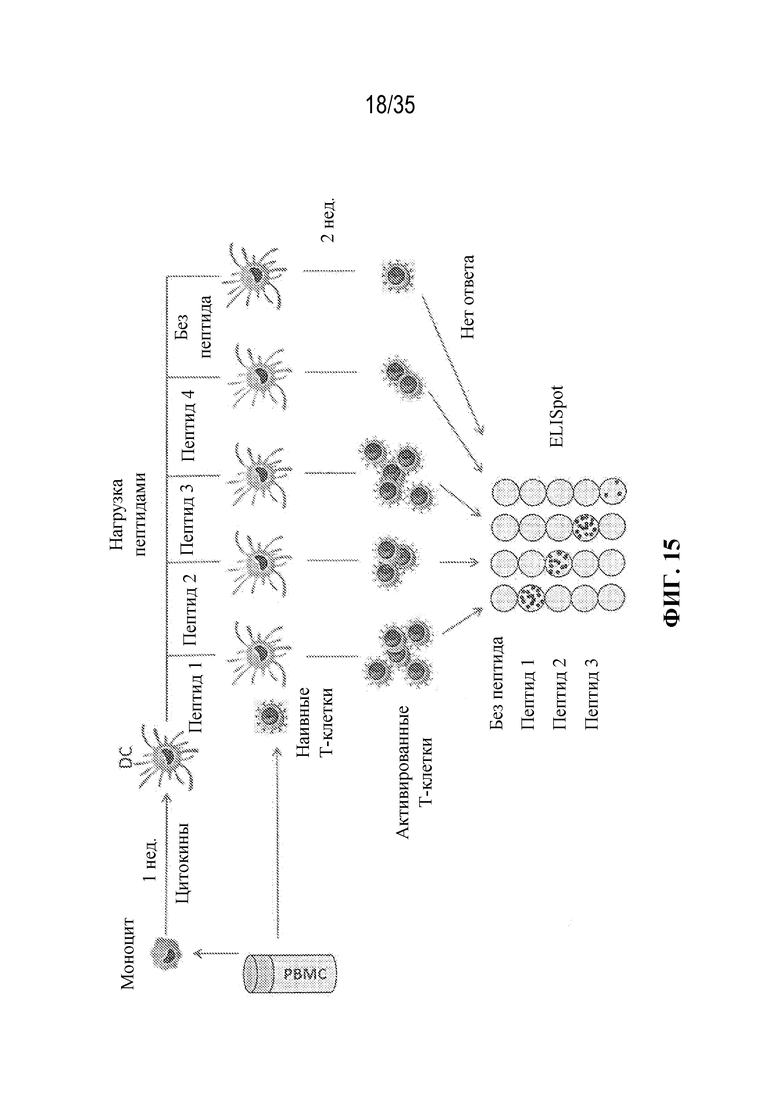
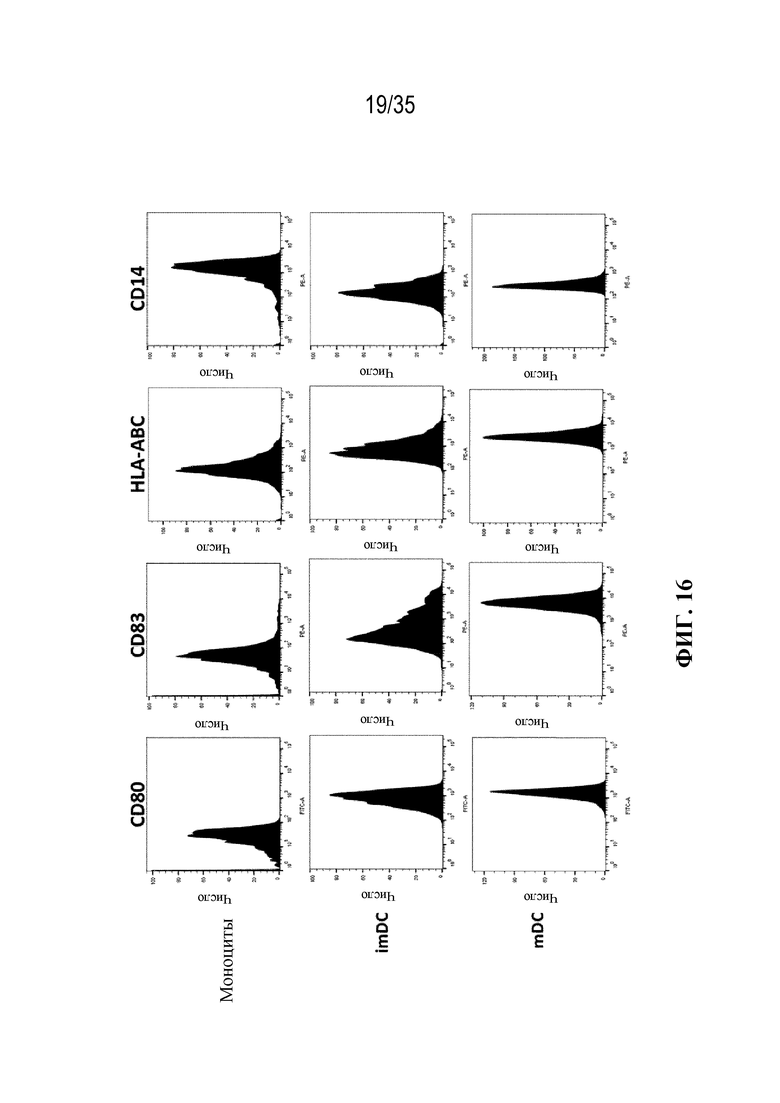

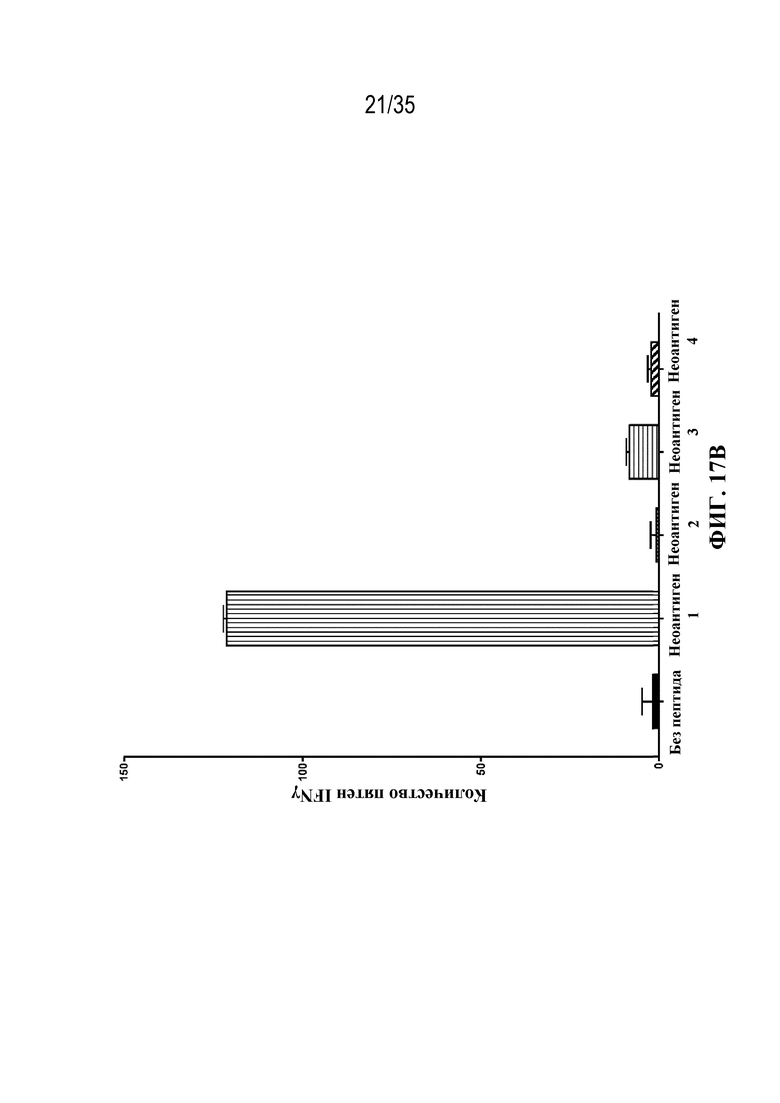

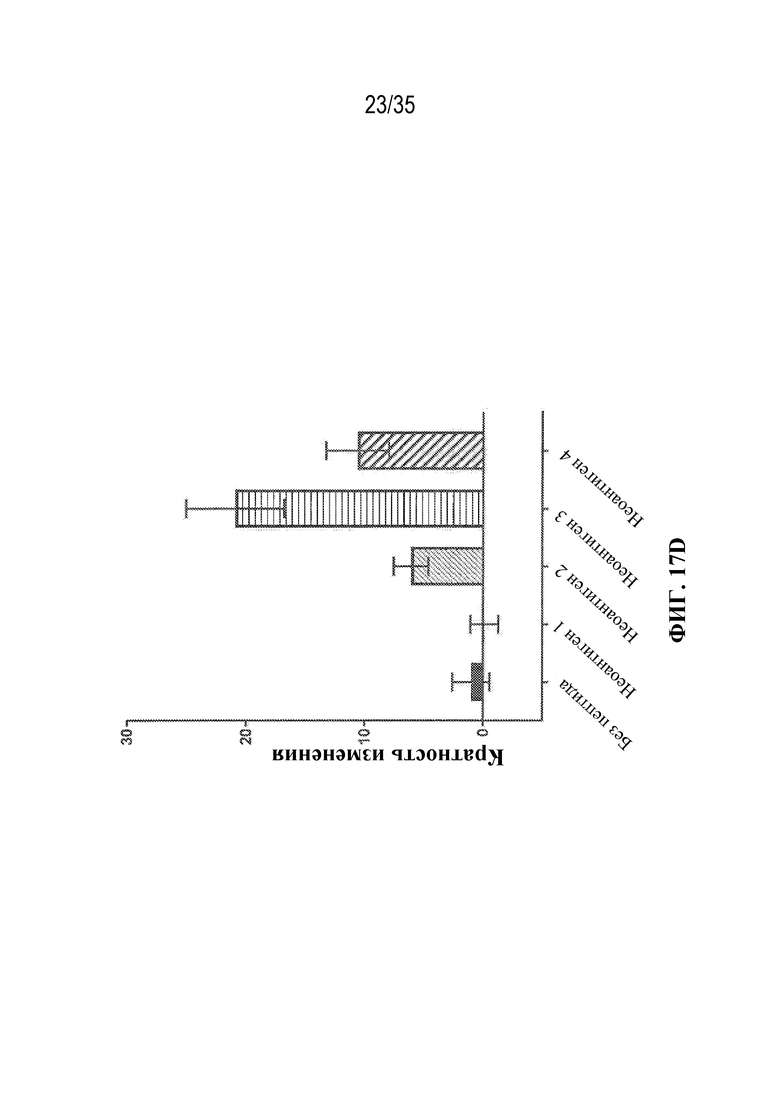
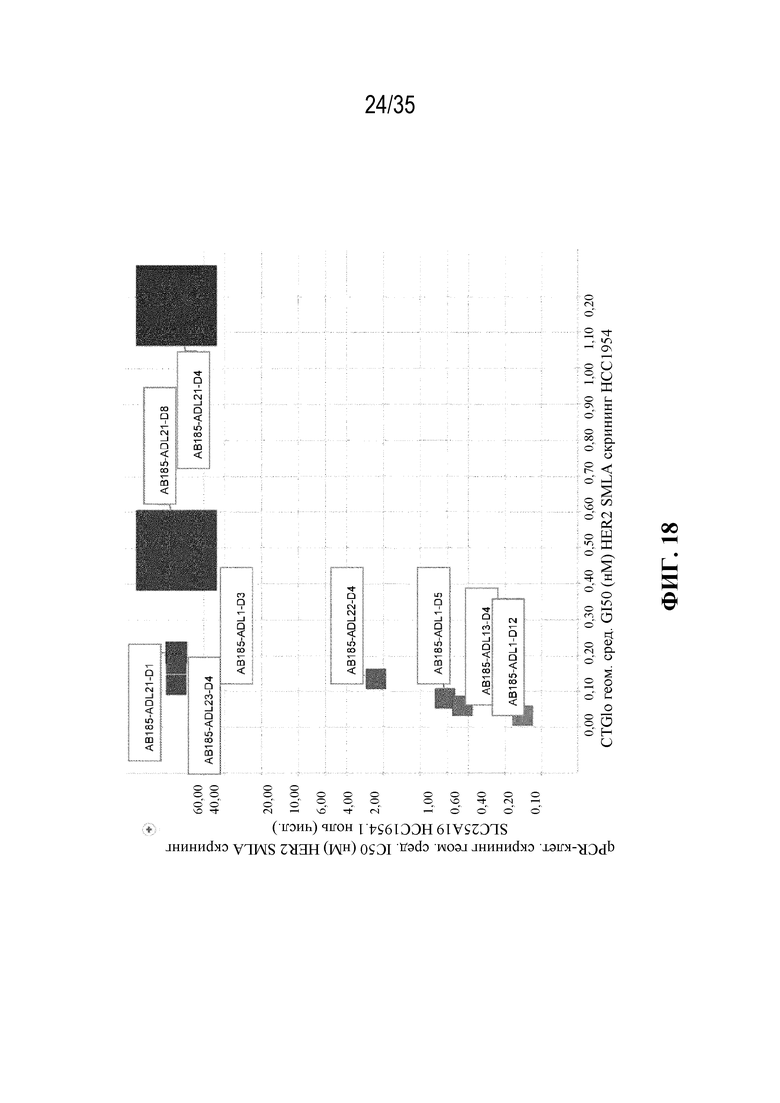
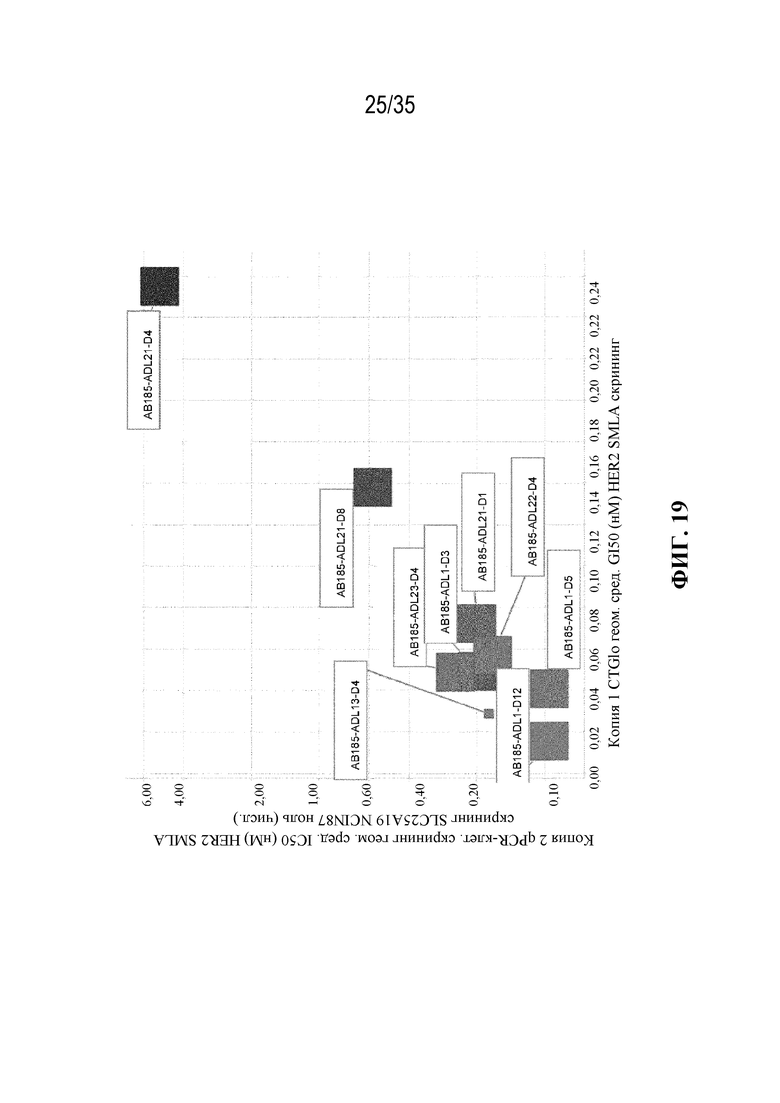
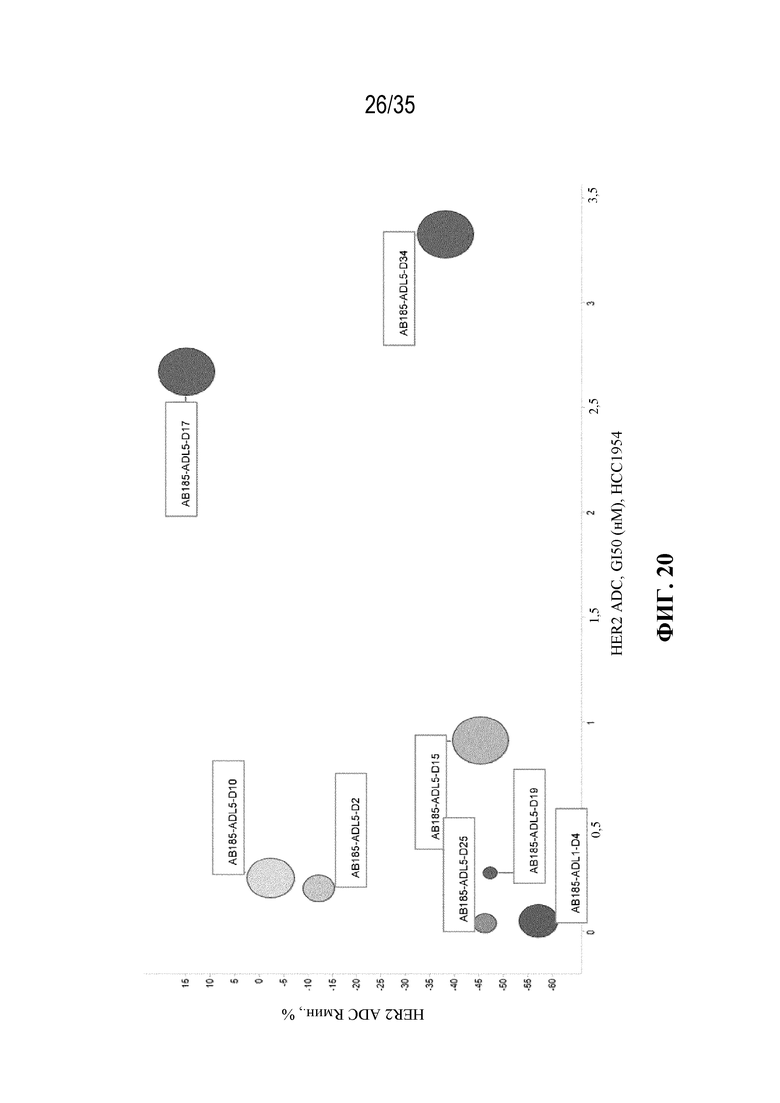
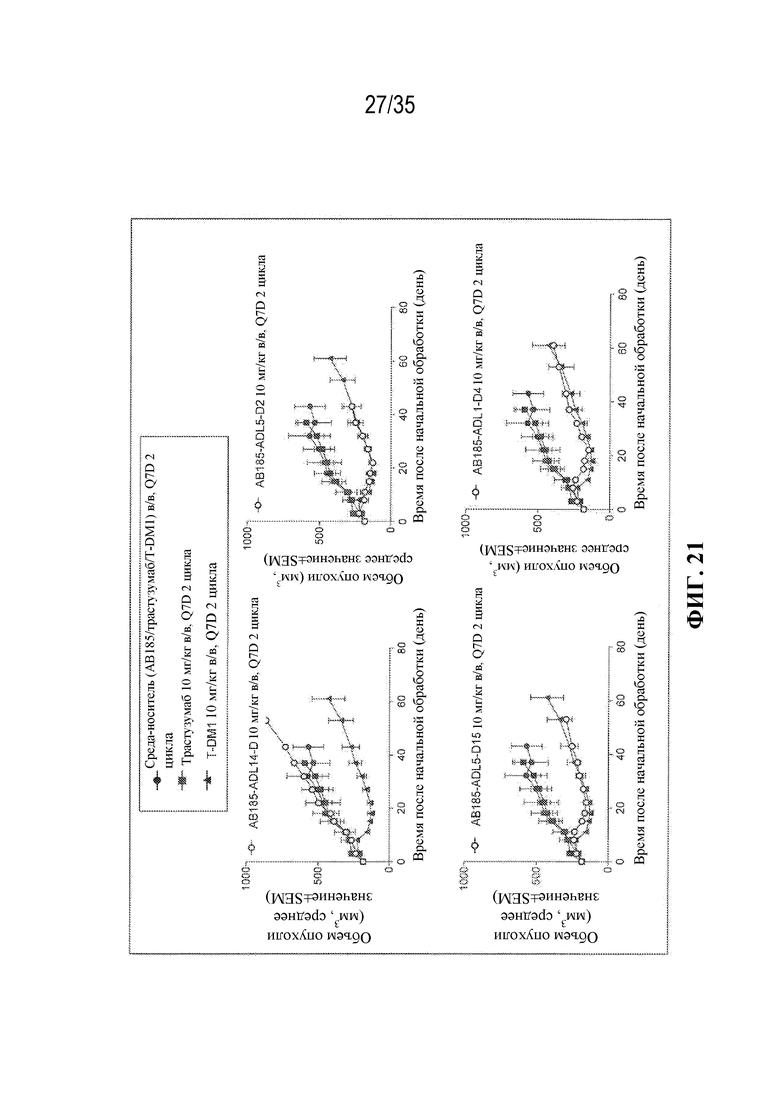
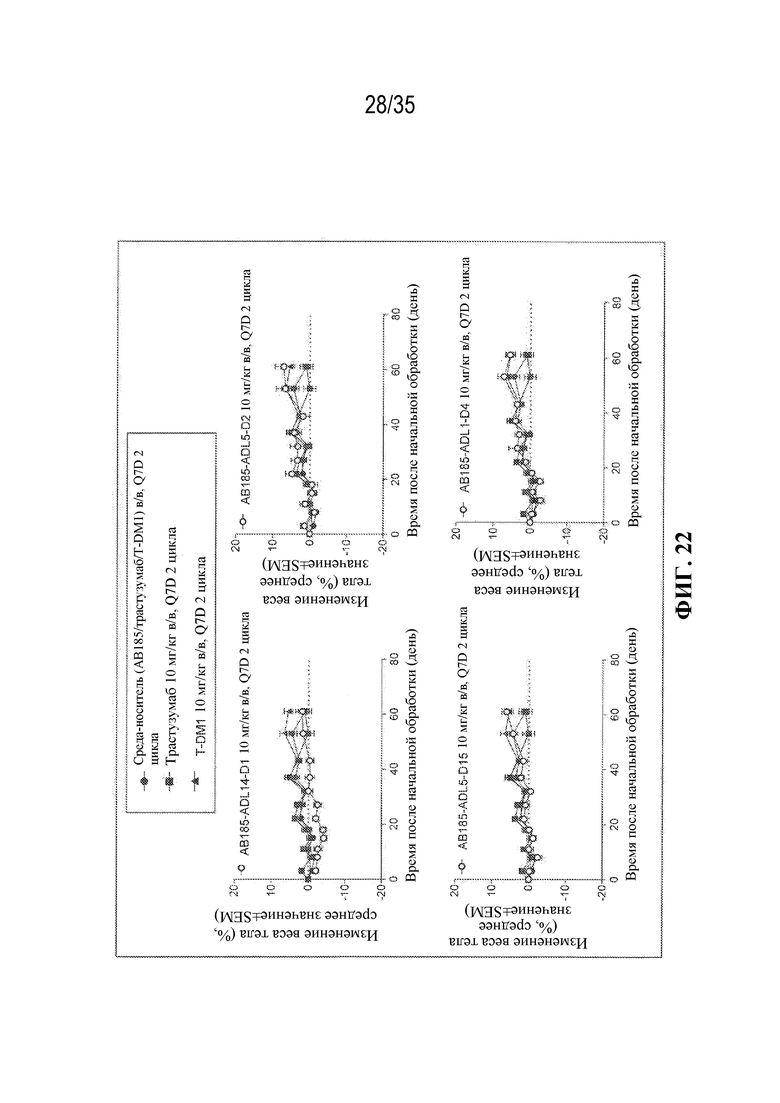
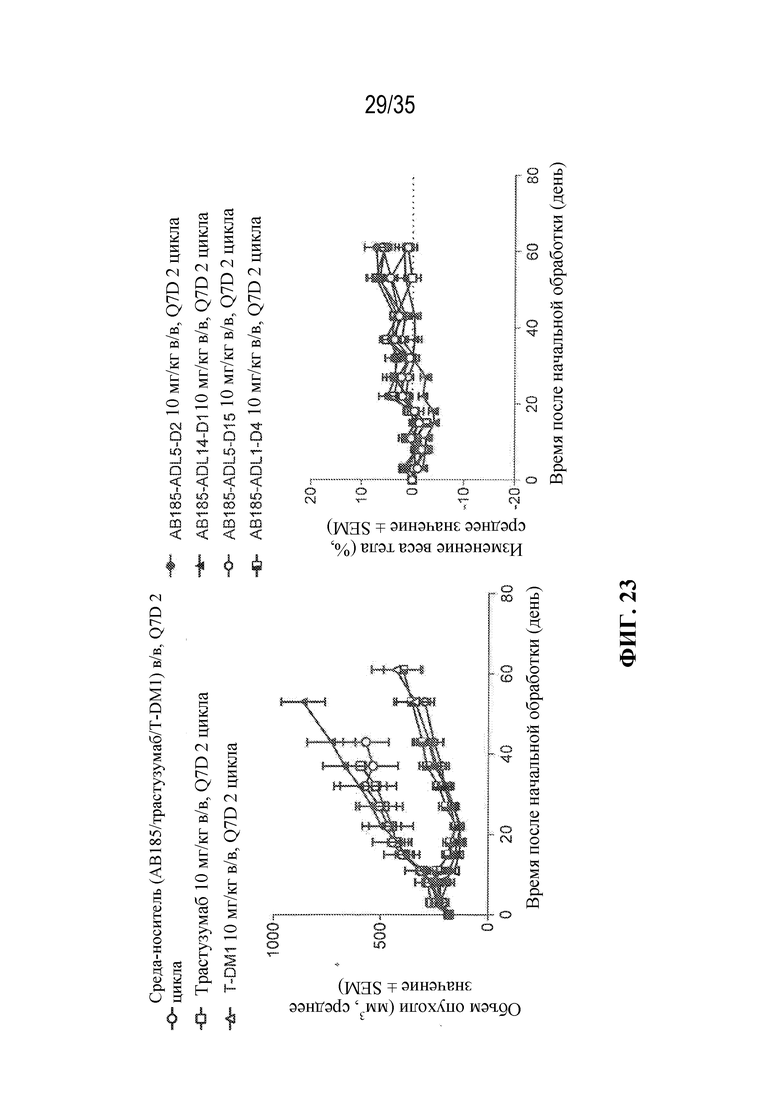
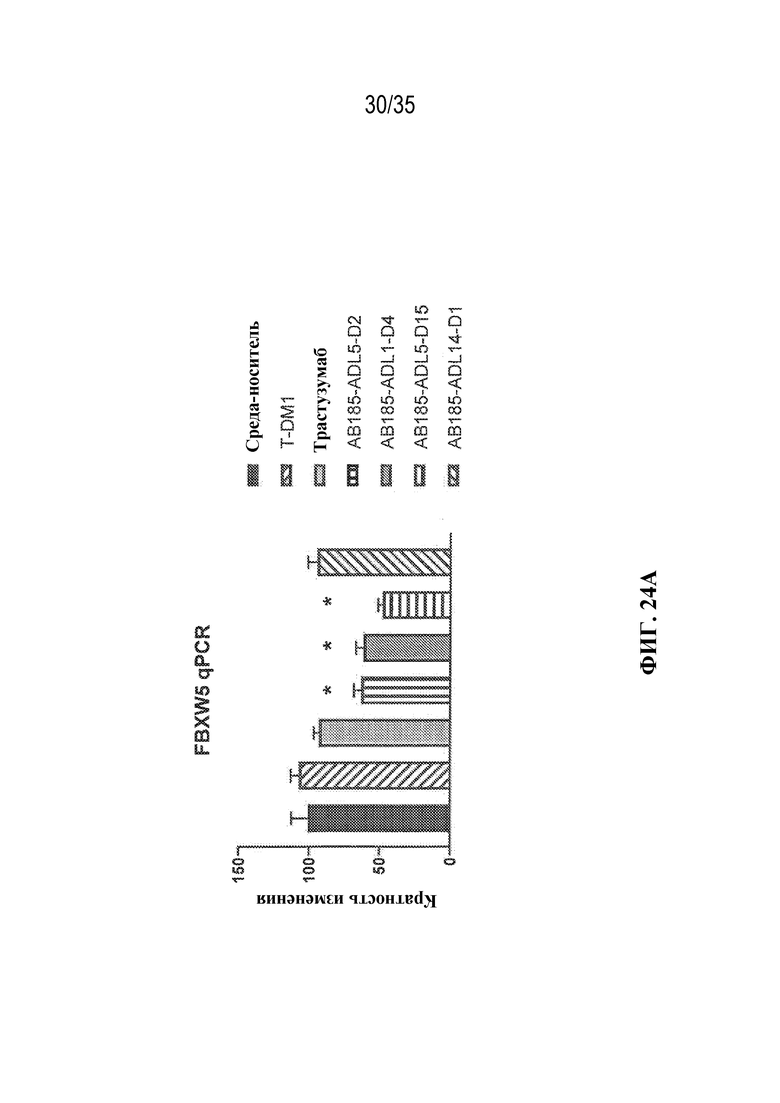
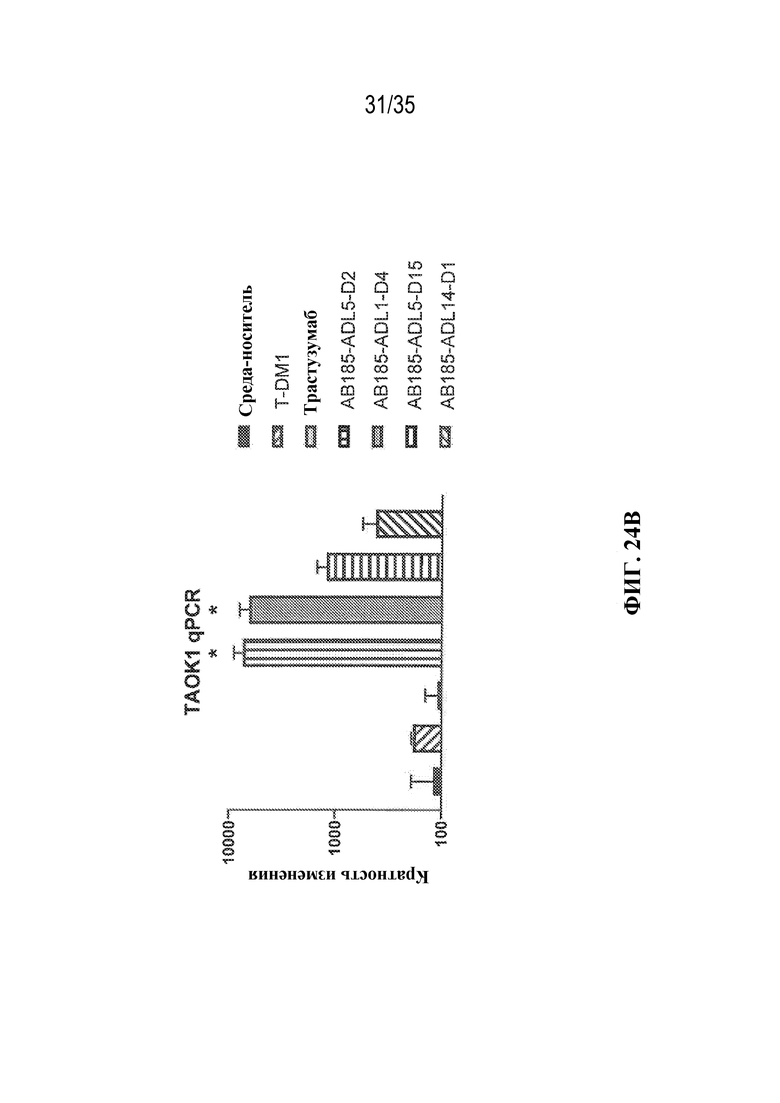
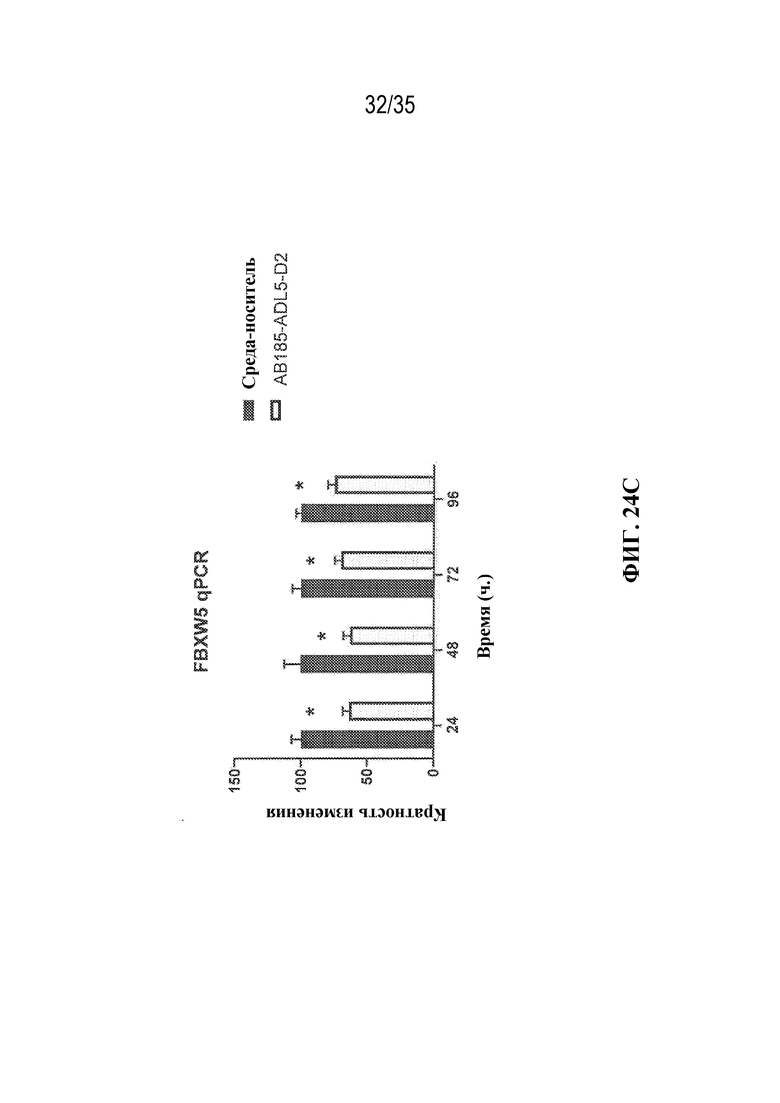
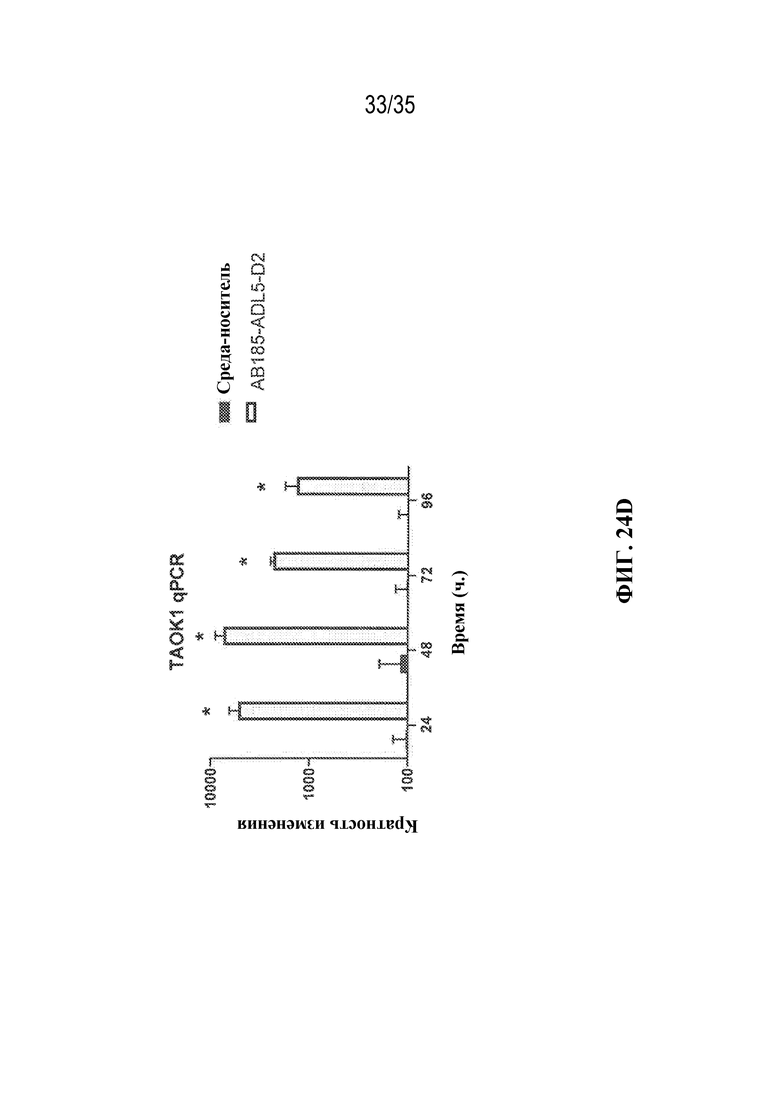
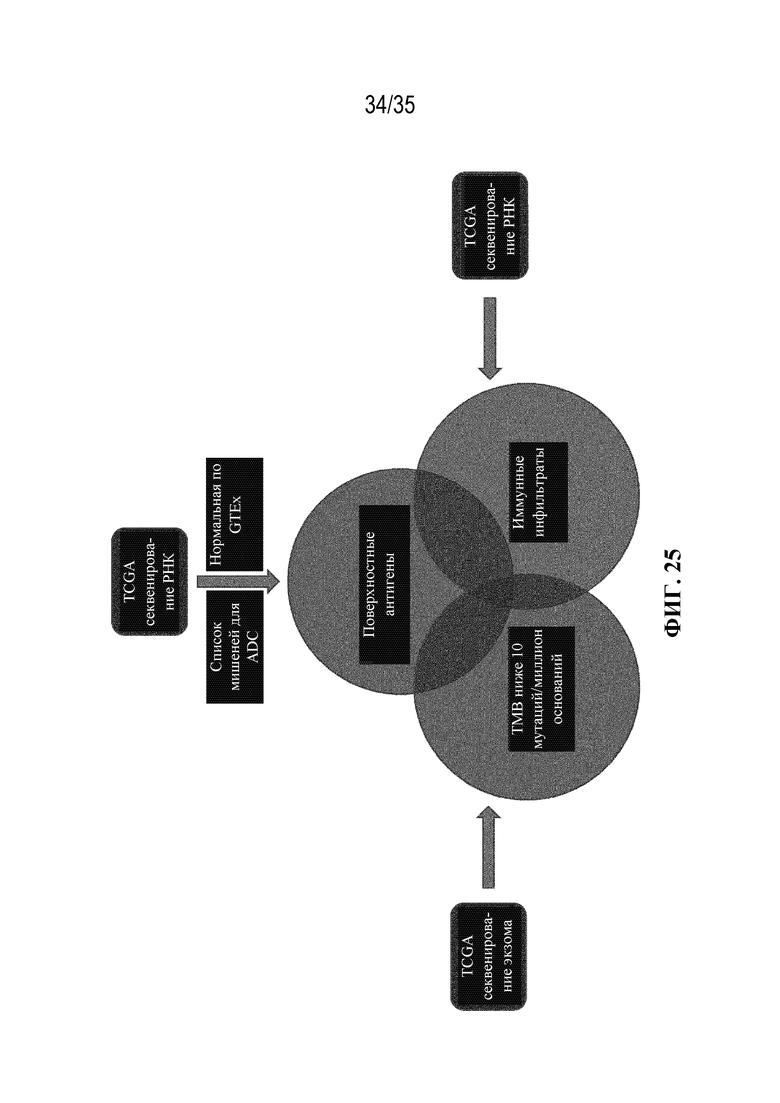
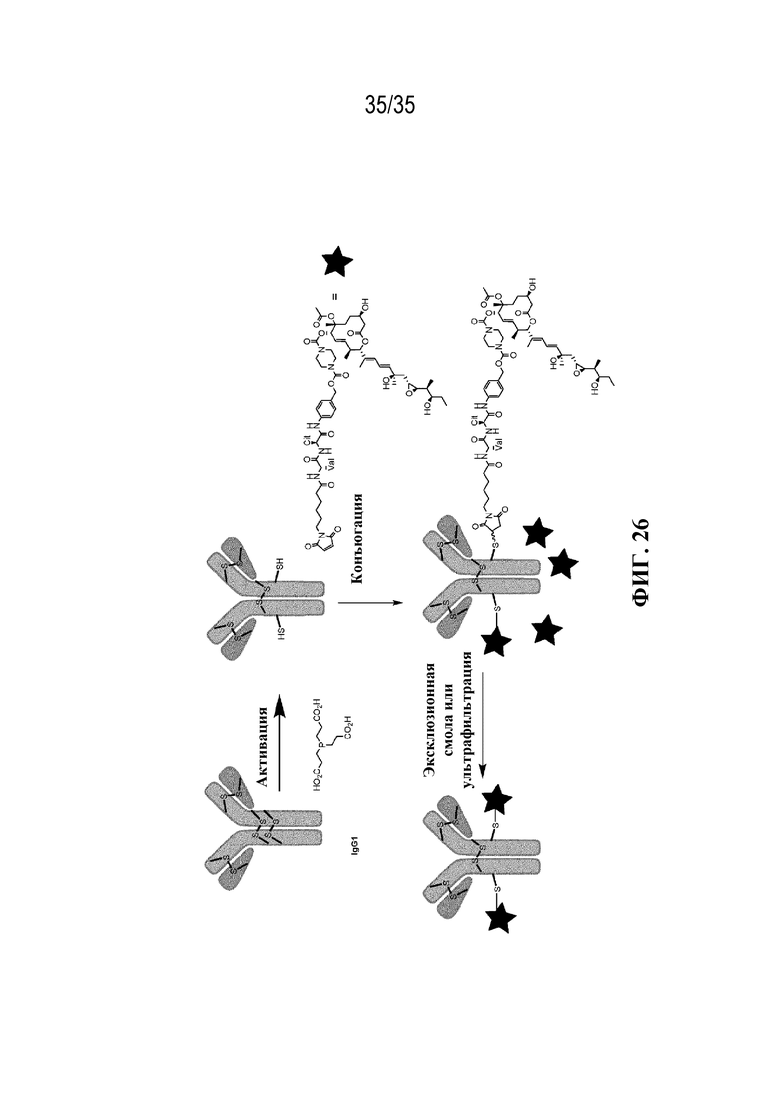
Изобретение относится к области биотехнологии, в частности к новым терапевтическим конъюгатам антител с лекарственными средствами, и может быть использовано в медицине. Изобретение раскрывает конъюгаты антител, способных связываться с опухолевыми антигенами, с фрагмент-лекарственными средствами, представляющими собой модуляторы сплайсинга, причем конъюгируемые фрагменты соединены между собой через линкер. Изобретение может быть применимо при лечении неопластических нарушений, в частности рака. 9 н. и 43 з.п. ф-лы, 10 пр., 27 табл., 26 ил.
1. Конъюгат для лечения неопластического нарушения, причем конъюгат включает формулу (I)
Ab-(L-D)p (I) [формула (I)],
где Ab представляет собой антитело или антигенсвязывающий фрагмент, которые целенаправленно воздействуют на неопластическую клетку;
D представляет собой модулятор сплайсинга;
L представляет собой линкер, который ковалентно связывает Ab с D; и
p составляет целое число от 1 до 15;
отличающийся тем, что
что L-D включает соединение формулы (III)
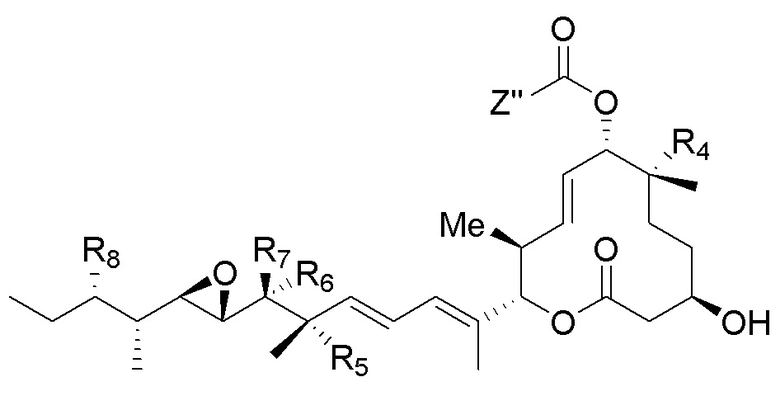 (III)
(III)
или его фармацевтически приемлемую соль, где:
R1 отсутствует или выбран из водорода, C1-C6алкильных групп, C1-C6алкилалкоксигрупп, C1-C6алкиламиногрупп, групп C1-C6алкилкарбоновой кислоты, C1-C6алкилгидроксигрупп, C3-C8циклоалкильных групп, бензильных групп, C3-C8гетероциклильных групп, групп -O-C(=O)-(C1-C6алкил) и -CD3;
R2 представляет собой линкер L, содержащий по меньшей мере один расщепляемый фрагмент;
R3 выбран из водорода, C1-C6алкильных групп, C1-C6алкилалкоксигрупп, C1-C6алкиламиногрупп, групп C1-C6алкилкарбоновой кислоты, C1-C6алкилгидроксигрупп, C3-C8циклоалкильных групп, бензильных групп, C3-C8гетероциклильных групп и групп -O-C(=O)-(C1-C6алкил);
каждый из R4, R5 и R8 независимо выбран из водорода, гидроксильных групп, групп -O-(C1-C6алкил), групп -O-C(=O)-(C1-C6алкил) и C1-C6алкильных групп;
каждый из R6 и R7 независимо выбран из водорода, -O-R17, -O-C(=O)-R17, -O-C(=O)-NR15R16, C1-C6алкильных групп и -NR15R16;
каждый из R15 и R16 независимо выбран из водорода, R17, -C(=O)-R17 и -C(=O)-O-R17;
R17 выбран из водорода, C1-C6алкильных групп, C3-C8циклоалкильных групп, бензильных групп и C3-C8гетероциклильных групп; и
Z'' выбран из  ,
,  ,
, 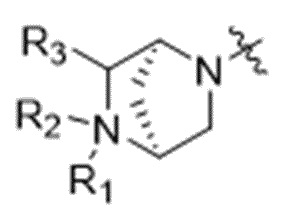 ,
, 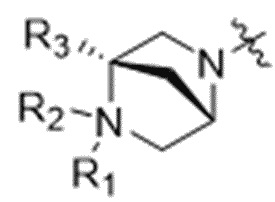 и
и 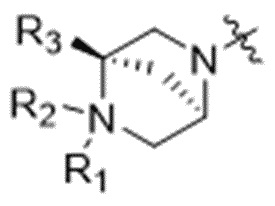 ,
,
где каждый из R1, R3, R4, R5, R6, R7, R8, R15, R16 и R17 независимо замещен 0-3 группами, независимо выбранными из атомов галогена, гидроксильных групп, C1-C6алкильных групп, групп -O-(C1-C6алкил), -NR15R16, C3-C8циклоалкильных групп, C1-C6алкилгидроксигрупп, C1-C6алкилалкоксигрупп, бензильных групп и C3-C8гетероциклильных групп;
где по меньшей мере один из R6 и R7 представляет собой водород; и
если Z'' представляет собой  и R3, R6 и R7 представляют собой H, R4 представляет собой метокси, а R5 представляет собой гидроксил, то R1 не является ни отсутствующим, ни метильным.
и R3, R6 и R7 представляют собой H, R4 представляет собой метокси, а R5 представляет собой гидроксил, то R1 не является ни отсутствующим, ни метильным.
2. Конъюгат по п. 1, где:
R1 отсутствует или выбран из водорода, C1-C4алкильных групп, групп C1-C4алкилкарбоновой кислоты, C1-C4алкилгидроксигрупп и C3-C8циклоалкильных групп;
R2 представляет собой линкер L, содержащий по меньшей мере один расщепляемый фрагмент;
R3 выбран из водорода, C1-C4алкильных групп, C1-C4алкилалкоксигрупп, групп C1-C4алкилкарбоновой кислоты и C1-C4алкилгидроксигрупп;
R4 выбран из водорода, гидроксильных групп, групп -O-(C1-C4алкил), групп -O-C(=O)-(C1-C4алкил) и C1-C4алкильных групп;
R5 выбран из водорода, гидроксильных групп, групп -O-(C1-C4алкил) и C1-C4алкильных групп;
R6 выбран из водорода, -O-R17, -O-C(=O)-R17 и C1-C4 алкильных групп;
R7 выбран из водорода, -O-R17, -O-C(=O)-R17, -O-C(=O)-NR15R16, C1-C6алкильных групп и -NR15R16;
R8 выбран из водорода, гидроксильных групп, групп -O-(C1-C4алкил) и C1-C4алкильных групп;
каждый из R15 и R16 независимо выбран из водорода, R17, -C(=O)-R17 и -C(=O)-O-R17;
R17 выбран из водорода, C1-C6алкильных групп, C3-C8циклоалкильных групп, бензильных групп и C3-C8гетероциклильных групп; и
Z'' выбран из  ,
, 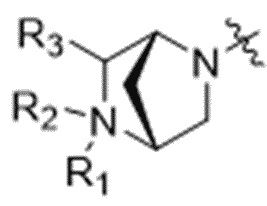 ,
, 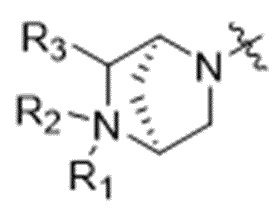 ,
, 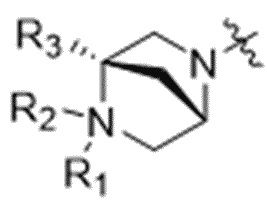 и
и 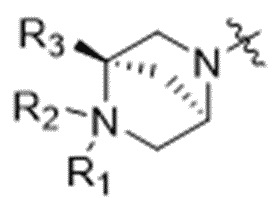 ;
;
где каждый из R1, R3, R4, R5, R6, R7, R8, R15, R16 и R17 независимо замещен 0-3 группами, независимо выбранными из атомов галогена, гидроксильных групп, C1-C6алкильных групп, групп -O-(C1-C6алкил), -NR15R16, C3-C8циклоалкильных групп, C1-C6алкилгидроксигрупп, C1-C6алкилалкоксигрупп, бензильных групп и C3-C8гетероциклильных групп;
где по меньшей мере один из R6 и R7 представляет собой водород; и
если Z'' представляет собой  и R3, R6 и R7 представляют собой H, R4 представляет собой метокси, а R5 представляет собой гидроксил, то R1 не является ни отсутствующим, ни метильным.
и R3, R6 и R7 представляют собой H, R4 представляет собой метокси, а R5 представляет собой гидроксил, то R1 не является ни отсутствующим, ни метильным.
3. Конъюгат по п. 1, где:
R1 отсутствует или выбран из водорода, метила и групп C1-C4алкилкарбоновой кислоты;
R2 представляет собой линкер L, содержащий по меньшей мере один расщепляемый фрагмент;
R3 выбран из водорода и групп C1-C4алкилкарбоновой кислоты;
R4 выбран из водорода, гидроксильных групп, групп -O-(C1-C4алкил), групп -O-C(=O)-(C1-C4алкил) и C1-C4алкильных групп;
R5 выбран из водорода и гидроксильных групп;
R6 представляет собой водород;
R7 представляет собой водород;
R8 выбран из водорода и гидроксильных групп; и
Z'' представляет собой  ;
;
где каждый из R1, R3, R4 независимо замещен 0-3 группами, независимо выбранными из атомов галогена, гидроксильных групп, C1-C6алкильных групп, групп -O-(C1-C6алкил), C3-C8циклоалкильных групп, C1-C6алкилгидроксигрупп, C1-C6алкилалкоксигрупп, бензильных групп и C3-C8гетероциклильных групп; и
где если R3, R6 и R7 представляют собой H, R4 представляет собой метокси, а R5 представляет собой гидроксил, то R1 не является ни отсутствующим, ни метильным.
4. Конъюгат по п.1, где L-D выбран из соединения формулы
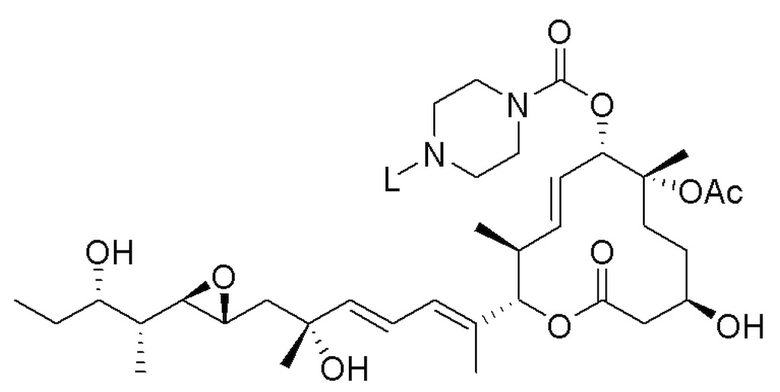
и его фармацевтически приемлемой соли.
5. Конъюгат по п.1, где L-D выбран из соединения формулы
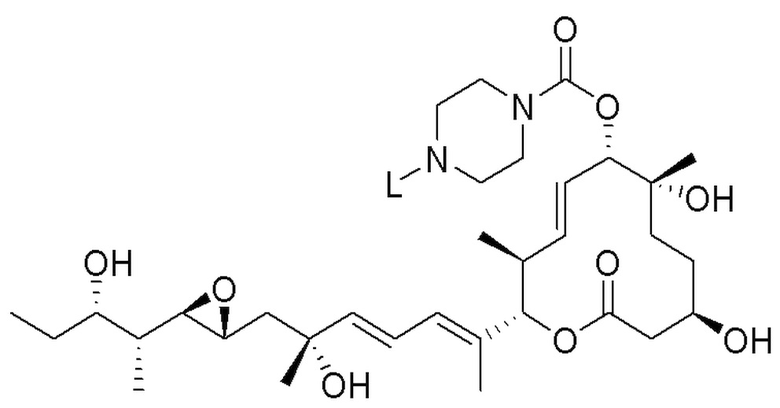
и его фармацевтически приемлемой соли.
6. Конъюгат по п.1, где по меньшей мере один расщепляемый фрагмент в линкере L содержит по меньшей мере один расщепляемый пептидный фрагмент.
7. Конъюгат по п.6, где расщепляемый пептидный фрагмент содержит валин-цитруллин (Val-Cit), валин-аланин (Val-Ala), глутамин-валин-цитруллин (Glu-Val-Cit) или аланин-аланин-аспарагин (Ala-Ala-Asn).
8. Конъюгат по п.7, где линкер содержит фрагмент малеимида (Mal).
9. Конъюгат по п.8, где фрагмент Mal включает малеимидокапроил (MC).
10. Конъюгат по п.9, где линкер содержит MC-Val-Cit или MC-Val-Ala.
11. Конъюгат по п.6, где линкер содержит по меньшей мере одно спейсерное звено, причем спейсерное звено содержит: (i) фрагмент полиэтиленгликоля (PEG), где фрагмент PEG содержит -(PEG)m- и m представляет собой целое число от 1 до 10; или (ii) алкильный фрагмент, где алкильный фрагмент содержит -(CH2)n- и n представляет собой целое число от 1 до 10.
12. Конъюгат по п.11, где спейсерное звено присоединено к малеимидному (Mal) фрагменту («Mal-спейсерное звено»).
13. Конъюгат по п.6, где расщепляемый фрагмент в линкере L содержит валин (Val), присоединенный к аланину (Ala), где Ala ковалентно присоединен к соединению формулы (III) непосредственно или через необязательное спейсерное звено.
14. Конъюгат по п.6, где расщепляемый фрагмент в линкере L содержит валин (Val), присоединенный к цитруллину (Cit), где Cit ковалентно присоединен к соединению формулы (III) непосредственно или через необязательное спейсерное звено.
15. Конъюгат по п.6, где линкер L непосредственно присоединен к фрагменту модулятора сплайсинга или где спейсерное звено присоединяет линкер L к модулятору сплайсинга.
16. Конъюгат по п.15, где спейсерное звено, соединяющее расщепляемый фрагмент в линкере с модулятором сплайсинга, является саморасщепляющимся.
17. Конъюгат по п.15, где спейсерное звено, соединяющее расщепляемый фрагмент в линкере с модулятором сплайсинга, содержит p-аминобензилоксикарбонил (pABC) или p-аминобензил (pAB).
18. Конъюгат по п.17, где pABC или pAB присоединяют расщепляемый фрагмент в линкере к модулятору сплайсинга.
19. Конъюгат по п.18, где расщепляемый пептидный фрагмент включает Val-Cit, Val-Ala, Glu-Val-Cit или Ala-Ala-Asn.
20. Конъюгат по п.19, где линкер содержит Val-Cit-pABC, Val-Ala-pABC, Val-Cit-pAB или Val-Ala-pAB.
21. Конъюгат по п.20, где линкер содержит MC-Val-Cit-pABC, MC-Val-Ala-pABC, MC-Val-Cit-pAB или MC-Val-Ala-pAB.
22. Конъюгат по любому из пп. 1-5 или его фармацевтически приемлемая соль, где линкер L содержит
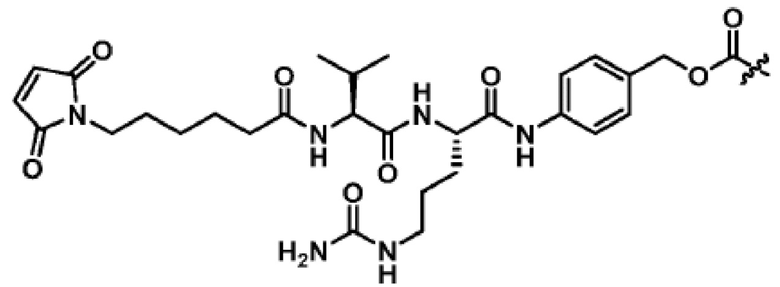 .
.
23. Конъюгат по любому из пп.1-21, где p равно от 1 до 10.
24. Конъюгат по любому из пп.1-21, где p равно от 2 до 8.
25. Конъюгат по любому из пп.1-21, где p равно от 4 до 8.
26. Конъюгат по любому из пп.1-21, где антитело или антигенсвязывающий фрагмент целенаправленно воздействует на неопластическую клетку, полученную из гематологического злокачественного новообразования или солидной опухоли; при этом гематологическое злокачественное новообразование выбрано из В-клеточного злокачественного новообразования, острого миелоидного лейкоза и множественной миеломы; и при этом солидная опухоль выбрана из рака молочной железы, рака желудка, рака предстательной железы, рака яичников, рака легких, рака матки, карциномы слюнных протоков, меланомы, рака толстой кишки, рака шейки матки, рака поджелудочной железы, рака почки, колоректального рака и рака пищевода.
27. Конъюгат по любому из пп.1-21, где
а) антитело или его антигенсвязывающий фрагмент целенаправленно воздействуют на клетку, экспрессирующую HER2, где антитело или антигенсвязывающий фрагмент представляют собой антитело против HER2 или антигенсвязывающий фрагмент; и/или где антитело или его антигенсвязывающий фрагмент содержит три определяющих комплементарность области тяжелой цепи (HCDR1, HCDR2 и HCDR3), содержащие аминокислотные последовательности SEQ ID NO: 1 (HCDR1), SEQ ID NO: 2 (HCDR2) и SEQ ID NO: 3 (HCDR3); и три определяющих комплементарность области легкой цепи (LCDR1, LCDR2 и LCDR3), содержащие аминокислотные последовательности SEQ ID NO: 4 (LCDR1), SEQ ID NO: 5 (LCDR2) и SEQ ID NO: 6 (LCDR3); и/или где антитело или антигенсвязывающий фрагмент содержит вариабельную область тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO: 19, и вариабельную область легкой цепи, содержащую аминокислотную последовательность SEQ ID NO: 20;
b) антитело или его антигенсвязывающий фрагмент целенаправленно воздействуют на клетку, экспрессирующую CD138; где антитело или антигенсвязывающий фрагмент представляет собой антитело против CD138 или антигенсвязывающий фрагмент; и/или где антитело или антигенсвязывающий фрагмент содержит три определяющих комплементарность области тяжелой цепи (HCDR1, HCDR2 и HCDR3), содержащих аминокислотные последовательности SEQ ID NO: 7 (HCDR1), SEQ ID NO: 8 (HCDR2) и SEQ ID NO: 9 (HCDR3); и три определяющих комплементарность области легкой цепи (LCDR1, LCDR2 и LCDR3), содержащие аминокислотные последовательности SEQ ID NO: 10 (LCDR1), SEQ ID NO: 11 (LCDR2) и SEQ ID NO: 12 (LCDR3); и/или где антитело или антигенсвязывающий фрагмент содержит вариабельную область тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO: 21, и вариабельную область легкой цепи, содержащую аминокислотную последовательность SEQ ID NO: 22;
c) антитело или его антигенсвязывающий фрагмент целенаправленно воздействует на клетку, экспрессирующую EPHA2; где антитело или его антигенсвязывающий фрагмент представляет собой антитело против EPHA2 или антигенсвязывающий фрагмент; и/или где антитело или антигенсвязывающий фрагмент содержит три определяющих комплементарность области тяжелой цепи (HCDR1, HCDR2 и HCDR3), содержащих аминокислотные последовательности SEQ ID NO: 13 (HCDR1), SEQ ID NO: 14 (HCDR2) и SEQ ID NO: 15 (HCDR3); и три определяющих комплементарность области легкой цепи (LCDR1, LCDR2 и LCDR3), содержащие аминокислотные последовательности SEQ ID NO: 16 (LCDR1), SEQ ID NO: 17 (LCDR2) и SEQ ID NO: 18 (LCDR3); и/или где антитело или антигенсвязывающий фрагмент содержит вариабельную область тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO: 23, и вариабельную область легкой цепи, содержащую аминокислотную последовательность SEQ ID NO: 24;
(d) антитело или антигенсвязывающий фрагмент целенаправленно воздействует на клетку, экспрессирующую CEACAM5; необязательно, где антитело или антигенсвязывающий фрагмент представляет собой антитело против CEACAM5 или его антигенсвязывающий фрагмент; или
(e) антитело или его антигенсвязывающий фрагмент целенаправленно воздействует на клетку, экспрессирующую STEAP1; необязательно, где антитело или антигенсвязывающий фрагмент представляют собой антитело против STEAP1 или его антигенсвязывающий фрагмент.
28. Конъюгат по п.27, где антитело или антигенсвязывающий фрагмент содержит константную область тяжелой цепи IgG1 человека и/или где антитело или антигенсвязывающий фрагмент содержит константную область легкой каппа-цепи Ig человека.
29. Фармацевтическая композиция для лечения неопластического нарушения, содержащая эффективное количество конъюгата по любому из пп.1-21 и фармацевтически приемлемый носитель.
30. Фармацевтическая композиция по п.29 для применения в лечении субъекта, имеющего неопластическое нарушение, где неопластическое нарушение представляет собой: (i) гематологическое злокачественное новообразование, выбранное из В-клеточного злокачественного новообразования, острого миелоидного лейкоза и множественной миеломы; или (ii) солидную опухоль, выбранную из рака молочной железы, рака желудка, рака предстательной железы, рака яичников, рака легких, рака матки, карциномы слюнных протоков, меланомы, рака толстой кишки, рака шейки матки, рака поджелудочной железы, рака почки, колоректального рака и рака пищевода.
31. Композиция для применения по п.30, где среднее значение p у конъюгата антитела и лекарственного средства в композиции составляет от 3,5 до 5,5, или от 7 до 9, или 4, или 8.
32. Способ лечения субъекта, имеющего неопластическое нарушение, включающий введение субъекту терапевтически эффективного количества композиции по п.29.
33. Способ по п.32, где неопластическое нарушение представляет собой: (i) гематологическое злокачественное новообразование, выбранное из В-клеточного злокачественного новообразования, острого миелоидного лейкоза и множественной миеломы; или (ii) солидную опухоль, выбранную из рака молочной железы, рака желудка, рака предстательной железы, рака яичников, рака легких, рака матки, карциномы слюнных протоков, меланомы, рака толстой кишки, рака шейки матки, рака поджелудочной железы, рака почки, колоректального рака и рака пищевода.
34. Способ по п.33, где среднее значение p у конъюгата антитела и лекарственного средства в композиции составляет от 3,5 до 5,5, или от 7 до 9, или 4, или 8.
35. Способ снижения роста опухоли у субъекта, страдающего опухолевым заболеванием, включающий введение субъекту терапевтически эффективного количества композиции по п.29.
36. Способ по п.35, где неопластическое нарушение представляет собой: (i) гематологическое злокачественное новообразование, выбранное из В-клеточного злокачественного новообразования, острого миелоидного лейкоза и множественной миеломы; или (ii) солидную опухоль, выбранную из рака молочной железы, рака желудка, рака предстательной железы, рака яичников, рака легких, рака матки, карциномы слюнных протоков, меланомы, рака толстой кишки, рака шейки матки, рака поджелудочной железы, рака почки, колоректального рака и рака пищевода.
37. Способ по п.36, где среднее значение p у конъюгата антитела и лекарственного средства в композиции составляет от 3,5 до 5,5, или от 7 до 9, или 4, или 8.
38. Способ подавления роста опухоли у субъекта, имеющего неопластическое нарушение, включающий введение субъекту терапевтически эффективного количества композиции по п.29.
39. Способ по п.38, где неопластическое нарушение представляет собой: (i) гематологическое злокачественное новообразование, выбранное из В-клеточного злокачественного новообразования, острого миелоидного лейкоза и множественной миеломы; или (ii) солидную опухоль, выбранную из рака молочной железы, рака желудка, рака предстательной железы, рака яичников, рака легких, рака матки, карциномы слюнных протоков, меланомы, рака толстой кишки, рака шейки матки, рака поджелудочной железы, рака почки, колоректального рака и рака пищевода.
40. Способ по п.39, где среднее значение p у конъюгата антитела и лекарственного средства в композиции составляет от 3,5 до 5,5, или от 7 до 9, или 4, или 8.
41. Фармацевтическая композиция для лечения неопластического нарушения, содержащая эффективное количество конъюгата по п.27 и фармацевтически приемлемый носитель.
42. Фармацевтическая композиция по п.41 для применения при лечении субъекта, имеющего неопластическое нарушение, где неопластическое нарушение представляет собой: (i) гематологическое злокачественное новообразование, выбранное из В-клеточного злокачественного новообразования, острого миелоидного лейкоза и множественной миеломы; или (ii) солидную опухоль, выбранную из рака молочной железы, рака желудка, рака предстательной железы, рака яичников, рака легких, рака матки, карциномы слюнных протоков, меланомы, рака толстой кишки, рака шейки матки, рака поджелудочной железы, рака почки, колоректального рака и рака пищевода.
43. Композиция для применения по п.42, где среднее значение p у конъюгата антитела и лекарственного средства в композиции составляет от 3,5 до 5,5, или от 7 до 9, или 4, или 8.
44. Способ лечения субъекта, имеющего неопластическое нарушение, включающий введение субъекту терапевтически эффективного количества композиции по п.41.
45. Способ по п.44, где неопластическое нарушение представляет собой: (i) гематологическое злокачественное новообразование, выбранное из В-клеточного злокачественного новообразования, острого миелоидного лейкоза и множественной миеломы; или (ii) солидную опухоль, выбранную из рака молочной железы, рака желудка, рака предстательной железы, рака яичников, рака легких, рака матки, карциномы слюнных протоков, меланомы, рака толстой кишки, рака шейки матки, рака поджелудочной железы, рака почки, колоректального рака и рака пищевода.
46. Способ по п.45, где среднее значение p у конъюгата антитела и лекарственного средства в композиции составляет от 3,5 до 5,5, или от 7 до 9, или 4, или 8.
47. Способ снижения роста опухоли у субъекта, имеющего неопластическое нарушение, включающий введение субъекту терапевтически эффективного количества композиции по п.41.
48. Способ по п.47, где неопластическое нарушение представляет собой: (i) гематологическое злокачественное новообразование, выбранное из В-клеточного злокачественного новообразования, острого миелоидного лейкоза и множественной миеломы; или (ii) солидную опухоль, выбранную из рака молочной железы, рака желудка, рака предстательной железы, рака яичников, рака легких, рака матки, карциномы слюнных протоков, меланомы, рака толстой кишки, рака шейки матки, рака поджелудочной железы, рака почки, колоректального рака и рака пищевода.
49. Способ по п.48, где среднее значение p у конъюгата антитела и лекарственного средства в композиции составляет от 3,5 до 5,5, или от 7 до 9, или 4, или 8.
50. Способ подавления роста опухоли у субъекта, имеющего неопластическое нарушение, включающий введение субъекту терапевтически эффективного количества композиции по п.41.
51. Способ по п.50, где неопластическое нарушение представляет собой: (i) гематологическое злокачественное новообразование, выбранное из В-клеточного злокачественного новообразования, острого миелоидного лейкоза и множественной миеломы; или (ii) солидную опухоль, выбранную из рака молочной железы, рака желудка, рака предстательной железы, рака яичников, рака легких, рака матки, карциномы слюнных протоков, меланомы, рака толстой кишки, рака шейки матки, рака поджелудочной железы, рака почки, колоректального рака и рака пищевода.
52. Способ по п.51, где среднее значение p у конъюгата антитела и лекарственного средства в композиции составляет от 3,5 до 5,5, или от 7 до 9, или 4, или 8.
| US 2014275010 A1, 18.09.2014 | |||
| US 8337856 B2, 25.12.2012 | |||
| KROP I.E | |||
| et al | |||
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| J Clin Oncol | |||
| Приспособление для суммирования отрезков прямых линий | 1923 |
|
SU2010A1 |
| Vol | |||
| Видоизменение прибора с двумя приемами для рассматривания проекционные увеличенных и удаленных от зрителя стереограмм | 1919 |
|
SU28A1 |
| No | |||
| Устройство для электрической сигнализации | 1918 |
|
SU16A1 |
| Pp | |||
| Ручной переносный станок для расточки и сверления отверстий | 1923 |
|
SU2698A1 |
| АНТИ-HER2 КОНЪЮГАТ АНТИТЕЛА С ЛЕКАРСТВЕННЫМ СРЕДСТВОМ | 2015 |
|
RU2683780C2 |
Авторы
Даты
2023-07-05—Публикация
2019-05-31—Подача