Данная заявка заявляет приоритет по Международной патентной заявке № PCT/CN2018/100792, поданной 16 августа 2018 г., полное содержание которой включено в данный документ посредством ссылки, как если бы она была приведена в полном объеме.
ОБЛАСТЬ ТЕХНИКИ ИЗОБРЕТЕНИЯ
Данное изобретение относится к соединениям с конденсированными кольцами формулы (I), формулы (II) или формулы (III), как дополнительно подробно описано в данном документе, которые применяют для ингибирования белков Ras, таких как К-Ras, H-Ras и N-Ras, а также к композициям, содержащим эти соединения и способам лечения путем их введения.
УРОВЕНЬ ТЕХНИКИ ИЗОБРЕТЕНИЯ
Ras представляет собой небольшой ГТФ-связывающий белок, который функционирует как нуклеотид-зависимый переключатель для центральных сигнальных путей роста. В ответ на внеклеточные сигналы Ras переходит из ГДФ-связанного (RasГДФ) в ГТФ-связанное (RasГДФ) состояние, что катализируется факторами обмена гуаниновых нуклеотидов (GEF), а именно белком SOS1. Активный RasГДФ опосредует разнообразные стимулирующие рост функции посредством прямых взаимодействий с эффекторами, включая Raf, PI3K и стимулятор диссоциации гуаниновых нуклеотидов Ral. Характерная ГТФазная активность Ras затем гидролизует ГТФ до ГДФ с терминацией сигнализации Ras. ГТФазная активность Ras может быть дополнительно ускорена посредством его взаимодействий с активирующими ГТФазу белками (GAP), включая опухолевый супрессор нейрофибромин 1.
Мутантный Ras имеет сниженную ГТФазную активность, что продлевает существование его активированной конформации, тем самым способствуя Ras-зависимой сигнализации и выживанию или росту раковых клеток. Мутация в Ras, которая влияет на его способность взаимодействовать с GAP или превращать ГТФ обратно в ГДФ, приведет к продлению активации белка и, следовательно, продлению поступления сигнала в клетку, говорящего ей продолжать расти и делиться. Поскольку эти сигналы приводят к росту и делению клеток, сверхактивная сигнализация RAS может в конечном итоге привести к раку. Мутации в любой из трех основных изоформ гена RAS (H-Ras, N-Ras или K-Ras) являются распространенными событиями в онкогенезе человека. Среди трех изоформ Ras (K, N и Н) наиболее часто мутирует K-Ras.
Наиболее распространенные мутации K-Ras встречаются в остатках G12 и G13 в Р-петле и в остатке Q61. G12C является частой мутацией гена K-Ras (глицин-12 на цистеин). Мутации Ras при раке ассоциируются с плохим прогнозом. Инактивация онкогенного Ras у мышей приводит к уменьшению размеров опухолей. Таким образом, в широком смысле Ras считается онкологической мишенью исключительной важности.
КРАТКОЕ ОПИСАНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
Один аспект изобретения включает соединение формулы (I):
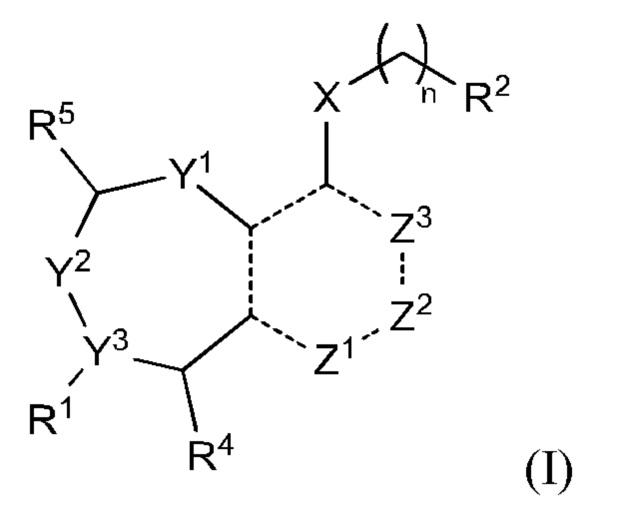
или его фармацевтически приемлемую соль;
где
R1 выбран из группы, состоящей из Н, С6-10 арила, 5-10-членного гетероарила и 5-10-членного гетероциклила, где каждый арил, гетероарил и гетероциклил необязательно замещен одним - четырьмя заместителями, где каждый заместитель независимо выбран из группы, состоящей из С1-6 алкила, -NH2, NH(СН3), -N(СН3)2, галогена, С1-6 галогеналкила, оксо, С1-6 гидроксиалкила, С3-6 циклоалкила, -ОС(=O)СН=СН2 и гидрокси;
R2 представляет собой электрофильный фрагмент, способный образовывать ковалентную связь с остатком цистеина в позиции 12 мутантного белка K-Ras G12C;
Y1 представляет собой C(H)(R6) или Y1 отсутствует;
Y2 выбран из группы, состоящей из N(R7) и C(H)(R8);
Y3 выбран из группы, состоящей из C(R3) и N;
Z1 выбран из группы, состоящей из N, N(R9), О, S, S(O) и S(O)2;
Z2 представляет собой C(R10), C(-L-R10a) или Z2 отсутствует;
Z3 выбран из группы, состоящей из N, N(R11) и C(R12);
каждый из R3, R4, R5, R6, R7, R8, R9, R10, R11 и R12 независимо выбран из группы, состоящей из Н, С2-6 алкенила, С1-6 алкокси, С1-6 алкила, С1-6 алкила, замещенного 4-10-членным гетероциклильным заместителем, С1-6 алкилсульфанила, С1-6 алкилсульфонила, С1-6 алкилтио, С2-6 алкинила, С1-6 алкиламино, амино, арила, арила, замещенного С1-6 алкилом, С1-6 аминоалкила, карбамоила, С1-6 карбамоилалкила, С1-6 карбоксиалкила, циано, С1-6 цианоалкила, С3-7 циклоалкила, галогена, С1-6 галогеналкокси, С1-6 галогеналкила, 5-10-членного гетероарила, 4-10-членного гетероциклила, гидрокси и оксо;
или R1 и R3 вместе с атомом углерода, с которым они связаны, могут образовывать необязательно замещенный 3-6-членный циклоалкил;
или R3 и R4, R3 и R8, R5 и R6 или R5 и R8, вместе с атомами, с которыми связан каждый из них, могут образовывать 3-6-членный циклоалкил или 3-6-членный гетероциклил;
L представляет собой связь, О, S или N(La);
R10a выбран из группы, состоящей из водорода, алкила, гидроксиалкила, дигидроксиалкила, алкиламинилалкила, диалкиламинилалкила, -Lb-NLaLc, гетероциклила, гетероциклил алкила, арила, гетероарила или гетероарилалкила, где каждый из Lb, гетероциклила, гетероциклилалкила, арила, гетероарила и гетероарилалкила может быть необязательно замещен одним или более Ld;
каждый La независимо представляет собой водород или С1-3 алкил;
Lb представляет собой С1-4 алкилен;
каждый Lc независимо представляет собой водород, ацил, С1-3 алкил, гетероалкил или гидроксиалкил;
каждый Ld независимо представляет собой водород, оксо, ацил, гидрокси, гидроксиалкил, циано, галоген, С1-6 алкил, аралкил, галогеналкил, гетероалкил, циклоалкил, гетероциклилалкил, алкокси, диалкиламинил, диалкиламидоалкил или диалкиламинилалкил, где С1-6 алкил может быть необязательно замещен циклоалкилом;
X выбран из группы, состоящей из С1-6 алкокси, С1-6 алкила, амино, С1-6 алкиламино, С1-6 алкилсульфанила, С1-6 алкилсульфонила, С1-6 алкилтио, С3-7 циклоалкила, 4-7-членного гетероциклила и 4-7-членного гетероциклиламино; каждый из которых необязательно замещен 1-4 заместителями, где каждый заместитель независимо выбран из группы, состоящей из С1-6 алкила, амино, С1-6 аминоалкила, карбамоила, С1-6 карбамоилалкила, карбокси, С1-6 карбоксиалкила, циано, С1-6 цианоалкила, галогена, С1-6 галогеналкила, гидрокси, С1-6 гидроксиалкила и 4-7-членного гетероциклила; где два геминальных заместителя могут быть взяты вместе с образованием С3-7 спироциклоалкила или 4-7-членного спирогетероциклила;
n выбрано из 0, 1 и 2; и
 представляет одинарную связь или двойную связь.
представляет одинарную связь или двойную связь.
Другой аспект изобретения включает соединение формулы (II):
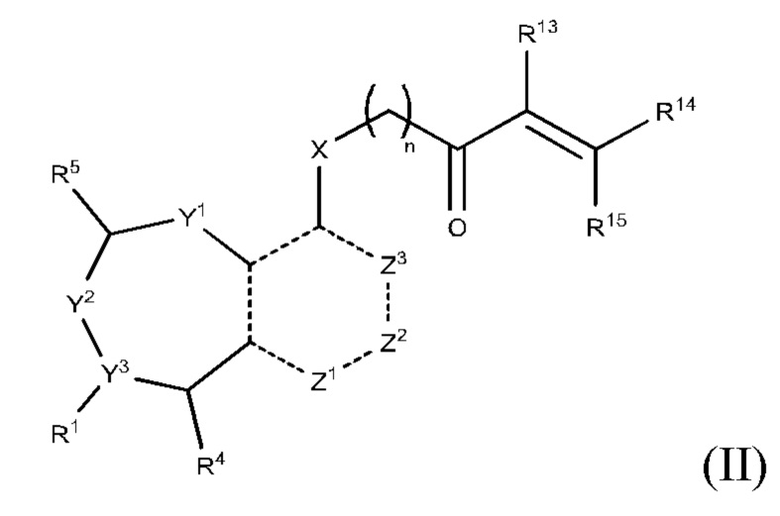
или его фармацевтически приемлемую соль;
где
R1 выбран из группы, состоящей из Н, С6-10 арила, 5-10-членного гетероарила и 5-10-членного гетероциклила, где каждый арил, гетероарил и гетероциклил необязательно замещен одним - четырьмя заместителями, где каждый заместитель независимо выбран из группы, состоящей из С1-6 алкила, -NH2, -NH(CH3), -N(CH3)2, галогена, C1-6 галогеналкила, оксо, C1-6 гидроксиалкила, С3-6 циклоалкила, -ОС(=O)СН=СН2 и гидрокси;
Y1 представляет собой C(H)(R6) или Y1 отсутствует;
Y2 выбран из группы, состоящей из N(R7) и C(H)(R8);
Y3 выбран из группы, состоящей из C(R3) и N;
Z1 выбран из группы, состоящей из N, N(R9), О, S, S(O) и S(O)2;
Z2 представляет собой C(R10), C(-L-R10a) или Z2 отсутствует;
Z3 выбран из группы, состоящей из N, N(R11) и C(R12);
каждый из R3, R4, R5, R6, R7, R8, R9, R10, R11 и R12 независимо выбран из группы, состоящей из Н, С2-6 алкенила, С1-6 алкокси, C1-6 алкила, С1-6 алкила, замещенного 4-10-членным гетероциклильным заместителем, С1-6 алкилсульфанила, С1-6 алкилсульфонила, С1-6 алкилтио, С2-6 алкинила, С1-6 алкиламино, амино, арила, арила, замещенного С1-6 алкилом, С1-6 аминоалкила, карбамоила, С1-6 карбамоилалкила, С1-6 карбоксиалкила, циано, С1-6 цианоалкила, С3-7 циклоалкила, галогена, С1-6 галогеналкокси, С1-6 галогеналкила, 5-10-членного гетероарила, 4-10-членного гетероциклила, гидрокси и оксо;
или R1 и R3 вместе с атомом углерода, с которым они связаны, могут образовывать необязательно замещенный 3-6-членный циклоалкил;
или R3 и R4, R3 и R8, R5 и R6 или R5 и R8, вместе с атомами, с которыми связан каждый из них, могут образовывать 3-6-членный циклоалкил или 3-6-членный гетероциклил;
R13 выбран из группы, состоящей из Н, циано и галогена; и каждый из R14 и R15 независимо выбран из группы, состоящей из Н, С1-6 алкила, С1-6 галогеналкила, циано и галогена; где С1-6 алкил необязательно замещен одним заместителем, выбранным из группы, состоящей из: метансульфонила (мезила), пара-толуолсульфонила (тозила), алкил- или арилсульфонатной уходящей группы, С1-6 алканоиламино, С1-6 алкокси, С1-6 алкиламино, С3-6 циклоалкиламино, С1-6 алкилсульфониламино, С6-12 диалкиламино и С1-6 галогеналкокси;
или
R13 и R14 вместе образуют тройную связь между атомами углерода, к которым они присоединены, или R13 и R14 вместе с атомами углерода, с которыми связан каждый из них, образуют С3-7 циклоалкенил, необязательно замещенный одним или двумя заместителями-галогенами; и R15 выбран из группы, состоящей из Н, С1-6 алкила С1-6 галогеналкила, циано и галогена; где С1-6 алкил необязательно замещен одним заместителем, выбранным из группы, состоящей из: С1-6 алканоиламино, С1-6 алкокси, С1-6 алкиламино, С1-6 алкилсульфониламино, С6-12 диалкиламино и С1-6 галогеналкокси;
L представляет собой связь, О, S или N(La);
R10a выбран из группы, состоящей из водорода, алкила, гидроксиалкила, дигидроксиалкила, алкиламинилалкила, диалкиламинилалкила, -Lb-NLaLc, гетероциклила, гетероциклил алкил а, арила, гетероарила или гетероарилалкила, где каждый из Lb, гетероциклила, гетероциклил алкила, арила, гетероарила и гетероарилалкила может быть необязательно замещен одним или более Ld;
каждый La независимо представляет собой водород или С1-3 алкил;
Lb представляет собой С1-4 алкилен;
каждый Lc независимо представляет собой водород, ацил, С1-3 алкил, гетероалкил или гидроксиалкил;
каждый Ld независимо представляет собой водород, оксо, ацил, гидрокси, гидроксиалкил, циано, галоген, С1-6 алкил, аралкил, галогеналкил, гетероалкил, циклоалкил, гетероциклилалкил, алкокси, диалкиламинил, диалкиламидоалкил или диалкиламинилалкил, где С1-6 алкил может быть необязательно замещен циклоалкилом;
X выбран из группы, состоящей из С1-6 алкокси, С1-6 алкила, амино, С1-6 алкиламино, С1-6 алкилсульфанила, С1-6 алкилсульфонила, С1-6 алкилтио, С3-7 циклоалкила, 4-7-членного гетероциклила и 4-7-членного гетероциклиламино; каждый из которых необязательно замещен 1-4 заместителями, где каждый заместитель независимо выбран из группы, состоящей из С1-6 алкила, амино, С1-6 аминоалкила, карбамоила, С1-6 карбамоилалкила, карбокси, С1-6 карбоксиалкила, циано, С1-6 цианоалкила, галогена, С1-6 галогеналкила, гидрокси, С1-6 гидроксиалкила и 4-7-членного гетероциклила; где два геминальных заместителя могут быть взяты вместе с образованием С3-7 спироциклоалкила или 4-7-членного спирогетероциклила;
n выбрано из 0, 1 и 2; и
 представляет одинарную связь или двойную связь.
представляет одинарную связь или двойную связь.
В другом аспекте изобретение включает соединение формулы (III):

или его фармацевтически приемлемую соль;
где
R1 выбран из группы, состоящей из Н, С6-10 арила, 5-10-членного гетероарила и 5-10-членного гетероциклила, где каждый арил, гетероарил и гетероциклил необязательно замещен одним - четырьмя заместителями, где каждый заместитель независимо выбран из группы, состоящей из С1-6 алкила, -NH2, -NH(CH3), -N(CH3)2, галогена, С1-6 галогеналкила, оксо, С1-6 гидроксиалкила, С3-6 циклоалкила, -ОС(=O)СН=СН2 и гидрокси;
Y1 представляет собой C(H)(R6) или Y1 отсутствует;
Y2 выбран из группы, состоящей из N(R7) и C(H)(R8);
Y3 выбран из группы, состоящей из C(R3) и N;
Z1 выбран из группы, состоящей из N, N(R9), О, S, S(O) и S(O)2;
Z2 представляет собой C(R10), C(-L-R10a) или Z2 отсутствует;
Z3 выбран из группы, состоящей из N, N(R11) и C(R12);
каждый из R3, R4, R5, R6, R7, R8, R9, R10, R11 и R12 независимо выбран из группы, состоящей из Н, С2-6 алкенила, С1-6 алкокси, С1-6 алкила, С1-6 алкила, замещенного 4-10-членным гетероциклильным заместителем, С1-6 алкилсульфанила, С1-6 алкилсульфонила, С1-6 алкилтио, С2-6 алкинила, С1-6 алкиламино, амино, арила, арила, замещенного С1-6 алкилом, С1-6 аминоалкила, карбамоила, С1-6 карбамоилалкила, С1-6 карбоксиалкила, циано, С1-6 цианоалкила, С3-7 циклоалкила, галогена, С1-6 галогеналкокси, С1-6 галогеналкила, 5-10-членного гетероарила, 4-10-членного гетероциклила, гидрокси и оксо;
или R1 и R3 вместе с атомом углерода, с которым они связаны, могут образовывать необязательно замещенный 3-6-членный циклоалкил;
или R3 и R4, R3 и R8, R5 и R6 или R5 и R8, вместе с атомами, с которыми связан каждый из них, могут образовывать 3-6-членный циклоалкил или 3-6-членный гетероциклил;
R19 выбран из группы, состоящей из оксиранила, азиридинила и циклопропила, где циклопропил необязательно замещен по меньшей мере одним галогеном; L представляет собой связь, О, S или N(La);
R10a выбран из группы, состоящей из водорода, алкила, гидроксиалкила, дигидроксиалкила, алкиламинилалкила, диалкиламинилалкила, -Lb-NLaLc, гетероциклила, гетероциклил алкил а, арила, гетероарила или гетероарилалкила, где каждый из Lb, гетероциклила, гетероциклил ал кил а, арила, гетероарила и гетероарилалкила может быть необязательно замещен одним или более Ld;
каждый La независимо представляет собой водород или С1-3 алкил;
Lb представляет собой С1-4алкилен;
каждый Lc независимо представляет собой водород, ацил, С1-3 алкил, гетероалкил или гидроксиалкил;
каждый Ld независимо представляет собой водород, оксо, ацил, гидрокси, гидроксиалкил, циано, галоген, С1-6 алкил, аралкил, галогеналкил, гетероалкил, циклоалкил, гетероциклилалкил, алкокси, диалкиламинил, диалкиламидоалкил или диалкиламинилалкил, где С1-6 алкил может быть необязательно замещен циклоалкилом;
X выбран из группы, состоящей из С1-6 алкокси, С1-6 алкила, амино, С1-6 алкиламино, С1-6 алкилсульфанила, С1-6 алкилсульфонила, С1-6 алкилтио, С3-7 циклоалкила, 4-7-членного гетероциклила и 4-7-членного гетероциклиламино; каждый из которых необязательно замещен 1-4 заместителями, где каждый заместитель независимо выбран из группы, состоящей из С1-6 алкила, амино, С1-6 аминоалкила, карбамоила, С1-6 карбамоилалкила, карбокси, С1-6 карбоксиалкила, циано, С1-6 цианоалкила, галогена, С1-6 галогеналкила, гидрокси, С1-6 гидроксиалкила и 4-7-членного гетероциклила; где два геминальных заместителя могут быть взяты вместе с образованием С3-7 спироциклоалкила или 4-7-членного спирогетероциклила;
n выбрано из 0, 1 и 2; и
 представляет одинарную связь или двойную связь.
представляет одинарную связь или двойную связь.
Другой аспект изобретения включает соединение формулы (IIa):

или его фармацевтически приемлемую соль;
где R1 и R8, каждый, независимо соответствуют определению выше для формулы (I) или формулы (II).
Другой аспект изобретения включает соединение формулы (III):

или его фармацевтически приемлемую соль;
где R1, R8, R9 и R10, каждый, независимо соответствуют определению выше для формулы (I) или формулы (II).
Другой аспект изобретения включает соединение формулы (IIn):

или его фармацевтически приемлемую соль;
где R1, R8, L и R10a, каждый, независимо соответствуют определению выше для формулы (I) или формулы (II).
Другой аспект изобретения включает соединение формулы (IIm):

или его фармацевтически приемлемую соль;
где R1, R8, R9 и R10, каждый, независимо соответствуют определению выше для формулы (I) или формулы (II).
Также предложена фармацевтическая композиция, содержащая соединение по изобретению или его фармацевтически приемлемую соль и фармацевтически приемлемое вспомогательное вещество.
Другой аспект включает способ лечения рака, включающий введение нуждающемуся в этом индивиду терапевтически эффективного количества соединения по изобретению или его фармацевтически приемлемой соли.
Другой аспект включает способ регуляции активности мутантного белка K-Ras G12C, включающий осуществление реакции мутантного белка с соединением по изобретению или его фармацевтически приемлемой солью.
Другой аспект включает способ лечения нарушения, опосредованного мутацией K-Ras G12C, у нуждающегося в этом индивида, включающий определение, имеет ли индивид мутацию; и в случае определения, что индивид имеет мутацию, введение индивиду терапевтически эффективного количества фармацевтической композиции по изобретению.
Другой аспект включает способ получения меченного мутантного белка K-Ras G12C, включающий осуществление реакции мутантного белка K-Ras G12C с меченным соединением по изобретению или его фармацевтически приемлемой солью для получения меченного мутантного белка K-Ras G12C.
Другой аспект включает способ ингибирования метастазов опухоли, включающий введение нуждающемуся в этом индивиду терапевтически эффективного количества соединения по изобретению или его фармацевтически приемлемой соли или фармацевтической композиции по изобретению.
Другой аспект включает способ опухоль-агностического лечения рака у нуждающегося в этом индивида, включающий определение, имеет ли индивид опухоль с мутацией G12C в белке K-Ras, H-Ras или N-Ras в опухоли; и если индивид имеет опухоль с мутацией, введение индивиду терапевтически эффективного количества соединения по изобретению или его фармацевтически приемлемой соли или фармацевтической композиции по изобретению.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
ОПРЕДЕЛЕНИЯ
Термин «галоген» или «гало» относится к F, О, Br или I. Кроме того, подразумевается, что такие термины, как «галогеналкил», включают моногалогеналкил и полигалогеналкил.
Термин «алкил» относится к насыщенному одновалентному углеводородному радикалу с линейной или разветвленной цепью. В одном примере алкильный радикал имеет от одного до восемнадцати атомов углерода (C1-18). В других примерах алкильный радикал представляет собой С1-12, С1-10, C1-8, С1-6, С1-5, С1-4 или С1-3. Примеры алкильных групп включают метил (Me, -СН3), этил (Et, -СН2СН3), 1-пропил (н-Pr, н-пропил, -СН2СН2СН3), 2-пропил (и-Pr, и-пропил, -СН(СН3)2), 1-бутил (н-Ви, н-бутил, -СН2СН2СН2СН3), 2-метил-1-пропил (и-Bu, и-бутил, -СН2СН(СН3)2), 2-бутил (c-Bu, с-бутил, -CH(CH3)CH2CH3), 2-метил-2-пропил (т-Bu, т-бутил, -С(СН3)3), 1-пентил (т-пентил, -СН2СН2СН2СН2СН3), 2-пентил (-СН(СН3)СН2СН2СН3), 3 -пентил (-СН(СН2СН3)2), 2-метил-2-бутил (-С(СН3)2СН2СН3), 3-метил-2-бутил (-СН(СН3)СН(СН3)2), 3-метил-1-бутил (-СН2СН2СН(СН3)2), 2-метил-1-бутил (-СН2СН(СН3)СН2СН3), 1-гексил (-СН2СН2СН2СН2СН2СН3), 2-гексил (-СН(СН3)СН2СН2СН2СН3), 3-гексил (-СН(СН2СН3)(СН2СН2СН3)), 2-метил-2-пентил (-С(СН3)2СН2СН2СН3), 3-метил-2-пентил (-СН(СН3)СН(СН3)СН2СН3), 4-метил-2-пентил (-СН(СН3)СН2СН(СН3)2), 3-метил-3-пентил (-С(СН3)(СН2СН3)2), 2-метил-3-пентил (-СН(СН2СН3)СН(СН3)2), 2,3-диметил-2-бутил (-С(СН3)2СН(СН3)2), 3,3-диметил-2-бутил (-СН(СН3)С(СН3)з, 1-гептил и 1-октил.
Термин «амино» относится к -NH2.
Термин «алкиламино» относится к -NH-алкилу.
Термин «циклоалкиламино» относится к -NH-циклоалкилу.
Термин «диалкиламино» относится к -М(алкилу)2.
Термин «оксо» относится к =O.
Термин «карбокси» относится к -С(=O)ОН.
Термин «карбамоил» относится к -C(=O)NH2.
Термин «алканоил» относится к -С(=O)-алкилу.
Термин «алканоиламино» относится к -NH-С(=O)-алкилу.
Термин «алкокси» относится к -О-алкилу.
Термин «алкилсульфанил» относится к -S(=O)-алкилу.
Термин «алкилсульфонил» относится к -S(=O)2-алкилу.
Термин «алкилсульфониламино» относится к -NH-S(=O)2-алкилу.
Термин «алкилтио» относится к -S-алкилу.
Термин «аминоалкил» относится к алкилу, замещенному одним амино-заместителем.
Термин «карбамоилалкил» относится к алкилу, замещенному одним карбамоил-заместителем.
Термин «карбоксиалкил» относится к алкилу, замещенному одним карбокси-заместителем.
Термины «циано» или «нитрил» относятся к - C=N или -CN.
Термин «цианоалкил» относится к алкилу, замещенному одним циано-заместителем.
Термин «галогеналкокси» относится к -О-галогеналкилу.
Термин «гетероциклиламино» относится к -NH-гетероциклилу.
Термин «гидрокси» относится к -ОН.
Термин «гидроксиалкил» относится к алкилу, замещенному одним гидрокси-заместителем.
Термин «алкенил» относится к одновалентному углеводородному радикалу с линейной или разветвленной цепью с по меньшей мере одной углерод-углеродной двойной связью и включает радикалы, имеющие «цис»- и «транс»-ориентации, или, в альтернативном варианте, «Е» и «2»-ориентации. В одном примере алкенильный радикал имеет от двух до восемнадцати атомов углерода (C2-18). В других примерах алкенильный радикал представляет собой С2-12, С2-10, С2-8, С2-6 или С2-3. Примеры включают, но не ограничиваются этим, этенил или винил (-СН=СН2), проп-1-енил (-СН=СНСН3), проп-2-енил (-СН2СН=СН2), 2-метилпроп-1-енил, бут-1-енил, бут-2-енил, бут-3-енил, бута-1,3-диенил, 2-метилбута-1,3-диен, гекс-1-енил, гекс-2-енил, гекс-3-енил, гекс-4-енил и гекса-1,3-диенил.
Термин «алкинил» относится к линейному или разветвленному одновалентному углеводородному радикалу с по меньшей мере одной углерод-углеродной тройной связью. В одном примере алкинильный радикал имеет от двух до восемнадцати атомов углерода (С2-18). В других примерах алкинильный радикал представляет собой С2-12, С2-10, С2-8, С2-6 или С2-3. Примеры включают, но не ограничиваются этим, этинил (-С≡СН), проп-1-инил (-С≡ССН3), проп-2-инил (пропаргил, -СН2С≡СН), бут-1-инил, бут-2-инил и бут-3-инил.
Термин «алкилен» относится к насыщенной, углеводородной группе с разветвленной или неразветвленной цепью, имеющей два одновалентных радикальных центра, полученных путем удаления двух атомов водорода от одного или двух разных атомов углерода исходного алкана. В одном примере двухвалентная алкиленовая группа имеет от одного до восемнадцати атомов углерода (C1-18). В других примерах двухвалентная алкиленовая группа представляет собой С1-12, С1-10, C1-8, С1-6, С1-5, С1-4 или С1-3. Примеры алкиленовых групп включают (-СН2-), 1,1-этил (-СН(СН3)-), (1,2-этил (-СН2СН2-), 1,1-пропил (-СН(СН2СН3)-), 2,2-пропил (-С(СН3)2-), 1,2-пропил (-СН(СН3)СН2-), 1,3-пропил (-СН2СН2СН2-), 1,1-диметилэт-1,2-ил (-С(СН3)2СН2-), 1,4-бутил (-СН2СН2СН2СН2-) и т.п.
Термин «арил» относится к карбоциклической ароматической группе, конденсированной с одной или более группами или нет, имеющей указанное число атомов углерода, или, если число не указано, до 14 атомов углерода. Один пример включает арильные группы, имеющие 6-14 атомов углерода. Другой пример включает арильные группы, имеющие 6-10 атомов углерода. Примеры арильных групп включают фенил, нафтил, бифенил, фенантренил, нафтаценил, 1,2,3,4-тетрагидронафтаценил, 1H-инденил, 2,3-дигидро-1H-инденил и т.п.(смотрите, например, Lang's Handbook of Chemistry (Dean, J. A., ed.) 13-oe издание, Таблица 7-2 [1985]). Конкретным арилом является фенил.
Термин «циклоалкил» относится к насыщенной углеводородной кольцевой группе. Циклоалкил охватывает моно-, би-, трициклические, спиро- и мостиковые насыщенные кольцевые системы. В одном примере циклоалкильная группа имеет от 3-12 атомов углерода (С3-12). В других примерах циклоалкил представляет собой С3-7, С3-8, С3-10 или С5-10. В других примерах циклоалкильная группа, как моноцикл, представляет собой С3-8, С3-6 или С5-6. В другом примере циклоалкильная группа, как бицикл, представляет собой С7-С12. В другом примере циклоалкильная группа, как спиро-система, представляет собой С5-12. Примеры моноциклических циклоалкилов включают циклопропил, циклобутил, циклопентил, циклогексил, циклогептил, циклооктил, циклононил, циклодецил, циклоундецил и циклододецил. Типовые конфигурации бициклических циклоалкилов, имеющих 7-12 кольцевых атомов, включают, но не ограничиваются этим, [4,4], [4,5], [5,5], [5,6] или [6,6] кольцевые системы. Типовые мостиковые бициклические циклоалкилы включают, но не ограничиваются этим, бицикло[2.2.1]гептан, бицикло[2.2.2]октан и бицикло[3.2.2]нонан. Примеры спироциклоалкилов включают спиро[2.2]пентан, спиро[2.3]гексан, спиро[2.4]гептан, спиро[2.5]октан и спиро[4.5]декан.
Термин «циклоалкенил» относится к неароматической, углеводородной кольцевой группе с по меньшей мере одной углерод-углеродной двойной связью. Циклоалкенил охватывает моно-, би-, трициклические, спиро- или мостиковые насыщенные кольцевые системы. Примеры моноциклических циклоалкенилов включают 1-циклопент-1-енил, 1-циклопент-2-енил, 1-циклопент-3-енил, 1-циклогекс-1-енил, 1-циклогекс-2-енил, 1-циклогекс-3-енил и циклогексадиенил. Типовые конфигурации бициклических циклоалкенилов, имеющих 7-12 кольцевых атомов, включают, но не ограничиваются этим, [4,4], [4,5], [5,5], [5,6] или [6,6] кольцевые системы. Типовые мостиковые бициклические циклоалкенилы включают, но не ограничиваются этим, бицикло[2.2.1]гептен, бицикло[2.2.2]октен и бицикло[3.2.2]нонен. Примеры спироциклоалкенилов включают спиро[2.2]пентен, спиро[2.3]гексен, спиро[2.4]гептен, спиро[2.5]октен и спиро[4.5]децен.
Термины «гетероциклическая группа», «гетероциклический», «гетероцикл», «гетероциклил» или «гетероцикло» используются взаимозаменяемо и относятся к любой моно-, би-, трициклической, спиро- или мостиковой, насыщенной, частично насыщенной или ненасыщенной, неароматической кольцевой системе, имеющей 3-20 кольцевых атомов, где кольцевые атомы представляют собой углерод, и по меньшей мере один атом в кольце или кольцевой системе представляет собой гетероатом, выбранный из азота, серы или кислорода. Если любой кольцевой атом циклической системы представляет собой гетероатом, эта система является гетероциклом вне зависимости от точки присоединения циклической системы к остальной молекуле. В одном примере гетероциклил содержит 3-11 кольцевых атомов («членов») и включает моноциклы, бициклы, трициклы, спиро- и мостиковые кольцевые системы, где кольцевые атомы представляют собой углерод, где по меньшей мере один атом в кольце или кольцевой системе представляет собой гетероатом, выбранный из азота, серы или кислорода. В других примерах гетероциклил содержит 4-10 или 5-10 кольцевых атомов. В одном примере гетероциклил содержит 1-4 гетероатома. В одном примере гетероциклил содержит 1-3 гетероатома. В другом примере гетероциклил включает 3-7-членные моноциклы, имеющие 1-2, 1-3 или 1-4 гетероатома, выбранных из азота, серы или кислорода. В другом примере гетероциклил включает 4-6-членные моноциклы, имеющие 1-2, 1-3 или 1-4 гетероатома, выбранных из азота, серы или кислорода. В другом примере гетероциклил включает 3-членные моноциклы. В другом примере гетероциклил включает 4-членные моноциклы. В другом примере гетероциклил включает 5-6-членные моноциклы. В некоторых вариантах осуществления гетероциклоалкил содержит по меньшей мере один атом азота. В одном примере гетероциклильная группа содержит 0-3 двойные связи. Любой гетероатом азота или серы может, необязательно, быть оксидирован (например, NO, SO, SO2), а гетероатом азота может, необязательно, быть кватернизирован (например, [NR4]+Cl-, [NR4]+OH-). Примерами гетероциклов являются оксиранил, азиридинил, тииранил, азетидинил, оксетанил, тиентанил, 1,2-дитиетанил, 1,3-дитиетанил, пирролидинил, дигидро-1Н-пирролил, дигидрофуранил, тетрагидрофуранил, дигидротиенил, тетрагидротиенил, имидазолидинил, пиперидинил, пиперазинил, изохинолинил, тетрагидроизохинолинил, морфолинил, тиоморфолинил, 1,1-диоксо-тиоморфолинил, дигидропиранил, тетрагидропиранил, гексагидротиопиранил, гексагидропиримидинил, оксазинанил, тиазинанил, тиоксанил, гомопиперазинил, гомопиперидини, азепанил, оксепанил, тиепанил, оксазепинил, оксазепанил, диазепанил, 1,4-диазепанил, диазепинил, тиазепинил, тиазепанил, тетрагидротиопиранил, оксазолидинил, тиазолидинил, изотиазолидинил, 1,1-диоксоизотиазолидиноил, 1,1-диоксоизотиазолил, оксазолидиноил, имидазолидиноил, 4,5,6,7-тетрагидро[2Н]индазолил, тетрагидробензоимидазолил, 4,5,6,7-тетрагидробензо[е]имидазолил, тиазинил, оксазинил, тиадиазинил, оксадиазинил, дитиазинил, диоксазинил, оксатиазинил, тиатриазинил, оксатриазинил, дитиадиазинил, имидазолинил, дигидропиримидил, тетрагидропиримидил, 1-пирролинил, 2-пирролинил, 3-пирролинил, индолинил, тиапиранил, 2Н-пиранил, 4Н-пиранил, диоксанил, 1,3-диоксоланил, пиразолинил, пиразолидинил, дитианил, дитиоланил, пиримидинонил, пиримидиндионил, пиримидин-2,4-дионил, пиперазинонил, пиперазиндионил, пиразолидинилимидазолинил, 3-азабицикло[3.1.0]гексанил, 3,6-диазабицикло[3.1.1]гептанил, 6-азабицикло[3.1.1]гептанил, 3-азабицикло[3.1.1]гептанил, 3-азабицикло[4.1.0]гептанил, азабицикло[2.2.2]гексанил, 2-азабицикло[3.2.1]октанил, 8-азабицикло[3.2.1]октанил, 2-азабицикло[2.2.2]октанил, 8-азабицикло[2.2.2]октанил, 7-оксабицикло[2.2.1]гептан, азаспиро[3.5]нонанил, азаспиро[2.5]октанил, азаспиро[4.5]деканил, 1-азаспиро[4.5]декан-2-онил, азаспиро[5.5]ундеканил, тетрагидроиндолил, октагидроиндолил, тетрагидроизоиндолил, тетрагидроиндазолил, 1,1 -диоксогексагидротиопиранил.
Термин «гетероарил» относится к любой моно-, би- или трициклической ароматической кольцевой системе, содержащей 1-4 гетероатома, выбранных из азота, кислорода и серы, и, в примере варианта осуществления, по меньшей мере один гетероатом представляет собой азот.Смотрите, например, Lang's Handbook of Chemistry (Dean, J. A., ed.) 13-oe издание, Таблица 7-2 [1985]. В это определение включены любые бициклические группы, в которых любые из вышеуказанных гетероарильных колец конденсированы с арильным кольцом, где арильное кольцо или гетероарильное кольцо соединено с остальной молекулой. В одном варианте осуществления гетероарил включает 5-6-членные моноциклические ароматические группы, где один или более кольцевых атомов представляют собой азот, серу или кислород. Примеры гетероарильных групп включают тиенил, фурил, имидазолил, пиразолил, тиазолил, изотиазолил, оксазолил, изоксазолил, триазолил, тиадиазолил, оксадиазолил, тетразолил, тиатриазолил, оксатриазолил, пиридил, пиримидил, пиразинил, пиридазинил, триазинил, тетразинил, тетразоло[1,5-b]пиридазинил, имидазол[1,2-а]пиримидинил и пуринил, а также бензо-конденсированные производные, например, бензоксазолил, бензофурил, бензотиазолил, бензотиадиазолил, бензотриазолил, бензоимидазолил, индазолил и индолил.
В конкретных вариантах осуществления гетероциклильная группа или гетероарильная группа присоединена в атоме углерода гетероциклильной группы или гетероарильной группы. В качестве примера, углерод-связанные гетероциклильные группы включают конфигурации связывания в положении 2, 3, 4, 5 или 6 кольца пиридина, положении 3, 4, 5 или 6 кольца пиридазина, положении 2, 4, 5 или 6 кольца пиримидина, положении 2, 3, 5 или 6 кольца пиразина, положении 2, 3, 4 или 5 кольца фурана, тетрагидрофурана, тиофурана, тиофена, пиррола или тетрагидропиррола, положении 2, 4 или 5 кольца оксазола, имидазола или тиазола, положении 3, 4 или 5 кольца изоксазола, пиразола или изотиазола, положении 2 или 3 кольца азиридина, положении 2, 3 или 4 кольца азетидина, положении 2, 3, 4, 5, 6, 7 или 8 кольца хинолина или положении 1, 3, 4, 5, 6, 7 или 8 кольца изохинолина.
В определенных вариантах осуществления гетероциклильная группа или гетероарильная группа является N-присоединенной. В качестве примера азот-связанные гетероциклильные или гетероарильные группы включают конфигурации связывания в положении 1 азиридина, азетидина, пиррола, пирролидина, 2-пирролина, 3-пирролина, имидазола, имидазолидина, 2-имидазолина, 3-имидазолина, пиразола, пиразолина, 2-пиразолина, 3-пиразолина, пиперидина, пиперазина, индола, индолина, 1H-индазола, положении 2 изоиндола или изоиндолина, положении 4 морфолина и положении 9 карбазола или β-карболина.
«Конденсированный» относится к любой кольцевой структуре, описанной в данном документе, которая имеет один или более общих атомов (например, атомов углерода или азота) с существующей кольцевой структурой в соединениях по изобретению.
Термин «ацил» относится к карбонилу, содержащему заместитель, представленный формулой -C(=O)-R, в котором R представляет собой заместитель, такой как водород, алкил, циклоалкил, арил или гетероциклил, где алкил, циклоалкил, арил или гетероциклил соответствуют определениям в данном документе. Ацильные группы включают алканоил (например, ацетил), ароил (например, бензоил) и гетероароил (например, пиридиноил).
Термин «алкиламинилалкил» относится к -алкил-NRx-алкилу, где Rx представляет собой водород.
«Аралкильная группа» содержит арильную группу, ковалентно связанную с алкильной группой, любая из которых может быть необязательно замещенной или незамещенной. Примером аралкильной группы является (С1-6)алкил(С6-10)арил, включая, без ограничения, бензил, фенэтил и нафтилметил. Примером замещенного аралкила является такой, в котором алкильная группа замещена гидроксиалкилом.
Термин «диалкиламинил» относится к -N(Ry)2, где каждый Ry представляет собой С1-3 алкил.
Термин «диалкиламинилалкил» относится к -алкил-N(Ry)2, где каждый Ry представляет собой С1-4 алкил, где алкил из -алкил- N(Ry)2 может быть необязательно замещен гидрокси или гидроксиалкилом.
Термин «дигидроксиалкил» относится к алкильной группе по определению в данном документе, где каждый из двух атомов углерода замещен гидрокси-группой.
Термин «галогеналкил» относится к алкильной цепи, в которой один или более атомов водорода замещены галогеном. Примеры галогеналкилов включают трифторметил, дифторметил и фторметил.
Термин «гетероалкил» относится к алкильной группе по определению в данном документе, где один или более атомов углерода в цепи замещены гетероатомом, выбранным из группы, состоящей из О, S и N.
Термин «гетероциклилалкил» относится к гетероциклильной группе по определению в данном документе, связанной с остальной частью молекулы алкильным линкером, где алкильный линкер гетероциклилалкила может быть необязательно замещен гидрокси или гидроксиалкилом.
«Гетероарилалкильная» группа содержит гетероарильную группу, ковалентно связанную с алкильной группой, где радикал находится на алкильной группе, любая из которых может быть необязательно замещенной или незамещенной. Примеры гетероарилалкильных групп включают гетероарильную группу, имеющую 5, 6, 9 или 10 кольцевых атомов, связанных с С1-6 алкильной группой. Примеры гетероаралкильных групп включают пиридилметил, пиридилэтил, пирролилметил, пирролилэтил, имидазолилметил, имидазолилэтил, тиазолилметил, тиазолилэтил, бензимидазолилметил, бензимидазолилэтил, хиназолинилметил, хинолинилметил, хинолинилэтил, бензофуранилметил, индолинилэтил, изохинолинилметил, изоиндоилметил, циннолинилметил и бензотиофенилэтил. Из объема этого термина явным образом исключены соединения, имеющие смежные кольцевые атомы о и/или S.
Термина «соединение(я) по изобретению» и «соединение(я) по настоящему изобретению» и т.п., если не указано иное, включают соединения формулы (I), формулы (II) и формулы (III) и соединения, перечисленные в таблицах в данном документе, включая их стереоизомеры (включая атропоизомеры), геометрические изомеры, таутомеры, изотопы и соли (например, фармацевтически приемлемые соли).
Термин «необязательно замещенный», если не указано иное, означает, что группа может быть незамещенной или замещенной одним или более (например, 0, 1,2, 3, 4 или 5 или более, или любой диапазон, получаемый из этих значений) заместителями, перечисленными для этой группы, в которой указанные заместители могут быть одинаковыми или разными. В варианте осуществления необязательно замещенная группа имеет 1 заместитель. В другом варианте осуществления необязательно замещенная группа имеет 2 заместителя. В другом варианте осуществления необязательно замещенная группа имеет 3 заместителя. В другом варианте осуществления необязательно замещенная группа имеет 4 заместителя. В другом варианте осуществления необязательно замещенная группа имеет 5 заместителей.
В контексте данного документа волнистая линия  которая пересекает связь в химической структуре, указывает точку присоединения атома, с которым волнистая связь соединена в химической структуре, с остальной молекулой или с остальным фрагментом молекулы. Если химическая структура содержит две волнистые линии, пересекающие связь, структура может быть соединена с остальной молекулой или с остальным фрагментом молекулы в любой ориентации.
которая пересекает связь в химической структуре, указывает точку присоединения атома, с которым волнистая связь соединена в химической структуре, с остальной молекулой или с остальным фрагментом молекулы. Если химическая структура содержит две волнистые линии, пересекающие связь, структура может быть соединена с остальной молекулой или с остальным фрагментом молекулы в любой ориентации.
В определенных вариантах осуществления двухвалентные группы описаны в общем случае без конкретных конфигураций связи. Понятно, что общее описание подразумевает включение обеих конфигураций связи, если не указано иное. Например, в группе R1-R2-R3, если группа R2 описана как -СН2С(O)-, понятно, что эта группа может быть связана как R1-CH2C(O)-R3, так и R1-C(O)CH2-R3, если не указано иное.
Термин «фармацевтически приемлемый» относится к молекулярным веществам и композициям, которые не вызывают побочную, аллергическую или другую нежелательную реакцию при введении животному, такому как, например, человек, в зависимости от ситуации.
Соединения по изобретению могут находиться в форме соли, такой как фармацевтически приемлемая соль. «Фармацевтически приемлемые соли» включают как соли присоединения кислот, так и соли присоединения оснований. «Фармацевтически приемлемая соль присоединения кислот» относится к солям, которые сохраняют биологическую эффективность и свойства свободных оснований и которые не являются биологически или иным образом нежелательными, образуемым с неорганическими кислотами, такими как хлористоводородная кислота, бромистводородная кислота, серная кислота, азотная кислота, угольная кислота, фосфорная кислота и п. т., а органические кислоты могут быть выбраны из алифатического, циклоалифатического, ароматического, аралифатического, гетероциклического, крбонового и сульфонового классов органических кислот, такие как муравьиная кислота, уксусная кислота, пропионовая кислота, гликолевая кислота, глюконовая кислота, молочная кислота, пировиноградная кислота, щавеленая кислота, яблочная кислота, малеиновая кислота, малоновая кислота, янтарная кислота, фумаровая кислота, винная кислота, лимонная кислота, аспарагиновая кислота, аскорбиновая кислота, глутаминовая кислота, антраниловая кислота, бензойная кислота, коричная кислота, миндальная кислота, эмбоновая кислота, фенилуксусная кислота, метансульфоновая кислота, этансульфоновая кислота, бензолсульфоновая кислота, пара-толуолсульфоновая кислота, салициловая кислота и т.п.
Термин «фармацевтически приемлемые соли присоединения оснований» включает полученные из неорганических оснований, такие как соли натрия, калия, лития, аммония, кальция, магния, железа, цинка, меди, марганца, алюминия и т.п. Конкретные соли присоединения оснований представляют собой соли аммония, калия, натрия, кальция и магния. Соли, полученные из фармацевтически приемлемых органических нетоксичных оснований, включают соли первичных, вторичных и третичных аминов, замещенных аминов, включая встречающиеся в природе замещенные амины, циклические амины и основные ионообменные смолы, такие как изопропиламин, триметиламин, диэтиламин, триэтиламин, трипропиламин, этаноламин, 2-диэтиламиноэтанол, триметамин, дициклогексиламин, лизин, аргинин, гистидин, кофеин, прокаин, гидрабамин, холин, бетаин, этилендиамин, глюкозамин, метилглюкамин, теобромин, пурины, пиперизин, пиперидин, N-этилпиперидин, полиаминные смолы и т.п. Конкретные органические нетоксичные основания включают изопропиламин, диэтиламин, этаноламин, трометамин, дициклогексиламин, холин и кофеин.
В некоторых вариантах осуществления соль выбрана из гидрохлорида, гидробромида, трифторацетата, фосфата, сульфата, ацетата, фумарата, малеата, тартрата, лактата, цитрата, пирувата, сукцината, оксалата, метансульфоната, пара-толуолсульфоната, бисульфата, бензол сульфоната, этансульфоната, малоната, ксинафоата, аскорбата, олеата, никотината, сахарината, адипата, формиата, гликолята, пальмитата, L-лактата, D-лактата, аспартата, малата, L-тартрата, D-тартрата, стеарата, фуроата (например, 2-фуроат или 3-фуроат), нападизилата (нафтален-1,5-дисульфонат или нафтален-1-(сульфоновая кислота)-5-сульфонат), эдизилата (этан-1,2-дисульфонат или этан-1-(сульфоновая кислота)-2-сульфонат), изотионата (2-гидроксиэтилсульфонат), 2-мезитиленсульфоната, 2-нафталенсульфоната, 2,5-дихлорбензолсульфоната, D-манделата, L-манделата, циннамата, бензоата, адипата, эзилата, малоната, мезитилата (2-мезитиленсульфонат), напзилата (2-нафталенсульфонат), камзилата (камфор-10-сульфонат, например, соль (1S)-(+)-10-камфорсульфоновой кислоты), глутамата, глутарата, гиппурата (2-(бензоиламино)ацетата), оротата, ксилата (пара-ксилен-2-сульфонат) и памоевого (2,2'-дигидрокси-1,1 '-динафтилметан-3,3''-дикарбоксилата).
«Стерильный» состав является асептическим или не содержит живые микроорганизмы и их споры.
Термин «стереоизомер» относится к соединениям, которые имеют идентичное химическое строение, но отличаются расположением атомов или групп в пространстве. Стереоизомеры включают диастереомеры, энантиомеры, конформеры и т.п.
Термин «хиральный» относится к молекулам, которые обладают свойством не совпадения при наложении с зеркальным отображением, тогда как термин «ахиральный» относится к молекулам, которые совпадают при наложении на зеркальное изображение.
Термин «диастереомер» относится к стереоизомеру с двумя или более центрами хиральности и молекулы которого не являются зеркальным отображением друг друга. Диастереомеры обладают отличными физическими свойствами, например, точками плавления, точками кипения, спектральными свойствами и биологической активностью. Смеси диастереомеров можно разделять с помощью аналитических процедур с высоким разрешением, таких как электрофорез и хроматография, такая как вэжх.
Термин «энантиомеры» относится к двум стереоизомерам соединения, которые не являются совмещаемыми зеркальными отображениями друг друга.
Стереохимические определения и обозначения, используемые в данном документе, в целом соответствуют S. P. Parker, Ed., McGraw-Hill Dictionary of Chemical Terms (1984) McGraw-Hill Book Company, New York; и Eliel, E. and Wilen, S., "Stereochemistry of Organic Compounds", John Wiley & Sons, Inc., New York, 1994. Многие органические соединения существуют в оптически активных формах, т.е. они обладают способностью вращать плоскость плоскополяризованного света. При описании оптически активного соединения приставки D и L, или R и S, используют для обозначения абсолютной конфигурации молекулы относительно ее хирального(ых) центра(ов). Приставки d и 1 или (+) и (-) применяют для обозначения направления вращения плоскополяризованного света соединением, при этом (-) или 1 означает, что соединение является левовращающим. Соединение с приставкой (+) или d является правовращающим. В случае заданной химической структуры эти стереоизомеры являются идентичными за исключением того, что они являются зеркальными отображениями друг друга. Также конкретный стереоизомер может называться энантиомером, а смесь таких изомеров часто называется энантиомерной смесью. Смесь энантиомеров в соотношении 50:50 называется рацемической смесью или рацематом, что может встречаться в химической реакции или процессе, когда отсутствует стереоселективность или стереоспецифичность. Термины «рацемическая смесь» и «рацемат» относятся к эквимолярной смеси двух энантиомерных соединений без оптической активности.
Термин «таутомер» или «таутомерная форма» относится к структурным изомерам с разной энергией, которые являются взаимопревращаемыми при переходе через низкоэнергетический барьер. Например, протонные таутомеры (также известные как прототропные таутомеры) включают взаимопревращения в ходе перемещения протона, например, кето-енольная и имин-енаминовая изомеризация. Валентные таутомеры включают взаимопревращения в ходе перегруппировки некоторых из связывающих электронов.
«Атропоизомеры» представляют собой стереоизомеры, возникающие из-за пространственного затруднения вращения вокруг одинарной связи, когда разница в энергии вследствие пространственной деформации или других факторов создает барьер для вращения, который является достаточно высоким, чтобы можно было выделить отдельные конформеры.
Определенные соединения по изобретению могут существовать в несольватированных формах, а также в сольватированных формах, включая гидратированные формы. «Сольват» относится к ассоциации или комплексу одной или более молекул растворителя и соединения по настоящему изобретению. Примеры растворителей, которые образуют сольваты, включают воду, изопропанол, этанол, метанол, ДМСО, этилацетат, уксусную кислоту и этаноламин. Определенные соединения по изобретению могут существовать в нескольких кристаллических или аморфных формах. В целом подразумевается, что все физические формы включены в объем настоящего изобретения. Термин «гидрат» относится к комплексу, в котором молекулой растворителя является вода.
«Метаболит» относится к продукту, образуемому посредством метаболизма в организме конкретного соединения или его соли. Такие продукты могут быть результатом, например, окисления, восстановления, гидролиза, амидирования, дезамидирования, этерификации, деэтерификации, ферментативного расщепления и т.п.вводимого соединения.
Продукты-метаболиты, как правило, идентифицируют путем получения радиоактивно меченного (например, 14С или 3Н) изотопа соединения по изобретению, вводимого в обнаруживаемой дозе (например, более чем около 0,5 мг/кг) животному, такому как крыса, мышь, морская свинка, обезьяна, или человеку, ожидания в течение времени, достаточного, чтобы произошел метаболизм (как правило, от около 30 секунд до 30 часов), и выделения продуктов превращения из мочи, крови или других биологических образцов. Эти продукты легко выделять, поскольку они помечены (другие выделяют посредством применения антител, способных связывать эпитопы, оставшиеся в метаболите). Структуры метаболитов определяют традиционным образом, например, с помощью МС, ЖХ/МС или ЯМР анализа. В целом, анализ метаболитов проводят так же, как и традиционные исследования метаболизма лекарственных препаратов, хорошо известные специалистам в данной области техники. Продукты-метаболиты, при условии, что они не встречаются in vivo, применимы в диагностическом анализе для терапевтического дозирования соединений по изобретению.
Описанное в данном документе изобретение включают меченые изотопами соединения по настоящему изобретению, которые идентичны перечисленным в данном документе, но за исключением того, что один или более атомов заменены атомом, имеющим атомную массу или массовое число, отличные от атомной массы или массового числа, обычно встречающихся в природе. Подразумевается, что все изотопы любого конкретного указанного атома или элемента входят в объем соединений по изобретению и их применения. Типовые изотопы, которые могут быть включены в соединения по изобретению, включают изотопы водорода, углерода, азота, кислорода, фосфора, серы, фтора, хлора и йода, такие как 2Н, 3Н, 11C, 13С, 14С, 13N, 15N, 15O, 17O, 18О, 32Р, 33Р, 35S, 18F, 36Cl, 123I и 125I. Определенные меченные изотопами соединения по настоящему изобретению (например, меченные 3Н и 14С) применимы в анализе тканевого распределения соединения и/или субстрата. Третированные изотопы (3Н) и изотопы углерода-14 (14С) применимы благодаря легкости получения и возможности обнаружения. Кроме того, замещение более тяжелыми изотопами, таким как дейтерий (т.е. 2Н), может обеспечивать определенные терапевтические преимущества в результате большей метаболической стабильности (например, повышения in vivo времени полужизни или снижения необходимых дозировок) и, следовательно, может быть предпочтительным в некоторых обстоятельствах. Замещение испускающими позитроны изотопами, такими как 15О, 13N, 11С и 18F, применимо в исследованиях методом позитронно-эмиссионной томографии (ПЭТ) для изучения занятости рецепторов субстрата. Меченные изотопами соединения по настоящему изобретению в общем случае можно получать, следуя процедурам, аналогичным описанным в данном документе в разделе примеров ниже, путем замещения меченным изотопом реагентом не меченного изотопом реагента.
В контексте данного документа термин «амино-защитная группа» относится к производному групп, обычно применяемых для блокирования или защиты аминогруппы при проведении реакций в других функциональных группах соединения. Примеры таких защитных групп включают карбаматы, амиды, алкильные и арильные группы и имины, а также многие производные N-гетероатомов, которые можно удалять с восстановлением необходимой аминной группы. Конкретными амино-защитными группами являются Pmb (пара-метоксибензил), Вое (трет-бутоксикарбонил), Fmoc (9-флуоренилметилоксикарбонил) и Cbz (карбобензилокси). Дополнительные примеры этих групп можно найти в Т. W. Greene and P. G. M. Wuts, "Protecting Groups in Organic Synthesis, 3rd ed., John Wiley & Sons, Inc., 1999. Термин «защищенный амино» относится к аминогруппе, замещенной одной из вышеуказанных амино-защитных групп.
В контексте данного документа термин «карбокси-защитная группа» относится к тем группам, которые являются стабильными в условиях последующей(их) реакции(ий) в других положениях молекулы, которые можно удалять в соответствующей точке, не разрушая остальную молекулу, с получением карбоксигруппы со снятой защитой. Примеры карбокси-защитных групп включают сложноэфирные группы и гетероциклильные группы. Сложноэфирные производные группы карбоновой кислоты можно применять, чтобы блокировать или защищать группу карбоновой кислоты при проведении реакций в других функциональных группах соединения. Примеры таких сложноэфирных групп включают замещенный арилалкил, включая замещенные бензилы, такие как 4-нитробензил, 4-метоксибензил, 3,4-диметоксибензил, 2,4-диметоксибензил, 2,4,6-триметоксибензил, 2,4,6-триметилбензил, пентаметилбензил, 3,4-метилендиоксибензил, бензгидрил, 4,4'-диметоксибензгидрил, 2,2',4,4'-тетраметоксибензгидрил, алкилоые или замещенные алкиловые сложные эфиры, такие как метил, этил, трет-бутил аллил или трет-амил, трифенилметил (тритил), 4-метокситритил, 4,4'-диметокситритил, 4,4',4''-триметокситритил, 2-фенилпроп-2-ил, сложные тиоэфиры, такие как трет-бутиловый сложный тиоэфир, сложные силиловые эфиры, такие как триметилсилиловые, трет-бутилдиметилсилиловые сложные эфиры, фенацил, 2,2,2-трихлорэтил, бета-(триметилсилил)этил, бета-(ди(н-бутил)метилсилил)этил, пара-толуолсульфонилэтил, 4-нитробензилсульфонилэтил, аллил, циннамил, 1-(триметилсилилметил)проп-1-ен-3-ил и подобные фрагменты. Другим примером карбокси-защитных групп являются гетероциклильные группы, такие как 1,3-оксазолинил. Дополнительные примеры этих групп можно найти в Т. W. Greene and P. G. M. Wuts, "Protecting Groups in Organic Synthesis, 3rd ed., John Wiley & Sons, Inc., 1999. Термин «защищенный карбокси» относится к карбоксигруппе, замещенной одной из вышеуказанных карбокси-защитных групп.
Соединения по изобретению могут содержать один или более асимметрических атомов углерода. Соответственно, соединения могут существовать в виде диастереомеров, энантиомеров и их смесей. При синтезе соединений можно использовать рацематы, диастереомеры или энантиомеры в качестве стартовых материалов или в качестве промежуточных соединений. Смеси конкретных диастереомерных соединений можно разделять или обогащать в отношении одного или более конкретных диастереомеров методами хроматографии или кристаллизации. Аналогично, энантиомерные смеси можно разделять или энантиомерно обогащать, используя те же методики или другие, известные в данной области техники. Каждый из асимметрических атомов углерода или азота может находиться в R- или S-конфигурации, и обе эти конфигурации входят в объем изобретения.
В проиллюстрированных в данном документе структурах, если стереохимия любого конкретного хирального атома не указана, все стереоизомеры предусмотрены и включены как соединения по изобретению. Если стереохимия указана цельным клином или пунктирной линией, представляющими конкретную конфигурацию, то этот стереоизомер указан и определен таким образом. Если не указано иное, при применении цельных клиньев или пунктирных линий подразумевается относительная стереохимия.
Другой аспект включает пролекарственные препараты соединений по изобретению, включая известные амино-защитные и карбокси-защитные группы, которые в физиологических условиях отделяются, например, гидролизуются, с получением соединения по настоящему изобретению.
Термин «пролекарственный препарат» относится к форме-предшественнице или производной форме фармацевтически активного вещества, которая является менее эффективной для пациента по сравнению с исходным лекарственным препаратом и подлежит ферментативным или гидролитическим активации или превращению в более активную исходную форму. Смотрите, например, Wilman, "Prodrugs in Cancer Chemotherapy" Biochemical Society Transactions, 14, pp. 375-382, 615th Meeting Belfast (1986) и Stella et al., "Prodrugs: A Chemical Approach to Targeted Drug Delivery," Directed Drug Delivery, Borchardt et al., (ed.), pp. 247-267, Humana Press (1985). Пролекарственные препараты включают, но не ограничиваются этим, фосфат-содержащие пролекарственные препараты, тиофосфат-содержащие пролекарственные препараты, сульфат-содержащие пролекарственные препараты, пептид-содержащие пролекарственные препараты, модифицированные D-аминокислотами пролекарственные препараты, гликозилированные пролекарственные препараты, Р-лактам-содержащие пролекарственные препараты, содержащие необязательно замещенный феноксиацетамид пролекарственные препараты или содержащие необязательно замещенный фенилацетамид пролекарственные препараты и 5-фторцитозиновые и 5-фторуридиновые пролекарственные препараты.
Конкретным классом пролекарственных препаратов являются соединения, в которых атом азота в амино-, амидино-, аминоалкиленамино-, иминоалкиленамино-или гуанидиногруппе замещен гидроксигруппой, -CO-R, -CO-OR или -CO-O-R-O-CO-R, где R представляет собой одновалентную или двухвалентную группу, например, алкил, алкилен или арил, или группу, имеющую формулу -С(O)-O-СР1Р2-галогеналкил, где Р1 и Р2 являются одинаковыми или разными и представляют собой водород, алкил, алкокси, циано, галоген, алкил или арил. В конкретном варианте осуществления атом азота представляет собой один из атомов азота амидиногруппы соединений по изобретению. Пролекарственные препараты можно получать путем проведения реакции соединения по настоящему изобретению с активированной группой, такой как ацильные группы, чтобы связать, например, атом азота в соединении с типовой карбонильной или активированной ацильной группой. Примерами активированных карбонильных соединений являются содержащие уходящую группу, связанную с карбонильной группой, и включают, например, ацилгалогениды, ациламины, соли ацилпиридиния, ацилалкоксиды, ацилфеноксиды, такие как пара-нитрофеноксиацил, динитрофеноксиацил, фторфеноксиацил и дифторфеноксиацил. Реакции в общем случае проводят в инертных растворителях при таких температурах, как от около -78 до около 50°С. Реакции также можно проводить в присутствии неорганического основания, например, карбоната калия или бикарбоната натрия, или органического основания, такого как амин, включая пиридин, триметиламин, триэтиламин, триэтаноламин и т.п.
Также охвачены дополнительные типы пролекарственных препаратов. Например, свободную карбоксильную группу соединения по изобретению можно дериватизировать в виде сложного амидного или алкилового эфира. В качестве другого примера соединения по изобретению, содержащие свободные гидроксигруппы, мжно дериватизировать в виде пролекарственных препаратов путем превращения гидроксигруппы в такую группу, как, без ограничения, сложноэфирная фосфатная, гемисукцинатная, диметиламиноацетатная или фосфорилоксиметилоксикарбонильная группа, как описано в Fleisher, D. et al., (1996) Improved oral drug delivery: solubility limitations overcome by the use of prodrugs Advanced Drug Delivery Reviews, 19:115. Также включены карбаматные пролекарственные препараты гидрокси- и аминогрупп, как и карбонатные пролекарственные препараты, сложные сульфонатные эфиры и сложные сульфатные эфиры гидроксигрупп. Также охвачена дериватизация гидроксигрупп, таких как (ацилокси)метиловые и (ацилокси)этиловые эфиры, где ацильная группа может представлять собой сложный алкиловый эфир, необязательно замещенный группами, включая, но не ограничиваясь этим, эфирные, аминные и карбоновокислые функциональные фрагменты, или где ацильная группа представляет собой сложный аминокислотный эфир, как описано выше. Пролекарственные препараты этого типа описаны в J. Med. Chem., (1996), 39:10. Более конкретные примеры включают замещение атома водорода в спиртовой группе такой группой, как (С1-6)алканоилоксиметил, 1-((С1-6)алканоилокси)этил, 1-метил-1-((С1-6)алканоилокси)этил, (С1-6)алкоксикарбонилоксиметил, N-(C1-6)алкоксикарбониламинометил, сукциноил, (С1-6)алканоил, альфа-амино(С1-4)алканоил, арилацил и альфа-аминоацил или альфа-аминоацил-альфа-аминоацил, где каждая альфа-аминоацильная группа независимо выбрана из L-аминокислот природного происхождения, Р(O)(ОН)2, -Р(O)(0(С1-6)алкила)2 или гликозила (радикала, получаемого в результате удаления гидроксильной группы гемиацетальной формы углевода).
Термин «уходящая группа» относится к части первого реагента в химической реакции, которая вытесняется из первого реагента в химической реакции. Примеры уходящих групп включают, но не ограничиваются этим, атомы галогенов, алкокси- и сульфонилоксигруппы. Примеры сульфонилоксигрупп включают, но не ограничиваются этим, алкил сульфонилоксигруппы (например, метилсульфонилокси (мезилатная группа) и трифторметилсульфонилокси (трифлатная группа)) и арилсульфонилоксигруппы (например, пара-толуолсульфонилокси (тозилатная группа) и пара-нитросульфонилокси (нозилатная группа)).
«Субъект», «индивиду» или «пациент» представляет собой позвоночное. В определенных вариантах осуществления позвоночное представляет собой млекопитающее. Млекопитающие включают, но не ограничиваются этим, сельскохозяйственных животных (таких как коровы), спортивных животных, домашних животных (таких как морские свинки, кошки, собаки, кролики и лошади), приматов, мышей и крыс. В определенных вариантах осуществления млекопитающее представляет собой человека. В вариантах осуществления, включающих введение соединения пациенту, пациент, как правило, нуждается в этом.
Термины «ингибирование» и «снижение», или любая вариация этих терминов, включают любое поддающееся измерению снижение или полное ингибирование с получением необходимого результата. Например, снижение может составлять около, не больше чем около или по меньшей мере около 5%, 10%, 15%, 20%, 25%, 30%, 35%, 40%, 45%, 50%, 55%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 95%, 99% или более, или любой диапазон, получаемый из этих значений, снижения активности по сравнению с нормой.
«Терапевтически эффективное количество» обозначает количество соединения по настоящему изобретению, такого как соединение формулы (I) и формулы (II), которое (i) лечит или предотвращает конкретное заболевание, состояние или нарушение или (ii) ослабляет, облегчает или устраняет один или более симптомов конкретного заболевания, состояния или нарушения и, необязательно, (iii) предотвращает или задерживает появление одного или более симптомов конкретного заболевания, состояния или нарушения, описанного в данном документе. В случае рака терапевтически эффективное количество лекарственного препарата может снижать число раковых клеток; уменьшать размер опухоли; ингибировать (т.е. в некоторой степени замедлять и предпочтительно останавливать) инфильтрацию раковых клеток в периферические органы; ингибировать (т.е. в некоторой степени замедлять и предпочтительно останавливать) метастазирование опухоли; ингибировать в некоторой степени рост опухоли; или смягчать в некоторой степени один или более симптомов, связанных с раком. В тех случаях, когда лекарственный препарат может предотвращать рост или уничтожать существующие раковые клетки, он может быть цитостатическим или цитотоксическим. В случае противораковой терапии эффективность можно определять, например, оценивая время до прогрессирования заболевания (ВДП) или определяя частоту ответа (40).
«Лечение» (и его вариации, такие как «лечить» или «лечащий») относится к клиническому вмешательству с целью изменения естественного течения заболевания индивида или клетки, лечение которых проводят, и может проводиться как для профилактики («профилактическое лечение»), так и во время клинической патологии («терапевтическое лечение»). Необходимые эффекты лечения включают предотвращение появления или повторного появления заболевания, облегчение симптомов, уменьшение любых прямых или непрямых патологических последствий заболевания, стабилизацию (т.е. отсутствие ухудшения) состояния заболевания, снижение скорости прогрессирования заболевания, ослабление или временное облегчение состояния заболевания, продление выживаемости по сравнению с ожидаемой выживаемостью при отсутствии лечения и улучшение прогноза. В некоторых вариантах осуществления соединения по изобретению применяют для задержки развития заболевания или нарушения или для замедления прогрессирования заболевания или нарушения. Те, кто нуждается в лечении, включают тех, у кого уже имеется патологическое состояние или нарушение, а также тех, кто предрасположен к патологическому состоянию или нарушению (например, вследствие генетической мутации), или тех, у кого необходимо предотвратить патологическое состояние или нарушение.
«Терапевтический эффект» в контексте применения этого термина в данном документе охватывает терапевтическую пользу и/или профилактическую пользу, как описано выше. Профилактический эффект включает задержку или устранение появления заболевания или патологического состояния, задержку или устранение появления симптомов заболевания или патологического состояния, замедление, приостановку или обращение прогрессирования заболевания или патологического состояния или любую их комбинацию.
В контексте данного документа выражения «совместное введение», «вводимый в сочетании с» и их грамматические эквиваленты охватывают введение двух или более агентов животному, включая людей, таким образом, что оба агента и/или их метаболиты присутствуют в организме субъекта одновременно. Совместное введение включает одновременное введение в отдельных композициях, введение в разное время в отдельных композициях или введение в композиции, в которой присутствуют оба агента.
Термины «антагонист» и «ингибитор» используются взаимозаменяемо и относятся к соединению, обладающему способностью ингибировать биологическую функцию целевого белка, путем ингибирования активности или экспрессии белка, такого как K-Ras, H-Ras или N-Ras G12C. Соответственно, термины «антагонист» и «ингибитор» определены в контексте биологической роли целевого белка. Хотя предпочтительные антагонисты по данному документу специфически взаимодействуют (например, связываются) с мишенью, соединения, которые ингибируют биологическую активность целевого белка путем взаимодействия с другими представителями пути передачи сигнала, представителем которого является целевой белок, также явным образом включены в это определение. Предпочтительная биологическая активность, ингибируемая антагонистом, связана с развитием, ростом или распространением опухоли.
В контексте данного документа термин «агонист» относится к соединению, обладающему способностью инициировать или усиливать биологическую функцию целевого белка, путем ингибирования активности или экспрессии целевого белка. Соответственно, термин «агонист» определен в контексте биологической роли целевого полипептида. Хотя предпочтительные агонисты по данному документу специфически взаимодействуют (например, связываются) с мишенью, соединения, которые инициируют или усиливают биологическую активность целевого полипептида путем взаимодействия с другими представителями пути передачи сигнала, представителем которого является целевой полипептид, также явным образом включены в это определение.
Термины «рак» и «раковый», «новообразование» и «опухоль», а также схожие термины, относятся к физиологическому состоянию или описывают физиологическое состояние у млекопитающих, которое, как правило, характеризуется нерегулируемым ростом клеток. «Опухоль» содержит одну или более раковых клеток. Примеры рака включают карциному, бластому, саркому, семиному, глиобластому, меланому, лейкоз и миелоидные или лимфоидные злокачественные образования. Более конкретные примеры таких раков включают плоскоклеточный рак (например, эпителиальный плоскоклеточный рак) и рак легких, включая мелкоклеточный рак легких, немелкоклеточный рак легких («НМРЛ»), аденокарциному легких и плоскоклеточную карциному легких. Другие раки включают рак кожи, кератоакантому, фолликулярную карциному, волосатоклеточный лейкоз, рак ротовой полости, рак глотки (оральный), рак губы, рак языка, рак ротоглотки, рак слюнной железы, рак пищевода, рак гортани, гепатоцеллюлярный рак, рак желудка, рак желудочно-кишечного тракта, рак тонкого кишечника, рак толстого кишечника, рак поджелудочной железы, рак шейки матки, рак яичника, рак печени, рак мочевого пузыря, гепатому, рак молочной железы, рак ободочной кишки, ректальный рак, колоректальный рак, рак мочеполовой системы, рак желчного протока, рак щитовидной железы, папиллярый рак, рак печени, рак эндометрия, рак матки, рак слюнной железы, рак почки, рак предстательной железы, рак яичка, рак вульвы, рак брюшной полости, рак анального канала, рак полового члена, рак костей, множественную миелому, В-клеточную лимфому, диффузную крупноклеточную В-клеточную лимфому (ДКВЛ), рак центральной нервной системы, рак головного мозга, рак головы и шеи, лимфому Ходжкина и сопуствующие метастазы. Примеры неопластических нарушений включают миелопролиферативные нарушения, такие как истинная полицитемия, эссенциальный тромбоцитоз, миелофиброз, такой как первичный миелофиброз, и хронический миелогенный лейкоз (ХМЛ).
«Химиотерапевтический агент» представляет собой агент, применимый при лечении заданного нарушения, например, рака или воспалительных нарушений. Примеры химиотерапевтических агентов хорошо известны в данной области техники и включают такие примеры, как описаны в публикации заявки США №2010/0048557, включенной в данный документ посредством ссылки. Кроме того, химиотерапевтические агенты включают фармацевтически приемлемые соли, кислоты или производные любого из химиотерапевтических агентов, а также комбинации двух или более из них.
Когда в данном документе заместитель изображен присоединенным в центре кольца, следует понимать, что заместитель может быть присоединен в любом положении кольца. Если кольцо представляет собой бициклическую систему с конденсированными кольцами, заместитель может быть присоединен в любом положении в любом кольце в бициклической кольцевой системе.
Если не указано иное, структуры, изображенные в данном документе, также включают соединения, которые отличаются только наличием одного или более обогащенных изотопами атомов. Типовые изотопы, которые могут быть включены в соединения по изобретению, включают изотопы водорода, углерода, азота, кислорода, фосфора, серы, фтора, хлора и йода, такие как 2Н, 3Н, 11C, 13С, 14С, 13N, 15N, 15O, 17O, 18О, 32P, 33P, 35S, 18F, 36Cl, 123I и 125I, соответственно. Меченные изотопами соединения (например, меченные 3Н и 14С) применимы в анализе тканевого распределения соединения или субстрата. Третированные изотопы (т.е. 3Н) и изотопы углерода-14 (т.е. 14С) применимы благодаря легкости получения и возможности обнаружения. Кроме того, замещение более тяжелыми изотопами, таким как дейтерий (т.е. 2Н), может обеспечить определенные терапевтические преимущества в результате большей метаболической стабильности (например, повышения in vivo времени полужизни или снижения необходимых дозировок). В некоторых вариантах осуществления в соединениях по изобретению один или более атомов углерода замещены 13С- или 14С-обогащенным углеродом. Замещение испускающими позитроны изотопами, такими как 15О, 13N, 11С и 18F, применимо в исследованиях методом позитронно-эмиссионной томографии (ПЭТ) для изучения занятости рецепторов субстрата. Меченные изотопами соединения в общем случае можно получать, следуя процедурам, аналогичным описанным в данном документе в разделах схем или примеров, путем замещения меченным изотопом реагентом не меченного изотопом реагента.
Явным образом предусмотрено, что любое ограничение, обсуждаемое в отношении одного варианта осуществления изобретения, может быть применимо к другому варианту осуществления изобретения. Кроме того, любые соединение или композицию по изобретению можно использовать в любом способе по изобретению, а любой способ по изобретению можно применять для получения или для применения любых соединения или композиции по изобретению.
Использование термина «или» обозначает «и/или», если четко не указано, что он относится только к альтернативным вариантам или же альтернативные варианты являются взаимоисключающими, хотя изобретение поддерживает определение, которое относится к единственным альтернативным вариантам и «и/или».
В тексте этой заявки термин около» используется для указания того, что значение включает стандартное отклонение ошибки для устройства или способа, применяемых для определения этого значения.
В контексте данного документа единственное число означает один или более, если явно не указано иное. В контексте данного документа «другой» означает по меньшей мере второй или более.
Используемые в данном документе заголовки предназначены только для упорядочения.
ИНГИБИТОРЫ RAS
В одном аспекте в изобретении предложены соединения, которые способны избирательно связывать и/или модулировать белок K-Ras, H-Ras или N-Ras с мутацией G12C. В одном варианте осуществления в изобретении предложены соединения, способные избирательно связывать и/или модулировать белок K-Ras с мутацией G12C.
Как было отмечено, один аспект изобретения включает соединение формулы (I):
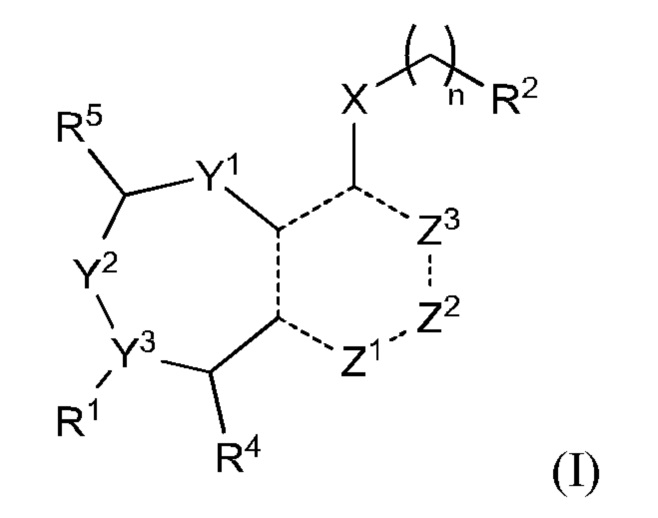
или его фармацевтически приемлемую соль; где
R1 выбран из группы, состоящей из Н, С6-10 арила, 5-10-членного гетероарила и 5-10-членного гетероциклила, где каждый арил, гетероарил и гетероциклил необязательно замещен одним - четырьмя заместителями, где каждый заместитель независимо выбран из группы, состоящей из С1-6 алкила, -NH2, -NH(СН3), -N(СН3)2, галогена, С1-6 галогеналкила, оксо, С1-6 гидроксиалкила, С3-6 циклоалкила, -ОС(=O)СН=СН2 и гидрокси;
R2 представляет собой электрофильный фрагмент, способный образовывать ковалентную связь с остатком цистеина в позиции 12 мутантного белка Ras G12C;
Y1 представляет собой C(H)(R6) или Y1 отсутствует;
Y2 выбран из группы, состоящей из N(R7) и C(H)(R8);
Y3 выбран из группы, состоящей из C(R3) и N;
Z1 выбран из группы, состоящей из N, N(R9), О, S, S(O) и S(O)2;
Z2 представляет собой C(R10), C(-L-R10a) или Z2 отсутствует;
Z3 выбран из группы, состоящей из N, N(R11) и C(R12);
каждый из R3, R4, R5, R6, R7, R8, R9, R10, R11 и R12 независимо выбран из группы, состоящей из Н, С2-6 алкенила, С1-6 алкокси, С1-6 алкила, С1-6 алкила, замещенного 4-10-членным гетероциклильным заместителем, С1-6 алкилсульфанила, С1-6 алкилсульфонила, С1-6 алкилтио, С2-6 алкинила, С1-6 алкиламино, амино, арила, арила, замещенного С1-6 алкилом, С1-6 аминоалкила, карбамоила, С1-6 карбамоилалкила, С1-6 карбоксиалкила, циано, С1-6 цианоалкила, С3-7 циклоалкила, галогена, С1-6 галогеналкокси, С1-6 галогеналкила, 5-10-членного гетероарила, 4-10-членного гетероциклила, гидрокси и оксо;
или R1 и R3 вместе с атомом углерода, с которым они связаны, могут образовывать необязательно замещенный 3-6-членный циклоалкил;
или R3 и R4, R3 и R8, R5 и R6 или R5 и R8, вместе с атомами, с которыми связан каждый из них, могут образовывать 3-6-членный циклоалкил или 3-6-членный гетероциклил;
L представляет собой связь, О, S или N(La);
R10a выбран из группы, состоящей из водорода, алкила, гидроксиалкила, дигидроксиалкила, алкиламинилалкила, диалкиламинилалкила, -Lb-NLaLc, гетероциклила, гетероциклил алкил а, арила, гетероарила или гетероарилалкила, где каждый из Lb, гетероциклила, гетероциклилалкила, арила, гетероарила и гетероарилалкила может быть необязательно замещен одним или более Ld;
каждый La независимо представляет собой водород или С1-3 алкил;
Lb представляет собой С1-4алкилен;
каждый Lc независимо представляет собой водород, ацил, С1-3 алкил, гетероалкил или гидроксиалкил;
каждый Ld независимо представляет собой водород, оксо, ацил, гидрокси, гидроксиалкил, циано, галоген, С1-6 алкил, аралкил, галогеналкил, гетероалкил, циклоалкил, гетероциклилалкил, алкокси, диалкиламинил, диалкиламидоалкил или диалкиламинилалкил, где С1-6 алкил может быть необязательно замещен циклоалкилом;
X выбран из группы, состоящей из С1-6 алкокси, С1-6 алкила, амино, С1-6 алкиламино, С1-6 алкилсульфанила, С1-6 алкилсульфонила, С1-6 алкилтио, С3-7 циклоалкила, 4-7-членного гетероциклила и 4-7-членного гетероциклиламино; каждый из которых необязательно замещен 1-4 заместителями, где каждый заместитель независимо выбран из группы, состоящей из С1-6 алкила, амино, С1-6 аминоалкила, карбамоила, С1-6 карбамоилалкила, карбокси, С1-6 карбоксиалкила, циано, С1-6 цианоалкила, галогена, С1-6 галогеналкила, гидрокси, С1-6 гидроксиалкила и 4-7-членного гетероциклила; где два геминальных заместителя могут быть взяты вместе с образованием С3-7 спироциклоалкила или 4-7-членного спирогетероциклила;
n выбрано из 0, 1 и 2; и
 представляет одинарную связь или двойную связь. В соответствии с некоторыми вариантами осуществления соединения формулы (I) или его фармацевтически приемлемой соли R2 представляет собой электрофильный фрагмент, способный образовывать ковалентную связь с остатком цистеина в позиции 12 мутантного белка K-Ras G12C.
представляет одинарную связь или двойную связь. В соответствии с некоторыми вариантами осуществления соединения формулы (I) или его фармацевтически приемлемой соли R2 представляет собой электрофильный фрагмент, способный образовывать ковалентную связь с остатком цистеина в позиции 12 мутантного белка K-Ras G12C.
В соответствии с некоторыми вариантами осуществления соединения формулы (I) или его фармацевтически приемлемой соли R2 представляет собой электрофильный фрагмент, способный образовывать ковалентную связь с остатком цистеина в позиции 12 мутантного белка H-Ras G12C.
В соответствии с некоторыми вариантами осуществления соединения формулы (I) или его фармацевтически приемлемой соли R2 представляет собой электрофильный фрагмент, способный образовывать ковалентную связь с остатком цистеина в позиции 12 мутантного белка N-Ras G12C.
В вышеприведенном определении R2, электрофильный фрагмент, способный образовывать ковалентную связь с остатком цистеина, определяют с помощью исследований алкилирования K-Ras G12C и анализа методом гомогенной флуоресценции с временным разрешением (ГФВР). Мутация G12C гена K-Ras представляет собой замену аминокислоты с глицина на цистеин в 12-ой аминокислоте. Соединения в соответствии с настоящим изобретением были обнаружены с помощью анализа ГФВР и анализа алкилирования K-Ras G12C, как дополнительно подробно описано ниже в данном документе, после чего использовали ЯМР-спектроскопию, чтобы подтвердить специфичность, с которой молекула присоединялась к G12C. В другом аспекте изобретение включает соединение формулы (II):
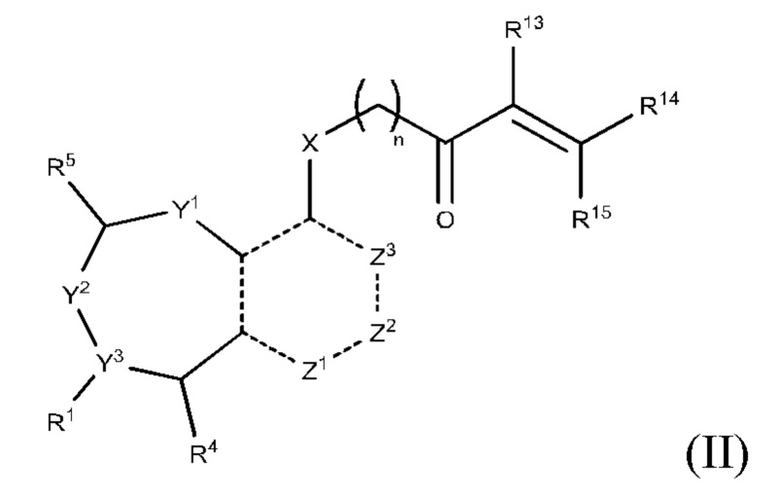
или его фармацевтически приемлемую соль;
где
R1 выбран из группы, состоящей из Н, С6-10 арила, 5-10-членного гетероарила и 5-10-членного гетероциклила, где каждый арил, гетероарил и гетероциклил необязательно замещен одним - четырьмя заместителями, где каждый заместитель независимо выбран из группы, состоящей из С1-6 алкила, -NH2, -NH(CH3), -N(CH3)2, галогена, С1-6 галогеналкила, оксо, С1-6 гидроксиалкила, С3-6 циклоалкила, -ОС(=O)СН=СН2 и гидрокси;
Y1 представляет собой C(H)(R6) или Y1 отсутствует;
Y2 выбран из группы, состоящей из N(R7) и C(H)(R8);
Y3 выбран из группы, состоящей из C(R3) и N;
Z1 выбран из группы, состоящей из N, N(R9), О, S, S(O) и S(O)2;
Z2 представляет собой C(R10), C(-L-R10a) или Z2 отсутствует;
Z3 выбран из группы, состоящей из N, N(R11) и C(R12);
каждый из R3, R4, R5, R6, R7, R8, R9, R10, R11 и R12 независимо выбран из группы, состоящей из Н, С2-6 алкенила, С1-6 алкокси, С1-6 алкила, С1-6 алкила, замещенного 4-10-членным гетероциклильным заместителем, С1-6 алкилсульфанила, С1-6 алкилсульфонила, С1-6 алкилтио, С2-6 алкинила, С1-6 алкиламино, амино, арила, арила, замещенного С1-6 алкилом, С1-6 аминоалкила, карбамоила, С1-6 карбамоилалкила, С1-6 карбоксиалкила, циано, С1-6 цианоалкила, С3-7 циклоалкила, галогена, С1-6 галогеналкокси, С1-6 галогеналкила, 5-10-членного гетероарила, 4-10-членного гетероциклила, гидрокси и оксо;
или R1 и R3 вместе с атомом углерода, с которым они связаны, могут образовывать необязательно замещенный 3-6-членный циклоалкил;
или R3 и R4, R3 и R8, R5 и R6 или R5 и R8, вместе с атомами, с которыми связан каждый из них, могут образовывать 3-6-членный циклоалкил или 3-6-членный гетероциклил;
R13 выбран из группы, состоящей из Н, циано и галогена; и каждый из R14 и R15 независимо выбран из группы, состоящей из Н, С1-6 алкила, C1-6 галогеналкила, циано и галогена; где C1-6 алкил необязательно замещен одним заместителем, выбранным из группы, состоящей из: метансульфонила (мезила), пара-толуолсульфонила (тозила), алкил- или арилсульфонатной уходящей группы, С1-6 алканоиламино, С1-6 алкокси, С1-6 алкиламино, С3-6 циклоалкиламино, С1-6 алкилсульфониламино, С1-12 диалкиламино и С1-6 галогеналкокси;
или
R13 и R14 вместе образуют тройную связь между атомами углерода, к которым они присоединены, или R13 и R14 вместе с атомами углерода, с которыми связан каждый из них, образуют С3-7 циклоалкенил, необязательно замещенный одним или двумя заместителями-галогенами; и R15 выбран из группы, состоящей из Н, С1-6 алкила C1-6 галогеналкила, циано и галогена; где C1-6 алкил необязательно замещен одним заместителем, выбранным из группы, состоящей из: С1-6 алканоиламино, С1-6 алкокси, С1-6 алкиламино, С1-6 алкилсульфониламино, С6-12 диалкиламино и С1-6 галогеналкокси;
L представляет собой связь, О, S или N(La);
R10a выбран из группы, состоящей из водорода, алкила, гидроксиалкила, дигидроксиалкила, алкиламинилалкила, диалкиламинилалкила, -Lb-NLaLc, гетероциклила, гетероциклилалкила, арила, гетероарила или гетероарилалкила, где каждый из Lb, гетероциклила, гетероциклилалкила, арила, гетероарила и гетероарилалкила может быть необязательно замещен одним или более Ld;
каждый La независимо представляет собой водород или С1-3 алкил;
Lb представляет собой С1-4 алкилен;
каждый Lc независимо представляет собой водород, ацил, С1-3 алкил, гетероалкил или гидроксиалкил;
каждый Ld независимо представляет собой водород, оксо, ацил, гидрокси, гидроксиалкил, циано, галоген, С1-6 алкил, аралкил, галогеналкил, гетероалкил, циклоалкил, гетероциклилалкил, алкокси, диалкиламинил, диалкиламидоалкил или диалкиламинилалкил, где С1-6 алкил может быть необязательно замещен циклоалкилом;
X выбран из группы, состоящей из C1-6 алкокси, C1-6 алкила, амино, C1-6 алкиламино, C1-6 алкилсульфанила, C1-6 алкилсульфонила, C1-6 алкилтио, С3-7 циклоалкила, 4-7-членного гетероциклила и 4-7-членного гетероциклиламино; каждый из которых необязательно замещен 1-4 заместителями, где каждый заместитель независимо выбран из группы, состоящей из C1-6 алкила, амино, С1-6 аминоалкила, карбамоила, С1-6 карбамоилалкила, карбокси, С1-6 карбоксиалкила, циано, C1-6 цианоалкила, галогена, C1-6 галогеналкила, гидрокси, С1-6 гидроксиалкила и 4-7-членного гетероциклила; где два геминальных заместителя могут быть взяты вместе с образованием С3-7 спироциклоалкила или 4-7-членного спирогетероциклила;
n выбрано из 0, 1 и 2; и
------представляет одинарную связь или двойную связь.
В другом аспекте изобретение включает соединение формулы (III):
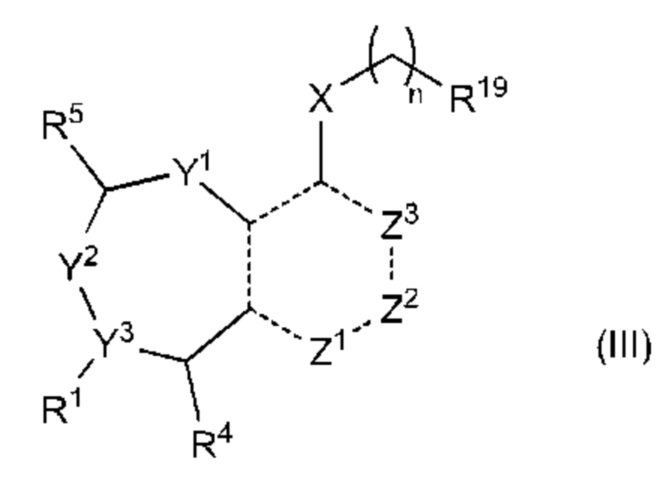
или его фармацевтически приемлемую соль; где
R1 выбран из группы, состоящей из Н, С6-10 арила, 5-10-членного гетероарила и 5-10-членного гетероциклила, где каждый арил, гетероарил и гетероциклил необязательно замещен одним - четырьмя заместителями, где каждый заместитель независимо выбран из группы, состоящей из C1-6 алкила, -NH2, -NH(CH3), -N(CH3)2, галогена, C1-6 галогеналкила, оксо, C1-6 гидроксиалкила, С3-6 циклоалкила, -ОС(=О)СН=СН2 и гидрокси;
Y1 представляет собой C(H)(R6) или Y1 отсутствует;
Y2 выбран из группы, состоящей из N(R7) и C(H)(R8);
Y3 выбран из группы, состоящей из C(R3) и N;
Z1 выбран из группы, состоящей из N, N(R9), О, S, S(O) и S(O)2;
Z2 представляет собой C(R10), C(-L-R10a) или Z2 отсутствует;
Z3 выбран из группы, состоящей из N, N(R11) и C(R12);
каждый из R3, R4, R5, R6, R7, R8, R9, R10, R11 и R12 независимо выбран из группы, состоящей из Н, С2-6 алкенила, C1-6 алкокси, C1-6 алкила, C1-6 алкила, замещенного 4-10-членным гетероциклильным заместителем, C1-6 алкилсульфанила, С1-6 алкилсульфонила, C1-6 алкилтио, С2-6 алкинила, С1-6 алкиламино, амино, арила, арила, замещенного С1-6 алкилом, С1-6 аминоалкила, карбамоила, С1-6 карбамоилалкила, С1-6 карбоксиалкила, циано, С1-6 цианоалкила, С3-7 циклоалкила, галогена, С1-6 галогеналкокси, С1-6 галогеналкила, 5-10-членного гетероарила, 4-10-членного гетероциклила, гидрокси и оксо;
или R1 и R3 вместе с атомом углерода, с которым они связаны, могут образовывать необязательно замещенный 3-6-членный циклоалкил;
или R3 и R4, R3 и R8, R5 и R6 или R5 и R8, вместе с атомами, с которыми связан каждый из них, могут образовывать 3-6-членный циклоалкил или 3-6-членный гетероциклил;
R19 выбран из группы, состоящей из оксиранила, азиридинила и циклопропила, где циклопропил необязательно замещен по меньшей мере одним галогеном; L представляет собой связь, О, S или N(La);
R10a выбран из группы, состоящей из водорода, алкила, гидроксиалкила, дигидроксиалкила, алкиламинилалкила, диалкиламинилалкила, -Lb-NLaLc, гетероциклила, гетероциклил алкила, арила, гетероарила или гетероарилалкила, где
каждый из Lb, гетероциклила, гетероциклилалкила, арила, гетероарила и гетероарилалкила может быть необязательно замещен одним или более Ld;
каждый La независимо представляет собой водород или С1-3 алкил;
Lb представляет собой С1-4алкилен;
каждый Lc независимо представляет собой водород, ацил, С1-3 алкил, гетероалкил или гидроксиалкил;
каждый Ld независимо представляет собой водород, оксо, ацил, гидрокси, гидроксиалкил, циано, галоген, С1-6 алкил, аралкил, галогеналкил, гетероалкил, циклоалкил, гетероциклилалкил, алкокси, диалкиламинил, диалкиламидоалкил или диалкиламинилалкил, где С1-6 алкил может быть необязательно замещен циклоалкилом;
X выбран из группы, состоящей из С1-6 алкокси, C1-6 алкила, амино, С1-6 алкиламино, С1-6 алкилсульфанила, С1-6 алкилсульфонила, С1-6 алкилтио, С3-7 циклоалкила, 4-7-членного гетероциклила и 4-7-членного гетероциклиламино; каждый из которых необязательно замещен 1-4 заместителями, где каждый заместитель независимо выбран из группы, состоящей из С1-6 алкила, амино, С1-6 аминоалкила, карбамоила, С1-6 карбамоилалкила, карбокси, С1-6 карбоксиалкила, циано, C1-6 цианоалкила, галогена, C1-6 галогеналкила, гидрокси, C1-6 гидроксиалкила и 4-7-членного гетероциклила; где два геминальных заместителя могут быть взяты вместе с образованием С3-7 спироциклоалкила или 4-7-членного спирогетероциклила;
n выбрано из 0, 1 и 2; и
------представляет одинарную связь или двойную связь.
В соответствии с некоторыми вариантами осуществления соединения формулы (I), формулы (II) или формулы (III) или его фармацевтически приемлемой соли, три из связей ------ представляют собой одинарные связи, а две или три из связей ------ представляют собой двойные связи. Конкретнее, соответствии с некоторыми вариантами осуществления соединения формулы (I), формулы (II) или формулы (III) или его фармацевтически приемлемой соли, связи ------определены так, что кольцо, содержащее эти связи, является гетероароматическим. В соответствии с другим вариантом осуществления соединения формулы (I), формулы (II) или формулы (III) или его фармацевтически приемлемой соли, четыре из связей------представляют собой одинарные связи, а две из связей------представляют собой двойные связи.
В соответствии с некоторыми вариантами осуществления соединения формулы (I), формулы (II) или формулы (III) или его фармацевтически приемлемой соли, R1 представляет собой С6-10 арил, необязательно замещенный одним - четырьмя заместителями, где каждый заместитель независимо выбран из группы, состоящей из C1-6 алкила, -NH2, галогена, C1-6 галогеналкила, оксо, C1-6 гидроксиалкила, -ОС(=О)СН=СН2 и гидрокси.
В соответствии с некоторыми вариантами осуществления соединения формулы (I), формулы (II) или формулы (III) или его фармацевтически приемлемой соли, R1 выбран из группы, состоящей из

где каждый
R20 независимо выбран из группы, состоящей из C1-6 алкила, -NH2, галогена, С1-6 галогеналкила, гидрокси, C1-6 гидроксиалкила, С3-6 циклоалкила и -ОС(=О)СН=СН2, а
р равно 0, 1, 2, 3 или 4. В одном варианте осуществления каждый R20 независимо выбран из группы, состоящей из C1-6 алкила, -NH2, -NH(СН3), -N(СН3)2, галогена, С1-6 галогеналкила, C1-6 гидроксиалкила, -ОС(=О)СН=СН2 и гидрокси, а р равно 0, 1, 2, 3 или 4.
В соответствии с некоторыми вариантами осуществления соединения формулы (I), формулы (II) или формулы (III) или его фармацевтически приемлемой соли, R1 выбран из группы, состоящей из

где каждый R20 независимо выбран из группы, состоящей из С1-6 алкила, -NH2, галогена, С1-6 галогеналкила, гидрокси, С1-6 гидроксиалкила, С3-6 циклоалкила и -ОС(=О)СН=СН2, а р равно 0, 1, 2, 3 или 4. В одном варианте осуществления каждый R20 независимо выбран из группы, состоящей из С1-6 алкила, -NH2, -NH(CH3), -N(CH3)2, галогена, C1-6 галогеналкила, С1-6 гидроксиалкила, -ОС(=О)СН=СН2 и гидрокси, а р равно 0, 1, 2, 3 или 4.
В соответствии с некоторыми вариантами осуществления соединения формулы (I), формулы (II) или формулы (III) или его фармацевтически приемлемой соли, R1 выбран из группы, состоящей из

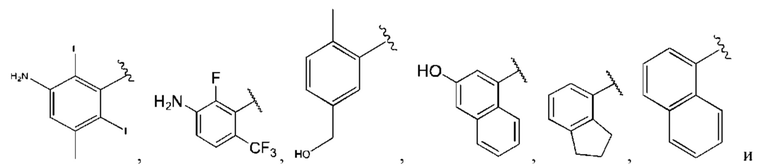
В соответствии с некоторыми вариантами осуществления соединения формулы (I), формулы (II) или формулы (III) или его фармацевтически приемлемой соли, R1 выбран из группы, состоящей из

В соответствии с некоторыми вариантами осуществления соединения формулы (I), формулы (II) или формулы (III) или его фармацевтически приемлемой соли, R1 представляет собой 
В соответствии с некоторыми вариантами осуществления соединения формулы (I), формулы (II) или формулы (III) или его фармацевтически приемлемой соли, R1 представляет собой 5-10-членный гетероарил, необязательно замещенный одним - четырьмя заместителями, где каждый заместитель независимо выбран из группы, состоящей из C1-6 алкила, -NH2, -NH(CH3), -N(CH3)2, C1-6 галогеналкила, С3-6 циклоалкила и галогена. В одном варианте осуществления С3-6 циклоалкил представляет собой циклопропил.
В соответствии с некоторыми вариантами осуществления соединения формулы (I), формулы (II) или формулы (III) или его фармацевтически приемлемой соли, R1 выбран из группы, состоящей из

где каждый R20 независимо выбран из группы, состоящей из C1-6 алкила, -NH2, -NH(CH3), -N(CH3)2, галогена, C1-6 галогеналкила, гидрокси, C1-6 гидроксиалкила, С3-6 циклоалкила и -ОС(=О)СН=СН2, а р равно 0, 1, 2, 3 или 4. В одном варианте осуществления каждый R20 независимо выбран из группы, состоящей из C1-6 алкила, -NH2, -NH(CH3), -N(CH3)2, галогена, C1-6 галогеналкила и С3-6 циклоалкила, а каждое р независимо равно 0, 1, 2, 3 или 4. В одном варианте осуществления С3-6 циклоалкил представляет собой циклопропил.
В соответствии с некоторыми вариантами осуществления соединения формулы (I), формулы (II) или формулы (III) или его фармацевтически приемлемой соли, R1 выбран из группы, состоящей из
 где
где
каждый R20 независимо выбран из группы, состоящей из C1-6 алкила, -NH2, -NH(CH3), -N(CH3)2, галогена, C1-6 галогеналкила, гидрокси, C1-6 гидроксиалкила, С3-6 циклоалкила и -ОС(=О)СН=СН2, а р равно 0, 1, 2, 3 или 4. В одном варианте осуществления каждый R20 независимо выбран из группы, состоящей из C1-6 алкила, -NH2, -NH(СН3), -N(CH3)2, галогена, C1-6 галогеналкила и С3-6 циклоалкила, а каждое р независимо равно 0, 1, 2, 3 или 4.
В соответствии с некоторыми вариантами осуществления соединения формулы (I), формулы (II) или формулы (III) или его фармацевтически приемлемой соли, R1 выбран из группы, состоящей из:

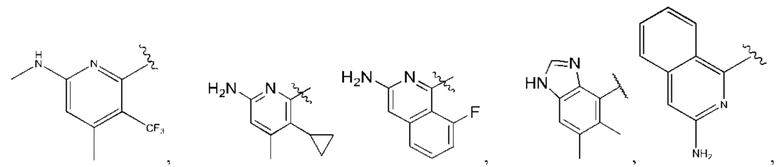
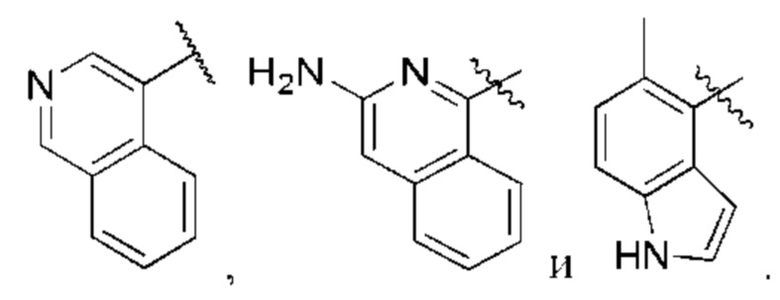
В соответствии с некоторыми вариантами осуществления соединения формулы (I), формулы (II) или формулы (III) или его фармацевтически приемлемой соли, R1 выбран из группы, состоящей из:

В соответствии с некоторыми вариантами осуществления соединения формулы (I), формулы (II) или формулы (III) или его фармацевтически приемлемой соли, R1 представляет собой Н.
В соответствии с некоторыми вариантами осуществления соединения формулы (I), формулы (II) или формулы (III) или его фармацевтически приемлемой соли, R1 представляет собой 5-10-членный гетероциклил, необязательно замещенный одним - четырьмя заместителями, где каждый заместитель независимо выбран из группы, состоящей из С1-6 алкила и оксо.
В соответствии с некоторыми вариантами осуществления соединения формулы (I), формулы (II) или формулы (III) или его фармацевтически приемлемой соли, R1 выбран из группы, состоящей из:
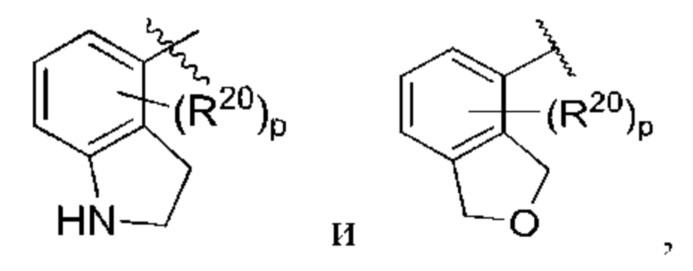
где каждый R20 независимо выбран из группы, состоящей из С1-6 алкила, -NH2, -NH(СН3), -N(СН3)2, галогена, С1-6 галогеналкила, гидрокси, С1-6 гидроксиалкила, С3-6 циклоалкила и -ОС(=О)СН=СН2, а р равно 0, 1, 2, 3 или 4. В одном варианте осуществления каждый R20 независимо представляет собой С1-6 алкил; а каждое р независимо равно 0, 1, 2, 3 или 4.
В соответствии с некоторыми вариантами осуществления соединения формулы (I), формулы (II) или формулы (III) или его фармацевтически приемлемой соли, R1 имеет следующую структуру:
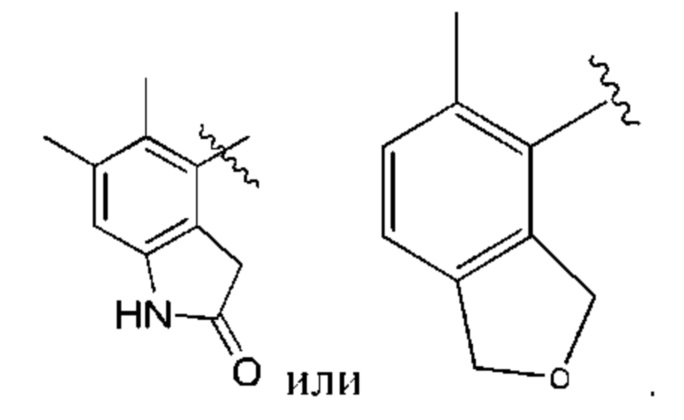
В соответствии с некоторыми вариантами осуществления соединения формулы (I), формулы (II) или формулы (III) или его фармацевтически приемлемой соли, R1 представляет собой С6-10 арил или 5-10-членный гетероарил, необязательно замещенный одним - четырьмя заместителями, где каждая по меньшей мере одна замена представляет собой амино. В одном варианте осуществления соединения формулы (I), формулы (II) или формулы (III) или его фармацевтически приемлемой соли, R1 представляет собой 5-10-членный гетероарил, содержащий по меньшей мере один кольцевой атом азота. В другом варианте осуществления соединения формулы (I), формулы (II) или формулы (III) или его фармацевтически приемлемой соли, R1 представляет собой 5-10-членный гетероциклил. В одном варианте осуществления, в котором R1 представляет собой 5-10-членный гетероциклил, гетероциклильный фрагмент содержит по меньшей мере один атом азота или кислорода.
В дополнительном варианте осуществления соединения формулы (I), формулы (II) или формулы (III) или его фармацевтически приемлемой соли, R1 представляет собой замещенный или незамещенный фенил, пиридинил, индазолил, изохинолинил, дигидро-1Н-инденил, нафталенил, дигидроизобензофуранил или бензоимидазолил. В другом варианте осуществления соединения формулы (I), формулы (II) или формулы (III) или его фармацевтически приемлемой соли, R1 представляет собой замещенный фенил, пиридинил, индазолил, изохинолинил, нафталенил, дигидроизобензофуранил или бензоимидазолил.
В другом варианте осуществления соединения формулы (I), формулы (II) или формулы (III) или его фармацевтически приемлемой соли, R1 представляет собой замещенный фенил или пиридинил. В другом варианте осуществления соединения формулы (I), формулы (II) или формулы (III) или его фармацевтически приемлемой соли, R1 представляет собой замещенный индазолил, изохинолинил, нафталенил или бензоимидазолил.
В одном варианте осуществления соединения формулы (I), формулы (II) или формулы (III) или его фармацевтически приемлемой соли, R1 имеет формулу, выбранную из группы, состоящей из:
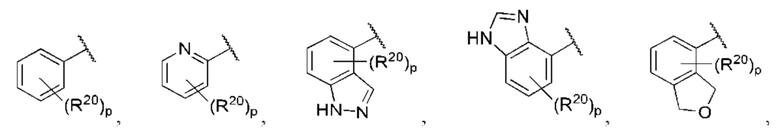
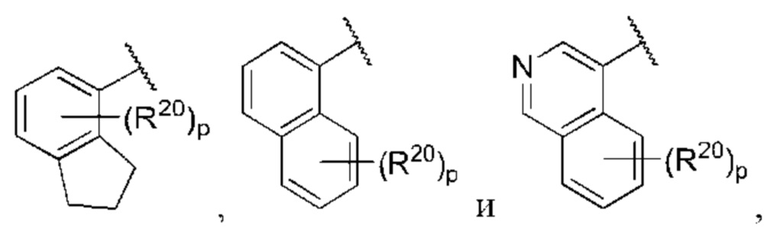
где каждый R20 независимо выбран из группы, состоящей из C1-6 алкила, -NH2, -NH(CH3), -N(CH3)2, галогена, C1-6 галогеналкила, гидрокси, C1-6 гидроксиалкила, С3-6 циклоалкила и -ОС(=О)СН=СН2, а р равно 0, 1, 2, 3 или 4. В одном варианте осуществления С3-6 циклоалкил представляет собой циклопропил. В одном варианте осуществления р равно 1. В другом варианте осуществления р равно 2. В другом варианте осуществления р равно 3. В одном предпочтительном варианте осуществления р равно 3, где по меньшей мере один R20 представляет собой амино.
В другом варианте осуществления соединения формулы (I), формулы (II) или формулы (III) или его фармацевтически приемлемой соли, R1 имеет формулу, выбранную из группы, состоящей из:

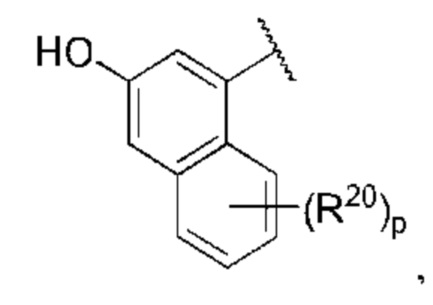 где R20 и р соответствуют определению выше. В соответствии с некоторыми вариантами осуществления соединения формулы (I), формулы (II) или формулы (III) или его фармацевтически приемлемой соли, R1 выбран из группы, состоящей из:
где R20 и р соответствуют определению выше. В соответствии с некоторыми вариантами осуществления соединения формулы (I), формулы (II) или формулы (III) или его фармацевтически приемлемой соли, R1 выбран из группы, состоящей из:
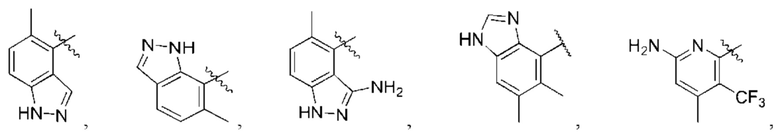


В соответствии с некоторыми вариантами осуществления соединения формулы (I), формулы (II) или формулы (III) или его фармацевтически приемлемой соли, R1 выбран из группы, состоящей из:
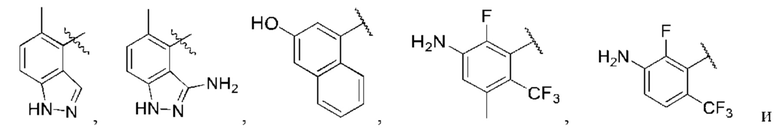

В соответствии с некоторыми вариантами осуществления соединения формулы (I), формулы (II) или формулы (III) или его фармацевтически приемлемой соли, R1 выбран из группы, состоящей из:
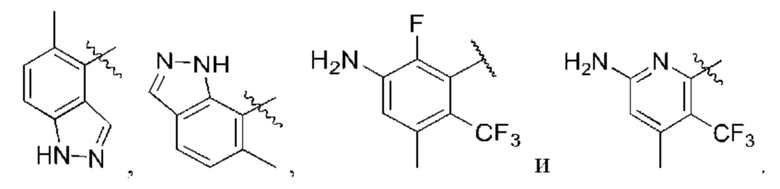
В другом варианте осуществления соединения формулы (I), формулы (II) или формулы (III) или его фармацевтически приемлемой соли, R1 представляет собой:

В соответствии с некоторыми вариантами осуществления соединения формулы (I), формулы (II) или формулы (III) или его фармацевтически приемлемой соли, R1 и R3 вместе с атомом углерода, с которым они связаны, могут образовывать необязательно замещенный 3-6-членный циклоалкил. В одном варианте осуществления 3-6-членный циклоалкил представляет собой циклогексил.
В соответствии с некоторыми вариантами осуществления соединения формулы (I), формулы (II) или формулы (III) или его фармацевтически приемлемой соли, Z1 представляет собой N; Z2 представляет собой C(R10) или C(-L-R10a); Z3 представляет собой N; и R, -L и R10a соответствуют определениям выше для формулы (I), формулы (II) или формулы (III).
В соответствии с некоторыми вариантами осуществления соединения формулы (I), формулы (II) или формулы (III) или его фармацевтически приемлемой соли, Z1 представляет собой N; Z2 представляет собой C(R10); Z3 представляет собой N; и R10 представляет собой Н.
В соответствии с некоторыми вариантами осуществления соединения формулы (I), формулы (II) или формулы (III) или его фармацевтически приемлемой соли, Z1 представляет собой N; Z2 представляет собой C(-L-R10a); Z3 представляет собой N; и -L и R10a соответствуют определениям выше для формулы (I), формулы (II) или формулы (III). В одном конкретном варианте осуществления L представляет собой О. В другом варианте осуществления L представляет собой О, и R10a выбран из группы, состоящей из гетероциклилалкила и гетероарилалкила, где каждый гетероциклил алкил и гетероарилалкил необязательно замещен одним или более Ld, где Ld соответствует определению выше для формулы (I), формулы (II) или формулы (III). В одном конкретном варианте осуществления каждый Ld независимо выбран из группы, состоящей из водорода, оксо, галогена и С1-6 алкила.
В соответствии с некоторыми вариантами осуществления соединения формулы (I), формулы (II) или формулы (III) или его фармацевтически приемлемой соли, Z2 представляет собой C(-L-R10a); a -L-R10a выбран из группы, состоящей из

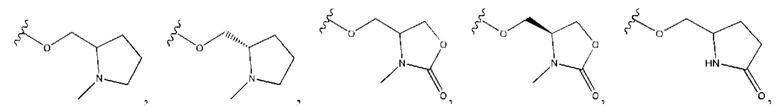
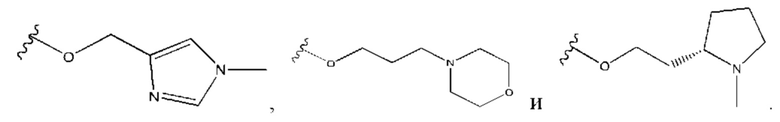
В одном таком варианте осуществления Z1 представляет собой N и Z3 представляет собой N.
В соответствии с некоторыми вариантами осуществления соединения формулы (I), формулы (II) или формулы (III) или его фармацевтически приемлемой соли, Z1 представляет собой N; Z2 представляет собой C(R10); Z3 представляет собой C(R12); и R10 и R12, каждый, независимо соответствуют определениям выше для формулы (I), формулы (II) или формулы (III).
В соответствии с некоторыми вариантами осуществления соединения формулы (I), формулы (II) или формулы (III) или его фармацевтически приемлемой соли, Z1 представляет собой N; Z2 представляет собой C(R10); Z3 представляет собой C(R12); R10 представляет собой водород; и R12 соответствует определению выше для формулы (I), формулы (II) или формулы (III).
В соответствии с некоторыми вариантами осуществления соединения формулы (I), формулы (II) или формулы (III) или его фармацевтически приемлемой соли, Z1 представляет собой S(O)2; Z2 отсутствует; и Z3 представляет собой N.
В соответствии с некоторыми вариантами осуществления соединения формулы (I), формулы (II) или формулы (III) или его фармацевтически приемлемой соли, Z1 представляет собой О; Z2 отсутствует; и Z3 представляет собой N.
В соответствии с некоторыми вариантами осуществления соединения формулы (I), формулы (II) или формулы (III) или его фармацевтически приемлемой соли, Z1 представляет собой N(R9); Z2 отсутствует; Z3 представляет собой N; и R9 соответствует определению выше для формулы (I), формулы (II) или формулы (III).
В соответствии с некоторыми вариантами осуществления соединения формулы (I), формулы (II) или формулы (III) или его фармацевтически приемлемой соли, Z1 представляет собой N; Z2 отсутствует; Z3 представляет собой N(R11); и R11 соответствует определению выше для формулы (I), формулы (II) или формулы (III).
В соответствии с некоторыми вариантами осуществления соединения формулы (I), формулы (II) или формулы (III) или его фармацевтически приемлемой соли, Z1 представляет собой S(O); Z2 отсутствует; и Z3 представляет собой N.
В соответствии с некоторыми вариантами осуществления соединения формулы (I), формулы (II) или формулы (III) или его фармацевтически приемлемой соли, Z1 представляет собой S; Z2 отсутствует; и Z3 представляет собой N.
В соответствии с некоторыми вариантами осуществления соединения формулы (I), формулы (II) или формулы (III) или его фармацевтически приемлемой соли, Z1 представляет собой N(R9); Z2 представляет собой C(R10); и Z3 представляет собой N.
В соответствии с некоторыми вариантами осуществления соединения формулы (I), формулы (II) или формулы (III) или его фармацевтически приемлемой соли, Z1 представляет собой N(R9); Z2 представляет собой C(R10); Z3 представляет собой N; и R9 представляет собой арил, замещенный C1-6 алкилом.
В соответствии с некоторыми вариантами осуществления соединения формулы (I), формулы (II) или формулы (III) или его фармацевтически приемлемой соли, R9 представляет собой арил, замещенный С3 алкилом. В одном варианте осуществления соединения формулы (I), формулы (II) или формулы (III) или его фармацевтически приемлемой соли, R9 представляет собой фенил, замещенный изопропилом.
В одном варианте осуществления соединения формулы (I), формулы (II) или формулы (III) или его фармацевтически приемлемой соли, R9 представляет собой
В одном варианте осуществления соединения формулы (I), формулы (II) или формулы (III) или его фармацевтически приемлемой соли, R10 представляет собой оксо.
В соответствии с некоторыми вариантами осуществления соединения формулы (I), формулы (II) или формулы (III) или его фармацевтически приемлемой соли, Y1 отсутствует; Y2 представляет собой C(H)(R8); Y3 представляет собой C(R3); a R3 и R8 соответствуют определениям выше для формулы (I), формулы (II) или формулы (III).
В соответствии с некоторыми вариантами осуществления соединения формулы (I), формулы (II) или формулы (III) или его фармацевтически приемлемой соли, Y1 отсутствует; Y2 представляет собой C(H)(R8); Y3 представляет собой C(R3); R3 соответствует определению выше для формулы (I), формулы (II) или формулы (III); и R8 выбран из группы, состоящей из Н и С1-6 алкила.
В соответствии с некоторыми вариантами осуществления соединения формулы (I), формулы (II) или формулы (III) или его фармацевтически приемлемой соли, Y1 отсутствует; Y2 представляет собой C(H)(R8); Y3 представляет собой C(R3); R3 соответствует определению выше для формулы (I), формулы (II) или формулы (III); и R8 выбран из группы, состоящей из Н, метила, этила и изопропила.
В соответствии с некоторыми вариантами осуществления соединения формулы (I), формулы (II) или формулы (III) или его фармацевтически приемлемой соли, Y1 отсутствует; Y2 представляет собой C(H)(R8); Y3 представляет собой C(R3); a R3, R4, R5 и R8, каждый, независимо соответствуют определениям выше для формулы (I), формулы (II) или формулы (III).
В соответствии с некоторыми вариантами осуществления соединения формулы (I), формулы (II) или формулы (III) или его фармацевтически приемлемой соли, Y1 отсутствует; Y2 представляет собой C(H)(R8); Y3 представляет собой C(R3); и R3, R4 и R5 представляют собой водород; a R8 соответствует определению выше для формулы (I), формулы (II) или формулы (III).
В соответствии с некоторыми вариантами осуществления соединения формулы (I), формулы (II) или формулы (III) или его фармацевтически приемлемой соли, Y1 отсутствует; Y2 представляет собой C(H)(R8); Y3 представляет собой C(R3); R3, R4 и R5 представляют собой водород; a R8 выбран из группы, состоящей из Н и C1-6 алкила. В соответствии с одним таким вариантом осуществления R8 выбран из группы, состоящей из Н и метила.
В соответствии с некоторыми вариантами осуществления соединения формулы (I), формулы (II) или формулы (III) или его фармацевтически приемлемой соли, Y1 представляет собой C(H)(R6); Y2 представляет собой C(H)(R8); Y3 представляет собой C(R3); a R3, R4, R5, R6 и R8, каждый, независимо соответствуют определениям выше для формулы (I), формулы (II) или формулы (III).
В соответствии с некоторыми вариантами осуществления соединения формулы (I), формулы (II) или формулы (III) или его фармацевтически приемлемой соли, Y1 представляет собой C(H)(R6); Y2 представляет собой C(H)(R8); Y3 представляет собой C(R3); R3, R4, R5, R6 и R8, каждый, представляют собой водород.
В соответствии с некоторыми вариантами осуществления соединения формулы (I), формулы (II) или формулы (III) или его фармацевтически приемлемой соли, Y1 представляет собой C(H)(R6); Y2 представляет собой N(R7); Y3 представляет собой C(R3); a R3, R4, R5, R6 и R7, каждый, независимо соответствуют определениям выше для формулы (I), формулы (II) или формулы (III).
В соответствии с некоторыми вариантами осуществления соединения формулы (I), формулы (II) или формулы (III) или его фармацевтически приемлемой соли, Y1 представляет собой C(H)(R6); Y2 представляет собой N(R7); Y3 представляет собой C(R3); и R3, R4, R5 и R6, каждый, представляет собой водород; a R7 соответствует определению выше для формулы (I), формулы (II) или формулы (III).
В соответствии с некоторыми вариантами осуществления соединения формулы (I), формулы (II) или формулы (III) или его фармацевтически приемлемой соли, Y1 отсутствует; Y2 представляет собой N(R7); Y3 представляет собой C(R3); a R3, R4, R5 и R7, каждый, независимо соответствуют определениям выше для формулы (I), формулы (II) или формулы (III).
В соответствии с некоторыми вариантами осуществления соединения формулы (I), формулы (II) или формулы (III) или его фармацевтически приемлемой соли, Y1 отсутствует; Y2 представляет собой N(R7); Y3 представляет собой C(R3); и R3, R4 и R5, каждый, представляют собой водород; a R7 соответствует определению выше для формулы (I), формулы (II) или формулы (III).
В соответствии с некоторыми вариантами осуществления соединения формулы (I), формулы (II) или формулы (III) или его фармацевтически приемлемой соли, Y1 отсутствует; Y2 представляет собой C(H)(R8); Y3 представляет собой N; a R8 соответствует определению выше для формулы (I), формулы (II) или формулы (III).
В соответствии с некоторыми вариантами осуществления соединения формулы (I), формулы (II) или формулы (III) или его фармацевтически приемлемой соли, где Y1 отсутствует; Y2 представляет собой C(H)(R8); Y3 представляет собой N; и R8 представляет собой водород.
В соответствии с некоторыми вариантами осуществления соединения формулы (I), формулы (II) или формулы (III) или его фармацевтически приемлемой соли, X представляет собой 4-7-членный гетероциклил.
В соответствии с некоторыми вариантами осуществления соединения формулы (I), формулы (II) или формулы (III) или его фармацевтически приемлемой соли, R3, R4, R5, R6, R7, R8, R9, R10, R11 и R12, каждый, независимо выбраны из группы, состоящей из Н, галогена, С3-7 циклоалкила, С1-6 алкила, арила, замещенного С1-6 алкилом, и оксо.
В соответствии с некоторыми вариантами осуществления соединения формулы (I), формулы (II) или формулы (III) или его фармацевтически приемлемой соли, R3, R4, R5, R6, R7, R8, R9, R10, R11 и R12, каждый, независимо выбраны из группы, состоящей из Н, С1-6 алкилаа, арила, замещенного С3 алкилом, и оксо.
В соответствии с некоторыми вариантами осуществления соединения формулы (I), формулы (II) или формулы (III) или его фармацевтически приемлемой соли, R3, R4, R5, R6, R7, R8, R9, R10, R11 и R12, каждый, независимо выбраны из группы, состоящей из Н, метила, этила, изопропила, фенила, замещенного изопропилом, и оксо.
В соответствии с некоторыми вариантами осуществления соединения формулы (I), формулы (II) или формулы (III) или его фармацевтически приемлемой соли, X представляет собой 4-7-членный гетероциклил, который необязательно замещен 1-4 заместителями, где каждый заместитель независимо выбран из группы, состоящей из C1-6 алкила, циано, C1-6 цианоалкила и C1-6 гидроксиалкила; где два геминальных заместителя могут быть взяты вместе с образованием 4-7-членного спирогетероциклила.
В соответствии с некоторыми вариантами осуществления соединения формулы (I), формулы (II) или формулы (III) или его фармацевтически приемлемой соли, X выбран из группы, состоящей из:



В соответствии с некоторыми вариантами осуществления соединения формулы (I), формулы (II) или формулы (III) или его фармацевтически приемлемой соли, X выбран из группы, состоящей из:
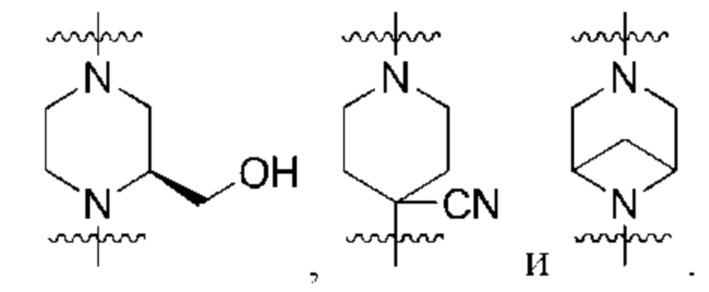
В соответствии с некоторыми вариантами осуществления соединения формулы (I), формулы (II) или формулы (III) или его фармацевтически приемлемой соли, X представляет собой пиперазин, который может быть незамещенным или замещенным. В некоторых вариантах осуществления пиперазин замещен одной или более группами, выбранными из СН3, CH2CN, СН2ОН, CN, CF3, CH2CF3 и CHF2.
В соответствии с некоторыми вариантами осуществления соединения формулы (I), формулы (II) или формулы (III) или его фармацевтически приемлемой соли, X представляет собой гомопиперазин, который может быть незамещенным или замещенным. В некоторых вариантах осуществления гомопиперазин замещен одной или более группами, выбранными из СН3, CH2CN, СН2ОН, CN, CF3, CH2CF3 и CHF2.
В соответствии с некоторыми вариантами осуществления соединения формулы (I), формулы (II) или формулы (III) или его фармацевтически приемлемой соли, X представляет собой 4-7-членный гетероциклиламино.
В соответствии с некоторыми вариантами осуществления соединения формулы (I), формулы (II) или формулы (III) или его фармацевтически приемлемой соли, X представляет собой 
В соответствии с некоторыми вариантами осуществления соединения формулы (I), формулы (II) или формулы (III) или его фармацевтически приемлемой соли, X представляет собой 
В соответствии с некоторыми вариантами осуществления соединения формулы (I), формулы (II) или формулы (III) или его фармацевтически приемлемой соли, n равно 0.
В соответствии с некоторыми вариантами осуществления соединения формулы (I) или его фармацевтически приемлемой соли, R2 выбран из группы, состоящей из:




где:
R16 выбран из группы, состоящей из C1-6 алканоила, C1-6 алкила, С1-6 алкилсульфонила и С3-6 циклоалкила;
R17 выбран из группы, состоящей из C1-6 алкила и C1-6 галогеналкила; и R18 представляет собой галоген.
В соответствии с некоторыми вариантами осуществления соединения формулы (I) или его фармацевтически приемлемой соли, R2 выбран из группы, состоящей из:


В соответствии с некоторыми вариантами осуществления соединения формулы (I) или его фармацевтически приемлемой соли, R2 представляет собой 
В соответствии с некоторыми вариантами осуществления соединения формулы (I) или его фармацевтически приемлемой соли, X и R2 могут вместе быть выбраны из группы, состоящей из:

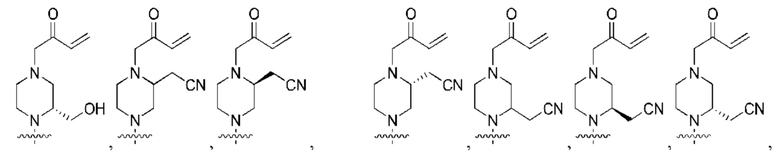





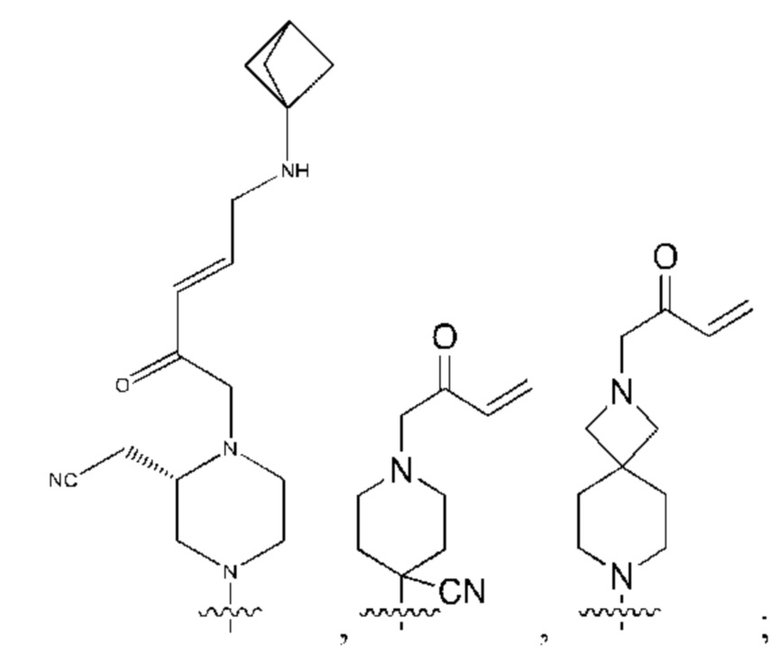
где R16, R17 и R18 соответствуют определениям выше.
В соответствии с некоторыми вариантами осуществления соединения формулы (I) или его фармацевтически приемлемой соли, X и R2 могут вместе быть выбраны из группы, состоящей из:




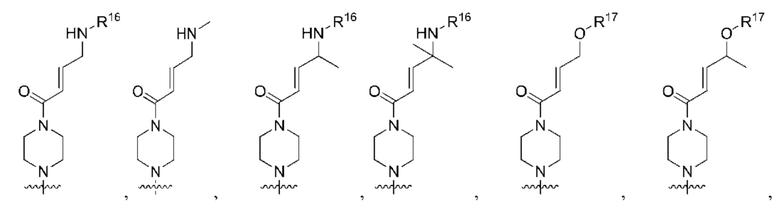
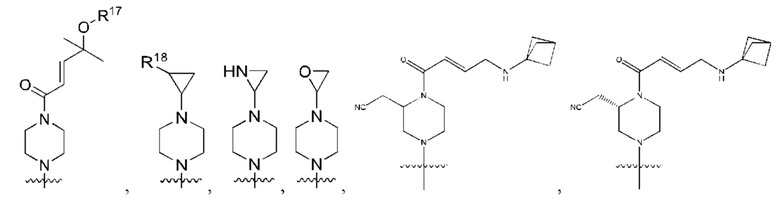
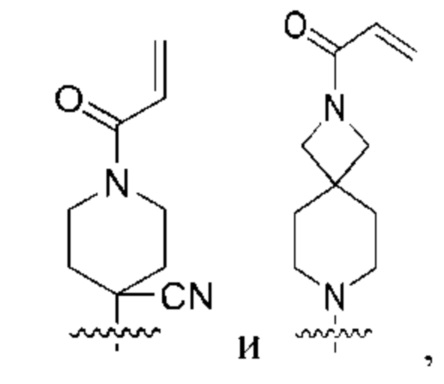
где R16, R17 и R18 соответствуют определениям выше. В соответствии с некоторыми вариантами осуществления соединения формулы (I) или его фармацевтически приемлемой соли, X и R2 могут вместе представлять собой
В соответствии с некоторыми вариантами осуществления R16 выбран из группы, состоящей из C1-6 алканоила, C1-6 алкила, C1-6 алкилсульфонила и С3-6 циклоалкила. В одном конкретном варианте осуществления R16 представляет собой метил.
В соответствии с некоторыми вариантами осуществления R17 выбран из группы, состоящей из C1-6 алкила и C1-6 галогеналкила.
В соответствии с некоторыми вариантами осуществления соединения формулы (II) или его фармацевтически приемлемой соли, R13 выбран из группы, состоящей из Н, циано и галогена; и каждый из R14 и R15 независимо выбран из группы, состоящей из Н, C1-6 алкила, C1-6 галогеналкила, циано и галогена; где C1-6 алкил необязательно замещен одним заместителем, выбранным из группы, состоящей из: метансульфонила (мезила), пара-толуолсульфонила (тозила), алкил- или арилсульфонатной уходящей группы, C1-6 алканоиламино, C1-6 алкокси, C1-6 алкиламино, С1-6 алкилсульфониламино, С6-12 диалкиламино, С3-6 циклоалкиламино и С1-6 галогеналкокси.
В соответствии с некоторыми вариантами осуществления соединения формулы (II) или его фармацевтически приемлемой соли, R13 и R14 вместе образуют тройную связь между атомами углерода, к которым они присоединены, или R13 и R14 вместе с атомами углерода, с которыми связан каждый из них, образуют С3-7 циклоалкенил, необязательно замещенный одним или двумя заместителями-галогенами; и R15 выбран из группы, состоящей из Н, С1-6 алкила С1-6 галогеналкила, циано и галогена; где С1-6 алкил необязательно замещен одним заместителем, выбранным из группы, состоящей из: С1-6 алканоиламино, С1-6 алкокси, С1-6 алкиламино, С1-6 алкилсульфониламино, С6-12 диалкиламино и С1-6 галогеналкокси.
В соответствии с некоторыми вариантами осуществления соединения формулы (II) или его фармацевтически приемлемой соли, R13, R14 и R15, каждый, представляют собой Н.
В соответствии с некоторыми вариантами осуществления соединения формулы (II) или его фармацевтически приемлемой соли, R13 представляет собой Н, и один из R14 и R15 представляет собой Н, а другой из R14 и R15 представляет собой C1, замещенный диалкиламино, и, конкретнее, представляет собой C1, замещенный диметиламиногруппой.
В соответствии с некоторыми вариантами осуществления соединения формулы (II) или его фармацевтически приемлемой соли, R13 представляет собой галоген и, в частности, может представлять собой F, a R14 и R15, каждый, представляют собой Н.
В соответствии с некоторыми вариантами осуществления соединения формулы (II) или его фармацевтически приемлемой соли, R13 представляет собой Н, и один из R14 и R15 представляет собой Н, а другой из R14 и R15 выбран из группы, состоящей из C1-6 алкила и C1-6 галогеналкила, где C1-6 алкил необязательно замещен одним заместителем, выбранным из группы, состоящей из C1-6 алкиламино и С3-6 циклоалкиламино. В одном варианте осуществления R13 представляет собой Н, и один из R14 и R15 представляет собой Н, а другой из R14 и R15 представляет собой C1 алкил, замещенный одним заместителем, выбранным из группы, состоящей из С1-6 алкиламино и С3-6 циклоалкиламино.
В соответствии с некоторыми вариантами осуществления соединения формулы (III) или его фармацевтически приемлемой соли, R19 представляет собой оксиранил.
В соответствии с некоторыми вариантами осуществления соединения формулы (III) или его фармацевтически приемлемой соли, R19 представляет собой азиридинил.
В соответствии с некоторыми вариантами осуществления соединения формулы (III) или его фармацевтически приемлемой соли, R19 представляет собой циклопропил, необязательно замещенный по меньшей мере одним галогеном.
В соответствии с некоторыми вариантами осуществления соединения формулы (I), формулы (II) или формулы (III) или его фармацевтически приемлемой соли, Z1 представляет собой N; Z2 представляет собой C(R10) или C(-L-R10a); Z3 представляет собой N; Y1 отсутствует; Y2 представляет собой C(H)(R8); Y3 представляет собой C(R3); X необязательно замещен 4-7-членным гетероциклилом; п равно 0; a R3, R8, R10, R10a и L, каждый, независимо соответствуют определениям выше для формулы (I), формулы (II) или формулы (III). В одном таком варианте осуществления Z2 представляет собой C(R10), a R10 представляет собой Н. В другом таком варианте осуществления Z2 представляет собой C(-L-R10a), L представляет собой О, a R10a представляет собой гетероциклилалкил или гетероарилалкил, где гетероциклилалкил и гетероарилалкил необязательно замещены одним или более Ld, а каждый Ld независимо соответствует определению выше для формулы (I), формулы (II) или формулы (III). В одном варианте осуществления каждый Ld независимо выбран из группы, состоящей из водорода, оксо, галогена и C1-6 алкила.
В соответствии с некоторыми вариантами осуществления соединения формулы (I), формулы (II) или формулы (III) или его фармацевтически приемлемой соли, Z1 представляет собой N; Z2 представляет собой C(R10) или C(-L-R10a); Z3 представляет собой N; Y1 отсутствует; Y2 представляет собой C(H)(R8); Y3 представляет собой C(R3); X необязательно замещен 4-7-членным гетероциклилом; n равно 0; a R3, R4, R5, R8, R10, R10a и L, каждый, независимо выбраны из группы, состоящей из водорода, галогена, С3-7 циклоалкила и C1-6 алкила. В одном таком варианте осуществления Z представляет собой C(R10), a R10 представляет собой Н. В другом таком варианте осуществления Z2 представляет собой C(-L-R10a), L представляет собой О, a R10a представляет собой гетероциклилалкил или гетероарилалкил, где гетероциклилалкил и гетероарилалкил необязательно замещены одним или более Ld, а каждый Ld соответствует определению выше для формулы (I), формулы (II) или формулы (III). В одном варианте осуществления каждый Ld независимо выбран из группы, состоящей из водорода, оксо, галогена и C1-6 алкила.
В соответствии с некоторыми вариантами осуществления соединения формулы (I), формулы (II) или формулы (III) или его фармацевтически приемлемой соли, Z1 представляет собой N(R9); Z2 представляет собой C(R10); Z3 представляет собой N; Y1 отсутствует; Y2 представляет собой C(H)(R8); Y3 представляет собой C(R3); X представляет собой 4-7-членный гетероциклил; п равно 0; a R3, R8, R9 и R10, каждый, независимо соответствуют определениям выше для формулы (I), формулы (II) или формулы (III).
В соответствии с некоторыми вариантами осуществления соединения формулы (I), формулы (II) или формулы (III) или его фармацевтически приемлемой соли, Z1 представляет собой N(R9); Z2 представляет собой C(R10); Z3 представляет собой N; Y1 отсутствует; Y2 представляет собой C(H)(R8); Y3 представляет собой C(R3); X представляет собой 4-7-членный гетероциклил; п равно 0; a R3, R4, R5, R8, R9 и R10, каждый, независимо выбраны из группы, состоящей из водорода, галогена, С3-7 циклоалкила, С1-6 алкила, арила, замещенного С1-6 алкилом, и оксо.
В соответствии с некоторыми вариантами осуществления соединения формулы (I), формулы (II) или формулы (III) или его фармацевтически приемлемой соли, Z1 представляет собой N(R9); Z2 представляет собой C(R10); Z3 представляет собой N; Y1 отсутствует; Y2 представляет собой C(H)(R8); Y3 представляет собой N; X представляет собой 4-7-членный гетероциклил; п равно 0; a R8, R9 и R10, каждый, независимо соответствуют определениям выше для формулы (I), формулы (II) или формулы (III).
В соответствии с некоторыми вариантами осуществления соединения формулы (I), формулы (II) или формулы (III) или его фармацевтически приемлемой соли, Z1 представляет собой N(R9); Z2 представляет собой C(R10); Z3 представляет собой N; Y1 отсутствует; Y2 представляет собой C(H)(R8); Y3 представляет собой N; X представляет собой 4-7-членный гетероциклил; п равно 0; a R4, R5, R8, R9 и R10, каждый, независимо выбраны из группы, состоящей из водорода, галогена, С3-7 циклоалкила, С1-6 алкила, арила, замещенного С1-6 алкилом, и оксо.
В соответствии с некоторыми вариантами осуществления соединения формулы (I), формулы (II) или формулы (III) или его фармацевтически приемлемой соли, конкретные комбинации R1, R2 (в случае наличия), R3, R4, R5, R6, R7, R8, R9, R10, R11, R12, X, Z1, Z2, Z3, Y1, Y2 и n включают:
(i) вариант осуществления, в котором Z1 представляет собой N; Z2 представляет собой C(R10); Z3 представляет собой N; Y1 отсутствует; Y2 представляет собой (H)(R8); Y8 представляет собой C(R3); R3, R4, R5 и R10, каждый, представляют собой водород; R1 и R8, каждый, независимо соответствуют определениям выше для формулы (I), формулы (II) или формулы (III); X представляет собой необязательно замещенный 4-7-членный гетероциклил; n равно 0; a R2 представляет собой 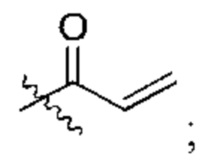
(ii) вариант осуществления, в котором Z1 представляет собой N; Z2 представляет собой C(R10); Z3 представляет собой N; Y1 представляет собой C(H)(R6); Y2 представляет собой C(H)(R8); Y3 представляет собой C(R3); R3, R4, R5, R6, R8 и R10, каждый, представляют собой водород; R1 соответствует определению выше для формулы (I), формулы (II) или формулы (III); X представляет собой 4-7-членный гетероциклил; n равно 0; a R2 представляет собой 
(iii) вариант осуществления, в котором Z1 представляет собой N; Z2 представляет собой C(R10); Z3 представляет собой N; Y1 представляет собой C(H)(R6); Y2 представляет собой N(R7); Y3 представляет собой C(R3); R3, R4, R5, R6 и R10, каждый, представляют собой водород; R1 и R7, каждый, независимо соответствуют определениям выше для формулы (I), формулы (II) или формулы (III); X представляет собой 4-7-членный гетероциклил; n равно 0; a R2 представляет собой 
(iv) вариант осуществления, в котором Z1 представляет собой N; Z2 представляет собой C(R10); Z3 представляет собой N; Y1 отсутствует; Y2 представляет собой N(R7); Y3 представляет собой C(R3); R3, R4, R5 и R10, каждый, представляют собой водород; R1 и R7, каждый, независимо соответствуют определениям выше для формулы (I), формулы (II) или формулы (III); X представляет собой 4-7-членный гетероциклил; n равно 0; a R2 представляет собой 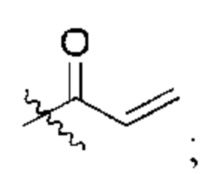
(v) вариант осуществления, в котором Z1 представляет собой N; Z2 представляет собой C(R10); Z3 представляет собой C(R12); Y1 отсутствует; Y2 представляет собой C(H)(R8); Y3 представляет собой C(R3); R3, R4, R5 и R10, представляют собой водород; R1, R8 и R12, каждый, независимо соответствуют определениям выше для формулы (I), формулы (II) или формулы (III); X представляет собой 4-7-членный гетероциклил; n равно 0; a R2 представляет собой 
(vi) вариант осуществления, в котором Z1 представляет собой S(O)2; Z2 отсутствует; Z3 представляет собой N; Y1 отсутствует; Y2 представляет собой C(H)(R8); Y3 представляет собой C(R3); R3, R4 и R5, каждый, представляют собой водород; R1 и R8, каждый, независимо соответствуют определениям выше для формулы (I), формулы (II) или формулы (III); X представляет собой 4-7-членный гетероциклил; n равно 0; а R2 представляет собой 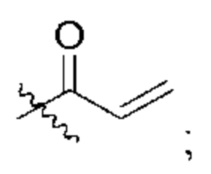
(vii) вариант осуществления, в котором Z1 представляет собой О; Z2 отсутствует; Z3 представляет собой N; Y1 отсутствует; Y2 представляет собой C(H)(R8); Y3 представляет собой C(R3); R3, R4 и R5, каждый, представляют собой водород; R1 и R8, каждый, независимо соответствуют определениям выше для формулы (I), формулы (II) или формулы (III); X представляет собой 4-7-членный гетероциклил; n равно 0; а R2 представляет собой 
(viii) вариант осуществления, в котором Z1 представляет собой N(R9); Z2 отсутствует; Z3 представляет собой N; Y1 отсутствует; Y2 представляет собой C(H)(R8); Y3 представляет собой C(R3); R3, R4 и R5, каждый, представляют собой водород; R1, R8 и R9, каждый, независимо соответствуют определениям выше для формулы (I), формулы (II) или формулы (III); X представляет собой 4-7-членный гетероциклил; n равно 0; a R2 представляет собой 
(ix) вариант осуществления, в котором Z1 представляет собой N; Z2 отсутствует; Z3 представляет собой N(R11); Y1 отсутствует; Y2 представляет собой C(H)(R8); Y3 представляет собой C(R3); R3, R4 и R5, каждый, представляют собой водород; R1, R8 и R11, каждый, независимо соответствуют определениям выше для формулы (I), формулы (II) или формулы (III); X представляет собой 4-7-членный гетероциклил; n равно 0; a R2 представляет собой 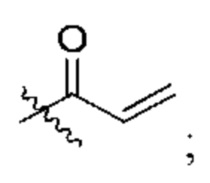
(x) вариант осуществления, в котором Z1 представляет собой S(O); Z2 отсутствует; Z3 представляет собой N; Y1 отсутствует; Y2 представляет собой C(H)(R8); Y3 представляет собой C(R3); R3, R4 и R5, каждый, представляют собой водород; R1 и R8, каждый, независимо соответствуют определениям выше для формулы (I), формулы (II) или формулы (III); X представляет собой 4-7-членный гетероциклил; n равно 0; а R2 представляет собой 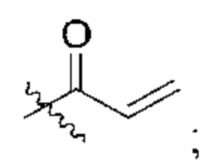
(xi) вариант осуществления, в котором Z1 представляет собой S; Z2 отсутствует; Z3 представляет собой N; Y1 отсутствует; Y2 представляет собой C(H)(R8); Y3 представляет собой C(R3); R3, R4 и R5, каждый, представляют собой водород; R1 и R8, каждый, независимо соответствуют определениям выше для формулы (I), формулы (II) или формулы (III); X представляет собой 4-7-членный гетероциклил; n равно 0; a R2 представляет собой 
(xii) вариант осуществления, в котором Z1 представляет собой N(R9); Z2 представляет собой C(R10); Z3 представляет собой N; Y1 отсутствует; Y2 представляет собой C(H)(R8); Y3 представляет собой C(R3); R3, R4, R5 и R8, каждый, представляют собой водород; R1 соответствует определению выше для формулы (I), формулы (II) или формулы (III); R9 представляет собой арил, замещенный C1-6 алкилом; R10 представляет собой оксо; X представляет собой 4-7-членный гетероциклил; n равно 0; a R2 представляет собой 
(xiii) вариант осуществления, в котором Z1 представляет собой N(R9); Z2 представляет собой C(R10); Z3 представляет собой N; Y1 отсутствует; Y2 представляет собой C(H)(R8); Y3 представляет собой N; R4, R5 и R8, каждый, представляют собой водород; R1 соответствует определению выше для формулы (I), формулы (II) или формулы (III); R9 представляет собой арил, замещенный С1-6 алкилом; R10 представляет собой оксо; X представляет собой 4-7-членный гетероциклил; n равно 0; a R2 представляет собой 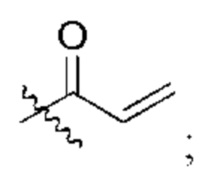 и
и
(ix) вариант осуществления, в котором Z1 представляет собой N; Z2 представляет собой C(-L-R10a); Z3 представляет собой N; Y1 отсутствует; Y2 представляет собой C(H)(R8); Y3 представляет собой C(R3); R3, R4, R5 и R8, каждый, независимо выбраны из группы, состоящей из Н и С1-6 алкила; R1 соответствует определению выше для формулы (I), формулы (II) или формулы (III); L представляет собой О; R10a представляет собой гетероциклилалкил или гетероарилалкил, где гетероциклилалкил и гетероарилалкил необязательно замещены одним или более Ld; Ld соответствует определению выше для формулы (I), формулы (II) или формулы (III); X представляет собой необязательно замещенный 4-7-членный гетероциклил; n равно 0; a R2 представляет собой 
В соответствии с некоторыми вариантами осуществления соединения формулы (I), формулы (II) или формулы (III) или его фармацевтически приемлемой соли, конкретные комбинации R1, R2 (в случае наличия), R3, R4, R5, R6, R7, R8, R9, R10, R11, R12, X, Z1, Z2, Z3, Y1, Y2 и n включают любой из вариантов осуществления (i) - (ix), где X представляет собой 
В соответствии с некоторыми вариантами осуществления соединения формулы (I), формулы (II) или формулы (III) или его фармацевтически приемлемой соли, конкретные комбинации R1, R2 (в случае наличия), R3, R4, R5, R6, R7, R8, R9, R10, R11, R12, X, Z1, Z2, Z3, Y1, Y2 и n включают любой из вариантов осуществления (i) - (ix), где R1 выбран из группы, состоящей из:

В другом варианте осуществления соединения формулы (I), формулы (II) или формулы (III) или его фармацевтически приемлемой соли, R1 представляет собой:

В соответствии с некоторыми вариантами осуществления формулы (I) или формулы (II) соединение имеет формулу, выбранную из группы, состоящей из:
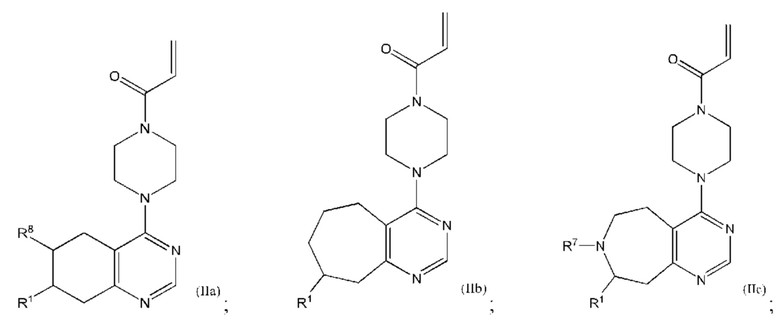


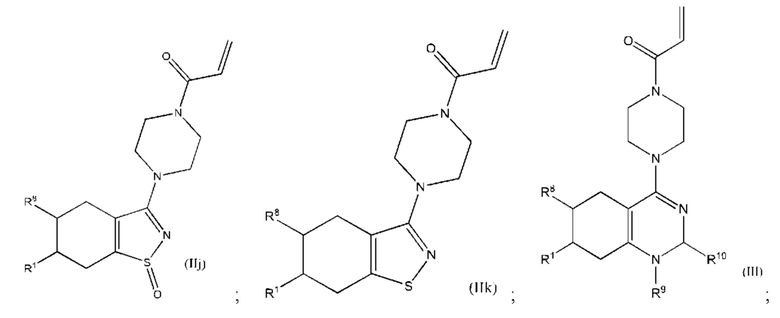

или его фармацевтически приемлемой соли, где R1, R7, R8, R9, R10, R10a, R11, R12 и L, каждый, независимо соответствуют определениям выше для формулы (I).
В соответствии с некоторыми вариантами осуществления формулы (I) или формулы (II) соединение имеет формулу (IIa):

или ее фармацевтически приемлемой соли, где R1 и R8 независимо соответствуют определениям выше для формулы (I) или формулы (II).
В соответствии с некоторыми вариантами осуществления формулы (I) или формулы (II) соединение формулы (IIa) имеет формулу, выбранную из группы, состоящей из:

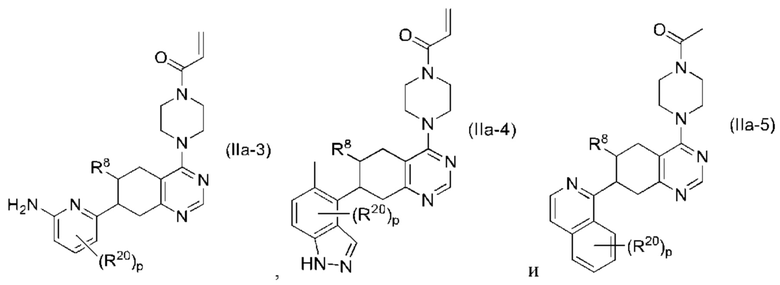
или его фармацевтически приемлемой соли, где каждый R20 независимо выбран из группы, состоящей из C1-6 алкила, NH2, NH(CH3), N(CH3)2, галогена, C1-6 галогеналкила, гидрокси, С3-6 циклоалкила, C1-6 гидроксиалкила и -ОС(=О)СН=СН2; каждое р независимо равно 0, 1, 2, 3 или 4; a R8 соответствует определению выше для формулы (I) или формулы (II).
В соответствии с некоторыми вариантами осуществления формулы (I) или формулы (II) соединение формулы (IIa) имеет формулу, выбранную из группы, состоящей из:

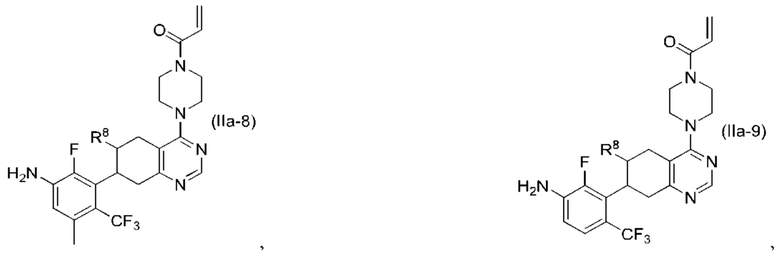
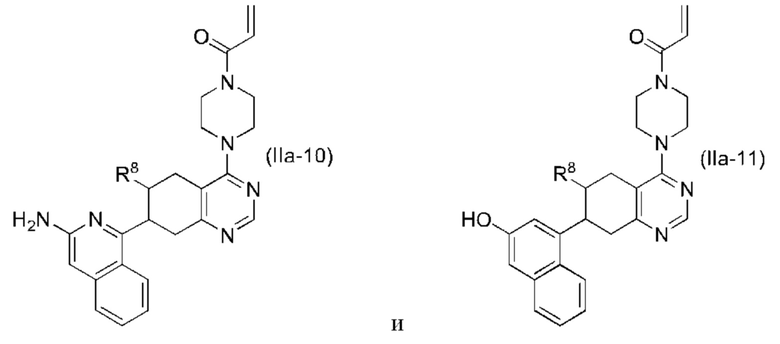
или его фармацевтически приемлемая соль, где R8 соответствует определению выше для формулы (I) или формулы (II).
В соответствии с некоторыми вариантами осуществления формулы (I) или формулы (II) соединение имеет формулу (III):
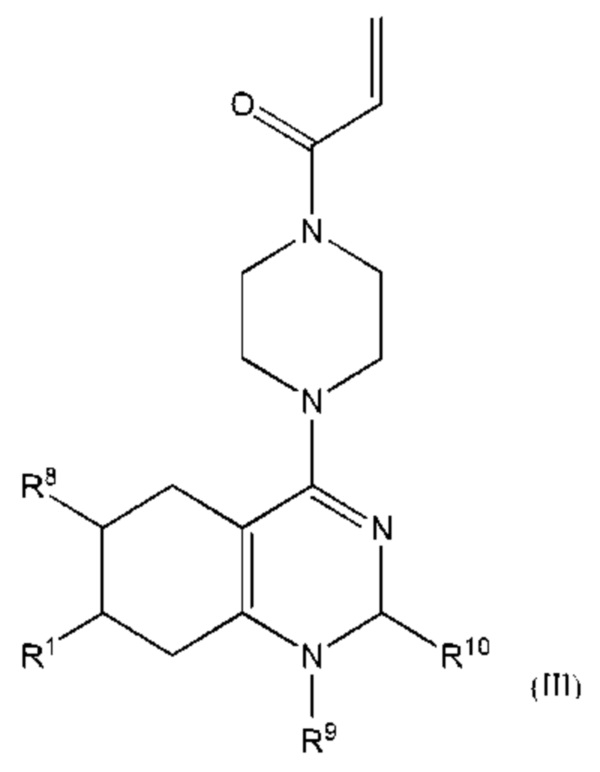
или ее фармацевтически приемлемой соли, где R1, R8, R9 и R10 независимо соответствуют определениям выше для формулы (I) или формулы (II).
В соответствии с некоторыми вариантами осуществления формулы (I) или формулы (II) соединение формулы (III) имеет формулу, выбранную из группы, состоящей из:


или его фармацевтически приемлемая соль, где R20 выбран из группы, состоящей из C1-6 алкила, NH2, NH(CH3), N(CH3)2, галогена, C1-6 галогеналкила, гидрокси, С3-6 циклоалкила, C1-6 гидроксиалкила и -ОС(=О)СН=СН2; р равно 0, 1, 2, 3 или 4; a R8, R9 и R10 независимо соответствуют определениям выше для формулы (I) или формулы (II).
В соответствии с некоторыми вариантами осуществления формулы (I) или формулы (II) соединение формулы (III) имеет формулу, выбранную из группы, состоящей из:


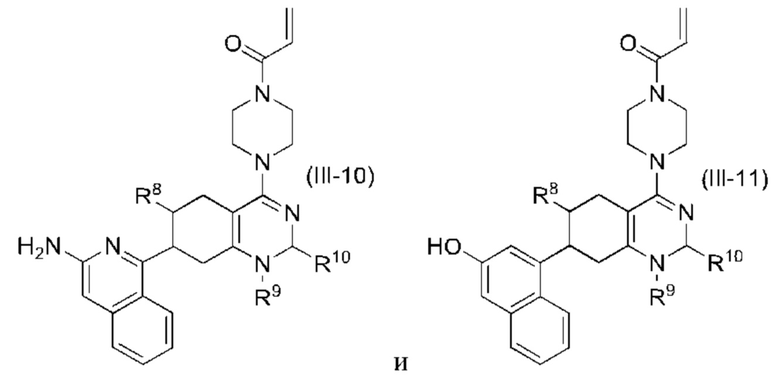
или его фармацевтически приемлемая соль, где R8, R9 и R10 независимо соответствуют определениям выше для формулы (I) или формулы (II).
В соответствии с некоторыми вариантами осуществления формулы (I) или формулы (II) соединение имеет формулу (IIm):

или ее фармацевтически приемлемой соли, где R1, R8, R9 и R10 независимо соответствуют определениям выше для формулы (I) или формулы (II).
В соответствии с некоторыми вариантами осуществления формулы (I) или формулы (II) соединение имеет формулу (IIn):

или ее фармацевтически приемлемой соли, где R1, R8, L и R10a независимо соответствуют определениям выше для формулы (I) или формулы (II).
В соответствии с некоторыми вариантами осуществления формулы (I) или формулы (II) соединение формулы (IIn) имеет формулу, выбранную из группы, состоящей из:

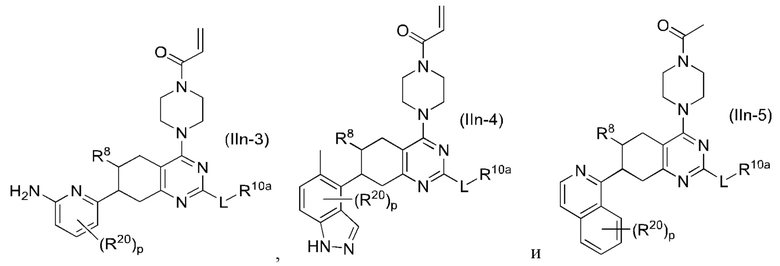
или его фармацевтически приемлемая соль, где каждый R20 независимо выбран из группы, состоящей из C1-6 алкила, NH2, NH(СН3), N(СН3)2, галогена, C1-6 галогеналкила, гидрокси, С3-6 циклоалкила, C1-6 гидроксиалкила и -ОС(=O)СН=СН2; каждое р независимо равно 0, 1, 2, 3 или 4; а R8, L и R10a независимо соответствуют определениям выше для формулы (I) или формулы (II).
В соответствии с некоторыми вариантами осуществления формулы (I) или формулы (II) соединение формулы (IIn) имеет формулу, выбранную из группы, состоящей из:



или его фармацевтически приемлемая соль, где R8, L и R10a независимо соответствуют определениям выше для формулы (I) или формулы (II).
В соответствии с некоторыми вариантами осуществления формулы (I) или формулы (II) или их фармацевтически приемлемой соли, соединение имеет формулу (IIa), где R8 выбран из группы, состоящей из Н и C1-6 алкила.
В соответствии с некоторыми вариантами осуществления формулы (I) или формулы (II) или их фармацевтически приемлемой соли, соединение имеет формулу (IIa), где R8 выбран из группы, состоящей из Н, метила и изопропила.
В соответствии с некоторыми вариантами осуществления формулы (I) или формулы (II) или их фармацевтически приемлемой соли, соединение имеет формулу (IIl), где R8 выбран из группы, состоящей из Н и метила; R9 представляет собой арил, замещенный C1-6 алкилом; а R10 представляет собой оксо.
В соответствии с некоторыми вариантами осуществления формулы (I) или формулы (II) или их фармацевтически приемлемой соли, соединение имеет формулу (IIl), где R8 представляет собой водород; R9 представляет собой арил, замещенный C1-6 алкилом; а R10 представляет собой оксо.
В соответствии с некоторыми вариантами осуществления формулы (I) или формулы (II) или их фармацевтически приемлемой соли, соединение имеет формулу (IIm), где R8 выбран из группы, состоящей из Н и метила; R9 представляет собой арил, замещенный C1-6 алкилом; а R10 представляет собой оксо.
В соответствии с некоторыми вариантами осуществления формулы (I) или формулы (II) или их фармацевтически приемлемой соли, соединение имеет формулу (IIm), где R8 представляет собой водород; R9 представляет собой арил, замещенный C1-6 алкилом; а R10 представляет собой оксо.
В соответствии с некоторыми вариантами осуществления формулы (I) или формулы (II) или их фармацевтически приемлемой соли, соединение имеет формулу (IIn), где R8 выбран из группы, состоящей из водорода и C1-6 алкила; L is О; R10a выбран из группы, состоящей из гетероциклилалкила и гетероарилалкила, где каждый гетероциклилалкил и гетероарилалкил необязательно замещены одним или более Ld; а каждый Ld независимо выбран из группы, состоящей из водорода, оксо, галогена и C1-6 алкила.
В соответствии с некоторыми вариантами осуществления формулы (I) или формулы (II) соединение имеет формулу (IIa), (IIl), (IIm) или (IIn), где R1 выбран из группы, состоящей из 

В соответствии с некоторыми вариантами осуществления формулы (I) или формулы (II) или их фармацевтически приемлемой соли, соединение выбрано из группы, состоящей из соединений из таблицы 1, приведенной ниже, или его фармацевтически приемлемой соли.
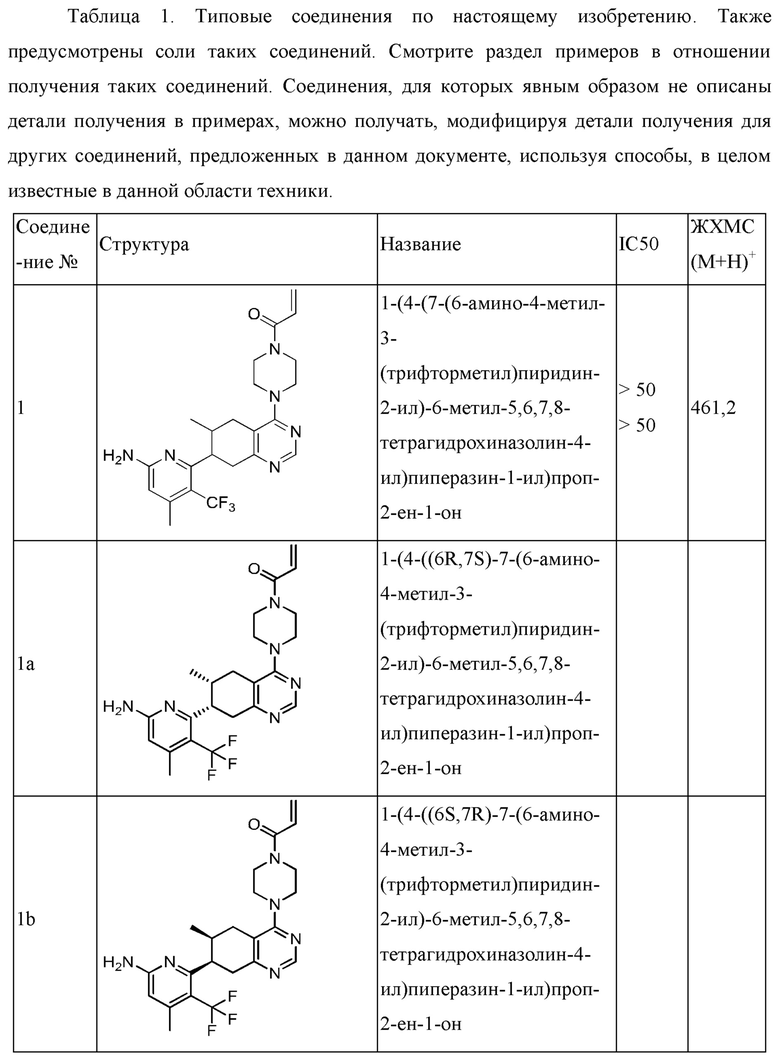
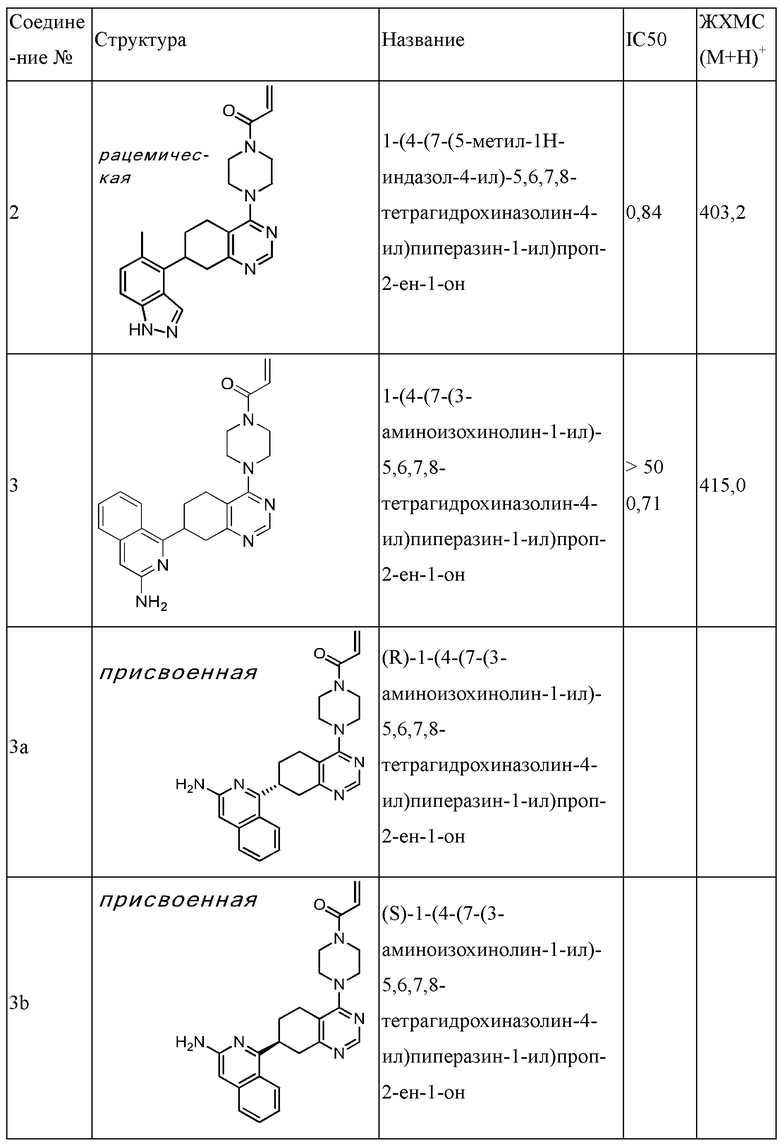



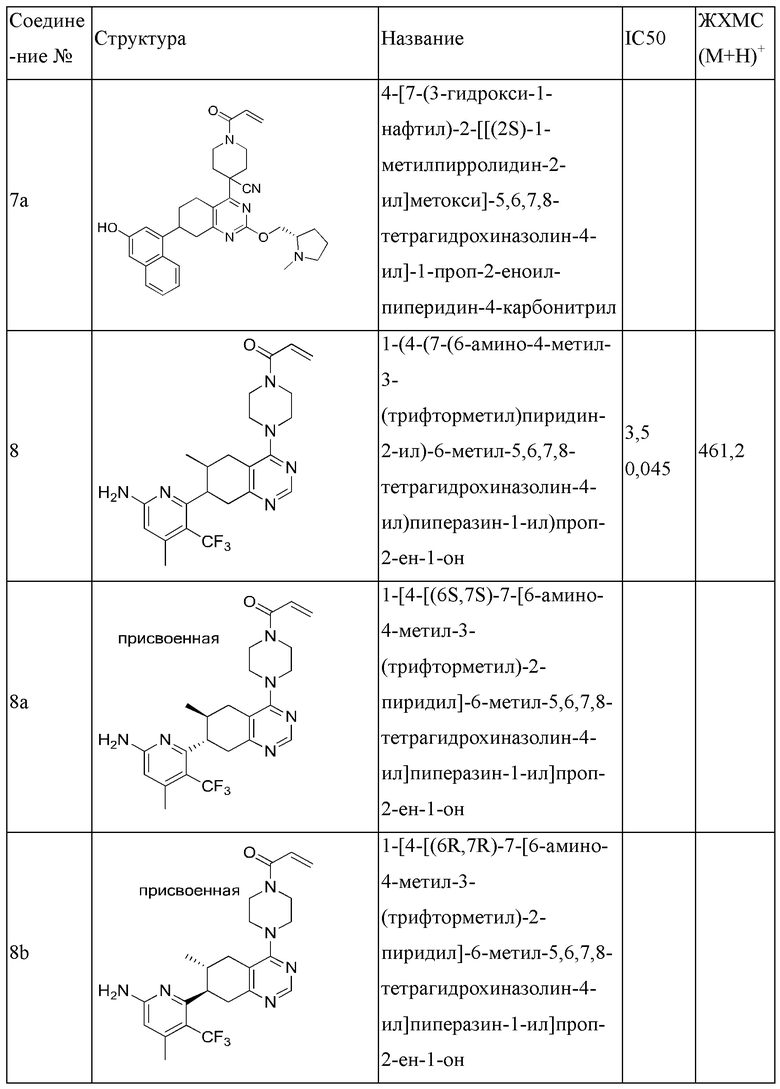
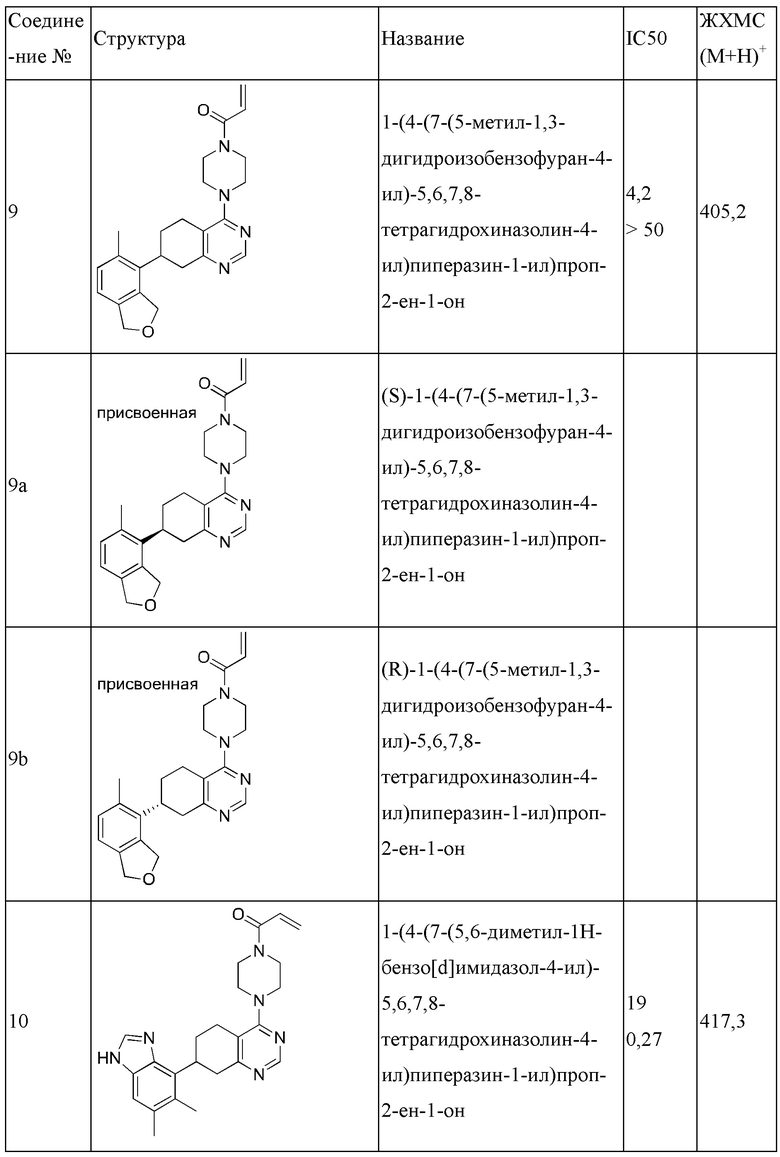

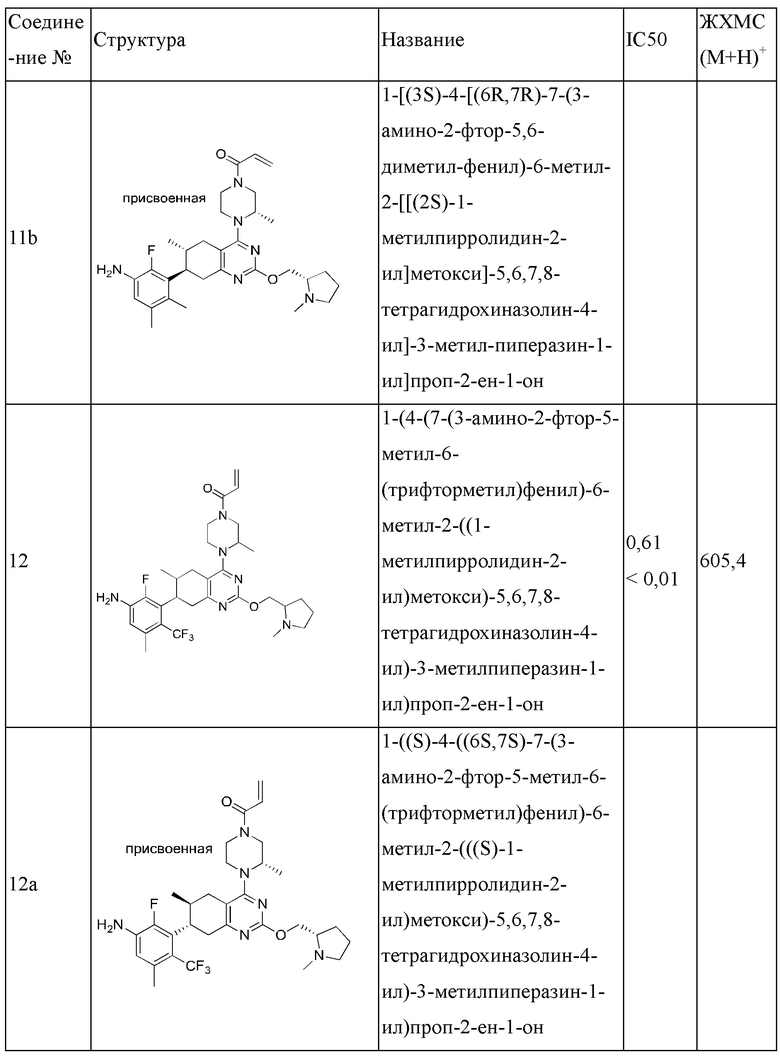


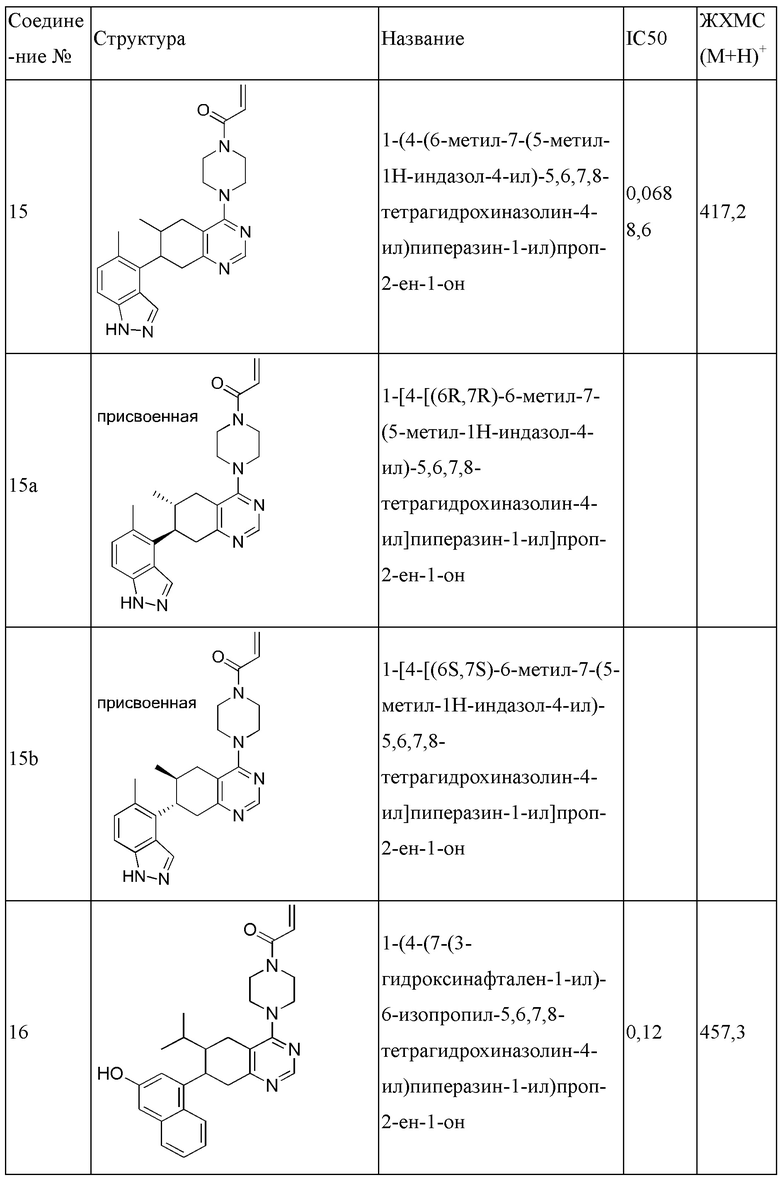
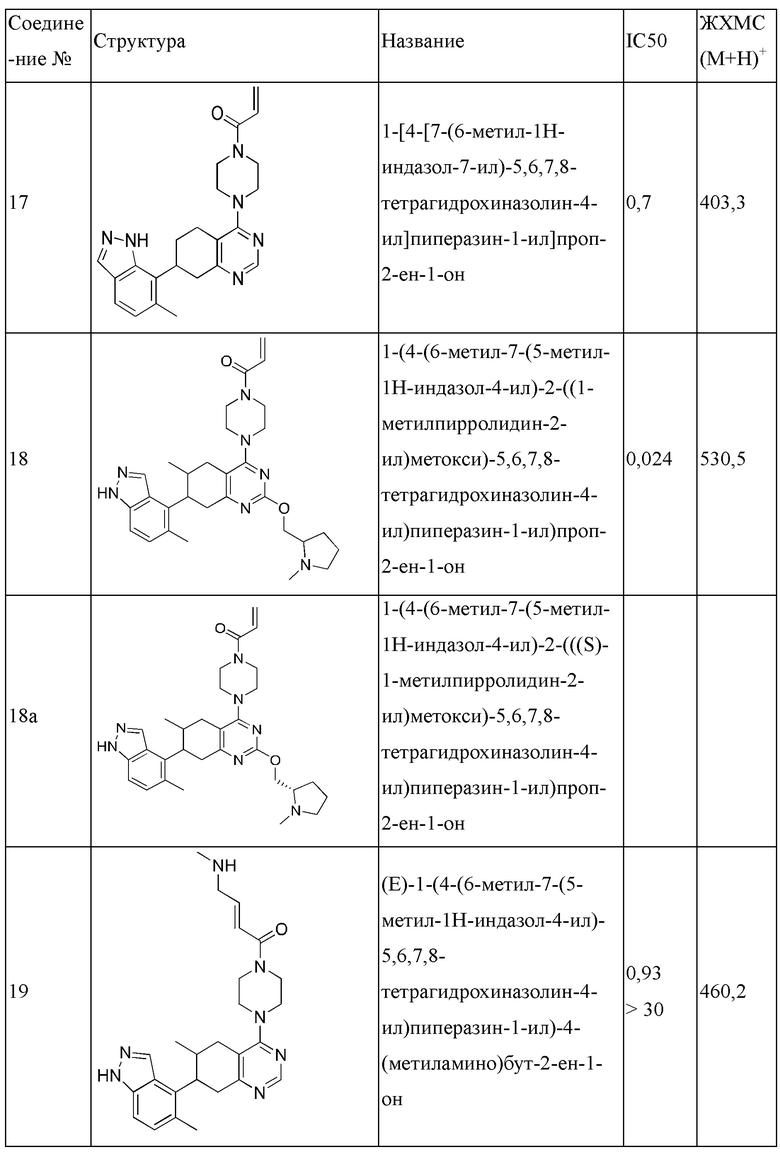
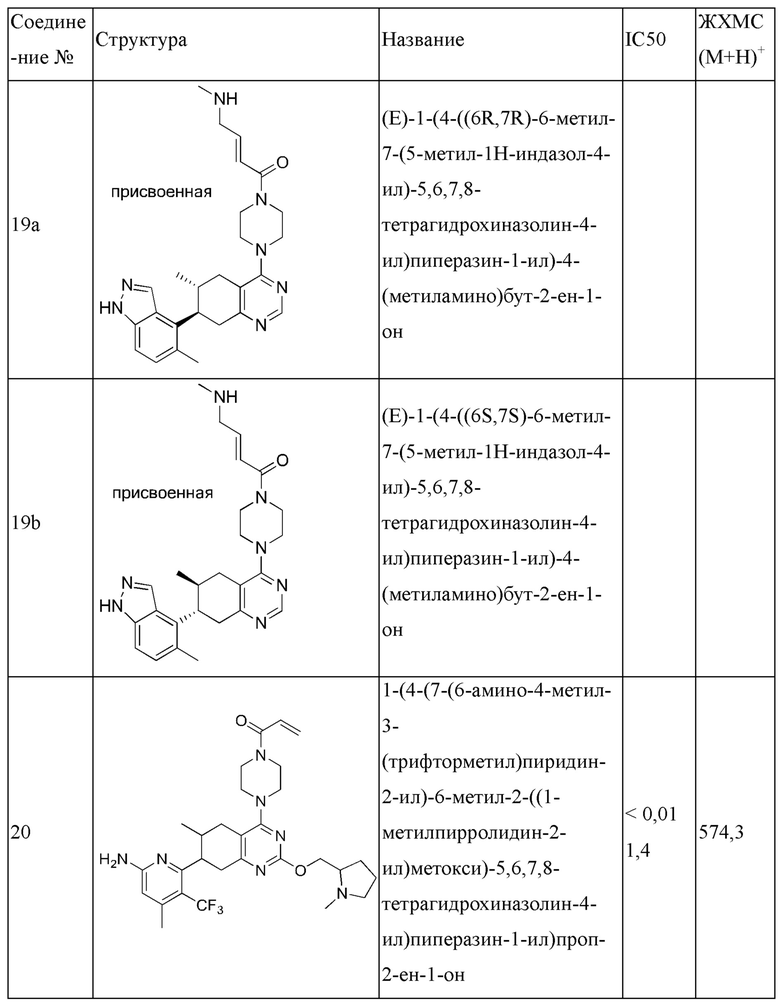


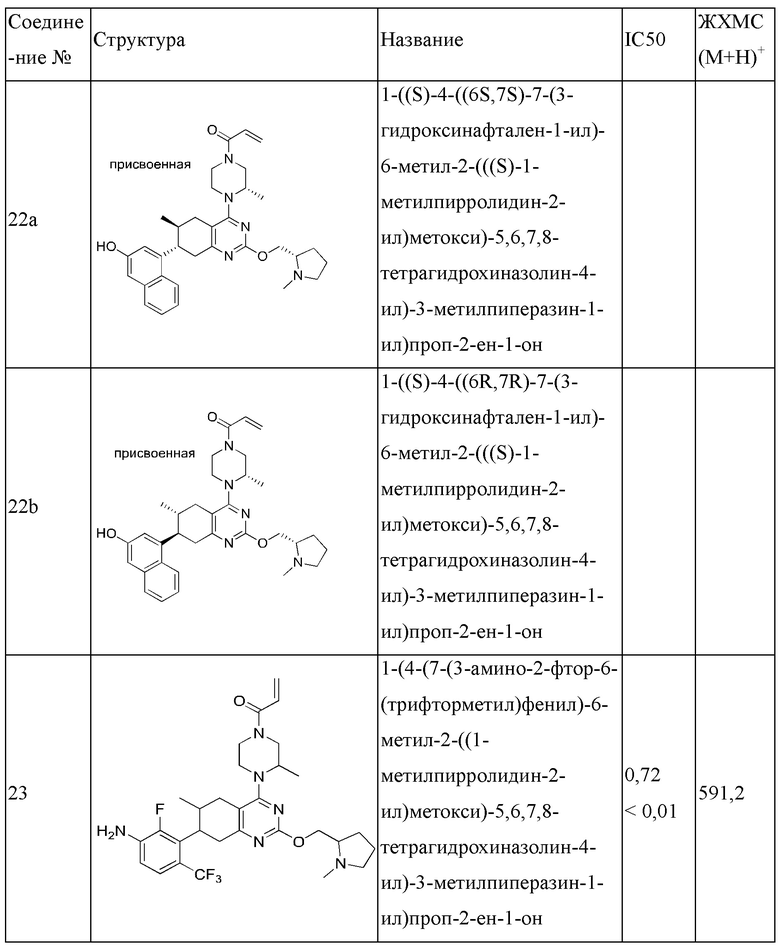


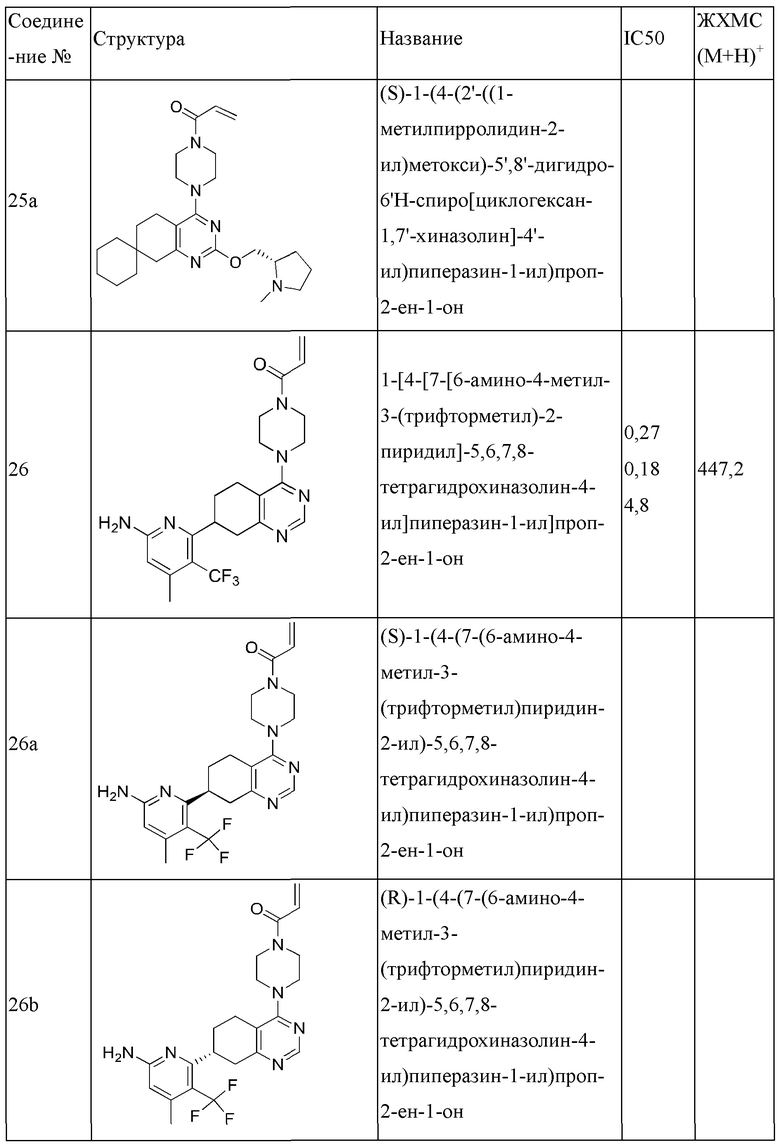


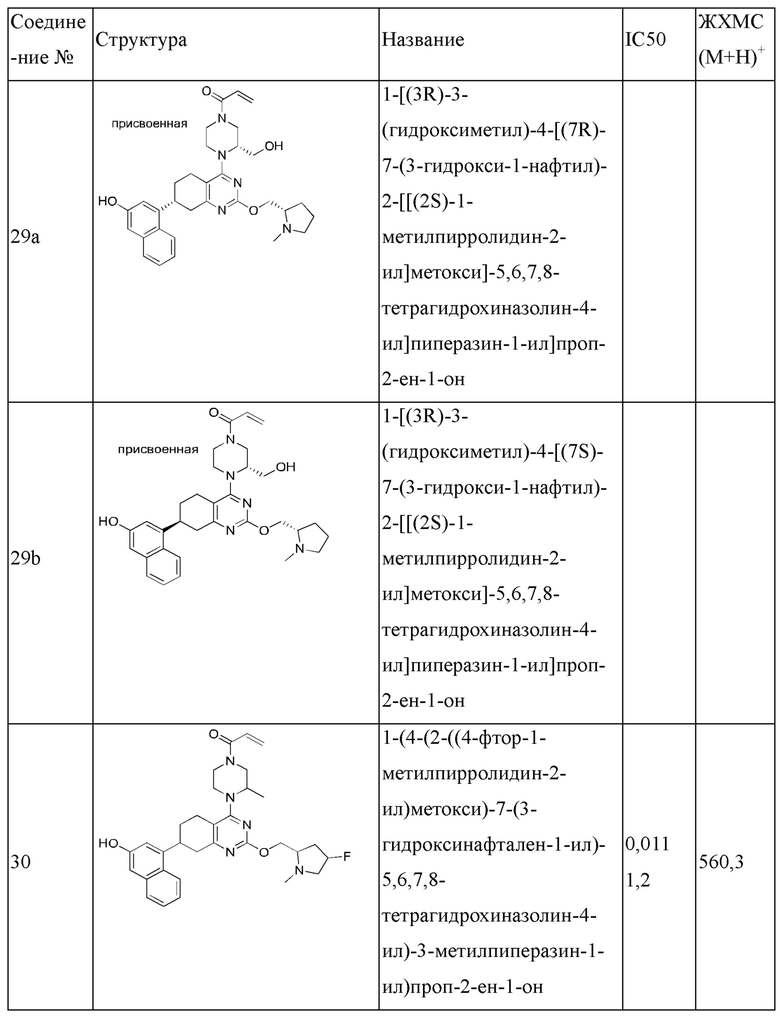


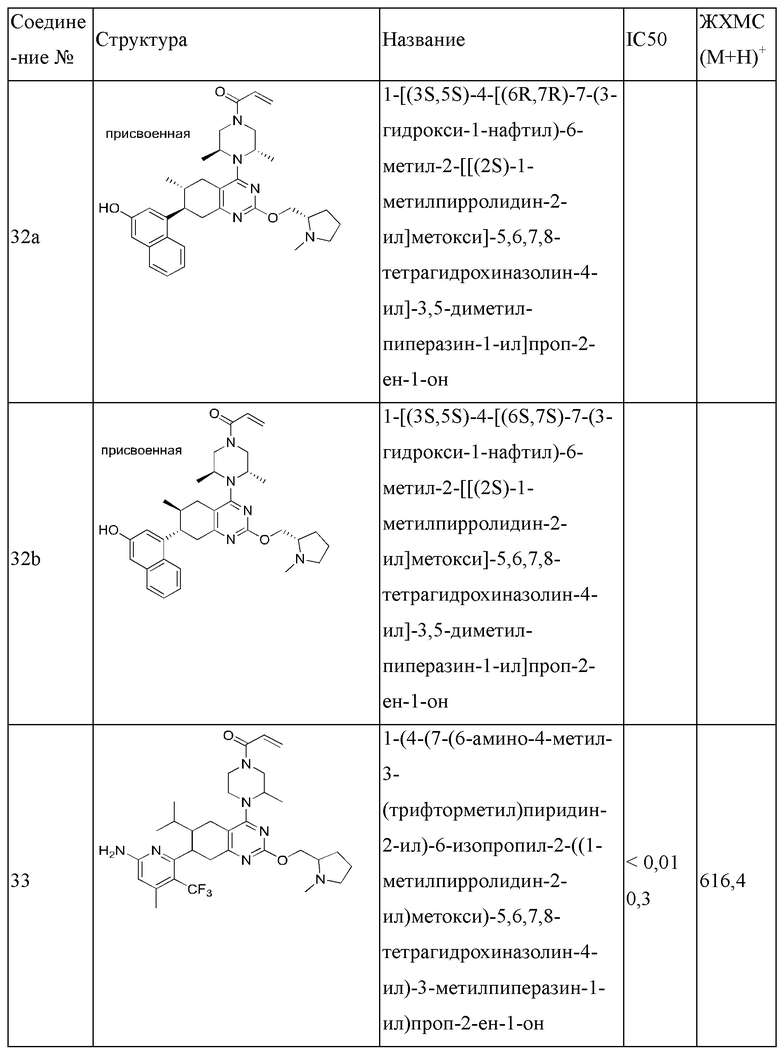
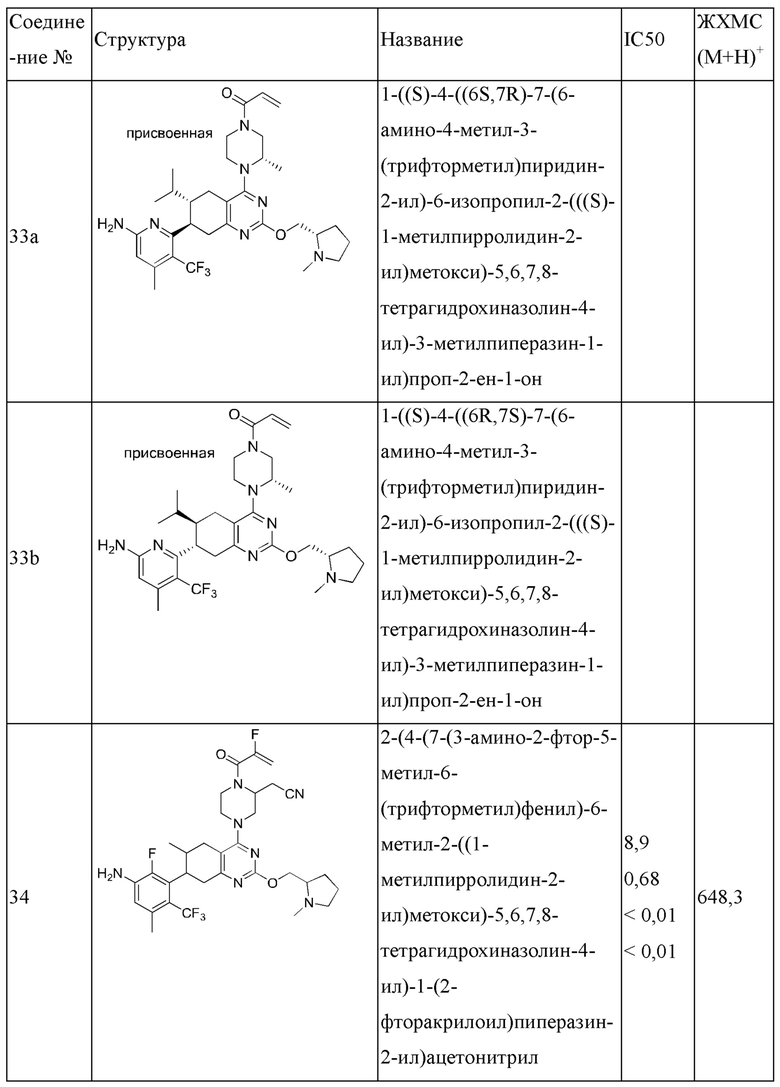



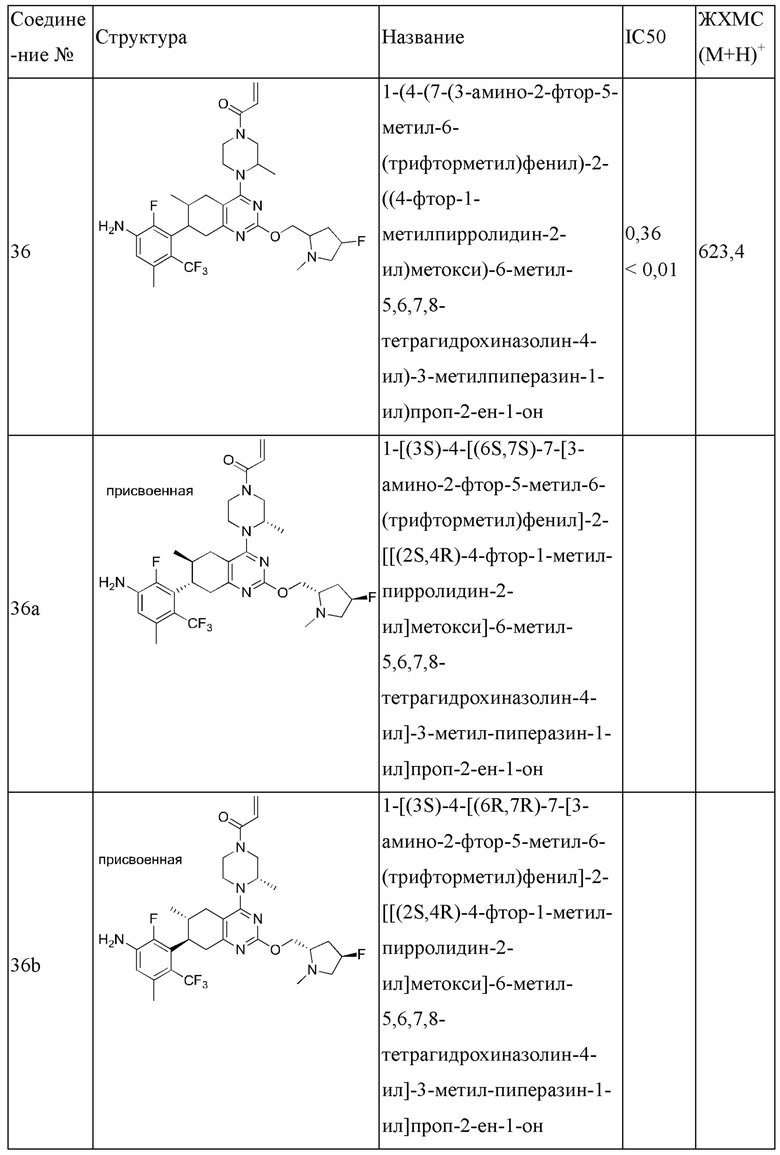

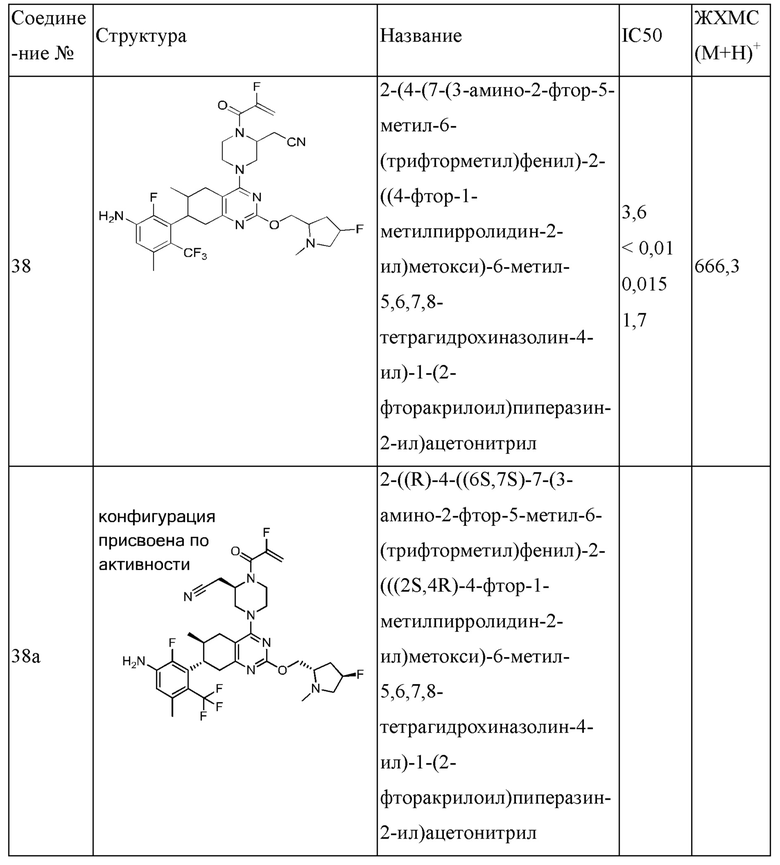


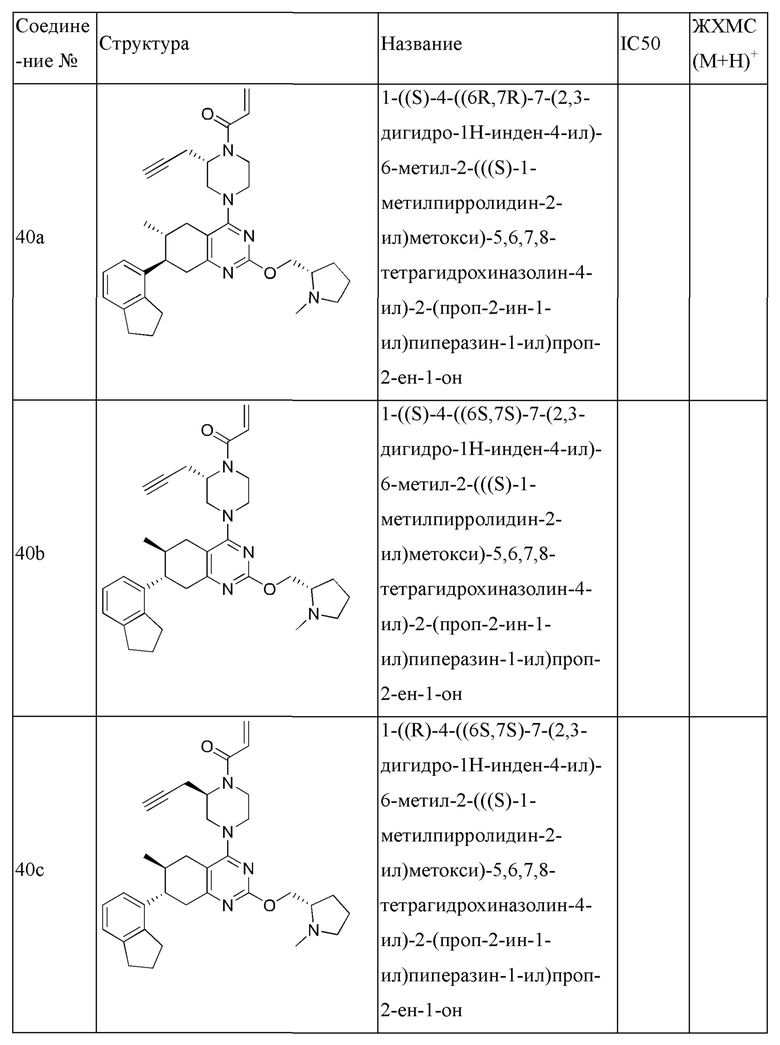
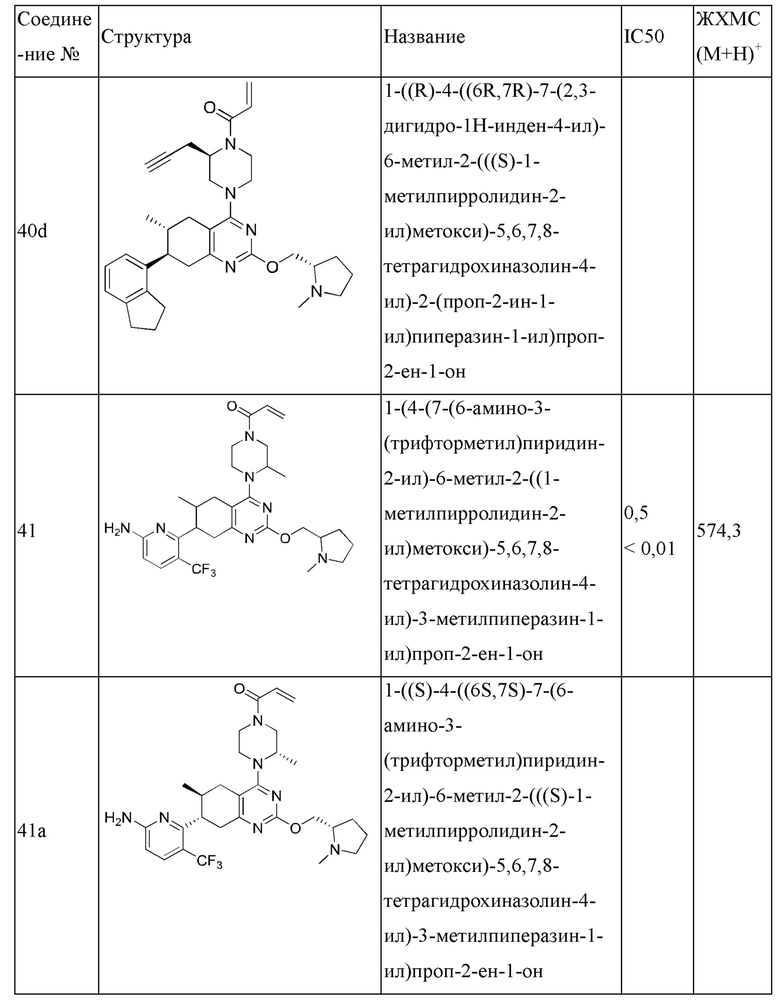
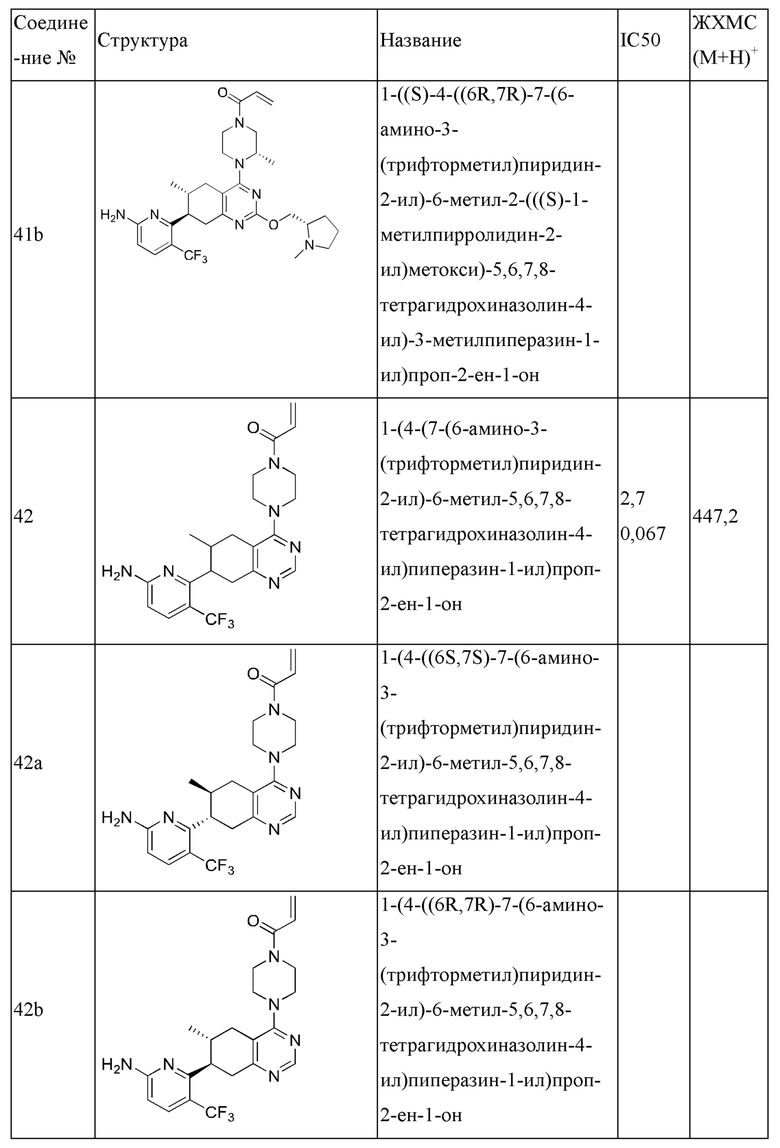
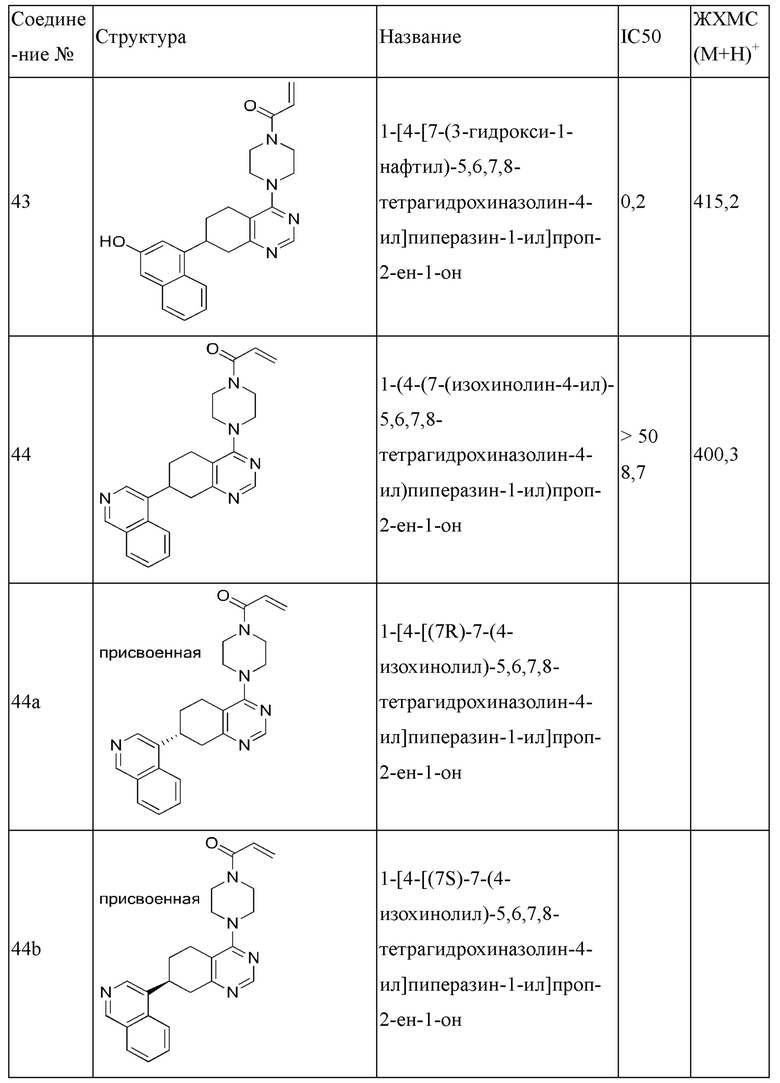




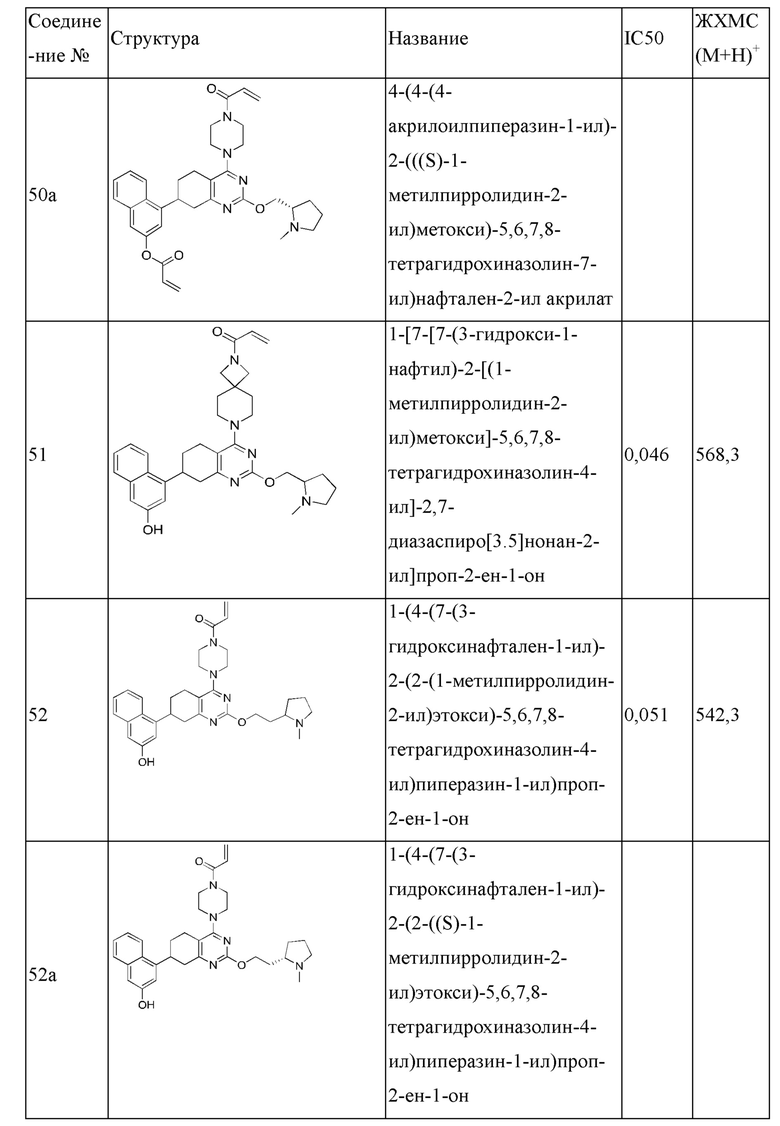


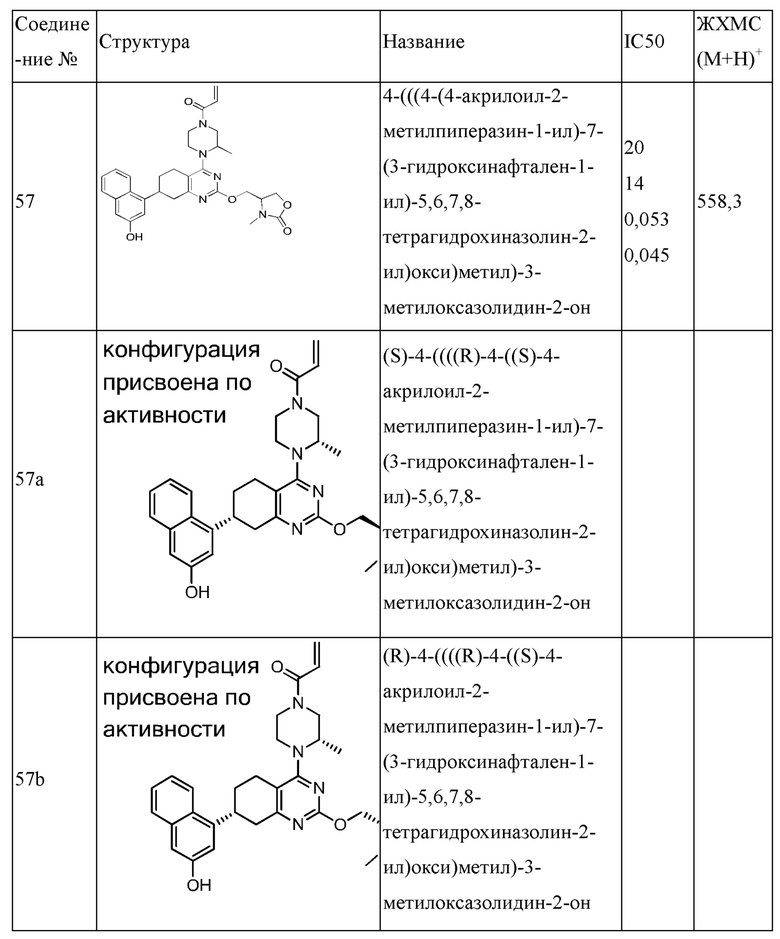
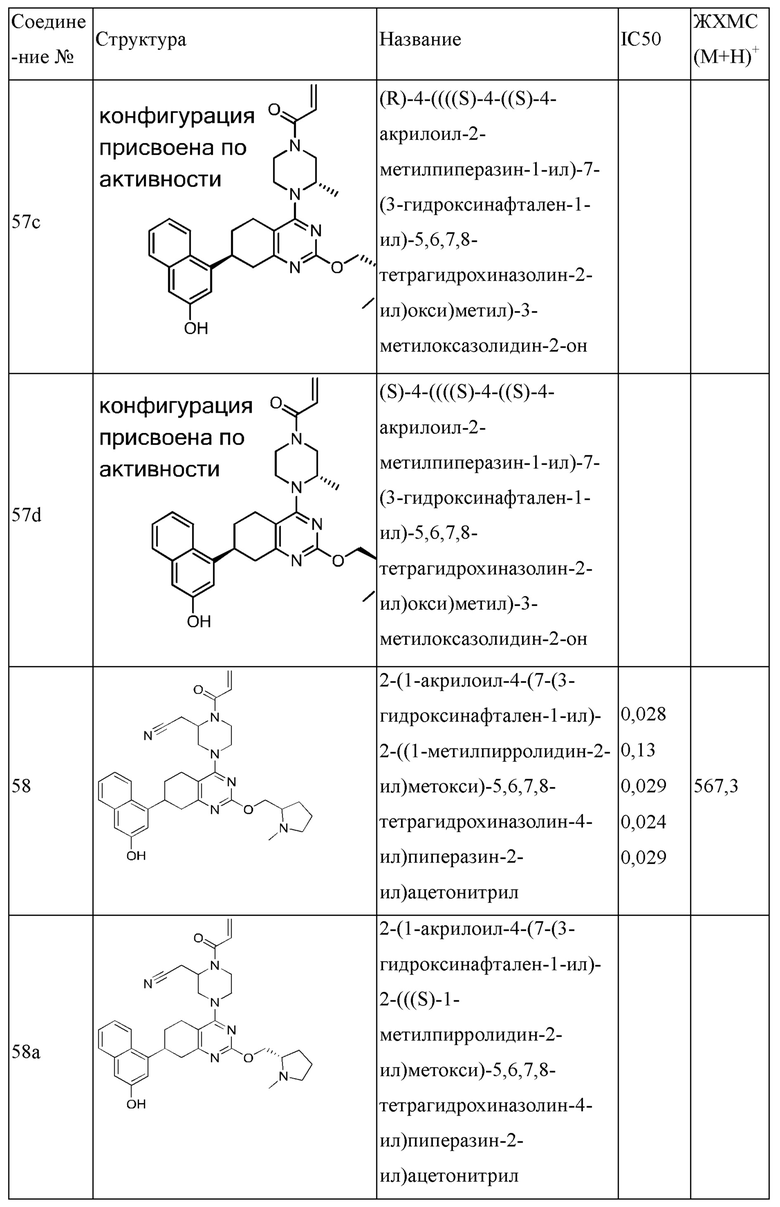
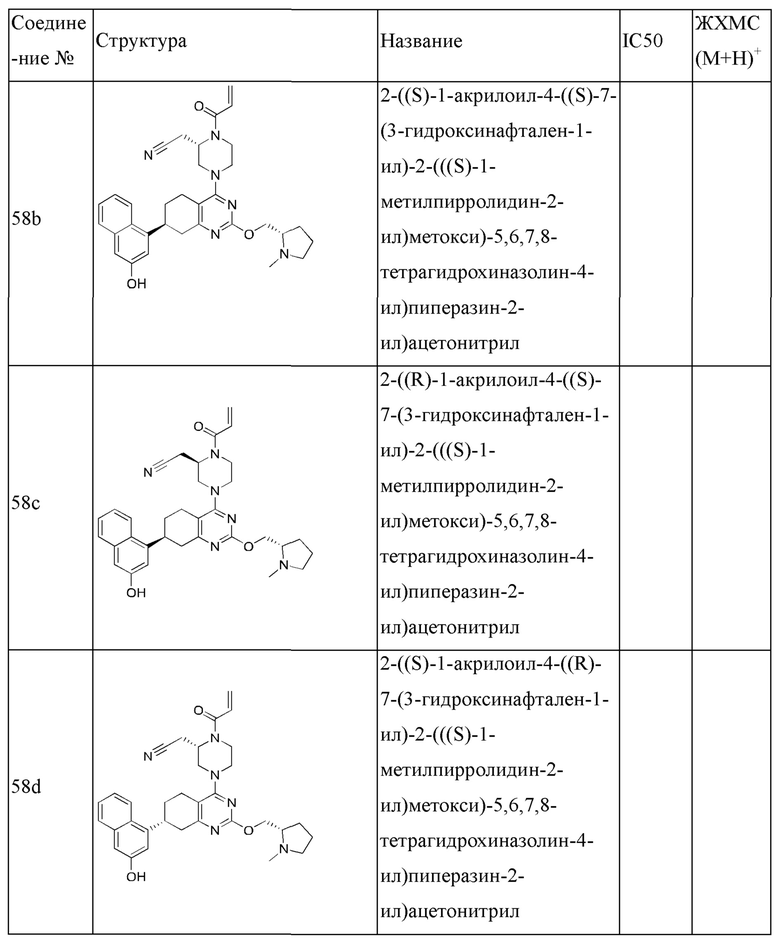






СИНТЕЗ ИНГИБИТОРОВ RAS
Соединения по настоящему изобретению можно получать рядом способов, изображенных на иллюстративных схемах реакций синтеза, показанных и описанных ниже. Стартовые материалы и реагенты, применяемые при получении этих соединений, в целом либо доступны от коммерческих поставщиков, таких как Aldrich Chemical Co., либо получены способами, известными специалистам в данной области техники, с придерживанием процедур, приведенных в таких ссылках, как Fieser and Fieser's Reagents for Organic Synthesis; Wiley & Sons: New York, vol. 1-21; R.C. LaRock, Comprehensive Organic Transformations, 2nd edition Wiley-VCH, New York 1999;
Comprehensive Organic Synthesis, B. Trost and I. Fleming (Eds.) vol. 1-9 Pergamon, Oxford, 1991; Comprehensive Heterocyclic Chemistry, A.R. Katritzky and C.W. Rees (Eds.) Pergamon, Oxford 1984, vol. 1-9; Comprehensive Heterocyclic Chemistry II, A.R. Katritzky and C.W. Rees (Eds) Pergamon, Oxford 1996, vol. 1-11; и Organic Reactions, Wiley & Sons: New York, 1991, vol. 1-40. Следующие схемы реакций синтеза являются просто иллюстративными для некоторых способов, которыми можно синтезировать соединения по настоящему изобретению, а специалисты в данной области техники могут вносить или предположить различные модификации этих схем реакций синтеза, ссылаясь на изложенное в данном документе изобретение.
В целях иллюстрации в схемах реакций ниже приведены пути синтеза соединений по изобретению, а также основные промежуточные соединения. Более подробное описание отдельных этапов реакций смотрите в разделе примеров ниже. Специалистам в данной области техники понятно, что можно использовать другие пути синтеза. Хотя некоторые конкретные стартовые материалы и реагенты проиллюстрированы на схемах и обсуждаются ниже, можно проводить их замену другими стартовыми материалами и реагентами, чтобы обеспечить ряд производных или условий реакций. Кроме того, многие соединения, полученные описанными ниже способами, можно дополнительно модифицировать в света этого изобретения, используя традиционные методы химии, хорошо известные специалистам в данной области техники.
Стартовые материалы и промежуточные соединения схем реакций синтеза можно выделять и очищать при необходимости, используя традиционные методики, включая, но не ограничиваясь этим, фильтрацию, дистилляцию, кристаллизацию, хроматографию и т.п. Характеристики таких материалов можно получать, используя традиционные средства, включая физические константы и спектральные данные.
Если не указано иное, описанные в данном документе реакции предпочтительно проводят в инертной атмосфере при атмосферном давлении в диапазоне температур реакций от около -78°С до около 150°С, более предпочтительно от около 0°С до около 125°С, и наиболее предпочтительно и удобно при комнатной температуре (или температуре окружающей среды) или при около 20°С.
Некоторые соединения на следующих схемах проиллюстрированы с обобщенными заместителями; однако специалист в данной области техники сразу поймет, что природу заместителей можно варьировать с получением различных соединений, предусмотренных в этом изобретении. Кроме того, условия реакций являются иллюстративными, а альтернативные условия хорошо известны. Последовательности реакций в следующих примерах не подразумевают ограничения объема изобретения, установленного в формуле изобретения.
СПОСОБЫ ЛЕЧЕНИЕ ИНГИБИТОРАМИ RAS И ИХ ПРИМЕНЕНИЕ
Соединения по настоящему изобретению применимы в качестве ингибиторов Ras. В одном аспекте соединения по настоящему изобретению применимы в качестве ингибиторов K-Ras. В другом аспекте соединения по настоящему изобретению применимы в качестве ингибиторов N-Ras. В другом аспекте соединения по настоящему изобретению применимы в качестве ингибиторов H-Ras. Соответственно, в одном варианте осуществления предложен способ приведения клетки, такой как ех vivo клетка, в контакт с соединением по настоящему изобретению или его фармацевтически приемлемой солью для ингибирования активности Ras (например, активности K-Ras, H-Ras и/или N-Ras) в клетке.
Дополнительно предложен способ предотвращения, лечения или ослабления тяжести заболевания или патологического состояния, восприимчивого к ингибированию Ras (например, K-Ras, H-Ras и/или N-Ras), у пациента, включающий введение пациенту терапевтически эффективного количества соединения по настоящему изобретению или его фармацевтически приемлемой соли.
В одном аспекте настоящее изобретение относится к способу предотвращения, лечения или ослабления тяжести заболевания или патологического состояния, восприимчивого к ингибированию K-Ras, у пациента, включающему введение пациенту терапевтически эффективного количества соединения по настоящему изобретению или его фармацевтически приемлемой соли.
В одном аспекте настоящее изобретение относится к способу предотвращения, лечения или ослабления тяжести заболевания или патологического состояния, восприимчивого к ингибированию H-Ras, у пациента, включающему введение пациенту терапевтически эффективного количества соединения по настоящему изобретению или его фармацевтически приемлемой соли.
В одном аспекте настоящее изобретение относится к способу предотвращения, лечения или ослабления тяжести заболевания или патологического состояния, восприимчивого к ингибированию N-Ras, у пациента, включающему введение пациенту терапевтически эффективного количества соединения по настоящему изобретению или его фармацевтически приемлемой соли.
Также предложен способ лечения рака у пациента, включающий введение пациенту терапевтически эффективного количества соединения по настоящему изобретению или его фармацевтически приемлемой соли.
Также предложен способ ингибирования Ras (например, K-Ras, H-Ras и/или N-Ras) у пациента, нуждающегося в терапии, включающий введение пациенту терапевтически эффективного количества соединения по настоящему изобретению или его фармацевтически приемлемой соли.
В одном аспекте настоящее изобретение относится к способу ингибирования K-Ras у пациента, нуждающегося в терапии, включающему введение пациенту терапевтически эффективного количества соединения по настоящему изобретению или его фармацевтически приемлемой соли.
В одном аспекте настоящее изобретение относится к способу ингибирования Н-Ras у пациента, нуждающегося в терапии, включающему введение пациенту терапевтически эффективного количества соединения по настоящему изобретению или его фармацевтически приемлемой соли.
В одном аспекте настоящее изобретение относится к способу ингибирования N-Ras у пациента, нуждающегося в терапии, включающему введение пациенту терапевтически эффективного количества соединения по настоящему изобретению или его фармацевтически приемлемой соли.
Также предложена фармацевтическая композиция, содержащая терапевтически эффективное количество соединения по настоящему изобретению или его фармацевтически приемлемой соли и фармацевтически приемлемое вспомогательное вещество. Соединения по изобретению, включая фармацевтические композиции, содержащие такие соединения, можно применять с описанных в данном документе способах.
В вариантах осуществления настоящего изобретения предложен способ ингибирования Ras-опосредованной клеточной сигнализации, включающий приведение клетки в контакт с терапевтически эффективным количеством одного или более описанных в данном документе соединений или их фармацевтически приемлемой соли. Ингибирование Ras-опосредованной передачи сигнала можно оценить и продемонстрировать рядом известных в данной области техники способов. Неограничивающие примеры включают демонстрацию (а) снижения ГТФазной активности Ras; (b) снижения аффинности связывания ГТФ или повышения аффинности связывания ГДФ; (с) повышения Kдисс. ГТФ или снижения Kдисс. ГДФ; (d) снижения уровней молекул передачи сигнала после пути Ras, такого, как снижение уровня pMEK; и/или (е) снижения связывания комплекса Ras с последующими сигнальными молекулами, включая, но не ограничиваясь этим, Raf. Для определения одного или более из вышеперечисленного можно использовать наборы и коммерчески доступные анализы.
В вариантах осуществления также предложены способы применения соединений или фармацевтических композиций по настоящему изобретению для лечения болезненных состояний, включая, но не ограничиваясь этим, состояния, обусловленные мутацией G12C K-Ras, мутацией G12C H-Ras и/или мутацией G12C N-Ras (например, рака).
В некоторых вариантах осуществления изобретения предложен способ лечения нарушения у нуждающегося в этом субъекта, причем указанный способ включает определение, имеет ли субъект мутацию G12C в K-Ras, H-Ras или N-Ras, и, если субъект определен как имеющий мутацию G12C в K-Ras, H-Ras или N-Ras, введение субъекту терапевтически эффективного количества по меньшей мере одного соединения по настоящему изобретению или его фармацевтически приемлемой соли.
Мутации G12C в K-Ras, H-Ras или N-Ras также были идентифицированы при гематологических злокачественных образованиях (например, раках, которые поражают кровь, костный мозг и/или лимфатические узлы). Соответственно, некоторые варианты осуществления относятся к введению описанного соединения по настоящему изобретению или его фармацевтически приемлемой соли (например, в форме фармацевтической композиции) пациенту, нуждающемуся в лечении гематологического злокачественного образования. Такие злокачественные образования включают, но не ограничиваются этим, лейкозы и лимфомы. Например, представленные соединения можно применять для лечения таких заболеваний, как острый лимфобластный лейкоз (ОЛЛ), острый миелогенный лейкоз (ОМЛ), хронический лимфоцитарный лейкоз (ХЛЛ), мелкоклеточная лимфоцитарная лимфома (МЛЛ), хронический миелогенный лейкоз (ХМЛ), острый моноцитарный лейкоз (ОМоЛ) и/или другие лейкозы. В других вариантах осуществления соединения по настоящему изобретению или их фармацевтически приемлемые соли применимы для лечения таких лимфом, как все подтипы лимфомы Ходжкина и неходжкинской лимфомы.
Определение, содержит ли опухоль или рак мутацию G12C в K-Ras, H-Ras или N-Ras, можно проводить путем оценки нуклеотидной последовательности, кодирующей белок K-Ras, H-Ras или N-Ras, путем оценки аминокислотной последовательности белка K-Ras, H-Ras или N-Ras или путем оценки характеристик предполагаемого мутантного белка K-Ras, H-Ras или N-Ras. Последовательности человеческих K-Ras (например, номер доступа NP203524), H-Ras (например, номер доступа NP001123914) и N-Ras (например, номер доступа NP002515) дикого типа известны в данной области техники.
Способы обнаружения мутации в нуклеотидной последовательности K-Ras, Н-Ras или N-Ras известны специалистам в данной области техники. Эти способы включают, но не ограничиваются этим, анализ полиморфизма длины рестрикционных фрагментов методом полимеразной цепной реакции (ПЦР-ПДРФ), анализ одноцепочного конформационного полиморфизма методом полимеразной цепной реакции (ПЦР-ОЦКП), анализ методом ПЦР в режиме реального времени, ПЦР-секвенирование, анализ специфической ПЦР-амплификации мутантной аллели (САМА), прямое секвенирование, реакции удлинения праймеров, электрофорез, анализ лигирования олигонуклеотидов, анализ гибридизации, анализ TaqMan, анализ методом генотипирования ОНП, анализ плавления с высоким разрешением и микроматричный анализ. В некоторых вариантах осуществления оценку образцов в отношении мутаций G12C в K-Ras, H-Ras или N-Ras проводят методом ПЦР в режиме реального времени. При проведении ПЦР в режиме реального времени используют флуоресцентные зонды, специфические к мутации G12C в K-Ras, H-Ras или N-Ras. Если мутация присутствует, происходит связывание зонда и обнаружение флуоресценции. В некоторых вариантах осуществления мутацию G12C в K-Ras, H-Ras или N-Ras идентифицируют, применяя метод прямого секвенирования конкретных областей (например, экзона 2 и/или экзона 3) в гене K-Ras, H-Ras или N-Ras. Эта методика позволяет идентифицировать все возможные мутации в секвенируемой области.
Способы обнаружения мутации в белке K-Ras, H-Ras или N-Ras известны специалистам в данной области техники. Эти способы включают, но не ограничиваются этим, обнаружение мутантного K-Ras, H-Ras или N-Ras с помощью связывающего агента (например, антитела), специфического к мутантному белку, белковый электрофорез и вестерн-блоттинг, а также прямое пептидное секвенирование. В способах определения, содержит ли опухоль или рак мутацию G12C в K-Ras, H-Ras или N-Ras, можно использовать разные образцы. В некоторых вариантах осуществления образец получен от субъекта, имеющего опухоль или рак. В некоторых вариантах осуществления образец представляет собой свежий опухолевый/раковый образец. В некоторых вариантах осуществления образец представляет собой замороженный опухолевый/раковый образец. В некоторых вариантах осуществления образец представляет собой фиксированный формалином и залитый парафином образец. В некоторых вариантах осуществления образец обработан до получения клеточного лизата. В некоторых вариантах осуществления образец обработан до получения ДНК или РНК.
Варианты осуществления также относятся к способу лечения гиперпролиферативного нарушения у млекопитающего, который включает введение указанному млекопитающему терапевтически эффективного количества соединения по настоящему изобретению или его фармацевтически приемлемой соли. В некоторых вариантах осуществления указанный способ относится к лечению рака, такого как острый миелоидный лейкоз, рака подростков, адренокортикальная карцинома детей, связанные со СПИДом виды рака (например, лимфома и саркома Капоши), рак анального канала, рак аппендикса, астроцитомы, атипичная тератоидно-рабдоидная опухоль, базальноклеточная карцинома, рак желчного протока, рак мочевого пузыря, рак костей, глиома ствола головного мозга, опухоль головного мозга, рак молочной железы, броехиальные опухоли, лимфома Беркитта, карциноидная опухоль, эмбриональные опухоли, герминогенная опухоль, первичная лимфома, рак шейки матки, детский рак, хордома, кардиальные опухоли, хронический лимфоцитарный лейкоз (ХЛЛ), хронический миелогенный лейкоз (ХМЛ), хронические миелопролиферативные нарушения, рак ободочной кишки, колоректальный рак, краниофарингеома, кожная Т-клеточная лимфома, внепеченочная протоковая карцинома in situ (DCIS), эмбриональные опухоли, рак ЦНС, рак эндометрия, эпендимома, рак пищевода, эстезионейробластома, саркома Юинга, экстракраниальная герминогенная опухоль, внегонадная герминогенная опухоль, рак глаза, фиброзная гистиоцитома кости, рак желчного пузыря, рак желудка, желудочно-кишечная карциноидная опухоль, желудочно-кишечные стромальные опухоли (ЖКСО), герминогенная опухоль, гестационная трофобластическая опухоль, волосатоклеточный лейкоз, рак головы и шеи, рак сердца, рак печени, лимфома Ходжкина, гипофарингеальный рак, интраокулярная меланома, опухоль из клеток островков поджелудочной железы, нейроэндокринные опухоли поджелудочной железы, рак почки, рак гортани, рак губы и ротовой полости, лобулярная карцинома in situ (LCIS), рак легких, лимфома, метастатический плоскоклеточный рак шеи со скрытым началом, срединная карцинома, рак ротоглотки, синдром множественных эндокринных новообразований, множественная миелома/плазмоклеточная опухоль, фунгоидный микоз, миелодиспластический синдром, миелодиспластические/миелопролиферативные новообразования, множественная миелома, карцинома из клеток Меркеля, злокачественная мезотелиома, злокачественная фиброзная гистиоцитома костей и остеосаркома, рак носовой полости и придаточных пазух носа, рак носоглотки, нейробластома, неходжкинская лимфома, немелкоклеточный рак легкого (НМРЛ), оральный рак, рак ротоглотки, рак яичника, рак поджелудочной железы, папилломатоз, параганглиома, рак паращитовидной железы, рак полового члена, фарингеальный рак, плевролегочная бластома, первичная лимфома центральной нервной системы (ЦНС), рак предстательной железы, ректальный рак, переходно-клеточный рак, ретинобластома, рабдомиосаркома, рак слюнной железы, рак кожи, мелкоклеточный рак легкого, рак тонкого кишечника, саркома мягких тканей, Т-клеточная лимфома, рак яичка, рак горла, тимома и рак вилочковой железы, рак щитовидной железы, переходно-клеточный рак почечной лоханки и мочеточника, трофобластическая опухоль, необычные детские раки, рак уретры, саркома матки, рак вагины, рак вульвы и индуцированный вирусом рак. В некоторых вариантах осуществления указанный способ относится к лечению неракового гиперпролиферативного нарушения, такого как доброкачественная гиперплазия кожи (например, псориаз), рестеноз или доброкачественная гиперплазия предстательной железы (ДГПЖ).
В определенных конкретных вариантах осуществления изобретение относится к способам лечения раков легких, включающих введение нуждающемуся в этом субъекту терапевтически эффективного количества соединения по настоящему изобретению или его фармацевтически приемлемой соли (или содержащей их фармацевтической композиции). В определенных вариантах осуществления рак легких представляет собой немелкоклеточный рак легких (НМРЛ), например, аденокарциному, плоскоклеточную карциному легких или крупноклеточную карциному легких. В других вариантах осуществления рак легких представляет собой мелкоклеточный рак легких. Другие виды рака, подлежащие лечению описанными соединениями, включают, но не ограничиваются этим, железистые опухоли, карциноидные опухоли и недифференцированные карциномы.
В одном варианте осуществления в изобретении предложен способ опухоль-агностического лечения рака у нуждающегося в этом индивида, включающий определение, имеет ли индивид опухоль с мутацией G12C в белке K-Ras, H-Ras или N-Ras в опухоли, и если индивид имеет опухоль с мутацией, введение терапевтически эффективного количества соединения по настоящему изобретению или его фармацевтически приемлемой соли, описанных в данном документе. В контексте данного документе «опухоль-агностический» относится к ракам (опухолям), имеющим конкретную генетическую мутацию или общий биомаркер, которые можно лечить описанным в данном документе соединением или его фармацевтически приемлемой солью, вне зависимости от типа опухоли. Таким образом, в одном варианте осуществления описанное в данном документе соединение или его фармацевтически приемлемую соль можно вводить описанному в данном документе индивиду, имеющему любой рак, содержащий мутацию G12C.
В некоторых вариантах осуществления в изобретении предложены способы ингибирования активности K-Ras, H-Ras или N-Ras с G12C в клетке путем приведения указанной клетки в контакт с количеством соединения по настоящему изобретению или его фармацевтически приемлемой соли, достаточным для ингибирования активности K-Ras, H-Ras или N-Ras с G12C в указанной клетке. В некоторых вариантах осуществления в изобретении предложены способы ингибирования активности K-Ras, H-Ras или N-Ras с G12C в ткани путем приведения указанной ткани в контакт с количеством соединения по настоящему изобретению или его фармацевтически приемлемой соли, достаточным для ингибирования активности K-Ras, H-Ras или N-Ras с G12C в указанной ткани. В некоторых вариантах осуществления в изобретении предложены способы ингибирования активности K-Ras, H-Ras или N-Ras с G12C в организме путем приведения указанного организма в контакт с количеством соединения по настоящему изобретению или его фармацевтически приемлемой соли, достаточным для ингибирования активности K-Ras, H-Ras или N-Ras с G12C в указанном организме. В некоторых вариантах осуществления в изобретении предложены способы ингибирования активности K-Ras, H-Ras или N-Ras с G12C у животного путем приведения указанного животного в контакт с количеством соединения по настоящему изобретению или его фармацевтически приемлемой соли, достаточным для ингибирования активности K-Ras, H-Ras или N-Ras с G12C у указанного животного. В некоторых вариантах осуществления в изобретении предложены способы ингибирования активности K-Ras, H-Ras или N-Ras с G12C у млекопитающего путем приведения указанного млекопитающего в контакт с количеством соединения по настоящему изобретению или его фармацевтически приемлемой соли, достаточным для ингибирования активности K-Ras, H-Ras или N-Ras с G12C у указанного млекопитающего. В некоторых вариантах осуществления в изобретении предложены способы ингибирования активности K-Ras, H-Ras или N-Ras с G12C у человека путем приведения указанного человека в контакт с количеством соединения по настоящему изобретению или его фармацевтически приемлемой соли, достаточным для ингибирования активности K-Ras, H-Ras или N-Ras с G12C у указанного человека. В других вариантах осуществления в настоящем изобретении предложены способы лечения заболевания, опосредованного активностью K-Ras, H-Ras или N-Ras с G12C, у субъекта, нуждающегося в таком лечении.
В некоторых вариантах осуществления в изобретении предложены способы лечения рака, включающие введение нуждающемуся в этом индивиду терапевтически эффективного количества соединения по настоящему изобретению или его фармацевтически приемлемой соли или фармацевтической композиции по настоящему изобретению. В некоторых вариантах осуществления индивид представляет собой человека. В некоторых вариантах осуществления введение осуществляют пероральным путем. В некоторых вариантах осуществления введение осуществляют путем инъекции. В некоторых вариантах осуществления рак опосредован мутацией K-Ras G12C, H-Ras G12C или N-Ras G12C. В некоторых вариантах осуществления рак опосредован мутацией K-Ras G12C. В некоторых вариантах осуществления рак представляет собой гемобластоз, рак поджелудочной железы, MYH-ассоциированный полипоз, колоректальный рак или рак легких. В некоторых вариантах осуществления рак представляет собой аденокарциному легких.
В некоторых вариантах осуществления в изобретении предложены способы регуляции активности мутантного белка, выбранного из группы, состоящей из K-Ras G12C, H-Ras G12C и N-Ras G12C, включающие осуществление реакции мутантного белка с соединением по настоящему изобретению или его фармацевтически приемлемой солью.
В некоторых вариантах осуществления в изобретении предложены способы ингибирования пролиферации клеточной популяции, включающие приведение клеточной популяции в контакт с соединением по настоящему изобретению или его фармацевтически приемлемой солью. В некоторых вариантах осуществления ингибирование пролиферации определяют как снижение жизнеспособности клеток клеточной популяции.
В некоторых вариантах осуществления в изобретении предложены способы лечения нарушения, опосредованного мутацией, выбранной из группы, состоящей из K-Ras G12C, H-Ras G12C и N-Ras G12C, у нуждающегося в этом индивида, включающие определение, имеет ли индивид мутацию; и, если индивид определен как имеющий мутацию, введение индивиду терапевтически эффективного количества соединения по настоящему изобретению или его фармацевтически приемлемой соли или фармацевтической композиции по настоящему изобретению. В некоторых вариантах осуществления нарушение опосредовано мутацией K-Ras G12C. В некоторых вариантах осуществления нарушение представляет собой рак. В некоторых вариантах осуществления рак является агностическим. В другом варианте осуществления рак представляет собой гемобластоз, рак поджелудочной железы, MYH-ассоциированный полипоз, колоректальный рак или рак легких. В некоторых вариантах осуществления рак представляет собой аденокарциному легких. В другом варианте осуществления рак представляет собой колоректальный рак.
В некоторых вариантах осуществления в изобретении предложены способы получения меченного мутантного белка K-Ras G12C, H-Ras G12C или N-Ras G12C, включающие осуществление реакции мутантного белка K-Ras G12C, H-Ras G12C или N-Ras G12C с соединением по настоящему изобретению или его фармацевтически приемлемой солью, чтобы в результате получить меченный мутантный белок K-Ras G12C, H-Ras G12C или N-Ras G12C.
В некоторых вариантах осуществления в изобретении предложены способы ингибирования метастазов опухоли, включающие введение нуждающемуся в этом индивиду терапевтически эффективного количества соединения по настоящему изобретению или его фармацевтически приемлемой соли или фармацевтической композиции по настоящему изобретению.
В некоторых вариантах осуществления в изобретении предложено применение соединения по настоящему изобретению или его фармацевтически приемлемой соли при производстве лекарственного средства для лечения рака. В некоторых вариантах осуществления лекарственное средство составлено для перорального введения. В некоторых вариантах осуществления лекарственное средство составлено для инъекции. В некоторых вариантах осуществления рак опосредован мутацией K-Ras G12C, H-Ras G12C или N-Ras G12C. В некоторых вариантах осуществления рак опосредован мутацией K-Ras G12C. В некоторых вариантах осуществления рак опосредован мутацией H-Ras G12C. В некоторых вариантах осуществления рак опосредован мутацией N-Ras G12C. В некоторых вариантах осуществления рак представляет собой гемобластоз, рак поджелудочной железы, MYH-ассоциированный полипоз, колоректальный рак или рак легких. В некоторых вариантах осуществления рак представляет собой аденокарциному легких. В некоторых вариантах осуществления в изобретении предложено применение соединения по настоящему изобретению или его фармацевтически приемлемой соли при производстве лекарственного средства для ингибирования метастазов опухоли.
В некоторых вариантах осуществления в изобретении предложено соединение по настоящему изобретению или его фармацевтически приемлемая соль или фармацевтическая композиция по настоящему изобретению для применения в способе терапевтического лечения организма человека или животного. В некоторых вариантах осуществления в изобретении предложено соединение по настоящему изобретению или его фармацевтически приемлемая соль или фармацевтическая композиция по настоящему изобретению для применения в способе лечения рака. В некоторых вариантах осуществления рак опосредован мутацией K-Ras G12C, H-Ras G12C или N-Ras G12C. В некоторых вариантах осуществления рак опосредован мутацией K-Ras G12C. В некоторых вариантах осуществления рак опосредован мутацией H-Ras G12C. В некоторых вариантах осуществления рак опосредован мутацией N-Ras G12C. В некоторых вариантах осуществления рак является агностическим. В другом варианте осуществления рак представляет собой гемобластоз, рак поджелудочной железы, MYH-ассоциированный полипоз, колоректальный рак или рак легких. В некоторых вариантах осуществления рак представляет собой аденокарциному легких. В некоторых вариантах осуществления в изобретении предложено соединение по настоящему изобретению или его фармацевтически приемлемая соль или фармацевтическая композиция по настоящему изобретению для применения в способе ингибирования метастазов опухоли.
ДОЗИРОВКИ И ВВЕДЕНИЕ
В настоящем изобретении предложены фармацевтические композиции или лекарственные средства, содержащие терапевтически эффективное количество соединения по настоящему изобретению или его фармацевтически приемлемой соли и по меньшей мере одно терапевтически инертное вспомогательное вещество, а также способы применения соединений по изобретению для получения таких композиций и лекарственных средств.
Следовательно, один вариант осуществления включает фармацевтическую композицию, содержащую терапевтически эффективное количество соединения по настоящему изобретению или его фармацевтически приемлемой соли. Дополнительный вариант осуществления включает фармацевтическую композицию, содержащую терапевтически эффективное количество соединения по настоящему изобретению или его фармацевтически приемлемой соли вместе с фармацевтически приемлемым вспомогательным веществом.
В одном примере терапевтически эффективное количество соединения по настоящему изобретению или его фармацевтически приемлемой соли с необходимой степенью чистоты можно изготовить путем смешивания с физиологически приемлемыми вспомогательными веществами, т.е. вспомогательными веществами, которые являются нетоксичными для реципиентов в применяемых дозировках и концентрациях, в виде дозированной формы при температуре окружающей среды и при соответствующем рН. рН состава зависит главным образом от конкретного применения и концентрации соединения, но, как правило, находится в диапазоне от около 3 до около 8. В одном примере соединение по настоящему изобретению или его фармацевтически приемлемая соль составлены в ацетатном буфере при рН 5. В другом варианте осуществления соединение по настоящему изобретению или его фармацевтически приемлемая соль являются стерильными. Соединение по настоящему изобретению или его фармацевтически приемлемую соль можно хранить, например, в виде твердой или аморфной композиции, в виде лиофилизированного состава или в виде водного раствора.
Композиции составляют, дозируют и вводят способом, соответствующим надлежащей медицинской практике. Факторы, которые необходимо учитывать в этом контексте, включают конкретное нарушение, подлежащее лечению, конкретного пациента, подлежащего лечению, клиническое состояние отдельного пациента, причину нарушения, место доставки агента, способ введения, схему введения и другие факторы, известные практикующим врачам. Вводимое «терапевтически эффективное количество» соединения по настоящему изобретению или его фармацевтически приемлемой соли будет основано на таких факторах и является минимальным количеством, необходимым для ингибирования активности K-Ras, H-Ras и/или N-Ras. Как правило, такое количество может быть ниже количества, являющегося токсичным для нормальных клеток ил пациента в целом.
Фармацевтическая композиция (или состав) для применения может быть упакована рядом способов в зависимости от способа, применяемого для введения лекарственного препарата. В целом, изделие для распределения содержит контейнер с находящимся в нем фармацевтическим составом в соответствующей форме. Подходящие контейнеры хорошо известны специалистам в данной области техники и включают материалы, такие как бутылки (пластиковые и стеклянные), саше, ампулы, пластиковые пакеты, металлические цилиндры и т.п. Контейнер также может содержать устройство с индикацией вскрытия для предотвращения непреднамеренного доступа к содержимому контейнера. Кроме того, контейнер может иметь этикетку с описанием содержимого контейнера. Этикетка также может содержать соответствующие предостережения.
Можно получать препараты с замедленным высвобождением. Подходящие препараты с замедленным высвобождением включают полупроницаемые матрицы из твердых гидрофобных полимеров, содержащие терапевтически эффективное количество соединения по настоящему изобретению или его фармацевтически приемлемой соли, которые имеют форму формованных изделий, например, пленок или микрокапсул. Примеры матриц с замедленным высвобождением включают сложные полиэфиры, гидрогели (например, поли(2-гидроксиэтилметакрилат) или поли(виниловый спирт)), полилактиды, сополимеры L-глутаминовой кислоты и гамма-этил-L-глутамата, неразлагаемый этиленвинилацетат, разлагаемые сополимеры молочной кислоты и гликолевой кислоты, такие как LUPRON DEPOT™ (инъекционные микросферы, состоящие из сополимера молочной кислоты и гликолевой кислоты и ацетата лейпролида), и поли-D-(-)-3-гидроксимасляную кислоту.
Доза для лечения пациентов-людей может находиться в диапазоне от около 0,01 мг до около 1000 мг соединения по настоящему изобретению или его фармацевтически приемлемой соли. Например, при лечении взрослых людей дозировки от 0,01 до 1000 мг, от 0,5 до 100 мг, от 1 до 50 мг в сутки и от 5 до 40 мг в сутки являются примерами дозировок, которые используются в некоторых вариантах осуществления. Типовая дозировка составляет от 10 до 30 мг в сутки. Точная дозировка будет зависеть от пути введения, формы, в которой вводят соединение, подлежащего лечению субъекта, массы тела подлежащего лечению субъекта и предпочтений и опыта лечащего врача. Дозу можно вводить один раз в сутки (р/с), дважды в сутки (д/с) или чаще в зависимости от фармакокинетических и фармакодинамических свойств, включая всасывание, распределение, метаболизм и выведение конкретного соединения. Кроме того, факторы токсичности могут влиять на дозировку и схему введения. При пероральном введении пилюлю, капсулу или таблетку можно принимать раз в сутки или чаще в течение определенного периода времени. Схему можно повторять в течение ряда циклов терапии.
Терапевтически эффективное количество соединения по настоящему изобретению или его фармацевтически приемлемой соли можно вводить любым подходящим образом, включая пероральное, местное (включая буккальное и подъязычное), ректальное, вагинальное, трансдермальное, парентеральное, подкожное, внутрибрюшинное, внутрилегочное, внутрикожное, интратекальное, эпидуральное и интраназальное, а также, при необходимости локального лечения, внутриочаговое введение. Парентеральные инфузии включают внутримышечное, внутривенное, внутриартериальное, внутрибрюшинное или подкожное введение.
Терапевтически эффективное количество соединения по настоящему изобретению или его фармацевтически приемлемой соли можно вводить в любой удобной форме для введения, например, в форме таблеток, порошков, капсул, растворов, дисперсий, суспензий, сиропов, спреев, суппозиториев, гелей, эмульсий, пластырей и т.д. Такие композиции могут содержать компоненты, традиционные для фармацевтических препаратов, например, разбавители, носители, модификаторы рН, подсластители, объемообразующие агенты и дополнительные активные агенты.
Типичный состав готовят путем смешивания терапевтически эффективного количества соединения по настоящему изобретению или его фармацевтически приемлемой соли и вспомогательного вещества. Подходящие вспомогательные вещества включают носители (например, микрокристаллическую целлюлозу, лактозу, маннит), растворители (например, жидкие полиэтиленгликоли), эмульсификаторы и диспергирующие или смачивающие агенты (например, додецилсульфат натрия, полиоксисорбитанолеат), связующие вещества (например, поливинилпирролидон), синтетические и природные полимеры (например, альбумин), стабилизаторы (например, антиоксид анты, например, аскорбиновую кислоту), красители (например, неорганические пигменты, например, оксиды железа) и корректоры вкуса и/или запаха, и хорошо известны специалистам в данной области техники и подробно описаны, например, в Ansel, Н.С., et al., Ansel's Pharmaceutical Dosage Forms and Drug Delivery Systems. Philadelphia: Lippincott, Williams & Wilkins, 2004; Gennaro, Alfonso R., et al. Remington: The Science and Practice of Pharmacy. Philadelphia: Lippincott, Williams & Wilkins, 2000; и Rowe, R.C., Handbook of Pharmaceutical Excipients, Chicago, Pharmaceutical Press, 2005. Составы также могут содержать один или более буферов, поверхностно-активных веществ, смазывающих агентов, суспендирующих агентов, консервантов, кроющих агентов, глидантов, технологических добавок, подсластителей, ароматизирующих агентов, вкусоароматических агентов, разбавителей или других известных добавок, чтобы обеспечить хороший внешний вид лекарственного препараты (т.е. соединения по настоящему изобретению или его фармацевтической композиции) или помочь при производстве фармацевтического продукта (т.е. лекарственного средства).
В определенных вариантах осуществления фармацевтические препараты для перорального применения получают путем смешивания одного или более твердых вспомогательных веществ с одним или более соединениями, описанными в данном документе, необязательно, измельчения полученной в результате смеси и обработки смеси гранул после добавления, при необходимости, подходящих вспомогательных ингредиентов для получения таблеток или сердцевины драже. Подходящие вспомогательные вещества представляют собой, в частности, наполнители, такие как сахара, включая лактозу, сахарозу, маннит или сорбит; препараты целлюлозы, такие как, например, кукурузный крахмал, пшеничный крахмал, рисовый крахмал, картофельный крахмал, желатин, трагакантовая камедь, метилцеллюлоза,микрокристаллическая целлюлоза, гидроксипропилметилцеллюлоза, карбоксиметилцеллюлоза натрия; или другие, такие как поливинилпирролидон (ПВП или повидон) или фосфат кальция. В конкретных вариантах осуществления необязательно добавляют дезинтегранты. Дезинтегранты включают, только в качестве примера, перекрестно-сшитую кроскармеллозу натрия, поливинилпирролидон, агар или альгиновую кислоту или ее соль, такую как альгинат натрия.
В одном варианте осуществления предложены дозированные формы, такие как сердцевины драже и таблетки, с одним или более подходящими покрытиями. В конкретных вариантах осуществления для покрытия дозированной формы применяют концентрированные сахарные растворы. Сахарные растворы, необязательно, содержат дополнительные компоненты, такие как, только в качестве примера, аравийская камедь, тальк, поливинилпирролидон, карбополовый гель, полиэтиленгликоль и/или диоксид титана, лаковые растворы и подходящие органические растворители или смеси растворителей. В целях идентификации в покрытия также необязательно добавляют красители и/или пигменты. Кроме того, красители и/или пигменты, необязательно, используют для указания разных комбинаций доз активного соединения.
В определенных вариантах осуществления терапевтически эффективные количества по меньшей мере одного из описанных в данном документе соединений составлены в виде других пероральных дозированных форм. Пероральные дозированный формы включают твердые капсулы, изготовленные из желатина, а также мягкие герметичные капсулы из желатина и пластификатора, такого как глицерин или сорбит. В конкретных вариантах осуществления твердые капсулы могут содержать активные ингредиенты в смеси с одним или более наполнителями. Наполнители включают, только в качестве примера, лактозу, связующие вещества, такие как крахмалы, и/или смазывающие вещества, такие как тальк или стеарат магния, и, необязательно, стабилизаторы. В других вариантах осуществления мягкие капсулы содержат одно или более активных соединений, которые растворены или суспендированы в подходящей жидкости. Подходящие жидкости включают, только в качестве примера, одно или более из жирных масел, жидкого парафина или жидкого полиэтиленгликоля. Кроме того, необязательно добавляют стабилизаторы.
В других вариантах осуществления терапевтически эффективные количества по меньшей мере одного из описанных в данном документе соединений составлены для буккального или подъязычного введения. Составы, подходящие для буккального или подъязычного введения, включают, только в качестве примера, таблетки, леденцы или гели. В других вариантах осуществления описанные в данном документе соединения составлены для парентеральной инъекции, включая составы, подходящие для болюсной инъекции или постоянной инфузии. В конкретных вариантах осуществления составы для инъекции представлены в единичной дозированной форме (например, в ампулах) или в многодозовых контейнерах. В составы для инъекции необязательно добавляют консерванты. В других вариантах осуществления фармацевтические композиции составлены в форме, подходящей для парентеральной инъекции, в виде стерильных суспензий, растворов или эмульсия в масляных или водных носителях. Парентеральный инъекционные составы, необязательно, содержат вспомогательные агенты, такие как суспендирующие, стабилизирующие и/или диспергирующие агенты. В конкретных вариантах осуществления фармацевтические составы для парентерального введения содержат водные растворы активных соединений в водорастворимой форме, в дополнительных вариантах осуществления суспензии соединения по настоящему изобретению или его фармацевтически приемлемой соли получают в виде соответствующих масляных инъекционных суспензий. Подходящие липофильные растворители или носители для применения в описанных в данном документе фармацевтических композициях включают, только в качестве примера, жирные масла, такие как кунжутное масло, или синтетические сложные эфиры жирных кислот, такие как этилолеат или триглицериды, или липосомы. В определенных конкретных вариантах осуществления водные инъекционные суспензии содержат вещества, которые повышают вязкость суспензии, такие как карбоксиметилцеллюлоза натрия, сорбит или декстран. Необязательно, суспензия содержит подходящие стабилизаторы или агенты, которые повышают растворимость соединений, для обеспечения получения высококонцентрированных растворов. В альтернативном варианте активный ингредиент может находиться в форме порошка для смешивания с подходящим носителем, например, стерильной апирогенной водой, перед использованием.
В определенных вариантах осуществления фармацевтические композиции составлены любым традиционным способом с использованием одного или более физиологически приемлемых вспомогательных веществ и ингредиентов, которые облегчают процесс обработки активных соединений в препараты, которые можно применять в фармацевтических целях. Надлежащий состав зависит от выбранного пути введения. Необязательно, применяют любые подходящие фармацевтически приемлемые методики и вспомогательные вещества. Фармацевтические композиции, содержащие терапевтически эффективное количество соединения по настоящему изобретению или его фармацевтически приемлемой соли производят традиционным образом, таким как, только в качестве примера, посредством традиционных способов смешивания, растворения, гранулирования, дражирования, отмучивания, эмульгирования, инкапсуляции, заключения или прессования.
Фармацевтические композиции содержат по меньшей мере одно фармацевтически приемлемое вспомогательное вещество и терапевтически эффективное количество соединения по настоящему изобретению или его фармацевтически приемлемой соли, описанных в данном документе, в качестве активного ингредиента. Активный ингредиент находится в форме свободной кислоты или свободного основания или в форме фармацевтически приемлемой соли. Кроме того, описанные в данном документе способы и фармацевтические композиции включают использование N-оксидов, кристаллических форм (также известных как полиморфы), а также активных метаболитов этих соединений, имеющих такой же тип активности. Все таутомеры описанных в данном документе соединений включены в объем представленных в данном документе соединений. Кроме того, описанные в данном документе соединения охватывают несольватированные, а также сольватированные формы с фармацевтически приемлемыми растворителями, такими как вода, этанол и т.п. Предполагается, что сольватированные формы представленных в данном документе соединений также описаны в данном документе. Кроме того, фармацевтические композиции, необязательно, содержат другие медицинские или фармацевтические агенты, вспомогательные вещества, такие как консервирующие, стабилизирующие, смачивающие или эмульгирующие агенты, агенты, способствующие растворению, соли для регуляции осмотического давления, буферы и/или другие терапевтически значимые вещества.
Способы получения композиций, содержащих терапевтически эффективное количество соединения по настоящему изобретению или его фармацевтически приемлемой соли, описанных в данном документе, включают смешивание соединения по настоящему изобретению или его фармацевтически приемлемой соли с одним или более инертными, фармацевтически приемлемыми вспомогательными веществами с образованием твердого, полутвердого или жидкого вещества. Твердые композиции включают, но не ограничиваются этим, порошки, таблетки, диспергируемые гранулы, капсулы, крахмальные капсулы и суппозитории. Жидкие композиции включают растворы, в которые растворено соединение, эмульсии, содержащие соединение, или раствор, содержащий липосомы, мицеллы или наночастицы, содержащие соединение, описанное в данном документе. Полутвердые композиции включают, но не ограничиваются этим, гели, суспензии и кремы. Форма описанных в данном документе фармацевтических композиций включает жидкие растворы или суспензии, твердые формы, подходящие для растворения или суспендирования в жидкости перед применением, или эмульсии. Эти композиции также необязательно содержат незначительные количества нетоксичных вспомогательных веществ, таких как смачивающие или эмульгирующие агенты, рН-буферные агенты и т.д.
В некоторых вариантах осуществления фармацевтическая композиция, содержащая терапевтически эффективное количество соединения по настоящему изобретению или его фармацевтически приемлемой соли, в качестве иллюстрации имеет форму жидкости, в которой агенты находятся в растворе, в суспензии или справедливы оба варианта. Как правило, когда композицию вводят в виде раствора или суспензии, первая часть агента находится в растворе, а вторая часть агента находится в форме частиц, в суспензии в жидкой матрице. В некоторых вариантах осуществления жидкая композиция включает гелевый состав. В других вариантах осуществления жидкая композиция является водной.
В определенных вариантах осуществления применяемые водные суспензии содержат один или более полимеров в качестве суспендирующих агентов. Применимые полимеры включают водорастворимые полимеры, такие как полимеры на основе целлюлозы, например, гидроксипропилметилцеллюлоза, и водорастворимые полимеры, такие как перекрестно-сшитые карбоксил-содержащие полимеры. Определенные фармацевтические композиции, описанные в данном документе, содержат мукоадгезивный полимер, выбранный, например, из карбоксиметилцеллюлозы, карбомера (полимера акриловой кислоты), поли(метилметакрилата), полиакриламида, поликарбофила, сополимера акриловой кислоты/бутилакрилата, альгината натрия и декстрана.
Применимые фармацевтические композиции также, необязательно, содержат солюбилизирующие агенты, способствующие растворимости соединения по настоящему изобретению или его фармацевтически приемлемой соли. Термин «солюбилизирующий агент» в общем случае включает агенты, которые приводят к образованию мицеллярного раствора или истинного раствора агента. Определенные приемлемые неионные вспомогательные вещества, например, полисорбат 80, применимы в качестве солюбилизирующих агентов, как и офтальмологически приемлемые гликоли, полигликоли, например, полиэтиленгликоль 400, или гликолевые эфиры.
Кроме того, применимые фармацевтические композиции необязательно содержат один или более рН-регулирующих агентов или буферных агентов, включая кислоты, такие как уксусная, борная, лимонная, молочная, фосфорная и хлористоводородная кислоты; основания, такие как гидроксид натрия, фосфат натрия, борат натрия, цитрат натрия, ацетат натрия, лактат натрия и трис-гидроксиметиламинометан; и буферы, такие как цитрат/декстроза, бикарбонат натрия и хлорид аммония. Такие кислоты, основания и буферы включены в количестве, необходимом для поддержания рН композиции в приемлемом диапазоне.
Кроме того, применимые композиции также, необязательно, содержат одну или более солей в количестве, необходимом для доведения осмоляльности композиции до приемлемого диапазона. Такие соли включают содержащие катионы натрия, калия или аммония и анионы хлорида, цитрата, аскорбата, бората, фосфата, бикарбоната, сульфата, тиосульфата или бисульфита; подходящие соли включают хлорид натрия, хлорид калия, тиосульфат натрия, бисульфит натрия и сульфат аммония.
Другие применимые фармацевтические композиции необязательно содержат один или более консервантов для подавления активности микроорганизмов. Подходящие консерванты включают содержащие ртуть вещества, такие как мерфен и тиомерсал; стабилизированный диоксид хлора; и четвертичные аммониевые соединения, такие как хлорид бензалкония, бромид цетилтриметиламмония и хлорид цетилпиридиния.
Другие применимые композиции содержат одно или более поверхностно-активных веществ для повышения физической стабильности или в других целях. Подходящие поверхностно-активные вещества включают полиоксиэтиленглицериды жирных кислот и растительные масла, например, полиоксиэтилен (60) гидрированное касторовое масло; и полиоксиэтиленалкиловые эфиры и алкилфениловые эфиры, например октоксинол 10, октоксинол 40.
Другие применимые композиции содержат один или более антиоксидантов для повышения, при необходимости, химической стабильности. Подходящие антиоксиданты включают, только в качестве примера, аскорбиновую кислоту и метабисульфит натрия.
В определенных вариантах осуществления композиции на основа водной суспензии упакованы в однодозовые не поддающиеся повторной герметизации контейнеры. В альтернативном варианте используют многодозовые поддающиеся повторной герметизации контейнеры, в случае чего композиция, как правило, содержит консервант.
В альтернативных вариантах осуществления применяют другие системы доставки для гидрофобных фармацевтических соединений. Липосомы и эмульсии являются примерами средств доставки или вспомогательных веществ, применимых в контексте данного документа. В определенных вариантах осуществления также применяют органические растворители, такие как N-метилпирролидон. В дополнительных вариантах осуществления описанные в данном документе соединения доставляют, используя систему для замедленного высвобождения, такую как полупроницаемые матрицы из твердых гидрофобных полимеров, содержащие терапевтический агент. В контексте данного документа применимы различные материалы для замедленного высвобождения. В некоторых вариантах осуществления капсулы с замедленным высвобождением обеспечивают высвобождение соединений в течение от нескольких недель до более чем 100 суток.
В изобретении дополнительно предложены ветеринарные композиции, содержащие по меньшей мере один активный ингредиент по определению выше с ветеринарным вспомогательным веществом. Ветеринарные вспомогательные вещества представляют собой материалы, применимые в целях введения композиции, и могут представлять собой твердые, жидкие или газообразные материалы, которые в ином случае являются инертными или приемлемыми в области ветеринарии и совместимы с активным ингредиентом. Эти ветеринарные композиции можно вводить парентерально, перорально или любым другим необходимым путем.
КОМБИНИРОВАННАЯ ТЕРАПИЯ
Соединения по настоящему изобретению или их фармацевтически приемлемые соли можно применять отдельно или в комбинации с другими терапевтическими агентами для лечения заболевания или нарушения, описанного в данном документе. Второе соединение фармацевтического комбинированного состава или схемы дозирования предпочтительно имеет активность, дополняющую соединение по настоящему изобретению или его фармацевтически приемлемую соль, так, что они не оказывают друг на друга негативного влияния. Комбинированная терапия может обеспечить «синергизм» и оказаться «синергетической», т.е. эффект, достигаемый при совместном применении активных ингредиентов, превышает сумму эффектов, получаемых в результате применения этих соединений по отдельности.
Комбинированную терапию можно применять в виде одновременной или последовательной схемы. При последовательном введении комбинацию можно вводить за два или более введений. Комбинированное введение включает совместное введение с использованием отдельных составов или одного фармацевтического состава и последовательное введение в любом порядке, причем предпочтительно, чтобы существовал период времени, когда оба (или все) активных агента одновременно проявляют свою биологическую активность.
Таким образом, комбинированная терапия в соответствии с настоящим изобретением включает введение соединения по настоящему изобретению или его фармацевтически приемлемой соли и применение по меньшей мере одного другого способа лечения. Количества соединения по настоящему изобретению или его фармацевтически приемлемой соли и другого(их) фармацевтически активного(ых) агента(ов) и относительное время введения выбирают с целью достижения необходимого комбинированного терапевтического эффекта.
В различных вариантах осуществления этого способа дополнительный терапевтический агент представляет собой ингибитор рецепторов эпидермального фактора роста (EGFR), ингибитор фосфатидилинозитолкиназы (PI3K), ингибитор рецепторов инсулиноподобного фактора роста (IGF1R), ингибитор Янус-киназы (JAK), ингибитор Met-киназы, ингибитор семейства киназ SRC, ингибитор митоген-активируемой протеинкиназы (МЕК), ингибитор киназы, регулируемой внеклеточными сигналами (ERK), ингибитор топоизомеразы (такой как иринотекан, или такой как этопозид, или такой как доцетаксел), таксан (такой как агент, оказывающий воздействие на микротрубочки, включая паклитаксел и доцетаксел), антиметаболит (такой как 5-FU или такой как гемцитабин) или алкилирующий агент (такой как цисплатин или такой циклофосфамид) или таксан.
В некоторых вариантах осуществления дополнительный терапевтический агент представляет собой ингибитор рецепторов эпидермального фактора роста (EGFR), такой как эрлотиниб или такой как афатиниб. В некоторых вариантах осуществления дополнительный терапевтический агент представляет собой прессу. В некоторых вариантах осуществления дополнительный терапевтический агент представляет собой моноклональное антитело, такое как цетуксимаб (Эрбитукс) или панитумумаб (Вектибикс). В некоторых вариантах осуществления ингибитор GFR представляет собой двойной или пан-FLER ингибитор. В других вариантах осуществления дополнительный терапевтический агент представляет собой ингибитор фосфатидилинозитол-3-киназы (PI3K), такой как GDC-0941, MLN1117, BYL719 (Алпелисиб) или ВКМ120 (Бупарлисиб). GDC-0941 относится к 2-(1Н-индазол-4-ил)-6-(4-метансульфонил-пиперазин-1-илметил)-4-морфолин-4-ил-тиено[3,2-d]пиримидин или его соль (например, бисмезилатную соль).
В других вариантах осуществления дополнительный терапевтический агент представляет собой ингибитор рецепторов инсулиноподобного фактора роста (IGF1R). Например, в некоторых вариантах осуществления ингибитор рецепторов инсулиноподобного фактора роста (IGF1R) представляет собой NVP- AEW541. В других вариантах осуществления дополнительный терапевтический агент представляет собой IGOSI-906 (линзитиниб), BMS-754807 или в других вариантах осуществления дополнительный терапевтический агент представляет собой нейтрализующее моноклональное антитело, специфическое к IGF1R, такое как AMG-479 (ганитумаб), СР-751,871 (фигитумумаб), IMC-А12 (циксутумумаб), МК-0646 (далотузумаб) или R-1507 (робатумумаб).
В некоторых других вариантах осуществления дополнительный терапевтический агент представляет собой ингибитор Янус-киназы (JAK). В некоторых вариантах осуществления дополнительный терапевтический агент представляет собой CYT387, GLPG0634, барицитиниб, лестауртиниб, момелотиниб, пакритиниб, руксолитиниб или TG101348.
В некоторых других вариантах осуществления дополнительный терапевтический агент представляет собой антитело против глипикана 3. В некоторых вариантах осуществления антитело против глипикана 3 представляет собой кодритузумаб.
В некоторых других вариантах осуществления дополнительный терапевтический агент представляет собой конъюгат антитело - лекарственный препарат (ADC). В некоторых вариантах осуществления ADC представляет собой полатузумаб ведотин, RG7986, RG7882, RG6109 или RO7172369.
В некоторых других вариантах осуществления дополнительный терапевтический агент является антагонистом MDM2. В некоторых вариантах осуществления антагонист MDM2 представляет собой идазанутлин.
В некоторых других вариантах осуществления дополнительный терапевтический агент представляет собой агонистическое антитело против CD40. В некоторых вариантах осуществления агонистическое антитело против CD40 представляет собой селикрелумаб (RG7876).
В некоторых других вариантах осуществления дополнительный терапевтический агент представляет собой биспецифическое антитело. В некоторых вариантах осуществления биспецифическое антитело представляет собой RG7828 (ВТСТ4465А), RG7802, RG7386 (FAP-DR5), RG6160, RG6026, ERY974 или анти-HER2/CD3.
В некоторых других вариантах осуществления дополнительный терапевтический агент представляет собой нацеленный иммуноцитокин. В некоторых вариантах осуществления нацеленный иммуноцитокин представляет собой RG7813 или RG7461.
В некоторых других вариантах осуществления дополнительный терапевтический агент представляет собой антитело, нацеленное на рецептор колониестимулирующего фактора 1 (CSF-1R). В некоторых вариантах осуществления антитело к CSF-1R представляет собой эмактузумаб.
В некоторых других вариантах осуществления дополнительный терапевтический агент представляет собой персонализированную противораковую вакцину. В некоторых вариантах осуществления персонализированная противораковая вакцина представляет собой RG6180.
В некоторых других вариантах осуществления дополнительный терапевтический агент представляет собой ингибитор белков BET (семейство бромодомена и экстратерминального домена) (BRD2/3/4/T). В некоторых вариантах осуществления ингибитор BET представляет собой RG6146.
В некоторых других вариантах осуществления дополнительный терапевтический агент представляет собой антитело, сконструированное для связывания с TIGIT. В некоторых вариантах осуществления анти-TIGIT антитело представляет собой RG6058 (MTIG7192A).
В некоторых других вариантах осуществления дополнительный терапевтический агент представляет собой селективный деструктор рецепторов эстрогена (SERD). В некоторых других вариантах осуществления SERD представляет собой RG6047 (GDC-0927) или RG6171 (GDC-9545).
В некоторых других вариантах осуществления дополнительный терапевтический агент представляет собой ингибитор МЕТ-киназы, такой как кризотиниб, тивантиниб, AMG337, кабозантиниб или форетиниб. В других вариантах осуществления дополнительный терапевтический агент представляет собой нейтрализующее моноклональное антитело к МЕТ, такое как онартузумаб.
В других вариантах осуществления дополнительный терапевтический агент представляет собой ингибитор семейства нерецепторных тирозинкиназ SRC. Например, в некоторых вариантах осуществления дополнительный терапевтический агент представляет собой ингибитор подсемейства семейства нерецепторных тирозинкиназ SRC. Типовые ингибиторы в этом направлении включают дазатиниб. Другие примеры в этом направлении включают понатиниб, саракатиниб и босутиниб.
В других вариантах осуществления дополнительный терапевтический агент представляет собой ингибитор митоген-активируемой протеинкиназы (МЕК). В некоторых из этих вариантов осуществления ингибитор митоген-активируемой протеинкиназы (МЕК) представляет собой траметиниб, селуметиниб, Котеллик® (кобиметиниб), PD0325901 или RO5126766. В других вариантах осуществления ингибитор МЕК представляет собой GSK-1120212, также известный как траметиниб.
В других вариантах осуществления дополнительный терапевтический агент представляет собой ингибитор киназы, регулируемой внеклеточными сигналами (ERK). В некоторых из этих вариантов осуществления ингибитор митоген-активируемой протеинкиназы (МЕК) представляет собой SCH722984 или GDC-0994.
В других вариантах осуществления ингибитор протеинкиназы представляет собой тазелисиб, ипатасертиб, GDC-0575, GDC-5573 (НМ95573), RG6114 (GDC-0077), CKI27, афатиниб, акситиниб, бевацизумаб, босутиниб, цетуксимаб, кризотиниб, дазатиниб, эрлотиниб, фостаматиниб, гефитиниб, иматиниб, лапатиниб, ленватиниб, ибрутиниб, нилотиниб, панитумумаб, пазопаниб, пегаптаниб, ранибизумаб, руксолитиниб, сорафениб, сунитиниб, SU6656, трастузумаб, тофацитиниб, вандетаниб или вемурафениб. В других вариантах осуществления дополнительный терапевтический агент представляет собой ингибитор топоизомеразы. В некоторых из этих вариантов осуществления ингибитор топоизомеразы представляет собой иринотекан. В других вариантах осуществления дополнительный терапевтический агент представляет собой таксан. Типовые таксаны включают таксол и доцетаксел.
Помимо вышеуказанных дополнительных терапевтических агентов с соединениями по изобретению можно применять другие химиотерапевтические средства, известные в настоящее время в данной области техники. В некоторых вариантах осуществления химиотерапевтическое средство выбрано из группы, состоящей из митотических ингибиторов, алкилирующих агентов, антиметаболитов, интеркалирующих антибиотиков, ингибиторов факторов роста, ингибиторов клеточного цикла, ферментов, ингибиторов топоизомеразы, модификаторов биологического ответа, антигормональных средств, ингибиторов ангиогенеза и антиандрогенов.
Неограничивающими примерами являются химиотерапевтические агенты, цитотоксические агенты и непептидные малые молекулы, такие как Гливек® (иматиниба мезилат), Велкейд® (бортезомиб), Касодекс (бикалутамид), Пресса® (гефитиниб) и адриамицин, а также множество других химиотерапевтических агентов. Неограничивающие примеры химиотерапевтических агентов включают алкилирующие агенты, такие как тиотепа и циклосфосфамид (Цитоксан™); алкилсульфонаты, такие как бусульфан, импросульфан и пипосульфан; азиридины, такие как бензодопа, карбоквон, метуредопа и уредопа; этиленимины и метилмеламины, включая альтретамин, триэтиленмеламин, триэтиленфосфорамид, триэтилентиофосфорамид и триметилолмеламин; азотистые иприты, такие как хлорамбуцил, хлорнафазин, циклофосфамид, эстрамустин, ифосфамид, мехлорэтамин, мехлорэтаминоксида гидрохлорид, мелфалан, новембихин, фенестерин, преднимустин, трофосфамид, урациловый иприт; нитрозомочевины, такие как кармустин, хлорозотоцин, фотемустин, ломустин, нимустин, ранимустин; антибиотики, такие как аклациномизины, актиномицин, аутрамицин, азасерин, блеомицины, кактиномицин, калихеамицин, карабицин, карминомицин, карцинофилин, Касодекс™, хромомицины, дактиномицин, даунорубицин, деторубицин, 6-диазо-5-оксо-L-норлейцин, доксорубицин, эпирубицин, эзорубицин, идарубицин, марцелломицин, митомицины, микофеноловую кислоту, ногаламицин, оливомицины, пепломицин, потфиромицин, пуромицин, квеламицин, родорубицин, стрептонигрин, стрептозоцин, туберцидин, убенимекс, циностатин, зорубицин; антиметаболиты, такие как метотрексат и 5-фторурацил (5-FU); аналоги фолиевой кислоты, такие как деноптерин, метотрексат, птероптерин, триметрексат; аналоги пурина, такие как флударабин, 6-меркаптопурин, тиамиприн, тиогуанин; аналоги пиримидина, такие как анцитабин, азацитидин, 6-азауридин, кармофур, цитарабин, дидезоксиуридин, доксифлуридин, эноцитабин, флоксуридин; андрогены, такие как калустерон, дромостанолона пропионат, эпитиостанол, мепитиостан, тестолактон; средства, угнетающие функции надпочечников, такие как аминоглутетимид, митотан, трилостан; пополнитель фолиевой кислоты, такой как фролиновая кислота; ацеглатон; гликозид альдофосфамида; аминолевулиновую кислоту; амсакрин; бестрабуцил; бисантрен; эдатраксат; дефофамин; демеколцин; диазиквон; эльфорнитин; эллиптиния ацетат; этоглюцид; нитрат галлия; гидроксимочевину; лентинан; лонидамин; митогуазон; митоксантрон; мопидамол; нитракрин; пентостатин; фенамет; пирарубицин; подофиллиновую кислоту; 2-этилгидразид; прокарбазин; полисахарид К; разоксан; сизофиран; спирогерманий; тенуазоновую кислоту; триазиквон; 2,2',2''-трихлортриэтиламин; уретан; виндезин; дакарбазин; манномустин; митобронитол; митолактол; пипоброман; гацитозин; арабинозид («Ara-С»); циклофосфамид; тиотепу; таксаны, например паклитаксел (Таксол™, Bristol-Myers Squibb Oncology, Princeton, N.J.) и доцетаксел (Таксотер™; Rhone-Poulenc Rorer, Antony, France); ретиноевую кислоту; эсперамицины; капецитабин; и фармацевтически приемлемые соли, кислоты или производные любого из вышеперечисленного. Также в качестве подходящих химиотерапевтических клеточных кондиционеров включены антигормональные агенты, действие которых состоит в регуляции или ингибировании действия гормонов на опухоли, такие как антиэстрогены, включая, например, тамоксифен (Нолвадекс™), ралоксифен, ингибирующие ароматазу 4(5)-имидазолы, 4-гидрокситамоксифен, триоксифен, кеоксифен, LY 117018, онапристон и торемифен (Фарестон); антиандрогены, такие как флутамид, нилутамид, бикалутамид, лейпролид и гозерелин; хлорамбуцил; гемцитабин; 6-тиогуанин; меркаптопурин; метотрексат; аналоги платины, такие как цисплатин и карбоплатин; винбластин; платину; этопозид (VP-16); ифосфамид; митомицин С; митоксантрон; винкристин; винорелбин; навелбин; новантрон; тенипозид; дауномицин; аминоптерин; Кселода®; ибандронат; камптотецин-11 (СРТ-11); ингибитор топоизомеразы RFS 2000; и дифторметилорнитин (DMFO). При необходимости, соединения или фармацевтические композиции по настоящему изобретению можно применять в комбинации с обычно прописываемыми противораковыми лекарственными препаратами, такими как Герцептин®, Авастин®, Газива®, Тецентрик®, Алеценза®, Перьета®, Венклекста™, Эрбитукс®, Ритуксан®, Таксол®, Аримидекс®, Таксотер®, ABVD, Авицин, абаговомаб, акридин карбоксамид, адекатумумаб, 17-N-аллиамино-17-деметоксигелданамицин, альфарадин, альвоцидиб, 3-аминопиридин-2-карбоксальдегид тиосемикарбазон, амонафид, антрацендион, анти-CD22 иммунотоксины, антинеопластические средства, антитуморогенные травы, апазиквон, атипримод, азатиоприн, белотекан, бендамустин, BIBW 2992, бирикодар, бросталлицин, бриостатин, бутионина сульфоксимин, CBV (химиотерапия), каликулин, неспецифические в отношении клеточного цикла антинеопластические агенты, дихлоруксусная кислота, дискодермолид, элсамитруцин, эноцитабин, эпотилон, эрибулин, эверолимус, экзатекан, эксисулинд, ферругинол, фородезин, фосфэстрол, химиотерапевтическая схема ICE, IT-101, имексон, имиквимод, индолокарбазол, ирофульвен, ланиквидар, ларотаксел, леналидомид, лукантон, луртотекан, мафосфамид, митозоломид, нафоксидин, недаплатин, олапариб, ортатаксел, РАС-1, папайя, пиксантрон, ингибитор протеасом, ребеккамицин, резиквимод, рубитекан, SN-38, салиноспорамид А, сапацитабин, стэнфорд V, свайнсонин, талапорфин, тариквидар, тегафур-урацил, темодар, тезетаксел, триплатина тетранитрат, трис(2-хлорэтил)амин, троксацитабин, урамустин, вадимезан, винфлунин, ZD6126 или зосуквидар.
Точный способ введения соединения и дополнительного терапевтического агента будет очевиден для специалиста в данной области техники. В некоторых типовых вариантах осуществления соединение и дополнительный терапевтический агент вводят совместно. В других вариантах осуществления соединение и дополнительный терапевтический агент вводят отдельно.
В некоторых вариантах осуществления соединение и дополнительный терапевтический агент вводят со вторым агентом одновременно или отдельно. Такие введение в комбинации может включать одновременное введение двух агентов в одной дозированной форме, одновременное введение в отдельных дозированных формах и отдельное введение. Это означает, что соединение и любой из дополнительных терапевтических агентов, описанных в данном документе, можно смешивать вместе в одной дозированной форме и вводить одновременно. В альтернативном варианте соединение и любой из дополнительных терапевтических агентов, описанных в данном документе, можно вводить одновременно, при этом оба агента находятся в отдельных составах. В другом альтернативном варианте можно вводить соединение, а сразу после него - любой из дополнительных терапевтических агентов, описанных в данном документе, или наоборот.В некоторых вариантах осуществления отдельного протокола введения соединение и любой из дополнительных терапевтических агентов, описанных в данном документе, вводят с интервалом в несколько минут, или несколько часов, или несколько суток.
ГОТОВЫЕ ИЗДЕЛИЯ
В другом варианте осуществления предложены готовое изделие или «набор», содержащие материалы, применяемые для лечения заболеваний и нарушений, описанных выше. В одном варианте осуществления набор содержит контейнер, содержащий соединение по настоящему изобретению или его фармацевтически приемлемую соль. Набор может дополнительно содержать этикетку или вкладыш в упаковку, находящиеся на нем или связанные с ним. Термин «вкладыш в упаковку» используется для обозначения инструкций, обычно включаемых в коммерческие упаковки терапевтических продуктов, которые содержат информацию о показаниях, применении, дозировке, введении, противопоказаниях и/или предупреждениях относительно применения таких терапевтических продуктов. Подходящие контейнеры включают, например, бутылки, флаконы, шприцы, блистерные упаковки и т.д. Контейнер может быть изготовлен из ряда материалов, таких как стекло или пластик. Контейнер может содержать соединение по настоящему изобретению или его фармацевтически приемлемую соль, или его состав, которые эффективны для лечения патологического состояния, и может иметь стерильное входное отверстие (например, контейнер может представлять собой пакет с раствором для внутривенного введения или флакон, имеющий пробку, прокалываемую гиподермической иглой для инъекций). По меньшей мере один активный ингредиент в композиции представляет собой соединение по настоящему изобретению или его фармацевтически приемлемую соль. В альтернативном или дополнительном варианте готовое изделие может дополнительно содержать второй контейнер, содержащий фармацевтический разбавитель, такой как бактериостатическая вода для инъекций (БВДИ), фосфатно-солевой буферный раствор, раствор Рингера или раствор декстрозы. Оно также может содержать другие материалы, необходимые с коммерческой и пользовательской точки зрения, включая другие буферы, разбавители, фильтры, иглы и шприцы.
В другом варианте осуществления наборы подходят для доставки твердых пероральных форм соединения по настоящему изобретению или его фармацевтически приемлемой соли, таких как таблетки или капсулы. Такой набор может содержать некоторое число единичных дозировок. Примером такого набора является «блистерная упаковка». Блистерные упаковки хорошо известны в упаковочной промышленности и широко применимы для упаковки фармацевтических единичных дозированных форм.
ДОПОЛНИТЕЛЬНЫЕ ВАРИАНТЫ ОСУЩЕСТВЛЕНИЯ
Дополнительные варианты осуществления приведены ниже.
Вариант осуществления 1: Соединение, имеющее формулу (I):
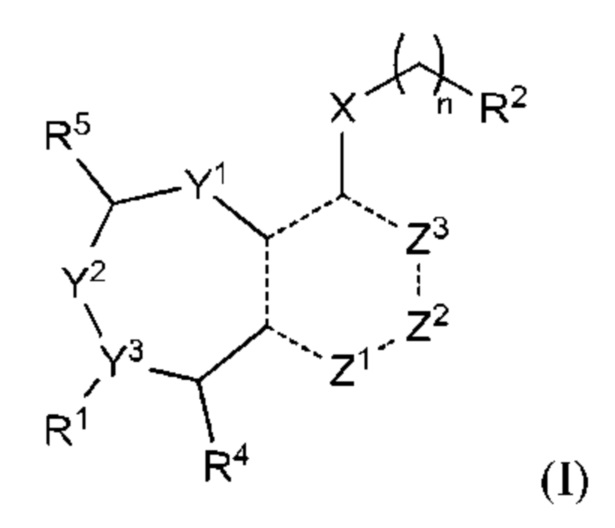
или его фармацевтически приемлемая соль; где
R1 выбран из группы, состоящей из Н, С6-10 арила, 5-10-членного гетероарила и 5-10-членного гетероциклила, где каждый арил, гетероарил и гетероциклил необязательно замещен одним - четырьмя заместителями, где каждый заместитель независимо выбран из группы, состоящей из C1-6 алкила, -NH2, -NH(CH3), -N(CH3)2, галогена, C1-6 галогеналкила, оксо, C1-6 гидроксиалкила, С3-6 циклоалкила, -ОС(=O)СН=СН2 и гидрокси;
R2 представляет собой электрофильный фрагмент, способный образовывать ковалентную связь с остатком цистеина в позиции 12 мутантного белка K-Ras G12C;
Y1 представляет собой C(H)(R6) или Y1 отсутствует;
Y2 выбран из группы, состоящей из N(R7) и C(H)(R8);
Y3 выбран из группы, состоящей из C(R3) и N;
Z1 выбран из группы, состоящей из N, N(R9), О, S, S(O) и S(O)2;
Z2 представляет собой C(R10), C(-L-R10a) или Z2 отсутствует;
Z3 выбран из группы, состоящей из N, N(R11) и C(R12);
каждый из R3, R4, R5, R6, R7, R8, R9, R10, R11 и R12 независимо выбран из группы, состоящей из Н, С2-6 алкенила, С1-6 алкокси, C1-6 алкила, С1-6 алкила, замещенного 4-10-членным гетероциклильным заместителем, С1-6 алкилсульфанила, С1-6 алкилсульфонила, С1-6 алкилтио, С2-6 алкинила, С1-6 алкиламино, амино, арила, арила, замещенного С1-6 алкилом, С1-6 аминоалкила, карбамоила, С1-6 карбамоилалкила, С1-6 карбоксиалкила, циано, С1-6 цианоалкила, С3-7 циклоалкила, галогена, С1-6 галогеналкокси, С1-6 галогеналкила, 5-10-членного гетероарила, 4-10-членного гетероциклила, гидрокси и оксо;
или R1 и R2 вместе с атомом углерода, с которым они связаны, могут образовывать необязательно замещенный 3-6-членный циклоалкил;
или R3 и R4, R3 и R8, R5 и R6 или R5 и R8, вместе с атомами, с которыми связан каждый из них, могут образовывать 3-6-членный циклоалкил или 3-6-членный гетероциклил;
L представляет собой связь, О, S или N(La);
R10a выбран из группы, состоящей из водорода, алкила, гидроксиалкила, дигидроксиалкила, алкиламинилалкила, диалкиламинилалкила, -Lb-NLaLc, гетероциклила, гетероциклил алкила, арила, гетероарила или гетероарилалкила, где каждый из Lb, гетероциклила, гетероциклилалкила, арила, гетероарила и гетероарилалкила может быть необязательно замещен одним или более Ld;
каждый La независимо представляет собой водород или С1-3 алкил;
Lb представляет собой С1-4алкилен;
каждый Lc независимо представляет собой водород, ацил, С1-3 алкил, гетероалкил или гидроксиалкил;
каждый Ld независимо представляет собой водород, оксо, ацил, гидрокси, гидроксиалкил, циано, галоген, С1-6 алкил, аралкил, галогеналкил, гетероалкил, циклоалкил, гетероциклилалкил, алкокси, диалкиламинил, диалкиламидоалкил или диалкиламинилалкил, где С1-6 алкил может быть необязательно замещен циклоалкилом;
X выбран из группы, состоящей из С1-6 алкокси, С1-6 алкила, амино, С1-6 алкиламино, С1-6 алкилсульфанила, С1-6 алкилсульфонила, С1-6 алкилтио, С3-7 циклоалкила, 4-7-членного гетероциклила и 4-7-членного гетероциклиламино; каждый из которых необязательно замещен 1-4 заместителями, где каждый заместитель независимо выбран из группы, состоящей из С1-6 алкила, амино, С1-6 аминоалкила, карбамоила, С1-6 карбамоилалкила, карбокси, С1-6 карбоксиалкила, циано, С1-6 цианоалкила, галогена, С1-6 галогеналкила, гидрокси, С1-6 гидроксиалкила и 4-7-членного гетероциклила; где два геминальных заместителя могут быть взяты вместе с образованием С3-7 спироциклоалкила или 4-7-членного спирогетероциклила;
n выбрано из 0, 1 и 2; и
 представляет одинарную связь или двойную связь. Вариант осуществления 2: Соединение по варианту осуществления 1, имеющее формулу (II):
представляет одинарную связь или двойную связь. Вариант осуществления 2: Соединение по варианту осуществления 1, имеющее формулу (II):
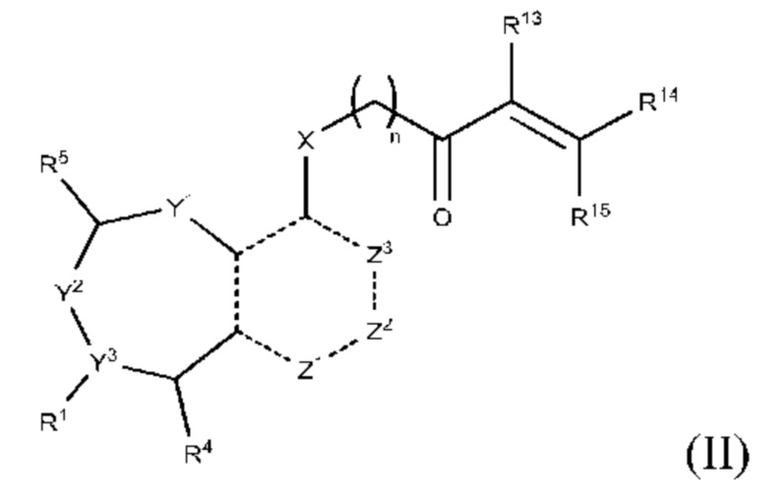
или его фармацевтически приемлемая соль; где
R1 выбран из группы, состоящей из Н, С6-10 ар ила, 5-10-членного гетероарила и 5-10-членного гетероциклила, где каждый арил, гетероарил и гетероциклил необязательно замещен одним - четырьмя заместителями, где каждый заместитель независимо выбран из группы, состоящей из С1-6 алкила, -NH2, -NH(CH3), -N(CH3)2, галогена, С1-6 галогеналкила, оксо, С1-6 гидроксиалкила, С3-6 циклоалкила, -ОС(=O)СН=СН2 и гидрокси;
Y1 представляет собой C(H)(R6) или Y1 отсутствует;
Y2 выбран из группы, состоящей из N(R7) и C(H)(R8);
Y3 выбран из группы, состоящей из C(R3) и N;
Z1 выбран из группы, состоящей из N, N(R9), О, S, S(O) и S(O)2;
Z2 представляет собой C(R10), C(-L-R10a) или Z2 отсутствует;
Z3 выбран из группы, состоящей из N, N(R11) и C(R12);
каждый из R3, R4, R5, R6, R7, R8, R9, R10, R11 и R12 независимо выбран из группы, состоящей из Н, С2-6 алкенила, С1-6 алкокси, С1-6 алкила, С1-6 алкила, замещенного 4-10-членным гетероциклильным заместителем, С1-6 алкилсульфанила, С1-6 алкилсульфонила, С1-6 алкилтио, С2-6 алкинила, С1-6 алкиламино, амино, арила, арила, замещенного С1-6 алкилом, С1-6 аминоалкила, карбамоила, С1-6 карбамоилалкила, С1-6 карбоксиалкила, циано, С1-6 цианоалкила, С3-7 циклоалкила, галогена, С1-6 галогеналкокси, С1-6 галогеналкила, 5-10-членного гетероарила, 4-10-членного гетероциклила, гидрокси и оксо;
или R1 и R3 вместе с атомом углерода, с которым они связаны, могут образовывать необязательно замещенный 3-6-членный циклоалкил;
или R3 и R4, R3 и R8, R5 и R6 или R5 и R8, вместе с атомами, с которыми связан каждый из них, могут образовывать 3-6-членный циклоалкил или 3-6-членный гетероциклил;
R13 выбран из группы, состоящей из Н, циано и галогена; и каждый из R14 и R15 независимо выбран из группы, состоящей из Н, С1-6 алкила, С1-6 галогеналкила, циано и галогена; где С1-6 алкил необязательно замещен одним заместителем, выбранным из группы, состоящей из: метансульфонила (мезила), пара-толуолсульфонила (тозила), алкил- или арилсульфонатной уходящей группы, С1-6 алканоиламино, С1-6 алкокси, С1-6 алкиламино, С3-6 циклоалкиламино, С1-6 алкилсульфониламино, С6-12 диалкиламино и С1-6 галогеналкокси;
или R13 и R14 вместе образуют тройную связь между атомами углерода, к которым они присоединены, или R13 и R14 вместе с атомами углерода, с которыми связан каждый из них, образуют С3-7 циклоалкенил, необязательно замещенный одним или двумя заместителями-галогенами; и R15 выбран из группы, состоящей из Н, С1-6 алкила С1-6 галогеналкила, циано и галогена; где С1-6 алкил необязательно замещен одним заместителем, выбранным из группы, состоящей из: С1-6 алканоиламино, С1-6 алкокси, С1-6 алкиламино, С1-6 алкилсульфониламино, С6-12 диалкиламино и С1-6 галогеналкокси;
L представляет собой связь, О, S или N(La);
R10a выбран из группы, состоящей из водорода, алкила, гидроксиалкила, дигидроксиалкила, алкиламинилалкила, диалкиламинилалкила, -Lb-NLaLc, гетероциклила, гетероциклил алкила, арила, гетероарила или гетероарилалкила, где каждый из Lb, гетероциклила, гетероциклилалкила, арила, гетероарила и гетероарилалкила может быть необязательно замещен одним или более Ld;
каждый La независимо представляет собой водород или С1-3 алкил;
Lb представляет собой С1-4алкилен;
каждый Lc независимо представляет собой водород, ацил, С1-3 алкил, гетероалкил или гидроксиалкил;
каждый Ld независимо представляет собой водород, оксо, ацил, гидрокси, гидроксиалкил, циано, галоген, С1-6 алкил, аралкил, галогеналкил, гетероалкил, циклоалкил, гетероциклилалкил, алкокси, диалкиламинил, диалкиламидоалкил или диалкиламинилалкил, где С1-6 алкил может быть необязательно замещен циклоалкилом;
X выбран из группы, состоящей из С1-6 алкокси, С1-6 алкила, амино, С1-6 алкиламино, С1-6 алкилсульфанила, С1-6 алкилсульфонила, С1-6 алкилтио, С3-7 циклоалкила, 4-7-членного гетероциклила и 4-7-членного гетероциклиламино; каждый из которых необязательно замещен 1-4 заместителями, где каждый заместитель независимо выбран из группы, состоящей из С1-6 алкила, амино, С1-6 аминоалкила, карбамоила, С1-6 карбамоилалкила, карбокси, С1-6 карбоксиалкила, циано, С1-6 цианоалкила, галогена, С1-6 галогеналкила, гидрокси, С1-6 гидроксиалкила и 4-7-членного гетероциклила; где два геминальных заместителя могут быть взяты вместе с образованием С3-7 спироциклоалкила или 4-7-членного спирогетероциклила;
n выбрано из 0, 1 и 2; и
 представляет одинарную связь или двойную связь.
представляет одинарную связь или двойную связь.
Вариант осуществления 3: Соединение по варианту осуществления 1, имеющее формулу (III):
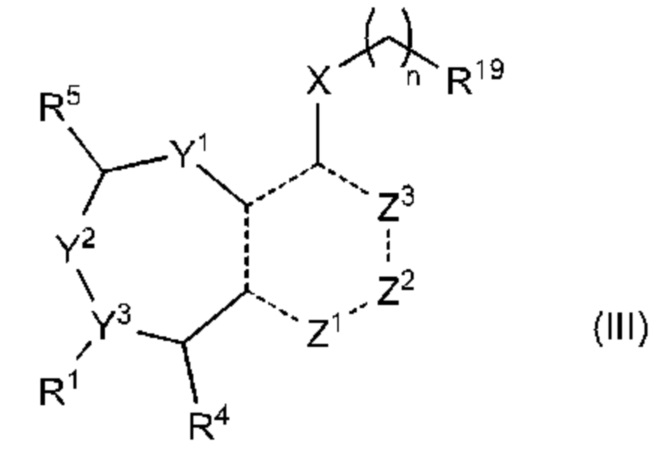
или его фармацевтически приемлемая соль; где
R1 выбран из группы, состоящей из Н, С6-10 арила, 5-10-членного гетероарила и 5-10-членного гетероциклила, где каждый арил, гетероарил и гетероциклил необязательно замещен одним - четырьмя заместителями, где каждый заместитель независимо выбран из группы, состоящей из С1-6 алкила, -NH2, -NH(СН3), -N(СН3)2, галогена, С1-6 галогеналкила, оксо, С1-6 гидроксиалкила, С3-6 циклоалкила, -ОС(=O)СН=СН2 и гидрокси;
Y1 представляет собой C(H)(R6) или Y1 отсутствует;
Y2 выбран из группы, состоящей из N(R7) и C(H)(R8);
Y3 выбран из группы, состоящей из C(R3) и N;
Z1 выбран из группы, состоящей из N, N(R9), О, S, S(O) и S(O)2;
Z2 представляет собой C(R10), C(-L-R10a) или Z2 отсутствует;
Z3 выбран из группы, состоящей из N, N(R11) и C(R12);
каждый из R3, R4, R5, R6, R7, R8, R9, R10, R11 и R12 независимо выбран из группы, состоящей из Н, С2-6 алкенила, С1-6 алкокси, С1-6 алкила, С1-6 алкила, замещенного 4-10-членным гетероциклильным заместителем, С1-6 алкилсульфанила, С1-6 алкилсульфонила, С1-6 алкилтио, С2-6 алкинила, С1-6 алкиламино, амино, арила, арила, замещенного С1-6 алкилом, С1-6 аминоалкила, карбамоила, С1-6 карбамоилалкила, С1-6 карбоксиалкила, циано, С1-6 цианоалкила, С3-7 циклоалкила, галогена, С1-6 галогеналкокси, С1-6 галогеналкила, 5-10-членного гетероарила, 4-10-членного гетероциклила, гидрокси и оксо;
или R1 и R3 вместе с атомом углерода, с которым они связаны, могут образовывать необязательно замещенный 3-6-членный циклоалкил;
или R3 и R4, R3 и R8, R5 и R6 или R5 и R8, вместе с атомами, с которыми связан каждый из них, могут образовывать 3-6-членный циклоалкил или 3-6-членный гетероциклил;
R19 выбран из группы, состоящей из оксиранила, азиридинила и циклопропила, где циклопропил необязательно замещен по меньшей мере одним галогеном;
L представляет собой связь, О, S или N(La);
R10a выбран из группы, состоящей из водорода, алкила, гидроксиалкила, дигидроксиалкила, алкиламинилалкила, диалкиламинилалкила, -Lb-NLaLc, гетероциклила, гетероциклил алкила, арила, гетероарила или гетероарилалкила, где каждый из Lb, гетероциклила, гетероциклилалкила, арила, гетероарила и гетероарилалкила может быть необязательно замещен одним или более Ld;
каждый La независимо представляет собой водород или С1-3 алкил;
Lb представляет собой С1-4алкилен;
каждый Lc независимо представляет собой водород, ацил, С1-3 алкил, гетероалкил или гидроксиалкил;
каждый Ld независимо представляет собой водород, оксо, ацил, гидрокси, гидроксиалкил, циано, галоген, С1-6 алкил, аралкил, галогеналкил, гетероалкил, циклоалкил, гетероциклилалкил, алкокси, диалкиламинил, диалкиламидоалкил или диалкиламинилалкил, где С1-6 алкил может быть необязательно замещен циклоалкилом;
X выбран из группы, состоящей из С1-6 алкокси, С1-6 алкила, амино, С1-6 алкиламино, С1-6 алкилсульфанила, С1-6 алкилсульфонила, С1-6 алкилтио, С3-7 циклоалкила, 4-7-членного гетероциклила и 4-7-членного гетероциклиламино; каждый из которых необязательно замещен 1-4 заместителями, где каждый заместитель независимо выбран из группы, состоящей из С1-6 алкила, амино, С1-6 аминоалкила, карбамоила, С1-6 карбамоилалкила, карбокси, С1-6 карбоксиалкила, циано, С1-6 цианоалкила, галогена, С1-6 галогеналкила, гидрокси, С1-6 гидроксиалкила и 4-7-членного гетероциклила; где два геминальных заместителя могут быть взяты вместе с образованием С3-7 спироциклоалкила или 4-7-членного спирогетероциклила;
n выбрано из 0, 1 и 2; и
 представляет одинарную связь или двойную связь. Вариант осуществления 4: Соединение по любому одному из вариантов осуществления 1-3 или его фармацевтически приемлемая соль, где R1 представляет собой С6-10 арил, необязательно замещенный одним - четырьмя заместителями, где каждый заместитель независимо выбран из группы, состоящей из С1-6 алкила, -NH2, галогена, С1-6 галогеналкила, оксо, С1-6 гидроксиалкила, -ОС(=O)СН=СН2 и гидрокси.
представляет одинарную связь или двойную связь. Вариант осуществления 4: Соединение по любому одному из вариантов осуществления 1-3 или его фармацевтически приемлемая соль, где R1 представляет собой С6-10 арил, необязательно замещенный одним - четырьмя заместителями, где каждый заместитель независимо выбран из группы, состоящей из С1-6 алкила, -NH2, галогена, С1-6 галогеналкила, оксо, С1-6 гидроксиалкила, -ОС(=O)СН=СН2 и гидрокси.
Вариант осуществления 5: Соединение по варианту осуществления 4 или его фармацевтически приемлемая соль, где R1 выбран из группы, состоящей из
 и
и 
где каждый R20 независимо выбран из группы, состоящей из С1-6 алкила, -NH2, -NH(СН3), -N(СН3)2, галогена, С1-6 галогеналкила, С1-6 гидроксиалкила, -ОС(=O)СН=СН2 и гидрокси, и р равно 0, 1, 2, 3 или 4.
Вариант осуществления 6: Соединение по варианту осуществления 5 или его фармацевтически приемлемая соль, где R1 выбран из группы, состоящей из
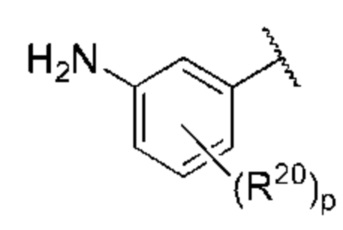 и
и  ,
,
где каждый R20 независимо выбран из группы, состоящей из С1-6 алкила, -NH2, -NH(CH3), -N(CH3)2, галогена, С1-6 галогеналкила, С1-6 гидроксиалкила, -ОС(=O)СН=СН2 и гидрокси, и р равно 0, 1, 2, 3 или 4.
Вариант осуществления 7: Соединение по варианту осуществления 5 или его фармацевтически приемлемая соль, где R1 выбран из группы, состоящей из 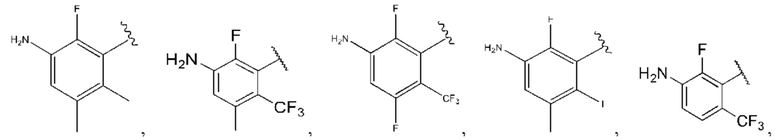
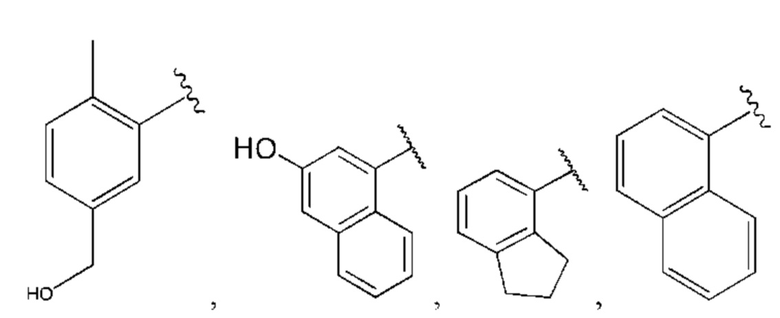 и
и 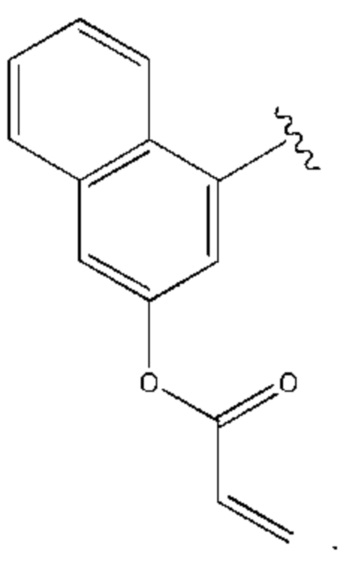
Вариант осуществления 8: Соединение по варианту осуществления 7 или его фармацевтически приемлемая соль, где R1 выбран из группы, состоящей из  и
и 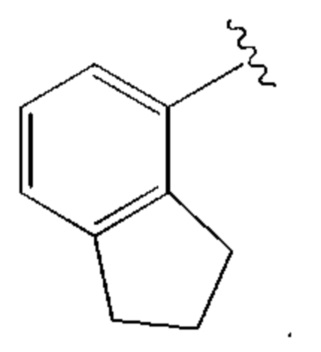
Вариант осуществления 9: Соединение по варианту осуществления 8 или его фармацевтически приемлемая соль, где R1 представляет собой: 
Вариант осуществления 10: Соединение по любому одному из вариантов осуществления 1-3 или его фармацевтически приемлемая соль, где R1 представляет собой 5-10-членный гетероарил, необязательно замещенный одним - четырьмя заместителями, где каждый заместитель независимо выбран из группы, состоящей из С1-6 алкила, -NH2, -NH(СН3), -N(СН3)2, С1-6 галогеналкила, С3-6 циклоалкила и галогена.
Вариант осуществления 11: Соединение по варианту осуществления 10 или его фармацевтически приемлемая соль, где R1 выбран из группы, состоящей из
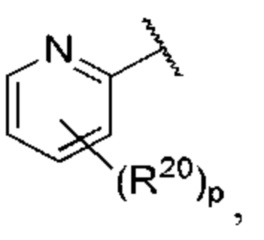
 и
и 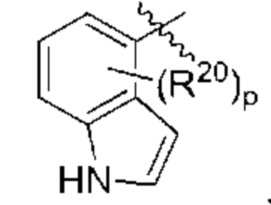 ,
,
где каждый R20 независимо выбран из группы, состоящей из С1-6 алкила, -NH2, -NH(СН3), -N(CH3)2, галогена, С1-6 галогеналкила и С3-6 циклоалкила, а каждое р независимо равно 0, 1, 2, 3 или 4.
Вариант осуществления 12: Соединение по варианту осуществления 11 или его фармацевтически приемлемая соль, где R1 выбран из группы, состоящей из
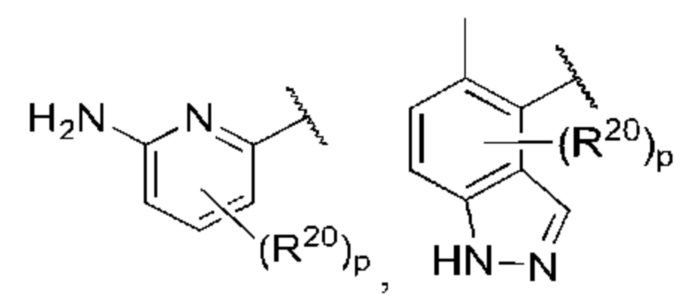 и
и 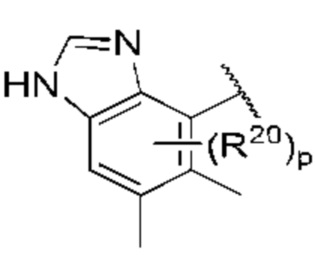 ,
,
где каждый R20 независимо выбран из группы, состоящей из С1-6 алкила, -NH2, -NH(СН3), -N(СН3)2, галогена, С1-6 галогеналкила и С3-6 циклоалкила, а каждое р независимо равно 0, 1, 2, 3 или 4.
Вариант осуществления 13: Соединение по варианту осуществления 11 или его фармацевтически приемлемая соль, где R1 выбран из группы, состоящей из:

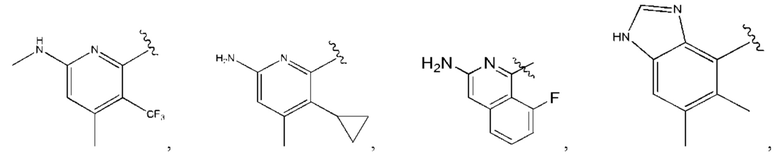
 и
и 
Вариант осуществления 14: Соединение по варианту осуществления 13 или его фармацевтически приемлемая соль, где R1 выбран из группы, состоящей из:

Вариант осуществления 15: Соединение по любому одному из вариантов осуществления 1-3 или его фармацевтически приемлемая соль, где R1 представляет собой водород.
Вариант осуществления 16: Соединение по любому одному из вариантов осуществления 1-3 или его фармацевтически приемлемая соль, где R1 представляет собой 5-10-членный гетероциклил, необязательно замещенный одним - четырьмя заместителями, где каждый заместитель независимо выбран из группы, состоящей из С1-6 алкила и оксо.
Вариант осуществления 17: Соединение по варианту осуществления 16 или его фармацевтически приемлемая соль, где R1 выбран из группы, состоящей из:
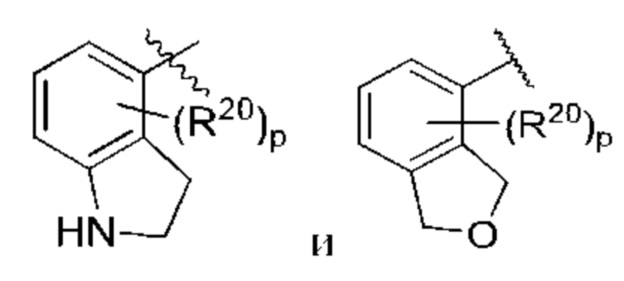 ,
,
где каждый R20 независимо представляет собой С1-6 алкил; и каждое р независимо равно 0, 1, 2, 3 или 4.
Вариант осуществления 18: Соединение по варианту осуществления 17 или его фармацевтически приемлемая соль, где R1 имеет следующую структуру:

Вариант осуществления 19: Соединение по любому одному из вариантов осуществления 1-3 или его фармацевтически приемлемая соль, где R1 и R3 вместе с атомом углерода, с которым они связаны, могут образовывать необязательно замещенный 3-6-членный циклоалкил.
Вариант осуществления 20: Соединение по любому одному из вариантов осуществления 1-3 или его фармацевтически приемлемая соль, где Z1 представляет собой N; Z2 представляет собой C(R10) или C(-L-R10a); и Z3 представляет собой N.
Вариант осуществления 21: Соединение по варианту осуществления 20 или его фармацевтически приемлемая соль, где Z2 представляет собой C(R10), a R10 представляет собой Н.
Вариант осуществления 22: Соединение по варианту осуществления 20 или его фармацевтически приемлемая соль, где Z2 представляет собой C(-L-R10a).
Вариант осуществления 23: Соединение по варианту осуществления 22 или его фармацевтически приемлемая соль, где L представляет собой О.
Вариант осуществления 24: Соединение по варианту осуществления 22 или варианту осуществления 23 или его фармацевтически приемлемая соль, где R10a выбран из группы, состоящей из гетероциклилалкила и гетероарилалкила, где каждый гетероциклилалкил и гетероарилалкил необязательно замещены одним или более Ld.
Вариант осуществления 24: Соединение по варианту осуществления 24 или его фармацевтически приемлемая соль, где каждый Ld независимо выбран из группы, состоящей из водорода, оксо, галогена и С1-6 алкила.
Вариант осуществления 25: Соединение по варианту осуществления 22 или его фармацевтически приемлемая соль, где -L-R10a выбран из группы, состоящей из


 и
и 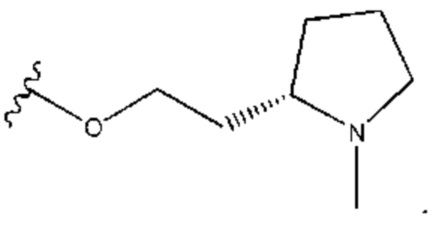
Вариант осуществления 27: Соединение по любому одному из вариантов осуществления 1-3 или его фармацевтически приемлемая соль, где Z1 представляет собой N(R9); Z2 представляет собой C(R10); и Z3 представляет собой N.
Вариант осуществления 28: Соединение по варианту осуществления 27 или его фармацевтически приемлемая соль, где R9 представляет собой арил, замещенный С1-6 алкилом.
Вариант осуществления 29: Соединение по варианту осуществления 28 или его фармацевтически приемлемая соль, где R9 представляет собой фенил, замещенный изопропилом.
Вариант осуществления 30: Соединение по варианту осуществления 29 или его фармацевтически приемлемая соль, где R9 представляет собой 
Вариант осуществления 31: Соединение по любому одному из вариантов осуществления 27-30, где R10 представляет собой оксо.
Вариант осуществления 32: Соединение по любому одному из вариантов осуществления 1-3 или его фармацевтически приемлемая соль, где Y1 отсутствует; Y2 представляет собой C(H)(R8); и Y3 представляет собой C(R3).
Вариант осуществления 33: Соединение по варианту осуществления 32 или его фармацевтически приемлемая соль, где R8 выбран из группы, состоящей из Н и C1-С6 алкила.
Вариант осуществления 34: Соединение по варианту осуществления 33 или его фармацевтически приемлемая соль, где R8 выбран из группы, состоящей из Н, метила, этила и изопропила.
Вариант осуществления 35: Соединение по любому одному из вариантов осуществления 1-3 или его фармацевтически приемлемая соль, где Y1 отсутствует; Y2 представляет собой C(H)(R8); и Y3 представляет собой N.
Вариант осуществления 36: Соединение по варианту осуществления 35 или его фармацевтически приемлемая соль, где R8 представляет собой Н.
Вариант осуществления 37: Соединение по любому одному из вариантов осуществления 1-3 или его фармацевтически приемлемая соль, где R3, R4, R5, R6, R7, R8, R9, R10, R11 и R12, каждый, независимо выбраны из группы, состоящей из Н, галогена, С3-7 циклоалкила, С1-6 алкила, арила, замещенного С1-6 алкилом, и оксо.
Вариант осуществления 38: Соединение по варианту осуществления 37 или его фармацевтически приемлемая соль, где R3, R4, R5, R6, R7, R8, R9, R10, R11 и R12, каждый, независимо выбраны из группы, состоящей из Н, С1-6 алкила, арила, замещенного С3 алкилом, и оксо.
Вариант осуществления 39: Соединение по варианту осуществления 37 или его фармацевтически приемлемая соль, где R3, R4, R5, R6, R7, R8, R9, R10, R11 и R12, каждый, независимо выбраны из группы, состоящей из Н, метила, этила, изопропила, фенила, замещенного изопропилом, и оксо.
Вариант осуществления 40: Соединение по любому одному из вариантов осуществления 1-3 или его фармацевтически приемлемая соль, где X представляет собой 4-7-членный гетероциклил, который необязательно замещен 1-4 заместителями, где каждый заместитель независимо выбран из группы, состоящей из С1-6 алкила, циано, С1-6 цианоалкила и С1-6 гидроксиалкила; где два геминальных заместителя могут быть взяты вместе с образованием 4-7-членного спирогетероциклила.
Вариант осуществления 41: Соединение по варианту осуществления 40 или его фармацевтически приемлемая соль, где X выбран из группы, состоящей из:


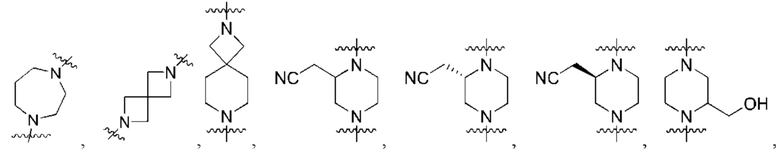
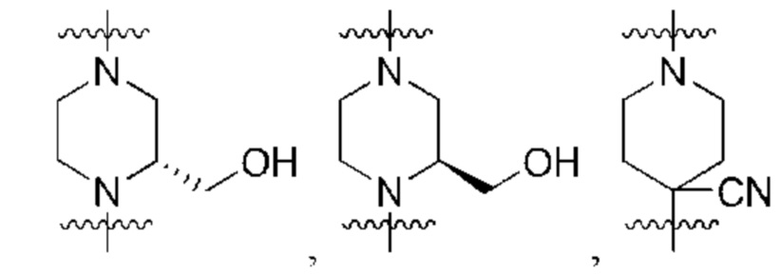 и
и
Вариант осуществления 42: Соединение по варианту осуществления 41 или его фармацевтически приемлемая соль, где X представляет собой 
Вариант осуществления 43: Соединение по любому одному из вариантов осуществления 1-3 или его фармацевтически приемлемая соль, где n равно 0.
Вариант осуществления 44: Соединение по варианту осуществления 1 или его фармацевтически приемлемая соль, где R2 выбран из группы, состоящей из:

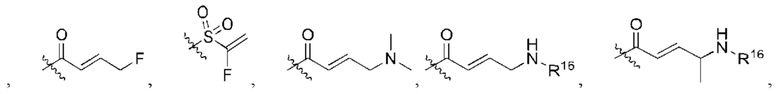

 и
и  где
где
R16 выбран из группы, состоящей из С1-6 алканоила, С1-6 алкила, С1-6 алкилсульфонила и С3-6 циклоалкила;
R17 выбран из группы, состоящей из С1-6 алкила и С1-6 галогеналкила; и
R18 представляет собой галоген.
Вариант осуществления 45: Соединение по варианту осуществления 1 или его фармацевтически приемлемая соль, где R2 выбран из группы, состоящей из:
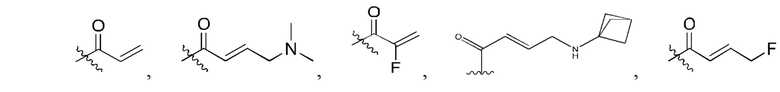 и
и 
Вариант осуществления 46: Соединение по варианту осуществления 1 или его фармацевтически приемлемая соль, где R2 представляет собой 
Вариант осуществления 47: Соединение по варианту осуществления 2 или его фармацевтически приемлемая соль, где R13 выбран из группы, состоящей из Н, циано и галогена; и каждый из R14 и R15 независимо выбран из группы, состоящей из Н, С1-6 алкила, С1-6 галогеналкила, циано и галогена; где С1-6 алкил необязательно замещен одним заместителем, выбранным из группы, состоящей из: метансульфонила (мезила), пара-толуолсульфонила (тозила), алкил- или арилсульфонатной уходящей группы, С1-6 алканоиламино, С1-6 алкокси, С1-6 алкиламино, С1-6 алкилсульфониламино, С6-12 диалкиламино, С3-6 циклоалкиламино и С1-6 галогеналкокси.
Вариант осуществления 48: Соединение по варианту осуществления 2 или его фармацевтически приемлемая соль, где R13 и R14 вместе образуют тройную связь между атомами углерода, к которым они присоединены, или R13 и R14 вместе с атомами углерода, с которыми связан каждый из них, образуют С3-7 циклоалкенил, необязательно замещенный одним или двумя заместителями-галогенами; и R15 выбран из группы, состоящей из Н, С1-6 алкила С1-6 галогеналкила, циано и галогена; где С1-6 алкил необязательно замещен одним заместителем, выбранным из группы, состоящей из: С1-6 алканоиламино, С1-6 алкокси, С1-6 алкиламино, С1-6 алкилсульфониламино, С6-12 диалкиламино и С1-6 галогеналкокси.
Вариант осуществления 49: Соединение по варианту осуществления 2 или его фармацевтически приемлемая соль, где R13, R14 и R15, каждый, представляют собой Н.
Вариант осуществления 50: Соединение по варианту осуществления 2 или его фармацевтически приемлемая соль, где R13 представляет собой F, a R14 и R15, каждый, представляют собой Н.
Вариант осуществления 51: Соединение по варианту осуществления 2 или его фармацевтически приемлемая соль, где R13 представляет собой Н; один из R14 и R15 представляет собой Н; а другой из R14 и R15 выбран из группы, состоящей из С1-6 алкила и С1-6 галогеналкила, где С1-6 алкил необязательно замещен одним заместителем, выбранным из группы, состоящей из: С1-6 алкиламино и С3-6 циклоалкиламино.
Вариант осуществления 52: Соединение по любому одному из вариантов осуществления 1-3 или его фармацевтически приемлемая соль, где Z1 представляет собой N; Z2 представляет собой C(R10) или C(-L-R10a); Z3 представляет собой N; Y1 отсутствует; Y2 представляет собой C(H)(R8); Y3 представляет собой C(R3); X представляет собой необязательно замещенный 4-7-членный гетероциклил; а n равно 0.
Вариант осуществления 53: Соединение по варианту осуществления 52 или его фармацевтически приемлемая соль, где R3, R4, R5, R8 и R10 независимо выбраны из группы, состоящей из водорода, галогена, С3-7 циклоалкила и С1-6 алкила.
Вариант осуществления 54: Соединение по любому одному из вариантов осуществления 1-3 или его фармацевтически приемлемая соль, где Z1 представляет собой N(R9); Z2 представляет собой C(R10); Z3 представляет собой N; Y1 отсутствует; Y2 представляет собой C(H)(R8); Y3 представляет собой C(R3); X представляет собой 4-7-членный гетероциклил; а n равно 0.
Вариант осуществления 55: Соединение по варианту осуществления 54 или его фармацевтически приемлемая соль, где R3, R4, R5, R8, R9 и R10 независимо выбраны из группы, состоящей из водорода, галогена, С3-7 циклоалкила, С1-6 алкила, арила, замещенного С1-6 алкилом, и оксо.
Вариант осуществления 56: Соединение по любому одному из вариантов осуществления 1-3 или его фармацевтически приемлемая соль, где Z1 представляет собой N(R9); Z2 представляет собой C(R10); Z3 представляет собой N; Y1 отсутствует; Y2 представляет собой C(H)(R8); Y3 представляет собой N; X представляет собой 4-7-членный гетероциклил; а n равно 0.
Вариант осуществления 57: Соединение по варианту осуществления 56 или его фармацевтически приемлемая соль, где R4, R5, R8, R9 и R10 независимо выбраны из группы, состоящей из водорода, галогена, С3-7 циклоалкила, С1-6 алкила, арила, замещенного С1-6 алкилом, и оксо.
Вариант осуществления 58: Соединение по варианту осуществления 1 или варианту осуществления 2 или его фармацевтически приемлемая соль, имеющее формулу (IIa):

или его фармацевтически приемлемая соль.
Вариант осуществления 59: Соединение по варианту осуществления 58 или его фармацевтически приемлемая соль, где R8 выбран из группы, состоящей из Н и С1-6 алкила.
Вариант осуществления 60: Соединение по варианту осуществления 59 или его фармацевтически приемлемая соль, где R8 выбран из группы, состоящей из Н, метила и изопропила.
Вариант осуществления 61: Соединение по варианту осуществления 58 или его фармацевтически приемлемая соль, имеющее формулу, выбранную из группы, состоящей из:

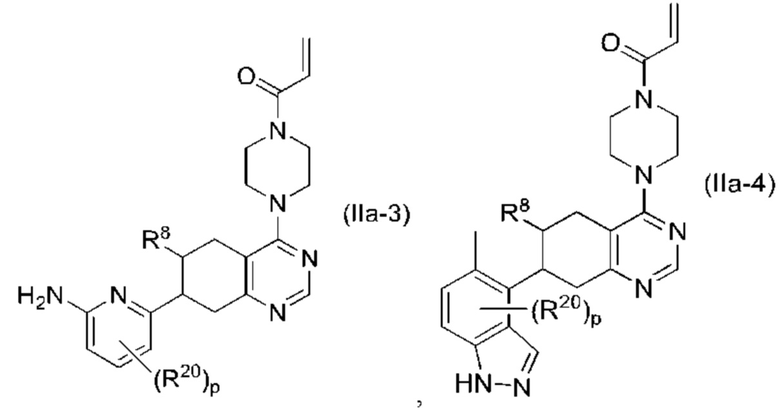 и
и
или его фармацевтически приемлемая соль, где каждый R20 независимо выбран из группы, состоящей из С1-6 алкила, NH2, NH(CH3), N(CH3)2, галогена, С1-6 галогеналкила, гидрокси, С3-6 циклоалкила, С1-6 гидроксиалкила и -ОС(=O)СН=СН2; и каждое р независимо равно 0, 1, 2, 3 или 4.
Вариант осуществления 62: Соединение по варианту осуществления 58 или его фармацевтически приемлемая соль, имеющее формулу, выбранную из группы, состоящей из:
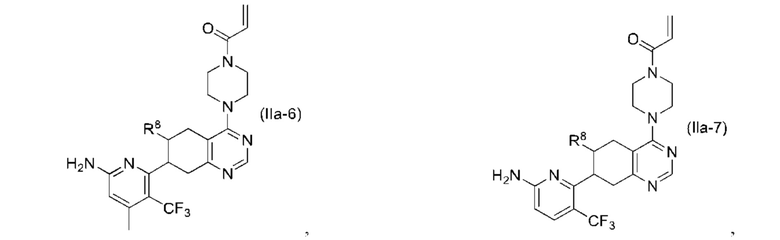
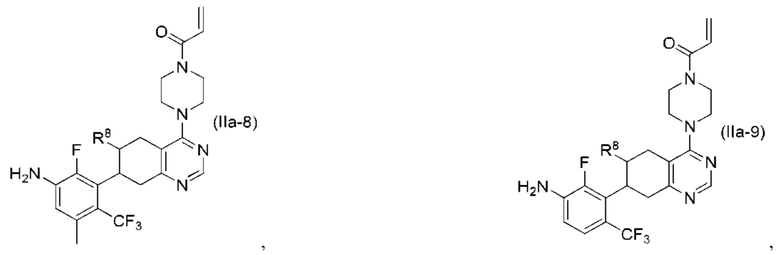
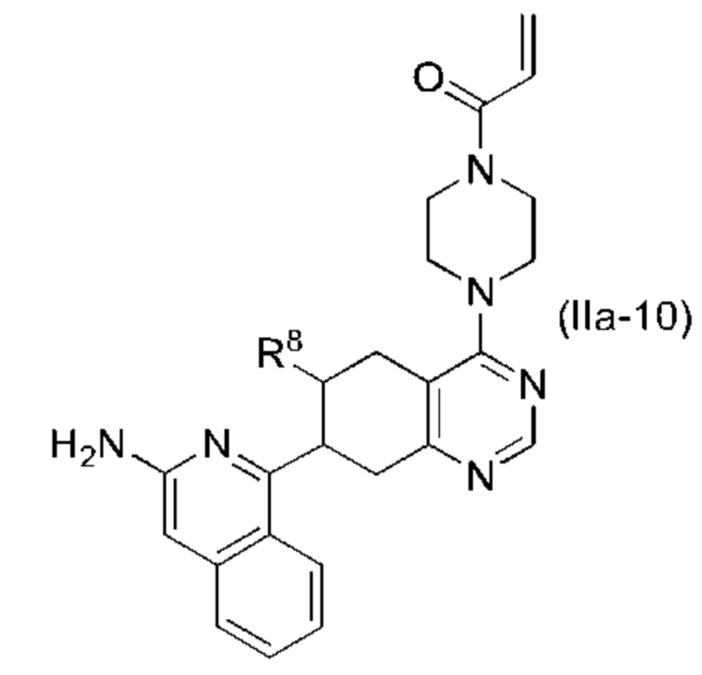 и
и 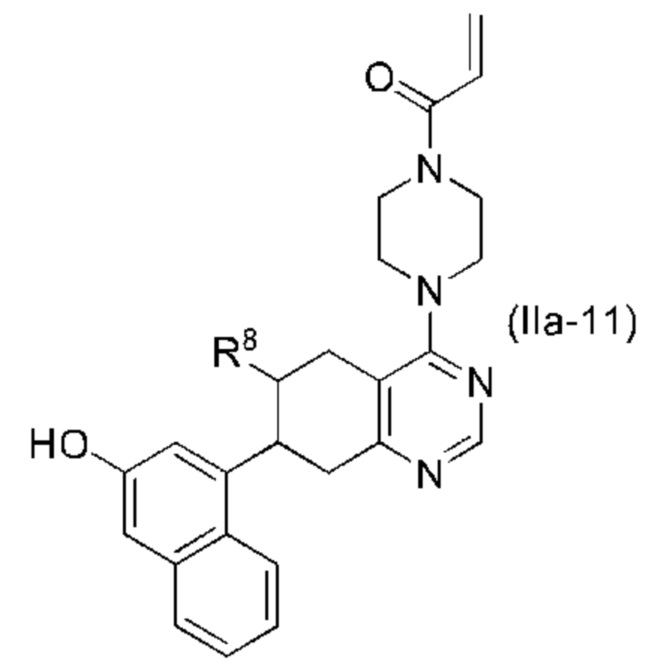
или его фармацевтически приемлемая соль.
Вариант осуществления 63: Соединение по варианту осуществления 1 или варианту осуществления 2 или его фармацевтически приемлемая соль, имеющее формулу (III):

или его фармацевтически приемлемая соль. Вариант осуществления 64: Соединение по варианту осуществления 63 или его фармацевтически приемлемая соль, где R8 представляет собой водород; R9 представляет собой арил, замещенный С1-6 алкилом; a R10 представляет собой оксо.
Вариант осуществления 65: Соединение по варианту осуществления 63 или его фармацевтически приемлемая соль, имеющее формулу, выбранную из группы, состоящей из:
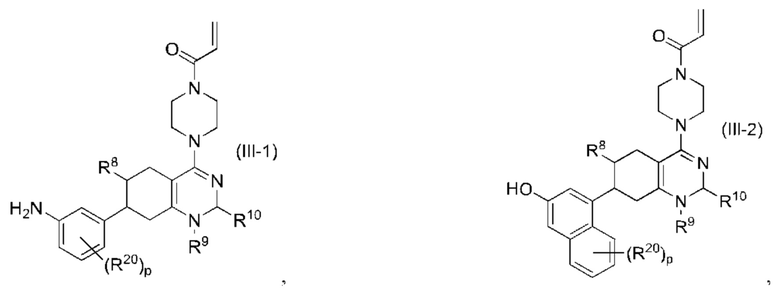
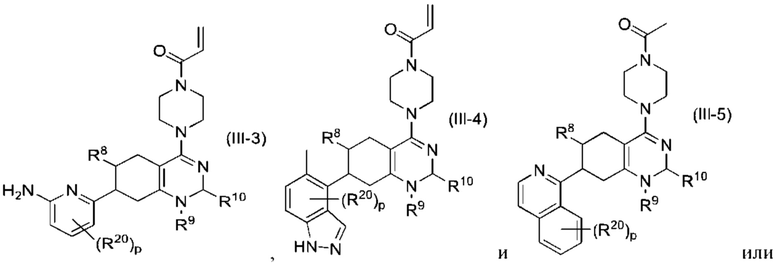
его фармацевтически приемлемая соль, где R20 выбран из группы, состоящей из С1-6 алкила, NH2, NH(СН3)2, N(СН3)2, галогена, С1-6 галогеналкила, гидрокси, С3-6 циклоалкила, С1-6 гидроксиалкила и -ОС(=O)СН=СН2; а р равно 0, 1, 2, 3 или 4.
Вариант осуществления 66: Соединение по варианту осуществления 63 или его фармацевтически приемлемая соль, имеющее формулу, выбранную из группы, состоящей из:
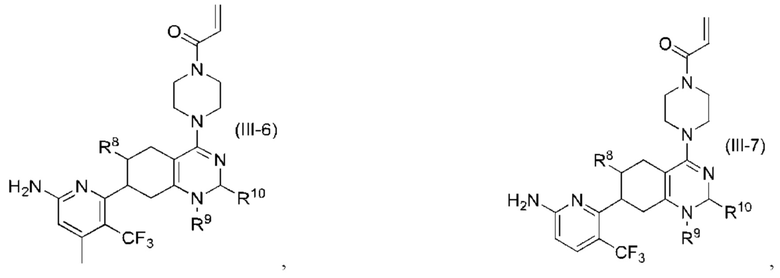


или его фармацевтически приемлемая соль.
Вариант осуществления 67: Соединение по варианту осуществления 1 или варианту осуществления 2 или его фармацевтически приемлемая соль, имеющее формулу (IIn):

или его фармацевтически приемлемая соль. Вариант осуществления 68: Соединение по варианту осуществления 67 или его фармацевтически приемлемая соль, имеющее формулу, выбранную из группы, состоящей из:

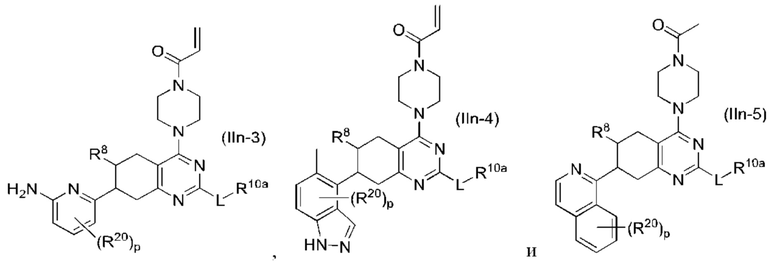
или его фармацевтически приемлемая соль, где каждый R20 независимо выбран из группы, состоящей из C1-6 алкила, NH2, NH(CH3), N(CH3)2, галогена, C1-6 галогеналкила, гидрокси, С3-6 циклоалкила, C1-6 гидроксиалкила и -ОС(=O)СН=СН2; а каждое р независимо равно 0, 1, 2, 3 или 4.
Вариант осуществления 69: Соединение по варианту осуществления 67 или его фармацевтически приемлемая соль, имеющее формулу, выбранную из группы, состоящей из:
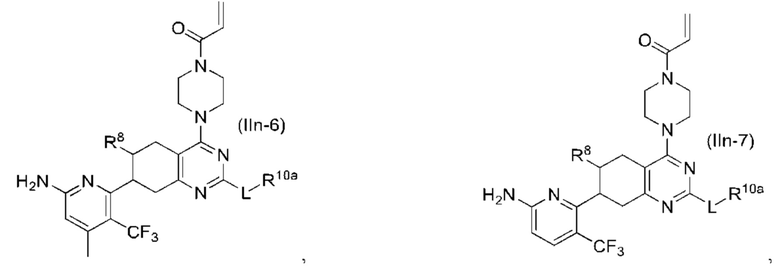


или его фармацевтически приемлемая соль.
Вариант осуществления 70: Соединение по варианту осуществления 1 или варианту осуществления 2 или его фармацевтически приемлемая соль, имеющее формулу (IIm):
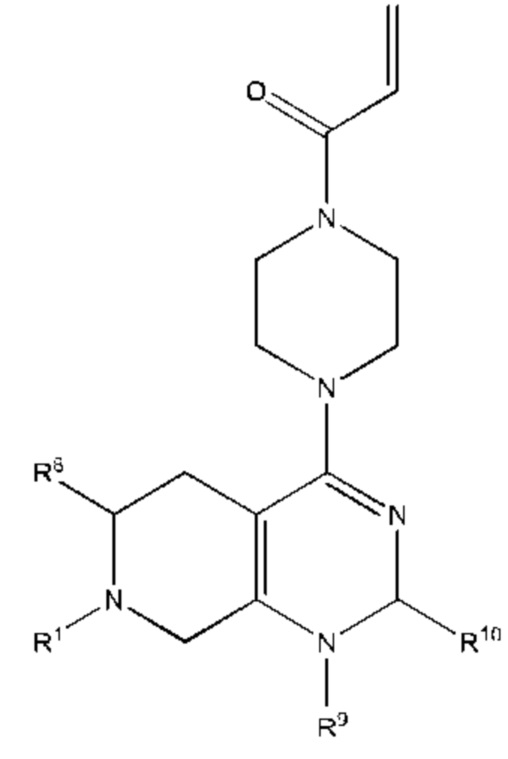 (IIm),
(IIm),
или его фармацевтически приемлемая соль. Вариант осуществления 71: Соединение по варианту осуществления 70 или его фармацевтически приемлемая соль, где R8 представляет собой водород; R9 представляет собой арил, замещенный С1-6 алкилом; a R10 представляет собой оксо.
Вариант осуществления 72: Соединение по любому одному из вариантов осуществления 58, 63, 67 или 70 или его фармацевтически приемлемая соль, где R1 выбран из группы, состоящей из


Вариант осуществления 73: Соединение по варианту осуществления 1 или варианту осуществления 2, выбранное из группы, состоящей из соединений из Таблицы 1, или его фармацевтически приемлемая соль.
Вариант осуществления 74: Соединение по варианту осуществления 1 или варианту осуществления 2 или его фармацевтически приемлемая соль, имеющее следующую структуру:
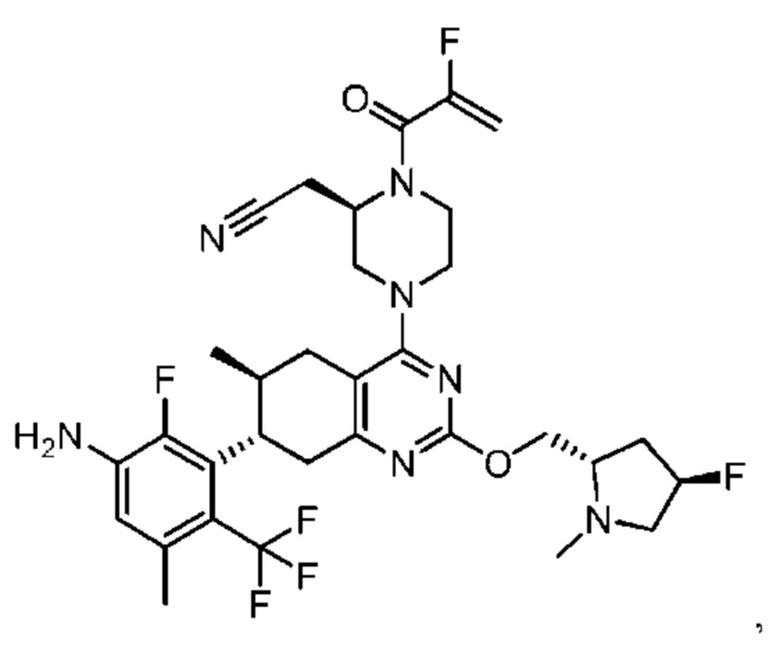
или его фармацевтически приемлемая соль.
Вариант осуществления 75: Соединение по варианту осуществления 1 или варианту осуществления 2 или его фармацевтически приемлемая соль, имеющее следующую структуру:

или его фармацевтически приемлемая соль.
Вариант осуществления 76: Соединение по варианту осуществления 1 или варианту осуществления 2 или его фармацевтически приемлемая соль, имеющее следующую структуру:

или его фармацевтически приемлемая соль.
Вариант осуществления 77: Соединение по варианту осуществления 1 или варианту осуществления 2 или его фармацевтически приемлемая соль, имеющее следующую структуру:
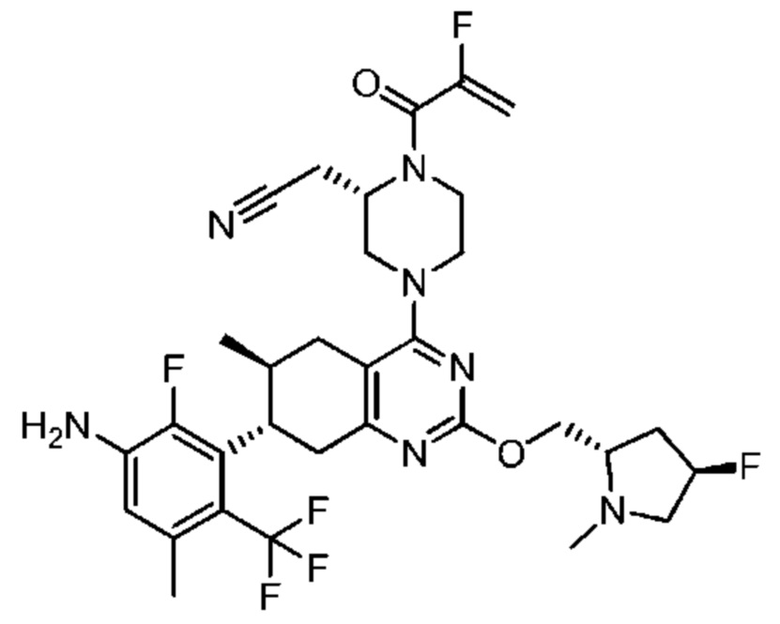
или его фармацевтически приемлемая соль.
Вариант осуществления 78: Соединение по варианту осуществления 1 или варианту осуществления 2 или его фармацевтически приемлемая соль, имеющее структуру, выбранную из группы, состоящей из:

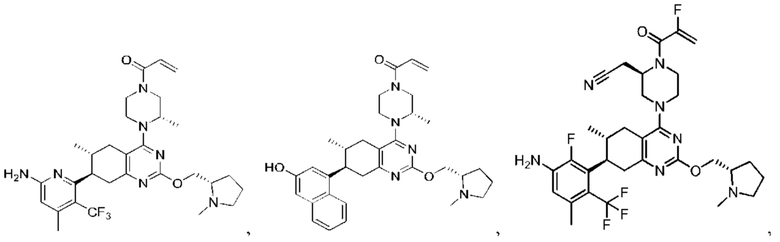



Вариант осуществления 79: Соединение или его фармацевтически приемлемая соль из Таблицы 1.
Вариант осуществления 80: Фармацевтическая композиция, содержащая соединение по любому одному из вариантов осуществления 1-79 или его фармацевтически приемлемую соль и фармацевтически приемлемое вспомогательное вещество.
Вариант осуществления 81: Фармацевтическая композиция по варианту осуществления 80, отличающаяся тем, что фармацевтическая композиция составлена для перорального введения.
Вариант осуществления 82: Фармацевтическая композиция по варианту осуществления 80, отличающаяся тем, что фармацевтическая композиция составлена для инъекции.
Вариант осуществления 83: Способ лечения рака, включающий введение нуждающемуся в этом индивиду терапевтически эффективного количества соединения по любому одному из вариантов осуществления 1-79 или его фармацевтически приемлемой соли или фармацевтической композиции по любому одному из вариантов осуществления 80-82.
Вариант осуществления 84: Способ по варианту осуществления 83, отличающийся тем, что индивид представляет собой человека.
Вариант осуществления 85: Способ по варианту осуществления 83, отличающийся тем, что введение осуществляют пероральным путем.
Вариант осуществления 86: Способ по варианту осуществления 83, отличающийся тем, что введение осуществляют путем инъекции.
Вариант осуществления 87: Способ по варианту осуществления 83, отличающийся тем, что рак опосредован мутацией K-Ras G12C.
Вариант осуществления 88: Способ по варианту осуществления 83, отличающийся тем, что рак представляет собой гемобластоз, рак поджелудочной железы, MYH-ассоциированный полипоз, колоректальный рак, рак легких или является агностическим.
Вариант осуществления 89: Способ по варианту осуществления 83, отличающийся тем, что рак представляет собой аденокарциному легких.
Вариант осуществления 90: Способ регуляции активности мутантного белка К-Ras G12C, включающий осуществление реакции мутантного белка с соединением по любому одному из вариантов осуществления 1-79 или его фармацевтически приемлемой солью.
Вариант осуществления 91: Способ ингибирования пролиферации клеточной популяции, включающий приведение клеточной популяции в контакт с соединением по любому одному из вариантов осуществления 1-79 или его фармацевтически приемлемой солью.
Вариант осуществления 92: Способ по варианту осуществления 91, отличающийся тем, что ингибирование пролиферации определяют как снижение жизнеспособности клеток клеточной популяции.
Вариант осуществления 93: Способ лечения нарушения, опосредованного мутацией K-Ras G12C, у нуждающегося в этом индивида, включающий определение, имеет ли индивид мутацию; и в случае определения, что индивид имеет мутацию, введение индивиду терапевтически эффективного количества соединения по любому одному из вариантов осуществления 1-79 или его фармацевтически приемлемой соли или фармацевтической композиции по любому одному из вариантов осуществления 80-82.
Вариант осуществления 94: Способ по варианту осуществления 93, отличающийся тем, что нарушение представляет собой рак.
Вариант осуществления 95: Способ по варианту осуществления 94, отличающийся тем, что рак представляет собой гемобластоз, рак поджелудочной железы, MYH-ассоциированный полипоз, колоректальный рак, рак легких или является агностическим.
Вариант осуществления 96: Способ по варианту осуществления 94, отличающийся тем, что рак представляет собой аденокарциному легких.
Вариант осуществления 97: Способ получения меченного мутантного белка К-Ras G12C, включающий осуществление реакции мутантного белка K-Ras G12C с меченным соединением по любому одному из вариантов осуществления 1-79 или его фармацевтически приемлемой солью для получения меченного мутантного белка К-Ras G12C.
Вариант осуществления 98: Способ ингибирования метастазов опухоли, включающий введение нуждающемуся в этом индивиду терапевтически эффективного количества соединения по любому одному из вариантов осуществления 1-79 или его фармацевтически приемлемой соли или фармацевтической композиции по любому одному из вариантов осуществления 80-82.
Вариант осуществления 99: Способ опухоль-агностического лечения рака у нуждающегося в этом индивида, включающий определение, имеет ли индивид опухоль с мутацией G12C в белке K-Ras, H-Ras или N-Ras в опухоли, и если индивид имеет опухоль с мутацией, введение индивиду терапевтически эффективного количества соединения по любому одному из вариантов осуществления 1-79 или его фармацевтически приемлемой соли или фармацевтической композиции по любому одному из вариантов осуществления 80-82.
Вариант осуществления 100: Применение соединения по любому одному из вариантов осуществления 1-79 или его фармацевтически приемлемой соли при производстве лекарственного средства для лечения рака.
Вариант осуществления 101: Применение по варианту осуществления 100, отличающееся тем, что лекарственное средство составлено для перорального введения.
Вариант осуществления 102: Применение по варианту осуществления 100, отличающееся тем, что лекарственное средство составлено для инъекции.
Вариант осуществления 103: Применение по варианту осуществления 100, отличающееся тем, что рак опосредован мутацией K-Ras G12C.
Вариант осуществления 104: Применение по варианту осуществления 100, отличающееся тем, что рак представляет собой гемобластоз, рак поджелудочной железы, MYH-ассоциированный полипоз, колоректальный рак, рак легких или является агностическим.
Вариант осуществления 105: Применение по варианту осуществления 100, отличающееся тем, что рак представляет собой аденокарциному легких.
Вариант осуществления 106: Применение соединения по любому одному из вариантов осуществления 1-79 или его фармацевтически приемлемой соли при производстве лекарственного средства для ингибирования метастазов опухоли.
Вариант осуществления 107: Соединение по любому одному из вариантов осуществления 1-79 или его фармацевтически приемлемая соль или фармацевтическая композиция по любому одному из вариантов осуществления 80-82 для применения в способе терапевтического лечения организма человека или животного.
Вариант осуществления 108: Соединение по любому одному из вариантов осуществления 1-79 или его фармацевтически приемлемая соль или фармацевтическая композиция по любому одному из вариантов осуществления 80-82 для применения в способе лечения рака.
Вариант осуществления 109: Соединение, его фармацевтически приемлемая соль или фармацевтическая композиция по варианту осуществления 108, отличающиеся тем, что рак опосредован мутацией K-Ras G12C.
Вариант осуществления ПО: Соединение, его фармацевтически приемлемая соль или фармацевтическая композиция по варианту осуществления 108, отличающиеся тем, что рак представляет собой гемобластоз, рак поджелудочной железы, MYH-ассоциированный полипоз, колоректальный рак, рак легких или является агностическим.
Вариант осуществления 111: Соединение, его фармацевтически приемлемая соль или фармацевтическая композиция по варианту осуществления 108, отличающиеся тем, что рак представляет собой аденокарциному легких.
Вариант осуществления 112: Соединение по любому одному из вариантов осуществления 1-79 или его фармацевтически приемлемая соль или фармацевтическая композиция по любому одному из вариантов осуществления 80-82 для применения в способе ингибирования метастазов опухоли.
ПРИМЕРЫ
Следующие примеры иллюстрируют получение и биологическую оценку соединений в рамках объема изобретения. Эти нижеприведенные примеры и способы получения приведены для того, чтобы специалисты в данной области техники могли более четко понять и реализовать на практике настоящее изобретение. Их не следует воспринимать как ограничивающие объем изобретения, а только как иллюстрирующие и представляющие его.
Некоторые из приведенных в данном документе структур соединений имеют обозначение «присвоенные». Если не указано иное, подразумевается, что термин «присвоенная» указывает на то, что стереохимия соединения была указана на основании активности и, таким образом, могла отличаться от изображенной для соединения.
В примерах используются следующие сокращения:
АЦН - ацетонитрил
B2pin2 - бис(пинаколато)дибор
BINAP - (+/-)-2,2'-бис(дифенилфосфино)-1,1'-бинафтил
ВОС - трет-бутоксикарбонил
ВОС2О - ди-трет-бутил дикарбонат
B(O-iPr)3 - триизопропилборат
ВОР - (бензотриазол-1-илокси)трис(диметиламино)фосфония гексафторфосфат
ДНУ - 1,8-диазабицикло[5.4.0]ундец-7-ен
ДКЭ - диэтилкарбонат
ДХМ - дихлорметан
ДДХ - 2,3-дихлор-5,6-дициано-1,4-бензохинон
ДГП - 3,4-дигидро-2h-пиран
ДИЭА - N,N-диизопропилэтиламин
ДИПЭА - N,N-диизопропилэтиламин
ДМА - N,N-диметилацетамид
ДМАП - 4-диметиламинопиридин
ДМФ - N,N-диметилформамид
ДМСО - диметилсульфоксид
ЭА - этилацетат
EtOAc - этилацетат
EtOH - этанол или этиловый спирт
HATU - 1-(бис(диметиламино)метилен)-1Н-1λ4-[1,2,3]триазоло[4,5-b]пиридин-3-оксид гексафторфосфат (V)
НС(ОМе)3 - триметоксиметан
ИПАЦ - изопропилацетат
(i-PrO)3В - триизопропилборат
KF - фторид калия
KHMDS - бис(триметилсилил)амид калия
КОАс - ацетат калия
ДАЛ - диизопропиламид лития
LiHMDS - бис(триметилсилил)амид лития или гексаметилдисилазид лития
m-СВРА или m-СРВА-3-хлорпероксибензойная кислота
MeCN - ацетонитрил
МеОН - метанол или метиловый спирт
MeONa - метоксид натрия или метанолат натрия
NBS - 1-бром-2,5-пирролидиндион
n-BuLi - н-бутиллитий
NIS - N-йодосукцинимид
NMP - 1-метил-2-пирролидинон
Оксон - пероксимоносульфат калия
P(t-Bu)3HBF4 - три-трет-бутилфосфония тетрафторборат
РСу3 - трициклогексилфосфин
Pd/C - палладий на углероде
Pd2(dba)3 - бис(дибензилиденацетон)палладий
Pd2(dba)3CHCl3 - трис(дибензилиденацетон)дипалладия (0) хлороформ
Pd(PPh3)2Cl2 - бис(трифенилфосфин)палладия (II) хлорид
Pd(dppf)Cl2 - 1,1'-бис(дифенилфосфино)ферроцен-палладия (II) дихлорид
Pd(dppf)Cl2CH2Cl2 - [1,1'-бис(дифенилфосфино)ферроцен]дихлорпалладий (II) в комплексе с дихлорметаном
Pd(OAc)2 - ацетат палладия (II)
Pd(pph3)Cl2 - бис(трифенилфосфин)палладия (II) хлорид
ПЭ - петролейный эфир
РМВС1 - 4-метоксибензилхлорид
РМВ - пара-метоксибензил
P(t-Bu)3HBF4 - три-трет-бутилфосфина тетрафторборат
RBF - фторид рубидия
[Rh(COD)Cl]2 - димер хлор(1,5-циклооктадиен)родия (I)
к. т. - комнатная температура
SEMCl - 2-(триметилсилил)этоксиметилхлорид
SEM - 2-(триметилсилил)этоксиметил
СФХ - сверхкритическая флюидная хроматография
Sn2(n-Bu)6 - гексабутилдитин
TBSCl - трет-бутилдиметилсилилхлорид
t-BuOK - трет-бутоксид калия
Tf2O - трифторметансульфоновый ангидрид
ТФА - трифторуксусная кислота
ТГФ - тетрагидрофуран
ТГП или THP - тетрагидропиран
ТМГ - тетраметилгуанидин
Тол. - толуол
TsOH - пара-толуолсульфоновая кислота
Zn(Me)2 - диметилцинк
Примеры 1a и 1b

1-(4-((6R,7S)-7-(6-амино-4-метил-3-(трифторметил)пиридин-2-ил)-6-метил-5,6,7,8-тетрагидрохиназолин-4-ил)пиперазин-1-ил)проп-2-ен-1-он (Пример 1а);
1-(4-((6R,7S)-7-(6-амино-4-метил-3-(трифторметил)пиридин-2-ил)-6-метил-5,6,7,8-тетрагидрохиназолин-4-ил)пиперазин-1-ил)проп-2-ен-1-он (Пример 1b)
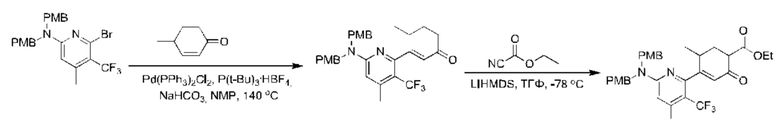
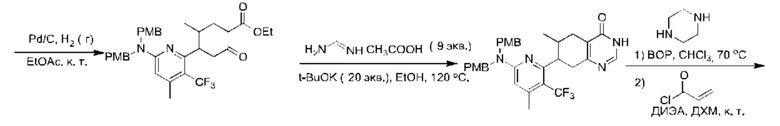
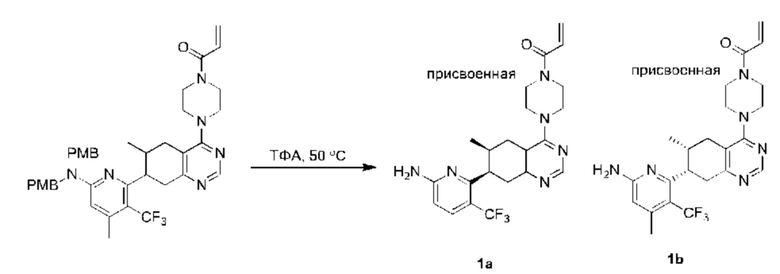
Этап 1: 3-[6-[бис[(4-метоксифенил)метил]амино]-4-метил-3-(трифторметил)-2-пиридил]-4-метил-цикл огекс-2-ен-1-он

В атмосфере азота раствор 6-бром-N,N-бис[(4-метоксифенил)метил]-4-метил-5-(трифторметил)пиридин-2-амина (9,00 г, 18,18 ммоль), 4-метилциклогекс-2-ен-1-она (3,96 г, 36,36 ммоль), бис(трифенилфосфин)палладия (II) хлорида (1,30 г, 1,80 ммоль), три-трет-бутилфосфин тетрафторбората (1,10 г, 3,60 ммоль) и бикарбоната натрия (4,60 г, 54,54 ммоль) в 1-метил-2-пирролидиноне (30 мл) перемешивали в течение 10 часов при 140°С. После завершения реакционную смесь разводили дихлорметаном, промывали водой. Органический слой сушили над безводным сульфатом натрия и концентрировали в вакууме. Остаток очищали с помощью флэш-хроматографии на силикагеле с элюированием петролейным эфиром/этилацетатом (4/1) с получением 3-[6-[бис[(4-метоксифенил)метил]амино]-4-метил-3-(трифторметил)-2-пиридил]-4-метил-циклогекс-2-ен-1-она (2,20 г, 4,20 ммоль, выход 23%) в виде желтого твердого вещества. ЖХМС (ИЭР, m/z): 525,2 [М+Н]+.
Этап 2: этил-4-[6-[бис[(4-метоксифенил)метил]амино]-4-метил-3-(трифторметил)-2-пиридил]-5-метил-2-оксо-циклогекс-3-ен-1-карбоксилат
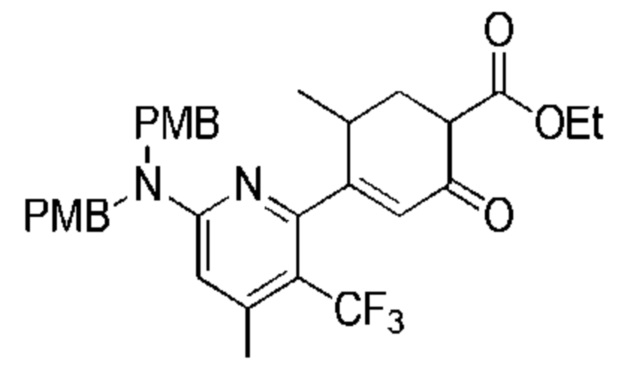
В атмосфере азота в раствор 3-[6-[бис[(4-метоксифенил)метил]амино]-4-метил-3-(трифторметил)-2-пиридил]-4-метил-циклогекс-2-ен-1-она (2,20 г, 4,20 ммоль) в тетрагидрофуране (100 мл) по каплям добавляли бис(триметилсилил)амид лития (5,5 мл, 5,46 ммоль, 1,0 М в ТГФ) и перемешивали в течение 1 часа при -78°С. Потом по каплям добавляли этилцианоформиат (0,60 г, 6,29 ммоль) и перемешивали при -78°С в течение 0,5 часа. После завершения реакцию гасили водным насыщенным раствором хлорида аммония, разводили дихлорметаном, промывали водой. Органический слой сушили над безводным сульфатом натрия и концентрировали в вакууме с получением неочищенного продукта этил 4-[6-[бис[(4-метоксифенил)метил]амино]-4-метил-3-(трифторметил)-2-пиридил]-5-метил-2-оксо-циклогекс-3-ен-1-карбоксилата (1,40 г, неочищенный) в виде желтого твердого вещества. ЖХМС (ИЭР, m/z): 597,2 [М+Н]+.
Этап 3: этил 4-[6-[бис[(4-метоксифенил)метил]амино]-4-метил-3-(трифторметил)-2-пиридил]-5-метил-2-оксо-циклогексанкарбоксилат
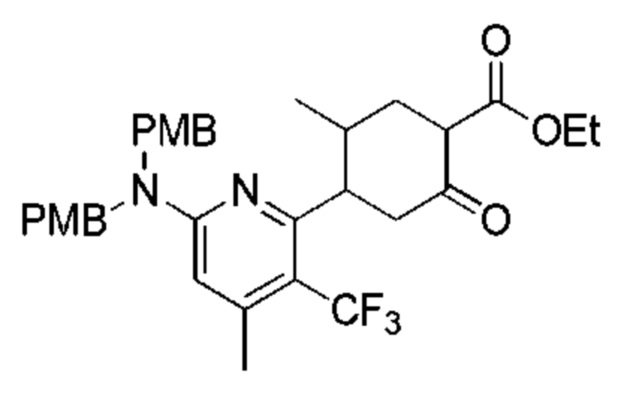
В атмосфере водорода в раствор этил 4-[6-[бис[(4-метоксифенил)метил]амино]-4-метил-3-(трифторметил)-2-пиридил]-5-метил-2-оксо-циклогекс-3-ен-1-карбоксилата (1,40 г, 2,34 ммоль) в этилацетате (100 мл) добавляли Pd/C (10%) (1,40 г) и перемешивали при 0°С в течение 20 минут. После фильтрации фильтрат концентрировали при пониженном давлении с получением неочищенного продукта этил 4-[6-[бис[(4-метоксифенил)метил]амино]-4-метил-3-(трифторметил)-2-пиридил]-5-метил-2-оксо-циклогексанкарбоксилата (1,00 г, неочищенный) в виде желтого твердого вещества. ЖХМС (ПЭР, m/z): 599,3 [М+Н]+.
Этап 4: 7-(6-(бис(4-метоксибензил)амино)-4-метил-3-(трифторметил)пиридин-2-ил)-6-метил-5,6,7,8-тетрагидрохиназолин-4(3Н)-он

Раствор этил 4-[6-[бис[(4-метоксифенил)метил]амино]-4-метил-3-(трифторметил)-2-пиридил]-5-метил-2-оксо-циклогексанкарбоксилата (1,00 г, неочищенный), формамидинацетата (1,70 г, 16,70 ммоль) и трет-бутоксид калия (3,80 г, 33,41 ммоль) в этиловом спирте (50 мл) перемешивали при 120°С в течение 5 часов. После завершения реакционную смесь концентрировали в вакууме. Реакционную смесь разводили дихлорметаном, доводили до рН=7 НС1/1,4-диоксаном, промывали водой. Органический слой сушили над безводным сульфатом натрия и концентрировали в вакууме. Остаток очищали с помощью флэш-хроматографии на силикагеле с элюированием дихлорметаном/метиловым спиртом (20/1) с получением 7-[6-[бис[(4-метоксифенил)метил]амино]-4-метил-3-(трифторметил)-2-пиридил]-6-метил-5,6,7,8-тетрагидро-3Н-хиназолин-4-она (0,40 г, 0,64 ммоль, выход 38,3%) в виде твердого вещества. ЖХМС (ПЭР, m/z): 579,3 [М+Н]+.
Этап 5: 1-[4-[7-[6-[бис[(4-метоксифенил)метил]амино]-4-метил-3-(трифторметил)-2-пиридил]-6-метил-5,6,7,8-тетрагидрохиназолин-4-ил]пиперазин-1-ил]проп-2-ен-1-он

Раствор 7-[6-[бис[(4-метоксифенил)метил]амино]-4-метил-3-(трифторметил)-2-пиридил]-6-метил-5,6,7,8-тетрагидро-3Н-хиназолин-4-она (370,0 мг, 0,64 ммоль), пиперазина (550,8 мг, 6,39 ммоль) и ВОР (565,6 мг, 1,28 ммоль) в хлороформе (6 мл) перемешивали при 70°С в течение 5 часов. После завершения полученный в результате раствор разводили дихлорметаном, промывали водой. Органический слой сушили над безводным сульфатом натрия и концентрировали в вакууме. Остаток растворяли в дихлорметане (10 мл) и по каплям добавляли акрилоилхлорид (0,15 мл, 12,79 ммоль) и перемешивали при 25°С в течение 10 минут. После завершения полученный в результате раствор гасили водой, разводили дихлорметаном, промывали водой. Органический слой сушили над безводным сульфатом натрия и концентрировали в вакууме. Полученный остаток очищали с помощью обращенно-фазовой хроматографии (ацетонитрил 0-80% в воде) с получением 1-[4-[7-[6-[бис[(4-метоксифенил)метил]амино]-4-метил-3-(трифторметил)-2-пиридил]-6-метил-5,6,7,8-тетрагидрохиназолин-4-ил]пиперазин-1-ил]проп-2-ен-1-она (70,0 мг, 0,10 ммоль, выход 15,6%) в виде белого твердого вещества. ЖХМС (ИЭР, m/z): 701,3 [М+Н]+.
Этап 6: 1-(4-((6R,7S)-7-(6-амино-4-метил-3-(трифторметил)пиридин-2-ил)-6-метил-5,6,7,8-тетрагидрохиназолин-4-ил)пиперазин-1-ил)проп-2-ен-1-он (Пример 1а); 1-(4-((6R,7R)-7-(6-амино-4-метил-3-(трифторметил)пиридин-2-ил)-6-метил-5,6,7,8-тетрагидрохиназолин-4-ил)пиперазин-1-ил)проп-2-ен-1-он (Пример 1b)
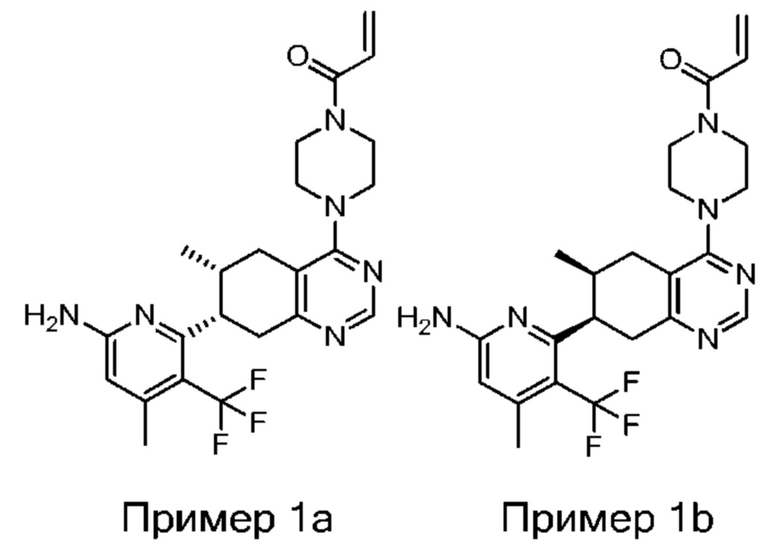
Раствор 1-[4-[7-[6-[бис[(4-метоксифенил)метил]амино]-4-метил-3-(трифторметил)-2-пиридил]-6-метил-5,6,7,8-тетрагидрохиназолин-4-ил]пиперазин-1-ил]проп-2-ен-1-она (70,0 мг, 0,10 ммоль) в трифторуксусной кислоте (5 мл) перемешивали при 50°С в течение 12 часов. После завершения полученный в результате раствор концентрировали в вакууме. Неочищенный продукт очищали с помощью препаративной ВЭЖХ со следующими условиями: колонка: колонка XBridge Prep С18 OBD 19 × 150 мм, 5 мкм; подвижная фаза А: вода (10 ммоль/л NH4HCO3), подвижная фаза В: АЦН; скорость потока: 25 мл/мин; градиент: от 31% В до 54% В за 7 мин; 254/210 нм; Rt: 5,88 мин, с получением 20 мг продукта в виде белого твердого вещества. Продукт дополнительно очищали с помощью хиральной препаративной ВЭЖХ со следующими условиями: (колонка CHIRALPAK IF2*25 см, 5 мкм; подвижная фаза: МТБЭ (10 мМ NH3-MEOH): EtOH; детектор, УФ 254 нм) с получением указанных в заголовке соединений. Стереохимия или относительные конфигурации указанных в заголовке соединений были приписаны на основании ЯМР и разницы в активности с транс-изомерами (примеры 8а и 8b). Абсолютные конфигурации указанных в заголовке соединений определены не были.
Пример 1а: l-(4-((6R,7S)-7-(6-амино-4-метил-3-(трифторметил)пиридин-2-ил)-6-метил-5,6,7,8-тетрагидрохиназолин-4-ил)пиперазин-1 -ил)проп-2-ен-1-он (5,3 мг, 0,012 ммоль, выход 11,5%, белое твердое вещество) 1Н ЯМР (300 МГц, метанол-d4; м. д.) δ 8,27 (с, 1H), 6,82 (дд, J=16,8, 10,6 Гц, 1H), 6,25 (дд, J=16,8, 2,0 Гц, 1H), 6,15 (с, 1H), 5,79 (дд, J=10,6, 2,0 Гц, 1H), 3,95-3,72 (м, 4Н), 3,68-3,53 (м, 3Н), 3,45 (шир. с, 2Н), 2,85-2,53 (м, 4Н), 2,26 (д, J=2,9 Гц, 3Н), 2,03 (шир. с, 1H), 1,48 (д, J=1,2 Гц, 3Н). ЖХМС (ПЭР, m/z): 461,2 [М+Н]+. Хиральная ВЭЖХ: Chiralpak IF-3(0,46*5 см, 3 мкм); обнаружение на 254 нм; МТБЭ (0,1% ДЭА): EtOH=90:10, 1,0 мл/мин); время удержания: 1,259 мин (более быстрый пик).
Пример 1b: 1-(4-((6S,7R)-7-(6-амино-4-метил-3-(трифторметил)пиридин-2-ил)-6-метил-5,6,7,8-тетрагидрохиназолин-4-ил)пиперазин-1-ил)проп-2-ен-1-он (5,0 мг, 0,011 ммоль, выход 10,9%, белое твердое вещество) 1Н ЯМР (300 МГц, метанол-d4; м. д.) δ 8,27 (с, 1H), 6,82 (дд, J=16,8, 10,6 Гц, 1H), 6,25 (дд, J=16,8, 2,0 Гц, 1H), 6,15 (с, 1H), 5,79 (дд, J=10,6, 2,0 Гц, 1H), 3,95-3,72 (м, 4Н), 3,68-3,53 (м, 3Н), 3,45 (шир. с, 2Н), 2,85-2,53 (м, 4Н), 2,26 (д, J=2,9 Гц, 3Н), 2,03 (шир. с, 1H), 1,48 (д, J=1,2 Гц, 3Н). ЖХМС (ПЭР, m/z): 461,2 [М+Н]+. Хиральная ВЭЖХ: Chiralpak IF-3(0,46*5 см, 3 мкм); обнаружение на 254 нм; МТБЭ (0,1% ДЭА): EtOH=90:10, 1,0 мл/мин); время удержания: 1,932 мин (более медленный пик).
Пример 2
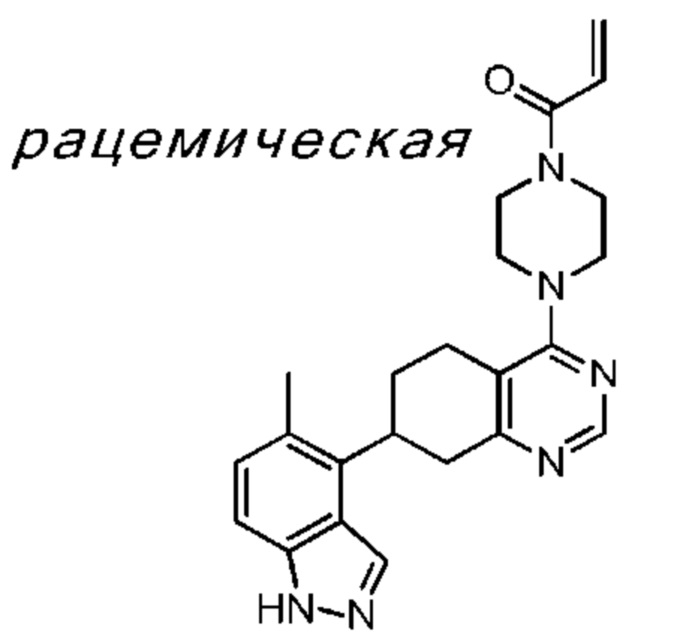
1-(4-(7-(5-метил-1Н-индазол-4-ил)-5,6,7,8-тетрагидрохиназолин-4-ил)пиперазин-1-ил)проп-2-ен-1-он(рацемат)
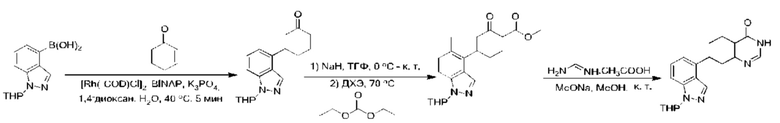

Этап 1: 3-(5-метил-1-тетрагидропиран-2-ил-индазол-4-ил)циклогексанон
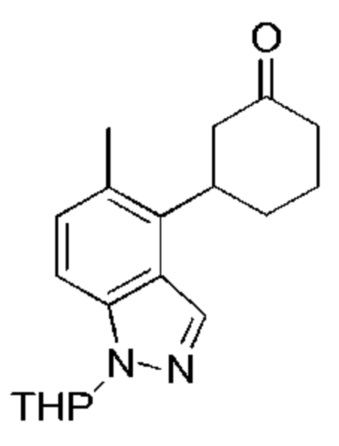
В атмосфере азота раствор (5-метил-1-тетрагидропиран-2-ил-индазол-4-ил)бороновую кислоту (1,07 г, 4,13 ммоль), 2-циклогексен-1-он (0,5 мл, 5,16 ммоль), BINAP (482,6 мг, 0,77 ммоль), дихлор(циклоокта-1,5-диен)рутения (II) (108,5 мг, 0,39 ммоль) и водного насыщенного раствора фосфата калия (1,28 мл) в 1,4-диоксане (10 мл) и воде (2 мл) перемешивали при 40°С в течение 5 минут. После завершения полученный в результате раствор разводили этилацетатом и промывали водой. Органический слой сушили над безводным сульфатом натрия и концентрировали в вакууме. Остаток очищали с помощью флэш-хроматографии на силикагеле с элюированием петролейным эфиром/этилацетатом (3/11) с получением 3-(5-метил-1-тетрагидропиран-2-ил-индазол-4-ил)циклогексанона (0,55 г, 1,76 ммоль, выход 34,1%) в виде светло-желтого масла. ЖХМС (ИЭР, m/z): 313,2 [М+Н]+.
Этап 2: этил 4-(5-метил-1-тетрагидропиран-2-ил-индазол-4-ил)-2-оксо-циклогексанкарбоксилат

В раствор 3-(5-метил-1-тетрагидропиран-2-ил-индазол-4-ил)циклогексанона (1,00 г, 3,20 ммоль) в тетрагидрофуране (2 мл) добавляли NaH (384,1 мг, 9,60 ммоль) и перемешивали при 0°С в течение 10 минут.Потом по каплям добавляли диэтилкарбонат (0,78 мл, 6,40 ммоль) и перемешивали при 70°С в течение 30 минут. После завершения реакцию гасили водным насыщенным раствором хлорида аммония, разводили этилацетатом и промывали водой. Органический слой сушили над безводным сульфатом натрия и концентрировали в вакууме. Остаток очищали с помощью флэш-хроматографии на силикагеле с элюированием петролейным эфиром/диэтиловым эфиром (3/1) с получением этил 4-(5-метил-1-тетрагидропиран-2-ил-индазол-4-ил)-2-оксо-циклогексанкарбоксилата (150,0 мг, 1,17 ммоль, выход 12,2%) в виде светло-желтого масла. ЖХМС (ИЭР, m/z): 385,2 [М+Н]+.
Этап 3: 7-(5-метил-1-тетрагидропиран-2-ил-индазол-4-ил)-5,6,7,8-тетрагидро-3Н-хиназолин-4-он

Раствор этил 4-(5-метил-1-тетрагидропиран-2-ил-индазол-4-ил)-2-оксо-циклогексанкарбоксилата (80,0 мг, 0,21 ммоль), формамидинацетата (75,7 мг, 0,73 ммоль) и метоксида натрия (56,2 мг, 1,04 ммоль) в метиловом спирте (1 мл) перемешивали при 50°С в течение 2 часов. После завершения реакционную смесь доводили до рН=6,0 HCl в 1,4-диоксане. Полученный в результате раствор очищали с помощью обращенно-фазовой хроматографии (ацетонитрил/вода=10% - 40%) с получением 7-(5-метил-1-тетрагидропиран-2-ил-индазол-4-ил)-5,6,7,8-тетрагидро-3Н-хиназолин-4-она (57,0 мг, 0,16 ммоль, выход 76%) в виде бело-желтого твердого вещества. ЖХМС (ИЭР, m/z): 365,2 [М+Н]+.
Этап 4: 7-(5-метил-1-тетрагидропиран-2-ил-индазол-4-ил)-4-пиперазин-1-ил-5,6,7,8-тетрагидрохиназолин
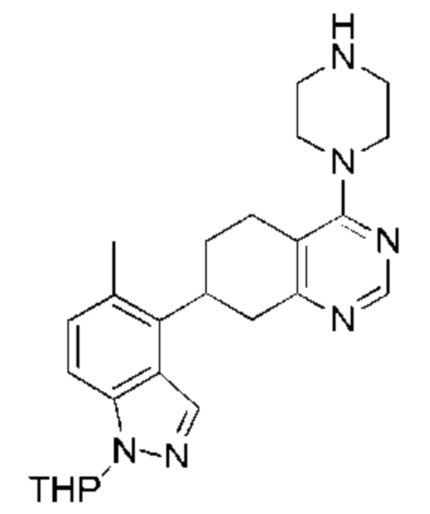
Раствор 7-(5-метил-1-тетрагидропиран-2-ил-индазол-4-ил)-5,6,7,8 -тетрагидро-ЗН-хиназолин-4-она (120,0 мг, 0,33 ммоль), пиперазина (283,6 мг, 3,29 ммоль), ВОР (291,3 мг, 0,66 ммоль) и 1,8-диазабицикло[5.4.0]ундец-7-ена (0,15 мл, 0,99 ммоль) в хлороформе (3 мл) перемешивали при 70°С в течение 1 часа. После завершения раствор концентрировали в вакууме. Остаток очищали с помощью флэш-хроматографии на силикагеле с элюированием дихлорметаном/метанолом (5:1) с получением 7-(5-метил-1-тетрагидропиран-2-ил-индазол-4-ил)-4-пиперазин-1-ил-5,6,7,8-тетрагидрохиназолина (120,0 мг, 0,28 ммоль, выход 84,3%) в виде белого твердого вещества. ЖХМС (ИЭР, m/z): 433,2 [М+Н]+.
Этап 5: 1-[4-[7-(5-метил-1-тетрагидропиран-2-ил-индазол-4-ил)-5,6,7,8-тетрагидрохиназолин-4-ил]пиперазин-1-ил]проп-2-ен-1-он

Раствор 7-(5-метил-1-тетрагидропиран-2-ил-индазол-4-ил)-4-пиперазин-1-ил-5,6,7,8-тетрагидрохиназолина (120,0 мг, 0,28 ммоль), акриловой кислоты (99,9 мг, 1,39 ммоль), HATU (158,2 мг, 0,42 ммоль) и N,N-диизопропилэтиламина (0,14 мл, 0,83 ммоль) в дихлорметане (6 мл) перемешивали при 25°С в течение 10 минут. После завершения реакцию гасили водным насыщенным раствором хлорида аммония, разводили дихлорметаном и промывали водой. Органический слой сушили над безводным сульфатом натрия и концентрировали в вакууме. Остаток очищали с помощью флэш-хроматографии на силикагеле с элюированием дихлорметаном/метанолом (10:1) с получением 1-[4-[7-(5-метил-1-тетрагидропиран-2-ил-индазол-4-ил)-5,6,7,8-тетрагидрохиназолин-4-ил]пиперазин-1-ил]проп-2-ен-1-она (60,0 мг,0,12 ммоль, выход 44,4%) в виде белого твердого вещества. ЖХМС (ИЭР, m/z): 487,3 [М+Н]+.
Этап 6: 1-(4-(7-(5-метил-1Н-индазол-4-ил)-5,6,7,8-тетрагидрохиназолин-4-ил)пиперазин-1-ил)проп-2-ен-1-он

Раствор 1-[4-[7-(5-метил-1-тетрагидропиран-2-ил-индазол-4-ил)-5,6,7,8-тетрагидрохиназолин-4-ил]пиперазин-1-ил]проп-2-ен-1-она (60,0 мг, 0,12 ммоль) в трифторуксусной кислоте (2 мл) и дихлорметане (5 мл) перемешивали при 25°С в течение 2 часов. После завершения растворитель концентрировали в вакууме. Неочищенный продукт очищали с помощью препаративной ВЭЖХ со следующими условиями: колонка: X Bridge С18, 19*150 мм, 5 мкм; подвижная фаза А: вода/0,05% ТФА, подвижная фаза В: АЦН; скорость потока: 20 мл/мин; градиент: от 30% В до 70% В за 10 мин; 254 нм. RT: [7 мин]. Это приводило к получению 1-[4-[7-(5-метил-1Н-индазол-4-ил)-5,6,7,8-тетрагидрохиназолин-4-ил]пиперазин-1-ил]проп-2-ен-1-она (12,9 мг, 0,03 ммоль, выход 26%) в виде белого твердого вещества. ЖХМС (ИЭР, m/z): 403,2 [М+Н]+.
Пример 2: 1Н ЯМР (300 МГц, метанол-d4, м. д.) δ 8,51 (с, 1H), 8,07 (с, 1H), 7,34 (д, J=8,4 Гц, 1H), 7,25 (д, J=8,4 Гц, 1H), 6,82 (дд, J=16,8, 10,8 Гц, 1H), 6,26 (дд, J=16,8, 1,8 Гц, 1H), 5,79 (дд, J=10,8, 1,9 Гц, 1H), 3,93-3,84 (м, 2Н), 3,80-3,70 (м, 5Н), 3,57-3,42 (м, 2Н), 3,38-3,35 (м, 1H), 3,28-3,22 (м, 1H), 3,14-2,92 (м, 2Н), 2,90-2,81 (м, 1H), 2,50 (с, 3Н), 2,40-2,24 (м, 1H), 2,20-2,09 (м, 1H).
Примеры 3а и 3b

(R)-1-(4-(7-(3-аминоизохинолин-1-ил)-5,6,7,8-тетрагидрохиназолин-4-ил)пиперазин-1-ил)проп-2-ен-1-он (Пример 3а);
(S)-1-(4-(7-(3-аминоизохинолин-1-ил)-5,6,7,8-тетрагидрохиназолин-4-ил)пиперазин-1-ил)проп-2-ен-1-он (Пример 3b)



Этап 1: 3-[3-[бис[(4-метоксифенил)метил]амино]-1-изохинолил]циклогекс-2-ен-1-он
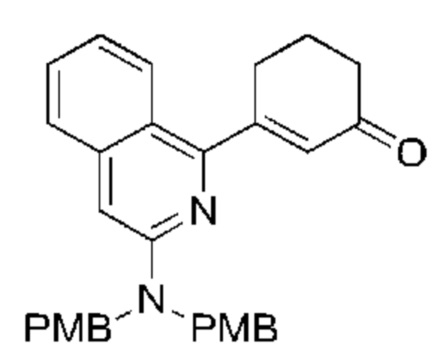
В атмосфере азота раствор 1-бром-N,N-бис[(4-метоксифенил)метил]изохинолин-3-амина (11,00 г, 23,74 ммоль), 2-циклогексен-1-она (4,56 г, 47,48 ммоль), бис(трифенилфосфин)палладия (II) дихлорида (1,67 г, 2,37 ммоль), три(2-фурил)фосфина (1,10 г, 4,75 ммоль) и бикарбоната натрия (5,98 г, 71,22 ммоль) в 1-метил-2-пирролидиноне (50 мл) перемешивали в течение 5 часов при 140°С. После завершения реакционную смесь разводили дихлорметаном и промывали водой. Органический слой сушили над безводным сульфатом натрия и концентрировали в вакууме. Остаток очищали с помощью флэш-хроматографии на силикагеле с элюированием петролейным эфиром/этилацетатом (10/1) с получением 3-[3-[бис[(4-метоксифенил)метил]амино]-1-изохинолил]циклогекс-2-ен-1-она (7,00 г, 14,63 ммоль, выход 50,5%) в виде красного масла. ЖХМС (ИЭР, m/z): 479,2 [М+Н]+.
Этап 2: этил
4-[3-[бис[(4-метоксифенил)метил]амино]-1-изохинолил]-2-оксо-циклогекс-3-ен-1-карбоксилат

В атмосфере азота в раствор 3-[3-[бис[(4-метоксифенил)метил]амино]-1-изохинолил]циклогекс-2-ен-1-она (7,00 г, 14,63 ммоль) в тетрагидрофуране (60 мл) по каплям добавляли бис(триметилсилил)амид лития (58,5 мл, 58,51 ммоль, 1,0 М в ТГФ) и перемешивали в течение 1 часа при -78°С. Потом по каплям добавляли этилцианоформиат (4,35 г, 43,88 ммоль) и перемешивали при -78°С в течение 1 часа. После завершения реакцию гасили водным насыщенным раствором хлорида аммония. Реакционную смесь разводили дихлорметаном. Органический слой промывали водой, сушили над безводным сульфатом натрия и концентрировали в вакууме. Остаток очищали с помощью флэш-хроматографии на силикагеле с элюированием петролейным эфиром/этилацетатом (8/1) с получением этил 4-[3-[бис[(4-метоксифенил)метил] амино]-1-изохинол ил]-2-оксо-цикл огекс-3-ен-1-карбоксил ата (3,80 г, 6,35 ммоль, выход 43,4%) в виде красного масла. ЖХМС (ИЭР, m/z): 551,2 [М+Н]+.
Этап 3: этил 4-[3-[бис[(4-метоксифенил)метил]амино]-1-изохинолил]-2-оксо-циклогексанкарбоксилат

В атмосфере водорода, в раствор этил 4-[3-[бис[(4-метоксифенил)метил]амино]-1-изохинолил]-2-оксо-циклогекс-3-ен-1-карбоксилата (3,40 г, 6,17 ммоль) в этилацетате (20 мл) добавляли Pd/C (1,00 г, 6,17 ммоль) и перемешивали в течение 2 часов при 25°С. После фильтрации фильтрат концентрировали при пониженном давлении. Остаток очищали с помощью флэш-хроматографии на силикагеле с элюированием петролейным эфиром/этилацетатом (7:1) с получением этил 4-[3-[бис[(4-метоксифенил)метил]амино]-1 -изохинолил]-2-оксо-циклогексанкарбоксилата (1,80 г, 3,26 ммоль, выход 47,5%) в виде желтого масла. ЖХМС (ИЭР, m/z): 553,3 [М+Н]+.
Этап 4: 7-[3-[бис[(4-метоксифенил)метил]амино]-1-изохинолил]-5,6,7,8-тетрагидро-3Н-хиназолин-4-он
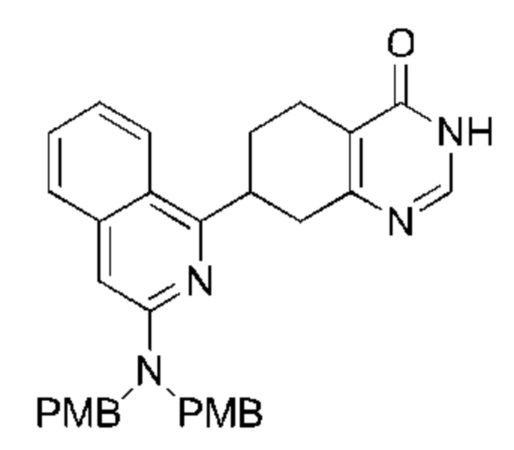
Раствор этил 4-[3-[бис[(4-метоксифенил)метил]амино]-1-изохинолил]-2-оксо-циклогексанкарбоксилата (1,80 г, 3,26 ммоль), метоксид натрияа (1,76 г, 32,57 ммоль) и формамидинацетата (2,03 г, 19,54 ммоль) в метиловом спирте (10 мл) перемешивали при 70°С в течение 2 часов. После завершения реакцию концентрировали в вакууме. Остаток очищали с помощью флэш-хроматографии на силикагеле с элюированием дихлорметаном/метиловым спиртом (10/1) с получением 7-[3-[бис[(4-метоксифенил)метил]амино]-1-изохинолил]-5,6,7,8-тетрагидро-3Н-хиназолин-4-она (0,70 г, 1,31 ммоль, выход 37,1%) в виде желтого масла. ЖХМС (ИЭР, m/z): 533,2 [М+Н]+.
Этап 5: 1-[4-[7-[3-[бис[(4-метоксифенил)метил]амино]-1-изохинолил]-5,6,7,8-тетрагидрохиназолин-4-ил]пиперазин-1-ил]проп-2-ен-1-он

Раствор пиперазин (0,57 г, 6,57 ммоль), 7-[3-[бис[(4-метоксифенил)метил]амино]-1-изохинолил]-5,6,7,8-тетрагидро-3Н-хиназолин-4-она (0,70 г, 1,31 ммоль), 1Н-бензотриазол-1-илокситрис(диметиламино)фосфония гексафторфосфата (0,87 г, 1,97 ммоль) и 1,8-диазабицикло[5.4.0]ундец-7-ена (0,39 мл, 2,63 ммоль) в хлороформе (8 мл) перемешивали при 70°С в течение 2 часов. По каплям добавляли акрилоилхлорид (0,36 г, 3,94 ммоль) и перемешивали при комнатной температуре в течение 30 минут. После завершения раствор концентрировали в вакууме. Остаток очищали с помощью флэш-хроматографии на силикагеле с элюированием дихлорметаном/метиловым спиртом (10/1) с получением 1-[4-[7-[3-[бис[(4-метоксифенил)метил]амино]-1-изохинолил]-5,6,7,8-тетрагидрохиназолин-4-ил]пиперазин-1-ил]проп-2-ен-1-она (0,40 г, 0,42 ммоль, выход 31,6%) в виде желтого твердого вещества. ЖХМС (ИЭР, m/z): 655,3 [М+Н]+.
Этап 6: (R)-1-(4-(7-(3-аминоизохинолин-1-ил)-5,6,7,8-тетрагидрохиназолин-4-ил)пиперазин-1-ил)проп-2-ен-1-он (Пример 3а) и (S)-1-(4-(7-(3-аминоизохинолин-1-ил)-5,6,7,8-тетрагидрохиназолин-4-ил)пиперазин-1-ил)проп-2-ен-1-он (Пример 3b)

Раствор 1-[4-[7-[3-[бис[(4-метоксифенил)метил]амино]-1-изохинолил]-5,6,7,8-тетрагидрохиназолин-4-ил]пиперазин-1-ил]проп-2-ен-1-она (0,40 г, 0,42 ммоль) в трифторуксусной кислоте (2 мл) и дихлорметане (4 мл) перемешивали при 25°С в течение 30 минут. После завершения раствор концентрировали в вакууме. Потом неочищенное вещество очищали с помощью препаративной ВЭЖХ со следующими условиями: колонка YMC-Actus Triart C18 30×250 мм, 5 мкм; подвижная фаза А: вода (10 ммоль/л бикарбоната аммония), подвижная фаза В: ацетонитрил; скорость потока: 60 мл/мин; градиент: от 33% В до 52% В за 7 мин; 254/220 нм; Rt: 5,77 мин с получением продукта. Смесь энантиомеров разделяли с помощью препаративной ВЭЖХ со следующими условиями: колонка: CHIRALPAK ID-03, 2,0 см, В.Д. *25 см L (5 мкм); подвижная фаза А: гексан:дихлорметан=3:1 (10 мМ NH3-МЕОН)-ВЭЖХ, подвижная фаза В: ИПА--ВЭЖХ; скорость потока: 18 мл/мин; градиент: от 50 В до 50В за 22 мин; 220/254 нм; RT1: 12,518; RT2: 16,645, с получением указанных в заголовке соединений. Стереохимия указанных в заголовке соединений была приписана на основании данных активности.
Пример 3а: (R)-1-(4-(7-(3-аминоизохинолин-1-ил)-5,6,7,8-тетрагидрохиназолин-4-ил)пиперазин-1-ил)проп-2-ен-1-он (11,3 мг, 0,026 ммоль, выход 6,4%, белое твердое вещество). 1НЯМР (300 МГц, метанол-d4 м. д.) 5 8,50 (с, 1H), 8,14 (д, J=8,5 Гц, 1H), 7,64-7,54 (м, 1H), 7,52-7,45 (м, 1H), 7,31-7,20 (м, 1H), 6,84 (дд, J=16,8, 10,6 Гц, 1H), 6,69 (д, J=0,9 Гц, 1H), 6,27 (дд, J=16,8, 2,0 Гц, 1H), 5,81 (дд, J=10,6, 2,0 Гц, 1H), 4,27-4,11 (м, 1H), 3,96-3,71 (м, 4Н), 3,70-3,58 (м, 2Н), 3,52-3,35 (м, 3Н), 3,20-2,92 (м, 2Н), 2,81-2,66 (м, 1H), 2,23 (д, J=13,0 Гц, 1H), 2,07-1,88 (м, 1H). ЖХМС (ИЭР, m/z): 415,2 [М+Н]+. Хиральная ВЭЖХ: CHIRALPAK ID-3 (4,6*50 мм, 3 мкм); обнаружение на 254 нм; н-гексан/ИПА=50/50; скорость потока: 1 мл/мин; время удержания: 12,518 мин (более быстрый пик).
Пример 3b: (8)-1-(4-(7-(3-аминоизохинолин-1-ил)-5,6,7,8-тетрагидрохиназолин-4-ил)пиперазин-1-ил)проп-2-ен-1-он (11,5 мг, 0,028 ммоль, выход 6,6%, белое твердое вещество). 1НЯМР (300 МГц, метанол-d4 м. д.) 5 8,50 (с, 1H), 8,14 (д, J=8,5 Гц, 1H), 7,64-7,54 (м, 1H), 7,52-7,45 (м, 1H), 7,31-7,20 (м, 1H), 6,84 (дд, J=16,8, 10,6 Гц, 1H), 6,69 (д, J=0,9 Гц, 1H), 6,27 (дд, J=16,8, 2,0 Гц, 1H), 5,81 (дд, J=10,6, 2,0 Гц, 1H), 4,27-4,11 (м, 1H), 3,96-3,71 (м, 4Н), 3,70-3,58 (м, 2Н), 3,52-3,35 (м, 3Н), 3,20-2,92 (м, 2Н), 2,81-2,66 (м, 1H), 2,23 (д, J=13,0 Гц, 1H), 2,07-1,88 (м, 1H). ЖХМС (ИЭР, m/z): 415,2 [М+Н]+. Хиральная ВЭЖХ: CHIRALPAK ID-3 (4,6*50 мм, 3 мкм); обнаружение на 254 нм; н-гексан/ИПА=50/50; скорость потока: 1 мл/мин; время удержания: 16,645 мин (более медленный пик).
Примеры 4а и 4b

1-(4-((6S,7S)-7-(5-(гидроксиметил)-2-метилфенил)-6-метил-5,6,7,8-тетрагидрохиназолин-4-ил)пиперазин-1-ил)проп-2-ен-1-он (Пример 4а);
1-[4-[(6R,7R)-7-[5-(гидроксиметил)-2-метил-фенил]-6-метил-5,6,7,8-тетрагидрохиназолин-4-ил]пиперазин-1-ил]проп-2-ен-1-он (Пример 4b)
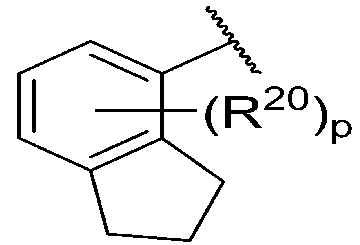
Этап 1: 2-[(3-бром-4-метил-фенил)метокси]тетрагидропиран

Раствор (3-бром-4-метил-фенил)метанола (9,00 г, 44,76 ммоль) и пара-толуолсульфоновой кислоты (3,85 г, 22,38 ммоль) в дихлорметане (40 мл) перемешивали при 25°С в течение 10 минут. Потом добавляли 3,4-дигидро-2h-пиран (7,53 г, 89,53 ммоль) и перемешивали при 25°С в течение 30 минут. После завершения реакцию гасили водным насыщенным раствором гидрокарбоната натрия и разводили дихлорметаном. Органический слой промывали водой, сушили над безводным сульфатом натрия и концентрировали в вакууме. Остаток очищали с помощью флэш-хроматографии на силикагеле с элюированием петролейным эфиром/этилацетатом (10/1) с получением 2-[(3-бром-4-метил-фенил)метокси]тетрагидропирана (9,20 г, 30,64 ммоль, выход 68,5%) в виде бесцветного масла.
Этап 2: 4,4,5,5-тетраметил-2-[2-метил-5-(тетрагидропиран-2-илоксиметил)фенил]-1,3,2-диоксаборолан
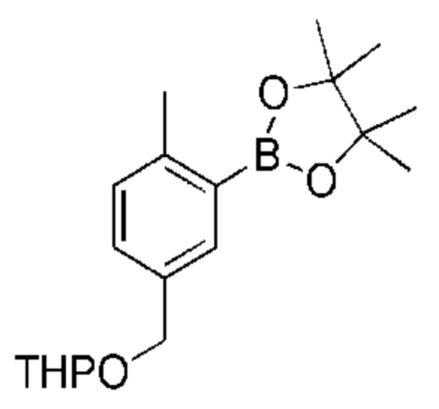
В атмосфере азота раствор 2-[(3-бром-4-метил-фенил)метокси]тетрагидропирана (9,20 г, 30,64 ммоль), бис(пинаколато)дибора (16,4 г, 64,52 ммоль), дихлорметанового комплекса 1,1'-бис(дифенилфосфино)ферроцен-палладия (II) дихлорида (2,63 г, 3,23 ммоль) и ацетата калия (6,32 г, 64,52 ммоль) в 1,4-диоксане (60 мл) перемешивали в течение 40 минут при 80°С. После завершения реакционную смесь разводили дихлорметаном. Органический слой промывали водой, сушили над безводным сульфатом натрия и концентрировали в вакууме. Остаток очищали с помощью флэш-хроматографии на силикагеле с элюированием петролейным эфиром/этилацетатом (10/1) с получением 4,4,5,5-тетраметил-2-[2-метил-5-(тетрагидропиран-2-илоксиметил)фенил]-1,3,2-диоксаборолана (9,00 г, 27,09 ммоль, выход 79,8%) в виде бесцветного масла.
Этап 3: 4-метил-3-[2-метил-5-(тетрагидропиран-2-илоксиметил)фенил]циклогексанон
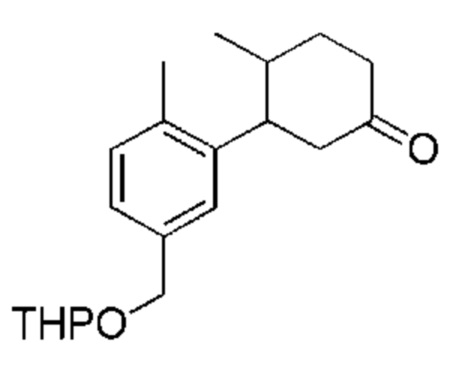
В атмосфере азота в раствор 4,4,5,5-тетраметил-2-[2-метил-5-(тетрагидропиран-2-илоксиметил)фенил]-1,3,2-диоксаборолана (9,00 г, 27,09 ммоль), 4-метилциклогекс-2-ен-1-она (3,28 г, 29,80 ммоль) и димера хлор(1,5-циклооктадиен)родия (I) (1,34 г, 2,71 ммоль) в 1,4-диоксане (50 мл) добавляли водный насыщенный раствор фосфата калия (10 мл) и перемешивали в течение 5 минут при 25°С. После завершения реакционную смесь концентрировали в вакууме, разводили дихлорметаном и промывали водой. Органический слой сушили над безводным сульфатом натрия и концентрировали в вакууме. Остаток очищали с помощью флэш-хроматографии на силикагеле с элюированием петролейным эфиром/этилацетатом (10/1) с получением 4-метил-3-[2-метил-5-(тетрагидропиран-2-илоксиметил)фенил]циклогексанона (4,50 г, 14,22 ммоль, выход 47,2%) в виде светло-желтого масла. ЖХМС: (ИЭР, m/z): 317,2 [М+Н]+
Этап 4: этил 5-метил-4-[2-метил-5-(тетрагидропиран-2-илоксиметил)фенил]-2-оксо-циклогексанкарбоксилат
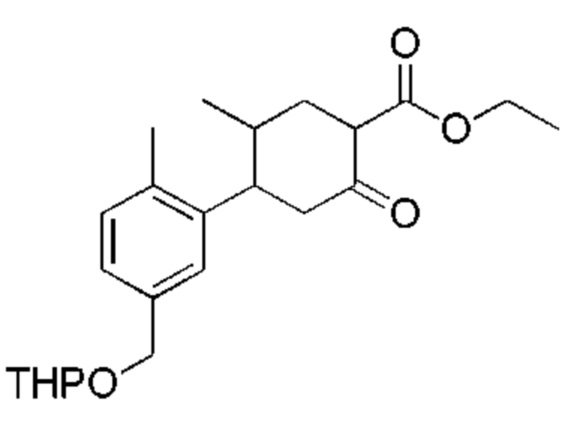
В атмосфере азота в раствор 4-метил-3-[2-метил-5-(тетрагидропиран-2-илоксиметил)фенил]циклогексанона (4,50 г, 14,22 ммоль) в тетрагидрофуране (70 мл) по каплям добавляли бис(триметилсилил)амид лития (14,22 мл, 14,22 ммоль, 1,0 М в тетрагидрофуране) и перемешивали в течение 10 минут при -78°С. Потом по каплям добавляли этилцианоформиат (1,69 г, 17,07 ммоль) и перемешивали при -78°С в течение 30 минут. После завершения реакцию гасили водой, концентрировали в вакууме, разводили дихлорметаном и промывали водой. Органический слой сушили над безводным сульфатом натрия и концентрировали в вакууме с получением неочищенного этил 5-метил-4-[2-метил-5-(тетрагидропиран-2-илоксиметил)фенил]-2-оксо-циклогексанкарбоксилате (5,00 г, неочищенный) в виде желтого масла. Неочищенный продукт непосредственно используют на следующем этапе без очистки. ЖХМС: (ИЭР, m/z): 389,2 [М+Н]+
Этап 5: 6-метил-7-[2-метил-5-(тетрагидропиран-2-илоксиметил)фенил]-5,6,7,8-тетрагидро-3Н-хиназолин-4-он
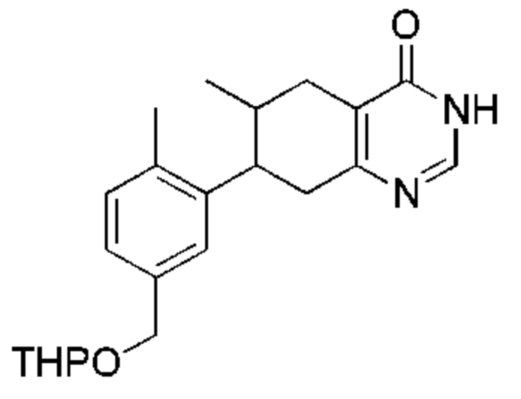
Раствор этил 5-метил-4-[2-метил-5-(тетрагидропиран-2-илоксиметил)фенил]-2-оксо-циклогексанкарбоксилата (3,00 г, 7,72 ммоль), формамидинацетата (4,02 г, 38,61 ммоль) и трет-бутоксид калия (6,07 г, 54,05 ммоль) в этаноле (40 мл) перемешивали при 120°С в течение 1 часа. После завершения реакцию разводили водой, доводили до РН=7,0 HCl/диоксаном, концентрировали в вакууме, экстрагировали этилацетатом и объединяли органические слои. Органический слой сушили над безводным сульфатом натрия и концентрировали в вакууме. Остаток очищали с помощью флэш-хроматографии на силикагеле с элюированием дихлорметаном/этилацетатом (3/1) с получением 6-метил-7-[2-метил-5-(тетрагидропиран-2-илоксиметил)фенил]-5,6,7,8-тетрагидро-3Н-хиназолин-4-она (1,50 г, 3,74 ммоль, выход 48,5%) в виде белого твердого вещества. ЖХМС: (ИЭР, m/z): 369,2 [М+Н]+
Этап 6: 1-[4-[6-метил-7-[2-метил-5-(тетрагидропиран-2-илоксиметил)фенил]-5,6,7,8-тетрагидрохиназолин-4-ил]пиперазин-1-ил]проп-2-ен-1-он
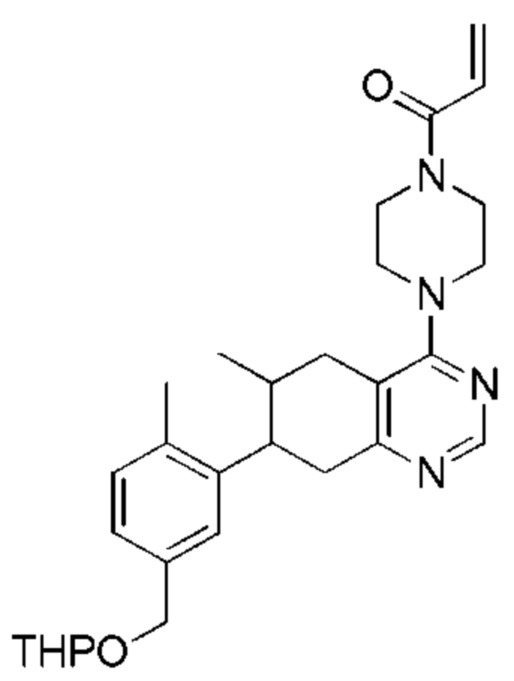
Раствор 6-метил-7-[2-метил-5-(тетрагидропиран-2-илоксиметил)фенил]-5,6,7,8-тетрагидро-3Н-хиназолин-4-она (1,00 г, 2,71 ммоль), пиперазина (1,17 г, 13,57 ммоль), бензотриазол-1-илокси)трис(диметиламино)фосфония гексафторфосфата (2,40 г, 5,430 ммоль) и 1,8-диазабицикло[5.4.0]ундец-7-ена (1,24 г, 8,14 ммоль) в хлороформе (10 мл) перемешивали при 60°С в течение 1 часа. После завершения реакционную смесь разводили дихлорметаном и промывали водой. Органический слой сушили над безводным сульфатом натрия и концентрировали в вакууме с получением неочищенного продукта. Потом раствор неочищенного продукта и этилдиизопропиламина (0,70 г, 5,43 ммоль) в дихлорметане (10 мл) перемешивали при комнатной температуре. Потом по каплям добавляли акрилоилхлорид (0,25 г, 2,71 ммоль) и перемешивали при комнатной температуре в течение 20 минут. После завершения реакцию гасили водой, разводили дихлорметаном, промывали солевым раствором, сушили над безводным сульфатом натрия и концентрировали в вакууме с получением неочищенного 1-[4-[6-метил-7-[2-метил-5-(тетрагидропиран-2-илоксиметил)фенил]-5,6,7,8-тетрагидрохиназолин-4-ил]пиперазин-1-ил]проп-2-ен-1-она (1,30 г, неочищенный). Неочищенный продукт непосредственно используют на следующем этапе без очистки. ЖХМС: (ИЭР, m/z): 491,3 [М+Н]+
Этап 7: 1-(4-((6S,7S)-7-(5-(гидроксиметил)-2-метилфенил)-6-метил-5,6,7,8-тетрагидрохиназолин-4-ил)пиперазин-1-ил)проп-2-ен-1-он (Пример 4а) и 1-[4-[(6R,7R)-7-[5-(гидроксиметил)-2-метил-фенил]-6-метил-5,6,7,8-тетрагидрохиназолин-4-ил]пиперазин-1-ил]проп-2-ен-1-он (Пример 4b)

Раствор 1-[4-[6-метил-7-[2-метил-5-(тетрагидропиран-2-илоксиметил)фенил]-5,6,7,8-тетрагидрохиназолин-4-ил]пиперазин-1-ил]проп-2-ен-1-она (1,30 г, 2,65 ммоль) в трифторуксусной кислоте (2 мл) и 1,2-дихлорэтане (5 мл) перемешивали при 25°С в течение 30 минут. После завершения реакционную смесь концентрировали в вакууме, разводили дихлорметаном, промывали солевым раствором, сушили над безводным сульфатом натрия и концентрировали в вакууме. Остаток очищали с помощью флэш-хроматографии на силикагеле с элюированием дихлорметан ом/этанол ом (10/1) с получением неочищенного вещества. Потом неочищенный продукт очищали с помощью препаративной ВЭЖХ со следующими условиями: колонка: колонка xbridge shield АРР8 OBD, 30*150 мм, 5 мкм; подвижная фаза А: вода (10 ммоль/л бикарбоната аммония), подвижная фаза В: ацетонитрил (0,1% диэтиламин); скорость потока: 60 мл/мин; градиент: от 23 В до 43 В за 7 мин; 254 нм; RT: 6,18 мин с получением продукта. Смесь энантиомеров разделяли с помощью хиральной препаративной ВЭЖХ со следующими условиями: колонка: chiralpak ic, 2*25 см, 5 мкм; подвижная фаза А: н-гексан/дихлорметан=3/1(10 мМ аммиак - метанол), подвижная фаза В: этанол; скорость потока: 40 мл/мин; градиент: от 30 В до 30 В за 19 мин; 220/254 нм) с получением указанных в заголовке соединений. Абсолютная конфигурация указанных в заголовке соединений была определена по данным активности и рентгенограммы белковой структуры соединения 21b.
Пример 4а: 1-(4-((6S,7S)-7-(5-(гидроксиметил)-2-метилфенил)-6-метил-5,6,7,8-тетрагидрохиназолин-4-ил)пиперазин-1-ил)проп-2-ен-1-он (57,5 мг, 0,14 ммоль, выход 5,3%, белое твердое вещество). 1Н ЯМР (300 МГц, ДМСО-d6, м. д.) 8,48 (с, 1H), 7,17 (с, 1H), 7,12 (д, J=7,8 Гц, 1H), 7,05 (дд, J=8,0, 1,6 Гц, 1H), 6,84 (дд, J=16,6, 10,4 Гц, 1H), 6,15 (дд, J=16,7, 2,4 Гц, 1H), 5,72 (дд, J=10,4, 2,5 Гц, 1H), 5,05 (т, J=5,7 Гц, 1H), 4,44 (д, J=5,7 Гц, 2Н), 3,84-3,43 (м, 6Н), 3,31-3,22 (м, 2Н), 3,13-2,91 (м, 2Н), 2,81-2,55 (м, 3Н), 2,31 (с, 3Н), 2,07-1,88 (м, 1H), 0,80 (д, J=6,4 Гц, 3Н). ЖХМС: (ИЭР, m/z): 407,2 [М+Н]+. Хиральная ВЭЖХ: CHIRALPAK IC-3 (4,6*50 мм, 3 мкм); обнаружение на 254 нм; н-гексан/этанол=70/30; скорость потока: 1 мл/мин; время удержания: 12,524 мин (более быстрый пик).
Пример 4b: 1-[4-[(6R,7R)-7-[5-(гидроксиметил)-2-метил-фенил]-6-метил-5,6,7,8-тетрагидрохиназолин-4-ил]пиперазин-1-ил]проп-2-ен-1-он (52,7 мг, 0,13 ммоль, выход 4,9%, белое твердое вещество). 1Н ЯМР (300 МГц, ДМСО-d6, м. д.) 8,48 (с, 1H), 7,17 (с, 1H), 7,12 (д, J=7,8 Гц, 1H), 7,05 (дд, J=8,0, 1,6 Гц, 1H), 6,84 (дд, J=16,6, 10,4 Гц, 1H), 6,15 (дд, J=16,7, 2,4 Гц, 1H), 5,72 (дд, J=10,4, 2,5 Гц, 1H), 5,05 (т, J=5,7 Гц, 1H), 4,44 (д, J=5,7 Гц, 2Н), 3,84-3,43 (м, 6Н), 3,31-3,22 (м, 2Н),3,13-2,91 (м, 2Н), 2,81-2,55 (м, 3Н), 2,31 (с, 3Н), 2,07-1,88 (м, 1H), 0,80 (д, J=6,4 Гц, 3Н). ЖХМС: (ИЭР, m/z): 407,2 [М+Н]+. Хиральная ВЭЖХ: CHIRALPAK IC-3 (4,6*50 мм, 3 мкм); обнаружение на 254 нм; н-гексан/этанол=70/30; скорость потока: 1 мл/мин; время удержания: 14,975 мин (более медленный пик).
Примеры 5а и 5b
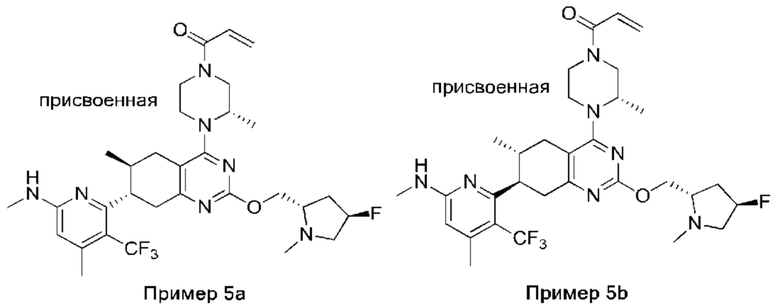
1-[(38)-4-[(6S,7S)-2-[[(2S,4R)-4-фтор-1-метил-пирролидин-2-ил]метокси]-6-метил-7-[4-метил-6-(метиламино)-3-(трифторметил)-2-пиридил]-5,6,7,8-тетрагидрохиназолин-4-ил]-3-метил-пиперазин-1-ил]проп-2-ен-1-он (Пример 5а);
1-[(3S)-4-[(6R,7R)-2-[[(2S,4R)-4-фтор-1-метил-пирролидин-2-ил]метокси]-6-метил-7-[4-метил-6-(метиламино)-3-(трифторметил)-2-пиридил]-5,6,7,8-тетрагидрохиназолин-4-ил]-3-метил-пиперазин-1-ил]проп-2-ен-1-он (Пример 5b)

Этап 1: 6-бром-N-[(4-метоксифенил)метил]-N,4-диметил-пиридин-2-амин

Раствор N-(4-метоксибензил)-N-метиламина (74,00 г, 489,90 ммоль) и 2,6-дибром-4-метилпиридина (41,00 г, 163,30 ммоль) в диметилсульфоксиде (100 мл) перемешивали при 100°С в течение 4 часов. После завершения реакционную смесь разводили водой, экстрагировали этилацетатом и объединяли органические слои. Органический слой промывали солевым раствором, сушили над безводным сульфатом натрия и концентрировали в вакууме. Остаток очищали с помощью флэш-хроматографии на силикагеле с элюированием петролейным эфиром/этилацетатом (8/1) с получением 6-бром-N-[(4-метоксифенил)метил]-N,4-диметил-пиридин-2-амина (44,00 г, 137,00 ммоль, выход 80,8%) в виде желтого масла. ЖХМС: (ИЭР, m/z): 321,1 [М+Н]+
Этап 2: [6-[(4-метоксифенил)метил-метил-амино]-4-метил-2-пиридил]бороновая кислота
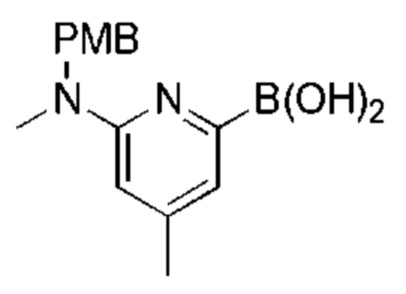
В атмосфере азота в раствор 6-бром-N-[(4-метоксифенил)метил]-N,4-диметил-пиридин-2-амина (44,00 г, 137,00 ммоль) в тетрагидрофуране (150 мл) по каплям добавляли n-BuLi (98,69 мл, 246,70 ммоль, 2,5 М в н-гексане) и перемешивали в течение 30 минут при -78°С. Потом добавляли триизопропил борат (77,3 г, 411,2 ммоль) и перемешивали при -78°С в течение 60 минут. После завершения реакционную смесь концентрировали в вакууме с получением неочищенного продукта. Неочищенный продукт [6-[(4-метоксифенил)метил-метил-амино]-4-метил-2-пиридил]бороновую кислоту (35,00 г, неочищенный) непосредственно используют на следующем этапе без очистки. ЖХМС: (ИЭР, m/z): 287,1 [М+Н]+
Этап 3: 3-[6-[(4-метоксифенил)метил-метил-амино]-4-метил-2-пиридил]-4-метил-циклогексанон
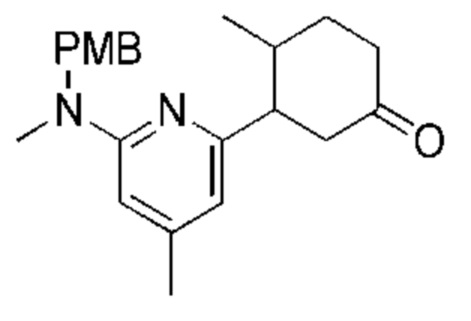
В атмосфере азота в раствор [6-[(4-метоксифенил)метил-метил-амино]-4-метил-2-пиридил]бороновой кислоты (35,00 г, неочищенная), 4-метилциклогекс-2-ен-1-она (21,60 г, 182,9 ммоль) и димера хлор(1,5-циклооктадиен)родия (I) (5,60 г, 12,19 ммоль) в 1,4-диоксане (100 мл) добавляли водный насыщенный раствор фосфата калия (20 мл) и перемешивали в течение 4 часов при 25°С. После завершения реакционную смесь концентрировали в вакууме, разводили дихлорметаном, промывали солевым раствором, сушили над безводным сульфатом натрия и концентрировали в вакууме. Остаток очищали с помощью флэш-хроматографии на силикагеле с элюированием петролейным эфиром/этилацетатом (5/1) с получением 3-[6-[(4-метоксифенил)метил-метил-амино]-4-метил-2-пиридил]-4-метил-циклогексанона (24,00 г, 68,18 ммоль, выход 57,2%) в виде желтого масла. ЖХМС: (ИЭР, m/z): 353,2 [М+Н]+
Этап 4: 3-[3-йодо-6-[(4-метоксифенил)метил-метил-амино]-4-метил-2-пиридил]-4-метил-циклогексанон
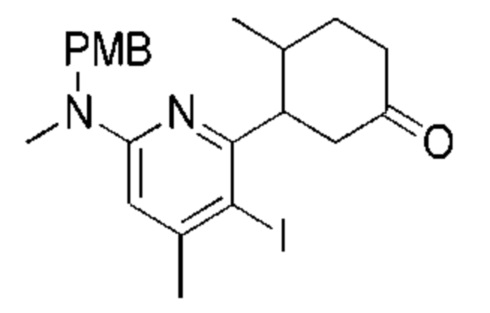
Раствор 3-[6-[(4-метоксифенил)метил-метил-амино]-4-метил-2-пиридил]-4-метил-циклогексанона (24,00 г, 68,18 ммоль) и N-йодосукцинимида (22,90 г, 102,30 ммоль) в ацетонитриле (80 мл) перемешивали при 25°С в течение 60 минут. После завершения реакционную смесь концентрировали в вакууме. Остаток очищали с помощью флэш-хроматографии на силикагеле с элюированием петролейным эфиром/этилацетатом (3/1) с получением 3-[3-йодо-6-[(4-метоксифенил)метил-метил-амино]-4-метил-2-пиридил]-4-метил-циклогексанона (14,00 г, 29,28 ммоль, выход 43,07%) в виде желтого масла. ЖХМС: (ИЭР, m/z): 479,1 [М+Н]+
Этап 5: 3-[6-[(4-метоксифенил)метил-метил-амино]-4-метил-3-(трифторметил)-2-пиридил]-4-метил-циклогексанон

В атмосфере азота раствор 3-[3-йодо-6-[(4-метоксифенил)метил-метил-амино]-4-метил-2-пиридил]-4-метил-циклогексанона (14,00 г, 29,28 ммоль), метил-2,2-дифтор-2-(фторсульфонил)ацетата (28,10 г, 146,30 ммоль) и йодида меди (I) (16,70 г, 87,80 ммоль) в N,N-диметилацетамиде (50 мл) перемешивали в течение 5 часов при 90°С. После фильтрации фильтрат собирали, разводили водой, экстрагировали этилацетатом и объединяли органические слои. Органический слой промывали солевым раствором, сушили над безводным сульфатом натрия и концентрировали в вакууме. Остаток очищали с помощью флэш-хроматографии на силикагеле с элюированием петролейным эфиром/этилацетатом (3/1) с получением 3-[6-[(4-метоксифенил)метил-метил-амино]-4-метил-3-(трифторметил)-2-пиридил]-4-метил-циклогексанона (9,00 г, 20,33 ммоль, выход 69,5%) в виде желтого масла. ЖХМС: (ИЭР, m/z): 421,2 [М+Н]+
Этап 6: этил 4-[6-[(4-метоксифенил)метил-метил-амино]-4-метил-3-(трифторметил)-2-пиридил]-5-метил-2-оксо-циклогексанкарбоксилат
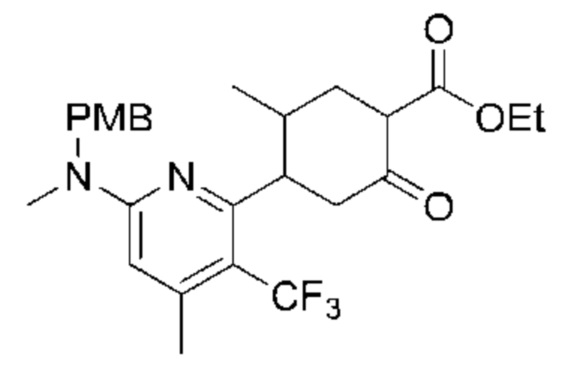
В атмосфере азота в раствор 3-[6-[(4-метоксифенил)метил-метил-амино]-4-метил-3-(трифторметил)-2-пиридил]-4-метил-циклогексанона (9,00 г, 21,40 ммоль) в тетрагидрофуране (50 мл) по каплям добавляли бис(триметилсилил)амид лития (32,1 мл, 32,11 ммоль, 1,0 М в тетрагидрофуране) и перемешивали в течение 20 минут при -78°С. Потом добавляли этилцианоформиат (2,55 г, 25,69 ммоль) и перемешивали при -78°С в течение 50 минут. После завершения реакцию гасили водой, концентрировали в вакууме, разводили дихлорметаном, промывали солевым раствором, сушили над безводным сульфатом натрия и концентрировали в вакууме с получением неочищенного продукта этил 4-[6-[(4-метоксифенил)метил-метил-амино]-4-метил-3-(трифторметил)-2-пиридил]-5-метил-2-оксо-циклогексанкарбоксилата (12,00 г, неочищенный), который непосредственно используют на следующем этапе без очистки. ЖХМС: (ИЭР, m/z): 493,2 [М+Н]+
Этап 7: 7-[6-[(4-метоксифенил)метил-метил-амино]-4-метил-3-(трифторметил)-2-пиридил]-6-метил-2-метилсульфанил-5,6,7,8-тетрагидрохиназолин-4-ол
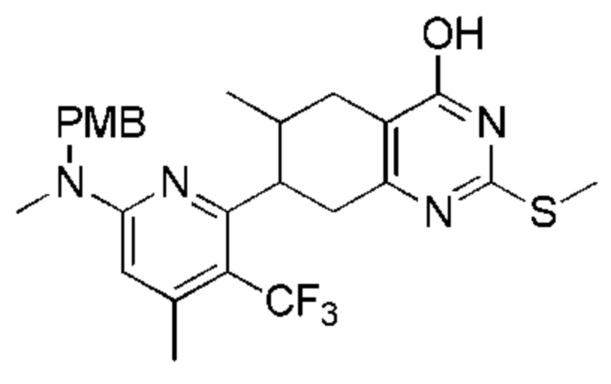
Раствор этил 4-[6-[(4-метоксифенил)метил-метил-амино]-4-метил-3-(трифторметил)-2-пиридил]-5-метил-2-оксо-циклогексанкарбоксилата (12,00 г, 15,84 ммоль), 2-метилизотиомочевины (14,30 г, 158,4 ммоль) и бикарбоната натрия (33,30 г, 395,90 ммоль) в этаноле (60 мл) и воде (12 мл) перемешивали при 50°С в течение 5 часов. После завершения реакционную смесь концентрировали в вакууме, разводили дихлорметаном, промывали солевым раствором, сушили над безводным сульфатом натрия и концентрировали в вакууме. Остаток очищали с помощью флэш-хроматографии на силикагеле с элюированием дихлорметаном/этилацетатом (1/1) с получением 7-[6-[(4-метоксифенил)метил-метил-амино]-4-метил-3-(трифторметил)-2-пиридил]-6-метил-2-метилсульфанил-5,6,7,8-тетрагидрохиназолин-4-ола (3,80 г, 7,33 ммоль, выход 44%) в виде белого твердого вещества. ЖХМС: (ИЭР, m/z): 519,2 [М+Н]+
Этап 8: трет-бутил (3S)-4-[7-[6-[(4-метоксифенил)метил-метил-амино]-4-метил-3-(трифторметил)-2-пиридил]-6-метил-2-метилсульфанил-5,6,7,8-тетрагидрохиназолин-4-ил]-3-метил-пиперазин-1-карбоксилат

В раствор 7-[6-[(4-метоксифенил)метил-метил-амино]-4-метил-3-(трифторметил)-2-пиридил]-6-метил-2-метилсульфанил-5,6,7,8-тетрагидрохиназолин-4-ола (3,80 г, 7,33 ммоль), N,N-диизопропилэтиламина (4,73 г, 36,64 ммоль) в дихлорметане (15 мл) добавляли трифторметансульфоновый ангидрид (3,72 г, 13,19 ммоль) и перемешивали при комнатной температуре в течение 30 минут. После завершения реакционную смесь концентрировали в вакууме с получением неочищенного вещества. Потом раствор неочищенного продукта и трет-бутил (3S)-3-метил-1-пиперазинкарбоксилата (14,68 г, 73,28 ммоль) в 1,4-диоксане (10 мл) перемешивали при 110°С в течение 5 часов. После завершения реакционную смесь концентрировали в вакууме. Остаток очищали с помощью флэш-хроматографии на силикагеле с элюированием дихлорметаном/этилацетатом (5/1) с получением трет-бутил (3S)-4-[7-[6-[(4-метоксифенил)метил-метил-амино]-4-метил-3-(трифторметил)-2-пиридил]-6-метил-2-метилсульфанил-5,6,7,8-тетрагидрохиназолин-4-ил]-3-метил-пиперазин-1-карбоксилата (4,00 г, 5,71 ммоль, выход 71,7%) в виде белого твердого вещества. ЖХМС: (ИЭР, m/z): 701,3 [М+Н]+
Этап 9: трет-бутил (3S)-4-[7-[6-[(4-метоксифенил)метил-метил-амино]-4-метил-3-(трифторметил)-2-пирид ил]-6-метил-2-метилсульфонил-5,6,7,8-тетрагидрохиназолин-4-ил]-3-метил-пиперазин-1-карбоксилат
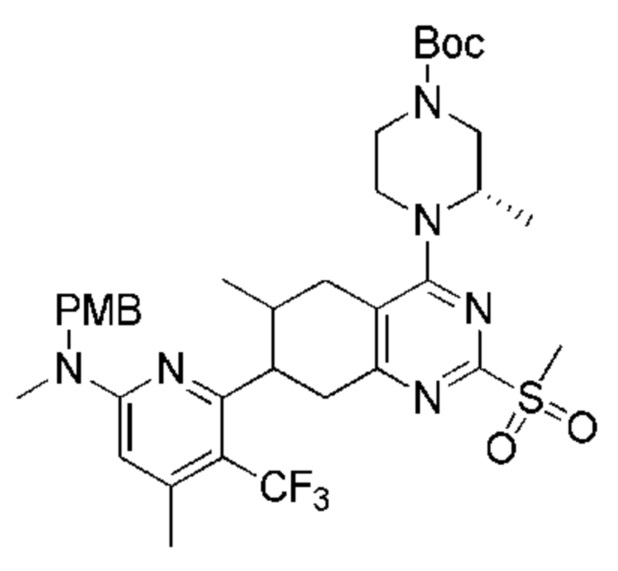
Раствор трет-бутил (3S)-4-[7-[6-[(4-метоксифенил)метил-метил-амино]-4-метил-3-(трифторметил)-2-пиридил]-6-метил-2-метилсульфанил-5,6,7,8-тетрагидрохиназолин-4-ил]-3-метил-пиперазин-1-карбоксилата (4,00 г, 5,71 ммоль) и 3-хлорпероксибензойной кислоты (1,97 г, 11,41 ммоль) в дихлорметане (20 мл) перемешивали при 25°С в течение 30 минут. После завершения реакционную смесь гасили водным насыщенным раствором бисульфита натрия, разводили дихлорметаном, промывали солевым раствором, сушили над безводным сульфатом натрия и концентрировали в вакууме с получением трет-бутил (3S)-4-[7-[6-[(4-метоксифенил)метил-метил-амино]-4-метил-3-(трифторметил)-2-пиридил]-6-метил-2-метилсульфонил-5,6,7,8-тетрагидрохиназолин-4-ил]-3-метил-пиперазин-1-карбоксилата (5,00 г, неочищенный) в виде желтого масла. ЖХМС: (ИЭР, m/z): 733,3 [М+Н]+
Этап 10: трет-бутил (3S)-4-[2-[[(2S,4R)-4-фтор-1-метил-пирролидин-2-ил]метокси]-7-[6-[(4-метоксифенил)метил-метил-амино]-4-метил-3-(трифторметил)-2-пиридил]-6-метил-5,6,7,8-тетрагидрохиназолин-4-ил]-3-метил-пиперазин-1-карбоксилат

В раствор [(2S,4R)-4-фтор-1-метил-пирролидин-2-ил]метанола (1,83 г, 13,71 ммоль) в N,N-диметилформамиде (20 мл) добавляли гидрид натрия (0,44 г, 14,67 ммоль, 60% дисперсия в минеральном масле) и перемешивали при 0°С в течение 10 минут. Потом добавляли трет-бутил (3S)-4-[7-[6-[(4-метоксифенил)метил-метил амино]-4-метил-3-(трифторметил)-2-пиридил]-6-метил-2-метилсульфонил-5,6,7,8-тетрагидрохиназолин-4-ил]-3-метил-пиперазин-1-карбоксилат (5,00 г, 4,57 ммоль) и перемешивали при 0°С в течение 30 минут. После завершения реакционную смесь гасили водой, экстрагировали этилацетатом, сушили над безводным сульфатом натрия и концентрировали в вакууме. Остаток очищали с помощью флэш-хроматографии на силикагеле с элюированием дихлорметаном/метанолом (10/1) с получением трет-бутил (3S)-4-[2-[[(2S,4R)-4-фтор-1-метил-пирролидин-2-ил]метокси]-7-[6-[(4-метоксифенил)метил-метил-амино]-4-метил-3-(трифторметил)-2-пиридил]-6-метил-5,6,7,8-тетрагидрохиназолин-4-ил]-3-метил-пиперазин-1-карбоксилата (1,80 г, 2,06 ммоль, выход 45,1%) в виде белого твердого вещества. ЖХМС: (ИЭР, m/z): 786,4 [М+Н]+
Этап 11: 1-[(3S)-4-[(6S,7S)-2-[[(2S,4R)-4-фтор-l-метил-пирролидин-2-ил]метокси]-6-метил-7-[4-метил-6-(метиламино)-3-(трифторметил)-2-пиридил]-5,6,7,8-тетрагидрохиназолин-4-ил]-3-метил-пиперазин-1-ил]проп-2-ен-1-он (Пример 5а); 1-[(3S)-4-[(6R,7R)-2-[[(2S,4R)-4-фтор-1-метил-пирролидин-2-ил]метокси]-6-метил-7-[4-метил-6-(метиламино)-3-(трифторметил)-2-пиридил]-5,6,7,8 -тетрагидрохиназолин-4-ил]-3-метил-пиперазин-1-ил]проп-2-ен-1-он (Пример 5b)

Раствор трет-бутил (3S)-4-[2-[[(2S,4R)-4-фтор-1-метил-пирролидин-2-ил]метокси]-7-[6-[(4-метоксифенил)метил-метил-амино]-4-метил-3-(трифторметил)-2-пиридил]-6-метил-5,6,7,8-тетрагидрохиназолин-4-ил]-3-метил-пиперазин-1-карбоксилата (1,00 г, 1,270 ммоль) в трифторуксусной кислоте (8 мл) перемешивали при 50°С в течение 20 минут. После завершения реакционную смесь концентрировали в вакууме. Неочищенный продукт 6-[2-[[(2S,4R)-4-фтор-1-метил-пирролидин-2-ил]метокси]-6-метил-4-[(2S)-2-метилпиперазин-1-ил]-5,6,7,8-тетрагидрохиназолин-7-ил]-N,4-диметил-5-(трифторметил)пиридин-2-амин (1,50 г, неочищенный) непосредственно используют на следующем этапе без очистки. Потом раствор 6-[2-[[(2S,4R)-4-фтор-1-метил-пирролидин-2-ил]метокси]-6-метил-4-[(2S)-2-метилпиперазин-1-ил]-5,6,7,8-тетрагидрохиназолин-7-ил]-N,4-диметил-5-(трифторметил)пиридин-2-амина (1,50 г, неочищенный) и N,N-диизопропилэтиламина (0,77 г, 5,97 ммоль) в дихлорметане (10 мл) перемешивали при -78°С. Потом добавляли акрилоилхлорид (0,110 г, 1,190 ммоль) и перемешивали при -78°С в течение 30 минут. После завершения реакционную смесь гасили водой, разводили дихлорметаном, промывали солевым раствором, сушили над безводным сульфатом натрия и концентрировали в вакууме. Остаток очищали с помощью флэш-хроматографии на силикагеле с элюированием дихлорметаном/метанолом (10/1) с получением продукта. Неочищенный продукт очищали с помощью препаративной ВЭЖХ со следующими условиями: колонка: колонка XBridge Prep OBD С18, 30×150 мм, 5 мкм; подвижная фаза А: вода (10 ммоль/л бикарбоната аммония), подвижная фаза В: ацетонитрил; скорость потока: 60 мл/мин; градиент: от 45 В до 75 В за 7 мин; 254 нм; RT: 5,67 мин, с получением необходимого продукта. Смесь диастереоизомеров разделяли с помощью препаративной хиральной ВЭЖХ со следующими условиями: колонка: CHIRALPAK IF, 2*25 см, 5 мкм; подвижная фаза А: гексан (8 ммоль/л аммиака, метанол) --ВЭЖХ, подвижная фаза В: этанол --ВЭЖХ; скорость потока: 20 мл/мин; градиент: от 15 В до 15 В за 33 мин; 254/220 нм; вводимый объем: 0,5 мл; число прогонов: 14, с получением указанных в заголовке соединений. Абсолютная конфигурация указанных в заголовке соединений была определена по данным активности и рентгенограммы белковой структуры соединения 21b.
Пример 5а: 1-[(3S)-4-[(6S,7S)-2-[[(2S,4R)-4-фтор-1-метил-пирролидин-2-ил] метокси]-6-метил-7-[4-метил-6-(метиламино)-3 -(трифторметил)-2-пиридил]-5,6,7,8-тетрагидрохиназолин-4-ил]-3-метил-пиперазин-1-ил]проп-2-ен-1-он (96,2 мг, 0,15 ммоль, выход 13%, белое твердое вещество). 1Н ЯМР (300 МГц, ДМСО-d6, м.д.) δ 6,97 (к, J=4,6 Гц, 1H), 6,92-6,72 (м, 1H), 6,25-6,10 (м, 2Н), 5,72 (дд, J=10,3, 2,4 Гц, 1H), 5,19 (д, J=27,0, 1H), 4,47-3,76 (м, 6Н), 3,55-3,37 (м, 3Н), 3,23-3,04 (м, 3Н), 3,03-2,84 (м, 2Н), 2,82-2,62 (м, 4Н), 2,50-2,36 (м, 5Н), 2,30 (с, 3Н), 2,22-2,01 (м, 2Н), 1,99-1,74 (м, 1H), 1,24 (шир. с, 3Н), 0,74 (д, J=6,3 Гц, ЗН). ЖХМС: (ИЭР, m/z): 620,3 [М+Н]+. Хиральная ВЭЖХ: CHIRALPAK IG-3 (4,6*50 мм, 3 мкм); обнаружение на 254 нм; н-гексан/этанол = 90/10; скорость потока: 1 мл/мин; время удержания: 15,5 мин (более медленный пик).
Пример 5b: 1-[(3S)-4-[(6R,7R)-2-[[(2S,4R)-4-фтор-1-метил-пирролидин-2-ил]метокси]-6-метил-7-[4-метил-6-(метиламино)-3-(трифторметил)-2-пиридил]-5,6,7,8-тетрагидрохиназолин-4-ил]-3-метил-пиперазин-1-ил]проп-2-ен-1-он (101,8 мг, 0,16 ммоль, выход 13,6%, белое твердое вещество). 1Н ЯМР (300 МГц, ДМСО-d6, м.д.) δ 6,96 (к, J=4,5 Гц, 1H), 6,91- 6,73 (м, 1H), 6,25-6,11 (м, 2Н), 5,72 (дд, J=10,4, 2,4 Гц, 1H), 5,21 (д, J=25,5 Гц, 1H), 4,39-3,54 (м, 6Н), 3,53-3,35 (м, 3Н), 3,21-2,97 (м, 3Н), 2,95-2,68 (м, 6Н), 2,62-2,52 (м, 1H), 2,48-2,42 (м, 1H), 2,38 (с, 3Н), 2,31 (с, 3Н), 2,21-1,71 (м, 3Н), 0,98 (д, J=7,1 Гц, 3Н), 0,74 (д, J=6,3 Гц, 3Н). ЖХМС: (ИЭР, m/z): 620,3 [М+Н]+. Хиральная ВЭЖХ: CHIRALPAK IG-3 (4,6*50 мм, 3 мкм); обнаружение на 254 нм; н-гексан/этанол = 90/10; скорость потока: 1 мл/мин; время удержания: 12,0 мин (более быстрый пик).
Примеры 6а и 6b

1-[4-[(7S)-7-индан-4-ил-5,6,7,8-тетрагидрохиназолин-4-ил]пиперазин-1-ил]проп-2-ен-1-он (Пример 6а);
1-[4-[(7R)-7-индан-4-ил-5,6,7,8-тетрагидрохиназолин-4-ил]пиперазин-1-ил]проп-2-ен-1-он (Пример 6b)
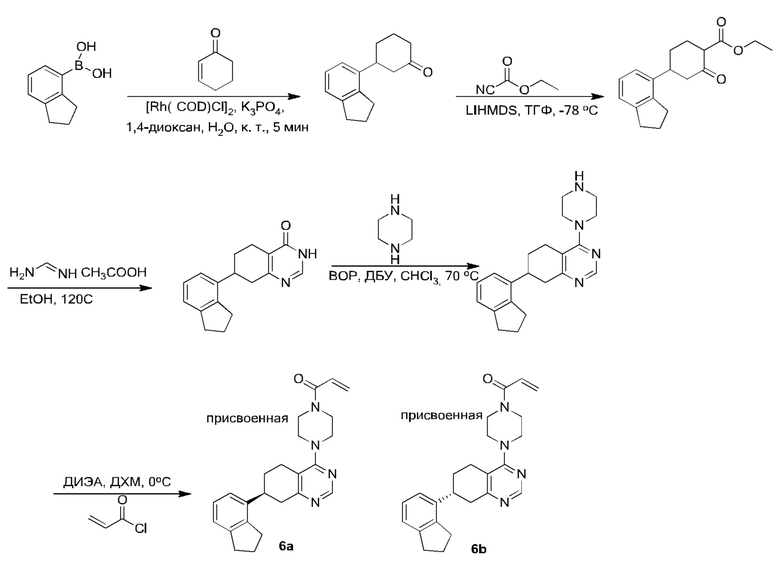
Этап 1: 3-индан-4-илциклогексанон
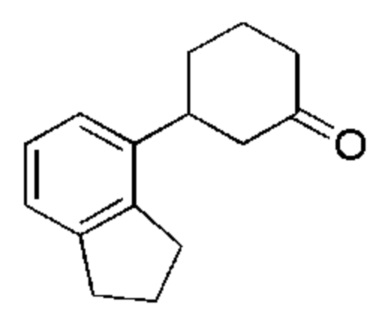
В атмосфере азота в раствор индан-4-илбороновой кислоты (10,0 г, 40,13 ммоль), 2-циклогексен-1-оны (19,30 г, 200,60 ммоль) и димера хлор(1,5-циклооктадиен)родия (I) (1,98 г, 4,01 ммоль) в 1,4-диоксане (30 мл) добавляли водный насыщенный раствор фосфата калия (6 мл) и перемешивали в течение 30 минут при 25°С. После завершения реакционную смесь разводили дихлорметаном, промывали солевым раствором, сушили над безводным сульфатом натрия и концентрировали в вакууме. Остаток очищали с помощью флэш-хроматографии на силикагеле с элюированием петролейным эфиром/этил ацетатом (5/1) с получением 3-индан-4-илциклогексанона (4,50 г, 19,73 ммоль, выход 49,2%) в виде желтого масла. ЖХМС: (ИЭР, m/z): 215,1 [М+Н]+
Этап 2: этил 4-индан-4-ил-2-оксо-циклогексанкарбоксилат

В атмосфере азота в раствор 3-индан-4-илциклогексанона (2,00 г, 9,33 ммоль) в тетрагидрофуране (15 мл) по каплям добавляли бис(триметилсилил)амид лития (12,1 мл, 12,13 ммоль, 1,0 М в тетрагидрофуране) и перемешивали в течение 20 минут при -78°С. Потом по каплям добавляли этилцианоформиат (1,11 г, 11,20 ммоль) и перемешивали при -78°С в течение 30 минут. После завершения реакционную смесь гасили водой, разводили дихлорметаном, промывали солевым раствором, сушили над безводным сульфатом натрия и концентрировали в вакууме с получением неочищенного этил 4-индан-4-ил-2-оксо-циклогексанкарбоксилата (2,00 г, 5,59 ммоль, выход 59,9%) в виде желтого масла. ЖХМС: (ИЭР, m/z): 287,2 [М+Н]+
Этап 3: 7-индан-4-ил-5,6,7,8-тетрагидро-3Н-хиназолин-4-он

Раствор этил 4-индан-4-ил-2-оксо-циклогексанкарбоксилата (2,00 г, 5,59 ммоль), формамидинацетата (2,91 г, 27,94 ммоль) и трет-бутоксида натрия (3,76 г, 39,11 ммоль) в этаноле (20 мл) перемешивали при 120°С в течение 3 часов. После завершения реакционную смесь концентрировали в вакууме. Остаток очищали с помощью флэш-хроматографии на силикагеле с элюированием дихлорметаном/этилацетатом (5/1) с получением 7-индан-4-ил-5,6,7,8-тетрагидро-3Н-хиназолин-4-она (0,80 г, 3,01 ммоль, выход 51,1%) в виде белого твердого вещества. ЖХМС: (ИЭР, m/z): 267,1 [М+Н]+
Этап 4: 7-индан-4-ил-4-пиперазин-1-ил-5,6,7,8-тетрагидрохиназолин
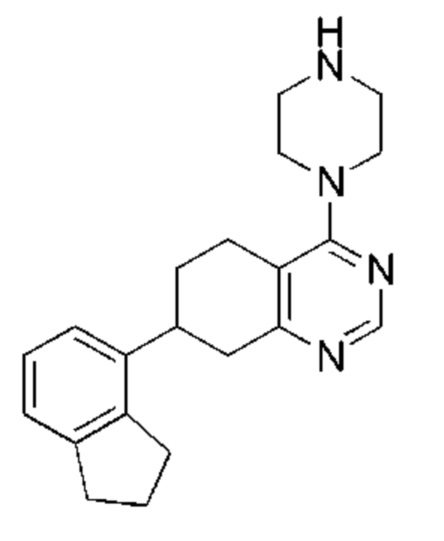
Раствор 7-индан-4-ил-5,6,7,8-тетрагидро-3Н-хиназолин-4-она (0,78 г, 2,93 ммоль), пиперазина (1,26 г, 14,64 ммоль), 1,8-диазабицикло[5.4.0]ундец-7-ена (1,34 г, 8,79 ммоль) и бензотриазол-1-илокси)трис(диметиламино)фосфония гексафторфосфата (2,59 г, 5,86 ммоль) в хлороформе (10 мл) перемешивали при 70°С в течение 2 часов. После завершения реакционную смесь концентрировали в вакууме. Неочищенный продукт очищали с помощью обращенно-фазовой хроматографии с получением необходимого продукта 7-индан-4-ил-4-пиперазин-1-ил-5,6,7,8-тетрагидрохиназолина (0,64 г, 1,91 ммоль, выход 53,6%) в виде белого твердого вещества. ЖХМС: (ИЭР, m/z): 335,2 [М+Н]+
Этап 5: 1-[4-[(7S)-7-индан-4-ил-5,6,7,8-тетрагидрохиназолин-4-ил]пиперазин-1-ил]проп-2-ен-1-он (Пример 6а); 1-[4-[(7R)-7-индан-4-ил-5,6,7,8-тетрагидрохиназолин-4-ил]пиперазин-1-ил]проп-2-ен-1-он (Пример 6b)

Раствор 7-индан-4-ил-4-пиперазин-1-ил-5,6,7,8-тетрагидрохиназолина (0,64 г, 1,91 ммоль) и N,N-диизопропилэтиламина (0,49 г, 3,83 ммоль) в дихлорметане (8 мл) перемешивали при 25°С. Потом добавляли акрилоилхлорид (0,17 г, 1,91 ммоль) и перемешивали при 25°С в течение 20 минут. После завершения реакционную смесь гасили водой, разводили дихлорметаном, промывали водой, сушили над безводным сульфатом натрия и концентрировали в вакууме. Остаток очищали с помощью флэш-хроматографии на силикагеле с элюированием дихлорметаном/метанолом (10/1) с получением продукта. Смесь энантиомеров разделяли с помощью хиральной препаративной ВЭЖХ со следующими условиями: колонка: CHIRALPAK IF, 3*25 см, 5 мкм; подвижная фаза А: гексан : дихлорметан = 3:1 (10 мМ аммиак - метанол) --ВЭЖХ, подвижная фаза В: этанол --ВЭЖХ; скорость потока: 45 мл/мин; градиент: от 10 В до 10 В за 20 мин; 254 нм; вводимый объем: 1,5 мл; число прогонов: 8, с получением указанных в заголовке соединений. Абсолютная конфигурация указанных в заголовке соединений была определена по данным активности и рентгенограммы белковой структуры соединения 21b.
Пример 6а: 1-[4-[(7S)-7-индан-4-ил-5,6,7,8-тетрагидрохиназолин-4-ил]пиперазин-1-ил]проп-2-ен-1-он (17,9 мг, 0,45 ммоль, выход 23,6%, белое твердое вещество). 1Н ЯМР (300 МГц, хлороформ-d, м.д.) 8,60 (с, 1H), 7,15 (д, J=5,7 Гц, 2Н), 7,00 (дд, J=5,7, 3,1 Гц, 1H), 6,60 (дд, J=16,8, 10,5 Гц, 1H), 6,33 (дд, J=16,8, 1,9 Гц, 1H), 5,74 (дд, J=10,5, 1,9 Гц, 1H), 3,79 (шир. с, 3Н), 3,72- 3,57 (м, 1H), 3,51 (дт, J=13,0, 5,0 Гц, 2Н), 3,43-3,12 (м, 4Н), 3,18-2,82 (м, 5Н), 2,77- 2,65(м, 2Н), 2,20-2,02 (м, 3Н), 1,92-1,74 (м, 1H). ЖХМС: (ИЭР, m/z): 389,2 [М+Н]+. Хиральная ВЭЖХ: CHIRALPAK IF-3 (4,6*50 мм, 3 мкм); обнаружение на 254 нм; н-гексан/этанол = 85/15; скорость потока: 1 мл/мин; время удержания: 12,417 мин (более быстрый пик).
Пример 6b: 1-[4-[(7R)-7-индан-4-ил-5,6,7,8 -тетрагидрохиназолин-4-ил]пиперазин-1-ил]проп-2-ен-1-он (17,7 мг, 0,45 ммоль, выход 23,3%, белое твердое вещество). 1Н ЯМР (300 МГц, хлороформ-d, м.д.) 8,60 (с, 1H), 7,15 (д, J=5,7 Гц, 2Н), 7,00 (дд, J=5,7, 3,1 Гц, 1H), 6,60 (дд, J=16,8, 10,5 Гц, 1H), 6,33 (дд, J=16,8, 1,9 Гц, 1H), 5,74 (дд, J=10,5, 1,9 Гц, 1H), 3,79 (шир. с, 3Н), 3,72- 3,57 (м, 1H), 3,51 (дт, J=13,0, 5,0 Гц, 2Н), 3,43-3,12 (м, 4Н), 3,18-2,82 (м, 5Н), 2,77- 2,65(м, 2Н), 2,20-2,02 (м, 3Н), 1,92-1,74 (м, Ш). ЖХМС: (ИЭР, m/z): 389,2 [М+Н]+. Хиральная ВЭЖХ: CHIRALPAK IF-3 (4,6*50 мм, 3 мкм); обнаружение на 254 нм; н-гексан/этанол = 85/15; скорость потока: 1 мл/мин; время удержания: 14,642 мин (более медленный пик).
Пример 7а

4-[7-(3-гидрокси-1-нафтил)-2-[[(2S)-1-метилпирролидин-2-ил]метокси]-5,6,7,8-тетрагидрохиназолин-4-ил]-1-проп-2-еноил-пиперидин-4-карбонитрил

Этап 1: трет-бутил 4-[7-[3-[трет-бутил(диметил)силил]окси-1-нафтил]-2-метил сульфанил-5,6,7,8-тетрагидрохиназолин-4-ил]-4-циано-пиперидин-1-карбоксилат

В атмосфере азота в раствор l-Boc-4-цианопиперидина (2,16 г, 10,26 ммоль) в тетрагидрофуране (20 мл) добавляли бис(триметилсилил)амид лития (12,83 мл, 12,83 ммоль, 1,0 М в тетрагидрофуране) и перемешивали в течение 10 минут при -78°С. Потом добавляли [7-[3-[трет-бутил(диметил)силил]окси-1-нафтил]-2-метилсульфанил-5,6,7,8-тетрагидрохиназолин-4-ил]трифторметансульфонат (3,00 г, 5,13 ммоль) и перемешивали при -78°С в течение 30 минут. После завершения реакцию гасили водой, разводили дихлорметаном, промывали солевым раствором, сушили над безводным сульфатом натрия и концентрировали в вакууме. Остаток очищали с помощью флэш-хроматографии на силикагеле с элюированием петролейным эфиром/этилацетатом (5/1) с получением трет-бутил 4-[7-[3-[трет-бутил(диметил)силил]окси-1-нафтил]-2-метилсульфанил-5,6,7,8-тетрагидрохиназолин-4-ил]-4-циано-пиперидин-1-карбоксилата (2,30 г, 3,35 ммоль, выход 65,3%) в виде желтого масла. ЖХМС: (ИЭР, m/z): 645,3 [М+Н]+
Этап 2: трет-бутил 4-[7-[3-[трет-бутил(диметил)силил]окси-1-нафтил]-2-метилсульфонил-5,6,7,8-тетрагидрохиназолин-4-ил]-4-циано-пиперидин-1-карбоксилат

Раствор 3-хлорпероксибензойной кислоты (0,80 г, 4,65 ммоль) и трет-бутил 4-[7-[3-[трет-бутил(диметил)силил]окси-1-нафтил]-2-метилсульфанил-5,6,7,8-тетрагидрохиназолин-4-ил]-4-циано-пиперидин-1-карбоксилата (1,00 г, 1,55 ммоль) в дихлорметане (15 мл) перемешивали при 25°С в течение 30 минут. После завершения реакцию гасили водным насыщенным раствором сульфита натрия, разводили дихлорметаном и промывали водой. Органический слой сушили над безводным сульфатом натрия и концентрировали в вакууме с получением неочищенного трет-бутил 4-[7-[3-[трет-бутил(диметил)силил]окси-1-нафтил]-2-метилсульфонил-5,6,7,8-тетрагидрохиназолин-4-ил]-4-циано-пиперидин-1-карбоксилата (1,00 г, неочищенный). ЖХМС: (ИЭР, m/z): 677,3 [М+Н]+
Этап 3: трет-бутил 4-[7-[3-[трет-бутил(диметил)силил]окси-1-нафтил]-2-[[(2S)-1-метил пирролидин-2-ил]метокси]-5,6,7,8-тетрагидрохиназолин-4-ил]-4-циано-пиперидин-1-карбоксилат
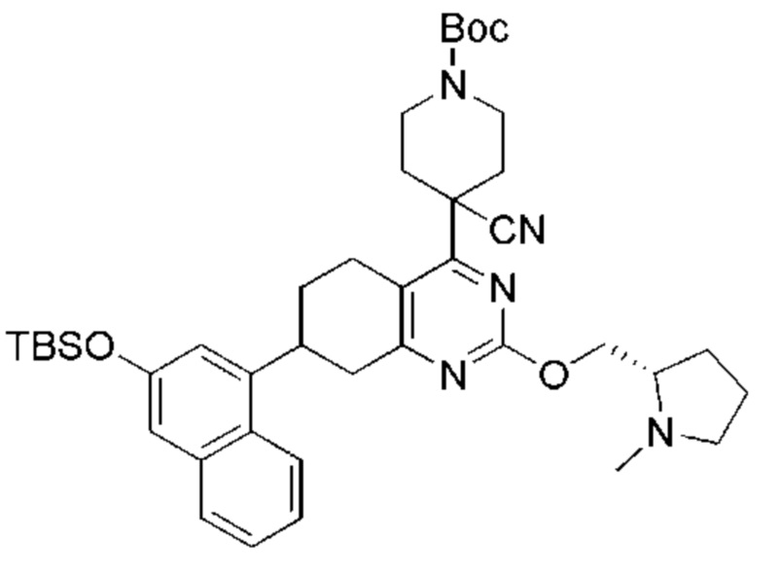
В раствор N-метил-L-пролинол (0,38 г, 3,32 ммоль) в ДМФ (30 мл) добавляли гидрид натрия (0,22 г, 5,54 ммоль, 60% дисперсия в минеральном масле) и перемешивали при 25°С в течение 20 минут.Потом добавляли неочищенный трет-бутил 4-[7-[3-[трет-бутил(диметил)силил]окси-1-нафтил]-2-метилсульфонил-5,6,7,8-тетрагидрохиназолин-4-ил]-4-циано-пиперидин-1-карбоксилат (1,00 г, 1,11 ммоль) и перемешивали при 25°С в течение 30 минут. После завершения реакцию гасили водой, разводили дихлорметаном, промывали солевым раствором, сушили над безводным сульфатом натрия и концентрировали в вакууме. Остаток очищали с помощью флэш-хроматографии на силикагеле с элюированием дихлорметаном/метанолом (8/1) с получением трет-бутил 4-[7-[3-[трет-бутил(диметил)силил]окси-1-нафтил]-2-[[(2S)-1-метилпирролидин-2-ил]метокси]-5,6,7,8-тетрагидрохиназолин-4-ил]-4-циано-пиперидин-1-карбоксилата (0,40 г, 0,56 ммоль, выход 45,6%) в виде желтого твердого вещества. ЖХМС: (ИЭР, m/z): 712,4 [М+Н]+
Этап 4: 4-[7-[3-[трет-бутил(диметил)силил]окси-1-нафтил]-2-[[(2S)-1-метилпирролидин-2-ил]метокси]-5,6,7,8-тетрагидрохиназолин-4-ил]-1-проп-2-еноил-пиперидин-4-карбонитрил
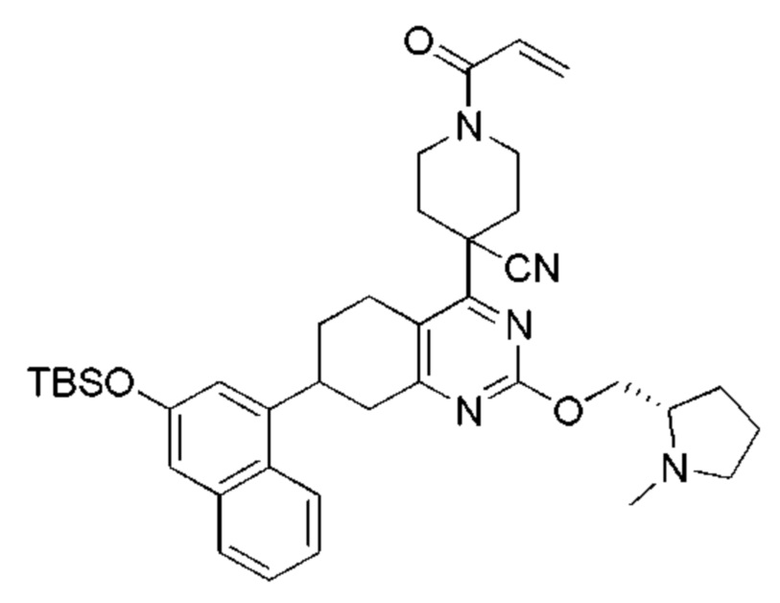
Раствор трет-бутил 4-[7-[3-[трет-бутил(диметил)силил]окси-1-нафтил]-2-[[(2S)-1-метил пирролидин-2-ил]метокси]-5,6,7,8-тетрагидрохиназолин-4-ил]-4-циано-пиперидин-1-карбоксилата (0,40 г, 0,56 ммоль) и трифторуксусной кислоты (1 мл) в дихлорметане (6 мл) перемешивали при 25°С в течение 20 минут. После завершения реакционную смесь концентрировали в вакууме с получением неочищенного продукта. Потом раствор неочищенного продукта и N,N-диизопропилэтиламина (0,22 г, 1,69 ммоль) в дихлорметане (6 мл) перемешивали в течение 10 минут при 25°С. Потом добавляли акрилоилхлорид (0,05 г, 0,56 ммоль) и перемешивали при 25°С в течение 30 минут. После завершения реакцию гасили водой, разводили дихлорметаном, промывали солевым раствором, сушили над безводным сульфатом натрия и концентрировали в вакууме с получением неочищенного продукта 4-[7-[3-[трет-бутил(диметил)силил]окси-1-нафтил]-2-[[(2S)-1-метилпирролидин-2-ил]метокси]-5,6,7,8-тетрагидрохиназолин-4-ил]-1-проп-2-еноил-пиперидин-4-карбонитрила (0,20 г, неочищенный). ЖХМС: (ИЭР, m/z): 666,4 [М+Н]+
Этап 5: 4-[7-(3-гидрокси-1-нафтил)-2-[[(2S)-1-метилпирролидин-2-ил]метокси]-5,6,7,8-тетрагидрохиназолин-4-ил]-1-проп-2-еноил-пиперидин-4-карбонитрил
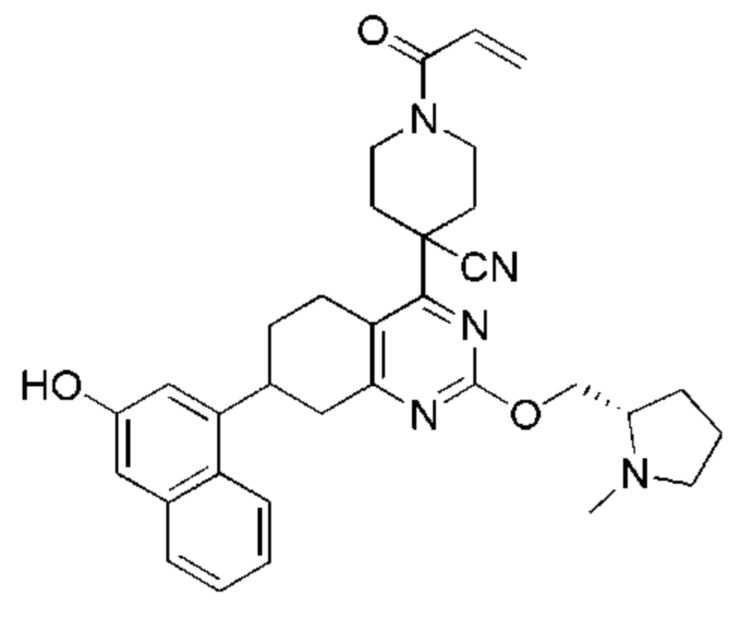
Раствор 4-[7-[3-[трет-бутил(диметил)силил]окси-1-нафтил]-2-[[(2S)-1-метилпирролидин-2-ил]метокси]-5,6,7,8-тетрагидрохиназолин-4-ил]-1-проп-2-еноил-пиперидин-4-карбонитрила (0,20 г, 0,20 ммоль) и фторида цезия (0,09 г, 0,60 ммоль) в тетрагидрофуране (2 мл) перемешивали при 25°С в течение 30 минут. После завершения реакционную смесь концентрировали в вакууме. Остаток очищали с помощью флэш-хроматографии на силикагеле с элюированием дихлорметаном/метанолом (10/1) с получением смеси четырех соединений. Неочищенный продукт очищали с помощью препаративной ВЭЖХ со следующими условиями: колонка: колонка XBridge Shield RP18 OBD, 30*150 мм, 5 мкм; подвижная фаза А: вода (10 ммоль/л бикарбоната аммония), подвижная фаза В: ацетонитрил; скорость потока: 60 мл/мин; градиент: от 38 В до 57 В за 7 мин; 254 нм; RT: 6,52 мин с получением продукта 4-[7-(3-гидрокси-1-нафтил)-2-[[(2S)-1-метилпирролидин-2-ил] метокси]-5,6,7,8-тетрагидрохиназолин-4-ил]-1-проп-2-еноил-пиперидин-4-карбонитрила (55,7 мг, 0,10 ммоль, выход 18,8%) в виде желтого твердого вещества. ЖХМС: (ИЭР, m/z): 552,3 [М+Н]+.
Пример 7а: 1Н ЯМР (300 МГц, ДМСО-d6, м.д.) δ 9,68 (с, 1H), 8,08 (д, J=8,5 Гц, 1H), 7,70 (дд, J=8,2, 1,4 Гц, 1H), 7,44-7,34 (м, 1H), 7,33-7,25 (м, 1H), 7,05-6,94 (м, 2Н), 6,85 (дд, J=16,7, 10,5 Гц, 1H), 6,12 (дд, J=16,7, 2,4 Гц, 1H), 5,70 (дд, J=10,5, 2,4 Гц, 1H), 4,68-4,45 (м, 1H), 4,38-4,20 (м, 2Н), 4,18-4,05 (м, 1H), 4,01- 3,85(м, 1H), 3,51-3,35 (м, 1H), 3,25-3,11 (м, 3Н), 3,08-2,86 (м, 3Н), 2,72-2,53 (м, 1H), 2,45-2,10 (м, 8Н), 2,08-1,83 (м, 3Н), 1,73-1,51 (м, 3Н).
Примеры 8а и 8b
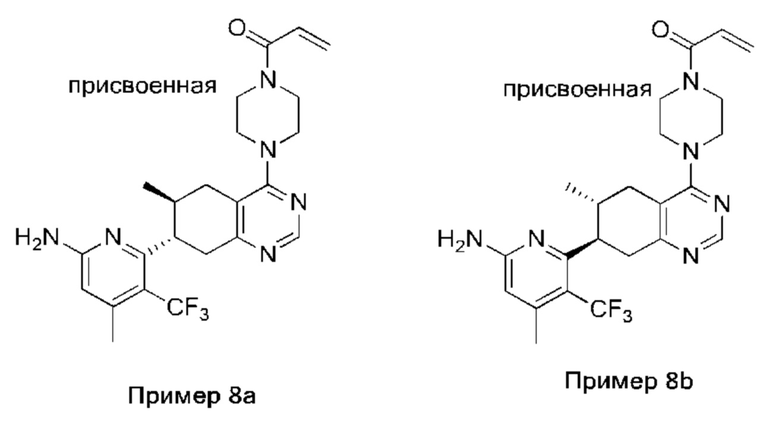
1-(4-((6S,7S)-7-(6-амино-4-метил-3-(трифторметил)пиридин-2-ил)-6-метил-5,6,7,8-тетрагидрохиназолин-4-ил)пиперазин-1-ил)проп-2-ен-1-он (Пример 8а);
1-(4-((6R,7R)-7-(6-амино-4-метил-3-(трифторметил)пиридин-2-ил)-6-метил-5,6,7,8-тетрагидрохиназолин-4-ил)пиперазин-1-ил)проп-2-ен-1-он (Пример 8b)
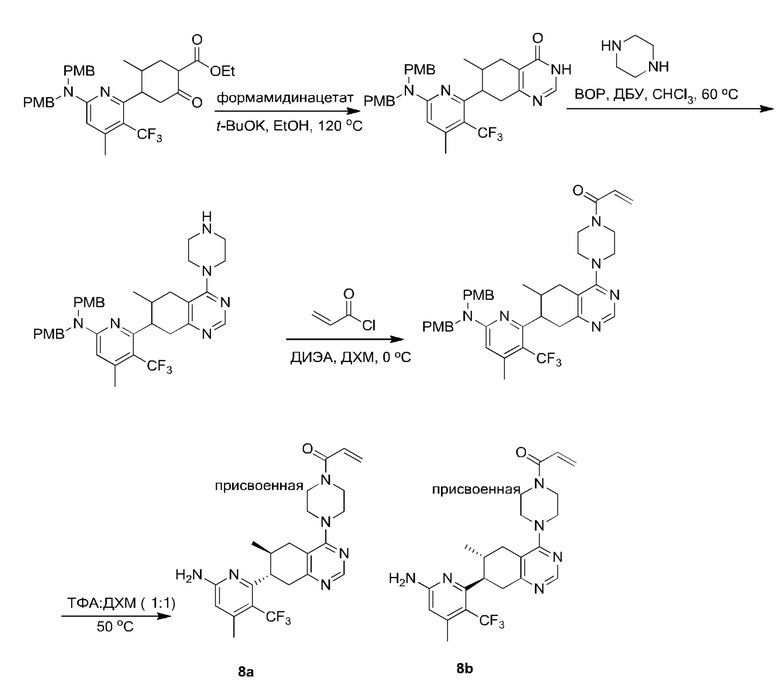
Этап 1: 7-(6-(бис(4-метоксибензил)амино)-4-метил-3-(трифторметил)пиридин-2-ил)-6-метил-5,6,7,8-тетрагидрохиназолин-4(3Н)-он
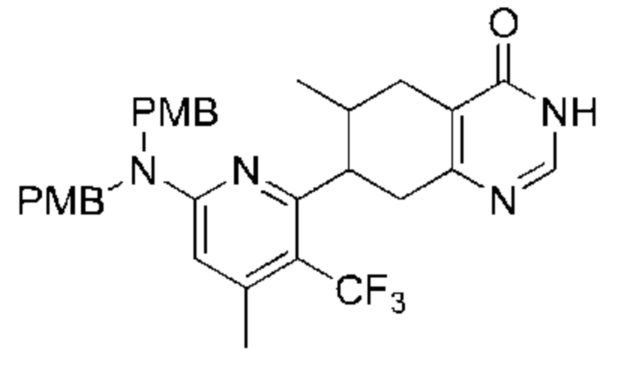
Раствор этил 4-[6-[бис[(4-метоксифенил)метил]амино]-4-метил-3-(трифторметил)-2-пиридил]-5-метил-2-оксо-циклогексанкарбоксилата (1,00 г, 1,67 ммоль), формамидинацетата (1,74 г, 16,7 ммоль) и трет-бутоксида калия (3,75 г, 33,41 ммоль) в этаноле (50 мл) перемешивали при 120°С в течение 5 часов. После завершения реакционную смесь концентрировали в вакууме. Реакционную смесь разводили дихлорметаном, доводили до рН=7 HCl/1,4-диоксаном и промывали водой. Органический слой сушили над безводным сульфатом натрия и концентрировали в вакууме. Остаток очищали с помощью флэш-хроматографии на силикагеле с элюированием дихлорметаном/метанолом (20/1) с получением 7-[6-[бис[(4-метоксифенил)метил]амино]-4-метил-3-(трифторметил)-2-пиридил]-6-метил-5,6,7,8-тетрагидро-3Н-хиназолин-4-она (0,37 г, 0,64 ммоль, выход 38,3%) в виде желтого твердого вещества. ЖХМС: (ИЭР, m/z): 579,3 [М+Н]+
Этап 2: N,N-бис[(4-метоксифенил)метил]-4-метил-6-(6-метил-4-пиперазин-1-ил-5,6,7,8-тетрагидрохиназолин-7-ил)-5-(трифторметил)пиридин-2-амин

Раствор 7-[6-[бис[(4-метоксифенил)метил]амино]-4-метил-3-(трифторметил)-2-пиридил]-6-метил-5,6,7,8-тетрагидро-ЗН-хиназолин-4-она (1,60 г, 2,77 ммоль), пиперазина (1,19 г, 13,83 ммоль), бензотриазол-1-илокситрис(диметиламино)-фосфония гексафторфосфата (2,45 г, 5,53 ммоль) и 1,8-диазабицикло[5.4.0]ундец-7-ена (1,26 г, 8,3 ммоль) в хлороформе (15 мл) перемешивали при 60°С в течение 2 часов. После завершения реакцию гасили водой. Полученный в результате раствор экстрагировали дихлорметаном и объединяли органические слои. Органический слой сушили над безводным сульфатом натрия и концентрировали в вакууме. Остаток очищали с помощью флэш-хроматографии на силикагеле с элюированием дихлорметаном/метанолом (10/1) с получением N,N-бис[(4-метоксифенил)метил]-4-метил-6-(6-метил-4-пиперазин-1-ил-5,6,7,8-тетрагидрохиназолин-7-ил)-5-(трифторметил)пиридин-2-амина (1,40 г, 2,16 ммоль, выход 78,3%) в виде желтого твердого вещества. ЖХМС: (ИЭР, m/z): 647,3 [М+Н]+
Этап 3: 1-[4-[7-[6-[бис[(4-метоксифенил)метил]амино]-4-метил-3-(трифторметил)-2-пиридил]-6-метил-5,6,7,8-тетрагидрохиназолин-4-ил]пиперазин-1-ил]проп-2-ен-1-он
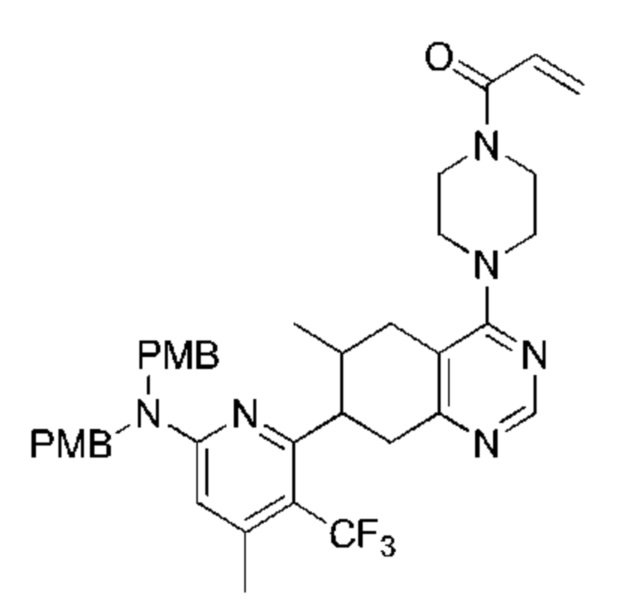
Раствор N,N-бис[(4-метоксифенил)метил]-4-метил-6-(6-метил-4-пиперазин-1-ил-5,6,7,8-тетрагидрохиназолин-7-ил)-5-(трифторметил)пиридин-2-амина (2,00 г, 3,09 ммоль) и N,N-диизопропилэтиламина (3,99 г, 30,92 ммоль) в дихлорметане (20 мл) перемешивали при 0°С в течение 5 минут. Потом добавляли акрилоилхлорид (0,48 г, 5,26 ммоль) и перемешивали при 0°С в течение 10 минут. После завершения реакционную смесь концентрировали в вакууме. Реакционную смесь разводили водой. Полученный в результате раствор экстрагировали дихлорметаном и объединяли органические слои. Органический слой сушили над безводным сульфатом натрия и концентрировали в вакууме. Остаток очищали с помощью флэш-хроматографии на силикагеле с элюированием дихлорметаном/метанолом (10/1) с получением 1-[4-[7-[6-[бис[(4-метоксифенил)метил]амино]-4-метил-3-(трифторметил)-2-пиридил]-6-метил-5,6,7,8-тетрагидрохиназолин-4-ил]пиперазин-1-ил]проп-2-ен-1-она (1,50 г, 2,14 ммоль, выход 69,2%) в виде желтого твердого вещества. ЖХМС: (ИЭР, m/z): 701,3 [М+Н]+
Этап 4: 1-[4-[(6S,7S)-7-[6-амино-4-метил-3-(трифторметил)-2-пиридил]-6-метил-5,6,7,8-тетрагидрохиназолин-4-ил]пиперазин-1-ил]проп-2-ен-1-он (Пример 8а) и 1-[4-[(6R,7R)-7-[6-амино-4-метил-3-(трифторметил)-2-пиридил]-6-метил-5,6,7,8-тетрагидрохиназолин-4-ил]пиперазин-1-ил]проп-2-ен-1-он (Пример 8b)

Раствор 1-[4-[7-[6-[бис[(4-метоксифенил)метил]амино]-4-метил-3-(трифторметил)-2-пиридил]-6-метил-5,6,7,8-тетрагидрохиназолин-4-ил]пиперазин-1-ил]проп-2-ен-1-она (1,50 г, 2,14 ммоль) и трифторуксусной кислоты (6,36 мл, 85,62 ммоль) в дихлорметане (6 мл) перемешивали при 50°С в течение 12 часов. После завершения реакционную смесь концентрировали в вакууме, разводили дихлорметаном, доводили до рН=7 насыщенным водным раствором бикарбоната натрия и промывали водой. Органический слой сушили над безводным сульфатом натрия и концентрировали в вакууме с получением необходимого продукта. Смесь энантиомеров разделяли с помощью препаративной ВЭЖХ со следующими условиями: колонка: CHIRALPAK IG-3, 4,6*50 мм, 3 мкм; подвижная фаза А: гексан (0,1% ДЭА) : EtOH = 70:30, подвижная фаза В:; скорость потока: 1 мл/мин; градиент: от 0 В до 0 В за мин; нм; RT1: 2,246; RT2: 2,814, с получением белого твердого вещества.
Пример 8а: 1-[4-[(6S,7S)-7-[6-амино-4-метил-3-(трифторметил)-2-пиридил]-6-метил-5,6,7,8-тетрагидрохиназолин-4-ил]пиперазин-1-ил]проп-2-ен-1-он (47,3 мг, 0,10 ммоль, выход 4,8%, белое твердое вещество). 1H ЯМР (400 МГц, ДМСО-d6, м.д.) δ 8,46 (с, 1H), 6,84 (дд, J=16,4, 10,4 Гц, 1H), 6,48 (с, 2Н), 6,21-6,13 (м, 2Н), 5,72 (дд, J=10,4, 2,4 Гц, 1H), 3,75 (шир. с, 2Н), 3,64-3,52 (м, 4Н), 3,30-3,27 (м, 2Н), 3,16-3,02 (м, 2Н), 2,87 (дд, J=17,2, 4,8 Гц, 1H), 2,65-2,54 (м, 2Н), 2,30 (к, J=3,6 Гц, 3Н), 2,08 (шир. с, 1H), 0,75 (д, J=6,4 Гц, ЗН). ЖХМС: (ИЭР, m/z): 461,2 [М+Н]+. Хиральная ВЭЖХ: CHIRALPAK IG-3 (4,6*50 мм); обнаружение на 254 нм; гексан (0,1% ДЭА)/EtOH = 70/30; скорость потока=1,0 мл/мин; время удержания: 2,236 мин (более быстрый пик).
Пример 8b: l-[4-[(6R,7R)-7-[6-амино-4-метил-3-(трифторметил)-2-пиридил]-6-метил-5,6,7,8-тетрагидрохиназолин-4-ил]пиперазин-1-ил]проп-2-ен-1-он (46,2 мг, 0,10 ммоль, выход 4,7%, белое твердое вещество). 1Н ЯМР (400 МГц, ДМСО-d6, м.д.) δ 8,46 (с, 1H), 6,84 (дд, J=16,4, 10,4 Гц, 1H), 6,48 (с, 2Н), 6,21-6,13 (м, 2Н), 5,72 (дд, J=10,4, 2,4 Гц, 1H), 3,75 (шир. с, 2Н), 3,64-3,52 (м, 4Н), 3,30-3,27 (м, 2Н), 3,16-3,02 (м, 2Н), 2,87 (дд, J=17,2, 4,8 Гц, 1H), 2,65-2,54 (м, 2Н), 2,30 (к, J=3,6 Гц, 3Н), 2,08 (шир. с, 1H), 0,75 (д, J=6,4 Гц, 3Н). ЖХМС: (ИЭР, m/z): 461,2 [М+Н]+. Хиральная ВЭЖХ: CHIRALPAK IG-3 (4,6*50 мм); обнаружение на 254 нм; гексан (0,1% ДЭА)/EtOH = 70/30; скорость потока = 1,0 мл/мин; время удержания: 2,795 мин (более медленный пик).
Примеры 9а и 9b

(S)-1-(4-(7-(5-метил-1,3-дигидроизобеюофуран-4-ил)-5,6,7,8-тетрагидрохиназолин-4-ил)пиперазин-1-ил)проп-2-ен-1-он (Пример 9а);
(R)-1-(4-(7-(5-метил-1,3-дигидроизобензофуран-4-ил)-5,6,7,8-тетрагидрохиназолин-4-ил)пиперазин-1-ил)проп-2-ен-1-он (Пример 9b)
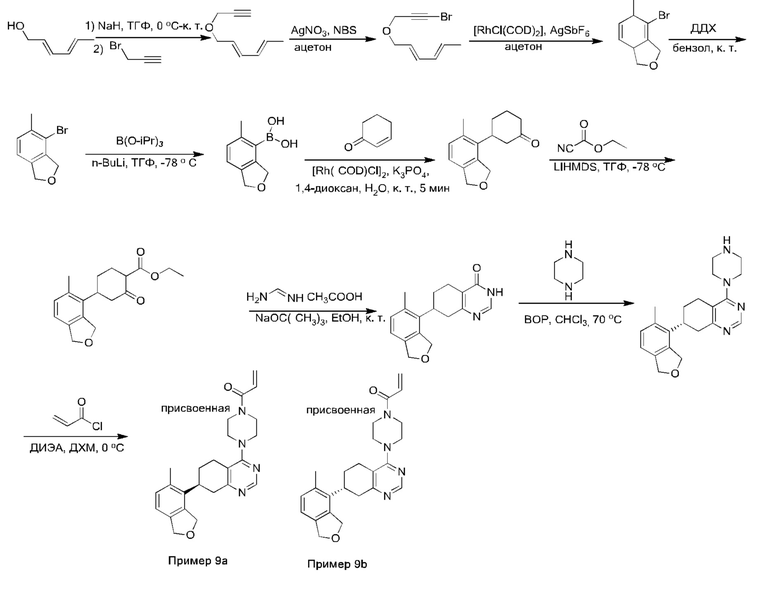
Этап 1: (2Е,4Е)-1-(проп-2-ин-1-илокси)гекса-2,4-диен

В раствор гидрид натрия (15,7 г, 392,3 ммоль, 60% дисперсия в минеральном масле) в тетрагидрофуране (50 мл) добавляли (Е,Е)-2,4-гексадиен-1-ол (35,0 г, 356,63 ммоль) в тетрагидрофуране (50 мл) при 0°С и перемешивали в течение 45 мин при комнатной температуре. Потом в реакционную смесь добавляли 3-бромпропин (50,91 г, 427,96 ммоль) при 0°С и перемешивали в течение 12 часов при комнатной температуре. После завершения реакцию гасили насыщенным раствором хлорида аммония. Реакционную смесь экстрагировали дихлорметаном и объединяли органические слои. Органический слой сушили над безводным сульфатом натрия и концентрировали в вакууме. Остаток очищали с помощью флэш-хроматографии на силикагеле с элюированием петролейным эфиром/этилацетатом (20/1) с получением (2Е,4Е)-1-проп-2-иноксигекса-2,4-диена (30,0 г, 220,3 ммоль, выход 61,8%) в виде желтого масла.
Этап 2: (2Е,4Е)-1-(3-бромпроп-2-инокси)гекса-2,4-диен

Раствор (2Е,4Е)-1-проп-2-иноксигекса-2,4-диена (5,00 г, 36,71 ммоль), 1-бром-2,5-пирролидиндиона (7,19 г, 40,38 ммоль) и нитрата серебра (6,24 г, 36,71 ммоль) в ацетоне (10 мл) перемешивали в течение 1 часа. После завершения реакционную смесь разводили диэтиловым эфиром и промывали водой. Органический слой сушили над безводным сульфатом натрия и концентрировали в вакууме. Остаток очищали с помощью флэш-хроматографии на силикагеле с элюированием петролейным эфиром/этилацетатом (20/1) с получением (2Е,4Е)-1-(3-бромпроп-2-инокси)гекса-2,4-диена (2,50 г, 11,62 ммоль, выход 31,7%) в виде желтого масла.
Этап 3: 7-бром-6-метил-1,3,3а,6-тетрагидроизобензофуран

Раствор димера хлор(1,5-циклооктадиен)родия (I) (1,15 г, 2,32 ммоль) и гексафторантимоната серебра (1,63 г, 4,65 ммоль) в ацетоне (200 мл) перемешивали при комнатной температуре в течение 0,5 часа. Потом добавляли (2Е,4Е)-1-(3-бромпроп-2-инокси)гекса-2,4-диен (20,00 г, 92,98 ммоль) и перемешивали при комнатной температуре в течение 0,5 часа. После завершения реакционную смесь разводили диэтиловым эфиром и промывали водой. Органический слой сушили над безводным сульфатом натрия и концентрировали в вакууме. Остаток очищали с помощью флэш-хроматографии на силикагеле с элюированием петролйным эфиром/дихлорметаном (1/2) с получением 7-бром-6-метил-1,3,3а,6-тетрагидроизобензофурана (16,00 г, 74,38 ммоль, выход 80%) в виде желтого масла.
Этап 4: 4-бром-5-метил-1,3-дигидроизобензофуран

В раствор 7-бром-6-метил-1,3,За,6-тетрагидроизобензофурана (16,00 г, 74,39 ммоль) в бензоле (123 мл) добавляли 2,3-дихлор-5,6-дициано-1,4-бензохинон (25,33 г, 111,58 ммоль) и перемешивали при комнатной температуре в течение 18 часов. После завершения реакционную смесь проводили через слой диоксида кремния, а растворитель удаляли с помощью ротационного выпаривания. Неочищенную реакционную смесь очищали с помощью колоночной хроматографии петролейным эфиром/этилацетатом (1/2) с получением 4-бром-5-метил-1,3-дигидроизобензофурана (7,00 г, 32,85 ммоль, выход 44,2%) в виде белого твердого вещества.
Этап 5: (5-метил-1,3-дигидроизобензофуран-4-ил)бороновая кислота
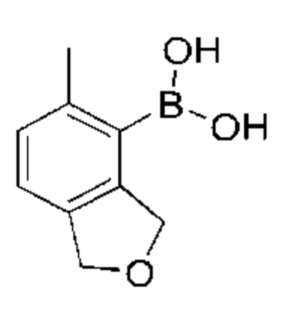
В атмосфере азота раствор 4-бром-5-метил-1,3-дигидроизобензофурана (5,00 г, 23,47 ммоль) и н-бутиллития (14,08 мл, 35,21 ммоль) в тетрагидрофуране (40 мл) перемешивали при -78°С в течение 10 минут. Потом добавляли триизопропилборат (2,65 г, 140,82 ммоль) и перемешивали при -78°С в течение 0,5 часа. После завершения растворитель концентрировали в вакууме с получением неочищенного продукта. Неочищенное вещество непосредственно использовали на следующем этапе без очистки. ЖХМС: (ИЭР, m/z): 179,2 [М+Н]+.
Этап 6: 3-(5-метил-1,3-дигидроизобензофуран-4-ил)циклогексан-1-он
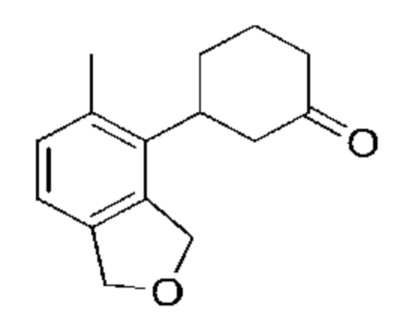
В атмосфере азота в раствор (5-метил-1,3-дигидроизобензофуран-4-ил)бороновой кислоты (5,0 г, неочищенный), циклогекс-2-ен-1-она (4,02 г, 41,85 ммоль) и димера хлор(1,5-циклооктадиен)родия (I) (1,38 г, 2,79 ммоль) в 1,4-диоксане (50 мл) добавляли водный насыщенный раствор фосфата калия (10 мл) и перемешивали при комнатной температуре в течение 5 минут. После завершения растворитель концентрировали в вакууме. Остаток разводили дихлорметаном и промывали водой. Органический слой сушили над безводным сульфатом натрия и концентрировали в вакууме. Остаток очищали с помощью флэш-хроматографии на силикагеле с элюированием петролейным эфиром/этилацетатом (3/1) с получением 3-(5-метил-1,3-дигидроизобензофуран-4-ил)циклогексан-1-она (4,40 г, 19,13 ммоль, выход 31,7%) в виде бесцветного масла. ЖХМС: (ИЭР, m/z): 231,1 [М+Н]+.
Этап 7: этил 4-(5-метил-1,3-дигидроизобензофуран-4-ил)-2-оксоциклогексан-1-карбоксилат

В атмосфере азота раствор 3-(5-метил-1,3-дигидроизобензофуран-4-ил)циклогексан-1-она (4,40 г, 19,13 ммоль) в тетрагидрофуране (40 мл) перемешивали при -78°С в течение 30 минут.Потом по каплям добавляли этилцианоформиат (4,36 г, 43,99 ммоль) и бис(триметилсилил)амид лития (38 мл, 38,26 ммоль, 1,0 М в ТГФ) и перемешивали при -78°С в течение 2 часов. После завершения реакцию гасили водой, концентрировали в вакууме, разводили дихлорметаном и промывали водой, сушили над безводным сульфатом натрия и концентрировали в вакууме. Остаток очищали с помощью флэш-хроматографии на силикагеле с элюированием петролейным эфиром/этилацетатом (3/1) с получением этил 4-(5-метил-1,3-дигидроизобензофуран-4-ил)-2-оксоциклогексан-1-карбоксилата (3,00 г, 9,92 ммоль, выход 46,2%) в виде бесцветного масла. ЖХМС: (ИЭР, m/z): 303,2 [М+Н]+
Этап 8: 7-(5-метил-1,3-дигидроизобензофуран-4-ил)-5,6,7,8-тетрагидрохиназолин-4(3Н)-он

Раствор этил 4-(5-метил-1,3-дигидроизобензофуран-4-ил)-2-оксо-циклогексанкарбоксилата (3,00 г, 9,92 ммоль), формамидинацетата (5,16 г, 49,61 ммоль) и трет-бутоксида натрия (6,67 г, 69,45 ммоль) в этаноле (40 мл) перемешивали при 120°С в течение 2 часов. После завершения растворитель концентрировали в вакууме. Остаток разводили дихлорметаном и промывали водой, сушили над безводным сульфатом натрия и концентрировали в вакууме. Остаток очищали с помощью флэш-хроматографии на силикагеле с элюированием дихлорметаном/метанолом (10/1) с получением 7-(5-метил-1,3-дигидроизобензофуран-4-ил)-5,6,7,8-тетрагидро-3Н-хиназолин-4-она (550,0 мг, 1,95 ммоль, выход 19,6%) в виде желтого твердого вещества. ЖХМС: (ИЭР, m/z): 283,1 [М+Н]+
Этап 9: 7-(5-метил-1,3-дигидроизобензофуран-4-ил)-4-(пиперазин-1-ил)-5,6,7,8-тетрагидрохиназолин
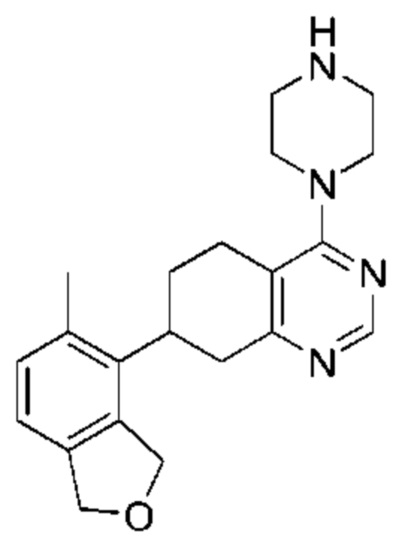
Раствор 7-(5-метил-1,3-дигидроизобензофуран-4-ил)-5,6,7,8-тетрагидро-3Н-хиназолин-4-она (0,75 г, 2,66 ммоль), бензотриазол-1-илокситрис(диметиламино)-фосфония гексафторфосфата (2,35 г, 5,31 ммоль), пиперазина (2,29 г, 26,56 ммоль) и 1,8-диазабицикло[5.4.0]ундец-7-ена (1,2 г, 7,97 ммоль) в хлороформе (10 мл) перемешивали при 70°С в течение 12 часов. После завершения растворитель концентрировали в вакууме. Остаток очищали с помощью флэш-хроматографии на обращенно-фазовой колонке с элюированием ацетонитр ил ом/водой (6/4) с получением 7-(5-метил-1,3-дигидроизобензофуран-4-ил)-4-пиперазин-1-ил-5,6,7,8-тетрагидрохиназолина (0,60 г, 1,71 ммоль, выход 64,5%) в виде желтого твердого вещества. ЖХМС: (ИЭР, m/z): 351,2 [М+Н]+.
Этап 10: (S)-1-(4-(7-(5-метил-1,3-дигидроизобензофуран-4-ил)-5,6,7,8-тетрагидрохиназолин-4-ил)пиперазин-1-ил)проп-2-ен-1-он (Пример 9а) и (R)-1-(4-(7-(5-метил-1,3-дигидроизобензофуран-4-ил)-5,6,7,8-тетрагидрохиназолин-4-ил)пиперазин-1-ил)проп-2-ен-1-он (Пример 9b)
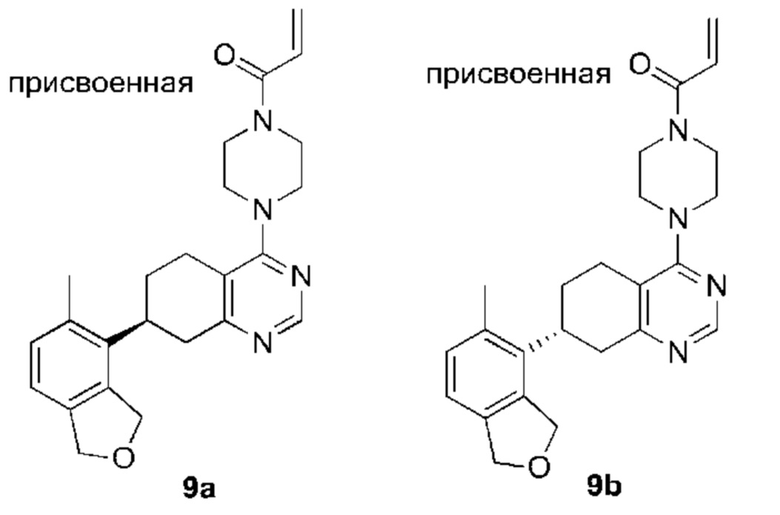
В раствор 7-(5-метил-1,3-дигидроизобензофуран-4-ил)-4-пиперазин-1-ил-5,6,7,8-тетрагидрохиназолина (600,0 мг, 1,71 ммоль) и N,N-диизопропилэтиламина (441,71 мг, 3,42 ммоль) в дихлорметане (60 мл) по каплям добавляли акрилоилхлорид (232,4 мг, 2,57 ммоль) и перемешивали при 0°С в течение 0,5 часа. После завершения реакцию гасили водой. Полученный в результате раствор разводили дихлорметаном и промывали водой. Органический слой сушили над безводным сульфатом натрия и концентрировали в вакууме. Остаток очищали с помощью флэш-хроматографии на силикагеле с элюированием дихлорметаном/метанолом (3/1) с получением диастереоизомеров в виде белого твердого вещества. Потом диастереоизомеры выделяли с помощью препаративной хиральной ВЭЖХ (колонка: CHIRAL ART Cellulose-SB, 4,6*100 мм, 3,0 мкм; подвижная фаза А: МТВЭ (0,1% ДЭА) : МеОН = 50:50, подвижная фаза В:; скорость потока: 1 мл/мин, с получением указанных в заголовке соединений. Абсолютная конфигурация указанных в заголовке соединений была определена по данным активности и рентгенограммы белковой структуры соединения 21b.
Пример 9а: (S)-1-(4-(7-(5-метил-1,3-дигидроизобензофуран-4-ил)-5,6,7,8-тетрагидрохиназолин-4-ил)пиперазин-1-ил)проп-2-ен-1-он (78,9 мг, 0,19 ммоль, выход 11,4%, светло-желтое твердое вещество). 1H ЯМР (300 МГц, ДМСО-d6, м. д.) δ 8,49 (с, 1H), 7,13-7,05 (м, 2Н), 6,84 (дд, J=16,5, 10,5 Гц, 1H), 6,14 (дд, J=16,5, 2,4 Гц, 1H), 5,72 (дд, J=10,5, 2,4 Гц, 1H), 5,12-5,02 (м, 2Н), 4,91 (с, 2Н), 3,75-3,60 (м, 4Н), 3,52-3,39 (м, 3Н), 3,29- 3,26 (м, 2Н), 2,96-2,83 (м, 2Н), 2,79-2,73 (м, 1H), 2,71-2,60 (м, 1H), 2,37 (с, 3Н), 1,98-1,95 (м, 1H), 1,82-1,71 (м, Ш). ЖХМС: (ИЭР, m/z): 405,2 [М+Н]+. Хиральная ВЭЖХ: CHIRAL Cellulose-SB (0,46*10 см); обнаружение на 254 нм; МТБЭ (0,1% ДЭА)/EtOH = 50/50; скорость потока = 1,0 мл/мин; время удержания: 2,444 мин (более быстрый пик).
Пример 9b: (R)-1-(4-(7-(5-метил-1,3-дигидроизобензофуран-4-ил)-5,6,7,8-тетрагидрохиназолин-4-ил)пиперазин-1-ил)проп-2-ен-1-он (138,5 мг, 0,34 ммоль, выход 20%, светло-желтое твердое вещество). 1H ЯМР (300 МГц, ДМСО-d6, м.д.) δ 8,49 (с, 1H), 7,13-7,05 (м, 2Н), 6,84 (дд, J=16,5, 10,5 Гц, 1H), 6,14 (дд, J=16,5, 2,4 Гц, 1H), 5,72 (дд, J=10,5, 2,4 Гц, 1H), 5,12-5,02 (м, 2Н), 4,91 (с, 2Н), 3,75-3,60 (м, 4Н), 3,52-3,39 (м, 3Н), 3,29- 3,26 (м, 2Н), 2,96-2,83 (м, 2Н), 2,79-2,73 (м, 1H), 2,71-2,60 (м, 1H), 2,37 (с, 3Н), 1,98-1,95 (м, 1H), 1,82-1,71 (м, 1H). ЖХМС: (ИЭР, m/z): 405,2 [М+Н]+. Хиральная ВЭЖХ: CHIRAL Cellulose-SB (0,46*10 см); обнаружение на 254 нм; МТБЭ (0,1% ДЭА)/EtOH = 50/50; скорость потока=1,0 мл/мин; время удержания: 4,071 мин (более медленный пик).
Примеры 10а и 10b

1-[4-[(7R)-7-(5,6-диметил-1Н-бензимидазол-4-ил)-5,6,7,8-тетрагидрохиназолин-4-ил]пиперазин-1-ил]проп-2-ен-1-он (Пример 10а);
1-[4-[(7R)-7-(5,6-диметил-1Н-бензимидазол-4-ил)-5,6,7,8-тетрагидрохиназолин-4-ил]пиперазин-1-ил]проп-2-ен-1-он (Пример 10b)

Этап 1: 2-йодо-3,4-диметил-6-нитроанилин
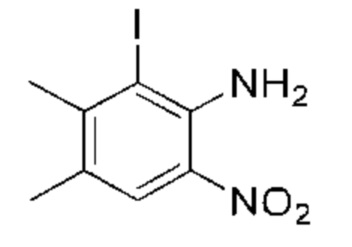
Раствор 4,5-диметил-2-нитроанилина (25,00 г, 150,44 ммоль), сульфата серебра (51,60 г, 165,48 ммоль) и йода (42,00 г, 165,48 ммоль) в этаноле (500 мл) перемешивали при комнатной температуре в течение 2 часов. После завершения реакционную смесь фильтровали, а фильтрат концентрировали при пониженном давлении. Остаток разводили дихлорметаном и промывали насыщенным раствором сульфита натрия, сушили над безводным сульфатом натрия и концентрировали в вакууме с получением неочищенного 2-йодо-3,4-диметил-6-нитроанилина (31,00 г, неочищенный) в виде желтого твердого вещества. ЖХМС: (ИЭР, m/z): 293,0 [М+Н]+
Этап 2: 3-йодо-4,5-диметилбензол-1,2-диамин
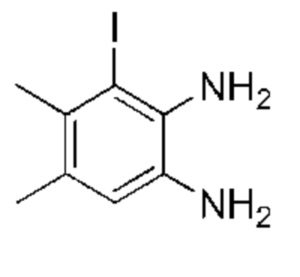
Раствор 2-йодо-3,4-диметил-6-нитро-анилин (25,00 г, 85,60 ммоль), железа (14,34 г, 256,79 ммоль) и хлорида аммония (22,68 г, 427,98 ммоль) в этаноле (400 мл) и воде (40 мл) перемешивали при 90°С в течение 12 часов. После завершения реакционную смесь фильтровали, а фильтрат концентрировали при пониженном давлении. Остаток разводили дихлорметаном и промывали насыщенным раствором хлорида натрия, сушили над безводным сульфатом натрия и концентрировали в вакууме с получением 3-йодо-4,5-диметилбензол-1,2-диамина (22,00 г, неочищенный) в виде неочищенного продукта. ЖХМС: (ИЭР, m/z): 263,0 [М+Н]+.
Этап 3: 4-йодо-5,6-диметил-1Н-бензо[d]имидазол

В раствор 3-йодо-4,5-диметилбензол-1,2-диамина (22,00 г, 83,94 ммоль) и триметоксиметана (93,0 мл, 839,69 ммоль) в N,N-диметилформамиде (150 мл) добавляли концентрированную хлористоводородную кислоту (10 мл) и перемешивали при комнатной температуре в течение 2 часов. После завершения реакционную смесь разводили водой. Реакционную смесь доводили до рН=7 насыщенным раствором бикарбоната натрия. Полученный в результате раствор экстрагировали дихлорметаном и объединяли органические слои. Органический слой сушили над безводным сульфатом натрия и концентрировали в вакууме. Остаток очищали с помощью флэш-хроматографии на силикагеле с элюированием дихлорметаном/метанолом (10/1) с получением 4-йодо-5,6-диметил-1Н-бензо[d]имидазола (20,0 г, 73,53 ммоль, выход 91,9%) в виде желтого твердого вещества. ЖХМС: (ИЭР, m/z): 273,0 [М+Н]+.
Этап 4: 2-[(4-йодо-5,6-диметил-бензимидазол-1-ил)метокси]этил-триметил-силан

В раствор 4-йодо-5,6-диметил-1Н-бензимидазола (10,00 г, 36,75 ммоль) в N,N-диметилформамиде (130 мл) добавляли и гидрид натрия (1,43 г, 47,78 ммоль, 80% дисперсия в минеральном масле) и перемешивали при 0°С в течение 30 минут. Потом добавляли 2-(триметилсилил)этоксиметилхлорид (7,98 г, 47,78 ммоль) и перемешивали при 0°С в течение 0,5 часа. После завершения реакцию гасили насыщенным раствором хлорида аммония. Полученный в результате раствор экстрагировали этилацетатом и объединяли органические слои. Органический слой промывали водой, сушили над безводным сульфатом натрия и концентрировали в вакууме. Остаток очищали с помощью флэш-хроматографии на силикагеле с элюированием дихлорметаном/метанолом (10/1) с получением 2-[(4-йодо-5,6-диметил-бензимидазол-1-ил)метокси]этил-триметил-силана (8,00 г, 19,88 ммоль, выход 54,1%) в виде желтого масла. ЖХМС: (ИЭР, m/z): 403,1 [М+Н]+.
Этап 5: 3-[5,6-диметил-1-(2-триметилсилилэтоксиметил)бензимидазол-4-ил]циклогекс-2-ен-1-он

В атмосфере азота раствор 2-[(4-йодо-5,6-диметил-бензимидазол-1-ил)метокси]этил-триметил-силана (2,00 г, 4,97 ммоль), 3-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)циклогекс-2-ен-1-она (1,66 г, 7,46 ммоль), бис(трифенилфосфин)палладия (II) хлорида (0,35 г, 0,50 ммоль) и фторида калия (0,58 г, 9,94 ммоль) в ацетонитриле (10 мл) и воде (2 мл) перемешивали при 80°С в течение 3 часов. После завершения растворитель концентрировали в вакууме. Реакционную смесь разводили водой. Полученный в результате раствор экстрагировали дихлорметаном и объединяли органические слои. Органический слой сушили над безводным сульфатом натрия и концентрировали в вакууме. Остаток очищали с помощью флэш-хроматографии на силикагеле с элюированием петролейным эфиром/этилацетатом (5/1) с получением 3-[5,6-диметил-1-(2-триметилсилилэтоксиметил)бензимидазол-4-ил]циклогекс-2-ен-1-она (1,80 г, 4,86 ммоль, выход 97,7%) в виде желтого масла. ЖХМС: (ИЭР, m/z): 371,2 [М+Н]+
Этап 6: этил 4-[5,6-диметил-1-(2-триметилсилилэтоксиметил)бензимидазол-4-ил]-2-оксо-циклогекс-3-ен-1-карбоксилат
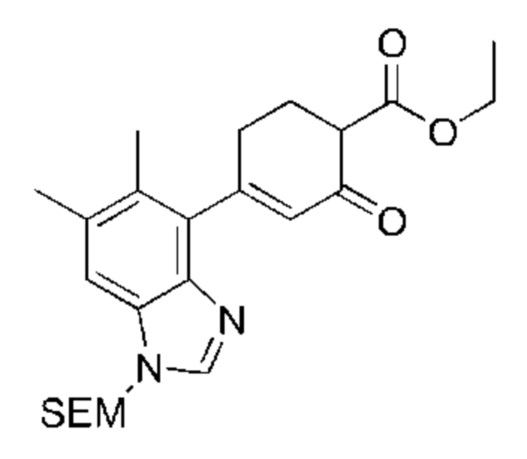
В атмосфере азота в раствор 3-[5,6-диметил-1-(2-триметилсилилэтоксиметил)бензимидазол-4-ил]циклогекс-2-ен-1-она (1,00 г, 2,7 ммоль) в тетрагидрофуране (10 мл) добавляли бис(триметилсилил)амид лития (8,1 мл, 8,1 ммоль, 1,0 М в ТГФ) и перемешивали при -78°С в течение 30 минут. Потом добавляли этилцианоформиат (0,8 г, 8,1 ммоль) и перемешивали при -78°С в течение 2 часов. После завершения реакцию гасили водой. Полученный в результате раствор экстрагировали дихлорметаном и объединяли органические слои. Органический слой сушили над безводным сульфатом натрия и концентрировали в вакууме. Остаток очищали с помощью флэш-хроматографии на силикагеле с элюированием петролейным эфиром/этилацетатом (1/1) с получением этил 4-[5,6-диметил-1-(2-триметилсилилэтоксиметил)бензимидазол-4-ил]-2-оксо-циклогекс-3-ен-1-карбоксилата (0,40 г, 0,90 ммоль, выход 33,5%) в виде желтого масла. ЖХМС: (ИЭР, m/z): 443,2 [М+Н]+
Этап 7: этил 4-[5,6-диметил-1-(2-триметилсилилэтоксиметил)бензимидазол-4-ил]-2-оксо-циклогексанкарбоксилат

В атмосфере водорода, раствор этил 4-[5,6-диметил-1-(2-триметил силилэтоксиметил)бензимидазол-4-ил]-2-оксо-циклогекс-3-ен-1-карбоксилата (3,00 г, 6,78 ммоль) и Pd/C (10%) (3,00 г, 6,78 ммоль) в метиловом спирте (75 мл) перемешивали при 50°С в течение 12 часов. После завершения реакционную смесь фильтровали, а фильтрат концентрировали при пониженном давлении. Неочищенный продукт непосредственно использовали для следующего этапа без очистки. ЖХМС: (ИЭР, m/z): 445,2 [М+Н]+
Этап 8: 7- [5,6-диметил-1-(2-триметил силилэтоксиметил)бензимидазол-4-ил]-5,6,7,8-тетрагидро-3Н-хиназолин-4-он

Раствор этил 4-[5,6-диметил-1-(2-триметилсилилэтоксиметил)бензимидазол-4-ил]-2-оксо-циклогексанкарбоксилата (3,00 г, 6,75 ммоль), формамидинацетата (3,51 г, 33,74 ммоль) и трет-бутоксида натрия (4,54 г, 47,23 ммоль) в этаноле (60 мл) перемешивали при 120°С в течение 1 часа. После завершения растворитель концентрировали в вакууме. Реакционную смесь разводили водой. Полученный в результате раствор экстрагировали дихлорметаном и объединяли органические слои. Органический слой сушили над безводным сульфатом натрия и концентрировали в вакууме. Остаток очищали с помощью флэш-хроматографии на силикагеле с элюированием дихлорметаном/метанолом (10/1) с получением 7-[5,6-диметил-1-(2-триметил силилэтоксиметил)бензимид азол-4-ил] -5,6,7,8 -тетрагидро-3Н-хиназолин-4-она (0,90 г, 2,12 ммоль, выход 31,4%) в виде желтого твердого вещества. ЖХМС: (ИЭР, m/z): 425,2 [М+Н]+
Этап 9: 2-[[5,6-диметил-4-(4-пиперазин-1-ил-5,6,7,8-тетрагидрохиназолин-7-ил)бензимидазол-1-ил]метокси]этил-триметил-силан
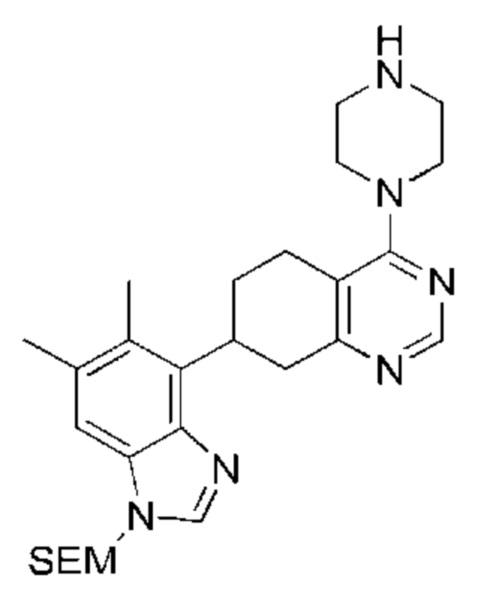
Раствор 7-[5,6-диметил-1-(2-триметил силилэтоксиметил)бензимидазол-4-ил]-5,6,7,8-тетрагидро-3Н-хиназолин-4-она (900,0 мг, 2,12 ммоль), бензотриазол-1-илокситрис(диметиламино)-фосфония гексафторфосфата (1,87 г, 4,24 ммоль), пиперазина (1,83 г, 21,2 ммоль) и 1,8-диазабицикло[5.4.0]ундец-7-ена (968,06 мг, 6,36 ммоль) в хлороформе (10 мл) перемешивали при 70°С в течение 4 часов. После завершения полученный в результате раствор разводили дихлорметаном и промывали водой. Органический слой сушили над безводным сульфатом натрия и концентрировали в вакууме. Остаток очищали с помощью флэш-хроматографии на силикагеле с элюированием дихлорметаном/метанолом (1/1) с получением 2-[[5,6-диметил-4-(4-пиперазин-1-ил-5,6,7,8-тетрагидрохиназолин-7-ил)бензимидазол-1-ил]метокси]этил-триметил-силана (600,0 мг, 1,22 ммоль, выход 57,4%) в виде цветного твердого вещества. ЖХМС: (ИЭР, m/z): 493,3 [М+Н]+
Этап 10: 1-[4-[7-[5,6-диметил-1-(2-триметилсилилэтоксиметил)бензимидазол-4-ил]-5,6,7,8-тетрагидрохиназолин-4-ил] пиперазин-1-ил]проп-2-ен-1-он

В раствор 2-[[5,6-диметил-4-(4-пиперазин-1-ил-5,6,7,8-тетрагидрохиназолин-7-ил)бензимидазол-1-ил]метокси]этил-триметил-силана (600,0 мг, 1,22 ммоль) и N,N-диизопропилэтиламина (314,75 мг, 2,44 ммоль) в дихлорметане (10 мл) по каплям добавляли акрилоилхлорид (132,26 мг, 1,46 ммоль) и перемешивали при 0°С в течение 1 часа. После завершения реакцию гасили водой. Полученный в результате раствор разводили дихлорметаном и промывали водой. Органический слой сушили над безводным сульфатом натрия и концентрировали в вакууме с получением 1-[4-[7-[5,6-диметил-1-(2-триметилсилилэтоксиметил)бензимидазол-4-ил]-5,6,7,8-тетрагидрохиназолин-4-ил]пиперазин-1-ил]проп-2-ен-1-она (600 мг, неочищенный) в виде желтого твердого вещества. ЖХМС: (ИЭР, m/z): 547,3 [М+Н]+
Этап 11: 1-[4-[(7R)-7-(5,6-диметил-1Н-бензимидазол-4-ил)-5,6,7,8-тетрагидрохиназолин-4-ил]пиперазин-1-ил]проп-2-ен-1-он (Пример 10а) и 1-[4-[(7S)-7-(5,6-диметил-1Н-бензимидазол-4-ил)-5,6,7,8-тетрагидрохиназолин-4-ил]пиперазин-1-ил]проп-2-ен-1-он (Пример 10b)

Раствор 1-[4-[7-[5-метил-1-(2-триметилсилилэтоксиметил)бензимидазол-4-ил]-5,6,7,8-тетрагидрохиназолин-4-ил]пиперазин-1-ил]проп-2-ен-1-она (584,6 мг, неочищенный) в трифторуксусной кислоте (4 мл) и дихлорметане (4 мл) перемешивали при 40°С в течение 0,5 часа. После завершения растворитель концентрировали в вакууме. Реакционную смесь разводили дихлорметаном. Полученный в результате раствор доводили до рН = 7 насыщенным раствором бикарбоната натрия. Полученный в результате раствор экстрагировали дихлорметаном и объединяли органические слои. Органический слой сушили над безводным сульфатом натрия и концентрировали в вакууме. Остаток очищали с помощью флэш-хроматографии на силикагеле с элюированием дихлорметаном/метанолом (5/1) с получением диастереоизомеров в виде белого твердого вещества. Потом диастереоизомеры выделяли с помощью препаративной хиральной ВЭЖХ (колонка: CHIRAL ART Cellulose-SB, 4,6*100 мм, 3,0 мкм; подвижная фаза А: гексан (0,1% ДЭА): EtOH = 50:50, подвижная фаза В:; скорость потока: 1 мл/мин, с получением указанных в заголовке соединений. Абсолютная конфигурация указанных в заголовке соединений была определена по данным активности и рентгенограммы белковой структуры соединения 21b.
Пример 10а: 1-[4-[(7R)-7-(5,6-диметил-1Н-бензимидазол-4-ил)-5,6,7,8-тетрагидрохиназолин-4-ил]пиперазин-1-ил]проп-2-ен-1-он (63,7 мг, 0,15 ммоль, выход 13,9%, белое твердое вещество). 1Н ЯМР (300 МГц, ДМСО-d6, м. д.) δ 12,15 (шир. с, 1Н), 8,49 (с, 1Н), 7,98 (с, 1Н), 7,21 (шир. с, 1Н), 6,85 (дд, J=16,5, 10,2 Гц, 1Н), 6,15 (дд, J=16,5, 2,4 Гц, 1Н), 5,72 (дд, J=10,5, 2,4 Гц, 1Н), 3,99-3,48 (м, 8Н), 3,30-3,20 (м, 2Н), 2,95-2,81 (м, 2Н), 2,69-2,64 (м, 2Н), 2,34 (д, J=12,5 Гц, 6Н), 1,87 (д, J=12,2 Гц, 1Н). ЖХМС: (ПЭР, m/z): 417,3 [М+Н]+. Хиральная ВЭЖХ: CHIRAL Cellulose-SB (4,6*100 мм); обнаружение на 254 нм; гексан (0,1% ДЭА)/EtOH = 50/50; скорость потока = 1,0 мл/мин; время удержания: 2,621 мин (более быстрый пик).
Пример 10b: 1-[4-[(7S)-7-(5,6-диметил-1Н-бензимидазол-4-ил)-5,6,7,8-тетрагидрохиназолин-4-ил]пиперазин-1-ил]проп-2-ен-1-он (81,5 мг, 0,19 ммоль, выход 17,8%, белое твердое вещество). 1Н ЯМР (300 МГц, ДМСО-d6, м. д.) δ 12,15 (шир. с, 1Н), 8,49 (с, 1Н), 7,98 (с, 1Н), 7,21 (шир. с, 1Н), 6,85 (дд, J=16,5, 10,2 Гц, 1Н), 6,15 (дд, J=16,5, 2,4 Гц, 1Н), 5,72 (дд, J=10,5, 2,4 Гц, 1Н), 3,99-3,48 (м, 8Н), 3,30-3,20 (м, 2Н), 2,95-2,81 (м, 2Н), 2,69-2,64 (м, 2Н), 2,34 (д, J=12,5 Гц, 6Н), 1,87 (д, J=12,2 Гц, 1Н). ЖХМС: (ИЭР, m/z): 417,3 [М+Н]+. Хиральная ВЭЖХ: CHIRAL Cellulose-SB (4,6*100 мм); обнаружение на 254 нм; гексан (0,1% ДЭА)/EtOH = 50/50; скорость потока = 1,0 мл/мин; время удержания: 3,244 мин (более медленный пик).
Примеры 11а и 11b

1-[(3S)-4-[(6S,7S)-7-(3-амино-2-фтор-5,6-диметил-фенил)-6-метил-2-[[(2S)-1-метилпирролидин-2-ил]метокси]-5,6,7,8-тетрагидрохиназолин-4-ил]-3-метил-пиперазин-1-ил]проп-2-ен-1-он (Пример 11а);
1-[(3S)-4-[(6R,7R)-7-(3-амино-2-фтор-5,6-диметил-фенил)-6-метил-2-[[(2S)-1-метилпирролидин-2-ил]метокси]-5,6,7,8-тетрагидрохиназолин-4-ил]-3-метил-пиперазин-1-ил]проп-2-ен-1-он (Пример 11b)
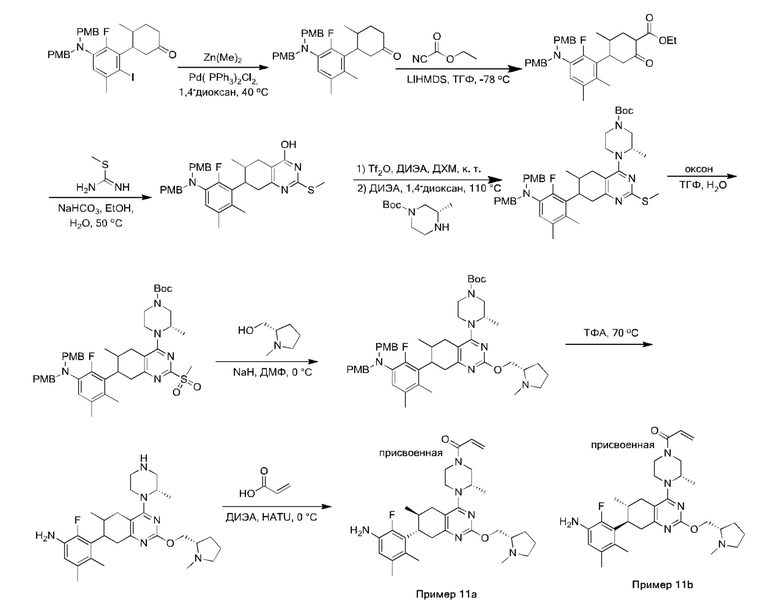
Этап 1: 3-(3-(бис(4-метоксибензил)амино)-2-фтор-5,6-диметилфенил)-4-метилциклогексан-1-он

В атмосфере азота раствор 3-[3-[бис[(4-метоксифенил)метил]амино]-2-фтор-6-йодо-5-метил-фенил]-4-метил-циклогексанона (15,00 г, 24,94 ммоль) и бис(трифенилфосфин)палладия (II) хлорида (1,75 г, 2,49 ммоль) в 1,4-диоксане (100 мл) перемешивали при 40°С в течение 5 минут. Потом добавляли диметилцинк (74,81 мл, 74,81 ммоль) и перемешивали при 40°С в течение 2 часов. После завершения реакцию гасили водой. Растворитель концентрировали в вакууме. Остаток разводили дихлорметаном и промывали водой. Органический слой сушили над безводным сульфатом натрия и концентрировали в вакууме. Остаток очищали с помощью флэш-хроматографии на силикагеле с элюированием петролейным эфиром/этилацетатом (5/1) с получением 3-(3-(бис(4-метоксибензил)амино)-2-фтор-5,6-диметилфенил)-4-метилциклогексан-1-она (5,90 г, 12,04 ммоль, выход 48,4%) в виде бесцветного масла. ЖХМС: (ИЭР, m/z): 490,3 [М+Н]+.
Этап 2: этил 4-[3-[бис[(4-метоксифенил)метил]амино]-2-фтор-5,6-диметил-фенил]-5-метил-2-оксо-циклогексанкарбоксилат
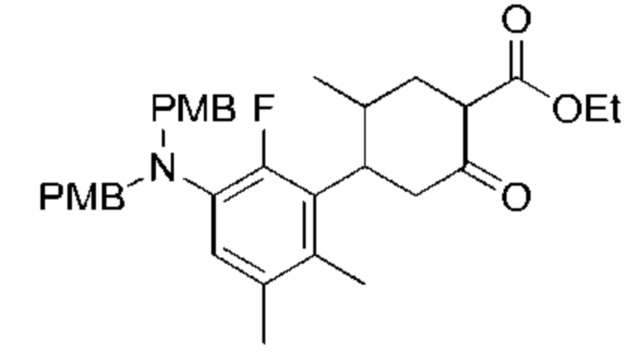
В атмосфере азота в раствор 3-(3-(бис(4-метоксибензил)амино)-2-фтор-5,6-диметилфенил)-4-метилциклогексан-1-она (5,00 г, 10,21 ммоль) в тетрагидрофуране (60 мл) по каплям добавляли и бис(триметилсилил)амид лития (20,42 мл, 20,42 ммоль, 1,0 М в ТГФ) и перемешивали при -78°С в течение 30 минут. Потом добавляли этилцианоформиат (2,33 г, 23,49 ммоль) и перемешивали при -78°С в течение 2 часов. После завершения реакцию гасили водой. Растворитель концентрировали в вакууме. Остаток разводили дихлорметаном и промывали водой. Органический слой сушили над безводным сульфатом натрия и концентрировали в вакууме. Остаток очищали с помощью флэш-хроматографии на силикагеле с элюированием петролейным эфиром/этилацетатом (3/1) с получением этил 4-[3-[бис[(4-метоксифенил)метил]амино]-2-фтор-5,6-диметил-фенил]-5-метил-2-оксо-циклогексанкарбоксилата (3,00 г, 5,34 ммоль, выход 52,3%) в виде бесцветного масла. ЖХМС: (ИЭР, m/z): 562,3 [М+Н]+
Этап 3: 7-[3-[бис[(4-метоксифенил)метил]амино]-2-фтор-5,6-диметил-фенил]-6-метил-2-метилсульфанил-5,6,7,8-тетрагидрохиназолин-4-ол

Раствор этил 4-[3-[бис[(4-метоксифенил)метил]амино]-2-фтор-5,6-диметил-фенил]-5-метил-2-оксо-циклогексанкарбоксилата (3,00 г, 5,34 ммоль), 2-метилизотиомочевины (14,85 г, 53,41 ммоль) и бикарбоната натрия (11,22 г, 133,53 ммоль) в этаноле (187 мл) и воде (37 мл) перемешивали при 50°С в течение 6 часов.
После завершения реакцию концентрировали в вакууме, разводили водой, экстрагировали дихлорметаном. Органические слои объединяли и концентрировали в вакууме. Остаток очищали с помощью флэш-хроматографии на силикагеле с элюированием дихлорметаном/этилацетатом (1/1) с получением 7-[3-[бис[(4-метоксифенил)метил]амино]-2-фтор-5,6-диметил-фенил]-6-метил-2-метилсульфанил-5,6,7,8-тетрагидрохиназолин-4-ола (1,30 г, 2,21 ммоль, выход 41,4%) в виде бесцветного твердого вещества. ЖХМС: (ИЭР, m/z): 588,3 [М+Н]+.
Этап 4: трет-бутил (3S)-4-[7-[3-[бис[(4-метоксифенил)метил]амино]-2-фтор-5,6-диметил-фенил]-6-метил-2-метилсульфанил-5,6,7,8-тетрагидрохиназолин-4-ил]-3-метил-пиперазин-1-карбоксилат
I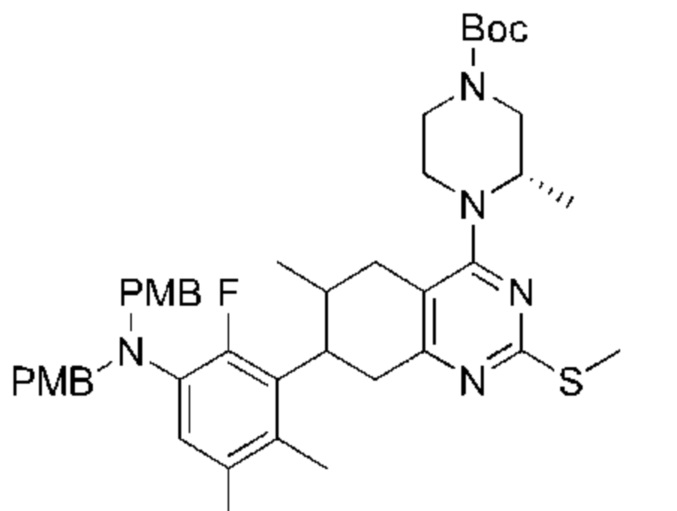
Раствор 7-[3-[бис[(4-метоксифенил)метил]амино]-2-фтор-5,6-диметил-фенил]-6-метил-2-метилсульфанил-5,6,7,8-тетрагидрохиназолин-4-ола (1,50 г, 2,55 ммоль) и N,N-диизопропилэтиламина (3,29 г, 25,52 ммоль) в дихлорметане (5 мл) перемешивали при 0°С в течение 0,5 часа. Потом добавляли трифторметансульфоновый ангидрид (1,44 г, 5,1 ммоль) и перемешивали при 0°С в течение 5 минут. Растворитель концентрировали в вакууме с получением неочищенного продукта. Потом добавляли неочищенный продукт, N,N-диизопропилэтиламин (3,29 г, 25,52 ммоль) и трет-бутил (3S)-3-метил- 1-пиперазинкарбоксилат (1,02 г, 5,1 ммоль) и перемешивали в 1,4-диоксане (15 мл) при 110°С в течение 5 часов. После завершения растворитель концентрировали в вакууме. Остаток очищали с помощью флэш-хроматографии на силикагеле с элюированием дихлорметаном/метанолом (4/1) с получением трет-бутил (3S)-4-[7-[3-[бис[(4-метоксифенил)метил]амино]-2-фтор-5,6-диметил-фенил]-6-метил-2-метилсульфанил-5,6,7,8-тетрагидрохиназолин-4-ил]-3-метил-пиперазин-1-карбоксилата (1,40 г, 1,82 ммоль, выход 71,2%) в виде желтого твердого вещества. ЖХМС: (ИЭР, m/z): 770,4 [М+Н]+.
Этап 5: трет-бутил (3S)-4-[7-[3-[бис[(4-метоксифенил)метил]амино]-2-фтор-5,6-диметил-фенил]-6-метил-2-метилсульфонил-5,6,7,8-тетрагидрохиназолин-4-ил]-3-метил-пиперазин-1-карбоксилат
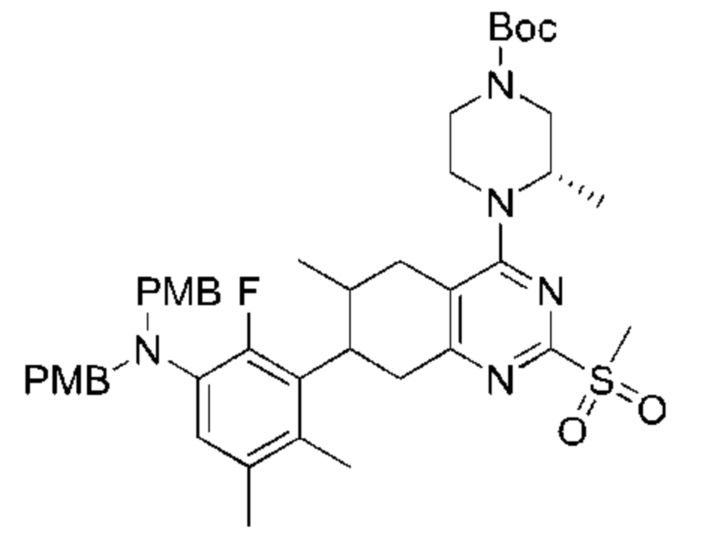
Раствор трет-бутил (3S)-4-[7-[3-[бис[(4-метоксифенил)метил]амино]-2-фтор-5,6-диметил-фенил]-6-метил-2-метилсульфанил-5,6,7,8-тетрагидрохиназолин-4-ил]-3-метил-пиперазин-1-карбоксилата (1,30 г, 1,69 ммоль) и оксона (3,11 г, 5,06 ммоль) в тетрагидрофуране (10 мл) и воде (5 мл) перемешивали при комнатной температуре в течение 6 часов. После завершения реакцию гасили насыщенным раствором сульфита натрия. Полученный в результате раствор экстрагировали дихлорметаном и объединяли органические слои. Органический слой сушили над безводным сульфатом натрия и концентрировали в вакууме. Остаток очищали с помощью флэш-хроматографии на силикагеле с элюированием петролейным эфиром/этилацетатом (3/1) с получением трет-бутил (3S)-4-[7-[3-[бис[(4-метоксифенил)метил]амино]-2-фтор-5,6-диметил-фенил]-6-метил-2-метилсульфонил-5,6,7,8-тетрагидрохиназолин-4-ил]-3-метил-пиперазин-1-карбоксилата (1,20 г, 1,49 ммоль, выход 88,6%) в виде бесцветного твердого вещества. ЖХМС: (ИЭР, m/z): 802,4 [М+Н]+
Этапы 6 и 7: трет-бутил (3S)-4-[7-[3-[бис[(4-метоксифенил)метил]амино]-2-фтор-5,6-диметил-фенил]-6-метил-2-[[(2S)-1-метилпирролидин-2-ил]метокси]-5,6,7,8-тетрагидрохиназолин-4-ил]-3-метил-пиперазин-1-карбоксилат

Раствор N-метил-L-пролинола (0,69 г, 5,98 ммоль) и гидрида натрия (0,18 г, 7,48 ммоль, 60% дисперсия в минеральном масле) в N,N-диметилформамиде (10 мл) перемешивали при 0°С в течение 0,5 часа. Потом добавляли трет-бутил (3S)-4-[7-[3-[бис[(4-метоксифенил)метил]амино]-2-фтор-5,6-диметил-фенил]-6-метил-2-метилсульфонил-5,6,7,8-тетрагидрохиназолин-4-ил]-3-метил-пиперазин-1-карбоксилат (1,2 г, 1,5 ммоль) и перемешивали при комнатной температуре в течение 1 часа. После завершения реакцию гасили насыщенным раствором хлорида аммония. Полученный в результате раствор экстрагировали этилацетатом и объединяли органические слои. Органический слой сушили над безводным сульфатом натрия и концентрировали в вакууме. Остаток очищали с помощью флэш-хроматографии на силикагеле с элюированием дихлорметаном/метанолом (10/1) с получением трет-бутил (3S)-4-[7-[3-[бис[(4-метоксифенил)метил]амино]-2-фтор-5,6-диметил-фенил]-6-метил-2-[[(2S)-1-метилпирролидин-2-ил] метокси]-5,6,7,8-тетрагидрохиназолин-4-ил]-3-метил-пиперазин-1-карбоксилата (0,80 г, 0,96 ммоль, выход 63,9%) в виде бесцветного масла. ЖХМС: (ПЭР, m/z): 836,5 [М+Н]+
Этап 8: 2-фтор-4,5-диметил-3-[6-метил-4-[(2S)-2-метилпиперазин-1-ил]-2-[[(2S)-1-метилпирролидин-2-ил]метокси]-5,6,7,8-тетрагидрохиназолин-7-ил]анилин

Раствор трет-бутил (3S)-4-[7-[3-[бис[(4-метоксифенил)метил]амино]-2-фтор-5,6-диметил-фенил]-6-метил-2-[[(2S)-1-метилпирролидин-2-ил]метокси]-5,6,7,8-тетрагидрохиназолин-4-ил]-3-метил-пиперазин-1-карбоксилата (1,10 г, 1,31 ммоль) в трифторуксусной кислоте (4,0 мл) перемешивали при 70°С в течение 12 часов. После завершения растворитель концентрировали в вакууме. Остаток очищали с помощью флэш-хроматографии на обращенно-фазовой колонке с элюированием водой/ацетонитрилом (1/2) с получением 2-фтор-4,5-диметил-3-[6-метил-4-[(2S)-2-метилпиперазин-1-ил]-2-[[(2S)-1-метилпирролидин-2-ил]метокси]-5,6,7,8-тетрагидрохиназолин-7-ил]анилина (0,50 г, 1,00 ммоль, выход 76,6%) в виде светло-желтого твердого вещества. ЖХМС: (ИЭР, m/z): 497,3 [М+Н]+.
Этап 9: 1-[(3S)-4-[(6S,7S)-7-(3-амино-2-фтор-5,6-диметил-фенил)-6-метил-2-[[(2S)-1-метилпирролидин-2-ил]метокси]-5,6,7,8-тетрагидрохиназолин-4-ил]-3-метил-пиперазин-1-ил]проп-2-ен-1-он (Пример 11а) и 1-[(3S)-4-[(6R,7R)-7-(3-амино-2-фтор-5,6-диметил-фенил)-6-метил-2-[[(2S)-1-метилпирролидин-2-ил]метокси]-5,6,7,8-тетрагидрохиназолин-4-ил]-3-метил-пиперазин-1-ил]проп-2-ен-1-он (Пример 11b)
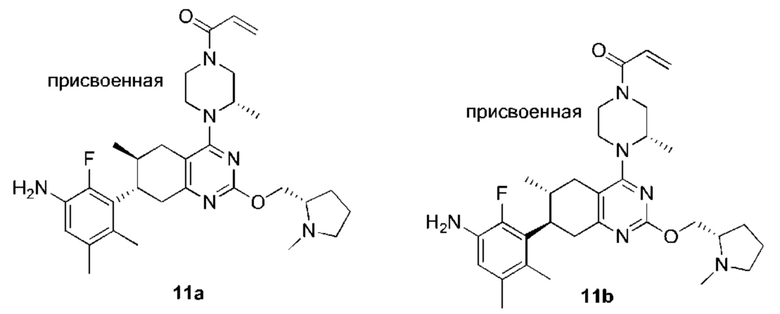
Раствор 2-фтор-4,5-диметил-3-[6-метил-4-[(2S)-2-метилпиперазин-1-ил]-2-[[(2S)-1-метилпирролидин-2-ил]метокси]-5,6,7,8-тетрагидрохиназолин-7-ил]анилина (500,0 мг, 1,01 ммоль), акриловой кислоты (91,12 мг, 1,01 ммоль), N,N-диизопропилэтиламина (194,8 мг, 1,51 ммоль) и O-(7-2-(7-азабензотриазол-1-ил)-N,N,N',N'-тетраметилурония гексафторфосфата (421,07 мг, 1,11 ммоль) в дихлорметане (100 мл) перемешивали при 0°С в течение 15 минут. После завершения реакцию гасили водой. Полученный в результате раствор экстрагировали дихлорметаном и объединяли органические слои. Органический слой сушили над безводным сульфатом натрия и концентрировали в вакууме. Остаток очищали с помощью флэш-хроматографии на силикагеле с элюированием дихлорметаном/метанолом (3/1) с получением диастереоизомеров в виде белого твердого вещества. Потом диастереоизомеры выделяли с помощью препаративной хиральной ВЭЖХ (колонка: CHIRALPAK IG-3, 4,6*50 мм, 3 мкм; подвижная фаза А: (гексан:ДХМ = 3:1) (0,1% ДЭА): EtOH = 50:50, подвижная фаза В:; скорость потока: 1 мл/мин, с получением указанных в заголовке соединений. Абсолютная конфигурация указанных в заголовке соединений была определена по данным активности и рентгенограммы белковой структуры соединения 21b.
Пример Па: 1-[(3S)-4-[(6S,7S)-7-(3-амино-2-фтор-5,6-диметил-фенил)-6-метил-2-[[(2S)-1-метилпирролидин-2-ил]метокси]-5,6,7,8-тетрагидрохиназолин-4-ил]-3-метил-пиперазин-1-ил]проп-2-ен-1-он (32,8 мг, 0,05 ммоль, выход 5,9%, белое твердое вещество). 1Н ЯМР (300 МГц, ДМСО-d6, м. д.) δ 6,90-6,77 (м, 1Н), 6,49 (д, J=9,0 Гц, 1Н), 6,15 (д, J=16,8 Гц, 1Н), 5,72 (д, J=10,5 Гц, 1Н), 4,70 (с, 2Н), 4,33-4,00 (м, 5Н), 3,90-3,85 (м, 1Н), 3,66-3,62 (м, 1Н), 3,50-3,39 (м, 2Н), 3,16-3,05 (м, 1Н), 2,93-2,84 (м, 4Н), 2,65-2,61 (м, 1Н), 2,43-2,38 (м, 1Н), 2,32 (с, 3Н), 2,16-2,10 (м, 8Н), 1,94-1,85 (м, 1Н), 1,70-1,55 (м, 3Н), 0,97 (шир. с, 3Н), 0,81 (д, J=6,3 Гц, 3Н). ЖХМС: (ИЭР, m/z): 551,3 [М+Н]+. Хиральная ВЭЖХ: CHIRALPAK IG-3 (0,46*5 см); обнаружение на 254 нм; (гексан:ДХМ = 3:1) (0,1% ДЭА)/EtOH = 50/50; скорость потока = 1,0 мл/мин; время удержания: 2,374 мин (более медленный пик).
Пример 11b: 1-[(3S)-4-[(6R,7R)-7-(3-амино-2-фтор-5,6-диметил-фенил)-6-метил-2-[[(2S)-1-метилпирролидин-2-ил]метокси]-5,6,7,8-тетрагидрохиназолин-4-ил]-3-метил-пиперазин-1-ил]проп-2-ен-1-он (33,4 мг, 0,06 ммоль, выход 6%, белое твердое вещество). 1Н ЯМР (300 МГц, ДМСО-d6, м. д.) δ 6,90-6,78 (м, 1Н), 6,49 (д, J=9,0 Гц, 1Н), 6,15 (д, J=16,8 Гц, 1Н), 5,73-5,69 (м, 1Н), 4,70 (с, 2Н), 4,38-3,88 (м, 6Н), 3,48-3,31 (м, 1Н), 3,15-3,03 (м, 3Н), 2,95-2,82 (м, 4Н), 2,45-2,40 (м, 1Н), 2,32 (с, 4Н), 2,17-2,09 (м, 8Н), 1,94-1,88 (м, 1Н), 1,66-1,56 (м, 3Н), 1,27 (д, J=6,3 Гц, 3Н), 0,81 (д, J=6,3 Гц, 3Н). ЖХМС: (ИЭР, m/z): 551,3 [М+Н]+. Хиральная ВЭЖХ: CHIRALPAK IG-3 (0,46*5 см); обнаружение на 254 нм; (гексан:ДХМ = 3:1) (0,1% ДЭА)/EtOH = 50/50; скорость потока = 1,0 мл/мин; время удержания: 1,261 мин (более быстрый пик).
Примеры 12а и 12b
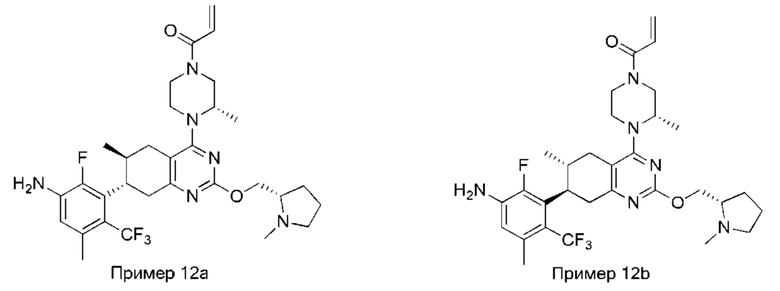
1-((S)-4-((6S,7S)-7-(3-амино-2-фтор-5-метил-6-(трифторметил)фенил)-6-метил-2-(((S)-1-метилпирролидин-2-ил)метокси)-5,6,7,8-тетрагидрохиназолин-4-ил)-3-метилпиперазин-1-ил)проп-2-ен-1-он (Пример 12а)
1-((S)-4-((6R,7R)-7-(3-амино-2-фтор-5-метил-6-(трифторметил)фенил)-6-метил-2-(((S)-1-метилпирролидин-2-ил)метокси)-5,6,7,8-тетрагидрохиназолин-4-ил)-3-метилпиперазин-1-ил)проп-2-ен-1-он (Пример 12b)
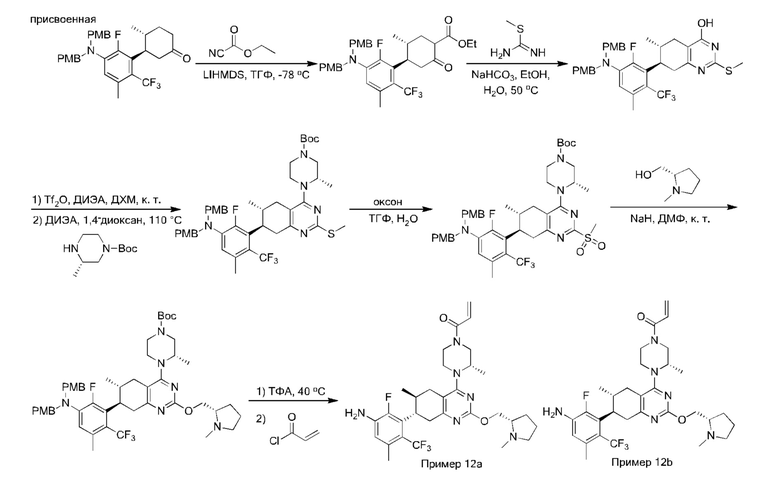
Этап 1: этил (4R,5R)-4-(3-(бис(4-метоксибензил)амино)-2-фтор-5-метил-6-(трифторметил)фенил)-5-метил-2-оксоциклогексан-1-карбоксилат

В атмосфере азота в раствор (3R,4R)-3-(3-(бис(4-метоксибензил)амино)-2-фтор-5-метил-6-(трифторметил)фенил)-4-метилциклогексан-1-она (2,70 г, 4,97 ммоль) в тетрагидрофуране (30 мл) по каплям добавляли бис(триметилсилил)амид лития (9,93 мл, 9,93 ммоль) и перемешивали при -78°С в течение 0,5 часа. Потом добавляли этилцианоформиат (1,13 г, 11,42 ммоль) и перемешивали при -78°С в течение 2 часов. После завершения реакцию гасили водой. После завершения реакцию гасили водой. Растворитель концентрировали в вакууме. Остаток разводили дихлорметаном и промывали водой. Органический слой сушили над безводным сульфатом натрия и концентрировали в вакууме. Остаток очищали с помощью флэш-хроматографии на силикагеле с элюированием петролейным эфиром/этилацетатом (4/1) с получением этил (4R,5R)-4-(3-(бис(4-метоксибензил)амино)-2-фтор-5-метил-6-(трифторметил)фенил)-5-метил-2-оксоциклогексан-1-карбоксилата (1,70 г, 2,76 ммоль, выход 55,6%) в виде бесцветного масла. ЖХМС: (ИЭР, m/z): 616,3 [М+Н]+
Этап 2: (6R,7R)-7-(3-(бис(4-метоксибензил)амино)-2-фтор-5-метил-6-(трифторметил)фенил)-6-метил-2-(метилтио)-5,6,7,8-тетрагидрохиназолин-4-ол
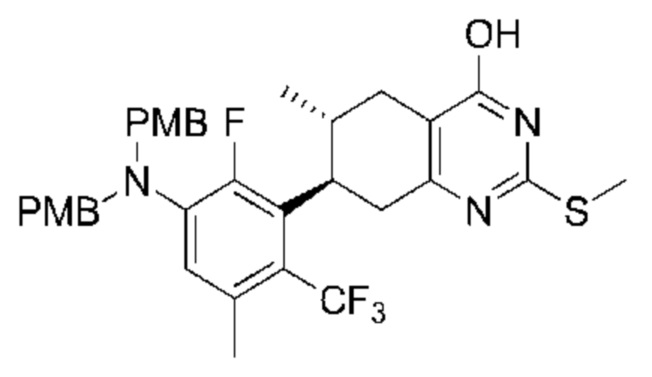
Раствор этил (4R,5R)-4-(3-(бис(4-метоксибензил)амино)-2-фтор-5-метил-6-(трифторметил)фенил)-5-метил-2-оксоциклогексан-1-карбоксилата (1,70 г, 2,76 ммоль), 2-метил-2-тиопсевдомочевины сульфата (7,68 г, 27,61 ммоль) и бикарбоната натрия (5,80 г, 69,03 ммоль) в этаноле (12 мл) и воде (2,5 мл) перемешивали при 50°С в течение 4 часов. После завершения растворитель концентрировали в вакууме. Реакционную смесь разводили водой. Полученный в результате раствор экстрагировали дихлорметаном и объединяли органические слои. Органический слой сушили над безводным сульфатом натрия и концентрировали в вакууме. Остаток очищали с помощью флэш-хроматографии на силикагеле с элюированием дихлорметаном/этилацетатом (4/1) с получением (6R,7R)-7-(3-(бис(4-метоксибензил)амино)-2-фтор-5-метил-6-(трифторметил)фенил)-6-метил-2-(метилтио)-5,6,7,8-тетрагидрохиназолин-4-ола (0,65 г, 1,01 ммоль, выход 36,7%) в виде желтого твердого вещества. ЖХМС: (ИЭР, m/z): 642,2 [М+Н]+.
Этап 3: трет-бутил (S)-4-((6R,7R)-7-(3-(бис(4-метоксибензил)амино)-2-фтор-5-метил-6-(трифторметил)фенил)-6-метил-2-(метилтио)-5,6,7,8-тетрагидрохиназолин-4-ил)-3-метилпиперазин-1-карбоксилат

Раствор (6R,7R)-7-(3-(бис(4-метоксибензил)амино)-2-фтор-5-метил-6-(трифторметил)фенил)-6-метил-2-(метилтио)-5,6,7,8-тетрагидрохиназолин-4-ола (650,0 мг, 1,01 ммоль) и N,N-диизопропилэтиламина (653,32 мг, 5,06 ммоль) в дихлорметане (5 мл) перемешивали при 0°С в течение 0,5 часа. Потом добавляли трифторметансульфоновый ангидрид (571,3 мг, 2,03 ммоль) и перемешивали при 0°С в течение 5 минут. Растворитель концентрировали в вакууме с получением неочищенного продукта. Потом добавляли неочищенный продукт, N,N-диизопропилэтиламин (653,3 мг, 5,06 ммоль) и трет-бутил (3S)-3-метил-1-пиперазинкарбоксилат (202,9 мг, 1,01 ммоль) и перемешивали в 1,4-диоксане (5 мл) при 110°С в течение 5 часов. После завершения растворитель концентрировали в вакууме. Остаток очищали с помощью флэш-хроматографии на силикагеле с элюированием дихлорметаном/метанолом (4/1) с получением трет-бутил (S)-4-((6R,7R)-7-(3-(бис(4-метоксибензил)амино)-2-фтор-5-метил-6-(трифторметил)фенил)-6-метил-2-(метилтио)-5,6,7,8-тетрагидрохиназолин-4-ил)-3-метилпиперазин-1-карбоксилата (660,0 мг, 0,80 ммоль, выход 79,1%) в виде желтого твердого вещества. ЖХМС: (ИЭР, m/z): 824,4 [М+Н]+
Этап 4: трет-бутил (S)-4-((6R,7R)-7-(3-(бис(4-метоксибензил)амино)-2-фтор-5-метил-6-(трифторметил)фенил)-6-метил-2-(метилсульфонил)-5,6,7,8-тетрагидрохиназолин-4-ил)-3-метилпиперазин-1-карбоксилат

Раствор трет-бутил (S)-4-((6R,7R)-7-(3-(бис(4-метоксибензил)амино)-2-фтор-5-метил-6-(трифторметил)фенил)-6-метил-2-(метилтио)-5,6,7,8-тетрагидрохиназолин-4-ил)-3-метилпиперазин-1-карбоксилата (660,0 мг, 0,80 ммоль) и пероксимоносульфата калия (1,48 г, 2,4 ммоль) в тетрагидрофуране (6 мл) и воде (3 мл) перемешивали при комнатной температуре в течение 3 часов. После завершения растворитель концентрировали в вакууме с получением неочищенного продукта. Неочищенный продукт непосредственно использовали для следующего этапа без очистки. ЖХМС: (ИЭР, m/z): 856,4 [М+Н]+
Этап 5: трет-бутил (S)-4-((6R,7R)-7-(3-(бис(4-метоксибензил)амино)-2-фтор-5-метил-6-(трифторметил)фенил)-6-метил-2-(((S)-1-метилпирролидин-2-ил)метокси)-5,6,7,8-тетрагидрохиназолин-4-ил)-3-метилпиперазин-1-карбоксилат

Раствор гидрида натрия (163,56 мг, 4,09 ммоль, 60% дисперсия в минеральном масле) и N-метил-L-пролинола (470,92 мг, 4,09 ммоль) в N,N-диметилформамиде (18 мл) перемешивали при 0°С в течение 0,5 часа. Потом добавляли трет-бутил (S)-4-((6R,7R)-7-(3-(бис(4-метоксибензил)амино)-2-фтор-5-метил-6-(трифторметил)фенил)-6-метил-2-(метилсульфонил)-5,6,7,8-тетрагидрохиназолин-4-ил)-3-метилпиперазин-1-карбоксилат (777,8 мг, 0,82 ммоль) и перемешивали при комнатной температуре в течение 6 часов. После завершения реакцию гасили насыщенным раствором хлорида аммония. Полученный в результате раствор экстрагировали дихлорметаном и объединяли органические слои. Органический слой сушили над безводным сульфатом натрия и концентрировали в вакууме. Остаток очищали с помощью флэш-хроматографии на силикагеле с элюированием дихлорметаном/метанолом (7/1) с получением трет-бутил (S)-4-((6R,7R)-7-(3-(бис(4-метоксибензил)амино)-2-фтор-5-метил-6-(трифторметил)фенил)-6-метил-2-(((S)-1-метилпирролидин-2-ил)метокси)-5,6,7,8-тетрагидрохиназолин-4-ил)-3-метилпиперазин-1-карбоксилата (550,0 мг, 0,62 ммоль, выход 75,5%) в виде желтого твердого вещества. ЖХМС: (ИЭР, m/z): 891,5 [М+Н]+.
Этап 6: 1-((S)-4-((6S,7S)-7-(3-амино-2-фтор-5-метил-6-(трифторметил)фенил)-6-метил-2-(((S)-1-метилпирролидин-2-ил)метокси)-5,6,7,8-тетрагидрохиназолин-4-ил)-3-метилпиперазин-1-ил)проп-2-ен-1-он (Пример 12а); 1-((S)-4-((6R,7R)-7-(3-амино-2-фтор-5-метил-6-(трифторметил)фенил)-6-метил-2-(((S)-1-метилпирролидин-2-ил)метокси)-5,6,7,8-тетрагидрохиназолин-4-ил)-3-метилпиперазин-1-ил)проп-2-ен-1-он (Пример 12b)

Раствор трет-бутил (S)-4-((6R,7S)-7-(3-(бис(4-метоксибензил)амино)-2-фтор-5-метил-6-(трифторметил)фенил)-6-метил-2-(((S)-1-метилпирролидин-2-ил)метокси)-5,6,7,8-тетрагидрохиназолин-4-ил)-3-метилпиперазин-1-карбоксилата (660,0 мг, 0,74 ммоль) в трифторуксусной кислоте (1,5 мл) и дихлорметане (7 мл) перемешивали при 40°С в течение 12 часов. После завершения растворитель концентрировали в вакууме с получением неочищенного продукта. Неочищенный продукт непосредственно использовали для следующего этапа без очистки. Потом в неочищенный продукт и N,N-диизопропилэтиламин (477,75 мг, 3,7 ммоль) в дихлорметане (7 мл) по каплям добавляли акрилилхлорид (67,04 мг, 0,74 ммоль) и перемешивали при -78°С в течение 10 мин. После завершения растворитель концентрировали в вакууме. Остаток очищали с помощью флэш-хроматографии на силикагеле с элюированием дихлорметаном/метанолом (10/1) с получением неочищенного продукта. Смесь очищали с помощью хСФХ. Стереохимия указанных в заголовке соединений была приписана на основании активности.
Пример 12а: (Пик 1): CHIRALPAK IF-3 4,6*50 мм, 3 мкм, гексан (0,1% ДЭА):EtOH = 75:25, 1,0 мл/мин, RT = 1,61 мин (более быстрый). 1Н ЯМР (300 МГц, ДМСО-d6, м. д.) δ 6,95-6,70 (м, 1Н), 6,58 (д, J=8,8 Гц, 1Н), 6,16 (д, J=16,7 Гц, 1Н), 5,84-5,62 (м, 3Н), 4,37-4,15 (м, 3Н), 4,09-3,98 (м, 1Н), 3,92-3,57 (м, 1Н), 3,50-3,04 (м, 5Н), 3,02-2,77 (м, 4Н), 2,70-2,55 (м, 1Н), 2,43-2,09 (м, 9Н), 2,01-1,80 (м, 1Н), 1,73-1,47 (м, 3Н), 1,07-0,91 (м, 3Н), 0,82 (д, J=6,2 Гц, 3Н). ЖХМС: (ПЭР, m/z): 605,4 [М+Н]+
Пример 12b: (Пик 2): CHIRALPAK IF-3 4,6*50 мм, 3 мкм, гексан (0,1% ДЭА):EtOH = 75:25, 1,0 мл/мин, RT = 2,22 мин (более медленный). 1Н ЯМР (300 МГц, ДМСО-d6, м. д.) δ 6,95-6,70 (м, 1Н), 6,58 (д, J=8,8 Гц, 1Н), 6,16 (д, J=17,7 Гц, 1Н), 5,87-5,60 (м, 3Н), 4,46-3,77 (м, 6Н), 3,58-3,40 (м, 1Н), 3,24-3,01 (м, 3Н), 3,00-2,68 (м, 4Н), 2,44-2,04 (м, 10Н), 2,01-1,79 (м, 1Н), 1,73-1,46 (м, 3Н), 1,27 (д, J=6,3 Гц, 3Н), 0,81 (д, J=6,3 Гц, 3Н).
Примеры 13а и 13b

(R)-1-(4-(7-(3-амино-2,5-дифтор-6-(трифторметил)фенил)-5,6,7,8-тетрагидрохиназолин-4-ил)пиперазин-1-ил)проп-2-ен-1-он (Пример 13а);
(S)-1-(4-(7-(3-амино-2,5-дифтор-6-(трифторметил)фенил)-5,6,7,8-тетрагидрохиназолин-4-ил)пиперазин-1-ил)проп-2-ен-1-он (Пример 13b)
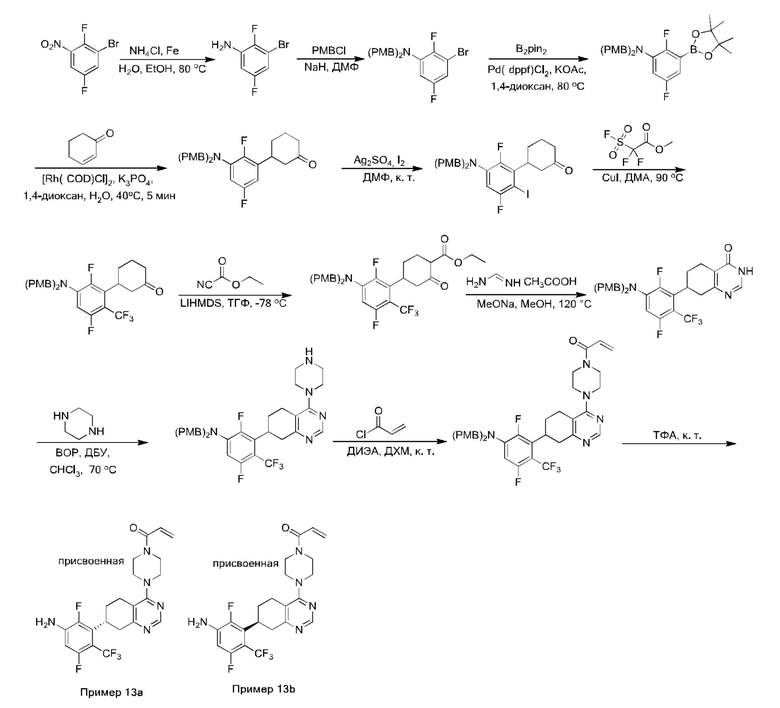
Этап 1: 3-бром-2,5-дифторанилин

Раствор 1-бром-2,5-дифтор-3-нитро-бензола (20,00 г, 84,04 ммоль), порошка железа (14,08 г, 252,11 ммоль) и хлорида аммония (22,27 г, 420,19 ммоль) в этаноле (400 мл) и воде (80 мл) перемешивали при 80°С в течение 2 часов. После завершения реакционную смесь фильтровали, а фильтрат концентрировали при пониженном давлении. Остаток разводили дихлорметаном и промывали насыщенным раствором хлорида натрия, сушили над безводным сульфатом натрия и концентрировали в вакууме с получением 3-бром-2,5-дифторанилина (12,00 г, 57,69 ммоль, выход 68,7%) в виде красного масла. ЖХМС: (ПЭР, m/z): 207,9 [М+Н]+.
Этап 2: 3-бром-2,5-дифтор-N,N-бис(4-метоксибензил)анилин
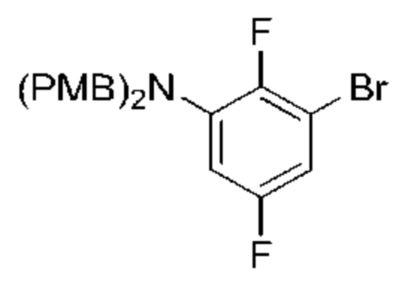
Раствор 3-бром-2,5-дифтор-анилина (12,00 г, 57,69 ммоль) и гидрида натрия (11,54 г, 288,46 ммоль, 60% дисперсия в минеральном масле) в N,N-диметилформамиде (150 мл) перемешивали при 0°С в течение 0,5 часа. Потом добавляли 4-метоксибензилхлорид (38,8 мл, 288,46 ммоль) и перемешивали при комнатной температуре в течение 0,5 часа. После завершения реакцию гасили насыщенным раствором хлорида аммония. Полученный в результате раствор экстрагировали этилацетатом и объединяли органические слои. Органический слой промывали водой, сушили над безводным сульфатом натрия и концентрировали в вакууме. Остаток очищали с помощью флэш-хроматографии на силикагеле с элюированием петролейным эфиром/этилацетатом (10/1) с получением 3-бром-2,5-дифтор-N,N-бис(4-метоксибензил)анилина (20,00 г, 44,61 ммоль, выход 77,3%) в виде желтого масла. ЖХМС: (ПЭР, m/z): 448,1 [М+Н]+.
Этап 3: 2,5-дифтор-N,N-бис(4-метоксибензил)-3-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)анилин

В атмосфере азота раствор 3-бром-2,5-дифтор-N,N-бис[(4-метоксифенил)метил]анилина (20,00 г, 44,61 ммоль), бис(пинаколато)дибора (33,99 г, 133,84 ммоль), 1,1'-бис(дифенилфосфино)ферроцен-палладия (II) дихлорида (3,27 г, 4,46 ммоль) и ацетата калия (8,74 г, 89,23 ммоль) в 1,4-диоксане (200 мл) перемешивали при 80°С в течение 3 часов. После завершения полученный в результате раствор концентрировали в вакууме, разводили дихлорметаном и промывали водой. Органический слой сушили над безводным сульфатом натрия и концентрировали в вакууме. Остаток очищали с помощью флэш-хроматографии на силикагеле с элюированием петролейным эфиром/этилацетатом (10/1) с получением 2,5-дифтор-N,N-бис(4-метоксибензил)-3-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)анилина (14,00 г, 28,26 ммоль, выход 63,3%) в виде желтого твердого вещества. ЖХМС: (ПЭР m/z): 496,2 [М+Н]+.
Этап 4: 3-(3-(бис(4-метоксибензил)амино)-2,5-дифторфенил)циклогексан-1-он

В атмосфере азота в раствор 2-циклогексен-1-он (8,15 г, 84,79 ммоль), 2,5-дифтор-N,N-бис(4-метоксибензил)-3-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)анилина (14,00 г, 28,26 ммоль), димера хлор(1,5-циклооктадиен)родия (I) (0,70 г, 1,41 ммоль) в 1,4-диоксане (100 мл) добавляли водный насыщенный раствор фосфата калия (10 мл) и перемешивали при 40°С в течение 5 минут. После завершения полученный в результате раствор концентрировали в вакууме, разводили дихлорметаном и промывали водой. Органический слой сушили над безводным сульфатом натрия и концентрировали в вакууме. Остаток очищали с помощью флэш-хроматографии на силикагеле с элюированием петролейным эфиром/этилацетатом (5/1) с получением 3-(3-(бис(4-метоксибензил)амино)-2,5-дифторфенил)циклогексан-1-она (8,00 г, 17,19 ммоль, выход 60,8%) в виде желтой жидкости. ЖХМС: (ИЭР, m/z): 466,2 [М+Н]+.
Этап 5: 3-(3-(бис(4-метоксибензил)амино)-2,5-дифтор-6-йодофенил)циклогексан-1-он

Раствор 3-(3-(бис(4-метоксибензил)амино)-2,5-дифторфенил)циклогексан-1-она (6,00 г, 12,89 ммоль), сульфата серебра (4,42 г, 14,18 ммоль) и йода (3,60 г, 14,18 ммоль) в ДМФ (60 мл) перемешивали при комнатной температуре в течение 1 часа. После завершения реакционную смесь фильтровали, а фильтрат концентрировали при пониженном давлении. Остаток очищали с помощью флэш-хроматографии на силикагеле с элюированием петролейным эфиром/этилацетатом (5/1) с получением 3-(3-(бис(4-метоксибензил)амино)-2,5-дифтор-6-йодофенил)циклогексан-1-она (3,50 г, 5,92 ммоль, выход 45,9%) в виде бесцветного масла. ЖХМС: (ИЭР, m/z): 592,1 [М+Н]+.
Этап 6: 3-(3-(бис(4-метоксибензил)амино)-2,5-дифтор-6-(трифторметил)фенил)циклогексан-1-он

В атмосфере азота раствор 3-(3-(бис(4-метоксибензил)амино)-2,5-дифтор-6-йодофенил)циклогексан-1-она (4,00 г, 6,76 ммоль), метил 2,2-дифтор-2-(фторсульфонил)ацетата (6,50 г, 33,82 ммоль) и йодида меди (1,29 г, 6,76 ммоль) в N,N-диметилацетамиде (40 мл) перемешивали при 90°С в течение 2 часов. После завершения реакцию разводили водой, экстрагировали этилацетатом и объединяли органические слои. Органический слой промывали водой, сушили над безводным сульфатом натрия и концентрировали в вакууме. Остаток очищали с помощью флэш-хроматографии на силикагеле с элюированием петролейным эфиром/этилацетатом (3/1) с получением 3-(3-(бис(4-метоксибензил)амино)-2,5-дифтор-6-(трифторметил)фенил)циклогексан-1-она (2,00 г, 3,75 ммоль, выход 55,4%) в виде светло-желтого твердого вещества. ЖХМС: (ИЭР, m/z): 534,2 [М+Н]+.
Этап 7: этил 4-(3-(бис(4-метоксибензил)амино)-2,5-дифтор-6-(трифторметил)фенил)-2-оксоциклогексан-1-карбоксилат

В атмосфере азота в раствор 3-(3-(бис(4-метоксибензил)амино)-2,5-дифтор-6-(трифторметил)фенил)циклогексан-1-она (1,80 г, 3,37 ммоль) в тетрагидрофуране (20 мл) добавляли бис(триметилсилил)амид лития (6,75 мл, 6,75 ммоль, 1,0 М в ТГФ) и перемешивали при -78°С в течение 0,5 часа. Потом добавляли этилцианоформиат (0,77 г, 7,76 ммоль) и перемешивали при -78°С в течение 2 часов. После завершения реакцию гасили водой. Полученный в результате раствор экстрагировали этилацетатом и объединяли органические слои. Органический слой сушили над безводным сульфатом натрия и концентрировали в вакууме. Остаток очищали с помощью флэш-хроматографии на силикагеле с элюированием петролейным эфиром/этилацетатом (4/1) с получением этил 4-(3-(бис(4-метоксибензил)амино)-2,5-дифтор-6-(трифторметил)фенил)-2-оксоциклогексан-1-карбоксилата (0,70 г, 1,16 ммоль, выход 34,3%) в виде бесцветного масла. ЖХМС: (ИЭР, m/z): 606,2 [М+Н]+.
Этап 8: 7-(3-(бис(4-метоксибензил)амино)-2,5-дифтор-6-(трифторметил)фенил)-5,6,7,8-тетрагидрохиназолин-4(3Н)-он

Раствор этил 4-(3-(бис(4-метоксибензил)амино)-2,5-дифтор-6-(трифторметил)фенил)-2-оксоциклогексан-1-карбоксилата (800,0 мг, 1,32 ммоль), формамидинацетата (687,7 мг, 6,61 ммоль) и MeONa (888,7 мг, 9,25 ммоль) в метаноле (10 мл) перемешивали при 120°С в течение 2 часов. После завершения растворитель концентрировали в вакууме. Остаток разводили дихлорметаном и промывали водой. Органический слой сушили над безводным сульфатом натрия и концентрировали в вакууме. Остаток очищали с помощью флэш-хроматографии на силикагеле с элюированием дихлорметаном/метанолом (10/1) с получением 7-(3-(бис(4-метоксибензил)амино)-2,5-дифтор-6-(трифторметил)фенил)-5,6,7,8-тетрагидрохиназолин-4(3Н)-она (400,0 мг, 0,68 ммоль, выход 51,7%) в виде желтого твердого вещества. ЖХМС: (ИЭР, m/z): 586,2 [М+Н]+.
Этап 9: 2,5-дифтор-N,N-бис(4-метоксибензил)-3-(4-(пиперазин-1-ил)-5,6,7,8-тетрагидрохиназолин-7-ил)-4-(трифторметил)анилин

Раствор 7-(3-(бис(4-метоксибензил)амино)-2,5-дифтор-6-(трифторметил)фенил)-5,6,7,8-тетрагидрохиназолин-4(3Н)-она (400,0 мг, 0,68 ммоль), бензотриазол-1-илокситрис(диметиламино)-фосфония гексафторфосфата (604,3 мг, 1,37 ммоль), пиперазина (588,4 мг, 6,83 ммоль) и 1,8-диазабицикло[5.4.0]ундец-7-ена (312,0 мг, 2,05 ммоль) в хлороформе (6 мл) перемешивали при 70°С в течение 4 часов. После завершения реакцию гасили водой. Полученный в результате раствор экстрагировали дихлорметаном и объединяли органические слои. Органический слой сушили над безводным сульфатом натрия и концентрировали в вакууме. Остаток очищали с помощью флэш-хроматографии на силикагеле с элюированием дихлорметаном/метанолом (1/1) с получением 2,5-дифтор-N,N-бис(4-метоксибензил)-3-(4-(пиперазин-1-ил)-5,6,7,8-тетрагидрохиназолин-7-ил)-4-(трифторметил)анилина (300,0 мг, 0,46 ммоль, 67,2%) в виде цветного твердого вещества. ЖХМС: (ИЭР, m/z): 654,3 [М+Н]+.
Этап 10: 1-(4-(7-(3-(бис(4-метоксибензил)амино)-2,5-дифтор-6-(трифторметил)фенил)-5,6,7,8-тетрагидрохиназолин-4-ил)пиперазин-1-ил)проп-2-ен-1-он
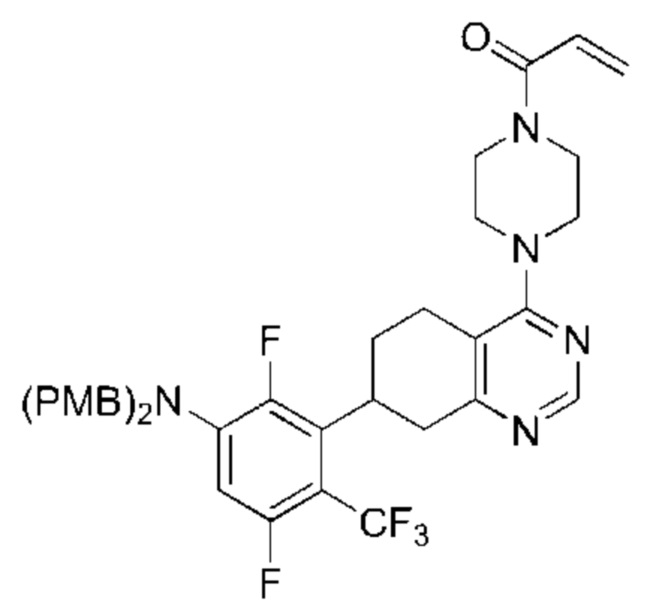
В раствор 2,5-дифтор-N,N-бис(4-метоксибензил)-3-(4-(пиперазин-1-ил)-5,6,7,8-тетрагидрохиназолин-7-ил)-4-(трифторметил)анилина (250,0 мг, 0,38 ммоль) и N,N-диизопропилэтиламина (98,7 мг, 0,76 ммоль) в дихлорметане (4 мл) по каплям добавляли акрилоилхлорид (51,9 мг, 0,57 ммоль) и перемешивали при 0°С в течение 0,5 часа. После завершения реакцию гасили водой. Полученный в результате раствор экстрагировали дихлорметаном и объединяли органические слои. Органический слой сушили над безводным сульфатом натрия и концентрировали в вакууме. Остаток очищали с помощью флэш-хроматографии на силикагеле с элюированием дихлорметаном/метанолом 0 0/1) с получением 1-(4-(7-(3-(бис(4-метоксибензил)амино)-2,5-дифтор-6-(трифторметил)фенил)-5,6,7,8-тетрагидрохиназолин-4-ил)пиперазин-1-ил)проп-2-ен-1-она (270,0 мг, 0,38 ммоль, выход 99,8%) в виде желтого масла. ЖХМС: (ИЭР, m/z): 708,3 [М+Н]+.
Этап 11: (R)-1-(4-(7-(3-амино-2,5-дифтор-6-(трифторметил)фенил)-5,6,7,8-тетрагидрохиназолин-4-ил)пиперазин-1-ил)проп-2-ен-1-он (Пример 13а) и (S)-1-(4-(7-(3-амино-2,5-дифтор-6-(трифторметил)фенил)-5,6,7,8-тетрагидрохиназолин-4-ил)пиперазин-1-ил)проп-2-ен-1-он (Пример 13b)

Раствор 1-(4-(7-(3-(бис(4-метоксибензил)амино)-2,5-дифтор-6-(трифторметил)фенил)-5,6,7,8-тетрагидрохиназолин-4-ил)пиперазин-1-ил)проп-2-ен-1-она (200,0 мг, 0,28 ммоль) в трифторуксусной кислоте (3 мл) и дихлорметане (3 мл) перемешивали при комнатной температуре в течение 3 часов. После завершения растворитель концентрировали в вакууме. Остаток разводили дихлорметаном. Реакционную смесь доводили до рН = 7 N,N-диизопропилэтиламином. Остаток очищали с помощью флэш-хроматографии на обращенно-фазовой колонке с элюированием водой/ацетонитрилом (4/6) с получением диастереоизомеров в виде белого твердого вещества. Потом диастереоизомеры выделяли с помощью препаративной хиральной ВЭЖХ (колонка: CHIRALPAK IC-3, 4,6*50 мм, 3 мкм; подвижная фаза А: гексан (0,1% ДЭА): EtOH = 50:50, подвижная фаза В:; скорость потока: 1 мл/мин, с получением указанных в заголовке соединений. Абсолютная конфигурация указанных в заголовке соединений была определена по данным активности и рентгенограммы белковой структуры соединения 21b.
Пример 13а: (R)-1-(4-(7-(3-амино-2,5-дифтор-6-(трифторметил)фенил)-5,6,7,8-тетрагидрохиназолин-4-ил)пиперазин-1-ил)проп-2-ен-1-он (34,2 мг, 0,07 ммоль, выход 25,9%, белое твердое вещество). 1Н ЯМР (300 МГц, ДМСО-d6) δ 8,52 (с, 1Н), 6,83 (дд, J=16,8, 10,5 Гц, 1Н), 6,54 (дд, J=14,4, 7,2 Гц, 1Н), 6,29 (с, 2Н), 6,14 (дд, J=16,8, 2,4 Гц, 1Н), 5,72 (дд, J=10,5, 2,4 Гц, 1Н), 3,75-3,69 (м, 2Н), 3,65-3,52 (м, 5Н), 3,22-3,20 (м, 1Н), 3,04-2,97 (м, 3Н), 2,85-2,74 (м, 1Н), 2,68-2,62 (м, 1Н), 1,99 (шир. с, 2Н). ЖХМС: (ИЭР, m/z): 468,2 [М+Н]+. Хиральная ВЭЖХ: CHIRALPAK IC-3 (4,6*50 мм); обнаружение на 254 нм; гексан (0,1% ДЭА)/EtOH = 50/50; скорость потока = 1,0 мл/мин; время удержания: 1,444 мин (более быстрый пик).
Пример 13b: (S)-1-(4-(7-(3-амино-2,5-дифтор-6-(трифторметил)фенил)-5,6,7,8-тетрагидрохиназолин-4-ил)пиперазин-1-ил)проп-2-ен-1-он (34,0 мг, 0,07 ммоль, выход 25,7%, белое твердое вещество). 1Н ЯМР (300 МГц, ДМСО-d6) δ 8,52 (с, 1Н), 6,83 (дд, J=16,8, 10,5 Гц, 1Н), 6,54 (дд, J=14,4, 7,2 Гц, 1Н), 6,29 (с, 2Н), 6,14 (дд, J=16,8, 2,4 Гц, 1Н), 5,72 (дд, J=10,5, 2,4 Гц, 1Н), 3,75-3,69 (м, 2Н), 3,65-3,52 (м, 5Н), 3,22-3,20 (м, 1Н), 3,04-2,97 (м, 3Н), 2,85-2,74 (м, 1Н), 2,68-2,62 (м, 1Н), 1,99 (шир. с, 2Н). ЖХМС: (ИЭР, m/z): 468,2 [М+Н]+. Хиральная ВЭЖХ: CHIRALPAK IC-3 (4,6*50 мм); обнаружение на 254 нм; гексан (0,1% ДЭА)/EtOH = 50/50; скорость потока = 1,0 мл/мин; время удержания: 1,920 мин (более медленный пик). Примеры 14а и 14b

трет-бутил (S)-4-((6R,7R)-7-(3-(бис(4-метоксибензил)амино)-2-фтор-6-йодо-5-метилфенил)-6-метил-2-(((S)-1-метилпирролидин-2-ил)метокси)-5,6,7,8-тетрагидрохиназолин-4-ил)-3-метилпиперазин-1-карбоксилат (Пример 14а)
трет-бутил (S)-4-((6S,7S)-7-(3-(бис(4-метоксибензил)амино)-2-фтор-6-йодо-5-метилфенил)-6-метил-2-(((S)-1-метилпирролидин-2-ил)метокси)-5,6,7,8-тетрагидрохиназолин-4-ил)-3-метилпиперазин-1-карбоксилат (Пример 14b)
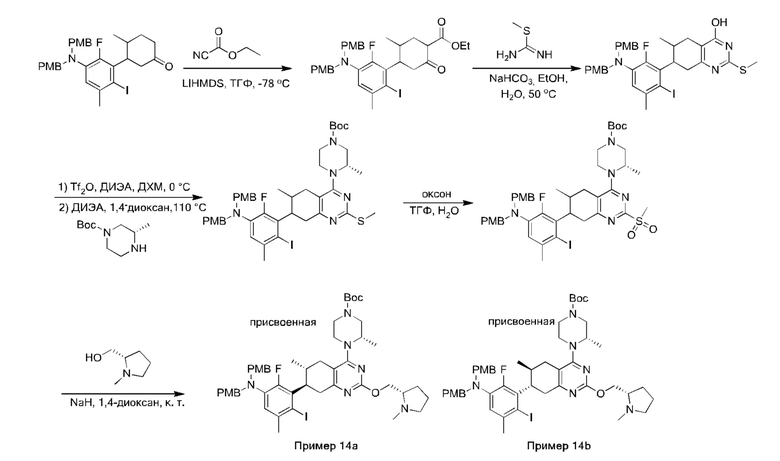
Этап 1: этил 4-(3-(бис(4-метоксибензил)амино)-2-фтор-6-йодо-5-метилфенил)-5-метил-2-оксоциклогексан-1-карбоксилат

В атмосфере азота в раствор 3-(3-(бис(4-метоксибензил)амино)-2-фтор-6-йодо-5-метилфенил)-4-метилциклогексан-1-она (6,00 г, 9,98 ммоль) в тетрагидрофуране (50 мл) по каплям добавляли бис(триметилсилил)амид лития (19,95 мл, 19,95 ммоль, 1,0 М в ТГФ) и перемешивали при -78°С в течение 0,5 часа. Потом по каплям добавляли этилцианоформиат (2,27 г, 22,94 ммоль) и перемешивали при -78°С в течение 2 часов. После завершения реакцию гасили водой. Полученный в результате раствор экстрагировали этилацетатом и объединяли органические слои. Органический слой сушили над безводным сульфатом натрия и концентрировали в вакууме. Остаток очищали с помощью флэш-хроматографии на силикагеле с элюированием петролейным эфиром/этилацетатом (4/1) с получением этил 4-(3-(бис(4-метоксибензил)амино)-2-фтор-6-йодо-5-метилфенил)-5-метил-2-оксоциклогексан-1-карбоксилата (2,50 г, 3,71 ммоль, выход 37,2%) в виде бесцветного масла. ЖХМС: (ИЭР, m/z): 674,2 [М+Н]+.
Этап 2: 7-(3-(бис(4-метоксибензил)амино)-2-фтор-6-йодо-5-метилфенил)-6-метил-2-(метилтио)-5,6,7,8-тетрагидрохиназолин-4-ол

Раствор этил 4-(3-(бис(4-метоксибензил)амино)-2-фтор-6-йодо-5-метилфенил)-5-метил-2-оксоциклогексан-1-карбоксилата (3,00 г, 4,45 ммоль), 2-метилизотиомочевины (12,38 г, 44,54 ммоль) и бикарбоната натрия (9,35 г, 111,35 ммоль) в этаноле (50 мл) и воде (10 мл) перемешивали при 50°С в течение 1 часа. После завершения реакционную смесь фильтровали, а фильтрат концентрировали при пониженном давлении. Остаток очищали с помощью флэш-хроматографии на силикагеле с элютрованием дихлорметаном/этилацетатом (3/1) с получением 7-(3-(бис(4-метоксибензил)амино)-2-фтор-6-йодо-5-метилфенил)-6-метил-2-(метилтио)-5,6,7,8-тетрагидрохиназолин-4-ола (0,70 г, 1,00 ммоль, выход 22,5%) в виде желтого твердого вещества. ЖХМС: (ИЭР, m/z): 700,1 [М+Н]+.
Этап 3: трет-бутил (3S)-4-(7-(3-(бис(4-метоксибензил)амино)-2-фтор-6-йодо-5-метил фенил)-6-метил-2-(метилтио)-5,6,7,8-тетрагидрохиназолин-4-ил)-3-метилпиперазин-1-карбоксилат
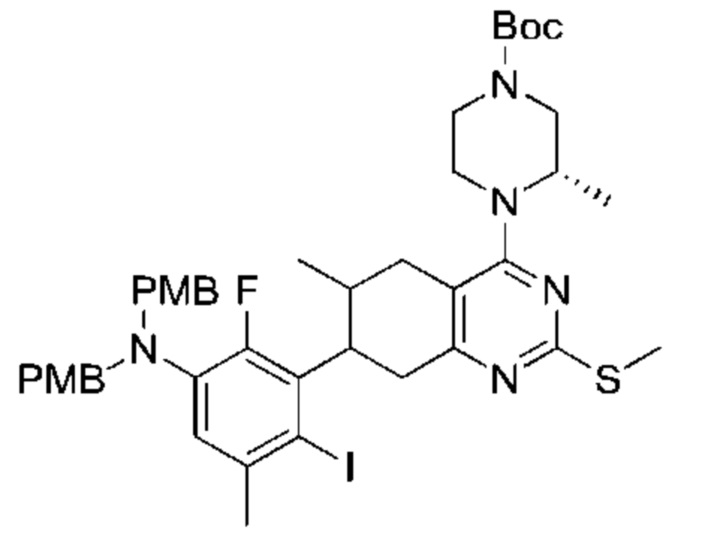
Раствор 7-(3-(бис(4-метоксибензил)амино)-2-фтор-6-йодо-5-метилфенил)-6-метил-2-(метилтио)-5,6,7,8-тетрагидрохиназолин-4-ола (700,0 мг, 1,00 ммоль) и N,N-диизопропилэтиламина (0,45 г, 3,00 ммоль) в дихлорметане (5 мл) перемешивали при 0°С в течение 5 минут. Потом добавляли трифторметансульфоновый ангидрид (564,6 мг, 2,00 ммоль) и перемешивали при 0°С в течение 30 минут. Растворитель концентрировали в вакууме с получением неочищенного продукта. Потом неочищенный продукт, N,N-диизопропилэтиламин (1,29 г, 10,01 ммоль) и трет-бутил (3S)-3-метил-1-пиперазинкарбоксилат (1,20 г, 6,00 ммоль) в 1,4-диоксане (6 мл) перемешивали при 110°С в течение 5 часов. После завершения растворитель концентрировали в вакууме. Остаток разводили дихлорметаном и промывали водой, сушили над безводным сульфатом натрия и концентрировали в вакууме. Остаток очищали с помощью флэш-хроматографии на силикагеле с элюированием петролейным эфиром/этилацетатом (3/1) с получением трет-бутил (3S)-4-(7-(3-(бис(4-метоксибензил)амино)-2-фтор-6-йодо-5-метилфенил)-6-метил-2-(метилтио)-5,6,7,8-тетрагидрохиназолин-4-ил)-3-метилпиперазин-1-карбоксилата (400,0 мг, 0,45 ммоль, выход 45,3%) в виде желтого твердого вещества. ЖХМС: (ИЭР, m/z): 882,3 [М+Н]+.
Этап 4: трет-бутил (3S)-4-(7-(3-(бис(4-метоксибензил)амино)-2-фтор-6-йодо-5-метилфенил)-6-метил-2-(метилсульфонил)-5,6,7,8-тетрагидрохиназолин-4-ил)-3-метилпиперазин-1-карбоксилат

Раствор трет-бутил (3S)-4-(7-(3-(бис(4-метоксибензил)амино)-2-фтор-6-йодо-5-метил фенил)-6-метил-2-(метилтио)-5,6,7,8-тетрагидрохиназолин-4-ил)-3-метилпиперазин-1-карбоксилата (660,0 мг, 0,80 ммоль) и пероксимоносульфата калия (1,48 г, 2,4 ммоль) в тетрагидрофуране (6 мл) и воде (3 мл) перемешивали при комнатной температуре в течение 3 часов. После завершения полученный в результате раствор разводили дихлорметаном, промывали водным насыщенным раствором тиосульфата натрия, сушили над безводным сульфатом натрия и концентрировали в вакууме с получением неочищенного продукта. Неочищенный продукт непосредственно использовали для следующего этапа без очистки. ЖХМС: (ИЭР, m/z): 914,3 [М+Н]+.
Этап 5: трет-бутил (S)-4-((6R,7R)-7-(3-(бис(4-метоксибензил)амино)-2-фтор-6-йодо-5-метилфенил)-6-метил-2-(((S)-1-метилпирролидин-2-ил)метокси)-5,6,7,8-тетрагидрохиназолин-4-ил)-3-метилпиперазин-1-карбоксилат (Пример 14а) и трет-бутил (S)-4-((6S,7S)-7-(3-(бис(4-метоксибензил)амино)-2-фтор-6-йодо-5-метилфенил)-6-метил-2-(((S)-1-метилпирролидин-2-ил)метокси)-5,6,7,8-тетрагидрохиназолин-4-ил)-3-метилпиперазин-1-карбоксилат (Пример 14b)
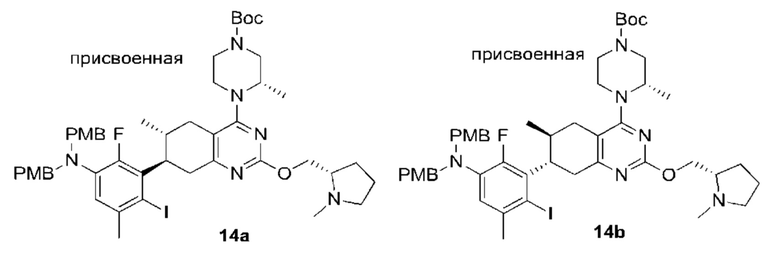
Раствор N-метил-L-пролинола (75,6 мг, 0,66 ммоль) и гидрида натрия (65,7 мг, 1,64 ммоль, 60% дисперсия в минеральном масле) в 1,4-диоксане (4 мл) перемешивали при комнатной температуре в течение 5 минут. Потом добавляли трет-бутил (3S)-4-(7-(3-(бис(4-метоксибензил)амино)-2-фтор-6-йодо-5-метилфенил)-6-метил-2-(метилсульфонил)-5,6,7,8-тетрагидрохиназолин-4-ил)-3-метилпиперазин-1-карбоксилат (300,0 мг, 0,33 ммоль) и перемешивали при комнатной температуре в течение 1 часа. После завершения реакцию гасили водой. Полученный в результате раствор экстрагировали дихлорметаном и объединяли органические слои. Органический слой сушили над безводным сульфатом натрия и концентрировали в вакууме. Остаток очищали с помощью флэш-хроматографии на силикагеле с элюированием дихлорметаном/метанолом (10/1) с получением диастереоизомеров в виде белого твердого вещества. Потом диастереоизомеры выделяли с помощью препаративной хиральной ВЭЖХ (колонка: CHIRALPAK IE-3, 4,6*50 мм, 3 мкм; подвижная фаза А: МТБЭ (0,1% ДЭА): EtOH = 80:20, подвижная фаза В:; скорость потока: 1 мл/мин, с получением указанных в заголовке соединений. Стереохимия указанных в заголовке соединений была приписана произвольным образом.
Пример 14а: трет-бутил(S)-4-((6R,7R)-7-(3-(бис(4-метоксибензил)амино)-2-фтор-6-йодо-5-метилфенил)-6-метил-2-(((S)-1-метилпирролидин-2-ил)метокси)-5,6,7,8-тетрагидрохиназолин-4-ил)-3-метилпиперазин-1-карбоксилат (54,4 мг, 0,06 ммоль, выход 17,5%, белое твердое вещество). 1Н ЯМР (300 МГц, ДМСО-d6) δ 7,17 (д, J=8,4 Гц, 4Н), 6,94 (д, J=8,7 Гц, 1Н), 6,84 (д, J=8,7 Гц, 4Н), 4,24-4,12 (м, 6Н), 4,00 (дд, J=10,8, 6,6 Гц, 1Н), 3,95-3,85 (м, 1Н), 3,70-3,67 (м, 7Н), 3,48-3,42 (м, 2Н), 2,95-2,90 (м, 2Н), 2,84 (д, J=9,3 Гц, 2Н), 2,60-2,56 (м, 2Н), 2,47-2,40 (м, 1Н), 2,34-2,28 (м, 7Н), 2,19-2,09 (м, 1Н), 1,93-1,84 (м, 1Н), 1,67-1,53 (м, 3Н), 1,42 (с, 9Н), 1,23 (с, 1Н), 1,00-0,93 (м, 4Н), 0,80 (д, J=6,0 Гц, 3Н). ЖХМС (ИЭР, m/z): 949,4 [М+Н]+. Хиральная ВЭЖХ: CHIRALPAK IE-3 (4,6*50 мм); обнаружение на 254 нм; МТБЭ (0,1% ДЭА)/EtOH = 70/30; скорость потока = 1,0 мл/мин; время удержания: 0,992 мин (более быстрый пик).
Пример 14b: трет-бутил(S)-4-((6S,7S)-7-(3-(бис(4-метоксибензил)амино)-2-фтор-6-йодо-5-метилфенил)-6-метил-2-(((S)-1-метилпирролидин-2-ил)метокси)-5,6,7,8-тетрагидрохиназолин-4-ил)-3-метилпиперазин-1-карбоксилат (44,3 мг, 0,05 ммоль, выход 14,2%, белое твердое вещество). 1Н ЯМР (300 МГц, ДМСО-d6) δ 7,17 (д, J=8,4 Гц, 4Н), 6,94 (д, J=8,7 Гц, 1Н), 6,84 (д, J=8,7 Гц, 4Н), 4,25-4,12 (м, 5Н), 4,08-3,97 (м, 2Н), 3,94-3,82 (м, 2Н), 3,73-3,70 (м, 7Н), 3,44-3,40 (м, 2Н), 3,10 (шир. с, 2Н), 2,96-2,90 (м, 2Н), 2,83-2,80 (м, 2Н), 2,45-2,39 (м, 1Н), 2,32-2,28 (м, 7Н), 2,19-2,11 (м, 1Н), 1,94-1,85 (м, 1Н), 1,69-1,53 (м, 3Н), 1,42 (с, 9Н), 1,30-1,23 (м, 4Н), 0,80 (д, J=6,0 Гц, ЗН). ЖХМС (ИЭР, m/z): 949,4 [М+Н]+. Хиральная ВЭЖХ: CHIRALPAK IE-3 (4,6*50 мм); обнаружение на 254 нм; МТБЭ (0,1% ДЭА)/EtOH = 70/30; скорость потока = 1,0 мл/мин; время удержания: 1,553 мин (более медленный пик).
Примеры 15а и 15b

1-(4-((6R,7R)-6-метил-7-(5-метил-1H-индазол-4-ил)-5,6,7,8-тетрагидрохиназолин-4-ил)пиперазин-1-ил)проп-2-ен-1-он (Пример 15а);
1-(4-((6S,7S)-6-метил-7-(5-метил-1Н-индазол-4-ил)-5,6,7,8-тетрагидрохиназолин-4-ил)пиперазин-1-ил)проп-2-ен-1-он (Пример 15b)
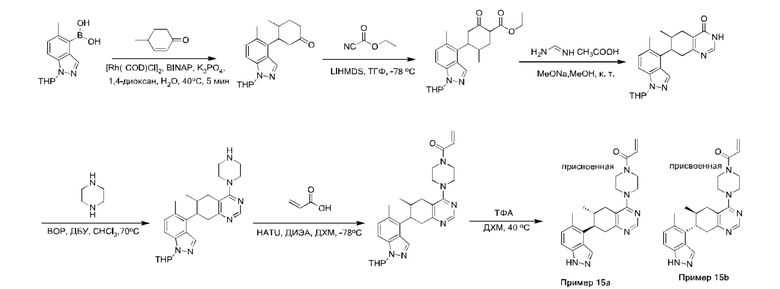
Этап 1: 4-метил-3-(5-метил-1-тетрагидропиран-2-ил-индазол-4-ил)циклогексанон

В атмосфере азота в раствор (5-метил-1-тетрагидропиран-2-ил-индазол-4-ил)бороновой кислоты (3,00 г, 11,76 ммоль), 4-метилциклогекс-2-ен-1-она (2,58 г, 23,58 ммоль), (+/-)-2,2'-бис(дифенилфосфино)-1,1'-бинафтила (1,44 г, 2,34 ммоль) и димера хлор (1,5-циклооктадиен)родия (I) (0,60 г, 1,20 ммоль) в 1,4-диоксане (15 мл) добавляли водный насыщенный раствор фосфата калия (3 мл) и перемешивали в течение 5 мин при 40°С. После завершения реакционную смесь концентрировали в вакууме. Реакционную смесь разводили дихлорметаном и промывали водой. Органический слой сушили над безводным сульфатом натрия и концентрировали в вакууме. Остаток очищали с помощью флэш-хроматографии на силикагеле с элюированием петролейным эфиром/этилацетатом (2/1) с получением 4-метил-3-(5-метил-1-тетрагидропиран-2-ил-индазол-4-ил)циклогексанона (1,50 г, 4,60 ммоль, выход 39%) в виде желтого твердого вещества. ЖХМС (ИЭР, m/z): 327,2 [М+Н]+.
Этап 2: этил 5-метил-4-(5-метил-1-тетрагидропиран-2-ил-индазол-4-ил)-2-оксо-циклогексанкарбоксилат

В атмосфере азота в раствор 4-метил-3-(5-метил-1-тетрагидропиран-2-ил-индазол-4-ил)циклогексанона (1,50 г, 4,62 ммоль) в тетрагидрофуране (50 мл) по каплям добавляли бис(триметилсилил)амид лития (6,0 мл, 6,00 ммоль) (1 M в ТГФ) и перемешивали в течение 1 часа при -78°С. Потом добавляли этилцианоформиат (0,69 г, 6,93 ммоль) и перемешивали при-78°С в течение 0,5 часа. После завершения полученный в результате раствор гасили водным насыщенным раствором хлорида аммония. Реакционную смесь разводили дихлорметаном и промывали водой. Органический слой сушили над безводным сульфатом натрия и концентрировали в вакууме. Остаток очищали с помощью флэш-хроматографии на силикагеле с элюированием петролейным эфиром/этилацетатом (2/1) с получением этил 5-метил-4-(5-метил-1-тетрагидропиран-2-ил-индазол-4-ил)-2-оксо-циклогексанкарбоксилата (0,78 г, 1,96 ммоль, выход 42,3%) в виде желтого твердого вещества. ЖХМС (ИЭР, m/z): 399,2 [М+Н]+.
Этап 3: 6-метил-7-(5-метил-1-тетрагидропиран-2-ил-инд азол-4-ил)-5,6,7,8-тетрагидро-3Н-хиназолин-4-он
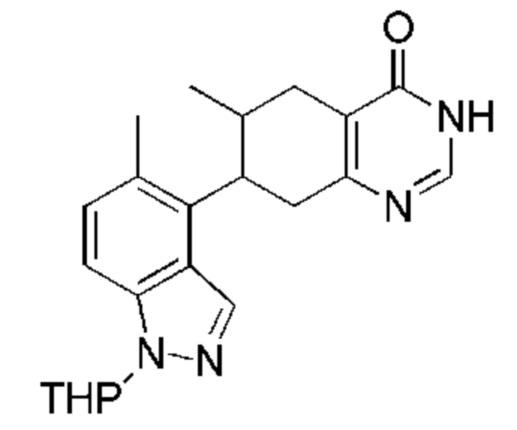
Раствор этил 5-метил-4-(5-метил-1-тетрагидропиран-2-ил-индазол-4-ил)-2-оксо-циклогексанкарбоксилата (0,72 г, 1,806 ммоль), формамидинацетата (0,57 г, 5,43 ммоль) и метоксида натрия (0,39 г, 7,24 ммоль) в метиловом спирте (20 мл) перемешивали при 25°С в течение 3 часов. После завершения реакционную смесь концентрировали в вакууме. Реакционную смесь разводили дихлорметаном, доводили до рН = 7 HCl в 1,4-диоксане и промывали водой. Органический слой сушили над безводным сульфатом натрия и концентрировали в вакууме. Остаток очищали с помощью флэш-хроматографии на силикагеле с элюированием петролейным эфиром/этилацетатом (1/1) с получением 6-метил-7-(5-метил-1-тетрагидропиран-2-ил-индазол-4-ил)-5,6,7,8-тетрагидро-3Н-хиназолин-4-она (450,0 мг, 1,20 ммоль, выход 66,4%) в виде желтого твердого вещества. ЖХМС (ИЭР, m/z): 379,2 [М+Н]+.
Этап 4: 6-метил-7-(5-метил-1-тетрагидропиран-2-ил-индазол-4-ил)-4-пиперазин-1-ил-5,6,7,8-тетрагидрохиназолин

Раствор 6-метил-7-(5-метил-1-тетрагидропиран-2-ил-инд азол-4-ил)-5,6,7,8-тетрагидро-ЗН-хиназолин-4-она (0,45 г, 1,13 ммоль), пиперазина (0,25 г, 2,97 ммоль), ВОР (0,68 г, 1,55 ммоль) и 1,8-диазабицикло[5.4.0]ундец-7-ена (0,53 мл, 3,57 ммоль) в хлороформе (10 мл) перемешивали при 70°С в течение 1 часа. После завершения реакционную смесь разводили дихлорметаном и промывали водой. Органический слой сушили над безводным сульфатом натрия и концентрировали в вакууме. Остаток очищали с помощью флэш-хроматографии на силикагеле с элюированием дихлорметаном/метанолом (20/1) с получением 6-метил-7-(5-метил-1-тетрагидропиран-2-ил-индазол-4-ил)-4-пиперазин-1-ил-5,6,7,8-тетрагидрохиназолина (460,0 мг, 1,03 ммоль, выход 86,6%) в виде желтого твердого вещества. ЖХМС (ИЭР, m/z): 447,3 [М+Н]+.
Этап 5: 1-[4-[6-метил-7-(5-метил-1-тетрагидропиран-2-ил-индазол-4-ил)-5,6,7,8-тетрагидрохиназолин-4-ил]пиперазин-1-ил]проп-2-ен-1-он
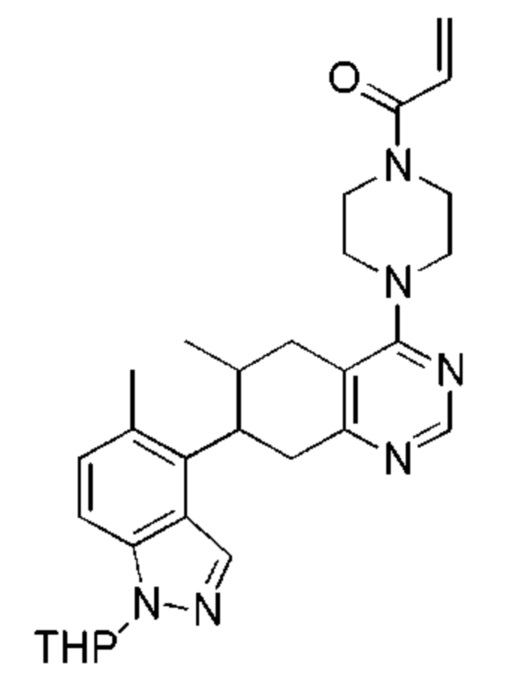
Раствор акриловой кислоты (142,0 мг, 1,97 ммоль), 6-метил-7-(5-метил-1-тетрагидропиран-2-ил-индазол-4-ил)-4-пиперазин-1-ил-5,6,7,8-тетрагидрохиназолина (440,0 мг, 0,99 ммоль), HATU (487,0 мг, 1,28 ммоль) и N,N-диизопропилэтиламина (0,34 мл, 1,97 ммоль) в дихлорметане (3 мл) перемешивали при -78°С в течение 0,5 часа. После завершения реакционную смесь разводили водой и экстрагировали дихлорметаном. Органические слои объединяли и промывали солевым раствором. Органические слои сушили над безводным сульфатом натрия и концентрировали в вакууме. Остаток очищали с помощью флэш-хроматографии на силикагеле с элюированием петролейным эфиром/этилацетатом (1/1) с получением 1-[4-[6-метил-7-(5-метил-1-тетрагидропиран-2-ил-индазол-4-ил)-5,6,7,8-тетрагидрохиназолин-4-ил]пиперазин-1-ил]проп-2-ен-1-она (200,0 мг, 0,40 ммоль, выход 40,5%) в виде твердого вещества. ЖХМС (ИЭР, m/z): 501,3 [М+Н]+.
Этап 5: 1-(4-((6R,7R)-6-метил-7-(5-метил-1Н-индазол-4-ил)-5,6,7,8-тетрагидрохиназолин-4-ил)пиперазин-1-ил)проп-2-ен-1-он (Пример 15а); 1-(4-((6S,7S)-6-метил-7-(5-метил-1Н-индазол-4-ил)-5,6,7,8-тетрагидрохиназолин-4-ил)пиперазин-1-ил)проп-2-ен-1-он (Пример 15b)
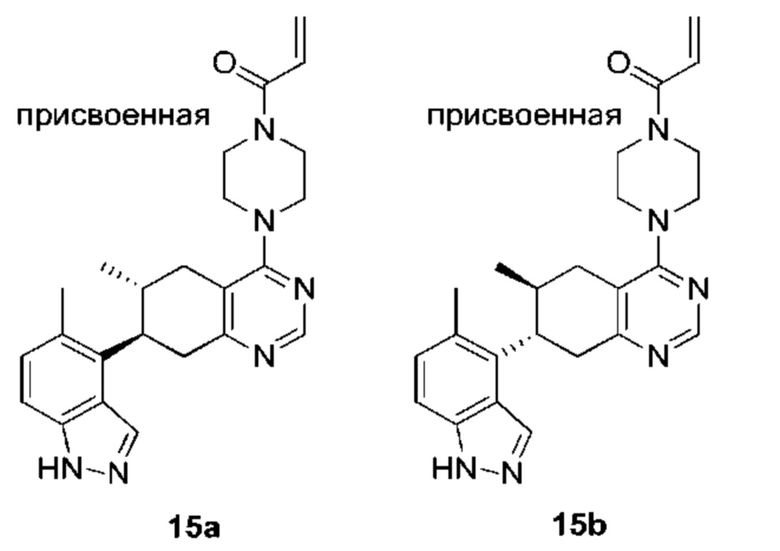
Раствор 1-[4-[6-метил-7-(5-метил-1-тетрагидропиран-2-ил-индазол-4-ил)-5,6,7,8-тетрагидрохиназолин-4-ил]пиперазин-1-ил]проп-2-ен-1-она (180,0 мг, 0,36 ммоль) в трифторуксусной кислоте (1 мл) и дихлорметане (5 мл) перемешивали при 40°С в течение 1 часа. После завершения растворитель концентрировали в вакууме. Остаток очищали с помощью препаративной ВЭЖХ с условиями с колонкой: колонка XBridge Prep С18 OBD 19×150 мм, 5 мкм; подвижная фаза А: вода (10 ммоль/л NH4HCO3), подвижная фаза В: АЦН; скорость потока: 25 мл/мин; градиент: от 25% В до 50% В за 7 мин; 254/220 нм; Rt: 7,23 мин. Смесь энантиомеров разделяли с помощью хиральной препаративной ВЭЖХ со следующими условиями: колонка: CHIRALPAK IA, 2*25 см, 5 мкм; подвижная фаза А: гексан (8 ммоль/л NH3.MeOH) -- ВЭЖХ, подвижная фаза В: ИПА--ВЭЖХ; скорость потока: 12 мл/мин; градиент: от 50 В до 50 В за 23 мин; 220/254 нм; RT1: 10,5; RT2: 16,5, с получением указанных в заголовке соединений. Абсолютная конфигурация указанных в заголовке соединений была определена по данным активности и рентгенограммы белковой структуры соединения 21b.
Пример 15а: 1-[4-[(6R,7R)-6-метил-7-(5-метил-1Н-индазол-4-ил)-5,6,7,8-тетрагидрохиназолин-4-ил]пиперазин-1-ил]проп-2-ен-1-он (4,3 мг, 0,01 ммоль, выход 2,9%, белое твердое вещество). 1Н ЯМР (300 МГц, ДМСО-d6, м. д.) δ 12,97 (с, 1Н), 8,52 (с, 1Н), 8,09 (с, 1Н), 7,32 (д, J=8,1 Гц, 1Н), 7,19 (д, J=8,4 Гц, 1Н), 6,86 (дд, J=16,8, 10,5 Гц, 1Н), 6,17 (дд, J=16,8, 2,4 Гц, 1Н), 5,77 (дд, J=10,2, 2,1 Гц, 1Н), 3,82-3,74 (м, 2Н), 3,68-3,52 (м, 4Н), 3,43-3,40 (м, 1Н), 3,28 (шир. с, 2Н), 3,20-3,12 (м, 1Н), 3,01-2,97 (м, 1Н), 2,77-2,62 (м, 2Н), 2,44 (с, 4Н), 0,73 (д, J=6,0 Гц, 3Н). ЖХМС (ИЭР, m/z): 417,2 [М+Н]+. Хиральная ВЭЖХ: CHIRALPAK IA-3 (0,46*5 см; 3 мкм); обнаружение на 254 нм; гексан (0,1% ДЭА)/ИПА = 50:50; скорость потока = 1,0 мл/мин; время удержания: 1,281 мин (более быстрый пик).
Пример 15b: 1-[4-[(6S,7S)-6-метил-7-(5-метил-1Н-индазол-4-ил)-5,6,7,8-тетрагидрохиназолин-4-ил]пиперазин-1-ил]проп-2-ен-1-он (5,2 мг, 0,01 ммоль, выход 3,5%, белое твердое вещество). 1Н ЯМР (300 МГц, ДМСО-d6, м. д.) δ 12,97 (с, 1Н), 8,52 (с, 1Н), 8,09 (с, 1Н), 7,32 (д, J=8,1 Гц, 1Н), 7,19 (д, J=8,4 Гц, 1Н), 6,86 (дд, J=16,8, 10,5 Гц, 1Н), 6,17 (дд, J=16,8, 2,4 Гц, 1Н), 5,77 (дд, J=10,2, 2,1 Гц, 1Н), 3,82-3,74 (м, 2Н), 3,68-3,52 (м, 4Н), 3,43-3,40 (м, 1Н), 3,28 (шир. с, 2Н), 3,20-3,12 (м, 1Н), 3,01-2,97 (м, 1Н), 2,77-2,62 (м, 2Н), 2,44 (с, 4Н), 0,73 (д, J=6,0 Гц, 3Н). ЖХМС (ИЭР, m/z): 417,2 [М+Н]+. Хиральная ВЭЖХ: CHIRALPAK IA-3; обнаружение на 254 нм; гексан (0,1% ДЭА)/ИПА = 50:50; скорость потока = 1,0 мл/мин; время удержания: 1,872 мин (более медленный пик).
Пример 16

1-(4-(7-(3-гидроксинафтален-1-ил)-6-изопропил-5,6,7,8-тетрагидрохиназолин-4-ил)пиперазин-1-ил)проп-2-ен-1-он

Этап 1: 4-изопропил-3-(3-(4-метоксибензилокси)нафтален-1-ил)циклогексанон
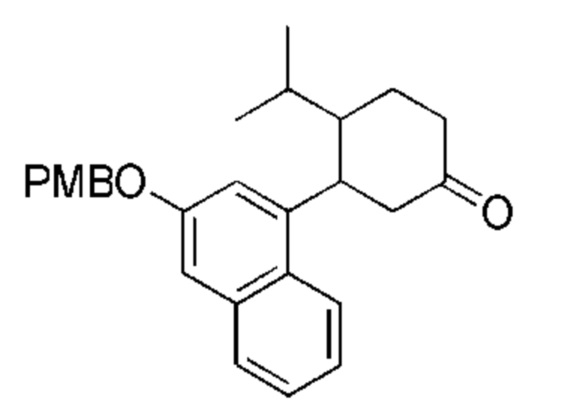
В атмосфере азота в раствор 4-изопропилциклогекс-2-ен-1-она (0,27 г, 1,92 ммоль), 2-[3-[(4-метоксифенил)метокси]-1-нафтил]-4,4,5,5-тетраметил-1,3,2-диоксаборолана (0,50 г, 1,28 ммоль), димера хлор (1,5-циклооктадиен)родия (I) (0,06 г, 0,13 ммоль), (+/-)-2,2'-бис(дифенилфосфино)-1,1'-бинафтила (0,16 г, 0,26 ммоль) в 1,4-диоксане (3 мл) добавляли водный насыщенный раствор фосфата калия (0,6 мл) и перемешивали в течение 5 минут при 40°С. После завершения реакционную смесь концентрировали в вакууме. Реакционную смесь разводили дихлорметаном и промывали водой. Органический слой сушили над безводным сульфатом натрия и концентрировали в вакууме. Остаток очищали с помощью флэш-хроматографии на силикагеле с элюированием петролейным эфиром/этилацетатом (1/1) с получением 4-изопропил-3-[3-[(4-метоксифенил)метокси]-1-нафтил]циклогексанона (0,14 г, 0,35 ммоль, выход 27,1%) в виде желтого твердого вещества. ЖХМС (ИЭР, m/z): 403,2 [М+Н]+.
Этап 2: этил 5-изопропил-4-[3-[(4-метоксифенил)метокси]-1-нафтил]-2-оксо-циклогексанкарбоксилат

В атмосфере азота в раствор 4-изопропил-3-[3-[(4-метоксифенил)метокси]-1-нафтил]циклогексанона (0,67 г, 1,66 ммоль) в тетрагидрофуране (30 мл) по каплям добавляли бис(триметилсилил)амид лития (3,3 мл, 3,33 ммоль, 1,0 М в ТГФ) и перемешивали в течение 1 часа при -78°С. Потом добавляли этилцианоформиат (0,38 г, 3,83 ммоль) и перемешивали при-78°С в течение 0,5 часа. После завершения реакцию гасили водным насыщенным раствором хлорида аммония и концентрировали в вакууме. Реакционную смесь разводили дихлорметаном, промывали водой. Органический слой сушили над безводным сульфатом натрия и концентрировали в вакууме с получением неочищенного продукта этил 5-изопропил-4-[3-[(4-метоксифенил)метокси]-1-нафтил]-2-оксо-циклогексанкарбоксилата (600,0 мг, неочищенный) в виде желтого твердого вещества. ЖХМС (ИЭР, m/z): 475,2 [М+Н]+.
Этап 3: 6-изопропил-7-[3-[(4-метоксифенил)метокси]-1-нафтил]-5,6,7,8-тетрагидро-3Н-хиназолин-4-он

Раствор этил 5-изопропил-4-[3-[(4-метоксифенил)метокси]-1-нафтил]-2-оксо-циклогексанкарбоксилата (0,60 г, неочищенный), формамидинацетата (1,97 г, 18,96 ммоль) и трет-бутоксида калия (4,26 г, 37,93 ммоль) в этаноле (50 мл) перемешивали при 120°С в течение 3 часов. После завершения реакционную смесь концентрировали в вакууме. Реакционную смесь разводили дихлорметаном, доводили до рН = 7 HCl/1,4-диоксаном и промывали водой. Органический слой сушили над безводным сульфатом натрия и концентрировали в вакууме. Остаток очищали с помощью флэш-хроматографии на силикагеле с элюированием дихлорметаном/метиловым спиртом (20/1) с получением 6-изопропил-7-[3-[(4-метоксифенил)метокси]-1-нафтил]-5,6,7,8-тетрагидро-3Н-хиназолин-4-она (150,0 мг, 0,33 ммоль, выход 26,1%) в виде твердого вещества. ЖХМС (ИЭР, m/z): 455,2 [М+Н]+.
Этап 4: 6-изопропил-7-[3-[(4-метоксифенил)метокси]-1-нафтил]-4-пиперазин-1-ил-5,6,7,8-тетрагидрохиназолин
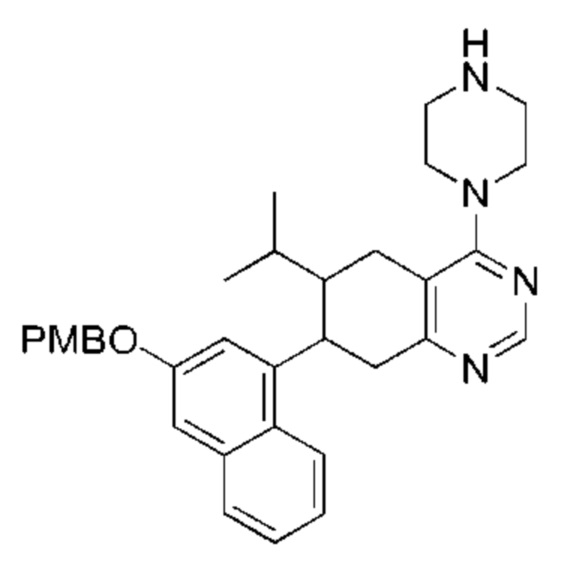
Раствор 6-изопропил-7-[3-[(4-метоксифенил)метокси]-1-нафтил]-5,6,7,8-тетрагидро-3Н-хиназолин-4-она (0,19 г, 0,42 ммоль), пиперазина (0,36 г, 4,18 ммоль), бензотриазол-1-илокситрис(диметиламино)-фосфония гексафторфосфата (0,24 г, 0,54 ммоль) и 1,8-диазабицикло[5.4.0]ундец-7-ена (0,13 мл, 0,84 ммоль) в тетрагидрофуране (4 мл) перемешивали при 70°С в течение 2 часов. После завершения реакционную смесь концентрировали в вакууме. Реакционную смесь разводили дихлорметаном и промывали водой. Органический слой сушили над безводным сульфатом натрия и концентрировали в вакууме с получением 6-изопропил-7-[3-[(4-метоксифенил)метокси]-1-нафтил]-4-пиперазин-1-ил-5,6,7,8-тетрагидрохиназолина (160,0 мг, неочищенный) в виде желтого масла. Неочищенное вещество использовали для следующего этапа без очистки. ЖХМС (ИЭР, m/z): 523,3 [М+Н]+.
Этап 5: 1-[4-[6-изопропил-7-[3-[(4-метоксифенил)метокси]-1-нафтил]-5,6,7,8-тетрагидрохиназолин-4-ил]пиперазин-1-ил]проп-2-ен-1-он

В раствор неочищенного 6-изопропил-7-[3-[(4-метоксифенил)метокси]-1-нафтил]-4-пиперазин-1-ил-5,6,7,8-тетрагидрохиназолин (0,16 г, неочищенный) и N,N-диизопропилэтиламина (98,7 мг, 0,76 ммоль) в дихлорметане (10 мл) по каплям добавляли акрилилхлорид (0,03 г, 0,31 ммоль) и перемешивали при 25°С в течение 1 часа. После завершения реакционную смесь разводили дихлорметаном и промывали водой. Органический слой сушили над безводным сульфатом натрия и концентрировали в вакууме. Остаток очищали с помощью флэш-хроматографии на силикагеле с элюированием дихлорметаном/метиловым спиртом (20/1) с получением 1-[4-[6-изопропил-7-[3-[(4-метоксифенил)метокси]-1-нафтил]-5,6,7,8-тетрагидрохиназолин-4-ил]пиперазин-1-ил]проп-2-ен-1-она (80,0 мг, 0,14 ммоль, выход 45,3%) в виде желтого твердого вещества. ЖХМС (ИЭР, m/z): 577,3 [М+Н]+
Этап 6: 1-(4-(7-(3-гидроксинафтален-1-ил)-6-изопропил-5,6,7,8-тетрагидрохиназолин-4-ил)пиперазин-1-ил)проп-2-ен-1-он

Раствор 1-[4-[6-изопропил-7-[3-[(4-метоксифенил)метокси]-1-нафтил]-5,6,7,8-тетрагидрохиназолин-4-ил]пиперазин-1-ил]проп-2-ен-1-она (0,06 г, 0,10 ммоль), этандиола дихлорида (0,02 мл, 0,21 ммоль) в дихлорметане (2 мл) перемешивали при 25°С в течение 48 часов. После завершения реакционную смесь разводили дихлорметаном и промывали водой. Органический слой сушили над безводным сульфатом натрия и концентрировали в вакууме. Неочищенный продукт очищали с помощью препаративной ВЭЖХ со следующими условиями: колонка: колонка: колонка XBridge Shield RP18 OBD 30*150 мм, 5 мкм; подвижная фаза А: вода (10 ммоль/л NH4HCO3), подвижная фаза В: АЦП; скорость потока: 60 мл/мин; градиент: от 36% В до 56% В за 7 мин; 220/254 нм; Rt: 6,22 мин, с получением 1-(4-(7-(3-гидроксинафтален-1-ил)-6-изопропил-5,6,7,8-тетрагидрохиназолин-4-ил)пиперазин-1-ил)проп-2-ен-1-она (11,3 мг, 0,025 ммоль, выход 23,8%) в виде белого твердого вещества. ЖХМС (ИЭР, m/z): 457,3 [М+Н]+
Пример 16: 1Н ЯМР (300 МГц, ДМСО-4, м.д.) δ 9,68 (с, 1H), 8,50 (с, 1H), 8,13 (д, J=8,5 Гц, 1H), 7,70 (д, J=8,1 Гц, 1H), 7,38 (т, J=7,4 Гц, 1H), 7,31-7,28 (м, 1H), 7,03-6,97 (м, 2Н), 6,84 (дд, J=16,7, 10,4 Гц, 1H), 6,15 (дд, J=16,7, 2,4 Гц, 1H), 5,72 (дд, J=10,4, 2,4 Гц, 1H), 3,97 (шир. с, 1H), 3,76-3,62 (м, 4Н), 3,52-3,47 (м, 3Н), 3,32-3,29 (м, 1H), 3,18-3,09 (м, 1H), 2,85-2,65 (м, 2Н), 2,56-2,54 (м, 1H), 2,04 (шир. с, 1Н),1,70 (шир. с, 1H), 0,96 (д, J=6,8 Гц, 3Н), 0,65 (д, J=6,7 Гц, 3Н).
Пример 17

1-[4-[7-(6-метил-1Н-индазол-7-ил)-5,6,7,8-тетрагидрохиназолин-4-ил]пиперазин-1-ил]проп-2-ен-1-он
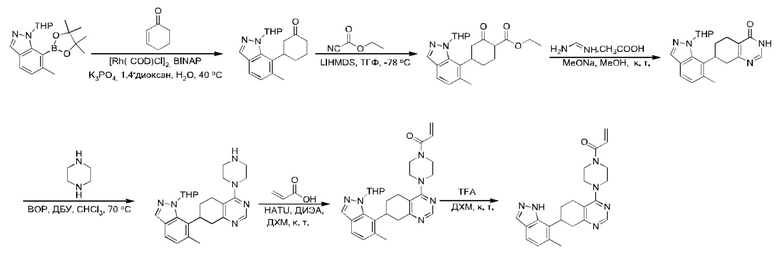
Этап 1: 3-(6-метил-1-тетрагидропиран-2-ил-индазол-7-ил)циклогексанон
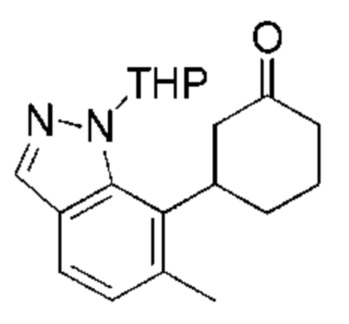
В атмосфере азота в раствор 6-метил-1-тетрагидропиран-2-ил-7-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)индазола (1,51 г, 2,65 ммоль), 2-циклогексен-1-она (0,76 г, 7,94 ммоль), (+/-)-2,2'-бис(дифенилфосфино)-1,1'-бинафтила (0,33 г, 0,53 ммоль) и димера хлор(1,5-циклооктадиен)родия (I) (0,13 г, 0,26 ммоль) в 1,4-диоксане (10 мл) добавляли водный насыщенный раствор фосфата калия (2 мл) и перемешивали в течение 5 минут при 40°С. После завершения реакционную смесь концентрировали в вакууме. Реакционную смесь разводили дихлорметаном и промывали водой. Органический слой сушили над безводным сульфатом натрия и концентрировали в вакууме. Остаток очищали с помощью флэш-хроматографии на силикагеле с элюированием петролейным эфиром/этилацетатом (3/1) с получением 3-(6-метил-1-тетрагидропиран-2-ил-индазол-7-ил)циклогексанона (1,00 г, 2,43 ммоль, выход 91,9%) в виде желтого твердого вещества. ЖХМС (ИЭР, m/z): 313,2 [М+Н]+.
Этап 2: этил 4-(6-метил-1-тетрагидропиран-2-ил-индазол-7-ил)-2-оксо-циклогексанкарбоксилат

В атмосфере азота раствор 3-(6-метил-1-тетрагидропиран-2-ил-индазол-7-ил)циклогексанон (1,00 г, 2,55 ммоль) в тетрагидрофуране (20 мл) по каплям добавляли бис(триметилсилил)амид лития (0,56 г, 3,32 ммоль) и перемешивали в течение 1 часа при -78°С. Потом добавляли этилцианоформиат (0,38 г, 3,80 ммоль) и перемешивали при -78°С в течение 0,5 часа. После завершения реакцию гасили водным насыщенным раствором хлорида аммония, разводили дихлорметаном и промывали водой. Органический слой сушили над безводным сульфатом натрия и концентрировали в вакууме. Остаток очищали с помощью флэш-хроматографии на силикагеле с элюированием петролейным эфиром/этилацетатом (1/1) с получением этил 4-(6-метил-1-тетрагидропиран-2-ил-индазол-7-ил)-2-оксо-циклогексанкарбоксилата (0,68 г, 1,78 ммоль, выход 69,6%) в виде желтого твердого вещества. ЖХМС (ИЭР, m/z): 385,2 [М+Н]+.
Этап 3: 7-(6-метил-1-тетрагидропиран-2-ил-индазол-7-ил)-5,6,7,8-тетрагидро-3Н-хиназолин-4-он

Раствор этил 4-(6-метил-1-тетрагидропиран-2-ил-индазол-7-ил)-2-оксо-циклогексанкарбоксилата (0,60 г, 1,56 ммоль), формамидинацетата (0,49 г, 4,69 ммоль) и метоксида натрия (0,42 г, 7,82 ммоль) в метиловом спирте (5 мл) перемешивали при 25°С в течение 1 часа. После завершения реакционную смесь концентрировали в вакууме. Реакционную смесь разводили дихлорметаном, доводили до рН=7 HCl/1,4-диоксаном и промывали водой. Органический слой сушили над безводным сульфатом натрия и концентрировали в вакууме. Остаток очищали с помощью флэш-хроматографии на силикагеле с элюированием петролейным эфиром/этилацетатом (1/1) с получением 7-(6-метил-1-тетрагидропиран-2-ил-индазол-7-ил)-5,6,7,8-тетрагидро-3Н-хиназолин-4-она (0,52 г, 1,44 ммоль, выход 92,1%) в виде твердого вещества. ЖХМС (ИЭР, m/z): 365,2 [М+Н]+.
Этап 4: 7-(6-метил-1-тетрагидропиран-2-ил-индазол-7-ил)-4-пиперазин-1-ил-5,6,7,8-тетрагидрохиназолин
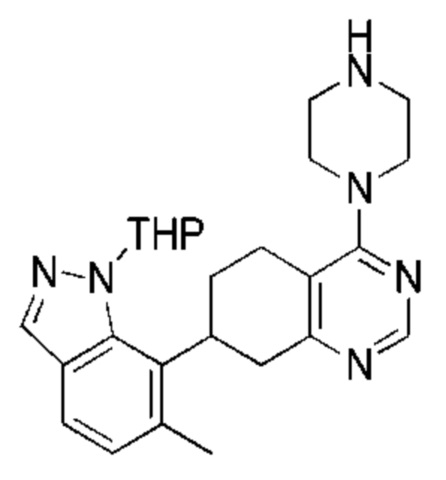
Раствор 7-(6-метил-1-тетрагидропиран-2-ил-индазол-7-ил)-5,6,7,8-тетрагидро-3Н-хиназолин-4-она (0,50 г, 1,33 ммоль), пиперазина (1,72 г, 19,99 ммоль), бензотриазол-1-илокситрис(диметиламино)-фосфония гексафторфосфата (0,88 г, 2,0 ммоль) и 1,8-диазабицикло[5.4.0]ундец-7-ена (0,53 мл, 3,57 ммоль) в хлороформе (10 мл) перемешивали при 70°С в течение 1 часа. После завершения реакционную смесь концентрировали в вакууме. Реакционную смесь разводили дихлорметаном и промывали водой. Органический слой сушили над безводным сульфатом натрия и концентрировали в вакууме. Остаток очищали с помощью флэш-хроматографии на силикагеле с элюированием дихлорметаном/метанолом (20/1) с получением 7-(6-метил-1-тетрагидропиран-2-ил-индазол-7-ил)-4-пиперазин-1-ил-5,6,7,8-тетрагидрохиназолина (0,43 г, 0,99 ммоль, выход 74,3%) в виде желтого твердого вещества. ЖХМС (ИЭР, m/z): 433,3 [М+Н]+.
Этап 5:1-[4-[7-(6-метил-1-тетрагидропиран-2-ил-индазол-7-ил)-5,6,7,8-тетрагидрохиназолин-4-ил]пиперазин-1-ил]проп-2-ен-1-он
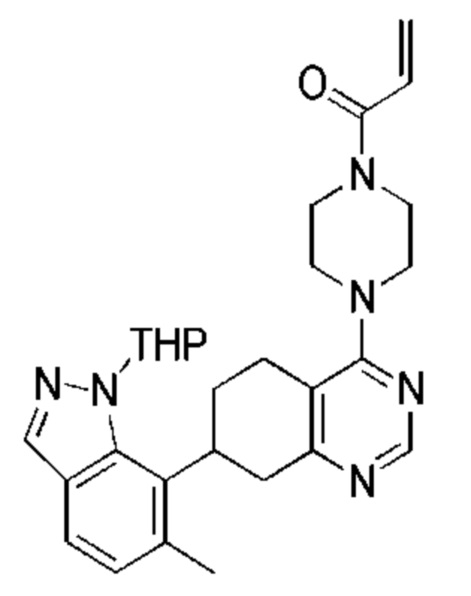
Раствор 7-(6-метил-1-тетрагидропиран-2-ил-индазол-7-ил)-4-пиперазин-1-ил-5,6,7,8-тетрагидрохиназолина (0,30 г, 0,70 ммоль), акриловой кислоты (0,25 г, 3,51 ммоль), N,N-диизопропилэтиламина (0,24 мл, 1,41 ммоль) и HATU (0,35 г, 0,91 ммоль) в дихлорметане (10 мл) перемешивали при 25°С в течение 5 часов. После завершения реакцию гасили водой. Реакционную смесь разводили дихлорметаном и промывали водой. Органический слой сушили над безводным сульфатом натрия и концентрировали в вакууме. Остаток очищали с помощью флэш-хроматографии на силикагеле с элюированием дихлорметаном/метанолом (20/1) с получением 1-[4-[7-(6-метил-1-тетрагидропиран-2-ил-индазол-7-ил)-5,6,7,8-тетрагидрохиназолин-4-ил]пиперазин-1-ил]проп-2-ен-1-она (100,0 мг, 0,21 ммоль, выход 29,2%) в виде светло-желтого твердого вещества. ЖХМС (ИЭР, m/z): 487,3 [М+Н]+.
Этап 6: 1-[4-[7-(6-метил-1Н-индазол-7-ил)-5,6,7,8-тетрагидрохиназолин-4-ил]пиперазин-1-ил]проп-2-ен-1-он

Раствор 1-[4-[7-(6-метил-1-тетрагидропиран-2-ил-индазол-7-ил)-5,6,7,8-тетрагидрохиназолин-4-ил]пиперазин-1-ил]проп-2-ен-1-она (0,10 г, 0,14 ммоль) в трифторуксусной кислоте (1 мл) и дихлорметане (1 мл) перемешивали при 25°С в течение 1 часа. После завершения растворитель концентрировали в вакууме. Неочищенный продукт дополнительно очищали с помощью препаративной ВЭЖХ с условиями: колонка XBridge Prep С18 OBD 19×150 мм, 5 мкм; подвижная фаза А: вода (10 ммоль/л NH4HCO3), подвижная фаза В: АПН; скорость потока: 25 мл/мин; градиент: от 22% В до 43% В за 10 мин; 254/220 нм; Rt: 8,48 мин, с получением 1-[4-[7-(6-метил-1Н-индазол-7-ил)-5,6,7,8-тетрагидрохиназолин-4-ил]пиперазин-1-ил]проп-2-ен-1-она (37,9 мг, 0,094 ммоль, выход 65,5%) в виде белого твердого вещества. ЖХМС (ИЭР, m/z): 403,3 [М+Н]+.
Пример 17: 1Н ЯМР (300 МГц, ДМСО-d6, м.д.) δ 12,75 (с, 1H), 8,51 (с, 1H), 7,99 (с, 1H), 7,50 (д, J=8,1 Гц, 1H), 6,95 (д, J=8,2 Гц, 1H), 6,84 (дд, J=16,7, 10,5 Гц, 1H), 6,14 (дд, J=16,7, 2,4 Гц, 1H), 5,71 (дд, J=10,4, 2,4 Гц, 1H), 3,79-3,61 (м, 6Н), 3,52-3,46 (м, 2Н), 3,29-3,19 (м, 2Н), 2,99-2,88 (м, 2Н), 2,72-2,68 (м, 1H), 2,46 (с, 3Н), 2,45-2,34 (м, 1H), 1,90-1,85 (м, 1H).
Пример 18а

1-(4-(6-метил-7-(5-метил-1Н-индазол-4-ил)-2-(((S)-1-метилпирролидин-2-ил)метокси)-5,6,7,8-тетрагидрохиназолин-4-ил)пиперазин-1-ил)проп-2-ен-1-он
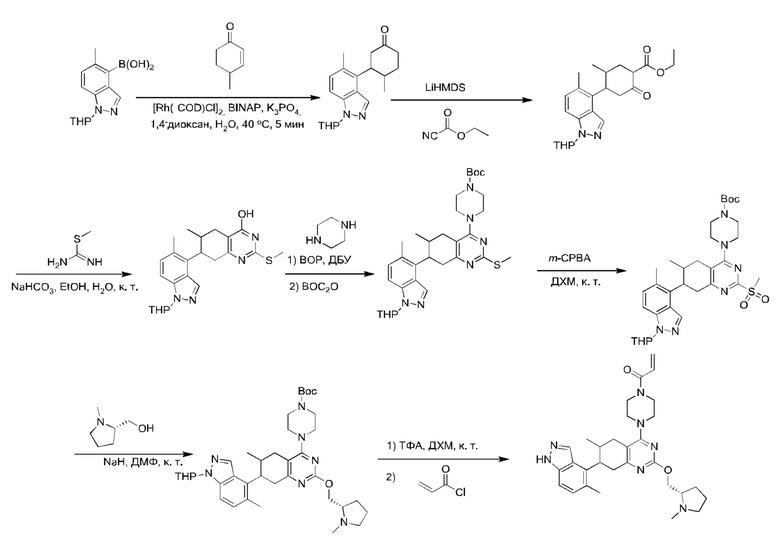
Этап 1: 4-метил-3-(5-метил-1-тетрагидропиран-2-ил-индазол-4-ил)циклогексанон
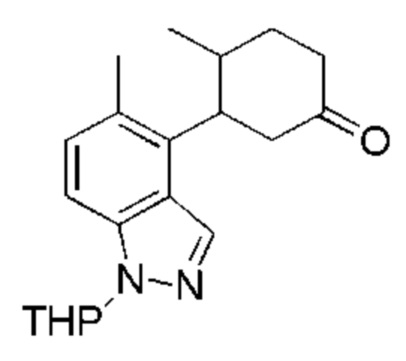
В атмосфере азота в раствор (5-метил-1-тетрагидропиран-2-ил-индазол-4-ил)бороновой кислоты (3,00 г, 11,76 ммоль), 4-метилциклогекс-2-ен-1-она (2,58 г, 23,58 ммоль), (+/-)-2,2'-бис(дифенилфосфино)-1,1'-бинафтила (1,44 г, 2,34 ммоль), димера хлор(1,5-циклооктадиен)родия (I) (0,60 г, 1,20 ммоль) в 1,4-диоксане (30 мл) добавляли водный насыщенный раствор фосфата калия (6 мл) и перемешивали при 40°С в течение 5 минут. После завершения реакционную смесь концентрировали в вакууме. Реакционную смесь разводили дихлорметаном и промывали водой. Органический слой сушили над безводным сульфатом натрия и концентрировали в вакууме. Остаток очищали с помощью флэш-хроматографии на силикагеле с элюированием петролейным эфиром/диэтиловым эфиром (2/1) с получением 4-метил-3-(5-метил-1-тетрагидропиран-2-ил-индазол-4-ил)циклогексанона (1,50 г, 4,60 ммоль, выход 39%) в виде желтого твердого вещества. ЖХМС (ИЭР, m/z): 327,2 [М+Н]+.
Этап 2: этил 5-метил-4-(5-метил-1-(тетрагидро-2Н-пиран-2-ил)-1Н-индазол-4-ил)-2-оксоциклогексан-1-карбоксилат

В атмосфере азота в раствор 4-метил-3-(5-метил-1-тетрагидропиран-2-ил-индазол-4-ил)-циклогексанона (1,50 г, 4,62 ммоль) в тетрагидрофуране (50 мл) по каплям добавляли бис(триметилсилил)амид лития (6,0 мл, 6 ммоль, 1,0 М в ТГФ) и перемешивали в течение 1 часа при -78°С. Потом добавляли этилцианоформиат (0,69 г, 6,93 ммоль) и перемешивали при -78°С в течение 0,5 часа. После завершения реакцию гасили водным насыщенным раствором хлорида аммония. Реакционную смесь разводили дихлорметаном и промывали водой. Органический слой сушили над безводным сульфатом натрия и концентрировали в вакууме. Остаток очищали с помощью флэш-хроматографии на силикагеле с элюированием петролейным эфиром/диэтиловым эфиром (2/1) с получением этил 5-метил-4-(5-метил-1-(тетрагидро-2Н-пиран-2-ил)-1Н-индазол-4-ил)-2-оксоциклогексан-1-карбоксилата (0,78 г, 1,96 ммоль, выход 42,3%) в виде желтого твердого вещества. ЖХМС (ИЭР, m/z): 399,2 [М+Н]+.
Этап 3: 6-метил-2-метилсульфанил-7-(5-метил-1-тетрагидропиран-2-ил-индазол-4-ил)-5,6,7,8-тетрагидрохиназолин-4-ол
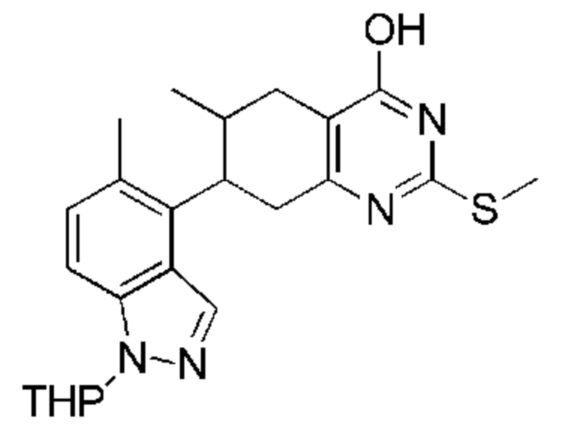
Раствор этил 5-метил-4-(5-метил-1-(тетрагидро-2Н-пиран-2-ил)-1Н-индазол-4-ил)-2-оксоциклогексан-1-карбоксилата (0,20 г, 0,5 ммоль), 2-метилизотиомочевины (0,27 г, 3,01 ммоль) и бикарбоната натрия (0,43 г, 5,02 ммоль) в этаноле (5 мл) и воде (1 мл) перемешивали при 25°С в течение 12 часов. После завершения реакционную смесь разводили дихлорметаном и промывали водой. Органический слой сушили над безводным сульфатом натрия и концентрировали в вакууме. Остаток очищали с помощью флэш-хроматографии на силикагеле с элюированием петролейным эфиром/диэтиловым эфиром (3/1) с получением 6-метил-2-метилсульфанил-7-(5-метил-1-тетрагидропиран-2-ил-индазол-4-ил)-5,6,7,8-тетрагидрохиназолин-4-ола (100,0 мг, 0,24 ммоль, выход 46,9%) в виде желтого твердого вещества. ЖХМС (ИЭР, m/z): 425,2 [М+Н]+.
Этап 4: трет-бутил 4-[6-метил-2-метилсульфанил-7-(5-метил-1-тетрагидропиран-2-ил-индазол-4-ил)-5,6,7,8-тетрагидрохиназолин-4-ил]пиперазин-1-карбоксилат
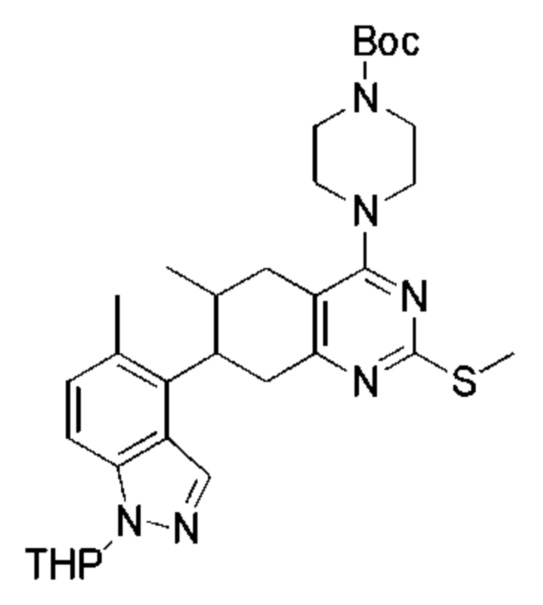
Раствор пиперазин (0,28 г, 3,30 ммоль), 6-метил-2-метилсульфанил-7-(5-метил-1-тетрагидропиран-2-ил-индазол-4-ил)-5,6,7,8-тетрагидрохиназолин-4-ола (0,14 г, 0,33 ммоль), бензотриазол-1-илокситрис(диметиламино)-фосфония гексафторфосфата (0,19 г, 0,43 ммоль) и 1,8-диазабицикло[5.4.0]ундец-7-ена (0,15 мл, 0,99 ммоль) в хлороформе (3 мл) перемешивали при 70°С в течение 3 часов. Потом добавляли ди-трет-бутил дикарбонат (1,44 г, 6,60 ммоль) и перемешивали при 25°С в течение 2 часов. После завершения реакционную смесь концентрировали в вакууме. Реакционную смесь разводили дихлорметаном и промывали водой. Органический слой сушили над безводным сульфатом натрия и концентрировали в вакууме. Остаток очищали с помощью флэш-хроматографии на силикагеле с элюированием петролейным эфиром/диэтиловым эфиром (3/1) с получением трет-бутил 4-[6-метил-2-метилсульфанил-7-(5-метил-1-тетрагидропиран-2-ил-индазол-4-ил)-5,6,7,8-тетрагидрохиназолин-4-ил]пиперазин-1-карбоксилата (130,0 мг, 0,22 ммоль, выход 66,5%) в виде желтого твердого вещества. ЖХМС (ИЭР, m/z): 593,3 [М+Н]+.
Этап 5: трет-бутил-4-[6-метил-2-метилсульфонил-7-(5-метил-1-тетрагидропиран-2-ил-индазол-4-ил)-5,6,7,8-тетрагидрохиназолин-4-ил] пиперазин-1-карбоксилат
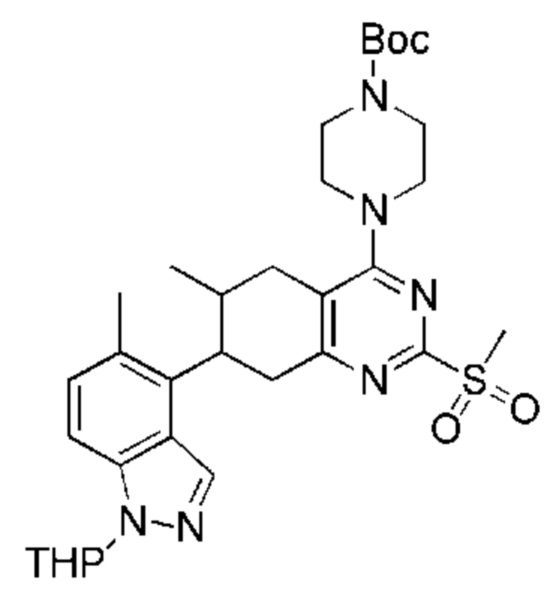
Раствор трет-бутил 4-[6-метил-2-метилсульфанил-7-(5-метил-1-тетрагидропиран-2-ил-индазол-4-ил)-5,6,7,8-тетрагидрохиназолин-4-ил]пиперазин-1-карбоксилата (0,20 г, 0,34 ммоль) и 3-хлорпероксибензойной кислоты (0,17 г, 1,01 ммоль) в дихлорметане (3 мл) перемешивали при 25°С в течение 1 часа. После завершения реакцию гасили водным насыщенным раствором NaHSO3. Реакционную смесь разводили дихлорметаном, промывали водой, сушили над безводным сульфатом натрия и концентрировали в вакууме с получением неочищенного трет-бутил-4-[6-метил-2-метилсульфонил-7-(5-метил-1-тетрагидропиран-2-ил-индазол-4-ил)-5,6,7,8-тетрагидрохиназолин-4-ил]пиперазин-1-карбоксилата (200,0 мг, неочищенный), который непосредственно используют на следующем этапе без очистки. ЖХМС (ИЭР, m/z): 625,3 [М+Н]+.
Этап 6: трет-бутил 4-[6-метил-2-[[(2S)-1-метилпирролидин-2-ил]метокси]-7-(5-метил-1-тетрагидропиран-2-ил-индазол-4-ил)-5,6,7,8-тетрагидрохиназолин-4-ил]пиперазин-1-карбоксилат
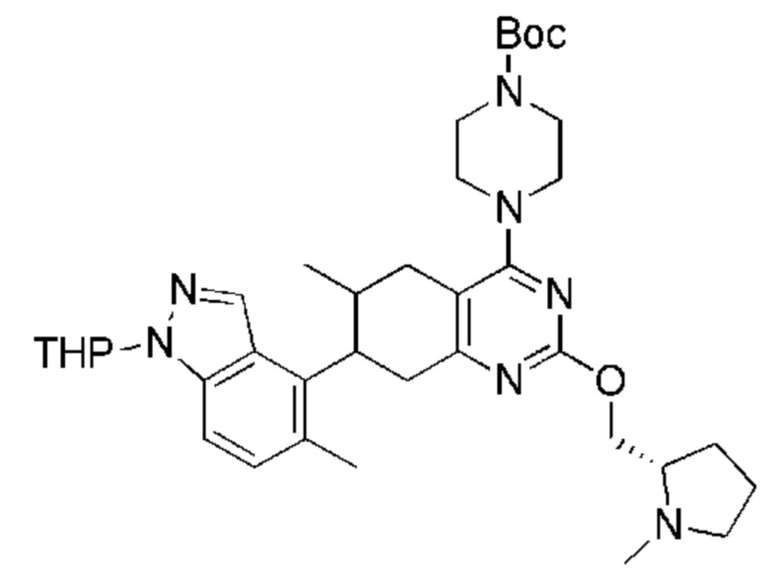
Раствор N-метил-L-пролинола (66,7 мг, 0,58 ммоль) и гидрида натрия (0,09 г, 2,88 ммоль, 60% дисперсия в минеральном масле) в N,N-диметилформамиде (2 мл) перемешивали при 25°С в течение 10 минут. Добавляли неочищенный продукт трет-бутил 4-[6-метил-2-метилсульфонил-7-(5-метил-1-тетрагидропиран-2-ил-индазол-4-ил)-5,6,7,8-тетрагидрохиназолин-4-ил]пиперазин-1-карбоксилат (0,18 г, 0,29 ммоль) и перемешивали при 25°С в течение 20 часов. После завершения полученный в результате раствор гасили и экстрагировали дихлорметаном. Органические слои объединяли, промывали водой, сушили над безводным сульфатом натрия и концентрировали в вакууме. Остаток очищали с помощью флэш-хроматографии на силикагеле с элюированием дихлор метаном/метанолом (20/1) с получением трет-бутил 4-[6-метил-2-[[(2S)-1-метилпирролидин-2-ил]метокси]-7-(5-метил-1-тетрагидропиран-2-ил-индазол-4-ил)-5,6,7,8-тетрагидрохиназолин-4-ил]пиперазин-1-карбоксилата (150,0 мг, 0,23 ммоль, выход 78,9%) в виде желтого твердого вещества. ЖХМС (ИЭР, m/z): 660,4 [М+Н]+.
Этап 7а: 6-метил-7-(5-метил-1Н-индазол-4-ил)-2-(((S)-1-метилпирролидин-2-ил)метокси)-4-(пиперазин-1-ил)-5,6,7,8-тетрагидрохиназолин

Раствор трет-бутил 4-[6-метил-2-[[(2S)-1-метилпирролидин-2-ил]метокси]-7-(5-метил-1-тетрагидропиран-2-ил-индазол-4-ил)-5,6,7,8-тетрагидрохиназолин-4-ил]пиперазин-1-карбоксилата (0,14 г, 0,21 ммоль) в дихлорметане (4 мл) и трифторуксусной кислоте (0,2 мл) перемешивали при 25°С в течение 3 часов. После завершения раствор концентрировали в вакууме с получением 6-метил-7-(5-метил-1Н-индазол-4-ил)-2-[[(2S)-1-метилпирролидин-2-ил]метокси]-4-пиперазин-1-ил-5,6,7,8-тетрагидрохиназолина (150,0 мг, неочищенный), который непосредственно используют на следующем этапе без очистки. ЖХМС (ИЭР, m/z): 476,3 [М+Н]+.
Этап 7b: 1-(4-(6-метил-7-(5-метил-1Н-индазол-4-ил)-2-(((S)-1-метилпирролидин-2-ил)метокси)-5,6,7,8-тетрагидрохиназолин-4-ил)пиперазин-1-ил)проп-2-ен-1-он

Раствор 6-метил-7-(5-метил-1Н-индазол-4-ил)-2-[[(2S)-1-метилпирролидин-2-ил]метокси]-4-пиперазин-1-ил-5,6,7,8-тетрагидрохиназолина (0,15 г, 0,27 ммоль) и N,N-диизопропил-этиламина (0,09 мл, 0,54 ммоль) в дихлорметане (2 мл) перемешивали при -78°С в течение 10 минут. Потом добавляли акрилилхлорид (0,02 мл, 0,24 ммоль) и перемешивали при -78°С в течение 0,5 часа. После завершения реакцию гасили водой, разводили дихлорметаном, промывали водой. Органический слой сушили над безводным сульфатом натрия и концентрировали в вакууме. Неочищенный продукт дополнительно очищали с помощью препаративной ВЭЖХ с условиями: колонка: колонка XBridge Prep OBD С18 30×150 мм, 5 мкм; подвижная фаза А: вода (10 ммоль/л NH4HCO3), подвижная фаза В: АЦП; скорость потока: 60 мл/мин; градиент: от 22% В до 42% В за 10 мин; 254/220 нм; Rt: 9,02 мин, с получением 1-[4-[6-метил-7-(5-метил-1Н-индазол-4-ил)-2-[[(2S)-1-метилпирролидин-2-ил]метокси]-5,6,7,8-тетрагидрохиназолин-4-ил]пиперазин-1-ил]проп-2-ен-1-она (7,6 мг, 0,014 ммоль, выход 5,4%) в виде белого твердого вещества. ЖХМС (ИЭР, m/z): 530,5 [М+Н]+.
Пример 18а: 1Н ЯМР (300 МГц, ДМСО-d6, м.д.) δ 12,96 (с, 1H), 8,08 (с, 1H), 7,29 (д, J=8,5 Гц, 1H), 7,17 (д, J=8,6 Гц, 1H), 6,85 (дд, J=16,7, 10,5 Гц, 1H), 6,15 (дд, J=16,7, 2,4 Гц, 1H), 5,72 (дд, J=10,4, 2,4 Гц, 1H), 4,30-4,19 (м, 1H), 4,07-3,93 (м, 1H), 3,87-3,71 (м, 2Н), 3,71-3,48 (м, 4Н), 3,32-3,20 (м, 3Н), 3,17-3,00 (м, 1H), 3,00-2,82 (м, 2Н), 2,73-2,52 (м, 3Н), 2,41 (с, 4Н), 2,33 (с, 3Н), 2,20-2,11 (м, 1H), 1,97-1,85 (м, 1H), 1,73-1,48 (м, 3Н), 0,70 (д, J=6,1 Гц, 3Н).
Примеры 19а и 19b


(Е)-1-(4-((6R,7R)-6-метил-7-(5-метил-1Н-индазол-4-ил)-5,6,7,8-тетрагидрохиназолин-4-ил)пиперазин-1-ил)-4-(метиламино)бут-2-ен-1-он (Пример 19а)
(Е)-1-(4-((6S,7S)-6-метил-7-(5-метил-1Н-индазол-4-ил)-5,6,7,8-тетрагидрохиназолин-4-ил)пиперазин-1-ил)-4-(метиламино)бут-2-ен-1-он (Пример 19b)

Этап 1: трет-бутил N-метил-N-[(Е)-4-[4-[6-метил-7-(5-метил-1-тетрагидропиран-2-ил-индазол-4-ил)-5,6,7,8-тетрагидрохиназолин-4-ил]пиперазин-1-ил]-4-оксо-бут-2-енил]кабамат

Раствор 6-метил-7-(5-метил-1-тетрагидропиран-2-ил-индазол-4-ил)-4-пиперазин-1-ил-5,6,7,8-тетрагидрохиназолина (0,59 г, 0,79 ммоль), (Е)-4-[трет-бутокси-карбонил(метил)амино]бут-2-еновой кислоты (0,51 г, 2,38 ммоль), HATU (0,39 г, 1,03 ммоль) и N,N-диизопропилэтиламина (0,28 мл, 1,59 ммоль) в дихлорметане (3 мл) и N,N-диметилформамиде (3 мл) перемешивали при 25°С в течение 0,5 часа. После завершения реакционную смесь разводили водой и экстрагировали дихлорметаном. Органические слои объединяли и промывали солевым раствором. Органические слои сушили над безводным сульфатом натрия и концентрировали в вакууме. Остаток очищали с помощью флэш-хроматографии на силикагеле с элюированием дихлорметаном/метанолом (20/1) с получением трет-бутил N-метил-N-[(E)-4-[4-[6-метил-7-(5-метил-1-тетрагидропиран-2-ил-индазол-4-ил)-5,6,7,8-тетрагидрохиназолин-4-ил]пиперазин-1-ил]-4-оксо-бут-2-енил]кабамата (0,15 г, 0,17 ммоль, выход 22%) в виде твердого вещества. ЖХМС (ИЭР, m/z): 644,4 [М+Н]+.
Этап 2: (Е)-1-(4-((6R,7R)-6-метил-7-(5-метил-1Н-индазол-4-ил)-5,6,7,8-тетрагидрохиназолин-4-ил)пиперазин-1-ил)-4-(метиламино)бут-2-ен-1-он (Пример 19а) и
(Е)-1-(4-((6S,7S)-6-метил-7-(5-метил-1Н-индазол-4-ил)-5,6,7,8-тетрагидрохиназолин-4-ил)пиперазин-1-ил)-4-(метиламино)бут-2-ен-1-он (Пример 19b)
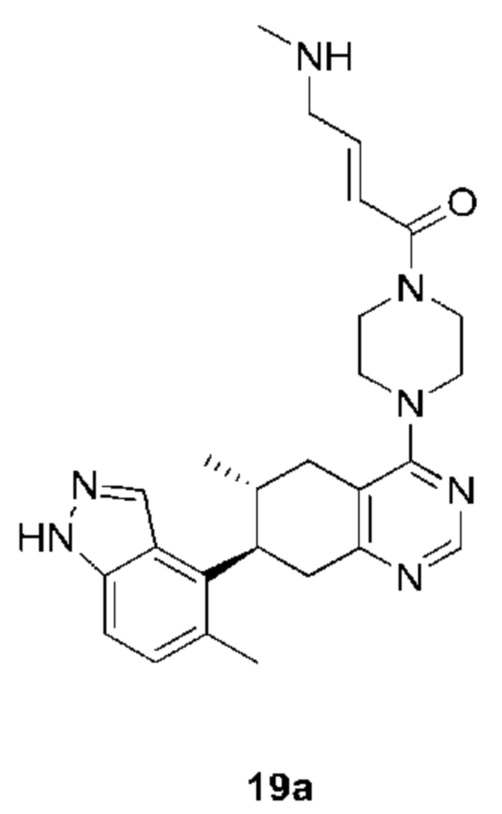
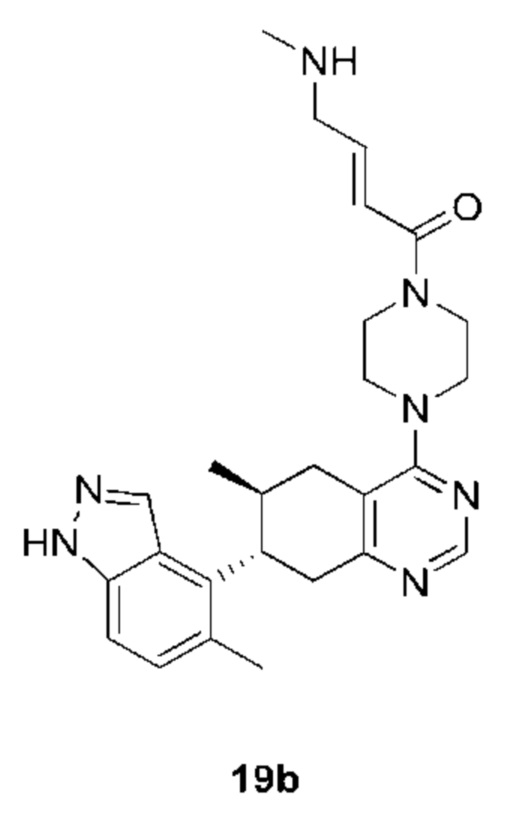
Раствор трет-бутил N-метил-N-[(Е)-4-[4-[6-метил-7-(5-метил-1-тетрагидропиран-2-ил-индазол-4-ил)-5,6,7,8-тетрагидрохиназолин-4-ил]пиперазин-1-ил]-4-оксо-бут-2-енил]кабамата (0,13 г, 0,20 ммоль) в трифторуксусной кислоте (1,5 мл) и дихлорметане (1,5 мл) перемешивали при 25°С в течение 1 часа. После завершения растворитель концентрировали в вакууме. Потом неочищенный продукт очищали с помощью препаративной ВЭЖХ со следующими условиями: колонка: колонка XBridge Shield RP18 OBD 30*150 мм, 5 мкм; подвижная фаза А: вода (10 ммоль/л NH4HCO3), подвижная фаза В: АЦП; скорость потока: 60 мл/мин; градиент: от 13% В до 36% В за 10 мин; 220/254 нм; Rt: 9,53 мин с получением необходимого продукта. Смесь энантиомеров разделяли с помощью хиральной препаративной ВЭЖХ со следующими условиями: колонка: CHIRALPAK 1С, 2*25 см, 5 мкм; подвижная фаза А: гексан:ДХМ=1:1 (10 мМ NH3 - МЕОН) --ВЭЖХ, подвижная фаза В: гексан --ВЭЖХ; скорость потока: 20 мл/мин; градиент: от 50 В до 50 В за 16 мин; 254/220 нм, с получением указанных в заголовке соединений. Абсолютная конфигурация указанных в заголовке соединений была определена по данным активности и рентгенограммы белковой структуры соединения 21b.
Пример 19а: (E)-1-(4-((6R,7R)-6-метил-7-(5-метил-1H-индазол-4-ил)-5,6,7,8-тетрагидрохиназолин-4-ил)пиперазин-1-ил)-4-(метиламино)бут-2-ен-1-он (3,5 мг, 0,0076 ммоль, выход 3,8%, белое твердое вещество). 1Н ЯМР (300 МГц, ДМСО-d6, м.д.) δ 12,95 (с, 1H), 8,48 (с, 1H), 8,05 (с, 1H), 7,27 (д, J=9,0 Гц, 1H), 7,16 (д, J=8,5 Гц, 1H), 6,82-6,55 (м, 2Н), 3,86-3,45 (м, 8Н), 3,30-3,05 (м, 5Н), 3,05-2,90 (м, 1H), 2,75-2,58 (м, 2Н), 2,41 (с, 4Н), 2,28 (с, 3Н), 0,70 (д, J=6,3 Гц, 3Н). ЖХМС (ИЭР, m/z): 460,2 [М+Н]+. Хиральная ВЭЖХ: CHIRALPAK IC-3 (0,46*5 см, 3 мкм); обнаружение на 254 нм; (гексан/ДХМ=1:1) (0,1% ДЭА): EtOH=50:50; скорость потока=1,0 мл/мин; время удержания: 2,159 мин (более быстрый пик).
Пример 19b: (Е)-1-(4-((6S,7S)-6-метил-7-(5-метил-1Н-индазол-4-ил)-5,6,7,8-тетрагидрохиназолин-4-ил)пиперазин-1-ил)-4-(метиламино)бут-2-ен-1-он (2,3 мг, 0,005 ммоль, выход 2,5%, белое твердое вещество). 1Н ЯМР (300 МГц, ДМСО-d6, м.д.) δ 12,95 (с, 1H), 8,48 (с, 1H), 8,05 (с, 1H), 7,27 (д, J=9,0 Гц, 1H), 7,16 (д, J=8,5 Гц, 1H), 6,82-6,55 (м, 2Н), 3,86-3,45 (м, 8Н), 3,30-3,05 (м, 5Н), 3,05-2,90 (м, 1H), 2,75-2,58 (м, 2Н), 2,41 (с, 4Н), 2,28 (с, 3Н), 0,70 (д, J=6,3 Гц, 3Н). ЖХМС (ИЭР, m/z): 460,2 [М+Н]+. Хиральная ВЭЖХ: CHIRALPAK IC-3 (0,46*5 см, 3 мкм); обнаружение на 254 нм; (гексан/ДХМ=1:1) (0,1% ДЭА): EtOH=50:50; скорость потока=1,0 мл/мин; время удержания: 3,065 мин (более медленный пик).
Примеры 20а и 20b


1-(4-((6R,7R)-7-(6-амино-4-метил-3-(трифторметил)пиридин-2-ил)-6-метил-2-(((S)-1-метилпирролидин-2-ил)метокси)-5,6,7,8-тетрагидрохиназолин-4-ил)пиперазин-1-ил)проп-2-ен-1-он (Пример 20а)
1-(4-((6S,7S)-7-(6-амино-4-метил-3-(трифторметил)пиридин-2-ил)-6-метил-2-(((S)-1-метилпирролидин-2-ил)метокси)-5,6,7,8-тетрагидрохиназолин-4-ил)пиперазин-1-ил)проп-2-ен-1-он (Пример 20b)

Этап 1: трет-бутил 4-(7-(6-(бис(4-метоксибензил)амино)-4-метил-3-(трифторметил)пиридин-2-ил)-6-метил-2-(метилтио)-5,6,7,8-тетрагидрохиназолин-4-ил)пиперазин-1-карбоксилат

В раствор 7-[6-[бис[(4-метоксифенил)метил]амино]-4-метил-3-(трифторметил)-2-пиридил]-6-метил-2-метилсульфанил-5,6,7,8-тетрагидрохиназолин-4-ола (1,30 г, 2,08 ммоль) и N,N-диизопропилэтиламина (1,81 мл, 10,4 ммоль) в дихлорметане (10 мл) добавляли трифторметансульфоновый ангидрид (0,63 мл, 3,75 ммоль) и перемешивали при 25°С в течение 1 часа. После завершения растворитель концентрировали в вакууме. Остаток разводили 1,4-диоксаном и доводили до рН>7 N,N-диизопропилэтиламином. Потом добавляли трет-бутил 1-пиперазинкарбоксилат (1,16 г, 6,24 ммоль) и перемешивали при 110°С в течение 12 часов. После завершения растворитель концентрировали в вакууме. Остаток очищали с помощью флэш-хроматографии на силикагеле с элюированием петролейным эфиром/диэтиловым эфиром (3/1) с получением трет-бутил 4-(7-(6-(бис(4-метоксибензил)амино)-4-метил-3-(трифторметил)пиридин-2-ил)-6-метил-2-(метилтио)-5,6,7,8-тетрагидрохиназолин-4-ил)пиперазин-1-карбоксилата (1,30 г, 2,08 ммоль) в виде желтого твердого вещества. ЖХМС (ИЭР, m/z): 793,4 [М+Н]+.
Этап 2: трет-бутил 4-[7-[6-[бис[(4-метоксифенил)метил]амино]-4-метил-3-(трифторметил)-2-пиридил]-6-метил-2-метилсульфонил-5,6,7,8-тетрагидрохиназолин-4-ил]пиперазин-1-карбоксилат

Раствор трет-бутил 4-(7-(6-(бис(4-метоксибензил)амино)-4-метил-3-(трифторметил)пиридин-2-ил)-6-метил-2-(метилтио)-5,6,7,8-тетрагидрохиназолин-4-ил)пиперазин-1-карбоксилата (1,00 г, 1,26 ммоль) и 3-хлорпероксибензойной кислоты (0,65 г, 3,78 ммоль) в дихлорметане (10 мл) перемешивали при 25°С в течение 1 часа. После завершения реакцию гасили водным насыщенным раствором Na2SO3. Реакционную смесь разводили дихлорметаном, промывали водой, сушили над безводным сульфатом натрия и концентрировали в вакууме с получением неочищенного трет-бутил 4-[7-[6-[бис[(4-метоксифенил)метил]амино]-4-метил-3-(трифторметил)-2-пиридил]-6-метил-2-метилсульфонил-5,6,7,8-тетрагидрохиназолин-4-ил]пиперазин-1-карбоксилата (1,20 г, неочищенный), который непосредственно используют на следующем этапе без очистки.
Этап 3: трет-бутил 4-[7-[6-[бис[(4-метоксифенил)метил]амино]-4-метил-3-(трифторметил)-2-пиридил]-6-метил-2-[[(2S)-1-метилпирролидин-2-ил]метокси]-5,6,7,8-тетрагидрохиназолин-4-ил]пиперазин-1-карбоксилат
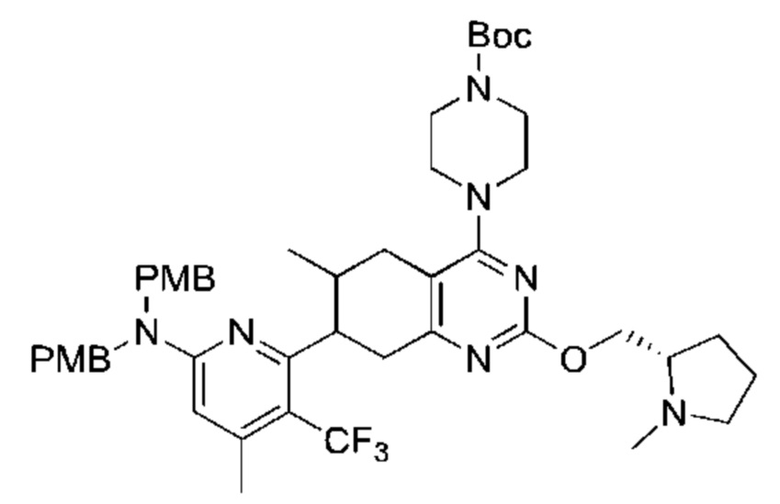
Раствор N-метил-L-пролинола (635,9 мг, 5,53 ммоль) и гидрида натрия (0,22 г, 5,53 ммоль, 60% дисперсия в минеральном масле) в N,N-диметилформамиде (5 мл) перемешивали при 25°С в течение 10 минут. Потом на последнем этапе добавляли неочищенный продукт трет-бутил 4-[7-[6-[бис[(4-метоксифенил)метил]амино]-4-метил-3-(трифторметил)-2-пиридил]-6-метил-2-метилсульфонил-5,6,7,8-тетрагидрохиназолин-4-ил]пиперазин-1-карбоксилат (1,20 г, неочищенный) и перемешивали при 25°С в течение 20 часов. После завершения реакцию гасили водой. Полученный в результате раствор экстрагировали дихлорметаном и объединяли органические слои. Органический слой промывали водой, сушили над безводным сульфатом натрия и концентрировали в вакууме. Остаток очищали с помощью флэш-хроматографии на силикагеле с элюированием дихлорметаном/метанолом (20/1) с получением трет-бутил 4-[7-[6-[бис[(4-метоксифенил)метил]амино]-4-метил-3-(трифторметил)-2-пиридил]-6-метил-2-[[(2S)-1-метилпирролидин-2-ил]метокси]-5,6,7,8-тетрагидрохиназолин-4-ил]пиперазин-1-карбоксилата (700,0 мг, 0,81 ммоль, выход 73,6%) в виде желтого твердого вещества. ЖХМС (ИЭР, m/z): 860,5 [М+Н]+.
Этап 4: 1-(4-((6R,7R)-7-(6-амино-4-метил-3-(трифторметил)пиридин-2-ил)-6-метил-2-(((S)-1-метилпирролидин-2-ил)метокси)-5,6,7,8-тетрагидрохиназолин-4-ил)пиперазин-1-ил)проп-2-ен-1-он (Пример 20а) 1-(4-((6S,7S)-7-(6-амино-4-метил-3-(трифторметил)пиридин-2-ил)-6-метил-2-(((S)-1-метилпирролидин-2-ил)метокси)-5,6,7,8-тетрагидрохиназолин-4-ил)пиперазин-1-ил)проп-2-ен-1-он (Пример 20b)
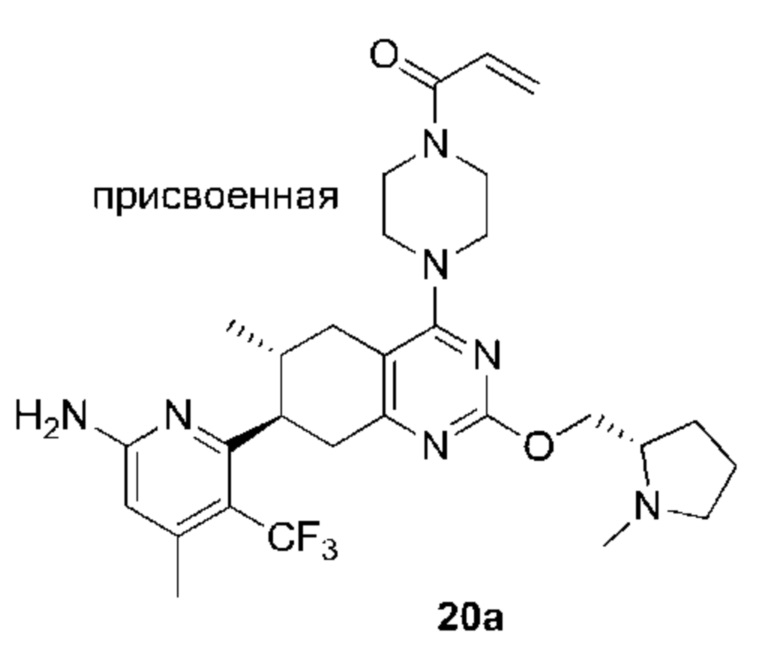

Раствор трет-бутил 4-[7-[6-[бис[(4-метоксифенил)метил]амино]-4-метил-3-(трифторметил)-2-пиридил]-6-метил-2-[[(2S)-1-метилпирролидин-2-ил]метокси]-5,6,7,8-тетрагидрохиназолин-4-ил]пиперазин-1-карбоксилата (0,70 г, 0,81 ммоль) в трифторуксусной кислоте (5 мл) перемешивали при 50°С в течение 12 часов. После завершения растворитель концентрировали в вакууме с получением неочищенного 4-метил-6-[6-метил-2-[[(2S)-1-метилпирролидин-2-ил]метокси]-4-пиперазин-1-ил-5,6,7,8-тетрагидрохиназолин-7-ил]-5-(трифторметил)пиридин-2-амина (500 мг, неочищенный). Раствор неочищенного 4-метил-6-[6-метил-2-[[(2S)-1-метилпирролидин-2-ил]метокси]-4-пиперазин-ил-5,6,7,8-тетрагидрохиназолин-7-ил]-5-(трифторметил)пиридин-2-амина (0,50 г, неочищенный) в дихлорметане (10 мл) доводили до рН>7 N,N-диизопропилэтиламином. Потом добавляли акрилилхлорид (0,07 г, 0,78 ммоль) и перемешивали при -78°С в течение 20 минут. После завершения полученный в результате раствор концентрировали в вакууме. Неочищенный продукт очищали с помощью препаративной ВЭЖХ со следующими условиями: колонка: колонка XBridge Prep OBD С18 30×150 мм, 5 мкм; подвижная фаза А: вода (10 ммоль/л NH4HCO3), подвижная фаза В: АЦН; скорость потока: 60 мл/мин; градиент: от 35 В до 53 В за 7 мин; 254/220 нм; RT1: 6,57; RT2:; вводимый объем: мл; число прогонов. Смесь диастереоизомеров разделяли с помощью препаративной хиральной ВЭЖХ со следующими условиями: колонка: CHIRALPAK IE, 2*25 см, 5 мкм; подвижная фаза А: МТБЭ (10 мМ NH3-MEOH) --ВЭЖХ, подвижная фаза В: МеОН -ВЭЖХ; скорость потока: 20 мл/мин; градиент: от 5 В до 5 В за 21 мин; 220/254 нм; RT1: 11,022; RT2: 13,553; вводимый объем: 0,3 мл, с получением указанных в заголовке соединений. Стереохимия указанных в заголовке соединений была приписана произвольным образом.
Пример 20а: 1-(4-((6R,7R)-7-(6-амино-4-метил-3-(трифторметил)пиридин-2-ил)-6-метил-2-(((S)-1-метилпирролидин-2-ил)метокси)-5,6,7,8-тетрагидрохиназолин-4-ил)пиперазин-1-ил)проп-2-ен-1-он (51,4 мг, 0,09 ммоль, выход 10,3%, белое твердое вещество). 1Н ЯМР (300 МГц, ДМСО-d6) δ 6,80 (дд, J=16,7, 10,4 Гц, 1H), 6,44 (с, 2Н), 6,27-6,03 (м, 2Н), 5,69 (дд, J=10,4, 2,5 Гц, 1H), 4,21 (дд, J=10,7, 4,8 Гц, 1H), 3,97 (дд, J=10,7, 6,5 Гц, 1H), 3,81-3,43 (м, 6Н), 3,32-3,18 (м, 2Н), 3,14-2,84 (м, 3Н), 2,79-2,65 (м, 1H), 2,60-2,51 (м, 1H), 2,48-2,38 (м, 2Н), 2,38-2,21 (м, 6Н), 2,20-2,0 (м, 2Н), 1,97-1,81 (м, 1H), 1,73-1,41 (м, 3Н), 0,71 (д, J=6,3 Гц, 3Н). ЖХМС (ИЭР, m/z): 574,3 [М+Н]+. Хиральная ВЭЖХ: CHIRALPAK IE-3(0,46*5 см; 3 мкм); обнаружение на 254 нм; МТБЭ (0,1% ДЭА): МеОН=95:5; скорость потока=1,0 мл/мин; время удержания: 2,928 мин (более быстрый пик).
Пример 20b: 1-(4-((6S,7S)-7-(6-амино-4-метил-3-(трифторметил)пиридин-2-ил)-6-метил-2-(((S)-1-метилпирролидин-2-ил)метокси)-5,6,7,8-тетрагидрохиназолин-4-ил)пиперазин-1-ил)проп-2-ен-1-он (48,5 мг, 0,08 ммоль, выход 9,8%, белое твердое вещество). 1Н ЯМР (300 МГц, ДМСО-d6) δ 6,80 (дд, J=16,7, 10,4 Гц, 1H), 6,44 (с, 2Н), 6,22-6,06 (м, 2Н), 5,69 (дд, J=10,4, 2,4 Гц, 1H), 4,20 (дд, J=10,8, 4,8 Гц, 1H), 3,99 (дд, J=10,7, 6,5 Гц, 1H), 3,71 (шир. с, 2Н), 3,62-3,45 (м, 4Н), 3,31-3,20 (м, 2Н), 3,15-2,86 (м, 3Н), 2,86-2,66 (м, 1H), 2,61-2,52 (м, 1H), 2,49-2,32 (м, 2Н), 2,28 (д, J=11,7 Гц, 6Н), 2,20-2,11 (м, 1H), 2,10-1,98 (м, 1H), 1,97-1,81 (м, 1H), 1,79-1,41 (м, 3Н), 0,71 (д, J=6,3 Гц, 3Н). ЖХМС (ИЭР, m/z): 574,3 [М+Н]+. Хиральная ВЭЖХ: CHIRALPAK IE-3(0,46*5 см; 3 мкм); обнаружение на 254 нм; МТБЭ (0,1% ДЭА): МеОН=95:5; скорость потока=1,0 мл/мин; время удержания: 3,483 мин (более медленный пик).
Примеры 21а и 21b


1-((S)-4-((6S,7S)-7-(6-амино-4-метил-3-(трифторметил)пиридин-2-ил)-6-метил-2-(((S)-1-метилпирролидин-2-ил)метокси)-5,6,7,8-тетрагидрохиназолин-4-ил)-3-метилпиперазин-1-ил)проп-2-ен-1-он (Пример 21а)
1-((S)-4-((6R,7R)-7-(6-амино-4-метил-3-(трифторметил)пиридин-2-ил)-6-метил-2-(((S)-1-метилпирролидин-2-ил)метокси)-5,6,7,8-тетрагидрохиназолин-4-ил)-3-метилпиперазин-1-ил)проп-2-ен-1-он (Пример 21b)

Этап 1: N,N-бис(4-метоксибензил)-4-метил-6-(трибутилстаннил)пиридин-2-амин

В атмосфере азота раствор 6-бром-N,N-бис[(4-метоксифенил)метил]-4-метил-пиридин-2-амина (42,00 г, 98,28 ммоль), гексабутилдитина (74,5 мл, 147,43 ммоль), бис(дибензилиденацетон)палладия (5,65 г, 9,83 ммоль), хлорида лития (21,33 г, 491,42 ммоль) и трициклогексилфосфина (5,51, 19,66 моль) в диоксане (300 л) перемешивали в течение 4 часов при 110°С. После завершения реакцию концентрировали при пониженном давлении. Остаток очищали с помощью флэш-хроматографии на силикагеле с элюированием петролейным эфиром/этилацетатом (1/1) с получением N,N-бис[(4-метоксифенил)метил]-4-метил-6-трибутилстаннил-пиридин-2-амина (60,0 г, 79,1 ммоль, выход 84,0%) в виде желтого масла. ЖХМС (ИЭР, m/z): 639,3 [М+Н]+.
Этап 2: 3-[6-[бис[(4-метоксифенил)метил]амино]-4-метил-2-пиридил]-4-метил-циклогексанон

В атмосфере азота в раствор 4-метилциклогекс-2-ен-1-она (2,18, 19,77 моль) и димера хлор(1,5-циклооктадиен)родия (I) (0,65 г, 1,32 ммоль) в тетрагидрофуране (100 мл) добавляли N,N-бис[(4-метоксифенил)метил]-4-метил-6-трибутилстаннил-пиридин-2-амин (10,00 г, 13,18 ммоль) и перемешивали при 60°С в течение 3 часов. После завершения реакционную смесь концентрировали в вакууме. Реакционную смесь разводили дихлорметаном и промывали водой. Органический слой сушили над безводным сульфатом натрия и концентрировали в вакууме. Остаток очищали с помощью флэш-хроматографии на силикагеле с элюированием петролейным эфиром/этилацетатом (3:1) с получением 3-[6-[бис[(4-метоксифенил)метил]амино]-4-метил-2-пиридил]-4-метил-циклогексанона (3,40 г, 7,41 ммоль, выход 56,3%) в виде желтого масла. ЖХМС (ИЭР, m/z): 459,3 [М+Н]+.
Этап 3: 3-[6-[бис[(4-метоксифенил)метил]амино]-3-йодо-4-метил-2-пиридил]-4-метил-циклогексанон

Раствор 3-[6-[бис[(4-метоксифенил)метил]амино]-4-метил-2-пиридил]-4-метил-циклогексанона (10,00 г, 21,81 ммоль) и N-йодосукцинимида (6,38 г, 28,35 ммоль) в N,N-диметилформамиде (125 мл) перемешивали при к.т. в течение 3 часов. После завершения реакционную смесь разводили водой, экстрагировали дихлорметаном и объединяли органические слои. Органические слои промывали водой, сушили над безводным сульфатом натрия и концентрировали в вакууме. Остаток очищали с помощью флэш-хроматографии на силикагеле с элюированием петролейным эфиром/этилацетатом (3/1) с получением 3-[6-[бис[(4-метоксифенил)метил]амино]-3-йодо-4-метил-2-пиридил]-4-метил-циклогексанона (11,00 г, 18,82 ммоль, выход 86,3%) в виде желтого твердого вещества. ЖХМС (ИЭР, m/z): 585,2 [М+Н]+.
Этап 4: 3-[6-[бис[(4-метоксифенил)-метил]амино]-4-метил-3-(трифторметил)-2-пиридил]-4-метил-циклогексанон

В атмосфере азота в раствор метил 2,2-дифтор-2-(фторсульфонил)ацетата (16,43 г, 85,54 ммоль) и йодида меди (9,76 г, 51,33 ммоль) в ДМФ (60 мл) добавляли 3-[6-[бис[(4-метоксифенил)метил]амино]-3-йодо-4-метил-2-пиридил]-4-метил-циклогексанон (10,00 г, 17,11 ммоль) и перемешивали при 90°С в течение 2 часов. После завершения в реакционную смесь добавляли воду, экстрагировали дихлорметаном и объединяли органические слои. Органические слои промывали водой, сушили над безводным сульфатом натрия и концентрировали в вакууме. Остаток очищали с помощью флэш-хроматографии на силикагеле с элюированием петролейным эфиром/этилацетатом (3/1) с получением 3-[6-[бис[(4-метоксифенил)-метил]амино]-4-метил-3-(трифторметил)-2-пиридил]-4-метил-циклогексанона (8,50 г, 16,14 ммоль, выход 94,3%) в виде желтого твердого вещества. ЖХМС (ИЭР, m/z): 527,2 [М+Н]+.
Этап 5: этил 4-[6-[бис[(4-метоксифенил)метил]амино]-4-метил-3-(трифторметил)-2-пиридил]-5-метил-2-оксо-циклогексанкарбоксилат

В атмосфере азота в раствор 3-[6-[бис[(4-метоксифенил)метил]амино]-4-метил-3-(трифторметил)-2-пиридил]-4-метил-циклогексанона (12,0 г, 22,79 ммоль) в тетрагидрофуране (400 мл) по каплям добавляли бис(триметилсилил)амид лития (45,6 мл, 45,58 ммоль, 1M в ТГФ) и перемешивали в течение 1 часа при -78°С. Потом по каплям добавляли этилцианоформиат (5,19 г, 52,41 ммоль) и перемешивали при -78°С в течение 0,5 часа. После завершения реакцию гасили водным насыщенным раствором хлорида аммония. Реакционную смесь разводили дихлорметаном, промывали водой. Органический слой сушили над безводным сульфатом натрия и концентрировали в вакууме с получением неочищенного продукта этил 4-[6-[бис[(4-метоксифенил)метил]амино]-4-метил-3-(трифторметил)-2-пиридил]-5-метил-2-оксо-циклогексанкарбоксилата (10,70 г, неочищенный) в виде желтого твердого вещества. ЖХМС (ИЭР, m/z): 599,3 [М+Н]+.
Этап 6: 7-[6-[бис[(4-метоксифенил)метил]амино]-4-метил-3-(трифторметил)-2-пиридил]-6-метил-2-метилсульфанил-5,6,7,8-тетрагидро-3Н-хиназолин-4-он
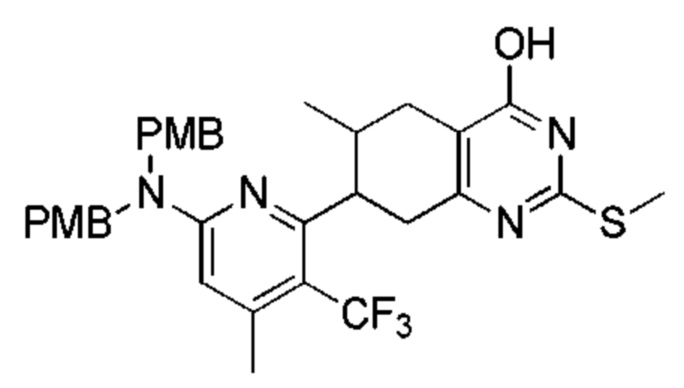
Раствор этил 4-[6-[бис[(4-метоксифенил)метил]амино]-4-метил-3-(трифторметил)-2-пиридил]-5-метил-2-оксо-циклогексанкарбоксилата (9,00 г, 15,03 ммоль), 2-метилизотиомочевины (27,11 г, 300,68 ммоль) и бикарбоната натрия (31,95 г, 375,85 ммоль) в этаноле (50 мл) и воде (10 мл) перемешивали при 50°С в течение 12 часов. После завершения реакционную смесь концентрировали в вакууме и разводили дихлорметаном, промывали водой. Органический слой сушили над безводным сульфатом натрия и концентрировали в вакууме. Остаток очищали с помощью флэш-хроматографии на силикагеле с элюированием дихлорметаном/этилацетатом (1/1) с получением 7-[6-[бис[(4-метоксифенил)метил]амино]-4-метил-3-(трифторметил)-2-пиридил]-6-метил-2-метилсульфанил-5,6,7,8-тетрагидро-3Н-хиназолин-4-она (2,30 г, 3,68 ммоль, выход 24,5%) в виде белого твердого вещества. ЖХМС (ИЭР, m/z): 625,2 [М+Н]+.
Этап 7: трет-бутил (3S)-4-[7-[6-[бис[(4-метоксифенил)метил]амино]-4-метил-3-(трифторметил)-2-пиридил]-6-метил-2-метилсульфанил-5,6,7,8-тетрагидрохиназолин-4-ил]-3-метил-пиперазин-1-карбоксилат

В раствор 7-[6-[бис[(4-метоксифенил)метил]амино]-4-метил-3-(трифторметил)-2-пиридил]-6-метил-2-метилсульфанил-5,6,7,8-тетрагидрохиназолин-4-ола (1,00 г, 1,60 ммоль) и N,N-диизопропилэтиламина (1,39 мл, 8,00 ммоль) в дихлорметане (5 мл) добавляли трифторметансульфоновый ангидрид (0,48 мл, 2,88 ммоль) и перемешивали при к.т. в течение 1 часа. После завершения растворитель концентрировали в вакууме.
Остаток разводили 1,4-диоксаном (10 мл) и доводили до рН>7 ДИЭА. Потом добавляли трет-бутил (3S)-3-метил-1-пиперазинкарбоксилат (1,60 г, 8,00 ммоль) и перемешивали при 110°С в течение 12 часов. После завершения растворитель концентрировали в вакууме. Остаток очищали с помощью флэш-хроматографии на силикагеле с элюированием петролейным эфиром/этилацетатом (3/1) с получением трет-бутил (3S)-4-[7-[6-[бис[(4-метоксифенил)метил]амино]-4-метил-3-(трифторметил)-2-пиридил]-6-метил-2-метилсульфанил-5,6,7,8-тетрагидрохиназолин-4-ил]-3-метил-пиперазин-1-карбоксилата (850,0 мг, 1,05 ммоль, выход 65,8%) в виде желтого твердого вещества. ЖХМС (ИЭР, m/z): 807,4 [М+Н]+.
Этап 8: трет-бутил(3S)-4-[7-[6-[бис[(4-метоксифенил)метил]амино]-4-метил-3-(трифторметил)-2-пиридил]-6-метил-2-метилсульфонил-5,6,7,8-тетрагидрохиназолин-4-ил]-3-метил-пиперазин-1-карбоксилат

Раствор трет-бутил (3S)-4-[7-[6-[бис[(4-метоксифенил)метил]амино]-4-метил-3-(трифторметил)-2-пиридил]-6-метил-2-метилсульфанил-5,6,7,8-тетрагидрохиназолин-4-ил]-3-метил-пиперазин-1-карбоксилата (0,20 г, 0,25 ммоль) и 3-хлорпероксибензойной кислоты (0,13 г, 0,74 ммоль) в дихлорметане (3 мл) перемешивали при к.т. в течение 1 часа. После завершения реакцию гасили водным насыщенным раствором Na2SO3. Реакционную смесь разводили дихлорметаном, промывали водой, сушили над безводным сульфатом натрия и концентрировали в вакууме с получением неочищенного трет-бутил(3S)-4-[7-[6-[бис[(4-метоксифенил)метил]амино]-4-метил-3-(трифторметил)-2-пиридил]-6-метил-2-метилсульфонил-5,6,7,8-тетрагидрохиназолин-4-ил]-3-метил-пиперазин-1-карбоксилата (300 мг, неочищенный), который непосредственно используют на следующем этапе без очистки. ЖХМС (ИЭР, m/z): 839,4 [М+Н]+.
Этап 9: трет-бутил(3S)-4-[7-[6-[бис[(4-метоксифенил)метил]амино]-4-метил-3-(трифторметил)-2-пиридил]-6-метил-2-[[(2S)-1-метилпирролидин-2-ил]метокси]-5,6,7,8-тетрагидрохиназолин-4-ил]-3-метил-пиперазин-1-карбоксилат
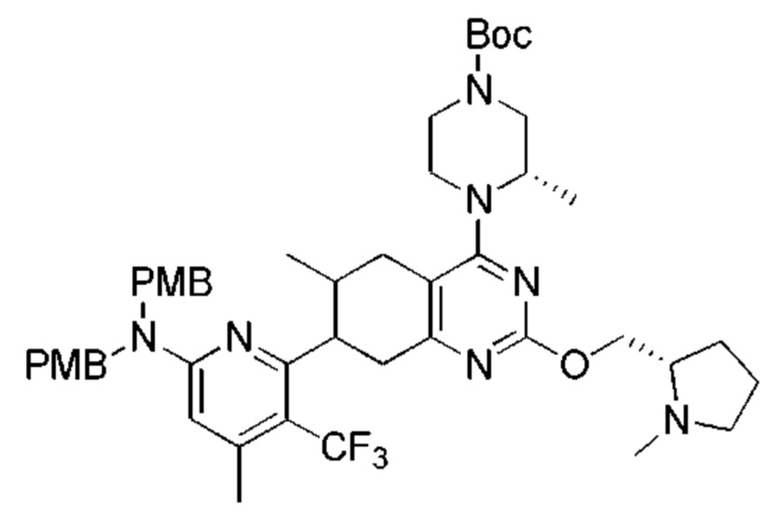
Раствор N-метил-L-пролинола (141,4 мг, 1,23 ммоль) и гидрида натрия (0,05 г, 1,23 ммоль, 60% дисперсия в минеральном масле) в N,N-диметилформамиде (3 мл) перемешивали при к.т. в течение 10 мин. Потом добавляли трет-бутил(3S)-4-[7-[6-[бис[(4-метоксифенил)метил]амино]-4-метил-3-(трифторметил)-2-пиридил]-6-метил-2-метилсульфонил-5,6,7,8-тетрагидрохиназолин-4-ил]-3-метил-пиперазин-1-карбоксилат (0,30 г, неочищенный) и перемешивали при к.т. в течение 5 часов. После завершения реакцию гасили водным насыщенным раствором хлорида аммония. Полученный в результате раствор экстрагировали дихлорметаном и объединяли органические слои. Органический слой промывали водой, сушили над безводным сульфатом натрия и концентрировали в вакууме. Остаток очищали с помощью флэш-хроматографии на силикагеле с элюированием дихлорметаном/метанолом (20/1) с получением трет-бутил(3S)-4-[7-[6-[бис[(4-метоксифенил)метил]амино]-4-метил-3-(трифторметил)-2-пиридил]-6-метил-2-[[(2S)-1-метилпирролидин-2-ил]метокси]-5,6,7,8-тетрагидрохиназолин-4-ил]-3-метил-пиперазин-1-карбоксилата (100,0 мг, 0,11 ммоль, выход 46,4%) в виде желтого твердого вещества. ЖХМС (ИЭР, m/z): 874,5 [М+Н]+.
Этап 10: 1-((S)-4-((6S,7S)-7-(6-амино-4-метил-3-(трифторметил)пиридин-2-ил)-6-метил-2-(((S)-1-метилпирролидин-2-ил)метокси)-5,6,7,8-тетрагидрохиназолин-4-ил)-3-метилпиперазин-1-ил)проп-2-ен-1-он (Пример 21а); 1-((S)-4-((6R,7R)-7-(6-амино-4-метил-3-(трифторметил)пиридин-2-ил)-6-метил-2-(((S)-1-метилпирролидин-2-ил)метокси)-5,6,7,8-тетрагидрохиназолин-4-ил)-3-метилпиперазин-1-ил)проп-2-ен-1-он (Пример 21b)
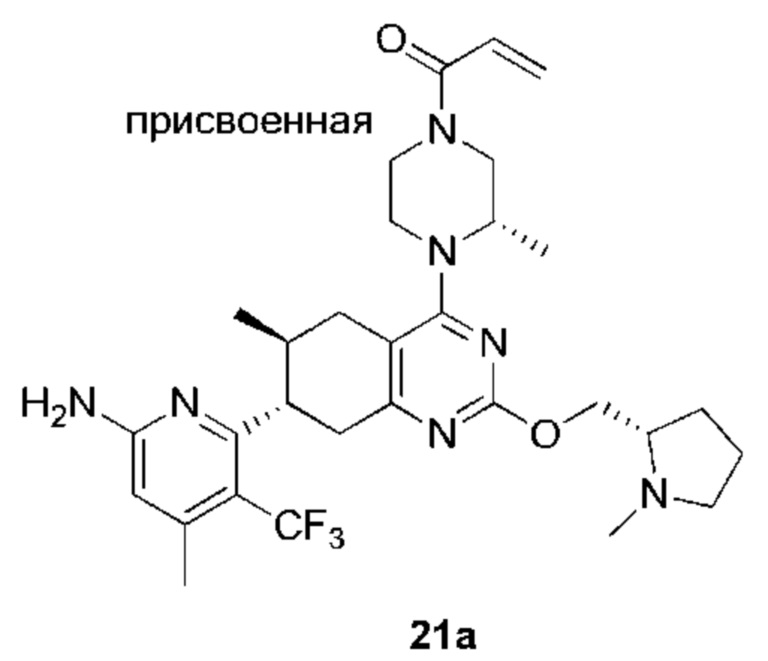
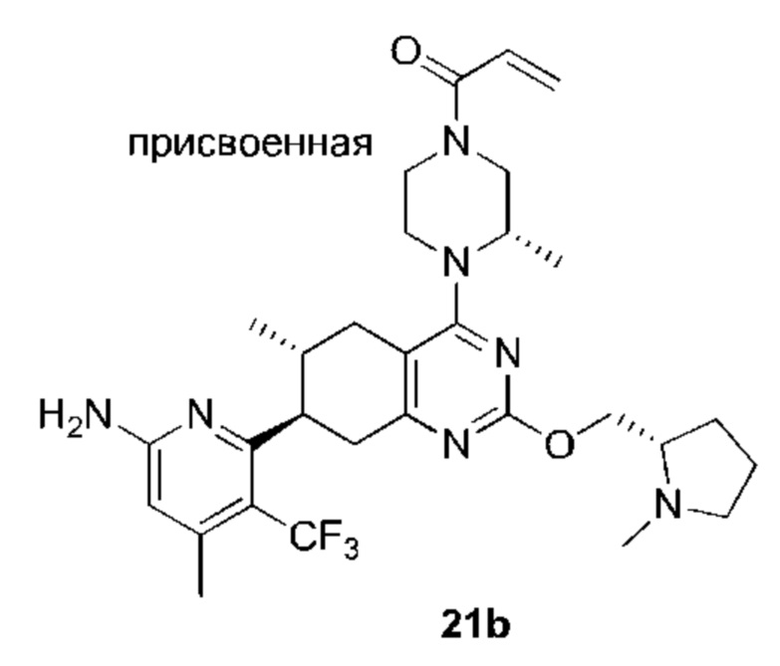
Раствор трет-бутил (3S)-4-[7-[6-[бис[(4-метоксифенил)метил]амино]-4-метил-3-(трифторметил)-2-пиридил]-6-метил-2-[[(2S)-1-метилпирролидин-2-ил]метокси]-5,6,7,8-тетрагидрохиназолин-4-ил]-3-метил-пиперазин-1-карбоксилата (0,70 г, 0,80 ммоль) в трифторуксусной кислоте (5 мл) перемешивали при 50°С в течение 12 часов. После завершения растворитель концентрировали в вакууме с получением неочищенного 4-метил-6-[6-метил-4-[(2S)-2-метилпиперазин-1-ил]-2-[[(2S)-1-метилпирролидин-2-ил]метокси]-5,6,7,8-тетрагидрохиназолин-7-ил]-5-(трифторметил)пиридин-2-амина (900 мг, неочищенный). Раствор неочищенного 4-метил-6-[6-метил-4-[(2S)-2-метилпиперазин-1-ил]-2-[[(2S)-1-метилпирролидин-2-ил]метокси]-5,6,7,8-тетрагидрохиназолин-7-ил]-5-(трифторметил)пиридин-2-амина (0,90 г, неочищенный) в дихлорметане (10 мл) доводили до рН>7 ДИЭА. Потом добавляли акрилилхлорид (0,14 г, 1,52 ммоль) и перемешивали при -78°С в течение 20 минут. После завершения полученный в результате раствор гасили водным насыщенным раствором хлорида аммония и концентрировали в вакууме. Потом неочищенный продукт очищали с помощью препаративной ВЭЖХ со следующими условиями: колонка: CHIRALPAK IE2*25 см, 5 мкм, S90IE0SCJ-VA001S90IE0SCJ-VA001; подвижная фаза: гексан (8 ммоль/л NH3.MeOH); детектор, УФ 254 нм. Смесь диастереоизомеров разделяли с помощью препаративной хиральной ВЭЖХ со следующими условиями: колонка: CHIRALPAK IE-3, 4,6*50 мм, 3 мкм; подвижная фаза А: гексан (0,1% ДЭА): EtOH=50:50, подвижная фаза В:; скорость потока: 1 мл/мин, с получением указанных в заголовке соединений. Абсолютная конфигурация указанных в заголовке соединений была определена по данным активности и рентгенограммы белковой структуры соединения 21b.
Пример 21а: 1-((S)-4-((6S,7S)-7-(6-амино-4-метил-3-(трифторметил)пиридин-2-ил)-6-метил-2-(((S)-1-метилпирролидин-2-ил)метокси)-5,6,7,8-тетрагидрохиназолин-4-ил)-3-метилпиперазин-1-ил)проп-2-ен-1-он (84,1 мг, 0,14 ммоль, выход 8,5%, белое твердое вещество). 1Н ЯМР (300 МГц, ДМСО-d6, м.д.) δ 6,97-6,71 (м, 1H), 6,44 (с, 2Н), 6,27-6,10 (м, 2Н), 5,72 (дд, J=10,4, 2,5 Гц, 1H), 4,39-3,94 (м, 5Н), 3,92-3,52 (м, 1H), 3,50-3,41 (м, 1H), 3,28-3,17 (м, 2Н), 3,13-2,67 (м, 5Н), 2,65-2,57 (м, 1H), 2,48-2,40 (м, 1H), 2,38-2,22 (м, 6Н), 2,21-1,78 (м, 3Н), 1,72-1,51 (м, 3Н), 1,02-0,88 (м, 3Н), 0,71 (д, J=6,4 Гц, 3Н). ЖХМС (ИЭР, m/z): 588,4 [М+Н]+. Хиральная ВЭЖХ: CHIRALPAK IE-3 (4,6*50 мм; 3 мкм); обнаружение на 254 нм; гексан (0,1% ДЭА): EtOH=50:50; скорость потока=1,0 мл/мин; время удержания: 2,100 мин (более медленный пик).
Пример 21b: 1-((S)-4-((6R,7R)-7-(6-амино-4-метил-3-(трифторметил)пиридин-2-ил)-6-метил-2-(((S)-1-метилпирролидин-2-ил)метокси)-5,6,7,8-тетрагидрохиназолин-4-ил)-3-метилпиперазин-1-ил)проп-2-ен-1-он (74,9 мг, 0,13 ммоль, выход 7,6%, белое твердое вещество). 1Н ЯМР (300 МГц, ДМСО-d6, м.д.) δ 6,95-6,70 (м, 1H), 6,45 (с, 2Н), 6,26-6,10 (м, 2Н), 5,75 (дд, J=10,4, 2,4 Гц, 1H), 4,43-3,67 (м, 6Н), 3,38-3,25 (м, 2Н), 3,16-2,68 (м, 6Н), 2,48-2,41 (м, 2Н), 2,36-2,23 (м, 6Н), 2,14 (к, J=8,6 Гц, 1H), 2,08-1,85 (м, 2Н), 1,71-1,45 (м, 3Н), 1,22 (шир. с, 3Н), 0,70 (д, J=6,4 Гц, 3Н). ЖХМС (ИЭР, m/z): 588,4 [М+Н]+. Хиральная ВЭЖХ: CHIRALPAK IE-3 (4,6*50 мм; 3 мкм); обнаружение на 254 нм; гексан (0,1% ДЭА): EtOH=50:50; скорость потока=1,0 мл/мин; время удержания: 1,780 мин (более быстрый пик).
Примеры 22а и 22b
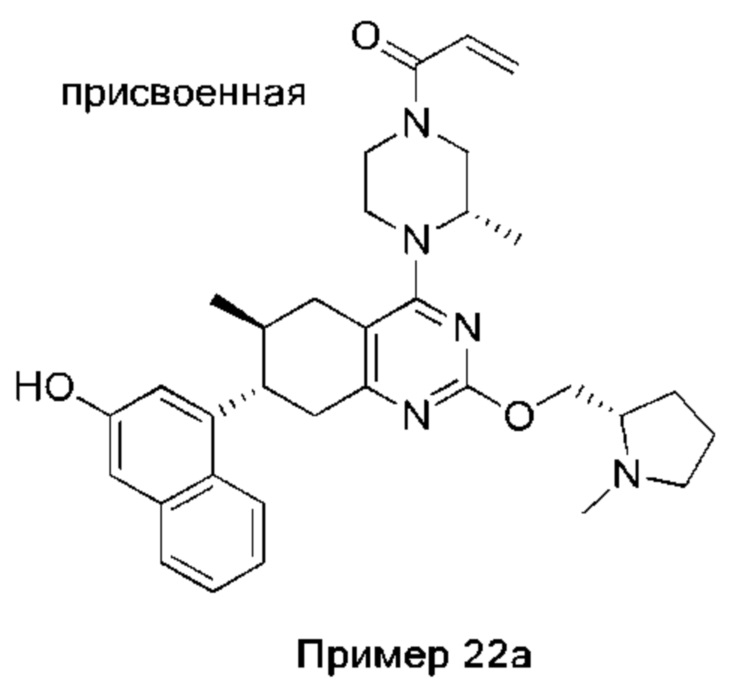

1-((S)-4-((6S,7S)-7-(3-гидроксинафтален-1-ил)-6-метил-2-(((S)-1-метилпирролидин-2-ил)метокси)-5,6,7,8-тетрагидрохиназолин-4-ил)-3-метилпиперазин-1-ил)проп-2-ен-1-он (Пример 22а)
1-((S)-4-((6R,7R)-7-(3-гидроксинафтален-1-ил)-6-метил-2-(((S)-1-метилпирролидин-2-ил)метокси)-5,6,7,8-тетрагидрохиназолин-4-ил)-3-метилпиперазин-1-ил)проп-2-ен-1-он (Пример 22b)
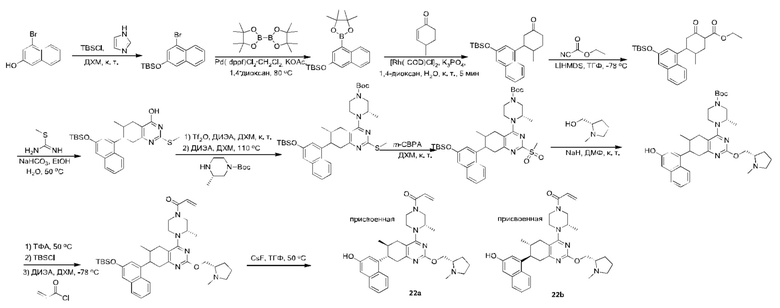
Этап 1: (4-бром-2-нафтил)окси-трет-бутил-диметил-силан

Раствор 4-бромнафтален-2-ола (35,00 г, 156,90 ммоль), трет-бутилдиметилсилилхлорида (35,47 г, 235,35 ммоль) и имидазола (32,04 г, 470,7 ммоль) в дихлорметане (200 мл) перемешивали при 25°С в течение 1 часа. После завершения растворитель разводили дихлорметаном и промывали водой, сушили над безводным сульфатом натрия и концентрировали в вакууме. Остаток очищали с помощью флэш-хроматографии на силикагеле с элюированием петролейным эфиром/этилацетатом (20/1) с получением (4-бром-2-нафтил)окси-трет-бутил-диметил-силана (48,00 г, 142,29 ммоль, выход 90,7%) в виде желтого масла.
Этап 2: трет-бутил-диметил-[[4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-2-нафтил]окси]силан

В атмосфере азота раствор (4-бром-2-нафтил)окси-трет-бутил-диметил-силана (48,00 г, 142,29 ммоль), бис(пинаколато)дибора (108,40 г, 426,88 ммоль), Pd(dppf)Cl2.CH2Cl2 (11,76 г, 14,23 ммоль) и ацетата калия (41,80 г, 426,88 ммоль) в 1,4-диоксане (200 мл) перемешивали в течение 3 часов при 80°С. После завершения реакционную смесь концентрировали в вакууме. Реакционную смесь разводили дихлорметаном и промывали водой. Органический слой сушили над безводным сульфатом натрия и концентрировали в вакууме. Остаток очищали с помощью флэш-хроматографии на силикагеле с элюированием петролейным эфиром/диэтиловым эфиром (3/1) с получением трет-бутил-диметил-[[4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-2-нафтил]окси]силана (50,00 г, 130,08 ммоль, выход 91,4%) в виде белого твердого вещества. ЖХМС (ИЭР, m/z): 385,2 [М+Н]+.
Этап 3: 3-[3-[трет-бутил(диметил)силил]окси-1-нафтил]-4-метил-циклогексанон
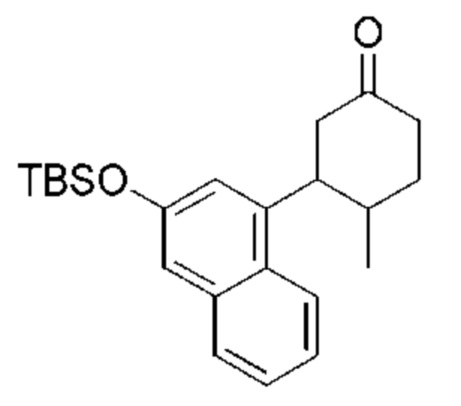
В атмосфере азота в раствор 4-метилциклогекс-2-ен-1-она (12,90 г, 117,07 ммоль), трет-бутил-диметил-[[4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-2-нафтил]окси]силана (30,00 г, 78,05 ммоль), димера хлор(1,5-циклооктадиен)родия (I) (3,86 г, 7,80 ммоль), (+/-)-2,2'-бис(дифенилфосфино)-1,1'-бинафтила (9,72 г, 15,61 ммоль) в 1,4-диоксане (50 мл) добавляли водный насыщенный раствор фосфата калия (10 мл) и перемешивали при комнатной температуре в течение 5 минут. После завершения реакционную смесь концентрировали в вакууме. Реакционную смесь разводили дихлорметаном и промывали водой. Органический слой сушили над безводным сульфатом натрия и концентрировали в вакууме. Остаток очищали с помощью флэш-хроматографии на силикагеле с элюированием петролейным эфиром/диэтиловым эфиром (3/1) с получением 3-[3-[трет-бутил(диметил)силил]окси-1-нафтил]-4-метил-циклогексанона (16,00 г, 43,41 ммоль, выход 55,6%) в виде желтого твердого вещества. ЖХМС (ИЭР, m/z): 369,2 [М+Н]+.
Этап 4: этил 4-[3-[трет-бутил(диметил)силил]окси-1-нафтил]-5-метил-2-оксо-циклогексанкарбоксилат
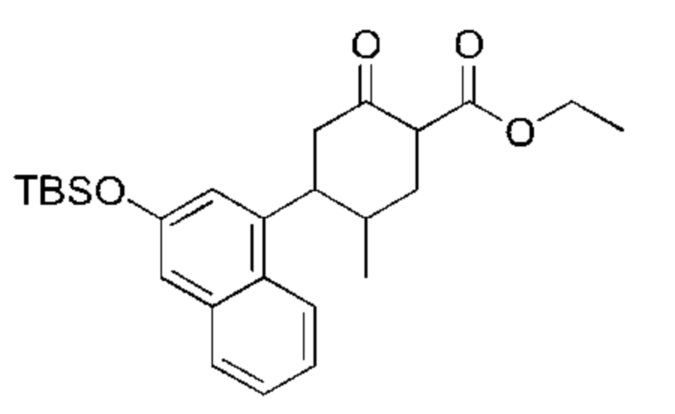
В атмосфере азота в раствор 3-[3-[трет-бутил(диметил)силил]окси-1-нафтил]-4-метил-циклогексанона (17,00 г, 46,12 ммоль) в тетрагидрофуране (200 мл) по каплям добавляли бис(триметилсилил)амид лития (92,2 мл, 92,25 ммоль, 1,0 М в ТГФ) и перемешивали в течение 1 часа при -78°С. Потом добавляли этилцианоформиат (10,51 г, 106,08 ммоль) добавляли и перемешивали при -78°С в течение 0,5 часа. После завершения реакцию гасили водным насыщенным раствором хлорида аммония. Реакционную смесь разводили дихлорметаном, промывали водой. Органический слой сушили над безводным сульфатом натрия и концентрировали в вакууме с получением неочищенного продукта этил 4-[3-[трет-бутил(диметил)силил]окси-1-нафтил]-5-метил-2-оксо-циклогексанкарбоксилата (20,00 г, неочищенный) в виде желтого твердого вещества. ЖХМС (ИЭР, m/z): 441,2 [М+Н]+.
Этап 5: 7-[3-[трет-бутил(диметил)силил]окси-1-нафтил]-6-метил-2-метилсульфанил-5,6,7,8-тетрагидрохиназолин-4-ол
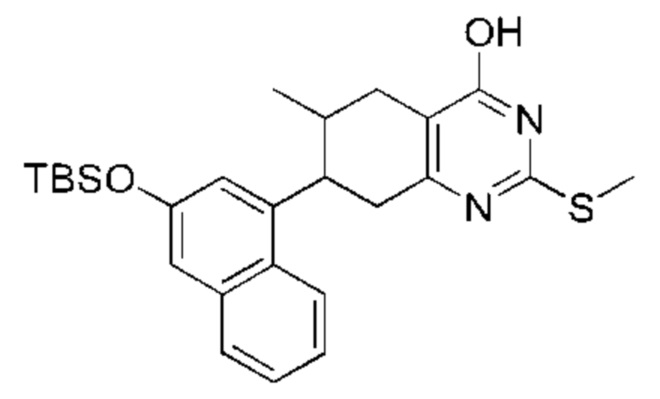
Раствор этил 4-[3-[трет-бутил(диметил)силил]окси-1-нафтил]-5-метил-2-оксо-циклогексанкарбоксилата (20,00 неочищенный), 2-метилизотиомочевины (122,75 г, 1361,6 ммоль) и бикарбоната натрия (144,70 г, 1702 ммоль) в этаноле (200 мл) и воде (40 мл) перемешивали при 50°С в течение 12 часов. После завершения реакционную смесь концентрировали в вакууме и разводили дихлорметаном, промывали водой. Органический слой сушили над безводным сульфатом натрия и концентрировали в вакууме. Остаток очищали с помощью флэш-хроматографии на силикагеле с элюированием дихлорметаном/этилацетатом (1/1) с получением 7-[3-[трет-бутил(диметил)силил]окси-1-нафтил]-6-метил-2-метилсульфанил-5,6,7,8-тетрагидрохиназолин-4-ола (10,30 г, 22,07 ммоль) в виде белого твердого вещества. ЖХМС (ИЭР, m/z): 467,2 [М+Н]+.
Этап 6: трет-бутил (3S)-4-[7-[3-[трет-бутил(диметил)силил]окси-1-нафтил]-6-метил-2-метилсульфанил-5,6,7,8-тетрагидрохиназолин-4-ил]-3-метил-пиперазин-1-карбоксилат

В раствор 7-[3-[трет-бутил(диметил)силил]окси-1-нафтил]-6-метил-2-метилсульфанил-5,6,7,8-тетрагидрохиназолин-4-ола (2,00 г, 4,29 ммоль) и N,N-диизопропилэтиламина (3,73 мл, 21,43 ммоль) в ДХМ (10 мл) добавляли трифторметансульфоновый ангидрид (1,3 мл, 7,71 ммоль) и перемешивали при к. т.в течение 1 часа. После завершения растворитель концентрировали в вакууме. Остаток разводили дихлорметаном (10 мл) и доводили до рН>7 ДИЭА. Потом добавляли трет-бутил (3S)-3-метил-1-пиперазинкарбоксилат (2,57 г, 12,86 ммоль) и перемешивали при 110°С в течение 12 часов. После завершения растворитель концентрировали в вакууме. Остаток очищали с помощью флэш-хроматографии на силикагеле с элюированием петролейным эфиром/диэтиловым эфиром (3/1) с получением трет-бутил (3S)-4-[7-[3-[трет-бутил(диметил)силил]окси-1-нафтил]-6-метил-2-метилсульфанил-5,6,7,8-тетрагидрохиназолин-4-ил]-3-метил-пиперазин-1-карбоксилата (1,80 г, 2,77 ммоль, выход 64,7%) в виде желтого твердого вещества. ЖХМС (ИЭР, m/z): 649,4 [М+Н]+.
Этап 7: трет-бутил(3S)-4-[7-[3-[трет-бутил(диметил)силил]окси-1-нафтил]-6-метил-2-метилсульфонил-5,6,7,8-тетрагидрохиназолин-4-ил]-3-метил-пиперазин-1-карбоксилат
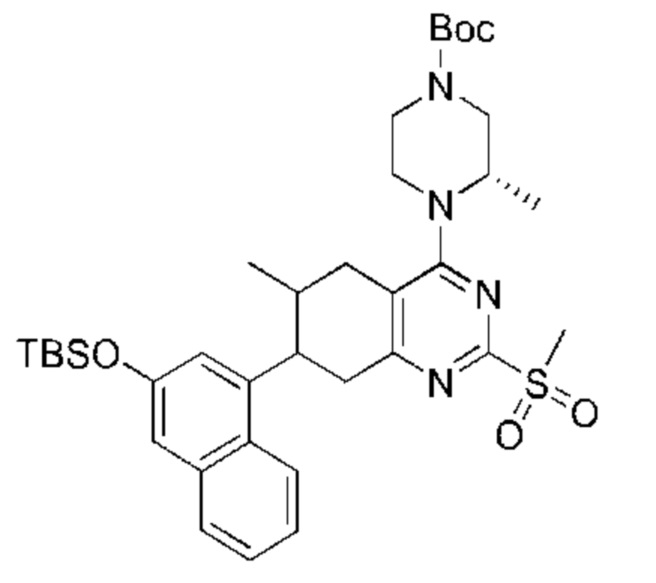
Раствор трет-бутил (3S)-4-[7-[3-[трет-бутил(диметил)силил]окси-1-нафтил]-6-метил-2-метилсульфанил-5,6,7,8-тетрагидрохиназолин-4-ил]-3-метил-пиперазин-1-карбоксилата (2,70 г, 4,16 ммоль) и 3-хлорпероксибензойной кислоты (2,15 г, 12,48 ммоль) в дихлорметане (10 мл) перемешивали при 25°С в течение 1 часа. После завершения реакцию гасили водным насыщенным раствором Na2SO3. Реакционную смесь разводили дихлорметаном и промывали водой. Органический слой сушили над безводным сульфатом натрия и концентрировали в вакууме с получением неочищенного трет-бутил(3S)-4-[7-[3-[трет-бутил(диметил)силил]окси-1-нафтил]-6-метил-2-метилсульфонил-5,6,7,8-тетрагидрохиназолин-4-ил]-3-метил-пиперазин-1-карбоксилата (3,50 г, неочищенный), который непосредственно используют на следующем этапе без очистки.
Этап 8: трет-бутил (3S)-4-[7-(3-гидрокси-1-нафтил)-6-метил-2-[[(2S)-1-метилпирролидин-2-ил]метокси]-5,6,7,8-тетрагидрохиназолин-4-ил]-3-метил-пиперазин-1-карбоксилат
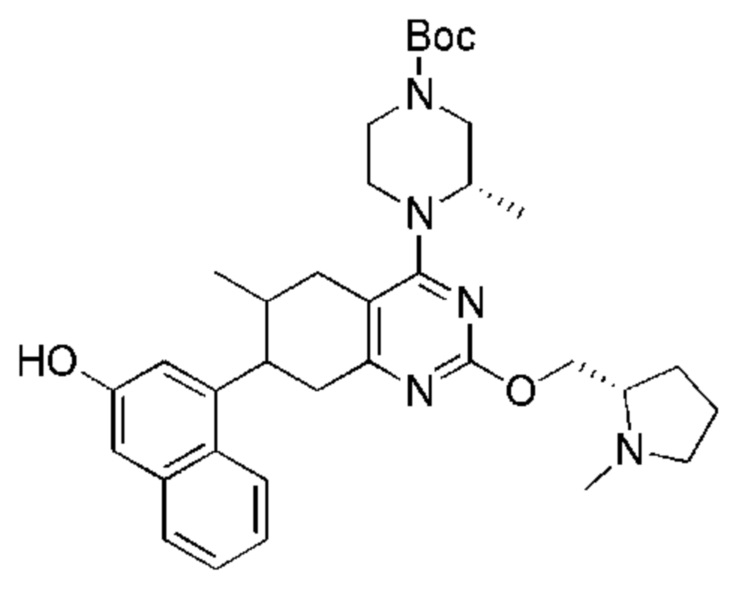
Раствор N-метил-L-пролинола (1,83 г, 15,93 ммоль) и гидрида натрия (0,64 г, 15,93 ммоль, 60% дисперсия в минеральном масле) в N,N-диметилформамид (10 мл) перемешивали при 25°С в течение 10 минут. Потом добавляли неочищенный продукт трет-бутил (3S)-4-[7-[3-[трет-бутил(диметил)силил]окси-1-нафтил]-6-метил-2-метилсульфонил-5,6,7,8-тетрагидрохиназолин-4-ил]-3-метил-пиперазин-1-карбоксилат (3,5 г, неочищенный) и перемешивали при 25°С в течение 6 часов. После завершения реакцию гасили водным насыщенным раствором хлорида аммония. Полученный в результате раствор экстрагировали дихлорметаном и объединяли органические слои. Органический слой промывали водой, сушили над безводным сульфатом натрия и концентрировали в вакууме. Остаток очищали с помощью флэш-хроматографии на силикагеле с элюированием дихлорметаном/метанолом (20/1) с получением трет-бутил (3S)-4-[7-(3-гидрокси-1-нафтил)-6-метил-2-[[(2S)-1-метилпирролидин-2-ил]метокси]-5,6,7,8-тетрагидрохиназолин-4-ил]-3-метил-пиперазин-1-карбоксилата (1,20 г, 1,99 ммоль, выход 62,6%) в виде желтого твердого вещества. ЖХМС (ИЭР, m/z): 602,3 [М+Н]+.
Этап 9: 1-((S)-4-(7-(3-(трет-бутилдиметилсилилокси)нафтален-1-ил)-6-метил-2-(((S)-1-метилпирролидин-2-ил)метокси)-5,6,7,8-тетрагидрохиназолин-4-ил)-3-метилпиперазин-1-ил)проп-2-ен-1-он

Раствор трет-бутил (3S)-4-[7-(3-гидрокси-1-нафтил)-6-метил-2-[[(2S)-1-метилпирролид ин-2-ил]метокси]-5,6,7,8-тетрагидрохиназолин-4-ил]-3-метил-пиперазин-1-карбоксилата (0,7 г, 1,16 ммоль) в дихлорметане (5 мл) и трифторуксусной кислоте (1 мл) перемешивали при 50°С в течение 0,5 часа. После завершения растворитель концентрировали в вакууме. Раствор неочищенного вещества в дихлорметане (5 мл) доводили до рН>7 N,N-диизопропилэтиламином. Потом добавляли имидазол (0,24 г, 3,49 ммоль) и трет-бутилдиметилсилил хлорид (0,88 г, 5,82 ммоль) и перемешивали при 25°С в течение 1 часа. После завершения растворитель концентрировали в вакууме. Остаток очищали с помощью флэш-хроматографии на обращенно-фазовой колонке с элюированием метанолом/Н2О (100/0) с получением неочищенного трет-бутил-диметил-[[4-[6-метил-4-[(2S)-2-метилпиперазин-1-ил]-2-[[(2S)-1-метилпирролидин-2-ил]метокси]-5,6,7,8-тетрагидрохиназолин-7-ил]-2-нафтил]окси]силана (790 мг, неочищенный). Раствор неочищенного трет-бутил-диметил-[[4-[6-метил-4-[(2S)-2-метилпиперазин-1-ил]-2-[[(2S)-1-метилпирролидин-2-ил]метокси]-5,6,7,8-тетрагидрохиназолин-7-ил]-2-нафтил]окси]силана (790 мг, неочищенный) в дихлорметане (5 мл) доводили до рН>7 N,N-диизопропилэтиламином. Потом добавляли акрилилхлорид (0,10 г, 1,15 ммоль) и перемешивали при -78°С в течение 20 мин. После завершения реакцию гасили водой. Реакционную смесь разводили дихлорметаном и промывали водой. Органический слой сушили над безводным сульфатом натрия и концентрировали в вакууме. Остаток очищали с помощью флэш-хроматографии на силикагеле с элюированием дихлорметаном/метанолом (5/1) с получением 1-((S)-4-(7-(3-(трет-бутилдиметилсилилокси)нафтален-1-ил)-6-метил-2-(((S)-1-метилпирролидин-2-ил)метокси)-5,6,7,8-тетрагидрохиназолин-4-ил)-3-метилпиперазин-1-ил)проп-2-ен-1-она (560,0 мг, 0,84 ммоль, выход 65,2%) в виде желтого твердого вещества. ЖХМС (ИЭР, m/z): 670,4 [М+Н]+.
Этап 10: 1-((S)-4-((6S,7S)-7-(3-гидроксинафтален-1-ил)-6-метил-2-(((S)-1-метилпирролидин-2-ил)метокси)-5,6,7,8-тетрагидрохиназолин-4-ил)-3-метилпиперазин-1-ил)проп-2-ен-1-он (Пример 22а); 1-((S)-4-((6R,7R)-7-(3-гидроксинафтален-1-ил)-6-метил-2-(((S)-1-метилпирролидин-2-ил)метокси)-5,6,7,8-тетрагидрохиназолин-4-ил)-3-метилпиперазин-1-ил)проп-2-ен-1-он (Пример 22b)
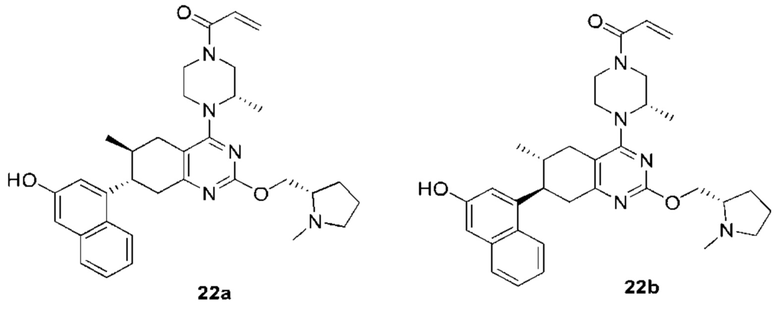
Раствор 1-((S)-4-(7-(3-(трет-бутилдиметилсилилокси)нафтален-1-ил)-6-метил-2-(((S)-1-метилпирролидин-2-ил)метокси)-5,6,7,8-тетрагидрохиназолин-4-ил)-3-метилпиперазин-1-ил)проп-2-ен-1-она (0,50 г, 0,75 ммоль) и CsF (0,34 г, 2,24 ммоль) в тетрагидрофуране (5 мл) перемешивали при 50°С в течение 1 часа. После завершения растворитель концентрировали в вакууме. Потом неочищенный продукт очищали с помощью препаративной ВЭЖХ со следующими условиями: колонка XBridge Prep OBD С18, 30×150 мм, 5 мкм; подвижная фаза А: вода (10 ммоль/л NH4HCO3), подвижная фаза В: АЦН; скорость потока: 60 мл/мин; градиент: от 30 В до 60 В за 7 мин; 254 нм; RT1: 6,45; RT2:; вводимый объем: мл; число прогонов:; Смесь диастереоизомеров разделяли с помощью препаративной хиральной ВЭЖХ со следующими условиями: колонка: CHIRALPAK ID-03, 2,0 см, В.Д. *25 см L (5 мкм); подвижная фаза А: МТБЭ (10 мМ NH3-MEOH) --ВЭЖХ, подвижная фаза В: EtOH --ВЭЖХ; скорость потока: 38 мл/мин; градиент: от 10 В до 10 В за 28 мин; 220/254 нм; RT1: 9,157; RT2: 20,703; вводимый объем: 3 мл; число прогонов: 3, с получением указанных в заголовке соединений. Абсолютная конфигурация указанных в заголовке соединений была определена по данным активности и рентгенограммы белковой структуры соединения 21b.
Пример 22а: 1-((S)-4-((6S,7S)-7-(3-гидроксинафтален-1-ил)-6-метил-2-(((S)-1-метилпирролидин-2-ил)метокси)-5,6,7,8-тетрагидрохиназолин-4-ил)-3-метилпиперазин-1-ил)проп-2-ен-1-он (89,9 мг, 0,16 ммоль, выход 21,7%, белое твердое вещество). 1Н ЯМР (400 МГц, ДМСО-d6) δ 9,63 (с, 1H), 8,14 (д, J = 8,7 Гц, 1H), 7,70 (д, J = 8,2 Гц, 1H), 7,39 (т, J = 7,5 Гц, 1H), 7,28 (т, J = 7,7 Гц, 1H), 7,14 (с, 2Н), 6,93-6,78 (м, 1H), 6,18 (д, J = 15,8 Гц, 1H), 5,73 (дд, J = 10,6, 2,2 Гц, 1H), 4,40-4,02 (м, 5Н), 3,98-3,61 (м, 2Н), 3,56-3,45 (м, 1H), 3,40-3,33 (м, 1H), 3,28-3,20(м, 1H), 3,11-2,90 (м, 3H), 2,89-2,74 (м, 1H), 2,69-2,60(м, 2Н), 2,33 (с, 3H), 2,23-2,00 (м, 2Н), 1,99-1,84 (м, 1H), 1,78-1,51 (м, 3H), 1,05 (д, J = 8,4 Гц, 3H), 0,78 (д, J = 6,4 Гц, 3H). ЖХМС (ИЭР, m/z): 556,3 [М+Н]+. Хиральная ВЭЖХ: CHIRALPAK ID-3(0,46*5 см; 3 мкм); обнаружение на 254 нм; МТБЭ (0,1% ДЭА): EtOH = 90:10; скорость потока = 1,0 мл/мин; время удержания: 2,793 мин (более медленный пик).
Пример 22b: 1-((S)-4-((6R,7R)-7-(3-гидроксинафтален-1-ил)-6-метил-2-(((S)-1-метилпирролидин-2-ил)метокси)-5,6,7,8-тетрагидрохиназолин-4-ил)-3-метилпиперазин-1-ил)проп-2-ен-1-он (83,0 мг, 0,15 ммоль, выход 20%, белое твердое вещество). 1Н ЯМР (400 МГц, ДМСО-d6) δ 9,64 (с, 1H), 8,10 (д, J = 8,6 Гц, 1H), 7,70 (д, J = 8,2 Гц, 1H), 7,38 (т, J = 7,5 Гц, 1H), 7,28 (т, J = 7,7 Гц, 1H), 7,09-6,98 (м, 2Н), 6,97-6,72 (м, 1H), 6,22-6,11 (м, 1H), 5,72 (дд, J = 10,4, 2,4 Гц, 1H), 4,45-3,99 (м, 5Н), 3,92-3,81 (м, 1H), 3,78-3,63 (м, 1H), 3,52-3,36 (м, 1H), 3,25-2,92 (м, 4Н), 2,88-2,70 (м, 1H), 2,65-2,57 (м, 1H), 2,33 (с, 3H), 2,24-2,01 (м, 2Н), 2,00-1,85 (м, 1H), 1,77-1,51 (м, 3H), 1,41 (с, 1H), 1,30-1,14 (м, 3H), 1,13-1,08 (м, 1H), 0,82 (д, J = 6,4 Гц, 3H). ЖХМС (ИЭР, m/z): 556,3 [М+Н]+. Хиральная ВЭЖХ: CHIRALPAK ID-3(0,46*5 см; 3 мкм); обнаружение на 254 нм; МТБЭ (0,1% ДЭА): EtOH = 90:10; скорость потока = 1,0 мл/мин; время удержания: 1,387 мин (более быстрый пик).
Примеры 23а и 23b

1-((S)-4-((6S,7S)-7-(3-амино-2-фтор-6-(трифторметил)фенил)-6-метил-2-(((S)-1-метилпирролидин-2-ил)метокси)-5,6,7,8-тетрагидрохиназолин-4-ил)-3-метилпиперазин-1-ил)проп-2-ен-1-он (Пример 23а)
1-((S)-4-((6R,7R)-7-(3-амино-2-фтор-6-(трифторметил)фенил)-6-метил-2-(((S)-1-метилпирролидин-2-ил)метокси)-5,6,7,8-тетрагидрохиназолин-4-ил)-3-метилпиперазин-1-ил)проп-2-ен-1-он (Пример 23b)

Этап 1: 3-[3-[бис[(4-метоксифенил)метил]амино]-2-фтор-фенил]-4-метил-циклогексанон

В атмосфере азота в раствор 2-фтор-N,N-бис[(4-метоксифенил)метил]-3-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)анилин (13,00 г, 27,23 ммоль), 4-метилциклогекс-2-ен-1-она (4,50 г, 40,85 ммоль) и димера хлор(1,5-циклооктадиен)родия (I) (1,35 г, 2,72 ммоль) в 1,4-диоксане (50 мл) добавляли насыщенный водный раствор фосфата калия (10 мл) и перемешивали в течение 5 минут при 50°С. После завершения реакционную смесь концентрировали в вакууме. Реакционную смесь разводили дихлорметаном и промывали водой. Органический слой сушили над безводным сульфатом натрия и концентрировали в вакууме. Остаток очищали с помощью флэш-хроматографии на силикагеле с элюированием петролейным эфиром/диэтиловым эфиром (3/1) с получением 3-[3-[бис[(4-метоксифенил)метил]амино]-2-фтор-фенил]-4-метил-циклогексанона (5,20 г, 11,27 ммоль, выход 41,4%) в виде желтого твердого вещества. ЖХМС (ИЭР, m/z): 462,2 [М+Н]+.
Этап 2: 3-[3-[бис[(4-метоксифенил)метил]амино]-2-фтор-6-йодо-фенил]-4-метил-циклогексанон
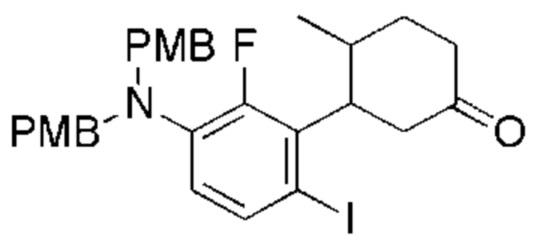
В раствор 3-[3-[бис[(4-метоксифенил)метил]амино]-2-фтор-фенил]-4-метил-циклогексанона (9,00 г, 19,5 ммоль) и N-йодосукцинимида (5,70 г, 25,35 ммоль) в ацетонитриле (10 мл) добавляли трифторуксусную кислоту (0,15 мл, 1,95 ммоль) и перемешивали при 25°С в течение 15 минут. После завершения растворитель концентрировали в вакууме. Остаток очищали с помощью флэш-хроматографии на силикагеле с элюированием петролейным эфиром/диэтиловым эфиром (3/1) с получением 3-[3-[бис[(4-метоксифенил)метил]амино]-2-фтор-6-йодо-фенил]-4-метил-циклогексанона (6,20 г, 5,80 ммоль, выход 29,8%) в виде желтого твердого вещества. ЖХМС (ИЭР, m/z): 588,1 [М+Н]+.
Этап 3: 3-[3-[бис[(4-метокси-фенил)метил]амино]-2-фтор-6-(трифторметил)фенил]-4-метил-циклогексанон

В атмосфере азота в раствор метил 2,2-дифтор-2-(фторсульфонил)ацетата (5,63 г, 29,32 ммоль) и йодида меди (3,35 г, 17,59 ммоль) в ДМФ (10 мл) добавляли 3-[3-[бис[(4-метоксифенил)метил]амино]-2-фтор-6-йодо-фенил]-4-метил-циклогексанон (6,50 г, 5,86 ммоль) при 80°С в течение 2 часов. После завершения в реакционную смесь добавляли воду, экстрагировали дихлорметаном и объединяли органические слои. Органические слои промывали водой, сушили над безводным сульфатом натрия и концентрировали в вакууме. Остаток очищали с помощью флэш-хроматографии на силикагеле с элюированием петролейным эфиром/этилацетатом (3/1) с получением 3-[3-[бис[(4-метокси-фенил)метил]амино]-2-фтор-6-(трифторметил)фенил]-4-метил-циклогексанона (3,00 г, 5,67 ммоль, выход 96,6%) в виде желтого твердого вещества. ЖХМС (ИЭР, m/z): 530,2 [М+Н]+.
Этап 4: этил 4-[3-[бис[(4-метоксифенил)метил]-амино]-2-фтор-6-(трифторметил)фенил]-5-метил-2-оксо-циклогексанкарбоксилат
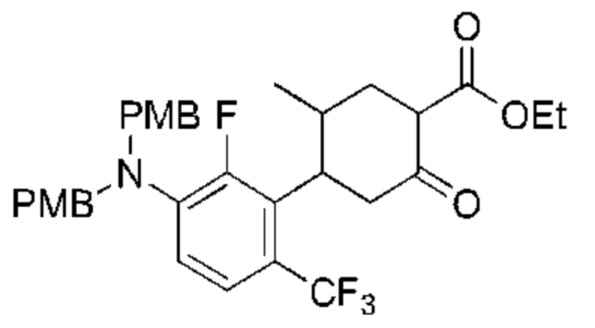
В атмосфере азота в раствор 3-[3-[бис[(4-метоксифенил)метил]амино]-2-фтор-6-(трифторметил)фенил]-4-метил-циклогексанона (3,30 г, 6,23 ммоль) в тетрагидрофуране (100 мл) по каплям добавляли бис(триметилсилил)амид лития (12,46 мл, 12,46 ммоль, 1Mb ТГФ) и перемешивали в течение 1 часа при -78°С. Потом по каплям добавляли этилцианоформиат (1,42 г, 14,33 ммоль) и перемешивали при -78°С в течение 0,5 часа. После завершения реакцию гасили водным насыщенным раствором хлорида аммония. Реакционную смесь разводили дихлорметаном, промывали водой. Органический слой сушили над безводным сульфатом натрия и концентрировали в вакууме с получением неочищенного продукта этил 4-[3-[бис[(4-метоксифенил)метил]-амино]-2-фтор-6-(трифторметил)фенил]-5-метил-2-оксо-циклогексанкарбоксилата (3,9 г, неочищенный) в виде желтого твердого вещества.
Этап 5: 7-[3-[бис[(4-метоксифенил)метил]амино]-2-фтор-6-(трифторметил)фенил]-6-метил-2-метилсульфанил-5,6,7,8-тетрагидрохиназолин-4-ол
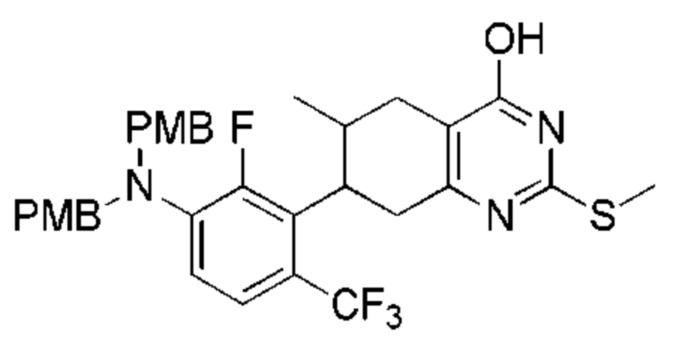
Раствор этил 4-[3-[бис[(4-метоксифенил)метил]амино]-2-фтор-6-(трифторметил)фенил]-5-метил-2-оксо-циклогексанкарбоксилата (3,9 г, неочищенный), 2-метилизотиомочевины (7,67 г, 85,2 ммоль) и тетраметилгуанидина (13,35 мл, 106,38 ммоль) в 1,4-диоксане перемешивали при 50°С в течение 12 часов. После завершения реакционную смесь концентрировали в вакууме и разводили дихлорметаном, промывали водой. Органический слой сушили над безводным сульфатом натрия и концентрировали в вакууме. Остаток очищали с помощью флэш-хроматографии на силикагеле с элюированием дихлорметаном/этилацетатом (1/1) с получением 7-[3-[бис[(4-метоксифенил)метил]амино]-2-фтор-6-(трифторметил)фенил]-6-метил-2-метилсульфанил-5,6,7,8-тетрагидрохиназолин-4-ола (0,90 г, 1,43 ммоль, выход 33,7%) в виде белого твердого вещества. ЖХМС (ИЭР, m/z): 628,2 [М+Н]+.
Этап 6: трет-бутил(3S)-4-[7-[3-[бис[(4-метоксифенил)метил]-амино]-2-фтор-6-(трифторметил)фенил]-6-метил-2-метилсульфанил-5,6,7,8-тетрагидрохиназолин-4-ил]-3-метил-пиперазин-1-карбоксилат
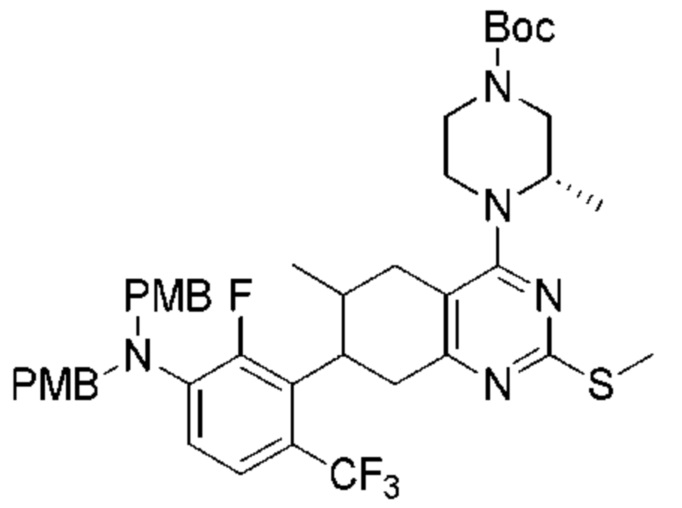
Раствор 7-[3-[бис[(4-метоксифенил)метил]амино]-2-фтор-6-(трифторметил)-фенил]-6-метил-2-метилсульфанил-5,6,7,8-тетрагидрохиназолин-4-ола (0,90 г, 1,43 ммоль), трифторметансульфонового ангидрида (0,43 мл, 2,58 ммоль) и N,N-диизопропилэтиламина (1,25 мл, 7,17 ммоль) в ДХМ (5 мл) перемешивали при к. т.в течение 1 часа. После завершения растворитель концентрировали в вакууме. Реакционную смесь разводили 1,4-диоксаном и доводили до рН>7 ДИЭА. Потом добавляли трет-бутил (3S)-3-метил-1-пиперазинкарбоксилат (0,86 г, 4,3 ммоль) и перемешивали при 80°С в течение 12 часов. После завершения растворитель концентрировали в вакууме. Остаток очищали с помощью флэш-хроматографии на силикагеле с элюированием петролейным эфиром/этилацетатом (3/1) с получением трет-бутил(3S)-4-[7-[3-[бис[(4-метоксифенил)метил]-амино]-2-фтор-6-(трифторметил)фенил]-6-метил-2-метилсульфанил-5,6,7,8-тетрагидрохиназолин-4-ил]-3-метил-пиперазин-1-карбоксилата (0,86 г, 1,06 ммоль, выход 74,1%) в виде желтого твердого вещества. ЖХМС (ИЭР, m/z): 810,4 [М+Н]+.
Этап 7: трет-бутил (3S)-4-[7-[3-[бис[(4-метоксифенил)метил]амино]-2-фтор-6-(трифторметил)фенил]-6-метил-2-метилсульфонил-5,6,7,8-тетрагидрохиназолин-4-ил]-3-метил-пиперазин-1-карбоксилат
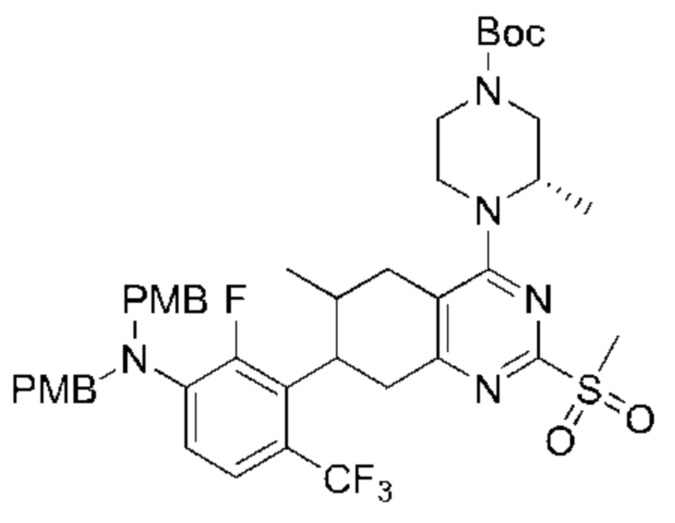
Раствор трет-бутил(3S)-4-[7-[3-[бис[(4-метоксифенил)метил]амино]-2-фтор-6-(трифтор-метил)фенил]-6-метил-2-метилсульфанил-5,6,7,8-тетрагидрохиназолин-4-ил]-3-метил-пиперазин-1-карбоксилата (0,80 г, 0,99 ммоль) и оксона (0,5 г, 2,96 ммоль) в ТГФ (5 мл) перемешивали при 25°С в течение 1 часа. После завершения реакцию гасили водным насыщенным раствором Na2SO3. Реакционную смесь разводили дихлорметаном, промывали водой. Органический слой сушили над безводным сульфатом натрия и концентрировали в вакууме с получением неочищенного трет-бутил (3S)-4-[7-[3-[бис[(4-метоксифенил)метил]амино]-2-фтор-6-(трифторметил)фенил]-6-метил-2-метилсульфонил-5,6,7,8-тетрагидрохиназолин-4-ил]-3-метил-пиперазин-1-карбоксилата (0,90 г, неочищенный), который непосредственно используют на следующем этапе без очистки.
Этап 8: трет-бутил (3S)-4-[7-[3-[бис[(4-метоксифенил)метил]амино]-2-фтор-6-(трифторметил)-фенил]-6-метил-2-[[(2S)-1-метилпирролидин-2-ил]метокси]-5,6,7,8-тетрагидрохиназолин-4-ил]-3-метил-пиперазин-1-карбоксилат
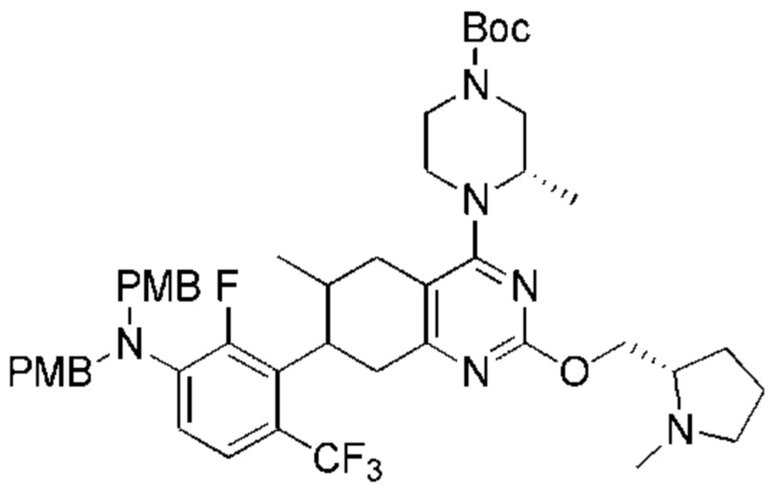
Раствор N-метил-L-пролинола (540,5 мг, 4,70 ммоль) и гидрида натрия (0,19 г, 4,7 ммоль, 60% дисперсия в минеральном масле) в 1,4-диоксане (4,5 мл) перемешивали при 25°С в течение 10 минут. Потом добавляли неочищенный продукт трет-бутил (3S)-4-[7-[3-[бис[(4-метоксифенил)метил]амино]-2-фтор-6-(трифторметил)фенил]-6-метил-2-метилсульфонил-5,6,7,8-тетрагидрохиназолин-4-ил]-3-метил-пиперазин-1-карбоксилат (0,90 г, неочищенный) и перемешивали при 25°С в течение 6 часов. После завершения полученный в результате раствор гасили и экстрагировали дихлорметаном. Органические слои объединяли, промывали водой, сушили над безводным сульфатом натрия и концентрировали в вакууме. Остаток очищали с помощью флэш-хроматографии на силикагеле с элюированием дихлорметаном/метанолом (20/1) с получением трет-бутил (3S)-4-[7-[3-[бис[(4-метоксифенил)метил]амино]-2-фтор-6-(трифторметил)-фенил]-6-метил-2-[[(2S)-1-метилпирролидин-2-ил]метокси]-5,6,7,8-тетрагидрохиназолин-4-ил]-3-метил-пиперазин-1-карбоксилата (0,46 г, 0,52 ммоль, выход 55,8%) в виде желтого твердого вещества. ЖХМС (ИЭР, m/z): 877,5 [М+Н]+.
Этап 9: 1-((S)-4-((6S,7S)-7-(3-амино-2-фтор-6-(трифторметил)фенил)-6-метил-2-(((S)-1-метилпирролидин-2-ил)метокси)-5,6,7,8-тетрагидрохиназолин-4-ил)-3-метилпиперазин-1-ил)проп-2-ен-1-он (Пример 23 а); 1-((S)-4-((6R,7R)-7-(3-амино-2-фтор-6-(трифторметил)фенил)-6-метил-2-(((S)-1-метилпирролидин-2-ил)метокси)-5,6,7,8-тетрагидрохиназолин-4-ил)-3-метилпиперазин-1-ил)проп-2-ен-1-он (Пример 23b)
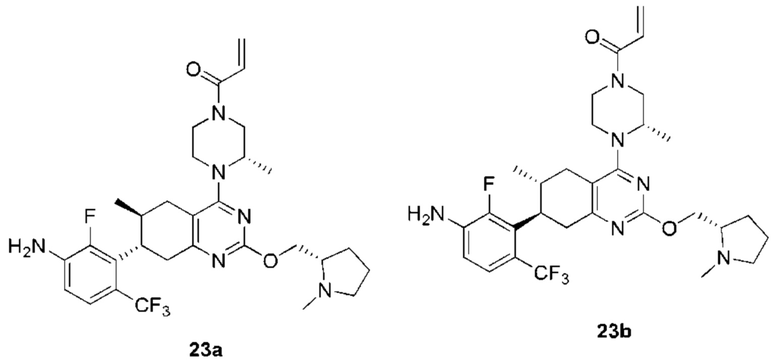
Раствор трет-бутил (3S)-4-[7-[3-[бис[(4-метоксифенил)метил]амино]-2-фтор-6-(трифторметил)фенил]-6-метил-2-[[(2S)-1-метилпирролидин-2-ил]метокси]-5,6,7,8-тетрагидрохиназолин-4-ил]-3-метил-пиперазин-1-карбоксилата (1,40 г, 1,60 ммоль) в дихлорметане (5 мл) и трифторуксусной кислоте (1,37 мл) перемешивали при 40°С в течение 0,5 часа. После завершения растворитель концентрировали в вакууме с получением 2-фтор-3-[6-метил-4-[(2S)-2-метилпиперазин-1-ил]-2-[[(2S)-1-метилпирролидин-2-ил]метокси]-5,6,7,8-тетрагидрохиназолин-7-ил]-4-(трифторметил)анилина (1,5 г, неочищенный) в виде желтого твердого вещества. Раствор неочищенного 2-фтор-3-[6-метил-4-[(2S)-2-метилпиперазин-1-ил]-2-[[(2S)-1-метилпирролидин-2-ил]метокси]-5,6,7,8-тетрагидрохиназолин-7-ил]-4-(трифторметил)анилина (1,50 г, неочищенный) в дихлорметане (20 мл) доводили до рН>7 ДИЭА. Потом по каплям добавляли акрилилхлорид (0,21 г, 2,35 ммоль) и перемешивали при 25°С в течение 20 минут. После завершения растворитель концентрировали в вакууме. Потом неочищенный продукт очищали с помощью препаративной ВЭЖХ со следующими условиями: колонка: колонка XBridge Prep OBD С18, 30×150 мм, 5 мкм; подвижная фаза А: вода (10 ммоль/л NH4HCO3), подвижная фаза В: АЦН; скорость потока: 60 мл/мин; градиент: от 30 В до 48 В за 7 мин; 254 нм; RT1: 9,40; RT2:; вводимый объем: мл; число прогонов:; Смесь энантиомеров разделяли с помощью хиральной препаративной ВЭЖХ со следующими условиями: колонка: CHIRALPAK IE, 2*25 см, 5 мкм; подвижная фаза А: гексан (8 ммоль/л NH3.MeOH)- ВЭЖХ, подвижная фаза В: EtOH-ВЭЖХ; скорость потока: 17 мл/мин; градиент: от 50 В до 50 В за 16,5 мин; 220/254 нм; RT1: 10,132; RT2: 12,679; вводимый объем: 0,6 мл; число прогонов: 11, с получением указанных в заголовке соединений. Абсолютная конфигурация указанных в заголовке соединений была определена по данным активности и рентгенограммы белковой структуры соединения 21b.
Пример 23а: 1-((S)-4-((6S,7S)-7-(3-амино-2-фтор-6-(трифторметил)фенил)-6-метил-2-(((S)-1-метилпирролидин-2-ил)метокси)-5,6,7,8-тетрагидрохиназолин-4-ил)-3-метилпиперазин-1-ил)проп-2-ен-1-он (40,3 мг, 0,068 ммоль, выход 2,6%, белое твердое вещество). 1Н ЯМР (300 МГц, ДМСО-d6, м. д.) δ 7,22 (д, J = 8,6 Гц, 1H), 6,90-6,72 (м, 2Н), 6,14 (д, J = 16,7 Гц, 1H), 5,87 (с, 2Н), 5,72 (дд, J = 10,4, 2,4 Гц, 1H), 4,38-3,98 (м, 5Н), 3,94-3,55 (м, 1H), 3,52-3,41 (м, 2Н), 3,29-3,18 (м, 1H), 3,10-2,80 (м, 5Н), 2,67-2,58 (м, 1H), 2,45-2,07 (м, 6Н), 1,98-1,82 (м, 1H), 1,72-1,49 (м, 3H), 0,97 (д, J = 7,9 Гц, 3H), 0,82 (д, J = 6,3 Гц, 3H). ЖХМС (ПЭР, m/z): 591,2 [М+Н]+. Хиральная ВЭЖХ: CHIRALPAK IE-3 (4,6*50 мм, 3 мкм); обнаружение на 254 нм; гексан (0,1% ДЭА): EtOH = 50:50; скорость потока = 1,0 мл/мин; время удержания: 2,031 мин (более медленный пик).
Пример 23b: 1-((S)-4-((6R,7R)-7-(3-амино-2-фтор-6-(трифторметил)фенил)-6-метил-2-(((S)-1-метилпирролидин-2-ил)метокси)-5,6,7,8-тетрагидрохиназолин-4-ил)-3-метилпиперазин-1-ил)проп-2-ен-1-он (56,6 мг, 0,096 ммоль, выход 3,7%, белое твердое вещество). 1Н ЯМР (300 МГц, ДМСО-d6) δ 7,23 (д, J = 8,6 Гц, 1H), 6,93-6,70 (м, 2Н), 6,14 (д, J = 16,5 Гц, 1H), 5,88 (с, 2Н), 5,73 (дд, J = 10,4, 2,5 Гц, 1H), 4,44-3,79 (м, 6Н), 3,55-3,40 (м, 1H), 3,31-3,23 (м, 1H), 3,22-2,78 (м, 6Н), 2,60-2,56 (м, 1H), 2,45-2,05(м, 6Н), 2,00-1,82 (м, 1H), 1,72-1,48 (м, 3H), 1,25 (шир. с, 3H), 0,82 (д, J = 6,4 Гц, 3H). ЖХМС (ПЭР, m/z): 591,2 [М+Н]+. Хиральная ВЭЖХ: CHIRALPAK ID-3 (4,6*50 мм, 3 мкм); обнаружение на 254 нм; гексан (0,1% ДЭА): EtOH = 50:50; скорость потока = 1,0 мл/мин; время удержания: 1,564 мин (более быстрый пик).
Примеры 24а и 24b

1-((S)-4-((6S,7S)-7-(6-амино-3-циклопропил-4-метилпиридин-2-ил)-2-(((2S,4R)-4-фтор-1-метилпирролидин-2-ил)метокси)-6-метил-5,6,7,8-тетрагидрохиназолин-4-ил)-3-метилпиперазин-1-ил)проп-2-ен-1-он (Пример 24а)
1-((S)-4-((6R,7R)-7-(6-амино-3-циклопропил-4-метилпиридин-2-ил)-2-(((2S,4R)-4-фтор-1-метилпирролидин-2-ил)метокси)-6-метил-5,6,7,8-тетрагидрохиназолин-4-ил)-3-метилпиперазин-1-ил)проп-2-ен-1-он (Пример 24b)
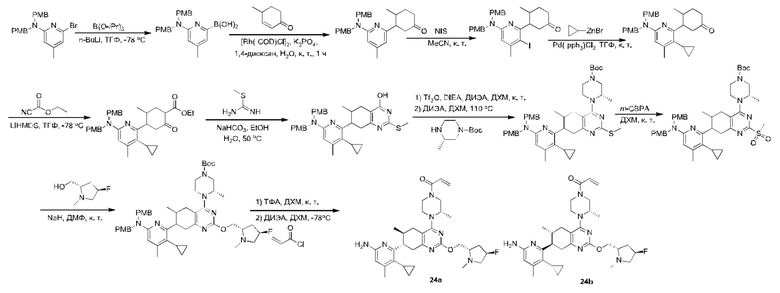
Этап 1: (6-(бис(4-метоксибензил)амино)-4-метилпиридин-2-ил)бороновая кислота
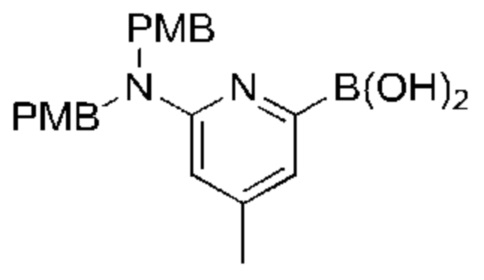
В атмосфере азота раствор триизопропилборат (44,01 г, 234,01 ммоль) в тетрагидрофуране (200 мл) перемешивали при -78°С в течение 5 минут. Потом по каплям добавляли 6-бром-N,N-бис[(4-метоксифенил)-метил]-4-метил-пиридин-2-амин (20,00 г, 46,8 ммоль) и перемешивали при -78°С в течение 30 минут. Потом добавляли н-бутиллитий (2,5 М в гексане) (28 мл, 70,2 ммоль) и перемешивали при -78°С в течение 20 минут. После завершения растворитель концентрировали в вакууме с получением неочищенного (6-(бис(4-метоксибензил)амино)-4-метилпиридин-2-ил)бороновой кислоты (60,0 г, неочищенная) в виде желтого масла. ЖХМС (ИЭР, m/z): 393,2 [М+Н]+.
Этап 2: 3-(6-(бис(4-метоксибензил)амино)-4-метилпирид ин-2-ил)-4-метилциклогексан-1-он

В атмосфере азота в неочищенную (6-(бис(4-метоксибензил)амино)-4-метилпиридин-2-ил)бороновую кислоту (60,0 г, неочищенный), 4-метилциклогекс-2-ен-1-он (5,16 г, 46,8 ммоль) и димер хлор(1,5-циклооктадиен)родия (I) (2,31 г, 4,68 ммоль) в 1,4-диоксане (200 мл) добавляли насыщенный раствор фосфата калия (40 мл) и перемешивали при 25°С в течение 1 часа. После завершения реакцию разводили водой, экстрагировали этилацетатом, сушили над безводным сульфатом натрия и концентрировали в вакууме. Остаток очищали с помощью флэш-хроматографии на силикагеле с элюированием петролейным эфиром/этилацетатом (10/1) с получением 3-(6-(бис(4-метоксибензил)амино)-4-метилпиридин-2-ил)-4-метилциклогексан-1-она (11,00 г, 23,9 ммоль, выход 51,3%) в виде желтого твердого вещества. ЖХМС (ИЭР, m/z): 459,3 [М+Н]+.
Этап 3: 3-(6-(бис(4-метоксибензил)амино)-3-йодо-4-метилпиридин-2-ил)-4-метилциклогексан-1-он

Раствор 3-(6-(бис(4-метоксибензил)амино)-4-метилпиридин-2-ил)-4-метилциклогексан-1-она (25,0 г, 54,50 ммоль) и N-йодосукцинимида (14,19 г, 63,0 ммоль) в ацетонитриле (250 мл) перемешивали при комнатной температуре в течение 2 минут. Потом добавляли трифторуксусную кислоту (0,60 г, 5,20 ммоль) и перемешивали при 25°С в течение 20 минут. После завершения растворитель концентрировали в вакууме. Раствор разводили водой. Полученный в результате раствор экстрагировали этилацетатом и объединяли органические слои. Органический слой сушили над безводным сульфатом натрия и концентрировали в вакууме. Остаток очищали с помощью флэш-хроматографии на силикагеле с элюированием петролейным эфиром/этилацетатом (3/1) с получением 3-(6-(бис(4-метоксибензил)амино)-3-йодо-4-метилпиридин-2-ил)-4-метилциклогексан-1-она (30,00 г, 51,3 ммоль, выход 94,1%) в виде желтого масла. ЖХМС (ИЭР, m/z): 585,2 [М+Н]+.
Этап 4: 3-[6-[бис[(4-метоксифенил)метил]амино]-3-циклопропил-4-метил-2-пиридил]-4-метил-циклогексанон
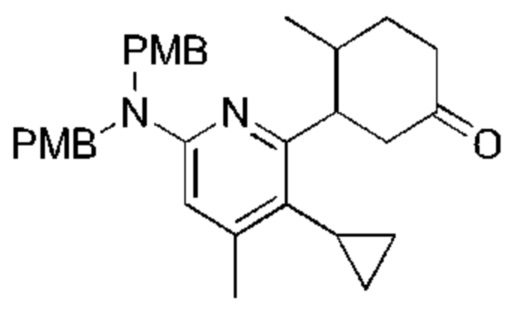
В атмосфере азота раствор бис(трифенилфосфин)палладия (II) хлорида (2,64 г, 3,70 ммоль) и бром(циклопропил)цинка (0,5 М в ТГФ) (60 мл, 28,2 ммоль) в тетрагидрофуране (110 мл) перемешивали при 25°С в течение 3 минут. Реакционную смесь разводили водой, экстрагировали дихлорметаном. Органические слои объединяли, сушили над безводным сульфатом натрия и концентрировали в вакууме. Остаток очищали с помощью флэш-хроматографии на силикагеле с элюированием петролейным эфиром/этилацетатом (10/1) с получением 3-[6-[бис[(4-метоксифенил)метил]амино]-3-циклопропил-4-метил-2-пиридил]-4-метил-циклогексанона (8,00 г, 16,0 ммоль, выход 85,2%) в виде желтого твердого вещества. ЖХМС (ИЭР, m/z): 499,3 [М+Н]+
Этап 5: этил 4-(6-(бис(4-метоксибензил)амино)-3-циклопропил-4-метилпиридин-2-ил)-5-метил-2-оксоциклогексан-1-карбоксилат

В атмосфере азота в раствор 3-[6-[бис[(4-метоксифенил)метил]амино]-3-циклопропил-4-метил-2-пиридил]-4-метил-циклогексанона (8,40 г, 16,85 ммоль) в тетрагидрофуране (20 мл) по каплям добавляли бис(триметилсилил)амид лития (25,27 мл, 25,27 ммоль, 1,0 М в ТГФ) при -78°С и перемешивали в течение 20 минут при -78°С. Потом добавляли этилцианоформиат (2,00 г, 20,21 ммоль) и перемешивали при -78°С в течение 30 минут. После завершения реакцию гасили водой. Реакционную смесь разводили дихлорметаном. Органический слой промывали солевым раствором, сушили над безводным сульфатом натрия и концентрировали в вакууме с получением неочищенного этил 4-(6-(бис(4-метоксибензил)амино)-3-циклопропил-4-метилпиридин-2-ил)-5-метил-2-оксоциклогексан-1-карбоксилата (12,00 г, неочищенный) в виде желтого масла. ЖХМС (ИЭР, m/z): 571,3 [М+Н]+.
Этап 6: 7-[6-[бис[(4-метоксифенил)метил]амино]-3-циклопропил-4-метил-2-пиридил]-6-метил-2-метилсульфанил-5,6,7,8-тетрагидрохиназолин-4-ол

Потом раствор неочищенного этил 4-(6-(бис(4-метоксибензил)амино)-3-циклопропил-4-метилпиридин-2-ил)-5-метил-2-оксоциклогексан-1-карбоксилата (12,00 г, неочищенный), бикарбоната натрия (35,37 г, 421,13 ммоль) и 2-метилизотиомочевины (15,19 г, 168,45 ммоль) в этаноле (25 мл) и воде (5 мл) перемешивали при 50°С в течение 12 часов. После завершения реакционную смесь концентрировали в вакууме, разводили дихлорметаном. Органический слой промывали солевым раствором. Органический слой сушили над безводным сульфатом натрия и концентрировали в вакууме. Остаток очищали с помощью флэш-хроматографии на силикагеле с элюированием дихлорметаном/этилацетатом (6/1) с получением 7-[6-[бис[(4-метоксифенил)метил]амино]-3-циклопропил-4-метил-2-пиридил]-6-метил-2-метилсульфанил-5,6,7,8-тетрагидрохиназолин-4-ола (1,90 г, 2,93 ммоль, выход 17,4%) в виде белого твердого вещества. ЖХМС (ИЭР, m/z): 597,3 [М+Н]+.
Этап 7: трет-бутил(3S)-4-[7-[6-[бис[(4-метоксифенил)метил]-амино]-3-циклопропил-4-метил-2-пиридил]-6-метил-2-метилсульфанил-5,6,7,8-тетрагидрохиназолин-4-ил]-3-метил-пиперазин-1-карбоксилат

Раствор 7-[6-[бис[(4-метоксифенил)метил]амино]-3-циклопропил-4-метил-2-пиридил]-6-метил-2-метилсульфанил-5,6,7,8-тетрагидрохиназолин-4-ола (1,9 г, 3,18 ммоль), трифтор-метансульфонового ангидрида (0,96 мл, 5,73 ммоль) и N,N-диизопропилэтиламина (2,77 мл, 15,92 ммоль) в ДХМ (10 мл) перемешивали при к. т.в течение 1 часа. После завершения растворитель концентрировали в вакууме. Реакционную смесь разводили дихлорметаном (10 мл) и доводили до рН>7 N,N-диизопропилэтиламином. Потом добавляли трет-бутил (3S)-3-метил-1-пиперазинкарбоксилат (1,91 г, 9,55 ммоль) и перемешивали при 110°С в течение 12 часов. После завершения растворитель концентрировали в вакууме. Остаток очищали с помощью флэш-хроматографии на силикагеле с элюированием петролейным эфиром/этилацетатом (3/1) с получением трет-бутил(3S)-4-[7-[6-[бис[(4-метоксифенил)метил]-амино]-3-циклопропил-4-метил-2-пиридил]-6-метил-2-метилсульфанил-5,6,7,8-тетрагидрохиназолин-4-ил]-3-метил-пиперазин-1-карбоксилата (1,90 г, 2,44 ммоль, выход 76,6%) в виде желтого твердого вещества. ЖХМС (ИЭР, m/z): 779,4 [М+Н]+.
Этап 8: трет-бутил(3S)-4-[7-[6-[бис[(4-метоксифенил)метил]амино]-3-циклопропил-4-метил-2-пиридил]-6-метил-2-метилсульфанил-5,6,7,8-тетрагидрохиназолин-4-ил]-3-метил-пиперазин-1-карбоксилат

Раствор трет-бутил(3S)-4-[7-[6-[бис[(4-метоксифенил)метил]амино]-3-циклопропил-4-метил-2-пиридил]-6-метил-2-метилсульфанил-5,6,7,8-тетрагидрохиназолин-4-ил]-3-метил-пиперазин-1-карбоксилата (1,90 г, 2,44 ммоль) и m-СВРА (1,24 г, 7,32 ммоль) в ДХМ (10 мл) и воде (5 мл) перемешивали при 25°С в течение 1 часа. После завершения реакцию гасили водным насыщенным раствором Na2SO3. Реакционную смесь разводили дихлорметаном и промывали водой. Органический слой сушили над безводным сульфатом натрия и концентрировали в вакууме с получением неочищенного трет-бутил(3S)-4-[7-[6-[бис[(4-метоксифенил)метил]амино]-3-циклопропил-4-метил-2-пиридил]-6-метил-2-метилсульфонил-5,6,7,8-тетрагидрохиназолин-4-ил]-3-метил-пиперазин-1-карбоксилата (2,00 г, неочищенный), который непосредственно используют на следующем этапе без очистки.
Этап 9: трет-бутил (3S)-4-[7-[6-[бис[(4-метоксифенил)метил]амино]-3-циклопропил-4-метил-2-пиридил]-2-[[(2S,4R-4-фтор-1-метил-пирролидин-2-ил]метокси]-6-метил-5,6,7,8-тетрагидрохиназолин-4-ил]-3-метил-пиперазин-1-карбоксилат
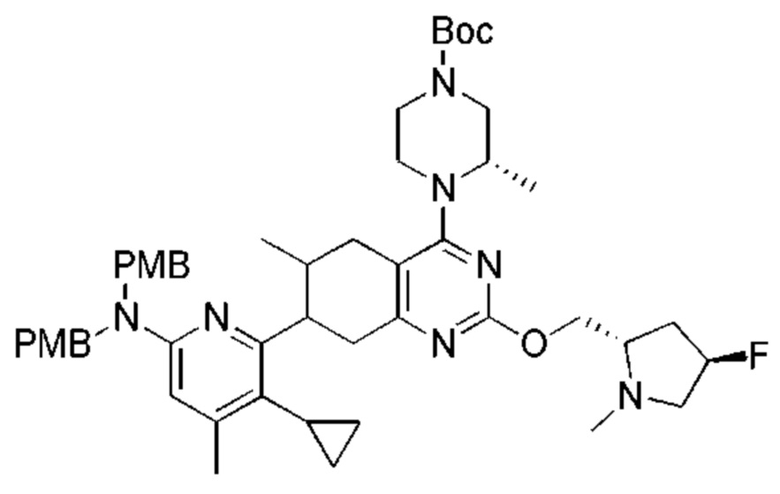
Раствор [(2S,4R)-4-фтор-1-метил-пирролидин-2-ил]метанола (1,49 г, 11,1 ммоль) и гидрида натрия (0,44 г, 11,1 ммоль, 60% дисперсия в минеральном масле) в ДМФ (10 мл) перемешивали при 25°С в течение 10 минут. Потом добавляли неочищенный продукт с последнего этапа трет-бутил (3S)-4-[7-[6-[бис[(4-метоксифенил)метил]амино]-3-циклопропил-4-метил-2-пиридил]-6-метил-2-метилсульфонил-5,6,7,8-тетрагидрохиназолин-4-ил]-3-метил-пиперазин-1-карбоксилат (2,00 г, неочищенный) и перемешивали при 25°С в течение 6 часов. После завершения реакцию гасили водным насыщенным раствором хлорида аммония. Реакционную смесь разводили дихлорметаном, промывали водой. Органический слой сушили над безводным сульфатом натрия и концентрировали в вакууме. Остаток очищали с помощью флэш-хроматографии на силикагеле с элюированием дихлорметаном/метанолом (5/1) с получением трет-бутил (3S)-4-[7-[6-[бис[(4-метоксифенил)метил]амино]-3-циклопропил-4-метил-2-пиридил]-2-[[(2S,4R)-4-фтор-1-метил-пирролидин-2-ил]метокси]-6-метил-5,6,7,8-тетрагидрохиназолин-4-ил]-3-метил-пиперазин-1-карбоксилата (1,10 г, 1,27 ммоль, выход 57,4%) в виде желтого твердого вещества. ЖХМС (ИЭР, m/z): 864,5 [М+Н]+.
Этап 10: 1-((S)-4-((6S,7S)-7-(6-амино-3-циклопропил-4-метилпиридин-2-ил)-2-(((2S,4R)-4-фтор-1-метилпирролидин-2-ил)метокси)-6-метил-5,6,7,8-тетрагидрохиназолин-4-ил)-3-метилпиперазин-1-ил)проп-2-ен-1-он (Пример 24а)
1-((S)-4-((6R,7R)-7-(6-амино-3-циклопропил-4-метилпиридин-2-ил)-2-(((2S,4R)-4-фтор-1-метилпирролидин-2-ил)метокси)-6-метил-5,6,7,8-тетрагидрохиназолин-4-ил)-3-метилпиперазин-1-ил)проп-2-ен-1-он (Пример 24b)
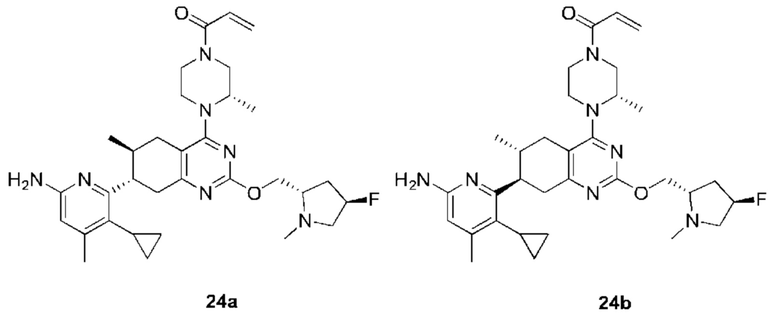
Раствор трет-бутил (3S)-4-[7-[6-[бис[(4-метоксифенил)метил]амино]-3-циклопропил-4-метил-2-пиридил]-2-[[(2S,4R)-4-фтор-1-метил-пирролидин-2-ил]метокси]-6-метил-5,6,7,8-тетрагидрохиназолин-4-ил]-3-метил-пиперазин-1-карбоксилата (1,10 г, 1,27 ммоль) в трифторуксусной кислоте (10 мл) перемешивали при 25°С в течение 0,5 часа. После завершения растворитель концентрировали в вакууме. Раствор неочищенного 5-циклопропил-6-((6R,7R)-2-(((2S,4R)-4-фтор-1-метилпирролидин-2-ил)метокси)-6-метил-4-((S)-2-метилпиперазин-1-ил)-5,6,7,8-тетрагидрохиназолин-7-ил)-4-метилпиридин-2-аминеина в дихлорметане (10 мл) доводили до рН>9 ДИЭА. Потом добавляли акрилилхлорид (0,08 г, 0,86 ммоль) и перемешивали при 25°С в течение 20 минут. После завершения реакцию гасили водой. После завершения реакционную смесь разводили дихлорметаном и промывали водой. Органический слой сушили над безводным сульфатом натрия и концентрировали в вакууме. Остаток очищали с помощью флэш-хроматографии на обращенно-фазовой колонке с элюированием ацетонитрилом/водой (45/55) с получением продукта. Продукт дополнительно очищали с помощью препаративной ВЭЖХ со следующими условиями: колонка: колонка XBridge Shield RP18 OBD, 30*150 мм, 5 мкм; подвижная фаза А: вода (10 ммоль/л NH4HCO3), подвижная фаза В: АЦН; скорость потока: 60 мл/мин; градиент: от 34 В до 64 В за 7 мин; 254 нм; Смесь диастереоизомеров разделяли с помощью препаративной хиральной ВЭЖХ со следующими условиями: колонка: CHIRALPAK IE, 3*25 см, 5 мкм; подвижная фаза А: гексан: ДХМ = 3:1 (10 мМ NH3-MEOH) --ВЭЖХ, подвижная фаза В: EtOH --ВЭЖХ; скорость потока: 30 мл/мин; градиент: от 50 В до 50 В за 30 мин; 220/254 нм; RT1: 16,281; RT2: 25,907; вводимый объем: 3 мл, с получением указанных в заголовке соединений. Абсолютная конфигурация указанных в заголовке соединений была определена по данным активности и рентгенограммы белковой структуры соединения 21b.
Пример 24а: 1-((S)-4-((6S,7S)-7-(6-амино-3-циклопропил-4-метилпиридин-2-ил)-2-(((2S,4R)-4-фтор-1-метилпирролидин-2-ил)метокси)-6-метил-5,6,7,8-тетрагидрохиназолин-4-ил)-3-метилпиперазин-1-ил)проп-2-ен-1-он (16,4 мг, 0,028 ммоль, выход 3%) в виде белого твердого вещества. 1Н ЯМР (300 МГц, ДМСО-d6, м. д.) δ 6,91-6,76 (м, 1H), 6,21-5,95 (м, 2Н), 5,70 (дд, J = 10,3, 2,4 Гц, 1H), 5,48 (с, 2Н), 5,15 (д, J = 56,4 Гц, 1H), 4,46-3,83 (м, 5Н), 3,65-3,34 (м, 4Н), 3,29-3,19 (м, 1H), 3,15-2,65 (м, 4Н), 2,59 (с, 1H), 2,44-2,37 (м, 5Н), 2,25 (с, 3H), 2,17-2,02 (м, 1H), 1,97-1,75 (м, 2Н), 1,60-1,49 (м, 1H), 1,08-0,89 (м, 5Н), 0,69 (д, J = 6,4 Гц, 3H), 0,50-0,30 (м, 2Н). ЖХМС (ИЭР, m/z): 578,4 [М+Н]+. Хиральная ВЭЖХ: CHIRALPAK IE-3 (4,6*50 мм, 3 мкм); обнаружение на 254 нм; (гексан/ДХМ = 3:1) (0,1% ДЭА): EtOH; скорость потока = 1,5 мл/мин; время удержания: 2,342 мин (более медленный пик).
Пример 24b: 1-((S)-4-((6R,7R)-7-(6-амино-3-циклопропил-4-метилпиридин-2-ил)-2-(((2S,4R)-4-фтор-l-метилпирролидин-2-ил)метокси)-6-метил-5,6,7,8-тетрагидрохиназолин-4-ил)-3-метилпиперазин-1-ил)проп-2-ен-1-он (22,7 мг, 0,039 ммоль, выход 4,1%). 1Н ЯМР (300 МГц, ДМСО-d6, м. д.) δ 6,91-6,75 (м, 1H), 6,30-5,95 (м, 2Н), 5,72 (дд, J = 10,3, 2,4 Гц, 1H), 5,49 (с, 2Н), 5,15 (д, J = 56,4 Гц, 1H), 4,47-3,78 (м, 6Н), 3,62-3,36 (м, 3H), 3,21-2,65 (м, 5Н), 2,49-2,41 (м, 3H), 2,37 (с, 3H), 2,25 (с, 3H), 2,17-2,02 (м, 1H), 1,99-1,74 (м, 2Н), 1,60-1,48 (м, 1H), 1,26 (д, J = 6,6 Гц, 3H), 0,95 (д, J = 8,4 Гц, 2Н), 0,69 (д, J = 6,4 Гц, 3H), 0,44-0,29 (м, 2Н). ЖХМС (ИЭР, m/z): 578,4 [М+Н]+. Хиральная ВЭЖХ: CHIRALPAK IE-3 (4,6*50 мм, 3 мкм); обнаружение на 254 нм; (гексан/ДХМ = 3:1) (0,1% ДЭА): EtOH; скорость потока = 1,5 мл/мин; время удержания: 1,470 мин (более быстрый пик).
Пример 25а

(S)-1-(4-(2'-((1-метилпирролидин-2-ил)метокси)-5',8'-дигидро-6'Н-спиро[циклогексан-1,7'-хиназолин]-4'-ил)пиперазин-1-ил)проп-2-ен-1-он
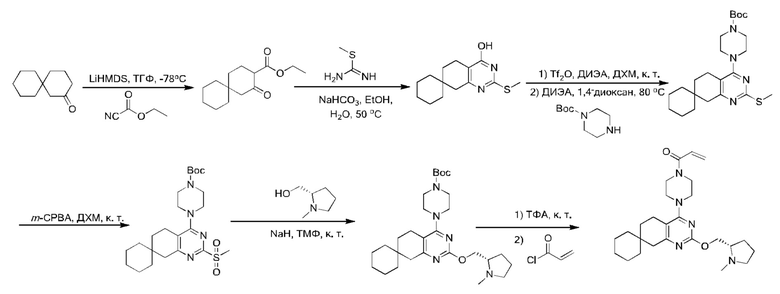
Этап 1: этил 2-оксоспиро[5.5]ундекан-3-карбоксилат
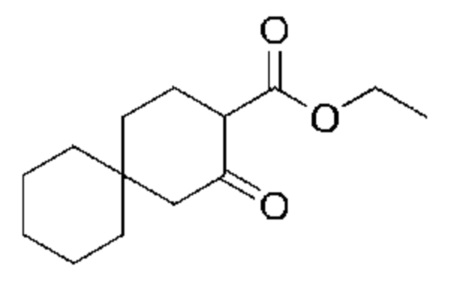
В атмосфере азота в раствор спиро[5.5]ундекан-4-она (3,0 г, 18,04 ммоль) в тетрагидрофуране (30 мл) добавляли бис(триметилсилил)амид лития (27,0 мл, 1 моль/л в гексане) и перемешивали 0,5 часа при -78°С. Потом добавляли этилцианоформиат (3,6 г, 36,09 ммоль) и перемешивали при -78°С в течение 2 часов. После завершения раствор гасили водой и экстрагировали этилацетатом. Потом органические слои объединяли, сушили над безводным сульфатом натрия и концентрировали в вакууме. Остаток очищали с помощью флэш-хроматографии на силикагелевой колонке с элюированием этилацетат/петролейным эфиром (1/4) с получением этил 4-оксоспиро[5.5]ундекан-3-карбоксилата (2,0 г, 8,39 ммоль, выход 46,5%) в виде желтого масла. ЖХМС (ИЭР, m/z): 239,3 [М+Н]+.
Этап 2: 2'-(метилтио)-5',8'-дигидро-3'Н-спиро[циклогексан-1,7'-хиназолин]-4'(6'Н)-он
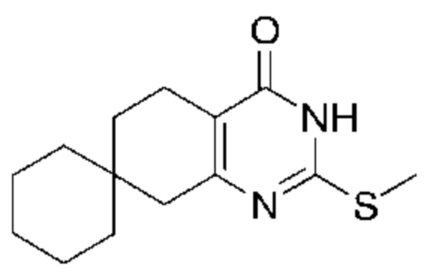
Раствор этил 4-оксоспиро[5.5]ундекан-3-карбоксилата (2,20 г, 9,23 ммоль) и 2-метилизотиомочевины (8,32 г, 92,31 ммоль) в этаноле (20 мл) перемешивали при 50°С в течение 0,5 часа. Потом добавляли бикарбонат натрия (15,51 г, 184,63 ммоль) и перемешивали при 50°С в течение 10 часов. После завершения раствор разводили водой и экстрагировали этилацетатом. Потом органические слои объединяли, сушили над безводным сульфатом натрия и концентрировали в вакууме. Остаток очищали с помощью флэш-хроматографии на силикагелевой колонке с элюированием метанолом/дихлорметаном (1/10) с получением 2'-(метилтио)-5',8'-дигидро-3'Н-спиро[циклогексан-1,7'-хиназолин]-4'(6'Н)-она (600 мг, 2,27 ммоль, выход 24,6%) в виде желтого твердого вещества. ЖХМС (ИЭР, m/z): 265,4 [М+Н]+.
Этап 3: трет-бутил 4-(2'-(метилтио)-5',8'-дигидро-6'Н-спиро [циклогексан-1,7'-хиназолин]-4'-ил) пиперазин-1-карбоксилат

Раствор 2'-(метилтио)-5',8'-дигидро-3'Н-спиро[циклогексан-1,7'-хиназолин]-4'(6'Н)-он (600,0 мг, 2,27 ммоль) и N,N-диизопропилэтиламина (585,5 мг, 4,54 ммоль) в дихлорметане (6 мл) перемешивали при 25°С в течение 0,5 часа. Потом добавляли трифторметансульфоновый ангидрид (960,4 мг, 3,4 ммоль) и перемешивали при 25°С в течение 2 часов. Полученный в результате раствор концентрировали в вакууме и разводили 1,4-диоксаном (6 мл). Потом добавляли раствор трет-бутил 1-пиперазинкарбоксилата (845,34 мг, 4,54 ммоль) и N,N-диизопропилэтиламина (585,5 мг, 4,54 ммоль) и перемешивали при 80°С в течение 3 часов. После завершения раствор разводили водой и экстрагировали этилацетатом. Потом органические слои объединяли, сушили над безводным сульфатом натрия и концентрировали в вакууме. Остаток очищали с помощью флэш-хроматографии на силикагелевой колонке с элюированием этилацетатом/петролейным эфиром (1/6) с получением трет-бутил 4-(2'-(метилтио)-5', 8'-дигидро-6'Н-спиро[циклогексан-1,7'-хиназолин]-4'-ил)пиперазин-1-карбоксилата (500 мг, 1,16 ммоль, выход 50,9%)] в виде желтого твердого вещества. ЖХМС (ИЭР, m/z): 433,3 [М+Н]+.
Этап 4: трет-бутил 4-(2'-(метилсульфонил)-5',8'-дигидро-6'Н-спиро [циклогексан-1,7'-хиназолин]-4'-ил) пиперазин-1-карбоксилат
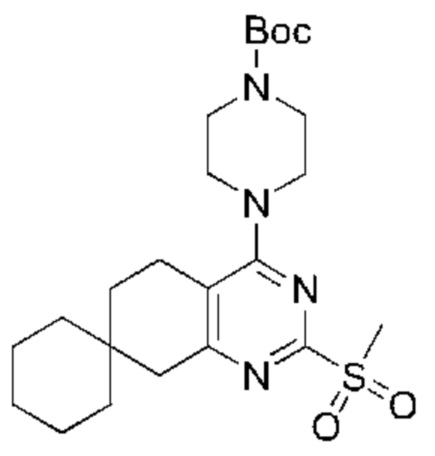
Раствор трет-бутил 4-(2'-(метилтио)-5',8'-дигидро-6'Н-спиро [циклогексан-1,7'-хиназолин]-4'-ил) пиперазин-1-карбоксилата (300,0 мг, 0,69 ммоль) и 3-хлорпероксибензойной кислоты (239,3 мг, 1,39 ммоль) в дихлорметане (10 мл) перемешивали при 25°С в течение 3 часов. После завершения раствор разводили водой и экстрагировали этилацетатом. Потом органические слои объединяли, сушили над безводным сульфатом натрия и концентрировали в вакууме. Остаток очищали с помощью флэш-хроматографии на силикагелевой колонке с элюированием этилацетатом/петролейным эфиром (1/5) с получением трет-бутил 4-(2'-(метилсульфонил)-5',8'-дигидро-6'Н-спиро[циклогексан-1,7'-хиназолин]-4'-ил)пиперазин-1-карбоксилата (260 мг, 0,56 ммоль, выход 80,7%) в виде желтого твердого вещества. ЖХМС (ИЭР, m/z): 465,2 [М+Н]+.
Этап 5: трет-бутил 4-[2-[[(2S)-1-метилпирролидин-2-ил]метокси]спиро[6,8-дигидро-5Н-хиназолин-7,1'-циклогексан]-4-ил] пиперазин-1-карбоксилат

В атмосфере азота в раствор н-метил-1-пролинола (99,15 мг, 0,86 ммоль) в тетрагидрофуране (6 мл) добавляли гидрид натрия (30,99 мг, 1,29 ммоль, 60% дисперсия в минеральном масле). Полученный в результате раствор перемешивали 0,5 часов при 25°С. Потом добавляли трет-бутил 4-(2'-(метилсульфонил)-5',8'-дигидро-6'Н-спиро[циклогексан-1,7'-хиназолин]-4'-ил)пиперазин-1-карбоксилат (200,0 мг, 0,43 ммоль) и перемешивали при 25°С в течение 2 часов. После завершения раствор разводили водой и экстрагировали этилацетатом. Потом органические слои объединяли, сушили над безводным сульфатом натрия и концентрировали в вакууме. Остаток очищали с помощью флэш-хроматографии на силикагелевой колонке с элюированием метанолом/дихлорметаном (1/10) с получением трет-бутил 4-[2-[[(2S)-1-метил пирролидин-2-ил] метокси]спиро[6,8-дигидро-5Н-хиназолин-7,1'-циклогексан]-4-ил]пиперазин-1-карбоксилата (150 мг, 0,30 ммоль, выход 69,7%) в виде желтого твердого вещества. ЖХМС (ИЭР, m/z): 500,7 [М+Н]+.
Этап 6а: (S)-2'-((1-метилпирролидин-2-ил)метокси)-4'-(пиперазин-1-ил)-5',8'-дигидро-6'Н-спиро[циклогексан-1,7'-хиназолин]
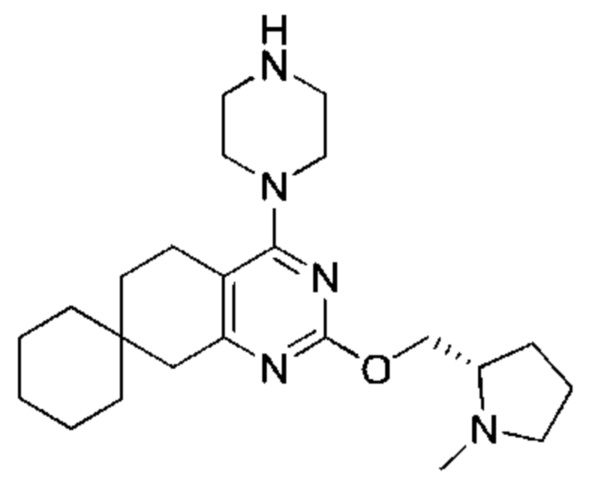
Раствор трет-бутил 4-[2-[[(2S)-1-метилпирролидин-2-ил]метокси]спиро[6,8-дигидро-5Н-хиназолин-7,1'-циклогексан]-4-ил]пиперазин-1-карбоксилата (150,0 мг, 0,30 ммоль) и трифторуксусной кислоты (1,00 мл) в дихлорметане (2,00 мл) перемешивали при 25°С в течение 2 часов. После завершения раствор разводили водой и экстрагировали дихлорметаном. Потом органические слои объединяли, сушили над безводным сульфатом натрия и концентрировали в вакууме. Остаток очищали с помощью флэш-хроматографии на силикагелевой колонке с элюированием метанолом/дихлорметаном (1/5) с получением 2-[[(2S)-1-метилпирролидин-2-ил]метокси]-4-пиперазин-1-ил-спиро[6,8-дигидро-5Н-хиназолин-7,1'-циклогексана] (100 мг,0,25 ммоль, выход 83,4%) в виде желтого твердого вещества. ЖХМС (ИЭР, m/z): 400,6 [М+Н]+.
Этап 6b: (S)-1-(4-(2'-((1-метилпирролидин-2-ил)метокси)-5',8'-дигидро-6'Н-спиро[циклогексан-1,7'-хиназолин]-4'-ил)пиперазин-1-ил)проп-2-ен-1-он

Раствор 2-[[(2S)-1-метилпирролидин-2-ил] метокси]-4-пиперазин-1-ил-спиро[6,8-дигидро-5Н-хиназолин-7,1'-циклогексана] (200,0 мг, 0,50 ммоль) и N,N-диизопропилэтиламина (0,09 мл, 0,50 ммоль) в дихлорметане (10 мл) перемешивали при -78°С в течение 5 минут. Потом добавляли акрилоилхлорид (46,0 мг, 0,51 ммоль) и перемешивали при -78°С в течение 0,5 часа. Полученный в результате раствор концентрировали в вакууме. Неочищенный продукт очищали с помощью препаративной ВЭЖХ со следующими условиями: колонка: колонка XBridge Shield RP18 OBD, 30*150 мм, 5 мкм; подвижная фаза А: вода (10 ммоль/л NH4HCO3), подвижная фаза В: АЦН; скорость потока: 60 мл/мин; градиент: от 29 В до 70 В за 7 мин; 220 нм; RT1: 6,5; RT2; объем ввода: мл; число прогонов, с получением (S)-1-(4-(2'-((1-метилпирролидин-2-ил)метокси)-5',8'-дигидро-6'Н-спиро[циклогексан-1,7'-хиназолин]-4'-ил)пиперазин-1-ил)проп-2-ен-1-она (20,3 мг,0,04 ммоль, выход 8,9%) в виде белого твердого вещества. ЖХМС (ИЭР, m/z): 454,6 [М+Н]+
Пример 25а: 1Н ЯМР (400 МГц, метанол-d4, м. д.) 6,84-6,78 (м, 1H), 6,28 (д, J = 2,0 Гц, 1H), 5,81 (д, J = 2,0 Гц, 1H), 4,40-4,39 (м, 2Н), 3,80-3,78 (м, 4Н), 3,54-3,79 (м, 4Н), 3,26 (с, 1H), 3,06 (с, 1H), 2,66 (с, 3H), 2,63-2,54 (м, 3H), 2,55 (с, 2Н), 2,20-2,13 (м, 1H), 1,93-1,83 (м, 2Н), 1,79-1,76 (м, 1H), 1,60 (м, 2Н), 1,58-1,45 (м, 6Н), 1,44-1,40 (м, 4 Н).
Пример 26

(S)-1-(4-(7-(6-амино-4-метил-3-(трифторметил)пиридин-2-ил)-5,6,7,8-тетрагидрохиназолин-4-ил)пиперазин-1-ил)проп-2-ен-1-он (Пример 26а)
(R)-1-(4-(7-(6-амино-4-метил-3-(трифторметил)пиридин-2-ил)-5,6,7,8-тетрагидрохиназолин-4-ил)пиперазин-1-ил)проп-2-ен-1-он (Пример 26b)

Этап 1: 3-[6-[бис[(4-метоксифенил)метил]амино]-4-метил-3-(трифторметил)-2-пиридил]циклогекс-2-ен-1-он
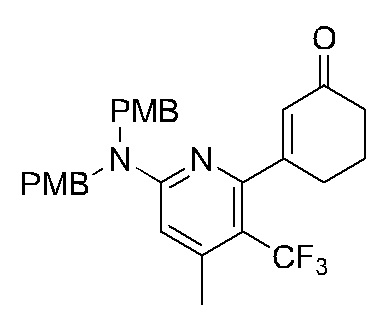
В атмосфере азота раствор 6-хлор-N,N-бис[(4-метоксифенил)метил]-4-метил-5-(трифторметил)пиридин-2-амина (20,24 г, 44,89 ммоль), 3-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)циклогекс-2-ен-1-она (4,99 г, 22,45 ммоль), аддукта трис(дибензилиденацетон)дипалладий- хлороформ (3,48 г, 3,37 ммоль), три-трет-бутилфосфин тетрафторбората (1,3 г, 4,49 ммоль) и фторида калия (2,6 г, 44,89 ммоль) в 1,4-диоксане (100 мл) и воде (10 мл) перемешивали при 80°С в течение 2 часов. После завершения полученный в результате раствор разводили этилацетатом и промывали водой. Органический слой сушили над безводным сульфатом натрия и концентрировали в вакууме. Остаток очищали с помощью флэш-хроматографии на силикагелевой колонке с элюированием дихлорметаном/метанолом (97/3) с получением 3-[6-[бис[(4-метоксифенил)метил]амино]-4-метил-3-(трифторметил)-2-пиридил]циклогекс-2-ен-1-она (5,96 г, 11,32 ммоль, выход 50,4%) в виде желтого твердого вещества. ЖХМС (ИЭР, m/z): 511,2 [М+Н]+.
Этап 2: этил 4-[6-[бис[(4-метоксифенил)метил]амино]-4-метил-3-(трифторметил)-2-пиридил]-2-оксо-циклогекс-3-ен-1-карбоксилат

В атмосфере азота в раствор 3-[6-[бис[(4-метоксифенил)метил]амино]-4-метил-3-(трифторметил)-2-пиридил]циклогекс-2-ен-1-она (2,59 г, 5,06 ммоль) в тетрагидрофуране (50 мл) и добавляли LiHMDS (10,13 мл, 10,13 ммоль) при -78°С в течение 1 часа. Потом добавляли этилцианоформиат (0,75 г, 7,59 ммоль) и перемешивали при -78°С в течение 2 часов. После завершения полученный в результате раствор гасили этанолом и концентрировали в вакууме. Остаток очищали с помощью флэш-хроматографии на силикагеле с элюированием дихлорметаном/метанолом (97/3) с получением этил 4-[6-[бис[(4-метоксифенил)метил]амино]-4-метил-3-(трифторметил)-2-пиридил]-2-оксо-циклогекс-3-ен-1-карбоксилата (2,21 г, 3,63 ммоль, выход 71,8%) в виде желтого твердого вещества. ЖХМС (ИЭР, m/z): 583,2 [М+Н]+.
Этап 3: этил 4-[6-[бис[(4-метоксифенил)метил]амино]-4-метил-3-(трифторметил)-2-пиридил]-2-оксо-циклогексанкарбоксилат

В атмосфере водорода раствор этил 4-[6-[бис[(4-метоксифенил)метил]амино]-4-метил-3-(трифторметил)-2-пиридил]-2-оксо-циклогекс-3-ен-1-карбоксилата (2,95 г, 5,06 ммоль) и Pd/C (0,30 г, 2,84 ммоль) в этилацетате (50 мл) перемешивали при 25°С в течение 5 часов. После завершения полученный в результате раствор фильтровали, а фильтрат концентрировали при пониженном давлении с получением этил 4-[6-[бис[(4-метоксифенил)метил]амино]-4-метил-3-(трифторметил)-2-пиридил]-2-оксо-циклогексанкарбоксилата (2,7 г, 4,61 ммоль, выход 91,1%) в виде белого масла. ЖХМС (ИЭР, m/z): 585,2 [М+Н]+.
Этап 4: 7-[6-[бис[(4-метоксифенил)метил]амино]-4-метил-3-(трифторметил)-2-пиридил]-5,6,7,8-тетрагидро-3Н-хиназолин-4-он
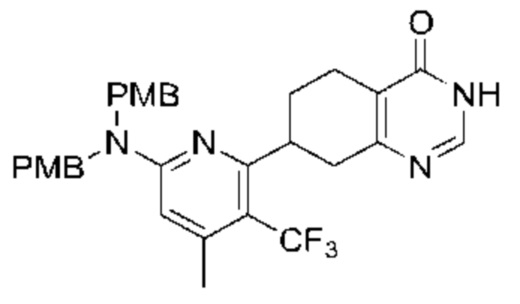
Раствор этил 4-[6-[бис[(4-метоксифенил)метил]амино]-4-метил-3-(трифторметил)-2-пиридил]-2-оксо-циклогексанкарбоксилата (2,95 г, 5,04 ммоль), формамидиния ацетата (3,15 г, 30,26 ммоль) и метанолата натрия (2,72 г, 50,43 ммоль) в метаноле (50 мл) перемешивали при 25°С в течение 5 часов. После завершения полученный в результате раствор концентрировали в вакууме. Остаток очищали с помощью флэш-хроматографии на силикагеле с элюированием дихлорметаном/метанолом (93/7) с получением 7-[6-[бис[(4-метоксифенил)метил]амино]-4-метил-3-(трифторметил)-2-пиридил]-5,6,7,8-тетрагидро-3Н-хиназолин-4-она (1,51 г, 2,68 ммоль, выход 53,1%) в виде белого масла. ЖХМС (ИЭР, m/z): 565,2 [М+Н]+.
Этап 5: N,N-бис[(4-метоксифенил)метил]-4-метил-6-(4-пиперазин-1-ил-5,6,7,8-тетрагидрохиназолин-7-ил)-5-(трифторметил)пиридин-2-амин
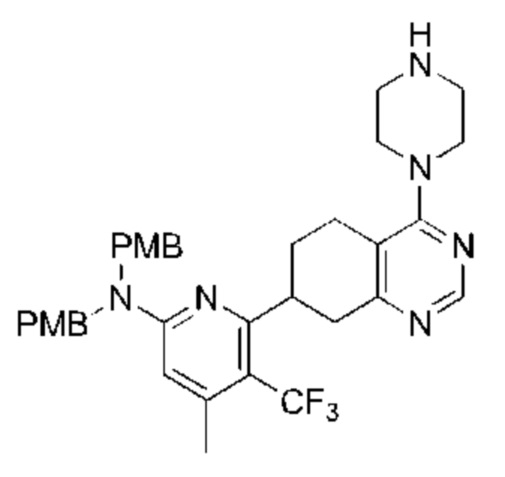
Раствор 7-[6-[бис[(4-метоксифенил)метил]амино]-4-метил-3-(трифторметил)-2-пиридил]-5,6,7,8-тетрагидро-3Н-хиназолин-4-она (0,99 г, 1,74 ммоль), пиперазина (3,01 г, 34,89 ммоль) и ВОР (1,54 г, 3,49 ммоль) в хлороформе (30 мл) перемешивали при 70°С в течение 12 часов. После завершения полученный в результате раствор концентрировали в вакууме. Остаток очищали с помощью обращенно-фазовой колонки с элюированием водой/ацетонитрилом (65/35) с получением N,N-бис[(4-метоксифенил)метил]-4-метил-6-(4-пиперазин-1-ил-5,6,7,8-тетрагидрохиназолин-7-ил)-5-(трифторметил)пиридин-2-амина (0,46 г, 0,72 ммоль, выход 41,3%) в виде желтого твердого вещества. ЖХМС (ИЭР, m/z): 633,3 [М+Н]+.
Этап 6: 4-метил-6-(4-пиперазин-1-ил-5,6,7,8-тетрагидрохиназолин-7-ил)-5-(трифторметил)пиридин-2-амин

Раствор N,N-бис[(4-метоксифенил)метил]-4-метил-6-(4-пиперазин-1-ил-5,6,7,8-тетрагидрохиназолин-7-ил)-5-(трифторметил)пиридин-2-амина (651 мг, 1,03 ммоль) в трифторуксусной кислоте (10 мл, 134,65 ммоль) перемешивали при 50°С в течение 12 часов. После завершения полученный в результате раствор концентрировали в вакууме. Остаток разводили дихлорметаном и доводили до рН 9 N,N-диизопропилэтиламином. Полученный в результате раствор концентрировали в вакууме. Остаток очищали с помощью обращенно-фазовой колонки с элюированием водой/ацетонитрилом (62/38) с получением 4-метил-6-(4-пиперазин-1-ил-5,6,7,8-тетрагидрохиназолин-7-ил)-5-(трифторметил)пиридин-2-амина (191 мг, 0,49 ммоль, выход 47,5%) в виде желтого твердого вещества. ЖХМС (ИЭР, m/z): 393 [М+Н]+.
Этап 7: 1-[4-[7-[6-амино-4-метил-3-(трифторметил)-2-пиридил]-5,6,7,8-тетрагидрохиназолин-4-ил]пиперазин-1-ил]проп-2-ен-1-он

Раствор акриловой кислоты (0,19 г, 2,57 ммоль), HATU (0,98 г, 2,57 ммоль) и N,N-диизопропилэтиламина (0,13 г, 1,03 ммоль) в дихлорметане (5 мл) перемешивали при 25°С в течение 30 минут. Потом этот раствор добавляли в раствор 4-метил-6-(4-пиперазин-1-ил-5,6,7,8-тетрагидрохиназолин-7-ил)-5-(трифторметил)пиридин-2-амина (0,19 г, 0,49 ммоль) в дихлорметане (5 мл) и N,N-диметилформамиде (5 мл) при 25°С, а полученный в результате раствор перемешивали при 25°С в течение 1 часа. После завершения полученный в результате раствор гасили водой и экстрагировали дихлорметаном. Органический слой концентрировали в вакууме. Остаток очищали с помощью флэш-хроматографии на силикагеле с элюированием дихлорметаном/метанолом (93/7) с получением 120 мг неочищенного вещества. Потом неочищенное вещество дополнительно очищали с помощью препаративной ВЭЖХ со следующими условиями с получением 1-[4-[7-[6-амино-4-метил-3-(трифторметил)-2-пиридил]-5,6,7,8-тетрагидрохиназолин-4-ил]пиперазин-1-ил]проп-2-ен-1-она (68,8 мг, 0,15 ммоль, выход 30,6%) в виде белого твердого вещества. Условия препаративной ВЭЖХ: колонка: колонка XBridge Prep OBD С18, 30×150 мм, 5 мкм; подвижная фаза А: вода (10 ммоль/л NH4HCO3), подвижная фаза В: АЦН; скорость потока: 25 мл/мин; градиент: от 28% В до 52% В за 7 мин; 254/220 нм; Rt: 5,85 мин.
Пример 26: 1Н ЯМР (400 МГц, ДМСО-d6, м. д.) 8,47 (с, 1H), 6,83 (дд, J = 16,7, 10,5 Гц, 1H), 6,49 (с, 2Н), 6,22 (с, 1H), 6,15 (дд, J = 16,7, 2,4 Гц, 1H), 5,72 (дд, J = 10,4, 2,4 Гц, 1H), 3,82-3,68 (м, 2Н), 3,67-3,54 (м, 2Н), 3,49-3,40 (м, 3H), 3,32-3,16 (м, 3H), 2,85-2,75 (м, 2Н), 2,65-2,56 (м, 1H), 2,29 (с, 3H), 1,92 (д, J = 12,7 Гц, 1H), 1,80-1,65 (м,1Н). ЖХМС (ИЭР, m/z): 447,2 [М+Н]+.
Примеры 27а и 27b

1-[4-[(7S)-7-[3-амино-2-фтор-5-метил-6-(трифторметил)фенил]-5,6,7,8-тетрагидрохиназолин-4-ил]пиперазин-1-ил]проп-2-ен-1-он (Пример 27а); и
1-[4-[(7R)-7-[3-амино-2-фтор-5-метил-6-(трифторметил)фенил]-5,6,7,8-тетрагидрохиназолин-4-ил]пиперазин-1-ил]проп-2-ен-1-он (Пример 27b)
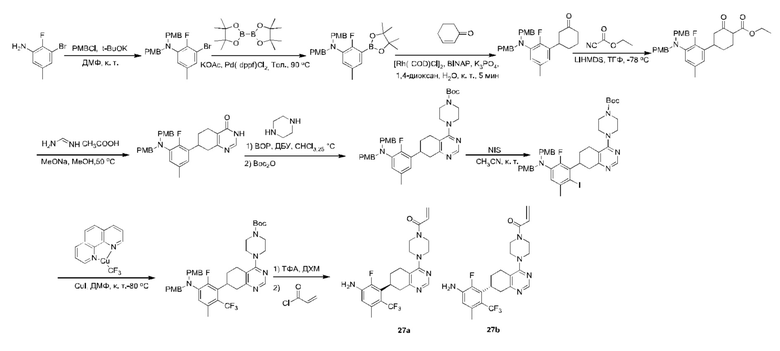
Этап 1: 3-бром-2-фтор-N,N-бис[(4-метоксифенил)метил]-5-метил-анилин
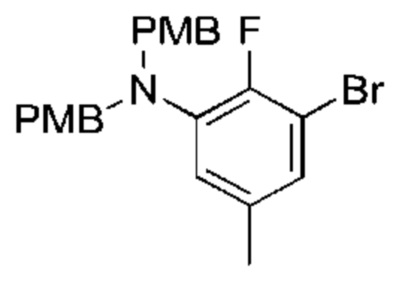
Раствор 3-бром-2-фтор-5-метил-анилина (6,5 г, 31,8 ммоль) и трет-бутоксид калия (10,7 г, 95,5 ммоль) в N,N-диметилформамиде (65 мл) перемешивали при 25°С в течение 5 минут. Потом добавляли 4-метоксибензилхлорид (17,2 мл, 127,4 ммоль) и перемешивали при 25°С в течение 16 часов. После завершения полученный в результате раствор разводили водой и экстрагировали этилацетатом. Органические слои объединяли, промывали солевым раствором, сушили над безводным сульфатом натрия и концентрировали в вакууме. Остаток растирали в метаноле и проводили вакуумную фильтрацию с получением 3-бром-2-фтор-N,N-бис[(4-метоксифенил)метил]-5-метил-анилина (9 г, 20,25 ммоль, выход 63,6%) в виде белого твердого вещества. ЖХМС (ИЭР, m/z): 444,1 [М+Н]+.
Этап 2: 2-фтор-N,N-бис[(4-метоксифенил)метил]-5-метил-3-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)анилин
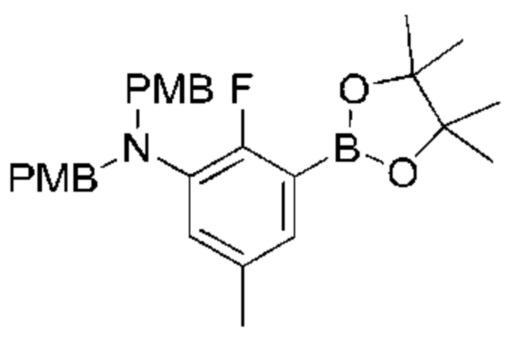
В атмосфере азота раствор бис(пинаколато)дибора (15,4 г, 60,7 ммоль), 3-бром-2-фтор-N,N-бис[(4-метоксифенил)метил]-5-метил-анилина (9,0 г, 20,2 ммоль), [1,1'-бис(дифенилфосфино)ферроцен]дихлорпалладия (II) (1,48 г, 2,0 ммоль) и ацетата калия (3,9 г, 40,5 ммоль) в толуоле (90 мл) перемешивали в течение 2 часов при 90°С. После завершения полученный в результате раствор концентрировали в вакууме. Остаток растворяли дихлорметаном и промывали солевым раствором. Органический слой сушили над безводным сульфатом натрия и концентрировали в вакууме. Остаток очищали с помощью флэш-хроматографии на силикагеле с элюированием петролейным эфиром/этилацетатом (5/1) с получением 2-фтор-N,N-бис[(4-метоксифенил)метил]-5-метил-3-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)анилина (9 г, 14,6 ммоль, выход 72,3%) в виде белого твердого вещества. ЖХМС (ИЭР, m/z): 492,3 [М+Н]+.
Этап 3: 3-[3-[бис[(4-метоксифенил)метил]амино]-2-фтор-5-метил-фенил] циклогексанон

В атмосфере азота раствор 2-циклогексен-1-она (8,8 г, 91,58 ммоль), 2-фтор-N,N-бис[(4-метоксифенил)метил]-5-метил-3-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)анилина (9,0 г, 18,3 ммоль), димера хлор(1,5-циклооктадиен)родия (I) (902,9 мг, 1,8 ммоль), BINAP (2,28 г, 3,6 ммоль) и фосфата калия (11,64 г, 54,9 ммоль) в 1,4-диоксане (180 мл) и воде (36 мл) перемешивали при 30°С в течение 5 минут. После завершения полученный в результате раствор концентрировали в вакууме. Остаток растворяли дихлорметаном и промывали солевым раствором. Органический слой сушили над безводным сульфатом натрия и концентрировали в вакууме. Остаток очищали с помощью флэш-хроматографии на силикагеле с элюированием петролейным эфиром/этилацетатом (5/1) с получением 3-[3-[бис[(4-метоксифенил)метил]амино]-2-фтор-5-метил-фенил]циклогексанона (5,5 г, 11,9 ммоль, выход 65,1%) в виде желтого масла. ЖХМС (ИЭР, m/z): 462,3 [М+Н]+.
Этап 4: этил 4-[3-[бис[(4-метоксифенил)метил]амино]-2-фтор-5-метил-фенил]-2-оксо-циклогексанкарбоксилат

В атмосфере азота в раствор 3-[3-[бис[(4-метоксифенил)метил]амино]-2-фтор-5-метил-фенил]циклогексанона (4,5 г, 9,7 ммоль) в тетрагидрофуране (45 мл) добавляли бис(триметилсилил)амид лития (1 M в ТГФ) (29,0 мл, 29,2 ммоль) при -78°С. Полученный в результате раствор перемешивали в течение 20 минут при -78°С. Потом добавляли этилцианоформиат (2,8 г, 28,6 ммоль) и перемешивали при -78°С в течение 30 минут. После завершения реакцию гасили водой и экстрагировали дихлорметаном. Потом органические слои объединяли, сушили над безводным сульфатом натрия и концентрировали в вакууме. Неочищенный продукт непосредственно используют на следующем этапе без очистки. ЖХМС (ИЭР, m/z): 534,3 [М+Н]+
Этап 5: 7-[3-[бис[(4-метоксифенил)метил]амино]-2-фтор-5-метил-фенил]-5,6,7,8-тетрагидро-3Н-хиназолин-4-он

Раствор этил 4-[3-[бис[(4-метоксифенил)метил]амино]-2-фтор-5-метил-фенил]-2-оксо-циклогексанкарбоксилата (10,0 г, 18,7 ммоль), формамидинацетата (11,6 г, 112,44 ммоль) и метанолата натрия (10,8 г, 187,4 ммоль) в метаноле (100 мл) перемешивали при 50°С в течение 1 часа. После завершения полученный в результате раствор доводили до рН 8 насыщенным раствором хлорида аммония и экстрагировали дихлорметаном. Потом органические слои объединяли, сушили над безводным сульфатом натрия и концентрировали в вакууме. Остаток очищали с помощью флэш-хроматографии на силикагеле с элюированием дихлорметаном/метанолом (10/1) с получением 7-[3-[бис[(4-метоксифенил)метил]амино]-2-фтор-5-метил-фенил]-5,6,7,8-тетрагидро-3Н-хиназолин-4-она (5 г, 9,7 ммоль, выход 51,9%) в виде желтого масла. ЖХМС (ИЭР, m/z): 514,2 [М+Н]+.
Этап 6: трет-бутил 4-[7-[3-[бис[(4-метоксифенил)метил]амино]-2-фтор-5-метил-фенил]-5,6,7,8-тетрагидрохиназолин-4-ил]пиперазин-1-карбоксилат

Раствор 7-[3-[бис[(4-метоксифенил)метил]амино]-2-фтор-5-метил-фенил]-5,6,7,8-тетрагидро-3Н-хиназолин-4-она (5,0 г, 9,7 ммоль), пиперазина (8,3 г, 97,3 ммоль), (бензотриазол-1-илокси)трис(диметиламино)фосфония гексафторфосфата (8 г, 18,8 ммоль) и ДБУ (4,4 г, 29,2 ммоль) в хлороформе (150 мл) перемешивали при 25°С в течение 30 минут. Потом добавляли ди-трет-бутилдикарбонат (53,1 г, 243,3 ммоль) и перемешивали в течение 30 минут. После завершения растворитель разводили дихлорметаном и промывали солевым раствором. Органический слой сушили над безводным сульфатом натрия и концентрировали в вакууме. Остаток очищали с помощью флэш-хроматографии на силикагеле с элюированием петролейным эфиром/этилацетатом (4/6) с получением трет-бутил 4-[7-[3-[бис[(4-метоксифенил)метил]амино]-2-фтор-5-метил-фенил]-5,6,7,8-тетрагидрохиназолин-4-ил]пиперазин-1-карбоксилата (4 г, 5,8 ммоль, выход 60,3%) в виде желтого масла. ЖХМС (ИЭР, m/z): 682,4 [М+Н]+
Этап 7: трет-бутил 4-[7-[3-[бис[(4-метоксифенил)метил]амино]-2-фтор-6-йодо-5-метил-фенил]-5,6,7,8-тетрагидрохиназолин-4-ил]пиперазин-1-карбоксилат
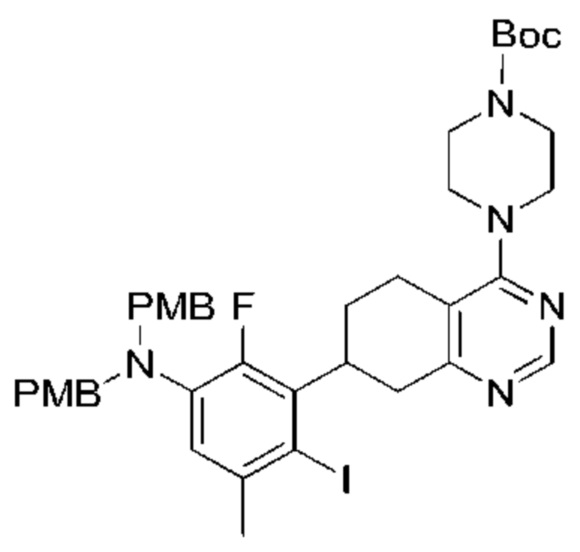
Раствор N-йодосукцинимид (0,49 г, 2,2 ммоль) и трет-бутил 4-[7-[3-[бис[(4-метоксифенил)метил]амино]-2-фтор-5-метил-фенил]-5,6,7,8-тетрагидрохиназолин-4-ил]пиперазин-1-карбоксилата (1,0 г, 1,4 ммоль) в ацетонитриле (10 мл) перемешивали при 25°С в течение 1 часа. После завершения реакцию концентрировали в вакууме. Остаток очищали с помощью флэш-хроматографии на силикагеле с элюированием ацетонитрилом/водой (9/1) с получением трет-бутил 4-[7-[3-[бис[(4-метоксифенил)метил]амино]-2-фтор-6-йодо-5-метил-фенил]-5,6,7,8-тетрагидрохиназолин-4-ил]пиперазин-1-карбоксилата (500 мг, 0,6 ммоль, выход 42,2%) в виде желтого твердого вещества. ЖХМС (ИЭР, m/z): 808,3 [М+Н]+
Этап 8: трет-бутил 4-[7-[3-[бис[(4-метоксифенил)метил]амино]-2-фтор-5-метил-6-(трифторметил)фенил]-5,6,7,8-тетрагидрохиназолин-4-ил] пиперазин-1-карбоксилат

В атмосфере азота раствор трет-бутил 4-[7-[3-[бис[(4-метоксифенил)метил]амино]-2-фтор-6-йодо-5-метил-фенил]-5,6,7,8-тетрагидрохиназолин-4-ил]пиперазин-1-карбоксилата (500 мг, 0,62 ммоль), (1,10-фенантролин)(трифторметил)меди (I) (1,93 г, 6,2 ммоль), йодида меди (2,34 г, 12,3 ммоль) в N,N-диметилформамиде (10 мл) перемешивали при 80°С в течение 16 часов. После завершения фильтрат собирали путем фильтрации и разводили водой, экстрагировали этилацетатом. Потом органические слои объединяли, сушили над безводным сульфатом натрия и концентрировали в вакууме. Остаток очищали с помощью флэш-хроматографии на силикагеле с элюированием дихлорметаном/этилацетатом (7/3) с получением трет-бутил 4-[7-[3-[бис[(4-метоксифенил)метил]амино]-2-фтор-5-метил-6-(трифторметил)фенил]-5,6,7,8-тетрагидрохиназолин-4-ил]пиперазин-1-карбоксилата (280 мг, 0,26 ммоль, выход 42,2%) в виде желтого твердого вещества. ЖХМС (ИЭР, m/z): 750,3 [М+Н]+
Этап 9а: 2-фтор-5-метил-3-(4-пиперазин-1-ил-5,6,7,8-тетрагидрохиназолин-7-ил)-4-(трифторметил)анилин
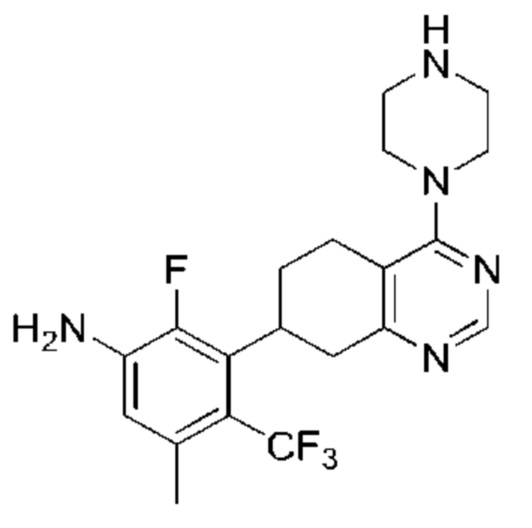
Раствор трет-бутил 4-[7-[3-[бис[(4-метоксифенил)метил]амино]-2-фтор-5-метил-6-(трифторметил)фенил]-5,6,7,8-тетрагидрохиназолин-4-ил]пиперазин-1-карбоксилата (260,0 мг, 0,35 ммоль) и трифторуксусной кислоты (0,5 мл, 6,73 ммоль) в дихлорметане (3 мл) перемешивали при 25°С в течение 2 часов. После завершения полученный в результате раствор концентрировали в вакууме с получением неочищенного продукта (150 мг, чистота 90%), который непосредственно использовали для следующего этапа без очистки. ЖХМС (ИЭР, m/z): 410,2 [М+Н]+
Этап 9b: 1-[4-[(78)-7-[3-амино-2-фтор-5-метил-6-(трифторметил)фенил]-5,6,7,8-тетрагидрохиназолин-4-ил]пиперазин-1-ил]проп-2-ен-1-он (Пример 27а) и 1-[4-[(7R)-7-[3-амино-2-фтор-5-метил-6-(трифторметил)фенил]-5,6,7,8-тетрагидрохиназолин-4-ил]пиперазин-1-ил]проп-2-ен-1-он (Пример 27b)
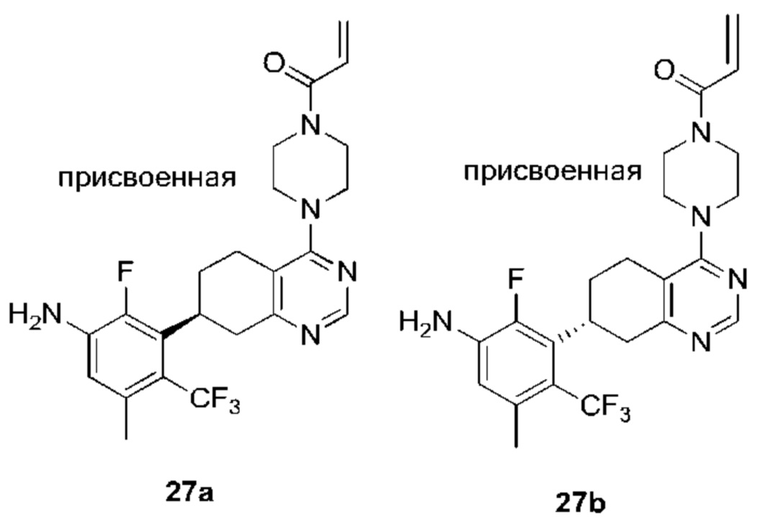
Раствор 2-фтор-5-метил-3-(4-пиперазин-1-ил-5,6,7,8-тетрагидрохиназолин-7-ил)-4-(трифторметил)анилина (150,0 мг, чистота 90%) и N,N-диизопропилэтиламина (141,7 мг, 1,1 ммоль) в дихлорметане (5 мл) перемешивали при -78°С в течение 3 минут. Потом добавляли акрилоилхлорид (33,1 мг, 0,3 ммоль) и перемешивали при -78°С в течение 1 часа. После завершения полученный в результате раствор концентрировали в вакууме. Остаток очищали с помощью флэш-хроматографии на силикагеле с элюированием дихлорметаном/метанолом (20/1) с получением 70 мг неочищенного продукта. Неочищенный продукт очищали с помощью препаративной ВЭЖХ с получением 26 мг белого твердого вещества. Продукт дополнительно очищали с помощью хиральной препаративной ВЭЖХ со следующими условиями (колонка: (HIRALPAK IA, 2*25 см, 5 мкм; подвижная фаза А: МТБЭ (10 мМ NH3-МЕОН) --ВЭЖХ-- подвижная фаза В: EtOH --ВЭЖХ; скорость потока: 15 мл/мин; градиент: от 10 В до 10 В за 15 мин; 254/220 нм) с получением указанных в заголовке соединений. Стереохимия указанных в заголовке соединений была приписана произвольным образом.
Пример 27а: 1-[4-[(7S)-7-[3-амино-2-фтор-5-метил-6-(трифторметил)фенил]-5,6,7,8-тетрагидрохиназолин-4-ил]пиперазин-1-ил]проп-2-ен-1-он (9 мг, 0,019 ммоль, выход 5,3%, белое твердое вещество). 1Н ЯМР (400 МГц, ДМСО-d6, м. д.) δ 8,48 (с, 1H), 6,83 (дд, J = 16,7, 10,4 Гц, 1H), 6,56 (д, J = 8,8 Гц, 1H), 6,14 (дд, J = 16,7, 2,4 Гц, 1H), 5,79 (с, 2Н), 5,72 (дд, J = 10,4, 2,0 Гц, 1H), 3,85-3,68 (м, 2Н), 3,61 (с, 2Н), 3,53-3,43 (м, 2Н), 3,40-3,35 (м, 1H), 3,31-3,21 (м, 2Н), 3,1-2,98 (м, 1H), 2,96-2,89 (м, 1H), 2,80-2,70 (м, 1H), 2,64 (д, J = 16,1 Гц, 1H), 2,29 (с, 3H), 2,09-1,90 (м, 2Н). ЖХМС (ИЭР, m/z): 464,2 [М+Н]+. Хиральная ВЭЖХ: колонка: CHIRALPAK IA-3, 4,6*50 мм; 3 мкм; обнаружение на 254 нм; МТБЭ (0,1% ДЭА): EtOH = 90:10; скорость потока = 1 мл/мин; время удержания: 1,296 мин (более быстрый пик).
Пример 27b: 1-[4-[(7R)-7-[3-амино-2-фтор-5-метил-6-(трифторметил)фенил]-5,6,7,8-тетрагидрохиназолин-4-ил]пиперазин-1-ил]проп-2-ен-1-он (6,8 мг, 0,014 ммоль, выход 4%, белое твердое вещество). 1Н ЯМР (400 МГц, ДМСО-d6, м. д.) δ 8,49 (с, 1H), 6,83 (дд, J = 16,7, 10,5 Гц, 1H), 6,56 (д, J = 8,8 Гц, 1H), 6,14 (дд, J = 16,7, 2,4 Гц, 1H), 5,79 (с, 2Н), 5,72 (дд, J = 9,6, 2,4 Гц, 1H), 3,85-3,75 (м, 2Н), 3,61-3,45 (м, 4Н), 3,40-3,35 (м, 1H), 3,30-3,20 (м, 2Н), 3,11-2,98 (м, 1H), 2,95-2,85 (м, 1H), 2,82-2,70 (м, 1H), 2,69-2,59 (м, 1H), 2,30 (м, 3H), 2,10-1,90 (м, 2Н). ЖХМС (ИЭР, m/z): 464,2 [М+Н]+. Хиральная ВЭЖХ: колонка: CHIRALPAK IA-3, 4,6*50 мм; 3 мкм; обнаружение на 254 нм; МТБЭ (0,1% ДЭА): EtOH = 90:10; скорость потока = 1 мл/мин; время удержания: 1,825 мин (более медленный пик).
Примеры 28а и 28b

1-[(3S)-4-[(7R)-7-(3-гидрокси-1-нафтил)-2-[[(2S)-1-метилпирролидин-2-ил]метокси]-5,6,7,8-тетрагидрохиназолин-4-ил]-3-метил-пиперазин-1-ил]проп-2-ен-1-он (Пример 28а); и
1-[(3S)-4-[(7S)-7-(3-гидрокси-1-нафтил)-2-[[(2S)-1-метилпирролидин-2-ил]метокси]-5,6,7,8-тетрагидрохиназолин-4-ил]-3-метил-пиперазин-1-ил]проп-2-ен-1-он (Пример 28b)
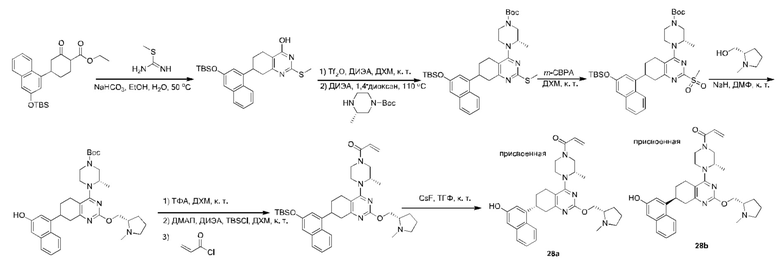
Этап 1: 7-[3-[трет-бутил(диметил)силил]окси-1-нафтил]-2-метилсульфанил-5,6,7,8-тетрагидрохиназолин-4-ол

Раствор этил 4-[3-[трет-бутил(диметил)силил]окси-1-нафтил]-2-оксо-циклогексанкарбоксилата (10,0 г, 23,4 ммоль), 2-метил-2-тиопсевдомочевины сульфата (65,25 г, 234,4 ммоль) и бикарбоната натрия (39,38 г, 468,8 ммоль) в этаноле (120 мл) и воде (25 мл) перемешивали при 50°С в течение 3 часов. После завершения реакцию разводили водой и экстрагировали дихлорметаном. Потом органические слои объединяли, сушили над безводным сульфатом натрия и концентрировали в вакууме. Остаток очищали с помощью флэш-хроматографии на силикагеле с элюированием дихлорметаном/метанолом (97/3) с получением 7-[3-[трет-бутил(диметил)силил]окси-1-нафтил]-2-метилсульфанил-5,6,7,8-тетрагидрохиназолин-4-ола (5 г, 11,0 ммоль, выход 47,1%) в виде белого твердого вещества. ЖХМС (ИЭР, m/z): 453,2 [М+Н]+.
Этап 2: трет-бутил (3S)-4-[7-[3-[трет-бутил(диметил)силил]окси-1-нафтил]-2-метилсульфанил-5,6,7,8-тетрагидрохиназолин-4-ил]-3-метил-пиперазин-1-карбоксилат 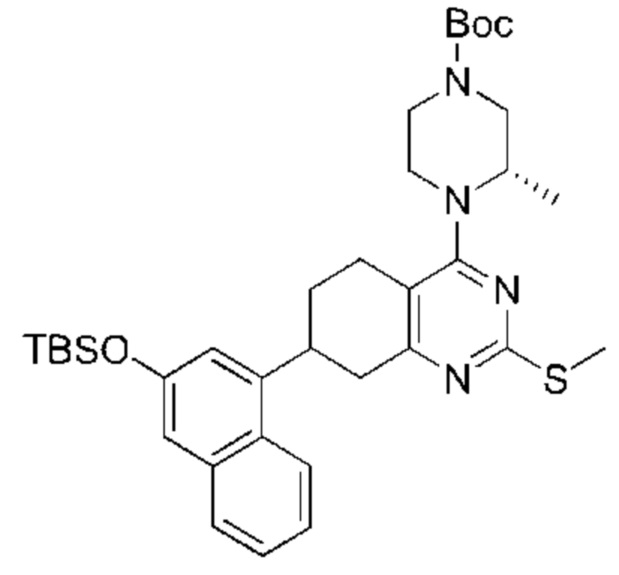
Раствор 7-[3-[трет-бутил(диметил)силил]окси-1-нафтил]-2-метилсульфанил-5,6,7,8-тетрагидрохиназолин-4-ола (2,0 г, 4,4 ммоль) и N,N-диизопропилэтиламина (2,84 г, 22,0 ммоль) в дихлорметане (20 мл) перемешивали при 25°С в течение 3 минут. Потом добавляли трифторметансульфоновый ангидрид (2,49 г, 8,8 ммоль) и перемешивали при 25°С в течение 1 часа. После завершения полученный в результате раствор концентрировали при пониженном давлении и растворяли в 1,4-диоксане (30 мл). Потом добавляли N,N-диизопропилэтиламин (4,41 г, 34,2 ммоль) и трет-бутил (3S)-3-метил-1-пиперазинкарбоксилат (1,37 г, 6,8 ммоль) и перемешивали смесь при 110°С в течение 16 часов. После завершения полученный в результате раствор концентрировали в вакууме. Остаток очищали с помощью флэш-хроматографии на силикагеле с элюированием гексаном/этилацетатом (7/1) с получением трет-бутил (3S)-4-[7-[3-[трет-бутил(диметил)силил]окси-1-нафтил]-2-метилсульфанил-5,6,7,8-тетрагидрохиназолин-4-ил]-3-метил-пиперазин-1-карбоксилата (1,8 г, 2,8 ммоль, выход 63,6%) в виде желтого твердого вещества. ЖХМС (ИЭР, m/z): 635,3 [М+Н]+.
Этап 3: трет-бутил (3S)-4-[7-[3-[трет-бутил(диметил)силил]окси-1-нафтил]-2-метилсульфонил-5,6,7,8-тетрагидрохиназолин-4-ил]-3-метил-пиперазин-1-карбоксилат

Раствор трет-бутил (3S)-4-[7-[3-[трет-бутил(диметил)силил]окси-1-нафтил]-2-метилсульфанил-5,6,7,8-тетрагидрохиназолин-4-ил]-3-метил-пиперазин-1-карбоксилата (2,0 г, 3,1 ммоль) и 3-хлорпероксибензойной кислоты (1,6 г, 9,4 ммоль) в дихлорметане (20 мл) перемешивали при 25°С в течение 2 часов. После завершения полученный в результате раствор гасили насыщенным раствором сульфита натрия. Полученный в результате раствор экстрагировали этилацетатом, сушили над безводным сульфатом натрия и концентрировали в вакууме с получением трет-бутил (3S)-4-[7-[3-[трет-бутил(диметил)силил]окси-1-нафтил]-2-метилсульфонил-5,6,7,8-тетрагидрохиназолин-4-ил]-3-метил-пиперазин-1-карбоксилата (1,5 г, 2,2 ммоль, выход 71%) в виде желтого твердого вещества. ЖХМС (ИЭР, m/z): 667,3 [М+Н]+.
Этап 4: трет-бутил (3S)-4-[7-(3-гидрокси-1-нафтил)-2-[[(2S)-1-метилпирролидин-2-ил]метокси]-5,6,7,8-тетрагидрохиназолин-4-ил]-3-метил-пиперазин-1-карбоксилат

Раствор N-метил-1-пролинола (1,72 г, 14,9 ммоль) в N,N-диметилформамиде (20 мл) перемешивали при 25°С в течение 5 минут. Потом добавляли гидрид натрия (479,8 мг, 11,99 ммоль, 60% дисперсия в минеральном масле) и перемешивали при 0°С в течение 30 минут. Потом добавляли трет-бутил (3S)-4-[7-[3-[трет-бутил(диметил)силил]окси-1-нафтил]-2-метилсульфонил-5,6,7,8-тетрагидрохиназолин-4-ил]-3-метил-пиперазин-1-карбоксилат (2,0 г, 3 ммоль) и перемешивали при 25°С в течение 1 часа. Полученный в результате раствор доводили до рН 8 насыщенным раствором хлорида аммония, экстрагировали этилацетатом и промывали водой. Органический слой сушили над безводным сульфатом натрия и концентрировали в вакууме. Остаток очищали с помощью флэш-хроматографии на силикагеле с элюированием дихлорметаном/метанолом (10/1) с получением трет-бутил (3S)-4-[7-(3-гидрокси-1-нафтил)-2-[[(2S)-1-метилпирролидин-2-ил]метокси]-5,6,7,8-тетрагидрохиназолин-4-ил]-3-метил-пиперазин-1-карбоксилата (1 г, 1,7 ммоль, выход 56,7%) в виде желтого твердого вещества. ЖХМС (ИЭР, m/z): 588,3 [М+Н]+.
Этап 5: 1-[(3S)-4-[7-[3-[трет-бутил(диметил)силил]окси-1-нафтил]-2-[[(2S)-1-метилпирролидин-2-ил]метокси]-5,6,7,8-тетрагидрохиназолин-4-ил]-3-метил-пиперазин-1-ил]проп-2-ен-1-он

Раствор трет-бутил (3S)-4-[7-(3-гидрокси-1-нафтил)-2-[[(2S)-1-метилпирролидин-2-ил]метокси]-5,6,7,8-тетрагидрохиназолин-4-ил]-3-метил-пиперазин-1-карбоксилата (1,3 г, 2,2 ммоль) и трифторуксусной кислоты (3 мл, 39,4 ммоль) в дихлорметане (15 мл) перемешивали при 25°С в течение 30 минут. После завершения полученный в результате раствор концентрировали при пониженном давлении и растворяли в дихлорметане (20 мл). Потом добавляли N,N-диизопропилэтиламин (1,4 г, 11 ммоль) и 4-диметиламинопиридин (268 мг, 2,2 ммоль) и перемешивали систему при 25°С в течение 5 минут. Потом добавляли трет-бутилдиметилсилил хлорид (663,0 мг, 4,4 ммоль) и перемешивали при 25°С в течение 1 часа. Потом добавляли акрилоилхлорид (198 мг, 2,2 ммоль) и перемешивали при 25°С в течение 30 минут. После завершения полученный в результате раствор концентрировали в вакууме. Остаток очищали с помощью флэш-хроматографии на силикагеле с элюированием дихлорметаном/метанолом (20/1) с получением 1-[(3S)-4-[7-[3-[трет-бутил(диметил)силил]окси-1-нафтил]-2-[[(2S)-1-метилпирролидин-2-ил]метокси]-5,6,7,8-тетрагидрохиназолин-4-ил]-3-метил-пиперазин-1-ил]проп-2-ен-1-она (300 мг, 0,4 ммоль, выход 18,2%) в виде желтого твердого вещества. ЖХМС (ИЭР, m/z): 656,4 [М+Н]+.
Этап 6: 1-[(3S)-4-[(7R)-7-(3-гидрокси-1-нафтил)-2-[[(2S)-1-метилпирролидин-2-ил]метокси]-5,6,7,8-тетрагидрохиназолин-4-ил]-3-метил-пиперазин-1-ил]проп-2-ен-1-он (Пример 28а) и 1-[(3S)-4-[(7S)-7-(3-гидрокси-1-нафтил)-2-[[(2S)-1-метилпирролидин-2-ил]метокси]-5,6,7,8-тетрагидрохиназолин-4-ил]-3-метил-пиперазин-1-ил]проп-2-ен-1-он (Пример 28b)

Раствор 1-[(3S)-4-[7-[3-[трет-бутил(диметил)силил]окси-1-нафтил]-2-[[(2S)-1-метилпирролидин-2-ил]метокси]-5,6,7,8-тетрагидрохиназолин-4-ил]-3-метил-пиперазин-1-ил]проп-2-ен-1-она (700,0 мг, 1,07 ммоль) и фторида цезия (648,8 мг, 4,2 ммоль) в тетрагидрофуране (10 мл) перемешивали при 25°С в течение 1 часа. После завершения полученный в результате раствор разводили водой и экстрагировали дихлорметаном. Потом органические слои собирали, сушили над безводным сульфатом натрия и концентрировали в вакууме. Остаток очищали с помощью флэш-хроматографии на силикагеле с элюированием дихлорметаном/метанолом (10/1) с получением неочищенного твердого вещества. Неочищенный продукт очищали с помощью препаративной ВЭЖХ с получением 150 мг белого твердого вещества со следующими условиями: колонка: колонка XBridge Prep C18 OBD 19×150 мм, 5 мкм; подвижная фаза А: вода (10 ммоль/л NH4HCO3), подвижная фаза В: АЦН; скорость потока: 60 мл/мин; градиент: от 30% В до 48% В за 7 мин; 254 нм; Rt: 6,5 мин. Продукт дополнительно очищали с помощью хиральной препаративной ВЭЖХ со следующими условиями: (колонка CHIRALPAK IA-3, 0,46*5 см, 3 мкм; подвижная фаза: (гексан:ДХМ=3:1) (0,1% ДЭА): EtOH=50:50; детектор, УФ 254 нм) с получением указанных в заголовке соединений. Абсолютная конфигурация указанных в заголовке соединений была определена по данным активности и рентгенограммы белковой структуры соединения 21b.
Пример 28а: 1-[(3S)-4-[(7R)-7-(3-гидрокси-1-нафтил)-2-[[(2S)-1-метилпирролидин-2-ил]метокси]-5,6,7,8-тетрагидрохиназолин-4-ил]-3-метил-пиперазин-1-ил]проп-2-ен-1-он (42,9 мг, 0,079 ммоль, выход 7,4%, белое твердое вещество). 1Н ЯМР (400 МГц, ДМСО-d6, м. д.) δ 9,68 (с, 1H, 8,08 (д, J=8,5 Гц, 1H, 7,77-7,63 (м, 1H, 7,40 (т, J=7,4 Гц, 1H, 7,30 (т, J=7,2, Гц, 1H, 7,01 (с, 2Н), 6,94-6,76 (м, 1H, 6,21-6,12 (м, 1H, 5,72 (дд, J=10,3, 2,4 Гц, 1H, 4,38-4,00 (м, 5Н), 3,94-3,81 (м, 2Н), 3,65-3,42 (м, 2Н), 3,31-3,18 (м, 1H, 3,08 (дд, J=18,1, 5,3 Гц, 1H, 2,98-2,84 (м, 3H, 2,83-2,72 (м, 1H, 2,63-2,53 (м, 1H, 2,33 (с, 3Н), 2,20-2,07 (м, 2Н), 1,96-1,77 (м, 2Н), 1,72-1,55 (м, 3Н), 1,02-0,98 (м, 3H. ЖХМС (ИЭР, m/z): 542,3 [М+Н]+. Хиральная ВЭЖХ: колонка: CHIRALPAK IA-3, 4,6*50 мм; 3 мкм; обнаружение на 254 нм; МТБЭ (0,1% ДЭА): EtOH=90:10; скорость потока=1 мл/мин; время удержания: 1,350 мин (более медленный пик).
Пример 28b: 1-[(3S)-4-[(7S)-7-(3-гидрокси-1-нафтил)-2-[[(2S)-1-метилпирролидин-2-ил]метокси]-5,6,7,8-тетрагидрохиназолин-4-ил]-3-метил-пиперазин-1-ил]проп-2-ен-1-он (42,3 мг, 0,078 ммоль, выход 7,3%, белое твердое вещество). 1Н ЯМР (400 МГц, ДМСО-d6 м. д.) δ 9,67 (с, 1H, 8,07 (д, J=8,5 Гц, 1H, 7,71 (д, J=8,1 Гц, 1H, 7,40 (т, J=7,5 Гц, 1Н),7,30 (т, J=7,2, Гц, 1H, 7,04-6,97 (м, 2Н), 6,93-6,75 (м, 1H, 6,23-6,12 (м, 1H, 5,73 (дд, J=10,4, 2,4 Гц, 1H, 4,42-3,99 (м, 5Н), 3,93-3,79 (м, 3H, 3,52-3,36 (м, 1H, 3,25-3,00 (м, 3H, 2,99-2,83 (м, 3H, 2,83-2,71 (м, 1H, 2,34 (с, 3H, 2,20-2,07 (м, 2Н), 1,99-1,78 (м, 2Н), 1,73-1,53 (м, 3H, 1,28-1,18 (м, 3H. ЖХМС (ИЭР, m/z): 542,3 [М+Н]+. ЖХМС (ИЭР, m/z): 542,3 [М+Н]+. Хиральная ВЭЖХ: колонка: CHIRALPAK IA-3, 4,6*50 мм, 3 мкм; обнаружение на 254 нм; (гексан/ДХМ=3:1) (0,1% ДЭА): EtOH=50:50; скорость потока=1 мл/мин; время удержания: 0,983 мин (более быстрый пик).
Примеры 29а и 29b

1-[(3R)-3-(гидроксиметил)-4-[(7R)-7-(3-гидрокси-1-нафтил)-2-[[(2S)-1-метилпирролидин-2-ил]метокси]-5,6,7,8-тетрагидрохиназолин-4-ил] пиперазин-1-ил]проп-2-ен-1-он (Пример 29а); и
1-[(3R)-3-(гидроксиметил)-4-[(7S)-7-(3-гидрокси-1-нафтил)-2-[[(2S)-1-метилпирролидин-2-ил]метокси]-5,6,7,8-тетрагидрохиназолин-4-ил] пиперазин-1-ил]проп-2-ен-1-он (Пример 29b)

Этап 1: 7-[3-[трет-бутил(диметил)силил]окси-1-нафтил]-2-метилсульфанил-5,6,7,8-тетрагидрохиназолин-4-ол

Раствор этил 4-[3-[трет-бутил(диметил)силил]окси-1-нафтил]-2-оксо-циклогексанкарбоксилата (10,0 г, 23,4 ммоль), 2-метил-2-тиопсевдомочевины сульфата (65,25 г, 234,4 ммоль) и бикарбоната натрия (39,38 г, 468,8 ммоль) в этаноле (120 мл) и воде (25 мл) перемешивали при 50°С в течение 3 часов. После завершения реакцию разводили водой и экстрагировали дихлорметаном. Потом органические слои объединяли, сушили над безводным сульфатом натрия и концентрировали в вакууме. Остаток очищали с помощью флэш-хроматографии на силикагеле с элюированием дихлорметаном/метанолом (97/3) с получением 7-[3-[трет-бутил(диметил)силил]окси-1-нафтил]-2-метилсульфанил-5,6,7,8-тетрагидрохиназолин-4-ола (5 г, 11,0 ммоль, выход 47,1%) в виде белого твердого вещества. ЖХМС (ИЭР, m/z): 453,2 [М+Н]+.
Этап 2: трет-бутил (3R)-4-[7-[3-[трет-бутил(диметил)силил]окси-1-нафтил]-2-метилсульфанил-5,6,7,8-тетрагидрохиназолин-4-ил]-3-(гидроксиметил)пиперазин-1-карбоксилат
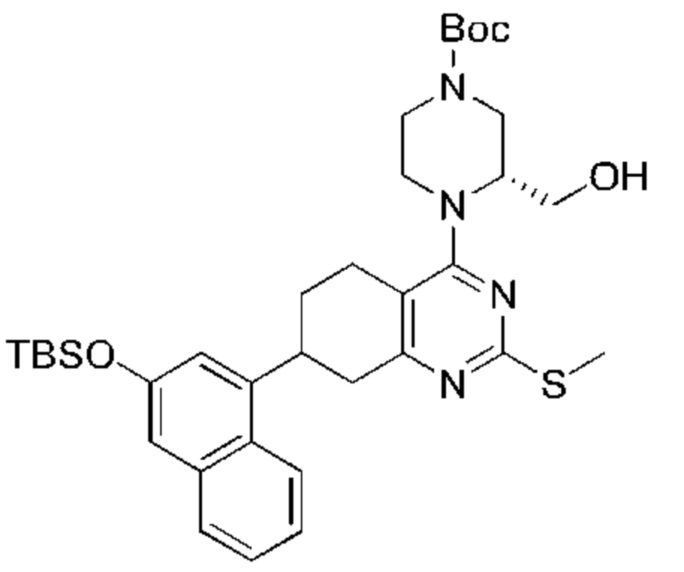
Раствор 7-[3-[трет-бутил(диметил)силил]окси-1-нафтил]-2-метилсульфанил-5,6,7,8-тетрагидрохиназолин-4-ола (5,0 г, 11,05 ммоль) и N,N-диизопропилэтиламина (7,17 г, 55,2 ммоль) в дихлорметане (50 мл) перемешивали при 25°С в течение 3 минут. Потом добавляли трифторметансульфоновый ангидрид (6,2 г, 22,1 ммоль) и перемешивали при 25°С в течение 1 часа. После завершения полученный в результате раствор концентрировали при пониженном давлении и растворяли в 1,4-диоксане (75 мл). Потом добавляли N,N-диизопропилэтиламин (11,0 г, 85,5 ммоль) и (R)-4-n-boc-2-гидроксиметил-пиперазин (3,7 г, 17,1 ммоль) и перемешивали при 110°С в течение 16 часов. После завершения полученный в результате раствор концентрировали в вакууме. Остаток очищали с помощью флэш-хроматографии на силикагеле с элюированием гексаном/этилацетатом (10/1) с получением трет-бутил (3R)-4-[7-[3-[трет-бутил(диметил)силил]окси-1-нафтил]-2-метилсульфанил-5,6,7,8-тетрагидрохиназолин-4-ил]-3-(гидроксиметил)пиперазин-1-карбоксилата (4 г, 6,1 ммоль, выход 71,9%) в виде желтого твердого вещества. ЖХМС (ИЭР, m/z): 651,3 [М+Н]+.
Этап 3: трет-бутил (3R)-3-[[трет-бутил(диметил)силил]оксиметил]-4-[7-[3-[трет-бутил(диметил)силил]окси-1-нафтил]-2-метилсульфанил-5,6,7,8-тетрагидрохиназолин-4-ил]пиперазин-1-карбоксилат
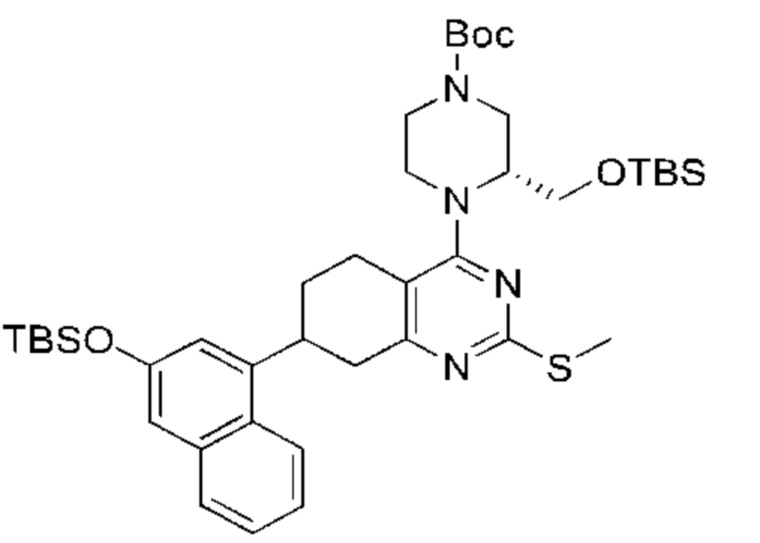
Раствор трет-бутил (3R)-4-[7-[3-[трет-бутил(диметил)силил]окси-1-нафтил]-2-метилсульфанил-5,6,7,8-тетрагидрохиназолин-4-ил]-3-(гидроксиметил)пиперазин-1-карбоксилата (4,0 г, 6,14 ммоль), 4-диметиламинопиридин (749,6 мг, 6,14 ммоль) и триэтиламина (1,8 г, 18,43 ммоль) в дихлорметане (40 мл) перемешивали при 25°С в течение 5 минут.Потом добавляли трет-бутилдиметилсилил хлорид (1,8 г, 12,29 ммоль) и перемешивали при 25°С в течение 1 часа. После завершения полученный в результате раствор промывали водой, сушили над безводным сульфатом натрия и концентрировали в вакууме с получением трет-бутил (3R)-3-[[трет-бутил(диметил)силил]оксиметил]-4-[7-[3-[трет-бутил(диметил)силил]окси-1-нафтил]-2-метилсульфанил-5,6,7,8-тетрагидрохиназолин-4-ил]пиперазин-1-карбоксилата (4,2 г, 5,5 ммоль, выход 89,3%) ЖХМС (ИЭР, m/z): 765,4 [М+Н]+.
Этап 4: трет-бутил (3R)-3-[[трет-бутил(диметил)силил]оксиметил]-4-[7-[3-[трет-бутил(диметил)силил]окси-1-нафтил]-2-метилсульфонил-5,6,7,8-тетрагидрохиназолин-4-ил]пиперазин-1-карбоксилат
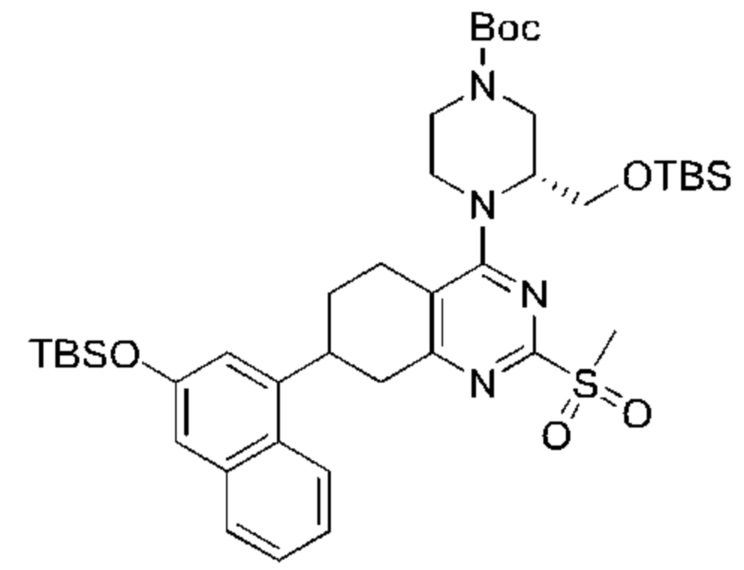
Раствор трет-бутил (3R)-3-[[трет-бутил(диметил)силил]оксиметил]-4-[7-[3-[трет-бутил(диметил)силил]окси-1-нафтил]-2-метилсульфанил-5,6,7,8-тетрагидрохиназолин-4-ил]пиперазин-1-карбоксилата (4,0 г, 5,2 ммоль) и 3-хлорпероксибензойной кислоты (2,7 г, 15,6 ммоль) в дихлорметане (40 мл) перемешивали при 25°С в течение 2 часов. После завершения полученный в результате раствор концентрировали в вакууме. Остаток очищали с помощью флэш-хроматографии на силикагеле с элюированием гексаном/этилацетатом (5/1) с получением трет-бутил (3R)-3-[[трет-бутил(диметил)силил]оксиметил]-4-[7-[3-[трет-бутил(диметил)силил]окси-1-нафтил]-2-метилсульфонил-5,6,7,8-тетрагидрохиназолин-4-ил]пиперазин-1-карбоксилата (2,3 г, 2,8 ммоль, выход 55,2%)в виде белого твердого вещества. ЖХМС (ИЭР, m/z): 797,4 [М+Н]+.
Этап 5: трет-бутил (3R)-3-[[трет-бутил(диметил)силил]оксиметил]-4-[7-(3-гидрокси-1-нафтил)-2-[[(2S)-1-метилпирролидин-2-ил]метокси]-5,6,7,8-тетрагидрохиназолин-4-ил]пиперазин-1-карбоксилат
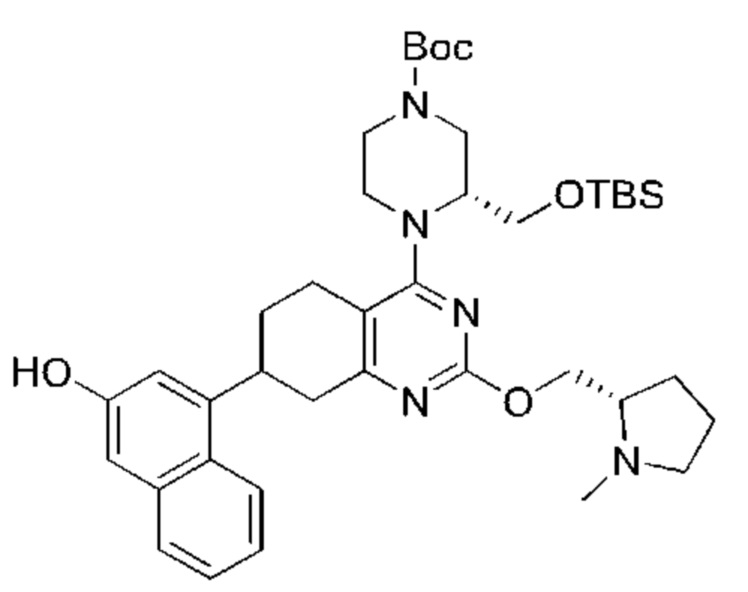
Раствор N-метил-1-пролинол (1,44 г, 12,5 ммоль) в N,N-диметилформамиде (20 мл) перемешивали при 25°С в течение 5 минут. Потом добавляли гидрид натрия (401,4 мг, 10,0 ммоль, 60% дисперсия в минеральном масле) и перемешивали при 0°С в течение 30 минут. Потом добавляли трет-бутил (3R)-3-[[трет-бутил(диметил)силил]оксиметил]-4-[7-[3-[трет-бутил(диметил)силил]окси-1-нафтил]-2-метилсульфонил-5,6,7,8-тетрагидрохиназолин-4-ил]пиперазин-1-карбоксилат(2,0 г, 2,5 ммоль) и перемешивали при 25°С в течение 1 часа. После завершения полученный в результате раствор доводили до рН 8 насыщенным раствором хлорида аммония и экстрагировали этилацетатом, промывали водой. Органический слой сушили над безводным сульфатом натрия и концентрировали в вакууме. Остаток очищали с помощью флэш-хроматографии на силикагеле с элюированием дихлорметаном/метанолом (10/1) с получением трет-бутил (3R)-3-[[трет-бутил(диметил)силил]оксиметил]-4-[7-(3-гидрокси-1-нафтил)-2-[[(2S)-1-метилпирролидин-2-ил]метокси]-5,6,7,8-тетрагидрохиназолин-4-ил]пиперазин-1-карбоксилата (1,3 г, 1,8 ммоль, выход 72,2%) в виде желтого твердого вещества. ЖХМС (ПЭР, m/z): 718,4 [М+Н]+.
Этап 6а: трет-бутил (3R)-3-[[трет-бутил(диметил)силил]оксиметил]-4-[7-[3-[трет-бутил(диметил)силил]окси-1-нафтил]-2-[[(2S)-1-метилпирролидин-2-ил]метокси]-5,6,7,8-тетрагидрохиназолин-4-ил]пиперазин-1-карбоксилат
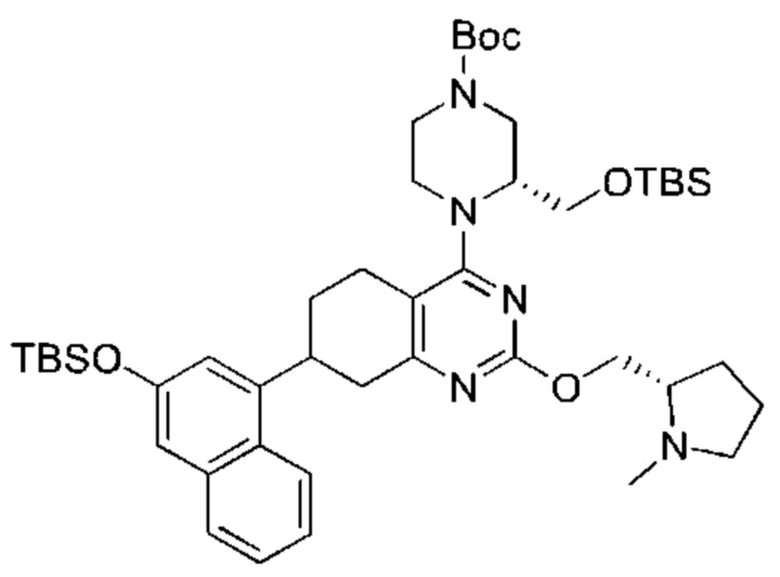
Раствор трет-бутил (3R)-3-[[трет-бутил(диметил)силил]оксиметил]-4-[7-(3-гидрокси-1-нафтил)-2-[[(2S)-1-метилпирролидин-2-ил]метокси]-5,6,7,8-тетрагидрохиназолин-4-ил]пиперазин-1-карбоксилата (400,0 мг, 0,5 ммоль), N,N-диизопропилэтиламина (215,6 мг, 1,67 ммоль) и 4-диметиламинопиридина (67,9 мг, 0,5 ммоль) в дихлорметане (4 мл) перемешивали при 25°С в течение 3 минут. Потом добавляли трет-бутилдиметилсилилхлорид (167,1 мг, 1,1 ммоль) и перемешивали при 25°С в течение 2 часов. После завершения реакцию разводили дихлорметаном, промывали водой и сушили над безводным сульфатом натрия. Полученный в результате раствор концентрировали в вакууме. Остаток очищали с помощью флэш-хроматографии на силикагеле с элюированием дихлорметаном/метанолом (20:1) с получением трет-бутил (3R)-3-[[трет-бутил(диметил)силил]оксиметил]-4-[7-[3-[трет-бутил(диметил)силил] окси-1-нафтил]-2-[[(2S)-1-метилпирролидин-2-ил]метокси]-5,6,7,8-тетрагидрохиназолин-4-ил]пиперазин-1-карбоксилата (400 мг, 0,5 ммоль, выход 86,3%) в виде желтого твердого вещества. ЖХМС (ИЭР, m/z): 832,5 [М+Н]+.
Этап 6B: 1-[(3R)-3-[[трет-бутил(диметил)силил]оксиметил]-4-[7-[3-[трет-бутил(диметил)силил]окси-1-нафтил]-2-[[(2S)-1-метилпирролидин-2-ил]метокси]-5,6,7,8-тетрагидрохиназолин-4-ил]пиперазин-1-ил]проп-2-ен-1-он

Раствор трет-бутил (3R)-3-[[трет-бутил(диметил)силил]оксиметил]-4-[7-[3-[трет-бутил(диметил)силил]окси-1-нафтил]-2-[[(2S)-1-метилпирролидин-2-ил]метокси]-5,6,7,8-тетрагидрохиназолин-4-ил]пиперазин-1-карбоксилата (400,0 мг, 0,4 ммоль) и трифторуксусной кислоты (164,3 мг, 1,4 ммоль) в дихлорметане (8 мл) перемешивали при 25°С в течение 4 часов. После завершения полученный в результате раствор концентрировали при пониженном давлении и растворяли в дихлорметане (5 мл). Потом добавляли N,N-диизопропилэтиламин (264,2 мг, 2,0 ммоль) и перемешивали при 25°С в течение 3 минут. Потом добавляли акрилоилхлорид (37,0 мг, 0,4 ммоль) и перемешивали при 25°С в течение 1 часа.
После завершения полученный в результате раствор концентрировали в вакууме. Остаток очищали с помощью флэш-хроматографии на силикагеле с элюированием дихлорметаном/метанолом (10/1) с получением 1-[(3R)-3-[[трет-бутил(диметил)силил]оксиметил]-4-[7-[3-[трет-бутил(диметил)силил]окси-1-нафтил]-2-[[(2S)-1-метилпирролидин-2-ил]метокси]-5,6,7,8-тетрагидрохиназолин-4-ил]пиперазин-1-ил]проп-2-ен-1-она (200 мг, 0,25 ммоль, выход 62,1%) в виде желтого твердого вещества. ЖХМС (ИЭР, m/z): 786,5 [М+Н]+.
Этап 7: 1-[(3R)-3-(гидроксиметил)-4-[(7R)-7-(3-гидрокси-1-нафтил)-2-[[(2S)-1-метилпирролидин-2-ил]метокси]-5,6,7,8-тетрагидрохиназолин-4-ил] пиперазин-1-ил]проп-2-ен-1-он (Пример 29а) и 1-[(3R)-3-(гидроксиметил)-4-[(7S)-7-(3-гидрокси-1-нафтил)-2-[[(2S)-1-метилпирролидин-2-ил]метокси]-5,6,7,8-тетрагидрохиназолин-4-ил]пиперазин-1-ил]проп-2-ен-1-он (Пример 29B)
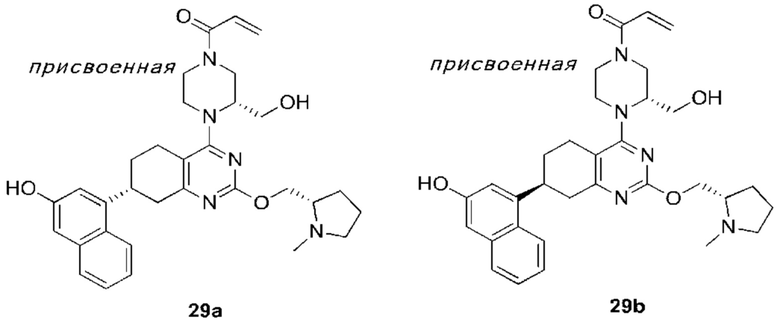
Раствор 1-[(3R)-3-[[трет-бутил(диметил)силил]оксиметил]-4-[7-[3-[трет-бутил(диметил)силил]окси-1-нафтил]-2-[[(2S)-1-метилпирролидин-2-ил]метокси]-5,6,7,8-тетрагидрохиназолин-4-ил]пиперазин-1-ил]проп-2-ен-1-она (200,0 мг, 0,2 ммоль) и фторида цезия (199,1 мг, 0,76 ммоль) в тетрагидрофуране (10 мл) перемешивали при 80°С в течение 24 часов. После завершения, после фильтрации фильтрат концентрировали при пониженном давлении с получением 120 мг неочищенного твердого вещества. Продукт дополнительно очищали с помощью препаративной ВЭЖХ со следующими условиями (колонка: колонка XBridge Prep Phenyl OBD, 5 мкм, 19*250 мм; подвижная фаза А: вода (10 ммоль/л NH4HCO3+0,1% NH3.H2O), подвижная фаза В: АЦН; скорость потока: 25 мл/мин; градиент: от 31 В до 49 В за 10 мин; 254/220 нм) с получением указанных в заголовке соединений. Абсолютная конфигурация указанных в заголовке соединений была определена по данным активности и рентгенограммы белковой структуры соединения 21b.
Пример 29а: 1-[(3R)-3-(гидроксиметил)-4-[(7R)-7-(3-гидрокси-1-нафтил)-2-[[(2S)-1-метилпирролидин-2-ил]метокси]-5,6,7,8-тетрагидрохиназоин-4-ил]пиперазин-1-ил]проп-2-ен-1-он (1,7 мг, 0,003 ммоль, выход 1,2%, белое твердое вещество). 1Н ЯМР (300 МГц, ДМСО-d6, м. д.) δ 9,67 (с, 1H, 8,06 (д, J=8,6 Гц, 1H, 7.71 (д, J=8,1 Гц, 1H, 7,50-7,20 (м, 2Н), 7,02 (с, 2Н), 6,95-6,70 (м, 1H, 6,15 (д, J=16,5 Гц, 1H, 5,72 (д, J=11,4 Гц, 1H, 4,92-4,51 (м, 1H, 4,50-4,31 (м, 1H, 4,29-4,18 (м, 2Н), 4,17-3,92 (м, 2Н), 3,91-3,73 (м, 2Н), 3,66 (д, J=13,0 Гц, 1H, 3,15-3,00 (м, 2Н), 2,99- 2,88 (м, 3H, 2,85-2,77 (м, 2Н), 2,63-2,60 (м, 1H, 2,41-2,31 (м, 4Н), 2,25-2,07 (м, 3H, 2,02-1,90 (м, 1H, 1,89-1,75 (м, 1H, 1,73-1,55 (м, 3H. ЖХМС (ИЭР, m/z): 558,3 [М+Н]+.
Пример 29b: 1-[(3R)-3-(гидроксиметил)-4-[(7S)-7-(3-гидрокси-1-нафтил)-2-[[(2S)-1-метилпирролидин-2-ил]метокси]-5,6,7,8-тетрагидрохиназол ин-4-ил]пиперазин-1-ил]проп-2-ен-1-он (4 мг, 0,007 ммоль, выход 2,8%, белое твердое вещество). 1Н ЯМР (400 МГц, ДМСО-d6, м. д.) δ 9,66 (с, 1H, 8,06 (д, J=8,7 Гц, 1H, 7,70 (дд, J=8,2, 1,4 Гц, 1H, 7,44-7,35 (м, 1H, 7,34-7,26 (м, 1H, 7,04-6,96 (м, 2Н), 6,89-6,72 (м, 1H, 6,14 (дд, J=17,0, 2,4 Гц, 1H, 5,71 (дд, J=10,4, 2,4 Гц, 1H, 5,07-4,76 (м, 1H, 4,47-4,22 (м, 3H, 4,19-4,02 (м, 2Н), 4,00-3,76 (м, 3H, 3,75-3,54 (м, 2Н), 3,20-2.72 (м, 7Н), 2,35 (с, 3H, 2,25-2,06 (м, 2Н), 2,00-1,88 (м, 2Н), 1,86-1,76 (м, 1H, 1,74-1,53 (м, 3H. ЖХМС (ИЭР, m/z): 558,3 [М+Н]+.
Примеры 30а и 30b

1-[(3S)-4-[(7S)-2-[[(2S,4S)-4-фтор-1-метил-пирролидин-2-ил]метокси]-7-(3-гидрокси-1-нафтил)-5,6,7,8-тетрагидрохиназолин-4-ил]-3-метил-пиперазин-1-ил]проп-2-ен-1-он (Пример 30а); и
1-[(3S)-4-[(7R)-2-[[(2S,4S)-4-фтор-1-метил-пирролидин-2-ил]метокси]-7-(3-гидрокси-1-нафтил)-5,6,7,8-тетрагидрохиназолин-4-ил]-3-метил-пиперазин-1-ил]проп-2-ен-1-он (Пример 30b)

Этап 1: трет-бутил-диметил-[[4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-2-нафтил]окси]силан

В атмосфере азота раствор (4-бром-2-нафтил)окси-трет-бутил-диметил-силана (20,0 г, 59,2 ммоль), бис(пинаколато)дибора (45 г, 177,8 ммоль), дихлорметанового комплекса 1,1'-бис(дифенилфосфино)ферроцен-палладия (II) дихлорида (4,9 г, 5,9 ммоль) и ацетата калия (17,4 г, 177,8 ммоль) в 1,4-диоксане (200 мл) перемешивали при 80°С в течение 2 часов. После завершения полученный в результате раствор разводили водой и экстрагировали дихлорметаном. Органические слои собирали и промывали солевым раствором. Органический слой сушили над безводным сульфатом натрия и концентрировали в вакууме. Остаток очищали с помощью флэш-хроматографии на силикагеле с элюированием гексаном/этилацетатом (10/1) с получением трет-бутил-диметил-[[4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-2-нафтил]окси]силана (18 г, 46,8 ммоль, выход 79%) в виде желтого твердого вещества. ЖХМС (ИЭР, m/z): 385,2 [М+Н]+.
Этап 2: 3-[3-[трет-бутил(диметил)силил]окси-1-нафтил]циклогексанон
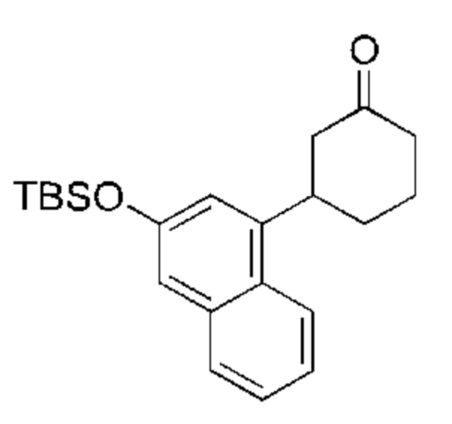
В атмосфере азота раствор 2-циклогексен-1-она (12,5 г, 130,08 ммоль), трет-бутил-диметил-[[4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-2-нафтил]окси]силана (10,0 г, 26,0 ммоль), фосфата калия (16,55 г, 78,0 ммоль) и димера хлор(1,5-циклооктадиен)родия (I) (1,28 г, 2,6 ммоль) в 1,4-диоксане (100 мл) и воде (20 мл) перемешивали при 25°С в течение 30 минут.После завершения реакцию разводили дихлорметаном, промывали водой и сушили над безводным сульфатом натрия. Органический слой концентрировали в вакууме. Остаток очищали с помощью флэш-хроматографии на силикагеле с элюированием гексаном/этилацетатом (10/1) с получением 3-[3-[трет-бутил(диметил)силил]окси-1-нафтил]циклогексанона (8 г, 22,5 ммоль, выход 86,7%) в виде белого твердого вещества. ЖХМС (ИЭР, m/z): 355,2 [М+Н]+.
Этап 3: этил 4-[3-[трет-бутил(диметил)силил]окси-1-нафтил]-2-оксо-циклогексанкарбоксилат

В атмосфере азота раствор 3-[3-[трет-бутил(диметил)силил]окси-1-нафтил]циклогексанона (10,0 г, 28,2 ммоль) в тетрагидрофуране (100 мл) перемешивали при -78°С в течение 2 минут. Потом добавляли бис(триметилсилил)амид лития (1Mb ТГФ) (84 мл, 84,6 ммоль) и перемешивали при -78°С в течение 1 часа. Потом добавляли этилцианоформиат (4,19 г, 42,3 ммоль) и перемешивали при -78°С в течение 30 минут. Реакцию гасили водой, экстрагировали этилацетатом, сушили над безводным сульфатом натрия и концентрировали в вакууме. Остаток очищали с помощью флэш-хроматографии на силикагеле с элюированием гексаном/этилацетатом (20/1) с получением этил 4-[3-[трет-бутил(диметил)силил]окси-1-нафтил]-2-оксо-циклогексанкарбоксилата (7 г, 16,4 ммоль, выход 58,2%) в виде желтого масла. ЖХМС (ИЭР, m/z): 427,2 [М+Н]+.
Этап 4:7-[3-[трет-бутил(диметил)силил]окси-1-нафтил]-2-метилсульфанил-5,6,7,8-тетрагидрохиназолин-4-ол

Раствор этил 4-[3-[трет-бутил(диметил)силил]окси-1-нафтил]-2-оксо-циклогексанкарбоксилата (10,0 г, 23,4 ммоль), 2-метил-2-тиопсевдомочевины сульфата (65,25 г, 234,4 ммоль) и бикарбоната натрия (39,3 г, 468,8 ммоль) в этаноле (120 мл) и воде (25 мл) перемешивали при 50°С в течение 3 часов. После завершения реакцию разводили водой и экстрагировали дихлорметаном. Потом органические слои объединяли, сушили над безводным сульфатом натрия и концентрировали в вакууме. Остаток очищали с помощью флэш-хроматографии на силикагеле с элюированием дихлорметаном/метанолом (97/3) с получением 7-[3-[трет-бутил(диметил)силил]окси-1-нафтил]-2-метилсульфанил-5,6,7,8-тетрагидрохиназолин-4-ола (5 г, 11,0 ммоль, выход 47,1%) в виде белого твердого вещества. ЖХМС (ИЭР, m/z): 453,2 [М+Н]+.
Этап 5: трет-бутил (3S)-4-[7-[3-[трет-бутил(диметил)силил]окси-1-нафтил]-2-метилсульфанил-5,6,7,8-тетрагидрохиназолин-4-ил]-3-метил-пиперазин-1-карбоксилат

Раствор 7-[3-[трет-бутил(диметил)силил]окси-1-нафтил]-2-метилсульфанил-5,6,7,8-тетрагидрохиназолин-4-ола (2,0 г, 4,4 ммоль) и N,N-диизопропилэтиламина (2,8 г, 22,0 ммоль) в дихлорметане (20 мл) перемешивали при 25°С в течение 3 минут. Потом добавляли трифторметансульфоновый ангидрид (2,49 г, 8,8 ммоль) и перемешивали при 25°С в течение 1 часа. После завершения реакцию концентрировали при пониженном давлении. Потом остаток, N,N-диизопропилэтиламин (4,41 г, 34,2 ммоль) и трет-бутил (3S)-3-метил-1-пиперазинкарбоксилат (1,3 г, 6,8 ммоль) в 1,4-диоксане (30 мл) перемешивали при 110°С в течение 16 часов. После завершения полученный в результате раствор концентрировали в вакууме. Остаток очищали с помощью флэш-хроматографии на силикагеле с элюированием гексаном/этилацетатом (7/1) с получением трет-бутил (3S)-4-[7-[3-[трет-бутил(диметил)силил]окси-1-нафтил]-2-метилсульфанил-5,6,7,8-тетрагидрохиназолин-4-ил]-3-метил-пиперазин-1-карбоксилата (1,8 г, 2,8 ммоль, выход 63,6%) в виде желтого твердого вещества. ЖХМС (ИЭР, m/z): 635,3 [М+Н]+.
Этап 6: трет-бутил (3S)-4-[7-[3-[трет-бутил(диметил)силил]окси-1-нафтил]-2-метилсульфонил-5,6,7,8-тетрагидрохиназолин-4-ил]-3-метил-пиперазин-1 -карбоксилат
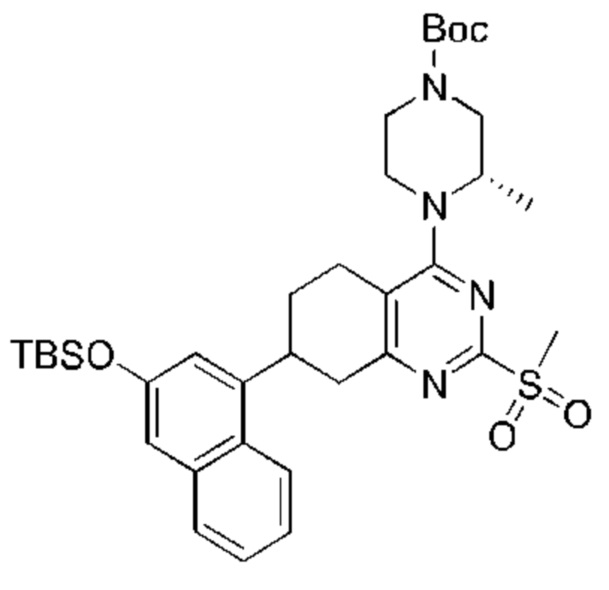
Раствор трет-бутил (3S)-4-[7-[3-[трет-бутил(диметил)силил]окси-1-нафтил]-2-метилсульфанил-5,6,7,8-тетрагидрохиназолин-4-ил]-3-метил-пиперазин-1-карбоксилата (2,0 г, 3,1 ммоль) и 3-хлорпероксибензойной кислоты (1,63 г, 9,4 ммоль) в дихлорметане (20 мл) перемешивали при 25°С в течение 2 часов. После завершения полученный в результате раствор гасили насыщенным раствором сульфита натрия. Полученный в результате раствор экстрагировали этилацетатом, сушили над безводным сульфатом натрия и концентрировали в вакууме с получением трет-бутил (3S)-4-[7-[3-[трет-бутил(диметил)силил]окси-1-нафтил]-2-метилсульфонил-5,6,7,8-тетрагидрохиназолин-4-ил]-3-метил-пиперазин-1-карбоксилата (1,5 г, 2,2 ммоль, выход 71%) в виде желтого твердого вещества. ЖХМС (ИЭР, m/z): 667,3 [М+Н]+.
Этап 7: трет-бутил (3S)-4-[2-[[(2S,4S)-4-фтор-1-метил-пирролидин-2-ил]метокси]-7-(3-гидрокси-1-нафтил)-5,6,7,8-тетрагидрохиназолин-4-ил]-3-метил-пиперазин-1-карбоксилата

Раствор [(2S,4S)-4-фтор-1-метил-пирролидин-2-ил]метанола (2,0 г, 14,99 ммоль) в N,N-диметилформамиде (20 мл) перемешивали при 25°С в течение 5 минут. Потом добавляли гидрид натрия (479,8 мг, 11,9 ммоль, 60% дисперсия в минеральном масле) и перемешивали при 0°С в течение 30 минут. Потом добавляли трет-бутил (3S)-4-[7-[3-[трет-бутил(диметил)силил]окси-1-нафтил]-2-метилсульфонил-5,6,7,8-тетрагидрохиназолин-4-ил]-3-метил-пиперазин-1-карбоксилата (2,0 г, 3 ммоль) и перемешивали при 25°С в течение 1 часа. После завершения полученный в результате раствор доводили до рН 8 насыщенным раствором хлорида аммония. Растворитель экстрагировали этилацетатом, промывали водой. Органический слой сушили над безводным сульфатом натрия и концентрировали в вакууме. Остаток очищали с помощью флэш-хроматографии на силикагеле с элюированием дихлорметаном/метанолом (10/1) с получением трет-бутил (3S)-4-[2-[[(2S,4S)-4фтор-1-метил-пирролидин-2-ил]метокси]-7-(3-гидрокси-1-нафтил)-5,6,7,8-тетрагидрохиназолин-4-ил]-3-метил-пиперазин-1-карбоксилата (500 мг, 0,82 ммоль, выход 27,5%) в виде желтого твердого вещества. ЖХМС (ИЭР, m/z): 606,3 [М+Н]+
Этап 8: трет-бутил-[[4-[2-[[(2S,4S)-4-фтор-1-метил-пирролидин-2-ил]метокси]-4-[(2S)-2-метилпиперазин-1-ил]-5,6,7,8-тетрагидрохиназолин-7-ил]-2-нафтил]окси]-диметил-силан
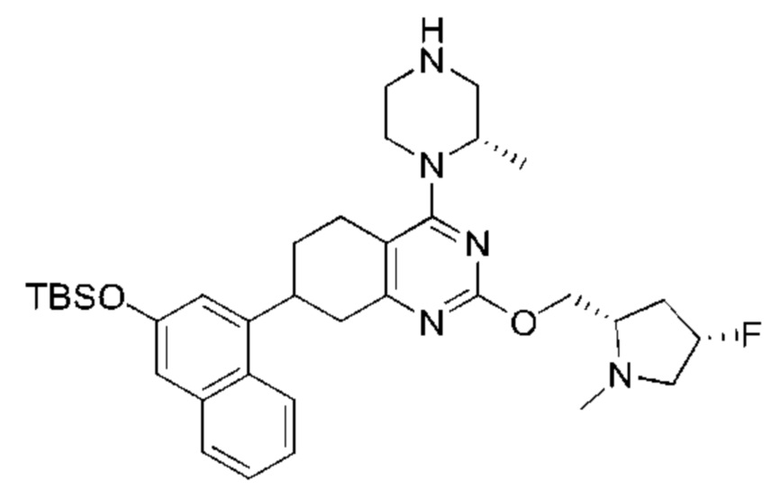
Раствор трет-бутил (3S)-4-[2-[[(2S,4S)-4-фтор-1 -метил-пирролидин-2-ил]метокси]-7-(3-гидрокси-1-нафтил)-5,6,7,8-тетрагидрохиназолин-4-ил]-3-метил-пиперазин-1-карбоксилата (500,0 мг, 0,83 ммоль) и трифторуксусной кислоты (1882,0 мг, 16,5 ммоль) в дихлорметане (25 мл) перемешивали при 25°С в течение 1 часа. После завершения полученный в результате раствор концентрировали в вакууме и растворяли в дихлорметане (20 мл). Потом имидазол (168,58 мг, 2,48 ммоль) и N,N-диизопропилэтиламин (2,1 г, 16,51 ммоль) в дихлорметане (25 мл) перемешивали при 25°С в течение 3 минут. Потом добавляли трет-бутилдиметилсилилхлорид (249,2 мг, 1,65 ммоль) и перемешивали при 25°С в течение 2 часов. После завершения полученный в результате раствор концентрировали в вакууме. Остаток очищали с помощью флэш-хроматографии на силикагеле с элюированием метанолом/водой (30:20) с получением трет-бутил-[[4-[2-[[(2S,4S)-4-фтор-1-метил-пирролидин-2-ил]метокси]-4-[(2S)-2-метилпиперазин-1-ил]-5,6,7,8-тетрагидрохиназолин-7-ил]-2-нафтил]окси]-диметил-силана (360 мг, 0,58 ммоль, выход 70%) в виде белого твердого вещества. ЖХМС (ИЭР, m/z): 620,3 [М+Н]+
Этап 9: 1-[(3S)-4-[7-[3-[трет-бутил(диметил)силил]окси-1-нафтил]-2-[[(2S,4S)-4-фтор-1-метил-пирролидин-2-ил]метокси]-5,6,7,8-тетрагидрохиназолин-4-ил]-3-метил-пиперазин-1-ил]проп-2-ен-1-он
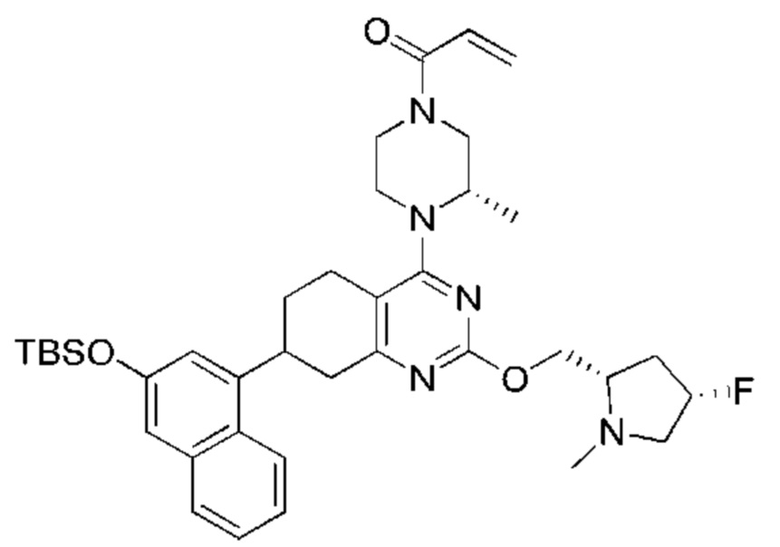
Раствор трет-бутил-[[4-[2-[[(2S,4S)-4-фтор-1-метил-пирролидин-2-ил]метокси]-4-[(28)-2-метилпиперазин-1-ил]-5,6,7,8-тетрагидрохиназолин-7-ил]-2-нафтил]окси]-диметил-силана (360,0 мг, 0,58 ммоль) и N,N-диизопропилэтиламина (224,7 мг, 1,74 ммоль) в дихлорметане (9 мл) перемешивали при 25°С в течение 3 минут. Потом добавляли акрилоилхлорид (63,0 мг, 0,70 ммоль) и перемешивали при 25°С в течение 30 минут. После завершения полученный в результате раствор концентрировали в вакууме. Остаток очищали с помощью флэш-хроматографии на силикагеле с элюированием дихлорметаном/метанолом (20/1) с получением 1-[(3S)-4-[7-[3-[трет-бутил(диметил)силил]окси-1-нафтил]-2-[[(2S,4S)-4-фтор-1-метил-пирролидин-2-ил]метокси]-5,6,7,8-тетрагидрохиназолин-4-ил]-3-метил-пиперазин-1-ил]проп-2-ен-1-она (320 мг, 0,47 ммоль, выход 81,8%) в виде желтого твердого вещества. ЖХМС (ИЭР, m/z): 674,3 [М+Н]+
Этап 10: один 1-[(3S)-4-[(7S)-2-[[(2S,4S)-4-фтор-1-метил-пирролидин-2-ил]метокси]-7-(3-гидрокси-1-нафтил)-5,6,7,8-тетрагидрохиназолин-4-ил]-3-метил-пиперазин-1-ил]проп-2-ен-1-он (Пример 30а) и 1-[(3S)-4-[(7R)-2-[[(2S,4S)-4-фтор-l-метил-пирролидин-2-ил]метокси]-7-(3-гидрокси-1-нафтил)-5,6,7,8-тетрагидрохиназолин-4-ил]-3-метил-пиперазин-1-ил]проп-2-ен-1-(Пример 30b)
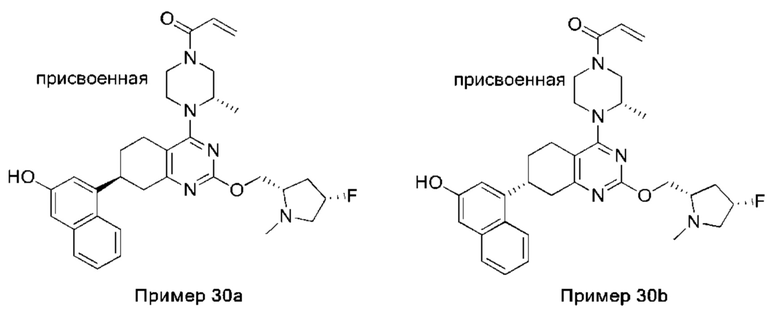
Раствор 1-[(3S)-4-[7-[3-[трет-бутил(диметил)силил]окси-1-нафтил]-2-[[(2S,4S)-4-фтор-1-метил-пирролидин-2-ил]метокси]-5,6,7,8-тетрагидрохиназолин-4-ил]-3-метил-пиперазин-1-ил]проп-2-ен-1-она (360,0 мг, 0,53 ммоль) и фторида цезия (324,7 мг, 2,14 ммоль) в тетрагидрофуране (5 мл) перемешивали при 25°С в течение 1 часа. После завершения полученный в результате раствор разводили водой и экстрагировали дихлорметаном. Потом органические слои собирали, сушили над безводным сульфатом натрия и концентрировали в вакууме. Остаток очищали с помощью флэш-хроматографии на силикагеле с элюированием дихлорметаном/метанолом (10/1) с получением неочищенного твердого вещества. Неочищенный продукт очищали с помощью препаративной ВЭЖХ с получением 150 мг белого твердого вещества со следующими условиями: колонка: колонка XBridge Shield RP18 OBD, 30*150 мм, 5 мкм; подвижная фаза А: вода (10 ммоль/л NH4HCO3), подвижная фаза В: АЦН; скорость потока: 60 мл/мин; градиент: от 28 В до 42 В за 10 мин; 254 нм; RT: 8,52. Продукт дополнительно очищали с помощью хиральной препаративной ВЭЖХ со следующими условиями: (колонка CHIRALPAK IA-3, 0,46*5 см, 3 мкм; подвижная фаза: (гексан:ДХМ=3:1) (0,1% ДЭА): EtOH=50:50; детектор, УФ 254 нм) с получением указанных в заголовке соединений. Абсолютная конфигурация указанных в заголовке соединений была определена по данным активности и рентгенограммы белковой структуры соединения 21b.
Пример 30а: 1-[(3S)-4-[(7S)-2-[[(2S,4S)-4-фтор-1-метил-пирролидин-2-ил]метокси]-7-(3-гидрокси-1-нафтил)-5,6,7,8-тетрагидрохиназолин-4-ил]-3-метил-пиперазин-1-ил]проп-2-ен-1-он (49,8 мг, 0,089 ммоль, выход 16,7%). 1H ЯМР (400 МГц, ДМСО-d6, м. д.) δ 9,66 (с, 1H, 8,08 (д, J=8,6 Гц, 1H, 7,70 (дд, J=8,3, 1,3 Гц, 1H, 7,40 (т, J=7,2 Гц, 1H, 7,31 (т, J=7,2 Гц, 1H, 7,02 (с, 2Н), 6,93-6,75 (м, 1H, 6,16 (дд, J=16,8, 6,8 Гц, 1H, 5,72 (дд, J=10,4, 2,4 Гц, 1H, 5,23-5,03 (м, 1H, 4,38-4,22 (м, 2Н), 4,19-4,04 (м, 2Н), 3,98-3,75 (с, 2Н), 3,66-3,43 (м, 2Н), 3,35-3,20 (м, 1H, 3,19-3,03 (м, 2Н), 3,00-2,85 (м, 2Н), 2,83-2,72 (м, 1Н),2,65-2,55 (м, 2Н), 2,48-2,37 (м, 1H, 2,39-2,27 (м, 4Н), 2,13 (д, J=12,4 Гц, 1H, 1,90-1,69 (м, 2Н), 1,02-0,98 (м, 3Н). ЖХМС (ИЭР, m/z): 560,3 [М+Н]+. Хиральная ВЭЖХ: колонка: CHIRALPAK IC-3, 4,6*50 мм, 3 мкм; обнаружение на 254 нм; (гексан/ДХМ=3:1) (0,1% ДЭА): EtOH=50:50; скорость потока: 1 мл/мин; время удержания: 2,482 мин (более медленный пик).
Пример 30b: 1-[(3S)-4-[(7R)-2-[[(2S,4S)-4-фтор-1-метил-пирролидин-2-ил]метокси]-7-(3-гидрокси-1-нафтил)-5,6,7,8-тетрагидрохиназолин-4-ил]-3-метил-пиперазин-1-ил]проп-2-ен-1-он (43,8 мг, 0,078 ммоль, выход 14,7%). 1H ЯМР (400 МГц, ДМСОА м. д.) δ 9,66 (с, 1H, 8,08 (д, J=8,6 Гц, 1H, 7,70 (дд, J=8,3, 1,3 Гц, 1H, 7,40 (т, J=7,2 Гц, 1H, 7,31 (т, J=7,2 Гц, 1H, 7,02 (с, 2Н), 6,93-6,75 (м, 1H, 6,16 (дд, J=16,8, 6,8 Гц, 1H, 5,72 (дд, J=10,4, 2,4 Гц, 1H, 5,23-5,03 (м, 1H, 4,38-4,22 (м, 2Н), 4,19-4,04 (м, 2Н), 3,98-3,75 (с, 2Н), 3,66-3,43 (м, 2Н), 3,35-3,20 (м, 1H, 3,19-3,03 (м, 2Н), 3,00-2,85 (м, 2Н), 2,83-2,72 (м, 1Н),2,65-2,55 (м, 2Н), 2,48-2,37 (м, 1H, 2,39-2,27 (м, 4Н), 2,13 (д, J=12,4 Гц, 1H, 1,90-1,69 (м, 2Н), 1,02-0,98 (м, 3Н). ЖХМС (ИЭР, m/z): 560,3 [М+Н]+. Хиральная ВЭЖХ: колонка: CHIRALPAK IC-3, 4,6*50 мм, 3 мкм; обнаружение на 254 нм; (гексан/ДХМ=3:1) (0,1% ДЭА): EtOH=50:50; скорость потока: 1 мл/мин; время удержания: 1,306 мин (более быстрый пик).
Примеры 31a и 31b

1-[(3S)-4-[(7S)-2-[[(2S,4R)-4-фтор-1-метил-пирролидин-2-ил]метокси]-7-(3-гидрокси-1-нафтил)-5,6,7,8-тетрагидрохиназолин-4-ил]-3-метил-пиперазин-1-ил] проп-2-ен-1-он (Пример 31а); и
1-[(3S)-4-[(7R)-2-[[(2S,4R)-4-фтор-1-метил-пирролидин-2-ил]метокси]-7-(3-гидрокси-1-нафтил)-5,6,7,8-тетрагидрохиназолин-4-ил]-3-метил-пиперазин-1-ил]проп-2-ен-1-он (Пример 31b)
Этап 1: трет-бутил-диметил-[[4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-2-нафтил]окси]силан

В атмосфере азота раствор (4-бром-2-нафтил)окси-трет-бутил-диметил-силана (20,0 г, 59,2 ммоль), бис(пинаколато)дибора (45 г, 177,8 ммоль), дихлорметанового комплекса 1,1'-бис(дифенилфосфино)ферроцен-палладия (II) дихлорида (4,9 г, 5,9 ммоль) и ацетата калия (17,4 г, 177,8 ммоль) в 1,4-диоксане (200 мл) перемешивали при 80°С в течение 2 часов. После завершения полученный в результате раствор концентрировали в вакууме. Полученный в результате раствор разводили дихлорметаном и промывали солевым раствором. Органический слой сушили над безводным сульфатом натрия и концентрировали в вакууме. Остаток очищали с помощью флэш-хроматографии на силикагеле с элюированием гексаном/этилацетатом (10/1) с получением трет-бутил-диметил-[[4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-2-нафтил]окси]силана (18 г, 46,8 ммоль, выход 79%) в виде желтого твердого вещества. ЖХМС (ИЭР, m/z): 385,2 [М+Н]+.
Этап 2: 3-[3-[трет-бутил(диметил)силил]окси-1-нафтил]циклогексанон
В атмосфере азота раствор 2-циклогексен-1-он (12,5 г, 130,08 ммоль), трет-бутил-д иметил-[[4-(4,4,5,5 -тетраметил-1,3,2-диоксаборолан-2-ил)-2-нафтил]окси]силана (10,0 г, 26,0 ммоль), фосфата калия (16,55 г, 78,0 ммоль) и димера хлор(1,5-циклооктадиен)родия (I) (1,28 г, 2,6 ммоль) в 1,4-диоксане (100 мл) и воде (20 мл) перемешивали при 25°С в течение 30 минут. После завершения реакцию разводили дихлорметаном, промывали водой и сушили над безводным сульфатом натрия. Органический слой концентрировали в вакууме. Остаток очищали с помощью флэш-хроматографии на силикагеле с элюированием гексаном/этилацетатом (10/1) с получением 3-[3-[трет-бутил(диметил)силил]окси-1-нафтил]циклогексанона (8 г, 22,5 ммоль, выход 86,7%) в виде белого твердого вещества. ЖХМС (ИЭР, m/z): 355,2 [М+Н]+.
Этап 3: этил 4-[3-[трет-бутил(диметил)силил]окси-1-нафтил]-2-оксо-циклогексанкарбоксилат
В атмосфере азота раствор 3-[3-[трет-бутил(диметил)силил]окси-1-нафтил]циклогексанона (10,0 г, 28,2 ммоль) в тетрагидрофуране (100 мл) перемешивали при -78°С в течение 2 минут. Потом добавляли бис(триметилсилил)амид лития (1Mb ТГФ) (84 мл, 84,6 ммоль) и перемешивали при -78°С в течение 1 часа. Потом добавляли этилцианоформиат (4,19 г, 42,3 ммоль) и перемешивали при -78°С в течение 30 минут. После завершения реакцию гасили водой, экстрагировали этилацетатом, сушили над безводным сульфатом натрия и концентрировали в вакууме. Остаток очищали с помощью флэш-хроматографии на силикагеле с элюированием гексаном/этилацетатом (20/1) с получением этил 4-[3-[трет-бутил(диметил)силил]окси-1-нафтил]-2-оксо-циклогексанкарбоксилата (7 г, 16,4 ммоль, выход 58,2%) в виде желтого масла. ЖХМС (ИЭР, m/z): 427,2 [М+Н]+.
Этап 4: 7-[3-[трет-бутил(диметил)силил]окси-1-нафтил]-2-метилсульфанил-5,6,7,8-тетрагидрохиназолин-4-ол

Раствор этил 4-[3-[трет-бутил(диметил)силил]окси-1-нафтил]-2-оксо-циклогексанкарбоксилата (10,0 г, 23,4 ммоль), 2-метил-2-тиопсевдомочевины сульфата (65,2 г, 234,4 ммоль) и бикарбоната натрия (39,3 г, 468,8 ммоль) в этаноле (120 мл) и воде (25 мл) перемешивали при 50°С в течение 3 часов. После завершения реакцию разводили водой и экстрагировали дихлорметаном. Потом органические слои объединяли, сушили над безводным сульфатом натрия и концентрировали в вакууме. Остаток очищали с помощью флэш-хроматографии на силикагеле с элюированием дихлорметаном/метанолом (97/3) с получением 7-[3-[трет-бутил(диметил)силил]окси-1-нафтил]-2-метилсульфанил-5,6,7,8-тетрагидрохиназолин-4-ола (5 г, 11,0 ммоль, выход 47,1%) в виде белого твердого вещества. ЖХМС (ИЭР, m/z): 453,2 [М+Н]+.
Этап 5: трет-бутил (3S)-4-[7-[3-[трет-бутил(диметил)силил]окси-1-нафтил]-2-метилсульфанил-5,6,7,8-тетрагидрохиназолин-4-ил]-3-метил-пиперазин-1-карбоксилат
Раствор 7-[3-[трет-бутил(диметил)силил]окси-1-нафтил]-2-метилсульфанил-5,6,7,8-тетрагидрохиназолин-4-ола (2,0 г, 4,4 ммоль) и N,N-диизопропилэтиламина (2,8 г, 22,0 ммоль) в дихлорметане (20 мл) перемешивали при 25°С в течение 3 минут. Потом добавляли трифторметансульфоновый ангидрид (2,49 г, 8,8 ммоль) и перемешивали при 25°С в течение 1 часа. После завершения реакцию концентрировали при пониженном давлении. Потом остаток, N,N-диизопропилэтиламин (4,41 г, 34,2 ммоль) и трет-бутил (3S)-3-метил-1-пиперазинкарбоксилат (1,37 г, 6,8 ммоль) в 1,4-диоксане (30 мл) перемешивали при 110°С в течение 16 часов. После завершения полученный в результате раствор концентрировали в вакууме. Остаток очищали с помощью флэш-хроматографии на силикагеле с элюированием гексаном/этилацетатом (7/1) с получением трет-бутил (3S)-4-[7-[3-[трет-бутил(диметил)силил]окси-1-нафтил]-2-метилсульфанил-5,6,7,8-тетрагидрохиназолин-4-ил]-3-метил-пиперазин-1-карбоксилата (1,8 г, 2,8 ммоль, выход 63,6%) в виде желтого твердого вещества. ЖХМС (ИЭР, m/z): 635,3 [М+Н]+.
Этап 6: трет-бутил (3S)-4-[7-[3-[трет-бутил(диметил)силил]окси-1-нафтил]-2-метилсульфонил-5,6,7,8-тетрагидрохиназолин-4-ил]-3-метил-пиперазин-1-карбоксилат

Раствор трет-бутил (3S)-4-[7-[3-[трет-бутил(диметил)силил]окси-1-нафтил]-2-метилсульфанил-5,6,7,8-тетрагидрохиназолин-4-ил]-3-метил-пиперазин-1-карбоксилата (2,0 г, 3,1 ммоль) и 3-хлорпероксибензойной кислоты (1,63 г, 9,4 ммоль) в дихлорметане (20 мл) перемешивали при 25°С в течение 2 часов. После завершения полученный в результате раствор гасили насыщенным раствором сульфита натрия. Полученный в результате раствор экстрагировали этилацетатом, сушили над безводным сульфатом натрия и концентрировали в вакууме с получением трет-бутил (3S)-4-[7-[3-[трет-бутил(диметил)силил]окси-1-нафтил]-2-метилсульфонил-5,6,7,8-тетрагидрохиназолин-4-ил]-3-метил-пиперазин-1-карбоксилата (1,5 г, 2,2 ммоль, выход 71%) в виде желтого твердого вещества. ЖХМС (ИЭР, m/z): 667,3 [М+Н]+.
Этап 7: трет-бутил (3S)-4-[2-[[(2S,4R)-4-фтор-1-метил-пирролидин-2-ил]метокси]-7-(3-гидрокси-1-нафтил)-5,6,7,8-тетрагидрохиназолин-4-ил]-3-метил-пиперазин-1-карбоксилат
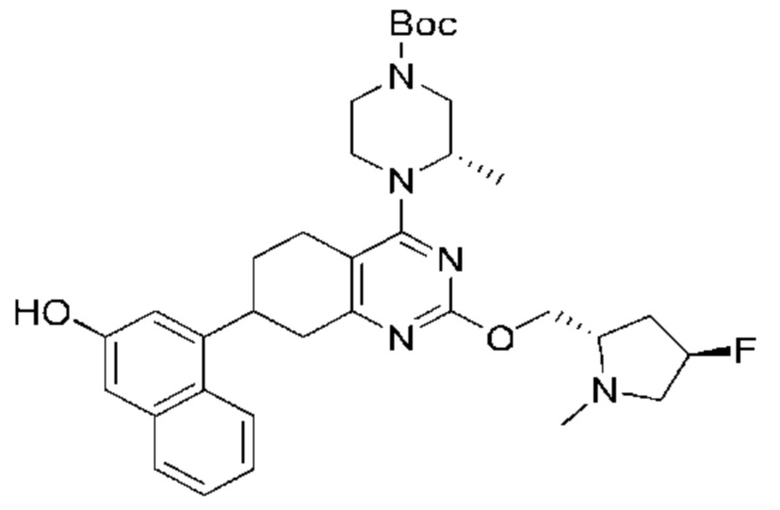
Раствор [(2S,4R)-4-фтор-1-метил-пирролидин-2-ил]метанола (2,0 г, 14,99 ммоль) в N,N-диметилформамиде (20 мл) перемешивали при 25°С в течение 5 минут. Потом добавляли гидрид натрия (479,8 мг, 11,9 ммоль, 60% дисперсия в минеральном масле) и перемешивали при 0°С в течение 30 минут. Потом добавляли трет-бутил (3S)-4-[7-[3-[трет-бутил(диметил)силил]окси-1-нафтил]-2-метилсульфонил-5,6,7,8-тетрагидрохиназолин-4-ил]-3-метил-пиперазин-1-карбоксилат (2,0 г, 3 ммоль) и перемешивали при 25°С в течение 1 часа. После завершения полученный в результате раствор доводили до рН 8 насыщенным раствором хлорида аммония. Растворитель экстрагировали этилацетатом, промывали водой. Органический слой сушили над безводным сульфатом натрия и концентрировали в вакууме. Остаток очищали с помощью флэш-хроматографии на силикагеле с элюированием дихлорметаном/метанолом (10/1) с получением трет-бутил (3S)-4-[2-[[(2S,4R)-4-фтор-1-метил-пирролидин-2-ил]метокси]-7-(3-гидрокси-1-нафтил)-5,6,7,8-тетрагидрохиназолин-4-ил]-3-метил-пиперазин-1-карбоксилата (500 мг, 0,82 ммоль, выход 27,5%) в виде желтого твердого вещества. ЖХМС (ИЭР, m/z): 606,3 [М+Н]+.
Этап 8: трет-бутил-[[4-[2-[[(2S,4R)-4-фтор-1-метил-пирролидин-2-ил]метокси]-4-[(2S)-2-метилпиперазин-1-ил]-5,6,7,8-тетрагидрохиназолин-7-ил]-2-нафтил]окси]-диметил-силан
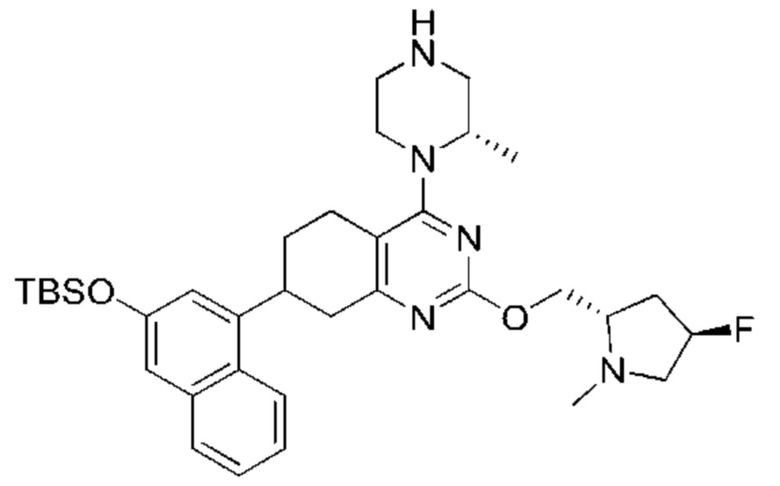
Раствор трет-бутил (3 S)-4-[2-[[(2S,4R)-4-фтор-l-метил-пирролидин-2-ил]метокси]-7-(3-гидрокси-1-нафтил)-5,6,7,8-тетрагидрохиназолин-4-ил]-3-метил-пиперазин-1-карбоксилата (500,0 мг, 0,83 ммоль) и трифторуксусной кислоты (1,8 г, 16,5 ммоль) в дихлорметане (25 мл) перемешивали при 25°С в течение 1 часа, полученный в результате раствор концентрировали в вакууме. Остаток, имидазол (168,5 мг, 2,48 ммоль) и N,N-диизопропилэтиламин (2,1 г, 16,51 ммоль) в дихлорметане (25 мл) перемешивали при 25°С в течение 3 минут. Потом добавляли трет-бутилдиметилсилил хлорид (249,2 мг, 1,65 ммоль) и перемешивали при 25°С в течение 2 часов. После завершения полученный в результате раствор концентрировали в вакууме. Остаток очищали с помощью флэш-хроматографии на силикагеле с элюированием метанолом/водой (30/20) с получением трет-бутил-[[4-[2-[[(2S,4R)-4-фтор-1-метил-пирролидин-2-ил]метокси]-4-[(2S)-2-метилпиперазин-1-ил]-5,6,7,8-тетрагидрохиназолин-7-ил]-2-нафтил]окси]-диметил-силана (360 мг, 0,58 ммоль, выход 70%) в виде белого твердого вещества. ЖХМС (ИЭР, m/z): 620,3 [М+Н]+.
Этап 9: 1-[(3S)-4-[7-[3-[трет-бутил(диметил)силил]окси-1-нафтил]-2-[[(2S,4R)-4-фтор-1-метил-пирролидин-2-ил]метокси]-5,6,7,8-тетрагидрохиназолин-4-ил]-3-метил-пиперазин-1-ил]проп-2-ен-1-он
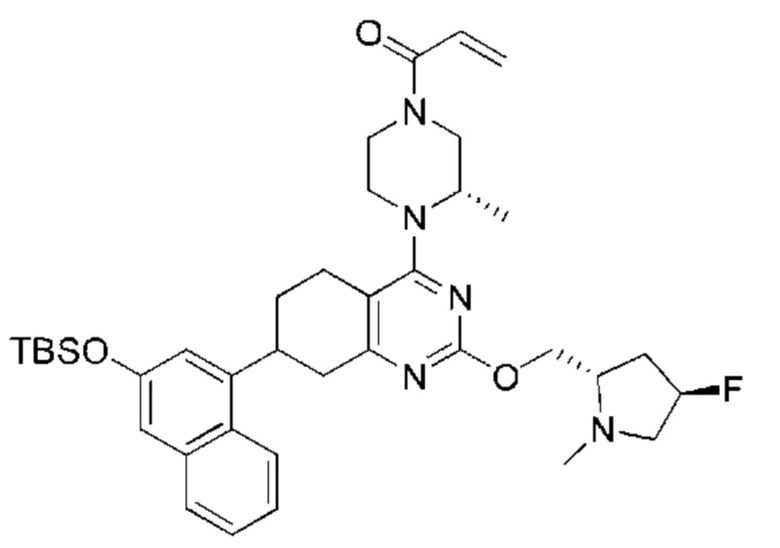
Раствор трет-бутил-[[4-[2-[[(2S,4R)-4-фтор-1-метил-пирролидин-2-ил]метокси]-4-[(2S)-2-метилпиперазин-1-ил]-5,6,7,8-тетрагидрохиназолин-7-ил]-2-нафтил]окси]-диметил-силана (360,0 мг, 0,58 ммоль) и N,N-диизопропилэтиламина (224,7 мг, 1,74 ммоль) в дихлорметане (9 мл) перемешивали при 25°С в течение 3 минут. Потом добавляли акрилоилхлорид (63,0 мг, 0,70 ммоль) и перемешивали при 25°С в течение 30 минут. После завершения полученный в результате раствор концентрировали в вакууме. Остаток очищали с помощью флэш-хроматографии на силикагеле с элюированием дихлорметаном/метанолом (20/1) с получением 1-[(3S)-4-[7-[3-[трет-бутил(диметил)силил]окси-1-нафтил]-2-[[(2S,4R)-4-фтор-1-метил-пирролидин-2-ил]метокси]-5,6,7,8-тетрагидрохиназолин-4-ил]-3-метил-пиперазин-1-ил]проп-2-ен-1-она (320 мг, 0,47 ммоль, выход 81,8%) в виде желтого твердого вещества. ЖХМС (ИЭР, m/z): 674,3 [М+Н]+.
Этап 10: 1-[(3S)-4-[(7S)-2-[[(2S,4R)-4-фтор-1-метил-пирролидин-2-ил]метокси]-7-(3-гидрокси-1-нафтил)-5,6,7,8-тетрагидрохиназолин-4-ил]-3-метил-пиперазин-1-ил]проп-2-ен-1-он (Пример 31а) и 1-[(3S)-4-[(7R)-2-[[(2S,4R)-4-фтор-l-метил-пирролидин-2-ил]метокси]-7-(3-гидрокси-1-нафтил)-5,6,7,8-тетрагидрохиназолин-4-ил]-3-метил-пиперазин-1-ил]проп-2-ен-1-он (Пример 31b)

Раствор 1-[(3S)-4-[7-[3-[трет-бутил(диметил)силил]окси-1-нафтил]-2-[[(2S,4R)-4-фтор-1-метил-пирролидин-2-ил]метокси]-5,6,7,8-тетрагидрохиназолин-4-ил]-3-метил-пиперазин-1-ил]проп-2-ен-1-она (320,0 мг, 0,47 ммоль) и фторид цезия (288,6 мг, 1,9 ммоль) в тетрагидрофуране (5 мл) перемешивали при 25°С в течение 1 часа. После завершения полученный в результате раствор разводили водой и экстрагировали дихлорметаном. Потом органические слои собирали, сушили над безводным сульфатом натрия и концентрировали в вакууме. Остаток очищали с помощью флэш-хроматографии на силикагеле с элюированием дихлорметаном/метанолом (10/1) с получением неочищенного твердого вещества. Неочищенный продукт очищали с помощью препаративной ВЭЖХ с получением 150 мг белого твердого вещества со следующими условиями: колонка: колонка: Xselect CSH F-Phenyl OBD, 19*250, 5 мкм; подвижная фаза А: вода (10 ммоль/л NH4HCO3), подвижная фаза В: EtOH; скорость потока: 25 мл/мин; градиент: от 73 В до 78 В за 8 мин; 254 нм; RT1: 7,3. Продукт дополнительно очищали с помощью хиральной препаративной ВЭЖХ со следующими условиями: (колонка CHIRALPAK IC-3, 0,46*5 см, 3 мкм; подвижная фаза: (гексан:ДХМ=3:1) (0,1% ДЭА): EtOH=50:50; детектор, УФ 254 нм) с получением указанных в заголовке соединений. Абсолютная конфигурация указанных в заголовке соединений была определена по данным активности и рентгенограммы белковой структуры соединения 21b.
Пример 31а: 1-[(3S)-4-[(7S)-2-[[(2S,4R)-4-фтор-1-метил-пирролидин-2-ил]метокси]-7-(3-гидрокси-1-нафтил)-5,6,7,8-тетрагидрохиназолин-4-ил]-3-метил-пиперазин-1-ил]проп-2-ен-1-он (43 мг, 0,076 ммоль, выход 16,2%, белое твердое вещество). 1Н ЯМР (400 МГц, ДМСО-d6, м. д.) δ 9,70 (с, 1H, 8,06 (д, J=8,6 Гц, 1H, 7,71 (дд, J=8,3, 1,4 Гц, 1H, 7,40 (т, J=7,2 Гц, 1H, 7,31 (т, J=7,2 Гц, 1H, 7,05-6,95 (м, 2Н), 6,94-6,76 (м, 1H, 6,23-6,10 (м, 1H, 5,73 (дд, J=10,4, 2,4 Гц, 1H, 5,29-5,07 (м, 1H, 4,43-4,27 (м, 2Н), 4,22-4,03 (м, 3Н), 3,92-3,82 (м, 2Н), 3,52-3,38 (м, 2Н), 3,37-3,40 (м, 1H, 3,26-3,14 (м, 1H, 3,08 (дд, J=18,2, 5,6 Гц, 2Н), 2,99-2,85 (м, 2Н), 2,78 (дд, J=18,2, 10,4 Гц, 1H, 2,47-2,40 (м, 1H, 2,38 (с, 3H, 2,19-2,05 (м, 2Н), 1,96-1,78 (м, 2Н), 1,24 (с, 3Н). ЖХМС (ИЭР, m/z): 560,3 [М+Н]+. Хиральная ВЭЖХ: колонка: CHIRALPAK IC-3, 4,6*50 мм, 3 мкм; обнаружение на 254 нм; (гексан/ДХМ=3:1) (0,1% ДЭА): EtOH=50:50; скорость потока: 1 мл/мин; время удержания: 2,852 мин (более медленный пик).
Пример 31b: 1-[(3S)-4-[(7R)-2-[[(2S,4R)-4-фтор-1-метил-пирролидин-2-ил]метокси]-7-(3-гидрокси-1-нафтил)-5,6,7,8-тетрагидрохиназолин-4-ил]-3-метил-пиперазин-1-ил]проп-2-ен-1-он (42 мг, 0,075 ммоль, выход 15,8%, белое твердое вещество). 1Н ЯМР (400 МГц, ДМС0-d6, м. д.) δ 9,74 (с, 1H, 8,08 (д, J=8,5 Гц, 1H, 7,70 (дд, J=8,2, 1,4 Гц, 1H, 7,40 (т, J=7,2 Гц, 1H, 7,29 (т, J=8,3, 6,8, 1,4 Гц, 1H, 7,01 (с, 2Н), 6,93-6,75 (м, 1H, 6,16 (дд, J=16,6, 6,8 Гц, 1H, 5,72 (дд, J=10,4, 2,4 Гц, 1H, 5,23-5,10 (м, 1H, 4,38-4,24 (м, 2Н), 4,20-4,02 (м, 2Н), 3,95-3,80 (м, 2Н), 3,64-3,43 (м, 2Н), 3,42-3,21 (м, 3H, 3,09 (дд, J=18,1, 5,2 Гц, 1H, 2,97-2,72 (м, 3H, 2,63-2,53 (м, 1H, 2,48-2,41 (м, 1H, 2,37 (с, 3H, 2,18-2,02 (м, 2Н), 1,97-1,75 (м, 2Н), 1,02-0,98 (м, 3H. ЖХМС (ИЭР, m/z): 560,3 [М+Н]+. Хиральная ВЭЖХ: колонка: CHIRALPAK IC-3, 4,6*50 мм, 3 мкм, 3 мкм; обнаружение на 254 нм; (гексан: ДХМ=3:1) (0,1% ДЭА): EtOH=50:50; скорость потока: 1 мл/мин; время удержания: 1,317 мин (более быстрый пик).
Примеры 32а и 32b

1-[(3S,5S)-4-[(6R,7R)-7-(3-гидрокси-1-нафтил)-6-метил-2-[[(2S)-1-метилпирролидин-2-ил]метокси]-5,6,7,8-тетрагидрохиназолин-4-ил]-3,5-диметил-пиперазин-1-ил]проп-2-ен-1-он (Пример 32а); и
1-[(3S,5S)-4-[(6S,7S)-7-(3-гидрокси-1-нафтил)-6-метил-2-[[(2S)-1-метилпирролидин-2-ил] метокси]-5,6,7,8-тетрагидрохиназолин-4-ил]-3,5-диметил-пиперазин-1-ил]проп-2-ен-1-он (Пример 32b)

Этап 1: трет-бутил (3S,5S)-4-[7-(3-гидрокси-1-нафтил)-6-метил-2-метилсульфанил-5,6,7,8-тетрагидрохиназолин-4-ил]-3,5-диметил-пиперазин-1-карбоксилат

Раствор [7-[3-[трет-бутил(диметил)силил]окси-1-нафтил]-6-метил-2-метилсульфанил-5,6,7,8-тетрагидрохиназолин-4-ил] трифторметансульфоната (2,0 г, 3,3 ммоль), трет-бутил (3S,5S)-3,5-диметилпиперазин-1-карбоксилата (1,43 г, 6,6 ммоль) и N,N-диизопропилэтиламина (1,29 г, 10,0 ммоль) в N,N-диметилацетамиде (20 мл) перемешивали при 95°С в течение 48 часов. После завершения полученный в результате раствор разводили водой, экстрагировали этилацетатом, сушили над безводным сульфатом натрия и концентрировали в вакууме. Остаток очищали с помощью флэш-хроматографии на силикагеле с элюированием петролейным эфиром/этилацетатом (7:3) с получением трет-бутил (3S,5S)-4-[7-(3-гидрокси-l-нафтил)-6-метил-2-метилсульфанил-5,6,7,8-тетрагидрохиназолин-4-ил]-3,5-диметил-пиперазин-1-карбоксилата (600 мг, 1,1 ммоль, выход 32,7%) в виде желтого твердого вещества. ЖХМС (ИЭР, m/z): 549,3 [М+Н]+.
Этап 2: трет-бутил (3S,5S)-4-[7-[3-[трет-бутил(диметил)силил]окси-1-нафтил]-6-метил-2-метилсульфанил-5,6,7,8-тетрагидрохиназолин-4-ил]-3,5-диметил-пиперазин-1-карбоксилат
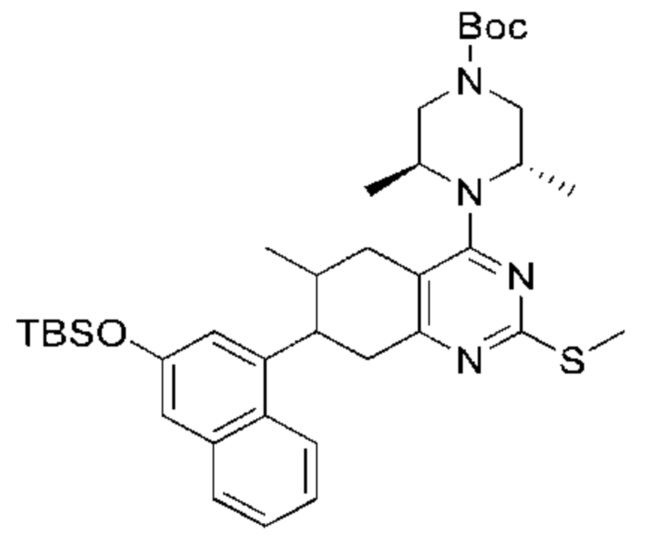
Раствор трет-бутил (3S,5S)-4-[7-(3-гидрокси-1 -нафтил)-6-метил-2-метил сульфанил-5,6,7,8-тетрагидрохиназолин-4-ил]-3,5-диметил-пиперазин-1-карбоксилата (600,0 мг, 1,1 ммоль), трет-бутилдиметилсилил хлорида (494,3 мг, 3,2 ммоль), N,N-диизопропилэтиламина (705,2 мг, 5,4 ммоль) и имидазола (223,3 мг, 3,2 ммоль) в дихлорметане (6 мл) перемешивали при 25°С в течение 1 часа. После завершения полученный в результате раствор концентрировали в вакууме. Остаток очищали с помощью флэш-хроматографии на силикагеле с элюированием петролейным эфиром/этилацетатом (10/1) с получением трет-бутил (3S,5S)-4-[7-[3-[трет-бутил(диметил)силил]окси-1-нафтил]-6-метил-2-метилсульфанил-5,6,7,8-тетрагидрохиназолин-4-ил]-3,5-диметил-пиперазин-1-карбоксилата (580 мг, 0,8 ммоль, выход 80%) в виде желтого твердого вещества. ЖХМС (ИЭР, m/z): 663,4 [М+Н]+.
Этап 3: трет-бутил (3S,5S)-4-[7-[3-[трет-бутил(диметил)силил]окси-1-нафтил]-6-метил-2-метилсульфонил-5,6,7,8-тетрагидрохиназолин-4-ил]-3,5-диметил-пиперазин-1-карбоксилат

Раствор трет-бутил (3S,5S)-4-[7-[3-[трет-бутил(диметил)силил]окси-1-нафтил]-6-метил-2-метилсульфанил-5,6,7,8-тетрагидрохиназолин-4-ил]-3,5-диметил-пиперазин-1-карбоксилата (580 мг, 0,87 ммоль) и 3-хлорпероксибензойной кислоты (299 мг, 1,74 ммоль) в дихлорметане (6 мл) перемешивали при 25°С в течение 30 минут. После завершения полученный в результате раствор гасили насыщенным, экстрагировали дихлорметаном и сушили над безводным сульфатом натрия. Растворитель концентрировали в вакууме с получением неочищенного твердого вещества. ЖХМС (ИЭР, m/z): 695,4 [М+Н]+.
Этап 4: трет-бутил (3S,5S)-4-[7-(3-гидрокси-1-нафтил)-6-метил-2-[[(2S)-1-метилпирролидин-2-ил]метокси]-5,6,7,8-тетрагидрохиназолин-4-ил]-3,5-диметил-пиперазин-1-карбоксилат
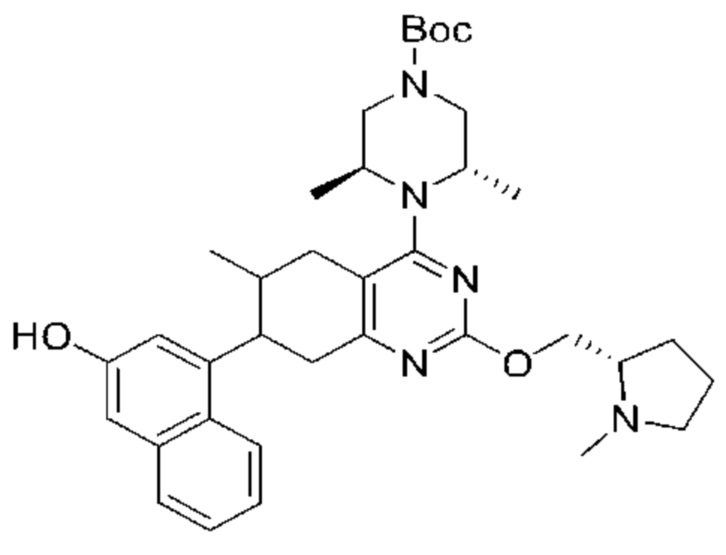
Раствор N-метил-1-пролинола (0,48 г, 4,1 ммоль) в ДМФ (6 мл) перемешивали при 25°С в течение 5 минут. Потом добавляли гидрид натрия (0,13 г, 3,34 ммоль, 60% дисперсия в минеральном масле) и перемешивали при 0°С в течение 10 минут. Потом добавляли трет-бутил (3S,5S)-4-[7-[3-[трет-бутил(диметил)силил]окси-1-нафтил]-6-метил-2-метилсульфонил-5,6,7,8-тетрагидрохиназолин-4-ил]-3,5-диметил-пиперазин-1-карбоксилат (0,58 г, 0,8 ммоль) и перемешивали при 25°С в течение 20 минут.
Полученный в результате раствор доводили до рН 8 насыщенным раствором хлорида аммония. Растворитель экстрагировали этилацетатом, промывали водой. Органический слой сушили над безводным сульфатом натрия и концентрировали в вакууме. Остаток очищали с помощью флэш-хроматографии на силикагеле с элюированием дихлорметаном/метанолом (10/1) с получением трет-бутил (3S,5S)-4-[7-(3-гидрокси-l-нафтил)-6-метил-2-[[(2S)-1-метилпирролидин-2-ил]метокси]-5,6,7,8-тетрагидрохиназолин-4-ил]-3,5-диметил-пиперазин-1-карбоксилата (400 мг, 0,6 ммоль, выход 77,8%) в виде желтого твердого вещества. ЖХМС (ИЭР, m/z): 616,4 [М+Н]+.
Этап 5: трет-бутил-[[4-[4-[(2S,6S)-2,6-диметилпиперазин-1-ил]-6-метил-2-[[(2S)-1-метилпирролидин-2-ил]метокси]-5,6,7,8-тетрагидрохиназолин-7-ил]-2-нафтил]окси]-диметил-силан
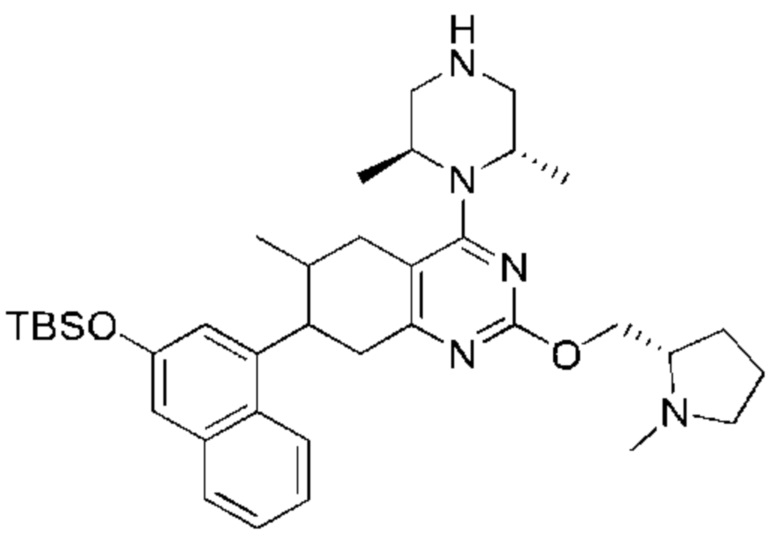
Раствор трет-бутил (3S,5S)-4-[7-(3-гидрокси-1-нафтил)-6-метил-2-[[(2S)-1-метилпирролидин-2-ил]метокси]-5,6,7,8-тетрагидрохиназолин-4-ил]-3,5-диметил-пиперазин-1-карбоксилата (400,0 мг, 0,6 ммоль) и трифторуксусной кислоты (1,48 г, 12,9 ммоль) в дихлорметане (6 мл) перемешивали при 25°С в течение 1 часа. Полученный в результате раствор концентрировали в вакууме. Остаток, имидазол (132,66 мг, 1,95 ммоль) и N,N-диизопропилэтиламин (1,6 г, 12,9 ммоль) в дихлорметане (6 мл) перемешивали при 25°С в течение 3 минут. Потом добавляли трет-бутилдиметилсилил хлорид (196,1 мг, 1,3 ммоль) и перемешивали при 25°С в течение 2 часов. После завершения полученный в результате раствор концентрировали в вакууме. Остаток очищали с помощью флэш-хроматографии на силикагеле с элюированием метанолом/водой (4:6) с получением трет-бутил-[[4-[4-[(2S,6S)-2,6-диметилпиперазин-1-ил]-6-метил-2-[[(2S)-1-метилпирролидин-2-ил]метокси]-5,6,7,8-тетрагидрохиназолин-7-ил]-2-нафтил]окси]-диметил-силана (280 мг, 0,4 ммоль, выход 68,4%) в виде желтого твердого вещества. ЖХМС (ИЭР, m/z): 630,4 [М+Н]+.
Этап 6: 1-[(3S,5S)-4-[7-[3-[трет-бутил(диметил)силил]окси-1-нафтил]-6-метил-2-[[(2S)-1-метилпирролидин-2-ил]метокси]-5,6,7,8-тетрагидрохиназолин-4-ил]-3,5-диметил-пиперазин-1-ил]проп-2-ен-1-он

Раствор трет-бутил-[[4-[4-[(2S,6S)-2,6-диметилпиперазин-1-ил]-6-метил-2-[[(2S)-1-метилпирролидин-2-ил]метокси]-5,6,7,8-тетрагидрохиназолин-7-ил]-2-нафтил]окси]-диметил-силана (380,0 мг, 0,6 ммоль) и N,N-диизопропилэтиламина (233,4 мг, 1,8 ммоль) в дихлорметане (4 мл) перемешивали при 25°С в течение 3 минут. Потом добавляли акрилоилхлорид (65,5 мг, 0,7 ммоль) и перемешивали при -78°С в течение 30 минут. Полученный в результате раствор концентрировали в вакууме. Остаток очищали с помощью флэш-хроматографии на силикагеле с элюированием дихлорметаном/метанолом (20:1) с получением 1-[(3S,5S)-4-[7-[3-[трет-бутил(диметил)силил]окси-1-нафтил]-6-метил-2-[[(2S)-1-метилпирролидин-2-ил]метокси]-5,6,7,8-тетрагидрохиназолин-4-ил]-3,5-диметил-пиперазин-1-ил]пропоен-1-она (280 мг, 0,4 ммоль, выход 67,9%) в виде желтого твердого вещества. ЖХМС (ИЭР, m/z): 684,4 [М+Н]+.
Этап 7: 1-[(3S,5S)-4-[(6R,7R)-7-(3-гидрокси-1-нафтил)-6-метил-2-[[(2S)-1-метилпирролидин-2-ил]метокси]-5,6,7,8-тетрагидрохиназолин-4-ил]-3,5-диметил-пиперазин-1-ил]проп-2-ен-1-он (Пример 32а) и 1-[(3S,5S)-4-[(6S,7S)-7-(3-гидрокси-l-нафтил)-6-метил-2-[[(2S)-1-метилпирролидин-2-ил]метокси]-5,6,7,8-тетрагидрохиназолин-4-ил]-3,5-диметил-пиперазин-1-ил]проп-2-ен-1-он (Пример 32b)
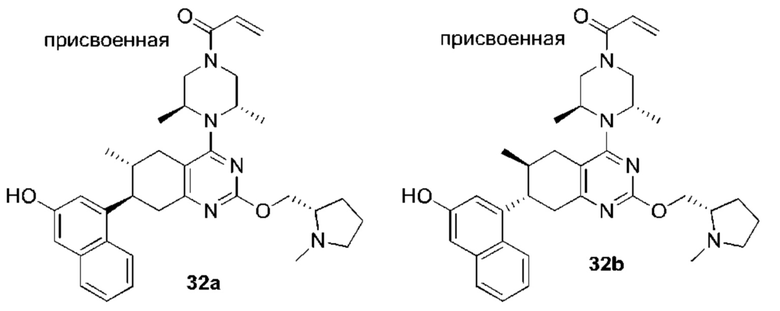
Раствор 1-[(3S,5S)-4-[7-[3-[трет-бутил(диметил)силил]окси-1-нафтил]-6-метил-2-[[(2S)-1-метилпирролидин-2-ил]метокси]-5,6,7,8-тетрагидрохиназолин-4-ил]-3,5-диметил-пиперазин-1-ил]проп-2-ен-1-она (268,0 мг, 0,4 ммоль) и фторид цезия (242,5 мг, 1,6 ммоль) в тетрагидрофуране (3 мл) перемешивали при 50°С в течение 1 часа. Реакцию разводили водой, экстрагировали дихлорметаном и сушили над безводным сульфатом натрия. Полученный в результате раствор концентрировали в вакууме. Остаток очищали с помощью флэш-хроматографии на силикагеле с элюированием дихлорметаном/метанолом (10/1) с получением неочищенного твердого вещества. Неочищенный продукт очищали с помощью препаративной ВЭЖХ с получением 150 мг белого твердого вещества со следующими условиями: колонка: Xselect CSH F-Phenyl OBD, 19*250, 5 мкм; подвижная фаза А: вода (10 ммоль/л NH4HCO3), подвижная фаза В: EtOH; скорость потока: 25 мл/мин; градиент: от 73 В до 78 В за 8 мин; 254 нм; RT1: 7,3. Продукт дополнительно очищали с помощью хиральной препаративной ВЭЖХ со следующими условиями: (колонка CHIRALPAK IC-3, 0,46*5 см, 3 мкм; подвижная фаза: (гексан:ДХМ=3:1) (0,1% ДЭА): EtOH=80:20; детектор, УФ 254 нм) с получением указанных в заголовке соединений. Стереохимия указанных в заголовке соединений была приписана произвольным образом.
Пример 32а: 1-[(3S,5S)-4-[(6R,7R)-7-(3-гидрокси-l-нафтил)-6-метил-2-[[(2S)-1-метилпирролидин-2-ил]метокси]-5,6,7,8-тетрагидрохиназолин-4-ил]-3,5-диметил-пиперазин-1-ил]проп-2-ен-1-он (40,8 мг, 0,071 ммоль, выход 18%, белое твердое вещество). 1Н ЯМР (400 МГц, ДМСО-d6, м. д.) δ 9,63 (с, 1H, 8,08 (д, J=8,6 Гц, 1H, 7,69 (дд, J=8,3, 1,3 Гц, 1H, 7,38 (т, J=7,4 Гц, 1H, 7,27 (т, J=7,4 Гц, 1H, 7,01 (с, 1H, 6,93 (с, 1H, 6,84 (дд, J=16,6, 10,5 Гц, 1H, 6,15 (дд, J=16,6, 2,5 Гц, 1H, 5,70 (дд, J=10,4, 2,4 Гц, 1H, 4,26 (дд, J=10,7, 5,0 Гц, 1H, 4,05 (дд, J=10,7, 6,4 Гц, 1H, 3,91-3,37 (м, 7Н), 3,07-2,87 (м, 3H, 2,69-2,58 (м, 1H, 2,58-2,52 (м, 1H, 2,48-2,38 (м, 1H, 2,33 (с, 3H, 2,26 (с, 1H, 2,21-2,09 (м, 1H, 1,99-1,86 (м, 1H, 1,74-1,50 (м, 3H, 1,01 (д, J=6,0 Гц, 6Н), 0,87 (д, J=6,5 Гц, 3H). ЖХМС (ИЭР, m/z): 570,3 [М+Н]+. Хиральная ВЭЖХ: колонка: CHIRALPAK IC-3, 4,6*50 мм, 3 мкм; обнаружение на 254 нм; (гексан/ДХМ = 3:1) (0,1% ДЭА): EtOH = 80:20, скорость потока: 1 мл/мин; время удержания: 1,326 мин (более быстрый пик).
Пример 32b: 1-[(3S,5S)-4-[(6S,7S)-7-(3-гидрокси-1-нафтил)-6-метил-2-[[(2S)-1-метилпирролидин-2-ил]метокси]-5,6,7,8-тетрагидрохиназолин-4-ил]-3,5-диметил-пиперазин-1-ил]проп-2-ен-1-он (35,1 мг, 0,061 ммоль, выход 15,4%, белое твердое вещество). 1Н ЯМР (400 МГц, ДМСО-d6, м.д.) δ 9,67 (с, 1Н), 8,17 (д, J=8,6 Гц, 1Н), 7,70 (д, J=8,2 Гц, 1Н), 7,38 (т, J=7,5 Гц, 1Н), 7,26 (т, J=7,6 Гц, 1Н), 7,05 (с, 1Н), 7,02 (с, 1Н), 6,97-6,77 (м, 1Н), 6,18 (дд, J=16,6, 2,4 Гц, 1Н), 5,73 (дд, J=10,4, 2,4 Гц, 1Н), 4,23 (дд, J=10,8, 5,0 Гц, 1Н), 4,08 (дд, J=10,8, 6,4 Гц, 1Н), 3,72 (с, 3H), 3,32 (с, 5Н), 3,06-2,77 (м, 4Н), 2,59-2,52 (м, 1Н), 2,31 (с, 3H), 2,19-2,05 (м, 2Н), 1,95-1,84 (м, 1Н), 1,72-1,49 (м, 3H), 0,93 (с, 6Н), 0,79 (д, J=6,3 Гц, 3H). ЖХМС (ИЭР, m/z): 570,3 [М+Н]+. Хиральная ВЭЖХ: колонка: CHIRALPAK IC-3, 4,6*50 мм, 3 мкм; обнаружение на 254 нм; (гексан/ДХМ = 3:1) (0,1% ДЭА): EtOH = 80:20, скорость потока: 1 мл/мин; время удержания: 1,933 мин (более медленный пик).
Примеры 33а и 33b

1-((S)-4-((6S,7R)-7-(6-амино-4-метил-3-(трифторметил)пиридин-2-ил)-6-изопропил-2-(((S)-1-метилпирролидин-2-ил)метокси)-5,6,7,8-тетрагидрохиназолин-4-ил)-3-метилпиперазин-1-ил)проп-2-ен-1-он (Пример 33а); и
1-((S)-4-((6R,7S)-7-(6-амино-4-метил-3-(трифторметил)пиридин-2-ил)-6-изопропил-2-(((S)-1-метилпирролидин-2-ил)метокси)-5,6,7,8-тетрагидрохиназолин-4-ил)-3-метилпиперазин-1-ил)проп-2-ен-1-он (Пример 33b)

Этап 1: 4-изопропилциклогекс-2-ен-1-он

В атмосфере азота раствор 4-изопропилциклогексанона (40,0 г, 285,2 ммоль) в тетрагидрофуране (400 мл) перемешивали в течение 5 минут при -78°С, добавляли диизопропиламид лития (2 M в ТГФ) (240 мл, 427,9 ммоль) и перемешивали при -78°С в течение 1 часа. Потом добавляли хлортриметилсилан (36,7 мл, 427,9 ммоль) и перемешивали при -78°С в течение 1 часа. После завершения растворитель разводили дихлорметаном и промывали солевым раствором. Органический слой сушили над безводным сульфатом натрия и концентрировали в вакууме. Раствор пара-бензохинона (20,64 г, 191,15 ммоль) и ацетата палладия (II) (42,8 г, 191,1 ммоль) в ацетонитриле (400 мл) перемешивали при 25°С в течение 10 минут. Потом добавляли (4-изопропилциклогексен-1-ил)окси-триметил-силан (58,0 г, 273,1 ммоль) и перемешивали при 25°С в течение 16 часов. После завершения, после фильтрации фильтрат концентрировали при пониженном давлении. Остаток очищали с помощью флэш-хроматографии на силикагеле с элюированием петролейным эфиром/диэтиловым эфиром (88/12) с получением 4-изопропилциклогекс-2-ен-1-она (16 г, 115,7 ммоль, выход 42,4%) в виде желтого масла. ЖХМС (ИЭР, m/z): 139,1 [М+Н]+.
Этап 2: 3-[6-[бис[(4-метоксифенил)метил]амино]-4-метил-2-пиридил]-4-изопропил-циклогексанон

В атмосфере азота раствор 4-изопропилциклогекс-2-ен-1-она (9,76 г, 70,5 ммоль) и димера хлор(1,5-циклооктадиен)родия (I) (2,32 г, 4,7 ммоль) в тетрагидрофуране (300 мл) перемешивали при 60°С в течение 5 минут. Потом добавляли N,N-бис[(4-метоксифенил)метил]-4-метил-6-трибутилстаннил-пиридин-2-амин (30,0 г, 47,0 ммоль) и перемешивали при 60°С в течение 20 часов. После завершения органический слой сушили над безводным сульфатом натрия и концентрировали в вакууме. Остаток очищали с помощью флэш-хроматографии на силикагеле с элюированием петролейным эфиром/этилацетатом (85/15) с получением 3-[6-[бис[(4-метоксифенил)метил]амино]-4-метил-2-пиридил]-4-изопропил-циклогексанона (4 г, 8,2 ммоль, выход 17,5%) в виде желтого масла. ЖХМС (ИЭР, m/z): 487,3 [М+Н]+.
Этап 3: 3-[6-[бис[(4-метоксифенил)метил]амино]-3-йодо-4-метил-2-пиридил]-4-изопропил-циклогексанон
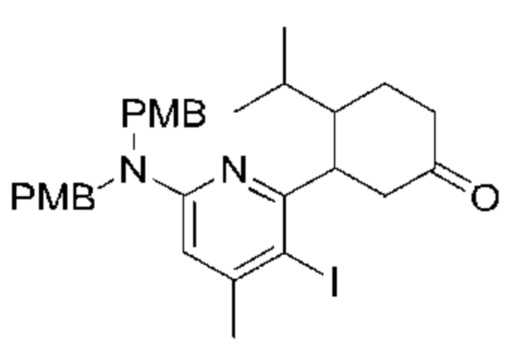
Раствор 3-[6-[бис[(4-метоксифенил)метил]амино]-4-метил-2-пиридил]-4-изопропил-циклогексанона (6,0 г, 12,33 ммоль) и N-йодосукцинимида (4,16 г, 18,4 ммоль) в ацетонитриле (60 мл) перемешивали при 25°С в течение 1 часа. После завершения полученный в результате раствор концентрировали в вакууме. Остаток очищали с помощью флэш-хроматографии на силикагеле с элюированием петролейным эфиром/этилацетатом (85/15) с получением 3-[6-[бис[(4-метоксифенил)метил]амино]-3-йодо-4-метил-2-пиридил]-4-изопропил-циклогексанона (6,6 г, 10,7 ммоль, выход 87,4%) в виде красного масла. ЖХМС (ИЭР, m/z): 612,2 [М+Н]+.
Этап 4: 3-[6-[бис[(4-метоксифенил)метил]амино]-4-метил-3-(трифторметил)-2-пиридил]-4-изопропил-циклогексанон
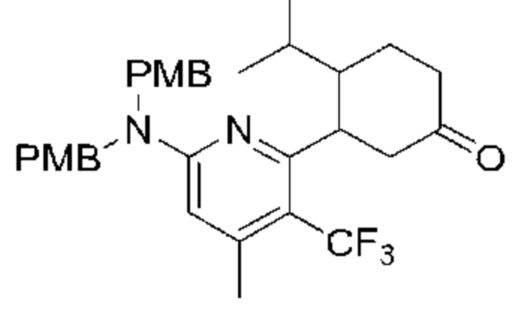
В атмосфере азота раствор 3-[6-[бис[(4-метоксифенил)метил]амино]-3-йодо-4-метил-2-пиридил]-4-изопропил-циклогексанона (6,6 г, 10,7 ммоль), метил 2,2-дифтор-2-(фторсульфонил)ацетата (10,3 г, 53,8 ммоль) и йодида меди (4,0 г, 21,5 ммоль) в N,N-диметилформамиде (70 мл) перемешивали при 90°С в течение 1 часа. После завершения, после фильтрации фильтрат разводили водой. Полученный в результате раствор экстрагировали дихлорметаном. Органические слои объединяли, промывали водой, сушили над безводным сульфатом натрия и концентрировали в вакууме. Остаток очищали с помощью флэш-хроматографии на силикагеле с элюированием петролейным эфиром/этилацетатом (85/15) с получением 3-[6-[бис[(4-метоксифенил)метил]амино]-4-метил-3-(трифторметил)-2-пиридил]-4-изопропил-циклогексанона (4,7 г, 8,4 ммоль, выход 78,6%) в виде желтого масла. ЖХМС (ИЭР, m/z): 555,3 [М+Н]+.
Этап 5: этил 4-[6-[бис[(4-метоксифенил)метил]амино]-4-метил-3-(трифторметил)-2-пиридил]-5-изопропил-2-оксо-циклогексанкарбоксилат
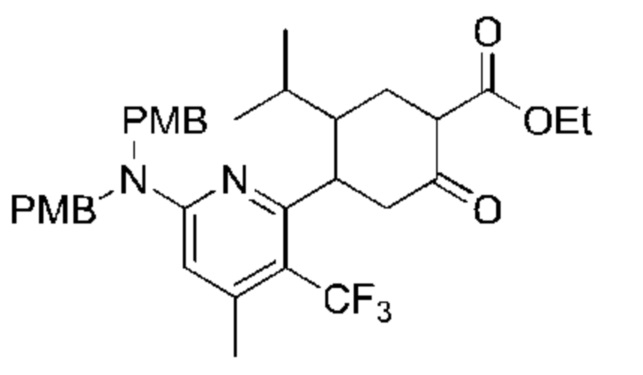
В атмосфере азота раствор 3-[6-[бис[(4-метоксифенил)метил]амино]-4-метил-3-(трифторметил)-2-пиридил]-4-изопропил-циклогексанона (4,6 г, 8,29 ммоль) в тетрагидрофуране (50 мл) перемешивали при -78°С в течение 2 минут. Потом добавляли бис(триметилсилил)амид лития (1 M в ТГФ) (16 мл, 16,59 ммоль) и перемешивали при -78°С в течение 20 минут. Потом добавляли этилцианоформиат (1,89 г, 19,08 ммоль) и перемешивали при -78°С в течение 30 минут. После завершения реакцию гасили водой, экстрагировали дихлорметаном, сушили над безводным сульфатом натрия и концентрировали в вакууме. Остаток очищали с помощью флэш-хроматографии на силикагеле с элюированием петролейным эфиром/этилацетатом (9:1) с получением этил 4-[6-[бис[(4-метоксифенил)метил]амино]-4-метил-3-(трифторметил)-2-пиридил]-5-изопропил-2-оксо-циклогексанкарбоксилата (4 г, 6,3 ммоль, выход 77%) в виде желтого масла. ЖХМС (ИЭР, m/z): 627,3 [М+Н]+.
Этап 6: 7-[6-[бис[(4-метоксифенил)метил]амино]-4-метил-3-(трифторметил)-2-пиридил]-6-изопропил-2-метилсульфанил-5,6,7,8-тетрагидрохиназолин-4-ол

Раствор этил 4-[6-[бис[(4-метоксифенил)метил]амино]-4-метил-3-(трифторметил)-2-пиридил]-5-изопропил-2-оксо-циклогексанкарбоксилата (4,0 г, 6,3 ммоль), метил карбамимидотиоата (1:2) (17,77 г, 63,83 ммоль) и бикарбоната натрия (10,72 г, 127,6 ммоль) в этаноле (40 мл) и воде (8 мл) перемешивали при 50°С в течение 3 часов. После завершения реакцию разводили водой и экстрагировали дихлорметаном. Потом органические слои объединяли, сушили над безводным сульфатом натрия и концентрировали в вакууме. Остаток очищали с помощью флэш-хроматографии на силикагеле с элюированием петролейным эфиром/этилацетатом (85/15) с получением 7-[6-[бис[(4-метоксифенил)метил]амино]-4-метил-3-(трифторметил)-2-пиридил]-6-изопропил-2-метилсульфанил-5,6,7,8-тетрагидрохиназолин-4-ола (2 г, 3,0 ммоль, выход 48%) в виде белого твердого вещества. ЖХМС (ИЭР, m/z): 653,3 [М+Н]+.
Этап 7: трет-бутил (3S)-4-[7-[6-[бис[(4-метоксифенил)метил]амино]-4-метил-3-(трифторметил)-2-пиридил]-6-изопропил-2-метилсульфанил-5,6,7,8-тетрагидрохиназолин-4-ил]-3-метил-пиперазин-1-карбоксилат

Раствор 7-[6-[бис[(4-метоксифенил)метил]амино]-4-метил-3-(трифторметил)-2-пиридил]-6-изопропил-2-метилсульфанил-5,6,7,8-тетрагидрохиназолин-4-ола (2,0 г, 3,06 ммоль), N,N-диизопропилэтиламина (1,98 г, 15,3 ммоль) и трифторметансульфонового ангидрида (1,56 г, 5,5 ммоль) в дихлорметане (20 мл) перемешивали при 25°С в течение 1 часа. После завершения реакцию концентрировали при пониженном давлении. Потом остаток, N,N-диизопропилэтиламин (1,98 г, 15,3 ммоль) и трет-бутил (3S)-3-метил-1-пиперазинкарбоксилат (1,23 г, 6,1 ммоль) в 1,4-диоксане (20 мл) перемешивали при 110°С в течение 16 часов. После завершения полученный в результате раствор концентрировали в вакууме. Остаток очищали с помощью флэш-хроматографии на силикагеле с элюированием петролейным эфиром/этилацетатом (85/15) с получением трет-бутил (3S)-4-[7-[6-[бис[(4-метоксифенил)метил]амино]-4-метил-3-(трифторметил)-2-пиридил]-6-изопропил-2-метилсульфанил-5,6,7,8-тетрагидрохиназолин-4-ил]-3-метил-пиперазин-1-карбоксилата (1,4 г, 1,6 ммоль, выход 54,7%) в виде белого твердого вещества. ЖХМС (ИЭР, m/z): 835,4 [М+Н]+
Этап 8: трет-бутил (3S)-4-[7-[6-[бис[(4-метоксифенил)метил]амино]-4-метил-3-(трифторметил)-2-пиридил]-6-изопропил-2-метилсульфонил-5,6,7,8-тетрагидрохиназолин-4-ил]-3-метил-пиперазин-1-карбоксилат
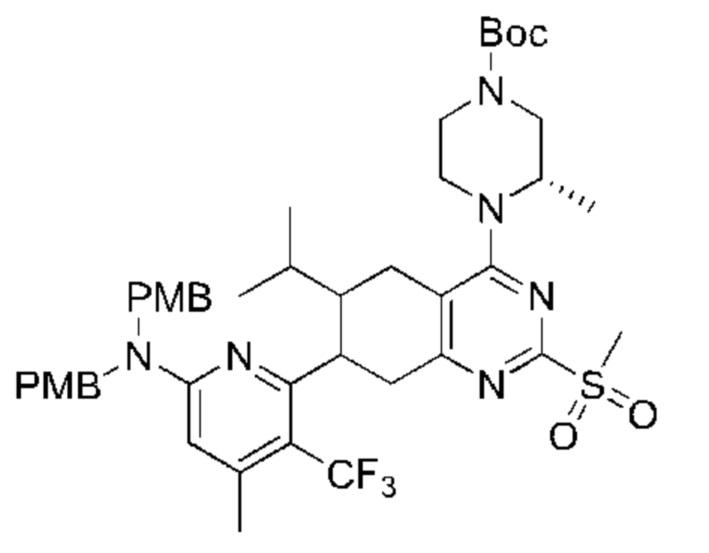
Раствор трет-бутил (3S)-4-[7-[6-[бис[(4-метоксифенил)метил]амино]-4-метил-3-(трифторметил)-2-пиридил]-6-изопропил-2-метилсульфанил-5,6,7,8-тетрагидрохиназолин-4-ил]-3-метил-пиперазин-1-карбоксилата (1,6 г, 1,9 ммоль) и 3-хлорпероксибензойной кислоты (0,33 г, 1,9 ммоль) в дихлорметане (16 мл) перемешивали при 25°С в течение 30 минут.Полученный в результате раствор гасили насыщенным раствором сульфита натрия, экстрагировали дихлорметаном. Потом органические слои собирали, сушили над безводным сульфатом натрия и концентрировали в вакууме. Остаток очищали с помощью флэш-хроматографии на силикагеле с элюированием петролейным эфиром/этилацетатом (5/1) с получением трет-бутил (3S)-4-[7-[6-[бис[(4-метоксифенил)метил]амино]-4-метил-3-(трифторметил)-2-пиридил]-6-изопропил-2-метилсульфонил-5,6,7,8-тетрагидрохиназолин-4-ил]-3-метил-пиперазин-1-карбоксилата (1 г, 1,1 ммоль, выход 60,2%) в виде белого твердого вещества. ЖХМС (ИЭР, m/z): 867,4 [М+Н]+
Этап 9: трет-бутил (3S)-4-[7-[6-[бис[(4-метоксифенил)метил]амино]-4-метил-3-(трифторметил)-2-пиридил]-6-изопропил-2-[[(2S)-1-метилпирролидин-2-ил]метокси]-5,6,7,8-тетрагидрохиназолин-4-ил]-3-метил-пиперазин-1-карбоксилат
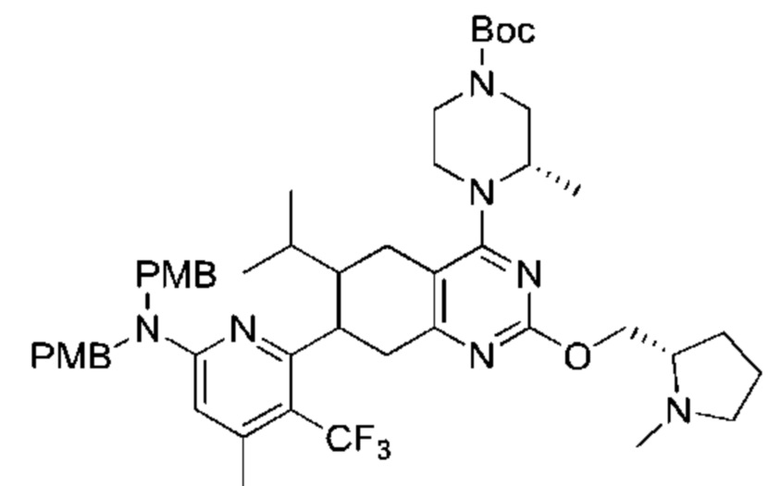
Раствор [(2S)-1-метилпирролидин-2-ил]метанола (0,27 г, 2,3 ммоль) в N,N-диметилформамиде (10 мл) перемешивали при 25°С в течение 5 минут. Потом добавляли гидрид натрия (0,18 г, 4,6 ммоль, 60% дисперсия в минеральном масле) и перемешивали при 0°С в течение 10 минут. Потом добавляли трет-бутил (3S)-4-[7-[6-[бис[(4-метоксифенил)метил]амино]-4-метил-3-(трифторметил)-2-пиридил]-6-изопропил-2-метилсульфонил-5,6,7,8-тетрагидрохиназолин-4-ил]-3-метил-пиперазин-1-карбоксилат (1,0 г, 1,15 ммоль) и перемешивали при 25°С в течение 30 минут. Полученный в результате раствор доводили до рН 8 хлоридом аммония. Растворитель разводили водой, экстрагировали ЭА, промывали водой. Органический слой сушили над безводным сульфатом натрия и концентрировали в вакууме. Остаток очищали с помощью флэш-хроматографии на силикагеле с элюированием дихлорметаном/метанолом (10/1) с получением трет-бутил (3S)-4-[7-[6-[бис[(4-метоксифенил)метил]амино]-4-метил-3-(трифторметил)-2-пиридил]-6-изопропил-2-[[(2S)-1-метилпирролидин-2-ил]метокси]-5,6,7,8-тетрагидрохиназолин-4-ил]-3-метил-пиперазин-1-карбоксилата (500 мг, 0,5 ммоль, выход 48,1%) в виде белого твердого вещества. ЖХМС (ИЭР, m/z): 902,5 [М+Н]+
Этап 10: 6-[6-изопропил-4-[(2S)-2-метилпиперазин-1-ил]-2-[[(2S)-1-метилпирролидин-2-ил]метокси]-5,6,7,8-тетрагидрохиназолин-7-ил]-4-метил-5-(трифторметил)пиридин-2-амин

Раствор трет-бутил (3S)-4-[7-[6-[бис[(4-метоксифенил)метил]амино]-4-метил-3-(трифторметил)-2-пиридил]-6-изопропил-2-[[(2S)-1-метилпирролидин-2-ил]метокси]-5,6,7,8-тетрагидрохиназолин-4-ил]-3-метил-пиперазин-1-карбоксилата (500,0 мг, 0,5 ммоль) в трифторуксусной кислоте (5 мл, 67,3 ммоль) перемешивали при 50°С в течение 8 часов. Полученный в результате раствор концентрировали в вакууме. Остаток очищали с помощью флэш-хроматографии на силикагеле с элюированием ацетонитр ил ом/вод ой (1:1) с получением 6-[6-изопропил-4-[(2S)-2-метилпиперазин-1-ил]-2-[[(2S)-1-метилпирролидин-2-ил]метокси]-5,6,7,8-тетрагидрохиназолин-7-ил]-4-метил-5-(трифторметил)пиридин-2-амина (200 мг, 0,3 ммоль, выход 64,2%) в виде белого твердого вещества. ЖХМС (ИЭР, m/z): 562,3 [М+Н]+
Этап 11: 1-((S)-4-((6S,7R)-7-(6-амино-4-метил-3-(трифторметил)пиридин-2-ил)-6-изопропил-2-(((S)-1-метилпирролидин-2-ил)метокси)-5,6,7,8-тетрагидрохиназолин-4-ил)-3-метилпиперазин-1-ил)проп-2-ен-1-он (Пример 33а) и 1-((S)-4-((6R,7S)-7-(6-амино-4-метил-3-(трифторметил)пиридин-2-ил)-6-изопропил-2-(((S)-1-метилпирролидин-2-ил)метокси)-5,6,7,8-тетрагидрохиназолин-4-ил)-3-метилпиперазин-1-ил)проп-2-ен-1-он (Пример 33b)
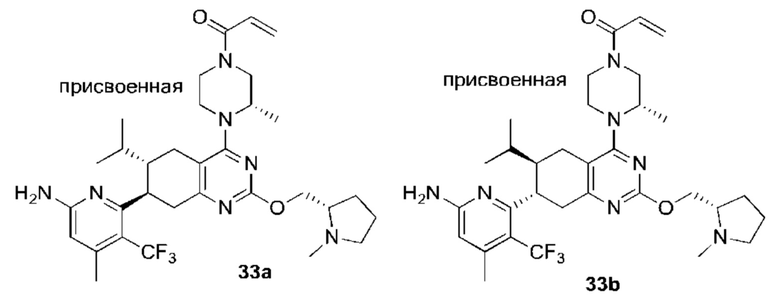
Раствор 6-[6-изопропил-4-[(2S)-2-метилпиперазин-1-ил]-2-[[(2S)-1-метилпирролидин-2-ил]метокси]-5,6,7,8-тетрагидрохиназолин-7-ил]-4-метил-5-(трифторметил)пиридин-2-амина (200,0 мг, 0,3600 ммоль) и N,N-диизопропилэтиламина (137,8 мг, 1,07 ммоль) в дихлорметане (2 мл) перемешивали при -78°С в течение 5 минут. Потом добавляли акрилоилхлорид (32,05 мг, 0,3600 ммоль) и перемешивали при -78°С в течение 30 минут. Полученный в результате раствор концентрировали в вакууме. Остаток очищали с помощью флэш-хроматографии на силикагеле с элюированием дихлорметаном/метанолом (10/1) с получением 110 мг твердого вещества. Неочищенный продукт очищали с помощью препаративной ВЭЖХ с получением 50 мг белого твердого вещества со следующими условиями: колонка: колонка XBridge Shield RP18 OBD, 30*150 мм, 5 мкм; подвижная фаза А: вода (10 ммоль/л NH4HCO3), подвижная фаза В: АЦН; скорость потока: 60 мл/мин; градиент: от 44 В до 65 В за 7 мин; 254 нм; RT1: 5,87. Продукт дополнительно очищали с помощью хиральной препаративной ВЭЖХ со следующими условиями (колонка: CHIRAL ART Cellulose-SB, 2*25 см, 5 мкм; подвижная фаза А: гексан (8 ммоль/л NH3.MeOH)-ВЭЖХ, подвижная фаза В: EtOH-ВЭЖХ; скорость потока: 20 мл/мин; градиент: от 20 В до 20 В за 12 мин; 220/254 нм) с получением указанных в заголовке соединений. Стереохимия указанных в заголовке соединений была приписана произвольным образом.
Пример 33а: 1-((S)-4-((6S,7R)-7-(6-амино-4-метил-3-(трифторметил)пиридин-2-ил)-6-изопропил-2-(((S)-1-метилпирролидин-2-ил)метокси)-5,6,7,8-тетрагидрохиназолин-4-ил)-3-метилпиперазин-1-ил)проп-2-ен-1-он (20 мг, 0,0325 ммоль, выход 9,1%, белое твердое вещество). 1Н ЯМР (300 МГц, ДМСО-d6, м.д.) δ 6,95-6,70 (м, 1Н), 6,44 (с, 2Н), 6,26-6,07 (м, 2Н), 5,71 (дд, J=10,4, 2,5 Гц, 1Н), 4,43-3,75 (м, 6Н), 3,58-3,36 (м, 1Н), 3,21-2,90 (м, 4Н), 2,87-2,69 (м, 2Н), 2,65-2,55 (м, 1Н), 2,44-2,39 (м, 1Н), 2,36-2,11 (м, 8Н), 2,08-1,81 (м, 2Н), 1,73-1,43 (м, 4Н), 1,31-1,18 (м, 3H), 0,85 (д, J=6,8 Гц, 3H), 0,72 (д, J=6,8 Гц, 3H). ЖХМС (ИЭР, m/z): 616,4 [М+Н]+. Хиральная ВЭЖХ: колонка: CHIRAL ART Cellulose-SB, 4,6*100 мм, 3 мкм; обнаружение на 254 нм; гексан (0,1% ДЭА): EtOH = 80:20, скорость потока: 1 мл/мин; время удержания: 2,435 мин (более быстрый пик).
Пример 33b: 1-((S)-4-((6R,7S)-7-(6-амино-4-метил-3-(трифторметил)пиридин-2-ил)-6-изопропил-2-(((S)-1-метилпирролидин-2-ил)метокси)-5,6,7,8-тетрагидрохиназолин-4-ил)-3-метилпиперазин-1-ил)проп-2-ен-1-он (18,2 мг, 0,0296 ммоль, выход 8,3%, белое твердое вещество). 1Н ЯМР (300 МГц, ДМСО-d6, м.д.) δ 6,89-6,71 (м, 1Н), 6,43 (с, 2Н), 6,26-6,09 (м, 2Н), 5,71 (дд, J=10,4, 2,4 Гц, 1Н), 4,41-4,11 (м, 3H), 4,08-3,83 (м, 2Н), 3,66-3,41 (м, 2Н), 3,29-3,11 (м, 2Н), 2,99-2,69 (м, 4Н), 2,45-2,23 (м, 8Н), 2,23-1,99 (м, 2Н), 1,97-1,80 (м, 1Н), 1,76-1,39 (м, 4Н), 1,24 (д, J=4,5 Гц, 1Н), 1,01 (д, J=5,9 Гц, 3H), 0,85 (д, J=6,9 Гц, 3H), 0,73 (д, J=6,9 Гц, 3H). ЖХМС (ИЭР, m/z): 616,4 [М+Н]+. Хиральная ВЭЖХ: колонка: CHIRAL ART Cellulose-SB, 4,6*100 мм, 3 мкм; обнаружение на 254 нм; гексан (0,1% ДЭА): EtOH = 80:20, скорость потока: 1 мл/мин; время удержания: 2,945 мин (более медленный пик). Примеры 34а, 34b, 34 с и 34d
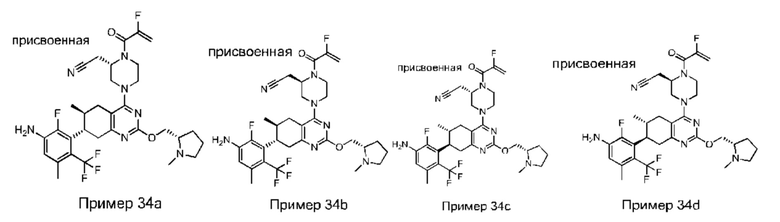
2-((R)-4-((6R,7R)-7-(3-амино-2-фтор-5-метил-6-(трифторметил)фенил)-6-метил-2-(((S)-1-метилпирролидин-2-ил)метокси)-5,6,7,8-тетрагидрохиназолин-4-ил)-1-(2-фторакрилоил)пиперазин-2-ил)ацетонитрил (Пример 34а); и
2-((R)-4-((6S,7S)-7-(3-амино-2-фтор-5-метил-6-(трифторметил)фенил)-6-метил-2-(((S)-1-метилпирролидин-2-ил)метокси)-5,6,7,8-тетрагидрохиназолин-4-ил)-1-(2-фторакрилоил)пиперазин-2-ил)ацетонитрил (Пример 34b); и
2-((S)-4-((6R,7R)-7-(3-амино-2-фтор-5-метил-6-(трифторметил)фенил)-6-метил-2-(((S)-1-метилпирролидин-2-ил)метокси)-5,6,7,8-тетрагидрохиназолин-4-ил)-1-(2-фторакрилоил)пиперазин-2-ил)ацетонитрил (Пример 34с); и
2-((S)-4-((6S,7S)-7-(3-амино-2-фтор-5-метил-6-(трифторметил)фенил)-6-метил-2-(((S)-1-метилпирролидин-2-ил)метокси)-5,6,7,8-тетрагидрохиназолин-4-ил)-1-(2-фторакрилоил)пиперазин-2-ил)ацетонитрил (Пример 34d)

Этап 1: 3-бром-2-фтор-N,N-бис[(4-метоксифенил)метил]-5-метил-анилин

Раствор 3-бром-2-фтор-5-метил-анилина (20,0 г, 98,02 ммоль) и гидрида натрия (19,6 г, 490,1 ммоль, 60% дисперсия в минеральном масле) в N,N-диметилформамиде (150 мл) перемешивали при 0°С в течение 0,5 часа. Потом добавляли 4-метоксибензилхлорид (79,6 мл, 588,12 ммоль) добавляли и перемешивали при комнатной температуре в течение 6 часов. После завершения реакцию гасили насыщенным раствором хлорида аммония. Полученный в результате раствор экстрагировали этилацетатом, сушили над безводным сульфатом натрия и концентрировали в вакууме. Остаток разводили метанолом. После фильтрации твердые вещества собирали и промывали метанолом с получением 3-бром-2-фтор-N,N-бис[(4-метоксифенил)метил]-5-метил-анилина (40 г, 90,0 ммоль, выход 91,8%) в виде желтого твердого вещества. ЖХМС: (ИЭР, m/z): 444,1 [М+Н]+.
Этап 2: (3-(Бис(4-метоксибензил)амино)-2-фтор-5-метилфенил)бороновая кислота
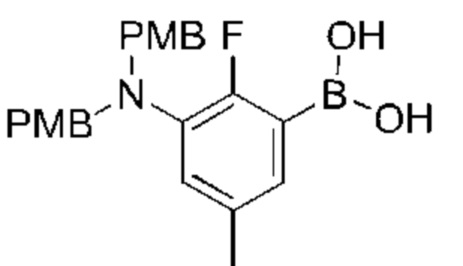
В атмосфере азота раствор триизопропилбората (44,01 г, 234,01 ммоль) в тетрагидрофуране (200 мл) перемешивали при -78°С в течение 5 минут. Потом по каплям добавляли 3-бром-2-фтор-N,N-бис[(4-метоксифенил)метил]-5-метил-анилин (20,0 г, 46,8 ммоль) и перемешивали при -78°С в течение 30 минут.Потом добавляли н-бутиллитий (2,5 М в гексане) (28 мл, 70,2 ммоль) и перемешивали при -78°С в течение 20 минут. После завершения полученный в результате раствор концентрировали в вакууме.
Этап 3: 3-(3-(бис(4-метоксибензил)амино)-2-фтор-5-метилфенил)-4-метилциклогексан-1-он
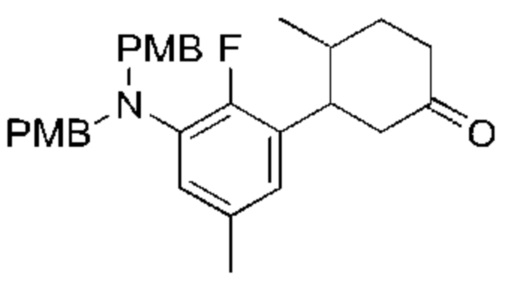
В атмосфере азота остаток с предыдущего этапа, 4-метилциклогекс-2-ен-1-он (5,1 г, 46,8 ммоль) и димер хлор(1,5-циклооктадиен)родия (I) (2,3 г, 4,68 ммоль) в 1,4-диоксане (200 мл) перемешивали при 25°С в течение 5 минут. Потом добавляли насыщенный раствор фосфата калия (40 мл) и перемешивали при 25°С в течение 1 часа. После завершения реакцию разводили водой, экстрагировали этилацетатом, сушили над безводным сульфатом натрия и концентрировали в вакууме. Остаток очищали с помощью флэш-хроматографии на силикагеле с элюированием петролейным эфиром/этилацетатом (10/1) с получением 3-(3-(бис(4-метоксибензил)амино)-2-фтор-5-метилфенил)-4-метилциклогексан-1-она (11 г, 23,9 ммоль, выход 51,3%) в виде желтого твердого вещества. ЖХМС: (ИЭР, m/z): 476,3 [М+Н]+.
Этап 4: 3-[3-[бис[(4-метоксифенил)метил]амино]-2-фтор-6-йодо-5-метил-фенил]-4-метил-циклогексанон

Раствор 3-(3-(бис(4-метоксибензил)амино)-2-фтор-5-метилфенил)-4-метилциклогексан-1-она (25,0 г, 52,5 ммоль) и N-йодосукцинимида (14,1 г, 63,0 ммоль) в ацетонитриле (250 мл) перемешивали при комнатной температуре в течение 2 минут. Потом добавляли трифторуксусную кислоту (0,6 г, 5,2 ммоль) и перемешивали при 25°С в течение 20 минут.После завершения полученный в результате раствор концентрировали в вакууме. Раствор разводили водой. Полученный в результате раствор экстрагировали этилацетатом и объединяли органические слои. Органический слой сушили над безводным сульфатом натрия и концентрировали в вакууме. Остаток очищали с помощью флэш-хроматографии на силикагеле с элюированием петролейным эфиром/этилацетатом (3/1) с получением 3-[3-[бис[(4-метоксифенил)метил]амино]-2-фтор-6-йодо-5-метил-фенил]-4-метил-циклогексанона (30 г, 49,8 ммоль, выход 94,9%) в виде желтого масла. ЖХМС: (ИЭР, m/z): 602,1 [М+Н]+.
Этап 5: 3-[3-[бис[(4-метоксифенил)метил]амино]-2-фтор-5-метил-6-(трифторметил)фенил]-4-метил-циклогексанон
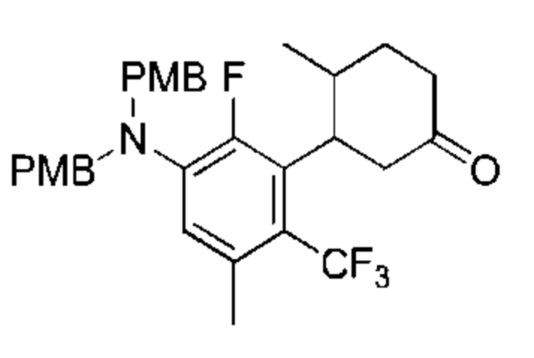
В атмосфере азота раствор 3-[3-[бис[(4-метоксифенил)метил]амино]-2-фтор-6-йодо-5-метил-фенил]-4-метил-циклогексанона (20,0 г, 33,2 ммоль), метил 2,2-дифтор-2-(фторсульфонил)ацетата (31,9 г, 166,2 ммоль) и йодида меди (12,6 г, 66,5 ммоль) в N,N-диметилформамид (200 мл) перемешивали при 80°С в течение 2 часов. После завершения реакцию гасили водой. Полученный в результате раствор экстрагировали этилацетатом и объединяли органические слои. Органический слой сушили над безводным сульфатом натрия и концентрировали в вакууме. Остаток очищали с помощью флэш-хроматографии на силикагеле с элюированием петролейным эфиром/этилацетатом (5/1) с получением 3-[3-[бис[(4-метоксифенил)метил]амино]-2-фтор-5-метил-6-(трифторметил)фенил]-4-метил-циклогексанона (12 г, 22,0 ммоль, выход 66,4%) в виде желтого масла. ЖХМС: (ИЭР, m/z): 544,2 [М+Н]+.
Этап 6: этил 4-[3-[бис[(4-метоксифенил)метил]амино]-2-фтор-5-метил-6-(трифторметил)фенил]-5-метил-2-оксо-циклогексанкарбоксилат
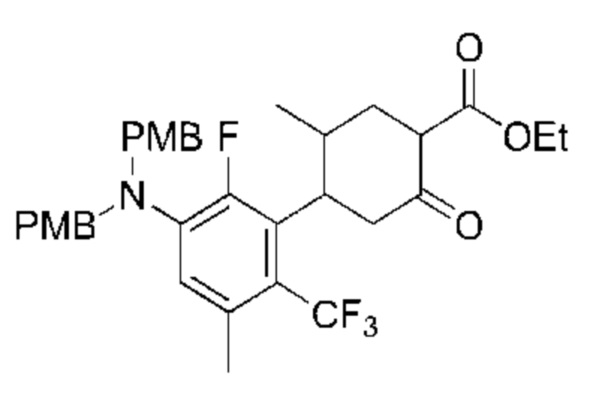
В атмосфере азота раствор 3-[3-[бис[(4-метоксифенил)метил]амино]-2-фтор-5-метил-6-(трифторметил)фенил]-4-метил-циклогексанона (10,0 г, 18,4 ммоль) в тетрагидрофуране (100 мл) перемешивали при -78°С в течение 3 минут. По каплям добавляли бис(триметилсилил)амид лития (1,0 М в ТГФ) (33 мл, 33 ммоль) и перемешивали при -78°С в течение 10 минут. Потом добавляли этилцианоформиат (4,1 г, 42,3 ммоль) и перемешивали при -78°С в течение 20 минут. После завершения реакцию гасили водой, экстрагировали этилацетатом, сушили над безводным сульфатом натрия и концентрировали в вакууме с получением неочищенного продукта. Неочищенный продукт непосредственно использовали для следующего этапа без очистки. ЖХМС: (ИЭР, m/z): 616,3 [М+Н]+.
Этап 7: 7-[3-[бис[(4-метоксифенил)метил]амино]-2-фтор-5-метил-6-(трифторметил)фенил]-6-метил-2-метилсульфанил-5,6,7,8-тетрагидрохиназолин-4-ол

Раствор этил 4-[3-[бис[(4-метоксифенил)метил]амино]-2-фтор-5-метил-6-(трифторметил)фенил]-5-метил-2-оксо-циклогексанкарбоксилата (20,0 г, 32,4 ммоль), 2-метил-2-тиопсевдомочевины сульфата (90,3 г, 324,8 ммоль) и бикарбоната натрия (54,5 г, 649,7 ммоль) в этаноле (200 мл) и воде (40 мл) перемешивали при 50°С в течение 4 часов. После завершения полученный в результате раствор разводили водой и экстрагировали этилацетатом. Потом органические слои объединяли, промывали солевым раствором, сушили над безводным сульфатом натрия и концентрировали в вакууме. Остаток очищали с помощью флэш-хроматографии на силикагеле с элюированием дихлорметаном/этилацетатом (4/1) с получением 7-[3-[бис[(4-метоксифенил)метил]амино]-2-фтор-5-метил-6-(трифторметил)фенил]-6-метил-2-метилсульфанил-5,6,7,8-тетрагидрохиназолин-4-ола (7 г, 10,9 ммоль, выход 33,6%) в виде желтого твердого вещества. ЖХМС: (ИЭР, m/z): 642,2 [М+Н]+.
Этап 8: трет-бутил 4-[7-[3-[бис[(4-метоксифенил)метил]амино]-2-фтор-5-метил-6-(трифторметил)фенил]-6-метил-2-метилсульфанил-5,6,7,8-тетрагидрохиназолин-4-ил]-2-(цианометил)пиперазин-1-карбоксилат
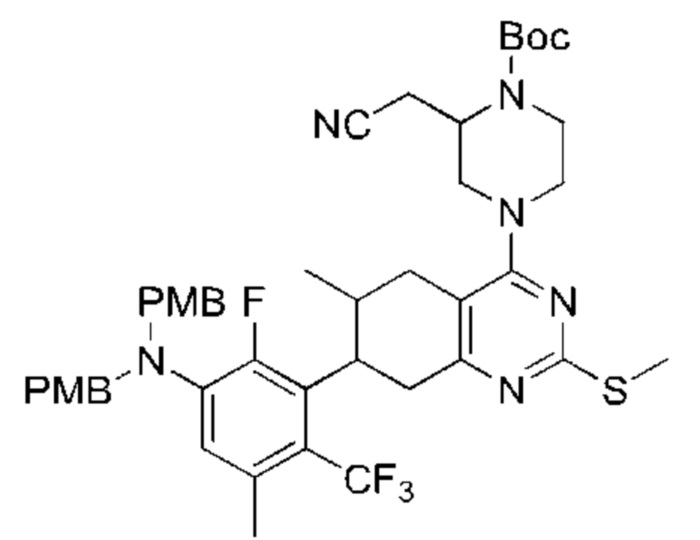
Раствор 7-[3-[бис[(4-метоксифенил)метил]амино]-2-фтор-5-метил-6-(трифторметил)фенил]-6-метил-2-метилсульфанил-5,6,7,8-тетрагидрохиназолин-4-ола (7,2 г, 11,2 ммоль), трифторметансульфонового ангидрида (5,7 г, 20,2 ммоль) и N,N-диизопропилэтиламина (8,68 г, 67,3 ммоль) в дихлорметане (72 мл) перемешивали при 25°С в течение 1 часа. После завершения реакцию концентрировали при пониженном давлении. Потом остаток,] N,N-диизопропилэтиламин (8,68 г, 67,3 ммоль) и 2-пиперазин-2-2-пиперазин-2-илацетонитрил (2,8 г, 22,44 ммоль) в 1,4-диоксане (72 мл) перемешивали при 80°С в течение 2 часов. Потом добавляли ди-трет-бутилдикарбонат (12,24 г, 56,1 ммоль) и перемешивали при 25°С в течение 1 часа. После завершения полученный в результате раствор концентрировали в вакууме. Остаток очищали с помощью флэш-хроматографии на силикагеле с элюированием петролейным эфиром/этилацетатом (10/1) с получением трет-бутил 4-[7-[3-[бис[(4-метоксифенил)метил]амино]-2-фтор-5-метил-6-(трифторметил)фенил]-6-метил-2-метилсульфанил-5,6,7,8-тетрагидрохиназолин-4-ил]-2-(цианометил)пиперазин-1-карбоксилата (8 г, 9,4 ммоль, выход 84%) в виде белого твердого вещества. ЖХМС: (ИЭР, m/z): 849,4 [М+Н]+.
Этап 9: трет-бутил 4-[7-[3-[бис[(4-метоксифенил)метил]амино]-2-фтор-5-метил-6-(трифторметил)фенил]-6-метил-2-метилсульфонил-5,6,7,8-тетрагидрохиназолин-4-ил]-2-(цианометил)пиперазин-1-карбоксилат

Раствор трет-бутил 4-[7-[3-[бис[(4-метоксифенил)метил]амино]-2-фтор-5-метил-6-(трифторметил)фенил]-6-метил-2-метилсульфанил-5,6,7,8-тетрагидрохиназолин-4-ил]-2-(цианометил)пиперазин-1-карбоксилата (8,0 г, 9,42 ммоль) и пероксимоносульфата калия (17,3 г, 28,2 ммоль) в тетрагидрофуране (80 мл) и воде (40 мл) перемешивали при комнатной температуре в течение 3 часов. После завершения растворитель концентрировали в вакууме, реакцию гасили сульфитом натрия, экстрагировали этилацетатом, сушили над безводным сульфатом натрия и концентрировали в вакууме с получением неочищенного продукта. Неочищенный продукт непосредственно использовали для следующего этапа без очистки. ЖХМС: (ИЭР, m/z): 881,4 [М+Н]+.
Этап 10: трет-бутил 4-[7-[3-[бис[(4-метоксифенил)метил]амино]-2-фтор-5-метил-6-(трифторметил)фенил]-6-метил-2-[[(2S)-1-метилпирролидин-2-ил]метокси]-5,6,7,8-тетрагидрохиназолин-4-ил]-2-(цианометил)пиперазин-1-карбоксилат
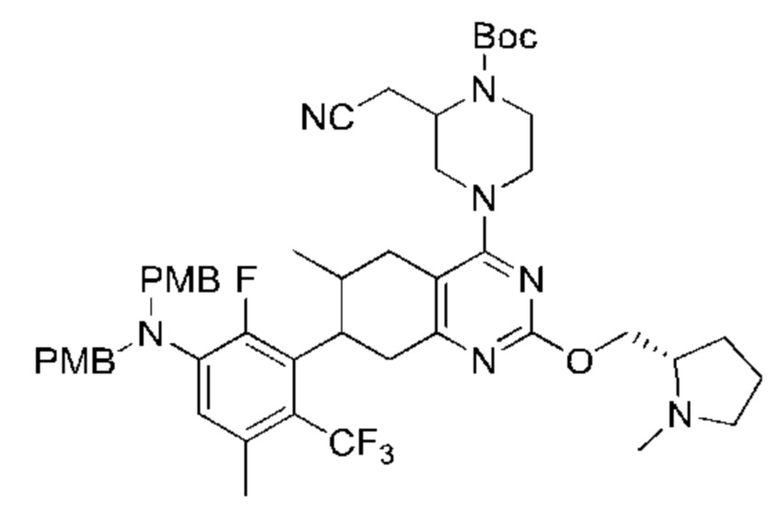
Раствор гидрида натрия (1,82 г, 45,4 ммоль, 60% дисперсия в минеральном масле) и N-метил-1-пролинола (2,09 г, 18,1 ммоль) в ДМФ (80 мл) перемешивали при 0°С в течение 10 минут. Потом добавляли трет-бутил 4-[7-[3-[бис[(4-метоксифенил)метил]амино]-2-фтор-5-метил-6-(трифторметил)фенил]-6-метил-2-метилсульфонил-5,6,7,8-тетрагидрохиназолин-4-ил]-2-(цианометил)пиперазин-1-карбоксилат (8,0 г, 9,0 ммоль) и перемешивали при комнатной температуре в течение 30 минут. После завершения реакцию гасили насыщенным раствором хлорида аммония и экстрагировали дихлорметаном. Потом органические слои собирали, сушили над безводным сульфатом натрия и концентрировали в вакууме. Остаток очищали с помощью флэш-хроматографии на силикагеле с элюированием дихлорметаном/метанолом (7/1) с получением трет-бутил 4-[7-[3-[бис[(4-метоксифенил)метил]амино]-2-фтор-5-метил-6-(трифторметил)фенил]-6-метил-2-[[(2S)-1-метилпирролидин-2-ил]метокси]-5,6,7,8-тетрагидрохиназолин-4-ил]-2-(цианометил)пиперазин-1-карбоксилата (5 г, 5,4 ммоль, выход 60,1%) в виде желтого твердого вещества. ЖХМС: (ИЭР, m/z): 916,5 [М+Н]+.
Этап 11: 2-[4-[7-[3-амино-2-фтор-5-метил-6-(трифторметил)фенил]-6-метил-2-[[(2S)-1-метилпирролидин-2-ил]метокси]-5,6,7,8-тетрагидрохиназолин-4-ил]пиперазин-2-ил] ацетонитрил
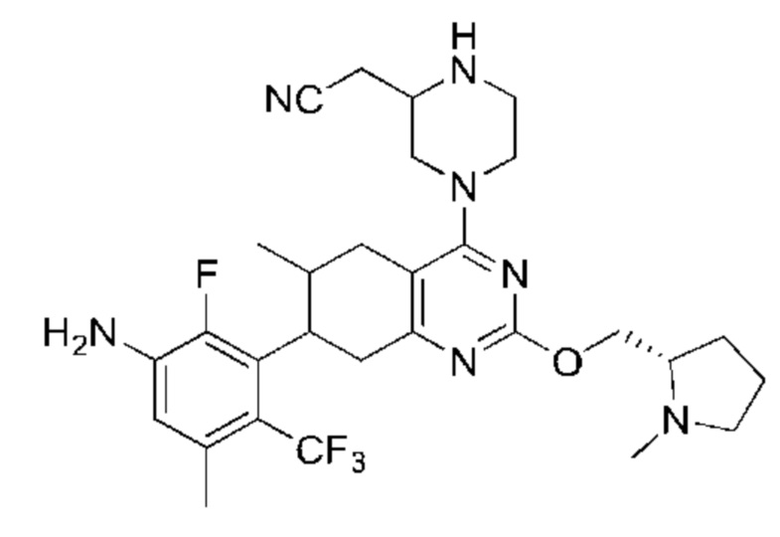
Раствор трет-бутил 4-[7-[3-[бис[(4-метоксифенил)метил]амино]-2-фтор-5-метил-6-(трифторметил)фенил]-6-метил-2-[[(2S)-1-метилпирролидин-2-ил]метокси]-5,6,7,8-тетрагидрохиназолин-4-ил]-2-(цианометил)пиперазин-1-карбоксилата (2,0 г, 2,1 ммоль) в трифторуксусной кислоте (24,89 г, 218,3 ммоль) перемешивали при 40°С в течение 7 минут. Полученный в результате раствор концентрировали в вакууме. Остаток очищали с помощью флэш-хроматографии на силикагеле с элюированием ацетонитр ил ом/вод ой (2:3) с получением 2-[4-[7-[3-амино-2-фтор-5-метил-6-(трифторметил)фенил]-6-метил-2-[[(2S)-1-метилпирролидин-2-ил]метокси]-5,6,7,8-тетрагидрохиназолин-4-ил]пиперазин-2-ил]ацетонитрила (1 г, 1,7 ммоль, выход 79,6%) в виде желтого твердого вещества. ЖХМС: (ИЭР, m/z): 576,3 [М+Н]+.
Этап 12: 2-((R)-4-((6R,7R)-7-(3-амино-2-фтор-5-метил-6-(трифторметил)фенил)-6-метил-2-(((S)-1-метилпирролидин-2-ил)метокси)-5,6,7,8-тетрагидрохиназолин-4-ил)-1-(2-фторакрилоил)пиперазин-2-ил)ацетонитрил (Пример 34а); 2-((R)-4-((6S,7S)-7-(3-амино-2-фтор-5-метил-6-(трифторметил)фенил)-6-метил-2-(((S)-1-метилпирролидин-2-ил)метокси)-5,6,7,8-тетрагидрохиназолин-4-ил)-1-(2-фторакрилоил)пиперазин-2-ил)ацетонитрил (Пример 34b); 2-((S)-4-((6R,7R)-7-(3-амино-2-фтор-5-метил-6-(трифторметил)фенил)-6-метил-2-(((S)-1-метилпирролидин-2-ил)метокси)-5,6,7,8-тетрагидрохиназолин-4-ил)-1-(2-фторакрилоил)пиперазин-2-ил)ацетонитрил (Пример 34с); и 2-((S)-4-((6S,7S)-7-(3-амино-2-фтор-5-метил-6-(трифторметил)фенил)-6-метил-2-(((S)-1-метилпирролидин-2-ил)метокси)-5,6,7,8-тетрагидрохиназолин-4-ил)-1-(2-фторакрилоил)пиперазин-2-ил)ацетонитрил (Пример 34d)
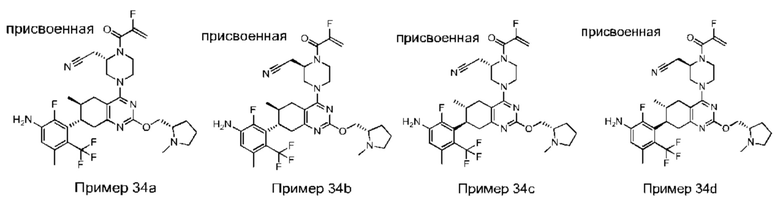
Раствор 2-[4-[7-[3-амино-2-фтор-5-метил-6-(трифторметил)фенил]-6-метил-2-[[(2S)-1-метилпирролидин-2-ил]метокси]-5,6,7,8-тетрагидрохиназолин-4-ил]пиперазин-2-ил]ацетонитрила (1,9 г, 3,3 ммоль), 2-фторакриловой кислоты (297,2 мг, 3,3 ммоль) и N,N-диизопропилэтиламина (1,28 г, 9,9 ммоль) в дихлорметане (38 мл) перемешивали при 25°С. Потом добавляли HATU (1,38 г, 3,6 ммоль) и перемешивали при 25°С в течение 1 часа. После завершения полученный в результате раствор концентрировали в вакууме. Остаток очищали с помощью флэш-хроматографии на силикагеле с элюированием дихлорметаном/метанолом (10/1) с получением 1,1 г неочищенного твердого вещества. Неочищенный продукт очищали с помощью препаративной ВЭЖХ со следующими условиями: колонка: колонка Xselect CSH OBD, 30*150 мм, 5 мкм; подвижная фаза А: вода (0,1% MR), подвижная фаза В: АЦН; скорость потока: 60 мл/мин; градиент: от 18 В до 42 В за 8 мин; 254/220 нм; RT1: 6,67; с получением 600 мг продукта. Продукт дополнительно очищали с помощью хиральной препаративной ВЭЖХ с получением указанных в заголовке соединений. Абсолютная конфигурация указанных в заголовке соединений была определена по данным активности и рентгенограммы белковой структуры соединения 21b.
Пример 34а: 2-((R)-4-((6R,7R)-7-(3-амино-2-фтор-5-метил-6-(трифторметил)фенил)-6-метил-2-(((S)-1-метилпирролидин-2-ил)метокси)-5,6,7,8-тетрагидрохиназолин-4-ил)-1-(2-фторакрилоил)пиперазин-2-ил)ацетонитрил (61 мг, 0,09 ммоль, выход 2,9%, белое твердое вещество). 1H ЯМР (300 МГц, ДМСО-d6, м.д.) δ 6,58 (д, J=8,8 Гц, 1Н), 5,76 (с, 2Н), 5,45-5,13 (м, 2Н), 4,80 (шир. с, 1Н), 4,21 (дд, J=10,8, 4,8 Гц, 1Н), 4,04 (дд, J=10,8, 6,4 Гц, 1Н), 3,95-3,81 (м, 2Н), 3,40-3,30 (м, 2Н), 3,27-3,17 (м, 2Н), 3,16-3,02 (м, 2Н), 2,97-2,84 (м, 4Н), 2,84-2,72 (м, 2Н), 2,53 (с, 1Н), 2,37-2,25 (м, 7Н), 2,19-2,10 (м, 1Н), 1,96-1,83 (м, 1Н), 1,72-1,50 (м, 3H), 0,83 (д, J=6,0 Гц, 3H). ЖХМС: (ИЭР, m/z): 648,3 [М+Н]+. Хиральная ВЭЖХ: колонка: CHIRALPAK IE-3, 4,6*50 мм, 3 мкм; обнаружение на 254 нм; (гексан/ДХМ = 3:1) (0,1% ДЭА): EtOH = 80:20, скорость потока: 1 мл/мин; время удержания: 1,884 мин (более быстрый пик).
Пример 34b: 2-((S)-4-((6S,7S)-7-(3-амино-2-фтор-5-метил-6-(трифторметил)фенил)-6-метил-2-(((S)-1-метилпирролидин-2-ил)метокси)-5,6,7,8-тетрагидрохиназолин-4-ил)-1-(2-фторакрилоил)пиперазин-2-ил)ацетонитрил (54,6 мг, 0,08 ммоль, выход 2,6%, белое твердое вещество). 1H ЯМР (300 МГц, ДМСО-d6, м.д.) δ 6,57 (д, J=8,8 Гц, 1Н), 5,77 (с, 2Н), 5,43-5,19 (м, 2Н), 4,76 (шир. с, 1Н), 4,22 (дд, J=10,8, 5,0 Гц, 1Н), 4,10-3,92 (м, 3H), 3,81 (д, J=12,6 Гц, 1Н), 3,40-3,35 (м, 1Н), 3,19 (д, J=6,3 Гц, 1Н), 3,13 (д, J=6,4 Гц, 1Н), 3,09-2,75 (м, 6Н), 2,69-2,60 (м, 1Н), 2,60-2,55 (м, 1Н), 2,45-2,10 (м, 9Н), 2,00-1,82 (м, 1Н), 1,73-1,48 (м, 3H), 0,83 (д, J=6,2 Гц, 3H). ЖХМС: (ИЭР, m/z): 648,3 [М+Н]+. Хиральная ВЭЖХ: колонка: CHIRALPAK IE-3, 4,6*50 мм, 3 мкм; обнаружение на 254 нм; (гексан/ДХМ = 3:1) (0,1% ДЭА): EtOH = 80:20, скорость потока: 1 мл/мин; время удержания: 2,272 мин (более медленный пик).
Пример 34 с: 2-((S)-4-((6R,7R)-7-(3-амино-2-фтор-5-метил-6-(трифторметил)фенил)-6-метил-2-(((S)-1-метилпирролидин-2-ил)метокси)-5,6,7,8-тетрагидрохиназолин-4-ил)-1-(2-фторакрилоил)пиперазин-2-ил)ацетонитрил (76,3 мг, 0,1 ммоль, выход 3,6%, белое твердое вещество). 1Н ЯМР (300 МГц, ДМСО-d6, м.д.) δ 6,58 (д, J=8,9 Гц, 1Н), 5,75 (с, 2Н), 5,46-5,13 (м, 2Н), 4,76 (с, 1Н), 4,23 (дд, J=10,8, 5,0 Гц, 1Н), 4,13-3,93 (м, 3H), 3,81 (д, J=12,8 Гц, 1Н), 3,45-3,40 (м, 1Н), 3,31-3,257 (м, 1Н), 3,21-2,77 (м, 7H), 2,68-2,53 (м, 2Н), 2,43-2,12 (м, 9Н), 1,98-1,84 (м, 1Н), 1,73-1,51 (м, 3H), 0,82 (д, J=6,2 Гц, 3H). ЖХМС: (ИЭР, m/z): 648,3 [М+Н]+. Хиральная ВЭЖХ: колонка: CHIRALPAK IC-3, 4,6*50 мм, 3 мкм; обнаружение на 254 нм; гексан (0,1% ДЭА): EtOH = 60:40, скорость потока: 1 мл/мин; время удержания: 2,489 мин (более быстрый пик).
Пример 34d: 2-((S)-4-((6S,7S)-7-(3-амино-2-фтор-5-метил-6-(трифторметил)фенил)-6-метил-2-(((S)-1-метилпирролидин-2-ил)метокси)-5,6,7,8-тетрагидрохиназолин-4-ил)-1-(2-фторакрилоил)пиперазин-2-ил)ацетонитрил (85,2 мг, 0,1 ммоль, выход 4%, белое твердое вещество). 1Н ЯМР (300 МГц, ДМСО-d6, м. д.) δ 6,57 (д, J=8,9 Гц, 1Н), 5,76 (с, 2Н), 5,45-5,13 (м, 2Н), 4,80 (шир. с, 1Н), 4,24 (дд, J=10,7, 4,8 Гц, 1Н), 4,04-3,78 (м, 4Н), 3,41-3,03 (м, 5Н), 2,97-2,69 (м, 6Н), 2,36-2,09 (м, 9Н), 1,97-1,81 (м, 1Н), 1,73-1,50 (м, 3H), 0,83 (д, J=6,0 Гц, 3H). ЖХМС: (ИЭР, m/z): 648,3 [М+Н]+. Хиральная ВЭЖХ: колонка: CHIRALPAK IC-3, 4,6*50 мм, 3 мкм; обнаружение на 254 нм; гексан (0,1% ДЭА): EtOH = 60:40, скорость потока: 1 мл/мин; время удержания: 3,293 мин (более медленный пик).
Примеры 35а, 35b, 35 с и 35d

2-((R)-1-акрилоил-4-((6S,7S)-7-(2,3-дигидро-1Н-инден-4-ил)-6-метил-2-(((S)-1-метилпирролидин-2-ил)метокси)-5,6,7,8-тетрагидрохиназолин-4-ил)пиперазин-2-ил)ацетонитрил (Пример 35а); и
2-((R)-1-акрилоил-4-((6R,7R)-7-(2,3-дигидро-1Н-инден-4-ил)-6-метил-2-(((S)-1-метилпирролидин-2-ил)метокси)-5,6,7,8-тетрагидрохиназолин-4-ил)пиперазин-2-ил)ацетонитрил (Пример 35b); и
2-((S)-1-акрилоил-4-((6S,7S)-7-(2,3-дигидро-1Н-инден-4-ил)-6-метил-2-(((S)-1-метилпирролидин-2-ил)метокси)-5,6,7,8-тетрагидрохиназолин-4-ил)пиперазин-2-ил)ацетонитрил (Пример 35 с); и
2-((S)-1-акрилоил-4-(6R,7R)-7-(2,3-дигидро-1Н-инден-4-ил)-6-метил-2-(((S)-1-метилпирролидин-2-ил)метокси)-5,6,7,8-тетрагидрохиназолин-4-ил)пиперазин-2-ил)ацетонитрил (Пример 35d)
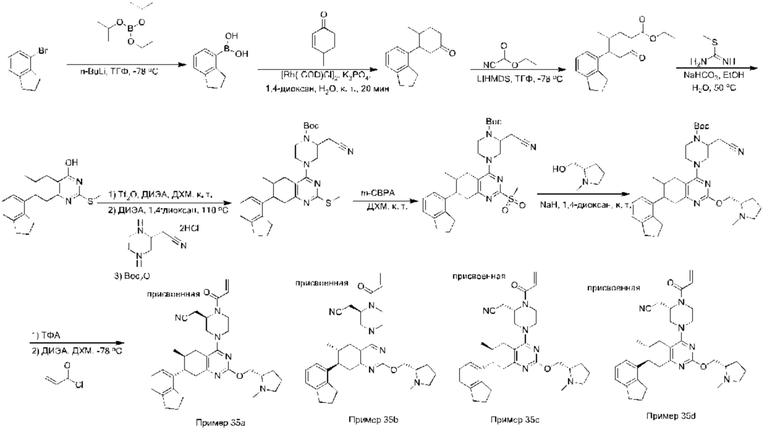
Этап 1: индан-4-илбороновая кислота
В атмосфере азота раствор 4-броминдана (5,0 г, 25,3 ммоль) в тетрагидрофуране (50 мл) перемешивали при -78°С в течение 5 минут. Потом по каплям добавляли триизопропилборат (23,86 г, 126,8 ммоль) и перемешивали при -78°С в течение 30 минут. Потом добавляли н-бутиллитий (2,5 М в гексане) (15 мл, 38,0 ммоль) и перемешивали при -78°С в течение 20 минут. После завершения реакцию гасили водой, экстрагировали дихлорметаном, сушили над безводным сульфатом натрия и концентрировали в вакууме. Остаток очищали с помощью флэш-хроматографии на силикагеле с элюированием дихлорметаном/этилацетатом (9/1) с получением индан-4-илбороновой кислоты (2,7 г, 16,6 ммоль, выход 65,7%) в виде белого твердого вещества. ЖХМС (ИЭР, m/z): 161,1 [М-Н]-.
Этап 2: 3-индан-4-ил-4-метил-циклогексанон

В атмосфере азота раствор индан-4-илбороновой кислоты (5,0 г, 30,8 ммоль), 4-метилциклогекс-2-ен-1-она (6,8 г, 61,7 ммоль), димера хлор(1,5-циклооктадиен)родия (I) (1,52 г, 3,0 ммоль) и фосфата калия (19,6 г, 92,6 ммоль) в 1,4-диоксане (50 мл) и воде (10 мл) перемешивали при 25°С в течение 20 минут. После завершения полученный в результате раствор разводили водой, экстрагировали дихлорметаном, сушили над безводным сульфатом натрия и концентрировали в вакууме. Остаток очищали с помощью флэш-хроматографии на силикагеле с элюированием петролейным эфиром/этилацетатом (5/1) с получением 3-индан-4-ил-4-метил-циклогексанона (4 г, 17,5 ммоль, выход 56,8%) в виде желтого масла. ЖХМС (ИЭР, m/z): 229,2 [М+Н]+.
Этап 3: этил 4-индан-4-ил-5-метил-2-оксо-циклогексанкарбоксилат

В атмосфере азота раствор 3-индан-4-ил-4-метил-циклогексанона (3,6 г, 15,7 ммоль) в тетрагидрофуране (40 мл) перемешивали при -78°С в течение 2 минут. Потом добавляли бис(триметилсилил)амид лития (1 М в ТГФ) (31 мл, 31 ммоль) и перемешивали при -78°С в течение 20 минут. Потом добавляли этилцианоформиат (3,5 г, 36,26 ммоль) и перемешивали при -78°С в течение 30 минут. После завершения реакцию гасили водой, экстрагировали дихлорметаном. Потом органические слои собирали, сушили над безводным сульфатом натрия и концентрировали в вакууме. Остаток очищали с помощью флэш-хроматографии на силикагеле с элюированием петролейным эфиром/этилацетатом (9/1) с получением этил 4-индан-4-ил-5-метил-2-оксо-циклогексанкарбоксилата (4 г, 13,3 ммоль, выход 84,5%) в виде желтого масла. ЖХМС (ИЭР, m/z): 301,2 [М+Н]+.
Этап 4: 7-индан-4-ил-6-метил-2-метилсульфанил-5,6,7,8-тетрагидрохиназолин-4-ол

Раствор этил 4-индан-4-ил-5-метил-2-оксо-циклогексанкарбоксилата (4,0 г, 13,3 ммоль), 2-метил-2-тиопсевдомочевины сульфата (37,1 г, 133,1 ммоль) и бикарбоната натрия (22,3 г, 266,3 ммоль) в этаноле (40 мл) и воде (8 мл) перемешивали при 50°С в течение 3 часов. После завершения реакцию разводили водой и экстрагировали дихлорметаном. Потом органические слои объединяли, сушили над безводным сульфатом натрия и концентрировали в вакууме. Остаток очищали с помощью флэш-хроматографии на силикагеле с элюированием дихлорметаном/этилацетатом (7/3) с получением 7-индан-4-ил-6-метил-2-метилсульфанил-5,6,7,8-тетрагидрохиназолин-4-ола (2 г, 6,12 ммоль, выход 46%) в виде белого твердого вещества. ЖХМС (ИЭР, m/z): 327,1 [М+Н]+.
Этап 5: трет-бутил 2-(цианометил)-4-(7-индан-4-ил-6-метил-2-метилсульфанил-5,6,7,8-тетрагидрохиназолин-4-ил)пиперазин-1-карбоксилат
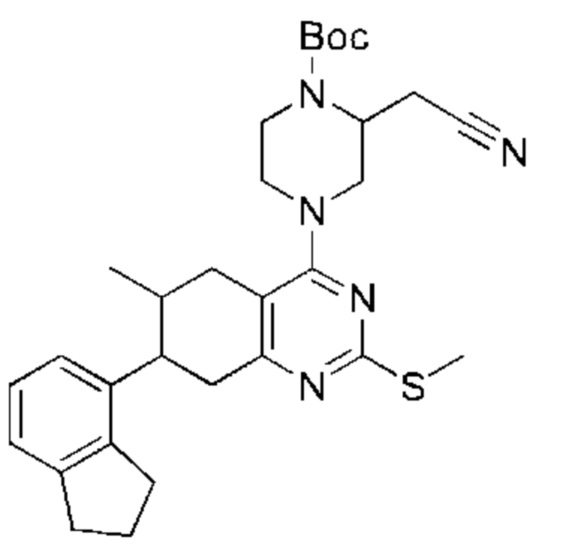
Раствор 7-индан-4-ил-6-метил-2-метилсульфанил-5,6,7,8-тетрагидрохиназолин-4-ола (2,0 г, 6,1 ммоль), трифторметансульфонового ангидрида (3,11 г, 11,0 ммоль) и N,N-диизопропилэтиламина (3,95 г, 30,6 ммоль) в дихлорметане (20 мл) перемешивали при 25°С в течение 1 часа. После завершения реакцию концентрировали при пониженном давлении. Потом остаток, N,N-диизопропилэтиламин (3,9 г, 30,6 ммоль) и 2-пиперазин-2-илацетонитрил (1,5 г, 12,2 ммоль) в 1,4-диоксане (20 мл) перемешивали при 110°С в течение 2 часов. Потом добавляли ди-трет-бутилдикарбонат (5,3 г, 24,5 ммоль) и перемешивали при 25°С в течение 1 часа. После завершения полученный в результате раствор концентрировали в вакууме. Остаток очищали с помощью флэш-хроматографии на силикагеле с элюированием петролейным эфиром/этилацетатом (10/1) с получением трет-бутил 2-(цианометил)-4-(7-индан-4-ил-6-метил-2-метилсульфанил-5,6,7,8-тетрагидрохиназолин-4-ил)пиперазин-1-карбоксилата (2,5 г, 4,6 ммоль, выход 76,5%) в виде белого твердого вещества. ЖХМС (ИЭР, m/z): 534,3 [М+Н]+.
Этап 6: трет-бутил 2-(цианометил)-4-(7-индан-4-ил-6-метил-2-метилсульфонил-5,6,7,8-тетрагидрохиназолин-4-ил)пиперазин-1-карбоксилат

Раствор трет-бутил 2-(цианометил)-4-(7-индан-4-ил-6-метил-2-метилсульфанил-5,6,7,8-тетрагидрохиназолин-4-ил)пиперазин-1-карбоксилата (2,5 г, 4,6 ммоль) и 3-хлорпероксибензойной кислоты (1,61 г, 9,3 ммоль) в дихлорметане (25 мл) перемешивали при 25°С в течение 30 минут. После завершения полученный в результате раствор гасили насыщенным раствором сульфита натрия, экстрагировали дихлорметаном. Потом органические слои собирали, сушили над безводным сульфатом натрия и концентрировали в вакууме. Остаток очищали с помощью флэш-хроматографии на силикагеле с элюированием петролейным эфиром/этилацетатом (5/1) с получением трет-бутил 2-(цианометил)-4-(7-индан-4-ил-6-метил-2-метилсульфонил-5,6,7,8-тетрагидрохиназолин-4-ил)пиперазин-1-карбоксилата (1,6 г, 2,8 ммоль, выход 60,4%) в виде белого твердого вещества. ЖХМС (ИЭР, m/z): 566,3 [М+Н]+.
Этап 7: трет-бутил 2-(цианометил)-4-[7-индан-4-ил-6-метил-2-[[(2S)-1-метилпирролидин-2-ил]метокси]-5,6,7,8-тетрагидрохиназолин-4-ил]пиперазин-1-карбоксилат
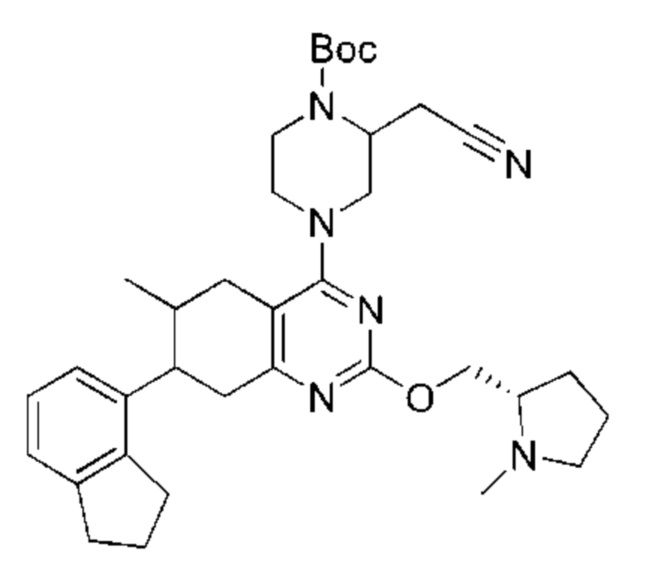
Раствор N-метил-1-пролинола (0,65 г, 5,6 ммоль) в 1,4-диоксане (80 мл) перемешивали при 25°С в течение 5 минут. Потом добавляли гидрид натрия (0,4 г, 11,3 ммоль, 60% дисперсия в минеральном масле) и перемешивали при 0°С в течение 10 минут. Потом добавляли трет-бутил 2-(цианометил)-4-(7-индан-4-ил-6-метил-2-метилсульфонил-5,6,7,8-тетрагидрохиназолин-4-ил)пиперазин-1-карбоксилат (1,6 г, 2,8 ммоль) и перемешивали при 25°С в течение 30 минут. После завершения полученный в результате раствор доводили до рН 8 насыщенным раствором хлорида аммония. Растворитель разводили водой, экстрагировали этилацетатом, промывали водой. Органический слой сушили над безводным сульфатом натрия и концентрировали в вакууме. Остаток очищали с помощью флэш-хроматографии на силикагеле с элюированием дихлорметаном/метанолом (10/1) с получением трет-бутил 2-(цианометил)-4-[7-индан-4-ил-6-метил-2-[[(2S)-1-метилпирролидин-2-ил]метокси]-5,6,7,8-тетрагидрохиназолин-4-ил]пиперазин-1-карбоксилата (1,1 г, 1,8 ммоль, выход 64,7%) в виде белого твердого вещества. ЖХМС (ИЭР, m/z): 601,4 [М+Н]+
Этап 8: 2-((R)-1-акрилоил-4-((6S,7S)-7-(2,3-дигидро-1Н-инден-4-ил)-6-метил-2-(((S)-1-метилпирролидин-2-ил)метокси)-5,6,7,8-тетрагидрохиназолин-4-ил)пиперазин-2-ил)ацетонитрил (Пример 35а); 2-((R)-1-акрилоил-4-((6R,7R)-7-(2,3-дигидро-1Н-инден-4-ил)-6-метил-2-(((S)-1-метилпирролидин-2-ил)метокси)-5,6,7,8-тетрагидрохиназолин-4-ил)пиперазин-2-ил)ацетонитрил (Пример 35b); 2-((S)-1-акрилоил-4-((6S,7S)-7-(2,3-дигидро-1Н-инден-4-ил)-6-метил-2-(((S)-1-метилпирролидин-2-ил)метокси)-5,6,7,8-тетрагидрохиназолин-4-ил)пиперазин-2-ил)ацетонитрил (Пример 35с); и 2-((S)-1-акрилоил-4-((6R,7R)-7-(2,3-дигидро-1Н-инден-4-ил)-6-метил-2-(((S)-1-метилпирролидин-2-ил)метокси)-5,6,7,8-тетрагидрохиназолин-4-ил)пиперазин-2-ил)ацетонитрил (Пример 35d)

Раствор трет-бутил 2-(цианометил)-4-[7-индан-4-ил-6-метил-2-[[(2S)-1-метилпирролидин-2-ил] метокси]-5,6,7,8-тетрагидрохиназолин-4-ил]пиперазин-1-карбоксилата (1,0 г, 1,6 ммоль) и трифторуксусной кислоты (3,8 г, 33,2 ммоль) в дихлорметане (10 мл) перемешивали при 25°С в течение 30 минут. После завершения полученный в результате раствор концентрировали при пониженном давлении и растворяли в дихлорметане (10 мл). Потом добавляли N,N-диизопропилэтиламин (2,1 г, 16,6 ммоль) и перемешивали при -78°С в течение 20 минут. После завершения полученный в результате раствор концентрировали в вакууме. Остаток очищали с помощью флэш-хроматографии на силикагеле с элюированием дихлорметаном/метанолом (10/1) с получением 1 г неочищенного твердого вещества. Неочищенный продукт очищали с помощью препаративной ВЭЖХ со следующими условиями: (колонка: колонка XBridge Prep OBD С18 30×150 мм, 5 мкм; подвижная фаза А: вода (10 ммоль/л NH4HCO3), подвижная фаза В: АЦН; скорость потока: 60 мл/мин; градиент: от 41 В до 71 В за 7 мин; 254 нм; RT1: 6,11) с получением 250 мг белого твердого вещества в виде смеси четырех изомеров. Продукт дополнительно очищали с помощью хиральной препаративной ВЭЖХ со следующими условиями (колонка CHIRALPAK IC-3, подвижная фаза: (гексан:ДХМ = 3:1) (0,1% ДЭА):EtOH = 50:50; детектор, УФ 254 нм) и (колонка CHIRAL Cellulose-SB, подвижная фаза: МТБЭ (0,1% ДЭА):ИПА = 80:20; детектор, УФ 254 нм) с получением указанных в заголовке соединений. Абсолютная конфигурация указанных в заголовке соединений была определена по данным активности и рентгенограммы белковой структуры соединения 21b.
Пример 35а: 2-((R)-1-акрилоил-4-((6S,7S)-7-(2,3-дигидро-1Н-инден-4-ил)-6-метил-2-(((S)-1-метилпирролидин-2-ил)метокси)-5,6,7,8-тетрагидрохиназолин-4-ил)пиперазин-2-ил)ацетонитрил (23,7 мг, 0,042 ммоль, выход 2,6%, белое твердое вещество). 1Н ЯМР (300 МГц, ДМСО-d6, м.д.) δ 7,20-6,99 (м, 3H), 6,98-6,74 (м, 1Н), 6,18 (дд, J=16,6, 2,3 Гц, 1Н), 5,76 (дд, J=10,4, 2,3 Гц, 1Н), 5,00-4,80 (м, 1Н), 4,45-4,31 (м, 1Н), 4,28-4,17 (м, 1Н), 4,09-3,96 (м, 2Н), 3,93-3,74 (м, 2Н), 3,70-3,55 (м, 1Н), 3,30-3,10 (м, 2Н), 2,99-2,63 (м, 12Н), 2,32 (с, 3H), 2,20-2,09 (м, 1Н), 2,07-1,83 (м, 4Н), 1,73-1,48 (м, 3H), 0,79 (д, J=6,4 Гц, 3H). ЖХМС (ИЭР, m/z): 555,3 [М+Н]+.
Хиральная ВЭЖХ: колонка: CHIRALPAK IC-3, 4,6*50 мм, 3 мкм; обнаружение на 254 нм; (гексан/ДХМ = 3:1) (0,1% ДЭА): EtOH = 50:50; скорость потока: 1 мл/мин; время удержания: 1,967 мин (более быстрый пик).
Пример 35b: 2-((R)-1-акрилоил-4-((6R,7R)-7-(2,3-дигидро-1Н-инден-4-ил)-6-метил-2-(((S)-1-метилпирролидин-2-ил)метокси)-5,6,7,8-тетрагидрохиназолин-4-ил)пиперазин-2-ил)ацетонитрил (20,6 мг, 0,036 ммоль, выход 2,2%). 1Н ЯМР (300 МГц, ДМСО-d6, м.д.) δ 7,20-6,95 (м, 3H), 6,94-6,76 (м, 1Н), 6,18 (дд, J=16,6, 2,3 Гц, 1Н), 5,77 (дд, J=10,4, 2,4 Гц, 1Н), 4,95-4,78 (м, 1Н), 4,53-3,86 (м, 4Н), 3,81-3,61 (м, 1Н), 3,52-3,38 (м, 1Н), 3,19-2,58 (м, 14Н), 2,44-2,37 (м, 1Н), 2,32 (с, 3H), 2,21-1,81 (м, 5Н), 1,72-1,47 (м, 3H), 0,80 (д, J=6,2 Гц, 3H). ЖХМС (ИЭР, m/z): 555,3 [М+Н]+. Хиральная ВЭЖХ: колонка: CHIRAL ART Cellulose-SB, 4,6*100 мм, 3 мкм; обнаружение на 254 нм; МТБЭ (0,1% ДЭА):ИПА = 80:20, скорость потока: 1 мл/мин; время удержания: 2,972 мин (более медленный пик).
Пример 35 с: 2-((S)-1-акрилоил-4-((6S,7S)-7-(2,3-дигидро-1Н-инден-4-ил)-6-метил-2-(((S)-1-метилпирролидин-2-ил)метокси)-5,6,7,8-тетрагидрохиназолин-4-ил)пиперазин-2-ил)ацетонитрил (20,3 мг, 0,036 ммоль, выход 2,2%). 1Н ЯМР (300 МГц, ДМСО-d6, м д.) δ 7,18-6,97 (м, 3H), 6,93-6,76 (м, 1Н), 6,18 (дд, J=16,7, 2,4 Гц, 1Н), 5,77 (дд, J=10,4, 2,3 Гц, 1Н), 4,95-4,78 (м, 1Н), 4,48-3,63 (м, 5Н), 3,51-3,35 (м, 1Н), 3,25-2,58 (м, 14Н), 2,41 (с, 1Н), 2,32 (с, 3H), 2,20-1,79 (м, 5Н), 1,72-1,45 (м, 3H), 0,80 (д, J=6,3 Гц, 3H). ЖХМС (ИЭР, m/z): 555,3 [М+Н]+. Хиральная ВЭЖХ: колонка: CHIRAL ART Cellulose-SB, 4,6*100 мм, 3 мкм; обнаружение на 254 нм; МТБЭ (0,1% ДЭА):ИПА = 80:20, скорость потока: 1 мл/мин; время удержания: 2,480 мин (более быстрый пик).
Пример 35d: 2-((S)-1-акрилоил-4-((6R,7R)-7-(2,3-дигидро-1H-инден-4-ил)-6-метил-2-(((S)-1-метилпирролидин-2-ил)метокси)-5,6,7,8-тетрагидрохиназолин-4-ил)пиперазин-2-ил)ацетонитрил (23,1 мг, 0,041 ммоль, выход 2,5%). 1Н ЯМР (300 МГц, ДМСО-d6, м.д.) δ 7,20-7,01 (м, 3H), 6,97-6,77 (м, 1Н), 6,18 (дд, J=16,6, 2,3 Гц, 1Н), 5,77 (дд, J=10,4, 2,3 Гц, 1Н), 4,98-4,78 (м, 1Н), 4,47-4,31 (м, 1Н), 4,23 (дд, J=10,7, 4,8 Гц, 1Н), 4,08-3,93 (м, 2Н), 3,92-3,72 (м, 2Н), 3,70-3,51 (м, 1Н), 3,29-3,10 (м, 2Н), 3,01-2,63 (м, 12Н), 2,31 (с, 3H), 2,16-2,13 (м, 1Н), 2,04-1,82 (м, 4Н), 1,70-1,47 (м, 3H), 0,79 (д, J=6,3 Гц, 3H). ЖХМС (ИЭР, m/z): 555,3 [М+Н]+. Хиральная ВЭЖХ: колонка: CHIRALPAK IC-3, 4,6*50 мм, 3 мкм; обнаружение на 254 нм; (гексан:ДХМ = 3:1) (0,1% ДЭА): EtOH = 50:50; скорость потока: 1 мл/мин; время удержания: 3,610 мин (более медленный пик). Примеры 36а и 36b
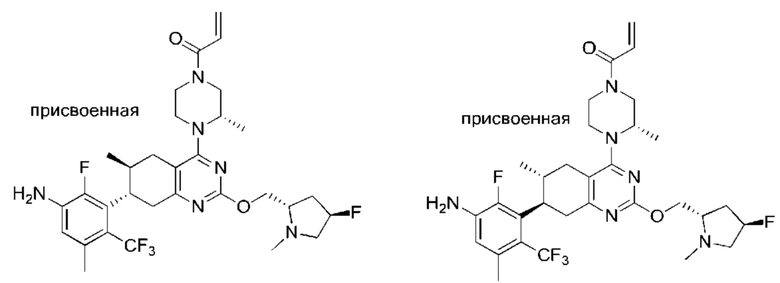
Пример 36а Пример 36b
1-[(3S)-4-[(6S,7S)-7-[3-амино-2-фтор-5-метил-6-(трифторметил)фенил]-2-[[(2S,4R)-4-фтор-1-метил-пирролидин-2-ил]метокси]-6-метил-5,6,7,8-тетрагидрохиназолин-4-ил]-3-метил-пиперазин-1-ил]проп-2-ен-1-он (Пример 36а); и
1-[(3S)-4-[(6R,7R)-7-[3-амино-2-фтор-5-метил-6-(трифторметил)фенил]-2-[[(2S,4R)-4-фтор-1-метил-пирролидин-2-ил]метокси]-6-метил-5,6,7,8-тетрагидрохиназолин-4-ил]-3-метил-пиперазин-1-ил]проп-2-ен-1-он (Пример 36b)
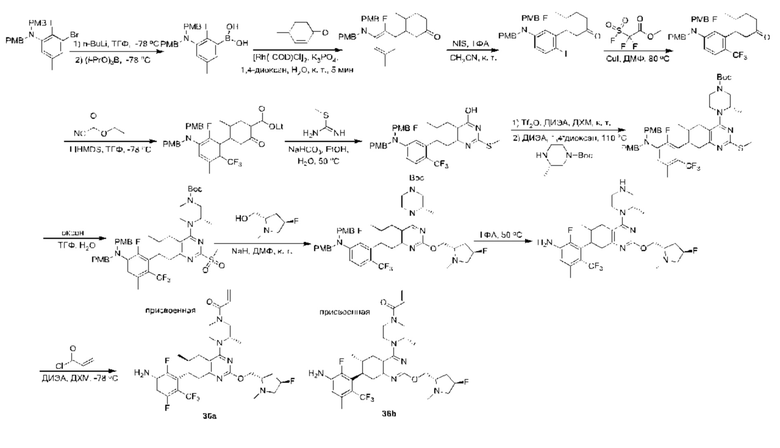
Этап 1: (3-(бис(4-метоксибензил)амино)-2-фтор-5-метилфенил)бороновая кислота

В атмосфере азота раствор 3-бром-2-фтор-N,N-бис(4-метоксибензил)-5-метиланилина (20,0 г, 46,8 ммоль) в тетрагидрофуране (200 мл) перемешивали при -78°С в течение 5 минут. Потом по каплям добавляли н-бутиллитий (2,5 М в гексане) (28 мл, 70,2 ммоль) и перемешивали при -78°С в течение 30 минут. Потом добавляли триизопропилборат (44,0 г, 234,0 ммоль) и перемешивали при -78°С в течение 20 минут. После завершения полученный в результате раствор концентрировали в вакууме.
Этап 2: 3-(3-(бис(4-метоксибензил)амино)-2-фтор-5-метилфенил)-4-метилциклогексан-1-он
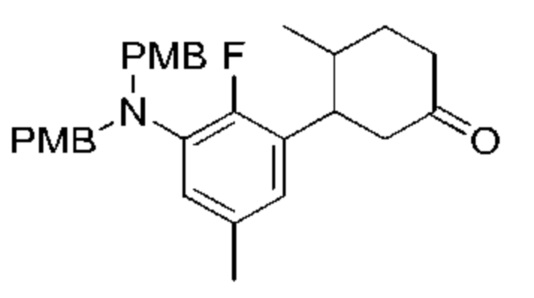
В атмосфере азота остаток с предыдущего этапа, 4-метилциклогекс-2-ен-1-он (5,1 г, 46,8 ммоль) и димер хлор(1,5-циклооктадиен)родия (I) (2,3 г, 4,68 ммоль) в 1,4-диоксане (200 мл) перемешивали при 25°С в течение 5 минут. Потом добавляли насыщенный раствор фосфата калия (40 мл) и перемешивали при 25°С в течение 1 часа. После завершения реакцию разводили водой, экстрагировали этилацетатом, сушили над безводным сульфатом натрия и концентрировали в вакууме. Остаток очищали с помощью флэш-хроматографии на силикагеле с элюированием петролейным эфиром/этилацетатом (10/1) с получением 3-(3-(бис(4-метоксибензил)амино)-2-фтор-5-метилфенил)-4-метилциклогексан-1-она (11 г, 23,9 ммоль, выход 51,3%) в виде желтого твердого вещества. ЖХМС: (ИЭР, m/z): 476,3 [М+Н]+.
Этап 3: 3-[3-[бис[(4-метоксифенил)метил]амино]-2-фтор-6-йодо-5-метил-фенил]-4-метил-циклогексанон

Раствор 3-(3-(бис(4-метоксибензил)амино)-2-фтор-5-метилфенил)-4-метилциклогексан-1-она (25,0 г, 52,5 ммоль) и N-йодосукцинимида (14,1 г, 63,0 ммоль) в ацетонитриле (250 мл) перемешивали при комнатной температуре в течение 2 минут. Потом добавляли трифторуксусную кислоту (0,6 г, 5,2 ммоль) и перемешивали при 25°С в течение 20 минут. После завершения полученный в результате раствор концентрировали в вакууме. Раствор разводили водой. Полученный в результате раствор экстрагировали этилацетатом и объединяли органические слои. Органический слой сушили над безводным сульфатом натрия и концентрировали в вакууме. Остаток очищали с помощью флэш-хроматографии на силикагеле с элюированием петролейным эфиром/этилацетатом (3/1) с получением 3-[3-[бис[(4-метоксифенил)метил]амино]-2-фтор-6-йодо-5-метил-фенил]-4-метил-циклогексанона (30 г, 49,8 ммоль, выход 94,9%) в виде желтого масла. ЖХМС: (ИЭР, m/z): 602,1 [М+Н]+.
Этап 4: 3-[3-[бис[(4-метоксифенил)метил]амино]-2-фтор-5-метил-6-(трифторметил)фенил]-4-метил-циклогексанон
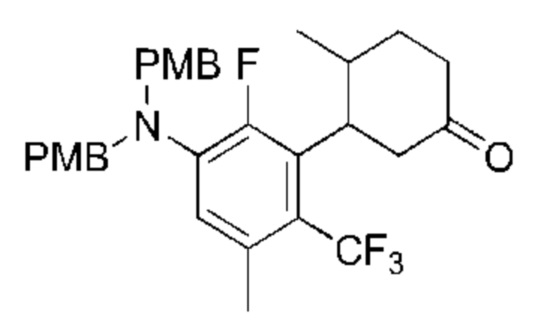
В атмосфере азота раствор 3-[3-[бис[(4-метоксифенил)метил]амино]-2-фтор-6-йодо-5-метил-фенил]-4-метил-циклогексанона (20,0 г, 33,2 ммоль), метил 2,2-дифтор-2-(фторсульфонил)ацетата (31,9 г, 166,2 ммоль) и йодида меди (12,6 г, 66,5 ммоль) в N,N-диметилформамиде (200 мл) перемешивали при 80°С в течение 2 часов. После завершения реакцию гасили водой. Полученный в результате раствор экстрагировали этилацетатом и объединяли органические слои. Органический слой сушили над безводным сульфатом натрия и концентрировали в вакууме. Остаток очищали с помощью флэш-хроматографии на силикагеле с элюированием петролейным эфиром/этилацетатом (5/1) с получением 3-[3-[бис[(4-метоксифенил)метил]амино]-2-фтор-5-метил-6-(трифторметил)фенил]-4-метил-циклогексанона (12 г, 22,0 ммоль, выход 66,4%) в виде желтого масла. ЖХМС: (ИЭР, m/z): 544,2 [М+Н]+.
Этап 5: этил 4-[3-[бис[(4-метоксифенил)метил]амино]-2-фтор-5-метил-6-(трифторметил)фенил]-5-метил-2-оксо-циклогексанкарбоксилат
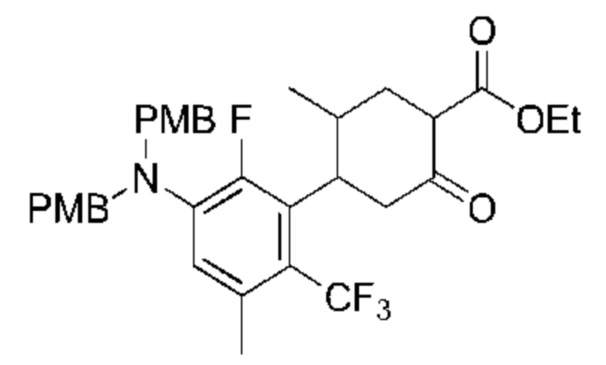
В атмосфере азота раствор 3-[3-[бис[(4-метоксифенил)метил]амино]-2-фтор-5-метил-6-(трифторметил)фенил]-4-метил-циклогексанона (10,0 г, 18,4 ммоль) в тетрагидрофуране (100 мл) перемешивали при -78°С в течение 3 минут. По каплям добавляли бис(триметилсилил)амид лития (1,0 М в ТГФ) (33 мл, 33 ммоль) и перемешивали при -78°С в течение 10 минут. Потом добавляли этилцианоформиат (4,1 г, 42,3 ммоль) и перемешивали при -78°С в течение 20 минут. После завершения реакцию гасили водой, экстрагировали этилацетатом, сушили над безводным сульфатом натрия и концентрировали в вакууме с получением неочищенного продукта. Неочищенный продукт непосредственно использовали для следующего этапа без очистки. ЖХМС: (ИЭР, m/z): 616,3 [М+Н]+.
Этап 6: 7-[3-[бис[(4-метоксифенил)метил]амино]-2-фтор-5-метил-6-(трифторметил)фенил]-6-метил-2-метилсульфанил-5,6,7,8-тетрагидрохиназолин-4-ол
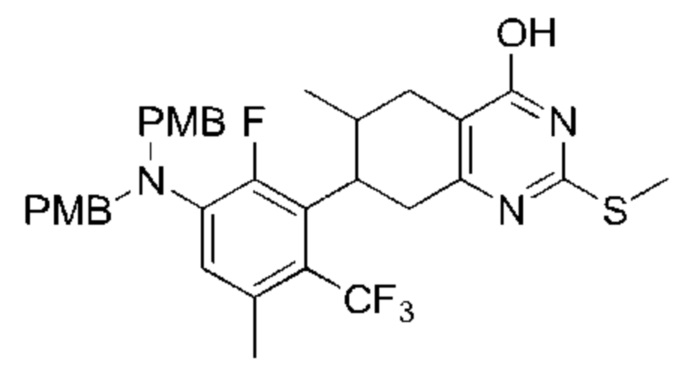
Раствор этил 4-[3-[бис[(4-метоксифенил)метил]амино]-2-фтор-5-метил-6-(трифторметил)фенил]-5-метил-2-оксо-циклогексанкарбоксилата (20,0 г, 32,4 ммоль), 2-метил-2-тиопсевдомочевины сульфата (90,3 г, 324,8 ммоль) и бикарбоната натрия (54,5 г, 649,7 ммоль) в этаноле (200 мл) и воде (40 мл) перемешивали при 50°С в течение 4 часов. После завершения полученный в результате раствор разводили водой и экстрагировали этилацетатом. Потом органические слои объединяли, промывали солевым раствором, сушили над безводным сульфатом натрия и концентрировали в вакууме. Остаток очищали с помощью флэш-хроматографии на силикагеле с элюированием дихлорметаном/этилацетатом (4/1) с получением 7-[3-[бис[(4-метоксифенил)метил]амино]-2-фтор-5-метил-6-(трифторметил)фенил]-6-метил-2-метилсульфанил-5,6,7,8-тетрагидрохиназолин-4-ола (7 г, 10,9 ммоль, выход 33,6%) в виде желтого твердого вещества. ЖХМС: (ИЭР, m/z): 642,2 [М+Н]+.
Этап 7: трет-бутил (3S)-4-[7-[3-[бис[(4-метоксифенил)метил]амино]-2-фтор-5-метил-6-(трифторметил)фенил]-6-метил-2-метилсульфанил-5,6,7,8-тетрагидрохиназолин-4-ил]-3-метил-пиперазин-1-карбоксилат

Раствор 7-[3-[бис[(4-метоксифенил)метил]амино]-2-фтор-5-метил-6-(трифторметил)фенил]-6-метил-2-метилсульфанил-5,6,7,8-тетрагидрохиназолин-4-ола (4,4 г, 6,8 ммоль), N,N-диизопропилэтиламина (4,4 г, 34,2 ммоль) и трифторметансульфонового ангидрида (3,4 г, 12,3 ммоль) в дихлорметане (50 мл) перемешивали при 25°С в течение 1 часа. После завершения реакцию концентрировали при пониженном давлении. Потом остаток, N,N-диизопропилэтиламин (4,42 г, 34,2 ммоль) и трет-бутил (3S)-3-метил-1-пиперазинкарбоксилат (2,7 г, 13,7 ммоль) в 1,4-диоксане (50 мл) перемешивали при 110°С в течение 16 часов. После завершения полученный в результате раствор концентрировали в вакууме. Остаток очищали с помощью флэш-хроматографии на силикагеле с элюированием петролейным эфиром/этилацетатом (85/15) с получением трет-бутил (3S)-4-[7-[3-[бис[(4-метоксифенил)метил]амино]-2-фтор-5-метил-6-(трифторметил)фенил]-6-метил-2-метилсульфанил-5,6,7,8-тетрагидрохиназолин-4-ил]-3-метил-пиперазин-1-карбоксилата (3,5 г, 4,2 ммоль, выход 62%) в виде белого твердого вещества. ЖХМС: (ИЭР, m/z): 824,4 [М+Н]+.
Этап 8: трет-бутил (3S)-4-[7-[3-[бис[(4-метоксифенил)метил]амино]-2-фтор-5-метил-6-(трифторметил)фенил]-6-метил-2-метилсульфонил-5,6,7,8-тетрагидрохиназолин-4-ил]-3-метил-пиперазин-1-карбоксилат

Раствор трет-бутил (3S)-4-[7-[3-[бис[(4-метоксифенил)метил]амино]-2-фтор-5-метил-6-(трифторметил)фенил]-6-метил-2-метилсульфанил-5,6,7,8-тетрагидрохиназолин-4-ил]-3-метил-пиперазин-1-карбоксилата (3,5 г, 4,2 ммоль) и пероксимоносульфата калия (7,8 г, 12,7 ммоль) в тетрагидрофуране (35 мл) и воде (17,5 мл) перемешивали при комнатной температуре в течение 3 часов. После завершения реакцию гасили насыщенным раствором сульфита натрия, экстрагировали этилацетатом. Потом органические слои собирали, сушили над безводным сульфатом натрия и концентрировали в вакууме с получением неочищенного продукта. Неочищенный продукт непосредственно использовали для следующего этапа без очистки. ЖХМС: (ИЭР, m/z): 856,4 [М+Н]+.
Этап 9: трет-бутил (3S)-4-[7-[3-[бис[(4-метоксифенил)метил]амино]-2-фтор-5-метил-6-(трифторметил)фенил]-2-[[(2S,4R)-4-фтор-1-метил-пирролидин-2-ил]метокси]-6-метил-5,6,7,8-тетрагидрохиназолин-4-ил]-3-метил-пиперазин-1-карбоксилат

Раствор гидрид натрия (0,5 г, 13,6 ммоль, 60% дисперсия в минеральном масле) и [(2S,4R)-4-фтор-1-метил-пирролидин-2-ил]метанола (0,7 г, 5,4 ммоль) в ДМФ (26 мл) перемешивали при 0°С в течение 10 минут. Потом добавлял трет-бутил (3S)-4-[7-[3-[бис[(4-метоксифенил)метил]амино]-2-фтор-5-метил-6-(трифторметил)фенил]-6-метил-2-метилсульфонил-5,6,7,8-тетрагидрохиназолин-4-ил]-3-метил-пиперазин-1-карбоксилат (2,6 г, 2,7 ммоль) и перемешивали при комнатной температуре в течение 30 минут. После завершения реакцию гасили насыщенным раствором хлорида аммония и экстрагировали дихлорметаном. Потом органические слои собирали, сушили над безводным сульфатом натрия и концентрировали в вакууме. Остаток очищали с помощью флэш-хроматографии на силикагеле с элюированием дихлорметаном/этилацетатом (3/1) с получением трет-бутил (3S)-4-[7-[3-[бис[(4-метоксифенил)метил]амино]-2-фтор-5-метил-6-(трифторметил)фенил]-2-[[(2S,4R)-4-фтор-1-метил-пирролидин-2-ил]метокси]-6-метил-5,6,7,8-тетрагидрохиназолин-4-ил]-3-метил-пиперазин-1-карбоксилата (1,2 г, 1,3 ммоль, выход 48,3%) в виде желтого твердого вещества. ЖХМС: (ИЭР, m/z): 908,5 [М+Н]+.
Этап 10: 2-фтор-3-[2-[[(2S,4R)-4-фтор-1-метил-пирролидин-2-ил]метокси]-6-метил-4-[(2S)-2-метилпиперазин-1-ил]-5,6,7,8-тетрагидрохиназолин-7-ил]-5-метил-4-(трифторметил)анилин

Раствор трет-бутил (3S)-4-[7-[3-[бис[(4-метоксифенил)метил]амино]-2-фтор-5-метил-6-(трифторметил)фенил]-2-[[(2S,4R)-4-фтор-1-метил-пирролидин-2-ил]метокси]-6-метил-5,6,7,8-тетрагидрохиназолин-4-ил]-3-метил-пиперазин-1-карбоксилата (1,2 г, 1,3 ммоль) в трифторуксусной кислоте (3,0 г, 26,4 ммоль) перемешивали при 50°С в течение 2 часов. Полученный в результате раствор концентрировали в вакууме. Остаток очищали с помощью флэш-хроматографии на силикагеле с элюированием ацетонитрилом/водой (2:3) с получением 2-фтор-3-[2-[[(2S,4R)-4-фтор-1-метил-пирролидин-2-ил]метокси]-6-метил-4-[(2S)-2-метилпиперазин-1-ил]-5,6,7,8-тетрагидрохиназолин-7-ил]-5-метил-4-(трифторметил)анилина (0,6 г, 1,1 ммоль, выход 89,3%) в виде желтого твердого вещества. ЖХМС: (ИЭР, m/z): 569,3 [М+Н]+.
Этап 11: 1-[(3S)-4-[(6S,7S)-7-[3-амино-2-фтор-5-метил-6-(трифторметил)фенил]-2-[[(28,4R)-4-фтор-1-метил-пирролидин-2-ил]метокси]-6-метил-5,6,7,8-тетрагидрохиназолин-4-ил]-3-метил-пиперазин-1-ил]проп-2-ен-1-он (Пример 36а); и 1-[(3S)-4-[(6R,7R)-7-[3-амино-2-фтор-5-метил-6-(трифторметил)фенил]-2-[[(2S,4R)-4-фтор-1-метил-пирролидин-2-ил]метокси]-6-метил-5,6,7,8-тетрагидрохиназолин-4-ил]-3-метил-пиперазин-1-ил]проп-2-ен-1-он (Пример 36b)

Раствор 2-фтор-3-[2-[[(2S,4R)-4-фтор-1-метил-пирролидин-2-ил]метокси]-6-метил-4-[(2S)-2-метилпиперазин-1-ил]-5,6,7,8-тетрагидрохиназолин-7-ил]-5-метил-4-(трифторметил)анилина (0,65 г, 1,1 ммоль), акриловой кислоты (0,08 г, 1,1 ммоль) и N,N-диизопропилэтиламина (0,44 г, 3,43 ммоль) в дихлорметане (6 мл) перемешивали при -78°С в течение 5 минут. Потом добавлял HATU (434,6 мг, 1,1 ммоль) и перемешивали при 25°С в течение 10 минут. После завершения растворитель разводили дихлорметаном и промывали солевым раствором. Органический слой сушили над безводным сульфатом натрия и концентрировали в вакууме. Остаток очищали с помощью флэш-хроматографии на силикагеле с элюированием дихлорметаном/метанолом (10/1) с получением 350 мг неочищенного твердого вещества. Неочищенный продукт очищали с помощью препаративной ВЭЖХ со следующими условиями: (колонка: колонка XBridge Prep OBD С18 30×150 мм, 5 мкм; подвижная фаза А: вода (10 ммоль/л NH4HCO3), подвижная фаза В: АЦН; скорость потока: 60 мл/мин; градиент: от 40 В до 70 В за 7 мин; 254 нм; RT1: 5,77) с получением 120 мг неочищенного продукта в виде смеси двух изомеров. Продукт дополнительно очищали с помощью хиральной препаративной ВЭЖХ со следующими условиями (колонка: CHIRALPAK IE-3, 4,6*50 мм, 3 мкм; подвижная фаза: гексан (0,1% ДЭА): EtOH = 50:50; скорость потока: 1 мл/мин; градиент: поддержание 20% В в течение 13 мин; 220/254 нм) с получением указанных в заголовке соединений. Абсолютная конфигурация указанных в заголовке соединений была определена по данным активности и рентгенограммы белковой структуры соединения 21b.
Пример 36а: 1-[(3S)-4-[(6S,7S)-7-[3-амино-2-фтор-5-метил-6-(трифторметил)фенил]-2-[[(2S,4R)-4-фтор-1-метил-пирролидин-2-ил]метокси]-6-метил-5,6,7,8-тетрагидрохиназолин-4-ил]-3-метил-пиперазин-1-ил]проп-2-ен-1-он (41,9 мг, 0,06 ммоль, выход 5,9%, белое твердое вещество). 1Н ЯМР (300 МГц, ДМСО-d6, м.д.) δ 6,95-6,73 (м, 1Н), 6,57 (д, J=8,8 Гц, 1Н), 6,16 (д, J=16,4 Гц, 1Н), 5,85-5,66 (м, 3H), 5,16 (д, J=56,0 Гц, 1Н), 4,37-3,98 (м, 4Н), 3,74 (дд, J=74,8, 13,6 Гц, 1Н), 3,53-3,34 (м, 3H), 3,31-3,29 (м, 1Н), 3,28-3,03 (м, 2Н), 2,95-2,78 (м, 3H), 2,59 (д, J=14,9 Гц, 1Н), 2,48-2,00 (м, 10Н), 1,97-1,74 (м, 1Н), 0,97 (т, J=7,9 Гц, 3H), 0,81 (д, J=6,2 Гц, 3H). ЖХМС: (ИЭР, m/z): 623,4 [М+Н]+. Хиральная ВЭЖХ: колонка: CHIRALPAK IE-3, 4,6*50 мм, 3 мкм; обнаружение на 254 нм; гексан (0,1% ДЭА): EtOH = 50:50; скорость потока = 1 мл/мин; время удержания: 2,058 мин (более медленный пик).
Пример 36b: 1-[(3S)-4-[(6R,7R)-7-[3-амино-2-фтор-5-метил-6-(трифторметил)фенил]-2-[[(2S,4R)-4-фтор-1-метил-пирролидин-2-ил]метокси]-6-метил-5,6,7,8-тетрагидрохиназолин-4-ил]-3-метил-пиперазин-1-ил]проп-2-ен-1-он (50,1 мг, 0,08 ммоль, выход 7%, белое твердое вещество). 1H ЯМР (300 МГц, ДМСО-d6, м.д.) δ 6,93-6,73 (м, 1Н), 6,58 (д, J=8,8 Гц, 1Н), 6,22-6,10 (м, 1Н), 5,87-5,67 (м, 3H), 5,17 (д, J=56,1 Гц, 1Н), 4,44-4,02 (м, 5Н), 3,99-3,76 (м, 2Н), 3,54-3,36 (м, 2Н), 3,32-3,28 (м, 1Н), 3,21-3,04 (м, 2Н), 2,96-2,80 (м, 3H), 2,45-2,26 (м, 8Н), 2,25-2,01 (м, 2Н), 1,98-1,74 (м, 1Н), 1,34-1,21 (м, 3H), 0,81 (д, J=6,3 Гц, 3H). ЖХМС: (ИЭР, m/z): 623,4 [М+Н]+. Хиральная ВЭЖХ: колонка: CHIRALPAK IE-3, 4,6*50 мм, 3 мкм; обнаружение на 254 нм; гексан (0,1% ДЭА): EtOH = 50:50; скорость потока = 1 мл/мин; время удержания: 1,606 мин (более быстрый пик).
Примеры 37а и 37b
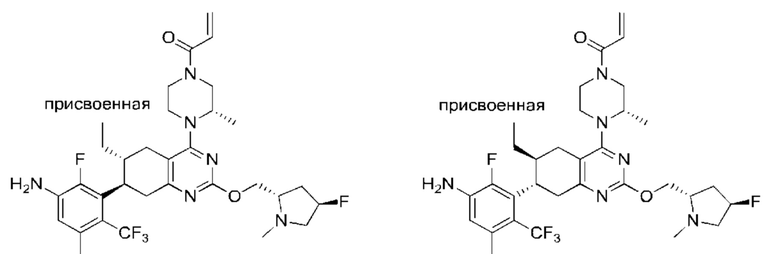
Пример 37а Пример 37b
1-[(3S)-4-[(6R,7R)-7-[3-амино-2-фтор-5-метил-6-(трифторметил)фенил]-6-этил-2-[[(2S,4R)-4-фтор-1-метил-пирролидин-2-ил]метокси]-5,6,7,8-тетрагидрохиназолин-4-ил]-3-метил-пиперазин-1-ил]проп-2-ен-1-он (Пример 37а); и
1-[(3S)-4-[(6S,7S)-7-[3-амино-2-фтор-5-метил-6-(трифторметил)фенил]-6-этил-2-[[(2S,4R)-4-фтор-1-метил-пирролидин-2-ил]метокси]-5,6,7,8-тетрагидрохиназолин-4-ил]-3-метил-пиперазин-1-ил]проп-2-ен-1-он (Пример 37b)
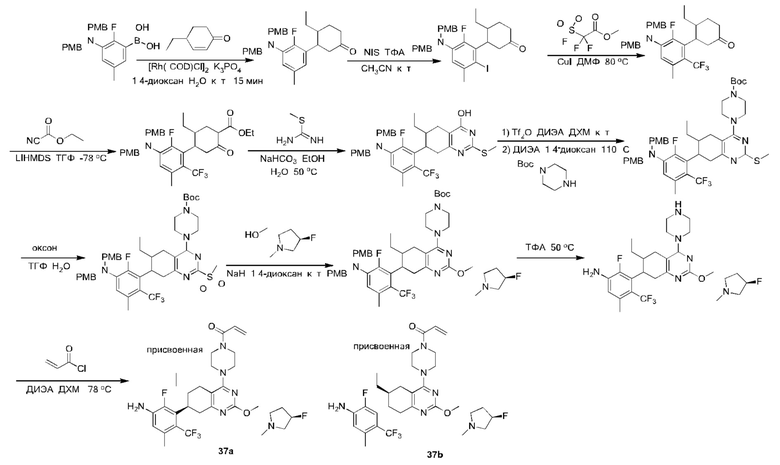
Этап 1 3-[3-[бис[(4-метоксифенил)метил]амино]-2-фтор-5-метил-фенил]-4-этил-циклогексанон
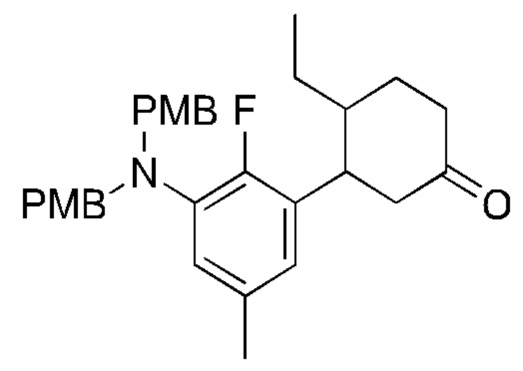
В атмосфере азота раствор [3-[бис[(4-метоксифенил)метил]амино]-2-фтор-5-метил-фенил]бороновой кислоты (20,0 г, 48,87 ммоль), 4-этилциклогекс-2-ен-1-она (6,07 г, 48,87 ммоль), димера хлор(1,5-циклооктадиен)родия (I) (1,2 г, 2,44 ммоль) и фосфата калия (31,1 г, 146,61 ммоль) в 1,4-диоксане (200 мл) и воде (40 мл) перемешивали при комнатной температуре в течение 15 минут После завершения полученный в результате раствор концентрировали в вакууме Остаток разводили водой, экстрагировали дихлорметаном и объединяли органические слои Органический слой сушили над безводным сульфатом натрия и концентрировали в вакууме Остаток очищали с помощью флэш-хроматографии на силикагеле с элюированием петролейным эфиром/этилацетатом (3/1) с получением 3-[3-[бис[(4-метоксифенил)метил]амино]-2-фтор-5-метил-фенил]-4-этил-циклогексанона (10 г, 20,4 ммоль, выход 41,8%) в виде бесцветного масла. ЖХМС: (ИЭР, m/z): 490,3 [М+Н]+
Этап 2: 3-[3-[бис[(4-метоксифенил)метил]амино]-2-фтор-6-йодо-5-метил-фенил]-4-этил-циклогексанон

Раствор 3-[3-[бис[(4-метоксифенил)метил]амино]-2-фтор-5-метил-фенил]-4-этил-циклогексанона (10,0 г, 20,42 ммоль) и N-йодосукцинимида (5,5 г, 24,51 ммоль) в ацетонитриле (200 мл) перемешивали при комнатной температуре в течение 2 минут.Потом добавляли трифторуксусную кислоту (0,2 г, 2,04 ммоль) и перемешивали при 25°С в течение 20 минут. После завершения реакцию гасили насыщенным раствором сульфита натрия, экстрагировали этилацетатом и объединяли органические слои. Органический слой сушили над безводным сульфатом натрия и концентрировали в вакууме. Остаток очищали с помощью флэш-хроматографии на силикагеле с элюированием петролейным эфиром/этилацетатом (3/1) с получением 3-[3-[бис[(4-метоксифенил)метил]амино]-2-фтор-6-йодо-5-метил-фенил]-4-этил-циклогексанона (9 г, 14,62 ммоль, выход 71,6%) в виде желтого масла. ЖХМС: (ИЭР, m/z): 616,1 [М+Н]+
Этап 3: 3-[3-[бис[(4-метоксифенил)метил]амино]-2-фтор-5-метил-6-(трифторметил)фенил]-4-этил-циклогексанон
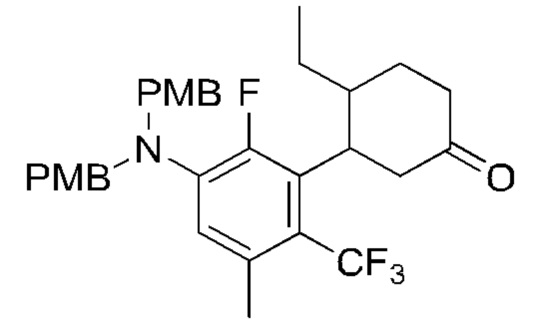
В атмосфере азота раствор 3-[3-[бис[(4-метоксифенил)метил]амино]-2-фтор-6-йодо-5-метил-фенил]-4-этил-циклогексанона (9,0 г, 14,62 ммоль), метил 2,2-дифтор-2-(фторсульфонил)ацетата (14,04 г, 73,11 ммоль) и йодида меди (5,5 г, 29,24 ммоль) в N,N-диметилформамиде (90 мл) перемешивали при 80°С в течение 2 часов. После завершения реакцию разводили водой. Полученный в результате раствор экстрагировали этилацетатом и объединяли органические слои. Органический слой сушили над безводным сульфатом натрия и концентрировали в вакууме. Остаток очищали с помощью флэш-хроматографии на силикагеле с элюированием петролейным эфиром/этилацетатом (5/1) с получением 3-[3-[бис[(4-метоксифенил)метил]амино]-2-фтор-5-метил-6-(трифторметил)фенил]-4-этил-циклогексанона (5 г, 8,96 ммоль, выход 61,3%) в виде желтого масла. ЖХМС: (ИЭР, m/z): 558,2 [М+Н]+.
Этап 4: этил 4-[3-[бис[(4-метоксифенил)метил]амино]-2-фтор-5-метил-6-(трифторметил)фенил]-5-этил-2-оксо-циклогексанкарбоксилат

В атмосфере азота раствор 3-[3-[бис[(4-метоксифенил)метил]амино]-2-фтор-5-метил-6-(трифторметил)фенил]-4-этил-циклогексанона (5,0 г, 8,97 ммоль) в тетрагидрофуране (2 мл) добавляли бис(триметилсилил)амид лития (1 М в ТГФ) (13,4 мл, 13,45 ммоль) при -78°С. Полученный в результате раствор перемешивали в течение 0,5 часа при -78°С. Потом добавляли этилцианоформиат (1,5 г, 15,24 ммоль) и перемешивали при -78°С в течение 2 часов. Реакцию гасили добавлением воды, экстрагировали этилацетатом, сушили над безводным сульфатом натрия и концентрировали в вакууме с получением неочищенного продукта. Неочищенный продукт непосредственно использовали для следующего этапа без очистки. ЖХМС: (ИЭР, m/z): 630,3 [М+Н]+.
Этап 5: 7-[3-[бис[(4-метоксифенил)метил]амино]-2-фтор-5-метил-6-(трифторметил)фенил]-6-этил-2-метилсульфанил-5,6,7,8-тетрагидрохиназолин-4-ол

Раствор этил 4-[3-[бис[(4-метоксифенил)метил]амино]-2-фтор-5-метил-6-(трифторметил)фенил]-5-этил-2-оксо-циклогексанкарбоксилата (5,0 г, 7,94 ммоль), 2-метил-2-тиопсевдомочевины сульфата (22,0 г, 79,41 ммоль) и бикарбоната натрия (13,3 г, 158,81 ммоль) в этаноле (50 мл) и воде (10 мл) перемешивали при 50°С в течение 4 часов. После завершения полученный в результате раствор концентрировали в вакууме. Остаток растворяли дихлорметаном и промывали солевым раствором.
Органический слой сушили над безводным сульфатом натрия и концентрировали в вакууме Остаток очищали с помощью флэш-хроматографии на силикагеле с элюированием дихлорметаном/этилацетатом (4/1) с получением 7-[3-[бис[(4-метоксифенил)метил]амино]-2-фтор-5-метил-6-(трифторметил)фенил]-6-этил-2-метилсульфанил-5,6,7,8-тетрагидрохиназолин-4-ола (1,5 г, 2,28 ммоль, выход 28,8%) в виде желтого твердого вещества ЖХМС (ИЭР, m/z) 656,2 [M+H]+
Этап 6 трет-бутил (3S)-4-[7-[3-[бис[(4-метоксифенил)метил]амино]-2-фтор-5-метил-6-(трифторметил)фенил]-6-этил-2-метилсульфанил-5,6,7,8-тетрагидрохиназолин-4-ил]-3-метил-пиперазин-1-карбоксилат
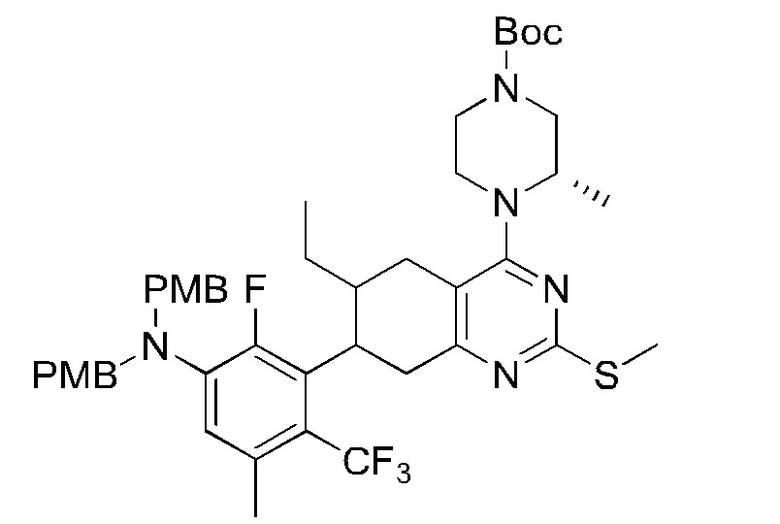
Раствор 7-[3-[бис[(4-метоксифенил)метил]амино]-2-фтор-5-метил-6-(трифторметил)фенил]-6-этил-2-метилсульфанил-5,6,7,8-тетрагидрохиназолин-4-ола (1,5 г, 2,29 ммоль), N,N-диизопропилэтиламина (1,4 г, 11,44 ммоль) и трифторметансульфонового ангидрида (1,1 г, 4,12 ммоль) в дихлорметане (15 мл) перемешивали при 25°С в течение 1 часа После завершения реакцию концентрировали при пониженном давлении Потом остаток, N,N-диизопропилэтиламин (1,4 г, 11,44 ммоль) и трет-бутил (3S)-3 -метил-1-пиперазинкарбоксилат (0,9 г, 4,57 ммоль) в 1,4-диоксане (15 мл) перемешивали при 110°С в течение 16 часов После завершения полученный в результате раствор концентрировали в вакууме Остаток очищали с помощью флэш-хроматографии на силикагеле с элюированием петролейным эфиром/этилацетатом (85/15) с получением трет-бутил (3S)-4-[7-[3-[бис[(4-метоксифенил)метил]амино]-2-фтор-5-метил-6-(трифторметил)фенил]-6-этил-2-метилсульфанил-5,6,7,8-тетрагидрохиназолин-4-ил]-3-метил-пиперазин-1-карбоксилата (1,3 г, 1,55 ммоль, выход 67,8%) в виде белого твердого вещества ЖХМС (ИЭР, m/z) 838,4 [М+Н]+
Этап 7 трет-бутил (3S)-4-(7-(3-(бис(4-метоксибензил)амино)-2-фтор-5-метил-6-(трифторметил)фенил)-6-этил-2-(метилсульфонил)-5,6,7,8-тетрагидрохиназолин-4-ил)-3 -метилпиперазин-1-карбоксилат

Раствор трет-бутил (3S)-4-[7-[3-[бис[(4-метоксифенил)метил]амино]-2-фтор-5-метил-6-(трифторметил)фенил]-6-этил-2-метилсульфанил-5,6,7,8-тетрагидрохиназолин-4-ил]-3-метил-пиперазин-1-карбоксилата (3,5 г, 4,2 ммоль) и пероксимоносульфата калия (7,8 г, 12,7 ммоль) в тетрагидрофуране (35 мл) и воде (17,5 мл) перемешивали при комнатной температуре в течение 3 часов После завершения реакцию гасили насыщенным раствором сульфита натрия, экстрагировали этилацетатом, сушили над безводным сульфатом натрия и концентрировали в вакууме с получением неочищенного продукта Неочищенный продукт непосредственно использовали для следующего этапа без очистки ЖХМС (ИЭР, m/z) 870,4 [М+Н]+
Этап 8 трет-бутил (3S)-4-[7-[3-[бис[(4-метоксифенил)метил]амино]-2-фтор-5-метил-6-(трифторметил)фенил]-6-этил-2-[[(2S,4R)-4-фтор-1-метил-пирролидин-2-ил]метокси]-5,6,7,8-тетрагидрохиназолин-4-ил] -3 -метил-пиперазин-1-карбоксилат
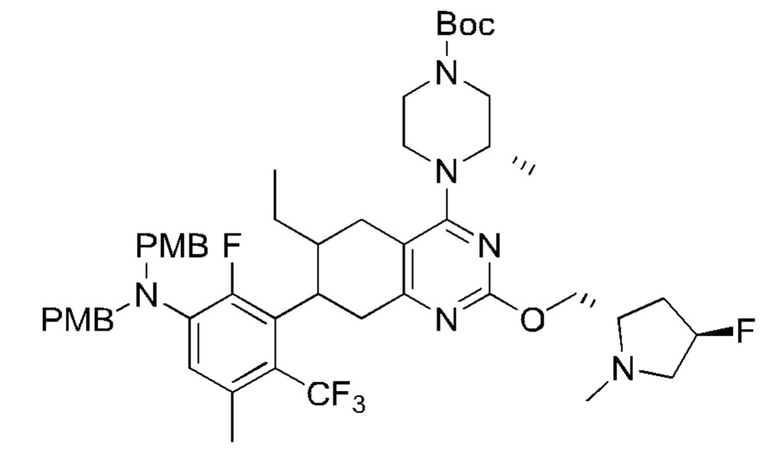
Раствор гидрида натрия (0,3 г, 7,47 ммоль, 60% дисперсия в минеральном масле) и [(2S,4R)-4-фтор-1-метил-пирролидин-2-ил]метанола (0,4 г, 2,99 ммоль) в 1,4-диоксане (12,79 мл) перемешивали при 0°С в течение 10 минут Потом добавляли трет-бутил (3S)-4-[7-[3-[бис[(4-метоксифенил)метил]амино]-2-фтор-5-метил-6-(трифторметил)фенил]-6-этил-2-метилсульфонил-5,6,7,8-тетрагидрохиназолин-4-ил]-3-метил-пиперазин-1-карбоксилат (1,3 г, 1,49 ммоль) и перемешивали при комнатной температуре в течение 30 минут После завершения реакцию гасили насыщенным раствором хлорида аммония Полученный в результате раствор экстрагировали этилацетатом, сушили над безводным сульфатом натрия и концентрировали в вакууме. Остаток очищали с помощью флэш-хроматографии на силикагеле с элюированием дихлорметаном/этилацетатом (3/1) с получением трет-бутил (3S)-4-[7-[3-[бис[(4-метоксифенил)метил]амино]-2-фтор-5-метил-6-(трифторметил)фенил]-6-этил-2-[[(2S,4R)-4-фтор-1-метил-пирролидин-2-ил]метокси]-5,6,7,8-тетрагидрохиназолин-4-ил]-3-метил-пиперазин-1-карбоксилата (0,8 г, 0,86 ммоль, выход 58%) в виде желтого твердого вещества. ЖХМС: (ИЭР, m/z): 923,5 [М+Н]+.
Этап 9: 3-[6-этил-2-[[(2S,4R)-4-фтор-1-метил-пирролидин-2-ил]метокси]-4-[(2S)-2-метилпиперазин-1-ил]-5,6,7,8-тетрагидрохиназолин-7-ил]-2-фтор-5-метил-4-(трифторметил)анилин

Раствор трет-бутил (3S)-4-[7-[3-[бис[(4-метоксифенил)метил]амино]-2-фтор-5-метил-6-(трифторметил)фенил]-6-этил-2-[[(2S,4R)-4-фтор-1-метил-пирролидин-2-ил]метокси]-5,6,7,8-тетрагидрохиназолин-4-ил]-3-метил-пиперазин-1-карбоксилата (0,8 г, 0,87 ммоль) в трифторуксусной кислоте (1,9 г, 17,33 ммоль) перемешивали при 50°С в течение 2 часов. Полученный в результате раствор концентрировали в вакууме. Остаток очищали с помощью флэш-хроматографии на силикагеле с элюированием ацетонитрилом/водой (1:1) с получением 3-[6-этил-2-[[(2S,4R)-4-фтор-1-метил-пирролидин-2-ил]метокси]-4-[(2S)-2-метилпиперазин-1-ил]-5,6,7,8-тетрагидрохиназолин-7-ил]-2-фтор-5-метил-4-(трифторметил)анилина (0,3 г, 0,51 ммоль, выход 59,4%) в виде желтого твердого вещества. ЖХМС: (ИЭР, m/z): 583,3 [М+Н]+
Этап 10: 1-[(3S)-4-[(6R,7R)-7-[3-амино-2-фтор-5-метил-6-(трифторметил)фенил]-6-этил-2-[[(2S,4R)-4-фтор-1-метил-пирролидин-2-ил]метокси]-5,6,7,8-тетрагидрохиназолин-4-ил]-3-метил-пиперазин-1-ил]проп-2-ен-1-он (Пример 37а) и 1-[(3S)-4-[(6S,7S)-7-[3-амино-2-фтор-5-метил-6-(трифторметил)фенил]-6-этил-2-[[(2S,4R)-4-фтор-1-метил-пирролидин-2-ил]метокси]-5,6,7,8-тетрагидрохиназолин-4-ил]-3-метил-пиперазин-1-ил]проп-2-ен-1-он (Пример 37b)
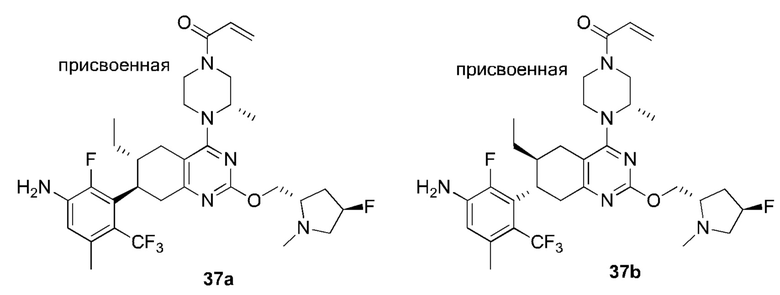
Раствор 3-[6-этил-2-[[(2S,4R)-4-фтор-1-метил-пирролидин-2-ил]метокси]-4-[(2S)-2-метилпиперазин-1-ил]-5,6,7,8-тетрагидрохиназолин-7-ил]-2-фтор-5-метил-4-(трифторметил)анилина (0,3 г, 0,48 ммоль), акриловой кислоты (0,03 г, 0,48 ммоль) и N,N-диизопропилэтиламина (0,19 г, 1,44 ммоль) в дихлорметане (2,8 мл) перемешивали при -78°С в течение 5 минут Потом добавляли HATU (182,7 мг, 0,48 ммоль) и перемешивали при 25°С в течение 10 минут После завершения растворитель разводили дихлорметаном и промывали солевым раствором Органический слой сушили над безводным сульфатом натрия и концентрировали в вакууме Остаток очищали с помощью флэш-хроматографии на силикагеле с элюированием дихлорметаном/метанолом (10/1) с получением 110 мг неочищенного продукта Продукт дополнительно очищали с помощью хиральной препаративной ВЭЖХ со следующими условиями (колонка CHIRALPAK Cellulose-SB, 4,6*100 мм, 3 мкм, подвижная фаза гексан (0,1% ДЭА) ИПА=70 30, скорость потока 1 мл/мин, RT1 3,785, RT2 5,481) с получением указанных в заголовке соединений Стереохимия указанных в заголовке соединений была приписана произвольным образом
Пример 37а 1-[(3S)-4-[(6R,7R)-7-[3-амино-2-фтор-5-метил-6-(трифторметил)фенил]-6-этил-2-[[(2S,4R)-4-фтор-1-метил-пирролидин-2-ил]метокси]-5,6,7,8-тетрагидрохиназолин-4-ил]-3-метил-пиперазин-1-ил]проп-2-ен-1-он (31,6 мг, 0,049 ммоль, выход 10,3%, белое твердое вещество) 1H ЯМР (300 МГц, ДМСО-d6, м д) δ 6,92-6,75 (м, 1Н), 6,58 (д, J = 9,0 Гц, 1Н), 6,1-6,12 (м, 1Н), 5,78-5,70 (м, 3Н), 5,17 (д, J = 56,2 Гц, 1Н), 4,41-3,82 (м, 6Н), 3,50-3,36 (м, 2Н), 3,20-3,04 (м, 3Н), 2,91- 2,82 (м, 3Н), 2,64-2,57 (м, 1Н), 2,41-2,23 (м, 8Н), 2,17-1,77 (м, 3Н), 1,29-1,18 (м, 4Н), 1,07-0,94 (м, 1Н), 0,87-0,82 (м, 3Н) ЖХМС (ИЭР, m/z) 637,3 [М+Н]+ Хиральная ВЭЖХ колонка CHIRAL ART Cellulose-SB, 4,6*100 мм, 3,0 мкм, обнаружение на 254 нм, гексан (0,1% ДЭА)/ИПА = 70/30, скорость потока = 1 мл/мин, время удержания 3,785 мин (более быстрый пик)
Пример 37b: 1-[(3S)-4-[(6S,7S)-7-[3-амино-2-фтор-5-метил-6-(трифторметил)фенил]-6-этил-2-[[(2S,4R)-4-фтор-1-метил-пирролидин-2-ил]метокси]-5,6,7,8-тетрагидрохиназолин-4-ил]-3-метил-пиперазин-1-ил]проп-2-ен-1-он (31,3 мг, 0,049 ммоль, выход 10,2%, белое твердое вещество). 1H ЯМР (300 МГц, ДМСО-d6, м. д.) δ 6,87-6,75 (м, 1Н), 6,59 (д, J = 9,0 Гц, 1Н), 6,19-6,14 (м, 1Н), 5,79-5,71 (м, 3Н), 5,26-5,08 (м, 1Н), 4,28-4,12 (м, 4Н), 4,08-3,82 (м, 1Н), 3,49-3,37 (м, 2Н), 3,27-3,08 (м, 2Н), 2,97-2,84 (м, 3Н), 2,73-2,64 (м, 1Н), 2,47 (с, 1Н), 2,36 (с, 4Н), 2,32-2,27 (м, 4Н), 2,17-1,75 (м, 4Н), 1,29-1,13 (м, 1Н), 1,05-0,95 (м, 4Н), 0,84-0,82 (м, 3Н). ЖХМС: (ИЭР, m/z): 637,3 [М+Н]+. Хиральная ВЭЖХ: колонка: CHIRAL ART Cellulose-SB, 4,6*100 мм, 3,0 мкм; обнаружение на 254 нм; гексан (0,1% ДЭА)/ИПА = 70/30; скорость потока = 1 мл/мин; время удержания: 5,481 мин (более медленный пик).
Примеры 38а, 38b, 38с и 38d

2-((R)-4-((6S,7S)-7-(3-амино-2-фтор-5-метил-6-(трифторметил)фенил)-2-(((2S,4R)-4-фтор-1-метилпирролидин-2-ил)метокси)-6-метил-5,6,7,8-тетрагидрохиназолин-4-ил)-1-(2-фторакрилоил)пиперазин-2-ил)ацетонитрил (Пример 38а); и
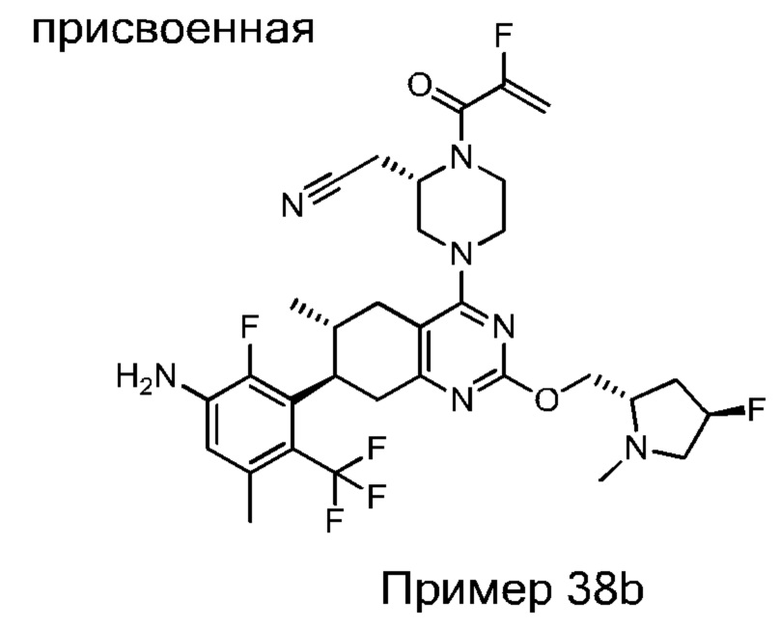
2-((S)-4-((6R,7R)-7-(3-амино-2-фтор-5-метил-6-(трифторметил)фенил)-2-(((2S,4R)-4-фтор-1-метилпирролидин-2-ил)метокси)-6-метил-5,6,7,8-тетрагидрохиназолин-4-ил)-1-(2-фторакрилоил)пиперазин-2-ил)ацетонитрил (Пример 38b); и
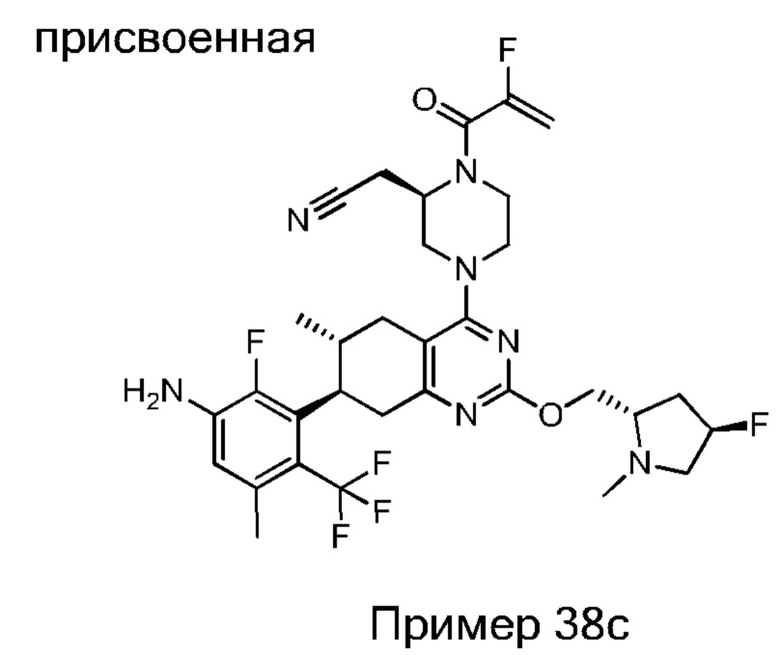
2-((R)-4-((6R,7R)-7-(3-амино-2-фтор-5-метил-6-(трифторметил)фенил)-2-(((2S,4R)-4-фтор-1-метилпирролидин-2-ил)метокси)-6-метил-5,6,7,8-тетрагидрохиназолин-4-ил)-1-(2-фторакрилоил)пиперазин-2-ил)ацетонитрил (Пример 38 с); и

2-((S)-4-((6S,7S)-7-(3-амино-2-фтор-5-метил-6-(трифторметил)фенил)-2-(((2S,4R)-4-фтор-1-метилпирролидин-2-ил)метокси)-6-метил-5,6,7,8-тетрагидрохиназолин-4-ил)-1-(2-фторакрилоил)пиперазин-2-ил)ацетонитрил (Пример 38d)
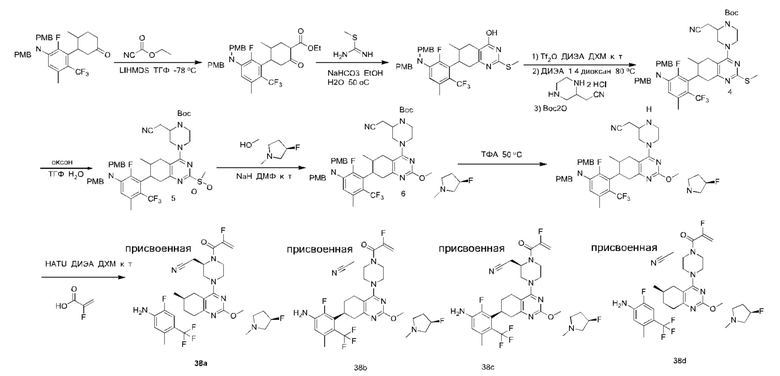
Этап 1: этил 4-[3-[бис[(4-метоксифенил)метил]амино]-2-фтор-5-метил-6-(трифторметил)фенил]-5-метил-2-оксо-циклогексанкарбоксилат

В атмосфере азота раствор 3-[3-[бис[(4-метоксифенил)метил]амино]-2-фтор-5-метил-6-(трифторметил)фенил]-4-метил-циклогексанона (10,0 г, 18,4 ммоль) в тетрагидрофуране (100 мл) перемешивали при -78°С в течение 3 минут. По каплям добавляли бис(триметилсилил)амид лития (1,0 М в ТГФ) (33 мл, 33 ммоль) и перемешивали при -78°С в течение 10 минут. Потом добавляли этилцианоформиат (4,1 г, 42,3 ммоль) и перемешивали при -78°С в течение 20 минут. После завершения реакцию гасили водой, экстрагировали этилацетатом, сушили над безводным сульфатом натрия и концентрировали в вакууме с получением неочищенного продукта. Неочищенный продукт непосредственно использовали для следующего этапа без очистки. ЖХМС: (ИЭР, m/z): 616,3 [М+Н]+.
Этап 2: 7-[3-[бис[(4-метоксифенил)метил]амино]-2-фтор-5-метил-6-(трифторметил)фенил]-6-метил-2-метилсульфанил-5,6,7,8-тетрагидрохиназолин-4-ол

Раствор этил 4-[3-[бис[(4-метоксифенил)метил]амино]-2-фтор-5-метил-6-(трифторметил)фенил]-5-метил-2-оксо-циклогексанкарбоксилата (20,0 г, 32,4 ммоль), 2-метил-2-тиопсевдомочевины сульфата (90,3 г, 324,8 ммоль) и бикарбоната натрия (54,5 г, 649,7 ммоль) в этаноле (200 мл) и воде (40 мл) перемешивали при 50°С в течение 4 часов. После завершения полученный в результате раствор концентрировали в вакууме. Остаток растворяли дихлорметаном и промывали солевым раствором. Органический слой сушили над безводным сульфатом натрия и концентрировали в вакууме. Остаток очищали с помощью флэш-хроматографии на силикагеле с элюированием дихлорметаном/этилацетатом (4/1) с получением 7-[3-[бис[(4-метоксифенил)метил]амино]-2-фтор-5-метил-6-(трифторметил)фенил]-6-метил-2-метилсульфанил-5,6,7,8-тетрагидрохиназолин-4-ола (7 г, 10,9 ммоль, выход 33,6%) в виде желтого твердого вещества. ЖХМС: (ИЭР, m/z): 642,2 [М+Н]+.
Этап 3: трет-бутил 4-[7-[3-[бис[(4-метоксифенил)метил]амино]-2-фтор-5-метил-6-(трифторметил)фенил]-6-метил-2-метилсульфанил-5,6,7,8-тетрагидрохиназолин-4-ил]-2-(цианометил)пиперазин-1-карбоксилат

Раствор 7-[3-[бис[(4-метоксифенил)метил]амино]-2-фтор-5-метил-6-(трифторметил)фенил]-6-метил-2-метилсульфанил-5,6,7,8-тетрагидрохиназолин-4-ола (7,2 г, 11,2 ммоль), трифторметансульфонового ангидрида (5,7 г, 20,2 ммоль) и N,N-диизопропилэтиламина (8,6 г, 67,3 ммоль) в дихлорметане (72 мл) перемешивали при 25°С в течение 1 часа. После завершения реакцию концентрировали при пониженном давлении. Потом остаток, N,N-диизопропилэтиламин (8,6 г, 67,3 ммоль) и 2-пиперазин-2-2-пиперазин-2-илацетонитрил (2,8 г, 22,44 ммоль) в 1,4-диоксане (72 мл) перемешивали при 80°С в течение 2 часов. Потом добавляли ди-трет-бутилдикарбонат (12,2 г, 56,1 ммоль) и перемешивали при 25°С в течение 1 часа. После завершения полученный в результате раствор концентрировали в вакууме. Остаток очищали с помощью флэш-хроматографии на силикагеле с элюированием петролейным эфиром/этилацетатом (10/1) с получением трет-бутил 4-[7-[3-[бис[(4-метоксифенил)метил]амино]-2-фтор-5-метил-6-(трифторметил)фенил]-6-метил-2-метилсульфанил-5,6,7,8-тетрагидрохиназолин-4-ил]-2-(цианометил)пиперазин-1-карбоксилата (8 г, 9,4 ммоль, выход 84%) в виде белого твердого вещества. ЖХМС: (ИЭР, m/z): 849,4 [М+Н]+.
Этап 4: трет-бутил 4-[7-[3-[бис[(4-метоксифенил)метил]амино]-2-фтор-5-метил-6-(трифторметил)фенил]-6-метил-2-метилсульфонил-5,6,7,8-тетрагидрохиназолин-4-ил]-2-(цианометил)пиперазин-1-карбоксилат
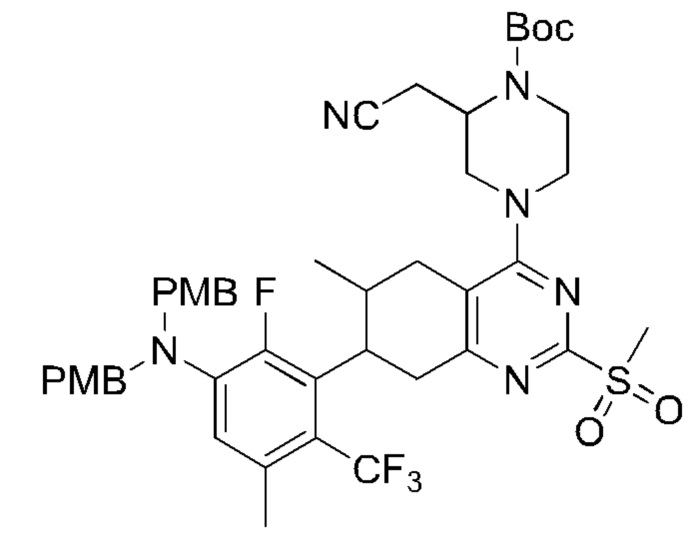
Раствор трет-бутил 4-[7-[3-[бис[(4-метоксифенил)метил]амино]-2-фтор-5-метил-6-(трифторметил)фенил]-6-метил-2-метилсульфанил-5,6,7,8-тетрагидрохиназолин-4-ил]-2-(цианометил)пиперазин-1-карбоксилата (8,0 г, 9,42 ммоль) и пероксимоносульфата калия (17,3 г, 28,2 ммоль) в тетрагидрофуране (80 мл) и воде (40 мл) перемешивали при комнатной температуре в течение 3 часов. После завершения растворитель концентрировали в вакууме, реакцию гасили сульфитом натрия, экстрагировали этилацетатом, сушили над безводным сульфатом натрия и концентрировали в вакууме с получением неочищенного продукта. Неочищенный продукт непосредственно использовали для следующего этапа без очистки. ЖХМС: (ИЭР, m/z): 881,4 [М+Н]+.
Этап 5: трет-бутил 4-[7-[3-[бис[(4-метоксифенил)метил]амино]-2-фтор-5-метил-6-(трифторметил)фенил]-2-[[(2S,4R)-4-фтор-1-метил-пирролидин-2-ил]метокси]-6-метил-5,6,7,8-тетрагидрохиназолин-4-ил]-2-(цианометил)пиперазин-1-карбоксилат

Раствор гидрида натрия (1,1 г, 28,38 ммоль, 60% дисперсия в минеральном масле) и [(2S,4R)-4-фтор-1-метил-пирролидин-2-ил]метанола (1,5 г, 11,35 ммоль) в ДМФ (50 мл) перемешивали при 0°С в течение 10 минут. Потом добавляли трет-бутил 4-[7-[3-[бис[(4-метоксифенил)метил]амино]-2-фтор-5-метил-6-(трифторметил)фенил]-6-метил-2-метилсульфонил-5,6,7,8-тетрагидрохиназолин-4-ил]-2-(цианометил)пиперазин-1-карбоксилат (5,0 г, 5,68 ммоль) и перемешивали при комнатной температуре в течение 30 минут.После завершения реакцию гасили насыщенным раствором хлорида аммония. Полученный в результате раствор экстрагировали этилацетатом, сушили над безводным сульфатом натрия и концентрировали в вакууме. Остаток очищали с помощью флэш-хроматографии на силикагеле с элюированием дихлорметаном/метанолом (7/1) с получением трет-бутил 4-[7-[3-[бис[(4-метоксифенил)метил]амино]-2-фтор-5-метил-6-(трифторметил)фенил]-2-[[(2S,4R)-4-фтор-1-метил-пирролидин-2-ил]метокси]-6-метил-5,6,7,8-тетрагидрохиназолин-4-ил]-2-(цианометил)пиперазин-1-карбоксилата (2,8 г, 2,99 ммоль, выход 52,8%) в виде желтого твердого вещества. ЖХМС: (ИЭР, m/z): 934,5 [М+Н]+.
Этап 6: 2-(4-(7-(3-амино-2-фтор-5-метил-6-(трифторметил)фенил)-2-(((2S,4R)-4-фтор-1-метилпирролидин-2-ил)метокси)-6-метил-5,6,7,8-тетрагидрохиназолин-4-ил)пиперазин-2-ил)ацетонитрил
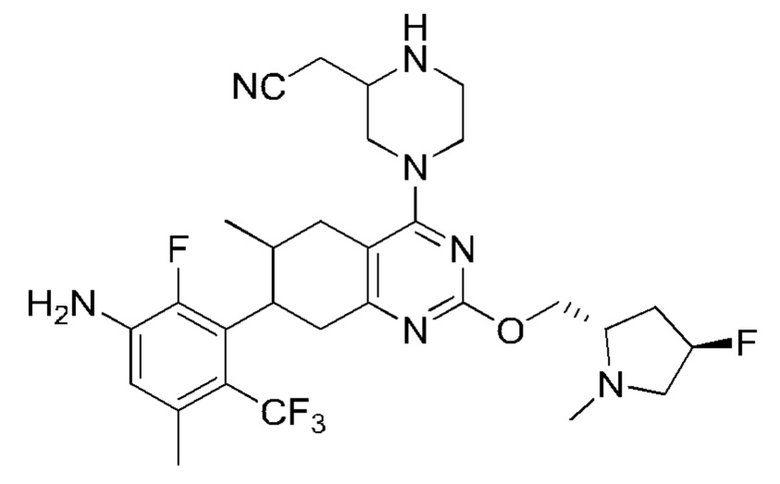
Раствор трет-бутил 4-[7-[3-[бис[(4-метоксифенил)метил]амино]-2-фтор-5-метил-6-(трифторметил)фенил]-2-[[(2S,4R)-4-фтор-1-метил-пирролидин-2-ил]метокси]-6-метил-5,6,7,8-тетрагидрохиназолин-4-ил]-2-(цианометил)пиперазин-1-карбоксилата (2,8 г, 3 ммоль) в трифторуксусной кислоте (34,17 г, 299,77 ммоль) перемешивали при 50°С в течение 7 минут. Полученный в результате раствор концентрировали в вакууме. Остаток очищали с помощью флэш-хроматографии на силикагеле с элюированием ацетонитрилом/водой(2:3) с получением 2-[4-[7-[3-амино-2-фтор-5-метил-6-(трифторметил)фенил]-2-[[(2S,4R)-4-фтор-1-метил-пирролидин-2-ил]метокси]-6-метил-5,6,7,8-тетрагидрохиназолин-4-ил]пиперазин-2-ил]ацетонитрила (1,2 г, 2,0 ммоль, выход 67,4%) в виде желтого твердого вещества. ЖХМС: (ИЭР, m/z): 594,3 [М+Н]+.
Этап 7: 2-((R)-4-((6S,7S)-7-(3-амино-2-фтор-5-метил-6-(трифторметил)фенил)-2-(((2S,4R)-4-фтор-1-метилпирролидин-2-ил)метокси)-6-метил-5,6,7,8-тетрагидрохиназолин-4-ил)-1-(2-фторакрилоил)пиперазин-2-ил)ацетонитрил (Пример 38а); и 2-((S)-4-((6R,7R)-7-(3-амино-2-фтор-5-метил-6-(трифторметил)фенил)-2-(((2S,4R)-4-фтор-1-метилпирролидин-2-ил)метокси)-6-метил-5,6,7,8-тетрагидрохиназолин-4-ил)-1-(2-фторакрилоил)пиперазин-2-ил)ацетонитрил (Пример 38b); и 2-((R)-4-((6R,7R)-7-(3-амино-2-фтор-5-метил-6-(трифторметил)фенил)-2-(((2S,4R)-4-фтор-1-метилпирролидин-2-ил)метокси)-6-метил-5,6,7,8-тетрагидрохиназолин-4-ил)-1-(2-фторакрилоил)пиперазин-2-ил)ацетонитрил (Пример 38 с); и 2-((S)-4-((6S,7S)-7-(3-амино-2-фтор-5-метил-6-(трифторметил)фенил)-2-(((2S,4R)-4-фтор-1-метилпирролидин-2-ил)метокси)-6-метил-5,6,7,8-тетрагидрохиназолин-4-ил)-1-(2-фторакрилоил)пиперазин-2-ил)ацетонитрил (Пример 38d)
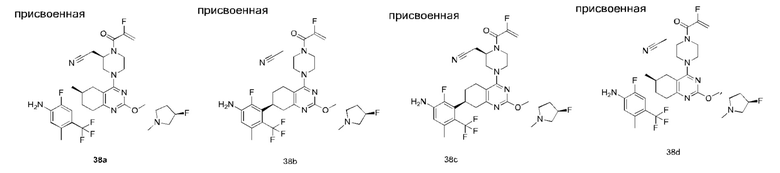
Раствор 2-[4-[7-[3-амино-2-фтор-5-метил-6-(трифторметил)фенил]-2-[[(2S,4R)-4-фтор-1-метил-пирролидин-2-ил]метокси]-6-метил-5,6,7,8-тетрагидрохиназолин-4-ил]пиперазин-2-ил] ацетонитр ила (1,2 г, 2,02 ммоль), 2-фторакриловой кислоты (182,0 мг, 2,02 ммоль) и N,N-диизопропилэтиламина (0,7 г, 6,06 ммоль) в дихлорметане (12 мл) перемешивали при 25°С. Потом добавляли HATU (0,8 г, 2,22 ммоль) и перемешивали при 25°С в течение 1 часа. После завершения растворитель разводили дихлорметаном и промывали солевым раствором. Органический слой сушили над безводным сульфатом натрия и концентрировали в вакууме. Остаток очищали с помощью флэш-хроматографии на силикагеле с элюированием дихлорметаном/метанолом (10/1) с получением 500 мг твердого вещества. Продукт дополнительно очищали с помощью хиральной препаративной ВЭЖХ с получением указанных в заголовке соединений. Абсолютная конфигурация указанных в заголовке соединений была определена по данным активности и рентгенограммы белковой структуры соединения 21b.
Пример 38а: 2-((R)-4-((6S,7S)-7-(3-амино-2-фтор-5-метил-6-(трифторметил)фенил)-2-(((2S,4R)-4-фтор-1-метилпирролидин-2-ил)метокси)-6-метил-5,6,7,8-тетрагидрохиназолин-4-ил)-1-(2-фторакрилоил)пиперазин-2-ил)ацетонитрил (49,6 мг, 0,074 ммоль, выход 3,7%, белое твердое вещество). 1Н ЯМР (300 МГц, ДМСО-d6, м. д.) δ 6,57 (д, J = 8,8 Гц, 1Н), 5,77 (с, 2Н), 5,40-5,35 (м, 3Н), 4,84 (шир. с, 1Н), 4,33-4,10 (м, 2Н), 3,94-3,82 (м, 3Н), 3,49-3,41 (м, 3Н), 3,25-3,05 (м, 3Н), 3,01-2,66 (м, 6Н), 2,44-2,17 (м, 8Н), 2,15-2,00 (м, 1Н), 1,95-1,73 (м, 1Н), 0,84 (д, J = 6,0 Гц, 3Н). ЖХМС: (ИЭР, m/z): 666,3 [М+Н]+. Хиральная ВЭЖХ: колонка: CHIRALPAK IE-3, 4,6*50 мм, 3 мкм; обнаружение на 254 нм; (гексан:ДХМ = 3:1) (0,1% ИПАмин): EtOH = 90:10, скорость потока: 1 мл/мин; время удержания: 3,658 мин (более быстрый пик).
Пример 38b: 2-((S)-4-((6R,7R)-7-(3-амино-2-фтор-5-метил-6-(трифторметил)фенил)-2-(((2S,4R)-4-фтор-1-метилпирролидин-2-ил)метокси)-6-метил-5,6,7,8-тетрагидрохиназолин-4-ил)-1-(2-фторакрилоил)пиперазин-2-ил)ацетонитрил (43,4 мг, 0,065 ммоль, выход 3,2%, белое твердое вещество). 1H ЯМР (300 МГц, ДМСО-d6, м. д.) δ 6,57 (д, J = 8,8 Гц, 1Н), 5,78 (с, 2Н), 5,46-5,06 (м, 3Н), 4,79 (шир. с, 1Н), 4,27-4,26 (м, 1Н), 4,13 (дд, J = 11,0, 5,4 Гц, 1Н), 3,98-3,75 (м, 3Н), 3,61-3,36 (м, 3Н), 3,30-3,23 (м, 1Н), 3,22-3,15 (м, 1Н), 3,14-2,90 (м, 4Н), 2,89-2,77 (м, 2Н), 2,68-2,57 (м, 1Н), 2,46-2,19 (м, 8Н), 2,17-2,00 (м, 1Н), 1,97-1,73 (м, 1Н), 0,82 (д, J = 6,2 Гц, 3Н). ЖХМС: (ИЭР, m/z): 666,3 [М+Н]+. Хиральная ВЭЖХ: колонка: CHIRALPAK IE-3, 4,6*50 мм, 3 мкм; обнаружение на 254 нм; (гексан:ДХМ = 3:1) (0,1% ИПАмин): EtOH = 90:10, скорость потока: 1 мл/мин; время удержания: 3,185 мин (более медленный пик).
Пример 38с: 2-((R)-4-((6R,7R)-7-(3-амино-2-фтор-5-метил-6-(трифторметил)фенил)-2-(((2S,4R)-4-фтор-1-метилпирролидин-2-ил)метокси)-6-метил-5,6,7,8-тетрагидрохиназолин-4-ил)-1-(2-фторакрилоил)пиперазин-2-ил)ацетонитрил (39,2 мг, 0,058 ммоль, выход 2,9%, белое твердое вещество). 1Н ЯМР (300 МГц, ДМСО-d6, м. д.) δ 6,58 (д, J = 8,8 Гц, 1Н), 5,78 (с, 2Н), 5,47-5,06 (м, 3Н), 4,72 (шир. с, 1Н), 4,30 (дд, J = 11,1, 4,7 Гц, 1Н), 4,13 (дд, J = 10,9, 5,4 Гц, 1Н), 3,89 (дд, J = 22,7, 13,3 Гц, 3Н), 3,59-3,40 (м, 3Н), 3,29-3,04 (м, 3Н), 2,98-2,72 (м, 6Н), 2,46-2,27 (м, 8Н), 2,24-2,05 (м, 1Н), 1,98-1,76 (м, 1Н), 0,84 (д, J = 6,1 Гц, 3Н). ЖХМС: (ИЭР, m/z): 666,3 [М+Н]+. Хиральная ВЭЖХ: колонка: CHIRALPAK IE-3, 4,6*50 мм, 3 мкм; обнаружение на 254 нм; (гексан/ДХМ = 3:1) (0,1% ДЭА): EtOH = 90:10, скорость потока: 1 мл/мин; время удержания: 3,421 мин (более быстрый пик).
Пример 38d: 2-((S)-4-((6S,7S)-7-(3-амино-2-фтор-5-метил-6-(трифторметил)фенил)-2-(((2S,4R)-4-фтор-1-метилпирролидин-2-ил)метокси)-6-метил-5,6,7,8-тетрагидрохиназолин-4-ил)-1-(2-фторакрилоил)пиперазин-2-ил)ацетонитрил (49,2 мг, 0,073 ммоль, выход 3,7%, белое твердое вещество). 1Н ЯМР (300 МГц, ДМСО-d6, м. д.) δ 6,58 (д, J = 8,8 Гц, 1Н), 5,79 (с, 2Н), 5,48-5,03 (м, 3Н), 4,78 (шир. с, 1Н), 4,26 (дд, J = 11,0, 4,8 Гц, 1Н), 4,16 (дд, J = 11,0, 5,4 Гц, 1Н), 4,01 (д, J = 13,5 Гц, 1Н), 3,82 (д, J = 12,7 Гц, 1Н), 3,52-3,25 (м, 5Н), 3,22-2,79 (м, 7Н), 2,69-2,57 (м, 1Н), 2,44-2,25 (м, 8Н), 2,20-1,99 (м, 1Н), 1,97-1,72 (м, 1Н), 0,83 (д, J = 6,2 Гц, 3Н). ЖХМС: (ИЭР, m/z): 666,3 [М+Н]+. Хиральная ВЭЖХ: колонка: CHIRALPAK IE-3, 4,6*50 мм, 3 мкм; обнаружение на 254 нм; (гексан:ДХМ = 3:1) (0,1% ИПАмин): EtOH = 90:10, скорость потока: 1 мл/мин; время удержания: 4,292 (более медленный пик).
Пример 39
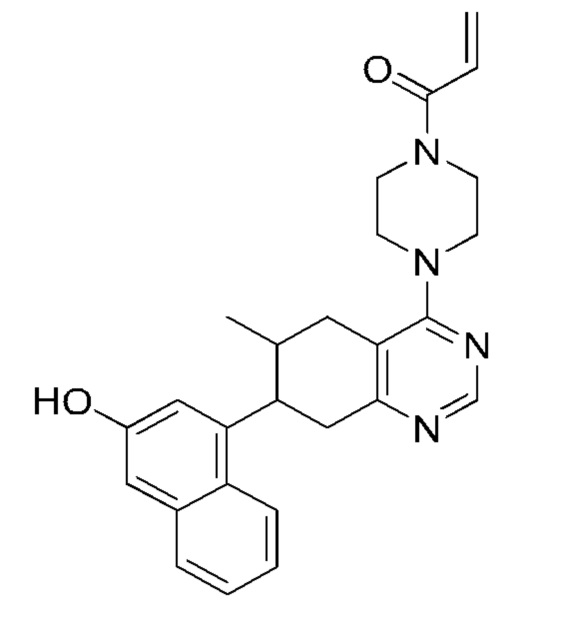
1-(4-(7-(3-гидроксинафтален-1-ил)-6-метил-5,6,7,8-тетрагидрохиназолин-4-ил)пиперазин-1 -ил)проп-2-ен-1 -он
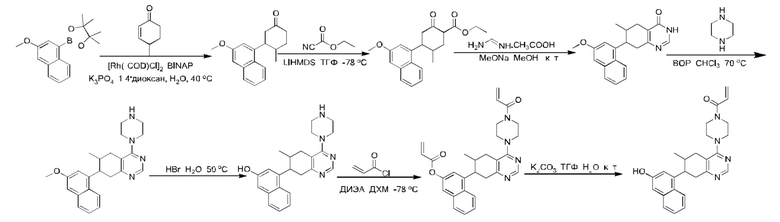
Этап 1: 3-(3-метокси-1-нафтил)-4-метил-циклогексанон
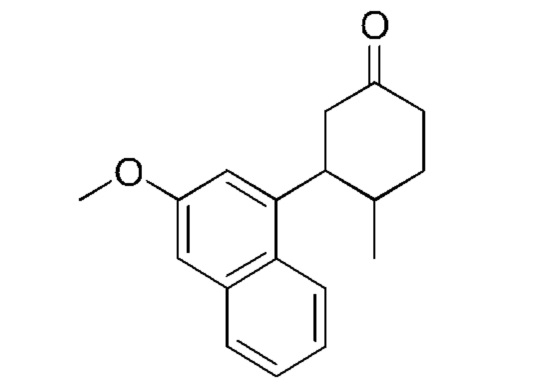
В атмосфере азота в раствор 2-(3-метокси-1-нафтил)-4,4,5,5-тетраметил-1,3,2-диоксаборолана (1,0 г, 3,52 ммоль) и 1,1'-бинафтил-2,2'-дифенилфосфина (0,44 г, 0,70 ммоль) в 1,4-диоксане (10 мл), воде (10 мл) добавляли 4-метилциклогекс-2-ен-1-он (0,78 г, 7,04 ммоль). Потом добавляли [Rh(COD)Cl]2 (0,17 г, 0,35 ммоль), фосфат калия (1,49 г, 7,04 ммоль) и перемешивали при 40°С в течение 0,5 часа. После завершения раствор разводили водой и экстрагировали этилацетатом. Потом органические слои объединяли, сушили над безводным сульфатом натрия и концентрировали в вакууме. Остаток очищали с помощью флэш-хроматографии на силикагеле с элюированием этилацетатом/петролейным эфиром (1/6) с получением 3-(3-метокси-1-нафтил)-4-метил-циклогексанона (500 мг,1,86 ммоль, выход 52,9%) в виде желтого масла. ЖХМС (ИЭР, m/z): 269,4 [М+Н]+.
Этап 2: этил 4-(3-метокси-1-нафтил)-5-метил-2-оксо-циклогексанкарбоксилат

В атмосфере азота в раствор 3-(3-метокси-1-нафтил)-4-метил-циклогексанона (0,6 г, 2,24 ммоль) в тетрагидрофуране (15 мл) добавляли LiHMDS (1,3 мл, 2 М в ТГФ) при -78°С. Полученный в результате раствор перемешивали в течение 0,5 ч при -78°С. Потом добавляли этилцианоформиат (0,33 г, 3,35 ммоль) и перемешивали при -78°С в течение 3 часов. После завершения раствор разводили водой и экстрагировали этилацетатом. Потом органические слои объединяли, сушили над безводным сульфатом натрия и концентрировали в вакууме. Остаток очищали с помощью флэш-хроматографии на силикагеле с элюированием этилацетатом/петролейным эфиром (1/8) с получением этил 4-(3-метокси-1-нафтил)-5-метил-2-оксо-циклогексанкарбоксилата (200 мг, 0,58 ммоль, выход 26,3%) в виде желтого масла. ЖХМС (ИЭР, m/z): 341,2 [М+Н]+.
Этап 3: 7-(3-метокси-1-нафтил)-6-метил-5,6,7,8-тетрагидро-3Н-хиназолин-4-он
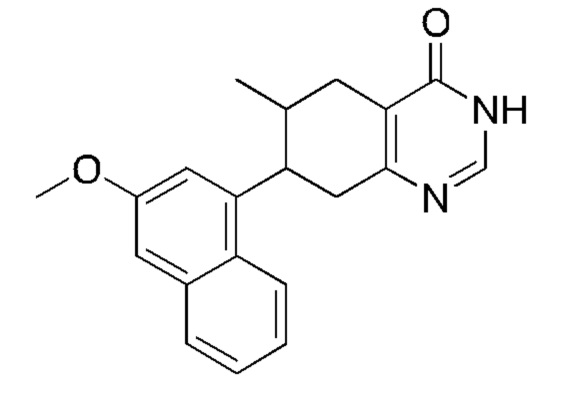
Раствор этил 4-(3 -метокси-1-нафтил)-5 -метил-2-оксо-циклогексанкарбоксилата (200,0 мг, 0,59 ммоль) и формамидинацетата (367,0 мг, 3,53 ммоль) в метаноле (6 мл) перемешивали при 25°С в течение 0,5 ч. Потом добавляли метанолат натрия (317,26 мг, 5,88 ммоль) и перемешивали при 25°С в течение 9 часов. После завершения раствор разводили водой и экстрагировали этилацетатом. Потом органические слои объединяли, сушили над безводным сульфатом натрия и концентрировали в вакууме. Остаток очищали с помощью флэш-хроматографии на силикагеле с элюированием метанолом/дихлорметаном (1/10) с получением 7-(3-метокси-1-нафтил)-6-метил-5,6,7,8-тетрагидро-3Н-хиназолин-4-она (110 мг, 0,34 ммоль, выход 58,4%) в виде желтого масла. ЖХМС (ИЭР, m/z): 321,2 [М+Н]+.
Этап 4: 7-(3-метокси-1-нафтил)-6-метил-4-пиперазин-1-ил-5,6,7,8-тетрагидрохиназолин

Раствор 7-(3-метокси-1-нафтил)-6-метил-5,6,7,8-тетрагидро-3Н-хиназолин-4-она (2,00 г, 6,2 ммоль) и бензотриазол-1-илокситрис(диметиламино)-фосфония гексафторфосфата (5,5 г, 12,5 ммоль) растворяли в ДХМ (20 мл). Потом добавляли пиперазин (17,5 г, 124,8 ммоль) и перемешивали при 70°С в течение 10 часов. После завершения раствор разводили водой и экстрагировали этилацетатом. Потом органические слои объединяли, сушили над безводным сульфатом натрия и концентрировали в вакууме. Остаток очищали с помощью флэш-хроматографии на силикагеле с элюированием метанолом/дихлорметаном (1/10) с получением 7-(3-метокси-1-нафтил)-6-метил-4-пиперазин-1-ил-5,6,7,8-тетрагидрохиназолина (1,5 г, 0,38 ммоль, выход 62,5%) в виде желтого масла. ЖХМС (ИЭР, m/z): 389,2 [М+Н]+.
Этап 5: 4-(6-метил-4-пиперазин-1-ил-5,6,7,8-тетрагидрохиназолин-7-ил)нафтален-2-ол
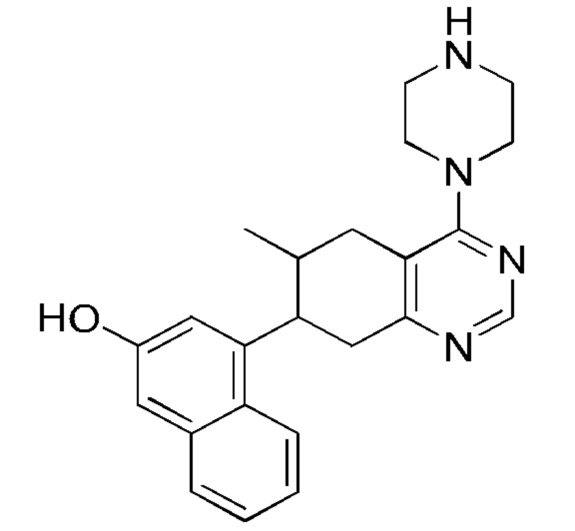
Раствор 7-(3 -метокси-1 -нафтил)-6-метил-4-пиперазин-1 -ил-5,6,7,8 -тетрагидрохиназолина (180,0 мг, 0,46 ммоль) в HBr (1 мл) (40% в Н2О) перемешивали при 50°С в течение 4 часов. После завершения полученный в результате раствор концентрировали в вакууме. Остаток очищали с помощью флэш-хроматографии на силикагеле с элюированием дихлорметаном/метанолом (1/10) с получением 4-(6-метил-4-пиперазин-1-ил-5,6,7,8-тетрагидрохиназолин-7-ил)нафтален-2-ола (120 мг, 0,32 ммоль, выход 69,2%) в виде белого твердого вещества. ЖХМС (ИЭР, m/z): 375,5 [M+H]+.
Этап 6: [4-[6-метил-4-(4-проп-2-еноилпиперазин-1-ил)-5,6,7,8-тетрагидрохиназолин-7-ил]-2-нафтил] проп-2-еноат
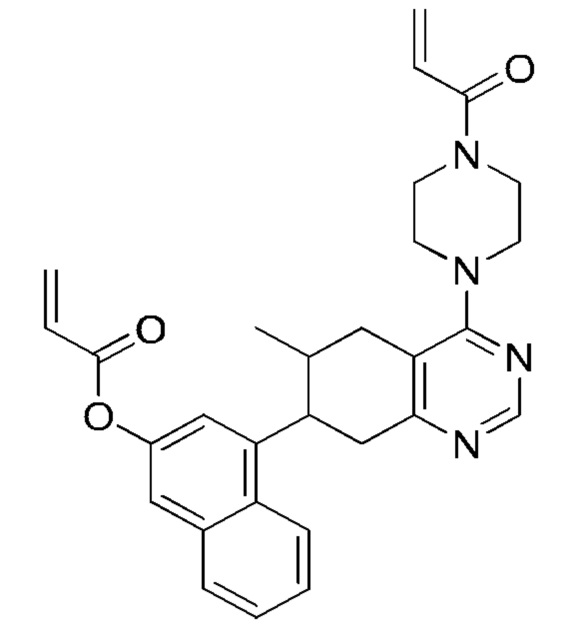
Раствор 4-(6-метил-4-пиперазин-1-ил-5,6,7,8-тетрагидрохиназолин-7-ил)нафтален-2-ола (100,0 мг, 0,27 ммоль) и N,N-диизопропилэтиламина (103,34 мг, 0,80 ммоль) в дихлорметане (6 мл) перемешивали при -78°С в течение 0,5 часа. Потом добавляли акрилоилхлорид (24,17 мг, 0,27 ммоль) и перемешивали при 25°С в течение 0,5 часа. После завершения раствор разводили водой и экстрагировали этилацетатом. Потом органические слои объединяли, сушили над безводным сульфатом натрия и концентрировали в вакууме. Остаток очищали с помощью флэш-хроматографии на силикагеле с элюированием метанолом/дихлорметаном (1/10) с получением [4-[6-метил-4-(4-проп-2-еноилпиперазин-1-ил)-5,6,7,8-тетрагидрохиназолин-7-ил]-2-нафтил] проп-2-еноата (90 мг, 0,18 ммоль, выход 69,2%). ЖХМС (ИЭР, m/z): 483,6 [М+Н]+
Этап 7: 1-(4-(7-(3-гидроксинафтален-1-ил)-6-метил-5,6,7,8-тетрагидрохиназолин-4-ил)пиперазин-1-ил)проп-2-ен-1-он
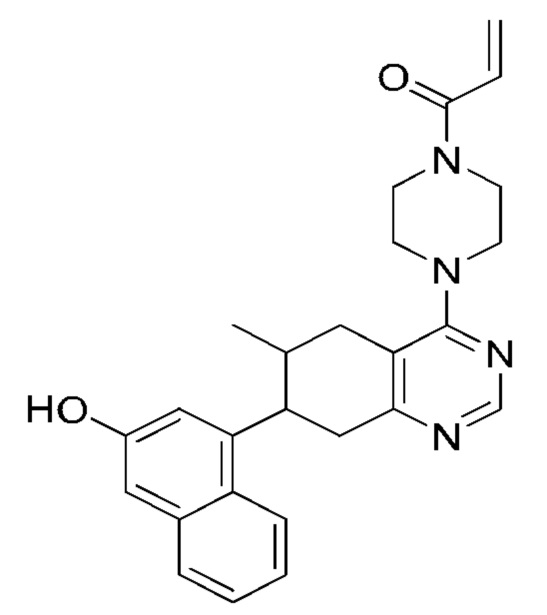
Раствор [4-[6-метил-4-(4-проп-2-еноилпиперазин-1-ил)-5,6,7,8-тетрагидрохиназолин-7-ил]-2-нафтил] проп-2-еноата (100,0 мг, 0,21 ммоль) и K2CO3 (28,64 мг, 0,21 ммоль) в тетрагидрофуране (2 мл) перемешивали при 25°С в течение 2 часов. После завершения полученный в результате раствор концентрировали в вакууме. Остаток очищали с помощью препаративной ВЭЖХ со следующими условиями: (колонка: XBridge Prep OBD C18 Column, 30×150 мм 5 мкм; подвижная фаза А: вода (10 ммоль/л NH4HCO3), подвижная фаза B:ACN; скорость потока: 60 мл/мин; градиент: от 32 В до 54 В за 7 мин; 254/220 нм) с получением 1-[4-[7-(3-гидрокси-1-нафтил)-6-метил-5,6,7,8-тетрагидрохиназолин-4-ил]пиперазин-1-ил]проп-2-ен-1-она (3,3 мг, 0,0077 ммоль, выход 3,7%) в виде белого твердого вещества. ЖХМС (ИЭР, m/z): 429,2 [М+Н]+.
Пример 39: 1H ЯМР (400 МГц, метанол-d4, м. д.) δ 8,47 (с, 1Н), 8,11 (д, J = 8,0 Гц, 1Н), 7,68 (д, J = 8,0 Гц, 1Н), 7,39-7,35 (м, 1Н), 7,31-7,27 (м, 1Н), 7,03-7,01 (м, 2Н), 6,84-6,77 (м, 1Н), 6,27-6,22 (м, 1Н), 5,80-5,77 (м, 1Н), 3,89-3,85 (м, 2Н), 3,77 (с, 3Н), 3,67-3,62 (м, 2Н), 3,48-3,42 (м, 2Н), 3,27-3,22 (м, 1Н), 2,98 (с, 1Н), 2,85-2,80 (м, 1Н), 2,71-2,65 (м, 1Н), 2,22 (с, 1Н), 0,95 (д, J = 8,0 Гц, 3Н).
Примеры 40а, 40b, 40 с и 40d
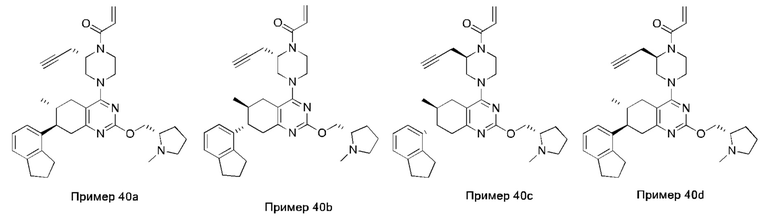
1-((S)-4-((6R,7R)-7-(2,3-дигидро-1Н-инден-4-ил)-6-метил-2-(((S)-1-метилпирролидин-2-ил)метокси)-5,6,7,8-тетрагидрохиназолин-4-ил)-2-(проп-2-ин-1-ил)пиперазин-1-ил)проп-2-ен-1-он (Пример 40а); и
1-((S)-4-((6S,7S)-7-(2,3 -дигидро-1Н-инден-4-ил)-6-метил-2-(((S)-1-метилпирролидин-2-ил)метокси)-5,6,7,8-тетрагидрохиназолин-4-ил)-2-(проп-2-ин-1-ил)пиперазин-1-ил)проп-2-ен-1-он (Пример 40b); и
1-((R)-4-((6S,7S)-7-(2,3-дигидро-1Н-инден-4-ил)-6-метил-2-(((S)-1-метилпирролидин-2-ил)метокси)-5,6,7,8-тетрагидрохиназолин-4-ил)-2-(проп-2-ин-1-ил)пиперазин-1-ил)проп-2-ен-1-он (Пример 40 с); и
1-((R)-4-((6R,7R)-7-(2,3-дигидро-1Н-инден-4-ил)-6-метил-2-(((S)-1-метилпирролидин-2-ил)метокси)-5,6,7,8-тетрагидрохиназолин-4-ил)-2-(проп-2-ин-1-ил)пиперазин-1-ил)проп-2-ен-1-он (Пример 40d)

Этап 1: ди-трет-бутил 2-(2-этокси-2-оксо-этил) пиперазин-1,4-дикарбоксилат

В атмосфере водорода раствор трет-бутил 4-бензил-2-(2-этокси-2-оксо-этил) пиперазин-1-карбоксилата (10,0 г, 27,59 ммоль) и Pd/C (0,50 г, 27,59 ммоль) в метаноле (100 мл) перемешивали при 25°С в течение 4 часов. После завершения полученный в результате раствор концентрировали в вакууме. Остаток растворяли в дихлорметане (200 мл) и добавляли ди-трет-бутил дикарбонат (12,04 г, 55,18 ммоль) и N,N-диизопропилэтиламин (10,68 г, 82,77 ммоль) и перемешивали при 25°С в течение 5 часов. После завершения растворитель разводили дихлорметаном и промывали солевым раствором. Потом органический слой сушили над безводным сульфатом натрия и концентрировали в вакууме с получением ди-трет-бутил 2-(2-этокси-2-оксо-этил) пиперазин-1,4-дикарбоксилата (12,2 г, 0,19 ммоль, выход 0,70%, чистота 60%) в виде желтого масла. Неочищенный продукт непосредственно используют на следующем этапе без очистки. ЖХМС (ИЭР, m/z): 373,5 [М+Н]+.
Этап 2: ди-трет-бутил 2-(2-гидроксиэтил)пиперазин-1,4-дикарбоксилат
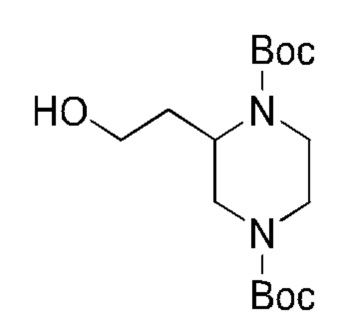
Раствор ди-трет-бутил 2-(2-этокси-2-оксо-этил) пиперазин-1,4-дикарбоксилата (5,00 г, 13,42 ммоль) в тетрагидрофуране (100 мл) перемешивали при 25°С в течение 0,5 часа. Потом добавляли алюмогидрид лития (1,02 г, 26,85 ммоль) и перемешивали при 25°С в течение 3 часов. После завершения реакцию гасили водой. После фильтрации фильтрат концентрировали при пониженном давлении с получением ди-трет-бутил 2-(2-гидроксиэтил) пиперазин-1,4-дикарбоксилата (3,2 г, неочищенный, чистота 70%), который непосредственно использовали на следующем этапе без очистки. ЖХМС (ИЭР, m/z): 331,4 [М+Н]+.
Этап 3: ди-трет-бутил 2-(2-оксоэтил) пиперазин-1,4-дикарбоксилат
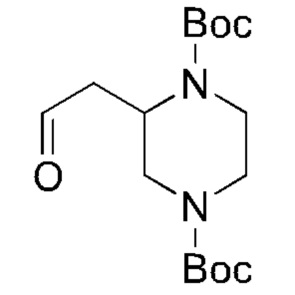
Раствор ди-трет-бутил 2-(2-гидроксиэтил) пиперазин-1, 4-дикарбоксилата (5,00 г, 15,13 ммоль) и реагент Десса-Мартина (12,84 г, 30,26 ммоль) в дихлорметане (100 мл) перемешивали при 25°С в течение 5 часов. После завершения полученный в результате раствор разводили этилацетатом и промывали водой. Органический слой сушили над безводным сульфатом натрия и концентрировали в вакууме с получением ди-трет-бутил 2-(2-оксоэтил) пиперазин-1,4-дикарбоксилата (3,5 г, 0,07 ммоль, выход 0,50%, чистота 68%) в виде желтого масла. Неочищенный продукт непосредственно используют на следующем этапе без очистки. ЖХМС (ИЭР, m/z): 329,4 [М+Н]+.
Этап 4: ди-трет-бутил 2-(проп-2-ин-1-ил)пиперазин-1,4-дикарбоксилат

Раствор ди-трет-бутил 2-(2-оксоэтил) пиперазин-1, 4-дикарбоксилата (1,00 г, 3,05 ммоль) и карбоната калия (0,84 г, 6,09 ммоль) в метаноле (30 мл) перемешивали при 25°С в течение 0,5 часа. Потом добавляли 1-диазо-1-диметоксифосфорил-пропан-2-он (0,58 г, 3,05 ммоль) и перемешивали при 25°С в течение 6 часов. После завершения раствор разводили водой и экстрагировали этилацетатом. Потом органические слои объединяли, сушили над безводным сульфатом натрия и концентрировали в вакууме с получением ди-трет-бутил 2-проп-2-инилпиперазин-1,4-дикарбоксилата (500 мг, 0,01 ммоль, выход 0,40%, чистота 70%) в виде желтого масла. Неочищенный продукт непосредственно используют на следующем этапе без очистки. ЖХМС (ИЭР, m/z): 325,4 [М+Н]+.
Этап 5: 2-(проп-2-ин-1-ил)пиперазин
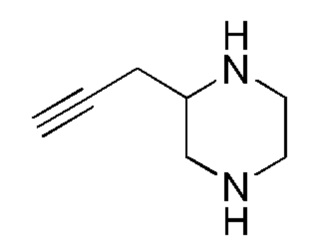
Раствор ди-трет-бутил 2-проп-2-инилпиперазин-1,4-дикарбоксилата (0,70 г, 2,16 ммоль) и трифторуксусной кислоты (5,00 мл) в дихлорметане (5,00 мл) перемешивали при 25°С в течение 3 часов. После завершения полученный в результате раствор концентрировали в вакууме с получением 2-проп-2-инилпиперазина (300 мг, 0,01 ммоль, выход 0,70%, чистота 60%) в виде желтого масла. Неочищенный продукт непосредственно используют на следующем этапе без очистки. ЖХМС (ИЭР, m/z): 125,2 [М+Н]+.
Этап 6: трет-бутил 4-(7-(2,3-дигидро-1Н-инден-4-ил)-6-метил-2-(метилтио)-5,6,7,8-тетрагидрохиназолин-4-ил)-2-(проп-2-ин-1-ил)пиперазин-1-карбоксилат

Раствор 7-(2,3-дигидро-1Н-инден-4-ил)-6-метил-2-(метилтио)-5,6,7,8-тетрагидрохиназолин-4-ола (600,0 мг, 1,84 ммоль) и N,N-диизопропилэтиламина (474 мг, 3,68 ммоль) в дихлорметане (10 мл) перемешивали при 25°С в течение 0,2 часа. Потом добавляли трифторметансульфоновый ангидрид (777 мг, 2,76 ммоль) и перемешивали при 25°С в течение 2 часов. После завершения полученный в результате раствор концентрировали при пониженном давлении и растворяли в 1,4-диоксане (10 мл). Потом добавляли N,N-диизопропилэтиламин (474,18 мг, 3,68 ммоль) и 2-проп-2-инилпиперазин (456,46 мг, 3,68 ммоль) и перемешивали при 110°С в течение 3 часов. Потом добавляли ди-трет-бутил дикарбонат (802 мг, 3,68 ммоль) и перемешивали при 110°С в течение 1 часа. После завершения полученный в результате раствор разводили этилацетатом и промывали водой. Органический слой сушили над безводным сульфатом натрия и концентрировали в вакууме. Остаток очищали с помощью флэш-хроматографии на силикагеле с элюированием этилацетатом/петролейным эфиром (1/6) с получением трет-бутил 4-(7-(2,3-дигидро-1Н-инден-4-ил)-6-метил-2-(метилтио)-5,6,7,8-тетрагидрохиназолин-4-ил)-2-(проп-2-ин-1-ил)пиперазин-1-карбоксилата (500 мг, 0,94 ммоль, выход 51,1%) в виде желтого твердого вещества. ЖХМС (ИЭР, m/z): 533,7 [М+Н]+.
Этап 7: трет-бутил 4-(7-(2, 3-дигидро-1Н-инден-4-ил)-6-метил-2-(метилсульфонил)-5,6,7,8-тетрагидрохиназолин-4-ил)-2-(проп-2-ин-1-ил)пиперазин-1-карбоксилат
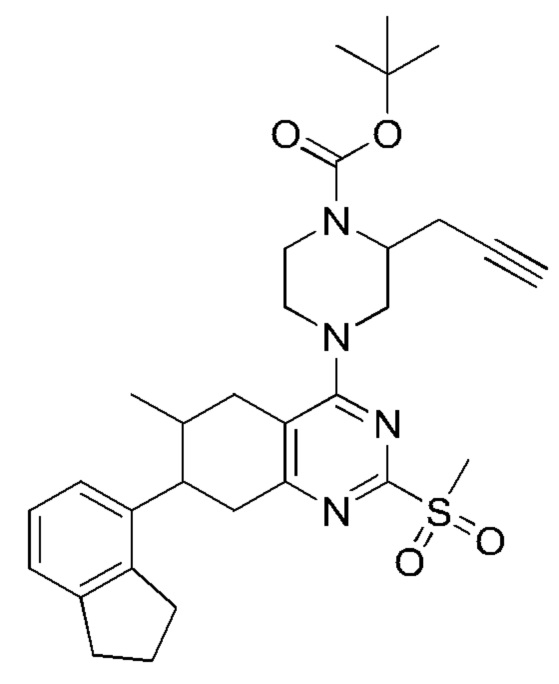
Раствор трет-бутил 4-(7-(2,3-дигидро-1Н-инден-4-ил)-6-метил-2-(метилтио)-5,6,7,8-тетрагидрохиназолин-4-ил)-2-(проп-2-ин-1-ил)пиперазин-1-карбоксилата (700,0 мг, 1,31 ммоль) и 3-хлорпероксибензойной кислоты (453,5 мг, 2,63 ммоль) в дихлорметане (10 мл) перемешивали при 25°С в течение 3 часов. После завершения полученный в результате раствор разводили дихлорметаном и промывали водой. Органический слой сушили над безводным сульфатом натрия и концентрировали в вакууме. Остаток очищали с помощью флэш-хроматографии на силикагеле с элюированием этилацетатом/петролейным эфиром (1/5) с получением трет-бутил 4-(7-индан-4-ил-6-метил-2-метилсульфонил-5,6,7,8-тетрагидрохиназолин-4-ил)-2-проп-2-инил-пиперазин-1-карбоксилата (560 мг, 0,99 ммоль, выход 75,5%) в виде желтого твердого вещества. ЖХМС (ИЭР, m/z): 565,7 [М+Н]+.
Этап 8 трет-бутил 4-(7-(2,3-дигидро-1Н-инден-4-ил)-6-метил-2-(((S)-1-метилпирролидин-2-ил)метокси)-5,6,7,8-тетрагидрохиназолин-4-ил)-2-(проп-2-ин-1-ил)пиперазин-1-карбоксилат

Раствор N-метил-1-пролинола (214,13 мг, 1,86 ммоль), гидрида натрия (59,5 мг, 2,48 ммоль, 60% дисперсия в минеральном масле) в 1,4-диоксане (6 мл) перемешивали при 25°С в течение 0,5 часа Потом добавляли трет-бутил 4-(7-индан-4-ил-6-метил-2-метилсульфонил-5,6,7,8-тетрагидрохиназолин-4-ил)-2-проп-2-инил-пиперазин-1-карбоксилат (700,0 мг, 1,24 ммоль) и перемешивали при 25°С в течение 2 часов После завершения полученный в результате раствор разводили дихлорметаном и промывали водой Органический слой сушили над безводным сульфатом натрия и концентрировали в вакууме Остаток очищали с помощью флэш-хроматографии на силикагеле с элюированием этилацетатом/петролейным эфиром (1/4) с получением трет-бутил 4-(7-(2,3-дигидро-1Н-инден-4-ил)-6-метил-2-(((S)-1-метилпирролидин-2-ил)метокси)-5,6,7,8-тетрагидрохиназолин-4-ил)-2-(проп-2-ин-1-ил)пиперазин-1-карбоксилата (300 мг,0,50 ммоль, выход 40,4%) в виде желтого твердого вещества ЖХМС (ИЭР, m/z) 600,8 [М+Н]+
Этап 9 1-((S)-4-((6R,7R)-7-(2,3-дигидро-1Н-инден-4-ил)-6-метил-2-(((S)-1-метилпирролидин-2-ил)метокси)-5,6,7,8-тетрагидрохиназолин-4-ил)-2-(проп-2-ин-1-ил)пиперазин-1-ил)проп-2-ен-1-он (Пример 40а), 1-((S)-4-((6S,7S)-7-(2,3-дигидро-1Н-инден-4-ил)-6-метил-2-(((S)-1-метилпирролидин-2-ил)метокси)-5,6,7,8-тетрагидрохиназолин-4-ил)-2-(проп-2-ин-1 -ил)пиперазин-1 -ил)проп-2-ен-1 -он (Пример 40b), и 1-((R)-4-((6S,7S)-7-(2,3-дигидро-1Н-инден-4-ил)-6-метил-2-(((S)-1-метилпирролидин-2-ил)метокси)-5,6,7,8-тетрагидрохиназолин-4-ил)-2-(проп-2-ин-1-ил)пиперазин-1-ил)проп-2-ен-1-он (Пример 40 с), 1-((R)-4-((6R,7R)-7-(2,3-дигидро-1Н-инден-4-ил)-6-метил-2-(((S)-1-метилпирролидин-2-ил)метокси)-5,6,7,8-тетрагидрохиназолин-4-ил)-2-(проп-2-ин-1-ил)пиперазин-1-ил)проп-2-ен-1 -он и (Пример 40d)
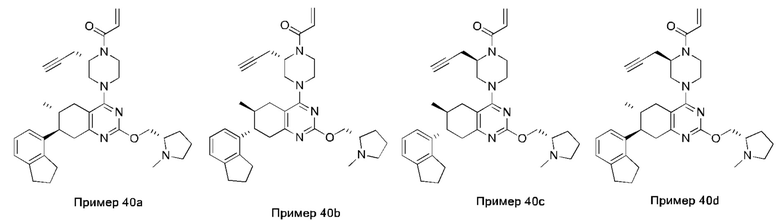
Раствор трет-бутил 4-(7-(2,3-дигидро-1Н-инден-4-ил)-6-метил-2-(((S)-1-метилпирролидин-2-ил)метокси)-5,6,7,8-тетрагидрохиназолин-4-ил)-2-(проп-2-ин-1-ил)пиперазин-1-карбоксилата (300,0 мг, 0,50 ммоль) и трифторуксусной кислоты (2 мл) в дихлорметане (6 мл) перемешивали при 25°С в течение 2 часов. Полученный в результате раствор концентрировали в вакууме. Потом реакционную смесь разводили дихлорметаном (30 мл). Потом добавляли N,N-диизопропилэтиламин (129,04 мг, 1 ммоль) и акрилоилхлорид (45,27 мг, 0,50 ммоль) и перемешивали при -78°С в течение 1 часа. После завершения раствор гасили водой, разводили ЭА и промывали солевым раствором. Органический слой концентрировали в вакууме. Неочищенный продукт дополнительно выделяли с помощью препаративной ВЭЖХ со следующими условиями: (колонка: колонка: XBridge Shield RP18 OBD, 19*250 мм, 10 мкм; подвижная фаза А: вода (10 ммоль/л NH4HCO3 + 0,1% NH3.H2O), подвижная фаза В: АЦН; скорость потока: 25 мл/мин; градиент: от 55 В до 68 В за 10 мин; 254 нм). Продукт дополнительно очищали с помощью хиральной препаративной ВЭЖХ со следующими условиями: (колонка CHIRAL Cellulose-SB, 4,6*100 мм, 3 мкм, подвижная фаза, гексан (0,1% ДЭА): EtOH = 80:20; детектор, УФ 220/254 нм) и (колонка: CHIRALPAK AD-H, 2,0 см, В. Д. *25 см L; подвижная фаза А: гексан (8 ммоль/л NH3.MeOH) - ВЭЖХ, подвижная фаза В: ИПА-ВЭЖХ; скорость потока: 20 мл/мин; градиент: от 20 В до 20 В за 16 мин; 220/254 нм) с получением указанных в заголовке соединений. Абсолютная конфигурация указанных в заголовке соединений была определена по данным активности и рентгенограммы белковой структуры соединения 21b.
Пример 40а: 1-((S)-4-((6R,7R)-7-(2,3-дигидро-1Н-инден-4-ил)-6-метил-2-(((S)-1-метилпирролидин-2-ил)метокси)-5,6,7,8-тетрагидрохиназолин-4-ил)-2-(проп-2-ин-1-ил)пиперазин-1-ил)проп-2-ен-1-он (10,4 мг, 0,019 ммоль, выход 3,8%, белое твердое вещество) (10 мг, 0,018 ммоль, выход 3,6%, белое твердое вещество). 1Н ЯМР (400 МГц, метанол-d4) δ 7,14-7,08 (м, 2Н), 7,01 (д, J = 7,4 Гц, 1Н), 6,83(с, 1Н), 6,26 (д, J = 16,0 Гц, 1Н), 5,80 (д, J = 10,6, 1H), 4,51 (с, 1Н), 4,38-4,35 (м, 1Н), 4,33-4,31 (м, 1Н), 4,18 (д, J = 13,7 Гц, 1Н), 4,04-4,01(м, 1Н), 3,71(с, 1Н), 3,50-3,40 (м, 1Н), 3,15-3,09 (м, 2Н), 3,00- 2,92 (м, 7Н), 2,81-2,74 (м, 3Н), 2,62-2,52 (м, 6Н), 2,42 (с, 2Н), 2,13-2,02 (м, 4Н), 1,86-1,81 (м, 2Н), 1,76-1,68 (м, 1Н), 0,89 (с, 3Н). ЖХМС (ИЭР, m/z): 554,4 [М+Н]+. Хиральная ВЭЖХ: Reg AD, 0,46*10 мм, 5 мкм; обнаружение на 254 нм; гексан (0,1% ДЭА): EtOH = 80/20; скорость потока = 1,0 мл/мин; время удержания: 2,857 мин (более быстрый пик).
Пример 40b: 1-((S)-4-((6S,7S)-7-(2,3 -дигидро-1Н-инден-4-ил)-6-метил-2-(((S)-1-метилпирролидин-2-ил)метокси)-5,6,7,8-тетрагидрохиназолин-4-ил)-2-(проп-2-ин-1-ил)пиперазин-1-ил)проп-2-ен-1-он (10,3 мг, 0,019 ммоль, выход 3,7%, белое твердое вещество). 1H ЯМР (400 МГц, метанол-d4) δ 7,14-7,08 (м, 2Н), 7,01 (д, J = 7,4 Гц, 1Н),6,81(с, 1Н), 6,25 (д, J = 16,0 Гц, 1Н), 5,81 (д, J = 10,6, 1Н), 4,52 (с, 1Н), 4,38-4,36 (м, 1Н), 4,33-4,30 (м, 1Н), 4,17 (д, J = 13,7 Гц, 1Н), 4,04-4,01(м, 1Н), 3,71(с, 1Н), 3,50-3,40 (м, 1Н), 3,15-3,09 (м, 2Н), 3,00-2,92 (м, 7Н), 2,81-2,74 (м, 3Н), 2,62-2,52 (м, 6Н), 2,42 (с, 2Н), 2,13-2,02 (м, 4Н), 1,86-1,81 (м, 2Н), 1,76-1,68 (м, 1Н), 0,89 (с, 3Н). ЖХМС (ИЭР, m/z): 554,4 [М+Н]+. Хиральная ВЭЖХ: RegAD, 0,46*10 мм, 5 мкм; обнаружение на 254 нм; гексан (0,1% ДЭА): EtOH = 80/20; скорость потока = 1,0 мл/мин; время удержания: 5,192 мин (более медленный пик).
Пример 40 с: 1-((R)-4-((6S,7S)-7-(2,3-дигидро-1Н-инден-4-ил)-6-метил-2-(((S)-1-метилпирролидин-2-ил)метокси)-5,6,7,8-тетрагидрохиназолин-4-ил)-2-(проп-2-ин-1-ил)пиперазин-1-ил)проп-2-ен-1-он (10,1 мг, 0,018 ммоль, выход 3,6%, белое твердое вещество). 1H ЯМР (400 МГц, метанол-d4) δ 7,13-7,07 (м, 2Н), 7,00 (д, J = 7,4 Гц, 1Н), 6,82 (с, 1Н), 6,24 (д, J = 16,0 Гц, 1Н), 5,80 (д, J = 10,6, 1Н), 4,51 (с, 1Н), 4,38-4,36 (м, 1Н), 4,33-4,30 (м, 1Н), 4,17 (д, J = 13,7 Гц, 1Н), 4,04-4,01(м, 1Н), 3,71(с, 1Н), 3,50-3,40 (м, 1Н), 3,15-3,09 (м, 2Н), 3,00-2,92 (м, 7Н), 2,81-2,74 (м, 3Н), 2,62-2,52 (м, 6Н), 2,42 (с, 2Н), 2,13-2,02 (м, 4Н), 1,86-1,81 (м, 2Н), 1,76-1,68 (м, 1Н), 0,89 (с, 3Н). ЖХМС (ИЭР, m/z): 554,4 [М+Н]+. Хиральная ВЭЖХ: Cellulose-SB, 4,6*100 мм, 3 мкм; обнаружение на 254 нм; гексан (0,1% ДЭА): EtOH = 80/20; скорость потока = 1,0 мл/мин; время удержания: 2,908 мин (более медленный пик).
Пример 40d: 1-((R)-4-((6R,7R)-7-(2,3-дигидро-1Н-инден-4-ил)-6-метил-2-(((S)-1-метилпирролидин-2-ил)метокси)-5,6,7,8-тетрагидрохиназолин-4-ил)-2-(проп-2-ин-1-ил)пиперазин-1-ил)проп-2-ен-1-он (10 мг, 0,018 ммоль, выход 3,6%, белое твердое вещество). 1H ЯМР (400 МГц, метанол-d4) δ 7,14-7,08 (м, 2Н), 7,01 (д, J = 7,4 Гц, 1Н), 6,81(с, 1Н), 6,25 (д, J = 16,0 Гц, 1Н), 5,81 (д, J = 10,6, 1Н), 4,52 (с, 1Н), 4,38-4,36 (м, 1Н), 4,33-4,30 (м, 1Н), 4,17 (д, J = 13,7 Гц, 1Н), 4,04-4,01(м, 1Н), 3,71(с, 1Н), 3,50-3,40 (м, 1Н), 3,15-3,09 (м, 2Н), 3,00-2,92 (м, 7Н), 2,81-2,74 (м, 3Н), 2,62-2,52 (м, 6Н), 2,42 (с, 2Н), 2,13-2,02 (м, 4Н), 1,86-1,81 (м, 2Н), 1,76-1,68 (м, 1Н), 0,89 (с, 3Н) ЖХМС (ИЭР, m/z) 554,4 [М+Н]+ Хиральная ВЭЖХ Cellulose-SB, 4,6*100 мм, 3 мкм, обнаружение на 254 нм, гексан (0,1% ДЭА) EtOH = 80 20, скорость потока = 1,0 мл/мин, время удержания 2,505 мин (более быстрый пик) Примеры 41а и 41b

1-((S)-4-((6S,7S)-7-(6-амино-3-(трифторметил)пиридин-2-ил)-6-метил-2-(((S)-1-метилпирролидин-2-ил)метокси)-5,6,7,8-тетрагидрохиназолин-4-ил)-3-метилпиперазин-1-ил)проп-2-ен-1-он (Пример 41 а), и
1-((S)-4-((6R,7R)-7-(6-амино-3-(трифторметил)пиридин-2-ил)-6-метил-2-(((S)-1-метилпирролидин-2-ил)метокси)-5,6,7,8-тетрагидрохиназолин-4-ил)-3-метилпиперазин-1-ил)проп-2-ен-1-он (Пример 41b)
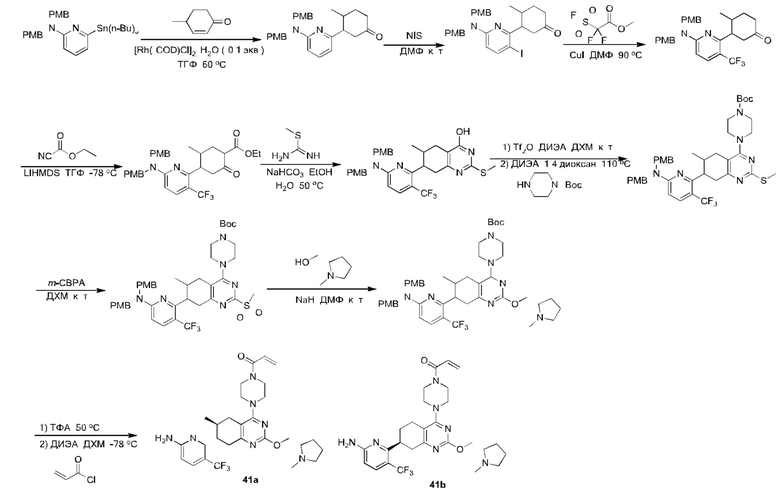
Этап 1 3-[6-[бис[(4-метоксифенил)метил]амино]-2-пиридил]-4-метил-циклогексанон

В атмосфере азота в раствор 4-метилциклогекс-2-ен-1-она (4,24 г, 38,49 ммоль) и [Rh(COD)Cl]2 (1,58 г, 3,21 ммоль) в тетрагидрофуране (400 мл) и воде (40 мл) добавляли N,N-бис[(4-метоксифенил)метил]-6-трибутилстаннил-пиридин-2-амин (20,0 г, 32,08 ммоль) Полученный в результате раствор перемешивали при 60°С в течение 2 часов После завершения раствор разводили водой и экстрагировали этилацетатом Потом органические слои объединяли, сушили над безводным сульфатом натрия и концентрировали в вакууме Остаток очищали с помощью флэш-хроматографии на силикагеле с элюированием этилацетатом/петролейным эфиром (1/6) с получением 3-[6-[бис[(4-метоксифенил)метил]амино]-2-пиридил]-4-метил-циклогексанона (5,00 г, 11,25 ммоль, выход 35,1%) в виде желтого твердого вещества ЖХМС (ИЭР, m/z) 445,6 [М+Н]+
Этап 2 3-[6-[бис[(4-метоксифенил)метил]амино]-3-йодо-2-пиридил]-4-метил-циклогексанон
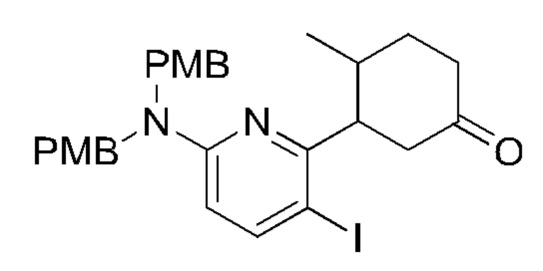
Раствор 3-[6-[бис[(4-метоксифенил)метил]амино]-2-пиридил]-4-метил-циклогексанона (6,00 г, 13,5 ммоль) и N-йодосукцинимида (3,48 г, 16,2 ммоль) в N,N-диметилформамид (50 мл) перемешивали при 25°С в течение 2 часов. После завершения полученный в результате раствор разводили этилацетатом и промывали солевым раствором. Органический слой сушили над безводным сульфатом натрия и концентрировали в вакууме. Остаток очищали с помощью флэш-хроматографии на силикагеле с элюированием этилацетатом/петролейным эфиром (1/7) с получением 3-[6-[бис[(4-метоксифенил)метил]амино]-3-йодо-2-пиридил]-4-метил-циклогексанона (5,2 г, 9,12 ммоль, выход 67,5%) в виде желтого твердого вещества. ЖХМС (ИЭР, m/z): 571,1 [М+Н]+.
Этап 3: 3-[6-[бис[(4-метоксифенил)метил]амино]-3-(трифторметил)-2-пиридил]-4-метил-циклогексанон
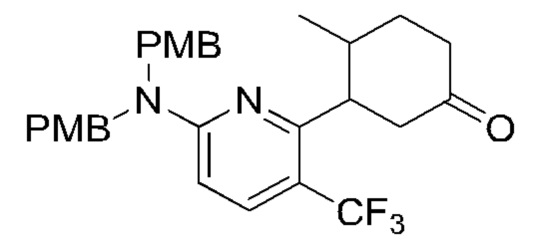
В атмосфере азота в раствор 3-[6-[бис[(4-метоксифенил)метил]амино]-3-йодо-2-пиридил]-4-метил-циклогексанона (5,6 г, 9,82 ммоль) и йодида меди (1,87 г, 9,82 ммоль) в N,N-диметилформамиде (10 мл) добавляли метил метил 2,2-дифтор-2-(фторсульфонил)ацетат (9,33 г, 49,08 ммоль). Полученный в результате раствор перемешивали при 90°С в течение 5 часов. После завершения полученный в результате раствор разводили этилацетатом и промывали солевым раствором. Органический слой сушили над безводным сульфатом натрия и концентрировали в вакууме. Остаток очищали с помощью флэш-хроматографии на силикагеле с элюированием этилацетатом/петролейным эфиром (1/6) с получением 3-[6-[бис[(4-метоксифенил)метил]амино]-3-(трифторметил)-2-пиридил]-4-метил-циклогексанона (4,2 г, 8,19 ммоль, выход 83,5%) в виде желтого масла. ЖХМС (ИЭР, m/z): 513,6 [M+H]+.
Этап 4: этил 4-[6-[бис[(4-метоксифенил)метил]амино]-3-(трифторметил)-2-пиридил]-5-метил-2-оксо-циклогексанкарбоксилат

В атмосфере азота в раствор 3-[6-[бис[(4-метоксифенил)метил]амино]-3-(трифторметил)-2-пиридил]-4-метил-циклогексанона (1,80 г, 3,51 ммоль) в тетрагидрофуране (20 мл) добавляли LiHMDS (2,11 мл, 4,21 ммоль) (1 М в ТГФ) при -78°С. Полученный в результате раствор перемешивали в течение 0,5 ч при -78°С. Потом добавляли этилцианоформиат (0,52 г, 5,27 ммоль) и перемешивали при -78°С в течение 2 часов. Реакцию гасили водой. После завершения полученный в результате раствор разводили этилацетатом и промывали солевым раствором. Органический слой сушили над безводным сульфатом натрия и концентрировали в вакууме. Остаток очищали с помощью флэш-хроматографии на силикагеле с элюированием этилацетатом/петролейным эфиром (1/5) с получением этил 4-[6-[бис[(4-метоксифенил)метил]амино]-3-(трифторметил)-2-пиридил]-5-метил-2-оксо-циклогексанкарбоксилата (600 мг, 1,03 ммоль, выход 29,2%) в виде желтого масла. ЖХМС (ИЭР, m/z): 585,6 [М+Н]+.
Этап 5: 7-[6-[бис[(4-метоксифенил)метил]амино]-3-(трифторметил)-2-пиридил]-6-метил-2-метилсульфанил-5,6,7,8-тетрагидрохиназолин-4-ол
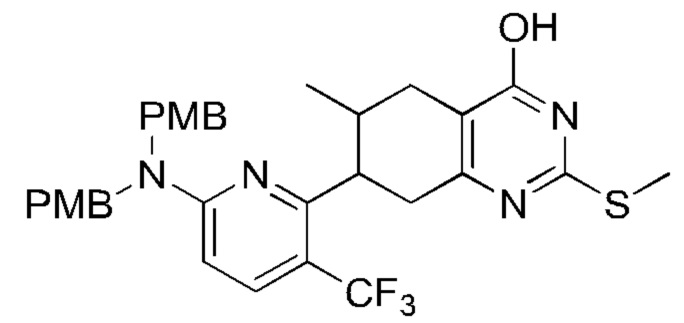
Раствор этил 4-[6-[бис[(4-метоксифенил)метил]амино]-3-(трифторметил)-2-пиридил]-5-метил-2-оксо-циклогексанкарбоксилата (1,5 г, 2,57 ммоль) и 2-метилизотиомочевины (2,31 г, 25,66 ммоль), бикарбоната натрия (4,31 г, 51,31 ммоль) в воде (10 мл) и этаноле (50 мл) перемешивали при 50°С в течение 9 часов. После завершения полученный в результате раствор разводили этилацетатом и промывали солевым раствором. Органический слой сушили над безводным сульфатом натрия и концентрировали в вакууме. Остаток очищали с помощью флэш-хроматографии на силикагеле с элюированием дихлорметаном/метанолом (10/1) с получением 7-[6-[бис[(4-метоксифенил)метил]амино]-3-(трифторметил)-2-пиридил]-6-метил-2-метилсульфанил-5,6,7,8-тетрагидрохиназолин-4-ола (0,65 г, 1,06 ммоль, выход 41,5%) в виде желтого твердого вещества ЖХМС (ИЭР, m/z) 611,7 [M+H]+
Этап 6 трет-бутил (3S)-4-[7-[6-[бис[(4-метоксифенил)метил]амино]-3-(трифторметил)-2-пиридил]-6-метил-2-метилсульфанил-5,6,7,8-тетрагидрохиназолин-4-ил] -3 -метил-пиперазин-1-карбоксилат
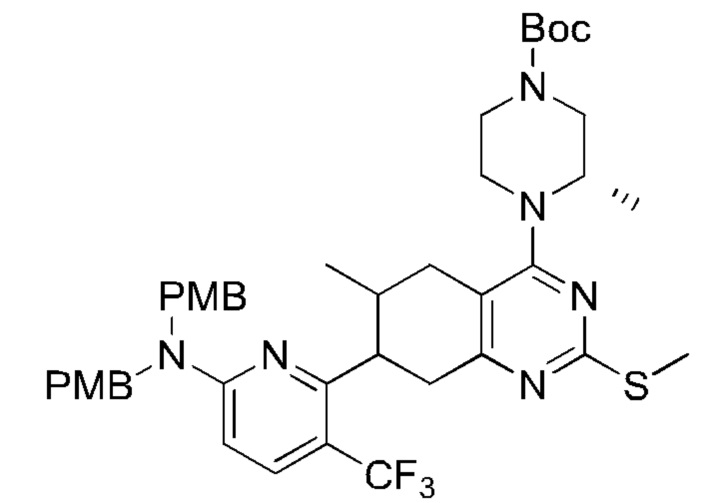
Раствор 7-[6-[бис[(4-метоксифенил)метил]амино]-3-(трифторметил)-2-пиридил]-6-метил-2-метилсульфанил-5,6,7,8-тетрагидрохиназолин-4-ола (500,0 мг, 0,82 ммоль) и трифторметансульфонового ангидрида (346,5 мг, 1,23 ммоль) в ДХМ (50 мл) перемешивали при 25°С в течение 3 часов Потом остаток концентрировали в вакууме Добавляли трет-бутил (3S)-3 -метил-1-пиперазинкарбоксилат (983,87 мг, 4,91 ммоль) и N,N-диизопропилэтиламин (316,85 мг, 2,46 ммоль) в 1,4-диоксане (50 мл) и перемешивали при 110°С в течение 3 часов После завершения полученный в результате раствор разводили этилацетатом и промывали солевым раствором Органический слой сушили над безводным сульфатом натрия и концентрировали в вакууме Остаток очищали с помощью флэш-хроматографии на силикагеле с элюированием метанолом/дихлорметаном (1/10) с получением трет-бутил (3S)-4-[7-[6-[бис[(4-метоксифенил)метил]амино]-3-(трифторметил)-2-пиридил]-6-метил-2-метилсульфанил-5,6,7,8-тетрагидрохиназолин-4-ил]-3-метил-пиперазин-1-карбоксилата (300 мг, 0,38 ммоль, выход 46,2%) в виде желтого твердого вещества ЖХМС (ИЭР, m/z) 794,0 [М+Н]+
Этап 7 трет-бутил (3S)-4-[7-[6-[бис[(4-метоксифенил)метил]амино]-3-(трифторметил)-2-пиридил]-6-метил-2-метилсульфонил-5,6,7,8-тетрагидрохиназолин-4-ил]-3-метил-пиперазин-1-карбоксилат
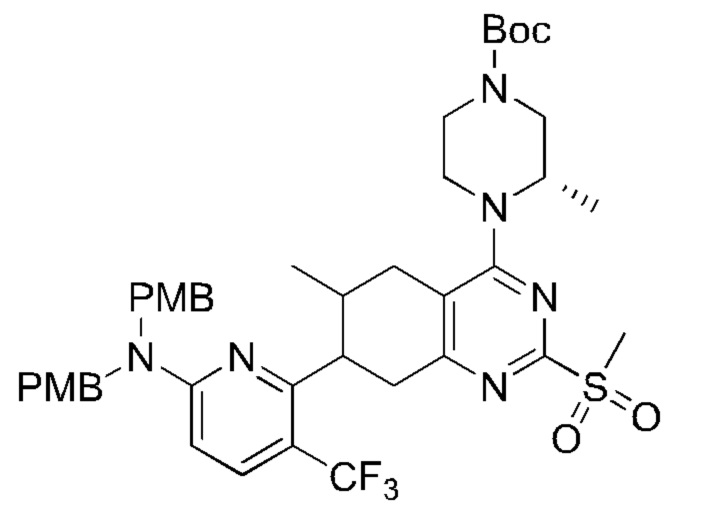
Раствор трет-бутил (3S)-4-[7-[6-[бис[(4-метоксифенил)метил]амино]-3-(трифторметил)-2-пиридил]-6-метил-2-метилсульфанил-5,6,7,8-тетрагидрохиназолин-4-ил]-3-метил-пиперазин-1-карбоксилата (300,0 мг, 0,38 ммоль) и 3-хлорпероксибензойной кислоты (130,58 мг, 0,76 ммоль) в дихлорметане (10 мл) перемешивали при 25°С в течение 3 часов После завершения полученный в результате раствор разводили этилацетатом и промывали солевым раствором Органический слой сушили над безводным сульфатом натрия и концентрировали в вакууме Остаток очищали с помощью флэш-хроматографии на силикагеле с элюированием метанолом/дихлорметаном (1/10) с получением трет-бутил (3S)-4-[7-[6-[бис[(4-метоксифенил)метил]амино]-3-(трифторметил)-2-пиридил]-6-метил-2-метилсульфонил-5,6,7,8-тетрагидрохиназолин-4-ил]-3-метил-пиперазин-1-карбоксилата (200 мг, 0,24 ммоль, выход 64,1%) в виде желтого твердого вещества ЖХМС (ИЭР, m/z) 825,0 [М+Н]+
Этап 8 трет-бутил (3S)-4-[7-[6-[бис[(4-метоксифенил)метил]амино]-3-(трифторметил)-2-пиридил]-6-метил-2-[[(2S)-1-метилпирролидин-2-ил]метокси]-5,6,7,8-тетрагидрохиназолин-4-ил]-3-метил-пиперазин-1-карбоксилат
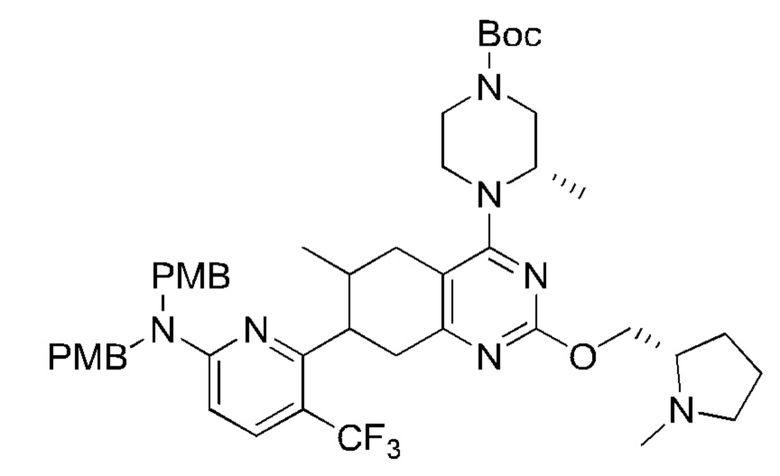
Раствор н-метил-l-пролинола (55,84 мг, 0,48 ммоль) и гидрида натрия (12,8 мг, 0,53 ммоль, 60% дисперсия в минеральном масле) в ДМФ (3 мл) перемешивали при 25°С в течение 2 часов Потом добавляли трет-бутил (3S)-4-[7-[6-[бис[(4-метоксифенил)метил]амино]-3-(трифторметил)-2-пиридил]-6-метил-2-метилсульфонил-5,6,7,8-тетрагидрохиназолин-4-ил]-3-метил-пиперазин-1-карбоксилат (200,0 мг, 0,24 ммоль) и перемешивали при 25°С в течение 3 часов. После завершения полученный в результате раствор разводили этилацетатом и промывали солевым раствором. Органический слой сушили над безводным сульфатом натрия и концентрировали в вакууме. Остаток очищали с помощью флэш-хроматографии на силикагеле с элюированием этилацетатом/петролейным эфиром (1/4) с получением трет-бутил (3S)-4-[7-[6-[бис[(4-метоксифенил)метил]амино]-3-(трифторметил)-2-пиридил]-6-метил-2-[[(2S)-1-метилпирролидин-2-ил]метокси]-5,6,7,8-тетрагидрохиназолин-4-ил]-3-метил-пиперазин-1-карбоксилата (120 мг, 0,14 ммоль, выход 57,6%) в виде желтого твердого вещества. ЖХМС: (ИЭР, m/z): 860,0 [М+Н]+.
Этап 9: 1-((S)-4-((6S,7S)-7-(6-амино-3-(трифторметил)пиридин-2-ил)-6-метил-2-(((S)-1-метилпирролидин-2-ил)метокси)-5,6,7,8-тетрагидрохиназолин-4-ил)-3-метилпиперазин-1-ил)проп-2-ен-1-он (Пример 41а); и 1-((S)-4-((6R,7R)-7-(6-амино-3-(трифторметил)пиридин-2-ил)-6-метил-2-(((S)-1-метилпирролидин-2-ил)метокси)-5,6,7,8-тетрагидрохиназолин-4-ил)-3-метилпиперазин-1-ил)проп-2-ен-1-он (Пример 41b)

Раствор трет-бутил (3S)-4-[7-[6-[бис[(4-метоксифенил)метил]амино]-3-(трифторметил)-2-пиридил]-6-метил-2-[[(2S)-1-метилпирролидин-2-ил]метокси]-5,6,7,8-тетрагидрохиназолин-4-ил]-3-метил-пиперазин-1-карбоксилата (200,0 мг, 0,23 ммоль) и трифторуксусной кислоты (6 мл) перемешивали при 50°С в течение 3 часов. После завершения полученный в результате раствор концентрировали в вакууме. Остаток растворяли в дихлорметане (5 мл), потом добавляли акрилоилхлорид (21,05 мг, 0,23 ммоль) и N,N-диизопропилэтиламин (89 мг, 0,69 ммоль) и перемешивали при -78°С в течение 2 часов. После завершения раствор гасили водой, разводили этилацетатом и промывали солевым раствором. Органический слой концентрировали в вакууме. Неочищенный продукт дополнительно выделяли с помощью препаративной ВЭЖХ со следующими условиями: колонка: CHIRALPAK IE, 2*25 см, 5 мкм; подвижная фаза А: МТБЭ (10 мМ NH3-MeOH) --ВЭЖХ, подвижная фаза В: МеОН -ВЭЖХ; скорость потока: 20 мл/мин; градиент: от 15 В до 15 В за 27 мин; 220/254 нм; RT1: 17,672; RT2: 23,294. Продукт очищали с помощью хиральной препаративной ВЭЖХ со следующими условиями: (колонка CHIRAL ART Cellulose-SB, 2*25 см, 5 мкм; подвижная фаза, гексан --ВЭЖХ и этанол -ВЭЖХ (выдержка 40% этанол --ВЭЖХ за 10 мин); детектор, УФ 220/254 нм) с получением указанных в заголовке соединений. Абсолютная конфигурация указанных в заголовке соединений была определена по данным активности и рентгенограммы белковой структуры соединения 21b.
Пример 41а: 1-((S)-4-((6S,7S)-7-(6-амино-3-(трифторметил)пиридин-2-ил)-6-метил-2-(((S)-1-метилпирролидин-2-ил)метокси)-5,6,7,8-тетрагидрохиназолин-4-ил)-3-метилпиперазин-1-ил)проп-2-ен-1-он (12,5 мг, 0,022 ммоль, выход 9,4%, белое твердое вещество). 1Н ЯМР (400 МГц, метанол-d4) δ 7,63 (д, J=8,0 Гц, 1H), 6,89-6,76 (м, 1H), 6,44 (д, J=8,0 Гц, 1H), 6,30-6,25 (м, 1H), 5,82-5,79 (м, 1H), 4,49-4,44 (м, 1H), 4,37-4,28 (м, 2Н), 4,13-4,08 (м, 1H), 4,97-4,93 (м, 1H), 3,79-3,74 (м, 1H), 3,62-3,39 (м, 3Н), 3,15-3,03 (м, 3Н), 2,94-2,86 (м, 1H), 2,79 (с, 1H), 2,71-2,65 (м, 1H), 2,52 (с, 3Н), 2,49-2,36 (м, 2Н), 2,20 (с, 1H), 2,14-2,05 (м, 1H), 1,87-1,80 (м, 2Н), 1,75-1,68 (м, 1H), 1,13 (д, J=8 Гц, 3Н), 0,87 (д, J=8 Гц, 3Н). ЖХМС: (ПЭР, m/z): 574,3 [М+Н]+. Хиральная ВЭЖХ: CHIRALPAK IE-3, 4,6*50 мм, 3 мкм; обнаружение на 254 нм; гексан (0,1% ДЭА): EtOH = 60:40; скорость потока = 1,0 мл/мин; время удержания: 2,711 мин (более медленный пик).
Пример 41b: 1-((S)-4-((6R,7R)-7-(6-амино-3-(трифторметил)пиридин-2-ил)-6-метил-2-(((S)-1-метилпирролидин-2-ил)метокси)-5,6,7,8-тетрагидрохиназолин-4-ил)-3-метилпиперазин-1-ил)проп-2-ен-1-он (10 мг, 0,017 ммоль, выход 7,5%, белое твердое вещество). 1Н ЯМР (400 МГц, метанол-d4) δ 7,63 (д, J=8,0 Гц, 1H), 6,89-6,75 (м, 1H), 6,44 (д, J=8,0 Гц, 1H), 6,30-6,24 (м, 1H), 5,82-5,79 (м, 1H), 4,53-4,49 (м, 1H), 4,39-4,22 (м, 3Н), 4,12-4,07 (м, 1H), 3,96-3,93 (м, 1H), 3,69-3,61 (м, 1H), 3,49-3,43 (м, 1H), 3,28-3,22 (м, 1H), 3,15-3,02 (м, 3Н), 2,90-2,84 (м, 1H), 2,78 (с, 1H), 2,64-2,59 (м, 1H), 2,53 (с, 3Н), 2,50-2,46 (м, 1H), 2,43-2,35 (м, 1H), 2,20 (с, 1H), 2,17-2,07 (м, 1H), 1,88-1,81 (м, 2Н), 1,76-1,67 (м, 1H), 1,42-1,39 (м, 3Н), 0,87 (д, J=8 Гц, 3Н). ЖХМС: (ПЭР, m/z): 574,3 [М+Н]+. Хиральная ВЭЖХ: CHIRALPAK IE-3, 4,6*50 мм, 3 мкм; обнаружение на 254 нм; гексан (0,1% ДЭА) : EtOH = 60:40; скорость потока = 1,0 мл/мин; время удержания: 2,194 мин (первый пик).
Примеры 42а и 42b
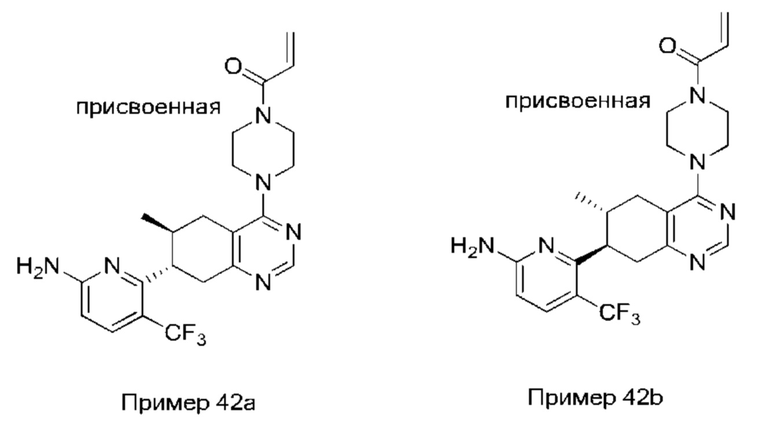
1-(4-((6S,7S)-7-(6-амино-3-(трифторметил)пиридин-2-ил)-6-метил-5,6,7,8-тетрагидрохиназолин-4-ил)пиперазин-1-ил)проп-2-ен-1-он (Пример 42а); и
1-(4-((6R,7R)-7-(6-амино-3-(трифторметил)пиридин-2-ил)-6-метил-5,6,7,8-тетрагидрохиназолин-4-ил)пиперазин-1-ил)проп-2-ен-1-он (Пример 42b)
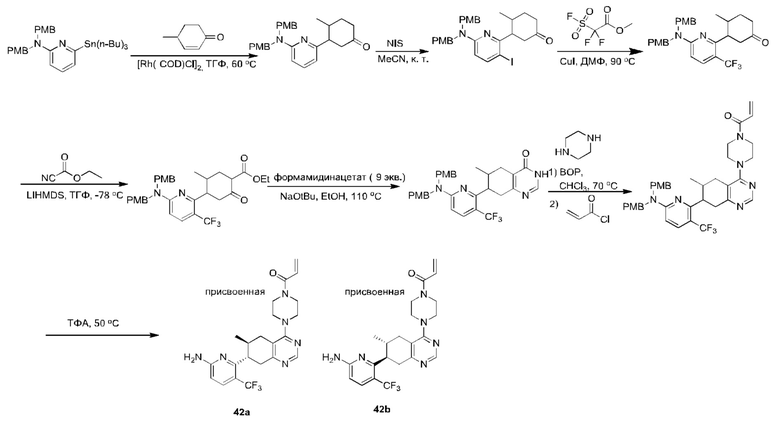
Этап 1: 3-[6-[бис[(4-метоксифенил)метил]амино]-2-пиридил]-4-метил-циклогексанон
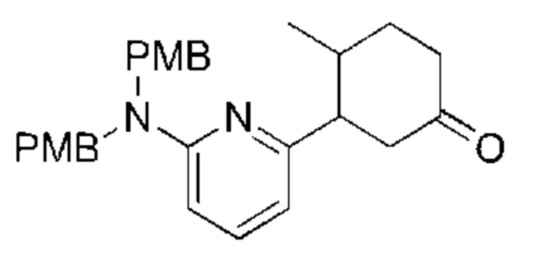
В атмосфере азота в раствор N,N-бис[(4-метоксифенил)метил]-6-трибутилстаннил-пиридин-2-амина (20,0 г, 32,08 ммоль) и 4-метилциклогекс-2-ен-1-она (4,24 г, 38,49 ммоль) в тетрагидрофуране (100 мл) добавляли [Rh(COD)Cl]2 (1,58 г, 3,21 ммоль). Полученный в результате раствор перемешивали при 60°С в течение 3 часов. После завершения полученный в результате раствор разводили этилацетатом и промывали водой. Органический слой сушили над безводным сульфатом натрия и концентрировали в вакууме. Остаток очищали с помощью флэш-хроматографии на силикагеле с элюированием этилацетатом/петролейным эфиром (1/3) с получением 3-[6-[бис[(4-метоксифенил)метил]амино]-2-пиридил]-4-метил-циклогексанона (8 г, 17,9 ммоль, выход 56,1%) в виде желтого масла. ЖХМС (ИЭР, m/z): 445,6 [М+Н]+.
Этап 2: 3-[6-[бис[(4-метоксифенил)метил]амино]-3-йодо-2-пиридил]-4-метил-циклогексанон

Раствор 3-[6-[бис[(4-метоксифенил)метил]амино]-2-пиридил]-4-метил-циклогексанона (5,00 г, 11,25 ммоль) и N-йодосукцинимида (2,53 г, 11,25 ммоль) в ацетонитриле (100 мл) перемешивали при 25°С в течение 4 часов. После завершения полученный в результате раствор разводили этилацетатом и промывали водой. Органический слой сушили над безводным сульфатом натрия и концентрировали в вакууме. Остаток очищали с помощью флэш-хроматографии на силикагеле с элюированием этилацетатом/петролейным эфиром (1/4) с получением 3-[6-[бис[(4-метоксифенил)метил]амино]-3-йодо-2-пиридил]-4-метил-циклогексанона (5,00 г, 8,76 ммоль, выход 77,9%) в виде желтого масла. ЖХМС (ИЭР, m/z): 571,5 [М+Н]+.
Этап 3: 3-[6-[бис[(4-метоксифенил)метил]амино]-3-(трифторметил)-2-пиридил]-4-метил-циклогексанон

В атмосфере азота в раствор 3-[6-[бис[(4-метоксифенил)метил]амино]-3-йодо-2-пиридил]-4-метил-циклогексанона (5,00 г, 8,76 ммоль) и метил 2,2-дифтор-2-(фторсульфонил)ацетата (10,10 г, 52,59 ммоль) в N,N-диметилформамиде (30 мл) добавляли йодид меди (1,67 г, 8,76 ммоль). Полученный в результате раствор перемешивали при 90°С в течение 5 часов. После завершения полученный в результате раствор разводили водой и экстрагировали этилацетатом. Потом органические слои объединяли, сушили над безводным сульфатом натрия и концентрировали в вакууме. Остаток очищали с помощью флэш-хроматографии на силикагеле с элюированием этилацетатом/петролейным эфиром (1/4) с получением 3-[6-[бис[(4-метоксифенил)метил]амино]-3-(трифторметил)-2-пиридил]-4-метил-циклогексанона (3,50 г, 6,83 ммоль, выход 77,9%) в виде желтого масла. ЖХМС (ИЭР, m/z): 513,6 [М+Н]+.
Этап 4: этил 4-[6-[бис[(4-метоксифенил)метил]амино]-3-(трифторметил)-2-пиридил]-5-метил-2-оксо-циклогексанкарбоксилат
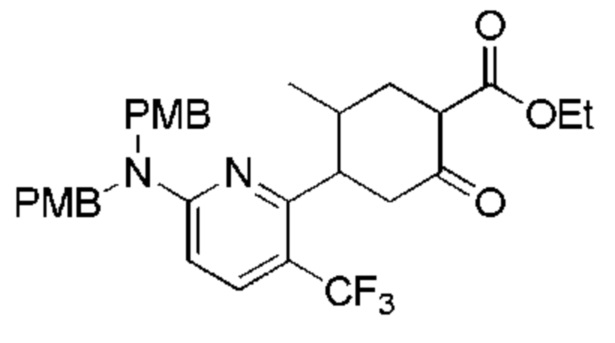
В атмосфере азота в раствор 3-[6-[бис[(4-метоксифенил)метил]амино]-3-(трифторметил)-2-пиридил]-4-метил-циклогексанона (2,00 г, 3,90 ммоль) в тетрагидрофуране (20 мл) добавляли LiHMDS (2,34 мл, 4,68 ммоль) (2Mb ТГФ) при -78°С. Полученный в результате раствор перемешивали 0,5 ч при -78°С. Потом добавляли этилцианоформиат (0,58 г, 5,85 ммоль) и перемешивали при -78°С в течение 3 часов. После завершения полученный в результате раствор разводили этилацетатом и промывали водой. Органический слой сушили над безводным сульфатом натрия и концентрировали в вакууме. Остаток очищали с помощью флэш-хроматографии на силикагеле с элюированием этилацетатом/петролейным эфиром (1/5) с получением этил 4-[6-[бис[(4-метоксифенил)метил]амино]-3-(трифторметил)-2-пиридил]-5-метил-2-оксо-циклогексанкарбоксилата (1,20 г, 2,05 ммоль, выход 52,6%) в виде желтого масла. ЖХМС (ИЭР, m/z): 585,6 [М+Н]+.
Этап 5: 7-[6-[бис[(4-метоксифенил)метил]амино]-3-(трифторметил)-2-пиридил]-6-метил-5,6,7,8-тетрагидро-3Н-хиназолин-4-он
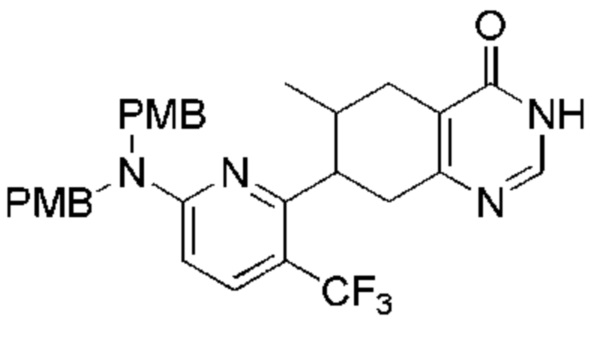
Раствор этил 4-[6-[бис[(4-метоксифенил)метил]амино]-3-(трифторметил)-2-пиридил]-5-метил-2-оксо-циклогексанкарбоксилата (1,50 г, 2,57 ммоль) и формамидинацетата (0,82 г, 15,39 ммоль) в этаноле (20 мл). Потом добавляли трет-бутоксид натрия (3,45 г, 30,79 ммоль) и перемешивали при 110°С в течение 3 часов. После завершения полученный в результате раствор разводили этилацетатом и промывали водой. Органический слой сушили над безводным сульфатом натрия и концентрировали в вакууме. Остаток очищали с помощью флэш-хроматографии на силикагеле с элюированием метанолом/дихлорметаном (1/9) с получением 7-[6-[бис[(4-метоксифенил)метил]амино]-3-(трифторметил)-2-пиридил]-6-метил-5,6,7,8-тетрагидро-3Н-хиназолин-4-она (1,10 г, 1,95 ммоль, выход 75,9%) в виде желтого масла. ЖХМС (ИЭР, m/z): 565,6 [М+Н]+.
Этап 6а: N,N-бис[(4-метоксифенил)метил]-6-(6-метил-4-пиперазин-1-ил-5,6,7,8-тетрагидрохиназолин-7-ил)-5-(трифторметил)пиридин-2-амин

Раствор 7-[6-[бис[(4-метоксифенил)метил]амино]-3-(трифторметил)-2-пиридил]-6-метил-5,6,7,8-тетрагидро-3Н-хиназолин-4-она (750,0 мг, 1,33 ммоль) и 1Н-бензотриазол-1-илокситрис(диметиламино)фосфонийгексафторфосфата (1,17 г, 2,66 ммоль) в хлороформе (30 мл) перемешивали при 25°С в течение 0,5 часа. Потом добавляли пиперазин (1,14 г, 13,28 ммоль) и перемешивали при 70°С в течение 9 часов. После завершения полученный в результате раствор разводили этилацетатом и промывали водой. Органический слой сушили над безводным сульфатом натрия и концентрировали в вакууме. Остаток очищали с помощью флэш-хроматографии на силикагеле с элюированием дихлорметаном/метанолом (9/1) с получением N,N-бис[(4-метоксифенил)метил]-6-(6-метил-4-пиперазин-1-ил-5,6,7,8-тетрагидрохиназолин-7-ил)-5-(трифторметил)пиридин-2-амина (600 мг, 0,95 ммоль, выход 71,4%) в виде желтого масла. ЖХМС: (ИЭР, m/z): 633,7 [М+Н]+.
Этап 6b: 1-[4-[7-[6-[бис[(4-метоксифенил)метил]амино]-3-(трифторметил)-2-пиридил]-6-метил-5,6,7,8-тетрагидрохиназолин-4-ил]пиперазин-1-ил]проп-2-ен-1-он

Раствор N,N-бис[(4-метоксифенил)метил]-6-(6-метил-4-пиперазин-1-ил-5,6,7,8-тетрагидрохиназолин-7-ил)-5-(трифторметил)пиридин-2-амина (300,0 мг, 0,47 ммоль) и N,N-диизопропилэтиламина (122,33 мг, 0,95 ммоль) в дихлорметане (6 мл) перемешивали при 25°С в течение 0,5 часа. Потом добавляли акрилоилхлорид (42,91 мг, 0,47 ммоль) и перемешивали при 25°С в течение 1 часа. После завершения полученный в результате раствор разводили этилацетатом и промывали водой. Органический слой сушили над безводным сульфатом натрия и концентрировали в вакууме. Остаток очищали с помощью флэш-хроматографии на силикагеле с элюированием дихлорметаном/метанолом (10/1) с получением 1-[4-[7-[6-[бис[(4-метоксифенил)метил]амино]-3-(трифторметил)-2-пиридил]-6-метил-5,6,7,8-тетрагидрохиназолин-4-ил]пиперазин-1-ил]проп-2-ен-1-она (150 мг, 0,22 ммоль, выход 46,1%) в виде желтого масла. ЖХМС: (ИЭР, m/z): 687,8 [М+Н]+
Этап 7: 1-(4-((6S,7S)-7-(6-амино-3-(трифторметил)пиридин-2-ил)-6-метил-5,6,7,8-тетрагидрохиназолин-4-ил)пиперазин-1-ил)проп-2-ен-1-он (Пример 42а); и 1-(4-((6R,7R)-7-(6-амино-3-(трифторметил)пиридин-2-ил)-6-метил-5,6,7,8-тетрагидрохиназолин-4-ил)пиперазин-1-ил)проп-2-ен-1-он (Пример 42b)

Раствор 1-[4-[7-[6-[бис[(4-метоксифенил)метил]амино]-3-(трифторметил)-2-пиридил]-6-метил-5,6,7,8-тетрагидрохиназолин-4-ил]пиперазин-1-ил]проп-2-ен-1-она (150,0 мг, 0,22 ммоль) и трифторуксусной кислоты (10 мл) перемешивали при 50°С в течение 3 часов. После завершения раствор гасили водой, разводили этилацетатом и промывали солевым раствором. Органический слой концентрировали в вакууме. Неочищенный продукт дополнительно выделяли с помощью препаративной ВЭЖХ со следующими условиями: колонка: CHIRALPAK IE, 2*25 см, 5 мкм; подвижная фаза А: МТБЭ (10 мМ NH3-MeOH) --ВЭЖХ, подвижная фаза В: МеОН -ВЭЖХ; скорость потока:: 20 мл/мин; градиент: от 15 В до 15 В за 27 мин; 220/254 нм; RT1: 17,672; RT2: 23,294. Продукт очищали с помощью хиральной препаративной ВЭЖХ со следующими условиями: (колонка CHIRAL ART Cellulose-SB, 2*25 см, 5 мкм; подвижная фаза, гексан --ВЭЖХ и этанол -ВЭЖХ (выдержка 40% этанол --ВЭЖХ за 10 мин); детектор, УФ 220/254 нм) с получением указанных в заголовке соединений. Абсолютная конфигурация указанных в заголовке соединений была определена по данным активности и рентгенограммы белковой структуры соединения 21b.
Пример 42а: 1-(4-((6S,7S)-7-(6-амино-3-(трифторметил)пиридин-2-ил)-6-метил-5,6,7,8-тетрагидрохиназолин-4-ил)пиперазин-1-ил)проп-2-ен-1-он (13 мг, 0,029 ммоль, выход 13,3%) в виде белого твердого вещества. 1Н ЯМР (400 МГц, метанол-d4) δ 8,48 (с, 1H), 7,65 (д, J=8,0 Гц, 1H), 6,83 (дд, J=16,0, 12,0 Гц, 1H), 6,46 (д, J=8,0 Гц, 1H), 6,30-6,25 (м, 1H), 5,82-5,79 (м, 1H), 3,93-3,88 (м, 2Н), 3,82-3,73 (м, 4Н), 3,58-3,54 (м, 2Н), 3,22-3,14 (м, 2Н), 3,04-2,95 (м, 1H), 2,80-2,75 (м, 1H), 2,65-2,58 (м, 1H), 2,25 (с, 1H), 0,89 (д, J=8,0 Гц, 3Н). ЖХМС: (ПЭР, m/z): 447,2 [М+Н]+. Хиральная ВЭЖХ: CHIRALPAK IE-3, 0,46*5 см, 3 мкм; обнаружение на 254 нм; (гексан : ДХМ = 3:1) (0,1% ДЭА) : EtOH=90:10; скорость потока = 1,0 мл/мин; время удержания: 4,577 мин (более медленный пик).
Пример 42b: 1-(4-((6R,7R)-7-(6-амино-3-(трифторметил)пиридин-2-ил)-6-метил-5,6,7,8-тетрагидрохиназолин-4-ил)пиперазин-1-ил)проп-2-ен-1-он (15 мг, 0,034 ммоль, выход 15,4%) в виде белого твердого вещества. 1Н ЯМР (400 МГц, метанол-d4) δ 8,46 (с, 1H), 7,65 (д, J=8,0 Гц, 1H), 6,87 (дд, J=16,0, 12,0 Гц, 1H), 6,46 (д, J=8,0 Гц, 1H), 6,30-6,25 (м, 1H), 5,82-5,79 (м, 1H), 3,93-3,88 (м, 2Н), 3,78-3,73 (м, 4Н), 3,49-3,41 (м, 2Н), 3,21-3,12 (м, 2Н), 3,04-2,95 (м, 1H), 2,80-2,75 (м, 1H), 2,65-2,58 (м, 1H), 2,26 (с, 1H), 0,90 (д, J=8,0 Гц, 3Н). ЖХМС: (ПЭР, m/z): 447,2 [М+Н]+. Хиральная ВЭЖХ: CHIRALPAK IE-3, 0,46*5 см, 3 мкм; обнаружение на 254 нм; (гексан : ДХМ = 3:1) (0,1% ДЭА) : EtOH = 90:10; скорость потока = 1,0 мл/мин; время удержания: 3,815 мин (более быстрый пик).
Пример 43
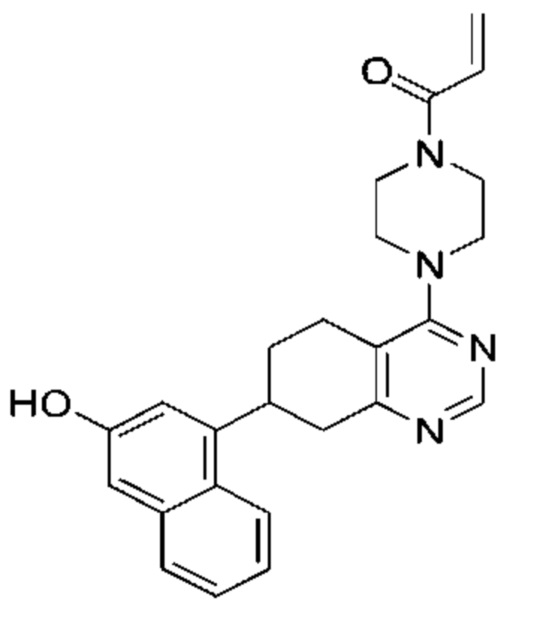
1-[4-[7-(3-гидрокси-1-нафтил)-5,6,7,8-тетрагидрохиназолин-4-ил]пиперазин-1-ил]проп-2-ен-1-он

Этап 1: 2-(3-метокси-1-нафтил)-4,4,5,5-тетраметил-1,3,2-диоксаборолан
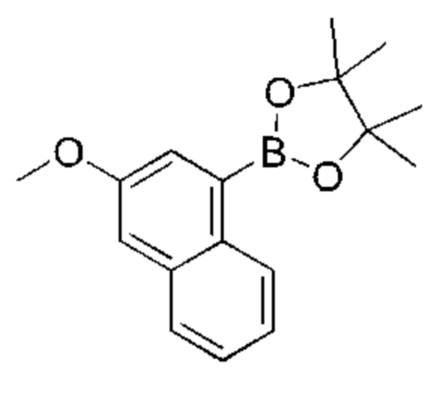
В атмосфере азота получали раствор 1-бром-3-метокси-нафталена (2,0 г, 8,44 ммоль), Pd(dppf)Cl2 (0,62 г, 0,84 ммоль), бис(пинаколато)дибора (6,43 г, 25,31 ммоль), ацетата калия (1,65 г, 16,87 ммоль) в 1,4-диоксане (20 мл). Полученный в результате раствор перемешивали при 100°С в течение 3 часов. После завершения раствор разводили водой и экстрагировали этилацетатом. Потом органические слои объединяли, сушили над безводным сульфатом натрия и концентрировали в вакууме. Остаток очищали с помощью флэш-хроматографии на силикагеле с элюированием петролейным эфиром/этилацетатом (10/1) с получением 2-(3-метокси-1-нафтил)-4,4,5,5-тетраметил-1,3,2-диоксаборолана (1,2 г, 4,2 ммоль, выход 50,1%) в виде желтого твердого вещества. ЖХМС (ИЭР, m/z): 285,2 [М+Н]+.
Этап 2: 3-(3-метокси-1-нафтил)циклогексанон

В атмосфере азота в раствор 2-(3-метокси-1-нафтил)-4,4,5,5-тетраметил-1,3,2-диоксаборолана (0,2 г, 0,70 ммоль) и 2-циклогексен-1-она (0,14 г, 1,41 ммоль), [Rh(CODCl)]2 (0,03 г, 0,07 ммоль), 1,1'-бинафтил-2,2'-дифенилфосфина (0,09 г, 0,14 ммоль) в 1,4-диоксане (4 мл), воде (1 мл) добавляли фосфат калия (0,3 г, 1,41 ммоль). Полученный в результате раствор перемешивали при 40°С в течение 0,5 часов. После завершения раствор разводили водой и экстрагировали этилацетатом. Потом органические слои объединяли, сушили над безводным сульфатом натрия и концентрировали в вакууме. Остаток очищали с помощью флэш-хроматографии на силикагеле с элюированием этилацетатом/петролейным эфиром (1/7) с получением 3-(3-метокси-1-нафтил)циклогексанона (130 мг, 0,51 ммоль, выход 72,6%) в виде желтого твердого вещества. ЖХМС (ИЭР, m/z): 255,3 [М+Н]+.
Этап 3: этил 4-(3-метокси-1-нафтил)-2-оксо-циклогексанкарбоксилат
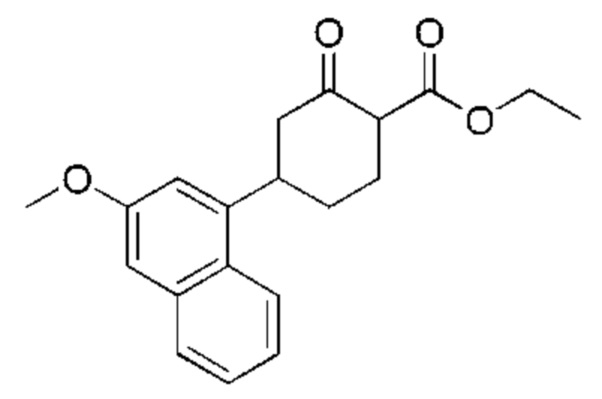
В атмосфере азота в раствор 3-(3-метокси-1-нафтил)циклогексанона (0,80 г, 3,15 ммоль) в тетрагидрофуране (20 мл) добавляли LiHMDS (3,77 мл, 3,77 ммоль) (1 M в ТГФ) при -78°С. Полученный в результате раствор перемешивали в течение 0,5 ч при -78°С.Потом добавляли этилцианоформиат (0,47 г, 4,72 ммоль) и перемешивали при -78°С в течение 3 часов. После завершения раствор разводили водой и экстрагировали этилацетатом. Потом органические слои объединяли, сушили над безводным сульфатом натрия и концентрировали в вакууме. Остаток очищали с помощью флэш-хроматографии на силикагеле с элюированием этилацетатом/петролейным эфиром (1/5) с получением этил 4-(3-метокси-1-нафтил)-2-оксо-циклогексанкарбоксилата (0,60 г, 1,84 ммоль, выход 58,4%) в виде желтого твердого вещества. ЖХМС (ИЭР, m/z): 327,4 [М+Н]+.
Этап 4: 7-(3-метокси-1-нафтил)-5,6,7,8-тетрагидро-3Н-хиназолин-4-он
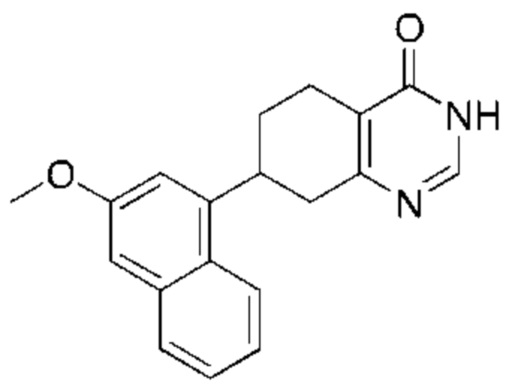
Раствор этил 4-(3-метокси-1-нафтил)-2-оксо-циклогексанкарбоксилата (0,60 г, 1,84 ммоль) и формамидинацетата (1,15 г, 11,03 ммоль) в метаноле (20 мл) перемешивали при 25°С. Потом добавляли метанолат натрия (0,99 г, 18,38 ммоль) и перемешивали при 25°С в течение 12 часов. После завершения раствор разводили водой и экстрагировали этилацетатом. Потом органические слои объединяли, сушили над безводным сульфатом натрия и концентрировали в вакууме. Остаток очищали с помощью флэш-хроматографии на силикагеле с элюированием дихлорметаном/метанолом (8/1) с получением 7-(3-метокси-1-нафтил)-5,6,7,8-тетрагидро-3Н-хиназолин-4-она (400 мг, 1,31 ммоль, выход 71%) в виде желтого твердого вещества. ЖХМС (ИЭР, m/z): 307,4 [М+Н]+.
Этап 5: 7-(3-метокси-1-нафтил)-4-пиперазин-1-ил-5,6,7,8-тетрагидрохиназолин

Раствор 7-(3-метокси-1-нафтил)-5,6,7,8-тетрагидро-3Н-хиназолин-4-она (0,40 г, 1,31 ммоль) и пиперазина (1,12 г, 13,06 ммоль) в хлороформе (20 мл). Потом добавляли 1Н-бензотриазол-1-илокситрис(диметиламино)фосфония гексафторфосфат (1,15 г, 2,61 ммоль) и перемешивали при 70°С в течение 9 часов. После завершения полученный в результате раствор концентрировали в вакууме. Остаток очищали с помощью флэш-хроматографии на силикагеле с элюированием дихлорметаном/метанолом (8/1) с получением 7-(3-метокси-1-нафтил)-4-пиперазин-1-ил-5,6,7,8-тетрагидрохиназолина (200 мг, 0,53 ммоль, выход 40,9%) в виде желтого твердого вещества. ЖХМС (ИЭР, m/z): 375,5 [М+Н]+.
Этап 6: 4-(4-пиперазин-1-ил-5,6,7,8-тетрагидрохиназолин-7-ил)нафтален-2-ол
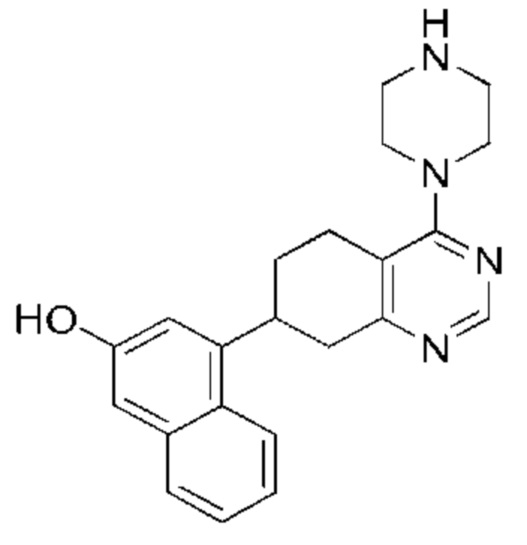
Раствор 7-(3-метокси-1-нафтил)-4-пиперазин-1-ил-5,6,7,8-тетрагидрохиназолина (0,5 г, 1,34 ммоль) и HBr-H2O (10 мл) (40% в H2O) в воде (10 мл) перемешивали при 50°С в течение 1 часа. После завершения раствор разводили водой и экстрагировали этилацетатом. Потом органические слои объединяли, сушили над безводным сульфатом натрия и концентрировали в вакууме. Остаток очищали с помощью флэш-хроматографии на силикагеле с элюированием дихлорметаном/метанолом (10/1) с получением 4-(4-пиперазин-1-ил-5,6,7,8-тетрагидрохиназолин-7-ил)нафтален-2-ола (0,20 г, 0,56 ммоль, выход 41,6%) в виде желтого масла. ЖХМС (ИЭР, m/z): 361,5 [М+Н]+.
Этап 7: 1-[4-[7-(3-гидрокси-1-нафтил)-5,6,7,8-тетрагидрохиназолин-4-ил]пиперазин-1-ил]проп-2-ен-1-он

Раствор 4-(4-пиперазин-1-ил-5,6,7,8-тетрагидрохиназолин-7-ил)нафтален-2-ола (0,10 г, 0,28 ммоль) и HATU (0,21 г, 0,55 ммоль), N,N-диизопропилэтиламина (0,14 г, 1,11 ммоль) в дихлорметане (5 мл) перемешивали при -78°С в течение 0,5 часа. Потом добавляли акриловую кислоту (0,03 г, 0,42 ммоль) и перемешивали при -78°С в течение 4 часов. После завершения раствор разводили водой и экстрагировали этилацетатом. Потом органические слои объединяли, сушили над безводным сульфатом натрия и концентрировали в вакууме. Неочищенный продукт дополнительно выделяли с помощью препаративной ВЭЖХ со следующими условиями: (колонка: Xbridge Shield RP18 OBD, 30*150 мм, 5 мкм; подвижная фаза А: вода (10 ммоль/л NH4HCO3), подвижная фаза В: АЦН; скорость потока: 60 мл/мин; градиент: от 26% В до 50% В за 7 мин; 220/254 нм; Rt: 6,53 мин) с получением 1-[4-[7-(3-гидрокси-1-нафтил)-5,6,7,8-тетрагидрохиназолин-4-ил]пиперазин-1-ил]проп-2-ен-1-она (3,2 мг, 0,0068 ммоль, выход 2,4%) в виде белого твердого вещества. ЖХМС (ИЭР, m/z): 415,2 [М+Н]+.
Пример 43: 1Н ЯМР (400 МГц, метанол-d4) δ 8,50 (с, 1H), 8,08 (д, J=8,0 Гц, 1H), 7,70 (д, J=8,0 Гц, 1H), 7,43-7,39 (м, 1H), 7,36-7,32 (м, 1H), 7,04-7,02 (м, 2Н), 6,86-6,80 (м, 1H), 6,27-6,24 (м, 1H), 5,80-5,75 (м, 1H), 4,06-3,99 (м, 1H), 3,92-3,86 (м, 2Н), 3,80-3,75 (м, 2Н), 3,68-3,63 (м, 2Н), 3,53-3,46(м, 2Н), 3,38-3,36(м, 1H), 3,05-2,90 (м, 2Н), 2,80-2,74 (м, 1H), 2,32-2,28 (м, 1H), 2,07-1,97 (м, 1H).
Примеры 44а и 44b

1-[4-[(7R)-7-(4-изохинолил)-5,6,7,8-тетрагидрохиназолин-4-ил]пиперазин-1-ил]проп-2-ен-1-он (Пример 44а); и
1-[4-[(7S)-7-(4-изохинолил)-5,6,7,8-тетрагидрохиназолин-4-ил]пиперазин-1-ил]проп-2-ен-1-он (Пример 44b)

Этап 1: 3-(4-изохинолил)циклогексанон

В атмосфере азота раствор изохинолин-4-бороновой кислоты (6,8 г, 39,3 ммоль), димера хлор(1,5-циклооктадиен)родия (I) (0,97 г, 1,96 ммоль) и 2-циклогексен-1-она (7,56 г, 78,6 ммоль) в 1,4-диоксане (62 мл) перемешивали при 25°С в течение 10 минут. Потом добавляли насыщенный раствор фосфата калия (5 мл, 39,3 ммоль) и перемешивали при 50°С в течение 24 часов. После завершения полученный в результате раствор концентрировали в вакууме. Остаток очищали с помощью флэш-хроматографии на силикагеле с элюированием дихлорметаном/метанолом (10/1) с получением 3-(4-изохинолил) циклогексанона (6,07 г, 26,94 ммоль, выход 68,6%) в виде коричневого масла. ЖХМС: (ИЭР, m/z): 226,0 [М+Н]+.
Этап 2: этил 4-(4-изохинолил)-2-оксо-циклогексанкарбоксилат
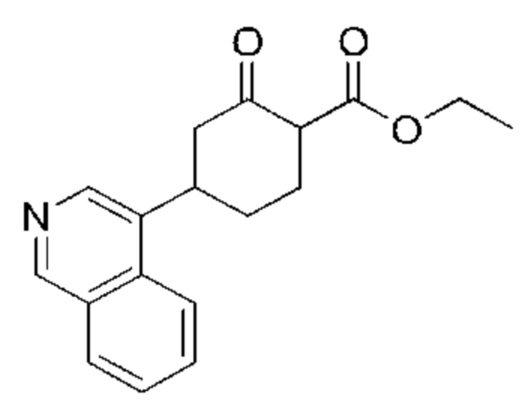
В атмосфере азота раствор 3-(4-изохинолил)циклогексанона (6,0 г, 26,6 ммоль) в тетрагидрофуране (40 мл) перемешивали при -78°С в течение 5 минут. По каплям добавляли бис(триметилсилил)амид лития (1,0 М в ТГФ) (40,4 мл, 40,4 ммоль) и перемешивали при -78°С в течение 10 минут. Потом добавляли этилцианоформиат (6,07 г, 61,25 ммоль) и перемешивали при -78°С в течение 20 минут. После завершения реакцию гасили водой, экстрагировали этилацетатом, сушили над безводным сульфатом натрия и концентрировали в вакууме с получением неочищенного продукта. Неочищенный продукт непосредственно использовали для следующего этапа без очистки. ЖХМС: (ИЭР, m/z): 298,1 [М+Н]+.
Этап 3: 7-(4-изохинолил)-5,6,7,8-тетрагидро-3Н-хиназолин-4-он

Раствор этил 4-(4-изохинолил)-2-оксо-циклогексанкарбоксилата (6,7 г, 22,53 ммоль) в метаноле (67 мл) перемешивали при 50°С в течение 10 минут. Потом добавляли метанолат натрия (12,17 г, 225,32 ммоль) и формамидинацетат (14,08 г, 135,19 ммоль) и перемешивали при 50°С в течение 30 часов. После завершения полученный в результате раствор концентрировали в вакууме. Остаток растворяли этилацетатом и промывали солевым раствором. Органический слой сушили над безводным сульфатом натрия и концентрировали в вакууме. Остаток очищали с помощью флэш-хроматографии на силикагеле с элюированием дихлорметаном/метанолом (5/1) с получением 7-(4-изохинолил)-5,6,7,8-тетрагидро-3Н-хиназолин-4-она (1,8 г, 6,49 ммоль, выход 28,8%) в виде коричневого масла. ЖХМС: (ИЭР, m/z): 278,1 [М+Н]+.
Этап 4: 7-(4-изохинолил)-4-пиперазин-1-ил-5,6,7,8-тетрагидрохиназолин
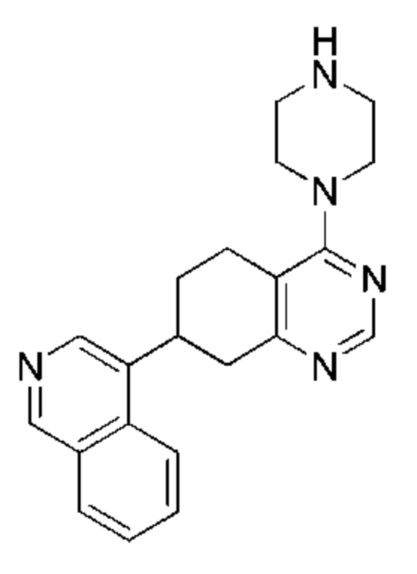
Раствор 7-(4-изохинолил)-5,6,7,8-тетрагидро-3Н-хиназолин-4-она (1,0 г, 3,61 ммоль), пиперазина (3,11 г, 36,06 ммоль) и ДБУ (1,65 г, 10,82 ммоль) в хлороформе (100 мл) перемешивали при 25°С в течение 5 минут. Потом добавляли ВОР (1,59 г, 3,61 ммоль) и перемешивали при 70°С в течение 2 часов. После завершения полученный в результате раствор концентрировали в вакууме. Остаток очищали с помощью флэш-хроматографии на силикагеле с элюированием водой/ацетонитрилом (4:1) с получением 7-(4-изохинолил)-4-пиперазин-1-ил-5,6,7,8-тетрагидрохиназолина (250 мг, 0,72 ммоль, выход 20,1%) в виде коричневого масла. ЖХМС: (ИЭР, m/z): 346,2 [М+Н]+.
Этап 5: 1-[4-[(7R)-7-(4-изохинолил)-5,6,7,8-тетрагидрохиназолин-4-ил]пиперазин-1-ил]проп-2-ен-1-он (Пример 44а); и 1-[4-[(7S)-7-(4-изохинолил)-5,6,7,8-тетрагидрохиназолин-4-ил]пиперазин-1-ил]проп-2-ен-1-он (Пример 44b)
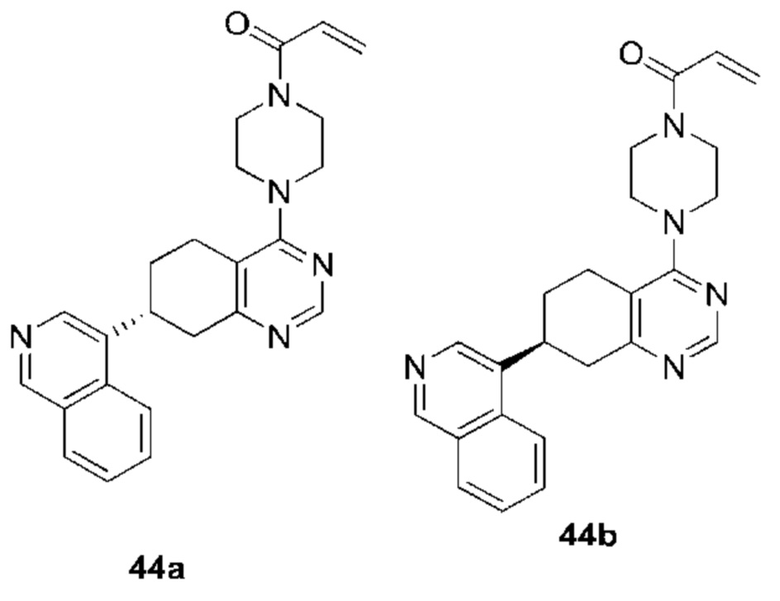
Раствор 7-(4-изохинолил)-4-пиперазин-1-ил-5,6,7,8-тетрагидрохиназолина (145,0 мг, 0,42 ммоль) и N,N-диизопропилэтиламина (271,2 мг, 2,1 ммоль) в дихлорметане (5 мл) перемешивали при 25°С в течение 10 минут. Потом добавляли акрилоилхлорид (37,9 мг, 0,42 ммоль) и перемешивали при 25°С в течение 30 минут. Полученный в результате раствор концентрировали в вакууме. Остаток очищали с помощью флэш-хроматографии на силикагеле с элюированием водой/ацетонитрилом (3:1) с получением 35 мг неочищенного твердого вещества. Продукт дополнительно очищали с помощью хиральной препаративной ВЭЖХ со следующими условиями: (колонка CHIRAL ART Cellulose-SB, 4,6*100 мм, 3 мкм; подвижная фаза: подвижная фаза А: (гексан : ДХМ = 1:1) (0,1% ДЭА) : EtOH=50:50, подвижная фаза В: скорость потока: 1 мл/мин; детектор, УФ 254 нм) с получением указанных в заголовке соединений. Стереохимия или абсолютная конфигурация указанных в заголовке соединений были приписаны на основании активности.
Пример 44а: 1-[4-[(7R)-7-(4-изохинолил)-5,6,7,8-тетрагидрохиназолин-4-ил]пиперазин-1-ил]проп-2-ен-1-он (10,4 мг, 0,02 ммоль, выход 6,2%, белое твердое вещество). 1Н ЯМР (300 МГц, ДМСО-d6, м.д.) δ 9,22 (с, 1H), 8,54 (с, 1H), 8,48 (с, 1H), 8,31 (д, J=9 Гц, 1H), 8,19 (д, J=9 Гц, 1H), 7,88-7,83 (м, 1H), 7,75-7,70 (м, 1H), 6,90-6,80 (м, 1H), 6,16 (дд, J=16,2, 2,4 Гц, 1H), 5,73 (дд, J=10,5, 2,4 Гц, 1H), 3,95-3,90 (м, 1H), 3,78-3,55 (м, 4Н), 3,54-3,49 (м, 3Н), 3,34-3,18 (м, 2Н), 3,05-2,95 (м, 2Н), 2,70-2,52 (м, 1H), 2,19 (м, 1H), 2,10-1,90 (м, 1H). ЖХМС: (ИЭР, m/z): 400,3 [М+Н]+. Хиральная ВЭЖХ: колонка: CHIRAL ART Cellulose-SB, 4,6*100 мм, 3 мкм; обнаружение на 254 нм; (гексан : ДХМ = 1:1) (0,1% ДЭА) : EtOH = 50:50; скорость потока = 1 мл/мин; время удержания: 1,596 мин (более быстрый пик).
Пример 44b: 1-[4-[(7S)-7-(4-изохинолил)-5,6,7,8-тетрагидрохиназолин-4-ил]пиперазин-1-ил]проп-2-ен-1-он (10 мг, 0,02 ммоль, выход 6%, белое твердое вещество). 1H ЯМР (300 МГц, ДМСО-d6, м.д.) δ 9,56 (с, 1H), 8,78 (с, 1H), 8,55 (с, 1H), 8,47-8,39 (м, 2Н), 8,11-8,06 (м, 1H), 7,94-7,89 (м, 1H), 6,89-6,80 (м, 1H), 6,18 (дд, J=16,8, 2,1 Гц, 1H), 5,76 (дд, J=10,2, 2,1 Гц, 1H), 4,09-3,91 (м, 3Н), 3,82-3,79 (м, 2Н), 3,69-3,62 (м, 2Н), 3,57-3,22 (м, 2Н), 3,18-3,08 (м, 3Н), 2,78-2,73 (д, J=15 Гц, 1H), 2,25-2,21 (м, 1H), 2,07-2,03 (м, 1H). ЖХМС: (ИЭР, m/z): 400,3 [М+Н]+. Хиральная ВЭЖХ: колонка: CHIRAL ART Cellulose-SB, 4,6*100 мм, 3 мкм; обнаружение на 254 нм; (гексан : ДХМ = 1:1) (0,1% ДЭА) : EtOH = 50:50; скорость потока = 1 мл/мин; время удержания: 2,431 мин (более медленный пик).
Пример 45а
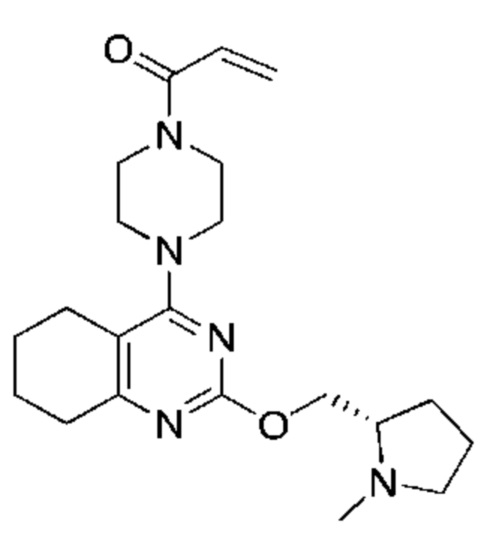
1-[4-[2-[[(2S)-1-метилпирролидин-2-ил]метокси]-5,6,7,8-тетрагидрохиназолин-4-ил]пиперазин-1-ил]проп-2-ен-1-он

Этап 1: 2-метилсульфанил-5,6,7,8-тетрагидро-3Н-хиназолин-4-он
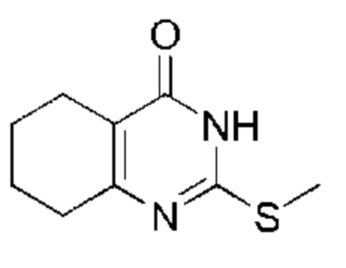
Раствор этил 2-циклогексанонкарбоксилата (5,0 г, 29,3 ммоль), метил-2-тиопсевдомочевины сульфата (55,3 г, 293,7 ммоль) и бикарбоната натрия (49,4 г, 587,5 ммоль) в воде (10 мл) и этаноле (50 мл) перемешивали в течение 2 часов при 50°С. После завершения полученный в результате раствор концентрировали в вакууме. Остаток растворяли этилацетатом и промывали солевым раствором. Органический слой сушили над безводным сульфатом натрия и концентрировали в вакууме. Остаток очищали с помощью флэш-хроматографии на силикагеле с элюированием дихлорметаном/метанолом (10/1) с получением 2-метилсульфанил-5,6,7,8-тетрагидро-3Н-хиназолин-4-она (5,1 г, выход 88,5%) в виде оранжевого твердого вещества. ЖХМС: (ИЭР, m/z): 197,1 [М+Н]+
Этап 2: трет-бутил 4-(2-метилсульфанил-5,6,7,8-тетрагидрохиназолин-4-ил)пиперазин-1-карбоксилат
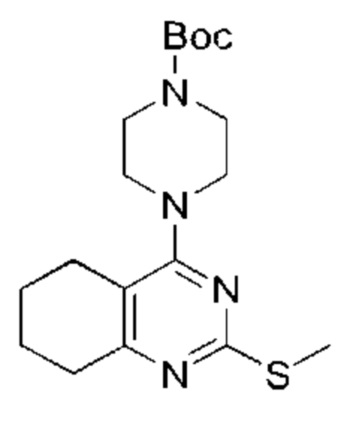
Раствор 2-метилсульфанил-5,6,7,8-тетрагидро-3Н-хиназолин-4-она (2,6 г, 13,25 ммоль) в дихлорметане (26 мл) перемешивали при 25°С в течение 5 минут. Потом добавляли N,N-диизопропилэтиламин (5,14 г, 39,74 ммоль) и трифторметансульфоновый ангидрид (6,73 г, 23,84 ммоль) и перемешивали при 25°С в течение 2 часов. После завершения реакцию концентрировали при пониженном давлении. Потом остаток, трет-бутил 1-пиперазинкарбоксилат (12,2 г, 65,48 ммоль) и N,N-диизопропилэтиламин (5,08 г, 39,29 ммоль) в 1,4-диоксане (695 мл) перемешивали при 80°С в течение 2 часов. После завершения полученный в результате раствор концентрировали в вакууме. Остаток очищали с помощью флэш-хроматографии на силикагеле с элюированием дихлорметаном/метанолом (10/1) с получением трет-бутил 4-(2-метилсульфанил-5,6,7,8-тетрагидрохиназолин-4-ил)пиперазин-1-карбоксилата (2,5 г, 6,85 ммоль, выход 52,4%) в виде белого твердого вещества. ЖХМС: (ИЭР, m/z): 365,4 [М+Н]+
Этап 3: трет-бутил 4-(2-метилсульфонил-5,6,7,8-тетрагидрохиназолин-4-ил)пиперазин-1-карбоксилат
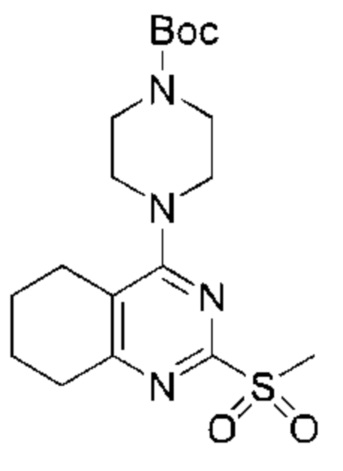
Раствор трет-бутил 4-(2-метилсульфанил-5,6,7,8-тетрагидрохиназолин-4-ил)пиперазин-1-карбоксилата (2,0 г, 5,49 ммоль) и пероксимоносульфата калия (10,12 г, 16,46 ммоль) в тетрагидрофуране (20 мл) и воде (10 мл) перемешивали при комнатной температуре в течение 3 часов. После завершения реакцию гасили насыщенным раствором сульфита натрия, экстрагировали этилацетатом, сушили над безводным сульфатом натрия и концентрировали в вакууме с получением неочищенного продукта. Неочищенный продукт непосредственно использовали для следующего этапа без очистки. ЖХМС: (ИЭР, m/z): 397,4 [М+Н]+
Этап 4: трет-бутил 4-[2-[[(2S)-1-метилпирролидин-2-ил]метокси]-5,6,7,8-тетрагидрохиназолин-4-ил]пиперазин-1-карбоксилат

Раствор гидрида натрия (0,68 г, 28,25 ммоль, 60% дисперсия в минеральном масле) и N-метил-1-пролинола (1,86 г, 16,14 ммоль) в 1,4-диоксане (16 мл) перемешивали при 0°С в течение 10 минут. Потом добавляли трет-бутил 4-(2-метилсульфонил-5,6,7,8-тетрагидрохиназолин-4-ил)пиперазин-1-карбоксилат (1,6 г, 4,04 ммоль) и перемешивали при комнатной температуре в течение 30 минут. После завершения реакцию гасили насыщенным раствором хлорида аммония и экстрагировали дихлорметаном. Потом органические слои собирали, сушили над безводным сульфатом натрия и концентрировали в вакууме. Остаток очищали с помощью флэш-хроматографии на силикагеле с элюированием ацетонитрилом/водой (1/5) с получением трет-бутил 4-[2-[[(2S)-1-метилпирролидин-2-ил]метокси]-5,6,7,8-тетрагидрохиназолин-4-ил]пиперазин-1-карбоксилата (1,4 г, 3,24 ммоль, выход 80,4%) в виде желтого твердого вещества. ЖХМС: (ИЭР, m/z): 432,3 [М+Н]+
Этап 5: (S)-2-((1-метилпирролидин-2-ил)метокси)-4-(пиперазин-1-ил)-5,6,7,8-тетрагидрохиназолин

Раствор трет-бутил 4-[2-[[(2S)-1-метилпирролидин-2-ил]метокси]-5,6,7,8-тетрагидрохиназолин-4-ил]пиперазин-1-карбоксилата (1,4 г, 3,244 ммоль) в трифторуксусной кислоте (6,4 г, 56,11 ммоль) перемешивали при 40°С в течение 2 часов. Полученный в результате раствор концентрировали в вакууме. Остаток очищали с помощью флэш-хроматографии на силикагеле с элюированием ацетонитрилом/водой (1:4) с получением (S)-2-((1-метилпирролидин-2-ил)метокси)-4-(пиперазин-1-ил)-5,6,7,8-тетрагидрохиназолина (0,6 г, 1,81 ммоль, выход 56,1%) в виде желтого твердого вещества. ЖХМС: (ИЭР, m/z): 332,2 [М+Н]+
Этап 6: 1-[4-[2-[[(2S)-1-метилпирролидин-2-ил]метокси]-5,6,7,8-тетрагидрохиназолин-4-ил]пиперазин-1-ил]проп-2-ен-1-он

Раствор (S)-2-((1-метилпирролидин-2-ил)метокси)-4-(пиперазин-1-ил)-5,6,7,8- тетрагидрохиназолина (0,6 г, 1,81 ммоль) в дихлорметане (10 мл) перемешивали при - 78°С в течение 5 мин. Потом добавляли акрилоилхлорид (0,2 г, 2,2 ммоль) и перемешивали при -78°С в течение 10 минут. После завершения полученный в результате раствор концентрировали в вакууме. Остаток очищали с помощью флэш-хроматографии на силикагеле с элюированием дихлорметаном/метанолом (10/1) с получением 1-[4-[2-[[(2S)-1-метилпирролидин-2-ил]метокси]-5,6,7,8-тетрагидрохиназолин-4-ил]пиперазин-1-ил]проп-2-ен-1-она (60 мг, 0,16 ммоль, выход 8,8%) в виде белого твердого вещества.
Пример 45а: 1Н ЯМР (300 МГц, ДМСО-d6, м.д.) δ 6,83 (дд, J=16,7, 10,4 Гц, 1H), 6,14 (дд, J=16,7, 2,4 Гц, 1H), 5,80-5,63 (м, 1H), 4,51-4,33 (м, 2Н), 3,77-3,54 (м, 5Н), 3,35 (с, 7Н), 2,96-2,81 (м, 1H), 2,75 (с, 3Н), 2,65 (м, 2Н), 2,22-2,07 (м, 1H), 2,01-1,84 (м, 2Н), 1,82-1,69 (м, 3Н), 1,67-1,55 (м, 2Н). ЖХМС: (ИЭР, m/z): 386,3 [М+Н]+.
Примеры 46а и 46b

(R)-1-(4-(7-(6-амино-3-(трифторметил)пиридин-2-ил)-5,6,7,8-тетрагидрохиназолин-4-ил)пиперазин-1-ил)проп-2-ен-1-он (Пример 46а); и
(S)-1-(4-(7-(6-амино-3-(трифторметил)пиридин-2-ил)-5,6,7,8-тетрагидрохиназолин-4-ил)пиперазин-1-ил)проп-2-ен-1-он (Пример 46b)

Этап 1: 6-хлор-N,N-бис[(4-метоксифенил)метил]-5-(трифторметил)пиридин-2-амин
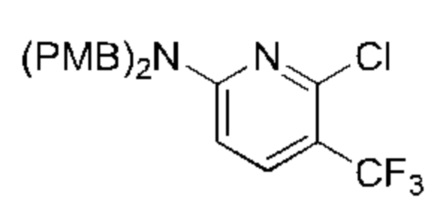
В раствор 6-хлор-5-(трифторметил)пиридин-2-амина (18,0 г, 91,58 ммоль) и t-BuOK (30,77 г, 274,73 ммоль) в ДМФ (200 мл) добавляли 4-метоксибензилхлорид (71,43 г, 457,88 ммоль) при 25°С и перемешивали при 25°С в течение 1 часа. После завершения реакционную смесь разводили водой и экстрагировали этилацетатом. Органические слои объединяли и концентрировали в вакууме. Остаток очищали с помощью флэш-хроматографии на силикагеле с элюированием петролейным эфиром/этилацетатом (17%) с получением 22 г (55%) 6-хлор-N,N-бис[(4-метоксифенил)метил]-5-(трифторметил)пиридин-2-амина в виде желтого твердого вещества. ЖХМС: (ИЭР, m/z): 437,1 [М+Н]+.
Этап 2: 3-[6-[бис[(4-метоксифенил)метил]амино]-3-(трифторметил)-2-пиридил]циклогекс-2-ен-1-он
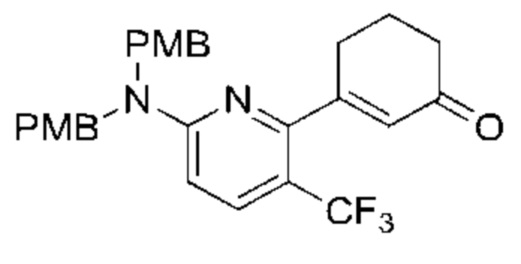
В атмосфере азота раствор 6-хлор-N,N-бис[(4-метоксифенил)метил]-5- (трифторметил)пиридин-2-амина (8,07 г, 18,47 ммоль), 3-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)циклогекс-2-ен-1-она (6,15 г, 27,71 ммоль), бис(трифенилфосфин)палладия (II) хлорида (1,3 г, 1,85 ммоль), фторида калия (2,14 г, 36,95 ммоль) и воды (54 мл) в ацетонитриле (270 мл) перемешивали при 110°С в течение 12 часов. После завершения полученный в результате раствор концентрировали в вакууме. Остаток очищали с помощью флэш-хроматографии на силикагеле с элюированием петролейным эфиром/этилацетатом (17%) с получением 4,2 г (45,8%) 3-[6-[бис[(4-метоксифенил)метил]амино]-3-(трифторметил)-2-пиридил]циклогекс-2-ен-1-она в виде белого твердого вещества. ЖХМС: (ИЭР, m/z): 497,2 [М+Н]+.
Этап 3: этил 4-[6-[бис[(4-метоксифенил)метил]амино]-3-(трифторметил)-2-пиридил]-2-оксо-циклогекс-3-ен-1-карбоксилат
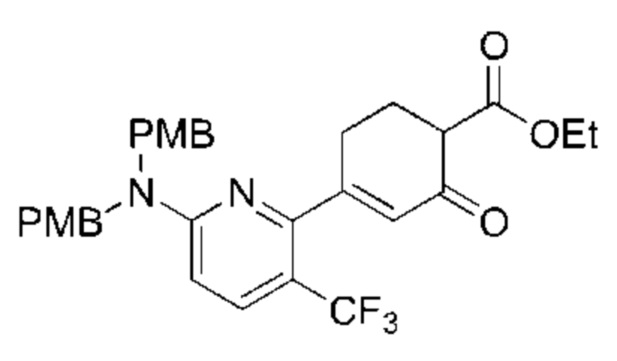
Раствор 3-[6-[бис[(4-метоксифенил)метил]амино]-3-(трифторметил)-2-пиридил]циклогекс-2-ен-1-она (8,1 г, 16,31 ммоль) и бис(триметилсилил)амида лития (32,63 мл, 32,63 ммоль) в тетрагидрофуране (80 мл) перемешивали при -78°С в течение 1 часа. Потом добавляли этилцианоформиат (4,04 г, 40,78 ммоль) и перемешивали при -78°С в течение 2 часов. После завершения полученный в результате раствор концентрировали в вакууме. Остаток очищали с помощью флэш-хроматографии на силикагеле с элюированием петролейным эфиром/этилацетатом (20%) с получением 7,2 г (77,6%) этил 4-[6-[бис[(4-метоксифенил)метил]амино]-3-(трифторметил)-2-пиридил]-2-оксо-циклогекс-3-ен-1-карбоксилата в виде желтого масла. ЖХМС: (ИЭР, m/z): 569,2 [М+Н]+.
Этап 4: этил 4-[6-[бис[(4-метоксифенил)метил]амино]-3-(трифторметил)-2-пиридил]-2-оксо-циклогексанкарбоксилат

В атмосфере водорода, раствор этил 4-[6-[бис[(4-метоксифенил)метил]амино]-3-(трифторметил)-2-пиридил]-2-оксо-циклогекс-3-ен-1-карбоксилата (7,2 г, 12,66 ммоль) и Pd/C (12,663 ммоль) в этилацетате (23 мл) перемешивали в течение 12 часов при 25°С. После завершения раствор фильтровали, а фильтрат концентрировали при пониженном давлении. Остаток очищали с помощью флэш-хроматографии на силикагеле с элюированием петролейным эфиром/этилацетатом (20%) с получением 6,29 г (87,1%) этил 4-[6-[бис[(4-метоксифенил)метил]амино]-3-(трифторметил)-2-пиридил]-2-оксо-циклогексанкарбоксилата в виде желтого масла. ЖХМС: (ИЭР, m/z): 571,3 [М+Н]+.
Этап 5: 7-[6-[бис[(4-метоксифенил)метил]амино]-3-(трифторметил)-2-пиридил]-5,6,7,8-тетрагидро-3Н-хиназолин-4-он

Раствор этил 4-[6-[бис[(4-метоксифенил)метил]амино]-3-(трифторметил)-2-пиридил]-2-оксо-циклогексанкарбоксилата (6,29 г, 11,4 ммоль), формамидинацетата (11,37 г, 109,32 ммоль) и трет-бутоксид калия (15,92 г, 142,12 ммоль) в этаноле (100 мл) перемешивали при 120°С в течение 2 часов. После завершения полученный в результате раствор концентрировали в вакууме. Остаток очищали с помощью флэш-хроматографии на силикагеле с элюированием дихлорметаном/метанолом (5%) с получением 2,9 г (48,2%) 7-[6-[бис[(4-метоксифенил)метил]амино]-3-(трифторметил)-2-пиридил]-5,6,7,8-тетрагидро-3Н-хиназолин-4-она в виде черного твердого вещества. ЖХМС: (ИЭР, m/z): 551,2 [М+Н]+.
Этап 6: N,N-бис[(4-метоксифенил)метил]-6-(4-пиперазин-1-ил-5,6,7,8-тетрагидрохиназолин-7-ил)-5-(трифторметил)пиридин-2-амин

Раствор 7-[6-[бис[(4-метоксифенил)метил]амино]-3-(трифторметил)-2-пиридил]-5,6,7,8-тетрагидро-3Н-хиназолин-4-она (1,5 г, 2,72 ммоль), пиперазина (0,7 г, 8,17 ммоль), бензотриазол-1-илокситрис(диметиламино)-фосфония гексафторфосфата (1,57 г, 3,54 ммоль) и 1,8-диазабицикло[5.4.0]ундец-7-ена (1,24 г, 8,17 ммоль) в хлороформе (25 мл) перемешивали при 70°С в течение 24 часов. После завершения растворитель разводили водой и экстрагировали дихлорметаном. Органические слои объединяли и концентрировали в вакууме. Неочищенный продукт непосредственно используют на следующем этапе без очистки. ЖХМС: (ИЭР, m/z): 619,3 [М+Н]+.
Этап 7: 1-[4-[7-[6-[бис[(4-метоксифенил)метил]амино]-3-(трифторметил)-2-пиридил]-5,6,7,8-тетрагидрохиназолин-4-ил]пиперазин-1-ил]проп-2-ен-1-он

Раствор N,N-бис[(4-метоксифенил)метил]-6-(4-пиперазин-1-ил-5,6,7,8-тетрагидрохиназолин-7-ил)-5-(трифторметил)пиридин-2-амина (1,75 г, 2,83 ммоль) и N,N-диизопропилэтиламина (1,82 г, 14,14 ммоль) в дихлорметане (30 мл) перемешивали при 0°С в течение 5 минут. Потом добавляли акрилоилхлорид (0,23 г, 2,55 ммоль) при 0°С и перемешивали при 25°С в течение 2 часов. После завершения полученный в результате раствор концентрировали в вакууме. Остаток очищали с помощью обращенно-фазовой хроматографии с получением 0,97 г (51%) 1-[4-[7-[6-[бис[(4-метоксифенил)метил]амино]-3-(трифторметил)-2-пиридил]-5,6,7,8-тетрагидрохиназолин-4-ил]пиперазин-1-ил]проп-2-ен-1-она в виде светло-желтого твердого вещества. ЖХМС: (ИЭР, m/z): 673,3 [М+Н]+.
Этап 8: (R)-1-(4-(7-(6-амино-3-(трифторметил)пиридин-2-ил)-5,6,7,8-тетрагидрохиназолин-4-ил)пиперазин-1-ил)проп-2-ен-1-он (Пример 46а) и (S)-1-(4-(7-(6-амино-3-(трифторметил)пиридин-2-ил)-5,6,7,8-тетрагидрохиназолин-4-ил)пиперазин-1-ил)проп-2-ен-1-он (Пример 46b)

Раствор 1-[4-[7-[6-[бис[(4-метоксифенил)метил]амино]-3-(трифторметил)-2-пиридил]-5,6,7,8-тетрагидрохиназолин-4-ил]пиперазин-1-ил]проп-2-ен-1-она (950,0 мг, 1,41 ммоль) в трифторуксусной кислоте (70 мл, 1,41 ммоль) перемешивали при 50°С в течение 8 часов. После завершения полученный в результате раствор концентрировали в вакууме. Остаток очищали с помощью обращенно-фазовой хроматографии непосредственно со следующими условиями: колонка С18, силикагель; подвижная фаза А: вода, В: MeCN, В % (5% ~ 70% за 30 мин); детектор, УФ 254 нм, с получением 380 мг неочищенного продукта в виде белого твердого вещества. Продукт дополнительно очищали с помощью хиральной препаративной ВЭЖХ со следующими условиями (колонка CHIRALPAK ID-3, 4,6*50 мм, 3 мкм; подвижная фаза: гексан (0,1% ДЭА) : ИПА = 50:50; детектор, 254 нм; скорость потока 1,0 мл/мин; температура: 25°С, 220/254 нм) с получением указанных в заголовке соединений. Стереохимия или абсолютная конфигурация указанных в заголовке соединений были приписаны на основании активности.
Пример 46а: (R)-1-(4-(7-(6-амино-3-(трифторметил)пиридин-2-ил)-5,6,7,8-тетрагидрохиназолин-4-ил)пиперазин-1-ил)проп-2-ен-1-он (115,6 мг, выход 18,9%, белое твердое вещество). 1Н ЯМР (400 МГц, ДМСО-d6, м.д.) δ 8,47 (с, 1H), 7,61 (д, J=8,0 Гц, 1H), 6,85-6,79 (м, 1H), 6,63 (с, 2Н), 6,38 (д, J=8,0 Гц, 1H), 6,14 (дд, J=16,8, 2,4 Гц, 1H), 5,71 (дд, J=8,0, 2,4 Гц, 1H), 3,73-3,70 (м, 2Н), 3,61-3,60 (м, 2Н), 3,52-3,47 (м, 2Н), 3,27-3,17 (м, 4Н), 2,85-2,79 (м, 2Н), 2,77-2,60 (м, 1H), 1,96-1,93 (м, 1H), 1,79-1,68 (м, 1H). ЖХМС: (ИЭР, m/z): 433,2 [М+Н]+. Хиральная ВЭЖХ: колонка: CHIRALPAK ID-3, 4,6*50 мм; 3 мкм; обнаружение на 254 нм; гексан (0,1% ДЭА)/ИПА = 50:50; скорость потока: 1 мл/мин; время удержания: 1,597 мин (более быстрый пик).
Пример 46b: (S)-1-(4-(7-(6-амино-3-(трифторметил)пиридин-2-ил)-5,6,7,8-тетрагидрохиназолин-4-ил)пиперазин-1-ил)проп-2-ен-1-он (131,7 мг, выход 21,6%, белое твердое вещество). 1Н ЯМР (400 МГц, ДМСО-d6, м.д.) δ 8,47 (с, 1H), 7,61 (д, J=8,0 Гц, 1H), 6,86-6,79 (м, 1H), 6,63 (с, 2Н), 6,38 (д, J=8,0 Гц, 1H), 6,14 (дд, J=16,8, 2,4 Гц, 1H), 5,71 (дд, J=8,0, 2,4 Гц, 1H), 3,74-3,70 (м, 2Н), 3,61-3,60 (м, 2Н), 3,52-3,47 (м, 2Н), 3,27-3,20 (м, 4Н), 2,85-2,79 (м, 2Н), 2,64-2,60 (м, 1H), 1,96-1,91 (м, 1H), 1,79-1,68 (м, 1H). ЖХМС: (ИЭР, m/z): 433,2 [М+Н]+. Хиральная ВЭЖХ: колонка: CHIRALPAK ID-3, 4,6*50 мм; 3 мкм; обнаружение на 254 нм; гексан (0,1% ДЭА)/ИПА = 50:50; скорость потока: 1 мл/мин; время удержания: 2,452 мин (более медленный пик).
Примеры 47а, 47b, 47с и 47d
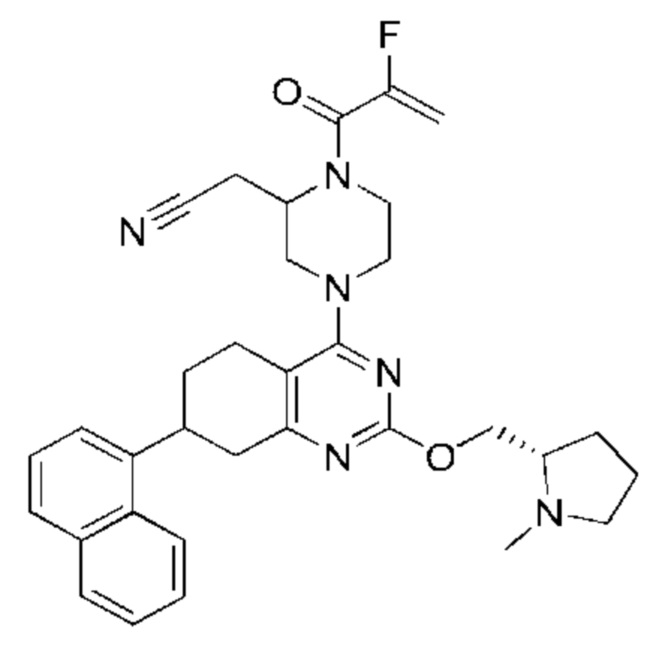
2-[1-(2-фторпроп-2-еноил)-4-[2-[[(2S)-1-метилпирролидин-2-ил]метокси]-7-(1-нафтил)-5,6,7,8-тетрагидрохиназолин-4-ил]пиперазин-2-ил]ацетонитрил
(Смесь четырех соединений, разделенных хСФХ)

Этап 1: 3-(1-нафтил)циклогекс-2-ен-1-он

В 200 мл КДК добавляли 1-нафтилмагния бромид (50,00 мл, 25,0 ммоль, 50,00 мл). Смесь охлаждали до -78°С и добавляли 3-этокси-2-циклогексен-1-он (1 экв., 25,0 ммоль, 3500 мг, 3,51 мл). Реакцию перемешивали в течение 45 минут при -78°С и нагревали до комнатной температуры. Реакцию гасили 1 Н HCl (60 мл), вливали смесь в разделительную воронку и разделяли слои. Водный слой экстрагировали изопропилацетатом (10 мл). Органические слои объединяли, концентрировали и хроматографировали силикагелем, используя смеси изопропилацетата/гептана, с получением 3,5 г необходимого продукта в виде прозрачного масла. Данные 1Н ЯМР совпадали с известными из литературы значениями (Tetrahedron, 65,, 2009, 489). 1Н ЯМР (400 МГц, хлороформ-d) δ 7,95-7,76 (м, 3Н), 7,55-7,44 (м, 3Н), 7,32 (дд, J=7,1, 1,2 Гц, 1H), 6,21 (д, J=1,6 Гц, 1H), 2,77 (тд, J=6,0, 1,6 Гц, 2Н), 2,60 (т, J=6,7 Гц, 2Н), 2,26 (р, J=6,3 Гц, 2Н).
Этап 2: Этил 4-(1-нафтил)-2-оксо-циклогекс-3-ен-1-карбоксилат
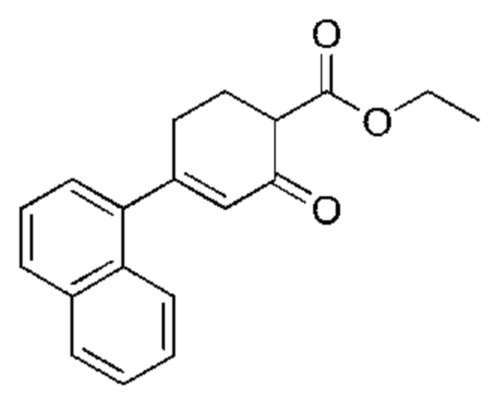
В раствор 3-(1-нафтил)циклогекс-2-ен-1-она (5,1 г, 22,9 ммоль) в сухом ТГФ (100 мл), охлажденный в бане с сухим льдом и ацетоном, добавляли гексаметилдисилазид лития (45,9 мл, 1 М), а полученную в результате смесь перемешивали в течение 1 часа. В нее добавляли чистый этилцианоформиат (3,40 мл, 34,4 ммоль) и перемешивали смесь в течение 0,5 часа. Баню из сухого льда убирали, а реакционную смесь гасили насыщенным раствором хлорида аммония и оставляли нагреваться до комнатной температуры. Реакционную смесь разводили изопропилацетатом (ИПАЦ) и отделяли органический слой. Органический слой промывали солевым раствором, сушили над сульфатом натрия, концентрировали, а остаток очищали с помощью флэш-хроматографии (силикагель, 0-30% IPAC/гептан) с получением этил 4-(1-нафтил)-2-оксо-циклогекс-3-ен-1-карбоксилата (6,50 г, 96%): 1Н ЯМР (400 МГц, хлороформ-d) δ 7,96-7,78 (м, 3Н), 7,59-7,41 (м, 3Н), 7,37-7,30 (м, 1H), 6,31-6,18 (м, 1H), 4,41-4,16 (м, 2Н), 3,57 (дд, J=9,4, 5,0 Гц, 1H), 3,00-2,75 (м, 2Н), 2,67-2,58 (м, 1H), 2,49-2,39 (м, 1H), 1,34 (т, J=7,1 Гц, 3Н); ЖХ/МС (ИЭР): m+Н=295,0.
Этап 3: Этил 4-(1-нафтил)-2-оксо-циклогексанкарбоксилат

Смесь этил 4-(1-нафтил)-2-оксо-циклогекс-3-ен-1-карбоксилата (6,50 г, 22,1 ммоль) в этаноле (100 мл) и 10% Pd-C (0,65 г) восстанавливали путем продувки водородом и откачки, а потом оставляли перемешиваться в атмосфере баллонного водорода в течение ночи. Реакционную смесь фильтровали через целит и промывали ДХМ. Объединенный фильтрат концентрировали и очищали с помощью флэш-хроматографии (силикагель, 0-20% IPAC/гептан) с получением этил 4-(1-нафтил)-2-оксо-циклогексанкарбоксилата (1,85 г, 28%) в виде масла: 1Н ЯМР (400 МГц, хлороформ-d) δ 12,30 (д, J=1,1 Гц, 1H), 8,08 (д, J=8,3 Гц, 1H), 7,87 (д, J=8,0 Гц, 1H), 7,75 (д, J=8,1 Гц, 1H), 7,55-7,35 (м, 4Н), 4,39-4,07 (м, 2Н), 4,00-3,52 (м, 1H), 2,94-1,74 (м, 6Н), 1,33 (т, J=7,1, 3Н); ЖХ/МС (ИЭР): m+Н=297,0.
Этап 4: 2-метилсульфанил-7-(1-нафтил)-5,6,7,8-тетрагидро-3Н-хиназолин-4-он
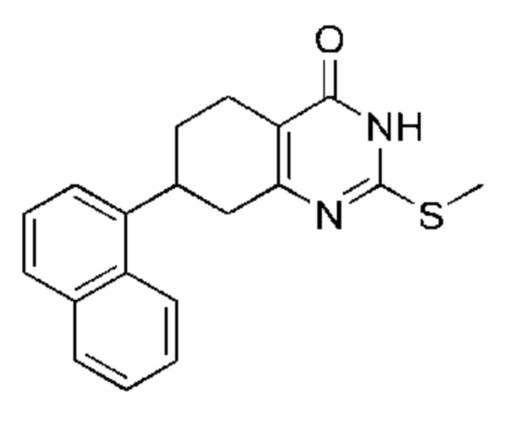
В смесь этил 4-(1-нафтил)-2-оксо-циклогексанкарбоксилата (1,50 г, 5,1 ммоль) и 2-метил-2-тиопсевдомочевины сульфата (4,31 г, 15,2 ммоль) в этаноле (25 мл) добавляли насыщенный раствор бикарбоната натрия (25 мл) и нагревали смесь при 50°С в течение 4 часов, реакционную смесь охлаждали, а твердое вещество удаляли путем фильтрации. Фильтрат обрабатывали насыщенным раствором хлорида аммония и экстрагировали ИПАЦ. Органический слой промывали солевым раствором, сушили над безводным сульфатом натрия и концентрировали. Остаток объединяли с вышеуказанным твердым веществом и очищали с помощью флэш-хроматографии (силикагель, 0-5% МеОН/ДХМ) с получением 2-метилсульфанил-7-(1-нафтил)-5,6,7,8-тетрагидро-3Н-хиназолин-4-она (0,35 г, выход 21,5%): 1Н ЯМР (400 МГц, ДМСО-d6) δ 12,28 (с, 1H), 8,20 (д, J=8,1 Гц, 1H), 7,94 (дд, J=7,6, 1,9 Гц, 1H), 7,81 (д, J=7,9 Гц, 1H), 7,61-7,42 (м, 4Н), 3,83 (д, J=12,9 Гц, 1H), 2,83 (кд, J=18,0, 7,7 Гц, 2Н), 2,52 (с, 2Н), 2,45 (с, 3Н), 2,09 (д, J=12,8 Гц, 1H), 1,97-1,82 (м, Ш); ЖХ/МС (ИЭР): m+Н=323,0.
Этап 5: трет-бутил 2-(цианометил)-4-[2-метилсульфанил-7-(1-нафтил)-5,6,7,8-тетрагидрохиназолин-4-ил]пиперазин-1-карбоксилат

2-метилсульфанил-7-(1-нафтил)-5,6,7,8-тетрагидро-3Н-хиназолин-4-он (0,35 г, 1,1 ммоль) растворяли в дихлорметане (5 мл) и добавляли ДИПЭА (0,70 мл 4,0 ммоль). В эту смесь добавляли трифторметансульфоновый ангидрид (0,28 мл; 1,63 ммоль) и перемешивали смесь в течение 0,5 часа. Реакционную смесь концентрировали и очищали с помощью флэш-хроматографии с получением трифлата (0,45 г, 91%); ЖХ/МС (ИЭР): m+Н=455,0.
В вышеуказанный трифлат в диметилацетамиде (3 мл) добавляли (±)2-пиперазин-2-илацетонитрила дигидрохлорид (0,29 г, 1,48 ммоль) и ДИПЭА (0,7 мл, 4,0 ммоль) и нагревали смесь при 85°С в течение 1 часа, а потом охлаждали до комнатной темрературы и добавляли ди-трет-бутил дикарбонат (0,65 г, 3,0 ммоль) и N,N-диметиламинопиридин (12 мг, 10%) и перемешивали при комнатной температуре в течение 2 часов. Реакционную смесь разводили ИПАЦ, промывали водой, солевым раствором, сушили над сульфатом натрия и концентрировали. Остаток очищали с помощью флэш-хроматографии (силикагель, 0-100% ИПАЦ/гептан) с получением трет-бутил 2-(цианометил)-4-[2-метилсульфанил-7-(1-нафтил)-5,6,7,8-тетрагидрохиназолин-4-ил]пиперазин-1-карбоксилата (0,35 г, 66%): ЖХ/МС (ИЭР): m+Н=530,3.
Этап 6: трет-бутил 2-(цианометил)-4-[2-метилсульфонил-7-(1-нафтил)-5,6,7,8-тетрагидрохиназолин-4-ил]пиперазин-1-карбоксилат

м-хлорпероксибензойную кислоту (0,46 г, 2,1 ммоль) добавляли в ледяной раствор трет-бутил 2-(цианометил)-4-[2-метилсульфанил-7-(1-нафтил)-5,6,7,8-тетрагидрохиназолин-4-ил]пиперазин-1-карбоксилата (0,50 г, 0,94 ммоль) в ТГФ (30 мл) и перемешивали в течение 2 часов. Потом реакционную смесь гасили раствором бисульфита натрия и экстрагировали ИПАЦ. Органический слой промывали солевым раствором, сушили над безводным сульфатом натрия и концентрировали. Остаток очищали с помощью флэш-хроматографии (силикагель, 20-100% IPAC/гептан) с получением трет-бутил 2-(цианометил)-4-[2-метилсульфонил-7-(1-нафтил)-5,6,7,8 -тетрагидрохиназолин-4-ил]пиперазин-1-карбоксилата (0,50 г, 94%): ЖХ/МС (ИЭР): m+Н=562,3.
Этап 7: трет-бутил 2-(цианометил)-4-[2-[[(2S)-1-метилпирролидин-2-ил]метокси]-7-(1-нафтил)-5,6,7,8-тетрагидрохиназолин-4-ил]пиперазин-1-карбоксилат
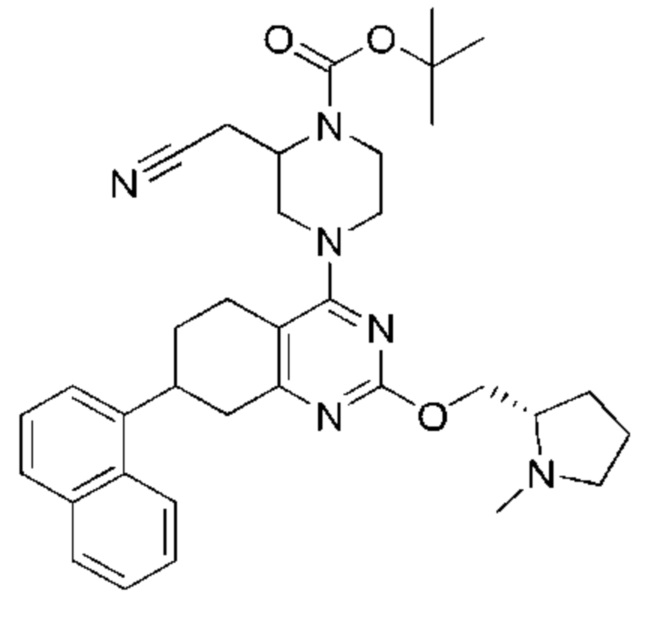
В раствор [(2S)-1-метилпирролидин-2-ил] метанола (0,21 г, 1,78 ммоль) в ТГФ (5 мл) добавляли гексаметилдисилазид калия (2,2 мл 1 М раствор) и перемешивали смесь в течение 10 минут, а потом охлаждали в ледяной бане. В эту смесь добавляли раствор вышеуказанного трет-бутил 2-(цианометил)-4-[2-метилсульфонил-7-(1-нафтил)-5,6,7,8-тетрагидрохиназолин-4-ил]пиперазин-1-карбоксилата в ТГФ (5 мл), а полученную в результате смесь перемешивали в течение 3 часов, гасили водой и экстрагировали IPAC. Органический слой промывали солевым раствором, сушили над безводным сульфатом натрия и концентрировали. Остаток очищали с помощью колоночной хроматографии (силикагель, 0-10% МеОН-ДХМ) с получением трет-бутил 2-(цианометил)-4-[2-[[(2S)-1-метилпирролидин-2-ил]метокси]-7-(1-нафтил)-5,6,7,8-тетрагидрохиназолин-4-ил]пиперазин-1-карбоксилата (0,34 г, 64%): ЖХ/МС (ИЭР): m+Н=597,4.
Этап 8: 2-[1-(2-фторпроп-2-еноил)-4-[2-[[(2S)-1-метилпирролидин-2-ил]метокси]-7-(1-нафтил)-5,6,7,8-тетрагидрохиназолин-4-ил]пиперазин-2-ил]ацетонитрил

трет-бутил 2-(цианометил)-4-[2-[[(2S)-1-метилпирролидин-2-ил]метокси]-7-(1-нафтил)-5,6,7,8-тетрагидрохиназолин-4-ил]пиперазин-1-карбоксилат (0,35 мг, 0,57 ммоль) растворяли в 10% ТФА/ГФИП и перемешивали в течение 2 часов. В смесь добавляли дополнительное количество ТФА (0,5 мл) и перемешивали в течение 0,5 часа, а потом концентрировали с толуолом. Остаток выпаривали вместе с толуолом еще два раза. Остаток растворяли в ИПАЦ и перемешивали над небольшим количеством бикарбоната натрия, а органический слой отделяли, сушили над сульфатом натрия и концентрировали. Очищали с помощью флэш-хроматографии: 0-10% аммиачный метанол-ДХМ с получением 2-(4-(2-(((S)-1-метилпирролидин-2-ил)метокси)-7-(нафтален-1-ил)-5,6,7,8-тетрагидрохиназолин-4-ил)пиперазин-2-ил)ацетонитрила (0,16 г); ЖХ/МС (ИЭР): m+Н=497,4.
В ледяной раствор вышеуказанного соединения в ДМФ (3 мл) добавляли 2-фторакрилат натрия (0,08 г, 0,7 ммоль); HATU (0,27 г, 1,42 ммоль) и ДИПЭА (0,25 мл, 1,4 ммоль), а смесь перемешивали в течение 10 минут и оставляли нагреваться до комнатной температуры, и перемешивали в течение 1 часа. Реакционную смесь разводили ДХМ и промывали водой. Органический слой отделяли, промывали солевым раствором, сушили над сульфатом натрия и концентрировали. Остаток очищали с помощью оВЭЖХ, а диастереомеры разделяли с помощью хСФХ (колонка: Chiralpak-ID; подвижная фаза: EtOH масс./0,1% NH4OH) с получением смеси четырех соединений (47а, 47b 47с, 4d). Данные для наиболее активного изомера (47d): 1Н ЯМР (400 МГц, ДМСО-d6) δ 8,24 (д, J=8,0 Гц, 1H), 7,96 (дд, J=7,5, 2,1 Гц, 1H), 7,86-7,75 (м, 1H), 7,60-7,52 (м, 2Н), 7,48 (дд, J=7,2, 5,7 Гц, 2Н), 5,39 (дд, J=18,0, 4,1 Гц, 1H), 5,28 (дд, J=49,8, 4,1 Гц, 1H), 4,27 (дд, J=10,9, 4,9 Гц, 1H), 4,07 (с, 1H), 3,96 (д, J=13,5 Гц, 3Н), 3,85 (д, J=13,7 Гц, 1H), 3,42-3,35 (м, 1H), 3,21 (дд, J=13,3, 3,6 Гц, 2Н), 3,10 (дд, J=18,3, 5,2 Гц, 2Н), 3,01-2,63 (м, 7Н), 2,35 (д, J=13,4 Гц, 3Н), 2,16 (д, J=12,9 Гц, 2Н), 1,90 (тд, J=11,9, 4,4 Гц, 2Н), 1,78-1,53 (м, 3Н); ЖХ/МС (ИЭР): m+Н=569,3.
Пример 48а
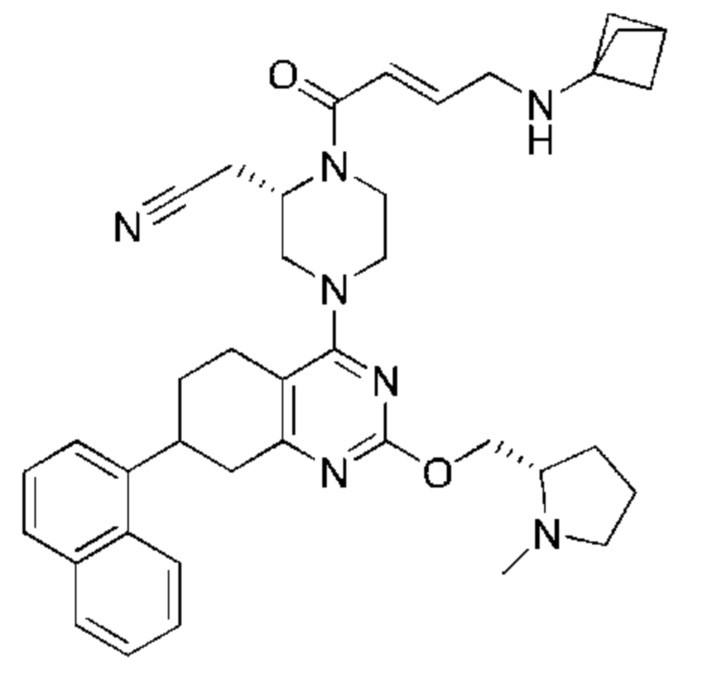
2-((2S)-1-((Е)-4-(бицикло[1.1.1]пентан-1-иламино)бут-2-еноил)-4-(2-(((S)-1-метилпирролидин-2-ил)метокси)-7-(нафтален-1-ил)-5,6,7,8-тетрагидрохиназолин-4-ил)пиперазин-2-ил)ацетонитрил

Этап 1: 2-((2S)-1-((Е)-4-хлорбут-2-еноил)-4-(2-(((S)-1-метилпирролидин-2-ил)метокси)-7-(нафтален-1-ил)-5,6,7,8-тетрагидрохиназолин-4-ил)пиперазин-2-ил)ацетонитрил

трет-бутил 2-(цианометил)-4-(2-(((S)-1-метилпирролидин-2-ил)метокси)-7-(нафтален-1-ил)-5,6,7,8-тетрагидрохиназолин-4-ил)пиперазин-1-карбоксилат (40 мг) в виде одного изомера (пример 47) растворяли в ДХМ, обработанном HCl-диоксаном (1 мл, 4 М), а смесь перемешивали в течение 2 часов и потом концентрировали. Полученный в результате остаток обрабатывали (Е)-4-хлорбут-2-еновой кислотой (18 мг, 0,13 ммоль), HATU (52 мг, 0,13 ммоль) и ДИПЭА (0,05 мл) в ДХМ в ледяной бане в течение 1 часа. Реакционную смесь разводили водой и ДХМ, органический слой отделяли, промывали солевым раствором, сушили над сульфатом натрия и концентрировали, а остаток очищали с помощью флэш-хроматографии (силикагель, 0-5% МеОН/ДХМ) с получением 2-((2S)-1-((Е)-4-хлорбут-2-еноил)-4-(2-(((S)-1-метилпирролидин-2-ил)метокси)-7-(нафтален-1-ил)-5,6,7,8-тетрагидрохиназолин-4-ил)пиперазин-2-ил)ацетонитрила (20 мг): ЖХ/МС (ИЭР): m+Н=599,3.
Этап 2: 2-((2S)-1-((Е)-4-(бицикло[1.1.1]пентан-1-иламино)бут-2-еноил)-4-(2-(((S)-1-метилпирролидин-2-ил)метокси)-7-(нафтален-1-ил)-5,6,7,8-тетрагидрохиназолин-4-ил)пиперазин-2-ил)ацетонитрил (Пример 48а)
Вышеуказанное соединение (10 мг) растворяли в ДМА (0,5 мл) и добавляли бицикло[1.1.1]пентан-1-амин:HCl, ДИПЭА (4,2 мг, 0,03 ммоль), йодид натрия (4,7 мг, 0,03 ммоль) и ДИПЭА (4,0 мг, 0,03 ммоль) и нагревали смесь при 50°С в течение ночи. Реакционную смесь охлаждали, разводили ИПАЦ, промывали водой, солевым раствором, сушили над сульфатом натрия и концентрировали. Остаток очищали с помощью флэш-хроматографии (силикагель, 0-10% МеОН/ДХМ) с получением указанного в заголовке соединения (3,2 мг, 30%): 1Н ЯМР (400 МГц, ДМСО-d6) δ 8,24 (д, J=8,3 Гц, 1H), 8,02-7,87 (м, 1H), 7,82 (д, J=7,8 Гц, 1H), 7,62-7,43 (м, 4Н), 6,76 (дт, J=15,1, 4,9 Гц, 1H), 6,71-6,54 (м, 1H), 4,86 (д, J=91,1 Гц, 1H), 4,25 (дд, J=10,8, 4,8 Гц, 1H), 4,14-3,71 (м, 5Н), 3,26-3,04 (м, 4Н), 3,04-2,80 (м, 6Н), 2,83-2,62 (м, 2Н), 2,33 (д, J=3,2 Гц, 5Н), 2,16 (к, J=8,5 Гц, 2Н), 1,99-1,83 (м, 2Н), 1,77 (с, 1H), 1,75-1,52 (м, 9Н). ЖХ/МС (ИЭР): m+Н=646,4.
Пример 49а
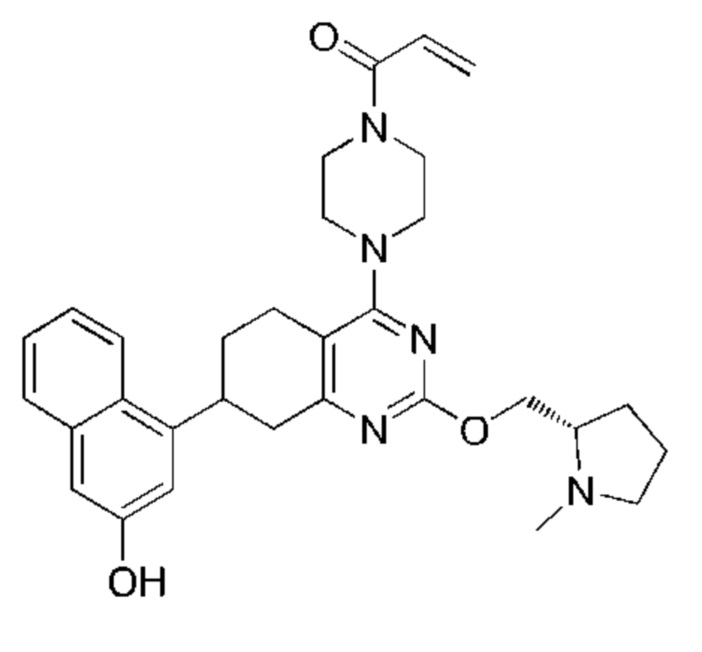
1-[4-[7-(3-гидрокси-1-нафтил)-2-[[(2S)-1-метилпирролидин-2-ил]метокси]-5,6,7,8-тетрагидрохиназолин-4-ил]пиперазин-1-ил]проп-2-ен-1-он
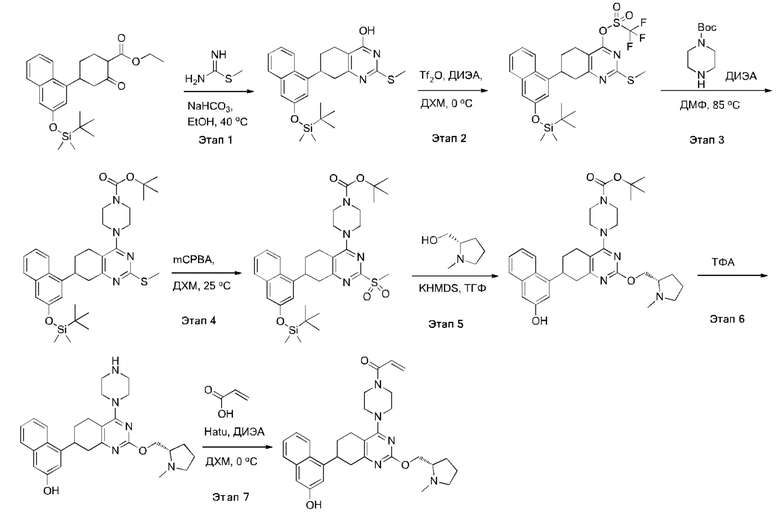
Этап 1: 7-(3-((трет-бутилдиметилсилил)окси)нафтален-1-ил)-2-(метилтио)-5,6,7,8-тетрагидрохиназолин-4-ол

Этил 4-[3-[трет-бутил(диметил)силил]окси-1-нафтил]-2-оксо-циклогексанкарбоксилат изначально получали, используя процедуру, аналогичную этапу 3 примера 43, при этом метиловый эфир в ней заменяли трет-бутил(диметил)силилэфиром. Потом в раствор раствор этил 4-[3-[трет-бутил(диметил)силил]окси-1-нафтил]-2-оксо-циклогексанкарбоксилата (530 мг, 1,24 ммоль) и 2-метил-2-тиопсевдомочевины сульфата (1,06 г, 3,73 ммоль) в этаноле (24,00 мл) добавляли насыщенный раствор бикарбоната натрия (12,00 мл). Реакционную смесь перемешивали при 40°С в течение 12 часов. Реакцию гасили насыщ. NH4Cl, потом экстрагировали EtOAc. Органические слои сушили сульфатом натрия, фильтровали и концентрировали с помощью роторного вакуумного испарителя. Неочищенный продукт очищали с помощью флэш-хроматографии на силикагеле (элюирование iPrOAc/Hep) с получением 7-(3-((трет-бутилдиметилсилил)окси)нафтален-1-ил)-2-(метилтио)-5,6,7,8-тетрагидрохиназолин-4-ола (355 мг, 63%). ЖХМС (ИЭР, m/z): 453,1 [М+Н]+.
Этап 2: 7-(3-((трет-бутилдиметилсилил)окси)нафтален-1-ил)-2-(метилтио)-5,6,7,8-тетрагидрохиназолин-4-ил трифторметансульфонат

В раствор 7-[3-[трет-бутил(диметил)силил]окси-1-нафтил]-2-метилсульфанил-5,6,7,8-тетрагидрохиназолин-4-ола (450 мг, 1,00 ммоль) в дихлорметане (50 мл) при 0°С добавляли N,N-диизопропилэтиламин (0,520 мл, 3,00 ммоль) и трифторметансульфоновый ангидрид (1 М) в метиленхлориде (1,20 мл, 1,20 ммоль). Реакционную смесь перемешивали при 0°С в течение 20 минут. Реакцию концентрировали, а неочищенный продукт использовали без очистки. ЖХМС (ИЭР, m/z): 558,0 [М+Н]+.
Этап 3: трет-бутил 4-(7-(3-((трет-бутилдиметилсилил)окси)нафтален-1-ил)-2-(метилтио)-5,6,7,8-тетрагидрохиназолин-4-ил)пиперазин-1-карбоксилат
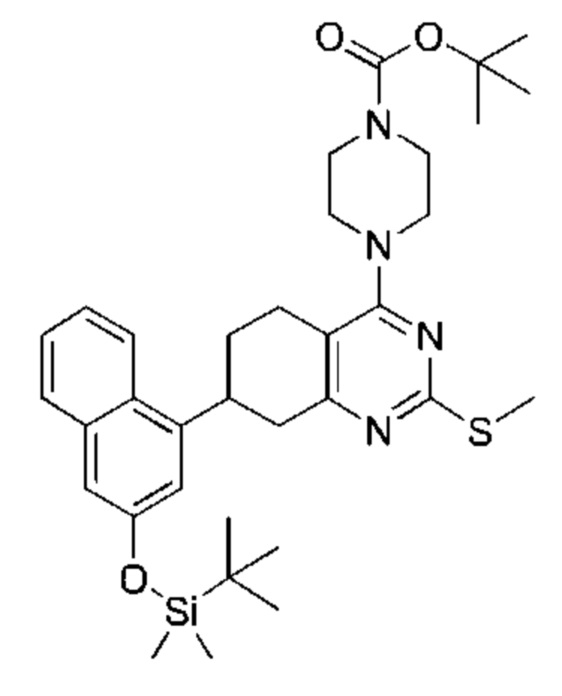
В раствор 7-(3-((трет-бутилдиметилсилил)окси)нафтален-1-ил)-2-(метилтио)-5,6,7,8-тетрагидрохиназолин-4-ил трифторметансульфоната (90 мг, 0,15 ммоль) в N,N-диметилформамиде (1,5 мл) добавляли N,N-диизопропилэтиламин (0,100 мл, 0,60 ммоль) и 1-boc-пиперазин (64,0 мг, 0,34 ммоль). Реакционную смесь перемешивали при 85°С в течение 2 часов. Реакцию гасили водой и экстрагировали EtOAc. Органические слои сушили сульфатом натрия, фильтровали и концентрировали с помощью роторного вакуумного испарителя. Неочищенный продукт очищали с помощью флэш-хроматографии на силикагеле (элюирование iPrOAc/Hep) с получением трет-бутил 4-(7-(3-((трет-бутилдиметилсилил)окси)нафтален-1-ил)-2-(метилтио)-5,6,7,8-тетрагидрохиназолин-4-ил)пиперазин-1-карбоксилата (62 мг, 65%). ЖХМС (ИЭР, m/z): 621,3 [М+Н]+.
Этап 4: трет-бутил 4-(7-(3-((трет-бутилдиметилсилил)окси)нафтален-1-ил)-2-(метилсульфонил)-5,6,7,8-тетрагидрохиназолин-4-ил)пиперазин-1-карбоксилат

В раствор трет-бутил 4-[7-[3-[трет-бутил(диметил)силил]окси-1-нафтил]-2-метилсульфанил-5,6,7,8-тетрагидрохиназолин-4-ил]пиперазин-1-карбоксилата (125 мг, 0,201 ммоль) в дихлорметане (4,00 мл) добавляли 3-хлорпероксибензойную кислоту (113 мг, 0,503 ммоль). Реакцию перемешивали при к. т. в течение 2 часов, потом гасили раствором NaHSO3 (5 мл). Реакционную смесь разводили ДХМ (10 мл) и промывали водой (10 мл). Органические слои сушили сульфатом натрия, фильтровали и концентрировали с помощью роторного вакуумного испарителя. Неочищенный продукт очищали с помощью флэш-хроматографии на силикагеле (элюирование iPrOAc/Hep) с получением трет-бутил 4-(7-(3-((трет-бутилдиметилсилил)окси)нафтален-1-ил)-2-(метилсульфонил)-5,6,7,8-тетрагидрохиназолин-4-ил)пиперазин-1-карбоксилата (85 мг, 65%). ЖХМС (ИЭР, m/z): 653,2 [М+Н]+.
Этап 5: трет-бутил 4-(7-(3-гидроксинафтален-1-ил)-2-(((S)-1-метилпирролидин-2-ил)метокси)-5,6,7,8-тетрагидрохиназолин-4-ил)пиперазин-1-карбоксилат

В раствор [(2S)-1-метилпирролидин-2-ил]метанола (37 мг, 0,31 ммоль) в тетрагидрофуране (1,5 мл) добавляли бис(триметилсилил)амид калия (0,9 М) в тетрагидрофуране (0,34 мл, 0,34 ммоль) при комнатной температуре. Реакцию охлаждали до 0°С, потом добавляли раствор трет-бутил 4-(7-(3-((трет-бутилдиметилсилил)окси)нафтален-1-ил)-2-(метилсульфонил)-5,6,7,8-тетрагидрохиназолин-4-ил)пиперазин-1-карбоксилата (100 мг, 0,15 ммоль) в ТГФ (2 мл). Реакцию оставляли потихоньку нагреваться до комнатной температуры в течение 18 часов. Реакционную смесь гасили водой и экстрагировали EtOAc. Органические слои сушили сульфатом натрия, фильтровали и концентрировали с помощью роторного вакуумного испарителя. Неочищенный продукт очищали с помощью флэш-хроматографии на силикагеле (элюирование МеОН/ДхМ) с получением трет-бутил 4-(7-(3-гидроксинафтален-1-ил)-2-(((S)-1-метилпирролидин-2-ил)метокси)-5,6,7,8-тетрагидрохиназолин-4-ил)пиперазин-1-карбоксилата (44 мг, 50%). ЖХМС (ИЭР, m/z): 574,3 [М+Н]+.
Этап 6: 4-(2-(((S)-1-метилпирролидин-2-ил)метокси)-4-(пиперазин-1-ил)-5,6,7,8-тетрагидрохиназолин-7-ил)нафтален-2-ол

Раствор трет-бутил 4-(7-(3-гидроксинафтален-1-ил)-2-(((S)-1-метилпирролидин-2-ил)метокси)-5,6,7,8-тетрагидрохиназолин-4-ил)пиперазин-1-карбоксилата (132 мг, 0,230 ммоль) в 5% трифторуксусной кислоте в гексафтор-2-пропаноле (3,5 мл, 2,30 ммоль) перемешивали при к. т. в течение 60 минут. Реакцию концентрировали, а неочищенный продукт очищали с помощью флэш-хроматографии на силикагеле (элюирование МеОН/ДХМ) с получением 4-(2-(((S)-1-метилпирролидин-2-ил)метокси)-4-(пиперазин-1-ил)-5,6,7,8-тетрагидрохиназолин-7-ил)нафтален-2-ола (70 мг, 64%). ЖХМС (ИЭР, m/z): 474,2 [М+Н]+.
Этап 7: 1-[4-[7-(3-гидрокси-1-нафтил)-2-[[(2S)-1-метилпирролидин-2-ил]метокси]-5,6,7,8-тетрагидрохиназолин-4-ил]пиперазин-1-ил]проп-2-ен-1-он

В раствор 4-(2-(((S)-1-метилпирролидин-2-ил)метокси)-4-(пиперазин-1-ил)-5,6,7,8-тетрагидрохиназолин-7-ил)нафтален-2-ола (А, 70 мг, 0,15 ммоль) и N,N-диизопропилэтиламина (0,13 мл, 0,74 ммоль) в дихлорметане (1,5 мл) добавляли акриловую кислоту (0,012 мл, 0,161 ммоль) и HATU (86,0 мг, 0,222 ммоль) при -78°С, потом реакционную смесь нагревали и перемешивали при 0°С в течение 15 минут. Реакцию гасили водой и экстрагировали EtOAc. Органические слои сушили сульфатом натрия, фильтровали и концентрировали с помощью роторного вакуумного испарителя. Неочищенный продукт подвергали обращенно-фазовой ВЭЖХ с получением 1-[4-[7-(3-гидрокси-1-нафтил)-2-[[(2S)-1-метилпирролидин-2-ил]метокси]-5,6,7,8-тетрагидрохиназолин-4-ил]пиперазин-1-ил]проп-2-ен-1-он в виде белого твердого вещества.
Пример 49а: 1Н ЯМР (400 МГц, ДМСО-d6) δ 9,67 (с, 1H), 8,06 (д, J=8,5 Гц, 1H), 7,71 (дд, J=8,2, 1,4 Гц, 1H), 7,41 (ддд, J=7,9, 6,7, 1,1 Гц, 1H), 7,31 (ддд, J=8,3, 6,8, 1,3 Гц, 1H), 7,01 (дд, J=13,9, 2,1 Гц, 2Н), 6,83 (дд, J=16,7, 10,5 Гц, 1H), 6,16 (дд, J=16,7, 2,4 Гц, 1H), 5,73 (дд, J=10,4, 2,4 Гц, 1H), 4,57 (д, J=12,5 Гц, 1H), 4,44 (ддд, J=12,5, 6,7, 4,2 Гц, 1H), 3,89 (с, 1H), 3,83-3,49 (м, 8Н), 3,11 (д, J=16,8 Гц, 2Н), 2,92 (с, 4Н), 2,80 (ддд, J=17,0, 10,5, 5,0 Гц, 1H), 2,58 (д, J=15,8 Гц, 1H), 2,29-2,10 (м, 2Н), 1,96 (д, J=87,1 Гц, 4Н), 1,25 (д, J=12,8 Гц, 1H). ЖХМС (ИЭР, m/z): 528,3 [М+Н]+.
Пример 50а

4-(4-(4-акрилоилпиперазин-1-ил)-2-(((S)-1-метилпирролидин-2-ил)метокси)-5,6,7,8-тетрагидрохиназолин-7-ил)нафтален-2-ил акрилат
4-(4-(4-акрилоилпиперазин-1-ил)-2-(((S)-1-метилпирролидин-2-ил)метокси)-5,6,7,8-тетрагидрохиназолин-7-ил)нафтален-2-ил акрилат получали в виде побочного продукта реакции, описанной на этапе 7 примера 49а.
Пример 50а: 1Н ЯМР (400 МГц, ДМСО-d6) δ 8,27 (д, J=13,9 Гц, 1H), 7,96 (дт, J=6,8, 3,5 Гц, 1H), 7,66 (д, J=2,2 Гц, 1H), 7,58 (дт, J=6,7, 3,3 Гц, 2Н), 7,27 (д, J=2,3 Гц, 1H), 6,84 (дд, J=16,7, 10,5 Гц, 2Н), 6,58 (дд, J=17,2, 1,6 Гц, 1H), 6,46 (дд, J=17,3, 10,1 Гц, 1H), 6,21-6,10 (м, 2Н), 5,72 (дд, J=10,4, 2,4 Гц, 1H), 4,25 (дд, J=10,7, 4,9 Гц, 1H), 4,09-3,92 (м, 3Н), 3,64 (с, 4Н), 3,13-2,75 (м, 4Н), 2,61-2,54 (м, 1H), 2,23-2,04 (м, 4Н), 1,97-1,79 (м, 4Н), 1,72-1,51 (м, 5Н), 1,24 (с, 2Н). ЖХМС (ИЭР, m/z): 582,3 [М+Н]+.
Пример 51

1-[7-[7-(3-гидрокси-1-нафтил)-2-[(1-метилпирролидин-2-ил)метокси]-5,6,7,8-тетрагидрохиназолин-4-ил]-2,7-диазаспиро[3.5]нонан-2-ил]проп-2-ен-1-он
Пример 51 получали в соответствии с процедурой, приведенной в примере 49а, за исключением того, что на этапе 3 примера 51 в качестве альтернативного реагента использовали коммерчески доступный трет-бутил 2,7-диазаспиро[3.5]нонан-2-карбоксилат вместо трет-бутил пиперазин-1-карбоксилата.
Пример 51: 1Н ЯМР (400 МГц, ДМСО-d6) δ 9,66 (с, 1H), 8,07 (д, J=8,5 Гц, 1H), 7.70 (дд, J=8,3, 1,3 Гц, 1H), 7,39 (ддд, J=8,1, 6,7, 1,1 Гц, 1H), 7,30 (ддд, J=8,3, 6,8, 1,4 Гц, 1H), 7,03-6,96 (м, 2Н), 6,33 (дд, J=17,0, 10,3 Гц, 1H), 6,11 (дд, J=17,0, 2,3 Гц, 1H), 5,67 (дд, J=10,3, 2,3 Гц, 1H), 4,24 (дд, J=10,7, 4,8 Гц, 1H), 4,06-3,94 (м, 3Н), 3,91-3,82 (м, 1H), 3,75-3,65 (м, 2Н), 3,06 (дд, J=18,2, 5,3 Гц, 1H), 2,98-2,83 (м, 2Н), 2,75 (дд, J=18,1, 10,6 Гц, 1H), 2,33 (с, 3Н), 2,14 (тд, J=15,1, 13,2, 9,4 Гц, 2Н), 1,98-1,71 (м, 6Н), 1,71-1,48 (м, 4Н). ЖХМС (ИЭР, m/z): 568,3 [М+Н]+.
Пример 52а

1-(4-(7-(3-гидроксинафтален-1-ил)-2-(2-((S)-1-метилпирролидин-2-ил)этокси)-5,6,7,8-тетрагидрохиназолин-4-ил)пиперазин-1-ил)проп-2-ен-1-он
Пример 52а получали в соответствии с процедурой, приведенной в примере 49а, за исключением того, что на этапе 5 примера 52а в качестве альтернативного реагента использовали коммерчески доступный (S)-2-(1-метилпирролидин-2-ил)этан-1-ол вместо (S)-(1-метилпирролидин-2-ил)метанола.
Пример 52а: 1Н ЯМР (400 МГц, ДМСО-d6) δ 9,66 (с, 1H), 8,06 (д, J=8,5 Гц, 1H), 7.71 (дд, J=8,3, 1,4 Гц, 1H), 7,40 (ддд, J=8,0, 6,6, 1,0 Гц, 1H), 7,31 (ддд, J=8,2, 6,6, 1,3 Гц, 1H), 7,01 (дд, J=13,1, 2,4 Гц, 2Н), 6,88-6,78 (м, 1H), 6,15 (дд, J=16,6, 2,4 Гц, 1H), 5,73 (дд, J=10,4, 2,4 Гц, 1H), 4,40-4,20 (м, 2Н), 3,87 (с, 1H), 3,82-3,57 (м, 5Н), 3,51 (тд, J=9,2, 6,9, 3,1 Гц, 3Н), 3,16-3,03 (м, 2Н), 2,99-2,70 (м, 6Н), 2,63-2,53 (м, 1H), 2,41-2,10 (м, 3Н), 2,05-1,78 (м, 4Н), 1,69 (с, 1H). ЖХМС (ИЭР, m/z): 542,4 [М+Н]+.
Пример 53а

1-((3S)-4-(7-(3-гидроксинафтален-1-ил)-2-(3-морфолинопропокси)-5,6,7,8-тетрагидрохиназолин-4-ил)-3-метилпиперазин-1-ил)проп-2-ен-1-он
Пример 53а получали в соответствии с процедурой, приведенной впримере 49а, за исключением того, что на этапе 5 примера 53а в качестве альтернативного реагента использовали коммерчески доступный 3-морфолинопропан-1-ол вместо (S)-(1-метилпирролидин-2-ил)метанола.
Пример 53а: 1Н ЯМР (400 МГц, ДМСО-d6) δ 9,64 (д, J=3,6 Гц, 1H), 8,07 (т, J=8,9 Гц, 1H), 7,70 (дд, J=8,3, 1,3 Гц, 1H), 7,40 (ддд, J=8,0, 6,7, 1,1 Гц, 1H), 7,30 (ддт, J=8,0, 6,7, 1,3 Гц, 1H), 7,00 (дд, J=12,1, 2,4 Гц, 2Н), 6,95-6,73 (м, 1H), 6,17 (д, J=16,8 Гц, 1H), 5,72 (дт, J=10,4, 2,3 Гц, 1H), 4,44-3,97 (м, 5Н), 3,85 (т, J=12,6 Гц, 2Н), 3,56 (с, 4Н), 3,44 (с, 1H), 3,21-3,01 (м, 2Н), 3,00-2,64 (м, 3Н), 2,37 (с, 5Н), 2,12 (д, J=12,3 Гц, 1H), 1,94-1,75 (м, ЗН), 1,23 (д, J=6,6 Гц, 2Н), 1,08-0,95 (м, 1H). ЖХМС (ИЭР, m/z): 572,3 [М+Н]+.
Пример 54а
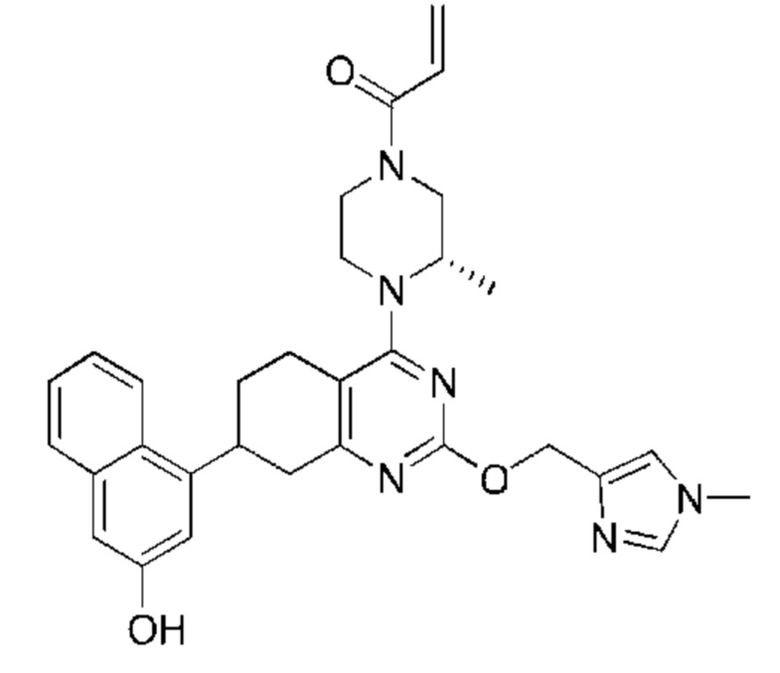
1-((3S)-4-(7-(3-гидроксинафтален-1-ил)-2-((1-метил-1H-имидазол-4-ил)метокси)-5,6,7,8-тетрагидрохиназолин-4-ил)-3-метилпиперазин-1-ил)проп-2-ен-1-он
Пример 54а получали в соответствии с процедурой, приведенной в примере 49а, за исключением того, что на этапе 5 примера 54а в качестве альтернативного реагента использовали коммерчески доступный (1-метил-1Н-имидазол-4-ил)метанол вместо (S)-(1-метилпирролидин-2-ил)метанола.
Пример 54а: 1Н ЯМР (400 МГц, ДМСО-d6) δ 9,65 (д, J=3,6 Гц, 1H), 8,06 (дт, J=17,2, 8,7 Гц, 1H), 7,71 (дд, J=8,3, 1,4 Гц, 1H), 7,62 (с, 1H), 7,45-7,24 (м, 2Н), 7,19 (д, J=1,3 Гц, 1H), 7,05-6,95 (м, 3Н), 6,83 (с, 1H), 6,17 (д, J=16,3 Гц, 1H), 5,72 (дт, J=10,5, 2,3 Гц, 1H), 5,12 (д, J=2,3 Гц, 2Н), 4,36 (с, 1H), 4,26 (с, 1H), 4,16 (д, J=13,3 Гц, 1H), 4,04 (д, J=11,8 Гц, 0Н), 3,87 (д, J=10,0 Гц, 2Н), 3,73-3,56 (м, 4Н), 3,46 (с, 1H), 3,11 (дт, J=18,4, 5,8 Гц, 1H), 2,91 (с, 2Н), 2,88-2,70 (м, 1H), 2,46 (с, 1H), 2,13 (д, J=12,5 Гц, 1H), 1,83 (д, J=11,7 Гц, 2Н), 1,23 (д, J=6,3 Гц, 2Н), 1,02 (дд, J=13,0, 6,5 Гц, 2Н). ЖХМС (ИЭР, m/z): 539,3 [М+Н]+.
Пример 55а

5-(((4-((S)-4-акрилоил-2-метилпиперазин-1-ил)-7-(3-гидроксинафтален-1-ил)-5,6,7,8-тетрагидрохиназолин-2-ил)окси)метил)пирролидин-2-он
Пример 55а получали в соответствии с процедурой, приведенной в примере 49а, за исключением того, что на этапе 5 примера 55а в качестве альтернативного реагента использовали коммерчески доступный 5-(гидроксиметил)пирролидин-2-он вместо (S)-(1-метилпирролидин-2-ил)метанола.
Пример 55а: ЖХМС (ИЭР, m/z): 542,2 [М+Н]+.
Пример 56а
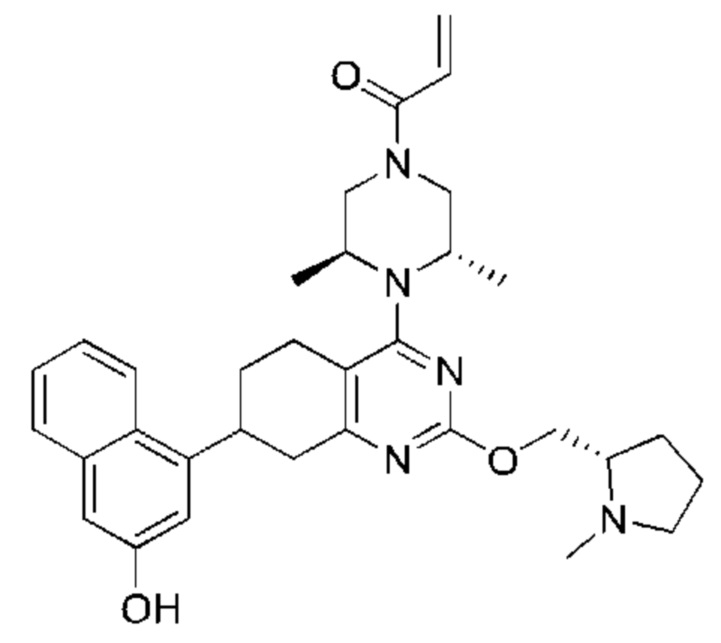
1-((3S,5S)-4-(7-(3-гидроксинафтален-1-ил)-2-(((S)-1-метилпирролидин-2-ил)метокси)-5,6,7,8-тетрагидрохиназолин-4-ил)-3,5-диметилпиперазин-1-ил)проп-2-ен-1-он
Пример 56а получали в соответствии с процедурой, приведенной в примере 49а, за исключением того, что на этапе 3 примера 56а в качестве альтернативного реагента использовали коммерчески доступный трет-бутил (3S,5S)-3,5-диметилпиперазин-1-карбоксилат вместо трет-бутил пиперазин-1-карбоксилата.
Пример 56а: ЖХМС (ИЭР, m/z): 556,4 [М+Н]+.
Примеры 57а, 57b, 57с и 57d
Примеры 57а, 57b, 57с, и 57d получали в соответствии с процедурой, приведенной в примере 49а, за исключением того, что на этапе 5 примеров 57а, 57b, 57с, и 57d в качестве альтернативного реагента использовали коммерчески доступный 4-(гидроксиметил)-3-метилоксазолидин-2-он вместо (S)-(1-метилпирролидин-2-ил)метанола.
Пример 57а: Пик 1 с хСФХ (колонка: Chiralpak-IA; подвижная фаза: МеОН с 0,1% NH4OH; RT=0,875 мин):

(S)-4-((((R)-4-((S)-4-акрилоил-2-метилпиперазин-1-ил)-7-(3-гидроксинафтален-1-ил)-5,6,7,8-тетрагидрохиназолин-2-ил)окси)метил)-3-метилоксазолидин-2-он
Пример 57а: 1Н ЯМР (400 МГц, ДМСО-d6) δ 9,66 (с, 1H), 8,08 (д, J=8,5 Гц, 1H), 7,70 (дд, J=8,3, 1,3 Гц, 1H), 7,40 (ддд, J=8,0, 6,7, 1,1 Гц, 1H), 7,30 (ддд, J=8,3, 6,8, 1,4 Гц, 1H), 7,01 (к, J=2,3 Гц, 2Н), 6,94-6,73 (м, 1H), 6,16 (дд, J=16,7, 6,7 Гц, 1H), 5,73 (дд, J=10,5, 2,4 Гц, 1H), 4,49 (дд, J=11,8, 3,6 Гц, 1H), 4,44-4,24 (м, 3Н), 4,23-4,01 (м, 3Н), 3,88 (д, J=8,8 Гц, 1H), 3,65-3,44 (м, 1H), 3,10 (дд, J=18,3, 5,2 Гц, 1H), 2,89 (д, J=12,7 Гц, 2Н), 2,78 (с, 4Н), 2,59 (т, J=10,6 Гц, 1H), 2,13 (д, J=12,4 Гц, 1H), 1,92-1,74 (м, 1H), 1,00 (ддд, J=20,1, 13,9, 6,6 Гц, 4Н). ЖХМС (ИЭР, m/z): 558,3 [М+Н]+.
Пример 57b: Пик 2 с хСФХ (колонка: Chiralpak-IA; подвижная фаза: МеОН с 0,1% NH4OH; RT=0,952 мин):
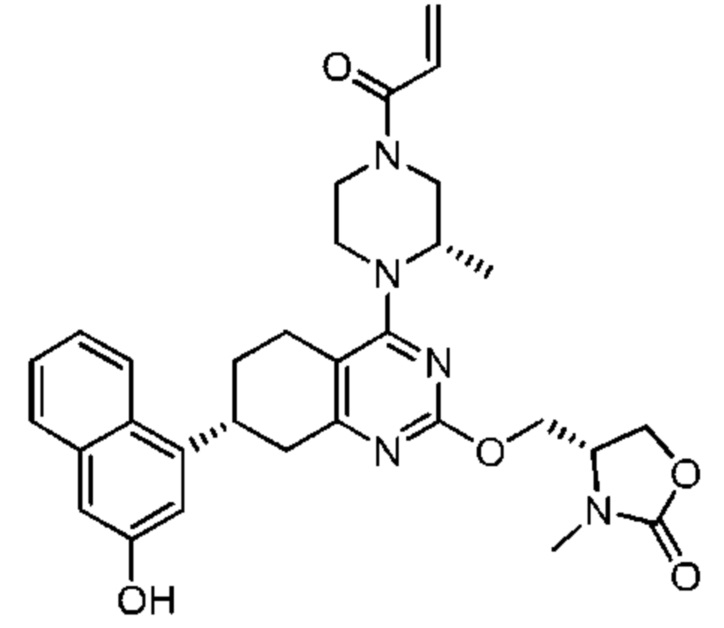
(R)-4-((((R)-4-((S)-4-акрилоил-2-метилпиперазин-1-ил)-7-(3-гидроксинафтален-1-ил)-5,6,7,8-тетрагидрохиназолин-2-ил)окси)метил)-3-метилоксазолидин-2-он
Пример 57b: 1Н ЯМР (400 МГц, ДМСО-d6) δ 9,66 (с, 1H), 8,08 (д, J=8,5 Гц, 1H), 7,70 (дд, J=8,2, 1,3 Гц, 1H), 7,40 (ддд, J=8,1, 6,7, 1,1 Гц, 1H), 7,30 (ддд, J=8,3, 6,8, 1,4 Гц, 1H), 7,01 (к, J=2,4 Гц, 2Н), 6,83 (дд, J=22,1, 12,6 Гц, 1H), 6,16 (дд, J=16,6, 6,7 Гц, 1H), 5,73 (дд, J=10,4, 2,4 Гц, 1H), 4,50-4,26 (м, 4Н), 4,22-4,02 (м, 3Н), 3,87 (с, 1H), 3,61 (д, J=12,9 Гц, 0Н), 3,51 (с, 2Н), 3,10 (дд, J=18,3, 5,2 Гц, 1H), 2,91 (с, 2Н), 2,87-2,73 (м, 1H), 2,79 (с, 3Н), 2,57 (д, J=14,0 Гц, 1H), 2,13 (д, J=12,4 Гц, 1H), 1,00 (ддд, J=21,3, 14,4, 6,4 Гц, 4Н). ЖХМС (ИЭР, m/z): 558,3 [М+Н]+.
Пример 57 с: Пик 3 с хСФХ (колонка: Chiralpak-IA; подвижная фаза: МеОН с 0,1% NH4OH; RT=1,27 мин):

(R)-4-((((S)-4-((S)-4-акрилоил-2-метилпиперазин-1-ил)-7-(3-гидроксинафтален-1-ил)-5,6,7,8-тетрагидрохиназолин-2-ил)окси)метил)-3-метилоксазолидин-2-он
Пример 57 с: 1Н ЯМР (400 МГц, ДМСО-d6) δ 9,65 (с, 1H), 8,06 (д, J=8,5 Гц, 1H), 7,70 (дд, J=8,3, 1,3 Гц, 1H), 7,40 (ддд, J=8,0, 6,7, 1,1 Гц, 1H), 7,30 (ддд, J=8,3, 6,8, 1,4 Гц, 1H), 7,05-6,95 (м, 2Н), 6,83 (ддд, J=26,1, 16,4, 10,3 Гц, 1H), 6,22-6,11 (м, 1H), 5,72 (дд, J=10,4, 2,4 Гц, 1H), 4,50-4,28 (м, 3Н), 4,24-4,04 (м, 4Н), 3,88 (д, J=13,4 Гц, 3Н), 3,35 (с, 1H), 3,15-3,02 (м, 1H), 2,93 (с, 1H), 2,79 (с, 4Н), 2,59-2,49 (м, 2Н), 2,12 (д, J=12.3 Гц, 1H), 1,23 (с, 3Н), 0,96 (т, J=6,5 Гц, 1H). ЖХМС (ИЭР, m/z): 558,3 [М+Н]+.
Пример 57d: Пик 4 с хСФХ (колонка: Chiralpak-IA; подвижная фаза: МеОН с 0,1% NH4OH; RT=1,63 мин):

(S)-4-((((S)-4-((S)-4-акрилоил-2-метилпиперазин-1-ил)-7-(3-гидроксинафтален-1-ил)-5,6,7,8-тетрагидрохиназолин-2-ил)окси)метил)-3-метилоксазолидин-2-он
Пример 57d: 1Н ЯМР (400 МГц, ДМСО-d6) δ 9,65 (с, 1H), 8,06 (д, J=8,4 Гц, 1H), 7,70 (дд, J=8,2, 1,3 Гц, 1H), 7,40 (ддд, J=8,0, 6,8, 1,1 Гц, 1H), 7,30 (ддд, J=8,3, 6,8, 1,4 Гц, 1H), 7,05-6,94 (м, 2Н), 6,93-6,73 (м, 1H), 6,16 (дд, J=16,6, 7,8 Гц, 1H), 5,72 (дд, J=10,4, 2,4 Гц, 1H), 4,48-4,26 (м, 4Н), 4,17 (с, 2Н), 4,17-4,00 (м, 2Н), 3,88 (д, J=13.4 Гц, 3Н), 3,19-3,02 (м, 2Н), 2,79 (с, 3Н), 2,86-2,67 (м, 1H), 2,47 (с, 1H), 2,12 (д, J=12.5 Гц, 1H), 1,32-1,19 (м, 4Н), 1,07-0,92 (м, 1H). ЖХМС (ИЭР, m/z): 558,3 [М+Н]+.
Пример 58а
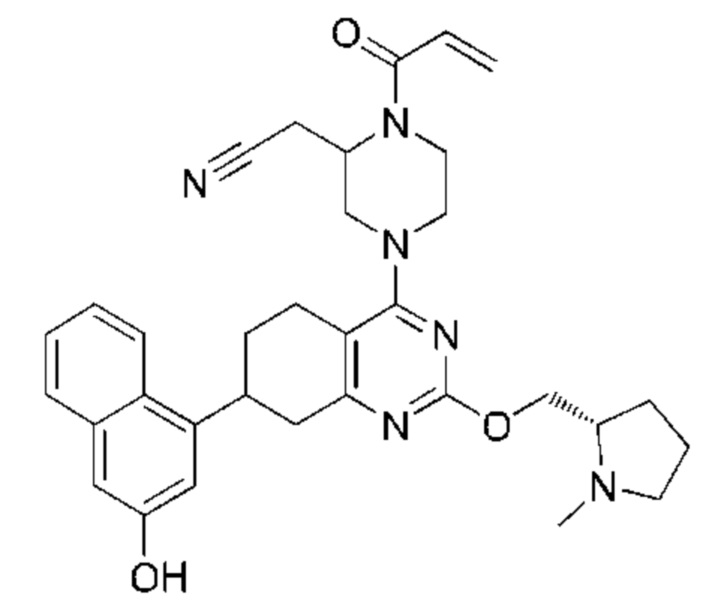
2-(1-акрилоил-4-(7-(3-гидроксинафтален-1-ил)-2-(((S)-1-метилпирролидин-2-ил)метокси)-5,6,7,8-тетрагидрохиназолин-4-ил)пиперазин-2-ил)ацетонитрил

Этап 1: трет-бутил 4-(7-(3-((трет-бутилдиметилсилил)окси)нафтален-1-ил)-2-(метилтио)-5,6,7,8-тетрагидрохиназолин-4-ил)-2-(цианометил)пиперазин-1-карбоксилат
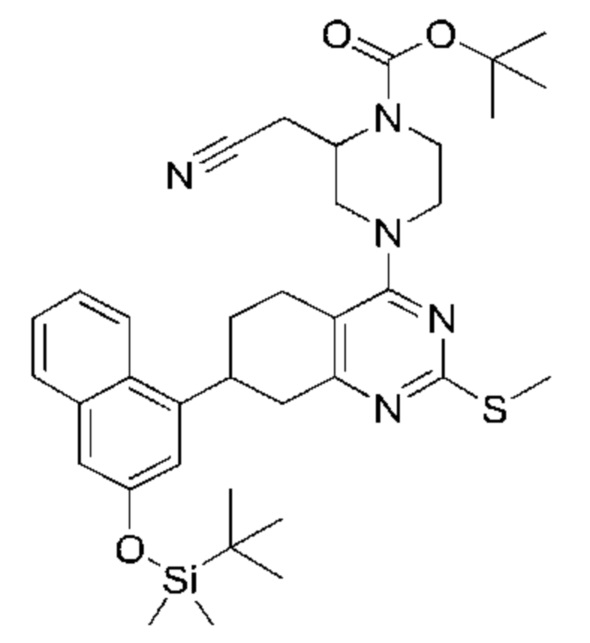
В раствор [7-[3-[трет-бутил(диметил)силил]окси-1-нафтил]-2-метилсульфанил-5,6,7,8-тетрагидрохиназолин-4-ил] трифторметансульфоната (500 мг, 0,855 ммоль) в N,N-диметилформамиде (9,0 мл) добавляли N,N-диизопропилэтиламин (0,60 мл, 3,4 ммоль) и 2-(пиперазин-2-ил)ацетонитрил (245,0 мг, 1,88 ммоль). Реакционную смесь перемешивали при 85°С в течение 1 часа. Реакцилнную смесь охлаждали до к. т., потом добавляли 4-диметиламинопиридин (10,00 мг, 0,085 ммоль) и ди-трет-бутил дикарбонат (577 мг, 2,57 ммоль), после чего перемешивали при к. т. в течение 18 часов. Реакционную смесь гасили водой и экстрагировали EtOAc. Органические слои сушили сульфатом натрия, фильтровали и концентрировали с помощью роторного вакуумного испарителя. Неочищенный продукт очищали с помощью флэш-хроматографии на силикагеле (элюирование МеОН/ДХМ) с получением трет-бутил 4-(7-(3-((трет-бутилдиметилсилил)окси)нафтален-1-ил)-2-(метилтио)-5,6,7,8-тетрагидрохиназолин-4-ил)-2-(цианометил)пиперазин-1-карбоксилата (392 мг, 69%). ЖХМС (ИЭР, m/z): 660,4 [М+Н]+.
Этап 2: трет-бутил 4-(7-(3-((трет-бутилдиметилсилил)окси)нафтален-1-ил)-2-(метилсульфонил)-5,6,7,8-тетрагидрохиназолин-4-ил)-2-(цианометил)пиперазин-1-карбоксилат
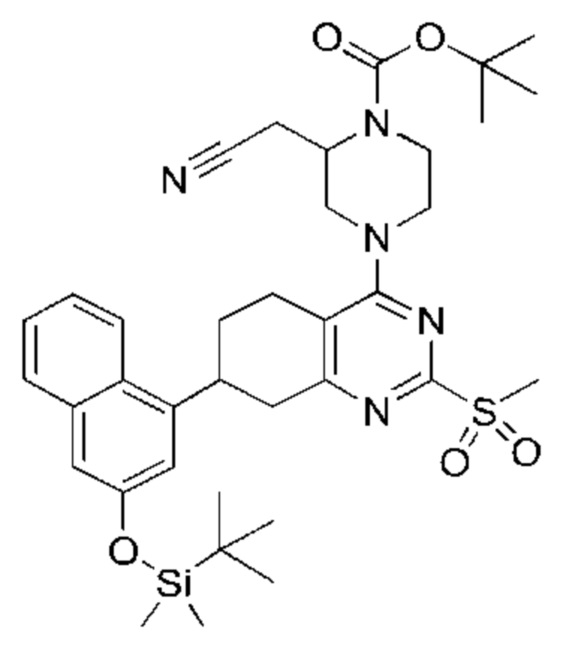
В раствор трет-бутил 4-(7-(3-((трет-бутилдиметилсилил)окси)нафтален-1-ил)-2-(метилтио)-5,6,7,8-тетрагидрохиназолин-4-ил)-2-(цианометил)пиперазин-1-карбоксилата (392 мг, 0,590 ммоль) в тетрагидрофуране (12,0 мл) добавляли 3-хлорпероксибензойную кислоту (333 мг, 1,49 ммоль). Реакцию перемешивали при 25°С в течение 2 часов, потом гасили раствором NaHSO3 (10 мл). Реакционную смесь разводили ДХМ (20 мл), промывали водой (15 мл). Органические слои сушили сульфатом натрия, фильтровали и концентрировали с помощью роторного вакуумного испарителя. Неочищенный продукт очищали с помощью флэш-хроматографии на силикагеле (элюирование iPrOAc/Hep) с получением трет-бутил 4-(7-(3-((трет-бутилдиметилсилил)окси)нафтален-1-ил)-2-(метилсульфонил)-5,6,7,8-тетрагидрохиназолин-4-ил)-2-(цианометил)пиперазин-1-карбоксилата (200 мг, 49%). ЖХМС (ИЭР, m/z): 692,3 [М+Н]+.
Этап 3: трет-бутил 2-(цианометил)-4-(7-(3-гидроксинафтален-1-ил)-2-(((S)-1-метилпирролидин-2-ил)метокси)-5,6,7,8-тетрагидрохиназолин-4-ил)пиперазин-1-карбоксилат
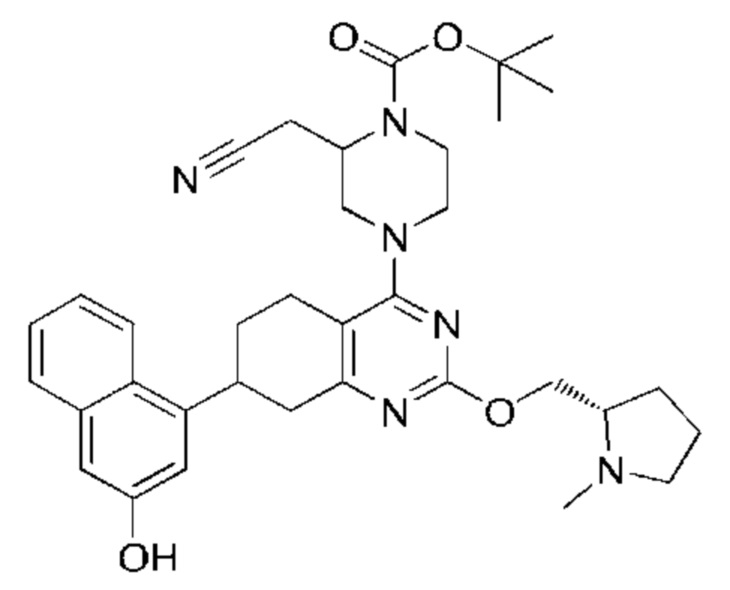
В раствор [(2S)-1-метилпирролидин-2-ил]метанола (0,14 мл, 139 мг, 1,2 ммоль) в тетрагидрофуране (6,0 мл) добавляли бис(триметилсилил)амид калия (0,91 М) в тетрагидрофуране (1,3 мл, 1,3 ммоль) при комнатной температуре. Реакцию охлаждали до 0°С, потом добавляли раствор трет-бутил 4-[7-[3-[трет-бутил(диметил)силил]окси-1-нафтил]-2-метилсульфонил-5,6,7,8-тетрагидрохиназолин-4-ил]-2-(цианометил)пиперазин-1-карбоксилата (400 мг, 0,58 ммоль) в ТГФ (3 мл). Реакцию оставляли потихоньку нагреваться до комнатной температуры в течение 12 часов. Реакционную смесь гасили водой и экстрагировали EtOAc. Органические слои сушили сульфатом натрия, фильтровали и концентрировали с помощью роторного вакуумного испарителя. Неочищенный продукт использовали без очистки. ЖХМС (ИЭР, m/z): 613,3 [М+Н]+.
Этап 4: 2-(4-(7-(3-гидроксинафтален-1-ил)-2-(((S)-1-метилпирролидин-2-ил)метокси)-5,6,7,8-тетрагидрохиназолин-4-ил)пиперазин-2-ил)ацетонитрил

Раствор трет-бутил 2-(цианометил)-4-(7-(3-гидроксинафтален-1-ил)-2-(((S)-1-метилпирролидин-2-ил)метокси)-5,6,7,8-тетрагидрохиназолин-4-ил)пиперазин-1-карбоксилата (280 мг, 0,38 ммоль) в 5% трифторуксусной кислоте в гексафтор-2-пропаноле (5,8 мл, 3,8 ммоль) перемешивали при к. т.в течение 24 часов. Реакцию концентрировали, а неочищенный продукт очищали с помощью флэш-хроматографии на силикагеле (элюирование МеОН/ДХМ) с получением 2-(4-(7-(3-гидроксинафтален-1-ил)-2-(((S)-1-метилпирролидин-2-ил)метокси)-5,6,7,8-тетрагидрохиназолин-4-ил)пиперазин-2-ил)ацетонитрила (84 мг, 43%). ЖХМС (ИЭР, m/z): 513,2 [М+Н]+.
Этап 5: 2-(1-акрилоил-4-(7-(3-гидроксинафтален-1-ил)-2-(((S)-1-метилпирролидин-2-ил)метокси)-5,6,7,8-тетрагидрохиназолин-4-ил)пиперазин-2-ил)ацетонитрил

В раствор 2-(4-(7-(3-гидроксинафтален-1-ил)-2-(((S)-1-метилпирролидин-2-ил)метокси)-5,6,7,8-тетрагидрохиназолин-4-ил)пиперазин-2-ил)ацетонитрила (А, 200 мг, 0,3902 ммоль) и N,N-диизопропилэтиламина (252,1 мг, 0,340 мл, 1,951 ммоль) в дихлорметане (5170 мг, 3,902 мл, 60,7 ммоль) добавляли акрилоилхлорид (38,84 мг, 0,03493 мл, 0,4292 ммоль) и HATU при -78°С. Реакционную смесь перемешивали при 0°С в течение 15 минут. Реакцию гасили водой и экстрагировали EtOAc. Органические слои сушили сульфатом натрия, фильтровали и концентрировали с помощью роторного вакуумного испарителя. Неочищенный продукт подвергали обращенно-фазовой ВЭЖХ с получением 2-(1-акрилоил-4-(7-(3-гидроксинафтален-1-ил)-2-(((S)-1-метилпирролидин-2-ил)метокси)-5,6,7,8-тетрагидрохиназолин-4-ил)пиперазин-2-ил)ацетонитрила в виде белого твердого вещества. Потом соединение подвергали хиральной СФХ с получением четырех изомеров.
Пример 58а: 1Н ЯМР (400 МГц, ДМСО-d6) δ 9,65 (д, J=10,9 Гц, 1H), 8,10-8,00 (м, 1H), 7,77-7,66 (м, 1H), 7,44-7,35 (м, 1H), 7,31 (ддд, J=8,3, 6,7, 1,4 Гц, 1H), 7,05-6,77 (м, 4Н), 6,18 (дт, J=16,6, 2,4 Гц, 1H), 5,77 (дд, J=10,5, 2,3 Гц, 1H), 5,07-4,32 (м, 2Н), 4,31-4,17 (м, 1H), 4,17-3,99 (м, 2Н), 3,86 (т, J=16,4 Гц, 4Н), 3,14-2,62 (м, 11Н), 2,34 (д, J=3,0 Гц, 4Н), 2,16 (кд, J=8,8, 2,8 Гц, 3Н), 1,98-1,77 (м, 3Н), 1,74-1,49 (м, 4Н), 1,23 (с, 2Н), 0,91 (ддд, J=39,9, 10,0, 5,1 Гц, 1H). ЖХМС (ИЭР, m/z): 567,3 [М+Н]+.
Примеры 58b, 58 с, 58d и 58е
Пример 58а подвергали хСФХ (колонка: Chiralpak-IA; подвижная фаза: МеОН с 0,1% NH4OH) с получением примеров 58b, 58 с, 58d и 58е. 58b, 58 с, 58d и 58е: ЖХМС (ИЭР, m/z): 567,3 [М+Н]+. Абсолютная стереохимия этих соединений была определена по данным активности и рентгенограммы белковой структуры соединения 21b.
Пример 58b: Пик 1 схСФХ:
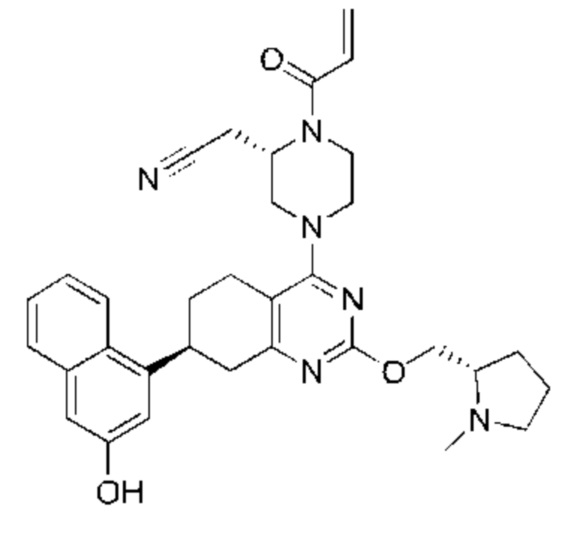
2-((S)-1-акрилоил-4-((S)-7-(3-гидроксинафтален-1-ил)-2-(((S)-1-метилпирролидин-2-ил)метокси)-5,6,7,8-тетрагидрохиназолин-4-ил)пиперазин-2-ил)ацетонитрил
Пример 58 с: Пик 2 с хСФХ:

2-((R)-1-акрилоил-4-((S)-7-(3-гидроксинафтален-1-ил)-2-(((S)-1-метилпирролидин-2-ил)метокси)-5,6,7,8-тетрагидрохиназолин-4-ил)пиперазин-2-ил)ацетонитрил
Пример 58d: Пик 3 с хСФХ:

2-((S)-1-акрилоил-4-((R)-7-(3-гидроксинафтален-1-ил)-2-(((S)-1-метилпирролидин-2-ил)метокси)-5,6,7,8-тетрагидрохиназолин-4-ил)пиперазин-2-ил)ацетонитрил
Пример 58е: Пик 4 с хСФХ:
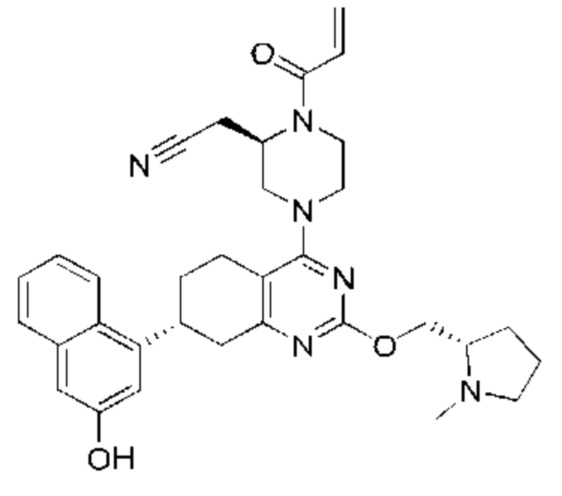
2-((R)-1-акрилоил-4-((R)-7-(3-гидроксинафтален-1-ил)-2-(((S)-1-метилпирролидин-2-ил)метокси)-5,6,7,8-тетрагидрохиназолин-4-ил)пиперазин-2-ил)ацетонитрил
Пример 59а
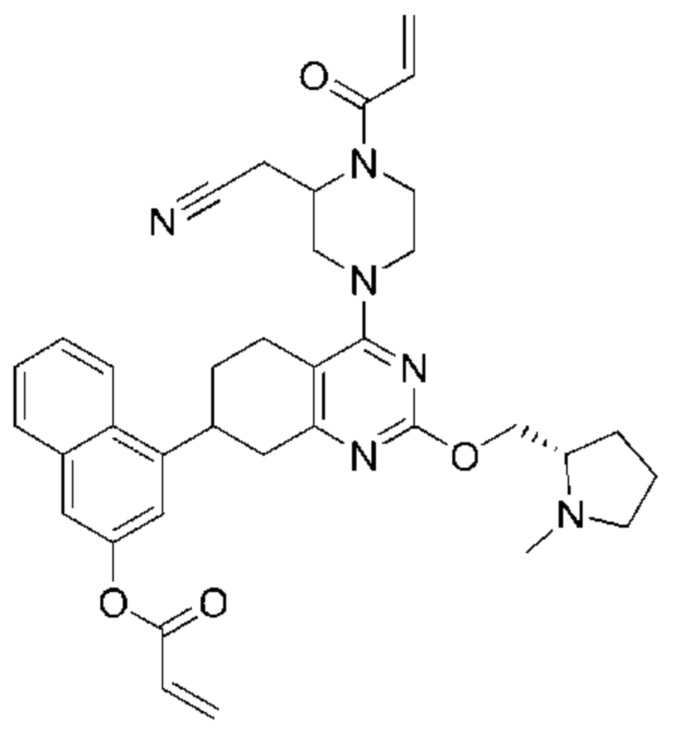
4-(4-(4-акрилоил-3-(цианометил)пиперазин-1-ил)-2-(((S)-1-метилпирролидин-2-ил)метокси)-5,6,7,8-тетрагидрохиназолин-7-ил)нафтален-2-ил акрилат
Пример 59а получали как побочный продукт в соответствии с процедурой, приведенной в примере 58а.
Пример 59а: ЖХМС (ИЭР, m/z): 621,3 [М+Н]+.
Пример 60

2-(4-акрилоил-1-(7-(3-гидроксинафтален-1-ил)-2-((1-метилпирролидин-2-ил)метокси)-5,6,7,8-тетрагидрохиназолин-4-ил)пиперазин-2-ил)ацетонитрил
Пример 60 получали в соответствии с процедурой, приведенной в примере 58а, за исключением того, что на этапе 1 примера 60 в качестве альтернативного реагента использовали трет-бутил 3-(цианометил)пиперазин-1-карбоксилат вместо 2-(пиперазин-2-ил)ацетонитрила.
Пример 60: ЖХМС (ИЭР, m/z): 621,3 [М+Н]+.
Пример 61а
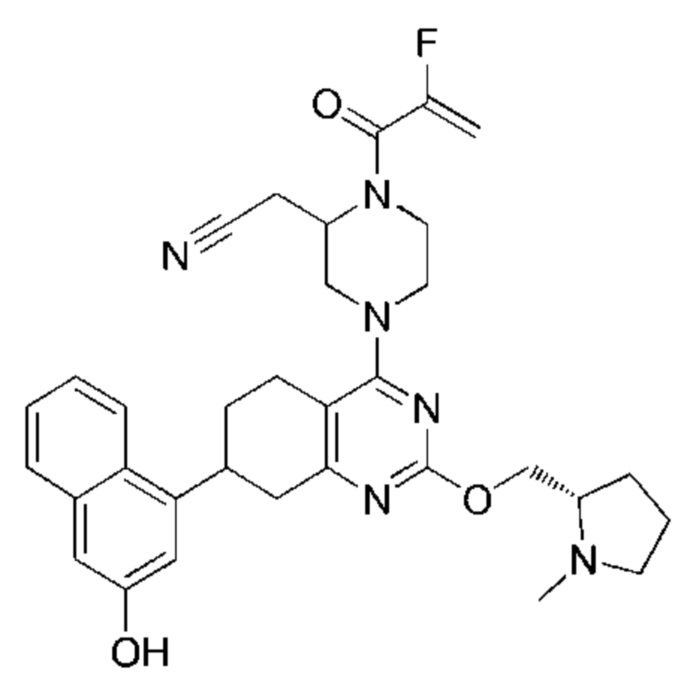
2-(1-(2-фторакрилоил)-4-(7-(3-гидроксинафтален-1-ил)-2-(((S)-1-метилпирролидин-2-ил)метокси)-5,6,7,8-тетрагидрохиназолин-4-ил)пиперазин-2-ил)ацетонитрил
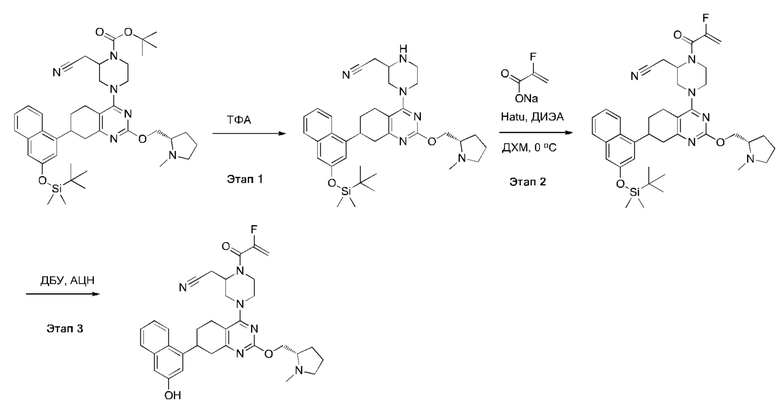
Этап 1: 2-(4-(7-(3-((трет-бутилдиметилсилил)окси)нафтален-1-ил)-2-(((S)-1-метилпирролидин-2-ил)метокси)-5,6,7,8-тетрагидрохиназолин-4-ил)пиперазин-2-ил)ацетонитрил

Раствор трет-бутил 4-[7-[3-[трет-бутил(диметил)силил]окси-1-нафтил]-2-[[(2S)-1-метилпирролидин-2-ил]метокси]-5,6,7,8-тетрагидрохиназолин-4-ил]-2-(цианометил)пиперазин-1-карбоксилата (700 мг, 0,963 ммоль) в 5% трифторуксусной кислоте в гексафтор-2-пропаноле (14,5 мл, 9,63 ммоль) перемешивали при к. т.в течение 4 часов. Реакцию разводили EtOAc и промывали насыщ. NaHCO3. Органические слои сушили сульфатом натрия, фильтровали и концентрировали с помощью роторного вакуумного испарителя. Реакцию концентрировали, а неочищенный продукт очищали с помощью флэш-хроматографии на силикагеле (элюирование МеОН/ДХМ) с получением 2-(4-(7-(3-((трет-бутилдиметилсилил)окси)нафтален-1-ил)-2-(((S)-1-метилпирролидин-2-ил)метокси)-5,6,7,8-тетрагидрохиназолин-4-ил)пиперазин-2-ил)ацетонитрила (511 мг, 85%). ЖХМС (ИЭР, m/z): 627,3 [М+Н]+.
Этап 2: 2-(4-(7-(3-((трет-бутилдиметилсилил)окси)нафтален-1-ил)-2-(((S)-1-метилпирролидин-2-ил)метокси)-5,6,7,8-тетрагидрохиназолин-4-ил)-1-(2-фторакрилоил)пиперазин-2-ил)ацетонитрил

В раствор 2-[4-[7-[3-[трет-бутил(диметил)силил]окси-1-нафтил]-2-[[(2S)-1-метилпирролидин-2-ил]метокси]-5,6,7,8-тетрагидрохиназолин-4-ил]пиперазин-2-ил]ацетонитрила (258 мг, 0,41 ммоль), 2-фторпроп-2-еноилоксинатрия (101,4 мг, 0,91 ммоль) и N,N-диизопропилэтиламина (0,36 мл, 2,1 ммоль) в ДХМ (8,0 мл) добавляли HATU (412 мг, 1,0 ммоль) при 0°С и нагревали до к. т. в течение 2 часов. Реакцию гасили водой и экстрагировали EtOAc. Органические слои сушили сульфатом натрия, фильтровали и концентрировали с помощью роторного вакуумного испарителя. Неочищенный продукт очищали с помощью флэш-хроматографии на силикагеле (элюирование МеОН/ДХМ) с получением 2-(4-(7-(3-((трет-бутилдиметилсилил)окси)нафтален-1-ил)-2-(((S)-1-метилпирролидин-2-ил)метокси)-5,6,7,8-тетрагидрохиназолин-4-ил)-1-(2-фторакрилоил)пиперазин-2-ил)ацетонитрила (254 мг, 88%). ЖХМС (ИЭР, m/z): 699,3 [М+Н]+.
Этап 3: 2-(1-(2-фторакрилоил)-4-(7-(3-гидроксинафтален-1-ил)-2-(((S)-1-метилпирролидин-2-ил)метокси)-5,6,7,8-тетрагидрохиназолин-4-ил)пиперазин-2-ил)ацетонитрил
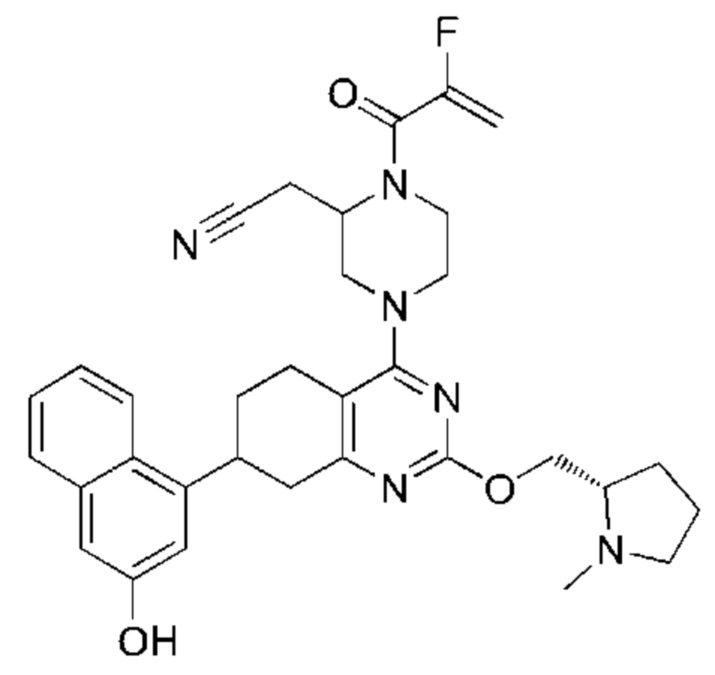
В раствор 2-(4-(7-(3-((трет-бутилдиметилсилил)окси)нафтален-1-ил)-2-(((S)-1-метилпирролидин-2-ил)метокси)-5,6,7,8-тетрагидрохиназолин-4-ил)-1-(2-фторакрилоил)пиперазин-2-ил)ацетонитрила (254 мг, 0,363 ммоль) в ацетонитриле (18,0 мл) и воде (1,8 мл) добавляли 1,8-диазабицикло[5.4.0]ундец-7-ен (0,11 мл, 0,76 ммоль). Реакционную смесь перемешивали при к. т. в течение 1 часа. Реакцию гасили насыщ. NH4Cl и экстрагировали EtOAc. Органические слои сушили сульфатом натрия, фильтровали и концентрировали с помощью роторного вакуумного испарителя. Неочищенный продукт подвергали обращенно-фазовой ВЭЖХ с получением 2-(1-(2-фторакрилоил)-4-(7-(3-гидроксинафтален-1-ил)-2-(((S)-1-метилпирролидин-2-ил)метокси)-5,6,7,8-тетрагидрохиназолин-4-ил)пиперазин-2-ил)ацетонитрила в виде белого твердого вещества. Потом соединение подвергали хиральной СФХ с получением четырех изомеров.
Пример 61а: ЖХМС (ИЭР, m/z): 585,3 [М+Н]+.
Примеры 61b, 61с, 61d и 61е
Пример 61а подвергали хСФХ (колонка: Chiralpak-IA; подвижная фаза: МеОН с 0,1% NH4OH) с получением примеров 61b, 61с, 61d и 61е. 61b, 61с, 61d и 61е: ЖХМС (ИЭР, m/z): 585,3 [М+Н]+. Абсолютная стереохимия этих соединений была определена по данным активности и рентгенограммы белковой структуры соединения 2lb.
Примеры 61b, 61с, 61d и 61е: 1Н ЯМР (400 МГц, AMCO-d6) δ 9,67 (д, J=8,8 Гц, 2Н), 8,04 (т, J=7,6 Гц, 1H), 7,71 (д, J=8,2 Гц, 1H), 7,41 (ддд, J=8,2, 6,7, 1,2 Гц, 1H), 7,31 (ддд, J=8,3, 6,8, 1,4 Гц, 1H), 7,05-6,93 (м, 2Н), 5,40 (ддд, J=18,0, 4,1, 2,3 Гц, 1H), 5,28 (д, J=50,0 Гц, 1H), 4,83 (с, 1H), 4,55 (с, 1H), 4,44 (т, J=9,5 Гц, 1H), 4,01 (т, J=12,5 Гц, 2Н), 3,87 (д, J=11,8 Гц, 4Н), 3,67-3,51 (м, 1H), 3,09 (тд, J=12,8, 12,3, 6,9 Гц, 3Н), 3,01-2,72 (м, 8Н), 2,28-1,95 (м, 3Н), 1,88 (д, J=21,5 Гц, 3Н). ЖХМС (ИЭР, m/z): 585,3 [М+Н]+.
Пример 61b: Пик 1 схСФХ:
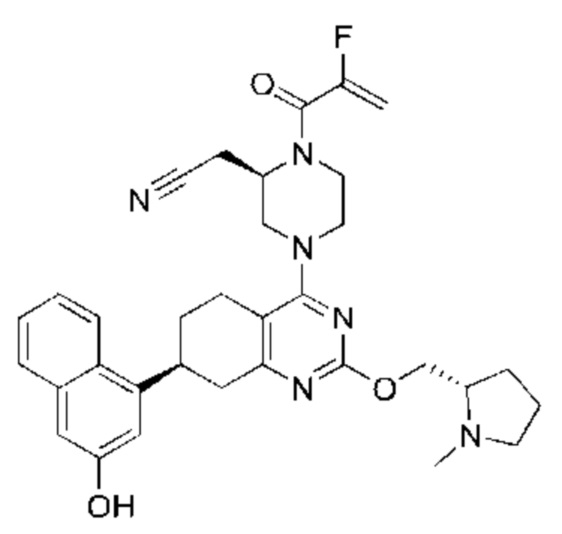
2-((R)-1-(2-фторакрилоил)-4-((S)-7-(3-гидроксинафтален-1-ил)-2-(((S)-1-метилпирролидин-2-ил)метокси)-5,6,7,8-тетрагидрохиназолин-4-ил)пиперазин-2-ил)ацетонитрил
Пример 61с: Пик 2 с хСФХ:
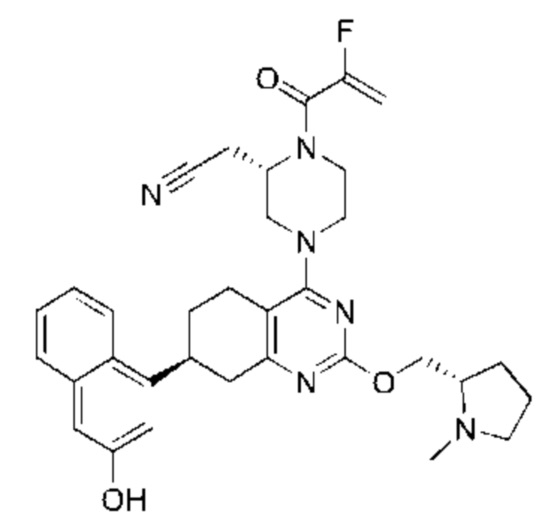
2-((S)-1-(2-фторакрилоил)-4-((S)-7-(3-гидроксинафтален-1-ил)-2-(((S)-1-метилпирролидин-2-ил)метокси)-5,6,7,8-тетрагидрохиназолин-4-ил)пиперазин-2-ил)ацетонитрил
Пример 61d: Пик 3 с хСФХ:
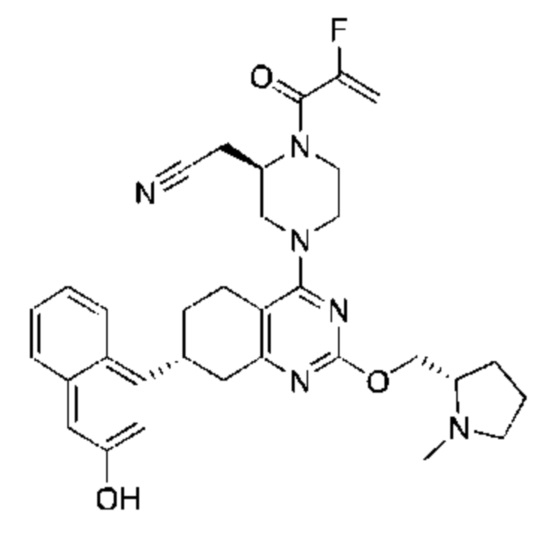
2-((R)-1-(2-фторакрилоил)-4-((R)-7-(3-гидроксинафтален-1-ил)-2-(((S)-1-метилпирролидин-2-ил)метокси)-5,6,7,8-тетрагидрохиназолин-4-ил)пиперазин-2-ил)ацетонитрил
Пример 61е: Пик 4 с хСФХ:
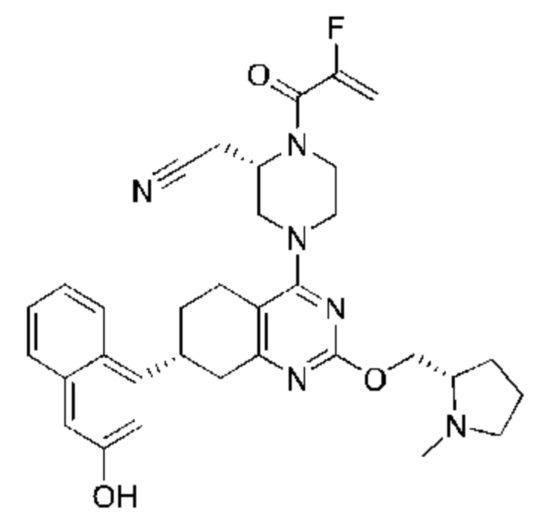
2-((S)-1-(2-фторакрилоил)-4-((R)-7-(3-гидроксинафтален-1-ил)-2-(((S)-1-метилпирролидин-2-ил)метокси)-5,6,7,8-тетрагидрохиназолин-4-ил)пиперазин-2-ил)ацетонитрил
Пример 62а

2-(1-((Е)-4-фторбут-2-еноил)-4-(7-(3-гидроксинафтален-1-ил)-2-(((S)-1-метилпирролидин-2-ил)метокси)-5,6,7,8-тетрагидрохиназолин-4-ил)пиперазин-2-ил)ацетонитрил
Пример 62а получали в соответствии с процедурой, приведенной в примере 61а, за исключением того, что на этапе 2 примера 62а в качестве альтернативного реагента использовали коммерчески доступную (Е)-4-фторбут-2-еновую кислоту вместо 2-фторпроп-2-еноилоксинатрия.
Пример 62а: 1Н ЯМР (400 МГц, ДМСО-d6) δ 9,68 (д, J=9,8 Гц, 1H), 8,09-8,00 (м, 1H), 7,71 (д, J=8,1 Гц, 1H), 7,40 (ддд, J=7,9, 6,7, 1,1 Гц, 1H), 7,31 (ддд, J=8,3, 6,8, 1,4 Гц, 1H), 7,05-6,69 (м, 4Н), 5,10 (т, J=42,4 Гц, 3Н), 4,52 (д, J=69,0 Гц, 3Н), 3,91 (д, J=40,6 Гц, 4Н), 3,16-2,69 (м, 11Н), 2,15 (с, 2Н), 1,88 (д, J=24,6 Гц, 4Н). ЖХМС (ИЭР, m/z): 599,3 [М+Н]+.
Примеры 62b, 62с, 62d и 62е
Пример 62а подвергали хСФХ (колонка: Chiralpak-IA; подвижная фаза: МеОН с 0,1% NH4OH) с получением примеров 62b, 62с, 62d и 62е. 62b, 62с, 62d и 62е: ЖХМС (ИЭР, m/z): 599,3 [М+Н]+. Абсолютная стереохимия этих соединений была определена по данным активности и рентгенограммы белковой структуры соединения 21b.
Пример 62b: Пик 1 с хСФХ:

2-((R)-1-((Е)-4-фторбут-2-еноил)-4-((S)-7-(3-гидроксинафтален-1-ил)-2-(((S)-1-метилпирролидин-2-ил)метокси)-5,6,7,8-тетрагидрохиназолин-4-ил)пиперазин-2-ил)ацетонитрил
Пример 62 с: Пик 2 с хСФХ:

2-((S)-1-((Е)-4-фторбут-2-еноил)-4-((S)-7-(3-гидроксинафтален-1-ил)-2-(((S)-1-метилпирролидин-2-ил)метокси)-5,6,7,8-тетрагидрохиназолин-4-ил)пиперазин-2-ил)ацетонитрил
Пример 62d: Пик 3 с хСФХ:

2-((R)-1-((Е)-4-фторбут-2-еноил)-4-((R)-7-(3-гидроксинафтален-1-ил)-2-(((S)-1-метилпирролидин-2-ил)метокси)-5,6,7,8-тетрагидрохиназолин-4-ил)пиперазин-2-ил)ацетонитрил
Пример 62е: Пик 4 с хСФХ:

2-((S)-1-((Е)-4-фторбут-2-еноил)-4-((R)-7-(3-гидроксинафтален-1-ил)-2-(((S)-1-метилпирролидин-2-ил)метокси)-5,6,7,8-тетрагидрохиназолин-4-ил)пиперазин-2-ил)ацетонитрил
Данные из примеров 1-62е обобщены в Таблице 1.
Биологические примеры
Анализ методом гомогенной флуоресценции с временным разрешением (ГФВР) K-Ras G12C, SOS1, Raf RBD в отношении ингибирования ГТФ-обмена
Чтобы определить активность соединений в отношении ингибирования обмена нуклеотидов, инкубировали различные концентрации с K-Ras G12C (25 нМ в реакции, 12,5 нМ конечная). Через 18 часов при комнатной температуре добавляли фактор ГТФ-обмена SOS1 GTP (1,67 нМ во время обмена, 1,25 нМ конечная) для инициации обмена нуклеотидов на ГТФ (200 мкМ во время обмена, 150 мкМ конечная). Уровень обмена ГТФ оценивали путем добавления Ras-связывающего домена, полученного из C-Raf, и антител обнаружения ГФВР ТЬ-анти-FLAG и D2-анти-his (Cis-Bio) в концентрации 50 нМ, 1 нМ м 12,5 нМ, соответственно. Через 2 часа измеряли отношение испускания на 665 и 615 нм с возбуждением на 320 нм на планшет-ридере Envision (Perkin Elmer).
Конечный реакционный объем составлял 20 мкл в планшете ProxiPlate-384F Plus (Perkin Elmer) в буфере, содержащем 20 мМ ГЭПЭС, 150 мМ NaCl, 1 мМ MgCl2, 0,1% БСА, 0,03% Твин-20 и 1 мМ ДТТ K-Ras G12C (остатки 2-188) и SOS1 (остатки 564-1049) имели N-концевую метку 6-His, а конструкция Raf-RBD (остатки 51-186 RAF1) имела N-концевую Flag-метку. Все конструкции экспрессировали в Е. coli и имели сайт расщепления Tev между меткой и представляющим интерес белком, который не использовался во время очистки. Данные ГФВР представлены ниже в Таблице 2.
Вестерн-блот-анализ для клеточного алкилирования K-Ras G12C
Клетки НСС1171 поддерживали в среде RPMI1640, дополненной 10% ФБС. Клетки высевали в 96-луночный планшет при 20000 клеток/лунка, и на следующие сутки в клетки добавляли соединения. Через 18 часов при 37°С клетки лизировали в буфере RIPA (Sigma R0278) с 0,5% ДСН и коктейлем ингибиторов протеазы/фосфатазы. После тщательного перемешивания для обеспечения полного лизиса лизаты просветляли путем центрифугирования перед тем, как перенести из каждой лунки по 20 мкл и объединить с загрузочным буфером и восстанавливающим агентом. После нагревания в течение 10 минут при 95°С по 15 мкл каждого образца загружали в 4-20% трис-глициновый гель и проводили электрофорез при 110 В в течение 165 минут в подвижном буфере ДСН-ПААГ. Гели переносили на нитроцеллюлозную мембрану, блокировали в течение 1 часа и окрашивали в течение ночи при 4°С первичным антителом против K-Ras (поликлональное Proteintech 12063-1-АР). Потом мембрану тщательно промывали и проводили контрокрашивание антикроличьим красителем IRDye 800CW (LI-COR 926-32211) в течение одного часа при комнатной температуре. После конечных промывок мембрану визуализировали на LI-COR Odyssey CLx при среднем разрешении. Алкилированный K-Ras был виден по электрофоретическому сдвигу относительно немодифицированного K-Ras. Для количественной оценки этого эффекта использовали программное обеспечение LICOR для того, чтобы очертить прямоугольник вокруг алкилированных и неалкилированных полос для каждой лунки, и измеряли общую интенсивность флуоресценции (ИФ) в каждой из этих полос. После этого для расчета % алкилирования использовали следующую формулу: ИФ(алкилированный) / (ИФ(алкилированный)+ИФ(неалкилированный))*100 для каждой лунки.
Для определения IC50 для каждого соединения использовали 7-точечную кривую доза - ответ. Данные клеточного алкилирования представлены ниже в Таблице 2.
В Таблице 3 приведены результаты описанных выше анализа ГФВР и Вестерн-блот-анализа.
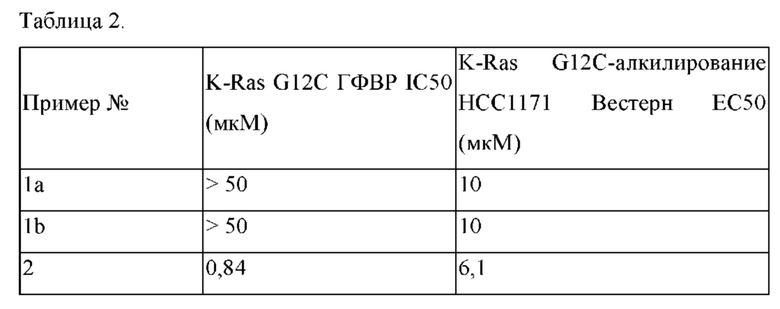

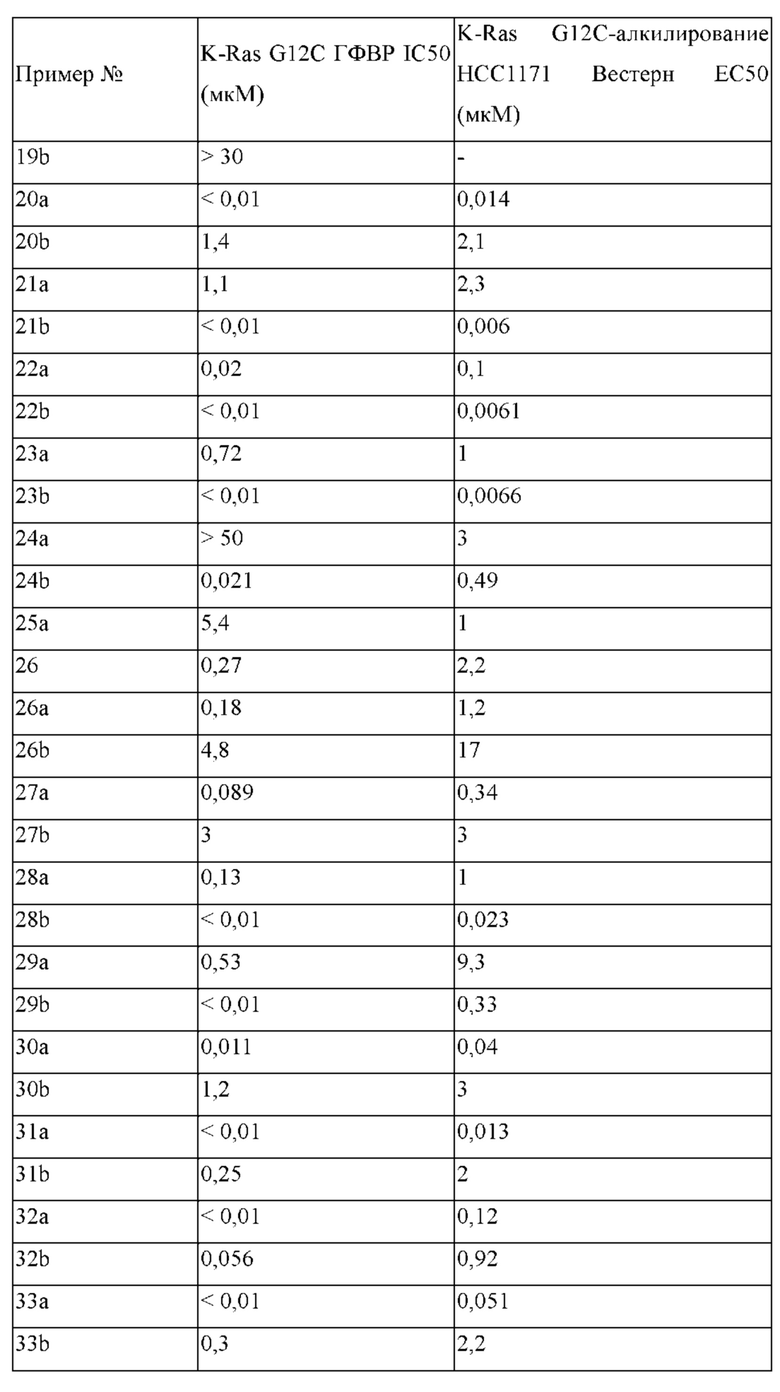
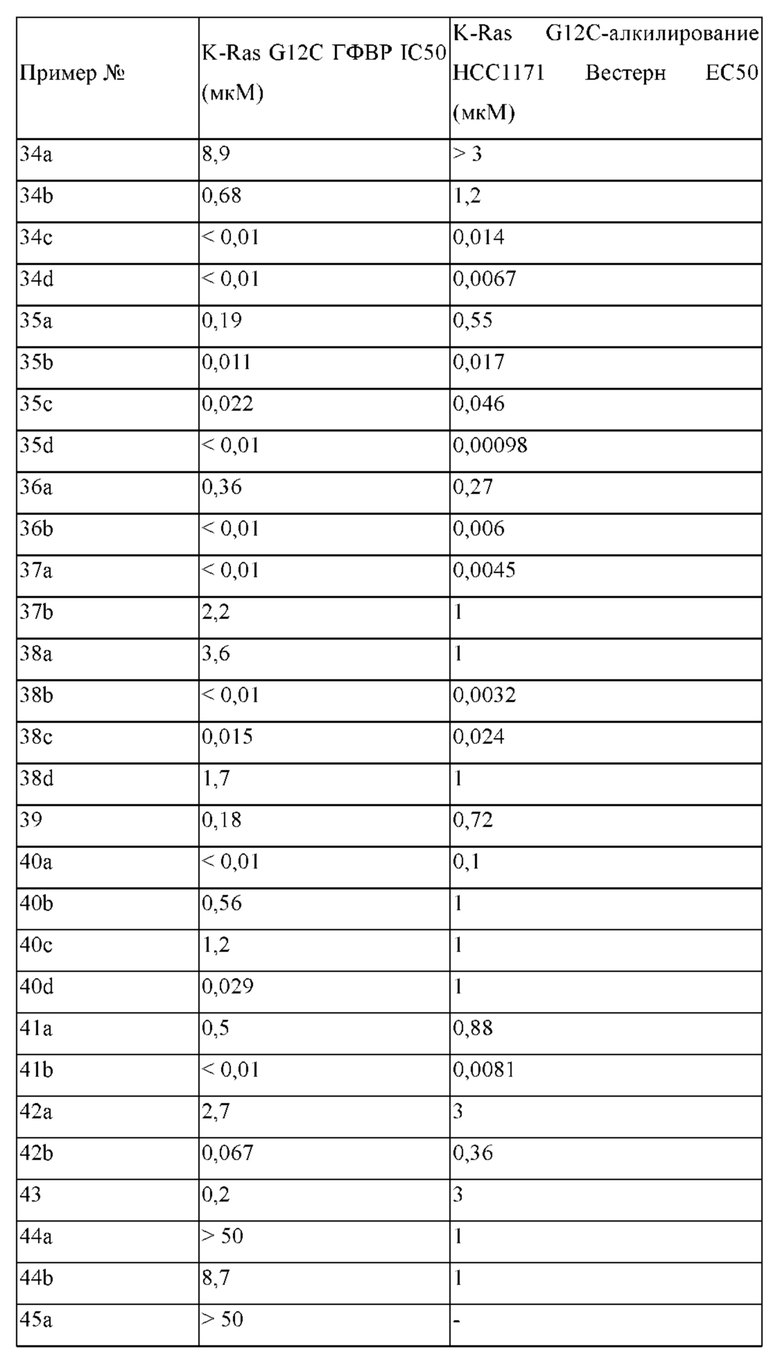


Анализ стабильности цельной крови
Анализ стабильности цельной крови проводили, используя свежую кровь с конечной концентрацией лекарственного препарата 1 мкМ. Смесь лекарственный препарат - кровь перемешивали при 37°С в течение 180 минут. Время полужизни афатиниба и других тестируемых соединений приведено в Таблице 3.

CTG-анализ жизнеспособности и избирательности K-Ras G12C в 3D культуре
Оценка пролиферации может позволить оценить эффект соединений на жизнеспособность и специфичность для обусловленных K-Ras G12C раковых клеточных линий. Оценку пролиферации проводили, используя 3 G12C-о6условленные (Н358, НСС1171 и НСС1792) и 2 не-С12С-обусловленные (РС-9 и А427) линии в ультранизких планшетах для присоединения, чтобы стимулировать рост 3D-сфероидов. На 1 сутки в 384-луночные черные ультранизкие планшеты для присоединения с прозрачным круглым дном (Corning 3830) высевали по 1000 клеток на лунку в 50 мкл среды RPMI1640, дополненной 10% ФБС и 2 мМ L-глутамина. На следующие сутки добавляли различные концентрации соединений, используя титрование по типу доза - ответ, начиная с 20 мкМ и поддерживая конечное количество ДМСО постоянным на 0,3%. Через семь суток после добавления соединений определяли количество жизнеспособных клеток путем добавления 40 мкл 3D-реагента CTG (Promega G9683), который лизирует клетки и генерирует сигнал люциферазы, пропорциональный количеству высвобождаемого АТФ. Планшеты интенсивно встряхивали в течение 25 минут. Потом планшеты инкубировали в течение дополнительных 10 минут. Потом планшеты кратко центрифугировали перед считыванием люминесценции на планшет-ридере Envision (Perkin Elmer). Люминесценцию из лунок, обработанных одним ДМСО, использовали для определения общей пролиферации, а 1 мкМ стауроспорина использовали для определения 100% ингибирования.
Признаки, раскрытые в вышеизложенном описании или нижеприведенной формуле изобретения, выраженные в конкретных формах или в терминах средств для осуществления раскрытой функции, или способа или процесса для достижения раскрытого результата, при необходимости, можно отдельно или в виде комбинации таких признаков использовать для реализации изобретения в его разнообразных формах.
Вышеизложенное изобретение было подробно описано посредством иллюстрации и примера в целях ясности и понимания. Для специалиста в данной области техники будет очевидно, что на практике можно реализовать изменения и модификации в рамках объема прилагаемой формулы изобретения. Следовательно, следует понимать, что вышеприведенное описание предназначено для иллюстрации, а не для ограничения. Следовательно, объем изобретения следует определять не со ссылкой на вышеприведенное описание, но вместо этого его следует определять со ссылкой на нижеприведенную прилагаемую формулу изобретения наряду с полным объемом эквивалентов, на которые имеет право такая формула изобретения.
Патенты, опубликованные заявки и научная литература, цитируемые в данном документе, составляют объем знаний специалистов в данной области техники и в полном объеме включены в данный документ посредством ссылки в той же степени, как если бы были включены явным образом и по отдельности.
| название | год | авторы | номер документа |
|---|---|---|---|
| БИЦИКЛИЧЕСКИЕ ЛАКТАМЫ И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2016 |
|
RU2827714C1 |
| БИЦИКЛИЧЕСКИЕ ГЕТЕРОЦИКЛИЛЬНЫЕ СОЕДИНЕНИЯ И ИХ ПРИМЕНЕНИЯ | 2020 |
|
RU2811612C2 |
| СОЛИ БИЦИКЛОЗАМЕЩЕННЫХ ПРОИЗВОДНЫХ АЗОПИРАЗОЛОНА, СПОСОБ ИХ ПОЛУЧЕНИЯ И ПРИМЕНЕНИЕ | 2010 |
|
RU2538977C2 |
| ИНГИБИТОРЫ АРГИНАЗЫ И ИХ ТЕРАПЕВТИЧЕСКИЕ ПРИМЕНЕНИЯ | 2011 |
|
RU2586219C2 |
| БИЦИКЛИЧЕСКИЕ ЛАКТАМЫ И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2016 |
|
RU2716136C2 |
| МОДУЛЯТОРЫ MAS-СВЯЗАННОГО РЕЦЕПТОРА G-БЕЛКА X2 И СВЯЗАННЫЕ С НИМИ ПРОДУКТЫ И СПОСОБЫ | 2021 |
|
RU2841536C1 |
| ИНГИБИТОРЫ СЕТР | 2006 |
|
RU2513107C2 |
| МОДУЛЯТОРЫ ПРОТЕОЛИЗА И СООТВЕТСТВУЮЩИЕ СПОСОБЫ ПРИМЕНЕНИЯ | 2019 |
|
RU2805511C2 |
| СОЕДИНЕНИЯ 8-МЕТИЛ-1-ФЕНИЛИМИДАЗО[1, 5-а]ПИРАЗИНА | 2011 |
|
RU2560162C2 |
| ФАРМАЦЕВТИЧЕСКОЕ СРЕДСТВО, СОДЕРЖАЩЕЕ ИНГИБИТОР НАТРИЙЗАВИСИМОГО ПЕРЕНОСЧИКА ФОСФАТА | 2015 |
|
RU2740008C2 |
Изобретение относится к соединению формулы (II) или его фармацевтически приемлемой соли, где R1 представляет собой  где каждый R20 независимо выбран из группы, состоящей из C1-6 алкила, галогена, циклопропила и C1-6 галогеналкила, а р представляет собой 1, 2 или 3; Y1 отсутствует; Y2 представляет собой C(H)(R8); Y3 представляет собой СН; Z1 представляет собой N; Z2 представляет собой C(-L-R10a); Z3 представляет собой N; каждый из R4 и R5 представляет собой водород; R8 выбран из группы, состоящей из Н и C1-6 алкила; -L-R10a выбран из группы, состоящей из
где каждый R20 независимо выбран из группы, состоящей из C1-6 алкила, галогена, циклопропила и C1-6 галогеналкила, а р представляет собой 1, 2 или 3; Y1 отсутствует; Y2 представляет собой C(H)(R8); Y3 представляет собой СН; Z1 представляет собой N; Z2 представляет собой C(-L-R10a); Z3 представляет собой N; каждый из R4 и R5 представляет собой водород; R8 выбран из группы, состоящей из Н и C1-6 алкила; -L-R10a выбран из группы, состоящей из 

 каждый из R13, R14 и R15 представляет собой Н или R13 представляет собой F, а каждый из R14 и R15 представляет собой Н; X представляет собой замещенный или незамещенный пиперазин, где указанный замещенный пиперазин замещен одной группой, выбранной из группы, состоящей из СН3 и CH2CN; n представляет собой 0 и
каждый из R13, R14 и R15 представляет собой Н или R13 представляет собой F, а каждый из R14 и R15 представляет собой Н; X представляет собой замещенный или незамещенный пиперазин, где указанный замещенный пиперазин замещен одной группой, выбранной из группы, состоящей из СН3 и CH2CN; n представляет собой 0 и  представляет одинарную связь или двойную связь. Изобретение также относится к лекарственному средству для лечения рака, опосредованного мутацией белка K-Ras G12C. Технический результат – получены новые соединения, которые могут найти применение в медицине для лечения раковых заболеваний. 21 н. и 30 з.п. ф-лы, 3 табл., 62 пр.
представляет одинарную связь или двойную связь. Изобретение также относится к лекарственному средству для лечения рака, опосредованного мутацией белка K-Ras G12C. Технический результат – получены новые соединения, которые могут найти применение в медицине для лечения раковых заболеваний. 21 н. и 30 з.п. ф-лы, 3 табл., 62 пр.

1. Соединение формулы (II):

или его фармацевтически приемлемая соль;
где:
R1 представляет собой  где каждый R20 независимо выбран из группы, состоящей из C1-6 алкила, галогена, циклопропила и C1-6 галогеналкила, а р представляет собой 1, 2 или 3;
где каждый R20 независимо выбран из группы, состоящей из C1-6 алкила, галогена, циклопропила и C1-6 галогеналкила, а р представляет собой 1, 2 или 3;
Y1 отсутствует;
Y2 представляет собой C(H)(R8);
Y3 представляет собой СН;
Z1 представляет собой N;
Z2 представляет собой C(-L-R10a);
Z3 представляет собой N;
каждый из R4 и R5 представляет собой водород;
R8 выбран из группы, состоящей из Н и C1-6 алкила;
-L-R10a выбран из группы, состоящей из 
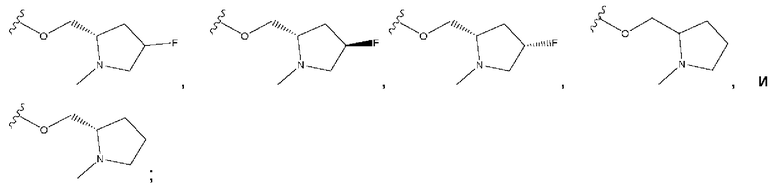
каждый из R13, R14 и R15 представляет собой Н или R13 представляет собой F, а каждый из R14 и R15 представляет собой Н;
X представляет собой замещенный или незамещенный пиперазин, где указанный замещенный пиперазин замещен одной группой, выбранной из группы, состоящей из СН3 и CH2CN;
n представляет собой 0; и
 представляет одинарную связь или двойную связь.
представляет одинарную связь или двойную связь.
2. Соединение по п. 1 или его фармацевтически приемлемая соль, где R20 выбран из группы, состоящей из C1-6 алкила, галогена и C1-6 галогеналкила.
3. Соединение по п. 1 или 2 или его фармацевтически приемлемая соль, где R1 представляет собой 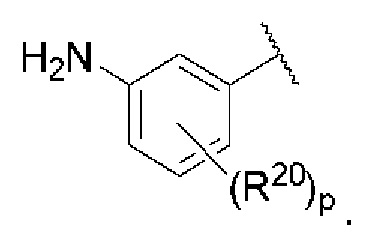
4. Соединение по п. 1 или 2 или его фармацевтически приемлемая соль, где R1 представляет собой 

5. Соединение по п. 4 или его фармацевтически приемлемая соль, где R1 представляет собой 
6. Соединение по п. 5 или его фармацевтически приемлемая соль, где R1 представляет собой: 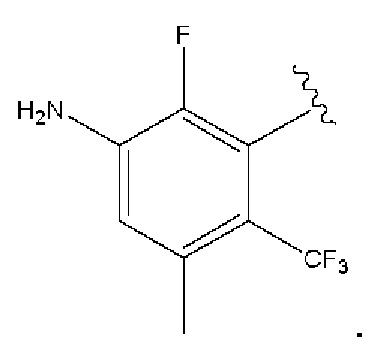
7. Соединение по п. 5 или его фармацевтически приемлемая соль, где R1 представляет собой
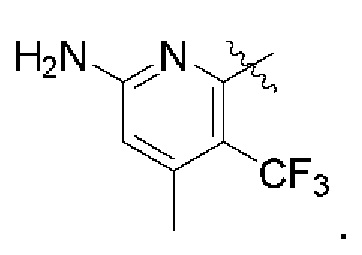
8. Соединение по любому из пп. 1-7 или его фармацевтически приемлемая соль, где R8 выбран из группы, состоящей из Н, метила, этила и изопропила.
9. Соединение по любому из пп. 1-8 или его фармацевтически приемлемая соль, где R8 выбран из группы, состоящей из Н и метила.
10. Соединение по любому из пп. 1-9 или его фармацевтически приемлемая соль, где X выбран из группы, состоящей из:

11. Соединение по п. 1, имеющее формулу, выбранную из группы, состоящей из:
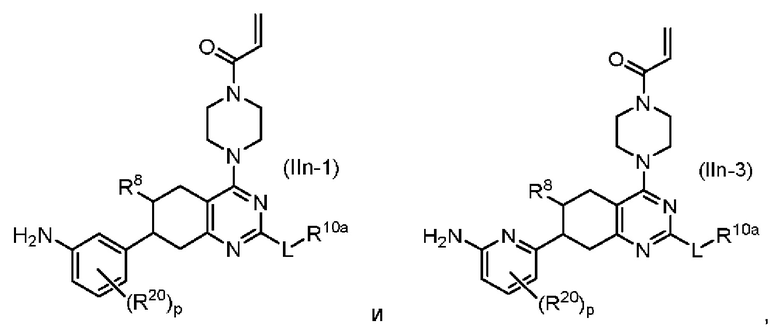
или его фармацевтически приемлемая соль.
12. Соединение по п. 1, имеющее формулу, выбранную из группы, состоящей из:

или его фармацевтически приемлемая соль.
13. Соединение, выбранное из группы, состоящей из:
1-(4-(7-(3-амино-2-фтор-5,6-диметилфенил)-6-метил-2-((1-метилпирролидин-2-ил)метокси)-5,6,7,8-тетрагидрохиназолин-4-ил)-3-метилпиперазин-1-ил)проп-2-ен-1-она (соединение 11);
1-[(3S)-4-[(6S,7S)-7-(3-амино-2-фтор-5,6-диметил-фенил)-6-метил-2-[[(2S)-1-метилпирролидин-2-ил]метокси]-5,6,7,8-тетрагидрохиназолин-4-ил]-3-метилпиперазин-1-ил]проп-2-ен-1-она (соединение 11а);
1-[(3S)-4-[(6R,7R)-7-(3-амино-2-фтор-5,6-диметил-фенил)-6-метил-2-[[(2S)-1-метилпирролидин-2-ил]метокси]-5,6,7,8-тетрагидрохиназолин-4-ил]-3-метилпиперазин-1-ил]проп-2-ен-1-она (соединение 11b);
1-(4-(7-(3-амино-2-фтор-5-метил-6-(трифторметил)фенил)-6-метил-2-((1-метилпирролидин-2-ил)метокси)-5,6,7,8-тетрагидрохиназолин-4-ил)-3-метилпиперазин-1-ил)проп-2-ен-1-она (соединение 12);
1-((S)-4-((6S,7S)-7-(3-амино-2-фтор-5-метил-6-(трифторметил)фенил)-6-метил-2-(((S)-1-метилпирролидин-2-ил)метокси)-5,6,7,8-тетрагидрохиназолин-4-ил)-3-метилпиперазин-1-ил)проп-2-ен-1-она (соединение 12а);
1-((S)-4-((6R,7R)-7-(3-амино-2-фтор-5-метил-6-(трифторметил)фенил)-6-метил-2-(((S)-1-метилпирролидин-2-ил)метокси)-5,6,7,8-тетрагидрохиназолин-4-ил)-3-метилпиперазин-1-ил)проп-2-ен-1-она (соединение 12b);
1-(4-(7-(6-амино-4-метил-3-(трифторметил)пиридин-2-ил)-6-метил-2-((1-метилпирролидин-2-ил)метокси)-5,6,7,8-тетрагидрохиназолин-4-ил)пиперазин-1-ил)проп-2-ен-1-она (соединение 20);
1-(4-((6R,7R)-7-(6-амино-4-метил-3-(трифторметил)пиридин-2-ил)-6-метил-2-(((S)-1-метилпирролидин-2-ил)метокси)-5,6,7,8-тетрагидрохиназолин-4-ил)пиперазин-1-ил)проп-2-ен-1-она (соединение 20а);
1-(4-((6S,7S)-7-(6-амино-4-метил-3-(трифторметил)пиридин-2-ил)-6-метил-2-(((S)-1-метилпирролидин-2-ил)метокси)-5,6,7,8-тетрагидрохиназолин-4-ил)пиперазин-1-ил)проп-2-ен-1-она (соединение 20b);
1-(4-(7-(6-амино-4-метил-3-(трифторметил)пиридин-2-ил)-6-метил-2-((1-метилпирролидин-2-ил)метокси)-5,6,7,8-тетрагидрохиназолин-4-ил)-3-метилпиперазин-1-ил)проп-2-ен-1-она (соединение 21);
1-((S)-4-((6S,7S)-7-(6-амино-4-метил-3-(трифторметил)пиридин-2-ил)-6-метил-2-(((S)-1-метилпирролидин-2-ил)метокси)-5,6,7,8-тетрагидрохиназолин-4-ил)-3-метилпиперазин-1-ил)проп-2-ен-1-она (соединение 21а);
1-((S)-4-((6R,7R)-7-(6-амино-4-метил-3-(трифторметил)пиридин-2-ил)-6-метил-2-(((S)-1-метилпирролидин-2-ил)метокси)-5,6,7,8-тетрагидрохиназолин-4-ил)-3-метилпиперазин-1-ил)проп-2-ен-1-она (соединение 21b);
1-(4-(7-(3-амино-2-фтор-6-(трифторметил)фенил)-6-метил-2-((1-метилпирролидин-2-ил)метокси)-5,6,7,8-тетрагидрохиназолин-4-ил)-3-метилпиперазин-1-ил)проп-2-ен-1-она (соединение 23);
1-((S)-4-((6S,7S)-7-(3-амино-2-фтор-6-(трифторметил)фенил)-6-метил-2-(((S)-1-метилпирролидин-2-ил)метокси)-5,6,7,8-тетрагидрохиназолин-4-ил)-3-метилпиперазин-1-ил)проп-2-ен-1-она (соединение 23а);
1-((S)-4-((6R,7R)-7-(3-амино-2-фтор-6-(трифторметил)фенил)-6-метил-2-(((S)-1-метилпирролидин-2-ил)метокси)-5,6,7,8-тетрагидрохиназолин-4-ил)-3-метилпиперазин-1-ил)проп-2-ен-1-она (соединение 23b);
1-(4-(7-(6-амино-4-метил-3-(трифторметил)пиридин-2-ил)-6-изопропил-2-((1-метилпирролидин-2-ил)метокси)-5,6,7,8-тетрагидрохиназолин-4-ил)-3-метилпиперазин-1-ил)проп-2-ен-1-она (соединение 33);
1-((S)-4-((6S,7R)-7-(6-амино-4-метил-3-(трифторметил)пиридин-2-ил)-6-изопропил-2-(((S)-1-метилпирролидин-2-ил)метокси)-5,6,7,8-тетрагидрохиназолин-4-ил)-3-метилпиперазин-1-ил)проп-2-ен-1-она (соединение 33а);
1-((S)-4-((6R,7S)-7-(6-амино-4-метил-3-(трифторметил)пиридин-2-ил)-6-изопропил-2-(((S)-1-метилпирролидин-2-ил)метокси)-5,6,7,8-тетрагидрохиназолин-4-ил)-3-метилпиперазин-1-ил)проп-2-ен-1-она (соединение 33b);
2-(4-(7-(3-амино-2-фтор-5-метил-6-(трифторметил)фенил)-6-метил-2-((1-метилпирролидин-2-ил)метокси)-5,6,7,8-тетрагидрохиназолин-4-ил)-1-(2-фторакрилоил)пиперазин-2-ил)ацетонитрила (соединение 34);
2-((R)-4-((6R,7R)-7-(3-амино-2-фтор-5-метил-6-(трифторметил)фенил)-6-метил-2-(((S)-1-метилпирролидин-2-ил)метокси)-5,6,7,8-тетрагидрохиназолин-4-ил)-1-(2-фторакрилоил)пиперазин-2-ил)ацетонитрила (соединение 34а);
2-((R)-4-((6S,7S)-7-(3-амино-2-фтор-5-метил-6-(трифторметил)фенил)-6-метил-2-(((S)-1-метилпирролидин-2-ил)метокси)-5,6,7,8-тетрагидрохиназолин-4-ил)-1-(2-фторакрилоил)пиперазин-2-ил)ацетонитрила (соединение 34b);
2-((S)-4-((6R,7R)-7-(3-амино-2-фтор-5-метил-6-(трифторметил)фенил)-6-метил-2-(((S)-1-метилпирролидин-2-ил)метокси)-5,6,7,8-тетрагидрохиназолин-4-ил)-1-(2-фторакрилоил)пиперазин-2-ил)ацетонитрила (соединение 34с);
2-((S)-4-((6S,7S)-7-(3-амино-2-фтор-5-метил-6-(трифторметил)фенил)-6-метил-2-(((S)-1-метилпирролидин-2-ил)метокси)-5,6,7,8-тетрагидрохиназолин-4-ил)-1-(2-фторакрилоил)пиперазин-2-ил)ацетонитрила (соединение 34d);
1-(4-(7-(3-амино-2-фтор-5-метил-6-(трифторметил)фенил)-2-((4-фтор-1-метилпирролидин-2-ил)метокси)-6-метил-5,6,7,8-тетрагидрохиназолин-4-ил)-3-метилпиперазин-1-ил)проп-2-ен-1-она (соединение 36);
1-[(3S)-4-[(6S,7S)-7-[3-амино-2-фтор-5-метил-6-(трифторметил)фенил]-2-[[(2S,4R)-4-фтор-1-метилпирролидин-2-ил]метокси]-6-метил-5,6,7,8-тетрагидрохиназолин-4-ил]-3-метилпиперазин-1-ил]проп-2-ен-1-она (соединение 36а);
1-[(3S)-4-[(6R,7R)-7-[3-амино-2-фтор-5-метил-6-(трифторметил)фенил]-2-[[(2S,4R)-4-фтор-1-метилпирролидин-2-ил]метокси]-6-метил-5,6,7,8-тетрагидрохиназолин-4-ил]-3-метилпиперазин-1-ил]проп-2-ен-1-она (соединение 36b);
1-(4-(7-(3-амино-2-фтор-5-метил-6-(трифторметил)фенил)-6-этил-2-((4-фтор-1-метилпирролидин-2-ил)метокси)-5,6,7,8-тетрагидрохиназолин-4-ил)-3-метилпиперазин-1-ил)проп-2-ен-1-она (соединение 37);
1-[(3S)-4-[(6R,7R)-7-[3-амино-2-фтор-5-метил-6-(трифторметил)фенил]-6-этил-2-[[(2S,4R)-4-фтор-1-метилпирролидин-2-ил]метокси]-5,6,7,8-тетрагидрохиназолин-4-ил]-3-метилпиперазин-1-ил]проп-2-ен-1-она (соединение 37а);
1-[(3S)-4-[(6S,7S)-7-[3-амино-2-фтор-5-метил-6-(трифторметил)фенил]-6-этил-2-[[(2S,4R)-4-фтор-1-метилпирролидин-2-ил]метокси]-5,6,7,8-тетрагидрохиназолин-4-ил]-3-метилпиперазин-1-ил]проп-2-ен-1-она (соединение 37b);
2-(4-(7-(3-амино-2-фтор-5-метил-6-(трифторметил)фенил)-2-((4-фтор-1-метилпирролидин-2-ил)метокси)-6-метил-5,6,7,8-тетрагидрохиназолин-4-ил)-1-(2-фторакрилоил)пиперазин-2-ил)ацетонитрила (соединение 38);
2-((R)-4-((6S,7S)-7-(3-амино-2-фтор-5-метил-6-(трифторметил)фенил)-2-(((2S,4R)-4-фтор-1-метилпирролидин-2-ил)метокси)-6-метил-5,6,7,8-тетрагидрохиназолин-4-ил)-1-(2-фторакрилоил)пиперазин-2-ил)ацетонитрила (соединение 38а);
2-((S)-4-((6R,7R)-7-(3-амино-2-фтор-5-метил-6-(трифторметил)фенил)-2-(((2S,4R)-4-фтор-1-метилпирролидин-2-ил)метокси)-6-метил-5,6,7,8-тетрагидрохиназолин-4-ил)-1-(2-фторакрилоил)пиперазин-2-ил)ацетонитрила (соединение 38b);
2-((R)-4-((6R,7R)-7-(3-амино-2-фтор-5-метил-6-(трифторметил)фенил)-2-(((2S,4R)-4-фтор-1-метилпирролидин-2-ил)метокси)-6-метил-5,6,7,8-тетрагидрохиназолин-4-ил)-1-(2-фторакрилоил)пиперазин-2-ил)ацетонитрила (соединение 38с);
2-((S)-4-((6S,7S)-7-(3-амино-2-фтор-5-метил-6-(трифторметил)фенил)-2-(((2S,4R)-4-фтор-1-метилпирролидин-2-ил)метокси)-6-метил-5,6,7,8-тетрагидрохиназолин-4-ил)-1-(2-фторакрилоил)пиперазин-2-ил)ацетонитрила (соединение 38d);
1-(4-(7-(6-амино-3-(трифторметил)пиридин-2-ил)-6-метил-2-((1-метилпирролидин-2-ил)метокси)-5,6,7,8-тетрагидрохиназолин-4-ил)-3-метилпиперазин-1-ил)проп-2-ен-1-она (соединение 41);
1-((S)-4-((6S,7S)-7-(6-амино-3-(трифторметил)пиридин-2-ил)-6-метил-2-(((S)-1-метилпирролидин-2-ил)метокси)-5,6,7,8-тетрагидрохиназолин-4-ил)-3-метилпиперазин-1-ил)проп-2-ен-1-она (соединение 41а); или
1-((S)-4-((6R,7R)-7-(6-амино-3-(трифторметил)пиридин-2-ил)-6-метил-2-(((S)-1-метилпирролидин-2-ил)метокси)-5,6,7,8-тетрагидрохиназолин-4-ил)-3-метилпиперазин-1-ил)проп-2-ен-1-она (соединение 41b);
или его фармацевтически приемлемая соль.
14. Соединение по п. 13, выбранное из группы, состоящей из:
1-[(3S)-4-[(6R,7R)-7-(3-амино-2-фтор-5,6-диметил-фенил)-6-метил-2-[[(2S)-1-метилпирролидин-2-ил]метокси]-5,6,7,8-тетрагидрохиназолин-4-ил]-3-метилпиперазин-1-ил]проп-2-ен-1-она (соединение 11b);
1-((S)-4-((6R,7R)-7-(3-амино-2-фтор-5-метил-6-(трифторметил)фенил)-6-метил-2-(((S)-1-метилпирролидин-2-ил)метокси)-5,6,7,8-тетрагидрохиназолин-4-ил)-3-метилпиперазин-1-ил)проп-2-ен-1-она (соединение 12b);
1-(4-((6R,7R)-7-(6-амино-4-метил-3-(трифторметил)пиридин-2-ил)-6-метил-2-(((S)-1-метилпирролидин-2-ил)метокси)-5,6,7,8-тетрагидрохиназолин-4-ил)пиперазин-1-ил)проп-2-ен-1-она (соединение 20а);
1-((S)-4-((6R,7R)-7-(6-амино-4-метил-3-(трифторметил)пиридин-2-ил)-6-метил-2-(((S)-1-метилпирролидин-2-ил)метокси)-5,6,7,8-тетрагидрохиназолин-4-ил)-3-метилпиперазин-1-ил)проп-2-ен-1-она (соединение 21b);
1-((S)-4-((6R,7R)-7-(3-амино-2-фтор-6-(трифторметил)фенил)-6-метил-2-(((S)-1-метилпирролидин-2-ил)метокси)-5,6,7,8-тетрагидрохиназолин-4-ил)-3-метилпиперазин-1-ил)проп-2-ен-1-она (соединение 23b);
1-((S)-4-((6S,7R)-7-(6-амино-4-метил-3-(трифторметил)пиридин-2-ил)-6-изопропил-2-(((S)-1-метилпирролидин-2-ил)метокси)-5,6,7,8-тетрагидрохиназолин-4-ил)-3-метилпиперазин-1-ил)проп-2-ен-1-она (соединение 33а);
2-((S)-4-((6R,7R)-7-(3-амино-2-фтор-5-метил-6-(трифторметил)фенил)-6-метил-2-(((S)-1-метилпирролидин-2-ил)метокси)-5,6,7,8-тетрагидрохиназолин-4-ил)-1-(2-фторакрилоил)пиперазин-2-ил)ацетонитрила (соединение 34с);
2-((S)-4-((6S,7S)-7-(3-амино-2-фтор-5-метил-6-(трифторметил)фенил)-6-метил-2-(((S)-1-метилпирролидин-2-ил)метокси)-5,6,7,8-тетрагидрохиназолин-4-ил)-1-(2-фторакрилоил)пиперазин-2-ил)ацетонитрила (соединение 34d);
1-[(3S)-4-[(6R,7R)-7-[3-амино-2-фтор-5-метил-6-(трифторметил)фенил]-2-[[(2S,4R)-4-фтор-1-метилпирролидин-2-ил]метокси]-6-метил-5,6,7,8-тетрагидрохиназолин-4-ил]-3-метилпиперазин-1-ил]проп-2-ен-1-она (соединение 36b);
1-[(3S)-4-[(6R,7R)-7-[3-амино-2-фтор-5-метил-6-(трифторметил)фенил]-6-этил-2-[[(2S,4R)-4-фтор-1-метилпирролидин-2-ил]метокси]-5,6,7,8-тетрагидрохиназолин-4-ил]-3-метилпиперазин-1-ил]проп-2-ен-1-она (соединение 37а);
2-((S)-4-((6R,7R)-7-(3-амино-2-фтор-5-метил-6-(трифторметил)фенил)-2-(((2S,4R)-4-фтор-1-метилпирролидин-2-ил)метокси)-6-метил-5,6,7,8-тетрагидрохиназолин-4-ил)-1-(2-фторакрилоил)пиперазин-2-ил)ацетонитрила (соединение 38b); или
1-((S)-4-((6R,7R)-7-(6-амино-3-(трифторметил)пиридин-2-ил)-6-метил-2-(((S)-1-метилпирролидин-2-ил)метокси)-5,6,7,8-тетрагидрохиназолин-4-ил)-3-метилпиперазин-1-ил)проп-2-ен-1-она (соединение 41b);
или его фармацевтически приемлемая соль.
15. Соединение по п. 14, выбранное из группы, состоящей из:
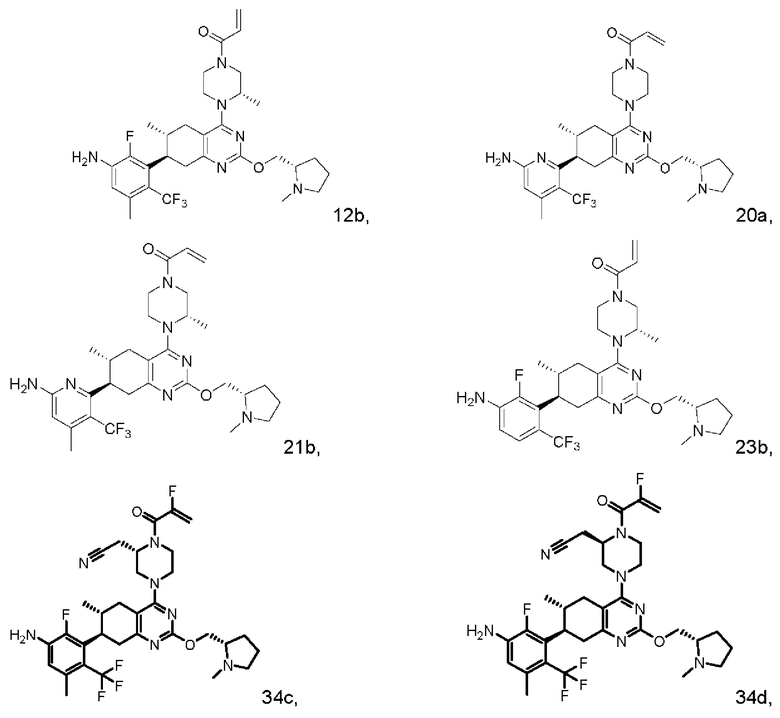

или его фармацевтически приемлемая соль.
16. Соединение по п. 15, выбранное из группы, состоящей из:
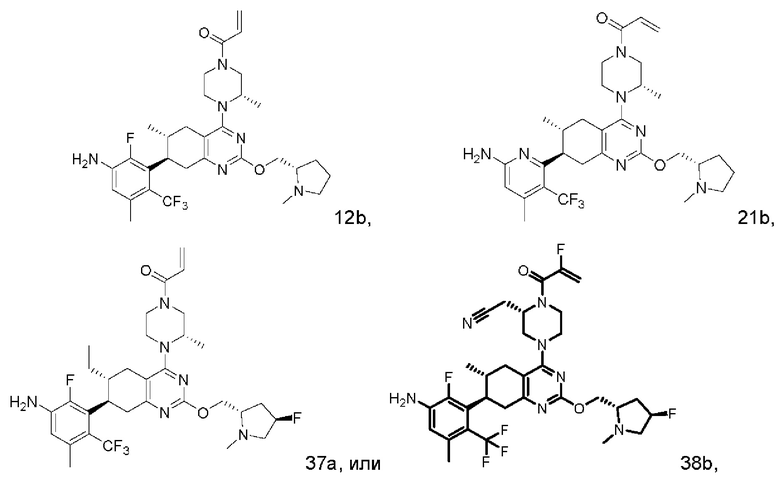
или его фармацевтически приемлемая соль.
17. Соединение формулы:
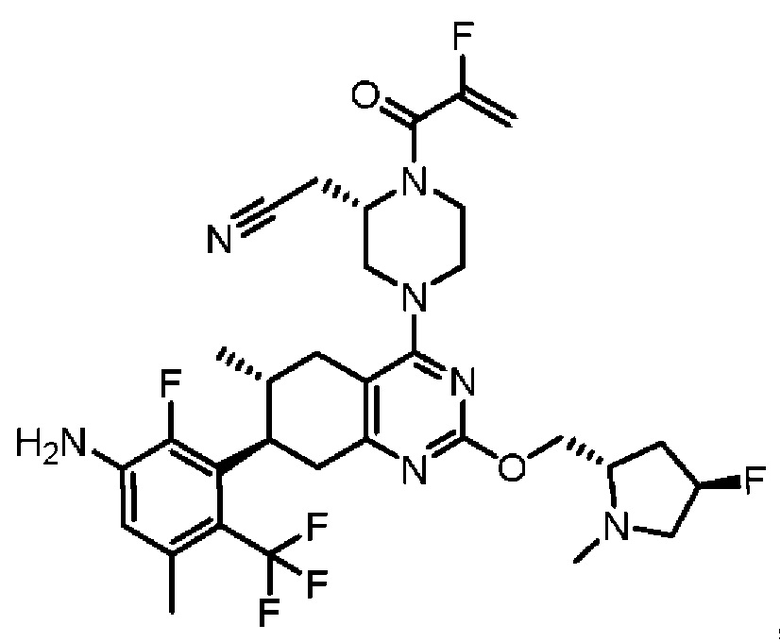
или его фармацевтически приемлемая соль.
18. Соединение по п. 17, которое представляет собой:

19. Соединение по п. 17, которое представляет собой фармацевтически приемлемую соль соединения формулы:
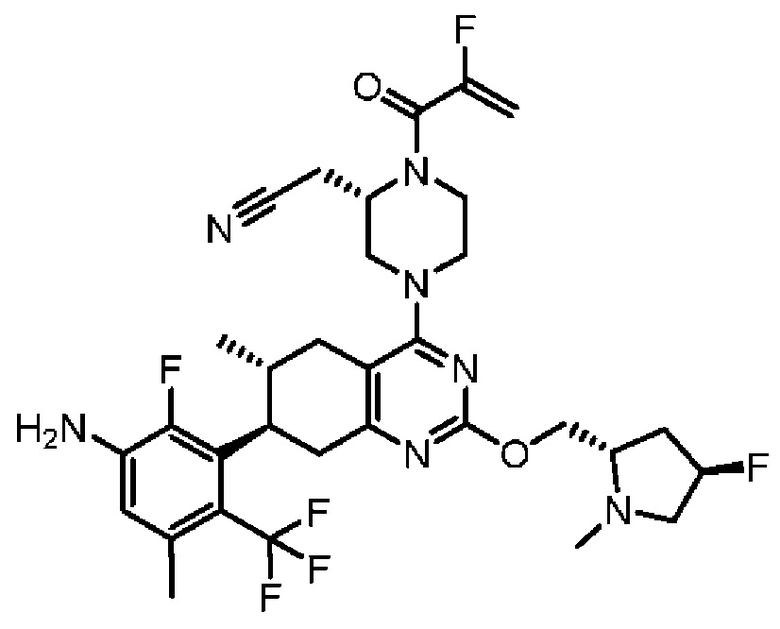
20. Соединение, имеющее формулу:

или его фармацевтически приемлемая соль.
21. Соединение по п. 20, которое представляет собой
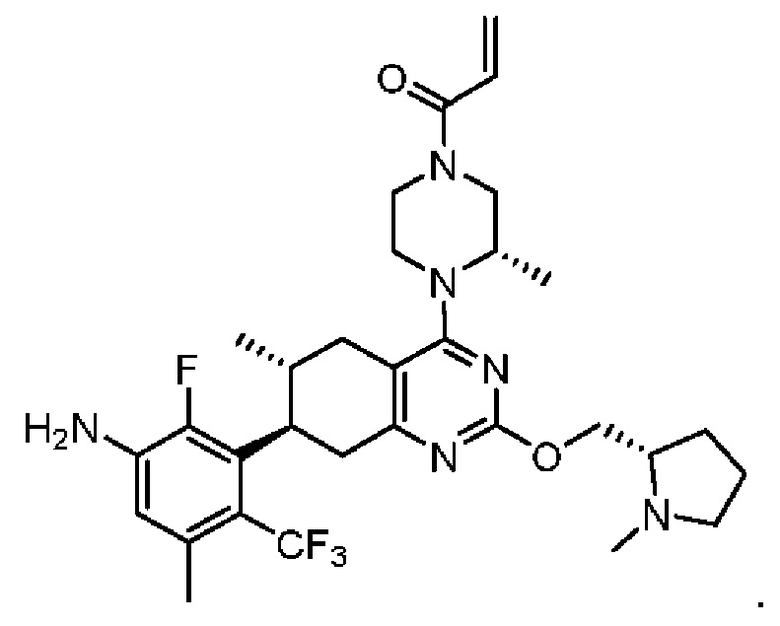
22. Соединение по п. 20, которое представляет собой фармацевтически приемлемую соль соединения формулы

23. Соединение формулы

или его фармацевтически приемлемая соль.
24. Соединение по п. 23, которое представляет собой

25. Соединение по п. 23, которое представляет собой фармацевтически приемлемую соль соединения, имеющего формулу

26. Соединение формулы
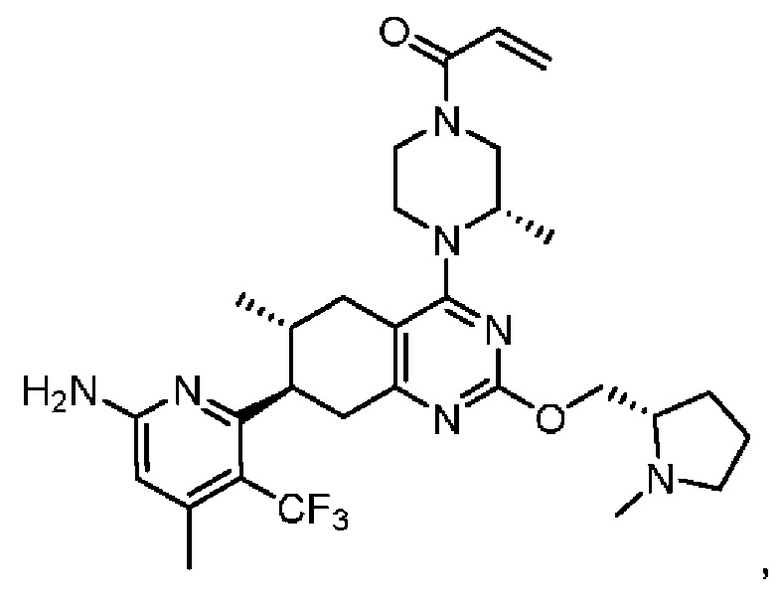
или его фармацевтически приемлемая соль.
27. Соединение по п. 26, которое представляет собой

28. Соединение по п. 26, которое представляет собой фармацевтически приемлемую соль соединения, имеющего формулу
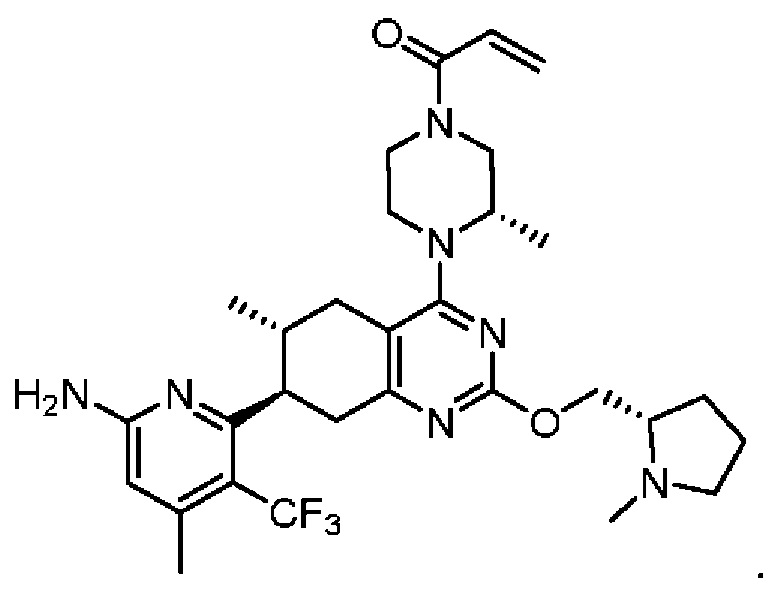
29. Соединение формулы

или его фармацевтически приемлемая соль.
30. Соединение по п. 29, которое представляет собой

31. Соединение по п. 29, которое представляет собой фармацевтически приемлемую соль соединения формулы
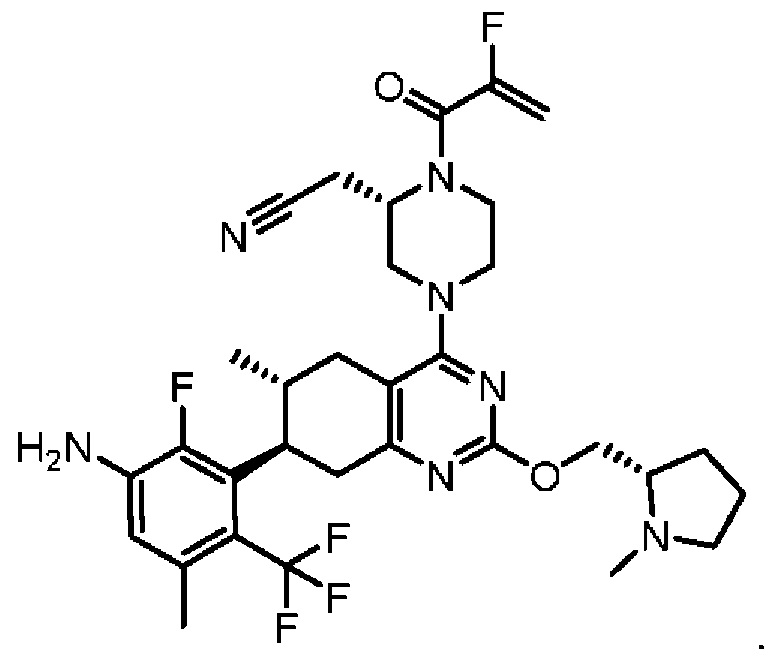
32. Соединение формулы

или его фармацевтически приемлемая соль.
33. Соединение по п. 32, которое представляет собой

34. Соединение по п. 32, которое представляет собой фармацевтически приемлемую соль соединения формулы
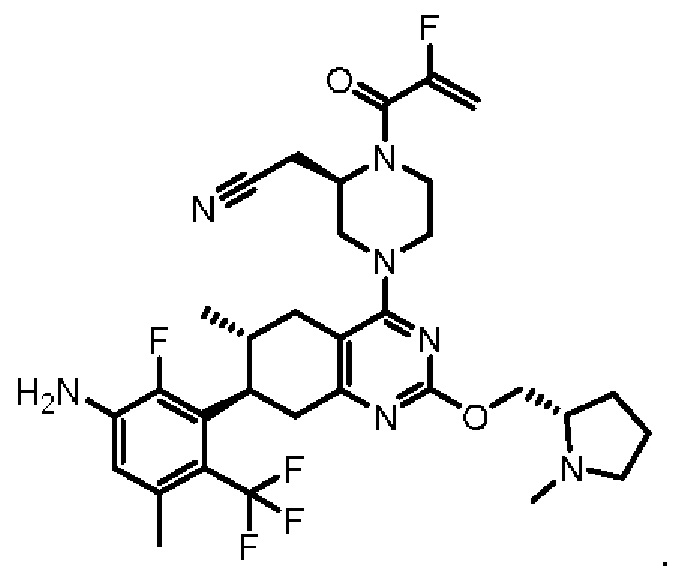
35. Соединение формулы
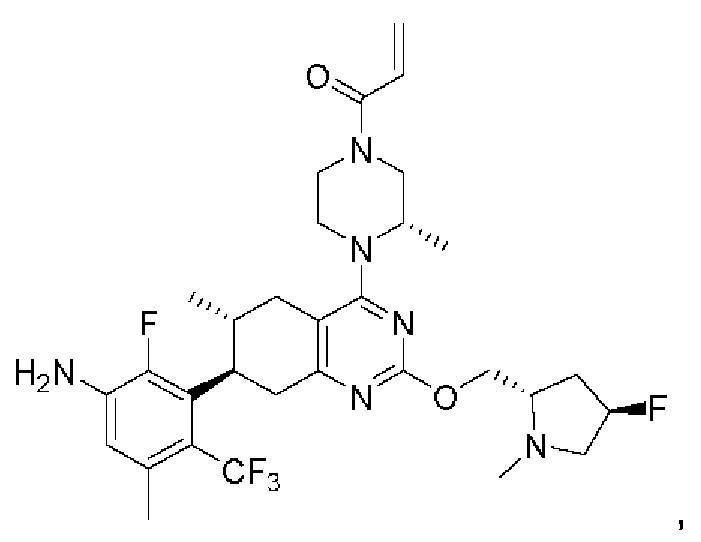
или его фармацевтически приемлемая соль.
36. Соединение по п. 35, которое представляет собой

37. Соединение по п. 35, которое представляет собой фармацевтически приемлемую соль соединения формулы

38. Способ ингибирования активности мутантного белка K-Ras G12C, включающий осуществление реакции мутантного белка с соединением по любому из пп. 1-36 или его фармацевтически приемлемой солью.
39. Агент для ингибирования активности мутантного белка K-Ras G12C, содержащий соединение по любому из пп. 1-37 или его фармацевтически приемлемую соль.
40. Способ ингибирования пролиферации клеточной популяции, содержащей мутантный белок K-Ras G12C, включающий приведение клеточной популяции в контакт с соединением по любому из пп. 1-37 или его фармацевтически приемлемой солью.
41. Агент для ингибирования пролиферации клеточной популяции, содержащей мутантный белок K-Ras G12C, содержащий соединение по любому из пп. 1-37 или его фармацевтически приемлемую соль.
42. Лекарственное средство для лечения рака, опосредованного мутацией K-Ras G12C, у индивида, имеющего такой рак и указанную мутацию, содержащее соединение по любому из пп. 1-37 или его фармацевтически приемлемую соль.
43. Лекарственное средство для лечения рака, опосредованного мутацией K-Ras G12C, у индивида, у которого было определено наличие указанной мутации, содержащее соединение по любому из пп. 1-37 или его фармацевтически приемлемую соль.
44. Лекарственное средство по п. 43, где рак представляет собой рак легких, колоректальный рак, рак аппендикса или рак поджелудочной железы.
45. Лекарственное средство для лечения рака легких, содержащего мутацию K-Ras G12C, у индивида, имеющего такой рак, содержащее соединение по любому из пп. 1-37 или его фармацевтически приемлемую соль.
46. Лекарственное средство по п. 45, где рак представляет собой немелкоклеточный рак легкого (НМРЛ).
47. Способ получения меченого мутантного белка K-Ras G12C, включающий осуществление реакции мутантного белка K-Ras G12C с соединением по любому из пп. 1-37 или его фармацевтически приемлемой солью для получения меченого мутантного белка K-Ras G12C.
48. Лекарственное средство для опухоль-агностического лечения рака у нуждающегося в этом индивида, имеющего опухоль с мутацией G12C в белке K-Ras в опухоли, содержащее соединение по любому из пп. 1-37 или его фармацевтически приемлемую соль.
49. Лекарственное средство для лечения опухоль-агностического рака, опосредованного K-Ras G12C, содержащее соединение по любому из пп. 1-37 или его фармацевтически приемлемую соль, у пациента с предполагаемым диагностированным раком.
50. Лекарственное средство для лечения рака, опосредованного мутацией K-Ras G12C, содержащее соединение по любому из пп. 1-37 или его фармацевтически приемлемую соль.
51. Лекарственное средство для ингибирования метастазов опухоли, опосредованной мутацией K-Ras G12C, содержащее соединение по любому из пп. 1-37 или его фармацевтически приемлемую соль.
| WO 2017201161 A1, 23.11.2017 | |||
| US 20020025968 A1, 28.02.2002 | |||
| WO 2017087528 A1, 26.05.2017 | |||
| Станок для изготовления бетонных и т.п. труб с арматурой | 1931 |
|
SU26611A1 |
| WO 2019155399 A1, 15.08.2019. | |||
Авторы
Даты
2022-11-14—Публикация
2019-08-15—Подача