Изобретение относится к области биотехнологии, ветеринарной микробиологии, иммунологии, вакцинологии и производству вакцин против лептоспироза лошадей, а именно к способу изготовления вакцины поливалентной против лептоспироза лошадей для ее усовершенствования.
Лептоспироз (лат. Leptospirosis) - природно-очаговая инфекционное заболевание человека и животных, относящаяся к убиквитарным инфекциям.
Возбудитель болезни - грамотрицательная бактерия рода Leptospira, лептоспиры относятся к классу Spirochaetes, порядку Spirochaetales, семейству Spirochaetaceae. В настоящее время классическая традиционная серологическая классификация насчитывает более 300 наименований сероваров лептоспир, которые объединены в 29 серологических группы в соответствии с антигенным родством [4]. Согласно генно-инженерной системе классификации, основанной на методе ДНК-ДНК гибридизации, известно о 21-ном виде лептоспир, которые разделены на три эволюционные ветви: 1) патогенные виды; 2) промежуточные (патогенно-подобные виды), 3) сапрофиты [1].
Источниками возбудителя инфекции являются более 130 видов животных (сельскохозяйственных, домашних и диких). В России лептоспироз у лошадей, в большинстве случаев, проявляется лихорадкой, желтушным окрашиванием слизистых оболочек и кожи, атонией желудочно-кишечного тракта. Преимущественно болезнь протекает бессимптомно, в виде лептоспироносительства, болеют животные всех возрастов, однако молодые переносят заболевание крайне тяжело, выздоровление длится долго. У кобыл возможны аборты в поздней стадии жеребости [2, 3].
В типичных случаях наблюдаются следующие клинические признаки болезни: резкое повышение температуры тела, кратковременная лихорадка, сильнейшая мышечная слабость, болезненность мышц, проявляются конъюнктивит, припухлость век, желтуха, гемоглобинурия, некроз кожи (данный клинический признак имеет патогномоничное значение) [3-5].
В России инфицированность лошадей лептоспирами остается достаточно высокой и составляет 6-9%. Летальность молодняка лошадей при лептоспирозе достигает в среднем 33%, при острой форме болезни - до 40-60%, в ряде научных сообщений указываются данные о 65-90%-ной летальности. По данным Информационно-аналитического центра Управления Ветнадзора ФГБУ «Федеральный центр охраны здоровья животных», в 2019 году в стране выявлено 33 неблагополучных пункта по лептоспирозу лошадей, в 2020 году - 37, в которых содержались 238 и 248 больных животных, соответственно [6].
Специфическая иммунизация животных противолептоспирозными вакцинами является основным методом профилактики и борьбы с лептоспирозом. Вакцину против лептоспироза животных применяют в неблагополучных хозяйствах и регионах, при выпасе в зоне природного очага лептоспироза, при выявлении в хозяйствах животных, сыворотка крови которых положительно реагирует на лептоспироз в реакции микроагглютинации (РМА) [1].
Применение вакцины позволяет профилактировать клинические проявления лептоспироза, включая аборты, лептоспироносительство и образование интенсивного очага лептоспироза. Вакцинации подлежат клинически здоровые животные [7].
Процесс изготовления инактивированной эмульсионной вакцины против лептоспироза лошадей состоит из следующих технологических этапов: культивирование производственных штаммов лептоспир в питательной среде,
- очистка бактериальной суспензии от балластных примесей,
- инактивирование бактериальной суспензии лептоспир,
- концентрирование полученного антигена лептоспир,
- соединение концентрированных антигенов лептоспир с адъювантом. В настоящее время существуют вакцины против лептоспироза
животных. Известен способ изготовления вакцины против лептоспироза животных концентрированной масляной в двух вариантах. Первый вариант включает в свой состав штаммы следующих серогрупп: «Ротопа», «Tarassovi», «Icterohaemorrhagiae», «Grippotyphosa», «Sejroe» (серовар Hardjo), «Canicola». Второй вариант вакцины состоит из штаммов следующих серогрупп возбудителей лептоспироза лошадей: «Ротопа», «Tarassovi», «Icterohaemorrhagiae», «Grippotyphosa», «Sejroe» (серовар Hardjo). Данная вакцина содержит в качестве антигена штаммы возбудителя лептоспироза лошадей, инактивированного формальдегидом и диспергированных в водно-масляной эмульсии. Следует отметить, что формальдегид является опасным альдегидом, способным вызывать аллергические реакции и повышенную токсичность. При использовании данной вакцины у отдельных животных может отмечаться повышение температуры тела на 0,5°С, некоторое угнетение и временный отказ от корма [2, 3, 4, 7, 8, 9].
Известен способ изготовления вакцины поливалентной «ВГНКИ» против лептоспироза животных» (I и II варианты). Первый вариант вакцины включает в свой состав штаммы следующих серогрупп: «Ротопа», «Tarassovi», «Icterohaemorrhagiae», а второй - «Ротопа», «Tarassovi», «Grippotyphosa», «Sejroe» (серовар Hardjo). Вакцина изготовлена из инактивированных культур лептоспир с добавлением формальдегида в качестве инактивирующего вещества (в концентрации 0,25%) и геля гидрата окиси алюминия в качестве адъюванта (в концентрации 30%). Недостатком данного способа является то, что вакцина обладает повышенной реактогенностью (в инструкции по применению вакцины отмечено, что у отдельных животных после введения вакцины могут наблюдаться угнетенное состояние, учащенное дыхание, снижение аппетита и кратковременное повышение температуры тела) [10].
Известна вакцина против лептоспироза животных инактивированная Лептопро (изготовитель Россия), которая включает в свой состав штаммы следующих серогрупп возбудителя лептоспироза: «Ротопа», «Tarassovi», «Icterohaemorrhagiae», «Grippotyphosa» и «Canicola». Вакцина изготовлена из смеси бактерий производственных штаммов лептоспир, инактивированных формальдегидом с добавлением адъюванта геля гидрата окиси алюминия (20%). Изготовитель указывает на возможные осложнения у животного, а именно, проявление аллергических реакций у лошадей и других видов животных. На месте инъекции возможно образование легкой припухлости, которая исчезает через 2-3 недели, (рекомендуется применять антигистаминные препараты (димедрол, кофеин, хлористый кальций и др.) [11].
Наиболее близким прототипом предлагаемой вакцины является вакцина против лептоспироза лошадей концентрированная и способ ее получения. Вакцина изготовлена из селекционированных инактивированных штаммов лептоспир пяти серологических групп по 16% каждого из штаммов следующих серогрупп: «Ротопа», «Tarassovi», «Icterohaemorrhagiae», «Grippotyphosa» и «Canicola» с общей концентрацией не менее 1 × 109 м.к. /доза (м.к. - микробные клетки), смешанных с адъювантом (20% по массе). Недостатком данной вакцины является то, что в препарате в качестве адъюванта используется гидроокись алюминия. Изготовитель вакцины ООО «ВетБиоХим» и ряд владельцев лошадей указывают на возможные у животного побочные действия и проявления препарата на месте инъекции в виде припухлости и аллергических реакций [12].
В связи с наличием недостатков, представленных выше, целесообразно разработать способ изготовления вакцины поливалентной против лептоспироза лошадей. В связи с вышеуказанными рисками является актуальным разработка безопасной вакцины против лептоспироза лошадей с низкой реактогенностью и выраженными иммуногенными свойствами.
Данный способ позволяет устранить недостатки, связанные с негативным влиянием на состояние здоровья лошадей и повышения эффективности применяемого препарата. Исходя из этого, целесообразно предложить способ изготовления вакцины поливалентной против лептоспироза лошадей с использованием альтернативного варианта адъюванта.
Задачей настоящего изобретения является разработка способа изготовления вакцины поливалентной против лептоспироза лошадей с использованием альтернативного варианта адъюванта с целью устранения вышеуказанных недостатков.
Данная задача решена благодаря созданию нового способа изготовления вакцины поливалентной против лептоспироза лошадей. Предложенный способ позволяет получать более эффективный вакцинный препарат против лептоспироза лошадей, который включает в свой состав гидрогелевый адъювант, оптимальный по токсичности и эффективности, и с низкой себестоимостью, а в качестве антигена - культуры штаммов пяти серогрупп лептоспир: «Leptospira Grippotyphosa» (ВГНКИ-1); «Leptospira Icterohaemorrhagiae» (ВГНКИ-2), «Leptospira Tarassovi» (ВГНКИ-4); «Leptospira Ротопа» (ВГНКИ-6); «Leptospira Canicola» (ВГНКИ-3), доминирующих в популяции лошадей на территории Российской Федерации. Наличие в составе вакцины инновационного гидрогелевого адъюванта Montanide GEL 01, обладающего пониженной реактогенностью на живой организм и широко не применяемого в отечественной ветеринарной биопромышленности, использование в качестве антигена серогрупп лептоспир, доминирующих в популяции лошадей, являлось основанием для создания нового биологического препарата с целью профилактики лептоспироза лошадей.
Сущность изобретения заключается в том, что новая поливалентная вакцина против лептоспироза лошадей содержит в качестве адъюванта Montanide GEL 01 (Seppic, Франция), инновационный препарат на основе высокомолекулярного полиакрилового полимера, диспергированного в воде, в качестве антигенов - смесь инактивированных формальдегидом концентрированных очищенных культур пяти следующих серологических групп лептоспир: «Ротопа», «Grippotyphosa», «Icterohaemorrhagiae», «Tarassovi» и «Canicola», доминирующих в популяции лошадей на территории Российской Федерации.
Неспецифические стимуляторы иммуногенеза - адъювантные вещества, обеспечивают эффективную специфическую защиту организма животных при наименьшем количестве антигена в вакцинном препарате. Адъюванты способствуют накоплению антигена в том месте, где он экспонируется лимфоцитами, создавая эффект «депо», и вызывают синтез цитокинов, регулирующих лимфоцитарные функции. В качестве адъюванта предлагается применять гидрогелевый адъювант Montanide GEL 01, который представляет собой белый, непрозрачный и текучий гель, обладающий низкой вязкостью, прост в использовании, известный ранее как PET GEL А [13]. В настоящее время Montanide GEL 01 в ветеринарной биологической промышленности Российской Федерации еще практически не применяется.
Предлагаемый способ позволяет разработать поливалентную вакцину для иммунизации лошадей против лептоспироза с использованием инновационного гидрогелевого адъюванта Montanide GEL 01, обладающего пониженной реактогенностью на живой организм и высокой иммуногенностью.
Технический результат заключается в создании нового вакцинного препарата против лептоспироза лошадей с применением масляного адъюванта оптимального по токсичности и эффективности.
В отличие от прототипа разработанный способ включает 9 следующих этапов исследования:
1 этап - Изготовление лептоспирозного антигена: культивирование производственных штаммов лептоспир, их инактивация и концентрирование.
2 этап - Подбор процентного соотношения между адъювантом и антигеном.
3 этап - Изучение реактогенности адъюванта на лабораторных животных (белые мыши).
4 этап - Оценка пирогенности адъюванта на лабораторных животных (кролики).
5 этап - Изготовление экспериментальных образцов эмульсионных вакцин.
6 этап - Определение типа полученной эмульсии.
7 этап - Контроль стабильности приготовленных образцов эмульсионных вакцин.
8 этап - Исследование иммуногенной активности экспериментальных образцов вакцин на лабораторных животных.
9 этап - Исследование иммуногенной активности, реактогенности экспериментальных образцов вакцин на естественно восприимчивых животных (лошади).
В отличие от прототипа разработанный способ позволяет создать поливалентную вакцину против лептоспироза для иммунизации лошадей с использованием гидрогелевого адъюванта Montanide GEL 01, обладающего пониженной реактогенностью, с высокой иммуногенностью.
Ключевым элементом заявляемого способа является применение для создания вакцины против лептоспироза лошадей гидрогелевого адъюванта Montanide GEL 01, обладающего пониженной реактогенностью, с высокой иммуногенностью.
Сопоставительный анализ с прототипом позволяет сделать вывод, что новизна и изобретательский уровень заявляемого изобретения заключается в создании безопасной, высокоиммуногенной, эффективной поливалентной вакцины против лептоспироза лошадей.
Сведений о разработке предлагаемого способа изготовления вакцины поливалентной против лептоспироза лошадей авторами не обнаружено.
Сущность предлагаемого изобретения заключает в последовательном выполнении этапов получения вакцинного препарата и исследовании его показателей, что отражено ниже.
На первом этапе проводят изготовление антигенной составляющей поливалентной вакцины против лептоспироза лошадей. В качестве антигена используют следующие производственные штаммы лептоспир: «Leptospira Grippotyphosa» (ВГНКИ-1); «Leptospira Icterohaemorrhagiae» (ВГНКИ-2), «Leptospira Tarassovi» (ВГНКИ-4); «Leptospira Ротопа» (ВГНКИ-6); «Leptospira Canicola» (ВГНКИ-3). Используемые для изготовления вакцины штаммы лептоспир каждый по отдельности засевают на буферно-сывороточную среду с добавлением 5% сыворотки барана, витаминов группы В (водородный показатель среды составляет 7,38). Высевы инкубируют в термостате при температуре 28-30°С в течение 5-7 суток.
Выращенные культуры лептоспир инактивируют путем добавления в микробную массу аминоэтилэтиленимина в концентрации 0,2% от общего объема среды, инкубируют 24 часа при комнатной температуре и подсчитывают концентрацию в 1,0 см3. Проводят концентрирование выращенной бактериальной массы лептоспир каждого штамма методом ультрафильтрации на полиамидных полых волокнах с заданным диаметром пор. Концентрированную микробную массу очищают от компонентов среды культивирования и инактиванта путем двукратного отмывания стерильным 0,9%-ным раствором натрия хлорида. Стандартизуют микробную массу лептоспир каждого штамма с помощью разведения 0,9%-ным раствором хлористого натрия до 1 млрд микробных клеток по оптическому стандарту мутности ОСО 42-28-29-86, соответствующему 10 единиц. Антигены смешивают между собой в равных количествах. В полученном антигене накопление лептоспир составляет по 1,0 млрд/см3. Полученный антиген расфасовывают во флаконы и контролируют общепринятыми методами на стерильность и безвредность.
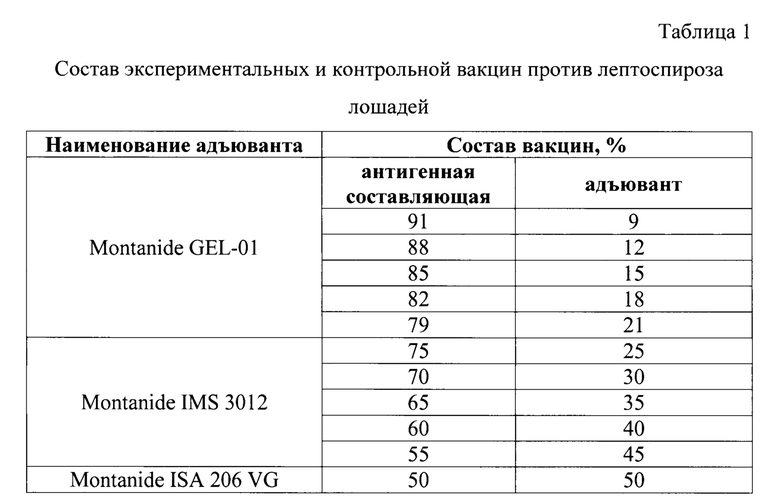
На следующем этапе работы проводят изготовление экспериментальных образцов вакцин (подбор процентного соотношения адъюванта к антигену). Для приготовления экспериментальных образцов используют образцы адъювантов Montanide GEL-01, Montanide IMS 3012 и антиген лептоспирозный, изготовленный из штаммов инактивированных лептоспир пяти серологических групп: «Leptospira Grippotyphosa» (ВГНКИ-1); «Leptospira Icterohaemorrhagiae» (ВГНКИ-2), «Leptospira Tarassovi» (ВГНКИ-4); «Leptospira Ротопа» (ВГНКИ-6); «Leptospira Canicola» (ВГНКИ-3). Вакцину, изготовленную с применением Montanide ISA 206 VG с лептоспирозным антигеном, использовали в качестве контроля, в которой соотношение адъюванта и антигена 50:50.
Для определения необходимой концентрации готовят опытные образцы вакцин путем добавления к антигену следующих адъювантов по отдельности: Montanide GEL-01 в количествах 9, 12, 15, 18, 21%; Montanide IMS 3012 - 25, 30, 35, 40, 45% (таблица 1).
Первоначально адъювант подогревают на водяной бане до температуры 30-40°С, температура антигена при этом соответствует 2-8°С.Смешивают адъювант и антигенную составляющую, тщательно перемешивают при помощи плосколопастной мешалки (350 об/мин). Полученную суспензию охлаждают до температуры 18-20°С.
В результате получают 10 экспериментальных образцов вакцин и 1 образец в качестве контрольного с адъювантом Montanide ISA 206 VG.
На следующем этапе исследования проводят определение стабильности экспериментальных образцов вакцин, изготовленных с применением адъювантов Montanide GEL-01 и Montanide IMS 3012 в сравнении с вакциной, изготовленной с использованием адъюванта Montanide ISA 206 VG. Эмульсионные вакцины, приготовленные на предыдущем этапе, наливают в градуированные бактериологические пробирки до 100 мм.
Стабильность вакцинных препаратов определяют путем выдерживания эмульсий при температурах 37 и 25°С в течение 14 дней. Наблюдение при хранении в температурных условиях 2-8°С осуществляют в течении 18 месяцев. Экспериментальные образцы при температурах 37 и 25°С по истечению 14 дней наблюдения продолжают отслеживать до полного расслоения.
При исследовании эмульсионных вакцин на стабильность возможно отслоением следующих фракций: А - прозрачное масло в верхней части эмульсионного столба, В - присутствие опалесцирующего масла, С -гомогенная эмульсия, D - плотная эмульсия, Е - наличие водной (антигенной) фракции в нижней части эмульсионного столба. В норме должна отсутствовать Е-фаза, допустимо отделение масляной фракции А. Наилучшим показателем считается наличие С-фракции в 100% (при оценке числовое значение выражается в мм по высоте эмульсии в пробирке; лучший показатель стабильности вакцины - наличие С, равного 100 мм).
На следующем этапе исследования проводят оценку реактогенности адъювантов на белых нелинейных мышах мужского пола (массой 19-21 г). Для проведения опыта используют белых мышей, из которых формируют 2 группы по 10 голов в каждой. В подушечку задней правой лапы вводят испытуемое масло, для контроля - эталонный образец Marcol-52. Через 10 суток после введения масла проводят учет результатов.
Далее проводят определение пирогенности адъювантов на кроликах массой 1,5-2,0 кг, из которых формируют 8 групп по 3 головы в каждой: первую группу инокулируют образцом IMS 3012 (35%), вторую группу - IMS 3012 (40%), третью группу - IMS 3012 (45%), четвертую группу - GEL-01 (15%), пятую группу - GEL-01 (18%), шестую группу - GEL-01 (21%), седьмой группе вводили образец масла - Marcol-52 (контрольное масло), восьмая группа - контроль без введения компонента.
Исследования по оценке реактогенности вакцин против лептоспироза лошадей проводят на животных. Лошадей разделяют на 4 группы по 3 головы в каждой: первой группе вводили образец вакцины, содержащей GEL-01 (15%), второй группе - GEL-01 (18%), третьей группе - вакцину 1 (наиболее близкий прототип), четвертой группе - вакцину 2. Вакцина 1 и вакцина 2 - наиболее частые представители на отечественном рынке, используемые как вакцины против лептоспироза.
Вышеуказанные вакцины вводят животным подкожно в среднюю треть шеи в дозе 6,0 см3. Результаты учитывают на 10 сутки после инъекции путем измерения длины, ширины, высоты олеогранулемы. Объем отека рассчитывали по формуле:
V - l × b × h,
где, l - длина, b - ширина, h - высота.
Определение иммуногенных свойств опытных образцов экспериментальных вакцин проводят согласно ГОСТ 33280-2015 [14]. В данном документе указано, что вакцина является активной, если не менее чем у четырех из пяти вакцинированных животных титр антител в сыворотке крови к лептоспирам всех серогрупп будет не ниже 1:400.
Иммуногенную активность объединенной пробы вакцины проверяют на пяти кроликах. Экспериментальную вакцину вводят однократно внутримышечно в объеме 0,5 см3 в среднюю треть бедра. Через 25 суток после введения вакцины у кроликов из ушной вены отбирают по 5,0-8,0 см3 крови для получения сывороток.
Иммуногенную активность вакцинного препарата определяют на лошадях. Экспериментальную вакцину вводят в область средней трети шеи или подгрудка в объеме 2,0 см3. Кровь от животных отбирали на 21 и 60 сутки после вакцинации.
Для получения антигенов суспензии производственных штаммов лептоспир «Leptospira Grippotyphosa» (ВГНКИ-1); «Leptospira Icterohaemorrhagiae» (ВГНКИ-2), «Leptospira Tarassovi» (ВГНКИ-4); «Leptospira Ротопа» (ВГНКИ-6); «Leptospira Canicola» (ВГНКИ-3) культивируют в течение 7 суток в термостате при температуре (29,0±1,0)° С до 60-100 подвижных лептоспир в поле зрения микроскопа при просмотре на предметном стекле капли культуры, накрытой покровным стеклом (увеличение составляет 400х).
Идентификацию штаммов лептоспир, входящих в состав экспериментальной вакцины, проводят с помощью перекрестной реакции микроагглютинации с эталонными контрольными штаммами лептоспир, входящими в состав диагностического набора «Сыворотки групповые агглютинирующие лептоспирозные» (ФКП «Армавирская биофабрика») в соответствии с инструкцией по применению.
Для выявления специфических антител полученную иммунную сыворотку крови отбирают и исследуют в реакции микроагглютинации микрометодом (мРМА), в которой в качестве антигенов применяют штаммы лептоспир, входящие в состав экспериментальной вакцины. мРМА проводят в 96-луночных полистироловых планшетах с U-образным дном. Сыворотки крови от кроликов разводят в 25 раз. Для этого в первый ряд U лунок вносят по 0,096 см3 физиологического раствора и добавляют по 0,004 см3 испытуемой сыворотки от вакцинированных кроликов. Схема разведения сывороток крови кроликов для мРМА представлена в таблице 11.
После приготовления исходного разведения сывороток крови в первом ряду в лунки второго и последующих рядов вносят по 0,05 см3 физиологического раствора. Из первого ряда после 4-5 кратного перемешивания компонентов реакции переносят содержимое по 0,05 см3 в лунки второго ряда. Во втором ряду повторяют 4-5 кратные перемешивания и переносят по 0,05 см3 разведения сыворотки из второго ряда лунок в третий ряд, из третьего ряда в четвертый (после перемешивания) и т.д. Из последнего ряда лунок удаляют 0,05 см3. После приготовления двукратных разведений сывороток крови в каждую лунку вносят по 0,05 см3 антигена. Разведения сывороток после смешивания с антигеном удваивается. Одновременно с основным опытом ставят контроли со всеми серогруппами лептоспир, входящими в состав вакцины. Контролем реакции служит смесь 0,05 см3 антигена (каждой серогруппы) с 0,05 см3 физиологического раствора, в которой лептоспиры должны оставаться подвижными, без видимых изменений морфологии, признаков агглютинации и лизиса. После постановки реакции планшеты осторожно встряхивают и инкубируют в течение 1 ч при температуре 30-37°С.
Реакцию учитывают методом микроскопии при помощи микроскопа с конденсором «темного поля» на стекле, используя окуляр 1 Ох, бинокулярную насадку 1,5х и объектив 20х (суммарное увеличение составляет 300 х).
Результаты мРМА оценивают в крестах по четырех балльной системе: (++++) четыре креста - агглютинированы 100% лептоспир; (+++) три креста - агглютинированы 75% лептоспир; (++) два креста - агглютинированы 50% лептоспир; (+) один крест - агглютинированы 25% лептоспир; (-) минус - агглютинация отсутствует.
Агглютинация проявляется в склеивании лептоспир. В контроле реакции лептоспиры остаются подвижными, без видимых изменений морфологии, признаков агглютинации и лизиса.
Сущность предлагаемого изобретения пояснена примерами его исследования, которые не ограничивают объем изобретения.
Пример 1. Изготовление антигенной составляющей поливалентной вакцины против лептоспироза лошадей.
Для изготовления антигена использовали следующие производственные штаммы лептоспир: «Leptospira Grippotyphosa» (ВГНКИ-1); «Leptospira Icterohaemorrhagiae» (ВГНКИ-2), «Leptospira Tarassovi» (ВГНКИ-4); «Leptospira Ротопа» (ВГНКИ-6); ((Leptospira Canicola» (ВГНКИ-3). Данные штаммы лептоспир каждый по отдельности засевали на буферно-сывороточную среду с добавлением 5% сыворотки крови барана, витаминов группы В (водородный показатель среды составляет 7,38). Высевы инкубировали в термостате при температуре 28-30°С в течение 5-7 суток.
Выращенные культуры лептоспир инактивировали путем добавления в бактериальную массу аминоэтилэтиленимина в концентрации 0,2% от общего объема среды, инкубировали 24 часа при комнатной температуре и подсчитывали концентрацию в 1,0 см3. Проводили концентрирование выращенной бактериальной массы лептоспир каждого штамма методом ультрафильтрации на полиамидных полых волокнах с заданным диаметром пор. Концентрированную микробную массу очищали от компонентов среды культивирования и инактиванта путем двукратного отмывания стерильным 0,9%-ным раствором натрия хлорида. Стандартизировали микробную массу лептоспир каждого штамма с помощью разведения 0,9%-ным раствором хлористого натрия до 1 млрд микробных клеток по оптическому стандарту мутности ОСО 42-28-29-86, соответствующему 10 единиц. Антигены смешивали между собой в равных количествах. В полученном антигене накопление лептоспир составляло по 1,0 млрд/см3. Полученный антиген был стерильным по данным исследования с помощью питательных сред СКА, СМПБ, ТГС, агар Сабуро.
Пример 2. Подбор процентного соотношения адъюванта и антигена и изготовление экспериментальных образцов вакцин.
Для приготовления экспериментальных образцов использовали адъюванты Montanide GEL-01, Montanide IMS 3012 и лептоспирозный антиген, изготовленный из инактивированных штаммов лептоспир пяти серологических групп: «Leptospira Grippotyphosa» (ВГНКИ-1); ((Leptospira Icterohaemorrhagiae» (ВГНКИ-2), ((Leptospira Tarassovi» (ВГНКИ-4); ((Leptospira Ротопа» (ВГНКИ-6); ((Leptospira Canicola» (ВГНКИ-3). В качестве контрольного образца вакцины использовали адъювант Montanide ISA-206 VG в соотношении с антигеном 50% на 50%.
Для определения необходимой концентрации соотношения адъюванта к антигену готовили опытные образцы вакцин путем добавления к антигену следующих адъювантов по отдельности: Montanide GEL-01 в количествах 9, 12, 15, 18, 21%; Montanide IMS 3012 - 25, 30, 35, 40, 45% (табл. 1).
Адъювант подогревали на водяной бане до температуры 30-40°С, температура антигена - 2-8°С.Смешивали адъювант и антигенную составляющую, тщательно перемешивали при помощи плосколопастной мешалки (350 об/мин). Полученную суспензию охлаждали до температуры 18-20°С. В результате получали 10 экспериментальных образцов вакцин и 1 образец в качестве контрольного с адъювантом Montanide ISA-206 VG.
Пример 3. Определение стабильности экспериментальных образцов вакцин против лептоспироза лошадей.
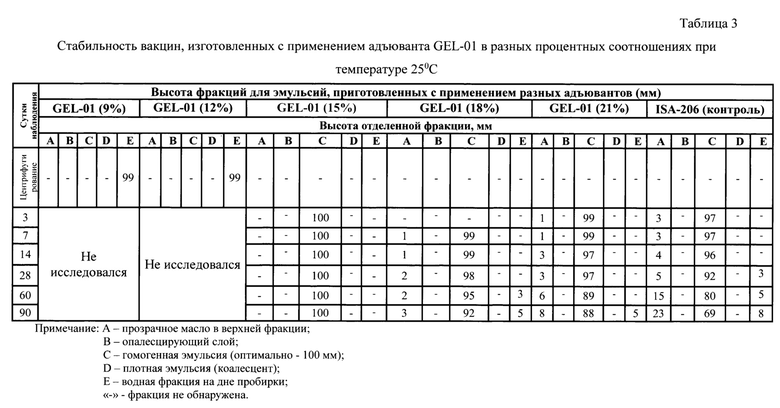
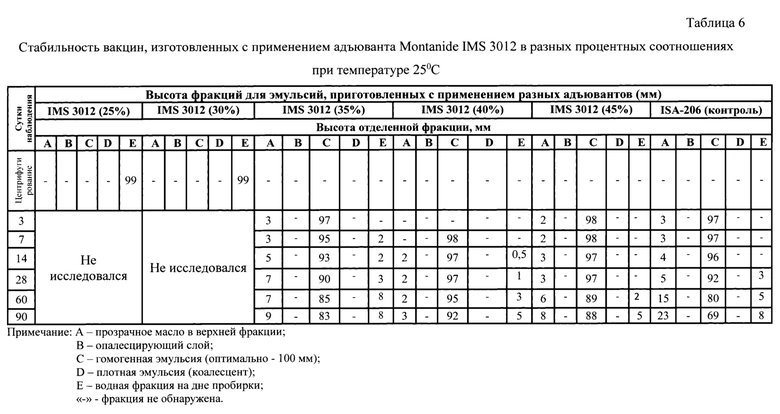
Проводили определение стабильности экспериментальных образцов вакцин, изготовленных с применением адъювантов Montanide GEL-01 и Montanide IMS 3012 в сравнении с вакциной, изготовленной с использованием адъюванта Montanide ISA-206 VG. Стабильность вакцинных препаратов определяли путем выдерживания эмульсий при температурах 37 и 25°С в течение 14 дней (табл. 2, 3, 5, 6). По истечении этого времени наблюдали за экспериментальными вакцинами до полного расслоения. Наблюдение при хранении в температурных условиях 2-8°С осуществляли в течение 18 месяцев (табл.4 и 7).
Результаты определения стабильности экспериментальных образцов вакцин против лептоспироза лошадей при температурах 37, 25 и 2-8°С представлены в таблицах 2-7, соответственно. Анализ данных таблиц показал, что на этапе центрифугирования образцов эмульсии обнаружили отслоение водной фракции на дне пробирки в образцах GEL-01 (9%), GEL-01 (12%), IMS 3012 (25%) и IMS 3012 (30%). Данные образцы в дальнейшем не использовали в опыте по оценке стабильности эмульсии. У образца IMS 3012 (35%) -обнаружили отслоение водной фракции на 7 сутки хранения при температуре 25 и 37°С, а при температуре 2-8°С на 3 сутки хранения. У образца IMS 3012 (40%) обнаружили отслоение водной фракции на 14 сутки хранения и образец IMS 3012 (45%) - на 60 сутки при температуре 25 и 37°С. Для эмульсии GEL-01 (18%) отмечали отслоение водной составляющей на 60 сутки при 25 и 37°С, при температуре 2-8°С отделения антигена не отмечали в течение 90 суток наблюдения. При хранении при температуре 2-8°С все образцы по сравнению с контролем Montanide ISA-206 VG не выделяли водной фазы, показали стабильные результаты, кроме IMS 3012 (35%) на 7 сутки, a IMS 3012 (40 и 45%) на 90 сутки хранения. У образца GEL-01 (15%) - отслоения антигенной фазы не отмечали до 90 суток включительно при всех указанных температурах (100 мм эмульсии С сохранялось при всех температурах в течение 90 суток после изготовления).
В итоге на основании полученных результатов можно сделать вывод, что из десяти экспериментальных образцов вакцин на инновационных адъювантах, образец GEL-01 (15%) обладал лучшей стабильностью. Данное соотношение антигена к адъюванту (85-Н5%) взято за основу при изготовлении вакцины поливалентной против лептоспироза лошадей (предлагаемое изобретение).
Пример 4. Исследование реактогенности адъювантов на белых нелинейных мышах.
Проводили оценку реактогенности адъювантов, указанных выше, на белых нелинейных мышах мужского пола (массой 19-21 г). Для проведения опыта использовали белых мышей, из которых формировали 2 группы по 10 голов в каждой. В подушечку задней правой лапы вводили испытуемое масло, для контроля - эталонный образец Marcol-52, как общедоступный отечественный стандарт масел. Через 10 суток после введения масла проводили учет результатов.
Результаты оценки реактогенности адъювантов на белых мышах представлены в таблице 8, из которой видно, что образец Montanide IMS 3012 обладал такой же реактогенностью, как и контрольный образец (коэффициент реактогенности равен 0). Образец Montanide GEL-01 имел отрицательный коэффициент реактогенности, т.е. отек лап меньше, чем у контрольного образца. Таким образом, образец Montanide GEL-01, обладал коэффициентом реактогенности минус 15. При коэффициенте реактогенности <24, препарат считается слабо реактогенным. Адъювант Montanide GEL-01 наиболее безопасен из исследуемых в данном эксперименте.
Пример 5. Определение пирогенности исследуемых адъювантов.
Проводили определение пирогенности адъювантов на кроликах массой 1,5-2,0 кг, из которых формировали 8 групп по 3 головы в каждой. Первую группу инокулировали образцом IMS 3012 (35%), вторую группу - IMS 3012 (40%), третью группу - IMS 3012 (45%), четвертую группу - GEL-01 (15%), пятую группу - GEL-01 (18%), шестую группу - GEL-01 (21%), седьмой группе вводили образец масла - Marcol - 52 (контрольное масло), восьмая группа -контроль без введения компонента. Результаты определения пирогенности адъювантов на кроликах представлены в таблице 9, из которой видно, что повышение температуры тела в среднем по группе у кроликов, инокулированных IMS 3012 (35%) и GEL-01 (18%), составила 0,2°С.У животных, которых инокулировали образцами IMS 3012 (40%), GEL-01 (15%) и Marcol-52 - 0,1°С, a IMS 3012 (45%) и GEL-01 (21%) - 0,4°С.Таким образом, в течение опыта температура тела у животных в среднем по группе не превышала 0,4°С, что указывает на апирогенность исследуемых адъювантов.
Пример 6. Оценка реактогенности вакцин против лептоспироза лошадей на животных.
Проводили оценку реактогенности вакцин против лептоспироза лошадей на естественно восприимчивых животных. Лошадей разделяли на 4 группы по 3 головы в каждой. Первой группе вводили образец вакцины, содержащей GEL-01 (15%), второй группе - GEL-01 (18%), третьей группе -вакцину 1 (наиболее близкий прототип) и четвертой группе - вакцину 2. Вакцина 1 и вакцина 2 наиболее распространены на отечественном рынке, среди вакцин против лептоспироза лошадей.
Вышеуказанные вакцины животным инокулировали подкожно в среднюю треть шеи в дозе 6,0 см3. Результаты учитывали на 10 сутки после инъекции путем измерения длины, ширины, высоты олеогранулемы. Объем отека рассчитывали по формуле:
V=l × b × h,
где l - длина, b - ширина, h - высота.
Результаты исследования реактогенности вакцин против лептоспироза на лошадях представлены в таблице 10, из которой видно, что вакцинный препарат 2 имеет наибольшую величину местной реакции в сравнении с другими образцами. Образец с адъювантом GEL-01 (18%) обладал такой же реактогенностью, как и образец вакцины 1 (наиболее близкий прототип). Величина отека у животных, иммунизированных вакциной против лептоспироза, которую создали с применением GEL-01 (15%), была меньше, чем у животных, иммунизированных другими образцами вакцин.
По результатам, полученным в ходе опыта, можно сделать вывод, что наименьшей реактогенностью обладал образец вакцины, изготовленный с использованием адъюванта GEL-01 (15%) (предлагаемое изобретение).
Пример 7. Определение иммуногенных свойств опытных образцов экспериментальных вакцин против лептоспироза лошадей.
Иммуногенные свойства опытных образцов экспериментальных вакцин определяли путем исследования сывороток крови на выявление в них специфических антител в защитных титрах к лептоспирам, входящим в состав экспериментальной вакцины против лептоспироза лошадей, согласно ГОСТ 33280-2015 [13]. В данном документе указано, что вакцина является активной, если не менее чем у четырех из пяти вакцинированных кроликов титр антител в сыворотке крови к лептоспирам всех серогрупп будет не ниже 1:400. Титром считают наибольшее разведение сыворотки, в котором реакция оценена не менее, чем на два креста.
Иммуногенную активность вакцин проверяли на пяти кроликах. Экспериментальные вакцины вводили однократно внутримышечно в объеме 0,5 см3 в среднюю треть бедра. Через 25 суток после введения вакцины у кроликов из ушной вены отбирали по 5,0-8,0 см3 крови для получения сывороток.
Иммуногенную активность вакцинного препарата (предлагаемое изобретение) определяли на лошадях. Экспериментальную вакцину вводили в область средней трети шеи или подгрудка в объеме 2,0 см3. Кровь от животных отбирали на 21 и 60 сутки после вакцинации.
Для выявления специфических антител полученную иммунную сыворотку крови кроликов и лошадей исследовали в реакции микроагглютинации микрометодом (мРМА), в которой в качестве антигенов применяли штаммы лептоспир, входящие в состав экспериментальной вакцины. Схема разведения сыворотки крови для мРМА представлена в таблице 11.
Для получения антигенов суспензии производственных штаммов лептоспир «Leptospira Grippotyphosa» (ВГНКИ-1); ((Leptospira Icterohaemorrhagiae» (ВГНКИ-2), ((Leptospira Tarassovi» (ВГНКИ-4); ((Leptospira Ротопа» (ВГНКИ-6); ((Leptospira Canicola» (ВГНКИ-3) культивировали в течение 7 суток в термостате при температуре (29,0±1,0)°С до 60-100 подвижных лептоспир в поле зрения микроскопа при просмотре на предметном стекле капли культуры, накрытой покровным стеклом (увеличение составляет 400х).
Идентификацию штаммов лептоспир, осуществляли с помощью перекрестной реакции микроагглютинации в микроварианте (мРМА) с эталонными контрольными штаммами лептоспир, входящими в состав диагностического набора ((Сыворотки групповые агглютинирующие лептоспирозные» (ФКП «Армавирская биофабрика») в соответствии с инструкцией по применению.
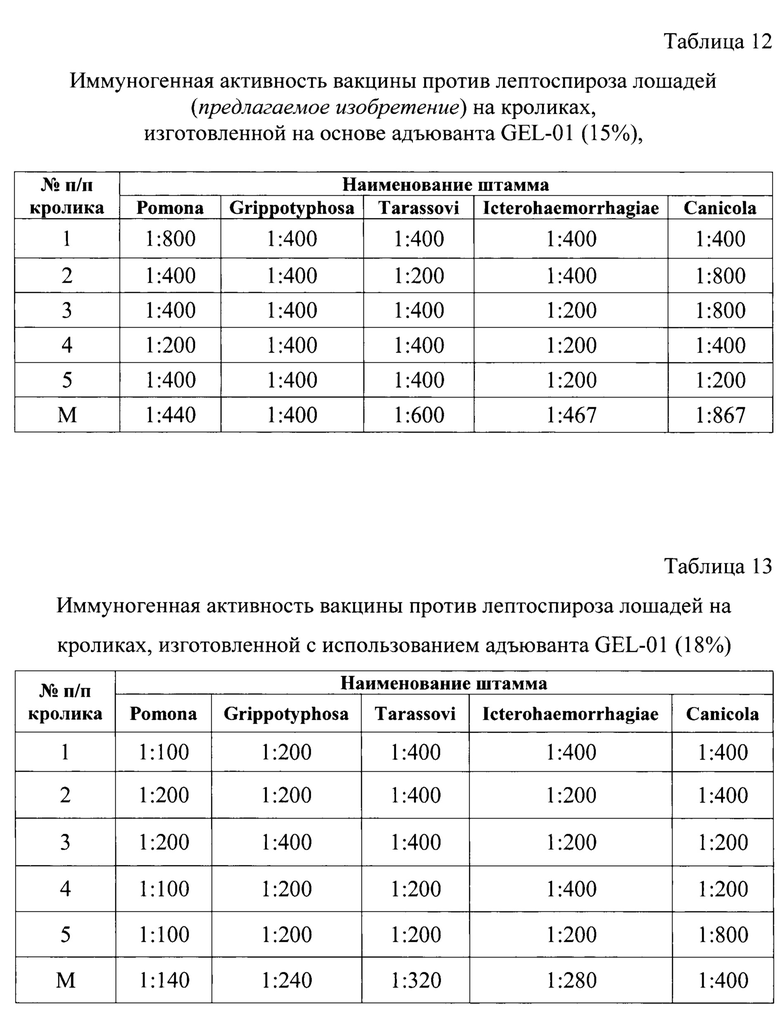
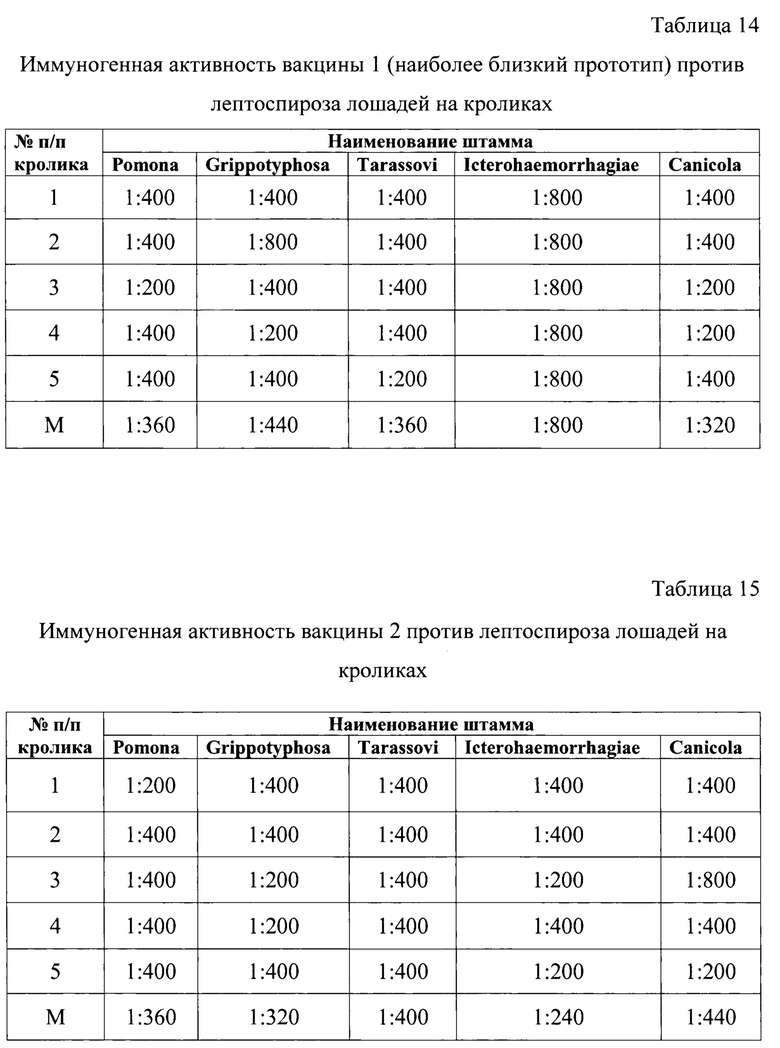
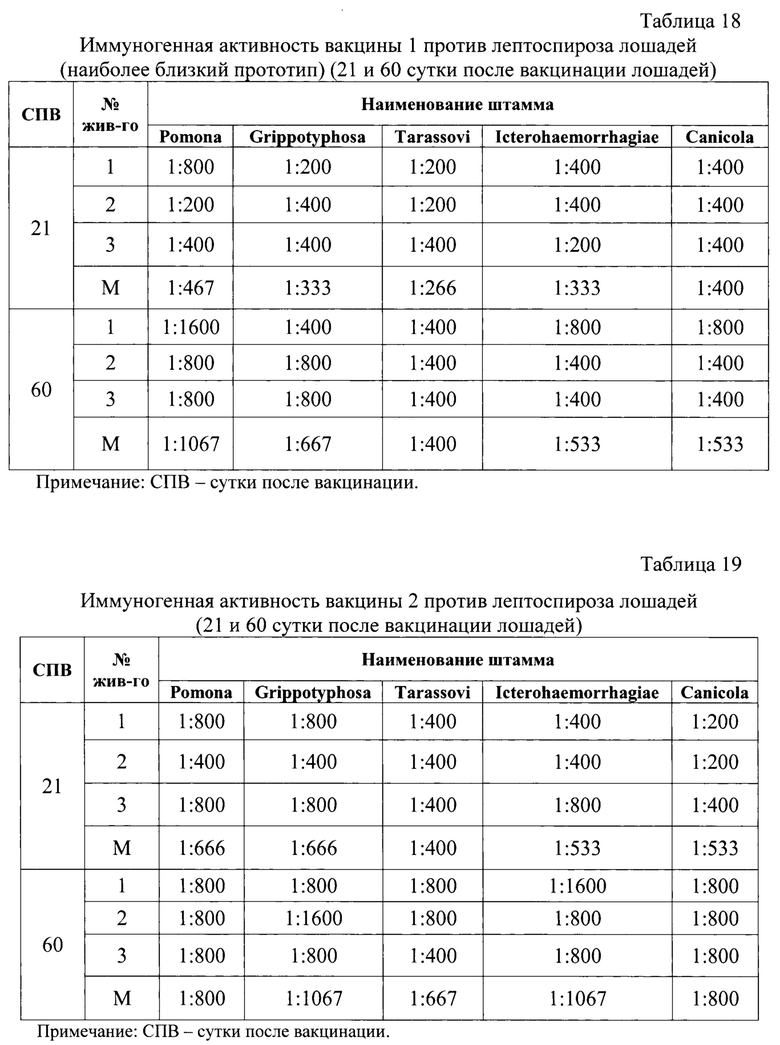
Результаты определения иммуногенной активности экспериментальных вакцин против лептоспироза лошадей учитывали методом микроскопии и отразили в таблицах 12-15 на кроликах и на лошадях в таблицах 16-19.
Из данных таблиц 12-15 следует, что при испытании на кроликах четырех следующих вакцин против лептоспироза лошадей: с использованием GEL-01 (15%), GEL-01 (18%), а также вакцины 1 и вакцины 2 наиболее высокие средние показатели по иммуногенной активности отмечали для экспериментальной вакцины, полученной с применением гидрогелевого адъюванта GEL-01 с 15%-ным содержанием в конечном продукте, а именно, средние титры нейтрализующих антител против штаммов инактивированных лептоспир пяти серологических групп: «Leptospira Grippotyphosa» (ВГНКИ-1); «Leptospira Icterohaemorrhagiae» (ВГНКИ-2), ((Leptospira Tarassovi» (ВГНКИ-4); ((Leptospira Ротопа» (ВГНКИ-6); ((Leptospira Canicola» (ВГНКИ-3) составляли 1:400, 1:467, 1:600, 1:440, 1:867, соответственно.
Из данных таблиц 16-19 следует, что при испытании на лошадях тех же четырех вакцин против лептоспироза лошадей наиболее высокие средние показатели по иммуногенной активности отмечали для экспериментальной вакцины, полученной с применением гидрогелевого адъюванта GEL-01 с 15%-ным содержанием в конечном продукте, а именно, средние титры нейтрализующих антител против штаммов инактивированных лептоспир пяти серологических групп: ((Leptospira Grippotyphosa» (ВГНКИ-1); ((Leptospira Icterohaemorrhagiae» (ВГНКИ-2), ((Leptospira Tarassovi» (ВГНКИ-4); ((Leptospira Ротопа» (ВГНКИ-6); ((Leptospira Canicola» (ВГНКИ-3) на 21 сутки после вакцинации составляли 1:933, 1:400, 1:400, 1:1067, 1:533, соответственно, на 60 сутки после вакцинации - 1:1600,1:1067, 1:1067,1:2133, 1:1067, соответственно.
Таким образом, приведенная выше информация свидетельствует о том, что способ изготовления вакцины поливалентной против лептоспироза лошадей, воплощающий предлагаемое изобретение, предназначен для получения вакцины против лептоспироза лошадей и использования в сельском хозяйстве, а именно в ветеринарной вирусологии и биотехнологии; подтверждена возможность осуществления представленного; вакцина против лептоспироза лошадей является безопасной в использовании и обладает высокой иммуногенной активностью.
Источники информации, принятые во внимание при составлении описания изобретения к заявке на выдачу патента РФ на изобретение «Способ изготовления вакцины поливалентной против лептоспироза лошадей»:
1. Picardeau М, Bertherat Е, Jancloes М, Skouloudis AN, Durski К, Hartskeerl RA. Rapid tests for diagnosis of leptospirosis: current tools and emerging technologies. Diagn Microbiol Infect Dis. 2014 Jan; 78(l): 1-8. doi: 10.1016/j.diagmicrobio.2013.09.012. Epub 2013 Oct 1. PMID: 24207075.
2. Ellis WA. Animal leptospirosis. Curr Top Microbiol Immunol. 2015;387:99-137. doi: 10.1007/978-3-662-45059-8_6. PMID: 25388134.
3. Verma A, Stevenson B, Adler B. Leptospirosis in horses. Vet Microbiol. 2013 Nov 29;167(l-2):61-6. doi: 10.1016/j.vetmic.2013.04.012. Epub 2013 Apr 16. PMID: 23647816.
4. Bernard WV. Leptospirosis. Vet Clin North Am Equine Pract. 1993 Aug;9(2):435-44. doi: 10.1016/s0749-0739(l7)30410-8. PMID: 8358656.
5. Malalana F. Leptospirosis in horses: A European perspective. Equine Vet J. 2019 May;51(3):285-286. doi: 10.1111/evj. 13022. PMID: 30950557.
6. Di Azevedo MIN, Lilenbaum W. Equine genital leptospirosis: Evidence of an important silent chronic reproductive syndrome. Theriogenology. 2022 Oct 15;192:81-88. doi: 10.1016/j.theriogenology.2022.08.029. Epub 2022 Aug 28. PMID: 36063673.
7. Divers TJ, Chang YF, Irby NL, Smith JL, Carter CN. Leptospirosis: An important infectious disease in North American horses. Equine Vet J. 2019 May;51(3):287-292. doi: 10.1111/evj.13069. Epub 2019 Jan 28. PMID: 30629756.
8. Arrieta-Bechara CE, Carrascal-Maldonado AY. Ocular leptospirosis: a review of current state of art of a neglected disease. Rom J Ophthalmol. 2022 Oct-Dec;66(4):282-288. doi: 10.22336/rjo.2022.53. PMID: 36589326; PMCID: PMC9773111.
9. Loureiro AP, Hamond C, Lilenbaum W. Leptospirosis in horses. Vet Rec. 2013 May 4;172(18):479-80. doi: 10.1136/vr.f2824. PMID: 23645436.
10. Вакцина поливалентная «ВГНКИ» против лептоспироза животных URL: https://vetsnab.info/vetpreparaty/vakczina-polivalentnaya-vgnki-protiv-leptospiroza-zhivotnyh/ (Дата обращения: 12.01.2023).
11. Вакцина против лептоспироза животных инактивированная «Лептопро». URL: https://www.stavbio.ru/products/leptopro/ (Дата обращения: 11.01.2023).
12. Вакцина против лептоспироза лошадей (производитель «ВетБиоХим»). URL: https://www.vetlek.ru/directions/?id=757 (Дата обращения: 12.01.2023).
13. Cauchard S, Bertrand F, Barrier-Battut I, Jacquet S, Laurentie M, Barbey C, Laugier C, Deville S, Cauchard J. Assessment of the safety and immunogenicity of Rhodococcus equi-secreted proteins combined with either a liquid nanoparticle (IMS 3012) or a polymeric (PET GEL A) water-based adjuvant in adult horses and foals-identification of promising new candidate antigens. Vet Immunol Immunopathol. 2014 Feb 15; 157(3-4): 164-74. doi: 10.1016/j.vetimm.2013.12.003. Epub 2013 Dec 17. PMID: 24445196.
14. ГОСТ 33280-2015 «Средства лекарственные для ветеринарного применения. Вакцины против лептоспироза животных».








| название | год | авторы | номер документа |
|---|---|---|---|
| ВАКЦИНА ПРОТИВ ЛЕПТОСПИРОЗА ЖИВОТНЫХ | 1990 |
|
RU2030915C1 |
| ВАКЦИНА ИНАКТИВИРОВАННАЯ КОМБИНИРОВАННАЯ ПРОТИВ ИНФЕКЦИОННОГО РИНОТРАХЕИТА, ВИРУСНОЙ ДИАРЕИ И ЛЕПТОСПИРОЗА КРУПНОГО РОГАТОГО СКОТА | 2009 |
|
RU2395297C1 |
| ВАКЦИНА ИНАКТИВИРОВАННАЯ КОМБИНИРОВАННАЯ ПРОТИВ ИНФЕКЦИОННОГО РИНОТРАХЕИТА, ВИРУСНОЙ ДИАРЕИ, РОТА-, КОРОНАВИРУСНОЙ БОЛЕЗНЕЙ И ЛЕПТОСПИРОЗА КРУПНОГО РОГАТОГО СКОТА | 2009 |
|
RU2395299C1 |
| АССОЦИИРОВАННАЯ ВАКЦИНА ПРОТИВ ЛЕПТОСПИРОЗА И КАМПИЛОБАКТЕРИОЗА КРУПНОГО РОГАТОГО СКОТА | 1992 |
|
RU2021818C1 |
| ИММУНОГЕННАЯ КОМПОЗИЦИЯ ИЗ УБИТОЙ БАКТЕРИИ ЛЕПТОСПИРЫ | 2013 |
|
RU2667642C2 |
| Новая поливалентная вакцина против лептоспироза человека и способ её получения | 2021 |
|
RU2753972C1 |
| ВАКЦИНА ПРОТИВ ЧУМЫ, АДЕНОВИРУСНЫХ ИНФЕКЦИЙ, ПАРВОВИРУСНОГО И КОРОНАВИРУСНОГО ЭНТЕРИТОВ, ЛЕПТОСПИРОЗА И БЕШЕНСТВА СОБАК | 2013 |
|
RU2546247C2 |
| Способ получения поливалентной вакцины против лептоспироза животных | 1975 |
|
SU555664A1 |
| ЛЕПТОСПИРЫ С ПОВЫШЕННОЙ АНТИГЕННОЙ МАССОЙ | 2013 |
|
RU2679040C2 |
| АССОЦИИРОВАННАЯ ВАКЦИНА ПРОТИВ ЛЕПТОСПИРОЗА И ПАРВОВИРУСНОЙ ИНФЕКЦИИ СВИНЕЙ | 1987 |
|
SU1538305A1 |
Изобретение относится к биотехнологии, ветеринарной микробиологии, иммунологии. Предложена поливалентная вакцина против лептоспироза лошадей, состоящая из активного вещества в виде антигенного материала из штаммов инактивированных лептоспир пяти серологических групп: Pomona, Tarassovi, Icterohaemorrhagiae, Grippotyphosa и Canicola, смешанных с адъювантом. Используют штаммы Leptospira Grippotyphosa ВГНКИ-1; Leptospira Icterohaemorrhagiae ВГНКИ-2, Leptospira Tarassovi ВГНКИ-4; Leptospira Pomona ВГНКИ-6; Leptospira Canicola ВГНКИ-3 в количестве 85% по массе с концентрацией каждого антигена по 1,0 млн микробных клеток/см3. В качестве адъюванта используют гидрогелевый адъювант Montanide GEL-01 с содержанием 15% по массе. Вакцина против лептоспироза лошадей является безопасной, ареактогенной и обладает высокой иммуногенной активностью, а именно после вакцинации позволяет индуцировать выработку антител против штаммов «Leptospira Grippotyphosa» (ВГНКИ-1); «Leptospira Icterohaemorrhagiae» (ВГНКИ-2), «Leptospira Tarassovi» (ВГНКИ-4); «Leptospira Роmоnа» (ВГНКИ-6); «Leptospira Canicola» (ВГНКИ-3) на 21 сутки с титрами 1:933, 1:400, 1:400, 1:1067, 1:533, соответственно, на 60 сутки после вакцинации - с титрами 1:1600, 1:1067, 1:1067, 1:2133, 1:1067, соответственно. 19 табл., 7 пр.
Поливалентная вакцина против лептоспироза лошадей, состоящая из активного вещества в виде антигенного материала из штаммов инактивированных лептоспир пяти серологических групп: Pomona, Tarassovi, Icterohaemorrhagiae, Grippotyphosa и Canicola, смешанных с адъювантом, отличающаяся тем, что используют штаммы Leptospira Grippotyphosa ВГНКИ-1; Leptospira Icterohaemorrhagiae ВГНКИ-2, Leptospira Tarassovi ВГНКИ-4; Leptospira Pomona ВГНКИ-6; Leptospira Canicola ВГНКИ-3 в количестве 85% по массе с концентрацией каждого антигена по 1,0 млн микробных клеток/см3, а в качестве адъюванта используют гидрогелевый адъювант Montanide GEL-01 с содержанием 15% по массе.
| Вакцина против лептоспироза лошадей, инструкция, 22.04.2021, весь документ, https://www.gama-market.ru/product/vaktsina_protiv_leptospiroza%20loshadey_2 | |||
| ВАКЦИНА ИНАКТИВИРОВАННАЯ КОМБИНИРОВАННАЯ ПРОТИВ ИНФЕКЦИОННОГО РИНОТРАХЕИТА, ВИРУСНОЙ ДИАРЕИ, РОТА-, КОРОНАВИРУСНОЙ БОЛЕЗНЕЙ И ЛЕПТОСПИРОЗА КРУПНОГО РОГАТОГО СКОТА | 2009 |
|
RU2395299C1 |
| Новая поливалентная вакцина против лептоспироза человека и способ её получения | 2021 |
|
RU2753972C1 |
| АССОЦИИРОВАННАЯ ВАКЦИНА ПРОТИВ ЛЕПТОСПИРОЗА И КАМПИЛОБАКТЕРИОЗА КРУПНОГО РОГАТОГО СКОТА | 1992 |
|
RU2021818C1 |
| Paul L | |||
| Wood et al., Lipidomic analysis of immune activation in equine leptospirosis and Leptospiravaccinated | |||
Авторы
Даты
2024-03-18—Публикация
2023-04-10—Подача