Изобретение относится к медицине, а именно к кардиохирургии, лучевой диагностике и радиологии, и может быть использовано для качественной и количественной оценки активности склеро-дегенеративных процессов биопротезов клапанов сердца.
Приобретенные пороки сердца являются одной из наиболее частых причин оперативных вмешательств на сердце. Среди них ведущую роль играют склеро-дегенеративные пороки клапанов сердца. Так в 2021 году выполнено 7911 вмешательств по причине дегенеративных изменений клапанов сердца. При этом доля изолированных протезирований аортального клапана составила 48,8% (3911 операций). У 29,1% пациентов данной категории было выполнено биопротезирование аортального клапана [Бокерия Л.А., Милиевская Е.Б., Прянишников В.В., Юрлов И.А., Кудзоева З.Ф. Сердечно-сосудистая хирургия – 2021 Болезни и врожденные аномалии системы кровообращения. Москва: М.: НМИЦ ССХ им. А.Н. Бакулева Минздрава России, 2022].
Несмотря на ряд преимуществ биопротезов сердца (в первую очередь - отсутствие необходимости постоянной антигокоагулянтной терапии) основной проблемой их использования является ограниченный срок службы в связи с естественной деградацией. По данным Johnston D.R. et al. (2015), при анализе более 12 тысяч случаев операций биопротезирования аортального клапана необходимость реопераций у пациентов моложе 60 лет составляет 45% через 20 лет после операции [Johnston D. R. и др. Long-Term Durability of Bioprosthetic Aortic Valves: Implications From 12,569 Implants // The Annals of Thoracic Surgery. 2015. Т. 99. № 4. С. 1239–1247].
Однако, по другим данным, отсутствие структурных изменений створок биологических протезов аортального клапана через 10 лет после операции составляет 44,2-50% [Bourguignon T. и др. Very long-term outcomes of the Carpentier-Edwards Perimount aortic valve in patients aged 50–65 years // European Journal of Cardio-Thoracic Surgery. 2015. Т. 49. № 5. С. 1462–1468, Kermen S. и др. Durability of a bovine pericardial aortic bioprosthesis based on Valve Academic Research Consortium-3 echocardiographic criteria // JTCVS Open. 2022. Т. 11. С. 72–80].
Основными причинами склеро-дегенеративных процессов биопротезов с последующей дисфункцией являются:
1. Механический износ створок протеза - ткани ксеноперикарда (бычьего или свиного) более плотные и жесткие чем створки аортального клапана. Постоянная гемодинамическая нагрузка на них приводит к их естественному старению и износу.
2. Кальциноз створок биологического протеза - основной причиной является хроническое воспаление в зоне операции в связи с аутоиммунным ответом на инородный материал в организме.
3. Инфекционный эндокардит - все пациенты после протезирования клапанов сердца включаются в группу высокого риска данного осложнения. В связи с чем всем пациентам рекомендована строгая антибиотикопрофилактика при стоматологических манипуляциях, операциях и тд.
Структурные изменения биологических протезов из-за кальцификации створок или разрушения коллагеновых волокон являются основными факторами, ограничивающими долговечность их службы в отдаленном периоде. По данным литературы основными факторами, ускоряющими процессы биодеградации биопротезов сердца, являются хронические болезни почек [Schoen F. J., Levy R. J. Calcification of Tissue Heart Valve Substitutes: Progress Toward Understanding and Prevention // The Annals of Thoracic Surgery. 2005. Т. 79. № 3. С. 1072–1080], сахарный диабет, метаболический синдром [Briand M. и др. Metabolic syndrome is associated with faster degeneration of bioprosthetic valves // Circulation. 2006. Т. 114]. Курение является активным фактором ускорения кальциноза биологических протезов в связи повышенным окислительным стрессом и его влиянием на метаболизм тканей [Lee S. и др. Calcification and Oxidative Modifications Are Associated With Progressive Bioprosthetic Heart Valve Dysfunction // Journal of the American Heart Association. 2017. Т. 6. № 5]. По данным Senage et al. [Sénage T. и др. Early Structural Valve Deterioration of Mitroflow Aortic Bioprosthesis // Circulation. 2014. Т. 130. № 23. С. 2012–2020], женский пол был связан с более высоким риском HVD. Дефицит витамина К является распространенным фактором развития как остеопороза, так и кальцификации артерий. Антагонист витамина К варфарин также был связан с повышенным риском кальцификации артерий и кальцификации нативного аортального клапана [Adams J., Pepping J. Vitamin K in the treatment and prevention of osteoporosis and arterial calcification // American Journal of Health-System Pharmacy. 2005. Т. 62. № 15. С. 1574–1581].
Дистрофическая кальциноз биопротезов сердца является пассивным процессом, не регулируемым клетками реципиента и определяемый отложением фосфатов кальция (CaPs) в створках клапана [Simionescu D. T. Prevention of calcification in bioprosthetic heart valves: challenges and perspectives // Expert Opinion on Biological Therapy. 2004. Т. 4. № 12. С. 1971–1985]. Помимо кальциноза клеток, минерализации могут подвергаться и волокнистые компоненты биопротезов. Коллаген типа I является преобладающим типом коллагена в сердечных клапанах и перикарде человека и свиней, а также играет роль в формировании костей. Осаждение и последующий рост кристаллов фосфатов кальция на коллагеновых волокнах начинается в пространствах его трехмерной структуры, называемых зонами перфораций [Kim K. M., Herrera G. A., Battarbee H. D. Role of Glutaraldehyde in Calcification of Porcine Aortic Valve Fibroblasts // The American Journal of Pathology. 1999. Т. 154. № 3. С. 843–852].
Другим важным компонентов развития биодеградации биологических протезов сердца является иммунный ответ организма на них. Он инициируется повреждением тканей, возникающим во время имплантации, и дополнительно усиливается за счет адсорбции белков сыворотки на поверхности имплантата [Murtazalieva P. и др. Prediction of Aortic Stenosis Progression by 18F-FDG and 18F-NaF PET/CT in Different Aortic Valve Phenotypes // Frontiers in Pharmacology. 2022. Т. 13]. Это запускает контакт системы активации, а также каскады фибринолиза и комплемента, что приводит к адгезии тромбоцитов и активированных лейкоцитов на поверхности протеза и, в конечном счете, к воспалению и тромбозу в области вокруг имплантата [Murtazalieva P. и др. Prediction of Aortic Stenosis Progression by 18F-FDG and 18F-NaF PET/CT in Different Aortic Valve Phenotypes // Frontiers in Pharmacology. 2022. Т. 13].
Иммунные инфильтраты, возникающие в результате имплантации, приводят к разрастаниям фиброваскулярной ткани в местах контакта тканей реципиента и протеза. Умеренные тканевые разрастания служат нетромбогенной поверхностью вдоль шва и улучшают прикрепление протеза к фиброзному кольцу аортального клапана. Однако чрезмерное разрастание внеклеточного матрикса, известное как паннус, может отрицательно влиять на створки, ограничивая их движение, тем самым способствуя стенозу и дисфункции клапана [Kratochwil C. и др. 68Ga-FAPI PET/CT: Tracer Uptake in 28 Different Kinds of Cancer // Journal of Nuclear Medicine. 2019. Т. 60. № 6. С. 801–805]. Долгое время считалось, что обработка биологического протеза глутеральдегидом позволяет минимизировать иммунный ответ на протез. Тем не менее, текущие исследования показывают, что обработка биопротезов глутеральдегидом недостаточно, чтобы полностью свести на нет иммунный ответ организма [Ovcharenko E. A. и др. Evaluation of a Failed Heart Valve Bioprosthesis Using Microcomputed Tomography // Sovremennye tehnologii v medicine. 2017. Т. 9. № 3. С. 15].
Таким образом, кальциноз биологических протезов с нарушением их функции является комплексным многокомпонентных процессом. Скорость разрушения протеза зависит от механических факторов, условий имплантации и иммунного статуса реципиента. С другой стороны, не вызывает сомнений единый алгоритм развития деградации биопротезов сердца - нарушение процессов естественной эндотелизации биологического протеза, с активацией и в тоже время нарушением коллаген-образующей функции фибробластов вследствие химической обработки, аутоиммунного ответа и механического стресса.
Основным методом оценки функционального состояния биологических протезов сердца является метод эхокардиографии. Данная методика позволяет оценить скоростные показатели на клапанах (в случае формирования стеноза вследствие биодеградации увеличивается скорость кровотока на клапане), косвенно определить структурную детериорацию (утолщение створок, уплотнение их), грубые морфологические изменения (отрыв биопротеза, отрыв створки). При ультразвуковом исследовании клапана сердца невозможно определить активность дегенеративных процессов у конкретного пациента. Описанные изменения характерны уже для поздней стадии структурных изменений биопротеза сердца, когда зачастую формируется дисфункция биологического клапана [Zoghbi W. A. и др. Recommendations for Evaluation of Prosthetic Valves With Echocardiography and Doppler Ultrasound // Journal of the American Society of Echocardiography. 2009. Т. 22. № 9. С. 975–1014].
Другим методом оценки морфологических изменений биоклапанов сердца является компьютерная томография. Данный метод позволяет выявить некальцинированное утолщение створок биопротеза и паннус [Cartlidge T. R. G. и др. Detection and Prediction of Bioprosthetic Aortic Valve Degeneration // Journal of the American College of Cardiology. 2019. Т. 73. № 10. С. 1107–1119]. Однако данная методика оценивает лишь морфологические изменения протеза, не позволяя оценить степень активности процессов дегенерации биопротеза.
Современные радионуклидные методы диагностики позволяют оценить активность патофизиологических, в том числе метаболических процессов в тканях организма человека. В литературе достаточно широко представлены результаты исследований по оценке активности кальциноза аортального клапана при формировании аортального стеноза и кальциноза биологических клапанов.
Позитронная эмиссионная томография (ПЭТ) с 18F-фторидом натрия (18F-NaF) является маркером активности кальцификации и повреждения сосудов при ряде сердечно-сосудистых заболеваний. Благодаря гипераккумуляции данного радиофармацевтического препарата в областях повышенной минерализации за счет связывания 18F-NaF с гидроксиапатитом путем обмена гидроксильными группами, результаты ПЭТ позволяют оценить активность процессов кальцификации клапана, что несет крайне важную информацию для оценки прогрессирования стеноза клапана [Murtazalieva P. и др. Prediction of Aortic Stenosis Progression by 18F-FDG and 18F-NaF PET/CT in Different Aortic Valve Phenotypes // Frontiers in Pharmacology. 2022. Т. 13, Murtazalieva P. M. и др. 18F-sodium fluoride and 18F-fluorodeoxyglucose positron emission tomography for assessment of aortic valve inflammation and calcification in patients with aortic stenosis // Russian Journal of Cardiology. 2019. № 12. С. 33–38].
Другим актуальным методом радионуклидной диагностики является ПЭТ-КТ - с 18F-фтордезоксиглюкозой. Радиофармацевтический препарат (РФП) 18F‐фтордезоксиглюкоза (18F-ФДГ) представляет собой синтетический аналог глюкозы и позволяет оценивать гликолитическую активность тканей. ПЭТ диагностика воспаления с помощью 18F-ФДГ основана на высоком захвате РФП клеточными элементами воспаления (активированными лимфоцитами, моноцитами и макрофагами) за счет увеличения концентрации внутриклеточных глюкозотранспортных белков и активации ферментов гликолитического каскада. Данное исследование позволяет определить степень активности воспаления на нативном и протезированном клапане сердца [Murtazalieva P. M. и др. 18F-sodium fluoride and 18F-fluorodeoxyglucose positron emission tomography for assessment of aortic valve inflammation and calcification in patients with aortic stenosis // Russian Journal of Cardiology. 2019. № 12. С. 33–38].
Необходимо подчеркнуть, что описанные методы позволяют оценить либо текущее инфекционное или асептическое воспаление на клапанах сердца, либо уже позднюю стадия формирования клапанного порока сердца в виде кальциноза.
Наиболее близким к предлагаемому является метод радионуклидной диагностики биодеградации протеза аортального клапана, путем оценки его кальцификации как одного из звеньев патогенеза патологического процесса методом ПЭТ-КТ, опубликованный в работе [Cartlidge T. R. G. и др. Detection and Prediction of Bioprosthetic Aortic Valve Degeneration // Journal of the American College of Cardiology. 2019. Т. 73. № 10. С. 1107–1119], который взят нами в качестве прототипа. Для оценки активности процесса кальцификации клапанов авторы использовали РФП 18F-фторид натрия (18F-NaF), который накапливается в областях повышенной минерализации, связываясь с гидроксиапатитом путем обмена гидроксильными группами.
В своей работе авторы сравнивают данные КТ ангиографии и ПЭТ с 18F-NaF у пациентов с имплантированными биологическими протезами аортального клапана. В исследование были включены 6 пациентов с доказанной дисфункцией биопротеза (аортальная регургитация и рестеноз протеза). При анализе данных КТ у всех пациентов выявлены изменения в виде кальциноза створок. По данным ПЭТ-КТ отмечалось выраженное накопление РФП в области кальцинированных створок.
В качестве группы сравнения авторы предложили когорту из 71 пациента без дисфункции биологического протеза аортального клапана по данным эхокардиографии. В данной группе у 51 из 71 (72%) исследуемых операция была выполнена 5 и менее лет назад. У 20 человек операция выполнена более 10 лет назад. У всех пациентов исходно не наблюдалось гемодинамических нарушений на биопротезе по данных эхокардиографии.
Авторы отметили, что повышенное накопление РФП в проекции имплантированного клапана выявлено у 24 пациентов, в то время как изменения створок по данным КТ ангиографии были зарегистрированы у 14 исследуемых. Таким образом, авторы делают выводу о большей чувствительности и специфичности радиологического исследования для идентификации процесса деградации биопротезов.
После наблюдения в течение 2,5 лет, авторы отметили что патологическая гиперфиксация РФП в проекции створок биопротеза по результатам ПЭТ-КТ строго коррелирует с изменениями гемодинамических характеристик по данным эхокардиографии. При статистическом анализе была выявлена строгая корреляционная зависимость (r=0,72, p<0,01)между наличие накоплением РФП и увеличением скорости на биопротезе (у пациентов с накоплением РФП ежегодный прирост скорости составил 0,3 м/с/год, у пациентов без накопления РФП 0,01 м/с/год). При мультифакторном анализе только накопление 18F‐NaF являлось достоверных предиктором формирования дисфункции биопротеза в будущем.
Несомненно, предложенный авторами способ доказал свою эффективность. Однако, используемый радиофармпрепарат обладает тропностью только к гидроксиапатиту кальция и отражает интенсивность кальцификации коллагена 1 типа, что является поздним этапом патогенеза деградации биопротеза. В связи с этим, предложенный авторами статьи – прототипа способ радиоизотопной диагностики деградации биологических протезов, является актуальным лишь на поздних стадиях патологического процесса.
Таким образом, актуальной задачей на сегодняшний день является поиск новых способов оценки активности склеро-дегенеративных процессов на биопротезах клапанов сердца на ранней стадии патогенеза биодеградации протезированного клапана, а именно потери эластичности створок. Выявленные изменения биопротезов позволят выявить группу риска пациентов на ранних сроках после его имплантации, когда не фиксируется гемодинамически значимых нарушений кровотока на клапане (стеноза или регургитации) и отсутствует кальциноз створок клапана.
Технический результат настоящего изобретения состоит в создании нового способа оценки активности склеро-дегенеративных процессов биопротезов клапанов сердца на ранних сроках после их хирургической имплантации.
Этот результат достигается тем, что в известном способе оценки активности склеро-дегенеративных процессов биопротезов клапанов сердца, включающем внутривенное введение пациенту радиофармацевтического препарата, позитронно-эмиссионную томографию сердца и расчет индекса накопления радиофармацевтического препарата, согласно изобретению, в качестве радиофармацевтического препарата используют 68Ga-ФАПИ-04 из расчета 1,5-2 МБк на 1 кг массы тела больного, но не менее 100 МБк, а позитронную эмиссионную томографию сердца проводят через 60 мин после его введения, оценку интенсивности накопления 68Ga-ФАПИ-04 в проекции имплантированного клапана выполняют путем расчета коэффициента дифференциального накопления (КДН max/mean) по формуле:
КДН max/mean = максимальный SUVмах над АК/средний SUVmean над пулом крови, где
SUV max - максимальное значение стандартизированного показателя накопления РФЛП, SUV mean - среднее значение стандартизированного показателя накопления РФЛП, АК — аортальный клапан, и при значении КДН max/mean выше 2 это расценивают как признак склеро-дегенеративных процессов биопротезов клапанов сердца.
Выполнение ПЭТ/КТ с 68Ga-ФАПИ-04 известно и широко применяется в нашей клинической практике для визуализации различных видов новообразований, в частности рака головы и шеи, желудочно-кишечного тракта, легкого, молочной железы с высоким контрастным отношением опухоли к фону. ФАПИ (Fibroblast Activation Protein Inhibitors) являются ингибиторами фибробластического активирующего белка (ФАБ), который вырабатывается фибробластами и присутствует в большинстве опухолей. Ингибирование ФАБ может оказывать воздействие на фибробласты [Kratochwil C. и др. 68Ga-FAPI PET/CT: Tracer Uptake in 28 Different Kinds of Cancer // Journal of Nuclear Medicine. 2019. Т. 60. № 6. С. 801–805]. ФАБ является ключевым фактором активации фибробластов и могут способствовать развитию фиброза. Ингибирование ФАБ может приводить к снижению активации фибробластов и снижению скопления соединительной ткани. Таким образом, ФАПИ могут оказывать воздействие на фибробласты путем ингибирования ФАБ, что может приводить к снижению развития фиброза и в некоторых случаях - к снижению роста и распространения опухолей [Kratochwil C. и др. 68Ga-FAPI PET/CT: Tracer Uptake in 28 Different Kinds of Cancer // Journal of Nuclear Medicine. 2019. Т. 60. № 6. С. 801–805].
ФАПИ-04 представляет собой ингибитор белка активации фибробластов, который изучается в качестве потенциального средства для лечения рака. Результаты доклинических исследований и клинических испытаний на ранней стадии показали многообещающие результаты для этого препарата [Varasteh Z. и др. Molecular Imaging of Fibroblast Activity After Myocardial Infarction Using a 68Ga-Labeled Fibroblast Activation Protein Inhibitor, FAPI-04 // Journal of Nuclear Medicine. 2019b. Т. 60. № 12. С. 1743–1749].
Помимо активного интереса использования данного метода у онкологов, опубликован ряд исследований по использованию ФАПИ в кардиологической практике. По данным Varasteh Z. et al. (2019) авторадиография и окрашивание поперечных срезов гематоксилин-эозином выявили накопление 68Ga-ФАПИ-04 преимущественно в зоне инфарктного миокарда. Иммунофлуоресцентное окрашивание подтвердило наличие ФАП-позитивных миофибробластов в поврежденном миокарде. Морфометрический анализ срезов сердца показал, что плотность ФАП-позитивных фибробластов в пограничной зоне в 3 и 8 раз выше, чем в очаге инфаркта и отдаленных участках соответственно [Varasteh Z. и др. Molecular Imaging of Fibroblast Activity After Myocardial Infarction Using a 68Ga-Labeled Fibroblast Activation Protein Inhibitor, FAPI-04 // Journal of Nuclear Medicine. 2019a. Т. 60. № 12. С. 1743–1749].
Занимаясь в течение ряда лет диагностикой образований различных локализаций методом ПЭТ с 68Ga-ФАПИ-04, в ряде случаев нами было обнаружено патологическое накопление РФЛП в миокарде и в клапанных структурах, в том числе у пациентов, в прошлом перенесших хирургическое лечение по пересадке искусственных клапанов. В частности, приводим клинический случай пациента с злокачественным новообразованием толстой кишки, демонстрирующий повышенную аккумуляцию 68Ga-ФАПИ-04 в области биопротеза аортального клапана.
Пациент Б., 73 лет. В 2019 году перенес оперативное лечение по поводу рака восходящей ободочной кишки в объеме правосторонней гемиколэктомии. При контрольной КТ органов брюшной полости в 2020 году был выявлен отдаленный метастаз в печени, по поводу чего выполнена чрескожная радиочастотная аблация. В период с 2019 по 2020 гг. проходил 4 курса химиотерапии. При контрольной КТ органов грудной клетки от апреля 2023 года - выявлено метастатическое поражение правого легкого и канцероматоз плевры. С целью оценки микроокружения опухоли в легком перед инициацией курса химиотерапии было выполнено ПЭТ-КТ 68Ga-ФАПИ-04 всего тела, радиофармацевтический препарат вводили внутривенно струйно активностью 208,2 МБк. При анализе зон сканирования ПЭТ было визуализировано выраженное накопление РФП в створках протеза аортального клапана. Коэффициент дифференциального накопления (КДН max/mean) рассчитывали по формуле:
КДН max/mean = SUVмах над АК/SUVmean над пулом крови.
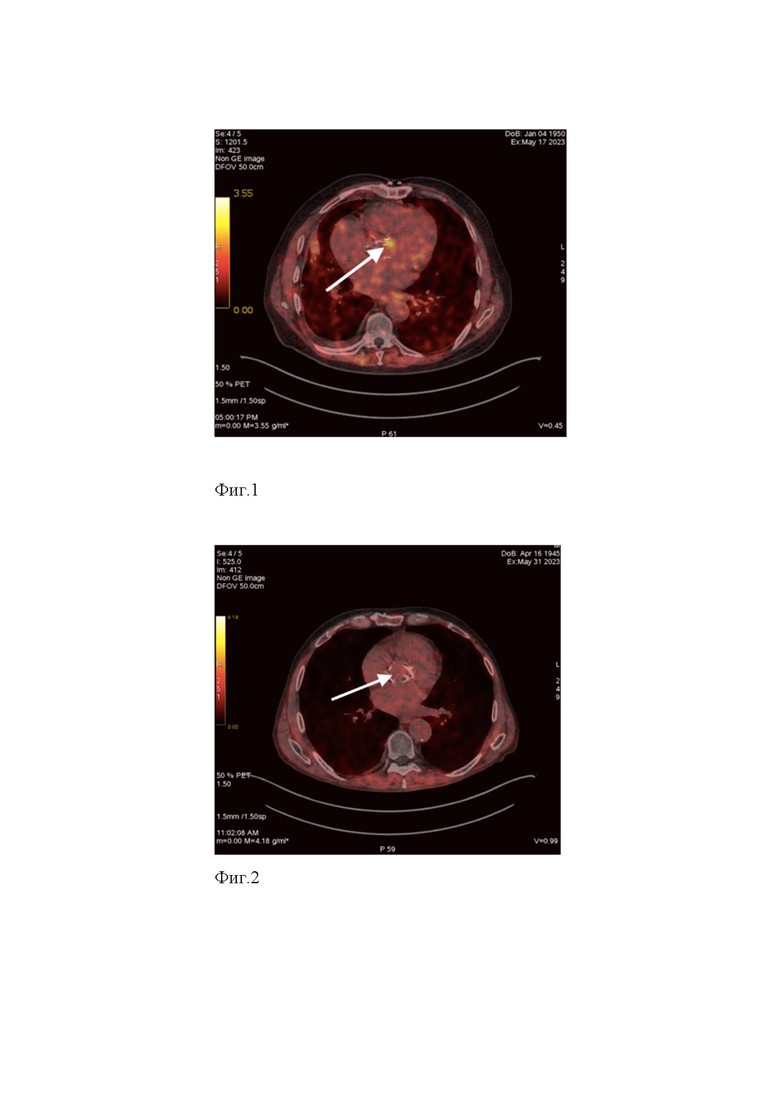
SUVмах над АК составил =2,6; SUVmean над пулом = 1,18. Коэффициент дифференциального накопления КДН max/mean, отражающий интенсивность аккумуляции 68Ga-FAPI-04 в проекции биопротеза клапана, составил 2,2. Из анамнеза известно, что ранее в 2019 году в рамках подготовки к онкологической операции у пациента был выявлен тяжелый аортальный стеноз. В 2019 году перенес операцию протезирования аортального клапана биологическим протезом в условиях искусственного кровообращения. Учитывая увеличение скоростных показателей на аортальном клапане (скорость максимальная после операции = 1,4 м/с, скорость максимальная через 8 лет после операции = 3,1 м/с) сделан вывод об активности фибропластических процессов на биопротезе аортального клапана (Фиг.1).
Это побудило нас попробовать использовать ПЭТ-КТ 68Ga-ФАПИ-04 в нашей клинической практике как выявления склеро-дегенеративных процессов биопротезов клапанов сердца на разных сроках после его имплантации. Мы провели 8 исследований ПЭТ-КТ 68Ga-ФАПИ-04 пациентам, ранее перенесшим протезирование аортального клапана биологическим протезом и сопоставили полученные данные с результатами эхокардиографии. Нами было установлено, что при значениях КДН max/mean более 2,0 отмечалось существенное ускорение максимальной скорости кровотока на протезированном клапане по сравнению с послеоперационными результатами ЭХОКГ, что позволило подтвердить активность склеро-дегенеративного процесса на протезированном клапане по данным ПЭТ.
Для лучшего понимания приводим описание чертежей.
Фиг.1 – Изображение ПЭТ-КТ с 68Ga-ФАПИ-04, аксиальный срез. В проекции аортального клапана визуализируется участок фиксации РФЛП (белая стрелка).
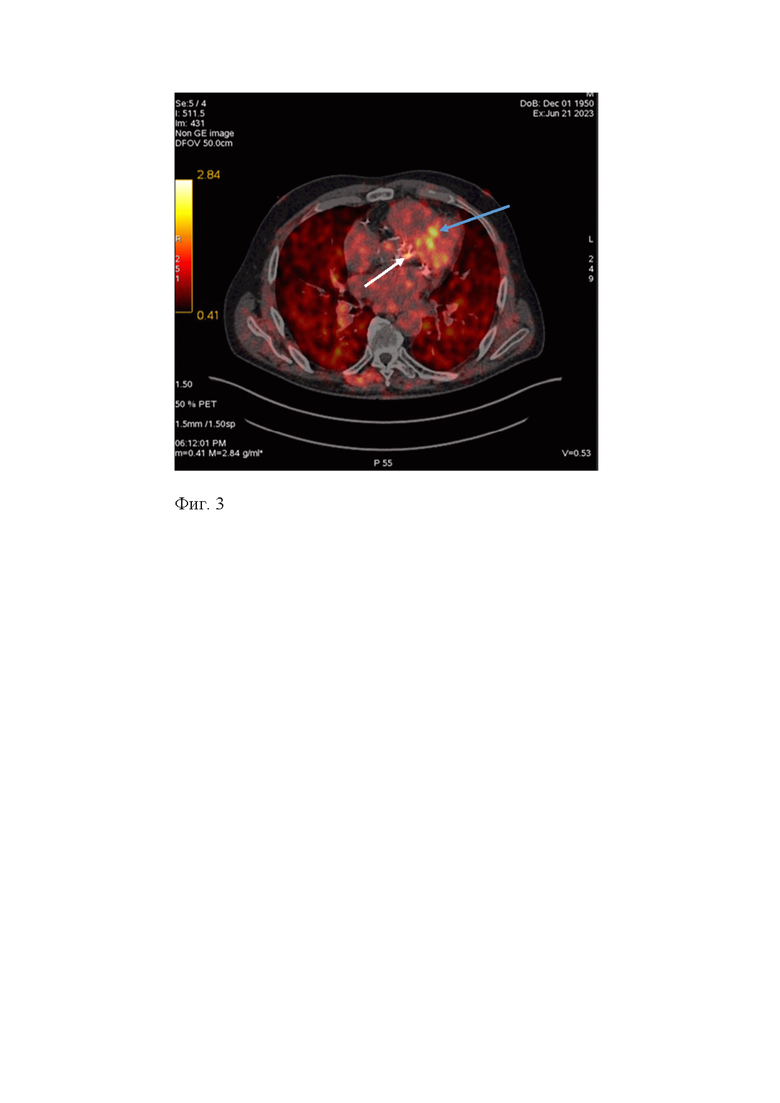
Фиг.2- Изображение ПЭТ-КТ с 68Ga-ФАПИ-04, аксиальный срез. В проекции аортального клапана не визуализируется патологическое накопление РФЛП (белая стрелка).
Фиг.3 - Изображение ПЭТ-КТ с 68Ga-ФАПИ-04, аксиальный срез. В проекции аортального клапана визуализируется участок фиксации РФЛП (белая стрелка), также определяется гиперфиксация РФЛП в миокарде базальных отделов межжелудочковой перегородки, вследствие формирования кардиофиброзных изменений на фоне высокой артериальной гипертензии (синяя стрелка).
Сущность способа поясняется примерами.
Пример 1.
Пациент Ч., 78 лет. В 2015 году выполнено протезирование аортального клапана по поводу аортального стеноза. Ежегодно наблюдался у кардиолога, выполнялась эхокардиография. Эхокардиографических признаков ускорения кровотока на протезе (скорость максимальная после операции = 2,1 м/с, скорость максимальная через 8 лет после операции = 2,26 м/с) или регургитации потока крови нет. Пациенту в плановом порядке выполнена ПЭТ-КТ 68Ga-ФАПИ-04, РФЛП активностью 220,5 МБк был введен пациенту внутривенно струйно. При анализе ПЭТ изображения отсутствовала гиперфиксация 68Ga-ФАПИ-04 в створках биопротеза (SUVмах над АК= 1,94; SUVmean над пулом крови = 0,97, КДН max/mean= 2,0), что позволило нам констатировать отсутствие биодеградации протеза клапана (Фиг.2).
Пример 2.
Пациент Л., 72 лет. В 2018 году выполнено протезирование аортального клапана. При динамическом наблюдении у кардиолога отмечено увеличение градиента в течение 5 лет с 25 до 40 мм рт ст. Пациенту в плановом порядке выполнена ПЭТ-КТ 68Ga-ФАПИ-04, РФЛП активностью 209,4 МБк был введен пациенту внутривенно струйно. Выявлено накопление РФПЛ в проекции протеза (SUVмах над АК= 2,48; SUVmean над пулом крови = 1,02, КДН max/mean= 2,43). КДН Также у пациента отмечена гиперфиксация РФЛП в базальных отделах, преимущественно межжелудочковой перегородки, что вероятно, связано с ремоделированием миокарда и формированием кардиофиброзных изменений на фоне высокой артериальной гипертензии. (Фиг. 3).
Разработанный и апробированный нами в клинических условиях способ оценки активности склеро-дегенеративных процессов биопротезов клапанов сердца позволяет оценить активность биологической деградации биопротезов на ранних стадиях, выявить группу риска пациентов с ранним формированием дисфункции биопротезов сердца и оптимизировать тактику лечения данной группы больных. Таким образом, перспективно исследование накопления препарата ФАПИ у пациентов с имплантированными биологическими протезами сердца.
К настоящему времени предлагаемым способом проведена визуализация биопротезов клапанов сердца у 8 пациентов. У трех пациентов выявлено накопление РФП в створках биопротезов. Средний срок у данных пациентов более 5 лет после операции на сердце.
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ радионуклидной диагностики рака предстательной железы | 2024 |
|
RU2830406C1 |
| Способ диагностики злокачественных новообразований органов малого таза | 2024 |
|
RU2828567C1 |
| СПОСОБ НЕОКУСПИДИЗАЦИИ АОРТАЛЬНОГО КЛАПАНА | 2020 |
|
RU2741253C1 |
| СПОСОБ ДИАГНОСТИКИ МРТ-НЕГАТИВНЫХ АКТГ-ПРОДУЦИРУЮЩИХ АДЕНОМ ГИПОФИЗА | 2018 |
|
RU2699218C1 |
| Устройство для формирования аортального клапана сердца | 2019 |
|
RU2721822C1 |
| Способ зашивания нижнего участка косопоперечной аортотомии, распространенной на некоронарный синус корня аорты | 2022 |
|
RU2786603C1 |
| СПОСОБ ПРОГНОЗИРОВАНИЯ РИСКА КАЛЬЦИФИКАЦИИ БИОЛОГИЧЕСКИХ ПРОТЕЗОВ КЛАПАНОВ СЕРДЦА | 2015 |
|
RU2597564C1 |
| СПОСОБ ИЗГОТОВЛЕНИЯ БИОПРОТЕЗА КЛАПАНА СЕРДЦА НА ГИБКОМ ОПОРНОМ КАРКАСЕ С НИЗКИМ ПРОФИЛЕМ | 2017 |
|
RU2698983C2 |
| Способ задней пластики корня аорты и выводного тракта левого желудочка для имплантации в аортальную позицию большего размера протеза | 2021 |
|
RU2774779C1 |
| СПОСОБ ПРОГНОЗИРОВАНИЯ РИСКА КАЛЬЦИФИКАЦИИ БИОЛОГИЧЕСКИХ ПРОТЕЗОВ КЛАПАНОВ СЕРДЦА, ИМПЛАНТИРОВАННЫХ В МИТРАЛЬНУЮ ПОЗИЦИЮ, НА ОСНОВАНИИ ГЕНОМНЫХ ПРЕДИКТОРОВ | 2016 |
|
RU2616507C1 |
Изобретение относится к медицине, а именно к кардиохирургии, лучевой диагностике и радиологии, и может быть использовано для диагностики склеро-дегенеративных процессов биопротезов клапанов сердца. Выполняют внутривенное введение пациенту радиофармацевтического препарата (РФП), позитронно-эмиссионную томографию сердца и расчет индекса накопления радиофармацевтического препарата. При этом в качестве РФП используют 68Ga-ФАПИ-04 из расчета 1,5-2 МБк на 1 кг массы тела больного, но не менее 100 МБк, а позитронную эмиссионную томографию сердца проводят через 60 мин после его введения. Оценку интенсивности накопления 68Ga-ФАПИ-04 в проекции имплантированного клапана выполняют путем расчета коэффициента дифференциального накопления (КДН max/mean) по формуле. При значении КДН max/mean больше 2 диагностируют склеро-дегенеративные процессы биопротезов клапанов сердца. Способ обеспечивает оценку активности биологической деградации биопротезов на ранних стадиях, выявление групп риска пациентов с ранним формированием дисфункции биопротезов сердца и оптимизацию тактики лечения данной группы больных за счет оценки интенсивности накопления 68Ga-ФАПИ-04 в проекции имплантированного клапана. 3 ил., 2 пр.
Способ диагностики склеро-дегенеративных процессов биопротезов клапанов сердца, включающий внутривенное введение пациенту радиофармацевтического препарата (РФП), позитронно-эмиссионную томографию сердца и расчет индекса накопления радиофармацевтического препарата, отличающийся тем, что в качестве РФП используют 68Ga-ФАПИ-04 из расчета 1,5-2 МБк на 1 кг массы тела больного, но не менее 100 МБк, а позитронную эмиссионную томографию сердца проводят через 60 мин после его введения, оценку интенсивности накопления 68Ga-ФАПИ-04 в проекции имплантированного клапана выполняют путем расчета коэффициента дифференциального накопления (КДН max/mean) по формуле:
КДН max/mean = SUVмах над АК/SUVmean над пулом крови,
где SUVmax - максимальное значение стандартизированного показателя накопления РФЛП, SUVmean - среднее значение стандартизированного показателя накопления РФЛП, АК - аортальный клапан, и при значении КДН max/mean больше 2 диагностируют склеро-дегенеративные процессы биопротезов клапанов сердца.
| СПОСОБ ДИАГНОСТИКИ ДИСФУНКЦИИ МЕХАНИЧЕСКИХ ДВУСТВОРЧАТЫХ КЛАПАНОВ СЕРДЦА | 2003 |
|
RU2272571C2 |
| СПОСОБ ПРОГНОЗИРОВАНИЯ РИСКА КАЛЬЦИФИКАЦИИ БИОЛОГИЧЕСКИХ ПРОТЕЗОВ КЛАПАНОВ СЕРДЦА | 2015 |
|
RU2597564C1 |
| Угольный комбайн | 1932 |
|
SU34495A1 |
| АСЛАНИДИ И.П | |||
| и др | |||
| Способ использования делительного аппарата ровничных (чесальных) машин, предназначенных для мериносовой шерсти, с целью переработки на них грубых шерстей | 1921 |
|
SU18A1 |
| Российский электронный журнал лучевой диагностики | |||
| Станок для придания концам круглых радиаторных трубок шестигранного сечения | 1924 |
|
SU2019A1 |
| Способ получения смеси хлоргидратов опийных алкалоидов (пантопона) из опийных вытяжек с любым содержанием морфия | 1921 |
|
SU68A1 |
| АСЛАНИДИ И.П | |||
| и др | |||
| Возможности позитронно-эмиссионной | |||
Авторы
Даты
2024-03-26—Публикация
2023-07-19—Подача