Изобретение относится к медицине, а именно к трансплантологии и сердечно-сосудистой хирургии, и может быть использовано для выявления и мониторинга лиц с высоким риском кальциевой дисфункции биологических протезов (БП) клапанов сердца.
Протезирование клапанов остается основным способом улучшения прогноза пациентов с приобретенными пороками сердца. Использование для имплантации протезов, изготовленных из биоматериалов, существенно лимитировано ограниченными сроками их функционирования в организме реципиента, вследствие развития кальцификации ксеногенной ткани. Однако ряд преимуществ БП перед механическими клапанами, к которым относят возможность отказа от антикоагулянтной терапии, создание оптимальных параметров внутрисердечной гемодинамики и постепенное развитие дисфункций, делает предпочтительным их применение в ряде клинических ситуаций, в том числе у лиц, имеющих высокий риск реопераций
Известно, что вероятность развития кальцификации биологических материалов определяется совокупным воздействием факторов имплантата и реципиента. Первая группа факторов обусловлена трансформациями, претерпеваемыми биоматериалом в процессе консервации и/или дополнительной модификации, то есть полностью зависит от предимплантационной обработки протеза [1-4]. К примеру, наиболее часто используемый в качестве консервирующего агента глутаровый альдегид провоцирует развитие кальцификации за счет формирования в коллагеновой матрице БП поперечных связей, напоминающих по структуре связи в костной ткани. Эта проблема десятилетиями стимулирует исследования, направленные либо на поиск альтернативных консервантов, либо на создание методов дополнительной модификации, призванной нивелировать отрицательные эффекты глутаральдегида [1, 5-9]. Одним из таких альтернативных сшивающих агентов является диглицидиловый эфир этиленгликоля - ДЭЭ, относящийся к группе эпоксидных соединений.
Известно, что риск развития кальцификации биологических протезов значительно снижается при девитализации или децеллюляризации ксеногенного материала, используемого при изготовлении имплантатов [10]. Предполагается, что клетки донора после трансплантации ткани вызывают иммунную реакцию, погибают и, в результате этого, инициируются процессы кальцификации и дегенерации ткани. Исходя из данного положения, предлагаются различные способы обработки трансплантатов, которые вызывают разрушение клеток донора на основе использования ферментов, гипотонического шока и детергентов. Однако децеллюляризация не является достаточным условием подавления кальциноза БП клапанов сердца, а стратификация риска развития кальций-ассоциированной дегенерации и своевременное выявление дисфункций трансплантата остается актуальной проблемой в хирургии клапанных пороков сердца.
Известно, что риск кальцификации биологического материала непосредственно связан с механической нагрузкой на створчатый аппарат протеза. Доказано, что более подвержены данному осложнению ксеногенные клапаны в митральной позиции, в меньшей степени - трикуспидальные имплантаты, а БП аортального клапана занимают промежуточное положение [15].
В свою очередь группа факторов риска реципиента, помимо возрастного критерия, включает весь комплекс его индивидуальных особенностей, а именно состояние метаболического, иммунологического и провоспалительного статуса, оказывающее прямое и/или опосредованное влияние на инициацию и развитие процесса кальциевой дегенерации БП, активно регулируемого на генетическом, биохимическом, клеточном и гормональном уровнях [11-14].
Известна взаимосвязь между концентрацией общего холестерина (ХС) сыворотки крови пациента и возникновением дегенеративных изменений БП (Farivar R.S., Cohn L.H. Hypercholesterolemia is a risk factor for bioprosthetic valve calcification and explantation. J Thorac Cardiovasc Surg 2003; 126 (4): 969-975). В исследовании показано, что для пациентов, реоперированных в связи с развитием кальцификации ксеногенной ткани протезов, характерны более высокие сывороточные концентрации общего холестерина (ХС) в сравнении с аналогичной группой лиц сопоставимого возраста и сохранным морфофункциональным состоянием имплантированных биологических клапанов в те же сроки наблюдения. В результате выявлена ведущая роль миграции липидов и клеточных элементов в ткань БП по аналогии с формированием атеросклеротического поражения артерий и кальцинированного стеноза нативного аортального клапана.
Среди прочих работ, посвященных изучению профиля кардиометаболического риска у реципиентов биологических клапанов, особого внимания заслуживает исследование Н. Mahjoub с соавторами (2013 г.), выполненное на группе из 203 пациентов с БП в позиции аортального клапана (ср. возраст на момент протезирования 67±8 лет) [15]. В группе пациентов с наличием дегенеративных изменений БП отмечено повышение концентрации общего ХС сыворотки крови (4,6±1,1, против 4,1±0,9 ммоль/л, р=0,05), ЛПНП (2,5±1,0, против 2,2±0,7 ммоль/л, р=0,02) и аполипопротеина В (АпоВ) (0,71±0,22, против 0,64±0,17 г/л, р=0,02) в сравнении с группой лиц, не имевших признаков структурных дисфункций имплантированных биологических клапанов. Однако сильнейшим независимым предиктором формирования дегенеративных изменений БП в данной работе явилось соотношение АпоВ/АпоА-I (0,48±0,17, против 0,41±0,11, р=0,004 - при сравнении групп; OR=l,41; 95% CI), отражающее баланс и качественный состав (размер, плотность, способность к окислению) про- и антиатерогенных частиц липопротеинов. По мнению авторов полученные результаты могут свидетельствовать о преимущественной роли дисрегуляции баланса транспорта ХС в возникновении и прогрессировании дисфункций, связанных с кальцификацией ксеноткани протеза.
Несмотря на имеющиеся достижения в изучении процессов патологической кальцификации мягких тканей, большую значимость приобретают исследования, направленные на выявление специфических факторов, способствующих раннему возникновению и ускоренному прогрессированию дегенеративных изменений БП. Приобретает актуальность разработка системного подхода к оценке вероятного прогноза дегенерации ксеноткани с учетом наиболее значимых критериев риска кальцификации, поскольку непредсказуемая прогрессия структурных изменений материала БП представляет угрозу для жизни пациентов. В связи с этим необходим регулярный мониторинг состояния реципиентов и контроль морфофункциональных параметров имплантированных клапанов в отдаленном периоде наблюдения, что позволит оптимизировать выявление потенциальных кандидатов для выполнения репротезирования даже при отсутствии явной клинической симптоматики дисфункций. В свою очередь, своевременно выполненное повторное хирургическое вмешательство (до развития тяжелых и необратимых нарушений внутрисердечной и системной гемодинамики) сопряжено со значительно меньшим риском осложнений и гораздо лучшим клиническим прогнозом.
Техническим результатом предлагаемого способа является повышение точности и специфичности прогнозирования риска развития кальцификации БП клапанов сердца, а также выявление и персональный мониторинг пациентов группы высокого риска развития дисфункций.
Технический результат достигается за счет комплексной оценки прогностических факторов и расчета вероятности риска развития кальцификации биологического материала протеза в зависимости от сроков функционирования в организме пациента.
Учитывая влияние на темпы развития патологической кальцификации характеристик ксеноматериала, способа консервации протеза и механической нагрузки, оказываемой на его створчатый аппарат в течение сердечного цикла, в исследуемую группу вошли пациенты с имплантированными в митральную позицию ксеноаортальными эпоксиобработанными клапанами. В отдаленном послеоперационном периоде пациентам выполняли регулярные контрольные осмотры, включающие общеклиническое исследование, проведение трансторакальной эхокардиографии (ЭХОКГ), а также оценку показателей минерального обмена.
Материалом для исследования служила сыворотка или плазма крови исследуемых пациентов. Методом твердофазного иммуноферментного анализа определяли концентрации паратиреоидного гормона (ПТГ), кальцитонина, 25-ОН витамина D, остеокальцина, костного изофермента щелочной фосфатазы, остеопротегерина и остеопонтина. Содержание кальция, фосфора и щелочной фосфатазы (ЩФ) оценивали на автоматическом биохимическом анализаторе KONELAB 320i (Финляндия) с использованием коммерческого набора (BioSys, Германия).
В исследование включено 172 пациента, из них у 63 выполнены повторные операции по причине развития кальциевой дегенерации БП. Характер сформировавшихся дисфункций идентифицирован при гистологическом и электронно-микроскопическом исследованиях эксплантированных протезов. Оставшиеся 109 реципиентов имели нормальную морфологию и функцию БП согласно данным ЭХОКГ.
Исходя из продолжительности временных интервалов от первичного протезирования до развития дисфункции БП и его замены, все пациенты были разделены на три группы: I - лица с функционированием имплантированного биологического клапана до четырех лет, II - срок от момента имплантации до репротезирования составил от четырех до восьми лет и III группа - с периодом функционирования протеза более восьми лет.
Исследуемые группы реципиентов БП не имели тендерных различий и были сопоставимы по этиологии пороков, объему и тяжести хирургических вмешательств. При этом пациенты с кальцификацией ксеноматериала протезов были достоверно моложе и характеризовались худшей комплаентностью к рекомендованной медикаментозной терапии.
Для оценки риска развития кальцификации применяли логистическую регрессию. Прогнозные модели строились для каждой из трех групп отдельно. При построении бинарной логистической регрессии использовали метод пошагового включения на основе максимального правдоподобия. Обработка данных проводилась в программе SPSS 17.
В качестве наиболее значимых факторов, определяющих вероятность кальцификации БП в первые четыре года после протезирования, были выделены пол пациента (X1), при этом для женщин значение коэффициента принималось равным 0, а для мужского - 1, его возраст, указанный в годах (Х2), значения сывороточных концентраций ЩФ (Х3), костного изофермента ЩФ (Х4), а также продолжительность функционирования БП (Х5) в годах (таблица 1).
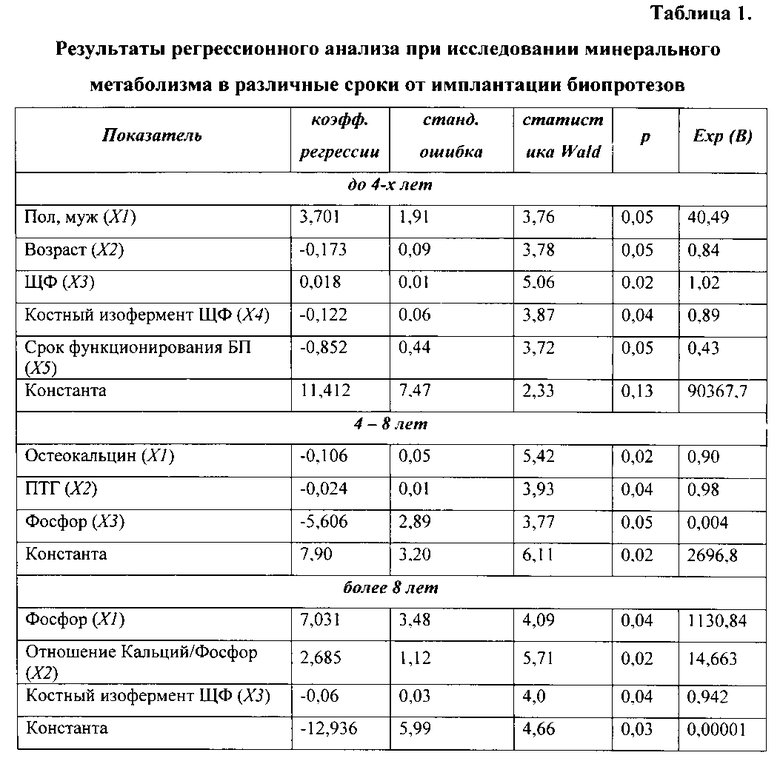

Выявлено, что во временном интервале до 4 лет риск кальциевой дегенерации протезов существенно преобладает у мужчин, а также при повышении содержания в сыворотке крови ЩФ и снижении ее костного изофермента. С увеличением возраста пациентов и сроков имплантации клапана отмечается уменьшение вероятности кальцификации.
Оценку риска вероятности развития раннего кальциноза БП (Р) осуществляли по формуле:
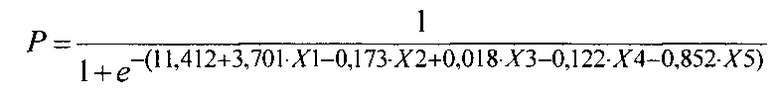
где коэффициенты регрессии, имеющие положительные значения, будут повышать, а отрицательные коэффициенты - понижать вероятность развития кальциноза.
Полученные значения вероятности развития кальциноза Р измеряются в пределах от 0 до 1. На первоначальном этапе в качестве порога классификации выбирается значение, равное 0,5. При таком пороге классификации чувствительность модели составила 67%, а специфичность - 100%. Для улучшения качества классификации и проверки адекватности модели был проведен ROC-анализ. Изменение порога отсечения (с 0,5 на 0,126) позволило увеличить чувствительность до 89%, при этом специфичность модели оставалась удовлетворительной - 71%.
Оценка кальций-фосфорного гомеостаза реципиентов в сроки от четырех до восьми лет от момента имплантации позволила отнести к числу факторов, оказывающих преимущественное влияние на сохранность структурной и функциональной стабильности БП, значения показателей остеокальцина (X1), ПТГ (Х2) и фосфора (Х3) (таблица 1). В представленном периоде времени повышение сывороточных концентраций данных аналитов сопровождалось уменьшением риска развития кальцификации.
Прогностическую оценку вероятности кальциевой дегенерации при средних сроках функционирования ксеноаортальных клапанов проводили по формуле:
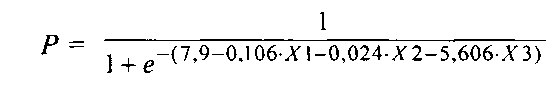
Качественными характеристиками данной модели являются: чувствительность - 86%, специфичность - 80%. По результатам ROC-анализа путем изменении порога классификации с 0,5 на 0,312 удалось повысить чувствительность модели до 93%.
При исследовании минерального обмена пациентов по прошествии восьми и более лет после протезирования основными факторами риска кальцификации явились: содержание в сыворотке крови пациентов фосфора (X1), величина кальций-фосфорного отношения (Х2) и уровень костного изофермента ЩФ (Х3) (таблица 1). Увеличение концентраций фосфора и значений показателя, характеризующего соотношение кальция и фосфора, оказывало прямое влияние на риск кальций-ассоциированных дисфункций имплантированных клапанов, а повышение костного изофермента ЩФ - обратное.
Прогностическая модель риска кальцификации при периоде функционирования БП в интервале более 8 лет имеет вид:
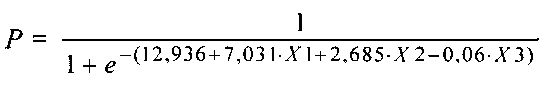
Первоначально специфичность данной модели составила 84%, а ее чувствительность - 57%. Качество классификации было улучшено посредством ROC-анализа при изменении порога отсечения (с 0,5 на 0,367). При этом чувствительность увеличилась до 71%, а специфичность осталась неизменной.
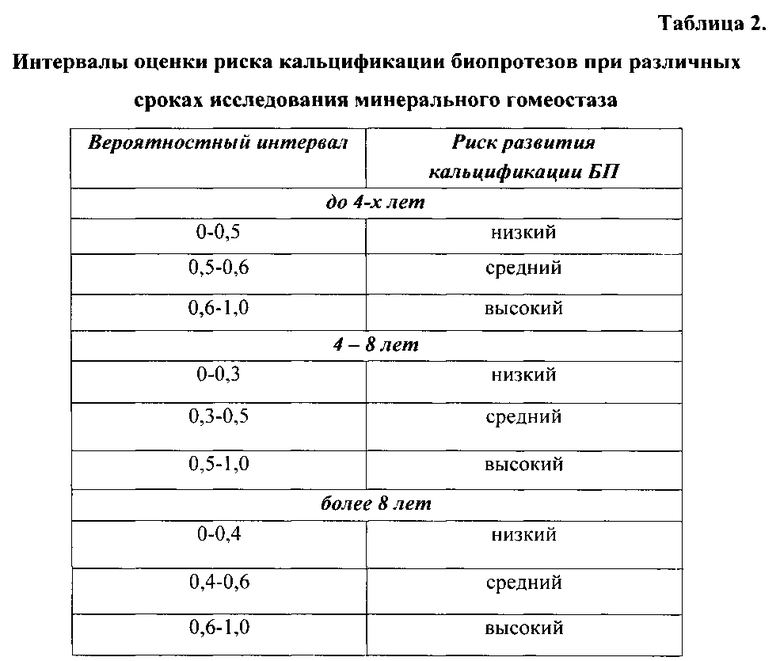
Последующий анализ значений чувствительности и специфичности позволил выделить условные интервалы качественной оценки риска дегенеративных изменений БП для каждого временного периода исследований минерального гомеостаза (таблица 2).
На заключительном этапе работы с целью тестирования эффективности построенных моделей была проведена проспективная оценка вероятности развития кальцификации ксеноаортальных протезов в зависимости от особенностей метаболического статуса реципиентов.
При низких и средних значениях риска морфофункциональное состояние имплантированных клапанов по данным ЭХОКГ оставалось удовлетворительным. В то время как у лиц с рассчитанным высоким риском в подавляющем большинстве случаев выявляли структурные изменения створчатого аппарата БП и нарушения внутрисердечной гемодинамики, свидетельствующие о необходимости проведения повторных хирургических вмешательств. Для данных пациентов были разработаны специальные алгоритмы амбулаторного наблюдения, позволяющие определить наиболее предпочтительные сроки выполнения репротезирования.
Ниже приведены примеры осуществления способа.
Пример 1. Пациент М., 60 лет (X1), оперирован три года назад (Х5), в возрасте 47 лет по поводу недостаточности митрального клапана III-IV ст., развившейся вследствие частичного отрыва хорд передней створки и ее расщепления в зоне А2 на фоне синдрома изолированной дисплазии соединительной ткани. Выбор для имплантации биологического протеза (БП) был обусловлен невозможностью адекватного мониторирования эффективности непрямых антикоагулянтов в послеоперационном периоде, высокой вероятностью сохранения синусового ритма и личными предпочтениями пациента. Исследование состояния кальций-фосфорного гомеостаза проведено спустя три года после выполнения митрального протезирования. Значения показателей щелочной фосфатазы (Х3) и ее костного изофермента (Х4) составили 87 Е/л и 17,82 Е/л, соответственно.
Расчет вероятной кальцификации биологического протеза (Р) проводили по формуле:

Прогнозная вероятность для данного временного интервала составила 0,96, что соответствовало высокому риску развития кальциевой дегенерации ксеногенного материала.
При проведении ЭХОКГ исследования отмечены структурные изменения БП, проявляющиеся присутствием отложений кальция преимущественно в основании створок имплантированного клапана и области комиссур (средний диастолический градиент на протезе составил 11,8 мм рт.ст.), и нарушение его замыкательной функции (центральная транспротезная регургитация II степени). В связи с наличием неблагоприятного прогноза для пациента разработан индивидуальный алгоритм дальнейшего наблюдения, позволяющий определить оптимальные сроки выполнения повторного хирургического вмешательства и провести адекватную предоперационную подготовку. Кроме того, была проведена коррекция получаемой медикаментозной терапии.
Пример 2. Пациентке У. 61 года БП имплантирован в возрасте 55 лет в связи с диагностированным ревматическим пороком митрального клапана с преобладанием стеноза. На момент оценки состояния минерального обмена срок функционирования БП составил 6,5 лет. Уровень остеокальцина в сыворотке крови (X1) соответствовал значению 12,66 нг/мл, концентрация паратиреоидного гормона (Х2) составила 103,8 пг/мл, содержание фосфора (Х3) - 0,88 ммоль/л.
В соответствии с формулой, используемой для выбранного временного интервала, был рассчитан риск развития кальцификации:

Таким образом, риск развития кальцификации БП был расценен как средний, а прогноз как относительно благоприятный. При выполнении ЭХОКГ исследования выявлено умеренное уплотнение створок имплантированного клапана при отсутствии существенных нарушений транспротезной гемодинамики (средний диастолический градиент был равен 7,9 мм рт.ст.). Пациентке рекомендовано выполнение ежегодных контрольных осмотров и незамедлительное обращение в клинику при ухудшении самочувствия.
Пример 3. У пациента И., 68 лет, показанием к хирургической коррекции порока также явилась ревматическая болезнь сердца с преимущественным поражением митрального клапана и развитием его стеноза и недостаточности равной степени выраженности. Кроме того, у больного имела место сопутствующая функциональная трикуспидальная недостаточность, по поводу которой было выполнено пластическое вмешательство (имплантировано опорное кольцо «Неокор»). При исследовании основных показателей, отражающих состояние минерального обмена, период времени от имплантации БП исчислялся 11,5 годами. Содержание в сыворотке крови пациента фосфора (X1) составило 1,01 ммоль/л, рассчитанная величина соотношения сывороточных концентраций кальция и фосфора (Х2) была равна 2,16, уровень костного изофермента ЩФ (Х3) - 28,14 Е/л.
Риск кальциевой дегенерации для данного периода эксплуатации митрального БП был рассчитан по формуле
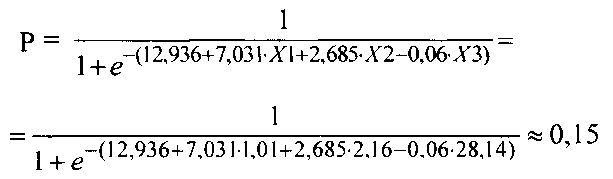
Прогнозная вероятность составила 0,15, что соответствовало низкому риску развития патологической кальцификации биоматериала протеза и наличию благоприятного прогноза.
По результатам ЭХОКГ состояние БП оставалось удовлетворительным, структурные изменения створчатого аппарата и нарушения внутрисердечной гемодинамики отсутствовали (средний диастолический транспротезный градиент составил 5,8 мм рт.ст.), замыкательная функция трехстворчатого клапана также была сохранна.
Практическая значимость предложенного способа заключается в возможности прогнозирования вероятности развития кальциевой дегенерации протезов, что позволит усовершенствовать алгоритмы наблюдения реципиентов на амбулаторном этапе, оптимизировать выбор сроков повторных хирургических вмешательств и будет способствовать повышению выживаемости, улучшению качества жизни пациентов и снижению экономических затрат на их лечение. Кроме того, на основании полученных знаний возможна разработка медикаментозных стратегий подавления кальциевой дегенерации биологических структур.
Литература
1. Барбараш Л.С. Биопротезы клапанов сердца, проблемы и перспективы. Л.С. Барбараш, Н.А. Барбараш, И.Ю. Журавлева. Кемерово. 1995; 400 с.
2. Grabenwger M., Sider J., Fitzal F. et al. Impact of glutaraldehyde on calcification of pericardial bioprosthetic heart valve material. Ann Thorac Surg. 1996; 62(3):772-777.
3. Schoen F.J., Harasaki H., Kim K.M., et al. Biomaterial associated calcification: pathology, mechanisms, and strategies for prevention. J Biomed Mater Res 1988; 22(Suppl. A1): 11-36.
4. Schoen F.J., Levy R.J. Calcification of tissue heart valve substitutes: progress toward understanding and prevention. Ann Thorac Surg 2005; 79:1072-1080.
5. Журавлева И.Ю., Глушкова T.B., Веремеев A.B. и др. Применение аминодифосфоната для профилактики кальцификации эпоксиобработанных биопротезов. Патология кровообращения и кардиохирургия. 2010; 2:18-21.
6. Chen C.N., Sung H.W., Liang H.F et al. Feasibility study using a natural compound (reuterin) produced by Lactobacillus reuteri in sterilizing and crosslinking biological tissues. J Biomed Mater Res. 2002; 61(3):360-369.
7. Tsai C.C., Chang Y., Sunget H.W. et al. Effects of heparin immobilization on the surface characteristics of a biological tissue fixed with a naturally occurring cross-linking agent (genipin): an in vitro study. J Biomaterial. 2001; 22:523-533.
8. Clark J.N., Ogle M.F., Ashworth P. et al. Prevention of calcification of bioprosthetic heart valve cusp and aortic wall with ethanol and aluminum chloride. Ann Thorac Surg. 2005; 79 (3); 897-904.
9. Neethling W.M., Hodge A.J., Clode P. et al. A multi-step approach in anti-calcification of glutaraldehyde-preserved bovine pericardium. J Cardiovasc Surg. 2006; 47(6):711-718.
10. Рындина Н.И. Исследование механизма инициации кальциноза трансплантатов клапанов сердца и разработка способов его предотвращения: автореф. дис. на соиск. учен. степ. канд. биол. наук: специальность 03.00.02 <Биофизика> / Рындина Наталья Ивановна; [Ин-т теорет. и эксперим. биофизики РАН]. - Пущино: 2006. - 22 с.: ил.; 21 см.
11. Oakley R., Kleine P., Bach D.S. Choice of Prosthetic Heart Valve in Today's Practice. Circulation 2008; 117(2):253-256.
12. Flameng W., Herregods M.C, Vercalsteren M. et al. Bioprosthetic-patient mismatch predicts structural valve degeneration in bioprosthetic heart valves. Circulation 2010; 121:2123-2129.
13. Ilbawi M.N. Valve replacement in children. Ann Thorac Surg. 1987; 44(4):398-403.
14. Antunes M.J., Santos L.P. Performance of glutaraldehyde-preserved porcine bioprosthesis as a mitral valve substitute in a young population group.Ann Thorac Surg. 1984; 37(6):387-392.
15. Thubrikar M.J., Deck J.D., Aouad J. et al. Role of mechanical stress in calcification of aortic bioprosthetic valves. J Thorac Cardiovasc Surg. 1983; 86:115-125.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПРОГНОЗИРОВАНИЯ РИСКА КАЛЬЦИФИКАЦИИ БИОЛОГИЧЕСКИХ ПРОТЕЗОВ КЛАПАНОВ СЕРДЦА, ИМПЛАНТИРОВАННЫХ В МИТРАЛЬНУЮ ПОЗИЦИЮ, НА ОСНОВАНИИ ГЕНОМНЫХ ПРЕДИКТОРОВ | 2016 |
|
RU2616507C1 |
| Способ оценки активности склеро-дегенеративных процессов биопротезов клапанов сердца | 2023 |
|
RU2816076C1 |
| Способ торакоскопического транскатетерного репротезирования митрального клапана самораскрывающимся биологическим протезом (варианты) | 2016 |
|
RU2632540C1 |
| Способ протезирования митрального клапана аутоперикардом | 2022 |
|
RU2804993C1 |
| СПОСОБ ИЗГОТОВЛЕНИЯ БИОПРОТЕЗА КЛАПАНА СЕРДЦА НА ГИБКОМ ОПОРНОМ КАРКАСЕ С НИЗКИМ ПРОФИЛЕМ | 2017 |
|
RU2698983C2 |
| СПОСОБ КОНСЕРВИРОВАНИЯ БИОТКАНИ ДЛЯ ПРОТЕЗИРОВАНИЯ КЛАПАНОВ СЕРДЦА И СОСУДОВ | 1992 |
|
RU2008767C1 |
| СПОСОБ РАСШИРЕНИЯ ФИБРОЗНОГО КОЛЬЦА АОРТАЛЬНОГО КЛАПАНА | 2000 |
|
RU2196515C2 |
| ЭКСТРАКАРДИАЛЬНЫЙ КЛАПАНОСОДЕРЖАЩИЙ КОНДУИТ И СПОСОБ ЕГО ИЗГОТОВЛЕНИЯ | 2001 |
|
RU2202991C2 |
| Транскатетерный торакоскопический способ протезирования митрального клапана у пациентов крайне высокого риска хирургического лечения (варианты) | 2017 |
|
RU2675068C1 |
| Способ прогнозирования осложнений, связанных с состоянием протеза и корня аорты после транскатетерной имплантации аортального клапана по данным компьютерной томографии | 2023 |
|
RU2820224C1 |
Группа изобретений относится к медицине, а именно к трансплантологии и сердечно-сосудистой хирургии, и может быть использована для прогнозирования риска кальцификации биологических протезов клапанов сердца. При сроке эксплуатации протеза менее 4 лет у пациента определяют пол, возраст, значение сывороточной концентрации щелочной фосфатазы, уровня костного изофермента щелочной фосфатазы, длительность функционирования биологического протеза в годах. Вероятный риск (Р) кальцификации определяют по формуле. При Р, равном 0-0,5, прогнозируют низкий риск кальцификации. При Р от 0,5 до 0,6 - риск средний. При значениях Р 0,6-1,0 вероятен высокий риск кальцификации импланта. При сроке эксплуатации протеза от 4 до 8 лет определяют значение сывороточного остеокальцина пациента, уровня паратиреоидного гормона, содержание фосфора в сыворотке крови. Вероятный риск (Р) кальцификации определяют по формуле. Низкий риск кальцификации прогнозируют при значениях Р от 0 до 0,3. Средний риск прогнозируют при Р 0,3-0,5. К группе высокого риска относят пациентов со значениями Р 0,5-1. При сроке эксплуатации протеза более 8 лет определяют содержание фосфора в сыворотке крови, значение кальций-фосфорного отношения, уровень костного изофермента щелочной фосфотазы. Вероятный риск (Р) кальцификации определяют по формуле, а низкий риск прогнозируют при Р 0-0,4. Средний риск при Р 0,4-0,6. Высокий риск кальцификации при Р от 0,6 до 1,0. Группа изобретений позволяет точно провести прогнозирование риска кальцификации биологических протезов клапанов сердца за счет оценки наиболее значимых показателей. 3 н.п. ф-лы, 2 табл., 3 пр.
1. Способ прогнозирования риска кальцификации биологических протезов клапанов сердца, включающий определение факторов риска кальциевой деградации ксеноткани реципиента, а именно пол (X1), возраст пациента в годах (Х2), отличающийся тем, что при сроке эксплуатации протеза менее 4 лет дополнительно определяют значение сывороточной концентрации щелочной фосфатазы (Х3), уровня костного изофермента щелочной фосфатазы (Х4), длительность функционирования биологического протеза в годах (Х5) и вероятный риск кальцификации определяют по формуле:
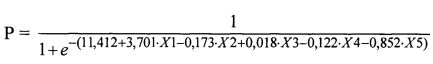 ,
,
при этом X1 принимает значение, равное 1 для лиц мужского пола, и значение, равное 0 для женщин, в случае расчетных показателей Р, равных 0-0,5, прогнозируют низкий риск кальцификации, при Р от 0,5 до 0,6 - риск средний, а при значениях Р в интервале 0,6-1,0 вероятен высокий риск кальцификации импланта.
2. Способ прогнозирования риска кальцификации биологических протезов клапанов сердца, включающий определение факторов риска кальциевой деградации ксеноткани реципиента, отличающийся тем, что при сроке эксплуатации протеза от 4 до 8 лет определяют значение сывороточного остеокальцина пациента (X1), уровня паратиреоидного гормона (Х2), содержание фосфора в сыворотке крови (Х3), а вероятный риск определяют по формуле:
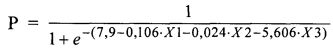 ,
,
при этом низкий риск кальцификации прогнозируют при значениях Р от 0 до 0,3, средний риск при Р 0,3-0,5, а к группе высокого риска относят пациентов со значениями Р 0,5-1.
3. Способ прогнозирования риска кальцификации биологических протезов клапанов сердца, включающий определение факторов риска кальциевой деградации ксеноткани реципиента, отличающийся тем, что при сроке эксплуатации протеза более 8 лет определяют содержание фосфора в сыворотке крови пациента (X1), значение кальций-фосфорного отношения (Х2), уровень костного изофермента щелочной фосфотазы, а вероятный риск кальцификации оценивают по формуле:
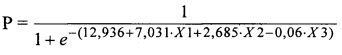 ,
,
при этом низкий риск прогнозируют при Р 0-0,4, средний риск при Р 0,4-0,6, а высокий риск кальцификации при Р от 0,6 до 1,0.
| MAHJOUB H | |||
| ApoB/ApoA-I ratio is associated with increased risk of bioprosthetic valve degeneration | |||
| J Am Coll Cardiol | |||
| Многоступенчатая активно-реактивная турбина | 1924 |
|
SU2013A1 |
| Способ прогнозирования тромбоза сосудистого протеза | 1985 |
|
SU1363070A1 |
| СПОСОБ ДИАГНОСТИКИ ОСЛОЖНЕНИЙ У АНГИОХИРУРГИЧЕСКИХ БОЛЬНЫХ ПОСЛЕ РЕКОНСТРУКТИВНЫХ ОПЕРАЦИЙ | 1992 |
|
RU2083984C1 |
| СПОСОБ ПРОГНОЗИРОВАНИЯ РАЗВИТИЯ ОСЛОЖНЕННОГО СИСТЕМНОГО ВОСПАЛИТЕЛЬНОГО ОТВЕТА У ПАЦИЕНТОВ С ИНФЕКЦИОННЫМ ЭНДОКАРДИТОМ | 2013 |
|
RU2520753C1 |
| WO 2001002031 A2 11.01.2001 | |||
| КОНДЮКОВА Н.В | |||
| Оценка состояния кальций-фосфорного гомеостаза у реципиентов биопротезов клапанов | |||
Авторы
Даты
2016-09-10—Публикация
2015-06-17—Подача