Настоящее изобретение относится к способу лечения, а именно к применению гепаринизированных наночастиц оксида железа в качестве радиосенсибилизатора с магнитным наведением при лучевой терапии злокачественных новообразований.
В области лучевой терапии за последнее время наблюдается существенный прогресс, обусловленный появлением высокоэнергетических источников облучения, расширением возможностей коллимации пучка ионизирующих частиц, применением эффективных режимов облучения и схем радиосенсибилизации и модификации.
Основная концепция радиосенсибилизации основана на повышении восприимчивости опухолевой ткани к облучению, которое приводит к увеличению эффективности лучевой терапии на фоне снижения дозы облучения и, соответственно, интенсивности сопутствующих побочных эффектов [Muschel R.J., Soto D.E., McKenna W.G., et al.//Radiosensitization and apoptosis. Oncogene. - 1998. N. 17. - P. 3359 - 33632.].
Использование наночастиц в качестве радиосенсибилизаторов привлекает к себе все большее внимание исследователей и находит все более широкое применение в онкологической практике. Частицы, размер которых в диаметре не превышает 100 нм, входят в категорию «наночастицы». Малый размер частиц способствует хорошему проникновению в клетки и их удержанию, что обеспечивает преимущественное их накопление в тканях-мишенях, в том числе и в ткани опухоли, сводя к минимуму риск поражения нормальной ткани.
В качестве агентов для разработки наноразмерных частиц выступают вещества, содержащие атомы золота, платины, висмута, тантала, а также железа [Espinosa A., Di Corato R., Kolosnjaj-Tabi J., Flaud P., Pellegrino Т., Wilhelm C. Duality of iron oxide nanoparticles in cancer therapy: amplification of heating efficiency by magnetic hyperthermia and photothermal bimodal treatment//ACS Nano. - 2016. - N. 10. - P. 2436-2446.; Kojima K., Takahashi S., Saito S., Nittami Т., Usugi E., Ishii K., Y. Hirokawa, Watanabe M. Magnetic iron oxide nanoparticles induce apoptosis and autophagic cell death in prostate cancer cells treated with docetaxel via ROS generation and NF-KB signaling. AACR Annual Meeting. - 2018.].
Наночастицы на основе оксида железа в основном состоят из магнетита (Fe3O4) или маггемита (γFe2O3), которые обладают суперпарамагнитными свойствами, а с помощью внешней магнитной силы эти частицы можно направить и локализовать в основной мишени - опухоли [Wadajkar AS, Menon JU, Kadapure T, et al. Design and Application of Magnetic-based. Theranostic Nanoparticle Systems//Recent Pat Biomed Eng. - 2013. -N. 6. - P. 47-57.]. Известно, что они обладают высокой биосовместимостью и незначительной токсичностью в отношении нормальных тканей, что позволяет использовать их в качестве потенциальных радиосенсибилизаторов [Mikhaylov G, Vasiljeva О. Promising approaches in using magnetic nanoparticles in oncology//Biol Chem. - 2011. - N. 392. - P. 955-960]. Кроме того, такие наночастицы обладают цитотоксическим эффектом в отношении опухолевых клеток за счет образования в них активных форм кислорода (АФК): перекиси водорода, гидроксильного и гидропероксильного радикалов и супероксидного аниона, которые вызывают повреждение ДНК и других клеточных структур.
Известно, что суперпарамагнитные наночастицы оксида железа повышают чувствительность опухолевых клеток in vitro и in vivo к рентгеновскому излучению [Russell Е., Dunne V., Russell В., et al. Impact of superparamagnetic iron oxide nanoparticles on in vitro and in vivo radiosensitisation of cancer cells//Radiat Oncol. - 2021. -N 16. - P. 104].
Весь спектр достоинств магнитных наночастиц оксида железа обусловливает целесообразность разработки эффективных режимов сочетанного применения наночастиц оксида железа с лучевой терапией с целью повышения эффективности лечения.
В научной и патентной литературе отсутствуют данные по внутривенному применению наночастиц оксида железа, покрытых гепарином, в качестве радиосенсибилизатора с направленным магнитным транспортом при лучевой терапии злокачественных новообразований. В России в настоящее время отсутствуют препараты и способы применения, аналогичные вышеприведенному по механизму действия.
Механизм действия наночастиц оксида железа под действием ионизирующего излучения связан с повышением уровня активных форм кислорода (in vitro, in vivo) вследствие диссоциации воды за счет усиления локализованной эмиссии вторичных электронов из наночастиц [Kempson I. Mechanisms of nanoparticle radiosensitization //WIREs Nanomedicine and Nanobiotechnology. - 2020. -№13. - e1656], при этом чем ниже рН среды, тем больше наночастицы стимулируют выход активных форм кислорода.
Из уровня техники известно изобретение по патенту RU 2490027 С9, относящееся к медицине и касающееся магнитных наночастиц для лечения и/или профилактики рака, выполненных из оксидов железа или чистого железа, содержащего оксидный слой, где по меньшей мере одно терапевтически активное вещество связано с указанными частицами. При этом высвобождение по меньшей мере одного терапевтически активного вещества вызывается, или инициируется, или существенно ускоряется переменным магнитным полем.
Согласно описанию наночастицы можно стабилизировать коллоидной защитной оболочкой, защищающей наночастицы от агломерации. Как правило, такие защитные оболочки или покрытия обеспечиваются аминогруппами или карбоксильными группами. Для таких защитных оболочек (покрытий) могут использоваться биологические, синтетические или полусинтетические полимеры. Для получения барьерного слоя обычно используются полимеры, предпочтительно биостабильные полимеры, например, весьма устойчивые к биологической деградации. Для образования клеточно-специфических оболочек (покрытий) предпочтительно использование биодеградируемых полимеров. В качестве такого полимера указан (среди множества других соединений) гепарин. К областям применения и использования наночастиц относятся гипертермия, радиотерапия, в частности параллельно с химиотерапией.
Предметом изобретения по заявке US 20200246179 А2 является способ лечения опухоли или другой патологии путем проведения термотерапии или комбинации термотерапии и иммунотерапии, необязательно в сочетании с доставкой генов. Комбинированная терапия благоприятно воздействует на опухоль и предотвращает рецидив опухоли, локально или в другом месте, за счет усиления иммунного ответа пациента - как в случае проведения первоначальной терапии, так и/или для более поздних стадий терапии. Терапия может дополнительно включать введение вакцины. Терапию в одном из вариантов реализации проводят металлическими наночастицами (железо), конъюгированными с гепарином.
Аналоги предлагаемого способа по технической сущности и достигаемому результату в патентной и научной литературе отсутствуют.
Список иллюстраций:
Фиг. 1 - Динамика роста карциномы толстой кишки СТ26 при воздействии НЧ в сочетании с лучевой терапией.
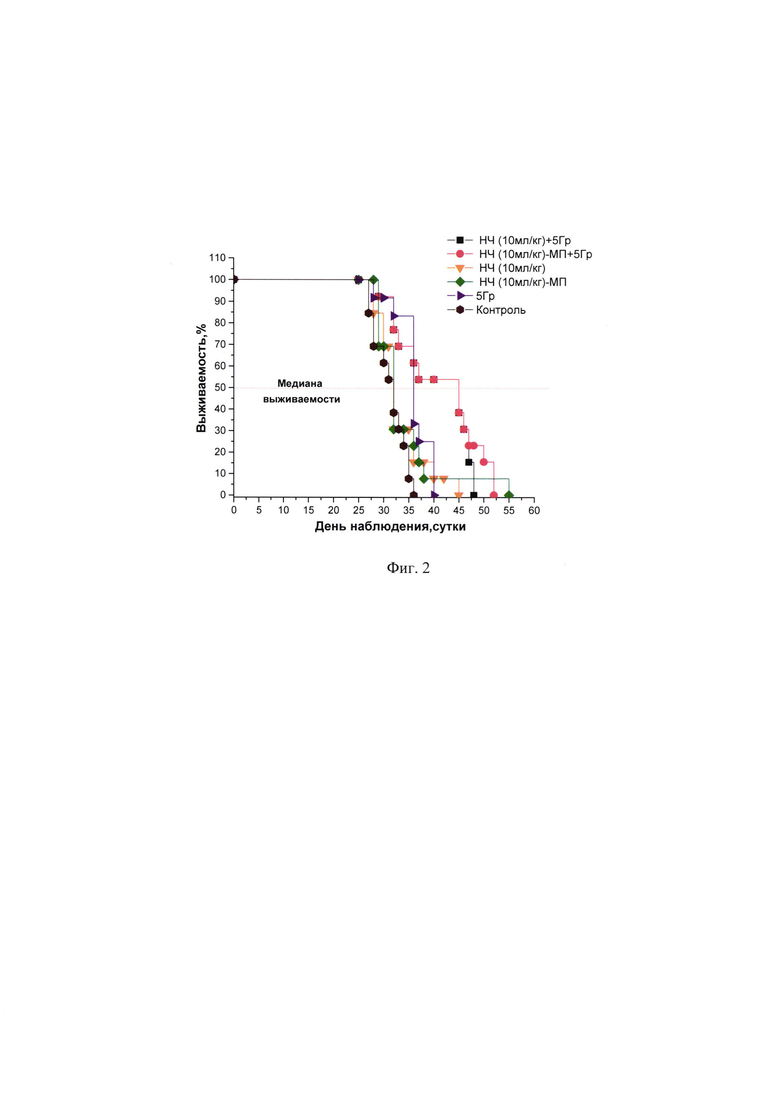
Фиг. 2 - Выживаемость мышей с СТ26 при воздействии НЧ в сочетании с лучевой терапией.
Фиг. 3 - Динамика роста опухоли шейки матки РШМ5 при воздействии НЧ в сочетании с лучевой терапией.
Фиг. 4 - Выживаемость мышей с РШМ5 при воздействии НЧ в сочетании с лучевой терапией.
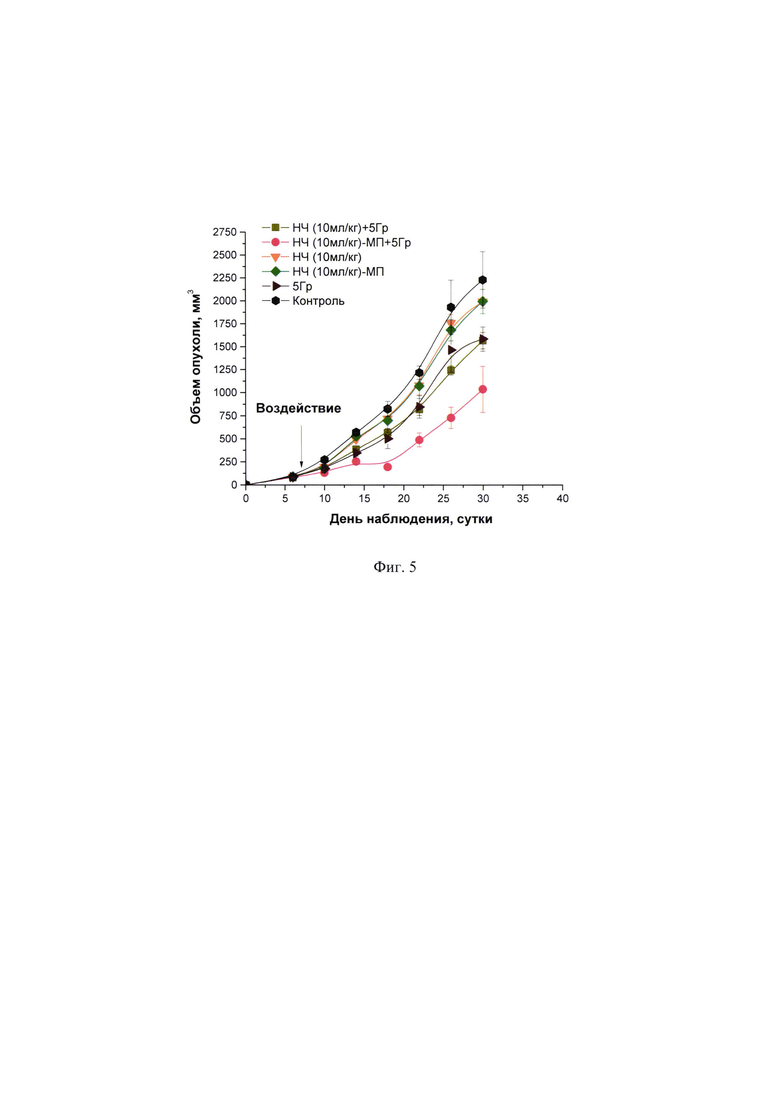
Фиг. 5 - Динамика роста саркомы S37 при воздействии НЧ в сочетании с лучевой терапией.
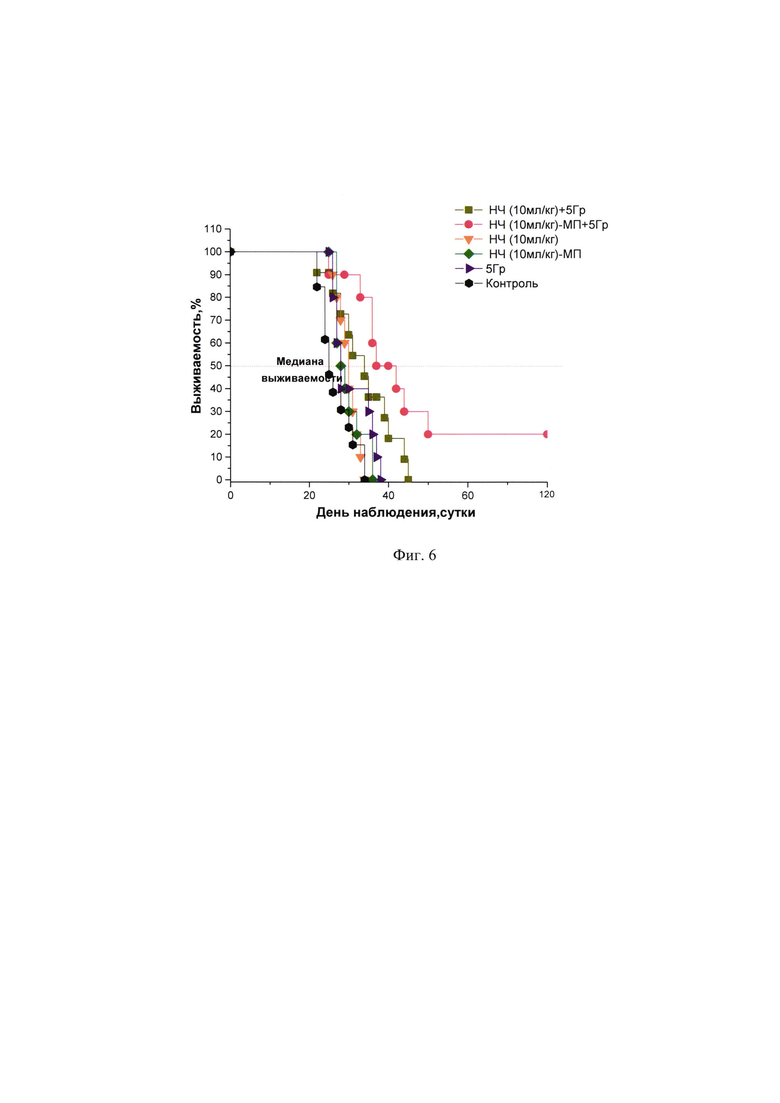
Фиг. 6 - Выживаемость мышей с саркомой S37 при воздействии НЧ в сочетании с лучевой терапией.
Задачей настоящего изобретения является разработка нехирургического способа лечения злокачественный новообразований с помощью наночастиц оксида железа, покрытых гепарином, в комбинации с магнитным транспортом и лучевой терапией.
Техническим результатом является разработка способа терапии злокачественных новообразований путем внутривенного введения наночастиц оксида железа, покрытых гепарином, создания постоянного магнитного поля в области опухоли и последующего ионизирующего облучения.
Гепаринизированные наночастицы оксида железа представляют собой магнетит (FeO⋅Fe2O3), покрытый гепарином. Частицы имеют сферическую форму и гидродинамический диаметр 200 нм по результатам динамического светорассеяния (ДЛС). Допускается наличие нескольких фракций наночастиц по размерам. Основные фракции частиц не должны превышать 200 нм с учетом стандартного отклонения. Электрокинетический потенциал частиц варьируется от -40 до -50 мВ. Содержание магнетита по отношению к другим фазам оксида железа должно составлять не менее 90%. Содержание магнетита в конечном продукте - 1,36%; гепарина - 1,48%, воды - 97,1%.
Четыре способа лечения пролиферативного заболевания (такого как злокачественное новообразование у индивидуума) с использованием наночастиц:
- внутривенное введение индивидууму эффективного количества гепаринизированных наночастиц железа в комбинации с однократным ионизирующим облучением в дозах от 1 до 5 Гр;
- внутривенное введение индивидууму эффективного количества гепаринизированных наночастиц железа в комбинации с многократным ионизирующим облучением в суммарной дозе не более 10 Гр;
- внутривенное введение индивидууму эффективного количества гепаринизированных наночастиц железа в комбинации с магнитным транспортом (постоянное магнитное поле, магнитная индукция 4,196 Гаусс) и однократным ионизирующим облучением в дозах от 1 до 5 Гр.
- внутривенное введение индивидууму эффективного количества гепаринизированных наночастиц железа в комбинации с магнитным транспортом (постоянное магнитное поле, магнитная индукция 4,196 Гаусс) и многократным ионизирующим облучением в суммарной дозе не более 10 Гр.
Для облучения могут быть использованы линейные ускорители со средствами визуализации, в том числе 3D-визуализации, MPT, КТ для моделированной по интенсивности лучевой терапии (IMRT). Опухолевые ткани при данном виде терапии получают максимальную необходимую дозу облучения, в то время как здоровые окружающие ткани не затрагиваются. В качестве магнитных установок могут быть использованы аппараты для магнитотерапии, включая приборы с технологией сфокусированного магнитного поля, с максимальной интенсивностью магнитного поля 128 мТл и модуляцией частоты 0-166 Гц.
Используемые в современных онкологических исследованиях линии мышей характеризуются разной радиочувствительностью, что усложняет экстраполяцию данных, полученных на одной чистой линии, на другую линию. С другой стороны, разные линии опухолевых клеток, берущие свое начало от одной опухоли, могут значительно отличаться по своей радиочувствительности. Поэтому гепаринизированные наночастицы могут применятся для разных видов опухоли, отсюда для однократного облучения выбрана доза 5 Гр, для многократного - не более 10 Гр суммарно [Irradiation of Rodents [электронный ресурс] - URL: https://www.bu.edu/researchsupport/compliance/animal-care/working-with-animals/procedures/irradiation-of-rodents-iacuc (дата обращения 21 ноября 2022); Директива Европейского парламента и Совета Европейского союза от 22 сентября 2010 г. N 2010/63/ЕС «О защите животных, использующихся для научных целей» [электронный ресурс]. - URL:https://ruslasa.ru/wp-content/uploads/2017/06/Directive_201063_rus.pdf (дата обращения 21 ноября 2022)].
Пример 1. Комбинированное применение гепаринизированных наночастиц оксида железа с лучевой терапией на мышиной модели перевиваемой опухоли карциномы толстой кишки СТ26.
Исследование эффективности указанной терапевтической схемы проводилось на самках мышей линии BALB/c возрастом 6-8 недель, с массой тела 19,8±0,9 г. Культуру клеток СТ26 поддерживали на среде RPMI1640 (ПанЭко, Россия), содержащей 10% эмбриональную телячью сыворотку (ЭТС) и антибиотики - пенициллин (50 мкг/мл) и стрептомицин (50 мкг/мл). Для прививки животным использовали клетки 2-4 пассажей. Для проведения исследования и получения модели перевиваемой опухоли СТ26 клетки инокулировали мышам линии BALB/c подкожно на внешнюю поверхность бедра по 0,5×106 клеток/мышь. Наночастицы в дозе 10 мл/кг внутривенно вводили мышам с карциномой толстой кишки СТ26. После введения лекарственного средства на основе наночастиц оксида железа проводили магнитное наведение соответствующей группе с использованием постоянного магнитного поля с магнитной индукцией 4,196 Гаусс в течение 15 мин. Магнитное поле создавали с помощью постоянных магнитов (Diameter 51 mm × Thickness 21 mm; Surface Field 4,196 Gauss; Permeance Coefficient 1,11; K&J Magnetics). Мышь фиксировали на приспособлении, устанавливали на внутреннюю поверхность бедра цилиндрический магнит напротив мишени - опухолевого образования, локализованного на внешней поверхности бедра. После магнитного наведения проводили лучевую терапию.
Локальное облучение в разовой очаговой дозе 5Гр на фоне однократного внутривенного введения НЧ в дозе 10 мл/кг (доза препарата 10 мл/кг является максимальной для исследования острой токсичности) приводило к повышению лечебного эффекта по сравнению с таковым в группе мышей с СТ26, которые получали НЧ в монорежиме в аналогичной дозе: показатель торможения роста опухоли (ТРО) составлял 48,0% через 11 дней после окончания лечения (21 день роста опухоли) против 21,0% в группе сравнения.
Внутривенное введение НЧ в дозе 10 мл/кг с направленным транспортом к опухолевому очагу посредством магнитного поля приводило к значительному увеличению противоопухолевой эффективности: показатель ТРО на 14 день после окончания лечения достигал 79,6%, в то время как в группах сравнения значения этого показателя составляли 48.0% (для группы животных без направленного транспорта НЧ) и 53,7% (для группы облучения). Средняя продолжительность жизни мышей составила 44,6±1,3 дня, выживаемость - 45,1 дней, увеличение продолжительности жизни (УПЖ) - 42,1% (Фиг. 1, Фиг. 2).
Пример 2. Комбинированное применение гепаринизированных наночастиц оксида железа с лучевой терапией на мышиной модели перевиваемой опухоли рака шейки матки РШМ5.
Исследование эффективности указанной терапевтической схемы проводилось на самках мышей-гибридов линии F1 (СВА × C57B1/6j) возрастом 6-8 недель, с массой тела 20.1±1,3 г. Штамм РШМ5 поддерживали в солидном варианте на мышах линии СВА, самках, путем подкожной перевивки по 50 мг опухолевой ткани в 0,9% NaCl в объеме 0,2 мл каждые 12-14 дней. Для получения солидной опухоли РШМ5 мышам F1 перевивали 20 мг опухолевого материала/мышь, в объеме 0,1 мл, подкожно на поверхность бедра. После введения лекарственного средства на основе наночастиц оксида железа проводили магнитное наведение соответствующей группе с использованием постоянного магнитного поля с магнитной индукцией 4,196 Гаусс в течение 15 мин. Магнитное поле создавали с помощью постоянных магнитов (Diameter 51 mm × Thickness 21 mm; Surface Field 4,196 Gauss; Permeance Coefficient 1,11; K&J Magnetics). Мышь фиксировали на приспособлении, устанавливали на внутреннюю поверхность бедра цилиндрический магнит напротив мишени - опухолевого образования, локализованного на внешней поверхности бедра. После магнитного наведения проводили лучевую терапию.
В группе животных, которым вводили НЧ внутривенно в дозе 10 мл/кг (доза препарата 10 мл/кг является максимальной для исследования острой токсичности) в сочетании с однократным облучением в дозе 5 Гр, наблюдалось торможение роста опухоли на 51,3% - 56,1%. Однако противоопухолевый эффект по ТРО на этом уровне сохранялся только в течение 5 дней, затем снижался до 15,3% на 44 день наблюдения. Средняя продолжительность жизни мышей составила 54,1±3,5 дня, увеличение продолжительности жизни (УПЖ) - 30,3%.
В группе животных, которые подвергались только локальному облучению в дозе 5 Гр, торможение роста опухоли в течение всего времени наблюдения составляло 62,5-71,4%, на 31 сутки наблюдения (через 13 дней после окончания лечения) ТРО составило 64.0%. Средняя продолжительность жизни - 47,3±5,7 дней, УПЖ - 56,1%.
При сохранении режима (введение внутривенно в дозе 10 мл/кг, с последующим облучением в дозе 5 Гр), но с применением магнитного наведения НЧ с помощью постоянных магнитов, включая увеличение временного интервала до 15 мин между их введением и сеансом лучевой терапии, была отмечена выраженная тенденция к повышению эффективности лечения мышей с РШМ5: соотношение Т/С - 29,3% (+++), УПЖ - 36,1%, выживаемость - 58,9 дней (Фиг. 3, Фиг. 4).
Пример 3. Комбинированное применение гепаринизированных наночастиц оксида железа с лучевой терапией на мышиной модели перевиваемой опухоли саркомы S37.
Исследование эффективности указанной терапевтической схемы проводилось на самках мышей-гибридов линии F1 (СВА × C57B1/6j) возрастом 6-8 недель, с массой тела 20.1±1,3 г. Штамм саркомы S37 поддерживали на мышах линии CD1, самцах, которым внутрибрюшинно инокулировали по 3×106 клеток/мышь в 0,9% NaCl в объеме 0,2 мл каждые 7-9 дней. Для получения солидной опухоли саркомы S37 опухолевые клетки инокулировали мышам F1 по 0,5×106 клеток/мышь в объеме 0,1 мл физиологического раствора, подкожно на внешнюю поверхность бедра. После введения лекарственного средства на основе наночастиц оксида железа проводили магнитное наведение соответствующей группе с использованием постоянного магнитного поля с магнитной индукцией 4,196 Гаусс в течение 15 мин. Магнитное поле создавали с помощью постоянных магнитов (Diameter 51 mm × Thickness 21 mm; Surface Field 4,196 Gauss; Permeance Coefficient 1,11; K&J Magnetics). Мышь фиксировали на приспособлении, устанавливали на внутреннюю поверхность бедра цилиндрический магнит напротив мишени - опухолевого образования, локализованного на внешней поверхности бедра. После магнитного наведения проводили лучевую терапию.
Комбинированное применение лучевой терапии на фоне внутривенного введения НЧ в дозе 10 мл/кг (доза препарата 10 мл/кг является максимальной для исследования острой токсичности) с направленным транспортом к опухолевому очагу посредством магнитного поля вызывало значимое усиление противоопухолевого действия радиотерапии в отношении саркомы S37. У мышей с опухолью наблюдали достоверное уменьшение объема опухолевого узла, что сопровождалось увеличением продолжительности жизни животных на 80,2% при достижении излеченности у 20% животных (2 из 10 мышей) (Фиг. 5, Фиг. 6).
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПРОТОННОЙ ТЕРАПИИ СОЛИДНОЙ КАРЦИНОМЫ ЭРЛИХА | 2023 |
|
RU2808984C1 |
| ЛЕЧЕНИЕ РАКА КОМБИНАЦИЕЙ ЛУЧЕВОЙ ТЕРАПИИ, НАНОЧАСТИЦ ОКСИДА ЦЕРИЯ И ХИМИОТЕРАПЕВТИЧЕСКОГО СРЕДСТВА | 2015 |
|
RU2704811C2 |
| СПОСОБ ФОТОН-ЗАХВАТНОЙ ТЕРАПИИ ОПУХОЛЕЙ | 2004 |
|
RU2270045C1 |
| Генотерапевтический препарат FCU1-BsFm/PP для лечения солидных опухолей | 2023 |
|
RU2824977C1 |
| СПОСОБ ИНДУКЦИИ АБСКОПАЛЬНОГО ПРОТИВООПУХОЛЕВОГО ЭФФЕКТА В ЭКСПЕРИМЕНТАЛЬНОЙ МОДЕЛИ КАРЦИНОМЫ ЭРЛИХА | 2020 |
|
RU2736120C2 |
| СПОСОБ ЛЕЧЕНИЯ АДЕНОКАРЦИНОМЫ ЭРЛИХА МЕТОДОМ ЛУЧЕВОЙ ТЕРАПИИ | 2021 |
|
RU2781902C1 |
| СПОСОБ ПОДАВЛЕНИЯ ОПУХОЛЕВОГО РОСТА | 2003 |
|
RU2255742C2 |
| СРЕДСТВО, ОБЛАДАЮЩЕЕ ИЗБИРАТЕЛЬНЫМ РАДИО- И ХИМИОЗАЩИТНЫМ ДЕЙСТВИЕМ | 2007 |
|
RU2339386C1 |
| Способ повышения эффективности действия ионизирующих излучений на меланому | 2021 |
|
RU2774032C1 |
| СПОСОБ ПОВЫШЕНИЯ ЭФФЕКТИВНОСТИ ДЕЙСТВИЯ ПРОТОННОЙ ТЕРАПИИ НА СТВОЛОВЫЕ КЛЕТКИ МЕЛАНОМЫ | 2022 |
|
RU2798733C2 |



Изобретение относится к медицине, а именно к онкологии и лучевой терапии, и может быть использовано для терапии злокачественных новообразований. Выполняют внутривенное введение наночастиц оксида железа, покрытых гепарином. Затем осуществляют магнитный транспорт наночастиц в область опухоли путем создания постоянного магнитного поля в области опухоли в течение 15 мин с последующим ионизирующим облучением. Способ обеспечивает максимально необходимую дозу облучения при проведении лучевой терапии без повреждения окружающих здоровых тканей за счет совокупности приемов заявленного изобретения. 1 з.п. ф-лы, 6 ил., 3 пр.
1. Способ терапии злокачественных новообразований путем внутривенного введения наночастиц оксида железа, покрытых гепарином, осуществления магнитного транспорта наночастиц в область опухоли путем создания постоянного магнитного поля в области опухоли в течение 15 мин и последующего ионизирующего облучения.
2. Способ по п. 1, где наночастицы имеют сферическую форму и гидродинамический диаметр до 200 нм.
| WO 2022187556 A1, 09.09.2022 | |||
| US 2005261745 A1, 08.12.2005 | |||
| JP 2011207887 A, 20.10.2011 | |||
| RU 2020139435 A, 02.06.2022 | |||
| WO 2006042724 A2, 27.04.2006 | |||
| ШИМАНОВСКИЙ Н.Л | |||
| и др | |||
| Наноразмерные частицы оксида железа для диагностики и гипертермической терапии в онкологиии | |||
| Российский биотерапевтический журнал | |||
| Способ приготовления лака | 1924 |
|
SU2011A1 |
| Видоизменение пишущей машины для тюркско-арабского шрифта | 1923 |
|
SU25A1 |
| REGO G.N.A | |||
| et al | |||
Авторы
Даты
2024-03-27—Публикация
2023-04-07—Подача