Изобретение относится к области медицины, а именно к клинической микробиологии, и может быть использовано для формирования биопленки Lactobacillus casei, выделенных из пародонтальных карманов, на инертных носителях.
Согласно данным литературы, вид L. casei с высокой адгезивной способностью выживает в стрессовых условиях полости рта, может формировать агрегаты, микроколонии, а далее и биопленки на поверхностях слизистой оболочки ротовой полости. L. casei с высокой адгезивной способностью может ингибировать активность патогенных бактерий, уменьшать взаимодействие между патогенными бактериями и слизистой оболочкой ротовой полости, конкурируя за рецепторы для адгезии эпителиальных клеток, и ингибировать образование биопленок патогенными бактериями [Jamal М., Ahmad W., Andleeb S., Jalil F., Imran M., Nawaz M.A. et al. Bacterial biofilm and associated infections // J. Chin. Med. Assoc. - 2018. - V. 81 (1). - P. 7-11; Barzegari A., Kheyrolahzadeh K., Khatibi S.M.H., Sharifi S., Memar M.Y., Vahed S.Z. The battle of probiotics and their derivatives against biofilms. Infect. Drag. Resistance. - 2020. V. - 13. - P. 659-72; Gou H.-Z., Zhang Y.-L., Ren L.-F., Li Z.-J., Zhang L. How do intestinal probiotics restore the intestinal barrier? // Front. Microbiol. - 2022. -V. 13. P. 929346; Vasiee A., Falah F., Mortazavi S.A. Evaluation of probiotic potential of autochthonous lactobacilli strains isolated from Zabuli yellow kashk, an Iranian dairy product // J. Appl. Microbiol. - 2022. - V. 133. - P. 3201-14]. Таким образом, информация о возможности воссоздания модели биопленок L. casei имеет большое значение для медицины и стоматологии, а именно для дальнейших исследований по созданию новых эффективных пробиотиков на основе биопленок для восстановления микробиологического равновесия полости рта при дисбиотических состояниях.
Известен способ моделирования биопленок, формируемых Vibrio cholerae Ol серогруппы на поверхности хитина, включающий использование хитина для формирования биопленки, образуемой клетками V. cholerae, с последующей инкубацией и анализом результатов в ПЦР, отличающийся тем, что в качестве хитина используют пластины речного рака Astacus astacus в количестве 10-15 штук и размером 0,3x0,3 см, которые размещают во флакон емкостью 100 мл, содержащий 30 мл отстоянной речной воды, затем флакон автоклавируют 10 минут при 120°С, а после охлаждения во флакон вносят взвесь культур Vibrio cholerae Ol серогруппы до конечной концентрации 104 м.к./мл, инкубирование проводят в заданные интервалы времени при 10°С и 28°С, анализ результатов образования как простых, так и сложных биопленок V. cholerae проводят в ПЦР с использованием праймеров:
VC 1699-1 GCTTAGCTATTTTTGGGTATAGGTT,
VC 1699-2 CGTTCATTTTTACTCAAACAGTCA
к INDEL-локусу 1699, при этом атоксигенные штаммы ctx-tcpA-формируют ампликон массой 132 п. о., а токсигенные штаммы ctx+tcpA+образуют ампликон массой 116 п. о., подтверждая присутствие клеток токсигенного штамма в составе сложной биопленки и способность колонизировать поверхность хитина [Патент РФ №2685878, 2019 г.].
Известен способ моделирования образования биопленок холерных вибрионов в условиях эксперимента, включающий формирование биопленок на твердом носителе, отличающийся тем, что биопленку создают на покровных стеклах, установленных наклонно под углом 10-12° к вертикальной оси в количестве 8-9 штук, которые помещают между витками пружинообразного приспособления, размещенного внутри емкости объемом 100 мл, затем емкость заполняют экспериментальной средой в объеме 40-50 мл до полного погружения покровных стекол, добавляют в емкость суспензию холерных вибрионов и инкубируют при конечной концентрации холерных вибрионов в n×108 КОЕ/мл с доведением до минимального порога чувствительности ОД КОЕ/мл при комнатной температуре [Патент РФ №2559546, 2015 г.].
Описанные способы не позволяют воссоздать модель биопленок в анаэробных условиях и потому не могут быть использованы для L. casei, как у предполагаемого кандидата в пробиотики полости рта.
Наиболее близким аналогом изобретения является способ формирования смешанной биопленки пародонтопатогенных анаэробных бактерий в условиях текучих сред in vitro, включающий три этапа, причем на первом этапе на подложку из полимерных материалов в замкнутой емкости вносят бактериальную взвесь чистой культуры Streptococcus sanguinis, на втором - Fusobacterium nucleatum, на третьем Porphyromonas gingivalis, или Aggregatibacter actinomycetemcomitans, или Tannerella forsythia, или Prevotella intermedia и культивируют 48 ч, 72 ч, 120 ч соответственно, при этом бактериальную взвесь каждой чистой культуры разводят в 0,1% полужидкой агаризованной среде - сердечно-мозговом бульоне BHI, LIM или АС, содержащей 0,01% менадиона и 0,1%) гемина, до концентрации 106-108 КОЕ/мл, замкнутую емкость помещают в микроанаэростат с постоянным составом бескислородной газовой смеси, состоящей из 80% азота, 10% водорода, 10% углекислого газа, который в свою очередь помещается в шейкер-термостат, обеспечивающий возвратно-поступательные движения в диапазоне 60-120 движений в минуту, при температуре 37°С с получением смешанной биопленки. [Патент РФ №2619169, 2017 г.]. Новизна этого способа состоит в том, что он позволяет при необходимости оценить вклад каждого вида в индукцию медиаторов воспаления, факторов патогенности или резистентности к антибиотикам. Недостатком прототипа является использование дорогостоящих коммерческих сред, кроме этого, не показана его эффективность при исследовании клинического материала.
Задачей изобретения является разработка достоверного и доступного способа формирования биопленки L. casei, выделенных из пародонтальных карманов.
Технический результат - получение биопленки L. casei, выделенных из пародонтальных карманов, на инертных носителях.
Предлагаемый способ проводят в три этапа: на первом -культивируют посевы лактобактерий, выделенных из пародонтальных карманов на агаре MRS для лактобактерий, на втором - культивируют выделенные изоляты на среде для лактобактерий, содержащей на 1 л питательной среды: пептон - 10 г, дрожжевой экстракт - 20 г, глюкоза - 20 г, твин-80 - 1 г, дикалия гидрофосфат - 2 г, ацетат натрия - 5 г, цитрат триаммония - 2 г, сульфат магния - 0,2 г, тетрагидрат сульфата марганца (MnSO4*4H2O) - 0,05 г, мясная вода - остальное до 1 л, рН 6.2, в течение 24 ч при 37°С.На третьем этапе чистые культуры разводят до концентрации 107КОЕ/мл и инкубируют под пленкой в лунках полистиролового планшета, который помещают в С02-инкубатор с постоянным составом бескислородной газовой смеси, содержащий 80% -азота, 15% - водорода, 5% - углекислого газа, в течение 3-14 суток при 37°С.
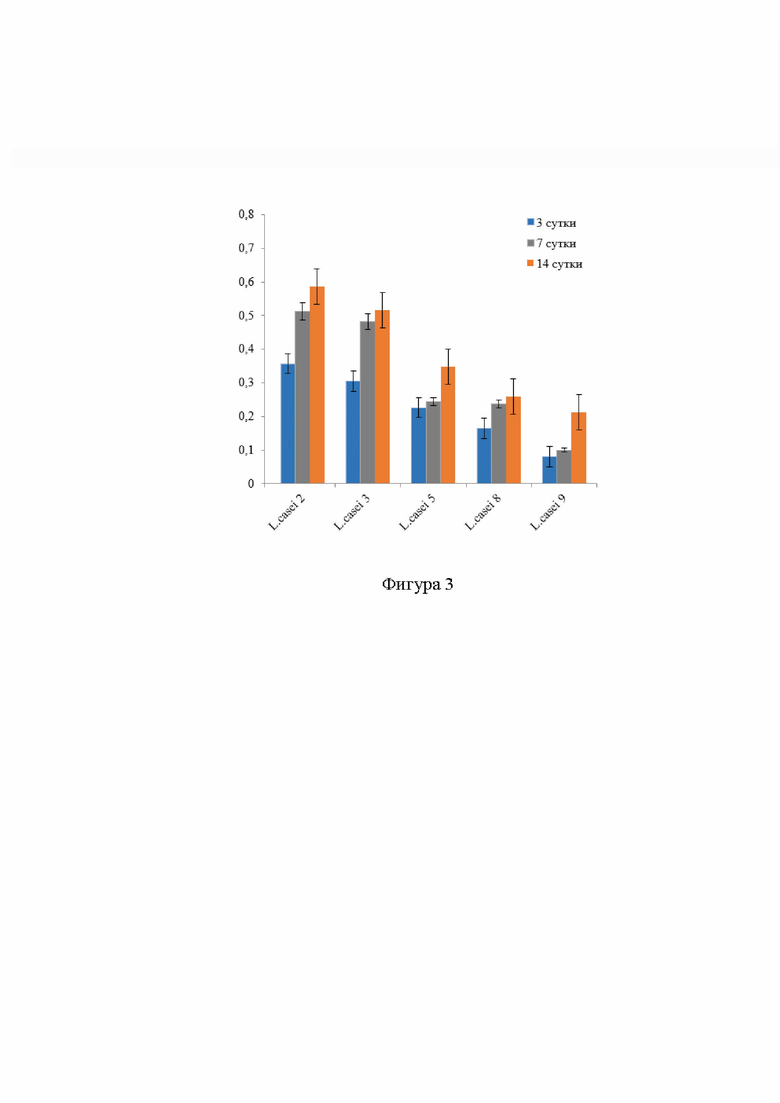
Изобретение иллюстрируется следующими фигурами: на фиг. 1 представлен вид колоний L. casei, выделенных из пародонтальных карманов, на агаре MRS для лактобактерий; на фиг. 2 - результат масс-спектрометрии чистых культур L. casei; на фиг. 3 - анализ изменений в относительной биомассе биопленок изолятовЬ. casei на 3, 7, 14 сутки.
Предлагаемый способ формирования биопленки L. casei, выделенных из пародонтальных карманов, на инертных носителях осуществляется следующим образом:
Первый этап. Для получения накопительной культуры клинический материал (содержимое пародонта) засеивают на агар MRS для лактобактерий [HiMedia Laboratories Pvt. Limited: [Электронный ресурс]. URL: https://himedialabs.ru. Дата обращения: 13.11.2023], инкубируют в течение 24 ч при температуре 37°С (фигура 1). Идентификацию до рода и вида проводят с помощью метода масс-спектрометрии (автоматической системы идентификации микроорганизмов по принципу MALDI-TOF) (Autof MS 2600, Китай) (фигура 2).
Второй этап: Выделенные изоляты L. casei культивируют в течение 24 ч при температуре 37°С на среде для лактобактерий, содержащей на 1 л питательной среды: пептон - 10 г, дрожжевой экстракт - 20 г, глюкоза - 20 г, твин-80 - 1 г, дикалия гидрофосфат - 2 г, ацетат натрия - 5 г, цитрат триаммония - 2 г, сульфат магния - 0,2 г, тетрагидрат сульфата марганца (MnSO4*4H2O) - 0,05 г, мясная вода - остальное до 1 л, рН 6.2.
Третий этап: суспензии суточных чистых культур L. casei, выращенных на среде для лактобактерий, разводят до концентрации 107 КОЕ/мл. В лунки полистиролового 48-луночного планшета вносят по 300 мкл полученной разведенной бактериальной суспензии. Планшет накрывают крышкой, заворачивают пленкой Parafilm («Атсог», США) и инкубируют в CO2-инкубаторе HF-100 (Heal Force, КНР) с постоянным составом бескислородной газовой смеси, содержащей 80% - азота, 15% -водорода, 5% - углекислого газа, в течение 3-14 суток при 37°С.
Пример №1. Пациент М., 48 лет. Диагноз: хронический генерализованный пародонтит средней степени тяжести. Жалобы на отечность десен, подвижность зубов, запах изо рта, кровоточивость десен, слизистое отделяемое из пародонтальных карманов.
Забор содержимого пародонта производился при помощи стерильных бумажных штифтов Absorbent Paper Points (МЕТА BIOMED, Южная Корея) (размер №25 по ISO). Стерильным пинцетом штифт вводили в наиболее глубокие участки пародонтальных карманов на 15 секунд, затем немедленно помещали в стерильные пробирки типа Eppendorf 1,5 мл объема с тиогликолевой средой (HiMedia, Индия). В дальнейшем в соответствии с предлагаемым нами способом культивирование содержимого пародонта осуществляли на агаре MRS для лактобактерий, затем проводили идентификацию до вида с помощью метода масс-спектрометрии (Autof MS 2600, Китай), после чего выделенные изоляты культивировали на среде для лактобактерий, содержащей на 1 л питательной среды: пептон - 10 г, дрожжевой экстракт - 20 г, глюкозу - 20 г, твин-80 - 1 г, дикалия гидрофосфат - 2 г, ацетат натрия - 5 г, цитрат триаммония - 2 г, сульфат магния - 0,2 г, тетрагидрат сульфата марганца (MnSO4⋅4H2O) - 0,05 г, мясная вода - остальное до 1 л, рН 6.2, в течение 24 ч при 37°С, суспензии чистых культур изолятов 2,3 L. casei разводили до концентрации 107 КОЕ/мл и культивировали под пленкой в лунках полистиролового планшета, который помещали в С02-инкубатор с постоянным составом бескислородной газовой смеси, содержащей 80% - азота, 15%) - водорода, 5% - углекислого газа, в течение 3-14 суток при 37°С.
Для проверки эффективности способа, сформировавшиеся на 3, 7, 14 сутки биопленки окрашивали генцианвиолетом («Агат-Мед», Россия), с последующим элюированием связавшегося с биопленками красителя этиловым спиртом. Результаты изменений в относительной биомассе бипленок выделенных изолятов L. casei, учитывали спектрофотометрически путем измерения оптической плотности спиртового экстракта при длине волны 590 нм с использованием прибора Enspire Model 2300 Multilabel Microplate Reader («Perkin Elmer», США) (таблица, фигура 3) [Вершинина З.Р., Чубукова О.В., Никоноров Ю.М., Хакимова Л.Р., Лавина А.М., Каримова Л.Р., Баймиев Ан.X., Баймиев А.X. Влияние сверхэкспрессии гена rosR на образование биопленок бактериями Rhizobium leguminosarum II Микробиология. - 2021. - Т. 90, №2. - С. 191-203.].
Пример №2. Пациент Б., 38 лет. Диагноз: хронический генерализованный пародонтит легкой степени тяжести. Жалобы на отечность и гиперемию десен, запах изо рта, кровоточивость десен периодическая.
Забор содержимого пародонта производился при помощи стерильных бумажных штифтов Absorbent Paper Points (МЕТА BIOMED, Южная Корея) (размер №25 по ISO). Стерильным пинцетом штифт вводили в наиболее глубокие участки пародонтальных карманов на 15 секунд, затем немедленно помещали в стерильные пробирки типа Eppendorf 1,5 мл объема с тиогликолевой средой (HiMedia, Индия). В дальнейшем в соответствии с предлагаемым нами способом культивирование содержимого пародонта осуществляли на агаре MRS для лактобактерий, затем проводили идентификацию до вида с помощью метода масс-спектрометрии (Autof MS 2600, Китай), после чего выделенные изоляты культивировали на среде для лактобактерий, содержащей на 1 л питательной среды: пептон - 10 г, дрожжевой экстракт - 20 г, глюкозу - 20 г, твин-80 - 1 г, дикалия гидрофосфат - 2 г, ацетат натрия - 5 г, цитрат триаммония - 2 г, сульфат магния - 0,2 г, тетрагидрат сульфата марганца (MnSO4⋅4H2O) - 0,05 г, мясная вода - остальное до 1 л, рН 6.2, в течение 24 ч при 37°С, суспензии чистых культур изолятов 5,8,9 L. casei разводили до концентрации 107 КОЕ/мл и культивировали под пленкой в лунках полистиролового планшета, который помещали в CO2-инкубатор с постоянным составом бескислородной газовой смеси, содержащей 80% - азота, 15%) - водорода, 5% - углекислого газа, в течение 3-14 суток при 37°С.
Для проверки эффективности способа, сформировавшиеся на 3, 7, 14 сутки биопленки окрашивали генцианвиолетом («Агат-Мед», Россия), с последующим элюированием связавшегося с биопленками красителя этиловым спиртом. Результаты изменений в относительной биомассе биопленок выделенных изолятов L. casei, учитывали спектрофотометрически путем измерения оптической плотности спиртового экстракта при длине волны 590 нм с использованием прибора Enspire Model 2300 Multilabel Microplate Reader («Perkin Elmer», США) (таблица, фигура 3) [Вершинина З.Р., Чубукова О.В., Никоноров Ю.М., Хакимова Л.Р., Лавина А.М., Каримова Л.Р., Баймиев Ан.X., Баймиев А.X. Влияние сверхэкспрессии гена rosR на образование биопленок бактериями Rhizobium leguminosarum II Микробиология. - 2021. - Т. 90, №2. - С. 191-203.].
Таким образом, предлагаемый нами способ формирования биопленок видом L. casei, выделенным из пародонтальных карманов, на инертных поверхностях продемонстрировал свою эффективность при исследовании клинического материала.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ФОРМИРОВАНИЯ БИОПЛЕНКИ LACTOBACILLUS FERMENTUM, ВЫДЕЛЕННЫХ ИЗ ПАРОДОНТАЛЬНЫХ КАРМАНОВ, НА ИНЕРТНЫХ ПОВЕРХНОСТЯХ | 2023 |
|
RU2817419C1 |
| Способ формирования смешанной биоплёнки пародонтопатогенных анаэробных бактерий в условиях текучих сред in vitro | 2015 |
|
RU2619169C1 |
| СПОСОБ СЕЛЕКТИВНОГО ВЫДЕЛЕНИЯ АУТОШТАММОВ LACTOBACILLUS SPP. ИЗ КЛИНИЧЕСКОГО МАТЕРИАЛА | 2018 |
|
RU2675315C1 |
| ПАРОДОНТАЛЬНАЯ ПОВЯЗКА | 2003 |
|
RU2240771C2 |
| Способ формирования смешанной биопленки пародонтопатогенных анаэробных бактерий in vitro | 2017 |
|
RU2661114C1 |
| ПРОБИОТИЧЕСКАЯ КОМПОЗИЦИЯ ДЛЯ ЗДОРОВЬЯ ПОЛОСТИ РТА | 2011 |
|
RU2584610C2 |
| СПОСОБ ПЕРВИЧНОГО ПОСЕВА ОТДЕЛЯЕМОГО ИЗ ПАРОДОНТАЛЬНЫХ КАРМАНОВ | 2022 |
|
RU2794355C1 |
| ШТАММ БАКТЕРИЙ LACTICASEIBACILLUS PARACASEI SUBSP. PARACASEI 1338 ВКМ B-3753D ДЛЯ ПРОИЗВОДСТВА КИСЛОМОЛОЧНЫХ ПРОДУКТОВ И В КАЧЕСТВЕ ПРОБИОТИКА | 2023 |
|
RU2816652C1 |
| СПОСОБ ЛЕЧЕНИЯ ПАРОДОНТИТА | 2009 |
|
RU2400243C1 |
| СРЕДСТВО ДЛЯ СЕЛЕКТИВНОГО ВЛИЯНИЯ НА БИОПЛЕНКООБРАЗОВАНИЕ МИКРООРГАНИЗМАМИ | 2016 |
|
RU2646488C2 |
Изобретение относится к биотехнологии и клинической микробиологии. Предложен способ формирования биопленки анаэробными бактериями Lactobacillus casei, выделенными из пародонтальных карманов, включающий культивирование содержимого пародонта на агаре MRS для лактобактерий в течение 24 ч при 37°С, затем выделенные изоляты культивируют на среде для лактобактерий заданного состава при рН 6.2 в течение 24 ч при 37°С, после чего чистые культуры разводят до концентрации 107 КОЕ/мл и культивируют под пленкой Parafilm в лунках полистиролового планшета, который помещают в CO2-инкубатор с бескислородной газовой смесью, содержащей 80% азота 15% водорода, 5% углекислого газа, в течение 3-14 сут. при 37°С. Изобретение обеспечивает воссоздание модели биопленок Lactobacillus casei для исследований по созданию новых эффективных пробиотиков в стоматологии. 3 ил., 1 табл., 2 пр.
Способ формирования биопленки анаэробными бактериями, включающий культивирование сначала на питательной среде, затем в аппарате для культивирования микроорганизмов в анаэробных условиях с бескислородной газовой смесью, содержащей 80% азота, водород и углекислый газ, отличающийся тем, что для формирования биопленки Lactobacillus casei проводят культивирование содержимого пародонта на агаре MRS для лактобактерий в течение 24 ч при температуре 37°С, после чего выделенные изоляты культивируют на среде для лактобактерий, содержащей на 1 л питательной среды: пептон – 10 г, дрожжевой экстракт – 20 г, глюкоза – 20 г, твин-80 – 1 г, дикалия гидрофосфат – 2 г, ацетат натрия – 5 г, цитрат триаммония – 2 г, сульфат магния – 0,2 г, тетрагидрат сульфата марганца MnSO4*4H2O – 0,05 г, мясная вода – остальное до 1 л, рН 6.2, в течение 24 ч при 37°С, после чего чистые культуры разводят до концентрации 107 КОЕ/мл и культивируют под пленкой Parafilm в лунках полистиролового планшета, который помещают в аппарат для культивирования микроорганизмов, в качестве которого используют CO2-инкубатор, содержащий 15% водорода, 5% углекислого газа, в течение 3-14 суток при 37°С.
| Способ формирования смешанной биоплёнки пародонтопатогенных анаэробных бактерий в условиях текучих сред in vitro | 2015 |
|
RU2619169C1 |
| СИСТЕМЫ И СПОСОБЫ ДЛЯ ВЫРАЩИВАНИЯ БИОПЛЁНКИ ПРОБИОТИЧЕСКИХ БАКТЕРИЙ НА ТВЁРДЫХ ЧАСТИЦАХ С ЦЕЛЬЮ КОЛОНИЗАЦИИ КИШЕЧНИКА БАКТЕРИЯМИ | 2016 |
|
RU2773533C2 |
| АФОНЮШКИН В.Н | |||
| и др | |||
| "Определение концентрации клеток в стационарно растущих культурах Lactobacillus salivarius в связи с формированием биопленок и агрегатов клеток"; Микробиология, 2017, т.86 N 6, с.770-776 | |||
| УСАТЫХ Е.А | |||
| "Оценка способности штаммов Lactobacillus spp | |||
| формировать биопленки"; | |||
Авторы
Даты
2024-05-21—Публикация
2023-11-24—Подача